Текст
Майкл Малрой
местная
анестезия
Иллюстрированное
практическое руководство
Данный файл представлен исключительно
в ознакомительных целях.
Все авторские права на данный файл
сохраняются за правообладателем.
Любое коммерческое и иное использование
кроме предварительного ознакомления запрещено.
Публикация данного документа не преследует
никакой коммерческой выгоды. Но такие документы
способствуют быстрейшему профессиональному и
духовному росту читателей и являются рекламой
бумажных изданий таких документов.
Все авторские права сохраняются за правообладателем.
местная
анестезия
regional
anesthesia
An Illustrated
Procedural Guide
THIRD EDITION
Michael F. Mulroy, M. D.
Staff Anesthesiologist
Department of Anesthesiology
The Virginia Mason Medical Center
Clinical Professor
apartment of Anesthesiology
eiversity of Washington
Seattle, Washington
Lippincott Williams & Wilkins
A Wolters Kluwer Company
Philadelphia • Baltimore • New York • London
Buenos Aires • Hong Kong • Sydney • Tokyo
Майкл Малрой
местная
анестезия
Иллюстрированное
практическое руководство
Перевод с английского
С. А. Панфилова
под редакцией профессора
С. И. Емельянова
Москва
БИНОМ. Лаборатория знаний
2 00 3
УДК 616-089.5
ББК Р451
М18
Малрой М.
Ml8 Местная анестезия: Иллюстрированное практическое руководство /
М. Малрой; Пер. с англ. С. А. Панфилова; Под ред. проф. С. И. Емельяно-
ва.— М.: БИНОМ. Лаборатория знаний, 2003. — 301 с.: ил.
ISBN 5-94774-069-9 (русск.)
ISBN 0-7817-3645-5 (англ.)
Практическое руководство, написанное известным американским анестезио-
логом, выдержавшее на английском языке три издания. Описаны наиболее часто
используемые методики местной анестезии для всех областей тела с обоснованием
причин и целей их применения. Приводятся фармакологические и физиологиче-
ские данные для выбора препаратов и доз. Отдельно обсуждается применение опи-
санных методик в педиатрии, акушерстве и послеоперационном обезболивании.
Для студентов медицинских вузов и практикующих хирургов и анестезио-
логов.
УДК 616-089.5
ББК Р451
В книге приводятся четкие показания к применению, противопоказания и дози-
ровки препаратов. Охцако цитателю настоятельно рекомендуется сверять указан-
ную информацию с данными производителей этих препаратов.
По вопросам приобретения обращаться:
В Москве
«БИНОМ. Лаборатория знаний» (095) 955-03-98, e-mail: lbz@aha.ru
В Санкт-Петербурге
«Диалект» (812) 247-93-01, e-mail: dialect@sndlct.iofTe.rssi.ru
ISBN 5-94774-069-9 (русск.)
ISBN 0-7817-3645-5 (англ.)
Опубликовано по договору с
Lippincott Williams & Wilkins, USA
© 2002 by Lippincott Williams & Wilkins
© перевод, оформление, БИНОМ. Лаборатория
знаний,2003
Брайану и Лоренсу, которые напоминали мне о том,
что есть более важные свершения, чем написание книги.
Моим предшественникам в клинике Вирджинии Мейсон;
особенно Дональду Брайденбо, который сделал
так много для других при создании отделения,
одинаково ободряя и обучая сотрудников и ординаторов
искусству местной анестезии и медицины, а также
основателю отделения Дану Муру, заложившему
традиции местной анестезии в клинике Вирджинии Мейсон.
Соавторы
Джеймс Хельман
Анестезиолог отделения анестезиологии Медицинского центра
Вирджинии Мейсон, Сиэтл, Вашингтон
Линда Джо Райс
Директор детской клиники лечения боли Санкт-Петербурга, Флорида,
профессор кафедры Университетского колледжа медицины
Южной Флориды, Тампа, Флорида
Содержание
Предисловие к русскому переводу...........................................9
Предисловие..............................................................10
Глава 1
Местные анестетики...................................................12
Глава 2
Клиническая характеристика местных анестетиков.......................24
Глава 3
Осложнения местной анестезии.........................................41
Глава 4
Премедикация и мониторинг............................................53
Глава 5
Оснащение............................................................60
Глава 6
Спинномозговая анестезия.............................................72
Глава 7
Эпидуральная анестезия...............................................97
Глава 8
Каудальная анестезия................................................120
Глава 9
Межреберная анестезия...............................................126
Глава 10
Паравертебральная блокада...........................................134
Глава 11
Симпатические блокады...............................................141
Глава 12
Блокады плечевого сплетения.........................................152
Глава 13
Внутривенная местная анестезия......................................173
8
Содержание
Глава 14
Периферические блокады нервов верхних конечностей...................179
Глава 15
Блокады пояснично-крестцового сплетения.............................185
Глава 16
Блокады периферических нервов нижней конечности.....................199
Глава 17
Анестезия дыхательных путей.........................................205
Глава 18
Блокады нервов лица и головы........................................212
Глава 19
Блокады шейного сплетения...........................................220
Глава 20
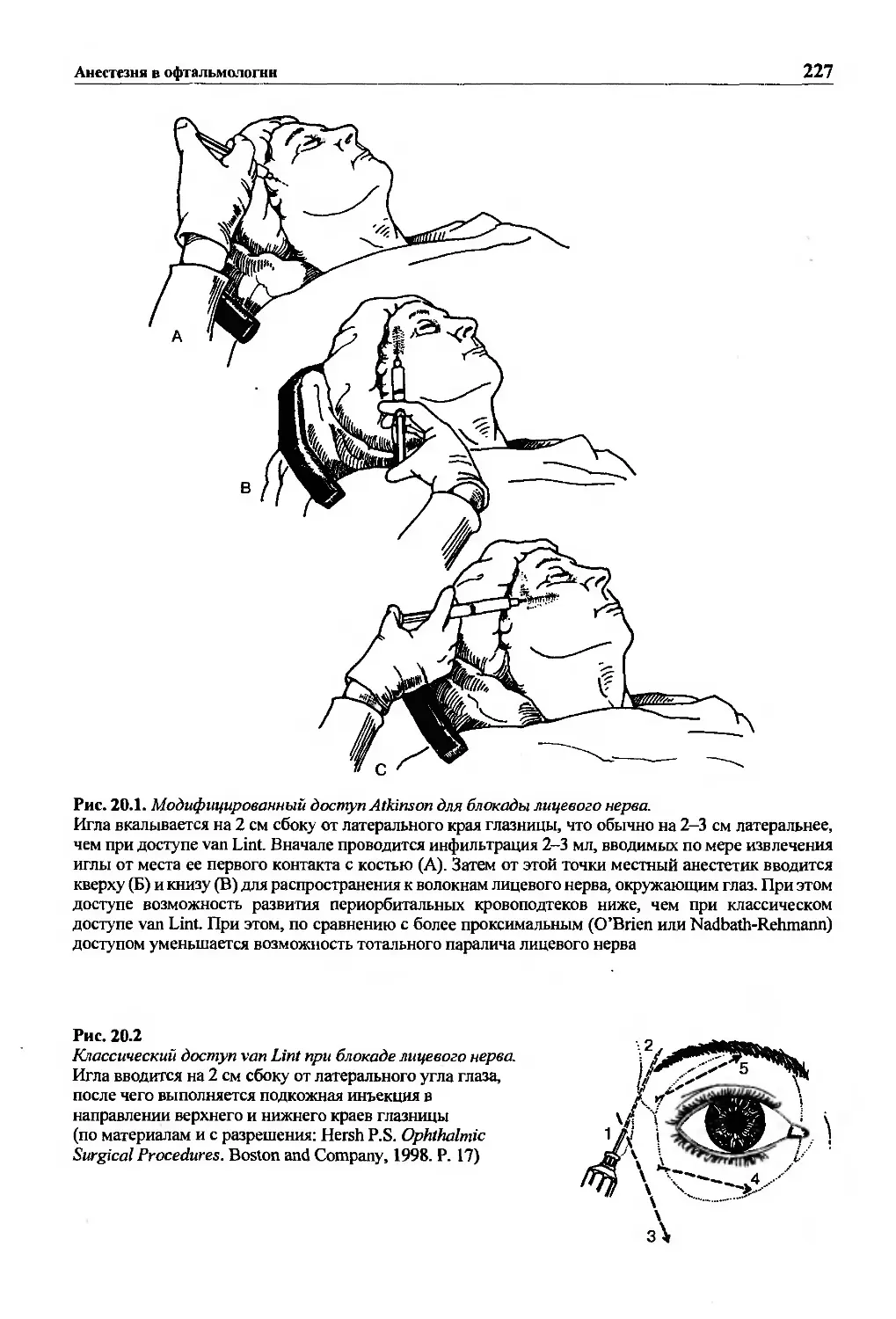
Анестезия в офтальмологии...........................................225
Глава 21
Местная анестезия в педиатрии ......................................233
Линда Джо Райс
Глава 22
Анестезия в акушерстве..............................................243
Глава 23
Лечение хронической боли............................................258
Джеймс Хельман
Глава 24
Лечение послеоперационных болей.....................................285
Предисловие к русскому переводу
Предлагаемая вниманию российского читателя книга известного американ-
ского анестезиолога Майкла Малроя посвящена одной из самых давних и много-
гранных проблем медицины — борьбе с болью. Это издание представляет собой
редкое сочетание описания классических методик местной анестезии и сведений
об особенностях действия и эффективности современных анестетиков.
Классические исследования, посвященные обезболиванию у хирургических
больных, были выполнены такими выдающимися хирургами, как В. Ф. Вой-
но-Ясенецкий и А. В. Вишневский. Развитие и повсеместное внедрение методов
общей анестезии привело к тому, что число хирургов, всесторонне владеющих
искусством местной анестезии, значительно уменьшилось. Однако в настоящее
время все большее число специалистов в нашей стране вновь обращают свое вни-
мание на возможность обезболивания путем локального и эффективного воздей-
ствия на периферическую нервную систему.
Достижение полноценного обезболивания необходимо не только для созда-
ния наилучших условий проведения оперативного вмешательства. Противостоя-
ние боли — это первостепенный моральный долг любого врача, стремящегося
облегчить страдания больного. Хотелось бы обратить особое внимание читате-
лей на раздел книги, посвященный обезболиванию в послеоперационном перио-
де и методам борьбы с болью при онкологических заболеваниях.
Надеюсь, что эта книга поможет хирургам и анестезиологам в их нелегкой
работе.
Академик РАМН, профессор В. Д. Федоров
Предисловие
Это практическое руководство предназначено как для студентов, так и для прак-
тикующих врачей. Оно содержит описания наиболее часто используемых мето-
дик местной анестезии, которые выполняются в операционной. Также оно
содержит обоснования причин и целей методик. Здесь также приведены фарма-
кологические и физиологические данные, помогающие выбрать препараты и
дозы, а также предотвратить наиболее частые осложнения. Это руководство со-
держит описания проведения наиболее широко распространенных методик для
всех областей тела, при этом их применение в таких специализированных облас-
тях, как педиатрия, акушерство и послеоперационное обезболивание обсуждает-
ся отдельно. При определенной широте этого практического руководства, его
целью, однако, не являлось достижение энциклопедической глубины. Для полу-
чения всеобъемлющих сведений по обсуждаемым здесь темам читатель должен
будет обратиться как к стандартным учебникам, так и оригинальным работам,
список которых приведен в конце каждой главы.
Знакомство с первыми пятью главами руководства дополняется последую-
щими, содержащими описания конкретных методик. В этом вводном разделе по-
дробно обсуждаются вопросы премедикации, необходимого оборудования и
наиболее частые осложнения; в дальнейшем они упоминаются лишь вкратце.
Особенности методик описаны в главах, посвященных аксиальным блокадам,
блокам нервов конечностей, головы и туловища. Кроме детального пошагового
описания методик проведения блокад, каждая глава содержит анатомический об-
зор, обсуждение препаратов и специфических осложнений. В последних главах
рассматривается применение местной анестезии в педиатрии, акушерстве, обез-
боливании при остром и хроническом болевом синдроме. В специализированных
изданиях можно найти значительно более подробные описания, однако те из
практикующих врачей, кто нечасто пользуются анестезией при хроническом бо-
левом синдроме или выполняют блокады у детей, найдут в последних главах по-
лезную для себя информацию. Эти главы особенно полезны для начинающих
врачей.
Руководство предназначено для практического использования при проведе-
нии анестезии. Тем не менее, для успешного выполнения местной анестезии во
время ее проведения требуется не просто следование плану процедуры. Читате-
лю, особенно начинающему врачу, для достижения успешной анестезии, прежде
чем подойти к пациенту, настоятельно рекомендуется более подробное ознаком-
ление с анатомическими деталями в обычных руководствах и атласах по анато-
мии. Трехмерная визуализация анатомических данных может оказать сущест-
венную помощь при проведении местной анестезии, позволяя изучать костные
ориентиры в прижизненной модели. Перед практическим применением анесте-
зии полезно ознакомиться с используемыми для ее выполнения препаратами и
связанными с ними осложнениями.
Предисловие
11
Описанные здесь методики широко применяются в Медицинском центре
Вирджинии Мейсон. В тех случаях, когда научные данные позволили провести
обоснованный выбор доступа или методики, приведены ссылки на использован-
ные источники. Однако во многом местная анестезия остается искусством. Опи-
сание многих доступов все еще по большей части основано на личном опыте и
предпочтениях. Даже в нашем отделении в проведении наиболее часто выполня-
емых блокад имеются существенные различия. Включить в руководство описа-
ние всех индивидуальных методик невозможно, но попытка лечить по универ-
сальным рецептам, взятым из «поваренной книги», была бы несчастьем для
медицины. Искусство местной анестезии изменяется, что отражается в появле-
нии новых препаратов, оборудования и методик. Многие из этих изменений
были учтены при новой, представленной вашему вниманию редакции этого изда-
ния. Нет сомнений в том, что в будущем нас ждут дальнейшие изменения.
Это руководство никогда не увидело бы свет без поддержки и участия все-
го коллектива отделения анестезии клиники Вирджинии Мейсон. Окончатель-
ный вариант текста отражает вклад каждого сотрудника (хотя не обязательно
это означает, что абсолютно все этот текст одобрили). Штатные сотрудники и
практиканты за эти годы сделали немало ценных замечаний по содержанию
книги и прояснили ряд спорных моментов: как водится, мы столькому можем
научиться у наших студентов, сколькому они научились у нас. Особую благо-
дарность хочу выразить доктору медицины Л. Райс за главу, в которой освеща-
ется применение местной анестезии в педиатрии, что в нашей клинике не прак-
тиковалось, и доктору медицины Дж. Хельману за его экспертную оценку
лечения хронических больных.
Я признателен А. Николс за ее терпение и усердие при изготовлении иллю-
страций к тексту, а также Дж. Смит за дополнительные штрихи, внесенные в
оформление издания. Наконец, особо следует отметить К. Перси, вдохновивше-
го меня на работу над третьим изданием. Хочется надеяться, что все эти усилия
привели к созданию руководства, способного помочь как новичкам, так и опыт-
ным специалистам повысить свой профессиональный уровень.
Майкл Ф. Малрой,
доктор медицины
Глава 1
Местные анестетики
Местные анестетики представляют собой сложные соединения, которые вызыва-
ют временное прекращение передачи нервного импульса по аксонам нервных
клеток. Используемые в настоящее время местные анестетики являются химиче-
скими производными кокаина, растительного алкалоида, выделенного из листь-
ев коки. Это плохо растворимое в воде слабое основание, является производным
бензойной кислоты, полученным путем ее соединения эфирной связью с третич-
ным амином. Структура большинства синтетических производных содержит три
основные функциональные единицы: гидрофильная и липофильная части соеди-
нены цепочкой, которая представляет собой сложный эфир или амид (рис. 1.1).
Рис. 1.1
Типичная структура молекулы
местного анестетика
—С—N
липофильная связывающее
часть
звено
гидрофильная
часть
Эти производные также плохо растворимы в воде и также являются слабыми
основаниями, которые используются в виде водных растворов гидрохлоридных
солей третичных аминов. Раствор местного анестетика содержит равновесную
смесь ионизированной (катионовой) соли и неионизированного основания. Су-
ществование ионизированной и неионизированной форм в сочётапии с липофи-
льной и гидрофильной частями исходного соединения обеспечивает возмож-
ность прохождения как через гидрофильные, так и через липофильные
мембраны, что является основным свойством, позволяющим проникать этим со-
единениям через оболочку нервной клетки и вызывать анестезию. В определении
возможностей, длительности действия и клинических характеристик каждого из
препаратов важным является соотношение этих физико-химических свойств в
оригинальной структуре каждого соединения. Эфирная или амидная связь между
двумя частями соединения определяет интенсивность метаболизма и опосредо-
ванное действие, проявляющееся в специфической токсичности веществ.
Местные анестетики
13
История
Кокаин, первый местный анестетик, был привезен в Европу из Южной Америки
в середине XIX столетия [1]. Koller в Вене первым обнаружил преимущество ко-
каина для местной анестезии в офтальмологии. Его сообщение в 1884 году, явив-
шееся значительным шагом вперед в обезболивании для хирургических целей,
было основано на экспериментальных данных. Однако вскоре стали очевидны
проблемы, связанные с нейротоксичностью кокаина, его системной токсично-
стью и рядом других дополнительных свойств. Эти ограничения послужили при-
чиной открытия химических производных, обладающих более выраженным
действием и меньшей токсичностью. Это был первый период интенсивного раз-
вития технологий местной анестезии. Все более широкое использование новых
местных анестетиков вскоре привело к тому, что роль кокаина была минимизи-
рована до использования его только как поверхностного анестетика в связи с его
уникальными сосудосуживающими свойствами.
Первый преемник кокаина был создан в Германии. Прокаин является
сложным эфиром диэтиламиноэтанола и парааминобензойной кислоты, веще-
ством, схожим с кокаином. Несмотря на то, что это соединение было лучше ко-
каина в отношении токсичности, прокаин все же обладал рядом нежелательных
свойств, связанных с коротким действием, системной токсичностью и аллерги-
ческими реакциями. Создание тетракаина позволило увеличить длительность
действия, однако не преодолело проблем, связанных с токсичностью. Второй
период развития средств для местной анестезии приходится на время между
1930и1960 годами и связан со Швецией, где были получены местные анестети-
ки с амидной связью, типичным представителем которых является лидокаин.
Аминоамиды являются химически более устойчивыми и обладают меньшим
аллергогенным потенциалом, чем эфиры. В дальнейшем на основе этой струк-
туры были созданы различные препараты, которые обладали большей длитель-
ностью и расширенным спектром действия (табл. 1.1).
Действие
Несмотря на энтузиазм химических исследований в начале XX столетия, знаний
о действии этих препаратов было очень мало. Совершенствование эксперимента-
льных технологий в 60-х годах позволило получить ясное представление о дейст-
вии местных анестетиков на клетку. Вещества, структурно близкие этим
препаратам, обладают сходным механизмом и местом действия. Несмотря на то,
что точный механизм молекулярного действия все еще обсуждается [2], основ-
ная последовательность событий при блокаде проведения импульса по нервному
волокну изучена.
Применение местных анестетиков к изолированным нервным волокнам вы-
зывает нарушение их функции, связанное с блокадой мембранной деполяриза-
ции. Целостность клетки и ее метаболизм не изменяются, однако, когда концент-
рация анестетика в нанесенном растворе достигает определенного уровня,
проведения электрического импульса в ответ на электрическую стимуляцию (де-
поляризация) не происходит. Происходит блокада проникновения натрия в клет-
ку, который вызывает процесс деполяризации в нормальных условиях. На про-
цесс реполяризации, связанной с током калия через особые калиевые каналы,
действия не оказывается. Физическая блокада, или конформационные изменения
в натриевых каналах, вызванные катионной формой местных анестетиков, при-
водят к их временной дисфункции.
Физико-химические свойства местных анестетиков
Таблица 1.1
Препарат (торговое название) Класс (год выпуска) Химическая структура Относительная активность Седалищный Седалищный рКл Жирораст- воримость Связывание с белками
нерв лягушки нерв крысы
Кокаин — СН,—СН СНСООСН, — — — — —
Прокаин (Новокаин) Бензокаин Сложный эфир (1905) Сложный NCH3—СНСООС6Н5 СН2— СН—сн2 хс2н5 h2n—("V- соосн2сн2т/ хс2н5 H2N —— СООС2Н5 1 1 8.9 3.5 0.6 5.8
Тетракаин эфир (1900) Сложный н<А сн3 16 8 8.5 80 75.6
(Понтокаин) 2-Хлоропрокаин (Незакаин) Лидокаин (Ксилокаин) эфир (1930) Сложный эфир (1952) Амид (1944) х н N —ГУ— cooch2n; NZ " ХСН3 /С1 /СЛ H2N—О- C00CH2N\ хс2н5 /СН3 ХС2Н5 4 4 1 2 8.7 7.72 2.9 64.3
(_)— nhcoch2n^
CHj С2Н5
Глава 1
Мепивакаин
(Карбокаин,
Полокаин)
Прилокаин
(Цитанест)
Ропивакаин Амвд(1995)
(Нар опин)
Бупивакаин Амид (1963)
(Маркаин,
Сенсоркаин)
Лево-бупивакаин
(Хирокаин)
Этидокаин Амид (1972)
(Дуранест)
Амид (1957)
Амид (1960)
2
3
16
2 7.6 0.8 77.5
2 7.7 0.8 55
8.1 14 95
8 8.1 27.5 95.6
8 7.74 141 94
Адаптировано из следующих источников: Covino B.G., Vasallo H.G. Local Anesthetic: Mechanism of Action and Clinical Use. New York: Grune &
Stratton, 1976, deJong R.H. Local Anesthetics. St. Louis: Mosby-Year Book, 1993.
Местные анестетики
16
Глава 1
Действия на наружное отверстие натриевого канала не оказывается. На-
хождение анестетика в непосредственной близости к наружному отверстию
натриевого канала само по себе не вызывает нарушения проводимости, как
было продемонстрировано в экспериментах с постоянным орошением нервно-
го волокна ионизированными молекулами лидокаина. Эта ионизированная (ка-
тионная) форма местного анестетика не может проникнуть через липидный
слой мембраны клетки или войти в канал непосредственно через его наружное
отверстие.. Неионизированная (жирорастворимая) основная форма молекулы
должна сначала проникнуть сквозь оболочку клетки и достичь аксоплазмы
(рис. 1.2).
Эпиневрий В + Н+ВН+
Рис. 1.2. Равновесный баланс местных анестетиков при прохождении клеточной мембраны.
Местные анестетики существуют в тканях в равновесном состоянии между ионизированной солью и
слаборастворимым основанием (В). Неионизированное основание обладает большей способностью
проникать через липидные барьеры эпиневрия и клеточной стенки, при этом на каждом уровне
восстанавливается равновесие концентраций с ионизированной формой в соотношении, зависящем
от кислотности тканей и константы диссоциации самого соединения. Основание может достигать
натриевого канала путем прямой диффузии через внутреннюю аксолемму, однако наиболее
вероятным является поступление в натриевый канал и связывание с его рецепторами именно
ионизированной формы с внутренней стороны аксоплазмы. (С разрешения Barash P.G., Cullen B.F.,
Stoelting, R.K., Eds. Clinical Anesthesia. Philadelphia: Lippincott, 2001)
Находясь внутри, молекула снова может равновесно существовать как в
ионизированной, так и неионизированной формах и это приводит к тому, что ка-
тионные формы молекул во время деполяризации могут проникать в канал со
стороны его внутреннего отверстия и нарушать ток ионов натрия. Эта блокада
является зависимой от концентрации и, чтобы преодолеть природные резервы
проводимости в нервных клетках млекопитающих, требуется нарушение тока че-
рез несколько смежных каналов (рис. 1.3). Взаимодействие местного анестетика
с каналом является обратимым, оно заканчивается, когда концентрация местного
анестетика становится ниже необходимого минимального уровня.
Местные анестетики
17
Тип Размер Функция
волокна (ц)
А альфа 12-20 Соматическое движение, пропреоцепция
бета 5-12 Тактильная чувствительность, ощущение давления
гамма 3-6 Сокращение мышечных волокон
дельта 2-5 Болевая, температурная, тактильная чувствительность
в <3 Автономная (преганглионарная)
с 0.3-1.4 Болевая чувствительность.
рефлекторные реакции
Автономная (постганглионарная)
Рис. 1.3. Классификация типов нервных волокон.
Для нарушения проводимости по большим миелинизированным волокнам требуется блокада трех
рядом расположенных узлов. Несмотря на то, что в лабораторных условиях эти волокна, по
сравнению с малыми волокнами, имеют доказанную равную или даже большую чувствительность к
местным анестетикам, клинически более быстро проявляется блокада малых нервных волокон
(болевых и симпатических). Это может быть связано с разницей в проникновении местного
анестетика в жировую ткань, окружающую различные нервные стволы или может отражать
какой-либо компонент частотно-зависимой блокады
Эти общие особенности местных анестетиков хорошо известны. Специфиче-
ское клиническое действие каждого вещества значительно отличается, поскольку
на каждую стадию анестезии оказывают влияние несколько факторов. Несколько
физико-химических свойств молекул этих веществ определяют, насколько хорошо
и как долго они будут проникать через ткани, клеточную стенку, а также обрати-
мость блокады проводимости (табл. 1.2).
Свойства местных анестетиков
Таблица 1.2
Характеристика Коррелят
Химическая связь Метаболизм
Жирорастворимость Константа диссоциации Активность Быстрота действия
Связывание с белками Продолжительность действия
Частотно-зависимая блокада Сенсорно-моторная диссоциация
Сосудорасширяющее действие Длительность, видимое действие
Проницаемость тканей Быстрота действия
Знание этих свойств помо! ает понять некоторые аспекты клинического дей-
ствия препаратов, а также предсказать действие новых, разрабатываемых ве-
ществ.
18
Глава 1
Физические свойства
Растворимость в жирах
Местом действия этих препаратов являются липидные структуры оболочки нер-
вных клеток. Неудивительно, что местные анестетики более растворимы в жи-
рах, чем в воде. В общем, как и газообразные анестетики, эти препараты
обнаруживают определенную связь между растворимостью в жирах и активно-
стью (см. табл. 1.1). Эта зависимость не является простой линейной. Различаются
даже определения растворимости, а определение активности является импириче-
ским, так что результаты этих тестов не могут быть точно воспроизводимыми,
как при испытании ингаляционных анестетиков.
Единицей активности местных анестетиков является минимальная концент-
рация (Ст) местного анестетика, необходимая для блокады проведения импульса
по нервному волокну с данным диаметром в течение «обоснованного» периода
времени. Это определение обычно производится орошением изолированной по-
рции периферического нерва животного раствором анестетика при одновремен-
ной стимуляции одного из концов нерва и регистрации потенциалов на другом
конце орошаемой порции нерва. К сожалению, это не является удовлетворитель-
ным определением, эквивалентным определению минимальной альвеолярной
концентрации (МАС), используемой для сопоставления доз газов при общей ане-
стезии у человека, поскольку различия в величинах минимальных концентраций
местных анестетиков основаны на экспериментальных данных. Эксперимента-
льные данные различаются в критериях степени блокады, времени блокады, кон-
центрации электролита в резервуаре для орошения, по наличию или отсутствию
оболочки нервного волокна, а также частоте стимуляции. Специфические осо-
бенности нервных волокон (большие волокна по сравнению с малыми, миелини-
зированные по сравнению с немиелинизированными) увеличивают степень это-
го несоответствия [3] (рис. 1.3). Концентрация препарата и pH используемого
перфузата также становятся причинами различий. Все это делает воспроизведе-
ние данных в различных исследованиях и лабораториях весьма трудным и приво-
дит к получению несогласующихся данных об активности препаратов. Две шка-
лы относительной активности, представленные в табл. 1.1, были получены в
особых лабораторных условиях при воздействии различными препаратами. При
других обстоятельствах могут быть получены другие данные. Все же, эти данные
демонстрируют приблизительную связь с растворимостью в жирах, они также
подчеркивают вариабельность измеряемых показателей и трудности экстраполя-
ции лабораторных данных на клиническую практику проведения местной анес-
тезии.
Дополнительным ограничением в понятии величины С1П является отсутствие
средств измерения средних значений концентраций местных анестетиков в тканях
при их клиническом применении. Даже если бы существовал метод представления
«тканевых эффектов» in vivo, между данными, полученными в лабораторных усло-
виях при воздействии на изолированный нерв, и клинической практикой оставался
бы еще целый ряд различий. Наиболее значимым расхождением является частое
лабораторное наблюдение более быстрой блокады больших миелинизированных
волокон типа А по сравнению с малыми волокнами типа С, в то время как у интакт-
ных животных, в общем случае, происходит наоборот. Другими примерами явля-
ются «снижение» действия лидокаина в связи с его сосудорасширяющим действи-
ем и «повышение» действия хлоропрокаина из-за его способности проникновения
в ткани.
Местные анестетики
19
Не оправдавшиеся в клинических условиях прогнозы были основаны на ла-
бораторных данных об активности препаратов. Многие хорошо известные несо-
ответствия («большая» активность мепивакаина, «меньшая» активность этидо-
каина) детально рассматриваются во 2-ой главе. Эти несоответствия делают
клиническую практику местной анестезии более значимой по сравнению с об-
суждением аналогичных проблем при общей анестезии. Несмотря на это, лабора-
торное определение активности является своего рода контрольным исследовани-
ем, при этом выбор препарата и его дозы обычно основывается на клиническом
опыте (см. табл. 2.1 и 2.2).
Константа диссоциации
Другим фактором, который влияет на способность местного анестетика про-
никать через липидные мембраны, является непостоянное соотношение жирора-
створимой (неионизированной) формы препарата с его водорастворимой (кати-
онной, протонной) формой. Поскольку местные анестетики являются слабыми
основаниями, они находятся в растворе в равновесном состоянии этими двумя
формами (рис. 1.4). Стремление к существованию в основной или ионизирован-
ной форме зависит от концентрации омывающих его ионов водорода и описыва-
ется как специфический для каждого препарата показатель, называемый кон-
стантой диссоциации (рКо).
рКа = 8.4
рКа = 9.4
H++R№»+RNH+ RNH+i»+RN
(1) (1000) рН = 5.4 (Ю00) (0.1)
( Ткань (
H++R№s+RNH+ РН=7-4 RNH+«s+RN + H+
(1) (Ю) Na (10) (0.1)
(0.1) (1) (0.1) (0.001)
Рве. 1.4. Влияние ионизации на активность.
Доля молекул местного анестетика, которая находится в основной (неионизированной) форме
зависит от его собственной константы диссоциации и pH раствора. Препарат с рК^ равной 8.4
диссоциирует на такое число положительно заряженных частиц, которое является в 103 большим, по
сравнению с 50% равновесной точкой при pH 5.4, что приводит к указанному соотношению. При
инъекции в ткани тела pH повышается и это соотношение стремится к равновесию, однако по
количеству положительно заряженных частиц все еще отличается от него в 10 раз. В растворах с
более высокой рК^ это соотношение смещено от равновесной точки еще больше. Поскольку только
неионизированные формы могут проникать через липидные мембраны, растворы с более высокой
рКо обычно действуют.медленнее вследствие меньшей эффективности препарата в месте действия
20
Глава 1
По определению рКо соответствует pH раствора, при котором 50% молекул
препарата находится в ионизированном состоянии четвертичного соединения
азота, а другие 50% в неионизированной третичной форме. При рК^ равной 7.4,
соответствующей нормальному pH тела, в ионизированной и неионизированной
формах находится одинаковое число молекул. Значение рКо большинства мест-
ных анестетиков больше, чем 7.4. Обычно растворы местных анестетиков, выпу-
шенные производителями, «кислее» по отношению к рКд самих препаратов, как
и нормальные ткани тела. Это приводит к преобладанию молекул местного анес-
тетика, находящихся в ионизированной форме. Более высокая рК„ (по сравнению
с pH тела) приводит к тому, что большая часть местного анестетика при pH тела
находится в виде заряженных молекул.
Для проникновения в нервную клетку необходима форма деионизированно-
го основания, при этом снаружи клетки преобладает ионизированная (катион-
ная) форма, что задерживает действие анестетика. Независимо от степени жиро-
растворимости, для препаратов со значением рК„, близким к pH тела ожидается
более быстрое начало действие препарата, в то время как препараты с высокой
константой диссоциации будут обладать меньшим числом свободных оснований
при pH тканей тела и должны действовать медленнее или «слабее». Преоблада-
ние недиффундируемой катионной формы также объясняет снижение эффектив-
ности большинства местных анестетиков при местном воспалении (тканевом
ацидозе). Коммерческие препараты местных анестетиков, содержащие эпинеф-
рин имеют пониженную pH (для сохранения эпинефрина), что также приводит к
замедлению действия, из-за присутствия относительно мало диффундирующей
основной формы.
Связывание с белками
Несмотря на то, что липиды мембран являются наиболее значительным препят-
ствием для проникновения местных анестетиков, местом действия препаратов
служат натриевые каналы, являющиеся белковыми структурами. Афинность
препарата к белковым соединениям зависит от длины их алифатических цепочек
соединения. Продолжительность действия местных анестетиков зависит от их
афинности к этим белковым соединениям. Большая способность к связыванию с
белками удлиняет время «вымывания» препарата из натриевого канала. Это осо-
бенно проявляется в действии бупивакаина и этидокаина, когда добавление не-
сколько более длинной цепочки к аминной части соответствующих исходных
соединений мепивакаина и лидокаина повышает как жирорастворимость, так и
связывание с белками, приводя к тому, что активность соединения повышается в
четыре раза, а время действия удваивается (см. табл. 1.1).
Связывание с белками также является важным фактором, влияющим на
токсичность. Значительное связывание с белками бупивакаина оказывается по-
лезным в акушерстве, поскольку снижает количество свободного препарата в
плазме у пациентов в норме и уменьшает способность препарата проникать в
плацентарный кровоток. Если место связывания с белками насыщается или на
это связывание оказывает влияние другое вещество, например, билирубин или
пропранолол, в связи с тем, что уровень местного анестетика в крови снижается,
токсическое воздействие на ЦНС может развиться при неожиданно низком уров-
не концентрации местного анестетика в крови.
Местные анестетики
21
Другие свойства
На клиническое действие местных анестетиков оказывает влияние несколько
факторов, которые не могут быть достаточно точно определены в лабораторных
условиях.
Вазодилатация
Все местные анестетики, за исключением кокаина, обладают двухфазной вазоак-
тивностью различной степени выраженности. Это действие является дозозависи-
мым и различается у каждого препарата. Бупивакаин в низких концентрациях
является вазоконстриктором и расширяет артериолы только в концентрациях,
превышающих клинические дозы. Лидокаин является констриктором в низких
концентрациях, однако его клинические уровни обычно приводят к вазодилата-
ции. В результате повышения местного кровотока увеличивается проникновение
. анестетиков в сосудистое русло, в связи с чем их активность и продолжитель-
ность действия уменьшаются. Лидокаин обладает двойной по сравнению с мепи-
вакаином активностью в лабораторных условиях, но эквивалентен ему по
действию в клинических условиях, поскольку вызывает более значительную
местную вазодилатацию. Этому действию может быть противопоставлено до-
бавление к местному анестетику сосудосуживающих веществ, что частично объ-
ясняет увеличение активности эпинефринсодержащих растворов. Как и
активность, от вазодилатации также зависит и длительность действия препарата.
Местная анестезия может быть непродолжительной в хорошо васкуляризирован-
ном эпидуральном или межреберном пространстве, однако ее действие может
быть более длительным в 4-6 раз в менее васкуляризированных областях пери-
ферической иннервации, например, при анестезии области седалищного нерва.
Зависимость от частоты стимуляции
Для большинства препаратов проникновение в натриевые каналы возможно то-
лько тогда, когда канал открыт во время деполяризации мембраны. Некоторые из
препаратов, в частности, лидокаин, ропивакаин и бупивакаин обнаруживают ин-
тересную особенность, связанную с пропорциональной зависимостью степени
блокады от продолжительности времени открытия канала. В особенности, они
вызывают более быструю и более выраженную блокаду нервных волокон, кото-
рые способны проводить высокочастотные импульсы (во время распространения
которых натриевые каналы открыты большую часть времени). В лабораторных
условиях эти различия могут быть продемонстрированы стимуляцией препари-
рованных нервных волокон током различной частоты и наблюдением за степе-
нью блокады при различных концентрациях анестетика. Клинически эта
частотно-зависимая блокада приводит к более значительному снижению нер-
вной передачи по болевым/чувствительным (высокочастотным) нервным волок-
нам по сравнению с двигательным (низкочастотным) проведением [4] (рис. 1.5).
Эти анестетики вызывают более выраженную анальгезию по сравнению с двига-
тельной блокадой, чем схожие препараты с меньшей частотной зависимостью.
Такая сенсорно-моторная диссоциация обычно находит свое отражение в клини-
ческом предпочтении тех, или иных препаратов. Этим объясняется, почему ли-
докаин и бупивакаин чаще предпочитают таким препаратам, как тетракаин и
этидокаин, обладающим схожими физико-химическими свойствами.
22
Глава 1
Рис. 1.5. Зависимость блокады от частоты стимуляции.
Местные анестетики лидокаин и бупивакаин вызывают более выраженную блокаду нервных
волокон, когда эти волокна стимулируются током высокой частоты. Напротив, этидокаин вызывает
одинаковую степень блокады вне зависимости от частоты стимуляции. Эта зависимость от частоты
стимуляции может объяснять сенсорно-моторную диссоциацию, наблюдаемую при блокаде
некоторыми местными анестетиками (с разрешения и по материалам Scurlock, J.E., Meymaris, Е.,
Gregus, J. The clinical character of local anesthetics: A function of frequency-dependent conduction block.
Acta Anesthesiol. Scand. 22: 601, 1978)
Тканевая проницаемость
Другим вариабельным и непредсказуемым свойством местных анестетиков явля-
ется их способность проникать через периневральную ткань и достигать мембра-
ны клетки. Это свойство является недостаточно широко изученным. Изолиро-
ванная оценка лидокаина не позволяет говорить о различиях в активности при
интактной или удаленной периневральной ткани, тем не менее, существует мно-
го ярких примеров клинических различий между препаратами, в особенности у
хлоропрокаина. В противовес предсказанному медленному началу действия,
основанному на его высокой константе диссоциации, этот препарат обладает од-
ним из наиболее быстрых клинических эффектов.
Резюме
Таким образом, местные анестетики действуют путем обратимой блокады натри-
евых каналов в мембране нервных клеток, прерывая передачу электрического
импульса. Некоторые из физических свойств местных анестетиков могут объяс-
нять и предсказывать их клиническое действие. Растворимость в жирах связана с
относительной активностью, константа диссоциации связана с началом дейст-
вия, а длительность действия зависит от способности связываться с белками. По-
скольку часто доминирующими факторами являются вазодилятация,
частотно-зависимая блокада и различная тканевая проницаемость, точное пред-
Местные анестетики
23
сказание клинического действия является трудным. Каждая глава этого руковод-
ства содержит конкретные предложения по применению препаратов, их
дозировке и ожидаемому действию в каждой особой клинической ситуации. В
следующей главе описаны некоторые характерные особенности применяющихся
в настоящее время местных анестетиков.
Литература
1. Fink, В. R. Leaves and needles: The introduction of surgical local anesthesia. Anest-
hesiology 63:77,1985.
2. Strichartz, G. Molecular mechanisms of nerve block by local anesthetics. Anesthe-
siology 45:421,1976.
3. Gissen, A. J., Covino, B. G., Gregus, J. Differential sensitivities of mammalian ner-
ve fibers to local anesthetic agents. Anesthesiology 53:467,1980.
4. Courtney, K. R., Kendig, J. J., Cohen, E. N. Frequency-dependent conduction
block: The role of nerve impulse pattern in local anesthetic potency. Anesthesiology
48:111,1978.
Глава 2
Клиническая характеристика
местных анестетиков
Физические свойства местных анестетиков (описанные в главе 1) помогают
определить большую часть их клинических свойств. Однако индивидуальные
клинические особенности делают теоретическое определение эффективности,
начала и продолжительности действия достаточно трудным. В этой главе будут
обсуждены эмпирические клинические данные наиболее часто используемых
местных анестетиков.
Общие принципы
Некоторые общие принципы применимы для всех препаратов этой группы.
Минимальная эффективная доза
Все местные анестетики при их избыточном применении вызывают местное и
системное токсическое действие. Диагностика и лечение токсических проявле-
ний обсуждаются в 3-й главе, однако более предпочтительно еще до начала лече-
ния произвести тщательный подбор препарата, его концентрации и объема.
Многие практикующие врачи убеждены, что избежать токсического действия
можно путем использования меньших, чем рекомендуемые производителем в ка-
честве максимальных, доз препарата. Эти дозы приведены в табл. 2.1. В действи-
тельности, клинически значимые уровни токсичности в крови могут быть
достигнуты гораздо меньшими количествами препаратов, если выполняется их
внутривенное введение или создаются условия, способствующие их быстрой аб-
сорбции. Риск неблагоприятного воздействия на пациента может быть миними-
зирован путем использования минимально эффективной дозы местного
анестетика. Желательно добиваться этой, наименьшей эффективной концентра-
ции местного анестетика при выполнении любой блокады. Для проникновения
через эпидуральную оболочку могут потребоваться наибольшие из рекомендо-
ванных производителем концентраций, однако при воздействии на перифериче-
ские нервы в использовании таких концентраций нет необходимости. Высокие
концентрации могут усилить двигательную блокаду и увеличить продолжитель-
ность блокады, однако при их использовании повышается суммарная доза препа-
рата, выраженная в миллиграммах, что ограничивает объем вводимого раствора.
С высокими концентрациями также связаны проблемы повреждения нерва или
тканей.
Концентрационный эффект
Другим способом получения наименьших эффективных концентраций является
ускорение действия анестетика и более «глубокая» блокада при относительно
высоких концентрациях. Как и в случае с ингаляционными веществами, началь-
Клиническая характеристика местных анестетиков
25
ная концентрация может быть увеличена для ускорения наступления его дейст-
вия (проникновения). Наиболее ярким примером является проникновение через
слизистые оболочки, скорость которого для местных анестетиков, в общем, до-
статочно медленная, что, прежде всего, обусловлено катионной формой их рас-
твора. Использование двух-четырех кратных концентраций по сравнению с
обычными, позволяет преодолеть медленное действие путем доставки большего
числа молекул в основной форме к участку их диффузии и таким образом до-
стичь действия равного действию на нервную ткань. Другим примером, является
использование более высоких концентраций в эпидуральном пространстве, где
жировая ткань, твердая мозговая оболочка и цереброспинальная жидкость явля-
ются значительными барьерами для проникновения. Использование 0.75% рас-
твора бупивакаина обеспечивает более быстрое действие, чем эквивалентный по
дозе в милиграммах 0.25% раствор. Другим распространенным клиническим
примером является использование 3% раствора хлоропрокаина. Несмотря на вы-
сокую константу диссоциации, этот препарат обладает медленным действием,
однако его низкая токсичность позволяет использовать высокие концентрации,
что обеспечивает быстрый клинический эффект. Преимущество использования
более высоких концентраций может быть нивелировано риском быстрого возра-
стания уровней препаратов в крови до величин токсического диапазона.
Объем
Объем раствора местного анестетика при выполнении блокады также должен
быть минимально необходимым для снижения общей дозы препарата. Требуе-
мый объем, часто обратно пропорционален точности анатомических ориентиров
и некоторые процедуры требуют значительных объемов препаратов. При точном
определении места введения препарата (при стимуляции нерва или при паресте-
зии) будут эффективными меньшие объемы. При использовании нейролитиче-
ских препаратов точное определение места их введения является обязательным,
поскольку даже небольшие объемы этих растворов могут вызвать значительное
повреждение тканей.
Продолжительность действия
Длительность блокады местными анестетиками определяется многими фактора-
ми, основным из которых является применяемый препарат. Специфическая ли-
пидная аффинность и способность связываться с белками определяют время, в
течение которого препарат будет эффективно действовать на липидный слой
мембраны нервной клетки. Влияние других факторов на продолжительность
клинического действия трудно предсказуемо и зависит от особенностей дейст-
вия данного препарата, вида блокады и индивидуальных особенностей пациента.
Одним из критических факторов является величина регионарного кровотока. В
областях с интенсивным кровообращением (таких как лицо и эпидуральное про-
странство) длительность действия будет меньшей по сравнению с областями,
имеющими более бедную васкуляризацию (такими как область седалищного
нерва или зоны расположения других периферических нервов). Возраст пациен-
та также будет оказывать влияние на продолжительность местной анестезии, по-
скольку кровоток во многих областях с возрастом уменьшается. На длительность
блокады также будет влиять применение сосудосуживающих средств или мест-
ных анестетиков, обладающих сосудорасширяющим действием.
Клинические дозы местных анестетиков
Таблица 2.1
Препарат (торговое название) Клинические концентрации Обычная доза (всего мг) Максимальная рекомендуемая доза Другое Токсические уровни в крови (мкг/мл)
Миллиграмм на килограмм веса тела С эпинефрином
Всего Миллиграмм на килограмм веса тела
ЦНС ССС
Кокаин 1%-4% 200 1.5 — — — — —
Прокаин (Новокаин) 1%-10% 500 — — — 1000 — —
Бензокаин 14%-20% — — — — — — —
Тетракаин (Понтокаин) 1% — — 200 — — — —
2-Хлоропрокаин (Незакаин) 1%-3% 800 11 1000 14 1000 — —
Лидокаин (Ксилокаин) О.5%-5% 300 4.5 500 7 500 18-21 35-50
Мепивакаин (Карбокаин, Полокаин) 1%-2% 400 — 550 7° 500 22 —
Прилокаин (Цитанест) — — — 500 — — 20 —
Ропивакаин (Наропин) 0.25%~1.0% 250 — 250 3 — 4 ?10
Бупивакаин (Маркаин, Сенсоркаин) Лево-бупивакаин (Хирокаин) 0.25%-0.75% 175 — 225 3 400 4.5-5.5 6-10
Этидокаин (Дуранест) 1%-1.5% 300 4 400 6 400 4.3 —
° — Специальная доза для эпинефринсодержащего раствора не установлена; эта доза является максимальной из указанных доз
ЦНС — центральная нервная система; ССС — сердечно-сосудистая система
Глава!
Клиническая характеристика местных анестетиков
27
Различная чувствительность
О различной чувствительности нервных волокон уже упоминалось (см. рис. 1.3). В
клиническом отношении небольшие или демиелинизированные волокна (волокна
типа В и С по физиологической классификации скорости проводимости) обладают
большей чувствительностью к действию местных анестетиков. Их небольшой диа-
метр и отсутствие миелиновой оболочки позволяют местному анестетику быстро
блокировать большую группу рядом расположенных натриевых каналов. Напро-
тив, для прерывания проводимости по большим миелинизированным волокнам
типа А, требуется значительно большая поверхность и протяженность блокады.
Несмотря на то, что волокна с меньшим числом натриевых каналов на единицу по-
верхности в постоянных лабораторных условиях могут быть блокированы легче, в
клинических условиях малые волокна, определяющие температурную чувствите-
льность и чувствительность к точечным уколам, анестезируются перед проприо-
цептивными и двигательными волоконами (тип А).
Различия в блокаде являются временными и наблюдаются в течение нача-
ла спинномозговой анестезии, так температурная чувствительность и чувстви-
тельность к точеным уколам исчезают быстрее. Различия наблюдаются и при
концентрационном эффекте, когда низкая концентрация местных анестетиков
может вызывать анальгезию без блокады двигательных волокон. Эти явления
более выражены при применении препаратов, вызывающих частотно-зависи-
мую блокаду.
С различным типом волокон связан феномен переменной блокады, оригина-
льное описание которой дано Wedensky. Это явление наблюдается во время нача-
ла и окончания нервной блокады, когда концентрация местного анестетика около
мембраны становится чуть ниже С,„. В этот момент может быть блокирована од-
ноимпульсная передача, однако в серии импульсов может быть проведен каждый
третий или четвертый импульс. По-видимому, первые несколько импульсов не
способны вызвать деполяризацию, однако они сенсибилизируют (или частично
деполяризируют) натриевый канал, создавая условия для деполяризации при
следующем импульсе. Клинически это может проявляться искажением чувстви-
тельности в виде ощущений «ползания мурашек» или «зуда» в частично анесте-
зированных областях. Этим можно объяснить, почему в зонах с утраченной чув-
ствительностью к точечному уколу может все еще сохраняться чувствительность
к рассечению кожи (множественные импульсы) как проявление частичной бо-
лезненности. Этим можно также объяснить наблюдаемую иногда явную «гипер-
стезию» при распространении и уменьшении области блокады. К счастью это
проходящее состояние является временной фазой в развитии общей анестезии и
для местной анестезии представляет скорее теоретический интерес, чем является
значимым клиническим фактором.
Другой вид различий в блокаде наблюдается при эпидуральной анестезии в
результате различного проникновения некоторого количества местного анесте-
тика в области отдельных спинномозговых нервов. Например, бупивакаин и хло-
ропрокаин вызывают хорошо выраженную анестезию дорсальных корешков
входящих волокон, в то время как этидокаин проникая в спинной мозг, вызывает
анестезию длинных нервных путей [1]. В результате, первые из упомянутых пре-
паратов вызывают более выраженную сегментарную блокаду, в то время как эти-
докаин может вызывать некоторую анестезию дистальнее места инъекции.
Наконец, был описан феномен тахифипаксии (2], при котором последовате-
льные инъекции (или инфузии) местных анестетиков делают их менее эффектив-
ными, т. е. снижается продолжительность или выраженность блокады. Это явле-
ние наблюдалось при спинальной, каудальной и эпидуральной анестезиях.
28
Глава 2
Механизм этого не ясен. Изменения pH тканей не объясняют этот феномен. До-
бавление эпинефрина к растворам местных анестетиков позволяет уменьшить
или предотвратить тахифилаксию. Это явление не создает проблем при примене-
нии низких концентраций местных анестетиков, например при введении 0.05%-
0.125% бупивакаина при обезболивании в послеоперационном периоде. Инфу-
зия опиоидов также позволяет устранить эту проблему. При нынешней клиниче-
ской практике, стандартом которой является использование в акушерстве и
управляемом обезболивании низких концентраций местных анестетиков в соче-
тании с опиоидами, тахифилаксия становится скорее казуистическим явлением,
нежели клинической проблемой.
Эффект мантии
Эффект «мантии» был описан при проведении анестезии периферических нервов
конечности. Наибольшая концентрация местного анестетика отмечается по пе-
риферии нервного пучка. Первоначально анестезия будет развиваться в этих
внешних (мантийных) волокнах, которые обычно иннервируют проксимальные
отделы конечности. Волокна, иннервирующие дистальные отделы конечности
располагаются ближе к «сердцевине» нерва; поэтому анестезия кисти или стопы
может происходить более медленно, поскольку концентрация местного анесте-
тика в срединной части нерва возрастает (путем диффузии) более медленно по
сравнению с периферической частью нервного пучка. Регрессия блокады может
происходить в обратной последовательности, поскольку концентрация анестети-
ка в первую очередь снижается в срединной части нервного ствола.
Эти тонкие различия могут наблюдаться при тщательном наблюдении за на-
чалом регрессии блокады, однако в целом они не оказывают влияния на ее клини-
ческое течение.
Характеристика препаратов
Кокаин
Кокаин утратил свое первоначальное значение как регионарный анестетик
вследствие своей локальной нейротоксичности и развития болезненного при-
страстия (коаинизма). Он все еще используется как поверхностный анестетик,
поскольку обладает сосудосуживающими свойствами. Это происходит из-за
того, что он блокирует обратный ток катехоламинов в симпатических нервных
окончаниях в отличие от других местных анестетиков, в клинических концентра-
циях оказывающих прямое вазодилятирующее действие. Кокаин в основном
применяется в области носоглотки в первую очередь для проведения интубации
или хирургических вмешательств (табл. 2.2). Обычный 4% раствор дает начало
анестезии на 4 или 5 минуте, однако это время может быть укорочено при испо-
льзовании более высоких концентраций или прямым применением свежих крис-
таллов. Максимальная рекомендуемая доза составляет 200 мг или 5 мл 4%
раствора. Общая токсичность местных анестетиков является кумулятивной, поэ-
тому широкая практика использования кокаина в носовой полости на фоне при-
менения практически любых количеств лидокаина или тетракаина для
фарингеальной или трахельной анестезии повышает риск системной реакции. К
счастью, общая абсорбция с поверхности слизистой оболочки является относите-
льно небольшой и системные реакции являются редкими, несмотря на широкую
практику игнорирования кумулятивных токсичных доз.
Таблица 2.2
Клиническое использование препаратов местных анестетиков
Препарат (торговое название) Поверхностная Спинномозговая Эпидуральная Для хирургических манипуляций в акушерстве (без консерванта) Блокада периферических нервов Внутривенная блокада
Кокаин 4% НВ НВ — НВ НВ
Бензокаин 5%-20% НВ НВ — НВ НВ
Короткого действия
Прокаин (Новокаин) НВ 10% НП НП 1% НП
2-Хлоропрокаин (Незакаин) НП НВ 2%-3% 2%-3% 1%-2% НП
Среднего действия
Лидокаин (Ксилокаин) 4% 5% 1.5% 2% 1.5% 2% ° 0.5% 1% 0.5%
Мепивакаин (Карбокаин, Полокаин) НВ НВ 1% 1.5% 2% НП 1% НВ
Прилокаин (Цитанест) НВ НВ 2%-3% НП 1% 0.5%
Длительного действия
Ропивакаин (Наропин) НВ 0.5%6 0.75%, 1%’ 0.2% 0.5% НВ
Бупивакаин (Мар каин, Сенсоркаин) НВ 0.5% 0.75% 0.5% 0.75%’ 0.125%г 0.25% 0.5%° 0.25% 0.5% 0.25% 6
Левобупивакаин (Хирокаин)
Этидокаин (Дуранест) НВ НВ 1% 1.5% НП 1% НП
Тетракаин (Понтокаин) 1%-2% 1% НВ НВ НВ НВ
Клиническая характеристика местных анестетиков
Замечания', препараты сгруппированы по общей продолжительности действия. У казанные концентрации рекомендованы для отдельных применений.
НВ — не выпускается; НП — нет показаний;
°— вызывает двигательную блокаду, достаточную для кесарева сечения; 6 — это использование не одобрено;
• — только для однократной инъекции; для повторных инъекций, или введения через катетер должны использоваться более низкие концентрации;
? — коммерческая форма не выпускается; перед применением должен разводиться.
30
Глава 2
В связи с возможностью развития болезненного пристрастия и проблемами
легальной продажи, как средство замещения этого единственного в настоящее
время клинического использования кокаина используется лидокаин в сочетании
с сосудосуживающими средствами.
Бензокаин
Бензокаин был первым синтетическим местным анестетиком. Несмотря на его
сходство с кокаином как производным бензойной кислоты, он не является клини-
чески эффективным. Строение молекулы этого вещества является исключением
из общей структуры местных анестетиков, поскольку в ней отсутствует третич-
ная аминогруппа. Это ограничивает переход соединения в неионизированное со-
стояние. Несмотря на то, что он может хорошо проникать через липидные слои,
он плохо растворим в воде и, поэтому, может продаваться только в низких кон-
центрациях. Его низкая растворимость в воде приводит к тому, что в аксоплазму
проникает очень малое количество препарата. Несмотря на его способность до-
стигать натриевых каналов путем прямой диффузии через клеточную мембрану
(другое исключение в действии местного анестетика) его клиническая эффектив-
ность является низкой. Использование бензокаина в настоящее время ограничи-
вается анестезией слизистых оболочек и (в высоких концентрациях) кожи. При
абсорбции чрезмерных доз была отмечена метгемоглобинемия.
Прокаин
Как первое успешное в коммерческом отношении производное кокаина прокаин
в течение многих лет был стандартным местным анестетиком. Его быстрый гид-
ролиз холинэстеразами плазмы делают его одним из наиболее безопасных препа-
ратов в отношении системных уровней в крови. Его эффективность
ограничивается плохой проницаемостью в ткани и коротким временем действия.
Прокаин в основном использовался для подкожной инфильтрации, при которой
весьма эффективным является его 1% раствор. Прокаин не является эффектив-
ным поверхностным средством и дает ненадежную анестезию при его использо-
вании в эпидуральном пространстве. При спинномозговой анестезии его блокада
по продолжительности близка к действию лидокаина, однако связана с большим
числом неудач и побочных эффектов (в особенности с тошнотой). При использо-
вании промышленно приготовленного 10% раствора, он должен разбавляться до
5% гипо- или гипербарической смеси. Интересно отметить, что при добавлении
фентанила для повышения надежности, выраженность зуда становиться боль-
шей, чем в тех случаях, когда этот опиоид сочетается с другими местными анес-
тетиками [3]. На уровне спинного мозга аминоэфирные соединения могут
вызывать различные взаимодействия с мю-опиоидами.
При применении прокаина, как и других эфиров отмечены случаи сенсиби-
лизации и аллергических реакций, обычно связанные с таким метаболитом, как
парааминобензойная кислота (РАВА). О частоте встречаемости этой проблемы
нет документальных данных, однако аллергическая сенсибилизация (к одному из
наиболее химически стабильных амидных препаратов) к прокаину более пред-
почтительна аналогичным реакциям к популярным аминоамидным местным
анестетикам. Кроме этого, высказывавшиеся ранее предположения о том, что
аминоэфиры более безопасны, чем аминоамиды на фоне развивающейся злока-
чественной гипертермии не подтвердились.
Клиническая характеристика местных анестетиков
31
Тетракаин
Другим эфирным производным бензойной кислоты является синтезированный в
1930 году тетракаин. Его высокая константа диссоциации обусловливает медлен-
ное начало действия, которое, однако является более продолжительным, чем у
прокаина. Несмотря на более выраженное действие, токсичность тетракаина так-
же пропорционально возрастает. До получения длительно действующих амино-
мидов он являлся препаратом выбора (в 0.25% и 0.5% концентрациях) для
длительной блокады периферических нервов. Его применение ограничивалось
максимальной дозой в 100 мг и медленным началом действия. В настоящее время
препарат используется для спинномозговой анестезии, при которой достаточно
эффективны небольшие (в мг) дозы. Он может приготовляться как гипобариче-
ский, изобарический или гипербарический раствор. В настоящее время препарат
продается в виде 1% раствора и нифаноидных кристаллов.
Тетракаин также использовался как прекрасный поверхностный анестетик,
в основном для глаз и верхних дыхательных путей. Абсорбция со слизистой при-
водит к быстрой анестезии, тем не менее, возможность системной токсичности
остается значительной.
2-хлоропрокаин
Последний из представляемых эфиров, хлоропрокаин также является одним из
наиболее безопасных в отношении системной токсичности местным анестети-
ком. Его быстрый гидролиз эстеразами плазмы позволяет вводить до 1000 мг
препарата без каких-либо признаков токсичности. Эта безопасность практически
нивелируется при неэффективности холинэстеразы плазмы. При эпидуральном
введении продолжительность анестезии составляет от 45 до 60 минут, что удов-
летворяет потребностям амбулаторной хирургии. Для эпидуральной анестезии
эффективен 2% или 3% раствор. Такой уровень активности превосходит ожидае-
мый только по лабораторным данным и физико-химическим свойствам и, веро-
ятно, связан в основном с тканевой проницаемостью этого препарата. Быстрое
начало анестезии хлоропрокаином делает его популярным как в амбулаторной
практике, так и в акушерстве. При использовании во время беременности быст-
рый гидролиз препарата сводит к минимуму его возможность проникновения че-
рез плаценту и действие на нервную систему новорожденного. В соответствии с
быстрым началом действия, хлоропрокаин характеризуется быстрым окончани-
ем действия, что может быть причиной значительного неудобства в конце хирур-
гических манипуляций или родов. Хлоропрокаин также использовался для
. блокады периферических нервов, однако здесь его применение ограничено не-
продолжительным действием.
С лекарственной формой хлоропрокаина было связано несколько серьезных
проблемных ситуаций. Клеймо нейротоксичности относится к коммерческой ле-
карственной форме гидрохлорида хлоропрокаина (Несакаин), выпускаемой в
1970-е годы (см. главу 3), и связано с присутствием в препарате бисульфитного ан-
тиоксиданта в 0.2 процентной концентрации при кислотности, равной 3.5. Рефор-
мулированный препарат, содержащий 0.07% бисульфита, не вызывал явлений
нейротоксичности. Другая лекарственная форма (с 0.01 % содержанием этилендиа-
минтетроацетатной кислотой [EDTA] в качестве антиоксиданта) была изъята из
продажи и заменена на препарат, не содержащий консервант. Возникающее при
применении достаточно больших количеств этого препарата раздражение мышц
спины не было устраненог полностью, однако встречается редко (см. главу 3).
32
Глава 2
Хлоропрокаин является идеальным препаратом в качестве эпидурального анесте-
тика для однократной инъекции в тех случаях, когда требуется быстрое прекраще-
ние действия, например, при анестезии в амбулаторных условиях [4].
Другой проблемой, связанной с хлорпрокаином, является его взаимодейст-
вие с опиатными рецепторами спинного мозга, что ограничивает его использова-
ние при процедурах, проведение которых требует стационарных условий. При
его инъекциях даже в небольших количествах активность и продолжительность
действия мю-опиоидных агонистов снижается.
Дибукаин
Этот местный анестетик, вероятно, наиболее известен в Соединенных Штатах,
где он используется как ингибитор холинэстеразы плазмы для выявления боль-
ных с дефектом этого фермента. Он выпускался в Соединенных Штатах только в
виде крема для местного применения, тем не менее, за пределами США он встре-
чается как спинномозговой анестетик, в частности в гипобарической форме. Он
является амидным препаратом с относительно выраженным действием.
Лидокаин
Первый из содержащих амидную связь местных анестетиков, лидокаин вскоре
заменил эфиры в их популярных клинических применениях в начале 1950-х го-
дов. Он обладает более длительным действием, чем прокаин и имеет более широ-
кие границы безопасности, чем тетракаин. Он также устранил случаи
аллергической сенсибилизации, наблюдаемые при использовании эфиров. В на-
стоящее время истинная аллергия на какой-либо анестетик амино-амидной груп-
пы является редкой. Лидокаин в 1% и 1.5% растворах стал стандартным
препаратом для блокады периферических нервов, также как 1.5% и 2% концент-
рации стали обычными для эпидуральной анестезии. Феномен частотно-зависи-
мой блокады также позволил улучшить соотношение блокады чувствительности
и двигательной активности по сравнению с тетракаином. С лидокаином были
связаны настолько значительные улучшения, что местные анестетики, создан-
ные в дальнейшем, были модификацией его аминоамидной структуры и сравни-
вались с ним как со стандартом.
Лидокаин хорошо абсорбируется при поверхностном применении и часто
используется для анестезии верхних дыхательных путей и трахеи. При его повер-
хностном применении требуются более высокие концентрации (4%), поскольку
его проникающая способность не столь велика, как при проведении инфильтра-
ционной анестезии. Лидокаин хорошо работает при местной инфильтрации и
при блокаде периферических нервов. В 0.5% концентрации он также эффективен
при проведении внутривенной региональной анестезии. Кроме эпидурального
использования, лидокаин зарекомендовал себя как эффективный субарахноида-
льный препарат. Он вызывает спинномозговую анестезию продолжительностью
от 45 до 90 минут. 2% раствор может быть использован для изобарической инъ-
екции или может быть разбавлен до гипобарической концентрации. Коммерче-
ский гипербарический препарат широко использовался в течение многих лет, од-
нако недавнее сообщение о преходящих неврологических симптомах (см.
главу 3) подтвердили необходимость использования этого препарата в неболь-
ших дозах и разведенных концентрациях.
Клиническая характеристика местных анестетиков
33
Имеется значительный объем данных о системных токсических эффектах
этого препарата, поскольку он широко применяется как ангиаритмическое сред-
ство в виде пролонгированных инфузий. В случаях нарушения режима инфузий
можно было наблюдать начало развития токсического влияния на центральную
нервную систему, особенно, в условиях снижения печеночного клиренса при на-
рушении функции печеночных клеток или нарушении печеночного кровотока.
Дозы аминоамидных препаратов, применяемые для анестезии, должны быть в та-
ких случаях снижены.
Рассматриваемый многими сегодня как «стандартный местный анестетик»
лидокаин не избежал некоторых сравнений. Несмотря на то, что он не проявляет
кардиотоксичности, начало его действия медленнее, чем у хлоропрокаина, а само
действие короче по длительности, чем у бупивакаина. Попытки улучшить начало
время действия привели к широким исследованиям карбоната препарата (см. раз-
дел Адъюванты в этой главе), а попытки увеличения продолжительности дейст-
вия позволили синтезировать следующее поколения местных анестетиков, полу-
ченное путем модификации молекулы лидокаина (см. табл. 1.1).
Эвтектическая смесь местных анестетиков
Одним из необычных применений лидокаина является сочетание его с прилокаи-
ном в виде крема для местного применения. Смесь на основе кристаллов каждого
из этих соединений позволяет получить новое эвтектическое сочетание местных
анестетиков (EMLA), которое имеет более низкую точку плавления и обладает
уникальными свойствами местного анестетика. Как смесь оснований она имеет
относительно высокое процентное содержание активной основной формы, кото-
рая также способнак проникать через кожу. Эта смесь обладает медленным нача-
лом действия, однако она весьма эффективна для поверхностной анестезии кожи.
Она широко применяется в педиатрии для анестезии над местом внутривенной
инъекции. Ссколько-нибудь значительной токсичности при применении этого
крема нет, однако медленное начало действия (необходимо наложение окклюзи-
онной повязки на 40-60 минут) ограничивает его применение.
Мепивакаин
Алифатическая часть этого соединения является циклическим третичным ами-
ном, так же как и у ропивакаина и бупивакаина, но его более короткая боковая
цепь, определяющие растворимость в жирах, и другие характеристики очень схо-
жи с аналогичными свойствами лидокаина. Клинически он также очень похож на
лидокаин. Мепивакаин является менее выраженным вазодилятатором, чем лидо-
каин, что делает его действие несколько более выраженным с некоторым увели-
чением продолжительности действия. При эпидуральном введении 1.5%
мепивакаин действует 4 часа, 1.5% лидокаин — 3 часа.
Применение мепивакаина удобно при проведении эпидуральной анестезии,
блокаде периферических нервов и инфильтрационной анестезии. Он плохо аб-
сорбируется слизистыми оболочками и, поэтому, непригоден для поверхностной
анестезии. Его метаболизм в организме плода и новорожденного является мед-
ленным и по этой причине он оказывается неподходящим для обезболивания в
акушерстве. Было отмечено накопление мепивакаина в плазме крови в результа-
те его связывания с белками, что может оказаться неблагоприятным фактором
при длительном дробном эпидуральном введении.
2—1685
34
Глава 2
Прилокаин
Это соединение представляет собой попытку улучшения лидокаина, результат
которой оказался двойственным. Препарат обладает наиболее быстрым метабо-
лизмом среди аминоамидных местных анестетиков. Это снижение потенциала
токсичности нивелируется особой токсичностью его метаболита ортотолуидино-
вого кольца, который вызывает метгемоглобинемию (см. главу 3). К сожалению,
в настоящее время в Соединенных Штатах отсутствует коммерческая форма пре-
парата для хирургической анестезии.
Бупивакаин
Бупивакаин представляет собой более удачный результат аналогичной попытки
улучшения достаточно хорошего соединения. Его структура представляет собой
молекулу мепивакаина с добавочной боковой четырехуглеродной алифатической
цепочкой. Эта структура позволила в значительной степени повысить раствори-
мость в жирах и связывание с белками, что обеспечивает значительно большую
продолжительность действия по сравнению с предшествующими амидными мест-
ными анестетиками. Его появление явилось первым значительным изменением в
этом классе препаратов. Повышение продолжительности действия было достигну-
то за счет замедления времени начала действия (латентный период от 15 до 20 ми-
нут), однако это было, в общем, достаточно подходящей ценой за значительное
увеличение продолжительности анестезии.
В клинических условиях бупивакаин используется в диапазоне концентра-
ций от 0.05% до 0.75%. Наиболее низкие концентрации используются для обез-
боливания путем эпидуральной инфузии (или потенцирования опиоидной ана-
льгезии) при обезболивании в акушерстве или послеоперационном периоде.
Несколько более высокие концентрации (0.125% и 0.25%) вызывают только час-
тичную эпидуральную анальгезию и незначительную двигательную блокаду, что
особенно полезно в акушерском обезболивании. Хорошая сенсорная анестезия
может быть получена при местной инфильтрации 0.25% раствора. Средняя кон-
центрация (0.5%) вызывает превосходную анестезию периферических нервов и
эпидуральную анестезию. При 0.75% концентрации достигается превосходная
эпидуральная анестезия с быстрым началом и глубокой двигательной блокадой.
Более высокие концентрации повышают возможность токсического действия и
не рекомендуются для использования в акушерской практике или при повторных
инъекциях в эпидуральные катетеры (см. главу 3). 0.75% раствор бупиваина так-
же является превосходным спинальным анестетиком и более предпочтителен,
чем тетракаин. Он может быть использован как изобарический или гипербариче-
ский раствор. Несмотря на то, что эпинефрин обычно добавляют в растворы всех
выше упомянутых концентраций для снижения системной абсорбции и усиления
блокады, его влияние на продолжительность анестезии бупивакаином (уже до-
статочно длительной) является минимальной.
Бупиакаин как и лидокаин обладает способностью вызывать частотно-зави-
симую блокаду, причем эта зависимость является значительной (см. главу 1), что
стало основой его репутации превосходного сенсорного анестетика по сравне-
нию с его способностью блокировать двигательную активность. Это обстоятель-
ство весьма удобно для пациентов, которые могут двигать конечностями еще в
период действия обезболивания. Этот эффект особенно полезен при акушерском
обезболивании. Значительное беспокойство в отношении бупивакаина вызывает
в настоящее время его кардиотоксичность, связанная с незапланированно высо-
кими уровнями в системном кровотоке (см. главу 3), что привело к появлению
двух более безопасных альтернативных аминоамидных препаратов.
Клиническая характеристика местных анестетиков
35
Ропивакаин
Опасения в отношении кардиотоксичности бупивакаина привело к созданию ро-
пивакаина, соединения химически и клинически занимающего промежуточное
положение между мепивакаином и бупивакаином. Его боковая цепочка является
пропиловой группой (по сравнению с метиловой группой мепивакаина и бутило-
вой группой бупивакаина). Он производится только в L-вращающей форме в
противоположность предшествующим местным анестетикам, которые выпуска-
лись как рацемические смеси. L-вращающая форма аминоамидов является менее
кардиотоксичной. При эпидуральной анестезии как и ожидалось, ропивакаин об-
ладает несколько менее выраженным действием [5,6] и несколько менее продол-
жительным действием по сравнению с бупивакаином. Ропивакаин обладает
большим клиническим сходством с бупивакаином при блокаде периферических
нервов и может применяться в каждой из ситуаций, в которых был бы использо-
ван бупивакаин [7, 8]. При концентрациях в 0.75% и 1.0% достигается хорошая
эпидуральная анестезия, в то время как 0.5% растворы эффективны для перифе-
рической блокады. Препарат обладает несколько более выраженной сенсор-
но-моторной диссоциацией. Однако это различие является неопределенным в
отношении выраженности действия и диапазон этого различия до сих пор нея-
сен. Это свойство позволяет использовать ропивакаин изолированно (без опио-
идов) в акушерской практике, а также при вливаниях с целью обезболивания. Он
является более безопасным в отношении кардиотоксичности и может быть, не-
смотря на свою высокую стоимость, стать препаратом выбора при проведении
местной анестезии в условиях высокого риска системной токсичности.
Левобупивакаин
Левобувакаин является очищенным L-энантиомером бупивакаина и как ропива-
каин обладает меньшим кардиотоксическим действием. Выпущенный в 2000
году он имеет клинические характеристики, схожие с рацемической смесью в от-
ношении начала действия, активности, длительности анальгезии и двигательной
блокады [9,10]. Он также обладает схожей с бупивакаином способностью потен-
цировать действие опиоидов и близкой к нему сенсорно-моторной диссоциа-
цией. Несмотря на то, что он является более дорогой альтернативой, он может
применяться при проведении анестезии в условиях, связанных с высоким риском
системной токсичности.
Этидокаин
Этидокаин является производным структуры лидокаина с более длинной и более
растворимой в жирах боковой цепочкой. Увеличение жирорастворимости и спо-
собности связывания с белками делает его по длительности действия схожим с
бупивакаином. Однако в отличие от бупивакаина действие этидокаина наступает
быстрее.
Несмотря на сходство этого препарата с бупивакаином (по физико-химиче-
ским свойствам) для его клинического применения требуются удвоенные кон-
центрации. Для проведения эпидуральной анестезии обычно используется 1.5%
раствор, для периферической блокады — 1% раствор. Этидокаин не обладает
свойством частотно-зависимой блокады и это провидит к более глубокой (иногда
беспорядочной) блокаде двигательных волокон. По этой причине он не пригоден
для обезболивания в акушерстве и в послеоперационном периоде.
36
Глава 2
При проведении эпидуральной анестезии этидокаин обладает более выра-
женной способностью проникать в спинной мозг. Он вызывает глубокую блока-
ду длинных нервных пучков внутри спинного мозга как при спиномозговой анес-
тезии быстрее, чем анестезию нервных пучков в месте их отхождения или в
дорзальном корешковом ганглии (как и бупивакаин и 2-хлоропрокаин) [1]. Не-
смотря на столь выраженную анестезию этидокаин остается не популярным пре-
паратом из-за несоразмерной двигательной блокады.
Адъюванты
Вазоконстрикторы
Вазоконстрикторы часто добавляют к растворам местных анестетиков для увели-
чения продолжительности действия анестезии. Путем замедления абсорбции они
также снижают величину пика уровня местных анестетиков в крови. При добав-
лении эпинефрина максимальные уровни в крови могут отмечаться не только не-
сколько позднее, но и быть меньшими. Эпинефрин может добавляться
практически к любому раствору местного анестетика для периферической блока-
ды, за исключением областей «концевых» артерий, например, в области пальцев
или полового члена, где воздействие на кровоток является нежелательным.
Вазокострикторы также улучшают качество и надежность блокады, в осо-
бенности при спинномозговой анестезии. Это было продемонстрировано при
проведении как спинномозговой анестезии, так и эпидуральной блокады тетра-
каином, лидокаином и бупивакаином. Механизм этого феномена неясен. Эпи-
нефрин может просто повышать количество действующего местного анестетика
путем уменьшения кровотока. Высказывается также предположение о том, что
он может обладать внутренними анестезирующими свойствами в субарахноида-
льном пространстве, возможно оказывая действие на болевые рецепторы. Одним
из негативных последствий присутствия эпинефрина в субарахноидальном про-
странстве является возможность задержки возвращения нормального мочеиспу-
скания, что может задержать движение больных в амбулаторном хирургическом
отделении [11].
Другой причиной добавления эпинефрина к раствору местных анестетиков
является его эффективность в определении непреднамеренной внутривенной
инъекции при введении тестовой дозы (см. главу 3).
Фенилэфрин является другим вазоконстриктором, который используется
для увеличения продолжительности спинномозговой анестезии. Эквивалентная
пролонгация может быть достигнута равнодействующими дозами (0.1 мг эпи-
нефрина = 1 мг фенилэфрина). Применение фенилэфрина лучше ограничить су-
барахноидальными инъекциями, поскольку его системная абсорбция из других
мест способна вызвать системную вазоконстрикцию и привести к снижению сер-
дечного выброса.
Эпинефрин, введенный в ткани, окружающие субарахноидальное простран-
ство, абсорбируется в общий кровоток и может при использовании достаточно
больших количеств препарата оказать неблагоприятное действия на сердеч-
но-сосудистую систему. В малых дозах бета-адренергический эффект является
обычно полезным, эпинефрин в растворе анестетика при эпидуральной анесте-
зии помогает поддержать сердечный выброс путем повышения сократимости
миокарда и частоты сердечных сокращений. Количество препарата, превышаю-
щее 0.25 мг в общей дозе, может быть связано с аритмией и другими нежелатель-
ными влияниями на сердце [12]. Если ожидается, что общая доза может достиг-
Клиническая характеристика местных анестетиков
37
нугь этой величины, концентрация эпинефрина должна быть снижена. В
частности, это означает, что если будет использовано более 50 мл раствора, кон-
центрация эпинефрина должна быть уменьшена до величины меньшей, чем
1:200000 (5 рг/мл).
Опиоиды
Добавление короткодействующих опиоидов, таких как фентанил и суфентанил, к
спинномозговым анестетикам по аналогии с действием эпинефрина приводит к
увеличению выраженности блокады, увеличивает продолжительность анесте-
зии, однако без увеличения времени восстановления мочеиспускания [13]. Эти
препараты во многих случаях также вызывают остаточную анестезию после
окончания действия местного анестетика. Такие сочетания оказываются особен-
но полезными для снижения общей дозы местного анестетика и разгрузки отде-
ления при анестезии в амбулаторных условиях. Однако, как и при эпидуральной
анестезии, их побочным эффектом является зуд (см. главу 24).
Клонидин
Альфа2-агонисты обнаруживают анальгезирующие свойства при их инъекции в
периневральное или субарахноидальное пространство. Побочные эффекты огра-
ничивают их изолированное применение, однако небольшие дозы клонидина
значительно пролонгируют действие местного анестетика при спинномозговой
[14], эпидуральной [15], внутривенной региональной [16] анестезии, перифери-
ческой блокаде [17, 18] как при инъекции вместе с препаратами, так и при перо-
ральном применении [19]. Это сочетание является полезным в акушерстве [20],
лечении боли [21], а также в хирургии. Применение ограничено такими систем-
ными побочными эффектами как гипотония и брадикардия при больших дозах,
однако при использовании небольших доз (от 50 мкг до 75 мкг), увеличение про-
должительности анестезии достигается без значимых побочных эффектов. Высо-
кая стоимость современной лекарственной формы клонидина является
фактором, в значительной степени ограничивающим его широкое применение в
Соединенных Штатах.
Алкалинизация
Алкалинизация коммерческих растворов местных анестетиков направлена на по-
вышение pH раствора до значений, близких к константе диссоциации, что приво-
дит к увеличению количества местного анестетика, находящегося вне клетки в
неионизированной основной форме. Эта форма более способна к диффузии и на-
ходится в относительно более высокой концентрации у клеточной мембраны,
быстрее проникает через нее, при этом лидокаин и мепивакаин начинают дейст-
вовать быстрее, в меньшей степени эти изменения сказываются на бупивакаине
[22]. Несмотря на то, что для бупивакаина было продемонстрировано увеличение
времени действия, риск преципитации значительно превышает пользу от быст-
рого начала действия этого препарата.
К раствору местного анестетика непосредственно перед инъекцией может
быть добавлен 8.4% раствор (1мЭкв/мл) бикарбоната натрия, выпущенный в про-
мышленных условиях. Для предотвращения чрезмерной алкалинизации должна
соблюдаться осторожность; эти слабо растворимые основания будут осаждаться
в высокощелочных растворах. Для улучшения скорости начала действия должно
быть добавлено такое количество бикарбоната, которое вызовет увеличение pH
38
Глава 2
раствора до 6.5-7.5. Превышение уровней, указанных в табл. 2.3, может вызвать
преципитацию части местного анестетика, находящегося в растворе в основной
форме и препарат окажется клинически не эффективным. После алкалинизации
растворы должны быть использованы в течение 6 часов.
Таблица 2.3
Дозы для алкалинизации местных анестетиков
Местный анестетик Доза бикарбоната pH конечного раствора
Хлоропрокаин 1 см3 за каждые 30 6.8
Лидокаин, мепивакаин 1 см3 за каждые 10 7.2
Бупивакаин 0.1 см3 за каждые 10 6.4
Карбонизация
Карбонатные соли местного анестетика были использованы в Канаде как еще
одно средство ускорения начала действия. Несмотря на то, что в отношении кли-
нической эффективности этой лекарственной формы имеются противоречивые
данные, лабораторные и клинические испытания показывают, что карбонизация
может сокращать время начала действия и время достижения анестетиком мак-
симальных уровней. Промышленный выпуск карбонатных солей является труд-
ным в техническом отношении и, к сожалению, в Соединенных Штатах они не
доступны.
Приготовление смесей
Смешивание растворов местных анестетиков также было одним из популярных
способов улучшения времени начала действия и продолжительности анестезии.
В целом, если к коротко действующим препаратам, таким как хлоропрокаин или
лидокаин добавить длительно действующие препараты, например, бупивакаин,
то результатом будет улучшение обоих свойств — быстрое начало действия и
длительная анестезия [23]. Очевидно, что при смешивании растворов окончате-
льная концентрация каждого из анестетиков будет получена после разбавления
его раствором другого препарата. Активность каждого препарата будет пропор-
циональна его окончательной концентрации.
Процесс смешивания не безопасен. Токсичность препаратов при их смеши-
вании по меньшей степени складывается и, для того, чтобы не превысить макси-
мальной рекомендуемой дозы, должна быть проявлена осторожность. Неожидае-
мое взаимодействие может быть также причиной синергической токсичности.
Бупивакаин обнаружил способность повышать уровни несвязанного мепивакаи-
на почти вдвое от ожидаемых концентраций, кроме этого, препарат способен
препятствовать гидролизу хлоропрокаина в плазме. Добавление хлоропрокаина
к бупизакаину при анестезии в акушерстве показало снижение продолжительно-
сти действия бупивакаина по сравнению с изолированным использованием пре-
парата [24]. Механизм этого взаимодействия полностью не ясен и возможно обу-
словлен физико-химическими свойствами препаратов. Это говорит о том, что
при использовании смеси веществ нужно действовать с осторожностью и в осо-
бенной степени учитывать сложение токсичности и синергическую токсичность
(если вообще стоит этим заниматься). Использование других методик, таких как
алкалинизация или выполнение блокады в индуктивных зонах может быть более
безопасным и эффектным в отношении времени начала анестезии.
Клиническая характеристика местных анестетиков
39
Гиалурон идаза
Использование гиалуронидазы было рекомендовано при блокаде перифериче-
ских нервов. Этот фермент нарушает связи коллагена в тонких коллагеновых пе-
регородках, что позволяет раствору значительно лучше проникать в ткань.
Несмотря на то, что при этом может ожидаться лучшее распространение местно-
го анестетика, этот факт не получил подтверждения; в действительности отмеча-
ется ухудшение качества анестезии, по крайней мере, эпидуральной.
Применение этого фермента ограничивается только ретробульбарными инъек-
циями.
Декстран
Декстран и другие высокомолекулярные соединения использовались как адъю-
вантные вещества с целью увеличения продолжительности действия смесей
местных анестетиков. Несмотря на некоторые положительные отчеты об увели-
чении продолжительности анестезии как декстраном, так и гиалуроновой кисло-
той, эти результаты не представляются надежными. Инкапсулирование местных
анестетиков в микросферы полимера выглядит очень перспективно в отношении
создания длительно действующего препарата, однако эта работа в настоящее
время находится на экспериментальной стадии.
Литература
1. Cusick, J. F., Myklebust, J. В., Abram, S. E. Differential neutral effects of epidural
anesthetics. Anesthesiology 53: 299,1980.
2. Bigler, D., Lund, C., Mogensen, T., Hjortso, N. C., Kehlet, H., Tachyphylexis du-
ring postoperative epidural analgesia — new insight. ActaAnaesthesiol. Scand. 31:
664, 1987.
3. Mulroy, M. F., Larkin, K. L., Siddiqui, A. Intrathecal fentanyl-induced pruritus is
more severe in combination with procaine than with lidocaine or bupivacaine. Reg.
Anesth. Pain Med. 26: 252,2001.
4. Mulroy, M. F., Larkin, K. L., Hodgson, P. S., Helman, J. D., Pollock, J. E.,
Liu, S. S. A comparison of spinal, epidurial, and general anesthesia for outpatient
knee arthroscopy. Anesth. Analg. 91: 860,2000.
5. Capogna, G., Celleno, D., Fusco, P., Lyons, G., Columb, M. Relative potencies of
bupivacaine and ropivacaine for analgesia in labour. Br. J. Anaesth. 82:371,1999.
6. Policy, L. S., Columb, M. O., Naughton, N. N., Wagner, D. S., van de Ven, C. J.
Relative analgesic potencies of ropivacaine and bupivacaine for epidural analgesia
in labor: Implications for therapeutic indexes. Anesthesiology 90: 944, 1999.
7. McClellan, K. J., Faulds, D. Ropivacaine: An update of its use in regional anaesthe-
sia. Drugs 60: 1065,2000.
8. Owen, M. D., Dean, L. S. Ropivacaine. Expert Opin. Pharmacother. 1:325,2000.
9. Foster, R. H., Markham, A. Levobupivacaine: A review of its pharmacology and
use as a local anaesthetic. Drugs 59: 551,2000.
10. McLeod, G. A., Burke, D. Levobupivacaine. Anaesthesia 56: 331,2001.
11. Chiu, A. A., Liu, S., Carpenter, R. L., Kasman, G. S., Pollock, J. E., Neal, J. M. The effects
of epinephrine on lidocaine spinal anesthesia: A crossover study. Anesth. Analg. 80:735,
1995.
12. Katz, R. L., Bigger, J. T., Jr. Cardiac arrhythmias during anesthesia and operation.
Anesthesiology 33: 193,1970.
40
Глава 2
13. Liu, S., Chiu, A. A., Carpenter, R. L., Mulroy, M. F., Alien, H. W., Neal, J. M., Pol-
lock, J. E. Fentanyl prolongs lidocaine spinal anesthesia without prolonging recovery.
Anesth. Analg. 80: 730,1995.
14. Bonnet, F., Buisson, V. B., Francois, Y., Catoire, P., Saada, M. Effects of oral and suba-
rachnoid clonidine on spinal anesthesia with bupivacaine. Reg. Anesth 15:211, 1990.
15. Eisenach, J. C., Lysak, S. Z., Viscomi, С. M. Epidural clonidine analgesia following sur-
gery: Phase I. Anesthesiology 71: 640,1989.
16. Reuben, S. S., Steinberg, R B., Klatt, J. L., Klatt, M. L Intravenous regional anesthesia using
lidocaine and clonidine. Anesthesiology 91: 654,1999.
17. Casati, A., Magistris, L., Fanelli, G., Beccaria, P., Cappelleri, G., Aldegheri, G.,
Torri, G. Small-dose clonidine prolongs postoperative analgesia after sciatic-femo-
ral nerve block with 0.75% ropivacaine for foot surgery. Anesth Analg. 91: 388,
2000.
18. Singelyn, F. J., Gouvemeur, J. M., Robert, A. A minimum dose of clonidine added
to mepivacaine prolongs the duration of anesthesia and analgesia after axillary brac-
hial plexus block. Anesth Analg. 83: 1046, 1996.
19. Liu, S., Chiu, A. A., Neal, J. M., Carpenter, R. L., Bainton, B. G., Gerancher, J. C.
Oral clonidine prolongs lidocaine spinal anesthesia in human volunteers. Anesthesi-
ology 82: 1353,1995.
20. D'Angelo, R., Evans, E., Dean, L. A., Gaver, R., Eisenach, J. C. Spinal clonidine
prolongs labor analgesia from spinal sufentanil and bupivacaine. Anesth. Analg. 88:
573, 1999.
21. Eisenach, J. C., DuPen, S., Dubois, M., Miguel, R., Allin, D. Epidural clonidine
analgesia for intractable cancer pain. The Epidural Clonidine Study Group. Pain 61:
391, 1995.
22. Capogna, G., Celleno, D., Laudano, D., Giunta, Б. Alkalinization of local anesthe-
tics. Which block, which local anesthetic? Reg. Anesth 20: 369, 1995.
23. Seow, L. T., Lips, F.J., Cousins, M. J., Mather, L. E. Lidocaine and bupivacaine
mixtures for epidural blockade. Anesthesiology 56: 177, 1982.
24. Cohen, S. E., Thurlow, A. Comparison of a chloroprocaine-bupivacaine mixture
with chloroprocaine and bupivacaine used individually for obstetric epidural ana-
lgesia. Anesthesiology 51: 288, 1979.
Глава 3
Осложнения местной анестезии
Каждая методика местной анестезии имеет специфические осложнения, связан-
ные с анатомическими особенностями, или самой процедурой. Отдельные пробле-
мы общего характера могут быть обусловлены иглами или препаратами местных
анестетиков. В этом разделе будут описаны неспецифические осложнения.
Токсичность местных анестетиков
Местные анестетики могут вызвать три вида лекарственных реакций.
Аллергия
Аллергия на препараты встречается редко и почти всегда связана с амино-эфир-
ными препаратами. Реакции истинной чувствительности на аминоамиды отмеча-
ются крайне редко. При аллергии на аминоэфиры не было обнаружено
перекрестных реакций на аминоамидные препараты. Амиды могут безопасно
применяться у пациентов с истинными аллергическими реакциями (крапивница,
бронхоспазм, гипотония) на аминоэфирные местные анестетики в анамнезе. Же-
лательно проведение кожной пробы [1], однако перед проведением хирургиче-
ского вмешательства анестезиолог редко получает все анамнестические данные,
позволяющие выполнить полноценное исследование. Если все же проба прово-
дится, следует учитывать, что аминоэфирные соединения обладают высокой
кожной реактивностью и могут вызывать схожие кожные реакции, которые дол-
жны дифференцироваться от истинной аллергии.
У большинства пациентов с «реакцией» на проведение пробы, она не являет-
ся связанной с истиной аллергией и наиболее часто симптомы обусловлены реак-
цией страха или т. н. «адреналиновыми» реакциями. Наиболее часто путаница
возникает у тех пациентов, которые имеют негативный опыт посещения данти-
ста. При этом симптомы обычно вызваны системной абсорбцией эпинефрина и
должны различаться с проявлениями истинной аллергии.
Ответственной за аллергические реакции считается парааминобензойная
кислота (РАВА), которая высвобождается при гидролизе аминоэфирных анесте-
тиков. У пациентов с известной аллергией к солнцезащитным кремам, содержа-
щим РАВА, желательно применение аминоамидных препаратов.
Тканевая нейротоксичность
Возникновение местной тканевой нейротоксичности возможно при инъекции
любого из препаратов. После инъекции местных анестетиков может отмечаться
также повреждение мышц, однако обычно оно не является выраженным и само-
стоятельно разрешается [2]. Проявления нейротоксичности вследствие инъекции
42
Глава 3
местных анестетиков отмечаются редко [3-5]. Наиболее частыми осложнениями,
связанными с инъекциями, являются травмирование нерва иглой и интраневра-
льная инъекция (см. раздел Нейропатия в этой главе). Высокие концентрации
местных анестетиков и включение в их раствор эпинефрина при интраневраль-
ном введении препарата влечет за собой повреждение нервного ствола. Раство-
ром местного анестетика, применяемым в клинике, который содержит
потенциально опасную концентрацию, является 5 % раствор лидокаина, исполь-
зуемый для спинномозговой анестезии. Несмотря на то, что в лабораторных
условиях этот препарат является токсичным для нервной ткани, отсутствие зна-
чимых клинических проблем предполагает, что разведение цереброспинальной
жидкостью позволяет избежать опасного уровня токсичности. Однако именно
после спинномозговой анестезии лидокаином наиболее часто отмечаются тран-
зиторные неврологические симптомы [4]. Симптомы, которые включают в себя
боль в спине, иррадиирующую в ягодицы или ноги, появляются через 6-24 часа
после разрешения блокады без нарушения двигательной активности или чувст-
вительности и обычно прекращаются спонтанно в течение 3-10 дней. Этот синд-
ром более часто отмечается у амбулаторных пациентов, в особенности, у тех из
них, кому проводилась артроскопия коленного сустава или у тех из них, которые
находились в положении для литотомии, однако с достоверно большей частотой
это явление связано с использованием лидокаина как местного анестетика [6].
При применении лидокаина частота этого симптома составляет от 15% до 30% и
может быть снижена до 3%-5%, при использовании очень небольших доз бупи-
вакаина (от 20 мг до 25 мг). До прояснения механизма развития этого синдрома,
возможно, следует избегать больших доз (более 100 мг лидокаина для спинно-
мозговой анестезии), а для проведения литотомии или артроскопических проце-
дур выбирать другие препараты или меньшие дозы (от 20 мг до 25 мг). В
настоящее время перед инъекцией рекомендуется разведение 5% раствора.
При инъекции любого местного раствора для воздействия на перифериче-
ские нервы должны быть использованы наименьшие эффективные концентра-
ции. Это позволит не только снизить риск местной или системной токсичности,
но и использовать большие объемы растворов, что может способствовать увели-
чению области анальгезии. Более высокие концентрации (0.75% бупивакаина,
1.5% этидокаина, 2% лидокаина и т. п.) должны быть зарезервированы для пер-
воначальной инъекции при эпидуральной анестезии.
Явления местной токсичности могут быть объяснены другими факторами.
До начала анестезии всегда необходимо помнить о возможно имеющемся по-
вреждении нервов. Растворение кристаллов при приготовлении раствора может
привести к токсической концентрации препарата. Попадание в раствор местного
анестетика веществ для стерилизации и обработки кожи является другой воз-
можной причиной нейротоксичности. Детергенты, используемые для обработки
оборудования и инструментов, должны быть удалены, так как могут привести к
образованию токсических веществ (см. главу 5).
Системная токсичность
Системная (воздействие на центральную нервную систему [ЦНС]) токсичность
возникает вследствие избыточных уровней местного анестетика в крови и являет-
ся наиболее серьезным и часто встречающимся осложнением при использовании
местных анестетиков. Наиболее часто к токсическому уровню приводит непредна-
меренная внутривенная или внутриартериальная инъекция. Токсичность может
возникнуть также в результате медленной абсорбции препарата после перифери-
ческой инъекции. Исторически, судороги при применении местных анестетиков
Осложнения местной анестезии
43
чаще всего возникали при внутривенном введении для эпидуральной анестезии, с
частотой, достигающей 1% при анализе большого числа наблюдений [7]. Исполь-
зование после 1980 года методики, основанной на «последовательной безопасно-
сти» значительно снизило частоту этого осложнения [8], а добавление пробных доз
еще больше снизило риск осложнения, но не свело его к нулю [9,10] (табл. 3.1). В
настоящее время риск системной токсичности представляется более высоким при
проведении блокады периферических нервов, однако в больших сериях наблюде-
ний он остается достаточно низким [3, 10].
Таблица 3.1
Риск возникновения системной токсичности
Автор Эпидуральная PCT Риск БПН РСТ Риск
Tanaka" 17439 20 11 на 10000
Brown 16870 2 1.2 на 10000 7532 15 19 на 10000
Auroy 30413 4 1.3 на 10000 21278 16 7.5 на 10000
" Tanaka не использовал тестовых доз эпинефрина; РСТ—реакции системной токсичнос-
ти; БПН — блокада периферических нервов.
Достоверно более высокие уровни в крови возникали в результате абсорб-
ции после проведения любой регионарной блокады, за исключением спинномоз-
говой анестезии, наиболее высокие уровни наблюдались после проведения меж-
реберной и эпидуральной блокады. Эти пиковые уровни возникали через 20
минут после инъекции, их выраженность зависела от общей дозы введенного
препарата, наличия сосудосуживающих веществ и интенсивности кровотока в
месте инъекции. Появление симптомов токсичности зависит от дозы, и все мест-
ные анестетики имеют сходный токсико-терапевтический диапазон в отношении
центральной токсичности. Повышение уровня местного анестетика в артериаль-
ной крови ведет к прогрессивной депрессии ЦНС. При достижении судорожного
порога (рис. 3.1) развиваются клонико-тонические судороги, вслед за которыми,
если уровень препарата в крови продолжает повышаться, может последовать
кома. Начальная стадия включает в себя нарушение баланса «угнетение-актива-
ция», которое вызывает неприятные субъективные сенсорные симптомы, вслед
за которыми развивается подергивание мышц, переходящее в истинный приступ
судорог. В целом, симптоматика достаточно пестрая. Она может включать в себя
такие классические проявления как «звон в ушах» или «онемение вокруг рта»,
однако может быть представлено и одним из многочисленных сенсорных фено-
менов или просто выражаться общими сенсорными расстройствами. Снижение
реактивности может быть только прелюдией к клонико-тоническим судорогам.
Местные анестетики сами по себе не вызывают прямого необратимого по-
вреждения ЦНС. Угнетение, как и при воздействии на периферические нервы яв-
ляется быстро обратимым, как только количество препарата в крови опустится
ниже судорожного порога. Основным риском для пациента в период судорог и
комы является мозговая гипоксия. Гипоксемия развивается крайне быстро, по-
скольку выраженные нарушения сокращения мышц приводят к апноэ. Быстро
развиваются ацидоз и гиперкалиемия. Поддерживающая терапия должна прово-
диться до снижения уровня анестетика в крови и включать в себя оксигенацию.
Вентиляция легких может осуществляться способом «рот в рот», через специаль-
ную маску или путем эндотрахеальной интубации. Если приступы судорог меша-
44
Глава 3
Рис. 3.1
Развитие симптомов токсичности
при применении местного анестетика (лидокаина).
й
При применении других местных анестетиков симптомы “
обычно наблюдаются именно в этой прогрессии г
и соотношении, за исключением влияния токсичности га
на сердечно-сосудистую систему (ССС), с
которое при более активно действующих “
амино-амидных препаратах проявляется §
при уровнях в крови, близких тем, §
которые приводят к возникновению судорог. о
(С разрешения и по материалам §
Barash P.G., Cullen B.F., Stoelting R.K., Ed.
Clinical Anesthesia. Philadelphia: Lippincott, 2001) §
ra
a.
>-
X
<D
30-]
25-
20-
15-
10-
5-
Токсические эффекты
Угнетение
деятельности ССС
Остановка дыхания
Кома
Судороги
Потеря сознания
Подергивания мышц
Нарушения зрения
Головокружения
Онемение языка
ют выполнению вентиляции, они должны быть купированы внутривенным вве-
дением быстродействующих противосудорожных препаратов. Могут быть
использованы тиобарбитураты, бензодиазепины, пропофол и сукцинилхолин;
препаратом выбора должен быть наиболее быстродоступный препарат. Дозы
барбитуратов и бензодиазепинов должны быть более низкими, чем используе-
мые для анестезии и подобраны так, чтобы не усугубить депрессию, которая раз-
вивается после приступа судорог и затрудняет неврологическую оценку. В це-
лом, для прекращения судорожной активности достаточно от 1 до 3 мг/кг
тиопентала. Очевидно, что сукцинилхолин не является противосудорожным пре-
паратом, однако он все же полезен при купировании судорог двигательной мус-
кулатуры для облегчения вентиляции, особенно, если внутривенное введение не-
доступно. Независимо от выбора препарата особенное внимание, даже большее,
чем необходимости купирования судорожной активности, должно уделяться
проведению оксигенаций.
Уровни судорожной активности различны для каждого препарата, однако
поскольку токсико-терапевтическое соотношение для ЦНС является схожим для
всех местных анестетиков, нельзя выделить какой-либо препарат более или ме-
нее склонный к индуцированию судорог в нормальных клинических дозах. Зна-
чительными факторами, влияющими на уровень судорожной активности, явля-
ются индивидуальные особенности. Любой фактор, который снижает клиренс
плазмы, будет способствовать значительному повышению ожидаемой токсично-
сти (такой как нарушение функции печени для амино-амидных препаратов или
дефицит псевдохолинэстаразы в плазме для аминоэфирных препаратов). Пред-
шествующий прием барбитуратов или бензодиазепинов будет способствовать
повышению судорожного порога, однако обычно это происходит при дозах, вы-
зывающих тяжелую седативную реакцию. Влияние обычной анестезиологиче-
ской премедикации не может защитить пациента от воздействия, неосторожно
вызванного высокими уровнями анестетика в крови. Гиперкапния, также как и
метаболический ацидоз будут понижать уровень судорожного порога всех мест-
ных анестетиков. Это является другой причиной, обусловливающей необходи-
мость вентиляции при лечении, даже до уровня средневыраженной гипервенти-
ляции. Снижение уровня диоксида углерода в артериальной крови будет
повышать судорожный порог и ускорять восстановление. Индивидуальные осо-
Осложнения местной анестезин
45
бенности пациента также влияют на развитие токсичности, однако данные о кон-
тролируемых исследованиях на человеке в этой области отсутствуют. Влияние
почечного клиренса и массы тела не доказано.
Токсичность местных анестетиков суммируется. Это верно как для препара-
тов одного и того же класса, так и для комбинации амино-эфирных препаратов с
амино-амидными. В частности это означает, что если была использована макси-
мальная рекомендованная доза амино-амидного препарата, то при добавлении
амино-эфирного препарата возможность развития токсичности повышается. Не
является решенным вопрос о «безопасном» интервале между введением боль-
ших доз.
В клинической практике существует несколько особых моментов. Во-пер-
вых, процедуры местной анестезии никогда не должны проводиться при отсутст-
вии «под рукой» реанимационного оборудования. Это оборудование должно
включать в себя емкость с кислородом и систему его подачи, набор лекарствен-
ных препаратов для реанимационных мероприятий и кардиомонитор. Если будет
вводиться значительное количество местного анестетика, должен быть налажен
внутривенный доступ, особенно при риске непреднамеренного внутрисосуди-
стого введения.
Во-вторых, должны быть предприняты предосторожности для того, чтобы
избежать высоких уровней анестетика в крови. Несмотря на то, что уровни в кро-
ви, связанные с развитием судорог известны для многих местных анестетиков,
при клинических дозах ими трудно управлять или предсказывать. Список макси-
мальных доз, рекомендованных производителями для периферических блокад
(см. табл. 2.1), основан на экстраполяции уровней в крови, полученных при экс-
периментах на животных при медленной подкожной или интраперитонеальной
абсорбции. Эти максимальные дозы трудно запомнить, поэтому может быть ис-
пользован упрощенный вариант, представленный в табл. 3.2. На величину этих
уровней будет влиять наличие или отсутствие сосудосуживающих веществ. Как
установлено, введение даже небольших количеств местного анестетика при
внутрисосудистой инъекции в зоне церебрального кровотока может приводить к
критическим судорожным уровням в крови. Частые аспирации, осторожная фик-
сация иглы, обязательное использование тестовых доз и дробные инъекции осо-
бенно показаны, когда место инъекции находится в непосредственной близости
от кровеносных сосудов.
Таблица 3.2
Упрощенный список максимальных доз
Продолжительность действия Химический класс Максимальные дозы
Сложные эфиры Амиды
Короткое Прокаин Хлоропрокаин 1000 мг
Среднее Лидокаин Мепивакаин Прилокаин 500 мг
Длительное Тетракаин Бупивакаин Левобупивакаин 250 мг
Ропивакаин Этидокаин 100 мг
46
Глава 3
Введение тестовой дозы представляет собой инъекцию такого количества
препарата, которое является достаточным для развития клинических признаков
субтоксичности, если инъекция выполнена внутривенно. В настоящее время наи-
более надежным индикатором внутрисосудистой инъекции является тахикардия,
вызванная внутривенным введением 15 мкг эпинефрина [11]. Частота пульса бу-
дет возрастать на 30% (от 80 до 110 ударов в минуту) через 20 сек. после инъек-
ции и возвращаться к норме в течение 60 сек (рис. 3.2).
Время (с)
Рис. 3.2. Изменения в процентах частоты сердечных сокращений, систолического кровяного
давления и диастолического кровяного давления после введения тестовой дозы эпинефрина
у здоровых лиц до бета-блокады и после кратковременной бета-блокады
Это повышение является транзиторным, для его обнаружения лучше испо-
льзовать устройство непрерывной регистрации пульса, чем вести подсчет вруч-
ную. Для этой пробы имеется несколько ограничений, поэтому всегда важно ис-
пользование ряда мер безопасности [7] (табл. 3.3). Тахикардии и изменений
систолического давления (повышение на 15 мм рт. ст.) не будет отмечаться у па-
циентов, получающих бета-блокаторы. В этих случаях необходимо постоянное
наблюдение или использование другого теста. Ответ на эпинефрин может быть
также снижен у пожилых пациентов. У пациентов, получивших премедикацию,
не будут отмечаться субъективные клинические симптомы, при общей анестезии
величина ответа на эпинефрин будет снижаться на 50%.
Существуют другие тесты. При приеме бета-блокаторов или противопока-
заниях к эпинефрину может потребоваться отмена премедикации или введение
больших доз местного анестетика. Дозы в 100 мг хлоропрокаина, 100 мг лидо-
каина или 25 мг бупивакаина, введенные внутривенно, могут вызвать субъек-
тивные признаки, что может быть использовано как надежный диагностиче-
ский заменитель в этой ситуации. Другой альтернативой является введение
1 мл воздуха во время звукового мониторирования сердечных шумов с исполь-
зованием прекардиального допплеровского стетоскопа. Это может быть испо-
льзовано в акушерской анестезии, но не должно применяться в операционных.
Крайне важными является ограничение дозы, использование аспирации и дроб-
Осложнения местной анестезин
47
Таблица 3.3
Критерии для тестовых доз эпинефрина
Ситуация Гемодинамический критерий
Пациент без особенностей ЧСС возрастает >20 уд/мин САД возрастает >15 мм рт. ст.
Бета-блокада САД возрастает >15 мм рт. ст.
Немолодой возраст ЧСС возрастает >9 уд/мин САД возрастает >15 мм рт. ст.
Общая анестезия ЧСС возрастает >8 уд/мин САД возрастает >13 мм рт. ст.
ЧСС — частота сердечных сокращений; уд/мин—ударов в минуту; САД — сис-
толическое артериальное давление.
ность инъекции. Третьей особенностью, связанной с токсическим влиянием на
ЦНС, является необходимость постоянного наблюдения даже в случае отрица-
тельных результатов введения тестовой дозы. Вследствие венозной абсорбции
уровень анестетика в крови будет непрерывно возрастать (рис. 3.3). Наблюдать
за возрастающим токсическим влиянием местного анестетика можно с помо-
щью оценки психического статуса пациента. Мы живем во времена технологи-
ческой зависимости от механических и электронных устройств, обеспечиваю-
Время (мин)
Рис. 3.3. Концентрация лидокаина в плазме продолжает возрастать в течение 20 минут после
инъекции и является более высокой при проведении межреберной блокады, чем после эпидуральной
или подкожных инъекций.
(С разрешения и по материалам Cousins M.J., Bridenbaugh P.O., Eds.
Neural Blockade in Clinical Anesthesia and Management of Pain. Philadelphia: Lippincott, 2001)
48
Глава 3
щих безопасность пациента. Однако, к сожалению, пока еще не существует
следящего устройства, которое могло бы четко определить повышение уровня
местного анестетика в крови. Постоянное общение и наблюдение за пациентом
анестезиологом является единственным эффективным средством слежения за
мозговой деятельностью после введения анестетика. Седативное действие бар-
битуратов и бензодиазепина может затруднять распознавание опасного уровня
токсичности местного анестетика.
Раннее обнаружение повышения уровня местного анестетика в крови и бы-
строе лечение, включающее оксигенацию, позволит предотвратить гипоксиче-
ские последствия для ЦНС, вызванные системной токсичностью. Несмотря на
детально разработанную методику, токсические реакции не исключены при лю-
бом применении достаточно больших количеств местных анестетиков, причем,
наиболее вероятно их возникновение при проведении блокады периферических
нервов. Если эти реакции во время распознаны и проведено соответствующее ле-
чение, они не вызывают каких-либо остаточных явлений.
Вопросы специфической токсичности
Прилокаин и бензокаин
Как бензокаин, так и метаболит прилокаина (орто-толуидин) вызывают метге-
моглобинемию и тревожный цианоз у людей. Это наблюдается только при высо-
ких дозах (около 500-600 мг). Прилокаин в настоящее время не выпускается,
однако эти осложнения с определенной частотой наблюдаются после использо-
вания больших доз бензокаина для поверхностной анестезии дыхательных пу-
тей.
2-Хлоропрокаин
В 1980 году, в нескольких отчетах описывалась нейротоксичность, возникающая
вследствие проведения эпидудуральной или каудальной (сакральной) анестезии
хлоропрокаином, препарат которого в качестве консерванта содержал 0.2% би-
сульфит. В настоящее время препарат хлоропрокаина не содержит консервантов
и не должен быть нейротоксичным, однако при инъекции больших количеств
препарата (более чем 40 см3) возникают боли в спине [12]. Эти боли исчезают
сразу после разрешения блокады и могут быть связаны со спазмами мышц спи-
ны. Эти явления при инъекции однократной дозы возникают нечасто, обычно хо-
ррошо лечатся опиодами, но в некоторых случаях могут быть достаточно
выраженными. Целесообразно ограничить применение этого препарата ситуаци-
ями, при-которых для инъекции требуется менее чем 30-35 мл.
Бунивакаин
При применении амидоаминов длительного действия бупивакаина и этидокаина,
были описаны случаи остановки сердца, возникающие вслед за реакциями сис-
темной токсичности, при которых реанимационные мероприятия были безу-
спешны. Эти случаи наиболее часто возникали в акушерской практике и обычно
развивались вслед за непреднамеренной внутривенной инъекцией. Несмотря на
то, что бупивакаин угнетает деятельность сердечно-сосудистой системы не боль-
ше чем лидокаин, на кровяное давление и сердечный выброс, по сравнению с ли-
докаином, он оказывает более продолжительное влияние. Бупивакаин угнетает
Осложнения местной анестезин
49
деятельность проводящей системы сердца и повышает частоту реэнтрантных
аритмий при концентрациях в сыворотке, несколько больших судорожного поро-
га. Так вентрикулярные аритмии (или асистолии) более часто встречаются при
высоких уровнях в крови бупивакаина и могут наблюдаться с большей частотой
в условиях ацидоза и гипоксемии, вызванных приступами судорог. Прямые реа-
нимационные мероприятия в этой ситуации не приносят успеха, однако для воз-
действия на электро-механическую диссоциацию и лечение реэнтрантной
аритмии без использования лидокаина необходимо проведение быстрой оксиге-
нации и введение больших, чем обычно доз эпинефрина. При беременности воз-
никают особые трудности, поскольку беременная матка затрудняет венозный
возврат в классическом положение на спине, и если проведение реанимационных
мероприятий затягивается, целесообразно раннее родоразрешение. Для сниже-
ния частоты подобных осложнений, особенно во время эпидурального введения,
необходимо соблюдение соответствующих предосторожностей, включающих
использование тестовых доз и дробные инъекции [7] (см. главу 7). Риск развития
системной токсичности остается более высоким при проведении блокады пери-
ферических нервов [3,10], в этой ситуации рекомендуется использование других
длительно действующих препаратов, таких как ропивакаин или левобупивакаин.
Механические осложнения
Нейропатия
Нейропатия может быть связана с непосредственным действием самого анесте-
тика, но наиболее часто это осложнение вызвано механической травмой нерва.
Регистрируются не все случаи нейропатии. В Соединенных Штатах, из всех су-
дебных исков, поданных против анестезиологов, 16% связано с повреждением
периферических нервов, однако в 28% этих случаев дело касается повреждения
локтевого нерва во время проведения общей анестезии. В отношении поврежде-
ния периферических нервов, спинномозговую анестезию и пояснично-крестцо-
вую блокаду чаще относят к случаям регионарной анестезии [13]. Это
согласуется с данными, которые говорят о том, что 23 судебных иска пришлось
на 720000 случаев спинномозговой и эпидуральной анестезии [14]. В большом
проспективном исследовании во Франции было отмечено, что повреждения пе-
риферических нервов являются редкими (34 случая на более чем 100000 анесте-
зий) и наиболее часто связаны с парестезиями во время проведения блокады или
болью при инъекции [3]. Вопросы безопасности, касающиеся парестезий, неяс-
ны. Несмотря на постоянные недочеты, связанные со случаями парестезии, во
многих обобщенных исследованиях отмечено, что прогнозируемые или неожи-
даемые парестезии закончились без последствий [15]. Selander et al. показали, что
иглы с длинным острым срезом вызывают более выраженную травму изолиро-
ванных нервов, чем иглы с коротким срезом [ 16] и этим можно объяснить некото-
рые случаи нейропатий после проведения периферической блокады (прямой
контакт с нервом). Число случаев прямой травмы нерва может быть снижено пу-
тем использования инфильтрационной техники или стимуляции нерва, что по-
зволяет избежать парастезии, но даже при этом может произойти
непреднамеренный контакт с нервом. После блокады плечевого сплетения с ис-
пользованием стимуляции нерва были отмечены короткие или длительные дизе-
стезии [17]. При каждом из этих доступов (либо в обычном поиске по парестезии)
использование игл с коротким срезом представляется вполне обоснованной ме-
рой предосторожности. К сожалению, нет данных о проспективных сравнитель-
50
Глава 3
ных исследованиях эффективности какой-либо из этих теоретически
предположенных мер предосторожности для уменьшения количества случаев
повреждения нерва.
. Интраневральное введение часто вызывает остаточное нарушение функции.
Интраневральная инъекция обычно проявляется судорожной болью во время ее
проведения. Неизвестно, связано ли повреждение нерва с повышением интранев-
рального давления или с чрезмерно высокой местной концентрацией анестетика,
однако инъекция должна быть немедленно прекращена, если пациент во время ее
проведения жалуется на боль.
Образование гематомы
После периферической нервной блокады также иногда наблюдается образование
гематомы. Это наиболее часто отмечается у пациентов с коагулопатиями. У обыч-
ных пациентов частые пункции артерии или вены во время проведения блокады не
приводят к осложнениям. Образование гематомы является весьма нежелательным,
так как экстраваскулярная кровь может препятствовать распространению местно-
го анестетика и скрывает анатомические ориентиры. В последующем, кальцифи-
кация организующейся гематомы может стать причиной значительного
неудобства для пациента, однако такие случаи встречаются чрезвычайно редко.
Перед выполнением блокады целесообразно расспросить пациента о всех случаях
бывших у него кровотечений, а также использовать иглы с наименьшим возмож-
ным диаметром и осторожно манипулировать вблизи сосудов.
Образование гематомы в эпидуральном или субарахноидальном простран-
ствах является более серьезным осложнением, поскольку здесь компрессия нер-
вного ствола может служить причиной его постоянного повреждения [18]. При
спонтанном формировании спинальной гематомы первоначальным симптомом
обычно является боль, за которой следуют неврологические нарушения. При
спинномозговой и эпидуральной анестезии проявления гематомы могут прояв-
ляться только чрезмерно длительной двигательной блокадой (ранние боли мас-
кируются анестезией). Важно раннее распознавание этой ситуации и своевре-
менное лечение. Использование этого вида анестезии (как и любой другой
блокады периферических нервов) у больных с нарушением коагуляции противо-
показано. Это также относится к пациентам с полной системной гепаринизацией
или лечению в предоперационном периоде коумадином, а также к тем случаям,
когда в послеоперационном периоде планируется введение тромболитических
препаратов. Использование низких доз коумадина перед ортопедическими про-
цедурами не препятствует проведению спинномозговой анестезии или кратко-
временной эпидуральной анальгезии [19]. Введение эпидурального катетера у
пациентов с временной гепаринизацией в течение хирургического вмешательст-
ва представляется безопасным [20]. Также связанным с низким риском образова-
ния гематомы представляется использование местной блокады на лице при вве-
дении «минидоз» гепарина. Риск формирования гематомы не возрастает у
пациентов, принимающих аспирин или другие нестероидные противовоспалите-
льные препараты [21]. Несмотря на то, что прием препаратов приводит к увели-
чению времени кровотечения, это обстоятельство не предполагает ухудшения
условий интраоперационного гемостаза. Эта информация не может быть исполь-
зована для оценки безопасности местной анестезии при приеме других антикоа-
гулянтов, например, таких как клопидогрел.
Большой проблемой для проведения местной анестезии в настоящее время
является использование низкомолекулярных препаратов гепарина в периопера-
ционном периоде для профилактики образования тромбов. Действие этих препа-
Осложнения местной анестезии
51
ратов схоже с действием гепарина, однако они не оказывают влияния на частич-
ное тромбопластиновое время или на активированное время свертывания крови,
которое обычно используют для определения активности гепарина. В Соединен-
ных Штатах это обстоятельство привело к тревожному увеличению эпидураль- -
ных гематом, поэтому в этих случаях постановка или удаление эпидурального
катетера или проведение нейроаксиальной блокады должны выполняться с осо-
быми мерами предосторожности [22]. Введение катетера должно проводиться не
менее чем за 2 часа до, или не менее чем через 12 часов после введения этих пре-
паратов.
Инфекция
При прохождении игл для анестезии через инфицированные ткани возможно за-
несение инфекции вглубь тканей или в субарахноидальное пространство, поэто-
му наличие местной инфекции рассматривается как противопоказание к
выполнению регионарной анестезии. Поднимался вопрос о том, является ли
спинномозговая анестезия безопасной процедурой у пациентов с отдаленными
очагами инфекции или сепсисом. Данные, полученные у животных, свидетельст-
вуют о том, что спинальная инъекция в этих ситуациях является безопасной при
системном введении антибиотиков [23]. Рост частоты использования эпидураль-
ных и спинальных катетеров, установленных на длительное время, сопровожда-
ется отдельными случяами инфицирования. У инкурабельных больных и
пациентов с хроническими болями диагноз и лечение этого осложнения могут
быть затруднены, и при развитии эпидуральной инфекции может потребоваться
удаление катетера. Самостоятельное развитие эпидуральных абсцессов является
редким. Более сложным вопросом является использование местной анестезии
при синдроме иммунодефицита человека (СПИД). У этих больных рано могут
развиваться инфекции ЦНС и это необходимо учитывать до выполнения блока-
ды. Данные о том, что спинномозговая или эпидуральная анестезия отягощают
состояние больных СПИДом и связанных с ним синдромов, отсутствуют, у этих
больных с многочисленными осложнениями местная анестезия часто является
наиболее предпочтительной процедурой. Наложение кровяной пломбы в эпиду-
ральном пространстве при СПИДе представляется безопасным.
Литература
1. Incaudo, G., Schatz, М., Patterson, R., Rosenberg, M., Yamamoto, F., Hambur-
ger, R. N. Administration of local anesthetics to patients with a history of prior ad-
verse reaction. J. Allergy Clin. Immunol. 61: 339, 1978.
2. Foster, A. H., Carlson, В. M. Myotoxicity of local anesthetics and regeneration of
the damaged muscle fibers. Anesth. Analg. 59: 727, 1980.
3. Auroy, Y., Narchi, P., Messiah, A., Litt, L., Rouvier, B., Samii, K. Serious compli-
cations related to regional anesthesia: Results of a prospective survey in France.
Anesthesiology 87: 479,1997.
4. Hodgson, P. S., Neal, J. M., Pollock, J. E., Liu, S. S. The neurotoxicity of drugs gi-
ven intrathecally (spinal). Anesth. Analg. 88: 797, 1999.
5. Kane, R. E. Neurologic deficits following epidural or spinal anesthesia. Anesth.
Analg. 60: 150,1981.
6. Freedman, J. M., Li, D. K., Drasner, K., Jaskela, M. C., Larsen, B., Wi, S. Transient
neurologic symptoms after spinal anesthesia: An epidemiologic study of 1,863 pati-
ents. Anesthesiology 89: 633,1998.
52
Глава 3
7. Mulroy, М. F., Norris, M. C., Liu, S. S. Safety steps for epidural injection of local
anesthetics: Review of the literature and recommendations. Anesth Analg. 85:
1346, 1997.
8. Tanaka, K., Watanabe, R., Harada, T., Dan, K. Extensive application ot epidural
anesthesia and analgesia in a university hospital: Incidence of complications related
to technique. Reg. Anesth. 18: 34,1993.
9. Hawkins, J. L., Koonin, L. M., Palmer, S. K., Gibbs, С. P. Anesthesia-related deaths
during obstetric delivery in the United States, 1979-1990. Anesthesiology 86:277,
1997.
10. Brown, D. L., Ransom, D. M., Hall, J. A., Leicht, С. H., Schroeder, D. R., Of-
ford, К. P. Regional anesthesia and local anesthetic-induced systemic toxicity: Sei-
zure frequency and accompanying cardiovascular changes. Anesth. Analg. 81: 321,
1995.
11. Moore, D. C., Batra, M. S. The components of an effective test dose prior to epidu-
ral block. Anesthesiology 55: 693, 1981.
12. Stevens, R. A. Back pain following epidural anesthesia with 2-chloroprocaine. Reg.
Anesth. 22: 299, 1997.
13. Kroll, D. A., Caplan, R. A., Posner, K., Ward, R. J., Cheney, F. W. Nerve injuiy as-
sociated with anesthesia. Anesthesiology 73: 202, 1990.
14. Aromaa, U., Lahdensuu, M., Cozanitis, D. A. Severe complications associated with
epidural and spinal anaesthesias in Finland 1987-1993. A study based on patient in-
surance claims. Acta Anaesthesiol. Scand. 41:445,1997.
15. Horlocker, T. T., Wedel, D. J. Neurologic complications of spinal and epidural
anesthesia. Reg. Anesth. Pain Med. 25: 83, 2000.
16. Selander, D., Dhuner, K. G., Lundborg, G. Peripheral nerve injury due to injection
needles used for regional anesthesia. An experimental study of the acute effects of
needle point trauma. Acta Anaesthesiol. Scand. 21: 182,1977.
17. Borgeat, A., Ekatodramis, G., Kalberer, F., Benz, C. Acute and nonacute complica-
tions associated with interscalene block and shoulder surgery: A prospective study.
Anesthesiology 95: 875, 2001.
18. Vandermeulen, E. P., Van Aken, H., Vermylen, J. Anticoagulants and spinal-epidu-
ral anesthesia. Anesth. Analg. 79: 1165, 1994.
19. Enneking, F. K., Benzon, H. Oral anticoagulants and regional anesthesia: A pers-
pective. Reg. Anesth. Pain Med. 23: 140, 1998.
20. Liu, S. S., Mulroy, M. F. Neuraxial anesthesia and analgesia in the presence of stan-
dard heparin. Reg. Anesth. Pain Med. 23: 157,1998.
21. Urmey, W. F., Rowlingson, J. Do antiplatelet agents contribute to the development
of perioperative spinal hematoma? Reg. Anesth Pain Med 23: 146, 1998.
22. Horlocker, T. T., Wedel, D. J. Neuraxial block and low-molecular-weight heparin:
Balancing perioperative analgesia and thromboprophylaxis. Reg. Anesth Pain
Med. 23: 164, 1998.
23. Carp, H., Bailey, S. The association between meningitis and dural puncture in bac-
teremic rats. Anesthesiology 76: 739,1992.
Глава 4
Премедикация и мониторинг
Премедикация и интраоперационная седация являются важными компонентами
местной анестезии. Несмотря на то, что «чистая» местная анестезия может быть
проведена без каких-либо дополнений, в особенности, в амбулаторной хирургии,
стационарные больные только в редких случаях бывают удовлетворены ею или
выбрали бы ее вновь. Седативное действие не подходит для акушерской практи-
ки или для манипуляций в блоке интенсивной терапии, где системные препараты
должны быть строго ограничены. Однако в операционной успешная местная ане-
стезия требует искусного использования дополнительных препаратов для дости-
жения их полезного совместного действия. Для этой цели при проведении
блокады при проведении хирургических манипуляций вместе с обезболивающи-
ми препаратами могут использоваться седативные средства, оказывающие до-
полнительное влияние.
Цели
Дополнительное введение лекарств предпринимается, в основном, для достиже-
ния одной из трех целей:
1. Для уменьшения волнения и улучшения возможности общения с беспокой-
ным пациентом;
2. Для обеспечения обезболивания и, таким образом, уменьшения степени дис-
комфорта, вызванного процедурой, в особенности введением игл или поиско-
выми манипуляциями для получения парестезии;
3. Для того чтобы пациент не помнил или не знал о манипуляциях, связанных
как с самим оперативным вмешательством, так и с непосредственным обеспе-
чением его проведения.
Иногда упоминается четвертая цель: это надежда повысить судорожный по-
рог местного анестетика. Этого не удается достичь при обычных дозах седатив-
ных препаратов, таких как бензодиазепины или барбитураты и наблюдается то-
лько при дозах, вызывающих бессознательное состояние у большинства
пациентов [1]. Такой подход не является гарантировано безопасным, поскольку
при этом возникает риск угнетения дыхательной и сердечной деятельности, кро-
ме того, выраженный седативный эффект может маскировать ответ на пробную
дозу [2,3] или затруднять раннее проявление признаков, которые обычно указы-
вают на проявление кардиотоксичности, вызванной с бупивакаином [4].
Широта диапазона седативного эффекта может зависеть от индивидуальных
особенностей пациента и особенностей ситуации (табл. 4.1). Существуют раз-
личные применения местной анестезии: непосредственное выполнение блокады
54
Глава 4
и интраоперационное обезболивание. Каждая из этих стадий требует соответст-
вующего использования седативных средств. Для небольших амбулаторных
процедур с невыраженным сопутствующим страхом пациента, требуется неболь-
шое седативное воздействие; использование в этих случаях значительного седа-
тивного воздействия будет негативно сказываться в периоде восстановления.
Для выполнения аксиллярной блокады, при которой выявляются парестезии, по-
требуется среднее количество опиоидов для облегчения дискомфорта, но не бо-
льше того, которое притупляет ощушение при контакте с нервом. Беспокойство
больного перед абдоминальной операцией требует использования седатиавных и
амнестических препаратов для установки эпидурального катетера, а также инт-
раоперационного введения легкого общего анестетика. У детей в большинстве
случаев для проведения блокады требуется применение общего анестетика. (Не-
смотря на то, что использование общего анестетика облегчает проведение мест-
ной блокады у детей, т. к. уменьшает риск повреждений, такая практика у взрос-
лых может повышать риск нежелательного повреждения нерва [5]). При
обучении манипуляциям значительное седативное воздействие и использование
анамнестических средств являются вполне уместными.
К сожалению, депрессанты повышают риск, связанный с проведением мест-
ной анестезии. Этот риск всегда должен быть взвешен по отношению к возмож-
ной пользе.
Таблица 4.1
Наиболее широко используемые седативные препараты,
применяемые для дополнения местной анестезии
Препарат (торговое название) Дозовый диапазон Применение Комментарии
Бензодиазепины
Мидазолам (Версед) 1-4 мг в/в Премедикация в амбулаторных условиях Внутримышечная премедикация в стационаре Возможна амнезия
Лоразепам (Ативан) 1—2 мг р.о. Премедикация в стационаре Амнезия, седативное действие в п/о периоде
Наркотики
Фентанил (Сублимаза) 25-200 мкг в/в Премедикация в амбулаторных условиях Короткое действие
Седативные/снотворные
Пропофол 25-50 мкг/кг/мин. в/в Седативный эффект во время блокады или операции Быстрое восстановление, противорвотное действие
Метогекситал 50-100 мкг/кг/мин. в/в Седативный эффект во время блокады или операции Быстрое восстановление, антианальгетическое действие
в/в — внутривенно; р.о. (per os) — через рот; п/о — послеоперационный.
Премедикации и мониторинг
55
Лекарственные препараты
Опиоиды
Препараты класса опиоидов являются идеальным дополнением при проведении
местной анестезии, поскольку они в соответствующих дозах вызывают анальге-
зию и обладают седативным действием без потери сознания. Поэтому, они обес-
печивают прекрасный контакт с пациентом и уменьшают дискомфорт,
связанный с введением иглы или парестезиями. Они также обладают желатель-
ным качеством легкой обратимости при применении налоксона. Главным недо-
статком опиоидов является угнетение дыхания, их дозы должны подбираться
индивидуально, а пациент находиться под постоянным наблюдением. Все опио-
иды в равной степени склонны к стимуляции хеморецепторов триггерной зоны и
вызывают тошноту. Эти явления зависят от дозы и в дозовом диапазоне седатив-
ного действия встречаются редко. Однако у чувствительных пациентов может
понадобиться премедикация противорвотными препаратами.
Фентанил является наиболее популярным опиоидным седативным средст-
вом, поскольку его действие начинается быстро, продолжается недолго, но, в то
же время, достаточно, а доза легко подбирается. Этот препарат в наибольшей
степени подходит для амбулаторных хирургических манипуляций, однако он
также весьма эффективен как седативное средство при проведении блокад в ста-
ционарных условиях. Дробное введение 25-50 мкг вызывает быструю анальге-
зию и седативный эффект на 20-30 минут. Этого времени обычно достаточно для
завершения блокады. Доза подбирается в зависимости от энергичности пациента
и не связана с размерами тела; следования графику мг/кг следует избегать. Мо-
жет отмечаться некоторое угнетение дыхания, поэтому необходима пульсовая
оксиметрия и дополнительная оксигенация.
Имеются производные фентанила. Схожим препаратом является суфента-
нил, однако его действие приблизительно в 10 раз выраженнее и, следовательно,
необходимо его соответствующее разведение. Алфентанил также является схо-
жим по действию, однако действует более коротко и менее выраженно, чем фен-
танил. Несмотря на то, что этот препарат, возможно, является идеальным средст-
вом как внутривенный анестетик, его седативное действие после болюсной
инъекции для обеспечения анестезии у амбулаторных больных может быть
слишком коротким. Действие ремифентанила является еще более коротким и в
действительности он может использоваться только для непрерывной внутривен-
ной инфузии. Стоимость и необходимость непрерывного введения этих двух
препаратов приводят к более частому предпочтению болюсного введения фента-
нила.
Морфин и меперидин являются длительно действующими препаратами,
обеспечивают хороший седативный эффект и достаточную анальгезию. Их дей-
ствие более продолжительно и наступает позже, чем у фентанила. В прошлом эти
препараты были популярными в стационаре для внутримышечной премедика-
ции, однако облегченный подбор дозы новых внутривенных опиоидов сделал их
использование менее широким.
Имеются также несколько опиоидов как с агонистическими, так и с антаго-
нистическими свойствами, благодаря которым предполагалось снизить угнетаю-
щее действие на дыхание. Эти препараты являются особенно полезными при
внутримышечной премедикации у стационарных пациентов, однако они не пока-
зали достоверных преимуществ в эффективности и безопасности.
56
Глава 4
Бензодиазеп ины
Бензодиазепины широко применяются для премедикации или как седативные
средства. Они являются эффективными анксиолитиками центрального типа дей-
ствия, а также обладают дополнительным свойством вызывать амнезию. Несмот-
ря на то, что они не предотвращают судорог в обычно используемых
клинических дозах [1], эти препараты эффективны в лечении токсичности, вы-
званной местным анестетиком и, поэтому при токсических реакциях они оказы-
ваются полезными в месте введения анестетика. Амнестические свойства,
особенно у длительно действующего лоразепама (дозы в 1—2 мг), являются преи-
муществом при применении у стационарных больных, так как в их памяти не
остается впечатлений от проведенной процедуры. Как и у морфина, для достиже-
ния пика их действия может потребоваться от 30 до 60 минут, в период повыше-
ния уровня в крови дополнительное внутривенное седативное воздействие
должно производиться с осторожностью. Часто седативное действие продолжа-
ется и в послеоперационной палате, особенно, у пожилых пациентов. С ростом
частоты применения эпидуральной анальгезии потребность в их длительном се-
дативном действии и дополнительной анальгезии в ранний восстановительный
период снижается, и длительно действующие препараты не используются.
Наиболее популярным бензодиазепином является мидазолам, который вы-
теснил диазепам для парентерального применения, поскольку обладает предска-
зуемым ответом на дозы и не вызывает реактивных изменений в венах в месте
введения. Мидазолам действует быстро и коротко и вызывает меньшее угнете-
ние дыхания, чем опиоиды. Он полезен для интраоперационного седативного
действия после того, как достигнут адекватный уровень блокады. Он также поле-
зен для создания амнезии обстоятельств выполнения блокады, несмотря на то,
что в этой ситуации он не обладает анальгетическим действием и требует допол-
нительного использования опиоидов. При использовании избыточных доз амне-
стический эффект может явиться недостатком, создающим нежелательную ситу-
ацию, приводящую к потере контакта с пациентом. Седативный эффект может
быть длительным, поэтому дозировка должна быть минимальной (от 1 до 3 мг в/в
с дробным внутривенным введением по 0.5-1 мг). В этих дозах его седативное
влияние длится около 30 минут. Амнестическое влияние непредсказуемо и про-
является в дозах меньших, чем требуется для седативного влияния, что может со-
здать проблемную ситуацию у амбулаторных больных. Даже кажущиеся внима-
тельными амбулаторные пациенты могут не запомнить данные им после
проведения вмешательства инструкции. Тем не менее, мидазолам является пре-
красным анксиолитиком и его амнестический эффект полезен как во время про-
ведения блокады, так и для интраоперационной седативной поддержки. Более
высокие дозы могут удлинить восстановительный период. Доступность специ-
фического антагониста флумазелина расширяет границы безопасности, однако
если необходима пролонгация седативного эффекта, более резонным выглядит
продление инфузии короткодействующего препарата.
Барбитураты
Барбитураты применяются как седативные средства в предоперационной. Они ме-
нее пригодны, чем два предыдущих класса препаратов, поскольку не являются ис-
тинными анальгетиками и не обладают амнестическими свойствами; они
вызывают подобные эффекты только в дозах, вызывающих бессознательное со-
стояние. При более низких дозах они фактически являются «антианальгетиками» и
могут вызывать повышенную болевую чувствительность и снижают возможность
Премедикация н мониторинг
57
общения с больным. При быстро действующих барбитуратах (например, при ин-
фузии 0.2% метогекситала) для «достаточной» анестезии без угнетения дыхания и
угрозы обструкции дыхательных путей требуется тщательный подбор дозы.
Инфузионное введение метогекситала является недорогим способом дости-
жения интраоперационного седативного эффекта (после выполнения блокады),
который может продолжаться на протяжении всего времени болезненного воз-
действия. Этот препарат обеспечивает более быстрое восстановление, чем мида-
золам при инфузионном введении с меньшей частотой кислородной десатура-
ции [6].
Пропофол
Пропофол в первую очередь является препаратом для общей анестезии, однако в
меньших дозах он также обладает прекрасным седативным эффектом. Тем не ме-
нее, он (как и бензодиазепины) не обладает анальгетическими свойствами и не яв-
ляется антианальгетиком как барбитураты. По предсказуемости амнестического
действия он не превосходит бензодиазепины, однако обеспечивает более быстрое
восстановление и оказывает противорвотное действие, которое является особенно
полезным для амбулаторных больных. Он может применяться в болюсном режиме
для достижения глубокого седативного эффекта во время проведения некоторых
селективных блокад (например, для ретробульбарной блокады), при которых в со-
хранении сознания пациента нет необходимости. При инфузионном введении во
время хирургических манипуляций он обладает анксиолитическим, седативным и
амнестическим свойствами, с лучшими результатами в дозовом диапазоне от 30 до
60 мкг/кг/мин. [7]. Он довольно дорог для продолжительных вмешательств, одна-
ко быстрое восстановление после его введения, противорвотное действие и легкий
подбор дозы делают его идеальным для седативного воздействия при непродолжи-
тельных амбулаторных процедурах. Сочетание небольших доз мидазолама и фен-
танила для проведения местной блокады с последующим вливанием пропофола
для седативного эффекта обеспечивает идеальное сочетание для достижения удов-
летворенности больного и быстрого восстановления.
Кетамин
Кетамин используется в низких дозах (от 20 до 30 мг внутривенно) в качестве седа-
тивного средства во время выполнения местной блокады, поскольку именно в этом
дозовом диапазоне он обладает анальгетическими свойствами. Большие дозы при-
водят к возникновению галлюцинаций при пробуждении. Этот препарат обладает
преимуществом сохранения стабильности сердечно-сосудистой системы, вызыва-
ет меньшее угнетение дыхания и угнетение рефлексов верхних дыхательных
путей. Препарат наиболее полезен для седативного воздействия во время спинно-
мозговой анестезии при переломе бедра у пожилых больных, когда полезной ока-
жется дополнительная анальгезия и поддержка сердечно-сосудистой системы.
Кислород
Несмотря на то, что кислород не является седативным препаратом, он подходит в
качестве дополнительного средства при использовании большинства седатив-
ных препаратов и анальгетиков. В частности, опиоидами вызывается угнетение
дыхания, что потенцируется добавлением бензодиазепинов. Кислородная диса-
турация наблюдается часто [8] и поэтому целесообразно использование интрана-
зальных катетеров или лицевой маски, особенно, у пожилых пациентов.
58
Глава 4
Другие дополнительные средства
Перед операцией следует в максимально возможной степени уменьшить реак-
цию страха у пациента. Доброжелательное внимание к тревогам пациента снижа-
ет необходимость в любом из вышеперечисленных препаратов. Большое
значение имеют такие вещи, как удобное расположение на операционном столе и
предложение теплого одеяла.
Музыка также обладает успокаивающим действием. Избранные записи мо-
гут быть воспроизведены через портативный кассетный плеер или через наушни-
ки. Это не только отвлекает и успокаивает большинство пациентов, но и позволя-
ет с помощью наушников скрыть множество тревожно раздражающих звуков и
разговоров в операционной.
Препараты для общей анестезии
Препараты для общей анестезии иногда полезны, а в отдельных случаях — необ-
ходимы. При хирургических манипуляциях в верхних отделах брюшной поло-
сти, проводимых под межреберной, спинномозговой или эпидуральной
блокадой, общая анестезия через эндотрахеальную трубку позволяет снизить вы-
раженность диафрагмальных рефлексов, защитить дыхательные пути и обеспе-
чить управляемую вентиляцию. Наличие местной блокады снижает
минимальную альвеолярную концентрацию при ингаляционной анестезии и,
когда эндотрахеальная трубка является значительным раздражением у пациента,
достаточным является фракционное введение минимальной альвеолярной кон-
центрации.
В педиатрии использование общей анестезии обычно для обеспечения вы-
полнения местной блокады. Такое сочетание может использоваться в ситуации, в
которой анатомические особенности являются более предсказуемыми, чего не-
льзя сказать о контакте с пациентом. У взрослых, тем не менее, проведение мест-
ной блокады, даже при стимуляции нерва, в условиях общей анестезии может по-
высить риск повреждения нерва или спинного мозга [5].
Среди общих анестетиков закись азота может оказывать седативное воздей-
ствие, что может быть использовано при полноценной блокаде у пациентов с бес-
покойством или страхом, в особенности, при использовании пропофола, если он
был добавлен после внутривенного введения опиоидов и седативное воздействие
уже оказано. Закись азота обладает преимуществом быстрого восстановления в
конце процедуры, в противоположность долговременному действию при введе-
нии больших количеств внутривенных препаратов.
Мониторинг
Во время операции под местной анестезией больные требуют такого же стандарт-
ного наблюдения, как и пациенты, получающие общую анестезию. При общей
анестезии наблюдение ведется при помощи электрокардиографии, устройства для
измерения кровяного давления, пульсового оксиметра, однако при местной анес-
тезии пациент должен также наблюдаться в отношении возможного появления
признаков системной токсичности. Особый мониторинг для обнаружения повы-
шения местного анестетика в крови должен заключаться в наблюдении за психиче-
ским статусом, что требует постоянного словесного контакта. Анестезиолог или
его ассистент должны находиться в контакте с пациентом для того, чтобы выявить
Премедикация и мониторинг
59
первые признаки изменений психической концентрации или невнятной речи, осо-
бенно, в первые 20 минут после инъекции. Применение дополнительного седатив-
ного воздействия будет затруднять раннее обнаружение угрозы токсичности.
Пульсовая оксиметрия является одним‘из наиболее частых способов мони-
торирования. При проведении местной анестезии полезной является информа-
ция о частоте сердечных сокращений, также как и о насыщении крови кислоро-
дом, в особенности, если седативное воздействие может привести к угнетению
дыхания. При введении пробной дозы для слежения за изменениями сердечных
сокращений эффективно определение пульса.
Наблюдение за кровяным давлением весьма важно при проведении спинно-
мозговой, эпидуральной анестезии, а также при выполнении симпатических бло-
кад. Автоматическое неинвазивное устройство с коротким циклом действия яв-
ляется для этой цели идеальным, поскольку освобождает руки анестезиолога для
внутривенных инъекций во время первоначальной стадии гипотензии. Исход-
ный уровень кровяного давления должен быть установлен до начала проведения
любой блокады, которая может оказать воздействие на симпатическую нервную
систему.
Необходимо также наблюдать за уровнем блокады, особенно, при проведе-
нии симпатэктомии. Уровень блокады и кровяное давление должны определять-
ся каждые 3—5 минут в течение первых 15 минут после начала ее выполнения.
Для своевременного выявления неожиданно высоких уровней за уровнем блока-
ды необходимо наблюдать на протяжении всей эпидуральной или спинномозго-
вой анестезии, поскольку при обеих процедурах может произойти изменение
уровня блокады даже спустя час.
Литература
1. De Jong, R. Н., Heavner, J. E. Local anesthetic seizure prevention: Diasepam ver-
sus pentobarbital. Anesthesiology 36: 449, 1972.
2. Moore, J. M., Liu, S. S., Neal, J. M. Premedication with fentanyl and midazolam
decreases the reliability of intravenous lidocaine test dose. Anesth. Analg. 86:1015,
1998.
3. Mulroy, M. F., Neal, J. M., Mackey, D. C., Harrington, В. E. 2-Chloroprocaine and
bupivacaine are unreliable indicators of intravascular injection in the premedicated
patient. Reg. Anesth. Pain Med. 23: 9, 1998.
4. Bernards, С. M., Carpenter, R. L., Rupp, S. M., Brown, D. L., Morse, В. V., Mo-
rell, R. C., Thompson, G. E. Effect of midazolam diazepam premedication on cent-
ral nervous system and cardiovascular toxicity of bupivacaine in pigs.
Anesthesiology 70: 318, 1989.
5. Benumof, J. L. Permanent loss of cervical spinal cord function associated with in-
terscalene block performed under general anesthesia. Anesthesiology 93: 1541,
2000.
6. Urquhart, M. L., White, P. F. Comparison of sedative infusions during regional
anesthesia — methohexital, etomidate, and midazolam. Anesth. Analg. 68: 249,
1989.
7. Smith, I., Monk, T. G., White, P. F., Ding, Y. Propofol infusion during regional
anesthesia: Sedative, amnestic, and anxiolytic properties. Anesth. Analg. 79: 313,
1994.
8. Smith, D. C., Crul, J. F. Oxygen desaturation following sedation for regional anest-
hesia. Br. J. Anaesth. 62: 206, 1989.
Глава 5
Оснащение
Регионарная анестезия может быть проведена практически любой иглой и шпри-
цем. Успешное проведение этой процедуры в большей степени зависит от опера-
тора, чем от качества инструмента. Тем не менее, существующие различия в
оснащении, делают некоторые устройства более эффективными по сравнению с
другими и в умелых руках могут оптимизировать проведение местной анестезии.
Общие принципы
Оснащение для местной анестезии обычно представляет собой готовый к приме-
нению стерильный набор. Этот набор должен включать в себя салфетки для обра-
ботки кожи, обкладочный материал, иглы, шприцы, емкости для растворов, а
также индикатор стерильности. Выбор оснащения зависит от специфических
особенностей блокады и от персональных предпочтений, тем не менее, должны
соблюдаться некоторые общие принципы.
Одноразовое или многоразовое оснащение
Наборы для многоразового использования позволяют проявить максимальную
гибкость в выборе особых игл, шприцев и катетеров. Такие наборы позволяют
применять предметы оснащения, созданные для особых, специфических случаев,
что обычно не относится к одноразовым наборам. Однако наборы для многократ-
ного использования требуют значительно больших начальных капиталовложений
и дополнительных затрат времени для их обработки, а также связаны с большим
риском заражения инфекционными заболеваниями.
В связи с возможностью заражения инфекционными заболеваниями [1], осо-
бенно новыми, возбудители которых устойчивы к традиционной стерилизации,
было создано одноразовое оборудование. Качество многоразовых наборов было
улучшено, производители часто готовы создавать наборы, отвечающие индиви-
дуальным нуждам. Производители также избавили лечебные подразделения и
госпитали от затрат, связанных со стерилизацией (но не от ответственности за
контроль стерильности).
Стерилизация
Если одноразовое оборудование не требует стерилизационной подготовки, пред-
меты многоразового использования перед очередным применением должны
быть вымыты и простерилизованы. Для мытья игл и шприцев многоразового
применения не должны использоваться растворы, содержащие детергенты, по-
скольку они, находясь в шприце или игле, вызывают химическое загрязнение
растворов местных анестетиков. Значительное бактериальное или вирусное за-
грязнение удаляется температурной стерилизацией при 121 °C в течение не ме-
Оснащение
61
нее 20 минут (пар под давлением). Соответствующие индикаторы достаточного
температурного воздействия должны быть помещены как внутри каждого стери-
лизуемого пакета, так и снаружи.
Пластмассовые и резиновые изделия не устойчивы к температурной обра-
ботке и должны стерилизоваться парами оксида этилена. Для удаления остаточ-
ного газа требуется длительная аэрация. Для контроля стерильности использу-
ются различные индикаторные полоски. Одноразовые наборы обычно снабжены
такими индикаторами, расположенными в центре пакета. Перед использованием
набора этот индикатор должен быть проверен.
Если в набор добавлен раствор местного анестетика, то после вскрытия на-
бора емкость с раствором должна быть обернута стерильным материалом и хра-
ниться в асептических условиях.
Обработка кожи
Антисептическая обработка кожи также требует тщательного внимания. В на-
стоящее время стандартным раствором, используемым для этой цели, является
раствор йодофора, называемый также йод-повидон. Действие этого раствора
основано на высвобождении свободного йода, которое зависит от разбавления
раствора водой. Важно точно соблюдать инструкции производителя по разбавле-
нию и использованию этого раствора. Эти средства являются «контактными», то
есть для уничтожения микроорганизмов не требуется обработки в особом режи-
ме или длительного взаимодействия. В отличие от использовавшихся ранее
спиртовых растворов йода эти препараты не вызывают ожога тканей, тем не ме-
нее, их избыточное количество на поверхности тела может вызвать раздражение
и после завершения блокады они должны быть смыты. Более предпочтительным
является использование одноразовых емкостей, поскольку многократно исполь-
зуемые емкости могут быть загрязнены [2].
У некоторых пациентов отмечается истинная аллергия к йод-содержащим
растворам для местного использования, в таких случаях следует применять дру-
гие растворы. Хлоргексидин является детергентом, который требует интенсив-
ной и длительной обработки кожи и должен быть смыт с нее перед инъекцией.
Изопропиловый спирт (70%) является третьим веществом, подходящим для об-
работки кожи, не требующим мытья щеткой. Имеется возможность попадания
этих веществ в раствор местного анестетика, если используются их неподкра-
шенные растворы.
Независимо от используемого вещества полная стерильность кожных по-
кровов достигается редко, поэтому должно уделяться тщательное внимание тех-
нике асептики. Обрабатываемое поле должно быть широким, а рабочая область
должна быть обложена стерильными полотенцами или пластиковыми материа-
лами.
Шприцы
Несмотря на то, что шприцы в целом играют роль средства доставки местного
анестетика, их особенности являются важными. Сопротивление между поршнем
и цилиндром становится критической величиной при использовании признака
«потери сопротивления» для идентификации эпидурального пространства. При
ощущении этого момента стеклянные шприцы превосходят большинство плас-
тических материалов. Некоторые новые технологии обработки поверхности по-
зволяют пластиковым изделиям обладать низким трением, однако в целом,
62
Глава 5
одноразовые изделия, действие которых основано на прокладке, имеющей плот-
ное сопротивление движению поршня, будут малозаметно изменять сопротивле-
ние инъекции при продвижении иглы. Недостаток стеклянных шприцев
заключается в том, что даже небольшое количество порошка из стерильных пер-
чаток может стать причиной залипания поршня в цилиндре, тем не менее, в це-
лом эти шприцы обеспечивают ощущение сопротивления в лучшей степени.
Размер шприца также влияет на работу. Самые маленькие шприцы (1 мл) по-
зволяют осуществить наиболее точную дозировку, которая требуется при добав-
лении эпинефрина к раствору анестетика. Шприцы с небольшим объемом (от 3
до 5 мл) дают лучшее ощущение сопротивления во время проникновения в эпи-
дуральное пространство, однако неудобны при инъекции больших объемов. Наи-
более удобными для руки являются 10 мл шприцы; шприцы больших объемов
тяжелы и громоздки, а для достаточного контроля требуется обычно две руки.
Они не позволяют осуществлять тонкий контроль, необходимый для локализа-
ции нервных стволов. Отсоединение и присоединение иглы при большом шпри-
це может быть также неудобным, если одна рука занята фиксацией иглы в месте
нахождения нерва. Большие шприцы также увеличивают вес системы для анес-
тезии и часто являются причиной нежелательного смещения иглы. 10 мл шприцы
являются компромиссным выбором для практических целей. Они неудобны час-
той перезаправкой, однако использование 10 мл шприцев ограничивает объем
инъецированного за один раз раствора, что является сдерживающим фактором
при введении больших объемов местного анестетика. При использовании шпри-
цев большего объема (20-30 мл) желательно исключить прямое соединение с иг-
лой путем использования короткой гибкой внутривенной трубки в качестве кон-
нектора. Это позволяет лучше управлять иглой, однако может потребовать
помощи ассистента для выполнения аспирации и инъекции.
Трехколенный адаптер удобен при использовании 10 мл шприца (управляе-
мый шприц, рис. 5.1). Он позволяет значительно лучше контролировать инъекцию
раствора, а также позволяет одному оператору одной рукой наполнять шприц, в то
время как другая рука фиксирует иглу в необходимом месте. Эти адаптеры одина-
ково пригодны как для пластиковых, так и для стеклянных шприцев.
Рис. 5.1. Трехколенный («управляемый») шприц.
Этот адаптер, присоединяемый к стандартному 10 мл шприцу, позволяет лучше контролировать
инъекцию, легче выполнять аспирацию и наполнять шприц одной рукой
Оснащение
63
Соединение с канюлей иглы может оказать влияние на легкость ее фикса-
ции. Адаптер типа Luer, на который плотно насаживается соразмерная канюля
иглы, не нуждается в сильной притирке для обеспечения герметизации, и, следо-
вательно, нежелательные движения иглы, когда она присоединена к шприцу, ме-
нее вероятны. Такое соединение также не позволяет вытекать жидкости при инъ-
екции. Герметичность соединения особенно важна при ощущении
сопротивления для идентификации эпидурального пространства.
Таким образом, в идеальном наборе должны находиться Luer-совместимые
шприцы объемом 1-, 3- и 10 мл с трехколенным адаптером на последнем, а также
стеклянный шприц для идентификации эпидурального пространства.
Иглы
Несмотря на то, что инфильтрация тканей может быть выполнена практически
любой иглой, специальные дополнения могут облегчить проведение местной
анестезии.
Иглы для местной блокады
Блокады периферических нервов наиболее часто выполняются иглой, снабжен-
ной специальным адаптером для стимуляции нерва (см. ниже). Диаметр этих игл
обычно составляет 22 G, они снабжены специальным адаптером типа Luer или
имеют боковое расширение для подключения 8-16 дюймового проволочного
коннектора, соединенного с пассивным электродом стимулятора нерва (рис. 5.2).
Иглы также покрыты изоляционным материалом для концентрации электриче-
ского тока на своем кончике, который обычно имеет короткий срез. Предполага-
ется, что число случаев повреждения нерва ниже при использовании игл с
коротким срезом (16/12 градусов) (рис. 5.2). При использовании игл с коротким
срезом сопротивление продвижению может возрастать. Имеются также иглы
большего диаметра (19 G) с приспособлением для проведения катетеров [3].
Местная анестезия может быть выполнена обычными неизолированными
иглами с использованием методики парестезии или анатомических ориентиров.
Выбор диаметра иглы основывается на компромиссе между легкостью проведе-
ния инъекции и дискомфортом при ее выполнении. Иглы с наименьшим диамет-
ром (от 25 до 32 G) наилучшим образом подходят для инфильтрации кожи, по-
скольку их проникновение ощущается в меньшей степени. Иглы с диаметром 23
G годятся для неглубоких блокад у худощавых пациентов, таких как аксиллярная
или межреберная. Иглы с большим диаметром, более ригидные, обычно требу-
ются для любого более глубокого доступа. Для выполнения большинства мест-
ных анестезий необходимы иглы диаметром 22 G и длиной от 1.5 до 2 дюймов.
Иглы диаметром 20 G и длиной от 5 до 6 дюймов используются для глубоких
блокад, таких как блокады чревного сплетения, где может понадобиться свобод-
ная аспирация.
Спинальные иглы
Необходимая длина спинальных игл составляет от 3.5 до 6.0 дюймов, эти иглы
обычно снабжены стилетом для предотвращения закупорки просвета во время
прохождения кожи или подкожных тканей до пункции твердой мозговой оболоч-
ки. В начале многообразие вариантов срезов игл было представлено всего лишь
одной оригинальной иглой Quincke (с острым срезом), затем появилось множест-
64
Глава 5
Рис. 5.2. Иглы для местной анестезии.
Для поверхностных блокад, таких как аксиллярная, наиболее эффективными являются короткие
иглы диаметром 25 G {вверху) с коротким срезом (по сравнению со стандартным иглой типа Quinc-
ke). При глубоких инъекциях могут использоваться более длинные иглы с «шариком безопасности»
(в середине) для предотвращения потери иглы в тканях при отделении канюли. Иглы, используемые
для стимуляции периферических нервов во время блокады (внизу) снабжены коннектором для сое-
динения со стимулятором и имеют отдельное короткое расширение для соединения со шприцем. Та-
кой адаптер избавляет от влияния веса шприца, подсоединенного к канюле иглы, и обеспечивает
наилучший контроль над ней
во игл, большинство из которых носило имя их создателей (рис. 5.3). Иглы с за-
кругленным острием типа Greene и Whitacre предназначены для уменьшения
травматического воздействия на твердую мозговую оболочку путем растягива-
ния и расщепления ее продольных волокон в большей степени, чем их разреза-
ния, что обеспечивает более быстрое закрытие отверстия в твердой мозговой
оболочке. Опыт использования игл с закругленным срезом, в особенности, иглы
Whitacre и ее модификации, выполненной Sprotte, показал значительное сниже-
ние числа случаев головной боли после спинномозговой пункции.
Диаметр спинальных игл также является важным параметром в отношении
возникновения головной боли, тем не менее, он не оказывает такого же влияния
как тип иглы (см. главу 6). Наименьшие иглы создают наименьшие отверстия,
при этом спинномозговой жидкости выделяется меньше, однако их проведение в
тканях и аспирация более трудные. Вполне обоснованным компромиссом явля-
ется использование игл диаметром 25 G с закругленным срезом.
Оснащение
65
Рис. 5.3
Срезы стандартных игл
для местной анестезии
Обычный срез (вид сбоку)
Короткий срез (вид сбоку)
Whitacre
Whitacre (вид сбоку)
Sprotte (вид сбоку)
Острие Greene
Острие Greene (вид сбоку)
Quincke
Quincke (вид сбоку)
Hustead (вид сбоку)
Tuohy (вид сбоку)
Эпидуральные иглы
Эпидуральные иглы имеют относительно больший диаметр, что необходимо как
для лучшего ощущения потери сопротивления, так и для проведения катетеров.
Тонкостенная игла диаметром 18 G является наименьшим портом, через который
можно провести катетер диаметром 20 G, наиболее широко для проведения катете-
ров используются иглы диаметром 16или 17 G. Вполне подходящей для однократ-
ной инъекции является игла диаметром 19 G. Использовались иглы диаметром
22 G, однако ощущение сопротивления через такое относительно узкое простран-
ство чрезвычайно затруднено.
Несмотря на то, что некоторые клиницисты для эпидурального или каудаль-
ного введения предпочитают притупленные иглы с коротким срезом типа Craw-
ford, для однократной инъекции может быть использована обычная игла типа Qu-
incke. Игла типа Tuohy с закругленным острием была первым проводником,
облегчающим установку катетеров. Эта игла в модификации Hustead с несколько
уменьшенным углом среза предназначена для снижения возможности изменения
диаметра катетера во время его проведения (рис. 5.3). Угол обоих срезов позволя-
ет направить катетер непосредственно вдоль главной оси эпидурального канала.
Однако более значительный изгиб и острие, расположенное под углом к продо-
льной оси иглы, создает условия для отклонения от намеченного пути введения.
3—1685
66
Глава 5
Более длинный срез также способствует тому, что потеря сопротивления может
передаваться от кончика иглы еще до полного открытия среза при прохождении
через ligamentum flavum. При использовании этих игл для проведения катетера
через связку может понадобиться дополнительное продвижение иглы на 2-3 мм
вперед от первоначальной точки пенетрации. Большинство этих игл выпускают-
ся с метками, нанесенными через 1 см, что позволяет лучше контролировать глу-
бину нахождения иглы или ее продвижение. Иглы типа Tuohy также выпускают-
ся с дополнительным каналом и концевыми отверстиями для подсоединения
дополнительных спинальных игл при проведении комбинированной спинномоз-
говой—эпидуральной анестезии [4].
В некоторых случаях канюли эпидуральных игл могут быть снабжены «кры-
лышками», которые позволяют лучше контролировать глубину проникновения,
в особенности при манипуляциях в торакальной зоне (рис. 5.4).
Рис. 5.4. Крыловидные адаптеры на канюле иглы.
Фланцы, присоединенные к канюле стандартной эпидуральной иглы, позволяют лучше
контролировать движение кончика иглы, если фланцы зажаты между большим и указательным
пальцами, в то время как другие пальцы опираются на кожу, контролируя, таким образом, глубину
проникновения. Существует несколько модификаций фланцев
Проводники
Проводники применяются при спинномозговой и эпидуральной анестезии. Име-
ются короткие иглы, иглы с большим диаметром просвета и с заостренной конце-
вой частью. При спинномозговой анестезии они проводятся через кожу в
межостистую связку. Они создают ригидный канал для подведения более гибких
спинальных игл небольшого диаметра. Эти иглы позволяют кончику спинальной
иглы избежать взаимодействия с кожей и, таким образом, предотвратить загряз-
нение раствором антисептика (которым готовили кожу) или обсеменения бакте-
риями кожи. При эпидуральной анестезии отверстия в коже, сделанные этими
иглами, снижают общее сопротивление игле и позволяют лучше почувствовать
ее проникновение через связки.
Катетеры
Для проведения через эпидуральные иглы или иглы для периферической блока-
ды существует множество катетеров. Их основной отличительной особенностью
является материал, используемый для их изготовления, свойства которого обес-
Оснащение
67
печивают их уникальные характеристики. Новейшие катетеры, изготовленные
из нейлона, полиамида или поливинила, представляют собой разумное сочетание
гибкости (повышение риска перегиба) и жесткости (риск пункции твердой моз-
говой оболочки или вены), позволяя осуществлять сбалансированный выбор сре-
ди широкого спектра имеющихся устройств. Катетер, армированный гибкой
расправляющейся проволокой, идеально сочетает в себе легкость введения, ми-
нимальную травматичность и низкий риск окклюзии или смещения. Если кате-
тер планируется оставить на несколько дней для проведения обезболивания в
послеоперационном периоде, то такие устройства позволяют обеспечить адапта-
цию к движению пациента и могут уменьшить число случаев смещения катетера.
Другое дополнительное устройство на эпидуральных катетерах представлено бо-
ковым каналом для инъекций с заглушкой на гибкой концевой части. Это может
уменьшить возможность пункции твердой мозговой оболочки, а наличие неско-
льких отверстий снижает возможность окклюзии катетера тканями или кровя-
ным сгустком. Однако несколько отверстий могут также затруднять
распознавание пункции твердой мозговой оболочки или вены, поскольку тесто-
вая доза может оказаться неэффективной, если в просвете сосуда или под твер-
дой мозговой оболочкой находится только одно отверстие. По этой причине
многие клиницисты предпочитают катетеры с одним каналом. С другой стороны,
при использовании катетеров с несколькими отверстиями аспирация может быть
эффективной. Метки через 1 или 5 см, нанесенные на протяжении первых 20 см,
помогают провести катетер на необходимую глубину. Рентгенопозитивные мар-
керы на катетере используются для подтверждения положения катетера; уста-
новленного на длительный срок, или катетеров, установленных для введения
нейролитических веществ. Выбор того, или иного из этих устройств зависит от
персонального опыта и предпочтения.
Для инъекции из шприца в катетер необходимы адаптеры. Для этого обычно
используются устройства типа Tuohy-Borst, в которых один элемент навинчива-
ется на другой, уплотняя его и фиксируя проведенный через него, окруженный
резиновый прокладной катетер. Коннекторов существует столько же, сколько и
катетеров и выбор того, или иного из них также зависит от индивидуального
предпочтения, основанного на надежности и легкости в использовании. Все кон-
некторы должны быть снабжены адаптером типа Luer для соединения со шпри-
цем и пробкой для сохранения стерильности в промежутке между инъекциями.
Все катетеры, используемые в хирургических отделениях для повторных инъек-
ций, должны быть четко помечены как эпидуральные катетеры для предупрежде-
ния непреднамеренного введения в них внутривенных препаратов.
Эпидуральные катетеры могут также вводиться в субарахноидальное про-
странство, тем не менее, использование для стандартных катетеров относитель-
но больших игл может повысить риск развития головной боли. Для разрешения
этой проблемы используются микрокатетеры (диаметром 27 G или меньше), про-
водимые через иглы небольшого диаметра. К сожалению, из-за проблем, связан-
ных с нейротоксичностью (см. главу 3), они были изъяты из продажи.
Инфузионные устройства
В последние 10 лет анестезиологи стали более активно использовать технологии
местного обезболивания в послеоперационном периоде для уменьшения боли (см.
главу 24). Существует несколько типов устройств для непрерывной инфузии,
обеспечивающей подведение местных анестетиков или их смеси с опиоидами для
обезболивания в послеоперационном периоде (рис. 5.5). У стационарных больных
68
Глава 5
Рис. 5.5
Примеры инфузионных помп
для использования в стационаре (А),
постоянной инфузии
в амбулаторных условиях (В)
и управляемого пациентом устройства
для инфузионного обезболивания
в амбулаторных условиях (С)
Оснащение
69
используются небольшие, электрически управляемые насосы, которые не только
обеспечивают непрерывную инфузию, но и могут управляться больным, что по-
зволяет ввести очередную дозу при необходимости. Эти устройства программиру-
ются индивидуально и демонстрируют высокую степень гибкости управления. Их
рабочая камера, как правило, недоступна для извлечения вводимого раствора, по-
скольку для этих целей обычно используются опиоиды. Важно, что такие устрой-
ства обладают как возможностью проведения непрерывной инфузии, так и
программирование интервалов «запрета на введение», что предупреждает передо-
зировку препарата пациентом. Механические нарушения в работе этих устройств
чрезвычайно редки, и они высокоэффективны при обезболивании в послеопераци-
онном периоде у стационарных больных.
При присоединении помпы д ля непрерывной инфузии использование посто-
янных катетеров для непрерывного введения может быть также полезно при вы-
полнении блокад периферических нервов. Для этого существует несколько моде-
лей. Простейшая из них представляет собой набор колб из упругого полимера,
которые содержат определенный объем местного анестетика под постоянным
давлением, содержимое этих колб проходит с определенной скоростью через
клапан, соединенный с катетером. Эти насосы могут осуществлять непрерывную
инфузию в течение 24- 48 часов для блокады плечевого сплетения или обезболи-
вания нижних конечностей. Ограничением для этих полимерных колб является
их фиксированный объем. Другим типом устройств являются питающиеся от не-
большой управляемой батареи программируемые механические помпы, которые
имеют такие же возможности для инфузии у стационарных больных. По жела-
нию пациента они могут обеспечивать как непрерывную инфузию, так и доба-
вочную болюсную инъекцию. Проблемы, связанные с механикой этих
устройств, возникают очень редко и они вполне подходят для длительного обез-
боливания в послеоперационном периоде как у стационарных, так и у амбулатор-
ных больных.
Стимуляторы нервов
Устройство для стимуляции периферических нервов подводит импульсный элек-
трический ток к кончику иглы для поисковой пункции. При касании иглой нерва
происходит деполяризация его мембраны. Эфферентные двигательные нервы
(волокна А-альфа) деполяризуются легче, поэтому такие устройства позволяют
идентифицировать смешанные периферические нервы, обеспечивающие сокра-
щение мышц лучше, чем неудобный метод сенсорной парестезии. Метод стиму-
ляции также более предпочтителен для анестезиолога, позволяя ему обнаружить
местонахождения нерва у пациента, находящегося в оглушенном или бесконтак-
тном состоянии.
Мера стимуляции зависит от силы электрического тока и расстояния между
источником тока и нервом. На этом принципе основана стимуляция нерва с раз-
личной силой тока. Относительно высокая сила тока (приблизительно от 2.0 до
2.5 мА) может быть использована для определения момента прикосновения к
нерву. Прогрессивное понижение силы тока позволяет установить отдаленность
иглы от нерва. В клинических условиях ток в 2.0 мА вызывает деполяризацию
двигательного нерва при дистанции около 1 см. По мере продвижения иглы к
нерву ток меньшей силы (от 0.5 до 0.6 мА) помогает определить близость нерва
[5]. Это подтверждается инъекцией в эту зону 2 мл местного анестетика, в резу-
льтате которой сокращение мышц прекращается.
70
Глава 5
Совершенные стимуляторы нервов имеют переменную выходную мощ-
ность с четким отражением силы генерируемого тока. Положительный (крас-
ный) электрод стимулятора подсоединяется к электрокардиографическому кож-
ному электроду, расположенному рядом с местом блокады. Отрицательный
(черный, катод) электрод подсоединяется к поисковой игле. Соединение может
быть обеспечено зажимом типа «аллигатор», однако более широко используются
изолированные иглы серийного производства со встроенным коннектором.
Рис. 5.6
Стимулятор нервов,
присоединенный к игле
для местной блокады.
Отрицательный (черный)
электрод присоединен к
поисковой игле,
положительный (красный)
электрод соединен
с референтным
электрокардиографическим
электродом, используемым
как «земля».
Для обнаружения нерва
величина электрического
тока, генерируемого
стимулятором,
устанавливается на 1-2 мА.
По мере приближения к
нерву сила тока снижается.
Ели игла находится рядом
с нервом, достаточной
является двигательная
стимуляция электрическим
током в 0.5 мА или меньше
Иглы с электроизоляцией (с оболочкой, покрытые тефлоном) позволяют
сконцентрировать электрический ток на кончике иглы и повысить точность об-
наружения нерва. Электроизоляция иглы приводит к тому, что после прохожде-
ния кончика иглы через нерв его деполяризация снижается, чего не происходит
при использовании не изолированных игл. Иглы с электроизоляцией более доро-
гие, однако являются лучшим выбором.
Стимуляторы нервов не заменяют знания анатомии и первоначального пра-
вильного расположения иглы. Они только лишь помогают определить удален-
ность иглы от нерва, если он находятся в непосредственной близости. Стимуля-
тор не поможет обнаружить нерв новичку, который не использует
анатомические данные. Утверждение о том, что использование стимулятора уме-
ньшает возможность повреждения нерва, является всего лишь предположением;
исследований, которые бы продемонстрировали расширение границ безопасно-
сти при использовании стимулятора, не проводилось, повреждения нервов отме-
чаются и при использовании стимулятора [6]. Стимуляторы особенно полезны
при оглушенном или бесконтактном состоянии пациента, а также в тех случаях,
Оснащение
71
когда стимуляция двигательных волокон должна заменить идентификацию нер-
вов путем парестезии. Стимуляторы также полезны для обучения ординаторов в
случаях выраженной премедикации, а также в педиатрической практике, где бло-
кады обычно проводятся в условиях седативного воздействия и анестезии. На-
против, даже использование стимулятора нерва не устраняет риск его поврежде-
ния, если блокада выполняется у взрослого пациента в бессознательном
состоянии [7]. Одним из нерешенных вопросов использования стимулятора мо-
жет быть необходимость работы двух человек — один в стерильных перчатках,
выполняющий саму процедуру, другой — оператор устройства, однако наличие
новых средств управления — ножных педалей — может решить эту проблему.
Литература
1. Tait, A. R., Tuttle, D. В., Prevention of occupational transmission of human immu-
nodeficiency virus and hepatitis В virus among anesthesiologists: A survey of anes-
thesiology practice. Anesth. Analg. 79: 623,1994.
2. Bimbach, D. J., Stein, D. J., Murray, O., Thys, D. M., Sordillo, E. M. Povidone
iodine and skin disinfection before initiation of epidural anesthesia. Anesthesiology
88:668, 1998.
3. Steele, S. M., Klein, S. M., D'Ercole, F. J., Greengrass, R. A., Gleason, D. A new
continuous catheter delivery system. Anesth Analg. 87: 228, 1998.
4. Rawal, N., Van Zundert, A., Holmstrom, B., Crowhurst, J. A. Combined spinal-epi-
durial technique. Reg. Analg. 22:406,1997.
5. Choyce, A., Chan, V. W., Middleton, W. J., Knight, P. R., Peng, P., McCart-
ney, C. J. What is the relationship between paresthesia and nerve stinulation dor
axillary brachial plexus block? Reg. Anesth. Pain Med. 26: 100,2001.
6. Borgeat, A., Ekatodramis, G., Kalberer, F., Benz, C. Acute and nonacute complica-
tions associated with interscalene block and shoulder surgery: A prospective study.
Anesthesiology 95:875,2001.
7. Benumof, J. L. Permanent loss ofo cervical spinal cord function associated with in-
terscalene block performed under general anesthesia. Anesthesiology 93:1541,
2000.
Глава 6
Спинномозговая анестезия
Спинномозговая анестезия является простейшей и наиболее эффективной мето-
дикой, доступной анестезиологу. Инъекция местного анестетика в легко иденти-
фицируемое спинномозговое пространство обеспечивает полноценный доступ
для воздействия на спинномозговые нервы, в результате чего развивается быст-
рая, глубокая и предсказуемая анестезия.
Анатомия
Пучки периферических нервов входят и выходят из черепа в составе спинного
мозга, проходящего в спинномозговом канале и содержащего защитную оболоч-
ку, в которой эти нервы омываются спинномозговой жидкостью. Твердая мозго-
вая оболочка является наиболее внешним слоем этой защиты и покрывает
лежащую под ней арахноидальную оболочку. Несмотря на то, что между ними
может существовать субдуральное пространство, наибольший объем занят суба-
рахноидальным пространством, расположенным между арахноидальной и мяг-
кой мозговой оболочкой, которая непосредственно покрывает спинной мозг.
Цереброспинальная жидкость в спинномозговом канале напрямую соединяется с
внутрижелудочковой и внутричерепной жидкостью и имеет одинаковый с ними
состав и давление.
Спинной мозг у взрослых обычно оканчивается на уровне I поясничного по-
звонка, в то время как спинномозговая полость продолжается в каудальном на-
правлении до уровня II крестцового позвонка. Эфферентные волокна выхолят из
спинного мозга через вентральный рог, афферентные и чувствительные волокна
входят в него через дорсальные рога (рис. 6.1). Дорсальные и вентральные волокна
с каждой стороны спинного мозга, соединяясь, формируют сегментарный нер-
вный пучок для каждого из дерматомов. Перед тем, как выйти через межпозвоноч-
ное отверстие на определенном уровне, эти нервы опускаются в спинномозговом
канале на различные расстояния. Большинство дистальных пучков из нижнепояс-
ничного и крестцового отделов преодолевают значительное расстояние между
местом их отхождения от спинного мозга и местом выхода из спинномозгового ка-
нала, формируя, таким образом, из своих волокон так называемый конский хвост,
проходящий в нижней части спинномозгового канала.
Пучки, выходя из спинномозговой полости, окружаются отростком твер-
дой мозговой оболочки, что продолжает их защиту омыванием спинномозго-
вой жидкостью. Эти отростки в шейном отделе распространяются до межпоз-
воночных отверстий, однако в поясничном отделе они имеют тенденцию
оканчиваться непосредственно в полости спинномозгового канала. Находясь в
полости спинномозгового канала пучки не окружены большим количеством пе-
риневральной ткани, которая препятствует действию местных анестетиков на
периферические нервы. Они также лишены буферного действия внеклеточной
Спинномозговая анестезия
73
Рис. 6.1. Тело позвонка позвоночного столба в поперечном разрезе, уровень L-3.
Твердая мозговая оболочка окутывает с боковых сторон выходящие из полости корешки
спинномозговых нервов. В грудном отделе эти «рукава» твердой мозговой оболочки могут
выходить через боковые отверстия. Эпидуральное пространство в основном занято венами. Задняя
часть эпидурального пространства, которое начинается сразу под желтой связкой, в поясничном
отделе имеет наибольшую на всем протяжении спинномозгового канала глубину — от 3 до 5 мм
жидкости. Местные анестетики, инъецированные в эту среду, не встречают
препятствий для своего действия на мембрану нервных клеток, что приводит к
быстрой анестезии.
Позвоночный столб осуществляет поддержку и защиту спинного мозга.
Каждый позвонок окружает и защищает спинной мозг с 4-х сторон, кроме этого,
отверстия между его отростками позволяют с каждой стороны выходить кореш-
кам спинного мозга. С задней стороны отверстие в спинномозговом канале обра-
зуется между дугами позвонков (рис. 6.1). Через эти отверстия осуществляется
спинномозговая анестезия. Вход в это пространство защищен плотной желтой
связкой и остистым отростком верхнего позвонка, который прикрывает это про-
странство, отходя под углом вниз. Остистые отростки сохраняют положение, вы-
ровненное вдоль одной линии, благодаря соединяющей их плотной межостистой
связке (см. рис. 6.6).
Позвоночный столб имеет характерные изгибы в поясничном и грудном от-
делах, которые влияют на распределение введенных препаратов. Выпуклость
кпереди в поясничном отделе приводит к распространению в цефалическом на-
правлении раствора, инъецированного ниже второго поясничного позвонка. Во-
гнутость в грудном отделе способствует при согнутой спине накоплению в этом
месте гипербарического раствора.
74
Глава 6
Показания
Местные анестетики в субарахноидальном пространстве в целом вызывают тота-
льную нервную блокаду каудальнее места инъекции; анестезия в цефалическом
направлении от места инъекции бывает различной по глубине и зависит от поло-
жения пациента, общей дозы введенного препарата и плотности раствора мест-
ного анестетика. Постепенное снижение концентрации местного анестетика в
цефалическом направлении является причиной изменения анестезии, связанной
с различной чувствительностью спинномозговых нервов. Симпатические волок-
на блокируются более низкими концентрациями препарата и поэтому (в зависи-
мости от введенного препарата), анестезия может наблюдаться на 2-6 сегментов
выше, чем анестезия чувствительных волокон. Таким же образом уровень сен-
сорной анестезии может быть на 2 дерматома выше, чем уровень двигательной
блокады, которая требует наибольших концентраций местного анестетика.
Спинномозговая анестезия низкого уровня (L-1) или седловидный блок ис-
пользуются для хирургических манипуляций на промежностной и перианальной
областях. Блокада среднего уровня (чувствительный дерматом Th 10) — для хи-
рургических операций на бедре и других отделах нижней конечности, включая
стопу. Тем не менее, для предотвращения турникетного дискомфорта может по-
требоваться несколько более высокий уровень. Этот уровень является оптималь-
ным для выполнения трансуретральной простатэктомии, поскольку он обеспечи-
вает хорошую анестезию, сохраняя чувствительность в брюшной полости и дне
мочевого пузыря, что позволяет выявить ранние признаки выхода в брюшную
полость введенной жидкости. Более высокие уровни спинномозговой анестезии
(Th 4-Th 6) предназначены для оперативных вмешательств на нижних отделах
брюшной полости, таких как паховая герниорафия, аппендэктомия, кесарево се-
чение и абдоминальная гистерэктомия. Тем не менее, при этих процедурах у па-
циента могут возникнуть неприятные ощущения, связанные с тракциями брю-
шины или органов брюшной полости и, поэтому, может потребоваться более
высокая блокада или дополнительное седативное воздействие.
С высокими уровнями спинномозговой анестезии связаны изменения функ-
ций сердечно-сосудистой и дыхательной систем. Торакальный симпатический
блок вызывает гипотонию, что приводит к обострению заболевания у пациентов
с гиповолемией, возникшей в результате снижения объема циркулирующей кро-
ви, дегидратации, диуретической терапии или передозировки слабительных
средств [1,2].
Несмотря на высокий уровень спинномозговой блокады, вентиляция легких
обычно при этом не нарушается, поскольку диафрагмальный нерв не блокируется.
Спинномозговая анестезия сама по себе не нарушает респираторный ответ на по-
вышение содержания углекислого газа. Однако у тучных пациентов в положении с
опущенным головным концом могут возникнуть трудности с вентиляцией легких,
особенно, при объемных вмешательствах на нижних отделах брюшной полости и
принудительной «укладке» петель кишечника. Экспираторный резервный объем и
сила кашля прогрессивно понижаются при повышении уровня спинномозговой
анестезии [1], таким образом, высокая спинномозговая анестезия не показана па-
циентам с респираторными заболеваниями. Блокада выше Th-10 без дополнитель-
ной вентиляции легких является неразумной у пациентов, которым для нормаль-
ного дыхания требуется значительное участие мышц брюшной стенки.
Еще более высокие уровни блокады (Th-1) создают условия для проведения
хирургических операций на верхних отделах брюшной полости, поскольку при
этом создается превосходная мышечная релаксация, необходимая для холеци-
Спинномозговая анестезия
75
стэктомии, пилоропластики, резекции кишечника и ревизии брюшной полости.
Спинномозговой блок приводит к тому, что хирург работает на сокращенном ки-
шечнике в связи с блокадой симпатической иннервации. Вмешательства на верх-
них отделах желудочно-кишечного тракта обычно требуют дополнительной лег-
кой общей эндотрахеальной анестезии для обеспечения адекватной вентиляции
легких, защиты дыхательных путей и притупления резидуальной диафрагмаль-
ной и висцеральной чувствительности. Если используется высокий спинальный
блок, изменения со стороны сердечно-сосудистой системы могут быть более глу-
бокими, а при тотальной симпатической блокаде может отмечаться выраженная
брадикардия, если только не добавлена антихолинергическая вагусная блокада.
У определенного числа пациентов спинномозговая анестезия не должна вы-
полняться. К таким случаям относится наличие инфекции в месте инъекции, не-
леченный сепсис, выраженная гиповолемия или коагулопатия. Не перспектив-
ными кандидатами для выраженной симпатической блокады являются пациенты
с высоким венозным давлением (например, при стенозе аорты). Если проводится
соответствующее лечение, лихорадка сама по себе не является противопоказани-
ем к выполнению спинномозговой анестезии [3].
Препараты
Наиболее широко применяемым местным анестетиком для спинномозговой ане-
стезии является лидокаин: 50 мл препарата вызывают блок на уровне Th 6- Th 10
продолжительностью приблизительно от 45 до 60 минут. Для нижних конечно-
стей это время составит 120 минут. Более низкие дозы, такие как 20-25 мг, вызы-
вают блок на уровне Th-10, не столь продолжительный, который лучшим
образом подходит для анестезии у амбулаторных пациентов при выполнении ар-
троскопии коленного сустава. При таких небольших дозах выраженность транзи-
сторных неврологических симптомов может снижаться (см. главу 3). Серийный
5% раствор содержит 7.5% декстрозы и, таким образом, уже является гипербари-
ческим. Серийный 2.5% раствор дает чисто изобарическую анестезию и для вы-
полнения гипобарической анестезии может быть разбавлен равным объемом
стерильной воды.
Для непродолжительных процедур также используется прокаин, однако он
не является столь же надежным анестетиком, как лидокаин, и его действие незна-
чительно короче действия лидокаина. 10% раствор должен быть разбавлен до 5%
концентрации добавлением равного объема спинномозговой жидкости (изобари-
ческий раствор) или глюкозы (гипербарический раствор). Действие мепивакаина
при спинномозговой анестезии является несколько более выраженным, чем дей-
ствие лидокаина.
Желательной альтернативой для более длительной блокады является бипу-
вакаин. Выраженность и продолжительность его действия зависит от дозы [4].
Доза в 5 мг вызывает блок на уровне Th-10 на протяжении около 90 минут, что
может быть использовано для некоторых амбулаторных процедур. Доза в 10 мг
вызывает анестезию на уровне мезогастрия на протяжении от 2 до 3 часов, одна-
ко более выраженная анестезия при дозах, превышающих 10 мг, часто является
причиной задержки мочи. Препарат, выпущенный в промышленных условиях,
является гипербарическим, однако его 0.5% раствор по существу является изоба-
рическим. Левобупивакаин вызывает схожую спинномозговую блокаду, в то
время как ропивакаин приводит к менее продолжительной и менее выраженной
анестезии [5]. Тетракаин в настоящее время используется почти исключительно
для спинномозговой анестезии. Преимущество его кристаллической формы за-
76
Глава 6
ключается в том, что препарат может быть разбавлен до нужной степени. Он дей-
ствует несколько более выражено, чем бупивакаин, поэтому для эквивалентной
блокады его доза может быть снижена на 30%.
Любой из этих препаратов может быть использован для постоянного обезболи-
вания, однако при этом, для повышения точности дозировки необходимо использо-
вать разведенные концентрации. 5% лидокаин при инъекции через микрокатетеры
может вызывать нейротоксичность и должен использоваться с осторожностью.
Для продления блокады и улучшения качества анестезии к растворам мест-
ных анестетиков традиционно добавляется эпинефрин (0.2 мг) (см. табл. 6.1). Он
также задерживает выделения [6]. Фенилэпинефрин несколько более эффективен
в увеличении времени блокады, чем эпинефрин, однако оба препарата пролонги-
руют окончательное разрешение блокады в большей степени, чем снижение ее вы-
раженности, что может быть использовано для увеличения продолжительности
анестезии нижних отделов брюшной полости. Другой альтернативой является по-
вышение дозы местного анестетика в миллиграммах. Клонидин также увеличива-
ет продолжительность спинномозговой анестезии при его пероральном приеме
или его добавлении к местному анестетику, однако он может оказывать побочное
седативное или сердечно-сосудистое действие. Интратрахеальное введение нео-
стигмина также увеличивает продолжительность анестезии, однако ценой за это
является выраженная тошнота. Фентанил в дозах от 10 до 25 Fr пролонгирует поте-
рю чувствительности так же, как эпинефрин, однако при этом не задерживает вы-
деления (табл. 6.1). Поскольку фентанил потенцирует действие местного анестети-
ка, он позволяет использовать меньшие дозы и может быть признан наиболее
предпочтительным дополнением, особенно, для амбулаторных целей [7]. В этих
дозах он может вызывать также некоторую анальгезию и не связан с высокой час-
тотой угнетения дыхания, однако может вызывать зуд.
Таблица 6.1
Продолжительность спинномозговой анестезии при введении 50 мг лидокаина
Продолжительность (мин.) ± стандартное отклонение
Раствор Уровень Perpec- На уровне Двига- Сниже- Сниже-
блокады СИЯ через 2 сегмента Th-12 при хирургической анестезии тельная блокада ние на уровне L1 ние на уровне S
1.5% чистый (изобарический) Th-6 (Th3-L2) 56±5 20 ± 13 71 ±8 104 ±5 130 ± 18
1.5% Декстроза Th-3 (Th7-Ll) 39±5 29 ±10 30±8 73 ± 10 99± 11
5% только с декстрозой Th-3 (C8-Th5) 50 ±16 49 ±30 88 ±20 109 ±6 150 ±8
5% с эпинефрином Th-4 56± 11 45 ±30 108 ± 30 96 ±42 156 ±43
5% с фентанилом 25 Fr с фентанилом Th-3 ThlO (Th5-12) 70 75 ±32 89 ±31 100 ±31 157 ± 11
Данные получены от Chiu et al. [8] и Liu et al. [18].
Несмотря на то, что общая доза является основным фактором, определяю-
щим окончательное распространение спинномозговой анестезии, на этот про-
цесс оказывает влияние множество других факторов (табл. 6.2 и 6.3). Наиболее
значительным фактором является как раз тот, который трудно измерить, а имен-
но, объем спинномозговой жидкости у пациента [8]. Среди других факторов, ко-
торые мы можем контролировать, основными факторами, определяющими рас-
Спинномозговая анестезия
77
пространение спинномозговой анестезии, являются положение пациента и
баричность растворов. Если инъекция гипербарического раствора выполняется в
положении сидя, она вызывает сакральную анестезию («седловидный» блок), в
то время как та же самая инъекция в стандартном положении лежа обычно оказы-
вает влияние на средне-грудные нервы, которые находятся в наиболее низкой в
этом положении части спинномозгового канала (рис. 6.2) [9]. Изобарический
раствор (без декстрозы) менее подвержен влиянию гравитации и, в целом, пре-
пятствует распространению анестетика от места инъекции, несмотря на измене-
ние положения пациента, тем не менее, окончательное распространение стано-
вится менее предсказуемым (рис. 6.3). Гипобарический раствор будет
способствовать распространению анестетика от места инъекции. Это полезно
при проведении перинеальной анестезии в коленно-локтевом положении.
Таблица 6.2
Факторы, влияющие на распространение и длительность действия
местных анестетиков при инъекции в субарахноидальное пространство
Влияние на распространение
Основные факторы
Гипо-, изо- или гипербаричность раствора
Положение пациента (за исключением изобарического раствора)
Доза и объем инъецированного препарата (за исключением изобарического раствора)
Второстепенные факторы
Уровень инъекции
Скорость инъекции/ барботирование
Размер иглы
Состояние пациента
Внутрибрюшное давление
Влияние на продолжительность
Вид препарата
Введенная доза
Присутствие вазоконстрикторов
Распространение блокады
Адаптировано из Wildsmith J.A., Rocco А.С. Current concepts in spinal anesthesia. Reg. Anest. 10:119,
1985.
Дозы при спинномозговой анестезии
Таблица 6.3
Доза (мг) Длительность (снижение на уровне Th-Ю) (часы)
Местный анестетик Седловидный Уровень блок Th-10 Th2-4 Чистый С эпинефрином
Прокаин 50 75 100 1.5 2
Лидокаин 40 50 75 1.5 2
Тетракаин 4 6 8-12 1.5 3-4
Бупивакаин 5 10 12 0.5 3-4
78
Глава 6
Рис. 6.2. Нормальные изгибы позвоночного столба.
Гипербарические растворы, инъецированные на уровне L-2, распространяются под влиянием
гравитации в нижележащий сакральный отдел и в наиболее глубокий средне-грудной отдел.
Поясничный лордоз (стрелка) в положении на спине под влиянием анестезии часто уменьшается,
тем не менее, распространение местного анестетика обычно происходит до этого уплощения.
Помещение ног в положение для литотомии также уменьшает этот изгиб, однако это оказывает
небольшое влияние на распространение раствора (с разрешения и по материалам From Raj, P.P.
Handbook of Regional Anesthesia. New York: Churchill Livingstone, 1985. P. 225)
Чистый раствор бупивакаина
\]ЦК Всегда блокируется
[УА;-] Может быть блокировано
Рис. 6.3. Распространение спинномозговой анестезии.
Возможное распространение анестезии, при применении двух различных препаратов бупивакаина,
каждый из которых медленно вводился на уровне L-3-L-4 в положении на боку по средней линии
Вместе с этими основными факторами на спинномозговую анестезию ока-
зывает влияние несколько второстепенных факторов, таких как объем и скорость
инъекции, уровень инъекции, состояние пациента (табл. 6.2). Несмотря на то, что
рост пациента не имеет отчетливой связи с распространением анестетика, у туч-
ных и пожилых пациентов уровень блокады оказывается выше ожидаемого.
Множество факторов, влияющих на окончательное распространение анестетика,
делают этот процесс труднопредсказуемым.
Спинномозговая анестезия
79
Техника
Гипербарический раствор, положение на боку, срединный доступ
Наиболее распространенной техникой проведения спинномозговой анестезии
является использование гипербарического раствора, вводимого по средней ли-
нии в положении на боку. Эта процедура обычно проводится в операционной,
поскольку анестезия наступает быстро, а подготовка к операции к этому време-
ни, как правило, заканчивается. Кроме этого, перемещение или транспортировка
пациента в ближайшие 30 минут после инъекции могут вызвать нежелательное
повышение уровня анестезии и привести к снижению кровяного давления. Если
движения неанестезированного пациента болезненны, блокада может быть вы-
полнена на каталке или на кровати.
1. После подключения следящих устройств и поддерживающей оксигенации
пациент помещается в положение на бок. Сторона проведения операции рас-
полагается ниже, для того чтобы обеспечить наиболее раннюю и наиболее
глубокую анестезию в месте проведения хирургического вмешательства (при
гипербарическом растворе). Под голову помещается валик или сложенное по-
лотенце, что необходимо как для удобства пациента, так и для выравнивания
позвоночного столба (рис. 6.4).
Рис. 6.4. Положение пациента при спинномозговой или эпидуральной блокаде.
Колени пациента приводятся к грудной клетке, а голова наклонена вперед для обеспечения
максимального сгибания вперед позвоночного столба. Под голову, но не под плечи, должен быть
помещен валик, иначе может произойти ротация позвоночника. Бедра и плечи должны быть
расположены перпендикулярно поверхности операционного стола, предотвращая обычное смещение
верхнего плеча пациента вперед. Линия между задними подвздошными гребнями обычно пересекает
позвоночный столб на уровне между IV и V поясничными позвонками или на уровне остистого
отростка IV поясничного позвонка. Аналогично для торакальной эпидуральной инъекции линия
между нижними углами лопаток должна проходить через остистый отросток IX грудного позвонка
2. Спина пациента перемещается к краю операционного стола, а его плечи вы-
равниваются так, чтобы они располагались перпендикулярно полу. Колени,
бедра и затем голова сгибаются так, чтобы обеспечить максимальное сгиба-
ние позвоночного столба кпереди. Бедра и спина выравниваются так, чтобы
они располагались перпендикулярно полу. Улучшению контакта с пациентом
будут способствовать теплое покрывало и легкое седативное воздействие.
Для создания правильного положения пациенту полезна помощь ассистента.
80
Глава 6
3. Остистые отростки и подвздошные гребни используются как анатомические
ориентиры. Линия между подвздошными гребнями проходит между IV и V
поясничными позвонками или на уровне остистого отростка IV пояснично-
го позвонка. Отростки поясничных позвонков идентифицируются и нумеру-
ются с определением наиболее широкого расстояния между ними. Обычно
для инъекции предпочитают промежуток между II и III поясничными по-
звонками, поскольку на этом уровне изгиб поясничного отдела позвоночни-
ка достигает максимума, что создает условия для распространения раствора
как в цефалическом, так и в каудальном направлении. Инъекции на уровне I
поясничного позвонка или выше следует избегать в связи с возможностью
повреждения спинного мозга. В месте предполагаемого введения иглы на-
носится маркер «X».
4. После того, как на кожу нанесен маркер, положение пациента вновь проверя-
ется для того, чтобы убедиться в том, что спина полностью согнута и перпен-
дикулярна полу. После этого вскрывается набор для местной анестезии,
производится обработка кожи и обкладка места инъекции.
5. После обработки кожи пациент предупреждается о начале процедуры и в мес-
те нанесения маркера иглой небольшого диаметра производится внутрикож-
ная инъекция местного анестетика. Затем, более длинная игла (1.5 дюйма)
используется для идентификации пространства между остистыми отростка-
ми, куда по линии предполагаемого введения иглы производится инъекция
местного анестетика. Игла располагается по средней линии с 10-15 градус-
ным краниальным отклонением. Некоторый объем местного анестетика оста-
ется в резерве на случай дополнительной анестезии или последующего
введения в другое межпозночное пространство.
6. После инфильтрации тканей, положение пациента вновь проверяется, поско-
льку пациент часто отстраняется от ощущения жжения при введении местно-
го анестетика, что уменьшает сгибание спины.
7. Проводниковая игла проводится через маркерную точку в направлении инфи-
льтрированного участка с небольшим краниальным отклонением. Использо-
вание проводниковой иглы позволяет уменьшить загрязнение спинальной
иглы раствором для обработки кожи, клетками эпидермиса, кожными бакте-
риями, однако основным ее предназначением является проведение более тон-
ких игл. Ее использование позволяет уменьшить отклонение кончика иглы,
происходящее из-за взаимодействия ее среза с тканями. Правильно введенная
проводниковая игла будет прочно удерживаться плотными волокнами межо-
стистой связки. Спинальная игла с закругленным срезом проводится через
проводник также с краниальным отклонением, однако в направлении, пер-
пендикулярном по отношению к спине, для того, чтобы сохранить срединную
траекторию (рис. 6.5).
8. Если игла натолкнулась на кость, следует заметить глубину ее проникновения в
ткани, затем частично извлечь и вновь ввести в более краниальном направле-
нии. Если после этого игла снова уперлась в кость, глубина ее проникновения
сравнивается с замеченной при предшествующей попытке (рис. 6.6). Если
кость находится глубже, чем при предыдущем контакте, возможно игла была
продвинута до верхнего края остистого отростка, т.е. ниже межпозвоночного
пространства, и угол ее введения должен быть отклонен в краниальном направ-
лении еще больше. Если кость оказалась ближе, чем при первом введении, игла
возможно достигла нижнего края остистого отростка над межпозвоночным
пространством и ее краниальное отклонение должно быть уменьшено. Если
при повторной попытке кость оказалась на той же глубине, скорее всего игла
Спинномозговая анестезия
81
Рис. 6.5. Спинальная игла и проводник.
Спинальная игла проводится через проводник большего диаметра. Использование проводника
позволяет избежать проблем, связанных с загрязнением кончика иглы раствором для обработки
кожи, клетками эпидермиса или кожными бактериями, а также создает жесткий канал для
проведения игл небольшого диаметра, использование которых снижает частоту возникновения
головной боли. При присоединении или отсоединении шприца от канюли иглы другая рука жестко
опирается на спину и прочно фиксирует канюлю, предотвращая тем самым ее нежелательное
перемещение или извлечение
Рис. 6.6. Введение спинальной иглы (вид сбоку).
При классическом срединном доступе игла вводится по средней линии межпозвоночного
пространства и продвигается с небольшим краниальным отклонением. Если это отклонение
является правильным (А), игла пройдет через межостистую связку, желтую связку и попадет в
эпидуральное пространство. Если игла уперлась в кость, это может быть связано с ее попаданием в
нижнюю часть остистого отростка (Б), в этом случае правильное направление иглы может быть
достигнуто ее краниальным отклонением. Если после этого игла вновь упирается в кость уже на
меньшей глубине (В) возможно она достигла верхнего края остистого отростка. Если контакт с
костью происходит на одинаковой глубине после нескольких изменений направления иглы (на
рисунке не показано), игла, скорее всего, упирается в боковую поверхность дуги и ее положение
должно быть скорректировано в направлении срединной линии
82
Глава 6
попала в боковую пластину тела позвонка и точка ее введения не находится на
средней линии. Направление иглы и проводника должно быть изменено так,
чтобы они оказались перпендикулярно к поверхности спины, после чего может
быть предпринята новая попытка. Такая схема логического анализа позволяет
свести к минимуму число повторных попыток.
Наиболее часто неправильное положение связано с тем, что пациент, отодви-
гаясь от анестезиолога пытается согнуть спину. При этом игла, оставаясь па-
раллельно полу, становится уже не перпендикулярной поверхности спины
(рис. 6.7). Необходимо несколько отклонить иглу в направлении к полу для
компенсации такого разворота позвоночника.
Рис. 6.7
Положение пациента, вид сбоку.
Большинство пациентов поворачивают
верхнюю часть своего тела вперед, пытаясь
согнуть спину, что приводит к смещению
спинальной (или эпидуральной) иглы,
вследствие этого ее необходимо направить
несколько ниже (В), для восстановления линии,
перпендикулярной срединной плоскости
9. Если направление иглы выбрано правильно, при ее движении будут ощуща-
ться два изменения сопротивления. Первое их них связано с прохождением
желтой связки, следующее за ним — с пункцией твердой мозговой оболочки.
После второго изменения сопротивления (ощущаемого как «провал»), стилет
извлекается для проверки истечения жидкости. Если свободного истечения
не наблюдается, канюля иглы поворачивается на 90 градусов для того, чтобы
устранить возможную обтурацию просвета иглы небольшим лоскутом твер-
дой мозговой или арахноидальной оболочки. При использовании игл неболь-
шого диаметра для того, чтобы убедиться в присутствии жидкости,
желательно выполнить аспирацию. Как последнее средство для устранения
обструкции через иглу может быть введено 0.1 мл воздуха, если жидкость все
же не получена, стилета возвращается в иглу, и игла продвигается вновь. Опи-
санные шаги повторяются до получения жидкости. Если игла продвинута до
канюли, а жидкость не получена, стилет извлекается на 3 мм, канюля повора-
чивается на 90 градусов, при этом на протяжении всего извлечения для полу-
чения жидкости желательно выполнение осторожной аспирации.
Спинномозговая анестезия
83
10. Если в какой-то момент отмечены явления парестезии, игла немедленно оста-
навливается. Иногда парестезия является быстропроходящей и невыражен-
ной, что указывает на проникновение в субарахноидальное пространство.
Если парестезия больше не наблюдается и получена жидкость, инъекция мо-
жет быть проведена как обычно. Более часто парестезия показывает, что игла
находится в спинномозговом канале, однако отклонилась от срединной ли-
нии и ее направление необходимо изменить. Во время явлений парестезии
инъекция не должна производиться ни при каких обстоятельствах.
11. Если жидкость получена, к канюле присоединяется шприц с раствором анес-
тетика. Канюля фиксируется рукой, упирающейся в спину пациента, и удер-
живется на месте между большим и указательным пальцами (рис. 6.5). Перед
инъекцией для подтверждения нахождения иглы в субарахноидальном про-
странстве производится осторожная аспирация 0.1-0.2 мл спинномозговой
жидкости. Раствор вводится медленно (0.5 мл в секунду). Для подтверждения
того, что игла не сместилась во время инъекции, после введения дозы вновь
аспирируется цереброспинальная жидкость. Аспирированная цереброспина-
льная жидкость вводится обратно и шприц, игла и проводник извлекаются
как единое целое.
12. После этого пациента просят вытянуть ноги. Если вводился изобарический
раствор, изменение положения тела перед хирургическими манипуляциями
может несколько повлиять на уровень анестезии. Если вводился гипобариче-
ский раствор, положение пациента, необходимое для хирургического вмеша-
тельства, должно быть обеспечено еще до инъекции (коленно-локтевое или
боковое положение) и не должно меняться в последующем. При использова-
нии гипербарического раствора, если требовалась низкая односторонняя ане-
стезия, пациент может оставаться на том же боку в течение 5 минут
(тотальной односторонней анестезии не достигается, однако на нижележащей
стороне анестезия будет более глубокой и продолжительной). Если пациент
сразу же повернулся на спину, уровень блокады обычно повышается до сред-
не-грудного. Для изменения положения тела больному оказывается помощь.
Интенсивное движение или перенапряжение могут стать причиной распро-
странения блокады. Ноги должны укладываться бережно для предотвраще-
ния давления на периферические нервы или костные выступы, поскольку
пациент в течение долгого времени не сможет предупредить о неудобстве,
связанном с давлением.
13. Сразу же должны быть измерены частота сердечных сокращений и кровяное
давление. Симпатические волокна анестезируются раньше других и венозный
кровоток в конечностях тотчас замедляется. Снижение венозного возврата мо-
жет вызвать понижение кровяного давления и частоты сердечных сокращений,
в особенности у пожилых пациентов и больных с волемическими нарушения-
ми. Постепенное повышение уровня анестезии также может привести к высо-
кой симпатической блокаде через 30-60 минут после инъекции, часто
проявляющейся выраженной брадикардией, а также снижением венозного воз-
врата, а блокада сердечных симпатических волокон дополнительно снижает
частоту сердечных сокращений (см. раздел «Осложнения» в этой главе).
14. Уровень температурной чувствительности проверяется через 2 минуты после
инъекции тампоном, смоченным в спирте (температурная чувствительность
анестезируется быстрее болевой). Этот ранний тест подтверждает наличие
анестезии и помогает определить уровень блокады. Если он ниже ожидаемо-
го, головная часть операционного стола должна быть опущена для создания
условий распространения гипербарического раствора в цефалическом на-
84
Глава 6
правлении. Распространение раствора начнется в течение первых 10 минут и
будет продолжаться до 30 минут после инъекции. Если определение темпера-
турной чувствительности затруднено, может быть использовано определение
чувствительности путем покалывания или точечным давлением.
15. В процессе операции желательна дополнительная оксигенация, особенно у
пожилых пациентов или у пациентов с высоким уровнем блокады или глубо-
ким седативным воздействием. Измерение уровня углекислого газа в выдыха-
емом воздухе может осуществляться через датчик, установленный либо в
лицевой маске, либо в назальный зонд, также весьма полезно наблюдение за
частотой дыхания. Во время длительных процедур может потребоваться се-
дативное воздействие, наркотическая или системная вагусная блокада пока-
зана при дистрессорном воздействии внутрибрюшных манипуляций.
16. В конце процедуры кровяное давление может вновь дестабилизироваться, что
требует тщательного наблюдения. Перемещение с операционного стола на ка-
талку и в послеоперационную палату часто связано с перераспределением кро-
ви и транзиторной гипотонией. Разрешения симпатической блокады следует
ожидать после исчезновения чувствительной и двигательной анестезии (вклю-
чая возвращение проприоцептивной чувствительности в большом пальце
ноги), однако перемещения должны осуществляться с осторожностью [10].
17. После пункции твердой мозговой оболочки для предотвращения спинальной
головной боли традиционно рекомендуется постельный режим в течение 24 ча-
сов. Подтверждением тому, что это уменьшает число случаев возникновение
головной боли нет, однако очевидно, что это задерживает развитие симптомов.
Поднятие тяжестей или переутомление лучше исключить, тем не менее, спин-
номозговая анестезия может применяться при амбулаторных хирургических
процедурах с ранней выпиской на амбулаторное лечение.
Пронированное положение
В том случае, если для хирургических манипуляций на ректальной или перианаль-
ной области выбирается коленно-локтевое положение, блокада может проводить-
ся после того, как пациент занимает это положение (что может уменьшить
возможность повреждений при поворотах анестезированного пациента). Посколь-
ку место операции обычно располагается выше уровня инъекции, положение про-
нации хорошо подходит для использования гипобарических растворов.
1. Пациент помещается в положение пронации на операционном столе с вали-
ком из подушки или одеяла под бедрами для сгибания нижней части спины.
Для удобства пациента его руки помещаются на подставки для рук (рис. 6.8).
Сгибание операционного стола помогает удерживать гипобарический рас-
твор в каудальном отделе.
2. Также как и при анестезии в боковом положении для обезболивания кожи и
введения проводниковой иглы анатомическими ориентирами являются ости-
стые отростки и подвздошные гребни. Ориентиры для выравнивания направ-
ления иглы такие же, как и в положении на боку. Доступ облегчается, если
имеются трехмерные анатомические данные.
3. Часто необходимо проведение аспирации, поскольку давление спинномозго-
вой жидкости в этом положении является относительно низким. Инъекция
должна производиться медленно, а игла не извлекаться до развития анесте-
зии. Анестезия подтверждается осторожными точечными покалываниями
или прикладыванием тампона, смоченным спиртом, к обеим сторонам периа-
нальной области.
Спинномозговая анестезия
85
Рис. 6.8. Копенно-локтевое положение.
При положении пациента на согнутом операционном столе (как это делается для проктологических
манипуляций) может быть использована спинномозговая анестезия гипобарическим раствором.
Линия сгиба операционного стола должна располагаться прямо под бедренными суставами,
использование валика, подложенного под бедра, помогает достичь сгибания, необходимого для
идентификации остистых отростков поясничных позвонков. Для подтверждения пункции твердой
мозговой оболочки часто бывает необходимо выполнение аспирации через спинальную иглу, так
как низкое давление цереброспинальной жидкости в этом положении не позволяет ей вытекать
самостоятельно
Положение сидя
У тучных пациентов или в случае, когда идентификация срединной линии за-
труднена, использование положения сидя часто помогает определить ориентиры
этой линии. Если пациент остается в этом положении после инъекции гипербари-
ческого раствора анестетика, возникает сакральная анестезия с классической
седловидной блокадой.
1. После того, как подсоединены следящие устройства, пациенту предлагают
сесть на операционный стол и повернуться так, чтобы ноги оказались на про-
тивоположной от оператора стороне. Седативное воздействие должно быть
минимальным. Для предания нужного положения тела может понадобиться
помощь. Ступни лучше опереть на стул так, чтобы бедра были несколько со-
гнуты. Спина должна оказаться как можно ближе к краю стола, а пациенту
предлагается «сгорбиться» так, чтобы согнутой оказалась нижняя часть спи-
ны (рис. 6.9). Сгибание может быть увеличено, если пациент наклонится впе-
ред и обопрется на устойчивую опору.
2. Подвздошные гребни и остистые отростки идентифицируются и маркируют-
ся так же, как и в положении на боку. У тучных пациентов межостистая линия
наиболее часто проходит через промежуток между III и IV поясничными по-
звонками, а не через IV и V поясничные позвонки. Намеченная точка ввода
иглы помечается маркером «X».
3. Выполняется обработка кожи и ее укрытие, которое может быть ограничено
одним полотенцем, кроме случаев использования самоклеящегося материала.
86
Глава 6
Рис. 6.9. Положение сидя для спинномозговой анестезии.
Ноги пациента свешиваются с края операционного стола, ступни опираются на стул для фиксации
сгибания в нижней части спины. Плечи наклоняются вперед, а сгибание пациента поддерживается
крепко зажатой подушкой, удерживаемой у живота. Если использовались седативные средства, в
этом положении пациента должен поддерживать ассистент, который кроме этого осуществляет
наблюдение за жизненноважными показателями. Это положение является оптимальным для
идентификации срединной линии у тучных пациентов, или у лиц с анатомическими особенностями
позвоночника
4. Инфильтрационная анестезия в месте инъекции и продвижение иглы выпол-
няется так же, как и в положении на боку. Если определение средней линии
затруднено, инфильтрационная игла небольшого диаметра может быть испо-
льзована для осторожного поиска остистых отростков. У больных, страдаю-
щих ожирением, с этой целью может быть использована 3.5-дюймовая игла
диаметром 25 G.
5. Кроме случаев выполнения истинной седловидной блокады игла удаляется
после инъекции, а пациенту сразу же помогают лечь на спину. Ноги переме-
щаются осторожно, поскольку они уже могут находиться в состоянии онеме-
ния. Если планируется выполнение чистой сакральной анестезии, пациент
остается в положении сидя в течение 5 минут, тем не менее, при этом будет
наблюдаться некоторое цефалическое распространение блокады.
Парамедианный (боковой) доступ
Классический срединный доступ, имеющий преимущество простоты выполне-
ния, подходит для большинства пациентов. У некоторых пожилых пациентов ме-
жостистая связка может быть в значительной степени кальцинирована, у
некоторых молодых пациентов продвижение иглы через эту плотную структуру
может быть затруднено. Прохождения этой связки можно избежать, используя
другие доступы.
Одной из альтернатив является боковой доступ, который также прост и тре-
бует для попадания в то же самое пространство отступа на полпальца от средней
линии. Игла вводится при небольшом медиальном отклонении, а также с обыч-
Спинномозговая анестезия
87
Рис. 6.10. Введение спинальной иглы, латеральный и парамедианный доступы.
При классическом срединном доступе игла проводится через межостистую связку с небольшим
краниальным отклонением и выходит через треугольную желтую связку в эпидуральное пространство
перед проколом твердой мозговой оболочки.. У пожилых пациентов с кальцифицированной
межостистой связкой точка ввода иглы может быть перемещена на ширину пальца латеральнее связки,
игла вводится до срединной линии, достигая желтой связки под небольшим углом. Третьим способом
является пункция кожи еще латеральнее и ниже по отношению к межпозвоночному пространству (на
палец от нижнего края остистого отростка) и проведение иглы прямо перпендикулярно до пластины
дуга позвонка, и ее дальнейшее продвижение с отклонением вверх и медиально до контакта со
связкой. Все три доступа подходят для выполнения как спинномозговой, так и эпидуральной
анестезии
ным краниальным отклонением (рис. 6.10). Для продвижения иглы полезно ис-
пользовать индивидуальные трехмерные анатомические данные, при этом кон-
чик иглы должен быть отклонен от средней линии так, чтобы достичь ее на
глубине желтой связки. С этого момента продвижение иглы и инъекция произво-
дятся так же, как описано выше, однако прохождения межостистой связки не тре-
буется.
Парамедианный или косой боковой доступ также начинают латеральнее
срединной линии, но на уровне остистого отростка у нижнего края межпозвоноч-
ного пространства. Отсюда игла должна быть направлена под углом 45 градусов
к средней линии и под углом 45 градусов в краниальном направлении до дости-
жения желтой связки в месте прохождения срединной линии (рис. 6.10). Вариан-
том этого доступа является проведение иглы непосредственно до пластины дуги
позвонка, а затем ее отклонение вверх для прохождения в желтой связке над вер-
хним краем дуги позвонка. Это дает возможность анестезиологу предвидеть глу-
бину нахождения связки, однако такой прием может стать причиной некоторого
дискомфорта пациента. Косой доступ обеспечивает идеальный угол для введе-
ния катетера, поскольку образующийся по отношению к коже угол уменьшает
возможность перегиба катетера.
88
Глава 6
Доступ Тейлора
У некоторых пациентов ни один из выше описанных доступов не позволяет про-
никнуть в спинномозговой канал в связи с кальцификацией или закрытием меж-
позвоночных пространств вследствие выраженных рубцовых изменений. В
таких случаях люмбо-сакральное отверстие (на уровне L-5-S-1) может быть все
еще проходимым, поскольку оно является наибольшим отверстием, ведущим в
спинномозговой канал. Латеральный косой доступ к этому пространству обозна-
чают как доступ Тейлора, в честь уролога, который популяризировал его исполь-
зование.
1. Этот доступ может использоваться у пациентов, находящихся в коленно-лок-
тевом положении, в положении на боку или сидя.
2. Идентифицируется задне-верхняя подвздошная ость, после чего кожа марки-
руется на 1 см медиальнее и 1 см ниже этой точки. Промежуток между V пояс-
ничным позвонком и крестцом также идентифицируется и маркируется.
3. После обезболивания кожи вводится четырех-пяти дюймовая игла, которая
направляется под углом приблизительно 45 градусов в краниальном направ-
лении и под углом приблизительно 45 градусов в медиальном направлении и
проводится к средней линии в пространство под V поясничным позвонком
(рис. 6.11). Более длинные иглы обычно требуются потому, что угол введения
создает более протяженную траекторию. Потеря сопротивления, создаваемо-
го связкой, и ощущение пункции твердой мозговой оболочки в этом случае
такие же, как и при срединном доступе.
Рис. 6.11
Доступ Тейлора
для спинномозговой анестезии.
Игла проводится на 1 см медиальнее
и 1 см ниже задне-верхней подвздошной
ости и продвигается под углом
45 градусов к средней линии и
45-градусным краниальным отклонением.
При контакте с дугой позвонка
направление иглы изменяется кверху и
медиально для проникновения в
пространство L-5-S-1
4. При коленно-локтевом положении может понадобиться аспирация спинно-
мозговой жидкости. При других положениях подтверждение пункции твер-
дой мозговой оболочки и инъекция препарата производятся так же, как
описано выше.
Установка постоянного катетера
Как и при эпидуральной анестезии, в субарахноидальное пространство может
быть введен катетер. Методика этой процедуры идентична установке постоянно-
го катетера при эпидуральной анестезии (см. главу 7) за исключением того, что
игла, посредством которой устанавливается катетер, продвигается до получения
Спинномозговая анестезия
89
жидкости; затем через ее просвет проводится катетер. Срез иглы должен быть на-
правлен краниально или каудально (в зависимости от направления анестезии);
при латеральном направлении будут возникать препятствия для проведения ка-
тетера. Используются те же самые препараты, как и при обычной спинальной
пункции. Должны быть предприняты меры предосторожности для предотвраще-
ния введения чрезмерных доз, поскольку в этом случае создается значительная
возможность накопления местного анестетика, что может вызвать местную ней-
ротоксичность (см. главу 3). Перед добавочной инъекцией следует выждать
время, необходимое для начала действия анестетика, проверка начала действия
должна проводиться в сакральных сегментах, где при каудально направленном
катетере действие препарата начнется раньше. После установленных интервалов
(от 40 до 90 минут в зависимости от препарата) могут быть проведены дополни-
тельные инъекции, начинающиеся с половины установленной дозы. Обычно,
время между инъекциями составляет 2/3 от ожидаемой продолжительности дей-
ствия первой дозы. Поскольку катетер и коннектор составляют при определении
объема инъецированного анестетика «мертвое пространство», катетер после
каждой инъекции должен быть промыт аспирированной спинномозговой жидко-
стью. Раствор препарата и наполненные шприцы должны быть закрыты для со-
хранения стерильности. Разбавление раствора местного анестетика может
сделать его введение более удобным.
Установка постоянного катетера связана с теоретическим риском инфици-
рования, поскольку в субарахноидальное пространство вводится инородное
тело. Достоверных доказательств увеличения этого риска не существует. Тем не
менее, должна быть обеспечена стерильность катетера, коннектора и шприца.
Частота случаев постспинальной головной боли может возрастать в связи с тем,
что для проведения катетера используются большие иглы. Эта методика хорошо
изучена у пожилых пациентов, риск развития у которых постспинальной голов-
ной боли небольшой.
Осложнения
Гипотония
Гипотония является наиболее частым побочным эффектом при спинномозговой
анестезии и вызвана прямым следствием венозного застоя и артериолярной диля-
тации, вызванной симпатической блокадой. Выраженность снижения кровяного
давления зависит от выраженности симпатической блокады, интраваскулярного
объема пациента и состояния сердечно-сосудистой системы [1,5] (табл. 6.4). Сни-
жение давления может быть уменьшено путем предварительного введения, по ме-
ньшей мере, 250-500 мл кристаллоидного раствора, однако эти данные не
достоверны. Если снижение давления происходит внезапно, до перераспределения
жидкости для временной поддержки давления показано введение вазопрессорного
средства умеренного действия. Внутривенное дробное введение эпинефрина в до-
зах 5—10 мг является средством выбора, поскольку этот препарат вызывает не толь-
ко вазоконстрикцию, но и повышает сердечный выброс [11]. Продолжительность
этой терапии составляет только 5-10 минут, для более длительной поддержки мо-
жет понадобиться внутримышечное введение дозы в 25 мг. Фенилэфрин является
вторым обоснованным выбором при наличии тахикардии, однако этот препарат
вызывает вазоконстрикцию с минимальным повышением (или снижением) сер-
дечного выброса [12].
90
Глава 6
Таблица 6.4
Сердечно-сосудистый ответ на субарахноидальную блокаду на 20-й минуте
Уровень Th-10 Уровень Th-1
Среднее артериальное давление -8% -22%
Частота сердечных сокращений Не изменяется -14%
Периферическое сопротивление -10% -7%
Сердечный выброс Не изменяется -19%
Адаптировано из Sivarajan М., Amory D. W., Lindbloom L.E., Schwettmann R.S., Systemic and regional
blood-flow changes during spinal anesthesia in the rhesus monkey. Anesthesiology 43: 78, 1975.
Поднятие ног помогает восстановить нарушенный кровоток, однако опуска-
ние головы во время спинального введения гипербарического раствора может
привести к незапланировано высокому уровню блокады. Идеальным компромис-
сом является сгибание операционного стола, поскольку ноги могут быть подня-
ты, в то время как голова остается на прежнем уровне или приподнимается, что
повышает венозный возврат с одновременной задержкой распространения сим-
патической блокады. Быстрое повышение уровня блокады должно подсказать
новичку о необходимости быстро привести операционный стол в положение с
приподнятым головным концом и опущенным ножным для остановки цефаличе-
ского распространения блокады. Эта ситуация особенно опасна, поскольку уси-
ливает венозный застой.
Несмотря на то, что введение жидкости является средством выбора для кор-
рекции нарушений, вызванных спинальной гипотонией, у пожилых пациентов или
при ограничении резервных возможностей миокарда оно должно проводиться с
осторожностью. Введение 1.5—2 литров солевого раствора может привести к быст-
рому развитию сердечной недостаточности у предрасположенных пациентов при
сочетании спинномозговой анестезии и симпатической блокады. В этой ситуации,
если спинномозговая анестезия является методикой выбора, более подходящим
средством компенсации является введение вазопрессорных средств. Другим сред-
ством в группе высокого риска является дробное введение небольших доз местно-
го анестетика через спинальный катетер при постоянном наблюдении за давлени-
ем крови. Эта методика связана с более низкими требованиями в отношении
дополнительного объема жидкости и введения вазопрессоров [13].
Брадикардия
Даже в отсутствии гипотонии или гипоксии во время спинномозговой анестезии
и даже на 30-45 минуте после ее начала может наблюдаться независимое возник-
новение брадикардии (редко) [14]. При уровне спинномозговой анестезии, до-
стигающем Th-2, блокируются сердечные симпатические волокна, и действие
вагуса становится не компенсированным. Брадикардия может быть вызвана та-
кими факторами как тракция брюшины или снижение венозного возврата, ее
происхождение может быть необъяснимым. При частоте сердечных сокраще-
ний, замедленной до 60-50 или 45 ударов в минуту сердечный выброс падает до
того уровня, на котором становится неадекватным миокардиальный кровоток и
происходит его быстрое ухудшение (рис. 6.12). Брадикардия с частотой ниже 50
ударов в минуту отмечается у 13 % обычных пациентов [ 15] и даже может быстро
прогрессировать до асистолии и остановки сердца [14]. Ранним лечением являет-
Спинномозговая анестезия
91
ся введение атропина (от 0.6 до 1.0 мг) и эфедрина, что может разорвать этот по-
рочный круг, однако эти препараты будут не эффективными, если циркуляция
крови уже прекратилась. В этой ситуации для восстановления циркуляции необ-
ходимо проведение наружного массажа сердца хирургом (или кем- либо из пер-
сонала) и внутривенное введение эпинефрина. При быстро начатом лечении
последствия этого осложнения наблюдаются редко (рис. 6.12).
Рис. 6.12. Внезапная брадикардия во время спинномозговой анестезии.
В момент времени, отмеченный стрелкой, у 85 летней пациентки была выполнена спинномозговая
анестезия 50 мг лидокаина. Несмотря на профилактическое введение 25 мг эфедрина частота
сердечных сокращений снизилась до 68 ударов в минуту и на 8 минуте после инъекции внезапно
развилась асистолия, устраненная анестезиологом. Частота этого феномена не известна. (По
материалам и с разрешения Mackey D. С., Carpenter R. С., Thompson G. Е., Brown D. L., Bodily М. N.
Bradycardia and asystole during spinal anesthesia: A report of three cases without morbidity.
Anesthesiology 70: 142, 1989)
Раннее распознавание этого осложнения является необходимым, так как
превентивное или раннее лечение легче и менее драматично, чем компрессия
грудной клетки в операционной. Использование от 0.4 до 0.6 мг атропина целесо-
образно всякий раз, когда пульс замедляется ниже 60 ударов в минуту.
Тотальная спинномозговая анестезия
Термин тотальная спинномозговая анестезия используется для обозначения си-
туации, когда анестетик достиг шейного отдела. Этот уровень блокады обычно
возникает непреднамеренно в результате неожиданных движений пациента, не-
правильного позиционирования или неправильной дозировки. Основными по-
следствиями являются потеря сознания, выраженная брадикардия, гипотония и
остановка дыхания. Несмотря на то, что может отмечаться паралич диафрагмаль-
ного нерва, остановка дыхания обычно развивается вследствие ухудшения кро-
воснабжения ядра дыхательного центра. К счастью, при распространении
местного анестетика так далеко в цефалическом направлении, концентрация пре-
парата обычно снижается — двигательный паралич является ограниченным, а
его течение коротким. Необходимо раннее распознавание этого осложнения для
предотвращения остановки сердца и гипоксического повреждения органов.
Лечение тотальной спинномозговой анестезии — симптоматическое. Под-
держивающая вентиляция легких должна быть обеспечена немедленно. Может
понадобиться эндотрахеальная интубация и механическое устройство для венти-
ляции. Для поддержки сердечного выброса быстро вводится атропин, эфедрин и
жидкость. Пациент обычно впадает в бессознательное состояние, но все же уме-
стно его словесное подбадривание, если он стремятся к восстановлению созна-
ния. Если необходимо осуществление поддерживающей вентиляции легких, це-
92
Глава 6
лесообразно использование амнестических средств. Если вентиляция и перфузия
полностью восстановлены, остаточные явления не наблюдаются.
Целесообразно принятие профилактических мер. После инъекции следует
избегать значительных перемещений и положений с запрокинутой головой (при
гипербарических растворах).
Тошнота
Часто сопутствующая высокой спинномозговой и эпидуральной анестезии тош-
нота является мучительным, но все же относительно неопасным побочным эф-
фектом. Она может возникать вследствие гипотонии, брадикардии или гипоксии.
Часто тошнота возникает как последствие нарушения соотношения симпатиче-
ского и парасимпатического тонуса внутренних органов и атропин в этом случае
является первым средством помощи [11]. Если этот препарат не помогает, могут
быть использованы противорвотные средства, например, 2 мг ондансетрона или
0.625 мг дроперидола. Препараты, вызывающие вазодилатацию, такие как хлор-
промазин, не подходят, однако могут быть рекомендованы антигистаминные
средства, производные фенотиазина или антагонисты серотонина.
Если спинномозговая анестезия выполнялась в связи с «полным» желудком,
лечения тошноты сильными седативными средствами необходимо избегать. Это
может привести к снижению респираторных рефлексов, что в свою очередь по-
вышает риск аспирации рвотного содержимого.
Постспинальная головная боль
Этот тип головной боли возникает вследствие подтекания спинномозговой жид-
кости через не закрывшееся пункционное отверстие твердой спинномозговой
оболочки. Результатом истечения жидкости для спинного и головного мозга счи-
тается растяжение менингеальной оболочки, происходящее всякий раз при вер-
тикальном положении тела. Это является признаком постспинальной головной
боли, возникающей, когда пациент встает и проходящей, когда он ложится. Этот
патогномоничный признак часто является единственным диагностическим про-
явлением. Локализация и выраженность этого осложнения являются различны-
ми, головная боль может начаться даже через несколько дней после
спинномозговой пункции [5].
Осложнение чаще наблюдается у молодых пациентов. Женщины подверже-
ны ему несколько чаще, чем мужчины, беременные женщины, в особенности.
Также важен размер иглы. При использовании игл с закругленным срезом и игл
небольшого диаметра частота случаев головной болидостоверно снижается [16],
такие иглы можно считать обоснованным выбором (рис. 6.13). Пребывание в по-
ложении лежа будет задерживать развитие симптомов, но не снижает частоту
случаев развития головной боли. Пользование воздушным транспортом, резкие
подъемы и напряжение будут приводить к появлению симптомов, даже после
успешного формирования эпидуральной кровяной пломбы.
Головная боль протекает в легкой форме и всегда проходит самостоятельно
без неврологических осложнений. Даже в редких случаях диплопии, которая воз-
никает вследствие перерастяжения отводящего нерва, она полностью разрешает-
ся. В 2/3 случаев головная боль самостоятельно проходит в течение недели, одна-
ко в редких случаях может длиться в течение месяцев. Стандартное лечение
включает в себя постельный режим, прием анальгетиков, а также питьевой ре-
жим с повышенным потреблением жидкости (несмотря на то, что эффективность
этого не доказана). Более специфическим лечением является формирование эпи-
Спинномозговая анестезия
93
Рис. 6.13. Зависимость возникновения постспинальной головной боли от иглы.
Несмотря на то, что при пункциях иглами Quincke, имеющих наименьший диаметр, возможность
возникновения постспинальной головной боли снижается, их применение чаще связано с
техническими трудностями. Иглы с закругленным срезом достоверно снижают частоту головной
боли (по материалам и с разрешения: Mulroy М. F., Wills R. Р. Spinal anesthesia for outpatients:
Appropriate agents and techniques. J. Clin. Anesth. 7: 622, 1995)
дуральной кровяной пломбы (см. главу 7). Выбор и применение этого лечения за-
висит от выраженности головной боли и от бытовых условий пациента. При
средневыраженной головной боли у пациентов хирургического стационара лече-
ние может быть менее неотложным, чем при головной боли такой же степени вы-
раженности у недавно родивших женщин, стремящихся поскорее домой для ухо-
да за ребенком.
Профилактика — самое дешевое лечение. Число случаев головной боли мо-
жет быть уменьшено путем использования у молодых пациентов эпидуральной
анестезии. Если у молодых пациентов выполняется спинномозговая анестезия,
следует использовать иглы с наименьшим диаметром и с закругленным срезом,
обычно для этого используются иглы диаметром 25 или 27 G, с кончиком типа
Whitacre. Пациенты должны быть предупреждены в отношении поднятия тяже-
сти, планирования путешествия на воздушном транспорте сразу после выполне-
ния спинномозговой пункции. Спинномозговая анестезия не противопоказана в
амбулаторных условиях, однако если после процедуры пациент должен уехать
на значительное расстояние от амбулаторного хирургического центра и его воз-
вращение для формирования эпидуральной кровяной пломбы чрезвычайно за-
труднительно, должны быть использованы другие методики.
Нейропатия
Повреждение нервов непосредственным введением препарата (при правильной
дозе и концентрации) встречается исключительно редко [17,18] (см. главу 3). Не-
смотря на то, что лабораторные исследования подтверждают, что нервная ткань
может быть повреждена любым из местных анестетиков, в клинических условиях
это происходит нечасто. Основная проблема в этом отношении связана с использо-
ванием спинальных микрокатетеров, посредством которых через короткие проме-
жутки времени вводятся повторные дозы, приводящие к созданию токсической
концентрации в области конского хвоста. Такие катетеры должны использоваться
с осторожностью, если они вообще должны использоваться (см. главу 5).
Повреждение нерва может наблюдаться при непосредственном введении
иглы в нервный корешок, что обычно вызывает выраженную парестезию во
время проведения блокады [19]. Интраневральная инъекция, проявляющаяся
парастезией во время введения препарата, приводит к повреждению нерва.
94
Глава 6
Причиной этого осложнения становится также загрязнение анестетика раство-
рами для обработки кожи, детергентами, химическими веществами для стери-
лизации.
Наличие подтвержденного неврологического нарушения не является проти-
вопоказанием для проведения спинномозговой анестезии. В общем, использова-
ние спинномозговой анестезии нежелательно при демиелинизирующих заболег
ваниях. Тем не менее, данных о том, что это ухудшает состояние, например, при
рассеянном склерозе нет.
В отношении беспокойства о возможном развитии нейропатии данные о бо-
льшом числе случаев показывают, что безопасность спинномозговой анестезии,
прежде всего, зависит от ее правильного выполнения.
Боль в спине
Боль в спине в месте инъекции может быть связана с множественной выражен-
ной периостальной травмой, однако более часто причина боли в спине после
спинномозговой или эпидуральной анестезии является неспецифической и свя-
зана с натяжением связок, которое отмечается при релаксации мышц спины. Это
также наблюдается после общей анестезии в положении на спине, особенно, если
она была выполнена на жестком плоском операционном столе. В любом случае
согревание и отдых обычно приносят облегчение через 1-2 дня. На этот досад-
ный побочный эффект жалуются приблизительно 40% пациентов.
Снижение слуха
После спинномозговой анестезии описаны случаи транзиторного непродолжите-
льного снижения слуха. Механизм этого явления неясен и может быть связан с
временным снижением давления черепно-мозговой жидкости или тракцией
внутричерепных нервов. Частота этого осложнения повышается при использова-
нии игл относительно большого диаметра (22 по сравнению с 26 G) [20, 21]. Это
осложнение является временным и невыраженным, однако четко зарегистриро-
ванным при аудиометрии и может явиться побочным эффектом, причиняющим
беспокойство некоторым пациентам.
Субдуральная инъекция
Субдуральное пространство по существу является потенциальным пространст-
вом между твердой мозговой и арахноидальной оболочками. При проведении
спинномозговой анестезии его обычно проходят незамеченным. В редких случа-
ях местный анестетик попадает через иглу или катетер в это пространство, в резу-
льтате чего инъецируемый препарат здесь широко распространяется. Если
введенная доза соответствует дозе, предназначавшейся для субарахноидального
введения анестетика (небольшая доза), несмотря на широкое распространение
препарата, результат анестезии нервов будет минимальным и разнородным, чем
можно объяснить многие случаи неудачной спинномозговой анестезии. Если
инъецирована эпидуральная доза, широкое распространение анестетика под
твердой мозговой оболочкой приведет к неожиданно распространенной блокаде,
описываемой как массивная экстрадуральная анестезия. Эта ситуация более
проблематична, если предпринималась попытка эпидуральной анестезии или по-
слеоперационной анальгезии. При неудавшейся спинномозговой анестезии по-
вторная инъекция является наиболее простым решением (тем не менее, должны
Спинномозговая анестезия
95
быть предприняты меры предосторожности для предотвращения реинъекции че-
рез спинальные катетеры, как описано в разделе «Нейропатии» в этой главе).
Эпидуральная или спинномозговая гематома
Эпидуральная или спинномозговая гематома является исключительно редким,
но потенциально опасным осложнением, поскольку длительная компрессия нер-
вов может привести к их постоянному повреждению (см. главу 3). Несмотря на
то, что эти гематомы наиболее часто возникают спонтанно, они могут возник-
нуть при попадании иглы в эпидуральное венозное сплетение у пациентов с на-
рушением свертывания крови или у лиц, получающих антикоагулянты.
Гематому следует подозревать, когда действие спинномозгового анестетика про-
должается необычно долго, в этих случаях показано выполнение компьютерной
томографии или магнитно-резонансного исследования спинномозгового канала.
Единственным доступным лечением является ранняя хирургическая декомпрес-
сия (до 6-8 часов), однако она оказывается успешной только в 50% случаев.
Спинномозговой абсцесс или менингит
Абсцесс или менингит вследствие бактериальной инфекции является редким.
Отмеченные случаи загрязнения цереброспинальной жидкости кожными бакте-
риями или через инструментарий являются единичными [18]. Использование по-
стоянных катетеров, которые создают путь для загрезнения, может повышать
этот риск. Развитие менингита после люмбальной пункции у пациентов с бакте-
риемией возникает более часто, особенно, в педиатрии. В моделях на животных
лечение антибиотиками до выполнения люмбальной пункции устраняет этот
риск [3].
Диагностику абсцесса лучше проводить с КТ иЯМТ сканированием спинно-
мозгового канала, в то же время для подтверждения менингита и для определе-
ния чувствительности к антибиотикам необходима люмбальная пункция.
Использование люмбальной пункции у пациентов с уже имеющимся СПИ-
Дом является спорным. Вирус иммунодефицита человека проникает в спинно-
мозговую жидкость на ранних стадиях этого заболевания и у 40% пациентов со
СПИДом имеются клинические признаки нейропатии. Тем не менее, у таких па-
циентов проводятся нейроаксиальные процедуры, включая формирование эпи-
дуральной кровяной пломбы. У таких больных целесообразно проведение инди-
видуальной оценки соотношения риск/польза.
Литература
1. Butterworth, J. Physiology of spinal anesthesia: What are the implications for mana-
gement? Reg. Anesth Pain Med 23: 370,1998.
2. Ward, R. J., Bonica, J. J., Freund, F. G., Akamatsu, T., Danziger, F., Englesson, S. Epidu-
ral and subarachnoid anesthesia. Cardiovascular and respiratory effects. JAMA 191:
275,1965.
3. Carp, H., Bailey, S. The association between meningitis and dural puncture in bacteremic
rats. Anesthesiology 76: 739,1992.
4. Liu, S. S., Ware, P. D., Alien, H. W., Neal, J. M., Pollock, J. E. Dose-response cha-
racteristics of spinal bupivacaine in volunteers. Clinical implications for ambulatory
anesthesia. Anesthesiology 85: 729, 1996.
5. Liu, S. S., McDonald, S. B. Current issues in spinal anesthesia. Anesthesiology^^: 888,
2001.
96
Глава 6
6. Chiu, A. A., Liu, S., Caipenter, R L., Kasman, G. S., Pollock, J. E., Neal, J. M. The effects
of epinephrine on lidocaine spinal anesthesia: A crossover study. Anesth. Analg. 80:735,
1995.
7. Liu, S., Chiu, A. A., Carpenter, R L., Mulroy, M. E, Alien, H. W., Neal, J. M., Pol-
lock, J. E. Fentanyl prolongs lidocaine spinal anesthesia without prolonging recoveiy.
Anesth. Analg. 80: 730,1995.
8. Carpenter, R. L., Hogan, Q. H., Liu, S. S., Crane, B., Moore, J. Lumbosacral cereb-
rospinal fluid volume is the primary determinant of sensoiy block extent and duration
during spinal anesthesia. Anesthesiology 89:24,1998.
9. Wildsmith, J. A. Predicting the spread of spinal anaesthesia. Вт. J. Anaesth. 62:353,
1989.
10. Pflug, A. E., Aasheim, G. M., Foster, C. Sequence of return of neurological function and
criteria for safe ambulation following subarachnoid block (spinal anaesthetic). Can.
Anaesth. Soc. J. 25: 133,1978.
11. Ward, R J., Kennedy, W. E, Bonica, J. J, Martin, W. E., Tolas, A. G., Akamatsu, T. Experi-
mental evaluation of atropine and vasopressors for the treatment of hypotension of
high subarachnoid anesthesia. Anesth. Analg. 45:621,1966.
12. Brooker, R., Butterworth, J., Kitzman, D., Berman, J., Kashtan, H., McKinley, A.
Treatment of hypotension after hyperbaric tetracaine spinal anesthesia. A randomi-
zed, double-blind, cross-over comparison of phenylephrine and epinephrine. Anesthe-
siology 86: 797, 1997.
13. Schnider, T. W., Mueller-Duysing, S., Johr, M., Gerber, H. Incremental dosing versus
single-dose spinal anesthesia and hemodynamic stability. Anesth. Analg. 77: 1174,
1993.
14. Caplan, R. A., Ward, RJ., Posner, K., Cheney, F. W. Unexpected cardiac arrest during
spinal anesthesia: A closed claims analysis of predisposing factors. Anesthesiology 68:
5, 1988.
15. Caipenter, R L., Caplan, R. A., Brown, D. L., Stephenson, C., Wu, R Incidence and risk
factors for side effects of spinal anesthesia. Anesthesiology 76: 906,1992.
16. Mulroy, M. F., Wills, R P. Spinal anesthesia for outpatients: Appropriate agents and
techniques. J. Clin. Anesth. 7: 622, 1995.
17. Hodgson, P. S., Neal, J. M., Pollock, J. E., Liu, S. S. The neurotoxicity of drugs given
intrathecally (spinal). Anesth. Analg. 88: 797, 1999.
18. Horlocker, T.,*Wedel, D. Neurologic complications of spinal and epidural anesthesia.
Reg. Anesth. Pain Med. 25: 83,2000.
19. Auroy, Y.,Narchi, P., Messiah, A., Litt, L., Rouvier, B., Samii, К Serious complications
related to regional anesthesia: Results of a prospective survey in France. Anesthesio-
logy 87:479, 1997.
20. Schaffartzik, W., Hirsch, J., Frickmann, F., Kuhly, P., Ernst, A. Hearing loss after
spinal and general anesthesia: A comparative study. Anesth. Analg. 91:1466,2000.
21. Wang, L. P., Magnusson, M., Lundberg, J., Tomebrandt, K. Auditory function after
spinal anesthesia. Reg. Anesth. 18: 162,1993.
Глава 7
Эпидуральная анестезия
В отличие от спинномозговой анестезии эпидуральная анестезия является техни-
чески более сложной в выполнении, но более гибкой в отношении распростра-
ненности, выраженности и длительности анестезии. Эта методика является более
предпочтительной, чем спинномозговая анестезия, поскольку она является сег-
ментарной и более упорядоченной, а также приводит к меньшему числу случаев
возникновения головной боли у молодых пациентов. Возможность продолжите-
льной анальгезии в послеоперационном периоде с наркотическими веществами
или местными анестетиками через постоянный катетер в значительной степени
увеличивают популярность этой методики [1].
Анатомия
При эпидуральной блокаде анестезируются нервные корешки, отходящие от
спинного мозга в месте их прохождения центральной части перидурального про-
странства спинномозгового канала (см. главу 6). Спинальное эпидуральное про-
странство спереди ограничено телами позвонков, сзади пластинами их дуг и
желтой связкой, которая жестко связывает костные арки. Эта плотная связка со-
здает сплошную заднюю стенку пространства. Толщина этой связки составляет
от 3 до 5 мм, она имеет форму «шатра» с наиболее острым углом по средней ли-
нии (см. рис. 6.10). Две ее боковые части соединяются и переплетаются с перед-
ним расширением межостистой связки, которая расположена между остистыми
отростками. У пациентов с обычным строением тела желтая связка находится на
глубине от 3.5 до 5 см от кожи. Сбоку граница сформирована ножками связки, пе-
редний край которой ограничивает сзади межпозвоночное отверстие, через кото-
рое из эпидурального пространства выходят корешки спинномозговых нервов.
Размер этих отверстий зависит от уровня спинномозгового канала и возраста па-
циента. На каудальном конце спинномозгового канала тела крестцовых позвон-
ков сливаются, формируя передние и задние сакральные отверстия.
Терминальной точкой канала является каналец, лежащий вдоль срединной линии
крестцово-копчиковой мембраны.
Центральная часть канала занята спинномозговым мешком, положение ко-
торого поддерживается тонкими боковыми связками. Различное количество со-
единительной ткани, расположенной дорсально по срединной линии, удержи-
вает твердую мозговую оболочку в непосредственной близости от желтой
связки и редко может препятствовать проникновению катетера или распростра-
нению местного анестетика. Однако в целом эти перемычки не препятствуют
распространению растворов в эпидуральном пространстве. Набольшей шири-
ны эпидуральное пространство достигает в задней части срединной плоскости.
Спинномозговой мешок конически сходится и оканчивается рядом с V пояс-
ничным позвонком, делая каудальную часть канала наболее просторной. В
4—1685
98
Глава 7
шейном отделе объем эпидурального пространства меньше, здесь твердая моз-
говая оболочка дает отростки, проникающие в отверстия, через которые выхо-
дят корешки спинномозговых нервов. В поясничной области эти отростки
оканчиваются внутри канала. В цефалическом конце канала пространство
оканчивается в месте прикрепления твердой мозговой оболочки к краям боль-
шого затылочного отверстия.
Перидуральное пространство не является пустым, а заполнено рыхлой сое-
динительной и жировой тканью. В целом здесь имеется развитая венозная сеть,
особенно выраженная при беременности (см. рис. 6.1). В грудном отделе на
пространство влияет отрицательное давление, создаваемое в плевральной по-
лости. В поясничном отделе давление в пространстве может быть равным атмо-
сферному или быть несколько ниже его. Глубина пространства в задней части
варьирует от 3—4 мм в грудном отделе до 5-6 мм в поясничном отделе. Наиболь-
шей глубины пространство достигает между II и III поясничными позвонками.
Утолщение спинного мозга в местах отхождения плечевого и поясничного
сплетений сужают внутри позвоночное пространство соответственно на уров-
нях СЗ-Т2 и Т9-Т12.
Для создания эпидуральной анестезии, эквивалентной субарохноидальной
блокаде, требуется больший объем местного анестетика. Для поясничной облас-
ти обычно требуется объем в 10 раз больший, однако для заполнения пространст-
ва в грудном отделе, достаточно меньшего объема. Больший объем местного
анестетика должен заполнить большее пространство и проникнуть через защит-
ные слои, окружающие нервы. Требуются более высокие концентрации, начало
действия более медленное. Распространение раствора анестетика зависит от со-
держимого пространства. От места инъекции анестезия распространяется как в
цефалическом, так и в каудальном направлении (рис. 7.1), однако распростране-
ние вверх из цервикальной части канала ограничено связками, прикрепленными
к твердой мозговой оболочке. Это ограничивает распространение анестезии до
высоких уровней ствола мозга, что возможно при незапланированно высокой
спинномозговой анестезии.
Показания
Эпидуральная инъекция анестетика вызывает регионарную анестезию в дерма-
томном «поясе», распространяющуюся в цефалическом и каудальном направле-
ниях от места инъекции. Высота пояса будет сильно зависить от дозы и объема
введенного препарата, а также от уровня инъекции. Эпидуральная анестезия в
поясничных сегментах особенно подходит для хирургических вмешательств на
нижних отделах брюшной полости или хирургических манипуляций на бедре
или колене. Введение больших доз в люмбальном отделе или инъекция на тора-
кальном уровне могут быть использованы для хирургических вмешательств для
верхних отделах брюшной полости, однако при этом обычно требуется дополни-
тельная легкая общая анестезия для осуществления контроля за движением диа-
фрагмы и вентиляцией легких. Сочетание общей анестезии с эпидуральной
анестезией позволяет снизить потребность в общих анестетиках [2]. Торакальная
эпидуральная анестезия может быть использована при операциях на органах
грудной клетки или на молочной железе. Перидуральная анестезия в нижней час-
ти спинномозгового канала выполняется путем каудальных инъекций (см. главу
8) и наилучшим образом походит для хирургических вмешательств в зоне иннер-
вации крестцового нерва.
Эпидуральная анестезия
99
Рис. 7 Л. Диаграмма распространения местного анестетика в эпидуральном пространстве.
Развитие эпидуральной анестезии сначала заметно в сегментах, ближайших к месту инъекции;
распространение происходит в следующие 20 минут как цефалическом, так и в каудальном
направлении от этого уровня
Как и спинномозговая анестезия, эпидуральная анестезия обладает преиму-
ществами мышечной релаксации и снижения тонуса кишечника. В отличие от
спинномозговой анестезии эпидуральная блокада является сегментарной и может
вызывать анестезию различного числа дерматомов, что является идеальным в та-
ких ситуациях, как обезболивание родов или торакотомия. Кроме этого, она обес-
печивает дополнительную гибкость глубины и продолжительности. Возможность
установки катетера в эпидуральное пространство обеспечивает гибкое управление
продолжительностью анестезии независимо от выбора препарата. Это наилучшим
образом подходит для длительных хирургических процедур или при непредсказу-
емости длительности вмешательства, а также может являться превосходным выбо-
ром в амбулаторной хирургии, где регулировка длительности хирургических про-
цедур позволяет более легко справиться с потоком больных [3]. Эпидуральная
100
Глава 7
анестезия также является оптимальным средством при родах и родовспоможении,
когда необходимая длительность обезболивания неизвестна и требования к уров-
ню и выраженности анестезии различны. Постоянное эпидуральное обезболива-
ние через катетер оптимально в послеоперационном сопровождении в торакаль-
ной хирургии и при вмешательствах на верхних отделах брюшной полости (см.
главу 24). Сегментарная торакальная блокада также использовалась для облегче-
ния болей в грудной клетке при коронарной ишемии [4].
Возможность избежать головной боли, возникающей после пункции твер-
дой мозговой оболочки, делает эпидуральную анестезию особенно подходящей
для молодых пациентов. Отсутствие этого осложнения не может быть гарантиро-
вано пациенту, поскольку сохраняется достоверная возможность головной боли
после пункции твердой мозговой оболочки иглами большого диаметра. Противо-
показания к эпидуральной анестезии такие же, как и для спиномозговой и вклю-
чают в себя отказ пациента, наличие инфекции в месте инъекции, гиповолемию и
коатулопатию.
Препараты
При эпидуральной анестезии использовались почти все местные анестетики. Для
проникновения через защитные слои твердой мозговой оболочки и создания
адекватной чувствительной и двигательной блокады требуются более высокие
концентрации препаратов. Низкие концентрации (в отличие от спинномозговой
анестезии) вызывают симпатическую или сенсорную анальгезию без обшей дви-
гательной блокады.
2-хлорпрокаин в 2% или 3% концентрации вызывает прекрасную блокаду
для коротких процедур, обеспечивая хирургическую анестезию на 45-60 минут с
быстрым разрешением [5]. Это может быть идеальным выбором для некоторых
амбулаторных вмешательств [3]. Если используется методика с установкой кате-
тера, повторные инъекции могут быть сделаны с интервалом 45-60 минут или
при первых признаках регрессии анестезии. Прекращение анестезии, вызванной
хлорпрокаином во время операции, может быть неожиданно быстрым. Прокаин
не является надежным препаратом как эпидуральный анестетик.
Лидокаин (1.5% или 2%) будет вызывать абдоминальную анестезию в тече-
ние 60-90 минут. Мепивакаин (1% или 1.5%) может действовать на протяжении
90-120 минут (рис. 7.2). При использовании этих амидов средней длительности
действия через установленный катетер, повторные инъекции могут планировать-
ся через 75—90 минут. Для вмешательств на верхних отделах брюшной полости и
торакальных процедур эти препараты среднего действия прекрасно подходят для
введения через эпидуральный катетер, при разрешении блокады к концу хирур-
гического вмешательства они позволяют осуществлять вливания для поддержки
анальгезии.
Бупивакаин вызывает более длительно действующую анестезию. Адекват-
ную блокаду вызывает его 0.5 % раствор, однако добавление эпинефрина или ис-
пользование 0.75 % концентрации дают более глубокую двигательную блокаду.
Левобупивакаин обеспечивает анестезию по выраженности и длительности, эк-
вивалентную рацемической смеси. Ропивакаин оказывает схожее действие, од-
нако оно несколько менее выражено и несколько короче, поэтому, для одинако-
вого воздействия требуется использование концентраций в 0.75 % или 1 %.
Этидокаин в концентрации 1.5 % даст абдоминальную анестезию на 3-5 часов,
он обеспечивает лучшее распространение анестезии в каудальном направлении,
Эпидуральная анестезия
101
Рис. 7.2. Длительность эпидуральной анестезии.
Уровень сенсорной дерматомной блокады (с величинами стандартных отклонений) по отношению к
времени, прошедшему после инъекции, на уровне II поясничного позвонка 20 мл 3%
2-хлорпрокаина, 1.5% лидокаина, 1.5% мепивакаина с эпинефрином 1:200000. Средняя общая
продолжительность действия составила 133, 182 и 247 минут, соответственно (с разрешения и по
материалам Kopacz D. J., Mulroy М. F. Chloroprocaine and lidocaine decrease hospital stay and
admission rate after outpatient epidural anesthesia. Reg. Anesth. 15: 19, 1990)
чем бупивакаин. Тем не менее, этидокаин не является популярным препаратом в
связи с его более глубоким двигательным блоком.
Эпинефрин обычно используют для увеличения длительности действия
этих анестетиков, однако при эпидуральной анестезии для его применения есть и
другие показания. В связи с обильным кровоснабжением этого пространства дол-
жно проводиться введение тестовой дозы для обнаружения внутривенной инъек-
ции (см. главу 3). Эпинефрин обычно является очень важным компонентом этого
теста [6]. Эпинефрин будет также снижать пик системного уровня в крови и уси-
ливать блокаду [7]. Это усиление позволяет использовать меньшие концентра-
ции местных анестетиков, что в свою очередь снижает возможность развития си-
стемной токсичности. Эпинефрин может снижать развитие тахифилаксии,
иногда наблюдающейся при постоянном введении.
При эпидуральной анестезии добавление эпинефрина помогает сохранить
стабильность сердечно-сосудистой системы. Количество препарата, которое
подвергается системной абсорбции, оказывает положительное инотропное влия-
ние на миокард, что в некоторой степени компенсирует гипотензию, вызванную
вазодилятацией в нижних конечностях. Несмотря на то, что эпидуральная анес-
тезия на уровне грудных дерматомов снижает кровяное давление, при добавле-
нии эпинефрина к местному анестетику сердечный выброс действительно повы-
шается. Этот эффект не оказывает влияния на кровообращение в условиях
гиповолемии.
В прошлом при эпидуральной анестезии рекомендовались другие адъюван-
ты. Для ускорения начала действия и увеличения распространения анестезии ис-
пользовалась гиалуронидаза. Однако это вызывало ненадежную анестезию и по-
этому эта комбинация более не рекомендуется. Использование бикарбоната для
подщелачивания растворов, а также использование карбонатных солей обсужда-
102
Глава 7
лось во второй главе. Для улучшения аналгезирующего эффекта добавлялся кло-
нидин, однако его использование может быть ограничено вызываемыми им по-
бочными гемодинамическими влияниями и седативным действием [8, 9].
Наиболее эффективными добавками для послеоперационного синергизма с
местными анестетиками являются опиоиды [1,10]. Тем не менее, их интраопера-
ционные преимущества при эпидуральной анестезии не были изучены также ши-
роко, как их интратекальное применение.
Дозировки
Расчет дозировки при эпидуральной анестезии является более сложной задачей,
по сравнению с другими видами местной блокады. На распространенность пре-
парата в эпидуральном пространстве влияет множество факторов (табл. 7.1). На
выраженность анестезии, в основном, влияет общая доза препарата и объем вве-
денного раствора, однако изменения могут быть связаны как с пациентом, так и с
методикой выполнения процедуры.
Таблица 7.1
Факторы, влияющие на дозировки при эпидуральной анестезии
Основные факторы
Возраст пациента
Место инъекции
Второстепенные факторы
Вес пациента
Рост пациента
Положение
Беременность
Имеющие минимальное значение
Скорость вливания/дробность инъекции
Направление среза иглы
Наличие атеросклероза
Доза в миллиграммах
На высоту блокады влияют как общая доза в миллиграммах, так и объем введенно-
го раствора. При введении одинаковых объемов раствор с более высокой концент-
рацией (с большей дозой в мг) будет вызывать большее распространение. Более
разбавленный раствор (с большим объемом) при одинаковой дозе в миллиграммах
будет распространяться дальше, чем раствор с меньшим объемом и более высокой
концентрацией. В целом, большее разбавление раствора может быть использовано
для обеспечения его распространения и снижения общей дозы в миллиграммах
(это уменьшит возможность развития системной токсичности).
Влияние увеличения инъецированного объема не линейно и верхний предел
полезных изменений ограничен приблизительно 20 мл при люмбальной инъек-
ции. На этом уровне дальнейшее повышение объема вводимого раствора приве-
дет к его вытеканию из эпидурального пространства через межпозвоночные от-
верстия (особенно у молодых пациентов).
Эпидуральная анестезия
103
Рис. 7.3. Влияние возраста на дозу при эпидуральной анестезии.
Доза, требуемая для эпидуральной анестезии, снижается с возрастом. Здесь показано использование
2% лидокаина при широком возрастном диапазоне. Несмотря на общую тенденцию, наблюдается
широкий разброс, который делает индивидуальное предсказание, основанное только на возрасте,
исключительно трудным (с разрешения и по материалам Bromage Р. R. Epidural Analgesia.
Philadelphia: Saunders, 1978. P. 138)
Факторы пациента (возраст, рост, вес)
В определении дозы, требуемой для эпидуральной анестезии, факторы пациента
играют более важную роль, чем при подборе дозы для спинномозговой анесте-
зии. Наиболее значительным фактором, влияющим на распространение эпидура-
льной анестезии, является возраст (рис. 7.3). Меньшие объемы вызывают более
высокое распространение у пожилых пациентов [11]. Это может быть связано с
происходящим с возрастом сужением межпозвоночных отверстий. У молодых
пациентов эти отверстия способны выпускать инъецируемый раствор, что требу-
ет повышения дозы местного анестетика, необходимой для анестезии определен-
ного числа сегментов. Эта зависимость не является линейной. Вторым фактором
является вес тела. Для полных пациентов требуется меньшая доза. Третьим фак-
тором, влияющим на дозу, является рост. Для высоких пациентов требуется бо-
льше раствора, однако это, как и вес, оказывает меньшее влияние, чем возраст.
Особенности методики
Гравитация оказывает минимальный клинический эффект, однако она является
причиной, оправдывающей проведение блокады на стороне оперативного вме-
шательства. К сожалению, положение сидя не позволяет повысить распростране-
ние выше крестцовой области. На распространение влияет место инъекции.
Каудальная анестезия требует больших объемов, для достижения уровня блока-
ды Th-10 обычно требуется 25 мл. Торакальная анестезия может быть достигнута
104
Глава 7
6 мл или 8 мл раствора, введенного на торакальных уровнях, поскольку здесь
эпидуральное пространство имеет наименьший объем. Направление среза иглы и
скорость инъекции оказывают небольшое влияние на распространение. Если ка-
тетер продвинут в пространстве более чем на 5 см, скорее всего он расположится
в стороне от средней линии, часто рядом с межпозвоночным отверстием, созда-
вая условия для истечения инъецируемой жидкости из канала [12]. К счастью, от-
носительно гомогенное распределение анестетика нивелирует эти факторы.
Определение дозы препарата для эпидурального введения является в значи-
тельной степени эмпирическим. Несмотря на то, что каждый из упоминавшихся
факторов имеет некоторую математическую корреляцию с высотой блокады в
популяции в целом, степень влияния каждого из них настолько широка, что дела-
ет точную дозировку невозможной. Некоторые авторы используют соотношение
«миллилитр/сегмент», однако все соглашаются, что в каждой формуле имеются
широкие отклонения и что возраст или общая доза могут нарушать это соотноше-
ние. Обоснованной оценкой выглядит использование соотношения объема или
дозы в миллиграммах с планируемым распространением у данного пациента, а
также увеличение или уменьшение объема в зависимости от наиболее важных
индивидуальных факторов, в особенности от возраста, роста и веса пациента
(рис. 7.4). Начало анестезии с небольших доз и дробное добавление препарата че-
рез катетер является обоснованным подходом, в особенности у пожилых или
тучных пациентов.
«Стартовая» Изменение
доза
Торакальная инъекция
Молодой, худой, высокий
Старый, полный, низкий
Увеличение на 2-4 см3
Уменьшение на 2 см3
Люмбальная инъекция
Молодой, худой, высокий
Старый, полный, низкий
Увеличение на 6-10 см3
Уменьшение на 3-6 см3
Рис. 7.4. Расчет эпидуральной дозы
Техника
Техника выполнения эпидуральной блокады является схожей с техникой спин-
номозговой анестезии. Как и при субарахноидальной блокаде может быть испо-
льзовано несколько положений пациента и несколько доступов к эпидуральному
пространству. Ниже будет описан классический срединный доступ при положе-
нии на боку, однако другие доступы и положения, описанные в главе 6, также
применимы, включая коленно-локтевое положение.
1. Пациент помещается в положение на боку с валиком под головой для вырав-
нивания спины параллельно поверхности операционного стола. Плечи, так
же как и бедра располагаются перпендикулярно поверхности стола. Колени
приводятся к голове, голова наклоняется вниз к коленям для придания внут-
риутробного положения с максимальным сгибом в поясничном отделе.
Эпидуральная анестезия
105
2. Подвздошные гребни и остистые отростки маркируются также, как и при
спинномозговой анестезии. Меткой «X» обозначают намеченное межпозво-
ночное пространство.
3. Обрабатывают кожу, обкладывают место инъекции, проводят местное инфи-
льтрационное обезболивание, как и при спинномозговой анестезии. Если пла-
нируется установка катетера, может потребоваться более широкая обкладка
кожи для того, чтобы предотвратить загрязнение его свободного конца при
его проведении. Игла, которой выполнялась инфильтрация, может служить
«разведчиком» для определения глубины расположения желтой связки у ху-
дых пациентов, а также для цефалическо-каудальной ориентировки в межо-
стистом пространстве.
4. Эпидуральная игла проводится через внутрикожный валик из местного анес-
тетика, своим срезом в краниальном направлении. Расположение среза в бо-
ковом направлении, особенно, при использовании игл типа Tuohy или
Hustead, будет приводить к боковому отклонению кончика иглы. Игла прово-
дится медленно через межостистую связку, останавливаясь в момент повы-
шения сопротивления, что соответствует достижению желтой связки
(рис. 7.5). Если срединная линия определена правильно, при контакте со связ-
кой игла встретит плотную ткань: сопротивление ее продвижению повысит-
ся. Глубина расположения этой связки от поверхности кожи при обычном
телосложении колеблется от 3.5 до 5.0 см и сильно зависит от веса тела паци-
ента.
Способность почувствовать повышение сопротивления приобретается с опы-
том. Новичок обязан иметь - буквально руку помощи. До достижения необхо-
димого уровня мастерства может быть произведено определенное число
неумышленных пункций твердой мозговой оболочки. При беременности
Рис. 7.5. Положение рук на эпидуральной игле.
Эпидуральная игла проводится через кожу в той же самой точке и направлении, что и спинальная
игла. Во время прохождения через межостистую связку необходим постоянный плотный контроль
за ее движением для определения момента некоторого повышения сопротивления движению, что
соответствует моменту проникновения в желтую связку. Несмотря на использование множества
доступов, наиболее распространенной техникой является прочное удерживание канюли иглы за
имеющиеся на многих эпидуральных иглах крылышки, с поддержкой ее другими пальцами,
установленными на саму иглу (как показано на рисунке), легкое усилие которых направлено от
спины. Такая фиксация предотвращает неожиданное смещение иглы вследствие движений пациента
или оператора
106
Глава 7
плотность связок понижается и у таких пациентов почувствовать небольшое
повышение сопротивления является наиболее сложной задачей.
5. При повышении сопротивления, связанного с достижением связки, стилет из-
влекается и к канюле иглы присоединяется 3-х и или 5-ти миллилитровый
стеклянный шприц с местным анестетиком или солевым раствором. Перед
присоединением в шпиц набирается небольшой пузырек воздуха (0.1-0.2 мл).
Заблаговременно выполнятся тщательная проверка свободного хода поршня
шприца. Обращаться со шприцем следует так, что бы тальк с перчаток не по-
пал на иглу. Шприц с плохо движущимся поршнем не позволит почувство-
вать потерю сопротивления.
На протяжении всей процедуры канюля иглы удерживается большим и указа-
тельным пальцем помогающей руки, тыльная поверхность которой прочно
опирается на спину пациента (рис 7.6).
Рис. 7.6. Продвижение эпидуральной иглы в межостистое пространство.
Как только желтая связка идентифицирована, к канюле иглы присоединяется шприц с 1 мл раствора
и 0.1 см3 воздуха. Основная рука прочно опирается на спину, одновременно удерживая канюлю иглы
между большим и другим пальцем. Другая рука осуществляет давление на поршень шприца так,
чтобы пузырек воздуха сжался на половину своего прежнего размера. Если игла действительно
находится в связке, эта компрессия возможна без инъекции жидкости. Основная рука осторожно и
медленно продвигает иглу вперед, поддерживая постоянное давление поршня. При входе в
эпидуральное пространство ощущается резкое падение сопротивления, что позволяет легко ввести
всю жидкость, находящуюся в шприце
На поршень шприца оказывается среднее давление большим пальцем основ-
ной руки. Если кончик иглы погрузился в желтую связку, инъекция раствора
будет невозможна, однако увеличение давления сожмет пузырек воздуха, на-
ходящийся в шприце.
6. Если достаточной компрессии не получено, игла слегка продвигается вперед
и тест повторяется до получения компрессии. Если есть сомнения относите-
льно места нахождения кончика иглы, или если сопротивление так и не было
получено, игла извлекается и вводится вновь после уточнения анатомических
ориентиров.
7. Если пузырек воздуха сжался на половину от своего первоначального объема
без инъекции жидкости, кончик иглы находится в желтой связке. Игла мед-
ленно продвигается через связку с сохранением постоянного давления на по-
ршень шприца, осуществляемого большим пальцем. Другая рука удерживает
канюлю иглы в течение всего времени ее продвижения. Основная рука осуще-
Эпидуральная анестезия
107
ствляет постоянное давление на поршень, но без продвижения шприца с иг-
лой. В начале продвижения пациент должен быть предупрежден о том, что он
может почувствовать «переливание» жидкости в спине, тем не менее, это
ощущение не будет болезненным и он не должен двигаться.
8. Как только кончик иглы проникает в находящееся под связкой пространство,
происходит резкое падение сопротивления. Все содержимое шприца быстро
попадает в эпидуральное пространство. Неожиданное введение жидкости в
спину может явиться причиной движения некоторых пациентов; вспомогате-
льная рука должна жестко контролировать глубину иглы, игла должна быть
зафиксирована на этой глубине.
9. Шприц осторожно отсоединяется без изменения положения иглы. При подсо-
единении катетера канюля прочно зажимается между большим и указатель-
ным пальцами и продвигается вперед на 1-2 мм, при этом тыл руки опирается
на спину пациента для лучшего контроля глубины продвижения. Это позво-
ляет полностью открыть срез иглы в эпидуральном пространстве.
10. В шприц набирается 0.5 мл воздуха, и он вновь тщательно подсоединяется к
канюле. Для обнаружения крови или цереброспинальной жидкости выполня-
ется осторожная аспирация. Если жидкость не получена, воздух из шприца
быстро вводится. Эпидуральное пространство не создает сопротивление инъ-
екции, тем не менее, небольшой объем воздуха может вернуться в шприц.
При сопротивлении инъекции воздуха положение иглы изменяется, а поиск
эпидурального пространства возобновляется. Если сопротивление отсутству-
ет, отмечается глубина проникновения иглы.
Может ощущаться ложное облегчение (потеря сопротивления), если игла до
достижения желтой связки после нахождения в межостистой связке вышла
через боковую поверхность этой связки. Тест с воздухом обычно выявляет та-
кую ситуацию, при которой кончик иглы находится в соединительной ткани
вне эпидурального пространства. Тест с воздухом может не проводиться,
если инъекция воздуха не желательна как при литотрипсии или анестезии в
педиатрии [13].
11. После того, как установлено правильное положение иглы, вводится тестовая
доза и проводится наблюдение для исключения интраваскулярной или суба-
рахноидальной инъекции (см. главу 3). Несмотря на то, что в этот момент уже
может быть введен катетер, возможность его интраваскулярного введения бу-
дет выше, если оно осуществляется до инъекции дозы местного анестетика, а
не после [14,15]. Выбранная терапевтическая доза вводится по 5 мл через 30
секундный интервал. Если должен быть введен катетер, 2-3 мл раствора мест-
ного анестетика резервируются для вводимой через катетер пробной дозы.
12. При использовании катетера его установка производится основной рукой, в
то время как вспомогательная рука продолжает фиксировать иглу (рис. 7.7).
После прохождения вводимым катетером изгиба кончика иглы появляется
ощущение сопротивления. Если кончик катетера не проходит конец иглы сво-
бодно, катетер удаляют и игла продвигается вперед на 1 мм; подтверждаю-
щие ее местоположение тесты повторяются.
После прохождения катетера через кончик иглы, он проводится дальше, но не
более чем на 5 см. При дальнейшем продвижении повышается возможность
скручивания, отклонения от срединной линии и попадания в межпозвоночное
отверстие. Если ощущается сопротивление это может признаком того, что
игла не находится в эпидуральном пространстве. После прохождения через
кончик иглы катетер не должен извлекаться. Это действие может привести к
надрыву катетера или полному его пересечению острым краем загнутого кон-
108
Глава 7
Рис. 7,7. Введение эпидурального катетера.
Игла по-прежнему удерживается опирающейся на спину рукой, прочно фиксируя ее канюлю (не
показано), в то время как другая рука проводит катетер через канюлю и осторожно продвигает его
через кончик иглы. Срез иглы расположен в цефалическом направлении, при котором создаются
наилучшие условия для проведения; при каудальном направлении катетер может выйти через одно
из межпозвоночных отверстий. Идеально, если катетер проведен только на 3- 4 см от кончика иглы;
дальнейшее его продвижение повышает возможность его бокового отклонения или выход через
межпозвоночное отверстие
чика иглы. Если встретились трудности, то иглу и катетер следует удалить
вместе, как одно целое, и начать процедуру снова.
13. После того, как катетер введен и прочно удерживается, игла полностью изв-
лекается. Извлечение проводится так, чтобы длина части катетера, находяще-
гося в эпидуральном пространстве не изменилась. Игла извлекается с
небольшим изгибом в направлении дуги среза так, чтобы острый край среза
не срезал катетер. Извлеченная из кожи игла осторожно удаляется через сво-
бодный конец катетера, к которому с соблюдением асептики подсоединяется
коннектор.
Длина части катетера, находящейся в эпидуральном пространстве, определя-
ется путем вычитания из величины общей длины введенной части катетера
величины отмеченного ранее расстояния от кожи до эпидурального про-
странства. Если длина катетера, введенного в эпидуральное пространство, со-
ставляет более 4 см, перед инъекцией препарата он осторожно извлекается до
необходимой длины. В этот момент пациента просят вытянуть ноги и через
катетер осторожно аспирируется кровь или спинномозговая жидкость.
14. Если катетер не вводился, игла удаляется и пациенту предлагают лечь на спи-
ну. При установке катетера пациент полностью вытягивает ноги и катетер
тщательно укрепляется на коже спины до того, как пациент повернется на
спину. Следует избегать крутых изгибов и тем более перегибов в месте выхо-
да катетера из кожи. Обычно для избежания перегиба катетера в месте его вы-
хода из кожи, катетер осторожно укладывают небольшой свободной петлей.
Если катетер установлен на несколько дней для послеоперационного обезбо-
ливания, место его прикрепления к коже должно быть укрыто стерильным ма-
териалом. Свободный конец катетера помещается на лопаточную область
пациента и здесь закрепляется так, чтобы не’было свободных петель и чтобы
не произошло случайного отсоединения адаптера.
Эпидуральная анестезия
109
15. Начало эпидуральной анестезии более медленно, чем спинномозговой анес-
тезии. Определение уровня анестезии может потребовать нескольких минут,
особенно, при использовании длительно действующих препаратов. Крестцо-
вая анестезия развивается более медленно, и может отсутствовать в тот мо-
мент, когда абдоминальная анестезия уже наступила. Если для дальнейших
действий требуется наличие анестезии, ее наступление должно быть подтвер-
ждено.
16. Каждое повторное введение в катетер должно сопровождаться всеми мерами
безопасности, как и при первом введении. Следует помнить, что ответ на
пробную дозу в условиях общей анестезии может измениться [6].
17. По окончании процедуры, если не планируется проведения послеоперацион-
ной анестезии или наркотического обезболивания, катетер должен быть уда-
лен. Необходимо обратить внимание на целостность его части, находившейся
в эпидуральном пространстве.
Парамедианный (латеральный) доступ
Кроме традиционного срединного доступа связка может быть пройдена через ла-
теральный доступ. Как и при спинномозговой анестезии, игла может быть направ-
лена под углом к связке, проникая через кожу на несколько сантиметров
латеральнее срединной линии и достигая ее в центре межпозвоночного простран-
ства. Это позволяет избежать прохождения кальцифицированных межостистых
связок, однако при этом утрачивается возможность использования межостистой
связки для определения срединной линии по мере продвижения иглы.
Популярным доступом при эпидуральной анестезии является парамедиан-
ный доступ, при котором игла проводится через кожу напротив остистого отро-
стка ниже межпозвоночного пространства и продвигается в связку сбоку и снизу,
как описано в главе 6. Преимущество этой методики состоит в том, что вначале
идентифицируется костная пластина той части дуги позвонка, которая находится
напротив остистого отростка, что дает ясное представление о глубине располо-
жения связки. Затем направление иглы изменяется медиально вверх для того,
чтобы пройти над дугой позвонка и войти в связку. Этот доступ также более
предпочтителен тем, что проникновение в эпидуральное пространство осуществ-
ляется под большим углом. Такое направление облегчает продвижение катетера,
а менее острый угол к коже снижает возможность перегиба катетера в этом мес-
те. Несмотря на эти теоретические преимущества существенных отличий резуль-
татов при этом доступе и срединном доступе нет [14].
Торакальная эпидуральная анестезия
Сегментарная анестезия верхних отделов брюшной полости или грудной клетки
может быть получена инъекцией локального анестетика в торакальный отдел
эпидурального пространства. Эта методика снижает общую дозу и в значитель-
ной степени улучшает условия для постторакотомического обезболивания инфу-
зиями жирорастворимых опиоидов, однако анатомические особенности этой
области создают значительные технические трудности. Во-первых, остистые от-
ростки, особенно с Th-4 по Th-10 являются более длинными и более выражено
отклонены книзу, что делает срединный доступ более трудным. Еще более суще-
ственным фактором является то, что в этой области твердая мозговая оболочка
ближе прилежит к желтой связке, а спинной мозг ближе расположен к твердой
мозговой оболочке. Пункция твердой мозговой оболочки сопряжена здесь с рис-
ком прямого повреждения спинного мозга. По этим причинам парамедианный
110
Глава 7
доступ предпочтительнее (см. главу 6), поскольку проникновение в межпозво-
ночное пространство сбоку позволяет легче определить безопасную глубину рас-
положения дуги позвонка и связки.
1. Пациент помещается в положение лежа на боку или сидя с максимальным сги-
банием шеи и верхнего отдела спины. Определяются и маркируются остистые
отростки. Остистый отросток VII шейного позвонка обычно больше других вы-
ступает над поверхностью шеи, что помогает определить этот уровень. Ниж-
ний угол лопатки определяется на уровне Th-9 (см. рис. 6.4). Маркер «X»
наносится на кожу на 1-1.5 см латеральнее остистого отростка на выбранном
уровне, обычно на 1 дерматомный уровень ниже центральной части области
хирургического вмешательства. В грудном отделе остистые отростки распола-
гаются над телами и дугами позвонков нижележащего сегмента. Катетер дол-
жен вводиться на один или два уровня ниже намеченного центра блокируемой
области, поскольку при введении он будет подниматься вверх по каналу.
2. Обезболивание места проведения иглы раствором анестетика проводится иг-
лой диаметром 22 G и длиной 1.5 дюйма. Кончик этой иглы может быть испо-
льзован для обнаружения пластины тела позвонка. У тучных пациентов для
идентификации кости и проведения адекватного обезболивания может пона-
добиться спинальная игла длиной 3.5 дюйма. Также необходимо выполнить
инфильтрационную анестезию периостальной зоны. Поисковая игла продви-
гается до верхнего края дуги позвонка и, затем, проводится через желтую
связку.
3. В связи с отмеченными анатомическими особенностями для этой манипуля-
ции наилучшим образом походит игла типа Tuohy со стилетом, которая дол-
жна продвигаться к дуге позвонка, со срезом, направленным краниально.
Игла продвигается вверх и медиально под углом 45-50 градусов и «пересека-
ет» дугу до проникновения в связку (рис. 7.8). Эпидуральное пространство
определяется методом потери сопротивления или методом «висячей капли»
(см. раздел «Висячая капля» и другие дополнительные методы в этой главе).
4. После прохождения связки игла продвигается только на 1 мм, после чего
устанавливается катетер. Эта процедура проводится по той же методике и с
теми же предосторожностями, что и люмбальная пункция. И на этом уровне
катетер в эпидуральном пространстве продвигается только на 3—4 см.
5. Для полноценной торакальной анестезии могут быть использованы более раз-
веденные растворы местных анестетиков (1% раствор лидокаина, 0.25% или
0.5% раствор бупивакаина). И в этом случае дозировки зависят от возраста и
веса пациентов, однако в целом они на 30-50% меньше люмбальных доз, по-
скольку в грудной области эпидуральное пространство имеет меньший объем.
Как и в поясничной области, сегментарная блокада будет распространяться на
несколько дерматомов выше и несколько дерматомов ниже места инъекции.
Симпатическая блокада может включать в себя блокаду симпатической иннер-
вации сердца, однако она не вызывает такую же степень периферической вазо-
дилятации и гипотонии как люмбальная блокада.
«Висячая капля» и другие дополнительные методы
Ранее описанная методика, основанная на ощущении потери сопротивления, явля-
ется модификацией первоначального (классического) метода определения эпиду-
рального пространства при люмбальной пункции. Кроме описанных методов с
жидкостью и пузырьками воздуха, идентификация также может быть проведена
с помощью заполненного воздухом шприца с периодическим баллотированием
Эпидуральная анестезия
111
Рис. 7.8. Торакальный эпидуральный доступ.
Игла проводится на один поперечный палец латеральнее нижнего выступа остистого отростка,
лежащего над выбранным межпозвоночным пространством. Игла проводится прямо
перпендикулярно к коже до контакта с дугой позвонка. Здесь направление иглы осторожно
изменяется с одновременным отклонением на 45 градусов медиальнее и 45 градусов краниальнее,
она проходит над дугой к желтой связке и входит в эпидуральное пространство, что определяется
методом потери сопротивления или методом висячей капли
поршня. Эта методика кажется наиболее простой, однако она предполагает преры-
вистое продвижение иглы и, соответственно, прерывистую оценку уровня сопро-
тивления, в отличие от его постоянного восприятия при использовании сжатого
пузырька воздуха. Кроме этого, беспокойство по поводу введения воздуха в эпиду-
ральное пространство может сделать этот метод не желательным [13]. Другим спо-
собом является использование солевого раствора, однако использование не
сжимаемой среды повышает риск искаженного восприятия сопротивления по-
ршня. Ни один из этих способов не дает такого плавного, или отчетливого ощуще-
ния потери сопротивления как сочетание воздуха и жидкости.
В грудной области эпидуральное пространство испытывает влияние отрица-
тельного давления грудной полости. В этой зоне капля раствора на канюле про-
двинутой иглы будет резко всасываться в эпидуральное пространство в связи с
наличием там отрицательного давления, как только игла пройдет желтую связку.
Метод «висячей капли», использующийся в грудной зоне, не подходит для пояс-
ничной области, где давление может быть равным атмосферному давлению.
Для облегчения идентификации эпидурального пространства в прошлом
было предложено несколько механических устройств, таких как устройства бал-
лонного типа или манометры. Несмотря на их удовлетворительную пригодность,
на практике, применяя простые методики, описанные выше, обычно не возника-
ет необходимости использования дополнительных устройств для определения
112
Глава 7
местоположения связки и эпидурального пространства. Также описано успеш-
ная идентификация с помощью ультрасонографии и флюороскопии, однако в це-
лом в этом нет необходимости. Эти методы могут помочь в редких случаях выра-
женного ожирения или деформации анатомических структур.
Другие положения пациента
Эпидуральная анестезия может быть также выполнена, если пациент находится в
положении сидя или лицом вниз, как было описано ранее для спинномозговой
анестезии (см. главу 6). Как и при спинномозговой анестезии, положение сидя
оказывается полезным у тучных пациентов. Это положение позволяет легче
идентифицировать костные анатомические ориентиры и срединную линию.
Эпидуральная анестезия в положении лицом вниз также используется на
практике, но не имеет широкого распространения. Методика и доступ в этом слу-
чае такие же, как и описанные ранее. Показанием для анестезии в положении ли-
цом вниз может являться необходимость избежать изменения положения тела
пациента после проведения блокады, однако при эпидуральной блокаде в тече-
ние 5—10 минут сохраняется адекватная резидуальная чувствительность и двига-
тельная функция, позволяющая безопасно придать нужное положение после
инъекции анестетика. Положение лицом вниз может позволить лучше развести
остистые отростки и больше отодвинуть твердую мозговую оболочку от связки,
однако эти второстепенные преимущества не стоят требуемых в этом случае до-
полнительных усилий.
Комбинированная спинномозговая-эпидуральная анестезия
Преимущества спинномозговой или эпидуральной анестезии могут быть объеди-
нены при комбинированной методике — быстрое начало действия и распростра-
нение инъекции в крестцовую область, в сочетании с возможностью
продолженной анестезии или анальгезии через эпидуральный катетер [16]. Это
особенно полезно в акушерской практике, но также применимо в хирургии при
таких вмешательствах, как брюшно-промежностная резекция и протезирование
коленного сустава, при которых необходимо быстрое начало крестцовой анесте-
зии, а также при обезболивании в послеоперационном периоде. Эта методика
обычно ограничена поясничной областью, где субарахноидальная инъекция яв-
ляется более безопасной.
1. Пациент подготавливается для проведения люмбальной эпидуральной анес-
тезии каким-либо из описанных доступов. Игла для эпидуральной анестезии
проводится в эпидуральное пространство по стандартной методике.
2. После пункции эпидурального пространства шприц отсоединяется от эпиду-
ральной иглы и сквозь нее на дистанцию, необходимую для пункции твердой
мозговой оболочки, проводится спинальная игла диаметром 25-27 G (см.
рис. 22.1). Эти иглы в серийных упаковках поставляются «парой» так, что
длина спинальной иглы (11-12 см) позволяет выдвинуть ее кончик на 5-10 мм
через эпидуральную иглу. Продвижение осуществляется либо через обычный
просвет иглы, либо через специально предназначенное для этого отверстие по
внешней кривизне среза эпидуральной иглы.
3. При свободном истечении спинномозговой жидкости спинальная игла фиксиру-
ется или закрепляется на канюле эпидуральной иглы (в некоторых наборах). Вы-
бранная доза для субарахноидального введения местного анестетика или
опиоида вводится по стандартной для спинномозговой анестезии или акушер-
Эпидуральная анестезия
113
ской аналгезии методике. Затем, спинальная игла извлекается и также по стан-
дартной методике через эпидуральную иглу проводится эпидуральный катетер.
4. Если спинальная игла не прошла твердую мозговую оболочку, то, возможно,
что эпидуральная игла отклонилась от средней линии или она недостаточно
продвинулась в эпидуральное пространство. Для коррекции ошибки ее поло-
жение должно быть изменено.
5. После того, как выраженность спинномозговой анестезии или опиоидного
эффекта начинает снижаться, доза местного анестетика, вводимого в эпиду-
ральный катетер, снижается на 10-20% (эпидуральная инъекция может «по-
высить» уровень спинномозговой анестезии, создавая возможность развития
незапланировано высокого блока). С этого момента действия через эпидура-
льный катетер выполняются по стандартной методике.
Эпидуральная кровяная пломба
Эта методика является окончательным средством лечения головной боли, воз-
никшей после пункции твердой мозговой оболочки. Симптомы, показания и
условия лечения описаны в главе 6.
Здесь приводится описание несложной методики.
1. Пациент помещается в положение на боку, анатомические ориентиры иден-
тифицируются, как и при обычной эпидуральной пункции. При возможности
инъекция проводится в то же межпозвоночное пространство, что и при перво-
начальной пункции твердой мозговой оболочки.
2. Обработка кожи спины и ее обкладка проводится в соответствии с правилами
асептики.
3. Обезболивание места инъекции и введение иглы выполняются так же, как и
при обычной эпидуральной анестезии. Как только при изменении сопротив-
ления идентифицировано эпидуральное пространство, положение иглы не
меняется, а пациента просят не двигаться.
4. Анестезиолог или его ассистент, используя стандартную методику в услови-
ях асептики, забирают кровь из вены пациента. Если анестезиолог работает
один, рука пациента фиксируется и подготавливается до начала процедуры.
Кровь должна забираться после идентификации эпидурального пространства
для предотвращения свертывания. Забранная кровь медленно вводится через
эпидуральную иглу; пациент предупреждается о том, что он может почувст-
вовать некоторое защемление или сдавление. Если пациент почувствовал
боль в спине или ногах, инъекция должна быть прекращена. После этого эпи-
дуральная игла удаляется.
Оптимальный объем крови, инъецируемый в эпидуральное пространство, не
определен. Есть сообщения о том, что успешный результат наиболее часто
достигается при инъекции 20 мл крови. Тем не менее, в большинстве исследо-
ваний 90-95% успешный результат был получен при «стандартной» 10 мл
инъекции. Введенные 10 мл распространяются на 6 сегментов выше и на 3
сегмента ниже места инъекции. Продолжение инъекции (для повышения объ-
ема раствора до 14 мл) будет вызывать корешковые боли, связанные с комп-
рессией нервов [17]. Представляется, что объем в 10-15 мл является
обоснованной величиной и, если больной почувствует боли до введения этого
объема, возможно, эпидуральное пространство достаточно заполнено и вве-
дение можно прекратить.
114
Глава 7
5. Облегчение наступает после инъекции через разное время. Некоторые пациен-
ты могут сразу же встать и ходить, излечиваясь, как библейские персонажи.
Другим, особенно тем, кто страдал длительным истечением спинномозговой
жидкости, может стать лучше в положении лежа, с исчезновением головной
боли только через несколько часов. Необходимость.вливаний жидкости при на-
ложении пломбы не установлена, тем не менее, внутривенное введение литра
сбалансированного солевого раствора может помочь при дегидратации и при
рвоте. Всем пациентам должна быть дана рекомендация избегать резких подъе-
мов тяжестей, напряжения или воздушных полетов сразу после наложения кро-
вяной пломбы. Достаточная длительность этого периода не определена. Если
симптомы не исчезают или возвратились вновь, через 24 часа может быть про-
ведено наложение второй пломбы. Несмотря на то, что частота успешного ле-
чения при наложении пломбы в первые 24 часа после пункции ниже, чем
спустя это время, это может быть простым отражением того, что пациенты с
выраженной головной болью отмечают меньшее облегчение.
Осложнения
Симпатическая блокада
Как и при спинномозговой анестезии, симпатическая блокада, вызываемая эпи-
дуральной анестезией, обычно приводит к снижению систолического давления с
гипотонией, выраженность которой не явно зависит от выраженности симпати-
ческой блокады. В отличие от спинномозговой блокады гипотония обычно раз-
вивается достаточно медленно и может быть компенсирована одним лишь
введением жидкости. Если введение жидкости недостаточно, средством выбора
является внутривенное или внутримышечное введение эфедрина, как и при спин-
номозговой анестезии. Как и при спинномозговой блокаде, возникающая гипото-
ния становится более выраженной на фоне волемических нарушений или
кровотечений, т. е. состояний, которые являются относительными противопока-
заниями к выполнению эпидуральной блокады.
Добавление эпинефрина к эпидуральному анестетику оказывает двойной
эффект. Симпатическая блокада, вызываемая чистым раствором лидокаина, при-
водит к минимальному снижению кровяного давления, в то время как при добав-
лении эпинефрина в соотношении 1:200000 вызывает более резкое снижение
давления (табл. 7.2). Этот феномен обусловлен вазодилятирующим действием
низких доз эпинефрина при его системной абсорбции. К счастью, этот препарат,
повышает сердечный выброс и улучшает кровоток в нижних конечностях.
Таблица 7.2
Сердечно-сосудистые изменения при эпидуральной анестезии
Эпидуральная блокада лидокаином Спинномозговая блокада
Чистый Эпинефрин 1:200000
Частота сердечных сокращений 7% 16% 4%
Среднее артериальное давление -9% -22% - 21%
Периферическое сопротивление -3% -40% -5%
Сердечный выброс — 5% 30% -18%
По материалам Ward R.J. et al. Epidural and subarachnoid anesthesia: Cardiovascular and respiratory ef-
fects. J.A.M.A. 191: 275, 1965.
Эпидуральная анестезия
115
Симпатическая блокада вызывает также другие побочные эффекты. Часто
возникает задержка мочи и требуется катетеризация мочевого пузыря (как и при
спинномозговой анестезии). Частота этого явления имеет нечетковыраженную
связь с продолжительностью действия местного анестетика. Считается, что при
наличии обструкции симпатическая блокада может привести к перфорации тон-
кого кишечника вследствие повышения перистальтического тонуса, однако эта
проблема еше не стала клинически значимой.
Внутрисосудистая инъекция
Внутрисосудистая инъекция является наиболее серьезной угрозой во время про-
ведения эпидуральной анестезии, особенно при введении больших объемов кон-
центрированного раствора местного анестетика. Риск этого осложнения
повышается при развитом венозном сплетении в эпидуральном пространстве.
Ситуация осложняется низким или отрицательным давлением в этих венах, что
может привести к ложноотрицательному результату попытки аспирации крови
для идентификации интраваскулярного положения иглы. При проведении аспи-
рации шприцем сосуды могут просто спасться. Эта проблема не преодолевается
использованием катетеров, поскольку даже этот мягкий пластический материал
может пенетрировать сосудистую стенку, что случается в эпидуральном про-
странстве с частотой от 1% до 8% случаев [5, 14, 15]. Установлено, что сосуды
повреждаются с меньшей вероятностью, если эпидуральное пространство перед
введением катетера расширено инъекцией раствора местного анестетика. Как из-
вестно, катетеры могут также мигрировать в просвет сосуда в промежутке между
инъекциями. Предотвращение и лечение этого осложнения подробно обсужда-
ются в других источниках; основными средствами предотвращения являются
осторожное введение пробной дозы и дробное введение. В настоящее время об-
щепринятым является тщательное слежение за реакцией сердечно-сосудистой
системы на пробное введение эпинефрина (рис. 7.9). Тем не менее, существует
множество клинических ситуаций, препятствующих проведению этого теста [6].
Даже в наборе для родовспоможения в центрах семейной медицины обязательно
должно быть оснащение для реанимационного пособия. При каждой повторной
инъекции больших объемов концентрированного раствора через катетер должно
быть обеспечено наблюдение за пациентом и соблюдаться предосторожность.
Тотальная спинномозговая анестезия
Тотальная спинномозговая анестезия может отмечаться при непреднамеренном
введении раствора местного анестетика в субарахноидальное пространство. Как
и при внутрисосудистой инъекции, большие объемы растворов, использующих-
ся для эпидуральной анестезии, приводят к значительным осложнениям. Их ле-
чение идентично действиям при незапланированно высокой спинномозговой
блокаде (см. главу 6). Однако его начало должно быть значительно более быст-
рым, само лечение более интенсивным и продолжительным. В результате субду-
ральной инъекции также может возникнуть незапланированно высокий
спинномозговой блок (см. раздел «Субдуральная инъекция» в этой главе).
И в этом случае наиболее эффективным средством является профилактика.
Следует проводить введение пробных доз, первоначальная и все последующие
инъекции должны быть дробными. После инъекции лидокаина для определения
начала сенсорной анестезии в крестцовых сегментах может потребоваться не ме-
нее 2-х минут [18]. Следует в большей степени полагаться на определение точеч-
ной чувствительности в крестцовых дерматомах, чем на субъективные признаки,
116
Глава 7
О 5 10 15 20 25 30 35 40 45 50 55 60 65 70 75 80
Время (с)
Рис. 7.9. Сердечно-сосудистая реакция на пробную дозу эпинефрина.
Внутривенная инъекция 15 мкг эпинефрина вызывает 30% повышение частоты сердечных
сокращений в течение 30 сек. у обычных пациентов, которое легко определяется пульсовым
оксиметром на электрокардиограмме или другими электронными средствами измерения пульса.
Этот рисунок отражает средние значения частоты сердечных сокращений у 6 человек,
регистрировавшуюся пятью устройствами после инъекции эпинефрина. Изменения пульса и их
продолжительность, представленные здесь, являются типичными
или возможность «пошевелить» пальцем ноги. Выявление пункции твердой моз-
говой оболочки катетером при первой инъекции может быть затруднено. Все по-
следующие инъекции должны быть дробными с тщательным слежением за уров-
нем сенсорной анестезии и систолическим давлением.
Если непреднамеренная пункция твердой мозговой оболочки выявлена до
инъекции, существует несколько вариантов действий. Если позволяет ситуация
может быть введен спинальный анестетик, для чего возможно, потребуется дру-
гой препарат и более низкие дозы. Эпидуральная анестезия может быть проведе-
на через другое межпозвоночное пространство или игла может быть частично из-
влечена до эпидурального пространства и на этом же уровне установлен катетер.
Если эпидуральная доза вводится на этом же уровне (или даже на другом уровне)
целесообразно 15—25% снижение дозы с тщательным наблюдением для раннего
распознавания диффузии анестетика через поврежденную твердую мозговую
оболочку и предотвращения высокого спинального блока [19].
Односторонняя или «пятнистая» блокада
Редко эпидуральный анестетик не вызывает ожидаемую сегментарную ане-
стезию. Описаны случаи односторонней блокады, наиболее часто это наблюда-
ется, когда катетер продвинут более чем на 5 см, и его кончик находится в сторо-
не от срединной линии [12]. Также отмечены случаи «пятнистой» блокады, при
которой анестезия не возникает в нескольких изолированных сегментах. Наибо-
лее часто не анестезируются крестцовые сегменты, что происходит из-за механи-
ческого препятствия распространению анестетика, которым является корешок
S-1 или стеноз спинномозгового канала.
Эпидуральная анестезия
117
Изредка воспрепятствовать распространению раствора могут пузырьки воз-
духа в эпидуральном пространстве, что приведет к появлению беспорядочно рас-
положенных неанестезированных областей. Использование значительных объе-
мов воздуха приводит к воздушной эмболизации вен и надключичной эмфиземе
[13]. Тем не менее, воздух способствует растяжению эпидурального пространст-
ва, что облегчает проведение катетеров, следует только благоразумно использо-
вать минимальный объем воздуха или применять вместо него солевой раствор.
Нейропатия и повреждение спинного мозга
При люмбальной эпидуральной, как и при спинномозговой анестезии может от-
мечаться повреждение корешков спинного мозга, однако это осложнение встре-
чается также редко. Торакальный или цервикальный доступы повышают риск
повреждения самого спинного мозга. Проявлением этого осложнения является
внезапная выраженная распространенная боль, возникающая во время продви-
жения иглы. Поскольку используются иглы большого диаметра, а ткань волокон
спинного мозга не регенерирует, результатом может быть постоянные и выра-
женные двигательные или чувствительные нарушения ниже уровня поврежде-
ния. Эти повреждения не поддаются лечению, но, к счастью, встречаются редко.
Решающее значение имеет профилактика. Всегда должна соблюдаться осто-
рожность при продвижении иглы рядом со спинным мозгом. Доступ в эпидура-
льное пространство выше уровня L-2 не должен проводиться без премедикации и
соответствующего навыка. Скрупулезное следование методике чрезвычайно
важно, а врач, не уверенный в себе, должен использовать другие метода анесте-
зии. Проведение таких блокад на фоне общей анестезии повышает риск нерас-
познанного контакта с нервной тканью [2]).
Головная боль
При эпидуральной анестезии может быть произведена непреднамеренная пунк-
ция твердой мозговой оболочки. Использование игл относительно большого диа-
метра повышает частоту возникновения головной боли (до 50% у молодых
пациентов, и особенно, при беременности). Лечение этой головной боли прово-
дится так же, как и после спинномозговой пункции. Профилактическое наложе-
ние кровяной пломбы для снижения числа случаев головной боли не показано.
Отрыв катетера
Как упоминалось выше, удаление катетера через иглу, срез которой расположен
под углом, может привести к его надрыву или полному пересечению. Это не на-
несет прямого вреда, поскольку материал катетера является не раздражающим и
«совместимым» с тканями. Пациент должен быть информирован о наличии этого
инородного тела, его хирургического удаления обычно не требуется. Пациент
должен быть осведомлен об этом, чтобы при абдоминальной рентгенографии в
дальнейшем этот неясный фрагмент не расценивался как объект, который подле-
жит удалению хирургическим путем.
Большее опасение вызывает то обстоятельство, что катетер, который прове-
ден в эпидуральное пространство на чрезмерную длину, может скручиваться, об-
разуя петли. Это возникает редко и наилучшим способом предотвращения явля-
ется ограничение проведения катетера в эпидуральное пространство не более
чем на 5 см. При скручивании некоторые катетеры могут быть расправлены осто-
рожной тракцией. Показания к хирургическому пособию могут возникать в слу-
чаях, если катетер оборвался на уровне кожи, создав при этом путь возможного
загрязнения эпидурального пространства.
118
Глава 7
Субдуральная инъекция
Как уже упоминалось в главе 6, субдуральное пространство является потенциа-
льным пространством между твердой мозговой и арахноидальной оболочками и
в него может проникнуть игла типа Tuohy или катетер. При инъекции в это про-
странство происходит широкое распространение препарата, в результате чего
возникает не запланировано широкая блокада, описанная как массивная экстра-
дуральная анестезия. Эта ситуация может возникнуть при проведении эпидура-
льной анестезии и обезболивании в послеоперационном периоде, и должна
подозреваться всякий раз, если эпидуральная доза вызвала более широкое чем
ожидалось распространении анестезии.
Эпидуральная гематома
Образуется редко и обычно, если она отмечается во время анестезии, связана с
коагулопатией [20,21]. Первым проявлением этого осложнения у неанестезиро-
ванного пациента является боль, вслед за которой появляется слабость в ногах.
При эпидуральной анестезии, если блокада не разрешается в ожидаемое время,
это должно вызвать подозрение в отношении сдавления спинного мозга вследст-
вие кровотечения и формирования гематомы. Склонность к такому осложнению
связана с коагулопатией. Диагностическими средствами в этих случаях является
магнитно-резонансная томография или аксиальная компьютерная томография.
Полное выздоровление является редким, если сразу же не была проведена деком-
прессионная ламинэктомия.
Влияние лечения антикоагулянтами на возможные осложнения эпидураль-
ной анестезии обсуждалось в главе 3.
Эпидуральный абсцесс
В эпидуральном пространстве инфекция развивается редко, риск этого осложне-
ния существует у больных с нарушением иммунитета, он также может повыша-
ться при введении стероидов. Абсцесс может проявляться болью и
неврологическими изменениями через несколько дней после проведения инъек-
ции, а также местной болезненностью, лихорадкой и лейкоцитозом. Наилучшим
диагностическим средством является магнитно-резонансная томография, при
неврологической симптоматике показана ранняя хирургическая декомпрессия.
Поверхностное воспаление или развитие инфекции в месте введения катетера на-
блюдаются более часто и обычно разрешаются после удаления катетера.
Ошибочное введение растворов
Инъекция не предназначенного для введения в эпидуральное пространство раствора
отмечается намного чаще, чем это регистрируется официально. Растворы хлорида
калия, тиопентала натрия, антибиотиков и многих других препаратов, предназна-
ченных для внутривенного введения, непреднамеренно вводятся через плохо поме-
ченные инъекционные порты теми, кто плохо знаком с назначением этих катетеров.
Наиболее часто это происходит при управляемом эпидуральном наркотическом
обезболивании, популярном при воздействии на послеоперационную боль в хирур-
гических палатах. К счастью, буферная емкость эпидурального пространства, а так-
же слои твердой мозговой оболочки, защищающей нервы, не позволяют развиться
химическому повреждению, поэтому серьезные последствия не были отмечены.
Тщательная маркировка катетеров и (в идеале) использование специальных цвет-
ных кодов для инъекционных портов могут во многом решить эту проблему.
Эпидуральная анестезия
119
Литература
1. Liu, S., Carpenter, R. L., Neal, J. M. Epidurial anesthesia and analgesia. Their role in
postoperative outcome. Anesthesiology 82: 1474,1995.
2. Hodgson, P. S., Liu, S. S., Epidurial lidocaine decreases sevoflurane requirement
for adequate depth of anesthesia as measured by the Bispec-tral Index monitor.
Anesthesiology 94: 799, 2001.
3. Mulroy, M. F., Larkin, K. L., Hodgson, P. S., Helman, J. D., Pollock, J. E., Liu, S. S. A
comparison of spinal, epidural, and general anesthesia for outpatient knee arthroscopy.
Anesth. Analg. 91: 860,2000.
4. Meissner, A., Rolf, N., Van Aken, H. Thoracic epidural anesthesia and the patient
with heart disease: Benefits, risks, and controversies. Anesth. Analg. 85: 517,1997.
5. Kopacz, D. J., Mulroy, M. F. Chloroprocaine and lidocaine decrease hospital stay and ad-
mission rate after outpatient epidural anesthesia. Reg. Anesth. 15: 19,1990.
6. Mulroy, M. F., Norris, M C., Liu, S. S. Safety steps for epidural injection of local anest-
hetics: Review of the literature and recommendations. Anesth. Analg. 85:1346,1997.
7. Burm, A. G., vanKleef, J. W., Gladines, M. P., Olthof, G., Spierdijk, J. Epidural anest-
hesia with lidocaine and bupivacaine: Effects of epineph-rine on the plasma concent-
ration profiles. Anesth. Analg. 65: 1281, 1986.
8. Milligan, K. R., Con veiy, P. N., Weir, P., Quinn, P., Connolly, D. The efficacy and safety
of epidural infusions of levobupivacaine with and without clonidine for postoperati-
ve pain relief in patients undergoing total hip replacement Anesth. Analg. 91: 393,
2000.
9. Paech, M J., Pavy, T. J., Orlikowski, С. E., Lim, W., Evans, S. F. Postoperative epidural
infusion: A randomized, double-blind, dose-finding trial of clonidine in combination
with bupivacaine and fentanyl. Anesth. Analg. 84: 1323,1997.
10. Curatolo, M., Petersen-Felix, S., Scaramozzino, P., Zbinden, A. M. Epidural fentanyl,
adrenaline and clonidine as adjuvants to local anaesthetics for suigical analgesia: Me-
ta-analyses of analgesia and side-effects. Acta Anaesthesiol. Scand. 42: 910,1998.
11 .Bromage, P. R. Ageing and epidural dose requirements: Segmental spread and pre-
dictability of epidural analgesia in youth and extreme age. Br. J. Anaesth. 41: 1016,
1969.
12. Hogan, Q. Epidural catheter tip position and distribution of injectate evaluated by
computed tomography. Anesthesiology 90: 964,1999.
13. Saberski, L. R., Kondamuri, S., Osinubi, O. Y. Identification of the epidural space:
Is loss of resistance to air a safe technique? A review of the complications related to
the use of air. Reg. Anesth. 22: 3,1997.
14. Griffin, R. M., Scott, R. P. Forum. A comparison between the midline and parame-
dian approaches to the extradural space. Anaesthesia 39: 584,1984.
15. Vemiquet, A. J. Vessel puncture with epidural catheters. Experience in obstetric pati-
ents. Anaesthesia 35: 660,1980.
16. Rawal, N., VanZundert, A., Holmstrom, B., Crowhurst, J. A. Combined spinal-epidu-
ral technique. Reg. Anesth. 22:406,1997.
17. Szeinfeld, M., Ihmeidan, I. H., Moser, M. M., Machado, R., Klose, K. J., Serafini, A.
N. Epidural blood patch: Evaluation of the volume and spread of blood injected into
the epidural space. Anesthesiology 64: 820,1986.
18. Abraham, R. A., Harris, A. P., Maxwell, L. G., Kaplow, S. The efficacy of 1.5% lidocai-
ne with 7.5% dextrose and epinephrine as an epidural test dose for obstetrics. Anest-
hesiology 64: 116,1986.
Глава 8
Каудальная анестезия
Другим доступом к перидуральному пространству является доступ через сакра-
льное отверстие в нижней части спины. Инъекция в сакральный канал приводит к
эпидуральной блокаде, однако для достижения абдоминальных уровней требу-
ются большие объемы раствора. Недостатки каудального доступа связаны с
большим разнообразием анатомических особенностей и большим риском внут-
ривенной инъекции.
Анатомия
Каудальный канал является наиболее низким расширением спинномозгового ка-
нала. Его дорсальная стенка сформирована задними частями дуг сросшихся кре-
стцовых позвонков. В норме прямое отверстие в канал имеется только на уровне
V крестцового позвонка, где отсутствие развитого остистого отростка и дуги по-
звонка привело к формированию отверстия в костной стенке канала. Это отвер-
стие с латеральной стороны ограничено крестцовыми рогами (не полностью
развитыми суставными отростками), и покрыто тонкой крестцово-копчиковой
связкой. В латеральной стенке канала имеются собственные отверстия, открыва-
ющиеся как на переднюю, так и на заднюю поверхность крестца на уровне от S-1
до S-4. Через эти видоизмененные межпозвоночные отверстия выходят передние
и задние корешки сакральных нервов.
Канал вогнут кпереди, однако вход в сакральное отверстие является плос-
ким (см. рис. 8.1). Угол канала к поверхности кожи зависит от пола и расы. У бе-
лых людей канал образует с поверхностью кожи угол приблизительно 35 граду-
сов, в то время как у представителей негроидной расы этот угол может достигать
45 градусов. У женщин обеих рас угол несколько меньше, чем у мужчин соответ-
ствующей расы. Угол сращения позвонков варьирует; канал может отсутство-
вать у 5—10% в популяции [1].
В этом канале спинномозговая оболочка заканчивается выше уровня II кре-
стцового позвонка. В крестцовой части канала она может расширяться, прибли-
жаясь к крестцовому отверстию на расстояние 3.5 см. Другим содержимым этого
пространства является рыхлая соединительная ткань, корешки нервов и общее
венозное сплетение.
Показания
Местные анестетики, введенные в сакральный канал, вызывают глубокую анес-
тезию крестцовых корешков. Эта методика является идеальной для хирургиче-
ских вмешательств на промежности и перианальной области, таких как
геморроидэктомия или прижигание опухолевидных образований прямой кишки.
Каудальная анестезия
121
Рис. 8.1. Анатомия крестца, вид сбоку.
Игла, направленная через крестцово-копчиковую мембрану под углом 45 градусов, обычно
проникает через связку и достигает передней костной стенки крестцового канала. Игла должна быть
повернута так, чтобы не повредить периостальный слой, угол продвижения изменяется так, чтобы
игла прошла вверх по каналу на 2-3 см без повторного контакта с костью. Это пространство
содержит распространенную сеть кровеносных сосудов, уровень окончания твердой мозговой
оболочки в крестцовом канале варьирует в широких пределах, однако обычно она оканчивается на
уровне S-2
При создании адекватного люмбального уровня блокады становится возможным
вмешательство на нижних конечностях. При введении больших объемов анесте-
зия может достигнуть нижних грудных дерматомов, после чего возможно прове-
дение таких вмешательств, как трансуретральная простатэктомия или
чрезвлагалищная гистерэктомия. Преимущества непрерывной методики анесте-
зии могут быть получены установкой в канал катетера.
Преимущество каудальной анестезии над люмбальной эпидуральной анес-
тезией заключается в том, что анестезия для хирургических вмешательств на
нижних конечностях ограничивается поясничными или крестцовыми корешка-
ми. По сравнению со спинномозговой анестезией, каудальная анестезия пред-
почтительна меньшей возможностью возникновения постдуральной головной
боли, однако это осложнение при каудальной анестезии все же встречается. Сни-
жение числа случаев головной боли при использовании спинальных игл с закруг-
ленным срезом делает это преимущество менее значимым. Эти возможные срав-
нительные преимущества должны быть взвешены против таких недостатков, как
более медленное начало действия, более высокая доза препарата, технические
трудности процедуры, связанные с анатомическими особенностями.
Более часто каудальный доступ применяется при анестезии в педиатриче-
ской практике, где анатомические структуры расположены более поверхностно
и более предсказуемо, что позволяет получить прекрасную анальгезию в послео-
перационном периоде. Использование постоянной каудальной анестезии в аку-
шерской практике снижается, что связано с необходимостью введения больших
объемов анестетика, а также в связи со значительным влиянием на рефлекс «вы-
талкивания». В редких случаях каудальная анестезия может быть проведена при
отсутствии возможности проведения люмбальной эпидуральной анестезии, на-
пример, у матерей со спинальным сращением, описанным Harrington.
122
Глава 8
Препараты
Для каудальной анестезии используются те же препараты, что и для люмбальной
эпидуральной анестезии. Те же самые соображения применимы при определе-
нии желаемого соотношения выраженности (двигательная блокада по отноше-
нию к чувствительной) и продолжительности анестезии.
В связи с возможностью утечки через боковые крестцовые отверстия и боль-
шим объемом канала, объемы растворов при каудальной анестезии требуются
больше, чем при эпидуральной анестезии. Введение 15 мл раствора может вы-
звать только сакральную (промежностную) анестезию, в то время как для полу-
чения блока на уровне Th-10 — Th-12 требуется введение 25 мл раствора. В сред-
нем требуется 2-3 мл на сегмент, в то время как при люмбальной инъекции
требуется половина этого объема. Также как и при люмбальной эпидуральной
анестезии у взрослых, возраст и вес непредсказуемо влияют на распространен-
ность сакральной анестезии. При беременности требуется некоторое снижение
дозы — 16-18 мл раствора дают блок на уровне Th-10.
Как и при эпидуральной инъекции, к раствору анестетика могут быть добав-
лены некоторые вещества. Эпинефрин увеличивает продолжительность дейст-
вия. Клонидин и опиоиды будут увеличивать выраженность и продолжитель-
ность анальгезии [2, 3].
Техника
Каудальная анестезия может быть проведена при коленно-локтевом положении
пациента или в положении на боку, а также коленно-грудном положении. По-
следнее положение предпочтительнее в акушерской практике, где матка мешает
занять положение на животе. Для принятия этого положения пациента просят
встать на колени и наклониться ничком. Это положение является также более
предпочтительным потому, что приводит к смещению ягодичных мышц от кре-
стцового отверстия.
В положении на боку верхнее бедро и колено сгибаются, также способствуя
отведению ягодичных мышц от крестцового отверстия. В коленно-локтевом по-
ложении под бедра пациента помещают подушку, для того чтобы зафиксировать
сгибание в бедренном суставе и разведение мышц, кроме этого, пациенту пред-
лагают развести ноги и повернуть стопы внутрь.
1. После того, как пациент занял соответствующее положение, идентифициру-
ются анатомические ориентиры. Крестцовый рог может быть легко пропаль-
пирован у худощавых пациентов, он находится сразу выше межягодичной
складки. Крестцово-копчиковая мембрана формирует мягкое уплощение
между и сразу же ниже этих выступов. Расположение этой области подтверж-
дается рисованием треугольника, образованного сакральным отверстием и
задними верхними подвздошными гребнями; он должен быть равнобедрен-
ным. Эта связка должна быть расположена на 4—5 см выше пальпируемой вер-
хушки копчика. Для ориентировки также могут быть использованы
крестцовые отверстия (рис. 8.2).
2. До обработки кожи в коленно-локтевом положении небольшой тампон поме-
щается в межягодичную складку для предотвращения стекания раствора в
промежность. После антисептической обработки и обкладки кожи иглой не-
большого диаметра над связкой внутрикожно вводится небольшое количест-
во раствора местного анестетика. Распространенная инфильтрация будет
затруднять идентификацию анатомических ориентиров.
Каудальная анестезия
123
Рис. 8.2
Анатомия крестца, вид сзади.
Крестцовое отверстие закрыто тонкой
связкой, лежащей между и несколько
ниже двух выступающих крестцовых
рогов. Треугольник, нарисованный
между вехне-задними подвздошными
гребнями и этим отверстием, обычно
является равнобедренным
3. Более глубокая инфильтрация выполняется иглой диаметром 22 G, снова без
значительной деформации тканей. Если не планируется установка катетера,
полная блокада с однократной инъекцией проводится иглой диаметром 22 G,
подразумевая, что ощущение потери сопротивления в перидуральном про-
странстве будет более отчетливым при игле меньшего диаметра, чем при ис-
пользовании традиционных игл диаметром 17-19 G. Даже при использовании
игл большого диаметра предварительный доступ иглой диаметром 22 G необ-
ходим для того, чтобы помочь определить расположение связки и канала,
упрощая, таким образом, доступ более толстой иглы.
4. Игла проводится через анестезированные ткани к связке под углом около 70
градусов к коже (перпендикулярно связке [рис. 8.1]). Достаточное давление
позволит игле пройти через фиброзную мембрану и «провалиться» в крестцо-
вый канал. В этом месте канал неглубокий, и энергичное продвижение приве-
дет к болезненному повреждению периостального слоя передней стенки
канала. Если множественные попытки не приводят к пенетрации связки в те-
чение нескольких минут, следует уточнить анатомические ориентиры. От 6
до 10% пациентов имеют сращение, препятствующее этому доступу [1] и у
них должны быть использованы другие методики.
5. После проникновения в канал канюля иглы опускается вниз в направлении
межягодичной складки так, чтобы кончик иглы после этого был бы продви-
нут в канал не более чем на 4 см, почти параллельно продольной оси спины.
Срез должен быть повернут лицевой частью вниз для снижения возможности
царапающего повреждения периостального слоя острым кончиком. Направ-
ление канала по отношению к коже у женщин обычно ожидается близким к
параллельному, однако у мужчин или афроамериканцев канал может более
крутым (канюля должна быть отклонена от перпендикулярного направле-
ния). Если угол составляет 50 градусов или больше, должно предполагаться
внутрикостное или транссакральное положение иглы. Путь продвижения
иглы должен находиться в срединной части канала, что соответствует средин-
• ной плоскости спины; если наблюдается боковое отклонение, игла должна
быть извлечена, а анатомические ориентиры определены заново.
6. При погружении иглы в канал на 2-4 см к канюле присоединяется небольшой
шприц с 1.5 мл воздуха и затем проводится острожная аспирация. Если крови
или спинномозговой жидкости не получено, для определения сопротивления
быстро вводится воздух. Если игла находится в эпидуральном пространстве,
сопротивления инъекции не должно быть больше того, что создается просве-
том иглы. Острая боль во время инъекции указывает на субпериостальное по-
ложение иглы, что требует ее переустановки.
124
Глава 8
7. Если нет болезненности или сопротивление продолжает ощущаться, допол-
нительно быстро вводится 5 мл воздуха, при этом пальцы, удерживающие
иглу слегка опираются на область кожи, расположенную выше иглы. Если
ощущается крепитация, игла, возможно, находится в подкожных тканях и ее
необходимо переустановить. В боковых отделах воздух может проникать че-
рез крестцовые отверстия (рис. 8.2). Это допустимо. Если при инъекции паци-
ент жалуется на чувство защемления по задней поверхности бедер, это может
подтвердить правильное положение иглы.
8. Другое подтверждение правильности положения иглы можно получить при
использовании стимулятора нервов, действие которого будет вызывать со-
кращение перианальных мышц, если игла находится в крестцовом канале [4].
9. Если используется катетер, он вводится после проведения этих подтверждаю-
щих тестов. Здесь может понадобиться введение катетера на большую (до
11—13 см) глубину, чем в поясничной области, особенно если планируется
проведение низкой абдоминальной анестезии (грудные корешки).
10. Через катетер или иглу (при методике с одной инъекцией) вводится пробная
доза местного анестетика объемом 3 мл с эпинефрином в разведении
1:200000, после чего производится наблюдение за частотой сердечных сокра-
щений и кровяным давлением.
11. Если признаков внутрисосудистой или субарахноидальной инъекции не вы-
явлено, может быть введена вся доза анестетика, а катетер закреплен. Обычно
адекватная хирургическая анестезия наступает через 20 минут.
12. Как и при всех методиках длительного введения, перед каждой повторной
инъекцией должна вводиться пробная доза.
Осложнения
Внутрисосудистая инъекция
Внутрисосудистая инъекция является наиболее распространенной серьезной
проблемой и наблюдается чаще, чем при эпидуральной анестезии [5]. Крестцо-
вый канал хорошо кровоснабжается, однако давление в венах является низким,
что затрудняет определение проникновения в сосудистое русло путем аспирации
крови. Обязательно должны вводиться пробные дозы, после чего за психическим
статусом пациента проводится тщательно наблюдение. Сама инъекция должна
быть дробной.
Повреждение надкостницы
Повреждение надкостницы является нечастым, однако может вызывать болез-
ненное ощущение на протяжении нескольких недель. Проводится энергичное ле-
чение теплом и противовоспалительными препаратами с соответствующими
дополнениями, если необходимо.
Пункция твердой мозговой оболочки
Пункция твердой мозговой оболочки является редкой и приводит к такому же ри-
ску тотальной спинномозговой анестезии и постспинальной головной боли, как и
при эпидуральной анестезии.
Каудальная анестезия
125
Внутрикостная инъекция
Внутрикостная инъекция является редкой, однако может привести к системной
токсичности, схожей с таковой при внутривенной инъекции. Аспирация вещест-
ва костного мозга обычно невозможна, а абсорбция является настолько медлен-
ной, что пробная доза не позволяет получить представления о положении иглы.
При инъекции терапевтической дозы системные проявления могут не отмечаться
в течение нескольких минут.
Пресакральная инъекция
Пресакральная инъекция также является редкой, однако описаны инъекции в
прямую кишку и инъекции в кожу черепа плода. Тщательное определение анато-
мических ориентиров снижает возможность этого осложнения, игла не должна
продвигаться в ткани на всю длину. Некоторые авторы указывают, что каудаль-
ная анестезия в акушерской практике противопоказана, если головка плода опус-
тилась в малый таз (и лежит непосредственно на передней поверхности крестца).
Гипертензия
При быстром введении описаны случаи гипертензии. Это может быть связано с
ответной реакцией на сдавление спинного мозга и спинальных нервов. Это явле-
ние обычно является проходящим и может быть предотвращено медленной инъ-
екцией.
Литература
1. Crightion, I. М., Валу, В. Р., Hobbs, G. J., A study of thye anatomy of the caudal
space using magnetic resonance imaging. Br. J. Anaesth. 78: 391, 19997.
2. Constant, I., Gall, O., Gouyet, L., Chuavin, M., Murat, I. Addition of clonidine or
fentanyl to local anaesthetics prolongs the duration of surgical analgesia after single
shot caudal block in children. Br. J. Anaesth. 80: 294, 1998.
3. Van Elstraete, A. C., Pastureau, F., Lebrun, T., Mehdaoui, H. Caudal clonidine for
postoperative analgesia in adults. Br. J. Anaesth. 84: 401,2000.
4. Tsui, В. C., Tarkkila, P., Gupta, S., Kearney, R. Confirmation of caudal needle pla-
cement using nerve stimulation. Anesthesiology. 91: 374,1999.
5. Brown, D. L., Ransom, D. M., Hall, J. A., Leicht, С. H., Schroeder, D. R., Of-
ford, K. R. Regional anesthesia and local anesthetic-induced systemic toxicity: Sei-
zure frequency and accompanying cardiovascular changes. Anesth. Analg. 81:321,
1995.
Глава 9
Межреберная анестезия
Для вмешательств на брюшной и грудной стенках межреберная блокада нервов
является альтернативой к спинномозговой и эпидуральной анестезии. Эта мето-
дика обеспечивает интра- и послеоперационное обезболивание на срок до 12 ча-
сов без явлений симпатэктомии, как это бывает при аксиальных блокадах; она
является полезной альтернативой в тех случаях, когда нейроаксиальная блокада
противопоказана. Эта процедура более утомительна, поскольку приходится вы-
полнять множество инъекций, так как приходится анестезировать много нервов и
пропуск одного из них может привести к снижению анальгезии.
Анатомия
Периферические соматические нервы грудной клетки выходят из позвоночного
столба и сразу же формируют малые дорсальные и большие вентральные ветви.
Эти вентральные соматические ветви идут в латеральном направлении под соот-
ветствующими им ребрами. На внутреннем нижнем крае каждого ребра имеется
канал для нерва и сопровождающих его артерии и вены, нависающий наружный
край ребра защищает эти образования от прямого внешнего воздействия. Эта ре-
берная борозда закрыта фасцией внутренней и наружной межреберных мышц.
Под внутренней межреберной мышцей находится париетальная плевра. На уров-
не среднеподмышечной линии бороздки становятся менее заметными, и нерв от-
ходят от ребра, отдавая боковые кожные, а также передние двигательные ветви.
По этим двум причинам выполнение надежной анестезии после передней подмы-
шечной линии является более трудным. Основной ствол продолжается кпереди,
обеспечивая чувствительную и двигательную иннервацию мышц и кожи перед-
ней части грудной клетки (Th-2 - Th-6) и брюшной стенки (Th-7 - Th-11).
Двенадцатый межреберный нерв является особенным, поскольку он не име-
ет близкой топографической связи со своим ребром. XII нерв сразу же отдает сое-
динительные ветви к подвздошно-паховому нерву и стандартная подреберная
инъекция может не вызвать анестезии этого нерва. I и II межреберные нервы так-
же отличаются от других тем, что их основные ветви соединены с нижними нер-
вами плечевого сплетения или сами распространяются на плечевую область в со-
ставе межреберно-брахиального нерва, обеспечивая чувствительность
медиальной поверхности верхней части плеча.
Ребра различаются между собой. По задней срединной линии все они хоро-
шо защищены массивной паравертебральной мышцей. Нижние шесть ребер на-
чинают хорошо пальпироваться сразу у латерального края этой мышцы и явля-
ются широкими, плоскими и расположены относительно поверхностно. Верхние
ребра защищены в большей степени лопатками и соединенными с ними мышца-
ми. Они более узкие и находятся глубже, поэтому, технически менее доступны,
что делает паравертебральный доступ в этом регионе более приемлемым.
Межреберная анестезия
127
Показания
Двусторонняя блокада VI—XII межреберных нервов обеспечивает сенсорную
анестезию брюшной стенки в соответствующих дерматомах, т. е. от мечевидного
отростка до лобковой кости. Брюшные мышцы в этом регионе релаксируются.
Висцеральная брюшина не анестезируется. Анестезия этих нервов будет вызы-
вать поверхностную анальгезию и релаксацию, необходимые для рассечения пе-
редней брюшной стенки. Для любого разреза по срединной линии необходима
билатеральная блокада, поскольку здесь имеется такая перекрестная иннерва-
ция, что сенсорные дерматомы одной стороны пересекают срединную линию.
Для внутрибрюшных вмешательств необходима дополнительная анестезия чрев-
ного сплетения или общая анестезия. Эта комбинированная методика идеально
подходит для хирургических вмешательств на верхних отделах брюшной поло-
сти, таких как холецистэктомия, спленэктомия или гастрэктомия. Даже при вис-
церальной анестезии обычно требуется, особенно у ослабленных больных,
эндотрахеальная интубация, контролируемая вентиляция легких и легкая под-
держивающая общая анестезия. Для хирургических вмешательств на средних от-
делах брюшной полости (операция при аневризме брюшной аорты, колэктомия и
т.п.) межреберная анестезия может быть дополнена паравертебральной блокадой
корешков I и II поясничных нервов.
Односторонняя блокада межреберных нервов может оказаться полезной для
снижения объема анестетика, требуемого для проведения торакотомии. Она сни-
жает требования к послеоперационной анальгезии, однако не так успешно, как
для абдоминальной хирургии. Для верхних ребер может оказаться необходимым
паравертебральный доступ (см. главу 10). Межреберная блокада в качестве един-
ственного анестезиологического пособия применяется редко, в основном для по-
верхностных вмешательств на грудной стенке. Она применяется для установки
дренажей в грудную полость или в качестве проводниковой анальгезии при чрез-
кожно-билиарном дренировании. Односторонняя блокада трех или более ребер
может применяться для снятия боли при переломе ребер. Сегменты выше и ниже
поврежденного ребра также должны быть блокированы в связи с перекрестной
чувствительной иннервацией дерматомов.
Эта методика также оказывается полезной при острых торакотомических
болях или боли при подреберном разрезе, а также при болях в области срединной
линии живота. Межреберная блокада при этих состояниях позволяет улучшить
вентиляцию легких, а также снизить дозу наркотических веществ у обычных па-
циентов. Это снижение не так эффективно, как при эпидуральных инфузиях и
для сохранения анестезии межреберные блокады необходимо повторять доста-
точно часто.
Препараты
Основной целью применения этой методики является получение длительной
анестезии, для чего наилучшим образом подходят длительно действующие ами-
но-амидные препараты. 0.5% растворы бупивакаина или левобупивакаина с эпи-
нефрином 1:200000 объемом от 3 мл до 5 мл на каждое ребро будут обеспечивать
анальгезию продолжительностью от 9 до 14 часов, а также адекватную интраопе-
рационную мышечную релаксацию в течение более короткого времени. Ропива-
каин эффективен в такой же степени, однако продолжительность его действия
втрое короче [1]. Если в мышечной релаксации нет необходимости, то для после-
128
Глава 9
операционного обезболивания более подходящими являются низкие концентра-
ции (0.25%), при этом общая доза снижается. Это является важным, поскольку
инъекция в хорошо васкуляризируемую область приводит к наиболее высоким
уровням анестетика в крови.
Техника
Задний доступ
Этот классический доступ может быть выполнен при традиционном поло-
жении лицом вниз (рис. 9.1), а также в положении сидя или в положении на боку
у пациентов с болями в животе или у ослабленных больных. Боковое положение
позволяет в наибольшей степени сместить лопатку в латеральном направлении,
однако при этом положении за один раз может быть блокирована только одна
сторона. При положении лицом вниз имеется большой риск угнетения дыхания
или обструкция дыхательных путей при седативном воздействии, которое требу-
ется обычно, чтобы пациент перенес 14 инъекций. Необходимо тщательное на-
блюдение за показателями жизненно важных функций.
Рис. 9.1
Анатомические ориентиры
для межреберной блокады.
Нижние края ребер определяются
в местах их наибольшего выступа
на спине. Ъти ориентиры обычно
располагаются на одной линии,
идущей с небольшим отклонением в
медиальную сторону от XII до VI ребра.
Точка определения XII ребра обычно
располагается приблизительно
в 7 см от срединной линии. Для
блокады чревного сплетения
(см. главу 11) рисуется треугольник
между маркерами XII ребер и нижним
краем остистого отростка XII грудного
позвонка. Основанием этого
треугольника является линия между
маркерами двух ребер. Для люмбальной
соматической (см. главу 10) или
люмбальной симпатической блокад
(см. главу 11) идентифицируются
поперечные отростки поясничных
позвонков, для чего проводятся линии
через верхние края остистых отростков
поясничных позвонков; поперечные
отростки каждого позвонка обычно
расположены в поясничной области
на этой линии
Межреберная анестезия
129
1. Пациент ложится лицом внимз, охватывая руками каталку или операционный
стол с боков, так чтобы лопатки отодвинулись от срединной линии латераль-
но. Под живот помещается подушка для того, чтобы спина оставалась выгну-
той, что создает условия для более отчетливой пальпации ребер. Голова
повернута в одну из сторон для создания наилучших условий для дыхания.
2. Обозначаются анатомические ориентиры. Маркируются остистые отростки и
нижний край ХП ребра в точке, на 7 см отстоящей от срединной линии
(рис. 9.1). Эти точки обычно соответствуют наиболее выступающему задне-
му закруглению ребра. Затем маркируются VI и VII ребра в местах, где они
могут быть легко определены — между лопаткой и межостистыми мышцами,
обычно на 4-5 см от срединной линии. На каждой стороне рисуется линия, со-
единяющая две эти точки маркировки ребер. Нижние края остальных ребер с
VI по XI маркируются на этой линии с каждой стороны. Эти линии должны
проходить через выступающий задний угол каждого ребра. Расстояние между
XI и XII ребром будет больше, чем между другими ребрами. Если будет про-
водиться блокада чревного сплетения, эти маркеры также будут использова-
ться (см. главу 11).
3. В процессе маркировки спины и подготовки оборудования ассистент, продол-
жая наблюдение за пациентом, начинает внутривенную инъекцию седативного
препарата. Наиболее подходящей является комбинация анальгетического и ам-
нестического препаратов.
4. После обработки и обкладки кожи в каждой из маркированных точек иглой
небольшого диаметра проводится внутрикожное введение анестетика. Реак-
ция пациента на 14 инъекций обычно указывает на достаточность седативно-
го воздействия.
5. Начиная с нижнего ребра выполняется последовательная блокада межребер-
ных нервов. XII нерв может быть пропущен, поскольку его различное поло-
жение делает его анестезию ненадежной. Анестезиолог стоит сбоку от
пациента, держа шприц в «каудальной» от него руке (правой, если он распо-
лагается с левой стороны от пациента). Указательный палец «краниальной»
руки помещается на кожу сразу выше наиболее нижнего маркера и должен ле-
жать на теле ребра. Кожный валик, образовавшийся в результате инфильтра-
ционной анестезии, смещается в краниальном направлении так, чтобы он
лежал над серединой ребра. Сквозь кожный валик, в направлении ребра про-
водится игла диаметром 22 G (рис. 9.2). Контакт с надкостницей должен быть
осторожным как для предотвращения дискомфорта у пациента, так и для
предотвращения вкола кончика иглы.
6. После того, как игла осторожно опирается на ребро, «краниальной» рукой
контролируется ее положение и положение шприца. Канюля иглы зажимает-
ся между большим и указательным пальцами, в то время как стержень иглы
опирается на средний палец (рис. 9.3). Локтевой край ладони опирается на
спину для предотвращения незапланированного изменения глубины проник-
новения иглы. Теперь пальцы «каудальной» руки вставляют в кольца шприца
и готовятся к выполнению инъекции. При 20 градусном краниальном откло-
нении иглы и шприца кончик иглы слегка приподнимается над надкостницей
и направляется вниз до тех пор, пока он не пересечет нижний край ребра. Эла-
стичность кожи (предварительно смещенной вверх так, чтобы анестезирован-
ный участок оказался над ребром) помогает направить иглу в правильном
направлении. При каждом «шаге» к краю ребра игла и шприц всегда должны
оставаться параллельными их первоначальному краниальному отклонению.
5—1685
130
Глава 9
Рис. 9.2
Положение рук и иглы при межреберной
блокаде; игла на ребре.
Указательный палец «краниальной» руки
определяет нижний край ребра и игла осторожно
проводится до кости. Затем, «краниальной»
рукой удерживается канюля иглы и
контролируется перемещение шприца
Рис. 9.3
Положение рук и иглы при межреберной
блокаде; игла под ребром.
Глубина вкола иглы контролируется рукой,
опирающейся на спину. Другой рукой
производится инъекция при положении иглы
под ребром, однако эта техника необходима
только тогда, когда игла находится рядом
с плеврой
Наиболее частой причиной неполноценного обезболивания является откло-
нение шприца в каудальном направлении.
7. Когда игла находится под ребром, ее краниальное отклонение сохраняется и
она продвигается на 2-3 мм в межреберный промежуток. В то время как «кра-
ниальной» рукой продолжают контролировать шприц, вводится 3-4 мл рас-
твора анестетика. Интраваскулярная инъекция предотвращается осторожной
аспирацией. Осторожное минимальное «покачивание» кончика иглы может
помочь предотвратить внутривенную инъекцию. Если кончик иглы находит-
ся в просвете сосуда, покачивание сделает его присутствие там временным. В
определении парастезии нет необходимости, если только не производится
нейролитическая блокада.
Во время инъекции «краниальная» рука опирается о грудную стенку, осуще-
ствляя надежный контроль за шприцем. Пальцы «каудальной» руки исполь-
зуются только для инъекции, но не для продвижения шприца или иглы.
Межреберная анестезия
131
8. После инъекции шприц и игла немедленно извлекаются до безопасного уров-
ня дорсальной поверхности ребра. Пальцы «каудальной» руки вынимают из
колец шприца, цилиндр шприца удерживается между большим и указатель-
ным пальцами. В это время «верхняя» рука уже не контролирует «каудаль-
ную» руку, а осуществляет поиск следующего ребра, при этом, игла
продолжает оставаться над ребром, нерв которого только что был блокиро-
ван.
9. Контроль за шприцем переходит от одной руки к другой, шприц с иглой пере-
мещается к следующему ребру. Если необходима дозаправка шприца, он от-
соединяется от иглы, а игла остается в коже как маркер последнего
блокированного нерва.
10. Блокада на противоположной стороне может осуществляться через средин-
ную линию или после перемещения к противоположной стороне операцион-
ного стола. Если анестезиолог переходит на противоположную сторону,
шприц снова лучше держать в «каудальной» руке. В противном случае, если
«каудальная» рука не основная, новичок может испытывать неудобства. Если
анестезиолог — правша, и выполняет блокаду с правой стороны пациента,
держа шприц в своей правой руке, ему будет трудно соблюдать необходимое
краниальное отклонение иглы. Игла часто поворачивается и отклоняется в ка-
удальном направлении, когда движется вдоль ребра, в результате чего рас-
твор местного анестетика может быть введен в стороне от места
расположения нерва.
11. Теперь, если необходимо, выполняется дополнительная блокада чревного
сплетения или люмбальная соматическая блокада.
12. Если блокада выполнялась на каталке, после ее завершения пациент переме-
щается в операционную, перекладывается на операционный стол, где после
проверки блокады и наступления анестезии хирург может приступить к вы-
полнению вмешательства.
Доступ по среднеподмышечной линии
При увеличении объема живота пациента, или если коленно-локтевому положе-
нию или боковом доступу препятствует боль, межреберные нервы могут быть
достигнуты по средне- или задней подмышечным линиям, когда больной лежит
на спине. Этот доступ также хорош для уменьшения послеоперационной боли,
если вначале хирургических операций межреберная блокада не выполнялась. Он
более трудоемкий, однако технически не сложен.
1. Пациент укладывается на спину, обе его руки разводятся в стороны и уклады-
ваются на подставки для рук. Ребра пальпируются и маркируются обычно по
задней аксиллярной линии.
2. На обеих сторонах кожа обрабатывается и обкладывается, после предупреж-
дения пациента проводятся внутрикожные инъекции анестетика (если проце-
дура проводится вначале или в конце общей анестезии, то в инфильтра-
ционной анестезии нет необходимости).
3. Анестезиолог может стоять либо у головного конца операционного стола
либо сбоку. Методика инъекции та же самая, что и при коленно-локтевом по-
ложении: шприц удерживается «каудальной» рукой, а при «пересечении»
ребра иглой и выполнении инъекции он контролируется обеими руками. За-
тем шприц перемещается к следующему ребру.
132
Глава 9
Установка постоянного катетера
Описана также методика установки постоянного катетера, используется стандар-
тный эпидуральный катетер, который устанавливается в межреберное простран-
ство через иглу типа Tuohy. Это может привести к анестезии нескольких уровней
в связи с медиальным распространением инъецируемого раствора к перидураль-
ным и паравертебральным областям. Обычно обеспечивается анестезия трех или
четырех сегментов. Для послеоперационного обезболивания может быть полезна
методика интраплевральной инъекции (см. главу 10).
Осложнения
Пневмоторакс
При этой методике пневмоторакс является наиболее частым осложнением, одна-
ко достаточно редким в опытных руках. Ключевым моментом для предотвраще-
ния этого осложнения является надежный контроль глубины проникновения
иглы рукой, опирающейся на спину во время выполнения инъекции. Кроме это-
го, на каждом этапе блокады, за исключением самой инъекции, игла должна
осторожно опираться на ребро. Ниже расположенная рука не может обеспечить
надежный контроль, поскольку она недостаточно фиксирована длинным «рыча-
гом плеча», за исключением момента проведения инъекции, когда игла распола-
гается ниже ребра. Пальцы этой руки не перемещают и не вынимают из колец
шприца за исключением момента, когда игла фиксирована у верхнего края ребра.
При соблюдении этих предосторожностей методика является достаточно
безопасной — пневмоторакс возникает менее чем у 1% пациентов. Это осложне-
ние должно подозреваться, если у пациента случился приступ кашля или возник-
ли боли во время инъекции, а также, если локализация ребра была затруднена,
что привело к частым пробным вколам «вслепую» (этот вариант проведения бло-
кады является нежелательным). Если имеются клинические признаки пневмото-
ракса, должно быть выполнено рентгенологическое исследование органов груд-
ной полости и, при необходимости, устранено проникновение воздуха.
Обструкция дыхательных путей и угнетение дыхания
Обструкция дыхательных путей и угнетение дыхания являются наиболее часты-
ми осложнениями, связанными с седативным воздействием в положении на жи-
воте во время проведения блокады. Должны быть в готовности средства для
искусственной вентиляции легких и реанимации, включая налоксон. Целесооб-
разно проведение дополнительной назальной оксигенации и пульсовой оксимет-
рии.
Дыхательная недостаточность
После межреберной блокады может отмечаться дыхательная недостаточность,
если двигательная блокада межреберных и верхних брюшных мышц проводи-
лась у пациентов с неэффективным диафрагмальным дыханием, а также в случа-
ях, когда легочная вентиляция в большей степени зависит от межреберных
мышц.
Межреберная анестезия
133
Системная токсичность
Также возможно развитие системной токсичности. Поскольку в хорошо ваксуля-
ризированные области вводится большой объем раствора, системная абсорбция
оказывается значительной. Даже при добавлении эпинефрина к 0.5% раствору
бупивакаина, уровень бупивакиана в крови может достичь 2 мкг/мл, что является
наибольшим уровнем для всех периферических блокад. Более низкие концентра-
ции бупивакаина или ропивакаина (0.25%) приведут к снижению уровня анесте-
тика в крови, приблизительно до 1 мкг/мл [1].
Гипотония
Гипотония возникает редко и может наблюдаться в результате субарохноидаль-
ной инъекции в твердую мозговую оболочку, если инъекция выполнена со значи-
тельным медиальным смещением. Более часто гипотония вызывается
эпидуральным или паравертебральным распространением местного анестетика к
симпатическому стволу. Препарат, введенный в межреберье, может легко пере-
меститься в медиальном направлении и распространиться на несколько дермато-
мов выше и ниже места инъекции.
Литература
1. Kopacz, D. J., Emanuelsson, В. М., Thompson, G. Е., Carpenter, R. L., Stephen-
son, С. A. Pharmacokinetics of ropavacaine and bupivacaine for bilateral intercos-
tal blockade in healthy male volunteers. Anesthesiology 81: 1139, 1994.
Глава 10
Паравертебральная блокада
Кроме блокирования стволов периферических нервов в месте их прохождения
вдоль ребер, анестезиолог может получить доступ к этим нервам рядом с местом
их выхода из межпозвоночных отверстий. Этот доступ особенно эффективен для
корешков поясничных нервов, которые не имеют сопровождающих их ребер, что
не позволяет определить их периферическое направление, а также для блокады
верхних грудных нервов, на уровне которых ребра обнаружить труднее.
Анатомия
Корешки грудных и поясничных нервов выходят из спинномозгового канала че-
рез соответствующие межпозвоночные отверстия в латеральной стенке канала.
Эти отверстия расположены кпереди от поперечных отростков и находятся на се-
редине расстояния между этими отростками. Спинномозговые нервы выходят из
канала сразу каудальнее и на 2 см выше соответствующих им поперечных отро-
стков. В торакальном отделе поперечные отростки, тела позвонков и поверхност-
ный листок плевры формируют треугольное пространство между каждой парой
ребер [1]. В этой области каждый спинномозговой нерв дает небольшую заднюю
ветвь для иннервации мышц и кожи, расположенных в срединной области спи-
ны. Большая часть нервных волокон продолжается в виде основного переднего
корешка к иннервируемым дерматомам и миотомам (рис. 10.1).
Поперечные отростки не могут идентифицироваться непосредственно, од-
нако их местоположение может быть установлено относительно остистых отро-
стков. В торакальном отделе длинные остистые отростки выступают в каудаль-
ном направлении, перекрывая поперечный отросток позвонка, расположенного
ниже. Область XI и XII позвонков является переходной зоной, в которой остис-
тый отросток лежит напротив межпозвоночного пространства. В поясничном от-
деле более прямые остистые отростки расположены над поперечными отростка-
ми этого же позвонка. За исключением переходной зоны в области Th-11 - Th-12
поперечный отросток обычно расположен на 3—4 см латеральнее остистого отро-
стка и слегка отклонен от него в краниальном направлении.
Показания
Торакальная паравертебральная блокада может быть использована как альтерна-
тива эпидуральной или межреберной анестезии [2], однако точность локализации
нерва не так велика и в нескольких исследованиях были отмечены неудачи в 10%
случаев [3, 4]. Определение парестезии может способствовать успеху, однако
стандартная методика основана на введении больших объемов и анатомических
знаниях. Это создает две проблемы: во-первых, слепое продвижение иглы за попе-
речный отросток повышает возможность того, что игла неожиданно спунктирует
Паравертебральная блокада
135
Плевра
Симпатический ствол
Дорсальный
корешковый ганглий
Межреберный нерв
Верхняя
поперечно-
реберная
связка
-----Ребро
Рис. 10.1. Паравертебральная блокада.
Сразу после выхода из межпозвоночного отверстия торакальный соматический нерв входит в
маленькое треугольное пространство, сформированное телом позвонка, плоской поверхностью
поперечного отростка и плеврой. Игла продвинута через это пространство над верхним краем
поперечного отростка через связку. Медиальное направление иглы является важным условием
снижения риска пневмоторакса (С разрешения и по материалам Barash Р. G., Cullen В. F., Stoelting
R. К., Eds. Clinical Ansthesia. Philadelphia: Lippincott, 2001.)
близкорасположенную подлежащую плевру, во-вторых, большие объемы требуют
ограничения числа уровней, которые могут быть блокированы до введения макси-
мальной рекомендованной дозы местного анестетика. Поэтому эта методика огра-
ничена ситуациями, при которых может понадобиться сегментарная анестезия
только нескольких дерматомов, особенно, когда необходима более проксимальная
блокада межреберного нерва. Классическим показанием является болевой синд-
ром в грудной клетке при острой инфекции Herpes zoster, а также для уменьшения
постторакотомической невралгии, если есть уверенность, что она связана с по-
вреждением дистальной части межреберного нерва. Другим показанием к исполь-
зованию является снятие боли, возникшей вследствие перелома ребра.
Торакальная блокада использовалась в хирургии молочной железы [5,6], включая
вмешательства, проводимые при раке в амбулаторных условиях [7]. В большинст-
ве случаев в связи с перекрестной чувствительной иннервацией должно быть бло-
кировано несколько корешков (по меньшей мере один выше и один ниже
требуемого сегмента). Использование постоянного катетера на одном уровне мо-
жет решить эту проблему при распространении большого объема анестетика на 2
или 3 рядом расположенных сегмента с каждой стороны.
Люмбальная паравертебральная блокада также может использоваться при
болевом синдроме. Кроме этого, она применяется как дополнительное к межре-
берной блокаде средство для обеспечения хирургической анестезии нижних от-
делов брюшной полости и верхних отделов нижних конечностей. В отличие от
торакальной паравертебральной блокады эта методика не связана с риском пнев-
136
Глава 10
моторакса, однако также требует введения больших объемов. Эта комбиниро-
ванная методика полезна при анестезии для аорто-бедренного шунтирования.
Изолированная поясничная блокада является высокоэффективной при операци-
ях по поводу паховых грыж, и в отличие от изолированной нейроаксиальной бло-
кады позволяет освободиться от боли после амбулаторных хирургических вме-
шательств [3]. Эта методика может обеспечить послеоперационное
обезболивание в течение 10 часов.
Препараты
Как и при межреберных блокадах для анестезии от 3 до 5 часов могут быть испо-
льзованы амино-амиды средней продолжительности действия (1% или 1.5% рас-
твор лидокаина, 1% раствор мепивакаина), однако в основном используются
амино-амидные препараты длительного действия. Сенсорная анестезия может
быть получена 0.25% раствором бупивакаина или ропивакаина, в то время как
несколько более длительная и глубокая анестезия, а также двигательная блокада
могут быть получены при 0.5% концентрации. Эти препараты с эпинефрином в
разведении 1:200000 могут обеспечить анестезию продолжительностью от 8 до
14 часов.
Поскольку четкая анатомическая связь между расположением нерва и кост-
ными анатомическими ориентирами отсутствует, для каждого нерва вводятся не-
сколько большие объемы растворов (5-10 мл по сравнению с 3—4 мл для межре-
берной блокады). Для предотвращения системной токсичности необходимо
сосредоточить внимание на общей дозе в миллиграммах. Если выполняется бло-
када нескольких нервов, для сохранения общей дозы в допустимых пределах мо-
жет потребоваться более разведенный раствор.
Могут применяться нейролитические препараты (см. главу 23), при этом ис-
пользуются меньшие объемы, для уверенной идентификации нерва необходимо
определение явлений парестезии, или рентгенологические данные о положении
иглы.
Техника
Методика люмбальной анестезии
1. Пациент помещается в коленно-локтевое положение, для поддержки изгиба
спины под живот подкладывается подушка. Идентифицируются остистые от-
ростки. Остистый отросток VII шейного позвонка определяется по его высту-
пу в верхней части спины, при этом отростки 4-х поясничных позвонков
находятся на или несколько выше межгребневой линии.
2. Остистые отростки, соответствующие нервам, блокада которых планируется,
маркируются на всем протяжении. В поясничной области верхний край отро-
стков будет соответствовать поперечному отростку и соответствующему ему
нерву, в то время как в грудном отделе остистые отростки ассоциированы с
нижележащим поперечным отростком и соответствующим ему нервом.
3. Через верхушку соответствующих остистых отростков обозначаются проек-
ционные линии поперечных отростков, затем, эти линии соединяются верти-
кальными линиями, проходящими параллельно позвоночному столбу на 3-4
см латеральнее срединной линии (см. рис. 9.1).
Паравертебральная блокада
137
4. После антисептической обработки кожи на пересечении горизонтальных и
вертикальных линий проводится местная инфильтрационная анестезия.
5. Игла диаметром 22 G и длиной 3-4 дюйма проводится через сформированный
кожный валик с 10-30 градусным краниальным отклонением. В поясничной
области требуется больший угол. На глубине 2.5-5 см в зависимости от комп-
лекции пациента игла должна достичь поперечного отростка. Если контакта с
костью на ожидаемой глубине не произошло, производятся осторожные по-
исковые движения в каудальном и краниальном отклонении. После того, как
кость найдена, отмечается глубина нахождения поперечного отростка.
6. Игла извлекается до кожи и перенаправляется в каудальном направлении (бо-
лее перпендикулярно к коже) и слегка медиально, продвижение осуществля-
ется так, чтобы игла прошла на 2 см ниже края поперечного отростка (рис.
10.2). Может произойти контакт с телом позвонка, что может быть использо-
вано в качестве анатомического ориентира. За исключением случаев исполь-
зования нейролитических средств, парестезий не ищут.
7. После того, как игла находится на 2 см ниже нижнего края поперечного отро-
стка, вслед за осторожной аспирацией вводится 5—10 мл раствора анестетика.
8. Когда паравертебральная анестезия на уровне Th-12 и L-1 выполняется как
дополнение к межреберной блокаде, она может быть выполнена из единого
вкола с каждой стороны. После того, как идентифицирован остистый отрос-
ток I поясничного позвонка с каждой стороны, латеральнее на 3 см его верх-
Рис. 10.2. Люмбальная паравертебральная блокада, вид сбоку.
Нижние края ребер определяются в местах их наибольшего выступа на спине. Игла проводится через
кожный валик ниже края поперечного отростка под углом 30-45° в краниальном направлении на
глубину от 3 до 5 см до контакта с костью. После того, как отросток идентифицирован, угол
продвижения иглы уменьшается так, чтобы она прошла ниже кости. Соматический нерв будет
находиться приблизительно на 2 см ниже поперечного отростка. В определении парестезии нет
необходимости, для анестезии соматического нерва инъецируется 10 мл раствора анестетика. Если
планировалось выполнение симпатической блокады игла может быть продвинута дополнительно на
3-4 см при небольшом медиальном отклонении до контакта с телом позвонка (рис. 11.4),
симпатический ствол лежит вдоль переднего края тел позвонков
138
Глава 10
него края наносится маркер «X». Для идентификации поперечного отростка
игла длиной 3 дюйма проводится перпендикулярно по отношению к коже че-
рез каждый из маркеров. После того, как игла «пересекла» отросток с краниа-
льной стороны, в область корешка Th-12 вводится 5-10 мл раствора
анестетика. Далее, игла «пересекает» каудальный край и инъекция повторяет-
ся для корешка I поясничного нерва.
Методика торакальной паравертебральной блокады
Несмотря на то, что описанная методика люмбальной анестезии может быть ис-
пользована и для торакальной области, в этом регионе выполнение блокады дол-
жно быть значительно точнее. Здесь нервные пучки лежат более поверхностно
под соответствующими поперечными отростками. Модифицированный доступ
может помочь лучше идентифицировать паравертебральный треугольник [1].
1. Торакальный доступ может быть использован как в положении пациента
сидя, положении на боку, так и в коленно-локтевом положении.
2. Определение поверхностных анатомических ориентиров, местная инфиль-
трационная анестезия на торакальных уровнях проводится также как и при
люмбальном доступе (рис. 10.3), игла проходит через кожу на 3 см латераль-
нее верхнего края остистого отростка, соответствующего ниже расположен-
ному блокируемому нерву.
Рис. 10.3
Поверхностные анатомические ориентиры для торакальной
паравертебральной инъекции.
Игла проводится через точку, расположенную на 3 см
латеральнее верхнего края остистого отростка, который
лежит над блокируемым сегментом
3. Игла диаметром 22 G и длиной 4 дюйма (при установке катетера используется
игла типа Tuohy) проводится перпендикулярно к поверхности кожи и продвига-
ется к ребру или поперечному отростку на глубину приблизительно 2.5-3.5 см.
4. После контакта с костью игла тклоняется в краниальном направлении, «пере-
секая» верхний край отростка. Присоединяется шприц, заполненный возду-
хом, и при продвижении иглы в нем создается давление. Потеря
сопротивления (как при эпидуральной инъекции) указывает на прохождение
иглы через связку в паравертебральное пространство.
5. Для исключения субарахноидального, а также интраваскулярного или инт-
раплеврального положения иглы проводится осторожная аспирация. Для
каждого блокируемого сегмента вводится 5 мл раствора анестетика, в уста-
новленный катетер болюсно вводится 15 мл.
6. Введение через катетер вызовет анестезию в нескольких сегментах, располо-
женных выше и ниже места инъекции. Катетер не должен продвигаться более
чем на 2 см от кончика иглы.
Паравертебральная блокада
139
Интраплевральный катетер
Модификацией паравертебрально-межреберной блокады является установка
внутриплеврального катетера для проведения инъекций местного анестетика в
плевральную полость. В плевральной полости раствор местного анестетика бло-
кирует торакальные нервы на нескольких уровнях, это происходит путем диффу-
зии через париетальную плевру в межреберные пространства или в
паравертебральные пространства. При одностороннем введении эта блокада мо-
жет обеспечить проведение холецистэктомии или нефрэктомии [8], однако она
менее эффективна для торакотомии в связи с потерями раствора анестетика через
дренажи, установленные в грудной полости. Требуемые для двусторонней бло-
кады большие объемы анестетика делают ее практически нецелесообразной. Не-
смотря на то, что более высокие концентрации местного анестетика будут
вызывать длительную блокаду, риск повышения в крови будет возрастать. Эта
методика по эффективности снижения боли сравнима с межреберной блокадой,
однако связана с достоверно более высоким риском осложнений (особенно рис-
ком пневмоторакса и высоких уровней местного анестетика в крови) [8, 9] осо-
бенно по сравнению с эпидуральным введением опиоидов.
1. Установка катетера может быть произведена при положении пациента на
боку, сидя или в коленно-локтевом положении.
2. Идентифицируется необходимый межреберный промежуток (для абдомина-
льной анестезии обычно восьмой), который маркируется на 8-10 см латераль-
нее срединной линии по верхнему краю ребра, ограничивающего межреберье
снизу.
3. После обработки кожи выполняется внутрикожное введение местного анес-
тетика и инфильтрация подлежащих мягких тканей до ребра.
4. Игла типа Tuohy вводится по верхнему краю ребра под углом 30-40° кверху,
«пересекая» ребро. К игле присоединяется небольшой, заполненный возду-
хом шприц со свободно ходящим поршнем, игла вводится в плевральную по-
лость, идентифицируемую по отрицательному давлению, вызывающему
аспирацию содержимого шприца.
5. Катетер продвигается в пространство на 5-6 см, вводится 20 мл раствора ане-
стетика (0.25% или 0.5% бупивакаина). Это обеспечивает обезболивание на
стороне проведения блокады в течение 6-8 часов.
Осложнения
Пневмоторакс
Пневмоторакс является наиболее серьезным осложнением торакального доступа
и отмечается приблизительно в 0.5-1% случаев [2, 6], если это осложнение воз-
никло, оно должно быть распознано. Плевра достаточно близко .находится от пе-
редней поверхности поперечного отростка и, поэтому, игла не должна
продвигаться более чем на 2 см за задний край отростка. Доступ при проведении
торакальной паравертебральной симпатической блокады требует более глубоко-
го введения иглы и увеличивает возможный риск. При установке внутриплевра-
льного катетера пневмоторакс возникает в 2% случаев [9].
140
Глава 10
Субарахноидальная инъекция
Риск субарохноидальной инъекции при торакальной паравертебральной блокаде
больше чем при межреберной блокаде, поскольку на этом уровне твердая мозго-
вая оболочка в большей степени проникает через межпозвоночные отверстия. В
результате торакальной инъекции может наступить тотальная спинномозговая
анестезия, действия при которой уже описывались (см. главу 6).
Системная токсичность
Поскольку большие объемы анестетиков используются вблизи кровеносных со-
судов возможно развитие системной токсичности. Осторожная аспирация, дроб-
ная инъекция, постоянное наблюдение за психическим статусом пациента
необходимо не только во время проведения инъекции, но и в течение 30 минут
после нее. Когда люмбальные паравертебральные инъекции сочетаются с межре-
берной блокадой, для предотвращения системной токсичности должны учитыва-
ться общая концентрация и общий объем анестетика. Внутриплевральная
инъекция 0.5% бупивакаина вызывает достоверное повышение системного уров-
ня анестетика в крови [8].
Распространение раствора
Может также наблюдаться распространение раствора, которое скоре всего, если
будут задействованы коммуникантные ветви, приведет к дерматомной симпатиче-
ской блокаде. При диффузии местного анестетика через межпозвоночные отвер-
стия может возникнуть эпидуральная анестезия, однако это не создает каких-либо
проблем, за исключением случаев использования нейролитических средств.
Литература
1. Eason, М. J., Wyatt, R. Paravertebral thoracic block — a reappraisal. Anaesthesia
34: 638, 1979.
2. Karmakar, M. K. Thoracic paravertebral block. Anesthesiology 95: 771,2001.
3. Klein, S. M., Greengrass, R. A., Weitz, C., Warner, D. C. Paravertebral somatic
nerve block for outpatient inguinal herniorrhaphy: An expanded case report of 22
patients. Reg. Anesth. Pain. Med. 23: 306, 1998.
4. Lohnqvist, P. A., Mackenzie, J., Soni, A. K., Conacher, I. D. Paravertebral blocka-
de. Failure rate and complications. Anaesthesia 50: 813, 1995.
5. Klein, S. M., Bergh, A., Steele, S. M., Georgiade, G. S., Greengrass, R. A. Thoracic
paravertebral block for breast surgery. Anesth. Analg. 90: 1402,2000.
6. Pusch, F., Freitag, H., Weinstabl, C., Obwegeser, R., Huber, E., Wildling, E. Single-
injection paravertebral block compared to general anaesthesia in breast surgery.
Acta Anaesthesiol. Scand. 43: 770, 1999.
7. Greengrass, R., O'Brian, F., Lyerly, K., Hardman, D,. Gleason, D., D'Ercole, F., Ste-
ele, S. Paravertebral block for breast cancer surgery. Can. J. Anaesth. 43:858,1996.
8. Scott, N. B., Mogensen, T., Bigler, D., Kehlet, H. Comparison of the effects of con-
tinouos intrapleural vs epidural administration of 0.5% bupivacaine on pain, meta-
bolic response and pulmonary function following cholecystectomy. Acta
Anaesthesiol. Scand. 33: 535, 1989.
9. Stromskag, К. E., Minor, B,. Steen, P. A. Side effects and complications related to
interpleural analgesia: An update. Acta Anaesthesiol. Scand. 34: 473, 1990.
Глава 11
Симпатические блокады
Периферический симпатический отдел автономной нервной системы сформиро-
ван ветвями, отходящими от грудных и верхних поясничных спинномозговых
сегментов. Корешки этих нервов содержат эфферентные волокна, регулирующие
вазоконстрикцию, и афферентные волокна, ответственные за внутрибрюшную и
внутригрудную «висцеральную» чувствительность. Выполнение селективной
анестезии этих волокон может оказаться особенно эффективным при острой и
хронической боли, а также явиться полезным дополнением хирургической ана-
льгезии при сочетании с другими местными или общими методиками. К счастью,
многие симпатические волока сгруппированы в отдельные нервы, узлы и сплете-
ния и не проходят в составе обычных соматических нервов. Это во многих ситуа-
циях создает условия для селективной симпатической блокады без двигательной
или сенсорной анестезии.
Анатомия
Тела преганглионарных симпатических эфферентных нервных клеток находятся
в симпатических центрах ствола мозга. Их аксоны в составе спинного мозга до-
ходят до одного из грудных или поясничных сегментов, где они выходят из боко-
вого столба серого вещества. Эти периферические волокна проходят через
межпозвоночные отверстия и сразу же покидают соматические нервы, главным
образом, в виде белых коммуникантных ветвей сливаясь в симпатические ганг-
лии, лежащие на передне-боковой поверхности тел позвонков. Несмотря на то,
что преганглионарные волокна выходят только на уровне с Th-1 по L-2, ганглио-
нарная цепочка формирует ствол, который на каждой стороне поднимается до
шеи и спускается к тазу, что обеспечивает каждую область тела своей порцией
симпатической иннервации. На шее цепочка симпатических ганглиев лежит
вдоль боковых поверхностей относительно ровных тел соответствующих по-
звонков; в грудной клетке они лежат больше кзади, рядом с головкой каждого
ребра (см. рис. 10.1). В брюшной полости и полости таза они расположены на те-
лах позвонков больше кпереди и более широко отделены от соматических нервов
(см. рис. 10.2). В ганглии преганлионарные волокна могут образовывать синапс
со своей постганглионарной парой, проходить до образования синапса вверх или
вниз несколько сегментов или проходить через ганглий, образуя синапс в диста-
льном дополнительном узле, таком как чревное сплетение или в органном спле-
тении, например, адренальном. Постганглионарные волокна, идущие к
соматическим дерматомам, покидают симпатический ствол в виде серых ветвей
и возвращаются в дорсальном направлении в область соответствующего сегмен-
тарного соматического нерва. Исключением является голова, где эти постгангли-
онарные волокна идут рядом с артериальными сосудами.
142
Глава П
Ганглии головы и шеи путем дополнительных соединений образуют три
группы с каждой стороны. Верхнее шейное сплетение расположено вдоль пер-
вых трех шейных позвонков и является самым большим из трех. Все волокна к
нему и к среднему шейному сплетению должны пройти через нижнее шейное
или звездчатое сплетение. Звездчатый ганглий образован слиянием первого
грудного сегментарного ганглия с ганглиями нижних шейных сегментов. Он ле-
жит на боковой поверхности седьмого шейного позвонка сразу кпереди от его
поперечного отростка. Место расположения ганглия находится позади каротид-
ной фасции и позвоночной артерии, сразу выше плевры, рядом с возвратным
(гортанным) нервом.
От грудных ганглиев отходят многочисленные ветви, образующие большой
и малый чревные нервы, идущие к дополнительному внутрибрюшному ганглию,
чревному сплетению. Эта развитая сеть симпатических нервов расположена в за-
брюшинном пространстве вдоль аорты и чревного ствола, приблизительно на
уровне первого поясничного позвонка. От этого сплетения, а также от верхнего и
нижнего брыжеечных сплетений расположенных более каудально, органы
брюшной полости получают постганглионарную иннервацию.
Ниже тела второго поясничного позвонка симпатические ганглии продол-
жают лежать на позвоночном столбе. Здесь их анатомические особенности наи-
более разнообразны, число и местоположение ганглиев подвержены значитель-
ным индивидуальным колебаниям даже на разных сторонах у одного человека.
Все преганглионарные волокна входят в симпатический ствол, начиная от уров-
ня первого поясничного позвонка и выше. Как и в голове, все волокна симпатиче-
ской иннервации нижней части тела должны пройти через этот один «воротный»
ганглий.
Таким образом, анатомические особенности симпатической системы позво-
ляют выделить три особых центра объединения волокон, что облегчает блокаду
их терминальных ветвей — звездчатый ганглий в голове, чревное сплетение в
брюшной полости и сплетение на втором поясничном позвонке, снабжающее
нижние конечности.
Показания
Блокада чревного сплетения является полезным дополнением межреберной бло-
кады нервов при абдоминальной анестезии (см. главу 9). При этом блокируются
афферентные и эфферентные симпатические волокна органов брюшной полости,
на которые межреберная блокада не оказывает воздействия. Блокада чревного
сплетения снижает требования к интраоперационному дополнению другими ане-
стетическими средствами. Расплатой за эту методику является гипотония, возни-
кающая в результате симпатической блокады. Более часто, блокада чревного
сплетения (как и другие симпатические блокады) наиболее полезна для диагнос-
тики и лечения хронических болей, вызванных распространением злокачествен-
ных новообразований [1, 2], в особенности при боли в животе, связанной с
поджелудочной железой (см. главу 23).
Блокада звездчатого сплетения может быть использована как дополнение
хирургической анальгезии для снижения боли при таких манипуляциях в груд-
ной полости как торакоскопия. При этой, более ограниченной блокаде не возни-
кает проблемы системной гипотонии. Блокада звездчатого ганглия и пояснично-
го симпатического сплетения в основном используются при болевом синдроме,
особенно, если в его формировании участвует сосудистый компонент. Это при-
менение блокады более полно обсуждается в главе 23.
Симпатические блокады
143
Препараты
Для блокады небольших немиелинизированных симпатических волокон могут
быть использованы растворы местных анестетиков в низкой концентрации. Эф-
фективны 0.5% раствор лидокаина, 0.25% раствор бупивакаина и другие эквива-
лентные дозы какого-либо из анестетиков. В целом, для блокады ганглиев
требуются большие объемы анестетиков по сравнению с блокадой симпатиче-
ских нервов, поскольку ганглий имеет не компактное, а диффузное расположе-
ние. Короткодействующие препараты могут быть использованы для
диагностических блокад или для дополнения хирургической анестезии, когда
длительная симпатическая блокада и гипотония могут оказаться нежелательны-
ми. Длительно действующие препараты подходят для проведения серии блокад
при разрушении симпатического ствола или диагностической блокады при боле-
вом синдроме в онкологической практике.
Этиловый спирт и фенол успешно использовались как нейролитические
средства для симпатических волокон, в основном для поясничного сплетения, в
связи с опасением повреждения фенолом тканей находящихся рядом кровенос-
ных сосудов в области шеи и живота. Поскольку к звездчатому и поясничному
сплетениям прилежат другие нервы, блокада этих сплетений связана с риском их
нейролитического повреждения.
Техника
Блокада звездчатого ганглия
Блокада звездчатого ганглия обеспечивает блокаду симпатической иннерва-
ции головы и рук. Классическая паравертебральная инъекция, описанная ниже,
может на самом деле не привести к прямой анестезии ганглия, однако она может
вызвать блокаду волокон, которые выходят из ганглия. Для инъекции непосред-
ственно в область расположения ганглия может понадобиться контролирующая
визуализация компьтерно-томографическим исследованием, что целесообразно
при использовании нейролитических средств.
1. Пациент укладывается на спину, руки находятся по бокам. Под шею помеща-
ется небольшой валик или подушка для удобного положения шеи.
2. На стороне инъекции маркируются медиальный край грудино-ключично-со-
сцевидной мышцы и перстневидный хрящ гортани. Приблизительно на 2 см
латеральнее бокового края перстневидного хряща осторожно пальпируется и
маркируется передний бугорок поперечного отростка VI шейного позвонка.
Это наиболее выступающий бугорок шеи. На таком же расстоянии от средней
линии, но на 1.5-2.0 см каудальнее маркером «X» обозначается проекция бу-
горка VII шейного позвонка. Этот маркер должен быть ниже медиального
края мышечного массива и приблизительно на два поперечных пальца выше
ключицы.
3. После обработки кожи в точке, маркированной «X», проводится поверхност-
ная инфильтрационная анестезия.
4. Игла диаметром 22 или 25 G длиной 1.5 дюйма с присоединенным 10 мл
шприцем проводится через маркированную точку и направляется прямо в
заднем направлении до контакта с костью. Во время этого мышечный массив
и каротидная фасция отодвигаются вбок указательным пальцем противопо-
ложной руки (рис. 11.1). Если бугорок не был обнаружен на глубине до 5 см,
144
Глава 11
Рис. 11.1. Блокада звездчатого ганглия.
Грудино-ключично-сосцевидная мышца (SCM) и каротидная фасция отодвигаются латерально во
время продвижения иглы прямо по латеральному краю тела VII шейного позвонка к поперечному
отростку. После контакта с костью игла несколько извлекается и перед дробной инъекцией
анестетика проводится осторожная аспирация
игла перенаправляется несколько медиальнее. Если и это не дает результата,
может быть произведено небольшое каудальное или краниальное отклоне-
ние. Парастезия в зоне иннервации плечевого сплетения указывает на откло-
нение иглы кзади и вбок. Если бугорок не идентифицируется, необходимо
переопределить анатомические маркеры.
5. После контакта с костью игла извлекается на 2 мм и проводится осторожная
аспирация (рис. 11.2). После введения 2 мл пробной дозы проводится тщате-
льное наблюдение за психическим статусом пациента. Если изменений не от-
мечено, дробно вводится 5-10 мл раствора с частой аспирацией, наблюдение
за психическим статусом продолжается постоянно.
6. Проявления синдрома Горнера (птоз, миоз, ангидроз и энофтальм) наступят в
течение 10 минут. Частым симптомом является также заложенность носа. Не-
смотря на то, что расширение сосудов рук не входит в классический синдром,
оно обычно наблюдается при этой блокаде вместе с синдромом Горнера.
7. Блокада может быть выполнена на уровне тела VI шейного позвонка, поско-
льку объема вводимого раствора достаточно для распространения от этого
уровня к волокнам ганглия. Несмотря на то, что это место более удалено от
предполагаемого места положения ганглия, оно также находится дальше и от
позвоночной артерии (которое на этом уровне переходит за поперечный отро-
сток), в связи с чем, риск артериальной инъекции старовится меньше. Мето-
дика этой блокады аналогична вышеописанной, за исключением уровня
места инъекции.
Симпатические блокады
145
Рис. 11.2. Блокада звездчатого ганглия, поперечный срез.
Показана игла, опирающаяся на передний край VII шейного позвонка. Сосудистый пучок,
заключенный в каротидную фасцию, а также позвоночная артерия расположены достаточно близко.
Паэтом уровне позвоночная артерия расположена сзади в своем канале, образованном поперечными
отростками, тем не менее, здесь она расположена рядом с местом инъекции. Корешки, образующие
плечевое сплетение также находятся сразу сзади и сбоку от места инъекции
Блокада чревного сплетения
Блокада чревного сплетения обычно проводится при болях, связанных с подже-
лудочной железой. Кроме этого классического описания существует еще неско-
лько других предложений, однако частота успешного проведения блокады при
различных доступах одинакова [3].
1. Пациент помещается в положение лицом вниз, под область таза подкладыва-
ется подушка для выравнивания поясничного изгиба.
2. Идентифицируются и нумеруются остистые отростки 12-го грудного и 1-го
поясничного позвонков, что выполняется обычно отсчетом от 4-го пояснич-
ного позвонка, который находится на и сразу выше линии между подвздош-
ными гребнями. Также идентифицируется 12-ё ребро, которое маркируется
меткой «X» на 7 см от срединной линии, как при межреберной блокаде (см.
рис. 9.1). Затем эти метки соединяются линией, проходящей через позвоноч-
ный столб. Наконец, путем соединения этих точек с остистым отростком
12-го поясничного позвонка (который лежит выше тела 1-го поясничного по-
звонка) рисуется треугольник.
3. После обработки кожи в местах нанесения маркеров «X» иглой небольшого
диаметра проводится внутрикожное введение анестетика. Более глубокая ин-
фильтрационная анестезия выполняется иглой диаметром 22 G.
4. На каждой стороне через точку, помеченную «X», проводится игла длинной 5
дюймов (6 дюймов для тучных пациентов) и направляется медиально с крани-
альным отклонением вдоль линий нарисованного треугольника к телу перво-
го поясничного позвонка. Игла должна продвигаться с отклонением кпереди
приблизительно под углом 45 градусов к коже.
5. После того, как тело позвонка достигнуто, игла извлекается на 5 см и откло-
няется так, чтобы ее дальнейшее продвижение привело к прохождению спе-
реди от тела позвонка (рис. 11.3). Миновав передний край тела позвонка,
146
Глава П
XII ребро
Чревное
железа
Левая
почка
Правая
доля
печени
12-перстная
кишка
Поясничная
мышца
Брюшная
аорта
Нижняя Поджелу-
полая дочная
вена
Рис. 11.3. Блокада чревного сплетения.
Поверхностные анатомические ориентиры описаны на рисунке 9.1. Игла проводится через кожу в
направлении бокового края треугольника, т.е. на 7 см от срединной линии по нижнему краю 12-ого
ребра. Продвижение проводится в медиальную сторону с отклонением кверху (вдоль боковой линии
нанесенного на кожу треугольника) до контакта с боковой поверхностью тела позвонка. Затем, она
продвигается больше кпереди, проходя мимо позвонка к превертебральному пространству, где
находится большой и малый чревный нервы и образованное ими чревное сплетение. Не следует
пытаться проводить иглу далеее — это может привести к попаданию в сосудистый пучок
кончик иглы продвигается еще на 2-3 см. Надкостница — чувствительная и
перемещение иглы может потребовать внутривенной анальгезии или седа-
ции.
На левой стороне, как только стала ощущаться пульсация аорты, продвиже-
ние иглы должно быть сразу же остановлено. При попадании иглы в просвет
сосуда игла извлекается из сосудистой стенки, а ее просвет немедленно очи-
щается от крови. На правой стороне игла обычно может быть продвинута на 1
см дальше, чем на левой. Идеально, если при рентгеноскопии или боковой
рентгенографии игла визуализируется лежащей у передней границы тела по-
звонка.
6. Для хирургических или диагностических блокад обычно достаточно опреде-
ления поверхностных костных ориентиров. При болевом синдроме, особенно
при инъекции нейролитических средств, должно быть обеспечено рентгено-
логическое подтверждение положения иглы путем проведения рентгеноско-
пии, рентгенографии или компьютерной томографии. Одним из средств
подтверждения положения иглы является инъекция небольшого объема рент-
геноконтрастного вещества.
7. На каждой стороне для исключения субарахноидальной или внутрисосуди-
стой инъекции должна проводиться осторожная аспирация и введение проб-
ной дозы.
8. На каждой из сторон вводится 20-25 мл раствора местного анестетика. Этот
объем требуется для диффузного распространения в области ганглия и под-
тверждением того, что инъекция проводится позади аорты и нижней полой
вены, путем диффузии местный анестетик достигнет сплетения и волокон
чревных нервов. Если процедура заканчивается дополнительной межребер-
ной блокадой, то для предотвращения введения токсических доз местного
анестетика объем или концентрация раствора могут быть уменьшены.
Симпатические блокады
147
9. До окончания гипотонического действия должно проводиться тщательное на-
блюдение за кровяным давлением. Если процедура проводилась с диагности-
ческими, а не хирургическими целями, пациент должен оставаться в
положении на спине, по крайней мере, в течение одного часа до восстановле-
ния венозного кровотока в связи с возможностью ортостатической гипото-
нии. Пациент должен подниматься постепенно при помощи персонала.
Другой доступ к чревному сплетению
Singler описал парамедианный доступ, при котором игла проводится ниже остис-
того отростка XII грудного позвонка и на 3 см от срединной линии, направление
продвижения иглы перпендикулярно поверхности кожи (4). Эта методика позво-
ляет уменьшить вероятность прохождения иглы через почку, однако достижение
корректной глубины является более трудным без применения рентгенологической
визуализации. Сплетение может быть достигнуто также спереди тонкой иглой под
рентгеноскопическим контролем с несомненно меньшим риском (5). При всех
этих доступах эффективность блокады может быть ограничена изменениями ана-
томических структур, вызванных опухолью [6].
Люмбальная симпатическая блокада
Также как симпатическая иннервация головы и рук симпатическая иннерва-
ция нижних конечностей может быть блокирована однократной инъекцией «во-
ротного ганглия», который получает от спинного мозга самые нижние симпати-
ческие волокна. Этим ганглием обычно является сплетение на II поясничном
позвонке; исследования на трупах подтверждают, что идеальным местом для
блокады является нижняя треть тела II поясничного позвонка или верхняя треть
тела III поясничного позвонка [7]. В связи с влиянием индивидуальных анатоми-
ческих особенностей целесообразна блокада нескольких уровней. При использо-
вании нейролитических средств для многоуровневого воздействия возможно бо-
лее разумным является проведение меньших инъекций на нескольких уровнях.
1. Пациент помещается в положение лицом вниз, под область таза подкладыва-
ется подушка. Если эффективность блокады будет оцениваться по изменению
кожной температуры, устанавливается кожный термометр. Повышение тем-
пературы на 3 °C после выполнения блокады подтверждает правильное поло-
жение иглы.
2. Остистые отростки идентифицируются и нумеруются, как и при блокаде
чревного сплетения, описанной выше. Горизонтальная линия проводится че-
рез срединную точку остистого отростка II поясничного позвонка, маркер
«X» наносится по ходу этой линии на 5 см от срединной линии с каждой сто-
роны (рис. 11.4). Эти маркеры должны лежать над пространством между по-
перечными отростками II и III поясничного позвонка.
3. После обработки кожи в месте каждого маркера выполняется внутрикожная
инъекция. Игла длиной 4 дюйма вводится под углом 45 градусов в краниаль-
ном направлении и осторожно проводится до контакта с поперечным отрост-
ком. После этого замечается глубина введения иглы, а сама игла
подтягивается к коже.
4. Теперь игла перенаправляется перпендикулярно к коже (на этот раз с неболь-
шим медиальным отклонением) и проводится непосредственно между двумя
поперечными отростками, продвигаясь на глубину на 5 см большую, чем
установленная глубина нахождения верхнего поперечного отростка (см.
148
Глава П
Рис. 11.4. Люмбальная симпатическая блокада.
При классическом паравертебральном доступе остистый отросток II поясничного позвонка
маркируется в своей выступающей точке на всем его протяжении, через срединную точку
проводится перпендикулярная линия. На 5 см от срединной линии на эту линию наносится маркер
«X». Это является обозначением точки вкола, которая расположена несколько каудальнее и
латеральнее точки, используемой для блокады симпатического нерва (см. рис. 10.2), что может
снизить возможность контакта с соматическим нервом. Как и при блокаде соматического нерва, игла
вводится сначала с краниальным отклонением для определения глубины расположения поперечного
отростка, затем ее угол становится более близким к перпендикулярному с небольшим медиальным
отклонением для достижения переднего края тела позвонка. Боковой доступ (левый) похож на
доступ для блокады чревного сплетения и начинается на 10 см латеральнее от срединной точки
остистого отростка II поясничного позвонка, игла проводится под углом 45 градусов до контакта с
телом позвонка, и затем проходит кпереди от него (см. рис. 11.3)
рис. 10.2). Для подтверждения близости симпатического ствола желателен
контакт иглы с телом позвонка. Если тело позвонка достигнуто, игла отклоня-
ется несколько латерально и «проходит» вдоль тела на необходимую глуби-
ну.
5. После достижения корректного положения иглы проводится осторожная ас-
пирация и инъекция пробной дозы с каждой из сторон. Если результат пробы
отрицательный, в каждую из сторон инъецируется 5-10 мл раствора.
6. Инъекция раствора не проводится при извлечении иглы, поскольку это может
вызвать анестезию II поясничного соматического нерва, находящегося сзади
симпатического ствола, сразу ниже поперечного отростка.
7. Блокада должна привести к расширению сосудов и повышению температуры
кожи нижних конечностей через 5-10 минут, однако для достижения резуль-
тата может понадобиться и 20 минут. Присутствие сенсорной анестезии в
зоне иннервации L-2 на латеральной поверхности бедер, показывает, что рас-
твор распространился кзади и достиг корешка соматического нерва. Это мо-
жет помешать интерпретации результатов при диагностических процедурах,
проводимых по поводу болевого синдрома.
Симпатические блокады
149
Другой люмбальный доступ
Поясничное сплетение может быть достигнуто из бокового доступа, схожего с
классическим доступом к чревному сплетению. Этот доступ снижает вероят-
ность прямого контакта с соматическим корешком II поясничного нерва.
1. Маркер наносится на 10 см латеральнее и прямо напротив II поясничного по-
звонка. Эта точка обычно расположена прямо над последним ребром
(рис. 11.4).
2. Игла длиной 6 дюймов и диаметром 22 G направляется к телу позвонка. После
контакта с ним игла «проходит» кпереди до достижения переднего края тела
позвонка.
3. Введенные в это место 5-10 мл местного анестетика достигнут симпатиче-
ских нервов.
Верхняя гипогастральная блокада
Оригинальное описание верхней гипогастральной блокады было дано Plancarte и
соавт. в 1990 году [8] (см. рис. 11.5). В 1997 году пригодность этой методики
была доказана при раке (9). В 1999 году Kanazi и соавт. усовершенствовали мето-
дику блокады верхнего гипогастрального сплетения использованием переднего
доступа [10].
Рис. 11.5. Положение иглы при верхней гипогастральной блокаде.
В положении на животе с каждой стороны вводится игла длиной 6 или 7 дюймов, точки вкола
находятся на 5-7 см латеральнее промежутка между V и IV поясничными позвонками, продвижение
осуществляется под углом 30 градусов в каудальном направлении и кпереди под рент-
геноскопическим контролем до контакта с передне-боковой поверхностью тела V поясничного
позвонка. Далее, игла проводится вперед на 1 см до прокола передней фасции поясничной мышцы и
достигает забрюшинного пространства кпереди от места соединения V поясничного и I крестцового
позвонков
150
Глава 11
Осложнения
Внутрисосудистая инъекция
Внутрисосудистая инъекция является наиболее вероятным осложнением этой
процедуры, поскольку большие объемы местного анестетика вводятся в непо-
средственной близости от сосудов. Наибольший риск связан с блокадой звездча-
того сплетения в связи с его непосредственной близостью к позвоночной артерии
(рис. 11.2); всего несколько миллиграмм анестетика, введенного здесь в просвет
сосуда, немедленно достигнут коры головного мозга с незамедлительным разви-
тием соответствующих симптомов.
Гипотония
При блокаде чревного сплетения может наблюдаться гипотония, особенно, у по-
жилых пациентов или у больных с волемическими нарушениями или
гипертоников. Симпатическая блокада у таких пациентов должна проводиться с
осторожностью. Все пациенты должны получать вливания от 10 до 15 мл/кг кри-
сталлоидных растворов через внутривенный катетер большого диаметра. После
блокады, особенно, чревного сплетения пациент должен перемещаться при по-
мощи персонала с тщательным наблюдением за кровяным давлением.
Брадикардия
В связи с воздействием на симпатические сердечные волокна после проведения
двусторонней блокады звездчатого ганглия может отмечаться брадикардия.
Субарахноидальная инъекция
После любой из блокад могут наблюдаться признаки субарахноидальной инъек-
ции, особенно выраженные, если были использованы нейролитические средства.
Должны применяться осторожная аспирация и пробные дозы, при инъекции в об-
ласть поясничного или чревного сплетения нейролитиков, положение иглы дол-
жно контролироваться рентгенологическим исследованием. Местный анестетик,
инъецированный на шее или в поясничной области, может вызвать высокую
спинномозговую блокаду, которая обычно длится недолго, в связи с разведением
раствора. Может понадобиться поддержка дыхательной и сердечно-сосудистой
деятельности.
1
Пневмоторакс
При блокаде звездчатого ганглия может возникнуть пневмоторакс, поскольку
купол плевры находится сразу латеральнее места инъекции. Кашель или боль в
грудной клетке при продвижении иглы должны сразу же вызвать подозрение с
незамедлительным проведением рентгенологического исследования. Пневмото-
ракс был также отмечен при блокаде чревного сплетения. При блокаде чревного
сплетения нейролитическими средствами отмечались плевральный выпот и боли
в надплечье в связи с раздражением диафрагмы этиловым спиртом.
Симпатические блокады
151
Блокада соматических нервов
Если игла находилась слегка кзади от симпатического ствола, при блокаде звезд-
чатого ганглия или поясничного сплетения может наблюдаться блокада сомати-
ческих нервов. Несмотря на то, что эта блокада не является значимой, она может
затруднять интерпретацию блокады, выполненной с диагностической целью.
Она может также задержать движение потока амбулаторных пациентов. При ис-
пользовании нейролитических препаратов это может стать более серьезной
проблемой, в этом случае необходимо прецизионное позиционирование иглы.
Блокада возвратного гортанного нерва
При блокаде звездчатого ганглия может наблюдаться блокада возвратного гортан-
ного нерва. Это вновь скорее один из нюансов процедуры, чем осложнение, однако
это может доставить неудобство пациенту. Это является одной из причин, по кото-
рой следует избегать двусторонних блокад. Если пациент жалуется на затруднение
глотания или ощущение отека в горле, он должен быть предупрежден о том, что не
следует есть или пить до полного разрешения блокады.
Паралич диафрагмального нерва
При блокаде звездчатого ганглия может наблюдаться паралич диафрагмального
нерва. Однако при использовании разбавленных концентраций местного анесте-
тика это явление возникает редко.
Литература
1. Practice guidelines for chronic pain management. A report by the American Society of
Anesthesiologists Task Force on Pain Management, Chronic Pain Section. Anesthe-
siology 86: 995, 1997.
2. Boas, R. A. Sympathetic nerve blocks: In search of a role. Reg. Anesth, Pain Med 23:
292,1998.
3. Mercadante, S., Nicosia, F. Celiac plexus block: A reappraisal. Reg. Anesth. Pain
Med. 23: 37, 1998.
4. Singler, R. C. An improved technique for alcohol neurolysis of the celiac plexus.
Anesthesiology 56: 137,1982.
5. Romanelli, D. F., Beckmann, C. F., Heiss, F. W. Celiac plexus block: Efficacy and safety
of the anterior approach. A. JR Am. J. Roentgenol. 160:497,1993.
6. De Cicco, M., Matovic, M., Bortolussi, R., Coran, F., Fantin, D., Fabiani, F., Caserta, M.,
Santantonio, C., Fracasso, A. Celiac plexus block: Injec-tate spread and pain relief in
patients with regional anatomic distortions. Anesthesiology 94: 561,2001.
7. Umeda, S., Arai, T., Hatano, Y., Mori, K., Hoshino, K. Cadaver anatomic analysis of the
best site for chemical lumbar sympathectomy. Anesth. Analg. 66: 643,1987.
8. Plancarte, R., Amescua, C., Patt, R. B., Aldrete, J. A. Superior hypogas-tric plexus
block for pelvic cancer pain. Anesthesiology 73:236, 1990.
9. Plancarte, R., de Leon-Casasola, O. A., El-Helaly, M., Allende, S., Lerna, M. J. Neuroly-
tic superior hypogastric plexus block for chronic pelvic pain associated with cancer.
Reg. Anesth. 22: 562,1997.
10. Kanazi, G. E., Perkins, F. M., Thakur, R., Dotson, E, New technique for superior hypo-
gastric plexus block. Reg,. Anesth. Pain Med. 24: 473, 1999.
Глава 12
Блокады плечевого сплетения
Плечевое сплетение удобно расположено для проведения местной блокады.
Имеется несколько точек, через которые можно достичь прекрасной анестезии
руки, надплечья или кисти при минимальном взаимодействии с пациентом, опи-
сано множество доступов.
Анатомия
Корешки вентральных нервов от С-5 до Th-1 переплетаются, формируя близко
расположенный узел так, что они проходят рядом с хорошо определяемыми ко-
стными, анатомическими и сосудистыми ориентирами на шее и надплечье. Появ-
ляясь на шее, все корешки выходят из спинного мозга во впадине между
передним и задним бугорком поперечного отростка позвонка и идут вбок между
передним и средним брюшками лестничной мышцы. Они заключены в длинном
узком пространстве между задней фасцией передней лестничной мышцы и пе-
редней фасцией средней лестничной мышцы, что создает условия для блокады
множества нервов сплетения однократной инъекцией.
В дистальном направлении корешки нервов отходят двумя верхними и ниж-
ними парами и вместе с проходящим посередине корешком С-7 формируют три
ствола сплетения. Стволы проходят над I ребром позади места прикрепления пе-
редней лестничной мышцы. Подключичная артерия поднимается из грудной
клетки и также пересекает I ребро сразу же позади прикрепления передней лест-
ничной мышцы, располагаясь кпереди от стволов сплетения. Стволы делятся и
переплетаются, формируя пучки и терминальные ветви для верхней конечности,
до своего окончательного деления они плотно окружают артерию.
На уровне клювовидного отростка находятся три ствола—латеральный, ме-
диальный и задний, который образуется путем двух делений. Задний пучок после
отхождения аксиллярного нерва продолжается в виде лучевого нерва. Латераль-
ный и медиальный пучки, отдавая основные ветви, формируют срединный нерв,
затем они продолжаются в виде меньших мышечно- кожного и локтевого нер-
вов, соответственно. Эти четыре основные нерва предплечья дополнены чувст-
вительными ветвями медиального кожного нерва плеча и медиального кожного
нерва предплечья, а также ветвями из нижнего пучка.
Несмотря на пользу знания этих ветвлений, доступ к плечевому сплетению
при анестезии основан на постоянных анатомических ориентирах шеи: бугорков
позвонков, I ребре или подмышечной артерии (рис. 12.1). Анестезия проводится
на уровне корешков (внутрилестничное пространство), стволов (надключичная
область), или терминальных ветвей (подмышечная область). Анестезия кореш-
ков соответствует дерматомным зонам, в то время как блокада терминальных
ветвей воздействует на область распространения нерва (Смотри раздел «Техника
аксиллярной блокады» в этой главе). Каждая точка блокады вызывает уникаль-
Блокады плечевого сплетения
1S3
Рис. 12.1. Общий вид плечевого сплетения.
Вентральные корешки спинномозговых нервов от пятого шейного до первого грудного сегмента
формируют плечевое сплетение. Верхняя и нижняя пара корешков образуют три ствола, которые
окружают подключичную артерию в месте ее прохождения над первым ребром (положение иглы
показано для надключичной блокады). Деление и переплетение стволов формирует четыре
терминальных нерва предплечья, которые окружают аксиллярную артерию — лучевой, срединный,
локтевой, и кожно-мышечный
ный рисунок распространения анестезии [1]. Анестезия в межлестничном про-
странстве более надежна и глубока для верхних корешков (С-5-С-7), она включа-
ет в себя сенсорную анестезию плечевого сплетения (С-2-С-4). Иногда анестезия
распространяется на дерматомы С-8-Th-1 (локтевая сторона руки) Эта методика
лучше всего подходит для хирургических манипуляций на надплечье и верхней
части руки. Аксиллярная блокада является надежной для анестезии трех нервов
руки (лучевого, срединного и локтевого), однако кожно-мышечный и медиаль-
ный кожный нерв предплечья и их чувствительные ветви на предплечье могут
оказаться неанестезированными, поскольку эти нервы выходят из периваскуляр-
ных пучков выше подмышечной области. Надключичная и подключичная блока-
ды проводятся там, где стволы и пучки лежат наиболее близко в фасциальных
оболочках до отхождения ветвей, что позволяет более легко вызвать сенсорную
анестезию всего предплечья и кисти. Такую анестезию нелегко вызвать блокадой
шейного сплетения (в надплечье).
Проксимальная фасциальная оболочка происходит из латерального расшире-
ния задней фасции передней лестничной мышцы и передней фасции средней лест-
ничной мышцы, она простирается от поперечных отростков до верхней части
руки, при этом длина ее индивидуальна (рис. 12.2). Winnie популяризировал испо-
льзование этой «оболочки» при одноинъекционной методике в области плечевого
сплетения и продемонстрировал широкое распространение раствора на протяже-
ние всей оболочки при однократной инъекции [2, 3]. К сожалению, в дистальной
части этой оболочки иногда имеются фасциальные перемычки [4]. Несмотря на то,
что они не полностью ограничивают распространение раствора анестетика [5], они
могут приводить к неудачной попытке анестезии одной болюсной инъекцией рас-
твора и делают частоту успеха при аксиллярной анестезии менее 100%.
154
Глава 12
Рис. 12.2. Формирование плечевого сплетения.
Нервы сплетения выходят из позвоночного канала через межпозвоночные отверстия и направляются
латерально и вниз через «желоб», сформированный боковыми расширениями поперечных
отростков позвонков. К переднему бугорку каждого из этих отростков присоединяется передняя
лестничная мышца, в то время как средняя лестничная мышца заканчивает формирование задней
стороны оболочки, в которой проходят нервы, присоединяясь к задним бугоркам
Препараты
При этих методиках 1% или 1.5% раствор лидокаина дает анестезию на 3-4 часа.
1.5% раствор мепивакаина может вызвать несколько более длительную анесте-
зию, продолжительность которой может быть увеличена на 4 часа добавлением
клонидина [6]. Если требуется большая продолжительность, 0.5% растворы бу-
пивакаина, левобупивакаина или ропивакаина обеспечат анальгезию на срок от
12 до 14 часов. Для анестезии плечевого сплетения в этом случае нет необходи-
мости повышать концентрацию, так как могли бы быть превышены максимально
рекомендованные дозы. Эпинефрин в разведении 1:200000 увеличит продолжи-
тельность анестезии и снизит максимальный уровень анестетика в крови.
Объем анестетика, который может быть инъецирован, обсуждается до на-
стоящего времени. Несмотря на то, что 25 мл раствора, инъецированного непо-
средственно рядом с нервом с использованием нейростимулятора или паресте-
зий, вызывает анестезию у большинства пациентов, обычно вводится 30-40 мл.
Установленным верхним пределом является объем в 50 мл, поскольку это коли-
чество соответствует максимальной дозе в миллиграммах используемых в насто-
ящее время местных анестетиков. Несмотря на то, что этот объем может дать не-
сколько более раннее начало анестезии и ее более широкое распространение, что
рекомендуется некоторыми авторами (1), Winnie и соавт. продемонстрировали
достаточное распространение при инъекции 40 мл во всех зонах введения. Селек-
тивная блокада отдельных нервов может снизить требования к объему анестети-
ка. Поскольку многие методики предусматривают дополнительное введение 5
или 10 мл раствора анестетика для межреберно-плечевых ветвей или перифери-
ческой блокады локтевого нерва, представляется целесообразным ограничить
объем инъекции в пространство, окружающее сплетение до 40 мл.
Блокады плечевого сплетения
155
Техника
Методика межлестничной блокады
Показания. Межлестничная инъекция проводится на уровне прохождения ко-
решков нервов рядом с бугорками поперечных отростков соответствующих по-
звонков. Анестезия является более выраженной на уровне С-4-С-7, однако
местный анестетик легко распространяется на вышележащие корешки, посколь-
ку межлестничное пространство продолжается в направлении шейного сплете-
ния. Поэтому, эта блокада является идеальной для оперативных вмешательств на
верхней части руки и надплечьи. Преимущества достижения шейного сплетения
(С-2-С-4) уравновешиваются параличом диафрагмы и локтевым (С-8-Th-l) «вы-
падением», так что эта блокада может потребовать дополнительной аксиллярной
или локтевой анестезии, если хирургическое вмешательство производится на ки-
сти.
Методика
1. Пациент укладывается на спину с головой слегка повернутой в противополож-
ную от хирургического вмешательства сторону. Небольшое сложенное поло-
тенце помещается под голову, рука на стороне вмешательства фиксируется у
боковой поверхности туловища и направлена в сторону ног. Идентифицируют-
ся и маркируруются следующие ориентиры: перстневидный хрящ, латераль-
ный край грудино-ключично-сосцевидной мышцы и межлестничное
углубление (рис. 12.3). Последнее может быть локализовано, если пациент под-
нимет голову и выдвинет ее вперед, как будто принюхиваясь к чему-либо. Два
пальца, помещаются вдоль бокового края напряженной грудино-ключично-со-
сцевидной мышцы, а после поворота кзади они переместятся на переднюю ле-
Рис. 12.3. Поверхностны анатомические ориентиры для межлестничной блокады плечевого сплетения.
Идентифицирована грудино-ключично-сосцевидная мышца, передняя лестничная мышца найдена
перемещением кончиков пальцев над латеральным краем большей мышцы при ее леком
напряжении. Обычно ощущается углубление между передней и задней лестничными мышцами.
Осторожно пальпируется находящейся на уровне перстневидного хряща бугорок шестого шейного
позвонка и на это место наносится маркер «X»
156
Глава 12
стничную мышцу. Лестничные мышцы лежат в большей степени дорсально,
чем латерально по отношению к грудино-ключично-сосцевидной мышце, и мо-
гут с трудом обнаруживаться у тучных пациентов. Межлестничное углубление
может быть пропальпировано осторожным перекатыванием сложенных паль-
цев в направлении кзади. Бугорок на поперечном отростке VI шейного позвон-
ка (бугорок Шассана) находится в основании этого углубления на уровне
перстневидного хряща, который обычно находится на уровне пересечения на-
ружной яремной веной заднего края грудино-ключично-сосцевидной мышцы.
Этот бугорок может быть идентифицирован практически у всех пациентов, он
является более надежным ориентиром для определения места положения нер-
вов. Если пальпация проводится осторожно, она не доставляет пациенту непри-
ятных ощущений. После локализации бугорка место его проекции должно
быть помечено маркером «X».
2. После обработки и обкладки кожи в межлестничном углублении на уровне
маркера «X» проводится внутрикожная анестезия. Игла диаметром 22 G и
длиной 1.5 дюйма проводится в каудальном и заднем направлении в сторону
бугорка. Необходимо, чтобы направление иглы было перпендикулярно по-
верхности кожи. Канюля иглы удерживается между большим и указательным
пальцем основной руки, ребро ладони которой прочно опирается на ключицу
или шею (рис. 12.4). Такая фиксация иглы снижает возможность ее нежелате-
льных смещений при ответах на стимуляцию или определении парестезии.
Рис. 12.4. Положение руки при межлестничной блокаде.
Игла проводится через кожу в точке, маркированной «X», и направляется ниже и медиальнее для
поиска бугорка, при этом, одна рука опирается о ключицу, осуществляя постоянный контроль за
глубиной проникновения
3. Игла продвигается до получения ответа на стимуляцию, парестезии или кон-
такта с костью. Если бугорок достигнут до идентификации нерва, игла извле-
кается почти до кожи и перенаправляется. Путь поиска нерва складывается из
миллиметровых шагов вдоль линии, перпендикулярной предполагаемому на-
правлению нерва (т. е. спереди назад); кончик иглы никогда не должен на-
правляться в краниальную или медиальную сторону (рис. 12.5). Это может
привести к проникновению в межпозвоночное отверстие и, возможно, к пунк-
ции позвоночной артерии или твердой мозговой оболочки. Более каудальное
направление будет увеличивать риск пневмоторакса.
Блокады плечевого сплетения
157
Рис. 12.5
Направление иглы при межлестничной блокаде.
Игла всегда сохраняет 45 градусный угол
к позвоночному столбу. Медиальное направление
может привести к проникновению в межпозвоночное
отверстие и вызвать эпидуральную, спинномозговую
или внутриартериальную инъекцию анестетика.
Каудальное направление приведет к контакту
с плеврой. Обратите внимание на отношение
позвоночной артерии и корешков нервов в области
поперечных отростков
4. При получении ответа на стимуляцию или явлениях парестезии в руке (обыч-
но в области большого пальца или предплечья) проводится осторожная аспи-
рация, после чего вводится 1 мл «пробной дозы». Если при этом тесте
отсутствуют ощущения дискомфорта или защемления, дробно вводятся
30-40 мл раствора анестетика. При отсоединении и наполнении 10 мл шприца
игла удерживается в одном и том же положении основной рукой. Другим спо-
собом является присоединение к игле через проводник для внутривенных
инъекций 50 мл шприца с местным анестетиком. Аспирация проводится через
каждые 3-5 мл инъекции, при этом пациент тщательно наблюдается в отно-
шении признаков внутрисосудистого введения препарата.
5. Анестезия оценивается через 5 минут, слабость двуглавой мышцы или сен-
сорная анестезия предплечья указывают на возможность начала хирургиче-
ского вмешательства. Может наблюдаться синдром Горнера, однако большее
внимание должно быть сконцентрировано на возможном укорочении дыхате-
льного цикла, что может указывать на пневмоторакс или паралич диафрагма-
льного нерва на стороне инъекции, если раствор распространился кпереди от
межлетничных мышц.
6. На практике также применяется постоянная межлестничная блокада [7]. По
этой методике соответствующая игла проводится с большим краниальным
отклонением в межлестничном углублении и направляется каудально и меди-
ально. После стимуляции нерва и введения дозы анестетика катетер прово-
дится на несколько сантиметров за кончик иглы. После этого, игла удаляется,
а катетер фиксируется к коже.
Надключичная блокада плечевого сплетения
Показания. Этот доступ облегчается предсказуемой анатомией трех основных
стволов сплетения, которые проходят над I ребром между прикреплениями пе-
редней и средней лестничной мышцы, сразу позади подключичной артерии.
Место пересечения нервами ребра находится позади середины ключицы, здесь
158
Глава 12
нервы лежат относительно поверхностно. Как уже упоминалось, эта методика
наиболее надежна для анестезии всех ветвей сплетения и в наибольшей степени
подходит для хирургических вмешательств на верней части руки и предплечье.
Риск пневмоторакса выше, чем при других методиках и может ограничить при-
менение этой блокады.
Методика
1. Пациент укладывается на спину и вытягивается, рука на стороне инъекции
укладывается по боковой поверхности туловища в каудальном направлении,
в таком положении лучше пальпируется ключица и лестничные мышцы.
2. Идентифицируются и маркируются ключица и лестничные мышцы, маркер
«X» наносится на кожу сразу позади точки середины ключицы или в межлест-
ничное углубление, если оно пальпируется на этом уровне. Лестничные мыш-
цы идентифицируются при приподнимании головы пациента в положение
«принюхивания». Пальцы помещаются на напряженную грудино-ключич-
но-сосцевидную мышцу и, затем, без давления перекатываются кзади на перед-
нюю лестничную мышцу. У худощавых пациентов в основании углубления
между передней и средней лестничными мышцами могут быть идентифициро-
ваны подключичная артерия или даже I ребро.
3. После обработки кожи в местах, маркированных «X», выполняется внутри-
кожная анестезия, игла диаметром 22 G и длиной 1.5 дюйма с трехколенным
шприцем проводится в каудальном направлении. Шприц удерживается так,
что его продольная ось была бы строго параллельна голове, обеспечивая по-
стоянное каудальное направление без медиального отклонения в сторону ку-
пола плевры. Не основная рука опирается на ключицу, удерживая канюлю
иглы между указательным и большим пальцами для предотвращения нежела-
тельных смещений при движении пациента (рис. 12.6).
Рис. 12.6. Положение рук при надключичной блокаде.
Игла направляется каудально позади срединной точки ключицы в межлестничное углубление.
Контроль за глубиной проникновения вновь осуществляется рукой, опирающейся на ключицу. Для
предотвращения медиального отклонения, которое повышает риск пневмоторакса, шприц
удерживается в сагиттальной плоскости параллельно голове пациента
Блокады плечевого сплетения
159
4. 1.5 дюймовая игла продвигается на глубину до ограничителя. Если I ребро не
достигнуто, игла для поиска ребра постепенно, по 4 мм на шаг, переориенти-
руется все более латерально. Если ребро не обнаружено латеральнее маркера
«X», поиск проводится с осторожным 2-х миллеметровым шагом медиальнее
маркера. У тучных или «толстошеих» пациентов для поиска ребра может по-
надобиться 2-х дюймовая игла. При возникновении острой боли в грудной
клетке, сочетающейся с кашлем, процедура прекращается и проводится рент-
генологическое исследование.
5. После контакта с I ребром игла извлекается почти до кожи и перенаправляет-
ся на 1-2 мм кзади до осторожного повторного контакта с ребром. Интенсив-
ный контакт с надкостницей вызывает болезненные ощущения у пациента и
притупляет и деформирует кончик иглы. Изменение направления иглы необ-
ходимо производить при почти полном ее извлечении до кожи; ее частичное
извлечение при дальнейшем, продвижении может привести только к смеще-
нию поверхностного пучка нерва (рис. 12.7).
6. В этой области ребро находится в переднезадней плоскости. Траектория по-
иска направлена кзади в сагиттальной плоскости, параллельной продольной
оси тела. В этой точке такая траектория также перпендикулярна нервному
пучку (рис. 12.1). Медиальное направление иглы может привести только к об-
Рнс. 12.7. Направление иглы при надключичной блокаде, вид сбоку.
Игла направляется вниз к I ребру, где может произойти ее контакт с тремя стволами плечевого
сплетения в месте их прохождения над I ребром. Ребро в этой точке лежит вдоль передне-задней
плоскости тела. Шприц удерживается в сагиттальной плоскости. Если игла достигла ребра без
идентификации нерва, перед изменением направления она должна быть почти полностью извлечена
до кожи, в противном случае, небольшие перемещения вдоль кости могут привести к перемещению
нервов впереди иглы
160
Глава 12
наружению легкого. Игла направляется кзади до тех пор, пока она не перей-
дет за задний край ребра; в этой точке ее направление изменяется кпереди до
ее прохождения через передний угол ребра или за подключичной артерией.
7. Стимуляция нерва или определение парастезии могут проводиться в любое
время. Чувствительность в спине или грудной клетке не должна изменяться;
успех анестезии будет большим при получении ответа на стимуляцию или па-
растезии в области кисти или предплечья. Пациент должен быть заблаговре-
менно предупрежден о том, что о парастезии следует известить голосом, но
при этом не двигаться. После сообщения пациента игла сразу же фиксируется
и производится медленное введение анестетика. Если парастезия усиливается
или пациент жалуется на щемящую боль, игла извлекается на 1 мм и инъекция
повторяется. Для предотвращения внутрисосудистой инъекции через каждые
3-5 мл дробного введения, проводится аспирация.
8. В общей сложности в область первой ответной реакции инъецируется
30—40 мл раствора. Перегородка, которая может ограничить аксиллярное рас-
пространение раствора, на этом уровне встречается редко и раствор надежно
распространяется на основные ветви сплетения.
9. Если ответной реакции не получено в первые 10 минут, переопределяются ана-
томические ориентиры и доступ повторяется. Если встретились трудности, то а
этом случае нервы, скорее всего, расположены позади первоначальной точки
контакта с ребром. Если парестезии не получено, путем серии из четырех-пяти
инъекций по 6-7 мл каждая может быть создана «стена» местного анестетика,
при этом, игла отдаляется от ребра, передвигаясь от артерии с шагом по три
миллиметра. Вероятность успешной анестезии при этом небольшая и лучше
использовать другой межлестничный, аксиллярный или внутривенный доступ.
10. Если необходимо применение жгута, может понадобиться создание подкож-
ного валика через аксиллярную область для анестезии кожи по внутренней
стороне верхней части руки, которая иннервируется межреберно-плечевыми
ветвями. Это может быть выполнено 5-10 мл раствора анестетика, инъециро-
ванного под кожу вдоль передне-подмышечной складки.
Другая методика: доступ «по отвесу». Для снижения риска контакта с лег-
ким при доступе к стволам плечевого сплетения могут применяться другие мето-
дики. Одна из них основана на том, что нервные стволы всегда лежат выше, чем
легкое. Положение пациента и подготовка к инъекции те же, что и при традици-
онном доступе. При положении пациента на спине игла проводится через кожу
сразу выше ключицы в точке, латеральнее места прикрепления грудино-ключич-
но-сосцевидной мышцы. При этом она направляется строго вниз, к полу (в зад-
нем направлении), вдоль линии, которую образовал бы отвес под силой тяжести
(рис. 12.8). Если затем игла будет перенаправлена с небольшими шагами к 15 гра-
дусному каудальному направлению, она будет контактировать с нервами и вызы-
вать парестезию или двигательный ответ. Рентгенологические исследования
подтверждают, что контакт с нервами всегда будет происходить перед контактом
с ребром или легкими [8].
Другая методика: подключичный доступ. Согласно другой методике,
предназначенной для снижения риска пневмоторакса, доступ к сосудисто-нер-
вному пучку осуществляется ниже ключицы, однако в точке, где основные пучки
расположены достаточно близко. Множество описанных вариантов этого досту-
па является отражением того, что нервы в этой области расположены достаточно
глубоко под кожей, а надежно и четко определяемые анатомические ориентиры
отсутствуют. В первоначальном описании, данном Raj для создания линии, опре-
деляющей срединную точку ключицы, используется бугорок VI шейного позвон-
Блокады плечевого сплетения
161
Вена
Г рудино-ключично-
сосцевидная
мышца
Плечевое
сплетение
Рис. 12.8. Доступ «по отвесу» при надключичной блокаде.
Игла проводится над срединной точкой ключицы, строго в заднем направлении. Если при первой
инъекции нервные стволы не достигнуты, игла очень маленькими шагами поворачивается в
каудальном направлении, при этом, она достигнет сосудисто-нервного пучка до контакта с легким
Артерия
Передняя
и средняя
1 лестничные
мышцы
—т—Ключица
ка и точка пульсации плечевой артерии, при этом, игла направлялась под углом
45 градусов латерально (рис. 12.9). Эти анатомические ориентиры могут распо-
лагаться слишком медиально и, поэтому, может быть выбран более латеральный
доступ с 65 градусным отклонением иглы [9]. Описан доступ, использующий бо-
лее латеральную точку с вертикальным направлением иглы [10].
Методика
1. Пациент помещается в положение на спине, его руки могут находиться в лю-
бом удобном положении, включая боковое расслабление.
2. На кожу наносится идентификационный маркер для клювовидного отростка.
Метка «X» наносится на 2 см каудальнее и 2 см медиальнее метки клювовид-
ного отростка.
3. В этой точке создается кожный валик и 2-х дюймовая игла проводится пер-
пендикулярно к коже в строго заднем направлении. Средняя глубина распо-
ложения пучка составляет 1.5 дюйма, однако у тучных пациентов может
потребоваться 3-х или 4-х дюймовая игла.
4. После того, как нервы обнаружены путем их стимуляции или по парестезии
кисти, вводится 25-35 мл местного анестетика. Реакция со стороны кож-
но-мышечного нерва достоверной не является.
5. Эта методика подходит также для установки постоянного катетера. Игла про-
водится таким же способом и, после идентификации сосудисто-нервного пуч-
ка, катетер устанавливается в латеральном направлении и прикрепляется к
коже.
6—1685
162
Глава 12
Рис. 12.9. Подключичный доступ.
Первоначальное описание этой методики для обозначения точки введения иглы использовало середину
линии между бугорком VI шейного позвонка и аксиллярной артерией (а), в этой точке игла направляется
под углом 45е латерально. Латеральный доступ на 2 см медиальнее и ниже клювовидного отростка
позволяет использовать более перпендикулярное направление, которое может снизить риск
пневмоторакса. При установке постоянного катетера более медиальное введение и большее отклонение
могут позволить легче войти катетеру и более прочно прикрепить его к коже
Аксиллярный доступ
Аксиллярный доступ к плечевому сплетению связан с наименьшим числом
серьезных осложнений. Он обычно требует множества инъекций в связи с боль-
шим разделением нервов. Три основные нерва остаются в сосудисто-нервном
пучке (срединный по верхней стороне артерии, лучевой- позади, локтевой - ниже
и сзади), однако часто присутствующие в этой области перегородки, разделяю-
щие эти нервы, не позволяют рассчитывать на однократную инъекцию. Три дру-
гих нерва покидают пучок выше этого уровня. Кожно-мышечный нерв находится
теперь в толще клювовидно-плечевой мышцы, медиальный кожный нерв плеча и
медиальный кожный нерв предплечья расположены в подкожных тканях позади
артерии.
Показания. Этот доступ обеспечивает анестезию трех терминальных нервов ки-
сти и поэтому подходит для большинства процедур в этой области. Этот доступ
может быть использован в качестве дополнения при обеспечении сенсорной ане-
стезии предплечья. В амбулаторных хирургических отделениях эта блокада час-
то является методикой выбора.
Методика
1. Пациент укладывается в положение на спину, с руками, отведенными на
90 градусов и согнутыми в локтях, при этом кисти удобно располагаются на
валике или подушке (рис. 12.10). Отведение свыше 90 градусов может нару-
шить определение аксиллярного пульса, а также ограничивает цефалическое
Блокады плечевого сплетения
163
Рис. 12.10. Положение для аксиллярной блокады.
Рука поднимается (отводится) на 90 градусов в плечевом суставе при согнутом под 90 градусов
локте, предплечье слегка поднимается на подушке. Более выраженное отведение может нарушить
определение пульсации подмышечной артерии, которая является основным анатомическим
ориентиром, обычно легко идентифицируемым осторожной пальпацией
распространение раствора анестетика, поскольку на периваскуллярную об-
ласть создается давление головкой повернутой плечевой кости.
2. Идентифицируется артерия, которая маркируется в аксиллярной области как
можно выше, обычно сразу у латерального края большой грудной мышцы.
3. После обработки и обкладки кожи артерия вновь идентифицируется и осто-
рожно фиксируется между двумя пальцами неосновной руки анестезиолога,
установленными на одном уровне (рис. 12.11). Обычно для этого используют-
ся указательный и средний пальцы, но могут быть использованы средний и
безымянный.
Рис. 12.11. Положение рук при аксиллярной блокаде.
Два пальца, выровненные по длине, фиксируют артерию, при этом, игла продвигается вдоль ее
длинной оси с центральным отклонением. Пальпация помогает не только идентифицировать сосуд,
но также сдавить периваскулярные ткани, способствуя, таким образом, центральному
распространению раствора анестетика
164
Глава 12
4. Кожный валик формируется над артерией, после чего вводится игла длиной
5/8 дюйма, присоединенная к трехколенному шприцу в 10 мл.
5. После этого имеется несколько вариантов действий:
(а) Простейшей методикой является инфильтрация периваскулярных тканей
на противоположных сторонах артерии [11]. Игла продвигается вдоль од-
ной из сторон артерии близко к ней настолько, насколько это возможно,
при этом производится аспирация (рис. 12.12). Если при аспирации крови
не получено, а глубина проникновения указывает на то, что игла находит-
ся сразу за сосудом, она медленно извлекается с одновременной инъек-
цией 3-4 мл анестетика. Затем, игла перенаправляется несколько дальше
от сосуда, это повторяется дважды, таким образом, производится три инъ-
екции местного анестетика (в общей сложности 10 мл) вдоль трех паралле-
льных линий по сторонам сосуда, окружая артерию от ее задней до
передней части. Шприц заполняется вновь, и процесс повторяется на про-
тивоположной стороне сосуда. После этих инъекций выполняется поддер-
живающая анестезия других нервов (см. пункт 6 этого раздела). Оценку
изменений в зоне иннервации дистальных нервов проводят через 5 минут,
если в области иннервации анестезия не наступила, проводится повторная
инъекция. Если в какой-либо момент произведена пункция артерии или
определяются явления парестезии, должны быть использованы другие до-
ступы на более низких уровнях.
(б) Трансартериальный доступ также является простым и надежным. Игла
преднамеренно продвигается внутрь сосуда при постоянной аспирации,
продвижение прекращается сразу после прекращения поступления крови.
Рис. 12.12. Периваскулярная инфильтрация при аксиллярной блокаде.
Игла продвигается рядом с артерией при постоянной аспирации, затем, по мере обратного движения
иглы производится несколько небольших дробных инъекций
Блокады плечевого сплетения
165
В этой точке игла фиксируется и в пространство позади артерии вводится
10 мл с дробной аспирацией для уверенности в том, что игла не сместилась
в просвет сосуда. Шприц заполняется вновь, игла извлекается через сосуд
с постоянной аспирацией, с помощью которой определяют момент, когда
она окажется у передней стенки артерии. В этой точке вводится еще 10 мл
анестетика, после чего выполняются дополнительные инъекции, описан-
ные в пункте 6 этого раздела.
(в) Доступ с использованием стимуляции нерва может быть использован для
определения трех нервных стволов, окружающих в аксиллярной области
артерию. Эта методика наиболее эффективна при смещении стимуляции в
дистальном направлении к границе верхней и средней трети плеча {«сред-
неплечевой» доступ), где все четыре основные нерва могут быть блокиро-
ваны отдельными инъекциями (рис. 12.13) [12]. При этом доступе рука
отводится на 80 градусов, плечевая артерия идентифицируется на границе
верхней и средней трети плеча. Вначале идентифицируется срединный
нерв введением иглы стимулятора в направлении плечевой артерии на вер-
хней стороне плеча, в направлении к подмышечной области. Стимуляция
срединного нерва в этой области приведет к сгибанию в лучезапястном су-
ставе, сгибанию пальцев или к пронации предплечья. Затем, игла перена-
правляется для идентификации локтевого нерва, при той же точке вкола
игла направляется кзади и ниже от артерии. Стимуляция нерва приведет к
локтевому сгибанию ладони или двух последних пальцев, либо к отведе-
Рис. 12.13. Среднеплечевой доступ при аксиллярной блокаде.
На этом уровне нервы разделены в большей степени, чем в подмышечной области, однако их все еще
можно легко идентифицировать путем стимуляции
166
Глава 12
нию большого пальца. Затем игла перенаправляется перпендикулярно к
коже и проводится на глубину артерии по задней стороне плеча для стиму-
ляции лучевого нерва. Изолированное сокращение трехглавой мышцы
вследствие прямой стимуляции может привести в замешательство, так что
нерв лучше идентифицировать разгибанием ладони или пальцев. Наконец,
игла перенаправляется выше артерии в толщу клювовидно-плечевой
мышцы, где сгибанием ладони идентифицируется кожно-мышечный нерв.
В область расположения каждого из трех первых нервов вводится 5-10 мл
местного анестетика, в то время как для кожно-мышечного нерва может
быть достаточно 5-6 мл.
(г) Четвертый доступ основан на традиционной методике парастезии. Паре-
стезия определяется на каждой стороне сосуда; это связано с тем, что кож-
но-мышечный и срединный нервы лежат выше артерии, а локтевой и
лучевой нервы — ниже (рис. 12.14). Парестезия вначале должна определя-
ться в области, наиболее близкой к зоне хирургического вмешательства.
Успех считается достигнутым при наличии парестезии, по крайней мере, с
одной стороны артерии, тем не менее, добиться парестезии после второй
инъекции через 5 минут после первой трудно, поскольку частичное рас-
пространение раствора анестетика может привести к гипестезии других
нервов. Рядом с областью развития каждой парестезии должно быть введе-
но от 10 до 20 мл раствора.
Рис. 12.14. Положение иглы в аксиллярной области при методике, основанной на парестезии.
Срединный (М) и мышечно-кожный нервы лежат кпереди от артерии (а). Последняя на этом уровне
обычно располагается в толще клювовидно-плечевой мышцы. Локтевой (U) лежит ниже, а лучевой
(R) нерв лежит ниже и кзади от артерии. Это расположение подвержено влиянию индивидуальных
особенностей, медиальный кожный нерв предплечья обычно располагается в подкожных тканях,
сразу ниже сосудисто-нервного пучка и анестезируется подкожной инъекцией в этой области вдоль
волокон межреберно-плечевой мышцы
Блокады плечевого сплетения
167
6. При всех аксиллярных доступах может потребоваться дополнительная анес-
тезия мышечно-кожного нерва, медиального кожного нерва предплечья и
межреберно-плечевых ветвей. Сначала производится веерообразная инъек-
ция в толщу клювовидно-плечевой мышцы, сразу выше артерии (рис. 12.15).
Эта мышца прижимается между большим и указательным пальцами одной
руки к латеральному краю большой грудной мышцы, при этом другой рукой
выполняется инъекция 5 мл раствора. Инъекция часто вызывает чувство ту-
пой болезненности, что может иметь сходство с парастезией, однако располо-
жение нерва в этой области является редким. Для получения анестезии
мышечно-кожного нерва были рекомендованы большие объемы инъекции
(до 40 мл) в собственную фасцию, однако при этом воздействия на нерв не
было получено в 25% случаев. Медиальный кожный нерв предплечья и его
сосед — медиальный кожный нерв плеча, могут быть блокированы инфиль-
трацией подкожных тканей введением 5 мл раствора сразу ниже сосуди-
сто-нервного пучка, на уровне где он параллелен подмышечной кожной
складке (рис. 12.14). В блокаде этих нервов обычно нет необходимости, если
хирургическое вмешательство ограничено областью кисти. Использование
жгута на верхней части руки может способствовать блокаде этих нервов и
межреберно-плечевых ветвей.
Рис. 12.15. Мышечно-кожный нерв.
Мышечно-кожный нерв лежит в толще клювовидно-плечевой мышцы. Эта мышца зажимается
между большим и указательным пальцем одной руки, при этом нерв блокируется инъекцией 5 см3
местного анестетика в толщу мышцы
168
Глава 12
Методика установки аксиллярного катетера
Методика установки аксиллярного катетера описана для использования в случа-
ях длительных хирургических вмешательств (таких как реимплантация пальцев
с использованием микрохирургической техники), или при необходимости длите-
льного послеоперационного обезболивания или симпатической блокады. Длите-
льная анестезия может быть достигнута установкой пластакового внутривенного
катетера вдоль подмышечного сосудисто-нервного пучка с использованием
дробных болюсных инъекций или постоянных инфузий раствора местного анес-
тетика. Длительно действующие амино-амидные анестетики обеспечивают анес-
тезию до 8 часов и могут повторно вводиться 2 или 3 раза в день. Непрерывная
инфузия 10 мл 0.2-0.25% раствора этих препаратов в час является другим спосо-
бом обеспечения постоянной анестезии.
Первоначальное размещение катетера может быть проведено на основе
ощущения катетера, «щелчка» катетера при прохождении им через фасциальную
оболочку, однако у тучных пациентов при этом могут возникнуть затруднения.
Простое помещение катетера в углубление между двуглавой и трехглавой мыш-
цами вдоль пучка также представляется эффективным. Достижение парастезии
или использование стимулятора нервов могут помочь установить положение ка-
тетера, если встретились трудности. Попытки прочно зафиксировать пучок мо-
гут привести к пункции артерии, возможно, с развитием гематомы, которая будет
препятствовать распространению раствора местного анестетика.
Использование коротких (1.5 или 2 дюйма) катетеров может уменьшить воз-
можность центрального распространения анестетика и увеличить частоту воз-
действия на мышечно-кожный нерв. Трехдюймовый катетер с гибким проводни-
ком может вставляться в верхние отделы подмышечной области, при этом
увеличивается возможность анестезии всех 4-х нервов предплечья. При соответ-
ствующей стерильной обработке места введения катетера, катетер может быть
оставлен на несколько дней.
Осложнения
Неудавшаяся блокада
Неудачи при блокаде нерва при этой методике отмечаются в 3-30% [13, 14] слу-
чаев, при этом незаблокированными остаются обычно один или два терминаль-
ных нерва. Такие последствия могут быть устранены повторной блокадой (при
отсутствии распространенной парестезии), периферической инъекцией (см. гла-
ву 14) или местной инфильтрационной анестезией, выполненной хирургом.
Успешная идентификация зоны иннервации чрезвычайно важна для проведения
соответствующей коррекции (рис. 12.16 и 12.17). Обычно обнаруживается отсут-
ствие анестезии в области иннервации С-8 - Th-1 при межлестничном доступе
или остаточная чувствительность мышечно-кожного нерва или медиального
кожного нерва предплечья при аксиллярной блокаде. Анестезия должна оцени-
ваться не позже 5 минут после завершения инъекции. Начало анестезии при ис-
пользовании любого препарата, включая бупивакаин, наступает в течение
5 минут [1], отсутствие анестезии в зоне иннервации нерва в течение этого вре-
мени указывает на необходимость альтернативных действий. Иногда простое
ожидание в течение следующих 5 минут позволяет дождаться анальгезии благо-
даря диффузии местного анестетика, тем не менее, альтернативный план обезбо-
ливания должен быть сообщен больному и хирургу еще до начала
Блокады плечевого сплетения
169
вмешательства. Если неадекватность анестезии обнаруживается во время разреза
(особенно на предплечье), хирургом должна быть проведена местная инфильтра-
ционная анестезия, а анестезиологом — внутривенное введение наркотических
средств, что может обеспечить необходимое дополнительное обезболивание.
Общая анестезия всегда должна рассматриваться как возможное средство при
любых местных блокадах.
Рис. 12.17. Чувствительные дерматомы терминальных нервов верхних конечностей.
Представлено распределение зон чувствительности терминальных нервов. Это распределение
отличается от классического дерматомного распределения корешков нервов (рис. 12.16). Если блокада
проводилась на уровне корешков (межлестничная блокада), распределение анестезии будет отличаться
от анестезии, полученной при блокаде на уровне терминальных нервов (аксиллярная блокада)
170
Глаяа12
Определение блокады может быть проведено быстро и эффективно методом
«толкни-тяни-щипни-щипни». Пациента просят разогнуть (толкнуть) предпле-
чье, преодолевая сопротивление (трехглавая мышца, лучевой нерв) и затем со-
гнуть (потянуть) руку, направляя большой палец к носу (двуглавая мышца, мы-
шечно-кожный нерв). Сенсорная анестезия кисти, определяемая шипком в области
возвышения большого пальца (срединный нерв) и возвышения мизинца (лучевой
нерв) подтвердит блокаду двух других нервов. Этот тест может быть проведен ме-
нее чем за минуту и выраженное снижение тонуса лучевой мышцы будет часто да-
вать ощущение пациенту, что блокада действует. Для глубокой анестезии руки
требуется не менее 20 минут, однако к счастью подготовка к хирургическим мани-
пуляциям, обкладка зоны вмешательства часто занимают весь этот временной ин-
тервал. Алкалинизация местного анестетика и проведение блокады в предопера-
ционной может сократить время начала действия и улучшить глубину анестезии к
моменту разреза; наиболее частой причиной «неудавшейся» анестезии является
выполненный хирургом преждевременный разрез.
Внутрисосудистая инъекция
Внутрисосудистая инъекция является наиболее серьезным возможным осложне-
нием. Она может возникнуть при выполнении надключичной или подмышечной
блокады в связи с близким расположением кровеносных сосудов и особенно ак-
туальна при межлестничной блокаде, в связи с непосредственной близостью по-
звоночной артерии к корешкам шейных нервов, и именно при этой блокаде
наиболее часто встречается это осложнение. Частая аспирация, дробные инъек-
ции и пристальное наблюдение за пациентом являются обязательными. Также
обязательным является доступность реанимационного оборудования и внутри-
венный доступ.
Пневмоторакс
В опытных руках данное осложнение возникает редко. В одном из исследований
надключичных блокад оно отмечено менее, чем в 1% случаев, тем не менее, риск
пневмоторакса все-таки имеется. Пневмоторакс может возникнуть также при
пункции плевры во время межлестничного доступа, если игла направлена слиш-
ком далеко вниз. Несмотря на то, что это осложнение не угрожает жизни, оно бо-
лезненно для пациента и доставляет ему серьезные беспокойства, особенно, если
оно приводит к неожиданной госпитализации амбулаторных пациентов. Пнев-
моторакс часто бывает небольшим и может разрешаться самостоятельно, его
симптомы могут проявиться не сразу. Каждый пациент, который жалуется на
боль в грудной клетке, или учащение дыхания, должен быть подвергнут физика-
льному и рентгенологическому исследованию; лечение заключается в дрениро-
вании грудной полости при соответствующих симптомах.
Нейропатия
Транзиторная нейропатия отмечается редко, в нескольких исследованиях она от-
мечена менее чем в 2% случаев (см. главу 3), перманентная дисфункция конечно-
стей развивается редко. Осложнение отмечается чаще, если определение
парестезии проводилось заостренной (иглой с длинным срезом), а также при по-
вторных контактах с нервом [15]. Особое внимание во время межлестничной и
надключичной блокад должно быть уделено пункции корешков нервов и их ство-
лов в местах, где они располагаются напротив костных структур. Как и во всех
Блокады плечевого сплетения
171
случаях, инъекция не должна продолжаться, если возникновение щемящей боли
указывает на интраневральное положение иглы.
Если в послеоперационном периоде обнаруживаются неврологические на-
рушения, неврологическое обследование должно быть проведено как можно ра-
ньше. Точное определение места повреждения может помочь установить связа-
ны ли нарушения непосредственно с инъекцией анестетика. При межлестничной
блокаде воздействие, оказывающееся на корешки и дерматомы, будет отличать-
ся от эффектов, вызванных аксиллярными инъекциями, при которых действие
оказывается на периферические нервы. Электромиографическое тестирование
может также помочь определению повреждения нервов, существующих до вме-
шательства.
Большинство повреждений периферических нервов самостоятельно разре-
шается в течение одного-шести месяцев. Сочувствие, внимательное отношение,
раннее начало физиотерапии помогут облегчить физические нарушения и смяг-
чить недовольство пациента, тем не менее необходимость длительного восстано-
вительного лечения вызывает одинаковое неудовольствие как у врача, так и у па-
циента.
Образование гематомы
При пункции артерии во время проведения надключичной и аксиллярной блока-
ды может отмечаться образование гематомы. Обычно это имеет небольшие по-
следствия, однако у пациентов с нарушением свертываемости крови это
осложнение может препятствовать проведению блокады. После пункции были
описаны временный спазм артерии и отсутствие ее пульса, а также окклюзия
подмышечной вены. Эти события являются редкими, однако они вновь подтвер-
ждают, что лучше всего добиваться минимальной степени воздействия на ткани.
Нежелательное распространение анестетика
Нежелательное распространение анестетика наиболее часто наблюдается при
межлестничном доступе. Наиболее серьезная проблема возникает при инъекции
раствора анестетика в эпидуральное или субарахноидальное пространство,
вследствие чего возникает высокая эпидуральная или тотальная спинномозговая
анестезия. Несмотря на то, что наиболее часто производится двусторонняя бло-
када шейного сплетения и блокада плечевого сплетения, возможность развития
общей спинномозговой анестезии не может быть исключена, что обусловливает
необходимость ее своевременного распознавания и лечения с применением вен-
тиляции легких и сердечно-сосудистых средств. Более часто раствор анестетика
распространяется к диафрагмальному нерву как в область его формирования из
корешков шейных нервов, так и в область его прохождения по передней поверх-
ности передней лестничной мышцы. При межлестничном доступе наблюдается
развитие одностороннего паралича диафрагмы на стороне блокады [16]. Паралич
только диафрагмы может не является проблемой у здоровых пациентов, однако
это осложнение может с трудом переноситься пациентами с респираторными за-
болеваниями. Симпатический ствол может также располагаться близко к месту
инъекции и развитие синдрома Горнера на стороне инъекции не является редко-
стью. Распространение анестетика после межлестничной блокады может также
стать причиной бронхоспазма.
Распространение анестетика в описанные выше области после надключич-
ной блокады встречается менее часто, с наименьшей вероятностью эти осложне-
ния можно ожидать после аксиллярной инъекции.
172
Глава 12
Литература
1. Lanz, Е., Theiss, D., Jankovic, D. The extent of blockade following various techniques
of brachial plexus block. Anesth. Analg. 62: 55, 1983.
2. Winnie, A. P. Interscalene brachial plexus block. Anesth. Analg. 49:455,1970.
3. Winnie, A. P., Collins, V. }. The subclavian perivascular technique of brachial ple-
xus anesthesia, Anesthesiology 25: 353,1964.
4. Thompson, G. E., Rorie, D. K. Functional anatomy of the brachial plexus sheaths.
Anesthesiology 59: 117, 1983.
5. Partridge, B. L., Katz, J., Benirschke, K. Functional anatomy of the brachial plexus
sheath: Implications for anesthesia. Anesthesiology 66: 743, 1987.
6. Singelyn, F., Gouvemeur, J:, Robert, A. A minimum dose of clonidine added to me-
pivacaine prolongs the duration of anesthesia and analgesia after axillary brachial ple-
xus block. Anesth. Analg. 83: 1046,1996.
7. Chelly, J., Casati, A., Fanelli, G., Continuous Peripheral Nerve Block Techniques.
London: Mosby, 2001.
8. Brown, D. L., Cahill, D. R., Bridenbaugh, L. D. Supraclavicular nerve block: Ana-
tomic analysis of a method to prevent pneumothorax. Anesth. Analg. 76:530,1993.
9. Klaastad, O., Lilleas, F. G., Rotnes, J. S., Breivik, H., Fosse, E. A magnetic resonance
imaging study of modifications to the infraclavicular brachial plexus block. Anesth.
Analg. 91: 929,2000.
10. Wilson,). L., Brown, D. L., Wong, G. Y., Ehman, R. L., Cahill, D. R. Infraclavicular
brachial plexus block: Parasagittal anatomy important to the coracoid technique.
Anesth. Analg. 87: 870,1998.
11. Thompson, G. E. Blocking the brachial plexus. Anaesth. Intensive Care 15:119,1987.
12. Bouaziz, H., Narchi, P., Mercier, F. J., Labaille, T., Zerrouk, N., Girod, J., Benhamou, D.
Comparison between conventional axillary block and a new approach at the midhu-
meral level. Anesth. Analg. 84: 1058, 1997.
13. Goldberg, M. E., Gregg, C„ Larijani, G. E., Norris, M. C., Marr, A. T., Seltzer, J. L. A
comparison of three methods of axillary approach to brachial plexus blockade for
upper extremity surgery. Anesthesiology 66: 814,1987.
Глава 13
Внутривенная местная анестезия
Внутривенная местная анестезия конечностей является одной из простейших и
старейших методик, однако для обеспечения безопасной и эффективной анесте-
зии она по прежнему требует знания анатомических особенностей, фармаколо-
гии и физиологии.
Анатомия
Периферические нервы верхних и нижних конечностей получают питание из
окружающих их небольших кровеносных сосудов. Растяжение вен этих нервов
введенным местным анестетиком вызывает проникновение раствора в нервную
ткань и приводит к анестезии, длительность которой зависит от концентрации
препарата в венозной системе. Необходимая концентрация обычно достигается
блокированием венозного кровотока с помощью наложенного на проксималь-
ную часть конечности жгута, после чего в расширившуюся венозную сеть, через
предварительно установленный катетер вводится раствор местного анестетика.
Анестетик в основном действует на небольшие нервы и нервные окончания и
лишь его небольшая часть достигает основных нервных стволов.
Методика внутривенной инъекции местного анестетика была впервые опи-
сана August Bier. Эта методика требует хирургической препаровки вен. В настоя-
щее время на практике применяются усовершенствованные внутривенные иглы
и пневматические жгуты, однако по-прежнему чаще всего эта методика называ-
ется блокадой Bier.
Показания
Внутривенная местная анестезия может быть использована при многих операциях
на дистальных отделах конечностей в тех случаях, когда нет противопоказаний к
наложению проксимального окклюзионного жгута. Эта методика обеспечивает
анестезию, достаточную для удаления инородных тел, эксплоративных вмешате-
льствах на нервах, хирургической обработке ран, а также при вмешательствах на
сухожилиях и суставах. Несмотря на то, что анестезия надкостницы при этом не
так выражена, как при других методиках, внутривенное обезболивание может
быть использовано при бурсэктомии или при репозиции простых переломов.
Эта методика не может быть использована при выраженных ишемических
расстройствах, при которых наложение сосудистого жгута противопоказано. Не-
которые хирурги могут быть также не удовлетворены количеством жидкости,
проникающей в зону хирургического вмешательства, особенно при проведении
вмешательств под контролем микроскопа, тем не менее, ткани при этом оказыва-
ются обескровленными.
Основным преимуществом внутривенной местной анестезии является ее
простота и надежность. Она является самой легковыполнимой и эффективной
174
Глава 13
блокадой руки, для простых коротких процедур и, поэтому, в наилучшей степени
подходит для использования начинающими хирургами или в амбулаторных
условиях. Ее недостатком является отсутствие анестезии в послеоперационном
периоде, а преимуществом — быстрое восстановление функции руки.
Эта блокада используется в основном для руки. Несмотря на то, что для сни-
жения дозы местного анестетика используется наложение жгута на предплечье,
стандартная методика по-прежнему предусматривает наложение жгута на плечо.
Для нижних конечностей требуется большие объемы препаратов, а достижение
адекватной окклюзии сосудов является более трудным из-за более массивных
мышц и более неровной формы бедра. Существуют также опасения, что внутри-
костные каналы способствуют попаданию раствора местного анестетика в сис-
темный кровоток, а также, что проведение блокады нижней конечности по этой
методике связано с высокой частотой системных реакций, обусловленных анес-
тетиком. Несмотря на то, что наложение жгута на голень способствует снижению
общей дозы местного анестетика, эта методика является не столь популярной,
как для верхней конечности.
Препараты
Наиболее часто используется лидокаин. Раствор должен быть разбавлен, если
из-за больших объемов, необходимых для наполнения венозной системы, может
быть достигнута максимальная доза. Обычным объемом для верхней конечности
является 50 мл 0.5% раствора лидокаина, в то время как при необходимости на-
полнения венозных каналов нижней конечности при наложении жгута на бедро
необходимо 100 мл (500 мг). У пациентов с меньшим весом общая доза может
быть рассчитана на основе введения 3 мг на кг веса тела 0.5% раствора лидокаи-
на. Мепивакаин также является эффективным при этом виде блокады.
Для этой блокады может быть использован бупивакаин (те же объемы 0.25%
раствора), однако системное распространение этого препарата является значите-
льной проблемой. Эффективным средством в отношении влияния на сердечную
деятельность является 0.2% раствор ропивакаина, который может также вызы-
вать некоторую остаточную анальгезию после снятия жгута [1]. Амино-эфирный
препарат 2-хлоропрокаин выводится быстрее. В одном сообщении его примене-
ние вызвало флебит, однако использование алкалинизированного раствора по-
зволяет свести к минимуму побочные эффекты и обеспечить обезболивание, эк-
вивалентное лидокаину [2].
Исследовались преимущества добавления различных препаратов к раство-
рам местных анестетиков. Меперидин, трамадол и кеторолак дают небольшие
преимущества и некоторые побочные эффекты [3-5]. Клонидин в дозе 1 мкг/кг
увеличивает продолжительность обезболивания после блокады лидокаином [6],
при этом более высокие дозы снижают боли, вызванные наложением жгута, од-
новременно вызывая некоторые побочные системные эффекты [7].
Техника
1. Пациент укладывается на спину и за ним обеспечивается необходимое на-
блюдение, которое включает в себя манжетное измерение кровяного давле-
ния для отслеживания систолических изменений, связанных с наложением
жгута, также обеспечивается внутривенный доступ на другой конечности.
Внутривенная местная анестезия
175
2. На проксимальную часть конечности, на которой планируется проведение
вмешательства, накладывается жгут. При длительных операциях популяр-
ным является наложение «двойной манжеты» для снижения боли, связанной
со сдавлением кожи манжетой в месте, где анестезия отсутствует (см. пункт 8
этого раздела). Однако присутствие двух манжет требует, чтобы они обе были
уже (5-7 см), чем стандартные манжеты для измерения кровяного давления
на руке (12—14 см). Более узкие манжеты не эффективно передают необходи-
мое давление глубоким тканям, вследствие чего окклюзионное давление на
вены оказывается меньше предполагаемого [8]. Если процедура будет про-
должаться менее часа (время развития неприятных ощущений связанных со
сдавлением), более приемлемым является использование манжет стандарт-
ной ширины.
3. На оперируемой руке или стопе устанавливается венозный катетер. Гибкий
небольшой пластиковый катетер диаметром 20 или 22 G помещается дисталь-
нее места хирургического вмешательства в положение, где он не будет сме-
щен повязкой Esmarch, используемой для обескровливания. Дистальное
местоположение, предпочтительно в передне-локтевой ямке, также уменьша-
ет возможность подтекания раствора под манжету. Катетер не жестко фикси-
руется и, если планируется последующее промывание просвета гепарином, к
нему подсоединяется небольшой шприц или инъекционная канюля.
4. Рука или нога поднимаются для создания венозного оттока, затем повязкой
Esmarch, наложенной от пальцев до жгута, производится обескровливание
конечности (рис. 13.1).
5. В жгуте создается давление на 100 мм рт. ст. выше, чем систолическое дав-
ление или давление не менее 300 мм рт. ст. Наполнение воздухом жгута
контролируется баллотированием манжеты и показателям давления. По-
сле надувания и удаления повязки Esmarch, адекватность окклюзии под-
тверждается отсутствием пульса на лучевой или задней большеберцовой
артерии.
Для поддерживаемого раздувания манжеты должен быть использован источ-
ник газа постоянного давления. Через все манжеты происходит небольшая
утечка и однократное раздувание стандартной манжеты для измерения кровя-
ного давления приведет к постепенному снижению давления, что в свою оче-
редь вызовет утечку анестетика с потенциально катастрофическими
последствиями. Манжеты должны быть проверены перед инъекцией и часто
проверяться во время проведения процедуры.
6. Конечность возвращается в обычное положение, и раствор местного анесте-
тика вводится через предварительно установленный катетер. Пациент преду-
преждается о том, что эта процедура связана с неприятными ощущениями
давления и покалывания, длящимися несколько секунд. Инъекция произво-
дится медленно (в течение 90 секунд или дольше) как для уменьшения этих
ощущений, так и, что более важно, понижения максимального венозного дав-
ления, которое не должно превысить давления окклюзионной манжеты [8].
Если хирургические манипуляции будут длиться менее часа, катетер удаляет-
ся, а место бывшего вкола прижимается, пока не закроется. Достаточная сен-
сорная анестезия наступает через 5 минут.
7. Ни при каких обстоятельствах манжета не должна сдуваться в течение пер-
вых 20 минут после инъекции.
8. Если процедура продолжается более 45 минут может быть использована
двойная манжета. При этом проксимальная манжета наполняется в первые
45 минут анестезии. Затем, над тканями, онемевшими от местного анесте-
176
Глава 13
Рис. 13.1
Техника внутривенной местной
анестезии.
Небольшой внутривенный катетер
установлен в области кисти, на
верхнюю часть конечности наложен
жгут. Для коротких операций может
быть использован одноманжетный жгут,
который может обеспечить более
надежную компрессию венозной
системы, чем показанная на рисунке
система из двух манжет.
Обескровливание руки достигается ее
подъемом и бинтованием эластической
повязкой Esmarch. После этого манжета
наполняется воздухом и производиться
инъекция анестетика
тика, надувается дистальная манжета, после чего проксимальная манжета (ле-
жащая на неанестезированной коже) сдувается. Достаточность давления
дистальной манжеты проверяется до сдутия проксимальной манжеты.
Несмотря на то, что эта методика якобы уменьшает неприятные ощущения
пациента в области наложения жгута, усложнение процедуры перемещением
манжеты создает дополнительный риск ее сдутия. Кроме этого использова-
ние более узких манжет может не обеспечить необходимой компрессии и
привести к проникновению раствора анестетика в системный кровоток.
9. Если после инъекции прошло более 45 минут анестезия может начать ослабе-
вать. Если для хирургического вмешательства требуется больше времени, че-
рез внутривенный катетер после 60-90 минут может быть выполнена
повторная инъекция раствора анестетика. Это мешает ходу хирургического
вмешательства и может нарушить стерильность в зоне операции, поэтому в
таких случаях более подходящим планом проведения анестезии является ис-
пользование других блокад, например блокады плечевого сплетения.
10. Воздух из жгута может быть выпущен через 45 минут с минимальным риском
возникновения симптомов системной токсичности анестетика, поскольку к
этому времени препарат связывается в тканях [9] (рис. 13.2). Если после инъ-
екции прошло менее 45 минут рекомендуется снятие жгута в два приема, ког-
да вначале воздух выпускается в течение 10 секунд, а затем, перед полным
сдутием манжеты она вновь наполняется на одну минуту. Это способствует
Внутривенная местная анестезия
177
Рис. 13.2
Влияние времени раздувания манжеты на системный уровень
местного анестетика в крови после внутривенной
регионарной блокады.
После снятия жгута уровень местного анестетика в крови
быстро повышается, однако он и снижается также быстро.
Если манжета сдута через 20 минут после ее наложения,
уровень в крови может достичь токсического
(симптоматического) уровня; после 45 минут это
маловероятно. Незаполненные кружочки (на графике)
показывают уровень в крови после введения 50 мл
1% раствора лидокаина; заполненные кружочки показывают
более низкие уровни, полученные после введения
0.5% раствора лидокаина. Возможно, что жгут не должен
сниматься менее чем через 20 минут при применении
любого препарата, а через 20-45 минут он должен сниматься
постепенно (с разрешения и по материалам Tucker G.T.,
Boas R. A. Pharmacokinetic aspects of intravenous regional
anesthesia. Anesthesiology 34: 538, 1971)
время наложения манжеты
(мин.)
постепенному вымыванию анестетика. Трехкратное повторение этого приема
задерживает достижение максимального уровня анестетика в крови, однако
это снижение не достоверно по сравнению с единовременным сдутием [10].
Как уже упоминалось, если прошло менее чем 20 минут, этот интервал дол-
жен быть заполнен приятной беседой, а удаление воздуха производиться в
два приема только после истечения этого времени. Эти шаги, однако не гаран-
тируют отсутствие развития системной токсичности.
Осложнения
Системная токсичность
При этой процедуре риск системной токсичности является значительным. Наи-
большая опасность возникает при неправильно наложенном в начале процедуры
жгуте, что приводит к увеличению внутривенного объема и концентрации препа-
рата. Каждый раз необходимо убеждаться в надежности жгута и исправности ис-
точника давления.
Даже при достаточном заполнении, использование узких манжет (5—7 см
шириной) для системы из 2-х жгутов, иногда будет приводить к утечке анестети-
ка. Использование манжеты стандартной ширины для взрослых (12-14 см) обес-
печивает более надежную компрессию венозной системы конечностей, особенно
нижних. Утечка более вероятна, если инъекция сделана быстро под высоким дав-
лением в вену, расположенную рядом с манжетой [8]. Наименьшая утечка на-
блюдается после инъекции, сделанной в дистальную вену в течение не менее 90
секунд вследд за обескровливанием руки и созданием давления в манжете до 300
мм рт. ст. Даже в случае нормально работающей манжеты в течение нескольких
минут необходимо тщательное наблюдение за психическим статусом пациента.
К концу процедуры в венах остается некоторое количество местного анесте-
тика и снятие жгута неизбежно приводит к вымыванию препарата в системный
178
Глава 13
кровоток. Для лидокаина после 45 минут эти уровни являются субтоксичными, а
наибольшая опасность имеется в течение первых 20 минут после инъекции [9]
(рис. 13.2). Эти временные ориентиры являются основными для определения
времени снятия жгута. В связи с индивидуальными особенностями полная безо-
пасность не может быть гарантирована, поэтому при этой методике все пациенты
должны тщательно наблюдаться в течение всего времени возможного развития
токсичности, связанной с местным анестетиком. Должно быть доступно реани-
мационное оборудование, а на другой конечности налажен внутривенный до-
ступ.
Литература
1. Hartmannsgruber, М. W., Silverman, D. G., Halaszynski, Т. М., Bobart, V.,
Brull, S. J., Wilkerson, C., Loepke, A. W., Atanassoff, P. G., Comparison of ropi-
vacaine 0.2% and lidocaine 0.5% for intravenous regional anesthesia in volunteers.
Anesth. Analg. 89: 727, 1999.
2. Lavin, P. A., Henderson, C. L., Vaghadia, H. Non-alkalinized and alkalinized
2-chloroprocaine vs lidocaine for intravenous regional anesthesia during outpatient
hand surjery. Can. J. Anaesth. 46: 939,1999.
3. Acalovschi, L, Cristea, T., Margarit, S., Gavrus, R. Tramadol added to li-docaine for in-
travenous regional anesthesia. Anesth. Analg. 92: 209,2001.
4. Reuben, S. S., Duprat, К. M. Comparison of wound infiltration with ke-torolac versus
intravenous regional anesthesia with ketorolac for postoperative analgesia following
ambulatory hand surgery. Reg. Anesth. 21: 565,1996.
5. Reuben, S. S., Steinberg, R. B., Lurie, S. D., Gibson, C. S. A dose-response study of intra-
venous regional anesthesia with meperidine. Anesth. Analg. 88: 831,1999.
6. Reuben, S. S., Steinberg, R. B., Klatt, J. L., Klatt, M. L. Intravenous regional anesthesia
using lidocaine and clonidine. Anesthesiology 91: 654, 1999.
7. Gentili, M., Bernard, J. M., Bonnet, F. Adding clonidine to lidocaine for intravenous re-
gional anesthesia prevents tourniquet pain. Anesth. Analg. 88: 1327,1999.
8. Grice, S. C., Morell, R. C., Balestrieri, F. J., Stump, D. A., Howard, G. Intravenous regio-
nal anesthesia: Evaluation and prevention of leakage under the tourniquet. Anesthesio-
logy 65: 316, 1986.
9. Tucker, G. T., Boas, R. A. Pharmacokinetic aspects of intravenous regional anesthe-
sia. Anesthesiology 34: 538,1971.
10. Sukhani, R., Garcia, C. J., Munhall, R. J., Winnie, A. P., Rodvoid, K. A. Lidocaine dis-
position following intravenous regional anesthesia with different tourniquet deflati-
on technics. Anesth. Analg. 68: 633, 1989.
Глава 14
Периферические блокады нервов
верхних конечностей
В отдельных случаях необходима анестезия одного из нервов плеча, предплечья,
кисти или пальцев. Более часто требуется дополнительная анестезия одной из пе-
риферических ветвей, в частности, при лишь частично успешной блокаде плече-
вого сплетения. Центральная блокада является наиболее эффективной, однако
периферический доступ к отдельному нерву иногда является более простым и
легким вариантом достижения анестезии.
Анатомия. Для обеспечения дополнительной анестезии иногда блокируют-
ся две проксимальные ветви плечевого сплетения - надключичный нерв и мы-
шечно-кожный нерв (см. главу 12). Надключичный нерв отходит от верхнего
пучка, сформированного V и VI шейными корешками и проходит косо латераль-
но под трапециевидной мышцей, проходя в надостистой вырезке к задней повер-
хности лопатки. Он обеспечивает чувствительную иннервацию плечевого суста-
ва и двигательную иннервацию надостистой мышцы, которая помогает
дельтовидной мышце при поднятии руки. Этот нерв также обеспечивает двигате-
льную иннервацию подостистой мышцы, которая поворачивает плечо кнаружи
(это движение является показателем стимуляции этого нерва), однако зона его
чувствительной иннервации на плече является небольшой.
Дистальные части основных периферических нервов руки в основном нахо-
дятся под мышечным массивом, однако в локтевой области и на запястье, где
мышцы менее рельефны, так как пересекают сухожилия, эти нервы имеют на-
дежные костные анатомические ориентиры. Терминальные нервы пальцев обна-
руживаются легко.
В локтевой области локтевой нерв находится поверхностно в углублении
медиального мыщелка плеча и локтевого отростка. При давлении на эту зону па-
рестезии возникают так легко, что она хорошо известна под названием «забавная
косточка». Срединный нерв располагается глубже, однако он может быть надеж-
но определен сразу медиальнее плечевой артерии в месте пересечения ею кож-
ной складки в передне-локтевой ямке. Лучевой и латеральный кожный нерв
предплечья пересекают локтевой сустав латеральнее между сухожилием двугла-
вой мышцы и местом прикрепления плече-лучевой мышцы. Первый из них ле-
жит непосредственно на плечевой кости в собственной борозде, в то время как
второй проходит поверхностно, и ниже этого уровня почти всегда начинает дели-
ться на терминальные ветви.
На ладонной поверхности запястья три нерва, иннервирующие кисть, вновь
становятся легко обнаруживаемыми. Локтевой нерв пересекает суставы запястья,
проходя над шиловидным отростком локтевой кости в сопровождении локтевой
артерии. Срединный нерв лежит по средней линии запястья, в глубине между су-
хожилиями длинной ладонной мышцы и сухожилием лучевого сгибателя запястья
(определяются при сгибании запястья). Лучевой нерв начинает распадаться на вет-
ви проксимальнее запястья, однако он может быть обнаружен рядом с лучевой ар-
терией; несколько его ветвей отклоняясь дорсально проходят над суставом и далее
через область анатомической «табакерки» на тыльную поверхность кисти.
180
Глава 14
Нервы пальцев являются терминальными чувствительными ветвями, кото-
рые проходят вдоль фаланг в виде дорсальной и вентральной ветвей по сторонам
для каждого пальца. Они легко блокируются при соблюдении осторожности в от-
ношении сопровождающих их артерий.
Показания
Надлопаточная блокада в основном используется для обезболивания плечевого
сустава при хирургических манипуляциях. Она может способствовать восста-
новлению после хирургических манипуляций в плечевой области, проводимых
под общей анестезией [1]. Однако в основном используется, если хирургические
манипуляции в плечевой области обеспечиваются межлестничной блокадой.
Блокада дистальных нервов является наилучшим дополнением анестезии
плечевого сплетения, которая в целом вызывает глубокую и длительную анесте-
зию предплечья. Иногда один из нервов оказывается незаблокированным. Ветв-
ление нервов (мышечно-кожного и медиального кожного нерва предплечья) осо-
бенно выражено в локтевой области, что часто делает инфильтрационную
анестезию места хирургического вмешательства наилучшим средством обезбо-
ливания. Для хирургии кисти дополнительная инъекция в локтевой области или
области запястья может «спасти» блокаду.
Блокада более периферических нервов может быть предпочтительной у па-
циентов с нарушениями коагуляции, когда центральные инъекции в область над-
ключичной или аксиллярной артерии нежелательны. Эти методики могут быть
также полезны для небольших локальных процедур в области иннервации одно-
го нерва, таких как обработка ран, удаление простых кист, или ревизия раны.
Дистальная блокада нервов является простейшей формой анестезии при ране-
нии пальцев или дренировании подногтевых гематом, однако эта анестезия не явля-
ется такой выраженной как при большинстве проксимальных блокад. В этих пери-
ферических областях следует избегать применения сосудосуживающих средств.
Препараты
Могут применяться любые местные анестетики короткого, среднего или длите-
льного действия в низких концентрациях, таких как 1% лидокаин или эквивален-
тные ему препараты, в зависимости от необходимой продолжительности
анестезии. Эпинефрин особенно противопоказан при блокаде нервов пальцев и, в
целом, не нужен при других периферических блокадах.
Техника
Надлопаточная блокада
Эта блокада наиболее легко выполнима у пациентов в положении сидя и, следо-
вательно, если она используется для послеоперационного обезболивания после
общей анестезии ее лучше начинать до хирургического вмешательства на плече-
вой области.
1. Пациенту предлагают сесть и наклониться вперед, опираясь на стандартный
столик Мейо или просто высокий стол, если были использованы седативные
препараты.
Периферические блокады нервов верхних конечностей
181
2. Идентифицируется ость лопатки, которая отмечается на протяжении всей ее
длины с формированием косой линии, направленной к верхне-наружной об-
ласти плеча. Определяется середина ости и в этой точке в вертикальном на-
правлении до нижнего угла лопатки проводится вторая линия (рис. 14.1).
Верхне-наружный квадрант, сформированный пересечением этих двух линий
делится пополам третьей линией протяженностью около 1 дюйма, в конечной
точке которой наносится маркер «X».
Рис. 14.1
Блокада надлопаточного нерва.
Маркируется ость лопатки, и ее средняя точка
устанавливается путем определения места
пересечения с линией, проходящий через нижний
угол лопатки. Вырезка лопатки, в которой
проходит нерв, находится приблизительно
на 1 дюйм выше и латеральнее
точки пересечения этих линий
3. Через маркер «X» проводится 4-х дюймовая игла, которая направляется пер-
пендикулярно к коже до осторожного контакта с лопаткой. Затем, игла прохо-
дит выше и медиальнее до входа в надлопаточную вырезку. После того, как
место вырезки определено, игла продвигается на 1 см.
4. В этот момент с высокой вероятностью успеха может быть введено 10 мл
местного анестетика. Можно ориентироваться на парастезию в области пле-
чевого сустава или использовать стимуляцию нерва, вызывая ротацию плеча.
Локтевая блокада
Требуется три отдельные инъекции. Поскольку ветви чувствительных нервов
предплечья всегда имеют широкие боковые разветвления, пресекающие поверх-
ностно этот сустав с образованием распространенной подкожной сети, хорошую
сенсорную анестезию предплечья только из этой области получить трудно. Бло-
када основных нервов в этой области на самом деле обеспечивает только анесте-
зию кисти и незначительно отличается от блокады в области запястья. Поэтому,
эта методика используется нечасто.
1. Для блокады локтевого нерва локтевой сустав пациента сгибается под углом
приблизительно в 30 градусов, после чего идентифицируется борозда медиа-
льного мыщелка плечевой кости. Более выраженное сгибание может привес-
ти к тому, что нерв отодвинется из этого углубления в латеральную сторону.
Иглой диаметром 25 G под фасцию в области углубления вводится 3-5 мл
182
Глава 14
местного анестетика. Могут определяться явления парестезии, однако в этом
нет необходимости. Для уменьшения возможности повреждения нерва следу-
ет избегать интраневральной инъекции или чрезмерного давления на это су-
женное пространство.
2. Для поиска срединного нерва локоть разгибается, и через руку, между двумя
мыщелками плеча, обычно на 2 пальца выше изгиба складки, проводится ли-
ния. Пульсация плечевой артерии определяется медиальнее по этой линии.
Игла диаметром 25 G и длиной 1.5 дюйма проводится на локтевой стороне ар-
терии и направляется к плечевой кости. Для более надежной анестезии опре-
деляются явления парастезии, однако они могут отсутствовать, если уже
имеется частичная анестезия. Если явления парестезии не обнаруживаются,
вдоль и глубже артерии создается «вал» из 5-7 мл раствора.
3. Для поиска лучевого нерва идентифицируется сухожилие двуглавой мышцы
плеча, идущее вдоль внутримышелковой линии, для этого пациента просят
напрячь мышцу. Затем, рука распрямляется, и игла проводится латеральнее
сухожилия двуглавой мышцы в углубление между ним и плече-лучевой мыш-
цей. Игла продвигается слегка в краниальном и медиальном направлении до
контакта с латеральным мыщелком плечевой кости, затем по мере постепен-
ного извлечения иглы веерообразно вводится 5-7 мл раствора. Обнаружение
парестезии увеличивает шанс успешной анестезии, поскольку лучевой нерв
не так легко обнаружить, как срединный или локтевой. Дополнительно под
кожу в области углубления вводится 3-5 мл для анестезии латерального кож-
ного нерва предплечья.
Лучезапястная блокада
На ладонной поверхности сустава должны быть выполнены три отдельные инъ-
екции (рис. 14.2).
Рис. 14.2
Периферические нервы в области запястья.
Срединный нерв лежит сразу вдоль лучевой
стороны длинного сгибателя ладони.
Локтевой и лучевой нервы лежат снаружи от
соответствующих артерий. На этом уровне
лучевой нерв уже отдает ветви,
поэтому он может быть блокирован
широкой подкожной инфильтрацией
анестетика
Длинный
сгибатель
ладони
Срединный
нерв
Лучевая
артерия
Лучевой
нерв
Лучевая
кость
Периферические блокады нервов верхних конечностей
183
1. Локтевой нерв блокируется иглой диаметром 25 G, проводимой по локтевой
стороне локтевой артерии, с дальнейшим продвижением иглы между ней и
локтевым сгибателем запястья к шиловидному отростку. По мере извлечения
иглы вводится 3—5 мл раствора.
2. Для блокады срединного нерва при сгибании запястья идентифицируется
длинный сгибатель ладони и лучевой сгибатель запястья. Игла проводится
между ними до глубокой фасции, затем, по мере извлечения иглы вводится
3-5 мл раствора.
3. Лучевой нерв ветвится еще до достижения запястья. Здесь, в дополнение к
уже введенным 3 мл раствора вдоль латерального края лучевой артерии на
два поперечных пальца выше запястья, поверхностное кольцо раствора дол-
жно распространяться от этой точки дорсально над краем запястья и к облас-
ти анатомической табакерки, образованной сухожилием разгибателя
большого пальца.
Пальцевая блокада
Периферические нервы, иннервирующие пальцы, расположены одинаково и мо-
гут быть блокированы инъекциями с каждой стороны в основании каждого пальца.
Наиболее частой проблемой этого вида анестезии является попытка начала вмеша-
тельства до истечения времени, достаточного для развития анестезии. Для адек-
ватного обезболивания может потребоваться от 10 до 15 минут.
1. ука пациента укладывается на ровную поверхность ладонью вниз с растопы-
ренными пальцами. У каждого пальца маркер «X» наносится на кожу в про-
странстве между головками пястных костей. Эти точки обычно находятся в
местах, где кожный рисунок изменяется от шероховатого на дорсальной по-
верхности кисти к гладкому на ладони. Для пальцевой блокады в этом месте
игла диаметром 25 G проводится вниз по направлению к головке пястной кос-
ти (рис. 14.3). Затем, вводится 1-2 мл раствора около вентральной головки и 1
мл около дорсальной головки, благодаря чему достигается анестезия как до-
рсальных, так и вентральных ветвей. Должны быть блокированы обе стороны
Рис. 14.3
Блокада пальцевых нервов.
Игла диаметром 25 G проводится
в дорсальном направлении
в межпальцевое пространство
под углом 45 градусов на уровне изменения
кожного рисунка и продвигается
до осторожного контакта с костью.
Игла извлекается на 3-4 мм с введением 2 мл
раствора без эпинефрина в ладонном направлении
и 1 мл вдоль дорсальной поверхности фаланг
184
Глава 14
каждого пальца. «Внешние» стороны указательного пальца и мизинца блоки-
руются инъекцией вдоль соответствующих краев кисти на уровне головок пя-
стных костей.
2. Для большого пальца производятся такие же инъекции с каждой стороны го-
ловки соответствуюшей пястной кости.
3. При блокаде терминальных нервов пальцев эпинефрин не используется.
Осложнения
Ишемия
Ишемия пальцев является наиболее серьезным осложнением и может быть пред-
отвращена не применением сосудосуживающих средств и избеганием инъекций
чрезмерно больших объемов растворов.
Нейропатия
Нейропатия при любой из этих методик в большинстве случаев наблюдается тог-
да, когда отмечалась парестезия. Высокие концентрации растворов анестетиков
должны применяться с осторожностью (см. главу 3). Интраневральная инъекция
(боль при инъекции) увеличивает возможность этого осложнения.
Литература
1. Ritchie, Е. D., Tong, D., Chung, F., Norris, A. M., Miniaci, A., Vairavanat-
han, S. D. Suprascapular nerve block for postoperative pain relief in arthroscopic
shoulder surgery: A new modality? Anesth. Analg. 84: 1306, 1997.
Глава 15
Блокады пояснично-крестцового
сплетения
Пояснично-крестцовое сплетение имеет сходные с плечевым сплетением черты
строения, что делает возможным его анестезию путем однократной инъекции.
Однако анатомические особенности пояснично-крестцовой области не столь
благоприятны для анестезии сплетения, как на шее. Эти различия делают мето-
дику, основанную на одной инъекции, более трудной и менее надежной, особен-
но, при наличии таких эффективных альтернатив, как спинномозговая,
эпидуральная и каудальная анестезии. Все же односторонняя блокада является
показанной в отдельных случаях, например, когда имеются противопоказания к
аксиальной блокаде. Положительным моментом является то, что условия для
обезболивания нижних конечностей в послеоперационном периоде лучше, по
сравнению с условиями обезболивания верхних конечностей, поскольку в этой
области блок периферических нерво длится больше и здесь может быть выполне-
но несколько блокад с использованием постоянного катетера, при которых до-
стигается превосходная анальгезия, даже по сравнению с эпидуральной
инфузией.
Анатомия
Нервы, обеспечивающие двигательную и чувствительную иннервацию нижних
конечностей, происходят из нервных корешков, расположенных от II пояснично-
го до III крестцового сегментов. Верхние ветви (L-2-L-4) формируют пояснич-
ное сплетение, от которого отходят латеральный кожный нерв бедра, бедренный
нерв и запирательный нерв (рис. 15.1). Они обеспечивают иннервацию верхней
части ноги вместе с ветвью бедренного нерва (подкожный нерв), которая прости-
рается в медиальном направлении ниже коленной области. Нижние корешки
(L-4- S-3) формируют два основных ствола седалищного нерва, а также больше-
берцовый и общий малоберцовый нервы (рис. 15.2). Они обеспечивают иннерва-
цию ноги ниже колена (рис. 15.3).
Как и в плечевом сплетении, корешки нервов после выхода из межпозвоноч-
ных отверстий проходят между фасциями двух мышц, представленными здесь
передней фасцией квадратной мышцы поясницы и задней фасцией поясничной
мышцы. Для седалищных корешков задним краем лакуны становится подвздош-
ная кость. К сожалению анатомическая «оболочка» здесь не такая подходящая
для блокады как на шее. Ветви поясничного сплетения (за исключением бедрен-
ного нерва) рано покидают лакуну, а седалищная часть в самом начале своего
формирования защищена крестцом. Анестезия путем однократной инъекции
возможна, однако толщина мышц спины делает идентификацию мест прохожде-
ния нервов более трудной. Поэтому, на практике, доступ для анестезиищижних
конечностей представлен отдельными инъекциями для задних (седалищных) и
передних (поясничное сплетение) ветвей.
186
Глава 15
Квадратная
мышца
поясницы
Поясничная
мышца
Последнее
ребро
Корешок L-2
Корешок L-3
Корешок L-4
Бедренный нерв
. Запирательный
нерв
Седалищный
нерв
Латеральный
кожный нерв
бедра
Подвздошный
Рис. 15.1. Анатомия поясничной лакуны.
Корешки поясничного сплетения выходят через отверстия в фасциальной оболочке между
квадратной мышцей поясницы сзади и поясничной мышцей спереди. Происхождение поясничного
сплетения является более широким, чем плечевого сплетения на шее. Поясничные корешки
формируют латеральный кожный нерв бедра, бедренный и запирательный нервы, они могут быть
блокированы легче, путем инъекции в эту фасциальную лакуну. Нижние крестцовые корешки
формируют седалищный нерв, однако в лакуне они лежат позади костных структур и не могут быть
легкодоступны при одной инъекции
Запирательный
Ветви поясничного сплетения отклоняются кпереди и так входят в полость
малого таза (рис. 15.1). Бедренный нерв в одиночестве продолжается в том же на-
правлении, что и в фасциальной лакуне позади поясничной мышцы, затем до пе-
ресечения с паховой связкой он проходит в углублении между поясничной и под-
вздошной мышцами. Под паховой связкой он проходит сразу позади и несколько
латеральнее бедренной артерии, которая является полезным надежным анатоми-
ческим ориентиром. Сразу ниже (или в отдельных случаях несколько выше) связ-
ки он отдает несколько порций ветвей, основной ствол продолжается медиально
и пересекает коленную область уже как подкожный нерв, который обеспечивает
чувствительную иннервацию медиальной поверхности икры до лодыжки, а так-
же медиальной части стопы. Напротив, латеральный кожный нерв бедра рано по-
кидает фасциальную оболочку и смещается латерально, проходя под паховой
связкой в направлении передней верхней подвздошной ости. Отсюда его терми-
нальные ветви обеспечивают чувствительную иннервацию латеральной поверх-
ности бедра. Третья ветвь, или запирательный нерв, сохраняет медиальное и зад-
нее положение в полости таза и проходит под верхней ветвью лобковой кости до
входа в запирательное отверстие, где отдает двигательные и чувствительные во-
• локна к медиальной поверхности бедра и коленной области.
Седалищный нерв является самым большим нервом человеческого тела. Он
представлен двумя основными стволами. Корешки с L-4 по S-2 формируют лате-
Блокады пояснично-крестцового сплетения
187
Рис. 15.2
Анатомия седалищного нерва.
Нерв выходит из полости таза
через подгрушевидное отверстие
и направляется по задней поверхности бедра
до места деления на большеберцовый
и общий малоберцовый нервы
сразу выше коленной области
Большеберцовый
нерв
Общий
малоберцовый
нерв
Задняя
верхняя
подвздошная
ость
Седалищный
бугор
Крестцовая
щель
г---Большой
\ вертел
ральный ствол, называемый общим малоберцовым нервом, в то время как другие
ветви с L-4 по S-3 формируют медиальный ствол, называемый большеберцовым
нервом. Объединенные пучки проходят по передней поверхности подвздошной
кости и затем выходят из полости таза через подгрушевидное отверстие, проходя
кпереди от грушевидной мышцы и между седалищным бугром и большим верте-
лом бедренной кости (рис. 15.2). Пучок опускается позади бедренной кости и
разделяется на две части в верхнем конце подколенной ямки. Малоберцовый
нерв обеспечивает иннервацию передней поверхности икры и дорсальной повер-
хности стопы, в то время как большеберцовые ветви, продолжая идти по задней
поверхности голени, достигают подошвенной поверхности ступни (см. главу 16).
Показания
Изолированная блокада седалищного нерва часто может обеспечить анестезию по-
дошвенной поверхности ступни и большую часть ее дорсальной поверхности, за
исключением медиального края, иннервируемого подкожными ветвями бедренно-
го нерва. Такая анестезия хорошо подходит для обезболивания при хирургических
манипуляциях на пальцах ноги. Несмотря на то, что если на бедро накладывается
жгут, часто требуется дополнительная анестезия. В этих случаях обычно выполня-
ется анестезия бедренного и латерального кожного нерва бедра [1].
188
Глава 15
Рис. 15.3
Дерматомы и ветви периферических
нервов нижних конечностей
Для хирургических манипуляций в области коленного сустава используется
комбинированная седалищно-бедренная блокада, подходящая для выполнения
артроскопии коленного сустава в амбулаторных условиях [2]. При выполнении
заместительной хирургической операции на коленном суставе однократная инъ-
екция [3] или постоянная анальгезия бедренного нерва [4, 5] обеспечивают уме-
ньшение послеоперационных болей и ускоряют реабилитацию. При хирургиче-
ских вмешательствах на коленном суставе в амбулаторных условиях
одно-инъекционная блокада бедренного нерва обеспечивает обезболивание на
18—24 часа после восстановления передней крестообразной связки [6]. Блокада
бедренного нерва также эффективна для обезболивания после хирургических
вмешательств на бедре [7] или переломах бедра [8].
Если инъекции для отдельных ветвей являются затруднительными или бо-
лезненными в связи с переломами или другими повреждениями, инъекцией боль-
шого объема может быть блокирована верхняя часть сплетения, находящаяся в
поясничной лакуне. Это не так надежно как аксиальная блокада, однако есть об-
стоятельства, когда промедление противопоказано в связи с возможностью раз-
вития инфекции или коагулопатии.
Методики с установкой постоянного катетера применяются при поясничной
блокаде, блокаде бедренного нерва, анестезии седалищного нерва и могут увели-
чивать продолжительность обезболивания без побочных эффектов, обычно на-
блюдаемых при центральной нейро-аксиальной анальгезии.
Для нижних конечностей также применяется внутривенная местная анесте-
зия (см. главу 13). Тем не менее, требуемые здесь большие объемы растворов де-
лают ее более опасной.
Блокады пояснично-крестцового сплетения
189
Препараты
Все местные анестетики, используемые для нижних конечностей, могут вызывать
более длительную анестезию, чем эквивалентные дозы для плечевого сплетения.
Лидокаин или мепивакаин в 1.5% или 2.0% концентрации могут обеспечить 3-х ча-
совую хирургическую анестезию с анальгезией длительностью от 4-х до 6 часов.
0.75% раствор ропивакаина обеспечивает такое же начало действия с более про-
должительной анальгезией (от 11 до 14часов)[1,9].0.5% раствор бупивакаина или
левобупивакаина с эпинефрином обладают более замедленным действием, однако
вызывают анестезию седалищного нерва продолжительностью от 18 до 24 часов,
или более. Если необходимость в двигательной блокаде небольшая, то могут быть
использованы более низкие концентрации. Небольшие дозы клонидина (1 мкг/кг),
добавляемые при блокаде периферических нервов, увеличивают продолжитель-
ность анестезии на 25% [10].
Техника
Ниже описываются общие методики анестезии нервов поясничных и крестцовых
корешков в местах их формирования или рядом с бедренным суставом; деталь-
ное описание блокады более периферических нервов дано в главе 16.
Лакунарная поясничная блокада
Теоретически, наиболее простым доступом к пояснично-крестцовому сплете-
нию является инъекция в поясничную лакуну. Фасциальные листки по задней по-
верхности поясничной мышцы и передней поверхности квадратной мышцы
поясницы ограничивают пространство, в котором находятся корешки нервов,
также как и лестничные мышцы на шее. При этом доступе обычно достигается
анестезия поясничных ветвей сплетения, однако он обычно не обеспечивает не-
обходимой анестезии седалищного сплетения.
1. Пациент помещается в коленно-локтевое положение или в положение на
боку, после чего идентифицируются остистые отростки поясничных позвон-
ков. Маркер «X» наносится на кожу в 5 см латеральнее остистого отростка
III поясничного позвонка, также как при методике, описанной для пояснич-
ной паравертебральной блокады (глава 10) или на межгребневую линию меж-
ду подвздошными остями (рис. 15.4).
Рис. 15.4
Кожно-анатомические ориентиры
для лакунарной поясничной блокады
190
Глава IS
2. В месте нанесения маркера «X» выполняется внутрикожная инфильтрацион-
ная анестезия, затем, игла длиной 4 дюйма проводится перпендикулярно
к коже (рис. 15.5). Лакуна может быть идентифицирована при снижении со-
противления инъекции жидкости или воздуху, также как при входе в эпидура-
льное пространство. Лакуна и корешки нервов должны находиться на
глубине 7—10 см, в зависимости от объема туловища пациента. Для получения
ответа на стимуляции или выявления парастезии осуществляется поэтапный
поиск в кранильно-каудальной плоскости (перпендикулярно к предполагае-
мому направлению нервов). Если игла наталкивается на поперечный отрос-
ток позвонка, она отклоняется в каудальном направлении, обходя его сбоку.
Медиальное отклонение иглы может привести к пункции твердой мозговой
оболочки и его следует избегать.
Рис. 15.5. Лакунарная поясничная блокада.
4-х дюймовая игла проводится перпендикулярно к коже в точке нанесения маркера «X» до
ощущения снижения сопротивления (как при эпидуральной инъекции). После этого, проникновение
в лакуну может быть подтверждено получением ответа на стимуляцию нервов. Если необходимо
длительное обезболивание, может быть установлен катетер
3. У некоторых пациентов подтверждением правильной локализации иглы яв-
ляется «хруст» как при прохождении через плотную оболочку. Это ощущение
возникает редко и не может служить таким же надежным подтверждением
положения иглы в лакуне, содержащей нерв, как двигательный ответ на сти-
муляцию нерва или выявление парастезии.
4. Когда попадание в лакуну подтверждено, производится аспирация и вводится
пробная доза для того, чтобы исключить внутрисосудистое положение иглы.
Затем, вводится 40 мл раствора местного анестетика и через 15-20 минут он
распространится на корешки пояснично-крестцового сплетения. Предполага-
Блокады поясиичио-крестцового сплетения
191
ется развитие анестезии бедренного нерва, латерального кожного нерва бедра и
запирательного нерва. Анестезии седалищного нерва обычно не происходит.
5. Постоянный катетер может быть установлен с использованием иглы для сти-
муляции большого диаметра, катетер прикрепляется к коже, также как и эпи-
дуральный [11]. Постоянная инфузия обеспечивает распространение
обезболивания на поясничное сплетение, что может быть использовано для
послеоперационного обезболивания при хирургических вмешательствах на
бедре или колене [12].
Одно-инъекционная блокада поясничного сплетения
в паховой области
Три ветви поясничного сплетения теоретически могут быть блокированы од-
но-инъекционным введением большого объема в место прохождения фасциаль-
ной оболочки, окружающей бедренный нерв, в направлении паховой связки,
вызывая блок «три в одном». Несмотря на то, что фасциальная анатомия предпо-
лагает наличие соединения между фасциями (фасциальными футлярами) трех
нервов, исследование распространения инъецируемого раствора [13] и определе-
ние блокады нервов по этой методике показали, что запирательный нерв и ветви
крестцового сплетения обычно не охватываются одно-инъекционной блокадой
[14,15]. Однократная инъекция на этом уровне до сих пор используется для анес-
тезии и анальгезии бедренного и латерального кожного нерва бедра [11].
1. Подготовка к блокаде бедренного нерва проводится так, как описано в соот-
ветствующем разделе этой главы (см. «Блокада бедренного нерва»).
2. Игла вводится с небольшим краниальным отклонением от перпендикулярно-
го угла (рис. 15.6). По этой методике двигательный ответ или парастезия вы-
Рис. 15.6. Блокада бедренного нерва
Игла проводится латеральнее артерии до получения двигательного ответа или парестезии. При
использовании иглы большого диаметра может быть установлен постоянный катетер
192
Глава 15
являются по ходу артерии. Когда ответ получен, игла фиксируется и артерия
дистальнее ввода иглы сдавливается пальцами другой руки. Затем, после
осторожной аспирации для предотвращения системного распространения бо-
льших объемов анестетика дробно вводится 40 мл раствора.
3. Если необходимо получение длительной анестезии, по аналогичной методике
в фасциальный футляр вводится внутривенный катетер диаметром 14 или
16 G, или может быть установлен катетер диаметром 20 G, который проводит-
ся строго в краниальном направлении по методике Seldinger, катетер может
быть введен и через большую иглу для стимуляции нервов (рис. 15.6)
Блокада седалищного нерва, задний доступ
Классической методикой является блокада седалищного нерва с локализацией
иглы по явлениям парестезии в зоне иннервации нерва или стимуляции нерва в
области его выхода через подгрушевидное отверстие.
1. Пациент помещается в положение на боку, с фиксированной верхней ногой
(рис. 15.7). Колено и бедро сгибаются под углом приблизительно 45 градусов,
а пациент слегка поворачивается кпереди. Верхняя поверхность большого
вертела бедренной кости маркируется по линии задней верхней подвздошной
ости. Местоположение вертела должно быть определено точно, что может
вызвать некоторые трудности у тучных пациентов. Эти два ориентира соеди-
няются линией.
Рис. 15.7. Блокада седалищного нерва, классический задний доступ.
Пациент укладывается в положение на боку с согнутым бедром и коленом, мышцы, лежащие над
седалищным нервом вытягиваются, что облегчает идентификацию. Нерв лежит ниже точки,
расположенной на 5 см каудальнее места пересечения перпендикуляра к линии, соединяющей
заднюю верхнюю подвздошную ость и большой вертел бедренной кости. Эта точка также обычно
определяется проведением перпендикуляра к линии, соединяющей большой вертел бедренной кости
и крестцовую щель
Блокады пояснично-крестцового сплетения
193
2. В середине этой линии проводится перпендикуляр длиной 5 см, направленный
каудально, здесь наносится маркер «X». Эта метка должна лежать над верхне-ла-
теральным краем U-образного подгрушевидного отверстия. Вторая линия про-
водится от вертела к крестцовой щели так, чтобы она пересекала маркер «X». У
высоких пациентов для пересечения перпендикулярной линии ее, возможно, по-
требуется продлить, нерв может лежать ближе к точке пересечения линии.
3. После обработки кожи в области метки проводится инфильтрационная анес-
тезия, затем 4-х дюймовая игла направляется перпендикулярно к коже. Игла
продвигается осторожно до получения двигательного ответа, парастезии или
контакта с костью. Если достигнута кость, измеряется глубина проникнове-
ния. Нерв будет находиться не намного глубже. Кость обычно является лате-
ральным краем отверстия, через которое выходит нерв, и контакт с ней
указывает на то, что иглу следует отклонить более медиально. Игла извлека-
ется почти до кожи и перенаправляется вдоль линии, перпендикулярной к ли-
нии предполагаемого прохождения нерва, до тех пор, пока он не будет
локализован. Если вновь достигнута кость, отмечается положение иглы и
между двумя точками контакта с костью мысленно определяется край отвер-
стия выхода седалищного нерва. Нерв выходит посредине медиальной сторо-
ны этого отверстия и направляется вниз посередине между большим
вертелом и седалищным бугром. При затруднениях поиску может помочь ри-
сование на коже линии предполагаемого прохождения нерва.
4. Если кость расположена на глубине равной всей длине иглы, может понадо-
биться более длинная игла (6 дюймов). Инфильтрация, выполненная «всле-
пую», редко бывает успешной. Если через 10 минут анестезия не наступила,
необходимо переуточнить анатомические ориентиры.
5. Если получен двигательный ответ или наступила парестезия в области одного
из основных стволов, при фиксированной игле вводится 25 мл местного анес-
тетика. Для повторной стимуляции в области прохождения других нервов,
положение иглы слегка изменяется, разделение дозы позволяет улучшить ка-
чество блокады [16]. Если пациент почувствовал боль или чувство защемле-
ния в ноге при инъекции, игла извлекается до исчезновения этих ощущений.
6. По такой же методике через иглу типа Tuohy может быть установлен постоян-
ный катетер [11].
Блокада седалищного нерва, доступ в положении для литотомии
Если пациент не может находиться в положении на боку, доступ к нерву может
быть осуществлен при положении на спине, в котором ассистент удерживает со-
гнутые ноги.
1. После помещения пациента в положение на спину ассистент сгибает бедро
пациента и удерживает его под углом 90 градусов. Маркер «X» наносится в
середине линии, проведенной от большого вертела до седалищного бугра.
2. После обработки кожи и инфильтрационной анестезии через маркер «X» про-
водится 4-х дюймовая игла. Двигательный ответ или парастезия определяют-
ся при движении иглы вдоль линии, перпендикулярной прохождению нерва,
после локализации которого вводится 25 мл анестетика.
Блокада седалищного нерва, передний доступ
Если бедро не может быть согнуто, при положении на спине нерв может быть до-
стигнут спереди. Большое расстояние, которое должна преодолеть игла, снижает
точность и надежность этой методики. Этот доступ является наименее надежным.
7—1685
194
Глава 15
1. При положении больного на спине проводится линия, соединяющая перед-
не-верхнюю подвздошную ость и лонный бугорок. Вторая линия проводится
параллельно первой, начинаясь на уровне большого вертела бедра и проходя
далее в медиальном направлении. Верхняя линяя делится на три равные части
и в точке на границе медиальной и средней трети книзу проводится перпенди-
кулярная линия, на месте их пересечения наносится маркер «X».
2. 6-ти дюймовая игла проводится через маркер «X» и направляется прямо кзади
до контакта с малым вертелом бедра. Затем, игла перенаправляется, проходя
медиально от кости, и продвигается на 2.5 см с поиском двигательного ответа
или парастезии в зоне иннервации седалищного нерва.
3. В область расположения нерва инъецируется 25 мл местного анестетика.
Если нерв не найден, местный анестетик может быть введен на 2.5 см кзади от
малого вертела с надеждой на то, что раствор попадет в фасциальное про-
странство, в котором находится нерв, однако очевидно, что надежность анес-
тезии при этом снижается.
Блокада бедренного нерва
Наиболее надежной зоной определения бедренного нерва является область, на-
ходящаяся сразу латерально и кзади от бедренной артерии, ниже паховой связки.
1. При положении пациента на спине метка «X» наносится сразу латеральнее
пульсации бедренной артерии на 2.5 см ниже паховой связки (рис. 15.8). На
этом уровне, обычно, нерв лежит ближе к артерии, чем на уровне связки [17].
2. После обработки кожи и инфильтрационной анестезии через метку «X» пер-
пендикулярно к коже проводится игла диаметром 22 G длиной 1.5-2 дюйма.
После того, как игла введена, указательный палец противоположной руки
определяет пульсацию бедренной артерии и игла направляется таким обра-
зом, чтобы пройти сразу латеральнее сосуда. У худощавых пациентов для до-
стижения области расположения нерва иглу достаточно ввести на 2.5 см. Игла
должна быть расположена к сосуду настолько близко, чтобы при отсутствии
ее фиксации руками было видно ее колебание при каждой пульсации сосуда.
3. Присоединяется 10 мл шприц с местным анестетиком и производится осто-
рожная аспирация. Затем, по мере извлечения иглы на 1.5 см, вводится 3-5 мл
анестетика, а игла повторно вводится на 1.5 см с небольшим латеральным (от
артерии) отклонением. Эта процедура повторяется после присоединения вто-
рого шприца с анестетиком, таким образом, веером латеральнее артерии в об-
щей сложности инъецируется 20 мл раствора. При этой методике в
достижении парестезии нет необходимости, и она выявляется редко. Инъек-
ция создает вал с боковой и поверхностной сторон нерва, обеспечивая анесте-
зию поверхностных сенсорных ветвей, которые отходят от основного ствола
на уровне или выше паховой связки.
4. Если произошла пункция артерии, игла просто извлекается и перенаправляет-
ся латеральнее.
5. При другом способе может быть использована стимуляция нерва, которая
приводит к сокращению четырехглавой мышцы бедра. После инъекции 25 мл
анестетика анестезия наступает через 20 минут. Если для определения откли-
ков различных ветвей ствола бедренного нерва (медиальных, срединных и ла-
теральных пучков) используется стимуляция нервов, то инъекция небольших
количеств анестетика в область каждой основной ветви может обеспечить бо-
лее быстрое начало блокады [18]).
Блокады пояснично-крестцового сплетения
195
Лонный
бугорок
Бедренная
артерия
Бедренная
артерия.
Подкожный
нерв
Передняя
верхняя
подвздошная
ость
Паховая
связка
Латеральный
кожный нерв
бедра
__Бедренный
нерв
Запирательный
нерв
Рис. 15.8. Блокада передних ветвей пояснично-крестцового сплетения в паховой области.
Латеральный кожный нерв бедра проходит приблизительно на 2.5 см медиальнее передней верхней
подвздошной ости и может быть наилучшим образом блокирован вдоль линии, проходящей на 2.5
см каудальнее передней верхней подвздошной ости. Бедренный нерв проходит вдоль и слегка сзади
от бедренной артерии. Наиболее доступным он становится приблизительно на 2.5 см ниже паховой
связки. На этой же линии запирательный нерв выходит из запирательного канала, однако он
расположен глубже и его определение менее надежно
6. Другим способом является простая инъекция 25 мл местного анестетика ниже
уровня подвздошной фасции. Игла проводится на 0.5 дюйма латеральнее ар-
терии на том же уровне и продвигается до двухкратного ощущения проникно-
вения через фасцию — через широкую фасцию бедра и подвздошную
фасцию. Инъекция анестетика производится после прохождения второй фас-
ции [14,15]. Эта методика является полезной для применения у детей, однако
также обеспечивает надежную анестезию у взрослых.
7. Как упоминалось выше, на этом уровне при использовании любой из этих ме-
тодик может быть установлен постоянный катетер.
Блокада латерального кожного нерва бедра
Расположение этого нерв на латеральной поверхности бедра вариабельно, одна-
ко он может быть надежно блокирован созданием «вала» анестетика медиальнее
и ниже передней подвздошной ости, что обычно достигается при стандартной
блокаде бедренного нерва. Изолированная блокада этого нерва оказывается до-
статочной для биопсии двуглавой мышцы бедра у пациентов с подозрением на
злокачественный характер гипертермии.
196
Глава 15
1. При положении больного на спине идентифицируется и маркируется перед-
няя верхняя подвздошная ость. Маркер «X» наносится на кожу на 2.5 см ниже
и на 2.5 см медиальнее этой ости (рис. 15.8).
2. После обработки кожи игла в 1.5 дюйма и диаметром 22 G вводится через
зону внутрикожной инфильтрационной анестезии и направляется с латераль-
ным отклонением в 45 градусов до проникновения через широкую фасцию
бедра. При этом возникает легкое ощущение «хруста». Затем, по мере мед-
ленного извлечения иглы, вводится 3-5 мл раствора анестетика, это повторя-
ется после перенаправления иглы несколько медиальнее и повторного
проникновения через фасцию. Игла продвигается медиально с инъекцией при
углублении и извлечении до создания вала из 15-20 мл раствора анестетика
шириной 5 см, расположенного как выше, так и ниже широкой фасции. Опре-
деления парестезии не производится.
Блокада запирательного нерва
Анестезия этого нерва трудно осуществима, поскольку он расположен глубоко и
рано начинает ветвиться. Традиционным доступом в месте прохождения нерва
создается широкий вал из раствора анестетика. При точной локализации нерва с
использованием стимуляции требуются меньшие объемы раствора анестетика.
Изолированная блокада этого нерва иногда оказывается полезной в лечении
спазмов мышц нижних конечностей.
1. При положении пациента на спине идентифицируется лонный бугорок и его
латеральный край маркируется. Метка «X» наносится на 1.5 см ниже и 1.5 см
латеральнее бугорка. Обратите внимание на то, что если провести линию от
бугорка к передне-верхней подвздошной ости маркеры всех трех ветвей пояс-
ничного сплетения будут находиться на параллельной линии, лежащей на 2.5
см ниже (рис. 15.8).
2. После обработки кожи и местной инфильтрационной анестезии медленно до
контакта с костью вводится 3-х дюймовая игла диаметром 22 G. Игла должна
достичь нижней ветви лонной кости, затем она перенаправляется несколько
латеральнее и каудальнее для того, чтобы пройти кнаружи от этой кости до
входа в запирательное отверстие (рис. 15.9). Игла продвигается на 2-3 см. По-
сле аспирации по мере извлечения иглы вводится 5 мл анестетика, затем игла
перенаправляется с небольшим латеральным отклонением. Этот процесс по-
вторяется до создания вала из 20 мл раствора, находящегося на пути нерва в
отверстии.
3. Для поиска нерва в этой области может быть использована стимуляция, за-
тем, после сокращения приводящей мышцы бедра вводится 10 мл раствора.
Осложнения
Системная токсичность
Наилучшим способом предотвращения системной токсичности является частая
аспирация и дробная инъекция в сочетании с наблюдением за частотой сердеч-
ных сокращений и использование эпинефринсодержащих растворов. При блока-
де нескольких нервов (до 4-5) требуется большой общий объем раствора, в этих
случаях в результате медленной абсорбции возможно развитие системной
токсичности. При инъекции больших объемов тщательное внимание должно
быть уделено и дозе в миллиграммах, необходимо использование низких концен-
траций, если могут быть превышены безопасные пределы.
Блокады пояснично-крестцового сплетения
197
Рис. 15.9. Анатомия запирательного нерва.
3-х дюймовая игла в метке «X» направляется перпендикулярно к коже как показано на Рисунке 15.5,
на 1.5 см ниже и латеральнее лонного бугорка. Когда игла достигнет нижней ветви лонной кости, она
перенаправляется слегка латеральнее и каудальнее до входа в запирательное отверстие. Вал из
анестетика создается инъекцией 20 мл раствора, вводимого по мере извлечения и продвижения иглы
в более латеральном направлении. Локализация нерва является более трудной, поскольку он не
лежит в непосредственной близости от таких ориентиров как кость или сосуд
Нейропатия
Нейропатия может быть вызвана интраневральной инъекцией или, изредка, мо-
жет быть обусловлена травматическим повреждением нерва иглой. Это осложне-
ние не нужно путать с продолжительной анестезией крайней длительности,
которая возможна при действии бупивакаина в области седалищного нерва.
Литература
1. Fanelli, G., Casati, A., Beccaria, Р., Aldegheri, G., Berti, M., Tarantino, F., Toni, G.
A double-blind comparison of ropivacaine, bupivacaine, and mepivacaine during
sciatic and femoral nerve blockade. Anesth. Analg. 87: 597, 1998.
2. Casati, A., Cappelleri, G.; Fanelli, G., Borghi, B., Anelati, D., Berti, M., Torri, G.
Regional anaesthesia for outpatient knee arthroscopy: A randomized clinical com-
parison of two different anaesthetic techniques. Acta Anaesthesiol. Scand. 44: 543,
2000.
3. Alien, H. W., Liu, S. S., Ware, P. D., Naim, C. S., Owens, B. D. Peripheral nerve
blocks improve analgesia after total knee replacement surgery. Anesth. Analg. 87:
93,1998.
198
Глава 15
4. Capdevila, X., Barthelet, Y., Biboulet, P., Ryckwaert, Y., Rubenovitch, J., d'Athis,
F. Effects of perioperative analgesic technique on the surgical outcome and duration
of rehabilitation after major knee surgery. Anes-thesiology 91: 8, 1999.
5. Singelyn, F. J., Gouvemeur, J. M. Extended «three-in-one» block after total knee ar-
throplasty: Continuous versus patient-controlled techniques. Anesth. Analg. 91:
176,2000.
6. Mulroy, M. F., Larkin, K. L., Batra, M. S., Hodgson, P. S., Owens, B. D. Femoral
nerve block with 0.25% or 0.5% bupivacaine improves postoperative analgesia fol-
lowing outpatient arthroscopic anterior cruciate ligament repair. Reg. Anesth. Pain
Med. 26: 24, 2001.
7. Singelyn, F. J., Vanderelst, P. E., Gouvemeur, J. M. Extended femoral nerve sheath
block after total hip arthroplasty: Continuous versus patient-controlled techniques.
Anesth. Analg. 92: 455, 2001.
8. McGlone, R., Sadhra, K., Hamer, D. W., Pritty, P. E. Femoral nerve block in the ini-
tial management of femoral shaft fractures. Arch. Emerg. Med. 4: 163,1987.
9. Casati, A., Fanelli, G., Borghi, B., Torri, G. Ropivacaine or 2% mepivacaine for lo-
wer limb peripheral nerve blocks. Study Group on Orthopedic Anesthesia of the Ita-
lian Society of Anesthesia, Analgesia, and Intensive Care. Anesthesiology 90: 1047,
1999.
10. Casati, A., Magistris, L., Fanelli, G., Beccaria, P., Cappelleri, G., Aldegheri, G.,
Toni, G. Small-dose clonidine prolongs postoperative analgesia after sciatic-femo-
ral nerve block with 0.75% ropivacaine for foot surgery. Anesth. Analg. 91: 388,
2000.
11. Chelly, J., Casati, A., Fanelli, G., Continuous Peripheral Nerve Block Techniques.
London: Mosby, 2001.
12. Chudinov, A., Berkenstadt, H., Salai, M., Cahana, A., Perel, A. Continuous psoas
compartment block for anesthesia and perioperative analgesia in patients with hip
fractures. Reg. Anesth. Pain Med. 24: 563, 1999.
13. Marhofer, P., Nasel, C., Sitzwohl, C., Kapral, S. Magnetic resonance imaging of the
distribution of local anesthetic during the three-in-one block. Anesth. Analg. 90:
119, 2000.
14. Capdevila, X., Biboulet, P., Bouregba, M., Barthelet, Y., Rubenovitch, J., d'Athis,
F. Comparison of the three-in-one and fascia iliaca compartment blocks in adults:
Clinical and radiographic analysis. Anesth. Analg. 86: 1039, 1998.
15. Ganapathy, S., Wasserman, R. A., Watson, J. T., Bennett, f., Armstrong, К. P.,
Stockall, C. A., Chess, D. G., MacDonald, C. Modified continuous femoral
three-in-one block for postoperative pain after total knee arthroplasty. Anesth.
Analg. 89: 1197, 1999.
16. Bailey, S. L., Parkinson, S. K., Little, W. L., Simmerman, S. R. Sciatic nerve block.
A comparison of single versus double injection technique. Reg. Anesth. 19:9,1994.
17. Vloka, J. D., Hadzic, A., Drobnik, L., Ernest, A., Reiss, W., Thys, D. M. Anatomi-
cal landmarks for femoral nerve block: A comparison of four needle insertion sites.
Anesth. Analg. 89: 1467,1999.
18. Casati, A., Fanelli, G., Beccaria, P., Cappelleri, G., Berti, M., Aldegheri, G., Torri,
G. The effects of the single or multiple injection technique on the onset time of fe-
moral nerve blocks with 0.75% ropivacaine. Anesth. Analg. 91: 181,2000.
Глава 16
Блокады периферических нервов
нижней конечности
Для хирургических манипуляций на стопе ветви седалищного и бедренного нер-
ва могут быть блокированы ниже бедра: в области коленного или голеностопно-
го сустава.
Анатомия
Две основные ветви седалищного нерва проходят позади бедренной кости как раз-
дельные стволы в единой эпиневральной оболочке. В подколенной ямке они де-
лятся на два отдельных ствола, формируя большеберцовый и общий
малоберцовый нервы. Верхней границей этой ямки является верхушка треуголь-
ника, сформированного двуглавой мышцей бедра и полусухожильными мышца-
ми. Окончательное разделение стволов происходит где-то между уровнем
подколенной складки и 10 см выше этого уровня [1]. Здесь нервы лежат посредине
между кожей и бедренной костью и поверхностнее подколенных сосудов. После
этого уровня ветви большеберцового и общего малоберцового нервов иннервиру-
ют переднюю и заднюю группы мышц голени. Терминальные ветви, идущие к сто-
пе, могут быть идентифицированы в месте их пересечения голеностопного
сустава, где они лежат на поверхности. Основным стволом, идущим к подошвен-
ной поверхности стопы, является задний большеберцовый нерв, который лежит
сразу кпереди и медиальнее ахиллова сухожилияи и проходит на уровне медиаль-
ной лодыжки по задней поверхности большеберцовой кости с задней большебер-
цовой артерией. Основным стволом, идущим к дорсальной поверхности стопы,
является глубокий малоберцовый нерв, который также в сопровождении своей ар-
терии (передней большеберцовой) проходит по передней поверхности голено-
стопного сустава позади сухожилия длинного разгибателя пальца сразу выше
большеберцовой кости. Две другие ветви седалищного нерва проходят достаточно
поверхностно. Поверхностные малоберцовые ветви по диагонали пересекают пе-
реднюю поверхность голеностопного сустава, икроножный нерв и подкожно, по-
зади латерального надмыщелка, идет к латеральному краю стопы.
Бедренный нерв посылает на стопу одну терминальную чувствительную
ветвь. Подкожный нерв пересекает коленный сустав с медиальной стороны и про-
ходит поверхностно над головкой большеберцовой кости. Он вновь располагается
поверхностно при прохождении кпереди к медиальному надмыщелку для обеспе-
чения чувствительной иннервации различных зон медиального края стопы.
Показания
Блокада на уровне голеностопного сустава может быть использована для боль-
шинства операций на стопе, включая бурсэктомию и иссечение невриномы. Мо-
жет понадобиться небольшая местная инфильтрационная анестезия надкостницы.
200
Глава 16
Если на голень накладывается жгут (или выбирается меньшее число инъекций),
подходящим и эффективным является подколенный доступ [2,3]. Последний так-
же проще для пациента и анестезиста, несмотря на то, что он связан с временной
утратой некоторых движений стопы. Это ограничение не так выражено, как при
блокаде в области бедра, поскольку мышцы бедра не подвержены распростране-
нию анестетика.
Препараты
Для этих блокад идеальными являются низкие концентрации средне- и длитель-
нодействующих амино-амидных препаратов. Как и при блокаде седалищного
нерва 0.5% раствор бупивакаина или ропивакаина могут обеспечить анестезию
продолжительностью от 12 до 24 часов при голеностопной блокаде [4] и от 15 до
18 часов при подколенной блокаде [5]. Обычно, для манипуляций на стопе не
требуется высоких концентраций анестетика. Клонидин, добавленный в дозе
10 мкг/мл, будет достоверно увеличивать продолжительность обезболивания ли-
докаином [6].
Техника
Блокада в подколенной области является простым и эффективным средством,
особенно полезным для амбулаторной хирургии; она может быть выполнена с
использованием стимуляции нерва или с определением парестезии; из заднего
или бокового доступа. Боковой доступ может занять больше времени, однако оба
доступа дают хорошую анестезию [7].
Подколенная блокада, задний доступ
1. Пациент помещается в положение лицом вниз, подколенная ямка обозначает-
ся линиями, нанесенными над нижними краями двуглавой мышцы бедра и су-
хожилием полусухожильной мышцы. Основание треугольника образует
кожная складка позади коленного сустава. Если мышцы плохо дифференци-
руются, пациент может помочь сгибанием колена на 20-30 градусов.
2. Треугольник разделяется надвое перпендикулярной линией, идущей от его
основания до верхушки. На 6 см вверх по этой линии и на 1 см латеральнее ее
наносится маркер «X» (рис. 16.1).
3. После обработки кожи и инфильтрационной анестезии места вкола иглы че-
рез маркер «X» под углом 45 градусов в краниальном направлении проводит-
ся 3-х дюймовая игла (рис. 16.2). Если получен двигательный ответ или
выявлена парестезия, игла извлекается до кожи и перенаправляется перпен-
дикулярно к линии прохождения нерва. Нерв должен лежать посредине меж-
ду кожей и костью.
4. После получения двигательного ответа или парестезии, игла несколько извле-
кается и вводится 30-40 мл местного анестетика. Если во время инъекции
ощущается боль или чувство защемления, игла извлекается.
5. Для длительного обезболивания также как и для бедренного нерва через иглу
для стимуляции или по методике Seidinger может быть установлен постоян-
ный катетер [8].
Блокады периферических нервов нижней конечности
201
Рис. 16.1
Подколенная блокада.
Два основных ствола седалищного
нерва делятся в подколенной ямке
на 7-10 см выше подколенной кожной
складки. Треугольник рисуется
с использованием головок двуглавой
мышцы бедра и полусухожильной
мышц и кожной складки подколенной
ямки; длинная игла проводится в точке,
расположенной на 1 см латеральнее
и на 6 см выше по линии от кожной
складки и делящей пополам
этот треугольник
Рис. 16.2
Подколенная блокада,
направление иглы.
Игла проводится через точку,
местоположение которой
описано на рис. 16.1
с 45-градусным краниальным
отклонением. Нерв обычно
достигается на полпути
между кожей и бедренной
костью
6. Бедренные ветви могут быть блокированы подкожной инъекцией 5-10 мл
раствора, введенного над медиальной головкой большеберцовой кости сразу
ниже колена. Это действие рекомендуется, если хирургические манипуляции
будут выполняться на медиальной стороне стопы или если на голень будет
наложен жгут. Достаточная анестезия должна наступить через 20 минут по-
сле инъекции.
Подколенная блокада, латеральный доступ
1. При положении больного на спине на латеральной стороне ноги идентифици-
руется углубление между двуглавой мышцей бедра и латеральной широкой
мышцей бедра, метка «X» наносится на уровне верхнего края надколенника.
202
Глава 16
2. После анестезии кожи в этой точке проводится 4-х дюймовая игла (рис. 16.3) с
30 градусным отклонением кзади (рис. 16.4), на стопе определяется двигате-
льный ответ или парестезия [5, 9]. Движение стопы в ответ на стимуляцию
нерва будет свидетельствовать о том, что блокада будет успешной, однако
еще большая частота успеха может быть достигнута при поиске двух отдель-
ных ответов (сгибание или пронация для малоберцового нерва и разгибание
или супинация стопы для большеберцового нерва), после чего производятся
две инъекции [10]. При одном отклике инъецируется 30-40 мл местного анес-
тетика, при раздельных ответах — 10 мл на каждую сторону.
3. Как и при заднем доступе для бедренного нерва требуются отдельные инъек-
ции.
Рис. 16.3 Латеральный доступ Рис. 16.4 Латеральный доступ, поперечный срез s' \ \ /шАИЛ s= \ 1'
Блокады периферических нервов нижней конечности
203
Голеностопная блокада
Голеностопная блокада требует большего числа инъекций и поэтому время ее
выполнения может быть более длительным, однако она может быть проведена
без обнаружения парестезии. Кольцевая анестезия вызывает блокаду всех пяти
ветвей, идущих к стопе (рис. 16.5). Согласно другому способу в дистальном на-
правлении может быть выполнена местная блокада терминальных ветвей.
Рис. 16.5
Голеностопная блокада.
Инъекция проводится отдельно для
каждого из пяти нервов.
Поверхностный малоберцовый нерв,
икроножный нерв и подкожный нерв
обычно блокируются простой
подкожной инфильтрацией, поскольку
в этой области они уже могут отдавать
многочисленные поверхностные ветви,
которые проходят нал голеностопным
суставом. Выявление парестезии
может понадобиться при блокаде
заднего большеберцового нерва
или глубокого малоберцового нерва,
однако обычно костные анатомические
ориентиры помогают достаточно точно
определить место
для глубоких инъекций
1. Блокада заднего большеберцового нерва. Она может быть проведена при положе-
нии пациента на животе или положении на спине. Если пациент находится в по-
ложении на спине, нога сгибается в колене так, чтобы подошвенная поверхность
стопы была параллельна поверхности стола. 1.5-дюймовая игла диаметром
23-25 G вводится на уровне медиального надмыщелка сразу позади места пуль-
сации задней большеберцовой артерии и направляется под углом 45 градусов
кпереди до выявления парестезии на подошвенной поверхности стопы. После
этого, если нерв найден, вводится 5 мл анестетика. Если нерв не обнаружен, в об-
ласть треугольника, образованного большеберцовой костью, артерией и ахилло-
вым сухожилием может быть введено 10 мл раствора.
2. Блокада икроножного нерва. При положении пациента на животе или поло-
жении на спине с согнутыми коленями, в поверхностные ткани позади лате-
ральной лодыжки в направлении углубления между надмышелком и
пяточной костью вводится около 5 мл раствора анестетика.
3. Блокада подкожного нерва. 5 мл раствора анестетика вводится в область под-
кожной вены на уровне медиального надмыщелка между кожей и поверхно-
стью кости.
4. Блокада глубокого малоберцового нерва. Продвигаясь кпереди от голеностоп-
ного сустава, игла вводится глубже под фасцию, сразу латеральнее передней
большеберцовой артерии на уровне кожной складки, после чего инъецируется
5 мл раствора. Если артерия не пальпируется, в качестве анатомического ори-
ентира может быть использовано сухожилие длинного разгибателя пальцев.
204
Глава 16
5. Блокада ветвей поверхностного малоберцового нерва. Из раствора местного
анестетика создается подкожный вал, лежащий книзу от передней большебер-
цовой артерии, вокруг латерального надмышелка (этот вал находится сверху
места предыдущей инъекции в область глубокого малоберцового нерва и, про-
должаясь латерально, соединяется с зоной инфильтрации, созданной в области
икроножного нерва). В общей сложности может потребоваться от 5 до 10 мл,
которые на протяжении 2-3 дюймов охватят все эти поверхностные волокна.
Осложнения
Нейропатия
Нейропатия является наиболее частой проблемой при блокаде периферических
нервов. Следует избегать применения игл с малым углом среза, парестезии во
многих зонах, высоких концентраций анестетика, а также прямой интраневраль-
ной инъекции. При блокаде в области голеностопного сустава необходимо избе-
гать прижимания нервного ствола к кости иглой во время инъекции. При
дистальных инъекциях, проводимых рядом с терминальными сенсорными нерва-
ми пальцев, следует избегать применения эпинефрина.
Литература
1. Vloka, J. D., Hadzic, A., April, Е., Thys, D. М. The division of the sciatic nerve in
the popliteal fossa: Anatomical implications for popliteal nerve blockade. Anesth.
Analg. 92:215,2001.
2. Hansen, E., Eshelman, M. R., Cracchiolo, A., 3rd. Popliteal fossa neural blockade as
the sole anesthetic technique for outpatient foot and ankle surgery. Foot Ankle Int.
21: 38,2000.
3. Singelyn, E. J., Gouvemeur, J. M., Gribomont, B. F. Popliteal sciatic nerve block
aided by a nerve stimulator: A reliable technique for foot and ankle surgery. Reg.
Anesth. 16: 278, 1991.
4. McLeod, D. H., Wong, D. H., Vaghadia, H., Claridge, R. J., Merrick, P. M. Lateral
popliteal sciatic nerve block compared with ankle block for analgesia following foot
surgery. Can. J. Anaesth. 42: 765, 1995.
5. Zetlaoui, P. J., Bouaziz, H. Lateral approuch to the sciatic nerve in the popliteal fos-
sa. Anesth. Analg. 87: 79, 1998.
6. Reinhart, D. J., Wang, W., Stagg, K. S,. Walker, K, J., Bailey, P. L., Walker, E. B.,
Zaugg, S. E. Postoperative analgesia after peripheral nerve block for podiatric sur-
gery: Clinical efficacy and chemical stability of lidocaine alone versus lidocaine
plus clonidine. Anesth. Analg. 83: 760,1996.
7. Hadzic, A., Vloka, J. D. A comparison of the posterior versus lateral approaches to
the block of the sciatic nerve in the popliteal fossa. Anesthesiology 88:1480,1998.
8. Singelyn, E. J., Aye, F., Gouvemeur, J. M. Continouos popliteal sciatic nerve block:
An original technique to provide postoperative analgesia after foot suggery. Anesth.
Analg. 83: 383, 1997.
9. Vloka, J. D., Hadzic, A., Kitain, E., Lesser, J. B., Kuroda, M., April, E. W., Thys,
D. M. Anatomic considerations for sciatic nerve block in the popliteal fossa through
the lateral approach. Reg. Anesth. 21: 414, 1996.
10. Paqueron, X., Bouaziz, H., Macalou, D., Labaille, T., Merle, M., Laxenaire, M. C.,
Benhamou, D. The lateral approach to the sciatic nerve at the popliteal fossa: One or
two injections? Anesth. Analg. 89: 1221, 1999.
Глава 17
Анестезия дыхательных путей
Анестезиологи часто интубируют пациентов, у которых не может быть выполне-
но обычное введение тиобарбитуратной сукцинил-холиновой смеси. Адекватная
регионарная или местная анестезия носовой или глоточной части дыхательных
путей у таких пациентов делает менее болезненным назальное или пероральное
проведение эндотрахеальных трубок или эндоскопов с волоконной оптикой.
Анатомия
Чувствительные волокна к слизистой оболочке полости носа идут от средней
ветви V черепно-мозгового нерва из крылонебного ганглия. Эта основная ветвь
лежит под слизистой оболочкой полости носа кзади от средней носовой ракови-
ны (рис. 17.1). Волокна от этого ганглия также обеспечивают чувствительную
иннервацию верхней части глотки, небного язычка и небных миндалин. Эти во-
локна могут быть блокированы проксимально путем прямой инъекции в область
верхнечелюстной ветви тройничного нерва, однако более легким доступом к ним
является аппликация местного анестетика на слизистую оболочку.
IX пара черепно-мозговых нервов (языкоглоточный нерв) обеспечивает чув-
ствительную иннервацию ротоглотки и окологлоточных областей, а также зад-
ней части языка. Этот нерв может быть блокирован прямой подслизистой инъек-
цией позади небной дужки, однако наиболее легко местная анестезия может быть
получена путем воздействия на его конечные ветви в полости рта и глотки.
Рис. 17.1. Анестезия слизистой оболочки полости носа.
Ватные тампоны, смоченные анестетиком, проводятся вдоль нижней и средней носовых раковин;
трансмембранная диффузия раствора после орошения слизистой анестетиком вызывает анестезию
крылонебного ганглия. Для обеспечения максимальной местной анестезии необходимо
использование широких тампонов и добавление к раствору анестетика сосудосуживающего средства
206
Глава 17
Чувствительная иннервация гортани выше голосовых связок обеспечивается
верхним гортанным нервом, являющимся ветвью блуждающего нерва. Этот нерв
отходит от основного ствола блуждающего нерва в каротидной оболочке и, на-
правляясь кпереди, отдает внутренние ветви, которые проникают через щитоподъ-
язычную мембрану. Позади этой мембраны ветви нерва обеспечивают чувствите-
льную иннервацию голосовых связок, надгортанника и черпаловидного хряща.
Ниже голосовых связок чувствительная иннервация обеспечивается ветвя-
ми возвратного гортанного нерва, который отдает двигательные волокна всем
внутренним мышцам гортани, кроме одной. Чувствительная иннервация трахеи
также обеспечивается возвратным гортанным нервом. Несмотря на то, что воз-
можна прямая блокада этого нерва (она расценивается как побочный эффект при
других местных блокадах на шее), более простым способом является поверхно-
стная анестезия.
Показания
При травме тканей лица или деформации дыхательных путей абсцессом или зло-
качественной опухолью, проведение интубации трахеи наиболее безопасно у па-
циента в сознании или под легким седативном воздействием. Это также
относится к случаям трудной интубации в анамнезе, шейной радикулопатии и
выраженной дыхательной недостаточности. Согласно руководству по манипуля-
циям на верхних дыхательных путях Американского общества анестезиологов,
необходимо знакомство с этими методиками [1,2].
Анестезия слизистой полости носа полезна при проведении назального зон-
да, она особенно удобна, если для снижения возможности кровотечения из сли-
зистой оболочки использован вазоконстриктор. Анестезия полости рта и ротог-
лотки позволяет проводить как ларингоскоп, так и интубационную трубку до
уровня надгортанника, эта анестезия также полезна при проведении трансэзофа-
геальной эхокардиографии, у находящихся в сознании пациентов. Анестезия
гортани и трахеи (блокады ветвей блуждающего нерва) позволяет пациентам пе-
реносить введение трубки или фиброскопа ниже голосовых связок без кашля или
двигательных реакций [3], а также снижает выраженность сердечно-сосудистых
реакций, обычно развивающихся при интубации трахеи. Однако блокада чувст-
вительности гортани может быть противопоказана, если имеется возможность
рвоты или аспирации. Проведение анестезии трахеи также нецелесообразно,
если необходимо сохранить кашлевой рефлекс.
Анестезия дыхательных путей также полезна для облегчения диагностиче-
ской фиброларингоскопии и может помочь возбужденным интубированным па-
циентам в блоке интенсивной терапии легче перенести наличие эндотрахеальной
трубки.
Препараты
Непосредственная блокада верхнего гортанного нерва может быть проведена ин-
фильтрацией таких местных анестетиков, как 1% или 1.5% лидокаин. Другие
зоны иннервации дыхательных путей почти также легко доступны для поверхно-
стной анестезии. Для преодоления обычно медленного проникновения препара-
тов через слизистую оболочку при поверхностной аппликации требуются более
высокие концентрации местных анестетиков. Коммерческие препараты местных
анестетиков, например, 10% ароматизированный лидокаин, выпускаются в виде
Анестезия дыхательных путей
207
пероральных спреев, однако при этом не может быть измерено введенное коли-
чество препарата. Лучшим способом является распыление известного количест-
ва анестетика (например, 10 мл 4% раствора лидокаина) через такой же
пульверизатор, какой используется в оториноларингологии. Для этого же приме-
няются 4% раствор лидокаина и 0.5-1% растворы тетракаина, предназначенные
для транстрахеальных инъекций или поверхностной аппликации. Эти высокие
концентрации заметно повышают риск быстрого достижения максимально реко-
мендуемых доз для этих препаратов. Эта проблема усугубляется распространен-
ной практикой использования неизмеряемых количеств нескольких различных
препаратов при проведении множественных блокад.
При анестезии слизистой оболочки полости носа для снижения числа случа-
ев кровотечения из слизистой требуется добавление сосудосуживающих препа-
ратов. Традиционным препаратом выбора был 4% раствор кокаина, поскольку он
является единственным местным анестетиком, обладающим сосудосуживаю-
щим свойством. Поскольку кокаин обладает высокой токсичностью и может
привести к развитию зависимости, лучшим выбором при топической анестезии
полости носа может быть использование 3% раствора лидокаина с 0.25% раство-
ром фенилэфрина.
Техника
Анестезия дыхательных путей может быть проведена при положении пациента
на спине, однако часто наиболее удобным для пациента является положение
лежа со слегка поднятой головой или положение сидя.
1. В полость носа в обе ноздри осторожно проводятся ватные тампоны на длин-
ном аппликаторе, смоченные 4% раствором кокаина (или смесью лидокаин-
фенилэфрин). Первый аппликатор вводится непосредственно вдоль нижней
раковины по направлению к задней стенке носоглотки (рис. 17.1). Второй ап-
пликатор вводится со слегка более краниальным отклонением, так чтобы
пройти вдоль средней носовой раковины и, затем, продвигается на полную
глубину до соприкосновения со слизистой оболочкой, покрывающей клино-
видную кость. Анестезия проводится с двух сторон, поскольку необходимо
обеспечить анестезию как самих ветвей крылонебного узла, так и поверхност-
ную анестезию самой слизистой оболочки. Для обеспечения проникновения
достаточного количества препарата через слизистую оболочку, время контак-
та со слизистой должно составить обычно от 2 до 3 минут. Аппликаторы со
скрученными ватными тампонами имеются в большинстве операционных и
их введение хорошо переносится пациентом. Тампоны больших размеров, ис-
пользуемые оториноларингологами менее удобны для пациента, однако бо-
лее эффективны для создания достаточной зоны распространения анестетика.
2. После введения назальных аппликаторов выполняется двусторонняя блокада
верхних гортанных нервов. При распрямленной голове пациента идентифи-
цируются щитовидный хрящ и подъязычная кость. Указательный палец сме-
щает кожу вниз над верхним краем пластины щитовидного хряща. Кожа
обрабатывается салфеткой, смоченной спиртом. Игла диаметром 23-25 G с
присоединенным к ней 5 мл шприцем, содержащим 1% раствор лидокаина,
вводится над верхним краем хряща. Затем, указательный палец перестает
смещать кожу, а игла проходит выше хряща через плотную щитоподъязыч-
ную мембрану. Теперь кончик иглы находится в рыхлой соединительной тка-
ни позади мембраны (рис. 17.2). После аспирации для исключения
208
Глава 17
Перстневидный хрящ
Верхний
гортанный
нерв
Большой рог
подъязычной
кости
Щитовидный
хрящ
Перстневидно-
щитовидная связка
Рис. 17.2. Блокада верхнего гортанного нерва.
Игла диаметром 23 или 25 G проводится над верхним краем боковой пластины щитовидного хряща,
затем она осторожно продвигается за хрящ до проникновения через щитоподъязычную мембрану.
После осторожной аспирации для исключения внутрисосудистой инъекции в пространство,
расположенное за мембраной, вводится 2-3 мл раствора местного анестетика
внутрисосудистого положения иглы за мембрану вводится 2.5 мл раствора
анестетика. Те же действия повторяются на противоположной стороне.
Согласно другому способу игла может быть введена по заднему (большому)
рогу подъязычной кости и проведена к мембране.в каудальном от кости на-
правлении.
Если будет проводиться транстрахеальная инъекция (пункт 4), эта игла и
шприц могут быть использованы для заключительной внутрикожной инъек-
ции 0.3 мл местного анестетика над перстне-щитовидной связкой по средней
линии шеи.
3. Слизистая полости рта и глотки обезболиваются поверхностной анестезией.
В общей сложности в распылитель помещается 4 мл 4% раствора лидокаина
или 0.5% раствора тетракаина. После орошения местным анестетиком языка,
пациенту предлагают прополаскать рот остатком раствора. Затем, онемевший
язык охватывается сухим марлевым тампоном и осторожно удерживается ру-
кой. Пациент сообщают о том, что во время распыления местного анестетика
он должен усиленно дышать, чтобы раствор достиг задней стенки глотки.
Анестезия, обеспеченная блокадой верхнего гортанного нерва, должна позво-
лить пациенту вдыхать распыляемый анестетик без позывов к рвоте и будет
приводить к некоторой анестезии трахеи.
4. Инъекция в подслизистую оболочку в основание передней небной дужки вы-
зовет глубокую анестезию и подавление рвотных движений [2]. После повер-
хностной анестезии, специальным шпателем язык смещается медиально,
благодаря чему открывается нижняя кривизна передней небной дужки
(рис. 17.3). Через спинальную иглу диаметром 25 G производится инъекция
2 мл 1% раствора лидокаина на глубину до 0.5 см под слизистую оболочку в
точке, находящейся на 0.5 см латеральнее основания языка. Более длинная
спинальная игла позволяет лучше контролировать ее положение в полости
рта через шприц, остающийся за его пределами. Аспирация производится пе-
ред каждой инъекцией для выявления внутрисосудистого положения иглы
или ее продвижения за задний край небной дужки. Двусторонняя инъекция
необходима для того, чтобы блокировать обе лингвальные ветви языко-гло-
Анестезия дыхательных путей
209
Рис. 17.3. Блокада языко-глоточного нерва (лингвальной ветви).
Язык отодвигается шпателем медиально, спинальная игла проводится в основание передней небной
дужки на 0.5 см латеральнее основания языка и продвигается на 0.5 см вглубь. После аспирации
вводится 2 мл местного анестетика. Для адекватной блокады рвотного рефлекса необходима
двусторонняя инъекция. Аспирацию легче производить трехколенным шприцем, использование 3-х
дюймовой (спинальной) иглы позволяет лучше видеть место инъекции, при этом рука остается вне
полости рта
точного нерва. Риск внутрисосудистой инъекции и значительные неудобства
для пациента делают другой способ анестезии — простую поверхностную
анестезию — лучшим выбором в большинстве случаев.
5. Наконец, путем транстрахеальной инъекции выполняется топическая анесте-
зия трахеи. Внутривенный пластиковый катетер диаметром 22 G с металличе-
ским стилетом проводится через перстневидно- щитовидную связку,
проникая через зону инфильтрационной анестезии кожи (рис. 17.4). Проник-
новение в трахею подтверждается аспирацией воздуха. Металлический сти-
лет удаляется, к пластиковой канюле, остающейся в трахее, присоединяется
шприц с 4 мл 4% раствора лидокаина. Лидокаин вводится во время вдоха па-
циента; впрыскивание будет вызывать кашель, что будет способствовать про-
никновению раствора выше трахеи на уровень голосовых связок.
210
Глава 17
Рис. 17.4. Транстрахеалъная инъекция.
Внутривенный катетер диаметром 20 G проводится через перстневидно- щитовидную связку. После
того, как проникновение в трахею подтверждено аспирацией воздуха, металлический стилет
удаляется, к игле, остающейся на месте, присоединяется шприц. Во время вдоха пациента
инъецируется 4 мл местного анестетика; поток воздуха будет относить раствор вниз по трахее, а
обычный рефлекторный кашель будет перемещать его вверх до уровня голосовых связок
6. Как дополнительное средство для анестезии слизистой оболочки полости
носа, после удаления аппликаторов может быть использовано введение гиб-
ких назальных катетеров, на которые нанесен крем, содержащий лидокаин.
Если в полость носа вводились тампоны достаточно больших размеров, это
будет способствовать расширению носовых ходов, что поможет свободно
провести эндотрахеаольную трубку. При широких дыхательных путях распы-
ление лидокаина этим способом будет обеспечивать его проникновение прак-
тически до голосовых связок.
7. Если назальные воздуховоды не использовались, назальные аппликаторы
удалятся и вводится эндотрахеальная трубка. Временной интервал для других
блокад обычно оказывается достаточным для развития анестезии слизистой
полости носа и рта. Если анестезии трахеи не наступило, анестезиолог должен
быть готов применить быстродействующий внутривенный седативный пре-
парат или анестезию для ослабления сердечно-сосудистых и кашлевых реф-
лексов, которые могут отмечаться при вводе трубки ниже голосовых связок.
Анестезия дыхательных путей
211
Осложнения
Системная токсичность
Системная токсичность является наиболее ожидаемым неблагоприятным явле-
нием, которое наблюдается чаще после абсорбции, чем после внутрисосудистого
введения. Несмотря на то, что не все количество местного анестетика абсорбиру-
ется, имеет значение общее количество использованного препарата, как показано
в табл. 17.1.
Таблица 17.1
Общепринятые дозировки, используемые для анестезии дыхательных путей
Препарат Количество (см3) Концентрация Общее количество в мг % от максимально рекомендованной дозы
Кокаин 3 4% 120 60
Тетракаин 5 1% 50 25
Лидокаин 5 1% 50
4 4% 160 40
Под рукой должно находиться реанимационное оборудование, пациент дол-
жен тщательно наблюдаться как во время блокады, так и в течение 20 минут по-
сле ее выполнения.
Носовое кровотечение
Носовое кровотечение может наблюдаться даже при введении в полость носа со-
судосуживающих средств. Для снижения возможности этого осложнения необ-
ходимо осторожное введение и свободное продвижение назальной трубки, при
этом, наличие деформаций полости носа или коагулопатии будут повышать риск
кровотечения.
Аспирация
Аспирация желудочного содержимого может произойти, если анестезия голосо-
вых связок и трахеи проводится на фоне рефлюкса или рвоты. Если имеется зна-
чительный риск аспирации, эта методика должна использоваться с
осторожностью (или не использоваться вообще).
Литература
1. Practice guideline for managements of the difficult airway. A report by the Ameri-
can Society of Anesthesiologists Task Force on Maangement of the Difficult Air-
way. Anesthesiology 78: 597,1993.
2. Benumof, J. L. Management of the difficult adult airway. With special emphasis on
awake tracheal intubation. Anesthesiology 75: 1087, 1991.
3. Graham, D. R., Hay, J. G., Clague, J., Nisar, M., Earis, J. E. Comparison or three
different methods used to achieve local anesthesia for fiberoptic bronchoscopy.
Chest 102: 704, 1992.
Глава 18
Блокады нервов лица и головы
Хирургические вмешательства на голове редко проводятся только под местной
анестезией, однако легковыполнимые блокады нервов головы используются во
многих диагностических и лечебных процедурах.
Анатомия
Чувствительные волокна к коже задней части головы отходят от верхних шейных
корешков и проходят в затылочной области в виде большого и малого затылоч-
ных нервов (рис. 18.1). Эти нервы могут быть блокированы поверхностно в коже
задней части головы или более центрально на уровне глубокого шейного сплете-
ния (см. главу 19). Кожа передней части головы и в том числе лица иннервирует-
ся ветвями тройничного нерва. Тремя основными ветвями этого
черепно-мозгового нерва являются глазной нерв, верхнечелюстной нерв и ниж-
нечелюстной нерв. От них отходят три основных чувствительных нерва лица:
надглазничный, подглазничный и подбородочный (рис. 18.2). Эти нервы могут
быть блокированы в области отверстий, через которые они выходят в поверхно-
стные ткани или более центрально, сразу после трифуркации и выхода из черепа.
Тройничный нерв отходит от основания варолиева моста и посылает свои
чувствительные волокна к большому тройничному (полулунному) ганглию, ле-
жащему у верхнего края каменистой части височной кости, сразу выше овально-
го отверстия. В прошлом, проводился прямой нейролизис этого узла этанолом
для его тотальной аблации. Риск внутричерепного распространения нейролити-
ческого раствора является значительным. В настоящее время наиболее распро-
страненной практикой является радиочастотное разрушение узла с использова-
нием радиологического контроля.
Рис. 18.1
Блокада затылочного нерва.
Большие и малые ветви
затылочного нерва выходят
из-под мышц на уровне выйной
складки на задней части головы.
Они могут быть легко блокированы
путем создания подкожного вала
раствора анестетика
Блокады нервов лица н головы
213
Рис. 18.2
Тройничный нерв,
сагиттальный вид.
Каждая из трех основных
ветвей тройничного нерва
выходит из черепа через
собственное отверстие
и обеспечивает
чувствительной иннервацией
лицо и нижнюю челюсть
Три ветви, идущие от узла, выходят из полости черепа через отдельное
отверстие. Наиболее верхней ветвью является глазной нерв, входящий в глазни-
цу через верхнюю глазничную щель. Его основная ветвь — лобный нерв — де-
лится на надглазничный и надблоковый нерв. Первый из них проходит по верх-
нему краю глазницы в надглазничной вырезке, в то время как второй нерв
покидает глазницу более медиально (рис. 18.3).
Рис. 18.3
Конечные ветви тройничного нерва.
Каждая из трех конечных ветвей
(надглазничная, подглазничная
и подбородочная) выходят
через соответствующие костные каналы
на одной линии, параллельной
срединной линии и отстоящей от нее
латерально на 2.5 см.
Подглазничный канал слегка отклонен
в краниальном направлении,
в то время как игла, введенная
в подбородочный канал, движется
медиально и слегка в каудальном
направлении
214
Глава 18
Средняя ветвь тройничного нерва — верхнечелюстной нерв - также являет-
ся полностью чувствительным, однако он несколько больше, чем глазной нерв.
Он выходит из полости черепа через круглое отверстие и пересекает крылонеб-
ную ямку и идет к латеральной пластинке клиновидной кости, проходя по дну
глазницы, и входит в подглазничный канал (рис. 18.2). В крылонебной ямке этот
нерв дает крылонебные ветви, идущие в медиальном направлении к глотке (см.
главу 17), а также подглазничную и задние зубные ветви. Передние зубные ветви
отходят от основного ствола еще в канале. Подглазничный нерв выходит через
подглазничное отверстие и сразу же делится на ветви, идущие к векам, носовые
ветви и губные ветви.
Нижнечелюстная ветвь является самой большой ветвью узла и выходит из
полости черепа через овальное отверстие. Он лежит сразу позади латеральной
пластины крыловидного отростка. От тройничного нерва в его состав входят то-
лько двигательные волокна, иннервирующие жевательные мышцы. Эти нервы
образованы передними ветвями, отделяющимися от основного ствола сразу по-
сле его выхода из полости черепа. Задние ветви образуют ушно-височный нерв,
который обеспечивает чувствительную иннервацию околоушной и височной об-
ластей. Основной ствол продолжается в виде нижнего альвеолярного нерва, иду-
щего к нижней челюсти. Его терминальной ветвью является подбородочный
нерв, который выходит через подбородочное отверстие, иннервируя нижнюю
губу и челюсть (рис. 18.2).
Все три основных ствола лежат глубоко и хорошо защищены костями чере-
па, нижней челюстью и скуловой дугой, а их терминальные ветви являются по-
верхностными и могут быть легко идентифицированы в области соответствую-
щих отверстий. Удобно, что все три наружных отверстия находятся на одной
линии (рис. 18.3).
Показания
Хирургические показания для анестезии этих нервов возникают редко. У ослаб-
ленных пациентов наложение фрезевых отверстий может быть проведено при бло-
каде затылочных нервов и местной инфильтрационной анестезии. В целом
анестезию ветвей тройничного нерва используют только с диагностическими це-
лями или для лечения боли. Изредка у пациентов с невралгией тройничного нерва
выполняется блокада его ветвей местным анестетиком или нейролитическим сред-
ством. Непереносимая боль, вызванная злокачественным новообразованием, так-
же может быть уменьшена нейролитической блокадой, однако внедрение в
клиническую практику лучевых методов, химиотерапии, методик радиочастотной
аблации, делают потребность в такой блокаде редкой. Блокада затылочных нервов
может быть использована для облегчения некоторых видов головной боли, однако
такое лечебное воздействие редко является достаточным по длительности.
Препараты
Для блокады лицевых нервов или нервов головы может быть использован любой
анестетик в низкой концентрации. Наиболее подходящими для диагностических
блокад являются 0.25% растворы бупивакаина или ропивакаина, поскольку дли-
тельность их действия может помочь отдифференцировать физиологические со-
ставляющие боли от психологических причин и может помочь в отборе
пациентов, нуждающихся в нейролитических инъекциях.
Блокады нервов лица и головы
215
Наиболее предпочтительным нейролитическим средством для фасциальных
блокад является этанол (см. главу 23), однако это лечение обычно является резер-
вным средством для больных, у которых не может быть проведена радиочастот-
ная аблация.
Техника
Блокада затылочного нерва
Большие и малые затылочные нервы выходят из-под мышц шеи, становясь на
каждой стороне поверхностными на уровне выйной линии, выступающего греб-
ня затылочной кости, проходящей от сосцевидного отростка до наружного заты-
лочного бугра (рис. 18.1).
1. Пациенту предлагают сесть и наклонить голову к грудной клетке.
2. Прощупывается наружный затылочный бугор и на этом уровне наносится
метка «X», сразу латеральнее места прикрепления мышц, распрямляющих
шею (обычно на 2.5 см латеральнее срединной линии).
3. После обработки кожи в месте маркера «X» проводится игла диаметром 23 G
и осторожно продвигается до контакта с костью. После этого она слегка изв-
лекается и под промаркированный участок вводится 3 мл местного анестети-
ка с каждой стороны.
4. Если необходима блокада малого затылочного нерва, игла отклоняется кпере-
ди и латерально вдоль поверхности черепа, после чего в эту область в направ-
лении сосцевидного отростка производится подкожная инъекция. В общей
сложности обычно бывает достаточно 6-8 мл раствора.
5. Следует соблюдать осторожность, чтобы не направить иглу в сторону боль-
шого затылочного отверстия.
6. Если необходима анестезия всей кожи головы, подкожный валик создается по
всей окружности основания черепа, однако с таким отклонением, чтобы с
каждой стороны он располагался над ухом и на этом же уровне распростра-
нялся кпереди.
Лицевая анестезия
Три терминальных чувствительных ветви тройничного нерва могут быть блоки-
рованы в области соответствующих отверстий. При этих трех блокадах пациент
лежит на спине со слегка приподнятой головой.
1. Для блокады надглазничного нерва по верхне-медиальному краю глазницы
пальпацией определяется надглазничная вырезка, которая обычно находится
приблизительно на 2.5 см от срединной линии. Необходимо определение па-
рестезии в области вырезки, если планируется инъекция нейролитического
средства, однако для простой анестезии в эту область может быть введено 2
мл раствора. Для медиальной (надблоковой анестезии) линия поверхностной
инфильтрации от уровня глазничного края должна быть продолжена медиа-
льно до пересечения со срединной линией.
2. Подглазничный нерв выходит из своего отверстия, расположенного сразу под
нижним краем глазницы и на таком же удалении от средней линии, как и над-
глазничная вырезка (приблизительно на 2 см от латерального края носа). Мес-
тоположение отверстия может быть определено пальпацией или осторожными
поисковыми движениями иглой диаметром 23 G. Игла должна быть проведена
216
Глава 18
через кожный валик на 0.5 см ниже предполагаемого уровня наружного отвер-
стия канала, поскольку канал имеет краниальное отклонение от этой точки
(рис. 18.3). После того, как отверстие идентифицировано, около него вводится
2 мл раствора местного анестетика. Если используется нейролитический пре-
парат, необходимо определение парестезии, после чего достаточным является
введение 1 мл этанола.
3. Подбородочный канал нижней челюсти также находится на 2.5 см от средин-
ной линии, обычно на середине расстояния между верхним и нижнем краем
челюсти. Его выходное отверстие обычно может быть пропальпировано, од-
нако оно может быть определено осторожными поисковыми движениями
иглы диаметром 23 G. Канал отклоняется медиально и книзу, поэтому игла не
должна проводиться перпендикулярно коже над его входным отверстием, а
на 0.5 см выше и на 0.5 см латеральнее него (рис. 18.3). Анестезия нерва до-
стигается инъекцией в отверстие 2 мл раствора анестетика. Если использует-
ся нейролитический препарат, необходимо определение парестезии с
меньшим объемом вводимого раствора. У пожилых пациентов возрастные из-
менения нижней челюсти могут привести к тому, что отверстия будут распо-
лагаться более близко к верхнему краю кости.
Блокада верхнечелюстного нерва
При невралгии тройничного нерва или невралгии его средней ветви (проявляю-
щейся как болями в тканях лица, так и в верхних зубах) требуется более проксима-
льная блокада, для чего верхнечелюстной нерв блокируется в крылонебной ямке.
1. Пациент лежит на спине, с головой слегка повернутой в противоположную от
блокады сторону.
2. Идентифицируется и маркируется скуловая дуга. Затем, пациенту предлага-
ют медленно открывать и закрывать рот, при этом, указательным пальцем пы-
таются определить верхний край нижней челюсти. Вырезка нижней челюсти
ощущается при ее движениях вверх и вниз кпереди от височно-нижнечелюст-
ного сустава по средней линии скуловой кости (рис. 18.4). В наиболее глубо-
кой точке над вырезкой наносится маркер «X».
Рис. 18.4
Основные ветви тройничного нерва,
вид сбоку.
Верхнечелюстная и нижнечелюстная ветви
выходят из полости черепа медиальнее
латеральной крыловидной пластины,
которая может служить анатомическим
ориентиром для их идентификации.
Игла, проведенная в направлении пластины,
может оказаться кпереди
от верхнечелюстного нерва и кзади
от нижнечелюстного
Блокады нервов лица и головы
217
3. После асептической обработки в месте маркера «X» проводится инфильтра-
ционная анестезия кожи.
4. Игла длиной 7.5 см проводится через маркер под углом 45 градусов в краниа-
льном направлении и слегка кпереди с прицелом на воображаемое положение
заднего края глазного яблока.
5. После контакта с крыловидной пластиной игла извлекается и перенаправля-
ется несколько кпереди. После того, как игла пройдет кпереди от крыловид-
ной пластины, нерв будет лежать на 1 см глубже (рис. 18.5). Правильная
локализация иглы подтверждается парестезией носа или верхних зубов.
Латеральная
крыловидная пластина
Рис. 18.5. Латеральный доступ к верхнечелюстному нерву.
Игла проводится через кожу сразу над вырезкой верхней челюсти и направляется кпереди и
краниально до контакта с крыловидной пластиной. По мере продвижения иглы кпереди от пластины
верхнечелюстной нерв окажется перед ней до своего повторного входа в кости черепа в
подглазничный канал в основании глазницы
6. Если парестезии не получено, анестезия может быть выполнена путем инъ-
екции 5 мл раствора в ямку на 1 см глубже пластины клиновидной кости.
При нейролитической блокаде парестезия должна быть получена обязатель-
но, после этого вводится 1 мл этанола. Инъекция этанола болезненна, поэто-
му голова пациента во время инъекции должна удерживаться ассистентом
для предотвращения смещения. После локализации нерва достижением па-
рестезии может быть оказано седативное воздействие или выполнено обез-
боливание.
218
Глава 18
Блокада нижнечелюстного нерва
Нижнечелюстной нерв может быть также блокирован при его невралгии, неврал-
гии тройничного нерва, болях, связанных с ростом злокачественной опухоли, од-
нако здесь анестезия может вызвать некоторую слабость жевательных мышц.
1. Положение пациента и анатомические ориентиры такие же, как и для верхне-
челюстного нерва (с пункта 1 по 3 рис. 18.4).
Рис. 18.6. Латеральный доступ к нижнечелюстному нерву.
Игла проводится также как и для блокады верхнечелюстного нерва, однако направляется кзади.
После контакта с крыловидной пластиной она направляется дальше кзади, и, проходя позади
пластины, должна достичь нерва
2. 5-ти сантиметровая игла проводится через кожный валик и направляется ме-
диально и слегка кзади (рис. 18.6). Требуется меньшее краниальное отклоне-
ние. Игла обычно располагается перпендикулярно поверхности кожи.
3. Игла продвигается до контакта с костью. Этой костью является задний край
латеральной крыловидной пластины. Игла перенаправляется для движения
позади пластины и после этого через 0.5-1 см должна достичь нерва.
4. Достижение нерва подтверждается парестезией в области нижней чедюсти
или зубов. Если парестезия не возникает, можно выполнить осторожные по-
исковые движения иглой в краниальном или каудальном направлении. Если
парестезия отсутствует, на 0.5 см глубже заднего края пластины может быть
введено 5-10 мл раствора с небезосновательной надеждой на получения при-
знаков анестезии. Требуется проведение аспирации и введение пробных доз,
поскольку в непосредственной близости находится средняя менингеальная
артерия.
5. Если используется этанол, достаточно 1 мл раствора, однако получение при-
знаков парестезия является обязательным. Эта инъекция также болезненна,
поэтому должны быть предприняты такие же меры предосторожности, как и
при блокаде верхнечелюстного нерва.
Блокады нервов лица в головы
219
Осложнения
Системная токсичность
Поскольку в непосредственной близости от этих нервов находится множество
кровеносных сосудов возможно развитие системной токсичности. Непреднаме-
ренная, выполненная под давлением инъекция в артериальное русло головы, мо-
жет привести к быстрому повышению внутримозгового уровня анестетика и
судорогам. Необходимо проведение частой аспирации, а инъекция должна быть
дробной.
Распространение анестетика
В отдельных случаях наблюдается распространение анестетика, наиболее часто в
область лицевого нерва при инъекции больших объемов раствора во время бло-
кады нижнечелюстного нерва. При проведении блокады верхнечелюстного нер-
ва также возможна ретробульбарная блокада нервов глазницы. Она имеет
небольшие последствия, если только не используется нейролитическое средство,
при введении нейролитического препарата повреждение зрительного нерва мо-
жет привести к слепоте.
Формирование гематомы
В этих обильно васкуляризированных зонах возможно формирование гематомы,
однако это редко имеет долгосрочные последствия. Перед выполнением этих
блокад должны быть устранены легко обратимые нарушения свертывания крови.
Глава 19
Блокады шейного сплетения
Нервные корешки на уровне II, III и IV шейных позвонков дают чувствительные
и двигательные волокна к шее и задней поверхности головы. Непосредственная
анестезия сплетения обычно приводит к двигательной и сенсорной анестезии в
области его ветвей. Анатомические особенности поверхностного сплетения по-
зволяют блокировать только чувствительные волокна.
Анатомия
Отличительная особенность шейных позвонков заключается в том, что они имеют
удлиненные поперечные отростки, в медиальной части которых проходит вертеб-
ральная артерия, а также хорошо выраженные желобки (борозды), в которых лате-
ральнее артерии выходят корешки соответствующих нервов (рис. 19.1). В каждой
борозде имеется передний и задний бугорки, которые часто могут быть легко про-
пальпированы на шее. Передние ветви со II по IV корешок формируют широкое
сплетение, которое обеспечивает двигательную иннервацию для мышц шеи и чув-
ствительную иннервацию затылочной области, шеи ниже нижней челюсти, а так-
же надплечья выше ключицы. Наиболее значительные двигательные волокна идут
от III, IV и V корешков к диафрагмальному нерву.
Яремная Поперечный отросток
вена VI шейного позвонка
Рис. 19.1. Анатомические ориентиры для блокады шейного сплетения.
Поперечные отростки находятся под латеральным краем грудино-ключично-сосцевидной мышцы, в
дистальной части каждого из отростков имеется желобок или борозда, в которой проходит нерв
Блокады шейного сплетения
221
Все волокна выходят (как и в плечевом сплетении) между передней и средней
лестничными мышцами. На этом уровне передняя лестничная мышца является тон-
кой, однако она уже служит анатомическим ориентиром для шейного сплетения, как
на более низком уровне для плечевого. Шейные двигательные ветви огибают лате-
ральный край передней лестничной мышцы и идут в каудальном и медиальном на-
правлении к мышцам шеи, проходя позади грудино-ключично-сосцевидной мышцы
и отдавая к ней передние ветви. Чувствительные волокна также выходят позади ле-
стничных мышц, однако они идут латерально и становятся поверхностными, выходя
из-под заднего края грудино-ключично-сосцевидной мышцы, отдавая ветви как к
передней, так и к задней поверхности шеи.
Показания
Поверхностная анестезия плечевого сплетения обеспечивает сенсорную анесте-
зию кожи шеи и надплечья выше ключицы, что может быть использовано для по-
лучения поверхностной анестезии при проведении тиреоидэктомии или
трахеостомии. Если необходима релаксация мышц, должна быть выполнена глу-
бокая блокада шейного сплетения. Даже при глубокой анестезии сплетения в от-
дельных случаях хирургу может понадобиться дополнительная блокада, в
особенности, в области верхнего полюса доли щитовидной железы, которая име-
ет частичную сенсорную иннервацию от черепно-мозговых нервов. Блокада
обеспечивает хорошее послеоперационное обезболивание [1]. Эта блокада дела-
ет возможным также проведение хирургических манипуляций в каротидной
зоне, тем не менее, может потребоваться некоторая местная инфильтрационная
анестезия языкоглоточных ветвей, окружающих каротидный синус. Изолирован-
ная поверхностная блокада сплетения также представляется достаточной для
проведения хирургических манипуляций в этой области [2].
Анестезия области надплечья может быть получена при глубокой анестезии
шейного сплетения, однако обычно она обеспечивается межлестничным досту-
пом к плечевому сплетению, при котором в блокаду неизбежно включаются и
нижние ветви от шейного сплетения. Этот доступ может быть даже более пред-
почтительным при хирургических манипуляциях на надплечье в случаях, когда
необходима двигательная блокада руки. Блокада шейного сплетения может до-
полнять торакальную эпидуральную анестезию при вмешательствах на молоч-
ной железе.
Препараты
Для хирургических манипуляций может быть использован любой средне- или
длительнодействующий амино-амидный препарат. Низкие концентрации подхо-
дят для поверхностной (сенсорной) блокады, более высокие концентрации, такие
как 1.5% раствор лидокаина или 0.5% раствор бупивакаина (или ропивакаина)
обеспечивают лучшую двигательную анестезию при глубокой блокаде сплете-
ния. Все препараты демонстрируют более короткую длительность действия на
шее по сравнению с другими областями периферических нервов в связи с тем,
что в области шеи имеется более интенсивный кровоток.
Техника
Как для глубокой, так и для поверхностной блокады пациент помещается на спи-
ну с небольшим валиком под затылком и головой, повернутой в противополож-
ную от блокады сторону.
Ill
Глава 19
Глубокая анестезия шейного сплетения
1. Идентифицируются и маркируются сосцевидный отросток и поперечный от-
росток VI шейного позвонка. Последний является наиболее выступающим
бугорком на шее и находится на уровне перстневидного хряща.
2. Линия, проведенная между двумя этими точками, соответствует плоскости
поперечных отростков шейных позвонков (рис. 19.2). Также маркируется ла-
теральный край грудино-ключично-сосцевидной мышцы.
Рис. 19.2. Поверхностные анатомические ориентиры для блокады шейного сплетения.
Проводится линия от сосцевидного отростка к бугорку VI шейного позвонка. Поперечные отростки
11,111 и IV шейных позвонков находятся на 0.5 см позади этой линии с интервалом 1.5 см ниже
сосцевидного отростка
3. Начиная от точки на 1.5 см ниже сосцевидного отростка осторожной пальпа-
цией идентифицируется бугорок II шейного позвонка, находящийся сразу по-
зади (на 0.5 см) проведенной линии. Над отростком наносится маркер «X».
4. Также каждый раз смещаясь на 1.5 см каудальнее идентифицируются и мар-
кируются отростки Ш и IV позвонков. Третий маркер должен находиться
приблизительно на уровне пересечения наружной яремной вены и груди-
но-ключично-сосцевидной мышцы.
5. После асептической обработки кожи под каждым маркером выполняется под-
кожная инфильтрационная анестезия.
6. В каждой из точек «X» перпендикулярно к коже вводится 3.5-сантиметровая
игла диаметром 22 G, которая направляется прямо кзади и слегка в каудаль-
ном направлении до контакта с поперечным отростком. Палец свободной
руки помогает определению ее места положения пальпацией.
7. Положение на поперечном отростке подтверждается краниальным и каудаль-
ным перемещением иглы; при этом она должна соскальзывать с отростка, а не
непрерывно контактировать с костью, как это было бы при достижении тела
позвонка (рис. 19.1). Последняя ситуация нежелательна, поскольку игла не
находится рядом с нервом и при этом увеличивается вероятность внутрисосу-
дистой или субарахноидальной инъекции.
8. При прочном удержании иглы в положении сразу над поперечным отростком,
к ней присоединяется шприц. Затем, небольшими порциями и при наблюде-
нии за психическим статусом больного вводится 3-5 мл раствора анестетика с
частой аспирацией.
9. Действие анестезии должно начаться через 5 минут.
Блокады шейного сплетения
223
Согласно другим способам используются различные варианты межлестнич-
ного доступа со стимуляцией нерва. Игла для стимуляции вводится в углубление
между мышцами на уровне С-4-С-5 (по верхнему краю щитовидного хряща).
Стимуляция мышцы, поднимающей лопатку, вызовет ее перемещение вверх и
ротацию кнутри, болюсная инъекция 40 мл местного анестетика приведет к бло-
каде сплетения [3].
Поверхностная анестезия шейного сплетения
Поверхностная анестезия шейного сплетения проводится в том же положении
пациента, что и глубокая анестезия сплетения.
1. Маркер «X» наносится на уровне поперечного отростка IV шейного позвонка
как описано выше или просто на место пересечения яремной вены с задним
краем грудино-ключично-сосцевидной мышцы.
2. После обработки кожи под маркером «X» создается подкожный валик из
местного анестетика.
3. Игла длиной 5 см вводится через валик, выполняется инфильтрационная анес-
тезия по заднему краю грудино-ключично-сосцевидной мышцы на 4 см выше и
ниже уровня маркера «X» (рис. 19.3). Для блокады всех поверхностных чувст-
вительных волокон может потребоваться 10 мл раствора анестетика.
Осложнения
Токсическое влияние на центральную нервную систему
Токсическое влияние на центральную нервную систему является наиболее серьез-
ным последствием глубокой блокады шейного сплетения, это осложнение связано
Шейное
сплетение
Рис. 19.3. Поверхностная блокада шейного сплетения.
Все чувствительные волокна сплетения выходят из-под бокового края грудино-ключично-сосцевидной
мышцы. Игла проводится в середине этой линии, обычно на месте пересечения наружной яремной вены
с мышцей, блокада всех терминальных ветвей может быть выполнена при инфильтрации в верхнем и
нижнем направлении
224
Глава 19
с близостью к месту инъекции позвоночной артерии. Требуется многократная
осторожная аспирация, а таежй введение препарата небольшими порциями
(1.0-1.5 мл) с тщательным наблюдением за психическим статусом пациента.
Спинномозговая анестезия
Может наступить спинномозговая анестезия, поскольку шейные корешки заклю-
чены в длинные отростки спинномозговой оболочки, проходящие через межпоз-
воночные отверстия. Игла может легко проникнуть в них, если в борозде
поперечного отростка она отклонилась в краниальном направлении. Поддержа-
ние каудального направления помогает избегать излишне медиального продви-
жения иглы. Избежать этого осложнения также могут помочь острожная
аспирация и дробное введение раствора.
Блокада диафрагмального нерва
Блокада диафрагмального нерва является неизбежной, поэтому глубокая блока-
да шейного сплетения должна использоваться с осторожностью у пациентов, ле-
гочная вентиляция которых зависит от диафрагмального дыхания. К счастью, у
большинства пациентов адекватная вентиляция обеспечивается межреберными
мышцами и во многих случаях блокада диафрагмального нерва остается просто
незамеченной. Очевидно, что двусторонняя блокада повышает возможность
того, что это осложнение может стать клинически значимым.
Блокада возвратного гортанного блуждающего нерва
Также может произойти блокада возвратного гортанного блуждающего нерва,
однако это причиняющее беспокойство осложнение не является серьезным.
Единственной проблемой при этом является невозможность оценки функции
гортани при тиреоидэктомии.
Формирование гематомы
Если произведена пункция крупного сосуда, в тканях шеи может сформировать-
ся гематома. Это осложнение может помешать только при таких хирургических
вмешательствах, как каротидная интимэктомия.
Литература
1. Dieudonne, N., Gomola, A., Bonnichon, Р., Ozier, Y. М. Prevention of postoperati-
ve pain after thyroid surgery: A double-blind randomized study of bilateral superfi-
cial cervical plexus blocks. Anesth. Analg. 92: 1538, 2001.
2. Pandit, J. J., Bree, S., Dillon, P., Elcock, D., McLaren, I. D., Crider, B. A compari-
son of superficial versus combined (superficial and deep) cervical plexus block for
carotid endarterectomy: A prospective, randomized study. Anesth. Analg. 91: 781,
2000.
3. Merle, J. C., Mazoit, J. X., Desgranges, P., Abhay, K., Rezaiguia, S., Dhonneur, G.,
Duvaldestin, P. A comparison of two techniques for cervical plexus blockade: Eva-
luation of efficacy and systemic toxicity. Anesth. Analg. 89: 1336,1999.
Глава 20
Анестезия в офтальмологии
Хирургические вмешательства в офтальмологии обычно проводятся под мест-
ной анестезией, а при удалении катаракты достаточной является поверхностная
анестезия. В офтальмологии пациенты часто являются пожилыми, у них чаще
встречаются системные заболевания, поэтому у них желательно проведение
местной блокады без сильных седативных воздействий и обшей анестезии.
Анатомия
Чувствительность глаз обеспечивается афферентными волокнами, идущими от ро-
говицы и конъюнктивы, эти волокна проходят через ресничный узел в ретробуль-
барном пространстве к первой ветви (глазная часть) V черепно-мозгового нерва.
Двигательная иннервация экстраокулярных мышц глаза, за исключением латераль-
ной прямой (иннервируется VI парой [отводящий нерв]) и верхней косой (иннерви-
руется IV парой [блоковый нерв]) обеспечивается двигательными волокнами III
пары черепно-мозговых нервов (глазодвигательный нерв). Двигательные волокна
глазодвигательного и блокового нервов проходят в ретробульбарном пространстве
через конус, образованный мышцами. Блоковый нерв лежит вне мышечного конуса
на верхне-медиальной стенке глазницы. Двигательные волокна VII черепно-мозго-
вого нерва (лицевого) контролируют сокращение круговых мышц глаза. Эти волок-
на выходят из основания черепа рядом с сосцевидным отростком и проходят
кпереди от козелка уха, отдавая ветви к мышцам, окружающим глазницу.
Показания
Анестезиолог может обеспечить местную анестезию для офтальмологических
вмешательств путем комбинации местной инфильтрации области лицевого нер-
ва и блокады двигательных и чувствительных ветвей к задней части глазницы пу-
тем пери- или ретробульбарной блокады. Блокада лицевого нерва будет
вызывать как чувствительную анестезию окологлазничной области, так и двига-
тельную блокаду век. Бульбарная блокада создает акинезию, необходимую для
удаления катаракты, энуклеации и других поверхностных офтальмологических
процедур, также как и сенсорная анестезия терминальных ветвей тройничного
нерва в ресничном ганглии.
Препараты
Для блокады VII черепно-мозгового нерва достаточной является 1% концентра-
ция лидокаина и мепивакаина. Для ретро- или перибульбарной блокады с целью
обеспечения хорошего двигательного блока используются более высокие кон-
8—1685
226
Глава 20
центрации. Для непродолжительных процедур подходящим является 2% раствор
лидокаина, однако 0.75% раствор бупивакаина или ропивакаина (чистый или
смешанный с 2% раствором лидокаина) обеспечивают хорошую акинезию и бо-
лее длительное обезболивание. Потенциальное преимущество глубокой двигате-
льной блокады должно быть взвешено против риска внутрисосудистой инъекции
в этой области. Для содействия распространению анестетика через мышечный
конус при ретробульбарной инъекции к его раствору добавляется гиалуронидаза
(7.5 единиц на миллилитр). Может быть добавлен эпинефрин в разведении
1:200000, однако при использовании бупивакаина это не дает каких-либо преи-
муществ. Выравнивание pH раствора бикарбонатом натрия приводит к ускоре-
нию начала действия бупивакаина и уменьшает необходимость дополнительных
блокад при перибульбарной методике.
Техника
При бульбарных блокадах полезным является внутривенное седативное воздей-
ствие, обеспечивающее анальгезию, амнезию, и, в то же время, взаимодействие с
пациентом, которое является важным фактором снижения риска повреждения
глазного яблока. Могут использоваться многие препараты, однако для этой кате-
гории пациентов идеальны седативные средства с наиболее коротким действием
(например, болюсные инъекции небольшого количества пропофола). В связи с
высокой частотой сопутствующих заболеваний и пожилым возрастом пациентов
при использовании седативного воздействия необходимо обеспечить тщатель-
ное наблюдение и поддерживающую оксигенацию. После выполнения блокады в
этой группе пациентов обычно не требуется дальнейшего седативного воздейст-
вия во время самого вмешательства.
Блокада лицевого нерва
Лицевой нерв может быть блокирован в любой точке от его конечных ветвей ря-
дом с глазом до места его выхода из полости черепа.
1. При простом доступе к терминальным ветвям 1.5-дюймовая игла вводится че-
рез кожный валик на 2 см латеральнее края глазницы. Игла продвигается вна-
чале вверх, по направлению к верхнему краю глазницы, куда по мере
извлечения иглы вводится 3- 4 мл анестетика. Затем, игла перенаправляется к
нижнему краю глазницы, а инъекция повторяется (рис. 20.1). Чувствительная
блокада век достигается подкожной инъекцией 1% раствора лидокаина или
мепивакаина через этот же доступ.
2. Классический доступ van Lint выполняется несколько более медиально в точ-
ке, расположенной на 2 см позади латерального угла глазной щели (рис. 20.2).
По мере извлечения иглы вводится 3 мл местного анестетика. Игла не извле-
кается из кожи и перенаправляется кверху и книзу с таким же объемом инъек-
ции (по 3 мл), производимой при извлечении. В результате двух инъекций
должен образоваться V-образный подкожный валик. Дополнительно могут
быть введены 2 мл в области верхушки «V» для обеспечения анестезии более
глубоких волокон.
3. При другом доступе, описанном Atkinson, игла вводится над скуловой дугой
на уровне латерального края глазницы и продвигается подкожно вверх в на-
правлении верхнего края глаза. При извлечении иглы инъецируется 3-4 мл
местного анестетика.
Анестезия в офтальмологии
227
Рис. 20.1. Модифицированный доступ Atkinson для блокады лицевого нерва.
Игла вкалывается на 2 см сбоку от латерального края глазницы, что обычно на 2—3 см латеральнее,
чем при доступе van Lint Вначале проводится инфильтрация 2-3 мл, вводимых по мере извлечения
иглы от места ее первого контакта с костью (А). Затем от этой точки местный анестетик вводится
кверху (Б) и книзу (В) для распространения к волокнам лицевого нерва, окружающим глаз. При этом
доступе возможность развития периорбитальных кровоподтеков ниже, чем при классическом
доступе van Lint При этом, по сравнению с более проксимальным (O’Brien или Nadbath-Rehmann)
доступом уменьшается возможность тотального паралича лицевого нерва
Рис. 20.2
Классический доступ van Lint при блокаде лицевого нерва.
Игла вводится на 2 см сбоку от латерального угла глаза,
после чего выполняется подкожная инъекция в
направлении верхнего и нижнего краев глазницы
(по материалам и с разрешения: Hersh P.S. Ophthalmic
Surgical Procedures. Boston and Company, 1998. P. 17)
228
Глава 20
4. Более проксимальная блокада лицевого нерва (рядом с ухом), описанная
O’Brien также вызывает парез круговой мышцы глаза, при этом меньше веро-
ятность периорбитальных экхимозов, неблагоприятно воспринимаемых па-
циентом и его близкими. Игла вводится на 1 см кпереди от козелка уха, после
чего, подкожно инъецируется 2 мл местного анестетика.
5. Блокада Nadbath-Rehmann выполняется введением 5/8-дюймовой иглы кпе-
реди от сосцевидного отростка на основании черепа и ее направлением выше
и кзади в сторону шило-сосцевидного отверстия (как бы в направлении верх-
него края противоположного уха) (Рис. 20.3). После осторожной аспирации
(близость сонной артерии) игла фиксируется и через нее вводится 3 мл рас-
твора местного анестетика.
Рис. 20.3
Блокада лицевого нерва
по Nadbath-Rehmann
Обе последние описанные блокады вызывают ненужную чувствительную и
двигательную блокаду нижней части лица. Наступающее в результате этого рас-
слабление мягких тканей лица может вызвать недовольство пациента или родст-
венников, однако это предпочтительнее по сравнению с риском кровоизлияний
(позади глаза), наблюдающихся при более дистальных методиках. Выбор места
инъекции должен основываться на компромиссе между этими побочными эф-
фектами. Другим способом предотвращения инъекции в область лицевого нерва
является введение больших объемов анестетика при перибульбарной методике.
Ретробульбарная блокада
1. Подготовительным этапом обычно является поверхностное нанесение мест-
ного анестетика на конъюнктиву. Подходящим для этого служит 1% раствор
тетракаина или другие офтальмологические препараты.
2. Нижняя точка края глазницы находится приблизительно на расстоянии одной
трети от латерального до медиального угла глаза (рис. 20.4). Эта точка обыч-
но находится под латеральным краем расширенного зрачка. Глазное яблоко
удерживается в среднем положении при взгляде вперед; отклонение вверх и
медиально может привести к повороту зрительного нерва и сосудов в сторону
предполагаемой траектории движения иглы [1].
3. 1.5 дюймовая игла диаметром 23 G с притупленным кончиком проводится
перпендикулярно к коже и направляется кзади параллельно нижней стенке
глазницы. Кончик иглы обычно располагается напротив линии экватора глаз-
ного яблока, сразу под кожей.
Анестезия в офтальмологии
229
Рис. 20.4. Ретробульбарная блокада.
А: Игла вводится перпендикулярно коже на уровне латерального края расширенного зрачка сразу
над нижним краем глазницы. Б: После проникновения через кожу игла отклоняется приблизительно
на 45 градусов в краниальном направлении и продвигается вглубь, при этом глазное яблоко
поворачивается вниз так, чтобы кончик иглы вошел в мышечный конус. В: После того, как кончик
иглы проникнет сквозь мышечный конус, глазное яблоко резко повернется обратно в нейтральную
позицию. После этого, в ретробульбарную область вводится 3 мл местного анестетика
4. После того, как игла окажется позади линии экватора глазного яблока, она от-
клоняется в верхне-назальном направлении под углом приблизительно в
45 градусов для проникновения через мышечный конус (рис. 20.5). Ввод иглы
в тело мышцы вызовет поворот глазного яблока книзу, с вращением глаза на
15-30 градусов вниз. После прохождения иглы через мышечный слой в конус
происходит резкое выравнивание глазного яблока обратно в нейтральную по-
зицию. Если этого обратного поворота не происходит, игла извлекается и пе-
ренаправляется.
Рис. 20.5
Направление иглы при
ретробульбарной инъекции.
Три положения иглы (А, Б, В)
соответствуют этапам,
показанным на рисунке 20.4
230
Глава 20
5. После осторожной аспирации медленно вводится 3-4 мл анестетика. Если
игла находится в конусе, сопротивления инъекции не должно ощущаться. Со-
противление может указывать на нежелательное внутримышечное положе-
ние иглы, при наличии этого ощущения положение иглы должно быть
изменено.
Если пациент жалуется на боль во время инъекции, должна подозреваться
перфорация склеры. Многие блокады проводятся при седативном воздейст-
вии, поэтому, этот признак может не проявляться. Другим признаком являет-
ся непрерывное движение глазного яблока, после того как игла проникла
через мышечный слой. Для ретробульбарной блокады применяются специа-
льные иглы с притупленным кончиком, предназначенные для снижения рис-
ка перфорации глазного яблока, однако лучшей защитой от этого осложнения
является предотвращение отклонения иглы при ее продвижении. Наиболь-
ший риск возникает при миопическом увеличении глазного яблока. В таких
случаях увеличивается длинная ось глазного яблока, поэтому, если этот пока-
затель превышает 25 мм, отклонение иглы должно производиться на большей
глубине.
6. Для улучшения условий распространения раствора на глазное яблоко в тече-
ние 5 минут должно оказываться осторожное давление, которое необходимо
прекращать каждые 30 секунд для предотвращения нарушения кровотока.
7. Небольшое увеличение объема анестетика вызывает более надежную блока-
ду блокового нерва (осуществляющего двигательную иннервацию верхней
косой мышцы), который находится вне мышечного конуса, содержащего дру-
гие двигательные нервы и цилиарный ганглий. Отсутствие воздействия на эту
мышцу обычно не создает проблем, поскольку ее движение ограничено. Если
после классической ретробульбарной блокады смещение глазного яблока вы-
зывает беспокойство, блоковый нерв может быть блокирован дополнитель-
ной инъекцией 1 мл анестетика, выполненной выше глазницы в область
верхней косой мышцы.
Перибульбарная блокада
В связи с возможностью ретробульбарного кровоизлияния и перфорации глазно-
го яблока при классическом ретробульбарном доступе ниже приводится описа-
ние техники перибульбарной инъекции. Анатомические исследования
подтвердили, что мышечный конус не является закрытым пространством с плот-
ной оболочкой, поэтому действие на цилиарный ганглий может быть оказано без
проникновения через мышцы этого конуса [2]. При перибульбарной блокаде
игла не проникает через мышечный конус, что теоретически уменьшает возмож-
ность осложнений. Снижение риска осложнений достигается за счет более мед-
ленного начала анестезии и необходимости в повторных инъекциях у 25-35%
пациентов (1, 3,4) по сравнению с 10% при ретробульбарных инъекциях.
1. Поверхностная анестезия выполняется так же, как и при ретробульбарной
блокаде.
2. 1.5 дюймовая игла диаметром 25 G проводится через конъюнктиву из точки в
нижней височной области выше нижнего края глазницы (рис. 20.6). Игла про-
двигается с небольшим отклонением кверху (параллельно поднимающейся
на этом уровне нижней стенки глазницы) без попытки проникновения в мы-
шечный конус, инъецируется 4-5 мл местного анестетика.
3. Игла повторно вводится в верхне-назальной области сразу ниже и медиальнее
верхне-блоковой вырезки, после чего дополнительно инъецируется 4-5 мл
Анестезия в офтальмологии
231
Рис. 20.6
Места вколов иглы
при ретробульбарной блокаде
раствора. Как и при первой инъекции, игла проводится по существу по касате-
льной к глазному яблоку без какой-либо попытки проникновения в мышеч-
ный конус. При обеих инъекциях игла вводится в полость глазницы только на
1 дюйм. Это в целом достаточно для достижения области, расположенной по-
зади линии экватора глазного яблока, однако благодаря тангенциальной тра-
ектории движения иглы ее проникновение в мышечный конус маловероятно.
4. Анестезия наступает более медленно, для решения о необходимости допол-
нительной инъекции следует выждать! 0 минут. Снижения зрения при этом
доступе обычно не наблюдается, однако, при диффузии анестетика в подкож-
ных тканях верхнего века часто наступает блокада седьмого нерва и второй
инъекции не требуется.
Осложнения
Образование ретробульбарной гематомы
Наиболее частым осложнением ретробульбарной блокады является кровоизлия-
ние, которое согласно данным некоторых отчетов наблюдается в 1% случаев, од-
нако при большем числе наблюдений это осложнение отмечается с меньшей
частотой [4]. Легко обратимые дефекты свертывающей системы крови должны
быть устранены еще до выполнения ретробульбарной инъекции. Ретробульбар-
ное кровоизлияние во время офтальмологической анестезии является серьезным
осложнением, которое при чрезмерно высоком давлении может привести к нару-
шению кровотока сетчатки. Признаки этого осложнения включают в себя быст-
роразвивающееся выпячивание глазного яблока, повышение внутриглазного
давления и появление субконъюктивальной гематомы. Должно быть обеспечено
наблюдение за пульсацией сетчатки, а операция отложена; для дренирования и
снятия давления может понадобиться латеральная кантотомия.
Анестезия ствола мозга
Распространение анестетика в область ствола мозга наблюдается редко (менее
чем в 0,5% случаев), однако это является осложнением, угрожающим жизни, по-
скольку при этом может наступить остановка дыхания. Механизм этого явления
не ясен, возможно, оно связано с распространением анестетика по зрительному
232
Глава 20
нерву к центральным отделам ствола мозга. Первыми признаками этого ослож-
нения могут быть поверхностное дыхание и дисфагия. Искусственная вентиля-
ция легких и поддерживающее лечение до разрешения симптомов обычно
оказываются достаточными.
Общая токсичность
При попадании анестетика в сетчаточную артерию возможно развитие системной
токсичности. Непреднамеренная, выполненная под давлением инъекция в артери-
альный кровоток головы может быстро привести к высокой концентрации местно-
го анестетика в сосудах мозга и развитию судорог. Перед инъекцией необходимо
выполнение острожной аспирации, а сама инъекция должна быть дробной.
Окуло-кардиальный рефлекс
Любое растяжение экстраокулярных мышц может вызвать рефлекторную бради-
кардию, на которую сразу же необходимо оказать лечебное воздействие атропи-
новой блокадой вагусного влияния.
Перфорация глазного яблока
Даже при использовании игл с притупленным кончиком и даже при перибуль-
барной блокаде может произойти перфорация глазного яблока, тем не менее, это
осложнение встречается менее чем в 0.1% случаев. К факторам риска относятся
наличие удлиненного глазного яблока, многократные инъекции, наличие вдавле-
ния склеры, а также использование игл с длинным срезом [1]. Это осложнение
может быть распознано при смещении глазного яблока при перемещении иглы
до инъекции. Перфорация также обычно вызывает боль и беспокойство. Должна
быть проведена консультация у офтальмолога, хирургическое вмешательство от-
' менено.
Внутримышечная инъекция
Введение местного анестетика непосредственно в мышечную ткань может при-
вести к ее деструкции и в последующем к развитию пареза [4]. К счастью, это
осложнение наблюдается редко и может быть предотвращено прекращением
инъекции при ощущении сопротивления.
Литература
1. Wong, D. Н., Regional anaesthesia for intraocular surgery. Can. J. Anaesth.
40: 635,1993.
2. Ripart, J., Lefrant, J. Y., de La Coussaye, J. E., Prat-Pradal, D., Vivien, B., Eled-
jam, J. J. Peribulbar versus retrobulbar anesthesia fro ophtalmic surgery: An anatomi-
cal comparison of extraconal and intraconal injections. Anesthesiology 94: 56,2001.
3. Ali-Melkilla, T. M., Virkkila, M., Jyrkkio, H. Regional anesthesia for cataract sur-
gery: Comparison of retrobulbar and peribulbar techniques. Reg. Anesth. 17: 219,
1992.
4. Hamilton, R. C., Gimbel, H. V., Strunin, L. Regional anesthesia for 12,000 cataract
extraction and intraocular lens implantation procedures. Can. J. Anaesth. 35: 615,
1988.
Глава 21
Местная анестезия в педиатрии
Линда Джо Райс
Несмотря на то, что местные методики в педиатрической практике имеют такие
же преимущества, как и у взрослых, методы, используемые для проведения мест-
ной анестезии, имеют свои отличительные особенности. Различия касаются ана-
томических особенностей и доз препаратов, а также взаимодействия с
пациентом. Для доступа к месту блокады у детей, особенно маленьких, требуется
общая анестезия, или глубокое седативное воздействие. Это внимание к психо-
логическому состоянию ребенка должно распространяться на весь период опера-
тивного вмешательства; дети плохо переносят пребывание в операционной и с
трудом сохраняют неподвижность, даже при адекватной с точки зрения хирурги-
ческого вмешательства блокаде [1]. Поскольку это требует применения глубоко-
го седативного воздействия или общей анестезии до выполнения блокады,
обычно необходимо два человека: один выполняет блокаду, другой наблюдает за
ребенком. Все методики, местные или общие, связаны с риском и этот риск дол-
жен быть взвешен в отношении возможной пользы анестезии у ребенка, также
как и у взрослых. К счастью, наиболее часто применяемые методы местной анес-
тезии, требуемой для общих хирургических процедур, у детей могут быть выпол-
нены относительно просто. В этой главе в первую очередь обращается внимание
на особенности местной анестезии у детей, отличающиеся от описанной в пред-
шествующих главах техники у взрослых. Существует множество прекрасных об-
зоров, посвященных применению местной анестезии в педиатрии, которые
освещают эти методики более детально [2-5].
Поверхностные блокады
Через интактную кожу хорошо проникает несколько местных анестетиков [6].
Эвтектическая смесь местных анестетиков (EJV1LA) представляет собой комби-
нацию из 5% лидокаина и 5% прилокаина, которая после наложения окклюзион-
ной повязки на 60-90 минут вызывает анестезию кожи глубиной на 5 мм.
Устройство Numby Stuff позволяет проводить ионофорез 2% лидокаина и эпи-
нефрина, в результате чего через 20 минут после применения достигается схожая
анестезия интактной кожи. В этом устройстве для ионофореза используется сла-
бый электрический ток, что иногда вызывает у маленьких детей неприятные
ощущения. Как EMLA, так и устройство Numby Stuff могут облегчить установку
внутривенного катетера, болезненный доступ к имплантированному внутривен-
ному катетеру или другие поверхностные процедуры. Все препараты поверхно-
стных местных анестетиков имеют ограничения, связанные с тем, что они
должны наноситься точно на ту область, которая должна быть анестезирована, а
перед началом их действия должно пройти различное время. Если анестезиолог
не попал в вену и выбирает новое место для инъекции, кожа в этом месте не будет
онемевшей.
234
Глава 21
Поверхностное нанесение местных анестетиков также успешно используется
для анестезии поверхностных слизистых оболочек. Слизистая оболочка полости
рта может быть анестезирована для более легкого прохождения этой части дыхате-
льного тракта или для ларингоскопии у младенцев и детей при потенциальных
трудностях интубации трахеи. Поверхностное эндотрахеальное применение лидо-
каина (от 1 до 2 мг/кг) часто используется перед общей анестезией у младенцев в
тех случаях, когда требуется проведение прямой диагностической ларингоскопии
для того, чтобы оториноларинголог мог увидеть движение голосовых связок.
Поверхностное применение 0.5% лидокаина или 0.25-0.5% бупивакаина ис-
пользуется во время проведения обрезания для обеспечения эффективного по-
слеоперационного обезболивания [7]. При обрезании у младенцев для анестезии
также используется EMLA, поскольку эта смесь может проникать через интакт-
ную крайнюю плоть. Нанесение других местных анестетиков может быть выпол-
нено после ампутации крайней плоти для того, чтобы оказать воздействие на сли-
зистую оболочку, через которую эти местные анестетики будут абсорбироваться.
Поскольку эта методика является поверхностной, количество нанесенного анес-
тетика не должно превышать достаточного для воздействия на все намеченные
области. Если используются мазь или желе, родителей необходимо успокоить в
отношении внешнего вида раневой поверхности, поскольку вид подсохшего
местного анестетика смешанного с кровью может их встревожить. Повторное на-
несение местного анестетика каждые 6 часов в течение 2 дней может обеспечить
эффективную послеоперационную анальгезию (8).
Поверхностная анестезия может быть использована для обеспечения эффек-
тивного послеоперационного обезболивания у детей, перенесших грыжесечение,
или хирургическое лечение гидроцеле. В этих случаях, достаточным является за-
полнение раны 0.25%-0.5% бипувикаином или 0.2%-0.5% ропивакаином, вы-
полненное в конце хирургического вмешательства, непосредственно перед за-
крытием раневой поверхности, воздействие на подвздошно-паховый нерв и
близлежащую мышечную ткань достигается в течение 1 минуты [9]. В результате
наступает обезболивание, эквивалентное обычной блокаде подвздошно-пахово-
го нерва.
Блокада подвздошно-пахового
и подвздошно-подчревного нерва
У детей при операциях по поводу паховой грыжи, гидроцеле или орхопексии эта
блокада обеспечивает обезболивание, эквивалентное каудальной блокаде
(рис. 21.1). Подвздошно-паховый нерв обычно оказывается в зоне хирургическо-
го вмешательства.
Методика
Эти нервы могут быть блокированы путем поверхностной анестезии, как описа-
но выше. Формальная блокада нервов может быть получена после индукции об-
щей анестезии [10]. Другая методика, при которой хирург инфильтрирует края
раны после выполнения разреза (при одновременном заполнении раны местным
анестетиком) является более эффективной по сравнению с методикой, при кото-
рой края кожи инфильтрируются перед закрытием раны. Чаще используется
0.25%-0.5% бупивакаин, в объеме от 5 до 10 мл в зависимости от размеров паци-
ента. Для этой блокады у детей также может быть использован 0.5 % ропивакаин.
Местная анестезия в педиатрии
235
Рис. 21.1. Подвздошно-паховая и подвздошно-подчревная блокада.
Игла диаметром 23-25 G проводится на 1 см медиальнее передней верхней ости подвздошной кости,
веерообразной инъекцией вдоль мышечного слоя в направлении от подвздошной кости к краю
прямой мышцы создается вал из анестетика. Введение 5-10 мл 0.25% бупивакаина вызовет
анестезию (заштрихованная область) областей иннервации подвздошно-пахового и
подвздошно-подчревного (область точечной штриховки) нервов (По материалам и с разрешения:
Yaster, М., Maxwell, L. G. Pediatric regional anesthesia. Anesthesiology 70: 324, 1989)
Осложнения
У 3-5 процентов детей, получивших эту блокаду, в отличие от применения поверх-
ностной анестезии может развиваться проходящая блокада бедренного нерва, что
приводит к временной неспособности сокращения четырехглавой мышца бедра.
Блокада полового нерва
Эта блокада может применяться для предоперационного обезболивания у маль-
чиков при выполнении обрезания или хирургическом лечении гипоспадии. Не-
смотря на то, что Американская Академия Педиатрии не одобряет проведение
обрезания, она одобряет использование местных анестетиков, если семья выра-
зила желание провести обрезание в неонатальном периоде. Как поверхностная
блокада кремом с EMLA, так и кольцевая блокада полового члена просты и свя-
заны с минимальным риском для новорожденного.
Методика
Наиболее простым способом блокады дорсальных половых нервов является под-
кожное введение 0.25%-0.5% раствора бупивакаина без эпинефрина с созданием
кольцевого валика вокруг основания полового члена [11]. При таком подкожном
введении местного анестетика он оказывается сразу над плотной фасцией, кото-
рая окружает тело, дорсальные нервы, артерии и вены полового члена. Местный
анестетик проникает через эту фасцию, вызывая анестезию. Другой методикой
является проведение блокады дорсальных половых нервов в подлобковой облас-
ти (рис. 21.2) [3]. При этом половой член отодвигается вниз, а инъекция местного
анестетика производится под фасцию Scarpa (которая книзу продолжается в фас-
цию, окружающую тело полового члена). На 0.5-1 см латеральнее срединной ли-
нии, ниже лонного сочленения выполняются две инъекции. Игла диаметром
236
Глава 21
23-25 G проводится несколько медиальнее и каудальнее до характерного ощу-
щения «хруста» при прохождении фасции Scarpa сразу ниже лобковой кости, по-
сле чего вводится 2^5 мл местного анестетика.
Рис. 21.2. Надлобковая блокада полового нерва.
Половой член отодвигается вниз, инъекция выполняется с каждой стороны у его основания на 0.5-1
см латеральнее срединной линии и ниже лонного сочленения. Игла провидится несколько
медиальнее и каудальнее, проникая через фасцию Scarpa
Осложнения
При кольцевой блокаде осложнений не наблюдается. Блокада дорсального поло-
вого нерва глубоко под фасцией в теле полового члена иногда вызывает сниже-
ние кровообращения в верхушке его головки.
Каудальная блокада
Каудальная блокада однократной инъекцией является одной из наиболее попу-
лярных и универсальных методик местной анестезии в педиатрии. Установка по-
стоянного катетера позволяет проводить введение местного анестетика или его
смеси с опиоидами.
Сочетание каудальной блокады с поддерживающей неглубокой местной
анестезией позволяет пациенту быстрее просыпаться, поскольку необходимость
в газообразных анестетиках снижается.
Анатомия
Выполнение каудальной блокады с технической точки зрения значительно легче
у детей, чем у взрослых. У младенцев и детей в области сакрального отверстия
меньше костных сращений, анатомические ориентиры лучше определяются, так
как жировой слой в ягодичной области развит меньше, поскольку его развитие
происходит во время достижения половой зрелости. Неразвитые ягодичные
мышцы и ограниченное развитие подкожно-жировой клетчатки создает условия
для лучшего определения анатомических ориентиров в области сакрального от-
верстия.
Местная анестезия в педиатрии
237
Рога V крестцового позвонка достаточно хорошо выступают, они лежат сра-
зу выше межягодичной складки. У младенцев и детей крестцово-копчиковая
связка не кальцифицирована; тактильные ощущения при ее пункции являются
достаточно схожими с ощущениями при введении иглы диаметром 18 Gb пери-
ферическую вену у взрослых. Твердая мозговая оболочка оканчивается между II
и Ш крестцовыми позвонками, при этом, длина крестца уменьшена в соответст-
вии с пропорциями тела ребенка. В связи с этим у младенцев возможна пункция
непрочных костей крестца или проникновение иглы под твердую мозговую обо-
лочку; наибольшее число катастрофических осложнений при каудальной блока-
де отмечается у младенцев, вес которых меньше 10 кг. У таких маленьких паци-
ентов при выполнении этой блокады особое внимание является жизненно
необходимым [12].
Показания
Каудальная блокада в сочетании с легкой общей анестезией обеспечивает пре-
красное до- и послеоперационное обезболивание при выполнении у детей хирур-
гических вмешательств в области сакрального сегмента (обрезание, дилатация
прямой кишки, лечение косолапости), а также при многих других хирургических
процедурах, выполняемых ниже диафрагмы. Этот список включает наиболее ча-
стые хирургические вмешательства, выполняемые в паховой области, такие как
герниорафия, орхипексия и лечение гидроцеле. У детей, перенесших ортопеди-
ческие вмешательства на нижних конечностях или урологические процедуры,
глубокое послеоперационное обезболивание может быть также получено с помо-
щью каудальной блокады.
Каудальные блокады обычно выполняются после общей анестезии и уста-
новки внутривенного катетера. Для того чтобы блокада была эффективной, тре-
буется только очень легкая общая анестезия. Время, потраченное на выполнение
блокады перед началом операции, компенсируется в конце ее, так как ребенок
проснется быстрее.
Препараты
0.25% раствор бупивакаина обеспечивает минимальную двигательную блокаду
при адекватной сенсорной блокаде. Общая доза бупивакаина не должна превы-
шать 3 мг/кг. Дозы 0.2%-0.25% ропивакаина не должны превышать 2 мг/кг веса
тела (13). Для легкого определения необходимого объема может быть использо-
ван способ Armitage [14]: 0.5 мл/кг веса тела для сакральной блокады, 0.75 мл /кг
веса тела для нижне-грудных сегментов и 1.25 мл/кг веса тела для блокады на
уровнях верхне-грудных сегментов.
Методика
Блокада обычно проводится после выполнения общей анестезии.
1. Пациент помещается в положение на боку, бедра и колени сгибаются так же,
как и при выполнении люмбальной пункции (рис. 21.3).
2. Пальпируется и маркируется наружное отверстие крестцового канала; в резу-
льтате получается фигура в виде буквы «С», находящаяся над межягодичной
складкой по средней линии, открытая часть «С» направлена в каудальную
сторону.
238
Глава 21
Рис. 21.3. Каудальная анестезия в педиатрической практике, положение на боку.
Эта методика выполняется после общей анестезии с установкой внутривенного катетера. Она легко
выполнима у детей в положении на боку, или на животе. Крестцово-копчиковая мембрана легко
идентифицируется с характерным «хрустом» при прохождении иглы, после чего игла продвигается
на 1-2 мм и инъекции выполняется
3. После асептической обработки следует либо «не касаться» области пункции,
либо использовать стерильные перчатки. Через крестцово-копчиковую связ-
ку под углом 60 градусов проводится одно-дюймовая игла диаметром 23 G
или внутривенная игла/катетер диаметром 22 G. Срез иглы должен быть рас-
положен в вентральном направлении для предотвращения пункции передней
стенки крестца. При пункции мембраны будет ощущаться «хруст»; канюля
иглы и шприц располагаются параллельно спинальной оси, а стержень иглы
продвигается дополнительно на 2 мм так, чтобы ее срез полностью оказался в
спинномозговом канале или чтобы внутривенный катетер при введении так-
же бы легко попал в этот канал.
4. После аспирации в канал вводится определенное количество местного анес-
тетика. Важно стабилизировать иглу так, чтобы давление поршня шприца не
вызывало ее смещения в канале. Наилучшими средствами против нежелате-
льной внутрисосудистой инъекции являются частая аспирация и дробная
инъекция местного анестетика, поскольку тестовая доза у детей не является
достоверной [12,15, 16]. У 50% детей при введении адекватных доз достига-
ется обезболивание до 12 часов.
Осложнения
В результате пункции твердой мозговой оболочки может наступить полная спин-
номозговая анестезия. Тщательная стабилизация иглы и частые осторожные ас-
пирации должны помочь в предотвращении этого осложнения. Были отмечены
нарушения сердечного ритма и остановка сердца, развивающаяся обычно у мла-
денцев весом менее 10 кг. До использования этой методики у младенцев реко-
мендуется накопить опыт, применяя ее у детей более старшего возраста.
Местная анестезия в педиатрии
239
Блокада подглазничного нерва
У детей при операциях по поводу незаращения губы или расщепления твердого
неба, а также при других хирургических вмешательствах на передней части твер-
дого неба, нижнем веке, крыльях носа или верхней губе эта простая блокада обес-
печивает отсутствие болевой чувствительности от 12 до 18 часов [17]. Даже если
во время проведения пластических хирургических операций местный анестетик
вводится непосредственно в ткани в зоне вмешательства, длительность местной
анестезии короче, чем при блокаде этого периферического нерва.
Анатомия
Подглазничная вырезка лежит на линии, соединяющей надглазничное и подбо-
родочное отверстие, и проходящей также через зрачок (рис. 18.3).
Методика
Для блокады этого нерва используется две методики. Обе эти блокады не предпо-
лагают инъекции непосредственно в вырезку или нерв. При первой из них под-
глазничное отверстие определяется указательным пальцем не основной руки —
приблизительно на 0.5 см от середины нижнего края глазницы. Игла диаметром
25 G проводится перпендикулярно к вырезке до контакта с костью; затем игла не-
сколько извлекается так, чтобы инъекция не оказалась внутрикостной, после
чего вводится 0.25-0.5 мл местного анестетика. После инъекции должен быть ви-
ден небольшой подкожный валик. При второй методике инъекция проводится
через полость рта, не оставляя при этом следов на лице. Губа приподнимается
над резцом и, после того, как указательным пальцем не основной руки определе-
на подглазничная вырезка, в ее направлении проводится 1.5 дюймовая игла диа-
метром 25 G так, чтобы ее кончик пальпировался в зоне вырезки. Будьте
осторожны, не уколите свой палец. Вводится 1-1.5 мл местного анестетика. Если
проведение блокады запланировано именно по этой методике, она должна быть
выполнена до хирургического вмешательства для того, чтобы перемещения вер-
хней губы не привели к ее повреждению во время хирургических манипуляций.
Блокады нервов конечностей
Основные методики блокады нервов конечностей у младенцев и детей являются
схожими с таковыми у взрослых с одним отличием: младенцы и дети не могут
взаимодействовать с врачом, поскольку они испытывают страх перед иглами и, в
общем, относятся подозрительно к медицинскому персоналу. Поэтому, при бло-
каде нервов у младенцев и детей одинаково важным является как седативное воз-
действие или легкая общая анестезия, так и использование стимуляции нервов.
Принципы использования стимулятора нервов детально описаны в главе 5.
Показания
Блокады нервов верхней конечности могут обеспечить мышечную релаксацию и
обезболивание при репонировании переломов, а также в ближайшем послеопера-
ционном периоде. Блокада бедренного нерва изолированная или в сочетании с
блокадой латерального кожного нерва бедра или паховая периваскулярная («три
в одном») блокада, могут обеспечить анестезию, необходимую для биопсии
240
Глава 21
мышц. Блокада бедренного нерва также дает прекрасное обезболивание и рас-
слабление мышц у детей с переломом бедренной кости. При дополнительной
блокаде седалищного нерва на нижней конечности могут быть выполнены прак-
тически все хирургические манипуляции. Однако обычно в педиатрической
практике при подготовке к хирургическому вмешательству на нижней конечно-
сти предпочтение отдается одно-инъекционной каудальной блокаде.
Препараты
Сочетание 0.5% раствора лидокаина и 0.12% раствора тетракаина с эпинефрином в
соотношении 1:200000 обеспечивает эффективную анестезию и обезболивание
длительностью до 12 часов, тем не менее, также используется 0.25% раствор бупи-
вакаина. Эта комбинация хорошо работает при проведении блокад с использова-
нием стимуляции нерва, поскольку лидокаин начинает действовать быстро; а
бупивакаин менее надежен. Необходимо помнить, что токсичность при комбина-
ции местных анестетиков является кумулятивной (табл. 21.1). Опыт применения
ропивакаина для блокады нервов конечности в педиатрической практике невелик.
Таблица 21.1
Дозы и объемы препаратов для местной анестезии в педиатрии.
Вещество Максимальная доза (мг/кг) с добавлением эпинефрина в разведении 1:200000
Лидокаин 7-10
Бупивакаин 2-3
Смесь
Лидокаина 5
Тетракаина 2
Блокада периферических нервов Объем (мл/кг)а
Аксиллярная 0.33
Внутрилестничная 0.25
Периваскулярная паховая 0.50
Седалищная 0.20
а Объем 0.25% бупивакаина или смеси лидокаин-тетракаин
Методика
Блокада нервов верхней конечности. Наиболее легким доступом к плечевому
сплетению является аксиллярный доступ, который выполняется по такой же ме-
тодике, как и у взрослых (см. главу 12). Полезно использование стимуляции нер-
ва, однако простая инфильтрация каждой из сторон хорошо пальпируемой
артерии обычно обеспечивает адекватную анестезию. Необходимые объемы
местных анестетиков приведены в табл. 21.1; эти объемы обычно включают бло-
каду кожно-мышечного нерва.
Блокада нервов нижней конечности. Блокада бедренного нерва описана в
главе 15; в педиатрической практике используется несколько ее модификаций. В
этом случае также полезно использование стимуляции нерва, однако эффективна
простая инфильтрация вдоль артерии.
Местная анестезия в педиатрии
241
Седалищный нерв легче блокировать на более отдаленном участке, чем ука-
зывается в классическом описании Labat. У детей редко имеется развитая под-
кожно-жировая клетчатка в ягодичной области, объем которой увеличивается в
пубертатном периоде, поэтому у них часто можно видеть седалищную борозду.
Ребенок помещается в положение на боку; голеностоп верхней ноги помещается
на колено нижней. Определяется и маркируется большой вертел и седалищный
бугор. К стимулятору нерва присоединяется игла диаметром 22 G (3.5 дюймовая
спинальная игла, если ребенок достаточно большой), она проводится по средней
линии между этими двумя анатомическими ориентирами до того, как будет заме-
чено сгибание назад или подошвенное сгибание стопы. Если положение иглы
правильное, все сгибания устраняются введением 1 мл местного анестетика.
Двигательная активность выше коленной области в большей степени связана с
прямой стимуляцией мышц и не указывает на правильное положение иглы.
Заключение
Тот факт, что вы владеете методикой, еще не означает, что это является лучшим
выбором для пациента. Несмотря на то, что эти методики достаточно безопасны,
они не лишены риска [18, 19]. Во всех случаях тщательное взвешивание риска и
пользы применения любой методики ложится на врача. Использование в предопе-
рационном периоде ацетаминофена или нестероидных противовоспалительных
препаратов, с последующим соответствующим местным обезболиванием, будет
только в том случае способствовать оптимальной анальгезии, если пероральные
анальгетики в послеоперационном периоде принимаются по временному графику,
обеспечивающему эффективные уровни в крови еще до того, как действие блока-
ды начнет уменьшаться, а это часто происходит к полуночи.
Литература
1. Dalens, В., Hasnaoui, A. Caudal anesthesia in pediatric surgery: Success rate and adverse
effects in 750 consecutive patients. Anesth. Analg. 68: 83,1989.
2. Broadman, L. M., Rice, L. J. Neural blockade for pediatric surgery. In Cousins, M. J.,
Bridenbaugh, P. O., Eds., Neural Blockade in Clinical Anesthesia and Management of
Pain, 3rd ed. Philadelphia: Lippincott, 1998.
3. Dalens, B. J. Regional anesthesia in children. In Miller, R. D. M., Ed, Anesthesia, 5th ed.
New York: Churchill Livingstone, 2000.
4. Rice, L. J. Regional anesthesia. In Motoyama, E., Davis, P., Eds., Smith’s Anesthesiafor In-
fants and Children, 6th ed. St. Louis: Mosby, 1995.
5. Sethna, N. R, Berde, С. B. Pediatric regional anesthesia. In Gregory, G. A., Ed., Pediatric
Anesthesia. New York: Churchill Livingstone, 1994.
6. Squire, S. J., Kirchhoff, K. L, Hissong, K. Comparing two methods of topical anesthesia used
before intravenous cannulation in pediatric patients. /. Pediatr. Health Care 14:68,2000.
7. Andersen, К. H. A new method of analgesia for relief of circumcision pain. Anaesthesia
44:118,1989.
8. Tree-Trakam, T., Pirayavarapom, S., Lertakyamanee, J. Topical analgesia for relief of
post-circumcision pain. Anesthesiology 67:395, 1987.
9. Casey, W. R, Rice, L. T., Hannallah, R. S., Broadman, L., Norden, J. M., et al. A compari-
son between bupivacaine instillation versus ilioin-guinal/iliohypogastric nerve block for
postoperative analgesia following inguinal herniorrhaphy in children. Anesthesiology 72:
636, 1990.
9—1685
242
Глава 21
10. Langer, J. C., Shandling, В., Rosenberg, M. Intraoperative bupivacaine during outpatient
hernia repair in children: A randomized double blind trial. /. Pediatr. Surg. 22:267,1987.
11. Broadman, L. M., Hannallah, R. S., Belman, B., Elder, P. T., Ruttiman, U., et al. Post-cir-
cumcision analgesia—a prospective evaluation of subcutaneous ring block of the penis.
Anesthesiology 67: 399,1987.
12. Veyckemans, R, Van Obbergh, L. J., Gouvemeur, J. M. Lessons from 1100 pediatric ca-
udal blocks in a teaching hospital. Reg. Anesth. 17: 119,1992.
13. Koinig, H., Krenn, C. G., Glaser, C., Marhofer, P., et al. The dose-response of cau-
dal ropivacaine in children. Anesthesiology 90: 1339, 1999.
14. Armitage, E. N. Local anesthetic techniques for prevention of postoperative pain. Br. J.
Anesth. 58: 790,1986.
15. Brendel, J. K., Yemen, T. A., Berry, F. A. Intravenous injection of local anesthetic:
Identification with isoproterenol and epinephrine in children during halothane anes-
thesia. Reg. Anesth. 18: 49,1993.
16. Freid, E. B., Bailey, A. G., Valley, R. D. Electrocardiographic and hemo-dynamic
changes associated with unintentional intravascular injection of bupivacaine with
epinephrine in infants. Anesthesiology 79: 394,1993.
17. Ahuja, A., Data, A., Krishna, A., Bhatacharya, A. Infraorbital block for relief of posto-
perative pain following cleft lip surgery in infants. Anaesthesia 49: 441,1993.
18. Giaufre, E., Dalens, B., Gombert, A. Epidemiology and morbidity of regional anesthe-
sia in children: A one-year prospective study of the French-Language Society of Pe-
diatric Anesthesiologists. Anesthesiology 83:904,1996.
19. Krane, E. J., Dalens, B. J., Murat, I., Murrell, D., et al. The safety of epidu-rals placed du-
ring general anesthesia. Reg. Anesth. 23:433,1998.
Глава 22
Анестезия в акушерстве
Несколько великолепных руководств по анестезии в акушерстве подробно опи-
сывают физиологию и проведение анестезии у рожениц [1—5]. В этой главе при-
водится краткое описание изменений в вышеприведенных методиках местной
анестезии, необходимых для их применения у здоровых беременных женщин. В
частности, описываются особенности применения эпидуральной, каудальной и
спинномозговой анестезии при вагинальном и кесаревом родоразрешении.
Анатомия
Анатомические условия проведения блокад у беременных женщин имеют неко-
торые отличительные особенности. Позиционирование пациентки осложняется
наличием увеличенной матки, которая ограничивает способность матери к мак-
симальному сгибанию поясничного отдела позвоночника. У пациенток, набрав-
ших вес, или при длительном постельном режиме костные анатомические
ориентиры могут быть скрыты. Идентификация связок может быть затруднена в
связи с тем, что ближе к сроку родоразрешения наступает их размягчение, вы-
званное гормональными изменениями.
Повышение внутрибрюшного давления также влияет на состояние эпидура-
льного и субдурального пространства. Эпидуральные вены становятся полно-
кровными, что повышает вероятность неожиданного контакта с ними. Объем
эпидурального пространства уменьшается, поэтому, для необходимых уровней
анестезии, как при эпидуральной, так и при каудальной методике требуется ме-
ньший объем раствора. Спинномозговая инъекция также приводит к блокаде
выше ожидаемого уровня, поэтому дозировка при всех этих методиках должна
быть снижена.
На управление анестезией также оказывает влияние изменение циркуляции
крови. Сердечный выброс повышается, поэтому внутрисосудистая инъекция бы-
стро приводит к проявлениям токсичности. Увеличенная беременная матка в по-
ложении на спине затрудняет венозный возврат от нижних конечностей, поэтому
необходимо обеспечить смещение матки от сосудов малого таза при выполнении
симпатической блокады, а также при проведении реанимационных мероприятий
или в тех случаях, когда пациентка помещается на спину для выполнения кесаре-
ва сечения.
В общем, эти особенности в значительной степени увеличивают технические
трудности и повышают риск проведения местной анестезии у беременных. Не-
смотря на то, что в некоторых лечебных учреждениях это принято, родильный дом
не является идеальным местом для выполнения новичком его первой регионарной
блокады. Перед применением этих методик в «родовой» ситуации, в которых па-
циентка часто требует быстрого и профессионального обезболивания, с ними нуж-
но хорошо познакомиться.
244
Глава 22
Показания
Дискомфорт, связанный с родами, проявляется в одной из трех форм, или в их со-
четаниях: 1. болезненные сокращения в раннем периоде; 2. растяжение родовых
путей во время родов; 3. хирургические боли при кесаревом сечении. Ощущение
сокращения матки обеспечивается нервными волокнами, входящими в спинной
мозг на уровне Х-ХП грудных дерматомов. Блокада этого пути в раннем периоде
родов может привести к их замедлению. Обычно, местное обезболивание не при-
меняется до начала ясно ощутимых и длительных сокращений матки, однако, это
не является критическим моментом расширения шейки матки, указывающим на
необходимость начала обезболивания [6]. Использование местного обезболива-
ния не является достоверным фактором удлинения родоразрешения или увеличе-
ния числа случаев, в которых возникала бы необходимость инструментальной
или оперативной помощи в родоразрешении [7,8]. Как только головка плода опу-
стится в родовой канал, начинает ощущаться растяжение влагалища, что обеспе-
чивается крестцовыми спинномозговыми нервами, иннервирующими брюшину.
Оперативное родоразрешение требует блокады кожной чувствительности в дер-
матомах нижней части живота, а также блокады висцеральной чувствительности
на уровне от II до IV грудных дерматомов. Каждая из этих фаз имеет отличия в
проведении анестезии.
Особенно полезной в акушерстве, в частности при сокращении матки в пер-
вой стадии родов, является поясничная эпидуральная блокада. Сегментарное
обезболивание может обеспечить проведение родов с использованием минима-
льных доз препаратов, ограничивая физиологические изменения и несколько
снижая подвижность матери. Методики с установкой постоянного катетера по-
зволяют наиболее гибко воздействовать на продолжительность и глубину блока-
ды так, что интенсивность блокады в отношении промежностной анестезии мо-
жет быть повышена ко времени родоразрешения или усилена в нужный момент
при кесаревом сечении. Использование эпидуральных катетеров повышает веро-
ятность внутрисосудистой или субарахноидальной инъекции. Установка катете-
ра и инъекция также требуют некоторого времени еще до наступления обезболи-
вания. Все же, при разумном балансе и взвешивании возможного риска,
эпидуральное обезболивание и анестезия часто оказываются полезной при есте-
ственном родоразрешении или кесаревом сечении [6].
Каудальная (сакральная эпидуральная) блокада также используется для
обезболивания в акушерстве и особенно эффективна непосредственно при родо-
разрешении, поскольку обеспечивает прекрасную анестезию сакральных кореш-
ков. При каудальной блокаде для получения обезболивания требуются большие
дозы препаратов, чем при люмбальной эпидуральной инъекции. Для легкого ро-
доразрешения нет необходимости достигать глубокого обезболивания сакраль-
ной области. Каудальное обезболивание более других продолжается во втором
периоде родов, влияя на рефлекс «выталкивания». Это обстоятельство может
оказаться неподходящим при длительных, требующих наблюдения, родов, на-
пример, при преждевременном родоразрешении. Анатомия крестцовой области,
по сравнению с поясничной, более вариабельна, поэтому методика этого обезбо-
ливания является более трудной (см. главу 8). По этим причинам каудальная ане-
стезия применяется редко.
В связи с появлением игл с закругленным срезом, позволяющих достоверно
уменьшить число случаев постдуральной головной боли у этой, подверженной
данному осложнению, категории больных, субарахноидальные методики вновь
становятся популярными. Увеличение использования субарахноидальных инъек-
Анестезия в акушерстве
245
ций также связано с накоплением опыта использования для субарахноидального
обезболивания при начале родов наркотических средств (9, 10). Эта методика из-
бавляет от боли без двигательной или симпатической блокады и может обеспечить
обезболивание на несколько часов, пока не будет начато эпидуральное введение
местного анестетика. Дополнительная установка эпидурального катетера (комби-
нированная спинномозговая-эпидуральная методика; см. раздел «Комбинирован-
ная спинномозговая-эпидуральная методика» в этой главе) позволяет в последую-
щем проводить непрерывную инфузию для более глубокого обезболивания окон-
чательной стадии родов. Опиоидное обезболивание может также обеспечить
большую подвижность вначале родов, что соответствует популярной концепции
«гуляющее эпидуральное поведение» во время начальной стадии родов. При позд-
них родах субарахноидальная инъекция только местного анестетика обеспечивает
быстрое наступление глубокой анестезии, что является полезным при естествен-
ном родоразрешении, когда важны быстрое действие и надёжность, поэтому такое
обезболивание хорошо подходит для скоротечных родов. Применение этой мето-
дики ограничивается ситуацией, когда роды начнутся в ближайшее время. Несмот-
ря на возможность быстрого развития вазодилятации и гипотонии, анестезия при
седловидной блокаде (низкой спинальной) остается основным средством в аку-
шерской практике при естественном родоразрешении во многих клиниках.
Другим распространенным показанием для анестезии является кесарево се-
чение. При более высоких дозах и концентрациях препаратов на уровне Th-2-
Th-4 для обеспечения двигательной и сенсорной анестезии могут использоваться
все вышеописанные методики. Если позволяет время для достижения адекватной
анестезии может быть установлен эпидуральный катетер. Наиболее часто для ке-
сарева сечения выбирают спинномозговую блокаду, поскольку при этой методи-
ке достигается быстрая и глубокая анестезия. Использование местного обезболи-
вания для оперативного родоразрешения снижает возможность развития
осложнений со стороны дыхательных путей, связанных с общей анестезией, в
Соединенных Штатах с помощью этой методики обеспечено снижение летально-
сти [11].
Обезболивание родов часто требуется пациенткам, ранее рожавшим абдо-
минально. При вагинальном родоразрешении после кесарева сечения риск
осложнений повышается. Однако в этом случае роды могут быть безопасными,
если обеспечено пристальное наблюдение для раннего выявления разрыва матки
[12, 13]. Эта ситуация требует наименьшей по глубине и высоте эпидуральной
блокады, а также интенсивного наблюдения за матерью и плодом во время дейст-
вия обезболивания.
Применение региональной методики при других осложненных акушерских
ситуациях требует комплексного решения. У пациенток с гиповолемией местная
анестезия в связи с симпатической блокадой может быть противопоказана. При
гипертонии или при преэклампсии эпидуральное обезболивание в раннем перио-
де может помочь снизить кровяное давление, повышение которого связано с при-
сутствием боли, однако, такое обезболивание может вызывать более резкие сер-
дечно-сосудистые изменения, поскольку такие пациентки часто испытывают
вазоконстрикцию и волемическое истощение. В серьезных случаях (диастоличе-
ское давление выше 110 мм рт. ст.) еще до начала симпатической блокады может
потребоваться обеспечение инвазивного гемодинамического наблюдения. Не-
подходящим для использования местного обезболивания является наличие коа-
гулопатии. Ягодичное предлежание, многоплодная беременность, преэклампсия
или сердечные заболевания матери, все это требует более детальных изменений
методики местного обезболивания, которые описать здесь не представляется
возможным.
246
Глава 22
Другим применением местной анестезии при беременности являются неаку-
шерские операции. Выбор анестезии должен быть продиктован типом операции
и состоянием пациентки. Использование региональной анестезии часто более
предпочтительно, поскольку при этом оказывается наименьшее из возможных
лекарственных влияний на плод, особенно, при спинномозговой блокаде. Не-
смотря на теоритические преимущества точные данные о превосходстве местной
анестезии над общей отсутствуют. Какая бы методика не использовалась, дол-
жно уделяться тщательное внимание обеспечению нормального кровоснабжения
матки и оксигенации. При проведении хирургических манипуляций на поздних
стадиях беременности необходимо интраоперационное наблюдение за состояни-
ем плода.
Препараты
Несмотря на то, что все местные анестетики могут вызывать анестезию в эпиду-
ральном пространстве, необходимо учитывать их действие на плод и новорож-
денного при высоких уровнях в крови у матери и проникновение через
плацентарный барьер. Особенно большая способность накапливаться в материн-
ском кровотоке присуща мепивакаину. Он недостаточно хорошо метаболизиру-
ется в крови новорожденных и длительная эпидуральная анестезия этим
препаратом может привести к его измеримым уровням в крови у плода, а также
привести к неврологическим изменениям. Этидокаин не применяется, поскольку
этот препарат вызывает долгую и глубокую двигательную блокаду. Неврологи-
ческие признаки, обнаруживаемые при применении хлоропрокаина, лидокаина и
бупивакаина не вызывают изменений неврологического статуса у новорожден-
ных. В дозах для эпидуральной анестезии эти препараты обеспечивают прекрас-
ное обезболивание с минимальной двигательной блокадой. В целом, они широко
используются на практике в минимальных дозах, как в отношении концентра-
ции, так и в отношении объема раствора. 6-8 мл 2% раствора хлоропрокаина или
1.5% раствора лидокаина, введенные на уровне II поясничного позвонка, вызыва-
ют быстрое обезболивание при родах. Аналогичная доза 0.25% раствора бупива-
каина используется в тех случаях, когда в быстром начале действия препарата
нет необходимости. Успешное обезболивание с меньшей двигательной блокадой
достигается введением 10 мл 0.125% бупивакаина. Эта концентрация также эф-
фективна для непрерывного введения. Достаточность этой дозы подтверждает
мнение о том, что при беременности чувствительность к местным анестетикам
повышается, в результате чего требуется введение меньших доз. Схожее обезбо-
ливание вызывается и левобупивакаином. Ропивакаин при эквивалентных дозах
может вызывать меньшую двигательную блокаду, однако, это может быть связа-
но с его меньшей активностью [14]. Добавление наркотических средств (См.
ниже) вызывает достоверное потенцирование низких доз бупивакаина, особен-
но, при его непрерывном введении [6].
При кесаревом сечении дозы и концентрации препаратов должны повыша-
ться. При абдоминальном родоразрешении для эпидуральной анестезии в об-
щем требуется от 15 до 20 мл 0.5% раствора бупивакаина или 2% раствора лидо-
каина. Несмотря на то, что 0.75% раствор бупивакина или левобупивакаина или
1 % раствор ропивакаина дают прекрасную двигательную блокаду, их использо-
вание при акушерских процедурах не рекомендуется. В первую очередь это
связано с тем, что при повышении васкуляризации эпидурального пространст-
Анестезия в акушерстве
247
ва они довольно легко вызывают системную токсичность, а при внутривенном
введении бупивакаина, проявления сердечной токсичности будут значительно
большими (см. главу 3). Очевидно, что полностью безопасного препарата не су-
ществует, и в тех случаях, когда речь идет о жизни матери и новорожденного,
для предотвращения внутрисосудистой инъекции самое пристальное внимание
должно уделяться использованию тестовых доз и дробности инъекции.
При спинномозговой анестезии дозы препаратов у беременных также дол-
жны снижаться (табл. 22.1). Использование небольших доз при субарахноидаль-
ной блокаде не предполагает каких-либо влияний на неврологическое состояние
плода. Используются все наиболее распространенные препараты для спинномоз-
говой анестезии, однако, меньшей популярностью пользуется лидокаин, поско-
льку существует мнение, что он вызывает транзиторные неврологические симп-
томы. Добавление опиоидов к бупивакаину может позволить уменьшить дозу
местного анестетика до 5 мг, а также снизить частоту гипотонии [15].
Таблица 22.1
Дозы препаратов для спинномозговой анестезии при родах
Препарат Седловидная блокада Кесарево сечение
Лидокаин 5% 25-40 мг 60-75 мг
Тетракаин 0.5% 3-6 мг 8-10 мг
Бупивакаин 7.5% 6-8 мг 10-12 мг
Используется также изолированное применение опиоидов для обезболива-
ния родов путем как эпидурального, так и интратекального введения. В идеале
они могут обеспечить обезболивание без двигательной или симпатической бло-
кады. Эпидуральные дозы оказались не эффективны. Субарахноидальное введе-
ние морфина позволяет пролонгировать обезболивание, однако, не является по-
пулярным в связи с длительным действием препарата и достоверным
повышением числа случаев зуда (табл. 22.2). Фентанил и суфентанил показали
себя как эффективные анальгетики при субарахноидальном введении, особенно
на ранних стадиях родов. Дозы в 25 мкг фентанила или 10 мкг суфентанила обес-
печивают анальгезию от 1 до 3 часов, позволяя пациенткам комфортно переме-
щаться до проведения более глубокого обезболивания эпидуральным введением
местного анестетика при необходимости. Если предполагаются длительные
роды, добавление морфина (0.25 мг) может продлить анальгезию, полученную
введением фентанила. Морфин менее эффективно продлевает анальгезию, вы-
званную суфентанилом, с достоверным увеличением числа случаев тошноты и
зуда. Также используется меперидин (от 15 до 20 мг), он обладает преимущест-
вом усиления свойств местных анестетиков [16]. Это может приводить к некото-
рой гипонии. Добавление 2.5 мг бупивакаина к опиоидному препарату будет так-
же потенцировать анальгезию и не приведет к развитию двигательной или
симпатической блокады. Для всех интратекально вводимых опиоидов предшест-
вующее внутривенное введение агонистов-антагонистов опиоидов будет сни-
жать их эффективность.
248
Глава 22
Таблица 22.2
Дозы наркотических препаратов для спинномозговой анестезии во время родав
Препарат Дозы Длительность Комментарии
Морфин 0.25-0.4 мг 1-4ч Общие побочные
Меперидин 10-20 мг 1-Зч эффекты: зуд, тошнота Действие местного
Фентанил Суфентанил 10-25 мкг 10 мкг 1-2ч 1-Зч анестетика: возможная гипотензия
Интратекальное применение опиоидов не оказалось, как ожидалось свобод-
ным от побочных эффектов. Наиболее часто отмечается тошнота и зуд, которые
возникают у 50% пациентов [17]. Гипотония отмечается у 7-20% пациентов [9].
Брадикардия у плода была отмечена в 15% случаев, однако, это не вызвало ка-
ких-либо значащих проблем [16]. Наибольшей трудностью субарохноидального
применения наркотических средств является то, что они не всегда обеспечивают
длительность обезболивания, достаточную даже для обычных родов и часто вы-
званная ими анальгезия неадекватна во второй стадии родов. Для этой стадии
обычно предполагается постоянная эпидуральная инфузия местных анестетиков.
К счастью, предшествующее интратекальное применение наркотических средств
потенцирует действие местных анестетиков. Несмотря на то, что интратекальное
введение не является панацеей, оно обеспечивает достаточную анальгезию у зна-
чительного процента женщин вначале родов и может принести особенную пользу
у отдельных пациенток, в частности, в случаях, когда женщина испытывает выра-
женный дискомфорт при ее первых (вероятно длительных) родах. У пациенток с
серьезными сердечными заболеваниями, которые не могут перенести симпатиче-
скую блокаду (например, стеноз аорты, синдром Eisenmenger), или у имеющих ал-
лергию к местному анестетику, постоянная субарахноидальная инфузия наркоти-
ческого вещества представляется выгодной альтернативой.
Опиоиды при эпидуральном обезболивании более эффективны как допол-
нительные средства [6]. Добавление от 50 до 100 мкг более жирорастворимого
фентанила к 0.125% или 0.06% раствору бупивакаина при эпидуральном введе-
нии приводит к улучшению качества обезболивания и снижению выраженности
двигательной блокады как при дробных инъекциях, так и при постоянной инфу-
зии во время родов. Не были выявлены ни явления депрессии у матерей, ни не-
врологические изменения у плода, однако, у 30% пациенток отмечался зуд. Так-
же может быть применен суфентанил.
Использование наркотических средств для спинномозговой и эпидуральной
анальгезии при обезболивании после кесарева сечения в наибольшей степени
предсказуемо и обеспечивает широкие границы безопасности. Добавление
0.1-0.25 мг морфина при спинномозговой анестезии во время кесарева сечения
позволяет достичь безопасного и надежного обезболивания послеоперационного
периода. Обычно эпидуральное введение 3-5 мг морфина вызывает анальгезию
на 12-18 часов, которая часто бывает достаточной для перехода на пероральные
анальгетики. В аналогичной ситуации эпидуральное введение наркотических
средств вызывает лучшее обезболивание, чем использование анальгезии, конт-
ролируемой пациентом. К сожалению, побочные эффекты в виде зуда (80%), за-
Анестезия в акушерстве
249
держки мочи (15-30%) и тошнота являются значительными недостатками эпиду-
рального применения наркотических средств. Из-за этих побочных эффектов
женщины обычно предпочитают аналгезию, управляемую пациентом, поскольку
при этом, в отличие от эпидурального обезболивания имеется возможность соб-
ственноручного управления уровнем обезболивания. Тем не менее, спинальное
или эпидуральное введение наркотических средств после кесарева сечения высо-
ко эффективно.
Добавление эпинефрина к растворам анестетиков, вводимых эпидурально,
при родах является спорным. Как обсуждалось в 7 главе, при этом появляются
некоторые преимущества, в частности, обезболивание наступает быстрее, а его
эффективность повышается, кроме этого, эпинефрин играет традиционную роль
удлинителя блокады. Выше рассмотрены сведения о поддержании сердечного
выброса и использовании эпинефрина как маркера внутривенной инъекции [18,
19]. Определенное количество эпинефрина при его системной абсорбции во
время эпидуральной блокады может повлиять на сокращение матки или крово-
ток. При нормальном кровоснабжении матки эпинефрин не вызывал клинически
значимых проблем при обычных объемах раствора в 6-8 мл с разведением
1:200000. Преходящие расстройства у плода были отмечены у 2 из 10 пациенток,
которым стандартная тестовая доза в 15 мкг была введена внутривенно. Вторым
вопросом является надежность реакции в виде тахикардии в ответ на введение
тестовой дозы анестетика при попытке выявления внутрисосудистой инъекции
[18-20]. Частота сердечных сокращений у матери во время родов изменяется на-
столько, что у 50% пациенток отмечается циклическое повышение пульса более
чем на 25 ударов в минуту. На таком фоне изменения, вызванные инъекцией эпи-
нефрина, могут оказаться незамеченными. Для того чтобы избежать этих трудно-
стей и уйти от вышеуказанных проблем, некоторые анестезиологи при анестезии
в акушерстве не включают эпинефрин в состав раствора для эпидуральных инъ-
екций. В большинстве случаев простая аспирация через эпидуральный катетер с
несколькими отверстиями заменяет стандартную инъекцию эпинефрина [21].
Кроме этого, избежать системной токсичности в результате эпидуральной ана-
льгезии при родах помогает разделение обычной эпидуральной дозы на две рав-
ные инъекции, объемом 3-4 мл каждая. При плановом кесаревом сечении, прово-
димом по желанию пациентки (вне родов), использование тестовой дозы
достаточно надежно. Как уже отмечалось, другим тестовым приемом является
введение 1 мл воздуха (с использованием допплерографии или обычной регист-
рации частоты сердечных сокращений плода). Применение проб при введении
эпидуральных доз при абдоминальном родоразрешении остается спорным. До
тех пор, пока не найдена надежная альтернатива эпинефрину очевидна необхо-
димость выполнения дробной инъекции, осторожная аспирация и тщательное
наблюдение.
Эпинефрин может быть также добавлен при субарахноидальной инъекции.
При кесаревом сечении он будет потенцировать действие местного анестетика,
увеличивая продолжительность блокады. При обезболивании родов он будет
пролонгировать действие опиоидов, однако, в условиях присутствия местного
анестетика может повышаться риск двигательной блокады [9]. Клонидин в дозе
50 мкг будет также пролонгировать обезболивание, однако, с одновременным се-
дативным и гипотензивным действием, по этой причине ни один из упомянутых
препаратов никогда не пользовался популярностью в качестве дополнительного
средства.
250
Глава 22
Техника
В общем, существует две клинические ситуации, когда перед анестезиологом в
акушерской практике возникает вопрос: обычное родоразрешение или кесарево
сечение. Выбор анестезии заслуживает отдельного обсуждения.
Вагинальные роды
Интермиттирующая эпидуральная анальгезия. Для вагинальных родов ин-
термиттирующая эпидуральная анальгезия является широко распространенной
методикой, ее описание приведено в главе 7. При беременности используется не-
сколько модификаций этой методики.
1. Анатомические особенности, детально описанные в этой главе, увеличивают
технические трудности. Риск аорто-кавальной компрессии обусловливает не-
обходимость проведения до начала анестезии внутривенных вливаний в объ-
еме от 500 до 1000 мл кристаллоидных растворов.
2. Во время родов местная инфильтрация кожи и более глубоких тканей может
проводиться как в перерывах между схватками, так и во время них.
3. Проникновение в эпидуральное пространство должно быть произведено меж-
ду схватками для предотвращения риска нежелательных смещений иглы.
Идеально, если вход в эпидуральное пространство, проведение катетера и из-
влечение иглы проводится между схватками так, чтобы кончик иглы не нахо-
дился в узком эпидуральном пространстве во время схваток.
4. Катетер продвигается в эпидуральном пространстве только на 3-5 см, при
этом, проводится осторожная аспирация. Инъекция препарата осуществляет-
ся порциями по 3-5 мл (в зависимости от концентрации) с 30 секундными ин-
тервалами для уменьшения возможности развития системной токсичности
вследствие внутрисосудистой инъекции. Стандартное наблюдение за часто-
той сердечных сокращений во время родов является трудным, но не невоз-
можным. При использовании эпинефрина инъекция тестовой дозы должна
проводиться сразу после схватки для того, чтобы избежать вводящего в за-
блуждение повышения частоты сердечных сокращений, наступающего вслед
за началом схватки. Как указывалось выше, некоторые анестезиологи избега-
ют применения эпинефрина и полагаются на аспирацию и дробную инъек-
цию, обеспечивающие проведение эпидуральной блокады при родах в
пределах безопасных границ.
5. Если анестезия получилась односторонней, пациентка должна быть повернута
на неастезированную сторону. Если катетер был введен на глубину более 3-х
см, он должен извлекаться с шагом по 1 см до достижения срединной линии, на
что будет указывать появление анальгезии на противоположной стороне.
6. После того, как эпидуральное обезболивание достигнуто, роженица не дол-
жна лежать на спине, а находиться в положении на боку для предотвращения
аорто-кавальной компрессии. Каждая повторная инъекция через катетер дол-
жна быть дробной. Измерение кровяного давления матери должно произво-
диться с пяти минутными интервалами, по меньшей мере, в течение 20 минут
после каждой инъекции. Гипотонию следует устранять вливанием жидкости
и изменением положения тела. При серьезных ситуациях для предотвраще-
ния нарушения кровотока в матке наиболее эффективными средствами явля-
ются внутривенное или внутримышечное введение эфедрина [22], однако,
при нормальной беременности может быть применен и фенилэфрин [20].
Анестезия в акушерстве
251
Эпидуральная анальгезия путем постоянной инфузии. Эта методика позво-
ляет достичь лучшего обезболивания и избежать периодов уменьшения обезболива-
ния, которые часто наблюдаются при методике интермиттирующей эпидуральной
анальгезии. После введение первоначальной дозы через эпидуральный катетер, к его
конектору присоединяется система, состоящая из шприца и насоса для постоянной
инфузии местного анестетика. Поскольку сопротивление току жидкости в катетере
высокое, требуется использование волюмометрического насоса с высоким давлени-
ем и соединительных трубок с низкой эластичностью. Насос настраивается так, что-
бы в час поступало от 8 до 12 мл 0.125% бупивакаина или смеси, содержащей
0.06%-0.1% раствор бупивакаина и 1-2 мкг/мл фентанила. Если во вводимый рас-
твор добавлен фентанил, то к первоначальной болюсной инъекции 0.25% раствора
бупивакаина должны быть также добавлены 25-50 мкг. Также эффективен 0.2% рас-
твор ропивакаина. Его взаимодействие с опиоидами недостаточно хорошо изучено.
Для оценки скорости инфузии уровень анальгетика должен проверяться
каждый час. Если анестезия становится неадекватной, может потребоваться по-
вторная болюсная инъекция 3-5 мл 0.25% раствора бупивакаина при одновре-
менном повышении скорости инфузии.
Эта методика позволяет избежать риска развития системной токсичности,
поскольку количество вводимого анестетика в любой из временных интервалов
недостаточно для развития этих симптомов, даже если катетер проникнет в кро-
веносный сосуд. Жалобы, связанные с уменьшением анестезии, должны расце-
ниваться как возможные указания на внутрисосудистое перемещение катетера.
Также и увеличение глубины анестезии может указывать положение катетера в
субарахноидальном пространстве.
Промежностная анестезия при родах часто бывает неадекватной, как при ин-
термиттирующей эпидуральной методике, так и при методике постоянного вве-
дения. При полулежачем положении пациенток может быть полезной болюсная
инъекция 4-6 мл 0.25% раствора бупивакина или 2% раствора хлоропрокаина.
Комбинированная спинномозговая-эпидуральная методика. Как описы-
валось выше в этой главе, такое сочетание является наиболее эффективным для со-
здания обезболивания при интратекальном введении наркотических средств для
того, чтобы избежать двигательной блокады в ранних стадиях родов, а также для
того, чтобы достичь глубокой анальгезии эпидуральным введением местного анес-
тетика во второй стадии родов. Несмотря на то, что эта методика в большинстве
ситуаций не превосходит стандартное эпидуральное обезболивание, она позволяет
достичь более быстрой анальгезии [23] с меньшей частотой «рвущих» болей позд-
нее в родах [24]. Эта методика представляет собой простое сочетание стандартной
эпидуральной и субарахноидальной инъекции. Она может выполняться путем раз-
дельных инъекций на двух уровнях или на одном уровне, однако, наиболее часто
используется техника проведения «иглы сквозь иглу» [10].
1. Пациентка подготавливается и помещается в положение для стандартной эпиду-
ральной инъекции, это может быть положение сидя или лежа на боку, по стан-
дартной методике в эпидуральное пространство вводится эпидуральная игла.
2. Для пункции твердой мозговой оболочки через эпидуральную иглу проводится
игла меньшего диаметра с закругленным срезом (рис. 22.1). Имеется несколько
коммерческих вариантов пар игл, в которых спинальная игла либо выходит че-
рез кончик эпидуральной иглы, либо проходит через специальное отверстие на
концевом изгибе иглы, расположенное на одной линии с основной осью иглы.
Другим вариантом является наличие специального канала в стержне эпиду-
ральной иглы. Принципиально важно, что спинальная игла должна иметь воз-
можность выходить за кончик эпидуральной иглы на расстояние до 10 мм.
252
Глава 22
Рис. 22.1. Комбинированная спинномозговая-эпидурапьная методика.
После идентификации эпидурального пространства по обычной методике, небольшая спинальная
игла проводится сквозь эпидуральную иглу для выполнения субархноидальной инъекции до
установки эпидурального катетера
3. После получения спинномозговой жидкости вводится интратекальный опио-
ид и спинальная игла удаляется. Добавление 2.5 мг бупивакаина будет увели-
чивать продолжительность обезболивания. Если пункция твердой мозговой
оболочки не произведена, первая игла может находиться вне эпидурального
пространства или может иметь тангенциальное отклонение от твердой мозго-
вой оболочки. В этих случаях может понадобиться репозиционирование эпи-
дуральной иглы.
4. Эпидуральный катетер вводится по стандартной методике, и, после удаления
эпидуральной иглы, закрепляется. При необходимости также по стандартной
методике проводится проверка возможного внутрисосудистого или субарах-
ноидального положения катетера. При правильном положении катетера вво-
дится местный анестетик. Инъекция через эпидуральный катетер обычно
вызывает анальгезию на более высоких уровнях по сравнению с предшеству-
ющей спинальной инъекцией, поэтому могут быть использованы меньшие
дозы.
5. Если пациентка хочет перемещаться после первой субарахноидальной инъек-
ции, она должна наблюдаться в течение 20 минут для исключения признаков
гипотонии или брадикардии у плода [9]. Во многих отделениях, прежде чем
разрешить пациентке ограниченное передвижение, убеждаются в адекватности
ее двигательной функции, например попросив встать на низкую скамейку.
Каудальная анестезия. Выполнение этой методики описано в главе 8, она
может использоваться в сочетании с люмбальной эпидуральной анестезией для
обеспечения лучшей анестезии промежности при родах. При изолированном ис-
пользовании сакральной анестезии обезболивание в первой стадии родов может
быть связано с более выраженной анестезией, чем необходимо матери, однако,
обезболивание стадии изгнания будет прекрасным. Поскольку при этой методи-
ке требуются более высокие дозы и она приводит к более глубокой анестезии,
этот способ обезболивания используется нечасто.
Анестезия в акушерстве
253
1. Часто наиболее легко достижимое положение для роженицы — на коленях с
наклоном вперед. Может быть также использовано положение на боку.
2. Каудальный катетер продвигается в канал на 8-12 см, для предотвращения
системной токсичности здесь также используется дробная инъекция. Для
обезболивания родов обычно требуется 16-18 мл одного из стандартных
местных анестетиков.
3. Если головка плода находится глубоко в родовом канале (сразу кпереди от
крестца), выполнение каудальной блокады может быть нежелательным в свя-
зи с риском инъекции в кожные покровы головки плода. Если эта методика
все же используется, особое внимание должно быть сосредоточено на том,
чтобы во время блокады не произошло проникновения иглы через крестец.
Спинномозговая анестезия. Она также проводится по стандартной мето-
дике при положении пациентки сидя (для создания классического седловидного
блока) или в положении на боку. Для уменьшения возможности возникновения
головной боли используются иглы небольшого диаметра (25-27 G) с закруглен-
ным срезом, однако, применение таких игл является с технической точки зрения
более трудным и требует большего времени. Анестезия в виде седловидного бло-
ка местным анестетиком выполняется только после полного раскрытия шейки
матки, когда родоразрешение ожидается не более, чем через 90 минут, при этом
не исключена необходимость проведения повторной блокады.
Кесарево сечение
В случае выполнения кесарева сечения выбор анестезии более сложен. Прежде
чем выбрать одну из методик обезболивания необходимо обсудить с акушером
степень неотложности этой операции. Если это вмешательство является «ургент-
ным», но не неожиданным, для достижения необходимой степени анестезии мо-
жет быть использовано усиление ранее выполненной эпидуральной блокады или
выполнена новая блокада. Если особенно необходима быстрота выполнения и
надежность, в наибольшей степени подходит спинномозговая анестезия, при со-
временном оборудовании и препаратах, являющаяся весьма популярной. Если
ситуация действительно неотложная, например, в случаях нарушения жизнедея-
тельности плода или кровотечения у матери требуется незамедлительное прове-
дение общей анестезии по стандартной методике, описанной в соответствующих
руководствах по акушерской анестезии.
При выполнении одного из видов местного обезболивания существует не-
сколько моментов, отличающихся от обезболивания при естественном родораз-
решении. Требуемым верхним уровнем анестезии обычно является II—IV груд-
ной дерматомы, а также глубокая двигательная блокада, обеспечивающая
необходимое расслабление передней брюшной стенки для проведения хирурги-
ческих манипуляций. Изменения кровяного давления будут более резкими, мат-
ку необходимо обязательно сместить в левую сторону. Матка смещается механи-
ческим устройством или с помощью валика, подложенного под правое бедро,
обеспечивающего 15 градусный наклон до рождения плода. Быстрое изменение
кровяного давления требует предварительного внутривенного вливания от 1000
до 1500 мл кристаллоидного раствора непосредственно перед выполнением бло-
ка. Может понадобиться внутривенное введение 10 мг эфедрина или внутримы-
шечная инъекция 25 мг этого препарата. Тоны сердца плода должны выслушива-
ться до последнего момента, перед выполнением разреза. По крайней мере, до
рождения ребенка должна проводиться дополнительная оксигенация матери с
пульсоксиметрическим мониторированием. Кровопотеря больше, чем при ваги-
254
Глава 22
нальном родоразрешении (около 1500 мл по сравнению с 500 мл), поэтому необ-
ходимо тщательное интраоперационное наблюдение за кровяным давлением.
Потеря крови может усиливать гипотонию и повышать число случаев тошноты.
Возможность воздушной эмболии вен или эмболизация амниотической жидко-
стью выше, чем при вагинальном родоразрешении. Кроме всех этих факторов ве-
роятность необходимости реанимационных мероприятий у новорожденного так-
же является большей (поскольку во многйх случаях кесарево сечение проводится
по жизненным показаниям для плода). В идеале неонатолог или второй анестези-
олог должны находиться в операционной при каждом кесаревом сечении.
Осложнения
В целом осложнения при использовании данных методик те же, что и у небере-
менных пациенток и контролируются также. Четыре осложнения заслуживают
специального обсуждения.
Системная токсичность
Системная токсичность является особенно нежелательной у рожениц. Венозное
полнокровие эпидурального пространства способствует внутрисосудистой инъ-
екции, быстрое кровообращение приводит к немедленному попаданию препара-
та в мозговой кровоток с немедленным развитием признаков токсичности. Более
часто отмечается сердечно-сосудистый коллапс. Он обычно связан с аорто-кава-
льной компрессией, поскольку при схватках пациентка обычно сразу же повора-
чивается на спину. Наиболее часто используемый препарат бупивакаин имеет
узкие границы безопасности и депрессивное действие на сердечную проводи-
мость. Сердечные реанимационные мероприятия затруднены вследствие давле-
ния увеличенной матки, а также снижения венозного возврата в результате
аорто-кавальной компрессии. При угнетении сердечной деятельности матери
для спасения плода может понадобиться срочное кесарево сечение. Ацидоз у ма-
тери будет приводить к ацидозу у плода, в этих услових повышается количество
местного анестетика, проходящего через плацентарный барьер и накапливающе-
гося в закисленной крови плода.
В родовых палатах семейных центров проведение реанимационных меро-
приятий может быть затруднено в большей степени в связи с отсутствием необ-
ходимого оборудования или его хранением в труднодоступном месте для созда-
ния «домашней обстановки». При наполненном желудке увеличивается
вероятность рвоты и аспирации, что неизбежно требует немедленную эндотрахе-
альную интубацию во время реанимации.
Предотвращение этого осложнения у беременных необходимо еше больше
и поэтому следует использовать тестовую дозу, дробные инъекции, минималь-
ные эффективные концентрации, а также проявлять тщательное внимание пси-
хическому статусу пациентки и появлению симптомов [19] (табл. 22.3). Испо-
льзование этих шагов достоверно снизило частоту этого осложнения после
1983 года, благодаря этому был также снижен риск летального исхода при при-
менении местной анестезии в акушерстве [11]. Новые, менее кардиотоксичные
аминоамиды ропивакаин и левобупивакаин могут помочь в дальнейшем сниже-
нии риска и сердечных осложнений при кесаревом сечении, тем не менее, ми-
нимальный риск может быть обеспечен адекватным количеством вводимого
анестетика.
Анестезия в акушерстве
255
Таблица 22.3
Обеспечение безопасности при инъекции анестетика в акушерстве
Процедура
Постоянное наблюдение за психическим
статусом
Осторожная аспирация
Тестовая доза эпинефрина
Тестовая доза местного анестетика
Комментарии
Может оказаться ненадежным тестом
в эпидуральном пространстве — лучше
использовать катетер с несколькими отверстиями
При беременности ненадежна
Надежность при беременности не проверялась
Дробная инъекция
Использование разбавленных растворов
Перемещение катетера, если блокада
неадекватна
Предпринимается при внутрисосудистом
положении катетера
Аспирация желудочного содержимого
Аспирация желудочного содержимого во время общей анестезии была признана
основной причиной материнской смертности. Все пациентки, которым выполня-
ется местное обезболивание, должны рассматриваться как возможные кандида-
ты для проведения общей анестезии, а прием твердой пищи должен быть
запрещен во время родов. Если имеется показание к кесареву сечению целесооб-
разно назначение жидких пероральных антацидов и внутривенное введение (Н2)
антагонистов гистамина (и/или метоклопрамида).
Постспинальная головная боль
У беременных постспинальная головная боль может отмечаться более часто. Хо-
тя ограничение приема жидкости и постельный режим после родов могут быть
эффективными, активное раннее лечение в виде наложения эпидуральной кровя-
ной пломбы показано для матерей, желающих сразу же вернуться домой для ухо-
да за новорожденным.
Инструментальное родовспоможение
Последним из «осложнений» при проведении анестезии, заслуживающих отде-
льного обсуждения, является увеличение числа случаев использования во время
родов с анестезией инструментального пособия. Это часто вызывает беспокойст-
ва у матерей и является темой разговора на курсах по подготовке к родам. При
эпидуральной анестезии во время родов акушерские щипцы применяются чаще,
однако, обезболивание вообще используется чаще при продолжительных (и воз-
можно менее эффективных) родах [7, 8]. Также нет очевидной связи между при-
менением щипцов и слабым изгнанием плода. Такие случаи не повышают риск
проведения кесарева сечения. Использование низких концентраций местных
анестетиков (обычно в сочетании с низкими дозами фентанила) может помочь
лучше сохранить силу изгнания и уменьшает число случаев инструментального
родовспоможения. Проведены несколько исследований, посвященных оценке
256
Глава 22
пользы снижения стресса и боли, и риска нарушения течения родов. Суждения на
эту тему остаются противоречивыми и, к сожалению, окрашены эмоциями, свя-
занными с господствующей в настоящее время в Соединенных Штатах точкой
зрения о «естественном родоразрешении». Несмотря на эти эмоции и реальные
сомнения, а также общее повышение риска, уместное анестезиологическое посо-
бие, если только оно не выходит за безопасные границы, может способствовать
успешному завершению беременности здоровой и счастливой матери.
Литература
1. Bimbach, D. J., Gatt, S. Р., Datta, S. Textbook of Obstetric Anesthesia. St. Louis: WB
Saunders, 2000.
2. Chestnut, D. H. Obstetrical Anesthesia: Principles and Practice. 2nd ed. St. Louis:
Mosby, 1999.
3. Dewan, D. M. Practical Obstetric Handbook. St. Louis: WB Saunders, 2000.
4. Hughes, S. Shnider and Levinson's Anesthesia for Obstetrics. 4th ed. Philadelphia:
Lippincott Williams & Wilkins, 2000.
5. Norris, M. C. Obstetric Anesthesia. 2nd ed. Philadelphia: Lippincott Williams &
Wilkins, 1999.
6. Practice guidelines for obstetrical anesthesia: A report by the American Society of
Anesthesiologists Task Force on Obstetrical Anesthesia. Anesthesiology 90: 600,
1999.
7. Chestnut, D. H. Does epidural analgesia during labor affect the incidence of cesarean
delivery? Reg. Anesth. 22:495,1997.
8. Halpern, S. H., Leighton, B. L., Ohlsson, A., Barrett, J. F., Rice, A. Effect of epidural vs pa-
renteral opioid analgesia on the progress of labor: A meta-analysis. JAMA. 280:2105,
1998.
9. Eisenach, J. C. Combined spinal-epidural analgesia in obstetrics. Anesthesiology 91:299,
1999.
10. Rawal, N., Van Zundert, A., Holmstrom, B., Crowhurst, J. A. Combined spinal-epidural
technique. Reg. Anesth. 22:406,1997.
11. Hawkins, J. L., Koonin, L. M., Palmer, S. K., Gibbs, С. P. Anesthesia-related deaths du-
ring obstetric delivery in the United States, 1979-1990. Anesthesiology 86: 277,1997.
12. Flamm, B. L., Lim, O. W., Jones, C., Fallen, D., Newman, L. A., Mantis, J. K. Vaginal
birth after cesarean section: Resultsofa multicenter study. Am. ]. Obstet. Gynecol 158:
1079, 1988.
13. Rageth, J. C., Juzi, C., Grossenbacher, H. Delivery after previous cesarean: A risk
evaluation. Swiss Working Group of Obstetric and Gynecologic Institutions. Obstet.
Gynecol. 93:332,1999.
14. Polley, L. S., Columb, M. O. Comparison of epidural ropivacaine and bupivacaine
in combination with sufentanil for labor. Anesthesiology 92:280,2000.
15. Ben-David, B., Miller, G., Gavriel, R., Gurevitch, A. Low-dose bupiva-caine-fentanyl
spinal anesthesia for cesarean delivery. Reg. Anesth. Pain Med. 25: 235,2000.
16. Honet, J. E., Arkoosh, V. A., Norris, M. C., Hufihagle, H. J., Silverman, N. S., Leigh-
ton, B. L. Comparison among intrathecal fentanyl, meperi-dine, and sufentanil for la-
bor analgesia. Anesth. Analg. 75: 734,1992.
17. Grieco, W. M., Norris, M. C., Leighton, B. L., Arkoosh, V. A., Hufihagle, H. J., Honet, J.
E., Costello, D. Intrathecal sufentanil labor analgesia: The effects of adding morphi-
ne or epinephrine. Anesth. Analg. 77: 1149,1993.
Анестезия в акушерстве
257
18. Bimbach, D. J., Chestnut, D. Н. The epidural test dose in obstetric patients: Has it out-
lived its usefulness? Anesth. Analg. 88: 971,1999.
19. Mulroy, M. P., Norris, M. C., Liu, S. S. Safety steps for epidural injection of local anest-
hetics: Review ofthe literature and recommendations. Anesth. Analg. 85:1346,1997.
20. Santos, A. C., Pedersen, H. Current controversies in obstetric anesthesia. Anesth.
Analg. 78: 753,1994.
21. Norris, M. C.. Ferrenbach, D., Dalman, H., Fogel, S. T., Borrenpohl, S., Hoppe, W., Ri-
ley, A. Does epinephrine improve the diagnostic accuracy of aspiration during labor
epidural analgesia? Anesth. Analg. 88: 1073,1999.
22. McGrath, J. M., Chestnut, D. H., Vincent, R. D., DeBruyn, C. S., Atkins, B. L., Podus-
ka, D. I, Chatterjee, P. Ephedrine remains the vasopressor of choice for treatment of hy-
potension during ritodrine infusion and epidural anesthesia. Anesthesiology 80:1073,
1994.
23. Hepner, D. L., Gaiser, R. R., Cheek, T. G., Gutsche, В. B. Comparison of combined spi-
nal-epidural and low dose epidural for labour analgesia. Can. J. Anaesth. 47: 232,
2000.
24. Hess, P. E., Pratt, S. D., Lucas, T. P., Miller, C. G., Corbett, T., Oriol, N., Sama, M. C.
Predictors of breakthrough pain during labor epidural analgesia. Anesth. Analg. 93:414,
2001.
Глава 23
Лечение хронической боли
Джеймс Хельман
Анестезиологам часто приходится консультировать пациентов, страдающих боля-
ми различной этиологии. Очевидно, что это связано с наличием у них опыта обез-
боливания в ходе хирургических операций. Существуют интервенционные
процедуры, направленные на видоизменение или прерывание передачи или вос-
приятия болевых импульсов. Они представляют собой диагностические и, воз-
можно, лечебные блокады нервов, которые могут привести к улучшению
состояния пациентов, страдающих хроническими болями, обусловленными злока-
чественными или доброкачественными заболеваниями. Однако успешное исполь-
зование интервенционных процедур ограничивается множеством факторов.
Выраженность боли, которая является субъективным ощущением, не имеет четкой
связи с тяжестью состояния пациента. Прогрессирование заболевания (например,
рост или инвазия опухоли) и анатомические особенности могут затруднять прове-
дение интервенционных процедур и снижать их эффективность. Кроме того, в
сложном патофизиологическом механизме боли могут принимать участие психо-
логические, социальные, финансовые и юридические факторы. Поэтому меткое
выражение Canon: «минимальная патология с максимальной дисфункцией остает-
ся загадкой хронической боли», является лаконичной формулировкой сути проб-
лемы [1]. Однако информация, полученная при невральной блокаде, позволяет
понять патофизиологию и определить локализацию ноцирецепции. Эти данные
используются в комплексном подходе к лечению пациентов с болевым синдро-
мом, который может включать пероральное и парентеральное введение лекарст-
венных препаратов, лечебные блокады и хирургические вмешательства,
дополняемые методами психологического воздействия [2].
Применение и интерпретация данных диагностических и терапевтических
блокад нервов является трудным. Некоторые, из описанных в этой книге методик,
могут с успехом применяться для лечения хронических болей. Тем не менее, мето-
дики местной анестезии не могут рассматриваться как панацея для лечения болей
любого происхождения, в частности, при хронических болевых синдромах, не свя-
занных со злокачественными заболеваниями. Ограничения связаны с точностью
выбора диагностической методики, правильностью ее использования и интерпре-
тации эффективности, как пациентом, так и врачом [3]. В данной главе описывают-
ся наиболее распространенные методики местных блокад, применяющиеся для ку-
пирования болей. Некоторые из описанных методик продолжают использоваться
скорее в силу традиций, а не благодаря своей эффективности [1].
Диагностика
Для стандартизации оценки результатов лечения необходимо всестороннее об-
следование пациентов, страдающих болями. Полученная информация может ис-
пользоваться как для оценки исходных показателей, так и для оценки изменений,
Лечение хронической боли
259
возникающих в процессе лечения. Оценка информации о болевом синдроме дол-
жна включать в себя: а) выявление основной жалобы и симптомов (характери-
стики болей; дата начала; условия возникновения; особенности болей, их
тяжесть и продолжительность; связанные симптомы; факторы, провоцирующие
возникновение болей и способствующие их стиханию); б) анамнез; в) данные о
медикаментозном лечении; г) результаты обследования органов и систем; д) се-
мейный анамнез; е) профессиональный и социальный анамнез. Физикальное об-
следование должно быть полным и включать оценку болевых ощущений в
момент проведения обследования, изучение неврологических нарушений и изу-
чение состояния костно-мышечной системы. Дифференциальная диагностика
должна проводиться с использованием рентгенологических методов обследова-
ния, электродиагностических тестов соматических функций, оценки гематологи-
ческих показателей и метаболического статуса.
Оценка выраженности боли является сложной задачей, так как пациенты со
схожими заболеваниями по-разному субъективно оценивают свое состояние. Не-
смотря на это, были разработаны и применяются различные методики оценки вы-
раженности боли и влияния на нее проводимого лечения. Одномерные шкалы из-
мерения выраженности боли просты в применении и включают в себя: а) цифро-
вые, б) визуальные, в) мимические шкалы. Эти методики не вызывают затрудне-
ний у пациентов и врачей, обладают доказанной надежностью и могут использо-
ваться для оценки эффективности обезболивания. Однако они не могут считать-
ся универсальными в связи с ограниченным выбором вариантов. Кроме того, их
использование затруднено у пожилых, умственно неполноценных и неконтакт-
ных пациентов. Дополнительным препятствием для точной интерпретации дан-
ных, полученных при интервенционных процедурах, является высокая частота
ответа на плацебо. Приблизительно у одной трети пациентов с острыми болями
отмечается ослабление болей при плацебо-вмешательствах, в группе пациентов с
хроническими болями эта цифра достигает двух третей. Таким образом, первона-
чальная и последующая оценка выраженности болевых ощущений, безусловно,
полезны, однако интерпретация полученных результатов должна проводиться
индивидуально для каждого пациента.
Дополнительные препараты и методы диагностических
и терапевтических вмешательств
Местные анестетики
Структура и фармакологические свойства местных анестетиков описаны в главе
1. Для лечения пациентов, страдающих хроническими болями, местные анесте-
тики применяются с целью создания блокад нервов, так как это ведет к прерыва-
нию ноцирецептивных путей. Считается, что блокада нервов изменяет или
прерывает передачу ноцирецептивных импульсов, рефлекторных механизмов
афферентного сегмента и самоподдерживающейся активности нейронных пулов
и спинного мозга. Кроме того, считается, что местные анестетики способны пре-
рывать цикл боль-спазм. В связи с этим блокада чувствительных окончаний
обычно приводит к ослаблению боли и прерыванию афферентных путей патоло-
гических рефлексов. В низких концентрациях местные анестетики способны
блокировать А-дельта, В и немиелинизированные С-дельта волокна без клиниче-
ски значимых нарушений моторных функций. Примечательно, что на ранних
стадиях развития хронической боли блокада нервов местными анестетиками мо-
260
Глава 23
жет приводить к облегчению болей в течение времени, превышающего фармако-
логическое действие препаратов на дни и недели. Механизм этого действия до
настоящего времени не известен, однако предполагается, что он может быть обу-
словлен физиологическими изменениями, связанными с хроническими болями.
Было показано, что внутривенное введение местных анестетиков эффектив-
но при таких сопровождающихся выраженными болями состояниях, как ожоги,
послеоперационные боли, боли центрального происхождения, деафферентаци-
онный синдром, синдром Рейно, фантомные боли, каузалгия, невриты и миофас-
циальные боли. Хотя традиционно применяемым местным анестетиком был про-
каин, выбор варьировал от хлоропрокаина до тетракаина. Ранее для устранения
болей, эти местные анестетики применялись в больших дробных дозах. Тем не
менее, для контроля скорости введения местных анестетиков применялись флоу-
метры и внутривенные насосы. Примерами внутривенного введения местных
анестетиков является введение лидокаина (0.15%) с помощью насоса по 4 мг/мин
в течение 1 часа и введение хлоропрокаина (1%) со скоростью 1.0—1.5 мг/кг/мин
до достижения общей дозы 10-20 мг/кг. Все инфузии проводятся при наличии
реанимационного оборудования и препаратов.
Кортикостероиды
Хотя введение кортикостероидов часто применялось для уменьшения отека и
воспаления вокруг нервных окончаний, эффективность и показания для приме-
нения данных препаратов окончательно не определены. Специалисты до сих пор
обсуждают тип, дозы, частоту, общее количество инъекций или возможность
применения других вмешательств. Множество исследований были проведены с
существенными нарушениями, а в систематических обзорах содержатся весьма
противоречивые выводы. Данные доступной литературы свидетельствуют о бе-
зопасности и эффективности широко применяющихся кортикостероидных пре-
паратов длительного действия, таких как метилпреднизолон (депомедрол),
триамцинолон диацетат (аристокорт), триамцинолон ацетонид (кеналог), а также
смеси ацетата и фосфата бетаметазона (целестон солуспан).
Побочное действие кортикостероидов главным образом обусловлено их хи-
мическими и фармакологическими свойствами. Основными теоретическими
осложнениями применения кортикостероидов являются подавление гипофизар-
но-надпочечниковой системы, гиперкоргицизм, синдром Кушинга, остеопороз,
аваскулярный некроз костей, стероидная миопатия, эпидуральный липоматоз,
увеличение массы тела, задержка жидкости в организме и гипергликемия. Тем не
менее, Manchikanti et al. при изучении влияния нейроаксиальных стероидов на
вес и плотность костной ткани не выявили различий между пациентами, полу-
чавшими и не получавшими кортикостероиды [4].
Частота и общее число инъекций или вмешательств является ключевой, хотя
и противоречивой и редко обсуждаемой проблемой. Некоторые авторы рекомен-
дуют делать одну инъекцию с диагностической и терапевтической целью, дру-
гие — три инъекции независимо от изменения состояния пациента; существует
точка зрения, согласно которой после трех инъекций необходимо повторение
курсов по три инъекции через 3,6 и 12 месяцев, и, наконец, ряд специалистов не
ограничивают максимальное число инъекций без указания их параметров. Каче-
ственных исследований, позволивших разрешить бы эту проблему, не проводи-
лось. Данные представленной литературы свидетельствуют о том, что наиболее
безопасными с точки зрения развития побочных эффектов являются инъекции
бетаметазона, повторяющиеся в течение 2 недель; если лечение проводится
Лечение хронической боли
261
с 6-недельными или более интервалами, любой из четырех препаратов безопасен
и эффективен [5].
Опиоды
Опиоиды обладают обезболивающим действием при системном и нейроаксиаль-
ном применении. Последовательный метод обезболивания подразумевает при-
менение пероральных неопиодных анальгетиков в сочетании с адъювантными
анальгетиками для устранения легких и средних болей с дальнейшим назначени-
ем пероральных опиоидных препаратов для устранения умеренных болей и, на-
конец, регулярное применение пероральных опиоидных препаратов
(быстродействующих и пролонгированных) при максимально выраженных бо-
лях, обусловленных злокачественными и доброкачественными заболеваниями.
Нейроаксиальные опиоиды применяются для устранения хронических болей,
обусловленных злокачественными и доброкачественными заболеваниями, в те-
чение вот уже двух десятилетий. Спинальные опиоиды обладают многообещаю-
щими показателями эффективности, однако интерпретация данных различных
исследований затруднительна в связи с различиями в критериях включения боль-
ных в выборку, показателях результативности и продолжительности наблюде-
ния. Сравнительное исследование эпидурального, субарахноидального и
интрацеребровентрикулярного введения опиоидов показало сравнимую эффек-
тивность у пациентов, страдающих раком, при этом отличные результаты были
отмечены у 60%-75% пациентов [6]. Ретроспективный опрос пациентов, стра-
давших доброкачественными и злокачественными заболеваниями, для купиро-
вания болей у которых использовалась интратекальная анестезия морфином,
показал, что в среднем боли снизились у 61% [7], в то время как у пациентов, у ко-
торых интратекальное введение морфина использовалось для купирования бо-
лей при синдроме неудачных операций на позвоночнике или арахноидите, было
малоэффективно [8]. Также как и при использовании пероральных опиоидов при
хронических болях, обусловленных доброкачественными заболеваниями, при-
менение спинальных опиоидов должно быть частью комбинированного междис-
циплинарного подхода к лечению боли. Целью лечения является не только
обезболивание, но и улучшение функционального состояния. Комбинированное
использование опиоидов и неопиоидных анальгетиков с периодическим приме-
нением местных анестетиков может быть более эффективным для купирования
нейропатических и эпизодических болей.
Под толерантностью понимают феномен снижения эффекта препарата или
необходимость повышения дозы для поддержания прежнего эффекта при его
длительном применении. Толерантность к обезболивающему действию опиои-
дов у человека после краткосрочного и длительного применения была четко по-
казана. Кроме того, имеет место толерантность к побочному действию опиоидов,
что является положительным моментом. Исследования на животных показали,
что продолжающаяся ноцирецепция может влиять на развитие толерантности к
обезболивающим препаратам. Несмотря на прогрессирование заболевания, у
многих онкологических пациентов длительно используются постоянные дозы
опиоидов. В клинических исследованиях длительного использования опиоидов у
пациентов, страдающих болями, обусловленными не злокачественными заболе-
ваниями, когда усиления ноцирецепции не происходит, увеличение дозы препа-
рата не было неизбежной клинической проблемой, хотя со временем нужда в уве-
личении дозы препарата иногда возникала.
262
Глава 23
Клиницисты должны разработать план мероприятий в отношении увеличе-
ния дозы обезболивающих препаратов и возможной толерантности у пациентов,
страдающих хроническими болями. При развитии толерантности возможны сле-
дующие подходы: 1) необходимо провести «дифференциальный диагноз» в свя-
зи со снижением обезболивающего эффекта, 2) доза опиоидов может быть увели-
чена, 3) альтернативный опиоидный препарат может применяться в меньшей
дозировке, 4) при стабилизации или снижении дозы препарата могут применять-
ся другие методики лечения боли.
Агонисты а2 -адренергических рецепторов
Агонисты аг-адренергических рецепторов в виде монотерапии или в комбина-
ции с другими лекарственными средствами приобретают все возрастающее зна-
чение в лечении интраоперационных и хронических болей. Препараты данной
группы влияют на возбудимость нервов и высвобождение медиаторов, воздейст-
вуя на многие G-протеины и на пре- и постсинаптические мембраны, как при
центральном, так и спинальном применении. При спинальном введении (эпиду-
ральном или интратекальном) агонисты а2-адренергических рецепторов подав-
ляют возбуждение нейронов задних рогов спинного мозга, индуцированное
А-дельта и С нервными волокнами. Наибольший эффект от использования
аг-агонистов наблюдается при лечении пациентов с деафферентацией и симпа-
тическими болями, обусловленными как злокачественными, так и не злокачест-
венными заболеваниями. К препаратам данной группы относятся клонидин,
гуанабенц, медетомидин и дексмедетомидин. Для выявления основных побоч-
ных эффектов, таких как гипотензия, брадикардия и седация, необходимо оце-
нить состояние сознания, измерить частоту сердечных сокращений, уровень
кровяного давления и использовать пульсовую оксиметрию (если доза препарата
более 300 мкг) [9]. Длительное использование аг-агонистов может привести к
развитию гипертензии при отмене препарата. Во избежание развития этого по-
бочного эффекта дозу бг-агонистов снижают постепенно [10].
Агонисты рецепторов у-аминомасляной кислоты.
у-аминомасляная кислота (ГАМК) является аминокислотой и служит основным ин-
гибирующим медиатором для спинного и головного мозга. Существует три типа ре-
цепторов ГАМК, обладающих различными свойствами (ГАМКд, .в и _с). Рецепторы
имеют раздельные локусы для связывания со многими классами седативных и сно-
творных препаратов, включая ГАМК, пикротоксин, барбитураты, бензодиазепины
и нейростероиды [11]. Наибольшая плотность распределения ГАМКВ рецепторов
приходится на моносинаптические 1а восходящие и нисходящие волокна. Они опо-
средуют медленное угнетение полисинаптических потенциалов и действуют на
пресинаптическом уровне, сокращая высвобождение субстанции Р и других основ-
ных медиаторов чувствительности. В норме рецепторы ГАМК в покое обладают
минимальной активностью [12]. Агонисты ГАМК, такие как баклофен, являются
эффективными обезболивающими средствами при острых болях, однако неэффек-
тивны при хронических болях. Данное явление может быть обусловлено избыточ-
ным выделением и насыщением ГАМК, что отмечается при хроническом болевом
синдроме. Агонисты ГАМК, такие как баклофен, используются при интервенцион-
ных процедурах для подавления спастической активности, обусловленной пораже-
нием спинного мозга или рассеянным склерозом [13, 14]. Баклофен подавляет
высвобождение возбуждающей аминокислоты из промежуточных нейронов спин-
Лечение хронической боли
263
ного мозга и основных афферентных путей, что приводит к миорелаксации. Препа-
рат может вводиться через постоянный интратекальный катетер и
имплантированный насос с резервуаром. Побочными эффектами препарата явля-
ются слабость, тошнота, рвота, сонливость, головокружение, атаксия и нарушения
сознания. Резкая- отмена баклофена может спровоцировать судороги. В ходе первых
исследований действия баклофена при его интратекальном введении проводились
периодические неврологические обследования для выявления мышечной спастич-
ности, а также оценка показателей гемодинамики и дыхания.
Методики диагностических и терапевтических
вмешательств
Диагностические блокады соматических нервов
Блокада отдельных периферических нервов и проводящих путей является диф-
ференциально-диагностической процедурой [15]. Терапевтическая блокада с ис-
пользованием местных анестетиков приводит к ослаблению болей на срок,
который определяется свойствами используемого препарата. Следовательно, мо-
жет потребоваться повторение этой процедуры. Положительное влияние повтор-
ных блокад нервов может облегчить приенение физиотерапии, так как они
снижают ограничение подвижности, обусловленное болью.
Блокады соматических нервов проводятся с диагностическими и терапевти-
ческими целями при хронических болях. Кроме того, данные вмешательства по-
зволяют определить эффективность нейролизиса, криоанальгезии и хирургиче-
ского пересечения нервов. К сожалению, ноцирецептивный источник боли
может находиться проксимальнее места проведения диагностического вмешате-
льства, что приводит к неправильному определению источника болевых ощуще-
ний. Кроме того, отдаленные результаты процедур денервации неудовлетворите-
льны, даже, несмотря на купирование болей при введении местных анестетиков.
Точность введения иглы обеспечивается знанием анатомии и особенностями
окружающих тканей, использованием рентгенологических методов, стимуля-
цией нервов и выявлением парестезии при введении иглы.
Данные, полученные при диагностических и терапевтических блокадах пе-
риферических нервов, должны тщательно изучаться, так как хронические боли
могут вызываться не только ноцирецептивным механизмом [16]. Хронические
боли, обусловленные повреждением периферических нервов, могут не зависеть
от периферической импульсации. Болевой синдром может быть обусловлен
спонтанной нервной активностью или нарушением проведения нервных импуль-
сов на супраспинальном уровне или в спинном мозге (центральная чувствитель-
ность). Диагностические процедуры, успешные лишь отчасти, скорее запутыва-
ют, чем вносят ясность. Кроме того, блокада периферических нервов имеет
ограниченное диагностическое значение в отношении прогноза результативно-
сти пересечения нервов и других методов денервации. Таким образом, диагнос-
тические блокады периферических нервов должны быть частью комплексного
подхода к диагностике и лечению хронической боли.
Блокада симпатического сплетения
Симпатические боли обусловлены симпатической эфферентной иннервацией
или нейрохимическим действием катехоламинов, а также действием катехола-
минов на кровообращение [17]. Боли, выраженность которых снижается при
264
Глава 23
симпатолитических процедурах (при использовании лекарственных средств или
путем проведения блокад симпатических нервов), могут рассматриваться как
симпатические, хотя в некоторых случаях достигается только временное обезбо-
ливание [18], степень симпатической дисфункции может быть не связана со сте-
пенью обезболивания или эффективностью симпатической блокады. В связи с
тем, что симпатические ганглии отделены от соматических нервов (за исключе-
нием торакальной области) возможно проведение селективной блокады симпа-
тических стволов без нарушения чувствительных и моторных функций.
Диагностическое и терапевтическое действие симпатических блокад при хрони-
ческих болях обусловлено следующими механизмами:
1. Блокада афферентных висцеральных ноцирецептивных волокон может при-
вести к ослаблению или устранению висцеральных болей;
2. Блокада симпатических эфферентных волокон может предотвратить взаимо-
действие между ноцирецептивной и симпатической нервной системой при
симпатических болях, обусловленных комплексными синдромами местных
болей;
3. Приводя к вазодилятации, симпатическая блокада может ослабить ишемиче-
ские боли и ускорить заживление хронических язв при неоперабельном забо-
левании периферических сосудов.
Нейролизис
Нейроаблация использовалась в дополнение к другим процедурам при трудно-
устранимых болях, обусловленных вторичным поражением при злокачествен-
ных заболеваниях, и иногда при болевом синдроме, сопровождающем не
злокачественные заболевания. Нейролизис следует применять только в отдель-
ных случаях при постоянных болях. Нейролизис дает более хорошие результаты
при болях соматического и висцерального происхождения, нежели чем при ней-
ропатических болях. Нейролизис следует использовать для лечения только тех
пациентов, у которых ни активная медикаментозная терапия, ни другие консер-
вативные методы лечения не дали результатов. Существует множество методов
нейролизиса - химические, термические и хирургические. В данной главе хирур-
гические методы не рассматриваются.
Химический нейролизис. Для лечения болевого синдрома применяются сле-
дующие нейролитические химические вещества: этиловый спирт, фенол и иногда
сульфат аммония, хлорокрезол и глицерин. Абсолютный этанол приводит к удале-
нию холестерина, фосфолипидов и цереброзидов из Нервной ткани и осаждает ли-
"лопротеины и мукопротеины. Этанол быстро распространяется из места введения.
Объем вводимого вещества обычно невелик и поэтому эффект употребления алко-
голя отсутствует. Однако могут развиваться осложнения, включая местное по-
вреждающие действие на ткани разной степени выраженности — от раздражения
до целлюлита и некроза. Иногда нейролизис с использованием спирта сопровож-
дается развитием болей в месте инъекции, невралгией различной продолжитель-
ности (от недель до месяцев), снижением чувствительности в зонах, иннервируе-
мых лизированным нервом (-ми). Разъяснение возможных осложнений пациенту
может уменьшить стрессовую реакцию при их развитии. Люмбальное и сакраль-
ное интратекальное введение этанола может привести к недержанию кала и мочи.
Предотвратить данное осложнение может проведение манипуляций при правиль-
ном положении пациента, а также гипобарические свойства этанола. Соматиче-
ская невралгия и параплегия вследствие сосудистого спазма могут наблюдаться
при симпатическом люмбальном нейролизисе алкоголем. Для нейролизиса алко-
Лечение хронической боли
265
голь предпочтительно вводить интратекально, в чревное сплетение, в поясничную
симпатическую цепочку, черепные нервы, паравертебрально и эпидурально.
Фенол или карболовая кислота — это производное моногидроксибензола,
плохо растворимое и медленно проникающее в ткани. Фенол вызывает неселек-
тивную денатурацию белков аксонов и переневральных кровеносных сосудов.
Дегенерация нервов происходит в течение приблизительно 14 дней, а восста-
новление — в течение 14 недель. В отличие от абсолютного этанола фенол вы-
зывает менее выраженную нейролитическую блокаду на менее продолжитель-
ное время. В сочетании с глицерином и контрастными растворами фенол
образует гипербарическую смесь. В низких концентрациях фенол действует
как местный анестетик, а в высоких концентрациях - как нейролитический пре-
парат. Поэтому введение фенола сопровождается менее выраженными болями,
чем введение этанола. При введении фенола вблизи крупных кровеносных со-
судов (например, чревное сплетение) следует учитывать высокое сродство пре-
парата к сосудистой ткани. Повреждение кровеносных сосудов может быть па-
тогенетическим фактором нейротоксического действия (например,
параплегии), присущего фенолу. Кроме того, также как и этанол, фенол при
подкожном введении может приводить к изъязвлению. С целью нейролизиса
фенол рекомендуется вводить эпидурально, паравертебрально, интратекально
и в область черепных и периферических нервов [19].
При введении химических нейролитических препаратов положение пациента
должно соответствовать баричности используемого вещества, особое внимание
необходимо уделить выбору места инъекции, а при введении препарата следует
периодически проводить аспирацию для предотвращения внутрисосудистого или
незапланированного интратекального введения вещества. Для определения поло-
жения иглы могут использоваться контрастные вещества и рентгенологические
методы, а также проводить периодические неврологические обследования во
время, и после проведения манипуляции.
Криолиз и криоанальгезия. В результате гипотермии нервных окончаний
развивается нейролизис различной продолжительности. Применение холода
приводит к удалению свободной воды из раствора. Образование кристаллов льда
вызывает изменения осмолярности тканей, проницаемости клеточной стенки и
разрушение миелина нервных окончаний [20]. Это приводит к повреждению ак-
сонов в зоне охлаждения. Однако эпиневрий, периневрий и эндоневрий не по-
вреждаются. Данный метод достаточно безопасен, однако, к сожалению, продол-
жительность обезболивания может быть различной.
Криолизу может быть подвергнут любой нерв, который можно выделить
прецизионно. Данный метод может применяться для устранения болей, обуслов-
ленных поражением периферических нервов, тазовых болей, болей в суставах
позвоночника, межреберной невралгии и лицевых болей. Первоначально нервны
блокируются местной анестезией, затем до выполнения лизиса дожидаются их
возвращения к исходному функциональному состоянию. Такой подход позволя-
ет выявить чувствительные ветви и предотвратить лизис двигательных нервов.
Кроме того, точное положение дистального конца криозонда может быть опреде-
лено с помощью рентгеноскопии. До начала манипуляции следует проверить со-
стояние оборудования для предотвращения негерметичности криозонда. Хотя
криозонды имеют изоляцию, повысить безопасность их использования, можно
вводя зонд через внутривенный катетер большого калибра. Следует подчерк-
нуть, что проведение криолиза может сопровождаться выраженными болевыми
ощущениями в начале цикла замораживания, о чем следует уведомить пациен-
тов. Кроме того, может потребоваться применение обезболивания и седации. Та-
266
Глава 23
ким образом, при проведении криолиза следует тщательно выделить чувствите-
льные нервные волокна путем стимуляции, контролировать положение
криозонда с помощью рентгеноскопии, использовать местные анестетики для
диагностических целей и вести мониторинг гемодинамических параметров и по-
казателей дыхания при использовании седативного воздействия [21].
Высокочастотный нейролизис. Электрический ток используется для раз-
рушения нервных структур и болевых проводящих путей. Термическое повреж-
дение при использовании высокочастотного воздействия развивается при нагре-
вании нервной ткани выше 45 °C. Повышение температуры происходит за счет
теплоты «трения», обусловленной движением молекул, в зоне действия перемен-
ного тока. Ток возникает из волн высокой частоты, которые образуют электро-
магнитное поле вокруг активного электрода. Активный электрод помещается в
зоне прохождения нерва, на который производится воздействие, а пассивный
электрод размещается таким образом, чтобы минимизировать прохождение тока
через сердце. Активный электрод не нагревается самостоятельно. Повышение
температуры происходит в результате прохождения электрического тока через
окружающие ткани. Постепенное увеличение мощности приводит к повышению
температуры тканей и термопары, соединенной с активным электродом. Мощ-
ность повышается до тех пор, пока не будет достигнута необходимая температу-
ра и требуемый объем воздействия. Оборудование для высокочастотного воздей-
ствия должно позволять 1) измерять сопротивление, силу тока и напряжение; 2)
вырабатывать волны различных частот; 3) точно измерять продолжительность
поддержания заданной температуры конца зонда. Таким образом, высокочастот-
ный генератор, снабженный термопарой с иглой, позволяет осуществлять введе-
ние, воздействие и мониторинг с помощью одного устройства. Преимуществами
устройств подобного рода является: низкая частота образования невром и низкая
частота тепловых повреждений окружающих тканей при контроле воздействия и
определения положения зонда электростимуляцией окружающих тканей; воз-
можность проведения процедур под местной анестезией или под седативным
воздействием; возможность повторения процедур при регенерации [22-24].
Показаниями для высокочастотного воздействия являются болевые синдро-
мы с вовлечением ганглиев на любом уровне (звездчатый, крылонебный, трой-
ничный, шейный, грудной, поясничный и крестцовый) и небольших суставов от
шейного до крестцового отделов позвоночника. Чрескожная хордотомия широко
применятся в лечении болей, вызванных раком, особенно при болях в противопо-
ложной стороне туловища. К осложнениям высокочастотного воздействия отно-
сятся невралгии, неполное разрушение симпатических стволов, пневмоторакс,
синдром Горнера и двигательный паралич. Для предотвращения указанных
осложнений необходимо [22-24]: 1) удостовериться в целостности изоляции
иглы, нарушение которой может привести к поражению тканей по ходу ее введе-
ния; 2) введение иглы осуществлять под контролем рентгеноскопии или компью-
терной томографии; 3) проводить стимуляцию с использованием широкого спек-
тра частот для точного позиционирования зонда и предотвращения повреждения
двигательных нервов. Пациенты с водителями ритма сердца составляют особую
группу и нуждаются в электрокардиографическом наблюдении. У пациентов с
имплантированными кардиостимуляторами применение радиочастотного воз-
действия может быть небезопасно.
Лечение хронической боли
267
Нейромодуляция спинного мозга
Впервые стимуляция спинного мозга при хронических болях была применена в
1967 году [25]. Предполагалось, что основным механизмом действия является
стимуляция крупных миелиновых волокон (А-бета) задних рогов спинного моз-
га. В последующем комплекс этого механизма был дополнен активацией нисхо-
дящих активирующих систем, воздействием на задние корешки, антидромной
стимуляцией, подавлением центральных симпатических нейронов и активацией
нейротрансмиттеров (нейромодуляторов) [26]. Эффективность данной методики
при правильном отборе пациентов возросла с введением в практику имплантиру-
емых электродов (электродный массив) [27], пульсовых генераторов, управляе-
мых компьютером, и высокочастотных устройств [28]. North et al., изучив
собственный двадцатилетний клинический опыт, установили, что у 52% пациен-
тов с имплантированными стимуляторами спинного мозга отмечается уменьше-
ние болей не менее, чем на 50% (при среднем сроке наблюдения 7 лет) [29].
Факторами, способствующими успеху лечения, были: 1) женский пол; 2) деаф-
ферентация или поражение нервов (в отличие от ноцирецептивных болей) и 3)
малое число операций в анамнезе [29]. Другими критериями отбора пациентов
для чрескожной стимуляции были объективные патологические данные, неэф-
фективность всех консервативных методов лечения, а также отсутствие призна-
ков грубых психиатрических расстройств и лекарственной зависимости. В
настоящее время диагностическими показаниями для стимуляции являются: 1)
периневральный фиброз (постламинэктомический синдром); 2) симпатические
боли; 3) адгезивный арахноидит; 4) повреждение периферических нервов (не-
вралгия); 5) заболевания периферических сосудов, сопровождающиеся ишеми-
ческими болями; 6) фантомные боли; 7) поражения спинного мозга с развитием
сегментарных болей и 8) стенокардия.
У пациентов, рассматривающихся в качестве кандидатов, четко определяет-
ся область возникновения болей, после чего в эпидуральное пространство вво-
дится пробный электрод (рис. 23.1). Электрод подсоединяется к пробному сти-
мулятору, после чего производится регуляция тока для достижения
обезболивающего эффекта. Если достаточная степень обезболивания достигнута
при пробной стимуляции, под кожей проводится проводник, который подсоеди-
няется к постоянному стимулятору, имплантированному в брюшную стенку. По-
стоянный стимулятор может быть запрограммирован с помощью внешнего
устройства. С другой стороны, при достижении обезболивания более крупные и
более прочные проводники могут быть введены через хирургический разрез и
также подключены к стимулятору.
Осложнениями введения электрода и имплантации пульсового стимулятора
или ресивера являются инфицирование ран, электромеханические поломки
(электрода, ресивера, пульсового генератора), смещение электрода и иногда
фиброз вокруг катетера [28]. Нейромодуляция может не дать эффекта при непра-
вильном скрининге пациентов во время чрезкожонй пробы (недостаточная дли-
тельность пробной стимуляции для определения эффективности), а также при
наличии у пациентов неправильных представлений об эффективности и возмож-
ностях методики [29].
Рентгенологические методы обследования
Рентгеноскопия и отчасти компьютерная томография являются важными допол-
нительными методами при выполнении интервенционных процедур в области
головы, шеи, грудной клетки, живота и таза. Рентгенологические методы позво-
268
Глава 23
Рис. 23.1. Имплантация стимулятора спинного мозга.
Пробный проводник вводится через эпидуральный катетер (А) и его положение определяется при
рентгеноскопии (Б). При достижении достаточной степени обезболивания проводник проводится
под кожей и присоединяется к программируемому имплантируемому стимулятору (В)
ляют обеспечить максимальную безопасность и эффективность вмешательств,
выполняемых с целью нейроаблации..Кроме того, применение при рентгеноско-
пии контрастных веществ повышает точность введения иглы (зонда). Контраст-
ные вещества, использующиеся при рентгеноскопии, являются ионными или
неионными веществами, имеющими в своем составе трехйодистое бензольное
кольцо. Применение неионных контрастных веществ (йопамидол [Isovue],
йогексол [омнипак]) по сравнению с ионными контрастными веществами (диа-
тризоат меглумин [ренографии, гипак], йоталамат меглумин [конрей]) снижает
риск токсического действия на ЦНС при введении вблизи центральных структур
нервной системы. Ионные контрастные вещества безопасны при введении вдали
от центральных структур нервной системы. Однако контрастные вещества могут
оказывать местное и системное токсическое действие. Признаки токсического
воздействия весьма вариабельны: от крапивницы и изъязвлений на коже (редко)
до бронхоспазма и анафилаксии. Лечение включает в себя воздействие на гипок-
семию, гипотонию и бронхоспазм [30-32].
Лечение отдельных синдромов: болевой синдром
при не злокачественных заболеваниях
Костно-мышечные боли в спине
Среди всех хронических болей большинство составляют боли в спине, включая
боли в шее, грудном и пояснично-крестцовом отделах позвоночника. Боли в спи-
не включают любые боли, обусловленные поражением позвонков, межпозвоноч-
ных дисков, спинного мозга, нервных корешков, суставов позвонков, связок и
мышц спины. Установлено, что у 15% жителей США отмечаются эпизодические
Лечение хронической боли
269
или постоянные боли в нижней части спины, наблюдающиеся в течение всей
жизни у 65%-80% [33]. При этом распространенность болей в шейном отделе
ниже, чем в нижней части спины, и составляет 35%-40%, из которых 30% пере-
ходит в хроническую форму [34]. Сведения о продолжительности болей в спине
разнятся. Считается, что в большинстве случаев боли сохраняются в течение ко-
роткого времени — в 80%-90% боли проходят в течение 6 недель, независимо от
используемого метода лечения; у 5%—10% пациентов боли переходят в хрониче-
скую форму. Однако данное утверждение поставлено под сомнение, поскольку
при данном состоянии имеется тенденция к рецидивам, и, таким образом, у боль-
шинства пациентов отмечаются множественные обострения. Данные других ис-
следований свидетельствуют о том, что боли в нижней части спины сохраняются
в течение 3 месяцев в 35%-79% случаев и до 12 месяцев в 35%-75% случаев [35].
История применения интервенционных методов лечения началась в 1901
году, когда впервые была произведена эпидуральная инъекция по поводу комп-
рессии нервного корешка поясничного отдела позвоночника. С тех пор техника
эпидуральных инъекций была в значительной мере усовершенствована, и были
разработаны другие интервенционные методы лечения. К интервенционным ме-
тодам лечения относятся не только нервные блокады, но и малоинвазивные хи-
рургические вмешательства, среди которых блокады периферических нервов,
инъекции в триггерные точки, эпидуральные инъекции, инъекции в межие сус-
тавы, блокады симпатических нервов, нейроаблация, внутридисковая термотера-
пия, декомпрессия дисков, имплантация морфиновых насосов и стимуляция
спинного мозга (см. раздел «Нейромодуляция» этой главы).
Обоснованием для использования диагностических и терапевтических бло-
кад нервов при болях в спине служит тот факт, что изучение клинической карти-
ны и применение визуализационных и нейрофизиологических методов исследо-
вания не позволяет выявить причину болей в спине у большинства пациентов, у
которых отсутствуют грыжи межпозвоночных дисков и неврологические рас-
стройства. Кроме того, было установлено, что частота неточных и неполных диа-
гнозов у пациентов, обратившихся за помощью в центры лечения боли, составля-
ет 40%-67%, а наличие органических изменений ошибочно трактовалось как
психосоматические изменения в 98 % подобных случаев [36]. Наконец, наиболее
значимой причиной служит тот факт, что даже опытные врачи, используя все до-
ступные диагностические методики, затрудняются в постановке правильного
диагноза в 85 % случаев хронических болей в нижней части спины. Таким обра-
зом, чрескожные инъекции рассматриваются как предпочтительный, а иногда и
решающий, интервенционный метод диагностики и лечения хронических болей.
Основным преимуществом различных типов инъекций является то, что дли-
тельность обезболивания значительно превышает относительно малую продолжи-
тельность фармакологического действия местных анестетиков и других использу-
емых при этом препаратов. Считается, что при блокаде нервов нарушается или
прекращается проведение ноцирецептивных импульсов, подавление рефлектор-
ных механизмов афферентных путей и самоподдерживающейся активности ней-
ронных пулов и центральных структур. Кроме того, считается, что под действием
местных анестетиков прерывается цикл «боль-спазм», в то время как кортикосте-
роиды уменьшают выраженность воспаления, подавляя синтез и выделение мно-
гих провоспалительных веществ. К механизмам действия кортикостероидов отно-
сятся стабилизация мембран, подавление синтеза и действия нейропептидов,
подавление активности фосфолипазы А2, длительное подавление импульсной ак-
тивности нейронов, подавление сенсибилизации нейронов задних рогов спинного
мозга, а также обратимый местный обезболивающий эффект [5].
270
Глава 23
Хотя эпидуральное введение кортикостероидов нередко применяется для
устранения отека и воспаления вокруг нервных корешков, эффективность и по-
казания для их использования до сих пор окончательно не определены. Множе-
ство исследований были проведены с существенными нарушениями, а в система-
тических обзорах содержатся весьма противоречивые выводы. Если и
достигалось обезболивание, то весьма непродолжительное, кроме того, не было
получено данных, подтверждающих эффективность эпидурального введения для
лечения болей в спине при отсутствии ишиаса [37]. Был проведен мета-анализ
данных 11 клинических исследований, в которых принимало участие 907 паци-
ентов, страдающих ишиасом при наличии клинических признаков раздражения
или компрессии нервных корешков. В разных исследованиях различалась лока-
лизация эпидуральных инъекций (люмбальная или каудальная) и используемые
препараты (метилпреднизолон, триамцинолон и гидрокортизон) [38]. Таким об-
разом, имеющиеся данные свидетельствуют о том, что эпидуральные инъекции
кортикостероидов приводят к краткосрочному облегчению болей в ногах, однако
малоэффективны при болях в спине и не влияют на функциональное состояние
при грыжах межпозвоночных дисков [39].
Недавно было завершено исследование Abram, посвященное эффективно-
сти эпидурального введения стероидов при люмбосакральной радикулопатии
[40]. Применялись различные методики эпидуральных инъекций стероидов (кау-
дальные, поясничные, торакальные, шейные эпидуральные, экстрафораминаль-
ные и трансфораминальные). В качестве основного показания рассматривались
боли, обусловленные радикулопатией, особенно если они были связаны с гры-
жей межпозвоночных дисков, и сопровождались снижением чувствительности
кожи и положительными признаками ишиаса. Наличие в анамнезе операций на
позвоночнике и большая длительность заболевания являлись плохими прогнос-
тическими факторами в отношении успешности предстоящего лечения. Сдавле-
ние спинного мозга также снижало шансы на успех лечения. По мнению автора
исследования иглу следовало вводить на уровне пораженного нервного корешка.
Эффективность трансфораминальных инъекций подтверждает это мнение. Од-
нако при компрессии нервных корешков возрастает риск травмирования нер-
вных корешков при введении иглы, а достоверные данные о соотношении преи-
муществ и риска при этом отсутствуют.
Наконец, эффективность любых методов лечения многократно снижается,
если боли обусловлены выполняемой работой и являются причиной выплаты
компенсаций по нетрудоспособности или являются предметом правовых взаимо-
отношений [41]. Необходимо подчеркнуть, что эпидуральное введение стерои-
дов не является окончательным методом лечения. Они могут применяться для
временного купирования болей, позволяя начать физиотерапию, и всегда дол-
жны дополняться обследованием, направленным на выявление причины болей.
Миофасциальные синдромы
Миофасциальные боли характеризуются пальпируемой напряженностью отде-
льных мышц. Эти боли обусловлены такими заболеваниями, как радикулопатия
и артропатия. Эти болезненные расстройства мышц и фасций являются примера-
ми «болевого цикла», при котором первичная мышечная боль или напряжение
вызывают спазм и, возможно, местную ишемию, что усиливает исходное боле-
вое ощущение и формирует порочный замкнутый круг. Спазм может привести к
нарушению положения тела или походки. Во многих случаях боли в мышцах или
фасциях приводят к формированию триггерных точек, надавливание на которые
Лечение хронической боли
271
вызывает обострение симптомов с воспроизведением зон болезненности. Основ-
ным методом лечения является интенсивная физическая реабилитация и растя-
жение мышц, что приводит к нормализации функционального состояния,
снижению рубцевания и образования контрактур. Кроме того, у многих пациен-
тов нормализация функционального состояния окончательно разрывает болевой
цикл.
Анестезиолог может внести свой вклад в лечение пациентов данной группы,
временно купировав циклические боли и создав условия для начала физиотера-
пии. Обезболивание может быть достигнуто за счет инъекций в триггерные точ-
ки. Хотя имеются данные о том, что обезболивание достигается в результате са-
мого факта введения иглы в триггерную точку [42], обычно в каждую
триггерную зону вводят небольшое количество длительно действующих мест-
ных анестетиков. Часто необходимо тщательное обследование с целью выявле-
ния не только активных, но и латентных триггерных зон. Некоторые специали-
сты вводят и пролонгированные кортикостероидные препараты, исходя из
предположения, что активность триггерных зон поддерживается и за счет хрони-
ческого воспаления. Однако преимущества данного метода лечения не подтвер-
ждены. Кроме того, может оказаться полезной чрескожная электростимуляция
нервных окончаний.
Синдромы ущемления нервов
Одной из форм хронических болей является четко отграниченная дизестезия по
ходу отдельных периферических нервов. Данное состояние нередко развивается
после перенесенных хирургических вмешательств, при которых происходит не-
преднамеренное пересечение или прошивание нервов. Наиболее часто подобные
нарушения формируются в зоне торакотомических и герниорафических разре-
зов, где периферические нервы проходят в непосредственной близости от зоны
хирургического вмешательства. Обычно боли возникают не остро, а развиваются
по мере формирования невромы в зоне регенерации поврежденного нерва. Вве-
дение местных анестетиков по ходу нерва проксимальнее зоны болезненности
приводит к временному обезболиванию, что помогает подтвердить диагноз.
Хотя некоторые исследователи сообщали о превосходном обезболивающем эф-
фекте при введении нейролитических препаратов, анестезиологи мало что могут
предложить пациентам данной группы, кроме подтверждения диагноза, кроме
того, может потребоваться повторное хирургическое вмешательство [43].
Парестезическая мералгия. Данный синдром связан с ущемлением наруж-
ной кожной ветви бедренного нерва ниже паховой- связки в том месте, где она
проходит медиальнее передней верхней ости подвздошной кости. Пациенты жа-
луются на парестезии и боль по передней или боковой поверхности бедра. Симп-
томы заболевания обычно усиливаются при ношении тугих поясов или тесной
одежды, а также при длительном стоянии. Диагностическая блокада нерва с ис-
пользованием местных анестетиков помогает подтвердить диагноз, однако лече-
ние ограничивается рекомендациями по снижению веса, подбору одежды и тер-
пения в ожидании выздоровления.
Комплексный синдром региональных болей
В середине XIX века Claude Bernard со своими коллегами-неврологами обнару-
жили связь между болью и симпатической нервной системой. Хотя название со
временем менялось (каузалгия, рефлекторная симпатическая дистрофия, комп-
272
Глава 23
лексный синдром региональных болей), проблема сохраняла свою актуальность.
Несмотря на то, что первоначальными критериями Международной Ассоциации
по Изучению Боли были только субъективные ощущения и наличие признаков и
симптомов в анамнезе, в дальнейшем встал вопрос об определении объективных
критериев. Рекомендуется включить в диагностические критерии хотя бы по од-
ному симптому из следующих четырех диагностических категорий, выделенных
факторным анализом: нарушение чувствительности (гиперестезия), вазомотор-
ные расстройства (температурная и/или цветовая асимметрия кожи), нарушение
иннервации потовых желез/отек (асимметричный отек пораженной конечности
и/или асимметричное потоотделение); а также дополнительный набор симпто-
мов, выработанный на основе факторного анализа: моторные/трофические нару-
шения (нарушение моторики или объективные признаки расстройства трофики)
[44].
У пациентов, страдающих синдромом региональных болей, выявляются
крайне гетерогенные симптомы. Неотъемлемым признаком заболевания являет-
ся боль и дисфункция симпатической нервной системы. Наиболее часто пациен-
ты жалуются на спонтанно возникающую жгучую, острую боль. Врач, проводя-
щий обследование, должен подтвердить наличие нарушений центральных
функций, выявив признаки аллодинии (незначительная стимуляция, ставшая те-
перь болезненной) или гиперпатии (слегка болезненная стимуляция, теперь со-
провождающаяся выраженными болевыми ощущениями, и/или болевые ощуще-
ния сохраняются в течение длительного времени).
Все методы лечения главным образом направлены на функциональное вос-
становление; блокады и психотерапия предназначены для пациентов, у которых
функциональный подход не дал результата. Комплексные методики лечения
боли, направленные на восстановление функции, обладают наибольшей эффек-
тивностью; их применение может сопровождаться нормализацией центральных
функций и/или исчезновением дистальных расстройств.
Для лечения синдрома региональных болей широко применяются симпати-
ческие блокады с использованием местных анестетиков [45]. С целью обезболи-
вания и для устранения вегетативных нарушений, связанных с синдромом регио-
нальных болей (нарушения кровообращения, температуры, потоотделение и
отеки) в публикациях, посвященных лечению взрослых, рекомендуется раннее
применение симпатических блокад, однако контролируемых исследований не
проводилось. Если функциональное восстановление не принесло результатов, по
этическим и экономическим соображениям оправданно краткосрочное пробное
применение небольшого число нервных блокад.
Внутривенная региональная анестезия используется как диагностический и
терапевтический метод при симпатических болях. Для внутривенной региональ-
ной анестезии используются местные анестетики в сочетании с гуанетидином,
бретилиумом, клонидином или стероидами. Целевые механизмы действия мест-
ных анестетиков при внутривенной региональной анестезии временны, к ним от-
носятся: 1) изменение проводимости мелких нервов и нервных окончаний; 2) из-
менение проводимости проксимальных нервных стволов; 3) ишемия нервных
структур и 4) непосредственная компрессия нервных волокон. Внутривенная ре-
гиональная анестезия с использованием гуанетидина и бретилиума оказывает
длительное действие у пациентов, страдающих симпатическими болями, подав-
ляя выделение норадреналина из нервных окончаний и благодаря способности
гуанетидина истощать запасы норадреналина в тканях.
Лечение хронической боли
273
Опоясывающий герпес (постгерпетическая невралгия)
К анестезиологам нередко обращаются по поводу болей, обусловленных опоясы-
вающим герпесом. Вирус опоясывающего герпеса вызывает острые боли и обра-
зование пузырьков на коже в области иннервации пораженного
черепномозгового или корешка периферического нерва. Обычно болезнь прохо-
дит самостоятельно, однако в острый период боли могут причинять значитель-
ные неудобства. Кроме того, у 30%-50% инфицированных пациентов старше 50
лет развиваются хронические боли в зоне соответствующего дерматома. Анесте-
зиологов в прошлом просили выполнять симпатическую блокаду с целью обез-
боливания или для уменьшения выраженности посттерапевтической невралгии,
однако возможности медикаментозной терапии вытеснили такой подход. При
развитии невралгии более эффективным является применение центрально дейст-
вующих препаратов. Нейролитические лекарственные средства при данном син-
дроме не используются.
Фантомные боли
Фантомные боли являются примером нейропатических болей, которые развива-
ются у 60%-80% пациентов, перенесших ампутацию [46]. Распространенность
фантомных болей не зависит от возраста у взрослых, пола и места ампутации.
Фантомные боли развиваются в ранние сроки после ампутации (более чем у 75%
пациентов — в первые дни после операции). Переходу боли из острой послеопе-
рационной в хроническую вероятно способствует множество факторов, однако в
связи с тем, что у многих пациентов боль развивается вследствие наличия недо-
статочности кровообращения до операции, это может привести к предопераци-
онной центральной сенситизации и увеличить риск развития хронических болей.
Данная гипотеза подтверждена результатами исследований, показавших, что
эпидуральное введение местных анестетиков и опиоидов (бупивакаина и морфи-
на) за 72 часа до операции приводит к снижению частоты развития фантомных
болей после ампутации [47]. Для изучения влияния периоперационной анальге-
зии на частоту развития фантомных болей применялись различные методики ре-
гионального обезболивания. Была выявлена эффективность методик эпиду-
рального введения лекарственных препаратов [48, 49] и отсутствие эффекта от
футлярных блокад периферических нервов [50].
Существует несколько механизмов развития фантомных болей, участие в
которых принимают периферические нервные структуры, а также головной и
спинной мозг. Первоначально процесс формируется на периферии с последую-
щим вовлечением спинного и головного мозга. При наличии интенсивных болей
перед ампутацией значительно возрастает частота болей в культе, а также фан-
томных болей возникающих спустя 1 неделю или 3 месяца после ампутации [51].
Однако по данным более современных исследований эпидуральная блокада, на-
чатая в среднем за 18 часов до операции и продолженная в послеоперационном
периоде, не приводит к уменьшению частоты фантомных болей и болей в культе,
по сравнению с контрольной группой, пациентам которой эпидурально вводился
физиологический раствор и которым перорально или внутримышечно вводились
опиоиды [52]. Тем не менее, пациентам обеих групп в послеоперационном пери-
оде в среднем в течение 166 часов эпидурально вводился бупивакаин и морфин.
Современные препараты могут быть недостаточно специфичными и мощными
(и создавать блокаду недостаточной продолжительностью) для предотвращения
развития и персистенции центральной сенсибилизации.
10—1685
274
Глава 23
Подходы к лечению отдельных синдромов: болевой
синдром при злокачественных новообразованиях
Боли при злокачественных новообразованиях
Лечение острых болевых синдромов является благодатным занятием для анестези-
олога, позволяющим быстро добиться очевидных результатов. Лечение хрониче-
ских болей представляет собой куда более трудную задачу. Чтобы начать лечение,
требуется приложить множество усилий и времени, а результатов приходится
ждать долго и порой напрасно. Пациенты, страдающие онкологическими заболе-
ваниями, тем не менее благодарны за любое облегчение своего состояния. Эпиду-
ральное введение опиоидов и невролитические блокады вознаграждают пациентов
и врачей за потраченное на это время. Существует множество факторов, участвую-
щих в развитии болей при злокачественных новообразованиях (непосредственное
поражение, сдавление или даже действие химиопрепаратов). В лечении болей так-
же существует несколько подходов.
Установка постоянных катетеров для эпидурального и спинномозгового
введения опиоидов. У многих пациентов при болях в грудной клетке, брюшной
полости, области таза или нижних конечностях, возникших в результате первич-
ной опухоли или метастазов в кости со временем пероральный прием анальгетиков
становится неэффективным или вызывает неприемлемые побочные эффекты. У
таких пациентов уменьшения болей можно добиться путем эпидурального введе-
ния опиоидов. При этом принципы и механизмы лечения такие же, как и описан-
ные ранее при послеоперационных болях, однако большое значение имеет отсут-
ствие нарушения сознания. Кроме того, у пациентов данной группы реже
наблюдаются побочные эффекты (в частности, угнетение дыхания) в связи с уже
имеющейся толерантностью к действию опиоидов. В действительности же, при
лечении таких пациентов к эпидуральному введению препаратов прибегают толь-
ко после того, как пероральный и парентеральный прием больших доз опиоидов
становится неэффективным. Опиоиды не подходят для лечения пациентов со сдав-
лением спинного мозга и нейропатическими болями [2], хотя инфузии местных
анестетиков могут облегчить их боль. Противопоказаниями являются нарушения
свертываемости крови и развитие инфекционных процессов в зоне введения.
Пробное эпидуральное введение морфина может быть осуществлено в тече-
ние 2-3 дней через временный катетер. Обычно эпидурально вводимая доза мор-
фина составляет одну десятую от внутривенной дозы. Однако расчет начальной
дозы у этих толерантных к опиоидам пациентов является трудным. Этот расчет
должен производиться с учетом возраста пациента, выраженности боли, приме-
няемой дозы опиоидов и наличия нейропатических болей (резистентных к опио-
идам) [53]. Очевидно, что исходная доза должна быть скорректирована. При до-
стижении адекватного уровня обезболивания, хирургическим способом может
быть имплантирован постоянный силиконовый катетер, соединенный со вторым
силиконовым катетером, выведенным под кожей на переднюю брюшную стенку
(рис. 23.2). Для периодического ведения препаратов катетеры присоединяются к
подкожному инъекционному порту, наличие которого снижает риск инфициро-
вания й смещения катетеров. Чрескожно введенные катетеры могут присоединя-
ться к внешним устройствам постоянного введения препаратов, использование
которых несложно. Стоимость подкожных программируемых насосов ограничи-
вает их использование при лечении пациентов с небольшой продолжительно-
стью жизни и драматически меняющимися требованиями к обезболиванию.
Лечение хронической боли
275
Рис. 23.2. Подкожный насос для эпидурального введения препаратов.
Постоянный силиконовый эпидуральный катетер вводится чрескожно или через хирургический
разрез, а затем проводится под кожей на боковую поверхность тела, где присоединяется к
имплантированному под кожу насосу. Насос имеет центрально расположенный порт для
чрескожного пополнения резервуара
Пациенты могут быть отпущены домой для введения препаратов в режиме,
установленном в лечебном учреждении, или их лечение может быть продолжено
путем непрерывного введения препаратов из портативного инфузионного насо-
са. В большинстве случаев местные анестетики не используются в начале лече-
ния в связи с их влиянием на двигательную активность, однако их потенцирую-
щее действие может понадобиться пациентам с выраженными болями и высокой
толерантностью к опиоидам. У большинства пациентов, которым проводится по-
добное лечение, снижается потребность в опиоидах.
У пациентов с толерантностью к опиоидам редко наблюдаются побочные
эффекты. Одной из основных проблем является синдром отмены опиоидов, раз-
вивающийся в связи с уменьшением дозы препаратов при переходе на их эпиду-
ральное введение. У пациентов с зависимостью, после установки катетера, дол-
жен быть продолжен пероральный прием опиоидов с постепенным сокращением
дозы. При эпидуральном введении морфина также развивается толерантность,
что требует постепенного увеличения дозы или сокращения интервалов между
инъекциями. Данное обстоятельство не представляет проблемы при лечении бо-
льных в терминальной стадии заболевания. При выраженных, неустранимых бо-
лях для проведения высокодозной терапии опиоидами или введения опиоидов в
сочетании с местными анестетиками может потребоваться госпитализация. Уси-
лить обезболивающее действие морфина можно путем добавления 0.06%-0.2%
бупивакаина, однако при увеличении концентрации это может вызвать двигате-
льную слабость и симпатическую блокаду. Кроме того, в качестве дополнитель-
ных препаратов могут использоваться клонидин, кетамин и иногда стероиды.
276
Глава 23
Тщательный подбор дозы может обеспечить комфортное состояние терминаль-
ного больного некоторое время без угнетения сознания. При неэффективности
эпидурального обезболивания можно перейти к интратекальному или интравен-
трикулярному введению, при этом также необходимо десятикратное снижение
дозы по сравнению с эпидурально вводимой дозой опиоидов. При проведении
таких инъекций также можно дополнительно использовать местные анестетики,
однако в этом случае риск развития побочных эффектов возрастает [54].
Нейролитические блокады
При злокачественных новообразованиях хронические боли могут быть обуслов-
лены поражением отдельных органов, периферических нервов, костей и собст-
венно спинного мозга. В течение столетий врачи мечтают о «серебряной пуле»,
способной избирательно облегчить боль, уничтожив инвазивный рост или пора-
женные нервы, не затронув при этом другие ткани. Нередко в этой роли выступа-
ет острие иглы анестезиолога, способное поразить локализованную боль.
Следует тщательно отбирать пациентов и получить у них информированное со-
гласие. Чтобы убедиться в эффективности предстоящей блокады нервов и проде-
монстрировать пациентам ожидаемые результаты, обязательно следует сделать
пробную инъекцию местных анестетиков. Перед введением любых нейролити-
ческих препаратов рекомендуется убедиться в правильном положении иглы по
наличию парестезии, путем введения местных анестетиков или используя рент-
генологические методы. В связи с тем, что в течение первых нескольких дней по-
сле введения любых нейролитиков площадь анестезии обычно несколько
уменьшается, может потребоваться их повторное введение. При любой методике
хороший результат достигается не более, чем в 60%-80% случаев. При этом со-
зданная блокада не является перманентной и разрешается в течение от несколь-
ких недель до нескольких месяцев.
В Соединенных Штатах для создания нейролитических блокад наиболее
широко используются спирт и фенол (см. раздел «Клинический нейролизис» в
данной главе). Современные нейролитические препараты, часто применяемые
при истинно сегментарных болях, не лишены побочных эффектов. Большую
часть побочных эффектов составляют нарушения двигательных функций и пора-
жения других тканей. Вероятность повреждающего действия двигательных нер-
вов для каждого конкретного препарата зависит от концентрации (табл. 23.1).
У некоторого числа пациентов (от 2% до 28% по данным разных источников) мо-
жет развиваться болезненный неврит или невралгия в сегменте, на который про-
изводилось воздействие. Применение нейролитических блокад лучше ограни-
чить группой пациентов с прогнозируемо невысокой продолжительностью
жизни, страдающих сильными некупируемыми болями, информированных о ри-
ске развития неврита, нарушений мочеиспускания, слепоты и параплегии. Перед
применением нейролитических препаратов следует тщательно изучить возмож-
ность использования альтернативных медикаментозных и хирургических мето-
дов лечения [55].
Лечение хронической боли
277
Нейролитические препараты
Таблица 23.1
Препарая ? Используемые концентрации Клиническое применение Комментарии
Этанол Абсолютный/ 95%а, 50% Черепномозговой нерв Чревное сплетение Субарахноидальное Боль во время инъекции Риск неврита, двигательная блокада периферических нервов Максимальная продолжительность, «лучшая» блокада Лучше всего подходит для блокады несоматических нервов у больных в терминальной стадии
Фенол 6%-8% водный раствор 5%-10% раствор в глицерине 6%—12% раствор в рентгеноконтрастном веществе (ренографии, метризамид) Периферические нервы Субарахноидальное Эпидуральное Анестезия при введении Менее выраженное, менее продолжительное действие по сравнению с этанолом Лучше подходит для блокады периферических нервов Трудности при смешивании, обращении с готовым раствором
“ Готовые формы; остальные растворы готовятся фармацевтами.
Блокада чревного сплетения. Возможно, данный тип нейролитической бло-
кады является оптимальным. Его использование приводит к ослаблению постоян-
ных тупых висцеральных болей в верхней и средней части живота, часто сопро-
вождающих рак поджелудочной железы. У девяноста процентов таких пациентов,
данный метод позволяет добиться отличных результатов. Менее хорошие резуль-
таты наблюдаются при болях, обусловленных хроническим панкреатитом [56,57].
Техника выполнения этой блокады описана в главе 11. Первоначально выполняет-
ся диагностическая блокада с использованием 50 мл 0.25% бупивакаина с целью
проверки эффективности предстоящего лечения, кроме того, диагностическая
блокада дает пациентам представление о возможных побочных эффектах. При
успешно выполненной манипуляции вызывается обезболивание и ортостатиче-
ская гипотензия, продолжающаяся несколько часов.
Блокада местными анестетиками может быть выполнена при использовании
только костных анатомических ориентиров. До введения этанола следует убеди-
ться, что игла располагается по переднему краю тела первого поясничного по-
звонка. Наиболее эффективно позволяет контролировать продвижение и поло-
жение иглы рентгеноскопия. В сложных случаях для более точного определения
положения иглы до инъекции нейролитического препарата может быть введено
небольшое количество контрастного вещества. В любом случае перед введением
следует сделать снимок, подтверждающий правильность положения иглы. У па-
циентов с выраженными отклонениями анатомического строения в редких слу-
чаях может потребоваться применение компьютерной томографии. Для умень-
шения выраженности неприятных ощущений вводят небольшое количество
278
Глава 23
местного анестетика. Затем 25 мл абсолютного этанола смешивают с равным ко-
личеством 0.5% бупивакаина и с каждой стороны через иглу вводится по 25 мл
полученного раствора. Перед извлечением иглы из нее удаляются остатки рас-
твора путем введения 1 мл воздуха.
Для предотвращения ортостатической гипотензии необходимо произвести
внутривенное вливание жидкости. В течение первого часа после манипуляции
пациент должен оставаться в покое, а в последующие 24 часа передвигаться толь-
ко с посторонней помощью. Иногда для поддержания уровня кровяного давле-
ния используется пероральный прием эфедрина. Может развиваться усиленная
моторика кишечника и диарея. Иногда раздражающее действие спирта на диа-
фрагму может вызвать боль в плече. Обезболивание может сохраняться от 4 не-
дель до 6 месяцев.
Блокада гипогастрального сплетения. Пациенты с распространенными
опухолями органов малого таза гинекологического, колоректального или моче-
полового генеза часто страдают от выраженных висцеральных болей, распро-
страняющихся по симпатическим афферентным волокнам гипогастрального
сплетения. Блокада гипогастрального сплетения может быть осуществлена при
соматической поясничной блокаде на уровне L-5- S-1 [58]. Методика, описанная
в главе 11, отличается тем, что игла вводится в каудальном направлении на уров-
не межпозвоночного пространства L-4—L-5. Убедиться в положении иглы на
уровне переднего края тела позвонка L-5-S-1 можно при помощи рентгеноско-
пии. Также как и при блокадах чревного сплетения, пробная блокада с использо-
ванием 0.25% бупивакаина выполняется до введения нейролитического препара-
та. Приблизительно у двух третей пациентов превосходный обезболивающий
эффект достигается при введении 10% фенола [59].
Симпатические блокады других локализаций. Симпатические блокады,
кроме блокад чревного сплетения, связаны с более высоким риском развития
осложнений. Показания для нейролитической блокады звездчатого ганглия воз-
никают редко, так как имеется риск нежелательного распространения нейроли-
тического препарата на рядом расположенные жизненно важные структуры. Хи-
мический нейролизис поясничного ганглия 3 мл этанола или фенола проводится
чаще, однако данное вмешательство может приводить к развитию неврита бед-
ренно-полового нерва, кроме того, в 20% случаев возникает «симпаталгия» (сим-
патическая невралгия) нижней конечности.
Нейролитические блокады периферических нервов. Блокада перифери-
ческих нервов с использованием нейролитических препаратов обычно ограничи-
вается блокадой ветвей тройничного нерва (см. главу 18), где нарушения двига-
тельной функции играют не столь важную роль. Высокочастотное разрушение
гассерового ганглия в большинстве случаев вытеснило методику, основанную на
инъекции [60]. Блокада межреберных нервов (см. главу 9) также редко сопровож-
дается нарушениями двигательных функций, однако связана с риском развития
неврита. Транссакральная блокада корешков нервов на уровне S-2 или S-3 при-
меняется при болезненных спазмах мочевого пузыря. Блокада корешков плече-
вого или пояснично-крестцового сплетений возможна, однако пациенты редко
соглашаются получить обезболивание взамен возможности утраты способности
передвигаться на своих собственных ногах. При использовании этанола и фенола
обезболивание сохраняется в течение от 1 до 6 месяцев.
При воздействии на периферические нервы следует вводить не более 1 мл
этанола, а фенола—не более 0.5 мл. При введении больших количеств возникает
риск распространения вещества на окружающие ткани, особенно в области голо-
вы, где другие черепномозговые нервы (такие как зрительный нерв) располага-
Лечение хронической боли
279
ются в непосредственной близости. Последним ограничением обезболивания яв-
ляется невозможность оценки достигнутых результатов непосредственно после
инъекции. При неполной блокаде должно пройти не менее 24 часов до повторно-
го введения.
Субарахноидальный нейролизис. Субарахноидальное введение 0.5 мл фе-
нола или 0.7-1.0 мл этанола используется для блокады отдельных нервных ко-
решков в областях от шеи до поясницы [61]. При проведении блокады с целью
снижения чувствительности пациент должен располагаться таким образом, что-
бы вводимый раствор омывал главным образом задние корешки. При введении
этанола (гипобарической жидкости) позвоночник пациента сгибается таким об-
разом, чтобы пораженный кожный сегмент располагался в наивысшей точке, при
этом пациент, лежа на боку, всем телом поворачивается вперед на 45 градусов
(рис. 23.3). При введении фенола (гипербарическая жидкость) пораженные ко-
решки должны располагаться в максимально низкой точке, при этом пациент по-
ворачивается назад так, чтобы задние корешки находились ниже вентральных
двигательных волокон (рис. 23.4). Необходимо установить положение иглы и
ввести небольшое количество местного анестетика для подтверждения правиль-
ности ее положения. Это важно, так как периферические корешки могут входить
в спинной мозг на несколько сегментов выше отверстий, через которые они про-
никают в позвоночный канал. Перед выполнением «постоянной» блокады необ-
ходимо четко определить сегмент, являющийся причиной жалоб пациента. Ней-
ролитический препарат следует вводить медленно по 0.1 мл, и определять
снижение чувствительности каждые 10 минут. При наступлении достаточного
обезболивания или достижении максимального объема инъекции пациент дол-
жен оставаться в прежнем положении в течение 30-45 минут для предотвраще-
Рис. 23.3. Положение пациента при спинномозговом введении этанола.
Пациент располагается пораженной стороной вверх в несколько ротированном кпереди положении,
таким образом, что задние корешки находятся в наивысшей точке и на них попадает основное
количество вводимого гипобарического вещества
280
Глава 23
Рис. 23.4. Положение пациента при спинномозговой инъекции фенола.
Фенол является гипербарической жидкостью, поэтому пациент помещается пораженной стороной
вниз, с поворотом назад, таким образом, чтобы действие инъекции было направлено на нервные
волокна задних корешков
ния распространения нейролитического вещества. При выполнении блокад на
нескольких уровнях, каждая из них должна выполняться через отдельную иглу.
Одновременно можно выполнять блокаду не более, чем на двух уровнях. Следу-
ющие инъекции можно выполнять только после оценки степени обезболивания
спустя 48 часов.
Область первоначального обезболивания сокращается в течение 24-48 ча-
сов после введения препарата, и у многих пациентов в течение следующих неско-
льких недель в пораженном сегменте восстанавливаются некоторые двигатель-
ные функции. Эффективное обезболивание достигается только у 40%-60%
пациентов. Если болевые ощущения возобновятся спустя 3-6 месяцев, блокаду
можно повторить, однако вероятность ее успеха меньше.
При субарахноидальных сакральных блокадах часто нарушаются функции
кишечника и мочевого пузыря. Близкое расположение крестцовых и поясничных
корешков в конском хвосте затрудняет выполнение селективных блокад в этой
области. Хотя введение 1-5 мл этанола при нахождении пациента в коленно-лок-
тевом положении может создать достаточную степень сакрального обезболива-
ния, данную методику не следует применять, если только пациент не подвергал-
ся хирургическим вмешательствам на мочевом пузыре или прямой кишке, или не
установлен постоянный мочевой катетер.
Эпидуральный нейролизис. Эпидуральные инъекции менее надежны по
сравнению с субарахноидальным нейролизисом. Труднее добиться попадания
вводимого вещества только на один корешок, также трудно определить выра-
женность достигаемого эффекта в момент инъекции. Эпидуральные нейролити-
ческие блокады применяются при болях в шейном и грудном отделе позвоночни-
ка. Эпидуральное введение этанола является наиболее болезненной процедурой
Лечение хронической боли
281
и может вызвать неполный нейролизис и привести к развитию невралгии в даль-
нейшем. Фенол может действовать лучше, однако в целом проведение эпидура-
льных инъекций менее желательно по сравнению со спинальными и симпатиче-
скими блокадами. Установка катетера с проведением повторных инъекций
может повысить шансы на успех.
Многопрофильные клиники лечения боли
Лечение боли, острой или хронической, требует тщательного выбора методик ле-
чения, точной интерпретации полученных данных и применения интервенцион-
ных процедур. По определению Международной ассоциации по изучению боли,
боль — это «неприятное сенсорное и эмоциональное ощущение, связанное с име-
ющимся или возможным повреждением тканей или ощущения, возникающие во
время такого повреждения». В дополнение к патофизиологическим механизмам
формирования боли, на восприятие боли влияют субъективные и эмоциональные
процессы. Когда дело касается пациентов данной группы, анестезиолог работает
в качестве одного из консультантов. Физиотерапия, психиатрия, нейрохирургия
и реабилитация - все эти методы могут играть равные по значению роли. В усло-
виях независимой практики анестезиолог, который пытается «решить» пробле-
мы таких пациентов, используя только методики местного лечения, оказывает и
себе, и пациенту плохую услугу. Хронические боли, обусловленные не злокаче-
ственными заболеваниями, могут быть обусловлены центральными механизма-
ми формирования боли, на которые блокады периферических нервов не
оказывают никакого влияния. В подобных ситуациях необходимо учитывать три
важных обстоятельства. Во-первых, в связи с тем, что такие боли являются мно-
гогранной проблемой, для их устранения обычно необходимо применить комп-
лексный подход. Во-вторых, при любом лечении боли один из врачей должен
взять на себя руководство группой специалистов. В-третьих, при любых ситуа-
циях следует предотвращать возможность причинения дополнительного вреда
пациенту. Данные, полученные при интервенционных процедурах, могут быть
ошибочно истолкованы при неправильном использовании шкал измерения боли,
эффекта плацебо, неправильном толковании клинических данных и вследствие
наличия у пациента ложных ожиданий. Диагностические и терапевтические
местные блокады могут рассматриваться только в качестве одной из многих со-
ставляющих при лечении болей различной этиологии.
Литература
1. Сатгоп, Н. The changing role of the anesthesiologist in pain management. Reg. Anesth.
14:4,1989.
2. Rowlingson, J. C. Interventional cancer pain management. Anesth. Analg. 86: 106,
1998.
3. Hogan, Q. H., Abram, S. E. Neural blockade for diagnosis and prognosis. A review. Anest-
hesiology 86: 216,1997.
4. Manchikanti, L, Pampati, V. S., Beyer, C. The effect of neuroaxial steroids on we-
ight and bone mass density: A prospective evaluation. Pain Physician 3:357,2000.
5. Manchikanti, L., Singh, V., Kloth, D., Slipman, C. W., Jasper, J. E, Trescot, A. M.
Interventional Techniques in the management of chronic pain (ASIPP Practice Guideli-
nes). Pain Physician 4:24,2001.
282
Глава 23
6. Ballantyne, J. C., Carr, D. В., Berkey, C. S. Comparative efficacy of epidural, suba-
rachnoid, and intracerebroventricular opioids in patients with pain due to cancer.
Reg. Anesth. 21: 542,1996.
7. Paice, J. A., Penn, R. D., Shott, S. Intraspinal morphine for chronic pain: A retrospecti-
ve, multicenter study. J. Pain Symptom Manage. 11:71, 1996.
8. Yoshida, G. M., Nelson, R. W., Capen, D.A., Nagelberg, S., Thomas, J.C., Rimoldi,
R.L., Haye, W. Evaluation of continuous intraspinal narcotic analgesia for chronic
pain from benign causes. Am. J. Oithop. 25: 693, 1996.
9. Kamibayashi, T., Harasawa, K., Maze, M. Alpha-2 adrenergic agonists. Can. J. Ana-
esth. 44: R13, 1997.
10. Eisenach, J. C., Kock, M. D., Klimscha, W. Alpha-2 adrenergic agonists for regional
anesthesia: A clinical review of clonidine (1984-1995). Anesthesiology 85: 655,
1996.
11. Canavero, S., Bonicalzi, V. The neurochemistry of central pain: Evidence from cli-
nical studies, hypothesis and therapeutic implications. Pain 74: 109,1998.
12. Bowery, N. G. GABA-B receptor pharmacology. Amu. Rev. Pharmacol. Toxicol. 33:
109, 1993.
13. Kerr, D. L, Ong, J. GABA receptors. Pharmacol. Ther. 67:, 187 1995.
14. Penn, R. D., Savoy, S. M., Corcos, D. Intrathecal baclofen for severe spinal spastici-
ty. N. Engl. J. Med. 320: 1517, 1989.
15. Amer S, Lindblom U, Meyerson BA, Molander C. Prolonged relief of neuralgia af-
ter regional anesthetic blocks: A call for further experimental and systematic clinical
studies. Pain 43: 287, 1990.
16. Wall, P. D„ Devor, M. Sensory afferent impulses originate from dorsal root ganglia as
well as from the periphery in normal and nerve injured rats. Pain 17:321,1983.
17. Janig, W., Stanton-Hicks, M., Reflex Sympathetic Dystrophy: A Reappraisal .Seattle:
IASP Press, 1996.
18. Stanton-Hicks, M., Janig, W., Hassenbusch, S., et al. Reflex sympathetic dystrophy:
Changing concepts and taxonomy. Pain 63: 127,1995.
19. Jain, S., Gupta, R., Neurolytic Agents in Clinical Practice. Philadelphia: .WB Saunders,
1996.
20. Evans, P. J. D., Lloyd, J. W., Green, C. J. Cryoanalgesia: The response to alteration in
freeze cycle and temperature. Br. J. Anaesth. 53: 1121, 1981.
21. Saberski, L. R., Cryoneurolysis in Clinical Practice. Philadelphia: WB Saunders,
1996.
22. Kline, M., Stereotactic Radiofrequency Lesions as Part of the Management of Pain.
Orlando, FL: Paul M. Deutsch Press, 1992.
23. Lord, S. M., Barnsley, L., Wallis, B. J. Percutaneous radiofrequency neu-rotomy for
chronic cervical zygapophyseal joint pain. N. Engl. J. Med. 335: 1721,1996.
24. Taha, J. M., Tew, J. M. Treatment of trigeminal neuralgia by percutaneous radiofrequen-
cy rhizotomy. Neurosurg. Clin. North Am. 8: 31,1997.
25. Shealy, C. N., Mortimer, J. T., Reswick, J. Electrical inhibition of pain by stimulation
of the dorsal column: Preliminary clinical reports. Anesth. Analg. 46:489,1967.
26. Shetter, A. Spinal cord stimulation in the treatment of chronic pain. Cmr. Rev. Pain
1: 213,1997.
27. North, R B., Ewend, M. G., Lawton, M. T. Spinal cord stimulation for chronic, int-
ractable pain: Superiority of «multi-channel» devices. Pain 44:119,1991.
28. Holsheimer, J. Effectiveness of spinal cord stimulation in the management of chronic
pain: Analysis of technical drawbacks and solutions. Neurosurgery 40: 990, 1997.
29. North, R. B., Kidd, D. H., Zahurak, M., et al. Spinal cord stimulation for chronic, int-
ractable, pain: Experience over two decades. Neurosurgery 32: 384,1993.
Лечение хронической боли
283
30. Cohan, R. Н., Bullard, М. A., Ellis, J. Н. Local reactions after injection of iodinated
contrast material: Detection, management, and outcome. Acad. Radial. 4:711,1997.
31. Gangi, A., Dietmann, J. L., Mortazavi, R. CT-guided interventional procedures for
pain management in the lumbosacral spine. Radiographics 18: 621,1998.
32. Thomsen, H. S., Bush, W. H. Jr. Adverse effects of contrast media: Incidence, preventi-
on and management. Drug. Saf. 19: 313,1998.
33. Manchikanti, L. Epidemiology of low back pain. Pain Physician 3: 167,2000.
34. Bovim, G., Schrader, H., Sand, T. Neck pain in the general population. Spine 19:
1307,1994.
35. Miedema, H. S., Chorus, A. M. J., Wevers, C. W. J. Chronicity of back problems du-
ring work life. 23: 2021,1998.
36. Hendler, N. H., Bergson, C., Morrison, C. Overlooked physical diagnosis in chronic
pain patients involved in litigation. Psychosomatics 37: 509,1996.
37. Koes, B. W., Scholten, R. J. P. M., Mens, J. M. A., Bouter, L. M. Efficacy of epidural ste-
roid injections for low back pain and sciatica: a systematic review of randomized clini-
cal trials. Pain 63: 279,1995.
38. Watts, R. W., Silagy, C.A. A meta-analysis on the efficacy of epidural corticosteroids
in the treatment of sciatica. Anaesth. Intensive Care 23: 564,1995.
39. McQuay, H., Moore, A., An Evidence-Based Resource for Pain Relief. Oxford: Ox-
ford University Press, 1998.
40. Abram, S. E. Treatment of lumbosacral radiculopathy with epidural steroids. Anest-
hesiology 91: 1937,1999.
41. Jamison, R. N., VadeBoncouer, T., Ferrante, F. M. Low back pain patients unres-
ponsive to an epidural steroid injection: Identifying predictive factors. Clin. J. Pain 7:
121,1993.
42. Cummings, T. M., White, A. R. Needling therapies in the management of myofascial
trigger point pain: A systematic review. Aich. Phys. Med. Rehabil. 82: 986,2001.
43. Massey, E. W. Sensory neuropathies. Semin. Neurol. 18: 177, 1998.
44. Bruehl, S., Harden, R. N., Galer, B. S. External validation of IASP diagnostic criteria
for complex regional pain syndrome and proposed research diagnostic criteria. Pain
81: 147, 1999.
45. Breivik, H., Cousins, M. J., Lofstrom, B. ]., Sympathetic Neural Blockade of the Upper
and Lower Extremity. Philadelphia: Lippincott-Raven, 1998.
46. Katz, J. Phantom limb pain. Lancet 350: 1338,1997.
47. Bach, S., Noreng, M. F., Tjellden, N. U. Phantom limb pain in amputees during the first
12 months following limb amputation, after preopera-tive lumbar epidural blockade.
Pain 33: 297,1988.
48. Jahangiri, M., Bradley, J. W. P., Jayatunga, A. P., Dark, С. H. Prevention of phantom limb
pain after major lower limb amputation by epidural infusion of diamorphine, clonidine
and bupivacaine. Ann. R. Coll. Surg. Engl. 76:37A, 1994.
49. Schug, S. A., Burrell, R., Payne, J., Tester, P. Pre-emptive epidural analgesia may prevent
phantom limb pain. Reg. Anesth. 20: 256,1995.
50. Elizaga, A. M., Smith, D. G., Sharar, S. R. Continuous regional analgesia by intraneural
block: effect on postoperative opioid requirements and phantom limb pain follo-
wing amputation. /. Rehab. Res. Dev. 31: 179,1994.
51. Nikolajsen, L., Ilkjaer, S., Christensen, J. H. Randomised trial of epidural bupivaca-
ine and morphine in prevention of stump and phantom pain in lower-limb amputation.
Lancet 350:1353, 1997.
52. Nikolajsen, L.,'Ilkjaer, S., Christensen, J. H. The influence of preampu-tation pain on
postamputation stump and phantom pain. Pain 72: 393,1997.
284
Глава 23
53. DuPen, S. L., Williams, A. R. The dilemma of conversion from systemic to epidural mor-
phine: A proposed conversion tool for treatment of cancer pain. Pain 56: 113,1994.
54. Deer, T., Winkelmuller W, Erdine, S., Bedder, M., Burchiel, K. Intrathe-cal therapy for
cancer and nonmalignant pain: patient selection and patient management. Neuromodu-
lation 2: 55, 1999.
55. Rowlingson, J. C. Management of malignant pain syndromes. Anesth. Analg. Review
Course Lectures: 79,1999.
56. Brown, D. L., Bulley, С. K, Quiel, E. L. Neurolytic celiac plexus block for pancreatic
cancer pain. Anesth. Analg. 66: 869,1987.
57. Thompson, G. E., Artin, R., Bridenbaugh, L. D., Moore, D. C. Abdominal pain and al-
cohol celiac plexus nerve block. Anesth. Analg. 56: 1, 1977.
58. Plancarte, R., Amescua, C., Patt, R. B., Aldrete, J. A. Superior hypogas-tric plexus
block for pelvic cancer pain. Anesthesiology 73:236,1990.
59. DeLeon-Casasola, O. A., Kent, E., Lerna, M. J. Neurolytic superior hy-pogastric ple-
xus block for chronic pelvic pain associated with cancer. Pain 54:145,1993.
60. Loeser, J. D. What to do about tic douloureux. J.A.M.A. 239: 1153,1978.
61. Hay, R. C. Subarachnoid alcohol block in the control of intractable pain: A report of re-
sults in 252 patients. Anesth. Analg. 41: 12,1962.
Глава 24
Лечение послеоперационных
болей
Традиционные методы лечения острых послеоперационных болей (внутримышеч-
ные инъекции опиоидов на основе потребности пациента, с ограничением по вре-
мени и дозе) часто приводят к длительным периодам неадекватного
обезболивания. Фиксированные дозировки не учитывают индивидуальных по-
требностей пациентов в обезболивании и широких различий в концентрациях ана-
льгетиков в крови. Не удивительно, что традиционные препараты опиоидов для
внутримышечного введения были практически полностью вытеснены более эф-
фективными методами лечения, позволяющими индивидуально корректировать
дозу препарата и, в последнее время, целенаправленно доставлять препараты к пе-
риферическим и центральным структурам нервной системы, что снижает развитие
системных побочных эффектов и осложнений. Анестезиологи, относятся к катего-
рии врачей, которые наилучшим образом знакомы с действием опиоидов, особен-
но в ситуации, когда эти препараты вводятся через эпидуральные катетеры или в
область периферических нервов. Естественно, анестезиологам пришлось участво-
вать в разработке концепции «службы острой боли» [1]. Послеоперационное обез-
боливание достаточно полно и детально описано в нескольких руководствах [2—5].
В данной главе описываются все методики лечения послеоперационных болей, на-
чиная с обезболивания, контролируемого пациентом.
Обезболивание, контролируемое пациентом
Прорывом в послеоперационном обезболивании стала разработка более совер-
шенных систем доставки препаратов, в частности систем обезболивания, контро-
лируемого пациентом. Сначала были предложены системы для внутривенного
введения препаратов. Они обладают большей эффективностью по сравнению с
традиционным внутримышечным введением, поскольку достаточный с незначи-
тельными отклонениями уровень анальгетика в крови достигается немедленно.
Системы введения, контролируемые пациентом, позволяют индивидуально
определять дозу препарата и регулировать режим обезболивания и дозировку в
зависимости от уровня активности. Выпускается множество различных насосов,
которые позволяют пациенту вводить небольшие дозы внутривенных опиоид-
ных препаратов при возникновении болевых ощущений и, таким образом, под-
держивать необходимый уровень препаратов в крови. Каждое устройство
снабжено «блокирующей» системой, обеспечивающей адекватный временной
интервал для развития достаточной анальгезии после каждой инъекции. Передо-
зировка предотвращается титрованием дозы самим пациентом, но, если доза ока-
залась выше нужной, развивающаяся седация в течении блокированного периода
обычно лишает пациента возможности введения лишней дозы, которая могла бы
привести к депрессии дыхания. В связи с тем, что подобные системы лишь под-
держивают концентрацию препарата в крови, для первоначального достижения
обезболивающего эффекта требуется болюсное введение опиоидов, обычно в
виде нагрузочной дозы, программируемой для каждого пациента.
286
Глава 24
Необходимость постоянных повторных инъекций для поддержания требуе-
мого уровня препарата в крови часто приводит к тому, что сон пациентов стано-
вится прерывистым. Большинство устройств могут осуществлять введение препа-
ратов в непрерывном режиме, что позволяет обойти эту проблему. При
непрерывном введении общая доза не снижается, что увеличивает риск развития
угнетения дыхания, так как процесс введения не контролируется пациентом [6].
Как бы то ни было, данный режим может использоваться в ночное время, в частно-
сти в первую ночь после операции. Все стандартные системы обезболивания, кон-
тролируемого пациентом, должны иметь функции, позволяющие медицинскому
персоналу регулировать как величину дозы, так и продолжительность интервалов
между введениями, чтобы удовлетворить потребность пациентов в обезболива-
нии. При любых режимах введения опиоидов необходимо учитывать возраст па-
циентов, при этом в молодом возрасте лечение начинается с более высоких доз.
Практически все существующие опиоиды применялись для введения подоб-
ным образом [7] (табл. 24.1). Морфин наиболее дешев, и часто лечение начинает-
ся именно с него. При развитии побочных эффектов (зуд, тошнота, дисфория) пе-
реходят . на прием другого препарата. Меперидин обладает такой же
эффективностью, однако продолжительность его действия несколько меньше.
Меперидин реже применяется в клинической практике, в связи с токсичностью
его основного метаболита — нормеперидина [7]. Гидроморфон является прием-
лемой альтернативной для пациентов, у которых при приеме других опиоидов
наблюдаются непереносимые побочные эффекты. Стоимость фентанила выше,
тем не менее, он также используется для лечения пациентов с повышенной чув-
ствительностью к другим опиоидам. Применение обезболивания, контролируе-
мого пациентом, нивелирует низкую продолжительность действия данного пре-
парата, однако при этом пациент будет вынужден вводить его чаще.
Таблица 24.1
Внутривенное введение препаратов, контролируемое пациентом:
препараты и дозировки
Препарат Первоначальная доза (мг) Поддерживающая доза
Морфин 5-20 0.5-2.5
Меперидин 50-250 10-25
Гидроморфон 1-2 0.05-0.25
Фентанил 0.075-0.1 0.010-0.050.
Как было указано выше, системы автоматического введения препаратов до-
статочно безопасны. Механические поломки достаточно редки [7]. Хотя подав-
ление центральной нервной деятельности и может развиваться, это наблюдается
не чаще, чем при использовании других методов введения препаратов. Риск дан-
ного осложнения возрастает при непрерывном введении препаратов или у паци-
ентов старшего возраста. Наибольшее число осложнений возникает при переда-
че управления системой введения членам семьи пациента. В целом данные
системы введения обладают высокой эффективностью, обеспечивая в послеопе-
рационном периоде необходимое обезболивание при одновременном снижении
общей вводимой дозы опиоидов по сравнению с предшествующим внутримы-
шечным введением. Высокая эффективность отмечается при периферических
вмешательствах и при операциях в нижнем отделе брюшной полости, однако
Лечение послеоперационных болей
287
нейроаксиальное введение опиоидов более подходит для купирования болей по-
сле операций в верхнем этаже брюшной полости и органах грудной клетки (см.
раздел «Нейроаксиальное обезболивание опиоидами» в этой главе). Системы
обезболивания, контролируемого пациентом, могут быть адаптировны к под-
кожным, периневральным и эпидуральным катетерам, что создает эффективную
систему доставки препаратов, описание которой приводится ниже.
Методики обезболивания, связанные с воздействием
на периферические нервы
Существует несколько методик местного обезболивания, обеспечивающих не-
прерывную анальгезию. Преимуществами целенаправленного обезболивания в
отдельной области являются минимальные двигательные нарушения и снижение
выраженности системных побочных эффектов, таких как седация и тошнота. Для
периферических инфузий обычно применяются местные анестетики в низких
концентрациях, однако в некоторых ситуациях могут использоваться опиоиды и
альфаг-агонисты. Эффективность и популярность непрерывного периферическо-
го введения препаратов возросли после появления новых систем непрерывного
введения посредством постоянных катетеров и портативных насосов небольших
размеров.
Инфильтрация хирургических ран
При простой инфильтрации раны слабыми растворами местных анестетиков в за-
висимости от локализации обезболивание может продолжаться 4—8 часов. Данная
методика используется главным образом в педиатрической практике, особенно
при блокадах в паховой области и области полового члена после урологических
операций (см. главу 21). Местная инфильтрация также эффективна у взрослых па-
циентов в амбулаторной практике [8], и позволяет выписывать таких пациентов
без системных побочных эффектов опиоидов. В условиях лечебного учреждения
обезболивание небольших ран может быть достигнуто посредством постоянного
введения 0.1% бупивакаина или ропивакаина по 6-12 мл в час через установлен-
ный катетер со множеством отверстий [9]. Ортопедическими хирургами данная
методика с использованием одноразовых насосов 24-часового действия применя-
ется для обезболивания после амбулаторных операций на плечевом суставе.
Другим приложением данной методики является введение препаратов в ко-
ленный сустав после артроскопических вмешательств. После введения бупива-
каина обезболивающий эффект продолжается несколько часов, считается, что
добавление опиоидов, таких как морфин, может существенно увеличивать про-
должительность обезболивающего действия [10], хотя данное положение при-
знается не всеми.
Катетеры для воздействия на периферические нервы
Блокада периферических нервов является отличным средством послеоперацион-
ного обезболивания [11], обезболивающий эффект может быть пролонгирован
установкой постоянных катетеров. Катетеризация бедренного нерва более эф-
фективна для обезболивания после операций на бедренном и коленном суставах
[12], она также ускоряет выздоровление и сокращает период реабилитации после
288
Глава 24
протезирования коленного сустава, по сравнению с обычными опиоидами и эпи-
дуральными инфузиями [13, 14]. В некоторых амбулаторных отделениях посто-
янные катетеры применяются для обезболивания при продолжающемся
наблюдении за пациентами в течение ночи [15]. Было показано, что введение
препаратов через катетеры, установленные в межлестничном пространстве по-
сле операций на плечевом суставе [16] и в поясничном отделе после операции на
передних крестовидных связках коленного сустава, позволяет произвести адек-
ватное обезболивание. Степень обезболивания при этом такая же, как и при эпи-
дуральном введении препаратов, однако блокада периферических нервов с
использованием катетеров имеет два преимущества: отсутствие симпатических
блокад, отсутствие необходимости в приеме опиоидов, что обычно требуется
при эпидуральном введении препаратов. Обычно проводятся инфузии малых доз
местных анестетиков, хотя добавление малых доз клонидина [17] и опиоидов
усиливает обезболивающий эффект.
Интраплевральные катетеры
Для обезболивания в послеоперационном периоде местные анестетики могут
вводиться по катетеру, установленному в плевральную полость. Техника интрап-
леврального введения препаратов описана в главе 10. Для обезболивания в по-
слеоперационном периоде можно вводить по 20 мл 0.5% бупивакаина каждые
6-12 часов или вводить препарат непрерывно. Удовлетворительные результаты
были достигнуты у некоторых пациентов при разрезах в подреберье, произведен-
ными во время холецистэктомии, а также у пациентов, перенесших торакото-
мию. Другие авторы установили, что при таком методе введения препаратов
степень обезболивания весьма различна, а используемые дозировки могут оказы-
вать системное токсическое действие. При торакотомических вмешательствах
данная методика не столь эффективна, как эпидуральное введение опиоидов [18].
Повторные межреберные блокады
Непрерывное обезболивание может быть достигнуто при введении в область
6-11 межреберного нервов один раз в 12 часов 3-5 мл 0.25% бупивакаина в ком-
бинации с эпинефрином в разведении 1:200000 [18]. Данная методика применя-
ется редко, так как выполнение инъекций каждые 12 часов создают большую
нагрузку на медицинский персонал, чем эпидуральные инфузии. Установка по-
стоянного катетера позволяет экономить время и силы. Данный метод обычно
применяется при лечении пациентов, находящихся в тяжелом состоянии и нуж-
дающихся в особом наблюдении, а также у пациентов с множественными пере-
ломами ребер, у которых угнетение дыхания в результате системного
воздействия опиодиов нежелательно.
Криоанальгезия
Данный подход к межреберной анальгезии был предложен для лечения посттора-
котомических болей, однако он не столь эффективен и популярен, как эпидураль-
ное введение опиоидов [18]. Криоанальгезия производится на интраоперационном
этапе посредством прямого замораживания межреберных нервов криозондом в те-
чение 2 минут. Применение криоанальгезии может сопровождаться развитием
причиняющих неудобства дизестезий у молодых пациентов, находящих неприят-
ным опоясывающее онемение (см. главу 23).
Лечение послеоперационных болей
289
Нейроаксиальная анальгезия опиоидами
Нейроаксиальное введение опиоидов стало большим шагом вперед в лечении
острых болей [19, 20]. Опиоиды эффективно блокируют перцепцию боли в зоне
задних корешков при введении в дозах, значительно меньших, чем дозы, необхо-
димые для системной анальгезии. Данный эффект наблюдается как при эпидура-
льном, так и при субарахноидальном введении препаратов, хотя при
эпидуральном введении для проникновения через мембраны требуется примене-
ние более высоких доз (до 10 раз выше). Прямое воздействие опиоидов на специ-
фические рецепторные точки снижает риск развития системных побочных
эффектов, связанных с внутримышечным и внутривенным введением препара-
тов, таких как угнетение дыхания и седация. Следует особо подчеркнуть, что при
данном способе введения препаратов после торакотомических [18] и абдомина-
льных [21] вмешательств достигается более эффективная анальгезия, по сравне-
нию с любой другой методикой.
Выбор опиоидов
Практически все существующие опиоиды применялись для введения в субарах-
ноидальное и эпидуральное пространства. Первоначально в эпидуральное про-
странство вводился морфин. В связи с плохой растворимостью в жирах, морфин
относительно медленно проникает в липидные слои спинного мозга [19]
(рис. 24.1). Хотя первоначально исследователи пришли к выводу, что данное
Церебральные
Тело Эпидуральное СМЖ Спинной СМЖ Эпидуральное Остистый
позвонка пространство мозг пространство отросток
Рис. 24.1. Место действия морфина при эпидуральном введении.
Гидрофильные наркотические анальгетики, такие как морфин, существуют, главным образом, в
ионизированной (D+) форме, и, в меньшем количестве, в неионизированной (D0) форме, медленно
проникают к месту воздействия в спинном мозге. Большая часть препарата, находящегося в
ионизированной форме, диффундирует из места введения в спинномозговую жидкость (СМЖ) или в
венозный кровоток, (с разрешения и по материалам из Cousins, М. J., Mather, L. Е. Intrathecal and
epidural administration of opioids. Anesthesiology 61: 276, 1984, публикуется в разрешения авторов)
290
Глава 24
ограничение может быть преодолено повышением доз препаратов, вскоре стало
ясно, что применение столь высоких дозировок приводит к увеличению числа
побочных эффектов, особенно центрального седативного и угнетения дыхания, в
связи с тем, что водо-растворимый морфин в спинномозговой жидкости распро-
страняется в цефалическом направлении. Низкие дозы препарата (для большин-
ства пациентов: 1-5 мг, исходя, главным образом, из возраста пациента [22])
создают адекватное обезболивание при минимальной выраженности побочных
эффектов, если однократное введение опиоидов производится не менее, чем за 60
минут. Непрерывное введение морфина предотвращает развитие феномена пи-
ков и плато, который наблюдается при дробном введении препарата, а также со-
провождается снижением частоты побочных эффектов (табл. 24.2).
Таблица 24.2
Эпидуральное введение опиоидов
Препарат Первоначальная доза Поддерживающая дозаа
Морфин 1-3 мг 0.04 мг/мл, 4-8 мл/ч
Меперидин 20-100 мг 1 мг/мл, 8-12 мл/ч
Гидроморфон 1-2 мг 0.02 мг/мл, 4-10 мл/ч
Фентанил 75-100 мкг 4 мкг/мл, 8-16 мл/ч
Суфентанил 50 мкг 2 мкг/мл, 8-12 мл/ч
“ Введение с меньшей скоростью эффективно при добавлении местного анестетика.
Ускорить наступление действия можно путем прямого субарахноидального
введения морфина, однако более узкий диапазон дозировок повышает риск угне-
тения дыхания в послеоперационном периоде (табл. 24.3). Субарахноидальное
введение опиодов остается действенной альтернативой (особенно для пациен-
тов, которым производится однократное введение препарата, и которые нужда-
ются в обезболивании только на 24 часа, например, при кесаревом сечении или
хирургическом вмешательстве на бедре), однако должно использоваться с осто-
рожностью.
Таблица 24.3
Дозы опиоидов для спинномозгового введения
при послеоперационном обезболивании
Препарат Доза Длительность действия
Морфин 0.1-0.3 мг 8-24 ч
Меперидин 10-30 мг 10-24ч
Фентанил 5-25 мкг 2-6 ч
Опиоиды с лучшей растворимостью в жирах меньше диффундируют в спин-
номозговую жидкость. Предполагалось, что такие опиоиды будут сохраняться в
зоне введения и, таким образом, оказывать более локализованное сегментарное
обезболивающее действие, с меньшей частотой побочных эффектов, таких как
центральное угнетение дыхания. Фентанил — показательный пример подобных
препаратов — оказывает локализованное сегментарное обезболивающее дейст-
Лечение послеоперационных болей
291
вие, которое требуется при постторакотомических болях [18,20], также имеются
некоторые данные о снижении частоты побочных эффектов [23]. В кровоток про-
никает значительное количество введенных жирорастворимых препаратов [24],
однако в ходе нескольких исследований было установлено, что уровень препара-
тов в крови после эпидурального введения такой же, как и после внутривенного.
У некоторых исследователей возник вопрос, возможно ли в принципе прямое
воздействие на спинной мозг и могут ли данные препараты применяться для ней-
роаксиальной аналгезии [25,26]. Другие данные свидетельствуют о том, что при
использовании малых доз происходит местное воздействие на спинной мозг, но
только в непосредственной близости к месту введения. Несмотря на то, что лабо-
раторные исследования выявили только системное действие, имеются данные
двух крупномасштабных клинических исследований, в ходе которых была про-
демонстрирована высокая эффективность эпидурального введения фентанила
[23,27]. В обоих исследованиях было показано, что локализация кончика катете-
ра имеет решающее значение; он должен располагаться рядом с дерматомным
источником боли. Также в ходе этих исследований было установлено, что при ис-
пользовании данного опиоида адекватное обезболивание может быть достигнуто
только при его применении в комбинации с местным анестетиком. Если требует-
ся создать обезболивание в большом количестве спинномозговых сегментов, не-
обходимо применение высоких доз (и системного воздействия) препарата, кроме
того, более эффективным может стать использование других опиоидов, более
широко диффундирующих из места введения.
Для введения в эпидуральное пространство применялись опиоиды и с более
высоким показателем растворимости в жирах, такие как суфентанил. В связи с
высокой растворимостью в жирах требуется применение более высоких доз. Для
эффективного обезболивания доза суфентанила должна быть эквивалентной
дозе фентанила. Хотя суфентанил может быть эффективным анальгетиком, тем
не менее, сохраняется мнение, что его действие также обусловлено только кон-
центрацией препарата в системном кровотоке. Также как и в случае с фентани-
лом, данное предположение было подтверждено при использовании более высо-
ких доз препарата. При инфузии в больших объемах менее концентрированного
раствора суфентанила наблюдалось усиление анальгетического действия, одна-
ко вопрос о преимуществах данного препарата перед фентанилом остается от-
крытым.
Применение опиоидов средней растворимости, таких как меперидин и гид-
роморфон, обеспечивает воздействие на спинной мозг с более широким распро-
странением и в течение более длительного времени, чем фентанил и, возможно,
реже вызывает побочные эффекты [28-30]. У препаратов данного класса возмож-
но наблюдается идеальный баланс между хорошим распространением и мень-
шим числом побочных эффектов, однако в настоящее время информации об их
клиническом применении недостаточно.
В общем, здесь просматривается связь, которая наводит на мысль, что за до-
статочное распространение препаратов, дающие прекрасное обезболивание
(морфин), приходится платить побочными эффектами. Более низкая частота по-
бочных эффектов у жирорастворимых препаратов связана с более низкой эффек-
тивностью, кроме случаев, когда для повышения системного уровня увеличива-
ется скорость инфузии. В связи с этим многие' авторы пришли к выводу, что
жирорастворимые препараты должны применяться только в ситуациях, когда ка-
тетер устанавливается непосредственно или рядом с «эпицентром» сегмента
тела, в котором находится источник болей, например, после торакотомии (в по-
добных случаях обезболивание достигается при использовании меньших доз
292
Глава 24
препаратов). Введение опиоидов, обладающих большей растворимостью в воде,
лучше производить через катетеры, установленные вдали от очага поражения
(поясничные катетеры при болях после торакотомии), или при наличии более
широких разрезов (операции на органах брюшной полости) (табл. 24.4). К сожа-
лению, проведено слишком мало сравнительных исследований, а клинической
информации, позволяющей сделать выбор препарата, недостаточно.
Таблица 24.4
Режимы послеоперационного обезболивания.
Хирургическое вмешательство Режим обезболивания
Торакотомия Введение морфина в поясничном или грудном отдел,
или введение фентанила в грудном отделе
Верхний этаж брюшной полости Введение гидроморфона, морфина или фентанила в
поясничном или нижне-грудном отделе
Нижний этаж брюшной полости Введение гидроморфона, морфина или фентанила в
поясничном отделе или внутривенная анальгезия,
контролируемая пациентом
Все опиоиды также вводились в субарахноидальное пространство. При этом
дозы препаратов существенно ниже, чем при эпидуральном введении, однако эф-
фективность данного метода введения ограничена (обычно) однократной инъек-
цией. Логично сделать выбор в пользу морфина, продолжительность действия
которого больше. К сожалению, при этих дозах препарата наблюдается дозозави-
симый ответ и относительно высокая частота побочных эффектов. Хотя основ-
ную опасность представляет угнетение дыхания, к счастью, оно развивается ред-
ко. Более частым осложнением является зуд, который наблюдается у 40%-60%
пациентов.
Добавление местных анестетиков
Эффективность эпидурального введения опиоидов повышается при их использо-
вании в комбинации со слабо концентрированными растворами местных анестети-
ков, такими как 0.05% раствор бупивакаина. Дополнительное введение местных
анестетиков оказывает выраженное синергетическое действие на качество ана-
льгезии, особенно, это касается двигательных нарушений и кашля, которые неред-
ко развиваются при введении жирорастворимых опиоидов [20, 31]. Хотя иногда
может потребоваться применение более концентрированных растворов бупивака-
ина (0.1%), максимальным эффектом обладает именно 0.05% раствор. При введе-
нии препарата в более высоких концентрациях обезболивающее действие
усиливается за счет некоторого подавления чувствительности, однако применение
высоких доз увеличивает риск развития двигательных блокад и гипотензии вслед-
ствие симпатической блокады [23]. Как бы то ни было, дополнительное введение
местных анестетиков значительно усиливает эффект эпидурально вводимых опио-
идов и показано как при использовании жирорастворимых, так и водораствори-
мых препаратов [23, 27, 32], при соответствующем наблюдении с целью
предотвращения ортостатической гипотензии и пролежней, развивающихся
вследствие потери чувствительности. Кроме того, что местные анестетики усили-
вают обезболивающее действие, они еще ускоряют нормализацию функции ки-
шечника после операций на органах брюшной полости [33]).
Лечение послеоперационных болей
293
Другие длительно действующие амино-амиды также эффективны, так как
все они обладают хорошей сенсорно-моторной диссоциацией и усиливают дей-
ствие опиоидов. Левобупивакаин действует также как рацемическая смесь.
Проводилось изучение возможности инфузий ропивакаина без опиоидов. Этот
препарат вызывает двигательную блокаду меньшей выраженности, чем бупи-
вакаин в той же концентрации, однако в концентрациях, требующихся для обез-
боливания при применении без опиоидов, выраженность двигательной блока-
ды резко возрастает. В комбинации с фентанилом в низких концентрациях
значительных различий по сравнению с эквипотенциальной смесью с бупива-
каином не наблюдается [20, 34]. Другие амино-амиды обладают менее выра-
женным кардиотоксическим действием, однако при использовании низко кон-
центрированных растворов и низкой скорости введения для обезболивания в
послеоперационном периоде данное преимущество может не оправдать допол-
нительных расходов.
Несмотря на наличие множества публикаций о комбинированном примене-
нии опиоидов и местных анестетиков практически при любых видах хирургиче-
ских вмешательств, четкие указания на оптимальные пропорции препаратов при
комбинированной терапии отсутствуют. Синергетическое действие препаратов
обусловливает необходимость увеличения количества одного препарата при
уменьшении количества другого. Используя комплексный метод «прямого поис-
ка» Curatolo установил взаимосвязь между дозами бупивакаина, фентанила и
клонидина [35]. До получения дополнительных данных по данному вопросу, для
практических целей можно использовать значения концентраций, приведенные в
табл. 24.2 [20]. Оправданным выглядит подход, в соответствии с которым начи-
нают со «стандартного» опиоида в комбинации с 0.05% раствором бупивакаина.
Если при контролируемом пациентом эпидуральном введении адекватного обез-
боливания добиться не удается, на первом этапе может быть в несколько раз уве-
личена скорость инфузии, а затем повышена до 0.1% концентрация бупивакаина.
Если первоначально был выбран жирорастворимый опиоид, в дальнейшем мож-
но перейти на применение водо-растворимого препарата (более широко распро-
страняющегося из зоны введения).
Другие адъюванты
Другими препаратами, обладающими собственным анальгетическим эффектом
или способными усиливать действие опиоидов, являются альфа2-агонисты
(клонидин, дексметомидин), агонисты NMDA (N-метил-О-аспартат) (кетамин),
и другие модификаторы нейротрансмиттеров. Эффективность кетамина была
подтверждена, однако безопасность его введения в эпидуральное пространство
находится под вопросом. Хотя клонидин обладает максимальной эффективно-
стью, однако его применение сопровождается высокой частотой развития гипо-
тензии и седативного эффекта [20], что может сузить использование данного
препарата до воздействия только на периферические нервы. Было показано, что
эпинефрин усиливает обезболивающее действие комбинации бупивакина и
фентанила. В настоящее время большинство специалистов, занимающихся
обезболиванием в послеоперационном периоде, заинтересованы в использова-
нии простейших комбинаций препаратов, до тех пор, пока не накопится больше
свидетельств того, что адъюванты улучшают анальгезию или уменьшают по-
бочные эффекты.
294
Глава 24
Система введения
Так же, как и в случае с комбинированным использованием препаратов, в боль-
шинстве публикаций содержатся простые описания при практически полном от-
сутствии сравнительного анализа. Считается, что после операций на органах
грудной клетки и верхнего этажа брюшной полости идеального обезболивания
при использовании минимальных доз препаратов позволяет достичь установка
эпидурального катетера в грудном отделе позвоночника. При этом частота дви-
гательных блокад минимальна [20, 23], особенно, при использовании опиоидов,
обладающих повышенной растворимостью в жирах. Хотя непрерывные инфузии
практически вытеснили методики болюсного введения, применение, контроли-
руемое пациентом, также улучшает показатели обезболивания и позволяет кор-
ректировать дозу препаратов в соответствии с индивидуальными потребностями
пациентов. Эпидуральная анальгезия, контролируемая пациентом, не эффектив-
на при отсутствии фоновых инфузий, однако ее использование в комбинации
(как указано в табл. 24.2) позволяет достичь лучшего обезболивания при мини-
мальной частоте побочных эффектов.
Комбинированное обезболивание
В идеале введение одного препарата должно создавать обезболивание без побоч-
ных эффектов, влияния на способность передвигаться и восстановление функций
кишечника. Однако такой панацеи не существует. Обсуждения заслуживают два
мнения. Во-первых, применение комбинаций препаратов более эффективно, чем
их раздельное использование [36,37]. Как было сказано выше, синергизм местных
анестетиков и опиоидов при введении в эпидуральное пространство обеспечивает
лучшее обезболивание, чем их раздельное применение, а также способствует бо-
лее быстрому восстановлению функций кишечника, чем изолированное исполь-
зование опиоидов. Кроме того, поддерживающее применение системных
анальгетиков, имеющих самостоятельный механизм действия, еще более усиливает
синергический эффект [38]. Так, регулярное применение нестероидных противовос-
палительных средств улучшает характеристики обезболивания, снижая потребность
в опиоидах при многих процедурах, таким образом, снижая риск угнетения дыхания
и пареза кишечника. Большинство специалистов, занимающихся обезболиванием,
применяют нестероидные противовоспалительные средства при всех режимах, а
введение в практику нового класса препаратов (ингибиторов циклооксигеназы-2)
будет способствовать еще большему расширению сфер возможного применения.
Регулярное введение ацетаминофена обладает сходными преимуществами и также
применяется многими специалистами.
Во-вторых, существуют другие факторы, определяющие окончательное вы-
здоровление при использовании адекватного обезболивания. Нормализация
функций кишечника имеет особое значение. У пациентов, которым обезболива-
ние проводилось в режиме, снижающем частоту пареза кишечника, и которые
рано начинали принимать пищу с низким содержанием жиров, наблюдалось
ускорение выздоровления. Немедикаментозное лечение, включающее ранее на-
чало приема пищи и раннюю активизацию больных, дает положительный эффект
и является полем для будущих исследований.
Лечение послеоперационных болей
295
Превентивное применение
Исследования на животных показали, что нейроаксиальное введение опиоидов в
предоперационный период ведет к значительному уменьшению выраженности
феномена возбуждения спинного мозга, обычно проявляющемуся при болевой
стимуляции, а также снижает потребность в обезболивании в послеоперацион-
ном периоде [39]. Однако достоверной информации о подобном влиянии у чело-
века до настоящего времени не получено [40]. Несколько публикаций
свидетельствуют об уменьшении потребности в обезболивании в послеопераци-
онный период при эпидуральном введении опиодов или инфильтрации кожи
местными анестетиками перед ее разрезом. Другими публикациями данный вы-
вод не подтверждается, возможно, потому, что потребность в послеоперацион-
ном обезболивании у человека определяется множеством факторов. Хотя
эпидуральное введение опиоидов само по себе не создает достаточного обезбо-
ливания при хирургических операциях, оно может снижать потребность в анес-
тетиках на 30%-40%.
В данном случае профилактический эффект определить не возможно. Как
бы то ни было, ранняя эпидуральная анестезия при хирургических вмешательст-
вах все еще рассматривается как результативный метод, при этом эпидуральный
катетер может устанавливаться до операции, а для введения препаратов может
использоваться комбинированная техника, включающая введение местных анес-
тетиков и опиоидов во время операции. Это позволяет легче перейти к эпидура-
льному введению препаратов в послеоперационный период.
Лечение побочных эффектов
Основной проблемой является угнетение дыхания. Как было сказано выше, при
использовании соответствующих доз риск угнетения дыхания не выше, чем при
внутримышечном введении опиоидов или внутривенном обезболивании, конт-
ролируемом пациентом [6,20] (табл. 24.5). Тем не менее, все пациенты, которым
проводится нейроаксиальное введение опиодов, должны находиться под наблю-
дением для выявления угнетения дыхания. Угнетение дыхания может развивать-
ся спустя 6-18 часов после первой инъекции или начала инфузии. Группу риска
составляют пациенты пожилого возраста, особенно принимающие другие сис-
темные опиоиды или седативные препараты. Этот риск также увеличивается при
операциях на органах грудной клетки и верхнем этаже брюшной полости. У па-
циентов, принимающих опиоиды в течение длительного времени, угнетение ды-
хания происходит реже. Эффективность механических устройств наблюдения не
подтвердилась [41]. Возрастающая седация в сочетании с уменьшением частоты
дыхания (менее 10 дыхательных движений в минуту) является наиболее досто-
верным признаком развивающейся дыхательной недостаточности и сигналом к
началу лечения антагонистами опиоидов. Однократного внутривенного введе-
ния налоксона не достаточно; угнетение дыхания разовьется вновь спустя 20 ми-
нут после окончания действия налоксона. Непрерывное введение налоксона
(5 мкг/кг/час) прекращает угнетение дыхания, не влияя на степень обезболива-
ния, и даже может рекомендоваться как профилактическая мера у пациентов, от-
носящихся к группе высокого риска. При соответствующем обучении
медицинских сестер и мониторинге состояния пациента, нейроаксиальное введе-
ние опиоидов успешно применялось для лечения пациентов, находящихся в об-
щих палатах, а не только в палатах интенсивной терапии [20, 23, 27, 32,41].
296
Глава 24
Факторы риска угнетения дыхания
Таблица 24.5
Внутривенное ОКП Эпидуральное введение опиоидов Оба метода
Непрерывное введение Торакальные, абдоминальные операции Пожилой возраст
Вмешательство членов семьи Пункция твердой мозговой оболочки Передозировка
Заболевания органов дыхания Интратекальное введение/эпидуральное Торакальный катетер Тяжесть состояния > 3 по классификации ASA Операция длительностью > 4 ч Другие наркотические/ седативные препараты
ОКП — обезболивание, контролируемое пациентом; ASA — Американское общество анестезио-
логов
Зуд — наиболее частая жалоба пациентов при нейроаксиальном введении
опиоидов. Выраженность зуда может быть снижена приемом антигистаминных
препаратов, однако высвобождение гистамина не является механизмом развития
этого симптома, поэтому более эффективным лечением является применение ан-
тагонистов опиоидов. Также как и в случае с угнетением дыхания, введение не-
больших доз антагонистов устраняет побочный эффект, не влияя на степень
обезболивания. Это относится как к полным антагонистам, таким как налоксон,
так и к агонистам-антагонистам, таким как налбуфин, который для устранения
этих симптомов вводился внутривенно в дозе от 1 до 3 мг или подкожно в дозе
10 мг (таблица 24.6).
Таблица 24.6
Побочшые эффекты эпидурального введения опиоидов
Побочные эффекты Частота Лечение
Угнетение дыхания Редко: < 0.2% Болюсное введение налоксона с последующей инфузией
Зуд 20%-60% Легкий: антигистаминные препараты Средний: налбуфин системно, 1-3 мг Выраженный: инфузии налоксона Отмечается реже при введении жирорастворимых препаратов
Тошнота 6%-50% Легкая: противорвотные Средняя: антагонисты опиоидов
Задержка мочи 4%-40% Катетеризация
Тошнота отмечается реже, однако также беспокоит пациентов. В данном
случае может проводиться симптоматическое лечение с использованием любых
распространенных противорвотных препаратов, а также лечение низкими доза-
ми антагонистов или агонистов-антагонистов. Задержка мочи — другой, причи-
няющий беспокойство, побочный эффект, который, к сожалению, полностью не
устраняется введением антагонистов. Установка постоянного мочевого катетера
Лечение послеоперационных болей
297
многим пациентам в послеоперационном периоде в течение всего времени эпи-
дурального введения опиоидов проводится без дополнительного обоснования.
Инфицирование в месте установки катетера происходит редко. Эпидураль-
ная анестезия может проводиться в течение нескольких дней или недель при
условии, что установка и фиксация катетера была произведена в асептических
условиях.
Эпидуральные гематомы образуются редко, однако являются серьезным
осложнением. Как было сказано в главе 7, при нарушениях свертываемости кро-
ви эпидуральные инъекции (или удаление катетеров) следует выполнять с осто-
рожностью. При риске образования гематом лучше не вводить никакой из мест-
ных анестетиков эпидурально (чтобы устранить сомнения относительно
двигательной слабости), а также проводить наблюдение за двигательной актив-
ностью через каждые 2 часа.
Недостаточное обезболивание отмечается редко: как правило, когда низкие
дозы используются для лечения пожилых пациентов или «стандартные» дозы -
для лечения молодых крепких пациентов. Болюсное введение фентанила (50-100
цг) или самостоятельное введение раствора обычно улучшают обезболивание на
несколько часов, однако исходная скорость инфузии должна быть увеличена,
если требуется более длительное усиление обезболивания. Если повторное бо-
люсное введение и увеличение скорости инфузии не приводят к усилению обез-
боливания, следует проверить эффективность эпидурального катетера путем
введения 5-10 мл 1.5% раствора лидокаина или 2% хлоропрокаина. При правиль-
ной установке катетера в большинстве случаев это создает обезболивающий эф-
фект, продолжающийся в течение 2 часов.
Наибольше трудности возникают при лечении пациентов, которые получали
опиоды в предоперационном периоде, и у которых поэтому развилась высокая то-
лерантность и даже, возможно, зависимость. В таких ситуациях может помочь вве-
дение в эпидуральное пространство более мощного опиоида [42]. Другим методом
лечения является эпидуральное введение местных анестетиков и внутривенное
введение опиоидов с помощью системы обезболивания, контролируемого пациен-
том, давая пациенту возможность при необходимости увеличивать дозу.
Результаты
Применение всех описанных методик, особенно эпидуральных инфузий опиои-
дов, требует особого внимания и учета дополнительных факторов риска. Регио-
нарные методики послеоперационного местного обезболивания необходимо
использовать только с учетом соотношения риск/польза. Несмотря на риск раз-
вития побочных эффектов и объем трудозатрат, эпидуральное введение местных
анестетиков или опиоидов для обезболивания в послеоперационный период при-
водит к улучшению состояния пациентов по нескольким показателям, имеющим
важное значение [43]. Прежде всего, это облегчение болей, особенно болей при
движении после торакотомии [18] и операций на органах верхнего этажа брюш-
ной полости [21]. Послеоперационные нарушения дыхания отмечаются реже
[44]. Восстановление функции кишечника происходит более быстро [33]. Устра-
нение повышенной свертываемости крови, обычно отмечаемой в период прове-
дения оперативного вмешательства, снижает частоту осложнений при
трансплантации сосудов [45,46] и снижает риск тромбоэмболических осложне-
ний [47]. Наблюдается тенденция к уменьшению выраженности гормональной
стрессовой реакции на операцию [43], включая снижение выброса катехолами-
298
Глава 24
нов [48], что может обусловливать тенденцию к снижению частоты сердечных
осложнений [43]. Кроме того, получены данные, подтверждающие снижение
смертности от сердечно-сосудистых осложнений, так как оптимальное обезболи-
вание имеет особое значение для пациентов группы высокого риска, склонных к
ишемии [49]. Наконец, оптимальный режим эпидуральной анальгезии может
снизить риск развития хронических послеоперационных болей [50]. Все выше ска-
занное относится к эпидуральной анестезии опиоидами - местными анестетика-
ми: блокада периферических нервов также обладает вышеописанными
преимуществами (см. раздел «Методики обезболивания, связанные с воздейст-
вием на периферические нервы» в данной главе) [13, 14]. Возрастающий объем
информации свидетельствует о том, что режимы обезболивания, описанные
здесь, обладают значительными преимуществами и могут применения.
Службы лечения острых болей
Использование данных методик является сложным и обычно требует создания
отдельной анестезиологической службы [1, 2]. Основной задачей подобных
служб является разъяснение сестринскому персоналу и хирургам ограничений и
осложнений описанных методик. Кроме того, экспертная под держка требуется
при изменении дозировок и при развитии необычных осложнений, и особенно
при возникновении технических проблем, когда нарушается функционирование
эпидуральных или периферических катетеров. При возникновении подобных
проблем необходимо оказание помощи опытными анестезиологами в течение 24
часов. В идеале такой коллектив должен обследовать пациентов, страдающих бо-
лями, не менее двух раз в день и быть доступным для консультаций. Неотъемле-
мой частью работы службы является выработка инструкций, содержащих четкие
указания для палатных врачей, по распознаванию и первичному лечению вышео-
писанных осложнений и побочных эффектов.
Результаты работы службы по лечению боли значительно улучшаются при
включении в ее состав медицинской сестры, которая займется обучением и под-
держкой палатных сестер, а также обеспечит оказание более постоянной и после-
довательной помощи пациентам. Кроме того, лучших результатов позволяет до-
биться использование стандартных протоколов при непрерывном введении
анальгетиков, а также регламентирование по лечению осложнений. В регламенте
должны быть описаны мероприятия по мониторингу показателей дыхания и пре-
дусмотрено разрешение начала лечения палатным медицинским сестрам (обыч-
но с применения налоксона) до прибытия специалистов по лечению боли.
Такая помощь должна входить в круг обязанностей анестезиологической
службы, а в более крупных лечебных учреждениях часто требуется наличие соб-
ственной отдельной службы. В менее крупных муниципальных лечебных учреж-
дениях для лечения пациентов, страдающих болями, особая служба может рабо-
тать по вызову, однако это требует интенсивного обучения всего сестринского
состава и регламентации действий при любых возможных событиях. В общем,
необходимо отметить, что организации, имеющие службы лечения боли, получи-
ли значительные преимущества при послеоперационном ведении пациентов.
Лечение послеоперационных болей
299
Литература
1. Ready, L. В., Oden, R., Chadwick, Н. S., Benedetti, С., Rooke, G. A., Ca-plan, R.,
Wild, L. M. Development of an anesthesiology-based postoperative pain management
service. Anesthesiology 68: 100, 1988.
2. Ferrante, F. M., VadeBoncouer, T. R. Postoperative Pain Management. Philadelp-
hia: WB Saunders, 1993.
3. Macintyre, P. E. Acute Pain Management: A Practical Guide. 2nd ed. Philadelphia:
WB Saunders, 2001.
4. Rawal, N., Jones, R. M., Aitkenhead, A. R. Management of Acute and Chronic Pain.
London: BMJ Publishing, 1998.
5. Sinatra, R. S., Acute Pain: Mechanisms and Management. St. Louis: Mosby-Year
Book, 1992.
6. Etches, R. C. Respiratory depression associated with patient-controlled analgesia: A re-
view of eight cases. Can. J. Anaesth. 41; 125,1994.
7. Macintyre, P. E. Safety and efficacy of patient-controlled analgesia. Br. J. Anaesth. 37: 36,
2001.
8. Ryan, J. A., Jr., Adye, B. A., Jolly, P. C., Mulroy, M. F., П. Outpatient inguinal hernior-
rhaphy with both regional and local anesthesia. Am. J. Surg. 148:313,1984.
9. Rawal, N., Axelsson, K., Hylander, J., Allvin, R., Amilon, A., Lidegran, G., Hallen, J.
Postoperative patient-controlled local anesthetic administration at home. Anesth. Analg.
86: 86,1998.
10. Stein, C., Comisel, K., Haimerl, E., Yassouridis, A., Lehiberger, K., Herz, A., Peter, K.
Analgesic effect of intraarticular morphine after arthro-scopic knee surgery. N. Engl.
J. Med. 325: 1123,1991.
11. Alien, H. W., Liu, S. S., Ware, P. D., Naim, C. S., Owens, B. D. Peripheral nerve blocks
improve analgesia after total knee replacement surgery. Anesth. Analg. 87:93,1998.
12. Ganapathy, S., Wasserman, R. A., Watson, J. T., Bennett, J., Armstrong, К. P., Stockall,
C. A., Chess, D. G., MacDonald, C. Modified continuous femoral three-in-one block
for postoperative pain after total knee arthroplasty. Anesth. Analg. 89: 1197,1999.
13. Capdevila, X., Barthelet, Y., Biboulet, P., Ryckwaert, Y., Rubenovitch, J., d'Athis, F. Ef-
fects of perioperative analgesic technique on the surgical outcome and duration of re-
habilitation after major knee surgery. Anes-thesiology 91: 8,1999.
14. Singelyn, F. J., Gouvemeur, J. M. Extended «three-in-one» block after total knee arthrop-
lasty: Continuous versus patient-controlled techniques. Anesth. Analg. 91:176,2000.
15. Grant, S. A., Nielsen, К. C., Greengrass, R. A., Steele, S. M., Klein, S. M. Continuous pe-
ripheral nerve block for ambulatory surgery. Reg. Anesth. Pain Med. 26: 209, 2001.
16. Klein, S. M., Grant, S. A., Greengrass, R. A., Nielsen, К. C., Speer, К. P., White, W.,
Warner, D. S., Steele, S. M. Interscalene brachial plexus block with a continuous
catheter insertion system and a disposable infusion pump. Anesth. Analg. 91: 1473,
2000.
17. Singelyn, F. J., Dangoisse, M., Bartholomee, S., Gouvemeur, J. M. Adding clonidine
to mepivacaine prolongs the duration of anesthesia and analgesia after axillary brac-
hial plexus block Reg. Anesth. 17: 148,1992.
18. Kavanagh, В. P., Katz, J., Sandier, A. N. Pain control after thoracic surgery. A revi-
ew of current techniques. Anesthesiology 81: 737,1994.
19. Cousins, M. J., Mather, L. E. Intrathecal and epidural administration of opioids. Anest-
hesiology 61: 276,1984.
20. Wheatley, R. G., Schug, S. A., Watson, D. Safety and efficacy of postoperative epidural
analgesia. Br. J. Anaesth. 87:47,2001.
300
Глава 24
21. Liu, S., Carpenter, R. L., Neal, J. M. Epidural anesthesia and analgesia. Their role in po-
stoperative outcome. Anesthesiology 82:1474,1995.
22. Ready, L. B., Chadwick, H. S., Ross, B. Age predicts effective epidural morphine dose
after abdominal hysterectomy. Anesth. Analg. 66:1215,1987.
23. Liu, S. S., Alien, H. W., Olsson, G. L. Patient-controlled epidural analgesia with bupi-
vacaine and fentanyl on hospital wards: Prospective experience with 1,030 surgical pa-
tients. Anesthesiology 88: 688, 1998.
24. Ummenhofer, W. C., Arends, R. H., Shen, D. D., Bernards, С. M. Comparative spinal
distribution and clearance kinetics of intrathecally administered morphine, fentanyl,
alfentanil, and sufentanil. Anesthesiology 92:739,2000.
25. de Leon-Casasola, O. A., Lerna, M. J. Postoperative epidural opioid analgesia: What are
the choices? Anesth. Analg. 83: 867,1996.
26. Peng, P. W., Sandier, A. N. A review of the use of fentanyl analgesia in the manage-
ment of acute pain in adults. Anesthesiology 90: 576, 1999.
27. Scott, D. A., Beilby, D. S., McClymont, C. Postoperative analgesia using epidural infu-
sions of fentanyl with bupivacaine. Aprospective analysis of 1,014 patients. Anesthe-
siology 83: 727,1995.
28. Chaplan, S. R., Duncan, S. R., Brodsky, J. B., Brose, W. G. Morphine and hydromorpho-
ne epidural analgesia. A prospective, randomized comparison. Anesthesiology 77:
1090,1992.
29. Liu, S., Carpenter, R. L., Mulroy, M. F., Weissman, R. M., McGill, T. J., Rupp, S. M.,
Alien, H. W. Intravenous versus epidural administration of hydromorphone. Effects on
analgesia and recovery after radical retropu-bic prostatectomy. Anesthesiology 82:
682,1995.
30. Paech, M. J., Moore, J. S., Evans, S. F. Meperidine for patient-controlled analgesia af-
ter cesarean section. Intravenous versus epidural administration. Anesthesiology 80:
1268,1994.
31. Solomon, R. E., Gebhart, G. F. Synergistic antinociceptive interactions among drugs
administered to the spinal cord. Anesth. Analg. 78: 1164,1994.
32. de Leon-Casasola, O. A., Parker, B., Lerna, M. J., Harrison, P., Massey, J. Postoperative
epidural bupivacaine-morphine therapy. Experience with 4,227 surgical cancer pati-
ents. Anesthesiology 81:368, 1994.
33. Steinbrook, R. A. Epidural anesthesia and gastrointestinal motility. Anesth. Analg.
86: 837, 1998.
34. Hodgson, P. S., Liu, S. S. A comparison of ropivacaine with fentanyl to bupivacaine
with fentanyl for postoperative patient-controlled epidural analgesia. Anesth. Analg.
92: 1024,2001.
35. Curatolo, M., Schnider, T. W., Petersen-Felix, S., Weiss, S., Signer, C., Scaramozzi-
no, P., Zbinden, A. M. A direct search procedure to optimize combinations of epidural
bupivacaine, fentanyl, and clonidine for postoperative analgesia. Anesthesiology 92:
325,2000.
36. Brodner, G., Van Aken, H., Hertle, L., Fobker, M., Von Eckardstein, A., Goeters, C.,
Buerkle, H., Harks, A., Kehlet, H. Multimodal periopera-tive management—combi-
ning thoracic epidural analgesia, forced mobilization, and oral nutrition—reduces hor-
monal and metabolic stress and improves convalescence after major urologic
surgery. Anesth. Analg. 92:1594,2001.
37. Kehlet, H., Dahl, J. B. The value of «multimodal» or «balanced analgesia» in postope-
rative pain treatment Anesth. Analg. 77: 1048, 1993.
38. Dahl, V., Raeder, J. C. Non-opioid postoperative analgesia. Acta Anaes-thesiol. Scand.
44: 1191,2000.
Лечение послеоперационных болей
301
39. Woolf, С. J., Chong, М. S. Preemptive analgesia—treating postoperative pain by pre-
venting the establishment of central sensitization. Anesth. Analg. 77: 362,1993.
40. Kissin, I. Preemptive analgesia. Anesthesiology 93: 1138,2000.
41. Ready, L. B., Loper, K. A., Nessly, M., Wild, L. Postoperative epidural morphine is
safe on surgical wards. Anesthesiology 75:452,1991.
42. de Leon-Casasola, O. A. Postoperative pain management in opioid-tol-erant patients.
Reg. Anesth. 21: 114,1996.
43. Kehlet, H., Holte, K. Effect of postoperative analgesia on surgical outcome. Br. J. Ana-
esth. 87: 62,2001.
44. Ballantyne, J. C., Carr, D. B., deFerranti, S., Suarez, T., Lau, J., Chalmers, T. C., Angelillo,
I. F., Mosteller, F. The comparative effects ofpostoper-ative analgesic therapies on pul-
monary outcome: Cumulative meia-analyses of randomized, controlled trials. Anesth.
Analg. 86: 598,1998.
45. Christopherson, R., Beattie, C., Frank, S. M., Norris, E. J., Meinert, C. L., Gottlieb, S.
O., Yates, H., Rock, P., Parker, S. D., Perler, B. A., et al. Perioperative morbidity in pa-
tients randomized to epidural or general anesthesia for lower extremity vascular sur-
gery. Perioperative Ischemia Randomized Anesthesia Trial Study Group.
Anesthesiology 79: 422,1993.
46. Tuman, K. J., McCarthy, R.)., March, R. J., DeLaria, G. A, Patel, R. V., Ivankovich, A.
D. Effects of epidural anesthesia and analgesia on coagulation and outcome after ma-
jor vascular surgery. Anesth. Analg. 73: 696,1991.
47. Rodgers, A., Walker, N., Schug, S., McKee, A., Kehlet, H., van Zundert, A., Sage, D.,
Eutter, M., Saville, G., Clark, T., MacMahon, S. Reduction of postoperative mortality
and morbidity with epidural or spinal anaesthesia: Results from overview of randomi-
sed trials. Вт. Med. J. 321: 1493,2000.
48. Breslow, M. J., Parker, S. D., Frank, S. M., Norris, E. J., Yates, H., Raff, H., Rock, P.,
Christopherson, R., Rosenfeld, B. A., Beattie, C. Determinants of catecholamine and
cortisol responses to lower extremity revas-cularization. The PIRAT Study Group.
Anesthesiology 79:1202,1993.
49. Beattie, W. S., Badner, N. H., Choi, P. Epidural analgesia reduces postoperative myo-
cardial infarction: a meta-analysis. Anesth. Analg. 93: 853-858,2001.
50. Perkins, F. M., Kehlet, H. Chronic pain as an outcome of surgery. A review of predicti-
ve factors. Anesthesiology 93: 1123,2000.
Учебное издание
Малрой Майкл
МЕСТНАЯ АНЕСТЕЗИЯ
ИЛЛЮСТРИРОВАННОЕ ПРАКТИЧЕСКОЕ РУКОВОДСТВО
Редактор А. Митрохин
Художник Н. Лозинская
Технический редактор Т. Блёнцева
Компьютерная верстка О. Лапко, В. Носенко
Лицензия на издательскую деятельность № 06331
от 26 ноября 2001 г.
Подписано в печать 14.04.03. Формат 70x100'/16.
Гарнитура Таймс. Бумага офсетная. Печать офсетная.
Усл. печ. л. 24,7. Тираж 3100 экз. Заказ1б85
Издательство «БИНОМ. Лаборатория знаний»
Телефон (095)955-0398. E-mail: Ibz@aha.ru
Отпечатано с готовых диапозитивов в полиграфической фирме «Полиграфист».
160001, г. Вологда, ул. Челюскинцев, 3.
Настоящее практическое руководство по местной анестезии,
выдержавшее три издания на английском языке, является
идеальным как для начинающих, так и для опытных врачей.
Оно содержит подробные описания наиболее часто
выполняемых процедур.
Откройте для себя современное и наиболее
полное руководство по регионарным блокадам!
В этой книге вы найдете достоверные описания всех
регионарных блокад, в том числе особенности их проведения
в акушерстве, педиатрии и при лечении хронической боли.
Здесь вы также познакомитесь с такими необходимыми
в клинической практике темами, как системная токсичность,
наблюдение за больным и обеспечение его безопасности,
а также с методиками обезболивания, контролируемыми
самим больным.
Приводится описание методик анестезии отдельных
областей тела с перечнем показаний и целей
каждой процедуры.
Фармакологические и физиологические данные помогут
вам сделать выбор эффективных препаратов и избежать
осложнений.
Пошаговое описание дополнено соответствующими
анатомическими данными, обсуждениями препаратов
и сведениями о лечении специфических осложнений.
Авторство бывшего президента Американского общества
по местному обезболиванию гарантирует точность
и надежность информации.
Иллюстрации отражают все этапы правильного
выполнения каждой процедуры.
Новые и дополненные разделы по:
новым методикам, таким, как постоянные блокады
с использованием микродозирующих систем;
традиционным и новым препаратам; isbn 5-94774-069-9
устройствам для наблюдения
за больным;
вопросам безопасности;
ш л 9*795947 74 06 9 0
лечению болевого синдрома.