Текст
Reagents for
Organic Synthesis
Volume 2
LOUIS F. FIESER
Sheldon Emery Professor of Organic Chemistry, Emeritus
Harvard University
MARY FIESER
Research Fellow in Chemistry
Harvard University
WILE Y-INTERSGIENCE
A DIVISION OF JOHN WILEY AND SONS
NEW YORK • LONDON • SYDNEY • TORONTO
1969
Л. ФИЗЕР, М. ФИЗЕР
Реагенты
для органического
синтеза
ТОМ V
ПЕРЕВОД С АНГЛИЙСКОГО
канд. хим. наук 3, Е, САМОЙЛОВОЙ
ПОД РЕДАКЦИЕЙ
академика И. ДЦ КД-1УНЯНЦА
и доктора хим, г/аую*Р,. ГУ ’КОСТ ЯНОВСКОГО
МОСКВА 197 1
ИЗДАТЕЛЬСТВО «МИР»
УДК 661.7/54-41
Редакция литературы по химии
Инд. 2-5-3
70
ПРЕДИСЛОВИЕ АВТОРОВ
Одобрительные отзывы, выраженные как в официальных рецен-
зиях. так и лично, побудили нас написать этот дополнительный том
«Реагенты для органического синтеза», объем которого определяет-
ся количеством новых реагентов, появившихся за два с половиной
года после окончания работы над первым томом.* Дополнительный
том содержит 1320 новых ссылок для 390 реагентов, обсуждавшихся
в первом томе *, и 550 ссылок для 226 реагентов, рассматриваемых
здесь впервые. Большая часть последних реагентов появилась,
когда первый том уже был написан, некоторые реагенты давно из-
вестны, но теперь они вновь нашли применение в современных ис-
следованиях. Интересно, что за этот период появилось много новых
окислительных (17) и восстановительных (11) агентов. Однако об-
ластью, в которой открыто наибольшее число новых реагентов, ока-
залась химия металлоорганических соединений. В этом томе рас-
смотрено 34 новых металлоорганических соединения, тогда как в
большем по объему первом томе* их 50. Все шире применяются и но-
вые фосфор- и сераоргаыические соединения.
Мы признательны нашим коллегам за помощь при подготовке
этого тома. /Многие из них прислали нам полезную информацию или
проверили отдельные разделы, имеющие отношение к их собственной
работе. Некоторые прислали нам рефераты, за которые мы особенно
благодарны.
/V!. Физер
Л. Ф. Физер
В русском переводе тома I —IV.— Прим. ред.
A
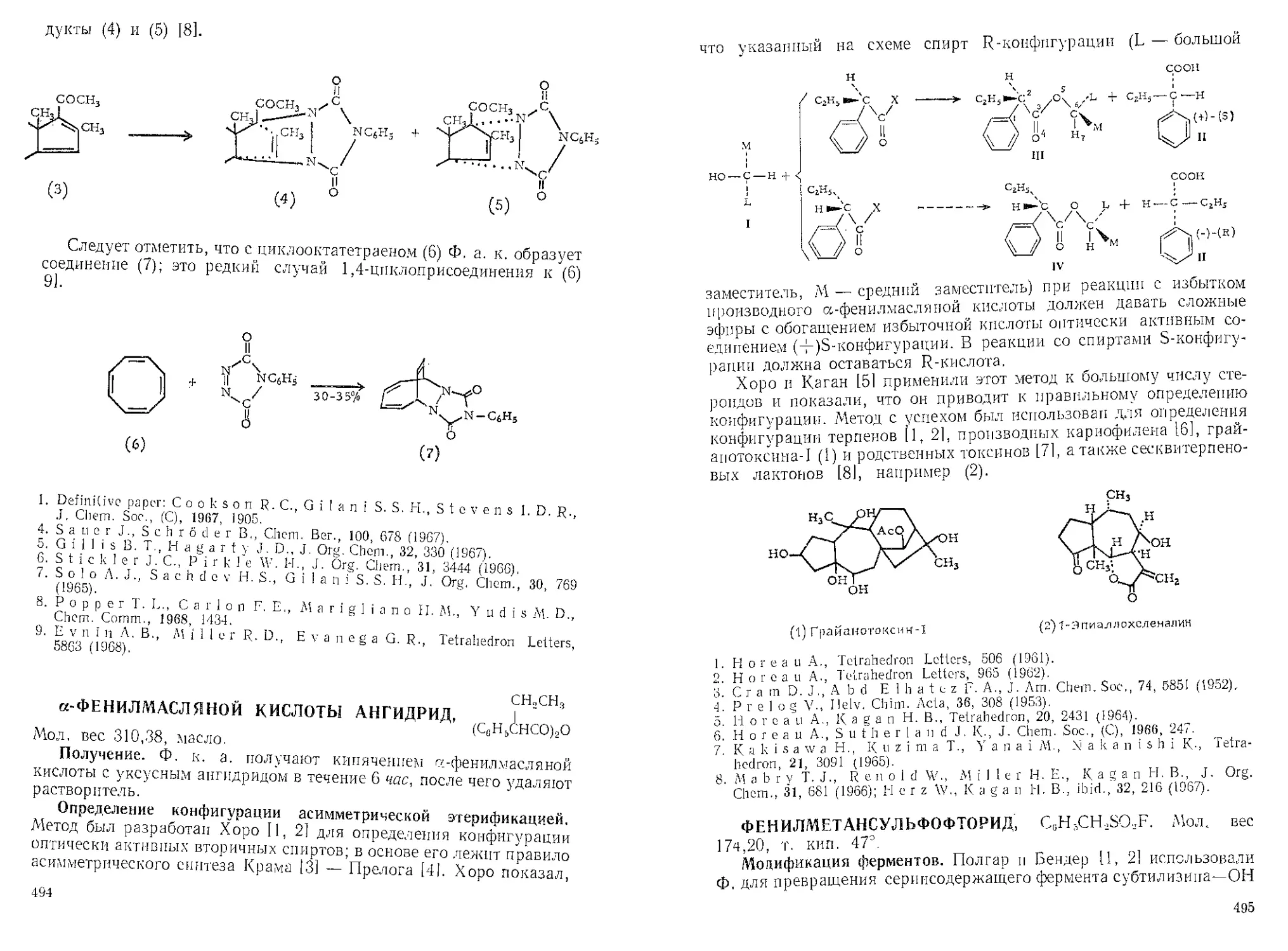
1-ДДАМАНТАНКАРБОНОВОЙ КИСЛОТЫ ХЛОРАНГИДРИД. Мол.
еес 198,69, т. пл. 54—56э.
Адамантан, полученный по методу Шлеиера [11, можно превра-
тить в 1-карбоновую кислоту карбоксилированием с помощью му-
равьиной кислоты, mpem-бутанола’и 96%-
ной серной кислоты[2];тот же продукт
f можно получить и из 1-бромадамантана,
j муравьиной кислоты и 96 % -ной сер ной
cocl кислоты [3],
Рапала и сотр. [4] получили 17[3-адаман-
таты стероидов действием этого хлоран-
гидрида на спирт в бензоле, содержащем эквивалентное коли-
чество пиридина. Ада.мантат 19-нортестостерона обладает значи-
тельно большей анаболитической активностью, чем другие эфиры.
Этот пространственно затрудненный хлорангидрид было пред-
ложено 151 использовать в синтезе нуклеозидов для защиты первич-
ной гидроксильной группы в положении 5'. В смеси бензол — пири-
дин А, к.х. реагирует с 2'-дезокси-5-фтор у ридином (3) с образованием
кристаллического эфира, в котором введенная группа может быть
либо в 3'-, либо в 5'-положении. Вопрос о том, какая из этих возмож-
ностей реализуется, удается решить с помощью ацетилирования.
При моноадамантоилировании (3) преимущественно атакуется пер-
вичная гидроксильная группа в положении 5'. Введение трифенил-
метильной группы и ацетилирование с последующим частичным
гидролизом приводит к 3'-О-ацетил-2'-дезокси-5-фторуридину (1),
который при адамаытоилировании до соединения (2) и дезацетили-
ровании дает 5'-адамантоил-2'-дезокси-5-фторуридин (4), идентичный
полученному прямым адамаытоилированием. Изомерный ему З'-ада-
мантоил-2'-дезокси-5-фторуридин (6) был получен при введении в
(3) трифенилметильной группы в положение 5', адамантоилировании
7
3’'-гидроксильной группы и обработке полностью защищенного про-
изводного (5) водной уксусной кислотой для удаления трифенилмс-
тилытон защитной группы. Продукт (6) действительно оказался
З'-изомером соединения (4). Изомеры отличаются по температурам
плавления, хроматографическому поведению и спектральным свой-
ствам. Интересно, что при обработке (5) водной уксусной кислотой
происходит избирательное отщепление трифснилметильной группы
без затрагивания адамантоильного заместителя. С другой стороны,
в соединении (2) в слабощелочной среде (0,025 н. NaOH) преимущест-
венно удаляется 3'-ацетильная группа, а в более щелочной среде
(0,25 н. NaOH) легко отщепляется адамантоильная группа в поло-
жении 5',
8
1 S c h 1 e v e r P R-, von, Donaldson M. M., Nicholas R. D. C u-
nas C.,'Org. Syn., 42, 8 (1962),
2 S tetter Й., Schwarz M., Hirschhorn A., Chem. Ber., 92, 1629
H 959).
□ Fieser L. F., N azer M. Z., ArcherS., Berberian D, A., SI igh-
tcrR. G., J, Med. Chem., 10, 517 (1967).
4 ]? a p ala R. T., Kra ay R. J., Gerzon K., J, Med. Chem., 8, 580 (1965).
9 Gerzon К., К a u D., J. Med. Chem., 10, 189 (1967).
АЗИДОФОСФОРНОЙ КИСЛОТЫ МЕТИЛОВОГО ЭФИРА HAT-
0
li
РИЕВАЯ СОЛЬ, CH3OPN3. Мол. вес 80,05, т. пл. 146—148°.
ONa
Получение [1]. Кристаллический реагент получают реакцией
диметил азидофосфата с иодистым натрием в ацетоне.
Применение [11. Реагент считается в высшей степени избира-
тельным для фосфорилирования аминов даже в разбавленных вод-
ных растворах.
1. Hamer N. К., Chem. Comm., 1967, 758.
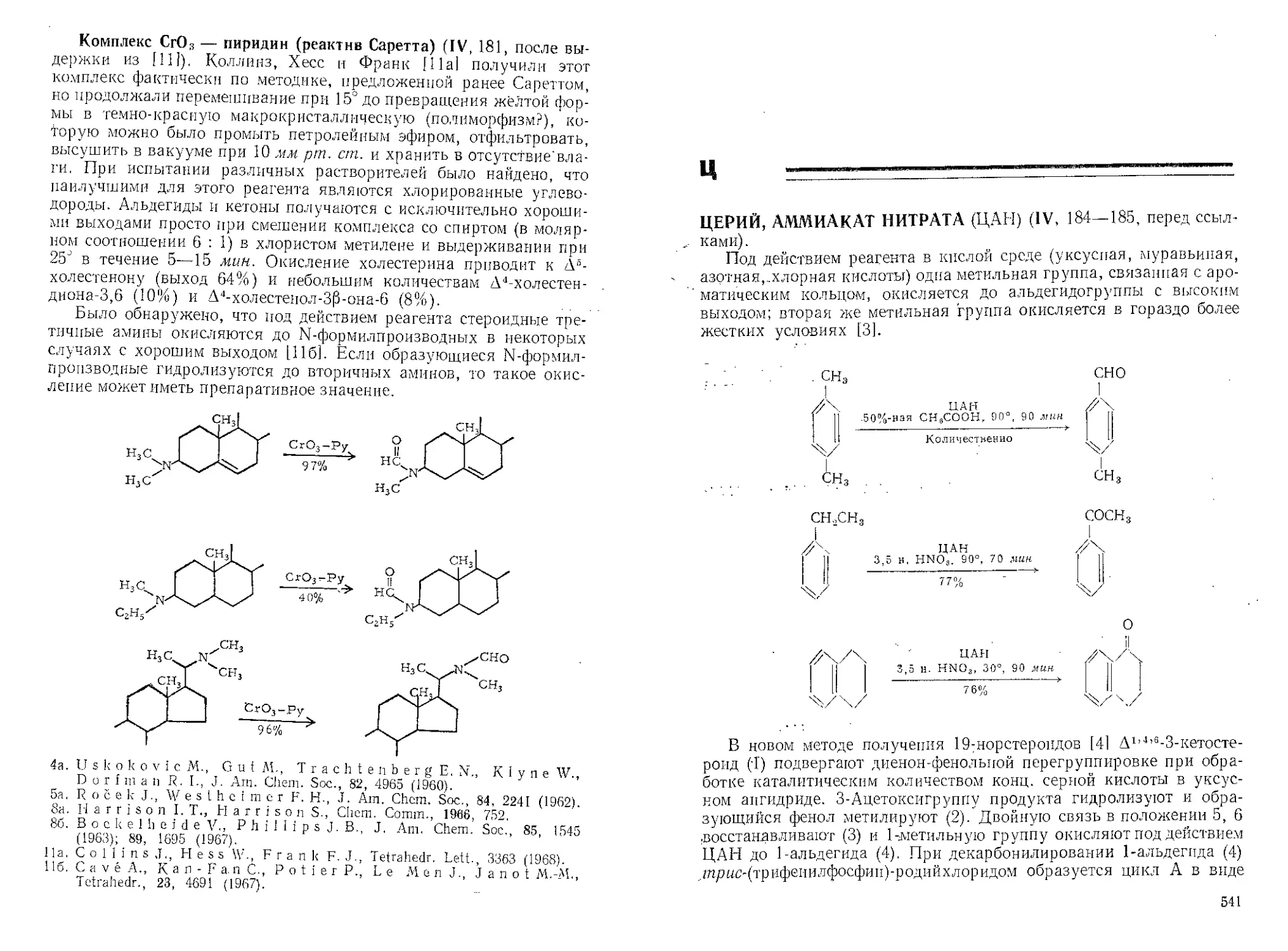
А30ДИКАРБ0Н0В0Й КИСЛОТЫ ДИЭТИЛОВЫЙ ЭФИР (I,
13—15).
Реакции Дильса — Альдера (I, 14, после выдержки из [9]).
С тропоном этот диенофил образует продукт 1,4-присоединения 19а]
CO2Et
N
II
N
I
CO2Et
(Перед ссылками.) При нагревании с реагентом в эфире аромати-
ческие гидроксиламины окисляются с выходами 70—90% [14]. Али-
фатические гидроксиламины дают более низкие выходы.
Реакция с пиримидинами [15]. С пиримидинами (1), содержащими
У С6 амино-или гидразиногруппу, но незамещенными у С5, А. к. д. э.
взаимодействует в ДМФА или хлорбензоле с образованием 5-(1,2-ди-
I АС Г ; ZNH, (NHNH,) ^Nrx/NH2(iNHNH2) I СЛЩМСХШЦСОгСДЦ j |j
5 40-90% NHCO2CsH5 (2) 1
СО2С2Н5
карбэтоксигидразин)-производных (2). Этот удобный метод введения
азота был использован в интересном синтезе антибиотика фервену-
9
линз (5). 1,3-Д|шетил-6-гпдразиноуранил (3) при обработке реа-
гентом образует (4), который в одну стадию превращается в анти-
биотик иод действием хлорокиси фосфора в ДМФА (в условиях ре-
акции Вильсмейсра).
Соответствующее (4) аминопроизводное (6) по указанной ниже
схеме образует 1,3-дпметплмочевую кислоту (8).
СО2С,н5
N- М'1С0,С,Н5
НСООН, Ni
74%
Н3СХ А А’НССЦДЩ
. ’ Г "к
/ч А 8 и-
О^\у/ ''NH,
i
сн3
(7)
O^N/^n/^O
I Н
СНз
Синтез дисульфидов [161. А.к.д.э. с меркаптаном (эфир, ком-
натная температура) дает аддукт 1:1(1), который при кипячении
в бензоле в течение 5 час реагирует со вторым эквивалентом меркап-
тана с образованием дисульфида. Этот метод особенно удобен для
синтеза несимметричных дисульфидов.
RSH
RSH + CJ-l^O-XX-NCOAH^ — СЛ-IACNH — N (SR)CO2C2H5------>
(П
—> RSSR-|- QIl&0.1!CNHNHCO2CaH5
Обзор [17].
9а. К i lahara Y., Л1 u г a t a I., N i t t a T., Tetrahedron Letters, 3003
(1967).
13. Definitive paper: Y о n c d a F., S u zuki K-, N i t t a Y., J. Org. Chem.,
32, 727 (1967).
14. T а у I о r E. C., Yoncda F., Chem. Comm., 1967 199.
15. Taylor E. C., So w inski F., J. Am. Chem. Soc., 90, 1374 (1968).
10
if, Щ uka i у ama T., Takahashi К,, Tetrahedron Letters, .>907 (1968),
17' f- h г E., Lind H., Angew, Chen;., Internal. Ed., 5, 3/2 (1966).
ДЗОТА ЧЕТЫРЕХОКИСЬ (1, 18-24).
Внимание! Сообщалось [lai о взрыве при взаимодействии реа-
гента в жидкой фазе с н- гекса ном при комн атной температуре.
(I, 19, после выдержки из [51). Сейферт описал методик}' (Org.
SyiL, 1967), по которой Л. ч., кислород и цпклооктен (1) вводят
в реакцию в эфирном растворе при охлаждении до — 20'. Образую-
Конфигурации неизвестны
щаяся смесь аддуктов (2), (3) и (4) при обработке триэтиламииом
превращается в нитроолсфип; I-пптропнклооктсн (5) был получен
в виде желтого масла с выходом 98%.
Окисление амидов (дезаминирование по Уайту) (продолжение
!, 21). Продукт бензоилирования 2-фепилэтиламнна (1) —соединение
(2) взаимодействует с Л. ч., образуя (3), термическое разложение
которого при 77' приводит к 2-феиилэтилбензоату (4) [22а].
Н
СсИ6СОС1 и,о4
С6Н5СНгСН„МН, ——CeH5CH.>CH.,\COC6H5 —
(1)
NO
—. CGHsCH.,CH2NCOCP)Hr, -A- CtiHsCfI..CH.,OCOCcH5 -bN3
СП (4;
Фуроксаны (I. 24, перед ссылками). Петерсон [291 обнаружил,
что при реакции А. ч. с избытком ацетона тунг 0—5' получается край-
не неустойчивое промежуточное соединение (1), разлагающееся при
нагревании до 30’ с. выделением окислов азота и образованием диаце-
тилфуроксана (2) с высоким выходом. Окись (2) с помощью триметил-
11
фосфита можно восстановить до диацетилфуразана (3). Эта реакция
с успехом применима и в случае ацетофенона.
СН3СОСН3 + N2O4 —> Продукт
5СЩ CH3Cfi------рССН3 (СН3О)3Р
93% N ,
о
(2)
(1)
снэ
L3
+ (сн3о)эро
(3)
la. U г b a n s k i Т., F а 1 е с к i J,, Chem. Ind., 1967, 1424.
22а. White Е. Н., Org. Syn., 47, 44 (1967).
29. Peterson L. I., Tetrahedron Letters, 1727 (1966).
АЗОТИСТОВОДОРОДНАЯ КИСЛОТА (I, 25—28).
Реакция Шмидта (I, 25—27), При исследовании душистых ве-
ществ мускуса, полученного из пахучих желез мускусной кабарги,
Шинц, Ружичка, Гейер и Прелог [4а] выделили, кроме мускона (III),
оптически активное основание общей формулы C16H25N, [a]D---17,4°,
7max267 нм, logs 3,7, которое было названо мускопиридином. Это
КМпО4
(III) JVJyCKOH, с16н30о
(IV) Мускопиридин, C16H25N
основание очень медленно окисляется перманганатом калия, но при
достаточно продолжительном воздействии образует пиридин-2.6-ди-
карбоновую кислоту (II). Этот факт свидетельствует о том, что в сое-
динении имеется 2,6-диалкилпиридиновая группа и отсутствуют ка-
кие-либо неароматические двойные связи. Биман, Бюхи и Уолкер
[46], считая, что сходство двух С ^-составляющих мускуса — муско-
12
на (Ci6H30O) и мускопиридина (C16H,3N) — неслучайно и опреде-
ляется биогенетическим родством, предложили для мускопиридина
структуру IV, циклическая система которой соответствует мускону,
।——с=о
(СНг)ю I
I----СНг
снгсо2с2н51
СН2СО2С2Н5^
(СН3)3СОК
CO2Et
I---с = сх
(сн2)10 I ^СН2СО2Н
I---СН2
со2еь
л
f----сх \
-----> (СНг)!0 II СНг
ПФ К 1--------сх„/
Всссгакоэление
по Вольеру-Кижнеру
(О
(СН2)10|| У
+ (E3Z)
13
а метильная группа в том же положении ответственна за оптическую
активность,
В полном синтезе мускопирлдина ключевая стадия состоит во
взаимодействии олефина и А.к. с образованием ненасыщенного амина
(реакция Шмидта). Исходное соединение циклододеканон (1) кон-
денсацией с диэтилсукцинатом по Штоббе превращается в (2). При
кипячении (2) с полифосфорной кислотой осуществляется циклиза-
ция и декарбоксилирование до соединения (4), при восстановлении
которого по Вольфу — Кижнеру происходит миграция двойной
связи и образуются олефины (5) и (6), При обработке последних А. к,
получается смесь неустойчивых тетрагидропирпдонов, непосредст-
венная ароматизация которых осуществляется дегидрированием над
палладиевым катализатором в 1-метнлнафталине (в н-цимоле дегид-
рирование происходит медленно). Образующаяся смесь изомерных
пиридинофанов (8) и (9) — низкоплавких кристаллических веществ—
легко разделяется хроматографически. Изомер (8) превращают далее
в N-окись (7), которая при взаимодействии с уксусным ангидридом
дает С-ацетоксипроизводное (10). Последующий гидролиз и окисле-
ние (10) приводят к кетону (И), в который под действием йодистого
метила и трет-бутилата калия вводят метильную группу в по-
ложение, соседнее с карбонильной группой. Восстановление по
Вольфу — Кижнеру дает маслообразное вещество, образующее пи-
кролонат с т. пл. 163—166°, идентифицированный по смешанной
пробе с пикролонатом природного (-г)-мускопиридина. Рацемиче-
ское основание разделяют на оптические антиподы с помощью ди-/г-
толуил-ь-винной кислоты (I, 381—382), Продукт охарактеризован
в виде пикролоната, не дающего депрессии температуры плавления
с пикролонатом заведомого мускопиридина.
Реакция с хинонами (I, 27—28, в конце раздела).
Две группы исследователей Г8а, 861 независимо установили
строение продукта, образующегося при взаимодействии 2,3,5-трп-
метил-1,4-бензохинона с А. к. в серной кислоте и показали ошибоч-
ность структуры (о), предложенной Мизити и сотр. [8].
Geyer U., Pre log V., Helv. ChimL
Walker В. H., J. Am. Chem. Soc., 79,
Moore H. W., Folkers K., Tetra-
4а. S с h i n z Н., R uzieka L.,
Acta, 29, 1524 (1946).
46. Biemann К., В и chi G.,
5558 (1957).
8, Definitive paper: M i s i t i D_,
hedron, 22, 1201 (1966).
14
ga. R 1 c h a r d s R. W., Smith R. M., Tetrahedron Letters, 2361 (1966).
86 В e d f о r d G. R., J ones G., Webster B. R., Tetrahedron Letters,
’ 2367 (1966).
АКРОЛЕИН, CH2=CHCHO. Мол. вес 56,06, т. кип. 51—53°,
уд. вес 0,841.
Триалкилборан, например (3), получаемый взаимодействием гек-
сена-1 (1) с дибораном 1(2), получен из NaBH4-0BF3L удивительно
легко вступает в реакцию 1,4-присоединения к А. с образованием
енолбората (4), который гидролизуется до альдегида (5) [11. Груп-
пой Брауна было показано, что удобнее добавлять воду к раствору
борорганического соединения в ТГФ; с последующим введением ак-
6СН.,=СНСН,СН5СНХН;54-В..Н6 —* 2В (СН2СН2СН2СН2СН2СН3)3 —>
сн3сн асн2сн 2СН аСН,СН 2СН =СНОВ R ,
G)
сн3сн,сн2снйснгснасн2сн3сно
(5)
ролеина происходит 1,4-присоединение с одновременным гидролизом
до альдегида (5). По данным газовой хроматографии выходы (5)
составляли 65, 71 и 77% за 10, 25 и 60 мин соответственно.
Другие примеры:
7? + СНг=СНСНО -80%.>
сн2сн2сно
2-Бромакролеин реагирует с алкилборанами аналогичным путем,
давая а-бромальдегиды с выходами 60—95%, Эти соединения чрез-
вычайно реакционноспособны и лучше всего сохраняются в виде со-
ответствующих диэтил ацеталей. Подобным же образом использует-
ся 2-метилакролеин [2].
1. Brown Н. С., R о g i с AL М., R a thke М. W., К a b а 1 k a G. W.,
J. Am. Chem. Soc., 89, 5709 (1967).
2. В г о w п Н. С., К a b а 1 к a G. W., R a f h к е М. W., R о g 1 с М. М.,
J. Am. Chem. Soc., 90, 4165 (1968).
АЛЮМИНИЙ. Ат. вес 26,98.
Работая над улучшением синтеза p-каротина и ликопина по Кар-
реру, группа немецких исследователей 111 использовала А. и следы
сулемы для конденсации 2 молей пропаргилбромида с 1,2-дихлор-
15
1,2-диэтоксиэтаном, в результате которой образуется диэтоксиди-
ацетиленовое производное (1), дающее при гидратации диэтоксиди-
кетон (2).
С,Н-,0 ОС3Н5 с.,н,о, .ОС.Н,
! | >СН —СН<
2нс^ссн,вгтС1сн—снс1 неясен/ '<Н.,С^СН->
8 7%
(1)
С2Н5ОХ ,ОС.)Н5
/СН~ сн^
о / \ о
Н2о II / \ II
—CH3CCHS CHXCHg
(2)
Шнейдер и Уидои [2] обнаружили, что А. лучше цинка для
конденсации пропаргилбромида с ацетоном по Реформатскому.
Н3СХ Ai Н3С
/С=О-у ВгСН.С = СН-----•> Х-сшс СН
Н3С'' ‘ 71% Нзсх|
он
(3)
Продукт (3) был получен в чистом виде без примеси алленов, нали-
чие которых неизбежно при использовании цинка.
1. К abb е H.-J., Truscheit Е., Elie г К., Ann., 684, 14 (1965).
2. Schneider D. F., Weedon В. С. L., J. Chem. Soc., (С), 1967, 1686.
АЛЮМИНИЯ БРОМИД (I, 37—38).
Внутримолекулярная циклизация Фриделя — Крафтса. Хьюсген
и Уги [7] сообщают, что для внутримолекулярной циклизации по
Фриделю — Крафтсу хлорангидридов co-фен ил алканкарбоновых кис-
лот (1) в парациклофаны (2) А. б. предпочтительнее хлористого
А1Вг3
-----
С5г
(1)71=8-15
(2)
алюминия. В обоих случаях требуется большое разбавление (в ка-
честве растворителя используют CS,), но с А. б. хлорангидрид кис-
лоты можно добавлять гораздо быстрее. Другое важное преимущест-
во состоит в том, что выходы с А1Вг3 обычно вдвое выше. Как правило,
выходы циклофанов средних размеров незначительны, но если п~ 15,
то парациклофан (2) получают с выходом 70% при использовании
в качестве катализатора А1Вг3 и 30% в случае применения А1С13.
16
Еще -более удивительны результаты циклизации, приводящей
к тетралиноцикленоиам [8], для которых только при использовании
А1Вг3 (но не А1С1з) были достигнуты вполне удовлетворительные
выходы в широком диапазоне изменения размера цикла (и=6—22);
некоторые примеры приведены ниже:
Размер цикла, п 6 8 9 10 11 12 14 16 18 22
Выход, % 93 68 51 18 32 47 64 58 64 55
Катализатор в синтезе адамантана. Шлейер и сотр. [9] обнару-
жили, что в присутствии больших количеств А. б. как катализатора,
й/дор-бутилбромида как активатора и НВг как сокатализатора не-
которые трициклические углеводороды, содержащие 10—12 углерод-
ных атомов, при 50° перегруппировываются в адамантан или его про-
изводные с алкильными заместителями в голове моста с выходами до
19%. Более эффективный комплексный катализатор был получен из
А1Вг3, НВг и смеси диметилциклогексанов [101. Робинсон и Таррат
[111 получили активный катализатор, добавляя при перемешивании
треш-бутилбромид к суспензии А. б. в углеводороде, который под-
вергается перегруппировке; выходы составляют 25-—65%. По-види-
мому, этот катализатор подобен «шламу А1Вг3», полученному из
А, б. и mpem-бутилбромида и описанному пока только в диссерта-
ции Вильямса [121. Этот катализатор был использован для перегруп-
пировки углеводорода ClgH24 (1), который рассматривается как геп-
тациклический [131, в триамантан (2):
Cl
(1)
Изомеризация. Найдено [141, что под действием А.б., очищен-
ного сублимацией или зонной плавкой, дифеи и л ацетилен димери-
зуется в^1,2,3-трифенилазулен с 10—15%-ным выходом. Механизм
этой необычной реакции 2Cl4H lu->C3tjH20 не вполне ясен; одно из
имевшихся бензольных колец расширяется до семичленного, другое
сужается на один углеродный атом, а три остаются без изменений.
В присутствии ионов переходных металлов (Vi+ или Ni2 + ) дости-
гается повышение выхода до 41%. Например, весьма эффективна
смесь четыреххлористого ванадия и цинковой пыли, так как под дей-
ствием цинка происходит восстановление до двухвалентного ванадия.
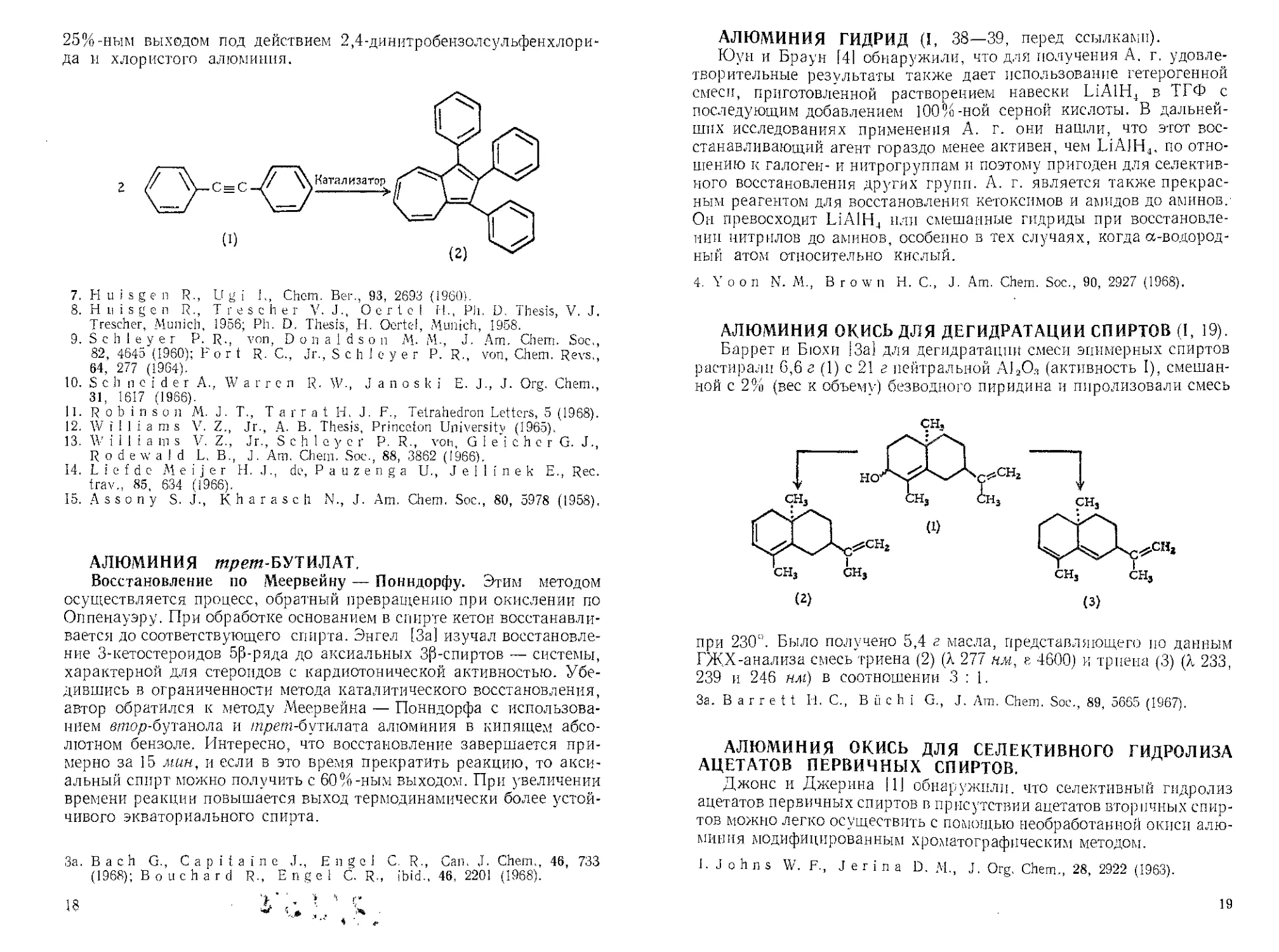
Ассони и Караш [15] осуществили с 25%-ным выходом димери-
зацию дифенилапетилена (1) в 1,2,3-трифенилазулен (2) почти с
25%-ным выходом под действием 2,4-динитробензолсульфенхлори-
да и хлористого алюминия.
7. Hui s g n R., Ug i 1., Chem. Ber., 93, 2693 (I960).
8. HiiisEjen R., Trescher V. J., Oerlol H., Ph. D. Thesis, V. J,
Trescher, Munich, 1956; Ph. D. Thesis, Fl. Ocrtel, Munich, 1958.
9. Schleyer P. R., von, Donaldson M. M-, J. Am. Chem. Soc.,
82, 4645 (I960); F о r t R. C., Jr., Schleyer P. R., von, Chem. Revs,,
64, 277 (1964).
10. Sell ncider A.. Warren R. AV., Janoski E. J., J. Org. Chem.,
31, 1617 (1966).
11. Robinson M. J. T., Tarrat H. J. F., Tetrahedron Letters, 5 (1968).
12. Williams V. Z., Jr., A. B. Thesis, Princeton University (1965).
13. AV i 1 1 i a m s V. Z., Jr., Schleyer P. R., von, Gle’ichcr G. J.,
Rodewald L, B., J. Am. Chem. Soc., 88, 3862 (1966).
14. L i e f d с M e i j e r H. J., de, P a uzenga U., J e I 1 i п e к E., Rec.
trav„ 85, 634 (1966).
15. A s s о n у S. J., Kharasch N., J. Am. Chem. Soc., 80, 5978 (1958),
АЛЮМИНИЯ /ире/и-БУТИЛАТ.
Восстановление по Меервейну — Понндорфу. Этим методом
осуществляется процесс, обратный превращению при окислении по
Оппенауэру. При обработке основанием в спирте кетон восстанавли-
вается до соответствующего спирта. Энгел [За] изучал восстановле-
ние 3-кетостероидов 5[5-ряда до аксиальных Зр-спиртов — системы,
характерной для стероидов с кардиотонической активностью. Убе-
дившись в ограниченности метода каталитического восстановления,
автор обратился к методу Меервейна — Понндорфа с использова-
нием emop-бутанола и mpem-бутилата алюминия в кипящем абсо-
лютном бензоле. Интересно, что восстановление завершается при-
мерно за 15 мин, и если в это время прекратить реакцию, то акси-
альный спирт можно получить с 60%-ным выходом. При увеличении
времени реакции повышается выход термодинамически более устой-
чивого экваториального спирта.
За. В а с h G., С а р i t a i п е J., Engel С. R., Сап. J. Chem,, 46, 733
(1968); Bouchard R., Engel C. R., ibid., 46, 2201 (1968).
АЛЮМИНИЯ ГИДРИД (I, 38—39, перед ссылками).
Юун и Браун [41 обнаружили, что для получения А. г. удовле-
творительные результаты также дает использование гетерогенной
смеси, приготовленной растворением навески LiAlH4 в ТГФ с
последующим добавлением 100%)-ной серной кислоты. В дальней-
ших исследованиях применения А. г. они нашли, что этот вос-
станавливающий агент гораздо менее активен, чем LiА1Н4, по отно-
шению к галоген- и нитрогруппам я поэтому пригоден для селектив-
ного восстановления других групп. А. г. является также прекрас-
ным реагентом для восстановления кетоксимов и амидов до аминов.'
Он превосходит ЫА1Н4 или смешанные гидриды при восстановле-
нии нитрилов до аминов, особенно в тех случаях, когда а-водород-
ный атом относительно кислый.
4. Yoon N. М., Brown Н. С., J. Am. Chem. Soc., 90, 2927 (1968).
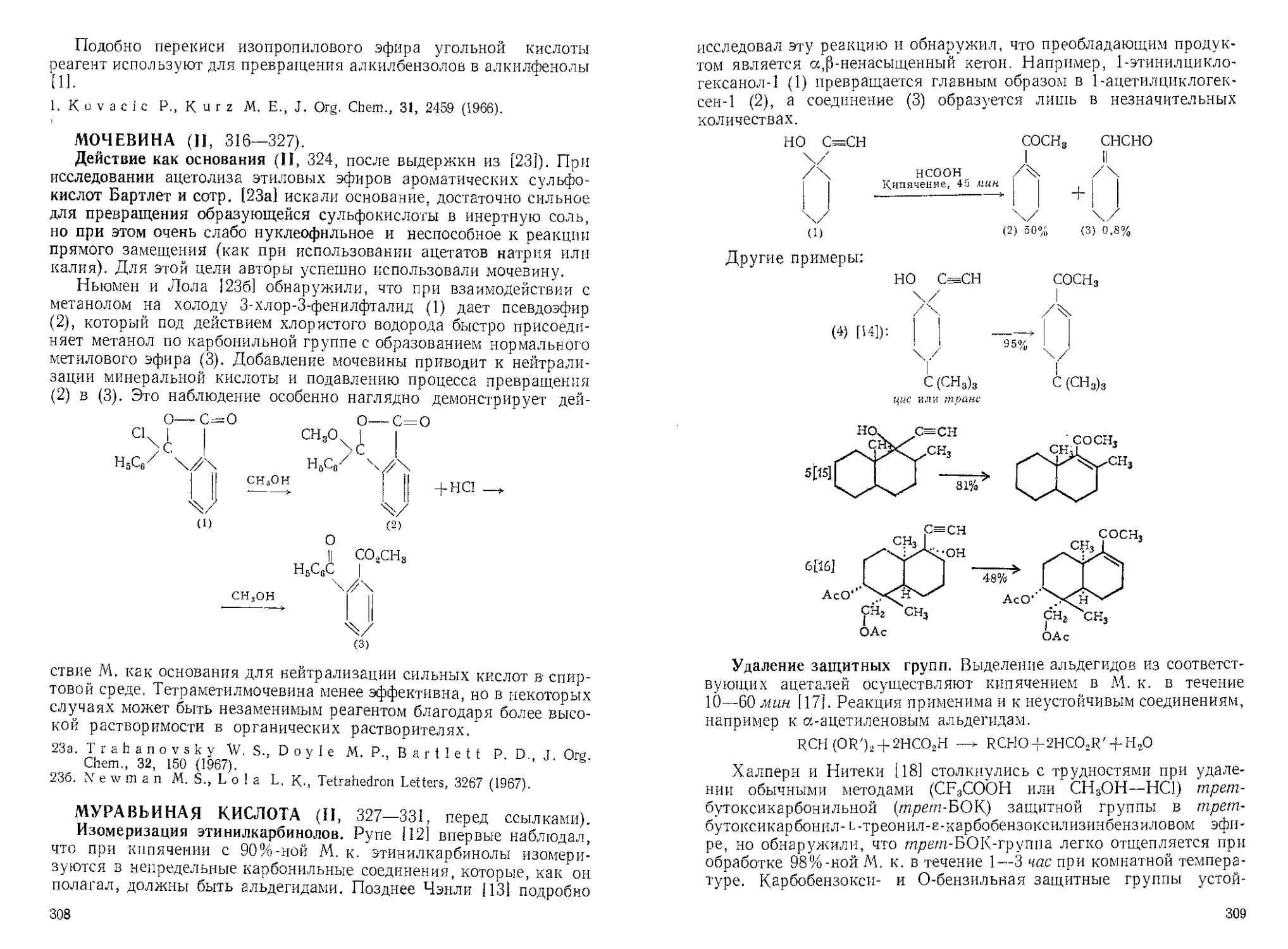
АЛЮМИНИЯ ОКИСЬ ДЛЯ ДЕГИДРАТАЦИИ СПИРТОВ (I, 19).
Баррет и Бюхи [За] для дегидратации смеси эпимерных спиртов
растирали 6,6 а (1) с 21 а нейтральной А12О3 (активность I), смешан-
ной с 2% (вес к объему) безводного пиридина и пиролизовали смесь
при 230% Было получено 5,4 г масла, представляющего по данным
ГЖХ-анализа смесь триена (2) (А 277 нм, е 4600) и трнена (3) (А 233,
239 и 246 нм) в соотношении 3:1.
За. Barrett Н. С., В ii с h i G., J. Am, Chem. Soc., 89, 5665 (1967).
АЛЮМИНИЯ ОКИСЬ для СЕЛЕКТИВНОГО ГИДРОЛИЗА
АЦЕТАТОВ ПЕРВИЧНЫХ СПИРТОВ.
Джонс и Джерина [1] обнаружили, что селективный гидролиз
ацетатов первичных спиртов в присутствии ацетатов вторичных спир-
тов можно легко осуществить с помощью необработанной окиси алю-
миния модифицированным хроматографическим методом.
1. Johns W. F., J е г i n a D. М_, J. Org. Chem., 28, 2922 (1963).
19
АЛЮМИНИЯ ОКИСЬ — КАЛИЯ ГИДРООКИСЬ («щелочная
окись алюминия»).
Кастеллс и Флетчер 11] получили этот реагент при встряхивании
в течение 2 час смеси 1 кг окиси алюминия с раствором 100 г КОН
в 75 мл воды. Образуется достаточно гомогенный адсорбат, который
можно перелить в хроматографическую колонку для элюирования
эфиром. Бэйрд и Уинстейн [2] использовали активированную порош-
кообразную 90%-ную А12О3 каталитической чистоты. При пропуска-
нии бензольного раствора эфира 3,5-динитробензойной кислоты через
колонку с этим реагентом происходит расщепление эфира, которое
можно наблюдать по мгновенно появляющемуся фиолетовому окра-
шиванию.
А1,О3 — КОН можно использовать для получения дихлоркарбе-
на или дибромкарбена из соответствующих галоформов L31. Смесь
циклогексена и галоформа в молярном соотношении 3 : 1 адсорби-
руют на реагенте и оставляют на 4 дня при комнатной температуре,
а затем вымывают эфиром. Получают 7,7-дигалоноркаран (2) с вы-
ходом 12—15% (в расчете на имеющееся в реагенте количество осно-
вания).
При пропускании через реагент раствора 2-/г-оксифенилэтилбро-
мида-1 (3) Бэйрду и Уинстейну 12] удалось выделить исключительно
неустойчивый спиро-[2,5]-октадиенон-3 (4) в виде твердого кристал-
лического вещества.
А12Оз--КОН
н2с---СН2Вг
(4)
О)
Джонс и сотр. ]41 исследовали дегидрогалогенирование соедине-
ния (5) и показали, что обычные реагенты [КОН, К2СО3, (C2H5)aN,
NaNH2l неэффективны, тогда как под действием А120з— КОН сое-
динение (5) превращается в (6) с выходом около 17%. Конечной
20
целью авторов был синтез полностью сопряженного декайна (7);
Н Н
трет-Ви (С= С),гС — С -== С — С — С = CH _трет-Ви (С С)5Н
CI С1
(5) (6)
1Си(ОАс)а, нодн, СН3ОН—Ру
1——----—————трет-Bu (С = C)10Bu-mpem
24%
(.7)
как это ни удивительно, оказалось, что это соединение можно полу-
чить непосредственно из (5), минуя выделение (6), сочетанием по
Эглинтону — Галбрайту [51 (П, 228).
[.Castells J., Fletcher G. A., J. Chemi Soc., 1956, 3245.
2. Baird R., W i nst e i n S., J. Am. Chem. Soc., 79, 4238 (1957); 85,567 (1963).
3. Serratosa F., J. Chem, Ed., 41, 564 (1964).
4. Jones E. R. H., Lee H. H., Whiting M. C.} J. Chem. Soc., 1960,
3483.
5. Eg! inton G., Galbraith A. R., J. Chem, Soc., 1959, 889.
АЛЮМИНИЯ ХЛОРИД (I, 41—54).
Катализатор реакции Дильса — Альдера (I, 51). Сиганек [33а]
обнаружил, что под влиянием А. х. сильно ускоряется реакция бен-
зола с дицианацетиленом по Дильсу — Альдеру. В присутствии этой
кислоты Льюиса реакция осуществляется при комнатной температу-
ре с образованием аддукта (1) с 63%-ным выходом и уменьшением
количества продуктов реакции Фриделя — Крафтса: нитрилов фе-
+ NC-C=C-CN
+ c6h5ccn + c6h5ccn
HCCN NCCH
(1) 63% (2) 11% (3) 4%
нилмалеиновой (2) и фенилфумаровой (3) кислот. В отсутствие А, х.
при 180 в течение двух дней образуется лишь 14% аддукта (1).
В обзоре реакций Дильса — Альдера Сойер [336] отмечает, что
в случае диенофилов, не имеющих полярных заместителей (СО, CN),
каталитический эффект кислот Льюиса отсутствует. По данным ПК-
спектроскопии кислота Льюиса образует комплексы с полярными
группами.
д А- х-~~ очень активный катализатор присоединения по Дильсу —
Альдеру диенов к производным акриловой кислоты [ЗЗв]. В этом
21
случае другие кислоты Льюиса либо обладают значительно меньшей
каталитической активностью, либо совсем ее не проявляют.
СН.
+ ,1 ЛЕМ
L снсо.,сн3 Ц L
'СО.2СН3
Сойер и Кредель [33г1 изучали присоединение циклопентадиена
к метилакрилату и обнаружили, что кислоты Льюиса не только
катализируют эту реакцию, но и повышают долю .эндо-продукта
(1). В отсутствие катализатора эндо- и жзо-продукты образуются
эндо
(I)
экзо
(Ю
в соотношении 82 : 18 (общий выход 22—51%); в присутствии А1С13
соотношение меняется до 98 : 2 (общий выход 79—81%).
Получение [3-гликозилхлоридов [381 (I, 53, перед ссылками).
В работе, выполненной в 1953 г. в Аделаидском университете (Юж-
ная .Австралия) н представленной в 1954 г. в докторской диссерта-
ции, Гагольский [391 нашел, что пентаацетат p-D-глюкопиранозы (1)
при взаимодействии с безводным А. х. в холодном хлороформе дает
с хорошим выходом продукт, идентичный «[3-ацетохлор глюкозе» (3),
полученной реакцией тетра-О-ацетил-а-d-глюкопиранозилхлорида
cis zci
(1)
Пентяацетат fl-D-глюкозы
-AlClgQAc
сн3
(2)
с «активным» хлоридом серебра [401. Почти в то же время аналогич-
ное наблюдение было сделано группой венгерских исследователей
[41]. В Аделаидском университете наблюдения Га голье ко го были
22
расширены Коритником и Миллсом [42], которые предполагали, что
реакция осуществляется с участием соседней 2-ацетоксигруппы и что
промежуточный комплекс (2) имеет конформацию вампы. Перенос
к тора в положение 1 происходит с расщеплением Сг-ацетоксилыюй
связи. Эта реакция применима к полностью ацетилированным аль-
допиранозам 1 : 2-/прлн:с-конфигурацин и стереоспенифична — обра-
зуются менее устойчивые аномеры, ацетил гликозил хлор иды 1 : 2-
щрщ-щконфигу рации.
Тр-имеризация алкинов (I, 53, перед ссылками). Бутин-2 (1)
три мер пзу етс я с выходом 60—70% до бициклического соединения
7 „ г А1С13/ОД
Z Н3 С — с - с “ СНз .-—---->
(1)
+ Н3С~С=С-СН3
—----------->
А1С13Н
(2) '
СН3
сн3
Н3С
н3с
сн3
(3)
(3) под действием безводного Л, х. пли алкилалюминийдихлорида
(около Ю мол. %) в бензоле или хлористом метилене при 25—35\
Углеводород (3) был тщательно идентифицирован и впервые описан
как гексаметилзамещенный дьюаровский бензол; его систематиче-
ское название: гексаметил бицикло-[2,2,0]-гексадисн-2,5 [43, 44].
В этой реакции предполагается образование промежуточного комп-
лекса AlCLj с тр и мети л метилен циклобутеном (2), сольватированного
бензолом [45L Реакция является первым препаративным способом
получения замещенного дьюаровского бензола. При взаимодействии
1 моля бутин а-2 с 0,5 моля безводного А. х. в циклогексане при 0°
происходит трициклотетрамеризация алкина до октаметил-син-три-
цикло-[4,2,0,03’5]-октадиепа-3,7 (4) с выходом 56% [461. Образова-
ние сн3
сн3
сн3
(4)
ине (4) включает, по-видимому, стадию димеризации комплекса (2).
23
33a. Ciganek Е., Tetrahedron Letters, 3321 (1967).
336. Sauer J., Angew. Chem., Internal. Ed., 6, 16 (1967).
ЗЗв. 1 n u к a i T., Kasai M., J. Org. Chem., 30, 3567 (1965); I n uk a i T.,
Koj'ima T., ibid., 31, 2032 (1966).
33r. Sauer J., Kredel J., Tetrahedron Letters, 731 (1966).
38. Topic suggested by Peter M. Barna, Calbiochem.
39. G a g о 1 s к i J., Ph. D. Thesis, Adelaide, 1954.
40. Schlubach H. H., Stadler P., Wolf I., Ber., 61, 287 (1928).
41. Zemplen G., Mester L., Eckhart E., Acta Chlm. Acad. Sei.
Hungaricae, 4, 53 (1954).
42. К о г у t n у к W., Mills J. A., J. Chem. Soc., 1959, 636.
43. Schafer W., Angew. Chem., Internal. Ed., 5, 669 (1966).
44. Schafer W., Hellmann H., Angew. Chem., Internal. Ed., 6, 518
(1967).
45. Schafer W., personal communication.
46. Rosenberg H. M., Eimutis E. C., Can. J. Chem., 45, 2263 (1967).
АМИД КАЛИЯ (I, 54—57, перед ссылками).
Нитрование кетонов [61. Нитрование соединений с активной
метиленовой группой алкилнитратами проводили обычно с помощью
mpem-бутилата калия в ТГФ; для этой цели основание возгоняли
и растворитель тщательно очищали. Фойер недавно показал, что
применение А. к. в жидком аммиаке значительно упрощает проведе-
ние этой реакции, причем выход продукта не уменьшается.
6. Feuer Н., И all А- М., Golden S., Reitz R. L., J. Org. Chem.,
33, 3622 (1968).
АМИД НАТРИЯ (I, 58—66).
Дегидрогалогенирование (I, 59—61, в конце раздела). Общий
метод превращения алкенов в алкины заключается в последователь-
ном бромировании и дегидробромировании. Уорд и ван Дорп [10а]
рекомендуют для дегидробромирования использовать А. н. в жидком
аммиаке. Примером служит получение диэтилацеталя пропаргило-
вого альдегида [106!:
сн„=снснощ вг2___—сн.вгснвгсно2!£122^£д
72-80% 80 — 82%
— СН.ВгСНВгСН (ОС2Н6)г NaNH;~N2h НС = ССН (ОС,Н5)„
75-78%
1,4-Отщепление HOR (перед ссылками). 1,4-Отщепление моле-
кулы спирта от ацетиленовых эфиров типа
СН,С=У-COR' или RC-C^CCH.OR'
I I
под действием щелочного металла в жидком аммиаке лежит в основе
общего метода построения ениновой системы НС=С—СН=СН—.
24
Аренс и сотр. [29] получили, например. гептен-З-ин-1 из метил-
пропаргилового эфира [29].
нс=ссн2осн3
(9
LiNHz, NH3> ыс^ССН2ОСНз *-ОДВг
: 80-86%
^пи,сн,сн?сн[71с=ссн2[осн;] -------> £сн3сн2сн2сн=с=с=сн2------------>
I--------------1 -носн3
(3) (4)
NaNH,
СН3СН,С1-12СН = СНС -= СН]-----> СН3СН3СН2СН =CHC^CNa
(5) Н,0 j 63-67% (6)
СН3СН,СНгСН = снс СН
()
Синтез кумуленов. Аренс и сотр. [30] разработали также способ
получения кумуленов. Примером служит синтез 1-метокси-4-метил-
пентатриена-1,2,3 (5).
нс^ссн2осн3 С4^--—> ыс=ссн2осн3 Li-производиое->
Эфир— ТГФ
>
68-72%
(2)
СН
HO-i-С^ССНзОСНз ВДОСН(ТЗОН)
82-88%
(О
СН,
1
С2Н3ОС-О
сн3 н
I I
(з)
(4)
Жидк.кн3 ON
2 NaNH2 СН3 ]
' cg ,,0, > ^С=С=С=СНОСН3 + С2Н5ОИа + СН“СН2
58-64% сНз^
(5)
Образование углеводородного цикла. Беннет и Скорч [31] обна-
ружили, что некоторые алифатические сложные эфиры, нитрилы,
сульфоны и кетоны, содержащие to-o-хлорфенильную группу, при
взаимодействии с амидом калия в жидком аммиаке образуют продук-
ты циклизации, содержащие углеводородный цикл, вероятно, через
промежуточный дегидробензол. Для реакции можно использовать
и продажный А. н. [32]. Этот метод является, по-видимому, наилуч-
шим для получения 1-замещенных бензциклобутенов.
25
10a. W а г cl J. Р., van Dorp D. A., Rec. trav., 85, 117 (1966): 86, 545 (1967).
10. \V a r d J. P., van Dorp D. A,, procedure submitted to Org. Syn., (1967).
17. Chaneo last cntrv to read: Kaiser E. AV, К e n v о n \V. G., H a u-
ser 'C. R., Org. Syn., 47. 72 (1967).
29. В r a n dsm a L., V с г к г u i j s s e H. D., A reus J. F., procedure
submitted to Org. Syn. (1967).
30. В r a n d s in a L., V ork ruijsse II. D., Arens J. F., procedure
submitted to Org. Svn. (1967).
31. В n n n e t t J. F., S к о r c z J. AJ. Org. Chem.. 27, 3836 (1962).
32. S к о rc z .1. Л., К a minski F. E., Org. Syn., 48, 53 (1968).
«-АМИНОБЕНЗОЙНАЯ КИСЛОТА. Мол. вес 137,14, т. пл.
188—189°. А. к. легко конденсируется с альдозами. Образующиеся
СНО
(Сиону H-H2N -/___СО..Н — CH--N -O'ZZ/
CI-КОН (CHOl-iy
сн.2он
при этом п-\Т'ГЛИкозиламинобензойные кислоты удобны для иденти-
фикации [11.
1. Ellis G. Р., Chem. Ind., 1966, 902.
CH,
2-АМИНО-2-МЕТИЛПРОПАНДИОЛ-1,3, CH,C-CH2OH. Мол. вес
1 ’ I
ОН хн.,
105,14, т. кип. 111—112,5°.
Лёблих и Лоуренс [11 описали метод выделения нсоабиетиновой
кислоты (см, структурную формулу) из сосновой живицы пли кани-
фоли с выходом 8—12% перекристаллизацией в виде соли с А.
I. L о е b 1 1 с h V. М., Lawrence R. V., J. Org. Chem21, 610 (1956).
Поправка к этой статье. Стр. 611, правая котища, троки 12 и 20: вместо
«3 lbs of amine» следует читать «1,5 lbs of amine».
АРИЛДИАЗОНИЯ ТЕТРАГАЛОГЕНБОРАТЫ (1, 71—73).
Внимание! Сообщалось о взрыве борфторида З-ппридилдиазония
[121. Хотя, как правило, борфториды диазония устойчивы при ком-
26
ватной температуре, с теми соединениями, которые разлагаются
ниже 100 \ следует обращаться с осторожностью 113!. Если разло-
жение наступает при температуре, близкой к комнатной, соль надо
полностью высушить и использовать по возможности быстрее,
щ/сйет. Eng- News, 45, Oct. 16, p. 44 (1967).
13 Doak G. O., Freedman L, D., Chem, Eng. News, 45, Dec. 18, p. 8
' (1967).
N-АЦЕТ АМИДОКАРБИНОЛ, CH;!CONHCH2OH. /Мол. вес 89,10,
т. пл. 50—52”.
Получение из ацетамида и формальдегида [1].
Защита цистеина 121. Взаимодействие А. с ь-цистеином в соляной
кислоте при pH 0,5 при 25 приводит к хлор гидр ату S-ацетамидоме-
тил- ь-цистеина, из которого последовательной обработкой AgaO
и H,S может быть выделено свободное основание. S-Ацетамидоме-
тильная группа устойчива к кислым агентам, которые обычно при-
меняются для удаления заместителей, неустойчивых в Кислой среде:
CF3COOH, HBr, НС1, HF; однако она эффективно отщепляется под
действием солей двухвалентной ртути (2 же) при pH 4 и комнатной
температуре — в условиях, когда устойчивы такие защитные груп-
пы, как карбобензокси, Ы-тре/и-бутоксикарбонильная и S-бензиль-
ная. По условиям растворимости эта группа пригодна для пептид-
ного синтеза как в безводной, так и в водной среде. Эта защитная
группа устойчива в условиях азидного метода синтеза пептидов.
CH2SH
H.,NCHCO.,H + CH3CONHCH.,OH
-H..0
CH.,SCH,NHCOCH3 ch2sch2nhcoch3
H3N-CHCO.,H 2^22^ H.,N —CHCOJ-]
ci-
Осуществленный недавно [31 полный синтез рибонуклеазы* вклю-
чал соединение различных пептидных звеньев для образования тет-
рагектапептида (104 остатка), известного как S-протеин. Этот поли-
пептид содержите остатков цистеина и 3 остатка метионина. Ацет-
амидометил ьная группа оказалась незаменимой защитной группой
для цистеиновых звеньев.
1. Einhorn A., Ladisch С., Ann., 343, 265 (1905).
2. \ eb с г D, F., Mil k q w ski J. D., Denkewa 1 ter R. G., Hir-
schmann R., Tetrahedron Letters, 3057 (1968).
3. Denkewalter R. G., Veber D. F., Holly F. W., Hirsch-
mann R., J. Am. Chem. Soc.. 91, 502 (1969).
Более поздние работы см. J. Am. Chem. Soc., 91, 501—503, 505—507 (1969),
а также Тезисы докладов Седьмого международного симпозиума по химии при-
тс)7пЬ'Х 2Ред1,11СНИ’1 > Бига, 21—27 нюня 1970 г., стр. 170, изд-во «Зинатне», Рига,
1У/0,-- Прим. ред. ’
27
АЦЕТИЛЕНДИКАРБОНОВОЙ КИСЛОТЫ ДИМЕТИЛОВЫЙ
ЭФИР (I, 78—79).
Синтез гетероциклических соединений (перед ссылками). В раз-
работанном Хендриксоном и сотр. 14] удобном общем методе
синтеза гетероциклических соединений ключевой стадией является
присоединение этого реагента по Михаэлю к различного типа суб-
стратам, имеющим по соседству с электрофильным центром амино-,
меркапто- или гидроксильную группу. Например, амин (1), выде-
ляемый нз хлоргидратаа-аминопропиофенона под действием ацетата
натрия, реагирует с А. к. д. э. при кипячении в метаноле. Через
10 мин осадок хлористого натрия отделяют фильтрованием и после
упаривания смеси получают продукт (4), который в присутствии
СеНаС = О СОаСН3
I -Р |
ch3chnh.2 с
(О III
с
I
соасн3
О)
ОН п
I
С6Н5С-------CCO.CH.J
I II
СН3СН- -ССО,СН3
4NZ
I
н
(4) J
сйн5с^оснсо,сн3
I II
сн3сн с—СО2СН3
xN/
I
н
L (3)
С0Н,С— ссо.,сн3
'll [|
н+ СН3СЧ /ССО2СН3
----XNZ
80% I
н
(5)
следов кислоты легко и с хорошим выходом превращается в пиррол
(5). Преимущество метода состоит в том, что ацетиленовое звено
реагента трансформируется в этиленовое, необходимое для построе-
ния ароматической гетероциклической системы.
СН3 СО,СН3
I I
0[4J) A/C^O+ й
III ।
NH, СО.2СН3
С6Н5С^О
C6HSCHNH
С6Н5
CO2CH3
C
111
c
I
CO2CH3
79%
СбН5г----|CO2CH3
СбН5|1 JjcOzCH3
C6H5
4. Hendrickson J. В.,
Hendrickson J. В.,
Soc., 86, 107 (1964).
5. James D. S., Fanta
Rees R., J. Am. Chem. Soc., 83, 1250 (1961);
Rees R., Templeton J. F., J. Am. Chem.
P, E., J. Org. Chem., 27, 3346 (1962).
28
АЦЕТИЛЕНИД ЛИТИЯ (I, 79—80, перед ссылками).
Гидрид лития нагревают с избытком ДМСО в атмосфере аргона
YQ___75°. К образовавшейся литиевой соли ДМСО [5] добавляют
небольшое количество трифенилметана, затем пропускают ацетилен
исчезновения красной окраски соли трифенилметиллития. Для
реакций алкилирования легко енолизуемых кетонов А. л. предпо-
чтительнее, чем ацетиленид натрия.
А. л. можно получить с количественным выходом при медленном
пропускании ацетилена в раствор литийнафталина в ТГФ [6]. При
добавлении к этому раствору а, р-непредельные кетоны этинили-
руются с хорошим выходом.
Другой способ получения А. л. состоит в нагревании лития
с графитом в бомбе или трубке при температуре выше 850°. При
этом образуется дилитийацетиленид — желтое вещество со светло-
серым отливом, которое можно растереть в тонкий порошок [7].
Дилитийацетиленид легко взаимодействует с ацетиленом в жидком
аммиаке с образованием прозрачного раствора ацетиленида лития.
LiC ~ CLi + НС = СН 2LIC СН
При этинилировании этим реагентом выходы иногда выше, чем с
реагентом, синтезированным из лития и ацетилена [8].
5. Kf iz J., Benes М. J., Резка J,, Tetrahedron Letters, 2881 (1965).
6. S u g а К., Watanabe S., T a к a h a s li i K., Chem. Ind., 1967, 1748;
Suga K., W a tanabe S,, Suzuki T., Can. J. Chem., 46, 3041 (1968).
7. H e г о 1 d A., Bull. soc. chim. France, 22, 999 (1955).
8. Mart in K. R-, Kamienski C. W., Dellinger M. H.,
Bach R. O., J. Org. Chem., 33, 778 (1968).
О О
АЦЕТИЛ-и-ТОЛУОЛСУЛЬФОНАТ, CH3C-O-СН3.
II "=
О
Мол. вес 214,24, т. пл. 54—56° (неочищенный).
Получение [11. Этот смешанный ангидрид сульфокислоты и кар-
боновой кислоты получается с количественным выходом при кипя-
чении безводной и-толуолсульфокислоты с избытком хлористого
ацетила до прекращения выделения хлористого водорода (3—5 час);
по удалении избытка хлористого ацетила остается бесцветный кри-
сталлический ангидрид. Кроме того, А. можно получить при взаимо-
действии безводной п-толуолсульфокислоты с избытком уксусного
ангидрида.
Расщепление простых эфиров [1]. Простые эфиры расщепляются
этим реагентом в относительно мягких условиях (25—130°; 2—48 час;
ооычный растворитель — ацетонитрил). Третий и пятый из нижепри-
веденных примеров особенно интересны, так как они демонстрируют
большую специфичность расщепления А. по сравнению с другими
реагентами. Поскольку сульфонатная группа в этом соединении
легко подвергается нуклеофильному замещению, может быть осу-
29
ществлен синтез новых замещенных ацетатов. Методика расщепле-
ния диоксана (4) подробно описана [2].
о
г.
(1) («-С4НЭ)2О —.—> л-С1Н[!О('СН3 -4-«-C4H()OTs
50%
о
I!
(2) ------> СН3СО (CH2)4OTs
} / 811 о /
о
/СН3
Г I !i
(3) ------>CH3CO(CH,)3CH
. z v 95|!A
/°\ 0
... I I--------^CH3COCH„CHaOCH,CII.,OTs
(4) | [ 87% 3 ~ 2 “ “
хо 7
о о
(5) СН3С CH2CH2OCH,CHaOTs__> CH3COCH2CH.,OTs
2 о
1. Karger М. Н., М azur Y., J. Am. Chem. Soc., 90. 3878 (1968).
2. К а г g e г zV). FI., M azur Y,, procedure submitted to Org. Syn. (1969).
а-АЦЕТОКСИАКРИЛОНИТРИЛ (I, 83). Исправление. Мол.
вес 111,10.
А. был также получен [1а| реакцией хлорацетальдегида (1) с
цианистым натрием в водном растворе при температуре от —10
до 0°. 2-Хлор-1-цианэтилацетат (2) получается с выходом 90% через
предполагаемые промежуточные соединения (а) и (б). Полагают, что
первой стадией реакции является образование циангидрина (а),
N;iCN
С1СН./ДЮ —•>
(I)
он
асн.,сн< •••—>сн3сос\
( - \CN -ЫС1 (б)
он
С1СМ,Снб
(а) 4 СМ
90%
zOCOCU, ,ососн3
С1СН..СН —----------> сн.,=с
ч 9 1- -х
'CN "CN
(2) (3)
который при отщеплении хлористого водорода и кетонизацин дает
ацетплиианид (б); последний ацетилирует циангидрин (а) с образо-
ванием 2-хлор-1-иианэтплацетата (.2), который был выделен. Дегидро-
галогенирование (2) тр инти ламином даета-ацетоксиакрилоннтрил (3),
la. Nowak R. М., J. Org. Chem., 28, 1182 (1963).
АЦЕТОН, СН;{СОСН3. Мол. вес 58,05, т. кип. 56—57\
Для очистки реагента, используемого при получении ацетонидов
углеводов, Уистлер и Уолфром 111 рекомендуют кипятить техниче-
ский анетон с небольшими порциями перманганата калия до устой-
чивой пурпурной окраски, затем перегнать, высушить в течение двух
дНей над безводными карбонатом калия или сульфатом кальция,
профильтровать и снова перегнать.
I Whistler R. L., Wo 1 from М. L., Methods in Carbohydrate Che-
mistry, 11, 319 (1963).
АЦЕТОНИТРИЛ, CH3CN. T. кип. 81,6°.
Этот апротонный смешивающийся с водой растворитель удобен
для проведения реакции Дильса — Альдера (I, 294). Моу [1] отме-
чает, что главной примесью, мешающей использовать А. в поляро-
графии, является акрилонитрил, который по температуре кипения
отличается от А. лишь па 4,2'д Для разделения рекомендуется пере-
гонка тройных н двойных азеотропов, которые оба вещества образуют
с этиловым спиртом и водой. К продажному А. добавляют 95?о -ный
этиловый спирт и перегоняют смесь на колонке Стедмана (60—65
теоретических тарелок). Очищенный таким образом А. пригоден
также для УФ-спектроскопии.
1, Мое _N. S,, Chem. Scand., 21, 1389 (1967).
БЕНЗИЛХЛ0РМЕТИЛ0ВЫЙ ЭФИР (I, 97).
Получение. Модифицированная методика [1а] позволяет избе-
жать использования большого избытка формальдегида, кроме того,
значительно упрощается выделение продукта.
la. С о п п о г D. S., Klein G. W., Т а у 1 о г G. N., procedure submitted
to Org. Syn. (1968).
р-БЕНЗОИЛПРОПИОНОВАЯ КИСЛОТА, CfiHaCOCH2CH2CO2H.
Мол. вес 178,18, т. пл. 116—119°.
Б. к. получают сукциноилированием бензола.
Защита ОН-групп [1]. Реагент взаимодействует с ОН-группами
в присутствии дициклогексилкарбодиимида, давая р-бензоилпро-
пионильные производные. Снятие защиты производится при комнат-
ной температуре обработкой гидразингидратом в пиридине с добав-
лением уксусной кислоты в качестве буфера. Расщепление иниции-
руется кетогруппой, которая избирательно реагирует с гидразином.
Применение смеси пиридин — уксусная кислота удобно, так как
при этом не затрагиваются чувствительная к кислотам метокситри-
тильная и чувствительная к основаниям цианэтилфосфатная защит-
ные группы, а также остается без изменения пиримидиновый цикл
дезоксицитидина и тимина. Эта защитная группа использовалась
в синтезе олигонуклеотидов; кроме того, найдено, что она удобна
в синтезах на нерастворимых полимерных носителях.
li и ндц д \
-О-ССНаСНаСС6Н5------>-ОНщС6Н5С >с=о
\снг—сн2
I, L е t s i п g е г R. L., Caruthers М. Н., Miller Р, S., Ogil-
vie К. К, J. Am. Chem. Soc., 89, 7146 (1967); see also Letsin-
g e r R. L., Miller P. S., Grams G. W., Tetrahedron Letters, 2621
(1968).
БЕНЗОЙНОЙ КИСЛОТЫ НАТРИЕВАЯ СОЛЬ (I, 101 — 102,
перед ссылками).
Анжиал и Стюарт [4] обнаружили, что тозилинозиты под дейст-
вием Б. к. н. с. в ДМФА претерпевают превращения по четырем
различным направлениям в зависимости от природы соседних групп.
Однако не всегда можно предсказать направление реакции: замеще-
ние с инверсией, непосредственное замещение, отщепление, образо-
32
В31-1ПС эпоксидного цикла с последующим раскрытием (против пра-
вила днакспалиного раскрытия). Авторы сделали довольно неожи-
данный вывод о малом различии реакционной способности аксиаль-
ной н экваториальной тозилоксигрупн.
4. А П g У а 1 S. J., Stewart Т. S., Australian J. Chem., 20, 2117 (1967).
о-БЕНЗОЛДИАЗОНИЙКАРБОКСИЛАТ (I, 104, перед ссылками).
Стайлс [4] нашел, что импульсный фотолиз Б. приводит к обра-
зованию N4, СО,, бифенплена и трифенилена. В преобладающих
количествах получается бифснилен, но выходы продуктов обычно
низкие. Фридман [51 получил бпфенилеи с выходом до 30%, пере-
мешивая Б. при слабом кипячении в 1,2-дихлорэтане (т.кпп. 83—84').
J- В и- г у R. S., S р о k i: s G. N., Stiles AL, J. Am. Chem. Soc., 84, 3570
(1962).
5. L о g n 1 1 о F. M., Seitz A. H., Eric d m a n L., Org. Syn., 48, 12(1968).
БЕРЧА ВОССТАНОВЛЕНИЕ (I, 108—110).
Анилин как сорастворитель. Стрельцова и Шилов [9] наблюдали
превращение дифенил ацетилена в 1,2-дифенил этан под действием
натрия в жидком аммиаке, содержащем анилин или /г-толупдпи;
зга реакция, по-видимому, включает промежуточное образование
стильбена. Восстановление системы стирольного типа металл-ам-
миачными реагентами возможно через последовательное присоеди-
нение электронов металла и протонов аммиака. Анилин может спо-
еебетвэвать этому процессу за счет повышения содержания актив-
ных протонов в реакционной среде-. Английским исследователям [101
удалось преодолеть трудности в осуществлении полного восстанов-
ления производных 9-дегпдро-о -гомоэстрона (1) путем применения
надежного метод г1 восстановления по Берчу с использован нем ани-
лина в качестве сорастворителя. Джонс [11] успешно использовал
.истод с применением анилина в качестве сорастворителя для вос-
2
№ J994
33
становления сопряженного диена (3) в А-1и)-дегидроэстрадиол (4;.
Восстановление фенолов по Берчу (I, НО, перед ссылками).
Считается, что свободные фенолы обычно не изменяются в условиях
восстановления по Берчу. Однако Фрайд и сотр. [12] отмечают, что
2-окси 7-метоксифлуорен (1) до некоторой степени восстанавливает-
ся; более того, если концентрацию лития повысить от 1,5 до 4 Д4, то
происходит практически полное восстановление фенольного кольца.
Так, из эстрона (4) было получено соединение (5) с 75% -ным выходом.
Восстановление аминов. Берч [13] обнаружил, htoN, N-диметил-
анилины восстанавливаются литием в жидком аммиаке, Сторк и Уайт
[14] сделали более существенное наблюдение; первичные амины,
соответствующие этим третичным, также могут восстанавливаться
с удовлетворительными выходами, В тщательном исследовании вос-
становления о-тол у иди на наибольшие выходы были получены при
использовании смеси литий — жидкий аммиак — mpem-бутапол.
Одно из преимуществ этого метода состоит в том, что непрореагиро-
вавший амин легко отделяется от нейтральных продуктов. Во всех
исследованных случаях желаемый ненасыщенный кетон был загряз-
нен примесью насыщенного кетона. Однако эти два продукта можно
34
qen<o разделить с помощью пиперидина, который количественно
NH, NH., О О
L си. к ' „сну д;н3 /Сн3
Z Щ 3 К;1. МН;|. /<\/ J / \/ /
| | <си^н | | НД|1 | [
X'z .r->0%
присоединяется к ненасыщенному кетону и совершенно не реагирует
с насыщенным. Для выделения ненасыщенного продукта пиперидино-
кето н превращают в подметил ат, который очищают кристаллизацией
из н-бутанола и расщепляют пиридином.
+ Руг/сНД
9. Стрельцова С. Г., Шилов Е. А., Укр. хим. ж., 22, 489 (I95G).
10. D о и g 1 a s G. Н., Graves J. М. Н., Hartley D,, Hu g-
li е s G. Л., М с L о и g h 1 i п В. J., S i d d a 1 1 J., Smith H., J.
Chem. Soc., 1963, 5072.
11. .1 oh ns W. F., J. Org. Chem., 31, 378,0 (1966).
12. F r i e cl J., A b г a h a m N. A., Santlianakr ishnan T. S., J.
Ain. Chem- Soc., 89, 1044 (1967).
13. Birch A. J., J. Chem. Soc., 1946, 593.
14. S I о r k G., W h 1 t e W- N., J. Am. Chem. Soc., 78, 4604 (1956).
9-БОРАБИЦИКЛО-[3,3,11-HOHAH (9-ББН). Мол. вес 122,02,
т. пл. 140—142А
Получение ill. Реагент (1) получают взаимодействием циклоок-
тадиена-1,5 с дпбораном в ТГФ:
(1)
9-ББН обладает удивительной термической стабильностью даже при
^UO и, что еще более неожиданно, необыкновенно устойчив на воз-
духе (по крайней мере в течение двух месяцев).
Гидроборирование * [2.L При гидроборировании олефинов реа-
гент проявляет такую же избирательность, как диизоамплборан
(Г 313, V, 123). Так, гексен-1 превращается в гексанол-1 (9996)
и гексанол-2 (1%), стирол — в 2-фенилэтанол (98%) и 1-фенилэта-
нол (2%). Эти реакции обычно завершаются за 5 мин, исключая
сильно пространственно затрудненные олефины (например, в случае
2,3-диметилбутена-2 требуется 24 час при 25').
Синтез 9-алкилбицикло-13,3,1Ьнонанолов-9 13]. Взаимодействие
9-ББН с олефинами и последующее карбонилирование приводят
к 9-алкилбицикло-[3,3,1]-понанолам-9 с общим выходом 85—9596.
1. Knights Е. F-, Brown Н. С., J. Am. Chem. Soc., 90, 5280 (1968).
2. Knights E, F., Brown II. C., J. Am. Chem. Soc.. 90, 5281 (1968).
3. Knights E. F., Brown H. C., J. Am. Chem. Soc., 90, 5283 (1968).
* Реакцией Э-алкил-Э-борабицикло-ТЗ, 3, 1 [-нонанов с СО и LiAH 1(ОСН3)3
и последующим окислением получают альдегиды:
СН3(СН,,)3СН = СН2 —>СН3(СН2)5СНО (77%)
C6H5CH==CI-I13 —> CfiH3CH3CIT2CHO (84%)
1 II Д J-CHO (79%)
Введение альдегидной i руппы осуществляется с сохранением конфигурации
Подобный синтез возможен в присутствии многих функциональных групп
[Brow n Н. С., Accounts Chem. Revs., 2, № 3, 65 (1969)].— Прим. ped.
36
БОРА ТРИБРОМИД <1, 110-111).
Последнюю работу по деметилированию метилариловых эфиров
см М cOfflie J. F., Watts Al. L.f W e s i D. E., Tetrahedron,
24’’ 2289 (1968).
Механизм расщепления простых эфиров
ArOCH3+BBr3
zCH3
ArO+<
чВ-Вг.{
~-£Н.й ArOBBr.,
1^2 АгОН -P H,3BO,7 -[- 2Н Вг
Реакция включает, по-видимому, комплексообразование реагента
с эфирным кислородом, поэтому рекомендуется брать 1 моль ВВг3
на эфирную группу и еще по 1 молю реагента на каждую имеющуюся
группу способную к образованию комплекса (например, — СНО,
—CN, -СО3Н).'
Последняя стадия в синтезе d, и-зеараленона (2) включает уда-
ление защитных групп из диметилового эфира (1). Обработка (1)
эфпратом трехфтористого бора пли днфеиилфосфидом натрия [За]
приводит только к моноэфирам, Полное расщепление с выходом 34%
было осуществлено под действием Б, т. в хлористом метилене [36].
1,3- Дибромадамантаи (I, ПО, после выдержек из [4] и [5]). Талати
и сотр. [5а1 не удалось повторить осуществленное Баухманом полу-
чение 1,3-дибромадамантана бромированием адамантана Б. т. в при-
сутствии следов А1Вг3, Однако они обнаружили, что 1,3-дибромада-
мантан можно получить с 86%-ним выходом бромированием смссыо
ВВг3—А1Вг3 в молярном соотношении 125: 1.
Тетрабромциклопронеи (1, 111, перед [1 — 61). Тетрахлорцгюо-
пропен (1) вступает в экзотермическую реакцию с Б.т. с образованием
тетрабромцпклопропена (2) и газообразного треххлористого бора
4 ВВг,
----
(2)
(9
37
с почти количественными выходами [71. Эта реакция необычна, так
как под действием кислот Льюиса тетрахлорциклопропен (1) пре-
вращается, как правило, в трихлорциклопропенплпевые соли. Счи-
тают, что реакция начинается с образования С:!С1 ВВг;{С1 ~, а полу-
чающаяся после внутрикомплексного обмена галогенов ионная пара
СчВг+ВС1р реагирует с ВВщ, давая наблюдаемые продукты.
За. М а п п Г. G., Р г a g п е 1 I М. J., J. Chem. Soc., 1965, 4120.
36. V 1 a t t a s J., Harrison I. T., Tokes L., F r i e d J. H., Cross
A. D., J. Org. Chem., 33, 4176 (1968).
5a. Ta laty E. R., Cancienne A. E., Jr., D u p u у A. E., J. Chem.
Soc., (C), 1968, 1902.
7. T о b e у S. W., West R.t J. Am. Chem. Soc., 88, 2481 (1966).
БОРА ТРИФТОРИДА ЭФИРАТ (I, 113—1 16, перед ссылками).
Внутримолекулярное ацилирование. Эта реакция является клю-
чевой стадией в новом синтезе твистановой циклической системы,
осуществленном группой канадских исследователей 1141. Исходное
соединение — декалнндпон-2,7 (3) можно легко получить гидриро-
ванием 2,7-диоксинафталина до смеси изомерных диолов (2) и окис-
лением этой смеси хромовым ангидридом [ 15, 16]. При последующей
обработке уксусным ангидридом, уксусной кислотой и Б. т. э. осу-
ществляется циклизация с одновременным ацетилированием до
8-ацетокситвистанона-4 |(4)~(4а)]. Твистанон-4 (5) получается в ре-
зультате шестистадийного превращения (4)=(4а): кетализаиия эти-
ленгликолем при С4, превращение ацетата в спирт под действием
LiAlHj, взаимодействие с бромистым тионилом с образованием
бромкеталя, гидрирование над никелем Ренея и декетализация.
38
расщепление окисей. Шоппи и сотр. 1.17] показали, что расщепле-
окиси (1) при обработке хлоргидратом пиридина происходит
нИ в ничтожной степени, но легко осуществляется под действием
Б /э в уксусном ангидриде (10 мин при 20°). Образующийся при
эл'ом'енолапетат (2) в результате кратковременного щелочного гидро-
лиза дает (4), по-видимому, через промежуточную стадию отщепления
формальдегида от (3).
Алкоксидьное замещение [181. При обработке диазоацетофенона
ВЕ3-эфиратом в эфире или бензоле при комнатной температуре
наблюдается выделение азота, но продукт реакции осмоляется. Если
в качестве растворителя использовать метанол, то образуется а-ме-
токсиацетофенон; эта реакция оказывается общим методом полу-
чения а-алкоксикетонов.
C6H5COCHN2ЩСН3ОН
СцН-СОСН2ОСН8+№, "
Расщепление эпоксидов с перегруппировкой. Ганстон предполо-
жил, что эпокси кислоты могут играть важную роль как промежуточ-
ные соединения^ в биосинтезах [191- Изучая этот вопрос, он вместе
с Кона хером [20] обнаружил, что при обработке ненасыщенного
энокспэфира метил вернолата (1) В F3-эф и ратом в холодном бензоле
получается несколько продуктов, причем два из них не удается
отделить друг от друга, а их общий выход составляет 34% . На осно-
вании химических свойств, ИК-, ЯМР- и масс-спектров авторы по-
лагают, что это щчд- и транс-формы эфира кетоциклопропан-
39
карбоновой кислоты (2):
CH,(CH2)4CI-IZ_\CHCH2CH=CH(CH2)7CO2CH3
СН2ч
СН3(С112)4СОСН2СН2^^\СН(С1-1.2)7СО2СН3
Расщепление пептидов. В присутствии ВЕ3-эфирата СЬ-группу
метионинсодержащих пептидов можно количественно удалить гидро-
генолизом над палладиевым катализатором 121].
[4. В с 1 а и g е г A., Poupart J., Dcslongchanips Р., Tetrahedron
Letters, 2127 (1968).
15, G а и t h i е г J., Deslongchamps P., Can. J. Chem., 45, 297 (1967),
16. Anderson Л. G,, В a r 1 о w D. O., J. Am. Chem. Soc., 77, 5165 (1955).
17. Shoppee C. W., Hughes N. W., Lack R. E., Tetrahedron Let-
ters, 5235 (1966).
[8. N e w m а п n M. S., Beal P. F., Ill, J. Am. Chem, Soc., 72, 5161 (1950).
19. Gunstone F. D., Chora. Ind., 1966, 1551.
20. Conacher H. B. S., Gunstone F. D., Chem. Comm., 1967, 984.
21. Okamoto AL, Kimoto S., Osh i ma T., I\ i n о m u r a Y.,
Kawesaki K., Y ajima H., Chem. Pharm. Bull., 15,1618 (1967).
БОРА ТРИФТОРИДА ЭФИРАТ — УКСУСНЫЙ АНГИДРИД
(I, 116, перед ссылками).
Этот комбинированный реагент был использован для селектив-
ного расщепления 1 -метил-7-оксабицикл о-[2,2, Ц-гептан-2,3-ди-
кар боновых кислот [31. Так, полученный при взаимодействии 2-ме-
тилфурана с малеиновым ангидридом и последующем гидрировании
эфир (1) при нагревании с Б. т. э.— У. а. дает (2) и продукт гидро,-
лиза (3). Очевидно, что для расщепления необходимы оба реагента.
L0"] -----II + 11
\Х^СООН АсО^Х^Х AcO'^sv/*4COOH
с^о
:оон
соон
3. Kitahara Y., Kato Т., О t о t a n 1 N., Inoue A., Izumi Н.,
J. Chem. Soc., (С), 1968, 2508.
БОРА ТРИФТОРИД (1, 111 —112) — ФТОРИСТЫЙ ВОДОРОД
(IV, 116—118),
Изомеризация алкилбензолов (I, 112). Пирсон и сотр. [1] де-
тально описывают использование жидкой смеси этих двух реаген-
тов для изомеризации /г-цимола в л/щимол при —78°. Безводный HF
окают, пропуская газ через спиральную медную трубку, погру-
С 4HV1O в смесь' сухого льда с изопропанолом. Жидкость собирают
* охлаждаемую сухим льдом полиэтиленовую бутыль на 500 мл,
снабженную магнитной мешалкой, и добавляют л-цимол, охлажден-
ный до—607 Затем в смесь при перемешивании и охлаждении
пропускают BFy. После соответствующей обработки и фракциони-
рования на колонке со спиральной насадкой длиной около 30 см
получают nt-цимол 98% -ной чистоты (ГЖХ) с выходом 75—80% •
1, Pearson D. Е., W у s о n g R. D,, Finkel J. AL, Org. Syn., 47,
40 (1967),
БОРА ТРИХЛОРИД (1, 116—118, перед ссылками),
С помощью Б. т. было осуществлено селективное деметилирова-
ние .метоксигруппы, находящейся в орто-положении к карбониль-
ной группе [91. К охлажденному раствору вещества в хлористом
метилене добавляют чистый Б. т., охлажденный до —70°. По окон-
чании реакции раствор отмывают водой от соляной и борной кислот.
Предполагается промежуточное образование шестичлепного цикла
с координационной связью. Продукт обычно получают с выходом
7о—95%.
9- D е а п у ,ц., G о о d с h i I d J.,
7 <(' i‘ t о n R. B., Parto n B.,
tetrahedron Letters, 4153 (1966).
H oughtnn L. E., M а г t i n J, A.,
Price A. W., Som v icli ien N.,
41
БОРНАЯ КИСЛОТА (I, 118—122).
Катализатор конденсации. Б.к. (а также борный ангидрид и
10-окси-10,9-бороксарофенантрен) [ 12а] применяют как катализатор
в альдольной конденсации и последующей дегидратации. Реакцию
проводят при кипячении в м-ксилоле с насадкой Дина — Старка
для удаления воды. Примеры [126]:
7 I
2СН3СН.,СН,СН.3СН2СН.;СНО + Н3ВО3 4- [СН3С6Н4СН3 (лс)1 —>
37,6 г 12,5 г 220 г
СД СН3СНгСНХН,СНХН„СН=х-сно
1011% ' |
СН3СН2СНгСНаСН3
7' 6' 5' 4' 3'
CtiHsCHO+CH3COC6Hs + H3BOa+lCH3C6H.1CHs (л01 —>
10,6 г 12.0 г 6,2 з 100 г
Кт'цячрцне 65 час
-------------> С6Н5СН=СНСОС6Н5
' -И;.,,
12а. Dewar М. J. S., D i е t z I?., Tetrahedron Letters, 14, 21 (1959).
126. Oflenhaucr R. D., NelsenS. F., J. Org. Chem., 33, 775 (1968).
БОРФТОРИСТОВОДОРОДНАЯ КИСЛОТА (I, 122—124, перед
ссылками).
Димеризация карбодиимидов [4]. При добавлении эфирного
раствора безводной Б. к. (0,5 эке) к раствору алифатического карбо-
диимида (1) в хлористом метилене наблюдается димеризация в со-
ответствующие соли (2), Последние не были выделены, но путем
подщелачивания превращались в диазетидины (3).
он'
90%
(2}
И)
Ароматические карбодиимиды (4) также подвергаются димери-
зации, однако при этом образуются замещенные хиназолиевые соли
42
(5), дающие при подщелачивании 3-арил-2-ариламино-4-арилимино-
хиназолииы (6).
2 C6H5--N=C=N-C6H5
(4}
4. Н а г t к е К., Rossbach F., Angew. Chem., Internal. Ed., 7, 72 (1968)
БРОМА АЗИД, Br —N=N=N. /Мол. вес 121,94.
Получение в растворе [11. К охлаждаемой льдом и хорошо пере-
мешиваемой смеси 32,5 г азида натрия и 100 мл хлористого метилена
добавляют 25 мл 30%-ной соляной кислоты и 8 а брома. Через 30—
60 мин органический слой, содержащий Б. а., декантируют и ис-
пользуют в реакции. При работе с реагентом, полученным этим
методом, взрывов не наблюдалось, хотя в литературе отмечались
его взрывчатые свойства 121.
Присоединение к олефинам Ш. В зависимости от полярности
растворителя Б. а. присоединяется к олефинам по ионному или ра-
дикальному механизму. Присоединение по ионному механизму
осуществляется в смеси нитрометан — хлористый метилен; в пентане
преобладает радикальное присоединение:
37% 27%
В условиях ионного механизма Б. а. стереоспецифически при-
соединяется к цис- и /нрщш-бутенам-2 [21.
1- Hassner A., Boerwinkle F., J. Am. Chem. Soc., 90, 216 (1968).
2. Spencer D. A., J. Chem. Soc., 127, 216 (1925).
43
N-БРОМЛЦЕТЛМИД (I, 125—126).
Взаимодействие с олефинами. При исследовании взаимодействия
циклогексена с NBA в четыреххлористом углероде при ультрафио-
летовом облучении было установлено, что первоначальным продук-
том реакции является трпнс-ацетамидоциклогексилбромид [121.
Аллильного бромирования не наблюдалось.
О о
15
4- CH3CNHBr
hf>, ССЦ^
36% *
NHCOCH3
н
Бромирование. NBA (немного более 1 же) в этаноле оказался
наиболее подходящим реагентом для бромирования эстрадиола [13].
По-видимому, при этом образуются почти равные количества 2-
и 4-бромэстрадиолов, но по условиям растворимости 2-бромпроизвод-
ное трудно выделить. При использовании NBA в количестве, пре-
вышающехМ эквивалентное более чем в два раза, с почти количест-
венным выходом получается 2,4-дибромэстрадиол [14].
СНаСОМНВг
сгн8он
5,5%
12. W о I f е S., A w а п g D. V. С., J. Am. Chem. Soc., 89, 5287 (1967).
13. U t п е Т.,Jobson R. В., L a n d g г a f F. W., J. Org. Chem., 33, 1654
(1968).
14. Woodward R. B., J. Am. Chem. Soc., 62, 1625 (1940).
N-БРОМАЦЕТАМИД — ФТОРИСТЫЙ ВОДОРОД (I, 126).
Получающийся из этих реагентов BrF взаимодействует с терми-
нальными алифатическими алкенами, давая вицинальные фтор-
бромиды [4]. Этим путем был, в частности, получен 1-бром-2-фтор-
гептан [5], на примере которого была показана [6] возможность
превращения подобных соединений в сс-фтор карбоновые кислоты
[71.
CH3CONHBr, HF
CHS(CH2)4CH—СНг ----р—-----> CH3(CH2)4CHFCH2Br _►
—?Ас> Nai^ СНз(СН ^1СНРСНг0С0СНз CH3(CH2)4CHFCO2H
4. Pattison F. L. М., Peters D. А. V., Dean F. Н., Can. J. Chem,.
43, 1689 (1965).
5. Dean F. Н., Amin J. H., Pattison F. L. M,, Org. Syn., 46, 10
(1966).
6. D e a n F. H., Amin J. H., Pattison F. L. M., Org. Syn,, 46, 37
(1966).
7. Pattison F. L. M., Buchanan R. L., D e a n F. H., Can. J.
Chem., 43, 1700 (1965).
44
м-БРОМАЦЕТОФЕНОН (фенацилбромид), CfiHaCOCH2Br. Мол.
вес 199,05, т. пл. 48—5Г. Получение см. I, 52.
Пептидный синтез. Зервас и corp. [11 получили фенациловые
эсЬпоы аминокислот при обработке карбобензоксиаминокислот Б.
в"присутствии триэтиламина в этилацетате. Фенацильная сложно-
эфириая группа устойчива к кислотам, но расщепляется при катали-
тическом гидрировании или при обработке тиофенолятом натрия
в неводной среде в мягких условиях. Австралийские химики [2],
изучавшие n-бромфенациловые эфиры, пришли к выводу, что слож-
ные эфиры типа фенациловых, как правило, непригодны для защи-
ты карбоксильной группы в случае медленных реакций конденсации.
l.StelakatosG. С., Paganou A., Zervas L., J. Chem. Soc.; (С),
" 1966, 1191.
2. L е d g е г R., Stewart F. H. C., Australian J. Chem., 20, 787 (1967).
БРОМИСТОВОДОРОДНАЯ КИСЛОТА (48%-ная) (I, 128—131,
перед ссыл ками).
Циклодегидратация с ароматизацией. Брэдшер [17] ввел этот
термин для реакций, в которых внутримолекулярная конденсация
сопровождается дегидратацией с образованием ароматической си-
стемы. В обширном исследовании такого типа реакций автор почти
неизменно в качестве кислотного катализатора использовал Б. к.
в кипящей уксусной кислоте. Ниже приводятся несколько типич-
ных примеров.
45
Было обнаружено, что для циклодегидратапии (3-оке и кетонов
типа (4) реагент Брэдшера превосходит полифосфорную кислоту или
смесь серная кислота—фосфорная кислота [21],
HBr-HOAc ,GH
<тггтячегт4г(а нп я пгт я- // \ / °
2 час, кипячение на водя- у/ \ /'
ной бане I 1| I
2 7-90%
сщ
(4)
сн3
Гидрирование. Гидрирование Д4-3-кетостероидов над палладием
в уксусной кислоте, содержащей Б. к., приводит к 3-кетонам с преи-
мущественным образованием 5|3-изомера [22], Б. к. оказалась на-
много эффективнее соляной и серной кислот, которые обычно ис-
пользовались для повышения содержания 5[3-кетонов.
17. Brads her С. К., Chem. Revs., 38, 447 (1946).
18. В г a d s h е г С. К., J ackson W. J., Jr., J. Am. Chem. Soc., 76, 734
(1954).
19. Bradsher С. K., Beavers L. E.. J. Am. Chem. Soc., 77, 453 (1955).
20. Bradsher С. K,., Brow ti F. C., Lea 1< e P. H., J. Am. Chem. Soc.,
79, 1471 (1957).
21. Canonne P., Holm P,, Leitch L. C., CanacL J. Chem., 45, 2151
(1967).
22. N ish imura S., Sh ima ha га M., Shi о t a M., Chem. Ind., 1966,
1796.
(—)сгБРОМКАМФОРл-СУЛЬФОКИСЛОТЛ, (1). Мол, вес
311,21, т. пл, 44—46°, [cdD —92° (НЮ).
•СНз
<< CH2SO3H
СНДСООН
СНг)6СООН
В полном синтезе природного (левовращающего) простаглИндиа-
на Еj(2) Кори н сотр. [11 разделяли промежуточный рацемический
амин (3) в виде соли с (—)-а-бромкамфор-л-сульфокислотой. После
однократной кристаллизации из смеси метанол — этил ацетат была
получена практически чистая диастереомерная соль с т, пл. 157—
46
159°, /Vs—59.6°. Максимальное вращение после многократной
кристаллизации составляет [а]й78—59,65°.
। С о г е у Е. JV 1 a t t a s 1., Н а г d i n g К., J. Am. Chem. Soc,, 91, 535
(1969)/
N-БРОМСУКЦИНИМИД * (I, 134—137).
Аллильное бромирование (I, 135, после выдержки из 181). Взаимо-
действие NBC с изолапахолом (1) в кипящем СС14 приводит к продук-
те впнильного замещения (2); таким же образом реагирует и N-иод-
ехклинпмид (NHC) [8а|. При циклизации впнильного бромида (2)
под действием NИС, а также при действии 2 же NHC на (1) получает-
ся производное фурана (3). Винильное замещение наблюдается и в
* Под действием N5C происходит стереоспецифическое mpa«c-N-6p0MHp0Ha-
нис 2-мстилэтилсниыииа |Кост я новск и ft Р. Г., Червив И. И., П а н ь-
ш и н О- А., Изв. АН СССР, сер. хим., № 6, 1423 (1968) |. Эго позволило осущест-
вить синтез первых соединений с оптически активным атомом азота в пе.мостико-
r-ioii системе |Ко стя и о в ск и ii Р. Г., С а м о й лова 3, Е., Чер в и и
И. И., Пав. АН СССР, сер. хпм., Ат 12, 2845 (1968); Tetrahedron Letters, Ab 9,
719 (1969); Костя новск и й Р. Г., С а м о ii лова 3. Е., Изв. АН СССР,
сер. хим., №> 3, 727 (1969)]:
R = CH3, ]a]D—8,1° R = CH3, ]а|п Щ49,7Э
R = C3H7, [ctJD — 19,2Q R = C3H7, [a]D+87,8e
Стереоспецифичность галогенирования определяется размером как реагента, так
к заместителя в положении 2. В таблице указано соотношение транс!цис-изомеров
R
1 'lai.
R Реагент
NaOCi NXC NaOBr NEC (СН.Щ СОС1
СЩ 1 38/1 2/1 транс транс —
су i7 транс транс трат —
С(;Н5 транс — ”— — транс 0)
Костя новск пн Р. Г., Фомичев А. А., Марков Б. И.. Червив И. И ,
Изи, ,\н СССР. СЧ'Р. хим., 2079 (1960).
К () с 1 я н о в с к и ii. Г. Г., Фо м и и е в А. А., Новиков 13. М., Ж, струит.
У114 - - Х» 4 (1971).— Прп.и. не рев.
47
тех случаях., когда боковая цепь имеет в аллильном положении атом
водорода при первичном или вторичном углероде, например (4)->(5).
Бромгидрины (I, 136, после выдержки из [12]). Получение бром-
гидринов реакцией олефинов с NEC и водой затруднено из-за огра-
ниченной растворимости олефинов в воде.. Дальтон и сотр. [12а]
сообщают, что эту реакцию можно осуществить с хорошим выходом
в ДМСО, содержащем небольшое количество воды. 10 лгмолей цикло-
гексена растворяют в 50 мл сухого ДМСО и прибавляют 25 л/молей
воды. Затем при охлаждении ниже 20° в атмосфере азота добавляют
20 жмолей NEC. Через 15 мин реакционную смесь выливают в боль-
шой объем воды и продукт экстрагируют эфиром. Изучение стерео-
NEG + H2o в ДМСО / \:/
| 15 мин, 20° [
специфичности этой реакции на примере транс-стильбена в присут-
ствии воды, обогащенной О18, и немеченого ДМСО подтверждает
предложенный механизм [1261.
Дегидрирование ароматических альдоксимов до окисей нитрилов
(1, 137, перед ссылками). NEC в ДМФА служит превосходным ре-
агентом для дегидрирования ароматических альдоксимов до соот-
48
BeTcrBVioi.ujix окисей нитрилов [17]. Для связывания отщепляющего-
ся бромистого водорода используют триэтиламип, но поскольку он
реагирует с NEC, его вводят в реакционную смесь через некоторое
CH = NOH
/О
СН.2С(Т дмфа
| у.МВг+(CjH5)3N -------.
СН,Сф 30%
О
время после добавления реагента; при 5—15° реакция завершается
в течение часа. Затем смесь разбавляют водой для осаждения окиси
нитрила. Этот метод лучше применявшегося ранее, в котором исполь-
зовали гипобромит натрия в водной щелочи [18].
Окисление (/.-оксикетонов (I, 137, перед ссылками). Под дейст-
вием NEC в безводном четыреххлористом углероде или в водно*м
диоксане алифатические а-окси кетоны окисляются до а-дикетонов
с хорошими выходами, причем в диоксане выходы выше [191.
8а. D u d 1 е у К- Н., М filer Н. W., Tetrahedron Letters, 571 (1968).
12а. Dalton D. R., Hendrickson J. B., J ones D. G., Chem. Comm.,
1966, 591.
126. Dalton D. R., Jones D. G., Tetrahedron Letters, 2875 (1967).
1". Grundmann C-, Richter R., J. Org. Chem., 33, 476 (1968).
18. G r u и d m a n n C., Dean J. M., J. Org. Chem., 30, 2809 (1965).
19. H о 1 1 in a n n R., В а г e t P., Compt. rend., 267 (C), 579 (1968).
БРОМТРИФТОРМЕТАН, BrF,C (I, 138). Мол. вес 148,93, т.
кип. — 59°, т. замерз. —168°, плотность газа при т. кип. 8,71 г! л.
Применение (помимо использования в качестве хладоагента или
Для огнетушения):
а) Источник дифторкарбена [II:
BrCF3 Т C^HgLi +
49
б) Бронирующий агент 1'21:
К Franzen V., F i к е n t s с h е г L., Chem, Вег,, 95, 1958 (1962); Fran-
zen V., ibid., 95, 1964 (1962),
2. Burgess С., Colley G., Feather P., Petrow V., Tetrahedron,
22, 4111 (1967).
БРОМТРИХЛОРМЕТАН (I, 138).
Получение (упрощенная методика) [la]. Смесь 168,5 г безводного
бромистого алюминия и 940 г сухого четыреххлористого углерода
кипятят с обратным холодильником в течение 45 .мин и дают остыть.
Твердое вещество отфильтровывают, а жидкость встряхивают с
170 мл б1’)) -иого раствора карбоната натрия, а затем дважды с 170 мл
воды. После высушивания над хлористым кальцием фракционируют
на колонке Влгре (70 щи); в качестве головного погона получают
480 мл СС14, а затем 193 г (51,4%) чистого Б.; т. кип. 102—106",
п™ 1,5063.
la. L е h rn а п n G., Lucke В., J, prakt. Chern., [4], 22, 230 (1963).
БРОМУКСУСНОЙ кислоты ЭТИЛОВЫЙ ЭФИР,
ВгСН.ССССЗН,-. Мол. вес 167,02, т, кип. 57—597'15 льи.
Превращение олефинов в сложные эфиры. Разработанный Брау-
ном Ц] метод двууглеродней гомологизации олефинов под действием
Б, к. э. э. дополняет известные методы одноуглеродной гомологиза-
ции олефинов окисью углерода и трехуглеродной гомологиза-
ции олефинов акролеином. Олефин превращают в триалкилборан
действием рассчитанного количества диборана в ТГФ при 0°. После
добавления эквимолярного количества Б. к, э. э. смесь обрабаты-
вают эквимолярным количеством mpem-бутилата калия в трет-
бутаноле. Реакция завершается, по-видимому, .мгновенно, .Можно
также использовать этиловый эфир хлоруксусной кислоты, по при
этом реакция осуществляется медленнее и с меньшим выходом.
Примеры.
CHXHnCI-I=rCH, 93% СН3(СН,,)4СО,,СпН5
(СН3)аС = СН2 78%" (СН3)2СНСН2СН,СО2СгН&
9 5%
50
Браун полагает, что эта реакция включает (а) образование кар-
баниона эфира, (б) образование координационного комплекса кар*
баниона с триалкилбораном, (в) перегруппировку и (г) протонолиз.
(a) mpem-BuO“K+ 4-ВгСН,СО.,С.Д-1Г)—> K + C"HBrCO.,C,H5 ^ирет-ВиОН
(б) R,;В у- К + С-НВгССусД К Ч RsBCHBrCO.,C2Hr,]"
к +1R3ВСНВгСО.,СНй] - —К I R,BrBCH RCO^CJ-IJ -
KBr-yR^BCHRCO.QH,
(г) R„BCHRCO.,C2H5 -|-mpem-Bi.iOH —> RCH2CO.,C2H5 mpeni-BuOBR,,
1 Bro w n H. C., Rogic M. M., Rathke M. \V.( Kabalka G. W.,
J. Am. Chem. Soc., 90, 818 (1968).
БРОМ(ХЛОР)ДИПИРИДИННИТРАТ, [Br(C,H-N),] + NO:. Мол.
вес Вг : 300,13 (Cl : 255,67); т. пл. (Cl) 77-78°.
Эти устойчивые соединения получают действием брома [1, .21
или хлора 131 на раствор нитрата серебра и пиридина в хлороформе.
При этом осаждается галогенид серебра, и комплекс выделяют из
раствора. Так, Карлсон [2] растворял 5,4 г брома в 30 мл хлорофор-
ма, охлаждал раствор до 15—20° и добавлял к нему охлажденный
раствор 5,2 г нитрата серебра в 10 г пиридина и 15 мл хлороформа.
Основную массу бромистого серебра удаляли центрифугированием,
остаток отфильтровывали через пористый стеклянный фильтр. При
добавлении эфира комплекс отделяется в виде масла и затем затвер-
девает. Миллс 14] использовал реагент, получаемый in situ, для ре-
акции с холестерилацетатом. Нитрат серебра (0,11 моля) растворяли
в смеси пиридина (18,7 мл) и хлороформа (250 мл); добавляли холе-
стерил ацетат (0,1 моля), охлаждали льдом с солью и перемешивали.
Затем в течение 30 мин добавляли раствор хлора в четыреххлорп-
стом углероде (100 мл 1,2 М раствора, рассчитанное количество
90 мл). Смесь доводили до комнатной температуры (30 мин) и хлори-
стое серебро отделяли фильтрованием. Фильтрат, объединенный с
промывным хлороформом, промывали водным раствором йодистого
калия, тиосульфата натрия и водой. После высушивания,упаривания
и кристаллизации из смеси хлористый метилен — метанол был полу-
чен с 59%-ным выходом З-ацетат-6-питрат 5а-хлорхолестандиола-3|3,
6[3 (2) удовлетворительной чистоты (т. пл. 139—141°).
51
1, Uschako w M. I., Tch istow W. O., Ber., 68, 824 (1935).
2. Carlsohn H., Ber., 68, 2209 {1935).
3. Usch а к о w M. IT c h i s t о w \V. O., Bull. soc. chiin. France, [5] 3,
2142 (1936).
4. Mills J. S., J. Chem. Soc., (C), 1966, 2261.
БР0МЦИАН (I, 138—141).
Синтез гетероциклических соединений (I, 141, перед ссылками).
Примеры;
1(101)
2ЦЦ)
4 (131)
Л
H^NC
N
5 [14])
BrCN
83% >
3[12])
6 [15])
H3cs h,cs xn. .n
P И NN, C- XN
i 2 Bros i I |f
HN-—N ------------. Hj\-—N-----X_NH.
67%
10. Leo nar d NT. JCurtin D. ¥., Beck К. M., J. Am, Chem. Soc.,
69, 2459 (1947).
II. Richardson A., Jr., J. Org. Chem., 28, 2581 (1963),
12. M filer Cj. W., Rose F. L., J. Chem. Soc., 1963. 5G42.
13. В a s u N. K., Rose F. L., J. Chem. Soc., 1963, 5660.
52
<4. Р о 1 t s К. T., Husby R. M., J. Org. Chem., 31, 3528 (1966).
Potts K. !, Hirsch C., J. Org. Chem., 33, 143 (1968).
Br
а-БРОМЦИАНАЦЕТАМИД, N=CCHCONH2. Мол. вес 162,99,
т, пл. 116—117°.
Реагент получают кипячением в течение 5 час раствора дибром-
циапацетамида и цианацетамида в этаноле в присутствии эфирата
тре.хфтористого бора; выход 74% 111.
Б. используется в реакциях фосфорилирования II—31.
I . Н a t а Т., М u k а i у a m а Т., Bull. Chem. Soc. Japan, 35, 1106 (1962).
2 Mitsunobu О., Onato T., ukaiyama T., J. Org. Chem., 30,
1071 (1965).
3 Obata T., Ueki M,, M ukaivama T., Bull. Chem. Soc. Japan, 39,
1040 (1966).
w/wn-БУТИЛА ГИДРОПЕРЕКИСЬ (I, 142—144).
Мейнвальд и сотр. fl la] декарбоксилировали кислоту (1) по
методу В ибер га и получили кристаллический спирт (5) с общим вы-
ходом 15%.
Эффективный метод окисления третичных аминов до окисей амн-
ион, описанный Шенгом и Зайачеком, см. Оксованадия ацетил аце-
т°взт (в этом томе).
Моно- и диэпокси-1,4-бензохиноны. Общий метод получения
моноэгюкси-1 ,4^бензохинонов описан /Моором [13]. Раствор 0,1 моля
53
1,4- бензохинона в 100 мл смеси абсолютного этанола и диоксана
(1:1) обрабатывают 0,11 моля Б. г., охлаждают до 5—10° и добав-
ляют 2мл. тритона В (30% -ный раствор гидроокиси бензилтриметил ам-
мония в метаноле). Газохроматографический контроль аликвотных
проб раствора показывает, что реакция завершается за 1—3 час.
После разбавления водой и кристаллизации моноэпоксиды выделя-
ют с выходами от 30 до 80%. Аналогичным образом, но при соот-
0)
(СИз)зСООН, СбЩСНДСНРзН/он"
--------——-— •--------->
7 3%
(2) Т-ПЛ. ИЗ-114е
ношении окислителя и хинона 2 : 1 были получены диэпоксиды.
Дурохинон (1) дает продукт с четкой температурой плавления;
хроматографпчески определяется лишь один изомер, который был
охарактеризован как пг^пне-форма 114].
На. М е 1 я w а 1 d J,, Shelton J. С., Buchanan G. L., Cour-
tin A., J. Org. Chem., 33, 99 (1968).
13. Moore H. \V., J. Org. Chem., 32, 1996 (1967).
14. Moore H. \V., private communication.
трет- БУТИЛ АМИН (I, 145),
орто-Бромирование фенолов. Методика, представленная д-ром
Д. Е. Пирсоном (Ванде.рбильтский университет), по существу, сов-
падает с опубликованной ранее 131 и в принципе заключается в сле-
дующем. При бромировании фенола в толуоле образуется гипобро-
мит (2), который претерпевает а,у-сдвиг брома и дает (3); в послед-
нем происходит а, у-сдв и г водорода в противоположном направлении,
приводящий к первому устойчивому продукту (4). Затем изомер (5),
отличающийся от (4) лишь расположением связей, через гипобромит
(6) и продукт его перегруппировки (7) превращается в 2,6-дибром-
фенол (8).
ОН ОВг о ОН
(5) (6) (7) (8)
54
1. Методика
В пятилитровую трех гордую колбу, снабженную мощной меха-
нг1ческой мешалкой (примечание 1), низкотемпературным термомет-
dOm и капельной воронкой с осущителы-юй трубкой, загружают
9 5 г сухого толуола и 147 г (2 моля) Б. (примечание 2), При переме-
шивании смесь охлаждают в бане (изопропанол — сухой лед) до
_20-У—30’ и в течение 10 мин добавляют 160 г ( 1 моль) брома.
Затем раствор охлаждают до — 703—75° и в течение 5 мин прибав-
ляют раствор 47 г (0,5 моля) безводного фенола в 100 мл хлористого
метилена; за время добавления фенола температура раствора подни-
мается примерно на 10Е Температуру реакционной смеси доводят
до комнатной (за 5—6 чш), затем смесь переносят в пятилитровую
делительную воронку и промывают 500 мл воды. Органический слой
дважды экстрагируют 10%-ным водным раствором едкого натра,
порциями по 300 и 200 мл. Объединенный щелочной раствор охлаж-
дают льдом (примечание 3) и подкисляют 20%-ной серной кислотой.
Продукт выделяется в виде .масла, его дважды экстрагируют хлори-
стым метиленом, порциями по 200 и 100 мл. Объединенный экстракт
высушивают сульфатом магния, фильтруют и упаривают при комнат-
ной" температуре. Получают 110 г (87%) 2,6-дибромфенола, т. пл.
50—53 \ Перекристаллизация путем вымораживания из 200 мл гек-
сана дает две порции продукта, в общей сложности 94 г (75%), т. пл.
55—562 (примечание 4).
2. Примемания
1. Бромирование происходит при температуре от —70° до комнат-
ной с осаждением большого количества бромгидрата Б.
2. Можно также использовать изопропиламин. В присутствии
триэтил амина также происходит почти исключительно opmo-заме-
щение, но имеет место и полигалогенирование.
3. При подкислении после охлаждения льдом получается бесцвет-
ный продукт. Если подкисление происходит с разогреванием, обра-
зуется продукт различной степени окрашенности (до коричневого)
и с более низкой температурой плавления.
4. Для получения о-бромфенола берут удвоенное количество фе-
нола и вдвое меньшее количество брома п Б. Реакционную смесь
после бромирования дважды экстрагируют 10%-ным водным раст-
вором едкого натра, порциями по 425 и 200 мл. Объединенный экст-
ракт подкисляют в двухлитровой делительной воронке и отделяюще-
еся .масло переносят в другую двухлитровую делительную воронку.
Оставшийся водный раствор дважды промывают гексаном (но 500,ил),
который затем переносят в воронку с маслообразным продуктом,
и полученную смесь промывают дистиллированной водой (четыре
раза по 500 мл) для удаления непрореагировавшего фенола. Послед-
няя процедура необходима, так как при получении ,о-бромфенола
оерется большой избыток фенола для подавления реакции дибромп-
Роваыия.
55
3. Pearson D. E., W у so ng R. D., В red er C. V-, J. Org. Chem.,
32, 2358 (1967).
трет- БУТИЛ AT КАЛИЯ (I, 147—168).
Циклизация Дикмана (I, 150, после выдержки из [61). Продолжая
работу, начатую с Леонардом 16], Шимельпфениг 16а] использовал
Б, к. для конденсации по Дикману эфиров п-фениленднкарбоновых
кислот в парациклофановые кетоны:
о=с с=о
,1 I
1СНг)л (СН2)д
Д-Кетоэфиры КОС(СНз)з-(СНз)1СО^
Изомеризация непредельных соединений (I, 151 —153). Под дей-
ствием каталитических количеств Б. к. в ДЛ1СО енины и кумулены
гладко изомеризуются в сопряженные трпены 1.66]:
_С^-С—СН = С^ j
и 1 КОС(СН3)3 в ДМСО-АС-^СНСН = СНСН_с/
\с=С=С=с/ J z
3-Диал кил аминобутины-1 (1), легко получаемые из ацетиленов
и вторичных аминов, изомеризуются под действием этого основания
в 2-диалкиламинобутадиены-1,3 (2); образования алленовых произ-
водных при этом не наблюдается 16в)
NR, NR2
| KOBu-mprm |
СН3СНС -=^ сн ——-—СН2 = С - СН -7 СН2
О V ,‘О
(1) (И
Основание Шиффа (4), полученное из а, |3-непредельного кетона,
например (3), изомеризуется под действием Б. к. в соединение (5),
в котором фенильная группа сопряжена с открытой диеновой систе-
мой [6г]. При гидролизе (5) образуется бензальдегид и предельный
R R
I I К ОС(СН3).,
C6HsCH2NH2 + O = CCH=^CHR' —> CcH5CH2N = CCH=CHR'----------------—>
(3) (4)
R
| Разб. AcOH
—> C6H5CHN — C = CHCH2R'------------ Cf H5CHO +
(5) (6)
R R
-p HX = <icH.2CH2R' О = CCHXH.R'
(7) (8)
56
кетон (8). Таким образом этот процесс можно использовать для се-
лективного восстановления двойной связи, сопряженной с кетогруп-
пой.
Под действием Б. к. в ДМСО циклический аллен (9) изомеризуется
Б ацетилен (10) [6дБ Другие основания [КОС(СН3)з в mpem-BuOH,
(ю)
КОН—С2Н5ОН, CH.-jLi и A120.j] непригодны для этой изомеризации.
При обработке каталитическим количеством твердого Б. к.
(без растворителя) в течение 2—3 час при 70° пропаргиловые
эфиры HCsC-CH?OR изомеризуются в аллениловые эфиры
CH2=C=CHOR с выходами 80—90% [бе]. Попытки осуществить
это превращение с помощью твердого едкого кали и амида натрия
оказались безуспешными.
(I, 152, после выдержки из [15].) В отличие от А4-3-кетостероидов
в А1’4-3-кетостероидах под действием Б. к.в /щши-бутаноле сопряже-
ние не нарушается, однако при обработке тем же основанием в ДМСО,
а затем водой А1 ,д-3-кетоны изомеризуются в А1;&-3-кетоны. Тот же
эффект наблюдается при обработке гидридом натрия или амидом нат-
рия в ТГФ (в этом случае для нейтрализации используется борная
кислота) [15а]. А4,1!-3-Кетон под действием метилата натрия в ДМСО
с последующей нейтрализацией водной уксусной кислотой дает енол
3-окси-3,5,7-триен, который легко превращается в А5’т-3-кетон под
действием этилацетата в атмосфере азота или при непродолжитель-
ном нагревании выше температуры плавления енола [156].
Дегидрогалогенирование (I, 154—155, после выдержки из [34]).
При обработке Б. к. в ДМСО при 30° 1,1-дихлор-2,2-диметил-З-про-
пилциклолролан (1) превращается в 2,2-диметилаллилиденцикло-
пропан (2) [34а].
н3с: >сн3
СН2СН2СН3
ClS'-’Cl
кос(сн3)2 н3с ,сн3
ДМСО у=сНг
60%
В разделе Лития дпциклогексиламид (V, 253) рассмотрено полу-
чение mpnwc-цнклодецена, осуществленное Трэйнхэмом и сотр. [346]
57
фотохимическим хлорированием циклодекана с последующим де-
гидрогалогенированием образующегося при этом 1-хлорциклодека-
на (4) дициклогексиламидом лития с 70%-ным выходом. Трэннхэм
и сотр. показали также, что дегидрогалогенирование 1-хлорцикло-
декана (4) под действием Б. к, в ДМСО дает с хорошим выходом цис-
циклодецен (5) высокой степени чистоты.
(3)
(5а).
(5)
Т.кип. 44 -4 5°
97% цис
Дегидрогалогенирование с перегруппировкой (I, 155, после
выдержки из (361). 1-Диметилалишо-2,2-дихлор-3,3-диметилцикло-
пропан (7) при дегидрохлорировании под действием Б. к. дает алке-
нинила.мин (8) с выходом 20—30% [36а]. Механизм реакции неясен,
так как попытки уловить промежуточный циклопропен оказались
безуспешными.
снзх ^сн3
C=CHNk
снэ ' СН3
КОС(СН3)з
снсц
КОС(СМ3)3
ДМСО
г 20-30%
снэ\ с _ с_ с _ снэ
CHr^ 'ХСН3
о
СН,^ II
r.„^C“CH2C-N(CH3)J!
1,4,5,6,9,10-Гексагидроантрацен (10) под действием 2 же надук-
сусной кислоты лает с почти количественным выходом диэпок-
сид (И) (син- и пнти-изомеры) [366], который бромируют 2 же
NBC в СС1, и сырой продукт бромирования дегидрогалогенируют
Б. к. в ТГФ с образованием карминно-красных кристаллов
58
1,6; 8,13 (сан- или анти-) (13) с выходом 5%.
[141-аннулен-диоксида-
Реакцией 1,1-дихлор-2,2,3-триметилциклопропана (14) с Б. к.
в ДМСО (обратное добавление, 25') в качестве двух главных продук-
тов получают З-хлор-З.З-диметилметилснциклоиропан (16) и 2-ме-
тнлпентс11-1-ин-3(17) 136в1. Митчелл и Зоидхеймер 136г1 показали,
что Б. к. в трет-бутаноле является наиболее подходящим реагентом
кос(снэ)3
ДМСО ,
--------
-НС1
(14)
сн2
сндо^с-су'
хсн3
(15) (16) (17)
Для дегндробромировання тетрабромида (7) в 1, 8-диэт и нил нафталин
(8). Реакцию необходимо проводить при температуре кипения; при
комнатной температуре главным продуктом оказывается енин(10).
59
Br- Вг~
i I
(СеНя),Р=- + Р(СгЦГ1)3
BrCH, CH,Br CH., CH.,
I I I " I
/X 2(C6H5)3p / ч /X
(ЗУ (4)
Окислительную конденсацию соединения (8) в циклический димер
(9) удается осуществить лишь с незначительным выходом. Наилуч-
ший результат (2%) получается при окислении (8) в бензоле в усло-
виях реакции Глазера. Циклический димерный продукт красного
цвета оказался очень неустойчивым.
Ацетали фен ил кетена можно получить с выходами от 20 до 80%
дебромированием ацеталей сс-бромфенил ацетальдегида, синтез кото-
рых легко осуществить несколькими общими методами [36д].
Дегидротозилирование. Б. к. в ДМСО — прекрасный реагент
для дегидротозилирования стероидных 12а-тозилоксиэфиров в Д11-
60
стероиды
[36е].
Обработкой дитозилата (1) Б. к. в ДМСО Реуш и Фрей [36 ж]
получили с хорошим выходом 3,3,6,6-тетраметилциклогсксадиеп-1,4
(2). Ранее этот несопряженный диен получали пиролизом 1,3-ди-
Н3С СН3
TsO^ yd /dis
(П
КОС(СН д,
ДМСО
(2)
ацетокси-2,2,5,5-тетраметилциклогексана, но этот метод осложнен
дальнейшим превращением (2) в и-ксилол.
Дегалогенирование под действием Б. к.— ДМСО-Яф(?ш-ВиОН.
Мойер [Збз? обнаружил, что при обработке 1,2,4-трибромбснзола
Б. к. в смеси этих растворителей образуется /z-днбромбензол с 70% -
нмм выходом. Эта реакция восстановительного дегалогенирования
Вг
Вг
Вг
I
КОС(СН3)ЧЩСН.ЩСОН-ЦМСО Дг
-------— - ---------------—--------------г
70%-----------------------[|
I
Вг
была подтверждена и развита в работе Беннетта [Зби]. Дегалогени-
рование осуществляется обычно из ор/;го-положения по отношению
к Другому атому галогена. Деиодирование осуществляется легче,
чсм дебромирование, дехлорирования же вообще не наблюдалось.
Этерификация, Хлорангидрид 3-индолилуксусной кислоты (1)
61
при обработке продажным Б. к. в трет-бутаноле превращается
в соответствующий шре/н-бутиловый эфир [3*6к1. Этот метод проще
по сравнению с обычно широко применяющимися реакциями кислоты
КОС(СН3)3-НОС(СН3)3
(1)
81-9 0%
(2)
с изобутиленом, переэтерификации или реакции ангидрида с трет-
бутанолом.
Расщепление а-гидропероксикетонов. 17а-Гпдроперокси-20-кето-
стероиды легко расщепляются под действием Б. к. с. образованием
17-кетостероидов [36л]. При этом нет необходимости в специальном
выделении пероксикетонов. Например, 20-кетопрегнан окисляют
в смеси ТГФ — mpew-BtiOH, содержащей Б. к., при обработке
1,1 экб- кислорода. Затем в раствор в течение нескольких минут п|зо-
пускают азот и смесь нагревают до 60-—703
Автоокисление (I, 161, после выдержки из [511). Было показано,
что при катализируемом основаниями автоокислеипи кетонов в
а-гидронерекиси наибольший выход продукта достигается при со-
блюдении следующих условий: минимальное время реакции, темпе-
ратура ниже —8“’, применение полярных апротонных растворителей
(димстоксиэтан или ДМФА) при молярном соотношении основания
и кетона более 2 [51 а!.
(После выдержки из [52].) По оригинальной методике Бартона
[52| в случае 20-кетостерондов не удавалось получить высокие вы-
ходы продуктов [52а], что заставило обратиться к Б. к. в смеси
ДМФА — ш/жш-бутанол. Эта система растворителей была с успехом
использована для автоокисления пиколинов [5261, которые практи-
чески не окисляются в шре/п-бутаноле. В чистом ДМФА автоокисле-
ние проходит быстро, но при этом окисляется и растворитель. Поэ-
тому рекомендуется использовать смесь ш/ллп-бутанола и ДМФА.
Можно использовать систему ТГФ — шрт-бутанол, но тогда окис-
ление замедляется. 17а-Гидроперекиси были получены с высоким
выходом. Затем было найдено, что для их восстановления в 17а-олы
вместо цинка в уксусной кислоте лучше использовать три эти л фос-
фит. Практически автоокисление и восстановление проводят в одну
стадию, получая а-кетолы с выходом 60—70%.
62
/После выдержки из 157].) При автоокислении в трет-бутаноле
отсутствии Б. к. <х- и p-тетралоны, а также 1,2-диоксинафталин
В пт 2-ОКСИ-1,4-нафтохинон с выходами от 50 до 80%; промежуточ-
на,. nnnfivKTOM в обоих случаях является, по-видимому, 1,2-нафто-
ным -
хинон ГБ7а, б|.
Эта реакция была использована в синтезе спинахрома D — 2,3,5,6,8-
пентаокси-1,4-нафтохинона [57в1.
При взаимодействии левопимаровой кислоты (1) с 1,4-бензохи-
ноном образуется аддукт желтого цвета, которому было приписано
строение (2) (Герц 157г1). При обработке 5 г (2) в 75 мл /??/жт-бутанол а
сначала раствором 0,7 г калия в 50 мл трет-бутанола, а затем в те-
чение 3 час током кислорода раствор приобретает темно-пурпурную
окраску. После добавления 60 мл. воды и удаления растворителя был
получен пурпурный остаток, из которого подкислением, экстракцией
растворителем и хроматографией был выделен гидрохинон (3) с
20%-ным выходом. Положение гидроксильной группы (из двух воз-
можных) установить не удалось.
пеп2%,аТ’К"С'"еИ'Д Кет0™? "л" Ы вместо ожидаемой гидро-
перекиси образуется фенол (6) [57д|.Соответствующая гидроперекись
63
была получена другим путем и было показано, что она не является
промежуточным продуктом данной реакции,
Расщепление неенолизующихся кетоиов (I, 162, после вы-
держки из 1601). В последующей работе по расщеплению кетонов
Гасман, Ламб п Залар [60а! установили, что наиболее удовлетвори-!
тельным реагентом является смесь Б. к. — вода в соотношении 10:3
в таких апротонных растворителях, как ДМСО, гл им, гексан и эфир..
Обычно предпочитают эфир. В большинстве случаев наилучшие вы-,
ходы кислот получают при проведении реакции в течение нескольких;
часов при комнатной температуре.
8 0%
(С6Н5)гС=О ------> сццсоон
Активирование литийорганических соединений (I, 166, перед
ссылками). В присутствии Б. к. повышается реакционная способ-
ность литийорганических соединений. Например, бензол не метал-
лируется и-бутиллитием при комнатной температуре, однако в при-
сутствии Б. к. фениллитий образуется с 77%-пым выходом, о чем
свидетельствует реакция с двуокисью углерода, приводящая к бен-
зойной кислоте. Легко металлируются также трифенилметан, ди-
фенилметан и толуол [-711.
64
а-Алкилированиекетонов. Моно-а-алкилирование кетонов обычно
трудновыполнимо, однако его можно непосредственно осуществить
реакцией триалкилборанов с а-бромкетонами в присутствии Б к
в ТГФ [72]. Например, 2-бромциклогексанон (1) при" взаимодейст-
вии с триэтил бораном дает 2-этил циклогексанон (2) с выходом 68%:
О о
/'\ -'Вг , (С2нй),в А ,с,н5
I । КOBij-wp/’w, ТГФ У
I J * I I
(I) (2)
Считается, что реакция включает образование аниона а-бромкетона,
взаимодействие с бораном и перегруппировку. При использовании
Б. к. в mpem-бутаноле выходы продукта намного ниже. а-Бромке-
тоны получают реакцией кетонов с бромной медью в смеси этилаце-
тат — хлороформ (метод Кинга и Острума (см. II, 240) [J.Ore. Chem
29. 3459 (1964)].
Другой пример:
Перегруппировка типа пинаколиновой. Монотозилат (1), полу-
ченный гидроксилированием сх-пинеиа с последующим тозилирова-
нием, при обработке Б. к. в mpe/п-бутаноле при 65° в результате
сужения цикла дает с 60%-ным выходом кетон (2) — 2а-ацетил-5,5-
диметилбицикло-12,1,11-гексан. В противоположность этому эпи-
щТАЙ Монотози;1ат (3) в тех же условиях образует окись сх-пинена
\ I / О J,
3
м 199 4
.65
6a. S c h i гл с 1 p f e n i g C, W., L i n Y.-T., Walker J. F., Jr., J, Org.
Chem., 28, 805 <1963).
66. Van D о ngen J. P. С. M., De Jong A. J., Selling H. A,,
Mon t ij п P. P., Van Boom J. H., Brandsma L., Rec. trav.
86, 1077 (1967).
6b. I; a г m e. r M. L., Billups W. E., Greenlee R. B., Kurtz A.N.,
J. Org. Chem., 31, 2885 (1966).
6r. Malhotra S. К., M о a к 1 e у D. F., J ohnso n F., J. Am, Chem.
Soc., 89, 2794 (1967).
6д. Nozaki JI., К a t 6 S., Noyori R., Can. J. Chem., 44, 1021 (1966).
6c. H off S., В r a n d s m a L., Arens J. F., Rec. trav., 87, 916 (1968).
15a. S h a p i г о E. L., Legga 11 T., We b or L., О 1 i v e t о E. P.f
Tanabe M., Crowe D. F., Steroids, 3. 183 (1964).
156. Kruger G., J. Org. Chem,, 33, 1750 (1968).
34a. Shields T. C., Billups W. E., Leplev A. R., J. Am. Chem.
Soc., 90, 4749 (1968).
346. T г a v n h a m J. G., Stone D. B., Couvillion J. L., J. Org,
Chem.', 32, 510 (1967).
36a. Shields T. C., Billups W. E., К u г t z A. N., Angew. Chem.,
Internal. Ed., 7, 209 (1968).
366. Vogel E., В isk up M., Vogel A., Gunther H., Angew. Chem.,
Internal. Ed., 5, 734 (1966).
36b. Shields T. C., Billups W. E., Chem. Ind., 1967, 1999.
36r. Mitchell R. IT., Sondheimer F., Tetrahedron, 24, 1397 (1968).
36д. Baldwin J. E., Walker L, E., J. Org. Chem., 31, 3985 (1966).
36e. Bharucha R. R., Scliren к H. M., Experian! ia, 21, 248 (1965),
36ж. R e u s c h W., Frey D. W., Tetrahedron Letters, 5193 (1967).
36з. M oyer C. I:., Jr., Dissertation Abstr., 24, 4412 (1965).
36n. Bunnelt J. F., Victor R. R., J. Am. Chem. Soc., 90, 810 (1968),
36k. Barna P. M-, procedure submitted to Org. Syn., (1966).
36л. S i d d a 1 1 J. B., Baddeley G. V., Edwards J. A., Chem. Ind,,
1966, 25.
51a. С Li b b о n R. С. P., Hewlett C., J. Chem. Soc., (C), 1968, 2978.
52a. Gardner J. N., Carlon F. E., Gno i O., J. Org. Chem., 33, 1566,
3294 (1968).
526. Bartok W., Rosenfeld D. D., S c r i e s h a m A., J. Org. Chem.,
28, 410 (1963).
57a. Baillie A. C., Thompson R. H., J. Chem. Soc. (C), 1966, 2184.
576. Kasturt T. R., Arunachalam T., Can. J, Chem., 44, 1086 (19G6);
see also Pettit G. R., Fleming W. С., P a u I 1 R. D., J. Org.
Chem., 33, 1089 (1968).
57b. Anderson H. A., Smith J., Thompson R. H., J. Chem. Soc.,
1965, 2141.
57r. Herz W., Blackstone R. C,, Nair M. G., J. Org, Chem., 32,
2992 (1967).
57д. С г о w sha w R., Newstead R. C., Rogers H. A. J., Tetrahedron
Letters, 2307 (1964).
60a. Gassman P. G., L u m b J.T., ZalarF. V.,J. Am. Chem. Soc.,
89, 946 (1967).
71. Schlosser M., J. Organometallic Chem., 8, 9 (1967).
72. Bro w п H. C., R о g i ё At. M., Rathke M. W., J. Am. Chem. Soc.,
90, 6218 (1968).
73. Carlson R. G., Pierce J. R., Tetrahedron Letters, 6213 (1968),
трет-БУТИЛГИПОИОДИТ (I, 168—169, перед ссылками).
Иодирование углеводородов. Тэннер и Гидли [41 получили этот
реагент обработкой mpem-бутилгипохлорита в четыреххлористом
66
углероде или фреоне ИЗ иодной ртутью:
2(CH3)3COC1 + Hgl2 — 2(СН3)3СО1HgCl2
Пои облучении таких растворов в присутствии углеводородов обра-
зуются" иодированные углеводороды с выходами 30—50%.
Циклогексан "трД-* Ппклогексилиодид
«-Бутан ---> СНаСН°СНаСНа1-рСН3СН.СНСН3
35% ~ |
I
4 Tanner D. D., G i d 1 е у G. С., J, Am, Chem. Soc., 90, 80S (1968).
тире/п-БУТИЛГИПОХЛОРИТ * (I, 169—174).
Получение (I, 170, перед разделом Галогенирование углеводо-
родов).'В новом препаративном методе [1а], который исключает
опасность работы с хлором под давлением и возможность взрыва из-
за плохого температурного контроля во время добавления хлора,
используется продажный раствор хлорной извести (хлорокс), кроме
того, процесс не требует сложной аппаратуры, занимает мало вре-
мени и обеспечивает высокую степень чистоты продукта.
Фотохлорирование простых эфиров (I, 173, перед ссылками).
Под действием Б. при низких температурах легко происходит «-за-
мещение, часто с удовлетворительными выходами [201.
la, М I в t z М. J-, W ailing С., procedure submitted to Org. Syn. (1968).
20. W ailing С., M intz M. J., J. Am. Chem. Soc., 89, 1515 (1967).
т/?ет-БУТИЛИЗОЦИАНИД, (CH3)3CN^C. Мол. вес 83,13,
т. кип. 91—92°/720 мм.
Получение [1]. К 4 молям /прет-бутиламина при охлаждении
медленно добавляют 3,52 моля эгилформиата, после прекращения
экзотермической реакции раствор кипятят с обратным холодильни-
ком 2 час. Фракционированием выделяют с высоким выходом N-
/нреш-бутилформамид, дегидратацию которого с образованием Б.
Н н
-нос.н4 I 1
(СН3)3СЫН2 + НСОгСаН5 ——% (CH3)3CN —с = о
У V , о
н н
(CHa).CN-(Uo + POCl3-HPy >(CH3)3CN^C%Py.HCl-j-Py.HPO3
проводят хлорокисью фосфора, добавляя ее по каплям при переме-
шивании и охлаждении льдом. Для нейтрализации образующихся
кислот используют пиридин. Смесь обрабатывают ледяной водой,
экстрагируют петролейным эфиром и после перегонки получают Б.
См, примечание к разделу N-Бромсукцннимнд.— Прим, перев.
3*
67
Новый синтез индола. Ниже представлен один из шести синтезов,
описанных Цее [21 без подробных объяснений с указанием лишь вы-
хода продукта, составляющего 15—4О?6:
^С6Н5
N'^4CONHC(CH3)3
С(СН3)3
1. У г и И., М е й р Р,, Липински й М., Б одешейм Ф., Розен-
даль Ф,, «Синтезы органических соединений», изд-во «Мир», М., 1964, сб. 12,
сгр, 188,
2. Zee h В., Tetrahedron Letters, 3881 (1967).
W-БУТИЛЛИТИЙ (I, 174—175).
Внимание! Реагент обладает сильным разъедающим действием,
при работе с ним следует надевать резиновые перчатки и защитные
счки.
Металлирующий агент (I, 174, после уравнения). Десен и Кэндил
[4а] обрабатывали эфирный раствор 1-фенилэтимил-8-бромнафтали-
на (1) раствором Б. в гексане при комнатной температуре и после
гидролиза получили единственный идентифицируемый продукт —
1-фенилаценафтилен (4) с 82% -ним выходом. Реакция является
первым примером внутримолекулярного присоединения литийорга-
68
яИческого соединения к
дифенила (5) получается
тройной связи. Подобным же образом из
производное флуорена (6).
(5)
(6)
В обоих этих примерах металлоорганическая группа расположе-
на в непосредственной близости от тройной связи. Однако Уорд [46]
показал, что такое стерическое требование не является необходимым
для этой реакции. Так, 6-бром-1-фенилгексин-1 (7) превращается
в бензплиденциклопентан (8) с выходом 60%. Уорд предполагает,
что промежуточной частицей при циклизации является не карбани-
он, а радикал:
С6Н5С = С(СН2)4Вг
а)к-Ви.1Д
й)НгО
С6н5/
+ СБН5С==С(СН2)7СН3
(7) (8) 60% 20%
СБН5С = С(СН2)4Вг СьЬЦС-СХСнОзСНг + И-Bu + LiBr
С
С6н5х
и -Ей
----->
При металлировании Б, в эфире и ТГФ реакция заметно ускоряется
по сравнению с углеводородными растворителями. И ст х эм и сотр.
[4в| предполагают, что в углеводородном растворителе реагент су-
ществует в виде полимера, а в эфире или ТГФ он диссоциирован.
Ацетилениды лития (I, 175, перед ссылками). Паттисон и Дир
1У1 обнаружили, что реагент удобен для превращения терминальных
алкинов в ацетилениды лития. Они нашли также, что взаимодейст-
ВИе этого реагента с дигидропираном является наиболее простым
69
и лучшим из известных до сих пор методов синтеза транс-\-оксино-
нена-4:
Li
Ацетилениды лития, как правило, более удобны в обращении,
чем ацетилениды натрия, так как литиевые производные растворимы
в диоксане. со-Фторалкины-1 можно легко получить из со-фторалкил-
галогенидов, и дальнейшие реакции ацетиленовой группы осуществ-
ляются без отщепления атомов фтора.
Синтез алленов (I, 175, перед ссылками). Тетраметоксиаллен
(3), диацеталь недокиси углерода, был получен следующим путем
[10]:
Вц Вг
СН.Д /ОСН3 снвгя-КОС(СН3)л СН3О /с\ /0СН3
СНзС)/ ХОСН3 47% СН3о/ хосн3
(I) (2)
снзо ОСН3
_______;С = С = С
7 2% CH3O'Z хосн3
(31 Т. пл. 65—67’
Реакции с соединениями, имеющими подвижный атом водорода
(I, 175, перед ссылками). Поданным Хаузера 1111 Б. дает дилитие-
вые соли с соединениями, содержащими подвижные атомы водорода,
даже в тех случаях, когда амид калия в жидком аммиаке оказывается
неэффективным. Так, ацетанилид (1) при взаимодействии с Б. в
ТГФ или эфире образует ди литиевое производное, которому припи-
сывается строение (2). Эта двойная соль при алкилировании хлори-
стым бензилом превращается в (3):
о о он
CH3C-NHC6H5 LBuL> LiCH2cW}C6H5 С^СЬЬР;> C6H5CH2CH2C~NC4HS
ТГФ
(1)
(2)
(3)
Синтез олефинов из диоксоланов (I, 175, перед ссылками). При
обработке бензилиденового производного /иранс-циклооктандиола-
1,2 (1) Б. в гексане при 2СГ в течение 14 нас был получен транс-
(1)
75УГ“>
70
клооктен с 75%-иым выходом [121. фуе-Изомер не обнаружен.
Реакция имеет общий характер и может быть использована наряду с
.ртодом синтеза олефинов из тиокарбонатов, предложенным Кори
(см. Триметилфосфит, HI, 388-390, и V, 436).
D е s s v R. Е., К a n d i 1 S. A., J. Org, Chem., 30, 3857 (1965); J. Am.
Chem. Soc., 88, 3027 (1966).
f Wa r d H. J?., J. Am. Chem. Soc., 89, 5517 (1967).
л ' pastham J. F,, Gibson G. W-, J. Am. Chem. Soc., 85, 2171 (1963);
gcret tas C. G., Eastham J. F., ibid., 88 , 5668 (1966).
9 pattison F. L. M., Dear R. E. A., Can. J. Chem., 41, 2600 (1963).
in Hoffman R. W., Bressel U., Angew. Chem., Internat. Ed., 6,
’ 808 (1967).
11 Gav R> L., Boatman S., Hauser C. R,, Chem. Ind., 1965, 1789.
12 Hines J. N., P e a g r a m M. J,, W h i t h a m G. H., Wright M.f
Chem. Comm., 1968, 1593.
я-БУТИЛМЕРКАПТАН. /Мол. вес 90,19,т. кип. 96—98%
Айрланд [11 обнаружил, что алкилирование оксиметиленовых
производных типа (1) несколько улучшается при предварительном
превращении их в «-бутилтиометиленовые производные (2) азеотроп-
ной перегонкой с Б. и бензолом в условиях кислого катализа. Про-
изводное (2) легко метилируется (3), а защитная н-бутилтиометиле-
иовая группа удаляется под действием водного едкого натра в ди-
этиленглпколе (4). н-Бутилтиометиленовую группу можно также
восстановить до метильной группы (5) десульфуризацией над нике-
лем Реиея. Если в соединении имеется легко восстанавливающаяся
двойная связь, как в производном /7трй«с-Дк-декалона-1, восстанов-
ление до метильной группы можно осуществить под действием нат-
рия в жидком аммиаке (выход 34%). Производное (3) можно также
восстановить в (6) и в результате перегруппировки в условиях кис-
лотного катализа превратить в сс, р-ненасыщенный альдегид (7).
9 °
II н-ЩН95Н В
—сне—с==снон ——» —СНС—C=CHSC4H9-h
I I -н*° 1 I
СН3 о
I 1!
С—с- с =CHSC4Hs-h
(3)
сн3 о
I II
-с—с-сн2
СН3 О
I II
-с—с—СНСНз
(5)
сн3 он
I I
-С-----СНС= CHSC4H8-h
(6)
сн3
-с-снесено
I I
(7)
71
I. Ireland R. E., Marshall J. A., J. Org. Chem., 27, 1615, 1620 (1962).
/n/^шБУТ ИЛОВОГО ЭФИРА УГОЛЬНОЙ И ДИЭТИЛО-
ВОГО ЭФИРА ФОСФОРНОЙ КИСЛОТ АНГИДРИД (3). Масло,
мол. вес 223,24.
Получение [1L трат-Бутилат калия в ТГФ обрабатывают сухим
льдом; к образующемуся mpem-бутилкарбонату калия (1) медленно
при перемешивании добавляют раствор диэтил хлорфосфата (2) в
ТГФ; продукт (3) получается в виде масла.
СОг || (С2НбО)2РС1(2)
(СНОСОК —ф-> (СН3)3СОСОК ----------------------
(О
О о
II II
(СН3)3СОС-0-Р(ОС2Н5)3
(3)
N-Защита аминокислот [11. Реагент взаимодействует с хлоргид-
ратами эфиров аминокислот, например глицина (4) в хлороформе,
содержащем триэтиламин, с образованием N-mpe/п-бутоксикарбо-
нильного производного (5). Свободную кислоту (6) можно выделить
о о
Il II
(СН3)3СОС- О—Р(ОС2Н5)3 -н С1Н H2NCH2CO2C2H5 —>
(3) (4)
О
|С2Н-)а N - СНС1а ||
—рту--------> (CH3}3COC-NHCH.2CO2C2H6
'1/0
(5)
О
он- II
—-----(СН3)3СОС—NHCH2CO2H
Води. ТГФ
(6)
после гидролиза в водном ТГФ.
I, Tarbell D. S., Insalaco Al. A., Proc. Natl. Acad. Set., 57, 233 (1967);
T a г b e II D. S., 1 n s a 1 а с о M. A., procedure submitted to Org. Syn.
mpem-БУТИЛ ХЛОРИСТЫЙ (I, 177).
В присутствии кислот Льюиса, таких, как А1С13, BCl3, FeCl3
и SnCl4, взаимодействие циклогептатриена с Б. х. приводит к солям
тропилия, например [1]:
72
К смеси 18,4 г циклогептатриена и 19 г Б. х. добавляют при переме-
шивании 16,2 г хлорного железа. Наблюдается выделение хлористо-
11 водорода; температуру реакции поддерживают не выше 50°’
Затем смесь перемешивают при 65° в течение 5 час, охлаждают и
разбавляют пентаном. Образующуюся суспензию продукта отде-
ляют декантацией от осадка непрореагировавшего хлорного железа.
Эту процедуру повторяют еще два раза; желтый комплекс отделяют
и промывают сначала этанолом и затем пентаном; выход продукта
3 г (5%).
Под действием комплекса Б. х. с хлористым алюминием (2)
1 5 дикетоны (1) превращаются в соли пириллия (3) [21.
1. В г у с с - S m I t h D., Perkins N. A., J. Chem. Soc., 1961, 2320.
2. В a 1 a b a n A. T., Compf. rend., 256, 4239 (1963); Ba I aban A. T., К a t -
r i t z k у A. R-, Semple В. M., Tetrahedron, 23, 4001 (1967).
mpeztt-БУТИЛХРОМАТ (I, 178).
При окислении а-ионона (1) под действием Б. помимо ожидаемо-
го продукта (2) образуется некоторое количество 1-оксиЛ-кето-
а-ионона (3). В неполярных растворителях, в частности в трет-
бутаноле, (3) может быть получен с выходом 23—27%. Эта реакция
окисления имеет практическое значение, так как (3) легко превра-
щается в абсцизовую кислоту (4) — растительный гормон, содер-
жащийся в листьях и цветах абсцизин [91.
9‘ 0 Ь с г t s D. L., Heckman R. А., Н е g е В. Р., Beilin S. А.,
Urg. Chem., 33, 3566 (1968).
73
Мтреот-БУТОКСИКАРБОНИЛОКСИ)-СУКЦИНИМИД,
О
СН,—СО. Ii
| ОСОС(СН3)3.
СН2 —СО7
Мол. вес 215,20, т. пл. 98—100°.
Реагент получают реакцией N-оксисукпинимида (111, 22) с трет-
бутил хлорформиатом [11.
трет-БОК-аминокислоты. трет-Бутокси карбон и льна я (трет-
БОК) группа стала такой же незаменимой для защиты аминогруппы
в пептидном синтезе, как и карбобензоксигруппа; однако существо-
вавшие методы ее введения имели ряд серьезных недостатков. Новый
быстрый и удобный метод состоит в аминолизе Б. натриевой солью
аминокислоты. Соответствующая трет-БОК-аминокислота полу-
чается с хорошим выходом, а побочный продукт —N-оксисукцин-
имид благодаря хорошей растворимости в воде легко отделяется от
трет-Б О К-производно го. Аминолиз проводят при 90° в течение
1,5—2 час.
Аналогичным образом получают и используют родственный Б.
К-(/иреш-бутоксикарбош1локси)-фталимид (1), мол. вес 263,24, т.
пл. 118° (разл.) [2].
О
II
/ч /с\ 0
/ \ II
|| 2n~-°coc<chs)3
А/ \q,/
il (I)
о
1. Frankel Al., Ladkany D., G i 1 о и C., Wolman Y., Tetrahedron
Letters, 4765 (1966).
2. G г о s s H., Bilk L., Angew. Chem., Internal. Ed., 6, 570 (1967).
ВИНИЛЛИТИЙ (I, 183—184, перед ссылками).
При взаимодействии В. с тетр афенилфосфон и йбр омидом в эфире
образуется стирол и трифенилфосфин [41:
ЦС6НДР+)^-фСН3-СНЫ C(;H-,CH-_-CH2-;~(CGHr,):?PpLiBr
65% 80%
Реакция имеет общий характер; так, из тетра-н-толилфосфонийбро-
мида получают n-метилстирол с выходом 61%. Аналогично реаги-
рует изопропениллитий.
4 Seyferth D., Fogel J., Н е е г е и J. К.., J. Am. Chem, Soc., 88,
' 2207 (1966).
ВИНИЛТРИФЕНИЛФОСФОНИЙ БРОМИД (I, 184 — 185, перед
ссылками).
Реакцией В. с кетомалоновыми эфирами типа (1) был осуществлен
синтез пяти- и шестичленных циклоалкенов:
О
II
СН3С(СН2)„СН(СО.гС2Н5)2 -рсн2 = СНР+(СаНг,)3Вг-
(1) п= I или 2
о
NaH II - +
— [СН3С(СН3)„С(СО2С2Н5)2СН3СНР(СГ}Н-)).1]
сн2
нс7"
—► С(СО2С2Н5)2-|-(СеН5)3РО
(2) п— !, выход 69%
« = 2. выход 5 1 %
При п~3 реакция не имеет места [51.
Разработан [61 общий метод наращивания кепи с применением
В., включающий промежуточное образование илпда и последующую
реакцию Виттита: J
С,Н5ОН —С2Н5О-№+ 2^-СПрДЩг
СН5ОСН2СНР(СйН5)3
-NaBr
[С,Н5ОСНгСНСНСг,Н5]
(CGH;):ip+o-
С21%ОСН2СН = СНС6Н5 % (СЙН5)ЙР = о
57%
(50/50 цис\тран.с}
75
Швейцер и Лер [7] показали, что под действием В. из нат-
риевой соли сс-оксикетона образуется 2,5-ДИГИдрофуран, например
3-фенилзамещенный (3).
СбН 5 6 7 8 \ ° NaH
Дон ЭФ1'!’'
'О
с '
6нгОЦа+
СНг=СНР(С6Н5)эВг~
СДт ZO _ /р(сбн5>з
СН;
I I __
Н2С снг
р- ^Р(С6НД
с-—сн
(3)
Реакцией натриевой соли салицилового альдегида с В. в ДМФА
Швейцер и Томпсон 18] получили 2Н-1-бензопиран (4).
снаон
NaOCH,
92—97%
/. ,сно
п.
^/XO-Na +
СНг = СНР-Г(СвН5)аВг- в ДМФА
54—58%
5. Schweizer Е. Е., O’N е i 1 1 G. J., J. Org. Chem., 30, 2082 (1965).
6. Schweizer Е. Е., Smuckcr L. D,, Votral R. L,, J. Org. Chem.,
31, 467 (1966).
7. Schweizer E, E., L i e h r J. G., J, Org. Chem., 33 , 583 (1968).
8. Schweizer E. E., Thompson J. G., procedure submitted to Org.
Syn. (1968).
ГЕКСАМЕТИЛДИСИЛАЗАН (I, 189).
Производные спиртов- (перед ссылками). Исследуя получение
О-триметилсилильных производных углеводов, Свилей и сотр. [4]
обнаружили, что сам Г. практически не вступает в реакцию, однако
при использовании Г. в сочетании с триметилхлорсиланом
(CHiOsSiCl получаются максимальные выходы. Рекомендуется сле-
дующее соотношение компонентов: 0,2 мл Г., 0,1 мл триметилхлор-
сйлана и 1 мл пиридина. Картер [51 получал реагент в пиридине из
2,5 мл Г. и 1,6 мл триметилхлорсилаиа. После центрифугирования
получается бесцветный прозрачный раствор, который можно хра-
нить в темноте в течение нескольких недель.
Триметилсилилэфиры намного более ле-
н тучи, чем обычные эфиры, и поэтому очень
нзС-,сн3 удобны для газо-жидкостной хроматогра-
Схсн3 фин. Например, Мейнвальду [6] не удава-
I L-OH лось осуществить непосредственную
ho'^sxx^ch3 очистку алленового сесквитерпеноида (1),
защитного вещества кузнечика Rotnalea
С1) microptera; однако бпс-триметилсилильное
производное этого соединения легко очи-
щается газо-жидкостной хроматографией.
Джерасси [7] подробно исследовал фрагментацию триметилси-
лилэфиров под электронным ударом.
5. С а г t е г Н. Е., Ga ver R. С., J. Lipid. Res., 8, 391 (1967).
6. M e i п \y a 1 d J.,E r ickson К., H ar t shor nM.,Mein\va 1 d Y. C.,
Eisner T., Tetrahedron Letters, 2959 (1968).
7. D iekman J., Djcr assi C., J. Org. Chem., 32, 1005 (1967); D i e k-
man J., Thomson J. B., D J e r a s s i C., ibid., 32, 3904 (1967)
ГЕКСАМЕТИЛЕНТЕТРАМИН (уротропин) (I, 189-193).
Реакция Соммле (I, 190—192, после выдержки из [11]). Акерман
и Серри 111а] описывают методику, по которой при обработке ж-ди-
(аминометил)-беизола (1) Г., соляной кислотой и воцной уксусной
CH2NH2 сно'
/й\ А
| I _______(СНЩ.\4 Л
L Конц. HCI, Н2О, СН3СОО?Г ) ||
z 4CH2N'H3 ^/^СНО
Ц)
77
кислотой при температуре кипения получают изофталевый альдегид
(2) с выходом около 60%.
Па. Ackcrm а п J. Н., Surrey A. R., Org. Syn., 47, 76 (1967).
ГЕКСАМЕТИЛТРИАМИД ФОСФОРИСТОЙ КИСЛОТЫ,
1(СНЯДМР (I, 193-194).
Реакция Витт и га (I, 194, перед ссылками). Одпгер и Эйтер [71
использовали этот реагент вместо трифенилфосфина в реакции Вит-
тита. Он особенно удобен потому, что образующийся при этом не-
олефиновый продукт — гексаметилтриамид фосфорной кислоты —
растворим в воде.
I) NaOCH.
l(GHa)sN!aP 2) СнНЩНО
С6Н5СН2Вг ---------- [(CH3)2N)sP-CH2C6H5(Br“) —------>
7 5%
C6H5CH = CHCSH5
l(CH3)2N]3PO
Восстановление гидроперекисей. В синтезе экдизона из эрго-
стерина одна из стадий состоит в озонировании (1) и превращении
его без изомеризации в альдегид (2) [81. Восстановление промежу-
точной гидроперекиси проводится в очень мягких условиях Г. ф. к.,
который превращается в гексаметилтриамид фосфорной кислоты;
последний легко отделяется от альдегида при промывании разб,
соляной кислотой.
7. О е d i g е г Н., Е 1 t е г К., Ann., 682, 58 (1965),
8. F и г 1 е п пт е i е г A., F ii г s t A., Langemann А., W а 1 d v о g е 1 G.,
Hocks P., Kerb U., Wiochert R., Helv. Chim. Acta, 50, 2387 (1967),
ГЕКСАМЕТИЛТРИАМИД ФОСФОРНОЙ КИСЛОТЫ (гексаме-
тапол), [(CH3)2N]3PO (I, 195. Поправка. В т, I в названии реа-
гента допущена ошибка; должно быть гексаметапол).
Обзоры [71. Даком [81 сообщает, что тщательно очищенное веще-
ство плавится при 7,2".
Восстановление. В этом триамиде а,[3-непредельные кетоны вос-
станавливаются литием (пли калием) до соответствующих насыщен-
ных кетонов. Использование эфира в качестве сорастворителя улуч-
78
шает выход; в отсутствие эфира часть ненасыщенного кетона остается
невосстановленной 191. Выходы сравнимы с получаемыми при вос-
становлении в жидком аммиаке.
Замещение. Реакции замещения в случае бромидов типа неопен-
тилбромида обычно трудно выполнимы. Однако Льюису и сотр. 1101
удалось легко осуществить замещение брома в Н) под действием
смеси ацетиленида лития и этилендиамина в гексаметаполе или
ДМСО. В этих условиях первоначально образующийся терминаль-
ный ацетилен (2) изомеризуется во внутренний изомер (3). В жидком
аммиаке и ДМФА эту реакцию провести не удается.
Пакьетт и Филипс [11] также сообщают, что гексаметапол являет-
ся превосходной средой для реакций замещения в бромидах типа
неопентильных. Они использовали этот растворитель для превраще-
ния димезилата (4) в дииодид (5) и последующей циклизации (5)
в сульфид (7).
Реагент считается прекрасным амидирующим средством [12].
при нагревании карбоновой кислоты с гексаметаполом при 180—
в течение 30—60 мин образуется соответствующий N, N-диме-
зиламид с выходом 50—90%. Добер [13] показал, что при исполь-
зовании гексаметапола в сочетании с ТГФ в присутствии избытка
79
амида натрия фенил галоген иды (реагирующие через промежуточ-
ный дегидробензол) подвергаются различным реакциям нуклео-
фильного замещения.
Ге ксаметапол-
ТГФ
NaNH,
14%
Эффекты растворителя в реакциях замещения, Кавэ, Гутарель
и сотр. [14] исследовали реакции нескольких 3 р-тозилоксистерои-
дов с азидом натрия в ДМСО, N-метилпирролидоне и гексаметаполе
и получили наибольший выход 3 а-азидостероидов в последнем рас-
творителе (реакция SjV2). Те же результаты были получены с 20а-
и 20р-тоз ил оксистероидами, которые превращаются в 2О|3- и 20а-
азидостероиды соответственно. В протонных растворителях обра-
зуются в основном продукты отщепления.
Дегидрогалогенирование. При нагревании в гексаметаполе при
120—140" а-бромкетоны с высоким выходом и без перегруппировки
превращаются в а, p-непредельные кетоны. Продукты выделяют
просто после разбавления водой, выходы обычно получаются выше,
чем при использовании Ь1гСО3/ЫВг/ДМФА [15].
7. Normant Н., Bull. soc. chim. France, 1968, 791, review with 187 refe-
rences, Normant H., Angew. Chem., Intermit. Ed., 6, 1046 (1967).
8. D u с о m JCom pt. rend,, 264 (C), 722 (1967).
9. Angibeaud P., Larche veq ue M., Normant H., Tchou-
bar B., Bull, soc, chim. France, 1968, 595.
10. Lewis R. G., Gustafson D. H., E r m a n W. F., Tetrahedron
Letters, 401 (1967).
11. Paquette L. A., Philips J. C., Tetrahedron Letters, 4645 (1967).
12. Kopecky J., Smcjkal J., Chem. Ind., 1966, 1529.
13. Caubcrc P.t Bull. soc. chim. France, 1967, 3446, 3451,
80
?4 Cave A., J ar re a u F.-X., Khuong-Huu Q., Leboeuf M.,
S e r b a n N., Gout arel R., Bull, soc. chim. France, 1967, 701; Lebo-
c u f Cave A., Goutarel R., Compt. rend., 264, 1090 (1967).
15 H a n ii a R'j Tetrahedron Letters, 2105 (1968).
ГЕКСАФТОР БУТИ H-2 (I, 196, перед ссылками).
Пакьетт [4] ожидал, что этот реакционноспособный диенофил
может вступать в реакцию с 2(1Н)-пиридоном (1), цисоидным диеном,
который не удавалось ввести в реакцию Дильса — Альдера. Однако
при этом наблюдается присоединение Г. по азоту с образованием про-
дукта (2)^. При взаимодействии с N-метилпроизводным (1), которое
не может вступать в реакцию такого типа, образуется лишь черная
смола.
I . I
Н F3CC—CHCF3
(I) (2)
4. Paquette L. A., J. Org. Chem., 30, 2107 (1965).
ГЕКСАХЛОРЦИКЛОПЕНТАДИЕН (J, 196, после уравнения).
Найдено [11, что Г. образует двойной аддукт с нафталином (вы-
ход 25—35%). Реакция интересна тем, что этот аддукт подвергается
* Реакц-нсй гексафторбутина-2 с 2-винил- и 2,3-дивинилазиридинами при
—/6 в фреоне 11 получены также соответствующие продукты присоединения по
связи N—Н, легко изомеризующиеся при комнатной температуре в азепины
например: r г ’
[8 t о g г у n Е. L,, В г о i s S. J„ J. Am, Chem. Soc., 89, 605 (1967)].— Прим.
81
замещению в p-положение ароматического кольца и, таким образом,
Р-замещенньге нафталины можно получить ретрореакцией Дильса —
Альдера. Ориентация атомов водорода в положениях 1, 2, 3 и 4
аддукта не установлена.
Обзор [2].
I, D a n i s h A. A., Silverma п М., Т a j i m a Y. A., J- Am. Chem. See.,
76, 6144 (1954); Fenyes J. G. E., J. Org. Chem., 27, 2614 (1962); Look M.,
procedure submitted to Org. Syn. (1966).
2. Ungnade W. E., McBee E. T., Chem. Revs., 58. 249 (1958).
ГЕКСАХЛОРЦИКЛОТРИФОСФАЗАТРИЕН (фосфонитрил-
хлорид), (1). Мол. вес 346,99, т. пл. 113—115°.
Обзоры [1].
Получение. Г. был впервые получен Либигом [2) реакцией пяти-
хлористого фосфора с аммиаком. В настоящее время его получают
из п яти хлор истого фосфора и хлористого аммония в аыьи-тетра-
хлорэтане [3].
Реакции. При взаимодействии Г. с бензоатом натрия при высоких
температурах образуется бензонитрил и бензойный ангидрид [4].
Амиды и гидразиды можно получить с хорошим выходом при
взаимодействии Г. с натриевой солью карбоновой кислоты в ТГФ,
бензоле или циклогексане при комнатной температуре с последую-
щим добавлением амина или гидразина [51.
Предполагается следующий механизм реакции:
+ RCOONа
1. S h aw R. A., Fitzsimmons В. W., S m i t h В. C., Chem. Revs., 62,
247 (1962); Paddock N. L., Quart. Rev., 18, 168 (1964); Shaw R. A.,
Chem. Ind., 1967, 1737.
2. L i e b 1 g J., Ann., 11, 139 (1834).
3. Nielsen M. L., Cranford G., Inorg. Syn., 6, 94 (1960).
4. В e z rn а п I. I., Reed W. R., J. Am. Chem. Soc., 82, 2167 (1960).
5. C a g 1 i о t i L., P о 1 о n i M., R о s i n i G., J. Org. Chem., 33, 2979 (1968).
ГЕКСАЭТИЛТРИАМИД ФОСФОРИСТОЙ КИСЛОТЫ \mpuc-(№
этиламино)-фосфинI, [(С2Н5)^Ы|3Р (I, 196, перед ссылками).
Частичная десульфуризация. При взаимодействии с Г.ф.к.
при 25—80~ дисульфиды (циклические, бензил, аралкил- и диал-
кил-) превращаются в сульфиды 13]. Например, при обработке ди-
бензилдисульфида 10/о-ным избытком Г. ф. к. в кипящем бензоле
RSSR' + [(C2H5).2N]3P RSR' + [(C.2H5)<,\]3P==S
82
5 час) получается дибензилсульфид с
ставляет интерес превращение (1) в (2) с
2 5°, 2 8 гас
------------
Количественна
80%-ным выходом. Пред-
количественным выходом.
и
(2)
3 Harpp D.N., Gleason J. С., Snyder J. Р., J. Am. Chem, Soc., 90,
' 4181 (1968).
/пре/n-ГЕПТИЛ АТ КАЛИЯ, (С2Н5)3СО~К+. Мол. вес 154,29.
Получение. Г.к. —реагент красного цвета— получают из калия
и избытка триэтилкарбинола, который служит и растворителем,
или из приблизительно эквимолярных количеств калия и спирта в
ксилоле или ундекане [11.
Дегидрогалогенирование алифатических и алициклических хло-
ридов. Браун [2] отмечает, что бимолекулярное отщепление гало-
геиоводородов от алкилгалогенидов под действием основания по
мере увеличения стерических требований приближается к расщепле-
нию гофмановскоготппа. Например, расщепление трет-амилброми-
да этилатом калия приводит к олефину-1 лишь с 30%-ным выходом,
„ г Вг Н2СХ ( а) С»Н5ОК 30%
Нз Хгги сн Освпва1,ие ЧсСНаСН3 б) (СНОСОК 72,5%
Г1 с/ 2 3 H3CZ ' ( в) (С2Н5);{СОК 88,5%.
под действием же Г. к. выход повышается до 88,5%. Эта реакция
представляет удобную возможность для осуществления сдвига
двойной связи и получения менее устойчивых метиленовых производ-
ных [21. Олефин обрабатывают хлористым водородом в эфире при
—70’, эфир удаляют при 0' и полученный таким образом третичный
хлорид обрабатывают избытком основания при 60 в течение 12 час.
Эта последовательность реакций была использована для превраще-
ния сс-цедрена (1) в менее устойчивый [З-иедрен (2) [11.
83
I. A c h a г у a S. P., Bro w n H. C., Chem. Comm., 1968, 305.
2. Brown H. C. Mor i t an i I., Okamoto Y., J. Am. Chem. Soc., 78,
2193 (1956).
ГИДРАЗИН (I, 197—211).
Восстановление по Вольфу — Кижнеру (I, 199—203, после
выдержки из [71). Механизм восстановления по Вольфу — Кижнеру
обсуждается в последнем обзоре [7а],
. Синтез фенилциклопропана (I, 206, перед разделом Другие
реакции). Лучшая методика получения фенилциклопропана (5)
описана Петерсеном и Скеллом [46а [: к смеси этанола и гидразингид-
/^ArCH=CHCH=N72
О)
рата при кипячении добавляют по каплям с контролируемой ско-
ростью коричный альдегид. Спустя некоторое время образуется азин
(4) и смесь становится оранжевой. Через 3 час фенилциклопропан
(5) отгоняют вместе с остатками гидразингидрата. Выход (5) состав-
ляет 45—56%.
Синтез пиразолов см. Фенил-(тригалогенметил)-ртуть в этом томе.
7а. Szmant Н. Н., Angew. Chem., Internal. Ed., 7, 120 (1968b
46a. Petersen R. J., Skell P. S., Org. Syn., 47, 98 (1967).
ГИДРОКСИЛАМИ НА ХЛОРГИДРАТ (I, 215—219, перед ссыл-
ками) .
Альдегиды, особенно ароматические, при кипячении в муравьи-
ной кислоте с небольшим избытком Г. х. и формиата натрия пре-
вращаются в нитрилы [15]. Промежуточным продуктом является,
по-видимому, формиат оксима (2), который в процессе обработки в
О
н и
/х /СНО /C=NOCH /ч ZC=N
А/ ж\/ /X/
I H^NOH I !1 -НСООН I ||
LL 'тДиГ I II
'Он Х/ХОН
(1) (2) ,3)
84
присутствии основания отщепляет муравьиную кислоту с обра-
зованием нитрила (3).
Алифатические альдегиды, их тримеры и бисульфитные про-
изводные при кипячении в 95%-ном этаноле с Г. х. и несколькими
каплями соляной кислоты в течение 6 час дают соответствующие
нитиилы с практически количественным выходом 116].
]5. van Е s Т„ J. Chew, Soc,, 1965, 1564.
16. I7 India у J- A., Tang C. S., Can, J. Chem. 45, 1014 (1967).
ГИДРОКСИЛАМИН-О-СУЛЬФОКИСЛОТА (ГАСК) (I, 211—214),
(I, 211): упрощенная методика получения ГАСК из сульфата
гидроксиламина и 60%-ного олеума описана Шмицем и сотр. [1а].
Образование нитрена (I, 212, после выдержки из [4]). Аппель
и Бюхнер [4а| в расчете на образование NH (нитрен, имен) при обра-
ботке ГАСК основанием провели реакцию ГАСК с бутадиеном-1,4
в метаноле в присутствии метилата натрия и получили пирролин-3,
однако с очень низким выходом.
Фрагментация (I, 212, перед разделом Аминирование). Процесс,
описанный как фрагментация аф-эпоксикетоксима с образованием
ацетиленового кетона [461, включает, по-видимому, следующие
стадии:
N N
N+ N + N = N
[ !
Реакция была применена к с-тероидному сс, [3-эпоксикетоксиму (1),
в котором диоксиацетоновая группировка в боковой цепи защищена
(1) (2)
85
в виде бг/с-метилендиоксипроизводного (Б МД-произ водного).
Обработка (1) 3 же ГАСК и 7 же NaOH в этаноле при комнатной
температуре приводит к ацетиленовому кетону (2) с хорошим выхо-
дом. Другим примером является фрагментация спиростановой
системы (3).
Диазиридины и диазирины (I, 214, перед ссылками). При иссле-
довании взаимодействия ГАСК со стероидными кетонами было уста-
новлено, что в реакцию вступают только несопряженные 2(5<х)-
кетоны и 3(5а или 5 |3)-кетоны [13]. Д4-3-кетостероиды, 17-кетосте-
роиды и 20-кетостероиды в реакцию не вступают. Раствор 502 мг
17сс-метил-5сс-андростанол-17[3юна-3 (1) в метаноле при 2~ насыщают
аммиаком, затем небольшими порциями добавляют 236 мг ГАСК.
Образующийся диазиридин (2) окисляют окисью серебра в эфире до
диазирина (3) с практически количественным выходом.
la. S с h m i t z Е., Ohme R., Schramm S., Ann, 702, 131 (1967).
4a. A p p e I R., Buchner O., Angew. Chem., Internal. Ed., 1, 332 (1962).
46. Wieland P., Kaufmann H., Eschenmoscr A., Heh. Chim.
Aeta, 50, 2108 (1967).
13. C h и г c h R. F. R., Kende A. S., \V e i s s M. .1., J. Am. Chem. Soc.,
87, 2665 (1965).
86
ГРИНЬЯРА РЕАКТИВЫ (I, 227—238).
Эшби [Quart. Rev., 21,259 (1967)1 опубликовал обзорную статью,
посвященную получению Г. р. и механизму реакций Гриньяра.
Активированный магний [7а] (I, 230, после выдержки из [7]).
Пориию магния в виде стружки или опилок интенсивно перемеши-
вают В атмосфере азота в течение одного дня. При этом магний
измельчается и становится серым или серо-черным. В таком виде
магний пригоден для получения Г. р. из n-6pow-(N, М-диметил)-ани-
лина- Ранее этот Г. р. получали только способом «вовлечения» или
с такими инициаторами, как иод и иодистый этил.
7а. Mendel A., J. Organometallic Chem., 6, 97 (1966).
1,5-ДИАЗАБИЦИКЛО-[4Д ОКНОНЕН-5 (ДБН) (1,240—242). В т. I
допущена неточность в названии реагента.
Реакция Виттига (перед ссылками). В статье Одигера и сотр. [5]
сообщается также, что этот реагент пригоден для дегидробромиро-
вания фосфониевых солей в реакции Виттига с альдегидами, чув-
ствительными к действию щелочей. В качестве растворителя исполь-
зуют ДМСО.
[(С6Н5)3РСН2СО2СН3] + Вг-
,;^_/^Сбн5СНО + ДМСО
--------“7--------> С6Н5СН^СНСОаСН3
‘ /о
Дегидрогалогенирование. Фогелю и Клярнеру [6] удалось впер-
вые получить 1,2-эпоксинафталин (3) бромированием дигидро-
1,2-эпоксинафталина NBC с последующим дегидрогалогенирова-
нием (2) под действием ДБН в ТГФ при 0е. Все другие испробован-
ные для этой цели основания оказались непригодными. Окись (3)
крайне неустойчива и в твердом состоянии перегруппировывается
(иногда со взрывом) в сс-нафтол.
Циклизация [7]. На одной из стадий полного синтеза проста-
гландина Кори и сотр. осуществили циклизацию кетоальдегида (1)
при обработке его 0,1 же ДБН; соответствующее производное цикло-
пентанола было выделено в виде ацетата (2) с выходом 45%.
о
п
HC-NH
Я-С5НП
88
g Vogel E., К 1 arner F.-G., Angew. Chem., Internal. Ed., 7, 374 (1968).
7 Corey E. J., Andersen N. H., Carlson R. M., Paust J.,
‘ Vedejs E., V I a t t a s I., Winter R. E. K-, J. Am. Chem. Soc., 90,
3245 (1968).
1,4-ДИАЗАБИЦИКЛО- 12,2,2]-ОКТАН (ДАБЦО) (иногда реагент
называют триэтилендиамином) (HI, 458). Мол. вес 112,18, т. пл.
159-160=. KJ
ТЕ
Комплексы с металлоорганическими соединениями. См. также
наблюдения Скреттаса и Истхэма в разделе Триэтилендиамин (III,
458).
Сообщалось fl], что реагент образует очень устойчивый комплекс
с бромом, под действием которого сульфиды окисляются до сульф-
оксидов с высоким выходом:
О"
C.H..N.-Вг, I
c«H5sc0H5 ----—----► C0H3S+C„Hs
г! gU
Металлирование. Реакцией тиоанизола, н-бутилбромида, лития
и ДАБЦО в ТГФ при 0 ° Кори и Сибах 12] получили фенилтиометил-
литий с 97%-ным выходом:
ТГФ, О3
w-BuLi+СеН55СН3Д-ДАБЦО —C6Hr,SCHaLi
Дегидрогалогенирование. Заугг и сотр. [3] описали дегидрогало-
генирование бромамида (1) до иминоэфира (2) с помощью этого ре-
агента в метаноле или ДМФА.
При обработке иод аз и дом этилового эфира кротоновой кислоты
(3) Хасснер и Фоулер [4] получили этил-3-азидо-2-иодпропион ат
6Г3С4 ,'Н ДАБЦО
>с-с/ —СН3СНСНСОаС2Н5 - сЦ
н/ ч:о2с2н5 ] । 50%
(3) N3 I
(4)
ДйГ сн3-с — снсо2с2н5
(5)
89
(4), который под действием ДА Б ЦО превращается в винил азид (5).
Образование (5) было подтверждено по ИК-и ЯМР-спектрам, однако
это соединение неустойчиво и при комнатной температуре с выде-
лением азота превращается в азирин (6).
Катализатор циклизации. Ньюмен и Курдювель |51 использовали
этот реагент в качестве катализатора для конденсации метилового
эфира о-бензоилбензойной кислоты (1) с метилхлоркарбонатом.
При нагревании образующегося при этом продукта (2) выделяется
углекислый газ и получается псевдоэфир (3).
сн3о
(дабцо) с6нг
С1СО2СН3
80% >
100-120°
-СО2>
89V
Известно [6], что этилен-бнс-(изоцианат) образует с высоким вы-
ходом 1-замещенные имидазолидоны-2 с соединениями, содержа-
щими активный водород, причем реакционная способность послед-
них уменьшается в ряду: R2NH>RNH2>ROH>RSH. В последнем
случае для реакции необходим катализатор — ДАБЦО («триэти-
лендиамин»):
CH,N=C = O
| + RSH-рДАБЦО
CHaN = C = O
г ° ц
[|
ch2nhcsr
- ch2n = c = o_
Кипячение н С„Нс
Тушение синглетного кислорода ]О3 осуществляется под дейст-
вием ДАБЦО и других третичных алифатических аминов [7].
1. О ае S-, О h п i s h 1 Y., Kozuka S., Taga k i W., Bull. Chem. Soc.
Japan, 39, 364 (1966).
2. Corey E. J., Seebach D., J. Org. Chem., 31, 4097 (1966).
3. ZauggH. E., Michaels R. J., Schaefer A. D., Wenthe A.M.,
W ash burn \V. H., Tetrahedron, 22, 1257 (1966).
4. H assner A., Fowler F. \V., J. Org. Chem., 33, 2686 (1968); see
also Fowler F. W., H assner A., L e v v L. A., Am. Chem. Soc. 89,
2077 (1967).
5. N e w m a n M. S-, Co u r d u ve 1 i s C., J. Am. Cliem. Soc., 88, 781 (1966).
6. T i I 1 e у J. N., S a у ig h A. A. R., J. Org. Chem., 29, 3347 (1964).
7. Ouannes C., W ilson T., J. Am. Chem. Soc., 90, 6527 (1968).
90
1,5-ДИАЗАБИЦИКЛО-[5,4,0|-УНДЕЦЕН-5 (ДБУ), (4). Мол.
вес 152,14, жидкость.
Реагент получают из капролактама (1) и акрилонитрила через
промежуточные соединения (2) и (3) [1].
(1) (2) (3) (4)
Дегидрогалогенирование [1]. Смесь эквимолярных количеств
основания и бромалкана нагревают при 80—90° с отгонкой обра-
зующегося алкена. Реакцию можно проводить в растворителе, на-
пример в ДМСО. Как видно из следующей таблицы, выходы алке-
нов значительно лучше, чем при использовании 1,5-диазабнцикло-
[4,3,01-нонена-5 (ДБН).
Бромалкан Алкен Выход, %
ДБН | ДБУ
4-Бро.м гептан Гептен-3 60 91
2-Бромгептан Гептен-I и гептен-2 (1:4) 36 78
2-Бромоктан Октен-1 и октен-2 (1:4) 40 84
1. О е d i g е г Н., Moller F г., Angew. Chem., Internal. Ed., 6, 76 (1967).
ДИАЗОАЦЕТАЛЬДЕГИД, N^N — CHCHO^N = N=CHCHO.
Мол. вес 70,06, т. кип. 40710 мм. Внимание^. Д. сильно взрывается
при перегревании.
Получение [1]. Реагент получают при нагревании в вакууме [3-(N-
мегил-Кт-фениламино)-акролеина с избытком н-толуолсульфонил-
азида (III, 355) до 70—80°; продукт отгоняют по мере образования.
СН3
I
С6НЛ'СН-СНСНО + п-СН3С6Н45ОгМ3
70%
СН3
I +
csh5nch - NSO2C6H4CHs-n + N ™ N—снсно
Предшественник формилкарбеиа 11]. В присутствии различных
катализаторов, из которых наиболее эффективным оказался ацетил-
91
ацетонат меди (II) (см. в этом томе), Д. разлагается с образованием
формллкарбена, который улавливается тетраметилэтиленом:
(СН3)2С = С(СН3)г J- ; СНСНО (СН3)2С-С(СН3)а
хсн/
I
сно
1, Arnold Z., Chem. Comm., 1967, 299.
ДИАЗОМЕТАН (I, 242—248).
б) Получение из метилнитрозамида я-толуолсульфокислоты
(I, 243). Поправка. К раствору едкого кали в воде следует сначала
добавить 25 мл 95%-ного этанола. В отсутствие спирта Д. не обра-
зуется.
Этерификация кислот (I, 245, в конце раздела). При получении
метиловых эфиров для газохроматографического анализа смесь
экстрагируют эфиром и обрабатывают Д. В случаях растворимых
в ' воде кислот (например, дикислоты, оксикислоты) экстракция
обычно затруднительна. При этом используют следующий простой
прием [14а].
Раствор жирной кислоты подщелачивают, освобождают от нейт-
ральных веществ и подкисляют до pH 3—4 соляной кислотой (избы-
ток которой затем превращается в хлористый метил). К охлажден-
ному раствору осторожно добавляют эфирный раствор Д.
Метилирование спиртов (I, 245, после выдержки из [18]). Д. в со-
четании с эфиратом трехфтористого бора используют для метилиро-
вания углеводов, содержащих заместители, которые отщепляются
под действием оснований, например ацетильные группы. Так, при
метилировании 1,2,3,4-тетра-0-ацетил-|3-о-глюкопиранозида (1)
Д.— BF3 было получено О-метильное производное (2), дезацетили-
рование которого под действием метилата натрия в метаноле дает
6-О-метил-D-глюкозу (4). Метилирование с помощью СНД—Ag2O
часто сопровождается миграцией ацетила и приводит к 2,3,4,6-
тетра-0-ацетил-|3-о-глюкопиранозиду (3) [18а].
92
Реакция Арндта — Эйстерта (I, 247, после выдержки из [291).
Описанная здесь методика получения этилового эфира 1-нафтил-
уксусной кислоты [29а] представляет модификацию реакции
Арндта — Эйстерта, разработанную Ньюменом и Билом [296]. При-
менение триэтиламина при образовании диазокетона дает возмож-
ность использовать только 1 же Д. [296].
1-С10Н7СОС1 + CH,N2 -I- (C2H5)3N _>
_> l-ClnH7CCH = .\ = N + (С3Н5)3ЙНС1
о
II 4- -
CCH^N-N СН2СО2СаН5
I !
(C3H5)3N
+c,hsoh - I || |
85—92% I II I
Раствор 30,5 г 1-нафтоилхлорида в 50 мл сухого эфира добавляют
в течение 30 мин при охлаждении льдом и перемешивании магнитной
мешалкой к раствору эквимолярных количеств Д. и триэтиламина в
900 мл сухого эфира. После перемешивания в течение 3 час при О3
хлоргидрат триэтиламина отделяют и промывают эфиром (выход
составляет 90% теоретического). После отгонки растворителя и
промывания остатка получают желтые кристаллы 1-диазоацетил-
нафталина (вызывает сильное раздражение кожи).
Раствор 15,7 г этого вещества в 50 мл абсолютного этанола поме-
щают в двугорлую колбу емкостью 150 мл, снабженную покрытой
тефлоном магнитной мешалкой, медицинской пробкой и обратным
холодильником, соединенным с устройством для сбора газа. Непо-
средственно перед реакцией готовят катализатор (1 г бензоата сереб-
ра растворяют в 10 мл триэтиламина) и после нагревания реакцион-
ной смеси до кипения через медицинскую пробку с помощью шприца
вводят 1 мл раствора катализатора. Затем, когда почти прекратится
выделение азота, вводят еще 1 мл раствора катализатора. Обычно
достаточно добавить катализатор 3—4 раза в течение не более
45 мин. Затем смесь кипятят 1 час,охлаждают, фильтруют и из фильт-
рата удаляют растворители на роторном испарителе при понижен-
ном давлении. Остаток растворяют в эфире и промывают по два раза
10%-ним раствором карбоната натрия, водой и насыщеным рас-
твором NaCl. Эфирный раствор фильтруют на конической воронке,
заполненной безводным сульфатом магния, и упаривают. После
перегонки получают этиловый эфир 1-нафтилуксусной кислоты, т.
кип. 100—10570,1 —0,2 мм, выход 84—92%.
Реакция с хлорметансульфохлоридом (I, 247, перед ссылками),
фп взаимодействии диазоалканов с алкиленсульфонами (RCH=SO2)
Образуются эписульфоны [321. Алкиленсульфоны получают дегид-
93
рохлорированием первичных алкансульфохлоридов под действием
триэтил амина. Реакция иллюстрируется методикой получения 2-
хлортиирандиоксида-1,1 (4) [33]. Суспензию 210 г снлыг-трцтиана
(т. пл. 218“) в смеси 1 л уксусной кислоты и 210 мл воды хлорируют
\ \+с1а cich2so2ci [cich=sos]
S. ZS H£O Эфир
(2) (3)
(1)
79—82% I CH2 = N = N
H Y H
>c — c<
Hz \ / 'CI
O3
0)
при перемешивании и температуре 40—50° в течение нескольких
часов, затем при перемешивании при —10“ в атмосфере азота до-
бавляют триэтиламин для дегидрогалогенирования (2), а вслед за
этим — эфирный раствор Д.
Синтез олефинов. Описанная выше реакция получения эписуль-
фонов является стадией общего синтеза олефинов [32]. Например,
из D-10-камфорсульфохлорида (1) получен о-2-оксо-7,7-диметил-1-
винилбицикло-]2,2,11-гептан (4) [34]. Соединение (1) последовательно
CH2SO2C1
(1)
(CzH5)jN^
-----——
обрабатывают триэтнламином и Д. Сырой эписульфон (3) при нагре-
вании до 90“ теряет двуокись серы с образованием олефина (4).
Выходы олефинов, полученных этим способом, составляют от 35 до
97% -
Присоединение к кетенам [35]. При добавлении охлажденного
(—78е) раствора Д. в хлористом метилене к избытку кетена образует-
ся циклопропанон, который идентифицирован по спектральным дан-
94
и химическим превращениям. Аналогичным образом в раство-
были получены метплциклопропанон, 2,2-диметилциклопропа-
и тетраметилциклопропанон. Механизм реакции не установлен,
по-видимому, метилен не является промежуточным продуктом.
ным
pax
нон
но,
сн2=с=о + ch2n2
CH?C1Z, -78°^
О
9 0%
п-i Contributed by Eiscnbraun Е. J., Oklahoma State Univ.
1 о ' q r o s E. G., F 1 e m a t t i S. M., Chem. Ind., 1966, 1556; Ma s t r o-
C па т d i 1.О., F 1 c m a t t i S. At., Deferaii J. O., Gross E. G.,
Carbohydrate Res., 3, 177 (1966); Deterrari J. 0., Gros E. G.,
Mast'ronar di I. 0., ibid., 4, 432 (1967).
29a Lee V. N e man AL S., procedure submitted to Org. Syn. (1968).
296 Newina n AL S., В e a 1, P. F., Ill, J. Am. Chem. Soc., 71, 1506 (1949),
' 72, 5163 (1 950).
32. О p i t 2 G., Fischer K., Z. Naturforsch., 18b, 775 (1963); Angew. Chem.;
Internal. Ed., 4, 70 (1965).
33. P a q u e t t e L. A., Wittenbro о k L. S., Kane V. V., J. Am.
Chem. Soc., 89, 4487 (1967); Paquette L. A., Wittenbrook L. S.,
procedure submitted to Org. Syn., (1967).
34. F i s c h e r \L, О p i t z G., Org. Syn., 48, 106 (1968).
35. T u г г о N. J., Hammond W. B., Tetrahedron, 24, 6017 (1968).
2-ДИАЗОПРОПАН (диметилдиазометан), (CH3).,C=N=N«h>
<-»(CH3).2C—N^N. Мол. вес 70,10.
Получение. Гидразон апетона окисляют свежеприготовленной
желтой окисью ртути (II) в сухом ксилоле [1, 2]:
(СН3)2С= N;NH3-r HgO —> (СН3),С—N=N
Синтез гелидиметилциклопропанов [3].При взаимодействии реа-
гента с бутенолидами (1) с хорошим выходом образуются пиразоли-
ны (2). Последние можно превратить в геминальные диметилцикло-
пропаны (3) пиролизом, а еще лучше — фотолизом в присутствии
бензофенона в качестве сенсибилизатора.
W (2) (3)
LStau dinger Н., G a u I е А., Вег., 49, 1897 (1916); G и h а Р. С., S а л-
karan D. К-, ibid., 70, 1688 (1937).
2. D а у А. С., Raymond Р_, W h i t i n g AL C. procedure submitted to
Org. Syn. (1966).
3. F r a n c k N e и m a n n AL, Angew. Chem,, Internal. Ed., 7, 65 (1968).
95
ДИАЗОУКСУСНЫ Й ЭФИР (I, 249—252, перед ссылками).
Синтез фуранов. 1,4-Присоединение карбеиоидов к сопряженным
диенам наблюдается исключительно редко; однако было обнаружено
[11], что дифторкарбен (получаемый из натриевой соли дифторхлор-
уксусной кислоты) вступает в реакцию 1,4-присоедпнения к 17 |3-
ацетокси-2-метоксиметилен-5а-андростаг1ону-3 (1) с образованием
двух эпимеров (2) с общим выходом 70%. На основе этой реакции
Шторм и Спенсер [12] разработали удобный метод синтеза фуранов.
Вместо дифторкарбена они использовали карбэтоксикарбен, полу-
чаемый из Д. э. в присутствии сульфата меди (II). Реакция с 2-мето-
ксиметиленхолеста ионом [(1), с соответствующим изменением в
n2chco£c2hs
CuSO4
V
(3)
кольце D] осуществляется аналогичным образом, но со спонтанной
потерей молекулы метанола и образованием эфира фуранкарбоно-
вой кислоты (3). Этот продукт был превращен с количественным
выходом в соответствующий фуран гидролизом до кислоты п декар-
боксилированием при температуре плавления в присутствии мед-
ного порошка.
Спенсер и сотр. [13] использовали эту реакцию в качестве клю-
чевой стадии в синтезе рацемического метилового эфира винатикой-
евой кислоты (6), тетрациклического фураноидного дитерпена. Так,
обработка а-метоксиметиленкетона (4) Д. э. в присутствии сульфата
меди (II) при 160° приводит к эфиру дигидрофуранкарбоновой ки-
96
слоты (5) с выходом приблизительно 30%. Последний в результате
селективного гидролиза и декарбоксилирования дает рацемический
метиловый эфир впнатикойевой кислоты (6).
Реакция с триалкилборанами [14]. При взаимодействии Д. э.
с триалкилборанами наблюдается выделение азота и после гидроли-
за образуется гомологизированный этиловый эфир:
R3B4-N2CHCO2C2H5 п ~ N% RCHsCO2C2H5
2) Н2О
Например, из гексена-1 был получен этиловый эфир каприловой
кислоты с 83%-ным выходом.
Аналогичным образом реагирует диазоацетонитрил * [151 с
образованием гомологизированного нитрила:
R3B + N2CHCN rch2cn
И „Л
в * Внимстие\ Выделение этого диазосоединения иногда сопровождается взры-
4 Ле 1994
97
11. Hodge P. Edwards J. A., Fried J. FL, Tetrahedron Letters,
5175 (1966).
12. S t о г m D. L., Spencer T. A., Tetrahedron Leiters, 1865 (1967).
13. Spencer T. A., V i 1 1 a r i c a R. M., Storm D. L., Weaver T. D.,
Friarv R. J., Poster J., Shafer P. R., J. Am. Chem. Soc., 89,
5498 (1967).
14. H о о z J., Linke S., J. Am. Cliem. Soc., 90, 6891 (1968).
15. Curt i us T., Ber., 31, 2489 (1898).
ДИАЦЕТИЛА И ТРИМЕТИЛФОСФИТА АДДУКТ (2,2,2-триме-
токс и-4,5-диметил-1,3-диоксафосфо лен) (1). Мол. вес 210,17.
Получение. Реагент получают с 95%-ным выходом из свежеперег-
нанного диацетила (бутандиона-2,3) и триметилфосфита (III, 388):
СН3—С-0
сн3—с=о
%Р(ОСН,)3
/ОСН,
Р—ОСНз
осн3
Мол. вес 86,09, Мол. вес 124,08, Т. кин. 45 — 5370,2 — 0.5 мм
т. кип. 88° т. кип. 1И“
(III, З&й)
Реакция с альдегидами [11. С пропионовым альдегидом реагент
(1) образует диастереомерные 1,3-дпоксафосфолаиовые циклические
системы (2). Продукт гидролизуется водой в бензоле до эршпро-аф-
диоксикетона (3). Ср. Ill, 388.
сн3о^ о—с—сн3 1
сн3о-р^ 1! + с-
CH,oZ Хо-с-сн, 3
(1)
НгО, СбНб
45%
СН3О ..О Н
г 20% СНЭО-Р‘' HjC'C
ls --> l\ 1/1
§7% СН3ОХо______С C2HS
I
с=о
1
сн3
СН3 (2)
С=О
н3с-А-он
Н-А-ОН
I
сгн5
(3)
Реакция с хлорангидридами кислот [21. С хлор ангидридами
алифатических и ароматических кислот аддукт образует фосфаты
а-оксиф-дикетонов (1) с выходами от 70 до 90%. Считают, что при
этом происходит нуклеофильное замещение при углероде карбо-
нильной группы хлор ан гидр и да. Образующиеся эфиры легко гидро-
лизуются при кипячении в водном бензоле (12 час) с образованием
98
а-оксифэ-дикетонов.
(оснэ)3
сн3
С^1
и
о
СН3 СН3 СН3 о
С —С -б + (СН3О)гРОН
6 он о
-СЦ3С1
78%
СН, СН, сн3
I 3 I 3 I
СН3О-Р=О
осн3
60-70%
со
1 D,mirez F Pat war dhan A. V., Ram ana than N., De-
1‘ s a i N. B., Greco С. V., Heller S. R-, J. Am. Chem. Soc., 87, 543
2. Ramirez F., В li a t i a S. B., Bigler A. J., Smith C.P., J.
Org.Chem., 33, 1192 (1968).
1,3-ДИБЕНЗИЛ-2-МЕТИЛ-2 ФОСФАИМИДАЗОЛИДИН, (2).Мол.
вес 284,34, т. кип. 1357'0,04 мм.
Получение [1]. При взаимодействии метилднхлорфосфина с ди-
этиламином образуется бис-(диэтиламид) метилфосфонистой кислоты
(1), из которого обработкой ?4,Пл-дибензилэтилендиамином полу-
чают реагент (2).
N(C2H5)2
CH3PCI?j + 2(C2H5)2NH --> СН3Р<
66% 'N(C2HS)2
(1)
СН,—сн2
so% у
СНз
(2)
Синтез олефинов. Реагент применяют для стереоспецифического
синтеза олефинов из тритио- и тионкарбопатов. Реакция осуще-
ствляется в мягких условиях (30'), что выгодно отличает реагент от
триметилфосфита [2} (см. IV, 388 и Триметилфосфит в этом томе).
Например, из ццс-циклооктена был получен оптически активный
тр«нс-циклооктен (6) [3]. При добавлении к цис-циклооктену (3)
Дптпоциана (I, 379) получают транс-} ,2-дитиоцианциклооктан (4),
который при кипячении с 47 %-ной бромистоводородной кислотой
образует иминодитиокарбонат (5). Последний разделяют на опти-
ческие антиподы с помощью (—)-1 -фен и л этансульфо кислоты путем
13-кратной кристаллизации соли из бутанона-2. Затем (+)-(5)-
изомер под действием сероводорода превращают в тритиокарбонат
(6), который при обработке реагентом (2) дает /пронс-циклооктен
(7). Оптическая чистота продукта 96%. Альтернативный метод
состоит в применении тионкарбоната (см. в разделе бис-(диметил-
амид) метилфосфоновой кислоты в этом томе).
Нг.С*ч
ВЦ
68%
н‘/с Дн
н^с^сн2
(7)
(-)-Антипод (+) -Антипод
1. С о г е у Е. J., Gumbo С. С., unpublished.
2. Corey Е. J., Pure Appl. Chem., 14, 19 (1967),
3. Corey E, J., Shulman J. I., Tetrahedron Letters, 3655 (1968).
ДИБОРАН (I, 258—268).
Восстановление (I, 260, после выдержки из [9]).
Кетоксимы восстанавливаются Д. до гидроксиламинов, тогда
как ацетаты или тозилаты кетоксимов под действием Д. в ТГФ при
комнатной температуре дают амины с выходами 60—75% [9а I:
R2C-XO — COR R2CI-INHa
(I, 262, после выдержки из [15]). Амид (1) с удовлетворительным
выходом восстанавливается Д. до амина (2), под действием литий-
алюминийгидрида восстановить (1) не удалось [15а].
В2Н£-ТГФ
61,4%
(2)
100
Часто с помощью Д. удается избирательно восстановить амидную
группу в присутствии сложноэфирной группы [1561:
CH2C£HS
соосн3
снгс6н3
ВгН6
54% Л
(I, 262, после выдержки из [16].) Джексон [ 16а] обнаружил неко-
торые различия при восстановлении ароматических альдегидов и ке-
тонов, имеющих электронодонорные заместители, под действием
д полученным из трифторида бора и боргидрида натрия, при про-
пускании его в раствор карбонильного соединения, и Д., полу-
чаемым in situ в присутствии карбонильного соединения. Например,
СН3
I
хххосн3
ОСНз
в2нв
(внутр.)
(2)
СНО СН20Н
I I
ВД10 /Ду
(внсшн.)
ХХ ХОСН3 9 5 /0 "У" хосн3
ОСН3 ОСНз
(1) О)
альдегид (1) подвергается исчерпывающему восстановлению Д.,
полученным в реакционной среде; в противном случае (1) восстанав-
ливается только до спирта (3). Для исчерпывающего восстановления
карбонильной группы необходимо наличие электронодонорных за-
местителей в ароматическом ядре.
Восстановление N-метиламида (1) в (2) достигается при исполь-
зовании большого избытка Д,; при меньших количествах восстано-
вителя образуется соединение (3) [1661. Под действием ЫА1Н4
Н3СОХ x^/CHOHCONHCHa
I II
Уч 81%
сен5сн3о/ ^/ осн2с6н5
(1)
н3со^^ .ch2ch2nhch3
С6Н5СН2ОХХХ ХОСН2С6Н3
(2)
Н3СОХ z /СНОНСНгМНС^й
III
с6н5сн2оххххосн3с6н5
(3)
это восстановление не имеет места.
101
9а. П a s s n е г A,, Ca tsoul acos P., Chem. Comm., 1967, 590.
15a. Schuetz R. D., N illcs G. P., Titus R. L., J. Org. Chem., 33,
1556 (1968).
156. Kornel At J., Thio P. A., Tan S. I., J. Org. Chem., 33, 3637
(1968).
16га. В i s w а г К. M., H о u g h t о n L. E., Jackson A. H-, Tetrahed-
ron, 22 Suppl. 7, 261 (1966).
166. Daly J. AV., В e n i g !i i J., Minnis R., Kanaoka Y., W i t-
kop B., Biochemistry, 4, 2513 (1965).
ДИБОРАН — БОРА ТРИФТОРИД.
Восстановление эпоксидов [1]. При восстановлении дибораном
в присутствии трифторида бора окись стирола и сходные ар и л эпок-
сиды претерпевают легкое расщепление против правила Марков-
никова. Это относится только к арилэпоксидам; алифатические и
СбН5СН-СН2 НД.. С6Н5СН,СН,ОН
\0/ 98%
8 2%
алициклические эпоксиды восстанавливаются таким же образом
под действием смеси диборан — боргидрид натрия (см. в этом томе).
1. Brown Н. С., Yoon N, М., Chem. Comm., 1968, 1549.
ДИБОРАН — НАТРИЯ (ЛИТИЯ) БОРГИДРИД.
Восстановление эпоксидов. Взаимодействие диборана с эпок-
сидами происходит сложным образом. Так, для восстановления оки-
си бутена-1 необходимо 48 час, при этом получается смесь бутанола-2
и бутанола-1 (в соотношении 24 : 1) с выходом лишь 48%. Взаимо-
действие диборана с тризамещенными эпоксидами осуществляется
еще более сложно, и простые спирты образуются в ничтожных коли-
чествах. Браун и Юун [1] обнаружили, что при наличии следов бор-
гидрида натрия или лития значительно повышается скорость ре-
акции и направление ее изменяется таким образом, что раскрытие
эпоксидного цикла происходит преимущественно против правила
Мэрковникова. Например, главным продуктом восстановления
окиси 1-метилциклогексена является ^wc-2-метилциклогексанол:
ВгН6 —NaBH4
0°, 24 час
100%
’4% 26%
102
Окись 2-метилбутена-2 дает преимущественно З-метилбутанол-2:
СН3
, ВЛ-1С - Li'BH ,
СНР^СНСН3 °" 24 w':. ; (СН3)2С11С}-1С1-13-Ь(СН3)2ССН2СН3
\/ 96 % | |
о он он
75% 25%
Восстановление смешанным гидридом (А1Н3• 2А1С13) приводит к
сложной смесн с более низким общим выходом.
1. Brown Н. с., Yoon N. М., J. Am. Chem. Soc., 90, 2686 (1968).
], 3-ДИ БРОМ-5,5-Д ИМЕТИЛ ГИДА НТО И Н (Г 269, перед ссыл-
ками).
Под действием этого реагента, а также NBA осуществляется оки-
сление вторичных ароматических спиртов; в первом случае выходы
немного выше |3]. Д1й-Прегнены при обработке Д. превращаются в
дмиц-Прегнаднеиы [4]; выходы не указаны.
3. С о г г а 1 R. A., Orazi О. О., Chem. Comm., 1965, 5.
4. Fukuoka М., М i t s u h a s II i H., Chem. Pharrn. Bull., 15, 2007 (1967);
16, 1634 (1968),
ДИБРОМИЗОЦИАНУРОВАЯ КИСЛОТА (ДБИ), (1). Мол. вес
268,89, т. пл. 307—309°.
Реагент получают ]11 при взаимодействии дилитиевой соли циа-
нуровой кислоты с избытком брома; выход составляет 88%. ДБИ
в конц. серной кислоте является эффективным агентом для броми-
рования ароматических соединений, в том числе и дезактивирован-
ных [2]. Продукты бромирования получаются с большими выхода-
ми, чем при использовании смеси бром — железо или NBC в серной
кислоте.
I!
С
Вг. /\ Вг
Nz
Н
(I)
103
1. Got tar di W., Monatsh., 98, 507 (1967).
2. Gottardi \V., Monatsh., 99, 815 (1968),
ДИБРОМУКСУСНОЙ КИСЛОТЫ ЭТИЛОВЫЙ ЭФИР,
Вг2СНСО.,С2Нг,. Мол. вес 245,91, т. кип. 194°.
Реакция с борорганическими соединениями [11. Браун распро-
странил реакцию этилового эфира бромуксусной кислоты с триал-
килборапамн на Д. к. э. э. Если использовать 1 же mpetn-бутплата
калия, образуетсяа-галогенкарбоиовая кислота; при использовании
2 же основания осуществляется дпалкилирование. Поскольку пер-
вая реакция легко проходит при 0е, а вторая требует более высо-
кой температуры (50е), можно вводить две различные алкильные
группы.
СН2^СН, —> (С2Н5)уВ
Вг,СНСОгС,Нз
tn рет-В иО К
2 rnpem-BuOI< v Вг3СНСО2С2Н5
С3Н5СНВгСО2С2Нв
87%
(С3Н5)2СНСО2СйНб
69%
.Можно также использовать этиловый эфир дихлоруксусной кисло-
ты, но выходы продуктов при этом ниже, особенно в случае затруд-
ненных триалкилборанов.
1. Brown Н. С., R о g i б М. М., Rathke М. W.,
J. Am, Chem. See,, 90, 1911 (1968).
К a b а 1 k a G. W.,
2,6-ДИ-шре/п-БУТИЛПИРИДИН (I, 272).
Браун и Каннер [11 отмечали также, что реагент не образует
комплекса с SO3*.
ДИГИТОНИН, СяЦН72О29. Мол. вес 1229,30. Спекается при 225%
плавится при 234—236 , [cd^J—54“ (в метаноле). Растворимость
(при 25е): 1 г Д. растворяется в 57 мл абсолютного илн в 220 мл
95%-ного этанола. В воде малорастворим, образует мыльную сус-
пензию. В хлороформе и эфире практически нерастворим. Содер-
жится в семенах Digitalis purpurea и Digitalis lanata вместе с род-
ственными стероидными сапогенинами — гитонином и тпгонином и
некоторыми сердечными гликозидами.
Строение. В состав Д. входит необычный стероидный сапогенин
дигитогенин, который через Зр-гидроксильпую группу связан с пен-
* Этот факт позволил оценить влияние атома азота на способность ядра к ре-
акциям замещения. Д. сульфируется под действием SO3 в жидкой SO2 (—10е)
с образованием 2,6-ди-трет-бу тилп и р иди н-3-сульфо кислоты. Сравнительными
экспериментами показано, что дезактивирующее действие азота по отношению
к реакциям замещения сравнимо с эффектом нитрогруппы в нитробензоле. Дез-
активирующее влияние пиридиниевого азота еще больше — пиридин и 2,6-лути-
дин в тех же условиях образуют только комплексы с SO3 и не подвергаются реак-
циям замещения в ядро. — Прим. редг
104
д и гитонин
Д. имеет две свободные гидроксильные группы в агликоновом и пят-
надцать в углеводном остатке молекулы. Тщательные исследования
Чете и Вульфа 11] показывают, что этот гликозид имеет развет-
вленную структуру:
Осаждение Зр-оксистероидов. Как наиболее характерное свой-
ство Д. давно известна его гемолитическая активность, состоящая
в способности даже при высоком разбавлении осуществлять разруше-
ние оболочки эритроцитов. В 1901 г. Рансом [21 обнаружил, что при
добавлении холестерина к раствору Д. в 95%-ном этаноле его гемо-
литическая активность исчезает. В 1907 г. Виндасе [3] нашел при-
чину этого явления. Оказывается, холестерин образует с Д. молеку-
лярный комплекс 1:1, дигитонид, который практически нераство-
рим в 90—95%-ном этаноле. В живых тканях холестерин присут-
ствует как в свободном виде, так и в форме эфиров высших жирных
кислот; Виндаус показал, что сложные эфиры в отличие от свобод-
ного спирта не осаждаются Д. При исследовании различных сапо-
нинов он обнаружил, что общим растворителем для них и холесте-
105
рина является водный этанол. Из всех комплексов холестерина,
изученных как ранее, так и впоследствии, комплекс с Д. является
наименее растворимым и поэтому наиболее подходящим для осаж-
дения. Например, тигонин отличается от Д. только тем, что в нем
отсутствуют 2а- и 15а-гидроксильные группы; растворимость
тигонида холестерина в 95% -ном этаноле при 185 составляет
150 же/100 мл [4], тогда как растворимость дигитонида холестерина
достигает лишь 14 мг!/100 мл [5]. Д., содержащий 17 гидроксильных
групп, которые составляют около 24% его молекулярного веса, не-
растворим в эфире, умеренно растворим в абсолютном этаноле и
более растворим в водном этаноле (80—95%); последний раствори-
тель обычно и используется для осаждения днгитоиидов. Образо-
вание комплекса с холестерином наблюдается при разбавлении
1 : 10 000. Для макроопределения холестерина Виндаус [61 добав-
лял раствор Д. в горячем 90%-ном этаноле к раствору образца в
горячем 95%-ном этаноле до прекращения образования осадка,
через несколько часов он собирал и взвешивал промытый эфиром
дигнтонид. Как было показано, сложные эфиры холестерина не
образуют комплексов с Д., поэтому такой метод дает возможность
определять как свободный, так и этерифицированный холестерин
[6]. Осаждением Д. из одной порции тканевого экстракта устанавли-
вают содержание свободного холестерина; осаждением после омы-
ления определяют общее количество присутствующего холестерина.
Виндаус также открыл способ микроопределения холестерина [51: он
наблюдал, что дигитонид холестерина, подобно самому холестерину,
дает чрезвычайно чувствительную цветную реакцию Либерманна—
Бурхарда [7] при добавлении свежего раствора одной капли кони,
серной кислоты в 1 мл охлажденного уксусного ангидрида к раство-
ру стерина в хлороформе; окраска очень интенсивная, хотя появ-
ляется медленно. С полностью очищенным холестерином эта проба
отрицательна; с холестериланетатом и Д5-холестеном — положитель-
на. В развитых позднее микрометодах содержание холестерина при
осаждении Д. определяется колориметрически по изменению интен-
сивности окраски в реакции Либерманна — Бурхарда за подходя-
щий промежуток времени.
Виндаус и Уибриг [81 обнаружили заметную стереоспецифич-
ность реакций осаждения Д.: холестанол-Зр и копростанол-Зр
осаждаются практически количественно, тогда как холестанол-Зсс
106
копростанол-За вообще не осаждаются. Таким образом, для обра-
зования ограниченно растворимого дигитонида 3-гидроксильная
rnvnna должна быть в [3-области независимо от экваториальной или
аксиальной ориентации; атом С6 может иметь а- или р-конфигура-
цию либо в молекуле может присутствовать 5,6-двойная связь. Д.
оказался исключительно удобным для изучения изомеризации ста-
нолов'при нагревании с раствором тра/д-амилата натрия, получен-
ным при кипячении тоннам илового спирта с натрием в бензоле
или ксилоле. В положении равновесия холестанол с экваториальной
гидроксильной группой содержит только около 10% эпихолеста-
нола (аксиального), но этот компонент с минимальным содержанием
можно выделить нз фильтрата после осаждения Д. главного про-
дукта. Холестанол можно регенерировать из дигитонида; комплекс
растворяют' в пиридине, в котором он нацело диссоциирует, Д.
осаждают эфиром и эфирный раствор обрабатывают соответствую-
щим образом. В случае копростанола при равновесии преобладает
неосаждающийся экваториальный За-ол. В поисках способа превра-
щения холестанола в копростанол Виндаус обнаружил, что при
гидрировании его над никелем при 200° образуется"смесь холеста-
нол а, эпихолестанола и эпикопростанола. Он удалял холестанол
осаждением Д., остаток изомеризовал под действием алкоголята,
вновь удалял образовавшийся холестанол н получал неосаждаю-
щийся остаток, в значительной мере обогащенный эпикопростапо-
лом. В результате многократного повторения операции он получил
чистый эпикопростанол. Многократной изомеризацией с последую-
щим осаждением Д. это соединение превращается в копростанол,
идентичный продукту бактериального восстановления холестерина
в кишечнике.
107
В связи с высокой стоимостью Д. особое значение имеет эффек-
тивный метод расщепления дигитонида (I, 334; ссылка [2|)_ При
нагревании на кипящей водяной бане дигитопид растворяется в
Д1ЧСО и полностью диссоциирует, при охлаждении осаждается сте-
рол, который экстрагируют гексаном.
1. Tscliesche R., Wulff G., Tetrahedron, 19, 621 (1963).
2. R ansom R., Dent. med. Wochensr., 27, 194 (1901).
3. W indans A., Ber., 40, 2637 (1907).
4. Tscliesche R., Ber., 69, 1665 (1936).
5. W indans A., Ber., 42, 238 (1909).
6. Windaus A., Z. phvsiol., 65, 110 (1910).
7. L ieberni a n n C., Ber., 18, 1803 (1885); Burchard H., Innaugural
Dissertation, Rostock (1889); sec Chem. Zcntr., 61, 1, 25 (1890).
8. W i n d a и s A., U i b r i g C., Ber., 47, 2384 (1914).
ДИИЗОБУТИЛАЛЮМИНИЙГИДРИД II, 275—278, после (4) - >
(5)1.
Бэран [7a] восстанавливал 6-лактон (7a) до полуацеталя (76)
при перемешивании смеси в толуоле при —60°.
Другие реакции восстановления (I, 278, после выдержки из [11]).
Данные Захаркина и Хорлиной [11] по восстановлению сложных
эфиров до альдегидов были успешно использованы группой венгер-
ских исследователей [11а] в новом полном синтезе эметина. На за-
вершающей стадии было необходимо осуществить восстановление
сложного эфира (1) до соответствующего альдегида (2), протоэме-
тина. Применение разнообразных методов оказалось безуспешным, и
лишь под действием Д. в толуоле при —60= восстановление (1) -> (2)
было осуществлено с очень хорошим выходом.
Восстановление а, p-непредельного у-лакто на в фуран (I. 278,
перед ссылками). Эта реакция послужила конечной стадией в пол-
108
НОМ синтезе сесквитерпена (±)-линдестрена (2) [141.
(2)
Гидроалюминироваиие алкинов. Гидрид реагирует с алкинами
в углеводородных растворителях путем присоединен и я с обра-
зованием транс-ьъ нил аланов (1) из алкинов-1 и цис-вини л аланов из
щзамещеиных алкинов. При обработке винилалана метиллитием
в эфире (1:1) образуется ате-комплекс (2), карбонизация которого
приводит к а, (3-непредельным кислотам (3) с выходом 70—80% [15].
nr_ru (С,НВ),А1Н Н\ /АЦС.НОз СНЩ1
Rz ХН
(1)
СН3 q Н СО2Н
| СОЕ; Н30Т /С^С\
НД zA1*(C4H9)o Li+----------------> Rz хн
>С = С<
_ Rz ХН -I
(2) (3)
На стадии гидролиза изобутильная группа превращается в изобу-
тан. Следует отметить высокую стереоспецифичность этой реакции.
Ате-комплексы реагируют при комнатной температуре с дициа-
ном, давая стерически чистые сс, непредельные нитрилы. Напри-
мер, из гексина-1 был получен нитрил трпнс-Д3-гептеновой кислоты
с выходом 87% [16]:
с4нэх И
C4HSC = CH хС = Сф
Н/ ХА1(С4Н,)2
СНДл
С4Н н
(CN)S >с=с/
Li+------Н- ЧС = N
При взаимодействии с галогенами винилаланы дают винилгало-
гениды; в этом случае ате- комплексы не образуются. Из Пал кино в
получаются /нрпяовин ил галогениды, а из диза метенных алкинов —
^uc-винилгалогениды [17].
н\с=с/А,(СА)! л-ц Н\с=с/Вг
R'Z ЧН r/ \н
транс
7а. Baran J. S., J. Org. Chem., 30, 3564 (1965).
Ila. Szantay C.,T6ke L., Kolonits P., J. Org. Chem., 31, 1447 (1966).
109
13. Correct to read: in a to H., Nagasaki T., Chem. Ind., 1965, 899;
J. Chem. Sec., (C), 1966, 377.
14. M i ii a t о 11, Nagasaki T., J. Chem. Soc., (C), 1968, 621.
15. Z w e i f e I G., Steele R. B., J. Am. Chem. Soc., 89, 2754 (1967).
16. Zweifel G., Snow J. T., W li i t n e v С. C., J. Ain. Chem. Soc., 90,
7139 (1968).
17, Zweifel G., W h i t n e у С. C., J, Am. Chem. Soc., 89, 2753 (1967).
ДИИ30ПР0ПИЛПЕР0КСИДИКАРБ0НАТ (I, 280, [21). >-
давление-. подробное исследование см. в работе: Kurz М. Е., К о-
v а с i с Р. J. Am. Chem. Soc., 89, 4960 (1967).
ДИИМИД (I, 280—282, перед разделом Обзоры).
Под действием Д., получаемого из гидразина, /прсшс-двойная
связь в цис, транс-сопряжеьшых диен карбоновых кислотах восста-
навливается быстрее, чем цис-двойная связь [10а]. Из цис, транс-
сопряжениых диенолов, в которых гидроксил находится в «-поло-
жении по отношению к диеновой группировке, под действием Д.,
полученного из гидразингидрата, часто в значительных количе-
ствах образуются азотсодержащие соединения. Этого удается избе-
жать при использовании в качестве источника Д. калиевой соли
азодикарбоновой кислоты [1061.
При попытке получения соответствующих cww-норборненов Фран-
зус и сотр. ПОв] восстанавливали Д. норборнадиены, имеющие в
положеннн 7 кислородсодержащие функциональные группы. По-
скольку восстановление Д. проходит через цис-присоединение и за-
анти, син.
Главным Побочный
X = Н, ОСОСН3, ОС(СН3)3
висит от стерических факторов, заместитель в положении 7 должен
затруднять образование экзоцнклического переходного состояния
с спц-двойной связью. В действительности главным продуктом ре-
акции оказывается ин/??и-изомер, а сын-изомер, если и образуется,
то в незначительных количествах. Этот неожиданный результат
объясняют сильным координационным взаимодействием частично
положительной N—N-связи с атомом кислорода в положении 7.
10а. М i к о I a j с z а к К- L.t Bagby М. О., Bates R. В., Wolff 1. А.,
J. Org. Chem., 30, 2983 (1965).
105. Powell R. G., Smith C. R., Jr., Wolff I. A., J. Org. Chem.,
32, 1442 (1967).
10b. Baird \V. C,, Jr,, Franzus B., Surridge J. H., J. Am. Chem.
Soc., 89, 410 (1967).
110
ДИЛЬСА - АЛЬДЕРА РЕАКЦИЯ, РАСТВОРИТЕЛИ (I, 291 —
9ОД) Ссылка [61: F i е s е г L. F., Org. Syn., 46, 44 (1966).
rt-ДИМЕТИЛАМИНОБЕНЗАЛЬДЕГИД (I, 301—302, перед
ссылками).
Синтез альдегидов. С алкил- или арилмагниибромидами реагент
образует /z-диметиламинофенилкарбинолы (I), которые легко рас-
щепляются солями диазония с образованием альдегида (2) и азобен-
зола (3) [□!.
Лучше использовать диазотированную сульфаниловую кислоту
ОН
RCHOy-ArN — N—N(CH3)2
(2) ''ТзГ''
ввиду легкого отделения образующегося при этом метилоранжа (3)
(Ar---/i-HOi{SCeHd—). Эта реакция расщепления уже довольно давно
известна как способ получения производных азобензола. Однако
выходы обоих продуктов составляют 50—80%, поэтому метод при-
годен для превращения RBr-^RCHO.
5. S t i I е s М., S i s t I A. J., J. Org. Chem., 25, 1691 (1960).
4,4'-б'ис-(ДИМЕТИЛАМИНО)-БЕНЗОФЕНОН (кетон Михлера).
Мол. вес 268,36, т. пл. 174—176°.
(CH3)2N -/ >-N(CH3)3
Сенсибилизатор фотохимических реакций. Де Боер, Турро и
Хэммонд 11! нашлн, что кетон Михлера сенсибилизирует фотохими-
ческую димеризацию бутадиена в цис- и транс-\ ,2-дивинилцикло-
Ах/
СНг=СНСН-СНг----—2---->
Сенсибилиза-
тор
н
4—сн=снг
сн=снг
-ф-СН—СН2
Н
7 -8%
4— Н
СН=СНг
60-65%
бутаны. грс-Изомер подвергается термической перегруппировке в
более высококипящий циклооктадиен-1,5. Выбор сенсибилизатора
зависит от энергии сипглет-триплетнего перехода, эффективности
Интер комбинационной конверсии и спектра поглощения сенсибили-
затора.
111
I. DeBoer C. D., T u rro N. J., Hammond G. S., Org. Syn., 47, 64
(1967).
К-(4-ДИМЕТИЛАМИНО-3,5-ДИНИТРОФЕНИЛ) ИМИД МАЛЕ-
ИНОВОЙ КИСЛОТЫ. Мол. вес 306,23, т. пл. 177—181°. Получение
Ш.
Реакция с тиолами. Реагент избирательно взаимодействует
с сульфгидрильной группой аминокислот или белков с образованием
производных (2), которые либо окрашены, либо приобретают окра-
ску при обработке нингидрином. Например, в случае цистеина сульф-
гидрильная группа присоединяется к активированной двойной
связи и образуется желтый нейтральный продукт (2). Это соединение
дает пурпурное окрашивание с нингидрином и даже в нейтральной
среде перегруппировывается в карбоновую кислоту (3) III.
0 v n н + 02N\ Xch I 3 CH3x > . . HSCHj СНСОГ . Д-n/ 1 CH / X- / X II 3 o2nz /~сн (У OX 04 CH?. * >—x ДС-СНо 3N-Д 1 CH3-' >=/ ДС-СН-S oX cZ + xCHa <2t H3N—CH 1OH" XCO- 0 O3N4 ("’IT Ч ch>^=>-n/ X oX o=c/ zlh2 XN- CH
Н !
со.н
(3)
Из карбоксипептидазы бычьей поджелудочной железы Винтерс-
бергер выделил пептид, содержащий тиольную группу, свя-
занную с цинком. Он удалял цинк хелатирующим агентом (1,10-
фенантролипом) или денатурацией, затем метил реакционноспособ-
ную сульфгидрильную группу, обрабатывая Д. м. к., и определял
аминокислотную последовательность.
Другие примеры использования реагента для определения по-
следовательности аминокислот см. в 131.
1. W i t t с г Л., Т и р р у Н., Bicchim. Biophys. Acta, 45, 429 (1960).
2. Wintcrsberger E., Biochemistry, 4, 1533 (19G5).
112
Gold A. H., Segal H. L,, Biochemistry, 3, 778 (1964); 4, 1506 (1965);
Yamashita T, et al., J. Biochern., 55, 576 (1964); 57, 460 (1965); N a-
rita К. Akao M., ibid., 58, 507 (1965); Tsunoda J. N., Yasu-
nobu к' T., j- Biol. Chem., 241, 4610 (1966); Mctrione R. At, John-
ston R. B.,’ Seng R., Arch. Biochem., 122, 137 (1967).
/яе/ярая«с-(ДИМЕТИЛАМИНО)-ТИТАН, Ti[N(CH3).,]4. Мол. вес
225—20, оранжевая жидкость, т. кип. 5070,05 мм.
Д. получают с 85%-ным выходом реакцией четыреххлористого
титана с диметиламинлитием [11.
Применение. Кетоны, даже пространственно затрудненные,
под действием реагента превращаются в енамины, например [2]:
сн3
I
СН3С-СНСН3
II
о
сн3
I
СН3СН —С—СНСНз
1
сн3 о
сн3
I
СН,~-С—снсн3
1
N(CH3),
сн3
1
СН3С = С—снсн3
i I
СН3 N(CH3)2
ТЛЬЦСНДЩ
Т i[ N (СН 3) aj-i
Соответствующий триамид мышьяковистой кислоты As[N(CH3),]3
менее реакционноспособен и взаимодействует только с незатруд-
ненными кетонами. В противоположность этому под действием со-
ответствующих фосфорных аналогов образуются эпоксиды (см.
Гексаметилтриамнд фосфористой кислоты).
При взаимодействии Д. с карбоновыми кислотами или их про-
изводными (эфиры, амиды, ангидриды) образуется игр нс-(диметил-
ами но)-метан HC[N(CH3)31:} илн винил идеи-бис-ди метил амин в зави-
симости от строения исходного соединения [31.
1. В г a d 1 е у D. С., Thomas Т. AT, J. Chem. Soc., 1960, 3857.
2. Weingarten Н., White W. A., J. Org'. Chem., '31, 4041 (1966).
3. Weingarten H., W h i t e W. A., J. Org. Chem., 31, 2874 (1966).
ДИМЕТИЛАМИНОТРИМЕТИЛСТАННАН *, (CH3)3SnN(CH3)2.
Мол. вес 207,88, т. кип. 126°.
Получение [1].
(СгН,),0
(CH3)2NLi-P(CH3)3SnCl -(CH-)3SnN(CH3),
, 91%
* Реакцией Д. с избытком этилен в ми на (кипячение в течение 1,5 час) получен
К-этилениминотриметилстаннан, выход 60%, т. кип. 53—55" (16 мм). [Кос т я-
11 о В е к II й Р. Г., Прокофьев А. К, Изв. АН СССР (сер. хим.), № 2, 473
(1967),. Это соединение не удается получить при взаимодействии тримстилхлор-
станнана с этцлениминкалием, а также в условиях реакции дегидроконденсации,
которая гладко и с высокими выходами осуществляется при взаимодействии эти-
лен и мн па с гидридами кремния в присутствии каталитических количеств калия
1~яЯ — е т к 11 н Л- 7, Пс р ч е и к о В. И., Баталова А. Г., ДАН СССР,
loo, 660 (1964)]. В случае триэтплстаннана при этом образуется гсксаэтплдистаю
нац с выходом 5]?6.— Прим. ред.
113
Дегидрохлорирование [2] осуществляется при обработке реаген-
том в мягких условиях. Например, при реакции станнана с н-бутил-
хлоридом (I) получается смесь продуктов:
(CHa)3SnN(CH3)s
СН3СНаСНаСНаС1 —(CH3)3SnCl.HN(CH3)2 +
(I) 4 0°, 4 час
; I СН3СН = CHCH3 цис 5,2°/с, транс 88,5%
I, СН3СН2СН==СН.> 6,3%
Под действием реагента соединение (2) претерпевает превращение,
которое не удавалось осуществить даже при обработке 1,5-диазаби-
цикло-44,3,б J-ноненом-5:
S0- 100’
1гНС12[Р(С6Н5)3] -ГгС1[Р(СеН5у
2 час
(3)
1. Jones К., L а р р е г t М. F., J. Chem. Soc., 1965, 1944.
2. С а г d i п D. J., L а р р е г t М, F., Chem. Comm., 1967, 1034.
N, N-ДИМЕТИЛАНИЛИН (I, 303—305, перед ссылками).
Восстановительное дебромирование а-бром- и а,а-дибромкетонов
(8]. При кипячении с Д. на масляной бане (220') а-бром-п а, а-ди-
бромкетоны подвергаются восстановительному дебромированпю. Под
действием других аминов, в том числе триэтиламина, N-метпланили-
ыа и N, N-диэтнл анилин а, не удается получить заметных количеств
продуктов дегалогенирования. Примеры:
c6h5n(ch3)2
24 ча.с
76% *
Л - Бром -сОкамфора d~ Камфора
Вг
СОСНВгСН,
C6H5N(CH3)2
2 час к _
----5^----
СОСН2СНЭ
rf-rz-Диб’ромпролиофенон
C6H5N(CH3)2
10 час
п~ Иромпропиофенон
7-Бром-2,2-дифенилциклогептанон 2,2-Дифенил циклогептанон
8. Glumanini A. G., Chimia, 21, 464 (1937).
114
ДИМЕТИЛ АЦЕТАМИД (I, 305—306, перед ссылками).
Этерификация (эффект растворителя). В обзорной статье, посвя-
щенной применению апротонных растворителей, Паркер [41 при-
водит своп неопубликованные результаты и отмечает, что «многие
карбоновые кислоты можно этерифицировать действием избытка
подпетого метила и бикарбоната натрия в Д. при комнатной темпе-
ратуре. В этом случае продукты получаются более чистые, чем при
использовании диазометана или диметилсульфата». Альварец п Уатт
[51 использовали этот метод для этерификации большого количества
(872 г) биснорхолановой кислоты (1); при комнатной температуре
для завершения реакции требуется 48 час, выход почти количествен-
ный. В этом случае этерификация метанолом в присутствии 2% (по
весу) серной кислоты приводит к соответствующему эфиру лишь с
выходом 53,6%.
(1)
4. Р а г k е г A. J., Advan, Org. Chem., Methods and Results, 5, 37 (1965).
5. A 1 v a re z F. S., W aft A. N., J. Org. Chem., 33, 2143 (1968).
2Д-ДИМЕТИЛБУТИЛ-2-БОРАН (тексилборан) (I, 307—308, пе-
ред ссылками).
Синтез кетонов [2, 3]. Пространственно затрудненный моно-
алкилборан П) реагирует с олефинами в две стадии: на первой обра-
зуется тексилалкилборан (2), на второй — тексилдиалкилборан
(3); в реакцию можно вводить два различных олефина *. Далее про-
СН3СН3 СН3 СН3
! 1 снг=снк 1 1 /Н
НС —С —ВН2-------> НС — С — В< —>
I I I | Cl-HCHaR
СН3СН3 СНл сн3
* Исходя из диенов, получают циклические кетоны с общим выходом 46,75
11 65% соответственно [3].— Прим. ред.
115
СН3СН3
CH2--CHR' I i ,CH2CH2R co, h3o
-—----HC—C —By ......>
i I xCH,CH9R' ioo°
CH3CH3
(3)
CH3CH3 ch2ch3r
I I / Н,Ог
—* HC — C-B—С/ ——
| || | \ NaOAc
CH3CH3OH OH \ch2CH2R'
II
RCH,CH2CCH,CH2R'
(5)
водят карбонилирование (3) в диглиме при 100° в присутствии доста-
точного количества воды, чтобы предотвратить образование триал-
килкарбинола за счет миграции алкильной группы от бора к угле-
роду в (4); затем (4) окисляют перекисью водорода в щелочной среде
до кетона (5), как описано в разделе Углерода окись (см. этот том).
Следует отметить, что успех синтеза зависит от стадии карбонили-
рования: важно, чтобы не происходило конкурентной миграциитек-
сильной группы- наряду с другими алкильными заместителями. На
последней стадии тексильная группа выделяется в виде 2,3-диметил-
бутанола-2 (тексилового спирта).
.В эту реакцию можно вводить терминальные олефины или диза-
мещенные внутренние олефины. Выходы продуктов составляют от
50 до 80 % .
Примеры:
СН3
1
СН3С=СН,> + СН2 = СНСН2СО2С2Н5----> (СН3)2СНСН,ССН2СН,СН2СО2С2Н5
84% |]
о
СсН5СН^СН2 + СН.>=СН(СН2)вСО=>СН3 —
73%
С6Н5СН2СН2С(СН2)10СО2СН3
+ сн2--chch-.cn
aCCH2CH2CH2CN
II z 2
о
+ СН%-=СНСП2С1
СОСН2СН2С1
116
БрауН [4] использовал этот синтез для получения полицикличе-
ских кетонов с /?2рйнс-сочленением колец, в которых карбонильная
гоуппа находится в a-положении к узловому атому. Например, при
взаимодействии сопряженного диена (1) с тексилбораном (RBHa) в
ТГФ при 0s был получен тексилборациклон (2), который карбонили-
ровали при 70 атм и 503. Окисление до циклического кетона (3) вы-
полняется обычным способом — действием перекиси водорода в
присутствии ацетата натрия,
1) со, н2о
2) H2O2-NaOAc
60% (оЗ[ДИЙ)
(3)
Замечательной особенностью этого метода является стереоспецифич-
ность реакции, обеспечивающая получение шршщ-сочлененной
инданоновой и декалоновой системы Исходные диены получают
реакцией циклического кетона с винил- или аллилмагнийгалогени-
дами и последующей дегидратацией образующегося третичного
спирта.
2. Brown Н. С., Negishi E.,J. Am. Chem, Soc., 89, 5285 (1967).
3, Brown H. C., Pfaffenberger C. D., J. Am. Chem. Soc., 89, 5475
(1967).
4. В г о w n H. C., Negishi E., Chem. Comm., 1968, 594.
N, N-ДИМЕТИЛГИДРАЗИН (I, 308—309, перед ссылками).
Для получения гидразона ацетофенона по методу, разработан-
ному Ньюкомом и Фишелом 14, 4а], смесь 0,1 моля кетона, 0,3 моля
* Реакция имеет общий характер; аналогично получены транс-сочлененные
бициклические кетоны с общим выходом 71, 68 и 54% соответственно. См. обзор
по реакциям карбонилирования органоборанов, включающий подробное рассмот-
Ре’”!е механизма реакции [Brown N. С,, Accounts Chem. Res,, 2, № 3, 65
(1969)1. — Прим. ped.
117
Д., 25 мл абсолютного этанола и 1 мл уксусной кислоты (катализа-
тор) кипятят с обратным холодильником в течение 24 час, пока бес-
цветный раствор не станет ярко-желтым. Затем смесь 0,05 моля пе-
регнанного желтого масла, 0,2 моля безводного гидразина и 15 мл
абсолютного этанола кипятят с обратным холодильником до тех пор,
СН3
I
z ХО Ц- H2NN(CH3)2 + Абе. С.,Н5ОН + СНзСООН —>
М/
0,1 моля 0,3 моля 25 мл
Кипячение 24 час
94-9Ь%
1-0,2 моля HSNNH,
я 15 мл EtOH
Кипячение
97-99%
СН,
I
с\ /
2
пока реакционная смесь не обесцветится. Летучие вещества удаляют
на роторном испарителе при температуре колбы не выше 20°; бес-
цветный остаток после затвердевания представляет собой почти
чистый гидразон ацетофенона, т. пл. 24—253.
4а. N ewkome G. R., Fishel D. L., procedure submitted to Org. Syn.
(1967).
ДИМЕТИЛКАРБМЕТОКСИМЕТИЛФОСФОНАТ,
О
I!
(CH3O),PCH2CO2CH3. Мол. вес 182,11.
Реагент получают из три мети лфосфита и метилового эфира бром-
уксусной кислоты (подобно диэтил карбэтоксиметилфосфонату).
Синтез олефинов Ш (см. Диэтил карбэтокспметилфосфон ат, I,
430—431). Реагент был использован на двух ключевых стадиях син-
теза ювенильного гормона Hyalophora cecropia — диметилового
эфира транс, транс,цис-\ 0,11-эпокси-7-этил-3,11 -диметил-2,6-три-
декадиеновой кислоты (формула I) — при получении соединений
118
цис-ll и транс,цис-Nll.
СООСН3
о
I.) (СН30)гР-СН^-С00СН3
г) Перегонна________
' 17 %
(37% транс)
ULIAIH, И»
2)PBr3 52%
I (((/-смесь)
1. D a h in К, H., Trost В, M., R б I 1 с r H., J. Am. Chem. Soc., S9, 5292
(1967).
ДИМЕТИЛ КАРБОНАТ, (CHSO)2C=O. Мол. вес 90,08, т. пл.
2—4", т. кип. 90°.
Карбметоксилирование. На одной из стадий полного синтеза
d, /-кариофиллена Кори и сотр. [1] обрабатывали циклический
кетон (1), 7,7-диметилбицикло-[4, 2, 0]-октанон-2, в диоксане
гидридом натрия и Д. при 80—85° и получили с высоким выхо-
дом р-кетоэфир (2).
NaH,
(СН3О)2С"О.вдиаксанеНз С
86%
(2)
Эйзенбраун и сотр. [2], занимаясь синтезом непетовьгх кислот,
нашли, что рассматриваемый метод «является идеальным для карб-
метоксилнрования 3-метплциклогексанона». При этом выходы про-
119
дуктов оказались выше, чем в двустадийном процессе, заключаю-
щемся в конденсации кетона с диэтилоксалатом и последующем де-
карбоксилировании образующегося а, у-ди кетоэфир а.
1. Corey Е. J., Mitra R. В., Udo Н., J. Chem. Soc., 86, 485 (1964).
2. Eisenbraun Е, J., Hancl P. G., Schorno K. S., D i 1 g e n Sr.
St. F., Osiecki J., J. Org. Chem., 32, 3010 (1967).
ДИМЕТИЛМЕД ВЛИТИЙ (литийдиметилмедь), (CH3)2CuLi. Мол.
вес 100,55.
Получение [1, 2]. Реагент получают в эфирном растворе из
метнллптия и иоднда меди в молярном соотношении 2 : 1 в атмосфере
азота при 0°. Предполагают [2], что это растворимое в эфире соеди-
нение представляет собой соль Li+ (СНзКСнщ анион которой изо-
электронен диметилдинку.
Реакции. Д. является превосходным реагентом для селективного
замещения иода или брома на метильную группу в самых разно-
образных соединениях. Кори и Познер [21 приводят, в частности,
с л еду ющ и е примеры:
Г СН
/\/ (CH3)sCui,i /\/ 3
I II Г4 ипг I II
(СН3)гСиЫ
9б¥<7С, -15°
65%
С6Н5-С-Н (й3-шс.ию С6Щ-С-Н
я —i;
н — с — Br 8Р/0 н — С-СН3
Реагент с трудом присоединяется к кетогруппам [3]. Это было
использовано для осуществления 1,4-присоединсния к а, р-ненасы-
щенному кетону (I) [41; в реакции с метил магний поди дом в при-
120
сутствии каталитических количеств ацетата меди выход (2) состав-
ляет лишь 16—21%). В аналогичных условиях с помощью этого
реагента вводится ангулярная метильная группа в кетон (3) с обра-
зованием (+)-Д1]-эремофиленона-3 (4) [5], который не удавалось
получить, используя CH3MgI+ ацетат меди.
Кори [61 применил реагент для улучшения конечной стадии в
синтезе шраме,тря^с-фарнезола (6).
j || | (CH3);CuLi j || |
У \/X'fXCH2OH \ Ч'ААСНгОН
Н3С/ ЧСН3 { Н3(У хсн3
(5) (6)
С ацетатами этиннлкарбинолов Д. образует алкнлаллены [7].
Простые ацетилены в эту реакцию не вступают.
„ . С6Н5ч ,н
(СНзЫСнШ ~
слднс.-сн 38%— н/ Хсн^
ОАс
Кори и Познер [81 получили ди-м-бутилмедьлитий и диэтилмедь-
литий и использовали их в подобных реакциях. Эти реагенты более
реакционноспособны, чем Д., но менее термически устойчивы. Они
121
также в большей степени склонны к обмену медь — галоген, однако
эту побочную реакцию можно подавить добавлением к реакционной
смеси избытка алкилгалогенпда, соответствующего медьалкиль-
ному реагенту. Выходы продуктов составляют 60—80%.
(7)
При взаимодействии реагента (50%-ный избыток) с олефином (7)
при —10° в течение ночи был получен продукт (8) с выходом 33%
[91. Подобная реакция гем-дифторциклопропена (9) приводит к
диену (10) с 74%-ным выходом.
(9) (10)
1. Gilman Н., Jones R. G., Woods L. A., J. Org. Chem., 17, 1630
(1952),
2. Corey E. J., Posner G. H., J. Am. Chem, Soc., 89, 3911 (1967).
3. Marshall J. A., R о e b k e H., J. Org. Chem., 33, 840 (1968).
4. H о u s e H. O.> Respress AV. L., W h i t e s i d e s G. M., J. Org.
Chem., 31, 3128 (1966).
5. Piers E., Keziere R. J., Can. J. Chem., 47, 137 (1969).
6. С о г e у E. J., Katzenellenbogen J. A., Posner G. H.,
J. Am. Chem. Soc., 89, 4245 (1967).
7. R on a P., Crabbe P., J. Am. Chem. Soc., 90, 4733 (1968).
8. С о г e у E. J,, Posner G. H., J. Am. Chem. Soc., 90, 5615 (1968).
9. R on a P., Tokes L., Tremble J., Crabbe P., Chem. Comrn,, 1969,
43.
2,6-ДИМЕТИЛПИПЕРИДИН. Мол. вес 114,19, т. кип. Ill—
113с
Лоуренс и сотр. 11] описали новый метод выделения палюстри-
новой кислоты — одной из шести изомерных кислот, содержащихся
в канифоли. Эта кислота составляет около 10% кислотной части ка-
нифоли, которая при термической изомеризации образует равно-
весную смесь абиетиновой, неоабиетиновой и палюстриновой кислот.
122
Единственным известным ранее методом выделения палюстрино-
вой кислоты была распределительная хроматография. Новый метод
основан на осаждении 2,6-диметилпи-
перидиниевой соли смоляных кислот
из раствора сосновой живицы или ка-
нифоли в ацетоне и последующей дроб-
ной кристаллизации соли из смеси
метанол — ацетон (1 : 1). Выход чистой
па люстр и новой кислоты из живичной
канифоли составляет 4%. Для выде-
ления свободной кислоты 10 г соли
растворяют в 350 мл 95% -кого этанола
и при перемешивании добавляют 100
мл охлажденной Зн. НаРО}. Затем добавляют ледяную воду
до помутнения раствора, осаждающуюся кислоту промывают водой
и кристаллизуют из горячего 95%-ного этанола.
1 Jove N. М., Jr.,Loeblich V. М., Lawrence R. V., J. Org. Chem.,
30/654 (1965).
бас-( 1,2-ДИМЕТИЛ ПРОПИЛ- 1)-БОРАН («диизоамилборан»)
(I, 313—316).
Установлено, что это лучший реагент для восстановления сте-
роидного лактона (1) до соответствующего полуацеталя (2) (при-
меняют Д. в ТГФ) 171. Применение для этой цели Tpn-mpwz-
бутоксиалюминийгидрида улучшений не дает.
(!) (2)
7. К i е г s t е a d R. W., Faraone A., J. Org. Chem., 32, 704 (1967).
ДИМЕТИЛСУЛЬФИД, CH3SCH3. Мол. вес 62,13, г. кип. 37—
38', 1,4351.
Олефин типа (1) легко превратить в альдегид (3) озонированием в
метаноле до метоксигидроперекиси (2) и восстановлением (2) Д. (1]:
ZOCHS
СНэ(СН.р5СН = СН., %/// СНн(СН.,).,СН/
(Ц СН?ОН щ ХООН
—- СН3(СН.,)5СН (CH3)2S + сн3он
С)
128
Этот восстановительный агент имеет много достоинств. Он в высо-
кой степени избирателен: ни нитро-, ни карбонильная группы им не
восстанавливаются. Избыток реагента легко удаляется выпарива-
нием (т. кип. 37е). Бэйли и сотр. 121 показали, что при озонировании
нафталина (1) в метаноле образуется смесь перекисей (3) и (4), вос-
становление которых йодистым натрием в уксусной кислоте приво-
дит в основном к полуальдегиду фталевой кислоты. Однако при
восстановлении Д. с хорошим выходом получается фталевый альде-
гид (5).
1. Pappas J, J., Ke a ven е у W. Р,, G anc her Е., Berger М.,
Tetrahedron Letters, 4273 (1966),
2. Bailey Р. S., Bath S. S., Dobinson F., G a r c i a - S h a r p F. J.,
Johnson C. D., J. Org. Chem., 29, 697 (1964).
ДИМЕТИЛСУЛЬФОКСИД (ДМСО) (I, 319—335). Обзор [la].
Метод очистки по Стейнеру кратко описан в [16],
ЭФФЕКТЫ РАСТВОРИТЕЛЯ (I, 320)
Замещение [1,321, после формулы (3)]. Аралкилгалогениды
гладко реагируют с тиомочевпной в ДМСО с образованием сульф-
гидрильных производных [12а].
SH
Дегидрогалогенирование (I, 321, после выдержки из [13]). ДМСО
является эффективным растворителем для дегидрохлорирования
124
первичных алкилхлоридов (1). В- реакции-можно использовать эти-
(C6II5)3CCH.,CH2Cl-H4MCO + NaOC,H5
(1)
— - (СЙН5),ССН- СН
90 % 1 ”л{
(2)
лат натрия, однако едкий натр почти так же эффективен, если доба-
вить 10% воды [14а]. Последний метод удобнее и требует меньше
времени.
Миграция двойной связи (I, 323, после выдержки из 1201). Для
зашиты гидроксильных групп в углеводах' применяют способ, со-
стоящий в образовании аллиловых эфиров и изомеризации под дей-
ствием оснований до цис-пропен иловых эфиров, которые легко рас-
щепляются кислотой [20]. Более удобный метод [20а] состоит в
обработке винилового эфира хлорной ртутью в присутствии окиси
ртути (для поддержания нейтральной среды). Этот метод имеет
особенно большое значение в случае сахаров, содержащих замести-
тели, неустойчивые к действию кислот.
(СН3)3СОК
ROCHaCH =СН2 дмс—> ROCH=CHCH3
1-ЫС1щьцо ROH_L_OHCCHCH^HgC1) + HC1
Бензилирование углеводов (I, 325, перед разделом Гидролиз).
Углеводы бензилируются с высоким выходом бензил хлоридом в
ДМСО в присутствии оснований [30а], наиболее подходящими из
которых являются гидрид натрия, амид натрия и гидроокись нат-
рия или калия.
Гидролиз (I, 325). Гидролитическое расщепление лактонной
группы диметилового эфира зеароленона (1) не удается осуще-
ствить в обычных условиях омыления, однако в кипящем ДА\СО
оно происходит почти количественно, но с рацемизацией [31а].
В удобном методе циклизации по Дикману диэтилового эфира
адипиновой кислоты в 2-карбэтокснциклопентаноп [3161 к смеси
натрия и толуола при нагревании на масляной бане и интенсивном
перемешивании медленно добавляют сложный эфир (60—110 = ,
8 час'). Немецкие химики [31в] обнаружили, что если вместо толуо-
ла взять ДМСО, процесс заметно упрощается и улучшается: ре-
акционная смесь становится гомогенной, не требуется специальной
мешалки, облегчается выделение продукта и повышается выход.
125
Кроме того,при этом устраняются ограничения в величине загрузки.
.ССИСЛД (CH.,) J ( XCO.,C2H5 5 молей -Г Na ЩС.,Н,ОН + ДМСО 6,3 г-атом 2,5 л ло: 0 Д СО,С2Н5
62-50* СНа С
сн Дн”
Понд и Каргилл [31г| нашли, что ДМСО лучше, чем бензол и
толуол, для С-алкилирования 2-карбэтоксициклопснтанона в виде
енолята калия. Енолят натрия дает почти такой же высокий выход
продукта, как и калиевая соль, по время реакции в последнем случае
в три раза больше.
К-ДМСО; СН3(СН2)2СНгВг
5 vac
——>
82%
СО2С2Н5
сн2(сн2)2сн3
Сообщалось, что водным ДМСО является превосходным раство-
рителем для превращения олефинов в бромгидрины под действием
NEC [31д]. ДМСО рекомендуют использовать также для щелочного
гидролиза пространственно затрудненных эпоксидов [31е|.
О-Алкилирование тирозина без защиты аминогруппы можно
провести в ДМСО с 40—80%-ным выходом [31ж]. Аминокислоту
растворяют в смеси ДМСО и водной щелочи и обрабатывают алкпл-
галогенидом. Основной побочной реакцией является диалкилнро-
вание с образованием сложного эфира.
ДМСО — прекрасный растворитель-катализатор для триметил-
силилирования катехоламинов гексаметилдисилазаном [31з[. При
80° реакция обычно заканчивается за 5—10 мин. Затем реакцией с
различными алифатическими кетонами первичные аминогруппы
превращают в основания Шиффа, удобные для газовой хроматогра-
фии.
Декарбоксилирование. Хлоргидрат 4-пиридилуксусной кислоты
декарбоксилируется в Д/МСО при 30" 131и]. В нейтральном водном
растворе эта реакция осуществляется при кипячении с обратным хо-
лодильником [31 к].
la. Review: Martin D., W cise A., Niclas Angew. Chern., In-
ternal. Ed., 6, 318 (1967).
16. R i t c h i e C. D., Skinner G, A., В a d d i n g V- G., J, Am. Chem.
Soc., 89, 2069, note 31 (1967).
12a. Pan H.-L., Fletcher T. L., Chem. Ind,, 1968, 546.
14a, N orman R. О. C,, Thom as С. B., ,1. Chem. Soc., (C), 1967, 1115.
20. Add: Gigg J., Gigg R,,J. Chem. Soc., (C), 1966, 82.
20a. Gigg R., Warren C. D., Tetrahedron Letters, 1683 (1967).
30a. Iwashige T., S a e k i H., Chem. Pharm. Bull., 15, 1803 (1967).
126
Taub D., G iro tra N. Hof fsommer R, D., К ио C.H.,
J £' S ] a t e s H. L., W eber S., \V end ler L., Tetrahedron, 24, 2443
(1968).
316 Пи н к и и П„ «Синтезы органических препаратов», сб. 2, ИЛ, М., 1949,
стр. 29/.
QiB z п Р а 11 с i с В., Т г р 1 п J,, procedure submitted to Org. Syn. (1967).
31c Pond D. M., Cargill R. L., J. Org. Chem,, 32, 4064 (1967).
Ш DaHon D. R., Hendrickson J. B., J ones D., Chem. Comm.,
1966, 591.
31 £J< в a r t i G., Macchia B., Macchia F., Tetrahedron Letters, 3421
(1965).
31ж. Solar S. L., Schumaker R. R., J. Org. Chem., 31, 1996 (1966).
313. Kawai S., Tamura Z., Chem. Pharm. Bull., 15, 1493 (1967).
31 n. J u r c h G. K., Jr., Ramey К, C,, Chem. Comm., 1968, 1211.
31 к Doering \V. E., von., Pasternak V. Z., J. Am. Chem. Soc., 72,
' 143 (1950).
РЕАКЦИИ (I, 325- 334)
Дегидратация [I, 324, после формулы (5)]. 4,6-О-Бензилиден-о-
глюкоза, циклический ацеталь, введенный Зервасом [34а] в 1931 г.,
оказался ценным промежуточным соединением для синтеза разно-
образных углеводов. Ранее1 это соединение получали реакцией о-
глюкозы с бензальдегидом в присутствии суспендированного плав-
ленного хлористого цинка; выход не превышал 42% [346}. По новой
методике Боффи 13-Ib] межмолекулярная дегидратация проводится
в гомогенном растворе в ДМСО; время реакции сокращается, а
выход повышается. Раствор о-глюкозы в ДМСО добавляют по кап-
лям в течение 30 мин к перемешиваемой смеси бензальдегида, ДМСО
и эфирата трехфтористого бора. Смесь перемешивают при 65“ в те-
чение 2 час, бледно-желтый раствор промывают и нейтрализуют твер-
дым бикарбонатом натрия. Растворитель упаривают в вакууме, оста-
ток кристаллизуют из смеси ацетон — петролейный эфир и получают
чистый ацеталь, т. пл. 180^-181°.
Окисление (I, 327—333). В поисках удобного способа получения
нингидрина Шиппер и сотр. [35а] применили метод окисления Корн-
олюма к 2-броминдандиону-1,3 (1) и действительно получили нин-
гидрин (2) с выходом 36% . Бромпроизводное (1) было получено бро-
мированием пндандиона-1,3 бромной медью (II, 239). Впоследствии
было найдено, что бромирование диона в .ДМСО приводит непосред-
127
ственно к нингидрину. Поскольку для реакции не требовалось экви-
молярного количества брома, естественно было заключить, что бром
регенерируется при окислении ДМСО бромистого водорода, полу-
чающегося при бромировании. Была разработана методика, по кото-
рой раствор днона (0,2 моля), безводного бромистого водорода (0,04
моля) и ДМСО (0,8 моля) нагревают при 70—90° до тех нор, пока’из
реакционной смеси отгоняется диметил сульфид. Выход нингидрина
80—82%. Предполагается, что реакция осуществляется через сле-
дующие стадии:
CH3SCH, + 2 НВг
II 3
О
> CH3SCH3 + Н2о + Вг2
128
(I, 327, после выдержки из [36].) Вставка. Торсселл [36а] привел
доказательства в пользу механизма с первоначальной нуклеофиль-
ной атакой ДМСО и образованием диметилсульфониевой соли, при
распаде которой образуется карбонильное соединение:
^снх + OS(CH3)3
K's. ч. + I -
>^OrS(CH,)z X
R’Z J
R.
;c~o + s(ch3)z + hx
R’z
(I, 328, после первого абзаца («... и 2|3,3а-диола».) Коэн и Тсуд-
жи [391 нашли, что под действием ДМСО в присутствии каталити-
ческих количеств эфирата трехфтористого бора эпоксиды окисляются
до а-оксикетонов:
। |So + дмсо +
Юг 40мл
BF3-EtaO
0,12 МЛ
76%
Паровая баня,22уде
Этот метод был использован для окисления мети л эпокси сте-
арата до соответствующего ацилоина [39а]. В недавней работе
Тсуджи [396] сообщает, что превращение эпоксидов в а-оксикетоны
происходит с лучшим выходом при пропускании воздуха в раствор
эпоксида в ДМСО (без BF3). Таким путем окись стирола дает фена-
циловый спирт с выходом 92%. В отсутствие кислорода окисление
не происходит. По-видимому, окислителем является ДМСО. При
О
О-в, ДМСО II
СеН6СН-СНа ———^СеН5ССН3ОН
\о/ 92,4
окислении ДМСО/BFa кислород не требуется.
(I, 329, 15-я строка сверху.) Следует читать:
Холаиол-24—> Холаналь-24 (85%)
[См. М о f f a 11 J. G., Org. Syn., 47, 25 (1967)1.
Окисление по Пфитцнеру — Моффатту (I, 329, перед «Диэр
и др. [42]). Эксперименты с изотопной меткой Фенселау и Моффат-
ОДхИ-С-ИОД! + '(СНэ)гЗ=О СбНц^С-МНСйНд КСНгОН^
о
+S(CH3)2
(1)
о
C6HuNHCNHC6Hn 4 НСНгО5(СН3)г -^rch-o. —> X . CHSr,„
j (\s+ + CH3S.CHj
та [41а] показывают, что первым промежуточным соединением при
окислении является аддукт (1). Предполагается, что при взаимодей-
ствии (1) со спиртом образуется дициклогексилмочевина и алкок-
сисульфониевая соль (2), которая, теряя протон, дает диметилсуль-
фид и карбонильное соединение.
С соединениями, содержащими активную метиленовую группу,
реагент образует устойчивые сульфониевые илнды [4161. Типичным
примером является реакция с димедоном:
Юлпиолей
c6HnN=c=wc6Hn+ (СН3)г5О + Н3РО4
Джонс и Уитфилд [41в] использовали ДМСО в сочетании с ДЦК
и ПТ ФА (пиридиния трифтор ацетат, т. пл. 78", получается с коли-
чественным выходом при взаимодействии пиридина с трифторук-
сусной кислотой в сухом эфире) и нашли, что этот реагент пригоден
для окисления стероидных А5-3|3-спиртов в Ай-3-кетоны.
ДЦК лучше заменить на диэтилкарбодиимид, так как образующаяся
при этом диэтилмочевина растворима в воде |41 г|.
34а. Z е г v a s L., Вег., 64, 2289 (1931).
346. W о о d Н. В,, Diehl Н, \V., Pletcher Н, G,, J. Am. Chem. Soc.,
79, 1986 (1957).
34в. В о f f i С., procedure submitted to Org. Syn. (1967),
35a. Schipper E., Cinnamon M,, Rascher L,, Ch i ang Y. H.,
О г о s 11 n i k \V., Tetrahedron Letters, 6201 (1968).
36a. T о r s s e 1 1 K,, Chem. Scand., 21, 1 (1967).
39a, Brousse E., Lefort D., Com pt. rend., 261, 1990 (1965).
396. Ts u j i T., Tetrahedron Letters, 2413 (1966).
41a. F c n s e 1 a u A. H., Moffatt J. G., J. Am. Chem. Soc., 88, 1762 (1966).
41 б. С о о k A. F., Moffatt .1. G., J. Am. Chem. Soc., 90, 740 (1968).
41 в. J о n e s J. B., AV I g f 1 e I d D. C., Can. ,1. Chem., 44, 2517 (1966).
41r. Unpublished procedure of J ones G. H., M о f f a t t J, G., cited by C o-
o k A. F., Moffatt ,1. G., J. Am. Chem. Soc., 89, 2697 (see footnote 13)
(1967).
130
ДМСО—уксусный ангидрид (I, 330, после выдержки из [43]).
Ппбоайт и Голдман [43а] сообщили далее об окислении вторичных
шотов до кетонов с помощью ДМСО — Ас.О при комнатной темпе-
пяту ре В случаях иохимбина и стероидных вторичных спиртов
окисление, по-видимому, происходит быстрее, чем ацетилирование.
Особенно ценно, что метод пригоден в случае пространственно за-
трудненных спиртов. Предполагается следующий механизм реакции:
о^+/сн3
кгс s
н сн3
>RZC=O + [CH3)2S
Этот метод также находит применение в области углеводов [4361.
Под действием ДМСО — Лс2О ароматические ацилоины окисляются
с хорошим выходом до а-д и кетонов; в случае алифатических ацилои-
нов выходы ниже [43в|.
Основной продукт взаимодействия реагента с холестерином —
метилтиометиловый эфир [43г]. При взаимодействии с реагентом
Пфитцнера — Моффатта образуется А^холестенон [43г].
Линдберг и Слессор [43д] нашли успешное применение реагента
в химии углеводов. Конденсация аномерных п-ксилопиранозидов
(1) и (2) с фенилборной кислотой приводит к 2,4-фенилборатам (3)
и (4), содержащим только одну гидроксильную группу, которую
можно окислить. Однако по отношению к обычным окислительным
агентам защитная группа слишком чувствительна. Подходящим
реагентом в данном случае оказался ДМСО в сочетании с уксусным
ангидридом, окисление которым приводит к метил а- и [З-в-эритро-
пентапиранозидулозам-3 (5) и (6) с хорошим выходом.
Под действием реагента различные инозиты превращаются в пен-
таацетоксибензол, по-видимому, через дикетоинозиты [43е1. Вместо
уксусного ангидрида можно использовать бензойный ангидрид,
Р2О5 и полифосфорную кислоту, но выходы при этом снижаются
[43ж].
Этот реагент оказался единственным подходящим окислителем
132
для превращения (1) в хинон (2) [43з].
(2)
Хортон и Джуэл 143и1 исследовали эффективность различных
реагентов для окисления углеводов со свободной вторичной гидрок-
сильной группой в кетоны и пришли к выводу, что наиболее удовлет-
ворительным является ДМСО —АсйО. Этот окислительобладает
особым преимуществом при получении кетонов, неустойчивых к
воде, так как в отличие от других реагентов удалить его можно про-
стой лиофилизацией.
Под действием ДМСО в сочетании с уксусным ангидридом осу-
ществляется окислительная перегруппировка полипоровой кислоты
(3) в дилактои пульвиновой кислоты (4), который в очень чистом виде
выделяется непосредственно из реакционной смеси [43к].
о
(Л (4)
43а. Albright J. D., Goldman L., J. Am. Chem. Soc,, 89, 2416 (1967).
436. Sowa W., Th om as G, H. S,, Can. J. Chem., 44, 836 (1966).
43b. VanDyke M., Pritchard N. D,, J. Org. Chem., 32, 3204 (1967).
43г. I f z a 1 S. M., Wilson D. A., Tetrahedron Letters, 1577 (1967).
43д. Lindberg B., S 1 e s s о r K. N., Chem. Scand., 21, 910 (1967); Car-
bohydrate Res., 1, 492 (1966).
43e. F a t i a d i A. J., Chem. Comm., 1967, 441.
43ж. Albright J. D,, Goldman L., J. Am, Chem. Soc., 87, 4214 (1965).
43з. Newman M. S., David C. C.T J. Org, Chem., 32, 66 (1967).
43и. Horton D.T Jewell J.S., Carbohydrate Res., 2, 251 (1966),
43k. Moore H. W., Wikholm R, J., Tetrahedron Letters, 5049 (1968).
ДМСО — серы трехокись (I, 334, перед ссылками). ДМСО с трех-
окисью серы в виде комплекса с пиридином в присутствии триэтил-
амина эффективный реагент для окисления первичных и вто-
ричных спиртов соответственно до альдегидов и кетонов с хорошим
выходом 156]. Реакция обычно закапчивается за несколько минут,
после подкисления продукты осаждают водой. Под действием реа-
гента аллиловые спирты окисляются до сс, р-непредельных карбо-
133
нильных соединений. Одно из преимуществ этого реагента по срав.,
нению с ДМСО — ДЦК состоит в том, что не требуется такой сложной
очистки, как при образовании дициклогексилмочевины. Тесто-
стерон с 17|3-гидроксильной группой очень быстро окисляется ре-
агентом до А4-андростендиона-3,17; для окисления 17-эпимера тре-
буется 35 мин,
Изомеризация эпоксидов. Кеннер и Стенхаген [561 кратко от-
мечали, что эпоксиды можно изомеризовать с высоким выходом в
мягких условиях под действием йодистого метила и йодистого нат-
рия в ДМФА. В недавней работе, посвященной этой изомеризации,
Кеннер 1571 использовал иод истый н-про пил и иодистый натрин в
ДМСО (80°, 3 час). Типичными примерами изомеризации служат
превращения эпоксициклогексана в циклогексанон (выход 90%)
и окиси стирола в фенилацетальдегид (выход 85%). Поскольку такое
превращение практически не происходит в сульфолане, ацетонит-
риле и мети л эти л кетоне, Кеннер предполагает, что реакция вклю-
чает образование активированного производного ДМСО.
ДМСО- SO3- Ру-EtsN
3 5 тин
Эпи те сто стерон
55. Р а г i k h J. R., Docring W. Е., von, J. Am. Chem. Soc., 89, 5505,
(1967).
56. Kenner G. W., Slcnhage n E-, Chem. Scand., 18, 1551 (1964).
57. Bethall D., Kenner G. W,, Powers P. J., Chem. Connn., 1968, 227.
ДИМЕТИЛСУЛЬФОКСИДА ПРОИЗВОДНЫЕ, а) МЕТИЛСУЛЬ-
ФИНИЛМЕТИЛИДНАТРИЙ (димсилнатрий), [CH3S(O->CH3^
^CH3(S=O)—CHJNa+ (I, 336, перед выдержкой из [51).
Штеттер и Хессе [4а] описали метод превращения эфиров окси-
кислот, например (1), в оксиалкилметилкетоны (2). При нагревании
11О(сн2%со.,с,н3 -р c6H5so,cH.,MgBr -_
-C2H,OMgBr
(1)
AIHg
—> HO(CH.,)5COCH2SO2C6I-15 --у НО(СЫ.,)-СОСН3
йы /У
(2)
134
фира с фен и л сульфон ил метил магни йбромидом получают соответ-
стВу1Ощнйа-сульфонил кетон, который затем восстанавливают амаль-
гамой алюминия, как при восстановлении [5-кетосульфоксидов по
Кори и Чайковскому.
Чешские исследователи [46] обнаружили, что димсилнатрий или
димсиллитий (последний получают при нагревании гидрида лития с
РМСО в ТГФ в атмосфере аргона при 70—75°) при взаимодействии
с алкинами-1 в ДМСО или в смеси ДМСО — ТГФ образуют ацетиле-
ниды металлов с практически количественными выходами.
О О
II- II
СНД CHoNa 1 (Li + ) -ь RC ^СН — CH3SCH3 + RC = CNa(Li)
Подученные этим способом ацетилениды щелочных металлов были
использованы в следующих реакциях:
RC-CNa(Li)
RPSO
>RCssCRT +
RC^CR' +
NaX
R'NaSO4
ECsCCRP.
О Na (Li)
Метилирование. По данным Хакомори [4bJ гликозидные поли-
сахариды легко подвергаются исчерпывающему метилированию при
обработке димсилнатрием в ДМСО и затем иодистым метилом:
n2
ROH + CH3SOCH2Na + RO~ Na + Щ CH3SOCH3
|сн31
ROCl-ls+Nal
Вилкас и Ледерер [4г] применили эту методику для О- и N-ме-
тилирования природных гликопротеинов и считают, что она эффек-
тивнее метилирования по Куну. Метилирование является удобным
приемом при установлении строения пептидов методом масс-спект-
рометрии.
Получение реагента (I, 339, после выдержки из [11]). Метил-
сульфинилметилиднатрий, полученный по методике, разработанной
Кори ц Чайковским, разлагается медленно при 70° и быстро при
Ко . Сьёберг [Па] предлагает методику получения раствора реа-
гента, который после затвердевания при 10° можно хранить по
крайней мере два месяца. ДМСО обрабатывают 50%-ной суспензией
гидрида натрия в минеральном масле, затем при постоянном пере-
мешивании подвергают облучению ультразвуком (аппарат Лехфельд-
’3). При этом температура повышается до 50’’, образуется тонкая
суспензия, а затем прозрачный раствор. Ультразвук выключают и
135
раствор покрывают слоем минерального масла толщиной 1 см. Не-
обходимое количество реагента отбирают из раствора пипеткой.
Катализатор перегруппировки. Под действием реагента осуще-
ствляется исключительно орто-перегруппировка йодистого бензил-
триметил аммония в а-метилбензилдиметиламин [1161*
Декарбоксилирование — дегидратация. Маршалл и Фобл [Нв]
осуществили синтез бицикло-[3,3,1]-нонена-1 (3), «являющегося
наиболее ярким примером нарушения правила Бредта»*, через
мезилоксикислоту (1). При обработке этой кислоты димсилнатрием
в ДМСО при 60; в течение 38 час выделяется двуокись углерода, а
остаток, по хроматографическим данным, представляет собой
смесь лактона (2) (30%) и олефина (3) (15%).
Вайсман [11г1 одновременно описал получение олефина (3)
пиролизом четвертичной аммониевой соли (4).
Гасман и Ричмонд [ 11д] расширили границы метода синтеза
метилкетонов по Кори — Чайковскому (I, 335), показав, что про-
межуточный |3-кетосульфоксид можно моно- и диалкилировать с
* Энергия напряжения в бицикло-[3, 3,1]-нонене-1 составляет 12 ккал/моль
[Lesko Р. М., Tuner R. В., J. Am. Chem. Soc., 90, 6888 (1968)]. Из сравне-
ния с другими напряженными системами (щрсшс-цпклооктен 9,2 ккал/моль, цис-
ди-трет-бутилэтилен 9,3 ккал/моль и диметилциклопропен 20 ккал/моль) можно
предполагать, что (3) еще не является предельно малым «нарушителем» правила
Бредта. См., например, синтез системы бицикло-[4, 2, 1]-нонен-1-оиа-8 [Car-
ruthers W., Q u г е s h I М. L, Chem. Comm., 1969, 832; Wiseman J, R.,
H a k-F oon Chan, AholaC. J., J. Am. Chem. Soc., 91, 2812 (1969)].—
Прим. ped.
136
использованием гидрида натрия как основания в ДМСО или ДМФА.
0 0- о сн3 о- о
II I NaH-ДМСО || | | Al(Hg) I*
C6H5CCH3S+CH3 —~—-C6H5CCH-S+CH3 ——>С6Н5ССН3
Оку, Какихана и Харт [Не} описывают простой синтез 1, 2, 3,
4 5, 8-гексаметилнафталина (5), образующегося с высоким выходом
из гексаметил-2,4-пиклогексадиенона [\1) = (1а)1, который легко по-
лучить окислением гексаметилбензола, как было описано ранее
(III, 429—430). 3,6-Диметилдегидробензол (2), получающийся при
апротонном диазотировании 3,6-диметилаитрани левой кислоты, при-
соединяется к диенону (1а) с образованием промежуточной мостико-
вой циклической системы (3). Присоединение димсилнатрия к кар-
бонильной группе (3) и последующий осторожный пиролиз приводят
к 1, 2, 3, 4, 5, 8-гексаметилнафталину с высоким выходом. При бис-
хлорметилировании (5) и восстановлении образующегося при этом
продукта (6) литийалюминийгидридом гладко получается октаметил-
нафталин (7), т. пл. 18Г\
сн3 сн3
о
I ]| J + (CH3)2CCCH2SOCH3
сн3 сн3
(СН3)2СНСО2Н + ДМСО
(5)
^CH2Ci2 + катализатор
СН3 СН3
нз сн2 ci
н3 с AixMxyjAsC Н2с 1
сн3 сн3
О)
137
Использование димсилнатрия в ДМСО при получении илидов
фосфора особенно удобно в синтезе летучих углеводородов, которые
легко выделяются из этого высококипящего растворителя [Пж].
Японские исследователи fils! изучали метилирование ароматичес-
ких углеводородов димсилнатрием. Нафталин оказался недостаточно
реакционноспособным, однако фенантрен дает 9-метилфеиантрен с
выходом 86% ; из антрацена получена смесь 9-метилантрацена (77%)
и 9,10-диметил антрацен а (13%).
Синтез трицикло- [4,4,0,02,7]-декановой системы по Хиткоку
[Ни (а)]. Ключевым промежуточным соединением в этом синтезе
является кетон Виланда — Мишера (4) [11к1, который легко полу-
чается двухстадийным синтезом по следующей схеме [ 11л1:
Этот кетон в три стадии превращают в тозилоксикетон (5), который
затем циклизуют в (6) при обработке димсилнатрием с отщеплением
тозплата и образованием связи между углеродными атомами в поло-
жениях 1 и 5. Выход на стадии циклизации составляет 70%. Подоб-
ная циклизация была ключевой стадией в полном синтезе трици-
клического сесквитерпена (+)-копаена (7) [Пи (б)!.
Синтез глиоксалей. Микол и Расселл [Нм] получали димсилка-
лий реакцией ДМСО с /п/ж/п-бутилатом калия и использовали этот
138
реагент в общем синтезе глиоксалей. Типичным примером является
получение фенилглиоксаля. При взаимодействии реагента с этил-
бензоатом (Т) образуется соль (2), которая при кислом гидролизе
СеН5СО.2С,Н5+СН35ОСН2-К !' [CeH5COCHSOCH3]~K+
(1) (2)
ОН
НС1, HtO I Cu(OAc)t
CeH5COCHSCH3 C8I I5COCHO
/ U - b 1 %
(3) на (1) (4)
дает полумеркапталь фенилглиоксаля (.3). Окисление последнего
ацетатом меди приводит к фенидглиоксалю (4).
б) ДИМЕТИЛСУЛЬФОНИЙМЕТИЛИД, (CH3)2S-CH2 (I, 339,
дополнение).
Методика Кори. Коксон и сотр. [13а] обнаружили, что этот
реагент при взаимодействии с нопиноном [(6), нумерация этого
раздела] с высоким выходом образует 2р,10-эпоксипинаи (7). Вос-
становление этого эпоксида литийалюминийгидридом приводит к
10а-пиианолу-2|3 (5).
(СН3)гЗ=СН2
Трост [ 136] нашел, что при взаимодействии реагента с аценафти-
леном в ДМСО — ТГФ образуется смесь 3-метилаценафтнлена (71 %),
5-мети л аценафтилена (3%) и непрореагировавшего углеводорода
(10,5%).
139
Аналогично флуорантрен (4) образует смесь 24,7% 1-метилфлуо-
рантрена (5) и 5,3% 3-мети л производного (6).
При взаимодействии диметилсульфонийметилида с 3-кето-5а-сте-
роидами (например, с дигидротестостероном) преимущественная
атака осуществляется в a-область [13в]. Однако при использовании
диметил сульфоксон иймет ил ида единственным продуктом оказы-
вается изомер (3), образующийся в результате p-атаки. Аналогичные
результаты были получены с холестаноном-3.
(2)Главный продукт (3) Побочный продукт
Первый гетероциклический аналог бициклобутана, З-фенил-1-
азабицикло-[1, 1, 01-бутан (8), был получен с 60%-ным выходом
реакцией 3-фенил-2Н-азирина (7) с диметилсульфонийметллидом в
___ДН5
+ CHz=S(CH3)2
N
сухом ТГФ при —10е [13 г]. При взаимодействии (7) с трифеиилфос-
фонийметилидом, диазометаном или диметилсульфоксонийметили-
дом сколько-нибудь заметного количества (8) ие образуется. Соедн-
140
неиие (8) чрезвычайно чувствительно к действию кислот, но устой-
чиво по отношению к щелочам и боргидриду натрия *.
в) ДИМЕТИЛСУЛЬФОКСОНИЙМЕТИЛИД (I, 341—345).
Чистое вещество было выделено Шмидбауэром и Троничем [16а]
осторожной перегонкой в вакууме: т. кип. 41—4370,1 мм, т. пл.
9^10°.
(I, 344, перед ссылками.) В результате стереоспецифичной ре-
акции с этиловым эфиром /прднс-коричной кислоты образуется эти-
ловый эфир 2-феиилциклопропан-1-карбоновой кислоты с 98,9%-ным
содержанием т/кшс-изомера [25]. Из пространственно затруд-
О
с6н5 /Н
(CH4),s=CH24- 'С=С;
'СО2С21-15 31%
СвН5Х /Н
с-с7
н/\/\д
> сн3
ненных эфиров коричной кислоты продукт получается с более высо-
ким выходом. Взаимодействие реагента с транс- N, N-диметилами-
дом коричной кислоты также стереоспецифично.
Кори и Чайковский [26] подробно описывают получение реаген-
та из йодистого триметилсульфоксоиия и гидрида натрия в диметил-
сульфоксиде и его реакцию с циклогексаноном, приводящую к обра-
зованию окиси метиленциклогексана.
О о
(СН3)г5+-СН3(1~) + NaH -ДМ?0» (СН3)23-СНг + Nal + Н2
О
(CH3)2S“CH2 _ДМСО у
67-76%
О
ф
CH3-S-CHj
* Незамещенный и 3-алкил(К=СН3,СаН5)-1-азабицикло-[1,[,0]-бутаны по-
лучены также циклизацией по схеме:
R
I
Вг — CHz— С—СНгВг
NH: • НВг
[Funke N, Angew. Chem., 81, 35 (1969)].- /7рим. ped.
141
Ландор и Пунджа [271 обнаружили, Что выходы в реакции дй-
метилсульфоксонийметилида с а, |3-ненасыщенными эфирами повы-
шаются при замене ДМСО на ДМФА. Эта спонтанная, экзотермич-
ная реакция заканчивается за несколько минут. Изучая стереохи-
мию реакций диметилсульфоксонийметилида с с;, |3-ненасыщенными
кетонами, Агами [28] нашел, что в двух случаях пространствен-
ное строение циклопропанового производного остается таким же,
как и в исходном еноне:
Нч /С6НЙ(СН3) Н. /С6Н5(СН3)
>С = С< —> )С-С<
СсНгД/ Н СсН.С/х/^Н
II II сн.
Четвертичные основания (1) — производные эстрона и эстради-
ола под действием реагента в присутствии 2 экь щелочи образуют
аннелировянные производные фурана, например (2) [29]:
Диметилсульфоксонийметилпд не реагирует с обычными А4-3-
кетостероидами [30], но вступает в реакцию с некоторыми сопря-
женными стероидными кетонами, например с (3) [31].
С а-галогенкарбонильными соединениями реагент образует цик-
лопропаны [32]:
О R —СО
R —С=О I, I ZCH.,
I +3(CH3)2S^CH, —нг-cz i “ +
R'-CHX 1 хсн2
о
!|
+ 2(CH^SO + (CH3)3S+X-
Выходы составляют от 15 до 35%,
142
Примеры:
C6H5CCHBrC6Hs
о
сн2—сн2
С6Н5СО-С-С6Н5
Обычно в реакциях илидов с олефинами, приводящих к цикло-
пропанам, ил ид поставляет лишь одну метиленовую группу; в рас-
сматриваемом случае и л ид дает две метиленовые группы.
4а. Stetter Н., Hesse R., Monatsh., 98, 755 (1967).
46 К г i z J., Benes М. J., Pcs k a J., Tetrahedron Letters, 2881 (1965);
* Coll Czech., 32, 358 (1967).
4в. Hakomori S., J. Biochemistry, 55, 205 (1964).
4r. Vilkas E., Lederer E., Tetrahedron Letters, 3089 (1968).
Ila. Si 6b erg K., Tetrahedron Letters, 6383 (1966).
116. Klein К. P., Hauser C. R., J. Org. Chem., 31, 4276 (1966).
11в. M a r s h a 1 1 J. A., F a u b 1 H., J. Am. Chem. Soc., 89, 5965 (1967).
lir. W iseman J. R., J. Am. Chem. Soc., 89, 5966 (1967).
11 д. Gassman P. G., Richmond G. D., J. Org. Chem., 31, 2355 (1966).
lie. Oku A,,Kaklhana T., FI a г t H., J. Am. Chem. Soc., 89, 4554 (1967).
11». At к Inson J. G., Fisher M. H., Horlcy D., Morse A. T.,
Stuart R.S.,Synnes E., Can. J. Chem., 43, 1614 (1966).
Из. N о s a к i K., Y amamoto Y.,Noy ori R., Tetrahedron Letters, 1123
(1966).
Ни. (a)Heatlicock С. H., Tetrahedron Letters, 2043 (1966); (6) J. Am. Chem.
Soc., 88, 4110 (1966).
11k. Wieland P., M i e s c h e г К., Flelv. Chim. Acta, 33, 2215 (1950).
11л. Рамачалдран С,, Нью и е л М. С., «Синтезы органических препа-
ратов», изд-во «Мир», 1964, сб. 12, стр. 52—54.
11м. М i к о 1 G. J., Russell G. A., Org. Syn., 48, 109, (1968).
13а. С о х о n J.M.,Dansted Е., Hartshorn М.Р., Richards К- Е.,
Tetrahedron, 24, 1193 (1968).
136. Trost В. М., Tetrahedron Letters, 5761 (1966).
13в. С о о к С. E.,Corley R. С., W а 1 1 М. Е., J. Org. Chem., 33, 2789 (1968).
13i- Н о г t m a n A. G., Robertson D. A., J. Am. Chem. Soc. 89 5974
(1967).
16a. S c h m i d b a u r H., T г о n i c h W., Tetrahedron Letters, 5335 (1968).
2o. Kaiser С., T г о s t В. M., Benson G., Weinstock J., J. Org.
Chem., 30, 3972 (1965).
26* h a к о v s к у M., procedure submitted to Org. Syn.
27. Lan dor S. R., Punja N., J. Chem. Soc., (C), 1967, 2495.
on ,g<an11 C-> Conipt, rend., 264 (C), 1128 (1967).
29. Lehma n n H.-G., Tetrahedron Letters, 607 (1968).
Corey E. J., Chav ко vs к у M., J. Am. Chem. Soc., 87, 1353 (1965).
ш. К г a к owe r G. W., V an Dine H. A., J. Org. Chem., 31, 3467 (1966).
~ f ’ C a u d i a n о G., T i с о z z i C., U m a n i - R о n ch i A.,
letrahedron Letters, 4481 (1968).
143
ДИМЕТИЛСУЛЬФОН (I, 345, перед ссылками).
Хауз и Ларсон [3] при нагревании смеси Д., ДМСО и гидрида
натрия в 1,2-диметоксиэтане до 60° получили анион Д., который при
взаимодействии с лактоном (1) образует р-кетосульфон (2). Послед-
ний превращали, как показано на схеме, в лактон (5), который пред-
ставляет интерес как пример бицикло-[3,2,11-октановой системы с
гидроксильной группой в голове моста. Как промежуточный продукт
Р-кетосульфон (2) лучше, чем |3-кетосульфоксид, поскольку он более
устойчив и не имеет дополнительной асимметрии.
NaH + CH3SO2CH3, .
ДМСО, СН3ОСН2СН2ОСН3; НД
(2)
3. House Н. О., Larson J. К-, J- Org. Chem., 33, 61 (1968).
ДИМЕТИЛСУЛЬФОНИЙКАРБЭТОКСИМЕТИЛИД (ДСКМ).
Мол. вес 148,23, жидкость; 1,5253—1,5263.
Получение [1], Этот ил ид получают в две стадии:
Вг-
BrCH2COaC2H5 + (CH3)aS—7 (CH3)2S+CHaCO2CaH5
У и /о
KiCQs-NaQH {СНз)23 = СНСО2СзН5
95% (1) (ДСКМ.)
Реакции. При взаимодействии ДСКМ. с а,р-непредельными
альдегидами и кетонами в апротонных растворителях образуются
циклопропаны с выходами от 65 до 90% [1]. Реакция напоминает
перенос метиленовой группы диметилсульфоксонийметилидом. С <х,0-
непредельными сложными эфирами ДСКМ образует эфиры ацикли-
144
ческих многоосновных кислот [21.
45°; 2,5 час HCCOCHg
CI-ЦСЦ /\
СН2 =СНСОСН3 + (1) о/—Н2С —СНСОгС2Н5+ (CH3)3S
нссно
СН3СН=СНСНО-4-(1) H3C~C^bnCOaC2H5 + (CHB)aS
।
н
С ангидридами (а также хлорангидридами кислот, ацетиленовыми
сложными эфирами и кетонами) ДСКМ образует устойчивые илиды
серы, а с а-дикетонами — эпоксиэфиры [3].
О
11
(1) + (С6Н5СО).2О —у С2Н5О2СССС6Нб
72/о 1^
S(CH3)2
о о
II /\
(1)4-С6Н6СОСОСвН& —7 с6н6сс-~снсо2сан5
У /о j
с6н5
1. Payne G. В., J, Org. Chem,, 32, 3351 (1967); 33, 1285 (1968),
2. Payne G. В„ J. Org. Chem., 33, 1284 (1968),
3, Payne G. B., J. Org. Chem., 33, 3517 (1968).
S
ЩС.. [|
ДИМЕТИЛТИОКАРБАМОИЛХЛОРИД, >NCC1. Мол. вес
н3с/
12 3,62, т. кип. 90—9570,5 мм, т. пл. 42,5—43,5°.
Получение [1—3]. Реагент можно быстро получить, добавляя
при перемешивании 740 г хлора, растворенного в 3 л четыреххлори-
стого углерода, к кипящей суспензии 2400 г тетраметилтиурамди-
сульфида в 5 л четыреххлористого углерода. Затем удаляют при-
близительно половину растворителя, реакционную смесь охлаждают,
отфильтровывают от осадка серы, концентрируют и перегоняют.
Получают 1980 г (80%) Д.; т. кип. 65—6870,2 мм.
Фенолы->тиофенолы. Общий метод превращения фенолов в тио-
фенолы Ньюмен и Хетцель [1] проиллюстрировали следующим
примером. К раствору нафтола-2 и едкого кали при перемешивании
Добавляют Д. в ТГФ, поддерживая температуру 12°. По завершении
образования О-2-нафтилдиметилтиокарбамата (2) смесь подщелачи-
145
вают и экстрагируют тремя порциями бензола. Однократная кри-
сталлизация из метанола дает бесцветный продукт; его помещают
в колбу, снабженную диффузионной трубкой (II, 111 —112), и ииро-
лизуют при 275л Образующийся при этом продукт перегруппиров-
ки — S-2-нафтплдиметилтно карбамат (3) гидролизуют щелочью,
/х /ч - ОН
+ (CH3),NCSCI + кон
К А
(1) 0.3 моля 0,4 моля 0,3 моля
200 дгл НЮ-30 .мл ТГФ, 12°, крист.
76 — 83%
270-275° (N»)
45 мин
(3)
затем подкисляют и получают нафталинтиол-2 (4). В тридцати иссле-
дованных случаях [21 выходы на стадии перегруппировки состав-
ляли 95—100% . Производное эстрона перегруппировывается в суль-
фолане с выходом 95%.
1. Newman М. S,, Hetzel F. W., procedure submitted to Org, Syn. (1967).
2, N e w m а л M. S., Karnes H. A., J. Org. Chem., 31, 3980 (1966).
3. G о s h о г n R. H,, Le v is W, W., Jr., J a u 1 E., R i t t e r E. J.. Org.
Syn., Coll. Vol., 4, 307 (1963).
ДИМЕТИЛ ФОРМАМИД (ДМФА) (I, 346—351).
Очистка. Moy [Moe N. S., Chem. Scand., 21, 1389 (1967)]
получил этот растворитель высокой степени чистоты для поляро-
графических исследований: сначала ДМФА высушивали над моле-
кулярными ситами (Линде 4А), затем обрабатывали активной окисью
алюминия (Woelm, первая степень активности). Титрование по
Фишеру показывает, что содержание воды после такой обработки
не превышает 0,01%.
Эффекты растворителя (1,346, после выдержки из ссылки [14]).
При обработке диметилсульфатом и карбонатом калия в ДМФ/\
фенолы и карбоновые кислоты превращаются соответственно в про-
стые и сложные метиловые эфиры с высокими выходами. Таким
146
образом, оказывается Возможным избирательно этерифи пировать
карбонильную группу в присутствии фенольной гидроксильной
группы. По-видимому, Д1МФА не участвует в реакции, так как при
взаимодействии с диэтилсульфатом образуются только соответствую-
щие этиловые эфиры [14а],
(1, 351, перед ссылками.) Описываемое ниже применение реакции
Лейкарта — Валлаха оказалось лучшим методом превращения цик-
лических и незатрудненных ациклических кетонов в третичные
амины [241, Смесь циклооктанона, ДМФА и муравьиной кислоты
нагревают в автоклаве при 190". Водный раствор хлоргидрата амина
сн3
сн3
+ НСО2Н
190°
16 час
71-75%
О. сн,
1ST
хсн3 + сог
0,79 моля 175 г 1002
т.кип. 63-64'73 мм
экстрагируют эфиром для удаления циклооктанона и циклоокта -
иола (смесь 1 : 1, 21г).
N, 1^,-Диметиламиды карбоновых кислот можно получить в одну
стадию реакцией карбоновой кислоты с ДМФА в присутствий
0,5 моля пятнокиси фосфора. Предполагают, что промежуточным
соединением в этой реакции является соответствующий ангидрид
кислоты [25]. До этого N, N-диметиламиды получали из ангидри-
дов или хлорангидридов кислот и диметиламина.
14а. Р a i 1 с г М., В е г g t h а 1 1 е г Р., Monatsh., 99, 103 (19G8).
24. Bach R. D., .1. Org. Chem., 33, 1647 (1968); Co p e А. С., В a ch R. D.,
procedure submitted to Org. Syn. (1967).
25, Schindlbauer H., Monatsh., 99, 1799 (1968).
ДИМЕТИЛФОРМАМИДА ДИЭТИЛАЦЕТАЛЬ (I, 351—352).
Конденсация с соединениями, имеющими активную метиленовую
группу. Одна из стадий полного синтеза природного фульвена —
фульвоплумиерина — заключается в конденсации смеси изомерных
диолов (1) с диметилацеталем ДМФА [1а].
Н0\ /\ /CO..CH3 Ич /Ох /СОХНз
но/ч 1 (CH5),NCH (OCI-I3)o zC' 1 |j ZL " (CH3).2XT/ ^O/\/\ /\N (CH3R ^XCHCO.,CH3 ) CO.CH, (!) (2)
1 а. в Li с h i G., Carlson J. A., J. Am, Chem. Soc., 90, 5336 (1968).
147
ДИМЕТИЛФОРМАМИД - ДИМЕТИЛСУЛЬФАТ (I, 353, перед
ссылками),
Методика получения 6-диметиламинофульвена подробно описана
Хафнером и сотр. [3],
3. Н a f п е г К,, V б р е 1 К. Н,, Р 1 о s s G., К б n i g С., Org, Syn., 47, 52
(1967),
ДИМЕТИЛФОРМАМИД — ХЛОРОКИСЬ ФОСФОРА (I, 359,
после выдержки из [71).
Комплекс (полученный предварительно) взаимодействует с 2-
метиламино-3-метилпиразином (1), образуя иммониевую соль (2),
которая при гидролизе дает 1-метил-4,7-диазаиндол-З-альдегид (3)
[7а]:
сн3
РОСЦ-ДМФА
(О
7а. К 1 u t с h к о S., Н a n s е n Н. V-, Meltzer R. I., J. Org. Chem.,
30, 3454 (1965).
3,5-ДИМЕТИЛ-4-ХЛ0РМЕТИЛИ30КСА30Л (I, 361, перед ссыл-
ками).
Более полное рассмотрение синтеза ненасыщенных трицикли-
ческих дикетонов Шторк приводит в работе 1967 г. [3]. В следую-
щем сообщении [4] обсуждается механизм аннелирования изокса-
золом.
Японские исследователи совместно со Сторком [5] применили
эту реакцию для получения пиридинов. Алкилирование реагентом
такого кетона, как ацетил ацетон, дает продукт (1), который при
каталитическом гидрировании над палладированным углем в при-
сутствии триэтиламина превращается в дигидропиридин (3). Обра-
ботка последнего нитритом натрия в соляной кислоте приводит к за-
148
метенному пиридину (4).
NaNO2
НС1
СН3ОС
HSC
(4)
Метод аннелирования изоксазолом был также использован в сте-
реоспецифическом синтезе d,l-о-гомотестостерон а (5), который
далее превращали в d,/-прогестерон 16].
3. Stork G., Danishefsky S., О h a s h i M., J, Am. Chem. Soc., 89,
5459 (1967).
4. Stork G., M cMurry J. E., J. Am. Chem. Soc., 89, 5463 (1967).
5. О h a s h i M-, К a m a c h i H.,Kak isawa H., S t о r k G., J. Am. Chem.
Soc., 89, 5460 (1967).
6- Stork G., McMurry J. E., J. Am. Chem. Soc., 89, 5464 (1967).
3,5-ДИМЕТОКСИБЕНЗИЛ-л-НИТРОФЕНИЛ КАРБОНАТ (1).
Мол. вес 333,29, т. пл. 114—115°.
Получение [1]. Реагент получают реакцией 3,5-диметоксибензой-
ной кислоты с алюмогидридом лития и ацилированием образую-
149
щегося при этом 3,5-диметоксибенз илового спирта /г-н итр офени ло-
вим эфиром хлоругольной кислоты.
СН.,0. сн3оч
___ тгф X__
//___СОиН : <щ___________S- сн2он >
z---z 74%
си3О' сн3о/
CII3O о
„-o.Nc.H.ocoa %—Ч-сн.,о-с-о~/—’Ч-ко,
61% ’Z^=z
CI4;iO/ (i)
Пептидный синтез, защита аминогруппы [1]. Реагент взаимо-
действует с аминокислотами в водном ТГФ в присутствии едкого
натра с образованием 3,5-диметоксибенз ил оксикар бон ильных про-
изводных с выходами 55—75%. Ниже приведен пример реакции с
ь-серином; [alDp-13,5'. Удаление защитной группы осуществ-
СН,ОЧ О
НОСН.СНСО.Н >--. z---s
% “ -I- у X~CHr,O—С-О-У X-NOa—*
\H2 .
L-Серин, [cz]p + 13,5“ CH3O'
HOCILCHCCU'I
NH 0CHb
NaOH | __/ hx>
Воды. ТГФ О—С—ОСН,—У Води, диоксан
[<z|D 4-1 5,0° •=/
осн,
ОСНз
НОСНХНСОоН /._Г
—> Г ” -4-НОСНа—Х> +СО2
NH.,
[(Z]D + 1 3.5° ОСН.,
ляется без применения кислоты, основания или восстановительного
расщепления — при простом облучении ртутной лампой высокого
давления в водном дпоксане в течение 1,5 кис выход 42—85%.
Этот метод особенно ценен благодаря нейтральным условиям отщеп-
ления защитной группы. Следует отметить, что при УФ-облучении
в тех же условиях расщепление карбобензоксипроизводных проис-
ходит лишь с очень низким выходом.
1. Chamberlin J. W., J. Org. Chem., 31, 1658 (1966).
2,5-ДИМЕТОКСИТЕТРАГИДРОФУРАН сн3о^хо/Чосй3
Мол. вес 132,16, т. кип, 144— 146е1.
150
Реагент получают каталитическим гидрированием 2,5-диметокси-
2,5-Дпгидрофурана [11.
Синтез пирролов. Клаусои-Кааз и Тайл [2] разработали эффек-
тивный одностадийный метод получения N-замещенных пирролов.
Например, конденсация Д. с метиловым эфиром антраниловой кис-
лоты в кипящей уксусной кислоте приводит к Г4-(2-карбметокси-
фенил)-пиррол у [31.
Кипячение
сн3согн
70-80%
1 F a k s t о г р J., R а 1 е i g h D., S с h n i е р р L. E., J. Am. Chem. Soc.,
' 72, 869 (1950).
9 Clauson-Kaas N., T v 1 c Z., Chem. Scand., 6, 667, 867 (1952).
£ Josey A. D., Org. Syn., 47, 81 (1967).
5,5-ДИМЕТОКСИ-1,2,3,4-ТЕТРАХЛОРЦИКЛОПЕНТАДИЕН
(1,363—364, перед ссылками).
На первой стадии синтеза 4-хлор бицикл о-[2,2,01-гексан-1-кар-
боновой кислоты (5) Шерер [41 осуществил присоединение по Диль-
су — Альдеру этого реагента к этилену. Эта реакция Дильса —
Альдера была также осуществлена практически с тем же выходом
Гассманом и Маршаллом [51. При восстановлении ненасыщенного
осн3
осн3
H,-Pd-C, (СгНй)3Н
93% *
(3)
ТГФ-NaOH
HC1
92, 6%
СО2Н
С1
(5)
тетрахлорида (2) в этаноле в присутствии избытка триэтил амина
происходит насыщение двойной связи и гидрогенолиз двух атомов
хлора с образованием насыщенного дихлорида (3), Затем кетальную
151
группу гидролизуют 96%-ной серной кислотой в хлористом метилене
при комнатной температуре и образующийся продукт (4) обраба-
тывают основанием для осуществления перегруппировки Фавор-
ского в (5), Этот синтез представляет значительный интерес, по-
скольку ранее известный фотохимический способ построения бици-
кло- [2,2,01-гексановой системы не позволял получить производ-
ные с функциональными группами в голове моста.
Шерер [6] отмечает, что восстановление (2) в (3) «не так просто,
как кажется». Другие исследователи повторили эту реакциюс удов-
летворительными результатами, но один из авторов утверждает, что
ингредиенты следует смешивать в определенном порядке: субстрат,
катализатор, этанол, триэтиламин. В более поздней работе Шерер
[7] описывает подробности эксперимента и отмечает, что большое
значение имеет чистота (2) и что обычно (всегда?) он добавлял амин
в последнюю очередь и восстановление всегда проходило удачно.
4. Scherer К. V., Jr., Tetrahedron Letters, 5685 (1966).
5. Org. Syn., 48, 68 (1968).
6. S c h e г e г К.. V., Jr., private communication.
7, Dauben W. G., C h i t wo о d J. L., Scherer К. V., Jr., J. Am. Chem.
Soc., 90, 1014 (1968).
1,1- ДИМЕТОКСИЭТАН, см. Уксусного альдегида диметил аце-
таль (в этом томе).
1,2- ДИМЕТОКСИЭТАН («глим») (I, 365—366, перед ссылками).
Хауз 110], проводивший систематическое исследование енолят-
анионов, выбрал этот растворитель, так как в нем для большинства
енолят-анионов достигается приблизительно 1 44 концентрация.
Кроме того, глим относительно летуч, легко отделяется от продукта,
не имеет достаточно кислых атомов водорода, которые могли бы
обмениваться с енолят-ан ионам и, и за счет сольватирования повы-
шает реакционную способность анионов.
В этом растворителе восстановление коричного спирта алюмогид-
ридом лития происходит в 13—47 раз быстрее, чем в эфире [11] и
даже в ТГФ.
Обзор [121.
10. House Н. О., Rec. Chem. Progress, 28, 99 (1967).
11. J о г g е п s о n М. J., Т h а с h е г A. F., Chem. Comm., 1968, 973.
12. Aga mi C., Bull. soc. chim. France, 1968, 1205.
ДИНАТРИЙАЦЕТИЛЕНИД.
При взаимодействии смеси моно- и динатрийацетиленидов с
а, и-дибромидом (1) образуется несопряженный линейный поли-
152
ацетилен (2) * и циклический полиацетилен (3) [1]. Результаты улуч-
шаются при проведении реакции в автоклаве при комнатной тем-
пературе [2].
NaC^CH
Вг (СНг)„Вг4- —> ИС С [(СН2)„ С = С1Л.1-1 +
NaC =. СМа
(1) (2)
—С^С-(СНДг-—-
-Н
—[(СН2)„—С^С]Х--
(3)
1. Wot iz J. Н., Adams R. F., Parsons C. G,, J. Am. Chem. Soc., 83,
373 (1961).
2. Hubert A. J., D a 1 e J., Chem. Ind., 1961, 1224; Hubert A. J., J.
Chem. Soc., (C), 1967, 2149.
ДИНАТРИЙФЕНАНТРЕН (CnHT 0Naa) (I, 366, перед ссылками).
Вицинальный дихлорид (1), являющийся аддуктом дегидробен-
зола и ^ис-ЗД-дихлорциклобутена, успешно дехлорируется Д. до
соединения (2) с 27%-ным выходом [2]. Под действием других реа-
гентов получается смесь тетралина и 1,4-дигидронафталина. Бенз-
* На основе подобных три ацетиленов получен новый класс, соединений кле-
точного типа:
НС[(СН2)п С = СН'3
Н и b о г t A. J., Hubert jM., Tetrahedron Letters, A"s 46, 5779 (1966).— Прим.
153
бицикло-[2,2,0]-гексадиен-2,5 (2) можно назвать «полудьюаров-
ским нафталином». Подобное дегалогенирование виц-дигалогенидов
до замещенных производных циклобутена было выполнено с приме-
нением пафталипнатрия [3].
2. McDonald R. М., F г i с к с у D. G., J. Am. Chem. Soc., 90, 5315 (1968).
3. Seoul en G. G.jBarton F. E., Jr., Burgess .1. R., Story P. R.,
Gar st J. F., Chem. Comm., 1969, 78.
2,4-ДИНИТРОФЕНИЛ ГИДРАЗИН (I, 371—372).
Карбонильные соединения (после ссылки 15]). Мак^Марри [5а]
исследовал избирательное восстановление олефиновой связи в при-
сутствии кетогруппы под действием диборана. Это удалось успешно
осуществить путем превращения соединения в ди нитрофен ил гидра-
зон, гидроборирования и удаления защитной группы озонолизом в
этилацетате при —78 Оксим и ацетаты оксимов восстанавливаются
ВН:!; при попытке защиты кетализацией в этом случае наблюдается
миграция двойной связи.
5а. McMurray J. Е,, Chem, Comm., 1968, 433; J. Am. Chem. Soc., 90, 6821
(1968).
4,4 -ДИ НИТРОДИ ФЕН И ЛИМИНО КСИЛ, (н-ПО,С(!НД,ПО.Мол.
вес 142,18, т. пл, 109°.
Д. получается при обработке 4,4'-динитродифенилгндроксил-
амина двуокисью азота [1|.
Окисление фенолов до хинонов. Форрестер и Томпсон [21 отме-
чали, что применение ими в окси л дисульфопата калия — неоргани-
ческого радикала —для окисления фенолов, аминов и гидрохино-
нов до хинонов ограничено из-за его нерастворимости в органи-
ческих растворителях. Они решили заменить его устойчивыми орга-
ническими иминокс ильными радикалами и нашли, что из четырех
исследованных радикалов лучшим является Д *.
NH2 О
I zch3 Д .сн3
j )/ г 2-0-N (ЯОЩ;, ф У
I 96%
Х-/Ч'ОСН3 • ' OCIP.
о
он о
H3C^Jx Z.CH3 Н3СХ 7^/СНз
* О химии и применении органических имипоксидьных радикалов см, моно-
графию Роза нцев Э. Г., Свободные иминоксильные радикалы, изд-во «Хи-
154
r Wieland H., I? о t II K-, Ber., 53, 210 (1920).
2’ For res 1 с r A. R., T h 0 m p son R. H., J . Chem. Soc., (C), 1966, 1844.
^с-(2т4-ДИНИТРОФЕНИЛ)-КАРБОНАТ (I, 372—373, перед
ссыпками).
Ганте [2] использовал этот реагент для синтеза пептидов и аза-
пептидов.
2. Gante .1., Chem. Ber., 99, 1576 (1966).
ДИ-л-НИТРОФЕНИЛСУЛЬФИТ, (n-NO2C(iH4—O)2S = O. Мол.
вес 226,33, т. пл. 104—106°.
Получение Ш. Д. получают реакцией n-нитрофенола со свеже-
псрегнанпым хлористым тионилом в присутствии триэтиламина в
эфире при 0°.
О
у— ч I1 Z--X
O2N-< Ч- OH^Ci-S — С1 + НО-/ M_no2-^
--/ \z==/
Эфир (0е); перекристал-
лизация (2 раза)
50-60%
О
O.,N S—0-2^___Ч_ no.
Пептидный синтез [2|. С N-защищеиными аминокислотами Д.
образует активные n-нитрофениловые эфиры, которые можно ис-
пользовать для образования связи с другими звеньями. Осложнения,
возникающие иногда из-за частичной рацемизации дипептида,
устраняются, когда в качестве терминальной группы используется
лейцин [31 или пролин [41, а также глицин. Д. применяют для
мия», М., 1970, в которой приведены подробные методики синтеза многих ради-
калов и промежуточных продуктов.
Исключительный интерес для решения структурных и стереохимических воп-
росов представляет метод радикальной метки. Так, орто-, мета-, пара-ориентация
заместителей легко решается на примере фталевых кислот по виду спектра ЭПР
бирадикальных диэфиров, получаемых действием хлорангидридов па 2, 2, 6, 6-
тстраметил-4-оксипиперидин-1-оксил. В случае орто-изомера ввиду сближенно-
сти парамагнитных центров и обменного взаимодействия обоих неспаренных эле-
ктронов даже при комнатной температуре наблюдается квинтиплетный спектр
вместо обычного триплетного для моиораднкала. В ор/по-нзомсрс обменное взаи-
модействие начинается при 140°, а триплетный спектр /г ара-изомер а нс изменяется
при 150' (Розанцев Э. Г., Г о л у б е в В. А., Изв. АН СССР, сер. хим., 718
(1965)]. Подобные различия наблюдаются в спектрах бирадикальных эфиров цис-
и ^арацс-цпклопропапдикарбоповых кислот [Р оз а н ц е в Э. Г., Крин и ц-
к а Я Л. А., Изв. АН СССР, сер. хим., 1137 (1967)].
Метод надежен, прост и требует микроколичеств образца,— Прим. ред.
155
синтеза циклических пептидов, которые не удается получить с по-
мощью дициклогексилкарбодиимида [5].
1. Iselin В., Schwyzer R., Helv. Chim. Acta, 43, 1760 (1960).
2. I s e 1 i n B,, R i 11 e 1 W., Sieber P., Schwyzer R., Helv. Chim.
Acta, 40, 373 (1957).
3. Studer R.O.,Lergier W., Helv. Chim. Acta, 48, 460 (1965).
4. О h n о M., I z u m i у a N., Bull. Chem. Soc. Japan, 38, 1831 (1965).
5. Ohno M., Kato T.,Makisumi S., Izumiya N., Bull. Chem. Soc.
Japan, 39, 1738, 1747 (1966).
2,4-ДИНИТРОФТОРБЕНЗОЛ (ДНФ) (1,374—376, перед ссыл-
ками) .
ДНФ быстро и количественно реагирует с альдитами и миоино-
зитом с образованием 2,4-динитрофениловых эфиров — кристалли-
ческих веществ, имеющих четкие и характеристичные точки плав-
ления. Лучше всего проводить реакцию при комнатной температуре
в ДМФА в присутствии триэтиламина [10].
2,4-Динитрофенилпроизводные гексозаминов имеют некоторое
применение для идентификации и разделения. Ллойд и Стэси [111
показали, что эти производные представляют интерес для синтеза
гликозидов, когда реакция конденсации с незащищенными гексоз-
аминами осуществляется с низким выходом. Эти производные полу-
чают нагреванием хлор гидрата гексозамина с ДНФ и бикарбонатом
натрия. Динитрофенильная группа устойчива в 1 н. соляной кис-
лоте и в растворе аммиака в метаноле, но легко отщепляется на
щелочной смоле амберлит IRA-400-OH. Вольфром с сотр. исполь-
зовали эту защитную группу в синтезе аномерных 9-(2-амино-2-
дезокси-о-глюкопиранозил)-аденинов [12] и 1-(2-амино-2-дезокси-
(З-о-глюкопиранозил)-тимина [13].
10. W о 1 f г о m М. L., Juliano В. О,, Toy М. S., Chaney A., J.
Am. Chem. Soc., 81, 1446 (1959).
Il, Lloyd P. F., Stacey M., Tetrahedron, 9, 116 (1960).
12, Wolfrom M. L., С a r g H. G., Horton D., J. Org. Chem., 30, 1556
(1965).
13. W oi f гот M. L., В h a t H. B., J. Org. Chem., 32, 2757 (1967).
ДИОКСАНДИБРОМИД * (I, 377—378, перед ссылками).
При обработке гуанозина (1) диоксандибромидом образуется 8-
бромпроизводное (2) с выходом 65% [4,5]. Выделяющуюся в реак-
* Устойчивый комплекс с диоксаном образует также нитроформ, крайне
взрывоопасный в обычном обращении [S h е с h t е г Н., Cates Н. L., J. Org.
Chem., 26, 51 (1961)].
К 15,1 г (0,1 моля) нитроформа добавляют по каплям 4,4 г (0,05 моля) диоксана
при охлаждении так, чтобы температура смеси была ниже 20". Затвердевающий
в белую кристаллическую массу продукт перегоняют (или возгоняют) в вакууме,
т. кип. 61—62° (9 мм), т. пл. 44—44,5°, выход 18 г (92%), состав C4HSO2> 2HC(N6S)3.
Комплекс диссоциирует в различных растворителях и служит удобным источни-
ком нитроформа.— Прим, ред.
156
ции бромистоводородную кислоту можно непосредственно использо-
вать как катализатор образования ацетонида. Например, при
Сз)
добавлении к реакционной смеси ацетона и диметоксипропана гуа-
нозин сразу превращается в 8-бром-2', З'-ацетонид (3) с 60%-ным
выходом.
4. I k е h а г а М., Т a d а Н., Muneyama К., Chem. Pharm. Bull., 13, 639
(1965).
5. I к е h а г а М., Muneyama К., J. Org. Chem., 32, 3039 (1967).
п
1,ЗДИТИАН,-^% Мол> вес 120,23, т. пл. 53—54°.
Получение [1]. Реагент получают с выходом 77—84% добавле-
нием эквимолярной смеси пропандитиола-1,3 и метилаля к раствору
эфирата трехфтористого бора в хлороформе при кипячении с обрат-
ным холодильником.
HS (CH,)3SH + H2C (ОСН3)2
ВР,-(С,НЩО
Кипячение, СНСЦ
+ 2СН3ОН
157
Образование связи С—С. При обработке Д. н-бутиллитием в
ТГФ при —30е в атмосфере азота он легко превращается в карба-
нион (2) [2]. В атмосфере азота при —20е прозрачный бесцветный
раствор устойчив по крайней мере в течение трех недель. Карбанион
очень реакционноспособен по отношению к разнообразным алкил-
галогенидам (особенно иодидам); выходы продуктов составляют 70—
90% . В молекулу Д. можно также ввести вторую алкильную группу,
‘\/н (СЫз)гСН1^ /-у H-BuLi
.Ан -вин > \__/*т.+ \_/\н(сн3)г -вин
> '—О Ц J о
(1) (2)
С\- (СН3)2СН1 Г~\,СН(СН3)2 _ ХСН(СН3)г
5ЛзН(СН3)2 85^(°^[^Й) \____g' СН(СН3)2 ' ХСН(СН3)2
1Л+
(4) (5) (6)
как показано на примере получения 2,2-диизопропил-1,3-дитиана
(5), 1,3-Дитианы типа (5) можно расщепить до соответствующих кар-
бонильных соединений (6) хлорной ртутью (см. Ill, 191—194) или
бромом в водной уксусной кислоте [31. Расщепление 1,3-дитианов
типа (3) приводит к альдегидам.
Карбанионы типа (2) и (4) легко реагируют с эпоксидами, обра-
зуя 1,3-дитианпроизводные |3-оксиальдегидов или [3-окси кетонов
соответственно. Например, карбанион (7) с окисью стирола даете
70%-ным выходом соединение (8), которое после гидролиза и дегид-
ратации превращается в бензальацетон (9).
... g
+ С6Н5СН—сн2 _+_^"ьюн» У Хен снс
70% \__S чснаСНС(
ОН
(8)
НгО. -Н2О> СНз<рсН=СНСбН5
О
(9)
Карбанионы типа (2) и (4) легко взаимодействуют с альдегидами
и кетонами, давая меркаптали а-оксиальдегидов и а-оксикетонов
158
соответственно:
(2)
с6н5сос6н5 + нйо
(10)
Анионы типа (4) [например, (7)] с двуокисью углерода при —70°
образуют тиокетали а-кетокарбоновых кислот (11) с выходами 70—
75%/Производные карбоновых кислот реагируют более сложным
образом, однако реакция с нитрилами, приводящая к 1,3-дитиан-
производным 1,2-дикетонов, иапрпмер (12), проходит без осложне-
ний [4],
со,, н,о
----i--->
70-75%
N, Н2О
Гу-
\_sAcc6h5
и
+ 1ЛОН
(11)
LiOH
C12)
Кори [5] и Брук [6] независимо обнаружили, что при взаимо-
действии карбанионов типа (2) или (4) с триметилхлорсиланом или
р одет в е ш-i ы ми соеди ней и я ми об р а з у юте я 1.3 -д ити а и п р ои з в одн ы е
силплкетонов или силилальдегидов:
У + (CH3)3SiCl -~L. Xsi(CH) ------------------------> О=С\$'(СН)
\___s' 70,6% \____g 51(снз)з XS1(CH3)3
(2) («) (,4)
На стадии гидролиза, например (13) ->(14), Кори использовал
смесь хлорида и окиси ртути(П) в водном метаноле, тогда как Брук—
модифицированную методику Уолфрома (III, 193, ссылка [14]),
применяя в качестве растворителя смесь ацетон — бензол — вода.
159
В случае летучих кетонов Брук предпочитает использовать водный
ДМСО.
Кори и Крауз [71 показали, что литиевые производные 1,3-
дитианов можно использовать для осуществления разнообразных
превращений циклогексенона-2. Например, п'ри взаимодействии
(7) с циклогексеноном осуществляется 1,2-присоединение и обра-
С1(СНг)лС1
7Z = 2-6
н
(СН2)аС1
TZ-BuLi
N2, -70
(*)
(21)
Около 80%
о= (сн^
зуется продукт (15), который при обработке 1%-ной водной серной
кислотой в диоксане с высоким выходом перегруппировывается в
аллильный изомер (16). Вторичная гидроксильная группа в (16)
легко окисляется двуокисью марганца, при этом дитиановая система
не затрагивается и образуется (18). Селективный гидролиз (16) до
(17) был осуществлен с помощью хлорной ртути в водном ацетонит-
риле в присутствии карбоната кадмия. Окислительный гидролиз
(18) смесью N-хлорсукцинимида и азотнокислого серебра в водном
160
ацетонитриле приводит к ендиону (19), который легко восстанавли-
вается до насыщенного 1,4-дикетона (20). Синтез соединений (17),
(19) и (20) иллюстрирует возможности применения бис-тиокарбанио-
нов для синтеза циклических систем, имеющих различные кислород-
содержащие функциональные группы в положениях 1 и 4.
2-Литий-1,3-дитиан также был использован для синтеза цикли-
ческих моно- и дикетонов [81. Например, (2) при взаимодействии
с а, со-дихлоралканами с высоким выходом образует 2(©-хлорал-
кил)-1,3-дитиан (21), в котором при обработке 1 же «-бутиллития в
атмосфере азота при низкой температуре происходит замыкание
цикла. При п=2—6 выходы продуктов составляют приблизительно
80%, однако восьмичленный цикл образуется с очень низким выхо-
дом. Гидролиз триметилентиокеталей проводят действием хлорной
ртути в этиленгликоле в присутствии следов кислоты.
Получение бис-тиокеталя циклогександиона-1,3 (25) служит
примером использования 2-литий-1,3-дитиана для синтеза цикли-
ческих дикетонов. Литиевое производное (2) превращают, как опи-
сано выше, в бис-дитиан (24), который затем последовательно нагре-
вают с н-бутиллитием, 1-иод-З-хлорпропаном и, наконец, снова с н-
бутиллитием [81.
1) ВгСНгСН(ОСгН5)2
HSCH2CH2CHZSH', BF3^
1)№ВиЫ
2) CI(CH2)3I
3) zf-ВцЫ
50% (общий)
(24) (25)
Сибах и Бек [91 описали -подробную методику получения цию
лобутанона.
1) и-сдцы
2) С1(СН2)3Вг
3)«-C4H^Li
65-70%
HgCl2
' Н2О
60-657? °
Группа химиков из Стэнфорда, [101 использовала методику Кори
Для синтеза соединений (о) и (7), являющихся двумя из трех главных
компонентов полового аттрактанта древесного жука Ips confusus.
Первое соединение было получено реакцией 2-изобутил-1,3-дитиана
(2) с 2-броммети л бутадиеном (1) с последующим удалением защитной
группы в (3) хлорной ртутью и карбонатом кадмия. Восстановление
^-метил-6-метилен-7-октенона-4 (4) боргидридом натрия приводит к
6
№ 1994
161
природному
продукту (5).
СНг /__________Sx/H
х—s/\ch2 EuL1
Bi-ен., сн + (1Н
СНа H3CZ 'сн3
(1) (2)
сн,
HgCi2; CdCOg
59% *
Н3С/ХСН3
(3)
сн.
/Сх
нйс \н
о=с сн2
^сн.,
I
сн
Н3С/ХСН3
0)
NaBH4
66%
сн3
II
/С\
H„CZ сн
'l I!
носн сн2
хсн.
I
сн
НаС7'7СН3
(5)
Другой аттрактант (7) был получен по той же методике конденса-
цией (1) с 2-изобутенил-1,3-дитианом (6).
СН.
Л
ВгСН. сн
I:
сн,
(!)
Ви
AgNOj
3) NaBH,
II
/Сх
н3с7 хсн3
(6)
сн.
II
/с\
нуД сн
I II
носн сн,
сн
II
с
H,cz хсн3
(")
Метод с использованием дитиана удобен в этих синтезах, так как
(1) невозможно превратить в реактив Гриньяра или литиевое произ-
водное.
1-62
Реакцией обмена с сухим этиленгликолем в ТГФ в присутствии
хлорной ртути дитиановую группу можно превратить в диоксолано-
вую группу [111.
Синтез циклофанов, Бокельхайде [12] расширил применение
метода Кори, использовав 1,3-дитианы в новом синтезе циклофапов,
которые ранее были доступны лишь с умеренными выходами, глав-
ным образом с помощью димеризации по Вюрну. Например, бис-
(1,3-пропандитиолацеталь) изофталевого альдегида (1) (полученный
при обработке изофталевого альдегида 1,3-пропандитиолом) под
действием w-бутиллития превращали в дпанион, реакцией которого
с ж-ксилилендибромидом получали производное [2,2]-метацик-
лофана (2) с выходом 28%. Гидролизом под действием хлорной
ртути в смеси метанол — ТГФ в запаянной ампуле соединение (2)
превращали в дикетон (3) с выходом 4296. При обработке никелем
Ренея из дитиана (2) образуется [2,21-метациклофан с 68%-ным вы-
ходом.
Реакцией с ц-ксилилендибромидом получаются несимметричные
циклофаны.
Преимущество этого метода перед реакцией Вюрца состоит в том,
что .можно получить производные, содержащие функциональные
группы в мостиках.
1. С о г е у Е. J., S с е b а с h D., procedure submitted to Org. Syn. (1966).
2. Corey E. J., S e e b a c li D., Angew. Chem., Internal. Ed., 4, 1075 (1965).
3. W eygan d F., Bestmann H. J., Chem. Ber., 90, 1230 (1950).
4. Corey E. J., Seebac h D., Angew. Chem., Internal. Ed., 4, 1077 (1965).
5. Corey E. J., Secb ach D., Freedman R., J. Am. Chem. Soc.,
89, 434 (1967).
6- Brook A. G., Duff J. M., Jones P. F., Davis N. R., J. Am.
_ Chem. Soc., 89, 431 (1967).
Ц С о rey E. J., Crouse D., J. Org, Chem., 33, 298 (1968).
6*
163
8. S e e b a c h D,, J ones N. R., Corey E. J., J. Org. Chem., 33, 300
(1968).
9. Seebach D., Beck A., procedure submitted to Org. Syn. (1968).
10. Reece C. A., Rodin J. O., Brownlee R, G., Duncan W. G.,
Silverstein R. M., Tetrahedron, 24, 4249 (1968).
11. Corey E. J. et al., J. Am. Chem. Soc., 90, 3245 (1968).
12. H у 1 t о n T., В о e к e 1 11 e i d e V,, J. Am. Chem. Soc., 90, 6887 (1968).
1,1-Д ИФЕНИЛГИДРАЗИН (I, 385, после выдержек из [1] и [2]).
Новая методика получения гидразина описана недавно Кога и
Анселм [2а]. Общий выход чистого продукта составляет 70%.
NaN3 mpem-BuOH
(CsH5)2NCOC1---(C6H6),NCON3 ----—>
—>(CeH5)iNNHCO2C(CH3)3 —-> (C6H5),NNH.3
2d. К о g a N., An sei me J.-P., J. Org. Chem., 33, 3963 (1968).
ДИФЕНИЛДИАЗОМЕТАН (I, 385—387).
Пептидный синтез (перед ссылками). Зервас и сотр. [9] обна-
ружили, что бензгидриловые эфиры пригодны для пептидного син-
теза. Они получали эти эфиры либо реакцией серебряной соли N-за-
щищенной аминокислоты с дифенилхлорметаном, либо реакцией Д.
с N-защищенной аминокислотой. Защитную группу отщепляют об-
работкой 0,2 и. раствором хлористого водорода в нитрометане.
Авторы получили этим способом а- и у-бензгидриловые эфиры
l-глутаминовой кислоты [101.
9. Stelakatos G. С., Р a g а п о u A., Zer vas L., J . Chem. Soc,, (C),
1966, 1191.
10. T a у lor-Pa pa d imi t r i о и J., Yo van i d is C., Paganou A.,
Zcrvas L., J. Chem. Soc., (C), 1967, 1830,
1,3-ДИФЕНИЛИЗОБЕНЗОФУРАН (2,5-дифенпл~3,4-бензофуран)
(I, 388—390).
Улавливающий агент (перед ссылками). Виттиг и Фриц [10]
использовали этот реагент для связывания 1,2-циклогексадиена
(2), образующегося -при дегидрогалогенировании 1-бромциклогек-
сена (1) трет-бути л атом калия в ДМСО.
(1) (2)
10. W i t t i g G., F r i t z e P., Angew. Chem., Internal. Ed,, 5, 846 (1966); Ann.,
711, 82 (1968).
164
[2-(л-ДИФЕНИЛ)-ИЗОПРОПИЛ]-ФЕНИЛ КАРБОН AT, (1).
Мол. вес 332,4, т. пл. 114—115'.
Этот смешанный карбонат получают из (п- дифенил)- ди мети л кар-
бппола и фенилового эфира хлоругольной кислоты [1]. Реагент
сн3 сн3
/3“Ч— С — ОСО2СвН5 ___Ч—С —OCON3
Х'=//-------- j / 4 I
СН3 СН3
(1) (2)
рекомендуют использовать для N-защиты а-аминокислот. Преиму-
щество этой защитной группы состоит в том, что она легко отщеп-
ляется разб. уксусной кислотой в условиях, когда устойчивы дру-
гие чувствительные к кислоте защитные группы [2].
С равным успехом можно использовать соответствующий азид
(2), мол. вес 270,3, т. пл. 109—110°.
1. S i е b е г Р., I s е I i п В., Helv. Chim. Acta, 51, 622 (1968).
2. S i c b с г P., I s e I i n B., Helv. Chim. Acta, 51, 614 (1968).
ДИФЕНИЛИОДОНИЙХЛОРИД (I, 391—392, перед ссылками).
Получение 1 -фенил-2,4-пентандиона (5) было подробно описано
ранее [За]. В расчете на то, что в фенилировании участвует только
одна из фенильных групп, выход продукта составляет 85—91%.
За. Hampton К. G., Harris Т. iM., Hauser С. R., procedure submit-
ted to Org. Syn. (1968).
ДИФЕНИДКАРБАМИНОИЛХЛОРИД (1, 392).
Уилшайр [2] предложил использовать реагент для введения
карбоксильной группы путем ацилирования по Фриделю— Крафтсу
с последующим гидролизом.
О
А1СЦ If Гидролиз
(C8H5)2NCOCl-J-HAr-(C6H5)2NCAr -----АгСО2Н
2. Wilshire J. F. К., Australian J. Chem., 20, 575 (1967).
ДИФЕНИЛКАРБОДИИМИД (I, 392).
Д. получают также реакцией циклоприсоединения окиси бензо-
нитрила (1) к N-сульфиниланилину (2) и последующим пиролизом об-
разующегося 1-оксо-4,5-дифенил-1,2,3,5-тиаоксадиазол ина-3 (3) [21.
С6н5 1 Ньсв сйн5
СВН5 1 С— N A(-SO,)
С _1_ N il - 51 1 ——- C6H5N-C-NC6H. N S 62>5%
N S \
4 il 0 0
,0 О
(1) (2) (3)
365
2. Rajagopalan P., Advani B. G., J. Org. Chem,, 30, 3369 (1965);
Rajagopalan P„ Ad vani B. G., T a I a t у C. N., procedure sub-
mitted to Org. Syn. (1967).
ДИФЕНИЛСУЛЬФОНИЙИЗОПРОПИЛИД, (CfiH5).,S=C(CH3)2
(4). Реагент неустойчив по отношению к влаге и воздуху при тем-
пературе выше —20'.
Получение in situ. Кори [1] получал этот чрезвычайно неустой-
чивый сулъфонийилид двумя методами. Лучший метод синтеза Д.—
из дифенилэтилсульфонийборфторида (2), который получают реак-
цией дифенил сульфид а (1) с триэтилоксонийборфторидом. Соль (2)
нагревают с 1,1 эле диизопропиламида лития и 1 же хлористого
метилена (это сочетание эквивалентно дихлорметиллитию CLCHLi)
CSH5 ес.нщо - bFj СйН5ч +
>3 — —> 'ySCHXHoBF.! —>
С8н-/ ссн/
G) (2)
1) U50-Pr.NLJ-СН.С1
СТЦОСНгСН2ОСНя
С6Н5
>SCHCH3I-
С6н/ I
сн3
(3)
2) СНД
От —70 до —5 0°
г/зо-Р, jNLi
СНЮСНгСН.ОСНз
------------------ >S^C(CH3)8
Сг>Н3
(4)
и обрабатывают СН:Д при охлаждении; при этом осаждается неустой-
чивый дифенилизопропилсульфонийиодпд (3), который обрабаты-
вают 1,1 же диизопропиламида лития при — 70э и получают мутный
оранжевый раствор Д. (4). Было найдено, что наиболее подходящим
основанием является стерически затрудненный диизопропиламид
лития; его получают непосредственно перед реакцией из н-бутилли-
тия в гексане и диизопропиламина в диметоксиэтане при —70°.
Днметоксиэтан в качестве растворителя в этом случае лучше, чем
ТГФ, особенно для превращения (3) в (4).
Взаимодействие с карбонильными соединениями. С насыщенными
альдегидами и кетона,ми Д. образует оксираны с выходами 74—82% .
Реакция завершается за 1—2 час при температуре от —70 до —30 ц
что определяется по исчезновению оранжевой окраски илида [1].
%С----О
V=O щ (СН3)Х= S(C6H5)2 -> + (C6H5),S
/ H3CZ хсн3
При взаимодействии с а, (3-ненасыщеннымн карбонильными сое-
динениями [21 Д. служит донором изопропилиденовой группы с
образованием ащи-диметилциклопропанов, например в реакциях с
166
ц11клогексеноном-2 и метилакрилатом:
(C6H5)2S = C(CH3)2
--------------—>
7 4%
н\
СИ
II
сн
НзСООС^
(C6Hs)2S
Следует отметить, что этот реагент имеет большую тенденцию к
образованию производных циклопропана, чем диметилсульфоний-
метплид, который с циклогексеноном-2 дает только оксиран.
Новый реагент был использован в простом стереоспецифическом
синтезе природного инсектицида — хризантемовой кислоты (6) —
из метилового эфира 5-метилы?грцяс-2,4-гексадиеновой кислоты (5),
К’ЦСОЦ
СН3ССНаС1^НС^СН + СНа0Н
сн,
транс (4)
—> (СН3),С = СНСН==СНСО2СН3
(5)
н н
I :
(СНЙ)2С=СН • с—-с- СО2СН3
H3CZ хсн8
(6)
полученного [3] реакцией металлилхлорида, ацетилена и метанола
в присутствии карбонила никели с последующей обработкой
основанием. Реакция (5) с Д. приводит к метиловому эфиру (+)-
транс-хризантемовой кислоты с выходом 72,5%.
1. Core v Е. JJ a u t е 1 a t AL, О р р о 1 z е г W., Tetrahedron Letters,
2325 0967).
2. С о г е у Е. J., J а и t е 1 a t М., J. Дгп. Chem. Soc., 89, 3912 (1967).
3. С h 1 ц s о 1 i G. P., Cassar L., Angew. Chem., Internal. Ed., 6, 124 (1967).
ДИФЕНИЛФОСФИНЛИТИЙ (I, 399, ссылка [2]). Последующая
статья: Mann F. G., P г a £( n e 1 1 M. J., J. Chem. Soc., 1965,
4120.
п-ДИФЕНИЛФОСФИНОБЕНЗОЙНАЯ КИСЛОТА,
(СсН5).=РСсН4СО,,Н(п). Мол. вес 306,29, т. пл. 156э.
167
Получение 111.
гсщцмгщг
С1гР-С6Н4Вф) ----> (СеНп)2Р-СсН4-Вг(Щ —
О ' 7о
н-BuLt, GOo
—--------- (С6Н5).,Р-С6Н4СО2Н(п)
Применение в синтезе Виттига. Шимепц и Тоуб [2] использовали
Д. к. в реакции Виттига вместо трифенилфосфина; преимущество
Д. к. состоит в том, что образующуюся в реакции окись, //-дифенил-
фосфинилбензойную кислоту (Cf.H5)2P(O)C6H4CO,H(/z), легко отде-
лить от продукта с помощью водного бикарбоната натрия. Д. к.
можно регенерировать из окиси восстановлением под действием
трихлорсилана [31.
1. G i 1 m а n Н,, В rown G. Е., J. Am. Chem. Soc., 67, 824 (1945).
2. Sch iemenz G. P., T h ob e J., Chem. Ber., 99, 2663 (1966).
3. Method of Fritzsche H., Hasserodt U., Kor t i F., Chem.
Ber., 98, 171 (1965).
ДИФЕНИЛФОСФОРИЛМЕТИЛЕНТРИФЕНИЛФОСФОРАН,
О
+ - II
(С6Н5)3РСНР(ОС6Н5)2. Мол. вес 508,47, т. пл. 149—150°.
Этот устойчивый илпд можно получить в больших количествах
благодаря легкой четвертизации трифенилфосфина дифеннлхлорме-
тилфосфонатом (175°, 4 чпс, выход 77%) [11.
При взаимодействии Д. с ароматическими и алифатическими
альдегидами при 100—110° образуются трпнс-дифенилвинилфос-
0 0
tt-XCi;H4CHO-C(C6Ha)3PCHP(OCsH,), п-ХСсН4СНт^= СНР(ОС6Н5).,
фонаты. В ДМСО реакция осуществляется быстрее, чем в толуоле.
Реакция была применена к подходящим образом защищенным
нуклеозидам и углеводам как. удобная замена фосфонатного ме-
тода. Гидролиз фениловых эфиров делает возможным синтез фос-
фоновых кислот.
1. Jones G. Н., Hamam ига Е. К., Moffatt J.G., Tetrahedron Let-
ters, 5731 (1968).
ДИФЕНИЛХЛОРФОСФАТ (I, 400—401).
(После выдержки из [4].) Д. используют для защиты амино-
группы в синтезе метил-2-амино-2-дсзокси-р-о -глюкопиранозидов
[4а]. Защитную группу удаляют либо гидрированием над PtO2
при высоком давлении, либо заменяют ее бензилы-юп группой,
которая удаляется гидрированием при значительно более низких
температурах. Уолфром [46] применял эту защитную группу в син-
тезе аминосахаров и нуклеозидов. См. также обзор ]4в].
168
4a. Z e r v a s L., К о n s t a s S., Chem. Ber., 93, 435 (1960).
46. Wolfrom M. L., Conigi i аго P. J., S о 1 t c s E. J., J. Org. Chem.j
32, 653 (1967).
4b Whistler R. L., Wolfrom M. L., Methods Carbohydrate Chem.,
’ 2, 270, 272, 277, 282 (1963).
\, S -ДИФЕНИЛЭТИЛЕНДИАМИН (I, 401—402).
(Перед ссылками.) Для предотвращения восстановления альде-
гида при получении его из тиоэфпра (1) десульфуризацией над
никелем Ренея в реакционную смесь добавляют Д,, чтобы связать
образующийся альдегид в соответствующее производное 1,3-дифе-
нилтетрагидроимидазола (2).
0 Vi* 1
Ь Мнкмь Ренея (ЦНЩСНД.Н Л\’С6Н6
RC — SC.H5 -- — — > IRCHO]---
- (СНзЦСО или ТГФ Следы АсОН
(1)
с6н5
N Н
/Хсн, н+ 1
— RCH I — R-C-0
\ /СН,
N
I
Ссн5
СМ
Показано [2], что этот реагент пригоден для улавливания аль-
дегидов, образующихся при восстановлении нитрилов, однако вы-
ходы в этом случае меньше, чем при использовании в качестве улав-
ливающего агента семикарбазида.
l.Bcstmann Н. J,, Schulz Н., Chem. Вег., 92, 530 (1959).
ДИФТОРАМИН * (I, 402—403).
Синтез диазиринов (I, 403, после выдержки из [41). При взаимо-
действии Д. с замещенными иминами образуются диазирины, фтор-
азосоединения и фторгидразоны, относительное содержание кото-
рых зависит от природы алкильных заместителей [4а! :
Rix nhf, Ri\ /Н Ri \
4C = NR----У >C< j| у- ;С—N —NR4-
R/ R./ "N r/ [
F
R1X
+ >C-NNHR
” См. работу [Фокин А. В., Косырев Ю. М., М а к а р о в В. А.,
1 оноссло в Н. П., ДАН СССР, 186, 112 (1968)] и обзор [Ф о к и и А. В.,
лосырев Ю. М., Усп. хим., 35, вып. 11, 1897 (1966)].— Прим. ред.
169
(I, 403, перед ссылками.) Д, реагирует с алифатическими альде-
гидами и кетопамп, давай дифтораминокарбинолы различной сте-
пени устойчивости [61. Ароматические альдегиды дают лишь незна-
чительные выходы аддуктов; ароматические кетоны с Д, не реаги-
руют.
ч X /ОН
)C = O4-HNF3 ;с<
7 / 4NF2
В конц. (не менее 92%-ной) серной кислоте альдегиды и кетоны
при взаимодействии с Д. образуют аци-бпс-дифтораминопроизвод-
ные.
nf2
сн3сосн3 СН3ССН3
85% |
nf2
К а, Р-ненасыщенным карбонильным соединениям Д. присоеди-
няется по Михаэлю 171.
С фенилгидразоном ацетона наблюдается бурная реакция, при-
водящая к N-фторнмину ацетона 18].
2(CH3)aC-N'NHC6H5 —1% (CH3)2C=NF + N2 + CeH6 +
-t-(CH3)aC=\NHCeH3-HF
Д. алкилируется карбониевыми ионами, которые получаются из
алкилгалогенндов, спиртов, олефинов или простых эфиров [91.
Взаимодействие с виниловыми эфирами осуществляется без ката-
лизатора; в реакции с олефинами применяют комплекс Д. с BF3
или с фосфорной кислотой.
(C6h5)3cbi-4-hnf3 (С0н5)3смрв
C6HeCQ3 + HNF24-CF;!COOH —> СеН5СС12НР2
4а. Graham W. Н., J. Am. Chem. Soc., 88. 4677 (1966).
6. Freeman J. Р., Graham W. H., Parker С. O-, J. Am, Chem.
Soc., 90, 121 (1968).
7. Baum K., J. Am. Chem. Soc., 90, 7083 (1968).
8. Bumgardner C. L., Freeman J. P., Tetrahedron Letters, 5547
(1966).
9. Graham W. H., Freeman J. P., J. Am. Chem. Soc., 89, 716 (1967).
1,1-ДИФТОР-2,2-ДИХЛОРЭТИЛЕН (I, 403, перед ссылками).
Повторное исследование 121 циклоприсоединения этого реагента
к бутадиену показало, что образуется также продукт 1,4-присоеди-
нения (2), количество которого зависит от температуры реакции:
170
при 60'J и 2,3% при 176°. Различия наблюдаются и в зависи-
мости от количества цисоидной формы в бутадиене.
В случае 2-алкилбутадиенов также образуются 1,4-аддукты,
причем их выход возрастает с увеличением объема алкильного заме-
стителя и достигает 45% в случае 2-трщн-бутилбутадиена (31.
ск2
II
СС1г
2. Swenton J. S., Bartlett Р. D., J, Am. Chem. Soc., 90, 2056 (1968).
3. В a г t 1 c t t P. D., W a 1 1 b i 1 1 i c h G. E. H., W ingrove A. S.,
Swenton J. S.. Montgomery L. K., Kramer B. D., J. Am.
Chem. Soc., 90, 2049 (1968).
силиг-ДИФТОРТЕТРАХЛОРАЦЕТОН (I, 403—404, перед ссыл-
ками).
Получение фторхлоркарбена см. также в работе: М о s s R. А.,
G с г s t 1 R., Tetrahedron, 23, 2549 (1967); J. Org. Chem., 32, 2268
(1967).
ДИФТОРХЛОРУКСУСНОЙ КИСЛОТЫ НАТРИЕВАЯ соль,
FXICCOONa (I, 404).
Получение. Для превращения дифторхлоруксусной кислоты
(мол. вес 130,49, т. кил. 122°) в соль Па] 60,7 ? едкого натра раство-
ряют при перемешивании в 700 мл метанола и к раствору медленно
добавляют при охлаждении 198 г дифторхлоруксусной кислоты
в 300 мл метанола, поддерживая температуру ниже 40'. Затем ме-
танол удаляют в вакууме при 40"\ соль растирают и высушивают в
течение ночи в вакууме (1 м.м) при комнатной температуре; выход
почти количестве и и ы й.
Синтезы R(Ar)—CH=CFn Па]. Получение |3,|3-дифтор стирол а
осуществляется следующим образом:
1 G0°
С6Н5СНО-4-(СсН)3Р+F2ClCCOONa
—> C(iIl5CH =CF, + СО2 — NaCl Д(СеГ15):1РО
Тоикоизмельченную Д. к. н. с. растворяют при перемешивании
в диглиме при 70* в течение 5 мин. Теплый раствор помещают в на-
гретую до 60* капельную воронку и добавляют при перемешивании
к смеси бензальдегида и трифенилфосфина в диглиме. Систему пред-
варительно продувают азотом. Во время добавления реагента (1,5—
2 час) температуру реакционной смеси поддерживают около 160*.
Продукты реакции вместе с диглимом быстро отгоняют в приемник,
охлаждаемый сухим льдом, и днсти л л ат фракционируют на колонке
171
со спиральной насадкой; выход продукта, собранного при темпера-
туре в головке колонки 52—54 40 мм, составляет 7,6—8,9 г.
Источник дифторкарбена (после выдержки из 15]), Более полная
статья: HerkesF. Е., Burton D. J., J. Org, Chem., 32,
1311 (1967). В ранней работе предполагалось, что реакция Д. к. и. с.
в присутствии трпфенилфосфипа включает образование дифторкар-
бена, который затем при взаимодействии с фосфином дает дифтор ме-
тилентрифепилфосфоран (C6HO):5P^-=CF2. Однако при добавлении
тетрамстнлэтилена в присутствии кетона не образуется сколько-
нибудь заметного количества соответствующего циклопропана.
Херкес и Бертон предполагают, что промежуточным продуктом
реакции является фосфобетаиновая соль (а), которая теряет дву-
окись углерода с образованием активного реагента (б).
F2ClCCOONa +
+ (C(iHrJ3PCF.2COO----(CeHft)3P — CFS
(C8I15)3P —NaCi (а) ^со2 (б)
(Перед ссылками.) При исследовании реакции холестерина с
дигалокарбенами было показано [61, что дпхлоркарбен не присоеди-
няется к довольно инертной двойной связи холестерина в отличие от
получаемого из Д. к. н. с. менее объемного дифторкарбена. 5^.6[3-
Ориентация образующегося при этом дифторциклопропанового про-
изводного установлена главным образом на основании ЯМР-корреля-
ций, которые, как позднее было показано, применимы и для решения
многих стереохимических проблем. Назер [71 обнаружил, что дихлор-
и дибромкарбены присоединяются к более реакционноспособной 5,6-
двойной связи тетрагидропиранилового эфира эргостерина, и при-
вел однозначные доказательства в пользу 5а,6а-конфигурации.
Каталитическое гидрирование приводит к соответствующему 5а, 6а-
мстиленовому соединению. При обсуждении различий между этими
и своими данными Дж. Фрид в частном сообщении указывает: «Мы
считаем эти результаты полностью совместимыми и не находим в
них несоответствия с электронными или стерически.ми требованиями».
Присоединение дифторкарбена по двойной связи ацетата 17[3-окси-
оа-А^андростенона-З (1) было осуществлено при добавлении по
каплям в течение 0,5—1 чпс насыщенного раствора 20—50 экв
Д. к. н. с. в диглиме или триглиме к 10 %-ному раствору енона (1)
в том же растворителе при 165—225? [8]. При температуре ниже 150°
172
присоединения не происходит, Несмотря на то что соль разлагается
при 125°. Подход активной частицы из относительно менее затруд*
ценной области молекулы [91 подтверждается данными спектров
ЯМР и молекулярного вращения. В случае стероидных диенонов и
триенонов ПО] присоединение осуществляется по двойной связи,
наиболее удаленной от кетогруппы. Например, из сопряженного
(4)
диецона (3) получено соединение (4). 2-Метоксиметилен-3-кетосте*
роид (5) образует. два; изомерных 1,4:аддукта (6) [Ц].
(5) (6)
Шлагель [12! сообщает, что при получении дифторкарбена и
ДИфторметилентрифенилфосфорана лучше применять не натриевую,
а литиевую соль дифтор хлор уксусной кислоты. Так, выход 4,5-
Дикарбэток'си-1,1-дифторноркарана при замене натриевой соли на
173
литиевую повышается от 25,7 до 50,6%.
:CF2^
сгн5оос
с2н5оос
СГг
la. F u q u a S. A., Duncan W. G., Silverstein R. M., Org. Syn.,
47, 49 (1967).
5. Definitive paper: Her kes F. E., Burton D. JJ. Org. Chem,, 32, 13i 1
(1967).
6. К л о x L, H., V e 1 a r d e E,, В e г g e r S,, C u a d r i e I I о D., L a n-
dis P. W., Cross A. D., J. Am, Chem. Soc., 85, 1851 (1963).
7. Nazer M. Z,, J. Org. Chem., 30, 1737 (1965).
8. Beard C., Dyson N. FL, Fried J. H., Tetrahedron Letters, 3281
(1966).
9. Fieser L. F., Experientia, 6, 312 (1950).
10. В e a r d C., Harrison 1, T., Kirkham L., F г i e d J, H., Tetrahed-
ron Letters, 3287 (I960).
11. Hodge P., Edwards J. A,, Fried J.H., Tetrahedron Letters, 5175
(1966).'
12. S 1 a g e I R. C., Chem. Ind., 1968, 848.
ДИ-р-ХЛОР-л-АЛЛИЛДИПАЛЛАДИЙ, (1). Мол. вес 366,45,
т. пл. 160° (с разя.).
Получение [1], Этот л-аллильный комплекс хлорида палладия
с высоким выходом образуется при пропускании окиси углерода
в раствор аллилхлорида в метаноле, содержащий хлорпалладинат
натрия,
Разложение диазоуксусного эфира [2]. Под действием этого
комплекса диазоуксусный эфир (2) в очень мягких условиях
(0—53) разлагается до карбена или родственных ему промежуточных
соединений, которые можно связать алкеном или алкином. На-
пример, в присутствии циклогексена такое разложение приводит
к этиловому эфиру бицикло-(4,1.0]-гептан-3'Карбоновой кислоты
(3) с выходом 47%.
1. Dent \V. Т., Long R., W i 1 k i и s о n A. J., J. Chem. Soc., 1964, 1585.
2. Armstrong R. К., J. Org. Chem., 31, 618 (1966).
1,3-ДИХЛОРАЦЕТОН, С1СН2СОСН2СГ Мол. вес 126,97, т. пл.
41—43°.
Синтез 1-арилциклопропанолов ио Де Пюи [II. В приведенном
ниже примере синтеза [21 раствор 0,2 моля Д. в эфире добавляют
в течение часа к эфирному раствору реактива Гриньяра, получен-
ного из 0,205 моля л-бромтолуола, и получают аддукт (1). В отдель-
ной колбе готовят раствор реактива Гриньяра из 1,18 моля бро-
мистого этила и магния в эфире и передавливают его азотом в лит-
С1СН2.
>C = O-pCH3C6H4MgBr
С1СН/
С1СН2ч ,OMgBr
С1СН/ хСеН4СН3-?г
(I)
CsH3MgBr
FeCI3
СН2. zOMgBr
। х
СН/ C6H4CH3-fi
(2)
NH4CI СНгх^/ОН
~нсГ CH3Z ХН4СН3-П
(3)
ровую капельную воронку. В другую капельную воронку емкостью
250 мл помещают отфильтрованный раствор 0,0154 моля безводного
хлорного железа в 200 мл. эфира.'Оба раствора одновременно до-
бавляют к раствору аддукта (1) в течение 2 час при перемешивании.
На этой стадии происходит замыкание циклопропанового кольца с
образованием соединения (2) и, по-видимому, С2Н4, С2Н6 и МрВгСГ
Реакционную массу выливают в смесь льда, соляной кислоты и
хлористого аммония, После соответствующей обработки и перегонки
получают сырой 1-ц-толилциклопропанол (3) с выходом 51—57%;
продукт перекристаллизовывают из пентана, т. пл. 38—39°.
1. DePuv С. Н., Dappen G. М., Е i 1 е г s К. L., К 1 е i n R. A., J. Org.
Chem., 29, 2813 (1964).
2. DePuv С. Н,, К 1 е i п R. A., Org. Syn., 47, 108 (19G7).
1.3-ДИХЛОРБУТЕН-2 (I, 405—407).
(I, 406, перед ссылками.) При изучении синтеза смоляных кис-
лот Айрланд и Кирстед 161 обнаружили, что при попытках анне-
лирования кетона (1) метилвинилкетоиом образуются лишь поли-
мерные смолы. Однако в присутствии амида натрия кетон (1) взаимо-
действует с Д., образуя соединение (2) с 69%-ным выходом. В кислой
среде винилхлорид (2) гидролизуется до дикетона (3). Этот ре-
зультат противоречит данным Прелога |71, который нашел, что
подобный кислый гидролиз сопровождается альдольной конденса-
цией. Альдольную конденсацию (3) можно осуществить при обра-
ботке его трет-бутилатом калия в трет -бутаноле, но при этом
значительное количество дикетона (3) подвергается расщеплению
175
до соединения (5).
Кэйн и Тал л ер [8] предложили следующий способ аннели рова*
ния 2,6-диметилциклогексанона. Исходный продукт конденсации.
(6) подвергают дегидрогалогенированию под "действнем 2 же амида
натрия в жидком аммиаке. Дальнейшая реакция соединения (7)
с тем же реагентом в толуоле приводит к изомеризации с перемеще-
нием тройной связи в терминальное положение и образованию про-
дукта (8). Соединение (8) гидратируют обычным методом с исполь-
зованием сульфата ртути (И) до дикетона (9), который с прекрасным
выходом циклизуется в /ираяс-8Д0-диметил-1(9)-окталон-2 (10).
Приведенный синтез расширяет возможности применения Д. для
аннелирования.
6. Ireland R. Е., Kierstead R. С., J. Org. Chem., 31, 2543 (1966).
7. P г e 1 о g V,, Zimmermann M., Helv. Chim. Acta, 32, 2360 (1949).
8. C a i n e D, T u 1 1 er F. N-, J. Org. Chem., 34, 222 (1969).
176
Ck z0
-cz \
ДИХЛОРВИНИЛЕНКАРБОНАТ [1] II C = 0.
c/V
Мол. вес
154,94, т. кип. 39—40°/10 мм.
Получение. Реагент получают исчерпывающим хлорированием
этиленкарбоната (1) с последующим частичным дехлорированием
•О
Н/У
8С1,
ftv
(-4I-ICJ)
Ci
, ! /°\
CI—с- \
| с=о
С1-С /
| '<У
CI
Zn(Cu)
ДМФА — эфир
(3)
(2)
цинк-медной парой в присутствии каталитических количеств Д.МФА.
Диенофил. Д. (3) взаимодействует с циклопентадненом (4) в кипя-
щем диоксане, давая производное зндо-биаикло- [2,2,1 [-гептана (5),
которое при обработке кислотой или щелочью превращается ва-дион
(6):
Фотоциклофил. При облучении в ацетоне Д. (3) реагирует при
комнатной температуре даже с этиленом, образуя циклоаддукт (7).
сн
II
СНг
ск о
+ f хс=о
C1-W
Cl
г
(3)
!- Scharf H.-D., Droste W„ Liebig R., Angew. Chem., Internal.
Ed., 7, 215 (1968).
177
2,3-ДИХЛОР-5,6-ДИЦИАН-1,4-БЕНЗОХИНОН (ДДХ) (I, 407—
413). Обзор реакций ДДХ см.: W а 1 к е г D., Н i е b е г t J. D.,
Chem. Revs., 67, 153 (1967).
Ароматизация (I, 407, после выдержки из 16]) диена (4а) осу-
ществляется под действием реагента, но с низким выходом [6а],
тогда как обработка палладированным углем в кипящем кумоле
сопровождается гидрогенолизом до 1,8-дифенил нафтали на.
(4а)
(4 б)
Дегидрирование карбонильных соединений (I, 410, после вы-
держки из 114а|). Обширное исследование дегидрирования З-кето-
стероидов под действием ДДХ проведено Тернером и Рингольдом
[1461. Авторы обнаружили, что сильные кислоты заметно катализи-
руют реакцию (обычно используется л-TsOH), а в некоторых слу-
чаях влияют и на ее направление. Например, в отсутствие катализа
А4-3-кетостероиды дегидрируются до А1,4-3-кетонов, тогда как при
каталитической реакции образуются исключительно А4,а-3-кетоны.
дмго),9(и)-3-кето-19-н0рсТер0идЫ дегидрируются до Д1,8’и3-кето-
19-норстероидов [14в1.
А5-3-Кетостероиды под действием ДДХ в кипящем бензоле пре-
вращаются в Д1,ц-диеноны-3 с выходом 80—85%. Те же результаты
1 /8
были получены с хлоранилом, который намного дешевле ДДХ.
При продолжительной обработке А5-еионов-3 2 же ДДХ получаются
,\1-1>6-триенОнЫ-3 с выходами около 70%. Эти продукты можно
получить из более доступных Лэ-еполов-3, но при этом требуется
3 экв хинона; выходы составляют около 50%. В тех же условиях под
действием хлоранила zV-еиолы-З не изменяются |14г].
Петтит и сотр. 114д] дегидрировали у, 6-пеиасыщенный эфир (1)
до а, р, у, б-диенового эфира (2) (метиловый эфир Зр-ацетоксиизо-
буфалина):
Окисление кислородсодержащих функциональных групп (I,
410, после выдержек из 115—171). Одна из стадий полного синтеза
простагландина Е; [17а] заключается в восстановлении енона (1)
боргидрпдом цинка в диметоксиэтане. Полученные эпимерные по
(2) Oda. 15-эпимера
С15 нитродиолы разделяют хроматографией на силикагеле. Нежела-
тельный 15|3-эпимер под действием ДДХ превращается в 15-кетон
с высоким выходом. Этот циклический процесс открывает путь к
эффективному синтезу желаемого продукта, 15а-ола.
(I, 410, после выдержки из 1191.) Упомянутое дегидрирование 2-
оксимстилен-3-кетостероидов было выполнено для соединений За-
ряда. Каспи и corp. [19а| показали, что эту реакцию можно приме-
нить и к соединениям 5|3-ряда, и деформилнрованием продукта под
действием трпс-(трифенилфосфин)-родийхлорида получили 1-
йег[[дро-з.1<ето_5р.стерО11дЬ1 Реакция представляет наиболее удоб-
ный в практическом отношении метод получения ненасыщенных
179
при Ci 3-кетостероидов 5{3-ряда.
(I, 410, в конце раздела.) При обработке изолапахола (3) экви-
молярным количеством ДДХ происходит окислительная циклизация
и образуется смесь двух дегидролапахонов (4) и (5), по-видимому,
через промежуточный трикетон. [3-Форма (5) под действием кислоты
изомеризуется в дегидро-а-лапахон (4), который таким образом
легко получается с общим выходом 60% [20а].
Дегидрирование 4,4г-диметоксидибензила (I, 412, перед ссыл-
ками).Финдлэй и Тернер [24] добавляли раствор 103 тиа ДДХ в 1,5 мл
диоксаиа к раствору 100 мг 4,4г-диметоксидибензила и смесь кипя-
тили с обратным холодильником на масляной бане при 105" в тече-
ние 18 час. По мере кристаллизации гидрохинона темно-зеленая
окраска раствора изменялась до бледно-желтой. После охлаждения
осадок отфильтровывали, промывали теплым бензолом (1 мл), затем
теплым хлороформом (6 мл) и после высушивания получали 95 мг
чистого (4). Полукристаллический остаток растворяли в 5 мл этил-
О
С1\/\/CN
сн3о—/ сн2сн2 —Ч Ч—осна + || || ЛЧЧТф
(1) ch'Y'Vn
6
(2)
180
он
CH 1 ZCN
, ________ \/\/
+ СН3О—^>-СН^СН—Ч-ОСН3+ | ||
(3)83% C1/W.N
OH
ацетата, пропускали через колонку с 2 г нейтральной окиси алюми-
ния и элюировали 100 мл этилацетата. После перекристаллизации
из этанола чистый стильбен получается в виде бесцветных пласти-
нок. ДДХ легко регенерируется из гидрохинона с выходом 90%
по методу Уолкера и Во (I, 413, ссылка [41): суспензию 5 г 2,3-
дпциангидрохинона в смеси 35 мл воды и 35 мл конц. соляной кис-
лоты окисляют 9,4 г 70%-ной азотной кислоты при 35е в течение
часа.
Дегидроциклизация. Группа английских исследователей [25]
сообщила, не указывая экспериментальных деталей, что этилми-
кофенолат (1) при кипячении с ДДХ в бензоле в атмосфере азота
гладко превращается в этилмикохроменат (2). Эта реакция, по-вп-
димому, является первым экспериментом in vitro, подтверждающим
гипотезу Оллиса и Сазерленда [26] о биогенезе хроменов. Италь-
янские исследователи [27] использовали этот метод для синтеза
большого числа природных хроменов.
Получение 3,7-диокси-2,6-антрахинона. Крайне неустойчивый
3,7-диокси-2,6-антрахинон (8) был получен при окислении 2,3,6,7-
тетраоксиантрацена под действием ДДХ, имеющего более высокий
окислительный потенциал [28]. 9,10-Диметильное производное (8)
более устойчиво. Исходное соединение (1) легко получается опи-
санной Оливерио [29] конденсацией ацетальдегида с вератроло.м.
Больдт [28] обнаружил, что при реакции с паральдегидом и уксус-
ным ангидридом в присутствии каталитических количеств 60%-ной
хлорной кислоты соединение (1) подвергается алкилированию с цик-
лизацией до тетр а мето кси-9,10-диметил антрацен а (2) с высоким вы-
ходом. Окисление (2) би хроматом натрия по методу Кейзона и Физера
1301 и деметилирование с помощью бромистого водорода приводят
181
к 2,3,6,7-тетраоксиантрахинону (3) с хорошим общим выходом.
Восстановление гидросульфитом натрия до антрон-антранола и
ацетилирование дают 2,3,6,7,9-пентаацетоксиантрацен (4). Его
гидрируют до (5), дегидрируют хлоранилом до (6) и дезацетилируют
спиртовой щелочью до 2,3,6,7-тетраоксиантрацена (7). При окисле-
нии (7) хиноном с более высоким окислительным потенциалом —
ДДХ — получают неустойчивый 3,7-диокси-2,6-антрахинон (8).
снэ о
(2) (3)
ОАс Н Н
(4) (5)
Более устойчивое 9,10-диметильное производное получают анало-
гично из промежуточного соединения (2).
Особый интерес представляет прямое восстановление тетраок-
сиантрахинона (3) до соответствующего тетраоксиантрацена (9)
182
при нагревании (50е) под давлением с избытком диборана в течение
4 час.
(3)
ВгНй —BFS
4 час, 50°
93%
Дегидрирование тетраметилэтилена под действием реагента при-
водит к 2,3-диметилбутадиену, который легко вступает в реакцию
Дильса — Альдера с хиноном и дает аддукт (1) с выходом около
45% 131].
Н;С^ /СН3
н
с
н3с сн3
0)
6а. House Н, О., Bashe R. W., II, J. Org. Chem., 32, 784 (1967).
146. Т urner А. В., R i л g о I d H. J., J. Chem. Soc., (C), 1967, 1720.
14b. Heller Al., Lenhard R. H., Bernstein S., Steroids, 10, 211
(1967).
14r. Turner A. B., J. Chem. Soc., (C), 1968, 2568.
14д. Kast uri T. R., Pettit G. R., J a e g g i K. A., Chem. Comm., 1967,
644.
17a. Coicv E. J., V 1 a 11 a s I., Harding K., J. Am. Chem. Soc., 91,
535 (1969).
19a. S h i m i z u Y., Mitsuhash i H., Caspi E., Tetrahedron Letters,
4113 (1966).
20a. Dudley R. H., Chiang R. W. J. Org. Chem., 34, 120 (1969).
24. F i n d I a v J. W. A., Turner A. B., procedure submitted to Org. Syn.
(1968).
25. Campbel I I. Al., С a 1 z a d i 1 1 a С. H., Al с С о r k i n d a 1 e N. J.,
Tetrahedron Letters, 5107 (1966).
26. Ollis W. D., Sutherland I. O., «Recent Developments in the Che-
mistry of Natural Phenolic Compounds», 84, Pergamon Press, Oxford, 1961.
27. C a r d j 1 1 о G., C r i с c h i о R., M e r 1 i л i L., Tetrahedron, 24, 4825
(1968).
28. В о 1 d t P., Chem. Ber., 100, 1270 (1967).
29. О 1 i v c r i о A., Boll. Sedutc Accad. Natural] Catania, 3, Ab 4 (1937).
30. Cason J., F i e s e r L. F., J. Am. Chem. See., 62, 2681 (1940).
31. A s a t о A. E., R i c f e r E. F., Chem. Comm., 1968, 1684.
ДИХЛОРКЕТЕН (I, 414, перед ссылками).
С рщ-циклооктеном Д. образует /(нс-10,10-дихлорбииикло-16,
2,0]-декаион-9, а с /ирпноциклооктеном — соответствующий транс-
изомер. Эта реакция, таким образом, представляет стереоспецифи-
ческое циклоприсоединение [4]:
183
Оба продукта дехлорируются при кипячении с трибутилстаннаном
в циклогексане, содержащем каталитические количества азоди изо-
бутиронитрила.
4. Montaigne R., G h о s е z L., Angew. Chem., Internal. Ed., 7, 221 (1968).
ДИХЛОРМЕТИЛЛИТИЙ, ТРИХЛОРМЕТИЛЛИТИЙ (I, 416—
417, перед ссылками).
С гексафтор ацетоном * в ТГФ при —100° Т. образует после под-
кисления комплекс (II), который при расщеплении дает бпс-(три-
фторметил)-трихлорметилкарбинол (III) с 50%-ным выходом [51.
CF3
(CF3)2C = O+CCl3Li —221 CF3-C-OH ... О<—I —22Х
ТГФ | X---1
CC13
(II)
CF3
CF3 — C —OH
I
CC13
(III)
Кёбрих [6] доказал, что реакция Т. с олефинами стереоспеци-
фична и, по-видимому, осуществляется без первоначального раз-
ложения реагента до дихлоркарбена. Автор предлагает циклическое
переходное состояние, включающее хлорид лития. При взаимодейст-
вии четырехбромистого углерода с фенил- или н-бутиллнтием был
* Обзор по химии гсксафторацетола см.: К г е s р а п С. G., М i d d 1 е-
t о n W. J., in «Fluorine Chemistry Reviews», vol. 1. Ed. by P. Tarrant, M. Dekker,
Inc., У. Y., 1967, pp. 144—191,— Прим. ped.
184
получен трибромметиллитий с высоким выходом
LiCCl3
Z6-
17b
С1
„,+ L1C1
□ .Filler R., S с h u г е R. М., J. Org. Chem., 32, 1217 (1967).
6. К б b г i с h G. et al., Angew. Chem., Internal. Ed., 6, 41 (1967).
7. Fischer R. H., Kobrich G., Chem. Ber., 101, 3230 (1968).
ДИХЛОРМЕТИЛМЕТИЛОВЫЙ ЭФИР, C12CHOCH3. Мол. вес
114,96, т. кип. 82—85,5“.
Реагент получают при добавлении по каплям к метилформиату
суспензии пятихлористого фосфора в хлорокиси фосфора при пере-
мешивании [1]. После двукратной перегонки продукт удовлетвори-
тельной степени чистоты получают с выходом 77—84%.
О
il
НСОСН3 + РС15
4,4 моля 4 моля
10—20°
РОС13
С12СНОСН3-РРОС13
Синтез альдегидов. Следующая реакция иллюстрирует общий
метод синтеза ароматических альдегидов: Д. э. присоединяется к ме-
зитилену в хлористом метилене в присутствии четыреххлористого
титана с образованием мезитилальдегида 12]:
+ С12СНОСН3
Е Gross -Н;, pi- eche A., Hott E., Beyer E., Org. Syn., 47, 47 (1967).
2. R ieche A., Gross H.( H 6 f t E., Org. Syn., 47, I (1967).
185
ДИХЛ0РМЕТИЛ-2-ХЛ0РЭТИЛ0ВЫЙ ЭФИР, НСС1.,0СНгСНаС1.
Мол, вес 163,44, т. кип. 106—110/10 лгм.
Реагент получают при обработке (3-хлорэтилового эфира муравьи-
ной кислоты пятихлористым фосфором III,
Получение циклопропанолов 121, При нагревании реагента с ме-
тиллитием в эфирном растворе в качестве промежуточного продукта
образуется реакционноспособное карбеноидное соединение, которое
реагирует с олефином, давая 2-хлорэтиловый эфир циклопропанола
(1) 131. Этот продукт можно превратить в циклопропанол либо рас-
щеплением литпйорганическим реагентом (2а), либо дегидрохлори-
рованием с последующим кислым гидролизом (26);
(1) НСС120СНгСНгС1 +
В обзоре, посвященном химии циклопропанов, Де Пюи 1.41 описы-
вает эту реакцию как «один из наиболее гибких методов.» получения
циклопропанолов.
1. Baganz Н., Domaschke L., Chem. Вег., 91, 653 (1958).
2. DePuv С. Н., D а р р е п G, М., Eilers !<,. L., К, 1 е i n R. A., J. Org.
Chem,, 29, 2813 (1964).
3. Scholl hop f U., P a u s t J., Al-Azrak A., Schumacher H.,
Chem. Ber., 99, 3391 (1966).
4, DeP uy С- H., Accounts Chem. Res,, 1, 33 (1968).
2,3-ДИХЛОРПРОПЕН, СН2 = СНС1СНгС1. Мол. вес 110,97,
т. кип. 92,5—95°,
186
Синтез циклических кетонов. Реагент используется в общем
методе синтеза циклических кетонов. Например, инден в ТГФ пре-
вращают в соответствующий реактив Гриньяра (1), который присое-
диняется к Д. в ТГФ", Образующееся при этом соединение (2) при
обработке 97% -ной муравьиной кислотой циклизуется в кетон (4)
[1]. Этот метод был распространен на гетероз амещенные циклогекса-
ноны [2].
1. Lansbury Р. Т., N i е п h о u s е Е. S.. J. Am. Chem. Soc., 88, 4290 (1966).
2. Lans b игу P, T., S c h a r f D. J., J. Am. Chem. Soc., 90, 536 (1968).
О
N,N-ДИХЛОРУРЕТАН (ДХУ), CSH5OC-NC12, Мол. вес 158,
желтая жидкость, т. кип. 60 715 мм, п™ 1,4594.
Получение. Этот реакционноспособный псевдогалоген получают
с 80% -ным выходом при взаимодействии уретана с рассчитанным
количеством хлора в водном буфере. В темноте реагент долго сохра-
няется без чрезмерного разложения. Чтобы работать с чистым реа-
гентом, его перегоняют перед использованием Ilk
Присоединение к алкенам. ДХУ почти количественно присоеди-
няется по двойной связи стирола [1] и щ/щнс-стильбена 111. Присое-
динение происходит против правила Марковникова с образованием
Р-хлор-N-xjopкарбаматов, которые восстанавливаются водным би-
сульфитом или сульфитом натрия до |3-хлоркарбаматов. В случае
терминальных олефинов с неразветвленной цепью выход [З-хлоркар-
баматов составляет 60—80%. Дизамещенные алкены дают смесь
стереоизомеров. Реакция ДХУ с циклогексеном приводит к сложной
187
смеси указанных ниже продуктов:
с6н5сн=сн, CiH.oconci^ с6н5снснг—n—сосгн5 .Natiso2> C6HsCHCH2_N(!1OC2H5
С1 С1 С1 н
Из ДХУ и норборнена (1), кроме хлоркарбаматов иорборнена, не-
ожиданно был получен 3-хлорнортрициклен (2) с выходом 45%.
Взаимодействие ДХУ с олефинами имеет обычные характери-
стики свободнорадикальной цепной реакции, для которой Фогли а и
Сверн [11 предложили следующий механизм:
О
II
C3H5OCNC12
А или hv
II
c2h6oc-n-
I
Cl
II I I
C2H5OC-N-C-C-
I I I
Cl
о
II
c2h6ocnci2
о
II I 1
C2H5OC-N—C-C—CI
Электроноакцепторные группы препятствуют реакции присоедине-
ния, а замещение при двойной связи приводит к стерическим затруд,
нениям [2[.
При обработке едким кали ^-хлоркарбаматы подобно ^-иодкарба-
матам (см. Иода изоцианат в этом томе) образуют азиридины с вы-
ходами от 45 до 75%. Р-Хлоркарбаматы, полученные из терми-
нальных олефинов, при пиролизе дают 5-алкилоксазолидоны с
188
выходами 45—80% (31.
С1 о
„ । ¥ в
сдн5—с--снг—n с-ос,н5
j
КОН; СгН5ОН^ С6Н5СН--сн2
И
60%
н
R-CH-CH,
ЙГ\:Лн —
о4=С-ОС2Н5
RCH—:—СН.
। Д1 '
С\ z>NH
о-сгн.
4 /
С1
~СгН5СТ
RCI-I--СНг
о NH
й
ДХУ с хорошим
Реакция с эфирами [4]. С ди-я-ал кил эфирами
в ы х одо м образует а - х л ор а л к и л и де н - бис- ка р б а маты:
С2Н5ОС2Н5 —> C1CH2CH(NHCO2C2H5)2
Со смешанными алкилариловыми эфирами, например с анизолом,
получаются продукты хлорирования в ароматическое ядро. Дибен-
зиловый эфир превращается в бис-карбонат бензальдегида.
1. F о g I Л а -Т. A., Swern D., J. Org. Chem., 31, 3625 (1966).
2. F о g 1 t a T. A., Swern D., J. Org. Chem., 33, 766 (1968).
3. F о g 1 i a T. A., S w cr n D., J. Org. Chem., 32, 75 (1967).
4. F о g 1 1 a T. A., Swern D., Tetrahedron Letters, 3963 (1967).
4«с-3,4-ДИХЛОРЦИКЛОБУТЕН, (5). Мол. вес 122,98, т. кип.
68—69У55 мм.
Получение [1, 21. В раствор циклооктатетраеиа (1) в четырех-
хлористом углероде пропускают сухой газообразный хлор (около
1 час), поддерживая температуру от —28 до —39°, до поглощения
эквимолярного количества хлора. Смеси дают нагреться до 0°,
добавляют порошкообразный карбонат натрия и встряхивают
несколько минут для удаления НС1, образование которого возможно
189
в ходе реакции. Реакционную смесь, содержащую диен (2). фильт-
руют в колбу, куда предварительно помещают 0,95 моля диметило-
вого эфира ацетилендикарбоновой кислоты, осторожно нагревают
раствор (сильно экзотермическая реакция) и затем кипятят с обрат-
ным холодильником в течение 3 час. Растворитель удаляют при
пониженном давлении, и аддукт Дильса — Альдера (3) пиролизуют
в процессе перегонки при 135—152720 мм. Сырой продукт пиролиза
перегоняют повторно, отделяя главным образом диметилфталат.
Окончательное фракционирование в вакууме (55 льи) на колонке
высотой 90 см с насадкой из платиновых спиралек дает 47—56%
чистого Д.; головная фракция содержит в основном 1,4-дихлорбу-
тадиен.
1. A v г a m М., D i n u 1 е s с u I., Е 1 i а п М., F а г с a s i и М., М а г 1 с а Е.,
Mateescu G,, Neiiitzcscu С. D., Chem. Вег., 97, 372 (1964).
2. Р с t t i t R., Henery Jprocedure submitted to Org. Syn. (1968).
1,1-ДИХЛОРЗТИЛЕН (I, 417—418). В следующей статье [31
описано несколько методик, в частности для получения [3» Р'
диметилмасляной кислоты:
200 /и 90%-ноН HsSO4 СН3
-г3 5 г ВТ'., при 5- 1 5г |
(СН3)3ССН-СН2^СС12 --------—---------> СН3ССН2СО2Н
< о % I
1 моль Цо2 моля I
сн3
1. Change to read: Bott K.., Chem. Вег., 100, 978. 2791 (1967).
3. Bott K-, Hellmann H., Angew. Chem., Internal. Ed., 5, 870 (1966).
ДИЦИАНАЦЕТИЛЕН (дин итрил ацетилендикарбоновой кис-
лоты) (I, 418—419. Поправка. В т. I ошибка: формула реагента
NCC=CCN). Внимание*. Реагент токсичен (хранить в вытяжном
шкафу) и потенциально взрывчат; однако в разбавленных раст-
ворах в инертных растворителях достаточно устойчив.
Получение (перед ссылками). Циганек [51 разработал препара-
тивный метод, который впервые сделал Д. доступным в больших
количествах. В методике приводятся строгие предупреждения,
касающиеся токсичности CS3, NaCN и NCG=CCN. На первой ста-
дии смесь 2,4 л ацетона, 100 мл воды и 300 мл CS? перемешивают при
нагревании с обратным холодильником, добавляют сразу все необ-
ходимое количество цианистого натрия (200 с) и перемешивают
7 час при 50—55°. Темный раствор декантируют и твердый остаток
промывают горячим метанолом (двумя порциями по 100 мл). Объе-
диненные жидкости концентрируют в вакууме при температуре, не
превышающей 45°, на роторном испарителе, снабженном вращаю-
щимся приемником, который погружен в баню с охладительной
смесью (СО 2 —ацетон) и через охлаждаемую ловушку соединен с
масляным насосом. Вес остатка — примерно 520 г. УФ-спектр в ме-
таноле показывает, что выход динатрневой соли динитрнла димер-
190
каптомалеиновой кислоты составляет 250—275 г. Подробное опи-
\С. z SNa
V
2CS2 + 2NaCN С "2S
NC/Z 4 SNa
NC^ ,SNa NCX/S^
C +COC12 -7—7- H Y = O4-2NaCl
q 53—57% q
NCZ 4 SNa NC'/XSZ
NCX ZSX
C \ 800’
il C = o N-C-C^C-C^N-PCOS + CS2 + S
Q ‘ ;O
ng/4" S'7
сание остальных стадий имеется в оригинальной работе.
Реакция Дильса — Альдера с ароматическими углеводородами.
Новый метод синтеза производных барреллена основан на необыч-
ном присоединении Д. к бензолу 161. Например, при нагревании Д.
в бензоле при 180 е в течение двух дней был получен 2,3-дицианбицик-
ло-[2,2,2]-октатриен-2,5,7 (1) с выходом 14%, Хлорид алюминия за-
NCC^CCN
(О
метно катализирует реакцию: в его присутствии присоединение про-
исходит при комнатной температуре, а выход (1) повышается до 63% .
Комплекс Д. с бромидом алюминия (1 : 1), который можно получить
смешением растворов обоих компонентов в циклогексане, реагирует
с бензолом, давая (1). Реакция облегчается, если в ароматическом
кольце имеются метильные заместители. Так, гексаметилбензол
легко реагирует с Д. при 130е без катализатора, образуя соответ-
ствующий аддукт Дильса — Альдера с выходом 83%.
2- Change to read: Cookson R. C,, Dance J., Godfrey M., Tetrahedron,
24, |529 (1968).
5. Ciganek E., procedure submitted to Org. Syn. (1968); Ciganek E.,
К r es p a n C. G., J. Org. Chem., 33, 541 (1968).
6- C i g a n e k E., Tetrahedron Letters, 3321 (1967).
ДИЦИАНДИА30МЕТАН, (NC)2C=N2. Мол. вес 92,06, т. пл.
75" (с разд.). Внимание} Кристаллическое вещество взрывоопасно.
Получение [1].
NH.NH, РЫОАеЦ
ТГФ.'-70° С1ЦСМ
(ХС)2СВг2 - ---> (NC)2C = NNH2 ----(NC)2C = N2
35-40% 96%
191
Дицианкарбен. При нагревании до 70° или при У Ф--обл учении Д,
отщепляет азот, образуя дицианкарбен (21. Одна из наиболее инте-
ресных реакций этого карбена — взаимодействие с бензолом, при-
водящее к 7,7-дицианноркарадиену (1) [31. Обычно норкарадиены и
(NC)ZC:
82%
CN
СП
(1)
циклогептатриены существуют как взаимопревращающиеся тауто-
мерные формы; однако (1), насколько это можно было определить,
существует в форме норкарадиена.
1. С i g а п е k Е., J. Org. Chem., 30, 4198 (1965).
2. С i g а п е к Е., J. Am. Chem. Soc., 88, 1979 (1966).
3. С i g а п е к Е., J. Am. Chem. Soc.. 89, 1454, 1458 (1967).
«ДИЦИАНДИАМИД» = N ЦИАНГУАНИДИН (I, 419-421,'
после выдержки из [1]) *.
N,N'-ДИЦИКЛОГЕКСИЛАМИДИН N-МОРФОЛИНКАРБОНО-
ВОЙ КИСЛОТЫ (I. 421. В т. I в названии реагента допущена
ошибка). Поправка. Этот третичный амин добавляют для повы-
шения растворимости нуклеотида, который затем реагирует с
ДЦК, образуя 3',5'-циклнческий фосфат. На эту поправку обратил
наше внимание проф. М. Смит (Университет Британской Колумбии,
Канада).
ДИЦИКЛОГЕКСИЛКАРБОДИИМИД (ДЦК) (I, 422—428).
Прочие N-ациламины (I, 425, после выдержки из ссылки [18]),
N-Формиламинокислоты легко получаются с помощью муравьиной
кислоты и ДЦК 119а].
Дегидратация амидов (1, 426, после выдержки из ссылки [24]).
Этот метод был применен Либереком и сотр. [25а] с той разницей,
что вместо карбобензоксигруппы они использовали трифенилме-
тильную группу, которую можно удалить обработкой 50%-ной ук-
сусной кислотой.
* Простой способ получения реагента состоит в следующем [1а]:
NH
Cu2+ ||
(H2N)2C=S------—> (H2N-CN) H2N-C—N —CN+CuS
н
К кипящему раствору 152 г (2 моля) тиомочевины в 500 мл воды добавляют пор-
циями при перемешивании 175 г (2,2 моля) CuO (II) и смесь кипятят 4 час. Осадок
CljS и CuO отфильтровывают и промывают водой. Продукт кристаллизуется из
раствора в виде призм, т. ил. 206—208'', выход 77 г (92%).
[la] Н a u s i g k D., Chem. Ber., 103, 325 (1970).
Прим, ped.
192
Нуклеотиды (I, 427, строки 2—4). Поправка. Следует читать:
«...Якоб и Корана [27] пришли к выводу, что наиболее эффективны
ДЦК, n-толуолсульфохлорид или мезитиленсульфохлорид». Таким
образом, эффективно любое из этих соединений. На эту поправку
паше внимание обратил проф. М. Смит (Университет Британской
Колумбии, Канада).
Дегидратация [Токсикетонов (I, 427, перед ссылками). Шмидт и
Мосмюллер [29] сообщали, что реакция карбодиимидов с первич-
ными и вторичными спиртами катализируется хлорной медью.
В процессе синтеза простагландина Кори и сотр. [30] обнаружили,
что катализируемая хлорной медью реакция р-оксикетонов и ДЦК
является удобным методом дегидратации с образованием а, $-не-
насыщенных кетонов в мягких условиях — в некислой и нещелочной
среде. По-видимому, при взаимодействии с гидроксильной группой
образуется производное о-алкилизомочевины, которое подвергается
циклоэлиминированию.
/R О-С-Н
C6H3NH=C==NHC6HS + НО”С^ ---------C6H5NH-C/’X{rXCHCOR' --->
chcor' Ду.'’
н ад
.О
с6н5ын-сД
NH
СбН5
R
+ с-н
^CHCOR'
I9a. Thomas J. О., Tetrahedron Letters, 335 (1967).
25а. Libcrek В.,В uczel Cz., Grzonka Z., Tetrahedron. 22, 2303 (1966).
29. S c h m 1 d t E., M о о s in u 1 1 e r F., Ann., 597, 235 (1955).
30. Corey E. J., Andersen N, H., Carlson К M., Paust J-,
Vedeis E., V I a t t a s I., Win ter R. E. K., J. Am. Chem, Soc., 90,
3245 (1968).
ДИЭТИЛАЛЮМИНИЙЦИАНИД (I, 428—429).
Получение реагента детально описано в [1а].
Гидроцианироваиие (перед ссылками). Под действием Д. осу-
ществляется присоединение HCN к сопряженной двойной связи.
7 1994
193
Прекрасным примером является превращение (1) в (2) 12]. В смеси
бензол — толуол при О'" требуется лишь 5 мин, чтобы реакция до-
стигла положения равновесия, при котором в смеси содержится
около 80% нитрила (2) и 20% исходного енона (1). Непрореагиро-
вавший енон (1) выделяют и снова вводят в реакцию и таким образом
цианкетон (2) получают с общим выходом 91,6% . Реагент эффективен
также и в других реакциях присоединения. Например, 6-метокси-
тетралон-1, который не удавалось гидроцианировать другими
методами, при обработке 2,3 же реагента в смеси бензол — толуол
при —25J гладко превращается в циангидрин (4), который дегидра-
тируется в (5) с выходом 85%; непрореагировавший (3) выделяют
с выходом 12% [3].
зпз (СгН6)2А1СМ
ЫО CN п
KHSO4
85%
la. Nagata W-, Y о s h I о k a M,, procedure submitted io Org. Syn. (1969).
2. Nagata W., Yosh i о k a M., Tetrahedron Letters, 1913 (1966).
3. Nagata \V., Y osh i oka AY., procedure submitted to Org. Syn. (1969).
ДИЭТИЛ КАРБОНАТ (I, 429—430, перед ссылками).
Методика с использованием этого реагента для превращения
циклооктанона в 2-карбэтоксициклооктанон описана в работе
[61. Сначала готовят суспензию гидрида натрия в минеральном
масле, избыток которого удаляют многократным промыванием бен-
о
91-94%
золом. Затем прибавляют Д. и при кипячении смеси с обратным хо-
лодильником в течение 3—4 час добавляют раствор цнклооктанона
в бензоле.
Этот метод пригоден также для получения 2-карбэтоксицикло-
алкапонов из циклононапона, циклодеканона и циклододеканона;
выходы продуктов составляют 85, 95 и 90% соответственно.
6. К г а р с h о A. Р., Diamanti J., Сауеп С., В i n g h a m R., Org.
Syn., 47, 20 (1967).
194
N, ]\-ДИЭТИЛ-1-ПР0ПИНШ1АМИН (N, N-диэтнламинопропин),
Qj43Q;_s=CN(C,Hri)-2. Мол. вес 111,19, т. кип. 130—132°.
Получение [1, 21.
СОСИ 4-
CH3CH.,CON(C2H5), ——2 CH3CHaCCl=N(C2H,)2Cl-
' * 9 5%
L т N (С 6 Н! jй
CH3CH2CC1^N(C2H-MC1------------> CH3C^CN(C2H5),
—2НС1 58%
Применение. Д. активно связывает воду, образуя амид [CH;jC=
и., о
^CN(C ЛД) 1 — -> СНзСН 2CON(C2H Л ,Д; в этом отношении он оказался
более реакционноспособным, чем дициклогексилкарбодиимид или
этокси ацетилен. Реагент удобен для получения амидов (1), ангид-
ридов карбоновых кислот (2) и алкилгалогенидов из спиртов (3)
[31. Алкиниламины, подобно дициклогексил карбодиимиду, можно
использовать в пептидном синтезе [41. По данным Вейганда [51
при этом практически отсутствует рацемизация, а выходы продуктов
Длкиниламин
(1) CcHr,CO2H-l-H2NCBH&--------, СцНйСОИНСйН5
Алкиниламин
(2) 2 н-С3Н7СО,Н •—-—(H-CjHfC0),0
9 3-9 6%
Алкпин-чамиц
(3) CfH3CH2OH%-HF----------> c(;h,ch2ch3f
60-9 0%
составляют от 40 до 90%.
Алкиниламины вступают также в реакции 1,2- и 1,3-циклопри-
соединения [3,61. В литературе появилось предварительное сооб-
щение об ацилировании, алкилировании и протонировании алкинил-
аминов [7].
I. Eilingsfclci Н., Seefcldcr -М-, W е i d i п g с г Н., Chem. Вег., 96,
2671 (1963).
2. В u I j i е R., Н а 1 1 е и х А., V i е h е Н. G., Angew. Chem., Internal.
Ed., 5, 584 (1966).
3. Viehe H.G., Fuks R.,Reinsle i n AV, Angew Chem., Internal. Ed., 3,
581 (1964).
4. В it i j 1 c R., V i e h e H. G., Angew. Chem., Internal. Ed., 3, 582 (1964).
5. W e у g a n d F., К 6 n i g W., В u i j 1 e R., Viehe H. G,, Chem. Ber.,
98, 3632 (1965).
6. Fuks R., В u i ] 1 e R., Viehe H. G., Angew. Chem-, Internal. Ed. 5,
585 (1966).
7. V iehc H. G., В u i j 1 e R., F u k s R., Mereny i R., О t h J. M. F.,
Angew. Chem., Internal. Ed., 6, 77 (1967).
ДИЭТИЛ-!!. 1,2,-ТРИФТОР-2-ХЛОРЭТИЛ)-АМИН * (I, 432—
433, перед ссылками).
* Фторирующие свойства реагента впервые обнаружили И. Н. Яровепко и
М. А. Ракша на примере превращения простых спиртов в алкилфторнды и кислот
во фторангидриды [ЖОХ, 29, выл. 7, 2159 (1959)]. Реагент используют для полу-
7* 195
Под действием этого реагента 1\Г,М-диметильные производные
{3-окси-а-аминокислот превращаются в соответствующие {3-фторза-
мещенные с выходами порядка 60% [7]. В случае свободной ами-
ногруппы не удается получить удовлетворительных результатов.
С О-изопропилиденовыми производными сахаров этот амин
дает соответствующие фтор хлор ацетаты [81- Ранее образование
сложных эфиров объясняли присутствием воды, однако в данном
случае эфиры получаются даже в абсолютно безводной среде.
ZO—сн2 о- ,О-сн3 о
О-С(сн3)2 5?с(сн3)2
7. Cohen A., Bergmann Е. D., Tetrahedron, 22, 3545 (1966).
8. Wood К- R-, Fisher D., К, е и t Р. W., J. Chem. Soc., (С), 1966, 1994.
М,Ы-ДИЭТИЛ-1,2,2-ТРИХЛОРВИНИЛАМИН (1, 433, перед
ссылками).
Под действием реагента 16-оксистероиды превращаются в 16-
хлорстероиды с «высоким выходом» [31; превращение происходит с
инверсией. Хлористый тионил для этой цели непригоден.
3. S р е г о G. В., Pike J. Е., Lincoln F. И., Thompson J. L., Ste-
roids, 11, 769 (1968).
чения фторпиклогексанов [Е 1 i е 1 Е. L., М а г t i и R. J. L., J. Am. „Chem. Soc.,
90, 682, 689 (1968)] и фторбицикло-[2, 2, 2]-октанов [К о р с с к у I., S ш е j к а 1
I., Ы a d I i с к У М-, Chem. Ind. (London), № 9, 271 (1969)1 из соответствующих
спиртов и для осуществления бекмановской перегруппировки в очень мягких
условиях [A u 1 г е у R. L., S с u 1 1 а г d Р. W., J. Am. Chem. Soc,, 90, 4924
(1968)].
Высокая подвижность атомов фтора в а-положении сказывается в невозмож-
ности получения предельных аддуктов перфторизобутилена с обычными вто-
ричными аминами [К н у н я н ц И. Л., Г е р м а н Л. С., Д я т к и п Б. Л.,
Изв. АН СССР (ОХН), 1353(1956)], которые, однако, удается получить с этилен-
имииами [К о с т я н о в с к и й Р. Г., Самойлова 3. Е., Ч е р в и н И.И.
Tetrahedron Letters, 3025 (1968); ДАН СССР, 186, 835 (1969)]. Ионный характер
a-F—С-связи подтверждается спектрами ПМР этих соединений, анионотропной
перегруппировкой [К о с т я н о в с к и й Р. Г., Самойлова 3. Е., Пле-
ханов В. Г., Изв. АН СССР (сер. хим.) № 1,201 (1970)]:
(CFj)2 CHCF —-N-
(СГ-)3 CMCF г- МСН2С(СНз)2е
а также исследованиями недавно синтезированных N-фторметил аминов [В 6 h-
m е Н., Н 1 1 р М., Chem. Вег., 103, 104 (1970)]:
СГ1 COF
(RaN)2CH? ---------> RgNCHgF
— Прим. ред,
19&
ДИЭТИЛФОСФИТ (I, 433—435).
Восстановление фенолов (I, 434, после выдержки из [31). При
разработке синтеза триптиндана (11) Томпсон [За] получил в ка-
честве промежуточного соединения метиловый эфир (8а), который
деметилировал в (9). Превращение (9) в (11) осуществлялось по
методу Кеннера и Уильямса [36] реакцией с Д. или мезилхлоридом
с последующим восстановлением диэтилфосфата или мезилата
натрием в жидком аммиаке. Выход продукта соответственно 58 и
36%.
За. Thompson Н. W., J. Org. Chem., 33, 621 (1968).
Зб. Kenner G. W., Williams N. R., J. Chem., Soc., 1955, 522.
ДИЭТ ИЛЦИАНМЕТИЛФОСФОНАТ (I, 437, перед ссылками).
В первом исследовании взаимодействия этого реагента с кетосте-
роидами Бозе и Дахилл [31 использовали в качестве основания амид
натрия, а в качестве растворителя — ТГФ; они осуществили реак-
цию с кетогруппами при С3, С17 и С20. В то же время Кори [4] пока-
зал, что димсилнатрий в сочетании с ДМСО успешно используется
в реакциях Виттига. Бозе и Ра мер [5] применили димсилнатрий в
ДМСО для реакции Д. с кетостероидами и обнаружили, что С3-,
Со-, С7- и С la- (но не Сг- и Сц-) кетостероиды легко образуют а, {3-
ненасыщенные нитрилы, причем во всех случаях получается, по-
видимому, один геометрический изомер.
197
Пайерс и сотр. [6] использовали димсилнатрий в ДМСО для
конденсации циклогексанона (1) с Д. и получили а, ^-ненасыщенный
нитрил (2) с выходом 88/о. Эта реакция является первой стадией
в полном синтезе (±)-4-деметиларистолона (5).
В новом способе получения кар денол и до в Петтит и Ярдли [7]
окисляли Зр-ацетокси-20-оксо-5а-прегнан (1) тетраацетатом свинца
до 21-ацетоксипроизводного (2). Последний оставляли на 3 дия при
комнатной температуре для реакции с карбанионом, полученным из
Д. и гидрида натрия в смеси минеральное масло — ТГФ. После
198
удаления растворителя и добавления разб. соляной кислоты по-
лучали иминолактон (6), который при обработке кипящей разб. кис-
лотой превращали в карденолид (7), т. пл. 245".
4, Corey Е. JС h а у к о w s к у М., J. Am. Chem. Soc., 87, 1345 (1965).
5. Bose А. К., Ramer R. М., Steroids, 11, 27 (1968).
б Piers Е. de W a a 1 W., В r i t t t о n R. W., Chem. Comm., 1968, 188.
7. P e t t i t G. R., Y ar d ley J. P., Chem. Ind., 1966, 553; Pettit G. R.,
II e r a 1 d C. L., Yardley J. P., J. Org. Chem., in press.
ДИЭТИЛ-[3-(ЦИКЛ0ГЕКСИЛАМИН0)-ВИНИЛФ0СФ0НАТ (2).
Мол. вес 245,29, т. кип. 151 — 152^/0,04 мм.
Реагент получают 11 1 при взаимодействии диэтилового эфира
формил метилфосфоновой кислоты (1) [21 с эквимолярным коли-
чеством циклогексил амина в метаноле с последующей перегонкой
сырого продукта над карбонатом калия.
О Н н
I: 1 х /---х сн;,он
(С2НаО)пР-С-=СНОН^ X /--------->
‘ (1) ' ИХ 4—7 -що
о н
!| [ Н\ /—\
(C2HgO)2PCH=C —N_____/
(2) 14
Формилолефииирование [1]. В присутствии гидрида натрия
фосфопат (2) реагирует с альдегидами и кетонами; например,
с циклогексаноном в ТГФ образуется а, [3-ненасыщенный альдимин
(3), который при гидролизе (щавелевой кислотой или уксуснокислым
буфером) дает формилолефин (4).
О
\ I1 '
\^О + (С2Н5О)3Р-СН=СН
(2)
н
>=CHCH=nX^
(3)
Этот реагент весьма удобен, так как реактив Виттига (СВН5)3Р =
СИСКО и обычные фос'фонаты типа (С2НГР)2РОСН3СН(ОС2Н5)2 не
реагируют с кетонами. Более того, реакции (2) стереоспецифичны и
приводят к //граж'-олефинам; например, из бензальдегида полу-
чается коричный альдегид с выходом 77%.
I. \'agataW.,Hayase Y., Tetrahedron Letters, 4359 (1968).
2. Da wson N. D., 'Burger A., J. Am. Chem. Soc., 74, 5312 (1952).
ДИЭТИЛЦИНК — МЕТИЛЕН ИОДИСТЫЙ (I, 437, перед ссыл-
ками).
199
Этот метод особенно удобен в случае виниловых эфиров и других
легко полимеризующихся олефинов. Кроме того, реакция стерео-
специфична, например и«с-пропенилизобутиловый эфир дает цисА-ме-
тил -2-изобутоксициклопропан, а /цреда-пропенил изобутил овый эфир
дает транс- 1-метил-2-изобутоксициклопропан [И.
Н2.
,ОС4Н9-пзо
СН2Ц-(СгН6)22п
Количественно
с/н
CH2I2-(C2Hs)£Zn
Количественно
Другая важная особенность состоит в том, что для реагента,
полученного из диэтилцинка и бензальиодида в реакциях с олефи-
нами явно выражена см«-стереоспецифичность; например, с цикло-
гексеном образуется смесь 7-фенилноркаранов, в которой соотноше-
ние эндо- и экзо-изомеров составляет 17 : 1 [21.
1. Definitive paper: F u г u k a w a J., Kuwabata N., Nishimu-
ra J., Tetrahedron, 24, 53 (1968).
2. Definitive paper: Furukawa J., Kuwabata N_, Nishimura J.,
Tetrahedron Letters, 3495 (1968).
1Д-ДИЭТОКСИПРОПИН-2, НС^ССН(ОС2Нб)о. Мол. вес 128,17,
т. кип. 138—139,5°.
Получение. Бромированием акролеина получают дибромакро-
леин, который при обработке триэтилортоформиатом дает 2,3-ди-
бром-1,1-диэтоксипропан (2) [11. Реагент получают дегидробромиро-
ванием (2) под действием амида натрия в жидком аммиаке (3);
Вг3 НС(ОС2Нв),
СН.^СНСНО —> ВгСНаСНВгСНО----------------->
(1) 79% на (П
NaNH2, NH,
ВгСНаСНВгСН(ОС2Н6)2-------------> НС=ССН(ОС2Н.>
(2) 65% (3)
Применение. Полученное из реагента в ТГФ гриньяровское про-
изводное (4) в присутствии каталитических количеств хлористой
меди взаимодействует с пропаргилбромидом и подобными галоге-
нидами, давая с хорошим выходом 1,2-диэтокси гексади ин-2,5 (5)
[2]. Так как гриньяровское производное (4) при нагревании обра-
200
зует 1,1,4-триэтоксигексадиин-2,5, его следует получать при ох-
-сгне
C2H6A\gBr-УНС^ССН(ОС2Н^)3 — -+ BrMgC^CCH(OC2H5)2 —► '
65% (4)
НС^ССНгВг(СигС12)
..- --------> НС^ССНгС«ССН(ОСаН6)а
65%------------(5)
лаждсмии льдом (31.
В условиях конденсации по Кадио-Ходкевичу легко осуществ-
ляется алкилирование реагента 1-бром-2-фенилацетиленом [41.
С6Н5С^СВгЧ-НС-^ССН(ОС2Н5)2 -+ CcH5CsCC^CCH(OCaH5)2
1. Sheehan J. С., R о b i n s о n C. A., J. Am. Chem. Soc., 71, 1437 (1949).
2. Ward J. P., van Dorp D. A., Rec. trav., 85, 117 (1966).
3. Ward J. P., van Dorp D. A., Rec. trav., 88, 177 (1969).
4. Ward J. P., van Dorp D. A., Rec. trav., 86, 545 (1967).
ж
ЖЕЛЕЗА НОНАКАРБОНИЛ (II, 5—6).
Получение [lai. Реагент образуется при выдерживании пентакар-
бонила железа на солнечном свету или, что лучше, при искусствен-
ном УФ-облучении:
ftv
2Fe(CO)5----> Fe2(CO)9-yCO
74%
Взаимодействие с ацетиленом описано в работе [11, см. II, 6.
(11,6, последняя строка.) Поправка', английские исследователи
отдают предпочтение структуре 1 [1а].
(11,6, перед ссылками.) При нагревании а, ор-дибром-о-ксилола
(1) с Ж. н. образуется крайне неустойчивый о-хинондиметан, который
можно выделить в виде устойчивого л-комплекса с трикарбонилом
железа (2) [4]. При нагревании до 5003 этот комплекс разлагается с
Fe2(CO),
GCH2
Fe(cO)3
СН2
U) (2) (3)
образованием бензциклобутена (3). Реакция является примером
того, как образование комплекса с переходным металлом стабили-
зирует крайне реакционноспособное соединение.
Циклобутадиен не удается получить в свободном состоянии,
однако при взаимодействии 3,4-дихлорциклобутена (1)с Ж. и. (2)
легко образуется его устойчивый комплекс циклобутадиенжелезо-
трикарбонил (3), который можно получить в количестве 10 г и более
+ Кег(СО)9 + С6Н6(Ыг) - >
46-50%
(1) (2) 2БОМ^
I + С12 + 3 СО
Fe(CO)3
(3)
60 г Около 275г
Реакцию следует проводить в хорошем вытяжном шкафу. Трех-
горлую колбу на 1 л, снабженную механической мешалкой, трубкой
для подачи азота и холодильником, который соединен со склянкой
Дрекселя, помещают на масляную баню и загружают 60 г (0,49 моля)
202
ццс-3,4-дихлорциклобутена (см. этот том) в 250 мл бензола. Систему
промывают азотом, затем добавляют первую порцию Ж. и, (50 г) п
смесь нагревают до 50—55? при перемешивании. Через 15 мин.,
когда бурное выделение окиси углерода ослабевает, добавляют еще
25 г Ж- н- Остальное количество реагента добавляют порциями по
25 а по мере прекращения выделения окиси углерода. Всего тре-
буется около 275 г Ж. н.; общее время реакции не превышает 5 час.
Смесь фильтруют с отсасыванием на воронке Бюхнера через слой
целита, осадок промывают пентаном до обесцвечивания фильтрата.
Бензол, а затем пентакарбонил железа (т. кип. 203'30 мм) удаляют
в вакууме и циклобутадиенжелезотрпкарбонил собирают в виде
бледно-желтого масла, т. кип. 47 73 мм.
|а. В г а у е Е. Н., Н u b е 1 W., Inorg. Svn., 8, 178 (1966).
4. R о t h W.R., Meier J. P., Tetrahedron Letters, 2053 (1967).
5. Pettit R., Hcner у J., procedure submitted to Org. Syn. (1968).
ЖЕЛЕЗА ПЕНТАКАРБОНИЛ (II, 6—7, перед ссылками).
Карбонильные соединения можно регенерировать из оксимов
кипячением в ди-н-бутиловом эфире с эквивалентным количеством
Ж. п. и каталитическим количеством эфирата трехфтористого бора
При обработке Ж. п. стероидные /Х2-4- и Д5’7-диены образуют
комплексы с трикарбонилом железа с выходами 30—70%. В тех же
условиях из трансоидных А3’5- и /V’“-дненов получаются комплексы
.А2’4-диенов. Цисоидные А-’,4-диены выделяются из комплексов об-
работкой хлорным железом. Таким путем можно превращать гете-
роаннулярные стероидные диены в менее устойчивые гомоаннуляр-
пые изомеры [71.
6. Alp е г Н., Edward J. Т., J. Org. Chem., 32, 2938 (1967).
7. Л 1 р е г Н., Е dwa г d J. Т., J. Organometallic Chem., 14, 411 (1968).
ЖЕЛЕЗА(Ш) ХЛОРИД (II, 8—11).
Окисление * (II, 10, после выдержки из (9а|). Под действием
Ж. х. (1 н. раствор в двухфазной системе с хлороформом (1 : 1)]
В т. Л (стр. 8) ошибка в формуле (1); должно быть
NH3C1-
I ОН
203
трифтор ацетат метокси -О-мётйлнорбел л адина (1) окисляется до
диенона (2) с 12%-ным выходом. При гидролизе продукта (2) 2 н.
Na2CO3 — СНС13 происходит еще одна внутримолекулярная кон-
денсация с образованием циклической системы криминовых алкалои-
дов (3) [961 *.
96. F г а л к В., L и b s I-L «7Angew. Chem., Internal. Ed., 7, 223 (1968).
* В полном синтезе d, Z-кринина [Whitlock Н. W., Smith G. L., J.
Am. Chem. Soc., 89, 3600 (1967)] использована изомеризация винилогов этилен-
амидов в пирролины-1 [Whitlock Н. W., Smith G. L., Tetrahedron Letters,
№ 19, 1389 (1965)1 подобная изомеризации эталенамидов в оксазолины-2 [Heine
Н. W., Angew. Chem., Internal. Ed., 1, ,W 10, 528 (1962); Derm er О. С., H am
G. E., «Efhylenimme and other Aziridines», Acad. Press, N. Y., London, 1969].—
Прим. ped.
204
ЖЕЛЕЗО (II, 11—12).
Влияние следов Ж. (после выдержки из [3]). Другой группе ис-
следователей [За] не удалось подтвердить эффект, оказываемый
Ж. при бромировании эстрона.
Кетоны из карбоновых кислот. При получении гептанона-4 смесь
4 молей w-масляной кислоты и 2,2 моля железной пудры кипятят
5 час с обратным холодильником в атмосфере азота и затем пере-
гоняют [41.
2СН3СН2СН2СО2Н 4-Fe (CH3CH2CH2CO2)aFe+H2
д
(CH3CH2CH2CO2)2Fe —--> (СН3СН2СН2)2СО
69—75%
Катализатор реакции Фриделя — Крафтса. Ж- является удов-
летворительным катализатором реакции алкилирования фениловых
эфиров mpem-бутил хлоридом [5].
СН3 СН3
! i
До 120°
I || +Fe-P(CH3)3CC1 89,5% | ||
^/\ХН3 Х)СН3
500 г 2 г 50 г+200 г С(СН. )3
За. U t n е Т., Jobson R. В., L а и d g г a f F. W., J. Org. Chem., 33, 1654
(1963).
4. D a v i s R., Granite C., S ch ultz H. P., Org. Syn., 47, 75 (1967),
5. Krausz F., Bull. soc. chim. France, I960, 1740.
ИЗОАМИЛ НИ1РЛ1 (II, 16).
Момоиптрование кетонов можно осуществить реакцией эквива-
лентных количеств кетона и И. в ТГФ в присутствии 50%-кого
избытка возогнанного трет-бутилата калия. При этом образуются
также и продукты расщепления, в случае циклических кетонов —
эфиры со-нитрокарбоновых кислот 11а|,
(Перед ссылками.) Хасснер [4] показал, что через а-нитрокетоны
достигается с прекрасным выходом перемещение карбонильной
группы к соседнему углеродному атому. Таким путем холестанон-3
превращается в холестанон-2.
la. F е и о г Н., Р i vawer Р. М., J. Org. Chem., 31, 3152 (1966).
4. Hassner А„ L а г k i n J. At., D о w d J. E., J. Org. Chem., 33, 1733 (1968).
ИЗОПРОПЕНИЛМЕТИЛОВЫЙ ЭФИР, СН2=С(СН3)ОСН3. Мол.
вес 72,10, т. кип. 36°.
Получение [1].
?Нз нф4е)’
СН2 - COCOCHs + 2СН3ОН--
200 ё
СН,
СН3С(ОСН3),фСН3СООН
150 г
СН, СН3
I (Ас),О-Ру !
СН3С(ОСН3)о ——> СН2 = СОСН34-СН3ОН
5 00 г 230 г.
Изопропеннлацетат превращают в диметилкеталь ацетона (2.2-
димсто кс и пропан) обработкой ацетатом ртути ( II) и эфир атом трех-
206
фтористого бора в метаноле [2]. Под действием уксусного ангидрида
в пиридине происходит отщепление элементов метанола и обра-
зуется И. э.
Синтезы [3-кетоалленов и ос, [3-иепредельных кетонов [11. И. э.
при взаимодействии с третичным ацетиленовым карбинолом в усло-
виях кислого катализа (и-толуолсульфокислота или особенно фос-
форная кислота) образует с высоким выходом [3-кетоаллен. Приме-
ром служит реакция с диметилэтинилкарбинолом (1). |3-Кетоаллен
(2) под действием 1?6-ного метанольного раствора едкого натра с
сн3
НЙС ] н +
>С —С = СНН- X. —
Н3С7 I Н.Х^ %ОСН3 <J5%
он
(1)
высоким выходом изомеризуется в сопряженный диенон (3). полу-
ченный в виде смеси цнс-тл/ишс-изомеров с преобладанием последне-
го (14% : 86%).
Эта реакция является удобным методом получения псевдоионона
(6) из дегидролиналоола (4).
(6)
Синтез у, б-непредельных кетонов [31. С третичными винилкарби-
нолами И. э. образует у,6-непредельные кетоны. Катализатором
служит фосфорная кислота; реакцию проводят в гептане или лиг-
207
роине в автоклаве при 125° в течение 15 час. Полагают, что реакция
CH3 1 CH3 , 1 Hr, 125°
,C. H.,CZ 1 'CH A OH (1) CH3 1 zCI-l„ + 2 ZC4 —— —> z “ HoCA' \OCH3 93^4% CH3 ] H3C4
H3C/C^CH^ ZCH2X /сц + C1 о I-! Й (2)
осуществляется с промежуточным образованием алл ил в ин илового
эфира (а), который в результате термической перегруппировки Клай-
зена дает продукт (2).
НзС^СНд
нс/\э
II I
сн2 с
ад-^снз
1. Saucy G., М а г b е t R., Helv. Chim. Acta 50, 1158 (1967).
2. С го x a 1 1 W. J., G 1 a v i s F. J., N e h e г W. T., J. Am. Chem. Soc., 70,
2805 (1948).
3. Saucy G., Marbet R., Helv. Chim. Acta, 50, 2091 (1967).
ИМИДАЗОЛ (II, 27—30).
(Перед ссылками.) Стьюарт [131 обнаружил, что в присутствии
каталитических количеств И. п-нитрофениловые эфиры можно ис-
пользовать для образования депсипептидной сложноэфирной связи.
В отсутствие И. взаимодействия не наблюдается.
Было найдено, что И. является эффективным катализатором
гидролиза ацетоксифлавонов в 60%-ном метаноле [141. Этот метод
особенно удобен потому, что ацетоксифлавоны гораздо легче очистить
кристаллизацией, чем оксифлавоны. Ацетокси флавон суспендируют
с 0,1 частью И. в 60%-ном водном этаноле и смесь кипятят с обрат-
ным холодильником в течение 24—50 час.
10. Add: See also М с G a h г е п W. J., Goodman М., Tetrahedron, 23, 2017
(1967).
13. Stewart F. Н. С., Chem. Ind., 1967, I960.
14. Looker J. H., Holm M. J., M Inor J. L., К a g a 1 S. A., J. Hetero-
cyclic Chem., 1, 253 (1964).
208
ИОД (II, 32—39).
Ароматическое иодирование (II, 34, после выдержки из 1121).
Полиалкилбеизолы с объемными группами не реакционноспособны
по отношению к самому И., но могут реагировать с ним в присутст-
вии окислительного агента. Группой японских исследователей 112а],
подробно изучавших используемые для этой цели реагенты (пер-
хлорат серебра, окись ртути, йодноватую кислоту, персульфат ка>;
лия и др.), найдено, что наиболее удовлетворительным является
сочетание И. с дигидратом иодной кислоты.
1
НзС\/\/СНз MH;,1O|; НзС\/\/СНз
I Н (следы H.SOJ и
1 I
С(СН3)3 С(СН3)3
Окисление (II, 35—36, после выдержки из [21]). Пропилен реа-
гирует с И. и надуксусной кислотой в уксусной кислоте с образо-
ванием 1-иод-2-ацетоксипропана с выходом 63—72% [21а]. Счи-
тается, что реакция включает атаку п-комплекса И.— олефин *
надуксусной кислотой. Реакция применима и к другим олефинам.
СН3СН—СН.,
СН3СН--=СН2+12 + СН-.СО3Н ------> I I
63-72% СН;}С^ I
н +
При взаимодействии с иодом в метаноле (3-кетосульфоксиды (1)
с высоким выходом превращаются в сс-кетоацетали (2). Полагают,
что действие И. состоит в удалении метилмеркаптана из равновесной
О он м,, ОСн;
। СНдОН ।
RCOCH2SCH3 RCOCH--=SCH3 RCOCHaSCH.
(1)
осн3
I 3 CH3OH
Z- RCOCHSCHg “12 RCOCH(OCH3)., LCH3SH
(2)
-a
2CH3SH C2ch3ssch3 + hi
* Недавно выделен. индивидуальный комплекс олефин — бром, стабильный
бромониевый ион адамантилидекадамантана
(Strating J., W i е г i п g a J.H., Wynber Н., Chem. Comm,, 1969, 907).—
Прим, ped.
2Q9
смеси и образовании HI, катализирующего перегруппировку Пум-
мерера. Бром в этой реакции тоже эффективен, по без существен-
ных преимуществ [216L
Окисление гидразонов альдегидов и кетонов (3) И. в нейтральной
среде приводит к соответствующим азинам (6) |21в1; считается, что
реакция осуществляется с промежуточным образованием радикала
(4), который затем димеризуется (5~). Дальнейшее окисление с поте-
рей молекулы азота дает азин (6).
Н НН
\ Ь \ 1 \ ! I /И
)C=NNH3—> РС=^ NN'-^ )C^NN~NN=C<------>
/ / / \ -хк
(3) М) (5)
_^>C = NN = C/
(6)
Катализатор дегидратации (II, 36—37). Поправка, внесенная
Хаттом (Монашский университет, Виктория, Австралия):
«В описании применения И. в качестве дегидратирующего агента
приведен пример его эффективности (которая несомненна) в пере-
группировке бензпинакона. Однако И.— далеко не самый подходя-
щий реагент, и маловероятно, чтобы он действовал так, как описано
(II, 36—37). Авторы, использовавшие реагент, не обращают внима-
ния на то, что при перегруппировке бензпинакона окраска И. исче-
зает вскоре после начала реакции. В соавторстве с Билом [25а]
нами показано, что иодистоводородная кислота, взятая в том же
количестве, оказывает точно такое же действие, как И. Более того,
при добавлении ацетата натрия в количестве, достаточном для
нейтрализации образующейся иодистоводородной кислоты, бенз-
пинакон не перегруппировывается при кипячении в уксуснокислом
растворе, который сильно окрашен И. Отсюда можно сделать вывод,
что за перегруппировку ответственна иодистоводородная кислота.
Применение Й. имеет тот серьезный недостаток, что он образует
полистоводородную кислоту за счет окисления некоторого коли-
чества бензпинакона в бензофенон. В особенности это сказывается,
когда перегруппировку используют для оценки миграционной спо-
собности. Вместе со Стефенсоном [256] нами было обнаружено, что
это может привести к совершенно неправильным выводам в тех
случаях, когда пинакон имеет заместитель в орто-положении и пере-
группировывается медленно. Мы нашли, что хлорная кислота в
уксусной кислоте является более активным реагентом и не вызывает
210
окисления. Этот реагент оказался единственным эффективным для
осуществления перегруппировки 2,2'-дифенилбензпинакона».
'Катализ <11, 38, после выдержки из [32!}. Группой канадских
химиков [32а! обнаружено, что трифенилкарбинол при обработке
И. в метаноле превращается в метиловый эфир с 90%-ным выходом.
Реакция применима для получения арил метилалкиловых эфиров.
Хотя И. играет здесь роль катализатора, более высокие выходы по-
лучаются при введении в реакцию почти эквимолярного количества
сн2он снгосн3
И. Кроме того, в присутствии И. как катализатора была осуществ-
лена следующая реакция Фриделя — Крафтса:
СЩО— / ^>-СН,ОНщ/ Ч-Оснз
СН3О-^ / У- осн3
12а. S u z u k i Н., Nakamura К., Goto R., Bull. Chem. Soc. Japan,
39, 129 (1966).
21a. Ogata Y., А о к i К., J. Org. Chem., 31, 1625 (1966); procedure submitted
to Org. Syn., (1966).
216. Moore T. L., J. Org. Chem., 32, 2786 (1967),
21b. Barton D. H. R., О’ В r i с n R. E., S t e г n h e 1 1 S., J. Chem. Soc.,
1962, 470.
25a. Beale С. H., Matt II. H., J. Am. Chem. Soc., 54, 2405 (1932).
256. Hatt H. H., Pilgrim A., Stephenson E. F. M., J. Chem. Soc.,
1941, 478.
32a. R utherford R. G., Marner O. A., Prokipcak J. M,, J o-
b i n R. A., Can. J. Chem., 44, 2337 (1966),
ИОДАЗИД (II, 39—40, перед ссылками).
Фоулер, Хасснер и Леви [41 показали, что И., полученный in
situ из азида натрия и монохлорида иода, при взаимодействии с ие-
разветвленными рис- и трпне-олефинами образует соответственно
трео- и эщшро-аддукты. Терминальные олефины дают аддукты с
азидной группой в положении 2; сопряженные олефины, например
1,2-дигидронафталин, образуют продукты, содержащие азидную
группу в аллильном положении. Присоединение И. к дифенилаце-
тилену осуществляется с умеренным выходом, при этом получается
неустойчивый, быстро разлагающийся желтый кристаллический
211
моноиодазид (2) (т. пл. 76°) с предполагаемой /прайс-конфигурацией.
I
C6H,C^CC6H,-|-I— N = N = N Сй1ЩС=ССаН-
(1) ' | + 2
N^N^N
(S)
Хасснер и Фоулер [51 показали, что присоединение И. к олефи-
нам является общим методом синтеза 2Н-азиринов. Образующийся
П'к .R
с=с<
R"^ 41
иодазид подвергается стереоспецифическому трйнс-дегидрогалоге-
нированию с образованием винилазида, который при фотолизе или
пиролизе дает 2Н-азнрин. Восстановление 2Н-азирина литийалю-
минипгидридом осуществляется стереоспецифично и дает с хорошим
выходом tpc-аз иридии.
4. Fowler F. W., Н a s s n е г A., L е v у L. A., J. Am. Chem. Soc., 89, 2077
(1967).
5. Н a s s n е г A., F о w 1 е г F, W., Tetrahedron Letters, 1545 (1967); J. Org.
Chem., 33, 2686 (1968).
ИОДА МОНОБРОМИД (II, 40, после выдержки из [1]).
Под действием И. м. с высоким выходом осуществляется моно-
бромирование стероидных альдегидов [2]. Предпочтительно обра-
зуются диастереомеры с ^-ориентацией атома брома. Реакция была
сн2
снг
н3с£с-н
использована для последовательного укорочения боковой цепи
желчной кислоты [3].
2. У а п и k a Y., Katz R., S а г е 1 S., Chem. Comm., 1968, 849.
3. Y a n u к a Y., Katz R., S a г e 1 S., Chem. Comm,, 1968, 851.
ИОДА НИТРАТ, INO3. Мол. вес 188,92.
Реагент получают in situ из нитрата серебра и иода [11:
AgN034U—> Agl + 1NO3
А3-Холестен под действием И. н. в ацетонитриле образует нитрат
212
За-иод-2Р-оксихолестаиа (2). Тот же эфир (2) получается с выходом
б()Т) при добавлении А3-холестена к раствору тетраокиси азота в
хлороформе, обработанному иодом. Однако если изменить порядок
добавления реагентов и к раствору иода и А3-холестена добавить
раствор тетраокиси азота, то в качестве единственного продукта
получается 2р-1юд-3а-нитрохолестан (3) с 60%-ным выходом;
1. К г о р р J. Е., Hass пег A., Kent G. J., Chem. Comm., 1968, 906.
ИОДБЕНЗОЛА ДИХЛОРИД (II, 43, перед ссылками).
Следует отметить, однако, что Кристол и сотр.[5] хлорировали
аценафтилен (1) под действием И. д. в хлороформе, содержащем 1,3,5-
тринитробензол в качестве ингибитора радикальной реакции, и
С1 Н
(1) ( 20% (2) Т, пл. GS°
CI Cl
I I
H-C-C-H
(3) T. пл. 116°
получили //гране-1,2-ди хлор аценафтен (2) с низким выходом; под
действием хлора был получен более высоко плав кий ц/гс-изомер (3)
с таким же низким выходом. Конфигурация продуктов была одно-
213
значно установлена экспериментами частичного разделения на ан-
типоды, что позволило различить цис-мезо- и d,l-mpшдхформы.
При взаимодействии циклогексена с И. д. получается исключи-
тельно транс-дихлорид [6]. Реакция с хлором в хлористом сульфу-
риле также приводит преимущественно к mpaw-дихлориду [71-
Подобным же образом И. д. взаимодействует с 1,4-диоксоциклогек-
сеном-2 и 1,4-ди гидрон афтал ином [81. Норборнен (4) под действием
И. д. образует смесь ж?о-^нс-2,3-дихлорнорборнапа и транс-2 23-
дихлорнорборнана (выходы не указаны [9]). При реакции с норбор-
ненкарбоновой кислотой (7) в качестве главного продукта полу-
чается эдзо-цпс-дихлорид (8) [101. Таким образом, стереохимия
реакции в высокой степени определяется стерическими факторами.
5. Crlstol S. J., S t е г m i t z F. R., Ramey P. S., J. Am. Chem. Soc,,
78, 4939 (1956).
6. Campbell J. R., Jones J. K. N., W о 1 I e S., Can, J. Chem., 44,
2339 (1966).
7, Summerbell K. !<., L u n k H. E., J. Am. Chem. Soc., 79, 4802 (1957).
8. Mousscron M., Jacquier R., Henry R.. Mousscron-Ca-
net M., Bull. soc. chim. France, 20, 628 (1953).
9. Poutsma M. L., J. Am, Chem, Soc., 87, 4293 (1965),
10. Masson S,, T h u i 1 1 e r A., Compt. rend., 264 (С), 1189 (1967).
1-ИОДГЕПТАФТОРПРОПАН, CF,CF.,CF.2E Мол. вес 295,94,
т. кип. 41,2°, уд, вес 2,1306, п^51,3391.
Получение. И. можно получить различными способами, например
реакцией трифтор подметана с тетрафторэтиленом |1); взаимодейст-
вием иодангидрида гептафтормасляной кислоты с иодом в платиновой
трубке при 550—602° [21.
Применение, а) Получение реактивов Гриньяра [3, 4, 5). б) При-
214
соединение к кратным связям [6, 7]:
CF3CF2CF2I
Норборнен
[7] НС^СН -CF3.9FzCF^I> 1НС = СНС3Г7
в) Иодирующий агент [8]:
1. Haszeldine R. N., J, Chem. Soc. 1949, 2856; 1953, 3761.
2. Haszeldine R. N., J. Chem. Soc., 1951, 584.
3. Брит. пат. 757893 [С. A., 51, 2126 (1957)].
4. Haszel dine R. N., J. Chem. Soc,, 1952, 3423.
5. P ierce O. R., Mei ners A. F., McB ее E. T., J, Am. Chem. Soc., 75
2516 (1953).
6. Brace N. O., J. Am. Chem. Soc., 86, 523 (1964).
7. Haszeldine R. N., J, Chem. Soc., 1950, 2789.
8. В urgess C., Cooley G., Feat her P., Petrow V., Tetrahedron,
23, 411 (1967).
И0ДИ30ЦИАНАТ (II, 44, перед ссылками).
Хасснер и сотр. 151 приводил1 подробную методику и обсуждают
границы применения реакции присоединения И. к олефинам. Для
превращения образующегося ₽-иодизоцианата в карбамат в каче-
стве катализатора рекомендуют применять метилат лития или нат-
рия. При получении азиридинов р-иодизоциана.т лучше превратить
в аддукт с бисульфитом натрия, который под действием основания
дает азиридин.
14. был использован на одной из стадий стереоспецифического
синтеза трансЛ ,2-диаминоииклогексана [6]. И. добавляют к цик-
логексену и сырой щрщщ-Р-подизоцианат переводят в карбамат (2),
который под действием едкого кали в метаноле с инверсией превра-
щается в азиридин (3). Обработка (3) азидом натрия в этаноле с по-
215
следующим каталитическим гидрированием и обработкой соляной
(1)
в МеОН
88%
1) NaN3-C2H5OH
2) H2-Pt
3) HCI
гг ~~ ;
60%
-I
кон-сн3он.
<э
'•КНСООСНз
NH
(3)
(2)
NH3 сГ
NH3C1
(4)
кислотой приводят к дихлоргидрату транс-1 ,2-диаминоциклогек-
сана (4).
Пакьетт и Кула 171 использовали И, в синтезе 1-карбметокси-2-
мети лаз едина из 2,5-дигидротолуола. Эта реакция является новым
общим методом получения 1Н-азепинов.
Сверн [8] определял относительные скорости реакции И. с раз-
личными ненасыщенными соединениями и получил результаты,
согласующиеся с механизмом электрофильной реакции. Хотя
И. удобно получать in situ, в случае ацетиленов, образующих
преимущественно дииодлроизводные 191, такой реагент не дает
удовлетворительных результатов. В этом случае лучше использо-
вать предварительно приготовленный раствор И. [10]. Избыток
цианата серебра обрабатывают иодом в эфире, ТГФ или глиме при
—30° в темноте. Приготовленный таким образом реагент взаимо-
действует с олефинами по крайней мере в 10 раз быстрее, чем полу-
ченный in situ.
5. Н assner A., L о г b о г М. 12., Heathcock С., J. Org. Chem., 32,
540 (1967).
6. S w i f t G., Swern D., J. Org. Chem., 32, 511 (1967).
7. Paquette L. A., К u h I a D. E., Tetrahedron Letters, 4517 (1967).
8. G e b e I e 1 n C. G-, Swern D., J. Org. Chem., 33, 2758 (1968).
9. Grimwood В. E., Sworn D., J. Org. Chem., 32, 3665 (1967).
10. R osen S., Swern D., Anal, Chem., 38, 1392 (1966).
216
ИОДИСТОВОДОРОДНАЯ КИСЛОТА (II, 44—46).
Восстановление (после выдержки из 15]). Группой австралий-
ских исследователей |5а! показано, что наилучшей методикой для
получения я-диацетилбензола является методика, предложенная
Уолфромом и Брауном [5]. Терефталевую кислоту под действием
хлористого тионила превращают в бнс-хлорангидрид, а затем (из-
согн COCI О 11 CCH1N2 COCH3
1 1
2SOCI, Г || 2CH.N3 п HI—CHCls 1 ||
V и м 68% (общий) 1 11
СО.2Н СОС1 cchn2 О СОСН3
бытком диазометана) в бис-ди азокетон. Последний восстанавливают
47%-ной И. к. в хлороформе до я-дпацетилбензола с общим выхо-
дом 68%. При использовании йодистого калия и фосфорной кислоты
выход снижается до 60%.
5а. Р о j е г Р. AV, Ritchie Е., Т а у I о г W. С., Australian J. Chem., 21,
1375 (1968).
ИОДНАЯ КИСЛОТА (II, 48—53).
Расщепление выц-гликолей (II, 48—50, в конце раздела). Новый
метод последовательного расщепления боковой цепи желчной кис-
лоты [10а] заключается ва-бромировании (2), гидролизе и перйодат-
ном окислении образующейся а-оксикислоты. На этой стадии раст-
вор соединения (3) в смеси ацетон — уксусная кислота — вода
217
(4:4:1) обрабатывают избытком перйодата натрия и перемешивают
при 40—50° в течение 24 час. Альдегид (4) получается с выходом
90%. При замене в смеси растворителей ацетона на этанол выход
продукта снижается. При расщеплении соединения (3) тетраацета-
том свинца образуется сложная смесь, из которой (4) удается выде-
лить с выходом только около 50%.
Окисление метилгликопиранозидов И. к. в ДМСО происходит
несколько необычно, так как расходуется только 1 моль окислителя.
Высокую стереоспецифичность окисления можно объяснить при
допущении большей реакционной способности б«^-ц«с-диолов (акси-
ально-экваториальные) по сравнению с виц-транс-диолам и (диэк-
ватор иальные или диаксиальные) [1061.
Окислительная димеризация [18] (II, 52, перед ссылками). Под
действием И. к. в водной уксусной кислоте при 48—51° в течение
45 мин пирен (1) превращается в дипирен (2). Успех этого простого
НДО6> АсОН-НгО (45 мин)
68-72%
синтеза связан со специфической способностью окислителя к обра-
зованию ассоциатов с молекулами пирена и отщеплением водорода
с образованием сольватированных уксусной кислотой радикалов,
способных к димеризации в дипирен.
Фатиади [191 изучал поведение других полициклических углево-
дородов по отношению к И. к. и обнаружил, что четыре из них
окисляются до хинонов, а не до продуктов димеризации.
218
о
Н510с-ДМФА
91-95%
НДОв-ДМФА
80—85%
Окисление нафталина И. к. заслуживает особого внимания, так как
под действием других реагентов наилучшие выходы 1,4-нафтохинона
составляют всего 18—22% (СгОа, см. том IV, 179—183).
2. Add: See also Sklarz В., Quart. Rev., 21, 3 (1967).
10a. Yanuka Y,, Katz R., Sarel S., Tetrahedron Letters, 1725 (1968).
106. Yu R. J., Bishop С. T., Can. J. Chem., 45, 2195 (1967).
18. F a t i a d i A. J., J. Org. Chem., 32, 2903 (1967); procedure submitted to
Org. Syn.
19. F a t i a d i A. J., Chem. Comm., 1967, 1087.
ИОДНАЯ КИСЛОТА — ХРОМОВАЯ КИСЛОТА.
Перолд и Пахлер Ц1 использовали иодную кислоту с. хромовой
(води. Н5Юе—СгО3) для расщепления первично-вторичной гли-
кольной группы соединения (1) с образованием карбоновой кислоты
(3). Более сильный окислитель — иодная кислота специфически
расщепляет <ш^-гликоль, а также регенерирует хромовую кислоту,
расходующуюся на окисление промежуточного альдегида (2).
(3) 843мг
1. Р е г о I d G. W., Р а с h I е г К. G. R., J. Chem. Soc,, (С), 1966, 1918.
219
/гаеотракяс-[ИОД-(ТРИ-н-БУТИ<ЛФОСФИН)-МЕДЫ,
[1СиР(С4Ни).3]4. Мол. вес 1575,08, т. пл. 75°.
Получение [I]. Этот комплекс получают с выходом около 50%
из подпетой меди и три-и-бутилфосфина:
4 (н-С4Н9)3Р-у4Си1 [1СиР(С4Н9)3]4
При хранении в холодильнике комплекс разлагается через несколько
дней. Он очень хорошо растворим в хлороформе, бензоле, толуоле
и эфире и умеренно растворим в этаноле и воде.
Окислительная конденсация. Литийорганнческие и магний орга-
нические соединения при взаимодействии с этим комплексом в ТГФ
или диметоксиэтане при —78° образуют ате-комплексы меди(1),
которые в присутствии атмосферного кислорода подвергаются кон-
денсации [2]. Типичным примером может служить реакция с н-бу-
тиллитием:
ТГФ 02
2C4HaLi 4-[ICuP(C4Hy)3l4 -~+ (C4H9).,CuLi СеН13
— / а 7й — i в
Главным продуктом является октан (выход 84%), кроме того, обра-
зуются бутен-1 (14%) и бутанол-1 (5%). Реакция эффективна в слу-
чае первичных, вторичных, винильных и арильных групп, однако
шрв/п-алкильные производные дают низкие выходы продуктов.
Для литийорганических соединений выходы несколько выше, чем
для соответствующих реактивов Гриньяра. Кроме кислорода, эф-
фективны и другие окислители, например нитробензол или СиС12-
ТМЭДА (V, 411). Применение двух различных литиевых реагентов
приводит, как правило, к образованию смеси продуктов.
Заключительная стадия синтеза природного фульвена — фуль-
воплумиерина (3) — включает конденсацию винилхлорида (1) и
л ити й -ди - {транс-1-пр оценил)-мед и (2), соединения, получаемого вы-
шеуказанным методом [3].
1. Kauffman G. В., Т е t е г L. A., Inorg. Syn., 7, 9 (1963).
2. Whitesides G.M.,S an Filippo J., Jr.,C a sey C,P.,P anekE.J.
J. Am. Chem. Soc., 89, 5302 (1967).
3. В ii c h i G„ Carlson J. A., J. Am. Chem. Soc., 90, 5336 (1968).
220
ИОНООБМЕННЫЕ СМОЛЫ (П, 62—71).
Кислые смолы (Н, 65, после выдержки из [17]). Модельную био-
генетическую циклизацию полиенов при катализе кислотами Льюиса
можно также осуществить с помощью катионообменных смол (ам-
берлит IR-20 и ХЕ-100) [17а]. Например, при циклизации метило-
вого эфира транс, mpawc-фарнезола (1) в присутствии смолы ХЕ-100
в уксусной кислоте образуется смесь продуктов (2), (3) и (4), кото-
рую можно разделить методом газовой хроматографии. Проведение
циклизации при 60° дает в качестве главного продукта бицикли-
ческое соединение (3) с выходом 42%.
Синтез пептидов на твердой фазе (II, 69, после выдержки из
[341). В настоящее время стал доступен продажный хлорметилиро-
ванный сополимер стирола с дивинилбензолом (2%) [34]. Подробно
описан [346] синтез на твердой фазе глицил- ь-аспартил- ь-серилгли-
цина.
Бензиловый эфир пептида можно переэтернфипировать при ком-
натной температуре метанолом или этанолом в присутствии сильной
анпонообменной смолы (Био-Рад AGI-X8; ОН “-форма). Эта реак-
ция удобна для снятия продукта со смолы в синтезе пептидов на
твердой фазе по Меррифилду [34в].
Для расщепления связи пептид-полимер с образованием эфира
пептида Бейерман [34г] предложил катализируемую третичными
аминами (триэтиламин, N-метилпиперидин) переэтерификацию. Ре-
акция проводится в мягких условиях (4—15 час, комнатная темпе-
ратура).
Анионообменные целлюлозы (II, 70, перед ссылками). Тенер и
сотр. [38а] перед разделением полинуклеотидов промывали смолу
0,1 н. раствором едкого натра, а затем 0,1 н. соляной кислотой.
Обработку повторяли дважды и обменник (в форме хлорида) отмы-
вали ст кислоты дистиллированной водой. Мелкодисперсные части-
цы удаляли двукратной декантацией.
221
17a. Mor iy ama H., Sugili ara Y., N'akanishi K., Tetrahedron Let-
ters, 2851 (1968).
346. Merrifield R. В., С о r i g 1 i a n о M. A., Biochem. Preparations,
12, 98 (1968).
34b. Halpern B,, Chew L., Close V., P a t t о n W., Tetrahedron Let-
ters, 5163 (1968).
34r. Bevcrman IL С., H indr Iks H., de L e e г E. W. B., Chem. Comm.,
1968, 1668.
38a. Tener G. M., Khorana H. G., M arkham R., P о 1 E. H., J. Am.
Chem. Soc., 80, 6223 (1958).
ИРИДИЕВЫЙ КАТАЛИЗАТОР.
Катализатор, полученный по методу Адамса, пригоден для вос-
становления ароматических нитросоедпнений в арилгидроксил-
амины [I].
1. Т а у а К., Chem. Comm., 1966, 464.
ИРИДИЙ НА СУЛЬФАТЕ БАРИЯ ИЛИ КАРБОНАТЕ КАЛЬЦИЯ-
Максимальная стереоспецифичность восстановления метиленового
соединения (I) до 1бр-метильного производного (2) достигается при
использовании иридия, осажденного на сульфате бария или карбо-
нате кальция; при этом образуется менее 2% 16а-метил изомер а. Пла-
тиновые катализаторы менее стереоспецифичны [I].
СН,ОАс
1
со
(.Gregory G. I , Hunt J. S,, М а у Р. J., N i с е F. А., Р h i i 1 i p s G. H.
J. Chem. Soc., (C), 1966, 2201.
ИРИДИЯ ТЕТРАХЛОРИД, IrCI.,. Мол. вес 334,03, коричневато-
черная гигроскопичная масса.
Как отмечалось ранее (IV, 134), при восстановлении 4-tnpem-
бутилциклогексанона в рпс-4-/лреш-бутилциклогексанол Илиел и
Дойль использовали трихлорид иридия. Однако этот реагент дол-
гое время не был доступен; в новой методике [II в качестве катали-
222
заторов используют И. т. в сочетании с триметилфосфитом, который
гидролизуется до фосфористой кислоты. Активным восстановитель'
пым агентом является, по-видимом у, производное иридия, содержа-
щее одну или более молекул фосфита в качестве лигандов. К раст-
вору И. т. (0,012 моля) в 4,5 мл коыц. соляной кислоты добавляют
50 мл триметилфосфита и этот раствор прибавляют к раствору 0,2 мо-
ля 4-т/жт-бутил циклогексанона в 635 мл изопропанола в колбе на
I г сно
(сн3)3с.
(СН3О)ЭР, (СН3)2СНОН (СН3)3С
2 л, снабженной обратным холодильником. Смесь кипятят 48 час,
изопропанол удаляют на роторном испарителе при пониженном
давлении, остаток разбавляют 250 мл воды и экстрагируют эфиром
(четыре порции по 150 мл). После концентрирования высушенного
экстракта получают ^ис-спирт в виде белого кристаллического ве-
щества. Перекристаллизация из 60%-ного водного этанола дает
продукт более чем 99%-ной чистоты, т. пл. 82—83,5°.
1. Е I i е 1 Е. L., D о у 1 с Т. W., Hutchins К. О., Gilbert Е. С., proce-
dure submitted to Org. Syn. (1968); the procedure was first described by H a d-
rl a d Y.M. H., Henbost H. В., H usb a л ds J., M i t c h e I 1 T. R. B.,
Proc, Chem. Soc., 1964, 361.
КАЛИЯ ГИДРИД (И, 76).
Для изомеризации циклооктадиенов в 1.щс-бицикло-[3,3,0]-октен-2
К. г.— более подходящий реагент, чем фенилнатрий, фенилкалий
и металлический калий [11.
К. г. активнее гидрида натрия как катализатор селективного
гидрирования пентадиенов-1,3 и пентина-2 в w-пентены. К- г. уско-
ряет гидрирование несопряженных диенов в моноолефины.
1. S 1 a u g h L. Н., J. Org. Chem., 32, 108 (1967).
КАЛИЯ ГИДРООКИСЬ (И, 77—80, перед ссылками).
Раствор метилового эфира левопимаровой кислоты (Г) и 5 мол. %.
К. г. в смеси эфир — метанол помещают в трубки Кариуса, уда-
ляют растворитель при пониженном давлении в атмосфере азота,
трубки запаивают в вакууме и нагревают на масляной бане при
200° (Лоуренс и сотр. [10]). Через определенные интервалы времени
трубки вскрывают и реакционную смесь анализируют на газо-жид-
костном хроматографе. Найдено, что реакция заканчивается через
24 час и приводит к четырем новым соединениям, изомерным лево-
пимаровой кислоте, три из которых были идентифицированы как
(2), (3) и (4). Во всех трех соединениях кольцо С ароматическое;
в (2) раскрыто кольцо В, а в (3) и (4) раскрыты кольца А и В.
W (2) 23%
Стране зо%
10. Taked а II., Schuller \V. Н., Lawrence R. V., J. Org. Chem.,
33, 3718 (1968).
224
КАЛИЯ ИМИНОКСИЛДИСУЛЬФОНАТ (П, 81—83).
Получение. Синг [1а| разработал улучшенную методику полу*
чения реагента, основанную на патенте Тейбера. Из нитрита натрия,
бикарбоната натрия и двуокиси серы с последующим окислением
перманганатом калия при контролируемом pH получают гидроксил*
аминдисульфонат натрия HON(SO3Na)s. Двуокись марганца уда-
ляют центрифугированием и фильтрованием. Соль Фреми выделяют
из фильтрата после добавления КС1 и перекристаллизовывают из
1 н. КОН. Полученный таким путем реагент можно хранить на
холоду в течение нескольких месяцев.
(Перед ссылками.) Под действием К. и. метиловый эфир 3-окси-
4-метоксифенилаланина (1) подвергается окислительной циклизации
в производное индола (2) [91.
Изотопной меткой О18 было показано, что при получении хинона
из фенола вторая кислородная функция образуется за счет К. и.,
что подтверждает следующий механизм реакции [10]:
H4/O^N(SO3K)3
|| j -Ц2 O18N(SO3K)3 || || +HON(SO3K)a
V \/
I
он о
1
О18
/\
|| || +HN(SO3K)3
При изучении окисления фенола (3), родственного антибиотикам
группы митомицина, было найдено [11], что необходимо использо-
8 № 1994
225
вать избыток К- и. и слегка повышенную температуру; при этом
альдегидная группа частично превращается в альдоксимную (5).
(3) 3,95 г
(4> 1,43г (сырой) (51 р 20 г (сырой)
la. S i n g h R. Р., Can. J. Chem., 44, 1994 (1966).
9. Wilcox M. E., W у 1 с r H., Mabry T. J., D r e i d i n g A. S., Helv.
Chim. Acta, 48, 252 (1965).
10. Teuber H.-J., Dietz К. H., Angew. Chem., Internat. Ed., 4, 871 (1965).
11. R о t h R. H., R e m e r s W. A„ We iss M. J., J. Org. Chem., 31, 1012
(1966).
КАЛИЯ ПЕРМАНГАНАТ (П, 84—97, перед ссылками).
Этот метод был также использован для получения 1- и 2-антраль-
дегидов из соответствующих метил кетонов [32а].
Окисление аминов. Первичные, вторичные и третичные
амины, имеющие атом водорода в «-положении по отношению к ами-
ногруппе, подвергаются окислительному гидролизу до соответст-
вующих альдегидов или кетонов под действием буферного раствора
К. п. в теплом водном трет-бут:аноле [3261.
(CH3)3CHNHa
сна—chnh2
I [
сна-сн2
КМпО» — вода. (СНДзСОН __
8 2»/ ( 3)2 —
КМпО, - вода. (СНЩСОН СН2—СО
СН2--СНй
71%
32а. Ferrari J. L., Hunsberger 1. М., Gutowsky Н. S., J. Am.
Chem. Soc., 87, 1247 (1965).
326. Rawalay S. S., Sliechter H., J. Org. Chem., 32, 3129 (1967).
КАЛИЯ ПЕРСУЛЬФАТ (П, 97—99, перед ссылками).
Реакция Байера — Виллигера. 2-Алкилциклопентаноны окис-
ляются под действием К- п. в водной серной кислоте до 6-лактонов
[91.
KjSaOs ~рззб.Н23О4
R %
СН3 28,6
M-CjHxj 51,2
Н -С8Н17 45,7
9. Р а г I i m е п t Т. Н., Р а г 1 i m е и t
Ind., 1966, 1845.
М. W., Fager son I. S., Chem.
КАЛИЯ ПЕРСУЛЬФАТ — СЕРЕБРА НИТРАТ.
Для окисления 5-оксиметилурацила в урацил-5-альдегид это
226
сочетание реагентов почти так же удовлетворительно, как двуокись
марганца, полученная по Аттенборро [I].
K„SO; - AgNO3
70-90%
О
JI /СНО
1. Brossmcr R,, Z i е g 1 е г D., Tetrahedron Letters, 5253 (1966).
КАЛИЯ ФЕРРИЦИАНИД (II, 102-107).
Окисление фенолов (II, 102—104, после выдержки из [6]). Дим-
рот и сотр. [6а] описали получение стабильного радикала 2, 4, 6-
трифепилфеноксила (4).
н5с6
I) I-I»SO4 — Na NO»
в АсОН
2) Гидролиз
K3Fe(CN%
Эфир-водн.
NaOH
8 1-9! %
сйн5 Ч- о.
н
(II, 106, перед ссылками.) Под действием щелочного К. ф.
2, 4, 5, 6-тетрафенилрезорцин (1) окисляется до тетрациклоиа (2)
с выходом 27% [201. Окисление можно также осуществить с помощью
Двуокиси свинца или о-хлоранила, но с меньшими выходами. 2,4,6-
Грифенилрезорцин (3) при окислении превращается в 2,3,5-трифе-
н и л циклопента диен (4), а 2,4-дифенилнафторезорцин (5) — в 2, 3-
8* 227
дифенилинденон-1 (6); выходы продуктов (4) и (6) не указаны.
6а. D i m г о t h К., Berndt A., Perst Н., R e i c h a r d t C.f procedure
submitted to Org. Syn. (1967).
20. GQsten H., Kirsch G.,Sch ul t e - Frohl hide D., Angew. Chem.,
Internat. Ed., 6, 948 (1967).
КАЛИЯ ФТОРИД (II, 107—109).
Катализатор конденсации (II, 107—108, после выдержки из
[5]). Под действием К. ф. (2,74 моля) в тетраметиленсульфоне при
195—200° хлорангидрид у-хлор масля ной кислоты (0,71 моля) пре-
вращается с 70%-ным выходом во фторангидрид циклопропанкарбо-
новой кислоты [5а]. Доказано, что реакция осуществляется в две
стадии: хлорангидрид превращается во фторангидрид, который за-
kf ZH
С1(СН3)3СОС1----------> C1(CH2)3COF-------I
195—200° V 73 195-200° СН / 4 С OF
тем циклизуется К. ф., действующим как основание. Замена К. ф.
менее доступным фторидом цезия на выход продукта не влияет.
Получение а, р-непредельных альдегидов (II, 109, перед ссыл-
ками). С целью осуществления обмена галогенов Эл кик [11] обраба-
тывал этиленкетали а-хлор- и а-бромальдегидов К. ф. в кипящем
этиленгликоле в течение 10—15 час. Однако в результате происхо-
дило дегидрогалогенирование с образованием а, ^-непредельных
228
этпленксталеп (выход 60—80%). Свободный альдегид выделяли об-
менной реакцией с ацетоном, катализируемой щавелевой или лимон-
ной кислотой (выход 50 — 80%).
5а. Dear R. Е. A., G i I b е г t Е. Е., J. Org. Chem., 33, 1690 (1968).
II. Elkik Е., Bull. sqc. chim. France, 1965, 283.
КАЛЬЦИЙ — ЖИДКИЙ АММИАК (Н, 110—III). Удаление
ацетоксильной группы из (1) достигается реакцией с кальцием в
жидком аммиаке, но не может быть осуществлено при кипячении
с цинком в уксусном ангидриде [31
3. В а г g s t a h 1 е г A. W., Sticker R. Е., Tetrahedron, 24, 2435 (1968)
КАЛЬЦИЯ БОРГИДРИД. Мол. вес 69,79.
Получение [11 К- б. в твердом виде получают реакцией безводного
хлористого кальция с бор гидридом натрия в ТГФ при перемешивании
в течение 4 — 8 час. После удаления хлористого натрия центрифуги-
рованием и испарения растворителя получают кристаллический
аддукт К. б. и ТГФ. Реагент можно также получать in situ при вза-
имодействии йодистого кальция и боргидрида натрия в ТГФ.
Восстановление. Реагент используют для восстановления эфиров
карбоновых кислот до первичных спиртов. Например, до соответ-
ствующих карбинолов были восстановлены этиловые эфиры п-
нитробензойной кислоты (выход 96%), фенилуксусной кислоты
(выход 90%) и глицина (выход 70%) [I]. Эта реакция весьма инте-
ресна во многих отношениях: можно использовать гидроксилсодер-
жащие растворители (этанол, вода); восстановление более избира-
тельно, чем в случае литийалюминийгидрида; реагент почти нейт-
ральный. Было найдено [21, что К- б.— подходящий реагент для
восстановления диметилового эфира 4, 4'-динитро-2, 2'-дифеновой
кислоты (1а) до соответствующего спирта (16) (выход 51%).
OaN-<^ no2
XR R/
(la) R=COOCH3
(16) R=CH2OH
.Реагент также пригоден для восстановления альдегидов и кето-
нов 13]. Так, с его помощью было осуществлено стереоспецифическое
восстановление ацет амин окето на (2) до т^ео-диола (3) с 70%-ным:
229
выходом [4]:
NHAc
n-O2N-C6H4—С-С-СН,ОН Са(ВНД
II I ' 70%
о и
(2)
Н NHAc
I I
—> n-O3N —СеНа-С-С—СН,ОН
I I
ОН н
(31
Восстановление (2) бор гидридом натрия приводит к смеси трео-
(25%) и эритро- (47%) диолов.
I. К о 1 I о и i t s с h J., F и с h s О., Gabor V-, Nature, 175, 346 (1955).
2. Dvorken L. V., Smyth R. B,,Mi s 1 о w K., J. Am. Chem. Soc., 80,
486 (1958).
3. Koi Ion itsch J., Fuchs O., Gabor V., Nature, 173, 4949 (1954).
4. L e v a 1 L , F о d о г G., R i t v а у - E m an d i t у К., Fuchs О., H a-
jos A., Chem. Ber., 93, 387 (1960).
КАЛЬЦИЯ ГИДРИД (11, 111—112).
Ацилирование третичных спиртов [6] (II, 112, перед ссылками).
В присутствии гидрида или карбида кальция третичные спирты
ацилируются с хорошими выходами под действием карбоновых кис-
лот или ангидридов. Так, из mpem-бутанола и уксусного ангидрида
был получен mpem-бутилацетат с 80%-ным выходом. 17а-Метил-
тестостерон ацилируется с выходом 89—96%.
6. О р р е п а и е г R. V., Monatsh., 97, 62 (1966).
КАЛЬЦИЯ КАРБОНАТ (II, 113—114).
Перегруппировка тозилатов (II, 114, перед ссылками). В про-
цессе разработки синтеза простагландина Орр п Джонсон [61 изу-
чили метод, в котором построение пятичленного цикла простаглан-
динового скелета достигается за счет модификации шестичленного
(7) (8) (9)
кольца. Исходным соединением для этого послужил циклогексан-
дион-1,4 (7), который обычным способом превращается в смесь
эпимерных дитозилатов (8). После этого смесь кипятят с карбонатом
230.
кальция в ДМФА в течение 2,5 час. Ожидаемый продукт (9) полу-
чается с выходом 88%. Одно из преимуществ этого метода состоит
в том, что кетогруппа образуется в положении, удобном для после-
дующего введения аллильной гидроксильной группы в боковую
цепь.
6. О г г D, Е., J о h п s о n F. В., Сап. J. Chem., 47, 47 (1969).
<Л10-КАМФОРСУЛЬФОКИСЛОТА (II, 115).
Новый метод разделения кетонов на оптические изомеры основан
на образовании иммониевой соли енамина, содержащей оптически
активный анион [2]. Кетон (I) превращали в пирролидин-енамин (2),
который обрабатывали К- (3). Образующуюся при этом соль (4)
разделяли на энантиомеры последовательной кристаллизацией.
Затем каждую энантиомерную соль кристаллизовали и гидроли-
зовали до чистого энантиомерного кетона (1).
d,/-Кетон (5) образует енамин с большим трудом, однако он был
разделен следующим образом: 7,7 г вещества растворяли в 45 мл
горячею абсолютного этанола и добавляли 6,4 г перхлората пирро-
лидина [31 и две капли пирролидина. Перхлорат енамина кристал-
лизовали и обрабатывали d-камфор-10-сульфонатом калия в аб-
231
солютном метаноле. После кристаллизации были получены энантио-
мерные соли, из которых выделили (-г)- и (—)-кетоны.
(5)
2. Adams W. R., Chapman О. L., Sieja J. В., Weis tea d W. J.,
Jr., J. Am. Chem. Soc., 88, 162 (1966).
3. Leonard N. J.,Paukstelis J. V., J. Org. Chem., 28, 3021 (1963).
КАРБМЕТОКСИМЕТИЛЕНТРИФЕНИЛФОСФОРАН (II, 116—
118, после выдержки из [3]).
Взаимодействие 3[3-ацетокси-20-кето-21-иод-А 5-прегнена (1) с К-
служит удобным методом синтеза метил-Зр-ацетокси-20-кето-21-нор-
5-шранс-22-холадиената (2). Эта реакция была использована в син-
тезе изокарденолидов [За].
снгх
(0
+ (C4HS)3P=CHCOOCH3
За. Pettit G. R.,Green В.,Das Gupta А. К., \V h i t е h о u s е Р. А.,
Y a r d I у G. V., J. Org. Chem., in press.
и-КАРБОКСИБЕНЗОЛСУЛЬФОНИЛАЗИД, n-HO2CCfiH4SO2N3.
Мол. вес 227,20.
Получение [I ]. Монокалиевую соль п-карбоксибензолсульфокис-
лоты обрабатывают хлорсульфоновой кислотой и образующийся
n-карбоксибензолсульфохлорид обрабатывают азидом натрия.
Введение диазогруппы [1|. Обычно для реакций введения ди-
азогруппы использовали n-толуолсульфонилазид; однако образую-
щийся при этом п -толуолсульфамид трудно отделяется от диазо-
соединения. Хендриксон и Вольф [1] обнаружили, что литиевая и
триэтил аммониевая соли К- растворимы соответственно в ТГФ и
ацетонитриле, а триэтиламмониевая соль ц-карбоксибензолсульф-
амида в ацетонитриле практически нерастворима. По стандартной
методике раствор карбоксиазида получают в ацетонитриле при
добавлении триэтиламина. После добавления соединения с активной
метиленовой группой в течение часа отделяется соль карбоксиамида.
Ее отфильтровывают и диазосоединение выделяют обычным способом.
Этим методом был получен 2-диазодимедон (2) с выходом 86% (при
232
использовании тозилазида выход 42%)
+ ho2cc6h4so2n3
+ I-1O2CC6H4SO8NH2
Возможны варианты этого метода. Например, можно формида-
ровать активную метиленовую группу и ион образующегося произ-
водного обрабатывать К.:
Ацетоуксусный эфир можно моноалкилпровать и затем вводить диа-
зогруппу с отщеплением ацетильной группы:
ChI3COCH2CO2R' CH3COCHCO8R' RCCO2R'
I и
R Ng
1. Hendrickson J. В., W о I f W. A., J. Org. Chem., 33, 3610 (1968).
я-КАРБОКСИФЕНИЛБОРНАЯ КИСЛОТА, n-HO2CCfiH4B(OH)2.
Мол. вес 135,97, т. пл. 225°.
Реагент получают окислением щтолилборной кислоты перманга-
натом калия в щелочном растворе [I].
п КМпО4—NaOH. нейтр.
(Oil---------------HOgCC^H^D^Ori^g
(1) (2)
Агоста 12] использовал К. к. в качестве вспомогательного реа-
гента для разделения при доказательстве нового типа оптической
активности. Летсингер и Гилпин [31 конденсировали 1,8-ДИлитий-
нафталин с аценафтенхиноном и получили диол (3) в виде кристалли-
233
ция. в которой расстояние между
ческого вещества с т. пл. 319—321 °, которое окисляли тетраацетатом
свинца в 1, 8-нафтоилнафталин (4). Анализ на молекулярных моде-
лях показывает, что в (4) возможна одна довольно жесткая изогну-
тая конформация (5) без нарушения валентных углов, в которой
карбонильные группы лежат в плоскости, образующей одинаковый
угол по отношению к обоим ароматическим кольцам. Эта конформа-
карбонильными группами состав-
ляет всего 2,5 А, благоприятству-
ет трансаннулярной реакции ди-
кетона, как это показано фо-
товосстановлением. Облучение
разбавленного раствора этого
соединения в изопропаноле при-
водит к тождественному (3) пи-
накону (6) с 55%-иым выходом.
Трансаннулярная реакция, приводящая к образованию кислородно-
го мостика, легче всего осуществляется при гидратации. При крат-
ковременном нагревании раствора дикетона (5) в уксусной кислоте,
содержащей разб. соляную кислоту, происходит практически ко-
личественное превращение в гликоль (7).
(5) х = н (6) х = н
Кипячение
АсОН- разб". НС[
СООН
Агоста [21 при нитровании гликоля [(6), X — Н| получил в ка-
честве единственного продукта соединение, охарактеризованное как
4-нитропроизводное [(6), X = NO3]. Если эта
молекула действительно неплоская, то ни-
трозаместитель должен создать возмож-
ность для молекулярной асимметрии. Ис-
ходя из этого, нитропроизводное обрабаты-
вали К- к. в бензоле с водоотделителем и
получили циклическую диоксабороланкар-
боновую кислоту (8) — соединение, которое
можно непосредственно использовать для
разделения на оптические изомеры. Карбо-
новая кислота (8) образует с хинином
кристаллическую соль, которая после че-
тырехкратной кристаллизации (aD—37,4°),
выделения органической кислоты и гидро-
234
лиза дает оптически активный нитрогликоль [(6), X = NC)21. Рас-
щеплением правовращающего изомера [(6), X = NO2I тетраацетатом
свинца был получен оптически активный дикетон 1(5), X — NO,,|,
рацемизацию которого наблюдали поляриметрически в хлоро-
формном растворе.
J. Michaelis A., Ann., 315, 19 (1901).
2. A g о s t a W. С., J. Am, Chem. Soc., 89, 3505 (1967); 89, 3926 (1967).
3. Letsinger R. L., G i 1 p i n J, A., J. Org. Chem., 29, 243 (1964).
n-КАРБОКСИФЕНИЛДИАЗОНИЙХЛОРИД [1],
n-HO2CC(iH4N=NCl.
Реагент, полученный in situ диазотированием n-аминобензойной
кислоты нитритом натрия в кислой среде, взаимодействует с соеди-
нениями, содержащими активную метиленовую группу (при pH<6,
чтобы избежать образования производного формазана) с образова-
нием и-карбоксифенил гидразонов, которые как одноосновные кис-
лоты могут быть оттитрованы 0,1 н. NaOH.
ho8cc6h4n^nci- + h2c/ ho2cc(;h4n = n-ch^ Z—
Z2 HO2CC6H4NHN=c/
1. F r i c d i g e г A., V e s t e r g a a г d J. H., Veibel S., .Monatsh,, 98,
1234 (1967).
N, N'-КАРБОНИЛДИИМИДАЗОЛ (П, 119—121).
В работе [Jal подробно описано получение реагента с выходом
80-94%.
(II, 12!, перед ссылками.) К. был использован для введения кар-
бонильной группы при получении пятичленных гетероциклических
систем, исходя из производных о-фенилендиамина (I), этиленди-
(nij
hoch2ch2nh
235
амина (II) и 2-фениламиноэтанола (III). Реакция осуществляется с
хорошими и даже очень хорошими выходами в ТГФ или смеси ТГФ—
бензол при 25—65° [12]. Ранее для подобных синтезов использо-
вали высокотоксичный фосген, причем для циклизации требовались
более высокие температуры.
la. Staab Н. A., Wendel К., Org. Syn., 48, 44 (1968).
12, W г i g 1) t W. B,, Jr,, J, Heterocyclic Chem., 2, 41 (1965).
1.1-КАРБОНИЛДИ-1. 2. 4-ТРИАЗОЛ, (1) (II, 121). Мол. вес
164,13.
(i)
В т. II реагент был неверно назван N, N'-карбонилди-симм-
триазолом. Строение установлено по данным спектров ЯМР [2],
2. Р о t t s К- Т., С г a w f о г d Т. Н., J. Org. Chem., 27, 2631 (1962).
КАРБОНИЛЦИАНИД, O=C(CN)2. Мол. вес 80,05, т. пл. -38°,
т. кип. 65—66°. Внимание! К. бурно реагирует с водой с образова-
нием цианистого водорода и двуокиси углерода.
Получение. Удобную методику, обеспечивающую высокий выход
реагента, разработал Мартин [1]. В колбу загружают смесь диэтил-
фталата и окиси тетрацианэтилена и добавляют по каплям ди-н-
бутилсульфид, поддерживая температуру 50°.
NCS CN
Ус__С С
NC'XQ/^CN
4- («-c4H9)as
NC.
------> >С-0 4
86—9 1% NCZ
н-С4Н9ч CN
XS = C-/
4'CN
Применение. При взаимодействии co спиртами и фенолами К.
образует эфиры цианмуравьиной кислоты; с первичными и вторич-
ными аминами он дает циаиформамиды; с N, N-диметиланилином —
[n-(CH3)2NC6H4hC (CN)2; с пирролом — 2-цианоформилпиррол.
К. реагирует с олефинами типа С=С—СН, а с некоторыми сопряжен-
ными диенами вступает в реакцию Дильса — Альдера с образова-
нием дициандигидропиранов.
1. М а г t i n Е. L,, procedure submitted to Org. Syn. (1968).
М-КАРБЭТОКСИ-2-ЭТОКСИ-1,2-ДИГИДРОХИНОЛИН. Мол.
вес 247,29, т. пл. 63,0—65°.
I
СО2С2Н5
236
Получение. Это интересное псевдооснование, впервые описанное
Белло и сотр. [11, теперь легко получается по следующей упрощен-
ной методике [21.
Смесь 92 мл (2 моля) абсолютного этанола и 155 мл (1,07 моля)
триэтиламина добавляют по каплям при перемешивании к хорошо
охлаждаемой (—5е) смеси 97 мл этилхлорформиата и 130 г (1 моль)
хинолина в 300 мл бензола. После перемешивания в течение часа
смесь промывают водой и водный слой экстрагируют хлороформом.
Объединенный органический раствор досуха выпаривают в вакууме.
При добавлении к остатку небольшого количества эфира (20 мл)
образуется белый твердый осадок, его собирают и промывают хо-
лодным эфиром; выход 140 г, т. пл. 63,5—65°. Из маточного раствора
после стояния на холоду в течение ночи дополнительно выделяют
25 г продукта; общий выход составляет 66%.
C2H5CO2C1
СгНэОН^
Реагент активирует конденсацию ациламииокислот с эфирами
аминокислот, которая осуществляется с высоким выходом в бензоле,
этаноле или ТГФ при комнатной температуре. Например, Bz-Leu-
Gly-OEt ([ccId—33,5°) был получен с выходом 95%; очень чувстви-
тельная проба Юнга указывает на отсутствие рацемизации. Акти-
вация карбоксильной группы состоит в промежуточном образовании
смешанного ангидрида [3].
1. В е 1 1 е а и В., М а г t е I R., Lacasse G., Menard М., Wein-
berg N. L., Р е г г о n Y. G., J. Am. Chem. Soc., 90, 823 (1968).
2. Belleau В., personal communication.
3. Belleau B., Malek G., J. Am. Chem. Soc., 90, 1651 (1968).
КЕТЕН (II. 125—129, перед ссылками).
Группа исследователей [181 занималась изучением ацетилиро-
вания стероидов с третичной гидроксильной группой (I). Обычные
кислотные катализаторы вызывают дегидратацию с образованием
Ап,1е-диена и поэтому непригодны. Ацетилирование (1) было осу-
ществлено (однако лишь с 20%-ным выходом) при использовании
237
К. и трет-бути лата калия в ТГФ. Сила основания, требующегося
для этой реакции, должна повышаться со стерической затруднен-
ностью гидроксильной группы.
18. Gardner J. N., Popper Т. L,, Carlon F. Е., Gnoj О., Her-
zog H. L., J- Org. Chem., 33, 3695 (1968).
КЕТЕНИЛ ИДЕНТРИФЕНИЛФОСФОРАН, (CGH5)3P=C-C-O.
Мол. вес 302,29, т. пл. 172—173,5°.
Получение этого устойчивого, но реакционноспособного фосфор-
органического соединения впервые было описано сотрудниками
фирмы «Монсанто;,-. На схеме показан наиболее подходящий из не-
скольких .описанных в литературе методов получения реагента [11;
Й'2,5 чис
S6- 1 10° + Води. Na,СО,
2(СвН,)аР-уСН2Вгг(Н.2) —> (С6Н5)3Р-—СН2—P(Cf>HB)3-----—>
(1) зь‘" Вг" Вг“
(2)
Н к, диглим (150°)
—* (CaHs)3P — С -- Р (Сг,Н5)з--—-------->
|. ' 4 /I)
Вг-
(3)
СО,, диглим
-> (СффЬР==С = Р (СвН5)з —^7—
(4)
(СбНГ1);}Р< + - /О JC|5O
\с—СД----------► (СвН5)3Р=С=С=О4-(С6Н5)3РО
(СЙНД}Р" "'О 19-^«
(5) (6) (7)
Трифенилфосфин (1) нагревают с бромистым метиленом в атмосфере
азота и получают метилен-бпе-(трифен и лфосфон и й)-бромид (2) [2].
Затем по методу Рамиреца и сотр. [3] бис-бромид обрабатывают вод-
ным карбонатом натрия и получают монобромид (3), который по
Бёруму и /Мэтьюсу [41 при обработке металлическим калием в диг-
лиме дает желтый кристаллический гексафенил карбодифосфоран
(4). Продукт перемешивают в диглиме в атмосфере азота и обраба-
тывают током двуокиси углерода. По мере взаимодействия желтая
окраска соединения (4) постепенно исчезает и образуется белый
продукт (5). На последней стадии синтеза при нагревании (5) в ди-
глиме при 145° осуществляется расщепление до К- (6) и окиси три-
фенилфосфина (7). Для получения К. в виде белых игл удовлетвори-
тельной чистоты (т. пл. 172—173,5°) необходима пятикратная кри-
сталлизация, поэтому выход продукта довольно низкий.
Бёрум и Мэтьюс указывают [1], что « в большинстве опытов (в
пяти случаях) аддукт (4) с двуокисью углерода нагревали в диглиме
при температуре около 120—125° (а не 140—145°). Образующийся
желтый раствор, содержащий приблизительно эквимолярную смесь
К. и окиси трифенилфосфина, можно затем непосредственно исполь-
238
зовать как источник К., так как окись трифенилфосфина легче от-
делить от аддуктов К., чем от самого К.».
Реакции. Новые реакции и соединения, полученные сотрудни-
ками фирмы «Монсанто», указаны в заголовках последних работ:
Мезомерные фосфониевые дикатионы 14];
Образование илидов при реакциях с нуклеофилами [4];
Мезомерные фосфониевые внутренние соли [5];
Устойчивые четырехчленные циклические аддукты илид — кетон
161;
Реакции 2,2-бнс-(трифтор метил) -винилидентрифенилфосфорана,
полученного из циклического аддукта илид — кетон [7];
Реакции циклоприсоединения кетенилидентрифенилфосфорана
181;
Синтез иминокетенилидентрифенилфосфоранов 19].
1. В i г um G. Н., М a 11 hews С, N., private communication.
2. D r i s с о I 1 J. S., G r i s 1 e у D. W., Jr., Pust ingcr J. V., Har-
ris J. E., Mat the w s C. N., J. Org, Chem., 29, 2429 (1964).
3. Ramirez F., Desai N. B., Hansen B,, McRel vie N. J. Am
Chem. Soc., 83, 3539 (1961).
4. Birum G. H., .Matthews C. N., J. Am. Chem. Soc., 88, 4198 (1966)’
Tetrahedron Letters, 5707 (1966).
5. Malt hews C.N.,Driscoll J.S., Birum G. FL, Chem. Comm., 1966,
736.
6. Birum G. H., Matthe w s C. N., Chem. Comm., 1967, 137.
7. Birum G. H., Ma t Hi ews C. N., J. Org. Chem., 32, 3554 (1967).
8. Birum G. FL, M althe w s C. N., J. Am. Chem. Soc., 90, 3842 (1968).
9. Birum G. H.,Matthe w s C. N., Chem. Ind., 1968, 653.
КИСЛОРОДА ДИФТОРИД (II, 130, перед ссылками).
Меритт [4] установил, что тетраметилаллен (1) поглощает 1 экв
OF2 при —78° с образованием двух летучих продуктов, которым
приписано строение (2) и (3).
О
(СН3)гС = С = С(СН3)2 + ОР2-~* (СН3)2С-С-С(СН3),+
(I) I 1
F F
G)
О
11 /СН.
+(СН3),С-С-СД
1 чсн3
F
(3)
4. М er г i t t R. F., J. Org. Chem., 30, 4367 (1965).
КОБАЛЬТА(П) АЦЕТАТ, Co(OCOCH3).,. Мол. вес 201,05.
Окислительное расщепление 1,2-диолов. Реагент катализирует
расщепление 1,2-гликолей кислородом в апротонных полярных раст-
ворителях (бензонитрил, ДМФА, сульфолан). Выходы альдегидов
239
составляют 60—81%. Возможно и дальнейшее окисление до карбо-
новых кислот [I].
С8Н17СНСН2ОН 2^ С8НпСОаН -[-СН2О4-НаО
I
он
1. de Vries G., Sc hors A., Tetrahedron Letters, 5689 (1968).
КОБАЛЬТА ГИДРОКАРБОНИЛ (II, 132, перед ссылками).
При гидроформилировании пентена-1 К. г. выход альдегида зна-
чительно возрастает при добавлении бензонитрила; другие нуклео-
фильные агенты менее эффективны [4]. Кроме того, бензонитрил
подавляет изомеризацию пентена-1 в пентен-2.
4. Roos L.,Orchin М., J. Org. Chem., 31, 3015 (1966).
^с-(КОБАЛЬТТЕТРАКАРБОНИЛ)ЦИНК, Zn[Co(CO)J2. Мол.
вес 749,62.
Реагент в виде желтых кристаллов получают [I] в автоклаве,
куда в атмосфере азота помещают цинковую пыль и раствор дико-
бальтоктакарбонила в толуоле и пропускают под давлением окись
углерода (210 атм при 20°).
Применение. Как правило, олигомеризацию олефинов проводят
с комплексами переходных металлов нулевой валентности (моно-
ядерные катализаторы); реакция обычно приводит к множеству
диенов (см. II, 5—6). Шраузер и сотр. [1] пришли к заключению, что
двуядерный катализатор, например Zn [Co(CO)J2, в котором два
(2) Биснор-Б
кобальтовых центра тесно связаны друг с другом, должен приводить
к новому переходному состоянию, из которого могут образоваться
иные продукты. В качестве модельного опыта авторы провели ди-
меризацию норборнадиена в присутствии нового катализатора и
получили с почти количественным выходом единственный димер с
т. пл. 65—65,6°, который по данным элементарного анализа (СиН 16),
ИК-, ЯМР- и масс-спектров однозначно соответствует структуре
(2). Для краткости соединение было названо биснор-S, его
полное название — эндо,цис,эндо-гептацикло-15,3,1,12 ,е, 14,13,1w 11,
О3’5 0й’к1-тетрадекаи. В качестве рабочей гипотезы для объяснения
образования (2) была предложена структура (3): при допущении
свободного вращения атомов кобальта по оси Со—Zn—Со струк-
тура (3) является единственно возможным переходным состоянием,
в котором молекулы субстрата расположены достаточно близко для
240
образования связей биснор-S.
Описанная димеризация заметно катализируется эфиратом трех-
фтористого бора и хлористым алюминием.
I. Schr a uzer G. N., В a s t i а п В. N., F о s s е I i u s G. A., J. .Am. Chem.
Soc., 88, 4890 (1966).
КСЕНОНОВАЯ КИСЛОТА, H6XeO6. Мол. вес 233,35. К.к, полу-
чают гидролизом четырехфтористого или шестифтористого ксенона
[11.
Окислительный агент [2]. К.к. легко реагирует с вицинальными
диолами в нейтральной или щелочной среде с образованием газо-
образного ксенона и соответствующих карбоновых кислот.
I. D u d I е у F. В., Gard G., С a d у G. Н., Inorg. Chem., 2, 228 (1963).
2. J a s е 1 s k i s В., V a s S., J. Am. Chem. Soc., 86, 2078 (1964).
л
ЛЕВУЛИНОВАЯ КИСЛОТА (II, 134—136, перед ссылками).
По данным Пондера и Уолкера [10] присоединение хлористого
нитрозила к олефинам с последующим гидролизом аддукта Л. к.
(0,1 н. раствор в НС1) является удобным общим методом превращения
олефинов в соответствующие хлоркетоны. Выходы (в расчете на
олефин) составляют от 60 до 90%. Однако в случае цис- и транс-
/ NOX
X
I
-С-С-
стильбенов реакция не имеет места. Эти углеводороды образуют ад-
дукты, но при попытке проведения гидролиза отщепляют NOC1
и превращаются в исходные олефины.
10. Р о п d е г В. W., Wa Iker D. R., J. Org. Chem., 32, 4136 (1967).
ЛИТИЙ-АЛКИЛАМИННОЕ ВОССТАНОВЛЕНИЕ (П, 141 — 150).
(II, 143—144, после выдержки из 161). Бенкесер и Кайзер 161
описали метод восстановления нафталина литием и смесью этиламина
и диметиламина с образованием смеси Д°,10-окталина (82?^) и ДЬ9-
окталина. Побочный продукт удаляют селективным гидроборирова-
нием бис-{\,2-диметилпропил-1)-бораном и окислением перекисью.
Эта методика описана также в Org. Syn. [6а].
(П, 150, перед ссылками.) Боров ни и сотр. [19] обнаружили, что
при литий-аминном восстановлении хромана (1) в 5, 6, 7, 8-тетра-
242
гиДрохроман (2) сочетание этиламина и ди метиламина в соотношении
] : 1 (по объему) дает более высокий выход и более чистый продукт,
чем один этиламин или смеси других аминов. Продукт (2) превра-
щали далее в 6-кетононанолид (4).
ба. Kaiser Е. М., Benkeser R. A., procedure submitted toOrg. Syn. (1968).
19. Borowitz I, J., G on isG., Kelsey R., R appR., W i 1 1 iamsG.J.,
J. Org. Chem., 31, 3032 (1966).
ЛИТИЙ-АММИАК (11, 151 — 153, перед ссылками),
З-Метиловый эфир эстрадиола удается успешно восстановить
с применением лития и газообразного аммиака [81. Хотя выход
продукта ниже, чем при использовании жидкого аммиака, вся опе-
рация значительно упрощается.
Удивительно, что при восстановлении литием в смеси аммиака
и эфира ендион (1) превращается в циклопропанол (2) [9].
'• (2)
8. F i s h е г J. F., S m i t h L. L., Steroids, 9, 97 (1967).
9. Ven kat araman i P. S., R e u s c h W., Tetrahedron Letters, 5283 (1968).
ЛИТИЙ — ДИФЕНИЛ (II, 155—156, перед ссылками).
Если описанную в работе [2] реакцию Д1,4-3-кетостероидов с ли-
тием и дифенилом в ТГФ проводить при температуре от —60 до
—40\ то удается получить А4-3-кетостероиды (31. Реакция имеет
243
препаративное значение, так как введение Л'^двойной связи В
5р-3-кетостероиды осуществляется с низким выходом.
3. W i е I а и d Р., А п п е г G., Helv. Chim. Acta, 51, 1698 (1968).
ЛИТИЙ — НАФТАЛИН, (C1OHS) Li+.
Получение в растворе [1,2]. Л.— н. получают при перемешивании
чистых кусочков лития (1 моль) с 0,3—0,5 моля нафталина в сухом
ТГФ в атмосфере азота.
Димеризация диенов. Под действием Л.— н. циклооктадиен-1,3
превращается в димер (3) [2]. Димеризация изопрена приводит
к смеси 2,6-диметил октадиена-2.6 (4) и 2,7-диметил окта диена-2,6
(5) [3].
0) (2) (3)
сн3 сн3
I [ R“Li +
СН2 = С—СН = СНа + СНа=С-СН = СНг---►
сн3 сн3
I I
—> СН3С=СНСН2СНХ=СНСН3
(4)
сн3 сн3
I | R-L1 +
сн.,=с—сн=сн.-усн2=СНС=СН9 ——>
сн3 CHS
сн3с:=снснасн2сн=^сн3
(5)
С этилвиниловым эфиром Л.— н. дает 1-этилнафталин с выходом
от 40 до 60% [1].
Л.— н. также был использован для синтеза ацетиленовых дио-
лов [4]. Например, 3-метилбутин-1 -ол-3 (6) нагревали с 2 молями
Л.— н. и к полученному дилитиевому производному добавляли
циклогексанон; диол (7) был получен с 60%-ным выходом. Можно
также проводить реакцию ацетилена с двумя различными кетонами.
СН3 СН3
Н3С—с—С^СНф-/ \=О —> HoC-C-CscV \
t J \ / 6(W J I Z \ /
[ \-----/ /о | Н0/ X-----
он он
(6) (7)
Реакцию ацетиленов с а, [3-непредельными кетонами, приводящую
к соответствующим этинилкарбинолам, удобно проводить с Л.— н.
244
15]. Примером служит взаимодействие (3-ионона с ацетиленидом ли-
тия, приводящее к этинил-р-ионолу.
fi -Ионон
Этинил-Д-ионол
С помощью Л.— н. в ТГФ удобно алкилировать амины алкилга-
логепидами. Например, к раствору Л,— н. в ТГФ прибавляют ди-
бензиламин, а затем «-гексилбромид; выход N-гексилдибензиламина
составляет 90% [6], Для алкилирования высших аминов обычно
требуется металлический натрий.
I. Suga К., Watanabe S., Т о г i i I., Chem. Ind., 1967, 360; Suga K-,
Watanabe S., P a n T. P., Australian J. Chem., 21, 2341 (1968).
2. Suga K-, Watanabe S., К a m m a K., Can. J. Chem., 45, 933 (1967).
3. Suga K., Watanabe S., J. Chem. Soc. Japan, Ind- Chem., 69, 354 (1966).
4. Watanabe S., S u g a K-, S uzuki T., Chem. Ind., 1968, 1489.
5. Suga K., Watanabe S, Suzuki T., Can. J. Chem., 46, 3041 (1968).
6. S u g a K., Watanabe S,,Pan T. P., F u j i t a T., Chem. Ind., 1969, 78.
ЛИТИЙ — ЭТИЛЕНДИАМИН (II, 158—159, перед ссылками).
Под действием этого реагента 1,4-ди-т/?е/п-бутил бензол с прек-
расным выходом восстанавливается до 1,4-ди-т/л?т-бутилциклогек-
сена 13].
Li
Н2КСНгСН2ННг
54-54,5*
Тотарилметиловый эфир (1) не восстанавливается литием в жид-
ком аммиаке, однако при обработке более активным реагентом—ли-
тием и этилендиамином, дает смесь четырех продуктов. Главным
из них является тотарол (2) — продукт не восстановления, а деме-
245
тилирования. Три побочных продукта (3), (4) и (5) не содержат кисло-
родной функциональной группы [4!.
3. S t о 1 о w R. D., W а г d J. A,, J. Org. Chem., 31, 965 (1966).
4. В е n п е t t С. R., Cambie R. С., Tetrahedron, 22, 2845 (1966).
N-ЛИТИЙЭТИЛЕНДИАМИН [II, 159—163, после формулы (17)].
Было также исследовано взаимодействие реагента с сесквитер»
пенами, имеющими циклы средних размеров, и дитерпенами [2а].
(Перед ссылками.) Под действием Л., взятого в избытке, олефин
(1) изомеризуется в (2) с 92%-ным выходом [6]. Первоначально
ЫНгСНгСН21Ч1Д
' <щ% :
(з) л~ Пинен
бициклическому углеводороду, названному ортоделом, была при-
писана структура (2), но впоследствии он был идентифицирован
как р-пинен (3).
2а. Joshi В. N., С h а к г a v а г t i К- К., В h a t t а с h а г у у a S. С.,
Tetrahedron, 23, 1251 (1967).
6. Burgstahler A. W., Sticker R. Е., Tetrahedron, 24, 2435 (1968).
ЛИТИЯ АЛЮМОГИДРИД (11, 163—179),
Синтез азиридинов * (II, 178. перед ссылками). Рассмотренный
* Более поздние работы Котсра и сотр. см. Tetrahedron Letters, 1651, 5759
(1968); Tetrahedron, 24, 3681, 5677 (1968).— Прим, иерее.
246
синтез ^цс-2-бензил-З-фекил азиридина является общим для кеток-
симов, имеющих ароматический заместитель в а- или ^-положении
к оксиминогруппе, и для альдоксимов с ароматическим заместите-
лем в P-положении к оксиминогруппе [36].
Другие примеры:
н
ЩНЩСЩ
II
NOH
ЫА1Н4, ТГФ
С а Н 5С“-—“ С Н g
4NZ
н
н
LiA!H4, ТГФ
34%
КОП
н
Сс1-1аС—сщ
4n'
Катализатор гомогенного гидрирования. Под действием Л.а.
в ТГФ или диглиме ацетилены стереоспецифически восстанавливают-
ся до транс-олефинов, В одном случае при проведении реакции в
толуоле наблюдалось ^нс-присоединение [37].
Слау [381 показал, что Л. а. может действовать как катализатор
гидрирования ацетиленов и сопряженных диенов до олефинов
в ТГФ под давлением. Ацетилены восстанавливаются стереоспеци-
фически до /7г/7Д«г-олефинов. Экспериментами с изотопной меткой
показано, что Л. а. присоединяется к тройной связи или сопряжен-
ной диеновой системе с образованием металлалкилов, которые затем
подвергаются гидрогенолизу.
СНа = СНСН =CHCIi34-LiAlH4 — «-(С5Н9)ЫД1Н3 i н-С5Н10-]-Ш1Н4
32. Change to: J о г g с n s о п М. J., Т h а с h е г А. Г., Org. Syn., 48, 75 (1968).
36. К о t е г а К., К i t a h о п о k i К., Org. Syn., 48, 20 (1968).
37. М. a g о о n Е. F., S 1 a u g h L. Н., Tetrahedron, 23, 4509 (1967).
38. S 1 a u g h L. H., Tetrahedron, 22, 1741 (1966).
ЛИТИЯ АЛЮМОГИДРИДА И 3-О-БЕНЗИЛ-1.2-О-ЦИКЛОГЕК-
СИЛИДЕН-а-О-ГЛЮКОФУРАНОЗЫ КОМПЛЕКС [11.
Углеводная компонента соответствует формуле (1). Комплекс
получают при добавлении модифицированного сахара к перемеши-
ваемой суспензии LiAIH4 в сухом эфире. После прекращения выде-
ления водорода раствор кипятят с обратным холодильником в те-
чение 2 час. Было показано, что под действием комплекса осущест-
247
6
вляется асимметрическое восстановление ке-
тонов; при этом получаются оптически актив-
ные спирты только (S)-конфигурации, опти-
ческая чистота которых достигает 40%. С
другой стороны, если к комплексу добавить
этанол, то по мере увеличения его коли-
чества конфигурация образующегося вторич-
ного спирта изменяется с (S) на (R). При
этом стереоспецифичность достигает максиму-
ма, а затем уменьшается по мере добавления
этанола. Поскольку стереоспецифичность
чрезвычайно чувствительна к стехиометрии
комплекса, целесообразно использовать за-
ранее стандартизованные растворы алюмо-
гидрида лития.
Приведенная формула комплекса (2) поясняет его действие.
Восстановитель имеет два активных атома водорода (а) и (Ь), но
один из них (а) настолько сильно экранирован бензильной группой,
S-Конфигурация
что другой атом (Ь) оказывается расположенным в единственном
направлении к карбонильной группе кетона (3), при восстановлении
которого и образуется спирт S-конфигурации (4). При обработке
(6)
R-Конфигурация
248
комплекса (2) небольшим количеством этанола более реакционно-
способный атом водорода (Ь) замещается на этоксигруппу, и в обра-
зующемся при этом комплексе (5) для восстановления используется
яругой водородный атом (а) с образованием спирта R-конфигурации
я
Различие R- и S-конфигураций легко понять на моделях, в ко-
торых размеры шариков уменьшаются с уменьшением «старшин-
ства» групп: 4, 3, 2, 1 (рис. Л-1).
Рис. Л-L R- и S-копфигурации.
1. Lan dor S. R., Miller В. J., Tatchell A. R., J. Chem. Soc., (C),
1966, 1822, 2280; 1&67, 197.
ЛИТИЯ АЛЮМОГИДРИД — АЛЮМИНИЯ ХЛОРИД (11,173—
183).
Восстановление кетонов (II, 181 — 182, после выдержки из [13]).
Джонс и сотр. [13а] описали удобный метод синтеза 5а-андростано-
249
на-16 (4). Сначала конденсацией 5сс-андростанона-17 (1) с бензаль-
дегидом был получен сопряженный кетон (2). 17-Кетогруппу удаляли
восстановлением LiА1Н4 — A1CL и озонолизом продукта (3) полу-
чали (4). Использование одного гидрида приводит к 16-бензилиде-
нолу-170. Этим методом были также получены 5а- и 50-2-кетостерои-
ды из 5а- и 50-3-кетостероидов [136].
Эшби и Пратер [13в] изучали состав смешанных гидридов в эфире
и пришли к выводу, что при реакциях Li Al 1Т4 и A1CL в соотношениях
3:1, 1:1, 1:3 и 1:4 образуются А1Н3, Н2А1С1, НА1С1а и
HA1CL-5A1CL соответственно.
9. Change to read: D a i g n а ц 1 t R. A., E 1 1 e 1 E. L., Org. Syn., 47, 37 (19G7).
13. Change to read: E 1 i e 1 E. L., M a r t i n R. J. L., N a s i p u r i D., Org.
Syn., 47, 16 (1967).
13a. Bridgeman J. E., J ones E. R, H., Meak insG.D., W icha J.,
Chem. Comm., 1967, 898.
136. Fetizon M., Gramai n J.-C., Hanna I., Compt. rend-, (C), 1967, 929.
13b. Ashby E. С., P r a t h e r J., J. Am. Chem. Soc., 88, 729 (1966).
ЛИТИЯ БРОМИД (II, 186—187, перед ссылками).
Л. б. заметно ускоряет реакцию кадмийорганических соедине-
ний с хлорангидридами карбоновых кислот, ио не с кетонами. Этот
эффект был использован для улучшения синтеза сс-кетоэфиров [3].
(CH3)2Cd-РС1СОСО2С„Н5 -lBr' ТГФ> СН3СОСО,С,Н=
51%
3. к О I 1 о n i t s с h J., J. Chem. Soc., (A), 1966, 453, 456.
ЛИТИЯ /?//?ИС-(/г^т-БУТОКСИ)-ЛЛЮМОГИДРИД (II, 187—193).
(II, 187, после выдержки из [2]). Сиггинс и corp. [2а] детально
разработали методику восстановления 3,5-динитробензоилхлорида
в соответствующий
СОС1
альдегид.
Н
I
С = О
ТЛАЦ-НОЩСНаЩц дяглим (-78°) I
82-86%
ОА/'^/'4NO2
O2N/Z^z 4NO.
(11,193, перед ссылками.) Удивительно, что трициклический ди-
кетон (1), промежуточный в синтезе эстрона, стереоспецифически
восстанавливается до 17а-кетола (2) [19].
250
Восстановление 3,4,5-триметоксибензоилхлорида до 3,4,5-три-
метоксибензальдегида под действием Л. б. осуществляется более
гладко, чем по Розенмунду (74%) [20].
СОС1
сн=о
LiAlH(OBu)3, диглим (Ns)
НзСО/^/^ОСНз
ОСН3
79,5%
НзСо/^/'^ОСНз
ОСН3
Под действием Л, б, а-фторацилфториды с удовлетворительным
выходом восстанавливаются до фторальдегидов [21]. Восстановление
обычными методами часто сопровождается гидрогенолизом связи
C-F,
При восстановлении Л. б. хлор ан гидр иды кислот с хорошим
выходом дают насыщенные и ненасыщенные жирные альдегиды [22].
При осуществлении полного синтеза макроциклического лакто-
на, зеараленона (1), Тауб и сотр. [23] показали, что Л. б. восста-
навливает только менее затрудненную карбонильную группу 3,5-ди-
метоксифталевого ангидрида (2), однако при этом получаются также
5,7-диметоксифталид [(4), в результате последующего восстановле-
ния] и 3,5-диметоксифтал ев а я кислота [(5), в результате гидролиза].
Л. б. [или ди-шрет-бутоксиалюмогидрид лития] в сочетании
с солями переходных металлов, особенно кобальта, является очень
активным катализатором гомогенного гидрирования ]24|,
2а. S i g g i us J. E., Larsen A. A., A cker m a n J. H., С a r a b a t e-
a s C, D., procedure submitted to Org. Syn. (1968).
19. К ц о С. H., Taub D., Wendler N. L., J. Org. Chem., 33, 3126 (1968),
20. Avers D.C.,Carpenter B. G., Dennev R. C., J. Chem. Soc., 1965.
3578.
21. BergmannE. D.,Cohen A., Tetrahedron Letters, 1151 (1965).
24 V a n k a t a R а о P., R am ach a n dra и S., Cornwell D. G., J.
Lipid Res., 8, 380 (1967).
251
23. Taub D.,- G irot ra N.N., Hoifsommer R. D., Kuo С. H., S I a-
t e s H. L., Weber S., Wen d ler N. L., Tetrahedron, 24, 2443 (1968).
24. S t e r n R., S a j u s L., Tetrahedron Letters, 6313 (1968).
ЛИТИЯ ГИДРИД, LiH. Мол. вес 7,95.
Применение. См. Метиллитий (в этом томе).
ЛИТИЯ ДИ ИЗОБУТИЛМЕТИЛ АЛЮМОГИДРИД. Мол. вес
164,19.
Цвейфель и Штиле [11 получили этот реагент (3) при добавлении
0,1 моля метиллития в эфире к 0,1 моля диизобутилалюминийгидрида
в глиме при температуре не выше 25°. Под действием диизобутил-
CH3LH4(CH3)2CHCHaMlH ™> [(CH3)2CHCH2].2Al-HCH3(Li-r)
(1) (2) (3)
алюмин ий гидр и да алкины восстанавливаются путем цис-присоеди-
нения, тогда как при восстановлении новым реагентом осущест-
вляется транс-присоединение. Карбонизация аддукта (4) с после-
дующим подкислением приводит к цис-а$-непредельной кислоте
(5) с хорошим выходом.
[(CI-l3)2CHCH.2]2Al-UCH3(LiT-)..{_RC^CR —>
(3)
Г н\
)С=С<
Rz -AIR
СИ,
Rz 'CO2H
(5)
I. Z w e I f e 1 G., Steele R. B., J. Am. Chem. Soc., 89, 5085 (1967).
H3C Li CH3
I I I
ЛИТИЯ ДИИЗОПРОПИЛАМИД, HC-N-CH . Мол. вес
in3 с!н3
107,12. Диизопропиламин, мол. вес 101,19, т. кип. 82—84°.
Направленная альдольная конденсация. Альдольную конденса-
цию альдегида с кетоном обычно провести не удается, поскольку
доминирует реакция самоконденсации альдегида. Однако Виттиг
и Рейф [1] показали, что такая конденсация возможна и осущест-
вляется, как правило, с хорошим выходом, если сначала альдегид
превратить в основание Шиффа (обычно с помощью циклогексил-
амина), а затем металлировать Л. д. (который выбран по очевидным
стерическим причинам) [2]. В случае кетонов этот путь лучше,
252
чем олефинизация через фосфораны.
L jNfw.w-CjH,).
CeH11NH!
сн3сно---------->CH3CH=NCeH11
|2фирг и
(1) (2)
(CtjHsisC—о НдСдх
LiCH,CH = NC6HU-------)С/ XNC6HU
-70’ и Г / \г» ___Т
(3)
н2о Н6С(
-СН2СН;
(4)
со.н
I
СОгН, пар
1 85%
(5) 92%
н5с6.
>C=CHCHO + C6H11NH2
Н5с6-
(6)
1. W i t t i g G., R e i f f H., Angew. Chem., Internal. Ed., 7, 7, (1968); W 1 t-
t i g G., Rec. Chem. Progr,, 28, 45 (1967).
2. W i ttig G., Hesse H., procedure submitted to Org. Syn. (1968).
ЛИТИЯ ДИЦИКЛОГЕКСИЛАМИД.
В новом удобном методе синтеза цис- и /пргис-циклодеценов
Трэйнхэм и сотр. [1] использовали в качестве исходного соедине-
ния циклодекан (1). Хлорирование (1) при УФ-облучении лампой
мощностью 150 вт приводит к хлорциклодекану (2). Часть продукта
дегидрогалогенируют следующим образом. В колбу, снабженную
магнитной мешалкой и обратным холодильником, помещают раст-
вор дициклогексил амина в эфире и в атмосфере азота прибавляют
к нему раствор «-бутиллития в гексане. Полученную смесь добавляют
к раствору хлор циклодекан а в гексане и кипятят 24 час. После со-
ответствующей обработки выделяют транс-циклодецен, т. кип.
153—155°; по данным газовой хроматографии продукт содер-
жит 96% /тг/7й«с-изомера. zj/щ-Изомер получают с 80%-ным выходом
дегидрогалогенированием (2) под действием трет-бутилата ка-
лия (см. в этом-томе).
в эфире
70%
w-BuLi
в гексане
9 6% транс
(3)
253
1. T r a v n h a m J. G., S I о n e D. В., С о и v i I I i о n J. L,, J. Org, Chem., 32,
510 (1967).
ЛИТИЯ ДИЭТИЛАМИД (11, 193-195).
Реакция с эпоксидами (11, 195, перед ссылками). Эпоксиды со
средним размером цикла реагируют с Л. д. более сложно. Напри-
мер, окись цмоциклооктена (I) дает главным образом бицикли-
ческий спирт (2), а окись трансщиклооктена (5) образует в основ-
ном эпимерный бициклический спирт (6) 13а]. Экспериментами с
LiN(CzH5)2i
LiN(CzH5)z
(6) 55-60% (3)10-15% (7) 32%
дейтерометкой Коуп показал, что бициклические спирты (2) и (6)
образуются за счет отщепления водорода от се-углеродного атома
эпоксида (а-отщепление) и внедрения карбеноида по транс-аннуляр-
ной связи С—Н.
В противоположность этому окиси цис- и транс-циклододецена
(8) и (9) при обработке основанием дают в качестве главного продук-
та аллиловый спирт — трйНоцнклододеценол-2 (10) [36]. Эта реак-
ция, по-видимому, включает отщепление водорода из [3-положения
эпоксида.
UNtCjHsb
------->
Крэндолл [Зв], подробно изучавший изомеризацию циклических
окисей под действием Л. д., считает, что [3-отщепление, приводящее
к аллильным спиртам, предпочтительнее в тех случаях, когда воз-
можно более выгодное транс-копланарное переходное состояние.
254
В тех случаях, когда оно недостижимо, наблюдается се-отщепление
и внедрение карбеноида.
Ганстон 13г] осуществил перегруппировку метилвернолата (11)
в метил кар иол ат (12) при обработке Л. д. в эфире при 0э в течение
часа. Автор считает, что природные продукты, содержащие группи-
171
ровку—СНОНСН=СН—, могут получаться из ц/щ-олефинов
Ц
—СН^СНСН;. —в результате перегруппировки соответствующих
эпоксидов.
/°\
СНЁ(СН.р4СН - СНСН2СН ~ СН(СНг)7СОаСН3 —*
60%
(11)
он
СНЯ(СН,2)4СНСН ZcHCH -СН(СН2)7СО.;СН3
(12)
Циклизация по Циглеру (11, 195, перед ссылками), Л.д. исполь-
зуется для циклизации динитрилов [10] по Циглеру, например:
Hr, С,
Н5сй
NH
Внутримолекулярное алкилирование галогенацетиленов [11].
Некоторые галогенацетилены при обработке основанием в ТГФ при
—10' в течение 1—3 час претерпевают внутримолекулярное алкили-
рование:
-НВг
С6Н5С^ОСН2)3Вг ------СДС- ССН — сна
68% \ /
сн2
снэ
“НВг У \гч
CeH5CsC(CH2)5Br------> С6Н5С^СС'Н СН3
740/0 1 I
СН2----сн2
Отмечалось, что при этом наблюдается обычная зависимость цикли-
зации от размеров цикла. При попытке получения циклобутанов
наблюдалось дегидрогалогенирование с образованием терминальных
олефинов.
255
В благоприятных случаях соответствующие алленовые изомеры
также подвергаются внутримолекулярной циклизации:
Н3С СН,
сн3 \с/
НгС = С = CHCGHaOTs—>НС^С—СН— сн2
I
СН,
За. For a review with references, see С о р е А. С., М а г t in М. М., М с К е г v е у
М. A., Quart. Rev., 20, 143—145 (1966).
36. N о z a k i Н., М о г i Т., N о у о г i R., Tetrahedron, 22, 1207 (1966).
Зв. С г а п d а 1 1 J. К-, L 1 л L.-H. С., J. Org. Chem., 33, 2375 (1968), and earlier
references cited therein.
3r. Conacher H. B. S., 6 u n s t о n e F. D., Chem. Comm., 1968, 281.
10. Kulp S. S., Can. J. Chem., 45, 1981 (1967).
И. Crandall J. K-, Key t on D. J., Chem. Comm., 1968, 1069.
ЛИТИЯ КАРБОНАТ -ЛИТИЯ БРОМИД (П, 199—202, перед
ссылками).
При бромировании с последующим дегидрогалогенированием
6-метокситетралон-1 (7) превращается в 6-метокси-а-нафтол (8)
с 80%-ным выходом [8]. Бромирование проводилось в эфире, содер-
ОО ОН
(7) 7 г 10,1 г (8) 4,95 е
жащем следы хлористого водорода, дегидробромирование — в ки-
пящем ДМФА под действием карбоната лития и бромида лития.
Применение для этой цели карбоната кальция дает менее удовлет-
ворительные результаты. Попытки дегидрирования (7) с помощью
палладия и хинонов к успеху не привели.
8. К a s t u г i Т. R., А г u n а с ha 1 a m Т., Can. J. Chem.,. 46, 3625 (1968).
ЛИТИЯ НИТРИД (II, 203, перед ссылками).
Реакция с хлорангидридами [3]. С хлористым бензоилом в диг-
лиме при комнатной температуре Л. н. образует трибензамид с очень
хорошим выходом.
о /о \
Диглим Н У )
ЗСеН5СОС1 + Li3N —-СеН5С- N\ ССеН5 А 4- 3LiCl
61%
Т. пл. 206-207°
3. Baldwin F. P.,BlanchardE.J., Koenig P.E..J. Ore. Chem. 30
671 (1965).
256
ЛИТИЯ ТРИМЕТОКСИАЛЮМОГИДРИД (II, 203—204, перед
ссылками).
Л. т. в значительной степени ускоряет реакцию окиси углерода
с борорганическими соединениями [4]. Реакцию можно проводить
при атмосферном давлении при 0—25° и соотношении реагентов
1:1:1, например:
ЗСН3(СН,)аСН = СН2 — [CH3(CH2)S]3B
ТГФ
наог
[СН3(СН,)5]вВ + СО+Ш1Н(ОСН3)з —> [X]---
Буфер
—> СН3(СН2)5СНО4-2СН3(СН2)5СН2ОН
Судя по количеству спиртов, образующихся при восстановлении,
выходы альдегидов в пяти случаях составляли 87—98%. Недостаток
реакции состоит в том, что только одна из трех алкильных групп
борорганического соединения превращается в альдегид.
4. Brown Н. С., Colem ап R. A., R a t h k е М. П7., J. Am. Chem. Soc,,
90, 500 (1968).
ЛИТИЯ ТРИЭТОКСИАЛЮМОГИДРИД (II, 204,перед ссылками).
Мак-Квиллин и Йитс [3] показали, что терпеновый лактон (1)
под действием Л. т. восстанавливается до лактола (2). При исполь-
зовании боргидрида натрия образуется диол.
3. McQuillin Р. J., Yeats R. В., J. Chem. Soc., 1965, 4273.
ЛИТИЯ ХЛОРИД (II, 204—205, перед ссылками).
Обычное превращение бензеуберанона (1) в бенз-12,31-тропон
(3) состоит в двукратном бромировании с последующим дегидро-
броыированием и осуществляется с умеренным выходом. Коллин-
топ и Джонс [5] обнаружили, что выход улучшается, если (1) ди-
бромировать до а,се-дибромкетона (2), который затем дегидробро-
9 1994 257
мируется с помощью Л. х. в ДМФА. Авторы предлагают следующую
схему реакции отщепления:
5. Col Jin t on Е. W., J о л е s G., Chem. Comm., 1968, 958.
М — --- " ----- 1
МАГНИЙ (II, 207—210, ссылка [4]). Изменить вторую часть, сле-
дует читать: Bryce-Smith D., Wakefield В. JOrg.
Syn., 47, 103 (1967).
МАГНИЙ — НАФТАЛИН (II, 211, ссылка [1!). См. также:
Markov Р., L a s а г о v D., Ivanov С., Ann., 704, 126 (1967).
МАГНИЙ — РТУТЬ ХЛОРНАЯ.
Группой французских исследователей [1] обнаружено, что маг-
ниевая стружка в сочетании с HgCl3 в сухом пиридине является
эффективным реагентом для восстановительной димеризации инда-
нонов, тетралонов и бензсуберонов. Порошкообразный магний ре-
агирует слишком бурно. Почти не уступает этому реагенту литий
в сухом эфире. Менее удовлетворительна амальгама алюминия;
фотохимическое восстановление не дает положительных результа-
тов, а при электролитическом восстановлении выходы очень низки.
I. М a j е г u s G., YaxE., Ourisson G., Bull. soc. chim. France, 1967, 4143.
МАГНИЯ БРОМИД БЕЗВОДНЫЙ, MgBr;. Мол. вес 184,15.
Реагент можно получить взаимодействием магния с бромом в
безводном эфире [11.
Методы получения насыщенных алкилбромидов непригодны для
синтеза соответствующих ненасыщенных бромидов, поскольку при-
водят к перестройке кратных связей. Метансульфонаты высших
непредельных спиртов, которые легко и с хорошим выходом полу-
чаются в чистом виде [21, можно количественно превратить в соот-
ветствующие алкенилбромиды под действием М. б. б. в эфире [31.
Обе реакции осуществляются без ipc-m/хшс-изомеризации или ка-
ких-либо других изменений двойных связей.
Для получения цмс-9-октадеценилбромида [41 к раствору
26,8 г (0,1 моля) чистого цш?-9-октадеценола в 90 мл пиридина при
охлаждении льдом и перемешивании в токе очищенного азота до-
бавляют по каплям в течение часа 17,2 г (0,15 моля) метансульфо-
хлорида. Перемешивание продолжают еще 5 час при комнатной
9*
259
температуре. Продукт реакции экстрагируют эфиром и кристалли-
зуют из абсолютного этанола при —30“ в виде длинных игл; цис-
9-октадеценнлметансульфонат сушат в токе сухого азота, а затем
в высоком вакууме, т. пл. 9—10°, выход 79,5—80%. Вторая порция
продукта повышает выход до 87—88%.
На последней стадии 17,4 г (0,05 моля) метаисульфоната и 650 мл
абсолютного эфира помещают в трехгорлую колбу на 1 л, снабжен-
ную обратным холодильником, вводной и выводной трубками для
подачи сухого азота и механической мешалкой. Добавляют трех-
кратный избыток М. б. б. (0,15 моля) при интенсивном перемеши-
вании для достижения полноты реакции в гетерогенной смеси.
Перемешивание продолжают при комнатной температуре в течение
24 час. Дальнейшая обработка включает экстракцию освобожденной
от воздуха водой, фильтрование раствора в гексан, удаление раст-
ворителя в токе чистого азота и высушивание в высоком вакууме.
ц Гу
CH3(CH2)7CH = CH(CH2)7CH2OH^CH3SO,Cl -——>
- НС1
CH3(CH2)7CH=CH(CH2)7CH.2OSO2CH3
MgBr2—эфир ц
---------—СН3(СН3)7СН = СН(СНс)7СН.,Вг
- MgBrfOSOjCH,)
I. Rowley Н. Н., J. Am. Chem. Soc., 72, 3305 (1950).
2. Baumann W.J,Mangold H. К., J- Org. Chem., 29, 3055 (1964).
3. Baumann W. J., MangoIdH. K., J- Lipid Res., 7, 568 (1966).
4. Baumann W. J., Gee R. D., M angold H. K., procedure submitted
to Org. Syn. (1967).
МАГНИЯ ОКИСЬ (И, 212—213, перед ссылками).
М. о. в ДМФА была использована для дегидробромирования
бромкетона (2) с образованием соединения (3) [5].
260
5. К u t n е у J. P., Cable J., Gladstone W. A. F,, Hanssen H, W.,
Torupka E. J., Warnock W. D. C., J. Am. Chem. Soc., 90, 5332 (1968).
МАЛОНОВОГО ДИАЛЬДЕГИДА ТЕТРАЭТИЛ АЦЕТАЛЬ,
санЁоч ,ос,н5
>снсн2сн<
c2h5oz хос2н5
Мол. вес 164,20, 4° 1,4081.
Применение [1]. М.д.т. (1) расщепляется соляной кислотой до
малонового диальдегида (2). который избирательно конденсируется
с аргинильными группами (3) белков и дает 6-1\1-(2-лнримидил)-ь -
орнитин (4). При этом наблюдаются некоторые побочные реакции, так
как применяется сильная кислота. Пептидные связи, соседние с мо-
дифицированным аргинильным остатком, устойчивы к действию
трипсина, поэтому М. д. т. используется для анализа аминокислот-
ной последовательности в белках.
zCH(OCnH5)2 ,,СН = О
сн2 10 н- 1IC1 СН2 КН
H,N / X-N'.CH,)3CHCO2H
I I
H \H2
(1) t2) (3)
’^/XNfCH2)3CHCO2H
I i
H NH3
(4)
I. King T. P., Biochemistry, 5, 3454 (1966).
МАРГАНЦА АЦЕТАТ, Mn(OAc)3-2HsO. Мол. вес 268,09.
Получение [11. М.а. получают при нагревании смеси 500 мл
уксусного ангидрида и 48 а ацетата марганца (II) Мп(ОАс)?-4Н2О с
обратным холодильником в течение 20 мин, к которой затем мед-
ленно добавляют 8,0 г КМпО4. Смесь кипятят еще 30 мин, затем
охлаждают до комнатной температуры и добавляют 85 мл воды.
Через 16 час М. а. отфильтровывают, промывают уксусной кислотой
и сушат на воздухе. Наиболее реакционноспособная форма реагента
получается при добавлении уксусного ангидрида в количестве,
эквивалентном гидратационной воде в Мп(ОАс)2-4Н3О.
Окисление олефинов. Две группы исследователей [1, 2] одновре-
менно сообщили, что под действием М. а. в присутствии уксусной
кислоты олефины окисляются до у-лактонов. С уксусным ангидридом
реакция ускоряется, а также повышается выход продукта. Реко-
261
мендуется использовать 0,1 моля олефина, 50 мл уксусной кислоты,
0,05 моля Мп(ОАс)3-2Н2О и кипятить смесь 30—60 мин. Примером
СНз Мп(0Ас)а2Н,0
Z---х НОАс, АсгО ч I
// Ч-С=С1-1а——-----------> Д—с—сн2
\=/ 720/а \=/ | |
О сн2
II
о
(!) (2)
служит окислениеа-метилстирола (1) до у-метил-у-феяилбутиролак-
тона (2) [11.
Другие примеры [2[:
Н5СД 1С6Н5
с6н5сн=снод -------> £
16%
п
о
Окисление ароматических углеводородов. При окислении то-
луола М. а. в кипящей уксусной кислоте получаются толилуксусная
кислота, изомерные мети л бенз и л ацетаты (главным образом орто-
замещенные) и бензилацетат. Реакция осуществляется по двум
конкурирующим механизмам, преимущественным из которых яв-
ляется свободнорадикальный с участием радикала -СН2СООН, обра-
зующегося при термолизе М. а.
1, Bush J. В., Jr., Finkbeiner Н,, J. Am. Chem. Soc., 90, 5903 (1968),
2. H eiba E, Dessau R. At, Koehl W. J., J. Am. Chem. Soc., 90, 5905
(1968).
3. Heiba E, !., Dessa u R, M., К о e h 1 W, J., Jr., J. Am. Chem, Soc,, 91,
138 (1969),
МАРГАНЦА трис- (АЦЕТИЛАЦЕТОНАТ) (MTA)* Мп(С8Н,О2)з.
Мол. вес 352,25.
* Подобного типа парамагнитные комплексы нашли широкое применение
в ЯМР-спектроскопин как реагенты для избирательного изменения химического
сдвига (shift reagents) [Ninckley С. С,, J. Am. Chem, Soc,, 91, 5160 (1969);
Briggs J,, Frost G. H.. Hart F, H., M о s s G, P., Staniforth
M. L,, Chem. Comm,, No. 12, 749 (1970)]. Наибольшее значение имеет ком-
плекс европия с дипивалоилмета пом Еи(ДПМ)3. Синтез [М а п Е. Н., Swaneer
F. W., Hauser С,, J. Am Chem. Soc., 73, 901 (1951); Eisentrant K.J.,
Sievers R, E,, J, Am, Chem. Soc,, 87,5254 (1965)], применение [Sanders
J, К. M., Williams D, H., Chem, Comm., No. 7, 422 (1970); De-
262
Дегидрокондеисация фенолов [1]. Дьюар обнаружил, что
среди разнообразных производных марганца МТА наиболее удобен
для дегидроконденсации фенолов. Например, [3-нафтол превра-
щается в 2,2'-диокси-1,Г-динафтил с выходом 69% (в ацетонит-
риле или сероуглероде, 5 час).
МТА растворим в органических растворителях и не окисляет бифе-
нолы до хинонов, как феррицианид калия. Однако реакцию следует
проводить без доступа кислорода. По-видимому, реакция включает
окисление фенола за счет переноса электронов и димеризацию обра-
зующихся при этом ароксильных радикалов.
1, Dewar М, J, S., N а к а у а Т., J. Am. Chem. Soc., 90, 7134 (1968).
МАРГАНЦА ДВУОКИСЬ АКТИВНАЯ (II, 218—227).
Получение (II, 220, после выдержки из 171). Белью и Тек-Линг
[7а] получили активную форму двуокиси марганца озонированием
водного раствора нитрата марганца (II), содержащего хлорную ки-
слоту. Реагент окисляет бензиловый спирт до бензальдегида (82%).
Голдман [76] получил осажденную двуокись марганца по мето-
ду Аттенборро, усовершенствованному Праттом и Саскиндом [7в];
это вещество можно хранить в закрытой склянке и при необходи-
мости активировать азеотропной отгонкой избытка воды с бензолом
в течение часа. М.д.а. можно хранить в бензоле не более года.
Окисление азотсодержащих соединений (II, 224, после выдержки
из [19, 201). Бхатнагар и Джордж [20а] обнаружили,чтофенилгид-
разоны халкона с хорошим выходом окисляются до пиразолов под
действием М. д. а., полученной по методу Пратта и Мак-Говерна
1191. Например, гидразон бензальацетофенона (1) дает 1,3,5-трифе-
пилпиразол (-1) с выходом 73%; предполагается промежуточное об-
’ен5—>
гпагсо Р., Elzey Th. К., Lewis R. В., Wenkert Е., J. Am. Chem.
Soc,, 92, 5734, 5737 (1970); HincklegC, C., J, Org. Chem., 35, 2834 (1970);
Eraser R. R,, W 1 g f i e 1 d Y. Y,, Chem. Comm, 1970, 1471; Wahl G. H.,
P e t e r s о n M. R., Chem. Comm,, 1970, 1167; Sanders J. К,. M,, W i 1-
liams D. H,, J. Am, Chem, Soc., 93, 641 (1971)]. О применении трис-
(гексафторацетилацетонатов) европия и празеодима см. J. Am, Chem. Soc.,-
93,1522(1 §71).-Прим. ред.
н
сс6на
263
разо'вание радикалов (2) и (3). о-Фенилендиамин и п-фенилендиамин
окисляются М. д. а. до соответствующих диаминоазосоединений
-с выходами около 25% [206].
(П, 225, после выдержки из [291.) М. д. а. с высоким выходом
превращает имидазолины в имидазолы. Например, (1) был превра-
щен в (2) с выходом 72% при перемешивании раствора (1) в хлоро-
форме с четырехкратным избытком тонкоизмельченного реагента
Аттенборро [29а1.
I
сн3
(2)
Обзор [321.
(II, 226, перед ссылками.) Окислительная циклизация ретику-
лина (1) в морфинановое производное изосалютаридин (2) осущест-
вляется под действием М. д. а. с использованием принципа гетеро-
генного разбавления, позволяющего поддерживать низкую кон-
центрацию (1) на поверхности МпО2 и большое расстояние между
молекулами 1331. Для этого МпО2 смешивают с силикагелем (раз-
мер частиц меньше 0,08 мм) в весовом отношении 1 : 3. Эта реакция
представляет интерес, так как, по-видимому, является одной из
стадий биосинтеза морфиновых алкалоидов [34].
Окислительные перегруппировки. Холл и Стори [35] обнару-
жили, что под действием /VI. д. а., полученной по методу Мансера,
Розенкранца и Зондхеймера (ссылка [5]: J. Chem. Soc., 1953,2189),
квадрицикланол (1) в хлороформе легко перегруппировывается
в норборнадиенол (2), который при 45° окисляется до трицикличе-
ской окиси (3) и бензальдегида. Выходы продуктов непостоянны
264
(от 5 до 70%); другие формы МпОг оказались неэффективными.
В формуле (3) протоны пронумерованы (отН1ДО Н8) для облегчения
анализа спектра ЯМР, который согласуется только с этой структу-
рой. Холл и Стори предлагают механизм, включающий изомериза-
цию через катион (26):
Перегруппировка может иметь место при окислении производ-
ного инозита (4) в лактон полуацеталя (5) 1361; это ключевая стадия
265
в превращении циклитов в гексозы. Однако более эффективное оки-
(4)
(5)
сление (4) достигается действием реагента Пфитцнера — Моффатта
с последующей реакцией Байера — Виллигера.
Окисление до фуксонов [37]. Полученная по методу Аттенборро
М. д. а. была использована для окисления 3,5-дизамещенных
4-окситрифенилметанов до 3,5-дизамещенных фуксонов с высоким
MnOs
выходом. Те же результаты получаются при использовании переки-
си никеля и двуокиси свинца. Оказывается, для гладкого окисления
необходимо замещение в положениях 3 и 5,
Окисление аллиловых и бензиловых спиртов. Двуокись марганца,
полученная озонированием нитрата марганца (II), является эффек-
тивным окислителем аллиловых и бензиловых спиртов [38].
Уидон и сотр. [39] проводили окисление гераниола и нерола
семью различными образцами М, д. а. Выходы были наиболее
/СН2ОН
|/чсн3
Ч[|
HaCZ ^-СНз
Гераниол
НОНаС^
I!
|/ХСН3
Х||
НзС-^СНз
Нерол
266
высокими (80%) при использовании продажного образца, получен-
ного по методу Болла, Гудвина и /Мортона (ссылка [1], II, 226), вы-
сушенного над Р2О5 и суспендированного в хлористом метилене,
а также щелочной МпСБ, полученной по методу Аттенборро [41
в петролеином эфире. Выходы с кислой МпОа (Мансера и сотр. 151)
существенно ниже.
Уил и и Айрик [401 получали М. д. а., добавляя насыщенный вод-
ный раствор перманганата калия к горячему раствору моногидрата
сульфата марганца в 30 мл воды до устойчивой пурпурной окраски.
Выпавшую в осадок двуокись марганца собирали, высушивали и
использовали для окисления хлоргидрата пиридоксина в хлоргид-
рат пиридоксаля.
(6) Хлоргидрат пиридоксина (7) Хлоргпдрат пиридоксаля
Было найдено, что МпОа в ДМСО при 100° является наилучшим
реагентом для окисления 5-оксиметилурацила (8) до урацил-5-аль-
дегида (9). Соотношение субстрата и реагента 1:5. При проведе-
нии реакции в водной среде выходы уменьшаются до 40—60% [411.
Разницы в действии МпО3, полученной различными способами, не
отмечалось.
О
/СН2ОН
|| в ДМСО
О А/
I
и
(8) 5-Оксиметилурацил
О
Л /СН=О
HN |?
85°/о ,1 II
О"'У
1
н
(9) Урацил-5-альдегид
Кори и сотр. [421 занимались разработкой простого метода оки-
сления аллиловых спитов в карбоновые кислоты без цис-транс-
изомеризации сс, p-ненасыщенной связи. Авторы считают, что в при-
сутствии цианистого водорода и цианид-иона а, [3-ненасыщенный
альдегид должен превращаться в циангидрин, дающий при окисле-
нии МпО2 ацилцианид, который в присутствии спирта должен пре-
267
вратиться в сложный эфир.
/ I1CN, NaCN \с„_с/ Мп°э
ХСНО ' / XCHCN ’
6н
V = с/ \ С = с/ + HC1N
/ ХССЫ / xco2r
Типичным примером применения этой реакции является окисле-
ние гераниола. Спирт (50 мг) окисляют М. д. а. в гексане до гераниа-
ля, выделяемого (48 мг) после фильтрования и удаления раствори-
теля. Затем альдегид перемешивают с цианистым натрием, уксус-
ной кислотой (для получения HCN), метанолом и МпО2 в течение
12 час при 20—25°. После удаления метанола метилгеранат (51 лга)
экстрагируют эфиром. Выход продукта достаточно высокий, изо-
меризации не наблюдается.
Превратить несопряженные альдегиды в эфиры этим методом
не удается.
Этот метод был специально отработан на одной из стадий синтеза
гормона С18, выделенного из Cecropia 'juvenile [431. Так, спирт (10)
превращали в метиловый эфир (11) с выходом 70%.
МпОг
СН3ОН, NaCN
•----------—>
70%
Окисление альдегидов до кислот см. Серебра (II) окись, том V.
Окисление алкиламинов. Исследования группы Хенбеста [24,
25] были продолжены на других объектах [44—46], например [461:
/СНзСНгк МпОз /СН3СН2ч
CeH5N( >NC6H,----------> CeH,N z XNCgH5
^СНХНы 80”/o ' | |
CH3 CHO
Окисление дигидробензолов. Этил-2,4~пентадиеноат (2) при вза-
имодействии с А’-пирролндпноциклогексеном (I) дает аддукт 1,4-
циклоприсоединения 1 : 1 (3), который подвергается реакции, об-
ратной присоединению по Михаэлю, с последующей изомеризацией
в (4). Под действием двуокиси марганца, полученной по Аттенборро,
268
соединение (4) окисляется до ароматической системы (5) [471
(4) (5)
Окисление с укорочением цепи. Бергсталер и Баркхурст [48]
исследовали окисление дикалийродизоната (1) до тригидрата кро-
коновой кислоты (2) с отщеплением двуокиси углерода и показали,
что продажная двуокись марганца для этой цели не пригодна.
Однако подходящим оказался реагент, полученный при нагревании
карбоната марганца при 295—310° (12—18 час) с последующей обра-
боткой 2Л4 азотной кислотой (30 мин) для удаления карбоната,
промыванием водой и высушиванием при 150—160° в течение 18—
о
(1)
1) МпОг—NaQH^
2) НС1-ВаС12
3) H2SO4
(2)
24 час [49]. М. д. а. (56 г, 0,65 моля) и дикалийродизонат (24,6 г,
0,1 моля) добавляют при перемешивании к раствору 40 г (0,1 моля)
едкого натра в 1 л воды. Смесь перемешивают при 20—25° в течение
10 мин и затем кипятят с обратным холодильником 1 час. Горячую
смесь фильтруют с отсасыванием и коричневый остаток, состоящий
главным образом из двуокиси марганца, промывают 800 мл горячей
воды. Фильтрат вместе с промывными водами нейтрализуют 210 мл
конц. соляной кислоты и смешивают с горячим раствором 50 г
(0,2 моля) дигидрата хлористого бария в 150 мл воды. Полученный
раствор нагревают до 90° и медленно охлаждают до комнатной
температуры, ярко-желтый осадок моногидрата кроконата бария
269
отфильтровывают с отсасыванием, промывают 100 мл воды и высу-
шивают на воздухе. Выход продукта составляет 20—25 г (68—85%).
Для выделения свободной кислоты 15 г (0,051 моля) моногидрата
кроконата бария добавляют при перемешивании к 50 мл водного
раствора 3 мл (0,055 моля) конц. серной кислоты, подогретого до
55°, После перемешивания в течение часа сульфат бария отфильтро-
вывают и промывают 10 мл горячей воды. Фильтрат и промывные
воды упаривают досуха на роторном испарителе с подогревом на
паровой бане до тех пор, пока не начнется кристаллизация. Раствор
охлаждают, темно-желтые кристаллы отфильтровывают с отсасы-
ванием и промывают 5 мл абсолютного этанола. Дальнейшее кон-
центрирование фильтрата и промывных вод дает в общем от 5,8
до 8,5 г (68—87%) тригидрата кроконовой кислоты, т. разл. около
155°.
7а. В е 1 е w J. S., Т е k - L i n g С., Chem, Ind., 1967, 1958.
76. G о I d m а п I, M., J, Org. Chem., 34, 1979 (1969),
7b, Pratt E. F.,Suskin d S, P,, J. Org. Chem., 28, 638 (1963),
20a, Bhatnagar I,, George M. V., Tetrahedron, 24, 1293 (1968).
206, Bhatnagar I,, G e о r g e M. V., J. Org. Chem,, 33, 2407 (1968),
29a. Martin P. K., Matthews H.R., R a p о p о r t FL, Thy agara-
Jan G., J. Org, Chem., 33, 3758 (1968).
32, Evans R. M., Quart. Rev., 13, 61 (1959).
33, F rank B,, D unke Im ann 2., Lubs H. J,, Angew, Chem,, Internat.
Ed., 6, 1075 (1967),
34, Barton D,H, R,, Kirby G, W,,Steglich W,,Thomas G. M.,
Battersby A. R., Dobson T, A,, R a m u z H,,J. Chem. Soc., 1965,
2423.
35. H a 1 1 T. K-, S t о г у P, R., J, Am, Chem. Soc., 89, 6759 (1967),
36, Fukam i H,, Koh H.-S., Sakata T,, Nakajima M., Tetrahedron
Letters, 4771 (1967),
37. Becker H.-D., J. Org. Chem., 32, 2943 (1967).
38. В e 1 e w J, S., T e к - L i n g C., Chem. Ind., 1967, 1958,
39. Burrell J. W. K., Garwood R. F., Jackman L. M., О s к а у E.,
Weedon В. C. L., J. Chem. Soc., 1966, 2144.
40. Wiley R. H., I r i с к G,, J. Med. Chem., 5, 49 (1962).
41. Brossmer R., Ziegler D., Tetrahedron Letters, 5253 (1966).
42, С о г e у E. J., Gilman N, W,, Ganem В. E,, J. Am, Chem. Soc., 90,
5616 (1968).
43. Corey E. J., Katzenellenbogen J. A., Gilman N, W.,
Roman S, A,, Erickson B. W., J, Am, Chem. Soc., 90, 5618 (1968).
44. Henbest H. B,, Patton R., J. Chem, Soc., 1960, 3557,
45. С u г г a g h E. F,, H e n b e s t H.B., Thomas A,, J. Chem. Soc., 1960,
3559,
46, Hen best H. B., S t r a t f о г d M. J, W. (replaces preliminary Paper
[25]), J. Chem. Soc., (C), 1966, 995.
47. Danishefsky S,,Cunningham R., J. Org. Chem., 30, 3676 (1965),
48. Burgstahler A. W., Bar khurst R, C,, Univ, of Kansas, private
communication.
49. Procedure of F a t i a d i A. S., Isbell H. S,, Sager W. F., J.
Res, Nat, Bur. Std., 67A, 153 (1963),
МЕДИ(!) АЦЕТАТ, CuOAc. Мол, вес 122,58.
Соединения одновалентной меди образуют устойчивые комплек-
сы с ацетонитрилом. Кочи [1] получил устойчивые бесцветные ком-
270
плексы М. а. в виде раствора в смеси ацетонитрил — уксусная ки-
слота двумя способами: 1) нагреванием ацетата меди (II) с мед-
ным порошком в смеси этих растворителей; 2) реакцией закиси
меди с уксусной кислотой в ацетонитриле:
CH3CN
Cu2O4-2HOAc-----—> 2СиОАс +Н2О
Этот комплекс инициирует при низких температурах радикальную
цепную реакцию разложения перекисей ацилов и алкилгидропере-
кисей.
I. К о с h i J. К., Bemis A., Tetrahedron, 24, 5099 (1968).
МЕДИ(П) АЦЕТАТ (11, 228, перед ссылками).
Безводный М. а. заметно катализирует окислительное декарбок-
силирование карбоновых кислот до олефинов под действием тетра-
ацетата свинца [71:
Си(ОАс),
СвН5СН2(СНг).,СО,Н+РЬ(ОАс)4 —
—> Cf)H5CH2CH = СН,2 + СО, + РЬ(ОАс), Д- 2СиОАс
нх уСОаН
СО, -Ц Pb(O Ас),+2СиОАс
В отсутствие катализатора наблюдается только декарбоксилирова-
ние с невысоким выходом, а образующиеся алканы недостаточно
чистые.
Моногидрат М. а. катализирует окисление смеси фенилацетилена
и вторичного амина воздухом с образованием инаминов [81:
Cu(OAc)E'O3
C6H5C^CH + HN(CH3)2 —C6H5C^C-N(CH3)a
U /(]
7. В а с h a J. D., К о с h i J. К-, Tetrahedron, 24, 2215 (1968).
8, Peterson L. I., Tetrahedron Letters, 5357 (1968).
нзСх . ^СНЭ
S-
I! I
°. xO
2Cu.
* H
сн CH;
МЕДИ(Н) АЦЕТИЛАЦЕТОНАТ,
Cu(C5HMH,0.
Разложение диазосоединений до карбенов
(см. также Диазоацетальдегид, т. V), Добавле-
нием различных соединений меди Хьюсгену
[11 удалось стабилизировать бензоилкарбен
(получаемый из диазоацетофенона) настолько,
чтобы наблюдать реакцию 1,3-диполярного
циклоприсоединения. При этом наиболее эф-
271
фективными оказались цианид меди (I) и М.а.
zCHN2 Г zCH:
C(i^5 С./ ----> С8НГ1 — с
^'0 -N2 . МО
с6н5сн = с=о <--------------1
Перегруппировка
Вольфа
Японские исследователи [2] также описали примеры модифика-
ции реакций карбенов при добавлении хелатных соединений меди.
Так, при получении дифенилкарбена термическим разложением ди-
фенилдиазометан (1) в апротонной среде превращается главным
образом в бензофеноназин (2), а в протонных растворителях —
в 1,1,2,2-тетрафен ил этан (3). Считается что последняя реакция
осуществляется за счет отрыва водорода от молекулы растворителя
(с,н5),см2
(4)
(Од)гс=ьт-м==с(с6ьуг
(2)
-n2
[tC6H5)2C:]
(3)
и димеризации получающегося при этом бензг и др ильного радикала.
При образовании карбена в присутствии медной пудры и в протон-
ной и в апротонной средах в качестве главного продукта получается
азин (2), В присутствии хелатного соединения меди соединение (3)
не образуется совсем, а продуктами реакции являются азин (2)
и тетрафен и л эти лен (4), соотношение которых зависит от раствори-
теля, Японские исследователи предполагают, что действие хелата
меди состоит в координации диазоалкана как пятого лиганда;
Си(асас)г
(1)------(2) Ш(СеН5)оС=С(СйН5)г
^Циклогексан
разложение этого комплекса приводит к комплексу карбена с медью,
который и вступает в наблюдаемые реакции.
l .Huisgcn I?., Binsch G., Ghosez L., Chem. Ber., 97, 2628 (1964).
2 . Nozaki H., Takay a H., Moriuti S., Noyori R., Tetrahedron,
24, 3655 (1968).
МЕДИ(1) ИОДИД (П, 231, перед ссылками).
Реакция Гриньяра. При катализе М. и. изопропенилмагнийбромид
эффективно присоединяется к сопряженной двойной связи циклогек-
272
сенона 12]:
Получение соединения (2) таким способом более удовлетворительно,
чем дегидратацией (3), при которой в качестве главного продукта
образуется более устойчивый сопряженный кетон (4).
2, House Н, О., L a t h a in R, A., S 1 a t е г С. D., J. Org, Chem., 31, 2667
(1966).
МЕДИ(П) НИТРАТ —УКСУСНЫЙ АНГИДРИД (II, 232—233,
перед ссылками).
Зондхеймер и сотр. 14] применили этот реагент для осуществле-
ния электрофильного замещения аннуленов. При нитровании 1,8-
бисщегидро-]14]-аннулена (1) нитратом меди в уксусном ангидриде
при комнатной температуре атакуется соседнее с тройной связью
положение и образуются черные игольчатые кристаллы 3-мононит-
росоединения (2), которое разлагается при нагревании выше 200°.
(2)
Еще более интересен тот факт, что этим
нитровать [18]-аннулен (3) [5], который не
реагентом можно про-
изменяется в обычных
273
условиях нитрования.
Новый метод нитрования был также использован в случае
[10]-аннуленоксида-1,6 (10) [61. Это интересное соединение нетруд-
но получить восстановлением нафталина натрием в жидком аммиаке
(5)—>(6), селективным моноэпоксидированием (7), бромированием (8)
и дегидробромированием под действием большого избытка едкого
кали в этаноле. Главным продуктом на последней стадии оказывает-
(8) (9) 20% (10) 50%
t А1гО3или51О2 Cu(NO3)>~Ac2O
'' * чыо2
I +1 jo j
(11) 30% (12)30%
ся П0]-аннуленоксид-1,6 (10); в качестве побочного продукта по-
лучается 1-бензоксепин (9) в виде желтой жидкости. Нитрование (10)
274
нитратом меди в уксусном ангидриде приводит к смеси 2- и 3-моно-
нитропроизводных,
4. G а о п i Y., S о п d h е i m е г F., J. Am, Chem. Soc., 86, 521 (1964).
5, Calder I, C,, G a r r e 11 P, J,, Longuet-Higglns H.C,, Sond-
heim er F., Wo I о vsk у R., J, Chem. Soc., (C). 1967, 1041.
6, Shan i A., Sondheimer F., J, Am. Chem. Soc,, 89, 6310 (1967).
МЕДИ (II) СУЛЬФАТ БЕЗВОДНЫЙ, CuSO4. Мол. вес 159,60.
Образование ацетонидов (изопропилиденовых производных). Ле-
вин и Типсон [11 получили 2', З'-О-ацетонид (2) уридина (1) с практи-
чески количественным выходом реакцией (1) с ацетоном и М. с. б.
в присутствии каталитического количества серной кислоты. При
комнатной температуре реакция завершается за 48 час.
Дегидратация. При нагревании с М. с. б. при 160° и давлении
20 мм рт. ст. хроманол-4 (1) превращается в 3,4-хромен (3) с выхо-
дом 76%. Предполагается промежуточное образование комплекса
(2) за счет неподеленной электронной пары кислорода и вакантной
ЗсТорбитали иона меди. При попытках дегидратации (1) под дейст-
вием n-толуолсульфокислоты наблюдается образование продуктов
осмоления [2].
1. Levene Р.А., Tipson R. S., J, Biol. Chem., 106, 113 (1934); T i p-
son R. S., Syn. Proc. Nucl. Acid Chem,, 1, 431 (1968).
2- Barant on F., F о n t a 1 n e G., M a 1 t t e P Bull, soc, chim. France,
1968, 4203.
275
МЕДНЫЙ ПОРОШОК* (11, 236—237).
(После выдержки из 14].) Пельтье и Хоули ]4а1 разработали
методику получения в больших количествах 2-фуранкарбоновой
кислоты, включающую синтез фурантетракарбоновой кислоты из
диэтилового эфира щавелевоуксyci-юй кислоты и декарбоксилирова-
ние под действием М. п. (полученной по Бэкеру) в хинолине в ат-
мосфере азота.
СНСОгС2Н5 СгН5О2С- СН.--снсо2с2н5
ССОгС2Н5 с2Н5ОгС-С=О O=C~CO2C2HS .gzS0^ Н-Ч.
| 63-75% ?1-93%
ОНа
С2^О2С
*с,н5огс
COCH НС]“Ас0Н
Кипяч.2*/ас
СО,СДД
97%
ногс
Н02С
Си + ХИНОЛИН
ССЩ
Диазокетоны (II, 236, перед ссылками). Шорм [9] обнаружил,
что в присутствии медной бронзы сс-диазокетоны разлагаются до
промежуточных соединений, которые при взаимодействии с олефи-
нами дают циклопропил кетоны:
Си /СИ»
C6H5CH=CH, + N2CHCOCH3 > CGH5CHZ-------^СНСОСНз
4 2 %
Сторк и Фичини [10] нашли, что внутримолекулярная циклизация
а-диазокетонов открывает интересные синтетические возможности;
так, при циклизации (1) с хороши.м выходом образуется бицикло-
14,1,0]-гептанон-2 (2):
Дёринг и сотр. [И] расширили область применения этой реакции
и синтезировали трициклические кетоны из моноциклнческих диазо-
кетонов; в качестве катализаторов с равным успехом они исполь-
зовали М. п., сульфат меди и иодид меди. В кратком предваритель-
ном сообщении 1121 описан синтез 8,9-дегидроадамантанона-2 (5)
с т пл. 206,5—207,5е из хлорангидридов кислот (3) и (4) через соот-
* В присутствии каталитических количеств М. п, этилен и мин легко металли-
руется под действием натрия, над которым он обычно перегоняется и хранится
без изменения (Костя н о век и й Р. Г., Эл ь н а т а н о в Ю. И., Хафи-
зов X., Изв, АН СССР, сер. хим,, 1918 (1970),— Прим, перев.
276
ветствующие диазо кетоны.
При исследовании внутримолекулярной циклизации в ряду
непредельных диазокетонов типа (6) Фоузи и Гутше [13]обнаружили,
что наибольшие выходы получаются при и=2, и поэтому считают,
что важное значение имеет расстояние между двойной связью и диа-
зоалкильной группой.
RCH=CH( CH2)nCOCHN2
(6)
CuSO4
Циклогексан
(7)
Эта реакция применима также к ненасыщенным эфирам диазоук-
сусной кислоты, например к (8). Хауз и Блэнкли отмечали 1141,
что в этом случае при разложении наблюдается некоторый индукци-
онный период, во время которого, по-видимому, образуется актив-
ный медный катализатор.
Монахан [151 использовал внутримолекулярную циклизацию
диазокетонов для получения сильно затрудненного 1,5,6-трифенил-
трицикло-[3,1,0,02,“1-гексанона-3 (13) из 1-(1,2,3-трифенилци-
К'лопропен-2-ил)-3-диазопропанона-2 (12). Исходное соединение
синтезировано из трифенилциклопропенилбромида (10) и этилбром-
ацетата с последующем превращением образующегося (И) в дназо-
кетон (12) обычным способом. Циклизация осуществляется в при-
277
сутствии М. п, в кипящем бензоле в атмосфере азота; выход (13)
составляет 57%.
1) ВгСН2СООС6Н5
2) кон
Н^Сй\_____I) (COCl)j,
V/ 2) СНД42 ,
[12)
S97»
н5с/ сн^соон
4а. Р е 1 I е t i е г S. W., На w 1 е у L, В., Jr,, procedure submitted to Org. Syn.,
(1967).
9, S о r m F. et al., Coll. Czech., 22, 1836 (1957); 23, 467, 1126 (1958),
10. S t о r k G., F 1 с 1 n i J,, J, Am. Chem. Soc., 83, 4678 (1961).
11. D о e r i n g W. E,, von, F о s s e 1 E. T, Kaye R. L., Tetrahedron, 21,
25 (1965).
12. В a 1 d w i n J. E., Foge Isong W. D., Tetrahedron Letters, 4089 (1966),
13, Fawzi M, M,,Gutsche C. D., J, Org. Chem., 31, 1390 (1966).
14. H о и s e H, О., В 1 a n k 1 e у C,, J. Org, Chem., 33, 53 (1968).
15. Mon ahan A. S,, J, Org. Chem,, 33, 1441 (1968).
МЕДЬ(!) БРОМИСТАЯ (И, 237—239).
Гомологизация (П, 238, после выдержки из [5]). В качестве
главного продукта превращения фенантрена получается дибензнор-
карадиен (4); наряду с этим образуется углеводород строения (5а)
или (56) 15а]. Реакция с антраценом более сложная [56]. Гомологи-
зация гексаметил замещенного дыоаровского бензола (6) приводит
к смеси продуктов (7) и (8), причем даже при большом избытке диа-
278
зометана преобладает соединение (7) [5в],
сн3
сн3
CHzN2, СигВг2
СН3 0° в ССЦ >
(<•') (7) (8)
Восстановительная димеризация (И, 238, перед ссылками).
Уест и Квитове к и [71 сообщали о получении октабромфульвалена
(3) восстановительной димеризацией гексабромциклопентадиена
(2) под действием М. б.:
. (1)
Вг Вг Бг
ВБг3 Br^S^XZ1" г Cu2Br2 BrrJsA Z^Br
> Y -----------* У—\
В г г 6,6% Вт 6 г
Вт Вг Вг
(3)
Исходное соединение (2) было получено реакцией гексахлорцикло-
пентадиена с трехбромистым бором. В типичном эксперименте к
10,9 г (2) в 27 мл 90%-ного водного 1,2-диметоксиэтана при —80°
добавляют 5,75 г М. б. Смесь перемешивают, давая ей нагреться до
0°. Реакция начинается при расплавлении воды, и весь реагент рас-
ходуется за 3 мин, Быстрым фильтрованием через пористый стеклян-
ный фильтр отделяют сырое твердое вещество фиолетового цвета,
которое хроматографируют на кремневой кислоте в системе хлоро-
форм — гексан, и получают 0,5 г (3) в виде темно-голубых кристал-
лов с т. пл. 170° (с разл,).
Реакция Меервейна (II, 238, перед ссылками). В 1939 г. Меервейн
открыл способ арилирования непредельных соединений диазоний-
галогенидами в присутствии каталитических количеств солей меди
]8]. Обычно для этих целей использовали хлорную медь (II). Од-
нако Клеланд [9] предпочитает применять М. б. и рекомендует
промывать соль (светло-зеленого цвета) ацетоном до получения бес-
цветного промывного растворителя,затем бензолом и гексаном.После
этого реагент высушивают при 120°; в результате такой обработки
получают лишь слабо окрашенную соль. Этот же автор рекомендует
также проводить реакции в почти безводной среде. Типичным при-
мером является получение п-ацетил-сс-бромгндрокоричной кислоты:
СигВг2
/ ч НВг, ацетон
СНУСО--/ N;Bi-+CH, = CHCO2H---------------->
ч.—/ 2 5 9—6 6 %
—СН3СО—________Ч-СН2СНВгСО2Н
279
5a. M ii 1 1 е г Е., К е s s I е г Н., Suhr Н., Tetrahedron Letters, 423 (1965).
56. Мй 11 er E,, Kessler H., Ann., 692, 58 (1966).
5в. M ii 1 1 e r E., Kessler H,, Tetrahedron Letters, 3037 (1968),
7. Kwl t о wskl P. T., West R,, J. Am. Chem, Soc., 88, 4541 (1966);
West R,, Kwit owski P. T., ibid., 90, 4697 (1968),
। 8, P о и д e с т в e д т X. С., мл., «Органические реакции», изд-во «Мир», М,,
1956, т. 11, стр. 199.
9. С 1 е 1 a n d G. H.t J. Org. Chem., 26, 3362 (1961); procedure submitted to
Org, Syn, (1968).
МЕДЬ(Н) БРОМНАЯ (II, 239—241).
Бромирование карбонильных соединений (П, 240, в конце раз-
дела). Джемисон [8а] сообщал, что некоторые ар ил метил кетоны под
действием реагента бромируются преимущественно в ядро.
8а. J е m i s о n R. W., Australian J. Chem,, 21, 217 (1968).
МЕДЬ(1) ХЛОРИСТАЯ (И, 241—246).
Катализатор реакции (сопряженного) присоединения реактивов
Гриньяра (II, 244, после выдержки из [1Q1). Илиел и сотр. [10а] об-
рабатывали эфирный раствор метилмагнийодида М. х. и затем при
перемешивании и охлаждении льдом добавляли по каплям эфирный
раствор диэтилового эфира изопропилиденмалоновой кислоты.
После соответствующей обработки получали днэтиловый эфир
Си2С12 н2о; h2so4
(CH3)oC^C(COsC3H5)2 + CH3MgI---> (СН3)3ССН(СО1СаН5)2
/лрет-бутилмалоновой кислоты с выходом от 82 до 94,5%. В отсутст-
вие М. х. выход снижается до 37—64% [1061.
Дегидроконденсация терминальных ацетиленов (II, 245, после
выдержки из [17]). Миллер [17а] описал методику конденсации аце-
тиленовых реактивов Гриньяра (1) с бромистым пропаргилом, ка-
тализируемой М. х. Продукт реакции — 1,4-динн (2) с чередующим-
ся положением простых и кратных связей — в мягких условиях
изомеризуется в сопряженный 1,3-диин (3).
C„H5MgBr CH=CCH,Br(Cti,CI,)
С6Н5С CH --------- CeH5C-=CMgBr ——-:--------—>
6 ° ТГФ, N2 ь •’ /1Ч 6 65%
(1)
4 1 C«HsONa - C2H5OH(N2)
—> C6H5C = CCH.,C CH ~------------------> CGH5C CC = CCH3
(2) ' (3)
Синтез диенов (II, 245, перед ссылками). Растворы винилмаг-
нийгалогенидов в ТГФ легко получить из винил галогенидов по
методу Норманта [19]. Кауффманн и Зам [20] обнаружили, что при
обработке раствора винил магний галогенида (1) в атмосфере азота
280
в ТГФ при температуре от —60 до —40° суспензией М.. х. получается
2 ;C-CHMgCi ->-2СиХ1, 2
R" (!)
Rz
>С—CH —Си
(й)
X /R
ЧС = СН — СН^С(
Rz (3) XR
—2Си
раствор зеленого или красного цвета; предполагается образование
винильного соединения меди (2). При нагревании реакционной
смеси до 20е образуется сопряженный диен (3), при этом интенсивная
окраска раствора исчезает и выделяется металлическая медь. При-
меры :
2СНа—CHMgCl-f-Cu2CI3
Зеленое промежуточ-
ное соединение
50,5%
СН2^СНСН = СН2
р 1_Г
। 3 Зеленое промежуточ-
| ное соединение
2СН3С =: CH - MgBr + Cu.2Cl,---------------—---------->
СН3 СН3
I I
СН3С=СНСН = ССН3
н н
I !
CH3C---C~MgBr
н
I
СН3С = С— MgBr
1
н
Красное промежуточ-
_ ное соединение
Си XI3 —— ------- . >.
81 %
н н н н
I I I I
сн3с=с—с=ссн3
н н н
I i I
сн3с=с—с=хсн3
н н
I 1
СН3С = С—С —ссн3
! I
н н
14,4
7,3
3,1
!0а. Е 1 i е 1 Е. L>, Н и t с h i n s R. О., К п о с Ь с г Sr, iM,, procedure submit-
ted to Org. Syn.
106. W ideq и ist S., Arkiv Kemi, B23, № 4, 1 (1946); Lampman G. M.,
Apt К. E,, M a г t 1 n E. J„ Wange n L, E., J. Org, Chem., 32, 3950
(1967).
17a, Miller S, I., procedure submitted to Org, Syn. (1966); see also Tani-
g и c h i H., Mathai I. M,, M i 1 1 e r S, I., Tetrahedron, 22, 867 (1966).
19. dormant H., Bull. soc. chim. France, 1957, 728,
20. Ka uf fm ann Th., Sa hm W., Angew. Chem., Internal. Ed., 6, 85 (1967),
МЕДЬ(Н) ХЛОРНАЯ (П, 246, перед ссылками).
Окисление гидразосоединений. Синтез бицикло-[2,1,0]-пентана
(6) из аддукта Дильса — Альдера циклопентадиена и азодикарбоно-
вого эфира (1) (1,13) был усовершенствован Гассманом и Мэнсфил-
дом [4]. Аддукт (1) гидрировали над палладированным углем; ди-
эфир (2) гидролизовали едким кали в этиленгликоле и раствор обра-
зующегося продукта (3) добавляли при перемешивании к 2 н. рас-
твору М. х. При этом голубовато-зеленая окраска раствора быстро
изменялась до кирпично-красной и осаждались ярко-красные
281
кристаллы комплекса меди (I) с 2,3-ди азаби цикло- [2,2,1] -гептеном -2
(4). При обработке (4) едким натром выделяется азосоедипение (5),
при пиролизе которого отщепляется азот и образуется бицикличе-
ский продукт (6).
_^cozc2h5
I
I
согсгн5
Эфир
91-95%
H2/PdC^
95-97°//
<'^NCQCZHS
^^-NCO2C2H5
[г)
(4)
NaOH
SS-94%
из (г)
IS 0 "19 5°
-------->
9 0-93,5%
Галогенирование кетонов. По данным Кочи [5] ацетон в водном
растворе реагирует с М. х. в присутствии хлористого лития (уве-
личивающего скорость реакции) по уравнению
2СиС1.г4-СН3СОСН3 2CuC1-J-CICH.2COCH3 + HCI
На основании этой реакции Косовер [6] разработал препаратив-
ный метод хлорирования кетонов. В качестве растворителя предпо-
читают использовать ДМФА, хорошо растворяющий и органические
соединения, и неорганические соли и нейтрализующий выделяющий-
ся хлористый водород (снижающий скорость реакции). Типичным
примером является хлорирование пропиофенона:
LiCI (1,8 моля)
ДМФА (900 лы)
CeH5COCH2CH3 + 2CuCl2------С6Н5СОСНС1СН3
1,5 моля 3,6 моля (после очистки)
Под действием реагента циклические аД-непредельные кетоны,
например циклогексенон-2, обычно превращаются в фенолы, ацикли-
ческие же непредельные кетоны могут хлорироваться:
СН2 = СНСОСН3 СН2 = СС1СОСН3
Хлорирование- фенола приводит к смеси п- и о-хлорфенолов,
причем обычно преобладает /гара-изомер (от 6 ; 1 до 10 : 1).
282
Джонсон
тона (1).
[71 использовал этот метод для хлорирования дике-
Окислительная циклизация. Уинберг и сотр. [8, 9] синтезиро-
вали все шесть изомерных циклопентадитиофенов — аналогов флуо-
рена (т. пл. 116—117~), в которых оба бензольных кольца замещены
тиофеновыми циклами. Синтез одного из шести изомеров (4) пока-
зан на следующей схеме. 3,3'-Дитиенилкарбинол (1) при восстанов-
лении под действием алюмогидрида лития и хлористого алюминия
в эфире дает дитиенилметан (2) с 88%-ным выходом. При добавлении
раствора (2) в СС14 к водному брому происходит быстрое обесцве-
чивание и образуется дибромид (3), т. пл. 43°. Обмен галогена на
металл и последующая внутримолекулярная окислительная кон-
денсация приводят к 4Н-циклопента-[2,1-Ь : 3,4-Ь']-дитиофену (4).
Метод окислительной циклизации хорошо разработан на всех дру-
гих исследованных примерах.
Дегидродимеризация 9-метокси-1О-метилантрацена [10]. Под
действием М. х. и бромной меди(Ц) 9-метокси- 10-метилантрацен
(1) превращается в продукт дегидродимеризации (4). Предполагают,
что реакция включает атаку метильной группы и димеризацию
283
образующегося радикала (2). В результате частичного деметили-
рования димера (3) под действием галогеноводорода и кетониза-
ции образуется продукт (4).
о
4. Gassman Р. G., М а и s f i е 1 d К. Т., procedure submitted to Org, Syn.,
(1966).
5. Kochi J. K., J. Am. Chem. Soc., 77, 5274 (1955).
6. Kosower E.M., С о I e XV. J., Wu G.-S., Candy D.E.,MeistersG.,
J. Org. Chem., 28, 630 (1963); Kosower E. M., XV u G.-S., J. Org. Chem.,
28, 633 (1963).
7. J о h n s о n W. S., Wiedha up K., Brady S. F., О I s e n G. L., J.
Am. Chem. Soc., 90, 5277 (1968); see also J о n h s о n W. S., L i T., F a u 1 k-
n e r D. J., C a m p b e 1 1 S. F., J. Am. Chem. Soc., 90, 6225 (1968).
8. W у n b e r g H., Kr a a k A., J. Org. Chem., 29, 2455 (1964).
9. К г a a k A., Wiersema A. K., J orders P., Wynberg H., Tetra-
hedron, 24, 3381 (1968).
10. Nonhebel D. C., R u s s e 1 1 J. A., Chem. Ind., 1968, 1841.
МЕДЬ ХЛОРНАЯ (БРОМНАЯ) — АЗОТА ОКИСЬ, CuX2-2H.2O—
—NO.
Одностадийное замещение первичной ароматической аминогруп-
пы на хлор или бром можно осуществить следующим образом [1]:
ArN’H2-yCuCI2-NO АгС1+2СиС1+ЩО + ЬЕ
Раствор амина в ацетонитриле добавляют к раствору хлорной
284
(или бромной) меди(П) в ацетонитриле в атмосфере окиси азота
при комнатной температуре. Выходы обычно составляют от 30
до 90%. Этот процесс, по существу, является одностадийной реак-
цией Зандмейера. При этом не требуется охлаждения льдом.
L Brack man W., Smit P. J., Rec. trav., 85, 857 (1966).
N-МЕТАНСУЛЬФИНИЛ-п-ТОЛУИДИН, CH3SONHCcH4CH3-ft.
Мол. вес 169,25, т. пл. 115—116°.
Реагент получают [11 из н-толуидииа и метансульфинилхло-
рида [21
Синтез олефинов. При обработке 2 же «-бутиллития М. образует
дилитмевое производное (2), которое при взаимодействии с кетонами,
например с бензофеноном, дает |3-оксисульфинамид (3). При нагре-
вании аддукта (3) до температуры плавления (137—139 ) отщепляется
ц-толуидин и двуокись серы и с высоким выходом образуется 1,1-
дифенилэтилен.
Р I) (СаН;)2СО
—78° ! 2) Н,0
СН35ОННСф%СН3нг4-2*-Ви1л LiCH2SONC6H4CH3-n -----—-----»
(1) (2)
ОН
H5c6 I д Н5С6
—> >C-CH,SONHC(iH4CH.rn-----> ЗС = СНЙ +
н5с/ (з} J 96%Н5С/(4)
+ SO2 + /i-CH3C6H4NH3
Взаимодействие (2) со сложными эфирами приводит после гид-
ролиза к метилкетонам с высоким выходом. Например, при реакции
с этиловым эфиром бензойной кислоты получается ацетофенон:
сЕн5со2с.нг, +CH,soNceH4cHvn —тгф ^2 С6Н5СОСН3
' ' | “ 1 ' ОЩО
Li Li
|3-Оксисульфинамиды расщепляются стереоспецифично путем
цис-элиминирования [3]. Например, из mpawc-р-оксиеульфинанилида
(5) образуется mpawc-циклододецеи (6) с выходом более 95?^. Дру-
(6)
•ь C6H5NH2 г SO2
гим доказательством стереоспецифичности служит термическая
устойчивость тр(7«с-2-оксициклогексаисульфН1-1анилида (7). В этом
285
случае при ijwc-отщеплении должен был образоваться чрезвычайно
/ \ /0Н
\'/4'SNHC6H5
II
о
(7)
неустойчивый щраяс-циклогексен.
1. С о г е у Е. J., Durst Т., J. Am. Chem. Soc., 88, 5656(1966); 90, 5548(1968).
2. D о u g 1 a s s I. B., F a r a h B. S., T h о m a s E, G., J. Org. Chem., 26, 1996
(1961).
3. Corey E.J., Durst T., J. Am. Chem. Soc., 90, 5553 (1968).
МЕТАНСУЛЬФОКИСЛОТА (11, 248—249).
Защита амидов карбоновых и сульфокислот (11, 249, перед ссыл-
ками) [4]. Бензильная группа является удобной защитной группой
для амидов карбоновых и сульфокислот, так как легко удаляется
при обработке М,, которая для этой цели оказалась более пригод-
ной, чем серная кислота [4].
О О
II /СбН5 н + ||
CfiH5C— N< с6н5с— nhc6h5
ЧСН2С6Н5
/СН3 н +
n-CH3C6H4SO,N.z —> tt-CH3C6H4SO2NHCH3
4CH2CSH5
Реакция циклизации. М. (90%-ная) используется для конденсации
о-ацетилбензойной кислоты (1) и 1,2-диметоксинафталина (2) с об-
разованием 3-метил-3-(3,4-диметокси-1-нафтил)-фталида (3) [51. В ка-
честве циклизующего агента М. значительно лучше, чем конц. сер-
ная кислота, так как не вызывает окисления или сульфирования
диметоксинафталина.
4. L о с v В., Haas М. A., Dowalo F., Chem. Ind., 1968, 973.
5. Newman M.S., Davis С. C., J. Org. Chem., 32, 66 (1967).
МЕТАНСУЛЬФОХЛОРИД (мезилхлорид) (11), 250—253. Вни-
мание! Рагент обладает лакримогенным и кожнораздражающим
действ йен.
286
Дезоксигенирование фенола превращением в мезилат или дп-
этилфосфат с последующим восстановлением натрием в жидком ам-
миаке см. Диэтилфосфит (т. 1 и V).
Реакция с метил- d-глюко пиранозидами [11] (II, 253, перед ссыл-
ками). При взаимодействии 2 же. М. с мети л-a-d-глюкопиранозидом
в ДМФА происходит селективное замещение первичной спиртовой
группы на хлор и получается 6-хлор-6-дезоксигексопиранозид без
образования промежуточного 6-О-мезилпроизводного. В случае
метил-а-о-ксилопиранозида, не имеющего первичной гидроксильной
группы, из реакции возвращается 99% неизмененного гликозида.
1
снон
неон
носн
I
неон
I
НС^—
1
СН2ОН
СНЩ0Х1 — ДМФА; 65'
снон
н(1он
носн
неон
I
нс-----
СН.гС1
11. Evans М. Е., Long L.., Jr., Parrish F. W., J. Org. Chem., 33, 1074
(1968).
МЕТИЛАЛЬ (II, 255—256, ссылка [3]).
Последняя статья: Schollkopf U., Kuppers H.,
Traenckner H.-J., Pitteroff W., Ann., 704, 120 (1967).
МЕТИЛАТ МАГНИЯ, Mg(OCH3)2. Мол. вес 86,39.
Получение [1]. В колбу на 2 л, снабженную осушительной труб-
кой, помещают 1 л сухого метанола (перегнанного над М. м.),
затем при охлаждении льдом добавляют магний тремя порциями
по 3 г. Когда весь магний прореагирует, охлаждающую баню уда-
ляют, колбу снабжают холодильником и к раствору добавляют во-
семь порций магния по 1,5 г. Основная часть М. м. кристаллизуется
при стоянии в холодильнике, после декантации к продукту добав-
ляют сухой метанол.
Для получения раствора М. м. в колбу на 2 л, снабженную осу-
шительной трубкой, помещают 1,2 л сухого метанола (перегнанного
над М. м.) и при охлаждении льдом добавляют четыре порции по
3 г магния до полного растворения.
Катализатор конденсации. Максфельдт и сотр. [2] обнаружили,
что М. м. является подходящим основным катализатором для кон-
денсации бензальдегида (1) с 2,2-диметоксибутаноном-З (2), приво-
дящей через промежуточные соединения (3) и (4) к 4-фенилциклопен-
тандиону-1,2 (5). Предполагается, что в ионном магниевом комплексе
(4) открытая цепь предшественника (3) приобретает конформацию,
удобную для внутримолекулярной конденсации по Михаэлю. По-
287
пытки применения других основных катализаторов не привели
Ш (2) (3) (4) (5)
к успеху. Продукт конденсации кеталя (2) с диметилоксалатом ана-
логичным образом можно циклизовать в 2,5-диокси-1,4-бензо-
хинон (7).
(2) (6) (7)
Конденсацией 4-метокси-2-метилпирона-2 (8) с и-метоксибенз-
альдегидом (9) в присутствии М. м. (полученного из 200 мг магния
и 10 мл метанола) синтезирован природный пирон янгонин (10) 13].
ОСН3
(8) 580 мг
(10) 160 мг
Конденсация 4-окси-6-метилпирона-2 с бензальдегидом в присут-
ствии пиперидина и уксусной кислоты приводит к продукту, иден-
тифицированному как (11) [41.
Он С6Н5ОН
Н3С 0 00 0 сн3
l.Muxfeldt Н., private communication.
2. М u х f е I d t H., Weigele M., Van Rheenen V., J. Org. Chem., 30
3573 (1965).
288
3. Bu ‘Lock J. В., Smith H. G., J. Chem. Soc., 1960, 502.
4. Douglas L. J., M опеу T., Tetrahedron, 23, 3545 (1967).
МЕТИЛАТ НАТРИЯ (II, 256—262, перед ссылками).
При обработке 2-цианметил-2',4'-диметоксибензофенона (1) М. н.
в ДМСО в атмосфере азота образуется темно-красный раствор, при
нагревании которого в течение 10 мин при 140° с последующим под-
кислением с почти количественным выходом получают 9-циан-2-
метоксиантранол-10 (3) [20]. Реакция осуществляется, по-видимому,
через промежуточный карбанион (2). При обработке щелочной пере-
кисью водорода аитранол окисляется в антрахинон (4) с выхо-
дом 90 %,
20. D a v i е s J. S., D a v i е s V. Н., Hassall С, Н., Chem. Comm., 1968,
1555
2-МЕТИЛБУТИЛАТ-2 НАТРИЯ (mpem-амилат натрия) (II, 265—
266, перед ссылками).
Конья [7] предлагает использовать это основание вместо обыч-
но применяющихся фениллития или н-бути л лития для получения
иестабилизированных фосфониевых илидов. Основание растворимо
в различных органических растворителях, а под влиянием образую-
щегося трет-амилового спирта, по-видимому, улучшаются выходы
в реакции Виттига.
7. С о п i a J.-M., L im asset J.-С., Bull, soc. chim. France, 1967. 1936.
МЕТИЛ ВИНИЛ КЕТОН (II, 266—274, перед ссылками).
Аннелирование эндоциклических енаминов. Стивенс и Уэнтланд
[20] получили нитрил 1-фенилциклопропанкарбоновой кислоты (2а)
10 № 1994
289
бис-алкилированием фенилацетонитрила (la) 1,2-дибромэтаном в
присутствии амида натрия. Контролируемое частичное восстановле-
ние нитрила (2а) приводит к альдегиду (За), который при конденса-
ции с метиламином в присутствии сульфата магния дает соединение
(4а). Было найдено, что этот циклопропилальдимин в условиях ки-
слого катализа подвергается термической перегруппировке в Д2-
пирролин (5а). Это пример нового эффективного общего метода син-
теза пирролннов. Стивенс и Уэнтланд [21] обнаружили далее, что
пирролин (5а) при взаимодействии с М. в этиленгликоле при 150°
(la) R = Н
(16) R = ОСН3
ВгСНгСНгВг
NaNH2
Эфир
(За)
(5а)
дает продукт аннелирования (6а) с 47%-ным выходом. Соединение
(6а) представляет особый интерес, так как его циклическая си-
стема родственна системе таких алкалоидов, как кринин (7), ме-
зембрин (8) и хазубанонин (9). Первые попытки применения нового
метода для синтеза мезембрина оказались безуспешными на первой же
стадии — при получении замещенного циклопропана (26) бис-алки-
лированием ди метоксифенил ацетонитрил а (16) дибромэтаном в при-
сутствии амида натрия. Однако реакцией соединения (16) с я-6утил-
литием в смеси ТГФ—гексан было получено дилитиевое производ-
ное (1в) (подобно синтезу дилитиевого производного бензилцианида
290
описанному ранее Кайзером и Хаузером [22]), которое гладко реа-
гирует с 1,2-дибромэтаном с образованием циклопропанового про-
изводного (26). Остальные стадии синтеза проходят так же гладко,
как и с модельным соединением, и приводят к (+)-мезембрину (8).
В одновременно опубликованных статьях Стивенс и Уэнтланд
[20] и Кили и Тэк [231 независимо сообщили о синтезе d,/-мезем-
брина из М-метил-3-(3,4-диметоксифенил)-пирролина-2 и М. В по-
следнем случае циклопропильное производное (36) было получено
реакцией аниона 3,4-диметоксифенилацетонитрила (1в) с 1,2-дибром-
этаном, причем в качестве растворителя использовался ДМСО,
а в качестве основания — его натриевая соль. Восстановление диизо-
бутил алюминий гидридом в эфире приводит к альдегиду, который
конденсируется с метиламином (взятом в избытке) в смеси бензол —
эфир в присутствии окиси кальция в качестве дегидратирующего
агента.
Исследуя далее применение М. для аннелирования эндоцикли-
ческих енаминов, Стивенс и Уэнтланд [21] сообщили о простом трех-
стадийном синтезе (±)-15,16-диметоксиэритринанона-3 (11), аналога
алкалоида, выделенного из Erythrina.
Реакция с триалкилборанами. Триалкилборан (1), получае-
мый гидроборированием алкена, легко вступает в реакцию 1,4-при-
соединенпя кМ. с образованием эфира (2), который в результате гнд-
Ю*
291
ролиза дает метил кетон (3) [24].
СН3 СН,
[ ' н»о I
R3B + CH,=CHCOCH3 RCH2CH = C— obr2 -Ж RCH2CH2C=-O
(*1) (2) (3)
1 Методика А. В раствор 100 жмолей октена-1 в 30 мл ТГФ после
продувания азота вводят шприцом 33,3 мл 1 /И раствора борана
в ТГФ. Спустя 1 час к смеси добавляют 50 жюлеп М. в 15 мл ТГФ.
Смесь выдерживают 2 час при 40°, затем добавляют 15 мл воды и рас-
твор нагревают при 40° еще 1 час, после чего высушивают над суль-
фатом магния и анализируют методом ГЖХ.
8 1
СН3СНаСН2СН2СН2СНаСН^=СН.г —>
99%
( 0
12 II
) СН3СНпСН3СН2СН2СН.,СН2СНпСН„СНгССН3 (85%)
“ сн, “ о
и I !1
I. CH3CH2CH2CH2CHaCH2CHCH2CHsCCH3 (15%)
5 "а
Методика Б. Гидроборированием, как описано выше, получают
40 жюлей борорганического соединения; к нему добавляют 100 лшо-
лей воды, затем 60 кмолей М. и смесь перемешивают при 25° в те-
чение 1 час. По данным ГЖХ-анализа выход и соотношение изоме-
ров практически такие же, как в предыдущей методике.
Метилкетоны легко превращаются путем галоформной реакции
в кислоты, поэтому рассматриваемая последовательность реакций
позволяет удлинить цепь на три углеродных атома.
20. S t е v е п s R. V., W е n t 1 a n d М. Р., J. Am. Chem. Soc., 90, 5580 (1968).
21. Stevens R.V., Went land M. P., Chem. Comm., 1968, 1104.
22. К a i s e г E., H a u s er C,, J, Am. Chem. Soc., 88, 2348 (1966).
23. К e e 1 у S. L., Jr., Tahk F. C., J. Am. Chem. Soc., 90, 5584 (1968).
24. Suzuki A., A г a s e A.,Matsumoto H., I t о h M., Brow n H. C.,
Rogic M. M-, Rathke M. W., J. Am. Chem. Soc., 89, 5708 (1967).
МЕТИЛЕНМАГНИЙБРОМИД (ИОДИД), CHa(MgX)a.
Реагент получают [1] при взаимодействии амальгамы магния
с бромистым метиленом СН2Вг2 (мол. вес 173,86, т. кип. 98,2°) или
иод истым метиленом СНД, (мол. вес 267,85, т. кип. 180 s). Оба ре-
агента под действием двуокиси углерода образуют малоновую ки-
слоту:
CH2I2+2Mg-^CH2(MgI)a —X—СН,(СО,Н),
Но наиболее интересна открытая Кэйнелли и сотр. 11] реакция
с карбонильными соединениями, сходная с реакцией Виттига;
CH2(Mgi3)2 + O=c/ СН2-С— OMgl СН, = с/
' I I 4
Mgl
292
Выходы составляют от 30 до 80%. По типичной методике смесь ке-
тона и бромистого (или йодистого) метилена добавляют по каплям
при перемешивании к суспензии амальгамы магния (в атмосфере
аргона). к,|3-Ненасыщенные кетоны реагируют путем 1,2- и (или)
1,4-присоединения. В субстрате допустимо наличие гидроксильной
группы, но при этом следует дополнительно вводить эквимолярное
количество реагента.
Примечание. Фидлер и сотр. [21 пытались получить мети л енмаг-
нийбромид и метиленмагнийиодид реакцией соответствующих гало-
генидов с магнием, однако предполагаемые продукты проявляли
незначительную активность по отношению к бензальдегиду. Позднее
итальянские исследователи достигли успеха, применяя более реак-
ционноспособную амальгаму магния.
И Са ineHi G., В е г 1 i п i F., G г a s s е I I i Р., Z u b i a n i С., Tetrahed-
ron Letters, 5153 (1967).
2, Fi d lerD. A., J ones J. R., C 1 а г k S. L., S i a n ge H., J. Am. Chem.
Soc., 77, 6634 (1955).
МЕТИЛЕН ХЛОРИСТЫЙ (11, 277).
Поправка Па]. Каррузерс [1] использовал более старую по сравне-
нию с указанной здесь систему нумерации. В действительности он по-
Хризен
лучил 6-, 2- и 3-ацетилхризены при ацетилировании хризена в нитро-
бензоле или сероуглероде и только один 6-изомер при использовании
в качестве растворителя хлористого метилена. На эту поправку наше
внимание обратил проф. Р. Г. Харвей из Чикагского университета,
la. Correction called to our attention by Prof. R. G. Harvey, Univ, of Chicago.
МЕТИЛ ИОДИСТЫЙ (II, 278—281).
Метилирование каротиноидных спиртов (II, 281). Мюллер и
Каррер [201 использовали условия Куна (СН31 — ДМСО — ДМФА
ВаО) для метилирования оксикаротиноидов [20а!.
Метилирование углеводов. Андерсон и Кри [211 осуществили
исчерпывающее метилирование моносахаридов и кислых дисаха-
ридов в одну стадию под действием смеси М. и.— гидрид натрия —
ДМСО; однако кислые полисахариды в этих условиях метилируются
лишь частично. Стеси и сотр. [22] метилировали глюкопиранозиды
обработкой смесью бромистого метила, гидрида натрия в ДМФА
или N-мети л пир рол и доне-2.
293
Десульфуризация. Хелмкамп и Петтитт [23] обнаружили, что
десульфуризацию цис-2,3-диметилтиирана можно осуществить ки-
Кипячение
в ацетоне
сн, .
> ^С-С^ + (CH3)3SI
н
пячением с М. и. в ацетоне; при этом образуются цис-бутен-2 и
триметнлсульфонийиодид. Позднее те же авторы [24] использовали
этот метод для десульфуризации циклооктенсульфида.
+ (CH3)3SI
20а. See also Schneider D.F., W eedonB.C.L., J. Chem. Soc., (C), 1967,
1686.
21. Anderson D. M. \V., Cree G. M., Carbohydrate Res., 2, 162
(1967).
22. Brim acorn be J. S., J ones B.D.,Stacey M., Willard J. J.,
Carbohydrate Res., 2, 167 (1966).
23. Helmkanip G. К., P c t i i t D. J., J. Org. Chem., 25, 1754 (1960).
24. P e t t i t t D. J., Helmkamp G. K., J. Org. Chem., 28, 2932 (1963);
29, 2702 (1964).
МЕТИЛЛИТИЙ (II, 282—285).
Синтез алленов (II, 281, после выдержки из [7]). Шарма и
сотр. [7а] из Индийского технологического института использовали
метод Унча и сотр. [7] для превращения ц нс, цш?-циклононадиена-1,5
(1) в еналлен ци кло декатри ей-1,2,6 (2). Восстановление алленовой
группы в (2) натрием в жидком аммиаке приводит к диену, который,
по данным газовой хроматографии, не содержит примесей. Согласно
ПК- и ЯМР-спектрам, а также результатам превращения в угле-
водород, идентифицированный как циклодекан, продукт является
цис, цис-цикло декадиеном-1,6 (3).
(Н,284, после выдержки из [8].) Сообщалось, что в некоторых
случаях были выделены неа л леновые продукты. Например, реакция
7,7-дибромноркарана (1) с М. в эфире приводит с 20%-ным выходом
к соединению (3), которое, по-видимому, образуется через проме-
294
жуточный карбен (2) [8а]:
(О
(С2Н5)гО^
(з)
Еще более интересна реакция (1) с М. в эфире при —80° (Моор
[8а]), которая дает углеводородную фракцию, на 40% состоящую
из сильно напряженного углеводорода (4):
CH3Li—эфир (-80°)
40%
(1) (4)
Скаттебол 186, 8в] исследовал действие М. на геминальные ди-
бромциклопропаны, содержащие олефиновую связь в боковой цепи
(5), и выделил почти равные количества двух продуктов (6) и (7).
Если реакция проводится при 0°, то преобладает аллен (6). Инте-
ресный напряженный трициклический углеводород (7) образуется,
СН31л
------->
-78°
(5) (6} 52% (7) 48%
по-видимому, в результате внутримолекулярного внедрения комп-
лексного карбеноидного промежуточного продукта.
ДЛОкталин (10) легко получается по Бенкесеру (1955 г.) восста-
новлением нафталина литием иэтиламиноми изомеризацией неболь-
шого количества Д1(в)-изомера. Группой индийских исследователей
[8г] осуществлено превращение этого углеводорода в производное
еелг-дибромциклопропана (11) и исследована реакция последнего
с М. в эфире при низкой температуре. В результате реакции с хо-
295
P3OS (1404
решим выходом образуется сильно напряженный полициклический
углеводород (13), вероятно, через карбен (12).
Унч и сотр. [8д] описали удобное одностадийное превращение
олефиналлен. включающее две следующие реакции:
ч 7 Вщ ,Вг
1) CBr4 + CH3Li [:СВг2]+ ;С=С< —► ч >С< z
Вг, /Вг х /
2) х \С< /+СН3Ы)С = С=С<
;С'С—-Сф / х
Например, к 0,5 моля циклооктадиена-1,5 в атмосфере азота при
—65° добавляют четырехбромистый углерод, а затем Л1. в эфире.
После соответствующей обработки получают циклононатриен-1,2,6
с выходом 70% (в расчете на СВга). При использовании н-бутилли-
СВг4 —CH3Li
тия выходы заметно снижаются.
Моор и Озретич [8е] синтезировали циклический кумулен —
циклодекатриен-1,2,3 (3) — следующим образом. Циклононадиен-1,2
(1) обрабатывали 1 же фенил-(трибромметил)-ртути в кипящем бен-
золе; после удаления бромистой фенилртути и растворителя полу-
чали 10,10-дибромбицикло-[7,1,01-децен-1,2 (2), который при вза-
296
имодействии с М. дает кумулен (3).
93%
(3)
Получение метилкетонов из кислот (II, 285). При исследовании
в ряду дитерпеновых кислот Бори и сотр. [10а] обнаружили, что
аксиальный метиловый эфир (1) гладко реагирует с М., образуя со-
ответствующий метилкетон (2), тогда как экваториальный эфир
(3) дает смесь метил кетона (4) и спирта (5) *.
* Разработан интересный вариант реакции литнйалкилов с карбонильными
соединениями. Смесь карбонильного соединения и алкнлгалогенида (10—15%-ный
избыток) добавляют по каплям к суспензии лития в ТГФ при охлаждении (не
297
Другим примером служит разработанный Бэром и Хаузом [106]
метод получения метил циклогексил кетона из циклогексанкарбоно-
вой кислоты. К суспензии гидрида лития в 1,2-диметоксиэтане
(свежеперегнанном над LiAlHJ при перемешивании добавляют по
каплям раствор циклогексанкарбоновой кислоты в 1,2-диметокси-
этане; смесь кипятят с обратным холодильником при перемешивании
до завершения образования литиевой соли циклогексанкарбоновой
кислоты и прекращения выделения водорода, затем охлаждают и
добавляют по каплям в течение 30 мин эфирный раствор М. После
подкисления, соответствующей обработки и перегонки получают
метилциклогексилкетон (4) в виде бесцветной жидкости. В другом
сообщении [10в] авторы предполагают образование дилитиевого
производного (3).
Енолят-анионы (II, 285, перед ссылками). Хауз и Трост [12]
разработали метод получения некоторых енолят-апионов обработкой
енолацетата М.
выше 0е). Реакция завершается за 2 час, выходы выше, чем в реакции Гриньяра.
Карбонильное соединение Алкнлгалогеиид Выход спир- та, %
CH3CH2CH^O СН31 51
CH3CHaCH = O СН3СНаВг 90
PhCOOMe МЫ 74
Параформ СН3 (СН2)4СНаВг 72
CHSCOCH3 Ph Вт 34
PhCH = O PhBr 96
PhCH=O СН2=СНСН2Вг 71
СНа==С (Me) СООМе С1-13 (СН.,)гСН2Вг 89
[Р е а г с е Р. J., R i с 11 а г d s D. Н., S с 1 1 1 у N. F., Chem. Comm., № 18,
1160 (1970)].— Прим. ped.
298
Определение [13] М. основано на реакции его с диметилфенил-
хлор силаном и последующем анализе методом газовой хроматогра-
фии.
Сн3 СН3
I I
CH3Li + C6H5-Si-CI ----» СсНБ- Si-CH,
I —NaCl ;
сн3 сн3
7а. Sh arms S. N., Sr ivasta va R. K., Devapr abhakara D.*
Can. J. Chem., 46, 84 (1968).
8a. Moore W. R., Ward Fl. R., M e r r i 11 R. I7., J. Am. Chem. Soc., 83,
2019 (1961).
86. S k a t t e b 0 I L., Chem. Ind., 1962, 2146.
8b. S k a t t e b ,o 1 L., J. Org. Chem., 31, 2789 (1966).
8г. V a i d v a n t h a s w a in v R., Devaprabhakara D., Chem. Ind.,
1968, 515.
8д. U n t c h K. G., Martin D. J., C a s t e 1 1 u c i N. T., J. Org. Chem.,
30, 3572 (1965).
8e. Moore W. R., О z r e t i c h T. M., Tetrahedron Letters, 3205 (1967).
10a. В о г у S., F c t i z о n M., R e n s J., Bull. soc. chim. France, 1966, 2011.
106. В a r e T, M., H ouse H. O., procedure submitted to Org Syn. (1968).
10b. House H.O.,Bare T. M., J. Org. Chem., 33, 943 (1968)'
12. House H. Q., Trost В. M., J. Org. Chem., 30 , 2502 (1965).
13. House H. O., Respess W. L., J. Organometallic Chem., 4, 95 (1965).
МЕТИЛМАГНИЙИОДИД (11, 286, перед ссылками).
Под действием М. (без растворителя, при 155—165°, 15 мин)
было осуществлено расщепление диметилового эфира (1) до d,(-кан-
набидиола (2) с. выходом 80%. Ранее в лаборатории Оуриссона
таким же способом были деметилированы производные диметокси-
резорцина.
СН3 сн3
I ' I
А ОСН3 он
(1)
2. Mechoulam R., G а о n i Y., J. Am. Chem. Soc., 87, 3273 (1965).
МЕТИЛМЕДЬ — ТРИ-я-БУТИЛФОСФИН, КОМПЛЕКС,
СН3СиР(я-Ви)3.
Метод получения комплекса, разработанный Хаузом [11, осно-
ван на реакции 1 экв CH3Li с 1 экв комплекса три-^-бутилфосфпна
с иодидом меди (1) [2] в эфире. Почти бесцветный эфирный раствор
комплекса устойчив при 0= по крайней мере несколько часов. Ре-
299
агент быстро и избирательно присоединяется к а,(3-непредельным
кетонам с введением метильной группы к ^-углеродному атому, но
менее реакционноспособен по отношению к изолированной карбо-
нильной группе. Так, с ненасыщенным кетоном (1) реагент образует
1,4-аддукт (2) и спирт (3) в соотношении 3:1. Реакция (1) с метил-
магнийбромндом, напротив, приводит с высоким выходом к третич-
ному спирту (3), а сопряженного присоединения прн этом вообще
не наблюдается.
2. 31, 3128 (1966).
Kaufman J. В., Teter L. A., Inorg. Syn,, 7'r 9 (1963).
N-МЕТИЛМОРФОЛИН (11, 287).
Было обнаружено, что в синтезе пептидов методом смешанных
ангидридов применение М. практически исключает рацемизацию,
тогда как широко применяющееся основание — триэтиламин при-
водит к значительной рацемизации [1]. Триметиламин также вызы-
вает сильную рацемизацию, но его можно с успехом применять,
если избегать избытка реагента. М. был использован Виландом [2]
в синтезе антаманида — циклического декапептида, выделенного
из Amanita phalloides, который является противоядием от токси-
нов Amanita.
1, A n d er son G. W., Z i m in е г m a n n J. F., C a [ 1 a h a n F. M., J. Am.
Chem. Soc., 88, 1338 (1966); 89, 5012 (1967).
2. \V ie land Th., Angew. Chem., Internal. Ed., 7, 204 (1968).
N-МЕТИЛ П ИРРОЛ ИДОН-2 (II, 292—293, перед ссылками).
Хенбест [5] использовал этот растворитель для проведения реак-
ции А4-3-кетостероидов с цианистым натрием, приводящей к 5сс-
и 5|3-циан-3-кетостероидам. Заместитель в положении 17 не оказы-
вает сильного влияния на стерическое направление присоединения.
При нагревании с трифенилфосфином п натриевой солью ди-
фторхлоруксусной кислоты в глиме или диглиме альдегиды превра-
300
щаются в 1,1-дифторэтилены. Кетоны в тех же условиях не вступают
в реакцию. Однако Фюка и corp. 161 обнаружили, что при исполь-
зовании в качестве растворителя М., а в качестве основания трибу-
тилфосфина реакция с удовлетворительными выходами осущест-
вляется и с кетонами.
5. Н е п b е s t Н. В., Jackson W. R., J. Chem. Soc., (С), 1967, 2465; see
also Heller M., Bernstein S., J. Org. Chem., 32, 3978 (1967).
6. Fuqua S. A., D u n c a n W. G,, S i 1 v e r s t e i n R. M., Tetrahedron Let-
ters, 521 (1965).
4-(МЕТИЛТИ0)-ФЕН0Л, HOC(SH4SCH3. Мол. вес 139,20, т.
пл. 86°.
Защита карбоксильной группы [11. Под влиянием дицикл огексил-
карбодиимида реагент взаимодействует с N-защищенной аминоки-
слотой, давая 4-(метилтно)-фениловый эфир (1). Этот защищенный
эфир при окислении избытком перекиси водорода в уксусной ки-
слоте превращается в сульфон (2), представляющий собой активи-
рованный эфир, пригодный для пептидного синтеза.
В последующей работе [2] было найдено, что для окисления лучше
использовать лд хлор надбензойную кислоту в диоксане. Стадию
активации можно проводить в присутствии N-Cb и mpem-бутил-
сложноэфирной защитных групп и в присутствии пептидных свя-
зей. Этот метод был успешно применен для синтеза защищенного
гептапептида (А82 — Л88) бычьего химотрипсиногена А.
/.—х дцк
RCHCCLH + HO—Ф >-SCH3------->
I
NH-Cb
О
/--х Н,Ог /—, II
—► RCHCO.-ф ^-SCH4 —RCHCOo-ф 'ф-SCH3
j " z^z • АсОН I “ н
NH-Cb (1) NH—Cb (2) О
Превращение 4-(метилтио)-фенилового эфира в активированный
4-(метансульфонил)-фениловый эфир происходит без рацемизации
[31.
1. Johnson В. J., Jacobs Р. М., Chem. Comm., 1968, 73.
2. Johnson В. J., Т г a s k Е. G., J. Org. Chem., 33, 4521 (1968).
3. Johnson B. J., Jacobs P. M.,J. Org. Chem., 33, 4524 (1968).
МЕТИЛТИОФОСФОНОВОЙ кислоты ДИМЕТИЛОВЫЙ
ЭФИР, CH3PS(OCH3).2. Мол. вес 140,13, т. кип. 40°/4,0 мм.
Получение [П. К суспензии 0,24 моля порошкообразного хло-
рида алюминия в метилди хлорфосфине (4 моля) при перемешивании
добавляют 4 г-атом серы. Полученный дихлорангидрид метилтио-
фосфоновой кислоты (1) превращают в диметокси-производное
301
(2) обработкой метилатом натрия.
2NaOCH3
AlCl34-CH3PCL-rS —-^CH.PSCL ~CH3PS (ОСН3).,
। -< - । 91,8% " * 78% A v
(1) (2)
Синтез олефинов [2]. Реагент (2) металлируется под действием
«-бути л лития, образуя а-литиевое производное (3), которое при
взаимодействии с различными карбонильными соединениями дает
аддукты типа (4), разлагающиеся при комнатной температуре до
олефинов (5). Этим способом 1,1-дифенилэтилен был получен с вы-
ходом 81%.
ТГФ, Ns
CH3PS(OCH3)., + «-BuLi LiCH2PS(°CH3)2
(2) (3)
(с0н3)8с=о. (C(jHs)2CCH2pS(осн3)2 21 тосАри2!°(с6н5)2с=сна
| 81 %
OLi
(4) (5)
1, Hoffmann F.W., Wadsworth D.H,, Weiss H. D., J. Am. Chem.
Soc., 80, 3945 (1958).
2. С о г e у E. J., Kwiatowski G. T,, J, Am. Chem. Soc., 88, 5654 (1966).
1-МЕТИЛ-З-п-ТОЛИЛТРИАЗЕН (II, 293, ссылка [1]).
Поправка. White E. H., Baum A. A., E i t e 1 D. E.,
Org. Syn., 48, 102 (1968).
4-МЕТИЛ-1,2,4,-ТРИАЗОЛИНДИОН-3,5, (2). Мол. вес 112,09,
красные кристаллы, т. пл. 98—98,5°.
1W получают [1] окислением 4-метилуразола (1) четырехокисью
азота.
О
HN-J. NO в CH CI
I \nch3 2^k....B CH1CA
HN----/ 81%
0
(1)
о
N___
и ;nch3
N—/
О
(2)
Реакция Дильса — Альдера. М. является одним из наиболее
реакционноспособных диенофилов. Так, под действием циклопен-
тадиена при —78° раствор красного диона мгновенно обесцвечивает-
ся [2, 3].
Реакция с моноолефинамн, имеющими аллильные атомы водо-
рода [4]. Этот дион исключительно реакционноспособен по от-
ношению к моноолефинам, имеющим аллильные атомы водорода,
например тетраметил этилену (3). Реакция осуществляется по типу
присоединения — замещения со смещением двойной связи в образу-
302
ющемся аддукте (4).
Н3С СН3 q
V n__
ii + и ;nch3
С N--
н/Хсн3 0
(3)
1. S t i с k 1 е г J. С., Р i г к 1 е W. Н., J. Org. Chem., 31, 3445 (1966).
2. Cookson R. С., G i 1 a n i S. S. H„ Stevens I. D. R., Tetrahedron
Letters, 615 (1962).
3. G i 1 1 i s В. T., Hagarty J. D., J. Org. Chem., 32, 330 (1967).
4. P 1 г к 1 e W. H., Stickler J. C., Chem. Comm., 1967, 760.
МЕТИЛФОСФОНОВОЙ КИСЛОТЫ ^ис-(ДИМЕТИЛАМИД),
CH3PO[N(CH3),L. Мол. вес 147,19, т. кип. 138°.
М. к, д. получают реакцией ди хлор ан гидрида метилфосфоновой
кислоты [1] с диметиламином 12]:
СН3С1 + РС13 СН3РОС1., I^±^CH3PO IN(CH3)2]2
Получение олефинов через фосфонамнды по Кори [3]. При обра-
ботке 1 экв w-бутиллития в атмосфере азота М. к. д. образует а-ли-
тиевое производное (2), которое с альдегидом или кетоном дает
бис-амид р-оксифосфоновой кислоты (3) с выходом 90—98%, Эти
аддукты представляют собой мелкокристаллические вещества, ко-
торые при кипячении в бензоле или толуоле в присутствии силика-
СЩРО [N (CH3),J, —LiCH.PO [N (СН3)2]2
3 L v —ВиН 90-98%
(1) (2)
ОН
R3CCHaPO[N(CH3)3]3 —7^ R2C = CH2 + [(CH3)2N]2POOH
Cd У О Уд
(3} (4)
геля претерпевают расщепление с образованием олефинов (4).
Метод имеет общий характер. Так, можно с успехом использовать
бис-(диметиламиды) этилфосфоновой и изопропилфосфоновой ки-
слот. Кроме того, литиевые производные можно алкилировать ио-
дистыми или бромистыми алкилами, которые почти не склонны к от-
303
щеплен ию:
Н О I) сн.,1 он сн3 о
Н С РГЧЧСН 1 1 ^нщослц Н^\1 1 J, д
Н —L — (Cn3)2J2 . - ---> / С— О--(ЦМ3)2]2 —>
1 Н5с/ I
Li H
H5Cfiy
—XC=CHCH3
H5c/
Этот метод интересен еще и потому, что может быть использован
для направленного синтеза цис- и траяс-олефинов [41. Образование
аддуктов происходит нестереоспецифично, но реакция отщепления
стереоспенифична (^яс-циклоэлиминирование). Примером служит
синтез цис- и трйяс-1-фенилпропенов. Первый был получен реак-
цией бензальдегида с а-литиевым производным бис-(диметила ми да)
этилфосфоновой кислоты, которая привела к двум диастереомерным
Р-оксифосфонамндам (5) в соотношении 3,5 : 1. Основной изомер
выделяется кристаллизацией и при пиролизе дает цис-}, -фен ил про-
пен. трпяс-Олефин был получен реакцией а-литиевого производ-
ного бис-(диметиламида) этилфосфоновой кислоты с метиловым эфи-
ром бензойной кислоты. Образующийся при этом Р-кетофосфонампд
ОН
I
С6Н5СНСНРО [N (СН3),]3 С6Н5СОСНРО [N (СН3)2],
сн3 сн3
(5) (6)
(6) в результате стереоспецифического восстановления боргидридом
натрия превращали в р-оксифосфонамид (5), изомерный получен-
ному первым способом. Пиролиз последнего приводит к транс-1-
фенилпропену. Другой возможный путь включает окисление (5)
активной МпО2 до кетона и последующее его восстановление,
Метод получения олефинов через фосфонамиды имеет некоторые
преимущества перед реакцией Виттига. Все реагенты дешевы и легко
получаются. Продукты реакции нетрудно выделить (отделение же
окиси трифенилфосфина иногда вызывает затруднения). Промежу-
точные амиды [3-оксифосфоновой кислоты легко очистить. Имеется
больше возможностей контролировать геометрию и положение
двойной связи.
1, Kinnear А. М., Perren Е. A., J. Chem. Soc., 1952, 3427.
2. Kosolapoff G, М.,Payne L. B„ J, Org. Chem.. 21, 413 (1956).
3. С о г e у E. J., Kwi at kowsk i G. T., J. Am. Chem. Soc., 88, 5652 (1966).
4. Corey E.J„Kwiatkowski G. T., J. Am. Chem. Soc., 88, 5653 (1966).
МЕТОКСИАЦЕТИЛЕН (II, 301—302, перед ссылками).
Эдман и Симмонс [5] показали, что этот метод (причем лучше
использовать этоксиацетилен) является наиболее удовлетворитель-
ным для дегидратации норборнадиен-2,3-Дикарбоновой кислоты
304
(5 ). Все другие известные способы синтеза ангидрида, в том числе
и с применением дициклогексил карбоди имида, дают низкие выходы.
5. Edman J. R„ S imtnons Н, Е,, J. Org. Chem., 33, 3808 (1968).
4-МЕТОКСИ-5,6-ДИГИДРО-2Н-ПИРАН, (3). Мол. вес 114,14,
т. кнп. 156—157°.
Получение [11. Этот метиловый эфир енола (3) получают перегон-
кой 4,4-диметокситетрагидропирана (2) с 0,1% мезитиленсульфо-
кислоты.
SOsH
Hscx/(xzCH3
СН3ОЧ /ОСН3
Защита гидроксильной группы [1]. Подобно дигидропирану,
М. присоединяет спирты в присутствии каталитических количеств
/?-толуолсульфокислоты с образованием кеталей (4). Однако пре-
имущество М.— в отсутствии введения нового асимметрического
roh4-ch3o-Z 22^ СНз°\/ \0
/ RO' 4-----7
(4)
центра. Образующиеся кетали очень неустойчивы по отношению
к разбавленным кислотам. М. был использован для защиты гидрок-
сильной группы в синтезе олигорибонуклеотидов.
1. R е е s е С. В., S a f f h i 1 1 R., Sulst on J. E., J. Am. Chem, Soc,, 89,
3366 (1967).
МЕТОКСИМАГНИЙМЕТИЛКАРБОНАТ (П, 303—307, ссылка
[71).
Последняя статья: Finkbe i пег H. L., J. Org. Chem.,
30, 3414 (1965).
а-МЕТОКСИМЕТИЛЕНТРИФЕНИЛФОСФОРАН (II, 307—308,
перед ссылками).
305
В модельных исследованиях реакции 20-кетостероидов с М.
Петтит и сотр. [21 нашли, что наиболее удобно гидроксильные груп-
пы защищать в виде тетрагидропираниловых эфиров и проводить
реакцию в кипящем диглиме (7 час). Из тетрагидропиранилового
эфира прегненолона авторы получили этим способом с выходом
83% виниловый эфир (2), который превращали в соответствующий
альдегид обработкой смесью 70%-нон хлорной кислоты и диэтило-
вого эфира (с одновременным гидролизом защитной группы).
(с6н5)3р=сносн3
<0 (2)
2. Pettit G.R.,Green В., Dunn G. L., Sunder-PlassmannP,,
J. Org, Chem., in press.
МОЛЕКУЛЯРНЫЕ СИТА (II, 309—311, перед ссылками).
В присутствии 14. с. Линде (гранулы, 4А) как осушителей аро-
матические альдегиды и кетоны легко реагируют с N-аминотрифенил-
фосфинимнном с образованием в качестве основных продуктов три-
фенилфосфазииов с выходами от 40 до 90% [131:
(C6H5)3P=NNHH-O=CR-2 —->(C6Hs)3P = N-N=CR2
Те же сита были использованы для получения азометина (2) из ан-
дростерона (1) и н-бутиламина [14]. Смесь андростерона (15 мг),
М. с. (0,5 г) и лкбутиламина (2 мл) выдерживали в атмосфере азота
в темноте при комнатной температуре в течение трех недель. Сита
отделяли, промывали 3 мл н-бути л амина, объединенные жидкости
фильтровали через кизельгур, растворитель удаляли и остаток
кристаллизовали.
Штерн и Болан [15] изучали этерификацию бензойной кислоты
(100 а) бутанолом-2 (300 мл) в присутствии 2 мл серной кислоты
в аппарате Сокслета, в экстракционную гильзу которого было по-
мещено 38 г сит Линде марки 5А. Оптимальный выход был получен
при кипячении в течение около 4 час. Этот метод удаления воды ока-
306
зался лучше многих других, в том числе и метода с использованием
ловушки Дина — Старка.
Сита Линде 4А ® СН3
H2SO4, 4 час h |
С6Н6СОгН4-СН8СН2СНСН3 •-—> С6Н5СОСН
| в и /и
он СН.СНз
В одном из ответов на вопросы д-р Штерн сказал: «Исследуя
применимость М. с. в синтезе, мы проверили четыре вида сит Лин-
де и обнаружили, что сита 4А п 5А работают очень хорошо, тогда
как сита 7А и 15Х неэффективны. Мы также изучили до некоторой
степени н другие молекулярные сига и нашли, что наилучшие ре-
зультаты получаются с ситами Линде».
Группой нидерландских химиков 116] исследована переэтери-
фикация типа RCOOCHg+R'OH-^RCOOR'-HCHsOH и показано,
что равновесие можно полностью сдвинуть вправо избирательным
поглощением метанола М. с. марки ЗА. При обмене эфиров с вто-
ричными, третичными и разветвленными первичными спиртами
пригодны также сита 5А,
13. Walker С. С., Sheeler Н., Tetrahedron Letters, 1447 (1965).
14. Bonnett R,, Emerson T. R., J, Chem. Soc., 1965, 4508.
15. S t e г n R. L., В о I a n E. N., Chem. Ind., 1967, 825: see also Harri-
son H, R,, H a у nes W. AL, Arthur P., E isenbra un E. J.,
Chem. Ind., 1968, 1568.
16, R о e 1 о f s c n D, P,, Hagendoorn J. A,, van В ekkum H., Chem.
Ind,, 1966, 1622,
МОЛИБДЕНА ГЕКСАКАРБОНИЛ, Mo(CO)«. Мол. вес 264,01,
разлагается около 150° без плавления, т, кип. 4287760 мм.
Эпоксидирование олефинов. Шенг и Зайачек [1] разработали
методику эффективного моноэпоксидирования циклооктадиена-1,5,
по которой смесь 1 моля диена, 0,5 моля 92%-ной m/wt-бутилгидро-
(СН3)3СООН-Мо(СО)б, 80'
77-82%
перекиси и 0,1 г М. г. загружают в цилиндрический стальной реак-
тор емкостью 500 мл и постепенно нагревают до начала экзотерми-
ческой реакции (87е), после чего поддерживают температуру около
100° в течение 30 мин. Кроме перегонки, не требуется никакой обра-
ботки продукта.
I S h с п g М. N., Z a j а с е k J, G., procedure submitted to Org, Syn, (1967),
МОНОНАДУГОЛЬНОЙ КИСЛОТЫ mpm-БУТИЛИЗОПРОПИ-
0
ЛОВЫЙ ЭФИР, (СН3)3СООСО-СН (СН3)2. 1Мол. вес 160,21.
307
Подобно перекиси изопропилового эфира угольной кислоты
реагент используют для превращения алкилбензолов в алкилфенолы
(И.
1, Kovacic Р,, К urz М. Е., J. Org. Chem., 31, 2459 (1966).
МОЧЕВИНА (II, 316—327).
Действие как основания (II, 324, после выдержки из [23]). При
исследовании ацетолиза этиловых эфиров ароматических сульфо-
кислот Бартлет и сотр. [23а] искали основание, достаточно сильное
для превращения образующейся сульфокислоты в инертную соль,
но при этом очень слабо нуклеофильное и неспособное к реакции
прямого замещения (как при использовании ацетатов натрия или
калия). Для этой цели авторы успешно использовали мочевину.
Ньюмен и Лола 1236] обнаружили, что при взаимодействии с
метанолом на холоду З-хлор-З-фенилфталид (1) дает псевдоэфир
(2), который под действием хлористого водорода быстро присоеди-
няет метанол по карбонильной группе с образованием нормального
метилового эфира (3). Добавление мочевины приводит к нейтрали-
зации минеральной кислоты и подавлению процесса превращения
(2) в (3). Это наблюдение особенно наглядно демонстрирует дей-
О—С=О О—С=О
С1 | I СН3Ох | I
/ с | > С I
Н5с/ \^\ н6с/
) || —£2 I || +HCI —+
Ш (2)
о
II соасн3
Н5СеС |
\/\
сн3он | ||
(3)
ствие М. как основания для нейтрализации сильных кислот в’ спир-
товой среде, Тетраметилмочевина менее эффективна, но в некоторых
случаях может быть незаменимым реагентом благодаря более высо-
кой растворимости в органических растворителях.
23а. Trahanovsky W. S.. D о у 1 е М. Р., В а г t I е 11 Р. D., J, Org.
Chem,, 32, 150 (1967).
236. Newman M. S., L о 1 a L, K., Tetrahedron Letters, 3267 (1967).
МУРАВЬИНАЯ КИСЛОТА (II, 327—331, перед ссылками).
Изомеризация этинилкарбинолов. Рупе [12] впервые наблюдал,
что при кипячении с 90%-ной М. к. этинилкарбинолы изомери-
зуются в непредельные карбонильные соединения, которые, как он
полагал, должны быть альдегидами. Позднее Чэнли [131 подробно
30S
исследовал эту реакцию и обнаружил, что преобладающим продук-
том является а,|3-ненасыщенный кетон. Например, 1-этинилцикло-
гексанол-1 (1) превращается главным образом в 1-ацетилциклогек-
сен-1 (2), а соединение (3) образуется лишь в незначительных
количествах.
(1) (2) 50% (3) 0,8%
Другие примеры:
но с^сн сосн3
\/ 1^
w 04]): | | J
С(СН3)3 С(СН3)3
цис или транс
Удаление защитных групп. Выделение альдегидов из соответст-
вующих ацеталей осуществляют кипячением в М. к. в течение
10—60 мин [17]. Реакция применима и к неустойчивым соединениям,
например к а-ацетиленовым альдегидам.
RCH (0R')2-}-2HCO2H —> RCHO4-2HCO2R'-PH2O
Халперн и Нитеки [18] столкнулись с трудностями при удале-
нии обычными методами (CF3COOH или СН3ОН—НС1) трет-
бутоксикарбонильной (mpem-БОК) защитной группы в трет-
бутоксикарбонил-ь-треонил-Е-карбобензоксилизинбензиловом эфи-
ре, но обнаружили, что треш-БОК-группа легко отщепляется при
обработке 98%-ной М, к. в течение 1—3 час при комнатной темпера-
туре. Карбобензокси- и О-бензильная защитные группы устой-
309
чивы к М. к. Другие защитные группы, неустойчивые в кислой
среде (N-тритильная, N-о-нитрофенилсульфонильная и О-трет-
бутильная простая и сложноэфирная группы), гладко отщеп-
ляются при обработке М. к.
12, Rupe Н. et al„ Helv, Chim. Acta, 9, 672 (1926); 11, 449, 656, 965 (1928).
13, C h a n 1 e у J. D., J. Am. Chem. Soc., 70, 244 (1948).
14. Newman M. S., Goble P, H,, J. Am. Chem. Soc., 82, 4098 (1960).
15. Johnson W, S., GrayS. L., Crandall J. K., Bailey D. M.,J.
Am. Chem. Soc., 86, 1966 (1964).
16. PelletierS. W., Prabhakar S., J. Am. Chem. Soc., 90, 5318 (1968).
17. Gorgues A., Compt. rend., 265 (C), 1130 (1-967).
18. H a 1 p e r n B„ N i t e c k i D. E., Tetrahedron Letters, 3031 (1967).
МУРАВЬИНОЙ КИСЛОТЫ ЭТИЛОВЫЙ ЭФИР (II, 332—335).
Формилирование кетонов (перед ссылками). Алкилирование а'-ме-
тиленовой или а'-метинильной группы циклических а-формилкето-
нов осуществляется с хорошим выходом [11]. Примером служит
реакция с 2-метилциклогексаноном [12].
11. В о a t m a n S., Н а г г i s Т. AL, Hauser С. R., J. Am. Chem. Soc., 87,
82 (1965).
12. В о a t m a n S., Harris T. M., Hauser C. R., Org. Syn., 48, 40 (1968).
НАДБЕНЗОЙНОЙ КИСЛОТЫ т/>ет-БУТИЛОВЫЙ ЭФИР (II,
342—346).
Взаимодействие с ненасыщенными соединениями (II, 344, после
выдержки из [7]). Подробная методика проведения реакции, от-
крытой Карашем, Сосновским и Янгом 17], описана на примере
превращения циклогексена в 3-циклогексенилбензоат [7а].
Н ОСОСеН5
/\ ° X
[ |]+с0н/о,с(сн3)3 I 1) +(СН3)3СОН
7а. Pedersen К., Jakobsen Р., La wesson S.-О., Org. Syn., 48,
18 (1963).
НАДЛАУРИНОВАЯ КИСЛОТА, СПН23СОООН. Мол. вес 216,31,
т. пл. 52.
Получение [11. Эта алифатическая надкислота, содержащая длин-
ную углеводородную цепь, легко получается реакцией лауриновой
кислоты с 0,5—2,0 молями 50—65%-ной перекиси водорода в конц.
серной кислоте; выход продукта почти количественный.
Окисление сульфидов до сульфоксидов [2]. В первых опытах по
окислению сульфида (1) в сульфоксид (2) Джонс и Грин [2] исполь-
зовали перекись водорода в уксусной кислоте, Для реакции тре-
бовалось 24 час. Затем они применили в качестве окислителя Н. к.
в петролейном эфире (40—60е), что позволило сократить время реак-
ции до 15 мин. Наблюдающееся при этом частичное окисление до
сульфона предотвращается при использовании менее 1 же Н. к. с по-
вторным окислением.
I. Р а г k е г W. Е., Ricciuti С., Ogg С. L-, Swern D., J. Am, Chem.
Soc,, 77, 4037 (1955).
2. Jones D. N., Green M. J., J, Chem. Soc., (C), 1967, 532.
311
НАДУКСУСНАЯ КИСЛОТА (П, 351—353).
Эпоксидирование олефинов (П, 351—352, после выдержки из
[3]). Неизвестный ранее моноэпоксид (2) крайне реакционноспособ-
ного циклопентадиена (1) был получен с выходом 70—75% [За].
Поскольку непредельный эпоксид (2) очень чувствителен к кисло-
СНэСООН 4 Na2CO3
—Т* Ii
70-75%
4- CH3COzNa+NaHCO3
О)
(2)
там, эпоксидирование проводят в хлористом метилене в присутствии
безводного карбоната натрия под действием 40%-ной Н. к., которую
предварительно обрабатывают ацетатом натрия для нейтрализации
следов минеральных кислот. Крэндолл и Полсон [36] использо-
вали этот метод при получении моноэпоксида (4) из 1,2-бпс-(изо-
пропилиден)-3,3-диметилциклопропана (3), а Крэндолл и сотр.
о н3с сн3
СН3СООН-Ыагсб3 Н3Сх^ /\ /СН3
[Зв] применили его к циклическим сопряженным С6 — С8-дненам.
В последнем случае при соотношении реагентов 1 : 1 получаются
хорошие выходы и упрощается отделение эпоксида от избытка
диена. Восстановление эпоксида (6) алюмогидридом лития приводит
к гомоаллиловому спирту (7).
о
СН,СООН
—:—*
50%
Этот метод был также использован для эпоксидирования
алкенилиденциклопропана (1); преобладающим продуктом реакции
(64%) является кетон (3). Второй продукт (27%) был идентифици-
рован как (4). Считается, что оба продукта образуются из промежу-
312
точного моиоэпоксида (2) [Зг].
СНз о сн
нэСх^ ? I 3
^>-С—С-ОАс
H3C<\ си3
СНз
СНз
н с ?Нз
13
(3)
(4)
Окисление аллена (5) 2 же Н. к. с высоким выходом приводит
к интересному диэпоксиспирану (6) [Зд]. При попытках получения
моноэпоксида из (5) при действии 1 же окислителя возвращается
непрореагировавший аллен и получается диэпоксид (6). Эпоксиди-
н ,сн3
(CH3)3CZ ’СН3
(СН3)3СЧ ZO^
(б)
сн3
сн3
(5)
НэС^ 6н3
рование аллена (7) неожиданно привело к циклопропанону (9),
по-видимому, через промежуточный моноэпоксид (8) [Зе]. Кэмп
(СН3)3СЧ
;С=С=СН3
(СН3)3С
(7)
’(СН3)3С о
С—с=сна
(СНз)3С
(8)
о
(СН3)3С с
С- сна
(СН8)3С
(9)
и Грин [Зж] обнаружили, что полученная под действием л^-хлор-
надбензойной кислоты окись аллена (11) при нагревании до 1003
перегруппировывается в циклопропанон (12). По-видимому, и в
313
этом случае циклопропанон более устойчив, чем эпоксид.
CHjJj с., >С(СНЛ, .о
c=c=cz лг-С1С6н4сооон, zs° , , / ,
С сносен С=СНС(СНЭ)Э—►
Со) о (И)
А
„loo; н-Т—\.С(сН!)3
(СН,)ЭС н
СП
За. К о г а с h М,, Nielsen D. R., Rideout W. Н,, J, Am. Chem. Soc.,
82, 4328 (1960).
36, С г a n d а 1 1 J. К., Ра ulson D. R., Org, Chem., 33, 991 (1968).
Зв. Crandall J. К., Parks D, В., Colyer R. A., W a t k 1 n s R. J,,
Arrington J. P., J, Org. Chem,, 33, 423 (1968).
Зг, C r a n d a 1 1 J. K., Paulson D. R., Bunnell C. A,, Tetrahedron
Letters, 5063 (1968).
Зд. С r a n d a 1 1 J, K,,Mach I eder W.H.,Thomas AL J,, J. Am, Chem.
Soc., 90, 7346 (1968),
Зе. С r a n d a 1 1 J,K,,Mach leder W, H., J. Am. Chem. Soc,, 90, 7347 (1968).
Зж. Camp R. L, Greene F. D,, J. Am. Chem. Soc., 90, 7349 (1968).
НАТРИЙ — АММИАК (И, 355, перед ссылками).
Восстановление ненасыщенных углеводородов. Гарднер и сотр.
[4, 5} обнаружили, что под действием натрия в жидком аммиаке
ациклические и циклические аллены восстанавливаются до моно-
олефинов с почти количественным выходом. Было найдено, что
двустадийный метод синтеза алленов по Дерингу и Ля Флямму
(II, 282, ссылка [21) пригоден и для получения циклононадиена-1,2
(3), восстановлением которого натрием в жидком аммиаке был
синтезирован цис-циклононен (4) [4].
При исследовании восстановления алленов с открытой цепью
были получены следующие результаты [51:
( НН
I ।
1 2 3 4 Na-NH, СН3С —С(СН2)3СН3 50%
(5) СН3СН = С=СН(СН2)4СН3---> Н
Нонадиен-2,3 । СНд£^С(СН2).СН3 50%
I н
314
сн3
(6) сн3с-с = снсн3
12 3 4
2-М.ет11Лпслтадиси"2,3
Na-NH3
сн3 н
1 I
СН3СНС = ССН3 48%
I
н
сн3
1
СН3СНС-ССН3 34%
сн3
ч СН3С-СНСН,СН3 18%
Следует отметить, что в обоих соединениях (5) и (6) преимуществен-
но восстанавливается более затрудненная двойная алленовая связь.
Как видно из примера получения соединения (4), циклические
аллены восстанавливаются до ^uc-циклоолефинов, Группой индий-
ских исследователей описан удобный способ получения цис,цис-
циклононадиена-1,5 (9). Исходя из легко доступного «шд^йс-цикло-
октадиена-1,5 (7), расширением цикла по Унчу н сотр, [7] получали
пиклононатриен-1,2,6 (8). При обработке (8) натрием в жидком ам-
миаке алленовая группа восстанавливается до ^c-олефиновой и
соединение (9) получается с высоким выходом.
Под действием натрия или калия в чистом жидком аммиаке при
60—130° в отсутствие кислот (воды или спиртов) бензол восстанав-
ливается исключительно в циклогексен [8]. Под действием лития
преимущественно образуются циклогексадиены.
4. Gardner Р. D,, Naray ana М., J. Org. Chem,, 26, 3518 (1961).
5. Devaprabhakara D,, Gardner P.D., J, Am. Chem, Soc,, 85, 648
(1963).
6. Va id yana thaswamy R.,De va pra bha kar a D., J, Org. Chem.,
32 , 4143 (1967),
7, U n t c h K. G,, Martin D. J., Ca s t e 11 u c i N, T., J, Org. Chem., 30,
3572 (1965).
8, S 1 a a g h L. H., R a 1 e у J. H., J. Org. Chem., 82, 369 (1967),
НАТРИЙ — /црт-БУ ТА НОЛ — ТЕТРАГИДРОФУРАН (П,
356-357).
Под действием смеси этих реагентов, которая равноценна пер-
воначально применявшейся смеси литий — трет-бутанол?— ТГФ
(К 153—155), осуществляется восстановление и дехлорирование (1)
315
с образованием (2) и (3) Ill.
1. Gass m а и Р. G,, Aue D. Н., Р а 1 t о n D. S., J, Am. Chem. Soc 90
7271 (1968). ’’ ’
НАТРИЙ — НАФТАЛИН (II, 357—359, перед ссылками).
Под действием Н.— н. сульфамиды расщепляются до аминов
с высоким выходом. В качестве растворителя в этом случае лучше
использовать 1,2-диметоксиэтан, чем ТГФ [8].
Н,— н. исключительно удобен для дегалогенирования вици-
нальных дигалогенидов даже в тех случаях, когда при этом обра-
зуется сильно напряженный олефин [91. Указанные ниже выходы
определены методом газовой хроматографии. Для выделенных про-
дуктов выходы несколько ниже.
СН3(СН2}4СНВтСНгВг ------сн3(сн2)4сн=сн2
>90%
8. J i S., G о г t 1 с г L. В., Waring А., В a 11 i s t i A., В a n k S.,C1 os-
son W. D., \V r i e d e P., J. Am. Chem. Soc., 89, 5311 (1967).
9.Scouten C.G.,Barton F. E., Jr„ Burgess J. R., Story P-R,,
Garst J. F., Chem, Comm., 1969, 78.
НАТРИЯ АЗИД (II, 359—362, перед ссылками).
Реакция Шмидта. По реакции Шмидта циклобутанкарбоновую
кислоту можно в одну стадию превратить в циклобутилам ин с вы-
соким выходом [12]. К смеси циклобутаг-i карбо новой кислоты, хло-
роформа и конц. серной кислоты при перемешивании добавляют
порошкообразный Н. а.; смесь нагревают при 50;; в течение 1,5 час.
При этом карбоновая кислота превращается в азид (а), который при
протонировании (б) теряет азот и перегруппировывается в изоцианат
16
(в). После нейтрализации основанием и перегонки получают чистый
амин, т. кип. 80,5—81,5°.
согн
NaN3 + Z H2SO,
СНС13,45-50°
О
!!-+-
C-N=N=N
г!
C-N-№N
(<*)
-Nz, -Н+
N=C=O н?°
-СО2
60-80%
(в)
(Г)
nh2
о
н
Замещение активированного галогена в ароматическом цикле
[13]. В синтезе 4-хлорбензфуразана (4) из 2,6-дихлоранилина (1)
на первой стадии (1) окисляют до нитрозосоединения (2), которое
кристаллизуется в виде темно-желтых игл. Продукт растворяют
в ДМФА при 95°, к образовавшемуся темно-зеленому раствору в те-
чение 20 мин добавляют раствор Н, а. в водном ДМСО (1 : 4 по объ-
ему). При этом температура поднимается до 115° и смесь приобре-
тает коричневую окраску. Через 10 мин раствор охлаждают до 30°
и выливают в воду. 4-Хлорбензфуразан (4) получают в виде
белого порошкообразного вещества, т. пл. 84—87°.
(3)
84-87%
12. Werner N. W., Casanova J., Jr., Org. Syn., 47, 28 (1967).
13. G h о s h P. B., procedure submited to Org. Syn. (1967).
НАТРИЯ АЛК)МОДИГИДРИД-бсы-(2-МЕТОКСИЭТИЛАГ).
NaH2Al(OCH2CH2OCH3)2. Мол. вес 202,17.
317
Получение [1].
Восстановление ароматических нитросоединений [2]. По восста-
новительным свойствам реагент подобен алюмогидриду лития.
Ароматические нитросоединения под действием 2 молей реагента
восстанавливаются до азосоединений с выходами от 40 до 90%.
При использовании 1,5 моля гидрида образуются азоксисоединения.
1. V i b J.,Casensky В., Machacek J., франц, пат. 1515582 (1967).
2. Corbett J. F., Chem. Comm,, 1968, 1257.
НАТРИЯ АЛЮМОХЛОРИД (II, 363—365, перед ссылками).
Циглер и сотр. [101 получили 4-оксихинолон-2 при нагревании
дианилида малоновой кислоты со смесью 3 молей хлористого алю-
миния н 2 молей хлористого натрия при 250°. Позднее был рассмот-
рен механизм этой реакции [111,
hnc6h5 го г
10. Z i е g 1 е г Е., W о 1 f f R., Карре Т., Monatsh. 96, 418 (1965).
11. Ziegler Е., Sterk Н., Monatsh., 98, 1104 (1967).
НАТРИЯ АМАЛЬГАМА (II, 366—370).
Получение (2%-ная) (II, 366, после выдержки из [41). Бломквист
и сотр. [4а] получали реагент по методике фирмы «Мерк», однако
авторы отмечают, что нет необходимости инициировать реакцию на-
греванием на пламени, если натрий разрезать ножницами и добав-
лять непосредственно к ртути.
Восстановление фталевой кислоты (перед ссылками). При пере-
мешивании и охлаждении на ледяной бане к раствору 1,02 моля фта-
левой кислоты и 281 г (2,07 моля) тригидрата ацетата натрия добав-
ляют 3400 г 3%-ной амальгамы натрия порциями по 50—100 г
[14]. После соответствующей обработки, подкисления и кристалли-
зации получают /прй«с-1,2-дигидрофталевую кислоту с выходом
62%.
Ma(Hg)
АсОН—AcONa—Н3О
4а. В 1 о m q u i s t A. T., H iscock В, F., Harpp D. X., J. Org. Chem.
31, 4121 (1966).
14. McDonald R. N,, Rcineke С. E., J. Org. Chem., 32, 1878 (1967);
procedure submitted to Org. Syn, (1967).
318
НАТРИЯ БИСУЛЬФИТ (II, 371—374, перед ссылками),
Расщепление оксимов. Было показано [17], что оксимы расщеп-
ляются под действием Н, б. при комнатной температуре в нейтраль-
ной водной среде с почти количественным выходом. Для выделения
продукта требуется лишь непродолжительная обработка кислотой.
I N’aHSOs ГСН3(СН2)6Ч /SO3Nai н +
СН3(СН2)аС — NOH--------> Л —>
НгО [_ Н' ЧОН J 87%
н
— СН3(СН2)ЙС = О
Эта реакция впервые была описана Пехманом 1181 в 1887 г., но
осталась незамеченной.
17. Р i n е s S. Н., С h е m е г d a J. М., К о z 1 о w s k i М. A., J. Org, Chem.,
31, 3446 (1966).
18. Р с с h гл a n п Н. von, Вег., 20, 2539 (1887),
НАТРИЯ БОРГИДРИД (И, 381—388, перед ссылками).
Сопряженные двойные связи. Двойные связи, сопряженные со
сложноэфирной, нитрильной, фенильной или амидной группами,
селективно восстанавливаются под действием Н. б. с выходами по-
рядка 60—80% [34 [.
NaBH4 в EtOH(25=)
C0H5CH=C(CO2C2Hd)2------------------> СеН5СНаСН(СО2С2Н5).г
69%
Восстановление тозилгидразонов. Каглиоти (Болонский уни-
верситет, Италия) разработал простой метод дезоксигенирования
алифатических альдегидов и кетонов в мягких условиях в нейтраль-
ной среде путем восстановления соответствующего тозилгидразона
Н. б. в метаноле [35, 36].
В случае ароматических карбонильных соединений тозилгндра-
зон восстанавливают алюмогидридом лития. Приведены подробные
319
методики для таких соединений, как сахара [36], кетоны с асим-
метрическим центром ва-положении [37] и др. Применение дейтери-
рованных реагентов позволяет получать меченые соединения 138].
Этот метод был успешно использован для восстановления про-
странственно затрудненного кетона (1); в этом случае, несмотря на
о н сн3
Н Н СН(СН3)г
(1)
образование гидразона, восстановление по Вольфу — Кижнеру
оказалось безуспешным [39].
Другие реакции. Получение алкилгалогенидов из спиртов
или эфиров лучше осуществлять реакцией с галогеном и Н. б.,
чем действием свободного диборана [40].
3ROH -f“2X2-f~ NaBH4 3RX + Н3ВО3 J- NaX 2Н2
Эта реакция лежит в основе метода низкотемпературного расщеп-
ления простых эфиров:
3ROR' 4- 2I2 + NaBHd B(OR)3 + 3R'I -R Nal -ф 2H2
| ЗНг°
3ROH-|-H3BO3
Максфельдт и сотр. [41] обнаружили, что ацилмалоновый эфир
(1), легко получаемый по Тарбеллу и Прайсу [42], под действием
Н. б. подвергается восстановительному расщеплению до альдегида
(2) и малонового эфира:
О О
RCCH(CO2C2H5)2 —ВД" КСН-уСН2(СО2С2Нра
(1) (2)
34. К a d i и S. В., J, Org. Chem., 31, 620 (1966).
35. С a g 1 i о t i L., Tetrahedron, 22, 487 (1966).
36. C a g I i о t i L.. procedure submitted to Org. Syn., (1968).
37. D e Beider A, N., Weigel H., Chem, Ind., 1964, 1689,
38. С о г e у E, J., Gros S. K-, J. Am. Chem, Soc., 89, 4561 (1967); Fi-
scher M., Pel all Z., W i 1 1 i a m s D.H., D j e r a s s i C., Chem. Ber,,
98, 3236 (1965).
39. White J. D., Gupta D, N., J. Am, Chem. Soc., 90, 6171 (1968).
40. L о n g L. H., Fr eeg Hard G. F., Chem. Ind., 1965, 223; Nature, 207, 403
(1965).
41. Muxield t H., Rogalski W., Klauenbcrg G., Chem. Ber,, 98,
3040 (1965).
42. T a r b e 1 1 D. S., P r i c e J. G., J. Org. Chem., 21, 144 (1956); 22, 245 (1957).
НАТРИЯ ГИДРИД (II, 392—401).
Ацилирование кетонов (II, 394—395, после выдержки из 181).
По аналогичной, упрощенной Анселме [8а] методике с использова-
320
нием Н. г. в ДМСО получают дибензоилметан:
NnH
С,Н5СОСН з + CGHSCO2CH3-----—
СН35ОСНЯ
НаРО4
[C6H5COCHCOC6H&]Na+ ——С6Н5СОСНаСОС6Н5
75-79%
Карбметоксилироваиие (перед ссылками) см. Диметилкарбонат,
V, 119).
Ацетилирование енолов. Из а-гало-а-арилацетофенона типа (1)
не удается получить енол ацетат реакцией с изо пропен ил ацетатом;
превращение же в енолят натрия под действием метилата натрия
с последующей обработкой хлористым ацетилом дает енолацетат
с низкими выходами. Однако Купер и Оуэн [28] нашли, что при
обработке кетона Н. г. в сухом метаноле, а затем (по прекращении
выделения водорода) — хлористым ацетилом ацетат енола (2) по-
лучается с выходом 50—70%.
NaH, СН8ОН
С6Н5СОСНВгС6Н5------------:
(1)
[С6Н5С = СВгСаН5‘
I
ONa J
СН3СОС1
----С6Н5С-СВгСеНл
(ЗСОСНз
(2)
Метилирование аминокислот и пептидов. Коггинс и Бенуатон
[29 J показали, что N-ацил и К-а л кокс и карбонил амино кислоты глад-
ко метилируются по азоту под действием йодистого метила в присут-
ствии Н. г. в кипящем ТГФ, содержащем ДМФА. Из бензоил- или
карбобензокси-ь-лейцин а получают после удаления защитной группы
оптически чистый N-метиллейцин с выходом 96?^. Алкилирования
а-углеродного атома при этом не наблюдается. При аналогичной
обработке полилейцина с последующим кислым гидролизом полу-
чается 91% N-метиллейцина и 1% лейцина. /Метилирование некото-
рых эфиров ацет и лди пептидов с последующим гидролизом приводит
к метиламинокислотам (выход выше 80%) и аминокислотам (ме-
нее 2%).
ЗМаН
I 8СНД I
С6Н5СН„ОСО-N— СНСО2Н-----------> С6Н5СН3ОСО — N — СНСО2СН3
I ТГФ-ДМФА I
С4НЭ С4НЭ
I) 1 Н. Маон СН,
2) НВг/НОАс । 3
- “ > hn-chco2h
С4Н9
8а, Anselme J.-P., J. Org. Chem., 32, 3716 (1967).
28, С о о р е г D, J., Owen L. N., J. Chem. Soc., (С), 1966, 533.
29. С о g g i n s J., Benoi ton L., Abstracts, 156th Meeting, Am. Soc. Div.
Biol. Chem,, Sept., 1968, No. 18.
11 № 1994
321
НАТРИЯ ГИПОБРОМИТ (II, 403—405, перед ссылками),
Дегидрирование ароматических альдоксимов (6). Незатруднен-
ные ароматические окиси нитрилов, например окись бензонитрила
(1), спонтанно димеризуются с образованием фуроксазанов или
(2)
(1)
1,2,5-оксадиазолоксидов-2(2).При наличии о,о'-заместителей димери-
зация затрудняется и в этом случае, например при дегидрировании
(3) под действием Н. г., удается получить с очень хорошим выходом
окись нитрила (4).
6. Grundmann С., Dean J. М., J, Org, Chern., 30, 2809 (1965).
НАТРИЯ ИЗОПРОПИЛАТ, (CH^CHONa. Мол. вес 82,09.
Получение и применение Н. и. описано в методике' синтеза
циклогексадиена-1,3 дегидробромированием 1,2-дибромциклогек-
1, ЗмоляВг2 в СС14
От - 5 до -1°
95%
Вг
100-110°
NaOCH(CH3)a
35-40% '
1, 5 МОЛЯ В
300МЛ СС14 И
15 МЛ абс. EtOH
сана 11]. К смеси 500 мл триглима и 300 мл изопропанола при пере-
мешивании добавляют небольшими порциями суспензию 2,23 моля
гидрида натрия в минеральном масле. Систему интенсивно проду-
вают азотом и основную часть изопропанола отгоняют. Колбу ва-
куумируют на водоструйном насосе и затем добавляют 1,2-дибром-
циклогексан с такой скоростью, чтобы поддерживать температуру
100-1103
1. Schaefer J. Р., Е л d е г s L., Org. Syn., 47, 31 (1967).
322
НАТРИЯ ИОДИД (II, 410—414, перед ссылками).
Деалкилирование арилалкиловых эфиров. Этот метод был исполь-
зован для деметилирования келлина (1) и виснагина (2) [181. В обоих
случаях 1 г .метилового эфира нагревали с 5 а галогенида щелочного
НСОгН: 9 0%
НСО2Н: 45%
металла в 30 мл муравьиной или уксусной кислоты в течение 6 час
при 100°. Хлористый натрий и хлористый калий оказались неэф-
фективными; в некоторых случаях иодистый калий превосходит
иодистый натрий [выходы (%) приведены в таблице].
Галогенид в нсоон В АсОН
За 36 За 36
NaBr 55 65 10 20
КВг 70 50 10 10
Nal 90 90 75 45
KI Окало 100 Около 100 80 60
18. М ц s t a f a A., S i d к у AV М., Mahran М. R., Ann., 704, [82 (1967).
НАТРИЯ НИТРИТ (II, 415—421, перед ссылками).
Натрия нитрит —• CF3C00H — ДМСО. Диазотирование бензил-
амина (1) Н. н. и трифторуксусной кислотой (при молярном соот-
11*
323
ношении 1 : 2 : 3) в ДМСО при 100G в течение 2 час приводит
с6н5сн2мнг . £j_ffaIiyo3. ДМСО
-нго, -n2
н
С6Н5сС O=S(CH3)2 -->
Н4---'
(2)
I -+хсн3
С£н5-С-хО— S
+ S(CH3)2
(з) (4)
к бензальдегиду (4) с выходом от 60 до 80% [251. При использовании
изоамил нитрита выход понижается.
25. S с h е i t К. Н., Каире W., Angew, Chem., Internal. Ed., 4, 787 (1965).
НАТРИЯ ПЕРБОРАТ (II, 421, перед ссылками).
Эпоксихиноны, например эпоксид юглона, получают реакцией
с Н. п. [3]:
3. Rashid A., Read G., J. Chem. Soc., (С), 1967, 1323,
НАТРИЯ И СВИНЦА СПЛАВ.
Фирма «J. Т. Baker Со.» выпускает этот сплав в виде высушен-
ных гранул, содержащих около 10% натрия и 90% свинца, под наз-
ванием «dri-Na».
Осушительный агент. Соросе [11 предложил использовать этот
сплав вместо натриевой проволоки для высушивания эфира и других
растворителей. Сплав очень медленно реагирует с водой и воздухом,
однако обеспечивает такую же степень высушивания эфира, как
и натриевая проволока. При добавлении сплава в воду или разбав-
ленную кислоту наблюдается умеренное взаимодействие без воспла-
менения выделяющегося водорода, поэтому остатки сплава легко
разложить непосредственно водой. Некоторые типичные результаты
высушивания растворителей приведены в таблице.
324
Растворитель Содержание водый), вес. %
до высушивания после высушивания
Бензол, образец I 0,017 0,005
Бензол, образец II 0,049 0,007
Циклогексан 0,006 0,006
Эфир 0,048 0,001
Пиридин 0,069 0,035
Определено титрованием по Фишеру.
1. Soroos Н., Ind. Eng. Chem., Anal. Ed., 11, 657 (1939).
НАТРИЯ СУЛЬФИТ, Na2SO3.
Фотовосстановление. При УФ-облучении 3,17р-эстрадиола
(Г) в водном этаноле, содержащем Н. с., в качестве главного продук-
та образуется Зр, 17р-диокси-5а, 10р-эстран (2). Восстановление (1)
боргидридом натрия дает с низким выходом соединения (3) и (4)
[IJ. Предполагается, что восстановление Н. с. осуществляется через
промежуточный сульфинат. Впервые этот новый метод применялся
при восстановлении кинуреновой кислоты (5) до кинуренина жел-
того (6) [21.
1. W a t е г s J, A., W i t к о р В., J. Am. Chem. Soc., 89, 1022 (1967).
2. Tokuyama Т., S е п о h S., S а к а п Т., В г о w п К. S., Jr., W i t-
кор В., J, Am. Chem. Soc., 89, 1017 (1967).
325
НАТРИЯ ТЕЛЛУРИД, Na.Je. Мол. вес 173,61.
Получение [1!. В колбу на 6 л загружают 716,4 г порошкообраз-
ного теллура и 5 л жидкого аммиака, затем при охлаждении до —60°
и перемешивании медленно добавляют 273,2 г натрия.
Восстановление галогензамещениых соединений. Под действием
Н. т. осуществляется восстановление галогена в ароматических
и алифатических соединениях:
CL
+ Na;, Те + CH3OH —
Cl 9
+ Те + NaCl + NaOCH3
С1гС=СС1г 4- NaaTe + CH3OH--> С1гС=СНС1 + Те + NaCl + NaOCH3
51%
I. Ma ck W., Angew, Chem., Internal. Ed,, 6, 1083 (1967).
НАТРИЯ ТРИТИОКАРБОНАТ, Na,CS3. /Мол. вес 154,21.
Получение [1]. Водный 33%-ный раствор Н. т. получают реак-
цией сероуглерода и сульфида натрия в воде с последующим упа-
риванием раствора при пониженном давлении.
Превращение галогенидов в меркаптаны [1]. При нагревании
галогенида с водным раствором Н. т. в течение 1—5 час при 60е
получают соответствующий меркаптан с выходом от 25 до 75%.
Предполагается следующий механизм реакции:
S s
il и
R~a-pNa2CS3 RSCS^Na+ —> RSCSH ---------RSH
-csa
1. М а г t i n D. JG г е с о С. С,, J. Org. Chem., 33, 1275 (1968).
НАТРИЯ ФТОРИД (II. 423, перед ссылками).
Было найдено, что под действием суспензии Н. ф. в безводных
тетраметиленсульфоне, ацетонитриле или ДМФА легко осущест-
вляется обмен галогена в хлорангидридах карбоновых кислот,
а-хлорэфирах, трихлорметансульфенхлориде, РОС13 и т. д. 121.
2. Т u I 1 о с k G. W., С о f f m a n D. D,, J. Org, Chem., 25,2016 (1960).
НАТРИЯ ЦИАНАТ (II, 426, ссылка 121).
Поправка. Loev В., Kormendy М. F., Goodman
М. М., Org. Syn., 48, 32 (1968).
НАТРИЯ ЦИАНИД — ДИМЕТИЛСУЛЬФОКСИД.
Декарбэтоксилирование гщи-дикарбэтоксильных производных
с-образованием этиловых^ эфиров успешно осуществляется при на-
гревании с цианистым натрием в ДМСО при 160s в течение 4 час.
1316
При этом, по-видимому, образуется по 1 молю двуокиси углерода
и этилена [ 11. Классический метод такого превращения включает
согсгн5
г г S + NaCN + ДМСО 2Г£°.4 . >
--- 7 5%
О, 5 МОЛЯ 1 моль
С О2 CjHfj
—н
омыление, декарбоксилирование и этерификацию.
Группой Джонсона [2] этот метод использован для декарбэто-
ксилирования малонового эфира (1).
NaCN
ДМСО^
Эта реакция применялась в полном синтезе дигидрокливаминов
и родственных алкалоидов. При этом ключевой промежуточный
продукт (3) (Р?=СООС2Н5) содержал нежелательную карбэтоксиль-
ную группу, которая удалялась под действием цианистого натрия
(3) r = соосгн5
(4) R = я
в ДМСО с образованием желаемого промежуточного соединения
((4), R---H] с 70/6-ным выходом 13].
1. К г а р с h о А. Р., G 1 у n п G. A., Grenon В. J,, Tetrahedron Letters,
215 (1967).
2. J о hnso n W. S.,Harbert C, A., St ipanov ic R. D., J. Am. Chem.
Soc., 90, 5279 (1968).
3. Har ley-Mason J., Atta-Ur-Rahman, Chem. Ind., 1968, 1845,
НИКЕЛЬ-АЛЮМИНИЕВЫЙ СПЛАВ (II, 434—435, перед ссыл-
ками) .
Грэхэм п Уильямс !91 обнаружили, что Н.-а. с. с водным едким
натром является удобным реагентом для восстановления кетокси-
мон до аминов без перегруппировок, которыми часто сопровождается
327
восстановление гидридом алюминия.
NOH NH2
СН2 —СНС-—С6Н5 Ni-A^L NaOH СН3 —СНСНСсН5
I I----------------------> I I
СН2 —СН2 57% сн2 —сн2
9. G rah am S. Н,, Williams A. J. S., J. Chem. Soc., (С), 1966, 655.
НИКЕЛЯ БОРИД (11, 435—436, перед ссылками).
Кларк и сотр. [4] сравнивали Н. б. и никель Ренея в реакции
десульфуризации гетероциклических тиолов и нашли, что никель
Ренея, как правило, превосходит Н. б. в отношении выхода про-
дуктов.
4. С 1 а г i< J., Grantham R. К., L у d i a t е J., J. Chem. Soc., (C), 1968,
1122.
НИКЕЛЯ КАРБОНИЛ (II, 436—439).
Гидрокарбоксилирование олефинов (II, 437—438, после выдержки
из [81). При взаимодействии Н. к. с 1,5-диенами в присутствии раз-
бавленных кислот вместо ожидаемых моно- и дикарбоновых кислот
образуются циклические кетоны. Например, гексадиен-1,5 с 70 %-
ным выходом превращается в смесь 2,5-диметилциклопентанона
и 2-метилциклогексанона [8а].
сн2—сн(сн2)2сн==сн2 нс1^
70%
35% 65%
Конденсация аллильных соединений (II, 438—439, перед ссыл-
ками); исправление и расширение метода. Данным Болда [12] о
конденсации аллилацетатов под действием Н. к. предшествовало
открытие Уеббом и Борхердтом [14] (1951 г.) конденсации аллил-
хлоридов под действием Н. к. в метаноле, которая осуществляется
с прекрасным выходом, например: *
25°
СН3СН — СНСН2С14-СН3ОН 4-Ni(CO)4 —
223г 250.«л 260г
СН3СН = СНСН-2СН2СН = СНСНз + 4СО + N1С12
74% 80%
Внимание' Уебб и Борхердт подчеркивают, что низкокипящий
Н. к. исключительно ядовит и легко воспламеняется, и рекомендуют
* Подобным своеобразным конденсирующим агентом является карбид каль-
ция, например:
2Ph2PCl + CaC2 —> Ph2PPPh2-*-СаС12 + С3
[S р а п i е г Е. J., С а г о р г е s о F, Е., Tetrahedron Letters, 199 (1969)],—
Прим. ред.
328
меры предосторожности для безопасного обращения с реагентом.
Реакции с Н. к. следует проводить без малейшего доступа кислоро-
да; все операции проводят в токе аргона либо в аргонной камере.
Кори открыл большие синтетические возможности при исполь-
зовании реакции конденсации в синтезе циклических и ациклических
ненасыщенных углеводородов. Так, Кори и Хаманака [13] (11,439)
снг РНг
СШаС^СНгС! + С1НгСч 3 Ni(CO)4 X f 3 МСЦ
С1НгС>ч^х,СНгС1 С1НгС' z ' 54% * -------- 2 V2 С°
сн2 сн2
(3) (4)
Ni(CO)4|-NiCl2, СО
ClHJCz'^CHrS*» w
гС'Т'СНг'“1‘
СНг
(5)
осуществили синтез полностью транс-\,6-диметил-Д1,5,е-циклодо-
декатриена [формула (2), II, 439]. Позднее Кори.и Земмельхак [15]
сообщили о циклотримеризации под действием Н. к. 1,1-бдс-хлор-
метилэтилена (3) в 1,4,7-триметиленциклононан (4) с очень хорошим
выходом. Тот же циклононан (4) был получен с прекрасным выходом
циклизацией дигалогенида (5).
Взятый в избытке, Н. к. реагирует с бромистым аллилом в бен-
золе с образованием л-комплекса аллилникель(1)бромида (6);
после удаления растворителя и кристаллизации из эфира при —70°
комплекс получают с выходом 80—95%. Такие л-комплексы доволь-
у\ Вг
2 ЙСН=СНСН2Вг + 2 Ni(CO)4 -----> R-Z кН + 2 СО
'i/ чв^
(б)
но инертны по отношению к алкилгалогенидам в эфире и углеводо-
родных растворителях, однако в более полярных координирующих-
ся растворителях (ДМФА, метил пирролидон, гексаметилтриамид
фосфорной кислоты) они легко реагируют с алкил-, винил- и арил-
иодидами с образованием продуктов конденсации:
R'l
RCH ^CHCHaBr+ Ni(CO)4 —>• л-Комплекс---->• R'CH<>C = CHa
ДМФА " I
СН3 СН3
‘3
(3)
Гидразон бензофенона окисляется
с количественным выходом [9].
Н. и. до дифенилдиазометана
Нг>С8
НЙСЙ
%C=NNH3
NiO;
н.-,свх - +
)С—N = N
Н5с/
3
Уорренер и Кэйн [101 окисляли 6-оксиметил-1-метмл-2-тиоура-
цил (3) до 1-метилоротовой кислоты (4) действием 6 экв Н. п., полу-
ченной по способу Накагава. Под действием Н. п. тиокарбонильная
o^\/Vo2h
сн3
(4)'
О
И
группа превращается в карбонильную, а оксиметильная окисляется
до карбоксильной группы.
Белью и Тек-Линг [111 сообщают, что Н. п., полученная озони-
рованием щелочного раствора сульфата никеля (II), обладает такими
же, если не лучшими, окислительными свойствами, что и Н. п.,
полученная по методу Накагава. Кроме того, бывает достаточно
меньших количеств Н. и., хотя в отдельных случаях выходы ока-
зываются ниже.
Фенилпропаргиловый спирт (5) окисляется И. п. в бензоле при
комнатной температуре до альдегида (6) с 70%-ным выходом [12].
С более низкими выходами подобные реакции окисления прово-
дились ранее с применением двуокиси марганца [131. При обра-
ботке 2 н. едким натром в водном метаноле альдегид (6) подвер-
гается дефор мил и рован ию до фенилацетилена с выходом 70%.
с^ссн2он ,с=ссно
/ /Чч/
V ;о% и
(5) (6)
8. Jensen S. L., Hertzberg S., Chem. Scand., 20, 1703 (1966).
9. Nakagawa K., Onoue H., M inami K-, Chem. Comm., 1966, 730,
10. Warrener R. N., Cain E. N., Tetrahedron Letters, 4953 (1967).
332
1 ] В е 1 е w J. S., Т е к - L f n g С., Chem. Comm., 1967, 1100.
]2 Atkinson R. Е., С и г t i s R. F., J о n e s D. M., T а у 1 о r J. A., Chem.
Comm., 1967, 718.
]3. J о n e s E. R. H-, S к a t t e b 0 1 L., W h i t t i n g M. C., J. Chem. Soc.,
1958, 1054.
НИТРИЛ ИОДИСТЫЙ (II, 441, перед ссылками).
Сообщалось о взаимодействии Н. и. с ненасыщенными углево-
дами [21. Например, при реакции с (1) образуется неустойчивый
аддукт (2), который при дегидрогалогенировании превращается
в (3).
CHNO,
(О
2. S z а г е k W. A., L a n с е D. G., В each R. L., Chem. Comm., 1968, 356-
НИТРИЛ ХЛОРИСТЫЙ (II, 441—442, ссылка [1]). Добавление.
Kaplan R. В., Shechter Н., Inorg. Syn., 4, 52 (1953).
НИТРОБЕНЗОЛ, С6Н5КОг. Мол. вес 123,11, т. кип. 210°.
Синтез феназинов. Холлиман и сотр. [11 использовали Н. одно-
временно в качестве растворителя и окислительного агента для
циклизации 2-аминоднфениламинов в феназины. Скорость реакции
зависит от характера и положения заместителей.
Феназины найдены среди метаболитов бактерий видов Pseudo-
monas.
СО2Н
| хттт Кипячение 4 час
CeH-,NO.. (400 мл)
5% PdC (2 е)
54%
X^X'NH3
2 [2])
Те же условия
СО2СН3
114 час
Кипячение в CsH.-NO2
(выход не указан)
3[3j)
333
L Hol liman P. G., J cfferv B. A., Brock I). J. 14., Tetrahedron, 19,
1841 (1963).
2. Brock D. J.H., Holliman F. G., Tetrahedron, 19, 1903 (1963); see also
19, 1911 (1963).
3. Herbert R.B.,Holliman F.G., К У nner s 1 ey J.D., Tetrahedron
Letters, 1907 (1968).
N-n-НИТРОБЕНЗОСУЛ ЬФОКСИУРЕТАН (II, 444—445).
В последующих статьях [2, 3] обсуждается образование карбэт-
оксинитрена в синглетном состоянии (1) и последующий переход
в триплетное состояние (2) как процесс, конкурентный реакции
присоединения к олефинам.
о о
I1. и .
С2Н5ОС —N: С3Н5ОС-N-
(1) " (2)
2. Lwowsk i W., М а г i с i с h Т. J,, J. Am. Chem. Soc., 87, 3630 (1965).
З.Мс Conaghv J.S., Jr.,Lwowski W., J. Am. Chem. Soc., 89, 2357 (1967);
89, 4450 (1967)
Л«-НИТР0БЕН30ЛСУЛЬФ0НИЛА ПЕРЕКИСЬ,
Lvi-O2NCfiH4—SO2Olo. Мол. вес 404,33, т. пл. 112s (с разл.).
Н. п. получают с 30%-ным выходом из л/-нитробензолсульфохло-
ряда и перекиси водорода [11. Н. и. относительно безопасен в обра-
щении и используется в синтезе фенолов, например:
OSO2OCeH4NO2-jt ОН
/Ч /Ч. /Ч
j| | + >O2NC6H4SO2O]2 1| | —1| |
\// \//
1, D annley R. L., С о г b е t t G. Е., J. Org. Chem., 31, 153 (1966).
НИТРОЗИЛСЕРНАЯ КИСЛОТА (II, 445—446). T. пл. 70°.
Н. к. получена 151 при пропускании сухого SO3 в дымящую азот-
ную кислоту при постепенном повышении температуры до точки
кипения. При охлаждении Н. к. затвердевает в низкоплавкие блед-
но-желтые кристаллы, которые в отсутствие влаги устойчивы при
комнатной температуре.
Н. к. превосходит хлористый нитрозил в реакции нитрозирования
анилидов с последующим превращением продукта в несимметричный
дифенил [61:
/\
А. /ч. ।
|| | _НО5О.МО^ || | fXNO!+N2 + CHsCOOH
HNCOCH3 ON\:COCH3 [I J
334
При взаимодействии Н. к. с 2-амино-3-хлор-1,4-нафтохиноном (1)
с почти количественным выходом был получен диазокетон (2) 171.
4-Лмино-3-бром-1,2-нафтохинон в эту реакцию не вступает.
О
(D
HOSO,NO,
6. Ahmad Y., Q u г е s h i М. 1., В a i g М. I., Сап. J. Chem., 45, J 539 (1967).
7. Mosby W. L-, S i 1 v a M. L.} J. Chem. Soc., 1964, 3990.
НИТРОЗИЛ ФТОРИСТЫЙ (11, 447).
Взаимодействие H. ф. с zV-стероидами (1) приводит к5а-фтор-4-
нптроиминам (2), которые при хроматографии на окиси алюминия,
содержащей 6% воды, превращаются в 5а-фтор кетоны-4 (3). При
дегидрофторировании последних получаются малодоступные Л5-4-
кетостероиды (4) 131.
3. Boswell G. A., Jr., J. Org. Chem., 33, 3699 (1968).
НИТРОЗИЛ ХЛОРИСТЫЙ (II, 447—456).
Присоединение к олефинам. При взаимодействии Н.х. с А2-
холестеном образуется зеленоватое масло, из которого не удается
выделить чистый нитрозохлорид. При дегидрохлорировании пири-
дином получают 2-нитро-А2-холестен с выходом 46%, а после вос-
335
становительного гидролиза последнего — холестанон-2 [24а].
46%
Zn-AcOH
-------
74%
24а. Тега da A., Hassner A., Bull. Chem. Soc. Japan, 40, 1937 (1967).
НИТРОНИЯ БОРФТОРИД (II, 463—464).
Поправки. Мол. вес 132,83, разлагается при 170°; первый раз-
дел заменить следующим текстом.
Получение. Первоначальная методика [1] включает взаимодей-
ствие азотной кислоты, фтористого водорода и трифторида бора в
нитрометане. Однако смесь азотной кислоты и нитрометана взрыв-
чата. Чтобы избежать этой опасности, Ола и Кун [21 разработали
модифицированную методику с использованием в качестве раство-
рителя хлористого метилена. Трехгор л ую полиэтиленовую колбу
объемом I л снабжают короткой вводной трубкой для подачи азота
и длинной — для газообразного трифторида бора, осушительной
трубкой и магнитной мешалкой, охлаждают смесью льда и соли
и продувают сухим азотом. При слабом токе азота и перемешивании
в колбу загружают 400 мл хлористого метилена, 41 мл красной
(содержащей NO2) дымящей азотной кислоты и 22 мл охлажденного
жидкого фтористого водорода. Затем при перемешивании пропус-
кают 136 г (2 моля) газообразного трифторида бора из баллона,
укрепленного на весах; первый моль BF3 поглощается в течение
около 10 мин, второй — в течение 1 час. Смесь оставляют под азотом
на охлаждающей бане на 1,5 час, затем взбалтывают и суспендиро-
ванный продукт отделяют на воронке Бюхнера с пористым стеклян-
ным фильтром, смывая его двумя порциями по 50 ли? нитрометана.
Собранный Н. б. промывают двумя порциями по 100 мл нитрометана
и двумя порциями по 100 мл хлористого метилена.
HNO3 + HF +2BF3 ——> O,N + BF7^H3O-BF3
a 1 1 3 64-80% 2 ' d
Выход бесцветного продукта составляет 85—106 г.
Применение для нитрования [21. В колбу, высушенную нагре-
ванием на открытом пламени и охлажденную током азота, загружа-
ют тетраметиленсульфон и Н. б. и при 10—20° и перемешивании
добавляют о-тол у нитрил. Затем смесь нагревают и в течение часа
выдерживают при 10*0—115°.
CN
+ z o2n+bf4"
48-53%
CN
336
1 J< u h n S. J., О 1 a h G. A., J, Am. Chem. Soc., 83, 4564 (1961).
2 . Olah G, A., Kuh n S. J., Org. Syn., 47, 56 (1967).
6tio(n- НИТРО ФЕНИЛ)- ФОСФ AT К ИСЛ Ы И,
HO(O)P(OCeH4NO2-n)2. Мол. вес 328,18, т. пл. 176—179°.
Получение. Реагент получают обработкой n-нитрофенола хлор-
окисью фосфора в ацетонитриле [11 или частичным гидролизом
т^ис-(«-нитрофенил)-фосфата под действием едкого натра [2].
Синтез нуклеозидов [31. Этот реагент превосходит п-толуолсуль-
фокислоту, этилполифосфат или хлористый цинк при получении
нуклеозидов сплавлением пуринов с полностью ацетилированными
пентозами или гексозами. Например, этим методом [4] сплавление
пурина (1) с тетра-О-ацетил-о-рибофуранозой (2) при 174—180°
(3) 30%
(4) 20%
(в вакууме водоструйного насоса) дает два нуклеозида — (3) и (4).
Главный продукт реакции (3) представляет собой триацетиль-
ное производное природного нуклеозидного антибиотика небула-
рина.
1. Hashizume Т., яп. пат. 18132 (1964) [С. А., 62, 5229 (1965)].
2. Hashizume Т., Hirohisa К., яп. пат. 15982 (1964) [С. А., 62, 6432
(1965)].
3. Hashizume Т., I wamura
4. Hashizume Т., 1 wamura
Н., Tetrahedron Letters, 3095 (1965).
Н., J. Org. Chem., 33, 1796 (1968).
п-НИТРОФЕНОЛ (II, 468, перед ссылками).
Де Тар и сотр. [21 подробно описали методику получения не-
которых п-нитрофениловых эфиров карбобензоксиаминокислот.
2. А 1 b е г s R. J., Е s t г i n N. F., DeTar D. F., procedure submitted to
Org. Syn. (1967).
337
НОРБОРНЕН (П, 468—470),
Бицикло-[3,2, П-октанон-З (11, 469). Рассмотренную методику
иногда не удается воспроизвести, так как присутствующий в трет-
бутилате калия треп?-бута но л реагирует с продуктом, препятствуя
тем самым стадии восстановления. Авторы предложили новую улуч-
шенную методику, показанную на следующей схеме:
„ NaOCH3.
У + С13ССОгСгН5 -------
о
+ CH3OCOQH5 + NaCl —*
LiAlHj
Нг5О4, Нг0
'С1 85-88%
р
5. J е f f о г d С, W., G u n s h е г JHill D. Т., В г u n Р., L е Gras J.,
Waegell В., procedure submitted to Org. Syn. (1968).
о
ЬОКИСЬ ЬФЕНИЛ-З-МЕТИЛФОСФОЛЕНА-З (Ш, 11).
Поправка. Основываясь на данных спектроскопии и результатах
озонолиза, Xунгер и сотр. [1а] показали, что это соединение в дей-
ствительности является изомерной окисью фосфолена-2 (За). Не-
давно Квин и Баркет [161 обнаружили, что аддукт изопренам ди-
хлорфеиилфосфина (2а) также имеет строение 2-фосфоленовой си-
стемы (по данным ЯМР-спектров). Направление перегруппировки
C6HSPC12
сК хс6н5 о' С6Н5'
(2а)
(за)
аддукта зависит от характера заместителя в дигалогенфосфине;
так, в случае дихлорметилфосфина образуется ожидаемая 3-фосфо-
деновая система.
la. Н u nger К., Н a sser о d t U., К о г t е F., Tetrahedron, 20, 1593 (1964).
16. Q u i n L. D., В а г k е t Т. Р., Chem. Comm., 1967, 914.
ОКИСЬ ЭТИЛЕНА (III, 11-12).
Получение дигалокарбенов (перед ссылками). Описано [2] полу-
чение дихлор карбенов при нагревании смеси галоформа, О. э,
и бромистого тетраэтил аммония (используется благодаря подходя-
щей растворимости) в присутствии олефина в запаянной ампуле
при 150° в течение приблизительно 5 час. Предполагается, что при
атаке окиси анионом брома образуется сильно основный алкоксид-
ный анион, отщепляющий протон от галоформа с образованием
тригалометильного аниона, который затем превращается в дигало-
Вг" + сн2—сн2
ВгСН2СН2О~ —СХ-^> ВгСН2СН2ОН + Хэс
X" + х2о
карбен. Этот метод дает удовлетворительные результаты при полу-
чении дихлоркарбена, в случае фторхлоркарбена и дифторкарбена
выходы ниже.
Реакции Виттига. О.э. используют в качестве основания при
получении реагентов Виттига из фосфониевых солей. Часто нет
необходимости в специальном получении соли; например, при вза-
имодействии смеси О. э., трифенилфосфина и этилового эфира бром-
уксусной кислоты с бензальдегидом при 25J образуется этиловый
эфир коричной кислоты с выходом 91% (соотношение транс- и
цис-изомеров 93 : 7) [31.
н с
2! ">О (СиН5)3Р Д- ВгСН2СО2С2Н5 -г СеН5СНО
Н3СУ
СНаВг
| -У(С6Н,)3РО + С8Н5СН = СНСО.,С2Н&
сн3он
2. W е у е г s t a h 1 Р., Klamann D,, Finger C.,Ner del F,, В u d-
dr us J., Chem. Ber., 100, 1858 (1967).
3. Buddrus J., Angew. Chem,, Internat. Ed., 7, 536 (1968).
ОКСАЛ ИЛ ХЛОРИД (HI, 13—19, перед ссылками).
При непродолжительном кипячении N-карбобензоксиамино-
кислоты (1) с 2 же О. в бензоле получается ангидрид N-карбокси-
а-аминокислоты (2), по-видимому, через соответствующий хлоран-
гидрид. Ангидриды типа (2) являются удобными исходными пр оду к-
RCHCOSH RCH — С = О
I (СОС1)3 I I
NH----------------HN О
I \/
СО,СН2С6НГ, с
(2)
тами для синтеза полипептидов [241.
24. К о п о р i ri s k a D., S iem ion ]. Z,, Angew. Chem,, Internat. Ed„ 6,
248 (1967).
N-ОКСИСУКЦИНИМИДА TP И ФТОР АЦЕТ AT. Мол. вес 197,09,
масло.
сн2с^°
| >NOCOCF3
сн..с<
Получение. N-Оксисукцинимид с небольшим избытком трифтор -
уксусного ангидрида в бензоле кипятят в течение 5 нас [11,
Использование в пептидном синтезе [1]. При взаимодействии
О. т. с N-защищенными аминокислотами происходит переэтери-
фикация с образованием активированных эфиров, которые исполь-
зуются в синтезе. При этом наблюдается лишь незначительная ра-
цемизация [2]. При использовании п-нитрофенилтрифтор ацетата
340
или 2,4,5-три хлор фенилтрифтор ацетата наблюдается полная раце-
мизация.
l.Sakakibara S., I п и к a i N., Bull. Chem. Soc. Japan, 38, 1979 (1965).
2. Sakak ibara S., I n и к a i N., Bull. Chem, Soc. Japan, 39, 1567 (1966).
ОКСОВАНАДИЯ АЦЕТ ИЛ АЦЕТО HAT (ванадила ацетилацето-
нат), VO[CH3C(O) = CHCOCH3]2. Мол. вес. 265,16, т. пл. 255° (разл.).
Окиси аминов. Удобный метод окисления третичных аминов,
с помощью которого легко получаются абсолютно безводные
окиси, иллюстрируется следующим примером [11. Смесь 23,5 а N.N-
диметилдодециламина, 9,2 а гидроперекиси mpem-бутила, 27 г трет-
бутанола и 0,5 г О. а. кипятят с обратным холодильником при пере-
мешивании в течение 15 мин и охлаждают до комнатной температу-
СН3 (СНДзСООН, (СНа)аСОН, VO[CHaC(O)=CHCOCHa]z
w-CigHggd — СН3
сн3
L
w-CjgHgsN — СН3
ры. трет-Бутанол быстро отгоняют на роторном испарителе (30—
40 мм) и получают 21 г окиси амина с т. пл. 123—125°. Продукт
растирают в 50 мл пентана, отфильтровывают и высушивают в ва-
кууме; выход 17,7 г.
1. S h е 11 g М. N., Zajacck J. G., J. Org. Chem., 33, 588 (1968); procedure
submitted to Org. Syn. (1967).
ОЛОВО (III, 24—25).
Дебромирование (III, 25, после выдержки из (81). 6-Бромнафтол-2
легко получается при дибромировании нафтола-2 в уксусной кис-
лоте с последующим удалением более подвижного атома брома
в «-положении восстановлением под действием О. в виде опилок
и бромистоводородной кислоты, которая образуется в процессе
бромирования [8а]. Восстановление можно также осуществить
под действием хлористого олова [861. Однако заметных преимуществ
ни один из двух реагентов не имеет.
144 г (1 моль)
в АсОН4~2 лшоль Вг2
4 00 мл
100 мл АсОН
В
8а. Кельш К., «Синтезы органических препаратов», сб. 3, ИЛ, iM., 1952,
стр. 115.
86. Fries K.,Schimmelschmidt К., Ann., 484, 245 (1930), see р. 293.
341
ОЛОВО ХЛОРИСТОЕ (111, 26—30, после выдержки из [7]).
Пептидный синтез. Гуанидиновую группу арпппша обычно
защищают нитрованием. В оригинальной методике Бергманна
и Зерваса [7а] защитную группу удаляли каталитическим гидриро-
ванием. Янг и сотр. [761 обсуждают ограничения этого метода
и сообщают о блестящих результатах электролитического восстанов-
ления. В более удобном методе восстановление осуществляют О. х.
(8-кратиый избыток) в 60%-ной муравьиной кислоте [7 в]. Таким об-
разом из поли-ь-нитроаргинина был получен хлоргидрат поли-ь-
аргинина с выходо.м 62,7%.
NH NH2
В II । н Pt
OaNN — С —NCH2CH»CH3CHCO2H
И
Нптроаргнпин
NH
Р I
---H2N-C —ХСН3СН3СНоСНСО,Н
н
Аргинин
7а. Bergmann Я, Zervas L., R i п к с Н., Z. phvsiol., 224, 40 (1934).
76. S с о р о s Р. М-, W а 1 s h a w К. В., W е 1 f о г d М., Young G. Т., J.
Churn. Soc., 1965, 782.
7в. Bavaka w а Т., F vi j 1 w а г a Y., N о g и с к i J., Bull. Chem. Soc.
Japan, 40. 1205 (1967).
ОРТОМУРАВЬИНОЙ КИСЛОТЫ ТРИЭТИЛОВЫЙ ЭФИР (III,
33-40).
По упрощенной методике получения реагента к смеси 180 мл
абсолютного этанола, 45 а формамида и 200 мл лигроина (70—80°)
при перемешивании и охлаждении добавляют по каплям 1 моль
хлористого бензоила [1а]. Через 2 час удаляют осадок бензойной
кислоты и хлористого аммония, фильтрат промывают охлажденной
льдом 3 н. щелочью, высушивают над карбонатом калия и перего-
няют, выход составляет 40—44%.
(III, 34—35, после выдержки из [6].) Трейбс Гба] сообщает,
что простейший способ получения азуленового альдегида из азулена
заключается в реакции с О. к, т. э. в петролейном эфире в присут-
ствии эфирата трехфтористого бора. Выходы составляют 86—90%.
Ранее этот альдегид получали реакцией Вильсмейера, но настоящий
метод более удобен.
1/^4 \ + НС(ОС2Н5)3 + Петэ^~й 4 is г 150лы 10г (синий) сно + BF3. (С2Н5)ЙО — 10 2 (Красный
342
(Ill, 39, перед ссылками.'» С N.N'-дифенилэтилендиамином
О. к. т. э. образует бищ(1,3-дифеш1Лимпдазол1[дилиден-2) с выходом
91—95% 1’281.
СГ,НЙ
i
хн
[90-200°
. +2СН<ОС=Н»)=-Z^,5h
Х\Н
1
спый
Свн5
i
,-Ж
H2CZ' \
। ;
н3сх /
Ж
I
Свн5
С6н5
I
ж
'СН.3
I
/СНа
с,н5
!а. О 11 гл с R., S с li ni i 1 z Е., Ann., 716, 207 (1968).
Ыт. Т г с i b s W. Tetrnhcdron Letters, 4707 (1967).
28. \V а и z 1 i с k B.-W., Org. Syn., 47, 14 (1967),
ОСМИЯ ЧЕТЫРЕХОКИСЬ (осмиевый ангидрид) (111, 40—46,
перед ссылками).
Окислением диметилового эфира гиббереллина Аи (1) О.ч.
в пиридине, а затем перйодатом натрия Кросс [13} получил в ка-
честве главного продукта ожидаемый норкетон (2). Кроме того, было
найдено небольшое количество соединения (3) — продукта после-
дующего окисления вторичной гидроксильной группы. В примеча-
нии автор указывает, что он сталкивался и с другими подобными
примерами окисления вторичных спиртов под действием О. ч.
(1) [59 мг
согсн3
(2) 52/иг
13. Cross 3. Е., j. Chem. Soc., (Cl, 1966, 501.
ОСМИЯ ЧЕТЫРЕХОКИСЬ — НАТРИЯ ХЛОРАТ.
В синтезе дптерисновых алкалоидов Виснер и сотр. [1,2] приме-
няли хлорат натрий в присутствии каталитических количеств
343
четырехокиси осмия, например:
НО-СН2
I
НОСН
сн3
к
сн
ммоля)
ммоля)
| осн
СН2 [
1, Wiesner К,, Chan К- К., Demerson С., Tetrahedron Letters, 2893
(1965).
2. Wiesner Kb, Santroch J., Tetrahedron Letters, 5939 (1966).
п
ПАЛЛАДИЕВЫЕ КАТАЛИЗАТОРЫ (Ш, 48—53).
Гидрогенолиз (I!!, 48—49, после выдержки из [4]). Хорнинг и
Рейзнер [4а] обнаружили, что палладий на угле является очень
эффективным катализатором гидрирования — гидрогенолиза без
добавления хлорной или серной кислоты. Авторы нашли, что этот
катализатор эффективен также при восстановлении 0-бевзоил-
пропионовой кислоты в у-фенилмасляную кислоту. При получении
О
--- |j Нг, Pd-C 7---х
" ССН3СН2СО2Н ------------А % —СН2СН2СН2СО2Н
этим методом у-фенилмасляной кислоты Шимельпфениг [46] исполь-
зовал продажный 10%-ный палладий на угле и 12 раз получал
выход, превышающий 90%.
Катализируемое палладием гидрирование 3 р-ацетокси- и 3[3-окси-
А5-стероидов приводит к соответствующим 3-дезоксистероидам с вы-
ходом 5—10%. Это гидрирование можно катализировать 70%-ной
хлорной кислотой. Поскольку Зр-ацетокси-5а-стер о иды устойчивы
к гидрогенолизу, можно предполагать, что реакция включает
частичную изомеризацию с перемещением двойной связи из положе-
ния 5 в положение 4 и последующий гидрогенолиз аллильной
группы [4в].
4а. Н о г п i n g Е. С., R i е s п е г D. В., J. Am. Chem. Soc., 71, 1036 (1949).
46. S с h i т е I р f е n i g C. W., personal communication.
4ы P e t t i t G. R., Das Gupta A. K.., Smith R. L., Can. J. Chem., 44,
2023 (1966); Pettit G. R., G r e e n В., К a s t u г i T. R., J. Org. Chem.,
in press.
10a. Add: Craw for d M., S u p anekarV. R., J. Chem. Soc., (C), 1966, 2252.
ПАЛЛАДИЙ ХЛОРИСТЫЙ, PdCl2 (III, 53).
(Перед ссылками.) Штерн и Спектор [2] обнаружили, что реакция
л-комплекса этилена и П. х. с уксусной кислотой в изооктане
в присутствии Na2HPO4 приводит с хорошим выходом к винил-
СН2^СН2 * СНзСООН—>снг=снососнэ + Pd + 2 но
PdCl2
ацетату. Бэйрд [3] реакцией л-комплекса норборнена (I) с ацетатом
натрия и хлорной медью получил экзо-2-хлор-сгш-7-ацетоксинор-
борнан (2) с выходом 84%. Хлорная медь использовалась не только
345
как источник хлор ид-иона, но и как окислительно-восстановитель-
ный реагент по отношению к П. х. Обработка соединения (2)
mpem-бутилатом калия в ДМСО дает с 70% -ным выходом смн-норбор-
И) О)
ненол-7 (3), чистота которого по данным ГЖХ-анализа составляет
83%. Эта двустадийная реакция является наиболее удобным спосо-
бом получения (3).
Карбонилирование различных непредельных соединений в при-
сутствии П. х. описано Тсуджи и сотр. [4—81. Реакция осущест-
вляется, по-видимому, через промежуточное образование комплек-
сов олефинов сП. х., однако непосредственно они не были получены.
Для простых олефинов реакцию можно представить следующей
схемой:
CQ 2RCH —CHoCOCl-y 2Pd
I I
Cl 4 R’oh
RCH-CH„COjr
I
Cl
Выходы изменяются в пределах от 5 до 40%. Изучение аллильных
соединений [5] и бутадиена [6] привело к следующей схеме образо-
вания комплексов бутадиена с П. х. и двух продуктов, получаемых
при карбонилировании:
CH.3C1 1 CH,CI CH2C1 СЩС1 CH2C1
CH z \. ci CH / \ co CH L KOH CH
HC"' 'Pc/ 'Pa CH —* li + I, — -r
% /' \ '/ \ / CH CH CH
CH, Cl CH, 1 CH2C1 1 СНД7ОС1 CH2CO,R
Было также исследовано каталитическое карбонилирование цикло-
окт адиена-1,5, циклооктадиена-1,3 17] и Ш1КЛодекатрпеиа-1,5,8 181.
2. Stern Е. W., Spector М. L., Proc. Chem. Soc., 1961, 370.
3. Baird \V. C., Jr., J. Org. Chem., 31, 2411 (1966).
4. T s u j i J., Mor i ka w a M., К i j i J., J. Am. Chem. Soc., 86, 4851 (1964).
5. T s и j i J. et al., J. Am. Chem. Soc., 86, 4350 (1964); Long R., W h i t -
field Ci. IL, J. Chem. Soc., 1964, 1852.
6. Tsuji J. el a!., Tetrahedron Letters, 605 (1964).
7. T s u j i J. et al., Bull. Soc. Chem. Japan, 39T 141 (1966),
8. T s u j i J,, Nog! T., Bull. Soc. Chem. Japan, 39, 146 (1966).
346
ПАЛЛАДИЯ(П) АЦЕТАТ (Ш, 53—54, перед ссылками).
Окислительная димеризация терминальных олефинов [31.
Д^Олефины, плюющие алкильный или арильный заместитель в поло-
жении 2, окисляются П. а. в уксусной кислоте в присутствии
ацетата натрия до 1,1,4,4-тетразамещенных бутадиенов-1,3 с выхо-
дами от 20 до 90%. Например:
С6Н5 С6НЙ СсН5
I Pd(OAc)« —NaOAc । i
сн2=с-сн3 .... Д СН3С=СН-СН=ССН3
91%
Бензильное окисление толуолов. Толуол окисляется эквимолярным
количеством П. а. в уксусной кислоте при 90° (13 час) до бензилаце-
тата (80%), бензальдегида (4%) и бензальдиацетата (6%); при этом
образуется палладий нулевой валентности [4]. Направление окисле-
ния в сильной степени зависит от электронного влияния заместите-
лей. Так, n-метокситолуол с 96%-ным выходом превращается в /г-ме-
токсибензилацетат, а n-нитротолуол практически не вступает
в реакцию.
3. V о 1 ger Н. С., Дес. trav., 86, 677 (1967).
4. Bushweller С. Н., Tetrahedron Letters, 6123 (1968).
ПАЛЛАДИЯ ГИДРООКИСЬ КАК КАТАЛИЗАТОР.
Этот катализатор гидрирования получают при добавлении не-
большого избытка раствора гидроокиси лития к горячему водному
раствору хлористого палладия; осадок промывают горячей дистил-
лированной водой до нейтральной реакции [1]. Восстановление
циклогексанонов в спирте с предварительно гидрированной гидро-
окисью палладия в качестве катализатора с хорошим выходом при-
водит к циклогексиловым эфирам [21. Например, при восстановлении
5а-холестанона-3 в метаноле получается 3^-метокси-оа-холестан
с выходом 91/0. Восстановление циклогексанола в этаноле дает
этилциклогексиловый эфир с 96%-ным выходом.
J. N i s h i in и г a S., Sh i mah ага М., S h i о t a M., J. Org. Chem., 31,
2394 (1966).
2. Xis h 1 m ura S., I t а у a T-, S h i о t a M., Chem. Comm., 1967, 422.
траш?-2,4-ПЕНТАДИЕНОВОЙ КИСЛОТЫ МЕТИЛОВЫЙ
ЭФИР, СН2=-СНСН=СНСО2СН3. Мол. вес 112,12, т. кип. 55—
57°/14 мм.
Получение. Реакцией акролеина с малоновой кислотой получают
кислоту, которую затем этерифицируют [11.
Синтез циклогексадиенов-1,3 [2]. Енамины, полученные из пир-
ролидина и циклических кетонов или простых альдегидов, вступают
с П. к. м. э. в реакцию 1,4-присоединепия; в условиях реакции
промежуточные аминоэфиры теряют элементы пирролидина с обра-
зованием производных метиловых эфиров 3,4-дигидробензойной
кислоты. С енаминами, полученными из морфолина, выходы продск-
347
тов значительно ниже.
1. A d 1 е г о v a A., Coll. Czech., 25, 226 (1860).
2. Berchtold G. А., С i a b a 11 о n i J., Tunick A, A,, J. Org. Chem.,
30, 3679 (1965).
ПЕНТАМЕТИЛБЕНЗИЛХЛ0РИД, (CH3)5CGCH2CI. Мол. вес
196,72, т. пл. 81—82°.
11. получают хлорметилированием пентаметилбензола под дейст-
вием формальдегида и конц. НС1 в уксусной кислоте [11.
Пептидный синтез. Стьюарт [2] предложил использовать пента-
метилбензиловые эфиры в пептидном синтезе, так как защитная
группа при этом легко отщепляется трифторуксусной кислотой,
а также смесью НВг—АСОН. 2,4,6-Триметилбензиловые эфиры
несколько более устойчивы.
1. A i k е n R. R., В a d g е г G. М., Cook J. W., J. Chem. Soc., 1950, 331;
Bennington F., M о r i n R. D., Cl ark L. C., Jr., J. Org. Chem., 23,
2034 (1958).
2. Stewart F. H. C., Australian J, Chem., 20, 2243 (1967); Chem. Ind., 1967,
I960.
ПЕНТАХЛОРФЕНОЛ (III, 56, перед ссылками).
Активированные пентахлорфениловые эфиры аминокислот по-
лучают также переэтерификацией прн взаимодействии триал кил ам-
мониевых солей ациламинокислот с пентахлорфениловыми эфирами
трихлоруксусной или дихлоруксусной кислот 12].
2. F u j I п о М., Hatanaka С., Chem. Pharm. Bull., 16, 929 (1968).
ПЕНТАЭТОКСИФОСФОРАН, (С3Н5О)5Р. Мол. вес 140,03.
П. можно удобно получить реакцией триэтилфосфита с перекисью
этила при комнатной температуре в течение 15 дней [1]. Максималь-
(С2Н5О)3Р + (С2НьО)г (С2НЙО)5Р
(1)
ная концентрация (1) в растворе составляет 60%. Концентрацию
реагента можно повысить путем перегонки при низком давлении.
348
Реакция алкилирования [1]. П. является мощным этилирующим
агентом, не требующим ни основных, ни кислых катализаторов;
в реакции не образуется ни кислоты, ни основания. Под действием
П. кислоты количественно превращаются в этиловые эфиры, фе-
нолы — в этилфениловые эфиры, енольные соединения — в эфиры
енолов. Малоновый эфир медленно реагирует с П. с образованием
диэтилового эфира этилмалоновой кислоты с выходом 88%.
1. Denney D. В., S a f е г s t е j n L., J. Am. Chem. Soc., 88, 1893 (1966).
н3сч H
wpa«4?-riEHTEH-3-OH-2, /С=с/ Мол. вес 84,11,
H3CZ
т. кип. 121 — 122,5°.
Получение. При получении этого непредельного кетона окис-
лением соответствующего спирта его трудно освободить от примеси
исходного продукта. Хауз и сотр. [1] показали, что П. лучше по-
лучать реакцией Виттига из уксусного альдегида и ацетил мети лен-
трифенилфосфорана.
СН3СНО + СН3СОСН = Р(С6Н5)3 —> СН3СН = СНСОСНз + (С6Н5)3РО
Аннелирование по Робинсону. Маршалл и сотр. 12] осуществили
полный синтез рацемического изонооткатона [а-ветивон (12)] следую-
щим образом. Изопропилиденмалоновый эфир (1) восстанавливали
до диола (2), который через дибромид (3) и тетраэфир (4) превращали
в непредельную ди карбоновую кислоту (5). Соответствующий диэти-
ловый эфир (6) при циклизации по Дикману под действием гидрида
натрия в 1,2-диметоксиэтане дает циклический (З-кетоэфир (7).
Аннелирование (7) по Робинсону проводится в мягких условиях.
Сначала при обработке соединения (7) П. в присутствии 0,1 же
метилата натрия при 0° осуществляется присоединение по 1Миха-
элю, затем под действием избытка того же основания при комнатной
температуре завершается альдольная циклизация. Кипячение полу-
ченного продукта (8) с этиленгликолем в присутствии п-толуолсуль-
фокислоты в бензоле (с водоотделителем Дина — Старка) приводит
к этиленкеталю (9). Его восстанавливают алюмогидридом лития до
спирта (10), который затем превращают в мезилат (11). Восстанов-
ление мезилата литием в системе аммиак — этанол дает смесь про-
(СНК-сА01 Г|Л1Н‘
‘СНа)2С^С\согсгн„
,СН9Вг
(СН3)2С—СД
хСН3Вг
(3)
zCHaOH РЕг
(снлс=с/ ЩЦ
ХСН2ОН
(2)
2NaCH(CO2C,H5)a
СНаОСН2СНгОСН3
349
.СН3СН(СОоС,Н5)г
(CH3)2C=C<
XCH2CH(CO2C3H5)2
(П
ОН"; H +
-2C0s
ZCH2CH2CO2H c,h5oh' h +
(CH3)2C = C< _5Н£Ш_Н—►
xCH2CH3COaH
(5)
—> Диэфир---------------s-
CH3OCH2CH2OCH3
(6)
дуктов, из которой после кислого гидролиза (для осуществления
декетализации) хроматографированием на силикагеле легко выде-
ляют рацемический изонооткатон (12).
1. House Н. О., R е s р a s s W. L., W h i t е s i d e s G. M.f J. Org. Chem.,
3!, 3128 (1966).
2. Marshall J. A., Faubl H., Warne T. M., Jr., Chem. Comm., 1967,
753.
ПЕРЕКИСЬ ВОДОРОДА В НЕЙТРАЛЬНОЙ СРЕДЕ (II!, 68—
70, перед ссылками).
Под действием перекиси водорода 1\,Ы-диметилгидразоны бенз-
альдегида и коричного альдегида с хорошим выходом окис-
350
ляются до соответствующих нитрилов [6].
C6H5CH-NN(CH3)a
Н,о. 'С6Н5СН = К 1
---—> ухдсн.п —>
:н3он 0/ v
C6H5C==N + HON(CH3)2
6. S m i t h R. F., Albright J. A., Waring A, M., J. Org. Chem., 31,
4100 (1966).
ПЕРЕКИСЬ ВОДОРОДА В ЩЕЛОЧНОЙ СРЕДЕ (I!!, 70-77).
Реакция Дэкина (111, 72, после выдержки из [111). Стоут отме-
чает, что из этого обсуждения следует неверный вывод о том, что
реакция Дэкина применима лишь для карбонильных соединений,
имеющих гидроксильную группу в орто-положении. Поскольку
Дэкин [Па] показал, что ванилин с хорошим выходом окисляется
до метокси гидрохинона, то очевидно, что также эффективна и гидро-
ксильная группа в поре-положении.
сно он
I I
он он
Ila. Dakin H. D., Am. Chem. J., 42, 477 (1909).
ПЕРЙОДАТЫ (111, 84—92).
Сульфиды-^сульфоксиды (111, 86). Окисление тиоанизола до
метилфенилсульфоксида по Леонарду и Джонсону [5] подробно опи-
сано в работе [5а]. По этой методике были получены еще десять
сульфоксидов с выходами от 65 до 99%. Этот метод оказался
О
C0H5SCH3 > C6H5SCH3-pNaIO3
91%
«исключительным» при получении 1-азуленилсульфоксидов [56].
Перйодат натрия можно с успехом использовать для окисления
тпоэфпров, имеющих дисульфидную связь [5в[. В приведен ном
ниже случае применение трехокиси хрома, перекиси водорода или
351
л/-хлорнадбензойной кислоты приводит к глубокому разложению.
NaIO4
СНчОН, 0°
Cf,H5SS(CH2)2CONH(CH2)2SCH(C6H5), —
z 1 /и
о
I
C6H5SS(CH2)2CONH(CH,)2SCH(C6H5)2
Окисление смесью перйодат — перманганат (S1S, 86—88, после
выдержки из [16]). При окислении (Р)-( + )-цитронеллола (8)
до 6-окси-4-метилгексанкарбоновой кислоты (9) по Лемье — Руд-
лофу Оверберджер и Кайе [16а] использовали в качестве раствори-
теля смесь ацетон — вода для осуществления реакции при высокой
концентрации реагентов,
I | юу+Мпор (5-ЮД | сн.ОН
\ сн,он —----------------> \гпн
II - Количественно
11
/\ 0
Н3С сн3
(8) (9)
Огисо и Пельтье [166] под действием реагента в «тщательно
подобранных условиях» осуществили окислительное расщепление
а,Р-непредельного кетона (10).
Окисление смесью перйодат — четырехокись осмия (III, 88—90
после выдержки из [22]). Группа английских исследователей сооб-
щает о двух случаях, когда отщепление экзоциклической метилено-
вой группы под действием этого реагента осуществляется более
гладко, чем при озонолизе [22а].
Шамма и Родригез [226] показали, что при каталитическом
окислении (1) до альдегида (2) по оригинальной методике Лемье —
Джонсона [18] (2 эхе NaIO4 добавляют в течение 30—40 мин) высо-
кий выход достигается только при проведении реакции в малых
масштабах (менее 5 г). С увеличением загрузки (1) выходы неизменно
снижаются. Это затруднение можно преодолеть, если добавлять
перйодат через капилляр в течение около 10 час. К раствору (1)
352
(0,09 моля) в диоксане добавляют OsO4 (7,8 жмоля). Смесь перемеши-
OsO4 -NalO,
(О (2)
вают 15 мин до образования осмата, затем разбавляют водой и обра-
батывают NaIO4 (0,21 моля) в воде в течение 10 час. Выход (2) со-
ставляет 79%.
Окислительное расщепление (111, 91, перед ссылками). Для пе-
рйодатного окисления различных вмц-дизамещенных липидов в ка-
честве растворителя рекомендуется использовать пиридин. Окисле-
ние осуществляется с высоким выходом при комнатной температуре.
Например, при окислении цис,цис-\0,13-нонадекадиендиола-1,2
метапер йодатом натрия в сухом пиридине был получен цис,цис-
9,12-октадекадиеналь-1 с выходом 71% 127].
Обзор применения П. в органической химии см. [28].
5а. J ohnson С. R., К е i s е г J. Е., Org. Syn., 46, 78 (1966).
56. R е р 1 о g 1 е L. L., Al aynard J. R., J. Org. Chem,, 32, 1909 (1967).
5в. Н i s к е у R. G., Н а г р о 1 d М. Н., J. Org. Chem., 32, 3191 (1967).
16а. Overberger С. G., Kaye Н., J. Am. Chem. Soc., 89, 5640 (1967).
166. О g 1 s о H., Pelletier S. W., Chem. Comm., 1967, 94.
22a. В a g g a 1 e у К. H., Dixon J. R., Evans J. M., Graham S. H.,
Tetrahedron, 23, 299 (1967); В agga ley К. H., Evans W. H., Gra-
ham S. H., Jonas D, A., Jones D, H., Tetrahedron, 24, 3445 (1968).
226. Shamma M., Rodriguez H. R., Tetrahedron, 24, 6583 (1968).
27. Baumann W.J.,Schmid H.H.O.,Mangold H. K., J. Lipid Res.,
10, 132 (1969).
28. Sklarz B., Quart. Rev., 21, 3 (1967).
ПЕРХЛОРИЛФТОРИД (111, 92-99).
Фторирование соединений с активной метиленовой группой (III,
92, после выдержки из [3]). Наблюдалось фторирование енолятов,
активированных только одной карбонильной группой. Например,
при обработке П. натрийенолята метилового эфира изомасляной
* Под действием реагента в щелочной среде осуществлено N-фторирование
2, 2, 4, 4-тетраметил пиперидина [Gardner D, М., Н е 1 i t z е г R., Rosen-
blatt D. H.,J. Org. Chem., 32, 1115 (1967)]. Сходным действием обладает пер-
фгорциперидин, при взаимодействии с которым получен N-фторпиперидин
[Banks R. Е., Н a s z е 1 d i n е R. N., Hatton RTetrahedron Letters,
3993 (1967)] и проведено фторирование 2-нитропропаиа и малонового эфира
[Banks R. Е., W i 1 1 i a m s о п G. Е., Chem. Ind. (London), 1964, 1864]. При
нагревании в присутствии CsF реагент присоединяется по связи N—F к перфтор-
пропену [Drcsdner R. D., Т 1 u m а с F.N., Young J. A., J. Org. Chem.,
3524 (1965)], а при УФ-облучепии — к перфторциклобутену [В а п k s R. Е. et
aL, Tetrahedron Letters, 3993 (1967)] и окисляется кислородом при УФ-облучении
До стабильного имипоксильного радикала [Banks R. Е., J. Chem. Soc. (С),
2!, 2608 (1968)]. — Прим. ред.
12
№ 1994
353
кислоты (1) в качестве единственного чистого продукта получается
соединение (3) с выходом 30% через промежуточное образование (2).
По-видимому, такое фторирование осуществляется успешно только
в случае замещения водорода при третичном углеродном атоме [За].
СН3
(CeHs)sCNa | FC1O3
(СН3)2СНСОаСН3--------------► NaCCO2CH3-----------
сн,
(I)
г СН3
I
FCCO2CH3
_ CHS
(2)
сн3 о сн3
(!) ' i1 i
FC—с—с—со,сн3
I I
СН3 СН3
(3)
(III, 95, после выдержки из [12].) При взаимодействии П.с енолди-
ацетатом тестостерона в водном диоксане Осава и Нимен выделили
пять продуктов [12а]. Среди 6-фтор- и 6-оксипроизводных преобла-
дают аксиальные изомеры. Это означает, что обе реакции включают
электрофильную атаку при С6. При обработке енолдиацетата 19-нор-
тестостерона П. в водном диоксане те же исследователи выделили
17-ацетат 6р-окси-19-нортестостерона (3) с 15%-ным выходом
[12а]. Патаки и Влос [126] добавляли 85 мл воды к раствору 12,25 г
енолдиацетата 19-нортестостерона в 550 мл ТГФ и при перемеши-
вании пропускали в раствор П. при комнатной температуре в тече-
ние 40 мин. С помощью хроматографии из реакционной смеси были
354
выделены три продукта:
За. G е n s 1 е г W. J,, Ah med Q. A., L е е d i п g М. V., J. Org. Chem.j 33,
4279 (1968).
12a. Osawa Y., N eeman AY, J. Org. Chem., 32, 3055 (1967).
126. P a t a k i J., W 1 о s R., Steroids, 11, 225 (1968).
ПИПЕРИДИН (III, 102—107, перед ссылками). Лоуренс и
сотр. [16] описывают метод выделения изодекстропимаровой кислоты
из сложной смеси смоляных кислот, присутствующих в сосновой
живице и канифоли.Метод состоит в осаждении пиперидиниевой соли
кислоты из н-гептаиового раствора и последующей дробной
кристаллизации из этанола.
16. J о у е N. М., Jr., L о е b 1 i с h V. М., Lawrence R. V., J. Org. Chem.,
30, 654 (1965).
ПИРИДИН (III, 107—114).
Бромирование (III, 111, после выдержки из [16]). Перельман и
сотр. [16а] обнаружили, что при бромировании в П.19-нор-ДМ1и)-
3-кетостероиды (1) претерпевают одностадийное превращение в со-
пряженные 19-нор-А4’°-3-кетостероиды (2). Родственное дегидриро-
вание (3)->(4) осуществляется под действием пербромида бромгид-
12* 355
рата пиридиния в FL [166].
Реакция с 1,1-ди гало циклопропанам и, полученными из эфиров
енолов (III, 114, перед ссылками). Циклопропан (2), полученный по
указанной схеме из циклогексанона (1), при кипячении в П. в тече-
ние 75 мин подвергается реакциям дегидрогалогенирования и расши-
рения цикла с образованием соединения (3) (выход 83%). Последую-
щее дегидрогалогенирование в (4) осуществляется под действием
трет-бутила калия в ДМСО. При обработке циклопропана (2)
горячим хинолином сразу образуется соединение (4), но лишь
0 НС(ОСгН5)з н"
82%
2) CI3CCO,OC2Hj, NaOCH3
8 6%
(2) (3)
(6)
с 38%-ным выходом. Расширение цикла рассматривается как реак-
ция карбониевого иона, которая облегчается эфирной группой [261.
На основе хлордиена (3) осуществлен простой синтез трополона (5)
и 3,5-циклогептадиенона (6).
Подобные реакции циклогептанона и циклооктанона приводят
к продуктам сужения цикла, по-видимому, за счет трансаннулярных
реакций, однако рассмотренная последовательность реакций ус-
пешно осуществляется в случае цикло додеканона [27].
16а. Perelman М., Farkas Е., Fornefeld Е. J., К г а а у R. J.,
R а р а 1 a R. Т., J. Am. Chem. Soc., 82, 2402 (1960).
166. Johns W. F., J. Org. Chem., 31, 3780 (1966).
26. Parham W. E., Soeder R. W., Throckmorton J. R,,
Kuncl K-, Dodson R. M., J. Am. Chem. Soc., 87, 321 (1965).
27. Parh am W. E,, S p e r 1 e у R. J., J. Org. Chem., 32, 926 (1967).
ПИРИДИН — АЛЮМИНИЯ ХЛОРИД.
Получение [1]. К 320 мл пиридина, содержащего 2,5% воды,
при нагревании до 50° добавляют 96 г безводного хлорида алюминия.
Образующийся расплав нагревают при 70° с 2 а медного катализа-
тора, полученного из раствора сульфата меди и цинковой пыли по
Брюстеру и Гренигу [21.
Реакции дегидроконденсации [11. Примеры типичных реакций
приведены ниже.
о nh2 II 1 А\/Ч/Ч Ру —А1С13—Си /Ч 111 III -~| II А/ч/ЧА W II о о nh2 //. A/L/s°3Na III Ill 'Ч/Ч/'ЧА' II о 0 nh2 nh„o II ! 1 II II 1 1 II II 1 Ч/Ч? 'А/Ч/Ч/ II II о о NH.0 №Оз5\А/\/ч 1 ll II 1т 'А/Ч/ЧА О 1 II II 1 О ^\/\/\ 1 II II 1 ^/YYXso*Na О NH-2
357
nh2o
I II li I
X/\/\X
о I i;
li I о
X\/x/4
x/\/\x
II I
0 NH.
Б Wick A. K-, Helv. Chim. Acta, 49, 1748, 1755 (1966).
2. Брюстер P., Грениг T., «Синтезы органических препаратов», ИЛ,
М., 1949, об. 2, стр. 370.
ПИРИДИНА N-ОКИСЬ (II!, 114).
При обработке реагентом (4 экв) в кипящем бензоле или толуоле
а-бром- и а-хлоркарбоновые кислоты подвергаются окислительному
декарбоксилированию [3]. Коэн и сотр. [4] отмечают, что поскольку
пивалиновая кислота совершенно инертна к N-окиси пиридина, то,
по-видимому, для реакции существенное значение имеет наличие
а-водородного атома, как, например, в фенилуксусной кислоте.
Предполагается, что промежуточным продуктом является а-пириди-
ниевый ион.
1
СбЩ-С-^С^
У Хо\н
1*2
+NCSHS
» с6н5с + сог + с6н5йн
о
3. Cohen Т., S о n g I. Н., J. Org. Chem., 31, 3058 (1966).
4. С о h е n Т., S о n g 1. Н., Pager J. Н., Deets G. L., J. Am. Chem. Soc.,
89, 4968 (1967).
ПИРИДИНА ХЛОРГИДРАТ (HI, 115—118).
Получение. П. х. удобно сушить азеотропной перегонкой с бен-
золом; для защиты от влаги П. х. хранят в бензоле [1а].
Расщепление метиловых эфиров фенолов (III, 116—117). Полу-
чение П. х. по методике Прея связано с некоторыми трудностями.
Было найдено [5а], что реагент можно легко получить смешением
пиридина с небольшим избытком конц. соляной кислоты и после-
дующей отгонкой при 210°. Подвергаемый расщеплению эфир
перемешивают при нагревании сП. х., смесь подщелачивают и уда-
ляют пиридин перегонкой с паром. Выходы в большинстве случаев
составляют 80—90%.
Ацетолиз (III, 118, перед ссылками). Маркер [И] разработал
метод, в котором стероидный сапогенин диосгении (1) используется
358
в синтезе стероидных гормонов. Ацетолизом диосгенина (1) под
действием уксусного ангидрида при повышенной температуре
получают ди ацетат фуростадиен а (2), который в четыре стадии пре-
вращают в прогестерон (6).
Гершберг и сотр. [12| обнаружили, что выход соединения (2)
повышается при проведении ацетолиза диосгенина (1) при темпе-
ратуре кипения уксусного ангидрида в присутствии каталитических
количеств кислот Льюиса (А1С13) или СН3СОС1. Позднее Даубен и
Фонкен [13] нашли, что при ацетолизе диосгенинацетата в (2) выход
еще более повышается (до 80%), если при обработке уксусным анги-
дридом в качестве катализатора использовать П. х. Уолл и сотр.
114] сообщают, что уксусный ангидрид с П. х, дает прекрасные
результаты с самыми разнообразными сапогенинами, включая
12-кетосапогеиины, которые не удавалось ввести в эту реакцию.
Перегруппировка Бекмана. При кипячении с безводным или
гидратированным П. х. оксимы а рил ал кил кетонов (оксим ацето-
фенона) и диарилкетонов (оксим бензофенона) подвергаются пере-
группировке Бекмана. В случае кетонов, имеющих в пара-положе-
нии метоксигруппу, наблюдается одновременное деметилирова-
ние [151.
la. Dr. Gilbert Е. Е., Allied Chem. Corp., private communication.
5a. С и г p h e у T. J., H о f f m a n E. J., M c D о n a 1 d C., Chem. Ind., 1967,
1138.
359
11. М а г к е г R. Е,, R oh г m a nn Е., J. Am. Chem. Soc., 62, 518 (1940),
12. Gould D. IL, Staeudle H., H е г s h b е г g Е. В., J. Am. Chem. Soc.
74, 3685 (1952).
13. D а и b с п W. G., Fonken G. J., J. Am. Chem. Soc., 76, 4618 (1954).
14, W a 1 1 M. E., К e и п e у H. ER о t h rn a n E. S., J. Am. Chern. Soc., 77,
5665 (1955).
15, R о у e r R., Demerseman P., С о 1 i n G.,Cheut in A., Bull. soc.
chim. France, 1968, 4090.
ПИРИДИН — н-БУТИЛЛИТИЙ.
Получение [11. К избытку пиридина в сухом эфире добавляют при
охлаждении н-бутиллитий в эфире. Реагент можно использовать
для осуществления преимущественного восстановления кетонов
в экваториальные спирты в неравновесных условиях, когда подход
гидрид-иона в аксиальное положение стерически затруднен. Так,
из 3,3,5-триметилциклогексанона получается 79% экваториального
спирта и 21 % аксиального. В отличие от этого при восстановлении
комплексными гидридами преимущественно образуется менее устой-
чивый аксиальный спирт [2].
79% 21%
1, А b г a m о v i t с h R. А., М а г s h W. С., S a h a J. G., Сап. J. Chem., 43,
2631 (1965).
2. Haubenstock Н., Е 1 i с 1 Е. L., J. Am. Chem. Soc., 84, 2363, 2368
(1962); Richer J.-С., J. Org. Chern., 30, 324 (1965).
ПИРОФОСФОРИЛТЕТР АХЛОРИД (ПФТХ) (III, 125—126, после
выдержки из [21).
Более удобный способ получения ПФТХ состоит в реакции фос-
форного ангидрида с пятихлористым фосфором (получаемым in
situ из РС13 и хлора); выход продукта составляет 34% [2а].
Р4О10 + 4РС1б 2РаО3С14 + 4РОС13
Грунце и Коранский [За] сообщают об использовании ПФТХ
для фосфорилирования нуклеозидов. Для фосфорилирования
21 -о кс и стер о и до в, в частности имеющих 16, 17-ацетонидную группу,
ПФТХ превосходит 2-ци ан этилфосфат [36]. Стероид растворяют
в чистом ПФТХ при 0°, через полчаса реакционную смесь выливают
в ледяную воду, при этом фосфат осаждается в виде твердого полу-
360
кристаллического вещества. Этим способом фосфаты I и II были
Под действием ПФТХ кортизон образует димерный продукт де-
гидратации, а 11-оксистероиды подвергаются исчерпывающей де-
гидратации. При разбавлении органическими растворителями
фосфорилирование подавляется.
2а. С г о f t s Р. С., Downie I. М., Н е s I о р R. В., J. Chem. Soc., i960,
3673.
За. Griinze Н., Koransky W., Angew. Chem., 71, 407 (1959).
36. S 1 a t es H.L,Weber S., Wendler N. L., Chem. Ind., 1967, 1174.
ПИРРОЛИДИН (III, 126—129).
Енамины (после выдержки из 141). Гэдсби и Лиминг [4а] ис-
пользовали ениминиевые соли для защиты А4-3-кетогруппировки
в стероидах. Енамин (2), полученный обычным образом из П., при
обработке сильной кислотой, например соляной или хлорной, дает
енимпниевую соль (3), После проведения электрофильных реакций
сГ
сю4"
CHjOBFf
В г'
при С17 или С2) исходную cV-3-кетогруппировку (1) регенерируют
под действием разб. щелочи. При получении 17-этиленацеталя
А4-андростентриона-3,11,17 [46] А4-3-кетогруппировку защищали
в виде ениминиевой соли (3), осуществляли кетализацию под дейст-
вием этиленгликоля (/i-TsOH) и защитную группу удаляли гидро-
лизом. Общий выход продукта составляет 72% . Ранее при непосред-
ственной кетализации 17-кетояа под действием этиленгликоля
выход не превышал 25%.
Катализатор конденсации (III, 129, после выдержки из [6]).
Циклизация (1) в (2) под действием П. по Ньюмену [6] осу-
ществляется с низким выходом. Было найдено, что если поддержи-
361
вать постоянную концентрацию П,, то выход можно повысить до
54%. К. смеси дикетона и основания при кипячении в бензоле
(2)
добавляют раствор П. в бензоле со скоростью отгонки раствори-
теля [6а].
4а. G a d s b у В., L е с m i n g М. R. G., Chem. Comm., 1968, 596.
46. К, е 1 1 у R. W., McClenag h а п I., Sykes Р. J., J, Chem. Soc., (С),
1967, 2375.
6а. G а г d n е г J. N., Л n d е г з о п В. А., О 1 i v е I о Е. Р., J. Org. Chem.,
34, 107 (1969).
ПЛАТИНОВЫЕ КАТАЛИЗАТОРЫ (1П, 129—132).
(III, 129, после выдержки из [3].) Было обнаружено, что в при-
сутствии окиси платины, гидрированной непосредственно перед
использованием, удается под действием кислорода ввести третичную
гидроксильную группу в 12а-положение де диметил амино- 12а-дезо-
кситетрациклина(1) и таким образом с удовлетворительным выходом
получить дсдиметнл аминотетрациклин HI) 13а|,
Катализатор Брауна и Брауна (Ш, 130). К ссылке [10] добавить:
BrownC. A., Brown Н. С., J. Org. Chem., 31, 3989 (1966).
Маната обнаружил, что на этом катализаторе осуществляется
селективное гидрирование стероидных а,[3-непредельных кетонов
[М a k a t а Н., Bull. Chem. Soc. Japan., 38, 500 [1965)].
За. M u х f e 1 d t Н„ В u h г G., Bangert R., Angew. Chem., Internat.
Ed., 1, 157 (1962).
ПЛАТИНОХЛОРИСТОВОДОРОДНОЙ КИСЛОТЫ КАЛИЕВАЯ
СОЛЬ, KaPtCl4.
В кратких сообщениях австралийских исследователей [1] ука-
зывается на использование П. к. к. с. как катализатора гомоген-
ной реакции введения дейтериевой или тритиевой метки в органи-
ческие соединения в уксусной кислоте.
1. Game! t J. L., Н о d g е s R. J., J. Am. Chem. Soc., 89, 4546 (1967); G a r-
nctt J. L., O’ Keefe J. H., С 1 a r i n g b о 1 dP.J., Tetrahedron Letters,
2687 (1968).
362
ПОЛ ИГЕКСАМЕТИЛЕНКАРБОДИИМИД 111,
HCH2)6N = С= N - N = С= N — ]rt — (CH2)6—.
П. был получен каталитическим декарбоксилированием гекса-
метилендиизоцианата с применением 1-окиси 1-фенил-З-метилфос-
фолеиа-3 (HI,11) в качестве катализатора и П-метилпирролидона-2
(Н, 292) как растворителя. Полученный полимер обрабатывали
этанолом для блокирования терминальных изоцианатных групп,
отделяли фильтрованием, измельчали., экстрагировали кипящим
хлористым метиленом для удаления низкомолекулярных соедине-
ний и обрабатывали N-ацетоксисукцинимидом для ацетилирования
свободных аминогрупп, образование которых возможно в ходе
полимеризации.
Этот полимер использован в качестве нерастворимого конденси-
рующего агента в пептидном синтезе по «обращенной» схеме
Меррифилда. При этом активированный эфир N-защищенной амино-
кислоты связан с нерастворимым полимером, а свободный пептид-
ный эфир остается в растворе.
1. Wolman Y., К i v I t у S., Frankel M., Chem. Comm., 1967, 629.
ПОЛИФОСФОРНАЯ КИСЛОТА (ПФК) (III, 132—146).
Циклодегидратация (III, 133—135). ПФК оказалась наиболее
удовлетворительным реагентом для циклодегидратации соединения
(1) с образованием смеси (3) и (4) [12а]. Метокс и групп а была введена
в соединение (1) для достижения достаточной растворимости в ПФК.
363
Другие реакции циклизации fill, 135—136). При нагревании
п-нитрофенилгидразона ацетофенона (1) с ПФ К образуется п-нитро-
фенилиндазол (2) 115а].
СН3
(1) (2)
С помощью ПФ К бромид 1-фенил-2-ацетонилизохинолиния (3)
можно циклизовать с хорошим выходом в (4). Под действием броми-
стоводородной или серной кислоты эта циклизация не осущест-
вляется [156]. Несмотря на жесткие условия, требующиеся для
циклизации, перхлорат 5-метилбенз-[а]-фенантридизиния высокой
степени чистоты выделяют1 с хорошим выходом.
Ароматические сульфоны можно получить с высоким выходом
при перемешивании смеси ароматического углеводорода, аромати-
ческой сульфокислоты и ПФК при 80° в течение 8 час [15в].
ArSOgH + Ar'H —ФД ArSO2Ar' + H2O
Реакции замещения (III, 145). Прямое амидирование аромати-
ческих соединений можно иногда осуществить под действием гидро-
ксамовой кислоты в ПФК [48а]:
О О
I! пфк !
RCNHOH-pArH —--К RCNHAr + H2O
Продукт выделяют экстракцией эфиром из разбавленной реакцион-
ной смеси. Интересным примером является внутримолекулярная
циклизация Р-фенилпропиогидроксамовой кислоты с образованием
дигидрохинолона-2:
II ПФК
/x/CH2CH.CNH0H -г | || |
364
Гидроксильную, метокси- и ацетоксйгруппы при атоме углерода
в голове моста бицикло-1.2,2,2]-октанов часто можно заместить на
галоген реакцией с галогенирующим агентом (РОС13, РВг3) в при-
сутствия ПФК i486]. В отсутствие ПФК при взаимодействии
он
75-80%
СН3
(1)
сн3
(2)
(1) с РОС13 наблюдается фосфорилирование гидроксильной группы:
-OH-+-OPOCU.
12а. Thompson Н. W., J. Org. Chem., 33, 621 (1968).
15. Change to read: Emniich T. L., Letsinger R. L., Org. Syn., 47, 54
(1967).
15a. Dennler E. B., Frasca A. R., Tetrahedron, 22, 3131 (1966).
156. Bradsher С. K., Kimb er R. W. L., J. Org. Chem., 30, 1848 (1965).
15b. Graybill В. M., J. Org. Chem., 32, 2931 (1967).
48a. Wassmundt F. W., Padegimas S. J., J. Am. Chem. Soc., 89, 7131
(1967).
486. Kopeckj' J., S m e j k a 1 J., Tetrahedron Letters, 1931 (1967); 3889 (1967).
ПОЛИФОСФОРНОЙ КИСЛОТЫ ЭФИРЫ (ПФЭ) [III, 146,
после формулы (3)].
В последующей работе показано,что строение ПФЭ сложнее, чем
предполагалось ранее [4а].
(Перед ссылками.) Заменить ссылку [9] на последнюю статью:
Chem. Pharm. Bull., 14, 934 (1966).
О других работах этой группы японских исследователей сообщили
Капаока и сотр. [10].
При нагревании в присутствии карбоновой кислоты в ПФЭ
/шра-замещенный ароматический азид (1) превращается в оксазол (2)
[111. При этом предполагается промежуточное образование
нитрена.
(1)
пфэ,и о-и 5°
8 3%
(2)
С помощью ПФЭ можно циклизовать хлор ангидриды кислот
[12]. В приведенном ниже примере смесь хлорангидрида кислоты
(полученного из 4,65 г у-фенилмасляной кислоты) и 23 г свежеприго-
товленного ПФЭ нагревали при 70s в течение 15 мин и выливали
365
в воду. а-Тетралон выделяли экстракцией эфиром.
В полном синтезе фенольного норапорфинового алкалоида d, I-
гернандина амид (3) гладко циклизуется до основания (4) под
действием ПФЭ [13].
4а. V а и W a z е г J. R., N orva I S., J. Am. Chem. Soc., 88, 4415 (1966),
10, К а п a о k a Y. et al.,Chem. Ind., 1964, 2102; Chem, Phann. Bull., 14, 934
(1966); 15, 101, 593 (1967),
11. Garner R,, Mullock E. B., S u s c h i t z k у H., J. Chem. Soc. (C),
1966, 1980.
12. В h a 1 i A., Kale N., Angew, Chem., Internal. Ed., 6, 1086 (1967).
13. 5oh K- S.} Lahey F. N., Tetrahedron Letters, 19 (1968).
РЕНЕЯ КАТАЛИЗАТОРЫ НИКЕЛЕВЫЕ (III, 157—167).
Нитрилы (III, 160—161, после выдержки из [23]). Разработанный
Бакебергом и Стаскуном [231 метод превращения нитрилов в аль-
дегиды оказывается непригодным для пространственно затруд-
ненных нитрилов; в этом случае рекомендуется [23а] использовать
влажный никель Ренея в муравьиной кислоте. Кислота служит
источником водорода, а никель катализирует и разложение кислоты,
и восстановление нитрила.
Диспропорционирование (III, 165). В отсутствие акцепторов или
доноров водорода под действием никеля Ренея в кипящем п-цимоле
осуществляется четыре типа реакций стероидов: окисление гидро-
ксильной группы в положении 3, восстановление 5,6-двойной связи,
изомеризация 5^-Н в 5а-Н и димеризация [45а].
Синтез альдегидов (III, 166, перед ссылками). Готтштейн и сотр.
[48] разработали эффективный метод превращения соли пенициллина
Схема I
J 3 NH'-M""' т о ( О В-С-ИН-1— сг __з| СНз J) ciCOjE? 2)NaSK ТГФ-СЯЬСОЛ “Т piYT Никель Ренел^ -X—Ч™ (СДОНСНН? СОЬЩ 0-6° З^СГГз Ts0H-H20 X Г*СНз -Г eWS Органический СьЭДЧ.. растворитель СН СЩ ’ К—сщ
О
II
&-C--NH
О)
367
с третичным амином (1) в соль тиокислоты (2) через этоксиму-
равьиный ангидрид (схема!). Последующая десульфуризация соли
(2) осуществляется никелем Ренея № 28 в смеси ТГФ — уксусная
кислота. Реакцию проводят в присутствии N,N'-дифенил этилен диа-
мина с целью получения альдегида в виде имидазолидинового произ-
водного (3). Альдегидную группу регенерируют обработкой (3)
2 же моногидрата п-толуолсульфокислоты (вместо обычно исполь-
зующейся минеральной кислоты) в смеси эфир — ацетон — хлори-
стый метилен (3:1: 1).
Стереоспецифичность. Говард и Морли [49] изучали стереоспе-
цифичность различных катализаторов гидрирования циклопентили-
денциклопентанола-2 (1). Наибольшее содержание транс-изомера
(2) было получено с никелем Ренея. Стереоспецифичность других
(2)96%
катализаторов изменяется в следующем ряду, борид никеля д>
>Ru/C>Pt>Rb/C>Pd/C.
23а, S t a s k u п В., Backeberg О, G,, J. Chem. Soc., 1984, 5880.
45а, Banerjee S. К., Chakra varti D., Ch akrav arti R. N.,
Mitra M. N., Tetrahedron, 24, 6459 (1968),
48. Gottstein W. J, et al., J. Org. Chem., 31, 1922 (1966); J. Med, Chem,, S,
794 (1966).
49. Howard T. J., Morley B., Chem, Ind., 1967, 73.
РОДИЯ ТРИХЛОРИД, RhCl3-3H2O. Мол. вес 263,33.
P. т. катализирует присоединение этилена и пропилена к сопря-
женным диенам, например к бутадиену-1,3 [11;
ГН сн ХГН СНСН сн RbCIUCH3CH=CHCH=--.CHCH3 67%
СН2 = СН2ЩСН3=СНСН=СН2 -j СН3СН^СНСИ2СН = СН2 22%
Кроме того, Р. т. является катализатором димеризации олефинов.
1. Aldersan Т.,Jenner E.L.,Lindsey R.V.,Jr.,J. Am. Chem. Soc.,
87, 5638 (1965).
РТУТИ(П) АЦЕТАТ (111, 173—184).
Присоединение к олефинам (111, 183, после выдержки из [36]).
Обзор реакций оксимеркурирования опубликован Китчин-
гом [36а].
Окислительная циклизация (Ill, 183, перед ссылками) была осу-
ществлена Джулиа, Коломером и Джулиа [381 при обработке Р. а.
некоторых фен ил замещенных олефинов. Например, при обработке
4-феиилбутена-1(1) Р. а. в уксусной кислоте с последующим добав-
лением хлорной кислоты образуется смесь, из которой с низкими
368
выходами были выделены три продукта, указанные ниже. При этом
наблюдалось образование некоторого количества металлической
ртути.
30%
Гидратация олефинов по Марковникову очень легко осуществ-
ляется при оксимеркурировании под действием Р. а. с последующим
демер курированием бор гидридом натрия [39].
Например, к смеси Ю.Олшоля Р. а., 10ш воды и 10 ли тетрагид-
рофурана в небольшой колбе добавляют при перемешивании Юдгмо-
лей гексена-1 и перемешивают еще 10 мин при 25° до завершения
оксимеркурировании, после чего добавляют 10 мл 3 /VI раствора
едкого натра, а затем 10 мл раствора 0,5 М боргидрида натрия в 3 Д'!
едкого натра. Восстановление оксимеркурированного производного
происходит почти мгновенно. Ртути дают осесть, после чего добав-
ляют хлористый натрий для насыщения водного слоя и отделяют
верхний слой, который содержит гексанол-2 в ТГФ; выход практи-
чески количественный.
СН3 (CH,)3CH = CHa СН3 (CH,)3CH-CH3HgOAc (Н) ->
ОАс(Н)
—В2Ц СН3(СН,)3СНСН3
96% j
он
369
Эта двустадийная реакция удобна для гидратации циклических
и бициклических олефинов, так как преимущественно дает спирты,
эпимерные получающимся при присоединении реактивов Гриньяра
к соответствующим кетонам [40]. Таким образом, гидратация проме-
жуточных ртутных производных осуществляется главным образом
с менее затрудненной стороны.
CH3MgBr; НгО
Hg(OAc)a; NaBH4i
Другим преимуществом этой реакции является отсутствие пере-
группировок промежуточно образующихся карбониевых ионов [41].
Например, норборнен (9) с количественным выходом превращается
в экзо-нор борнеол (10), чистота которого выше 99,8%.
Hg(OA'c)2; NaBH4^
100%
(9) (Ю)
Реакция с сан- и анти-замещенными норборненами стереоспе-
цифична, Так, снн-оксинорборнен (11) дает экзо-син-2,7-диокси-
норборнан (12) с 83%-ным выходом, а антн-оксинорборнен (13)
дает жзо-анти-2,7-диоксинорборнан (14) с выходом 96%) [421.
370
Группа исследователей из Новой Зеландии [43] использовала
реакцию Брауна для превращения а-терпинеола (15) в 1,8-цинеол
(16= 16а) с выходом около 90%. Впервые это превращение было
осуществлено с помощью серной кислоты, но выход не достигал
и 5%; позже выход был улучшен до 19% : реакцию проводили с ацета-
том ртути с последующим демеркурированием под действием гидра-
зина.
цис —> транс-Изомеризация. Бициклический дитерпеноидиый
спирт абиенол (1) входит в состав эфирных масел многих хвойных
растений. Хотя строение его было установлено, неясной оставалась
конфигурация А ^-двойной связи. Сравнение ЯМР-спектра этого
спирта со спектрами соответствующих цис- и транс-кислот и а- или
цис-Авенал
р-оцимеиа свидетельствует в пользу цис-конфигурации. Миллс [44]
случайно обнаружил, что обработка этого спирта Р. а. в уксусной
кислоте и последующая обработка цинковой пылью приводят к сое-
динению, имеющему большее время удерживания на ГЖХ и оха-
рактеризованному как транс-абиенол, т. пл. 51—52,5°, ао4~25а,
Z,Et0H 232 нм (е 22 500). Открытие транс-изомера подтвердило цис-
конфигурацию природного спирта.
Ацетоацетилирование. Соли ртути, в частности Р. а., являются
эффективными катализаторами ацетоацетилирования слабых нук-
леофилов (например, мочевины, дифениламина, п-нитроанилина,
371
фенола) дикетеном при комнатной температуре [45].
(C6H5)2nh + HiC
о
НОАс,
Z4¥gC> (C6H5)zNCOCH2COCH3
95%
36а К 1 t с h i n g W., Organometallic Chem. Rev., 3, A, 61 (1968).
38. Julia M., С о 1 о m e г E., J u 1 i a S,, Bull. soc. chim. France, 1966, 2397.
39. Brown H.C., Geogh ega n P., Jr., J. Am. Chem. Soc., 89, 1522 (1967).
40. Bro w n H. С., H a m in a r W, J,, J. Am. Chem. Soc., 89, 1524 (1967).
41. Bro w n H. C,, Kawakami J. H., Ikegam I S., J. Am. Chem. Soc,,
89, 1525 (1967).
42. Bair W. C., Jr., В u z a M., J. Org. Chem., 33, 4105 (1968).
43. С о x о n J. M,, Hartshorn M. P,, Mitchell J. W., Ri-
ch a r d s К. E., Chem. Ind., 1968, 652.
44. Mills J. S., J. Chem. Soc., (C), 1967, 2514.
45. Завьялов С. И., Г у и a p В. И., M и хайлопуло И. А., Овеч-
кина Л. Ф., Tetrahedron, 22, 2003 (1966).
РТУТИ ОКИСЬ (ЖЕЛТАЯ) (Ш, 184—187, перед ссылками).
Окисление 1,1-дизамещенного гидразина — 3-аминооксазоли-
динона-2 (1) — бромной водой, смесью иодноватокислый калий —
HNO3 или бромноватокислым калием в 6 н. соляной кислоте приво-
дит к соединению с т. пл. 299е, которое теперь идентифицировано
как транс-3,3'-азо-бш>(оксазолидинон-2) (2). Форжоне и сотр. [15]
проводили окисление Р. о. ж. в диоксане или ТГФ при 25° и полу-
чили изомерный продукт с т. пл. 17Г, выход которого [вместе с. не-
большой примесью трпне-изомера (2)] составлял 50%. ИК-, УФ-,
КРС- и ЯМР-спектры, а также схема распада под электронным
NHZ
Диоксан или ТГФ
(О 25°
50% + 10% (2)
76-86%
(2) Т.ПЛ 298-299°
N = N
(3) Т.пл 170-171°
ударом соответствовали ожидаемым для шге-изомера. Убедительные
доказательства ^пс-трянс-природы этих двух соединений были
получены при превращении (3) в (2) при УФ-облучен и и в кристалл ц-
372
ческой состоянии. За 8 час изомеризация осуществляется приблизи-
тельно на 40%. Предполагается, что окись ртути, имеющая поли-
мерное строение, способна образовывать высокоупорядоченные
стереоспецифические промежуточные хелаты.
15 Forgione P.S,, Sprague G. S., Troffkin FI. J., J. Am. Chem.
Soc., 88, 1079 (1966).
РТУТИ(1) ТРИФТОРАЦЕТAT, Hg2(OCOCF3)a. Мол. вес 627,26.
P. т. получают при взаимодействии карбоната ртути(1) с три-
фторуксусной кислотой (избыток) или реакцией три фтор ацетата
натрия с нитратом ртути(1) (выход 67,7%) [1].
Синтез фенилацетиленов [2]. Под действием Р.т. в эфире или
диоксане при 40—50° гидразоны замещенных бензилкетонов окис-
ляются до фенилацетиленов. Необходимо использовать кислород-
NNFF
С Н ГНС ГЫ 2Hg* (0С0СЩ)г
С6Н5С^СС6Нй + 4 [CF3COzH.(C.2H5)2O]-p4Hg-EN2
430/
/о
содержащие растворители, так как они образуют комплексы с три-
фторуксусной кислотой, которая иначе присоединялась бы к ацети-
ленам. Для реакции необходима абсолютно безводная среда.
1. Swarts F., Bull, Soc, Chim. Beiges, 48, 179 (1939).
2. T h e i s R. J., Dessy R. D,, J, Org. Chem., 31, 624 (1966).
РУТЕНИЯ ЧЕТЫРЕХОКИСЬ (Ш, 197—201).
(1П, 200, после раздела «Окисление простых эфиров»). Р. ч.
в системе СС14—Н2О была использована для окисления водораство-
римого спирта (1) в кетон (2). Соединение (1) не окисляется воздухом
в присутствии платинового катализатора [За].
RuO4, ССЩ-НгО
63ft
Я"_.СН3 (Вг“)
СН2СО2СН3
Под действием Р. ч. в сочетании с перйодатом натрия фенильные
заместители окисляются до карбоксильных групп [36], а циклобута-
373
нолы — до циклобутанонов:
ед
KuO4—NaIO4<
...Н
СО2Н
RuO4-NaIO4.
25^ ‘
Нч^СО2Н
Ru.O4-NaIO4,
Серусодержащие соединения (111, 200, после выдержки из [4]).
Утверждение, что сульфиды инертны к четырехокиси осмия, не
является абсолютно верным. Некоторые сульфиды, например
дифенил- и дибензилсульфид, действительно инертны по отношению
к OsO4; однако тиациклогексан S(CH2)5 при обработке четырех-
окисью осмия при —15° в течение 2 час превращается в сульфон
OaS(CH2)5 с 58%-ным выходом [4а1.
Окисление углеводов (111, 200—201, перед ссылками). В недав-
ней работе Бей нон и сотр. [11] сообщают, что Р. ч. лучше получать
из гидратированной (а не безводной) двуокиси рутения RuOa-
2Н2О. Гидратированную двуокись рутения (0,001 моля) добавляют
к водному раствору перйодата натрия (0,01 моля) и смесь встряхива-
ют до превращения нерастворимой черной двуокиси в четырехокись.
Продукт экстрагируют четыреххлористым углеродом и этот раствор
добавляют к субстрату в четыреххлористом углероде, хлористом
метилене или ацетоне. Было найдено, что под действием Р. ч. одина-
ково легко окисляются аксиальные и экваториальные гидроксиль-
ные группы пираноидных циклов, а также эндо- и экзо-гидроксиль-
ные группы 1,4;3,6-диангидридов. Хотя в настоящее время широко
применяются реагенты на основе ДМСО, группа английских иссле-
дователей считает, что Р. ч. все же представляет интерес, когда
необходимо быстро и с хорошим выходом получить чистые про-
дукты.
Хортон и Джеуэл [12] использовали Р. ч. в СС14 для избиратель-
ного окисления изолированных вторичных гидроксильных групп
углеводов в кетогруппы, однако для этой цели более пригоден ДМСО
в уксусном ангидриде.
Окисление ароматических стероидов и сопряженных кетостерои-
дов. При исследовании окисления различных стероидов поддейст-
374
внем Р. ч. Каспн и сотр. Г131 получали реагент сначала in situ
из двуокиси рутения и перйодата натрия, а затем регенерировали
р. ч. в процессе реакции, добавляя раствор перйодата натрия.
В качестве растворителя использовали смесь ацетона и воды.
За реакцией легко следить по изменению окрашивания, так как
двуокись черного, а четырехокись желтого цвета. Под дейст-
вием Р. ч, ароматические стероиды расщепляются с удовлетвори-
тельным выходом. Например, из эстрона (1) с хорошим выходом по-
лучается дикарбоновая кислота (2). Однако реакция с диацетатом
эстрадиола осуществляется совершенно по-иному: главным является
продукт окисления по двум бензильным положениям кольца В —
соединение (4), а дикарбоновая кислота, соответствующая (2),
получается только с низким выходом. Р. ч, пригодна для расщепле-
ния стероидных кетонов, в которых карбонильная группа сопряжена
с одной пли двумя двойными связями, В некоторых случаях полу-
чаются более высокие выходы, чем при озонолизе. Например, ацетат
тестостерона (5) расщепляется до кетокислоты (6) с 80%)-ным выхо-
дом. При окислении (7) образуется кетокислота (8) с элиминирова-
375
нием звена, состоящего из С3 и С4, а 1,4-диендиоиы-3,11 вопреки ожи-
даниям дают ендионы (9)->(10).
За, Н о u s е Н. О., Т е f е г t i 1 1 е г В. A., J, Org. Chem., 31, 1068 (1966).
36. С а р u t о J, A., F и с h s R., Tetrahedron Letters, 4729 (1967),
4а. Н е п b е s t Н. В., К h a n S. A., Chem. Comm., 1968, 1036,
П. Be у non P, J., Collins P. M., Gardiner D., Overend W. G.,
Carbohydrate Res., 6, 431 (1968).
12. Horton D,, Jewell J. S,, Carbohydrate Res., 2, 251 (1966),
13, P i a t a k D. M., В h a t H. B.,Caspi E., J. Org. Chem,, 34, 112 (1969);
P i a t a k D. M,, H er bs t G., W i ch a J,, Caspl E,, ibid., 34, 116
(1969).
САЛЬКОМИН [1,2-этилен-бнс-(салицилиденамино)-кобальт(П)1.
(Лторожно\ Реагент очень токсичен.
Получение [1]. Этот каштанового цвета хелат получают из
ПдХ'-дисалицилальэтилендиамина и хлорида кобальта (11).В твердом
состоянии и в различных растворителях С. обратимо связывает
кислород (1О2 ' 2Со) [2], Ван Дорт и Гюрсен [3] использовали С.
для гомогенного катализа при окислении фенолов молекулярным
кислородом. При окислении в метаноле фенолы со свободным пара-
положением образуют главным образом n-хиноны (выход от 15 до
80%), В хлороформе в основном получаются сложные продукты
радикальных превращений.
1. «Неорганические синтезы», ИЛ, М., 1952, сб. Ill, стр. 184—188,
2. Faigenba um И, М., W i b е г I е у S. Е., Chem. Revs., 63, 269 (1963).
3. Van Dor t H. M., Geursen H. S„ Rec. trav., 86, 520 (1967).
СВИНЕЦ. Ат. вес 207,21.
Группой венгерских химиков установлено [11, что пирофорный С.
можно получить обработкой окиси свинца парами фурфурола при
290°. Очистить С, можно промыванием бензолом и водным спиртом.
Он описан как новый реагент для реакций типа синтеза Вюрца,
например:
РЪ
2СН3СН2СН2СН2Вг CH3CH2CH2CH2CH2CH2CH2CHS
00
Pb
2СеН&СОС1 С6Н5СССеН5
Азоу и Гримшоу [2] получили тонкодисперсный С. при взаимо-
действии тетраацетата свинца с боргидридом натрия в водном
растворе. Под действием этой формы С. хлористый бензил при кипя-
чении с обратным холодильником в бензоле превращается в дибен-
зил с 70%-ным выходом. Однако такой же эффективностью обладает
продажная свинцовая пудра (измельчение от 100 меш до пылевид-
ного). Обе эти формы С. эффективны также при восстановлении
377
ароматических нитросоединений в азоксисоедпнения; выходы обычно
составляют 40—70%, причем образуются только траноизомеры,
1. Meza го s L., Tetrahedron Letters, 4951 (1967).
2. A z о о J. Л,, Grimsha w J., J. Chem. Soc., (C), 1968, 2403.
СВИНЦА ДВУОКИСЬ (111, 202—205).
Гидрохиноны хиноны (111, 203, после выдержки из 171).
Наиболее удобный метод синтеза 4,5-диметокси-о-бензохииона
[8] заключается в окислении катехина (7) С. д. в присутствии
метилата натрия 17а],
РЬО2
CHsOH-CH,ONa
Н3СО\^//О
НзСс/^/^О
Окислительное декарбоксилирование (111, 204, после выдержки
из [101). Эйзенбраун 110а] показал, что окислительное декарбокси-
лирование непетоновой кислоты (1) является лишь частным случаем
общей реакции у-кетокислот. Продажная С. д, практически почти
так же эффективна, как и специально полученная по методу Деринга
и Финкельштейна [9], Для у-кетокислот, не имеющих алкильных
или арильных заместителей в и- и p-положениях, выходы продуктов
составляют 30—40%, тогда кака- или ^-замещенные у-кетокислоты
дают чистые а, ^-непредельные кетоны с выходами до 92%. По
лучшей методике тщательно перемешанную смесь С. д., y-кетокис-
лоты и тонкорастертого стекла помещают в сублимационную трубку,
которую затем вакуумируют и до уровня заполнения помещают
в предварительно нагретую до 250° сублимационную печь, и, р-Не-
предельный кетон отгоняется и конденсируется в холодной части
трубки, Вся операция занимает около 10 лшн.
Внимание! Реагенты должны быть тщательно перемешаны,
а горячий остаток после реакции декарбоксилирования необходимо
защищать от контакта с воздухом.
(Ill, 205, перед ссылками.) Баррель и Глена [15] окисляли спирты
типа (1) до кетонов (2) с помощью продажной С. д. Выходы продукта
RCHOHC^CH —В RCC^CH
О
(2)
составляют 25—40%, если R —алкил или циклогексил, и повы-
шаются до 60—80%, когда R-арильная или замещенная винильная
группа.
7а, W а л z 1 i с k H.-W., J a h п к е U., Chem. Вег,, 101, 3744 (1968).
10а. Н е г t z 1 е г D. V., В е г d a h I J. М., Е i s е п b г а и п Е. JJ, Org.
Chem., 33, 2008 (1968).
15. В а г г е 1 1 е М., G 1 е n a t R., Bull, soc, chlm, France, 1967, 453.
378
СВИНЦА ДИАЦЕТАТА ТРИГИДРАТ (111, 206—207, перед ссыл-
ками).
С. д. т. был успешно использован [4] для замещения брома на
ацетоксигруппу:
РЬ(ОАсД
80-9 0%
%С1
(СН2)3 |:н
^сно с о сн3
Реагент превосходит ацетат серебра, который ранее применялся
для таких реакций замещения. Приведенный пример является одной
из стадий в превращении циклических кетонов в циклические
р-ди кетоны.
4. Schank К., Eistert В., FelzmannJ.H., Chem, Ber,, 99, 1414 (1966).
СВИНЦА ТЕТРААЦЕТАТ (111, 208—242).
а-Ацетоксилирование карбонильных соединений (III, 212—214,
после первого абзаца на стр, 214). Петтит [10а] обнаружил также, что
21-ацетокси л ирование 20-кетостероидов осуществляется лучше
при окислении С.т. в присутствии эфирата трифтористого бора в ка-
честве катализатора. Так, Аэ-3р,21-диацетоксипрегненон-20 был
получен из прегненолона с выходом 69%.
(Ill, 214, последнее уравнение.) Поправка. Вторая и третья
формулы в уравнении неверны, Следует читать 118а]:
Гипоиодитная реакция (111, 228, после выдержки из [56]). Под
действием С.т. в сочетании с иодом цедранол (1) был окислен до
окиси цедраиа (2) с 50%-ным выходом |56а1. При использовании
одного С.т. получаются лишь следы окиси (2).
Окислительное декарбоксилирование (111, 234, после выдержки
из [70а]). Туфарелло и Киссел [7061 описали упрощенную методику
окислительного декарбоксилирования дпзамещенных малоновых
379
кислот. Кислоту окисляют С.т. при кипячении в бензоле, содер-
жащем 2 же пиридина. При этом выделяется двуокись углерода и
образуется геминальный диацетат, который легко гидролизуется
кислотой или основанием до кетона. Выходы составляют 45—70%.
R ч /СО3Н рь (ОАс)4 R х /ОАс н+ или ,ОН“ R ч
>С< —-—>• >с< --------->- >с=о
Rf/ ХСО3Н Ру R'/ хОАс R'/
Кочи [70в1 обнаружил, что окислительное декарбоксилирование
С.т. катализируется не только пиридином, но даже в большей сте-
пени ацетатом меди Си(ОАс)г и другими солями меди (П). Поскольку
кислород ингибирует реакцию, механизм ее, по-видимому, свободно-
радикальный. Этот метод имеет препаративное значение. Так, Йен-
сен и Джонсон [70 г] превратили тетрагидроабиетиновую кислоту
(1) в смесь диенов (2) с выходом 76%. Эта методика была использо-
вана в трехстадийном синтезе фихтелита (6) из абиетиновой кис-
лоты (3).
Герц и сотр. [70д] применили этот каталитический метод для
превращения (7) в (±)-метилтрахилобанат (8), один из предста-
вителей нового класса пентациклических тритерпенов, открытого
380
Оуриссоном и сотр. Г70е].
Окислительное декарбоксилирование монокарбоновых кислот
замедляется кислородом [70 д], но кислород повышает выход олефи-
нов.при окислительном бис-декарбоксилировании (9)~>(10) [70ж[.
Атмосфера
Выход соединения (10), %
Азот
Воздух
Кислород
38,4
43
52
В совместной публикации три различные группы исследователей
сообщают, что окислительное декарбоксилирование 1,2-дикарбоно-
вых кислот, как правило, происходит с большим выходом при элект-
ролизе, чем при обработке С. т. [R a d 1 i с k Р. С. et al., Sims
J. J., van T amelen E.E., Whiteside sT., Tetrahedron Letters,
5117 (1968)]. Аналогичный вывод независимо и одновременно был
сделан в работе Вестберга и Даубена [We s t b e r g H. EL,
D a u b e n H. J., Jr., Tetrahedron Letters, 5123 (1968)].
При окислении С. т. в присутствии ацетата меди в качестве ката-
лизатора холановая кислота превращается в Д22-норхолен-24
с 60%-ным выходом [V a i d у a A. S., Dixit S. М., Rao
A. S., Tetrahedron Letters, 5173 (1968)].
381
В случае некоторых непредельных карбоновых кислот обра-
ботка РЬ(ОАс)4 приводит к образованию ацетоксилактона, напри-
мер (12) [70s].
(12)
С. т. медленно взаимодействует с пиридином, при этом образуется
красный раствор, который постепенно изменяется до желтого.
Из смеси С, т. и пиридина в бензоле после стояния Партч [70и]
выделил пиридинат тетраацетата свинца в виде желтого твердого
вещества.
При обработке С. т, в уксусной кислоте незамещенные амиды
карбоновых кислот превращаются в ариламины [70к]; при этом
предполагается промежуточное образование ацилнитрена:
О Г О
II PbfOAc). II
RC- NH2 [RC—N:
R—N=C=O
н н
I I
—> R —N —С=о —> R —NCOCHg
I
OAc
Батлер [70л] рассматривал реакции С. т. с замещенными гид-
разонами как способ получения новых гетероциклических систем,
Збирал и Вернер [70м] разработали новый метод получения
эфиров а-кето карбоновых кислот, заключающийся в ацетилирова-
нии метоксиметилентрифенилфосфорана и окислении продукта С. т.
ОСН3 ОСН3
RCOCI ] РЬ (ОАс)., |
(С6Н5)3Р = СНОСН3 - (С6Н5)3Р =CCOR ——— О = С—CR
О
Различные реакции окисления (П1, 239, после выдержки из [881).
де Грот и Уинберг 188а] использовали С, т. в пиридине (в условиях
Партча [88]) для селективного окисления а-оксикетогруппы в I без
382
затрагивания сульфидной группы.
Н3С^
СИг-С
S
Хсн2-с
н3с^
/СН3
Хс-О
хснон
чсн3
РЬ(ОАс)4
Ру ч
80%
н3с сн3
сн,— сС
s' f=o
Ч С-О
СНг-сГ'
г3с сн3
Оксимы взаимодействуют с С.т. (0,5 же) в уксусной кислоте при
70° (1 час) с образованием соответствующих карбонильных соедине-
ний с выходами от 60 до 90%. В присутствии эквивалентного коли-
чества безводного ацетата натрия эту реакцию можно провести даже
Rx Rx
2 pC=NOH Д-Pb (ОАс)4 —> 2 >C=O + N.,-RPb (ОАс).,-р2НОАс
R/ Rz
с ненасыщенными оксимами. Например, цитраль был получен из
соответствующего оксима с 80%-ным выходом. Окисление ацето-
феноноксима было проведено с девятью реагентами; наилучшим
оказался С.т. (выход 95%) [886].
СН3
| Pb (OAc),-NaO Ас
(СН3)2С = СН (CH2)2C==CHCH = NOH------
сн3
(СН3).2С = СН (СН2).,С=СНСН=О
1. В а г t о п D. Н. R,, L i е г Е. F,, М с G h i е J. F.f J. Chem. Soc., (С),
1968, 1031.
10а. Pettit G. R,, Н е г а 1 d С. L., Y а г d 1 е у J. Р., J. Org. Chem., in
press.
18a. This correction was kindly reported by Dr. Jerry W. Ellis.
56a. В a g g a 1 e v К. H., Norin T., S und in S., Chem. Scand., 22, 1709
(1968).
706. T u f a г i e 1 1 о J. J,, Kissel W, J., Tetrahedron Letters, 6145 (1966).
70b, Kochi J. K., J. Am. Chem. Soc., 87, 1811 (1965).
70r. Jensen N. P., Johnson W. S., J, Org. Chem., 32, 2045 (1967).
70л. Herz W., Mirrington R.N., Young H., Tetrahedron Letters, 405
(1968).
70e. H u g e 1 G., L о ds L., M e 1 I о r J. M., T h e о b о 1 d D, W,, О u г i s-
son G.t Bull. soc. chim. France, 1963, 1974; 1965, 2882, 2888; HugelG.,
Lods L., Mel lor J.M., Ourisson G., ibid, 1965, 2894.
70ж. С i m a r u s t 1 C.M., Wol insky J., J, Am. Chem. Soc., 90, 113 (1968).
70a. Moriartv R. M., Walsh H. G., G о p a 1 H., Tetrahedron Letters,
4363, 4369 (1966).
70n. Partch R.E., Monthony J., Tetrahedron Letters, 4427 (1967).
70k. AcottB., Beckwith A. L. J., Chem. Comm., 1965, 161.
70л. Butler R. N., Chem. Ind., 1968, 437.
70m. Z b i r a 1 E., Werner E., Tetrahedron Letters, 2001 (1966).
72. Add: See also AcottB., Beckwith A.L. J., H a ss a n a 1 i A,, R e d-
m on d J. W., Tetrahedron Letters, 4039 (1965).
383
СВИНЦА ТЕТРААЦЕТАТ — N-БРОМСУКЦИНИМИД.
Бартон, Льер и Мак-Ги [1] применили тетр а ацетат свинца в соче-
тании с N-бромсукцинимидом в кипящем бензоле для осуществления
аллильного ацетокси л ирования. Авторы полагают, что механизм
и сфера применения этой новой реакции заслуживают дальнейшего
исследования. Например, p-амирен [Д12-олеанен (1)1 превращали
в Д12-1 lcz-ацетоксиолеанен; соответствующий спирт (2) был выделен
после гидролиза с 50%-ным выходом.
88а. de G г о о t Ле., W у n b е г g Н., J. Org. Chem,, 31, 3954 (1966).
886. Yukawa Y., S a k a 1 M., SuzukiS., Bull. Chem. See. Japan, 39, 2266
(1966).
СВИНЦА ТЕТРА-(ТРИФТОРАЦЕТАТ), Pb(OCOCF3)4. Мол. вес
659,13, температуру плавления не удается определить из-за слиш-
ком высокой гигроскопичности.
Получение. Белый кристаллический реагент, чрезвычайно чув-
ствительный к влаге, был впервые получен и использован в качестве
катализатора полимеризации олефинов химиками компании «Дюпон»
[11. Смесь РЬ3О4 (7,5 г), (CF3CO)2O(15 г) и CF3CO2H (26 г) перемеши-
вают при комнатной температуре до обесцвечивания.
Окисление [2]. С.т. взаимодействует с неактивированными угле-
водородами, например с бензолом, н-гептаном, а также с толуолом,
образуя трифторацетоксипроизводные, которые легко гидролизуют-
ся до соответствующих фенолов или спиртов. Выходы составляют
54+10%.
О
СеНе —» c6h5occf3 с6наон
о
н-С7Н1в h-C7H1sOCCF3 —2^ н-С7Н15ОН
о
II но
СеН5СН3 CaH5CH2OCCF3 СВН5СН2ОН
]. Е. I. du Pont de Nemours and Co (by J. R.Converv), пат. ФРГ 1094462 (1958).
[С. A., 56, 1603 (1962.)]
2. P a r t c h R. E., J. Am. Chern. Soc., 89, 3662 (1967).
384
СЕЛЕНА ДВУОКИСЬ (III, 246-256).
Окисление (III, 246—248, в конце раздела). Оротовый альдегид
(2) можно получить непосредственно окислением 6-метилурацила
(1) С. д. в уксусной кислоте с выходом 58% [10а].
Н Н
°ч/\д° SeO,- AcOH 1 |
hnU ' hnU j
сн3 сно
(I) (3)
Гидроксилирование в аллильное положение (III, 248—251).
Удивительно, что при окислении а-циклодигидрокостунолида (1)
под действием С. д. осуществляется атака аллильной метиковой
группы с образованием в качестве главного продукта соединения
(II) (выхода 30%) [18а].
I и
Ключевым промежуточным соединением в синтезе тетрацикличе-
ского тритерпена а-оноцерина является соединение (5), получение
которого включает аллильное окисление а,р~непред ель кого слож-
ного эфира (I). Окисление проводят действием SeO2 в кипящей
уксусной кислоте [186]. Для превращения образующегося при этом
ненасыщенного оксилактона (2) в насыщенную кетокислоту (5)
13 № 1994
385
требуется, как можно предполагать, несколько стадий. Однако
совершенно неожиданно было обнаружено, что при простом кипяче-
нии оксилактона (2) с едким натром в этиленгликоле в течение
2 час соль ненасыщенной окси кислоты (3) диспропорциейируется
с образованием соли насыщенной кетокислоты (4), подкислением
которой получают непосредственно насыщенную кетокислоту (5),
При обработке С, д. в ТГФ в присутствии уксусной кислоты
непредельные стероидные эфиры цис-конфигурации типа (6) подвер-
гаются аллильному гидроксилированию при Clfl П8в]. При этом
образуются и а- и ^-спирты. Соединения (7) и (8) были использованы
для получения 16-галокортикондов.
(8)
Ключевой стадией частичного синтеза стероидного гормона насе-
комых экдизона является введение 14а-гидроксильной группы.
Трн группы исследователей [18г—18д] осуществили это превраще-
ны илиЬрН
5яН илиЭрн
ние с высоким выходом аллильным окислением А7--6-кетостероидов
(За и 5J3) под действием С. д. в диоксане.
10а. Zee-Cheng K.-Y., Cheng С. С,, J. Heterocyclic Chem., 4, 163 (1967).
16, Add: Zee-Cheng K.-Y., Cheng С. C., Tetrahedron, 22, 3189 (1966).
18a, Pathak S. P., К u 1 k a r n i G. H., Chem. Ind., 1968, 913.
186. D a n i e 1 i N., Mazur Y., Sondheimer F., Tetrahedron, 23, .609
(1967).
18b, Pike J.E., Li neo lnF.H.,SperoG.B., Jackson R.W.,Thomp-
son J. L., Steroids, II, 755 (1968).
18r. Furlenmeier A., Furst A., L. angemann A., Waldvo-
g e i G., Kerb CI., Hocks P,, W iecliert R., Helv. Chim. Acta, 49,
1591 (1966).
18д. S i d d a 1 1 J. B,, Marsha I I J. P., Bowers A.,Cross A. D., E d-
wards J. A., Fried J, H., J. Am. Chem. Soc., 88, 379 (1966).
СЕЛЕНА ДВУОКИСЬ — ПЕРЕКИСЬ ВОДОРОДА.
Коксои и сотр. [1] использовали сочетание этих реагентов
(0,66 моля Н2Огф-13,3 дгмоля SeOJ для окисления [З-пинена (1)
386
б трамс-пинокарвеол (2), Выход продукта оказался выше, чем при
использовании одной окиси селена в эквимолярном количестве.
сн>
49-55%.
(1) О, 5 моля (2)
Кроме того, упростилось отделение селен содержащих соедине-
ний от продукта реакции.
1. С о х о п J. М., D а п s t е d Е., Hartshorn М. Р., procedure submitted
to Org. Syn. (1968).
СЕРА ДВУХЛОРИСТАЯ (III, 261, перед ссылками).
Реакция С. д, с циклическими диенами была распространена на
циклические полиолефины 15]. При взаимодействии С. д. с циклоок-
татетраеном (5) в качестве главного продукта образуется соединение
(6). Эта реакция представляет интерес, так как обычно присоедине-
ние к циклооктатетраену сопровождается перегруппировкой угле-
sci2
-----
31%
родного скелета. Циклогептатриен (7) под действием С. д. дает соеди-
нение (8) с выходом 35%.
sci2
----->
35%
(7} (3)
5. Lautenschlaeger F., J. Org. Chem., 33, 2627 (1968).
СЕРА ЧЕТЫРЕХФТОРИСТАЯ (III, 262—263),
(III, 263, после выдержки из [7)). Босвелл [7а] получал 6,6-ди-
фтор-А4-3-кетостероиды (4) по следующей схеме. При взаимодейст-
вии С.ч. с 5а-фтор-6-кетоном (1) (получение см. Нитрозил фтори-
стый, III, 447) был получен 5а,6,6-трифтор-Зр-ацетоксистероид (2).
36-Ацетоксигруппу гидролизовали и образующийся Зр-ол окисляли
13*
387
реагентом. Джонса. Дегидрофторированием соединения (3) путем
пропускания через колонку с нейтральной окисью алюминия был
получен (4).
(Перед ссылками.) Крам и Уингроув [9] обнаружили, что при
взаимодействии оптически активной (—)-кИслОты с С.ч. не наблю-
дается потери дейтерия, и заключили, что эта реакция стереоспеци-
фична.
СН3 СИ,
J SF4 J
C6HSCH3C- D —> C6H5CH2C-D
СО2Н CF3
7а. В о s w с 1 1 G. A., Jr., J. Org. Chem., 31, 991 (1966).
9. С г a m D. J., \V i n g г о v е A. S., J. Am. Chem. Soc., 86, 5490 (1964); see
also Della E. W-, J. Am. Chem. Soc., 89, 5221 (1967).
СЕРЕБРА БОРФТОРИД (III, 264^266).
Получение [1]. Окись серебра (1,0 г) растворяют в 45%-ной
борфтористоводородной кислоте (7,2 г).
Синтез тропона [11. Синтез природного тропона незукона (4) был
осуществлен присоединением ди хлор карбена (СНС!3—трет-бут-
лат калия) к 1-изопропил-4-метоксициклогексадиену-1,4 (2), который
получают из анизола (1) восстановлением по Берчу. Образующийся
аддукт-(3) обрабатывают С.б. и получают тропой (4) с. 68%-ним
выходом. С применением нитрата серебра выход (4) снижается до
20% , по-видимому, в результате вторичных реакций с образующейся
азотной кислотой.
Хроматография [2]. Хроматография с обращением фаз на бумаге
из стекловолокна с использованием в качестве элюента растворов
С.б. является удобным методом разделения сесквитерпенов даже
в тех случаях, когда его не удается осуществить на окиси алюминия
388
и газо-жидкостной хроматографией. Нитрат серебра для этого не-
пригоден ввиду слишком ограниченной растворимости,
[.Birch A. J., К е е t о n R., J. Chem. Soc., (С), 1968, 109.
2. W 1 с k b е г g В., J. Org. Chem., 27, 4652 (1962); Е п z е 1 1 С., Chem. Scand.,
15, 1303 (1961); В а г г с t о Н. S., Е n z е 1 1 С., ibid., 15, 1313 (1961); Rune-
berg J., ibid., 14, 1985 (1960); W e s t f о 1 t L., Wickb erg B., Arkiv
Kemi, 26, 545 (1967).
СЕРЕБРА КАРБОНАТ (III, 267, перед ссылками).
Окисление. При попытке получения гликозидов кодеина Рапо-
порт 12] обнаружил, что под действием С.к., полученного из нит-
рата серебра и карбоната натрия, кодеин окисляется до кодеи-
нона с 75%-ным выходом. Позднее Клётцель [31 отмечал, что про-
дажный С.к. также эффективен для этого окисления,
Фетизон [4] обнаружил, что свежеприготовленный С. к. является
очень активным окислительным агентом по отношению к спиртам,
но его трудно отфильтровать и промыть. Это осложнение устраняется
при осаждении С. к. в присутствии целита, который промывают
метанолом, содержащим 10% конц. соляной кислоты, затем водой
до нейтральной реакции и высушивают при 120°. С. к. получают
следующим образом. Нитрат серебра (34 а) растворяют в 200 мл
дистиллированной воды, прибавляют 30 г очищенного целита. затем
при перемешивании магнитной мешалкой добавляют 30 г декагид-
рата карбоната натрия в 300 мл дистиллированной воды. Через
10 мин желто-зеленый осадок отфильтровывают, промывают дистил-
лированной водой до нейтральной реакции и высушивают в течение
нескольких часов на роторном испарителе при нагревании на паро-
вой бане. Реагент можно хранить, но лучше готовить его непосредст-
венно перед употреблением.
При окислении спиртов избыток С. к. (8—15 лгмолей) суспенди-
руют в растворе спирта (1 жмоль) в бензоле (60 мл). Часть бензола
удаляют азеотропной отгонкой, оставшийся раствор кипятят с об-
ратным холодильником. По окончании окисления осадок отфильтро-
вывают, а альдегид или кетон выделяют из бензола обычным
образом.
Примеры.
Андростанол-Зр->Андростанон-3 (87%).
X ол анол-24—' Хола нал ь-24 (94,5%).
Холановой кислоты метиловый эфир—> 3-Кето-7а,12а-диоксихо-
лановой кислоты метиловый эфир (9096).
Гераниол->Гераниаль (97%).
Нафтогидро хинона Нафтохинон (100%).
Заслуживает внимания селективное окисление 3-гидроксильной
группы метилового эфира холановой кислоты. К действию С. к.
устойчивы также ацетильная, этиленкетальная и этилентиокеталь-
ная группы.
Окисление можно также проводить в толуоле или в случае
очень реакционноспособных спиртов (аллилового и бензилового)—
389
в хлороформе и хлористом метилене. Аллиловые спирты можно из-
бирательно окислить в ацетоне.
2. R apoport Н., R cist Н. N., J. Am. Chem. Soc., 77, 480 (1955).
3. King \V., Pc ii prase W. G., KloetzelM. C., J. Org. Chem., 26, 3558
(1961).
. 4. Fetizon M., G о I f i e r At, Cornpt. rend., 267, 900 (1968).
СЕРЕБРА НИТРАТ (III, 267-271).
Комплексы (III, 270, после выдержки из [17]). Гидрирование
эфиров и глицеридов частично эпоксидированных жирных кислот,
имеющих ненасыщенные группы, проводят в этаноле при низком
давлении с палладием на угле в качестве катализатора. В присут-
ствии С. н. обеспечивается полная защита этиленовых связей, по-
видимому, за счет образования л-комплексов, и продуктами восста-
новления являются соответствующие монооксппроизводные [17а[.
.ЩКОч
—СН-СН — (СН,)„-СН — СН-—:-----> — сн-CH — (СН2)„—СН-СН >
° AgK'O, Ч0/
Нг, Cd-С
-----—СН —СН — (СН,)„-СН-СН2-
1 ~ !
AgNO3 ОН
Коуп и сотр. [17б| пиролизовали гидроокись N,N,N-триметил-
аммония (1) в вакууме в атмосфере азота и получили с 89%-пым
выходом смесь циклооктенов, которая по данным ИК-спектров
состояла из 4096 мне-изомера (2) и 60% транс-изомер а (3). Эту
смесь удается легко разделить, так как транс-изомер (3) реагирует
с водным С. н. и образует растворимый в воде л-комплекс, тогда как
цпе-изомер в эту реакцию не вступает. Таким образом, весь угле-
водород распределяют между н-пентаном и 20%-ным водным раство-
ром нитрата серебра, водный слой экстрагируют пентаном для
удаления ппс-циклооктена, выход которого после перегонки состав-
ляет 29% . Водный раствор, содержащий AgNO3, медленно добавляют
к конц. водному раствору аммиака, содержащему измельченный лед.
N(CH3)3
(он’)
110-125° (Nz)
89% ;
(4 " (2)
Пентан |водн.А§К03
£ ~^,бодн. раствор nh3
цис-Циклооктен (2) тдяяг-Циилооктен (з)
40% 60%
Отделенный таким образом транс-углеводород экстрагируют пента-
ном и перегоняют; выход 45,496.
390
Стерины и их ацетаты были разделены с помощью колоночной
и тонкослойной хроматографии на силикагеле, пропитанном
С н. [17в1.
По новой методике получения циклооктина из 1-бромцнклоок-
тена Внттиг и Дорш [17 г] выделяли продукт в виде кристалличе-
ского комплекса с С. н. состава 2:1с выходом 30%. При этом
циклооктадиен-1,3 и циклооктен остаются в растворе. Обработкой
комплекса гидроокисью аммония выделяют свободный циклооктин
в чистом виде. При обработке комплекса тетрафенилциклопентадие-
Чистый
ионом в бензоле при комнатной температуре в течение 24 час хромато-
графически выделяют декарбонил и ров айны и аддукт с выходом 87% .
Каталитическое гидрирование 7-ацетокс и норбор надиена приво-
дит главным образом к стш-7-ацетоксинор бор йену и некоторому
количеству пялш-изомера. Франзус П7д] обнаружил, что син-7-
ацетат образует комплекс с серебром, который почти в десять раз
(4)
более стабилен, чем соответствующий комплекс ан/л/2-7-ацетата.
Такого различия в устойчивости комплексов достаточно для осуще-
ствления эффективного разделения изомеров. Автор объясняет
391
это тем, что ион серебра образует хелат за счет как двойной связи,
так и ацетокси группы (4), Удивительно, что комплекс (4) даже
более устойчив, чем комплекс самого норборнена. Оказалось, что это
явление носит общий характер. Так, щю-циклооктен-4-ол-1 по ко-
ординационной способности более активен, чем ^«с-циклооктен.
В ациклических терминально-ненасыщенных спиртах наивысшая
способность к комплексообразованию наблюдается в том случае,
когда двойная связь находится в А4-положении к гидроксильной
группе, однако при А3- и Д6-положениях способность к комплексо-
образованию также повышается 117еГ
Дегидробромирование [III, 270, после формул (1)^(2)[. Какие
[19] описал удобную методику получения фенилбензгидрилкетона
(5). К раствору трифен и л этилена в хлороформе при перемешивании
н охлаждении смесью сухой лед — изопропиловый спирт добавляют
(СвН5),С = СНСвНа (СсН5),С-СНСвН5
В СНС1з Вг Вг
(1)
(СВН5)2С-СНСЦН5
I I
Вг ОН
(3)
— (С6Н5)2СНСС6Н5
li
о
(5)
сразу весь раствор С. н. в смеси метанол — вода (12%-ный).
Взаимодействие с триалкилборанами. При обработке С. н. в
присутствии едкого натра или едкого кали три ал кил бораны подвер-
гаются конденсации [201. Например, гексен-1 гидроборируют при
обработке бор гидридом натрия и трифторидом бора в диглиме.
К раствору добавляют водное едкое кали, а затем водный С. н.
Главным продуктом реакции является «-додекан (66%), кроме того,
получаются 5-метилундекан (5%) и смесь гексена-1 и «-гексана.
В случае внутренних олефинов выходы продуктов конденсации
несколько снижаются. Возможно также проведение конденсации
смешанных триалкилбора нов [21].
з „ н
СН,(СН2)3СН = СН2 —[СН:,(СН2)3СН2СН.,]3В
AgNO3
------> СН3(СН.2)3СН2СН2-СН2СН2(СН2)3СН3
392
17a. Subbarao R., Rao G. V., A c h а у а К.. T., Tetrahedron Letters,
379 (1966).
176. Cope A. C., Pike R. A.,Spencer C. F., J. Am. Chem. Soc., 75, 3212
(1953); Cope A. C., Bach R. D., procedure submitted to Org. Syn. (1967).
17b. Vroman H. E., Cohen C. F., J. Lipid Res., 8, 150 (1967); Swob o-
d a J. A., T h о m p s о n M. J., ibid., 8, 152 (1967); Kammereck R.,
Lee W.-H., P a I i о к a s A., Sch roepper G. J., Jr., ibid., 8, 282
(1967).
I7r. Wittig G., D о r s c h H.-L., Ann., 711, 46 (1968).
17д. Franzus B., Baird W.C., Jr., Snyder E. I., S urridge J. H.,
J. Org. Chem., 32, 2845 (1967).
17e, Gray D., Wies R. A., Closson W. D., Tetrahedron Letters, 5639
(1968).
18. См. HI, стр. 271: Cromwell N. H-, Ay er R. P., Foster P.W.,J.
Am. Chem. Soc., 82, 130 (1960).
19. К a к i s F. J., procedure submitted to Org. Syn. (1968).
20. В г о w n H. C., Hebert N. C., Sn у der С. H., J. Am. Chem. Soc.,
83, 1001 (1961).
21. В г о w n H. C., VerbruggeC., Snyder С. H., J. Am. Chem. Soc,,
83, 1001 (1961).
СЕРЕБРА ОКИСЬ (HI, 272—276, после выдержки из [12]).
Удобный способ получения диазомалонового эфира состоит в кон-
денсации диэтилового эфира мезоксалевой кислоты (1) с гидразином
и окислении гидразона под действием С. о. в ТГФ [12а]. Выход (3)
составляет 67%.
С2Н5ОгСх
)С=О
С2Н5О2С/
H.NNH;, водн. АсОН
7 5%
(П
С,Н5О3СЧ
)с= nnh2
С2Н5О2С
с2н5о3сХс=й= -
89 % С3НБО.2с/
(2)
(3)
I2a. Ciganek Е., J. Org. Chem., 30, 4366 (1965).
СЕРЕБРА (И) ОКИСЬ, AgO. Мол. вес 113,88.
Получение [1]. Быстрый и удобный метод получения С, о. состоит
в окислении нитрата серебра(1) (51 г) пероксидисульфатом калия
в щелочной среде.
4AgN'O3 + K2S2O8 + 8NaOH
4AgO Д- K2SO4 + 3Na2SO4<2NaNO3 2KNO3 + 4H2.O
Реакцию проводят при перемешивании и нагревании до 85—90°.
Черный осадок С. о. отделяют на воронке Бюхнера и для удаления
сульфат-ионов промывают слегка щелочной водой. Выход 35 г (94%).
Свойства [1]. Реагент, по-видимому, является настоящей окисью,
а ие перекисью. При подкислении он не дает свободной перекиси
водорода, но в некоторой степени его поведение характерно для
соединений, содержащих ион металла в сильно окисленном валент-
ном состоянии, которое может стабилизироваться координацией,
В разбавленных кислотах С. о. растворяется с выделением кисло-
393
рода. Раствор С. о. в конц. азотной кислоте — коричневый, а в конц.
серной кислоте — оливково-зеленый.
Окислитель в органической химии. Снпер [2| обнаружил, что
под действием С. о. в водных растворах кислот (Н\’ОЯ, Н-3РО4,
АсОН) бензиловые спирты окисляются до бензальдегидов, а алли-
ловые спирты — до соответствующих замещенных акролеинов.
При окислении метильной группы или ароматического кольца
также образуются альдегидные группы, однако в присутствии
нескольких заместителей окислению подвергается только один
из них.
Кларк и сотр. [31 нашли, что окисление осуществляется также
в нейтральной или даже слабощелочной среде. В этом случае реак-
ция включает двухэлектронный перенос с образованием металличе-
ского серебра, которое можно легко выделить из реакционной смеси.
Примеры.
Бензальдсгид~>-Бензойная кислота (57%).
Бензгидрол-»- Бензофенон (70%).
Анисовый спирт-^Анисовый альдегид (44%).
Т рифени лфосфит->Т р ифен и лфосфат (30 %).
Бензиламин-»- Щ^альдегид (23%).
(Бензонитрил (7/ %).
D.L-Валин^Изомасляная кислота (100%).
Кори и сотр, 14! исследовали окисление акролеинов до эфиров
карбоновых кислот под действием активной двуокиси марганца (см.
Марганца двуокись активная) в условиях катализа цианид-ионом.
При замене двуокиси марганца на С. о. авторы с удивлением обна-
ружили, что продуктами окисления являются свободные кислоты.
Однако преимущество С. о. состоит в том, что несопряженные аль-
дегиды окисляются в смеси ТГФ — вода (9 : 1) в отсутствие цианид-
иона. Например, додеканол и формилциклогексен-2 под действием
избытка С. о. окисляются до соответствующих кислот с выходами
90 и 97%.
I. Н a in in е г R. N., К 1 с i п b е г g JInorg. Syn., 4, 12 (1953).
2. S у per L., Tetrahedron Letters, 4193 (1967).
3. Clarke T. G., Hampson N. A., L cc J. В., M о r I c v J. R., S c a n-
Inn B., Tetrahedron Letters, 5685 (1968).
4. Corcv E. J., G i 1 m a n N. W., Ganem В. E., J. Am. Chem. Soc., 90,
5616 (1968).
СЕРЕБРА ПЕРХЛОРАТ, AgC104. Мол. вес 207,34.
С. п. получают реакцией Ag.:COs с 10%-ной хлорной кислотой,
обработка включает фильтрование, удаление воды в вакууме и
азеотропную сушку с бензолом.
Метилирование. Труднодоступный ранее 1-метилтимин (3) можно
394
легко получить следующим двухстадийным синтезом Ill:
СНД-AgClO,
I
сн3
О)
Тимин (1) нагревают с гексаметилдисил азаном, образующееся при
этом 2,4-бнс-О-триметилснлильное производное (2) обрабатывают
иодистым метилом и С. п. и получают (3).
Перегруппировки. Под действием С. п. в кипящем ацетоне Бенн
[2] осуществил перегруппировку ацетата этинил карбинол а (4) в изо-
мерные аллены (5) и (6), конфигурация которых была установлена
на основании дисперсии оптического вращения и данных ЯМР-
спектров.
(5)
42%
Квазиреакция Фаворского. При взаимодействии 4(е)-бромада-
мантанона (1) с перхлоратом серебра в смеси вода — ацетон (1 ; 2)
образуется лишь незначительное количество ожидаемого 4-окси-
адамантанона (3), главным же продуктом является бицикло-[3,3,1]-
395
нонен-2-карбоновая кислота-7 (2). Предполагается, что эта реакция
родственна известным квазиреакциям Фаворского некоторыха-бром-
кетонов; по-видимому, реакции способствует наличие жесткого
копл а парного фрагмента в (1).
1. W i t t е n b и г g Е., Chem. Вег., 99, 2380 (1966).
2. Benn W. R.,J. Org. Chem., 33, 3113 (1968).
3. Udding A. C., WynbergH., Strating J., Tetrahedron Letters, 5719
(1968).
СЕРЕБРА ФТОРИД, AgF. Мол. вес 226,88.
5,6-Непредельные гексопиранозиды, например (2), получают
обычно обработкой 6-дезокси-6-иод(или бромфпроизводных (1) С. ф.
в пиридине [1].
ОАс
(1) 1,2 2
(2) 0,3 2
Этот метод был распространен на синтез 5-дезокси-4,5-непредель-
ных фуранозидов 121 (3)-> (4) и 4',5'-непредельного нуклеозида
(6) 131.
н о—С(СН3)2
При взаимодействии олефинов с бромом или иодом в присутствии
тонкоизмельченного С. ф. наблюдается присоединение BrF или IF
соответственно. В случае циклогексена осуществляется исключи-
тельно m/xwc-присоединение [41,
396
С непредельными углеводами (гликали пираноз) наблюдается и
цис- и транс-присоединение, однако последнее преобладает [5]:
I. Helfer ich В., Him men Е-, Вег., 61, 1825 (1929); 62, 2136 (1929);
Review: Ferrier R. J., Adv. Carbohydrate Chem., 20, 122 (1965).
2. Hough L., Otter B., Chem. Comm., 1966, 173.
3. Ver hey den J. P. H., MoffattJ.G.,J. Am. Chem. Soc., 88, 5684 (1966).
4. HallL. D., J onesD. L., Manville J.F., Chem. Ind., 1967, 1787.
5. Hall L. D., Manvill e J. F., Chem. Comm., 1968, 35.
СЕРЕБРА ХЛОРАТ (III, 277, перед ссылками).
C.x. в сочетании с каталитическим количеством четыр-ехокиси
осмия в воде был использован для цас-гидроксилирования непре-
дельного тетрола (1) с образованием труднодоступного аллоино-
зита (2) 13].
(1) (2)
Мак-Кдсланд и сотр. [41 пытались с помощью этого реагента
превратить 3-ц.иклогексениловый эфир бензойной кислоты (3)
в соответствующий 1,2-цмс-диол; однако после бензоилирования
сырой реакционной смеси был выделен единственный продукт —
кетодибензоат (4). Механизм этого неожиданного окисления гидро-
ОСОС6Н5
/---\ AgClO3-OsO4; СаН6СОС! /--\|
1\—10% ——/
С6Н5СОО (3) /0 СвН.аСОО (4) 4.Q
ксильной группы не ясен. Циклогексен-З-ол (5) взаимодействует
с реагентом обычным образом, давая после бензоилирования ожидае-
397
мый трибензоат (6),
AgClO3-0sO4; С6Н5СОС1
15%
ОСОс6Н5
.. OCOC6HS
сьн5соо\--V 5
(6)
3. A n g у а 1 S. J., G i 1 h a m Р. Т., J. Chem. Soc., 1958, 375.
4. McCaslandG. Е., Naumann М. О., D urh am LJ., J, Org. Chem.,
31, 3079 (1966).
СЕРНИСТОЙ КИСЛОТЫ N,N-ДИ ЭТИ ЛАМИ ДА МЕТИЛОВЫЙ
ЭФИР (111,278).
Изменить первое предложение-. реагент получают из днэтиламина
и метилового эфира хлорсернистой кислоты.
СЕРНИСТЫЙ АНГИДРИД (III, 278—279, перед ссылками).
Реакция Дильса — Альдера. При взаимодействии С. а. с цис-
гексатриеном в эфире при комнатной температуре наблюдается
1,6-присоединение с образованием 2,7-дигидротиепин-1,1-диокси-
25°
(1)
(2) Т.ПЛ. 108°
(4)
да (2) 12]. Реакция подобна 1,4-присоединению С. а, к бутадиену
(см. Сульфолен в этом томе). Бромированием и последующим де-
гидрогалогенированием соединение (2) было превращено в неизвест-
ный ранее ч пепин-1, I-диоксид (4).
Дезоксигенирование N-окисей пиридинов [3]. В кипящий рас-
твор N-окиси пиридина в диоксане или воде в течение 3 час пропу-
скают слабый ток С. а. Соответствующий пиридин получают с выхо-
сн3сн3. z сн3сн2 ' ..
so2
Кипячение { Дно1’са'н4%зо.
г pj^rl О К.С d Л , 0'3 /О
дом от 21 до 78% . Неароматические N-окиси этим способом не вос-
станавливаются.
2. Mock \V. L., J. Am. Chem. Soc., 89, 1281 (1967).
3. D a n i h е г F. А., Н а с к 1 е у В. Е., Jr., J. Org. Chem., 31, 4267 (1966).
СЕРНЫЙ АНГИДРИД — ДИОКСАН (III, 281).
Сульфирование антрацена 16а]. Антрацен сульфируется под
действием комплекса в диоксане почти полностью до 9-сульфокис-
398
лоты. Равновесные концентрации в значительной степени зависят
от температуры: при повышении температуры увеличивается коли-
чество антрацена. Однако, поддерживая температуру реакции
около 40°, можно за 20 час получить антрацен-9-сульфонат натрия
с 70%-ным выходом.
6а. Zorn И., Н I n t е г h о f е г О., S с 11 i n d 1 b a u е г Н., Monatsli., 98,
2406 (1967).
СЕРНЫЙ АНГИДРИД — ПИРИДИН (III, 282—283).
Получение [после (6)1. Методику (б) можно выполнить с
6,17 а пиридина и 4,51 г хлорсульфоновой кислоты в 15 мл четырех-
хлористого углерода [la, 161.
Сульфаты (перед ссылками). Гьюзли и Руофф [91 предложили
использовать комплекс серный ангидрид — пиридин в ДМФА для по-
лучения глюкозо-6-сульфата. Эта методика обеспечивает минималь-
(1) 0,12 МОЛЯ
В HCON(CH3)i + PySO3 В HCON(CH3)a
3 00 мл OjlZjyjoJifl 125
Перемешивание 2tbwc
Обработка .превращение в сырую сйль
40% + 14%
ное образование полисульфатов. Хотя для синтезированной таким
образом соли получен точный анализ на содержание бария, бумаж-
ная хроматография показывает наличие глюкозы, глюкозо-6-суль-
фата и глюкозодисульфата.
Окислительный агент. Парик и Деринг [10] описали новый окис-
лительный агент, содержащий серный ангидрид в виде комплекса
с пиридином и ДМСО в присутствии триэтиламина. Первичные и
вторичные спирты легко окисляются под действием этого реагента
при комнатной температуре до альдегидов и кетонов соответственно.
Аллиловые спирты окисляются до соответствующих а,p-непредель-
ных карбонильных соединений.
ДМСО, Et3N
---------_>
45%
(1) (2)
399
Реагент был успешно использован для окисления комплекса
иорборнадиенола-7 с трикарбонилом железа (1) в кетон (2), простей-
шее устойчивое производное неизвестного в свободном виде норбор-
цадиенона-7 [161. При окислении под действием СгО3 образуется
бензальдегид.
Та. Fieser L. F., J. Am. Chem. Soc., 70 , 3232 (1948); «Современные методы
эксперимента в органической химии», ГНТИХЛ, М., I960, стр. 395—396.
16. LandesbergJ. М., Sieczkowski J., J. Am. Chem. Soc., 90, 1655
(1968).
9. Guiseley К. В., Ruoff P. M., J. Org. Chem., 26. 1248 (1961).
10. P a r 1 k h J. R., von Doering W. E., J. Am. Chem. Soc., 89, 5505
(1967).
СИММОНСА — СМИТА РЕАГЕНТ (III, 286—290, перед ссыл-
ками).
' Модифицированный реагент, получаемый кипячении большого
избытка цинк-медной пары с иодистым метиленом в эфире в течение
4—6 час, при взаимодействии с 17 (З-ацетокси-11 [3-окси-Дмш-ЭСТре.
ноном-3 (1) дает соединение (2) и спироциклопропан (3) [17]. Это
единственный случай, когда под действием реагента наблюдается
ОАс
ICH2ZnI
Нет избытка z,n
реакция Виттига. Соответствующий 11-дезоксианалог в эту реакцию
не вступает. В противоположность этим результатам с модифициро-
ванным реагентом взаимодействие (1) с реагентом, полученным
in situ при молярном соотношении цинка и йодистого метилена при-
мерно 1:1, приводит к соединению (4) — продукту ангулярного
метилирования при С10.
При взаимодействии реагента с а,р-непредельными кетонами
часто не удается получить удовлетворительных результатов [181.
Монти [19] разработал модифицированную методику, которая, по-
видимому, имеет общий характер. Енин (5) при обработке красной
окисью ртути, трихлоруксусной кислотой, BF3 и этиленгликолем
400
образует диоксолан (6), который взаимодействует с реагентом Обыч-
ка Hg2+
R1CH=C—С=СН - СС1зс°гН, BF,
НОСН2СНгОН
(5)
R2
> ^СН;-----С —С-сн3
''''о
R2
А> RlCH=C-C-CH3
ох хо
L_____I
(6)
R2
R1 СН--С-ССН,
\ / Л
СН, о
Н3О
(7)
(8)
иым образом и после кислого гидролиза дает кетон (8).
Видал, Дюмон и Арнауд [20] обнаружили, что под действием
реагента Симмонса — Смита ацетиленовые спирты типа (9) образуют
а, p-ненасыщенный кетон (10) и кетоциклопропан (И). При исполь-
зовании вместо эфира смеси эфир — 1,1-диметоксиэтан (1 : 1) наб-
людается ускорение реакции и несколько повышается выход (10;.
СН3С = С—СНСН3
ICHjZnl,
эфир
Н3с/
С-СНССН3 +
II
(10) о
(9)
10%
сн2. ,сн3
+ । X
СН/ 'СН,С —СН,
II
о
(11) 3 0%
Сообщалось [21], что при кипячении в эфире по методике Шенка
и Шехтера [3] (III, 286) Д5(10)-эстрен-За, 17р-двол (12) не взаимодей-
ствует с реагентом Симмонса — Смита; однано циклопропановое
производное (13) можно получить с 85%-ным выходом, если отогнать
эфир до половины первоначального объема и затем нагреть реакцион-
ную смесь на водяной бане при 92° в течение 3 час.
401
17. T u r n b u 1 1 P., S у h о г а К., F r i e d J. H., J. Aru. Chem. Soc., 88, 4764
(1966).
18. A г in u n d Y., Pcrraud R., Pierre J.-L., А г и а ц d P., Bull. sue.
chim. France, 1965, 1893; Conia J.-M., Limasset J.-C., Tetrahedron Let-
ters, 3151 (19(55).
19. о n t i H., Conipt. rend., 265 (C), 522 (1967).
20. Vidal AL, D u m ontC., Arnaud P., Tetrahedron Letters, 5081, (1966).
21. Guin sig R., Cross A. D., J. Am. Chem. Soc.. 87, 4629 (1965); see also
Rees R., S I r i к e D. P., S m i t h H., J. Med. Chem., 10, 783 (1967).
СУЛ ЬФОЛ EH-3 (2,5-дп гидротиофен диоксид-1,1, «бутадиенсуль-
фон»), [T^so2 Мол. вес 118,15, т. пл. 64,5—65°.
Получение [I]. Бутадиен и двуокись серы в соотношении 1 : 2
в присутствии 1% гидрохинона для предупреждения полимеризации
негревают в стальной бомбе в течение 12 час при 100° или выдержи-
вают в течение 2—3 недель при комнатной температуре в колбе для
проведения реакций под давлением (выход 80—85%) [1]. Продукт
очищают кристаллизацией из воды [11 или из метанола [2], осветляя
раствор норитом.
Источник бутадиена. При нагревании до ПО—130J реагент раз-
лагается с выделением SO, и образованием чистого бутадиена. Бэкер
и Блаас [31 впервые указали на преимущества использования С.
вместо бутадиена-1,3 в реакциях Дильса — Альдера: этот реагент
кристаллический, невоспламеняющийся, нетоксичный, негигроско-
пичпый, не имеет запаха и достаточно устойчив. Сэмпл и Хэтч [21
описали метод получения диэтилового эфира /лрс?кс-Д4-тетрагидро-
фталевой кислоты: в автоклав загружают 0,51 моля С., 0,50 моля
диэтилового эфира фумаровой кислоты, абсолютный этанол п неболь-
0, 51 мОЛЯ 0} 50 МОЛЯ 9 0 мл
СгН5ОН +
шое количество гидрохинона; смесь нагревают при 100—105° в те-
чение 8—10 час. Те же авторы [4] разработали для студенческого
лабораторного практикума методику проведения реакции С. (25 г)
с малеиновым ангидридом (15 а) в ксилоле (нагревание на открытом
пламени), которая приводит к образованию ангидрида эндо-цис-
402
4-циклогексен-1,2-дикарбоновой
кислоты с выходом 82—90%.
Дегидробензол не реагирует с бутадиеном как диенофил, по-
видимому, потому, что диен существует в трансоидном состоянии.
Однако с бутадиеном, полученным из С., дегидробензол дает
с 9%-ным выходом 1,4-дигидронафта л ин. Реакцию проводят разло-
жением бензолдиазонийкарбоксилата-2 и С. при 100° в пентаноне-2
151. Эта реакция возможна, по-видимому, потому, что генерируется
бутадиен цисоидной конформации.
1. Grummit О., Ardis А. Е., F i с k J., J. Am. Chem. Soc., 72, 5167 (1950).
2. SampleT. Е., Jr., Н a t с h L. F., procedure submitted to Org. Svn. (1967).
3. Backer H. J., В 1 a a s T. A. H., Rec. trav., 61, 785 (1942).'
4. Sample T. E., Jr., H a t c h L. F., J. Chem. Ed., 45, 55 (1968).
5. H ate h L. F,, Peter D., Chem. Comm., 1968, 1499.
«СУЛЬФО-МИКС» (раствор м- нитробензоле ул ьфо кислоты в
серной кислоте).
Получение 11,2]. К 880 г 20%-ного олеума в колбе на 2 л добав-
ляют по каплям при перемешивании 197 г нитробензола. Темпера-
тура смеси медленно повышается до 60—70°, и эту температуру под-
держивают в течение 6—8 час до тех пор, пока образец смеси не ста-
новится полностью растворимым в воде.
Катализатор конденсации. Реагент катализирует конденсацию
4-аминопир иди на (1) с метилвпнилкетоном, приводящую к 4-метпл-
1,6-нафтиридину (2), и с кротоновым альдегидом, приводящую
403
к 2-метил-1.6-нафтиридину (3); в обоих случаях выходы низкие.
сн3
о I
п м/Х/Х
СН3ССН~CHu +Сульфо-микс + Н2О( I 20°, 5 час) 1Ni II I
(2)
| СН8СН = СНСНО + Сульфо-МИКс+Н.О (120°, 5 час)
N
О)
Конденсация 4-аминопиридина (1) с глицерином в присутствии
реагента дает 1,6-нафтиридин (4) с выходом до 45% [2,3]:
он он он /\/
К и СНгСНСНг+ Сульфо-микс (130°, 4 час) ^1 I |
40-4 5%
S
(4) N
Подобным образом из 2-аминопиридина (5) был получен 1,7-нафти-
ридин (6) [2], а из 3-аминопиридина (7)— 1,5-нафтиридин (8) [2].
Те же условия
v\NH. х/х/
N Мз N
(5)
\/NHa КХ/Х>
(/ Те же условия f (f X
N N
(7) (8)
]. U t e r m о h 1 e n W. P., Jr., J. Org. Chem., 8, 544 (1943).
2. Paudler W. W., KressT. J., procedure submitted to Org. Syn. (1967).
3. К r e s s T. J., P a u d I e r W. W., Chem. Comm., 1967, 3.
СУЛЬФОУКСУСНАЯ КИСЛОТА (Ill, 291-292). Исправить
формул;/: H О2СС Н 2SOаО Н.
СУЛЬФУРИЛ ХЛОРИСТЫЙ (III, 292-296).
Хлорирование ароматических соединений. Де ла Мар и Сузуки
115а), исследовавшие хлорирование нафталина, 1-метил нафта л ина
404
и 2-метилнафталина под действием С. х., считают, что главные про-
дукты образуются в результате реакции электрофильного замеще-
ния. Подобные результаты получены при взаимодействии с молеку-
лярным хлором.
Хлорирование метилсульфидов и метиловых эфиров (III, 295).
Методика Дэвиса и Лонгхида [22] опубликована в Org. Syn., 47,
23 (1967). Однако по сообщению д-ра Лонгхида там имеется ошибка,
на которую впервые обратил внимание д-р Гросс: продукт является
не«а-хлоранизолом», а п-хлоранизолом. См. также: S h a m m а М.,
Novak L., Kelley М. G., J. Org. Chem., 33, 3335 (1968).
Хлорирование окиси циклогексена (III, 295, после раздела Суль-
фанилиды). При кипячении С. х. с окисью циклогексена в присут-
ствии 1 же пиридина в хлороформе с 70%-ным выходом образуется
СНС13,КИПЯЧ.
-----------
70%
продукт, содержащий до 99% мнс-1,2-дихлорциклогексана [23а].
Смесь хлористый тионил — пиридин менее эффективна: общий
выход дихлоридов понижается до 50%, а содержание ^нс-изомера
составляет 93,5%.
15а. de la М а г е Р, В. D., Suzuki Н., J. Chem. Soc., (С), 1967, 1586.
23а. Campbell J. K.,JonesJ. K.N., Wolfe S., Can. J. Chem., 44, 2339
(1966).
т
ТАЛЛИЯ(1) БРОМИД, Т1Вг. Мол. вес 284,31.
Конденсация арильных и алкильных реактивов Гриньяра Ill.
При кипячении с Т. б. в смеси ТГФ — бензол в течение нескольких
часов арил- и в/иор-алкплмагнийбромиды подвергаются конденса-
ции. Оптимальное соотношение реагентов: 1,5—2,0 моля Т. б. на
1 моль реактива Гриньяра. Например, смесь 0,0675 моля и-тол ил-
магнийбромида и 0,135 моля Т. б. нагревают с обратным холодиль-
ником при перемешивании в атмосфере азота в течение 4 час. После
подкисления разб. соляной кислотой и обычной обработки 4,4'-ди-
метилбифенил был получен с выходом 91%. Однако ор/??о-замещен-
Н3С - / S - MgBr н.с - S-CH8
\=/ 9Ю,;, \=/
ные реактивы Гриньяра не образуют продуктов конденсации;
например, мезитплмагнийбромид образует димезитилталлий(1 II)-
бро.мид АгйТ1Вг. В подходящих случаях новая методика заменяет и
даже превосходит классический синтез биарилов по Ульману.
втор-Алкильные реактивы Гриньяра образуют продукты конден-
сации с выходами около 50%. При взаимодействии с первичноал-
кильными алифатическими реактивами Гриньяра образуются лишь
следы конденсированных алканов, а главными продуктами яв-
ляются диалкилталлий(Ш)бромиды.
1. М с К i 1 1 о р А., Е 1 s о m L, F., Taylor Е. С., J. Am. Chem. Soc., 90,
2423 (1968).
ТАЛЛИЯ ТРИАЦЕТАТ (III, 297—298).
Получение. Кочи и Бети Па] разработали метод получения боль-
ших количеств (467 г, 61%) реагента 97%-ной частоты, исходя из
окиси таллия(Ш). Коричневую окись растворяют в смеси уксусная
кислота (2 л) — уксусный ангидрид (ПО нм), перемешивая смесь
при 80—90°, раствор фильтруют через пористый стеклянный
фильтр и охлаждают. Отделяющийся продукт перекристаллизовы-
вают, как было описано ранее.
Окисление енаминов [6] (перед ссылками). Под действием Т.т.
в ледяной уксусной кислоте или хлороформе при комнатной темпе-
ратуре енамины окисляются с образованием (после гидролиза)
а-ацетоксипроизводных исходных кетонов. Например, N-1-цикло-
гексен и л морфолин превращается в 2-ацетоксициклогексанон с вы-
406
ходом около 70%. Реакцию можно проводить со смесью циклогекса-
нона и морфолина, из которых енамин образуется in situ. Пирроли-
диновые енамины дают несколько меньшие выходы. Выходы ацето-
ксипроизводных, как правило, выше, чем при прямом окислении
кетонов Т. т. или тетр а ацетатом свинца. Кроме того, реакция
стереоспецифична; так, при окислении енамина, полученного из
морфолина и 4-трет-бутилциклогексанона, образуется только
шрпнс-2-ацетокси-4-трет-бутилциклогексанон.
Окислительная перегруппировка халконов. При обработке Т. т.
в кипящем метаноле 4-метоксихалкон (1) превращается в 1,2-диарил-
3,3-дпметоксипропанон-1(2). Реакция представляет интерес,
Т1(ососн3)3
сн3он
W (2)
поскольку было показано, что биосинтез изофлавоноидов из халко-
новых предшественников включает 1,2-миграцию арильных
групп [71.
]<1. К о с h i J, К., Bethea Т. W., Ill, J. Org. Chem., 33, 75 (1968).
(5. Kuehne M. E., Gi acobbe T. J., J. Org. Chern., 33, 3359 (1968).
7. Ollis W. D., Ormand K. L.,Sut li erla n d I. 0., Chem. Comm., 1968,
1237.
ТЕТРАГЕПТИЛАММОНИЯ ХЛОРИД, [CH3(CH2)614N (’СП. Мол.
вес 446,25.
Применение [1]. Экстракцией раствором этой липофильной
четвертичной аммониевой соли в хлороформе или эти л ацетате
в результате анионного обмена удается количественно выделить
из водных растворов полярные анионные липиды (например, соп-
ряженные стероидные).
1. Hofmann A. F., J. Lipfd Res,, 8, 65 (1967).
ТЕТРАГИДРОФТАЛАЗИН, (5). Мол. вес 134,18, т. пл. 196,5—
197,5°.
407
Получение. Детально описана [11 методика фотохимического
хлорирования о-ксилола; конденсацией образующегося я, а'-днхлор-
о-ксилола (2) с фтальгидразидом (3) получают 1,2, 3, 4-тетрагидро-
фталазиг-ю-[2,3:Ь]-фтальгидразид (4).
(4) (5) Т. пл. 197°
S/\ZH‘HCI
(6) Т. пл. 233 — 236°
Селективное осаждение формальдегида. В разбавленном водном
растворе, слегка подкисленном уксусной кислотой, Т. осаждает
формальдегид в виде малорастворимого гексагидротетр азина (7).
Осаждение происходит количественно, и таким путем можно легко
определить содержание формальдегида при концентрациях от
8,6-10-6 г'мл. Другие альдегиды не мешают этой пробе. Таким спо-
собом можно определить и метанол, предварительно окисляя его до
формальдегида либо над раскаленной медной проволокой, либо
обработкой персульфатом калия.
I. Ohme R., S с h m i t z Е., Z. anal. Chem., 220, Vol. 2, 105 (1966).
ТЕТРАГИДРОФУРАН (III, 299—301).
Эффекты растворителя (III, 299—300). Ацетиленид натрия удобно
получать реакцией натрия с ацетиленом в ТГФ [11а]. Классический
способ с использованием жидкого аммиака более трудоемкий.
Па. Normant J.-F., Bull. soc. chim. France, 1965, 859.
408
ТЕТРАМЕТИЛ ГУАНИДИНИЯ АЗИД, (2). Мол. вес 158,21,
т. пл. 90—93°.
Получение [11. Высушенный эфирный раствор азотистоводород-
ной кислоты (полученный при добавлении в течение 30 мин 80 мл
конц. соляной кислоты к холодному раствору 1 моля азида натрия
в 200 мл воды с последующей экстракцией эфиром) добавляют к раст-
вору 1 моля тетраметил гуанидина (I) в 750 мл эфира при 0°. Продукт
(2) промывают двумя порциями эфира и кристаллизуют из смеси
хлороформ — эфир.
NH
II
(ch3)2n-c-n(ch3)2
HN3 (0°)^
86%
NH2
cL
*^N(CH3)2
N3
(1) (2)
Получение алкилазидов [1]. T. а. является наилучшим реагентом
для получения алкилазидов из соответствующих ал кил галоген идо в
прежде всего благодаря простоте получения, устойчивости и раство-
римости в низкокипящих органических растворителях, например
СНС13. Выходы продуктов составляют от 60 до 96% . Более реакцион-
носпособные ал кил галоген иды, в частности бромистые алкилы,
реагируют экзотермически, поэтому в начале реакции требуется
охлаждение. Растворимость соединения (2) в хлороформе упрощает
выделение продукта. При добавлении эфира осаждается хлоргидрат
тетраметил гуанидина, а в смеси хлороформ — эфир остается алкил-
азид.
5-Замещенные тетразолы [1]. При нагревании Т. а. с аромати-
ческими нитрилами при 100—125° с хорошим выходом образуются
5-арилтетразолы.
H5C8CsN-P(2) 3 ‘iaC1 Н5Са — С\ I!
й 17 75% а 'N —N
Н
!. Papa A. J., J. Org. Chem., 31, 1426 (1966).
ТЕТРАМЕТИЛЕНСУЛЬФОН (сульфолан) (III, 305—306, перед
ссылками).
Ломм и Оуриссон [111, изучавшие окисление камфанолов тетра-
ацетатом свинца в бензоле, обнаружили, что при удалении бензола
перегонкой возникает серьезная опасность потери очень летучих
продуктов. Вместе с тем известно промышленное применение суль-
фолана для экстракции ароматических соединений из смесей угле-
водородов. Исходя из этого, авторы добавляли к отгону пентан,
затем раствор несколько раз экстрагировали несмешивающимся
с ним сульфоланом. Оставшийся пентановый раствор промывали
409
водой для удаления сульфолана и после этого выделяли летучие
циклические эфиры, образовавшиеся при окислении. Таким спо-
собом удается вернуть более 70% камфена.
Ускорение реакций, катализируемых кислотами. Уайтинг и сотр.
Г12—151 использовали этот растворитель в реакциях алифатических
и ароматических углеводородов в кислой среде. Например, в системе
бензол — сульфолан под действием борфтористоводородной кислоты
(HBF4, эквимолярная смесь BF3 и безводного HF) А3,!’-окталин п
/ирнж-А3-окталин быстро изомеризуются в смесь А9-окталина,
А3,9-окталнна и четырех других изомеров в соотношении 90 : 9 : 1.
При замене сульфолана уксусной кислотой заметно понижается
скорость реакции и выход [121. Раствор 85%-ной перекиси водорода,
HF и BF3 в сульфолане, по-видимому. содержит сопряженный ка-
тион НлОг4‘, являющийся мощным, хотя и неселективным окисли-
телем, иод действием которого осуществляется глубокое расщепле-
ние бензола и циклогексана при комнатной температуре [131. При
обработке фен ил гидрокси л амин а борфторнстоводородной кислотой
в сульфолане образуется катион CGF15NH, активный агент для аро-
матического феииламинирования []4|. При этом образуются смеси
изомеров с общим выходом от 20 до 55%. При обработке фосфор-
фтористоводородной кислотой (HPFg, полученной из PF.-J-HF) в
сульфолане под действием арилпзоцианатов осуществляется ари-
ламинокарбонилировапие [15! +
АгНД-Аг'ЫСО АгСОЫНАЫ
Катализатор конденсации. В поисках удобного .метода синтеза
3,4-бензфеиантрена группой исследователей в Оксфорде [16] осу-
ществлена циклодегидратация 2-(р-фенилэтил)-1,2,3,4 -тетрагидро-
нафтола-1 (1) в гексагидробензфенантрен (2) (выход 74%) при обра-
(з)
ботке полифосфорной кислотой (ПФ1\) в сульфолане при 125^
в течение 1 час. В тех же условиях под действием ПФ.К без раство-
рителя образуется только трициклический углеводород (3), выде-
ленный в ничтожном количестве. Эти результаты свидетельствуют
410
о том, что сульфолан является эффективным катализатором кон-
денсации.
11. L 11 о m in е J., О ti г i s s о п G., Tetrahedron, 24, 3201 (1968).
12. Powell J. W., Whiting M. C., Proc. Chem. Soc., 1960, 412.
13. A Ider R. W., W h i t i n g M. C., J. Chem. Soc., 1964, 4707.
14. Paris h J. H., W h i t 1 n g M. C., .1. Chem. Soc., 1964, 4713.
15. Л 1 d e r R. W., C h a 1 k 1 e у G. R., W h i t i n g M. C., J. Chem. Soc., (C),
1966, 52.
16. В и г cl i t t N. A., W h i t i n g M. С., V en a n z i L. J. Chem. Soc., (C),
1967, 2273.
ТЕТРАМЕТИЛ ПИРОФОСФИТ (к разделу Тетраэтил пирофосфит,
III, 320—321).
Этот реагент использован [4] для циклизации пептидов путем
активирования аминогруппы. Реакцию проводят при температуре
140“ в условиях высокого разбавления.
4. Rothe AV, Rothe I., В г ii п i g H-, Schwenke K..-D., Angew. Chem.,
71, 700 (1959).
N,N,N',N -ТЕТРАМЕТИЛЭТИЛЕНДИАМИН (ТМЭДА),
(СН3).Л’СН.СН2.М(СН3)2. Мол. вес 116,21, т. кип. 120—122°.
Металлирование диалкилсульфидов |11. ТМЭДА образует с
н-бутиллитием очень реакционноспособный комплекс, под дейст-
вием которого диметилсульфид металлируется с образованием ме-
тилтиометил лития :
Н3С СН,
CH3SCH. + K-C4H9Li/ | —>
h/
нХ XCH3
HSC сн3
N7
^CH3SCHaL/ | 4-C4H10
X у
N
H8c XCH3
Этот карбанион является удобным промежуточным продуктом для
синтеза функционально замещенных органических сульфидов.
Диалкилсульфиды, имеющие |3-водородный атом, превращаются
главным образом в олефины.
1. Peterson D. S., J, Org. Chem., 32, 1717 (1967).
411
ТЕТРАМЕТОКСИЭТИЛЕН, (СН3О)2С=С(ОСН3)г. Мол. вес
148,16, т. кип. 140°, т. пл. 2—4°.
Обзор 111.
Получение [2]. Т. (2) получают пиролизом 5-фенил- 1,2,3,4-тет-
рахлор-7,7-диметоксинорборнадиена (1) при 130° в атмосфере азота
rip и давлении 4 мм. Работа с загрузкой более 25 г взрывоопасна1.
Свойства. Этот реагент, имеющий четыре электронодонорных
заместителя, является аналогом тетрацианэтилена, содержащего
четыре электроноакцепторные группы. Так, со слабыми л-кисло-
тами он образует комплексы с переносом заряда, например с нит-
рилом фумаровой кислоты и 1,3, 5-тр и нитробензолом. Представляет
интерес использование Т. для синтеза в качестве сильного восста-
новительного агента, растворимого в органических растворителях.
При этом Т. окисляется в дикатион (СН3О)2С—С(ОСН3)2, являющий-
ся мощным метилирующим агентом. Например, при восстановлении
хлоранила (3) с 88%-ным выходом образуется диметиловый эфир
тетрахлоргидрохинона (4), а при восстановлении перекиси бензоила
(5) получается метиловый эфир бензойной кислоты (6) с выходом
74% [3].
II II II
С.Н.С-О — О —С—СаН3 2С6Н,С—осн3
74%
(5) (6)
Т. легко вступает в реакцию 2+2-циклоприсоединения с элект-
рофильными агентами, давая четырехчленные карбоциклические
и гетероциклические соединения [4J. Например, реакция Т. с тетра-
циан эт и л е и ом при 0° приводит к а дд у кт у (7) с вых одо м 6 3 % .
(СН3О)гС=С(ОСН3)г + (CN)2C=C(CN)2
(2)
______> (CH3O)2j-----|(CN)Z
(СН3О)2|____I(cnj2
(7)
412
Присоединение к азодикарбоновому эфиру дает диазетидин (8)
с выходом 98%, а присоединение к фенилизоцианату — азетиди-
ион (9) с 76%-ным выходом.
(сн3о)21—n-cooc2h3
(СН3О)21-N-COOC2H5
(СН3О)г
(СН3О)2
:О
N-C6HS
(8) (9)
1, Hoffmann R. W., Angew. Chem., Internat. Ed., 7, 754 (1968).
2. Hoffmann R. W., Hauser H., Tetrahedron, 21, 891 (1965).
3. Hoffmann R. W., Schneider J., Chem. Ber., 100, 3689 (1967).
4; Hof fmann R. W., Hauser H., Angew. Chem., Internat. Ed. 3, 380
(1964).
ТЕТРА НИТРОМЕТАН (HI, 307—309, перед ссылками).
В предварительном сообщении [7] описывается необычная реак-
ция Т. с циклогексеном, 1-метилциклогексеном, 1-метилциклогеп-
теном и циклооктадиеном-1,5.
6. Change to read: Riordan J. F., S о k о I о v sky M., V a 1 1 e e B. L.,
J. Am. Chem. Soc., 88, 4104 (1966); Sokolovsky M., R iordan J. F.,
Va II ее B.L., Biochemistry, 5, 3582 (1966); R ior dan J. F., Sokolov-
sky M., Vallee B. L., Biochemistry, 6, 358 (1967).
7. Bradshaw R. W., Tetrahedron Letters, 5711 (1966).
(+)- и (—)-а-(2,4,5,7-ТЕТРАНИТРО-9-ФЛУОРЕНИЛИДЕН-
АМИНООКСИ)-ПРОПИОНОВАЯ КИСЛОТА (HI, 309, перед ссыл-
ками) .
Реагент успешно применяется для разделения на антиподы 15-
и 16-метилхолантренов [31:
сн2-сн сн-сн3
сн3 сн3
Ссылку [11 заменить: Block Р., Jr., Newman M.S Org
Syn., 48, 120 (1968).
3. Newman M. S., Wotring R. W., Jr., Pandit A., Chakrabar-
t i P. M., J. Org. Chem,, 31, 4293 (1966).
ТЕТРАФЁНЙЛЭТИЛЕН, (СйН5),С=С(С6Нэ)г. Мол. вес 332 45
т. пл. 222—224°.
413
Катализатор конденсации Вюрца. Мюллер и Рошайзен [1] от-
мечают, что низкие выходы в конденсации по Вгорцу двух молекул
бен зил галогенида могут быть связаны с тем, что реакция, по край-
ней мере частично, осуществляется в гетерогенной фазе на поверх-
ности металла. Авторы обнаружили, что Т. образует аддукт, содер-
жащий два атома натрия, который достаточно растворим в ТГФ
и глиме для того, чтобы осуществилась конденсация двух молей
хлористого бензила:
(СБН5)гС-С(С6Н5)3Щ2С6Н5СНгС1 —
Na Na
С6Н5СН2СН2СВН5(СбН5)3С — CfCgHg).,
С фтористым, бромистым и йодистым бензилом выходы составляют
соответственно 68, 76 и 74% . Неудобство этого метода состоит в том,
что соотношение молекулярных весов реагентов требует введения
в реакцию почти восьмикратного по весу количества Т. по сравнению
с хлористым бензилом. Однако если использовать эффективную
мешалку, то достаточно и каталитических количеств Т., т. е. 0,05
моля вместо 1 моля. При этом Т. выполняет роль переносчика ме-
талла.
2С0НоСН2Х 4 2Na C6Hp-L,CH,C6H5 + 2№Х
Бокелхайде и сотр. [2] показали, что по этой модифицированной
реакции Вюрца заметно облегчается синтез [2, 21-метациклофанов,
например 4,12-диметил-[2, 21-метациклофана (2). Для дибромида,
соответствующего (1), ио не имеющего двух метильных заместите-
лей, циклизация осуществляется с выходом 77%.
(1) 5,ог
ТГФ -------*
44%
100 Л7Л
1. М li 1 1 е г Е., R б s с h е 1 s е п G., Chein. Вег., 90, 543 (1957).
2 . Lindsay W. S,, S t о k es Р., Н u m ber L. G., Boekelheide V.,
J. Am. Chem. Soc., 83, 943 (1961).
414
ТЕТРАХЛОРЦИКЛОПЕНТАДИЕНОНА ЭТИЛЕНКЕТАЛЬ,
Мол. вес 261,93, т. пл. 64,5—65,5°, т. кип. 78—80с7
/0,13 мм.
Получение. Т. э. с хорошим выходом получают при взаимодейст-
вии гексахлорциклопентадиена с этиленгликолем и едким кали
[I, 21.
Диен Дильса — Альдера [1—31. Этот реакционноспособный диен
в реакции Дильса — Альдера обладает тем недостатком, что под-
вергается конкурентной димеризации. Однако желаемый аддукт
легко дехлорируется по методу Уинстейна (L^-mpem-бутанол)
[4], а защитная этилен кетальная группа весьма просто удаляется.
Так, Стедман и Миллер 13] сообщают о двух способах синтеза соеди-
нения клеточного типа — кетона гексацикло-15,4,1,02’и,0зли,
05,9,08,111-додеканона-4 (6). В лучшем из способов первая стадия —
415
это реакция Дильса — Альдера между Т. э. (1) и 1,2, 3, 4, 7, 7-гек-
сахлорнорборнадиеном (выход 18%), Последующие стадии вклю-
чают фотохимическую циклизацию соединения (3) в «клеточное»
соединение (4), дехлорирование по Уинстейну (5) и гидролиз ке-
тальной группы.
1. С h а п g W.- Н. J. Chem. Soc., 1965, 2305.
2. Leoal D. M., Gossel ink E. P., Ault A., Tetrahedron Letters, 579
(1964).
3. S t e d m a n R. J., M i 1 1 e г L. S., J. Org. Chem., 32, 35 (1967).
4. Вг uck P., Thompson D, W i n ste in S., Chem, Ind., 1960, 405,
ТЕТРАЦИАНЭТИЛЕН (III, 314—318). Обзор: DharD. N„
Chem. Revs., 67, 611 (1967).
ТЕТРАЭТИЛАММОНИЯ АЦЕТАТ (HI, 318—319, перед ссыл-
ками) .
Коуп и Нили [5] осуществили эпимеризацию цис- оксиэфир а (1)
путем превращения в тозилат (2) и реакцией 5м2-замещения под
действием Т. а. (с инверсией) с последующим щелочным гидролизом
эфира.
5. С о р е А. С., N е а 1 у D. L., J. Am. Chem. Soc., 87, 3122 (1965).
ТЕТРАЭТИЛАММОНИЯ ИОДАТ, (C2H5)4N + IO4-. Мол. вес
261,19, т. пл. 176—177°.
Получение [1]. Раствор иодной кислоты Н5Ю0 (0,034 моля)
и 26%-ной гидроокиси тетраэтил аммония (0,034 моля) в 20 мл воды
выпаривают при пониженном давлении, твердый остаток экстра-
гируют горячим /npem-бутанолом, продукт осаждают диизопропи-
ловым эфиром и кристаллизуют из mpem-бутанола; выход 8,5 г
(82%). Т. и. растворим в воде, уксусной кислоте, ацетоне, пириди-
не, ДМФА, хлороформе.
Окислитель [1]. Т. и. обладает такими же окислительными свой-
ствами, как и другие соли иодной кислоты, однако высокая раство-
римость в воде делает его очень удобным в некоторых случаях.
Т. и. может найти применение как соокислитель для гомогенных
реакций в водной фазе; он был использован для специфического
окисления гидроксиламинов типа (1).
И3сГЪ°1 Н3С4—V°~l
Н3C^NH Ю—' н3сN О—I
ОН О
(9 (2)
416
1. Qureshi A. К,, Sklarz В., J. Chem, Soc., (C), 1966, 412.
N, N -ТИ0КАРБ0НИЛДИИМИДА30Л (HI, 323, перед ссылками).
Фокс и сотр, [3] указывают, что затруднения, возникающие при
получении реагента по Штаабу и Уолтеру [1], удается преодолеть,
применяя несколько модифицированную методику Рейда и Бека
|4], по которой синтез проводят в атмосфере азота в абсолютно без-
водной среде. Выход продукта составляет 80—90%.
Другой возможный способ синтеза [51 состоит в обработке три-
метилсилилпмидазола [6] тиофосгеном в безводном бензоле при 0°.
Через 1 час бензол и триметилхлорсилан удаляют при пониженном
давлении; желтый порошкообразный остаток Т. можно использо-
вать без дополнительной очистки.
==\
|__\-Si(CH3)3 + С1-С-С1
+ 2 (CH3)3SiCl
3. Fox J. J., .Miller N. Wempen I., J, Med. Chem., 9, 101 (1966).
4. Reid W., Beck В. M., Ann., 646, 96 (1961).
5, Pullukat T. J„ Urry G., Tetrahedron Letters, 1953 (1967).
6. В irkof fer L., R i t t e r A., Angew. Chem., Internal. Ed., 4, 427 (1965).
ТИОМОЧЕВИНА (HI, 324—328).
Соединения включения. Как уже отмечалось (III, 325), Веркаде
и сотр. [9] сообщали об эффективном способе разделения цис- и
трпнс-4-изопропилциклогексан-1 -карбоновых кислот, основанном
на том, что /иранс-кислота в отличие от изомер а образует соеди-
нение включения с Т. Однако авторам ие удалось объяснить это
различие, которое-становится понятным при рассмотрении моделей
цис- и транс-изомеров, помещенных в целлулоидный цилиндр,
диаметр которого в,определенном масштабе соответствует свободному
траве, т. ял, 94-95°
40-41°
пространству в канале соединения включения Т. (см. II, 317—-319).
Цилиндр, способный вместить модель транс-кислоты, имеет диаметр
20,6 сщ (рис. Т-1), что немного меньше диаметра цилиндра, вме-
щающего адамантан, который также образует соединение включе-
ния с Т., но не образует его с мочевиной. Модель ^йс-кислоты, имею-
14 № 1994 417
щей один аксиальный и один экваториальный заместители, не по-
ра с. Т-1.
мещается в цилиндр такого диаметра (рис. Т-2).
Рис. Т-2.
ТИОНИЛ ХЛОРИСТЫЙ (III, 329—335),
Эфиры аминокислот (III, 331, после выдержки из [161). Де Тар
и сотр. [16 а] описали получение хлор гидрата р-метилового эфира
п-аспарагиновой кислоты с помощью Т. х. и метанола. Этот метод
оказался наиболее подходящим для этерификации этилендпамнн-
тетрауксусной кислоты [166].
Циклические ангидриды (III, 335, перед ссылками). Сотрудники
фирмы «Мерк» [301 впервые получили хлор гидр ат ангидрида и-глу-
418
таминовой кислоты путем перемешивания раствора и-глутаминовой
। ХСО.,Н SOC1, + CP;JCOOH; эфир
h2n/xco.3h
/°
кислоты в трифторуксусной кислоте при мед- .............JZ"
ленном добавлении Т. х. Затем к смеси до- | I
бавляли эфир до помутнения и раствор оставляли
для кристаллизации продукта. Аналогичным обра- с
зом был получен хлоргидрат ангидрида ь-аспа- II
ратиновой кислоты с выходом 70%. °
16а. В а с h Н., Gouge М., Honsberg W., Honsberg U., De-
Таг D. F., procedure submitted to Org. Syn. (1967).
166. Alner D. J., С 1 a r e t P. A.,Osborne A. G., Chem. Ind., 1968, 1565.
30. К о 1 I о n i t s c h J,, Rosegay A., Chem. Ind., 1964, 1867.
NH2
I
L-ТИРОЗИНГИДРАЗИД, 4-HOC6H4CH,CHCONHNHa. Мол. вес
195,21.
Получение. Этиловый эфир тирозина обрабатывают свежеперег-
нанным гидразингидратом, выход 94% [1].
Разделение на оптические антиподы [2]. Карбобензоксипроиз-
водные о, ь-пролина, о, ь-аланина и о, ь-изолейцина были раз-
делены в виде диастереомерных солей с ь-тирозингидразидом дроб-
ной кристаллизацией из низших спиртов или воды. В случае о, ь-
феиилаланина выходы низкие.
1, С u г t i u s T., J. prakt. Chem., [2] 95, 349 (1917).
2. Vogler K., La n z P., Helv. Chim. Acta, 49, 1348 (1966).
ТИТАН ТРЕХХЛОРИСТЫЙ, TiCi3. Мол. вес 104,27.
Реакция с метиллитием. При смешении Т. т. в глиме с метил-
литием в эфире при температуре от —50 до —SO2' образуется темно-
зеленый раствор, по-видимому, триметил титан а. Продукт не удает-
ся выделить, при температуре выше —20° он разлагается с выделе-
нием газа и образованием черных игл, которые при взаимодействии
с водой дают метан [11.
Конденсация аллиловых спиртов в диены-1,5. Ван Тамелен и
сотр. [21 обнаружили, что аллиловый спирт превращается в диен-1,5
при обработке Т. т. (0,5 моля) и метиллитием (1,5 моля) в глиме при
—78°, нагревании смеси до комнатной температуры и последующем
кипячении при 83" в течение 15 мин.
СН,=СНСН2ОН-гНОСНаСН=СНа T1CL'+CH^L1> CH,=CHCH2CH2CH = сн2
14* 419
Гераниол дает с 80%-ным выходом смесь углеводородов, обра-
зующихся в результате межмолекулярной конденсации в положе-
ниях С-1, С-Г и С-1, С-3' в соотношении 7:1. Бензиловый
спирт превращается в 1, 2-дифенилэтан с выходом 78%. В реакции
можно использовать и другие алкил- или ариллитивые соединения.
С применением избытка одного из аллиловых спиртов можно осу-
ществить смешанную конденсацию.
1. Clauss К., Beerman С., Angew. Chem., 71, 627 (1959).
2. Sharpless К- В., Н a n z 1 i k R. Р., v a n Tamelen E. E., J. Am.
Chem. Soc., 90, 209 (1968).
ТИТАН ЧЕТЫРЕХХЛОРИСТЫЙ (HI, 342—344).
Синтез альдегидов (перед ссылками). Довольно общин способ
получения ароматических альдегидов иллюстрируется синтезом
мезитил альдегида из мезитилена и ди хлорметил метилового эфира
(см. в этом томе) в присутствии Т. ч. как катализатора.
Синтез енаминов. Уайт и Вейнгартен [91 обнаружили, что Т. ч.
можно использовать в синтезе енаминов; он является не только
эффективным акцептором воды, но и кислым льюисовским ката-
лизатором:
О NR,"
II ’ I
2RCH,— CR' + 6HNR/H-TiCl4 2RCH =CR' -|-4R''NH2CI -фТ1О2
Кетимины. Вейнгартен, Чапп и Уайт [10] обнаружили ряд не-
достатков в существующих методиках получения кетиминов из за-
мещенных циклогексанонов и первичных аминов и предложили но-
вый более мощный метод, применимый к сильно затрудненным ке-
сн3
косснГ + (CH3)2CHNH2 + TiCl4 Кипячение 7vac в толуолу
67%
СН3
(СН3)2
----> HjC-C-CH3| + (CH3)2CHNH3C1
тонам типа камфоры. Раствор кетона и изопропиламина в толуоле
обрабатывают Т. ч. в толуоле при 0—5° и смесь кипятят с обратным
холодильником в течение 7 час, при этом медленно отделяется хлор-
гидрат амина. Смесь доводят до комнатной температуры и обраба-
тывают пентаном; хлоргидрат амина отфильтровывают и перегонкой
фильтрата выделяют продукт.
5. Add: F i п k b е 1 n е г Н. L., Соор егб, D., J. Org. Chem., 27, 3395 (1962).
9. W h i t е W- A., Weingarten H., J- Org. Chem., 32, 213 (1967).
10. Weingarten H., Chupp J. P., W h i t e W- A., J. Org. Chem., 32,
3246 (1967).
420
n-ТОЛУОЛСУЛЬФОНАТ СЕРЕБРА (HI, 355, после выдержки
из [11).
По мнению Гоффмана [lai, Т. с. гораздо легче получать реак-
цией (1), а не (2):
I) AgNO3 + NaOTs AgOTs + NaNO3
2) Ag2O + HOTs СН-Щ AgOTs4-H3O
Автор пишет: «Прежде всего AgNO3 более доступен, чем Ag2O,
которую обычно нужно получать непосредственно перед реакцией
и которая склонна к разложению. Далее, AgOTs практически мгно-
венно осаждается при простом смешении насыщенных растворов
эквимолярных количеств AgNO3 и NaOTs. Таким образом получа-
ется бесцветный реагент, который непосредствен и о пригоден к упот-
реблению. При обычной температуре он не разлагается на свету»,
la. Hoffmann Н. М. R., private communication.
n-ТОЛУОЛСУЛЬФОНИЛАЗИД (тозилазид) (III, 355—357).
Диазосоеди нения. Обзор [2а].
Получение диазоциклопентадиена по Дерингу и Де Пюи [2].
Вейл и Кэйс [26] нашли, что фен ил литий можно заменить другими
основаниями, лучше всего диэтиламином или этаноламином. Смесь
циклопентадиена, Т. и диэтиламина оставляют при 0° на три дня;
затем добавляют воду и диазоциклопентадиен экстрагируют эфиром;
выход 73%. С применением в качестве растворителя ацетонитрила
выход несколько повышается [2в].
Синтез азидов [6] (перед ссылками). При взаимодействии гало-
генмагииевой соли анилина с Т. с умеренным выходом образуется
фенил азид. Считается, что реакция осуществляется через промежу-
точное образование аниона триазена. Таким же способом бензилазид
был получен с выходом 20%.
трет-Бутиловый эфир диазоуксусной кислоты [7].
О 38 — 40°
СН3ССН2СОС(СН3)3 + Н3С >-SN3
|| 1! \=/ и
0 0 о ~TosNH=
421
—> СН3С — С-С — ОС(СН3)3 —’------НС-СОС(СН3)3
i| |! 1| 68-70% || ||
О N+ О N+ О
!1 !1
N- N’
Реакция с ацилметилентрифенмлфосфоранами [81. Т. с ацил-
метилентрифен ил фосфоранами (1) при комнатной температуре
с хорошим выходом дает 1,5-дизамещенные 1,3,5-триазолы (5).
о
(С6Н5)3Р = CHCR
(1)
+ rn3
(2)
R = C6H5) n -NO2C6H4,
n -BrC6H4
R' = ?7-CH3C6H4SO2
«WO +
R
(3)
4" NaS03—n— СНз
I
(C6HS)3P=C-C-R'
II
О
(6a) R-H; RJ - ОС >Нз
(66) R--CH3; R'-OCJIs
(6b) R = H; R' = N(C;H5)3
R
(C6Hs)3P^MTs -f- N^C-C-R'
О
(10) (9)
R О
-b I H
(C6Hrl3P-C-C-R'
Ts~N N
\ //
N
R
(сдар-^И11'
Is-/) N:?
(8)
422.
Если карбонильная группа в илиде имеет слабо электрофильный
характер, как, например, в сложных эфирах или амидах, реакция
принимает иное направление и приводит к а-диазоэфиру (9) или
амиду и N-тозилтрифенилфосфинимину (10). Такая реакция осу-
ществляется очень легко и может проводиться в апротонных раст-
ворителях.
2а. Regitz М., Angew, Chem., Internal. Ed., 6, 733 (1967).
26. Weil T., Cais M., J. Org. Chem., 28, 2472 (1963).
2b. R c g i t z M., Liedhegener A., Tetrahedron, 23, 2701 (1967).
6. Fischer AV., Ansclme J.-P., J. Am. Chem. Soc., 89, 5284 (1967).
7. R e g i t z M., Hocker J., Liedhegener A., Org. Syn., 48, 36 (1968).
8. Harvey G. R., J. Org. Chem., 31, 1587 (1966).
n-ТОЛУОЛСУЛЬФОНИЛГИДРАЗИН (тозилгидразин) (HI, 357—
362, название изменено).
Такое название реагента следует предпочесть часто применяю-
щемуся «л-толуол сульфонил гидр аз ид», например, в «Chemical Abst-
racts» и в сб. «Синтезы органических препаратов» при описании синте-
за, основанного на оригинальном способе Фрейденберга и Блюммеля
[Ann., 410, 45 (1924)1, которые, однако, называли реагент п-толуол-
сульфогидразином.
Получение (III, 357). Поправка [1а]. Вторую строку после урав-
нения заменить: через 15 мин смесь разделяется на две фазы. Ниж-
ний водный слой отбрасывают, верхний тетрагидрофурановый слой
фильтруют с отсасыванием через целит и к фильтрату при переме-
шивании добавляют двукратное (по объему) количество воды.
Реакция элиминирования (III, 358, после выдержки из [7]).
По оригинальной методике Кэйва [6] отщепление TsO- проводят
обработкой разбавленным раствором едкого натра в двухфазной
системе. Муховски [6а] указывает, что лучше использовать основ-
ную окись алюминия (pH 10—10,5), суспендированную в хлористом
метилене или этилацетате; выходы продуктов ие ниже 80% и иногда
(4) (5)
423
Достигают количественных. В этих условиях тозилгидразоны про-
стых альдегидов и кетонов не разлагаются. Мейнвальд и сотр. [6б|
применили этот метод для интересного синтеза ацетоксиди азокетон а
(5), исходя из 1-борнилацетата (1).
В реакции Бэмфорда — Стивенса (2J в качестве основания обыч-
но используют метилат натрия. Кирмс и сотр. [6в] показали, что
под действием амида натрия или гидрида натрия тозилгидразоны
алифатических и циклических кетонов превращаются в олефины-1.
Например, тозилгидразон пентанона-2 образует пентен-1 с выходом
83% и небольшие количества цис- и трййс-пентенов-2.
СН3СН2СН2СН2ССН3
I1, —% СН3СН2СН2СН = СН2 + СН3СН2СН =снсн3
NNHSO2CflH5 83% 14% транс, 3% цис
При взаимодействии Т. с ортоэфиром (6) при комнатной темпера-
туре происходит отщепление двух молекул метанола и с хорошим
выходом образуется тозильное производное (7) [6г], представляю-
щее интерес как возможный источник 1-метоксикарбена.
СН3О
n-CH,C6H4SO2NHNH2 +
Н
(6)
/ОСН3
^n-CH3C6H4SO,NHN = C/ 4-2СН3ОН
(7) 'Н
Новый метод синтеза олефинов, разработанный Шапиро и Хитом
[6д], заключается в обработке алифатического тозилгидразона,
имеющего rz-водородный атом, алкиллитием в эфире или гексане;
выходы высокие. Примеры:
ч /ОСН3
\с/ 3 —>
/ Х-ОСН 93%
424
Применение 2 экв бутиллития позволяет избежать образования
продуктов катионоидных и карбеноидных превращений 1бе1.
Этот метод был использован Мейнвальдом [6ж1 для синтеза Край-
пе напряженного бицикло-[2, 1, 1]-гексена-2 из тозилгидразона
бицикло-[2, 1, 1 ]-гексанона-2 (4). Расщепление по Гофману в этом
случае оказалось безуспешным.
Избыток CH3L1
15УДС, 25°
25%
Другой возможный способ получения бицикло-[2, 1, 1]-гексена-2
из бицикло-12, 1, 1]-гексанона-2 (1) описан Бондом и Сцербо [6з].
Кетон восстанавливают до спирта (2), гидроксильную группу с вы-
соким выходом замещают на бром под действием РВг3 и дегидробро-
мирование осуществляют обработкой трат-бутил атом калия в
л7/?ет-ВиОК,
ДМСО
20% (обилий)
ДМСО при 50°. Общий выход несколько ниже, чем в методе Мейн-
вальда, но зато олефин можно выделить перегонкой, не прибегая
к препаративной ГЖХ.
Шапиро и Дункан [би] применили этот метод для получения
борнена-2 (6) из тозилгидразона камфоры (5).
СНдЫ, эфир
66%
НзСх^СЩ
+ H-CH3CtH4SOzLi 4- N3 + СН4
(5) (6)
Метод синтеза олефинов был распространен на получение сопря-
женных диенов из тозилгидразонов а, |3-непредельных кетонов [6к].
Реакция особенно удобна для получения циклогексадиенов-1,3,
например (8). Тозил гидразон |3-ионона (9) превращали в триен (Ю).
425,
Для получения алленои этот метод непригоден. В последующих
80%
снаы
(СгНЕ);;О
(7)
(Ю)
исследованиях было показано, что отщепляющийся а-водородный
атом должен входить в метиленовую или метильную группу. Метил-
литий — более подходящий агент для этой реакции, чем «-бутил-
литий.
Фрагментация а, ^-эпоксикетонов. Эта реакция фрагментации
является мощным и широко применимым новым синтетическим ме-
тодом, который имеет много общего с рассмотренным способом полу-
чения олефинов с помощью Т. Поразительные успехи с применением
этого метода получены в совместной работе нескольких исследова-
(4)
(5) +TsOH + Na
J R = СН3
(6) Зкзальтом
СН3
снгсн2снгсн2снгснсн2
| \=0
СЩСЩСЩСНг СН2СН2СНг
(7) (VJyCKOH
426
тельских групп [6л — 6н]. В рассмотренной ранее работе по синтезу
мускопиридина Биман, Бюхи и Уолкер [6о[ разработали эффектив-
ный трехстадийный метод превращения легко доступного циклодо-
деканона (]) 16п] в бицикло-110, 3, 01-Д1 (12)-пентадеценон-13 (2).
а, Р-Непредельный кетон легко реагирует с перекисью водорода
в щелочной среде с образованием бициклического а, р-эпоксикетопа
(3), который дает с Т. производное (4). При обработке 2 эка метилата
натрия в метаноле или ДМСО соединение (4) превращается в цикло-
пентадецин-4-он-1 (5) с выходом 60—65%. Более высокий выход
(80%) был неожиданно получен при обработке в кислой среде, как
указано на схеме. Каталитическим гидрированием циклопентаде-
цин-4-она-1 (5) легко получается экзальтон (6). Аналогично осу-
ществлен синтез мускона (7), содержащего дополнительную р-ме-
тильную группу, которую вводят метилированием бициклического
а, р-непредельного кетона (2а).
Реакция фрагментации была использована для получения разно-
образных секостероидных ацетиленовых кетонов, например (2) 16р].
Это соединение (2) можно снова превратить в исходный ос, Р-непре-
дельный кетон (4) гидратацией тройной связи с последующей цикли-
зацией под действием mpm-бутилата калия. Сообщалось также,
что две стадии реакции фрагментации можно выполнять в обратном
порядке; так, эпоксидирование тозилгидразона а, р-непредельного
кетона под действием ж-хлор надбензойной кислоты приводит к фраг-
ментированному кетону. Этот метод особенно удобен в тех случаях,
когда трудно осуществить прямое эпоксидирование а, р-непредель-
пого кетона. С таким же успехом можно использовать метансульфо-
427
нилгидразин. Ниже приведен другой пример этой реакции [6с1:
о
TsNHNHz; ОН\
80% *
Отмечается, однако, что 2, 3-эп окси циклогексанон не образует со-
ответствующего гексин-1-аля-6, что указывает на изменение на-
правления реакции при наличии p-водородного атома.
Применение реакции фрагментации, по-видимому, ограничивает-
ся циклическими соединениями, так как обработка окиси пгранс-
халкона (5) Т. в подкисленном этаноле при 50° в течение 5 мин при-
н
Хс—GH3C6H4NHNHa
с6н5-** N-I
(5)
Н. OHzCiH5
с4н/ у
SO2C6H4CH3
(6)
водит к 4-оксипиразолину (6) 16т]. По-видимому, образующийся
тозил гидразон подвергается внутримолекулярному превращению
с раскрытием, а затем замыканием цикла с образованием пиразо-
лина.
Образование карбена [бу]. При обработке «-тозилгидразона (V)
ацетамидом натрия в апротонной среде при 175° образуется 10-кар-
бенабицикло-15, 2, 11-декан, который подвергается трансаннулярной
циклизации в трицикло-15, 2, 1, 0,4,10]-декан (VI) с 87%-ным выхо-
дом. Высокий выход этой реакции с участием карбена связан с ог-
раниченной конформационной подвижностью циклического карбена
(восьмичленный цикл) и с повышением напряжения в других воз-
можных продуктах.
V» V
428
6a. Muchowski J.M., Tetrahedron Latters, 1773 (1966).
66. Mei nw aid J., Shelton J.C., Buchanan G. L., Courtin A., J.
Org. Chem., 33, 99 (1968).
6b. Kirmse W., von Billow B.-G., Schepp H., Ann., 691, 41 (1966).
6r. McDonald R. M., Krueger R. A., J. Org. Chem., 31, 488 (1966).
6д. S h a p i г о R. H., H e a t h M. J., J. Am. Chem. Soc., 89, 5734 (1967).
6e. Kaufman G., Cook F., Shechter H., Bayless J,, Fried-
m a n L., J. Am. Chem, Soc., 89, 5736 (1967).
6ж. Meinwald J., U n о F., J. Am. Chem. Soc., 90, 800 (1968).
6з. В о n d F. T., S c e r b о L., Tetrahedron Letters, 2789 (1968).
би. Shapiro R. H., Duncan J. H., procedure submitted to Org. Syn. (1968).
6k. D a uben W. G., Lorber M. E., Vietmeyer N. D, Shapi-
ro R.H., Duncan J. H., Tomer K-s J-Am. Chem. Soc., 90, 4762 (1968).
6л. Ohloff G., Becker J., Schulte-ElteK- H. (Firmenich), Helv.
Chim. Acta, 50, 705 (1967).
6м. E s c h e n m о s e r A., F e 1 i x D., (ETH), О h 1 о f f G. (Firmenich), Helv.
Chim. Acta, 50, 708 (1967).
6h. Schreiber J.,Felix D.,Eschenmoser A. (ETH), W inter M.,
Gautechi F., Schulte - Elte К- H., SundtE., Ohloff G.
(Firmenich), Kalvoda J., Kaufmann H., Wieland P., A n-
n e r G. (Ciba, Basel), Helv. Chim. Acta, 50, 2101 (1967).
6o. В i e m a n n K-, В u c h i G., Walker В. H., J. Am. Chem. Soc., 79,
5558 (1957).
6n. Wilke G., Angew. Chem., 69, 397 (1957); 75, 10 (1963).
6p. Tanabe M., Crowe D. F., D e h n R. L., DetreG., Tetrahedron Let-
ters, 3739 (1967).
6c. Tanabe M., Crowe D. F., Dehn R. L., Tetrahedron Letters, 3943
(1967).
6т. P a d w a A., J. Org. Chem., 30, 1274 (1965).
6y. J а с о b s о n T., Chem. Scand., 21, 2235 (1967).
ТРЕХХЛОРИСТЫЙ АЗОТ (III, 367—368, перед ссылками).
В реакции аминирования л/-ксилол в 6—8 раз активнее других
изомеров; поэтому из смеси ксилолов, выделенной из каменноуголь-
ной смолы, можно с умеренным выходом получить 3, 5-диметил-
анилин (20—30%) [3]. Аминирование дифенила под действием Т. а.
в о-дихлорбензоле в присутствии хлористого алюминия приводит
к 3-аминодифенилу с выходами до 27% [4].
Реакция аминирования не ограничивается ароматическими угле-
водородами, она применима также к алифатическим углеводоро-
дам с третичным атомом углерода. mpem-Бутилхлорид при взаимо-
действии с Т. а. в присутствии хлористого алюминия дает трет-
бутиламин с 88% -ным выходом 15]. Метил циклогексан превращается
в 1-амино-1-метилциклогексан с выходом около 67% (в расчете на
Т. а.). Оптимальные условия реакции: С7Н14—А1С13—NC13 в соот-
ношении 2:2:1, растворитель — хлористый метилен, температура
0±5° [6]. В тех же условиях из адамантана почти количественно
получается 1-аминоадамантан [7].
3. К о v а с i с Р. et al., J. Org. Chem., 32, 585 (1967).
4. К о v a c i с P., H a r r i s о n A. K-, J. Org. Chem., 32, 207 (1967).
5. Kovacic P., Lowery M. K., Chem. Comm., 1966, 651.
6. Kovacic P., Chaudhary S.S., Tetrahedron, 23, 3563 (1967); Org. Syn.,
48, 4 (1968).
7. К о v a c i с P., R о s k о s Pr D., Tetrahedron Letters, 5833 (1968).
429
N N
СМ.И.И-ТРИАЗИН, I Г, 1Мол. вес 81,08, т. кип. 78—80°.
, Т. можно использовать вместо цианистого водорода в синтезе
альдегидов по Гаттерманну [11. В рядах фурана и пиррола, а также
в случае реакционноспособных бензоидных соединений для реакции
не требуется катализаторов Фриделя — Крафтса, например:
Эфир -СНС13
86%
Н3С ГФ'' ^сно
В случае фениловых эфиров и менее реакционноспособных аро-
матических соединений необходимо использовать хлористый алю-
миний и повышенную температуру.
1. Kreutzberger A., Angew. Chem., Internal. Ed. 6, 940 (1967).,-
1,2,4-ТРИАЗОЛ (III, 369—370).
Получение. Удобный способ получения Т. с выходом 70% [lai
состоит в дезаминировании З-амино-1, 2, 4-триазола по методу Ген-
ри и Финнегана [161, включающему диазотирование и восстановле-
ние под действием гипофосфористой кислоты.
(III, 370, перед ссылками.) Виланд и Кале [4| обнаружили, что
это полярное соединение является лучшим из нескольких исследо-
ванных веществ для катализа конденсации и-тиокрезиловых эфи-
ров в пептидном синтезе.
la. у a n d е г Brink W. М., personal communication.
16. Henry R. A., Finnegan W. G., J. Am, Chem. Soc., 76, 290 (1954).
4. Wieland Th., Kahle U., Ann., 691, 212 (1966).
(7пс-(ТРИБРОММЕТИЛ)-РТУТЬ, (Br3C)2Hg. Мол. вес 704,12,
т. пл. 148° (с разл.).
Это металлоорганическое соединение получают с 85—95%-ным
выходом реакцией хлорной ртути (сулема) с трибром ацетатом натрия
(молярное соотношение 1 : 2,5—3,0) в глиме. Реагент является
удобным источником дибромкарбена. Так, с циклогексеном в кипя-
щем бензоле в атмосфере азота он дает днбромноркаран с выходом
430
54% [И.
Ujl +(Br3C)2Hg -------> \ Гх/Вг 4- Br3CHgBr
У L kmr
54%
Таким же способом получают бис-(трихлорметил)-ртуть, кото-
рую используют как источник дихлоркарбена. В этом случае тре-
буется нагревание при 170—190°, а выход дихлорциклопропанов не
превышает 2546 [2].
1. R о b son R., D 1 с k s о n I. Е., J. Organometallic Chem., 15, 7 (1968).
2. Logan Т. J., J. Org. Chem., 28, 1129 (1963).
2,4,6-ТРИБРОМФЕНОЛ. Мол. вес 330,82, т. пл. 93—95°.
Сложные эфиры этого пространственно затрудненного фенола
были получены под действием N-карбобензоксиаминокислот в при-
сутствии дициклогексил карбодиимида [1].
1. Scott-Burden Т., Hawtrey А. О., Tetrahedron Letters, 4831 (1967).
ТРИ-н-БУТИЛСТАННАН (III, 372—373).
Поправка (HI, 372). В последнем уравнении следует изменить
соотношение двух продуктов на обратное.
(III, 373, перед ссылками.) Под действием Т. осуществляется
стереоспецифическое восстановление геминальных фторгалогенцик-
лопропанов до фторциклопропанов 110]:
Циклопропенон (3) был впервые получен восстановлением тетра-
хлорциклопропена (1) 2 же Т. [И] с последующим осторожным гид-
ролизом (2). В подходящих условиях удается получить 3-хлорцик-
лопропен С выходом 22% [12].
Cl С1 —/ 2 Bu,SnH X * Cl ci (1) НН НН ¥ -^ V c¥ci о (2) (3) 431
транс- и цщ?-Изомеры се-хлордекалина восстанавливаются Т.
до одинаковой смеси транс- и цис-декалинов, в которой преобладает
транс-изомер. Грини и Лаури [13] указывают, что Т. можно исполь-
зовать для восстановления третичных галогенидов, что представляет
особый интерес при получении соединений, меченных дейтерием
или тритием.
Обзор [14].
10. Ando Т., Namigata F., Ya mana ka H., Funasaka W-, J.
Am. Chem. Soc., 89, 5719 (1967).
11. Bres low R., R у an G., J. Am. Chem. Soc., 89, 3073 (1967).
12. Breslow R., Groves J. T., Ryan G., J, Am. Chem. Soc., 89, 5048
(1967).
13. .Greene F. D., Lowry N. N., J. Org. Chem., 32. 882 (1967).
14. Kuivila H. G., Accounts Chem. Res., 1, 289 (1968).
ТРИМЕТИЛАМИНА ОКИСЬ (HI, 377—378).
Синтез альдегидов (перед ссылками). Для высушивания дигид-
рата Т. о. Франзен [5] рекомендует смешать его с ДМФА и перего-
нять сначала при нормальном, а затем при пониженном давлении
до полного удаления растворителя. Остаток растворяют в хлоро-
форме и обрабатывают н-окти л иодидом, который добавляют по
каплям при перемешивании в течение 20—30 мин. Затем смесь ки-
пятят с обратным холодильником в течение 20 мин, охлаждают и
обрабатывают 2 н. водной серной кислотой при 50°. Органический
слой отделяют, промывают, сушат и концентрируют. Остаток дваж-
СНС1-
h-C8HuI-HCH3)3N —> о— h-C7H15CHO-P(CH3)3N + HI-
4 ], о — 4 3 %
ды перегоняют и получают 10,6—11,0 г «-октаналя.
5. Franzen V., Org. Syn., 47, 96 (1967).
ТРИМЕТИЛБОРАТ (HI, 380-381), (СН3О);3В. Мол. вес 103,92,
т. кип. 67—69°.
Применение Т. на одной из стадий превращения арилгалогенида
в соответствующий фенол иллюстрируется получением 6-метокси-
нафтола-2 (4) из 6-бром-2-метоксинафталина (1) [11. Из арилгалоге-
нида (1) и магния в присутствии каталитического количества иода
при кипячении в ТГФ получают реактив Гриньяра (2). Под дейст-
вием Т. в ТГФ соединение (2) превращается в эфир (3), при окисле-
нии которого перекисью водорода в уксусной кислоте образуется
6-метоксинафтол-2 (4) и диметилборат.
/\/WMgA
!11 J
(2)
432
R(OCH3).
НЁОг, воды. AcOH
(3)
/\/W0H
+ HOB(OCH3)a
сн3о//Х;'//ч^
(4)
1. К i d w е 1 1 R. L., Murphy AL, Dar ling S. D., procedure submitted to
Org. Syn. (1968).
ТРИМЕТИЛОКСОНИЯ БОРФТОРИД (III, 382).
По ранее описанной методике [1] Т. б. получают взаимодействи-
ем диметилового эфира с борфторидом триэтилоксония. По новой
методике [2] Т. б. синтезируют реакцией эпихлоргидрина с димети-
ловым эфиром и эфиратом трехфтористого бора. Таким образом,
удается обойтись без промежуточного получения борфторида три-
этилоксония. Полученный новым методом кристаллический Т. б.
можно хранить в течение года в эксикаторе над драйеритом при
—20°.
2. Curphey Т. J., procedure submitted to Org. Syn. (1968).
ТРИМЕТИЛОКСОНИЯ 2,4,6-ТРИНИТРОБЕНЗОЛСУЛЬФОНАТ
(III, 382, перед ссылками).
Этот устойчивый алкилирующий агент получают по методу,
описанному в работе [1], а также реакцией кислоты с борфторидом
триметилоксония; выход 71—76% [2]. Соль можно хранить в закры-
том сосуде при 5—10° в течение месяца, при этом наблюдается раз-
ложение только на 10%. Реагент негигроскопичен.
Алкилирующий агент. С циклооктеисульфидом Т.т. образует
2,4,6-тринитробензолсульфонат S-метилсульфония [2];
Этот более реакционноспособный по сравнению с иодистым мети-
лом алкилирующий агент при взаимодействии с анионами енолятов
лития дает меньше продуктов диалкилирования, но больше пр оду к-
433
тов О-алкилирования [3].
2. Ре 11 i t D.J., Helmkamp G. K., J. Org. Chem., 29, 2702 (1964).
3. House H, O-, Tros t В. M., J. Org. Chem., 30, 2503 (1965); House H. O.,
Rec. Chem. Progr., 28, 98 (1967).
5ас-(ТРИМЕТИЛСИЛИЛДИХЛ0РМЕТИЛ)-РТУТЬ,
[(CH3)3SiCCl.2l.2Hg. Мол. вес 488,62, т. пл. 151—153".
Получение [1].
[(CH3)GSiCClJHg-rCsH3Li ——* (CH3)3SiCCl.jLi 4-C8HG („высокий выход")
(CH3),SiCClaLi4-HgBr., —I [(CH3)sSiCCl.2].2Hg-|-LiBr
Применение Ш. При нагревании до 115° соединение разлагается
с образованием триметилсилилхлоркарбена:
(СНз)351СС12]ДЗ£ + +
118 > 2 [ + 2C6H5HgCl
L J/^Si(CH3)3
82%
62%
Чтобы использовать обе группы (CH3)3SiCCl.>, в реакцию вводят
дифенилртуть. При нагревании до более высоких температур реагент
дает триметилсилилдихлорметильпые радикалы.
1. Seyferth D,, Н a n s о и Е. М., J. Am. Chem, Soc,, 90, 2438 (1968).
1-ТРИМЕТИЛСИЛИЛПРОПИНИЛЛИТИЙ-З,
(CH3)3SiC=CCH2Li.
Получение в растворе.
(CH3)3SiCl + CH3C-~CLi CH:jC =CSi(CH3)3 -+
(1) (2) й0 'tac (3)
н-BuLi (ар^ [еще CSi(CH3)..]Li
-ВиН (4)
Кори и Кирст 1П получили этот реагент (4) кипячением триме-
тил хлорелл ана (1) с пропин и л литием (2) в эфире в течение 30 час.
Образующийся при этом 1-триметилснлилпрояин-1 (3) металлиро-
434
вали до (4) при добавлении эквивалентного количества н-бутиллития
в присутствии тетраметилэтилендиамина в качестве комплексооб-
разующего агента.
Синтез ацетиленов [1]. При взаимодействии Т. с первичными га-
логенидами в эфире (0°, 12 час) образуются главным образом ацети-
СН3(СН2)51 [CH.Chez CSi(CH3)3]Li
-^CH3(CH2)eC = CSi(CH3):}-rCH3(CH2)5CH-C=CHSi(CH3)3
55° (Следы)
j Ag +, затем CN “
CHg(CH2)eC^CH
лены и лишь следы алленов. Удаление защитной триметилсилиль-
ной группы обработкой нитратом серебра в этаноле, а затем циани-
дом натрия приводит к терминальным алкинам.
Синтез 1,5-диенов и 1,5-енинов [1]. Разработанный Кори синтез
особенно интересен потому, что его можно использовать для полу-
чения 1,5-диеновой системы, характерной для ациклических изо-
преноидов. Например, транс, трп«с-фар незол был синтезирован,
исходя из геранилбромида (5), следующим путем:
(^)
1) сн2=о
Z)HzSO4 .
0 LiAlHo
CH.ONa
2) Ь
19)
Проп и пилирование с помощью (4) осуществляется стереоспецифич-
но с образованием продукта (6), который после обработки нитратом
серебра в этаноле при 25°, а затем цианидом натрия образует аце-
тилен (7). Следующую стадию — оксиметилирование в (9) — вы-
полняют по Зондхеймеру [21: реакцией (7) с этилмагниибромидом
получают гриньяровское производное (8), которое затем обрабатыва-
ют газообразным формальдегидом в атмосфере азота и подкисляют.
Две последующие стадии проводят, как описано Кори, Катценел-
ленбогеном и Познером [3], которые показали, что при кипячении
435
со смесью алюмогидрида лития и метилата натрия в ТГФ с последую-
щим иодированием получается у-иодаллиловый спирт (10). Алкили-
рование (10) диметилмедвлитием (см. в этом томе) дает спирт (11),
идентичный природному транс, транс-фарнезолу.
1 1. Corey Е. J., Kirst Н. A., Tetrahedron Letters, 5041 (1968).
2. Sondheimer F., J. Am. Chem. Soc., 74, 4040 (1952).
3. Core у E. J., Ka tzene I I en bogen J. A., Posner G. A., J. Am.
Chem. Soc., 89, 4245 (1967).
ТРИМЕТИЛ-(ТРИФТОРМЕТИЛ)-СТАННАН (III, 386—387,
ссылка [2]). Последующая работа: Se у f e r t h D., De r tou z. os
H.,SuzukiR,Mui J. Y.-P., J. Org. Chem., 32, 2980 (1967).
ТРИМЕТИЛФОСФИТ (HI, 388—390).
Синтез олефинов |III, 389—390, после формулы (5)]. Кори и
сотр. [4а] распространили этот метод на получение относительно
неустойчивых олефинов. При обработке транс-1, 2-циклооктентион-
карбоната (6) триизооктилфосфитом при 135° в течение 24 час при
непрерывном пропускании через систему тока аргона летучие про-
дукты быстро удаляются и получается тране-циклооктен (7) с вы-
ходом 75%.
(RO)3p~aprory
+ (RO)3PS + СОг
(6) (7) 75%
При попытках получения тем же методом транс-циклогептена
из транс-1,2-циклогептентионкарбоната (8) был выделен только
цис-циклогептен. Однако реакция транс-1,2-циклогептентиощ
карбоната (8) с Т. в присутствии 2,5-дифенил-3,4-бензофурана
(9) в качестве акцептора приводит к аддукту (10) с т. пл. 150°, ко-
торый является изомером известного аддукта бензофурана с цис-
циклогептеном (т. пл. 185°). Отсюда следует, что первичным про-
дуктом превращения транс-1,2-циклогептентионкарбоната являет-
ся транс-циклогептен.
(8)
436
При получении олефинов нагреванием 1,2-тритиокарбонатов
с три ал кил фосфитом также наблюдается стереоспецифическое цис-
отщепление. Примером служит получение mpawc-циклооктена из
^ас-изомера:
н2з
EtOH
77%
(13)
(12)
[(СН3)гСНСНгСН2СН2СНгСНгО]3Р
(14) > (15)
При добавлении родана к ^ас-циклооктену получают транс-
1, 2-дитиоцианциклооктан (12), который при кипячении (2 час) с
47%-ной бромистоводородной кислотой с последующей нейтрализа-
цией карбонатом натрия количественно превращается в иминодитио-
карбонат (13). При взаимодействии соединения (13) с сероводородом
в этаноле образуется транс-тиокарбон ат (14), нагреванием кото-
рого с три изооктил фосфитом при 135й (41 час) получают транс-цик-
лооктен (15) с непрерывным удалением его из сферы реакции по
мере образования.
Другой путь к промежуточным тритиокарбонатам заключается
в реакции цис- и транс-1,2-эпоксидов с метилксантогенатом калия;
реакция сопровождается вальденовским обращением и приводит
к транс- и цис-] ,2-тритиокарбонатам соответственно.
Кори и Шульман [46] осуществили прямой синтез оптически чис-
того транс-циклооктена. Оптически активный (-]-)-транс-],2-
циклоктандиол (16) получали обработкой раствора рацемического
диола в ТГФ небольшим избытком н-бутиллития, а затем 1 же фта-
(RO)3P?
(!б) (17) (18)
(+)-Антипод (+)-Антипод (-)-Антипод
437
левого ангидрида. Образующийся полуэфир фталевой кислоты
разделяли на антиподы через соль со стрихнином путем многократ-
ной кристаллизации. Затем через оптически активный диол полу-
чали тионкарбонат (17). Реакция (17) с триизооктилфосфитом (17
час, при 130'') приводит с 84%-ным выходом к (—)-шрц«с-циклоок-
тену (18) с оптической чистотой более 99%.
Превращение RCHO в RCH2COOH (III, 390, перед ссылками).
При взаимодействии Т. с 1,3-дитиоциклогексантионом-2 (1) (полу-
чают с выходом более 60% реакцией триметилендибромида с три-
тиокарбонатом натрия [9]) с количественным выходом образуется
/\ 2(СИаО)3Р /\
СвН3СНО
S S
~(CHsO)aPS
90%
S S
S
(I)
Р(ОСН3)3
(2)
С6Н5СН2СО2Н
(4)
с6н5сн
илид (2) (N2, 55°, 3 час), который в результате быстрой экзотермиче-
ской реакции с альдегидами, например с бензальдегидом, дает тио-
ацеталь кетена (3). Поскольку при гидролизе тиоацеталей кетенов
образуются карбоновые кислоты, этот метод открывает возможность
превращения альдегида в гомологичную кислоту [10]. С кетонами
илид (2) не реагирует.
4а. С о г е у Е. J., С а г е у F. A., Winter R. А. Е., J. Am. Chem. Soc., 87,
934 (1965).
46. С о г е у Е. J., Shulman J. 1., Tetrahedron Letters, 3655 (1968).
9. Mills W. H., Saunders В. C., J. Chem. Soc., 1931, 537.
10. Corey E. J., Markl G., Tetrahedron Leiters, 3201 (1967).
ТРИМЕТИЛФОСФИТА-МЕТИЛМЕДИ КОМПЛЕКС,
[(СН3О)зР]3СиСНз. Мол. вес 450,80, т. кип. ПО—111°.
Комплекс получают 11] реакцией
СН3С11 + 3 (СН3О)3 Р 1(СН3О)3Р]3 СиСН3
Он относительно устойчив, растворяется в эфире и частично раство-
ряется в воде.
Применение {]}. Подобно диметил медь литию этот комплекс
используют для сопряженного присоединения к а, р-пепредельным
кетонам, однако необходимо присутствие различных солей (йоди-
стый литий, бромистый литий и т. д.). Были также получены по-
438
добные комплексы три-и-бутилфосфита и три-н-бутилфосфина, ко-
торые менее удобны для применения.
о
| |] + [(СНэО)3Р^3СчСН3 + Lil
1 C'lL LI
0,34 моля 0,34
моля
98% транс
2% цис
I. Н о use Н. О., Fischer W. F., Jr., J, Org. Chem,, 33, 949 (1968).
ТРИМЕТИЛХЛОРСИЛАН (III, 390—391).
Ацилоиновая конденсация (перед ссылками). Шраплер и Руль-
манн [2] нашли, что если ацилоиновую конденсацию проводить
в присутствии Т., то можно выделить промежуточный ендиол в виде
триметилсилильного производного и повысить выход конечного
продукта. Гидролизуют соляной кислотой в ТГФ.
4 Ка.
-2 RONa
С-ОК’а
(СН2)„ II
У C-ONa
2 (CH3)3SiCl
f g-os;(ch3),
(CH2};7 II
V C-OSi(CH3)3
H Cl
ТГФ
w-3,4,8 ; <351X04=91-93 % ,55 “89 %, 20-54 %
Блумфилд Г31 обнаружил, что этот метод в применении к соеди-
нению (1) позволяет получить с высоким выходом сильно напря-
женное циклобутеновое кольцо (2). При кипячении в метаноле си-
лилэфирные группы легко гидролизуются с образованием ацилои-
на (3). Существенное преимущество рассматриваемого метода состоит
Na, толуол
2 (CH3)3SiCl
bsi(CH3)3
(г)
ZOSi(CH3)3
в подавлении конденсации Дикмана, которая является конкурент-
ным процессом в обычной ацилоиновой конденсации [4]. Так, при
попытках циклизации эфиров (4) и (6) под действием избытка сплава
натрий — калий получались смеси нескольких соединений, из ко-
торых не удавалось выделить кристаллические продукты [51. В при-
сутствии Т. ацилоиновые производные (5) и (7) были получены с пре-
439
красным выходом [4].
8
7
OSi(CH3)3
OSi(CH3)3
OSi(CH3)3
OSi(CH3)3
(7)
Другие триметилсилиловые эфиры енолов. Сторк и Худрлик
[6] разработали метод превращения 2-метилциклогексанона в два
соответствующих енолята натрия. Кетон кипятят с гидридом нат-
рия в глиме, охлаждают и добавляют избыток триэтиламина и Т.;
______NaH
СН3ОСН2СН2ОСН3
|(CH3)3SiCl
73:29
затем смесь разбавляют пентаном и промывают сначала разб. соля-
ной кислотой, затем водным бикарбонатом натрия. Два изомерных
силиловых эфира выделяют с помощью препаративной газовой
хроматографии. Эти триметилсилиловые эфиры енолов — идеаль-
ные исходные продукты для получения енолятов металлов; в реак-
циях с металлоорганическими соединениями единственным побоч-
OSi{CH3)3 OLi
| LiCH3 |
/4s/ —-/4s/+(CH3)4Si
44(1
ным продуктом является инертный тетраалкилсилаи. Енолят ли-
тия, полученный из соединения (1), метилируется с общим выходом
80% [71
OSi(CH3)3 О
JWCH(CH3)2 i)CH3Li J’CH(CH3)2 2) сн31 / у 80% ' | СН3
(2)
Защита терминальной ацетиленовой группы. Ирборн и сотр. [8]
обнаружили, что при обработке гриньяровского реактива (1) Т.
в ТГФ образуется соединение (2). Превращение соединения (2)
в реактив Гриньяра (3) и карбонизация приводят к (4).
(CHa)aSiCl
n-BrC6H4C =s CMgBr —>
([) 87%
Mg
—> м-ВгС6Н4С = CSi(CH3)3 >
(2) ТГФ
co2
—> [BrMgCeH4C = CSi(CH3)3] — r
(3) /0%
> n-HOaCC6H4C = CSi(CH3)3
(A)
Советские исследователи [9] обнаружили, что силильный за-
меститель при углеродном атоме с тройной связью защищает этот
ненасыщенный центр при гидрировании. Это открытие было
использовано Шмидтом и Аренсом ПО] для избирательного восста-
новления центральной тройной связи в соединении (I) с сохранением
двух терминальных тройных и двух двойных связей. Соедине-
ние (I) через Mg Вг-про изводи ое превращали в биотриметил сил иль-
ное производное (II). При гидрировании над палладиевым катали-
НС^ С— СН = С(СН3) —СН3 — С^С—СНа—С(СН3)=СН—c-СН (I)
83°/ I Г C3H5/MgBr
Sd/“ J, 2) (CHa)3SiCl
(CH3)3Si — С = CCH =C(CH3)CH2C = CCH2C(CH3)^CH — С C—Si(CH3)3 (II)
80% | Hg./Pd- BaSO4
(CH3)3Si—CSCCH=C(CH3)CH2CH=CHCH2C(CHS)=CH-~CC—Si(CH3)3 (III)
90°/ J О AgNOa
d KCN/HSO
HCsC-CH = C(CH3)-CH2—CH=CH — CH2—C(CH3)=CH— C = CH (IV)
затором избирательно восстанавливалась центральная тройная
связь без затрагивания двух =С—Si(CH3)3-rpynn и двух =СН-
групп. Для удаления защитных групп соединение (III) обрабатыва-
ли спиртовым раствором нитрата серебра. Образующийся при этом
ацетиленид серебра под действием конц. водного раствора циани-
стого калия дает соединение (IV).
441
Ацилирование малоновых эфиров. Моноацилирование натрий-
малоновых эфиров обычно сопровождается диацилированием. Этот
побочный процесс можно исключить следующим образом: реакцией
натриймалонового эфира с Т. получают «кетенацеталь» (1), который
легко реагирует с ангидридами и хлорангидридами кислот с обра-
зованием ацилмалоновых эфиров (2) [11]. Выходы составляют от
50 до 80%.
азрснщ .OSifCH.)?
(C.2H3OOC)2CHNa С2Н-ООССН = С< ’ ' —>
Н) хос2н5
__R0C1 RCOCH(COOC2H5).,
•~ClSi(CHa)a ^2)
Синтез изоцианатов [12]. При термическом расщеплении урета-
нов изоцианаты образуются с низкими выходами, так как для реак-
ции требуются высокие температуры (200—300°). Однако N-силил-
уретаны расщепляются при гораздо более низких температурах.
Например, уретан (1) обрабатывают Т. в присутствии триэтнламина
в кипящем толуоле в течение 2 час. После охлаждения осадок хлор-
О О
Il (СНЩ5Ю1 II А
RNHCOR'------—^RNCOR' —* RN = C = O4-R'OSi(CH3)3
Л) I (3) (4)
Si(CH3)3
(2)
гидрата триэтиламина отделяют фильтрованием и перегонкой филь-
трата выделяют изоцианат (3). Для N-силилирования карбамоил-
хлоридов RNHCOC1 используют триметилсилилацетамид; расщеп-
ление до изоцианата в этом случае осуществляется при температуре
от —20 до 0*.
2. S с h г а р 1 е г U., R ii h 1 m a п n К., Chem. Вег., 97, 1383 (1964).
3. В I о о m f i e 1 d J. J., Tetrahedron Letters, 587 (1968).
4. В 1 о о m f i e 1 d J. J., Tetrahedron Letters, 591 (1968).
5. В loomiield J. J., I r e 1 a n J. R. S., J. Org. Chem., 31, 2017 (1966).
6. Stork G., Hu drl i k P. F., J. Ain. Chem. Soc., 90, 4462 (1968).
7. Stork G., Hudrlik P. F., J. Am. Chem. Soc., 90, 4464 (1968).
8. Earborn C., Thonipso n A. R., Walton D. R. M., J. Chem. Soc.,
(C), 1967, 1364.
9. Ш a x о в с к и й Б. Г., Стадн пчук М. Д., П е т р о в А. А., ЖОХ, 35,
1036 (1965).
10. Schmidt Ы. М., Arens J. F., Rec. trav., 86, 1138 (1967).
И. Schmidt U., Sch wocha u M., Tetrahedron Letters, 4491 (1967).
12. Greber G., К г i c li e 1 d о r f Fl. R., Angew. Chem., Internal. Ed., 7, 941
(1968).
ТРИФЕНИЛМЕТИЛБОРФТОРИД (III, 399—401, после выдерж-
ки из [51).
Дегидрирование. Т.— наиболее подходящий реагент для дегид-
рирования соединения (1) до дибензсесквифульвалепа (2) [5а].
442
В синтезах с применением хлоранила и смеси NBC — триэтиламин
выходы (2) снижаются до 7 и 1 % соответственно.
(c£h5)3c+bf4" '
30-35%
f V
0) (2)
5а. Prinzbach Н., S е i р D., Knothe L.^Faisst W., Ann,, 698,
34 (1966).
ТРИФЕНИЛМЕТИЛЛИТИЙ (III, 396, перед ссылками).
Томбоулян и Стеховер [5] получали этот реагент с количествен-
ным выходом при металлировании трифен ил метан а под действием
«-бутиллития (50—150%-ный избыток) в ТГФ или в 2-метилтетра-
гидрофуране. Авторы рекомендуют получать н-бутиллитий из ли-
тия и «-бутилхлорида непосредственно перед реакцией в том же
растворителе. Если обмен проводится при комнатной температуре,
избыток бутиллития быстро реагирует с ТГФ. При взаимодействии
Т. с бензофеноном в ТГФ образуется 1-дифен и л оксиметил-4-ди-
фенил метилбензол.
сгн5 С0нг, сен3 С6НЙ
I /------ч I ТГФ; Н = О I ,------ч ]
Li— с— " А-рс = О------------>Н—С-----" С—OH + LiOH
I \=/ I I \=/
СеН5 С0Н5 С6Н5 С0Н5
5. Т о m b о u 1 i a n Р., S t е h о w е г К., J. Org. Chem,, 33, 1509 (1968).
2,2,2-ТРИФЕНИЛ-1,2-ОКСАФОСФОЛАН, (1). Мол. вес 320,36
т. ил. 116—117°.
Получение [11.
№Н (С0Н5)зР — СН.2_
(СаН5)3Р(СН2)3ОНЬ 1 i -
ХУ
н2
(1а)
ДГ7(С0Н5)3Р-СН
I
/СН3
носн.
(16)
Реакция Виттига [21. Реагент [в форме илида (16)] присоеди-
няется к альдегидам с образованием у, б-непредельных спиртов
443
с соотношением ц«с-транс-изомеров 1:1. Кетоны вступают в реак-
цию гораздо труднее.
RCHOH-(CfiH5)3P — СН(СН2)2ОН
-> (СЙН5)3РО +
R. /СН3СНгОН R. ,Н
н /О ~ С. । — Сч
\н + н/ ХСН2СН2ОН
1. Hands A. R., М е г се г A. J. Н., J. Chem. Soc., (С), 1967, 1099.
2. Hands A. R., М е г с е г A. J. Н., J. Chem. Soc., (С), 1968, 2448.
ТРИФЕНИЛПРОПАРГИЛФОСФОНИЙБРОМИД, (1), Мол. вес
381,24, т. пл. 156—158".
Т. получают с 56%-ным выходом реакцией трифенилфосфина,
бромистого водорода и пропаргилбромида [11:
(С6Н5)3Р + НВг + НС^ССН2Вг [(С6Н5)3Р+СН3С
(1)
СН]Вг-
Реакция типа реакции Виттита. При взаимодействии с бензаль-
дегидом в жидком аммиаке Т. образует смесь енинов (2) и (3). В слу-
чае коричного альдегида из полученной смеси легко кристаллизу-
ется продукт, который по данным ИК-спектров является изомером
(6).
1. Е i t е г К„ О е d i g е г Н., Ann., 682, 62 (1965).
ТРИФЕНИЛСТАННАН (III, 401—402, перед ссылками).
Под действием Т. осуществляется избирательное восстановление
двойной связи окиси мезитила с количественным выходом [10.1:
2 (СеНДчЗпН
(СН3)гС = СНСОСНз-----—>
—> (СН3)гСНСНгСОСН3 -р (C^Hg)3Sn — SnfCgH^lg
444
При обработке хлорангидридами кислот и Т. наблюдается вос-
становительное ацилирование кетонов с высоким выходом [111:
СвН5СОСН3 Н- СН3СОС1 + (CGH3)3SnH —---------->
Количественно
ососн3
—* СеН5С HCH3-f- (CeH5)3Sn — Sn(CGH5)3
10. Pereyre M., Valade J., Compt. rend., 260, 581 (1965).
11. Kaplan L., J. Am. Chem. Soc., 88, 1833, 4970 (1966).
ТРИФЕНИЛФОСФИН (III, 402—413).
Реакция Виттига (III, 402—407). Бертон и Краутш[6а1 получали
фторхлорметилентрифенилфосфоран для реакции с карбонильными
соединениями следующими двумя путями:
Триглим, 85%
1) (C6H5)3P + CFCI3CO.2Na-----А-
)ус=о
(C0H5)3P = CFC1---> (C6H5)3PO+Ac=CFCI
трет-ВиО К, 0°
2) (CeH5)3P^cFCIaH (C6H5)3P = CFC1
1 till Idn
о
----->(CeH5)3PO + >C = CFCl
Обычно первый метод обеспечивает несколько большие выходы
с альдегидами и реакционноспособными кетонами, тогда как второй
метод более подходит для менее реакционноспособных кетонов,
поскольку илид получают в мягких условиях. При реакции обра-
зуется смесь цис- и транс-олефинов, и метод получения илида не
оказывает влияния на соотношение изомеров.
Дезоксигенирование (III, 407—409, после выдержки из [22]).
Дезоксигенирование нитрозобензола под действием Т. или трибутил-
фосфина в присутствии диэтиламина приводит к расширению цикла
и образованию 2-диэтиламино-7Н-азепина [22а]:
4- (с6н5)3р + (c2hs)2nh
С^м(с2н5)2
+ (С6Н5)3РО
62% 70%
Предполагается, что расширение цикла происходит через проме-
жуточное образование нитрена, подобно тому как это наблюдается
при фотолизе фенил азида в присутствии амина.
Восстановление озонидов (III, 409—410, после выдержки из
[23]). Паппас и сотр. [23а] обнаружили, что Т. является наилучшим
445
реагентом для восстановления озонидов, получаемых из нафтали-
нов.
сно
сно
осн3
сногн
I
сно
+СН3ОН + (СбН5)3РО
Дегалогенирование (III, 410, после выдержки из [28]). Дарлинг
и Кидуэлл [28а] получили дифенилкетен с 81,5%-ным выходом де-
бромированием бромангидрида а-бромдифенилуксусной кислоты
под действием Т.:
(С6Н5)2СВгСОВгЩ(С6Н5)3Р —щД (СЙН5)2С = C = O-i~ (СвН5)3РВг2
е Н о , о
Пер хлор пентанон-3 (1) при обработке Т. дегалогенируется до
п ер хлорди винил кетон а (2) [286]. Для превращения образующегося
дихлорида трифенилфосфина в окись трифенилфосфина перед вы-
делением кетона (2) смесь обрабатывают водой.
СС13 СС1,
] i:
ССЬ Эфир (5-35е) СС1
I ЛЩНЩР I
С^О —> С--О4-2(С6ЫГ,)3РС12
CCI, СС1 Н.,0
1 II 1
СС13 СС13 2(СД1Й)8РО
(2)
Пептидный синтез (III, 412, перед ссылками). В присутствии Т.
медные соли карбоновых кислот конденсируются с сульфенамидами
по следующей схеме [33]:
[CH3(CH2)4CO2]aCu + 2C(iH8S\(CH2CH2CH.,CH3)3 +
+ 2(СеН,)3Р гСН^СН.ЙСОХХСН.СН.СН.СНз),-’-
95%
-HC6H5S)2Cu + 2(CgH5)3P-O
93%
Реакция была использована в синтезе пептидов, например этилового
эфира карбобензокси-ь-фенилаланилглицина (выход 96%).
446
Перегруппировка Бекмана 1-хлор-1-нитрозоциклогексана (2)
осуществляется с хорошим выходом следующим путем [34]:
О) (2)
(3)
Хлорированием оксима циклогексанона (1) получают соединение
(2), которое при взаимодействии с Т. в бензоле и последующем гид-
ролизе дает е-капролактам (3) с выходом 96%.
ба. В u г t о n D.J., Krutzsch Н. С., Tetrahedron Letters, 71 (1968).
22а. OdumR. A., Brenner МJ. Am. Chem. Soc., 88, 2074 (1966).
23a. Pappas J. J., Keavency W. P., Berger AL, Rush R. V., J.
Org. Chem., 33, 787 (1968).
28a. Darling S.D, Kidwell R. L., J. Org. Chem., 33, 3974 (1968).
286. P i 1 g r a tn K., OhseH., Angew. Chem., Internat. Ed., 5, 837 (1966).
33. Mukaiyama T., U e k i M., Ala r uv a m a H., M a I s ue d a R.,
J. Am. Chem. Soc., 90, 4490 (1968).
34. Oh no AL, Sakai I., Tetrahedron Letters, 4541 (1965).
ТРИФЕНИЛФОСФИНДИБРОМИД (III, 413—415),
(III, 414, после выдержки из 171.) Рекомендуется использовать
этот реагент для превращения фенолов в ар и л бромиды [7а]. Трифе-
нилфосфин реагирует с бромом в ацетонитриле при Оф при добавле-
нии фенола образуется комплекс, который разлагается при нагре-
вании с образованием арилгалогенида, окиси трифенилфосфина и
бромистого водорода.
7. Change to: S с h а е f е г J. Р., II i g g i n s J. G., S h e n о v P. K6, Org. Syn.,
48, 51 (1968).
7a. S c h a e f e r J. P., H i gg i ns J., J. Org. Chem., 32, 1607 (1967).
ТРИФЕНИЛФОСФИНДИФТОРИД, (CBHr,)sPF2. Мол. вес 300,28,
т. пл. 134—142° (не совсем чистый). Вещество токсично.
Получение. Японские исследователи [1] получили этот реагент
по усовершенствованной ими методике, которую впервые описал
Смит [2]. Трифенилфосфин в бензоле нагревают в автоклаве с четы-
рехфтористой серой; выход 92,5%.
Получение алкилфторидов [1]. При взаимодействии реагента с
первичными и вторичными спиртами образуются соответствующие
алкилфториды; выходы, как правило, составляют от 50 до 70%.
1. 1< о b а у a s h i Y., A k a s h i С., Chem. Pliarm. Bull., 16, 1009 (1968).
2. S m i t h W. C., J. Am. Chem. Soc., 82, 6176 (1960).
бйс-(ТРИФЕНИЛФОСФИН)-ИРИДИЙ (HI) ТРИГИДРИД,
IrHJPfCuH;-,)..]].,. Мол. вес 731,79, т. пл. 184—185J (разл.).
Получение [1, 2].
447
Катализатор гидрирования [3]. Этот комплекс оказажя эффек-
тивным катализатором гомогенного гидрирования альдегидов в при-
сутствии уксусной кислоты.
l .ChattJ., Coffov ItS., Shaw В. L., J. Chem. Soc.., 1965, 7391.
2 . Vaska L., J. Am. Chem. Soc., 83, 756 (1961).
3. Coffey R. S., Chem. Comm., 1967, 923.
Дпг-(ТРИФ1НИЛФОСФИН)-НИКЕЛЬДИХЛОРИД,
:[(C6H5)3p]2NiCl2. Мол. вес 654,15, темно-голубые кристаллы.
Получение [I]. Реагент получают с выходом 84% при взаимо-
действии гексагидрата хлорида никеля с трифенилфосфином в ле-
дяной уксусной кислоте.
Реакция аллиловых спиртов с реактивом Гриньяра. В присутст-
вии каталитических количеств реагента взаимодействие «-пропил-
магнийбромида с аллиловыми спиртами приводит к смеси изомер-
ных олефинов [2], например:
ОН
= 1
НзС/^/^ОН НзС/^/д- Н3ОХ Нзс/Х-У + Н3с/\/
(1) 37% <3% 16%
(CHsCH2CH2,MgBr
ИЛИ----------
он
32% 2 0% 9% 32%
(2)
Интересно, что изомерные аллиловые спирты дают соответствую-
щие олефины в различных соотношениях. Если в молекуле гринь-
яровского реактива нет р-водородного атома, реакция осуществля-
ется с образованием С—С-связи 13]:
СН.3 = СНСН2ОН + CH3MgBr —СН2 = СНСН2СН3
СН2 = СНСН2ОН + C6HsCH2MgBr сн2 = СНСН2СН2С0Н5
C6H5CH-CHCH2OH+CHsMgBr —СвН5СН=СН2СН2СН3
Следующий пример показывает заметную тенденцию к образо-
ванию терминального олефина:
--- ZOH - СН3 /___________
< X -ECH3MgBr~x х +< >=к
х—/х—сн2 х----/Х=СН2 \--------Z %— сн3
1. Venanz i L. М., J. Chem. Soc., 1958, 719.
2. Felkin H., Swierczewsk i G., Compt. rend., 266 (C), 1611 (1968).
3. Chui t C., Felkin H., Frajerman C., Roussl G. Swierc-
zewski G., Chem. Comm., 1968, 1604.
/п/тлТРИФЕНИЛФОСФИНфРОДИИХЛОРИД (III, 415). Мол.
вес 952,20, т. пл. 140° (разл.).
448
Это твердое кристаллическое вещество существует в красной
и желтой формах, идентичных по своим химическим свойствам, но
отличающихся, по-видимому, только степенью раздробленности.
Растворимость комплекса при 25е в хлороформе и хлористом мети-
лене составляет около 20 г/л, в бензоле и толуоле — около 2 г/д,
в уксусной кислоте, ацетоне и низших алифатических спиртах раст-
воримость намного ниже. В и-гексане и циклогексане комплекс
практически нерастворим. Т. получают при взаимодействии RhCl3*
. ЗН2О в этаноле с шестикратным молярным избытком трифенилфос-
фина, выполняющего роль комплексующего и восстановительного
агента, который, кроме того, подавляет диссоциацию [1, 2].
Гомогенное каталитическое гидрирование. Уилкинсон и сотр.
Ц] обнаружили, что комплекс является активным катализатором
гидрирования в гомогенных растворах; особенно сильно ускоряется
восстановление алкенов и алкинов 12, 3]. Джерасси и Гутцвиллер
[4] получали комплекс различными методами и исследовали его
применение для гомогенного гидрирования стероидов. В присутст-
вии этого катализатора легко и с высоким выходом восстанавливает-
ся пространственно незатрудненная дизамещенная двойная связь:
Легко восстанавливается
Легко восстанавливаются также незатрудненные дизамещенные
сопряженные 1, 2-двойные связи А1-3-кетостероидов (а), однако
Р, р-дизамещенные сопряженные кетоны (б) в тех же условиях
в реакцию не вступают.
Легко
восстанавливается
(а)
(б)
Подобные наблюдения были сделаны Пайерсом и Ченгом [5]
в случае диенонового эфира (1). В указанном синтезе ожидалось
селективное восстановление дизамещенной 1, 2-двойной связи без
15 № [994
449
затрагивания триза.мещенной 4, 5-двойной связи. Результаты пред-
варительных исследований показали, что обычные методы гетеро-
генного каталитического гидрирования здесь непригодны, и авторы
обратились к новому методу гомогенного каталитического гидриро-
вания. Действительно, соединение (1) гладко восстанавливается
в бензоле в присутствии Т. и желаемый мононенасыщенный кетон
(2) получается с почти количественным выходом. Этот же катализа-
тор был с успехом использован для восстановления микроколичеств
ненасыщенных альдегидов в насыщенные [6].
В результате трудоемких исследований Брауп и Пижкевич [7]
впервые осуществили непрямое превращение эремофилона (1) в со-
единение (4). Селективным эпоксидированием эремофилона (1)
в щелочной среде получали соединение (2), затем избирательно
восстанавливали 13,14-двойиую связь; полученный продукт (3)
дезоксигенировали под действием хлористого хрома в уксусной
кислоте и получали 13, 14-дигидроэремофилон (4) с общим выходом
63%. В дальнейшем при гомогенном гидрировании с хлорродиевым
450
комплексом 13, 14-дигидрид (4) был получен с 94%-ным выходом.
Эти результаты согласуются с соотношением реакционной способ-
ности изолированных и сопряженных двойных связей, установлен-
ным Джерасси и Гутцвиллером [41 при восстановлении стероидов.
Гомогенное каталитическое гидрирование гексина-1 в смеси
этанол — бензол быстро завершается при давлении 1 атм и 0°
с образованием н-гексана [81. Прекращение восстановления до пол-
ного насыщения приводит к смеси гексена-1 и гексана.
Берч и Уолкер [9] показали, что в присутствии комплекса 1, 4-
нафтохинон восстанавливается до 1, 2, 3, 4-тетр аги др о-1, 4-диоксо-
нафталина. 1,4-Бензохинон сначала превращается в хингидрон.
Хиноны с высоким окислительным потенциалом вызывают разру-
шение катализатора.
Нитростирол в метилэтилкетоне восстанавливается до 1-фенил-
2-нптроэтана ПО]. Гидрирование проводят в круглодонной колбе
i(C9H5)sP]3RhCI
C6H5CH = CHNO„ + H, 2-1У2—CdH5CH2CH.,NO,
41% ‘
с магнитной мешалкой и тефлоновой чашечкой для катализатора
с держателем, укрепленным в боковом отводе. Систему трижды
промывают водородом с предварительной откачкой и чашечку с ка-
тализатором опускают в раствор. Когда катализатор растворится,
начинают пропускать водород. Гидрирование проводят при комнат-
ной температуре и начальном давлении водорода около 85 см в те-
чение около 90 час. Затем большую часть растворителя отгоняют
и катализатор осаждают, добавляя 30 мл петролейного эфира (60—
80°). Образующуюся суспензию пропускают через колонку с окисью
алюминия размером 2х 12 см и продукт элюируют 10 мл петролей-
ного эфира. Эфир отгоняют и продукт перегоняют, т. кип. 76—
7770,5 мм.
Деформилирование. Применение Т. представляет большие син-
тетические возможности, так как его можно использовать для эф-
фективного удаления защитной формильной группы. Шимизу,
Митсухаши и Каспи [11] разработали превращение соединения (1)
в формиленон (3), который затем необходимо было деформилиро-
вать. Авторы обнаружили, что формиленон (3) с высоким выходом
15*
451
превращается в (5) под действием Т. (4). Хроматографией реакцион-
ной смеси было показано наличие 17 р-окси-Д^б Р-андростенона-3
(5) и двух побочных продуктов: окиси трифенилфосфина (6) и жел-
того б/щ-(трифенилфосфин)-родийкарбонилхлорида (7).
Декарбонилирование [121. Алифатические альдегиды декарбо-
нил и руются до соответствующих углеводородов согласно следую-
щему уравнению:
RCHO-H(CcH5)3P]3RhCl —>
RH + ((CGH5)3P]aRhCl(CO)-p(CeH5)3P
Реакцию проводят при комнатной температуре или при кипячении
в бензоле или толуоле; выходы, как правило, составляют от 65 до
90%. Под действием Т. при относительно низких температурах
хлорангидриды ароматических кислот декарбонилируются до арил-
хлоридов (АгСОС!—* ArCl). Ацилгалогениды типа (1) превращаются
в олефины [131:
[(С6Н5)аР |а RhCI
С6Н5СН2СН.,СОС1 -^С6Н5СН ^снг
7 1 %
(I) (2)
Если образование олефина невозможно, получаются алкил- или
арилгалогениды.
Ангулярное метилирование. Даусон и Айрланд [141 разработали
стереоспецифический метод введения ангулярной метильной груп-
пы, основанный на декарбонилировании альдегида под действием 7.
/-Карвон (б) путем аннелирования и других подходящих реакций
превращали в аллиловый спирт (2). При введении ангулярного уг-
леводородного заместителя вместо получения винилового эфира и
последующей перегруппировки Клайзена авторы обратились к ме-
тодике с использованием ацеталя амида, введенной Эшенмозером
452
в 1964 г. и описанной в разделе Диметилацетамида ди этил а пета.ль
(I, 306). Амид (3) выделяли с низким выходом в виде масла и пре-
Н3СО^ /ОСП-,
ch3cn(ch3)2
, , Д,ксилол
СН(СН3)г 30%
(СН3)2К. К-Н,
и
° (3)
СН3
; jL 1) H,-Pd
> 2)ЫЛ1(ОС:Н5)гН2
JL JL *
СН(СШ2
вращали гидрированием и восстановлением под действием диэтокси-
алюмогидрида лития в кристаллический альдегид (4) с т. пл. 170—
173°. Кипячением альдегида (4) с родиевым комплексом в бензоле
в течение 22 час был получен в виде масла углеводород (5), в котором,
судя по ИК-спектру, отсутствует альдегидная группа, а по спектру
ЯМР появляется новая метильная группа.
Другие реакции. Блюм и сотр. [15] сообщают, что металлоорга-
нический комплекс вызывает декарбонилирование карбонильных
соединений и десульфонирование ароматических сульфохлоридов.
Авторами установлено, что при нагревании этилбензола, флуорена
и аценафтена (порции по 20 г) с 100 мг родиевого комплекса при 130°
в течение 5 час эти соединения окисляются на 10—60% до ацетофе-
нона, флуоренона и аценафтенона соответственно.
Берч 116] обнаружил, что тетралин (1) в бензоле в присутствии
комплекса (5% по весу) окисляется воздухом до спирта (2), выход
которого составляет 48%, а 40% исходного вещества возвращается
453
в неизмененном виде. В отсутствие растворителя при температуре
паровой бани с 40%-ным выходом образуется кетон (3) и возвраща-
ется значительная часть (1). Кетон (3) представляет интерес как
ключевое промежуточное соединение в полном промышленном син-
тезе эстрона.
Комплекс катализирует изомеризацию 1, 4-диенов в 1,3-диены,
реакцию лучше всего проводить в кипящем хлороформе (2 час,
1 вес. % катализатора) 117].
1. О s b о г n J. A., Wilkinson G.} Inorg. Syn., 10, 67 (1967),
2. Young J. F.t Osborn J. A., Jardine F. H., Wilkinson G.,
Chem. Comm., 1965, 131; Osborn J. A., Jardine F. H., YoungJ. F.,
Wilkinson G., J. Chem. Soc., (A), 1966, 1711.
3. Bennet t M. A., L о n g s t a f f P. A., Chem. Ind., 1965, 846.
4. D j e r a s s i C., G u I z w i 11 er J., J. Am. Chem. Soc., 88, 4537 (1966).
5. P i e г s E,,Cheng K. F., Can. J. Chem.. 46, 377 (1968).
6. J ardine F. H., W i 1 k i n s о n G., J, Chem. Soc., (C), 1967, 270.
7. Brown M-, P Iszkiewicz L. W., J. Org. Chem., 32, 2013 (1967).
8. J a r d i n e F. H., Osborn J. A., W i 1 k i n s о n G., Y о n n g J. F.„
Chem. Ind., 1965, 560.
9. Birch A. J., Walker K, A. M., Tetrahedron Letters, 3457 (1967).
10. J a r d i n e F. FL, procedure submitted to Org. Syn. (1968).
11. S h i m i z u Y., M i t s u h a s h i FL, C a s p i E-, Tetrahedron Letters, 4113
(1966).
12. T s u j i J., Ohno K., Tetrahedron Letters, 3969 (1965); 2173 (1967); J. Am.
Chem. Soc., 88, 3452 (1966); Ohno К,, T s u j i J., J. Am. Chem. Soc., 90, 99
(1968).
13. Blum J., Tetrahedron Letters, 1605 (1966); BlumJ., Oppenheimer
E., Bergmann E. D., J. Am. Chem. Soc., 89, 2338 (1967).
14, D a w s о n D. J., Ireland R. E.. Tetrahedron Letters, 1899 (1968).
15. В 1 u m J., R о s e n m a n FL, Bergmann E. D., Tetrahedron Letters,
3665 (1967).
16. В i r c h A. J., S u b b a Rao G. S. R., Tetrahedron Letters, 2917 (1968).
17. В i r c h A. J., S u b b a Rao G. S. R., Tetrahedron Letters, 3797 (1968).
трас (ТРИФЕНИЛФОСФИН) РУТЕНИЙДИХЛОРИД,
l(C6H,hPl3R LiCl,.
Реагент получают in situ в эфире из трифенилфосфина и RuCl3.
454
Применение. Комплекс является эффективным катализатором
гомогенного гидрирования ацетиленов до цис-олефинов [1].
1. Jardine I., М с Q u i 1 1 i n F. J., Tetrahedron Letters, 4871 (1966).
ТРИФЕНИЛФОСФИН — УГЛЕРОД ЧЕТЫРЕХХЛОРИСТЫЙ
(III, 415—416, перед ссылками).
Широкое применение реагента в химии углеводов обусловлено,
в частности, тем, что к его действию устойчивы группы, обычно
используемые для защиты углеводов (апетальная, эфирная, слож-
ноэфирная) [3].
Н3С. 70—СН2
/с\
Н3С/ 'О—СНСН2ОН
(С(.нд,р^сс14 Н3С .0—СН2
—----:----* /Cz I
80% НД ЧО—СНСН„С1
Реагент является эффективным средством замещения гидро-
ксильной группы на хлор в эфирах оксикарбоновых кислот 14].
При использовании четырехбромистого углерода при этом образу-
ются соответствующие бромэфиры. Замещение осуществляется
с инверсией. Метод применим к пространственно затрудненным
а-оксиэфирам. Хуз и Гилани [5] установили, что реакция ускоряет-
ся, если вместо трифен и л фосфина использовать три-я-октилфосфин.
При кипячении с трифенилфосфином, СС14, ДМСО и цианистым
натрием первичные и вторичные спирты превращаются в нитрилы
16]. К смеси нонанола-2, СС14 и трифенилфосфина после непродол-
жительного кипячения добавляют ДМСО, отгоняют летучие продук-
CH3(CH3)6CHCH3 + (CGH6)3P + CCl4+NaCN CH3(CH2)BCHCHS
। /и/0 !
ОН CN
ты до тех пор, пока температура не поднимется до 90°, затем добав-
ляют цианистый’натрий и раствор кипятят при перемешивании еще
2 час. Охлажденный раствор выливают в водный раствор сульфата
железа(П) со льдом, экстрагируют хлороформом, перегоняют и
получают нитрил 2-метилпеларгоновой кислоты. Эту реакцию
можно использовать для введения первичной аминогруппы в угле-
воды через соответствующие нитрилы:
Восстанов-
ление
--------
ОАс
В некоторых случаях [7] возникают затруднения при отделении
алкилхлоридов от окиси трифенилфосфина. При этом трифенил-
фосфин можно заменить на трис-(диметиламид) фосфористой кис-
лоты, который превращается в 1(CH3)2N]3PO.
455
3. Lee J. В,, Nolan T. J., Can. J. Chem., 44, 1331 (1966); Tetrahedron, 23,
2789 (1967).
4. Lee ,1. B., D о w n i e I. AL, Tetrahedron, 23, 359 (1967),
5. H о о z .1., G i ] a n i S. S. H., Can. J. Chem., 46, 86 (1968),
6, В г e t t D,, D о w n i e 1. M., L e e ,1. B., J. Org. Chem,, 32, 855 (1967).
7. D о w n i e 1. M., Lee J. B,, Matough 51. F. S., Chem, Comm., 1968,
1350.
£шс-(ТРИФЕНИЛФОСФИН)-ХЛОРКАРБОНИЛРОДИЙ,
[P(C6Hs)3l2Ph(CO)Cl. Мол. вес 459,63.
Реагент является эффективным катализатором декарбонилиро-
вания ароилгалогенидов до ар ил галогенидов [1]. См. также трис-
(Трифенилфосфин)-родийхлорид (V, 448).
1. Tsuji J,, Oh по К., Tetrahedron Letters, 4713 (1966).
ТРИФЕНИЛФОСФИТ * (III, 416, перед ссылками).
Райдон [4] подробно описал две методики, одна из которых (А)
является наиболее простой и эффективной для стерически затруд-
ненных спиртов (например, неопентилового спирта), а другая (Б)
предпочтительна в случае неустойчивых спиртов.
4, R у d о п Н. N., procedure submitted to Org. Syn. (1967).
ТРИФЕНИЛФОСФИТА ДИБРОМИД (HI, 416, ссылка [1]).
Последующая работа: Black D. K.t Landor S. R., Patel
A. N., Whiter P. F., J. Chem. Soc., (C) 1967, 2260.
ТРИФЕНИЛФОСФИТА ИОДМЕТИЛАТ (HI, 416—417). До-
полнение. См. также; Verhey den J. P. H., M о f f a t J. G.
J. Am. Chem. Soc., 88, 5684 (1966).
ТРИФЕНИЛХЛОРМЕТАН (III, 417-419, после формулы (7)].
Лерфельд [6a] обнаружил, что в случае производных углеводов
трифенилметильная защитная группа отщепляется с высоким выхо-
дом под действием некоторых сортов продажного силикагеля. На-
пример, раствор 1 г метил-2, 3, 4-три-0-ацетил-6-0-тритил-а-о -глю-
* При взаимодействии реагента с циклопропиллитием получен трициклопро-
пилфосфин, который отличается пониженной основностью [рКа: (>—)3Р 7,60;
(\ /)з^Э,70; (^_/)3Р 2,73] и в отличие от низших триалкилфосфинов не
горит на воздухе [Denney D. В., G г о s s F. J., J. Org. Chem., 32, 2445
(1967)]. —Прим, ped.
456
копиранозида (1) в 8 мл бензола заливают в колонку, наполненную
100г силикагеля (Davison grade 12, степень активности I). В колон-
ку добавляют еще 170 мл бензола, выдерживают 16 час при комнат-
ной температуре и затем элюируют 600 мл 10%-кого раствора
этилацетата в бензоле. Тонкослойная хроматограмма элюата указы-
вает на наличие трифенил карбинола и следов исходного вещества.
Затем продукт элюируют 600 мл 25?6 -пого раствора метанола в этил-
ацетате. Растворитель удаляют на роторном испарителе и остаток
высушивают в вакуум-эксикаторе. Получают 553 мг (98%) вещества,
которое растворяют в небольшом количестве эфира и добавляют
гексан до помутнения. В течение ночи на холоду из раствора выпа-
дают иглоподобные кристаллы (81%).
6а. Lehr tel d J., J. Org. Chem., 32, 2544 (1967).
ТРИФТОРМЕТИЛГИПОФТОРИТ, CF3OF. Мол. вес 88,01; газ.
Получение [11. Т. получают при обработке метанола или окиси
углерода дифторидом серебра и фтором *.
Применение. В предварительном сообщении 121 впервые пока-
зано, что Т. гладко реагирует с виниловым эфиром (1а) и енамином
(16) в CFC13 при —75° с образованием в обоих случаях 2а-фторхоле-
станона-3 (2).
(16) R = —N
* Другие способы получения: а) окисление метана дифторидом кислорода
[М а г a n t z L. В., J. Org. Chem., 30, 4380 (1965)]; б) действие фтора в присутст-
вии CsF па фосген или дифторфосген [J. Am. Chem. Soc., 88, 4531 (1966)]. Извест-
ны также высшие перфторалкилгипофториты (Lustig М., Р i t о с h е 1 1 1
A. R,, R u f f J. К., J. Am. Chem. Soc., 89, 2841 (1967)]
CF3COF CF3CF.2OF (96%)
(CF3)2C0£rC-f! (CF3)aCFOF (98%)
а также чрезвычайно термически устойчивые перфторалкилгипохлориты
(Gould D. Е., Anderson L. R,, Young D. Е., Fox W- В., Chem.
Comm., 1968, 1564]
CIF, CsF
COFa --------CF^OCl (т. кип. —47°),
-20°
GIF, CsF
(CF3).,CO ——> (CF3).2CFOC1
— Прим, ped,
457
Другим примером использования Т. является взаимодействие
с метиловым эфиром эстрона (3), приводящее к 10 ^-фтор-19-норан-
дростадиен-1,4-диону-3,17 (4) * * [3].
Гз4 Ф
1. К е 1 I о g g К. CL, Cady G. Н., J. Ага, Chem. Soc,, 70, 3986 (1948),
2. В а г t о n D. H. R., God in h о L. S., Hesse R. H., P e c h c t M. M.,
Chem. Comm., 1968, 804.
3. Barton D. H. I?., Ganguly A. K., Hesse R, H., Loo S. N., P e-
c h e t M. M., Chem. Comm., 1968, 806.
ТРИФТОРНАДУКСУСНАЯ КИСЛОТА (III, 422—431).
Пагано и Эммонс На] описывают методику окисления 2, 6-ди-
хлоранилнна до 2, 6-дихлорнитробензола, согласно которой к хло-
nh2 no2
CL I ,C1 CL ,С1
I || 90%-ная НЮ,, (CF;,CO)ZO, СНгС1, । ||
рпстому метилену без перемешивания добавляют перекись водорода
(90%-ную), затем к двухслойной системе при перемешивании и
охлаждении льдом медленно добавляют трифторуксусный ангидрид.
Перемешивание продолжают при комнатной температуре в течение
30 мин и добавляют по каплям раствор 2, б-дихлоранилина; в ре-
зультате экзотермической реакции смесь разогревается до кипения.
Затем добавляют воду, органический слой отделяют, промывают,
высушивают и удаляют растворитель. После кристаллизации остат-
ка получают светло-желтый продукт, т. пл. 68—70°.
(HI, 429.) Поправка. В формуле (4) не хватает одной метильной
группы. Должно быть:
О
/\/СНз
II 1ЧсНз
_ _____ сн3
* В обзоре по новым методам специфического фторирования стероидов и
углеводов под действием Т. [Barton D. Н. R., Puce and Appl. Chem., 21, № 2,
285 (19/0)1 описана реакция Т. с дифенил ацетиленом с образованием PhCF2CFx
X(OCFs)Ph и стереоспецифическое присоединение Т. к /щс- и тракс-стильбенаы.—
Прим. ред.
458
Т. к.— бора трифторид (III, 429—430, после выдержки из 1131).
Харт и Лернер [13а] обнаружили, что под действием Т. к. алкены
окисляются непосредственно до кетонов. Предполагается, что реак-
ция включает атаку двойной связи ОН + с образованием карбкатио-
на и последующую миграцию гидрид-иона, приводящую к кетону:
о
Нч ЛНз
>с=с<
н3с/ хсн3
ОН -1
I +
н —с —с —сн3
Jh3 chs
СН3ССН(СН3)2
Другие примеры этой реакции описаны в [136].
la. Pagano A, S,, Emmons W. D., procedure submitted to Org. Syn.
13. Add: HartH, LangeR. AL, Collins P. AL, Org. Syn., 48, 87 (1968).
13a. Hart H., Lerner L. R., J. Org. Chem., 32, 2669 (1967).
136. Hart H., Lange R. AL, J. Org. Chem., 31, 3776 (1966); С о 1 1 i n s P. Al.,
H a r t H., J. Chem. Soc., (C), 1967, 895; H a r t H., Murray R. K., Jr.,
J. Org. Chem., 32, 2448 (1967).
ТРИФТОРУКСУСНАЯ КИСЛОТА (III, 432—434).
Конденсация с последующей циклизацией (III, 432—433, в конце
раздела). Одностадийный синтез флавонов осуществляется конден-
сацией фенола с малоновой кислотой в присутствии Т. к. [За].
Он О
I 'I
/\ носч
I II + +
но/"^/ , со,н
CFSCOOH
100%
Конденсация этан-1,2-дитиола (III, 434, перед ссылками).
Поданным Коффена [13] Т. к. является прекрасным реагентом для
конденсации кетонов с этандитиолом, которая приводит к этилен-
тиокеталям. Автор установил также, что в отсутствие карбониль-
ного соединения Т. к. конденсируется с этандитиолом и с высоким
выходом образуются кристаллические ортотиоэфиры.
.сн, sh
HS-^ Кипяч.
cf3CO2H^
HSL / 89%
^СН.2
Т. ПЛ, 85°
459
Расщепление эпоксидов. Было показано 114], что эпоксид (1) при
обработке Т. к. превращается в 16-метилен-17 а-оксипроизводное
(2).
Гидролиз ацетальных групп. Под действием 90%-ной (по объему)
водной Т. к. ацетальные группы сахаров и нуклеозидов гидроли-
зуются при комнатной температуре в течение 5—10 мин. Уксусная
кислота для этой цели непригодна 1151.
За, Woods L, L., S а р р J., J. Org. Chem., 29, 3445 (1964).
13. С о f f е n D, L., Chem, Comm., 1967, 1089.
14. T a u b D., Hof fsommer R. D,, Wendler N. L,, J. Org, Chem.,
29, 3486 (1964).
15. С r i s t e n s e n J. E., Goodman L., Carbohydrate Res., 7, 510 (1968).
ТРИХЛОРАЦЕТИЛИЗОЦИАНАТ, CC13CONCO. Мол. вес 188,40,
т. кип. 80—855
Получение [11.
СС13С-МНг . ICOClh
-HCi
о о
II II
o-c-c-ci
.1
CC13C=NH
о—с—о
—»cci3'i с—о
о
CC13C—N==C=O
Идентификация спиртов. Взаимодействие T. со спиртами завер-
шается за несколько минут с образованием карбаматов, по ЯМР-
спектрам которых можно определить, являлся ли спирт первичным,
вторичным или третичным [2]. В случае третичных спиртов исчезает
О
CC1.{C-N = C = O —2L CC13C-N-C-OR
о он
сигнал, соответствующий гидроксильному протону, и появляется
пик NH. Вторичные и первичные спирты можно различить, измеряя
площадь сигналов, смещающихся в слабое поле, и таким образом
460
определяя число атомов водорода в a-положении к гидроксильной
группе.
Этот метод применим к стероидным спиртам, даже к II |3- и 17 а-
гидроксильиым группам [3]. При сравнении спектров ЯМР до и
после добавления Т. можно получить некоторую информацию об
окружении гидроксильной группы. Аллиловые спирты легко отли-
чить по сдвигу в слабое ноле винильных протонов в ^-положении
к гидроксильной группе.
1. S р е z i а 1 е A. J., S m i t h L. R,, J. Org. Chem., 27, 3742 (1962).
2. G о о d 1 c t t V. W., Anal. Chem., 37, 431 (1965).
3. Tr eh a n 1. R,, Alonder С., В ose A. K., Tetrahedron Letters, 67 (1968).
ТРИХЛОРИЗОЦИАНУРОВАЯ КИСЛОТА (трихлорфульмину-
ровая кислота), (1). Мол. вес 232,42, т. пл. 145°.
Получение [1!.
С1
КО\А/ОК .
] JI -L зс13 —I | + зкс1
N N 90% CLN NCI
Y V
ок о
(1)
Превращение простых эфиров в сложные [2]. Под действием Т. к.
в присутствии избытка воды простые эфиры типа RCH.,OR' превра-
щаются в эфиры карбоновых кислот. Бензилэтиловый эфир превра«
сн3сн2ос3н5 сн3соос3н5
щается главным образом в бензальдегид.
1. Smolin Е. М., Rapoport L., «s-Trfazine and Derivatives», 391, Inter-
science, New York, 1959.
2. J uenge E. C., Beal D. A., Tetrahedron Letters, 5819 (1968).
ТРИХЛОРУКСУСНАЯ КИСЛОТА (HI, 446, перед ссылками).
При взаимодействии Т. к. с циклическим енамином N-1-цикло-
гексен ил морфолином в дихлорэтане отщепляется двуокись углерода
и образуется №П-(трихлор.метил)-циклогексил]-морфолин, который
при гидролизе дает 1-циклогексенкарбоновую кислоту 131.
461
3. A I t G. H., Speziale A, J., J. Org. Chem., 31, 1340 (1967); procedure sub-
mitted to Org. Syn. (1967).
ТРИХЛОРУКСУСНОЙ КИСЛОТЫ НАТРИЕВАЯ СОЛЬ (III,
446—448).
Получение дихлоркарбена (Ill, 447—448). Пир и Шорс [71
показали, что при взаимодействии аллена (1) с дихлоркарбеном,
полученным из хлороформа и zn/wz-бутилата калия, образуется
только смола; однако реакция с дихлоркарбеном, полученным из
Т. к. н. с. в нейтральной среде, приводит к 2,2-дихлорметилен-
циклопропану (2) с выходом около 20%. Эта реакция послужила
первой стадией в синтезе диспиро-[2, 0, 2, 2]-октена-7 (6) [8]. При
снг=с=снг -i-9ciz
20%
СН2—С——— СНг ci Длительное
_7 1 награвдние
С Iх С1 Количеств. ' Х.С1 Количеств. ’
0) (2) (3)
Zn-C2H5OH
(4)
щ Na—ТГФ
трет -ВиОН
С1 80%
(6)
нагревании в течение часа при 215° соединение (2) количественно
перегруппировывается в дихлорметилепциклопропан (3); более
продолжительное нагревание приводит к 7, 7, 8, 8-тетрахлордиспи-
ро-[2, 0, 2, 2]-октану (4) также с количественным выходом. Дехло-
рирование в (5) осуществляется при обработке соединения (4) цин-
ком в этаноле; оставшиеся два атома хлора в (5) восстанавливают
натрием в смеси ТГФ—mpm-бутанол с образованием соединения (6).
Трихлорметилирование (перед ссылками). Альдегиды и хлоран-
гидриды кислот также подвергаются трихлорметилированию [91.
CCI3COONa
сен0сно ———> сен5снон
•J V /0 |
СС13
CClaCOONa
СН3СОС1 ---------> СН3С = О
20% d |
CCI,
7, Р е е г Н. G., S с h о г s A., Rec. trav,, 86, 161 (1967),
8. D о 1 b i e r W. R., Jr., LomasD., Tarrant P., J. Am. Chem. Soc.,
90, 3594 (1968).
9. Winston A., Sharp J. C., AtkinsK.E., В a 11 i n D. E,, J. Org.
Chem., 32, 2166 (1967).
бис-(2,2,2-ТРИХЛОРЭТИЛ) ХЛОРФОСФАТ, (C13CCH2O)2POC1.
Мол. вес 379,24, т. пл. 37—42°.
462
Т. получают реакцией 2, 2, 2-трихлорэтанола с хлорокисью фос-
фора по аналогии с синтезом бис-(2, 2, 2-трифторэтил)-хлорфосфата
Ill.
Т. взаимодействует с защищенными нуклеозидами, давая 5'-бис-
(2, 2, 2-трихлорэтил)-фосфаты, которые при обработке цинковой
пылью в смеси пиридин — вода (9: 1) расщепляются до нуклеозид-
б'-фосфатов |2].
9 0-9 5%
НО R
1. Houben-Weyl, Organische Phosphorovcrbindungen, Part 2, Vcrlag Thieme,
Stuttgart, 1964, p, 276.
2. Eckstein F., S c li e i t К.-H., Angew. Chenb, Internal. Ed., 6, 362 (1967);
Fran ke A.,Schei t К.-H., Eckstein F.( Chem. Ber., 101, 2998 (1968).
ТРИЭТИЛАЛЮМИНИЙ (HI, 450—451).
Присоединение HCN (III, 450—451). На одной из стадий полного
синтеза d, Татизина Нагата и сотр. [За] пытались осуществить со-
пряженное присоединение цианистого водорода к промежуточному
соединению (1). Использование цианистого калия и хлористого ам-
мония в ДМФА не привело к успеху. С помощью Т. и цианистого
водорода желаемый циан кетон был получен в сыром виде с выходом
лишь 11%. Тогда авторы использовали вместо Т. менее основный
диэтилалюминийхлорид и получили кристаллическую смесь эпи-
меров (2) и (3) с выходом 72—75%.
Подробно описано [36] гидроцианирование 3 fJ-ацетокси-Д5-
холестенона-7 в 3 р-ацетоксн-5 а-иианхолестанои-7. В этом случае
463
реакция в высокой степени стереоспецифична.
(СаН5)3А1 “HCN
______ТГФ1______
92, 5%
см
За. Nagata \V., Sugasa wa Т., N ar isa d а М., Wa kabay ash i T.,
Hayasc Y., J. Am. Chem. Soc., 89, 1483 (1967).
36, Nagata W., Yoshioka M., procedure submitted to Org. Syn. (1969).
ТРИЭТИЛАМИН (HI, 451—458).
Очистка. Бреслоу и Познер [Org. Syn,, 47, 62 (1967)1 рекомен-
дуют очищать продажный Т. с отделением первичного и вторичного
аминов и воды либо перегонкой с уксусным ангидридом, а затем
над окисью бария, либо реакцией с фенилизоцианатом. Роджерс
мл., Альберс и Де Тар рекомендуют кипячение с фталевым ангидри-
дом с последующей перегонкой (методика представлена в Org. Syn.).
Синтез ангидридов (III, 452—453, в конце раздела). По методу
Риндеркнехта и Гутенштейна [Org. Syn., 47, 89 (1967)] суспензию
никотиновой кислоты при перемешивании обрабатывают холодным
12,5%-ным раствором фосгена в бензоле при 5е в присутствии Т.
О О
Смесь доводят до комнатной температуры (45 мин}, нагревают до
кипения и хлор гидр ат Т. отфильтровывают с отсасыванием. Нико-
тиновый ангидрид достаточно высокой степени чистоты выделяют
из бензольного раствора несколькими порциями, выход достигает
93%.
Синтез смешанного ангидрида иллюстрируется на примере полу-
чения n-нитрофенилового эфира карбобензокси-Ь-серилглицина по
методу Де Тара (цитировано выше).
Дегидрогалогенирование (III, 456, выдержка из [161, после пер-
вого уравнения). Поправка. В реакции, приведенной в [16], дициан-
карбен, по-видимому, не образуется, Больдт и сотр, [16а] обнару-
жили, что инициированная светом реакция броммалопонитпила
464
с тетраметилэтиленом приводит к образованию при комнатной тем-
пературе аддукта (3) с практически количественным выходом. При
обработке аддукта Т. отщепляется бромистый водород и образуется
производное циклопропана (4).
>(CN)2
ВЫ
СН3 снэ
СН3Х ХСН,
NC^ СК
Вг СН
н3с-с-(!:-сн3
Н3С сн3
(C2HS)3N
ЛИЗ г >
NC СК
+
(1) (2)
(3) (4)
Бреслоу и Познер (цитировано выше) приводят подробную ме-
тодику превращения а, а'-дибромдибензил кетон а в дифенилцикло-
пропенон [17].
Описан простой способ получения у-кротолактона [(7), А“,?-
бутенолида] [18а]. Винилуксусную кислоту (5) превращают в ди-
СН2=СНСН2СООН -ВГг> СНДС1Д> CH2BrCHBrCH2COOH chci3> Г 1
93, 5% (сырого) 54% (оЗщ,ИЙ)
(5)
(6)
бромид (6) и сырой продукт кипятят в хлороформе с избытком Т.
Отщепление бромистого водорода и лактонизация приводят к соеди-
нению (7) с общим выходом 54%.
Межмолекулярное дегидрогалогенирование (1П, 457, перед
ссылками). К раствору хлорангидрида циклогексанкарбоновой
кислоты в бензоле при перемешивании в атмосфере азота добавляют
Т. и смесь нагревают с обратным холодильником в течение ночи [24].
Хлоргидрат амина отфильтровывают, бензольный раствор про-
мывают разб. соляной кислотой и водой, высушивают и упаривают.
О, 205 МОЛЯ
В 250мл бензола
О,35моля (C2H5)3N
49 - 58% '
_ДиспирО-/5,1, 5,1/н'Тетра-
декандион-7Д4
Остаток кристаллизуют из смеси лигроин — этанол и получают
чистый диспироциклодикетон, т. пл. 161—162Х
Гидрогенолиз. При удалении галогена из органической молекулы
путем гидрогенолиза образующийся галогеноводород необходимо
нейтрализовать, так как он отравляет катализатор. Рейнеке [25]
показал, что в ряде случаев для нейтрализации лучше использо-
463
вать Т., а не едкий натр. Оверберджер и Кем [26] нашли, что указан-
О О
I ,СН3 /хедСИз
| [\CHCl.2CH,OH-Et.,iN | |\сн
1^/1 Pd,c-H2 ’ 1^ J 3
(1) (3)
ные на схеме условия являются оптимальными для гидрогенолиза
сс-бромлактона (3).
(3)
Ориентация ароматического замещения. Пирсон [271 исследовал
различные случаи направленной ориентации замещения с целью
получения единственного изомера. В примере, приведенном в томе I
(стр. 52—53), рассмотрено бромирование ацетофенона, опи-
санное Пирсоном как «эффект избытка катализатора». При
бромировании фенола гш/дызамещение обычно преобладает над орто-
замещением. Однако если реакцию проводить при —70° в присутст-
вии спльноосновного алифатического амина, содержание ирто-
изомера значительно возрастает [28]. По лучшей методике к холод-
ному раствору шрт-бутиламина в толуоле добавляют бром и после
охлаждения приблизительно до — 70э смесь быстро обрабатывают
фенолом, добавляя его по каплям. Под действием 1 же брома фенол
превращается в 2-бромфенол с выходом 60%, а при обработке 2 же
брома — в 2,6-дибромфенол с 87%-ным выходом. Третичные амины,
например ДАБЦО и Т., также ускоряют ф/шьбромирование фено-
лов. В тех же условиях при хлорировании образуется смесь о- и
и-хлорфеиолов в соотношении 2:1.
16а. Boldt Р., S с Ii u 1 z L., Е t zem ii 1 1 er J., Chem. Вег., 100, 1281 (1967).
18а. Fra n с k - Neumann Al., Berger С., Bull. soc. chim, France, 1968,
4067.
24. T u rro N. J., Leerniaker s P. A., Vesley G. F., Org. Svn., 47,
34 (1967).
25. R e i n ec ke ALG., J. Org. Chem., 29, 299 (1964).
26. Overbcrger C. G., К а у e H., J. Am. Chem. Soc., 89, 5640 (1967).
27. Person D. E.. J. Tenn. Acad. Sci., 40, 97 (1967).
28. Pearson D. E., Wvsong R. D,, Bredcr С. V,, J. Org. Chem., 32,
2358 (1967).
ТРИЭТИЛЕНДИАМИН (IH, 458).
Это название устарело; теперь, как правило, реагент называют
1, 4-диазабицикло-[2, 2, 2[-октан (см. этот том).
466
ТРИЭТИЛОКСОНИЯ БОРФТОРИД (III, 459—461) (триметилок-
со и и я борфторид, III, 382).
Восстановление N-моно и N-дизамещенных амидов 18] (перед
ссылками). При обработке амида (1) реагентом в хлористом мети-
лене получается с прекрасным выходом соль иминоэфира (2). Для
восстановления иминоэфира (2) в амин (3) хлористый метилен уда-
ляют при пониженном давлении, остаток растворяют в абсолютном
О ОС2Н5
|! ZR' (C3Hs)3O + BF4 I + ZR' NaBH4 ZR'
C-N< —------------>RC=N< BF7 —RCH2N<
CHeCI2 XR" ЕЮН (3) \R»
(1)
этаноле и обрабатывают избытком бор гидрида натрия при 0—25°.
Общий выход составляет 81—94%.
C6H6CONH,
(4)
ОС2Н5
(С2НЩО+BF7 j NaBH4
----------tC6H,C = NH ------>C6H5C s N
(5) 3»-60% %,
| (EtONa), 60°, 1 час
95%
При попытке восстановления иминоэфира (5), полученного из
незамещенного амида (4), образовался соответствующий нитрил
(6) с общим выходом от 30 до 60%.
Алкилирование сульфидов. Выясняя возможную роль сульфо-
ниевых илидов в конденсации аллильных остатков, приводящей
к сквалену и родственным терпенам, Болдвин и сотр. 19] исследова-
ли алкилирование сульфида (1). Единственным продуктом была сим-
метричная соль (2). Затем авторы использовали менее затрудненный
Jc2h5)3o+bf4'
* СЙ2С12
(CH3)3O+BF4'
ch3no2
(5)
467
реагент — борфторид триметилоксония в нитрометане — и полу-
чили, как и ожидалось, соль (3). При обработке н-бути л литием эта
соль перегруппировывается в соединение (4), восстановление кото-
рого натрием в жидком аммиаке приводит к скваленоподобному
углеводороду (5). Десульфуризация аллильных сульфидов никелем
Ренея дает сложную смесь продуктов.
О-Алкилирование енолят-ионов под действием Т. б. в полярных
апротонных растворителях (1,2-диметоксиэтан) осуществляется
в незначительной степени, однако в ДМСО или ДМФА эта реакция
становится главной [10].
Дезацетилирование. N-ацетильные группы ацетамидодезоксиса-
харов избирательно отщепляются в мягких условиях под действием
Т. б. с последующим гидролизом промежуточной соли иминоэфира
[11]. Сложиоэфирные, ацетальные и гликозидные группы при этом
не затрагиваются.
8. В о г с h R. F., Tetrahedron Letters, 61 (1968).
9. В a I d w i n J. Е., Hackles R.E., Kelly D. P., J. Am. Chem. Soc.,
90, 4758 (1968).
10. HeiszwolfG.J., Kloosterziel H., Chem, Comm., 1966, 51.
11. HanessianS,, Tetrahedron Letters, 1549 (1967).
ТРИЭТИЛСИЛАН (III, 461—462, перед ссылками).
Петтит и сотр. 14] описали пример отщепления карбобензокси-
группы под действием Т. и хлористого палладия в присутствии
триэтиламина; выход 70%. При гидрогенолизе выход несколько
ниже (60%), а при сольволизе трифторуксусной кислотой — лишь
22%.
4. Pettit G.R., SmlthR.L., Das Gupta A. K-, Occolowitz
J. L., Can. J. Chem., 45, 501 (1966).
ТРИЭТИЛФОСФИТ (HI, 463—469).
Фосфонатная модификация (III, 464, в конце первого раздела).
транс-3-Азастильбен успешно получается по фосфоиатной модифи-
468
кации реакции Виттига [4а]:
Восстановление гидроперекисей (III, 465). Оригинальная мето-
дика (I, 160) превращения стероидных С.,0-кетонов в 17 а-окси-20-
кетоны включала две стадии: автоокисление в присутствии трет-
бутилата калия и восстановление образующейся 17 «-гидроперекиси
цинковой пылью в уксусной кислоте. Гарднер и сотр. [8а], приме-
нившие эту реакцию, получили лишь 22%-ный выход и поэтому ис-
следовали возможность применения другого известного к тому вре-
мени метода восстановления гидроперекисей триалкилфосфитами.
В результате был разработан одностадийный метод: автоокисление
в присутствии Т. и гидрида натрия в качестве основания в смеси
ДМФА — mpem-бутанол при температуре от —20 до —25°. Выходы
продукта составляют в среднем 60—70%. Этот метод был исполь-
зован также в случае Д115-лрегненонов-20 (1); при этом образуется
несколько продуктов, главными из которых являются (2) и (3), по-
лученные, однако, с невысоким выходом.
(2)
Реакция с аскаридолом. Природная эндо-перекись аскаридол (1)
при нагревании с Т. при 160—170° образует ц-цимол (2) [86]. Это
(2)
469
превращение впервые было осуществлено Хорнером [8в] под дейст-
вием триэтилфосфина; однако считалось, что продукт реакции яв-
ляется п-А'2-ментеноксидом-1,4, образующимся при отщеплении
одного атома кислорода.
, Восстановление азотистых соединений (III, 467—463).Поправка.
Название соединения (2) — 2-н-метоксифенилиндазол.
Описано получение этим методом 2-фенилиндазола [23а].
Смолинский и Фойер [26а! полагают, что дезоксигенирование
ароматических нитросоединений осуществляется в две стадии,
включающие восстановление до нитрозосоединения, а затем до
нитрена:
-Й-б
P(OEt)3
г :P(OEt)3
—N: [+(EtO)jPO] ------------
•’О
---* (Ею)эро3
с>
Обзор [266].
4а. V i 1 1 a n i Г. J., Mann Т. A., procedure submitted to Org. Syn. (1967).
8a. G a r d n er J, N,, Carlon F. E., GnojO., J. Org. Chem., 33, 3294
(1968); Gardner J. N., Pop per T. L., Car Ion F. E., GnojO.,
Herzog H. L., J. Org. Chem., 33, 3695 (1968).
86. Kametani T., Ogasawara K., Chem. Ind., 1968, 1772.
8b. Horner L., J urge lei t W., Ann., 591, 138 (1955).
23a. Cadogan J. I.G., Mackie R. K., Org. Syn., 48, 113 (1968).
26a. S m о 1 insky G., Feuer В. I., J. Org. Chem., 31, 3882 (1966).
266. C a d о g a ii J. I. G., Quart. Rev., 22, 222 (1968).
УГЛЕРОДА ОКИСЬ, СО. Мол. вес 28,01, т. кип. —191,5°.
Взаимодействие с трналкнлборанами *. У. о. взаимодействует с
триалкилбораном, полученным in situ в диглиме, при 100° и атмо-
сферном давлении. Промежуточное борорганическое соединение
окисляют перекисью водорода до триалкилкарбинола с прекрасным
выходом [1]. Таким образом можно легко получить трет-карбинолы
с сильно разветвленными алкильными группами, которые трудно
СО; Н,02 /Z
80% 41 I j
(общий) 3
сон
доступны через реактивы Гриньяра. В присутствии небольших
количеств воды миграция третьей алкильной группы от бора к угле-
роду затрудняется и в результате образуется диалкилкетон:
н2о
R3B-LCO~
fRB —CR,"
i I
ОН он _
444 2RoC = 0
NaOH
В присутствии боргидрида натрия или лития реакция У. о.
с триалкилборанами приводит к образованию гомологичного спир-
та [2].
1) NaBH4
2) КОН
R3B~yCO~—— - RCH3OH
1. Brown Н. С., Rathke М, W., J. Am. Chem, Soc., 89, 2737, 2738 (1967).
2. R a t h k e M. \V., Brown H. C., J. Am. Chem, Soc., 89, 2740 (1967).
УГОЛЬНОЙ КИСЛОТЫ трет-БУТИЛОВОГО ЭФИРА АЗИД
(IV, 6).
Внимание'. Вдыхание даже небольших количеств паров вещества
вызывает сильную головную боль.
Получение (проверено). Предлагаемый способ [1а] удобнее опи-
санной ранее методики Карпиио [11. В трехгорлую колбу (на 300 мл),
снабженную механической мешалкой, помещают 120 мл ДМСО и
8,1 г (0,1 моля) измельченного азида калия (азид натрия менее раст-
ворим в Д1МСО). Смесь перемешивают около 30 мин до растворения
ОО О
Я Я дмсо II
(СН3)3С — ОС —О — Р(ОС,НЯ)2ДК\3- (CH3)3C-OCN3
* См. обзор: Brown Н. С., Accounts Chem. Res., 2, № 3, 65 (1969).— Прим,
ped.
471
основного количества соли, затем при охлаждении водой (поддер-
живая комнатную температуру) медленно добавляют 25,4 г (0,1 моля)
смешанного ангидрида mpem-бутилового эфира угольной и диэтило-
вого эфира фосфорной кислот (новый реагент, см. стр. 72). Смесь
перемешивают еще час при температуре не выше 25е и затем при
охлаждении прибавляют 120 мл дистиллированной воды. Раствор
экстрагируют тремя порциями эфира по 120 мл. Объединенные эфир-
ные вытяжки экстрагируют дистиллированной водой (тремя пор-
циями по 6 мл) и 20 мл насыщенного раствора хлористого натрия.
Эфирный раствор сушат сульфатом магния, фильтруют и упаривают
в вакууме водоструйного насоса при комнатной температуре. По-
лучают 11—14 г светло-желтой жидкости, которую перегоняют в ва-
кууме водоструйного насоса из колбы Клайзена с коротким дефлег-
матором.
N-Защитная группа аминокислот (перед ссылками). Для полу-
чения ГАтреш-бутоксикарбониламинокислот Де Тар [41 предлагает
брать 1,1 же реагента и 4 же триэтиламина на 1 же аминокислоты.
Карпино и Барр [51 использовали трст-бутоксикарбонильпую
группу для защиты аминогруппы пиррола при присоединении его
к дегидробензолу по Дильсу — Альдеру для получения 7-азабенз-
норборнадиена (5). Раствор пиррола в ТГФ перемешивают в атмос-
фере азота и при комнатной температуре обрабатывают эквивалент-
ным количеством калия. Образующаяся при этом калиевая соль
(2) при взаимодействии с mpe/п-бутил азидофор ми атом превращается
в N-mpm-бутоксикарбонилпиррол (3). о-Бромфторбензол под дейст-
вием магния в ТГФ дает дегидробензол, который в присутствии за-
щищенного производного (3) образует аддукт Дильса — Альдера
(4) с выходом 35—41 %. Защитную группу удаляют осторожной
обработкой соляной кислотой при 0° и получают свободное основа-
472
ние — 7-азабензиорборнадиен (5). Расщепление соляной кислотой
при 25" приводит главным образом к хлоргидрату а-нафтиламина
(6). Как и следовало ожидать для системы с напряженной двойной
связью, защищенное производное (4) легко реагирует с фенилази-
дом, давая аддукт (7), который при пиролизе превращается в
1-фенил-1, 2, 3-триазол (8).
1 а. Т а г Ь е 1 1 D. S-, Insalaco М. A., Proc. Natl. Acad. Sci., 57, 233 (1967).
4. E s t г i n N. F., Alemany A. A., DeTar D. R, procedure submitted
to Org. Syn. (1967).
5. C a r p i п о L. А., В a г r D. E., J. Org. Chem., 31, 764 (1966).
УГОЛЬНОЙ КИСЛОТЫ /ире/и-БУТИЛОВОГО ЭФИРА
ФТОРАНГИДРИД, (CH3)3COCOF. Мол. вес 120,12, т. кип. 4715 мм.
Реагент получают реакцией карбонилхлорфторида с шрат-бута-
нолом.
(СН3)3СОН 4-C1COF (CH3)aCOCOF жНС1
В отличие от очень неустойчивого mpem-бутилового эфира хлор-
угольной кислоты этот реагент можно хранить несколько месяцев
при 0—20°. Подобно азиду mpem-бутилового эфира угольной кисло-
ты, он легко взаимодействует с аминокислотами, давая трет-бу-
токсикарбонильные (БОК) производные 11].
1. Schnabel Е., Herzog Н., Hoffmann Р., К I a u k е Е., Ugi I.,
Angew. Chem., Internal. Ed., 7, 380 (1968).
УГОЛЬНОЙ КИСЛОТЫ /npe/w-БУТИЛПЕНТАХЛОРФЕНИЛО-
o
II
ВЫЙ ЭФИР. С6С15ОСОС(СН3)3 Мол. вес 366,46, т. пл. 116—117°.
Реагент получают реакцией пентахлорфенилхлорформиата (т. пл.
58°) с mpem-бутаыолом в бензоле в присутствии пиридина. Подобно
трет-бутил азидоформиату и mpem-бутил-тг-нитрофен ил кар бон ату
он при взаимодействии с аминокислотами дает mpem-бутоксикарбо-
нильные производные с выходами от 60 до 85% Ill.
I. F u j i п о M., Hatanaka С., Chem. Pharm. Bull., 15, 2015 (1967).
УГОЛЬНОЙ КИСЛОТЫ /ирелл-БУТИЛ-2,4,5-ТРИХЛОРФЕНИ-
ЛОВЫЙ ЭФИР, (3). Мол. вес 297,57, т. пл. 67—68,5 °.
Получение [1]. Раствор 100 г фосгена в 375 мл толуола перемеши-
вают при —10° и обрабатывают 0,86 моля 2, 4, 5-трихлорфенола,
а затем 0,87 моля диметил анилина, который добавляют с такой ско-
ростью, чтобы поддерживать температуру реакции 5—10° (около
20 мин}. После перемешивания в течение ночи при 22—24° к смеси
добавляют 100 г льда и образующийся осадок бмс-(2, 4, "5-трихлор-
фенил)-карбоната отделяют фильтрованием (9,5 а). Органический
слой в фильтрате отделяют и промывают 2 и. соляной кислотой и
10%-ным раствором поваренной соли. После упаривания раствора
получают 134,5 г (60%) чистого 2, 4, 5-трихлорфенилхлорформиата
473
(2), т. кип. 93—9570,4—0,6 мм; т. пл. 62—63°. На следующей ста-
Cl\ rnr'i ск о
COCI3;
CJ-b-NfCHs)
60%
Cl
Cl
(2)
0
Хинолин; НОС(СНч)а z.-х |!
С1 —ОСОС(СН3)3
55-65%
(3)
дни раствор сырого хлорформиата (2) (из 3,6 моля 2, 4, 5-трихлор-
фепола) в 400 мл хлористого метилена добавляют в течение часа
при 30—32° и перемешивании к раствору трсш-бутанола и хинолина
(по 3,6 моля) в 900 мл хлористого метилена. Смесь перемешивают
в течение ночи при 22—24°, затем добавляют ледяную воду и фильт-
рованием суспензии отделяют бис-(2, 4, 5-трихлорфенил)-карбонат
(189 а, 25%). Органический слой фильтрата отделяют, промывают
водой, 2 н. соляной кислотой, снова водой, сушат и упаривают. Оста-
ток кристаллизуют из смеси метанол — вода (раствор осветляют
активированным углем) и получают 610 г (65%) реагента (3) в виде
бесцветных пластинок.
Пептидный синтез 11]. При взаимодействии реагента с амино-
кислотами в присутствии триэтиламина образуются N-mpem-бу-
токсикарбоииламинокислота и 2, 4, 5-трихлорфенол, которые экстра-
гируют этилацетатом и при обработке дициклогексилкарбодиимидом
с высоким выходом получают 2, 4, 5-трихлорфениловый эфир N-
mpem-бутоксикарбониламинокислоты. Этот активированный эфир
пригоден для пептидного синтеза (UI, 449).
С1 О
R — СНСООН + С1 —^^3^— ОСОС(СН3)3 —►
NH3
С1\
С1 —%— ОН -у RCHCOOH
ХС1 NHCOC(CH3)3
]дцк
С1Ч
RCHCOO —Ci
NHCOC(CH3)3 ^С1
474
1. Broadbent W., Morley J.S.,Stone В. E., J. Chem. Soc., (C), 1967,
2632.
УГОЛЬНОЙ КИСЛОТЫ ЭТИЛОВОГО ЭФИРА АЗИД (IV, 9—11,
после выдержки из 131).
При УФ-облучен и и смеси дигидропирана и У. к. э. э. а. Браун
и Эдвардс [За! получили с высоким выходом крайне реакционноспо-
собное соединение, которое не было очищено, но, судя по продукту
гидролиза — уретану (7), является азиридином (6).
о
ц
C2HsOCN3
.J
hv
Ц)
У. к. э. э. а. вступает также в фотохимическую реакцию с енол-
ацетатами, например с изопропенилацетатом и 1-ацетоксициклогек-
сеном [Зб]. При этом также образуется N-карбоэтоксиазиридин
в виде неустойчивого масла. Продукты внедрения промежуточного
предполагаемого карбоэтоксинитрена по связи С—Н образуются
в незначительных количествах.
За. Brown I., Ed war ds О. E., Can. J. Chem., 43, 1266 (1965).
Зб. К e a n a J. F. W., К e a n a S. B., Beet ham D,, J, Org. Chem,, 32, 3057
(1967).
УКСУСНАЯ КИСЛОТА, CH3COOH. Мол. вес 60,05, т. кип. 118°.
Использование У. к. в качестве разбавителя иногда существенно
улучшает процесс ацетилирования. Эффективный метод фермента-
тивного разделения, рассмотренный на примере D, ь-аланина (1),
включает превращение (1) в п, L-N-ацетильное производное (2) и
ферментативный гидролиз природного L-N-ацетилаланина. ь-
Аланин нерастворим в спирте и поэтому легко отделяется от раство-
римого в спирте N-ацетилаланина. Стадия ацетилирования связана
с затруднениями, так как в очень жестких условиях N-ацетильное
производное (2) может частично превращаться через енол (3) в аз-
лактон (4). Для точного контроля реакции [Г] смесь 2а D, ь-аланина
и 5 мл У. к. нагревают в пробирке до температуры немного выше
100° и добавляют 3 мл уксусного ангидрида. Температура сначала
падает до 91—95° (охлаждение при добавлении реагента), потом под-
нимается до 100—ЮЗ3 (экзотермическое ацетилирование) и затем
475
начинает снижаться. После соответствующей обработки D, L-ацетил-
аланин получают с почти количественным выходом.
d, l-ch3chco2h D, l-ch3chco2h
NHa NHCOCH3
(1) (2)
CH3CHCO.2H
сн3
(3)
_HSO сн3сн-—с=о
— I I
Sc/°
I
сн3
(4)
Бергсталер и Уорден [21 разработали метод получения бензофу-
рана (6) из о-формилфеноксиуксусной кислоты (5), заключающийся
в кипячении в течение 8 час смеси 0,5 моля (5), 2,2 моля уксуснокис-
лого натрия, 450 мл уксусного ангидрида и 450 мл У. к. Бензофуран
(6), продукт циклодегидратации и декарбоксилирования, был полу-
чен с выходом 65,7%. В отсутствие У. к. выход бензофурана сни-
жается вдвое, и с выходом 45% получается кумариловая кислота
(7).
1. «Физер Л., «Современные методы эксперимента в органической химии»,
«Госхимиздат, М., 1960, стр. 148.
2. В и г g s t a h 1 е г A. W., Worden L. R., Org. Syn., 46, 28 (1966).
УКСУСНАЯ КИСЛОТА 80%-НАЯ.
Инициативу использования этого реагента для расщепления
ацетонидов Рейхштейн и сотр. [1] приписывают Любарту. Швей-
476
царские исследователи продемонстрировали эффективность и уни-
версальность этого метода при установлении строения строгозида —
сердечного глюкозида, родственного уабаину (1). При попытке кис-
лого гидролиза рамнозид уабаин давал только продукты глубокого
расщепления или смолы. Манних и Зиварт [21 обнаружили, что,
несмотря на очень малую растворимость в ацетоне, при встряхива-
нии на холоду суспензии глюкозида в растворе хлористого водо-
рода в ацетоне вещество быстро растворяется с отщеплением ос-
татка сахара и образованием моноацетонида. При выдерживании
в течение 1 или 2 недель из раствора осаждаются кристаллы 1,
3-моноацетонида уабаина. Этим методом Рейхштейн и сотр. полу-
чили из 24,25 г уабаина 14,44 г 1,19-ацетонида (2), который
при ацетилировании дает ацетатапетонид (3). Раствор 6 г (3) в
250 мл 80%-ной У. к. выдерживали 3 дня при 2O'J, затем упаривали
в вакууме. Кристаллизация остатка из воды дает 3, 11-диаиетат
уабагенина (4) с выходом 80%.
Совсем недавно Любарт [3] сообщил о селективном гидролизе
ацетонидной группы диацетата 17, 20 сс-изопропилидендиокси-5 |3-
прегнандиола-3 а, 21 (5) с сохранением первичной и вторичной
477
ацетокси групп.
1. G е i g е г U. Р., Weiss Ek,, Reichstein Т., Helv. Chim. Acta, 50,
194 (1967).
2. Mannich C., Siewart G,, Ber., 75, 737 (1942).
3. Lewbart M. L,t J Org. Chem., 33, 1695 (1968).
УКСУСНОГО АЛЬДЕГИДА ДИМЕТИЛАЦЕТ АЛЬ (1,1 -диметок-
сиэтан), СН3СН(ОСН:,)2. Мол. вес 90,12, т. кип. 63—65°.
О’Мира и Шеперд [1] обнаружили, что этот реагент удобен для
превращения альдопираноз в этилиденовые производные. К сус-
пензии 58 г метил-Р-п-глюкопиранозида (1) в 250 мл У. а. д. при
перемешивании добавляли по каплям 2,5 мл конц. серной кислоты.
Смесь встряхивали 48 час, фильтровали и твердый продукт (2) дваж-
ды кристаллизовали из этанола. Метил-4 : 6-О-этилиден-р-о-глюко-
пиранозид (2) высокой степени чистоты был получен с 65%-ным
выходом. Ранее это превращение было осуществлено при обработке
глюкозида паральдегидом в присутствии серной кислоты [21, но
выходы были непостоянны из-за побочной реакции, приводящей
к метил-4 : 6-О-этилиден-2 : З-О-диэтилидеиоксо-р-о-глюкопира-
нозиду. Возможность подавления побочной реакции при исполь-
зовании У. а. д. была подтверждена и другой группой английских
исследователей [31.
1. О’М е а г a D., Shepherd D. М., J. Chem. Soc., 1955, 4232.
2. Helferich В., Appel Н., Ber„ 64, 1841 (1931); Dewar J., Fort G.,
J. Chem. Soc,, 1944, 492.
3. Honeyman J.,Sten ing T.C., J, Chem, Soc,, 1957, 3316.
478
УКСУСНОЙ КИСЛОТЫ л-НИТРОФЕНИЛОВЫЙ ЭФИР,
СНзСО2С6Н4КтО2-я. Мол. вес 181,15, т. пл. 78°.
У. к. н. э. получают реакцией хлористого ацетила с «-нитрофе-
нол ятом натрия.
N-Ацетилирование основных аминокислот. Действием У.к. н. э.
на водный раствор медной соли основной аминокислоты получают
N-ацетильные производные [I]. Преимущество этой методики перед
обычными способами синтеза с использованием уксусного ангидри-
да состоит в полноте реакции. В применении к ь-лизину метод прост
и обеспечивает лучшие выходы чистого E-N-ацетил- ь-лизина. К ки-
пящему водному раствору ь-лизина (0,1 моля) добавляют избыток
карбоната меди(П), раствор фильтруют, охлаждают до 25° и обра-
батывают бикарбонатом натрия, У. к. н. э. и несколькими милли-
литрами этилацетата для поддержания концентрации ацетат-ионов
в растворе. После перемешивания в течение 15 час образующийся
осадок медной соли отфильтровывают, суспендируют в воде и ион
меди осаждают сероводородом. Раствор упаривают досуха и N-аце-
тиллизин кристаллизуют из смеси вода — этанол.
В случае других основных аминокислот, когда медная соль аце-
тиламинокислоты не осаждается, ион меди отделяют на ионообмен-
ной смоле дауэкс 50 и продукт элюируют Зн. гидроокисью аммония.
1. В е п о i t о п L., L е с I е г с J., Can. J. Chem., 43, 991 (1965); Leclerc J.,
В eno it on L., ibid., 46, 1047 (1967).
УКСУСНОЙ КИСЛОТЫ СЕРЕБРЯНАЯ СОЛЬ (IV, 18—20).
цис-Гидроксилирование (IV, 20, после выдержки из 1101). Од-
нако в случае ал кил замещенных олефинов реакция нестер еоспеци-
фична [10а]. Например, 1, 2-диметилциклогексен дает с 50%-ным
выходом смесь цис- и трансЛ, 2-ди мети л циклогександи слов-1, 2,
в которой несколько преобладает ццс-изомер. Гэнстон и Моррис
[106] сообщают, что им не удалось окислить тетраметил этилен и
фенантрен с применением смеси У. к, с. с.— иод — влажная уксус-
ная кислота.
Реакция с ге.^-дигалоциклопропанами (IV, 20, перед ссылками).
Геминальные дигалоциклопропаны взаимодействуют с электрофиль-
ными агентами, наиболее эффективными из которых являются
AgOAc
НОАс
26%
(2)
У. к. с. с.— уксусная кислота и смесь ацетата натрия с нитратом
серебра. В результате образуются продукты с открытой цепью [12].
В случае же гци-дигалоциклопропанов, получаемых из циклооле-
финов, наблюдается расширение цикла. Так, 7, 7-дихлорбицикло-
479
[4, I, Ol-гептан (1) под действием смеси У. к. с. с.— уксусная кисло-
та дает 2-хлор-3-ацетоксициклогептен (2) с выходом 26% (чистый
продукт). лш-Дигалоциклонропаны, получаемые из нециклических
олефинов, дают продукты раскрытия цикла. Например, 1, 1-дибром-
2, 2-дифенилциклопропан (3) превращается в 1,1-дифенил-2-бром-
3-ацетоксипропен-1 (4) (131.
С6Н5. AgOAc CbHs^_ /СН20Ас
X . НОАс / |
^’в^Вг * CfcHs Вг
(3) (4)
10а. Bunton С. А.,СаггМ. D., J. Chem. Soc., 1963, 770.
106. Gunstone F. D., Morris L. J,, J. Chem. Soc., 1957, 487.
12. S a n d 1 e r S. R., J. Org. Chem., 32, 3876 (1967).
13. S a n d I e r S. R,, procedure submitted to Org. Syn. (1968).
УКСУСНОМУРАВЬИНЫЙ АНГИДРИД (IV, 21—22). Мол. вес
88,06.
(IV. 22, перед ссылками.) Улучшенная препаративная методика,
разработанная, по существу, Мураматсу и сотр. [41, описана Кри-
меном [6]. В двухлитровую трехгорлую колбу, снабженную мешал-
кой, термометром, обратным холодильником с хлоркальциевой
трубкой и капельной воронкой, помещают 300 г (4,41 моля) тонко-
измельченного формиата натрия и 250 мл абсолютного эфира (не-
большой избыток формиата натрия гарантирует отсутствие в про-
дукте примеси хлористого ацетила). В капельную воронку помеща-
О О
II II
СН3СОС1 Д-НСООМа — > СН3С —О —СН Д-NaCl
ют 294 г (266 мл, 3,75 моля) хлористого ацетила, устанавливают ох-
лаждающую баню (20—24°), чтобы контролировать слабоэкзотер-
мичную реакцию, и приблизительно за 5 мин добавляют хлористый
ацетил, поддерживая температуру реакции 23—27°. При этой тем-
пературе перемешивание продолжают в течение 5,5 час до
завершения реакции. Затеям смесь фильтруют с отсасыванием и оса-
док соли промывают эфиром. Эфир удаляют в вакууме и после пере-
гонки остатка получают 212 г (65%) бесцветного У. а. с т. кип.
27—28°/10 мм или 38— 38,5°/39 мм, ^°1,388.
Смешанный ангидрид можно хранить при 4° в круглодонной кол-
бе с полиэтиленовой пробкой. Поскольку влага катализирует раз-
ложение продукта на уксусную кислоту и окись углерода, его не
следует запаивать в ампулы для хранения.
Спектроскопические характеристики [61. В ИК-спектре смешан-
ного ангидрида имеются полосы поглощения карбонильной группы:
1765 и 1791 см~г и полоса 1050 см~г, характерная для валентных
колебаний С—О—С, к которым может быть отнесена и полоса
1180 см~г. В спектре ЯМР наблюдаются синглетные сигналы от
480
ацетильных протонов (6=2,25) и от формильного протона (6=9,05).
В спектре ЯМР недостаточно очищенного продукта могут появлять-
ся сигналы, указывающие на наличие следующих примесей: НСООН,
6 = 8,05; (НСО)А 6 = 8,85; СН3СНО, 6 = 2,05; СН3СООН, 3=2,05;
СН3СОС1, 6=2,68; (СН3СО),О, 6=2,20.
Взаимодействие с реактивами Гриньяра. Эдвардс и Камман [7]
изучали взаимодействие фенилмагнийбромида в эфире при —70°
с 1 экв У. а. и нашли, что в большей степени реагирует менее затруд-
ненная карбонильная группа смешанного ангидрида, в результате
чего выход альдегида (5) значительно выше, чем ацетофенона (6).
При проведении реакции в эфире соотношение продуктов почти оди-
0 0 О OMgBr BrMgO О
II II I! I I II
CeH,MgBr-LCH3C-O-CH —> СН3С-О-С-Н + СН3С —О—сн
(6 (2) I j
C(jH5 С0Н6
(3) (4)
1 ( 0
i I II
O = CH + CH3C
ccH5 t0H5
(5) (S)
Эфир, -70° 82,9 мол. % 17,1 мол. %
(б) ТГФ, —70° 53,5 » 46,5 »
(в) Эфир, 0° 84,0 з 16,0 »
каково при 0 и —70°. Такой избирательности взаимодействия не
наблюдается при использовании в качестве растворителя ТГФ;
альдегид и кетон при этом образуются почти в одинаковых количест-
вах. Существенное преобладание альдегидов над кетонами в продук-
тах реакции наблюдалось еще с четырьмя другими ароматическими
реактивами Гриньяра; с алифатическими реагентами это преобла-
дание менее выражено.
Защитная группа в пептидном синтезе. Для превращения ами-
нокислоты в N-формильное производное не требуется предваритель-
ного получения У. а. Шихан и Янг [5] добавляли по каплям 83 мл
уксусного ангидрида к смеси 0,1 моля аминокислоты и 250 мл 88% -
ной муравьиной кислоты с такой скоростью, чтобы поддерживалась
температура 50—60°. Смесь перемешивали 1 час при комнатной
температуре, прибавляли 80 мл ледяной воды и концентрировали
при пониженном давлении. Твердый остаток легко кристаллизуется
из воды или водного этанола.
Формилирование аминов и спиртов. Этот реагент был предложен
Бегалем [8], который обнаружил, что с простыми спиртами У. а.
реагирует в одном направлении с образованием ал кил формиатов,
не содержащих примесей ацетатов. Херд и сотр. 19] нашли, что при
16 № 1994 481
взаимодействии У. а. (получен из муравьиной кислоты и кетена)
с анилином образуется с количественным выходом форманилид.
В другой работе 1.101 было обнаружено, что при смешении У. а.
с 2-нитро-2-метилпропанолом-1 наблюдается эндотермическая, а с 2-
нитро-2-метилпропаидиолом-1,3 экзотермическая реакция; при
смешении У. а. с 2-нитробутанолом-1 и трис-(оксиметил)-питроме-
таном заметного температурного эффекта не обнаруживается. Этот
способ получения эфиров муравьиной кислоты интересен тем, что
позволяет избежать нагревания в процессе реакции и не требует
применения в качестве катализатора серной кислоты. Ола ЦП
использовал этот смешанный ангидрид для получения фторангид-
рида муравьиной кислоты.
Под действием У. а, незатрудненные фенолы с удовлетворитель-
ными выходами превращаются в формиаты [12!.
6. Krimen L. I., procedure submitted to Org. Syn, (19G7).
7. Edwards W. R., Jr., КашшалпК- P-, Jr., J. Org. Chem., 29, 913
(1964).
8. Behal A., Compt. rend., 128, 1460 (1900).
9. Hurd C. D., Roe A. S., J. Am. Chem. Soc., 61, 3355 (1939).
10. H u г d C. D., Drake S.S., Francher O., J. Am. Chem. Soc., 68, 789
(1946).
11. Olah G. A., Kuhn S.J.,J. Am. Chem. Soc., 82, 2380 (I960).
12. S 6 f и k u S.. M u r a m a t s u I., 11 agi tani A., Bull. Chem. Soc. Japan,
40, 2942 (1967).
О О
II II
УКСУСНОФОСФОРНЫЙ АНГИДРИД, но - P - оссн,.
он
гМол. вес 136,01.
Безводную фосфорную кислоту можно получить растворением
113 г пяти оки сп фосфора в 150 а ортофосфор пой кислоты при 60—70°
[11. Образующийся продукт представляет собой жидкость, кристал-
лизующуюся при стоянии (т. пл. 42°). Кристаллическое вещество
можно перевести в жидкость быстрым нагреванием при 60°; при
продолжительном нагревании или более высокой температуре об-
разуется полифосфорная кислота.
У. а.— удобный ацетилирующий агент [1]. Его получают не-
посредственно перед использованием, добавляя 1 м.л безводной
фосфорной кислоты к 4 мл уксусного ангидрида (молярное соотно-
шение 1 : 1,7) в градуированной пробирке. Смесь перемешивают
до получения гомогенного раствора; обычно температура повышается
до 50—55°.
Ацетилирование. Инозит (1), имеющий пять экваториальных и
одну аксиальную гидроксильную группу, ацетилируют при пере-
мешивании 20 г (1) с 200 ма реагента при 85° в течение 15 мин. После
обработки ледяной водой получают 47 з (97%) почти чистого гекса-
ацетата инозита (2). Попытки получения ацетата из кроконовой
кислоты (3) оставались безуспешными при использовании всех
482
известных методов ацетилирования,
включая применение очень
активного реагента Фрица — Шенка (уксусный ангидрид и хлор-
ная кислота в этилацетате [2]). С помощью У. а, диацетат кроконовой
кислоты (4) был получен с хорошим выходом.
, , 11 I’
(H0)zP-O-CCH3
2 5 МЛ
(3)1 г
50°, 15 мин
1 о7<>
Этот реагент можно также использовать в реакции Тиле —
катализируемом кислотой присоединении уксусного ангидрида
к хинону с последующим превращением в триацетат оксигидрохи-
нона [1]. Обычные катализаторы этой реакции — конц. серная
кислота и эфират трехфтористого бора; наиболее мощным катали-
затором является хлорная кислота. Метод, приведенный на следую-
щей схеме, использован в единственном описанном эксперименте.
Указанный выход продукта кажется удивительно низким, так как
новый реагент отличается мягким ацетилирующим действием бла-
yl 0 0
\\ 11 I il
|| ||-Н(НО)гР-О-ССН
ОСОСНз
60-, 5 п
^^ОСОСНз
ОСОСНз
годаря отсутствию окислительных свойств у фосфорной кислоты.
1. F a t i a d i A. J., Carbohydrate Res., 6, 237 (1968).
2. Fr i t z J. S.,Schen k G, H., Anal. Chem., 31, 1808 (1959).
УКСУСНЫЙ АНГИДРИД (IV, 22).
Реакция Полозове кого [1]. Эта реакция заключается во взаимо-
действии N-окиси третичного амина (1) с У. а.; в качестве главного
продукта образуется N-ацилнрованный вторичный амин (2), побоч-
16*
483
ным продуктом дезаминирования является кетон (3):
НО- Н
) | /СНЗА 0 | .Ас
r„C-N+< 2Х r-C-N< -PR-C = O
I <Н3 ( Чн3 I
R' R' R'
(1) (2) (3)
Изучение механизма реакции Полоновского не дало окончатель-
ных результатов [2]. Недавно французские исследователи [3], за-
нимающиеся стероидными алкалоидами, пришли к выводу, что три-
фторуксусный ангидрид должен быть более реакционноспособным,
и исследовали эту реакцию на примере N-окиси N-метилдигидро-
5 а-паравалларина (4). Данные спектров ЯМР свидетельствуют
в пользу образования иммониевых солей (5) и (6). Гидролиз водным
бикарбонатом натрия приводит к продуктам (7) и (8).
(7) 60%
(3) 40%
Реакция Тиле. В типичной реакции Тиле [4, 5] 1,4-бензохинон
(1) при температуре не выше комнатной и перемешивании добавляют
к раствору катализатора (например, конц. серной кислоты) в У. а.
Образующийся продукт 1,4-присоединения (2) быстро енолизуется
в (3), ацетилирование которого дает с высоким выходом 1, 2, 4-
ососн3 п ососн3
(1)
\^\эсосн3 'У^ОСОСНз
ОН J ососн3
(3) (4)
три ацетокси бензол (4). В нескольких случаях Тиле использовал
в качестве катализатора хлористый цинк, но заметных преимуществ
это не дало. По-видимому, наиболее подходящей кислотой Льюиса
484
должен быть эфират трехфтористого бора, так как он жидкий и сме-
шивается с У. а. Так, 1, 4-нафтохинон с эфиратом трехфтористого
бора дает 1, 2, 4-триацетоксинафталин с 81%-ным выходом, при
использовании же в качестве катализатора серной кислоты выход
снижается до 74,5% (Физер [61 и Реагенты, I, 116).
Вильгус и Гэйтс [71 («Eastman Kodak») сообщают, что тол ух и нон
(1) при взаимодействии с У. а. и серной кислотой дает с 90%-ным
выходом смесь, состоящую, по данным ГЖХ-анализа, из 2, 4, 5-
тр п ацето кси производи ого (2) (78%) и 2, 3, 5-изомера (3) (14,5%).
Таким образом, эта реакция включает атаку новой ацетоксильной
группой пара- и мепга-асложений относительно метильной группы.
(I)
(2) 2, 4, 5-Изомер
78%
ОАс
НзС\Л/0Лс
+
6ас
(3) 2, 3, 5-Изомер
Н, 5%
Данные, рассмотренные ранее (I, 116), показывают, что для
пространственно незатрудненного а-нафтохиноиа ВЕ3-эфират яв-
ляется более удовлетворительным катализатором ацетоксилирова-
ния по Тиле, тогда как для затрудненных хинонов этот катализатор
менее эффективен, чем серная кислота. Так, в присутствии BF3-
эфирата 2,5-диметил-1, 4-бензохинон гладко присоединяет У. а.,
а 2, 6-диметил-1, 4-бензохинон не реагирует и вступает в реакцию
Тиле лишь в присутствии серной кислоты. Теоретическая интерпре-
тация отмеченной закономерности и относительной инертности 2-
метил-1,4-нафтохинона к смеси У. а.— ELSCk дана в книге Л. Физе-
ра и М. Физер «Органическая химия», т. П, изд-во «Химия», М.,
1970, стр. 422.
Вильгус и Гэйтс [71 нашли, что при катализе ВЕ3-эфиратом 2-
метил-1, 3, 4-триацетоксинафталин образуется с 27%-ным выходом
за 18 час и с 52%-ным выходом за 120 час. Бертон и Прейл (IV, 150)
обнаружили, что более эффективным катализатором Тиле является
хлорная кислота: в ее присутствии затрудненные хиноны вступают
в реакцию, давая с умеренными выходами 2-метил-1, 3, 4-триацеток-
синафталин. Изучение образцов 1, 4-нафтохинона различной сте-
пени чистоты (К, 432—433) еще раз продемонстрировало эффектив-
ность хлорной кислоты как катализатора ацетоксилирования «-хи-
нонов по Тиле. I, 2-Нафтохинон по отношению к Ас2О — H2SO4 поч-
ти так же реакционноспособен, как 1,4-нафтохинон к Ас~О — BF3
(Л. Физер, М. Физер, «Органическая химия», т. II, изд-во «Химия»,
М., 1970, стр. 422). Ацетилирование по Тиле осуществляется с хоро-
485
шим выходом, несмотря на присутствие метильного заместителя по
соседству с одной из хиноидных карбонильных групп [8] *.
Лоунасмаа [9] (Технический университет, Хельсинки) кипятил
в течение нескольких часов раствор 2,6-диметокси-1,4-бензохинона
в У. а. в присутствии уксуснокислого натрия и после добавления
воды, экстракции хлороформом и кристаллизации из уксусной
кислоты выделил бесцветный продукт с т. пл. 149—150°, которому
на основании данных элементарного анализа (СфДЧ^Ой), ИК-. ЯМР-
и масс-спектров было приписано строение (6).
ООО 000
II il ;l II II
СН3СО- 4-СН3С—О—ССН3 —> СН3СОН +СН3С—О —с—сн2
(1)
;| II
О, ,СЩС—О —ссн3
CHgO^^^ /ОСНз
II
о
сн3соон
* Указанный на схеме выход получен Л. Физсром при повторении экспери-
мента с 492 мг хинона, который обрабатывали холодным раствором 0,5 г серной
кислоты в 30 мл уксусного ангидрида. Продукт осаждается при добавлении воды,
выход 500 мг (85%); кристаллизация из уксусной кислоты дает белые иглы (т. пл.
159°).
486
II Г
НОЧ ,СН.,С— О—ссн
СН3ОЧ О'СНз
о о
|1 II
СН-С-О-ССН3
(4)
(СН3СО)аО
нго
G)
о о
ОСОСНз
сн—со2н
(6)
1. Polonowski М., Polonowski .4., Bull. soc. chim, France, [4] 39,
147 (1926); 41, 1190 (1927).
2. Wcnkert E., Expcrientia, 10, 346 (1954); Huisgcn R. et al., Chem. Ber.,
92, 3223 (1959); 93, 363 (1960); Tetrahedron Letters, 783 (1965); Oae S, К i-
t а о T., К i t а о к a Y., J. Am. Chem, Soc., 84, 3366 (1962).
3. C a v e A., Kan -Fa n C., Po t ier P., Le Men J., Tetrahedron, 23, 4681
(1967).
4. Thiele J., Ber., 31, 1247 (1898).
5. T h 1 e 1 e J., WinterE., Ann., 311, 341 (1899).
6. F i c s e r L. F., J. Am. Chem. Soc., 30, 3165 (1948).
7. AV ilgus H. S., Ill, G a t e s J. W., Jr., Can. J. Chem., 45, 1975 (1967).
8. Fieser L.F.,Seligman A. M., J. Am. Chem. Soc,, 56, 2690 (1934).
9. Lounasmaa M., Tetrahedron Letters, 91 (1968); Chem. Scand., 22, 70 (1968).
ФЕНАНТРЕНХИНОН (IV, 24, перед ссылками).
Ф. специфически реагирует с аргинином и аргинилпептидами
с образованием сильно флуоресцирующих 2-амино-1Н-фенантро-
[9,10-<Л-имидазолов. Реакция используется как крайне чувстви-
тельная проба на аргининсодержащие пептиды [6].
6. YamadaS,, Itano Н. A., Biochem. Biophys. Acta, 130, 538 (1966).
ФЕНИЛБОРНАЯ КИСЛОТА (IV, 30—31). Исправленный мол.
вес 121.94.
(Перед ссылками.) Брукс и Уотсон [51 показали, что идентифи-
кацию 1, 2- и 1, 3-диолов методами газовой хроматографии и масс-
спектрометрии удобно осуществлять в виде эфиров фенилборной
кислоты. /{цс-Диольная структура сесквитерпеноида (1) подтверж-
дается образованием циклического эфира (2), полученного из не-
скольких микрограммов диола, выделенного газохроматографически
и охарактеризованного хромато-масс-спектрометрически.
Эфиры фенилборной кислоты были использованы как защищен-
ные производные при окислении гликозидов под действием ДМСО —-
АсоО [6]. Особое преимущество их состоит в легкости отделения от
неустойчивых кетогликозидов и, конечно, в устойчивости к окисли’
тельному агенту.
5. В г о о k s С. J. W., Watson JChem. Comm., 1967, 952.
6. L i n d b е г g В., Slessor К. N., Chem. Scand., 21, 910 (1967).
ФЕНИЛГИДРАЗИН (IV, 31—36, перед ссылками).
Синтез 1,3.о-трифеиил-2-пиразолина [18]. Смесь бензальането-
фенона, уксусной кислоты и ф. нагревают при 90—100° в течение
2—3 час, затем охлаждают до комнатной температуры. Продукт от-
деляется в виде мелких желтых кристаллов удовлетворительной
488
чистоты; т. пл. 130—13 К, 7тах 240 и 355 нм (е„.1ах 13 620 и 16 950 со-
ответственно).
сн=снс6н3 с6н5
сАн5-с=о h2nnh
АсОН
90-100^
79%
,____^н5
г п
СДГ/ЩЧ'''1'4
С6Н5
18. S а и d 1 с г S. R., procedure submitted to Org. Syn. (1968).
ФЕНИЛДИАЗОМЕТАН (IV, 36—37, перед ссылками).
Каталитическая активность. Диазоалканы, в частности Ф.,
катализируют конденсацию соединений, содержащих активный атом
водорода, например метилсалицилата (1), с изоцианатами и изотио-
цианатами. Первоначально образующийся аддукт (2) подвергается
циклизации в (3). Скорость катализируемой реакции прямо пропор-
циональна подвижности активного протона. Каталитический эф-
фект объясняется образованием комплекса диазоалкан — субстрат
(3) 0.95 г
с мостиковым протоном. Аналогичным образом объясняется реак-
ция циклизации первоначально образующихся аддуктов 13].
Другие примеры.
2. Change to: Anselme J.-P., Org. Preparations Procedures, 1, 73 (1969).
3, Capuano L., Zander M., Chem. Ber., 99, 3085 (1966).
489
4, Capuano L.,Zander M., ('hem. Bcr., 100, 3520 (196/).
5. C a puano L. L., W e 1 t e r M., Chem. Bcr.. 101, 3671 (1968),
о-ФЕНИЛЕНДИОКСИФОСФОРТРИБРОМИД,
О
>PBr3.
О
Мол. вес 347,84, т. пл. 67—70;!.
Реагент получают подобно соответствующему трихлориду (IV,
41) при взаимодействии пирокатехина с РВгй, а затем с бро-
мом. С эфирами муравьиной кислоты Ф. образует дибромметил-
алкиловые эфиры Ц):
О
ROCHO-q
РВг,
~ 00%
ROCHBr, -I-
О
z\
Br
0
О
С карбоновыми кислотами или их ангидридами Ф. дает соответст-
вующие бромангидриды с выходами 80—94% [2L
1. Gross Н., К а г s с h U., J. prakt. Chem., 29, 315 (1965).
2. Gloede J., Gross H., Chem. Ber., 109, 1770 (1967).
0-ФЕНИЛЕНДИОКСИФОСФОРТРИХЛОРИД (IV, 41—42).
(Перед ссылками.) Реагент был использован для превращения
аминов в изотиоцианаты [21. Сначала амин реакцией с сероуглеро-
дом превращают в дитиокарбаматалкиламмониевую соль, которую
затем нагревают с Ф. в бензоле. При использовании хлорокиси фос-
СТ, н-
2C6HaCH2NH3 -Р CsH5CH2NHCS-СЙН,СНЧМН3
II
S
о
I I! Zpci*
———- сен5сн2\—c=s
фора выходы несколько ниже.
Было найдено [31, что реагент лучше и яти хлор истого фосфора
для превращения циклических кетонов (с 8— 12-членными циклами)
в 1-хлор циклоалкены.
70-8 5% >
72 = 6-10
490
2. Martin D., Beyer E., Gross H., Chem. Bcr., 98, 2425 (1965).
3. Schank K-, E isiert B., Fclzmann J. H., Chem. Ber., 99, 1414
(1966).
бнс-о-ФЕНИЛ ЕНПИРОФОСФИТ (I, 42, перед ссылками).
Реагент лучше, чем дициклогексил карбодиимид, для циклизации
модельных пента- и гексапептидов, по менее пригоден в случае
трипептидов [3].
3. М i 1 1 е г Л. W., S in i t h P. W. G., J. Chem. Soc., (C), 1967, 2140.
о-ФЕНИЛЕНХЛОРФОСФАТ (IV, 42—43).’
Фосфорилирование. Для превращения соединения (4) в (о) Каль-
дерон [2а] использовал гидрогенолиз над катализатором Адамса.
2а. Calderon J., Moreno G., Anales Real. Soc. Espan., Fis. Quim., 56,
B, 603 (1960); Caiama M. A., Calderon J., Anales Real. Soc. Espan.,
Fis. Quim., 62, B, 1015 (1966).
Д\/\
о-ФЕНИЛЕНХЛОРФОСФИТ, | || ^>PC1. Мол. вес 174,52,
т. пл. 30, т. кип. 9Г/18 мм.
Получение. Ф. синтезируют из катехина и РС1;;, выход 949о [1].
Превращение спиртов в иоднды [2], При обработке спирта, на-
пример циклогексанола (1), Ф. в эфире в присутствии пиридина об-
разуется фосфит (3), который при обработке иодом дает желаемый
иодид (4) и о-фенплениодфосфат, быстро гидролизующийся до соеди-
(3) в НаО
нения (5). Этот метод имеет особое значение в случае спиртов, легко
подвергающихся реакции элиминирования. Описанный метод яв-
ляется улучшением реакции Форсмана и Лип кин а 13], которые в ка-
честве ключевого реагента использовали дифенилхлорфосфит.
1. С г о f t s Р. С., Mark es J. Н. Н., R ydon Н. N., J. Chem. Soc., 1958,
4250.
2. Corey E.J., Anderson J. E., J. Ощ. Chem., 32, 4160 (1967).
3. Forsman J. P., Lipkin D.,J. Am. Chem. Soc., 75, 3145 (1953).
491
ФЕНИЛИЗОТИОЦИАНАТ (IV, 44—45, перед ссылками)
На основе приведенной схемы расщепления под действием Ф.
был разработан прибор для автоматического определения амино-
кислотной последовательности в белках и пептидах [41.
4. EdmanP., Begg G., European J. Biochcm., 1, 80 (1967).
ФЕНИЛИЗОЦИАНАТ (IV, 45—46, перед ссылками).
Карбанилаты [5]. Ф. при взаимодействии с углеводами, имею-
щими свободную гидроксильную группу, дает карбанилаты — легко
О
CSH6N=C = O II
ROH --------ROCNHCcH5
Ру
кристаллизующиеся производные, устойчивые к кислому гидролизу,
но расщепляющиеся метилатом натрия в метаноле. Поскольку Ф.
легко гидролизуется до амина, использующийся в качестве раство-
рителя пиридин должен быть тщательно высушен.
В примере, описанном Хироном и сотр. [61, метил-а-э-глюкозу
превращали в 6-тритилыюе производное (1), ацетилированием ко-
торого получали соединение (2). Детритилирование (2) дает метил-
2, 3, 4-три-0-ацетил-а-э-глюкозу (3), которая под действием Ф. в пи-
ридине образует 6-карбанилат метил-2, 3, 4-три-О-ацетнл-а-о-глю-
копираиозида (4): 50 а (0,156 моля) (3) растворяли в 40 мл пиридина,
добавляли 0,234 мл Ф. и нагревали при 100° в течение часа. После
соответствующей обработки и двукратной кристаллизации из метано-
ла соединение (4) было получено с выходом 84%.
5. Н earon W.M., Whistler R.L., Wol from М. L., Methods Carbo-
hydrate Chem., 2, 239 (1963).
6. H e а г о n W. M., H i a 11 J. D., Fordyce C. R., J. Am. Chem. Soc.,
66, 995 (1944).
N-ФЕНИЛ ИМИД АЗОДИ КАРБОНОВОЙ КИСЛОТЫ (IV, 46—
47, перед ссылками).
492
Зауэр и Шредер [4] выделили красный кристаллический Ф. а. к.
с 50%-ным выходом при окислении 4-фенил у р азол а бромной водой.
Кинетические исследования показывают, что как диенофил этот
реагент несколько более реакционноспособен, чем тетрацианэтилен.
Гиллис и Хагарти [5] обнаружили, что 4 фенилуразол легко окис-
ляется тетраацетатом свинца в хлористом метилене; авторы разра-
ботали методику проведения реакции Дильса — Альдера с получе-
нием диенофила в присутствии диена в хлористом метилене или
ацетонитриле при охлаждении.
^СН3
РЪ(ОАс)4
СН,С13, 0-5°
Выход 62%
Стиклер и Пиркл [61 сообщают, что четырехокись азота пре-
восходит все ранее упомянутые окислительные агенты по удобству,
выходам и чистоте получаемого Ф. а. к. При пропускании газооб-
разной четырехокиси азота в суспензию уразола в холодном хло-
ристом метилене наблюдается быстрое растворение с образованием
красного раствора, из которого после удаления растворителя полу-
чают с количественным выходом кристаллический Ф. а. к.
Даже при комнатной температуре ф. а. к. быстро реагирует
с диеновой системой 3 р-ацетокси-17-цианандростатриена-5,14, 16
(1). При этом образуется аддукт (2), который, однако, при комнат-
ной температуре легко распадается на исходные продукты. В про-
ем
(1)
о
I!
CftN I!
&
тивоположность этому аддукт (1) с малеиновым ангидридом устой-
чив даже при 180° 17]. Ф. а. к. также легко взаимодействует с 16-
метилпрегнатриен-4,14,16-дионом-3,20 (3), давая изомерные ад-
493
дукты (4) и (5) 18].
Следует отметить, что с циклооктатетраеном (6) Ф. а. к. образует
соединение (7); это редкий случай 1,4-циклоприсоединения к (6)
9].
(6)
о
II
if NC6Hs
n /
хс
30-35%
(7)
I. Definitive paper: Cookson R.C., Gilan i S. S. H., Stevens I. D, R.,
.1, Chem. Soc., (C), 1967, 1905.
4. Sauer J., Schrfider B,, Chem. Ber., 100, 678 (1967).
5, Gillis В. T., H a g a r t v J. D., J. Org. Chem., 32, 330 (1967).
6. S t i c k 1 e r J. С., P i r k Ге W. M., J. Org. Chem., 31, 3444 (1966).
7. S о 1 о A. J., Sachdc v H. S., GilaniS. S. 11., J. Org. Chem., 30, 769
(1965).
8. Pop per T. L., Carlon F. E., iM a г i g I i a n о II. M., Y u d i s M. D.,
Chem. Comm., 1968, 1434.
9. E v n i n A. B., Miller R. D., E va nega G. R., Tetrahedron Letters,
5863 (1968).
СНЛСНЧ
а-ФЕНИЛМАСЛ ЯНОЙ КИСЛОТЫ АНГИДРИД, I
(CeH&CHCO)2O
Мол, вес 310,38, масло.
Получение. Ф. к. а. получают кипячением п-фенилмасляной
кислоты с уксусным ангидридом в течение 6 час, после чего удаляют
растворитель.
Определение конфигурации асимметрической этерификацией.
Метод был разработан Хоро [1,2] для определения конфигурации
оптически активных вторичных спиртов; в основе его лежит правило
асимметрического синтеза Крама [31 — Прелога [41. Хоро показал,
494
что указанный на схеме спирт R-конфигурации (L — большой
заместитель, М — средний заместитель) при реакции с избытком
производного а-фенилмасляной кислоты должен давать сложные
эфиры с обогащением избыточной кислоты оптически активным со-
единением (д-)5-конфигурации. В реакции со спиртами S-конфигу-
рации должна оставаться R-кислота,
Хоро и Каган [51 применили этот метод к большому числу сте-
роидов и показали, что он приводит к правильному определению
конфигурации. Метод с успехом был использован для определения
конфигурации терпенов [1, 21, производных кар иофи лена [6], грай-
апотоксина-1 (1) и родственных токсинов [71, а также сесквитерпено-
вых лактонов [81, например (2).
(1) Грайанотоксин-!
(2) ЫЭпиаллохс.пеналин
1. HoreauA., Tetrahedron Letters, 506 (1961).
2. Н о г с а и A., Tetrahedron Letters, 965 (1962).
3. Cram D. J,, A b d E 1 h a t e z Г. A., J. Am. Chern. Soc,, 74, 5861 (1952),
4. Pre)o§ V., Helv. Ch ini. Acta, 36, 308 (1953).
5. Horcau A., Kagan H. B,, Tetrahedron, 20, 2431 (1964).
6. Horeau A., S u t h e г 1 a 11 d J. K., J. Chem. Soc., (C), 1966, 247.
7. К a k i s a w a H., Kuzima T., Yanai AL, \ a k a n ish i K-, Tetra-
hedron, 21, 3091 (1965).
8. M a b r v T. J., R e и о 1 d W., Miller H. E., Ragan H. B., J. Org.
Chem,, 31, 681 (1966); Herz W., К a g a n H. B., ibid.,' 32, 216 (1967).
ФЕНИЛМЕТАНСУЛЬФОФТОРИД, CBHriCH2S02F. Мол. вес
174,20, т. кип. 47°.
Модификация ферментов. Полгар п Бендер [1, 21 использовали
Ф. для превращения серинсодержащего фермента субтилизипа—ОН
495
в цистеинсодержащий фермент субтилизин—SH;
Р cm C(.Hr,CH;.SO2F _ ru /— и
Субтилизин —ОН --------—> Субтилизин— OSO2CH2CeH5 —►
О
II
CH3CS- нго
,---------------> Субтилизин —SCOCH,-------> Субтилизин — SH
-C6HsCH2SO-
Для первой стадии этого процесса был выбран Ф., так как при
SN 2-замещении на второй стадии фенил метансульфонильная группа
является более легко уходящей, чем л-толуолсульфонильная.
1. Р о 1 g а г L., В ей der Al. L., J. Am. Chem. Soc,, 88, 3153 (1966).
2. P о 1 g a r L., Bender M. L., Biochemistry, 6, 610 (1967).
2-ФЕНИЛ-3-МЕТИЛ-2-Ф0СФА-1.3-0КСА30ЛИДИН, (3), Мол.
вес 180,17, т. кип. 72—7570,3 льи.
Получение. Ф. получают [1] при нагревании фенилдихлорфос-
фина с 2-метиламиноэтанолом в присутствии 2 же триэтилами на:
СН3
СН3 |
/С! | 2(G2h,)3N /N — СН,2
С6Н5Рф -У HN—СН2 С6Н6Р< 1
ХС| I 41% хо-сн.
(1) НО-СН3 (3)
(2)
Применение 111. Под действием Ф. при низкой температуре (20—
30°) изоцианаты теряют кислород и превращаются в изонитрилы
с выходами от 50 до 90%.
СН3 СН3
I О |
zn-ch2 4- _ II .N —СН2
RN = C=CH-C0Hap/ | 1?К^СДСсН-Р( |
XO —CH3 \o —CH,2
1. Mukaiyama T., Y о k о t a Y,, Bull. Chem. Soc, Japan, 38, 858 (1965),
ФЕНИЛТИОМЕТИЛЛИТИЙ, C0H5SCH2IJ. Мол. вес 130,13.
Получение [1]. Ф. был получен в растворе несколькими мето-
дами, из которых наиболее эффективно металлирование тиоанизола
w-бутил литием в присутствии триэтилендиамина (I И, 458) с выходом
97%. В отсутствие амина выход снижается до 35%.
Гомологизация первичных бромистых и иодистых алкилов. Кори
и Хотела [2[ разработали удобный дв у стадийный метод гомологи-
зации первичных алкилбромидов и иодидов. Примером служит
превращение 1-иоддекана в 1-иодундекан. Иодид обрабатывают не-
большим избытком Ф. в ТГФ в атмосфере азота при —70°. Фенилтио-
CH3(CH2)8CH2I+C6H5SCH2“Li+
CH,I, Nal, ДМФА
-> CH3(CH2)8CHaCH3SC6H3 -----------> СН3(СН2)8СН2СН31
93% (общий)
496
группу образующегося фенил-н-ундецил сульфида замещают на иод
обработкой большим избытком йодистого метила в 1 н. растворе
йодистого натрия в ДМФА в безводной среде.
В случае аллильных галогенидов несколько большие выходы
получаются при использовании Ф. и иодистой меди(1). Ф. переме-
шивают с небольшим избытком иодистой меди(1) в ТГФ при —50°;
при этом образуется тонкая серая суспензия фенилтиометилмеди.
Под действием этого реагента бромистый аллил превращается в 4-
иодбутен-1 с выходом 52%.
Еще более интересно применение метода для превращения ге-
ранилбромида (1) в гомогеранилиодид (2). В этом случае вторую
/\/СНз /\/СНз
н3с/\н3 н3с/хсн3
(П (2)
стадию проводят в присутствии небольшого количества карбоната
кальция и ртути для предотвращения образования HI или 12, кото-
рые катализируют изомеризацию А3-двойной связи.
1. Corey Е. J., S е е b а с h D., J. Org. Chem., 31, 4097 (1966).
2. Corey Е. J., Jautelat M., Tetrahedron Letters, 5787 (1968).
ФЕНИЛ-(ТРИГАЛОГЕНМЕТИЛ)-РТУТЬ (IV, 52—56).
Получение днгалогенкарбенов (IV, 55, после выдержки из [7|).
Аллиламины, содержащие не менее четырех углеродных атомов
в аллильной цепи, образуют с Ф. производные циклопропана (2),
а также продукты расщепления (3) и (4) [7а[.
ZCH3 2CeH5HgCCl3
2R,NCH2CH-C<----------------►
\сн3
(1)
/СН3
К.,\СН3СН —с<
Хг/ ХСН3
a7' 4ci
? J (2)
/С1 С113
4-С1СНХН =С(
I 'С1 “
С1
(3) (4)
В ранних исследованиях было показано, что дихлор- и дибром-
карбены, полученные из галоформов, не реагируют с затрудненными
двойными связями стероидов. Однако Бонд и Корнелиа [76] сооб-
497
щают, что если в качестве источника карбена использовать Ф., то
удается осуществить его внедрение по А7-, А5- и Ай-двойным связям.
Кинетические исследования реакции фепил-(дихлорбромметил)-
ртути с олефинами показывают, что дихлор карбен выделяется в виде
свободной частицы. Кроме того, независимость реакции от влияния
заместителей в фенильном ядре позволяет предполагать, что выде-
ление карбена осуществляется по согласованному механизму через
циклическое переходное состояние (5а) или (56) [7в].
ЩВг:
C6H5-Hg~C--Cl
JC1
..Вт
C6H5-Hg‘t ;
*'С —Cl
I
Cl
(56)
Синтез пиразолов (перед ссылками). В новом удобном двустадий-
ном синтезе пиразолов, разработанном Пархамом и Дули [121,
енолацетат, например изопропенилацетат (1), конденсируют с фе-
о ОСОСНз СН1"ЫС=СН! C^gCCl, ,СН»С—СИ, НзС^ Кипячение Б С6Нб Cl<z' ''''Cl (78%) (1) (2) HjC. 4 H2NNH^ JI [I 92% * '4NZ^ H (3)
нил-(трихлорметил)-ртутью (IV, 52^—53); образующийся ащи-ди-
хлорциклопропилацетат (2) обрабатывают гидразином (или его
производным) и получают пиразол (3).
Предложен следующий механизм реакции:
сн3
СЩС^СЩ СЩСТНМН,
/Л О
сы
+ СН,С-С = СН2
II I 2
О CL
|нщнн2
СН3С-----СНС1
N .СЩ
)
I- н
. сняс-------сн
-----> и it
-HCL ^СН
Y
н
Представляет интерес применение этого метода в синтезе гете-
роциклического метациклофана (8)—3,5-1101-пиразолофана [13].
Циклододеканон (4) превращают в енол ацетат (5), кипячение кото-
498
рого с фенил-(трихлорметил)-ртутыо в бензоле в атмосфере азота
в течение 48 час приводит к 1-ацетоксп-2,2-дихлорбицикло-110, 1, 00
тридекану (6). Реакцией (6) с гидразином получают в качестве глав-
ного продукта (выход 49%) твердое вещество, идентифицированное
как 3, 5-[ 101-пиразолофап (8) путем окисления нейтральным перман-
ганатом до 3,5-пиразолдикарбоновой кислоты. По данным Я1МР-
спектров в остатке после удаления ацетилгидразина и основного
количества (8) обнаружено два пиразола. Одним из них был (8),
а другим оказался неизвестный изомерный пиразол, идентифици-
рованный как (7) путем его встречного синтеза из (9).
Синтез метациклофана. Паркам и Райнхарт [14] синтезировали
новый класс метациклофанов реакцией (1) с 2 же феиил-(трихлор-
метил)-ртути в кипящем бензоле; промежуточный дихлорциклопро-
пан (2) претерпевает спонтанное раскрытие цикла с образованием
циклофана (3) с 73%-ным выходом (после очистки).
499
Диарилциклопропеионы. Ди ар йл ацетилены реагируют с фенил-
(дихлорбромметил)-ртутью, давая после гидролиза реакционной
смеси диарилциклопропеионы [15]. Диалкил ацетилены в эту реак-
цию не вступают.
СбН5
S +
с
C6HS
C6H5HgCCl2Br--->
с6н5
н2о
63%
с6н5
7а. Parham W. Е., Р о t о s k i J. jR., J. Org. Chem., 32, 278 (1967).
76. В о n d F. T., Cornelia jR. H., Chem. Comm., 1968, 1189.
7b. S e у f e r t h D., Mui J. Y.-P., В u r 1 i t c h J. M., J. Am. Chem. Soc., 89,
4953 (1967); S e у f e r t h D., Mui J. Y.-P., Damrauer jR., ibid., 90,
6182 (1968).
8. Add: Seyferth D., Mui J. Y.-P., J. Am. Chem. Soc., 88, 4672 (1966).
12. Parham W. E., Dooley J. F., J. Am. Chem. Soc., 89, 985 (1967).
13. Parham W. E., S p e r 1 e у jR. J., J. Org. Chem., 32, 926 (1967).
14. Parham W.E., Rinehart J. K., J. Am. Chem. Soc., 89, 5668 (1967).
15. Seyferth D., Damrauer jR., J. Org. Chem., 31, 1660 (1966).
ФЕН ИЛТРИМЕТИЛ АММОНИЯ ПЕРБРОМИД (IV, 56—57, после
выдержки из [2]).
Ф. п. можно получить in situ смешением растворов эквивалент-
ных количеств бромистого фенилтриметиламмония (мол. вес 375,
95) и брома (мол. вес 159,83) в ТГФ с раствором эквивалентного ко-
личества кетона в ТГФ.
1-ФЕНИЛ-5-ХЛОРТЕТРАЗОЛ, ZN-N Мол. вес 180,60,
С1—с<у !|
XN-N •
сен6
т. пл. 122—123°.
Получение. Ф. получают из фенилкарбиламинхлорида и азида
натрия [1].
Замещение фенольного гидроксила на водород. Муслинер и Гэйтс
[2] описывают метод гладкого удаления фенольного гидроксила
в мягких условиях, включающий конденсацию Ф. с фенолом в аце-
тоне в присутствии карбоната калия и гидрогенолиз образующегося
500
1-фен ил тетр азол илового эфира над палладированным углем.
ОСНЙ
ij: +“
ОН
I
CBHS
(1)
Pd-C, H2
ОСН,
I
(2) 83%
н
/N- N
XN-N
I
C6H5
Другой пример реакции — превращение 4-оксидифен ил а в ди-
фенил [3].
СсН5
1. М a g g i u 1 I 1 С. A., P a i n e R. А., белы. пат. 671402 (1966) [{С. A., 85,
8926 (1966).!; англ. пат. 1128025; франц, пат. 1451028; пат. ФРГ Г251327.
2. Musliner W. J., Gates J. W., Jr., J. Am. Chem. Soc., 88, 4271 (1966).
3. Musi i n e r W. J., G a t e s J. W., procedure submitted to Org. Syn.
ФЕНИЛЦИАНАТ, C6H5OC=N. Мол. вес 119,12, т. кип. 82—
83716 мм.
Получение [1]. К раствору фенола в ацетоне при О3 добавляют
жидкий хлорциан, затем по каплям при перемешивании прибавляют
триэтиламин, поддерживая температуру не выше 10°.
(C2H3)sN
c6h5oh-i-ci-c = n---> c6h5oc = n
у 4 /о
Применение [21. Под действием Ф. карбоновые, тиокарбоновые
и сульфокислоты превращаются в соответствующие ангидриды;
501
при этом образуется фенилкарбамат, слабо растворимый в воде и
О
2С|2СНСООН -|-CgHsOCN -7-^ (С12СНСО),О + c6h5ocni-i2
бензоле. Реакцию проводят при кипячении в бензоле в течение от
15 мин до 2,5 час; выходы высокие.
1. G г i g a t Е., Р ti 11 е г R., Chem. Ber., 98, 1168 (1965).
2. G г i g a t Е., Р ii t t е г R., Chem. Ber., 98, 1359 (1965).'
d- и Z-a-ФЕН ИЛЭТ ИЛ АМИНЫ, C6H,CH(NH2)CHh. Мол. вес
121,18, т. пл. 184—185°, aD+39,5°.
Получение (/./-формы 111.
Разделение иа антиподы [21.
Применение для разделения циклоалкенов. транс-Циклоалкепы
средних размеров (Ся— С1()) могут существовать в энантиомерных
формах благодаря невозможности поворота транс-двойной связи
относительно остальной части молекулы. Разделение этих соеди-
нений на оптические изомеры не может быть выполнено обычными
методами образования производных из-за отсутствия солеобразую-
щих групп. Однако Коуп и сотр. 131 нашли эффективный метод
разделения, основанный на способности алкенов к комплексообра-
зованию с соединениями платины. Комплекс этилена с двухлори-
стой платиной и (+)- или (—)-а-фенилэтиламином существует толь-
ко в одной форме, так как этилен симметричен. Но добавление этого
основания к раствору платинового комплекса транс-циклооктепа
открывает путь для образования диастереомерных комплексов,
соответствующих R- и S-формам основания. Разделение осуществля-
ется фракционной кристаллизацией при —20° (при 25" жидкость).
Под действием цианистого калия из комплекса выделен (—)-угле-
водород, aD—411°.
Диастерео тер ные Котплексы
502
Подобным образом были разделены цис.транс-циклооктадие-
ны-1, 5 (3, 4) (модели этих изомеров удается построить только при
значительной деформации углов и связей) [4], транс-6, 7, 10, 11-
тетрагидро-5Н-бензоциклонопен (5, 6) 151 и /п/?дас-бицикло-[8, 2, 21-
тетрадекатетраен-5, 10, 12, 13 (7) 161.
1. Ингерсолл А., «Синтезы органических препаратов», ИЛ, М., 1949, со. 2,
стр. 522.
2. И п г с р с о л л А., «Синтезы органических препаратов», ИЛ, М., 1949, со. 2,
стр. 526.
3. Соре А. С., G а п е 1 I i п С. R., Johnso n Н. W., Jr., \z а п A uken
Т. V., W inkier И. J. S., J. Am. Chem. Soc., 85, 3276 (1963).
4. Соре А. С., Hecht J . К., J ohnson И. W., Jr., К е 11 с г Н., W inkier
Н. J. S., J. Am. Chem. Soc., 88, 761 (1966).
5. Соре А.С., Ford ice М. W., J. Am. Chcni. Soc., 89, 6187 (1967).
6. Cope A. С., P a w s о n B. A., J. Am. Chem. Soc,, 90, 636 (1968).
ФОРМАЛЬДЕГИД (IV, 65—72).
Восстановление (IV, 66, после выдержки из [31).
Романел,.ти и Бекер [За1 описали получение этилового эфира
п-диметиламинофенидуксусной кислоты. В сосуд для гидрирования
(прибор Парра) помещают 41,8 г этилового эфира п-нитрофенилук-
сусной кислоты, 40 мл 40%-ного водного формальдегида, 200 мл
95%итого этанола и 2 а 10%-ного палладия на угле. Систему нес-
колько раз эвакуируют и заполняют водородом, затем проводят
гидрирование под давлением около 4 атм в течение 2—4 час.
Х>~снхо,с,н5
СН,О, и,, Pd/c
бШ?-(МетИлеидиокси)(ВМД) производные стероидов (IV, 71,
перед ссылками). Имеется сообщение [231 со ссылкой на патент [24]
о расщеплении БМД-производных различных дифторметиленовых
503
стероидов 40%-ной водной фтористоводородной кислотой «с высо-
ким выходом».
За. R о m a n е 1 1 i М. G., Becker Е. I., Org. Syn., 47, 69 (1967).
23. Н а г г i s о n 1. Т., Beard С., Kirkham L.f J a m i е s о n 1. М.
Rooks W., Fried J. H., J. Med. Chem., 11, 868 (1968).
24. A 1 v a r e z F., S i d d a 1 1 J. B., R uiz А., пат. США 3338930 (1967).
ФОРМАМИД (IV, 72—74, перед ссылками).
Синтез w-цианкарбоновых кислот. Вассерман и Дракри [8, 91
разработали новый метод получения co-циан карбоновых кислот
(IV). Первая стадия заключается в конденсации циклического аци-
лоина I (х=4, 5, 6 и 10) с Ф. в кислой среде и приводит к конденси-
рованному оксазолу II. Типичный эксперимент, например при л*=4:
раствор 4 а оксазола в 1 л СН2С12, содержащий метиленовый голубой
в качестве сенсибилизатора, облучают в течение 12—14 час УФ-
лампой (275 вт) при перемешивании и пропускании сухого кисло-
Ш
IV
рода, чтобы получить кислород в синглетном состоянии (-0—О ).
После испарения растворителя при комнатной температуре
получают сырой продукт, в ПК-спектре которого имеется четкое
поглощение, характерное для нитрильной группы (2250 см-1) и
для ангидрида (1785, 1765 елг*1); в спектре ЯМР имеется синглетный
сигнал (т 0,9), характерный для формильного протона. При обра-
ботке Ш легко отщепляется СО и образуется цианкарбоновая кис-
лота IV. В реакциях превращения П——> IV (х=4, 5, 6, 10) вы-
ходы составляют 80—90%. Как показано ниже для оксазола V,
полученного из циклододеканонола, реакция включает промежу-
точное образование озонида VI, который перегруппировывается
в цианангидрид 111, х=10. Потеря окиси углерода из смешанного
504
ангидрида муравьиной кислоты приводит к продукту VII.
Реакция со сложными эфирами [10]. В присутствии метоксиль-
ного иона в качестве катализатора сложные эфиры при взаимодейст-
вии с Ф. или N-метил формамидом образуют амиды:
(Na + O-CHS), 94—96°, 23—72 час
RCO2CH3-l hconh2 ——---------—ля/ -
2 J 3 50—74%
-Л RCONH2 + HC02CH3+CH3OH
8. Wasserman И. Н., Druckrcy Е., J, Am. Chem. Soc., 90, 2440 (1968).
9. Ref. I of this paper [1] should be to Tetrahedron Suppl., 7, 441 (1966).
10. Allred E. L., H urwitz M. D., J. Org. Chem., 30, 2376 (1965).
ФОРМАМИДИНИЯ АЦЕТАТ (IV, 74—75).
Ссылка [21: Ta v lor E. C., Eh r h a г t W. H., К a w a n i-
si M., Org., Syn.,46, 39 (1966).
ФОСГЕН (IV, 76—81).
Циклические карбонаты (IV, 79). Реакцию стероидного цис-
дисла-1,3 с Ф. в смеси пиридин — хлороформ, в результате которой
образуется циклический карбонат, Платнер п сотр. [12а] приводят
как доказательство tfwc-расположения гидроксильных групп. Дру-
гой пример описан Булшем, Раулем и Оуриссоном [126];
Лактоны (IV, 80, перед разделом Бензиловые эфиры аминокис-
лот). Лактонизация оксикислоты (4) в (±)-дидезоксизеаралан (5)
была осуществлена под действием Ф. и триэтиламина в условиях
505
высокого разбавления в бензоле
провести при действии обычных
[14а]. Циклизацию (4) не удается
реагентов (трифторуксусный ан-
(4)
гидрид, дициклогексил карбодиимид, тионнлхлорпд, п-толуолсуль-
фохлорид).
12а. Р 1 a t t п с г Pl. Л., F it г s t А., К о 1 1 е г F., L а п g W., Hclv. Chim.
Acta, 31, 1455 (1948).
326. Boulcli N. L., R а о и 1 Y., Ourisson G., Bull. soc. chim. France,
1967, 2413.
14a. Wehr meister H. L.( Robertson D. E., J. Org. Chem., 33, 4173
(1968).
ФОСФИН (Фосфористый водород) (IV, 81).
В упомянутой ссылке на генератор для получения газообразного
реагента описан синтез Ф. реакцией фосфида алюминия с водой.
Гокхэйл и Джолли [1а| получили Ф. пиролизом фосфористой кис-
лоты :
4Н3РО;1 ЗН;;РО4 — РН3
Заменить фразу после первого уравнения и формул (1) и (2):
Следует отметить, однако, что в тех же условиях 6-нитрохшюлин
(1) дает соединения (2) и (3), тогда как при восстановлении 2-1-штро-
нафталшга образуются продукты (4) и (5) [16].
506
la. Gokhale S. D., J о 11 у W. L., Inorg. Syn., 9, 56 (1967).
16. Bella a r 1 Д. C., Rec. trav., 83, 718 (1964); R u m m ens F. H. А., В el-
la a г t A. C., Tetrahedron, 23, 2735 (1967).
ФОСФОРА ХЛОРОКИСЬ (IV, 84—90).
Дегидратация спиртов смесью Ф. х.— пиридин (IV, 86’—88 в
конце раздела). Тебаин (1) можно рассматривать как метиловый
эфир енольной формы кодеин он а (2), однако прямой синтез его осу-
ществить не удалось. Недавно Рапопорт [12а] провел удобный кос-
(2)
венный синтез тебаина (1) из Дк-дигидротебаина (3). Добавление
метил тип обромита (полученного из NBA в метаноле) приводит к со-
единению (4) с 62%-ным выходом; дегидробромирование (4) под
ок
।
СН3СНгС(СН3)
80%
(3) (4) (5)
действием калия в mpcm-амиловом спирте дает диметилкеталь ко-
деинона (5). Наиболее удовлетворительным реагентом для отщепле-
ния метанола оказалась смесь Ф. х.— пиридин. Применение и-то-
луолсульфокислоты дает неустойчивые выходы, в лучшем случае
достигающие 40% .
Ф. х.— хлористое олово — пиридин (IV, 89—90, перед ссыл-
ками), Джонсон [201 установил, что стереоспецифичность синтеза
олефинов по Корнфорту можно повысить, если реакцию Гриньяра
(первая стадия) проводить при низкой температуре (—90°).
Ф. х.— фосфорная кислота — фосфорный ангидрид (IV, 90,
перед ссылками). Первоначально для циклодегидратации арилмас-
ляной и арилпропионовой кислот использовали фосфорный ангид-
рид в фосфорной кислоте [21], однако этот реагент был в значитель-
ной степени вытеснен продажной полифосфорной кислотой. Берч
[22] обнаружил, что смесь РОС13— Н3РО4— Р.2ОЙ по крайней мере
в двух случаях дает более высокие и воспроизводимые выходы, чем
первоначально использовавшийся реагент. Промежуточными про-
507
дуктами при этом могут быть хлор ангидриды кислот. Из дг-метокси-
фенилпропионовой кислоты с помощью нового реагента был полу^
чен 5-метоксигидриндон с выходом 85% 122], тогда как ранее приме-
нявшийся метод дает только 55%-ный выход.
12а. Rapoport Н., Lovell С. Н., R с i s t Н. R., Warren М. Е., Jr.,
J. Am. Chem. Soc., 89, 1942 (1967).
20. В r a d у S. F., I 11 on M. A., J ohnson W. S., J. Am. Chem. Soc., 90,
2882 (1968).
21. Birch A. J., J a eger R., Robinson R., J. Chem. Soc., 1945, 582.
22. Birch A.J., Subba Rao G. S. R., Tetrahedron Letters, 2763 (1967).
ФОСФОРНЫЙ АНГИДРИД — wpew-АМИН.
Шайблер и сотр. [11 использовали Р2О5 в сочетании с хинолином
для дегидратации неустойчивого к кислотам амида диэтилацеталя
глиоксалевой кислоты. Мак-Элвен и Кларке [2] не смогли воспроиз-
р.о,
(C,H5O)2CHCONH.,~—(С,Н5О)2СНС ~ N
1Т|
вести этот опыт, но обнаружили, что если в качестве основания ис-
пользовать триэтиламин, то нитрил получается с выходом 76—79%.
Недавно Стивенс и Сингал [3] использовали Р2О5— пиридин (по-
следний служит также и растворителем) для дегидратации амидов
типа (1) до кетиминов (2). Для облегчения перемешивания Р2О5
смешивают с песком, флорисилом (см. IV, 62—63) или окисью алю-
миния. Под действием Р2О.-}— пиридин мочевины легко дегидр'ати-
О Н
HsCMchLn-E~Ь-Х ДШЩ HsCt>c^c_N-/—У-х
н5с/ 1%С/ \=/
(П (2)
руются до к ар боди имидов [4]:
Р,О5-Ру
QHnNHCONHCeH^ C6HnN = С-NC6HU
l. ScheiblcrH.et al., Вег., 67, 1507, but see 1513 (1934).
2. McElvainS. AL, ClarkeR.L, J. Am. Chem. Soc., 69, 2661 (1947).
3. StevcnsC. L., Singhal G. H.,J. Org. Chem., 29, 34 (1964).
4. S te ven s C. L., S i n g h a I G. H., Ash A. B., J. Org. Chem., 32, 2895
(1967).
ФОСФОР ТРЕХБРОМИСТЫЙ (IV, 109—111 ; после выдержки из
151).
508
При обработке соединения (1) Ф. т. в ТГФ был получен с 20%-
ным выходом высоконенасыщенный 13-членный циклический аллен
— 1-бромциклотридекади ен-1,2-триин-4>8,10 (2). Продукт (2)
он
(2)
взрывает при температуре около 65° и медленно разлагается при
хранении в темноте при 0° [5а]. Использовавшаяся ранее для по-
добных превращений конц. бромистоводородная кислота [56] в дан-
ном случае непригодна.
ба. Leznoff С. С., Son dheimer F., J. Am. Chem. Soc., 90, 731 (1968);
P i 1 1 i n g G. M., Sondhcimer F., ibid., 90, 5610 (1968).
56. В 1 a c k D. !<., Landor S. R., Patel A. N., Whiter P. F., Tetra-
hedron Letters, 483 (1963).
ФТАЛАЗИНДИОН-1,4, (П). Л^ол. вес 160,13.
Впервые Ф. был получен в растворе окислением фталгидразида
(1) тетраацетатом свинца при 0° в ацетонитриле [1]. Позднее он был
выделен в виде зеленого кристаллического вещества при окислении
натриевой соли фталгидразида треш-бутилгипохлоритом [2].
I и
Подобно родственному N-фен ил им иду аз одик ар боновой кислоты,
Ф. является высокореакционноспособным диенофилом. Под дейст-
вием Ф. был получен первый из известных для циклооктадиена-1, 3
аддуктов Дильса — Альдера (III) [3].
Из стероидного Азл,1с-диенона-20 были получены 14 а,17 а- и
14 р, 17 р-аддукты [4].
509
1. С 1 е in с п t R. А-, J. Or" Chem., 25, 1724 (I960); 27, 1115 (1962).
2. Kcaly T. J., J. Am. Chem, Son., 84, 965 (1962).
3. C li ;t p m а и O. L., Domini a n n i S. J., J. Org. Chem., 31,3862 (1962),
4. Popper T. L., Carlo n F. E., M a r i g I i а п о H, M., Y u d i s M. D.,
Chem. Comm., 1968, 1431.
ФТОРДИХЛОРУКСУСНОЙ кислоты МЕТИЛОВЫЙ ЭФИР,
CCEFCCECH:;. Мол. вес 160,95, т. кип. 114,5— 115,5/732 мм.
Получение [1]. Смесь 1 моля фтор ди хлор уксусной кислоты, 1,5 мо-
ля метанола и 50 мл коиц. серной кислоты кипятят с обратным хо-
лодильником в течение 5 час и оставляют при 25“ на 17 час, затем
из реакционной смеси отгоняют сложный эфир, который промывают
до нейтральной реакции, высушивают и перегоняют над PXL,;
выход 145 а (90%).
Получение хлорфторкарбена. А1ур и Левин [1] провели экспе-
рименты, чтобы доказать образование хлорфторкарбена. Однако
более убедительные результаты получены японскими исследовате-
ля .ми [21. К смеси 0,75 моля циклогексена, 0,6 моля гидрида натрия
п 0,6 моля Ф. к. м. э. при комнатной температуре постепенно до-
бавляют 0,6 моля метанола. Выход 7-фтор-7-хлорноркарана состав-
ляет 60%) и является наивысшим из сообщавшихся в литературе.
CFCljCOzCHj
:CFC1
1. Moore R. Д., Levine R., J. Org. Chem., 29, 1883 (1964).
2. A n d о T., Yamanaka H., Terabc S., Hori ke A., Funasaka
VV., Tetrahedron Letters, 1123 (1967).
ФТОРИСТЫЙ ВОДОРОД БЕЗВОДНЫЙ (IV, 116—118, перед
ссылками).
В синтезе кумаринов из фенолов и p-кетоэфиров по Пехману [51
классическим конденсирующим агентом и растворителем является
серная кислота. По данным Ку [61 4-метил-7-оксикумарин получа-
ется с более высоким выходом при использовании полифосфор ной
кислоты (ПФК), однако Уолл и сотр. [7] безуспешно пытались при-
менить ПФК для конденсации а-арил-Р-кетоэфиров типа (2). Они
нашли, что прекрасные результаты в этом случае получаются при
использовании жидкого фтористого водорода. Эквивалентные ко-
личества резорцина и р-кетоэфира (2) растворяют в жидком HF
и смесь перемешивают в течение ночи; за это время почти все коли-
СОаС3Н-
I //—X Hi'
НО. z. ,011 О С—/ у—осн, —+
\/\/ %, / 1 Х=/ ' 53%
I I %. С н
' CJK
Ш ' (2)
510
честно фтористого водорода испаряется, остаток удаляют током
азота; образовавшееся масло затвердевает при промывании водой.
Пептидный синтез, отщепление защитных групп, Сакакибара и
Шимониши [8] показали, что при обработке Ф. в. б. полностью
защищенного производного окситоцина — окта пептидного гормона
задней доли гипофиза — отщепляются N-карбобензокси-, S-беп-
зил- и Э-гс-метокси бенз ильная защитные группы. Для предотвраще-
ния полимеризации бензилфторидов добавляют анизол. Ленард
п Робинсон [9] использовали этот реагент для снятия пептида с но-
сителя в твердофазном синтезе брадикинина по Меррифилду.
5. Р с с 11 ш а п п И., тол, D u isberg С., Вег., 16, 2119 (1883).
6. Коо J., Chem. Ind., 1955, 445.
7. С о о к С. F,., Corley R. С., W а 1 1 ,М. Е., J. Огц. Chem., 30, 4114 (1965).
8. S а к а к i b а г a S., S h i in о n i s li i Y., Bull. Clicm. Soc. Japan, 33, 1412
(1965).
9, Lenard J., Robinson A. B., J. Am. Chem. Soc., 89, 181 (1967).
ФТОРИСТЫЙ ВОДОРОД — ПЯТИФТОРИСТАЯ СУРЬМА
Насыщенные алифатические углеводороды легко карбонил ир у -
юте я окисью углерода в жидком HF в присутствии SbF^. Конечным
продуктом реакции является карбоновая кислота, сложный эфир
или кетон в зависимости от сольволиза реакционной смеси водой,
спиртом или углеводородом [1]. Активным промежуточным продук-
том реакции является, по-видимому, гексафтор антимонат карбо-
ппя.
Этим методом изопентан превращается в смесь пяти кислот:
НнС
>снсн,сн3
Н.Г/
со,
н2о
ю%
5%
8%
V 2%
2,2-диметилмасляной кислоты
2Ддиметилмасляной кислоты
2-этилмасляной кислоты
2-метилвалерьяновой кислоту
3-метилвалерьяновой кислоты
I. Р a a t z I?., Weisgerber G., Chem. Ber,, 100, 984 (1967).
ФТОРСУЛЬФОНОВАЯ КИСЛОТА (IV, 118—119).
Устойчивые карбониевые ионы. Ола и сотр. [5] сообщили о не-
посредственном наблюдении методом ЯМР феиониевого иона, про-
межуточное образование которого впервые постулировано Крамом
[6]. При обработке я-(р-хлорэтил)-анизола (1) Ф. к.— SbCl5 в SO2
при —70° образуется спирановый ион, имеющий, по данным ЯМР,
строение (2).
PSO2OH- SbCl5-so2
в)
(г)
Ола [7] опубликовал обзор своих работ по изучению устойчивых
долгоживущих карбониевых ионов. Ниже приводятся ссылки на
последующие сообщения * [8].
Обзор [9].
5. Olah G.A., Com i sa го w М. В., Naman worth E., Ramsey B.,
J. Am. Chem. Soc., 89, 5259 (1967),
6. C r a m D, J,, J. Am. Chem. Soc., 71, 3863 (1949); 74, 2129 (1952).
7. О 1 a h G. A., Chem. Eng. News, 45, 78, March 27 (1967).
8. OlahG. A. et ah, J. Am. Chem. Soc., 89, 156, 711, 1027, 1268, 1725, 2227,
2692, 2694, 2993, 2996, 3576, 3582, 3586, 3591 4736, 4739, 4744, 4752, 4756, 5687,
5692, 5694 (1967); 90, 401, 405, 927, 933, 938, 943, 947, 1884, 2583, 2587, 2726,
4323, 4666, 4672, 6085, 6087, 6461, 6964, 6988 (1968).
9. Gillespie R. J., Accounts of Chem. Res., 1, 202 (1968).
* Более поздние работы Ола п сотр. см. J. Am. Chem, Soc., 92, 3831, 5531
(1970).— Прим. ped.
512
X
ХИНОЛИН (IV, 120—122).
Контролируемое гидрирование. При изучении контролируемого
гидрирования ацетиленов в фщ-олефины Крам и Аллинжер 13а1
обнаружили, что палладий на сульфате бария со следами чистого X.
(синтетического) превосходит катализатор Линдлара по простоте и
воспроизводимости методики (X., полученный из каменноугольной
смолы, оказался непригодным для этой цели.) Например, 19,2 а
диметилового эфира 5-дециндикарбоновой-сс, со-кислоты гидриро-
вали в присутствии 0,4 г 5%-ного палладия на сульфате бария и
0,4 г синтетического X. в 100 мл метанола. Слабоэкзотермическая
реакция завершается через 20 мин с поглощением 1 экб водорода.
Тем же способом циклододекадиин-4,7 (3) с высоким выходом ВОССТа-
ftr ’ С ' ' И HL. — Pd-хинолин —СН3ОН
Щ-Н.Щ (СН 3)3 --------------------—
I ; 97%
со2сн3 со2сна
(СН2)3
to2CH3
(сн2)3
io2cH3
навливается в /ц(с,^пс-циклододекадиен-1,7 (4).
н н
г.__, г ГЦ —Pd- —ГЦ________,
I Д хинолин-СН3ОН Г р,
(СН2)4 (СНЦ 4 ------------------(СН2Х (СН2)4
! I 87% I I
i_ Г г . j I______С - С_______I
н н
(3) Т, пл. 37° (4)
За, Gram D. JА 1 1 i n g е г N., J. Am. Chem, Soc,, 78, 2518 (1956).
ХЛОРАМИН * (IV, 123—126).
Расширение цикла фенолов (IV, 125, перед разделом Азирины).
Для проведения реакции с расширением цикла фенолов фенол бе-
* Реакцией X. с третичными аминами получают 1, 1, 1-тризамещенные соли
гидразина (О m i е t a n s k i G, М_, S i s 1 е г Н_ Н_, J. Am. Chem. Soc., 78,
1211 (1956)1-— Прим. ред.
17 № 1994
513
рется в избытке и служит растворителем. Пакьетт н Фарли 117а]
нашли, что при избытке X. происходит окислительная димериза-
ция фенола:
СНЯ НУС /СНВ
/ ^-ОН-CINH, ~ НО-^ V-/ ^>-ОН
\^/ “ 9% \=/ \=/
ХСН3 Н3С' сн3
//С(СН3)<. (СН3)3С^ //С(СН3)3
V-...OH -I-C1NH, _120^ 1иХ О=(
:/ - 34% у=/
"С(СНз)3 (CH3);1CZ ХС(СН3)3
Считают, что реакция осуществляется по радикальному механизму.
Диазиридины (IV, 126, после формулы (4)). Шмиц и сотр. [19а1
установили, что при взаимодействии X. с шиффовыми основания*ми,
полученными из альдегидов, кетонов и циклических кетонов, об-
раз уюте я ди а з и р ид 11 н ы с вы х од ам и от 20 до 70% . Авторы пр вводят
доказательства в пользу непосредственного нуклеофильного при-
соединения X.
Н2О(Н + )
С = О +
NHR
nh2
(2) (3)
Ди аз ир иди и (1) гидролизуется водной щавелевой кислотой до
карбонильного соединения (2) и алкилгндразина (3). Вместо X.
можно использовать N-хлорметиламин или N-хлорпроизводные
других первичных алифатических аминов [196].
13. Delinitive paper; Cava М. Р,, V о g t В. R., J. Org. Chem., 30, 3775 (1965).
15. Add; Paquette L. A., Far lev W. C., J. Am. Chem. Soc., 89, 3595
(1967).
17a. Paquette L. A.,Farley W. C., J. Org. Chem., 32, 2718 (1967).
19a. S c li m i t z E., H a b i s c h D., Chem. Ber., 95 , 680 (1962); Sell m i t z E.,
Chem., Intermit. Ed., 3, 333 (1964).
196. Schmitz E., S c h i n k о w s k i K., Chem. Ber., 97, 49 (1964),
ХЛОРАНИЛ (IV, 127—130).
Дегидрирование (IV, 129, перед разделом Аллильное, окисление).
Реакцией тетрафенилциклопентадиенилнатрия (1) с бромистым тро-
пи л нем (2) был получен углеводород (3) [8а], который при кипяче-
нии с X. дегидрируется до тетрафенилсесквифульвалена (4). При
этом из первоначально темно-красного раствора выпадают зелено-
514
вато-черные иглы с металлическим блеском, т. ил, 250° (с разд.).
(О
8а. Р г i п z Ь а с h Н., S е i р D-, К п о t h е L., Faisst W., Ann., 698, 34
(1966).
1-ХЛОРБЕНЗОТРИАЗОЛ, (1). Мол. вес 153,57, т. пл. 105—106°,
Peai'ei-гт получают с 90%-ным выходом реакцией бензотриазола
в 50%-пой водной уксусной кислоте с водным гипохлоритом нат-
рия in.
I
а
(О
Это соединение с положительным галогеном в мягких условиях
и с высокими выходами окисляет спирты до альдегидов или кетонов,
а гидразосоединения до азосоединений. Окислитель при этом пре-
вращается в хлоргидрат бепзогриазола. Кроме того, (1) окисляет
Ьаминобензотриазол до дегидробензола (выход 80%; требуется
2 моля окислителя) и 2-аминобензотриазол до цис, цис-\,4-дициан-
бутадиена-1,3 [11.
1. R с с s С. W-, S t о г г R. Е., Chern. Comm., 1968, 1305.
515
ХЛОРБРОМ (IV, 132).
Реагент получают in situ из N-бромацетамида и HCI [11. Присое-
динение X. к холестерину и его производным даст с хорошим выхо-
дом 5 а-бром-6 ₽-хлордигалогениды [1]. Однако, как сообщал Ха-
винга [2], в случае 1-метилциклогексена сочетание NBA— конц.
соляная кислота приводит к образованию смеси ди бромида, бром-
хлорида и бромгидрина. При использовании NEC — НС1 в хлорис-
том метилене получается .только бромхлорид, причем в случае
алкилциклогексенов образуется смесь изомерных т/шнобромхлори-
дов. Авторы объясняют эти результаты механизмом, предусматри-
вающим образование циклического бромониевого иона, который
претерпевает т^анс-диаксиальное раскрытие, -давая соответствую-
щий бромхлорид.
1. ZicglerJ.B., ShabicaA.C., J. Am, Chem. Soc,, 74, 4891 (1952).
2. II ageman H.J., Ha vinga E., Rec. trav., 85, 1141. (1966).
ХЛОРИРИДИЕВАЯ КИСЛОТА И ИРИДИЯ ТРИХЛОРИД (IV,
133—134, перед ссылками),
Хенбест и сотр. [1] предложили использовать хлор иридиевую
кислоту как катализатор в сочетании с водным изопропанолом и
триметилфосфитом для восстановления кетонов до спиртов; при этом
преимущественно образуются аксиальные спирты.
Для восстановления 4-трет-бутилциклогексанона до соответст-
вующего ^нс-спирта Илиел и Дойль [21 использовали трихлорид
иридия и вначале получили хорошие результаты (см. IV, 134)-.
Однако позднее Илиел [3} отмечал, что «из-за непостоянной раство-
римости продажного трихлорида иридия в НС1 эта методика не всег-
да воспроизводима». Затем он обнаружил, что трихлорид иридия
можно с успехом заменить тетрахлоридом. Эту новую методику см.
в разделе Иридия тетрахлорид (т. V, стр. 222). ' -
3. Е I i е 1 Е. L., private communication.
ХЛОРИСТЫЙ ВОДОРОД БЕЗВОДНЫЙ, НС1. Мол. вес 36,46.
Отец и сын Брауны [11 сконструировали хороший автоматиче-
ский генератор водорода из бор гидрида натрия и хлористого водо-
рода для восстановления ненасыщенных соединений. Позднее
старший Браун и Рей [2] использовали этот прибор для превраще-
ния реакционноспособных третичных спиртов в хлориды и для гид-
рохлорирования некоторых олефинов. Хлористый водород полу-
чается автоматически, и образование его прекращается по оконча-
нии реакции. Таким образом, оказывается возможным следить за
скоростью расхода хлористого водорода и превращать практически
количественно спирт или олефин в конечный продукт, который при
этом не подвергается действию избыточного количества гидрохло-
рирующего агента.
1. Brown С. A., Brown Н. С., J. Am. Chem. Soc., 84, 2829 (1962),
2. Brown Н. С., R е I М.-H., J. Org. Chem., 30, 1091 (1966),
516
ХЛОРМЕТИЛБЕНЗИЛСУЛЬФИД, CeH5CH2SCH2Cl. Мол. вес
172,68, т. кип. 78 /0,2 лыц
Получение [1]. Реагент получают катализируемой хлористым
йодородом реакцией бепзилмер каптана с полиоксиметиленом. Не-
приятный запах меркаптана можно в значительной мере устранить,
если сразу же промыть аппаратуру щелочным раствором перман-
ганата.
Защита меркаптогруппы цистеина. Для защиты HS-группы ци-
стеина в пептидном синтезе обычно используется S-бензильпая
группа. Оказалось, однако, что при снятии защиты натрием в жид-
ком аммиаке часто наблюдаются нежелательные побочные реакции.
Янг и сотр. 11, 2} рекомендуют использовать S-бепзилтиометильную
группу, которую можно удалить под действием ацетата ртути в 80% -
ной муравьиной кислоте (для подавления образования тиазолидин-4-
карбоновой кислоты добавляют этиленгликоль). С применением
этой защитной группы был осуществлен синтез аналитически чис-
того глутатиона с почти количественным выходом.
1. В г о w л 1 е е Р. J. Е., С о х М. Е., Handford В. О., Marsden J. С.,
q и п у G. Т., J. Chem. Soc,, 1964, 3832.
2. Gamble R., Purkavastha RY о u n g G, T., J. Chem. Soc., (C),
1968, 1219,
м-ХЛОРНАДБЕНЗОЙНАЯ КИСЛОТА (IV, 138—143).
Получение [la! (IV, 138, в конце страницы). Реакцию м-хлор-
бензоилхлорида с перекисью водорода в присутствии гептагидрата
сульфата магния и водной натриевой щелочи в дпоксане проводят
в полиэтиленовом стакане, поскольку стеклянная поверхность
катализирует разложение надкислоты. Образующийся продукт
содержит 80—85% активного кислорода.
Эпоксидирование (IV, 141, после выдержки из [6|)_ Для эпокси-
дирования а, р-непасыщенных сложных эфиров обычно требуется
щелочная среда, однако этиловый эфир 4{//с-сх-фе’шлкоричной кис-
лоты (1) можно непосредственно эпоксидировать X. к., взятой в не-
большом избытке, в хлористом метилене [бай
СфЩ, ,СЙН=> гн С1
УС^С< -H*-ClCfiH4COsH
Hz ХСО2С3Н5 65%
(1) 0,DIG моля 0.02 моля
СсН- /С6Н5
— V—с<
н/ \/ хсоас2нб
о
(2)
Окисление по Байеру — Виллигеру (IV, 141, после уравнения).
При окислении метил кетона (1) действием X. к. был подучен ацетат
(2) с выходом 91% |2ай Раствор 1 г (1) в 3 мл хлороформа добавляли
517
при перемешивании к раствору 1,89 г. X. к. в 10 мл хлороформа.
Ж-СГС6ЬЦСО3Н
91% ~
ососн-
(2)
Степень взаимодействия контролировали ГЖХ-анализом; при ком-
натной температуре в темноте реакция завершается за 20 час.
Расщепление тетрагидрохромана (IV, 141, после уравнения).
Ошибки в предварительном сообщении [Boro w I t z I. J., G o-
n i s G., Tetrahedron Letters, 1151 (1964)] были исправлены в после-
дующей статье: В orow i tz 1. J,, Gonis G,, Kelsey R.,
Rappe R., WilliamsG. J., J. Org. Chem., 31, 3032 (1066).
Исправленный вариант уравнения:
Тетрагидрохроман (2) окисляется X. к. до 6-кетононанолида (5)
при тщательном соблюдении условий (2,8 же X, к., хлористый ме-
тилен, комнатная температура). Предполагают промежуточное об-
разование эфира оксинадкислоты (4), который подвергается фраг-
ментации с образованием (5). При использовании надфталевой кис-
лоты образуется гликоль (3), из которого расщеплением под дейст-
вием тетраацетата свинца получают (5).
3-Фенил-2-«-алкилоксазираны. Эти соединения можно получить
с выходом более 60% окислением иминов * X. к. 166]. Надуксус-
* Окислением мстил ими на бензофенона оптически активными надкислотами
был получен 2-метнл-3,3-д11фен11ло1\саз11ран — соединение, оптически активное
только за счет асимметрии атома азота [М о п t з п а г у F,, М о г г е t t i L,
Т о г г с G., Chem. Comm, № 24, 1694 (1968)]. Аналогично осуществляется аенм-
618
мая кислота в этом случае обычно непригодна.
/О.
QH.CH^NR С6Н5СН — NR
la . М C’T) о n а 1 d R. S t е р р е 1 R. N., D о г s а у J. Е., procedure sub-
mitted to Org. Syn. (1963).
2a. Ale inwa Id J., T 1.1 f a r i e I 1 о J. ,1Hurst J.J.. J. Org. Chem., 29,
2914 (1964).
6a. Valente V. R., Wolfhage n J. L., J. Org. Chem., 31, 2509 (1966).
66. P e v; s G. R., J. Org. Chem., 32, 1628 (1967).
ХЛОРНАЯ КИСЛОТА (IV, 143—151).
В дополнении к разделу Иод в качестве катализатора дегидрата-
ции (в этом томе) обращается внимание на тот интересный факт,
что X. к, является лучшим реагентом для осуществления пинако-
линовой перегруппировки бензпинаконов.
Синтез енолацетатов (IV, 148, после выдержки из 1181). Было
показано, по крайней мере в двух случаях, что катализируемое X. к.
ацетилирование енолов уксусным ангидридом является термоди-
намически контролируемым процессом Н8а1, Например, при реак-
ции 17 р-ацетокси-5р-андростанона-3 (1) с уксусным ангидридом
в присутствии X к. получаются два енол ацетата (2) и (3) в соотно-
шении 93,5 : 6,5. Соотношение, вычисленное на основании относи-
тельной устойчивости (2) и (3), составляет 96 : 4. Если смесь, состоя-
щую из 65% (2) и 35% (3), поместить в условия реакции, то равно-
весная смесь (2) и (3) 96 : 4 получается через 3,5 час, Енолацетнли-
рование (1) изопропенилацетатом в соответствии с кинетическим
контролем приводит к смеси (2) и (3) в соотношении 71 : 29. При
наличии 11р-гидроксильной группы относительное содержание
(3) повышается [1861.
Другие случаи каталитического действия. (IV, 149—150, после
выдержки из [241). Обработка стероидного 5 a,G а-диол а (1) сле-
дами X. к, в кипящем диоксане вызывает перегруппировку в 5-эпи-
мер ные кетоны (2) и (3). Под действ нем этилата натрия в этаноле (3)
превращается в (2); в положении равновесия смесь содержит 93%)
метрическое эпоксидирование олефинов |см., на пример, М on tana г i F.,Mor-
retti 1., Torre G., Chem. Comm., № 3, 135 (1969)] — Прим, nepee.
519
X. к. сильно ускоряет мер курирование ароматических соеди-
нений в уксусной 'кислоте, превращая ацетат ртути(П) в положи-
тельно заряженный электрофил [246. в, г|.
HCIO4 --11g(OAc)3 ты Hg OAcClOR щ НОАс
X. к. (70%-ная) превосходит серную и мстапсульфокислоту при
изомеризации олеиновой кислоты в у-сгеаролактом (2). Оптималь-
ные условия изомеризации: молярное соотношение реагентов 1:1;
температура 100°, время реакции 3 час [24 д].
н м
IlClOj, 100е, 3 час
СНа(СН2)/ Х(СН2)7СО,Н 60-65%"
(Л
СН3(СН2)13СН—сн2
б7 сн3
% с %
(5)
Этерификация (IV, 151, перед ссылками). При обработке триал-
килортоформиатом и 72%-ной X. к. (2: 1) 3 |)-окси-Д5-стероиды
этерифицпруютен с выходом 75—85% [261.
18а. Champagne)., Favre Ы., Vocel le Dk, Z b i к о w ski I., Can.
J. Chem., 42, 212 (1964); Liston A. J., J. Org. Chem., 31, 2105 (1966).
186. Liston A. <J., H о wa r d M., J. Org. Chem., 32, 1034 (1967).
24a. Fe tizon M., F о у P., Bull. soc. chim. France, 1967, 265'3.
246. Brown H. C., McGary C. W., Jr., J. Am. Chem. Soc,, 77, 2306 (1955).
24b. Schramm R. M., Klapproth W. S., W e s t h e i m e r F. H., J.
Phys, Colloid Chem., 55, 843 (1951),
24r. Kr cage A. J., D ub eck M., Brown H. C. J. Org. Chem., 32, 745
(1967).
24д. S h о wel 1 J. S., S worn D., Noble W. R., J. Org. Chem., 33, 2697
(1968).
26. D u s z a J. P., J oseph J.P., BernstelnS., Steroids, 8, 495 (1966).
N-ХЛОРСУКЦИНИМИД * (IV, 1 55, перед ссылками).
" См. примечание к разделу Х-Бромеукцинимид.— Прим. рей.
520
Хлорирование. Изучая монохлорирование 1,3-дигидро-2Н-
азелинонов-2Исходная система (1)1, Пакьетт 141 обнаружил, что с X.
выходы значительно выше, чем с другими хлорирующими агентами,
такими, как tn pern-бути л гипохлорит, хлорамин и хлор. В зависи-
мости от характера заместителей при N, С;} и С7 эти циклические
диен амиды хлорируются в положения С4 или C(J. Родственная сис-
тема, пиридои-2 (2), дает 5-хлорпиридон-2 (3) с 95%-ным выходом.
Пакьетт считает, что наиболее вероятным механизмом реакции яв-
ляется прямое электрофильное замещение. Он отмечает, что направ-
ление хлорирования согласуется с «принципом наименьшего дви-
жения» Хайна 15], который гласит, что «такие элементарные реак-
ции осуществляются тем благоприятнее, чем меньше происходит
изменений в положении атомов и в электронной конфигурации».
4. Paquette L. A., Farley W, С., J. Org. Chem,, 32, 2725 (1967).
5. Н 1 л с J., J. Org. Chem., 31, 1236 (1966).
ХЛОРСУЛЬФОИЗОЦИАНАТ (IV, 155—156). Т. кип.
54—567100 лш. Обзор: Graf R., Angew. Chem., Internat. Eel., 7,
172 (1968).
Внимание! X. очень едкий и бурно реагирует с водой.
Получение [П.
Синтез нитрилов [2]. Реагент взаимодействует с ароматическими
углеводородами, которые легко подвергаются электрофильному
замещению (например, антрацен), давая N-сульфохлор иды амидов
карбоновых кислот. Последние при обработке ДМФА теряют 8ОЯ
и НС1, превращаясь в нитрилы. Аналогичные продукты образуются
CsN
ЦМФА |
-НС1 м\/М/Ч
88-91% ^ | || | |
также при взаимодействии X. с кислотами, например с коричной
кислотой:
CISO.NCO
с6н5сн=^снсо„н —1> c6h5ch=chconhsoxi —>
ДМФА
——------CfiH5CHz= CHCN
-ыщ, -на %4_87%
521
1. G г я f R., Orq. Svn., 46, 23 (1966).
2. Loha tisG., Chem. Ber., 100, 2719 (1967), procedure submitted to Org. Syn.
(1968).
ХЛОРСУЛЬФОНОВАЯ КИСЛОТА (IV, 156, перед ссылками).
Декарбонилирование сложных эфиров. При растворении этило-
вого эфира 1,2-диметилциклопропен-З-карбоновой кислоты (I)
в X. к. (или фторсульфоновой кислоте) при комнатной температуре
выделяется окись углерода и по данным спектров ЯМР 161 с почти
количественным выходом образуется лиметилцнклопропенплий-ион
(1) (2)
(2), Эта методика проще и удобнее, чем метод с использованием
хлорной кислоты, предложенный ранее для получения дифенил цик-
лоп ропен или й-ион а [7],
6, Farnu m D. G., М е h t a G., S i 1 b е г ш а и R. G., J. Аги, Chem. Sue.,
89, 5048 (1967).
7. Farnu in D. G., Burr M., J. Am. Chem. Soc., 82, 2651 (1960).
ХЛОРУГОЛЬНОЙ КИСЛОТЫ трет-АМИЛОВЫЙ ЭФИР (IV,
158). Мол. вес 150,61.
Получение 111.
СИ, О СН, О
I || Ру(-60Л I ' ii
CH3CH2C--OH-i-ClCCl -777—> CHgCHoCO-СС1
j 60% !
CHg CH;?
Пептидный синтез Ш X. к. а. э. представляет собой бесцветное
вещество, которое при глубоком охлаждении можно хранить боль-
ше десяти дней. Реагент используют вместо карбобензоксихлорида
для N-защиты аминокислот. Конденсация с аминокислотами про-
водится в хлороформе в присутствии трнэтиламина. Защитная
группа удаляется при обработке трифторуксусной кислотой или
хлористым водородом.
О новых пр шпорах использования этого реагента в пептидном
синтезе сообщал Сакакнбара 12, 3|. Однако в некоторых случаях
в качестве побочных продуктов образуются уреиды. Эту побочную
реакцию можно почти полностью подавить, используя в качестве
основания этиловый эфир N, N-диэтил глицина вместо триэтил ами-
на 141.
Использование X. к. а. э. для получения трс/и-амилоксикарбо-
ниламинокнелот имеет некоторые ограничения, так как необходима
абсолютно безводная среда. Сакакнбара 15] превратил этот реагент
22
в более удобный трет-амил азидоформват (т. кил. 81,5—82751 —
53 мм) реакцией с безводным гидразином, приводящей к трет-
амилкарбазату, и последующим взаимодействием с нитритом нат-
рия (ср. с синтезом трт-бутилазидоформната, IV, 6). Этот азидо-
формиат при взаимодействии с аминокислотами в водном диоксане
в присутствии триэтиламина дает N-mpem-амилокснкарбонил амино-
кислоты с выходом 70—95%.
1. S a k a k i Ъ а г и S., S h i п М., F u j i п о At, S h i m о n i s h I Y., 1 и о и с
S-, 1 n и к a i N., Bulk Chem. Soc. Japan., 38, 1522 (1965); Sakakibara
S., Fujino M-, ibid., 39, 947 (1966).
2. Sa к a к i b ar a S., Fujino M., Bull. Chem. Soc. Japan., 39, 947 (1966).
3. S а к a к i b a г a S., Inukai N., Bull. Chern. Soc. Japan, 39, 1567 (1966);
S а к a к i b a r a S., I t о h M., ibid., 40, 646 (1967).
4. Wi llstatter R., Ber., 35, 584 (1902).
5, Honda I„ Sb imon ishi Y., Sakakibara S., Bull. Chem, Soc.
Japan, 40, 2415 (1967),
ХЛОРУГОЛЬНОЙ КИСЛОТЫ БЕНЗИЛОВЫЙ ЭФИР (карбобенз-
окенхлорид) (IV, 158—160).
Пептидный синтез (IV, 158—159). Де Тар [6а1 описал способ
получения бцс-карбобензокси-н-гистидииа, основанный, по сущест-
ву, 7ia методе Патчорника, Бергера и Канальского 1661.
н2кснсо2н
С——N
II %СН +2С6Н3СН.гОСОС1 +NaaCO3 —>
СН —Nz
I
н
CflHsCH2OCONHCHCO,H
I
СНп
I
C — N.
|1 ДСН
СН —Ьм
С-ОСН2СЙН5
1!
о
6а. Wieland А. А., А 1 b е г s R. J., DeTar D. F., procedure submitted
to Org. Syn. (1967).
66. Pate horni k A., Berger A., Katcha I s k i E., J. Am. Chem, Soc.,
79, 6416 (1957).
ХЛОРУГОЛЬНОЙ КИСЛОТЫ изо- и emop-БУТИЛОВЫЕ
ЭФИРЫ (IV, 160—161, перед ссылками).
Воган [61 отмечает, что в пептидном синтезе методом смешанных
ангидридов этот реагент имеет некоторое преимущество по сравне-
нию с другими простыми производными. Андерсон и сотр. [71 коне-
523
татировали: «Поскольку при использовании изобутилового эфира
хлоругольной кислоты выходы немного выше» (ссылка на статью
1952 г.), «мы ввели в практику этот реагент». Авторы отмечали так-
же, что реагент обладает еще одним преимуществом — он устой-
чив при хранении.
б. V a u g h a n J. R., Jr., О s a t a R. L., J. Am. Chem. Soc., 74, 676 (1952).
7. Anderson G. \V., Zimmerman J. E., Callahan F, M-, J. Am.
Chem. Soc., 88, 1338 (1966); 89, 5012 (1967).
ХЛОРУГОЛЬНОЙ кислоты трет- БУТИЛОВЫЙ ЭФИР. Заме-
чание об этом реагенте см. Хлоругольной кислоты изо- и втор-
бутиловые эфиры (IV, 161, 15]).
Получение (проверено). На одной из стадий полного синтеза
цефалоспорина С (1) Вудвард и сотр. [1] получили X. к. б. э. in
situ из mpem-бутанола, фосгена и пиридина в хлористом метилене
Hj’n/
снгососн3
(1)
при —74° и использовали его для синтеза трет-бутоксикарбоинль-
пого производного аминокислоты. Защитную группу затем удаляли
обработкой трифторуксусной кислотой.
Йаджима и Каватани [2] получали X. к. б. э. в условиях Вуд-
варда и обработкой раствора азотистоводородной кислотой в смеси
эфир — триэтил амин превращали в mpm-бутилазидоформиат с вы-
ходом 35%. По-видимому, это наиболее удобный способ получения
реагента.
1. Woodward R. В., et aL, J. Am. Chem. Soc., 88, 852 (1966).
2. Y a j ima H., Kawatani H., Chem. Pharm, Bull., 16, 183 (1968).
ХЛОРУГОЛЬНОЙ КИСЛОТЫ ИЗОБУТИЛОВЫЙ ЭФИР,
(СН3)2СНСН2ОСОС1 (IV, 160—161). Мол. вес 136,58, т. кип. 123— 126э.
Изобутоксикарбонильная группа была использована в синтезе
олигонуклеотидов для защиты гидроксильной группы в положении
5' дезоксирибозидов 111. Реагент проявляет высокую избиратель-
ность по отношению к З'-гидроксильной группе, о чем свидетельст-
524
йует высокий выход (1) (2). Защитная группа гладко удаляется
(3) (4)
при щелочном гидролизе: (3) -> (4).
1. Ogilvie К, К-, L е t s i n g e г R. L,, J. Org. Chem., 32, 2365 (1967),
ХЛОРУГОЛЬНОЙ КИСЛОТЫ n-НИТРОФЕНИЛОВЫЙ ЭФИР,
n-OjNCeHjOCOCl. Мол. вес 201,57, т. пл. 80—8Г. Реагент очищают
возгонкой.
X. к. н. э. используют’для защиты гидроксильных групп в нук-
леозидах; при этом образуются Опроизводиые двух типов, удобные
для дальнейшего синтеза [11. Так, в присутствии пиридина в бен-
золе X. к. н. э. взаимодействует с изолированной гидроксильной
группой 5'-тритилтимидина (1), давая б'-О-тритил-З'-О-и-нитрофе-
ноксикарбонилтимидин (2), который при гидролизе в кипящей вод-
ArOCOCl
Ру
89% ’ >
СП
525
о
о
(4)
Сз)
ной уксусной кислоте образует 3'-защищенный нуклеозид — З'-О-п-
нптрофеноксикарбопилтимидин (3). Как и следовало ожидать для
нитрофениловых эфиров, соединения (2) и (3) под действием имида-
зола в органических растворителях легко и количественно превра-
щаются в б'-О-тритнлтимндин и тимидин соответственно. Устой-
чивость и-нитрофенокснкарбонильной защитной группы демонст-
рируется фосфорилированием (3) 0-циан эти л фосфатом в присутствии
диппклогексилкарбодиимида в пиридине; после гидролиза продукта
фосфорилирования с хорошим выходом получают тимидин-5'-фос-
фат (4).
С рибонуклеозидами, например с уридином (5), X. к. и, э.
взаимодействует иначе благодаря наличию в (5) 2',3'-грю-гликоль~
ной группы, Так, в пиридине с высоким выходом получается цикли-
(S)
(О
ческнй 2',3'-карбопат (6), т. пл. 120—125" (с разд.). Циклические
карбонаты гидролизуются при обработке разбавленным раствором
едкого натра в водном пиридине при нагревании.
1. L е t s i n g 13 г R. L., О g f 1 v i e К. K.., J. Org. Chem., 32, 296 (1967).
ХЛОРУГОЛЬНОЙ КИСЛОТЫ ТИОБЕНЗИЛОВЫЙ ЭФИР,
C6H5CH2SCOC1. Мол. вес 176,66, т. пл. 12", т. кип. 6570,01 мм.
Реагент получают при взаимодействии бенз и л мер каптана с фос-
геном |1]. Аминокислоты и пептиды гладко ацилируются под дейст-
526
вием реагента в смеси вода — диоксан при 0° в присутствии окиси
магния, бикарбоната натрия или карбоната натрия. Эта защитная
группа была успешно использована в некоторых пептидных синте-
зах [2], а также для защиты гидроксильных групп в синтезе углево-
дов [3L
1. Kollonitsch J,, Gabor V., И a j 6 s A., Nature, 177, 841 (1956),
2. Kollonitsch J,, Hajos A,, Gabor V., Chem. Ber., 89, 2289, 2293
(1956); McCorquodale D. J,, Mueller G. C,, Arch, Biochem. Bio-
ph ys., 77, 13 (1958).
3. W i 1 I a r d J. J,, Can. J, Chem., 40, 2035 (1962); W И 1 a r d J. J., S a d о w-
s k f J., Vitale W., ibid., 41, 1223 (1963).
ХЛОРУГОЛЬНОЙ КИСЛОТЫ 0, P, р-ТРИБРОМЭТИЛОВЫ й
ЭФИР, СВг3СНаОСОС1. Мол. вес 345,25, т. кип. 47—5070,05 мм.
X. к. т. э. получают реакцией ₽, р, p-трибромэтанола с фосгеном
в бензоле. При взаимодействии с первичными и вторичными гидрок-
сильными группами нуклеозидов реагент дает р, р, р-трибромэтокси-
карбонильные производные (1). Защитную группу удаляют р-эли-
м и и нр оваяием под действием ци н к - мед н о й пары [ 1 ],
О
ROH 4-СВг,ДН3ОСОС1 —> CBr3CHaOCOR CBra = CH.34CO2 + ROH
Л)
1. Cook A, F., J. Org. Chem,. 33, 3589 (1968).
ХЛОРУГОЛЬНОЙ КИСЛОТЫ р,р,р-ТРИХЛОРЭТИЛОВЫЙ
ЭФИР, CC13CH,OCOC1 (TrOCOCl). /Мол. вес 211,88, т. кип. 171 —
1727760 мм, 75—76760 мм.
Реагент получают при пропускании фосгена в раствор трихлор-
этанола в смеси бензол — диэтиланилии. Под действием этого устой-
чивого хлорформиата гидроксильная и аминогруппы ацилируются
при комнатной температуре в пиридине или в условиях Шоттен —
Баумана (1—3) [11, Защитная группа удаляется при обработке
цинковой пылью в метаноле, Эта группа устойчива в условиях реак-
ции Саррета, окисления по Джонсу, а также к действию смеси
диоксан — НС1, трифторуксусной кислоты в течение 30 мин и к гид-
(1) Т. ПЛ.150-152°
(2) Т.ПЛ. 123-124°
(3) Т.ПЛ. 140-141°
527
рированию. Удаление защитной группы иллюстрируется следующим
экспериментом. Образец производного эпиандростерона (1) (107 мг)
перемешивают с 107 мг цинковой пыли в 1 мл уксусной кислоты в те-
чение 70 мин. Смесь фильтруют, фильтрат разбавляют водой, экст-
рагируют хлороформом и после кристаллизации получают эпианд-
ростерон (56 мг, 84%).
1. W i в d h о ] z Т, В., J о h n s t о п D, В. R., Tetrahedron Letters, 2555 (1967).
ХЛОРУГОЛЬНОЙ КИСЛОТЫ ФЕНИЛОВЫЙ ЭФИР (фенил-
о
хлорформиат), с1СОС0Н3, М°л- вес 156,57, т. кип, 68—7Г79 мм.
Расщепление третичных аминов [11. Третичные алифатические,
и алициклические амины подвергаются дезалкилированию при
взаимодействии с X, к. ф. э. в хлористом метилене при 10—40°
в течение 3—6 час. Выходы составляют 80—92%. Как по эффектив-
о
О
II
R3N + C1COC6HS-
+ 1
R„N — COCGH
[
R
ci-
О
II
R2NCOC6H5 + RC1
5
ности, так и по удобству применения реагент более предпочтите-
лен, чем бромциан. Такое расщепление было распространено на
некоторые алкалоиды, например 21-дезоксиаймалин (1). Реакция
(1) с этил- или фенилхлорформиатом (1,1 же) в хлористом метилене
при 25° завершается за 2 час. После удаления растворимых в воде
продуктов хлоруретан (2) получают с выходом 55%; N-феноксикар-
бонильный аналог (3) в тех же условиях был получен практически
с количественным выходом. Под действием как этил-, так и фенил-
хлорформиата 17-гидроксильная группа в заметной степени не
ацилируется. В самом аймалине имеется другая вторичная спирто-
528
вая группа в положении 21 сс, которая избирательно ацилируется
под действием обоих реагентов,
1, Hobson J, D., McCluskey J. G,, J. Chem. Soc., (C), 1967, 2015,
ХЛОРУГОЛЬНОЙ КИСЛОТЫ ЭТИЛОВЫЙ ЭФИР (IV, 162—
165).
Синтезы методом смешанных ангидридов (IV, 163, после вы-
держки из 16]). Виланд [6а] использовал этот реагент для односта-
дийной циклизации пептидов. Например, i-Try-Gly-L-Leu-L-Ala-
d-Тйг (1) обрабатывают Х.к.э.э. и C5H5N-HC1 (5 же) в смеси
ДМФА — ТГФ при 15°. К образующемуся смешанному ангидриду (2)
(без выделения) добавляют триэтил амии, что приводит к циклизации
в (3) с 30%-ным выходом. В отсутствие хлоргидрата пиридина вы-
ход (3) снижается до 8%. Одностадийный синтез с использованием
бис-(2, 4-динитрофеиил)-карбоната вместо X. к. э. э. осуществля-
ется с выходом лишь 13%.
pNHCH—-СНСН(ОН)СН3 Г NНСН^СН(ОН)СН3
I I
с'П - О = С — ОСОчСл Н5
СвН,ОСОС1 3 3 °
R —----R ->
| NHJ | NH3+Q-
L СО—in — СН, — ф-Индолил) LCO—(ЗН — СН3 — ф-Индолил)
R = Gly-L-Leu-L-Ala (О
(1)
p-NH —СН — СН(ОН)СН3
С = О Г со,
I + ч но
КН ( сгн5он
LCO — СНСНг — ф-Индолил)
G)
6а. Wieland Th., F а с s е 1 J., F a u 1 s t i с h H., Ann., 713, 201 (1968),
(C,H;)SN
30%~
N-ХЛОР-К-ЦИКЛОГЕКСИЛ БЕНЗОЛСУЛЬФ АМИД,
C6HjSO,NClC(iHn, Мол, вес 273,7.8, т. пл. 89°.
Этот пссвдогалогсн получается в виде масла, которое медленно
кристаллизуется после кипячения с петролейным эфиром.
Получение [1].
CeH5SO.Cl ^H,NCeI-I(1
Количественно
—> СвЩ5ОгХНСвНп Jl?-CLccHeSO3NClC(iH
Py
Аллильное хлорирование [1]. Реагент пригоден для хлорирования
олефинов; реакция катализируется перекисью бензоила, Выходы
составляют от 40 до 80%, Под действием реагента 1-метилнафталин
превращается в 1-хлорметилнафталин с выходом 63?%
1. Т h е i 1 а с к с г W., Wessel Н., Ann., 703, 34 (1967).
529
XPOMA(II) АЦЕТАТ (IV, 169—170).
Деиодирование иодкетонов (IV, 170, после формул (4) — (6)1.
Попытки декодирования иодлактона (7) в различных условиях
(облучение, каталитическое гидрирование) оказались безуспешны-
ми. Восстановление было с удовлетворительным выходом осушест-
(7) 1, 20 г
(8) 0,66 г
влено по методу Бартона и Басу 12, 51 с использованием иона двух-
валентного хрома в ДМСО в присутствии этилмеркаптана. Реакция
осуществляется с обращением 15а |.
Восстановительное дегалогенирование (IV, 170, перед ссылками).
Восстановление 1, 2, 3, 4, 7, 7-гексахлор-5-5«о>о-ацетоксибицикло-
|2, 2, П-гептена-2 (1) X. а. приводит главным образом к замещению
атома хлора в анти-положении к двойной связи; при этом (2) по-
лучается с 78%-ным выходом 17]. Это же преимущественное направ-
ление реакции сохраняется и при восстановлении цинком в уксус-
ной кислоте, по в этом случае образуется уже четыре продукта.
При использовании палладированного угля наблюдается восста-
новление и дехлорирование винильной системы.
5а. В а с h i ЛЕ D., Epstein J.W., Н е г z b е г g - Л1 i n z I у Y., Loe-
w e n t h a I H. .1. E., J. Org. Chem., 34, 12G (1969).
7. W i 1 1 i а ш son 1<. L., Hsu Y. F. L., Y oung E. I., Tetrahedron,
24, 6007 (1968).
XPOMA(Il) СУЛЬФАТ (IV, 170—171).
Получение (IV, 150). По усовершенствованной методике [3!
смесь 300 г водного X. с., 2 л воды, 75 г гранулированного цинка
и 4 мл ртути перемешивают в токе азота при нагревании около 30 час
до изменения первоначально зеленой окраски раствора на темно-
голубую. Образуется прозрачный раствор, не требующий фильтро-
вания.
530
Восстановление (IV, 171). При восстановлении X. с. а, р-нена-
сыщенных сложных эфиров, кислот и нитрилов, как правило, об-
разуются равные количества мезо- и d, /-продуктов. Восстановление
проводят в гомогенной смеси вода — ДМФА. Например 141:
БЮХ—-С—Н ю мин, води, дмфа CH,CO.,Et
ii __ 2Сг-+-!-2Н+ ------——| ' 4- +
Н-С —CO2Et 800 CH2CO,Et
Некоторые олефины также восстанавливаются под действием реа-
гента при комнатной температуре в водном ДМФА. Восстановление
тетраз амещенных олефинов приводит к смеси равных количеств
мезо- и ф /-алканов. С другой стороны, диметиловый эфир 2,3-диме-
тилмалеиновой кислоты восстанавливается исключительно в цис-
форме с образованием диметилового эфира л/сзо-2, З-диметиляптар-
ной кислоты. Было обнаружено, что многие ненасыщенные соеди-
нения инертны по отношению к этому реагенту, например этиловый
эфир коричной кислоты, изопрен, стирол.
3. Castro С. Е., procedure submitted to Огц. Syn. (1968).
4. Z u г q i у a h A., Castro С. Eprocedure submitted to Org. Syn. (1968);
sec also Castro С. E., S t e p h e n s R. D., M о j e S., J. Am. Chem. Soc.,
88, 4964 (1966).
XPOMA(II) ХЛОРИД (IV, 171 — 173).
Восстановление (IV, 172. после формулы (4)]. Восстановление
9а-бром-11 Р-ацетокси-А^-З-кетостероида X. х. вместо ожидаемого
I, 4, 9(11)-триена дает 5,9-пиклостероид llOal:
При обработке 6-нитрохолестерилацетата 8 же 0,1 н. X. х, в ки-
пящем ТГФ (в атмосфере азота, 3 час) получается оксим 3 Р-ацеток -
си-5 а-окси-6-кетохолестана [10 б].
[IV, 172, после формулы (6)]. При восстановлении 5 ct-хлор-б р-
нитрохолестанола-3 р (7) 4 .эко X. х. в кипящем ТГФ был получен
соответствующий 5 а-окси-6-окснм (10) с выходом 86% 11 lai. Пред-
полагают, что реакция осуществляется через промежуточное обра-
531
зование соединений (8) и (9), и тогда 5-ОН и N-ОН группы должны
находиться в нн/ии-иоложении.
Отщепление ацетоксильной группы (IV, 173, перед ссылками).
Калвода и Аппер [13] осуществили новый синтез А4,й-3-кето-19-
порстероидов. Они окисляли (1) до 10-ацетоксистероид а (2) под
действием тетраацетата свинца и карбоната кальция. 10-Ацетокси-
группу отщепляли обработкой X. х. в уксусной кислоте. Образую-
щийся при этом продукт (3) при непродолжительном нагревании
в уксусной кислоте изомеризуется в 19-нордиенон (4). При вос-
становлении (2) цинковой пылью получается неоднородный продукт.
10а, Robinson С. Н., G п о j О,, О 1 i v е t о Е. Р., Barton D. Н, R.,
J. Org. Chem., 31, 2749 (1966),
106. Hanson J. R., Premuzlc E., Tetrahedron Letters, 5441 (1966).
Ila. Hanson J. R,, PromnzicE., Tetrahedron, 23, 4105 (1967).
1'3, KalvorJa J., Anner G., Helv. Chim. Acta, 50, 269 (1967).
532
ХРОМИЛА АЦЕТАТ (IV, 173, перед ссылками).
При исследовании фотоизомеризации г|пс,^цс-1,5-циклоокта-
диена (1) Сринивазан 13] идентифицировал очень интересный про-
дукт превращения как трицикло-13, 3, 0, 0-Н-октан (2) и повысил
его выход с 1 до 30%. При изучении окисления углеводорода (2)
X. а. Мейнвальду и Каплану [4] удалось увеличить выход до 50%.
Окислительный агент был получен при добавлении 40 г хромового
ангидрида к смеси 200 мл уксусной кислоты и 200 мл уксусного ан-
гидрида при перемешивании в течение 1 час. Затем смесь охлажда-
ли до 0°, добавляли окисляемый углеводород и перемешивали при
0—3°. Дальнейшая обработка состоит в разбавлении водой, нагре-
вании до 100°, добавлении раствора едкого натра в количестве,
достаточном для нейтрализации 9096 уксусной кислоты, и исчерпы-
вающей экстракции эфиром.
(Ас0)2СгО2^
60%
9-1 (ГЖХ)
При окислении реагентом 3, 5-цикл оандростана (5) образуются
три кетона (6) — (8) и возвращается 30% исходного вещества [51.
При окислении (5) хромовым ангидридом были получены те же са-
мые’продукты, но с общим выходом 20%. Известно лишь несколько
примеров окисления в «-положение к циклопропановому кольцу.
Обзор окисления алкенов X. а. опубликован Вибергом [6].
533
3 р-Ацетокси-5 а, 6 [З-дихлорандростанон-17 (9) окисляется X, а.
до соответствующего 14 а-окспсоединения (10) с 25%-ным выходом
17]. Этот метод лучше, чем окисление хромовым ангидридом по
Андрэ и сотр. [81, в котором требуется катализ бромистым водоро-
дом или хлорной кислотой,
3. Srinivasan R., J. Am, Chem, Soc., 85, 3048 (1963); 86, 3318 (1964).
4, M ein wald J., Kaplan В, E., J. Am, Chem. Soc., 89, 261 1 (1967),
5, В e ugelmans R., Toub iana R,, Cornpt. rend., 264 (C), 343 (1967),
6. W i b erg К. B., «Oxidation in Organic Chemistry», Part A, 131——135, Acade-
mic Press, New York, 1965.
7, Sykes P. J,, К c 1 1 у R. W-, ,1. Chem. Soc., (C), 1968, 2346.
8, Andre A, I7., St., MacPli il I amy H. B., Nelson J. A., S h a b i c a
A. C., S c h о 1 z C, R., J. Am. Chem. Soc., 74, 5506 (1952),
ХРОМИЛА ХЛОРИД (IV, 174—175),
(IV, 175, перед ссылками,) С терминальным олефином 2, 4, 4-
триметилпентеном-1 (1) реакция осуществляется в ином направле-
нии [81. Углеводород, растворяют в хлористом метилене, предвари-
СН3 СН3
I СгОЮЦ Zn-H.jO |
СИССОН,С=СН, Комплекс - • > СН3ССНгСНСНО
( I ‘ СЩСЦ (9} /0 - / 8% |
СН3 СН, * СН3 СН3
(I) (3)
тельно обработанном X. х., добавляют X. х. и перемешивают при
0—5°. Затем смесь обрабатывают цинковой пылью для разложения
комплекса и получают 2, 4, 4-триметилпентаналь (3).
Тетраметилэтилен окисляется реагентом до пинаколина с 50%•
ным выходом
СН, СНз СН.,
CHSC ССН3 —> (СН3)3СС^О
Окисление тетрафенил эти лен а (4) под действием X. х. проис-
ходит с циклизацией и дает 9, 10-дифенилфенантрен (5) с 70%-ным
выходом [91. То же соединение (5) получается в качестве главного
продукта при окислении реагентом 1, 1, 2, 2-тетрафенилэтанола
110].
534
Freeman F., Cameron P. J., DuBois R. H., J. Org. Chem., 33,
3970 (1968); Free m а п F., D uBois R. H., procedure submitted to Org.
Syn. (1968).
9. Gatzke A. L., Stairs R. A., Diaper D. G. M., Can. J. Chem., 46,
3695 (1968).
10. Neu itzescu C. D., Bull. soc. chim. France, 1968, 13-19.
ХРОМОВАЯ КИСЛОТА, H2CrO4 (IV, 175—179),
Реактив Джонса (IV, 177, после выдержки из (71). Лави и сотр.
17а] обрабатывали стероидный лактон (1) реактивом Джонса в на-
дежде па образование соответствующего енона. Но вместо этого они
получили эпокси ди кетон (2). Тот же самый продукт образуется из
изомерного аллилового спирта (3). Дальнейшими исследованиями
было установлено, что эпоксидирование, имеет место только в том
случае, когда гидроксильная группа аксиальна, и при условии, что
окисление — более медленный процесс, чем эпоксидирование двой-
ной связи. Эпоксидирование осуществляется стереоспецифично;
в продукте реакции эпоксигруппа находится по ту же сторону моле-
кулы, что и гидроксильная группа в исходном соединении.
Двухфазное окисление (IV, 178, после 1121). По методу Брауна
и Гарга [111 аллильные спирты (1) окисляются до соответствующих
ви ни л кетонов (2) с приемлемыми выходами. Из-за конкурентного
окис,тения двойной связи требуется 30—40% -ный избыток окисли-
теля [ 1 lai. Реактив Джонса для этой цели менее удовлетворителен.
R-CHCH=CH., НЮ1ТЦ R-CCH=CHa
1 ----— il
ОН 50-6 5% о
(П (Ц
Двухфазная система была использована для избирательного
окисления алкилбораногруппы в присутствии двойной связи 11161,
Так, при обработке циклического диена (3) 1 экв диборапа был по-
лучен алкилборан (4), который затем окисляли смесью водная X.
535
к,— эфир до 8-циклогексадеценона-1 (5), вещества с мускусным
запахом.'
Окисление в присутствии нитрата марганца, Mn(NO3)2 (IV, 178,
перед ссылками). Окисление вторично-третичного вицинального
гликоля (1) X. к. в водной уксусной кислоте, содержащей немного
серной кислоты, преимущественно приводит к. расщеплению . до
17-кетона (74%). Однако при добавлении нитрата марганца в ка-
честве главного продукта получается ацетат кортизона (2) [15].
7а. Glotter Е., Greenfield S., Lavic D.. J. Chem, Soc., (C), 1968,
1646.
1 la. V anst о n с A. E., W h itchurst J. S., J. Chem. Soc., (C), 1966, 1972.
116. W ideinan L. G., J. Org. Chem., 33, 4541 (1968).
15. Walker В. H., J. Org. Chem., 32, 1098 (1967).
ХРОМОВЫЙ АНГИДРИД (IV, 179—183).
Водная уксусная кислота (препаративные методики) (IV, 180,
после пункта «г»).
д) Ускоковпч и сотр. [4а] обрабатывали X. a. d-гомо-диол-17а,
17аа (1) в смеси 80%-пая уксусная кислота — хлористый метилен
и эту двухфазную систему встряхивали при комнатной температуре
в течение 72 час до появления фиолетовой окраски уксуснокислого
слоя. Из раствора в хлористом метилене был выделен ди кетон (2).
Реакция является, по-видимому, первым примером окислительного
536
расщепления дитретичного 1, 2-гликоля до дикетона.
(1)100мг
Водная уксусная кислота (скорость окисления) (IV, 180, после
выдержки из [5]). По данным Рочека и Вестгеймсра !5а] рпс-1,2-
диметилп.иклопентандиол-1,2 (1) окисляется хромовой кислотой
в воде или в 90%-ной уксусной кислоте до гептандиопа-2,6 (2)
намного быстрее, чем транс-изомер (3). Так, окисление (1) в (2)
(з)
осуществляется в воде в 17 000 раз, а в 90% -ной уксусной кислоте —
в 800 раз быстрее, че,м (3). Авторы предполагают, что нпс-диол обра-
зует с хромовой кислотой циклический эфир, расщепление кото-
рого является стадией, определяющей скорость реакции. 1Мехаппзм
окисления транс-изомера, но-впдямому, иной.
Безводный СгО3 — уксусная кислота (реактив Фнзера) (IV, 180,
после выдержки из [8]).Защита спиртовой группы путем превращения
в метиловый эфир имеет ограниченное синтетическое применение
из-за низких выходов при последующем расщеплении эфира. Было
обнаружено [8а], что иод действием реактива Физера метиловый
эфир превращается в соответствующий формиат, который гидроли-
зуется основанием до спирта с выходом 50—60% . Например, 200 мг
СН3'(СН2)16ОСН3 —в АсОН-снф]щ CH3(CHJ15OCUO (II)
(D 'ОН-
CH^CHJijOlI
Т. пд(. 49 — 50“
гексадецилметилового эфира (1) окисляли суспензией Х.а. (1 е) в сме-
си уксусная кислота (10 мд) — хлористый метилен (10 мл) при 20°
в течение часа и после хроматографирования па силикагеле получи-
ли гексадецилформиат (II) с выходом 48%.
’537
Другой пример: расщепление стероидного 3-метплового эфира
(III) после предварительной защиты двойной связи бромированием:
Бокелхайде и Филлипсу 1861 удалось осуществить синтез очень
интересного соединения — трансЛЬ, 16-днметилдигидроппрена (17).
Они нашли, что по всем данным, включая спектральные и химиче-
ские свойства, этот углеводород, имеющий заместитель во внутрен-
осн3
I
/\ РВГ3
I |! —
Вг/ху хсн2он
сн3
осн3
р
11 L i АIН 4
ВЫ'"У' 'СОаСН3
сн,
(6)
538
осн.
осн.
6сн3
('ll) СНЩг 1
(12) CHjOH
*(13) СнгВ1-
(и) сил.
(10) X - CN
Na
(С6Щ)гС=С(С6Н5Ц
-------------—>
ней полости (4/Н~2) электронного облака, является ароматической
молекулой, На одной из стадий синтеза (ым. уравнение) между двумя
молекулами (8) образуется одно ще/пй-звено и таким образом полу-
чается производное дибензила (9) при взаимодействии с магнием
в присутствии FeCl3. При реакции дииодида (14) с тоикоизмельчен-
ным натрием и тетрафенилэтиленом в ТГФ строится второе мета-
звено, что приводит к трициклическому диметиловому эфиру (15).
Этот 8,16-диметил-5,13-диметокси-[2, 2]-метациклофан ранее по-
лучали 14-стадийным синтезом с выходом 1,9%. Затем был найден
более короткий и удобный путь, по которому (15) был получен на
десятой стадии с общим выходом 5,1%,
Далее возникло другое затруднение: обычные методы деметили-
рования оказались непригодными для диэфира (15), Однако данные
ЯМР-спектров свидетельствовали о том, что финиш этого синтеза
уже недалек. Дальнейшие попытки расщепления метоксильных
групп в (15) контролировали цветной пробой с хлорным железом на
содержание в реакционной смеси фенола, И сразу было найдено,
что хлорное железо деметилирует диеноп с высоким выходом. Дейст-
вием безводного реагента в хлорофор.ме был достигнут выход 93‘%
(эта реакция приведена в т. 11, стр. 9), Из других испытанных окис-
лительных агентов это превращение идет под действием хромовой
кислоты с количественным выходом при комнатной температуре.
Окислительное деметилирование метиловых эфиров хлорным
железом неприменимо, по-видимому, в тех случаях, когда ему со-
путствует реакция сочетания, как это имеет место в рассмотренном
примере (8)-—49).
539
Комплекс СгО3 — пиридин (реактив Саретта) (IV, 181, после вы-
держки из 1Ш), Коллинз, Хесс и Франк [11а] получили этот
комплекс фактически по методике, предложенной ранее Сар том,
но продолжали перемешивание при 15° до превращения жёлтой фор-
мы в темно-красную микрокристаллическую (полиморфизм?), ко-
торую можно было промыть петролейным эфиром, отфильтровать,
высушить в вакууме при 10 мм рт. ст. и хранить в отсутствие'вла-
ги, При испытании различных растворителей было найдено, что
лаилучшими для этого реагента являются хлорированные углево-
дороды. Альдегиды и кетоны получаются с исключительно хороши-
ми выходами просто при смешении комплекса со спиртом (в моляр-
ном соотношении 6 : 1) в хлористом метилене и выдерживании при
25' в течение 5—15 мин. Окисление холестерина приводит к А5-
холестенону (выход 64%) и небольшим количествам Д4-холестен-
диона-3,6 (10%) и А4-холестенол-Зр-она-6 (8%).
Было обнаружено, что под действием реагента стероидные тре-
тичные амины окисляются до N-формилпроизводных в некоторых
случаях с хорошим выходом [116]. Если образующиеся N-формил-
пропзводные гидролизуются до вторичных аминов, то такое окис-
ление может иметь препаративное значение.
4а. U skokovic М., Ст u t М., Т г а с h t е л b е г g Е. X., К I у п е W.,
Dorfman К. I., J. Am. Chem. Soc., 82, 4965 (1960).
5a, Rocek J., Weslhcimcr F. H., J. Am. Chem. Soc,, 84, 2241 (1962).
8a, Harrison I. T., Harri so n S., Chem. Comm., 1906, 752,
86. В о c k e 1 li e j d e V., P h i 1 1 i p s J. B., J, Am. Chem. Soc,, 85, 1545
(1963); 89, 1695 (1967),
Ila, CollinsJ,, Hess W., Frank F. J., Tetrahedr. Lett., 3363 (1968).
116, C a v ё А., К a n - F a.n С., P о t i er P., L e Men J., J a n о t М.Х.,
Tetrahedr., 23, 4691 (1967).
ц
ЦЕРИЙ, АММИАКАТ НИТРАТА (ЦАН) (IV, 184—185, перед ссыл-
ками) .
Под действием реагента в кислой среде (уксусная, муравьиная,
азотная,..хлорная кислоты) одна метильная группа, связанная с аро-
матическим кольцом, окисляется до альдегидогруппы с высоким
выходом; вторая же метильная группа окисляется в гораздо более
жестких условиях [3].
I
сн3
ЦАГТ
.50%-ная СНаСООН, 90°. 90 мин
Количественно
ЦАН
3,5 н, HNOS, 90°, 70 мин
ПАИ
3,5 н. HNO^, 30°, 90 мин
7 6%
В новом методе получения 19; нор стероидов [41 Л1,4’8-3-кетосте-
роид (Г) подвергают диенон-фенолыгой перегруппировке при обра-
ботке каталитическим количеством конц. серной кислоты в уксус-
ном ангидриде. З-Ацетоксигруппу продукта гидролизуют и обра-
зующийся фенол метилируют (2). Двойную связь в положении 5, 6
.восстанавливают (3) и 1-метильную группу окисляют под действием
ЦАН до 1-альдегида (4). При декарбонилировании 1-альдегида (4)
„трнс-(трифенилфосфип)-родийхлоридом образуется цикл А в виде
541
метилфенилового эфира, пригодного для восстановления по Берчу.
Цпклопропи л карбинол окисляется ЦАН до соответствующего
альдегида за 5—15 мин при 75“ с выходом 64% [51. Эта реакция
является, по-видимому, наиболее удобным способом получения
указанного альдегида.
Г>СНгОН %№)гСе(*Юг)г> Г^СН=О
64%
Арилциклопропаны расщепляются ЦАН до динптратов и нитрат-
ацетатов [61;
ЦАН Ph^^ONO,
/ МеСМ ONOa
11(44%)
НОАс
Ph О А с
ONCC
(15%)
ЦАН
ONO? ONOS
JllAr = C6H3 (80%)
IV Аг =Л-С1С6Н4 (81%)
1(1(53%)
+
IV (63%)
ON02OAc
Ar = CeH5 (8%)
Аг =п-С1С6Н4 (4%)
542
Оксимы и семикарбазоны под действием реагента окисляются
до исходных карбонильных соединений с выходами 70—80%. Ре-
акция осуществляется быстро при О', подходящими растворителя-
ми являются водные спирты, ацетонитрил и уксусная кислота [7].
2. Add; Т rahanovsky W. S,, Y о u п g L. В., В г о w n G. L., J , Org.
Chem., 32, 3865 (1967).
3. Sy per L., Tetrahedron Letters, 4493 (1966).
4. LaingS. B., Sykes P. J., J, Chem, Soc,, (C), 1968, 2915.
5, Young L. B., Trahanovsky W.S., J. Org. Chem., 32, 2349 (1967).
6, Young L. B., Tetrahedron Letters, 5105 (1968).
7. Bird,]. W., Diaper D. G. M., Can. J. Chem., 47, 145 (1969).
ЦЕРИЯ СУЛЬФАТ, Ce(SO4)2-4H2O. Мол. вес 404,32.
Окисление пирокатехина. При окислении пирокатехина окисью
серебра (111, 272) в абсолютно безводной среде Вильштеттер и Пфан-
неиштиль впервые получили о-бензохинон. Однако Брокхауз П1
сообщил недавно, что с-бенз охи ион устойчив в водной среде при pH
1—3 и его можно получить следующим образом: 1 г пирокатехина
в 65 мл хлороформа добавляют к 130 мл 20%-ной серной кислоты,
содержащей 7,34 г окислителя и лед, и смесь интенсивно встряхи-
вают в течение нескольких секунд. Затем смесь еще встряхивают
с раствором Ц. с, (10% от теоретического) при О’, промывают 0,01 н.
серной кислотой и сушат сульфатом натрия. Выход (в растворе)
86%.
1. Brockhaus R., Ann., 712, 214 (1968).
ЦИАНАЗИД, N = N — N—C=^N (IV, 185—186, перед ссылками).
Ц. реагирует с алканами при 40“' с отщеплением азота и образо-
ванием алкилцианамидов [2], По-видимомт, при этом получается
циан нитрен (NCN), который внедряется по связи С—Н:
?%CN Д-RH RNHCN-л N2
2. А и a s t a s s I о и A, G,, Simmons Н. Е,, Marsh F. D., J. Am, Chem.
Soc., 87, 2296 (1965).
ЦИКЛОГЕКСАНДИОН-1,2. Мол. вес 112, 12, т. пл. 39°, т. кип.
75—79716 мм.
Получение [1, 2]
/\ '° /\/°
j у 8 час при 87" f \
1 I I +SeC^ —I I
\/ \/%
ан 3 И)
ГТ FeCl3-2 H.HC1
Р+ (СН-ЩВО + BF3-Et2O--> 1 I —--------—---»
н 7 6% ОН 7 6 А
543
Химическая модификация аргинина [4]. При взаимодействии
Ц. (1) с ь-аргинином (2) в водном 0,2 ц, едком натре была получена
новая а-амипокислота, №-(4-оксо-1, 3-диазаспиро-[4, 4]-нонанили-
ден-2)-ь -орнитин (3), строение которой было подтверждено встреч-
ным синтезом. Отсюда был сделай вывод о том, что в процессе фер-
HN Н
I + /C-NCH,CH.,CH,CHCO,H-->
\/ х0 H2i\ NH
(1)
Н2С^СН2
I !
Н2С сн,
Х(>----С = О
I I
HN NH
с7
II
NCH2CH.,CH2CHCOnH
I
NH,
(3)
моптативпого гидролиза белка под действием трипсина Ц. специфи-
чески реагирует с гуанидиновой группой аргинина, поэтому при
ферментативном гидролизе расщепляются только лизильные связи.
1. Н а с h С. С., В a n k s С. V.. Diehl Н., Org. Syh„ Coll. Vol., 4, 229 (1963),
2. Colien T., T s u j i T,, J, Org. Chem., 26, 1681 (1961).
3, DeBorger L., Anteunis Al., Lammens H., Vcrzele M., Bull,
see. chim. Belg., 73, 73 (1964).
4. I о i K., Bvnum E., Norris E., I t a n о H. A., J. Biol. Chem., 240,
PC3455 (1965); 242, 1036 (1967).
ЦИКЛОПЕНТАДИЕНОНА КЕТАЛИ (диметил-, диэтил-, три-
метилен- и этиленкетали).
Получение. Циклопентадиеноп имеет очень короткий период
существования и даже при очень низких температурах подвергает-
ся спонтанной димеризации. Предполагая, что кетали циклопента-
диенона будут менее реакционноспособными, Итон и Хадсон
11] предприняли попытки получения этих производных. Обработкой
соответствующего кеталя циклопента пом а 2 экв бромгндрата
пиридинийпербромида были получены с хорошим выходом
соответствующие кетали 2, 5-дпбромциклопентаиоиа в виде масел.
При обработке трет-бутил атом калия в ДМСО при 18—20° осущест-
544
вляется двойное дегидробромирование; после добавления ледяной
воды ненасыщенный кеталь экстрагируют холодным пентаном. Ке-
тали более устойчивы, чем исходный кетон, однако их следует ис-
пользовать сразу после получения и только в разбавленных раст-
ворах.
Реакции Дильса — Альдера. Диметил-, диэтил- и тримети-
ленкетали циклопентадиенона легко реагируют с реакционно-
способными диенофилами, например малеиновым ангидридом, тет-
рацианэтиленом или л-бензохиноиом, с образованием производных
норборненона. Этиленкеталь пентадиенона в эти реакции не всту-
пает. Менее активные диенофилы следует брать в большом избытке.
Кетальную защитную группу удаляют при обработке кислотой [1].
При окислительном разложении комплекса трикарбонила же-
леза с циклобутадиеном (тетраацетатом свинца в пиридине) в при-
сутствии диэтил кеталя циклопентадиенона выделяющийся в ка-
честве промежуточного продукта циклобутадиен образует с диэтил-
кеталем аддукт I. Облучение раствора I в ацетоне приводит к 9, 9-
диэтоксигомокубапу, который в кислой среде гидролизуется до
гомокубанона (II). Представляет интерес соответствующий спирт
гомокубанол, так как полученный из пего катион является молеку-
лой с флуктуирующими связями * [2].
о
I п
* Имеется в виду непрерывная обратимая внутримолекулярная перегруппи-
ровка типа перегруппировки Коупа, представления о которой развиты в замеча-
1 8 № 1994
545
1. Eaton R. E., Hudson R. A., J. Am. Chem. Soc., 87, 2769 (1965).
2. Barborak J.C.,Pelt it R., J. Am, Chem. Soc., 89, 3080 (1 967),
ЦИКЛОПРОПИЛТРИФЕНИЛФОСФОНИЙБРОМИД. (2). Мол.
вес 383,26, т. пл. 189—190=.
Реагент получают несколькими способами, из которых наиболее
удобный состоит во внутримолекулярной циклизации 3-бромпро-
пилтрифенилфосфонийбромида (1) под действием гидрида натрия
в ТГФ [1]
NaH ^Нлч
](СеН5)3Р + СН.,СНХН,Вг] Вг--> | >СНР+ (С6Н3)3Вг~
59-/5% СН.7
(!) J (2)
В присутствии фениллития реагент взаимодействует с карбо-
нильными соединениями с образованием циклопропилиденовых
производных [2]:
(5)
тельной работе В, Деринга, доложенной в декабре 1961 г, в Ленинграде на Между-
народном симпозиуме, посвященном столетию теории химического строения
А. М. Бутлерова [Журнал ВХО им. Д. И. Менделеева, VII, № 3, 308 (1962)],
и позднее опубликованной [von D о г i п g XV. Е., Roth W. R., Tetrahedron,
19, 715 (1963)]. В этой работе Деринг исследовал непрерывную перегруппировку
Коупа в 3, 4-гомотропилидене и предсказал удивительные свойства буллвалена,
в котором непрерывная перегруппировка Коупа должна привести к перемещению
связей по поверхности этой сферической молекулы и усреднению всех протонов.
Вскоре буллвален был синтезирован и изучен Шрёдером [Schroder G,,
О t h J. F. М,, М е г ё п у i R., Angew. Chem,, 77, 774 (1965); Schroder G,,
О t hj, F. M., Angew. Chem,, 79, 458 (1967)]. В спектре ЯМР буллвалена при на-
гревании наблюдается синглетный сигнал от всех протонов,
О энергия активации перегруппировки £а=Д1,8 ккал/люль,
log Д = 12,3. Обзор о молекулах с флуктуирующими связями см.:
Шрёдер Г., От Ж Ф, М., Мерен и Р., Усп. хим., 36,
выц. 6, 993 (1967). О металлоорганических соединениях с флук-
туирующими связями имеется обзор: Cotton г. A., Accounts
Chem. Res., 1, Ke 9, 257 (1968), а также многочисленные работы, например;
Davison A., R a k 1 t а Р Е., Inorg. Chern., 9, № 2, 289 (1970); Гришин
Ю, К., Сергеев Н. М., У с т ы н ю к Ю. A., J, Organometallic Chem,, 22, 361
(1970).— Прим. ред.
546
С натриевой солью салицилового альдегида (6) реагент дает смесь
2,3-дигидро-7-бензоксепина (7) и 2-метил-З-хромена (8):
1. S с h w е i z е г Е. Е., Thompson J.G., Shaffer Е.Т,, Hanson
Н, К., procedure submitted to Org. Syn. (1968).
2. Sc h wei zer E. E., Berninger C. J., Thompson J. G., J. Org.
Chem., 33, 336 (1968).
ЦИНКА БРОМИД, ZnBr,. Мол. вес 225,19, т. пл. 394°.
Робертс и Мазур [1] при обработке смеси циклопропилметилхло-
рида и циклобутилхлорида (приблизительно 2 : 1) хлоридом цинка
в конц. соляной кислоте (реагент Лукаса [2]) получили гомоаллил-
хлорид с выходом 46%. Соответствующие бромиды изомеризуются
под действием Ц. б. в 48%-ной броми сто водородной кислоте.
С1
ZiiCla-HCl^ СН2-СНСН2СН2С1
7 6%
Джонсон [3] пытался применить эту перегруппировку на одной
из стадий стереоспецифического синтеза соединений с тра«с-три-
замещенной двойной связью, однако в сильнокислой среде наблюда-
18*
547
лась нежелательная изомеризация. Позже было найдено, что наи-
более подходящим для этого реагентом является безводный Ц. б.
в эфире. Так, при обработке карбинола (1) трехбромистым фосфором
в присутствии коллидина получали смесь бромидов (2) и (3). Смесь
обрабатывали Ц. б. при 0° и с выходом 85—90% выделяли продукт,
который является транс-диеновым бромидом (4).
Эта методика была использована как ключевая стадия в синтезе
рацемического ювенильного гормона (7) [41. Карбинол (5) бромиро-
ванием и описанной выше перегруппировкой превращают в транс,
/прпнс-бромдиенсвый эфир (6), из которого в несколько стадий по-
лучают гормон (7).
1. R о b е г t s J. D., М a z ц г R. Н., J. Am. Chem. Soc., 73, 2509 (1951).
2. Lucas Н. J., J. Am. Chem. Soc,, 52, 802 (1930).
3. Bradv S. F., I 1 t о n M. A,, Johnson W. S., J. Am. Chem. Soc., 90,
2882 (1968).
4. Johnson W. S., Li T., Faulkner D. J., C a m p b el 1 S. F., J. Am.
Chem. Soc,, 90, G225 (1968). .
ЦИНК АМАЛЬГАМИРОВАННЫЙ (IV, 202—204, перед ссыл-
ками).
Свенсон [9] предпринимал безуспешные попытки восстановления
кегогрунпы 3-перинафтанон-1-карбоновой кислоты (1) методом Ху-
анг-Минлона и десульфуризацией этилентиокеталя. Необходимую
кислоту (2) ему удалось получить, правда с низким выходом, вос-
становлением по Клемменсену в модификации Мартина.
%/\/Н
| " р'СО2Н
(I)
Zn(Hg)-HCI, С6Н3СН3
9. Svensson Т., Arkiv Kemi, 26, 27 (1967).
548
ЦИНКА ХЛОРИД (IV, 205—209, перед ссылками).
Реакция Бланка. Взаимодействие п-бромтолуола с формальде-
гидом в присутствии каталитических количеств кислот Льюиса
было изучено с целью применения изомерных хлорметильных про-
изводных в синтезе метилхолантрена. Физер и Селигман [18] сплав-
ляли безводный Ц. х. с 1% хлорида алюминия. После охлаждения
к сплаву добавляли /г-бромтолуол и параформ и в смесь медленно
пропускали ток хлористого водорода при нагревании до 45—50"
в течение 18 час. По сравнению с чистым Ц. х. применение этого
смешанного катализатора позволяет повысить выход продукта
почти в три раза.
СН3
I
|| +(СН„О)/г + [280 г7пС1„Л-2,8 г А1С13]
Сплав
/ДО/
/d /о
Получение циклогептандиона-1,3. Индийские химики [19] по-
лучили этот дион из дигидрорезорцина (1) превращением его в мс-
ноэтиленкеталь (2) и последующей реакцией с диазоуксусным эфи-
ром, катализируемой безводным Ц. х. Авторы отмечают, что боль-
шую роль играет качество Ц. х. Продукт (3) превращают в дион (4)
при гидролизе и декарбоксилировании под действием водного ед-
кого кали.
18. F i е s е г L. I7., S & 1 i у m a n А. М., ,1. Am. Chem. Soc., 57, 942 (1935).
19. Sei v arajan R., Хага ya п К. V., Swaminathan S., procedure
submitted to Org. Syn. (1968).
549
ЦИНК, ДРУГИЕ ФОРМЫ (IV, 213—214, после выдержки из
[3]).
Аналогично из трибромацетилбромида под действием цинка,
активированного медью, был получен дибромкетен 13а].
За. Brady W, Т., J. Org. Chem., 31, 2676 (1966).
ЦИНК-МЕДНАЯ ПАРА [IV, 214—214, перед ссылками).
Синтез алленов. Сообщение Гинзбурга [51 о восстановлении
диметилпропаргилхлорида (5) Zn-Сн-парой в этаноле до 3-метил-
бутадиена-1, 2 (6) было подтверждено Хенн ионом и Шиханом [6],
которые применили этот метод для получения гексадиена-1, 2 (8).
СН3 СН3
( Zn - Си, ЕЮН [
сн3с—с = сн-----------СН3С=С=СНЙ
I (6)
С1
(5)
Zn — Си, Е(ОН
сн3сносн.хн—с = сн ———----------> СНХНХН2СН = С=СН,
I 71% ' (8)
CI
(?)
Авторы предлагают следующий механизм этой интересной перегруп-
пировки:
с2н5—о— и
R-CHC1-C^CH + Zn + С,Н5ОН->R-GH-C=CH---->R~CH=C«CH2 + CSHSO-Zn-Cl
ZnCl
Недавно подобный пример описан группой английских исследова-
телей [7].
СН3СНС1 — С = ССН.2СН.,ОАс —> сн3сн==с=снсн.,сн,он
4 9%
5. Гинзбург Ю. И., ЖОХ, 10, 513 (1940).
6, Hetinion G. F., Sheehan J-C-.J-.J,, Am. Chem. Soc., 71, 1964 (1949).
7, L a n d о r P. D., Landor S, R., Pepper E.P., J. Chem. Soc., 1967,
185.
ЦИНКОВАЯ ПЫЛЬ (IV, 215—227).
Ц. п,— уксусная кислота, расщепление сульфонов (IV, 219,
после выдержки из [19а]). Расщепление сс-ароилсульфонов цинком
в уксусной кислоте осуществляется с лучшим выходом, чем под
действием амальгамы алюминия (57%) [236].
Zn - АсОН. ЕЮН
C6H5COCHSOsCH3 ——-------------> С6Н5СОСНгСН3
I ' s /о
сн3
550
Ц. п.— минеральная кислота (IV, 220—221, в конце раздела).
Замещенные индолы с удовлетворительными выходами восстанав-
ливаются до индолигюв оловом или Ц. п. в соляной кислоте; неза-
мещенный индол в этих условиях полимеризуется. Однако под
действием Ц. п. в 85%-ной фосфорной кислоте индол восстанавли-
вается до индолина* с выходом 64—69%. Этот метод был использо-
ван также для восстановления двух замещенных индолов [28а].
Реакция Серини (IV, 223—224, после выдержки из [42]). Рубин
и Браун [42а] описали применение в реакции Серини активирован-
ного цинка; 1100 а гранулированного цинка (30 меш) обрабатывают
4,4 л конц. серной кислоты, содержащей 2 мл 90% -ной азотной кис-
лоты.
Реакция Серини является общим синтетическим методом. Так,
Гера и сотр. [426] обнаружили, что эта реакция — наиболее под-
ходящий метод удаления третичных гидроксильных групп в диаце-
тате тетрола (5) с образованием дикетона (6). Эта реакция была
использована на одной из стадий полного синтеза производных р-
амирипа (9) и (10) [42в], Диацетат (7) превращается в дикетон, ко-
торый в результате равновесной реакции под действием основания
дает более устойчивый эпимер (8). Циклодегидратацию дикетона
* Гидрированием индола при нормальном давлении в смеси СН3СООН —
2 и. НО над Pd (OH).2/BaSO4 (1,5 '/ас при 60е) ипдолнн получен с 90%-ным
выходом. Последующее гидрирование в тех же условиях, но с заменой раст-
ворителей дает следующие продукты [Kuhn R., Bu tula I., Aug. Chem.,
80, 189 (1968)]:
— Прим. ped.
551
осуществляют под действием хлорной кислоты и уксусного ангид-
П) (8)
(9) (Ю)
ряда в смеси бензол — уксусная кислота при комнатной темпера-
туре.
Гера [42г] обнаружил, что реакция применима к ацетатам ацик-
лических диолов и, таким образом, служит общим методом синтеза
альдегидов и кетонов. При этом необходимо использовать чистые
ацетаты диолов и активированный цинк.
Примеры:
СН3 сн,
СзНцССНДЭАс-----С5НПСНСНО
5 11 । " 62% 3 11
ОН
он
[
(СаН-).,ССН,ОАс —(СаНй)2СНСНО
1 о %
ОАс ОН
I 1
С6Н5СН - С(СН3), СеН5СОСН (СН3)2
/О
C-Алкилирование (IV, 225, перед ссылками). При обработке а-
бромкетонов (1) или (3) подпетым метилом и Ц. п. в смеси бензол —
ДМСО (10 : 1) образуются соответствующие сс-метил кетоны (2) и
552
(4) [521.
В некоторых случаях наряду с алкилированием наблюдается
конденсация сс-бром кетонов в фураны. Например, а-бромцик-
логептанон (5) при концентрации 0,016 44 образует в качестве глав-
ного продукта а-метилкетон (6) с 43\'о-пым выходом, но в более
концентрированных растворах (0,28 А1) с 58%-ным выходом полу-
чается фуран (7).
Zn, СН31, С6Н6-ДМСО
(5) (6) (7)
Восстановление по Клемменсену. Японские химики [53] акти-
вировали продажную Ц. п. промыванием 2%-ной соляной кислотой
в течение 3—4 мин. Затем реагент промывали последовательно во-
дой, этанолом, ацетоном и эфиром и нагревали при 90° в вакууме
в течение 10 мин.
Под действием этого реагента в уксусном ангидриде, насыщенном
хлористым водородом, незатрудненные кетогруппы стероидов вос-
станавливаются до метиленовых групп [54]. Наиболее высокие вы-
ходы получаются со свежеприготовленным реагентом [53]. Кроме
того, реагент восстанавливает сс-галоген- и а-ацетоксикетостероиды;
например, 2а-бромхолестанон-3 дает холсстан с выходом 86%. Эта
реакция была открыта в процессе исследования алкалоида изодаф-
нифидлина [551.
Синтез кумуленов. Дегалогенированием 1,4-дихлоралкинов-2,
синтезированных из 1, 4-ди оке нал к инов-2 и тнонилхлорида, были
получены с очень хорошими выходами 1, 2, 3-триены. В этой реак-
ции с равным успехом использовали Ц. п. или иодистый натрий
553
в ДМСО при 80° 156].
\с-с-зссн,2с1 ч>с^с^с=сн,
С1
Изомеризация а, p-непредельных кетонов и эфиров. При восста-
новительном дебромировании под действием цинка в водном этаноле
6 Р-бром-Д4-холестенон-3 (1) превращается в Д5-холестенон-3 (2)
с частичной изомеризацией в сопряженный кетон. Однако несопря-
женный кетон удается получить с выходом 25% . Перекрестносопря-
женный кетон 6 Р-бром-Д1,4-андростадиендион-3,17 (3) превраща-
ется в Д1,&-андростадиендион-3,17 (4).
Подобным образом у-бром-а,р-непредельные эфиры превраща-
ются в Р,у-непредельные эфиры при обработке цинком в уксусной
кислоте [58]. Выходы продуктов составляют 75—95%.
Примеры:
/\ /\ /с°Ан5 /х/ч zCOaC2H5
В г ])Ас ОАс
Вг
(СН3)-А.
'%ХСОХ2Н5
^СО,С2Н5
236. House Н.О., Larson J. К., J. Org. Chem., 33, 61 (1968).
28a. Dolby L. J-, G r i b b 1 c G. W., J. Heterocyclic Chem., 3, 124 (1966).
42a. R u b i n M. B., Brown A, P,, procedure submitted to Org. Syn. (1967);
Rub in M. B., Biossey E.C., Steroids, 1, 453 (1963).
426. Gbera E., Gibson AL, Sondhcimer F., J. Am. Chem. Soc., 84,
2953 (1962).
42b. Ghera E., Sondheimer F., Tetrahedron Letters, 3887 (1964).
42r, Ghera E., Chem. Comm., 1968, 1639.
554
52 S p e n с е г Т. А., В r i 11 о n R. W., Watt D. S., J. Am. Chem. Soc.,
89, 5727 (1967).
53. Yamamura S., Chem. Comm., 1968, 1494.
54. Yamamura S., Ueda S., Hira ta Y., Chem. Comm., 1967, 1049;
Yamamura S., FI i r a t a Y., J. Chem. Soc., 1968, 2887.
55. Yamamura S., [rikawa H., H i ra t a Y., Tetrahedron Letters,
3361 (1967).
56. M о n t 1 j n P. P., Bran dsma L., Arens J. F., Rec. trav., 86, 129
(1967).
57, Nussbaum A. L,,ToplissG.B.,Popper T. L.,OlivetoE.P<,
J, Am. Chem. Soc., 81, 4574 (1959).
58. M о p p e 11 С. E., S u t h e r 1 a n d J. R., J. Chem. Soc., (C), 1968, 3040.
ЩАВЕЛЕВАЯ КИСЛОТА (IV, 229—232).
Получение безводной щавелевой кислоты. У. Т. Форд подтверж-
дает предостережение о том, что проведение дегидратации дигидрата
Щ. к. нагреванием при 100° в сушильном шкафу небезопасно.
ЩАВЕЛЕВОЙ КИСЛОТЫ ДИЭТИЛОВЫЙ ЭФИР (IV, 232—233).
Этилоксалоилкетоны (после выдержки из [31). Прямое мономе-
тилирование Д4-холестенона приводит к 4-метилхолестенону-З.
Монометилирование при С2 может быть достигнуто предваритель-
ной конденсацией соединения и Щ. к. д. э. с образованием 2-этил-
оксалоильного производного (2) [За], Эта группа стабилизирует
соответствующий (2) енолят-анион, способствуя тем самым метили-
рованию при С3. Гидролитическое отщепление активирующей груп-
пы в сильнощелочной среде благоприятствует экваториальной (а)
ориентации 2-метильного заместителя в (4).
За. Mazur Y<,Sondheimer F,, J. Am. Chem. Soc., 80, 5220 (1958); perti-
nent publications by other groups in the same period: R i n g о 1 d H. J., Ro-
senkranz G„ J, Org. Chem., 21, 1333 (1956); Hogg J. A., Lincol n,
F. H., J ackson R. W., Schneider W. P_, ,1. Am. Chem. Soc., 77,
640 (1955); MousseronM., W i n t er n i t z F., de PauletA.C.,
Compt. rend., 245, 185 (1957).
556
э
ЭТАНОЛАМИН (IV, 235). Поправка. Мол. вес 61,09, т. пл. 9—10°.
Новое применение (перед ссылками). Живица, стеклообразное
коричневое твердое вещество, получаемое из выделений сосны,
состоит главным образом из смеси кристаллических диеновых кис-
лот общей формулы С20Нд0О2, а именно (1) — (4) и (6) — (7). При
мягком дегидрировании кислоты (1) — (4) дают один и тот же про-
дукт — дегидроабиетиновую кислоту (8), в молекуле которой име-
ется одно ароматическое кольцо. По улучшенной методике получе-
ния (8) [3] смесь 500 г канифоли с 1 г 5%-ного палладия на угле пе-
ремешивают в атмосфере азота при нагревании; когда температура
поднимется до 280°, перемешивание продолжают еще час, медленно
пропуская азот. Раствор 100 г образовавшейся диспропорциониро-
557
ванной канифоли в 250 мл 95%-ного этанола фильтруют с отсасыва-
нием, нагревают до 70° и добавляют к нему 18 г этаноламина.
Раствор разбавляют 250 мл воды, подогретой до 80—85е, и экстра-
гируют изооктаном (три порции по 75 мл), предварительно нагре-
тым до 60°. Кристаллизация соли начинается при температуре около
'50° и продолжается в течение ночи. Кристаллический продукт рас-
тирают в холодном 50%-ном этаноле и перекристаллизовывают,
затем растворяют в горячем этаноле, подкисляют соляной кислотой
и выделяют чистую дегидроабиетиновую кислоту, т. пл. 171,5—
172,5е; fa]DH-62° (2%, в ЕЮН); выход'ЗО—36 г (51—61%).
Пимаровая (6) и изопимаровая (7) кислоты отличаются от абие-
тиновой кислоты строением углеродного скелета; кислоты (6) и
(7), присутствующие в канифоли, теряются в процессе получения
дегидроабиетиновой кислоты. На стадии дегидрирования над пал-
ладием обе эти кислоты действуют как акцепторы водорода, пре-
вращаясь в смесь дигидропимаровой и дигидроизопимаровой кис-
лот. Под действием конц. серной кислоты пимаровая и изопимаро-
вая кислоты перегруппировываются в абиетиновую кислоту.
3, Н а 1 b г о о k N. J., Lawrence R. V., J. Org. Chem., 31, 4246 (1966);
procedure submitted to Org. Syn. (1967).
ЭТИЛАТ ТАЛЛИЩ1), Ш, ТЮС2Н5. Мол. вес 249,43.
H5 C2 • •»О-T1
/I Zl
Tl—O<1-C2HS
lzT i/0”*СгНз
HSC2—О------T1
(1)
Получение [2], Э. т. легко получают обработкой таллиевой дроби
парами этанола при кипячении с обратным холодильником с одновре-
менным пропусканием кислорода над поверхностью металла.
2Т1 (металл)-р1/. О., Т12О
Т1гО + 2С2Н5ОН —/ 2Т1ОС,Н5 + Н2О
(1)
Металлический таллий (т. пл. 303е) выпускается фирмой «Alfa
Inorganic» в виде стержней диаметром около 1,5 см. Чистый кусок
металла зажимают щипцами и расплавляют в пламени газовой го-
релки так, чтобы капли расплавленного металла падали в стакан
на 2 л, наполненный холодной водой.
Окисление таллия проводят в приборе (рис. Э-1), изготовлен-
ном из трубки размером 5x30 см, снабженном сверху муфтой, а сни-
зу керном 24/40. В середине трубки на зубцах устанавливают фар-
форовый тигель — фильтр Гуча, Трубку для подачи кислорода
впаивают на 4—5 см ниже зубцов и загибают вверх таким образом,
чтобы ее конец был приблизительно на 1 см ниже дна тигля. Решет-
558
чатое дно тигля покрывают стеклянной ватой
для того, чтобы задерживались черные час-
тички окиси таллия или металла. Затем в
тигель помещают высушенную между листа-
ми фильтровальной бумаги таллиевую дробь
(100 а).
Сверху укрепляют обратный холодильник,
снабженный осушительной трубкой с аскари-
том или натронной известью для защиты от
двуокиси углерода, которая быстро реагирует
с Э. т. Снизу устанавливают круглодонную
колбу емкостью 500 мл, содержащую 350 мл
этанола. Спирт кипятят с одновременным
пропусканием сильного тока кислорода.
Этанол частично уносится из системы током
кислорода, поэтому следует контролировать
уровень этанола в колбе таким образом, что-
бы его оставалось не менее 300 мл. Кипяче-
ние продолжают 12—16 час-, за это время
таллий постепенно растворяется с образова-
нием Э. т., который в виде тяжелого бес-
цветного масла стекает из реакционной труб-
ки в кипящий этанол. Реакцию прекращают,
когда исчезнут последние следы блестящего
металла. Продукт извлекают пипеткой и ис-
пользуют для проведения реакций, описанных
ниже. Следует отметить, что верхний слой
представляет собой этанол, насыщенный Э. т.
(около 9 г на 100 мл) и его также можно не-
посредственно использовать во многих реак-
циях.
Применение. Э. т. растворим в большинст-
ве органических растворителей, в том числе в
гептане, и поэтому обладает значительным
преимуществом перед этилатом натрия для использования в катали-
зируемых основаниями гомогенных реакциях в неполярных раство-
рителях. Под действием Э. т. большинство -ди карбон ильных соеди-
нений превращается в стабильные бесцветные кристаллические соли
1 : 1 (2), устойчивые на свету. Они легко образуются при добавле-
нии Э. т. к раствору ^-дикарбонильного соединения в инертном
растворителе, например бензоле или петролейном эфире. При по-
9 9 „ 9 Т]+ о о о
RCCHjCR’ -IP-_ ^CR1 RCCHCR1 + ТП
СН
(2) (3)
559
следующем нагревании с иодистыми алкилами эти соли подверга-
ются моно-С-алкилированию с почти количественным выходом [3].
Таллиевую соль нагревают с избытком йодистого алкила, иодистый
таллий удаляют фильтрованием и перегонкой выделяют продукты
моно-С-алкилирования (3). Реакцию не удается провести с трет-
бутилиодидом, но с изопропил иодидом и первичными алкилиодида-
ми взаимодействие осуществляется почти количественно. Эта мето-
дика алкилирования в нейтральной среде позволяет избежать всех
обычно наблюдаемых побочных реакций, сопровождающих алкили-
рование енолятов натрия или калия (диалкилирование, О-алкили-
рование, расщепление р-дикетоиа, конденсации Клайзена, окисли-
тельные конденсации и др.).
Таллиевые соли р-дикарбонильных соединений можно также
ацилировать, причем направленно осуществлять О- или С-ацилиро-
ванне. Например, реакция таллиевой соли ацетилацетона (4) с хло-
ристым ацетилом в эфире при —78° приводит к енолацетату без
rpjT V/
11 Ti ’I
сС-С дс-сн,
'СИ
СН3СОС1/-78°
CH3COF, 25°
(СН3СО)3СН
примеси три а цетил мета на с выходом более 90%. С другой стороны,
обработка этой же соли фтористым ацетилом в эфире при комнатной
температуре дает с выходом более 95% три ацетил метан без примеси
енолацетата.
1, 1, 1-Триацетилэтан (5) можно получить с общим выходом,
превышающим 90%, из ацетилацетона либо а) метилированием тал-
лиевой соли (4) иодистым метилом с последующим превращением
снова в таллиевую соль и С-ацетилированием фтористым ацетилом,
снл
юн3сог
СНЭСН(СОСН3)3
(СН3СО)3СН
тюсгн>
тюсд
СН3СО.
снл
(СН3СО)3С-СН3
560
либо б) ацетилированием (4) фтористым ацетилом до триацетилме-
тана с последующим превращением снова в таллиевую соль и С-
метилированием под действием йодистого метила.
Алкилирование и ацилирование с использованием таллиевых
солей известны как реакции Тэйлора — Мак-Киллопа.
Те же исследователи показали, что под действием Э. т. таллиевые
соли можно получить из самых разнообразных субстратов кислого
характера. Причем по сравнению с солями щелочных или других
тяжелых металлов эти продукты обладают преимуществами либо
по выходу продукта и специфичности реакций, либо по удобству и
простоте обработки [4]. Таллиевые соли фенолов, например, легко
получить с количественным выходом при добавлении Э. т. к раство-
ру фенола в бензоле или этаноле. Эти соли представляют собой устой-
чивые четко плавящиеся бесцветные кристаллы, которые можно
перекристаллизовывать из воды или водного этанола. При обработ-
ке суспензии этих солей в эфире эквимолярным количеством апил-
или ароилгалогенида при комнатной температуре с последующим
отделением осаждающегося галогенида таллия фильтрованием и
выпариванием растворителя образуются чистые фениловые эфиры,
АтОН
TlOCjHg
ArOTs
(-100%)
ArOCOR
выходы которых редко бывают ниже 97%, Точно так же обработка
таллиевых солей фенолов тозилхлоридом в ДМФА при комнатной
температуре дает чистые кристаллические фенилтозилаты с выхо-
дами 92—96%.
Таллиевые соли карбоновых кислот можно легко получить с ко-
личественным выходом при добавлении Э. т. к раствору кислоты
в эфире или этаноле 15]. Соли представляют собой устойчивые, не
чувствительные к свету кристаллические вещества с четкой темпе-
ратурой плавления. При обработке этих солей ацил- или ароилхло-
ридами (в стехиометрических количествах) с последующим отделе-
нием хлористого таллия фильтрованием и выпариванием раство-
рителя образуются кристаллические ангидриды карбоновых кислот
с количественным выходом. Этот метод, использующий стехиомет-
(100%)
(100%)
561
рические количества обоих реагентов и обеспечивающий количест-
венные выходы при комнатной (или ниже) температуре, оказался
наиболее простым способом получения смешанных ангидридов,
позволяющим избежать реакций диспропорционирования.
Симметричные ангидриды получают также непосредственной
обработкой таллиевой соли карбоновой кислоты хлористым тиони-
лом в эфире при комнатной температуре. Промежуточные диацил-
или диароил сульфиты спонтанно теряют сернистый ангидрид с об-
разованием симметричных ангидридов, выходы которых после пере-
гонки составляют 96—98%.
Таллиевые соли карбоновых кислот были также использованы
Тэйлором и Мак-Киллопом [61 в реакции Хунсдикера; при этом по-
лучены очень высокие выходы первичных алифатических бромидов.
Легкость получения, нечувствительность к свету и чистота таллие-
вых солей карбоновых кислот определяют их преимущество перед
обычно применяющимися в реакции Хунсдикера солями серебра.
2НСОГТ1+ +ЗВг3 —> 2RBr Щ2СО. 4-TLBr.j
При взаимодействии таллиевых солей лактамов (например, пи-
ридона-2) с иодистыми алкилами наблюдается исключительно N-
алкилирование [5], причем чаще всего нет заметных синтетических
преимуществ перед использованием солей натрия или калия. Од-
нако в некоторых случаях применение таллиевой соли позволяет
значительно упростить весь процесс. Например, фенантридинон
очень легко алкилируется при добавлении стехиометрического ко-
личества Э. т. к перемешиваемой суспензии соединения в ДМФА
при комнатной температуре; уже через 30 сек смесь становится гомо-
генной, к ней добавляют 1 экв йодистого метила и образующийся
осадок йодистого таллия отфильтровывают. После разбавления
фильтрата водой получают 6-метил-5(6Н)-фенантридинон с коли-
чественным выходом.
Обработка суспензии таллиевой соли пиридона-2 (6) ацил- или
ароилхлоридом в эфире при комнатной температуре приводит к ко-
личественному превращению в 2-ацилокси- или 2-ароилоксипири-
дин (7). Последние соединения — исключительно активные ацили-
рующие и ароилирующие агенты даже по сравнению с исходными
562
хлор ангидридами [5].
о
п
RCCl^
А
9-Незамещенные пурины также легко образуют таллиевые соли,
которые алкилируются преимущественно, если не исключительно,
в положение 9 [7]. Таллиевые соли пурина и 6-хлорпурина полу-
чают при обработке Э. т, при перемешивании в этаноле. Соответст-
вующую соль аденина получают в диметилацетамиде. Бензилирова-
ние и метилирование этих солей приводит исключительно к 9-ал-
килпроизводным. Через таллиевые соли удается ввести в пурин и
аденин остатки рибозы; так были получены небуларин и аденозин.
Легкость образования, устойчивость, высокая степень чистоты,
растворимость и реакционная способность таллиевых солей пуринов
наряду с их избирательным алкилированием в положение 9 незави-
симо от заместителя в положении 6 — все это заставляет предпола-
гать, что такие производные могут служить превосходными проме-
жуточными соединениями в синтезе нуклеозидов.
Тэйлор и Мак-Киллоп [5] обнаружили также, что при разложе-
нии таллиевых солей трихлоруксусной и дифторхлоруксусной кис-
лот в присутствии олефинов образуются аддукты дихлор- и дифтор-
карбена соответственно. Для разложения этих таллиевых солей
СС13СОО“Т1+
Циклогексен
(30%)
ccif2coo-ti+
(60%)
с образованием карбенов необходимы температуры приблизительно
на 100° более низкие, чем для разложения соответствующих натрие-
вых или калиевых солей.
1. Contributed by Taylor Е. С.
2. Z е 1 е s к о И. J., Та у lor Е.С., М с К i И о р A., procedure submitted
to Org. Syn.
563
3. Tay lor Е. С., H a w к s G. EL, Ш, М с К i 11 о р A., J, Am. Chem. Soc.,
90, 2421 (1968).
4. 'Гау lor Е. С., McLa v G. W., М с К i 1 1 о р A., J. Am. Chem. Soc., 90,
2422 (1968).
5. Unpublished work..
6- Ai с К i 1 1 о p А., В г о m 1 e у D., Taylor E. C., J. Org. Chem., in press.
7. Taylor E. С., M a к i Y., M с К i 1 1 о p A., J. Org. Chem., in press.
N-ЭТИЛБЕНЗИЗОКСАЗОЛИЯ БОРФТОРИД (IV, 248—249, пе-
ред ссылками).
Было показано, что. два производных этого реагента пригодны
для получения активированных эфиров: борфторид ГЧ-этил-5,7-
дихлорбензизоксазолия (1) 131 и борфторид Ы-этил-7-оксибензизок-
сазолия (2) [4].
И н
с1\/х/с\
| || N’hC,H5BF4~ | || N+C.,H5BF4"
'Ч/Хо/ '^|-/х-о/
C1 он
(В (2)
3. R a j а р р a S., A k е г b а г A. S., Chem. Comm., 1966, 826.
4. I(emp D. S., C h i e n S. AV., J. Am. Chem. Soc., 89, 2743 (1967).
ЭТИЛВИНИЛОВЫЙ ЭФИР (IV, 251—253, [7]). Дополнение.
S m r t J„ C h 1 a d e к S., Coll. Czech., 31, 2978 (1966).
1-ЭТИЛ-3-(гДИМЕТИЛАМИНОПРОПИЛ)-КАРБОДИИМИДА
ХЛОРГИДРАТ (IV, 253—254).
Получение. В работе [la] подробно описана несколько модифи-
цированная методика.
la. Sheehan J. С., Cruickshank Р. A., Org. Syn., 48, 83 (1968).
ЭТИЛДИЦИКЛОГЕКСИЛАМИН (IV, 254, перед ссылками).
В осуществленном Муксфельдтом и сотр, [5] первом полном син-
тезе террамицина (1) — антибиотика группы тетрациклинов —
последняя стадия заключается в диалкилировании первичной
(О
аминогруппы при С4. Реакция с использованием диметилсульфата
и Э. в ТГФ осуществляется с выходом 33%.
564
5. iM u x f е 1 d t H., H a r d t m а п n G., Ratha wa la F-, Vede js E.,
Mooberry J. B., J. Am. Chem. Soc,, 90, 6534 (1968).
ЭТИЛЕНА И N-ОКСИИМИДА МАЛЕИНОВОЙ КИСЛОТЫ СО-
ПОЛИМЕР (II),
Блоу и сотр. [1] впервые использовали этот реагент в пептидном
синтезе. Его получают конденсацией сополимера этилена и малеи-
нового ангидрида (I) с хлоргидратом гидроксиламина в ДМФА
(схема 1).
Схема 1. Получение и реакции сополимера этилена и N-окси-
имида малеиновой кислоты в пептидном синтезе:
—сн2сн2 — СН СН —
I I
/С /Сх
о/ \о/
I
NHaOH-HCI
й7~
п
г—СН.СН.2 — СН СН—ц
[ I
/Сх Хсх
XN / ^0
он
II
БОК-NHCH (R,) СО2Н; ДЦК или
изобутилхлорформиат
(2)
Г— СН2СН2 — СН СН —
o/C\n/CM
BOK-NHCHCOO
L £
III
HsNCH (Rs) CONHR
Д)
r — CH2CH, — CH-CH —
zC Л
q/ \n /
I
OH J.
ф БОК-NH CHCON HCHCON HR
I I
Rl
БОК-а-аминопроизводные аланина, фенилаланина, треонина, ме-
тионина, лейцина и др. были получены с выходами около 70% либо
методом смешанных ангидридов, либо с применением дициклогек-
силкарбодиимида. Полученные полимерные сложные эфиры (III)
были использованы в качестве промежуточных соединений для
синтеза пептидов в этилацетате. Нерастворимые побочные продукты
отделяли фильтрованием или центрифугированием и после быст-
рого удаления растворителя получали хроматографически чистые
пептиды.
I. Loufer D. A., ChapmanT.M., М а 1 Ь о г о u g h D. I., Vaidya
V. М<, В 1 о и t Е. R., J. Am. Chem. Soc., 90, 2696 (1968).
ЭТИЛЕНДИТИОЛ (IV, 261—262, перед ссылками).
Недостаток метода защиты кетогруппы превращением в этилен-
тиокеталь (2) был связан с трудностью удаления защитной группы,
565
так как этилентиокетали устойчивы к основаниям и лишь частично
гидролизуются кислотами. Даум и Кларке [6] сообщают, что этилен-
тиокетали можно гладко окислить избытком надфталевой кислоты
до дисульфонов (3) и регенерировать кетогруппу разложением в ще-
лочной среде в присутствии кислорода. Эту новую защитную группу
используют при последующем введении заместителя, не устойчи-
вого в кислой среде. К сожалению, для двух проведенных ре-
акций [61 выходы на последней стадии составляли лишь 39 и 40%.
6. Da um S. J., С 1 а г k е R. L., Tetrahedron Letters, 165 (1967).
М-ЭТИЛ-5-ФЕНИЛИЗОКСАЗОЛ ИЙ-З'-СУЛЬФОНАТ (IV, 267—
268).
В работе [5] имеются ссылки на применение Э. в пептидном син-
тезе. Петтит [6] рекомендует использовать этот реагент для синтеза
стероидных пептидов.
5. Woodward R. В., О 1 о f s о п R. А-, М а у е г Н., Tetrahedron, 22,
Suppl., 8, 321 (1966).
6. Р е t t 1 t G. R., S m i t h R. L,, К 1 i n g е г H., J. Med. Chem., 10, 145 (1967).
ЭТОКСИАЦЕТИЛЕН (IV, 268—273).
Пептидный синтез (IV, 271, после выдержки из 114]). При вза-
имодействии фталевой кислоты с Э. в присутствии эфира аминокис-
лоты с хорошим выходом получается фталоильное производное
[14а].
14а. Banks G.R., Cohen D., PattendenG.E., Thomas J. A.G.,
J. Chem. Soc., (C), 1967, 126.
АВТОРСКИЙ указатель
Аби (Abe Y.) И! 249, 256
Абботт (Abbott F. Р.) II 70
Абботт (Abbott Т. W.) I 78
Абдель-Рахман (Abdel-Rahman M'Ad IV 137
Абдель-Рахман (Abdel-Rahman М. О.) 1
73; II 105; III 164, 167
Абдерхальден (Abderhalden Ed I 221; III
181, 184
Абд Эльхатез (Abd Elhatcz F. Ad V 495
Абелл (Abell R, D.) II 261
Абенд (Abend P. Gd 11 238
Абендрот (Abendroth H. J.) 1 214
Абодерин (Aboderin A, A.) I 387
Абрамов В. С. II 39
Абрамович (Abramowitch В.) IV 209
Абрамович (Abramovitch R. A,) V 360
Абрахам. (Abraham N, Ad I 109, 110; Il 237;
V 35
Авант (Awang D. V. Cd V 44
Авила (Avila N. Vd I 413
Аврам (Avram Md V 190
Аврамов (Avramoif M.) I 16; HI 304, 394
Агата (Agata I.) HI 68
Агами (Agami Gd 1 334; V 142, 143. 152
Агнелло (Agnello E. J.) Ill 2HJ; IV 129
Агоста (Agosta W. Cd V 233. 235
Адам (Adam Wd I 188
Адамс (Adams E. W.) H 210; III 193
Адамс (Adams J. B., Jr.) I 387; IV 9
Адамс (Adams J. T.) I 65 66, 112; 11 230;
IV 233
Адамс (Adams R.) I 38, 87, 106, 209, 221,
302 390; II 210 389, 409, 458; III 13, 18,
129', 131, 171, 172, 193. 205, 430, 431;
IV 72, Ю4, 109, 188, 210. 221, 266. 24g
Адамс (Adams R. F.) V 153
Адамс (Adams \V- Rd V 232
Адамчик (Adamcik J. A.) HI 457
Адваии (Advani B. Bd V 166
Аддицг (Udding А. С.) V 39o
Аддисон (Addison C. C.) I 24
Адкинс (Adkins Hd 1 10, 147. 286, 291;
11 430; III 110, 114 156, 157, 166, 167.
193; IV 24, 51
Адлер (Adler E.) I 413; Il 226
Адлсрова (Adlerova Е.) V 348
Азадорьян (Asadorian A. Ad 1 38
Азицгер (Asinger F.) V 331
Азоу (Azoo J. Ad V 377
Айвей (Iwai 1.) I 166 384; Hl 184
Айди (Ide W. S.) I 219' II 238; III 26, 30, 76;
1V 15, 17
Alien (Ayer D. Ed I 433
Aiiep (Ayer R. P.) HI 271; V 393
Айер (Iyer I<. Nd II 187
Aiiepc (Ayers D. Cd HI 137, 145; V 251
Айерс (Ayers P. Wd I 388
Айкен (Aiken R. R.) V 348
Айри (Irie Kd HI 148
Айрик (Irieh Gd V 267, 270
Айрланд (Ireland R.Ed 1 151. 167; II 53,
111. 112, 192, 193. 239: [II 194. 197'
IV 178, 179, 192; V 71. 72, 175, 452, 454
Айрлэи (Irelan J, R.S.) V 442
Ансслии (Iselin B.) HI 323; IV 132; V lo6,
163
Айслер (Isler О.) II 116, 118, 137, 270, 273;
HI 352, 353; IV 253, 267, 274
Айснер (Isner W. G.)'ill 448
Акабори (Akabori Sd II 303
Акао (Akao Md V 113
Акахори (Akahorj Y.) I 363
Акаши (Akashi С.) V 447
Акер (Acker D. S.) I, 32; II 39; III 314
Акеркар (Akcrkar A. Sd IV 248; V 564
Акерман (Ackerman Jd III 197
Акерман (Ackerman J. H.) V 77, 78, 251
Акмац (Ackman R. Gd III 132
Akott (Ackolt B.) Ill 242; V 384
Аксельрод (Axelrod A. E.) I 93
Аксельрод (Axelrod J.) Ill 84
Аксельрод (Axelrod L. R.) IV 151
Актон (Acton E.Md I 102
Дкхтар (Akhtar Md I 168. 169; Щ 188
Александер (Alexander Kd HI ЗОИ IV 90
Алпминоза fAliminosa L.Md III 183
Аллан (Allan L. Td H 331
Аллен (Allen C. Fd IV 110, HI, 121, 122
248
Аллен (Allen C.F. Hd I 64 , 66 130. 1(57.
193, 307, 384; II 38, 261, 335 362 374,
380 404, 410, 420, 425; III 39, 40' 107,
114 311, 327, 330, 335. 354 442 463;
IV 23. 29 72, i 13 209, 259 264
Аллен (Allen D. S., Jr) III 92, 197
Аллен (Allen G. R.) HI 256
Аллеи (Allen J. Cd I 280
Аллен (Allen Sd I 117
Аллен (Allen W. S.) II 388; III 46' IV 90,
173
Аллинжер (Allinger N. L.) I 167* II 224,
226; III 48, 53; V 513
Аллфин (Allphin N. Ld II 377, 380
Алиер (Alner D, J.) V 419
Аль-Азрак (Al-Azrak А.) V 186
Альберн (Alburn H. Ed 111-457
Альберс (Albers R. .1.) V 337, 464, 523
Альберт (Albert Ad Ш 360; IV 90
Альбертсон (Albertson N. F.) I 427; Щ 280;
IV 201
Альбрехт (Albrecht H. Р.) II 461
Альбрехт (Albrecht R.) I 225; III 345
Альварец (Alvarez F. Sd I 24, 267. 268;
V 115, 594
Альдер (Alder Rd I 209, 211; II 216; IV 26,
27, 29
Альдер (Alder R. W.) I 124; HI 306; V 411
Альдерсон (Alderson Td V 368
Алькони (Alkonyi I.) Ill 176, 184
Альманн (Alemany A. Ad V 473
Альмиралте (Almirante Ld HI 439, 443
Альпер (Alper Hd V 203
Альт (Alt G. Hd 1 174; V 462
Альтман (Altman L. Jd I 416, 417
Амеидолла (Amendolla С.) I 221, 226
Амин (Amin E. Sd II, 443
Амин (Amin J. Hd V 44
Амороса (Amorosa Md BI 241
Амьяр (Amiard Gd III 67, 419
Анагностопулос (Anagiioslopotilos C.E.)I 24
Анастассиу (Anastassion A. Gd V 5 13
Анбар (Anbar Md I 237
5S7
Англа (Angla В,) Ш 324 327
Ангус (Angus А. В.) IV 1б7
Андерсен (Andersen N. И.) V 89, 193
Андерсен (Andersen V. KJ Ц 245
Андерсон (Anderson A. G., Jr.) I 370, 3S0;
II 233. 461; III 166, 171 172. 308 309.
415, 443; IV 248; V 40
Андерсон (Anderson A. S.) II 281
Андерсон (Anderson A. W.) J] 454, 456
Андерсон (Anderson В. A.) V 361
Андерсон (Anderson В. C.) Ill 39, 40
Андерсон (Anderson В. T.) I 181
Андерсон (Anderson С, В.) Ш 297. 298
Андерсон (Anderson C. D.) I 159. 167
Андерсон (Anderson С. E.) Ill 291
Андерсон (Anderson D. M. W.) V 293, 2s4
Андерсон (Anderson G. J.) I 335; III 355
Андерсон (Anderson G. \V.) 1 177, 435. 436,
438; H 22, 120, 121; III 22. 321; 1V J6‘
V 300, 523. 524
Андерсон (Anderson E. L.) I 275
Андерсон (Anderson H. V.) П 353' III 40
291
Андерсон (Anderson J, E.) V 491
Андерсон (Anderson L. R.) V 457
Андерсон (Anderson R.) I 370
Андерсон (Anderson R. G.) Ill 171, 172, 443
Андерсон (Anderson R, S.) 1 263; П 16
Андо (Ando T.) V 432, 510
Андреадес (Andreades S.) I 32; II 129, 447
Андреевич (Andrejevic V.) Ill 241
Андрэ (Andr£ A, F. St.) V 534
Андрюс (Andrus D, W.) I 130, 275
Анет (Anet E. F. L, J.) I 41
Анжело (Angelo Б.) II 359
АнЖиал (Angyal S. J.) I 193, 275. 438; II 59
71, 465; III 224, 240; IV 195, 136; V 32
33, 397
Анжибо (Angibeaud P.) V 80
Анликер (Anliker R.) IV 226
Аннер (Anner G-) III 241, 457; V 244. 429. 532
Ансбахер (Ansbacher S.) II 30, 245
Анселл (Ansell M. F.) I 31; Il'440
Анселм (Anse)me .J.-P.) IV 37; V 164, 321
423, 489
Анслоу (Anslow W, KJ I 223
Анспон (Anspon H. D.) IИ 335
Антее (Anthes E.) Щ 13. 187
Антеунис (Anteunis M.) Ц 11; V 544
Антонуччи (Antonucci R.) Ш 354
Аншютц (Anschutz R.) IV 24
Аньиотри (Agnihotri R. KJ II 150
Аоки (Aoki KJ И 38; V 211
Доки (Aoiti T.) Ill 451
Аппель (Appel H.) V 478
Аппель (Appel R.) I 215; V 85. 86
Аппельбаум (Appelbaum A.) I[ 346
Апплебаум (Applebaum MJ IV 143
Апплеквист (Applequist J.) HI 59
Апт (Apt К. E.) V 281
Арапакос (Arapakos P, G.) I 80, 81
Apac (Arase A.) V 292
Арбузов Б. A. H 39
Аргабрайт (Argahright P. A.) I 167, 334, 345
Ардао (Ardao M. I.) I 115
Ардис (Ardis A, E.) V 402
Аренс (Arens .1. E.) I 414: П 285, 302; IV 133
269, 271—273; V 26, 441, 442, 533
Арзуманьян (Arzoumanian H.) I 102
Аригони (Arigoni D.) Ш 227, 241
Арингтон (Arrington .1. P.) V 314
Арисон (Arison B. H.) I 313; II 401
Аркелл (Arkell А.) Ш 190
Аркус (Arcus C. L.) Ill 121, 123, 306
Арлт (Arlt H. G.t Jr) II 107
Арманд (Armand Y.) V 401
АрмитаЖ (Armitage J. В.) I 253
Армстронг (Armstrong E.C.) HI 260
Армстронг (Armstrong R, KJ V 174
Армур (Armour A. G.) I 397
Арнауд (Arnaud P.) V 400, 401
Арндт (Arndt F.) I 247; V 93
Арнетт (Arnett E.M.) Ill 305. 306
Арним (Arnim KJ III 129
Арнольд (Arnold С.) I 33, 334
Арнольд (Arnold H, R.) 11 235
Арнольд (Arnold H. W.) Ill 193
Арнольд (Arnold R.T) I 78. 157 167; II
137; 111 67; IV G3, 65
Арнольд (Arnold Z.) 1 357; V 92
Лрнцен (Arntzen С. E,) 11 141
Аррегыон (Arreguin Л-l.) 1 267, 268
Арт (Arth G. E.) Il 273; III 236; IV 151. 183,
272
Артерс (Arters A. A.) IV 209
Артур (Arthur P.) II 311: V 307
Артур (Arthur P., Jr.) 1 291
Лрунахалам (Arnnachalam 1.) V 256
Арчер (Archer S.) Ill 149; IV 197; V 9
Арчер (Archer W- JJ I 360; III 145
Асато (Asato A. E.) V 183
Аскани (Askani R.) I 15
Асибург (Aspburg K-) III 285
Асселпно (Asscllneau С.) IV 60
Ассони (Assony S. J.) V 18
Аткинс (Atkin’s К- E.) V 462
Аткинсон (Atkinson J. G.) V 143
Аткинсон (Atkinson R. E.) V 333
Атга-Ур-Рахман (Atta-Ur-Rahman) V 327
Аттенборо (Alter,burrow J.) I| 85, 97 179,
219, 320, 222. 223, 225, 226; IV 203
Атуотер (Atwater N. W.) II 426: IV 62, 63
Ayopeii (Aubrey N. E.) HI 67
Ay вере (Auwers K-, von) II -121
Аугустин (Augustine R. L.) I 377
АудреОт (Audrieih L, F.) I 215
Лульт (Ault A.) V 416
Аумюллер (Ai-imulier W.) IV 152
Аурнхаммер (Aurnhammer R.) IV 50
Аустин (Austin N. A.) Ill 234, 256
Аустиц (Austin P. R.) Ill 239
Аутенрит (Atilenricth W.) Ill 149
Афонсо (Afonso A.) I 182; II 153
Аффроссмен (Affrossman S.) Ill 307
Ахайа (Achaya К. ТЛ V 39.3
Ахариа (Acharya S. P.) V 84
Ахмад (Ahmad A.) I 219
Ахмад (Ahmad Y.) V 334, ЗЗГ>
Ахматович (Achmatowiez В.) II 462
Ахмед (Ahmed Q. A.) V 355
Ахола (Ahola G. J.) V 135
Ахуджа (Ahnja H. S.) IV 126
Am (Ash А. В.) Ш 296; V 508
Аш (Ash B. D.) II 350
Ашкенази (Askenasy P.) II 56
Ашкрафт (Ashcraft A. C.) Ill 200
Atuyops (Ashworth P. .1.) I 66
Аяад (Ayad R. N.) Ill 312
Аяада (Ayada A.) I 96
Аянгар (Ayyangar N, R.) I 268. 279; 1Ц 377
Баарда (Baaija D, G.) I 387
Бабад(ВаЬаФ H.j I 150, 166
Бабкок (Babcock G. S.) I 106
Бабкок (Babcock J. С.) IV 63, 130
Бабкок (Babcock S. H.) I 433
Бабл (Btibl E. C.) HI 91
Баганц (Baganz H.) I 174; V 186
Бадпар (Badhwar I-S.) IV 209
Баддили (В ad di ley J.) Ill 283; IV 85. 90
Бадер (Bader A. R.) I j-1, 179, 286; III 76 84,
138, 145
Бадер (Badcr F- E.) I 427; Ill 47
Бадер (Bader H.) Ill 339
Бадштюбнер (Badsliibncr W.l 111 107
Баер (Baer E.) 1 70, 379 401; IV 38
,568
Баер (Baer Ii.) И 281
Баер (Baer Н. Ii.) II 462
Баер (Baer К.) IV 58
Базилевский М. В. I 3fil; II 299
Байбл (Bible R. Н., Jr.) IV 62, С>3
Банер (Baeyer А.) 1 219; II 121. 123
Байер (Bayer R. Р.) III 67
Байео (Bayer \V.) I 183; II 298
Байерс (Byers J. R.) II 39; III 327 335;
IV 95
Байзср (Balzer М.) I 188
Бак (Buck R. R.) Ш 302
Бак (Вис S. R.) Ill 84
Бакеберг (Backeberg О. G.) II 405; III 1CG’
V 367, 368
Баклер (Buckler S. А.) I 14-1, 219; III 431;
IV 81
Баклес (Buckles R. Е.) I 126, 12/; III 299
330, 335; IV 18, 20
Бакыен (Buckman J. D.) IV 18
Бакстер (Baxter I.) II 331
Бакстер (Baxter J. F.) IV 238
Бакшевский (Buckschewski FI.) II 421; III
413
Балабан (Balaban А. Т.) V 73
Баласубраманян (Balasubramanian D.) Ill
56
Баласубрахмаиьям (Balasubrahmanyam
S. N.) Ill 78
Балл (Bull В. A.) II 409
Баллард (Ballard D. A-) II 389
Баллестер (Ballester M.) HI 29o, 296
Балл uh a (Ballina R.) HI 56
Баллок (Bullock M. W-) II 157; III 340
Баллоу (Ballou С. E.) 1 401
Бальдауф (Baldauf H.-J.) HI 444
Бальтаззи (Baltazzi E.) I 223; III 280
Бальтцли (BaltzlyR.) 1 200, 210; III 30, 187
Бамбергер (Bamberger E.) Il 7 8, 125; HI
226, 240
Бомгарднер (Bumgardner C. L.) I 403; II 462,
463; III 321; V 170
Бампус (Bumpus F. M.) I 427
Бангерт (Bangert R.) II 30; V 362
Банде (Bunds J.) Ill 18/
Баннел (Bunnell С. A.) V 314
Баннистер (Bannister В.) I 166
Бантисес (Bantjes A.) ill 354
Бацтон (Bunion С,. A.) II 52
Баняп (Bunyan P. J.) HI 468
Бапат (Bapat D- S.) I 268
Бар (Barr D. E.) V 472, 473
Баракат (Barakat M. Z.) 1 136, 137
Барборак (Barborak J. С.) V a46
Бартер (Barger G-) III 322
Барден (Burden M. G.) I 335
Бардос (Bardos T.J.) II 18
Барет (Baret P.) V 49
Баркер (Barker G. R .) II 281
Баркер (Barker E.) IV 113
Баркет (Barket T. P.) V 339
Баркли (Barkley L. B.) Ill 149, 150. 167;
IV 148, 151
Баркхурст (Barkhurst R. С.) V 269, 270
Барлин (Barlin G. В.) I 193; It 59
Барлоу (Barlow D - О.) V 40
Барлтроп (Barltrop J. A.) IV 100, 1G7
Барнес (Barnes C. S.) Hl 2o4, 2аб; IV 226
Барнес (Barnes D. R.) I “0
Барнес (Barnes J. D.) IV 190
Барнес (Barnes J. H.) II 39
Барнес (Barnes R. A.) 1 17d; Hl 145
Барнес (Barnes R. P.) HI 118, 119
Барнштофф (Barnstorf; H. D.) IV 11
Барон (Взгоп F. A.) J 195
Барон (Baron W.) IV 235
Баррель (Barrelle M.) V 378
Баррера (Barrera J.) HI 99
Баррет (Barret H. С.) V 19
Барретт (Barrett A. W.) Ill 184
Барретт (Barrett С. B.) HI 171
Барретт (Barrett J. H.) IV 143
Барретт (Barrett S. O.) Ill 367
Барроус (Burrous M. L.) II 150, 195
Бартел (Barthel J. W.) IV 226
Барти (Barti G.) V 127
Бартлетт (Bartlett M. F.) Ill 241
Бартлетт (Bartlett P.D.) I 83, 144, 175
176, 188, 271, 313, 396. 403; II 103, 106,
115, 1 16, 137, 141; V 171, 308
Бартлетт (Bartlett R.S.) I 268
Бартман (Bartman W.) HI 366
Барток (Bartok W.) I 167
Бартон (Barton D. H. R ) I 153, 167—169,
199, 209, 333. 335 369, 370; II 43, 102,
106, 412, 414; III 43. 46, 149, 175. 183,
188 229, 241, 254. 256, 457; IV 32, 36 63,
77 80, 148. 151, 170, 173, 175, 226; V 211,
270, 383, 384, 458, 530, 532
Бартон (Barton F. E., Jr.) V 153, 316
Бартон (Barton M. A.) IV 24
J5apya (Barna H. B.) HI 345
Баруа (Barua R. R.) Ill 345
Баруша (Bharucha R. R.) I 167
Баскоул (Bascoul J.) IV 226
Eacc (Bass J. D.) IV 57
Басс (Bass R. C.) Ill 302
Басс (Buss D. H.) I 330, 335
Бассилиос (BassilfoS FI. F.) IV 153
Бает (Bast H,) Ill 184
Бастиан (Bastian B. N.) V 241
Бастус (Bastns L. В.) I 225
Басу (Basu N. R.) IV 169, 170; V 52 530
Бат (Bhat H. B.) HI 444; V 156 376
Баталова Л. Г, V 113
Батахарпя (Bhattacharyya В, К.) II 342-
IV 168
Батахария (Bhattacharyya S. С.) II 163;
V 246
Батлер (Butler D. Е.) I 173
Батлер (Butler G. В.) HI 412
Батлер (Butler R,) I 210; HI 40
Батлер (Butler M. E.) HI 19
Батлер (Butler R. N.) V 382, 384
Батон (Buton C, A.) Ill 76
Батт (Bh.gtt Л1.) 1 268
Баттенберг (Battenberg E.) Ill 461
Баттпсти (Battisti A.) V 316
Бауде (Baude F, J.) IV 233
Баум. (Baum A- A.) II 293; V 302
Баум (Baum К.) V 170
Бауман (Bauman L.) I! 330
Бауманн (Baumann W. J.) V 260, 353, 527
Баумгартен (Baumgarten E.) II 22; Hl 396,
399
Баумгартен (Baumgarten H. E.) I 164 168
174; Il 210, 257, 262; HI 241
Баумгартен (Baumgarten P.) Ill 282, 283
Eayxep (Baticher R.) IV 161
Баухман (Baughman G. L.) I 110, III; V 37
Бауэр (Bauer C. D.) I 377
Bayop (Bauer L.) Ill 364, 366
Бауэр (Bauer M.) I 247, 248
Бауэр (Bauer V. J.) I 427; HI 354
Бафус (Bafus D. A.) 1V 237
Bax- (Bach G.) V 18
Bax (Bach Ы.) V 419
Bax (Bach R. D.) I 185; V 147, 393
Бах (Bach R. О.) V 29
Баха (Bacha J . D.) V 271
Бахман (Bachman G. В.) I 24, 28 215; 11
3/4, 442; III 39, 146
Бахман (Bachmann W. E.) 1 54, 174, 190,
199, 248; Il 39, 212; III 394, 4(9; IV 233
Бачелор (Bachelor F. M.) Ill 340
Бачи (Bachi M. D.) V 530
569
Башаращ (Bacharach G.) II '233
Вебере (Babers F. H.) II 289
Бенерунг (Beveritng W. N.) Ill 172
Бевингтон (Bevingoii .EC.) I 31
Бег (Begg G.) V 492
Бегаль (Behal A.) V 481, 482
Ведерка (Bederka ,1. P. M.) HI 448
Бедокяи (Bedonkian P. Z.) II 29 30; III 349
, 354; IV 13
Бедфорд (Bedford G. J?.) V 15
Безман (Bezman 1. I.) V 82
Бейер (Beyer E.) V 185, 491
Бенер (Beyer Ы.) I 3'2, 33. 302
Беперман (Beyerman H. С.) II 22, 30, 121;
HI 309, 370, 434; V 221, 222
Бейлер (Beyler R. E.) I 107 178; II 273;
1V 7'2, 151. 183
Бейион (Bcynon P.J.) Ш 200, 201; V 374, 376
Беиседоу (Basedow О. H.) Ill 468
Бейш (Bashe R. \V.) II 199; V 183
Бек (Beck A.) V 161, 164
Бек (Beck В. M.) V 417
Бек (Beck K.M.) V 52
Бек (Beck P. E.) I 15, 320 334
Бек (Beck W.) 11 359
Беквпт (Beckwith A. L. J.) 1 146 169; II
340; 111 241, 242; V 384
Беке (Becke J.) Ill 67
Беке-Геринг (Becke-Geehring M.) HI 126
Бекер (Becker A.) Ill 90, 92
Бекер (Becker E. I.) I 53; II 112 258 262,
308; 1Ц 19. 373, 402; IV 36, 52' 190' 248'
V 503, 504
Бекер (Becker 14.) II 297
Бекер (Becker H. D.) I 335. 336 344 345
413; H 223, 226. 441; V 270
Бекер (Becker H. G. O.) Ill 278
Бекер (Becker .1.) V 429
Бекерра (Becerra R.) I 126
Бекерскн (Bekersky 1.) II 353
Беккум (Be.kkum H,, van) III 327
Беклер (Bockler J.D.) 1 271
Бекманн (Beckmann T.) П 443
Беккам (Beckham 1. J.) II 430, 455
Беланже (Belanger A.) V 40
Белдер (Beider de A. N.) 11 388
Беленький; Д. И. I 378
Белл (Bell A.) I 130, 307, 384; II 335 362'
IV 23. 209
Белл (Bell E. V.) I 367; II 458
Белл (Bell E. W.) ] 173
Белл (Bell H. M.) 11 388
Белл (Hell 1-1 11 222, 226
Белл (Bell R. R.) Ill 223, 240
Беллаарт (Bellaart А. С.) IV 81; V 332, 333
507
Беллами (Bellamy E.) Ill 118
Беллки (Beilin S. A.) V 73
Белло (Bello J.) I 137
Белло (Belie,rni В.) V 237
Белчер (Belcher R.) 11 97; IV 62
Белью (Belew J, S.) V 263, 270
Беме (Bochme W. R.) Ill 295
Бемис (Bemis Д.) V 271
Венгельсдорф (Bengelsdorf I. S.) Ill 468
Eeirreu (Bengen M. F.) II 316. 326; V 490
Бендер (Bender M. L.) II 30, 464, 465; IV 227
247, 248; V 495. 496
Бендер (Bender V.) Il 71
Беперджи (Benerjee R.) IV 179
Бенсрджи (Banerjee S. R.) II 234
Бенес (BeneS M. J.) V 29, 143
Бенин» (Benign; J.) V 102
Бен-Ишай (Ben-Ishai D.) IV 160
Бенкесер (Bcnkeser R. A.) Il 141, 143 — 146
150, 195, 205, 451, 456; V 242, 243
Бенн (Benn W, R.) I 210; V 394, 395
Беннет (Bennett A,) IV 158
Беннет (Bennett C, R.) V 246
Беннет (Bniniett .1. F.) I 53. 57, 04 66. !04,
370, 371; 11 410, 414; V 25. 26, 61, 66
Беннет (Bennelt G. E.) 1 145
Беннет (Bennett G. M.) 1 367, 370; II 458
Беннет (Bennett M. A.) V 454
Беннет (Bennett R. P.) I 215
Беннингтон (Bennington Г.) V 348
Бенсон (Benson R.) IV 17
Бенсон (Benson R. E.) I 34, 317: III 56
Бенсон (Benson W. R.) I 376, 377; 1161
Бентли (Bentley P. FI.) Il 468; Ill 449
Бентли (Bentley R.) I 189
Бенто;; (Benton F. L.) I 111; II 388
Бепуатон (Benoiton L.) Щ 436; V 321, 479
Бенц (Bentz F.) HI 385
Бенц (Benz E.) HI 367
Бенц (Benz XV.) Il 121
Бен-Эфраим (Ben-Efraim D. A.) I 151, 166
Бера (Bera В. С.) IV 185
Бсранек (Beranek J.) IV 22
Бербериаи (Berberian D. A.) V 9
Берник (Berwick M. A.) 11 307
Берг (Berg C. J.) II 43
Бергельсон (Bergelson L. D.) I 350; HI 378
405, 412
Бергер (Berger A.) Ill 193, 276 IV IGO;
V 523
Бергер (Berger С.) V 466
Бергер (Berger C. R. A.) II 183
Бергер (Berger J.) I 138
Бергер (Berger M.) V 124, 447
Бергер (Berger S.) I 433; IV 151; V 174
Берглунд (Berglund С.) I 100; II 346
Бергман (Bergmann E. D.) I 103, 309; II
60, 67, 70; V 196, 251, 454
Бергман (Bergmann F.j'lil 16. 19
Бергман (Bergmann W.) IV 227
Бергманн (Bergmann M.) II 129 313; IV 77,
80, 160; V 342
Бергсталер (Burgstuhler A. W.) I 72 73 185
186, 271; II 141, 146, 150 193—195:
HI 164, 167, 168 172 179 J 84; V 229'
246. 269, 270, 476
Бергтэллер (Bergihaller P.) V 147
Берд (Bird C. W.) I[ 6. 436. 437, 439
Берд (Bird ,1. W.) V 543
Бер дал (Berdahl J. M.) V 378
Бердптт (Burditt N. A.) V 411
Березин (Berezin G. H.) IH 288, 290
Беренбаум (Berenbaum ,M.) I 210
Берепд (Behrend R.) II 30
Берингер (Beringer F. M.) I 390—392' II 57
59, 99. 308
Берингер (Behringer H.) Ill 339
Беркли (Berkley L. B.) 1V 19, 20
Беркович (Berkowitz L. M.) Hl 196 — 201
Беркоз (Berkoz В.) I 210, 413, II 114
Берлин (Berlin J.) 11 414
Берлин (Berlin R. D.) Ill 394
Берлин (Berlin T.) I 121
Бердинге (Berlingnet L.) I 226
Берлин» (Eerlini F.) V 293
Берло (Berio R.C.) I 210
Бернауер (Bernauer К.) IV 226
Берндт (Berndt A.) V 228
Бернесе (Burness D.) i| 215, 216 237; IV
120, 1S2
Бернетт (Burnett R. E.) I 132
Бернингер (Berninger C. J.) V 547
Бернройrep (Bernreuther E.) П 216
Бернхард (Bernhard H.) Ill 457; IV 161
Бернхард (Bernhard S. A.) II 218
Бернштейн (Bernstein S.) I 10, 126, 137
348, 350; II 214, 2/5, 276, 382, 388; III 44’
46, 253, 256. 354; IV 87, 90, 173 184'
233; V 183, 301, 520
Бернштейн (Bernstein S, С.) IV 213
570
Бсроза (Bcroza И.) III 92
ЕеррП (Berry С. MJ 1 313
Берри (Berry R, S.) IV И; V 33
Берс (Berse С.) 1V 161
Берсон (Berson ,1. А.) 1 390
Бертелли (Bertclli О, ,1.) I 13-1; Щ 401
Бертер (Bcrther С.) III 84
Берти (Berli GJ II 299, 300
Бертпль (Bertile В.) II 463
Бертин (Berlin D.) I 407; П 202
Бертнер (Burtncr R. Rj I 110: III 304
Бертон (Burton D. .1 ) V 172, 174. 445, 447
Бертон (Burton И.) И 433; IV 150. 151; V 485
Бертон (Burton R. В.) 11 14
Берторелло (Bertorello Н. EJ I 283
Бертхольд (Berthold R. V.) Ill 328
Берхтольд (Berchtold G. А-) V 348
Верц (Bertz R. T.) IV 101
Берцелиус (Berzelius .1. J.) 11 74
Берч (Birch A. J.) I HO, 152, 166, 334, 377;
II 151, 183, 230, 239; III 134, 145; V 35,
388, 389, 451, 453, 454, 507, 508
Берчелл (Birchall J. MJ 1 404
Берштейн (Burstein S. Fl.) 1 167, 376, 4J0,
413: li 3i1
Бесендорф (Beseiidorf FJ.) 11 “0
Бесон (Beson G.) V 143
Бессон (Besson A.) Ill I2G
Бестиап (BeMian H.) I 311, 312; IV 263,
2(>4
Бестманп (Bestmann H. JJ II 117, 118.
419, 421; III 405, 411—413, 415; V 163
169
Бетал (Bethall D.) V 134
Бетеяький (Bcten’Ki) L. J.) Il 357
Бсти (Bethea T. W., HI) V 406 — 407
Беттс (Betts В. E.) 1 88
Бетципг (Betzing H.) II 216
Бехтлер (Bechtler G.) 1 318; II 281
BeU (Betz W.) IV 80
Бечп (Biichi G.) I 173, 174, 285, 286; Ш 179,
184, 931, 234, 334, 335: V 147
Бечи (Biichi H.) I 3;>1, 3o2
Бёкер (Beucker H.) II 61
Бёль (Boll W.) 11 308; HI 412
Бёль (Boll W. A.) I 242
Бем (Biihm W.) Ill 68, 444
Бёме (Bohme FI.) V 196
Бёрдж (Bnrdge D. N.) И 150
Бёрсл (Burrell J. W. !<_.) V 270
Бсркланд (Birkeland S, P.) I 248; III 46
Бсркхнмер (Birkhimer G. A.) IV 271, 273
Бёрлич (Btirlitch J. M.) IV 36; v 500
Вёрп (Burn A. .1.) Ill 468
Берн (Burn D.) I 360, 413
Бёрум (Birum G, H.) HI 296; V 238, 239
Бёрч (Burch J. E.) 1 364
Бианко (Bianco E. J.) Hl 367
Виард (Beard С.) V 1U, 504
Биаре (Bears W. L.) I 58
Биверс (Beavers L. E.) V 46
Бигби (Bigby D. BJ I 279, 315
Биггс (Biggs B. S.) H 326
Бнгелои (Bigelow L. A.) I 121
Бигелоу (Bigelow H. EJ IV 227
Бигелоу (Bigelow M- HJ 1 253
Биглер (Bigler A. J.) V 99
Бигли (Bigley B. J.) I 363
Бигли (Bigley D. В.) I 268; IV 167
Бииель (Bickel A, F.) I 167; HI 394
Бикель (Bickel H.) 1 427; HI 47
Бпкерт (Bickert E.) П 106
Викофф (Bickoft E. M-) I 318
Бил (Beal G. D.) П 48
Бил (Beal D. A.) V 461
Бил (Beal P. F.) I 102, 103; III 457; V 40, 93,
93
Бпл (Beale С. HJ V 210, 211
Бил (Beel J. A.) II 156, 157
Билк'(Bilk 1,.) V /4
Биллетер (Billcter О. С.) I 105
Биллина (Billica H. R.) Ill 156, 157, 166
Биллимориа (Billimoria J. D.) I 65, 70, 378
Биллс (Bills E, J.) 1 193
Биллман (Billman J. H ) 1 69, /0, 302, 370,
394; III 379
Биман (Biemann K-) V 14, 427, 429
Бимс (Bea тез A. N.I I 413
Бин (Bean F. R.) IV 31
Вин (Bean H. J.) I 130; III 114
Бинам (Bynuni E.) V 544
Бппгхам (Bingham R.) V 194
Бинкс (Binks R.) Ill 25; 1V 137
Биновн (Binov'i L. .1.) I 137; Ill 107
Ghiiiu (Binsch GJ V 272
Бирвпт (Bierwirth E.) Ill 462
Биребум (Beereboom J. J.) I 173
Биркеибах (Birkenbach L.) I 44
Бпрнофср (BirkoferL.) I 189; 11 150; III 383,
385. 390, 482
БирляДейме (Birladeame L.) Ill 241
Бирман (Beermail С.) V 420
Бирнат (Biernat J. F.) Ill 367; IV 12
Бирнбаум (Birnbaum S. M.) IV 165
Бирчел (Birchall J. At.) I 404
Бирштейн (Birsteln O.) Ill 328
Бисвар (Biswar R. At.) V 102
Бисс (Biss J. W.) 1 278
Бисселл (Bissell E. R.) I 167; III 243
Бисслнг (Bissing D. E.) 1 416; HI 375
Битое (Bithos Z. J.) Ill 168, 172
Битам (Beeihani D.) V 475
Биффин (Biffin M. E. GJ 1 248
Бич (Beach F. EJ IV 29
Бич (Beach R. L.) V 333
Бич (Beech W. F.) I 73; IV 72
Бичем (Beachem M. TJ Ш 145
Бишоп (Bishop С. T.) П 399, 401; V 219
Бишоп (Bishop W. S.) 11 326; III 329 335‘
IV 101
Бишоф (Bischoff CJ Ill 69, 70
Биэд (Beard C.) Ill 312
Блуас (Blaas T. A. H.) V 401, 402
Бланк (Blanc P. V.) I 85
Бланшар (Blanchard E. J.) II 203; V 256
Бланшар (Blanchard E. P.) Il 115; III 289
Бланшар (Blanchard H. S.) II 132
Блардиислли (Blardlnelli A.) И 274
Блатт (Blatt A. H.) IV 98
Блаттер (Blatter H. MJ II 464
Блаут (Blont E< R.) V 565
Баашкс (Blaschkc FI.) IV 11
Блесен (Blegen J. R.) II 39
Близзард (Blizzard R. M.) 11 169, 178
Блике (Blicke F. F.) IV 414
Бликенстафф (Blickenstaff R. T.) Ill 117,
118
Блодингер (Biodinger J.) I 435, 436; III 321
Блок (Block E.) Ill 261
Блок (Block P.. Jr.) Ill 309; IV 71; V 411
Блом (Blohm H-W.) IV 90
Блом (Blom <). H.) I 15
Бломквист (Blomquist A. T.) I 107, 419; Ц
230. 235, 465; III 315, 318, 337, 340, 360;
V 318
Блоссп (Blossey E, С.) V 5o4
Блотнп (Blotny GJ III 367
Блох (Pdoch EJ II 316
Блох (Bloch H. S.) II 210
Блох (Bloch K.) Ill 327
Блум (Bloom B. MJ III 99; 1V 20. 21
Блсмфнлд (Bloomfield J. JJ I 334; II 394
400; V 439, 442
Блэдоп (Bladon P.) I 24. 305; Il 414; IV 173
Блэйк (Blake J.) HI 107
Блэйкер (Blaker J. WJ 1 112
571
Блэк (Black А, Р.) II 289
Блэк (Black D. К.) I 118; III 416; V 436,
509
Блэк (Black Н.К-) II 133, 246
Блэквелл (Blackwell J.) И 183
Блэквуд (Blackwood R. К,,) I 334; IV 22
Блэнк (Blank В.) III 201
Блэнк (Blank R. Н.) III 4(1; IV 90
Блэнкли (Blankley С. J.) V 277, 278
,Блэр (Blair Н. S.) Ill 53
Блэчфорд (Blatchford J. К.) И 371
Блюз (Blues Е. Т.) II 210
Блюм (Bluhm A. L.) II 384. 388
Блюм (Blum J.) I 137; II 233; III 290'
IV 158; V 433, 454
Блюм (Blum S.) 1 194
Блюмбергс (Blumbergs J. Н.) IV 143
Блюменталь (Blumenthal D.) IV 213
Блюммель (Bliimmel F.) Ill 3G0; V 4'23
Блюизтенн (Blucstein В. R.) I 21
Боббит (Bobbit J.M.) II 70; III 84, 91
Бобко (Bobko Е.) II 97
Бобст (Bobst А.) III 434
Богельманс (Beiigclmans R.) V 534
Богерт (Bogert V. V.) Ill 99
Боданский (Bodanzkv М.) I 427; Ц 468; IV
271, 273
Боден (Boden Н.) I 350; 11 292, 376. 380
Бодешейм (Bodesheim F.) 11 335; IV 90
Боер (Boer Н.) II 110
Боер, дс (Boer Th. J., de) I 245, 247, 248;
III 363, 366
Soec (Boes O-) Hl 70
Боссе (Boese A. B., Jr.) II 129
Бозе (Bose А- К..) I 428, 431, 437; Ц] 45“'
IV 116; V 197, 199, 461
Бозе (Bose J. L.) IV 90, 210
Бозекен (Bocseken J.) I 1'21; II 340, 34'2;
III 41, 46
Бойд-(Boyd T.) IV 94
Бойд (Boyd V.) IV 198
Boiiep (Boyer J. H.) I 145; II 362, 410; Ш
408, 412'
Бойкесс (Boikess R. S.) Hi 290
Борланд (Boyland E.) II 99; Ш 222, 2+0
Бокелхайде (Boekcllielde V.) I 210; Il 11,
67, 71, 281; 111 158, 166; IV 266; V 163.
164, 414, 538, 540
Бокемюллер (Bockemuller W.) HI 243
Болан (Bolan E. N.) V 3Q6, 307
Волд (Bauld N, L.) II 438, 439; V З28
Болдви+i (Baldwin D. E.) 1 67
Болдвин (Baldwin $.) 1 166; IV 96
Болдуин (Baldwin F. P.) V 236
Болдуин (Baldwin J. E.) V 467, 46S
Болен (Bohlen D. H.) I 210
Болл (Ball D. H.) I 334
Болл (Bail S.) II 85, 97, 226
Боллин (Ballin S. G.) I 407
Боллинг (Balling W, J.) IV 25
Боллингер (Bollinger M.) П1 197
Болхофер (Bolhofer W. A.) I 350
Больдт (Boldt P.) V 181, 183, 464, 465
Вольман (Bohlmann F.) I 253: II 303; IV
83, 84, 227
Бомель (Beumcl O. F.) I 81. 397' II ] 62,
163; III 373, 402
Бомон (Beaumont S. M.) HI 21
Бон (Bohn R.) 1 120, 121
Бонавентура (Bonaventura M. M.) Il 150
Бонд (Bond А. С.) II 163, 178; HI 462 '
Бонд (Bond F. T.j V 425, 429, 497. 500
Бондявалли (Bondawalli F.) Il 39
Бопстти (Bonelli G.) И 255
Бонин (Bonin W., von) II 388
Боннер (Bonner R. M.) I 167
Боннер (Bonner T.G.) [ 117. 118
Боннер (Bonner W. A.) I 427; III 340.
Бог,нет (Bonnet Y .) Ill 394
BoHiieTT (Bonnett R.) V 307
Бонсо (Bonso О.) IV 167
Боцтекое (Bontekoe J. 8.) II 22; III 434
Бонтрон (Bonthrone W.) HI 401
Борвицкл (Boerwinkle F.) V 43
Боргнарт (Borgward! S.) I 350
Борден (Porden G. W.) I 121
Борден (Borden M. R.) HI 243
Бордуэлл (Bordwcll F. G.) I 82; III 281, 296,
336, 339, 468; IV 209
Борел (Borel E.) I 31, 368; II 125; IV 183
Бори (Богу S.) V 297, 299
Борк (Bork S.) 11 133
Боркенхаген (Borkenhagen L.) I 150
Бори (Born H.) IV 19"
Норнштейн (Bornstein J.) I 70. 130, [31; III
Боровас (Borovas D.) II 467; III 395. 419
Боронин (Borowitz I. J.) J 366: III 412; IV
143; V 242, 243, 518
Борроуз (Borrows E. T.) II 38
Борум (Вогцгп О- H.) Ill 114
Борх (Borch R.) I 14]
Борх (Borch R. I'.) V 468
Борхердт (Borcberdt G. T.) V 328, 331
Боршер (Borchert E. E.) II 241, 246
bee. <Eos H. J. T.) IV 272
Ьосиелл (Boswell G. A.) II 447; V 335, 387,
388
Боснии (Boskln M. J.) Щ 374
Боссхэрд (Bossbard H, H.) 1 354, 357
Бост (Bost R. \V.) IV 72
Бот (Barh S. S.) V 124
Ботпер-Бай (Bothner-By A, A.) I 109, 110
Ботт (Bott К..) I 418; V 190
Ботт (Bott R. W.) Ill 132
Боттассмо (Bottaccio G.) IV 61
Боттерст (Botl'eron D. G.) IV 253
IIotthhh (Bottini A. T.) I 66. 193
Ботторфф (Bottorff E. M.) IV 240, 247
Боудакян (Bouclakian M. M.) II 109
Боуден (Bowdin E.) IV 232
Боуден (Bowden R.) II 246; IV 178
Boyepe (Bowers A.) I 126, 413; II 114, 193.
412, 414; HI 227, 241, 243, 256; IV 72,
130, 173, 178; V 386
Боукет (Bouket J. L.) IV 261
Боултон (Boulton A. J.) Ц 362
Боумен (Bowman С. M.) IV 31
Боумен (Bowman R. E.) J 275; II 217
Боутмен (Boatman S.) V 71, 310
Боуэр (Bowyer W. J.) Il 180, 183; IV 149,
151
Боффн (Boffi С.) V 129, 131
Бошарт (Boshart G. L.) 1 303; III 367' IV
254
Врано (Bravo P-) I 417; V 143
Браггер (Bruggcr M.) HI 266
Бразен (Brasen W. R.) I 64, 66; II 281, 367,
369, 370
Брайджуотер (Bridgwater A,) I 93
Бране (Brye F- H.) V 203
Брайс (Brice C.) Hl 225. 240
Брайе-Смит (Brvce-S-mith D.) II 210 337;
HI 63, 67, 283; V 73, 259
Брайт (Bright R. D.) I 57
Бранд (Brand E.) HI 327; IV 80, 81
Бранд (Brand F. С.) II 327
Бранденберг (Brandenberg W.) I 121
Брандсма (Brandsma L.) V 2(i, 555
Брандстром (Brandstrom A.) I 33
Брандт (Brandt P. R.) I 414
Браннен (Brannen C. G.) II 157
Брант (Brant .1. H.) IV 250
Братке (Bralkc R.) II 125
Брауде (Braude E. A.) 1 351, 396. 412. ИЗ;
II 220, 226, 429, 466; IV 95, 96. 132, 183
572
Браудер (Browder L. Е.) II 187
Браун (Brown А. Е.) I 2S3
Браун (Brown А. Р.) V 551, 55-1
Браун (Brown В. К.,) I 209, 221; II 409
Браун (Brown В. R.) I 39, 303: И 179, 183
Браун (Brown С. АЛ II 436; III 130, 132;
V 362, 516
Браун (Brown С. ЕЛ I 54; IV 104, 109.
209
Браун (Brown D.) I 427
Браун (Brown D. М.) 1 97, 257, 401. 427;
IV 38. 90
Браун (Brown Е. V.) III 68
Браун (Brown F. С.) V 46
Браун (Brown J. С.) I 154, 167
Браун (Brown G.) I 100, 385; И 261, 339;
IV 94, 123
Браун (Brown G. Е.) V 168
Браун {Brown G. Б.) V 543
Браун (Brown Н. С.) I 39, 100. 115, 117, 118,
‘213, 215, 259, 262, 263, 268, 272, 279, 308,
315; II 173, 178. 186, 187, 193. 196, 203,
204, 381, 388, 433, 436; Ш 15, 18, 130, 132,
29,3, 296,335 306 371, 372, 377, 381, 390,
433, 434; IV 126, 166, 179, 264; V 13, 19,
36, 50, 51, 83, 84, 102—104. 1 17, 237,
292. 362, 371, 372, 393, 471, 516, 320, 535
Браун (Brown !) V 475
Браун (Brown J. В.) I 66; II 11; III 24
Браун (Brown J. Н.) IV 82
Браун (Brown J, Н.. Jr.) I 363; II 1'2
Браун (Brown J. J.) I 10; II 214; IV 184, 233
Браун (Brown J. W.) И 150, 199; IV 143
Браун (Brown К. <$., Jr.) V 325
Браун (Brown М.) I 66; V 430, 454
Браун (Brown М. S.) II 388
Браун (Brown N. С.) II 99
Браун (Brown P.M.) IV 81
Браун (Brown R.) I 82; III 339
Браун (Braun J., von) I 28, 139, 141; 111 102,
107; IV 111, 173
Браун (Braun R. A.) I 383
Браун (Brown R, A.) Ill 4G1
Браун (Brown R. R.) J 206; It 236; III 123
Браун (Brown R. L.) II 46
Браун (Brown R. T.) Hl 178, 184; IV 226
Браун (Brown T. L.) IV 237
Браун (Brann W.) II 425
Браун (Brown W.G.) Ц 163, 169, 178, 179,
381, 388; III 19
Браунворт (Braunworth J. B.) Ill 145
Браунли (Brownlee P. J. E.) V 517
Браунли (Brownlee R. G.) V 164
Браунлинг (Braunling II.) Il 30, 121, 178
Брауэр (Brauer G.) Ill 261
Бревер (Brewer H. W-) II 141
Бревстер (Brewster J. H.) Ill 367
Бреган (Bregan W. H.) Ill 854
Бредди (Breddy L, J.) Ill 53
Бреденберг (Bredeflbcrg J. В.) I 182; II 15’3
Бредер (Breder С. V.) V 56, 466
Бредерен (Brederek H.) 1 316, 318, 352, 334;
II 39, 30; IV 35, 36, 7-1 — 76
Брей (Brey W. S., Jr-) IV 237
Брейтнер (Breitner ЕЛ Ill 172, 173, 194' 197
Брек (Breck D. \V.) II 311
Брендан (Brennan M. R.) HI 340
Бреннейзен (Brenneisen R.) I 24
Бреннер (Brenner M.) 1 .30; III 152, 153, 331,
335; IV 81; V 44 7
Бреннерман- (Bren taw man M. C.) Ill 146
Брепнннгер (Brenniuger W.) I 210; Ц 316;
III 354; IV 197
Бреслауэр (Breslauer H ) Ill 184
Бреслоу (Breslow D. S.) II 22, 132, 359;
IV 212, 213
Бреслоу (Breslow R-) 1 416. 4(7; 11 169,
Ш; Ill 456, 457; V 432, 464, 465
Брессел (Bressel U.) V 71
Брестер (Brewsier R. Q.) I 367; Il 33, 42
237; IV 45; V 357, 358
Бретт (Brett ID.) V 456
Бреттинг (Bretting С.) II 245
Брехт (Brecht E. A.) HI 291
Брехбголер (Brechbiihlcr H.) I 351, 352
Бриггс (Briggs L. H.) I 28; II 55
Бригль (Brigl P.) I 400, 401; IV 38
Бриджмен (Bridgeman J. ЕЛ V 230
Бриззолара (Brizzolara A.) II 316; Ill 129
Бринтзннгер (Brlntzingcr НЛ 1 436
Бриттон (Britton R. W.) V 199, 655
Бродбент (Broadbent H, S.) Ill 107 168,
172; V 475
Броди (Brodie В. B.) Ill 84
Брозертон (Brotherton T. К.) I 66, 104
Бройер (Breuer A.) HI 120, 123
Бройер (Breuer E.) 1 215; IV 126
Бройн (Braun G.) II 342; III 277
Бройс (Brois S. J.) II 4,56; III 27, 30; V 81
Brok (Brock ID. J. H.) V 334
Брокман (Brockmann H.) 1 41, 367
Брокман (Brockman I. A.. Jr.) Ill 340
Брокхауз (Brockhaus R.) V 543
Бромлей (Bromley D.) V 564
Бромфилд/ВгогпБеШ R. В.) IV 193
Броссмер (Brossmer R.) V 227, 270
Брук (Brook A- G.) I 16, 17, 24, 412; IV 132;
V 159, 163
Брук (Bruck P.) Il 1.55; V 416
Брукнер (Bruckner V.) IV 198
Брукс (Brooks C. J. W.) II 391; V 488
Брмкс (Brooks L. A.) Il 30, 235; Ш 332,
335' iv 233
Брукс'(Brooks R. E.) I 210
Брукс (Brooks S. G.) 11 99
Брукс (Brooks T. W.) Ill 412
Бруме (Broome J.) 1 39; П 183
Брун (Brun P.) V 338
Брунинге (Brunings R. J.) Ill 279
Брункен (Bruuken J.) Ill 183
Бруно (Bruno J. J.) I 275 — 278
Брунс (Bruns L.) IV 29
BpycOEi (Brtison H. A.) I 31; IJ 92, 97; HI 394
Bpycce (Brousse E.) V 131
Брутчср (Bratcher F. V-, Jr.) IV 19, 30'
Бручи (Brutschy F. I.) 1 (59, 16"; [[ 27
Брэдбери (Bradbary J. H.) I 211
Брэди (Brady S. F.) V 284, 508. 548
Брэди (Brady \V. T.) IV 214; V 550
Брэдли (Bradley A.) Ill G7
Брэдли (Bradley ID. С.) V 11_3
Брэдлоу (Bradlow H. В.) I 275
Бпэдшер (Bradsher C. R.) Ill 305, 306; V 45,
'46, 365
Брэдшоу (Bradchow С. P. С.) I 173
Брэдшоу (Bradshaw R.W.) V 411
Брэйс (Brace N. O-) V 215
Брэкмен (Brachman W.) Il 232; V 285
Брэннон-(Brannen C. G.) II 157
Брюне (Bruice T. C.) I[ 30
Брюкнер (Bruckner H.) I 239
Брюни (Brunie J.-C,.) Ill 142. 146
Брюнп (Bruni R. J.) I 262, 368
Бргониг (Bruni# H.) V 411
Брюс (Bruce D. В.) Ц 363
Брюс (Bruce J. M-) I 54
Брюс (Bruce N. F.J’IIl 99
Брюс (Bruce W. F.) 1 37; II 376, 380; Ill 131;
IV 81
Буассель (Boisselle A. P.) I 130, 131
IjvaccoHa (Boissonnas R.A.) 1 210, 317,
330; П 123; HI 3G7, 41 9, 434. 449. 457;
IV 6. 32, 36, 1G0, 161
Бублитц (Bublitz D. E.) 1 134; {V 201
Byro (Bougauli JD Hi 161- '67
Будде (Buddc \V. M.) II 410
573
Будевиц (Budewitz Е. Р.) Ill 56: IV 227
Будзикевич (Budzikiewicz Н.) I 210
Бидзиярек (Budziarek R.) IV 226
Будрус (Buddru? J.) V 340
Буза (Вига Н.) V 372
Бузер (Boozer С. Е.) 1 396
Бук (Buck J. S.) 1 219; 11 238; Ш 26, 30, 76;
IV 13, 17, 109
Букинхэм (Buckingham D. А.) III 459
'Букок (Boocock J. R. В.) Ill 312
Бу’Лок (Bu’LocK J- В.) V 289
Були (Bouleh N. L.) V 505, 506
Буиге (Bunge W.) И 357
Бур (Buhr G.) V 362
Бург (Burg А . В.) I I94, 268; 111 379
Бургель (Bourgnel M.) I 59, 66
Бургер (Burgher R. D.) Hl 132
Бургер (Burger A.) I 130; Il 374; V 199
Бургесс (Burgess С.) V 50, 215
Бургссс (Burgess J. R.) V 153. 316
Бургоин (Burgoync E, E.) I 10
Буржуа (Bourgeois R.C.) I 193
Буркхардт (Burckhardt G.) Ill 148
Буркхар.дт (Burkhardt G. N.) Ill 283
Буркхардт (Burckhardt U.) I 104; ]V 273
Бурхард (Burchard H.) V 106, 108
Бурлалт (Burlant W. J.) 11 39
Бурман (Boorman E.J.) Ill 450
Буспе (Bourne E. J.) I 117, 118; Il I 443, 444
Бурр (Burr M.) V 522
Бурхэм (Bnrhani R. L.) Ill 445
Бусквет (Bousquet E. W.) I 218
Бул (Booth A. N.) I 318
Бут (Booth J.) 1П 222, 240
Бут (Boothe J. H.) I 69
Бутенандт (Buicnandt A.) 11 103, 106, 443;
IV 90, 227
Evtc (Boots S. G.) Ill 373
Бух (Buch R. R.) Ill 302
Буханан (Buchanan G. L.) V 54, 429
Буханан (Buchanan J. В.) I 37
Буханан (Buchanan J.G.) Ill 283
Бухянан (Buchanan R. L.) V 4-1
Бухард (Bouchard R.) V 18
Бу-Xoil (Buu-Hoi N. P.) HI 162, [66, 167
Бухта (Buchta E.) 1 183; II 168. 169, 178, 298
Буцсль (Buczel Cz.) V 193
Буцкус P. Ф. I 134
Буш (Bush .1. B., Jr.) V 262
Буш (Bush W. M.) I 175
Буш (Busch T.) 1 100; Ш 301
Бу швеллер (Bushwellet С. H.) V 347
Бхатн (Bnati A.) V 366
Бхатаагар (Bhatnagar J.) V 263, 270
Бхатья (Bhatia S. В.) V 99
Бьеррум (Bjerrum J.) II 210
ВыоДжль (Bnijle R.) V 195
Бьюист (Bulst G. J.) II 52
Бьюль (Buyle R.) I 282; 1V 166
Бьюрикс (Btiriks R. S.) H 410
Бэвип (Bavin P. M. С.) I 210; IV 64, 65
Бэвли (Bavlcy A.) II 226
Бэгбап (Bagby M. О.) V 110
Бэгли (Bagli J. F.) I 413; 11 226; III 241
Бэгэлм (Baggaley К.. H.) V 353, 384
Бэдгер (Badger G. M.) HI 137, 162, 167'
V 348
Бэддинг (Budding V. G.) II 183; V 126
Бэйг /Baig M. I.) V 335
Бэкес (Backes J. V.) I 270
Бэйлес (Bayless J.) V 429
Бэйли (Bailey A. S.) I 356. 357; III 100
Бэйли (Bailey D. M.l V 310
Бэйли (Bailey G. A.' III 46
Бэйли (Bailey G. M.) Ill 33
Бэйли (Bailey E.J.) I 167
Бэйли (Bailey P. S.) II 4[3, 414; III 6, 10;
V 124
Бэйли (Bailey W. J.) II 183
Бэйрд (Baird R.) V 21
Бэйрд (Baird W. C., jr.) V 110, 345, 346
372, 393
Бэйтор (Bator В.) IV 12
Бэйтс (Bates E. В.) II 179
Бэйтс (Bates R. В.) V 110
Бэк (Buck A.) IV 72
Бэк (Вас N. V j HI 16/
Бэкер (Baker A. W.) Ill 184
Бэкер (Baker B. R.) I 102, 330, 335; II 217,
290, 448, 455
Бэкер (Baker C. S.L.) II 246; HI 417
Бэкер (Baker E. Б.) I 76
Бэкер (Baker F. W.) I 138; III 187
Бэкер (Baker G. P.) II 42, 56
Бэкер (Backer H. J.) I 245 247, 248; III 363,
366; V 401, 402
Бэкер (Baker R. H.) II 375, 3S0, 456; IV 209
Бэкер (Baker T. N., HI) Il 136. 456
Бэкер (Baker W.) 1 193; 11 99; III 53, 76;
IV 119
Бэккер (Bakker G. R.) In 145
Бэкон (Bacon R. G. R.) II 231, 421; IV 157
Бэлком (Balcom D.) I 210
Бэлком (Balcom D. M..J III 160. 166
Бэлон (Baton A. D. J.) Ill 322
Бэмфорд (Bamford W, R.) Ill 360; V 424
Бэн (Ban Y.) Ill 148
Бэнк (Bank S.) 11 359: V 316
Бэнкс (Banks G. V.) Ill 256; V 544
Бэнкс (Banks D. F.) II 43
Бэнкс (Banks G. R.) V 566
Бэнкс (Banks R. E.) V 353
Бэннард (Bannard R. A.) I 249; Ц 70; IV 138
Бэр (Behr L. D.) HI 2/6
Бэр (Bare T.M.) V 298, 29f)
Бэран (Baran J. S.) I 186; HI 43, 46; V 108,
109
Бэрантон (Baranton F.) V 275
Бэртон (Burton D. J.) 1 404; II 14; HI 422
Бэттерсби (Battcrsby A. R.) Ill 25; V 270
Бэттин (Battin D. E.) V 462
Бюлов (Biilov B.-G. yon) V 429
Бюкур (Bucourt R.) I 407; H 70
Бк>сс (Busse A.) I 367
Бюхи (Bilchi G.) V 14, 19. 147, 220. 427, 429
Бюхлер (Buehler С. A.) H 256
Бюхнер (Buchner В.) I 54; IV 113
Бюхнер (Biichner E.) I 250, 252; Hl 240
Бюхнер (Biichner О.) V 85, 86
Бюхцср (Buchner W.) I 213
Бючер (Bucher J. E.) II 95, 97
Бавасоур (Vavasour G. R.) IV 138, 168
Вавзонек (Wavzonek S.) I 66, 130; HI 271;
IV 247
Вагланд (Wagland A. A.) 1V 151
Вагнер (Wagner A. F.) II 401; 111 340
Вагнер (Wagner C. D.) I 144
Вагнер (Wagner E.C.) I 88; II 331; III 114,
IV 41, 81, 109
Вагнер (Wagner G.W.) Il 304, 306
Вагнер (Wagner W.) И 109
Вагнер (Wagner W. M.) Ill 448
Ваде (Wade R. H.) Ill 166
Bajiac (Vyas G. N.) I 317; II 281
Вайдиа (Vaidya A. S.) V 381
Bali дна (Vaidya V. M.) V 565
Вайдянтасвами (Vaidyanthasvamy R.) V 299,
ВайленФелз (Wallenfels К.) II 281
Вайли (Wylie A. G.) II 388
Вайман (Wyman D. P.) HI 295
Вайман (Wyman L. J.) Ц up, 111
Вайи (Wynn W- R.) HI 99
Вайнберг (Weinberg D. S'.) Ill 414, 415
574
Вайнберг (Weinberg N. L.) V 237
Вайнгартен (Weingarten И.) V 113, 420, 421
Вайсоки (Wysocki A. J.) Ill 280
Вакабаясп (Wakabayashi N.) Ill 241
Вакабаясп (Wakabayashi T.) V 464
Вакилвала (Wakihvala M, V.) II 421
Валент (Valente V. R.) V 519
Валента (Valenla Z.) IV 227
Валцавндан (Valiaveedan G. D.) Ill 191
Валинентн (Valiccnti J. A.) 1 334
Валканас (Valkanas G.) I 73
Валли (Vallee B. L.) Ill 309; V 413
Валлах (Wallach О.) I J36
Вальборг (W’ahiborg II. J.) 11 199
БальборсКий fWalborsky H M.) II 53;
111 267, 271/ 337, 339
Вальдеи (Walden P.) II 100
Вальдманн (Waldmann I-I.} IV 116
Вальдфогель (Waldvogcl G.) V 78, 386
Вальтер (Walter I?.) IV 34—36
Вадчйд (Valade J.) V 443
Вамбсганс (Warobsgans A.) 1 174
Ban Аллан (VanAllan J.) I 64, 6(1, 70; IV 259
Ван Аллан (VanAlian J. A.) H 374, 380-
HI 40, 311, 327, 342; IV 41, 72, 2 18
Ван Аллен (Van Allen J. D.) II 380
Ван Аммерс (Van Arnmers M.) Ill 431
Ван Аукен (Van Aukon T. V.} Ill 153; V 503
Ban Бэк (Van Вас N.) Ill 166
Ban Вазер (Van Wazer J. R.) V 336
Ванг (Wang L. L.) Ill 145
Ванг (Wang S.) 1 374; IV 238
Ванг (Wang S. S.) Ill 276
Ванг (Wang T. S.) I 350
Вангедал (Vangedal S.) Ill 422
Ванген (Wangen L. E.) V 281
Ван Дейк (Van Dyke M.) V 133
Ван Дейк Тирс (Van Dyke Thiers G.) IV 109
Ван де Кастль (Van de Castle J. F.) Ill 221
220
Ванденберг (Vandenberg G. 13.) Ill 99
Ван Ден Бринк (Van Den Brink W, Al.) 11
121; 111 370
Вандепхэвел (Vandenheuvei F. A.) Ill 132
ван дер Бринк (van tier Brink W. M.) V 430
Ван дер Вен (Van der Ven S.) III 448
ВанДерверф (Van der Werf С, A.) I 62, 60;
II 322, 326, 361, 362
Ван Дер Ген (Van der Gen A.) I 15
Ван дер Керк (Van der Kerk-G. J, M.) I 238;
II 32 372, 373 402
Вандер Слау (Vander Siouw G, G.) Ill 360
ВаидеЬхаге (Vanderhaeghe H.) И 25
Ван Дин (Van Dine H. A.) V 143
Вандлер (Wandler N. L.) 1 139
Ban Дори (Van Dorp D. A.) II 285; III 256;
IV 133, 269; V 24, 26, 201
Ван Дорт (Van Dort JJ, Al.) V 377
Ван Дуурен (Van Dunren B. L.) II 352, 353
Ванино (Vanino L.) I 93
Ван Кампен (Van Campen Al, G.) I 262, 268
Ванкель (Vankel R. A.) Ill 205
Ван Клаверен (Van Klaveren W.) HI 64, 68
Ван Мейтер (Van Manter H. L.) IV 227, 228
Ванн (Wann R. E.) Ill 296, 468
Ваннагат (Wannagat U.) I 73; III 386
Ванновиюс (Wannowius H.) 11 46, 240
Ван Оверстратен (Van Ovcrstraelen A.) 1 282
Bail Ренеи (Van Rheenen V.) V 288
Ван Скутен (Van Schooten J.) II 110
Ванстоун (Vanstone A- E.) V 536
Ван Тамелен (Van Tamelen E. E.) I 13, 282;
III 161, 167, 232, 241, ,344; V 381, 419, 420
Ван Хозер (Van Hoozcr R.) Ill 36j
Ваицлик (Wanzlick H.-W.) 1 402; V 343; 378
Ван Эе (Van Es A. T.) Ill 331, 435; IV 22
ван Эс (van Es T.) V 85
Ван Эсс (Van Ess P. R.) И 285
Барана (Warawa E. J.) I 86
Bape (Ware J, C.) 11 241, 246
Варзински (Warzynski R. J.) II 212
Варимби (Varimbi S. P.) II 407, 409
Варлаид (Varland R. И.) H 335
Варма (Varma K. R.) IV 214
Варма (Varma V.) 1 279
Варнав (Warnant J.) II 202; III 67, 93, 99
Bappenrpan (Varrentrapp F.) 11 77, 79
Вартон (Wharton P. S.) I 203, 210; II 302;
IV 272
Вас (Vas S.) V 241
Василевски (Wasielewski C.) Ill 296; IV 12
Васка (Vaska L.) V 448
Вассерман (Wassermann H. Н.) II 302; III
58, 67, 289, 290; IV 271, 272; V 504, 505
Вассмундт (Wassmundi F,W.) V 365
Ватакенчерри (Vatakencherry P. A.) Ill 201
Ватанабе (Watanabe S.) V 29, 245
Ватанабе (Watanabe W. H.) HI 179, 184
Вахтер (Wachter W.) 11 42, 56
Вебб (Webb G. B.) 11 205; Hl 184
Вебб (Webb R, F.) Ц 250, 414; III 419
Вебб (Webb R.G.) I 388
Веббер (Webber G, Al.) I 110; II 156
Веббер (Webber J. M.) 1118
Вебель (Veibel S.) V 235
Вебер (Veber D, F.) V 27
Вебер (Weber K. IT.) II 389; IV 132
Вебер (W7eber L.) II 421
Вебер (Weber R.) I 392
Вебер (Weber S.) V 127, 252, 361
Вегель (Waegell В.) V 338
Пеглер (Wegler R.) [II 22, 261
Вегнер (Wegner E.) IV 126
Вегнер (Wegner P.) Ill 383
Веддиге (Weddtge H.) I 436
Ведейс (Vedejs E.) V 89, 193, 565
Вейганд (Weygand F.) I 181, 224, 376; II 30,
120, 121, 173, 178, 295; HI 21, 369, 370
434, 436; IV 9, 114; V 163, 195
Вейгеле (Welgele M.) V 288
Вейгсль (Weigel H.) Il 388
Вейд (Wade R. H.) II 420; 461; IV 248
Вейдинген (Weidingen H.) I ,3,57
Вейдшп'ер (Weidinger H.) V J95
Вейдман (Weidmann G.) HI 240
Вейерсталь (Weyerstahl P.) Il 446; V 340
Вейзенбори (Weisenborn F. L.) II 395 400
Вейл (Weil E. D.) Ill 261
Вейл (Weil J. A.) HI 205
Вейл (Weil T.) V 421, 423 ,
Вейлард (W’eijiard J.) I 225; 1Ц 83, 240, 345
Вейман (Weimann G.) I 365; III 319
Вейнер (Weiner M. A.) 1 35, 1S3; HI 430
Вейнер (Weiner N.) Il 264; IV 235, 242, 248
Вейнер (Weiner S, A.) I 345
Вейикауфф (Weinkauff O- J.) Hl 458: 1V 114
Вейнтрауб (Weintraub P, M. )IV 126
Вейнхеймер (’Weinheimer A. J.) I 57; H 76
Вейнштейн (Weinstein В.) V 232
Вейишток (Weinstock J.) I! 67, 71,-281, 360,
362; IV 226; V 143
Вейс (Weis C. D.) 1 419; HI 408, 412
Вейс (Weiss A.) Ill 241; IV 173
Belie (Weiss E.) Il 6
Bene (Weiss J.) Ill 304
Вейс (Weis K.) HI 191
Befic (Weiss К.) 1 15
Вейс (Weiss M.) IV 71
Вейс (WeisS M. J.) Il 16, 83, 151 — 153; jJi
420: IV 173; V 86, 226
Вейс (Weiss R.) Ill 260; IV 17
Beiic (Weiss U.) 1 58
Вейс (Weiss W.) HI 83
Вейсбергер (Weissberger A.) I 214’ 11 290’
1П 354; IV 36
575
Вейсблат (Welsblatt D. J.) II 23, 25, 455;
III 40
Вейсгербер (Wcisgerber С. A.) I 100
Вейсгсрбер (Weisgerber G.) V 512
Вейсе (Weise A.) V 126
Вейсс (Weiss Ek.) V 4z8
Вейсс (Weiss H. D.) V 30'2
Всйссгербер (Weissgerber R.) 11 103, 107
'Вейссенфелс (Weissenfels M.) Ш 184
Вейссман (Weissman P. M.) II 187, J93, 203
204
Вейссман (Weissman S. I.) Il 359
Вейц (Weitz E.) HI 76
Вейцман (Weizmann Ch.) | 120, 121
Вейцманн (Weismann M.) III 19
Вейчст (Wcichet J.) Ill 47
Веларде (Velarde E.) 1 433: IV 151; V 174
Веласко (Velasco M.) II 301
Вел (Wehl J.) I 350
Вельюз (WeIIuz, L. A-) I 133, 137, 406, 407;
II 31, 206; 111 67, 152, 153. 419
Венапци (Venanzi L. M.) V 411, 448
Вен дер (Wender I.) I 291; II 7, 132, 159
162, 163, 439; III 256
Вендлер (Wendler N. L.) I 167. 316; II 26,
27, 76, 106, 226, 230, 2o3. 409, 413, 414;
III 124, 204, 205, 344, 354, 360; IV 19, 20,
175; V 127, 251, 252, 361, 460
Венпс (Wenis E.) 1 357
Венкатараман (Venkataraman 1<.) I 268;
IV 209
Венкатараманн (Venkataramarii P. S.l V 243
Бенкерт (Wenkert E.) I 79, 144, 181, 182;
II 152, 153; HI 178, 184, 352, 354; V 487
Вептс (Wenthe A. M.) V 90
Вепстер (Wepster В. M.) Ill 327
Вербер (Werber E. X.) Ill 145
Вердер (Werder F., von) IV 191
Beperre (Vieregge H.) IV 272
Верзеле (Verzele Al.) II II; V 544
Беринга (Wleringa J. H.) V 209
Веркаде (Vcrkade P. E.) Ill 327; V 4]7
Веркруйссе (Verkniijsse H. D.) V 26
Верлей (Verley M. A.) 1 64, 66
ВермеЙстер (Wehrmeister H. L.) I 370; V 506
Вернер (Werner E.) V 382, .384
Вернер (Werner N. \V.) V 317
Вернон (Vernon С. A.) II 341
Вернон (Vernon J. FI.) I 370
Верселлоне (Vercellone A.) I 116
Верселлоттп (Vercellotti J.R.) IV 185
Версема (Wiersema А. К..) V 284
Bee (Wies R. A.) V 393
Весли (Vesley G. F.) V 466
Вессели (Wessely F.) Ill 226, 240
Вессель (Wessel H.) V 529
Вест (West R.) V 38
Вест (West D. E.) V 37
Вест (West E. S.) I 317
Вестберг (Westberg II. H.) V 381
Вестгеймер (Westheimer F. H.) 1 24; II 403-
V 537, 540
Вестергард (Vestergaard J. Н.) V 235
Вестфаль (Westphal U.) I 11
Ветмейер (Vietmeyer N. D.l V 429
Веттер (Vetter H.) I 7; Il 67
Веттштейп (Wetrstein A.) I 107, 108, 178
277, 278: II 193, 202; III 241, 256, 276;
IV 144, 131
Вецель (Wetzel W. FI.) II 38
Вехтер (Wechter W. J.) 1 126, 268
Вешер (Wilcher К.) IV 137
Вёрффель (Worffel V.) IV 143
Вцб (Vib G.) V 318
Виберг (Wiberg E.) I 39
Виберг (Wiberg R. В.) II 03, 143, 144 *’48'
HI 75, 76, 249, 256; IV 72; V 53, 533, 534
Вцгтман (Wightman R. H.) I 335; IV 80
Вида.п (Vidal M.) V 400, 401
Видмер (Widmer E.) 1 54
ВпДхауп (Wicdhaup К..) V 284
Вне (Viehe H. G.) И 277; V 195
Визанский (Wisansky W- A.) II 39. 245
Визелогль (Wiselogic F. Y.) IV 227
Вила (Vila J.) IV 1G8
Виланд (Wieland A. A.) V ,323
Виланд (Wieland H.) И 34a; [V 26, 29, 168;
V 155
Виланд (Wieland P.) II 193, 202; Ill 241,
457; V 85. 138, 143, 244, 429
Виланд (Wieland T.) I 177; II 30, 418, 420,
456; III 329, 457; IV 8, 161
Виланд (Wieland Th.) V 300, 430, 529
Билд (Wild F.) [ 138. 367
Вилде (Wilde H.) I 211
Вилдииг (Wilding I. G.) I 436
Вилдман (Wildman W. С.) IV 250
Вилдс (Wilds A. L.) IV 233
Вилер (Wiehlcr G.) I 115
Вилзбах (Wilzbach К. E.) Ill 402
Виличек (Wieleseck R.) II 405
Виллани. (Villani F. J.) V 470
Вилларика (Villarica R. M.) V 98
Вилкас (Wilkas M.) II 236, 237, 342, 462;
III 240
Вилкокс (Wilcox D. J.) II 445
Вилкокс (Wilcox M. E.) V 226
Вилл (Vill J. J.) Il 118
Бплленберг (Willenberg E.) IV 162
Виллигер (Villiger V.) 1 219; II 124, 125
ВиллиманН (Willimann L.) I 141
Виллотти (VlHotti R.) II 25
Виллфанг (Willfang G.) Ill 461
Вилт (Wilt M. H.) Ill 53
Вилчек (Wiichek M.) II 150; IV 81. 160
Впльгеродт (Willgerodt С.) II 43; HI 261
Вильгус (Wilgus H. S.) V 485, 487
Вильке (Wilke G.) I 278; III 323; V 429
Вильнер (Wilner D.) I 186
Вильсмейер (Vilsrneier A.) I 354, 357; II 295,
297
Вильсон (Wilson A. N.) II 227; Ill 340;
' IV 95, 101, 102
Вильсон (Wilson В, M.) II 4]4
Вильсон (Wilson С. V.) I 121; III 434, 435;
IV 78, 80
Вильсон (Wilson D. A.) I 31; V 133
Вильсон (Wilson E.) HI 114, 2o6, 354; IV
226
Вильсон (Wilson I. B.) Ill 340
Вильсон (Wilson J.G.) II 465
Вильсон (Wilson J, W.) I 305; II 131; III 296
Вильсон (Wilson R. A. L.) 11 178
Вильсон (Wilson T. L.) IV 91
Вильсон (Wilson W.) II 109; III 40
Вильсон (Wilson W. С.) II 324, 326
Впльштеттер (Willstatter R.) Ill 202, 205,
209, 239, 272, 276; V 523, 543
Вильямс (Williams V. Z., jr.) V 18
Вингиелло (Vingiello F. A.) I 238
Винглер (Wlngler F.) Ill 289
Виндаус (Windaus A.) 11 337, 338, 342;
III 173-175, 183; IV 168, 189, 191, 216,
225—227; V 105, 106, 108
Випдхольц (Windholz T- В.) V 528
Вннемаи (Winemaii R. J.) HI 287, 290
Винкельман» (Winkelmann E.) HI 241
Винкельманн (Winkelmann E. H.) I 137
Винкельмюллер (Winkclm idler W'.) I 73, 124
Винклер (Winkler H. J. 8.) HI 153; V o03
Виноградова Л. П. Ill 67
Винсент (Vincent B. F.) I 268
Винтер (Winter E.) IV 183; V 487
Винтер (Winter M.) I 351; V 429
Винтер (Winter P. К.) I 38
Винтер (Winter R.) Ill 201
576
Винтер (Winter R. E. К) V 89
Винтерпиц (Winternitz F.) V 556
Впнтерсбергср (Wintersberger E.) V 112
Винтерштейн (Winterstein A.) J 37; 111 207,
208; IV 82, 83, 222, 226, 227
Виитерштейнер (Wintersteiner О.) II 339,
342; 1H 53, 365, 366; IV 159, 160
Випьо дю (Vlgneaud.V-- du) I 427; II 213,
330, 468; III 321; IV 161
Вщюнд (Vipond H. J.) 11 365; III 40
Внппель (Wippel H. G.) 1H 412
Вир (Veer W. L. С.) H 421
Виравагу (Veeravagu P.) I 167
Вирк (Virk К.) I 334; 11 281
Вирккала (Wirkkala R. A.) Ill 433, 434
Впрс (Wirth H. О.) Il 33, 38
Впсзорек (Wieczorek J.) II 156
Buckoiitiihh (Viscontini M.) 1 300; Il 210,
255; III 434
Вислиценус (Wfslicenus J.) Ill 120, 123
Вислиценус (Wislicenus H.) I 37
Виснер (Wiesner K-) I 413; V 343, 344
Висолый (Vizsolyi J. P.) I 427
Вист (Wiest 318
Витали (Vitali R.) Ill 40
Виткой (Witkop В.) I 140, 141, 334; II 61,
62; III 145, 226, 240, 285; IV 82; V 102,
325
Внтиауер (Wltnauer L. P.) Il 326
Виттен (Witten С. H.) 111 31; 1V 109
Виттенберг (Wittenberg D.) I 399; HI 399
Виттенбрук (Wit ten brook L. S.) V 95
Впттенбург (Wittenburg E.) V 395
Виттиг (Wittig G.) I, 56, 57, 108, 175, 248.
366, 390; II 139, 141, 203, 225, 227, 276,
277 294, 307, 308; HI 286, 289, 301, 398,
,399, 402 — 406, 408, 412; IV 27, 29, 40, 116,
234; V 78, 88, 164, 252, 253, 391, 393, 443,
444, 445
Виттенберга (Vittemberga B.) Ill 145
Виттер (Witter A.) V 112
Виттрайх (Wittreich P. E.) II 401
Витэйл (Vitale W.) V 527
Вииеманн (Witzemann E. J.) II 97
Вича (Wicha J.) V 250, 376
Вичтерле (Wichterle O-) I 85
Влаттае (Vlattas 1.) V 38, 47, 89, 183, 193
Влие (Vliet E. В.) II 375, 380; IV 178
Влос (Wlos R.) V 354, 355
Влука (Wluka D. J.) I 34
Bo (Waugh T. D.) I 224, 413; Il 374; III 207,
256; V 18!
Boran (Vaughan J. R.. Jr.) HI 387, 388
-157; IV IG1; V 523. 524
Воган (Vaughan T- H.) 1 65
Воган (Vaughan W. R.) 1 156, 167; Il 237,
257, 262; III 333, 335; IV 213
Boran (Vaughan W- L.) IV 214
ВоДоз (Vodoz С.) II 17
Возе (Vose С. E.) IV 109
Во-Куанг (Vo-Quang L.) I 366
Bo-Куапг (Vo-Quang Y.) 1 366
Воливский (Wollnsky J.) I 155, 167, 431;
III 337, 340; V 384
Волленсак (Wollensak J.) II! 107
Волнак (Wolnak В.) I 70, 370
Воловский (Woloysky R.) II 228; III 270,
271, 301; V 275
Воллере (Volpers F.) 1 41
Волпол (Walpole A. L.) Ill 53
Волтан (Wolfhan H.) Ill 399
Волтуйс (Wolthuis E.) IV 127, 130, 234
Волфе (Wolfe J. F.) I 113
Волфе (Wolfe J. K.) 11 14
Волфе (Wolfe I. R-, Jr.) Ill 303
Волфе (Wolfe S.) I 268; V 44, 214, 405
Воль (Wohl A.) II 214, 216
Вольман (Vollmann H.) II 297
Вольман (Woltnan Y.) V 74, 363
Вольф (Wolf I.) V 24
Вольф (Wolf W. A.) V 2,32, 233
Вольф (Wolff I. A.) IV 91; V 110
Вольф (Wolfl H.) 1 28
Вольф (Wolff K.) HI 149
Вольф (Wolll L.) 1V 25, 29
Вольф (Wolff M. E.) II 193; III 200, 201
Вольф (Wolff R. E.) I 86
Вольф (Wolff R.) V 318
В ольфен Штейн (Wolffenstcin R.) Ill 21
Вольфстирн (Wolistirn R. В.) II 237
Вольфхаген (Wolfhagen J, L.) V 519
Вомак (Womack E. В J II 420; III 329, 335
Вонг (Wong E. J.) II 401
Воонг Сипг-Тау (Voong S.-T.) I 219
Воссель (Vocelle D.) V 520
Bocc (Voss G.) II 80
Вотиз (Wotiz J. H.) I 291; V 153
Вотрэл (Votral R. L.) V 76
Вреде (Wrede F.) Ill 203, 205
Ври, де (Vries В., de) 111 269, 271
Вриде (Wriede P.) II 359; V 316
By (Wu G.-S.) V 284
By (Wu M. T.) 1 428; Ill 141, 145
Вуд (Wood A.) 1 238
Вуд (Wood C.S.) Il 409
Вуд (Wood G. W.) 1 41; IV 178
Вуд (Wood H. В.) II 456; V 131
Вуд (Wood 11. C. S.) II 39, 388
Вуд („Wood J., Jr.) IV 203, 204
Вуд (Wood J. L.) ] 380, 435
Вуд (Wood К- H.) I 435
Вуд (Wood K. R.) V 196
Вуд (Wood M. F.) I 157, 165, 167, 168
Вуд (Wood S. E.) I 268
Вудберн (Woodburn H. M.) II 100, 167, 178
Вудвард (Woodward R. В.) I 86, 153, 159,
167, 214, 382, 425; II 27, 141; III 30, 47,
105, 107, 123, 149, 393, 394; IV 19, 20, 248,
250, 268; V 44, 524, 566
Вудкок (Woodcock S. J.) I 436
Вудруфф (Woodruff E. H.) I 54
Вудс (Woods G. F.) I 275
Вудс (Woods L, A.) V 122
Вудс (Woods L. L.) Ill 432, 434; V 460
Вулдридж (Wooldridge K. R.) I 413; IV 132
Вули (Woolly D. W.) II 71
Вуллетт (Woollett С. H.) II 41
Вулсей (Woolsey N. F.) I 169; III 241
Вулф (Wolf C. N.) II 404; III 70
Вулф (Wolf D.) II 392
Вулф (Wolf D. E.) HI 167
Вулф (Wolf F. J.) I 225; HI 240. 345
Вулфолк (Woolfolk E.O.) Il 162; III 392;
IV 29
Вулхаус (Woolhouse R. A.) Ill 344
Вульф (Wulff G.) V 105, 108
Вульфф (Wulff С.) I 110, 111
Вундерлих (Wunderlich K.) Hl 266
Вюнш (Wiinsch E.) II 22
Габбард (Gabbard R. B.) HI 92, 99
Габор (Gdbor V.) II 186; V 230, 527
Габриэль (Gabriel S.) Il 31, 430
Гавер (Gaver R.C.) V 77
Гавриленко В. В. II 362
Гагольскип (Gagolski J.) V 24
Гадески (Gadecki F. A.) Ill 401
Газдар (Gazdar M.) Hl 70
Газис (Gazis E.) Il 467; HI 395, 419
Гай (Gaj B. J.) Ill 396
Галат (Galat A.) I 121; И 66, 70
Галбрайт (Galbraith A. R.) II 228; V 21
Гале (Gale D. M.) Hl 242
Галлахер (Gallagher T. F.) I 125; Ij 25;
III 350, 354; IV 226
19 № 1994
577
Галлэ (Galiais F.) 11 203
Галтон (Gallon S. A.) I 392
Гамбле (Gamble E. L.) I Hi
Гамильтон (Hamilton F. H.) Ill 193; IV 226
Гамильтон (Hamilton R. W.) 11 414
Гаммет (Hammett L. P.) Il 31; III 302, 303,
319
Гангьюли (Ganguly А. Kd V 458
Ганеллин (GanelUn C. R.) HI 153; V 503
Ганем (Ganem В. E.) V 270, 39'3
Ганнон (Gannon W. F.) I 248; И 178; III 354;
IV 197
Гансон (Hanson E. R.) II 33
Гансон (Hanson H. T-) I 334
Ганстоп (Gunstone F. E>.) V 25o, 256
Ганте (Gante J.) V 155
Ганн (Hantzsch A.) II 39, 40
Ганчер (Gancher E.) V 124
Ганье (Gagneux A.) I 173, 305
Гарбич (Garbisch E. W.) I 82
Гарбрехт (Garbrecht W. I.) Ill 279, 280
Гарвуд (Garwood R. F.) Ц 231; ill 312;
V 270
Гарг (Garg С. P.) II 204; IV 179; V 535
Гард (Gard G.) V 241
Гардаи (Gardent J.) II 331
Гарден (Garden J. F.) II 281
Гарди (Gardi R.) Ill 40
Гардинер (Gardiner D.) V 376
Гарднер (Gardner D. M.) V 353
Гарднер (Gardner J, H.) II 97; IV 215
Гарднер (Gardner J. N.) V 238, 362, 469, 470
Гарднер (Gardner P. D.) I 156, 16S, 167, 201,
334, 338, 345; II 283, 285; III 137, 145,
392, 394, 449, 450; V 314, 315
Гарднер (Gardner T. S.) I 357
Гармез (Garmaise D, L.) Ill 354
Гарнер (Garner B. J.) I 335; IV 80
Гарнер (Garner R.) V 366
Гарнет (Garnett J. L) V 362
Гарратт (Garratt S.) I 428
Гарретт (Garrett E. R.) II 353; III 291
Гарретт (Garrett P. Jd V 275
Гаррис (Garris S. A.) 11 224, 374; HI 167;
IV 95, 102
Гаррисон (Garrison J.) I 370
Гаррисон (Garrison W. E., Jr.) II 261
Гарсиа (Garcia E. E.) I 95; III 262
Гарсиа (Garcia H.) Ill 99
Гарсиа-Муноз (Garcia-Munoz G.) Ill 172
Гарсиа-Шарп (Garcia-Sharp F. J.) V 124
Гарет (Garst J. F.) V 153, 316
ГаееК (Hasek W. Rd Ill 263
Гаул (Gaule A.) V 95
Гаскуань (Gascoigne J. Ad I 225
Гасман (Gassman P. G.) V, 281, 284, 316
Гастон (Gaston L, Kd Ill 187
Гати (Gati A.) Ill 344
Гатина (Gatica J.) II 414; IV 173
Гаттерманн (Gattermann L.) IV 188, 210, 226,
266; V 430
Гаудемар (Gaudemar Al.) IV 214
Гаудиаио (Gaudiano G.) 1 417; V 143
Гаудри (Gaudry R.) I 226, 413; ll 307; III 17,
19, 241; IV 72, 274
Гаффрон (Gaffron H.) Ill 283
Гацке (Gatzke A. L.) V 535
Гебелин (Gebelein C. G.) V 216
Гебель (Goebel P.) I 37, 38
Геберт (Gebert Wd Ill 118
Геган (Guegan R.) II 301
Гедке (Godke W.) Ill 243, 246
Гейбель (Gaibel, Z. L. F.) I 118
Гейгер (Geiger Kd III lai
Гейгер (Geiger U. P.) V 478
Гейер (Geyer U.) V 14
Гейлорд (Gaylord N. G.) II 170, 178; III 344
Гсйсслер (GeissIerG.) Ill 301
Гейстлнк (Geistlich P.) HI 183
Гейтж (Ghatge В, В.) II 163
Гейтс (Gates J. W., Jr.) 1 258; III 327; V 485
487, 500, 501
Гейффи (Gaiffe А.) 1П 166
Гелблум (Gelblum E.) I 271
Геллер (Geller H. H.) 1 275
Геллерт (Gellert H.-G.) Ill 376, 451
Гельферих (Gelferich В.) Il 252, 253; III 191
417, 419; IV, 14, 17, 59, 60; V 396, 478
ГенрИ (Henry Rd V 214
Генри (Henry R. A.) V 430
Генслер (Gensler W. Jd I 275, 276; III 301;
V 355
Георгес (Georges L. W.) II 421
Георгиан (Georgian V.) I 210
Гера (Ghera Ed I 159, 167; III 394; IV 151;
5"1 о о
Герберт (Herbert R. В.) V 334
Гергель (Gergel W. Cd И 71
Герзон (Gerzon Kd I 9; IV 151; V 9
Геринг (Goering H. LJ II 346; Hl 303
Герман Л. С. V 196
Германек (Hefmanek S. ) II 202
Германн (Germaim F. E, Ed IV 83
Геро (Gero S, D.) J 118, 275; IV 196
Герольд (Gerold С.) I 125; II 423; HI 256
Герр (Herr M. E.) Ill 8. 10, 106, 107, 126, 129
Герреро (Guerrero T. Jd II 46, 370; IV 95
Герсен (Geursen H. Sd V 377
Герсманн (Gersmann H. R.) I 167 366; III
394
Герстл (Gerstl Rd V 17|
Герхарт (Gerhart H. L.) I 33; III 296, 335
Герцберг (Hertzberg E. В.) V 359, 360
Герцберг-Минцли (Herzberg-Minzly Y.) V
530
Гершберг (Hershberg E. В.) 1 125 228 238;
II 14, 54, 59, 111, 137, [38, 141, 297’ 351,
353—355, 365, 421, 428; III 56, 1 18, 123,
124, 217, 240, 252, 256, 260; IV 118, 122,
151, 227, 235, 236, 240, 247; V 359. 360
Гершкович (Hershkowitz R.L.) III 415
Гершон (Gershon H.) Ill 99
Гёвеке (Gowecke S.) II 389; IV 7
Гёрлер (Gorier Kd Ш 276
Гёсл (Gosl R.) I 214
Гёстен (Glisten Н.) II 359
Гётлих (Gothlich Lj II 42Г III 413
Гёфт (Hoft Ed I 407; HI 124
Гжонка (Grzonka Zd V 193
Ги (Gee M.) U 281
Ги (Gee R, Dd V 260
Гианнотти (Giannotti Rd HI 56
Гиббс (Gibbs D, E.) Ill 394
Гибиан (Gibian H.) 1 422
Гибсон (Gibson G, Wd V 71
Гибсон (Gibson M.) V 554
Гигж (Glgg J.) V 126
Гигж (Gigg R.) I 334; V 126
Гиддингс (Giddings B.) HI 445
Гидли (GidleV G. С.) V 66. 67
Гиза (Giza C,’ Ad II 48; III 380; IV 6, 7
Гик (Gick H.) HI 302
Гил-Ab (Gil-Av Ed II 355
Гилани (Gilani S. S, H.) IV 47; V 303, 455,
456, 494
Гилберт (Gilbert Ad HI 67
Гилберт (Gilbert E. Cd V 223
Гилберт (Gilbert E. E.) U 250; V 229, 359
Гиллис (Gillis Bd Ш 295
Гиллис (Gillis B. Td I 15, 334; V 303, 493,
494
Гилман (Gilman H.) 1 95, 175, 229, 238, 396,
399, 432; II 139, 140, ]4I, 157, 195, 285,
357; HI 167, 396, 402; IV 49; V 122, 168
Гилман (Gilman N- Wd V 2/0, 393
Гилмонт (Giimont P.) I 111
57§
Гилмор (Gilmore W. F.) I 366
Гилон (Gilon С.) V 74
Гилпин (Gilpin J. R.) IV 138
Гилпин (Gilpin J. A.) V 233, 236
Гиледорф (Gilsdorf R. T.) II 179
Гилхэм (Gilbam P. T.) V 39/
Гильмона (Gniilemonat Ad III 248, 252, 256
Гинзбург (Ginsburg D.) [ 170, 173; IV 19, 20
Гинзбург Ю. И. V 550
Гинсберг (Hinsberg H. F.) П 41, 435
Гинсберг (Hinsberg О.) IV 41
Гиормани (Giormani V.) I 335
Гиринг (Geering E.J.) 1 392
Гиш (Gish D. I.) HI 321; [V 161
Гласс (Glass D. S.) I 166
Глейзер (Glazier E. R.) 11 241
Глейчер (Gleicher G. J.) V 18
Глена (Glenat R.) V 378
Гленн (Glenn T. H.) I 387
Гл neon (Gleason J. С.) V 82
Глинн (Glynn G. A.) V 327
Глоде (Gloede J.) IV 42; V 490
Глозауэр (Glosauer O-) II 82
Глоклинг (Glockliiig F.) IV 119
Глоттер (Glotter E.) V 536
Глур (Gloor U.) П 137
Глэвис (Glavis F. J.) V 208
Глэдстоун (Gladstone W, A. F.) V 261
Глэйз (Glaze W. H.) 1 184
Глзтгхард (Glatthard R.) I 373; IV 8
Гмюндер (Gmiinder J.) IV 21
Гнодж (Gnoj q.) IV 173; V 238, 470, 532
Гнюхтель (Gnflchtel A.) II 252
Гобл (Goble P. H.) V 310
Гог (Gouge M.) V 419
Гоган (Gaughan E. J.) I 414; II 241
Гоггнн (Goggin P.) Ill 431
Гогенлоэ-Орпнген (Hoheniohe-Oehringen K.)
I 181, 182
Года (Godat J.-P.) IV 30
Годефруа (Godefroi E. F.) I 275
Годин (Godin D.) I 413
Годино (Godinho L. S.l V 458
Годфри (Godfrey M.) V 191
Гозес (Ghosez L.) I 414; V 184, 272
Гокхейл (Gokhale S. D.) V 506, 507
Голд (Gold A. N.) V 113
Голд (Gold A. M,) III 240
Голд (Gold H.) Ill 461
Голд (Gold M, H-) I 390; III 444
Голдберг (Goldberg J, H.) 1 365
Голдберг (Goldberg I'd. W.) Ill 189, 190, 347
Голдблатт (Goldblatt L. A.) IV 165
Голдман (Goldman I.M.) V 263, 270
Голдман (Goldman L.) 1 329, 335; III 367;
V 130, 133
Голд.иан (Goldman N. L.) Il 153
Голдырсв Л. H. I 121
Голлемап (Holleman A. F.) II 369; HI 67
Голт (Gault H.) I 125
Голубев В. A. V 155
Голфаер (Golfier М.) V 390
Голь (Ganle А.) V 95
Гольдкамп (Goklkamp А. Н.) I 436
Гольдмахер (Goldmacher J. Е.) I 214; HI 146
Гольдфарб (Goldfarb A. R.) 11 276
Гольдфарб (Goldfarb Ya. L.) II 357
Гольдфранк (Goldfrank М.) 1 17, 18
Голъдшмид (Goldschmid Н. R.) Ill 240
Гольдшмидт (Goldschmidt St.) I 396- Il 90
97, 421
Гольдштейн (Goldstein A.) II 230, 235
Гольдштейн (Goldstein .1. FI.) I 81
Гомолка (Homolka В.) I 223, 224
Гомппер (Gompper RJ II 30; IV 74, 76
Гонзалез (Gonsalez D.) II 226
Тонне (Gonis G.) IV 143; V 243, 5[8
Гонтарев Б. А, П 188
Гопал (Gopal H.) V 384
Гор (Gore I, Y.) II 78, 80
Гор (Gore P. H.) Il 39, 237; IV 228
Гордон (Gordon J. T.) Il 39
Гордом (Gordon M.) II 71
Гордон (Gordon M- E.) Ill 387
Гортлер (Gortler L. В.) V 316
Горун (Gorup В.) IV 268
Госден (Gosden A.) II 440
Госселинк (Gosselink E. P.) V 416
Гот (Godt H. C., Jr.) 1П 296, 468
Готечи (Gautechi F.) V 429
Гото (Goto T.) II 339, 342, 381* IV 151, 227,
260 — 262; V 211
Готтарди (Gottardi \V.) V 104
Готтлиб (Gottlieb H. B.) Ill 416
Готтфрид (Gottfried S.) I 309; III 351, 354
Готтштейн (Gottstein W. J.) I 240; V 367, 368
Готфредсен (Gotfredsen W. O.) Ill 422
Готье Gautier Ad IV 44
Готье (Gauthier J.) V 40
Гоуер (Gower L. H.) Ill 394
Гоулд (Gould D.) 1 77, 126, 127; II 421
Гоулд (Gould D. H.) V 360
Гоулд (Gould D. E.) V 457
Гоулд (Gould F, E.) Il 290; III 157, 166
Гофман (Hofmann F. W.) Ill 466, 468
Гофманн (Hofmann A.) I 352, 382; Il 83; IV 76
Гофманн (Hofmann A. W.) II 297; Ijj 40;
IV 44
Гофманн (Hofmann J. E.) I 167, 195, 334,
345; II 311
Гофманн (Hoffmann F. W.) V 302
Гофманн (Hofmann К.) I 93, 177; IV 5, 6
Гофманн (Hofmann R. A.) Ill 41, 46
Гоффман (Hoffman A. S.) HI 420
Гоффман (Hoffman E. J.) V 359
Гоффман (Hoffman F.) I 178; IV 72
Гоффман (Hoffman J.) ill 67
Гоффман (Hoffmann R, W.) 1 108; IV 29;
V 71, 413
Гоффманн (Hoffmann A. R.) I 271, 366*
II 285
Гоффманн (Hoffmann E.) IV 116
Гоффманн (Hoffmann H.) HI 374, 407, 412,415
Гоффманн (Hoffmann H. M. R.) Щ 355;
V 421
Гоффманн (Hoffmann P.) V 473
Гоффманн (Hoffmann W.) II 202
Гоффмейстер (Hoifmeisler H.) H 44
Гофштейп (Gofstein R.) Ill 302
Гохин (Goheen D. W.) Il 257, 262
Гош (Ghosh P. В.) Il 362; V 317
Гошорн (Goshorn R, H.) IV 94; V 146
Граббс (Grubbs E, J.) I 248
Грабер (Graber R. P.) II 230
Грабовяч (Grabowich P.) Ill 53
Гранен (Graven M.) I 413
Гравер (Graser F.) II 456
Грайм (Grime R.) II 421
Грамэн (Gramain J .-С.) V 250
Грандберг И. И. I 309
Гранди (Grundy J.) I 20, 24
Гранито (Granito С.} V 205
Грановнч (Granowltz S.) IV 226
Грант (Grant F, W.) П 97
Грант (Grant L. R.) Ill 115, 118, 119
Грант (Grant M. S.) I 380
Грэнтхэм (Grantham R. К.) V 328
Грас (Gras M. A. M- P.) I 15
Грасела (Gracela R.) HI 118
Грасселли (Grasselli P.) Ц 388: V 293
Грассманн (Grassmann W.) Ill 129
Грассхофф (Grasshoff H. J.) Ц 202
Граф (Graf R.) IV 156; V 521, 322
Графен (Grafen P.) Ill 10
Гребе (Graebe С.) II, 88, 97, 428; Ш 202
205; IV 24
19*
579
Гребер (Greber G.) V 442
Гребке (Groebke W.) Ill 184
Греве (Grewe F.) Ill 22
Грене (Grewe R.) I 167; П 385, 388; IИ 19;
IV 196
Грегори (Gregory G. I.) V 222
Грегори (Gregory H.) II 468; III 449
Греземковскшй (Grezemkovsky R.) I 413, 433
Грей (Gray A. P.) Ill 145
Трей (Gray A. R.) II 324, 326; III 256
Грей (Gray D.) V 393
Грей (Gray S. L.) V 310
Грей (Gray S.) I 175
Грейвилл (Graybill B.M.) V 365
Грейвс (Graves J. M. H.) I 166, 334
Грейг (Greig C. G.) IV 160
Греко (Greco С. С.) V 326
Греко (Greco С- V.) Ill 262; V 99
Греида (Grenda W. J.) IV 154
Грениг (Greening T.) II 237
Гренон (Grenon B. J.) V 327
Гретш (Groisch H.) Ill 148
Грешам (Gresham T. L.) Il 129; III 149, 150
Грёнваль (Gronwall S.) I 90, 98, 100, 285,
286; Il 346
Гриббл (Gribble G. W.) V 554
Гривски (Grlvsky E. M.) I 210
Грижа (Grigat E.) V 502
Грим (Grim S. O.) Ill 412
Грнмвуд (Grimwood В. H.) V 216
Гримм (Grimm D.) Il 420
Гриммин (Grrmmin W. R. С.) П 70
Грнмпюу (Grimshaw J.) V 377, 378
Грин (Green A. G.) II 407, 400
Грин (Green В.) I 268; II 185; V 232, 306, 345
Грин (Green G. F. H.) II 99, 114
Грин (Green J. W.) II 52; III 187
Грин (Green M.) Ill 436
Грин (Green M, J.) V 311
Грин (Green F. D.) V 313, 314
Гринаф (Greenough W. B., Ill) II 119
Гринвальд (Greenwald R.) I 344, 416, 417;
111 412
Гринвуд (Greenwood F. L.) I JOO; III 10
Грини (Greene F. D.) I 168, 188, 427; V 432
Гринли (Greenlee R. В.) V 66
Грипспаи (Greenspan F. P.) 11 100; III 56
Гринфильд (Greenfield H.) I 289, 291
Гринфильд (Gregnfield S.) V 536
Гринхалф (Greenhalgh R.) 11 70
Грииштейн (Greenstein J. P.) IV 165
Гриньяр (Grignard V.) I 238
Грир (Greer F.) II 264, 265
Грисволд (Griswold P- H.) Ill 194
Грисли (Grisley D. W.) Ill 412; V 239
Триггер (Gritter R. L.) II 220, 226
Гриффин (Griffin С. E.) П 71; III 230
Гриффин (Griffin R. W., Jr.) II 307
Гришин Ю. К. V 546
Гроб (Grob С. A.) I 170, 173, 305; II 142, 150
368, 370; III 223, 224, 230, 240, 241; IV 135
163, 165, 236
Гровер (Grover P. К.) I 413; П 355; III 166;
IV 90, 210
Гровснштейн (Grovenstein E., Jr.) Ill 241
Грос (Gros E. G.) V 95
Грос (Gros S. К.) V 320
Гросс (Gross E.) 1 140, 141; II 62; III 285
Гросс (Gross В. E.) Ill 260
Гросс (Gross F, J.) V 456
Гросс (Gross H.) I 407; III 39, 124; IV 42;
V 74, 185, 405, 490, 491
Гросс (Gross N.) IV 98
Гроссе (Grosse A. V-) II 111, 112
Гроссман (Grossman J.) II 25, 61
Гроссман (Grossman L. I.) Ill 412
Гроте (Grote A., von) II 136
Грубер (Gruber R. J,) III 261
Грубер (Gruber W.) Ш 126
Груммнт (Grummlt O.) Ill 56, 311; IV 52,
72. 209, 227; V 402
ГрунД (Grund G.) Ill 184
Грундсманп (Grundemann E.) I 147; III 67
Грундкс-Шрот (Grundke'Schroth G.) HI
101
Грундмацн (Grundmann С.) I 183, 250; III
107, 390, 467, 468; V 49, 322
Грундон (Grundon M. F.) I 166, 168, 209
Грунсвальд (Grunewald G. L.) I 419; ill 125
Грунце (Grunze H.) Ill 126; V 360, 361
Грузи (Gruen H.) II 393, 400
Груэнхут (Grueiihiit N. S.) 1 18
Грэйвз (Graves J. M. H.) V 35
Грэм (Gram H. F.) II 455
Грэнат (Granath K- A.) Ill 285
Грэсли (Grasley M. H.) IV 237
Грэхэм (Graham C. L.) I 97
Грэхэм (Graham J. H.) HI 118, 119
Грэхэм (Graham J, R.) I 73
Грэхэм (Graham S. H.) V 327, 328, 353
Грэхэм (Graham W. H.) I 402, 403, 405;
V 170
Грюсснер (Griissner W. S.) Il 235
Гуа (Guha P. С.) V 95
Губерт (Hubert A. J.) V 153
Губин (Gubisch N.) I 210
Гудвин (Goodwin S.) II 187; III 226, 240
Гудвин (Goodwin T. W.) II 85, 97, 226
Гудлетт (Goodiett V.W.) V 461
Гудлицкий (Hudlicky M.) I 85
Гудмен (Goodman L.) I 102, 306; HI 434;
V 460
Гудмен (Goodman M.) I 305. 427; V 208
Гудмен (Goodman M. M.) II 427; V 326
Гудчайлд (Goodchild J.) V 41
Гузен (Goosen A.) I 169
Гузнк (Guzik H.) Ill 167
Гулати (Gulati R. С.) IV 209
Гулланд (Gulland J. M.) Ц 281
Гупар В.И. V 372
Гуншер (Grinsher J.) V 338
Гунтер (Gunsher J. A.) II 470
Гупта (Gupta D. N.) V 320
Гупта (Gupta P.) Г 306
Гурвич (Hurwitz В, M.) 11 409
Гурвич (Hurwitz M. D.) V 505
Гуревич А. И. I 344
Густафсон (Gustafson D. H.) V 80
Гутарсль (Goutarel H.) V 80, 81
Гут (Gut M.) V 540
Гутенштейн (Gutenstein M.) IV 81; V 464
Гутманн (Gutmann H.) Ц 118
Гутманн (Gutmann H. R.) Ill 68
Гутовский (Gntowsky H. S.) Il 97; V 226
Гутселл (Gutsell E. S.) I 176
Гуттманн (Guttmanu St.) II 23z; HI 434; IV
266
Гутше (Gutsche C. D.) I 110, 248; II 141,
416, 420; IV 165, 179; V 277, 278
Гуцвиллер (Gutzwiiler J.) V 449, 451, 454
Гхатак (Ghatak U. R.) II 185
Гэдсбн (Gadsby В.) V 361, 362
Гэй (Gay R. L.) V 71
Гьюзли (Gujseley К- В.) V 398, 399
Гэйтс (Gates M ) I 167, 200, 209, 375, 376"
II 8, 11, 458
Гэнстон (Gunstone F. D.) II 245; III 92 269
271; IV 20; V 39, 40. 479, 480
Гэсс (Gass J. D.) II .307
Гэссмен (Gassman P. G.) I 15 162, 168; II
155; III 87, 9l; IV 126; V 64, 66, 136, 143,
151
Гэш (Gash V. W.) Ill 184
Гюин (Guynn R.) [I 46
Гюйо (Guyot A.) I 390
Гюнтер (Gunther W. H.) II 179
580
Гюнтер (Gunter F.) 1 412
Гюнтер (Giitither D.) I 311, 313
Гюнтер (Gunther P.) Hl 316, 318
Гютри (Guthrie J. D.) IV 81
Дабек (Dubeck M.) V 520
Д’Адамо (D'Adamo A. F., Jr.) II 456
Дадли (Dudley F. В.) V 183, 241
Дадли (Dudley К. H.) V 49
ДаЦан (Dayan J. E.) I 226
Дайсон (Dyson G. M.) и 430
Дайсон (Dyson N. Id.) V 174
Даком (Ducom J.) V 78, 80
Даллас (Dallas M.. S. J.) Ill 271
Дальтон (Dalton D. R.) V 48, 49, 127
Дам (Dahm К. Id.) V 119
дамл (Damle S. В.) II 141
Дамодаран (Damodaran N-P.) II 271
Дамрауср (Damrauer R.) IV 56; V 500
Дамшродер (Damschroder R. E.) II 421; IV 4[
Д’Ан (d’Ans J.) П 129
Д’Анжели (D Angeli F.) I 286, 335
Даниели (Daniell N.) Ill 256; IV 274; V 386
Данихер (Daniher F. A.) V 397
Данишевский (Danishefsky S.) II 226; V
149, 270
Даниэльс (Daniels P. J. L.) IV 175
Даниэльс (Daniels R.) I 256; II 225, 227;
III 84; IV 250
Данн (Dann О.) II 81, 83
Данненберг (Dannenberg H.) IV 128, 130
Дании (Duntiy S.) I 210
Дане (Dance J.) I 419; V 191
Дар (Dhar D. N.) V 416
Дарби (Darby W. J.) II 232; IV 72
Дарзан (Darzens G.) I 66; III 307, 308, 319,
335
Дарлинг (Darling S, D.) II 153; V 433, 446,
447-
Дархэм (Durham L. JJ III 335, 457; V 39/
Дас Гупта (Das Gupta А. К.) V 232, 343, 468
Д’Асколи (D’Ascoli R.) HI 99
Даслер (Dasler W.) I 377
Датта (Datta A. P.) II 120, 121
Даубен (Dauben H. J,, Jr.) I 124, 137; II 300,
420, 461; 111 158, 166, 399, 401; IV 200,
246, 248; V 381
Даубен (Danben W. G.) I 275; Il 183, 452,
453; 111 288, 290; V 152, 369, 360, 429
Дауд (Dowd D.) II 178
Дауд (Dowd J. E.) V 206
Дауд (Dowd P.) I 396
Дауд (Dowd S. R.) IV 56
Даултон (Daulton A. 1.) II 442
дауни (Downie I. M.) Ill 416; V 361, 456
Даурти (Dougherty G.) II 236
Даусон (Dawson C. R.) 11 55, 357
Даусон (Dawson D. J.) V 452, 454
Даусон (Dawson N. D.) V 199
Даут (Daudt W. Id.) HI 241
Даути (Doughty J, В.) IV 264
Даум (Daum S. J.) V 566
Дафф (Duff J. С.) I 192, 193
Дафф (Duff J. M.) V 163
Дафф (Duff R. B.) Ill 283
Дволайтский (Dvolaitsky M.) IV 57, 258
Двонч (Dyonch W.) Ill 457
Дворкен (Dvorken L. V.) V 230
Дворник (Dvornik K. D.) Ill 89, 92
Де Ат (De Alh G. С.) I 28
Де Пелдер (De Beider A, N.) V 320
Дебель (Doebel K. J.) Ill 189, 100
Де Бельмон (De Bellmont E. G.) IV 277
Де Еенвиль (De Benneville P. L,) Il 316
Де Боер (De Boer C. D.) V 111, 112
Де Борже (De Borger L.) И Ц; V 544
Дев (Dev S.) Ill 271
Дев (Dev V.) I 193
де Вааль (de Waal W.) V 199
Де Валд (De Wald H. A.) Ill 434
Девапрабхакара (Devaprabhakara D.) I 166,
334; V 299, 315
Де Винтер (De Winter M.) HI, 256
Де Вита (De Vita С.) IV 11
Де Витт (De Witt E. J.) HI 371
де Bpaiia (de Vries G.) V 240
Дсгснги (Deghenghi R.) 1 218; II 25; III 17,
19; IV 274
Де Грот (de Groot Ae.) V 382, 384
ДеД?керипг (Degering E. F.) IV 94
Дсзиредж (Deatherage F. E.) I 66; ц 11;
HI 24
Дезэ (Desai N. В.) I 416; III 390, 468; v 99,
239
Дезэ (Desai R. D.) IV 29
Депхлер (Deichler Clir.) I 120, 121
Дек (Deck H. R.) II 204
Де Камп (De Camp V.) II 41
Декер (Decker С. A.) 1 427
Деккер (Dekker С. A.) IV 151
Де ла Map (De la Mare B. D.) V 404, 405
Делбаер (Delbaere P.) Ill 295
Делении (Deleplne M.) I 190, 193
Делиа (Delia T. J.) IV 143
Де Лир (de Leer E. W. В.) V 222
Делла (Della E. W.) V 388
Деллинжер (Dellinger M. H.) V 29
Делофе (Dculofeu V.) II 46, 370; IV 95
Делпьер (Delpierre G. R.) I 387
Делфин (Delfin J.) 1 433
Дельмоите (Delmonte D. W.) II 183
ДеЛэч (DeLaitsch D. M.) I 275
Демекер (Demaecker J.) Ill, 28, 30
Демерсман (Demerseman P.) V 360
Демерсон (Demerson С.) V 344
Деминг (Deming P. Id.) Ill 77
Демлов (Dchmiov E. V.) IV 272
ДеМотт (DeMott D, N.) HI 313
Демут (Demuth E.) I 393, 394; II 8
Дсиекас (Denekas M. O.) Ill 107
ДеНет (DeNet R. W.) I 350
Денкевальтер (Denkewalter R. G.) V 27
Денлер (Dennler E. В.) V 365
Денни (Denney D, В.) I 168; II 118, 346;
III 374; IV 143; V 349, 456
Денни (Denney D. Z.) II 345, 346
Денни (Denney R. С.) HI 137, 145; V 251
Деннинг (Denning G. S., Jr.) И 119, 468
Депо (Deno N. C.) Ill 341; IV 119
Денот (Denot E.) I 126; II 193; Hi 241,
243, 256
Дент (Dent W. T.) V 174
Дентон (Denton D. A.) HI 145
Денун (Denoon С. E., Jr.) I 75, 112; II 230
Ден Хертог (Den Hertog Id.) Ill 431
Деора (Deorha D. S.) I 306
Де Памфилис (De Pamphilis M. L.) Ц 71
Де Пюи (De Puy С. H.) I 83; II 74, 135, 136,
285; III 356, 357, 360; V 175, 186, 421
Дербишир (Derbyshire D. H.) Ill 277
Деринг (Doering W. E., von) I 24, 79, 158,
167, 175; II 282, 285, 347, 350; Щ 204,
205, 356, 357; IV 25, 29; V 127. 134, 276,
278, 314, 378, 398, 399, 546
Дерк (Docrk E.) II 443
Дермер (Dermer О- С.) V 204
Дерст (Dufst T.) V 286
Дсртузо (Dertonzos H.) V 436
Дерш (Dersch F.) Ill 399
Дершовиц (Dershowitz S.) Ill 390, 412
Дсслонгчампс (Deslongchamps P.) V 40
Dcccay (Dessau R. M.)’V 262
Десси (Dessy R. E.)I 273; II 80, Sir III 6, 10;
V 68. 71, 373
58V
Де Тар (De Tar D. F.) П1 366, 457; V 337,
418, 419, 464, 472, 473, 523
Детерманн (Determann H.) I 177; ][ 456
Детр (Detre G.) V 429
Деферрарп (Deferrari J. О,) V 95
Дефлорин (Deflorin A. M.) II 106
Джадж (Judge J. M.) Ill 456, 457
Джакер (Jucker E.) I 40; II 391; III 78
Джакоббе (Giacobbe T. J.) V 407
Джансен (Jansen А. В. A.) Il 97, 179, 225,
227
Джансен (Jansen A. P.) I 367
Джансен (Jansen J.E.) II 129; III 149, 150
Джанссен (Janssen D. E.) И 38; III 434, 435
Джаст (Just G.) 1П 14, 18
Джейги (Jaeggi R.) V 183
Джеймс (James D. S.) V 28
Джеймс James L. В.) I 301
Джеймс (James F. L.) Ill 354
Джеймс (James P. N.) I 360; II 83
Джекмен (Jackman L. M.) I 407, 412, 413;
IV 129, 132; V 270
Джекмен (Jackman MJ III 149
Джекнов (Jacknow В, В.) 1 173
Джекобс (Jacobs P. M.) V 301
Джексон (Jackson A.) I 275
Джексон (Jackson A. H.) II 106, 274; V 101,
102
Джексон (Jackson B. G.) II 153
Джексон (Jackson C. L.) 1V 132
Джексон (Jackson E. L.) II 52
Джексон (Jackson H. L.) Ill 278
Джексон (Jackson R. W.) Ill 99; V 386,
555
Джексон (Jackson R.) II 129
Джексон (Jackson W, J., Jr.) V 46
Джексон (Jackson W, R.) II 293; V 301
Джелинек (Jellinek G.) II 83
Джелинек (Jellinek E.) V 18
Джемисон (Jamieson I. M.) V 504
Джемисон (Jamison J. D.) Щ 145
Джемисон (Jamison R. W.) V 280
Дженкинс (Jenkins G. L.) Ill 40
Дженкинс (Jenkins R. L.) IV 72, 104, 109
Дженкинсон (Jenkinson D. S.) Ill 260
Дженнер (Jenner E. L.) Ш 83, 132, 145; V
368
Джеоджеган (Geoghegan P., Jr.) V 372
Джерасси (Djerassi С.) I 58, 74, 86, 13'7, 147,
160, 173, 186, 210; 11 23, 25 27, 38, 39,
60, 91, 111, 114, 202, 248, 301, 316, 414;
III 89, 92, 115, 120, 123, 164, 167, 198,
201, 256; IV 151, 173,176, 178, 226; V 77,
320, 449, 451, 454
Джерина (Jerina D. M.) V 19
Джерусси (Jerussi R. A.) Ill 78
Джеффери (Jeffery В. A.) V 334
Джефферис (Jefferies P. R.) IV 19, 20
Джеффорд (Jefford C. W.) Il 470; V 338
Джешкейт (Jeschkeet H.) IV 162
Джёрд (Jurd L.) Il 38
Джиллеспи (Gillespie H. В.) I 2 23; II 46'
IV 95
Джиллеспи (Gillespie R. J.) IV 119; V 512
Джиллис (Gillis R. G.) IV 248
Джобин (Jobin R. A.) V 211
Джобсон (Jobson. R. В J V 44, 205
Джозеф (Joseph J. P.) V 520
Джой (Joye N, M., Jr.) V 123, 355
Джойс (Joyce R. J.) I 435
Джолад (Jolad S. DJ IV 72
Джолли (Jolly W. L.) V 506, 507
Джон (John E. V, О.) IV 70
Джонас (Jonas D. H.) V 353
Джонс (Jones B. D.) V 294
Джонс (Jones D.) V 127
Джонс (Jones D. H.) V 353
Джонс (Jones D, G.) V 49
Джонс (Jones D. M-) I 429, 430; V 333
Джонс (Jones D. N.) Ill 240; V 311
Джонс (Jones D, S.) Ill 388
Джонс (Jones D. W.) I 167
Джонс (Jones E.) Ill 240
Джонс (Jones E. R. H.) I 41, 59, 60, 66, 78,
238, 253; II 109, 176, 179, 222, 226, 227
302, 439, 436; III 339, IV 51, 151, 176, 178
235, 268, 272; V 21, 249, 250, 333, 535 ’
Джонс (Jones G.) V 15, 258
Джонс (Jones G. H.) V 131, 168
Джонс (Jones J. В.) V 130, 131
Джонс (Jones J. E.) II 297; IV 90
Джонс (Jones J. H.) Ill 21
Джонс (Jones J. K. N.) Ill 201, 360; V 214,
405
Джонс (Jones J. R.) V 293
Джонс (Jones KJ V 114
Джонс (Jones P. F.) V 163
Джонс (Jones P. G.) Il 414; IV 151
Джойс (Johns R. В.) I 252
Джонс (Jones R. E.) I 125; II 97
Джонс (Jones R.G.) I 175, 224, 275; Il 141;
III 76, 123; IV 41, 49; V 122
Джонс (Jones V. К..) I 101; III 373
Джонс (Jones W- A.) Ill 92
Джонс (Jones W, E.) I 82; 111 339
Джонс (Johns W. F.) 1 167; III 366; IV 272-
V 19, 35, 357
Джонс (Jones W. J.) I 335; II 96, 97; III
355
271,
Джонс (Jones W. M.) I 387; П 383, 388'
111 379; IV 237
Джонсон (Johnson A- P.) I 327, 335
Джонсон (Johnson A. W.) I 252, 253; II 106;
IV 274
Джонсон (Johnson B. J.) Ill 56; V 301
Джонсон (Johnson C. D.) I 372; V 124
Джонсон (Johnson C. R.) I 23, 24, 174; IH 86
91; V 351—353
Джонсон (Johnson D.) Ill 187
Д?консон (Johnson D. L.) IV 266
Джонсон (Johnson F. В.) V 230, 231
Джонсон (Johnson G. D.) Ill 32
Джонсон (Johnson G. S.) II 290; III 157
160, 167
Джонсон (Johnson H. E.) II 420; III 328; IV
165
Джонсон (Johnson H- L.) IV 123
Джонсон (Johnson PE W.) V 503
Джонсон (Johnson EL W., Jr.) I 134, 335;
III 153
Джонсон (Johnson J. E.) II 169, 176, 178
Джонсон (Johnson J. L.) Щ 8, 10, 107
Джонсон (Johnson J. M.) II 227
Джонсон (Johnson J. R.) I 37, 53, 221, 262,
268, 285; II 54, 215, 216, 409; III 32; IV
31, 13
Джонсон (Johnson R. С.) I 126
Джонсон (Johnson T. F. N.) Ill 21
Джонсон (Johnson W- S.) I 96, 123, 124, 150,
166, 167, 248, 425, 427; Il 22, 73, 74, 205,
217, 268, 273, 332, 335, 376, 380, 394, 400;
III 9, 10, 46, 88, 92, 118, 119, 195-197,
295, 302, 303, 351, 354, 362, 366; IV 21,
57, 90, 166, 170, 179, 213, 250, 258, 278‘
V 283, li84, 310, 327, 380, 384, 507, 508,
547, 548
Джонсон (Johnson W. W.) 11 41
Джонстон (Johnston D. B. R.) I 79; V 628
Джонстон. (Johnston F.) I 83
Джонстон (Johnston H. W.) IV 80, 160
Джонстон (Johnston J. D.) Ц 414
Джонстон (Johnston R. В.) V 113
Джонстоун (Johnstone H. F.) Ill 193
Джордаан (Jordaan J. H.) II 456
Джордан (Jordan E, F., Jr.) Il 81; III 24, 189
Джордан (Jourdan F,) IV 36
582
Джордж (George М. V.) V 263, 270
Джоси (Josey A. DJ Ill 145; V 151
Джоши (Joshi В. SJ I 188; II 106
Джоши (Joshi В. NJ V 246
Джуенге (Juenge E. CJ I 183, 184; V 461
Джулиан (Julian P, L.) IV 173
Джулиано (Juliano E, (J,) V 156
Джулиано (Juliano P. CJ HI 448
Джунгникель (Jungnickel J. LJ IV 62
Джуо (Juo C. ID Ill 344
Джус (Joos WJ Il 227
Джуэл (Jewell J, SJ V 133, 374, 376
Дзнмиан (Dziemian R, LJ Ill 145
Диамацти (Diamanti J.) V 164
Диапер (Diaper D. G, MJ 11 384, 388; V 535,
543
Дибел (Deebel G. FJ II 256
Дивли (Diveley W. RJ I 364
ДнГиоргио (DeGiorgio J. В J II 226
Дикель (Dickel G, В.) III 24, 67
Дикерхуф (Dickerhoof D. Wj IV 237
Дикин (Deakin SJ I 83
Дикинсон (Dickinson C, LJ II 326; III 318;
IV 258
Дикки (Dickey J, BJ III 30, 326; III 23, 25,
262, 32 7; IV 95
Дикман (Diekman JJ V 56, 77, 125, 349
Дикон (Deacon B, Dj IV 41
Днкопп (Dickopp Hj III 385
Дикс (Dix D. TJ I 195
Диксит (Dixit S. jMJ V 381
Диксон (Dickson I, EJ V 431
Диксон (Dixon J. A J II 406, 409
Диксон (Dixon J. RJ V 353
Диксон (Dixon J. SJ 1 141
Диларис (DiJaris I.) I 367
Диллон (Dillon T, EJ I 111
Диль (Diehl HJ III 256; IV 111; V 544
Диль (Diehl H.WJ II 100; 111 84; V 131
Диль (Diehl J.) I 397
Диль (Diehl J, FJ I 427
Дильген (Dilgeii) V 120
Дильс (Diels OJ I 15, 221; III 243, 244, 246,
463; IV 11, 23
Дильтей (Dilthey WJ I 299; HI 310, 311;
IV 59
ДиманТ (Dimant EJ HI 19
Диммиг (Dimming^ D. AJ III 107
Димрот (Dimroth I<J V 227, 228
Димрот (Dimrolh OJ I 118, 121; III 209,
210, 212, 216, 239, 242, 243; IV 28, 29
Дин (Dean E, W.) II 197
Дин (Dean F. HJ HI 98, 99; V 44
Дин (Dean F. MJ Щ 198, 20i; V 41
Дин (Dean J. Mj V 49, 322
Дин (Dean P. D. GJ II 199
Дин (Dean R. EJ Ш 53
Дина (Deana A, AJ IV 49
Дина (Deana A. HJ 1 390
Динвидди (Dinwiddle J,G., Jr J II 273
Динеер (Dincer DJ I 363
Динсмор (Dinsmore RJ IV Hl
Динулеску (Dlnulescu 1.) V 190
Дир (Diehr H. J.) Щ 374; IV 156
Дир (Dear R. EJ 1 81; II 152, 153; 111 246
Дир (Dear R. E, AJ V 69, 71, 229
Дирксен (Dirksen H. WJ Hl 307
Дитмар (Dithmar 1<J III 183
Дитрих (Dietrich Pj IV 275
Дитрих (Dietrich RJ III 360
Дите (Deets G. LJ V 358
Диттманн (Dittmann W. DJ III 78
Дитц (Dietz K, NJ V 226
Дитц (Dietz RJ V 42
Дитше (Dietsche W. Hj Ш 313
Дишарт (Dishart K, JJ III 482
Днзр (Dyer J. RJ I 329, 335
Доб (Daub G. HJ 1 166; II 74, 394, 400; IV
278
Добинсон (Dobinson FJ V 124
Добринер (Dobriner KJ II 25
Добсон (Dobson T, AJ V 270
Лопало (Dowalo F.) V 286
Довелл (Dovell F. SJ ill 132
Доганж (Doganges P. TJ III 201
Доггарт (Doggart J, RJ II 421
додж (Dodge R, AJ II 374
Додсон (Dodson R. MJ I 210; 11 241; III 340;
IV 65, 122, 130; V 357
Доерр (Doerr I. LJ I 94
Дойел (Deuel HJ I 31, 368; II 125
Дойль (Doyle M. PJ V 308
Дойль (Doyle T. WJ I 134; V 222, 223, 516
Дойфоуд (Doifode K- BJ П 240, 241
Докинс (Dawkins C. W. CJ IV 61
Докнер (Doekner TJ 1 75
Докс (Dox AJ I 16
Долби (Dolby L. J.) V 554
Долбьер (Dolbier \V. R., Jr.) V 462
Долински (Dolinski R. JJ Ц 108, 109
Долл (Doll LJ IV 81
Доллакер (Dallacker F.) IV 90
Домашне (Domaschke LJ V 186
Домингес (Dominguez X. AJ III 157, 166;
IV 226
Доминианни (Dominianni) V 510
Дональдсон (Donaldson M, MJ V 9, 18
Донахо (Donahoe H. BJ II 326
Донливи (Donleavy J, JJ 11 ^27
Дорнфельд (Dornfeld C. AJ III 39
Дорофсенко Г. H. IV 151
Дорсэй (Dorsay J. EJ V 519
Дорфман (Dorfman L.) I 137
Дорфман (Dorfman RJ Ц 330
Дорфман (Dorfman R. IJ V 540
Дорш (Dorsch H.-Lj V 391, 393
Досон (Dawson R. LJ III 290
Досон (Dawson WJ III 102
Доубенко P. IV 154
Доук (Doak G. OJ V 27
Доукас (Doukas H. MJ II 180, 183
Доути (DoutyC. FJ Ill 303, 306''
Дохерти (Doherty D. CJ III 172
Дохетл (Daughhetie P. H., Jr J I 335
Драго (Drago R, JJ IV 126
Драго (Drago R. SJ IV 126
Драйден (Dryden H. L,, Jrj 1 110, 227; II 156
Дракри (Druckrey EJ V 504, 505
ДраховЦаль (Drahowzal Fj HI 268, 271
Дрегер (Dreger L. HJ I 427; III 354
Дреджер (Dreger E. EJ J 141; II 234; HI 12,
39; IV 233
Дрезднер (Dresdner R. DJ V 353
Дрейдинг (Dreiding A. SJ I 174; V 226
Дректер (Drekter I. J J III 283
Дресслер (Dressier R. LJ HI 241
Дрефаль (Drefahl GJ I 21, 24, 345; JI 44,
203, 276
Дрёге (Droge HJ HI 141
Дризен (Driesen H.-EJ I 345
Дрис (Drees FJ I 75
Дрисколл (Driscoll J, SJ V 239
Дрншель (Drischel Wj I 417
Дросте (Droste WJ V 1/7
Друммонд (Drummond G. J J I 421
Дрэйк (Drake G. L,, Jrj IV 264
Дрэйк (Drake H. A J I 126
Дрэйк (Drake N, L.) III 271; IV 22
Дрэйл (Drake S, SJ V 482
Дрэйк (Drake W. V.) П 41
Дрю (Drew H. DJ I 68
Дуглас (Douglas D. EJ IV 167
Дуглас '(Douglas G. HJ V 35
Дуглас (Douglas L, J J V 289
Дугласс (Douglass I. В.) I 100; V 286
583
Дугласс (Douglass J. P.) 1 376
Дук (Duck E, W.) HI 324
Дулелко В. И. IV 131
Дули (Dooley J. F.) V 498, 500
Дулптгл (Doolittle R. E.) II 70
Дулл (Dull M. F.) 11 238
Дулов (Dillow R.) j 268
Дункан (Duncan \V, G.) 1 404; V 164, 174
301
Дункельманн (Dunkeimann Z.) V 370
Дункер (Drunker P. M.) 11 110
Дуни (Dunn G, E.) 11 157
Дуин (Dunn G. L.) V 300
Дунн [fliinii J, T.) II 430
Дунненберген (Dunnenbergen M.) II 14
ДуннИган (Dunnigan D. A.) 1 350
Дуракян (Doorakian G. A.) Ill 121, 123
Дуренбос (Doorenbos N. L.) 1 428; III 141,
145
Дурнбос (Doorubos T.) Il 302
Дусберг (Duisberg С.) П 70; V 511
Дутга (Dutta P, С.) II 265, 266
Дутчер (Dutcher J. D.) I 37; 1V 160
Душа (Dusza J, P.) V 520
Дьеруп (Deyrup A, J.) II 31
Дьеруп (Deyrup J, A.) I 416, 417; H 31
Дьюар (Dewar J.) V 478
Дьюар (Dewar J, H.) I 83, 285
Дьюар (Dewar M. J.S.) 1 118, 210; V 43,
262, 263
Дьюар (Dewar R. В. К.) I 118
Дьюц (Dewey R, S.) I 13, 282
Дыовалл (Duval H. M.) Ill 53
Дэвид (David С. С.) V 133
Дэвидсон (Davidson E, B.) Ill 375, 376
Девидсон (Dayjdson D.) II 218; IV 71
Дэвидсон (Davidson L. H.) I 54
Дэвидсон (Davidson R.S.) Ц 179
Дэнис (Davis A. W.) II 8; IV 122, 232
Дэвис (Davis B. R.) II 55
Дэвис (Davis C. S.) Ill 40, 296; V 405
Дэвис (Davies C. W.) II 70
Дэвис (Davis E. Aj III 280
Дэвис (Davis J. A.) Ill 187
Дэвис (Davies J, E.) Ill 92
Дэвис (Davies J. S.) V 28'J
Дэвис {Davies V. H.) V 289
Дэвис (Davis С. С.) V 286
Дэвис (Davis R. E.) 11 241
ДЭвпс (Davis M.) Ill 354
Дэвис (Davis N. R.) V 163
Дэвис (Davis R.) V 205
Дэвис (Davis R. В.) [V 137
Дэвис (Davis R. E.) Ill 409, 412, 468
Дэвис (Davis R. H.) II 53; III 271, 339
Дэвис (Davis R, V.) IV 156
Дэвис (Davies T, M.) HI 240
Дэвис (Davies W. C.) Ill 412
Дэй (Day A.C.) I 198, 209; 11 106; IV 167;
V 95
Дэй (Day R, J.) I 134
Дэйв (Dave K. G.) I 79
Дэйви (Davey W.) I 88
Дэйвс (Daves G. D., Jr.) Ill 341
Дэйл (Dahle N. A.) Ill 431
Дэйл (Dale J.) V 153, 331
Дэйли (Daly J, W.) V 102
Дэйн (Dane E.) 1 75
Дэйхилл (Dahill R. T„ Jr.) I 431, 437
Дэкнн (Dakin H. D.) I 225; III 77, 112, 114
15 6; V 3 51
Дэн (Dehn R. L.) V 439
Дэн (Dehn W. M.) II 388, 389
Дэни (Danehy J. P.) IV 264
Дэннкер (Daetiiker H. V.) IV 236
Дэниш (Danish A. A.) V 82
Дэнили (Dannley R. E.) V 334
Дэне (Dains F. В.) I 100; II 38, 42; IV 45
Дэнстед (Dansted E.) V 143, 387
Дэньо (Daiguatilt R. A.) II 183; V 250
Дэппеп (Dappen G. M.) II 285; V 175, 186
Дю Bya (Du Bois R. H.) V 535
Дюбуи (Dnbuis R.) II 136, 137
Дюкуорт (Duckworth A. C.) HI 431, 438, 443
Дюмон (Dumont С.) V 400, 401
Дюннавант (Dn;m;ivant \V. R.) 1 57, 66
Дюпюи (Dupuy A. E.) V 38
Днэ^кхеймер (Diirckheimer W.) II 389; IV
Дюрр (Дйгг F. И.) Ц 121
Дюпон (Dutton G. R.) IV 90
Дю Фе (Du Feu E. C.J II 273
Дюфе (Dufay Ph.) I 407
Дюфур (Dufour С.) 1 125
Дяткин Б. JI. V 196
Егава (Egawa Y.) I 32
Ейгнебсргер (Eig&nberger E.) 1 377
Ейтс (Yates P.) Il 224, 226, 231
Енссн (Jensen С. B.) Hl 256
Енеен (Jensen E. V.) Ill 92, 99, 468; IV 201
Ецсен (Jensen F, R.) Ш 402
Енсеи (Jensen К. A.) IV 16?
Енсеп (Jensen N. P.) V 380, 384
Енсен (Jensen S, L.) 1V 129, 130
Енссен Jenssen В.) 1 167
Еитш (Jentzsch J.) II 316
Евч (Jentsch J.) H 22
Есефи (Youssefyeh R. D.) I 116; II 187
Жазельскис (Jaselskis В.) V 241
Жак (Jacques J.) Ill 184, 240; IV 57, 258
Жаке (Jacquier R.) V 214
Жанлоз (Jeanloz R. W.) I 8G
Жарвазы (Szarvasy £.) II 303, 306
Жардэп (Jardine F. II.) Ill 415; IV 158; V
434
Жардэн (Jardine R.V.) Ill 123
Жардэн (Jardine I.) V 455
Жарро (Jarreau F.-X.) V 81
Жаффе (Jaffe H, H.) I 273
Жвачек (Zvacek J.) Ill 47
Жданов Ю. A. IV 151
Желеско (Zelesko M.. J.) V 563
Жемличка (Zemlicka J.) I 357; IV 22
Желотт (Gelofre B.) IH 283
Женест (Geneste J. M.) 1 168
Жеррар (Gerrard W.) I 117, 118; III 328, 332.
335, 381
Жимаиини (Giumanini A. G.) V 114
Жирар (Girard A.) II 12—14
Жиротра (Girotra N. N.) V 127, 252
Жол (Jaul E.) V 146
Жали (Joly R.) II 199, 202; III 67, 93, 99;
IV 11
Жоржес (Gorgues A.) V 311
Жотела (Jaufelat M.) V 167, 496, 497
Жуль (Joule D. A.) I 81
Жуллье (Joullie M. M.) 1 188: 111 145
Жюлиа (Julia M.) Ц 301; IV 272
Жюлиа (Julia S.) I 88, 407; И 266, 301;
Hl 67, 03, 99
Жюлиа (Julia S. A.) I 81
Забкиевич (Zabkiewjz J. A.) J 166
Забрншке (Zabriskie J. L.) 1 375, 376
Завьялов С. И. I 181, 182, 183; III 67; V 372
Загер (Sager W. F.) 1 223, 224; III 29.30,
431; V 270
Задражил (Zadrazii S.) HI 285
Заначек (Zajacek J. G.) V 53, 307, 341
Зак (Sack A.) ‘ III 291, 292
Залар (Zalar F-V.) I 168
584
Задар (Zalar F. ZJ V 64, 66
Задков (Zalkow L. HJ Ill 214, 240; 1V 1]
Зальцман (Saltzman H.) 11 54, 07. 59, 353
Зам {Sahm W.) V 280, 281
Замбито (Zambito A. J.) II 420
Зангер (Sanger F.) I 376
Зангстер (Saiigster I.) Ill 372; IV 31
Зандбсрг (Sandberg RJ I 90, 285
Зандмепер (Sandmeycr TJ 1 219; II
42. 23/, 241
Заугг (Zaugg H. E.) I 334, 350; II 128, 129,
308, 370, 395, 400; IV 238, 247; V 89, 90
Зауер (Saner H.) IV 29
Зауер (Sauer J. С.) I 291, 310, 312; [II 39,
452 457' IV 202 227
Зауэр (Sauer J.)“ 111 318; IV 201; V 493, 494
Зауэр (Saner R. OJ I 189
Зауэре (Sauers С. KJ IV 165
Захаркин Л, И. I 278; II 362; V 108
Збирал (Zbiral E.) Ill 240; V 382, 384
Эдепик (Zderie J. A.) I 413; II 114, 191, 193;
IV 144, 150, 151
Зеелер (Seeler F.) Ill 120, 123
Зеефельдер (Seefelder M.) I 357; V 195
Зсйдиг (Seidig K.-D.) 1 211
Зейед (Zayed S.M. A. D.) I 11
Зейс (Sens E. J.) II 259, 262
Зелинский H. Д, IV 93
Земмельхак (Semmelhaek M. FJ V 329, 331
Зсмплен (Zemplen G.) V 24
Зервас(Zervas L.) I 256, 367, 400, 401; Il 467,
468; III 395, 419; IV 77, 80, 160; V 45,127,
131, 164, 169, 342
Зенке (Sonke H.) Ill 376
Знбер (Sieber N.) IV 209
Зибер (Sieber P.) II 444; III 388, 434; IV 6,
132; V 155, 165
Зиберт (Siebert E.) IV 57
Зибиковски (Zlbikowski I.) V 520
Зив ван дер (Zeeuw van der) I 366
Зиварт (Stewart G.) V 477, 478
Зигель (Siege! E.) II 249; III 67
Зигель (Siegel HJ II 456
Зильберман (Sllberman M.) V 552
Зцльбсрт (Silbert L. S.) I 90, 144; II 249;
III 67
Знмиатайский (Siemiatycki M.) Ill 401
ЗнмХен (Simchcn G.) I 354
Зихер (Sicher J.) Ill 396
Зи-Ченг (Zee-Cheng K. Y.) V 386
Злей (Zietz A.) I 194
Зобсл (Zobel HJ IV 91
Золлингер (Zollinger HchJ I 357
Зобрист (Zorbrist F.) IV 189, 190
Зондхеймер (Sondheimer P.) I 69, 74, 166,
167, 268, 315; II 27, 231, 226, 228, 301,
414; III 92, 249, 250, 256, 354, 394; IV 150,
151, 2’26, 260, 274; V 59, 66, 264, 275,
389, 435, 436, 509, 554, 556
Зорбах (Zorbach W. W.) II 171, 178; III 191
Зубиани (Zubiani GJ V 293
Зупанчич (Zupancic В.) V 127
Зургеиор (Zurgenor D. MJ 1 144
Зурквпя (Zurqnivah A.) V 531
Зюс (Sus О.) IV 113
Ибаньес (Ibanez L, CJ 1 126; Il 193; 111 241 •
IV 130
Ибн-Раза (Ibnc-Rasa К. M.J HI 328
Иборн (Eaborn CJ Ill 132; V 441, 442
Ив (Ives D, A. J.) I 167. 209; III 149; IV 151
Ивамото (Iwainoto MJ J 315
Ивамура (Iwamura HJ V 337
Иванов (Ivanov С.) V 259
Иванов X. II 211
Ивашиге (iwashige T J V 126
Ивес (Eaves D- EJ I 31
Игано (Igano KJ II 440
Иде (Ide J.) 'I 166, 384
Идсе {Eades F. D. MJ I 334
Идлер (Idler D. Rj Ill 422
Hep (Iyer K. W.) I 116
Израелстам (Israelstam S. SJ 11 70
Изуми (Izumi H.) V 40
Изумийа (Iziimtya N.) V 156
Икегамн (ikegaml S.) V 372
ИкеДа (Ikeda SJ Ц 227
Икехара (Ikchara M.) I 357; V 157
Икке (ickc R. NJ IV 72
Идет (liett J. DJ I 436
Илмел (Eliel E, Lj II 20, 180—183, 297,
208; III 152, 153. 333; IV 72, 103. 134;
V 196, 222, 223, 250, 280, 281, 360, 516
Илтоц (Ilton M. A.) V 508, 548
Иманнси (Imanishi M.) IV 179
Имого (Irnoto EJ I 85
Ин атоме (Inatome M.) Ill 184
Инг (Ing H. R.) 1 210
Ингем (Ingham R. KJ IH 402
Ингерсолл (Ingersoll A. Wj I 223; IV 59,
60; V 503
Ингланд (England D. С.) I 291
Инглиш (English J., Jr.) 1 226; III 194; IV
136, 137
Инглунд (Englund В J [V 246, 24S
Инмен (Inman C. EJ III 99
Иисалако (Insalaco M. A.) V 72, 473
Ину (Inoue A J V 40
Ину (Inoue KJ Ц 282
ИнУ (Inoue N.) Ill 214
Ину (Inoue S.) IV 158; V 523
Ииуаки (Inuaki NJ IV 158
Инукай (Inukai NJ П1 434; V 341, 523
Инукай (Inukai TJ V 24
Инфанте (Infante R.) Il 59
Иихоффен (Inhoffen H. H.) II 75. 76, 133,
303; III 40; IV 83, 84
Йоргенсен (Jorgensen P. MJ [I 245
Йоргенсон (Jorgenson M. J J I 39; 11 175,
179; V 247
Ипатьев В. H. Ill 336, 339
Ирвин (Irvine J.) Ill’32
Ирвнн (Irvine J. CJ II 280
Ирвин (Irvine J. W., Jr.) Ill 369
Ирвниг (Irving G. CJ IV 196
ИрДЛи (Eardley S.) II 275, 276
Ирнарт (Iriarte JJ 11 191. 193
Исбелл (Isbell H. SJ V 270
Ислам (Islam A. M.) I 121; III 319; IV 96
Иссидоридес (Issidorides C. HJ I 130, 334;
И 226
Истерби (Easterby D. G.) Ш 360
Истмен (Eastmen R. HJ II 95, 97
Истхэм (Eastham J. F.) 1 186; 11 26, 27,
183; 111 84, 458; V 69. 71
ИтазаКИ (Itazaki H.) J 209
Итайа (Itaya T.) V 347
Итано (Itano H. Aj V 488, 544
Ито (Ito KJ И 332
Итон (Eaton P.) I 54
Итон (Eaton P. EJ I 334; III 122, 123
Итон (Eaton R. EJ V 544 — 546
Итох (Itoh MJ V 292, 523
Ифзал (Ifzal S. MJ V 133
ИффленД (Iffland D. CJ III 215, 216, 240,
416, 417
Итикава (Ichikawa KJ II 388
Йаджиме (Vajima H.) V 40, 524
Йамада (Yamada S.) V 488
Йамамото (Yamamoto Y.) V 14,3
Йамамура (Yamamura SJ V 555
Йамашита (Yamashita T.) V 113
Йанаи (Yanai MJ V 495
585
Йасунобу (Yastinobn К. TJ V 113
Йерг (Jorg JJ Ill 240
Йергене (Jurgens Е J II 350
Йитс (Yeats R. BJ V 257
Йованидис (Yovanidis С.) V 164
Йокота (Yokota Y.) V 496
Йонеда (Yoncda FJ 1 15; V 10
Йонеда (Yotieda TJ IV 22
Йоргенсон (Jorgenson M, J.) V 152
Йорденс (.lordens PJ V 284
Йорка (Yorka К- V.) HI 119
Йоска (Yoska J.) Il 192, 193
Йост (Jost EJ II 30
Йост (Jost K.-H.) Ill 105
Йост (Yost D. MJ Il 130
Йоулус (Youlus J.) Ill 151
Йохимс (Jochims J. С.) IV 227
Йошиока (Yoshioka MJ I 429; III 451; V 194,
464
Йошисато (Yoshisato E.) V 331
Йукава (Yukawa Y.) V 384
Кабалка (Kabalka G. WJ V 15, 51, 104
Кабасакалян (Kabasakalian P.) II 14
Каббн (Kabbe H.-JJ I 242; III 298; V 16
Каббоп (Cubboti R.C. Pj V 66
Кабезас (Cabezas Ma. Ej II 193; HI 241
Кавабата (Kawabata NJ I 437
Кавагна (Cavagna G.) II 129
Каван (Kawai S.) V 127
Кавайа (Khawaja T. A.) IV 43
Каваками (Kawakami J. H.) V 372
Каваннси (Kawanisi M.) IV 75; V 505
Каватаин (Kawatani KJ V 524
Кавахара (Kawahara TJ II 446
Кавесаки (Kawesaki KJ V 40
Кавэ (Cave A.) V 80, 81, 487, 540
Кагал (Kagal S. A.) V 208
Каган (Kagan F.) Ill 99, 263
Каган (Kagan H. B.) Ill 184; IV 57, 258;
V 495
Каглиото (Caglioto L.) II 388; V 82, 319, 320
Каденбах (Cadenbach GJ I 92
Кадер (Kader A. Tj III 361
Кадеш (Kadesch R. Cj II 264, 265
Кадин (Radin S. В.) V 320
Кадио (Cadiot PJ III 290
Кадогэн (Cadogan J. I. GJ I 280; Il 17: HI
469; V 470
Каелике (Kaelic.ke J.) ]V 114
Казана (Kazama Y.) I 58
Казан (Kazan JJ I 427
Казанова (Casanova J., Jr.) I 142; Hl 201,
233, 241; V 317
Казенски (Cascnsky BJ V 318
Кайен (Kayen C,J V 194
Кайз (Rise M, AJ II 327, 455
Кайзер (Kaiser EJ V 291, 292
Кайзер (Kaiser E.Mj' II 150, 195, 205;
V 26, 242, 243
Кайзер (Kaiser HJ II 335; III 292
Канач (Kalcac В J III 47
Какие (Kakis F, JJ V 392, 393
Какисава (Kakrsawa HJ V 149, 495
Какихана (Kakihana TJ V 137, 143
Калама (Calama M. AJ V 491
Калбертсон (Culbertson T. P.) HI 19
Калвери (Calvery H, О J I 401
Калвода (Kalvoda JJ II 193; ill 241; V 429
532
Кале (Kahle UJ V 430
Калсрт (Rahlert Ej II 256
Калзада (Calzada M. CJ IV 72
Каллаган (Callahan F,M.) Il 22; V 300, 524
Каллен (Callen J. EJ HI 39; IV 264
Каллен (Cullen EJ II 355; I[I 166
Каллио (Kallio R. EJ III 271
Каллис (Callis C. FJ 11 97
Калм (Kalm M. JJ I 167; IV HI, 122, 248
Калнпнс (Kalnins M. VJ I 351; II 311
Калп (Kulp S. SJ V 236
Кальб (Kalb LJ III 209, 239
Кальдер (Calder I. Cj V 275
Кальдерон (Calderon J J V 491
Кальзадилла (Calzadilla C. HJ V ] 83
Каначи (Kamachi HJ V 149
Камби (Gambia R. CJ II 55; V 246
Камбо (Gumbo C. CJ IV 140, 143; V 100
Камерино (Camerino В J I 116. 160
Камерон (Cameron A. F. В.) И 97, 179, 225
Камерон (Cameron D. DJ HI 10, 119
Камерон (Cameron M. DJ I 143
Камерон (Cameron P. J J V 535
Камерон-Вуд (Cameron-Wood MJ IH 468
Каметанн (Kametani TJ IV 123; V 470
Каминский (Kamienski C. WJ I 176; Ц 141'
V 29
Каминский (Kaminski F. EJ V 26
Кайм (Ramin OJ I 130: U 330, 375 380'
IV' 226 '
Камм (Капин R. MJ IV 248
Камма (Kamma KJ V 245
Камманн (Kammann К- P-, JrJ V 481, 482
Каммарата (Cammarata AJ II 346
Каммерек (Kanwnercck RJ V 393
Камп (Kampe WJ V 324
Кампень (Campaigne EJ I 100, 137 193,
360; II 410; III 272, 276, 296
Кампмейер (Kampmeier J. A J I 69; II 17, 277
Kan (Khan В, TJ III 113
Kan (Khan M. AJ III 277
Кан (Khan N. A J I 59, 60, 66; II 11, 91, 97*
III 24
Kan (Khan S. A.) V 376
Кан (Kan R, OJ I 54; II 388
Канаока (Kanaoka У J IH 148; V 102, 365,
366
Кане (Kane S. <S J 111 18
Канеко (Kancko С.) I 144, 182; II 153
Канкл (Kuncl KJ V 357
Каннер (Kanner BJ I 272; V 104
Каннингэм (Cunningham JJ I 323, 334
Каннингэм (Cunningham K, GJ Hl 102
Каннингэм (Cunningham RJ V 270
Канон (Carionne Pj V' 46
Капсьснн (Cancienne A. E., JrJ V 38
Кантор (Kantor S. WJ I 57; II 76
Кан-Фац (Kan-Fan CJ V 487, 540
К^пеллер (Kapeller H.) IV 6, 268
Капнтэйн (Capitaine JJ V 18
Каплан (Kaplan B. EJ V 533, 534
Каплан (Kaplan JJ HI 30
Каплан (Kaplan LJ V 445
Каплан (Kaplan R. BJ I 442; V 333
Капуано (Capuano LJ V 489, 490
Каппе (Карре TJ V 318
Капур (Kapoor A J TH 56
Капуто (Caputo J. A J I 377; V 376
Кар (Kahr KJ JII 84
Карабатис (Carabateas C. DJ V 251
Карабпнос (Karabinos J. VJ I 335
Карайои-Жантиль (Karayon-Gentil A.) I 350
Караш (Kharasch M. Sj I 98, 100, 107, 188;
II 103, 106, 133, 243, 245, 344, 346; III
15, 18, 293, 296, 468; V 311
Караш (Kharasch NJ I 369, 3/0; HI 294
296; V 18
Карбон (Carbon J. HJ II 400
Карбонн (Carboni R. AJ HI 263, 318
Карг (Karg EJ HI 53
Карг (Carg H - GJ V 156
Каргер (Karger M. HJ V 30
Каргилл (Cargill R.Lj V 126, 127
Кардвелл (Cardwell H. M. EJ IV 229, 232
Карденас (Cardenas C. GJ I 166, 334, 344
586
Карди (Cardy D. Е.) V 284
Кардилло (Cardillo G.) V 183
Кардин (Cardin D. J.) V 114
Кари (Carey F. A.) V 438
Каркзаг (Karczag A.) IV 198
Каркханис (Karkhanis Y. D.) Щ 21
Карлетон (Carleton P. W.) IV 132
Карлин (Carlin R. В.) IV 232
Карлон (Carlon F. E.) V 238, 470, 494, 510
Карлсмпт (Carlsmith A.) Il 353; HI 68
Карлсон (Carlsohn H.) V 51, 52
Карлсон (Carlson H. D.) H 129
Карлсон (Carlson J. A.) V 147, 220
Карлсон (Carlson P,) Il 44
Карлсон (Carlson R. D.) Ill 333, 335
Карлсон (Carlson R. G.) IV 173
Карлсон (Carlson R. M.) [1 80, 85, 253, 255,
Й56; V 89, 193
Кармак (Carmack M.) Ill 261; IV 18
Кармас (Cartnas G.) Ill 166; It7 46, 213
Кармихаэль (Karmichael J- F.) I 96
Кармоди (Carmody D. R.) I 194
Карнен (Carney R. W. J.) I 144
Кариес (Karnes H. A.) V 146
Каро (Caro И.) II 123, 125
Каронна (Caronna G.) I 28
Kaponpeco (Caropreso F. E.) V 328
Карпентер (Carpenter B. G.) V 251
Карпентер (Carpenter F. H.) IV 161
Карпентер (Carpenter W. R.) IV 194
Карлино (Carpino B, A.) Ill 379, 380; IV G, 7
Карпино (Carpino L. A.) I 12; II 31; III 379,
380; IV 6, 7, 191; V 471 — 473
Карпио (Carpio H.) I 413; II 114; IV 130,
151
Kapp (Carr M. D.) V 4 80
Каррер (Karrer P-) II 15, 170, 178, 2o5,
281, 340—342; IV 226; V 293
Каррол л (Carroll M. F.) I 286
Карролл (Carroll P. M.) I 86, 374, IV 258
Кэрролл (Carroll S.) Ill 187
Каррузерс (Carruthers \V.) II 277; V 136, 293
Kappa (Carre P.) Il 300
Карстенс (Karstens А.) Ш 246
Картер (Carter H, E.) Ill 181, 184; IV 80,
160; V 77
Картер (Carter K. N.) IV 258
Картер {Carter P. H.) Ill 25
Карузерс (Karuthers M. II.) V 293
Кархарт (Carhart H.W.) II 169, 178; III 335
Карш (Karsch U.) V 490
Касаи (Kasai M.) V 24
Касанова (Casanova J.) V 317
Касерио (Caserio M.) I 248
Касани (Kaslni G.) I 306
Каска (Kaska W. С.) I 275, 278
Каспн (Caspi E.) 1 413; II 355; III 78, 166;
V 183, 375, 376, 451, 454
Kaccap (Cassar L.) V 167
Кассиди (Cassidy H. G.) IV 136, 137
Кастаньер (Castaner J.) Ill 296
Кастелли (Castelli P. P.) Ill 40
Кастеллс (Castells J.) HI 198, 201; V 21
Кастеллуччи (Castellucci N.T.) 11 285; Hi
290; V 299, 315
Кастл (Castle J. E.) 1 196
Кастл (Castle R.N.) II 421
Кастриллон (Castrillon J. P. A.) Ill 412
Кастро (Castro С. E.) Il 24); IV 171; V' 531
Кастурн (Kasturi T. R.) I 268; II 124 125,
185; V 183, 256, 345
Катавала (Kafhawala F.) V 565
Кател (Catel J.) I 390
Катерберг (K.aterberg G. J.) I 414
Катлер (Cutler F. A., Jr.) I 256; IV 173
Катлин (Catlin W. E.) 1 432
Като (Cato T.) V 40, 156
Катрицки (Katritzky A. R.) II 362; V 73
Катсояннис (Katsoyaiinis P.O.) HI 321
Катсуки (Katsuki S.) 11 430
Катсулако’с (Catsoulaco’s P.) V 102
Каттелайн (Cattelain E.) Ill 167
Каттер (Cutter H. В.) IV 173
Катце н ел лен богеп (Katzenellehbogen E. R.)
II 25
Катцспелленбоген (Katzenellenbogen J. A.)
V 122, 270, 435, 436
Kay (Kan D.) IV 151; V 9
Kayep (Kauer J. C.) 1 15, 66; IV 167
Каузер (Kauser W. M.) 1 66
Каунт (Caunt D.) II 17
Кауфман (Kaufman C. W.) II 157
Кауфман (Kaufman D.) I 11
Кауфман (Kaufman G. M.) Ill 360
Кауфман (Kaufman J, В.) V 300
Кауфман (Kaufman K- L.) 11 71
Кауфман (Kaufman P. R.) Ц1 292, 295
Кауфман (Kaufmann H.) V 8’6, 429
Кауфман (Kaufmann L.) 1 37
Кауфман (Kaufman S.) I 431
Кауфман (Kaufmann St.) I 69, 74; П 414
Кауфман (Kaufman W, E.) Ill 39
Кауффманн (Kauffman G. B.) Ill 374; V 220
Кауффманн (Kauffmann H.) II 330
Кауффманн (Kauffmann T.) 11 392
Кауффманн (Kauffmann Th.) V 280, 281
Кафаджи (Knafaji A, N.) I 345
Кац (Ratz A.) I 178
Кац (Katz L.) Ill 274, 276
Кац (Katz R.) V 212, 219
Кац (Katz T. J.) I 86; III 173
Канальский (Katehalski E.) Ill 275, 276;
IV 160; V 523
Кашеликар (Kashelikar D. V.) Ill 191, IV
26 э
Квант (Quang L. V.) Ill 290
Квебек (Qfiabeck G.) 11 129
Квейль (Quayle O. R.) Il 375, 380
Кверри (Querry W. V.) Il 217
Квидико (Quilico A.) I 214, 357, 417; II
94, 97
Квинн (Quinn H.W.) Ill 264, 266
Квинн (Quinn R. A.) II 95, 97
Квинт (Quint F.) Ill 311
Kbhtobckh (Kwitowski P. T.) V 279, 280
Kbo (Quo S.-G.) 1 238
Квок (Kwok R.) II J93
Квуреши (Qureshi A. K-) V 417
Квуреши (Qureshi M, I.) Ill 271; V 335
Квятовски (Kwiatowski G. T.) V 302, 304
Кевнлл (Kevill D. N.) Ill 320
Keni (Kiigi H.) IV 132
КеЗере (Keziere R. J.) V 122
Кей (Kaye H.) V 352, 353, 466
Кей (Kave I. A.) I 58; 11 391; 111 168, 172;
IV 235
Кей (Kaye S.) HI 383
Кейзер (Keiser J. E.) V 353
Кейзон (Cason J.) I 167, 334; II 195; III 14,
18, 210, 329, 335, 457; V 181, 183
Кейл (Keil E.) II 203
Кейлих (Keilich G.) 11 202
Кейтон (Keyton D, J.) V 256
Кейтс (Kates Af.) IV 38
Кейтманй (Keutmann E. H.) II 14
Кек (Keck H.) IV 76
Келла (Celia J, A.) I 110
Келлар (Cuellar L.) I 413; И 193; 111 241
Келлер (Keller H.) V 503
Ксллерт (Kellert M. D.) I 100
Келлн (Kelley II. С.) IV 255
Келли (Kelley M. G.) V 405
Келли (Kelly D. P.) V 468
Келли (Kelly R- В.) I 167; II 224, 227; III
149; IV 268
Келлн (Kelly R. \V.) V 362, 534
587
Келлог (Kellogg К- G.) V 458
Келлом (Kellom D. Б.) HI 146
Келси (Kelsey R.) V 243, 518
Кель (Kuehl W. .1., Jr.) 1 176
Кельвин (Calvin M.) Ill 146, 148
Кельш (Koelsch C. F.) I 38'7, 388; V 341
Кем (Kehm В. B.) H 262; Ш 40
Кеммерер (Kammerer H.) Ill 239
Кемп (Kemp D. S.) I 215; IV 248; V 564
Кендалл (Kendall E.C.) 1 130, 372; 11 135,
136; III 193, 208, 251, 256, 278, 290, 291;
IV 226
Кендалд (Kendall D. L.) I 350
Кенде (Kende A. S.) I 69; III 99; V 86
Кеийоп (Kenyon W. G.) 1 66; V 26
Kennon (Kenyon W. О.) I 106
Кеннард (Kennard К. С.) IV 111
Кеннеди (Kennedy A.) Ill 312
Кеннеди (Kennedy E. R.) II 42, 43, 54, 57,
59
Кеннеди (Kennedy R. J.) II 84
Кеннер (Kenner G. W.) 1 97, 257, 400, 427,
435, 436; II 274, 365; III 161, 166, 280,
387, 388, 390, 419; IV 24; V 134, 197
Кеннер (Kenner J.) HI 226, 240
Кении (Kenney H. E.) V 360
Кент (Kent F, W.) II 233, 401
Кент (Kent G, J.) V 213
Кент (Kent P. W.) V 196
Кейт (Kent R. E.) IV 101
Кеитенко (Ceiitenko W.) IV 101
Кеприии (Ceprini M. Q.) Ill 56
Керб (Kerb U.) V 78, 386
Кервин (Kerwin J. F.) HI 201
Кергомард (Kergomard A.) 1 168; II 404
Керештеси (Keresztesy J,C.) Hi 167
Керн (Kern J. W.) HI [31
Керн (Kern W.) Ц 38
Кертин (Curtin D. Y.) I 69, 176, 401; Il 17,
/277; III 58, 67; V 5’2
Кертин (Curtin J. H.) [I 71
Кертис (Curtis G. G.) IV 126
Керфапто (Kerfanto M.) II 316
Кесслер (Kessler II.) 11 238; V 280
Кеттль (Kettle S. F.) II 7
Кёбрих (Kobrich G.) 1 417; 111 445, 446;
V 184. 185
Кёглер (Kugler H.) Ill 184
Кёниг (Konig С.) IV 11
Кёниг (Konig К. H.) Ill 210, 240, 276
Кёниг (Konig H.) I 34s
Кёниг (Konig W.) Il 121; Hi 21; V 195
Кёц принта fin (Konigstein CJ.) II 38
Kepax (Cnmigh E. F.) V 270
Кёрби (Kirby G. W.) I 370; V 270
Кёрби (Kirby R. H.) I 238; II 141; IV 63
Кёрднпг (Kording P.) Hl 246
Кёрмендн (Kormendy К.) IV 198
Кёрфи (Curphey T. J.) V 359, 433
Кёрх (Kirch L.) Il 132
Кёстер (Koster H.) Ill 40
Киблер (Kibler C. J.) II 290; III 114, 354
Кибурц (Kyburz E.) Ill 76
Кнеэнти (Klvity 3.) V 363
Кивни (Keaveney W. P.) V 124, 447
Кидд (Kidd D. A. A.) 1 382
Кнджи (Kiji J.) I 345; V 346
Кидузлл (Kidwell R. L.) V 433, 446, 447
Кией (Kiyoi R.) II 303
Киккапа (Kikkawa I.) HI 451
Кили (Kealy T. J.) I 174; IV 47; V 510
Кили (Keely ,8. L., Jr.) V 291, 292
Кнлиани (Kilians H.) IV 178. 179
Килмер (Kilmer G. W.) Ill 260, 261
Килрой (Kilroy M.) Ill 132. 197
Ким (Kim C. S. Y.) I 138, 175
Кимбер (Kimber R. W. L.) V 365
Кнмел (Kimet W.) 1 285
Кимото (Kinioto S.) V 40
Кина (Keana J, F.) I 96; V 475
Кина (Keana S. В.) V 475
Книг (King F. E.) I 130
Кинг (King G.) Il 52
Кинг (King H.) 1 22j; II 423
Кинг (King H. S.) II 39, 281; IV 95
Книг (King L. С.) II 39, 240, 241; V 65
Книг (King R. W.) II 295; IV 36
Книг (King T. J.) I! 106
Кинг (King T, P.) V 261
Книг (King W.) V 390
Книг (King W. В.) II 354. 355; IV 247
Кингсбури (Kingsbury С. A.) I 334; HI 306
Кннгслей (Kingsley R. В,) IV 165
Киндлео (Kindler K.) HI 48, 53, 166, 260,
261
Кипи (Keeney M.) II 135, 136
Кинкл (Kinel F. A.) I 413
Кинней (Kinney C. R.) 11 235
KiiHuep (Kinnear A. M.) П 297; V 304
Киннерсли (Kynnersley J- D.) V 334
Киномура (Kinomura Y.) V 40
Кинугава (Kinugawa Z.) I 95
Киридес (Kyrides L.P.) IV 114, 209, 247
Кирк (Kirk D. N.) I 360, 413; IV 11, 235
Киркхэм (Kirkham L.) V 174, 504
Кирыс (Kirmse W.) V 423, 429
Кирмер (Ktrner W. R.) HI 335
Кнрпал (Rirpal A.) Ill 68
Киррманп (Kirrmaim A.) IV 267
Кирст (Kirst H. A.) V 434, 436
Кирстед (Kierstead R, С.) V 175, 176
Кирстед (Kierstead R, W.) I 427; Ш 47;
V 123
Кнртли (Kirlley M.) 1 ,7
Кирх (Kirch L.) II 13n
Кирхнер (Kirchner F. Kd II 252
Кирхнер (Kirchner J. R.) 1 47, 48
Кпрххоф (Kirchhof W.) I 278; П 350; HI 78
Кирш (Kirsch G.) V 228
Кисель (Kiesel R. J.) Ill 373, 402
Кислих (Kieslich К.) IV 227
Кисперский (Kispersky J. P.) Ill 142, 146
Кисс {Kiess A. A.) II 388
Кисс (Kiss J.) I 133, H 444
Киссел (Kiessei M.) 1V 253, 254
Киссел (Kissel W, J.) V 379, 3S4
Киссингер (Kissinger L. \V.) 11 456
Киссман (Kissmaii H. M.) Ill 145, 420
Китагава (Kitagawa J.) 1 334
Китао (Kitao T.) V 487
Китаока (Kitaoka Y.) V 487
Китахара (KHahara Y.) V 10, 40
Кнтахопоки (Kitahoiioki R.) Il 179; V 247
Китон (Keaton O. D.) 1 299; II 74, 264, 265
Китон (Keeton R.) V 38 9
К,Итчпнг (Kitching W.) Ill 54; V 368, 372
Кифер (Kiefer E. F.) I 34; V 183
Кифер (Kiefer H.) 1 366
Кич (Keach De, W. T.) I 97
Киши (Kishi Y,) 1V 260, 261
Клагер (Klager K-) I 256; III 146
Клагстт (Clagett D, С.) Щ 289, 290
Клагс (Klages F.) Ill 360
Клазен (Clasen H.) II 362
Клаизеп (Klaisen L.) II 7, 8, 131, 335, 417,
418, 420; HI 35, 40; IV 36, 238, 247, 248
Клайн (Kline G. В.) 1 39; III 123
Клайн (Kleine E.) 1 204, 210
Клайн (Klyne W.) V 540
Клайтон (Clayton D. W.) HI 280
Клантон (Clayton J. С.) IV 259
Клайтон (Clayton R, В.) I 41
Клашшн (Klamann D.) II 446; HI 118; V 340
Клацдерман (Klandermini В. H.) II 465
Клаппрот (Klapproth W.S.) V 520
Клар (Clar E.) IV 130
588
Кларет (Claret Р. А.} V 419
Кларингболд (Claringbold Р. JJ V 362
Кларк (Clark С.Т.) Ш 84
Кларк (Clark Н.С.) III 387
Кларк (Clarke Н. TJ I Юб, 130, 219; II
8, 234, 380; П1 25, Ц4, 276; IV ИЗ, 122
232, 243, 248
Кларк (Clark JJ I 360: V 328
Кларк (Clark J. С.) I 73; II 439
Кларк (Clark L. С., Jr.), V 348
Кларк (Clark R. 17.) I 106, 318; II 448, 456,
462, 463; III 365, 366
Кларк (Clark S. LJ V 293
Кларк (Clark T. H.) II 227
Кларк (Clark W- MJ 1 257
Кларк (Clark W. Mjl 257
Кларке (Clarke F. Н„ Jr.) I 150, 166
Кларке (Clarke KJ IV 209
Кларкс (Clarke M. FJ II 97
Кларке (Clarke R. LJ V 508, 566
Кларке (Clarke T. G.) V 393
Класс (Klass D. L.) I 257; III 283; IV 19, 20
Клауеяберг (Klauenberg G.) V 320
Клауке (KJauke E.) V 473
Клаус (Claus C.J.) II 178
Клаусон-Кааз (Clauson-Kaas NJ II 216;
V 15'1
Клаусс (Clauss KJ V 420
Клебе (Klebe J. FJ HI 384
КлейДсрер (Kleiderer E. CJ IJ 97; II] 165,
167
Клейн (Klein H. CJ II 39
Клейн (Klein J J 1 103; HI 68
Клейн (Klein K. PJ V 143
Клейн (Klein M. PJ III 148
Клейн (Klein OJ II 421; III 413
Клейн (Klein R. AJ II 285; V 175, 186
Клейпберг (Kleinberg J.) Il 43; III 445;
IV 201; V 393
Клейвфелтер (Kleinfelter D. CJ II 468, 4 70
Клейншмидт (Kleinschmidt R. FJ II 72;
IV 48
Клене (Kleis A. A. В J III 32“
Клеланд (Cleland G. HJ V 279, 280
Клеменс (Clemens D. H.) IV 247. 248
Клеменс (Clemens L. MJ III 310
Клемент (Clement HJ 1 238
Клемект (Clement R. A.) HI 210, 240; IV
47; V 510
Клемка (Klemka A. JJ 364, 365
Клемм (Klemm KJ IV 76
Кле.мменсен (Klemmensen EJ IV 204
Клемменсен (Klemmensen P.) Ill 150
Клемо (Clemo G. RJ IV 122
Клётцель (Kloetzel M. С.) V 389, 390
Кли (Klee W.) II 30
Клибер (Klttiber R. WJ II 22, 217; IV 166,
278
Кливлэнд (Cleveland E. A.) II 235
Клипер (Klieger E.) I 422
Климстра CKlimstra P. OJ II 415; 1И 271
Клингер (Klinger HJ V 566
Клинк (Klinck J J I 193
Клинтон (Clinton R. OJ И 290, 335
Клисс (Kliss R. MJ III 200
Клиффорд (Clifford A. A J II 228
Клоке (Cioke J. В J III 296
Клоновский (Klonowski R. SJ I 167
Клоса (Klosa J.) Hl 367
Клосс (Closs G. LJ I 65, 66, 138, 175; II
187, 452, 456; Ш 27, 30, 360; IV 133
Клосс (Gloss L. EJ 1 138, 175; HI 360
Клоссон (Closson R .DJ 111 107
Клоссон (Closson W. D.) II 359; V 316, 393
Клотц (Klotz I. MJ 1 82
Клоуз (Close VJ V 222
Клоуз (Close W. JJ IV 190
Клохс (Klohs M. WJ IV 165
КлошТерциль (Kloosterziel HJ HI 448; V
468
Клучко (Klutchko SJ V 148
Клэпп (Clapp M. А.) II 414
Клэпп (Clapp R. CJ Ill 241
Клюге (Kluge MJ I 211
Клярнер (Klarner F. -GJ V 88. 89
Кпаак (Knaack D. Fj Ill 299
Кнабе (Knabe J.) Ill 179, 184
Кнай (Kny HJ 1 173, 305
Кнапп (Knapp K. HJ III 241
Кнаусс (Knauss EJ I 390
Кневель (Knevel A. MJ Ill 40
Книль (Kniel P.) I 364
Кнобер (K.noeber M. Sr J V 281
Кнопка (Knopka W.NJ HI 145
Kjiot (Knothe LJ V 443, 315
Кпотцерус (Knotnerus J J II 110
Кпоф (Knof LJ 11 301
Кнунянц И. Л. V 1 %
Ко (Сое D.) HI 416
Коан (Coan S. BJ II 308
Кобайаши (Kobayashi Y.) V 447
Кобёр (СацЬёге PJ V79, 80
Кобнер (Kpebner AJ Ill 145
Кобурн (Coburn E. RJ I 130, 238, 307; IИ
107
Ковак (Kovac L. RJ II 109
Ковакс (Kovacs J J III 36
Кован (Cowan DJ I 238. 271
Коиаико {Cowanko NJ III 157
Ковахе (Kovache AJ II 330
Ковачик (Kovacic. P.) I £14, 280; Il 241;
III 368; V 110, 308, 429
Коверт (Covert L. WJ Ш 166
Кови (Covey R. Aj III 3/0
Kora (Coga NJ V 164
Коган (Kogan l.C.) I 58
Коггинс (Coggins J J V 321
Кодама (Kodama HJ I 58
Кодерр (Coderre R. А.) III 149
Коджима (Kojima TJ V 2 4
Кодицгтон (Codington J. FJ 1 94, 102
Кодл (Caudle E. CJ II 39; IV 95
Козак (Kosak A. IJ II 39
Козел (Rosel С.) II 392
Козловски (Kozlowski M. AJ V 319
Козоуер (Kosower E.) II 129; IV 24“
Козуца (Kozuka SJ V 90
Койл (Coyle J- JJ IV 133
Кокер (Cocker J. D.) II 388; III 240
Кокер (Cocker WJ 111 258, 260
Кокер (Coker W. PJ III 172
Кокор (Kocor MJ III 254, 255
Кокс (Cox A.) I 370; IV 63
Кокс (Cox G. J J II 423
Коке (Cox J. R., Jrj I 24
Кокс (Cox M- EJ V 517
Кокс (Cox R. F. В J I 88; IV 80
Kokcoh (Coxoil J. MJ V 139, 143, 303, 372
386, 387
Колби (Colby T. H.) I 144
Колбурн (Colburn С. В.) I 403; III 312
Коле (Cole WJ II 39; IV 173, 233
Колеман (Coleman P. DJ III 306
Колеман (Coleman G. HJ I 54, 106, 302;
II 245, 335, 455, 458; HI 39, 193, 267, 333;
IV 36, 72, 264
Колеман (Coleman J. EJ II 97, 326
Колеман (Coleman R. A.) V 257
Колер (Kohler E. PJ I 245, 248; H 429;
Ill 76
Колер (Kohler HJ II 295
Колин (Colin G.) V 360
Колинезе (Colinese D. LJ II 6
Колл (Koll WJ I 15
Коллер (Koller E. PJ II 253, 374
Коллетт (Coliett A. RJ IV 264
589
Коллинз (Collins DJ IV 7
Коллинз (Collins D. J.) I 115. 116; II 39
Коллинз (Collins J. C.. Jr.) Ill 366; V 539,
540
Коллинз (Collins P. FJ II 70, [41
Коллинз (Collins P, M.) Ill 301; V 376, 459
Коллинз (Collins R. FJ I 382; II 70
Коллинтоп (Collinton E, W.) V 258
КоЛлман (Collman J. P.) Ш 459
Коллонич (Kollonitsch J.) I 186; V 230,
250, 419, 527
Коли (Kolm HJ Ill 413
Колобельский (Kolobielski MJ III 195, 197
Коломер (Kolomer EJ V 368, 373
Колоцж (Colonge J.) Ill 142, 146
Колопиус (Colonius HJ II 141
Колс (Coles J. A.) II 220, 226; IV 95, 96
Колсон (Colson A.) 1 92
Колтер (Colter A. KJ HI 276, 310
Кольбе (Kohlbe H.) II 417
Кольер (Colyer R. A.) V 314
Кольтгофф (Kolthoff I.M.) II 97
Комиссаров M, Б. IV 119; V 512
Кон (Koh G. A. R.) П 109; IV 201
Koh (Cohn W. EJ Ill 172
Koh (Kohn E. JJ Ill 166
Koh (Kohn Pj 1 316
Копана (Konaka R.) Il 440
Конант (Conant J. В.) II 39, 375, 380; IV
173
Konaxep (Coiiacher H. B. S.) V 39, 40, 256
Копбер (Conbere J. P.) I 256
Копеки (Konecky M. P.) Ill 146
Конец (Cohneu E.) Ill 92
Кониг (Koenig P. F.) II 203; V 256
Конигсберг (Konigsberg MJ I 455
Коиигсберг (Konigsberg NJ I 137
Копильяро (Conigliaro P. J J V 169
Конли (Conley R, TJ Ill 141, 145
Конлон (Conlon L. EJ III 179, 184
Коннер (Conner R. MJ I 370; 11 410, 414
Коннор (Connor RJ III 327
Коннолли (Connolly R. EJ III 373, 402
Конопинска (Konopinska DJ V 340
Конрад (Conrad FJ II 442
Конрад (Conrad MJ II 276; IV 34, 36
Конрад (Konrad Pj [ 75
Конров (Conrow I<J I 124; III 469; IV 109
200
Константин (Constantin J. MJ III 11
Константине (Constantine D. AJ IV 232
Констас (Konstas SJ V 169
Констэбль (Constable E. W.) IV 72
Коптоии.ч (Kontowicz A. DJ III 145
Конья (Conia J.-MJ II 266, 289, V 401
Копеки (Kopecky J.) V 80, 196, 365
Копеланд (Copeland P. GJ III 53
Копенхавер (Copenhaver J. EJ IV 209
Копенхавер (Copenhaver J. WJ 1 253
Коппе (Корре VJ IV 84
Копренс (Coppens Gj III 320
Крппингср (Coppinger G. M.) I 188, 350;
II 103, 106
Коппл (Kopple K- D J I 303
Корана (Khorana H. GJ 1 237, 365. 374
381, 400, 421, 423, 427. 428; И 71, 247’
31 1, 467; III 144, 146, 309, 319, 375. 377;
V 222
Коранский (Koransky WJ III 126; V 360,
361
Корах (Korach Al J IV 201; V 314
Корбетт (Corbett G, EJ V 334
Корбетт (Corbett J. Fj V 318
Корбетт (Korbett R. E.) I 405
Корби (Corby N. SJ I 97
Корбин (Corbin T. FJ IV 215
Корелл (Corel 1 MJ II 29/
Коретт (Caret t RJ 11 70
Кори (Corey E. JJ I 40. 70. 142, 282, 303
335, 337, 344, 345,; II 159, 202,218, 270’,
273, 439; Ill 66, 68, 198, 201, 233, 241
247, 256, 261, 287. 290, 363, 366, 389, 390’
399, 406, 412; V 46, 47, 88, 89, 90 100
119—122, 135, 136, 139, 141, 143, 159
160, 163, 164, 167, 183, 193, 197 267,
270, 286. 302, ,304, 320, 329—331, '434 —
438, 491, 496 — 407,
Корильяно (Corigliano M. AJ V 222
Коритннк (Korytnyk Wj I 268; V 24
Корли (Corley R.CJ 1 345; V 143, 511
Корменди (Konnendy M. Fj 1 345, II 426;
III 432, 434; V 326
Корнблюм (Kornblnm N.) I 321, 334, 335,
350; II II, 12, 96, 97, 454, 456; III 271,
355, 417, 461; IV 17, 18. 98
Корнвелл (Cornwell D, GJ V 251
Корнелиа (Cornelia R. HJ V 497, 500
Корнелл (Cornell D.) IV 11
Корнет (Kornet M. JJ 1 392; Il 71; V 102
КорнфеЛЪд (Kornfeld E. CJ II 141; III 122,
123, 165, 167
Корнфорз (Cornforth J. WJ II 78 —80 89, 97,
267, 273, 372, 374; III 7, ID, 29, 30, 85,
91; IV 90, 181, 183, 220, 226
Корнфорз (Cornforth R. И.) III 29, 30, 85,
91, IV 90, 1 81, 183, 220, 226
Корозек (Korosec P. SJ I 318
Коррал (Corral R. Aj 1 126, ‘283; V 103
Коррейа (Correia J. S J I 334
Корсон (Corson В, В.) Il 210, 327, 374' 111
208; IV 36, 109
Корти (Korti Fj V 168, 339
Кортез (Kortez H. VJ I 167
Кортес. (Cortes GJ III 328
Кортиз (Cortege FJ I 130; II 330
Косматое (Cosmatos A J 1 401
Косовер (KosoWer E.M.) II 70; V 282, 284
Косолапов Г. M. I 378; V 304
Коссвиг (Kosswig KJ II 350
Костопаяаготис (Costopanagiotis AJ 1 211;
III 434
Костяновский P, Г. V 47. 113, 196, 276
Косырев Ю. M. V 169
Котера (Kotera KJ Il 179; V 246, 247
Коттейхан (Kottenhahn A. PJ I 248, 249
Коттер (Cotter R. JJ I 210, 382; II] 187;
IV 50, 165
Коттл (Cottle D. LJ IV 227, 228
Коул (Cole W. J J V 284
Коулее (Cowles E. Jj III 309
Коудкее (Koulkes MJ Ill 181, 184
Коулсон (Coulson D. RJ II 308
Коултер (Coulter A. WJ IV 126, 226
Коунселл (Connsell R.EJ III 195, 197
Коуп (Cope A. CJ I 69, 210, 227, 285, 321,
334; II 172, 178, 193, 195, 281, 374;
ill 70, 132, 144—146, 153, 172, 185, 187,
231, 232, 241, 3,54; IV 50, 92, 95, 226; V
147, 254, 256, 390, 393, 416, 502, 503
Коупер (Cowper R. MJ 1 54
Коутс (Coates G. EJ IV 119
Коутсогеоргопулос (Coutsogeorgopoulos C J
II 71
Кофлер (Kofler MJ II 137, 273
Кофод (Kofod HJ III 327
Коффен (Coifen D. Lj V 459, 460
Коффи (Coffey С, E.) Il 7
Коффи (Coffey R. SJ V 448
Коффи (Coffey SJ IV 198
Коффман (Coffman D, DJ I 66, 78; П 123;
III 263, V 326
Kox (Koch Hj II 331
Kox (Koch H. PJ IV 178
Kox (Koch H.-SJ V 270
Kox (Koch S. D.) ill 290
Kox (Koch W.GJ II 157
590
Кохсн (Cohen D.) IV 273; V 566
Кохен (Cohen F.) 1 350
Кохеи (Cohen S. G.) IV 30
Кохер (Kocher F. W.) I 125
Кохлин (Koechiin В. A.) 1 125; III 354
Кохмани (Kochmann F. L.) IV 24
Кохайд (Cochand Ch.) II 342
Кочетков H. К. I 361; Il 299
Кочешков К. A. I 401
Коли (Kochi J. К.) V 270, 271, 282, 284,
380, 384, 406, 407
Кошалка (Koszalka T. R.) II 216
Коши (Kochi J. К.) I 144; II 239, 241 346,
401; III 234, 241
Кошланд (Koshland D. E., Jr.) Ill 21
Коэн (Cohen A.) V 196, 251
Коэн (Cohen C. F.) V 393
Коэн (Cohen T.) I 103, 335; HI 114; V 129,
358, 344
Коэн (Cohen F, L.) Ill 131
Коэн (Cohen H.) Ill 40
Краак (Kraak A.) V 284
Краббе (Crabbe P.) IV 130; V 122
Крановер (Krakower G. W-) II 199; V 143
Крам (Gram D. J.) I 152, 166, 168, 248, 322,
334, 370; II 137; HI 48. 53. 306; IV 17,
20; V 388, 494, 495, 512, 513
Крамар (Kramar V.) HI 396
Крамблнсс (Crumblies A. I..) Ill 301
Крамер (Cramer F.) I 351; III 101, 444;
IV 52, 98
Крамер (Cramer R. D.) 1 291; HI 132
Крамер (Kramer B. D.) V 171
Крамер (Kraemer G.) Ill 357
Кранц (Krantz A. B.) Ill 283
Кранц (Krantz K- D.) 1 65, 66
Крапшо (Krapcho A, P.) I 110; V 194, 327
Крастес де Поле (Crastes de Paiilet A.) IV
226
Кратовнл (Kratovil E. J.) IV 156
Kpay (Crowe D. F.) V 429
Крауз (Crouse D.) V 163
Краузе (Krause FI. J.) 11 133
Краузе (Krause J. F.) I 167
Краузе (Krause R. F.) IV 52
Краусс (Krauss H.-L.) IV 173
Краут (Krauth C. A.) Ill 84
Крауфорд (Crawford M.) Ill 51. 53; V 345
Крауфорд (Crawford T- M.) V 236
Kpavm (Krausz F.) V 205
Крафт (Kraft H-) HI 202, 205
Крафт (Kraft L.) Ill 240
Крацер (Kratzer ,1.) Il 446
Крацер (Kratzer P.) IV 90
Кребс (Krebs A.) I 390; III 45”; IV 29
Кребс (Krebs L. S.) I 210
Кредель (Kredel J.) V 24
Крезге (Kresg? A. J.) V 520
Kpeit (Kraay R. J.) Ill 123; V 9, 357
Kpefi (Kray W. C., Jr.) IV 171
Крейсслер (Kreyssler H. A.) I 134
Крейтон (Creighton A. M.) I 413
Крейчи (Kraychy S.) IV 250
Кремер (Kremer С. B.) Ill 328
Кремер (Kramer 17. N.) 1 273
Кремер (Kramer G.) IV 26, 29
Кремер (Cremer S. E.) II 233, 401
Кремере (Kremers N.) II 42)
Кремли (Cremlyn R.J.W.) ill 29P, 301
Kpccnan (Krespan C. G.) 1 419,; Ш 242
318; V 184, 191
Кресс (Kress T. .1.) V 404
Крессмэп {Cressman H, W, J.) I 141; Ц 38
Кретц (Kratz O.) Ill 114
Кретчер (Cretcher L. H.) I! 414
Кретьен-Бессьер (Chrctien-Bessicre Y.) 1 268
Креше (Kresze G.) I 225; HI 345
Крёнке (Krohnke F-) 1J 59, 457, 458; 1Ц 370
Kpenep (Kroper Fl.) H 439
Кржиж (Kfiz J,) V 29, 143
Крзек (Krsek G.) I 286. 291; III 157, 166
Крзикалла (Krzikaila H.) I 105; III 313
Kpn (Cree G. M.) V 293, 294
Кривун С. В. IV 151
Криге (Criegee R.) I 253, 256; II 59, 100,
101; III 41—43, 46, 67, 216 219 220 222,
225, 239, 240. .316, 31 8
Крикорян (Krtkorian S. E.) Ill 448
Крнмен (Rrimen L. I.) V 480, 482
Криммви (Crimmin W, R. С.) II 70
Кринер (Criner G, X.) HI 240
Kpниццкая JI. A. V 155
Кривицкий (Krynitsky J. A.) I 285; Il 129;
III 31, 335; IV 109
Kpuntic (Cripps H. N.) I 34
Кристенсен (Cristenscn J. E.) V 460
Кристи (Christie B. J.) 1П 157
Кристи (Christie S. M. H.) I 258
Кристманн (Christmann «. F.) I 168
Кристол (Cristol S. J.) Ill 186, 187; IV [75;
V 213, 214
Кричевский (Kriichevsky T. H.) I 125; III
354
Кричелдорф (Kricheldorf H. R.) V 442
Кричио (Cricchio R.) V 183
Кроветти (Crovetti A. J.) Ill 67; IV 105,
109
Крокер (Crocker R. E.) II 262
Кроксол (Croxatt W. J.) V 208
Кромби (Crombie L.) I 247, 248; II 220, 226
Кромвелл (Cromwell N. FI.) Hl 271, 320;
IV 17; V 393
Кронин (Cronin C. J.) H 109; IV 185
Кропп (Kropp P. J.) Ill 366
Кропп (Kropp J. E.) V 213
Кросби (Crosby D. G.) II 350, 351; HI 328
Кросс (Cross A. D.) I 301, 413, 433; IV 130,
151; V 38, 174, 386, 401
Кросс (Cross В.) II 346
Кросс (Cross В. E.) Ill 260; V 343
Кросс {Cross G. W.) I 404
Кросс (Cross L.C.) HI 3,39
Кросслен (Crossley F.) II 290 '
Кроссли (Crossley J.) 11 220, 226
Кроссли (Crosslev N, S.) II 150
Kpoy (Crow W. Ь.) П 17
Кроули (Crowley B. R.) I 147
Кроули (Crowley G. P.) Il 334, 335
Кроули (Crowley P. J.) I 12; IV 6
Kpoymoy (Crawshaw A.) I 41
Крофте (Crofts P.C.) IV 42; V 361, 491
Крубер (Kruber О.) II 105, 107
Крузе (Kruse C. \V.) II 72, 108, 109, 218
Крук (Knick K.-H.) II 308
Крук (Knick P.) Ill 240
Крукшанк (Cruickshank P, А.) Щ 118, 149,
367; IV 254; V 564
Крумкалнс (Krumkalns E. V.) I 9
Крути (Krutzsch H. С.) V 445, 447
Круцбергер (Kreutzberger A.) V 430
Крэг (Craig D.) I 54; II 245, 335; IV 201
Крэго (Cragoe E. J.. Jr.) HI 293
Крэйг (Craig C. A.) Ill 420
Крэйг (Craig J.C.) II 140, 141; HI 25
Крэйн (Crane K- F) I 37a
Крэндолл (Crandall J. Кб П 195, 456; IV
179; V 254, 256. 310. 312, 314
Крэнфорд (Cranford G.) V 82
Крюгер (Kruger C. R.) HI 386
Крюгер (Krueger P. A.) II 41
Крюк (Knick K.-H.) HI 412
Крюрке (Kriierke U.) 1 291
Ксуонг (Xuong N, D.) HI 167
Ky'(Koo J.) HI 107, 135, 139, 145; V 510
oil
591
Куадриелло (Cuadrieilo D.) I 433; IV 151;
V 174
Куарт (Kwart H.) I 179, 396
Кубик (Kubik D.) I 247
Кувабата (Kuwabata N.) V 200
Куваджима (Kuwajima 1.) 1 258
Кувильон (Couvillion J. L.) V 254
Кугита (Kugita H.) 1 70
Куен (Kuehne M. E.) I 110; II 14, 145; V
407
Кузима (Kuzima T.) V 495
Кук (Cook C. D.) IV 104, 109, 209
Кук (Cook A. F.) V 131, 527
Кук (Cook С. E.) I 345; V 143, 511
Кук (Cook F.) V 429
Кук (Cook H. G.) I 376, 436
Кук (Cook J. W.) IV 100, 101; V 348
Кук (Cook P. L.) II 435
Кук (Cook P. F. E.) I [22; III 444
Кук (Cook N. C.) Ill 382, 383
Куке (Cooke G. В.) IV 22
Куксон (Cookson R. С.) I 15, 73, 419; II 5,
6, 439; IV 47; V 191, 494
Кула (Kuhla D. E.) V 216
Кулен (Kuhleii L.) IV 151
Кули (Cooley G.) V 215
Кулкарни (Knlkarni А, В.) II 178
Кулкарни (Kulkarni G, H.) V 386
Кулл (Kull H.) Il 370
Куллцнейн (Kull inane N.M.) Ill 28 30
344; IV 61
Кульгеп (Culhane P. J.) II! 184
Кулька (Kulka M.) I 50, 54
Кумай (Kumai M.) I 24
Кумамото (Kumamoto T.) HI 469
Кумбс (Coombs R. V.) I 413
Кун (Kuhn L.P.) Ill 221, 222, 240
Кун (Kuhn M.) I 380
Kyn (Kuhn R.) I 37, 318, 334, 345, 348, 350,
387, 388, 396, 398; H 137, 278. 279; HI
64, 67, 104, [07, 203 — 205, 207, 208 386'
IV 83, 222, 226, 227
Kyn (Kuhn 8.) II 458; III 266
Кун (Kuhn S. J.) I 76, 90, 92, 1 12, 285; II 461
464; HI 266, 306; IV 76; V 336, 337, 482 ’
Кун (Kuhn W. E.) IV 226
Куидигер (Kundiger D.) I 155, [67
Кунонг-Хью (Khunong-Huu Q.) v 81
Кунц (Kuntz I.) I 392
Kyo (Kuo С. H.) П 106, 409; Ill 205; V 127,
251, 252
Kynac (Cupas С.) V 9
Kynac (Cupas С. A.) IV 119
Купер (Cooper D. J.) V 321
Купер (Cooper F. С.) I 54
Купер (Cooper G. D.) IH 343, 344; V 421
Купер (Cooper J. A.) ] ] I 330, 335
Купер (Cooper S. R.) IV 209
Купман (Roopman H.) Il 12
Купчик (Kupchik E. J.) Ill 373, 402
Купшан (Kupchan S. M.) 1 186; III 322, 328
Курат (Kurath P.) I 178
Курдювель (Courduvclis С.) V 90
Курков (Kurkov V.) I 379
Курпюн (Kurpjnn C.) HI 101
Куртин (Conrtin A.) V 54, 429
Куртис (Curtis О. E.) II 262
Курц (Kurtz J.) Ill 276
Курц (Kurtz P.) 11 246
Курц (Kurz M. E.) I 280; V 110, 116, 308
Курцер (Kurzer F.) 11] 207, 335; IV 46 187
Курциус (Clirtius T.) V 98, 419
Курниус (Curtins Th.) Il 360, 362; 111 357
Кутнер (Kutner A.) II 448, 45G
Кутни (Kjitney J. P.) Ill 178, 184; IV 226;
V 261
Кушинг (Cushing 1. В.) IV 156
Кушинг (Cushing M. L.) I 18
Ку шинке (Kuchinke E.) II 80
Кэвилл (Cavil! G. W. K.) Ill 213, 240
Кэди (Cady G. H.) V 241
Кэзлоу (Kaslow С. E.) 1 285; II 326, 352,
354
Кэйбл (Cable J.) V 26]
Кэйв (Cava M. P.) I 174, 390; 11 276; III 62,
67, 360, 435; IV 18, 49,61, 102,103, 126-
V 423, 514
Кэйд (Cade J. N.) Ill 301
Кэйзи (Casey C.) Ill 434
Кэйзи (Casey С. P.) V 220
Кэйи (Cain B, F.) Il 55
Кэйн (Cain E. N.) V ЗЗЭ
Кэйн (Caine D.) V 176
Кэйн (Cain M. E.) II 311
Кэйн (Капе V. V.) V 95
Кэйнелли (Caiiielli G.) I 241; V 292, 293
Кэйрнс (Cairns T. L.) I 196, 317
Кэйс (Cais M.) V 421, 423
Кэмбл (Gamble R.) V 517
Камерон (Cameron P. J.) V 535
Кэмпбелл (Campbell В. К.) I 24. 62, 66, 78
Кэмпбелл (Campbell В. N., Jr.) I 39
Кэмпбелл (Camphell C. D.) 1 215; III 238,
242
Кэмпбелл (Campbell J. A.) IV 63, 130
Кэмпбелл (Campbell I.O.) II 229, 230
Кэмпбелл (Campbell l.M.) V 183
Кэмпбелл (Campbell J. R.) V 214, 405
Кэмпбелл (Campbell J. R. В.) 1 121* HI
319
Кэмпбелл (Campbell K. N.) I 19, 24 62,
66, 78; 11 272, 274
Кэмпбелл (Campbell S. F.) V 284, 548
Кэмпбелл (Campbell T. W.) I 384, ,392 427;
II 104, 107; III 11. 12, 412; IV 237
Кэмпбелл (Campbel! W. P.) Ill 458
Кэмп (Camp R. L.) V 313, 314
Кэмпорие (Kampouris E.M.) I 106
Кэндил (Kandil S, A.) V 681 71
Кэннон (Cannon G. W.) II 301
Кэнтоии (Canton! G. L.) HI 285
Кэнтрилл (Cantrill ,1. E.) I 188
Кэнтролл (Cantrail E- W.) II 159; HI 397,
399
Кэткарт (Cathcart J. A.) I 54
Кэтч (Catch J. R.) II 109
Кэхилл (Cahill W. M.) II 127, 129
Кювила (Kuivila H. G.) I 395, 397; HI 372,
373, 402; V 432
Кювиньи (Cuvigny J.) I 195
Кювиньи (Cuvigny T.) 1 195
Кюле (Ktthle E.) Ill 261
Кюнг (Kiing F. E.) II ]28, 129
Кюиг (Kiing W.) IV 137
Кюипсрс (Kiippers H.) II 255, 256
Лабз (Lubs H. J.) V 270
Лаблер (Labler L.) IV 155
Лавагнино (Lawagnino E. R.) Hl 172
Лавессон (Lawesson S.-O.) I 90, 98, 100.
144, 286, Il 346; III 150, 301; IV 192;
V 311
Ладе (Lahde E.) 1 427
Ладенбург (Ladenburg К.) II 421
Ладпш (Ladisch G.) V 27
Лазаров (Lasarov D.) V 259
Лаззелл (Lazzelle C. L.) IV 264
Лайл (Lyle G. G.) Ill 370
Лайл (Lyle R. E.) HI 370
Лайман (Lyman R. L.) I 318
Лаймон (Limon D. С.) 1 413; IV 144. 151
Лайпбек (Lineback D. R.) HI 187
Лайкен (Lynen F.) Ill 126
Лайонс (Lyons J, A.) I 396
Лайонс (Lyons J. E.) Ш 383
592 -
Лайр (Liehr J. G.) V 76
Лайр (Lier E. F.) V 383, 384
Лайт (Light R. KJ 1 183, HI 173
Лайтфут (Lightfoot E.N.J ]] I 2/9
ЛаЛовд (LaLonde) [I 3’4; IV 183
Лак (Luck J. MJ ] 136, 137
Лак (Lack R. E.) Ill 25; V 40
Лакасс (Lacasse G.) V 237
Ламб (Lumb J. T.) V 61, 66
Ламберт (Lambert B.F.) I 110: II] 241
Ламберт (Lambert R.F.) II 150
Ламменс (Lammens H.) II 11; V 544
Лампман (Lampman G. MJ V 281
Ланг (Lang D.) IV 201
Ланг (Lang J.) 11 66, 70
Ланг (Lang WJ I 305; II 446; V 506
Ланге (Lange R.G.) i 50, 54
Ланге (Lange R. MJ V 459
Лангенбек (Langenbeck WJ 1 21, 24
Лангеманн (Langemann A.) 11 137; V 78,
386
Ланглей (Langley W. D.) I 138, 252; Il 12 5;
IV 72
Ланглуа (Langlois D. P.) JI 235
Лангхсльд (Langheld KJ Ш 146, 148
Лангхэм (Langham WJ II 141. 285
Ланда (Landa SJ Ill 327
Ландауер (Landauer S. R.) Ill 416, 417
Ландграф (Landgraf F. WJ ] 427; V 44 205
Ландесберг (Landesherg J. MJ V 399
Ландесман (Landesman H.) 11 316; III 129
Ландесман (Landesman H. RJ HI 241
Ландис (Landis P, W.) IV 151; V 174
Ландольт (Landolt F.) II 326
Ландор (Landor P. DJ II 246; III 417; IV
205; V 5.50
Ландор (Landor S. R.) I 118; II 246; III 416,
417; IV 205,V 142, 143, 249, 456, 509. 5b0
Ланзилотти (Lanzilotti A. E.) HI 367
Ланк (Ltink H. EJ V 214
Ланкелма (LankeJma Fl. PJ I 196
Ланс (Lance D. GJ V 333
ЛенфорД (Lanford R. В.) I 369
Ланц (Lanz PJ V 419
Лаос (Laos 1 J 11 426
Папидо (Lapldot Y.) 1П 319
Лапин (Lapin HJ Ill 301
Лапинский (Lapinski R. LJ II 59
Лапкин (Lapkin M.) II 109
Лапперт (Lappert M. FJ I 117, 1 ]8; V 114
Ла Праде (LaPradc J. EJ Ill 448
Ларбер (Larber M. E.) IV 213
Лардон (Lardon A.) I 126; II 330; HI 18,
437, 443
Ларкин (Larkin J. MJ 11 16; V 206
Лазаров (Lasarov D.) V 259
Ларсен (Larsen A. A.) V 251
Ларсен (Larsen E. H.) I 90, 100; IV 192
Ларчевек (Larchevcque M.) V 80
Ларсон (Larson J. KJ V 144, 554
Ласковский (Laskowski S. С.) II 290
Латем (Lalham FL G., Jr.) I 24, HI 19, 21
Латем (Latham R.A.) V 273
Латоретт (Latourctte И. Rj II 290
Лау (Lowe G.) IV 132
Лаубах (Laubach G, DJ HI 279; IV 129
Лаунер (Laiiener H.) II 59
Лаури (Lowry B. R.) 1 144
Лаури (Lowery M. R.) V 429
Лаури (Lowry N. NJ V 432
Лаутепшлагер (Lautensch Iaeger F.) Hi 261
V 387
Лаутербах-Re ft л (Lauterbach-Keil G.) Ill
240
Лауэр (Lauer W. MJ IV 18, 22
Лахи (Lahey F, N ) V 360
Лахман (Lachman A.) I 218
Лебеф (Leboeuf M.) V 81
Лебл (Loebl HJ 111 83
Леваль (Lcval L.) V 230
Левассер (Levasseur L, A.) I 421
Лсверинг (Levering D. R.) IH 166
Леви (Levy D.) HI 413. 415
Леви (Levy G.) Ill 307. 308
Леви (Levy L. A.) II 39, 40; V 90, 211, 212
Леви (Levy N.) I 24
Левин (Levine J.) IV 210
Левин (Levine R.) V 510
Левин (Lewin N.) 11 306
Левин (Levin N.) I 177
Левин (Levcne P. A.) IV 226; V 273
Левин (Levine R.) 1 66. 112, 280,291, ]| 230,
274, 404; III 396, 399, 422
Лепин (Levine R. HJ I 1/0, 173
Левин (Levine S. G.) I 77; [I 307, ,308; Ill
320
Лешшский (Levinsky J, A.) Ill 368
Левинсон (Levinson A. S.) I! 133, 199; Ш
129
Левиятов (Levintow L.) IV 165
Левис (Levis W. \V., Jr.) V 146
Леггатт (Leggatt TJ V 66
Леггеттер (Leggetter В, EJ I 206, 210
Легер (Legcr F.) II 4l
Ле Гофф (Le Goff E.) 1 327, 334, 391; II 99,
107, 109, HI 287, 290
Ле Грас (Le Gras J.) V 338
Ледерер (Lederer E.) II 14; V 135, 143
Ледерер (Lederer KJ I 397
Ледерман (Lederman I.) I 41
Леджер (Ledger R.) IV 261; V 45
Ледницер (Lednlcer Dj HI 152, 153, 171,
172, 309
Ледхегенер (Liedhegener A.) V 423
Лезноф (Leznoff С. С.) V 309
Лейбе (Leube H.) HI 413
Ленбпер (Leubner G. W.) I 193; Ш 374
Лейве (Laves FJ II 320, 326; IH 325, 327
Лейксенринг (Leichsenring G.) 11] 84
Леймгрубср (Leirngruber WJ I 167
Лсйрд (Laird A. HJ II 468; Ill 391,449
Лейсестср (Leicester J.) 11_ 109; IV 258
Лейстер (Leister HJ I 3/6
Лейтч (Leitch L. CJ V 46
Лейх (Leigh F.) 1 231, 238; III 301
Лейшон (Leyshon D. MJ Ill .344
Леклерк (Leclerc J.) V 479
Лекомтс (Lecomte J.) I 125
Леке (Lex C. GJ 11 38
Лемал (Lemal D.MJ II 5, 6; III 265, 266:
V 416
Леман (Lehmann G.) I 87; V 50
Леман (Lehmann H. G.) I 345; V 143
Ле Man (Le Men ,1.) V 487, 540
Ле Матье (Le Mathieu R.) Il 46
Лемин (Lemin A. J.) IV 178
Лемкуль (Lchmkuhl H.) Hl 376, 451
Леммерман (Lemmerman LJ I 62, 66
Лемье (Lemieux R. UJ I 127; II 456; III
86, 88, 91, 92; V 352
Ленард (Lenard J.) V 511
Ленгьедь (Lengvel 1.) 1 164, 168
Ленк (Lenk C, TJ II GO, 61
Ленхард (Lenhard R. H.) 1 10, 350: II 214;
III 46; IV 90, 184, 232; V 183
Леонард (Leonard J. A.) 1 18
Леонард (Leonard N. J.) I 149, 166, 246,
248; II 157, 158; Ill 86, 91, 177, 184;
V 52, 56, 232, 351
Леопардт (Leonhardt MJ II 428
Леоне (Leone R. E.) I 370
Леплейвц (Leplawy M. TJ Ill 388; IV 19]
Леп.пи (Lcpley A. R.) V 66
Лерже (Lergier WJ V 155
ЛернвсренД (Leriverend P.) IV 261
Лернер (Lerner L, M.) I 316
593
Лернер (Lerner L. I?.) V 459
Лерх (Lercli A.) 1 175
Лерх (Lerch В.) I 365
Лерфельд (Lehrfeld J.) V 456, 457
Леско (Lesko P, M.) V 136
Леспио (Lespieau R.) I 66
Лессли (Lesslie T. E.) I 79
Ле Сюер (Le Suer W,M.) Ill 272, 276, 296
Лето (Leto J, R,) III 369
Лето (Leto M. F.) HI 369
Летсингер (Letsinger R. L.) 1 370, 392; II
69, 71; III 135, 145; V 233, 235, 365, 525.
526
Леттерс (Letters E. В.) I 175
Леттерс (Letters R.) HI 283
Леупольд (Leupokl E.) II 430
Лефар (Lefar M-) Il 353
Лефорт (Lefort D.) V 131
Леффертс (Lefferts E. В.) 1 176, II !3f, 141
Леффлер (Leffler J. E.) 1V 151
Леффлер (Loeffler L. J.) [ 85
Леффлер (Leffler Л4.) 1 91
Лёблих (Loeblich V. M.) V 26, 123, 355
Лёвенфельд (Lbwenfeld R.) 1 376
Лёкен (Loken В.) I 69; И 27. 301
Лем (Lhomme J.) V 409, 411
Лёхель (Lochel W.) 1 402
Ли (Lee С.) II 158
Ли (Li С. H.) I 141; IV 268
Ли (Lee F. T.) I] 155
Ли (Lee H. H.) V 21
Ли (Lee J.) I 35/
Ли (Lee J. B.) Ill 41Q; V 456
Ли (Lee V,) V 95
Ли (Lee W. H) V 39,3
Ли (Li T.) V 548
Лианг (Liang P.) 1 31; HI 308
Либек (Leaback D, H.) IV 160
Либенов (Liebenow W.) I 385
Либер (Lieber E.) HI 114. 166; IV 28, 29
Либерек (Liberek В.) Ц 197 199; V 192
193 ’
Либерман (Lieberman С.); V 106, 108
Лнберманн (Liebermann D.) П 300
Либерманн (Liebermann L.) ]V 156
Либиг (Liebig J.) V 82
Либиг (Liebig R.) V 177
Ливингстон (Livingston A. L.) I 318
Ливингстон (Livingston J, R.) I 334
Ливитт (Leavitt J. J.) Ill 145
Лившиц (Liwschitz Y.) I 94; Ill 84
Лиггетт (Ligett W. R.) II 227
Лндайте (Lydrate J.) V 328
Лидделл (Liddell H. G.) IV 214
Лидер (Leader H-) II 401
Лидииг (Leeding M. V.) V 355
Лидс (Leeds N. S.) IV 226
Лиз (Leese C. L.) 11 76
Лиз (Lease M. F.) I 282
Лик (Leacke P. H.) V 46
Лил (Leal J. R.) II 301
Лиллис (Lillis G. A.) II 455
Лильен (Lillicn I) 1 335, 391; I] 99
Лимассе (Limassct J.-C.) V 289, 401
Лимборг (Limborg F.) II 216
Лиминг (Leeming M. R. G.) V 361, 362
Лин (Lin L.-H. С) V 256
Лин (Lin Y.-T.) V 66
Линаре (Linares H.) I 88
Линге (Linge H.) Ill 313
Линд (Lind F. R.) TV 81
Линд (Lind H.) V 11
Линдберг (Lindberg В.) V 131, 133, 488
Линде (Lynde E. J.) I 413
Линдеман (Lindemann H.) 11 463
Линденберг (Lindenberg E.) Ш 134
Линденманн (Lindenmann A.) I 40; Ц 39L
III 78
Линдлар (Lindlar H.) II 136, 137; III 354;
IV 253, 267
Линдсей (Lindsay D. G.) IV 122
Линдсей (Lindsay J. К.) 1 58
Линдсей (Ljndsay R. О.) II 420; IV 29
Линдсей (Lindsay W. 5.) V 414
V 368
Линдсей (Lindsey R, V., Jr.) 1 34; 111 132;
Линдстром (Lindstrom E. G.) I 219
ЛипДхард (Lindhard M.) II 44
Лини (Leeney T.) Ill 460, 461
Линк (Link К. P.) 1 221
Линке (Linke S.) V 98
Линкольн (Lincoln D. N.) IV 119
Линкольн (Lincoln F. H., Jr.j) II 353; III
291; V 386, 556
Линн (Lirin В о.) II 401
Линсерт (Linsert О.) ПТ 183. IV 227
Лицстед (Linstead R. Р.) I 396, 412, 413‘
И 250, 320, 326. 414, 111 18, 49, 53, 449,
450; [V 78, 81, 132
Линч (Lynch В, M.) Ill 276, 277
Линч (Lynch Р. Р.) II 183
Линческй (Lyncheski А. М.) 11 118
Липинский (Lipinski М.) II 335; IV 90;
V 68
Липкалис (Liepkalns V. А.) Ш 368
Липкин (Lipkiii D.) II 359; V 491
Липп (Lipp И.) IV 90
Лирмакерс (Leermakers Р. А.) V 466
Лисси (Lyssy Th. М.) И 358, 359
Листер (Lister J, И.) 1 360
Листон (Liston A, J.) V 320
Лигван (Litvan F.) II 17
Литго (Lythgoe В. J.) Н 177, 179, 212, 213
Лите (Leete J. F.) IV 17
Литл (Ljtle R. L.) 1 210; III 360: IV 126
Литтелл (Littell R.) II 388; П1 46, 253, 256,
354; IV 90
Литтл (Little Е, L.) Ill 318
Лиу (Liu J. S.) Ill 241: IV 119
Лиу (Liu Т. М.) I 351; II 311
Лиу (Lin W. R.) I 141
Лихтенхаллер (Lichtenhaier F. М.) II 461,
462
Ллойд (Llyod Е. Т.) III 344
Ллойд (Lloyd Р. F.) И 461; V 156
Ллойд (Lloyd W. D.) I 67
Ло (Law Н. D.) П 444; III 421; IV 175 268
Ловель (Lovell В. J.) I 41
Ловель (Lovell С. Н.) V 508
Левенталь (Loewenthal Н. J. Е.) V 530
Ловцова А, Н. IV 53. 56
Логан (Logan Т- J.i V 431
Логеманн (Logemann W.) И 129
Лодер (Loder J. W.) II 97; III 260
Лодз (Lods L.) V 384
Лоев (Loev В.) I 345, 377; Ц 70 249,
III 432, 434; V 286, 326
Лоев (Loew G.) Ц 178
Лоза (Loza М. С.) Ш 243
Лок (Lock М. V.) 11 281
Локе (Locke D. М.) I 435; II 316, 353; IV 179
Локе (Locke J. М.) III 241, 323
Локхарт (Lockhart L. В., Jr.) 1 54; IV ] 13
Лола (Lola L. I<.) V 308
Ломас (Lomas D.) V 462
Ломбард (Lombard R.) 11 314
Ломбардино (Lombardino J. G.) Ц 403
Лонг (Long A. G.) П 38, 99, 114, 275 276
414
Лонг (Long F.A.) Ш 261
Лонг (Long J. W,) I 127
Jlonr(Long L,, Jr.) I 130. 334; V 267
Лонг (Long L. H.) 1 268; V 320
Лонг (Long L.M.) I ]93
594
Лонг (Long N, H.) II 388
Лонг (Long RJ V 174, 346
Лонге-Хиггинс (bouquet — Higgins H. C.)
V 275
Лонгли (Longley R. 1., Jr.) I 227; И 235,
274; HI 166
Лонгон (Longone D. T.) Ill 318
Лонгс'гафф (Longstaff P. A.) IV 158; V 454
Лонгхид (Longheed G. S.) Ill 296; V 405
Лопез (Lopez I. C.) Ill 166
Лопикес (Lopiekes D. V.) Ill 290
Лорбер (Lorber M. EJ V 216, 429
Лоренц (Lorenz D. H.) Ill 402
Лоренц (Lorenz M.) IV 155
Лоренц (Lorenz О J Ill 412
Лоренц (Lorenz R. RJ IV 197
Лоренци (Lorenzi G. PJ I 278
Лоретги (Lorette bl. BJ 1 272, 363; II 64,
70
Лоринг (Loring H. S.) I 330
Лорман (Lohrmann RJ HI 319, 377
Лосе (Losse Gj I 393, 394, 436; IV 162
Лотспейч (Lotspcich F. J.) IV 52
Лоу (Loo S. N., V 4 58
Лоу (Low I.) II 281
Лоунасмаа (Lounasmaa AL) V 486, 487
Лоуренс (Lawrence R. Vj 1 67; V 26, 122,
123, 224, 355, 558
Лоусон (Lawson A.) IV 187
Лоусон (Lowson J. E.) Ill 241
Лоусон (Loawson R.) Ill 62, 67
Лоусон (Lawson W- В.) Il 62
Лоутон (Lawton E. Aj I 356, 357
Лоуфер (1.outer D. A.) V 565
Лоухид (Lougheed G. S.) V 405
Лохаус (Lohaus GJ V 522
Лохаус (Lohaus H.) 11 104, 106
Лохмар (Lohmar R. L.) IV 91
Лошуа (Loshua S. С.) 1 130
Лувиси (Luvisi J, P.) II 470
Лук (Look M.) V 82
Лукас (Lukas GJ I 286; III 335
Лукас (Lucas G. B.) Ill 426, 431
Лукас (Lucas H. J.) 1[ 42, 43, 54, 57, 53;
111 267, 271; IV 25, 265; V 547, 548
Лукас (Lucas R. A.) Ill 145
Лукашевски (Lukaczewski HJ I 464
Лукер (Looker J. HJ V 208
Лукес (Lukes R.M.) 1 167, 256; IV 372
Лунд (Lund H.) II 208, 210; IV 165
ЛунДин (Lundeen A. J.) Ill 367
Лунн (Lunn W. H. W.) I 335
Луск (Lusk D. 1.) Ill 30]
Лустиг lLustig MJ V 457
Луц (Lutz E, F.) Ill 33, 344; IV 205
Луц (Luiz W. B.) Hl 309, 310
ЛьвовсКл (Lwowski WJ II 445; IV 9, II;
V 334
Льюис (Lewis A.) Ill 256
Лыоис (Lewis B. A.) ]] Il
Льюис (Lewis В. B.) Ill 201
Льюис (Lewis G. S.) j 303
Льюис (Lewis J. RJ 111 204, 205
Льюис (Lewis J. W.) I 268; II 183
Льюис (Lewis R. G.) V 78, 80
Льюис (Lewis R. L.) I 273
Льюис (Lewis R. N.) 1 33
Льюис (Lewis T. В.) II 150
Льюис (Lewis T. K.J III 149
Льюис (Lewis W. P. GJ III 412
Лэдбури (Ladbury J. WJ II 97
Лэдиш (Ladisch Cj V 2/
Лэдкани (Ladkany D.) V 74
Лззнр (Lazier W. А.) II 226, 234, 235
Лэйк (Lake D. E.) 1 38
Лэйкман (Lakeman J.) I 15
Лэмб (Lamb R. CJ I 388
Лэнгдон (Langdon J.Mj 1 357
Лэнгфорд (Langlord R. B.) Ill 294, 296
Лэнсбури (Lansbury R. T.) I 16; II 183 —
185; IV 183; V 187
Лэнфер (Lanpher E. JJ IV 48
Лэць (Laing S, В.) V 543
Лэпуорс (Lapworth AJ JJ 92, 97; III 283
Лэсй (Lecey A. BJ IV 248
Лэси (Lacey R, NJ I 286; II 129
Лю (Lew H. Y J II 38
Любарт (Lewbart M. L.) Il 230; IV 32, 36;
V 476 — 478
Людвиг (Ludwig WJ III 241
Людериц (Liideritz О J I II
Люенз (Lewenz G. FJ III 383
Люйтен (Lujlten J. С. A.) II 238; III 32,402
Люкинг (Hiking M.) II 121
Люкке (Lucke В.) V 50
Люкке (Lucke E.) I 210; II 316; HI 354;
IV 197
Люсье (Lucier J. J J 1 318
Лютгрингхаус (Liittringhaus А.) II J41, 337,
338, 342; III 307; IV 227
ЛютЦ (Lutz R. EJ I 258
Люциус (Lucius GJ Ill 184
Ляви (Lavie t>j I 186; V 536
Ляппорт (Lapporte S. LJ III 166, 167
Ляпьер (Lapierre J. Cj II 459
Лярраби (Larabee R. RJ II 187
Ля Флямм (La Flame P. MJ I 175; II
285; V 314
Ля Форм (La Forge F. В.) IV 135, 137
Ma (Ma S-Yj II 136
Ma (Ma VJ IV 79. 81
Maae (Maas S. P. J J IV 183
Мабри (Mabry T. JJ V 226, 495
Маггьюлли (Magqiulll С, А.) V 501
Магерляйн (Magerlein B. JJ II 288; Ш 99,
256
Маграт (Magrath D. 1.) I 97
Магун (Magoon E. FJ V 247
Мадден (Madden D.AJ 1 112
Мадер (Mader W. J.) HI 302
Маеда (Maeda S.) 11 376
Мазумдар (Mazumdar B. N. GJ II 70
Мазур (Mazur R. HJ II 30; III 23; V 547,
548
Мазур (Mazur YJ I 1 16, 268; Il 1 13, 114,
187; III 256; IV 274; V 30, 386, 556
Мазурек (Mazurek MJ 11 206
Май (Mai J.) IV 96, 98
Майер (Mayer H.) IV 268; V 566
Майер (Mayer RJ I 350; II 106
Майер (Mayer R. LJ I 58
Майер (Mayer R. P.) 1 176
Майер (Mayer LL) H 34G
Майер (Mayer W.) I 390
Майерс (Myers T. CJ IV 201
Майерус (Majerus Gj V 259
Майло (Mylo В J JI 216
Майлс (Miles DJ I 193
Майлс (Miles G. B.) III 84
Майлс (Myles J. RJ 1 430
Майлс (Miles M. Lj II 401; III 412
Майо (Mayo F. R.) I 98, 100, 107
Майо (Mayo J.) IV 7
Майтте (Maitte PJ V 2/5
Майчил (Micheei F. ) 1V 155
Мак RMack WJ V 326
Макар (Makar S.MJ IV 153
Макаров В.A, V 169
Макартни (Macartney J. HJ II 316
Мак-Артур (Mc.Artur R. EJ II 156, 157
Маната (Makata HJ V 362
Мак-Би (McBee E. TJ 1 364, 376, 377’ Il
61; III 296, 313; V 82, 215
Мак-Брайд (McBride J. A, HJ I 363 413,
595
Мак-Врайд (McBride J.M.) I 144
М;;к-Гарен (McGahren W. J.) V 208
Мак-Гари (McGary C. W., Jr.) V 520
Мак-Ги (McGhie J. F.) HJ 167; IV 175; V
383, 384
Мак-Ги (McGee J, J.) II 133
Мак-Гнпн (McGinn F. A.) ]V SO
Мак-Гире (McGuire S. E.) ill 145
Мак-Глоттен (McGlotten J.) II 14
Мак-Гоисрн (McGowern T. P.) II 223, 226;
V 263
Мак-Гон лгал (McGonigal W. E.) 1 335
Мак-Грегор (McGregor A. С.) 1 177, 438
Мак-Грегор (MacGregor P.) HI 99
Мак-Грир (McGreer D. Г,.) IV 260, 261
АЛак-Гукин (McGuckin VV. F.) IV 1?3
Мак-Дональд (McDoimkl С.) V 3u9
Мак-Дональд (McDonald P. M.) V 429
Мак-Донпльд (McDonald R. N.) 1 370, 380,
384; JI 104, 107; ill 16. 19, 412; IV 237;
V 153, 318, 519
Мак-Доуелл (McDowell J. W.) I 302; III
379
Макензи (Mackenzie К.) IV7 59
Микерджи (Mukherjee S. L.) II 266, 267
.Макерджи (.Mukherjee T, К.) I 421
Маки (Maki V.) V 564
Маки (Mackie R. K.) Hl 468; V 470
Макин С, M. Il 216
Мак-Нптош (McIntosh A, V., Jr.) 1 173
Макисуми (Makisumi S.) V 156
Макита (Makila M.) I 189
Мак-Калеб (McCaleb К- E.) JI 273; IV 250
Мак-Каллум (McCallum K. S.) II 463; Ш
443
Мак-Кэнтс (McCants D.,Jr.) 1 23, 24, 174;
III 91
Мак-Карти (McCarthy E.P.) HI 295
Мак-Каскер (McCusker P. A.) Ill 372
Мак-Касланд (McCasland G.E.) Il 55; V 396,
397
Мак-Катчс1[1 (McCutcheon J. \V)1V 214
Мэк-Кннллии (McQnillin F. J.) I 97; И 273;
IV 226; V 257, 453
Мак-Kefi (McKay A. F.)I 247; II 297; IV 139,
168
Мак-Кей (MacKay D. D.) H 410
Мак-Кен (McKay F. C.) fV 201
Мак-Кейн (McCain G. H.) 11 71
Мак-Келви (McKelvie Is’. ) I 416; V 239
Мак-Кензи (McKenzie В.) I 130’ III 290,
291
Мак-Кензи (McKenzie B. F,1 Il 136; Ш 208,
256, 278; IV 226
Мак-Ken на (McKenna J.) IV 226
Мак-1\еппа (McKenna J. F.) 1 112
Мак-Кеоп (McKeon T. F,, Jr.), IV 258
Мак-Керни (McKeryey M. A.) V 256
Мак-Керти (McCarthy W-C-) 1 193
Мак-Киллоп (McKHiop A.) 1 394; III 65,
68; V 56 1 —564
Мак-Клан ax ан (.McClanahan J. L.) IV 10]
АЛак-Класки (McCluskey J.G.) V 529
Мак-Клепагап (McClenaglian I.) V 362
Мак-Клоски (McCloskey A. L.) H 22, 217;
IV 166, 278
Мак-Клур (McClure J. D.) HI 68, 427, 431
Мак-Кой (McCoy L, L.) I ]37; II 396, 401
Мак-Кольм (McColm E. M.) I 226
Мак-Комби (McCombie H.) I 435
Мак-Конаги (MeCoriaghy J. S., Jr.) V 334
Mak-Коркденл (McCorqiiodale D, J.) V 527
Мак-Коркдепл (McCorquodale D. W.) IV 156
Мак-Коркпндэпл (McC.orkindale N. J.) V I83
Мак-Кормак (McCormack W. В.) II 59 286;
HI И
Мак-Коринн (McCormick J.) Ill 260
Мак-Крае (McCrae W.) II 228, 246
Мак-Криди (McCready R. M.) II 281
Мак-Криндл (McCrindle R.) 1 256
Мак-KvsMK (McKusick В. С.) I 196, 303;
HI 56, 278, 318; IV 81
Мак-Даморе (McLamore W. M.) Ill 394; IV
250
Мак-Jlaypiiii (McLaurin R, D.) IV 132
Мак-Дафлин (McLaughlin К- С.) 1 224; II
88, 97; IV 41
Мак-Лахлин (McLachlin D. M.) Ill 114
Макледер (Machleder W, H.) V 314
Мак-Дсод (McLeod D. J.) HI 335, 457
Мак-Леод (McLeod G. L.) II 406, 409
Мак-Дин (McLean A.F.) il 129
Мак-Лохлпп (McLoughlin B. J.) V 35
Мак-Лэган (McLagan N. F.) 1 378; II 65,
70
Мак-Лэн (McLay G. W.) V 564
Мак-Магон (McMahon E.M.) IV 250
Мак-Магон (McMahon R. E.) II] 40; IV 248
Мак-Манус (McManus S. P.) II 274
Мак-Мери (McMurry J. E.) V 149, 154
Мак-Микип (McMeekin W.) I 24
Мак-Миллан (McMillan A.) II 18
Мак-Моррис (McMorris T.C.) IV 36
Ma к-Муллен (McMullen C. W.) Ill 118
Мак-Нейл (AlcNeil D.) Ill 53
Мак-Нинч (McMinch H- A.) I 95
Мак-Ноли (McNoIly S.) I 118
Мак-Нэми (McNamee P. J.) I 427
Мак-Оми (McOmie J. F.) I III, 193; IV
137: V 37.
Мак-Пик (McPeek D. L.) Il 350
Мак-Ричи (MacRitchie D. D.) I 357, 387
Максвелл (Maxwell С. E.) [11 260
Мак-Свини (McSweeney J. V.) I 345
Максфельдт (Muxfelclt H.) V 287, 288, 320,
362, 565
Макуипп (Maquenne M.) IT 27, 30
Мак-Уиртер (McWhirter J.) Ill 329. 335
Мак-Фарлеид (McFarland J. W.) I 105; HI
354; IV 101
Мак-фарлнн (McFarlin R. F.) H 193
Мак-Фелами (.McPhiHamy FI. B.) Ill 145;
V 534
Мак-Ферсон (McPherson S. P.) IV 29
Маки на (Macch ia В.) V 127
Макчна (Macehia F.) V 127
Мак-Шейн (McShane H. F.) Ill 12; IV 72
Мак-Шепн (McShane H.F., Jr.) Ill 12
Мак-Эвой (McEvoy F. J.) IT 276
Мак-Элвен (McElvain S. M.) 1 15a, 167
II 97, ]03, 107, 243, 282, 393, 400; Ш
115, 204, 205; IV 72, 101 239, 24], 247; V 508
Мак-Элхинпи (McElhinney R. S.) 1 167
Мак-Ювен (McEwen W.E.) И 362; HI 145;
IV 109, 201
Мак-Юрен (McEwen W. L.) 1 132; II 90, 97
Малапрейд (Malaprade I..) II 48, 52
Малек (Malek G.) V 2,37
Малеки (Malecki F. E.) Hl 360
/'Лаллан (Malian J. M.) Il 150
Маллок (Milllock E. В.) V 366
Малхотра (Malhotra S. К..) I 151, 166; V 66
Мамер (Marner О. A.) V 211
Man (Man E. H.) Il 122
Манасе (Manasse О.) II 402
Манвилл (Manville J. F.) V 396
Мансолд (Mangold FL L.) V 260, 353
Мандель (Mandell L.) I ,81, 108; IV 173
Манейама (Mnneyama R.) V 157
Мани (Mouev T.) V 289
Манк (Mancfc Ph.) I 248
Maim (Mann F. G.) 1 399, II 42 56; V 38,
167 ...
Манн (Mann M. J.) I 275; III 123
Манн (Mann S.) I 293
Манн (Mann T. A.) V 470
596
Маннинг (Manning D T.) П 456
Маннинг (Manning R. Е.) I 17,3, 174
Манних (Mannich J. P.) V 477, '178
Мапкштрек (Manrischtreck Aj II 121
Маиолопоуло (Manolopou]o M.) II 234
Минсера (Maneera О) I 74; II 221, 22(3, 414;
IV 173; V 264
Минске (Manske R. F.) I 210
Маньяни (Magnani A.) IV 173, 241, 247
Машоик (Matiyik R. M.) I 113
Марэзей (Marathey M. G.) Il 241
Маранц (Marantz L. В.) V 457
Марбет (Marbet R.) V 208
Марвел (Marvell C, S.) I 106, 130, 218, 22G;
11 39, 245, 240, 330, 354, 355, 389, 398,
401, 434; HI 108, 109, 114, 360y IV 72,
95, 104, 109, 137, 221, 226, 233, 247
Марвелл (Marvell E. N.) IV 103
Маргрейв (Margrave J. L.) I 427; III 354
Маре, де ла (Mare de la P, B. D.) Ill 341
Маригдиапо (Marigliano H. M.) V 494, 510
Марика (Marica E.) V 190
Марикич (Maricich T. J.) II 445; IV II;
V 334
Маринер (Marinier В.) IV 197
Марино (Marino J, p.) I 335
Мариэлла (Mariella R. P.) Il 262, 335; V 248
Марк (Mark V.) 1 193, 194; III 377, 464, 468
Марк (Meark H. F.) ) HI 344
Маркби (Markby R.) Il 7, 439
Марквальд (Markwald W-) 1 31
Марке (Marquet A.) HI 123, 184; IV 57, 258
Маркевич (Markiewitz К. H.) 11 357
Маркер (Marker R. E.) 11 [25; V 358, 360
Маркес (Markes .1. H. H.) IV 42; V 491
Маркис (Marquis E, T.) II 285
Маркис (Marquis R.) II 214, 216
Марко (/Marko G. J.) 1 275; III 412
Агарков В,И. V 47
Марков П. П 211; V 259
Маркс (Marx A. F.) IV 272
Маркус (Markus R.) I 416
Марктшеффел (Marktscheffel F.) 11 183; III
240
Маркхам (Markham R.) V 222
Марлборо (Marlborough D. I.) V 565
Мармор (Marmor S.) II 407, 409
Марсден (Marsden C.) I 295
Марсден (Marsden J. С.) V 517
Мартел (Martel J.) 1 413; III 67
Мартел (Martel R.) V 237
Мартелл (Martell A. E.) HI 205
Мартенс (Martens T. Fj I 106
Мартин (Marlin B.P.) II 225, 227
Мартин (Martin Dj V 126, 4 91
Мартин (Martin D. G.) II 205, 380; III 263
295; IV 179
Мартин (Martin D. J.) I] 28[>; V 299, 315,
326
Мартин (Martin E. С.) И 456
Мартин (Martin E. J.) V 281
Мартин (/Martin E. L.) II 434: Hl 20, 193,
335; IV 41, 202, 204, 225, 227; V 236
Мартин (Martin Hj Ш 276
Мартин (Martin .1.) IV 205
Мартин (Martin J. A.) V 41
Мартин (Martin J, В.) I 122
Мартин (Martin J, С.) I 137; III 91, 197
Мартин (Martin K. JJ I 403
Мартин (Martin K. R.) V 29
Мартин (Martin M, M.) V 256
Мартин (Martin P. p.) V 270
Мартин (Martin R. J. I-.) 11 1 S3; V 190 250
IV 155
Мартин (Martin R. II.) I 137; HI 28, 30;
Мартин (Marlin W. Bj 11 400
Мартин (Martin W. F.) Ill Зуд
Мартини (Martini С. M.) Hl 149
Мартиус (Martins С.) 1 247
А1аруйама (Maruyama H.) V 447
Марц (Martz M.D.) IV 112, 113
/Марчанд (Marchand B.) Ill 46, 240
Марш (Marsh F. D.) IV 186; V 543
Марш (Marsh J. P., Jr.) Ill 431
Марш (Marsh M. MJ IV 102, 103
Марш (Marsh W. С.) V 360
Маршалл (Marshall C. UR) II 426
.Маршалл (Marschall Dj Il 303
/Маршалл (Marshall J. A.) II 182, 193, 230,
273; V 349, 350
Маршалл (Marshall J. P.) V 386
Маршалл (Marshall J. L.) V 151
Маршалл (Marschall \V. S.) IV 18
Масгрейв (/Musgrave О. С.) IV 130
/Масгрейв (/Musgrave W. R. R.) Ц1 431
Масдюпюи (Musdupuy E.) II 203
Маскитти (Mascitti A.) iv 81
Маслин Д. H. Il 362
Масон (Mason D.) II 99
Масон (Mason H. L.) IV 173
Масон (Mason H. S.) 1 54
Macon (Mason J. L.) IV 29
Macon (/Mason P. S.) II 203
Массенгалс (Massengale J. T.) II 70
Массон (Masson SJ V 214
Мастронарди (Mastronardi 1. О J V 95
Матап (Mathal 1. M.) V 281
Матзр (Matar A.) 1 130
Матееску (Mateescii G.) V 190
Матеос (Mateos J, LJ II 181, 183, 188, 193;
IV 126
Мато (Matough M. F. SJ V 456
Матсугума (Matsuguma H. J.) 1 215
Матсумото (Matsumoto H.) V 29a
Матсьюда (Matsueda R.) V 447
Матти (/Matthey G.) I 407; III 30
Матье (Mathieu J.) I 38, 407; HI 67; iv 126
Мауери (Mowery D. F.) II 70
Маузеролл (Mauzerall D J II 403
Маузнср (Mausner M.) 1 392
Маурер (Maurer KJ 1 21, 24
Маурукас (Manrukas J,) IV 38
Маутнер (Mauthner J.) IV 226
Max (Mah R. W. H.) I 14э
Махадеван (Mahadevan A. P.) II 420, 446
Махадеван (Mahadevan V.) I 370; 11 71
Махачек (Machacok J.) V 318
Махачек (Machacek V.) Ill 327
Maxon (Mahon .i. J.) Ill 304
Махони (Mahoney L. R.) 1 11
Махран (Mahraii M. R.) V 323
Мачелл (Machell GJ Ill 328, 335
Мачлейдт (Machleidt HJ Hl 92, 99
Мебане (Mebane A. D.) I 80; HI 166; IV 46
213
Meirc.eti (Meuwsen A,) 1 214
Модема (Medema D.) Hi 327
Меджор (Major R. TJ 1 345; Ц 397, 401
/Меервейн (.MeerWein H.) I 307, 352, 353;
II 26; Hl 264, 266, 375 376, 382, 460, 461;
V 279
Мс-зарош (MSzaros I..) V 378
Мей (May E. L.) HI 19
Meii (May H. J.) 1 174
Мейджер (Meijer H. J. de Liefde) V 18
МейДжсрт (Majeri HJ HI 376
Мепепхофер (Mcienhofer J.) 11 468
Meiiep (Meier J.) 1 309
Мейер (Meyer E.) Ill 441, 443
.Мейер (.Aleyer E. W.) 1V 173
Meiiep (Meyer HJ I 73
.Мейер (Meyer H. E.) 1 381
Мейер (Meyer J.) Hl 411, 413
Meiiep (-Meier J. P.) V 203
Meiiep (Meyer Rj И 210; HI 133, 145; 1V 151
Мейер (Meyer К. H.) Ill 25, 217, 240; IV 156
597
Мейер (Meyer R, В.) I 66
Мейер (Meyer V.) II 56; III 271
Мейер (Mever W. L.) Il 153, 199; HI 10, И9,
129
Мейерс (Meyers A. I.) Ill 168, 172
Мейерс (Meyers C. Y.) 11 70, 81
Мейли (Meuley \V, С.) Il, 406
Меймарогл (MeimarogI C.) Ill 123
Мейнард (Maynard J. A.) ] 435
Мейнвальд (Meinwald J.) 11 135, 136, 449,
450, 453, 456, 470; Hl 87, 91, 233, 241, 248,
256; IV 123, 124, 179, 216; V 53, 54, 424,
425, 429, 519, 533, 534
Мейнвальд (Meintvald Y. С.) II 135, 136, 456,
465; 111 315, 318; V 77
Мейнерс (Meinerc A. F.) V 215
Мейр (Meyr R.) I 168; II 330, 335; IV 43,
44, 90; V 68
Мейселс (Meisels A.) Ill 92
Мейси (Macey W. A. T.) Il 109; IV 258
Мейстер (MeystreCh.) II 53, 193; Ш 241, 256
А1ейстер (Meister H.) I 233
Мейстере (.Meisters G.) V 284
Меке (Mecke R.) I 380; 11 425
Меклер (Mekler A.) II 281; III 166
Меламед (Melamed G.) Ill 166
Мелдрам (Meldrum A. N.) Il 2-18
Меллор (Mellor J, M.) V 384
Мелозе (Mehlose К.) 1H 22
Мельби (Melbv L, R.) I 305; II 326; III 318;
IV 258
Мельвилль (Melville D. В.) ПI 167
МельтЦер (Meltzer R. 1.) V 148
Men (Man E. H.) II 122
Менапейс (Menapace L. \V.) Ill 373, 402
Менард (Mdnard M.) V 237
Менглер (Mengler H.) II 128, 129
Мендель (Mendel A.) V 87
Мен пни (Men ini E.) I 178
Менди (Manley N. С.) II 336, 342
Менотти (Menotti A. R.) II 373, 374
МенсфилД (Mansfield К, T.) I 15
Мердок (Murdock К. С.) 1 39
Мереи (Murert J. F.) Ill 431
Mepenn (Mereiiyi F.) Il 25
Мерен и (Mer^nyi R.) V 195, 546
Mepep (Merer J. J.) Ill 100
Мерк (Merk R.) IV 179
Мерк (Merk F.) IV 103
Мерк (/Merk F. H.) Ill 261
Меркер (Maerker G.) I 96
Меркер (Mercer A. J. H.) V 444
Меркл (Mark! G.) Il 434; V 438
Меркле (Merkle H. R.) HI 446
Мерклинг (Merkling N.) II 210
Мерлини (Merlini L.) V 183
Меррилл (Murrill N.) Ill 118
Меррилл (Merrill S. H.) И 396, 400
Мерритт (Merritt C., Jr.) I 54
Мерритт (Merritt R. F.) 11 130; V 239, 299
Меррифилд (Merriiild R. В.) I 68, 71; V 221,
222
Меррифилд (Merrifild R. E.) HI 318
Мертел (Mertel H, E.) 1 256
Мертен (Merten R.) 11 276
Мерто (Murto M.-L.) I 334
Мерфи (Murphy C. J.) I 95
Мерфи (Murphy M.) V 433
Мерфи (Murphy T. J.) II 205; IV 36
Мерфи (Murphy W. S.) I 215; lv 126
Мерчисон (Murchison J. TJ lv 253
Месзарос (Meszaros M.) IV 198
Местер (Mester L.) II 295; V 24
Меткалф (Metcalf W- S.) [ 405
Меткалфе (Metcalfe T. R.) IV 122
Мет-Кон (Meth-Cohn O.) Ill 431
Метлин (Metlin S.) I 29l
Метрион (Metrione R. M.) V 113
Метцгер (Metzger H.) I 345
Мехленбахер (Mehlenbacher V. С.) IV 22
Мехта (Mehta A. S.) 1 321
Мехта (Mehta С. V.) IV 29
Мехта (Mehta G.) V 522
Мехта (Mehta N. В.) I 210
Мехта (Mehta S. M.) II 421
Мечоулам (Mechoulam R.) 1 167 Щ; 92
354; V 299
Мёллер (Moller F.) I 242
Мёллер (Moller Fr.) V 91
Мёллер (Moller G.) Hl 240, 276
Мёрк (Mork P. С.) I 167
Мива (Miwa T. К.) IV 91
Мид (Mead E, J.) II 186; HI 391
Миддлтон (Middleton W. J.) и 326; HI 112
114, 242, 318, 412; IV 258; V 184
Миддлтон (Myddleton W. W.) ]II 181, 184-
Мидер (Meader A. L.) I 248
Мизитн (Misiti D.) I 27, 28; V 14
Мийано (Miyano M.) Ill 18
Мийано (Miyano S.) Ill 172
Мийашита (Miyashlta K.) Ill 148
Мик (Meek E. G.) HI 4o
Мик (Meek J. S.) HI 187
Микинс (Meakins G. D.) II 55, 456; и I 201-
IV 20, 91; V 250
Микласиевич (Miklasiewicz E. J.) Щ 457
Микол (Mikol G, J.) I 344; V 138, 143
Миколайчак (Mikolajczak K. L.) V 110
Микулек (Mikulec R. A.) Ill 187
Милас (Milas N. A.) I 144; II 424; HI 67, 84
Милевич (Milewlch L.) IV 143
Милерт (Mielert A.) Ill 318; IV 201
Милитцер (Militzer \V, J.) II 40
Милковски (Milkowski J. D.) V 27
Милке (Milks J. E.) Ill 76
Милл (Mill P. J.) H 70
Миллар (Millar I. T.) 1 128; Il 141
Миллер (Miller A E. G.) I 278
Миллер (Miller A, W.) V 491
Миллер (Miller В.) I 360
Миллер (Miller B, J.) V 249
Миллер (Miller С. E.) I 214, 282, 417
Миллер (Miller E.) II, 43, 412, 414
Миллер (Miller E, G.) 1V 126
Миллер (Miller G. E.) II 423
Миллер (Miller G. L.) II 213
Миллер (Miller G. W-) V 52
Мидлер (Miller H. E.) V 495
Миллер (Miller H, W.) V 49
Миллер (Miller J.) 1 334
Миллер (Miller J. В,) I 387
Миллер (Miller К- E.) И 38; IH 167
Миллер (Miller L. А.) Ill 184
Миллер (Miller L. E.) II 70
Миллер (Miller L. S.) II 157; V 415, 416
Миллер (Miller M. A.) 11 296
Миллер (Miller N.) V 417
Миллер (Miller P. S.) V 32
Миллер (MiTler R.) II 76
Миллер (Miller R, D.) V 494
Миллер (Miller R. E.) IV 232
Миллер (Miller R. G.) I 104
Мидлер (Miller S. E.) II 55; IV 239, 247
Миллер (Miller S. I.) 11 405; V 280, 281
Миллер (Miller W. T., Jr.) 1 138, 175 416,
417; HI 446
Миллетт (Millett W. H.) Ц 331; IV 41
Миллиган (Milligan В.) IV 19. 20
Миллидж (Millidge A. F.) HI 53
Миллс (Mills J. A.) V 24
Милле (Mills J. S.) 11 И]; Ш 99; lv 173;
V 51, 52, 371, 372
Миллс (Mills R. H.) Ill 458
Миллс (Mills W. H.). 438
Милдуард (Millward В. В.) I 167
Минами (Minami К.) II 440; V 332
598
Минато (Minato HJ I 144; III 376; V 110
Мннаш (Minasz R. Л.) IV 5fy
Винклей (Minklei A. OJ II 157
/Миннис (Minnis RJ V 102
Миннис (Minnis WJ Il 38
Минор (Minor J. LJ V 208
Минот (Minot MJ I 3o0
Минц. (Miniz M. J.) V 07
Мир (Mier J. DJ Ill 40
Мирригтов (Mirrlgton R. NJ V 384
Мирцва (Mierznva S. A., Jr.) J 275; II 261;
'll 449
Мирш (Mirsch MJ 11] 12'4
Мислоу (Mislow KJ IV 96; V 230
Митг.раши (Mitarashi HJ 1V 36
Murray (Mitgau RJ JI 178, 295
Митра (Mitra M. NJ V 368
Митра (Mitra R. BJ I 142, 345; V 120
Митсунобу (Mitsnnobu OJ IV 48; V ,33
Митсухашц (Mitsuhashi HJ V 103, 183,
451, 454
Митгаг (Mittag EJ Ш 395
Миттаг (Mittag R J 11 253
Митчелл (Mitchel 1 D. L J 11 384, 388
Митчелл (Mitchell F, WJ IV 263
Митчелл (Mitchel! J. WJ V 372
Митчелл (Mitchell M. J J 1 390; IV 4S, 61
Митчелл (Mitchel) P. V'. Dj I 408, 413
Митчелл (Mitchel) R, HJ V 59, 66
Митчелл (Mitchell T. R. Bj IV 132,; V 223
Митчелл (Mitchell WJ III 322
Михайлович (Mihailovic M. Lj.) II 178;
III 241 249
Михайлопуло И. A. V 372
Михаэлис (Michaelis A J I 196; V 235
Михаэле (Michaels R. J J I 350; Il 297; V 90
Михаэль (Michael A J ]1 264, 324, 326
Михаэль (Michael DJ III 412
Михельсон (Michelson A, WJ III 419
Maxima (Mihina J. SJ J 28
Михлер (Michler W J III 307
Мичович (Micovic V. MJ II 178; 1V 195,196
Мишели (Micheli R A J HI 431
Мишелоттн (Michelotti F, W J II 262
Мишель (Michel R E J III 19
Митер (Miescher KJ II 288; Ill 84, 437;
V 138, 143
Модест (Modest E. JJ I 420
Модже (Moje S.) V 531
Мозинго (Mozingo RJ I 132; Ill 48, 53, 161,
163. 166. 167; IV 71
Мойер (Moyer С. E., Jr.) V 61, 66
Мойер (Moyer J. RJ II 336, 342
Мойер (Moyer W. W-. JrJ II 338, 401
Мойл (Moyle MJ III 25
Мойр (Moir R. Y.) II 237
Mok (Mock W. LJ I 70, 282; V 397
Мокадло (Mocadlo P. EJ I 144
Мокзар (Moczar EJ 11 295
Мокита (Mokita MJ I 189
Молау (Molau G. EJ I 40
Моле (Mohle K.-DJ II "6
Молинет (Molinet CJ IH 296
Моллет (Mollet PJ 1 lit
Моллой (Molloy B. BJ I 414; IV 132
Монагль (Monagle J. J J 1 392, 42;; HI 11,
12, 3?8
Монахан (Monahan A. SJ V 27/, 278
МонДер (Monder CJ V 461
Мондон (Mondon A.) HI 189
Мониз (Moniz W. BJ II 40b, 409
Монсебуа (Monssebois CJ V 331
Монтафон (Montavon -MJ II 119; III 354,
IV 253, 267, 274
Монтгомери {Montgomery J. A.) I 438
Монтгомери (Montgomery L. KJ I 403; V 171
Монтгомери (Montgomery hi. А.) IV 99
Монти (Monti HJ V 399, 401
Моитинь (Montijn P. PJ V 555
Mohtohii (Monthony J J V 384
Монтэнь (Montaigne RJ 1 414; V 184
Монье-Вильямс (Monier-Williams G. WJ IV
276
Moop (Moore В J II 97
Moop (Moore F. WJ 11 14], 285
Moop (Moor H. WJ I 28; 360; V 14. 63, 54, 133
Moop (Moore J. A J I 247
Moop (Moore L. LJ IV 240. 247
Moop (Moore MJ II 339. 342, III 53, 365, 366
Moop (Moore R. EJ 1 210
Moop (Moore SJ I 221; П 70, 71
Moop (Moore W. RJ 1 175; Il 282, 283, 285;
HI 448; V 295, 296, 299
Моппетт (Moppett C. EJ V 555
Моранд (Morand Pj 1 413
Моранд (Morand P. Fj I 413; III 241
Моргай (Morgan L. R.. Jr.) 1 145
Морган (Morgan R. L.) Ill 99
Моргснтау (Morgenthau J. L,, JrJ II 178
Морено (Moreno GJ V 491
Mopac (Morse A, TJ V 143
Мори (Mori H.) Hl 295
.Мори (Могу R J I 357
Мори (Mori S J IV 226
Мори (Mori TJ V 256
Мориарти (Moriarty R. M.) IV 72; V 384
Моринаке (Moriwake TJ II 210
Морийама (Morlyama H.) V 222
Мори кава (Morikawa MJ V 346
MopiiKotni (Moriconi E. Jj III 67
Морцкофер (Moerikofer A. WJ I 268
Mopiin (Morin R. DJ V 34 8
Морита (Morita Kj I 357; III 99; IV 179
Моритаяп (Moritani IJ I 167; V 84
Мориути (Morhiti SJ V 272
Мориц (Moritz K.-L.) IV 11
Морк (Mork Ы. MJ III 99
Морланд (Moreland W. T., JrJ III 455, 457;
IV 254
Морли (Morley В J V 368
Морли (Morley J. FJ IH 246, 256
Морли (Morley J. RJ V 393
Морли (Morley J. SJ 11 468; III 449; V 475
Морлок (Morlock GJ IV 74
Морневек (Morneweck S. TJ I 280
Мороз (Moroz EJ IV 126
Моррис (Morris G. FJ II /4
Моррис (Morris J, MJ II 203
Моррис. (Morris L. J J III 92, 269, 217;IV 20;
V 470, 489
.Моррис (Morris L. RJ HI 115
Моррисон (Morrison D. CJ IV 41
Моррисон (Morrison D. E.) Ill 123
Моррисон (Morrison G. CJ IV 101
М.оррисон (Morrison HJ II 226
Морроу (Morrow D. FJ III 19
Мортенсен (Mortensen H. Ej IV 265
Мортон (Morton A. A J I 430
Мортон (Morton FJ 1И 240
Мортон (Morton J. R.) II 455
Мортон (Morton R. A J II 85, 97, 219, 226
Мортон (Morton R. В J V 41. 267
Морхауз (Morehouse F. SJ IV 170
Mop хауз (Morehouse S. MJ III 54
Морш (Moersch G. WJ 111 19
Мосби (Mosby W. LJ I 206, 210; V 335
Мосеттпг (Mosettig EJ I 334,11 374; III 19, 53
Мосмюллер (Moosmiiller Fj V 193
Мосс (Al oss R. A J V 171
Motkok (Motcock G. T.) Ц 156
Mott (Mott Lj HI 415
Моттрам (Mottram E. NJ II 92, 97
Moy (Moe N, SJ V 31
Моукли (Moakley D. FJ V 66
Моул (Mole T.) I 210
Моффат (Moffat J.) II 335
599
Моффат (Moffat J. G.) I 328, 335, 363, 374.
421; II 70, 335; III 309, 417; IV 131, 193;
V 129, 131, 168, 396, 456
Моффетт (Monett R. Б.) I 199; II 23, 25,
177, 178; HI 159, 166, 394; IV 201, 247, 248
Мошер (Mosher H. S.) I 219; II 332, 3a3;
HI 68
Мошер (Mosher R. A.) Ill 468
. Мошер (Mosher W. A.) I 383IV 183
Мровка (Mrowca J. J.) HI 173
Муберри (Mooberry J. В ) V 565
Myr (Moog L.) i'll 419
Мугдан (Mugdan M.) Ill 84
Муй (Mui J. Y. P.) Ill 387; IV 56; V 436, 500
Мукава (Mukawa F.) 111 240
Мукаяма (Mukaiyama T.) I 258, 270; II 282;
III 469; IV 46, 48; V II. 53, 496
Муксфельд (Muxfeldt H.) Ill 460. 461; V 564,
565
Муллер (Muller G.) I 4I3; IV 126
Муллер (Muller R. J.) I 166
Мумо (Mutnaw С, E.) Ill 394
Муиавалли (Mnnavalii S.) Ill 316, 318
Муни (Mooney В.) II 99
Муни (Mooney R, A.) IV 58
Мунк (Munk M. E.) I 395
Мунро (Monro D.) JI 421
Myp (Moore R. A.) V 510
Myp (Moore T, L.) V 211
Мурадян (Mooradian А.) Ш 296
Мураками (Murakami M.) IV 22
Мура Кампо де (Монга Campos de M.,) I 397
Мураматсу (Mtiramatstt I.J V 480, 482
Мураматсу (Muramatsu L.) IV 22
Мурата (Murata 1.) V 10
Мурахаши (Murahashi S.) 1 29[
Муслицер (Musliner XV. J.) V 500, 501
Муссерон (Mousscron M-) V 214, 556
/Муссероп-Канэ (Mousseron-Canet M.) V 214
Мустафа (Mustafa A.) V 323
Мут (Muth K-) IV 49
Мутцеибекер (Mutzenbecker J., von), I 210
Мухаммад (Muhammad N.) Ill 328
Муховеки (MHchowski J. M.) V 423, 429
Мэй (May G. E.) Ill 32
Мэй (May P. J.) V 222
Мэйнард (Maynard ,1. R.) V 333
Мэйтлис (Maitlis P. M.) 1 107
ЛЪллори (Mallory F, В.) Il 39, 362, 407,409
Мэмлок (Mamlok I.,) IV .17, 258
Мэнсфилд (Mansfield К. T.) V 1581, 284
Мэнсфильд (Mansfield G. H.) I 66
Мэнч-Петерсен (Munch-Petersen) II 245, 360.
362
Мэррей (Murray K.) J 268
Мэррей (Murray M, A.) Ill 161, 166
Мэррей (Murray M. F.) I 275
Мэррей (Murray R. K., Jr.) V 459
Мэррей (Murray R. \V.) II 226; IV 7, 44
Мэррей (Murray T. F.) I 106; IV 243, 248
Мэтеии (Matheny N. P.) I 134
Мэтесон (Matheson J. M.) IV 130
Мэттер (Matter M.) I 373; IV 8
Маттесон (Matteson D. S.) I 145
Мэттингли (Mattingly T. \V.) 11 44j; lv 11
Мэттис (Matthies D.) Ill 166
Мэттокс (Mattox V. R.) I 372; 11 133, 136,
230; 111 256, 278; IV 32, 36
Мэтью (Mathew I<. K.) HI 30; IV 90. 226
Мэтьюс (Matthews А, О.) 11 375, 380
Мэтьюс (Matfheews C, N.) V 238, 239
Мэтьюс (Matthews H, R.) V 270
Мэтьюс (Matthews R. S.) HI 168. 172
Мюле (Miihle G.) I 75
Мюллер (Mueller G. С.) V 527
Мюллер (Attiller E.) I 215, 247. 248: Il 102,
106, S38, 239, 357, 448, 456; IV 200; V 280,
414
Мюллер (Mtiller G.) И 276
Мюллер (Milllcr H.) 1 278, 400, 401; II 28],
392; IV 38; V 293
Мюллер (Muller H.-R.) I 282
.Мюллер (Muller R. H.) IV II
Мюльцср (Mil i Iner F. X.) [Il 389, 390
Мюнх (Miinch G, Z.) Ill 126
Мюрке (Miirke H.) HI 1 83
Мюррей (Murray J, I.) П 262, 324, 326
Нагабхушап (Nagabhushati T, L.) II 4o6
Магазе (Nagasc К.) I 315
Нагасаки (Nagasaki T.) HI ,376; V 110
Нагата (Nagata W.) I 200, 209. 429; HI 451;
V 194, 199. 463, 464
Наджасакп (Najasaki T. I.) I 278
Насмура (Naempra K-) Ш 249, 256
Назаров И. H.. I 181. 182
Мазер (Nazer M. Z.) | 38, 91; П 155; V 9
17'2, 174
Найлен {Nylen Р.) I 431
Matte (Nice F. А.) V 222
Найстед (Nysted L. N.) Ill 304
Найстром (Nystrom R. F.) II 163, 178, 179,
183; 111 19
Найт (Knight ,1. С.) I 268; HI 20!
Найт (Knight H. В.) II З26; 1П 24, 302
Найте (Knights E. F.) V 36
Накагава (Nakagawa K-) 11 440; HI 242‘
V 332
Накадзима (Nakajima ,M.) II 38, 42; V 270
Наказакн (Nakazaki M.) HI 249, 256
Накайа (Nakaya T.) V 263
Накамура (Nakamura К.) V 211
Наканиси (Nakanishi К.) IV 183; V 222, 495
Наканнсн (Nakanishi 5.) Ill 99; IV 201
Макано (Nakano T.) I 210; Il 202
Наката (Nakata H.) [II 198. 199, 201
Наката (Nakata T.) Il 440
Накви (Naqyi 8. M.) II 212
Наманмрт (Namanworth E.) V 512
Намбу (Nambn H.) H] 468, 469
Наметкин H. С. V 113
Намнгата (Namigata F.) V 432
Намкунг (Namkung M.) I 210; 11 38; III 30!
Нанди (Nandi U. S.) I 11
Напье (Napier D, R.j III 360, 433; IV 126
Напье (Napier R.) П 346
Наранг (Narang S, A.) II 247
Нараян (Narayai; К- V.) V 549
Нараяна (Narayana M.) II 285; V 315
Нараянан (Narayanan C. R.) 1 116; II 187
Нарисада (Narisada M.) V 464
Нарита (Narita К.) V 113
Нарпик (Nanik’k M.) IV 250
Насипури (Nasipuri D.) II 20, [83; V 230
Натан (Nathan A, H.) Il 283, 353; III 291
Нательсон (Natelson S.) I 290, 309; III 283,
351, 3n4
Натта (Natta G.) I 291; HI 344
Науманн (Naumann M. О.) V 397
Науманн (Naumann R.) ] 167
Наумов Ю. A. I 309
HaxMufic (Nachmias G.) II 14
Hr (Ng Y. H.) IM 173
Невилль (Neville R- G.) П 133
HenuTT (Nevitt T. D.) Ill 60S
Herep (Neher H. T.) Ill 184
Herep (Neher W. T.) V 208
Нсрдсл (Nerdi'l Г.) V 340
Негиши (Negishi F.) V 117
Нсйвард (N’ivard R. ,1. F.) Ц 123; HI 23
Нейве (Naves Y. P.l 11 39
Нейк (Naik D. N.) Ill 469
Нейклмс (Neuklis W- A.) Ill 19
Нейлор (Naylor M. 7w) ]I 456
Нейлор (Naylor P.) IV 30
600
Нейлсон (Neilson Т.) II 388
Нейман (Neumann F. XV.) IV 18, 225
Heiip (Nair M. DJ Ill 430, 431
Heilp (Nair M. G.) V 06
Пейрат (Neiirath G.) II 443
Нейрейтср (Neureiter N. 1’.) IH 468
Нейс (Nace H. R.) I 334; Ji 193
НепснепДер (Neiswender D. D., Jr.) 11 406,
409
Нейшене (Nations R. G.) Ill 197
Некоечеа (Necoechea EJ I 413
Нелб (Nelb R. G.) II 196
He.’ibCeU (Nelsen S. F.) I 271; V 42
Нельсон (Nelson А. В J II 420
Нельсон (Nelson J. A.) 233; V 334
Нельсон (Nelson J. S.) 1V 165
Нельсон (Nelson N. NJ I 108, 110, 366;
II 356
Неницеску (Nenitzescu C. D.) 1 252, 390;
HI 185, 187; 1V 17; V 190, 535
Ненский (Nencki M.) IV 208, 209
Heprep (Nerger W.) I 381
Нердел (Nerdel F.) V 340
HepHiir (Nehring R.) Ill 319
Нес (Nes W. RJ I 11
Несмеянов A. H. I 401; Hl 191, 193
Нет (Netti F, TJ IV 126
Неттлетон (Nettleton D. D., Jr.) II 273
Неф (Net J. U.) IV 44
Нефкенс (Netkens G. H. L.) II 123; III 23;
IV 138
Нехватал (Nechvatal A.) I 172
Нидерпрюм (Niederpriim H-) III 386
Нидлес (Needles H. L.) I 134
Никлас (Niklas H.) I 209, 211
Николаидес (Nicolaides E. Dj Ill 434
Николаидес (Nicolaides N.) II 326; HI 325,
327
Николас (Nicholas R. D.) Il 348, 351; V 9
Никольс (Nichols G.) I 106; III 335
Никольс (Nichols JJ IV 165, 276
Никольсон (Nicholson J.) IV 30
Никлас (Niclas H.-Jj V 120
Никлас (Niklas HJ 1 209, 211
Никон (Nickon A.) I 214; Il 97, 222, 226
Нил (Neale R. S.) IV 155
Нилакантан (Neelakantan S.) [ 427
Нили (Nealy D. LJ V 416
Нили (Neely L.) 11 12
Нилла (Nilles G. P.) V 102
Нильсен (Nielsen A. T.) IV 194
Нильсен (Nielsen D. RJ IV 201; V 314
Нильсен (Nielsen M. L.) V 82
Нильсен (Nieisen S. DJ Ill 2-19, 256
Нильссон (Nilsson M.) Il 25
Ниман (Niemann CJ I 132
Нимен (Neeman M.) 1 245, 248; 111 46, 95,
99‘ V 354 355
Нимец (Nimetz M.) HI 2, 41
Нинхауз (Nienhouse E. S.) V 187
Нитеки (Nitecki D. EJ 1 303; V 309, 310
Питта (Nitta T.) V 10
Нитта (Nitta V. J.) 1 15; V 10
Нитхаммер (Niethammer KJ I 390
Нпхольсои (Nicholson D. (j.) I 38
Ницшке (Nitzschke M.J II 316
Нишикава (Nishikawa M.) I 357
Нпшимура (Nishimura J.) I 437; V 200
Нищимура (Nishimura S.) V 46, 347
Нишимура (Nishimura TJ IV 183
Нобиль (Nobile A.) HI 256
Нобль (Noble E. GJ IH 450
Нобль (Noble W. R.. Jr.) II 326; V 520
Нобухара (Nobuhara Y.) Ц 303
Новак (Novak LJ V 405
Новак (Nowak R. MJ 11 273; V 30
Новиков В. M. V 47
Новоселов Н. П. V 169
Ногуши (Noguchi S.) I 357; IV 179
Ноджаки (Noguchi J.) V 342
Ноджи (Nogi Т.) V 346
Ное (Noe J. L.) 11 263
Нозаки (Nozaki Н.) I 58 V 256, 272
Нозое (Nozoe SJ И 270, 273; IV 225
Но.чбауер (Neubauer О.) И 99
Нейберг (Neuberg С.) IV 156
Нойбергер (Neuberger А.) И 129
Нойгебауэр (Neugebauer F. А.) 1 387, 388
Нойман (Neumann Р.) I 277
Нойоне (Noyons S.) I 367
НойорИ (Noyori R.) V 143, 255, 272
Нойс (Noyes W. А.) I 177; II ]7, 105, 107
Нойс (Neuss N.) II 342
Нокс (Knox G. R.) 1 166, 168, 334
Нокс (Knox L. HJ I 433; 11 115, 116; IV 151:
V 174
Нолан (Nolan Т. J.) V 456
Ноланд (Noland W. Е.) II 461, 466; IV 233
Ноллер (Noller С. R.) 11 38, 253, И1 76, 160,
166, 335, 382; IV 90, III, 2]5
Нолтес (Noltes J. G.) Ill 373, 402
Нонине (Nomine G.) 1 40; И 70, 202; IV II
Нонхебель (Nonhebel D. CJ Н 241. 246'
V 284
Норвал (Norval S.) V 366
Норд (Nord F. FJ II 179; IV 232
Нордии (Nordin 1, CJ I 185, 186; II 193; Щ
184
НорДин (Nordin P.) IH 285
Норимберски (Norymberski J. KJ I 178;
Il 391; IV 225
Норин (Norin T.) V 384
Норкросс (Norcross B, FJ Ц 393, 400
Норман (Norman R. О, С.) 1 147; HI 83;
V 126
Норман (Normant HJ i 195, 231, 238; II 358,
359; V 280, 281
Норман (Normant J.) I 195
Норман (Normant J.-FJ V 408
Нормингтон (Normington J, B.) 11 261
Норрис (Norris E.) V 544
Норрис (Norris J. FJ И 109, 364, 365
Нортон (Norton A. A.) IV 48
Нортон (Norton D, GJ 1 312; IV 95, 214
Нортон (Norton J. A.) I 390
Нортон (Norton К. В J 1 186
Носаки (Nosaki К J V 143
Hot (Not HJ I 32, 33, 302
Ноулес (Knowles W. SJ I 174; Ш 150, 390;
IV lo)
Нохира (Nohira H.) IV 46
Ношко (Noszko Lj 11 458
Нукада (Nutcada KJ H 436
Нукина (Nukina SJ I 131
Нуля (Null G.) 1 179
Нуссбаум (Nussbaum A. L.) I 363; 111 256;
V 555
Нуссбаумер (Nussbaumer Th.) 1 413
Нуссим (Nussim MJ 264, 268, 315; Il 114
Нутиле (Nutile A. NJ II 274, 276
Ньюболд (Newbold B. TJ 111 68
Ньюбоулд (Newbould J.) II 53
Ньювенхьюз (Nieuwenhuis H. J- W,) 1 167;
IH 394
Ньювенхыоз (Nieuwenhuis JJ IV 273
Ньювирт (Neuwirth H.) II 242
Ньюелл (Newell L. С.) IV 52
Ньюком (Newkome G. RJ I 309; V 117, Ц8
Ньюкомер (Newcomer J. S.) 1 364; HI 313
Ньюленд (Nieuwland J. A J I 58, 59, 65, 78;
HI 190
Ньюманн (Neumann FJ HI 256
Ньюмен (Newman H.) Ill 443, 444
Ньюмен (Newman M. S.) I 37, 102, 103, 137,
194, 221. 350, 388, 390; II 64, 65, 70, 80,
81, 91, 97, 112, 235, 268, 269, 273, 281, 290
601
292, 293, 355, 376, 380, 396, 400, 405, 409,
448, 456; III 6, 10, 107, III, 114, 129, 134,
145, 152, 153, 157, IGG, 171, 17'2, 189, 190,
309, 310, 354, 435, 442, 444, 451, 457;
V 40 90, 93, 95, 133. 143. 145, 146, 286,
308, 310, 36), 362, 413
НьюстиД (Newstead R. CJ JV 66
Ньютон (.Newton A.) Ill 377
Ньютон (Newton L. WJ 1 83. 130, 307
Ньютон (Newton M. VJ Il 335
Ньюхол (Newhall W. FJ 1 140, 141
Нэджл (Nagy S. MJ I 219
Нэйлор (Naylor C, A., Jr.) !,I 97; IV 215
Нэш (Nash B. W.) 1 31
Обата (Obata TJ V 33
Обенланд (Obenland С. О.) IV 132
Оберраух (Oberrauch Ы.) 1 178
Оберстер (Oberster A. E.) 1 178
О'Брайен (O’Brien J. P.) Ill 99
О’Брайен (O’Brien R. E.) Ill 457; V 211
Овербек (Overbeck H.) I 381
Оверберджер (Cverberger C. GJ I 210; Il 75,
76, 262, 403; IV 37; V 352. 353, 466
Оверенд (Overend W. G.) I 225; Il 414; HI
201; V 376
Овертон (Overton К. H.) I 256
Оверчук (Overchuk N. A.) II 459
Овечкина Л. Ф. V 372
Огард (Ogard A. E.) 11 362
Огасавара (Ogasawara KJ V 470
Огата (Ogata YJ Il 34, 38, 42; V 211
Orr (Ogg C. LJ V 311
Огилви (Ogilvie K- KJ V 52s, 526
Огисо (Ogiso A.) Ill 184
Огисо (Ogiso HJ V 352, 353
Огларусо (Ogliaruso MJ I 53; III 19
Одигер (Oediger H.) I 241, 242; 111 415;
V 78, 88, 91, 444
Одум (Odum R. A.) IV 25. 29; V 447
Одье (Odier M. E.) IV 156
Озретич (Ozretich T. M.) V 296, 299
Ойстер (Oyster L.) IV 24
Окава (Okawa KJ Il 331
Окамото (Okamoto M.) 1 282; Il 456 III 468;
V 84
Оквуд (Oakwood T. SJ I 100
О’Киф (O’Keefe J. HJ V 362
Окколовиц (Occolowitz J. L.) V 468
О’Коннор (O’Connor G. L.) 11 193
О’Коннор (O’Connor R, RJ II 17
О’Коннор (O’Connor R. T.) I 67
О’Коннор (O'Connor W. F.) HI 67
Оке (Oakes V.) I 269
Оксли (Oxley P.) HI 366
Оксман (Oxman MJ I 256; Ill 76
Оксфорд (Oxford A. EJ Hl 241
Окуда (Okuda T.) I 32, 357; IV 248, 277
Окумура (Okumura T.) Ill 451
Окумура (Okumura YJ HI 296, 335
Оку (Oku A.) v 137, 143
Ола (Olah G. A.) I 73, 76, 90, 92, III, 112,
285; II 458, 459, 461, 469; Ill 264, 266,
306; IV 76, 119; V 336, 337
Ола (Olah J. A.) I 112; 11 458
Оландер (Olander C. P J IV 45
Олбрайт (Albright J. A.) V 351
Олбрайт (Albright J. DJ I 329, 335; III 367;
V 130, 133
Олдридж (Aldridge F. TJ 1V 185
Олдрич (Aldrich P.) II 123, 215, 216
Оле (Ohle I-I.) 11 421
Оливарес (Olivares E.) Ill 99
Оливер (Oliver J. P.) Ill 373
Оливери-Мандала (Oliveri-Mandala E.) I 28
Оливерио (Oliverio A.) V 181, 183
Оливето (Oliveto E. P.) I 77, 125, 126, 127,
363; П 25 351, 353, 421, 423, 456; 11199,
118, 256,; IV 151, 173; V 362, 532, 555
Олингер (Ohlinger HJ II 195; I 50
Олкотт (Olcott H. 5.) IV 95, 102
Оллснбп (Allenby О. C. WJ 1 247
Оллендорф (Ollendoff G.) Ill 82
Оллеренщо (Ollerenshau J. E.) Ill 47
Оллестои (Allcslon D. L.) Hl 373
Оллис (Ollis W. DJ V 183
Олофсон (Olofsoii R. A ) 1 335; IV 268; V 566
Олред (Allred E. LJ V 505
Олсен (Olsen G. LJ V 284
Олсен (Olsen M. J.) IV 143
Олсен (Olsen R. EJ I 66
Олсен (Olsen R. К.) IV 157
Олсон (Olson С. E.) 1 53, 179
Олфьсри (Olfieri С. CJ Ill 281
Олхейм (Ajheim R. J.) Ill 145
Олшевски (Olszewski) III 408, 4]2
Ольшлагер (Glschlager А. С.) IV 11
Олъшлегер (Oelschlager HJ Ill 26, 30
О’Мира (O’Meara D.) V 478
ОмитанскиЙ (Omitanski G. MJ ,1V 126
Онато (Onato TJ V 53
Онда (Onda) 11 421
Ондетти (Ondetti M. A.) IV 199
О’Нейл (O’Neill G. J.) I 252; IV 53, 55, 56;
V /6
О’Нейл (O’Neill I. K.) 11 456
О’Нейл (O’Neill R. С. OJ Ill 295
Ониши (Ohnishi YJ V 90
Oho (Ohno M.) [ 282; II 451, 456
Сну (Onoue HJ II 440; HI 242; V 332
Опи (Opie J. Wj II 8
Опиц (Opitz G.) V 95
Опденау&р (Oppenauer R. V.) 1 147, 159, 178;
11 13, V 230
Оппеихеймер (Oppenheimer E.) V 454
Опполцер (Oppolzer W.) V 167
Срази (Orazi О. О.) I 126, 283; V 103
Орволл (Orwali E FJ 11 237, 326
Оргел (Orgel L. E.) II 7
ОрманД (Ormand K- L.) V 407
Opo (Horeau A.) Ill 240; V 494, 495
Орошиик (Oroshnik WJ I 80; III 166; IV 45,
46, 21 I, 213; V 131
Opp (Orr D. E.) V 230, 231
Opp (Orr J. С.) II 193
Ортен (Orten J, M.) I 225
Ортгманн (Orttmaun H.) Ill 13
Орчин (Orchin M.) 1 287, 291; II 132, 371;
111 24, 245, 246, 392, V 240
Осава (Osawa TJ I 86
Осава (Osawa YJ Ill 99; V 354, 355
Осато (Osato R. L.) Ill 388; IV 161; V 524
Осбонд (Csbond J. M.) II 137
Осборн (Osborne A. G.) V 419
Осборн (Osborn C. L.) I 167, 345
Осборн (Osborn J. A.) Ill 415; IV 158; V 454
Осеки (Osiecki J.) V 120
Оскар (Oscar J. A.) 11 70
Оскей (Oskay EJ H 231; V 270
Остерберг (Osterberg A. E.) Ill 193
Остерлииг (Osterling R. E.) Ill 99
OcTpVM (Ostrum G. KJ II 240, 241; V 65
Ocyra (Osuga D. TJ Ill 187
От (Oth J. M. F.) V 195, 546
Ототанп (Ototani NJ V 60
Отри (Aittreu R. L.j V 196
Ott (Ott A С.) 1 275
Ott (Ott E.) 11 218; IV 109, 114
Отт (Ott G. HJ I 126
Ott (Ott H.) Ill 431
Оттене (Ottens В J П 421
Оттер (Otter BJ V 396
Оттербахер (Otterbacher T. J.) IV 71
Оттманн (Ottmann G.) 1 250, 252
Otto (Otto KJ H 14
602
Отто (Otto SJ Ill 378
Оуаннес (Ouanncs VJ IV 57, 258; V 90
Оуз (Ohse H.) V 447
Оуеллетте (Ouellette R. J.) Hl 241, 297, 298
Оуингс (Owings F. FJ Ill 201
Оуриссон (Ourisson G ) Ji 178; HI 266, 269,
27], 316, 318; V 2,5'3, 381, 384, 409, 41],
505, 506
Оутон (Oughton J. G.) 11 414; IV 173
Оуэй (Oae SJ V 90, 487
Оуэн (Owen L. NJ 11 97, 230, 414; III 319,
340; IV 262; V 321
Оуэн (Owen T. С.) I 67; II 223, 226
Офйер (Ofner A J 11 137
Оффенбекер (Offenbacker) Il 342
Оффенманн (Offetimann KJ IV 80
Оффен xayep (Oflenhauer R. DJ V 42
Охара (Ohara KJ I 24
Охашн (Ohashi MJ V 149
Охват (Ochwat PJ II 363, 365
Охки (Ohki EJ IV 225
Охлофф (Ohloff GJ [ 204, 210; V 429
Охме (Ohme RJ I 215; Il 409; IV 126; V 86,
343, 408
Охно (Ohno KJ 111 4]5; IV 158; V 454, 456
Охно (Ohno MJ V 156, 447
Охта (Ohta MJ 1 431, 437; III 241
Очснер (Ochsner PJ II 424, 425
Очнаи (Ochiai EJ IV 35, 36, 113
Ошима (Oshima TJ V 40
Оэ (Aue D. HJ V 316
Павлат (Paviath AJ HI 266
Павлик (Pavlic A. A.) Ill 166
Пагано (Pagano A. SJ I 18; III 425, 430;
V 458, 459
Пагану (Paganou AJ V 164
Падва (Padwa A J I 168; V 429
Паддок (Paddock N. LJ V 82
Падмасани (Padmasani Rj I 427
Пайвевер (Pivawer P. MJ V 206
Пайер (Pier S. MJ IV 104, 109
Пайерс (Pierce A. CJ Г 188
Пайерс (Pierce J, KJ V 66
Пайерс (Pierce O. RJ V 215
Пайерс (Pierce J. VJ 1 188, 111 340
Пайерс (Piers E J II 236; V 122, 199, 449, 454
Пайерс (Piers J<J III 123
Пайк (Pike J. EJ III 99, 263, 366; V 386
Пайк (Pike R.AJ HI 172; V 393
Пайн (Payne G. В J I 142, 145; II 313; HI 67,
71, 72, 76, 77, 78, 82, 84; V 145
Пайн (Payne G, KJ IV 52
Пайн (Payne L. BJ V 304
Пайн (Payne H. A. SJ I 413 IV 132
Пайне (Pines HJ 1 40, 161, 167; II 355
Пайне (Pines S, Hj V 319
Пакраши (Pakrashi -5. Cj II 114
Паксу (Pacsu EJ 11 t>2
Пакьетт (Paquette L. A J I 308, 309; II 356;
III 315, 318, 461; IV 125, ] 26 143, 277;
V 78, 80, 81. 93, 216, 514, 521
Палнокас (Pallokas A J V 393
Палладии А. В. II 374
Палмер (Palmer F. S.) IV 118
Палмер (Palmer P. J J I 303; 1V 175
Палтон (Palton D. SJ V 316
Пан (Pan H. LJ II 38; HI 463
Пан (Pan T. PJ V 245
Панднт (Pandit A J V 413
Пандит (Pandit U. KJ I 15, 211
Панек (Panek E. J J V 220
Паниззи (Panizzi LJ I 357
Паннвиц (Pannwitz Pj j| 330
Паннеман (Panneman H. J.) IV 2/2
Паноуз (Panonse J. JJ I 178
Панс (Panse PJ I 10]
Паньшин О. A. V 47
Папа (Papa A. JJ V 409
Папа (Papa DJ II 41, 434, 435; III 335
Пападопулос (Papadopoulos E. PJ II 226
Папаламброу (Papalambrou PJ II 253
Папанастассио (Panariastassiou Z. В.) I 262,
268; II 18
Папенмайер (Papenmaier G. JJ И 335
Паппалардо (Pappalardo ,IJ I 54, 78
Паппас (Pappas J. JJ I J66; III 295; V 124,
44o, 447
Паппас (Pappas S. P.) ill 232 241
llanno (Pappo RJ 1 166, 265, 268; III 90,
92, 197, 366, IV 20, 21, 197
Парагамяи (Paragamian VJ I 54
Парамесваран (Parameswaran K- NJ III 241
Парелло {Parello JJ II 295
Парент (Parent KJ I 551; II 311
Парецт (Parent R. A.) II 141
Пари (Paris GJ I 226
Парик (Parikh J. RJ v 398, 399
Парик (Parikh V, MJ III 201
Париш (Parish J. HJ I 124; V 411
Париш (Parish R. GJ HI 438 443
Парк (Park C, HJ III 241
Паркер (Parker A. JJ I 334
Паркер (Parker С. О J V 1/0
Паркер (Parker WJ IV 205
Паркер (Parker W. EJ V 311
Паркес (Parkes G. D.) Ill 446
Паркс (Parks C. RJ III 412
Паркс (Parks D. В.) V 314
Парлнмеит (Parliment M. W.) V 226
Парлимеит (Parliment T. HJ V 226
Парнас (Panias J.) Ill 202, 205
Парнелл (Parnell E. W.) Ill 296
Паррик (Parrick J J 1 371, 372
Парриш (Parrish F. WJ V 287
Парсонс (Parsons C. G.) V 153
Парсонс (Parsons T. G.) II 401
Партасаратн (Parthasarathy P. CJ II 306
Партон (Parton В.) V 41
Партридж (Partridge M, W J I 54, 210; II 365;
III 40
Партч. (Partch R. EJ III 239, 242; V 382, 384
Пархам (Parham J. CJ I 64, 66; III 305, 306
Пархам (Parham W. EJI 273; Il 261, 423;
III 40, 449; IV 63, 65, 121, 122; V 357,
498—500
Пасковпч (Paskovich D. Hj 111 266
Паскуори (Pasquori 1J III 344
Пассерон (Passeron S.) I 425, 427
Пастернак (Pasternak V. ZJ V 127
ПастинДЖер (Pustinger J. V.) V 239
Пасто (Pasto D. J.) I 282; IV 140, 143
Патай (Pataj JJ III 19
Патак (Pathak S. PJ V 386
Патаки (Pataki JJ II 414; V 354, 355
Патаки (Pataki S.) IV 151
Патвардхаи (Patwardhan A- V.) V 99
Пател (Patel A. NJ II 416, 417; V 456, 509
Пател (Patel D. KJ IV 235
Пател (Patel R, P.) HI 331, 335
ПателЛН (Patelli В J I 116, 167
Патрик (Patrick Jj I 372
Патрик (Patrick T. M., Jr J I 100; III 114
Паттенден (Pattenden G. E J V 566
Паттерсон (Patterson D. В J HI 402
Паттерсон (Patterson E. LJ III 340
Паттерсон (Patterson J. MJ III 109, 114
Паттерсон (Patterson L. A.) I 132
Паттисон (Pattison F, L. MJ I 80; 11 152, 153;
III 98, 99, 246; V 44, 69, 71
Паттон (Patton J. WJ 11 70
Паттон (Patton RJ V 270
Паттон (Patton WJ V 222
Патчетт (Patched A. A J 1 167; III 149
Патчорник (Patchornik AJ 11 149, 150; IV 81,
160, V 523
603
Паудлер (Paudlcr W. W.) V 404
Пауелл (Powell A. R.) Ш 54
Пауелл (Powell J. R.) 1V 46, 187
Пауелл (Powell J. W.) I 1114; ill 360; V 232,
411
Пауелл (Powell R. G.) V 110
Пауерс (Powers J. G.) Il 401
Пауерс (Powers P. J.) V 134
Паузенга (Pauzenga U-) V 18
ПаукстелИС (Paukstelis J- V.) I 195; V 232
Паули (Pauly H.) IV 136, 137
Пауль (Paul H.) Ill 30
Пауль (Paul M. A.) II 31
Паульсен (Paulsen H.) Ill 266; IV 120
Паусакер (P^usacker R. H.) Il 59
Пауст (Pans! J.) V 89, 186, 193
Пауфлер (Pauflcr R. M.) II 271, 274; Ш 125
Пахлер (Pachler R. G. R.) V 219
Паи, (Paatz R.) V 512
Пацельт (Patzelt H.) I 124
Пачифччи (Pacific! J, G.) 1 Э88
Пачтер (Pachter 1.) Ill 149
Педерсен (Pedersen K~) V 31 ]
Педерсон (Pederson R. L.) I 275
Педли (Padley F. В.) Ill 271
Пейдж (Page G, A.) II 352, 353, 435
Пейп (Pape P. G.) II 155
Пелах (Pelah Z.) V 320
Пельк (Pelc В.) II 200, 202
Пельстер (Pelster A.) I 124
Пельтер (Pelter A.) I 327, 335
Пельтье (Pelletier S, W.) I 434, 435; Tl 305,
306, 316, 355; III 361, 366; IV 179; V 276,
278, 310, 352, 353
Пенмен (Penman D, R.) I 193
Псннрэйз (Penprase W. G.) V 390
Пеппер (Peper J, M.) II 234
Персйр (Pereyre M.) V 445
Перельман (Perelman M.) HI 121 123-
V 355, 357
Перера (Perera D.) I 94; Ш 84
Перилыптейн (Perilstein W. L.) HI 5, 10
Перкин (Perkin A. G.) II 389
Перкин (Perkin F, M.) IV 175
Перкинс (Perkins Ё. G.) IV 213, 213
Перкинс (Perkins N. A.) V /3
Перлин (Perlin A. S.) H 206; III 325, 240
Перлман (Perlman P. L.) HI 256
Перлштейн (PerIstein T.) II 39; Ш 457
Пернерт (Pernert J. С.) IV 85
Перолд (Pcrold G. W.) V 219
Перрен (Perren E. A.) 11 297; V 304
Перри (Perry B. J.) П 281; IH 377; IV 113
Перри (Perry F. M.) 11 436
Перри (Perry R. H., Jr.) 1 406
Перрин (Perrine T. D.) П 106, 107
Перро (Perraud R.) V 401
Перрон (Perron Y. G.) у 237
Перст (Perst H.) V 227
Перун (Perun T. J.) 11 196
Перчеико В. H. V 113
Перье (Perrier G.) I 45, 54
Песаро (Pesaro M.) 1 167
Песка (Peska J.) V 29, 143
Песнель (Pesitejle P.) IH 269, 271
Петер (Peter D.) V 402
Петер (Peter H.) Hl 366
Петер (Peter H. H.) i ц0; П 141
Петерс (Peters D. A, V.) V 44
Петерс (Peters E. D.) J 144; IV 62
Петерс (Peters M, A.) I 252, 387; II 364
365, 403, 419, 421
Петерсен (Petersen J, M.) I ]74; II 210 257
261
Петерсен (Petersen Q. R.) ][I 348 354
Петерсен (Petersen R. С.) I 350
Петерсен (Petersen R. J.) у 84
Петерсон (Peterson D. S.) V 411
IV 41
I 118
183,
267
161,
232,
247,
291
388;
Петерсон (Peterson E, A.) II 71
Петерсон (Peterson J. О.) Ц 185
Петерсон (Pi’lcrson L. H.) II 397, 401: In 340
Петерсон (Peterson L. I.) V 12, 271
Петерсон (Peterson P. E.) Ill 434
Петерсон (Peterson R. A.) Ill 457
Петерсон (Pckrson W. D.) H 421; I1
Петрагнани (Peiragnani N.) I 397; H
Петри (Petry R, C.) Ill 312
Петрой A, A. V 44'2
Петров В. I 175. 360, 41,3; 111 354; IV II
233. 235; V .50, 215
Петру (Petru F.) IV 116
Петруша (Pieirtisza E, W.) [II 462
ПетрцнлКа (Pctrzilka Th.) 1 305; JV
Петтерсон (Petterson R. С.) I 174
Петтит (Pettit G, R.) ] 54, 268, 351; II 124
125, 180, 183, 185, 311, 386, 388; HI
167; IV 149, 151, V 179, 183, 199,
305, 345, 379, 384, 468, 566
Петтит (Pettit R.) IH 296; V 190, 203, 546
Петтитт (Pettitt D.) Hl 382; V 294, 434
Пехман, фон (Pechmann H- von) I 243
249; И 64, 70; V 319, 310 511
Пеше (Pechct M. M.) IV 170; V 458
Пнапгадосн (Piantadosl С.) И 71, Hl
Пнагак (Piatak D. M.) I 54; II 185, 386
V 376
Пиграм (Peagram M. J.) V 71
Пикет (Pikci J- E.) 11 205
ПнлбнМ (PiSbeam A.) HI 301
Пилгрим (Pilgrim A.) V 211
Пилгрим (Pilgrim F. J.) Ill 367
Пнлгрэм (Pilgram К.,) V 447
Пижкевнч (Piszkiewicz L. M.) V 454
Пилинг (Peeling E. R. A.) IH 132
Пиллай (Pillai C. N.) 1 40
Пиллинг (Pilling G. M.) V 509
Пнльман (Pealman W. M.) 1 239
Пингсрт (Pingcrt F. P.) IV 12-3
Пиндер (Pinder A. R.) I 82; 111 339
Ппни (Pjnhey J. M.) Ill 431
Пинкни (Pinkney P.) II 394
Пинкни (Pinkney P. S.) V 127
Пиннелл (Pinnell R. P.) Ill 445
Пино (Pino P.) I 278, 291
Пинсон (Pinson R., Jr.) Ill 99, 279
Пир (Peer (H. G.) V 462
Пиркл (Pirkle W. H.) I 282, 375, 376; V 303,
493, 494
Пирл (Pearl I. A.) II 80; HI 273, 276
Пирльмац (Pearlman \V. M.) I 239; III 53
Пирс (Pearce A. A.) I 268
Паре (Pearce P. J-) V 298
Пирс (Piers E.) HI 184
Пирс (Piers K.) HI 123
Пирси (Piercey M. R.) И 446
Пирсон (Pearson В. D.) Ц1 47
Пирсон (Pearson D, E.) I 42, 52—54. 231,
238, 271, 291, 299; II 73, 74, 264, 263‘
III 141, 146, 166, 401; IV 258; V 41, 54,
33, 466
Пирсон (Pearson D. L.) П 420, 461; IV 248
Пирсон (Person R. E.) ] 137
Пнруе (Pirone R. P-) IV 156
ПчтоМеллИ (Piiochelli A. R.) V 457
Пигг (Pitt В. M.) HI 296
Питтман (Pittman C. U., Jr.) IV 119
Питтс (Pitts E. H., Jr.) I 90, 97
Питчфорт (Pitchforth L. L-) III 394
11нхл (Pich] К. E.) IV 156
Пиче (Piche I..) IV 161
Планта, фон (Plants C,, von) 11 137
Плас, пан дер (Plas van der H, C.) Hl 335
Платнер (Plainer Pl. A.) I 250, 252, 305;
Il 169, 178, 253, 457, 458; III 76, 114, 260;
V o05, 506
Плаха (Plaga L.) Ill 47
604
Плесек (Plesek J.) IV 19S
Плесе (Pless J, T.) I 347, 350; I]I 449
Плинингер (Plieninger H.) II 201, 202
Плосс (Ploss G.) V 148
Плуммер (Plummer C. W.) HI 271
Плюи (Plume G.) Ill 23
Иобицер (Pobiner H.) I 195; II 311
Поджер (Pojer P. M.) V 217
Подуска (Pociuska К.) II 22
Познер (Posner G. H.) V 120—122, 435, 436
Познер (Posner J.) Ill 457; V 464, 465
Покельс (Pockels U.) Il 141
Пол (Pohl R. J.) Ill 435
Пол (Pol E. H.) V 222
Полак (Polak R. J.) II 109
Подачек (Polacheck J- W.) HI 84
Полгар (Polgar L.) V 49b, 496
Поленский (Polenski В.) IV 76
Полл (Pauli R. D.) V 66
Поллак (Pollack M. A.) 1 438
Поллауд (Pollaud R.) Il] 166
Поллианн (Pollmann W.) Ш 148
Полони (Poloni M.) V 82
Полоновски (Polonovski M.) V 483, 484, 487
Полсон (Paulson D. R.) V 312, 314
Полстер (Polster R.) I 56
Поль (Paul D. E.) Il 357, 359
Поль (Paul R.) I 275; 11 22, 120, 121
Поль (Panlet A, C, de) V 556
Польке (Pohlke R.) I 390; IV 61
Помер (Pohmer L.) IV 116, 234
Померой (Pomeroy J. H.) Ill 420
Понд (Pond D. M.) V 126, 127
Пондер (Ponder B. W.) Il 135, 136; V 242
Понзио (Pouzlo G.) I 19, 24; IV 30
Понсолд (Ponsold КЗ I 205, 210, 345; II 276
Понсолд (Ponsold R.) II 44
Попжак (Popjak G.) П 78—80; III 7, 10,
85, 91; IV 183
Попов А. И, HI 299
Попп (Popp F. D.) Ill 145
Поппер(Роррег T. L.) Ill 256; V 238, 470,
494, 510, 555
Порат (Porath J.) Ill 284, 285
Порт (Port W.) 1 96
Портер (Porter G. С.) IV 32, 36
Портер (Porter H. D.) II 421; IV 36
Портер (Porter P, R.) II 434; IV 137
Портер (Porter R. R.) I 37(j
Порц (Portz W.) IV 59, 60
Посвик (Posvlc H.) H 335
Послср (Posler J.) V 98
Пост (Post H. W.) J 438; IH 40; IV 248
Постерпак (Pasternak Th.) I 21, 398, 399;
III 277
Постовский И. I 12J
Постхюмус (Posthumus T.) Ill 256
Потемпа (Potempa S, J.) j 370
Потоски (Potoski J. R.) V 500
Потросов В. И. I 401
Поттер (Potter H.) I 248; 11 374, 429
Поттс (Potts К, T.) I 66; IV 259; V 53, 236
Поуп (Pope И. W.) I 53
Поусон (Pawson В. A.) V 503
Прабхакар (Prabhakar S.) V 310
Правда (Pravda Z.) IV 81
Прагнелл (Pragncll M. J.) I 399; V 38, 167
Прадхан (Pradhan S. К.) I 167, 413
Прайке (Prykc J. M.) Ill 1G7
Прайне (Pnns D, A.) 11 52, 368, 37'0
Прайс (Price A. W.) V 41
Прайс (Price С. С.) I 54, 78, 219, 323, 334:
II 52, 423; 111 70, 456, 457; IV 248, Э-59, 277
Прайс (Price Л, A.) Il 209, 210; IV 165
Прайс (Price J. G.) V 320
Прайс (Price J. R ) III 74, 76
Прайс (Price P.) Il 70
Прайс (Price S.) Ill 331, 335
Прасад (Prasad D.) Ill 372; IV 31
Пратер (Prather J.) V 250
Пратт (Pratt В. С.) 1 291
Пратт (Pratt E. F.) Il 221, 223, 226; V 263,
270
Пратт (Pratt W, L. С.) I 367
Праут (Prout F. S.) 1 32, 225
Прево (Prevost С.) H 54, 55
Прей (Prey V.) 1 38; III 115, 116 118;
V 358
Прсйл (Praill P. F, G.) 11 433; IV 150, 151;
V 485
Прелог (Prelog V.) IV 122; V 14 176, 494
495
Преображенский H. A. IV 272
Престон (Preston J.) 1V 254
Прилл (Prill E. A.) I 105, 107
Принибах (Prinzbach H.) V 443, 515
Притнер (Preitner G.) IV 160
Прицик: (Pritzsche A.) IV 65
Причард (Prichard \V. W.) 1 221
Причард (Pritchard N. D.) V 133
Пробст (Probst W, J.) I 126
ПрокаЙ (Prokai В.) II 286; IV 56
Прокипкак (Prokjpcak J. M.) Ill 399; V 211
Прокофьев A- R. V 113
Проке (Prox A.) 11 121; 111 21
Проскауер (Proskauer 5.) Ill 390
Просков (Proskow S.) Ill 68
Проссер (Prosser T.) Ill 335
Протопала (Protopapa H. R.) I 421
Прует (Pruett R, L.) I 433
Прупс (Proops W. R.) 11 245
Пул (Pool W. О.) IV 41
Пуллакат (PuIInkat T. J.) V 417
Пуммерер (Pummerer R.) II 453, 456
Пунджа (Punja N-) V 142, 143
Пуитамбекср (Puntambecker S. V-) 111 387
Пуиар (Poupart J.) V 40
Пуркайаста (Purkayastha Rd V 517
Пус (Poos G. I.) I 141, 167; II 273; IV 151,
183, 272
Путербаух (Puterbaugh W. H.) I 57, 58; U 22
Путнам (Putnam S. T-) III 213, 240
Путнам (Putnam R. E.) 1 181, 196
Путсма (Poutsma M. L.) V 214
Пфанненштиль (Pfannensticl A.) Ill 27a
276; V 543
Пфау (Pfau A.) I 250, 252
Поаффенбах (Pfaffenbach P. I.) IV 197
Пфаффенбергер (Pfaj'fcnberger C. Dj V 117
Ноейл (Pfeil E.) Ill 461
Пфенницгер (Pfenninger F.) Ill 187
Пфистер (Pfister К.) I 230; HI 83
Пфиффнер (Pfiffner A.) I 54
Пфицнер (Pfitzner К, E.) I 328, 335
Пфлаум (Pflaum D, J.) 1V 264
Пфоль (Pfohl W.) Ill 376, 431
Пьер (Pierre J.-R.) V 401
Пьепде (Pierdet A.) [ 407
Пьстра (Pietra S.) I 204, 210; Ill 197; IV 169
Пьюз (Pews R. G.) V 519
Пэйдджимас (Padegimas S. J.) V 365
Пэйлср (Pailer M.) V 147
Пэйн (Paine R. A.) V 501
Пюрди (Purdie T.) Il 281
Пютгер (Putter R.) V 502
Paaiu (Raasch M. S.) Ill 265
Рабинзон (Rabinson Y .) 1 94; 111 84
Рабинович (Rabinowitz R.) I 416; Ш 466,
4p8
Рабинович (Rabinowitz J.) Ill 146
Рабьяп (Rabiant J.) IV 49
Раджагопал (Rajagopal S.) IV 72
Раджагопалан (Rajagopalau R.) I 141
Раджагопалан (Rajagopalau P.j V ]66
S05
Раджагопалан (Rajagopalan S.) I 137; II 53;
HI 67, 114, 256; IV 165, 326
Раджаппа (Rajappa S.) IV 248; V 564
Радзишевский (Radziszewski B.) Il 30;lI 1 76
Радин (Radin N, S.) I 363
Радлик (Radlick P.) HI 247, 256, 290
Радлик (Radlick P. С.) V 381
РадшеЙт (Radscheit К.) IV 84
Разникевич (Raztiikiewicz T.) I 226
Part (Ray F. E.) 11 380, 381
Рай (Ray R. E.) I] 426
Райдон (Rydon H. N.) 1 269; III 416, 417
436; IV 42; V 456, 491
Райерсон (Ryerson G. D.) I 116
Райзнер (Riesner D. В.) V 345
Райландер (Rylander P. N.) Ill 30, 131, 132,
169, 172, 173, 196—201
Райли (Wrigley T. I.) Ц 150, 338, 342; IV 151
Раймонд (Raymond M. A.) Ill 412
Раймонд (Raymond P.) V 95
Райнер (Rayner L. 8.) Il 212, 213
Райнхарт (Rinehart J. К.) V 499, 500
Райнхарт (Rinehart K. L.) II II; IV 212, 213
Райс (Rice К- С.) I 335
Райс (Rice R, G.) Ill 166
Райс (Rice R. V.) II 48
Райсер (Ryser G.) 11 118, 137
Райт (Wright G. F.) I 247; Il 370
Райт (Wright J, В.) I 176, 305
Райт (Wright M-) V 71
Райт (Wright W. B., Jr.) V 236
Раконеза (Rakoneza N.) Ill 197
Ракхит (Rakhit S.) IV 257, 258
Ракша M. A, V 195
Ралейг (Raleigh D.) И 216; V 151
Раллс (Ralls J. W.) Ill 354
Ралстон (Ralston A. W.) IV 41
Ральф (Ralph R.) I 427
Раман (Raman P, V. A.) HI 114
Раманатан (Ramanathan N.) 1П 390; V 99
Рамачандран (Ramachandran J.) IV 268
Рамачандран (Ramachandran L. K.) Ill 91
Рамачандран (Ramachandran S.) Il 268 269
273, 281, 293; 111 107, 129, 166; V 143, 251
Рамер (Ramer R. M.) V 197, 199
Рами (Ramey I<. С.) V 127
Рами (Ramey P. S.) V 214
Рамирец (Ramlpez F.) I 416; III 388, 390,
412, 465, 468; V 99, 238, 239
Раммлер (Rammler D, H-) I 365, 427; IH 319;
IV 149, 151
Рамп (Ramp F, L.) I 268; III 371
Рамсделл (Ramsdell P. A.) II 56
Рамсей (Ramsey В.) V 512
Рамсей (Ramsey J, В.) IV 185
Рамсей (Ramsay О, В.) II 119
Рамуц (Ramuz H.) V 270
Рандел (Randel W.) I 247; Ц 448, 456
Ранеберг (Runeberg J.) II 11
Ранк (Rank B.) Ill 240
Ранникко (Rannikko V.) Ill 11
Рансом (Ransom R.) V 105, 108
Pao (Rao A. S.) V 381
Pao (Rao C. N. R.) IV 28, 29
Pao (Rao D. V.) Ill 241
Pao (Rao G. V.) V 393
Pao (Rao P. N.) I 178; IV 151
Pao (Rao P. V.) V 251
Pao (Rao U. V.) Ill 373
Pao (Rao V. V.) II 70
Pao (Rao V. S.) Ill 280
Рапала (Rapala R. T.) Ill 123, 170, 172
195, 197; V 7, 357
Рапапорт (Rapaport H.) IV 137
Рапопорт (Rapoport H.) I 167; П 388; V 270
389, 390, 507, 508
Рапопорт (Rapoport L.) V 461
Рапп (Rapp R.) V 243, 518
Раппопорт (Rappoport Z.) Ц 54
Pape (Rabrs E. J.) IV 18
Рассвейлер (RassWeiler C. F.) 11 87
Рассел (Russel J. H.) I 353
Расселл (Russell G. A.) I 137, 335, 336 344
345; II 441; III 296; V 138, 143
Расселл (Russell J. A.) V 284
Расселл (Russell J. R.) 1 247; III 68, 339
Расселл (Russell M.) IV 38
Расселл (Russell P. В.) I 210
Расселл (Russell R. R.) Il 322, 326
Ратке (Rathke M. W-) I 215; HI 381; V 15,
51, 104, 257, 292. 471
Ратто (Ratts K. \V.) I 275, 416; III 412
Ратфелдер (Rathfelder P.) 11 227
Раубе (Raube R.) IV 248
Раудниц (Raudnitz H.) II 430
Раули (Rowley H. Н.) V 260
Рауль (Raoul Y.) V 505, 506
Payccep (Rausser R.) II 421; III 118
Рафаэль (Raphael R. A.) I 80, 121, 151, 166,
256; II Ц, 76; III 189, 319, IV 96, 205
Рафф (Raft P.) П 203
Раффелсон (Raffelson H.) Ill 150 IV 151
Paxa (Raha С.) I 305; 11 217
Рацкин (Ratzkln H.) I 427
Раш (Rush R. V.) V 447
Рашель (Rachele J. R.) I 363
Рашер (Rascher L.) V 131
Рашиг (Raschig F.) IV 126
Рашид (Raschid A.) V 324
Раян (Ryan G.) V 432
Раян (Ryan K. J.) I 102
Раян (Ryan P. W.) Il 150
Раян (Ryan R. W„ Jr.) Ill 311
Ребер (Reber F.) H 330; HI 18
Реберг (Rehberg С. E.) Ц 330; III 354
Реверден (Reverdin F.) 11 262
Реган (Regan С, M.) I 387
Реггель (Reggel L.) Il 158, 159, 162, 163;
HI 392
Регенасс (Regenass F, A.) 1 346
Региц (Regitz M.) HI 357; V 423
Редди (Reddy J. S.) I 81
Редеман (Redemann С. E.) I 132, 210; IV 25
РеДеман (Redemann К. 1.) 1 210
Редмонд (Redmond J. W.) V 384
Редмонд (Redmond W.) I 71; III 307
Редмор (Redmore D.) I 178
Резерфорд (Rutherford D.) IV 196
Резерфорд (Rutherford R. G.) I 71; III 306,
307, 399, 442. 444
Резерфорд (Rutherford R. G.) V 211
Рей (Rai C.) IH 145
Рей (Rel M.-H.) V 516
Рейд (Reid D. E.) HI 435
Рейд (Reid D, H.) I 413: IH 401; IV 132
Рейд (Reid J. D.) 11 129
Рейд (Reid W.) V 417
Рейзнер (Reisner D. В.) IV 101; V 345
Реймлннгер (Reimlinger H.) J 247, 252
11 225, 226
Реймонд (Reymond D.) 1 21, 24
Рейн (Rein В. M.) Ill 415
Рейнеке (Reinecke M. G.) V 465, 466
Рейндел (Reindel F.) 11 94, 97
Рейнеке (Reineke С. E.) V 318
Рейнер (Rainer G.) IV 75
Рейнольдс (ReynoII C. A.) 1. 210
Рейнольдс (Reynolds D. D.) I 54, 106, 132'
III -119; IV 266
Рейнольдс (Reynolds G. F.) 1 273
Рейнольдс (Rayiiolds FI. H.) I 121
Рейнольдс (Reynolds S.) I 280
Рейнольдс (Reynolds W, E.) IV 29
Рейнхарт (Reinhart J.) Ill 444
Рейнхеймер (Reinheimer J, D.) I 376
Рейнхекель (Reinheckel H.) Ill 45]
606
РсЙиштсйл (Reinstein М-) И 277; V 195
Рейс? (Reist Е. J.) I 102
Рейст (Reist Н. R.) V 390, 508
РейтсеМа (Reitsema R. Н.) 1 186; II 377, 380
Рейф (Reif О. J.) 1 Иб; II 351, 353
Рейф (Reii Е.) Ill 84
Рейф (Reiff Н.) V 253
Рейх (Reich D, А.) I 414
Рейх (Reich Н.) I 372; Ill 46
Рейх (Reich W. S.) IV 43
Рейхардт (Reichardt С.) V 227,
Рейхерт (Reichert J. S.) I 78; III 190
Рейхл (Reichie W, R.) I 210; III 360
Рейхштейн (Reichstein T.) I 24; 126, 353;
II 14. 50—63, 235 330; III 13, 18, 46, 241,
437, 443; IV 146, 151; V 476 478
Рейц (Reitz R. L.) V 21
Реке (Raccke В.) II 427
Рекоидо (Recundo E.) I 425, 427
Ремар (Rernar J. F.) Ill 341
Ремере (Remers W. A.) II 83; V 226,
Реми (Remy D. С.) II 395, 400
Ремик (Remick M. N.) Il 183
Ремпфер (Rempfer H.) IV 76
Рейсе» (Remsen 1.) IV 106, 107, 109
Ренвик (Renwick A. A.) Ill 99
Ренк (Renk E.) Ш 24i
Ренн (Renn К.) I 396
Реннхард (Rennbard H. Ц-) IV 22
Рено (Renaud D. J.) Ill 457
Ренолд (Renold W-) V 495
Ренолл (Renoll M.) Ill 354
Ренс (Rens J.) V 299
Ренфроу (Renfrow A.) 1 153, 167
Ренфроу (Renfrow* W. В.) 1 57, 153, 167
Ренфооу (Renfrow W. B., Jr.) I 218; Il 369;
111'399
Реплогль (Replogle L. L.) V 353
Penne (Reppe H. G.) Ill 399
Penne (Reppe W.) 256; II 6, 7, 439; III 4i5
Рерик (Rerick M. N.) II 183, 388
Pec (Res M.) Ill 197
Ресслер (Ressler С.) I 427; III 321; IV 265
Pecnec (Respess \V. L.) V 122 300
Рете (Riitz R.) HI 146, 148
Реутов О. A. IV 53, 56
Реуш (Reusch W.) Il 46; V 61, 66, 243
Рефн (Refn S.) 11 245
Рёллер (Roller H.) V 119
Рельке (Roeike H.) II 230
Рёнерт (Rohnert H-) IV 36
Рёнш (Ronsch H.) II 414
Рёпш (Ropsch A.) Ill 436
Рёшейаен (Roscheisen G.) V 414
Рзешортарска (Rzeszortarska B.) HI 22
Рибзомер (Riebsomer J. L.) Ill 32
Phb (Reeve W.) 1 II; HI 157
Ривер (Riviere H.) Ill 58, 67
Рнвес (Reeves W. АЛ IV 81, 264
Ривешил (Rieweschl G., Jr.) II 381
Ривлин (Rivlin V. G.) III 240
Рнгамонтя (Rlgamonti J.) I 71
Ригби (Rigby w.) I 186; II 83, 84, 389, 391
Риггс (Riggs N. V.) 11 59
Ригель (Riegel В.) II 426; III 354
Ригель (Riegel E. R.) IV 244, 248
Рид (Reed О. E.) 1 247
Рид (Read G.) V 324
Рид (Reed H. W- B.) Ill 415
Рид (Reed L. J.) Ill 40
Рид (Reed R.) I 231; In 458
Рид (Reed R. A.) 1 269
Рид (Reed R. R.) HI 203, 204
Рид (Reed W. R.) V 82
Рид (Read T. O.) Hi 412
Рид (Reid E. E.) I 132, 306
Ридл (Riedl J.) HI 276
Рид (Ried W.) I 75; II 128, 129; III 302, 360
Риду (Rideout W.-H.) V 314
Рибкорп (Rickborn В.) I 166, 268, 334;
III 306
Рпкеибахер (Rrckenbacher H.R-) HI 152, 153
Рикка (Ricca A.) 1 417
Рилей (Riley H, A.) Ill 246, 256
Рилей (Riley J. P.) H 246
Риманн (Riemann U.) Ill 183
Ример (Riemer J.) HI 13
РимшнейДер (Riemschneider R.) Ill 318
Рингольд (Ringold H. J.) I 69, 151, 166, 186,
376, 377, 410. 413; H 25 27. 39, ill, 193,
301, 311, 412, 414, 420, 462; III 94, 99,
166, 241; IV 130, 173, 248; V 178, 183, 556
Риндеркнехт (Rinderknecht H.) IV 79, 81;
V 464
Риникер (Riniker B.) Ill 76
Ринке (Rinke H.) V 342
Ринкес (Rinkes I. J.) HI 27, 30
Риордан (Riordan J, F.) Ш 308, 309- V 413
Рис (Rees C. W.) I 18, 215; 111 238 242;
V 515
Рис (Rees R.) V 28, 40J
Рис (Reece C. R.) V 164
Puce (Reese С, В.) IV 43, 122; V 305
Price (Riess J.) IV 90, 99
Рнст (Rist С. E.) П 70
Ритвай-Эмандити (Ritvay-Emandity Kn
V 230
Риттел (Rittel W.) IV 132; V 155
Риттер (Ritter A.) I 189; Ill 383, 385, 391
462; V 417
Риттер (Ritter D. M.) HI 391
Риттер (Ritter E, J.) V 146
Риттерсдорф (Rittersdorf W.) HI 444
Ритчи (Ritchie В.) IV 90
Ритчи (Ritchie С. D.) V 126
Ритчи (Ritchie E.) v 217
Рихе (Rieche A.) 1 146, 147, 407; ]Ц 39, 67,
69, 70, 124; IV 275; V 185
Рихтер (Richter H. J.) I 54; III 241; IV 63, 65
Рихтер (Richter M.) I 21, 24
Рихтер (Richter R.) V 49
Рнхтмайер (Richtmyer N- К.) II 100; III 76,
240
Риц (Reeiz T.) I 431
Ричардс (Richards p. H.) V 298
Ричардс (Richards H.-H-) 1,11 285
Ричардс (Richards К. E.) V 143, 372
Ричардс (Richards R. W.) V 15
Ричардсон (Richardson A,, Jr-) V 52
Ричер (Richer J.-G.) IV 197; V 360
Ричмонд (Richmond G. D.) A’ 136; 143
Риччнути (Ricciuti С.) I! 97; V 311
Ришбейт (Rischbieth P.) II 136
Po (Ro R- S.) I 54
Робб (Robb С, M.) Ill 2ll5
Роббинс (Pobbins В. К.) 1 275
Роббинс (Robbins F.) II 421
Роберсон (Roberson E. B.) Ill 97, 99
Робертс (Roberts A.) 11 183
Робертс (Roberts C. W.) Ill 321
Робертс (Roberts D. С.) H 393, 400
Робертс (Roberts D. L.) V 73
Робертс (Roberts F. E.) II 436
Робертс (Roberts G- P.) Il 461
Робертс (Roberts J. D.) 1 248, 378; Hl 40,
303, 319; IV 248; V 547, 548
Робертс (Roberts R. M.) Ill 40
Робертс (Roberts W.) I 339, 345
Робертсон (Robertson A. V.) IV 82
Робертсон (Robertson D. A.) V 143
Робертсон (Robertson D. E.) V 505
Робертсон (Robertson D. N.) I 275; II 213, 214
Робертсон (Robertson G. R.) JI 375, 380
Робине (Robinet F, G.) I 387
Робине (Robins В. K-) I 275
рЗбйнсон (Robinson А. В.) V 511
607
Робинсон (Robinson С. А.) V 201
Робинсон (Robinson С. Н.) 1 77, 126, 127,
363; 111 99; IV 143, 173; V 532
Робинсон (Robinson D. В.) IV 227
Робинсон (Robinson F. M.J IV 272
Робинсон (Robinson G. М.) 11 92, 97
Робинсон (Robinson .1. С., Jr.) IV 60
Робинсон (Robinson М. J, Т.) V 18
Робинсон (Robinson RJ I 54, 87, 223; 11 17,
92, 97, 239, 267, 268, 273, 334, 335; III 74,
7 6, 134, 145; V 349, 508
Робинсон (Robinson R. Е.) 11 150, 456
Робинсон (Robinson R. М.) Ill 173
Робинсон (Robinson S. A.) II 97
Робисон (Robison В. L.) IV 98
Робисон (Robison M. MJ IV 93
Робке (Roebice H.) II 230; V 122
Робких (Roeblich V. M.) 1 67
Робсон (Robson J. H.) I 18; III 444
Робсон (Robson. R.) V 431
Робэк (Roebuck A.) ill 67
Рогальскнй (Rogalski W.) HI 461; V 320
Рогинский (Roginski EJ HI 173, 197
Рогич (Rogic M. M.) V 15, 51 104, 292
Родгмаи (Rodgman A.) I 15
Родда (Rodda FI. J.) Ill 167
Роджерс (Rogers C. UR IV 36
РоДЖерс (Rogers P. F., Jr.) V 464
Роджерс (Rogers H. A. J.) V 66
Роджерс (Rogers J. WJ IV 6, 161
РоДиг (Roedig А.) Ц 80, 435
Родин (Rodin J. О J V 164
Родин (Rodin R. LJ Ill 56
Родионов В. M. IV 57, 58
Родригез (Rodriguez Н. RJ V 352, 353
Рожое (Rogier Е, R.) Il 273; III 197; 1V 250
Розанцев Э. Г. V 154, 155
Розе '(Rose J. DJ II 246
Розен (Rosen P.) I j 153
Розен (Rosen S.) V 216
Розен ‘Rosen W. E.) II 97
Розенау (Rosenau J. DJ 1 141
Розенберг (Rosenberg H. Al.) V 24
Розенберг (Rosenberg S. DJ Ill 402
Розенбург (Rosenborg D. WJ II 253, 254;
111 1 83
Розенгейм (Rosenheim О J Ill 250, 256
Розендаль (Rosendahl F.) IV 90; V 68
Розенкранц, (Rosenkranz G.) I 69, 74, 186;
II -27, 221, 226, 248, 301, 414; Hl 167; IV
122, 173; V 264, 556
Розенман (Rosetiman H.) V 454
Розенмунд (Rosenround K- W.) Ill 48, 53
Розенталь (Rosen'.hal A.) I 18
Розенталь (Rosen.nal <9 ) HI 53
Розенталь (Rose’-thal F.) H 335
Розенфельд (Rosenfeld D. 2.) I 167, 195;
V 66
Розенфельд (Rosenfeld R. S.) IV 226
Розенфельдер (Rosenfelder W. JR III 175, 183
Poiiep (Royer R.) Ill 360; V 360
Рокаш (Rokach J.) IV 74
Роланд (Roland J. RJ Ill 318
Ролл (Roll L. J.) H 295; IV 226
Роллетт (Rollett A.) II 125
Ролле (Rolls J. WJ IV 250
Ролофф (Roloff H.) Ill 184
Роман (Roman S. A.) V 270
Ро.чанеллн (Romanelli M. G.) V 503,. 504
Ромеро (Romaro M. A.) Ill 240, 302, 303;
IV 165
Ромо (Romo J,) II 248
Рона (Rona J.) V 122
PoimiiH (Ronwin Ej IV 166
Ропдестведт (Rondestvedt C. S.) ill 281;
V 280
Ронзпо (Ronzjo A. RJ. 1 224; П 374; HI 207,
256
Ромео (Ronco A.) JI 273
Роозен (Roosen PR IV 36
Pooc (Roos HR I 121
Pooc (Roos L.) V 240
Ропер (Roper J. N., Jr.) IV 250
Pop (Rohr Wj III 421
Popnr (Rorig 1<R II 414
Рорманн (Rohrmann ER V 360
Pociihh (Rpsini G.) V 82
Роске (Roeske R.) II 2s
Росное (Roskos P. D.) V 423
Росс (Ross J. A.) IV 112, [13
Росс (Ross J. HR I 249
Росс (Ross N. С.) II 274
Росс (Ross W, AR 111 167
Россбах (Rossbach F.) V 43
Pot (Roth К.) V 155
Pot (Roth R. HR V 226
Pot (Roth W. R.) I 366; V 203, 546
Ротман (Rothman E. S.) И 39, JU 457; V 360
Ротаан (Rothman L, A.) Ill 373, 402
Ротрок (Rothrock H. S.) IV 191
Pott (Rott U.) II 276
Poy (Roe A. S.) V 482
РоУ (Rowe C. A. Jr.) I 166, 334
Poy (Rowe E. J J II 71
Poy (Rowe F. MR II 407, 409
Роудва.чьд (Rodewald L. В.) V 18
Роуз (Rose F. LR V 52
Роузгей (Rosegay A.) V 419
Роуланд (Rowland A. T.) I 334
Роулец (Rawalay S. S.) V 226
Роуланд (Rowland S. PR IV 210
Роут (Rothe I.) V 411
Роут (Rothe MR V 411
Роухи-Лариджани (Rowhj-Laridjani MR
III 240
Рохов (Rochow E. G.) HI 311, 386
Рочек (RoCek JR V 537, 540
Рош (Roche L. К.) II 211
Роэ (Roe A.) I 73
Роэлофсеи (Roelofsen D. P.) V 307
Руби (Ruby P. R.) IV 72
Рубил (Rubin MJ IV 151
Рубин (Rubin M. B.) III 10, 366; V 551, 554
Рудицгер (Rudinger JR 1 177; II 455, 456;
IV 81
Рудлоф, фон (Rudloff E., von) I 40; Ш 86, 91,
107, 114, V 352
Рудовский (Rudowski AR IV 31
Рудольф (Rudolph W.) IV 173
Ружжьери (Piiggieri de P.) I 88; IV 168
Ружичка (Ruzicka LJ II 105, 107, 125, 457,
458; III 113, 114; V 14
Руйль (Ruyle W. V.) Ill 183
Рук (Ruck F,) I 121
Рукс (Rooks W.) V 504
Румменс (Rummens F, H, AR V 507
Руммерт (Rummert G.) Il 303
Рунберг (Runeberg JR V 389
Рунге (Runge FJ II 255, 256
Руофф (Ruofr P. M.) V 398, 399
Pyne (Rupe HJ V 308, 310
Руске (Ruske WJ I 183
Русси (Rotissi G.) V 448
Руссо (Rousseau GJ II 206
Рутецберг (Rutenberg A. At.) Щ 302
Рутковский (Rutkowski A. J.) Ill 372
Рутледж (Rutledge P. S.) Il 55
Руфф (Ruff J, KJ II ]30; V 457
Руфф (Ruff OR 111 79, 83
РуХоф (Ruhoff J. RJ I 132, 306; Il 97
Ручманн (Rutschmann J J IV 264
Руше (Rusche JJ Hl 124
Рушиг (Rnschig HJ IV lol, 152, 155
Рходс (Rhoads S. J.) ill 19
Рышкевич (Ryskjewicz E, EJ I 360
608
Рэбджои (Rabjohn N.) I 15; III 256; IV 6,
11, 72
Рэдди (Ruddi A. W.) 11 245
Рэйли (Raley .1. H.) V 515
Рэнд (Rand L.) I 210, 37b, 3/7; II 61, 107—
100; HI 450; IV 104
Рэндалл (Randall A. A.) Ill 437_
RacOepH (Rasburii J. \V,) 1 371. 3/2
Pjoerr (Riiegg R.) II 118, 137; Ill 354; 1V 253,
2G7, 274
Рюльманн (Riihlmauh К.) V 439. 442
Рюхард (Riichardt С.) I 101, 1 88; II 121, 439;
111 114
Рюц (Ruiz A.) V 504
Сабет (Sabet C. R.) 1 95
Сабо (Sabo E. F.) 1 126; IV 148, 151, 173
Сава (Sawa Y. 1\.) I 37G
Савас {Savas E. S.) III 468
Савидес (Savides С.) I 168: II 16
Савилль (Saville N. M.) 1 117
CaBnm<.nii(Sawicki E.) II 262, 263
Саджус fSajus L.) V 252
Садовски (Sadowski ,1.) V 527
Сазерленд (Sutherland I. О.) V 181, 183
Сазерленд (Sutherland J. К.) V 495, 555
Сазерленд (Sutherland M. D.) Ill 271
Сазерленд (Sutherland В. G.) I 413; IV 132
Сайкс (Sykes P. J.) V 362, 534, 540
Сайнерхолм (Synerholm M.) Ill 301; IV 209
Сайхун (Sayhun M. R. V.) 1 334
Сакай (Sakai I.) V 447
Сакай (Sakai M.) V 384
Сакаи (Sakan T.) V 325
Сакакибара (Sakakibara S.) II 303; III 434'
IV 158; V 341, 511, 520, 521, 523
Саката (Sakata T.) V 270
Сакс (Sachs D. H.) II 11, 155; HI 448
Cane (Sax K. J.) I 137; HI 354
Сакстон (Saxton J. E.) I 66
Сакстон (Saxton M. R.) I 421
Сакур (Sackur O.) Ill 295
Сакурзго (Sakurago H.) II 342
Сакураи (Sakurai H.) I 188
Саламон (Salamon A.) II 125
Салвадори (Salvador; G.) I 101
Салем. (Salem A. Y.) IV' 153
Салим (Salim N.) I 118
Салисбури (Salisbury L.) HI 240
Салливан (Sullivan A. P., Jr.) HI 83
Салливан (Sullivan E. A.) Ill 303
Саями (Salmi E. J.) Ill 11
Салстоп (Sulston J. E.) V 305
Салца (Saltza M. H., von) HI 340
Самарнтано (Samaritano R. H.) I 31G
Самбет (Sambeth J.) HI 126
Саммербелл (Summerbell К. К.) Il 211;
V 214
Саммерс (Summers G. H, R.) I 39, 41; II 193
Саммор (Sammour A. E.) I 210
Самойлова 3. E. V 47, 196
Самохвалов Г, И. 1V 253
Сампсон (Sampson VV. L.) HI 76
Самрелл (Sumrell G.) I 167
Самуэль (Samuel D.) Ill 321
Сандберг (Sundberg R. I,) III 468
Сандервирт (Sunderwirth S. G.) 1 318
Сандер-ПЛассман (Sunder-Plassmann P.)
V 306
Саидин (Sandin R. В.) Ц 41, 59; Ill 27, 30;
IV 101
Сандия (Sundin S.) V 384
Сандлер (Sandler S. R.) V 480, 489
Сандстрем (Sandstrom G.) [ 90
Сэндстром (Sandstrom W- M.) [J 368, 3'70
Сандулсско (Sandulesco G.) II 14
Санкаран (Sankaran D. К..) V 95
Саннье (Sannie С.) I 178
Сантанакрншнап (Sanlhanakrishnan T. S.)
V 35
Сантилли (Saniilli A. A.) IV 7
Саптро1! (Santroch J.) V 344
Сантурри (Santnrri P.) II 421
Санфилиппо (San Filippo J., Jr.) V 220
Санфилиппо (Sanfilippo S.) I 372
Санчез (Sanchez M. B.) Ill 236
Cann (Sapp J.) Ill 434; V 460
Сарел (Sarel S.) I 210; II 401; III 92; V 212,
219
Caperr (Sarett L. FK) I 153 166, 178, 256;
II 268, 273, 281; III 1 1, 44, 46 256; IV 72
87, 90. 151, 180, 183, 270, 272; V’ 539
Сарид (Sarld S.) Il 150
Сарин (Sarin P. S.) Ill I66‘
Саркис (Sarkis A.) IV 126
Сарма (Sarma P. S.) Ill 91
Сарматиз (Surmatis J. D.) II 137
Сасаки (Sasaki К.) 11 230
СасКннД (Saskind S. P.) V 263, 270
Сассе (Sasse W. H. F.) III 157, 166, 167
Caro (Sato E.) Ill 148
Сато (Sato Y.) 24; II 446
Саузен (Sausen G. N.) Hl 197, 318
Сауки (Saucy G.) HI 183, 354; IV 226; V 208
Саундерс (Saunders В. С.) 1 376, 435, 436;
V 438
Саундерс (Saunders J. H.) I 78; H 75, 70;
IV 101
Саундерс (Saunders M.) IV 44
Саут (South A.) Ill 298
Саферстснп (Saierstesn L.) V 349
Сафхмлл (Saifhill R.) V 305
Cax (Sah P. P. T.) II 136
Саха (Saha J. G.) V 360
Сахьюл (Sahyun M. R. V.) I 168, 334
Сачдев (Sachdev H. S.) V 494
Снампнатан (Swaminaihan S.) II 273, 281;
HI 166; V 549
Сван (Swan G. A.) I 162. 168; II 331
Сван (Swan J. Al.) Ill 321
Сванн (Swann S.) II 261
Сварте (Swarts F.) V 3/3
Сведи (Swedi A.) 1 291
Свенсон (Swensoii J. S.) Ill 457
Свенссон (Svensson T.) V 543
Свентон (Swenton J. S.) V 171
Сверн- (Swern D.) I 90, 144, 181, 247; II 93,
97, 248, 249, 318. 319, 321, 326; IH 23
24, 61, 66 — 68. 184, 246, 302, 339; V 188
189, 216, 311, 520
Сверченски (Swierczewski G.) V 448
Светт (Swett I.. R.) H 400
Свилей (Sweeley С. С.) I 189; V 77
Свинделле (Swindells R.) Ill 201; IV 91
Свитенбенк (Swithenbank C.) Ill 256
Свифт (Swift G.) V 216
Свишер (Swisher J. V.) II 109; IV 184
Свобода (Swoboda .1. A.) V 393
Сегал (Segal H. L.) V 113
Сеговиа (Segovia R.) IV 36
Седел (Seden T.) 1 414
Седлан (Sedlak J.) I 100
Сей (Sei R.) J 58
Сейд (Seide W.) V 331
Сейдел-Пенне (Seyden-Penne J.) II 48
Сейдл (Seidl G.) 1V 52
Сейдл (Seidl I..) [V 126
Сейднер (Seidner R.) II 401
Сейкел (Seikel M.) Ill 68
Сейлер (Seyler R. C.) 1 107
Сейп (Seip D.) V 443, 515
Сейф (Safe S.) Il 237
20 № 1994
609
Сейфарт (Sevfarth Н, Е.) LV 275
Сейферт (Seyferth D.) 1 35, 93. 183, 181, 238,
272; 11 47. 285, 111 301, 372, 373, 387.
404, 412, 420; IV 53, 55. 50; V И, 75, 434,
436, 500
Сейферт (Seifert Р.) IV 19/
Сейферт (Seifert W. К.) V 11
Сейц (Seitz А. Н.) V 33
Сека (Seka R.) IV 41
Сейера (Sekera V. С.) Ill 108, 114, 366
Секи (Seki F.) II 266
Секлйа (Sekiya М.) ] I 332
Секстон (Sexion Н.) IV 103
Селби (Selby W. М.) Ц 141
Селнараджап (Selvarajaii R.) V 549
Селигман (Seligman А. М.) I 257; V 487, 549
Селлипг (Selling Н. А.) V 66
Селлстедт (Sollstedt J. Ц.) II 466
Семной (Siemion I. Z.) V 340
Семен (Senion W. L.) 1 219
Семпл (Semple В. М.) V 73
Сен (Sen .1. N.) I 348
Сенг (Seng F.) II 118; III 412
Сено (Senoli S.) V 325
Сербаи (Serban N V 81
Сергеев H. М. V 546
Сергенор (Surgenor О. М.) I 144
Серебряков Е. II. I 169; 111 241
Серини (Serini A.) Ill 40, 46
Серматис (Surmatis .1. Е>.) И 137
Серота (Scrota S.) II] 92
Серратоза (Serratosa F.) V 21
Серри (Surrey A. R.) ]Ц 203. 205; 1V 90;
V 77, 78
Серридж (Snrridge J. FI.) 1 15; V 110, 393
Сертис (Surtees J. R.) Ц 227
Серфонтейн (Serionlcin W- J.) II 452, 456
Сет (Seth S. R.) IV 209
Сетна (Sethna S. М.) I 48, 54; П 99
Сеттлейг (Settlage Р. II.) II 230; III Ц4
Сефтон (Sephton 11. Н.) Ill 240
Сечковски (Sieczkowski J.) V 399
Сешарди (Seshadri S.) Ill 134, 145
Сешарди (Seshadri T. R.) ] 423. 427; HI 166
Сёрбо (Sorbo В.) I 370
Сибах (Seebach D.) V 89, 90, 161, 163, 497
Сибек (Seebeck E.) IV 145, 151
Сибек (Seebeck S.) Ill 240
Сивазанкаран (Sivasankaran K.) Ill 132
Спггинс (Siggins J. E.) V 251
Сигер (Seager J. H.) Ill 184
Сиддолл (Siddall J.) V 35
Сиддолл (Siddall J. В.) I J66, 334; V 386, 504
Сиджвик (Sidgwick N. V.) IV 190
Сидкай (Sidky M. M.) V 323
Сиз (Seese W, S.) ]V 126
Сплбер (Silber R. н.) IV 32, 36
Силвер (Silver B. L.) I[ 1321
Снлвервуд (Silvenvood H. A.) Ill 24, 245, 246
Силверсмит (Silversmith E. F.) HI 303
Силерт (Seelerl K-) I 345
Сплнгер (Seeliger D.) (I 281
Силловей (Sillovray H, L.) II 423
Сильва (Silva M. L.) V 335
Сильверман (Silverman M.) V 82
Сильверштейп (Silverstein R. M.) I 360 404‘
V 164, 174, 301
Симамура (Simamura O.) 11 342
Снмарустп (Simarusti С. M.) V 384
Спмингтон (Simiugton R. M.) IV al
Само!: (Simon P.) I 88
Симонс (Simons D. M.) Ill 40
Симонс (Simons J. И.] IV 118
Симонс (Simons J. I\.) I 421
Симмонс (Simmons H, E.) И 40, 47; III 286
289; IV 213; V 304. 305, 543
Симонс (Simmons H. D., Jr.) IV 56
Симмонс (Simmons T. S.) Ill 468
Симпсон (Simpson P. V.) I 9?
Симс (Sims H.) IV ill
Симс (Sims J. J.) V 381
Симе (Sims P.) II 99
Снмхеп (Simehen G.) IV 76
Спнвел (Snivel F.) ill 240
Синг (Singh P. P.) 1 334; I] 281
Синг (SinghR. P.) V 225. 226
Сингал (Singhal G. Ы.) V 308
Сингер (Singer A.) II 97; IV 72
Синглетон (Singleton F. G.) I 210
Синя (Sinz A.) 'I 215
Синнамон (Cinnarnon ,J. M.) 1 15
Синнамон (Cinnamon M.) V 131
Синнс (Syrtnes E.) V 143
CnoTTH (Ciotti C.J., Jr.) Ill 367
Сипер (Syper L.) v’393, 343
Сипос (Sipos F.) HI 396
Снркар (Sircar J. C.) HI 172
Сирл (Searle N, E.) [ 252
Сирл (Searle G. D.) II 415; III 271
Сирл (Searle R. J. G.) Hl 263, 468
Сирлес (Searles S.. Jr.) 1 131, 335; III 382'
IV 265
Сирси (Searcy A. M.) I 17.3
Снспдо (Sisido К.) I 58, 95
Сиглер (Sjsler H. H.) IV 136
Слети (Sisti A. J.) V 111
Сита (Sila G.E.) 111 183
Ситтнг (Si11 ig M.) 11 371
Сихора (Syliora К.) V 401
Скалсра (Scalera M.) IH 283
Скаллард (Sciillard P. W.) V 196
Сканлан (Scanlan J.T.) HI 24, 67, 246
Скаттебол (Skaltebfll L.) I 78, 148, 134, 166,
238. 252. 351; H 282, 284, 285; IV 268-
V 295, 299
Скаффопе (Scaffone E.) I 335
Скелл (Skell P. -S.) I 57, 137; V 83
Скнаки (Sciaky R.) I 167
Скнллп (Seilly N. F.) V 298
Скиннер (Skinner G. A.) V 126
Скиннер (Skinner W. A.) I] 455
Скларж (Sklarz В.) V 219, 353, 417
Скола (Scola D. A.) 11 70
Скорч (Skorcz J. A.) V 26
Скотони (Scotoni R., Jr.) Ill 309
Скотт (Scott С. В .) Ш 468
Скотт (Scott J. E.) II 430; IV 185
Скотт (Scott M. D.) I 166, 168. 210
Скотт (Scott N.D.) I 366; ]] 357 359
Скотт (Scott R. W.) IV 109
Скотт (Scott W, J.) 11 425
Скотт-Верден (Scott-Burden T.) V 431
Скоурс (Skopes P. M.) V 342
Скоутен (Scotiten C. G.) V 153, 316
Скоффоне (Scotfnne E.) I 286
Скрайбнер (Scribner R.M.) I 21, 23, 24
Скрайшэм (Scriesham A.) V 66
Ckperrac (Screttas C. □) Ill 458; V 71
Скулли (Scully C-N.) 1V 265
Скэйф (Scaile C. W .) I 24
Скэнлон (Scanlon В.) V 393
Слай (Sly W. G.) I 291
Слайтер (Slighter R.G.) V 9
Слаунвайт (Slautiwhite W. R., Jr.) Il 12
Слау (Slangh L. H.) V 224, l?47, 315
Слейтер (Slater C. D.) V 273
Слейтер (Slater G.P.) Ill 240
Слсйтор (Slaytor M.) Il 183
Слейте (Slates H. 1..) Ц 106, 226, 253, 409
413, 414; 111 124, 205 344- IV Ю, 20,
175; V 127, 252, 361
Слессор (Sjessor K. N.) V 131, 133, 488
Слетциигер (Sletzingcr M.) Il 55
Сломи (Slomp G.) 1 126; III 8, 10, 107
С,порах (Slorach S, A.) II 365; III 40
Слота (Slots P, J.) I 194
610
Слотта (Slotta KJ I 141; IV 188
Слуфф (Slooff G.) 11 342
Смайли (Smiley R. A.) I 33, 334
Смайле (Smiles S.) I 74; Ill 70
Смайт (Smyth J.) I 394
Смайт (Smyth R. В.) V 230
Смарт (Smart N. A.) 1 177
Смарт (Smart W. DJ Ill 172
Смат (Smat R. J.) 11 74
Смежкал (Smcjkal J.) V 80, 196, 365
Смелли (Smalley R. K.) HI 1 13
Смептовски (Smentowski F. J,) I 333
Смик (Smick R. L.) IV 11
Смиссмаи (Smjssman E.E.) I 256; III 431
Смит (Smit P. J.) V 285
Смит (Smith A. E.) II 316, 326; III 324, 327
Смит (Smith B.C.) V 82
Смит (Smith B.H.) II 465
Смит (Smith С, P.) V 99
Смит (Smith C. R.. Jr.) IV 91; V 99
Смит (Smith C. W.) I 312; II 292; III 77, 78;
IV 95
Смит (Smith D. S.) I 210, 382; III 187
Смит (Smith E. В.) I 388
Смит (Smith E. W.) Ill 26, 30
Смит (Smith G. F.) 1 360; IV 226
Смит (Smith G. L.) Ill 318; V 204
Смит (Smith H.) I 110; V 401
Смит (Smith H- A.) Ill 168, 172
Смит (Smith H. G .) V 289
Смит (Smith J.) V 36
Смит (Smith J. A.) Ill 360
Смит (Smith J. R. L.) Ill 83
Смит (Smith J. S.) Il 74
Смит (Smith R . J,) III 261
Смит (Smith L.A.) Ill 262
Смит (Smith L, H.) IV 111
Смит (Smith L. I.) 1 210, 211, 221, 387, 394;
II 8, 298, 326; HI 5, 10, 26, 30, 187; IV 28,
29, 276
Смит (Smith L. L.) I 432, 433; V 243
Смит (Smith L. R.) HI 19; V 461
Смит (Smith M.) I 365, 421; II 230; V 192,
193
Смит (Smith N. L.) IV 126
Смит (Smith N. R.) II 237; III Ц4; IV 122
Смит (Smith P. A. S.) I 54, 210; 11 362, 388,
420
Смит (Smith P. N-) III 319; 1V 262
Смит (Smith P. V.) IV 226
Смит (Smith P. W. G.) V 491
Смит (Smith R. D.) 11 46, 47, 123; HI 145,
286, 289; IV 215, 226
Смит (Smith R. FJ I 210, 309; V 351
Смит (Smith R. H.) I J id
Смит (Smith R, L.) V 345, 461, 468, 566
Смит (Smith R, M.) V 15
Смит (Smith S.) 11 163
Смит (Smith S.G.) Il 311
Смит (Smith T. D.) II 246
Смит (Smith W. C.) HI 263
Смит (Smith W. C.) HI 60, 67; V 447
Смит (Smith W. T.) II 235, 406, 409
Смолин (Smolin E,M.) 1 66; IV 247; V 461
Смолинскпп (Smolinsky G.) II 137; V 470
Смрт (Smrt J-) I 35"; IV 22, 233; V 564
Снадер (Snader К. M.) I 345
Снайдер (Snyder С- H.) 1 157, 167; II 79;
V 393
Снайдер (Snyder E. I.) I 282
Снайдер (Snyder H, R.) 1 223, 358, 360,
380; II 30, 46, 100, 218, 235, 262; III 76,
144—146, 167, 327, 332, 335; IV 58, 95
157, 233. 265
Спайдер (Snyder J. P.) V 82
Снайдер (Snyder W- H.) I 323, 334
Скатцке (Snatzke G.) 1 350; III 199, 201;
IV 183
Сник (Sneeii R- A.) i 134
Сновер (Snover J. A.) 1 268
Сцодди (Snoddy C. S., Jr.) II 253; 111 360
Сноу (Snow J. T.) V 110
Собел (Sobel A. E.) HI 283
Собер (Sober H. А.) Ц 71
Cob (Sauve D. M.) II 150 456
Сова (Sowa F, J.) I 112
Сова (Sowa W.) V 133
Соваж (Saifvag'c J. P.) Ii 456
Соипискн (Sowjnski F.) V 10
Соедер (Soeder R. W.) IV 122; V 357
Сойер (Sauer J.) V 24, 438
Сойер (Sawyer А. К.) 1 397
Сойер (Sawyer R. L.) I 273
СоКол (Sokol P. E.) I 54; HI 19
Соколовска (Sokolowska T.) IV 12
Соколовский (Sokolovsky M.) IV 160; V 413
Солар (Solar S. L.) V 127
Соллман (SolIman P. В.) 11 241
Солмс (Solms U.) II 178
Соло (Solo A. J.) V 494
Соловей (Solovay S. B.) Ill 271
Соломон (Solomon D. Ц.) Hi 213, 240
Соломон (Solomon M. G.) Ill 281
Соломон (Solomon S.) 1 148, 166; Il 285
Соломонпка (Solomotilca E.) I 252; III 185,
187; IV 17
Солтес (Sollcs E. J.) V 169
Солцберг (Soltzberg S.) Il 421
Сомброек (Sombroek W.) I 367
Сомвичеп (Somvichien N.) V 41
Соммер (Sommer L. H.) Ill 462
Соммер (Sommer N. В.) I 285, IV 18
Соммерс (Sommers A. H.) 1 350
Соммерс (Sommers G. FI, R.) 1 221
Соммле (Sommelet M.) 1 190, 103
Cour (Song J.) I 168
Сонг (Song I. H.) 1 103; III 114; V 358
Сошгенбург (Soiinenburg F.) Ill 257
Conep (Soper F. G.) 1 214
Соросе (Soroos H.) V 324, 325
Сорри (Sorrie A. J. S.) II 365
Cochobckhi! (Sosnovsky G.) Il 314, 346; 111
445: V 311
Сотисваран (Sotheeswaran SA Ill 241
Сото (Soto A. R.) I 157. 167
Соудеи (Sowden J. С.) I 24
Coyepc (Sowers E. EJ Ill 348, 354
Coyepc (Sauers R. R.) II 140, 141
Софуку (Sofuku S.) V 482
Cox (Soh R. S.) V 366
Спадафино (Spaclafino L.P.) I 388
Спаньер (Spanier E, .1.) V 328
Спарке (Sparkc M- B-) Il 285
Спасов (Spassow А.) II 210, 230; IV 209
Спектор (Spector M-L.) Ill 53; V 345, 346
Спенс (Spence J. MJ Ill 53
Спенсер (Spenser С.) 111 163, 167
Спенсер (Spencer C. F.) IH 172; V 393
Спенсер (Spencer D. A.) V 43
Спенсер (Spencer I. D.) I 2Hi
Спенсер (Spencer R- RJ I 102
Спенсер (Spencer T. A.) Hi 354; V 96, 98, 555
Cnepoep (Sperber NJ II 368,^370
Сперли (Sperley R- Jj V 357, 500
Сперлинг (Sperling RJ Ill 281
Спет (Spaeth E.C.) I 39
Сйеииале (Speziale A. J.) 1 275, 415, 416,
433; Hl 19, 327, 374, 375, 404, 412; IV
262; V46I, 462
Сиилейн (Spillane L- JJ I 22]
Спплкер (Spilker A.) IV 3t), 29
Cnnpc (Spiers D. BJ 1V 8 I
Спирс (Spiers L.) II 350
Споерри (Spoerri P. E.) Ill 283
Cuoync (Spokes G. NJ V 33
20*
611
Спрагью (Sprague G. S.) V 373
Спринг (Spring F. SJ Ill 102; IV 226
Спринзак (Sprinzak Y.) 1 IS; III 393, 304
Спэнглер (Spangler F. WJ Ill 107, 334, IV
264
Сривастава (Sriwastawa H, С.) I 334; Il 279,
281
Сривастава (Srivastava R. К.) V 299
Сринпвазап (Srinivasan R.) Il 246; V 533,
. 534
Cpyr (Sroog С. EJ И 167, 178
Стадлер (Stadler P.) V 24
Стадлер (Stadler P, A.) II 83
Стадничук M. Д. V 442
Стапл (Stille J. KJ I 210: III 10, 268, 271
Стайлос (Stylos NJ II 333
Стайлс (Stiles M.) I 104, 176; II 304, 306; IV
273; V 33, 111
Сталь (Stahl F.) Ill 251, 256
Сталь (Stahl R. Ej II 465
Стамп (Stump B. LJ Ill 168, 172
Стэнсбери (Stansbury H. A.) 11 245, 348, 350,
454, 456
Старк (Stark A.) 1 215
Старк (Stark D. DJ II 197
Старки (Starkey E. В J I 73, 124
Старлинг (Starling \V. WJ Ill 250, 256
Старр (Starr DJ Ill 301
Старчер (Starcher P. $.) II 350
CracKvH (Stasknn BJ II 405, 435; III 166;
V 367, 368
Стауелл (Stowell J, CJ I 168
Стаунтон (Staunton JJ I 86
Стахел (Stahel RJ I 383
Стаче (Stache U.) IV 84
Стаюдл (Staeudle H.) IV 151; V 360
Стейнг (Stange H.) II 290; III 166
Стек (Stcc W.) IV 191
Стелакатос (Stclakatos G, С.) V 164
Стемнел (Stempel A J I 427
Стемпел (Stempel G, HJ I 101
Стемпер (Stamper W. EJ I 54
Стемпфли (Stempflj J. GJ III 23, 25
Стенберг (Stenberg J. FJ Ц 171, ]78
Стеиинг (Steniiig T. CJ V 478
Стеиленк (Stenlake J. BJ II 227
Стенли (Stanley T. WJ II 263
Стенсер (Stancer H. Cj IV 38
Стерлинг (Sterling J J Hl 434
Стенберг (Sternberg H. WJ I 291; II 6, 7,
132, 436, 439
Стернстрём (Stjcrnstrom N. E.) Щ Ц8
СтернхелЛ (Sternhell SJ I 167; III 457; V 211
Стеси (Stacey G. JJ I 435, 436
Стесн (Stacey MJ I 118, 225; Il I 443, 444;
IV 185; V 293, 294
Стефанов (Stephanon S. EJ II 84
Стефен (Stephen Ej IV 155
Стефен (Stephen HJ IV 155
Стефенс(Stephens C. RJ 111 367; IV 22
Стефенс (Stephens J. RJ II 404
Стефенс (Stephens R. DJ IV 171; V 531
Стефенсон (Stephenson E. F. MJ II 46 IV
.95; V 210, 211
Стефенсон (Stephenson LJ [I 203, 414
Стефенсон (Stephenson OJ IV 133
Стефенсон (Stephenson T. A J 1ц 53
Стеховер (Stehower KJ V 433
Стивен (Steven A, BJ II 389
Стивенс (Stevens C. LJ I ,393; 11 412, 414*
III 295; V 508
Стивенс, де (Stevens G., de ) 11 464
Стивенс (Stevens H, CJ I 414
Стивенс (Stevens I. D. R J I 15; IV 47; V 494
Стивене (Stevens R. VJ V 290—292
Стивенс (Stevens T, EJ I 18, 403; II 41; III
352, 354
Стивенс (Stevens T, SJ IJI 360; V 424
Стивенс (Stevens WJ IV 22
Стивенсон (Stevenson G J I 137
Стивенсон (Stevenson H. BJ I 34: IV 191
Стивенсон (Stevenson RJ I 24, 426, 427;
III 240, 413, 415
Стикер (Sticker R. EJ W229, 246
Стиплер (Stickler J. CJ V 303, 493, 494
Стилмар (Stihnar F. В J IV 118
Стипановпч (Stipanovic R.DJ V 327
Стирлинг (Stirling C, J. MJ III 361
Стирнс (Stearns J. AJ IV 209
Стифф (Stiff J. FJ 1 III
Стогрин (Stogryn E. LJ V 81
Стодола (Stodola F. HJ IV 226. 248, 254
Стоилкович (Stojiljkovic AJ HI 241; IV [95.
196
Сток (Stock A. MJ и 84
Сток (Stock L.Mj I 1,38; III 187, 438, 443
Стокелъ (Stockel R. FJ III 141, 146
Стокер (Stocker J. Hj III 169, 172
Стопп (Stopp GJ I 307, 352, 3,53
Стори (Story P.RJ I 83; II 346; V 153, 264,
265, 270, 316
Сторк (Stork G.) I 141, 166, 361, Зоб; II 39,
151, 153, 316; III 90. 92 102, 105, 107,
127, 129, 231, 241; IV 272' V 35, 148,
149, 276, 278, 440, 442
Стормонт (Stormont R. TJ I 88
Сторпи (Slorni A.) I 137
Сторр (Storr R.CJ I 214
Сторр (Storr R. EJ V 315
Стоукс (Stokes PJ V 414-
Стоун (Stone B. EJ V 475
Стоун (Stone D. BJ V 25 +
Стоун (Slone G. RJ [II 172. [73, 196, 197
Стоун (Stone HJ III 144, 146. 301; IV 102
Стоун (Stone R. MJ III !4[, [46
Стоут (Stout G. HJ V 351
Стоффи (Stolfey D. GJ II 150
Страйк (Strike D. PJ V 401
Стратинг (Strating J.) V 209. 395
Страчан (Strachan R. GJ 313
Стрейтвизер (Streitwicser A., Jrj III 303
Стрельцова С. Г. V 33, 35
Стретфорд (Stratford M. J. WJ Ц 227; V 270
Струве (Struve A.) I 167; III 19
Струве (Struve W. SJ I 248
Струббплгс (Stabbings RJ II 421
Стэйрс (Stairs R. A J V 535
Стьюарт (Stewart C. A., Jrj III 318
Стьюарт (Stewart F. H. CJ IV 261; V 45
208, 348
Стьюарт (Stewart J J I 71
Стьюарт (Stewart J. E.) [II 271
Стьюарт (Stewart J. MJ II 71, 100; IV 265
Стьюарт (Stewart O. J J II 231
Стьюарт (Stewart R. SJ V 143
Стэси (Stacy G. BJ II 423; III 70, 187
Стэси (Stacey MJ V 156
Стюарт (Stewart T. S.) V 32, 33
Субба Pao (Subba Rao В. Cj I 268; Ц 186,
193, 388
Субба Pao (Subba Rao C. S. RJ V 454
Суббарао (Subbarao RJ V 393
Суббаров (Subbarow J.) I 137
Субо (Subo E. FJ HI 53
Cyra (Suga KJ V 29, 245
Сугасава (Sugasawa T.) V 464
Сугимото (Sugimoto NJ I 96
Сугита (Sugita J J II 440
CyrHxapaJSugihara J.-MJ IV-31
Сугихара (Sugihara' Yj V 222
Суза (Sousa J. A J [1 3 84, 388
Сузуки (Suzuki A.) V 292
Сузуки (Suzuki Hj V 21 1, 404. 405
Сузуки (Suzuki KJ I 15, 95; V 10
Сузуки (Sitzuki MJ I 32, 357
Сузуки (Suzuki RJ 1 95; V 436
612-
Сузуки (Suzuki SJ V 384
Сузуки (Suzuki T.) V 29, 245
Суида (Suida WJ IV 226
Сунтен (Suijten J. G. HJ Ill 373
Сукфюлл (Siickfiill F.) Ill J 83
Сулли (Sully B, D.) Ill 290
Суомер (Swamcr F. WJ I 431; II 22, 393,
400; IV 233
Супанекар (Snpanekar V. RJ Ill 53; V 345
Cyp (Suhr H.) I 248; V 280
Суссман (Sussman S.) I 144; III 84
Cvtbhk (Sontwick P. LJ II 47, 48
Сутер (Suter C. MJ 1 33; III 260, 281, 296,
335
Сутере (Slithers B. R.) I 54
Сутклайфф (Sutcliffe F. К.) I 54
Суттср (Sutter MJ Ill 46
Cyx (Stih J. TJ I 141, 236
Сушицкий (Suchiizky H.) Hl 14s, 431; V 366
Сцербо (Scerbo LJ V 425. 429
Сьеджа (Sieja J. В.) V 232
Сьёберг (Sjobcrg В J I 240
Сьёберг (Sjoberg R.) V 135, 143
Сьёберг (Sjoberg SJ I 240
Сьёквист (Sjoquist J.) IV 45
Сэйки (Saeki H.) V 129
Сэйр (Sayre J. LJ II 210
СэЙт (Sayigh A.) Ill 20a; V 90
Сэм (Selim E. J.) II 233, 401; HI 92
Саммерс (Summers R. M.) II 326; III 352,
354
Сэмпл (Sample T. E., Jr,) V 401, 402
Сэидборп (Sandborn L. T.) I 380, 373; II 380;
HI 387
Сэндерс (Sanders F.) Ill 340
Сэндерсон (Sanderson A. RJ Ill 283
Сэндерсон (Sanderson J. J.) I 113; III 292
Сэндерсон (Sanderson T, F.) I 67, 232
Сэндри (Sandri J. M.) Il 262
Сэндс (Sands C, A.) HI 1 19
Сюзи (Susi P. V.) 1 33
Сюррей (Surrey A. RJ I 130, 318; III 76
Табери (Tabern D. LJ II 99
Таборский (Taborsky R. G.) I 209, 210
Тавс (Tavs PJ IV 173
Тагаки (Tagaki WJ V 90
Тада (Tada H.) V 157
Таджнма (Tajima Y. A.) V 82
Тазума (Tazuma J. J.) H 233
'Гайа (Taya KJ V 222
Тайгай (Tigai B. 5.) II 163
Тайгарян (Thyagarajan B. SJ I 14|; II 106
Тайгарян (Thyagarajan GJ V 270
Тайл (Tyle ZJ V 151
Taiiuep (Tyner D, A.) IV 250
Тайчковский (Tvczkowski E. A.) Ill 99
Так (Tahir F. С.) V 291, 292
Такайа (Takaya FI.) V 272
Такайа (Takaya TJ I 8o
Такахаси (Takahashi HJ I 431, 437
Такахаси (Takahashi К J V II, 29
Такеда (Takeda HJ V 224
Такеда (Takeda Y.) I 95
Такеда (Takeda KJ II 114
Такеда (Takeda MJ 1 70
Талати (Talaty C. N.) V 166
Талати (Talaty E. R.) V 37, 38
Талер (Thaler WJ I 173
Талер (Thaler W. A.) I 15
Таллер (Tuller F. NJ V 176
Тамелен (Tamelen E. EJ I 137
Тамм (Tamm Ch J I 24; И 189, (93
Тамура (Tamura Z.) V 127
Тан (Tan S. I J V 102
Танабе (Tanabe KJ II 456
Таиабе (Tanabe MJ I 363; V 429
J апака (Tanaka KJ III 285
Танер (Tuner R. В J V 136
Танигучп (Tartigtichi HJ V 281
Таник (Tunic k A. A.) V 348
Танпепбаум (Tannenbaum SJ HI 383
Тарбелл (Tarbell D. SJ 1 205, 210, 304, 394;
H 131. 195, 196, 209, 210, 216, 233 352,
353, 398, 401, 435; III 90 92 296, 457;
IV 165; V 320
Тарлтон (Tarlton E. JJ II 97
Таррант (Tarrant P.) V 184, 462
Таррат (Tarrat H. J. Fj V 18
Tacaira (Tasaka KJ I 270
Татлоу (Tatlow С. E. MJ III 443
Титлом (Tallow J. CJ III 443, 444
Татте (Thatte S. DJ IV 7
Татчелл (Tatchell A. R.) V 249
Тауб (Taub В.) I 133; III 271
Тауб (Taub D.) I 316; II 27, 104, 106, 230.
409; III 97, 99, 124, 204, 205, 343, 344;
394; IV 250; V 127, 251, 252, 460
Тафт (Taft D. DJ III 99
Тахара (Tahara A J I 182; II 153
Тачер (Thacher A. FJ II 179; V 247
Таширо (Tashiro MJ I 24
Ташнср (Taschner EJ H 197, 199; III 22,
296, 367; IV 12
Твейт (Tweit R. CJ III 340; IV 130
Твелвс (Twelves R. RJ III 394
Твитен (Tveten J. IJ 1 401
Тевальт (Thewalt IJ I 299; III 311
Тегнер (Tegner CJ II 285
Теддер (Tedder .1. MJ III 357, 443, 444
Тедипи (Tedeschi RJ I 254
Тедфорд (The.dford R.) I 16; 11 185
'I ей (Tai W. T.) I 252
Тейбер (Tenber H. J J II 81—83; V 226
Тейлакер (Theilacker WJ IV 125, 126; V 529
Тсцлиг (Theilig G.) IV 74
Тейлор (Taylor J. WJ III 24|
Тейлор (Taylor M. EJ I 113
Тейлор (Taylor M. DJ HI 115, 118, 119
Тейлор (Taylor L. DJ IV 137
Тейн (Thain E. M.) IV 85, 90
Тейнисссн (Tetmisscn H. PJ II 136
Тейс (Theis R. J.) V 373
Тейт (Tate В. E.) I 83
Teiir (Tate D. P.) II 150; IV 196
Тейт (Tate M. E.) II 399, 401
Тейте (Taits S. Z.) II 357
Тск-Лпнг (Tek-Ling С.) V 263, 270. 332, 333
Теккер (Tucker S. HJ II 245
Телегина H. И. II 216
Тслинский (TelinskiT. Jj II 414
Теллер (Teller D. M.) I 433
Темпле (Temple CJ I 438
Темплетои (Templeton J. Fj I 167; V 28
Тенер (Tener G. M.) IV 193; V 221, 222
Теобальд (Theobald D. WJ II 23
Теобальд (Theobald J. MJ I 319
Теоболд (Theobold D. W.) V 383
Теодоропулос (Theodoropoulos D.M..) Ill
355. 419
Тсрада (Terada A.) V 336
Теранииш (Teranishi R.) I 185, 186; II 26, 27
Терасава (Terasawa T.) HI 451
Терентьев А. П. I 378
Тсрзо (Terzeau H.) Ill 145
Термэн (Thurman J. CJ 1 356, 357
Тернбулл (Turnbull J. HJ III 40, IV 99
Тернбулл (Turnbull PJ V 401
Тернер (Turner A J I 413
Тернер (Turner Л, В.) V 178, 183
Тернер (Turner A. FJ I 427; II 467
Tepnep (Tm-ijer E. EJ II 357; Ш 240
Тернер (Turner .1. M.) HI 2,0. 391
Tepnep (Turner .I.OJ IV 119
Тернер (Turner LJ II 353; Hi 68
613
Тернер (Turner Р. В.) [V 160
Тернер (Turner R. В.) И 270, 273; UI 273,
340, 354; IV 63, 151
Тернер (Turner R.W.) 1 414
Тернер (Turner W. N.) Ill 390
Тернквнст (Turnquest В. W.) Ц 30
Террелл (Terrell R.) II 316: III 129
Терри (Terry Р. II.) 1 12; IV 6, 7
Терри (Terry W. G.) 11 274
Тсрш (Tursch В.) II 316
Терэпб (Terabe S.). V 510
Теесер (Tesser G. ,1.) II 123; Ш 23
Тессье (Tessier J.) I 407; II 70
Тетаз (Tetaz J. R.) И 465
Тетер (Teter L. A.) 1H 374; V 220, 300
Тетлоу (Tetlow Л. J.) и 42. об
Тефертнллер (Tefertiller В. А.) V 376
Теке (Токе L.) V 109
Тскес (Tokes L.) V 38, 122
Тиббеттс (Tibbetts Г.) IV 7
Тибери (Tiberi R.) I 363
Тнг (Teague P.O,.) IV 101
Тпгер (Taeger E.} II 256
Тидеман (Tiedeman T.) ill 187
Тикельмацц (Ticckelmann H.) Ill 40; IV
248
Тикоццп (Ticoz.zi С.) V 143
Тиле (Thiele J.) 1 Г2, 13. 37. 198, 209, 408.
412' HI 207, 208,; IV 47, 181, 183; V 484 —
487
Тиллей (Tilley J. N.) V 90
Тиллман (Tillman P.) IV 1 I
Тиллотсон (Tillotson A.) IV 175
Тило (Thilo E.) HI 146, 148
Тильден (Tilden W. A.) Il 449, 456
Тиман (Tieman С. H.) Ill 444
Тиман (Tyrnan J. H. B.) [1] 166, 167
Тиммонс (Timmons C. J.) I 178
Тиммонс (Timmons R. J.) I 13, 282
Тин (Tien ,1. M.) 1 335; IV 235
Тинги (Thiti D. S.) I 134
Тио (Tio G. О.) II 178
Тио (Thio P. A.) V 102
TunccHi (Tipson R. S.) Il 4I41 IV [56; V 2/5
Тир (Thier W.) I 282
Тнрней (Tierney P. A.) I 118, 268
Титер (Teeter II. AT.) 1 173
Титов (Titov M. I,) II 22
Титус (Titus R. L.) V 102
Тиффани (Tiffany B. D.) II 193, 195
Тичи (Tichv M.) Ill .396
Тишлер iTishler M.) I 248, 252; 11 93, 717, 112
226, 369, 374, 429: III 76, 83, 114, 183,
256, 354; IV 226, 238, 247
T(J6n (TobeV 3. TV.) HI 447, 448; V 38
ТобЛер (Tobler F,.) I 273
Тодд (Todd A. R.j I 07, 257, 381, 427; III 418,
419; IV 84, 90
Тодд (Todd D.) I 198, 209; HI 205
Тодд (Todd H. R.) I 301; IV 243, 248
Тодд (Todd L. J.) IV 56
Тодд (Todd M.. Y,) 111 468
Toil (Toy M, S.) V 156
Toiin (Тоупе К.) Ill 241
Токапне (Tocanne J. F.) IV 60
Тонко (Tocco G.) HI 284
Токуйама (Tokuyama T.) V 325
Токумару (Tokumaru К.) H 342
Тркура (Tokura N.) II 446
Толнсдорф (Tolksdorf S.) Ill 236
Толлеис (Tollens В.) H 136; III 345
Тольгези (Tolgyesi W. S.) I /3, 76
ТольДте (ToeIdle W.) Hl 419
Томас (Thomas A.) 1 643; V 270
Томас (Thomas А. В.) Ц 311
Томас (Thomas B. R.) 1 209; IV 151
Томас ( Thomas С. В.) V 126
Томас (Thomas D. A.) HI 240
Томас (Thomas E, G.) | 351; II 311; V 286
Томас (Thomas G, G.) H 70
Томас (Thomas G. H.) II 25, 61. 150
Томас (Thomas G. H. S.) IV 185; V 133
Томас (Thomas G. M.) V 270
Томас (Thomas J. A. G.) V 566
Томас (Thomas J. O.) A7 193
Томас (Thomas M- J.) V 314
Томас (Thomas О. H.) II 456
Томас (Thomas P. D.) Ill 184
Томас (Thomas P. L.) IV 199
Томас (Thomas S. L. S.) Ill 33
Томас (Thomas T.M..) V 113
Томней (Tomasi G. E.) 11 157
Томаш (Tomasz J.) IV 198
Томаш (Tomasz Al.) II 220, 226, 335; IV 272
Томбоулян (Tomboiilian P.) HI 396; V 443
Томе (Thome С.) I 397
Томср (Tomer К.) V 429
Томлин (Tomlin J. E.) HI 167
Томмпла (Tom mi la E.) I 334
Томоеда (Tomoeda M.) Ill 146
Томпсон (Thompson A.) HI 184
Томпсон (Thompson A. R.) V 442
Томпсон (Thompson С. M.) II 8
Томпсон (Thompson D.) II 155; V 416
Томпсон (Thompson G.) Ill 394
Томпсон (Thompson H. \V.) V 197, 363
Томпсон (Tompson J. G.) V 76, 547
Томпсон (Thompson J. I,.) I 173: V 386
Томпсон (Thompson II. T.) I 248; H 374, 429
Томпсон (Thompson AT. ,1.) V 393
Томпсон (Thompson P.) H 362
Томпсон (Thompson Q. E.) Hl НО. 114,
150, 390
Томпсон (Thompson R. В.) I 78; IV 194
Томпсон (Thompson R.) II 1G3
Томпсон (Thompson R. H.) V 155
Томсон (Thomson J. В.) V 77
Томсон (Thomson R. ,j.) HI 391
Томсон (Thomson R. H.) H 281, 364, 365
Томсон (Thomson S. J.) Ill 307
Тоней (Tawney P.O.) 11 243
Топука (Tonooka К.) II 282
Тополь (Toepel T.) I 256
Топлисс (Topliss G. В.) V 555
Topaii (Torii I.) V 245
Topnroe (Torigoe M.) Ill 167
Торомапон (Toromanoil E.) I 407
Toptie (Thorpe J. F,) Ц 109; 1V 201
Торссел.ч (Torssell К.) V 129, 131
Торупка (Torupka E. J.) V 261
Тосолини (Tosolini G.) II 129; III 439. 443
Тотгер (Totter J. R.) Ц 232; IV 72
Toyaii (Toi K-l V 544
Тоуб (Thobe J.) V 168
Тоулзе (Towles J-[. V.) Hl 301; IV 90
Трапнслнс (Traynells V. J.) I 325, 331, 334,
335, 34a
Тракслер (Traxler R. N.) IV 83
Трамбулл (Trumbull E, R.) II 195
Трамбулл (Trumbull P. A.) 11 |95
Tpattacco (Trapasso L. E.) 1 268; III 371
Тратантони (Tratanloni .1. С.) I 374
Трауб (Traub H.) IV 76
Траубе (Tranbe W.) HI 283
Траулиман (Tranliman H. D.) 1 193
TpaxanoBCKiiii (Trahanoxsky W. S.) IV 185-
V 308, 543
Трахтенберг (Trachtenberg E. N.) V 540
Tpeaoti (Trevoy L, W.) Ij 169, 178, 335- 1V
241, 247
Трепбер (Treiber A. J. H.) IV 56
Трейбс (Treibs- W.) Hl 12, 13. 8l, 84, Ю1.
176. 177, 184; IV 36, 198; V 342, 343
Трсйл (Trail M. M..) II 22
Трейлор (Traylor T. G.) HI 183, 184
Трейнард (Trayuard J.-C.) Il 93, 97
614
Трелфолл (Threlfall Т.) I 167
Трсмбл (Tremble J.) V 122
Треппер (Trcnner N. R.) I 313; II 401
Трек an (Trchan I. R.) V 4 C> 1
Трешер (Trescher V, J.) V 18
Трескеп (Trosken О.) 1 290; Hl 311
Триплетт (Trippett 8.) Ill 413
Трпстер (Trister <S. M.) П .32
Тристрам (Tristram 13. W.) II 300; IV 98
Тришманп (Trischmann II.) I 318, 331, 345;
II 279, 281; III 380
Троззоло (Trozzolo A, M.) II 226
Трокмортон (Throckmorton .1. R.) V 3.57
Трокслер (Troxlcr G.) II 83
Трон ич (Tronich W.) V 141. 143
Трост (Trost В. M.) Il 24, 23; III 396; V 119,
139, 143, 298, 299, 43-1
Трофименко C. 1 2/8
Троффкин (Troifkin IT. J.) V .373
Трпнп (Trpin J.) V 127
TpycTT (Truetl и. I..) Ill 119
Трукср (Trucker D. E.) 11 308
Трусхепт (Truscheit E.) I 241, 242; V 16
Трэйпхэм (Traynham J. G.) V 57, 66, 253, 254
Трэпкнер (Traenckner H.-J.) V 287
Трюмгш (Triimpy F.) II 88, 97
Tpioc (Truce W. E.) | 179; II 148, 150, 435.
436; III 281, 296
Trail (Tsai L.) IV 113
Тсангарнс (Tsangaris J.) HI 355
Тсуда (Tsuda K.) 1V 222, 225
Тсуджн (T.siijt J.) И 133; III 415; IV 158;
V 34G, 454, 456
Тсуджи (Tsuji N,) 1 376
Тсуджи (Tsuji T.) I 335; II 440; V 129, 131,
544
Тсукамото (Tsukamoto A.) II 178, 196. 204;
IV 264
Тсунода (Tsi.inoda J. N.) V 113
Тсутсуми (Tsutsumi S.) V 331
Тубяпа (Toubiana R.) V 534
TvflSo.iji (Titdball J. K.) HI 344
Тулей (Tulev W. F.) I 223: III 131, 132
Тулл (Tull R.) Il 97; HI 295
Ty.’i/iap (ТнПаг B. F.) I Ю0, 137; IV 82
Туллок (Ttillock C. W.) II 122, 123; III 263
Туллок (Tullock G. W.) V 326
Тунг (Tung С. C.) HI 412
Турман (Thurman J. С.) I 356, 357
Турман (Thurman. N.) Ill 193
Typpo (Turro N. J.) II 129; V 9o, Hl, 112,
466
Туттл (Tuttle N.) II 39
Туфарелло (Tut ane I Io J. J.) HI 241; V 379,
384, .519
Тупт-Макзка (Tuszy-Maczka M.) HI 254,
2 56
Tsiiep (Thayer F. К.) I 130; IV 17
Тэйлор (Taylor E. R.) I 130; II 97; IV 113
Тэйлор (Taylor E, С.) 1 93, 393, 394; II 325,
327, 402, 403; III 65, 68; IV 74, 75, 109,
248; V 10, 561—564
Тэйлор (Taylor J. A.) V 333
Тэйлор (Taylor W. С.) V 217
Тэйлор-Hanадпмитроу (Taylor-Papadimit-
riou J-) V 164
Тюзюн (Tiizi’in С.) I 53; HI 19
Тэнг (Tang C. S.) V 85
Тэннер (Tanner D. D.) V 66, (37
Тыольер (Thuillier A.) V 214
Уаддйнгтон-Фптер (Waddington-Fea ter S.M.)
11 179
Уайдман (Wideman L. G.) V .536
Уайз (Wise H. E., Jr.) II 383, 38_9
Уаизгарвер(Wisegarver В. В.) IV 72
Уайлдс (Wields A, L.) II 27, 39; IV 249, 250
Уайлер (Wyler H.) V 226
Уайли (Wiley R. H.) I 75, 78, 210; II 237;
HI 68, 114, 187; IV 122; V 267, 270
Уайман (Wyman D. P.) HI 292. 295
Уайнберг (Wynberg H.) HI 354; |V 250
Уайт (White A. M, S.) 11 J S3
Уайт (White D. M.) Ill 384
Уайт (White E. El.) I 21, 22, 24; II 293;
_V 12, 302
Нант (White J.) 11 4o6
Уайт (White J. D.) Ill 179, 184; V 320
Уайт (White J. E.) HI 100
Уайт (White J. W.) Ill 394
Уайт (White R. W.) II 312
Уайт (White W. A.) V 113, 420, 421
Уайт (White W- N.) HI 102, [07; V 35
Уайтер (Whiter P. F.) Hl 416; 456, 509
Уайтинг (Whiting M. С.) 1 66, /8, 122, 124,
]98. 209, 238, 253, 339, 345, 351; II 179,
222, 226, 302, 303, 439; III 306, 360; IV 30,
268, 272; V 21, 95, 410, 411
Уайтли (Whiteley №. A.) I 270
Уайтло (Whitelaw S. P.) II 250
Уайтлок (Whitlock H. W.) II 396, 400; III
401
Уайтмен (Whitman В.) П 435; IV 145, 151
Уайтмен (Whitman G. M.) I 291
Уайтсайда (Whitesides G. M.) V 220, 300,
350
Уайтсайдз (Whilesides T.) V 38J
Уайттекер (Whittaker N.) II 212, 213
Уайттл (Whittle C. W.) Ill 167, 168
Уайтфилд (Whitefield G. H.) V 346
Уайтхауз (Whitehouse P. A.) V 232
Уайтхед (Whitehead C. W-) II 262; 1И 40
Уайтхем (Whitham G. H.) H 346; 439; V 71
Уайтхерст (Whilehurst J. S.) V 536
Уакер (Wacker W. E. C.) HI 309
Уарбартон (Warburton W. К.) II 205; HI
53, 184
Уарвик (Warwick G. P.) I 193
Уарн (Warne T. M., Jr.) V 350
Уарнок (Warnock W. D.C.) V 261
Уассон (Wasson R. L.) HI 76
У ат (Wat E. R.M.) V 330, 331
Уатсон (Watson H. G.) I 436
Уатсоп (Watson W. F.) I 396
Уатт (Walt A. N.) V 115
Уатт (Watt С. T.) I | 5
Уатт (Watt D. S.) V 555
Уатт (Watt G. W.) I i 10
Уаттей (Watthey J. W. H.) I 166
Уатте (Watts M. L.) 1 I 1 1; V 37
Угелыптад (Ugelstad J.) I 167
Уги (Ugi I.) I 163, 168; II 330, 335; IV 44,
SO, 87, 90; V 18, 68, 473
Уда (Lida H.) 1 34з; Hl 290
УДенфрннД (Udenfriend S.) Ill 80, 84
Удо (Udo EL) V 120
Уебб (Webb I. D.) V 328, 331
Уебстер (Webster B.) Ill 357
Уебстер (Webster B. R.) V 15
Уебстер (Webster C- J.) IV 130
Уебстер (Webster D. E.) Ill 132
Уебстер (Webster E. R.) IV 264
УейкфплД (Wakefield B. J.) II 210; V 259
Усилье (Wailes P. С.) I 193
Уеймаут (Weymouth F. J.) 1 257
Усйт (Waite J, A.) Ill 40
Уеллмен (Wellman W- F.) HI 142, 145
Уеллс (Wells W. W.) I 189
Уелстед (Welstead W. J. Jr.) II 295; IV 36‘
V 232
Услтер (Weller M.) V 470
Уелфорд (Welford M.) V 342
Уелч (Welch E.) 1V 36, 209
Уелч (Welch R. W.) II 470
Уелчер (Welcher A. D.) 1 435, 436; III 321
615
Уемпен (Wcmpeti I) V 417
Уемпл (Wemple J- Al.) I 252
Уендел (Wendel К.) Il 121; III 329; V 236
Уиберли (Wiberley S. E.) V 377
Уибриг (Uibrig С.) V 106, 108
Уивер (Weaver T. D.) V 08
УигфиЛД (Wiglield D. С.) V 130, 131
Уиддоусои (WiddoV'Son D. A.) II 2'26
Упдквист (Wideqiiisi S.) V 281
Уидон (Weedon В. C. L.) II 80, 133, 231,
246; IV 129, 130, 178, 272; V IG, 266, 270
Уин (Wick A. E.) 1 307
Уик (Wick A. IG) V 358
Ункберг (W'ickberg В.) V 389
Ункенс (Wikens J. C.) 11 137
Уцкхолм (Wikhalm R. J.) V 133
Уилдс (Wilds A, L.) I 1 10, 248, 366; Il 268,
273, 286; III 13, 18
Уилер (Wheeler A. S.) 1 200
Уилер (Wheeler J.W.) Hl 241
Уилер (Wheeler О. H.) II 14, 181, 183, 188,
193 226
Уилер (Wheeler T. S.) 11 11; III 109, 114
Уили (Wiley D. W.) I 7S; III 114, 318
Упли (Wiley G. A.) Ill 413 — 415
Уилкинс (Wilkins С. IC, Jr.) Il 276
Уилкинсон (Wilkinson A, J.) V 174
Уилкинсон (Wilkinson G.) II 11; HI 54,
369, 415; IV 158, 201; V 449, 434
Уилкинсон (Wilkinson P. A.) II 450
Уилкинсон (Wilkinson R. G.) I 69
Уиллард (Willard С.) I 360
Уиллард (Willard J. J.) V 294, 527
Уиллеме (Willems A, G. M.) I 211
Уиллетт (Willett J. E.) Ill 436
Уиллис (Willis C. J.) HI 387
Уиллис (Willis R, G.) I 166
Унлмарт (Wilmarth W. К.) HI 204, 205
Уилмс (Wilms H.) IV 29
Унлсмор (Wilsmore N.M.) 1 83
Уилсон (Wilson T.) V 90
Уилшайр (Wilshire J. F, К.) V 165
Уильямс (Williams A. J. S.) V 328
Уильямс (Williams В.) 1 367
Уильямс (Williams D. H.) I 210; II 114; III
164, 167; V 320
Уильямс (Williams D.M.) HI 115
Уильямс (Williams F. T., Jr.) II 95, 97
Уильямс (Williams G. J.) V 243, 517
Уильямс (Williams J. А.) Ц 217
Уильямс (Williams J.F.A.) I 137
Уильямс (Williams J. H.) Ill 354
Уильямс (Williams J. К.) I 34; Ш 315, 318
Уильямс (Williams J. L. R.) 1 54
Уильямс (Williams J. W.) I 285; II 125, 129;
III 31; IV 109
Уильямс (Williams H. R.) I 219
Уильямс (Williams R, I. H.) II 233, 401;
III 92, 354
Уильямс (Williams M, W-) 1 177, 319
Уильямс (Williams N. R.) 1 435, 436; II 355;
V 197
Уильямс (Williams P. H.) Hi 68, "7, 82,
84, 431
Уильямс (Williams R.O.) II 6, 430
Уильямс (Williams A. J. S.) V 327, 328
Уильямсон (Williamson G. E.) V 353
Уильямсон (Williamson R, L.) IH 302, 303'
IV 57, 170; V 530
Уильямсон (Williamson S. M.) I 66. 101
Уинбер (Wynber H.) V 209
Уинберг (Wynberg H.) I 64, 66; H 273, 423-
V 283, 284, 38a, 384, 395
Унягроув (Wingrove A. S.) V 171. 388
Уиндус (Windus W.) IH 327, 335
Уинслоу (Winslow E.C.) I 419
Уинстед (Winstead M. B.) Ill 19
Уинстейн (Winstein S.) I 166; II ] 55, 311;
III 54, 232, 241, 267, 271, 287, 290, 297.
298, 303, 319; IV 18, 20; V 21, 116. 416
Уинстон (Winston А.) Ш 448; V 46'2
Уинтер (Winter R. A. E.) II 380, 390; V 438
Умети' (Wysong R. D.) V 40, 5G, 466
Уистлер (Whistler R. L.) Ill 84; V 31, 169,
492
Уитерслл (Wiiherell D. R.) HI 268, 271
Уитлок (Whitlock H. W-) V 204
Уитмор (Whitmore F. С.) Il 39, 420, 4G1;
111 180, 184, 192, 19,3, 462
Уитмор (Whitmore M. G.) II 420, 461
Уитни (Whitney G. С.) V 110
Уитроу (Withrow J. R.) II 115
Уичелхаус (Wichelhaus H-) II II; III 37,
40
Уичерс (Wichers E.) III 131
Улдолл (Uldall 1.) I 138
Уле (Uhie F. C.) Ill 331
Улиг (Uhlig F.) Ill 145
Улих (Ulich L. H.) Ill 13, 18
Ульбрихт (UIbrichi T. L. V.) II 414; IV 248,
277
Ульман (Ullman E. F.) Hl 76
Ульман (Ullmann F.) Il 424, 4<t5
Ульрих (Ulrich С.) IH 340
Умани — Роичи (Umani — Ronclii A.) V 143
Умбрейт (Umbreit G. R.) II 227
Умезава (Umezawa О.) IV 123
Умхоефер (Umhoefer R. R.) Il 211
Уигиаде (Utignade H. E.) 1 364; II 237, 326
456; III 271
Уигнадс (Ungnade W. E.) V 82
Ундервуд (Underwood H. W.) I 70; П 424,
425; IV 24
Ундхейм (Undheim R.) I 269
Унни (Until M. R.) I 268
Уно (Uno F.) V 429
Уно (Uno H.) I 35/
Унч (Uiitch K. G.) Il 284, 285; V 294, 296,
299, 315
Уодсворт (Wadsworth D. H.) V 302
Уолкер (W;alkcr В. И.) V 14, 427, 429, 536
Уолкер (Walker С. С.) V 307
Уолкер (Walker D.) I 413; V 178, 181
Уолкер (Walker D.M.) In 410, 412
Уолкер (Walker D. R.) V 242
Уолкер (Walker G. N.) HI 107, 394
Уолкер (Walker H. G., Jr.) II 279, 281
Уолкер (Walker J. F.) I 36G; II 359; V 66
Уолкер (Walker R. A,M.) V 451, 454
Уолкер (Walker L. E.) 1 309; V 66
Уолкер (Walker P. G.) IV 160
Уолкер (Walker R.) Ill 46
Уолкер (Walker R. W.) II 253
Уолкер (Walker T.) II 97, 179, 205, 226,
414; III 184; IV 151
Уолл {Wall M, E.) 1 77, 345; II 38, 39; Hl
92, 457; V 143, 359, 360, 510, 511
Уоллбпллич (Waiibillich G. E. Н.) V 171
УоллеифеДс (Wallenfels К.) I 3j8; IV 83
Уоллес (Wallace T. J.) 1 195, 311; Il 220,
226; HI 304
Уоллинг (Walling С.) I 11, 100, 137, 144,
168, 170, 173, 219; 11 237; 1Ц 339, 422,
466, 408; V 67
Уоллннгфорд (Wallingford V. H.) 1 429 430;
И 41
Уоллис (Wallis E. S.) 11 43
Уолтер (Walther G.) Ill 323, 329, 421; V 417
Уолтер (Walther M-) 11 70
Уолтер (Walther R. J.) II 4.56
Уолтер (Walther W.) Ill 240
Уолтерс (Walters D.R.l IV 160
Уолтерс (Walters P. M.) 11 282
Уолтон (Walton D. R. M.) V 442
Уолтон (Walton E.) IH 195, 197, 340
616
Уолфром (Wolfrom М. L.) I 18, 121; И -'16,
421, 433, 455; III 84, 91, 182, 184, 187,
193, 340, 443, 444; 1V 185; V 31, 156
168, 169, 217, 402
Уолш (Walsh E. J., Jr.) П1 373
Уолш (Walsh H. G.) V 384
Уолш (Walsh M, R.) IV 155
Уолш (Walsh W. L.) I 70; II 424, 425
Уолшоу (Walshaw К. В.) II 25; V 342
Уорд (Ward E, R.) 1 1 420, 446
Уорд (Ward H. R.) II 285; V 60, 71, 299
Уорд (Warci J. A.) V 246
Уорд (W’ard J. P.) V 26, 201
Уорд (Ward M. G.) II 193
УорД (Ward M. L.) IV 210
Уорден (Worden L. R.) I 271; II 146, 150,
195; V 476
Уоринг (Waring A. M.) V 351
Уоринг (Waring A. J.) Ill 429, 431
Уоринг (Waring A.) V 316
Уорк (Work J, В.) IV 82
Уорнер (Warner (’„ R.) Ill 373, 402
Уорнер (Warner P.O.) 11 109
Уорнхоф (Warnhof E. W.) 1 252; II 205, 380;
III 295; IV 179
Уоррен (Warren V. D.) I 334; V 126
Уоррен (Warren С. К.) IV 129, 130
Уоррен (Warren M, E., Jr.) V 508
Уоррен (Warren R.W.) V 18
Уорренер (Warrener R. N.) V 332
Уоррол (Worrall D. W.) Il 461
Уоррол (Worrall R.) Ц1 443
Уорролл (Worrall W. S.) I 166
Уотерс (Waters .1. A.) V 325
Уотерс (Waters W. A.) I 145, 147; JI 228;
III 240, 277, 296
Уоткинс (Watkins R. J.) V 3|4
Уотрипг (Wotring R. W., Jr.) V 413
Уотсон (Watson J.) V 488
Уошберн (Washburn W. H.) V 90
Урбан (Urban R.S,) I 138, 167
Урбанский (Urbanski T.) V 12
Урнон (Urjon E.) I 238
Урквиза (Urquiza M.) II 226
Урквцза (Urquiza R.) II 243
УрКвхарт (Urqunart G. G.) IH 327
Уршпрунг (Ursprting J. J.) Ill 68
Усингер (Usinger R.P.) Ill 468
Ускокович (Uskokovic M.) HI 46; V 536,
540
Устывюк Ю. A. V 546
Утермолеп (Utermohlen H. p., Jr.) IV 250;
V 404
Утзпнгер (Utzinger G. Ed.) I 346
Утне (Utne T.) II 300; IV 165; V 44, 205
Уэдсворт (Wadsworth W- S. Jr-) 1 430, 431,
434, 435, 437; II 262; HI 321, 4o8
Уэйелл (Wcyell U. J.) I 303
Уэйлен (Whalen D. M-) 1 416, 417; III 446
Уэйли (Whaley A.M.) iV 209
Уэйн (Wayne W.) I 147
Уэйман (Wakeman N.) Ill 421
Уэлли (Whatley M.) 11 320, 326; IV 81
Уэллп (Whalley W. В.) I 376
УэнД.ланД (Wandland R.) II 374; IV 183
УэнТланд (Wentland M, P.) V 289—292
Уэст (West R.) V 38
Уэст (West H, D.) Hl 184
Уэст Рандольф (West RandoH) 111 112, 114
Уэст Роберт (West R.) 1 184; III 447, 448,
V 279, 280
Уэст (West R. W.) I 270
Уэст (West T- .8.) IV 62
Уэстон (Weston A. W.) II 287, 297
Уэстон (Weston G. О.) I 413
Фабер (Faber E.M.) Il 423
Фабиан (Fabian J.) II 316
Фабиан (Fabian J.M.) IV 178
Фавр (Favre H.) IV 197; V 520
Фагер (Fager J.H.) HI 114; V 358
Фагерлунд (Fagcriiind U. H. M.) Hl 404,
412
Фагерсои (Fagerson I.S.) V 225
Файкош (Fajakos J.) I 210; II 24, 25, J88,
192, 193
Файнберг (Feinberg A. H-) II 311
Файгснбаум (Faigenbanm И.М.) V 377
Файсст (Faisst W,) V 443. 615
Факсторп (Fakstorp J.) 11 216; V 151
Фалеки (Falecki J.) V |2
Фанлемап (Vanneman C. R.) HI 444
Фанта (Fanta G. F.) IV 261
Фанта (Fanta P. E.) 1 ,305, II 131; III 296;
V 28
Фанта (Fanta W. 1.) II 230, 269, 273
Фар (Fahr E.) I 15; V 11
Фарах (Farah В.) I 404
Фарах (Farah B, $.) V 286
Фараон (Faraone A.) V 123
Фарбер (Farber M.) Ill 205
Фаренхольц (Fshrenboliz R.) II 346
Фаркаш (Farkas E.) Ill 123, 172, 195 197,
295; V 357
Фаркаши (Farcasiu M.) V 190
Фарли (Farley W.C.) V 514, 521
Фарлоу (Farlow M. W.) I 54; II 122; IV 80
Фармер (Farmer M. L.) J 69; II 277; V 66
Фарнсворт (Farnsworth D. W.) Ill 145
Фарнум (Farnum D. G.) V 522
Фаро (Faro H.P.) 1 169; Hl 241
Фаррар (Farrar K. R.) I 41; 11 226; IV 51
Фаррар (Farrar M. W.) II 405; III 150,
458; IV 151
Фаррингтон (Farrington J. A.) Ill 391
Фартинг (Farthing А, С.) IV 160
Фасель (Faescl J ) V 25 9
Фатиадп (Fatiadi A. J.) I 223; HI 30; V 133,
218, 219
Фаунтейн (Founlaln K- R.) I 414
Фауст (Faust T.) I 121
Фахр (Fakhr l.MJ I II
Фогли (Fegley M. F.) IV 81
Феддер (Feddcr J.E.) Ill 19
Федорук (Fedoruk N.) I 248; 11 46
Фезер (Feather P.) I 360; V 60, 2| 5
Фейгл (Feigj F.) I 302; Il 362
Фейерштейн (Fcnerstein R.) IV 137
Фейлген (Feulgen R.) HI 130, 132
Фейрер (Feurer M.) II 178; IV 132, 272
Фейрз (Fierz- H- E.) IV 11
Фелдкамп (Feldkamp R. F.) IV 82
Феликс (Felix D.) I 307; V 429
Фелкин (Falkin H.) V 448
Фелл (Fell В.) V 331
Фелхабер (Fehlhaber fl. W-) HI 199, 201
Фельдман (Feldman A. M.) 1 271
Фельдман (Feldman L. 1J Ill 46; IV 90,
173
Фсльцманн (Felzmann J. H.) V 379, 491
Фепайз (Fenyes J. G, E.) V 82
Фепел (Fehnel E. A.) IV 18
Феннесси (Fennessey P. V.) I 334
Фепсло (Fenselau A, H.) IV 233; V 129, 131
Фентон (Fenton H. S. II.) Ill 78, 83
Фербер (Ferber E.) I 239
Фербрюгге (Verbrugge С.) V 393
Фергюсон (Ferguson L. N.) IV 175
Фереби (Ferebce R.) II 273
Ферланд (Ferland J.M.) IV 151
Фернскесс (Fernckess H.) 11 333
Ферихольц (Fernbolz H.) Ц 313, 341 342-
HI 60, 67
Ферихольц (Fernholtz E.) Ш 354
Феррари (Ferrari J. L.) Ц 97; V 226
Ферраро (Ferraro J. J,) 1 58
617
Феррел (Ferre! R. E.) IV 95, 102
Ферри (Ferry C. W.) HI 30
Ферри (Ferry N.) II 327
Феррис (Ferris A. F.) Il 289, 290; III 157,
160, 166, 353, 431, 443
Феррьс (Ferrier R. J.) Ill 372, 443; IV 31;
V 396
Ферст (Furst A.) I 205, 210
Фсрталср (Verfalier S.) I 178
Ферхейдеп (Vcrhcyc’en J. P. H.) Ill 417;
V 396, 456
Фершингер (Ferchitiger D.) Ill 118
Фесслер (Fessler W. A.) 11 455
Фестерберг (V’eslerberg A,) III 244
Фетзер (Fefzcr V.) IV 80
Фетизон (Fctizon M.) V 250. 299, 38E), 390
520
Фечер (Fechcr R-) I 102
Фёлш (Folsch G.) I 427
гРёпель (Vopel К. H.) V 148
Фёттингер (Fottinger \V.) IV 174
Фидлер (Fidler D. A.) V 293
Фидлер (Fiedler С.) II 256
Физер (Fieser L. F.) I 2i, 28, 53, 54, 91, 115,
119, 137, 173, 209, 221, 248, 252, 299, 376
377, 380. 382, 387, 391; II 11, 14, 18, 24,
25. 53, 79, 80, 97, 104, 107, 112, 131, 141,
155, 178, 232, 234. 248, 295, 297, 326, 339,
342, 355. 364, 365, 374, 375, 380, 381, 388,
389, 403, 421 428, 432, 433 434; III 20,
30, 56, 67, 76, 1 14, 1 19, 123, '125, 1(57, 236,
240, 241, 246, 256, 260, 261, 271, 27G, 281,
283, 284, 292, 296, 302, 303, 311, 335 412,
448, 457, 458; IV 17, 18, 20. 41. 50, 62, 63,
90, 101, 118,151, 165, 168, 183, 197, 204,
213, 226, 227, 232, 234, 236, 240, 247, 262,
272; V 9, 111, 174, 181, 183, 399, 476. 485—
487, 537, 549
Физер (Fieser M.) I sOfr, II 11, 70, 80, 94, 234,
295, 342, 365, 373, 374, 388, 389, 403; III
76, 246, 292; IV 20, 227
Фик (Fick J.) V 402
Фикеи (Ficken G. E.) IV 81
Фикепшер (Fikentscher L ) I 138, 270; V 50
Филдс (Fields D. В.) I 243
Филдс (Fields D. L.) IV 266
Филдс (Fields E. К.) I[ 133. 134; IH 7, 10,
447, 448
Филдс (Fields T. L.) I 69
Фили (Feely F.) Ill 166
Филипп (Philipp A.) IV 274
Филиппе (Philipps G. H.) II IIP In 240;
V 222
Филипс (Philips J. С.) V 78, 80
Фплипсбори (Phi 1 ipsborn W., von) IV 226
Фи лира (Filira F.) I 286, 335
Филлер (Filler R.) I 137; II 212; III 116,
11 8, 280; V I 85
Филлипс (Phillips В.) II 348, 351
Филлипс (Phillips D, D.) I 11
Филлипс (Phillips ,1, В.) II 11; V 538, 540
Филлипс (Phillips M.) I 11>1
Филлипс (Philips R.) I 367; IV 82
Филлипс (Phillips W. D.) Ill 318
Филпотт (Philpott P. G.) Ц 137
Фильд (Field В. О.) I 20, 24
Фильд (Field L.) I 104, 106, 318: II 250*
HI 114. 237, 241, 354, 365, 366; IV 18, 101
Фильд (Field R. E.) IH 107
Фипан (Finan P. A.) I 69. 101
Финберг (Finberg II.) I 38
Фингер (Finger С.) V 340
Фипджер (Finger G. С.) I 345, 376; II 108,
109
Фиидлэй (Findlay J. \V. A.) V 183
Финдлэй (Findlay J.A.) V 85
Финеллй (Finelli A.) I 430; V 218
Финкбейнер (Finkbeiner H. L.) Il 304- 305'.
Ill 343, 344; V 305
Фпнкбсйпер (Finkbeiner H.) Ill 384; V
262
Финке (Vincke P.) I 183
Финкель (Finkel J. M.) V 41
Финкельштейн (Finkelstein M.) HI 204. 20j;
V 378
Финкенор (Finckeiior L. E.) I 77, 126, 127,
363
Финнеган (Finnegan R.A.) I 144
Финнеган (Finnegan W. G.) I 196; V 430
Финнерти (Finnerty .1. L.) I 376
Фнпхольт (Finholt A.E.) II 163, 178, 362;
III 402
Фире (Firth W. C.. Jr.) HI 187
Фиск (FiskM. T.) II 297. 298; III 335; IV 72
Фиттембсрга (Vitlemberga B.) Ill 145
Фпттиг (Fittig R.) IV 107, 109
Фишиббон (Fitzgibbon W. E.) IV 15!
Фицпатрик (Fitzpatrick J.T.) IV 258
Фицсиммонс (Fitzsimmons B. W.) V 82
Фиш (Fish M.S.) Ill 107
Фпшбейи (Fishbeiu L.) II 12
Фишел (Fishel D.L.) I 309; 1] 380; V 117,
118
Фишер (Fisher B. S.) Ill 318
Фишер (Fischer E.) I 385; 11 367—369; HI
25, 193; IV 32. 36, 207, 209
Фишер (Fisher F.) I 65
Фишер (Fischer G. J.) II 129
Фпшср (Fischer Hans) I 37, 75, 350; II 420;
IV 165
Фишер (Fischer Hcrbest) II 137
Фишер (Fischer H. O. L.) I 70
Фишер (Fischer H . P.) IV 163, 165
Фишер (Fisher J. F.) I 256; IV 173; V 243
Фишер (Fischer J. L.) 11 84
Фишер (Fischer К.) IV 62; V 95
Фишер (Fischer M.) V 320
Фншер (Fischer N.) V 95
Фишер (Ficher W.) V 423
Фишер (Fisher XV. F., Jr.) V 439
Фишер (Fisher D.) V 196
Фишер (Fischer J, F.) V 243
Фишер (Fischer R. H.) V 185
Фишман (Fishman J.) II 355; HI 167
Фпчнпп (Ficini J.) V 276, 278
Флавин (Flavin M.) I 370
Флатов (Flatorv L.) И 9f*
Флаутт (Flantt T. J.) Ill 158, 166
Флематтп (Flematli S. M.) V 95
Флеминг (Fleming W. С.) V 66
Флетчер (Fletcher G, A.) V 21
Флетчер (Fletcher H. G. Jr.) Ill 84; V 131
Флетчер (Fletcher R. S.) HI 366
Флетчер (Fletcher T. L.) 1 115, 210; II 38;
III 301, 463; V I2G
Флеш (F|es D.) Ill 172
Флмп'е (Fligge M.) H 446
Флинн (Flynn F. F.) IV 81
Флитвуд (Flee(wood P.) II 157
Флиттср (Flitter D.) II 31G, 326; Ш 324,
327
Флицир (Fliszaar S.) I 101
Флодии (Flodin P.) IH 285
Флойд (Floyd D. E.) IV 239, 247
Флоод (Flood D. T.) I 73, 116
Флорес (Flores R. H.) IV 126
Флорес (Flores R. J.) Ill 457
Флори (Flory К.) I 417; III 446
Флориан (Florian W.) 1 307, 352, 353
Флуд (Flood .8. H.) II 461; III 266, 306
Фл')пг (Flaig \V.) I 35
Фобл (Faiibl H.) V 136, 143. 350
Фошшкель (Vosvinkcl E.) I 427
Фоголср (Vogcler К.) И 30; [II 329; IV 8
Фогель (Vogel A. I.) 11 109; [V 25g
618
Фогель (Vogel Е.) I 2-11, 242, 366; IV 258;
v 8‘’
Фогель (Fogel J.) V 75
Фогьдьзонг (Fogclsong W. D.) V 278
Фогл (Vogl O.) HI 39, 40
Фоглер (Vogler KJ V 419
Фоглна (Foglia T. A.) V 188, 189
Фогт (Vogt B. RJ I 174; IV 124, 126; V 514
Фогт (Vogt С. M.) I 24
Фогт (Vogt P. J.) Ill 40
Фогт (Vogt R. R.) 1 6G, 174
Федор (Fodor G.) V 230
Фоелл (Foell T. .1.) I 433
Фойтг (Voigt A.) II 208, 210; IV 165
Фой (Foy PJ V 520
cboiiep (Feuer В, 1.) V 470
Фойер (Feuer MJ I 24, 162, 168, 268; II 16;
IV 104, 109; V 24, 206
Фокин А. В. V 169
Фокс (Fox F, TJ Il 263
Фоке (Fox J. J,) I 94, 102; V 417
Фокс (Fox W. В.) V 457
Фолгер (Volger H. C.) 11 232: V 347
Фолди (Foldi V.S.) I 427; 111 12
Фолкерс (Folkcrs KJ I 28; II 399; 401; III
1G3. 167, 340; V 14
Фолкнер (Faulkner D. J.) V 284, 548
Фолстих (Fanlstich HJ V 529
Фолшоу (Falshaw С. P.) II 106
Фольц (Foltz C. Jd.) II 62
Фомичев A. A. V 47
Фонкен (Fonken A.) I 126
Фонкен (Fonken G. S.) | 173; 11 22, 217;
IV 166, 278
Фонкен (Fonken G. J.) II 456; V 339, 360
Фоне (Femes W.S.) II 398, 401
Фонтэн (Fontaine FJ 1 370
Фонтэн (Fontaine GJ V 27o
Фонтэн (Fontaine T.D.) 11 180, 183
Фоорхиз (Voorhees V,) III 131
ФорбеС (Forbes W. F.) IV 90
Форбрюгген (Vorbrtiggcn H.) I 352, 353; Il
114; IH 89, 92
Форд (Ford M.) II 109
Форд (Ford M. C.) Ill 296
Форд (Ford T. A.) 1 291
ФорД (Ford W. TJ V 556
Фордайс (Fordice M. W.) V 503
Фордайс (Fordyce C. RJ V 323
Форджоне (Forgione P. S.) I 39'2: V 372, 373
Форд-Мур (Ford-Moore A. HJ II 57, 281,
411 — 414; III 376, 468; IV 113
Фордхэм (Fordham W. DJ I 275
Форлендер (Vorlander DJ I 296, 299; HI
395; IV 57, 65, 243, 248
Форманек (Formanek HJ I 15
Формо (Formo M. W.) 1 221; II 54, 57, 61,
409
ФорнеФельд (Fornefeld E. ,J.) Ill J 23; V 359
Форрест (Forrest H- S.) IV 84, 99
Форрест (Forrest J.) I 101
Форрестер (Forrester A. RJ V 134, 155
Форсман (Forsman J. P.) V 491
Форстер (Forster M.. О.) IV li, 126
Форт (Fort A. W.) 11 241
Форт (Fort G.) V 478
Форт (Fort R.C., Jr.) V 18
Фортеибо (Fortenbaiigh R. В.) Il 243, 245
Фортк (Fortey E. C.) HI 193
Фосвинкель (Voswinckel H.) 11 430
Фосер (Vosef WJ Ill 236
Фосетт (Fawcett F. S.) I! 123; III 263
Фосетт (Fawcett J. SJ II 466; IV 183
Фоскер (Fosker A. P.) II 444; IV 268
ФоссеЛЬ (Fossel E, TJ V 278
Фосселиус (Fosselins G, A.) V 241
Фостер (Foster А. В.) I 1 18; II 414; IV 185
Фостер (Foster D.G.) Ill 245, 246
Фостер (Foster D. J J 1 273, 397
Фостер (Foster G. kJ 111 193
Фостер (Foster H.MJ Il 262; IH 167, 327
Фостер (Foster P. WJ Ill 271; V 393
Фостер (Foster R. T J HI 10
Фостер (Foster \V. E.) Ill 379
Фотакн (Photaki I.) HI 419; IV 81
Фотергилл (Fothergill G, AJ I 101
Фоузп (Fawzi M. Mj V 277, 278
Фоулер (Fowler F. WJ V 69, 90, 211, 212
Фоулер (Fowler R. В.) IV 201
Фразер (Fraser MJ I 41,3; IV 132
Фразер (Frazer M. J.) Ill 328. 335
Фразер (Fraser M. Mj III 189
Фразер (Fraser W. A.) [I 75
Фразер-Рейд (Fraser-Reid В J I 127
Фразпер (Frazier H. W.) IV 17, 18
Фрай (Fry A, J J HI 266
Фрай (Fry E. M.) Ш 458; IV 50
Фрайд (Fried JJ I 109 1 1 0, 126; II 147
150, 199; IH 49, 53; IV 139, 143, 151, 173;
V 401
Фрэйер.ман (Frajerman CJ V 448
Фрайз (Fries R.) V 341
Фрайннет (Frainnet E.) HI 462
Фрлиэри (Friary R. JJ V 98
Фрям (Frahm E. D.G.) IV 134
Фрзм (Frahm HJ 1 377
Франзен (Franzen V.) 1 138, 270, 34,5; HI
2 r 6, 378, 4o7; V 50, 432
Фраизус (Franztis В.) I 15; IV 103; V 110,
391 393
Франк (Franck В J I HI
Франк (Frank F- JJ V 539, 540
Франк (Frank BJ V 270
Франк (Frank G. A.) I 101
Франк (Franck R. L.) II 398, 355; IV 80,
160, 226
Франк — Нейманн (Franck — Neumann MJ
V 95, 466
Франке (Franke A J V 463
Франке (Franke GJ III 84
Франке (Franke I(J III 276
Франке (Franke WJ I 253, 357, 3G0
ФрапКел (Frankel At.) V 74, 363
Фрапкел (Frankel M. BJ 111 444
Фрапкенфельд (Frankenfeld J. WJ III 366,
367
Франко (Franco RJ HI 166
Франкус (Frankus EJ H 150
Франс (France HJ II 455; IV ,81
Франчер (Francber OJ V 482
Франшимон (Franchimont MJ IH 292
Фраска (Frasca A. RJ V 365
Фратантони (Fratantoni J. CJ IV 258
Фреденбурх (Vredenburgh W, A.) H 205
Фреденхш'ен (Fredenhagen KJ I 92
Фрей (Fray G, Jj I 54
Фрей (Frey A. JJ I 427; JI 83; III 47. 265,
266
Фрей (Frey D. A J ill 268, 271
Фрей (Frey D. WJ V 61. 66
Фрей (Frey WJ fl 129
Фрей (Frey HJ 111 256
Фрейберг (Freiberg L. A.) II 226
Фрейденбсрг (Freudenberg I<J III 360; V
423
Фрейермут (Freyermut H. BJ IH 84
Фрейре (Froitre B. TJ П 216
Фрейфелдер (Freifelder Mj III 169, 170,
172, 173, 19G, 197
Фремерн (Fremery M. IJ H 134; III 7, 10
Френд (Friend A. WJ II 179
Френд (Friend N.A.C.) Ill 246, 2.56
Френкель (Fraenkel GJ I 195
Френкель-Конрат (Fraenicel-Conrat HJ IV
95, 102
Френч (French J. С.) I 395; II 4i2, 414
619
Фреон (Freon P.) I 427
Фресно (Fresco J. I?.) I 275
Фриборн (Freeborn E.) II 327
Фригуард (Freeguard G. F.) I 268; II 388;
V 320
Фрид (Fried J, H.) II 274, 2iG; HI 254, 256;
V 172, 174, 386, 401, o04
Фридель (Friedel R.A.) II 159, -163
Фридсманн (Friedemann P.) Ill 239
Фридигер (Friediger A.) V 235
Фридли (Friedli H.) HI 277
Фридман (Friedman B. S.) II! 339
Фридман (Friedman C.) Il 237
Фридман (Freedman L.) II 129, 293; III 151;
V 33
Фридман (Freedman L, D.) V 27
Фридман (Friedman L.) I 104, 147, 210,
334, 350, 351; Il 10, II, 376, 380, 427;
HI 335, 360, 446; IV 154, 247, 259
Фридман (Freedman H. H.) Ill 121, 123
Фридман (Friedman O,M.) I 257
Фридман (Freedman R.) V 163
Фридман (Friedman S.) I 291, Il 159, 163;
III 256
Фрике (Fricke F.) I 248
Фрике (Frieclte H.) Il 238; IV 200
Фрики (Frickey D. G.) V 35, 38, 153
Фримэн (Freeman F.) V 535
Фримэн (Freeman J. P.) 1 19, 24, 31, 89,
403; II 316, 395, 400, 463; III 97, 99, 216,
240, 312, 431; V 170
Фримэн (Freeman R, С.) II 433, III 374
Фринор (Freenor F. J.) Ill 415
Фриселл (Frisell С.) 1 285; II 346
ФриЦ (Fritz C, G.) Ill 309
Фриц (Fritz J. S,) IV 151; V 483
Фрице (Fritze P.) V 164
Фрицше (Fritzsche H.) V 168
Фрич (Fritsch W.) IV 152, 155
Фриш (Frisch M. A.) 1 427; HI 354
Фроемсдорф (Froemsdorf D. H.) HI 360
Фройцхайм-Кюльхорн (Froitzheim-Kuhlhorn
H.) IV 29
Фро.ман (Vroman H. E.) V 393
Фромме (Fromme I.) I 11
Фроммельд (Frommelt! H.-D.) ill 390
Фростик (Frostick F. С.) 1 113; II 350; Hl
292
Фрулла (Frulla F, F.) И 157
ФрУт (Fruit R. E.) IV 119
Фрутон (Fruton J, S.) 1 387
Фрэмтон (Frampton V. L.) Hl 131
Фу (Fu S.-C. J,) III 145
Фуас (Fouace A,M.) 11 48
Фуггер (Fugger J.) H 231
Фугнитто (Fugnitto R.) Ill 401
Фуджи (Fujii T.) 1 24
Фудживара (Fujiwara KJ I 187, 188, 431,
437
Фудживара (Fuiwara V.) у 342
Фуджимото (Fujimoto M.) Ill 451
Фуджино (Fujino M.) IV 158; V 473, 523
Фуджита (Fujita E.) Ill 322; V 245
Фуджита (Fujita T.) I 96; V 245
Фуками (Ftikami H.) V 270
Фукс (Fuchs H.G.) II 53
Фукс (Fuchs О.) II 186; V 230
Фукс (Fuchs R.) V 376
Фукс (Fuks R.) V 195
Фукуока (Fukuoka M.) V 103
Фукусима (Fukushima D. 1\.) IV 22G
Фуллер (Fuller G.) Ill 306, 306
Фулмер (Fulmer R. W.) Hi 184
Фулмор (Fulmor W.) 11 16
Фунасака (Funasaka W.) V 423, 510
Фунахаши (Ftinahashi T.) 1 188
Фунг (Fung D, P. С.) Ш 390
Функ (Funk K. F.) HI 278
Функе (Funke W.) V 141
фуосс (Fiioss R.M.) HI 306
Фурленменер (FuHenmeiei* A,) V 78, 38G
Фуруйа (Ftirnyn Y,) II 38
Фурукава (Furukawa J.) I 437; V 200
Фуррер (Furrer M.) II 457, 458; Ш 114
Футе (Foote J. L.) 1 215
Фыозон (Fuson R. С.) II 235, 409; Ill 137,
145, 237, 241; IV 72, 210
Фэсман (Fasman G. D.) I 97; III 276
Фэтин (Fateen A, E. К.) I 210
Фюка (Fuqua S.A.) 1 404; V 174, 301
Фюрст (Furst A.) II 1/8, 253; V 78, 386, 506
Хааб (Haab F.) Ц 342
Хааг (Haag A.) Ill 404, 412; IV 273
Хааг (Haag W. О.) II 355; 111 408, 412
Хаак (Haack A.) II 297
Xaac (Haas M, A.) V 286
Xaac (Haas W, L.) I 9, 405
Хаасе (Haase F.) Ill 21
Хааф (Haaf W.) 11 33!
Хаббард (Hubbard W. N.) I 427; HI 354
Хабер (Haber F.) I 350
Хабер (Haber R. G.) IV 103
Хабер (Huber G,) 111 240
Хаберфильд (Haberfield P,) 1П 306
Хабиб (Habecb A. F. 5. A.) Ill 445
Хабнш (Habisch D.) IV 126; V 514
Хавен (Haven A. C.) Ill 11
Хагартя (Hagarty J, D.) V 303, 493, 494
Хагел (Hugel G.) V 384
Хчгслох (Hagelloch G.) [ 318
Хагемайер (Hagemeyar H. J., Jr.) I 83 — 85;
II 25, 269, 273
Хагепдоорн (Hagendoorn J. A.) V 307
Хагитани (Hagitani A.) IV 22; V 482
Хаглид (Haglid F.) Ill 118
Хаддад (Haddad Y.M. Y.) IV 134; V 223
Хаддадин (Haddadin M. J.) I 391; II 18,
104, 107, 160; Ill 125, 311, 412; IV 234
Хадлер (Hadler H. I.) II 273; IV 250
Хадсон (Hudson В. E.) IV 103, 209
Хадсон (Hudson B.E., Jr.) HI 399
Хадсон (Hudson C. S.) II 52, Ю0; III 84
Хадсон (Hudson R. A.) V 544, 546
Хадсои (Hudson R, F.) 1 101
Хаздра (Hazdra J. J.) 11 150, 195
Хазен (Hazen G. G.) I 253, 254; П 254
Хазен (Hazen R. K-) Il 374
Хайакава (Hayakawa T.) V 342
Хайас (Havase Y.) V 199, 464
Хайд (Hyde D. К. А.) Ц 211
Ханд (Hyde E. К.) II 180
Хайди (Hidy P. H.) I 394
Хайерс (Hiers G. S.) I 130, 2l9
Хайзер (Hiser R. D.) IV 258
Хайменс (Hymans W- E.) Il 456; IV 179
Хайн (Hine J.) IV 44; V 521
Хайне (Heine H. W.) V 204
Xaffiic (Hines J.N.) V 71
Xafioui (Hajos A.) V 230, 527
Xafipa (Haira A. R.) I 3G3
Хак (Hach С. C.) Ill 250; V 544
Хаклз (Hackels R. E.) V 468
Хакли (Hackley B. E„ Jr,) V 397
Хакомори (Hakomori S.) V 135, 143
Хала (Hala S.) HI 327
Халл (Hull C. J.) Il 303
Халл (Hull D. С.) I 84, 85; II 25
Халле (Halletix A.) V 195
Халлсуорс (Hallsworth A. S.) II 150
Халперн (Halpern В.) I 301; V 222, 309, 310
Халперн (Halpern О.) Il 39, 389
Халтои (Hutton R. F.) Ц 403
Хальбрук (Halbrook N. J.) V 558
620
Хамамура (Hatnamura Е. К.) V 168
Хаманака (Hamanaka Е.) II 430; V 329—331
Хамбер (Humber L. G.) V 414
Хамбш (Hambsch Е.) I 318
Хамер (Hamer ,J.) 1 145
Хамер (Hamer N. KJ V 9
Хамерсма (Hamersma J.W.) ] 282
Хамильтон (Hamilton С. S.) IV |13
Хамильтон (Hamiltom R. J.) Ill 271
Хамлет (Hamlet J. С.) I 41; 11 226, 414;
IV 51, 151
Хаммар (Hammar W, J,} V 372
Хаммер (Hammer I.) I 396; III 203—205,
210
Хаммер (Hammer R. N.) V 393
Хамон (Hamon D. P. G.) I! 141
Xan (Hahn R. С.) IV 215
Ханауэй (Hanaway W. L.) I 197
Ханак (Hanack M.) I 179; HI 276
Ханафуза (Hanafusa T.) Ill 241
Ханг (Hung V. Y.) Ill 277
Хапдрик (Handrick R.G.) П 30, 235
Ханессиан (Hanessian S.) V 468
Xauae (Hanzc A. R.) I 173; II 288
Хаизел (Hanzel R. S.) Ill 468
Ханзлик (Hanzlik R. P.) V 420
Хаиимен (Hotieyman J.) V 478
Ханкин (Hankin H.) II 435
XaincoK (Hancock J. E. H.) Ill 18
Ханн (Hann R.M.) II 100
Ханна (Hanna I.) V 250
Ханна (Hanna R.} V 8!
Хансбергер (Hunsberger I.M.) I 335; II 97;
HI 262; IV 235; V 226
Хансбури (Hansbury E.) Ш 147, 148
Хансене (Hanseke G.) I 385
Хансен (Hansen В.) V 230
Хансен (Hansen H. V.)V 148
Хансен (Hatuten J.) II 392
Хансли (Hensley V. L.) I 366; Il 359
Хаислик (Hanslick R. $.) IV 81
Хансон (Hanson E. M.) V 434
Хансон (Hanson E- R.) Il 39
Хансон (Hanson H. R.) V 547
Ханссен (Hansscn H. W.) V 261
Хант (Hunt J. С.) II 414
Хант (Hunt J- H.) I 219
Хант (Hunt J. S.) Il 99; V 222
Хант (Hunt R. H.) 1 166
Хантер (Hmitcr G.E).) II 78, 79; III 7, Ю
Хантер (Hunter J. H.) I 199, 209
Хантер (Hunter R. F.) II -130
Харберт (Harbert С. A.) V 327
Харвей (Harvey R, G.) HI 468; V 293
Харви (Harvey G, R.) V 423
Харвуд (Harwood H. J.) IV -41
Харгров (Hargrove W. W.) 1 53, 54
Хардеггер (Hnrdegger E.) I 50. 54, 387
Хардер (Harder R. J.) I 196; HI 263
Харди (Hardie B. A.) Ill 266
Харди (Hardy E. E.) I 431
Харди (Hardy D. V. N.) IV 46
Харди (Hardy W. В.) II 243, 245; Ill 283
Хардин (Hardin В. A.) II 461
Хардинг (Harding К.) V 47, 183
Хардстоун (Hardstoue J.D.) Ц 39
Хардтман (Hardtmann G.) V ,"65
Харли-Мэсон (Harley-Mason J.) II 106; III
460, 461; IV 137; V 327
Хармон (Harmon R. M.) Ill 401
Харпер (Harper J. L.) IV 191
Харпольд (Harpold M. H.) V 253
Xapnn (Harpp D. N.) V 82, 318
Xeppitc (Harris A. D.) I 318
Харрис (Harries C. D.) HI 5
Харрис (Harris С. E.) IV 17
Харрис (Harris С. M.) I 6-i, 66
Харрис (Harris G. C,J 1 67, 252
Харрис (Harris H.) Ill II#
Харрис (Harris J. E.) V 239
Харрис (Harris L, S.) HI 331, 335
Харрис (Harris R.C.) IV 250
Харрис (Harris R, F.) I 81; I! 162, 163
Харрис (Harris T. M.) I 64, 66, 392; II 401;
V 165, 310
Харрисон (Harrison A. RJ V 424
Харрисон (Harrison G. С.) IV 11!
Харрисон (Harrison I. TJ Il 222, 296; V 174
Харрисон (Harrison H. R.) II 129, 311; V
307
Харрисон (Harrison SJ V 540
Харрисон (Harrison W. A.) II 456
Xappuccoit (Harrison R.) 1 210
Харт (Hart HJ II 259, 262; Hl 428, 429,
431; V 137, 143, 459
Хартаф (Hartough H.D.) Il 39
Хартвэлл (Hartwell J, L.) 1 28, 162, 168;
II 297; IV 18, 90
Хартсиштейн (Hartenstein A J IV II
Хартке (Hartke RJ V 43
Хартли (Hartley DJ V 35
Хартман (Hartmann A. GJ I 40
Хартман (Hartman J,L.) Ill 68
Хартман (Hartman LJ 1 121
Хартман (Hartman W.W.) I 141; II 39, 281,
295, 380, 423; HI 23, 25, 262; IV 18, 95,
226
Хартунг (Hartung W. HJ I 177; Il 290
Хартцлер (Hartzler H. D.) 1 154, 167
Хартшорн (Hartshorn MJ V 77
Хартшорн (Hartshorn M. PJ IV 235; V 143,
372, 387
Харфенлст (Harfenist MJ II 226; III 441,
443
Харше (Harshe S. NJ I 334; Il 281
Хасби (Husby R.M.) V 53
Хасбэндс (Husbands J,) IV 134, V 223
Xace (Hase S,) II 331
XaceK (Hasek R. H.) Il 70; III 195, 197; IV
2o0
Хасегава (Hasegawa M.) I 210; Il 202
Хасибулла (Hasibullah) III 328
Хаскельберг (Haskelberg L.) I 121
Xacc (Hass H. В.) II 464, 465; IV 248
Xacc (Hass H.) II 97
Xассал (Hassall С. HJ HI 204, 205; V 289
Хассанали (Hassanali A.) V 384
Xacceii (Hussey A, S.) П 375, 380, 452, 456;
II! 145
Хассеродт (Hasserodt U,) V 168, 339
Xaccuep (Ilassiier A.) II 16, 39, 40, 44, 387,
388, 44i, 450, 456; IV 126, 266; V 206. 2! I,
212, 2]3, 215, 216, 43, 89, 90, 102
Хаспельдин (Haszeldine R.NJ I 404; I! 59,
60; III 421; V 21,5, 353
Хата (Hata TJ 1 270; V 53
Хатанака (Hatanaka С.) V 473
Хатт (Hatt H. HJ I 69, 209; V 210, 211
Хаттон (Hatton RJ V 353
Хаттон (Hutton T. WJ I 103, 248
Хаттрер (Huttrer С. P.) I 58
Хатфилд (Hatfield M. Rj IV 170
Хатчинс (Hutchins R. О.) V 223, 281
Xay (Howe RJ IV 226
Хаубейн (Haubein A, Hj II 140, 141, 157
XavSeHCTOK (Haubenstock HJ III 375, 376;
V 360
Xav3 (House H. О.) I 52, 54, 101, 112, 116
150, 166, 248, 366; Il 24, 25, 79, 178, 35 Г
353; III 76, 354, 373, 396; IV 173, 197;
V 183, 273, 277, 278, 298, 299, 300 349
350
Хаузер (Hauser C. F.) In 412
Хаузер (Hauser C. RJ | 55, 57, 58, 59. 63,
6b, 112, 113, 218, 391, 392, 431; II 22
75, 76, 199, 210, 212, 230, 281, 367 369’
621
370, 393, 400. 401’ 111 291, 292, 396, 399;
IV 209, 212, 213, 233; V 26, 70, 71, 143,
1G3, 310
Хаузер (Hauser HJ V 413
Хаузер (Hauser С.) V 291, 292
Хаузер (Hauser Т. R.) И 263
Хаузик (Hausigk D.) V |92
Хдуптманн (Hauptmann Н.) III 149
Хауптмаин (Hauptmann S.) [ 211
Хаустон (Houston В.) IV 175
Хауторн (Hawthorne J. О.) Ill 5,3
Хауторн (Hawthorne М. F.) I 268; HI 119,
381
Хаф (Hough L.) Ill 360; V 396
Хафизов X. V 276
Хафмеи (Huffman J. WJ I 80, 81; 11 187
Хафнер (Hainer К.) I 124, 354; II 335; III
292; IV 11; V 148
Хаффорд (Hutlord D, L.) II 216
ХаЦ (Hatz Е.) 1 351, 352
Хаш (Hatch L. FJ 1 406, 407; V 401, 402
Хашимото (Hashimoto YJ I 248
Х.ашихама (Hachihama YJ II 227
Хаши пуме (Hashizume TJ V 337
Хаяо (Науао SJ Ill 145
Хва (I-hva J. С. Н.) IV 111
Хеббелинк (Hebbelynck М- Fj IV 155
Хебенброк (Hebenbrock К. Fj IV 130
Хеберт (Hebert N. С.) V 393
Хеде (Haede WJ IV 1.52, 155
Хедерик (Hederich V.) Ill 266
Хедже (Hedge J. А.) II 218
Хеджер (Hager F. DJ II 39, 42; IV 95
Хедрик (Hedrick G. WJ I 67
Хей (Hay A. SJ II 132, 245
Хей (Hey D. G.) II 55; Hj 435; IV 20
Xeii (Hey D. H.) I 280; H 109, 133, 455
Хейаши (Hayashi RJ II 456
Хейба (Heiba E. I.) V 262
Хейвуд (Heywood D. Lj II 348, 349, 351
Хейгеман (Hageman H, A.) I 141
Хейгеман (Hageman H.Jj V 51G
Хейдберг (Heidberg J.) Ill 205
Хейдкамп (Heydkamp W. RJ I 215; IV 126
Хейес (Hayes F, NJ Ш 14 7, 148
Xeiiani' (Heisig G. В.) IV 72, 248
Хейл (Heyl D.) Il 22/
Хейл (Heyl F. WJ III 8, 10, 106, 107
Хеплброннер (Heilbronner EJ Ill 308
Хейлманн (Heilmann RJ V 49
Хейльброн (Heilbron I. MJ II 448, 455; III
339; IV 178, 269, 272
Хейм (Heim P.) I 268
Хеймакер (Haymaker C. R.) Ill 167
Хейманн (Heymann И.) I 115; II 388
Хеймбах (Heimback KJ Il 216
Хейме (Heymes R.) Ill 419
XeiiH (He in D. WJ III I 45
Хенн ((Hein R. WJ II 71
Хейне (Heine H. WJ III 19; IV 227, 2281
V 204
Хейнес (Haynes G. RJ I 210; III 4,50
Хейнес (Haynes N. B.j 1 178
Xeihiec (Haynes W. MJ II 311; V 307
Хейни (Heitiey R. EJ I 82
Хейнингер (Heininger S. AJ II 230
Хейнке (Heinke В J IV 8
Хейнс (Heyns KJ HI 181, 184, 266; IV J20
Хейнц (Heinz G.i I 183
Хейицельмап (Heinzelman R. VJ II Ц, 374
Хейс (Hays H, RJ I 335; IV 265
Xeiic, Де (Hetis J. G., cle) IV 183
Хейслер (Heusler KJ I 178; Il 193, 202,
245; III 241, 394; IV 250
Хейслер (Heisler R. Y.) I] 362
Xeiiccep (Heusser HJ I 74; Il 178, 212; III
76, 1 83; IV 226
Хейсцволф (Heiszwolf G, JJ II 22; V 468
Хейфиц Л. A. II 125
Хецшксйл (Hejschkeil RJ 1 248
Хек (Heck L. L.) [ 238
Хек (Heck R. Fj II 132, 339
Хекер (Hecker E.) И 443; 111 441 — 443
Хекерт (Heckert R. EJ III 3l8
Хекман (Heckman R. A J V 73
Хекснер (Hexпег L>. E.) I 75, 210
ХекстоЛл (Hextail P. J J 111 391
Хелблинг (Helbling RJ III 183
Хелджесон (Helgeson R. CJ 1 248; IV 20
Хелгрсп (Helgren P. F.) HI 172
Хелицер (Heliizer RJ V 353
Хеллер (Heller MJ 1 350; И 276; III 46 243
256; IV 90; V 183, 301
Хеллер (Heller S. RJ V 99
Хеллерман (Hellerman Lj II 56
ХеЛл.маин (Hellmann Hj V 190
Хеллмен (Hellman H. MJ HI 78
Хеллмут (He I Im u th RJ III 239
Хелмкамп (Helmkamp G. I<J II 448, 456
462, 463; III 382; V 294, 434
Хемс (Hems B. A.) |1 38, 97, 179, 226; IV 259
Хенбест (Henbest H. В J I 41, 67, 166 168,
200, 209; П 14 7, 148, 150, 178, 227/ 226
227, 293, 338, 342; III 213, 215 240- IV 51,
134, 151, 178, 516; V 223, 268, 300, 301
Хендерсон (Henderson A. T.) I 366
Хендерсон (Manderson W. Wj [V 1G7
Хендриксон (Hendrickson J. В.) I 73; II 388;
V 28, 49, 127, 232, 233
Хендриксон (Hendrickson Y. GJ III 67
Хеиека (Henecka HJ И И
Хеиери (Henery JJ V 190, 203
Хеннесси (Hennessy D. J J III 281
Хенкель (Henkel J.) IV 275
Хенклер (Henkier HJ II 392
Хенль (Hahnle RJ I 179
Хепль (Henle FJ 1 36
Xeini (Henn B. RJ 1 357
Хенне (Hemie A, Lj I 196; III 5, 10, 421, 443
XeintitoH (Heimion G. FJ IH 367, 372; IV
2aS; V 550
Хенрик (Henrich P.) Ill 53
Хенриксен (Henrikson B. WJ IV 261
Хенри-Логан (Henery-Logan K- RJ I 427
Хепсеке (HensckeG.) I| £95, 421
Хекфорд (Hanford W. Ej I 310, 312
Хенце (Henze H. R.) III 13O, 131; IV 253
Хералд (Herald C. Lj V 199, 384
Херберц (Herbertz TJ I 253
Хербст (Herbst R. M.) I 28
Хергенротер (Hergenrother W, L.) I 331
334, 335
Херд (Hurd C. DJ I 24, 438; II 125; Ю9:
III 139, 145, 239, 364, 366; IV 253; V 481,
482
Хердеггер (Herdegger EJ III 34~
Херинг (Hering Hj III 193; 1V 203, 204
Херпнк (Herynk Jj III 187
Херкес (Herkes F. EJ I 404; III 422’ V 172'
174
Херлингер (Herlinger HJ П 30
Херманн (Hermann R. В J 11 226
Хермансен (Hermansen D. EJ II 157
Хермес (Hermes M. E.) IV 81, 186
Херольд (Herold A J V 29
Херрик (Herrick E. CJ Ill 354
Херст (Hurst J, J.) Ill 241; V 519
Хертлер (Hertler W. RJ I 32; II 39; Щ
314: 363, 366
Херц (Herz J, E.) IV 165; 226
Xepu. (Herz WJ 11 199; IV ИЗ; V 63, 66,
380, 384, 495
ХерЦиг (Herzig P. Th J IV 63
Хернлер (Hertzler D. Vj V 378
Херцог (Herzog H.) V 473
622
Херцог (Herzog Н. L,) 1 125, II] IIP, 256;
V 238; 470
Хеслинга (Heslinga LJ I 414
„Хесс (Hess G. P.) I 427
Xccc (Hess H. J.) I 345
Xcce (Hess KJ I 377
Xecc (Hess О.) IV 36
Xecc (Hess W. Wj V 539, 540
Хессе (Hesse Gj Ill 469
Хессе (Hesse HJ V 253
Хессе (Hesse R.) V 134, 143
Хессе (Hesse R. Hj IV 170; V 458
Хесслер (Hessler E. J.) I 137
Хестер (Hester W. FJ Ill 76
Хетиель (Hetzel F. WJ V 145, 116
Хеффер (Hcffer J. PJ Ill 54
Хе.хт (Hecht RJ II 121
Xerep (Hoger E.) Ill 240
Хёциг (Hunig SJ I 210, 282; П 316
Хёриг (Horing CJ ] 215
Херль (Harle H.) II 141
Хёрауф (Horauf WJ 1 236
Х'ёрманп (Hermann H.) 11 178
Хёфт (Hbfi EJ Ill 124; V 135
Хжельт (Hjelte N, S.) I 205, 210
Хибер (Hicber WJ II 350
Хиберт (Hiebert J. DJ V 178
Хиггинс (Higgins J. GJ HI 41,5; V 447
Хигнит (Hignife CJ II! 145
Хидерпрюм (Hiederprum HJ III 386
Хидж (Hege B. Pj V 7,3
Хизер (H iser R. D J IV 258
Хнкнпботтом (Hickmboltom W. JJ II 183,
285, 401; III 312, 378
Хиксон (Hixon R, MJ II 421; HI 301
Хилдебранд (Hildebrand R, P.) HI 271
Хилкеи (Hilcken VJ III 239
Хил (Heal H. G.) HI 386
Хилл (Hill A. .1.) J 97
Хилл (Hill A. SJ I 215
Хилл (Hill D, TJ V 338
Хилл (Hill H. A, О J 11 231
Хилл (Hill J. \V.) II 90, 97
Хилл (Hill PJ Ill 5, 10
Хилл (Hill R, KJ I 84, 85, 2:53, 235, 256;
HI 140, 145, 254, 256, 366
Хилл (Hill R.MJ I 225
Хилл (Hill T„ Jrj 11 119
Хиллер (Hiller GJ 11 316
Хиллмен (Hillman M. E, D,J Hl 381
Хили (Hilp MJ V 196
Хилтон (Gyltoti TJ V 164
ХимелbtUTeiiH (Himelstein NJ III 132, 197
Хпммен (Himmen EJ V 396
Хиидерсиmi (Hindersinn R, RJ III 197
ХинДрикс (Hindriks Hj V 222
Хипп (Heaney HJ I 128; Il 141
Хинклей (Hinckley A. AJ II 39-1, 396, 400;
III 303
Хинман (Hinman R. L.) Ц 66, 70
Хиио (Hitio J. BJ 1 133
XiDipiiKC (Hinrichs IJ 1V 196
Хинтерхофер (Hinterholer OJ V 398
Хинц (Hinz GJ Hl 376
Xnpafi (Hirai SJ HI 451
Хиракура (Hirakura MJ II 2Q6
Хирата (Hirafa YJ V 555
XnpeH (Heereii J. KJ HI 301; IV 56; V 75
Хирон (Hearon W. MJ V 492
Хнрохнса (Hirohisa К.) V 337
Хнрст (Hearst P. J.) ц 2зЗ; III 335
Хирт (Hirt R J И 59
Хирш (Hirsch A. Fj in 291
Хирш (Hirsch CJ V 53
Хиршмани (Hh'schmann RJ I 2з6, 313:
11 253; Hl 43, 46, 360; V 27
Хиршхорн (Hirschhorn Aj V 9
Хнскп (Hiskey C, FJ II 253; ill 360
Xhckii (Hiskev R. G.) I 387; Il 76, 403;
' IV 9; V 333
Хнскок (Iliscock B. FJ V 318
Хит (Heath M- JJ V 424
Хиткок (Hcathcock CJ II 44, 387, 388, 456;
V 138,' 143, 216
Хитцлер (Hitzier F.) I 427
Хайатт (Hyatt A, A J II 285
Хлавка (Hlavka J. Jj IV 199
Хоббс (Hobbs J J JI 39
Хоберг (Hoberg H.) J 248, 428; HI 286, 289
Хобсон (Hobson J. Dj V 5'29
Xor (Hoeg D. FJ HI 30!
Хогг (Hogg J, AJ I! 59, 288, 353; Hl 291;
IV 63; V 556
Ходгсон (Hodgson H. HJ II 417, 420, 443,
446
Ходгсон (Hodgson W. GJ 1 271; 111 26, 30
Ходж (Hodge J. EJ II 70
Ходж (Hodge PJ V 98
Ходжас (HojaS Z, GJ III 189
Ходжес (Hodges PJ V HI, 362
Ходкевнч (Chodkicwicz WJ 1 218. 219;
II Э45
Хоелзел (Hoeizel С. В J ill 241
Коен (Hoehn H. Hj I 304; III 187
Хоеш (Hoescb KJ IV 208, 209
Хойзер (Huyser F. SJ 1 11, 138; II 43; III
313, 445
Хойле (Hoyle GJ 111 304
„Хок (Hock К J IJ 27(5
Хокама (Hokama TJ I 98; Ц 442
Хокер (Hocker Jj V 423
Хоке (Hawks G. Hj I 394; V 564
Хоке (Hocks P.) V 78. 386
Хол (Hohl ThJ II 342
Холдейн (Holclane J J I 398
Холиле (Holysz R. Pj |1 199, 200, 205
Холл (Hall A. MJ V 2 1
Холл (Hall D. MJ I 334, HI 141 146
Холл (Hall H. R., Jrj HI 367
Холл (Hall J. H.) II 388
Холл (Hall L, Dj V 396
Холл (Hall R. Hj I 257; III 144, 146
Холл (Hall T, KJ V 264, 265, 270
Холл (Hall W. A J HI 306
Холлас (Ilallas G J I 112
Холли (Holly F, WJ JJI 340: V 27
Холлиман (Holliman F. GJ V 333, 334
Холлингшед (Hollingshead R. G, WJ III 446
Холм (Hol tn A J IV 167
Холм (Holm M. JJ V 208
Холм (Holm P J V 46
Холм (Holm R. TJ Ju 78
Холман (Holman R. TJ II 320, 326
Холмквист (Holmquist H. EJ I 291
Холмс (Holmes II. Lj I 22); II 81, 335, 403,
409; ]V 241, 247
Холмс (Holmes J J in 296
Холмс (Holmes J. BJ IH 4|6
Холмс (Holmes R. RJ I 117: III 67
ХолСолл (Halsall T, GJ II 25, 388; IV 178
Холстен (Hols’ten J. RJ H 1)0, 97
Холтон (Hollon P. GJ I 413
Холтон (Holton P. JJ III 243
Х’олубек (Holtibek J J II 202
Холум (Holiitn J. R.) IV 183
Холум (Holtim L. BJ I -138
Холштейн (Hohfstein Gj I /3
Хольберг (Hoiberg Bj III 336, 339
Хольден (Holden R. FJ I 317
Хольц (Holtz H. DJ I 138: 111 187
Хомейер (Homeyer A. HJ I 429, 430
Хомутова E. Д, 1 361; II 299
Хонда (Honda 1J V 523
Хопиен (Honneti L. RJ 1J] 401
Хонольд (Honold EJ IV 168
Хонсберг (Honsberg WJ V 419
623
ХопЦ (Hontz A.).Hl 114; IV 105, 109
Хонцль (Honzl J.) I 177; II 455, 456
Хоппер (Hopper R. J.) HI 368
Хонфф (Hopff H.) I 73; III 344
Хорайк (Ногike A.) V 510
Хорват (Horvath BJ Ill 256
Хорвиц (Horwitz J. PJ II 212
Хорли (Horley DJ V 443
Хорлина И. M, I 278; II 362; V 108
Xopn (Horn D. H. S.) 11 133
Хорне (Horne W. HJ |V 80
Хорнер (Horner L.) 1 137; 11 348, 3.50, 353
358, 350, 380; 111241,407, 410. 412, 413,
415; IV 132; V 470
Хорнески (Hornesky SJ I <104
Хорнинг (Horning E. С.) 1 301, 430; П 187;
III 10", 140, 145; IV 101, 210, 248; V 345
Хорнинг (Horning M, GJ 1 301; III 107
Хорнунг (Hornung К. HJ I 307
Хорром (Horrom B. \V.) I 330
Хорсвилл (Horswill E. CJ II 53
Хорст (Horst I) IV 59
Хортмаи (Hortmann A, G.) и 202; III 68;
V 143
Хортон (Horton D.) I 118; III 340, 390;
V 133, 156, 374 376
Хортон (Horton H. R J Ill 21
Хортон (Horton R. L.) I 69
Хортон (Horton W. ,1.) Ill 394
Хоскинс (Hoskins J, A.) II 39; IV 228
Хоскинсон (Hoskinson R. MJ I 438
-Xoy (Howe E. EJ II 420
Хоуард (Howard С. С.) II 463
Хоуард (Howard E., Jr.) HI 408, 412
Хоуард (Howard J. В J I 105
Хоуард (Howard J. F.. Jr.) I 291
Хоуард (Howard J. WJ Il 76; III 261
Хоуард (Howard K. LJ I 387; III 187
Хоуард (Howard R. В.) I 126
Хоуард (Howard W. L.) I 272; 363; HI 172
Хоуелл (Howell C. F.) I 227
Хоук (Howk B. WJ I 291; III 40; IV 202
Хоули (Hawley L, B., .Jr.) V 276, 278
Хоуорт (Haworth R. D.) II 17
Хоутон (Howton D. R.) HI 339
Хоутри (Hawtrey А. О.) V 431
Хофер (Hofer P.) IV 143
Хофт (Holt E,) I 407; V 66
Хоффепберг (Hollenberg D. S.) 1 Ils
Хоффер (Hoffer M.) Ill 104
Хоффзоммер (Hoffsommcr R. D.) I 316;
H 27; Hi 124; V 127, 252, 460
Хоффпзуер (Hoffpauir С. I.) IV 264
XovuiTefin (Hochsteiii F. A.) II 163, 172, 178
179, 370; IV 267
Христенсен (Christensen B, GJ I 313
Хрнстенсен (Christensen N. Hj III 279
Христенсен (Christensen J. E.) II 3 88
Христиан (Christian .1.) Ill 107
Хрутфорд (Hnitford B. FJ I 57
Xcy (Hsu Y. F. LJ V 330
Хуанг Пао-туиг (Huang P.) I 210
Xyanr (Hnang 5. J.) I 391, 392; и 308
Хуанг (Huang W. Y.) II 381; 111 167; IV 168,
r 226
Хуанг-Минлон (Huang-Min loti) 1 199; 209'
210: It 24, 25; III 162, 354
Хубахср (Hu bach er M.) Il 467
Хубер tHtiber WJ II 273; HI 335
Хуберт (Hubert A. J.) V 153
Хупер (Hoover F. W-) IV 191
Хугзанд (Hoogzand С.) I 291
Хуго (Hugo J. MJ I 186
Xvroc (Hugos H.) и 157
Худак (Hudak NJ 11 470
X удек (Hndec J.) [| 6, 439
Худрлпк (Hudrlik O.) Ill too
Худрлик (Hudrlik P. FJ V 440, 442
Xygep (Hooker S. С.) П I I
Х'ммфлетт (Humphlett W. J.) HI 335; IV
'78. 80
Хунгср (Hunger KJ IV 9; V 339
Хунзикер (Hunsiker F.) Ill 389, 390
Хутон (Hooton S.) I 210
Хьедс (Hjeds H.) II 276
Хьюз (Hughes G. A.) V 35
Хыоз (Hughes G. KJ II 237
Хьюз (Hughes H.) IV 209
Хьюз (Hughes N. W.) V 40
Хьюз (Hughes W. B.) Ill 301
Хьюсген (Huisgen RJ II 448; 455; III 431;
IV II, 28, 29; V 18, 271, 272, 487
Хыоугг (Hewett W. A.) HI 336, 339
Хьятт (Hiatt G. D.) V 492
Хэзелер (Haeselcr P. R.) IV 238
Хэм (Ham G. E.) Ill 172; V 204
Хэммонд (Hammond G. S.) I II, 396; II
398, 401; V HI, 112
Хэммонд (Hammond W. A.) II 115
Хэммонд (Hammond W. В.) II 139; V95
Хэмлсон (Hampson N, A.) V 393
Хэмптон (Hampton A.) 1 363, 374; IV 258
Хэмптон (Hampton R. G.) I 392; V 165
ХэмэлаИнеи (Hamalainen С.) II 129
Хэмэлидис (Hatnaliclis С.) Il 468
Хэндз (Hands A, R.) V 444
Хэне.т (Hanel P. G.) V 180
Хэндфорд. (Handford В. O-) Hi 21; V 517
Хэнкок (Hancock E. M.) |[ 281, 374
Хэнтресс (Huntress E, H,) I 79
Хюбель (Hiibel W.) I 291; II 6; V 203
Хюбнер (Huebner C. F.) HI 85, 91
Хюбнер (Hubner R.) II 125
Хювлетт (Hewlett A, P.) 1 238
Хюкель (Hiickel WJ IV 143
Хюмарк (Hughmark P, B.) 1V 18
Хюн (Huynh С.) I 413; IV 126
Хюниг (Hilnig ,S.) II 316; III 70, 351; 354"
JV 197, 235, 253, 254
Хюсман (Huisman H. О.) I 15, 211
Хюттель (Hiittei RJ HI 274, 276
Цая (Zahn H.) I 423, 427
Han (Zahn R.) II 363, 365
Цандер (Zander H.) Щ 283
Цандер (Zander Mj IV 129; V 489 490
Цаорал (Zaoral Mj I 357; HI 387, 388
Цаппи (Zappi E. V.) IV 167
Царт (Zart A.) IV 34, 36
Цаффароци (Zaffaroni A.) II 14
Цвейфель (Zweifcl G.) I 115, 259, 268, 275,
279, 308, 315; HI 301, 371. 372, 377;
V 110, 252
Цвильгмейер (ZwUgmeyer F.) IV 244, 248
Цес (Zeeh B.) ] 248; V 68
Цезарь (Caeser G. V.) 1 17, 18; IV 203, 204
Целлер (Zeller H. G.) II S3
Целлер (Zeller PJ 11 118; III 354; IV 253,
267, 275
Цернер (Zerner В.) IV 227
Цетше (Zetzsche F.) I 381; IV 122
Цефтель (Zeftel LJ Il 196
Цехменстер (Zechmelster LJ II 37, 39
Циганек (Ciganek E.) Ц 171, 178; III 70,
132, 239, 242; V 24. 190—192, 403
Цигенбейн (Ziegenbein WJ | 278, 357, 360;
Il 446
Циглер (Ziegler D.) V 227, 270
Циглер (Ziegler E.) V 318
Циглер (Ziegler G. R.) II 405
Циглер (Ziegler J. В.) ] 127; H 100; ]V 143
151. 265; V 516
Циглер (Ziegler RJ 1 227, 278; II 141, 156,
195, 357; HI 375, 376, 398, 399, 451 IV
29, 50, 187, 188
624
Циле (Ziele К.) 1 73
Цимерман-Крэг iCymerman.Craig J.) Ц 97-
III 260
Циммер (Zimmer G.) Ill 30
Циммер (Zimmer Н.) II 76
Циммер (Zimmer W .) (И 420
Циммерман (Zimmerman Н. Е.) 1 419'
II 271, 273; 111 125, 260
Циммерман (Zimmerman J. Е.) II 22; ]Ц
22; V 524
Циммермапн (Zimmermann F.) IV 109
Циммермапн (Zimmermann J. F.) V 300
Циммерманн (Zimmermann М.) V 176
Цинзер (Zinser D.) IV II
Цинке (Zincke Th.) Ill 120, 123
Циннср (Zinner G.) Ill 278
Циннер (Zinner H.) II 80
Цоебелейн (Zoebelein A.) II 07
Цозель (Zosel K.) HI 376, 431
Цоллнер (Zoellner E. A.) Il 141
Цорн (Zorn H.) V 398
Цюльсдорф (Znhlsdorff G.) Ill 183
Lliopxep (Zurchef A.) Ill 183
Чабаттони (Ciabattoni J.) V 348
Чадвнк (Chadwick D, H.) 1 431
Чайенг (Chiang R- W.) V 183
Чайенг (Chiang Y. II.) V 131
Чайкин (Chaikin S. W.) li 381. 388
Чайковский (Chaykowskv M.) I 303, 335,
336, 344, 345; II ill, Г12; HI 412; IV 102;
V 135. 136, 141, 143, 199
Чайльс (Chiles H. M.) 1 87
Чайнард (Chinard F. P.) Ц 56
Чайнн (Chinn L. J.) 1 166
Чайнопорос (Chjuoporos E.) Ill 145
Чайрас (Chiras S. J.) II 157
Чакрабарти (Chakrabarti P. M.) V 411
Чакравартн (Chakravarti D.) V 368
Чакраварти (Chakravarti К. К.) V 246
Чакрэвартн (Chakravarti R, N.) V 368
Чалмерс (Chalmers V.) Ill 193
Чамберлин (Chamberlin E . M.) II 300; I [ I 183
Чамберлин (Chamberlin J. yv.) V 150
Чамберс (Chambers R. D.) Ill 427, 431
Чамберс (Chambers R, W.) I 378, 379; III 309
Чамберс (Chambers \V. .1.) I 58, 66
Чанг (Chang F. С.) I 156, 157, 165, 167,
168; III 117, 118, 236, 241
Чанг (Chang W. H.) IV 132; V 416
Чаннинг (Channing D. M.) IV 160
Чао (Chao О.) IV 126
Чао (Chao T. S.) IV 28, 29
Чапин (Chapin R. M.) I 405
Чапп (Chupp J. P.) V 420, 421
Чард (Chard S. J.) I 188; 1V 61
Чарлсон (Charlson A. J.) Ц1 240
Чарльз (Charles R. G.) I 75; II 39
Чатт (Chat! J.) III 184; V 448
Чаттавэй (Chattaway F. D.) Hl 304
Чаттерджи (Challerjee S.) I 421
Чаудэри (Chandhary S. 5.) HI 3o8; V 429
Чеботар (Czebotar V. J.) II |8
Чемерда (Chemerda J. M.) Il 300; IH 46,
183, 295; IV 173; V 319
Чен (Chen M. M.) II 448, 456
Ченг (Cheng С. С.) V 386
Ченг (Cheng Ц, F.) V 449, 454
Чени (Cheney L. С.) I 240
Чепмен (Chapman J. H.) Ц 9?, Ill 179,
226; 111'340
Чепмен (Chapmaii О. I,.) j 1 294, 29.у IV
36; V 232, 510
Чепмен (Chapman N. В.) I 137; III 241*
IV 207, 209
Чепмен (Chapman T. M.) V 565
Чеппелл (Chappell R- L.) 11 306
Чеппелли (Chappell? E. W.) I 137
Чернпи И. И V 47. 196
Черни (Charney W.) Ill 256
Чеше (Tschesche R.) IH 88, 92; V 105, 108
Чёрч (Church R. F.) 11 239; IV 1/9; V 86
Чижевский (Czyzewski A.) Il 421
Чизоли (Chinsoli G. P.) IV 61; V 167
Чизхолм (Chisholm M.) Ill 299, 301
Читвуд (Chitwood J. L.) V 152
Чладек (Chladek S.) IV 253; V 564
Ч мол и К (Smolik S.) Ill 47
Чодрофф (Chodroff S.) II 39
Чоигиц (Chetilin A.) V 360
Чоклн (Chalkley G, R.) V 411
Чоппин (Choppin A. R.) IV 6. 161
Чортпк (Chortvk О. T.) HI 140, 145, 366
Чоу (Chow Y , L.) I 370; IV 63
Чубар (Tchotibar B.) Ill 295: V 80
Чудд (Chndfl С. C.) Ill 56; IV 327
Чуди (Tschudi G.) I 167, 200
Чунг (Chung В. C.) Ill 415
Чунг (Chong D,j IV 268
Чупг-Тупгшуп (Chiing-Tungsluin) I 210
Чьем (Chien P.-L.) I 73; II 195
Чью (Chew L.) V 222
Чью? (Chuit С.) V 448
Чьяиг (Chiang R. W.) V 183
Чэн (Chan К. К.) V 341
Чэни (Chanev A.) V 156
Чэнли (Chanicy J. О.) V 308, 310
Чэттерджи (Chatterjee В. G.) I| 70
Чэттерджи (Chatterjee S.) IV 421
Шаал (Schaal V.) II 435
Illaait (Schaap L.) I 167
Шабика (Shabjca A. С.) I 127; IV 145, 151;
V 516. 534
Шабрие (Chabrier P.) IJ 47, 48; 111 167
Шабтай (Shabtai J.) II 355
Шавел (Shavel J., Jr.) I 24; 101
Шадвелл (Shadwell J.) 11 8
Шайблер (Scheibler H.) V 508
Шайдер (Shyder H. R.) IV 53
Iliaiin (Shine H. J.) I 372
Шайота (Shiota M.) V 46, 374
Шаллер (Schaller H.) I 365; Ш 319, 375;
IV 98
ПНмма (ShammaM.) Ill 341; V 352, 353, 40з
Шампань (Champagne J.) V 520
Шан (Shan В. M.) Il 281
Шани (Shani A.) V 275
Шанк (Schank R.) v 379, 491
Шэнли (Shanley E. C.) HI 56
Шантаи (Szantay С.) V 109
Шапиро (Shapiro L.) ] 166; 11 421
Шапиро (Shapiro E. L.) V 66
Шапиро (Shapiro P.) I 379; HI 492
Шапиро (Shapiro R. II.) V 424, 425, 429
Шапиро (Shapiro S. L.) 111 151
Шапиро (Shapiro S. H.) IV 233
Шаппелл (Schappe 11 F. G.) I 40
Шарбье (Charbier P.) 1 350
Шарек (Szarek W. A.) V 333
Шарефкин (Sharefkin J. G.) II 54, 57, 59,
353
Шарки (Sharkey W- H.) I 181; HI 412
Шарма (Sharma S. N.) V 294, 299
Шарп (Sharp L. W. A.) Ill 266
HJapn(Sharp J.C.) III 4-18; V 462
Шарп (Sharp M.) IV 24/
Шарпе (Sharpe A. G.) II GO; III 266, 421
Шарплес (Sharpless К. В.) V 420
Шарф (Scharf D. ,1.) V 187
Шарф (Scharl H. D.) V 177
Шарье (Charrler G.) Ill 284; I V 30
Шауб (Schaub R. E.) II 16, 151 — 153, 217
Шафер (Schafer W.) V 24
625
Шафер (Schaler W R.) Hl 240
Шафер (Shafer I1 R ) V 98
Шаффер (Schaffer E ) Hl I 18
Шаффер (Shaflcr E T.) V a47
Шаффнер (Schaffner I. J.) 11 272, 273
Шаффнер (Schaffner R.) H 02, 431
Ulax (Shah G. D.) IV 90, 210
Шах (Shah N, M.) 1 48. 34, 317
Щах (Shah R, С.) I 48. 54; IV Э0, 210
Шах (Shah V. R.) iv 00, 210
Шахак (Shahak 1.) I 300, 431; If 60
Шаховским Б. Г. V 442
Шрайнер (Schwyzer R.) 1 211; II 342, 444;
Hl 388, 434; IV 6, 132, 264, 268; V 156
Шварц (Schwartz G.) IV 103
Шварц (Schwartz И.) 1 427
Шварц (Schwarz M.) V О
Шварц (Schwarz R.) Hl 103; IV 203, 204
Шварц (Schwarz V.) IV 170
Ш варц (Schwartz M. A.) ] 137; III 344
Шварц (Schwartz N.) 11 226; III 204, 205
Шварц (Schwartz N, N.) IV 143
Шварценбах (Schwarlzeiibach K-) 1 248;
III 289
Шварцман (Schwarizman L. Il.f 1 278
Швебке (Schwebke G, L.) I *35
Швсйгср (Schwefgvr R.) Ill 84
Швейцер (Schweizer E. E.) I 183. 252, 273;
II 261; HI 172, 173, 44V IV 53, 55, 36, 121,
122; V 76, 547
Швейцер (Schweizer E. H.) IV ,6
Швейцер (Schweizer I?.) HI 230
Швекендик (Schwcckendick W.) 111 415
Швепк (Schwcnck G. О.) 1 15
Швснк (Schwenk E.) 11 314. 316, 434, 435;
111 240, 251, 2.56. 335; IV 145, 151
Швснке (Schwenke K.-D.) V 411
Шверин (Schwerin S.) IV 126
Шво (Shvo Y .) I 1 86
Швохау (Schwochan M.) V 412
Шейдеггер (Scheideggcr U.) Ill 92
Шейпер (Schemer P-) HI 24 |
Шейт (Scheif V 324
Шейфел (Scheifele H. J.) ill 363, 366
Шекенбах (Schekenbach F.) I 13
Шекспайдер (Schexnayder D. A.) I 370
Шелдон (Sheldon J. С.) I 24
Шелке (Szelke .4.) II 458
Шеллснберг (Schelleiiberg W. D.) I 256
Шелле ибер rep (Schellenberger IL) Ill 240
Шеллкопф (Schoelkopf U.) I 175; II 233;
256. 276, 277, 294; Ш 402, 412; V 287
Шелтон (Shelton J. С.) V 34, 42'1
Шелтон (Shelton J. R.) II 71
Шемин (Shemin D.) Ill 193
Шемякин M, M. I 344, 3o0; III 378, 405, 412
Шен (Shen T- Y) II 439
Шенг (Sheng AL N.) V 53, 307, 341
Шенекер (Shonecker B.) Il 276
Шенк (Shank R. S.) HI 286, 289; V 401
Шенк (Schenck Fr.) IV 191
Шенк (Schenk G. FI.) IV 146, 151; V 483
Шенк (Schenck H. R.) Ill 76
Шенкер (Schenker E.) II 388
Шеннон (Shannon J. S.) IV 133
Шеноп (Shcnoy P. K.) Ill 415; V 447
Шецстоун (Shenstone \V. A.) II 436
Шепард (.Shepard E. R.) Ill 172
Шепард (Shepard 1. G.) I 31, 89; 11 316
Шеперд (Scheperd D. A.) Ill 10
Шеперд (Shepherd D. M.) V 478
Шеперс (Schepers R. G.) IV 155
Шеин (Scheppe IL) V 429
Шеппард (Sheppard О. E.) Ill 25
Шеппард (Sheppard N.) Il 42, 36
Шеппард (Sheppard R. C.) Ill 388; IV 24
Шеппард (Sheppard W. A.) II 46, 123; 1ц
267, 432
Шецф (Schopl C ) 1 86
Шербюлье (Rheibulier E.) И 326; HI 144, 146
Шерер (Scherer R. V., Jr) 4' 151, 152
Шеридан (Sheridan J.) 1 238
Шерман (Sherman C. S.) |V 203, 204
Шерман (Sherman .) [V 142, 143
Шерман [Sherman W. R.) H 327, 402, 403;
IV 248
Шерред (Sherred J. A.) I 130
Шерфе (Scharfc E.) ill 53
Шесмит (Shoesmith .1. В.) [ 398
Шефер (Schaefer A- P.) V 00
Шснер (Shaefcr \V. E.) IV 25
Шефер (Schaefer G. F.) Il 4IQ
Шефер (Schaefer J. P.) HI '25, 247, 256, 414,
4 5; V 322,- 447
Шефер (Schafer W ,) 1 III; 111 26 I; V 24
Шеферд (Shepherd B. D.) Ill 328, 335
Шеферд (Shepherd D. A.) HI 107
Шеферд (Shepherd ,1. W.) 1 168; II 16
Шефт (Shcft I.) Hl 391
Шеффер (Scheffer A.) Ill 76
Шеффлер (Schelfier К.) Il 106
Шехтер (Schachter O.) Ill 304
Шсхтер (Shechter H.) I 24, 147, 334, 350,
331; II 10, 1 I, 95, 97. 293, 380, 442; III 97,
99, 144, 146, 286, 289, 301, 360; IV 102,
154, 215, 239; V 156, 226, 307, 333, 400,
429
Шёберл (Schohcrl A.) I 115
Шеллкопф (SchollkopI U.) V 186
liicrs (Schon G.) I 3o2, 353
[[Ан (Schoeii R. L.) Il 238, 262
Шенберг (Schonberg A.) I 200, 210; HI 401
Шёне (Schone N,) 1 307
Шспхеймер (Schoeiichoimcr R.) II 412, 414
Ши (Shea J, L.) 111 99
Шиверс (Shivers ,1. С.) IV 209
Шнгематсу (Shigematsu N.) I (16
Шидт (Schiedl U.) II 106
Шик (Schick A.) II 106
Шик (Schlek H.) 1 343
Шилдс (Schields J. F.) I 131; IV 161
Шилдс (Schields T. С.) I 167, 315; V 66
Шилдкнехт (Schildknechl FI.) IV 174
Шилл (Schill G.) II 1 18
Шиллер (Schiller H .) Hl 13/
Шиллингтон (Shillington J. K.) П 119
IlhiJion E. A. V 33. 33
Шнлц (Scliiltz L, R.) Ill 184
Шильднек (Shildiieck P, R.) I 54; III 327
Шим (Shim K, S.) II 5. 6
Шимам (Schiemann G.) I 73, 124
Шимахарз (Shitnahara АЗ.) V 46, 347
Шимельпфепиг (Schimelptenlg C, W.) I 149,
166; V об, 66, 345
Шиммельшмидт (Schimtnelsehinidt R.) V341
Шимени (Schimenz G. P.) V 168
Шимик (Chimiak A.) IV 12
Шинину (Schimizu V.) Ill 78; V 183, 451,
454, 523
Шимке (Schimke H.) Ill 445
Шпмопиши (Schimonishi Y.) II 303; IV 158;
V 311
Шин (Shin M.) IV L>8; V 523
Шинллбауэр (Schinblb апег H.) V 147
Шппдлбауэр (SchiridIbauer W.) V 398
Шиндлер (Schindler О.) I 353
Шимер (Shiner V. J.) I 285
IIIiiiiKoBCKH (Shfnkowski R.) V 514
Шпиц (Schinz H.) I 141; IH 274, 276; IV 190,
197, 258; V 14
Щипковский (Shipkowski. E R.) II 109
Шипим (Shipman J. J.) IV 201
LLhUmep (Schipper E.) IV 165; V 129, 131
Шпрдхар (Shirdhar D. R.) Ц 239
Шпрлей (Sirley D. A.) U 463
Шпрлен (Shirley R, V.) Ill ^2, 67
626
Ширмер (Schirmer J Dj | 9|; [V 197
Шири (Schirp HJ 11 427
IJIncc (Schiess P. W.) 1 134, 167; ll 150:
III 194, 197. 940: IV 170
Шнсслер (Schiessler R. W J II 316, 326;
1И 324, 327
Шпфф-Шенхаф (SchjH-Shcnhav Hj IV 116
Шихан (Sheehan J. C,J I 164, 168, 190, 193,
303, 350, 427; Il 331; HI 116. 118, 149.
340. 341. 365-367, 394; IV 22, 154, 199,
253; V 201, 481, 530, 364
lllnxep (Sicher .1.) 111 396
Шлагель (SI age I R.C.) V 174
Шлезингер (Schlesinger H. J.) I 268; Il 163,
178, 180. 381. 388; III 379, 39|, 402
Шлейер, фон (Shleyer P. R., von) Ц 348,
351, 470; III 366; V 7. 18
Шленк (Schlenk HJ II 320, 320
Шленк (Schlenk W-, Jr.) Il 31G, 326
ШлеуССпер (Sch kmssner KJ HI 207, 208
Ш.ч'ефер (Schlaeter F, WJ Ill 360
Шлпхтинг (Sch 1 ichting О.) I 256
Шлоедрр (Schloeclcr H.) HI ,398, 399
Шлоссер (Schlosser И.) 1 168; Il 308; 5-' 66
Шлюбах (Sehlubach H. H, V 24
Шмант (Szmant H. H.) HI 413; V 84
Шмерлинг (Schmerling Lj II 470
Шпигель (Schmicgel K. l\.) Ill 354
Шмигель (Schmiegcl W. WJ Ill 354
Шмид (Schmid H.) JI 170. 178; IV 226
Шмид (Schmid H. H. О.) V 353
Шмид (Schmid H. J.) I 170, 173; IV 155
Шмид (Schmid M.) [ 357'
Шмидбауьр (Schmidbaner H.) V 141, 143
Шмидлин (Schmidlin J.) I 277, 278; II 288;
III 84, 274, 276; IV 144, 151
Шмидт (Schmidt E.) I 427; V 193
Шмидт (Schmidt H. M.J V 441, 442
Шмидт (Schmidt K- F.) I 25, 28
Шмидт (Schmidt M.) ]V 1,56
Шмидт (Schmidt O. Th.) Ill 439, 443
Шмидт (Schmidt R. D.) I 215
Шмидт (Schmidt R. E.) I 120, 121
Шмидт (Schmidt UJ Ill 7, 10, 469
Шмидт-Томе (Schmidt-Tome J.) 1V 86, 88,
90, 152, 155, 227
Шмндхаммер (Sciimidhammer L.) 1] 121
Шмир (Schmir G, L.) II 30
Шмитт (Schmitt J.) I 94
Щмиц (Schmitz E.) I 147, 215; 11 409; 111
67; IV 125, 126. 275; V 85, 86, 343, 408, 514
ШмиЦ (Schmitz J.) II 30
Шмукер (Smncker L. D.) V 76
ШмуЦ (Schmutz J.) Il 5(1
Шмуцлер (Schrmitzler R.) IV 138
Шмушкович (Szmnszkovicz J.) II 273, 311.
316; III 15, 18, 19, 129; IV 183, 197, 250
Шнабель (Schnabel E.) V 473
Шнейдер (Schneider 19. F.) V 16, 294
Шнейдер (Schneider A.) V 18
Шнейдер (Schneider H. J.) | 10
Шнейдер (Schneider J.) Ill 376; IV 29; V 411
Шнейдер (Schneider KJ III 376
Шнейдер (Schneider LJ Il 340, 342
Шнейдер (Schneider N, M.) 1 278
Шнейдер (Schneider O.) Ill 46
Шнейдер (Schneider W.) Ill 291, 292
Шнейдер (Schneider W. P.) II 73, 74. 137,
288; V 556
Шнелль (Schnell B.) 11 ,337
ШниДер (Schnider P.) II 70
Шннпп (Schniepp L. Ej 1 275; II 216; V 13]
Шнпцер (Schnizer A. W.) II 129
Шнорренберг (Schiiorrenberg W.) Ill 67
Шоддер (Schodder HJ I 41
Шоенек (Schoeneck W ) II 392
Шок (Schock R. U.) ]I 99
Шокина В. В, IV 272
Шокхор (Shiikhor 1, К.) И' 259
Шоли (Scholl R.) Ill 133, 143
Шоллер (Scholler К.. L.) IV 83
Шольц (Scholz С. R.) I 58; III Н5, 120,
123; V 534
Шоммер (Schommer WJ IV 59
Шопбаум (Schonbattm G. R.) IV 227
Шоиле (Shonle H. A.) HI 76
Шоно (Shono T.| II 227
Шоппн (Shoppee C. WJ I 41, 221; 11 193;
V 39. 40
Шор (Shore P. A.) Hl 84
Шорз (Sjchors А.) V 240, 462
Шоры (Sorm FJ 1 358; 11 24, 25; 111 285;
IV 165; V 276, 278
Шормова (Sormova Z.) Ill 285
Шорно (Schorno K. S.) V 120
Шорт (Short W. A.) IV 101
Шорт (Short W. F.) HI 366
Шоссер (Schosser H. P.) IV 75
Шоу (Shaw B, L.) I 66; II 302; IV 272; V 448
Шоу (Show D, L.) HI 241. 298
Шоу (Shaw G.) 1 83, 285
Шоу (Shaw R. A,) V 82
Шоуелл (Showell J. S.) I 247; Hl 68, 339
Шоуни (Shawky M.) IV 153
ШоулДерс (Shoulders B. A.) 1 167. 345
Шоулер (Showier A. J.) I 122; HI 444
Шоф (Shoaf C. J.) II 193
Шофилд (Shotield J. A.) I 381; IV 160
Шофилд (Scholield К J II ,39
Шофилд (Schofield P.) IV 160
Шпатц (Spalz MJ I 239
Шпауде (Spattde S.) Ц 392
Шпепдель (Speidel P. E.) Ill 419
Illnepo (Spero G, B.) Ill 167
Шпепдель (Speidel P. E.) Ill 41 p
Шпет (Spath E.) Ц 228
Шпигельберг (Spiegelberg HJ I 133
Шпильман (Spielman M. A.) Ill 261; IV 190
Шпильфогель (Spilfogel SJ III 256
Шпрсхср (Sprccher M.) Ill 92. 354
Шрадер (Schrader E.) Ill 100
Шрайнер (Shriner R. LJ I 301; II 87, 97,
303; HI 70 [31 193, 342; IV 18, 36, SO,
225, 243, 248
Шрамм (Schramm G.) HI 148
Шрамм (Schramm R. M.) V 520
Шрамм (Schramm SJ I 215; V 86
Шраплер (Schrjipler UJ V 439, 442
Шраузер (Schranzer G. N.) V 240,241
Шредер (Schroeder E, F.) II 97
Шредер (Schroeder GJ II 314
Шредер (Schroeder H. R.) IV 50, 117, 118
Шредер (Schroeder L. R.) HI 187
Шрейбер (Schreiber £. CJ III 27p
Шрейбер (Schreiber J.) I SO, 167, 302, 351,
352; JI 199; III 266; IV 183; V 42!)
Шрейбер (Schreiber KJ II 411, 414
Шрекер (Schreckcr A. WJ I 162, 168; I! 22
Шренк'(Schrenk H. И.) I 167; V 66
Шретер (Schroeter G.) I 393, 394; II 125, 362
Шрёдель (Schrodel R.) Ill 469
Шрёдер (Schroder В.) V 493, 494
Шредер (Schroder EJ I 422
Шрёдер (Schroder G.) V 546
Шрёдер (Schroeder w.) Ill 274, 276
Шридхар (Shridhar D. R.) И 239
IJlpiicxetiM (Schriesheim A.) I ьэ, 158. 166,
167, 195. 334. 345, 397; II 310, 3ll
Шройдер (Schranzer G. N.) 11 6,’7, 43G. 439
Шролл (Schroll G. W.) II 150; HI 130
Illponnep (Schroepper G. J., Jr.) V 393
Штааб (Slaab H. A.) I 238, 398‘ H 29 30
120, 121, 174, 178; HI 323, 329, 421’- IV
76, 98; V 236. 417
Штааб (Staab \V.) HI 439, 443
Штаврнк (Stavrik S.) I 413
627
Штайгер {Staiger G.) И 82, 83
Штаклис (Staklis A ) 111 241
Штамм (Stamm D.) II 443
IIItiiih'o (Stange H.) V 293
Шташ'е (Stange О.) IV 47, 168
Штапп (Stapp R.) IV 4 8
Штарр (Starr L, D.) 1 345
1Г1таудингер (Stand inger H.) I 393, 394;
III 13, 18. 184, 185, 187, 411, 41.3; V 95
Штахманц (Stahmann M. A.) Jl 313
Штеглих (Steglich W.) I 181; III 434; V 270
Штедман (Stedman R. J.) 1 400; 111 280;
V 416
ШтеФср (Steiger P.) I 219
Штейгер (Steiger R. E.) Ill 114, 205
Штенгмап (Steigman J.) Ill 302, 303, 319
Штсйермарк (Stevermark P. R.) IV 191
Штейн (Stein G,) IV 26, 27, 29
Штейн (Stein W. H.) Il 70, /1
Штейнберг (Steinberg A. M.) I 210
Штейнберг (Steinberg G. M.) I 436
Штейнекер (Steinacker R. H.) II! 40
Штейнер (Steiner К.) I 54
Штейнер (Steiner U.) Ill 274, 276
Штейнкопф (Steinkopt W.) Ill 444
Штейнпрейс (Steinpreis. R.) Ill 190
Штейихардт (Steinnardt С. К.) I 248; 11 158,
165, 178
Штельберг-Штейнхаген (Stallberg-Stenhagen
S.) HI 14, 18
Штенберг (Stenberg V. I.) I 247
Штсппель (Steppel R. N.) V 519
Штерк (Sterk Ы.) V 318
ШтермиЦ (Stermitz F, R .) V 214
Штенхаген (Stenhagen E.) V 134
Штерн (Steam A.) Ill 402
Штерн (Stern E. W.) HI 53; V 345, 346
Штерн (Stern F.) 11 129
Штерн (Stern G.) 11 [92
Штерн (Stern R.) IV 136; V 252
Штерн (Stern R. L-} V 306, 307
Штеттер (Stotter H.) I 37, 110, HI; III 39,
40; V 9, 134, 143
Штеффген (Steffgen F. W.) IV 183
Штиле (Steele D.) Ill 197
Штиле (Steele R. В.) V 110, ’262
Штпллих (Stillich O.) Ill 291. 292
Штин (Steen К.) I 307, 351
Штокман (Stockmann H.} I 11
Штокстад (Stockstad E. L. R.) HI 340
Штолар (Stolar S. M.) Ill 46; IV 90
Штолль (Stoll A.) 1 40, 382; 11 390, 391;
III 77, 78; IV 145, 151, 267
Штолль (Stoll M.) II 125
Штолоу (Stolow R. D.) II 15(1; V 246
Штольберг (Stolberg L’. G.) HI 132
Шторм (Storm D. L.) V 96, 98
Штрайк (Stryk F,, yon) II 253
Штрак (Strack E.) Ill 203, 205
Штраус (Straus E>. В.) I 2/5
Штраус (Straus F,) 111 120. 123
Штраусс (Strauss H. E.) Ш 121, 123
Штрик (Streeck FI.) II 297
Штромайер (Strohmayer II. Г.) IV 58
Штромберг (Stromberg V. L.) П1 140, 145
Штрубе (Strube R. E.) II 22
Штуббс (Stubbs R. D.) IV 226
Штудер (Studer R. O-) V 155
Штумпф (Stumpf W.) II 350; III 78
Штурм (Sturm G. P.) Ш 394
Штюбе (Stiiebe С.) I 196
Штюбер (Stiiber O.) Ill 271
Шубарт (Schubart R.) I 242
Шудель (Schtidel P.) 1 167; IV 253
Шуей (Schuetz R, D.) II 100; III 98, 99
327, 468; V 102
Шуллер (Schuller W. H.) V 224
Шульман (Shulman J. I.) V 100, 437,- 438
Шульман (Shulman R. S.) II 307
Lil ул ь ге-Фрол и и де (Schul (e-Froh linde D J
Il 106; V 228
Шулью-Эльт (Schulte-Elte К- Н.) V 429
Шульц (Schulz J.) II 39”
Шульц (Schulz H.) II 118; HI 403, 412;
V lu9
Шульц (Schultz G.) IV 24
Шульц (Schultz H. S.) Hl 82, 84
Шульц (Schulz H. P.) V 205
Шульц (Schulz 1,.) V 406
Шульце (Schulze F.) I 238; 11 195
Шульце (Schultze E.) Ill 239
Шульце (Schulze W.) Hl 239, 276
Шумакер (Schumaker R. R.) V 127
Шумакер (Shumaker S. H.) IV 18
Шумахер (Schumacher H.) V 186
Шумами (Schumann 1.) IV 36, 160
IIIvm6 (Schumb W. C.) Ill 56
Шунк (Schunk С. H.) Il 268, 273; 111 13, 18;
IV 250
Шупак (Shupack S. I.) II 371
Шуринк (Shurink H- В.) II 411, 414; IV HI
Шустер (Schuster D. ].) II 155
Шу (Schuh H,, von) IV 35, 36
Шу (Schuh H. G.) IV 74
Шур (Schure R. M.) V 185
Шуэтт (Schuett W, R.) Ill 166. 167
Шыо (Shew D.) IV 173
Шюслер (Schiissler H.) 1 423, 427
Шюц (Schutz G.) Ill 401
Эберль (Eberle H.) IV 50
Эби (Eby C, J.) I 113
Эбке (Ebkc К ) IV 126
Эбнотср (Ebnother С.) II 255
Эванега (Evanega G. R.) V 494
Эванс (Evans D.) HI 16/
Эванс (Evans D. D.) I 303
Эванс (Evans D. E.) 1 303
Эванс (Evans E. A.) 1 331; II 429
Эванс (Evans G. W.) 11 34G
Эванс (Evans J. M.) V 333
Эванс (Evans M. E.) V 237
Эванс (Evans R. F.) HI 335, 431
Энанс (Evans R. M.) 11 97, 99, ]79, 226,
414; IV 131, 170; V 270
Эванс (Evans T. W.) II 389
Эванс (Evans W. L.) I [32; II 93, 97; HI
193, 274, 276, 419
Эвнин (Evriiu А. В.) V 494
Эгге (Egge H.) I 318; II 281
Эггенспергер (Eggensperger H.) 1 1/9; HI
276
Эге (Ege G, E.) II 202
Эге (Ege S. N.) Ill 301
Эглинтон (Eglinton G.) 1 66, 166; 1 1 229
230, 246; IV 272;V 21
Эгнелл (Egnell С.) I 427
Эдвард (Edward J. T.) Ш 260; IV 147, 151;
V 203
Эдвардс (Edwards В. E .) IV 151
Эдвардс (Edwards B, F. R.) HI 28, 30, 344
Эдвардс (Edwards D.) 11 226
Эдвардс (Edwards J.) Ill 94, 99
Эдиардс (Edwards J. A.) IV 72; V 98, J7*f,
386
Эдвардс (Edwards .1. D.) I 118; III 145
Эдвардс (Edwards J. D., .Ir.) Ill 131
Эдвардс (Edwards J. O.) Ill 76, IV 255
Эдвардс (Edwards О. E.) II 106; III 89, 92;
V 475
Эдвардс (Edwards P. N.) IV 226
Эдвардс (Edwards W. R., Jr,,) V 48], 482
Эдене (Edens С. O.) Hl 39, 40; IV 259
Эдман (Edman .1. R.) V 304, 305
Эдман (Edman P.) IV 44, 45; V 492
628
Эй (Enw J., von) П 53
Эйгенманн (Eigenmann E. W.) I 167
Эйзенбраун (Eisenbratm E. J.) I 86; Il 129,
311; III 84, 204, 205; jy 177, [79; у 93,
119, 120, 307, 378
Эйзепмап (Eisenmann J. L.) I 288, 291
Эйзцер (Risner T.) V 77
Эйлар (Eilar R. R.) IV 175
Эйлерс (Eilers I<. L.) II 285; V 175, ] 86
Эйлингсфсльд (Eilingsfeld H.) I 357; V [95
Эймс (Ames S. R.) Ill 91
Эймутис (Eimutis E. С.) V 24
Эйпснорз (Ainsworth С.) II 331, 335, 395,
400; III 370; IV 247
Эйпхорн (Einhorn A.) Ill 124; V 27
Эйсерт (Erscri M. A.) II 47
Эйстерт (Eisiert В.) V 93, 379 491
Эйтель (Eitel D. E.) II 293; V 302
Эйтер (Eiter R.) I 240, 242; II 117, 118;
V 16, 78, 444
Эйхер (Eicher T.) Ill 399, 457
Эйхлер (Eichler S.) 1 101; III 114
Эйш (Eisch J. J.) I 35, 275, 276, 278; II 156
Эк (Eck R. Rl; von) 1 211
Экк (Eck J. C.) HI 109, 114, 275, 276; IV 95
Экхардт (Eckhardt H. J.) II 342
Экхарт (Eckhart E.) V 24
Экштейн (Eckstein F.) V 463
Элад (Elad D.) I 179; III 43, 46; IV 74
Элам (Elam E. U.) HI 197
Элберт (Elbert W.) II 263
Элбе (Elbs К.) 11 97, 99
Эл-Вахаб (El-Wahab M. F. A.) I 137
Элвидж (Elvidge J. A.) I 248
Элдерфильд (Elderfield R. С,) I 421; III 189,
328
Элиан (Elian M.) V, 190
Элике (Elix J. A.) IV 226
Элиот (Eliot C. G.) I 384
Элкик (Elkik E.) V 228, 229
Элке (Elks J.) I 167; II 38, 111; IV 173, 226
Эллегаст (Ellegast R.) II! 370
Эллестед (EHcslead R, В.) II 141
Эллзи (Ellszey S. E.) Ill 408, 412
Эллингбо (Ellingboe E. R.) HI 339
Эллингтон (Ellington P.S.) II 56; IV 20
Эллиот (Elliot D. F.) II 109
Эллиотт (Elliott C. G.) I 384
Эллиотт (Elliott H, W.) IV 137
Эллис (Ellis В.) I 360, 413; IV 183
Эллис (Ellis G, P.) V 26
Эллис (Ellis J. \V.) HI 240; V 383
Эллис (Ellis R. С.) II 301
Эллис (Ellis S, H.) I 193
Эллис (Ellis S. R.) I 28
Эллмап (Ellman G. L.) I 370
Элмор (Elmor D, T.) I 257, 394
Элой (Eloy F.) I 282
Эл-Садр (El-Sadr M. M.) I 137
Элсингер (Els Inger F.) Il 196, 197, 199,
354, 355
Элсом (Elsom L. F.) V 406
Элстон (Elston С. T.) Ill 144, 146
Элькобайзг; (Elkobaisi F, M.) 11 401
Эльнатапов Ю. и. V 276
ЭмДе (Emde H.) ll 367, 370
Эмелеус (Erneleus H, J.) HI 386
Эмерсон (Emerson О. H.) I 211; [1 326
Эмерсон (Emerson M. T.) HI 373
Эмерсон (Emerson 'Г. R.) V 307
Эмерсон (Emerson W. S.) 1 430; 1 1 235,
274; III 114, 166; IV 275
Эммик (Emmick T. L.) HI 145; V 365
Эммонс (Emmons W. D.) I 18, 19, 24, 89,
430, 431, 433, 437; II 262, 312, 348, 351,
395, 400; HI 321, 353. 422 — 426, 431,
437, 441, 443, 468, V 458, 459
Эмптоз (Emptoz G.) 1 366
Эигел (Engel Ch. R.) Il 25; III 14, 18, 124;
IV 257, 238; V 18
Энгел (Engel L. L.) II 193; III 256, 278
Энгслберц (Engclbertz P.) I 141
Энгельхардт (Engelhardt V. A.) 1 291; 11
326; Ilf 263, 318; IV 238
Энгл (Engle R. R.) HI 198, 201; IV 178
Эндерс (Enders L.) V 322
Эндлер (Endler A. S.) II 112; 1V 36
Энз (Fjiz W-) 15' 60,61
Энзелл (En-zell С.) V 389
Эяслин (Erislln P. R.) i 186
Эпплеуайт (Applewhite T. H.) IV 165
Эппльквист (Applecjuist D. E.) I 65; III 263;
IV 259—261
Эптон (Epton R -) I 69
Эпштейн (Epstein .1. W.) V 530
Эпшчейп (Epstein M.) IV 81
Эргун (Erguii S.) I 291
Эренштейн (Ehrenstein M.) II 14; IV 63
Эрлг (Erig J.) IV 248
Эриксон (Erickson К.) V 77
Эриксон (Erickson E. R.) I 438
Эриксон (Erickson B. W.) V 270
Эриксон (Erickson F. В.) 1 100
Эриксон (Erickson R. L.) 1 431
Эриксон (Erickson R. L ) I 135. 167
Эриксон (Erickson R. E.) II 413, 414; HI 6,
10, 241
Эриксон (Erickson R. L.) Ill 183
Эрколи (Ercoli A.) 1 88; III 40; 1V 168
Эрколи (Ercoli R.) I 291
Эрлангер (Erlanger B. F.) IV 80, 81
Эрман (Erman \V. F.) Ill 118, 158. 166; V 80
Эрпе (Erne К.) H 70
Эрнер (Erner \V. E.) HI 316
Эрнест (Ernest I.) Ill 47
Эрреде (Errede L. A.) ] 151, 166
Эртель (Oertel H.) V 18
Эрдтман (Erdfman EE) I 116; II 11;II1II6,
118
Эрхардт (Erhardt F.) II I0r>
Эрхарт (Erhart G.) IV 52. 152
Эрхарт (Erhart O.) Ill 46
Эрхарт (Ehrhart \V. A.) IV 75
Эрхарт (Ehrhart W. H.) V 505
Эрц (Ertz R.) 1 211
Эскламадон (Esclamadon C.) Ill 462
Эсмей (Esmay D. L.) II 141
Эсс (Ess R, J.) Ill 468
Эстль (Astle M. .1.) II 67, 70, 71
Эстрип (Estrin N. F.) V 337, 473
Этард (Elard M. A.) IV 175
Эттлингср (Ettlingen M. G.) Ill 76
Этторре (Ettorre R.) II 388; IV 226
Э'гцемюллер (Etzemtiller J.) V 466
Эффснбергср (Effenberger F,) I 352, 354;
IV 75, 76
Эшбахер ^Aeschbacher R.) Ill 347
Эшби (Ashby E. С.) I 231, 238; Ill 372, 379,
458; V 87, 250
Эшенмозер (Eschenmoser A.) I 80, I08, 167,
307, 351 352; И 197, 199; III 265, 266,
461; IV 183; V 86, 429, 452
Эшерих (Escherich C.) Ill 307
Эшли (Ashley W. С.) IV 36, 209
Эштон (Aschton A. A,) II 326, 327
Ю (Yu R. J.) V 219
Юбедь (Uebcl J- J.) Ill 91
Юбервассер (Ueberwasser H.) II! 457
Юда (Ueda S.) A' 555
Юднс (Yudis M. D.) 1 392; V 494, 510
Юки (Ueki M.) V 5 3, 44?
Юнгер (Junger A,) in 419
lOtio (Ueno Y.) I 85
Юргеле (Jurgrleit W.) V 476
629
Юри (Urry G.) V' 417
Юрч (.lurch G. R., Jr.) V 127
Юуи (Yoon N. M.) I 39; II 204; V 19, 10?„
103
Ягер (Yeger O.) Ill 74, 76, 92, [83, 227, 228,
2417 IV 226
Ягер (Ysieger R-) III 145; V 508
Яги (Vagi K.) Ill 84
Якоб (Jacob T. A.) Ill 183
Якоб (Jacob T. M.) I 427, 428; I
Якоби (Jacoby A. L.) II 141 I 247
Якобс (Jacobs A. M.) I 35
Якобс (Jacobs R. L.) II 100; HI 327, 468
Якобсон (Jakobsen P.) V 311
Якобсон (Jakobson H- J.) I 90, 100; ill 468;
IV 192
Якобсон (Jakobson E. С.) Il 362
Якобсон (Jacobson MJ III 87, 92
Якобсон (Jacobson N,) I 397
Якобсон (Jacobson T.) V 429
Якона (lacona R. N.) I 334
Яке (Yax E.) V э.'О
Ямазаки (Yamazaki H.) Ш 373
Яманака (Yamaiiaka H.) Ill 4(18: V 432, 510
Ямартпно (Jamarlino R. Ij 1 291
Ямашииа (Jamashina I.) II 430
Ян (Yuan С.) IV 262
Ян (Yuan E.) 1 363
Янпгита (Yanagita M.) II 227, 266
Янг (Yang D. D. H.) II 331; IV 22; V4SI
Янг (Yaung D, P.) II] 84
Янг (Young D. E.) V 457
Янг (Young I-l.) V 384
Янг (Young F. G.) Ill 292
Янг (Young G. T.) I 319; Ell 21; IV 160;
V 342, 517
Янг (Уы-nig J. F.) HI 415; IV 158; V 454
Янг (Yonng L. В.) IV 185; V o43
Янг (Yang N, С.) II 144; HO, 344 346
Янг (Young R. J.) II 61; III 224, 240
Янг (Young R. V.) II 357
Янг (Young R. W.) I 435, 436
Янг (Young W. С.) II 54, 303, 319
Янзен (Jansen E. G.) 1 335
Янн (Yaney D.) IV 126
Янке (Jahnke D.) Ill 451
Янн (Jann К.) 1 248
Янннос (Yiannios C. N.) 1 335
Яиоски (Janoski E. J.) V 18
Янот (Janot Д1. M.) V 540
Яновская Л. A. I 378
Янука (Yanuka Y.) I 210; HI 92; V 212, 219
Ярбро (Yarbro C. L.) Ill 291
ЯрДли (Yardly G, V.) V 23'2
Ярдли (Yardley J. P.) I 413; V 198, 199, 384
Я ровен ко H. H. V 195
Яррар (Jarrar A.) II 226
Ярт (Jart А.) и 245
Ясуда (Yasuda K.) Ill 29э, 295
Ятес (Yates P.) I 54, 167; Ц 226
Яунип (Jaiinin R.) IV 30
УКАЗАТЕЛЬ РЕАГЕНТОВ ПО ТИПАМ РЕАКЦИЙ
Автоокисление, /прет-Бутилат кали?!. Сальномин.
Автоокисления катализаторы, трет-Бутилат калия. Гексаметилтриамид фосфористой кис-
лоты. Кобальта (II) ацетат-бромид. Меди(И) нитрат — пиридин.
Адамантана синтез, катализаторы. Алюминия бромид.
Азирины- Хлорамин.
Азлактонов синтез. Гиппуровая кислота.
Акабори реакция. Гидразина сульфат.
Активная метиленовая группа, реактивы. Диметнлацетамида диэтилацеталь. Днметилформа-
мида диэтилацсталь. Циануксусной кислоты трет-бутпловый эфир.
С-Алкилирование. Амид натрия, трет-Бутилат калия. Ди метил медьлитий. Диметнлсульфат.
Диметилсульфоксид. Ди мстил сульфоксида производные (а). 1,3-ДиТиаи. Диэтилсульфат.
Лития диэтиламид. Мстил бромистый. 2-Метилбутилат-2 натрия. Метил хлористый.
Нитрозонпя гексафторфосфат. Тстраметилмоневина. Трнметилоксоиия борфторид. Трн-
метилоксонпя 2,4,6-трп нитробензол сульфон ат. Трифенилмстил натрий. Триэтилоксония
борфторид. Этилат натрия,
N-Алкилирование. Диметнлсульфат. Эти л ди циклогексил а мин. Эти лен диамин.
О-Алкилирование. Диметнлсульфат. Днметилсульфоксид (ДМСО). Пентаэтоксифосфоран.
Серебра борфторид. Уксусного ангидрида ди метил ацеталь.
S-Алкплирование. Трнметилоксония борфторид.
Алкилнитриты. Нитрозил хлористый.
Алкилсульфиты. Тпоннл хлористый -
Алкоголиз нитрилов. л-Толуолсульфокислота.
Алленкарбоновые кислоты. Никеля карбонил.
Алленов синтез. МетиллитиГь
Аллильная конденсация. Никеля карбонил. Титан треххлористый.
Аллильное ацетоксилирование. Свинца тетрааиетат.
Аллильное бензоилирование. Бензойной кислоты шрепг-бутиловый эфир.
зт-Аллильные комплексы хлорида палладия. Ди-,и-хлор-л-аллилдипалладий.
Аллофанаты. Циановая кислота.
Альдегидов защита. Метнлбснзтиазолон-2-гидразоп, хлоргндрат.
Альдозы деградация. 2,4-Дипитрофторбензол (ДНФ).
Альдольная конденсация. Лития диизопропиламид.
Алюминия амальгама. Ртуть хлорная (сулема).
Амальгамирование, Ртуть хлорная (сулема).
Амидирование, Гексаметилтри амид фосфорной кислоты.
Аминирование, Аммония ацетат и формиат, Гндроксиламин-О-сульфокислота, тетракис-
(Диметиламино)-титан. Днметилформамид. Треххлорнстып азот. О-(2,4,6-Триметилбеп-
зол)-гидроксиламин. Хлорамин.
Аминирование восстановительное. Бензиламин.
Аминов к ацетилену присоединение. Кадмия ацетат — цинка ацетат,
Аминокислот выделение из солей. Ионообменные смолы. Пиридин. Серебра окись.
Аминокислотных последовательностей анализ. Малонового диальдегида тетраэтилацеталь.
Аминокислот эфиры, Тиопил хлористый.
Амины затрудненные. S, 6-Ди-трот-бутил пиридин.
Ангидридов образование. Тионнл хлористый.
Ангидриды смешанные. Три фтор уксусный ангидрид.
Анионообменпики. Тетрагеитиламмония хлорид.
Аннелирование. 2,3-Диметил-2-бутилборан. 3,5- Ди мети л-4-хлорметилизоксазол, 1,3-Дихл ор-
бутен-2. Метил вини л кетон. Щранс-Пентеи-З-он-2. Пирролидин.
Антиоксидант, Олово хлористое (см. также 1,2-Нафтохинон).
Арбузова реакция. ДнэтнлКарбэтоксифосфонат.
Арилы бромистые АгОН, Три мстилборат-
Арндта — Эйстерта реакция, Диазометан,
Ароматизация (см. также Дегидрирование). 2.3-Дихлор-5,6-днцнан-1,4-бензохннон.
Ароматическое замещение. Меди(П) нитрат — уксусный ангидрид. Ортомуравьииой кислоты
трпэтиловьгй эфир. Хлортиоциан.
Ацетилена реакции присоединения. Алюминия хлорид. Гексафторбутйн-2. Иода азид.
1-Иодгептафторпропаи. Симмонса — Смита реагент. Тиоуксусная кислота. Цинка иодид
(катализатор).
Ацетиленов гидратация. Ртути окись (желтая, красная). (щс-(л-Толуолсульфамид)-ртуть.
Ацетиленов гидрокарбоксилирование. Никеля карбонил.
Ацетиленов связывание. н-Бутиллитий. Меди закись. Медь хлористая. Медь хлористая,
комплекс с хлористым аммонием.
Ацетиленов три- и тетрамеризация. бпс-(БенЗоН1Прил)-1|алладий(И)-хлорид. Тиган четырех-
хлористый. тетр а кис-(Трех хлор истый фосфор)-и икель(О). бис-(Т рифенилфосфнн)-никель-
дикарбоннл.
631
Ацетилирование. А цели л те кеа фтор анти мои ат. N-Ацетил имидазол, 2- и З-Ацетоксипириднны.
N-Ацстоксифтальимцд. Бора трифгорид. Бор;, трифторида эфират. Катализаторы (см.
Уксусный ангидрид). Кетен. Магнии. Пиридин. Тетпаэтиламмоиця ацетат. и-Толуолеуль-
фок нс лота. Три-н-гексилэтмламмоиия гидроокись. З.-З.б-Тргтнзопропгглбсттчолсулырохло-
рид. Трифсиплметиляатрпй. Уксусная кислота. Уксусной кислоты натриевая соль.
Уксусной кислоты и-нигрофениловый эфир. Уксусной кислоты фениловый эфир. Уксусной
кислоты хлорангндрид. Увсуснофосфорнып ангидрид. Уксусный ангидрид. Хлорная кис-
лота. Пинка хлорид.
Ацстоацстилирование. Ацетоуксусной кислоты фтора и гидрид. Дикстеп. Ртутц(И) ацетат.
Ацетонидов образование. Ацетон. 2,2-Д|)метокси11ропап. 2,2-Диэтоксипропан. Ионообменные
смолы. Меди(П) сульфат.
Ацетоксилирование. Ртути ацетат. Свинца ацетат. Свинца тетраацетат.
Ацстоэтилирование. Метил ни и ил кетон.
Ацидолиз. Муравьиная кислота.
Ацилирование (см. также Ацетилирование, карбэтокеплированис). Ацилы фтористые. Бензо-
плнзотиоциапат (см. Гиппуровая кислота). Диизопропнлнатрипамид. Магний. Мстансуль-
фокислоты ангидрид. Мстаисульфохлорпд. Натрия гидрид. Пиридин. Трифторуксусный
ангидрид. Хлоруксуеной кислоты ангидрид, Хлоруксусной кислоты хлорннгидрид.
N-1 - Циклогексен ил морфолин.
Ацилирование, амиды. Этилат таллия.
Ацилирование аналитическое. Стеариновой кислоты ангидрид.
Ацилирование, кетоны. Натрия гидрид.
Ацилирование, реакция Фриделя — Крафтса. Метилен хлористый.
Ацилирование, третичные спирты. Кальция гидрид.
Ацилоиновая конденсация. Трсгметилхлорсилан.
Байера — Виллигера реакция. Калия персульфат. Перекись водорода. лмХлорнадбензойная
кислота.
Барга реакция. .Медь хлористая.
Белки. Конце в ы х групп анализ: а-Нафтил изотио циан ат. Фенилизотиоцианат. Меркаптогрупп
введение: S-Ацстплмеркаптояитарной кислоты ангидрид. Модифицирование: 1-Ннтро-
гуаиил-З,.j-дпметнлпиразол. Определение SH-группы: о-Иодозобштзойная кислота. Селек-
тивная реакция с триптофановым остатком: 2-Окси-5-нптробензилбромиД. Фракциониро-
вание; Иоииобменпые смолы.
Бензилирование. Амид калия. Диметилсульфокспд. Натрия гидроокись.
Борорганических соединений аддукты-. Дибромуксусноп кислоты этиловый эфир.
Брауна реакция. Бромцпан. Пиперидин. Тиопил хлористый. Фосфор трехбромистый.
Бромалкилироваиие. Алюминия бромид.
Бромгидрииов получение. N-Бромсукцинцмцд (N5C).
Бромирование. Алюминия бромид. Алюминия хлорид. Бензоила перекись. Бора трибромид.
Бромистоводородной кислоты удаление (связывание): ацетамид, калия хлорат. N-Бром-
ка продактам. N- Бромсукцинимпд
Бромтрифторметаи. Бромтрихлорметан, п-Бутиламин. 1.3-Дибром-5,5-диметилгндаитоин,
Дибромизокиануровая кислота. Диокеана дибромид. Железо. Иод. Иода мопобромид.
Медь бромная. Натрия гипобромит. Пиридин. Пиридина пербромид. Пиридиния бромгид-
рата пербромид. Ртути ацетат. Сера. Сера однохлориста я. Серебра сульфат. Тетрахлор-
1,2-дибромэтап. (й-Трнбромацстофспон. Трпметиламмгншя а рпбромид. Трифенилфосфни-
дябромид.Трифторацстилгипогалогепиты. Трихлормстапсульфобромид. Уксусной кислоты
натриевая соль. Фенилтриметиламмопия пербромпд. Фосфор треххлористый. Хлорбром.
Бромкарбонилирование. Оксалилбромид.
Бромноватистая кислота. Хлорная кислота.
Бромфторирование. Серебра фторид.
Бэнфорда — Стивенса реакция. «-Толуол сульфонил гидразин.
Бюхнера реакция. Диазоуксуспый эфир.
Винса раствор. Иода монохлорид.
Вильгеродта реакция. Морфолин. Сера.
Вильсмейера реакция. Азодпкарбоиовой кислоты диэтнлевый эфир.
Вильямсона синтез. Этилат натрия.
Випильнос замещение. N-Бромсукципимид.
Внттига реакция. Катализатор: Бензойная кислота. Основания; mpcm-Бутилат калия, н-
Бутиллптиц (см. «1реги-Бу1илат калия). Метилат натрия. Натрия гидрид — диметплсуль-
фоцсид том. Диметилсульфоксида производные (а)1. <5«с-(Триметнлсилнл) — Натрипамид.
Этилат лития. Этилат натрия (см. ырсиг-Бущлат калия). Реагенты; Гексаметплтриамид
фосфористой кислоты. 1,5-Диазабицикло-[4.3,0]-нонсн-5. Дифенилсульфонийизопроннлид.
и-Дифснплфосфинбензойная кислота- Карбыетоксимстилептрифенилфосфоран. 2-Метил-
бутилат-2 натрия. Метиленмагипйбромпд (хлорид). Метилентрпфенплфосфорац. Метокси-
мстнлентрифенилфосфоран. Симмонса — Смита реагент. Циклоиропилтрифспплфосфоний-
бромид. Этилена окись. Фосфонатная модификация: Диэтплцнанметилфосфоцат. Тстра-
этплсукцинилфосфоиат. 3 риэтилфосфпн. Триэтолфосфит, Диэтилкарбэтокснметилфосфо-
нат.
Внттига типа реакция. Диэтилфосфпт.
Включения комплексы. Мочсипг!а. Тиомочсвипа.
Водорода акцептор. Олеиновая кислота.
Воды определение. Фишера реактив.
Воды акцептор. Титан четыреххлористый.
Вольфа — Кижиера восстановление. Гидразин.
632
Восстановительное ацетилирование. Тетр а мети л аммония бромид. ТрпэтилаМин.
Восстановительное детозилнрование. Натрия амальгама.
Восстановительное расщепление 2,4-дипитрофеиилгидразонов. Хрома(П) хлорид.
Восстановление бимолекулярное. Магнии — ртуть хлорная.
Восстановление, реактивы. Алкиламипбораны. Алюминия амальгама. Алюминия гидрид.
Антрацеп-9,10-диимия. треш-Бутилат алюминия. н-Бутиллитии — пиридин. Гексамстил-
триа.мид фосфористой кислоты. Гидразин. Гидразин — металлические катализаторы.
Гидроксиламин. Днборап. Диборан — бора трнфторид. Диборан — натрия боргидрнд.
Диизобутилалюмпппйгндрид. Дцизопивокамфнлборан. Ди имид. Дикобалштоктакарбопил.
Дпметпла.миноборан. ДЗ-Днметплбу.)ол-2-бораи. бнг-(1,2-Диметилпропнл-))-боран. Ди-
метилсульфид. Димстплфосфпт. Дифенилсила!). Диэтилфосфпт. )Келеза(П) сульфат.
Железо- Изоборпилднхлоралюмннат. Изопропил ат алюминия. Иодистоводородиая кис-
'лота. Иридий треххлорипыи (сы. Хлорнридиевая кислота). Кальцийгексампи. Кальций —
'жидкий аммиак. Калинин боргпдрид. Литий — алкиламии. Литий — аммиак. Литий —
гексаметилтриамид фосфорной кислоты. Литий — дифенил. Литий — N-метиланплин'
Литии — и-лропиламии. Литий — этиленднамнн. Лития алюмогидрид. Лития алгомогид-
рид — алюминия хлорид. Лития алюмогидрид — пиридин. Лития боргидрпд. Лития
лфыс'(П1ре/н-бутокси')-алюмогидрид. Лития гидрид. Лития Диизобутил метил алюмогидрид.
Лития диэтоксиалюмог’идрпд. Лития моноцнанборгпдрид. Лития триметоксиалюмогидрид.
Лития триэтоксиалюмогидрид. Магний — изогцюпанол. Магния амальгама. /Меди хромит.
Медь — аскорбиновая кислота. Метилмагнппбромпд. .Муравьиная кислота. Муравьиной
Кислоты триметиламмоппевая соль. Натрий аммиак. Натрий — аммиак — этанол.
Натрий алюмогидрид. Натрия амальгама. Натрия бисульфит. Натрия боргпдрид. Натрия
боргндрид — ВГ3 (см, ДДХ). Натрия гидразид. Натрия гидрид. Натрия гидросульфат.
Натрия гидросульфит. Натрия иодид. Натрия сульфид. Натрия теллурид. Натрия тиосуль-
фат. Никель-алюминиевый сплав. Олово. Олово бромистое. Олово — НВг. Олово хлори-
стое. Пиридинборац. Пиридин — «-бутиллнтий. Свинец. Тетрамети л аммония боргпдрид.
Тиогликолевая кислота. Титан четырех хлор истый. Три-н-бутилстаннан. Триизобутилалю-
миний. Трцметпламипоборац. Трпметилсилан (непрямое). Три метил фосфит (см. Азота
четырехокись). Трпмстоксиборгидридиатрий. Трпфенплстаниан. трыс-(Трцфеяилфосфин)-
родиихлорид. Триэтилепгликоль (см. Цинк). Триэтилфосфит. 1’риЭТоксналюМогндрид-
натрий. Фелинга жидкость. Фен ил гидразин. Формальдегид. Фосфин. Фосфония иодид.
Фосфора дниодид. Фосфор — иодистоводородиая кислота. Фосфор красный. Фосфорно-
ватистая кислота. X л ори р и ди ев а я кислота. Хлор иридиевая кислота — из о про па но л. Хро-
ма(Ц) ацетат. Хрома(П) сульфат. Хрома(П) хлорид. Церия(Ш) гидроокись. Циклогексилат
алюминия. Цинк. Цинка гидросульфит. Цинк амальгамированный. Цинк-мсдная пара. Эти-
лен-1 , 2-бис-[амипоборан].
Восстановления методы. Бёрча восстановление. Бимолекулярное. Магний — ртуть хлор-
ная. Буво— Блана восстановление: Фенол. Вольфа — Кижнера, Хуанг— Минлона вос-
становление: трет-Бу гил ат калия — диметил сульфоксид. Гидразин. Триэтаноламин.
Восстановительное ацетилирование: Уксусный ангидрид. Восстановительное дебромиро-
вание: Ы,Ц-Диметиланилин. Восстановительное метилирование: Формальдегид. Клемен-
сена — Мартина восстановление: Ртуть хлорная. Цинк амальгамированный. Меервейна —
Понндорфа восстановление: трегп-Бутилат алюминия. Изопропилат алюминия. Относи-
тельная реакционная способность: Толленса реактив. Розенмунда реакция: Лития диэток-
сиалюмогидрид. Тстраметилтиомочевина. Стереоспецифичность или S: Лития алюмо-
гидрида и 3-О-1,2-О-цш<логексплпдсн-а-Ц-глюкофуранозы комплекс. Фенолы: Диэтнл-
фосфит. Этилентиокеталя получение: Ренея катализаторы никелевые. Этилендитйол.
Вспенивания устранение, Октанол-2.
Вюрца типа конденсация. Свинец пирофорный. Тетрафенилэтилен.
Галогенов обмен. Бора трибромид. Сера четырехфтористая.
Галогенов получение. Перекись водорода.
Галогенгидринирование. Ацетнлгипобромит. N-Бромацетамид. N-Бромсукцинамид. трет-
Бутилгипобромит.
Галооксизамещение. Натрия гипохлорит.
Галоформное окисление. Натрия гипогалогепиты.
Гаттермана альдегидов синтез, сияя-Триазин. Цианистый водород. Цинка хлорид.
Гаттермана — Коха реакция. Алюминия хлорид. Медь хлористая.
Гелля — Фольгарда — Зелинского реакция. Фосфор красный. Фосфор трехбромистый.
Геша реакция. Цинка хлорид.
Гидратация ацетиленов. Ионообменные смолы. Ртути ацетат.
Гидратация олефинов. Ртутп(]1) ацетат.
Гидридного иона отщепление. Трифеиилметилперхлорат.
Гидрирование, стереоспецифичность. Ренея катализатор никелевый.
Гидрирования катализаторы. Адкинса катализатор. Иридий. Иридий — BaSO,( или СаСО3.
Иридия тетра хлорид — триэтилфосфит. Калия гидрид. Линдлара катализатор (см. также
Малеиновый диальдегид. Никеля борид. Этокснацетпленцд лития). Лития алюмогидрид.
Меди(П) хромит. Олово хлористое. Палладиевые катализаторы. Палладия гидроокись.
Палладия гидроокись на угле. Платиновые катализаторы. Ренея катализатор никечсный.
Ренея катализаторы. Родиевые катализаторы. Трибутилборан. блюфТрнфецилфосфии)-
ириднптригндрид. /71рис-(Трнфенилфосфин)-родийхлорид. Трифторуксусная кислота.
Хлорная кислота (промотор).
Гидрирования промотор, Бройистоиодородная кислота.
Гидроалюминирование алкинов. Диизобутил алюмин ни гидрид.
Гидроборирование. Акролеин. Анизол (растворитель). 9-Борабццикло-[3,3,1]-цопап. Диборан.
' 2,3-Д п метил бутил-2-боран б«с-( 1,2-Диметилпропи л-1)-боран. ТриизоНинокамфилбораи.
633
Гидрогенолиз, Адкинса катализатор. Палладиевый катализатор. Палладий. Ренея панель.
Родин. Триэтн.чамни.
Гидро карбоксилирование. Никеля карбокнл.
Гидроксила защита. ₽-Бет|.зоплпро1шощ>вая кислота. 4-М.етокси-5,6-Дгггцдро-2Н-пирап. Ти-
тл и новой кислоты хлорангидрид. Хлоругольной кислоты нзобутиловый эфир. Хлоруголь-
ной кислоты л-нптрофепиловый эфир.
Гидроксилирование. Борная кислота. Калия перманганат. Калия персульфат.Мононадянтар-
ная кислота. Надбензойная кислота. Надуксусная кислота. Осмия четырехокись. Осмия
четырехокись — бария хлорат. Осмия четырехокись — перекись водорода. Перекись
водорода. Перекись нодорода — селена двуокись. Свинца тетра-(трнфторацетат). Селена
двуокись. Серебра ацетат — иод. Серебра хлорат. Трифторпадуксуспая кислота. Уксус-
ной кислоты серебряная соль.
Гидролиз. AjuoMii и и я окись. Бромпстоводородная кислота, трет-Бутил ат калия. Винион кис-
лоты натрий-калиевая соль, тетрагидрат. Диметилсульфоксид. Железа пентакарбонил
ионообменные смолы. Калия персульфат. Левулиновая кислота. Магния сульфат. Медн(П)
сульфат. Морфолин. Нитрозил хлористый. Пировиноградная кислота (обменная реакция).
Полифосфорная кислота. Трифторуксусной кислоты серебряная соль (емг-дибромиды).
Фосфорная кислота (85%-пая) - уксусная кислота (1 : 1).
Гидроперекиси. Перекись водорода.
Гидроформилирование. ДикобальтоктаКпрбоипл. Кобальта гидрокарбоиил. трйсДТрифенил-
фОСф1П1)-роДПЙХЛОр|гД.
Гидрохлорирование. Хлористый Водород.
Гидроцнанярованпе. Диэтилалюминийцпанид. Триэтилалюмнний. Триэтилалюмцний —
цианистый водород.
Глицидных эфиров конденсация. КобалЬта(П) хлорид. Хлор уксус ной кислоты щрещ-бутило-
вый эфир.
Глутарового альдегида предшественник. 2-Этоксц-1,2-дигидропнран.
Гомологизация. Акролеин. Бромуксусной Кислоты этиловый эфир. Дназоуксусной кислоты
этиловый эфир. .Медь бромистая — диазометаи. Метил вин ил кетон. Триметнлфосфит,
Углерода окись. Фенилтиометиллитий.
Гомоциклических колец замыкание. Амид натрия.
Гофмана расщепление, модифицированное. Фепиллптий.
Гриньяра реакции катализаторы. Кобальта(И) хлорид, МеДп(И) ацетат. Медь бромистая.
Медь хлористая.
Гриньяра реакция. Аппаратура. Анализ RMgX. Вннплгалогениды. Газообразные галоидные
алкилы. Гидролиз. Способ «вовлечения». Сорастворители, «Обратная реакция» Грнпьяра.
] Примеры.
Гриньяра реакция, другие примеры. Акролеина Диэтилацеталь. щрещ-Бугила гидроперекись,
и-Бутил борат. Гриньяра реактивы. Дибромдифтормета п. Дибромэтай («вовлечение»).
Диэтплсульфат. (-Иодгеитафторпропан. МеТиленмагцийбромид. Метилмедь — три-н-бу-
тнлфосфин, комплекс. Муравьиной кислоты этиловый эфир. Надбензойной кислоты
шрвж-бутилопый эфир. Окись этилена. Ортомуравьииой кислоты триэтиловый эфир. Сера,
Триыетилсна окись. бцс-(Трпфе11Илфосфип)-ппкельдихлорид. Уксусиомуравьппьгй ангид-
рид. Хлор угольной кислоты этиловый эфир. Этинил Магнийбромид. Этоксиметилсианилнн.
Эфиров сложных синтез (см. З-Дпметиламииоиропиламии). См. также Дихлор фор мокси м.
Гриньяровского типа реакция. ВиииЛлитий.
Дакица реакция. Перекись водорода.
Даффа реакция. Гекса метилен Тетр амии.
Двойной связи миграция, Днметилсульфоксид — трет -бутилат калия.
Дебенаоилирование бензоиламинов. Трпэтилоксония борфторид.
Дебромирование. Дифенилтеллурнд. Тиомочевила. Триметнлфосфит. Трифенилфосфин.
Хромд(Ц) сульфат. Цинк-медная пара.
Дегалогенгидринирование, Цинк, пыль.
Дегалогенирование. Гидразин — палладий. N, N-Диметиланилип. Днметилсульфоксид—
NaH. Дииатрийфенантрен. Железа иеитакарбоннл. Литий — трет-бутанол — тетрагид-
рофуран. Магний — под — эфир. МеДпая пудра — бензойная кислота. Метпллитпй. Нат-
рий — щрещ-бутанол — тетрагпдрофурап. Натрия иодид. Натрия теллурид. Олово. Три-
/'-бутнлетаннаи. Уксусной кислоты натриевая соль. Хрома(П) хлорид. Цинк, пыль. Цинк,
пыль — этанол (см. Аллен, получение. Гексафторбутпи-Д получение).
Дегидратацищщая конденсация. Калия бисульфат.
Дегидратация. Алюминия окись для дегидратации спиртов (см. также Дигпдропираи. полу-
чение). Алюминия окись — пиридин — разбавитель (песок). Бора трпфторпд. Борная
кислота. N-Бромацетамнд — пиридин — SCK. Бромистоводородпая кислота. Днкетен.
Диметилсульфоксид. Диметнлформамид — тпонилхлориД. Д ифенплкарбодиимид. Ди-
цнклогексплкарбодинмнд, N. N-Диэтнл-1-пропинилампн, Жирара реактив. Иод. Калия
бисульфат. Мез ил хлор ид — сернистый ангидрид. Мстил кетена днэтилацеталь. Метил-
х.чорсульфит. Метокеиацстилеп. Нафталинф-сульфокиелота. Пиридин. Тнонпл хлори-
стый. п-Толуолсульфокислота. д-Толуолсульфохлорид. Тория двуокись. Трцфснцлфос-
фнндибромид. Фенилнзоцианаг. Феннлцнанат. Фло’риснл. Фосген. Фосфора хлорокись.
Фосфора хлорокись — пиридин. Фосфора хлорокись — фосфорная кислота — фосфорный
ангидрид. Фосфорный ангидрид. Фосфорный ангидрид — трет-амии. Фталевый ангидрид.
Щавелевая кислота. Этиленхлорфосфит.
Дегидрирование. Адкинса катализатор. Азодикарбоновой кислоты диэтцловый эфир. 1,4-
Бепзохинон. N-Бромсукцинпмид. шрет-Бутилат калии. 1,3-Дибром-ё,5-ДпметиЛгпданто-
ип. К.Ц-Дифенил-М'-пикрплгидразпл (радикал). 2,3-ДиХЛор-.5,б-ДИЦиан-1,4-бензохннои.
G34
N-Л н тип этиле иди а мни. Марганца двуокись. Меди(П) хромиг. Иадбеизойиая кислота.
Натрия боргидрид. Натрия гнпобромнт. Олеиновая кислота. Палладии. Пиридиния бром-
гидрата иербромид. Ренея катализаторы никелевые. Ртути аистят. Селей. Селена двуокись.
Сера (см. 1,2-Нафтойный ангидрид, получение). Тетрацианэгилеи. Тиопил хлористый.
Трифенил метилперхлорат, и- Хлоранил.
Дегидрирование с перегруппировкой. /идет-Бутилат калия.
Дегидробензола предшественники. 1-Амипобеизотриазол (см. 1-Хлор бензотиазол). о-БснЗоЛ-
диазои nil карбоксил ат. 1,2,3-Ееизтиадиазол-1,1 -диоксид, о- Бромиодбеизол. Дифснилиодо-
ний-2-карбоксилат (моногидрат). о-Фторбромбензол.
Дегидробензола присоединение. Фен илазид.
Дегидробензол, улавливающие реагенты. 1,3-Дифеи ил изобензофуран. 2.5-бис-(п-Метоксифе-
нил)-3,4-дифенилц11клопентадиенон. Тетрафеиилциклопентадиспон.
Дегидрогалогенирование. Алюминия окись (см. Сера четырехфто ристая). Алюминия окись —
калия гидроокись. Амид калия. Амид натрия. Бензгштрнметиламмониймезитоат. mpei>i-
Бутиламин. щрт-Бутнлат калия. 2-Бутилцпклогексилач натрия, 1'ексаметилтриамид фос-
форной кислоты. oipem-Гситилат калия. 1_.о-Дпазабицинло-[3,4,0]-но1гсп-5. 1,4-Диазабп-
цикло-[2,2,21-октЗН. 1,5-Диазабци,икло-[о,4,0]-ундецсн-5. Дн метил а ми потримети л стан-
нан. N,П-ДиМетиланилип (ем. также Этокспацетилен, получение). Диметнлсульфоксид.
Ди метил сульфоксид — трет-б утилит калия. Дп метил сульфоксид — натрия бикарбонат.
Диметилформамнд. 2,4-Дииитрофенилгидразин. Изопропнлат натрия. Ионообменные смо-
лы. Калия фторид. Кальция карбонат. КОН. раствор и метаноле (см. также Димстилфор-
мамид). си.ши-Коллидин. Литий. Лития ди цикло гексил амид. Лития карбонат. Лития
карбонат — лития бромид. Лития хлорид. Магния окись. Натрия бикарбонат (см. Натрий
иодистый). Натрия гидрид. Натрия иодид — 1,2-диметоКсиэтан (см. Тетрахлорциклопеи-
таДиеион. получение). Пиридин (см. Нитрозил хлористый). Родии (3%) на окиси алюми-
ния. Серебра нитрат. Серебра окись. Серебра фторид. Тетра'лпламмония хлорид. Три-н-бу-
тнламин. Триметиламнн (см. Бора трихлорид). Трпмстнлфосфит. Трпэтилампн (см. Сер-
нистый ангидрид). Угольной кислоты этилового эфира гидразид. Уксусной кислоты натри-
евая соль — ацетонитрил (см. Тстрахлорциклоиентадиенон. получение). N-Фсиплморфо-
лин. Хинолил. Цезия фторид. Этилат натрия (см. 1-Этоксибутсн-1-ин-3). Эти лди изо про пи-
ла ми и - Эти л ди Ни кл ог? ксн л а м и и.
Дегидротозилирование. трет-Бутилат калия.
Дегидроциклизация. Натрия алюмохлорид.
Дезалкилирование шре/н-аминов. Хлоругольная кислота, фениловый эфир.
Дезалкилирование фенольных эфиров. Натрия иодид.
Дезаминирование. Азота четырехокись. Арилдиазония гексафторфосфаты. Арилдиазония
теграгалогеибораты. Гидроксил амин-О-сульфокислота. Днфторамип. Нитрозил хлори-
стый. З-Нитро-М-пичрозокарбазол. Тстраметилмочсвина. Фосфориоватистая кислота.
Дез ацет пл про ванне. Лития алюмогидрид. Метиллитий. Трцэтилоксоиия борфторид.
Дезацетоксилированне. Кальций — жидкий аммиак. Хрома(П) хлорид.
Дезодоранты. Гиамииьг.
Дезоксигенирование. Гецсаметцлтриамид фосфорной кислоты. 9-Дпазофлуорен. 2,4-ДцНитро-
фторбензол. Дпэтилфосфит. Диэтилхлорфосфит. Натрия боргидрид. Сернистый ангидрид.
Грп-д-бутилфосфип. ТрифепиЛфосфин. Триэтилфосфнт. 2-Феиил-3-метил-2-фосфа-1,3-
оксазолпдин. Фспнл-(трнгалогенметил)-ртуть. 1-Фепил-й-хлортстразол. Фосфор треххло-
ристый.
Декарбоксилирование. Бензойный ангидрид. N-Бромсукцпнимпд. wpent-Б ути л а гидропере-
кись. трещ-БутилгипоноДИт. М.М-Дпметиланилин. Диметилсульфоксид. N,Х!-Диметил-п
толуидин (см. Калия перманганат, ссылка 32). Железо. Калия фторид. Лития иодид
безводный. лДдп(П) карбонат основной. Л')еди(П) хромат. Медные соли. Медный порошок.
Натрия гипохлорита раствор. Свинца двуокись. Свинца тетраацеcar. Хинолин.
Декарбоксилирование окислительное. Пиридина М-окись. Свинца двуокись. Свинца тетрааце-
тат.
Декарбоинлирование. Палладии. Стекло (см. Щавелевой кислоты Лнэтиловый эфир). р-Толу-
олсульфохлорид. шрисЦТрнфенплфосфин)-родий хлорид. г5иг,-(Трифенилфосфпн)-хлоркар-
бонплроднй. Хлорсульфоновая кислота.
Декарбэтоксилпрование. Натрия цианид — дпметилсульфоксид.
Делепипа реакция. Гексаметилентетрамин.
Демеркурировапие. Натрия боргидрид [см. Ртутц(П) ацетат].
Деметилирование. Бора трихлорид. Метнлмагнийподид. Свинца тетраацетат. Тиофенолят
натрия. Фосфор красный. Хромовый ангидрид.
Десульфуризация. Алюминия амальгама) Гсксаэтцятриамид фосфористой кислоты. Литий-
алкнламинное восстановление. Метил иодистый. Никеля борид. Никеля перекись. Ренея
катализаторы кобальтовые. Ренея катализаторы никелевые. Трпфспилфосфии. Триэтил-
фосфит.
Дехлорирование. Калия гидроокись — ацетон. Магний (см. Тетрахлорфуран, получение).
Магний — под — эфир. й-Толуолсульфонилгилразид. Трпизопропилфосфит. Триэтилфос-
фит.
Дехлорирование восстановцте.ЧЕ.пое. Магния окись.
Диазирины — диазиридины. ]’идроксила.мин-О-сульфокислота.
а-Диазокетоны. Хлорамин.
Диазония соли. Азота четырехокись. Диазония тетрафторбораты. Ннтрозилсерная кислота.
Диазосоединения. /1-Тплуолсульфонилазид.
Диазотирование. Изоамилшпрпт. Изоамилнитрит — трифторуксусная кислота. Мочевина.
Натрия интриг — трифторуксусная кислота — ДМСО. Сульфаминовая кислота.
Диенов присоединение. Родия трпхлорнд.
1,5-Диены из аллиловых спиртов. Титан треххлористый.
Диены несопряженные. ] ,4-Нептадисн.
635
Диимида предшественники. Азодикарбоновой кислоты дикалиевая соль. Гидразин. Гцдро-
ксп.аампгнО-сульфокислота. Хлоруксусной кислоты гидразида хлоргндрат.
а-Днкетопа аддукт. Триэтилфосфп г.
Дикмана циклизация, трет-Бутилат калия. Диметилсульфоксид. Этилат калия.
Днльса - Альдера диенофилы. Азодикарбоновой кислоты ди-гнрет-бутнлоиый эфир. Азодп-
карбо:!оио1г кислоты дпэтпловый эфир. Акролеин [см. 1 -(о-Иитрофенил)-бутадиен 1,3].
Аллиловый спирт (см. Литий). Ацетцлендикарбоповая кислота. Ацетилепдикарбоновой
кислоты ди метиловый эфир. Лцетплендикарбоновой кислоты диэтплорып эфир. а-Ацетокси-
пнтрил. 1,4-Бензохинон (см. также 1,4-Мафтохинон, получение). Гексафторбутии-2.
транс-1,2-Дибензоил этил он. Дифенил ацетилен. Дихлорвинпленкарбонат. Ди хлорке'1 ей.
Диинанацетилен. Малеиновый ангидрид (см. Пиклопеитадиен и Дильса — Альдера
реакция, растворители). Метилвинилкетоп, Метиленуреган (см. Метилендиуретан).
4-Метил -1,2,4-триазолн пдцоп-3,5. Нафтацен-9,10,1 1,12-дикиrioii 1-4- Нафтохицон. Тетра-
ЦНИИЭТИЛСИ. га-Фенилмаленпанил. Х-Фецилимид азодикарбоповой кислоты. N-Фенндма-
лепнпмид. Фталазиндиоп-1,4. 1,4-ЭпдоксоЛ,4-дигпдропафталцн. Этилен (см. б,й-Дпмето-
кси-1,2,3,4-тетрахлорциклопентадиен).
Дильса — Альдера диены. [-Ацстоксибутадиен. Бензол. Бутадиен. Гексахлорцпклопентади-
ен. транс-транс-1,4-Ди ацетоксибутадиен. 2,3-ДиМсти л бутадиен. 214-Диметил-1,3-пелта-
диен (см. Азодикарбононой кислоты диэтиловып эфир). 6,6-Диметилфульнен (см. а-Ацето-
кспакрилонитрил). 5, и-Ди метокси-1,2.3.4-тетра хлорцикло пента диен. транс-транс-1,4-
Дифенилбутадиен. 2,3-Дпфенплбутадиен. 1,3-Д ифепнлизобензофуран (см. также трет-
Бутилат калия). чнс-7,8-Дпхлорбг1ЦИ1<ло44.2,0.]-октадиен-2,-1 (см. рис-3,4-Дихлорцикло-
бутен). Изобензофуран. 2,а-бцс-(л-Метоксифенил)-3,4-дифенилциклопептадиепоп. 1-(о-
Нитрофенил)-бутадиен-1,3. Оксепиц (см. 1.3-Диазабиццкло-[3.4.0]-нонен-3). транс-2,4-
Пентадиеновой кислотьт метиловый эфир. Пипсрнлен. а-Пирон (см. также Метилвинилке-
тон ). Стероидные А1' ’ ’’-диены (см. 4-Феиил-1,2,4-триа.золпндпон-3.5). ТетрафенплцнКло-
пенгадпенон. Тетрахлорфуран. Тетрахлорциклопентадпспоп. Тетрахлорциклопентадие-
иопа этилен кета,>1Ь. Фенплцпклоп- Циклопептадпеп. Циклопснтадиена кетали. Ццклоок-
татстраен (см. 4-Фейил-1,2.4-трнззолиндпоп-3,3).
Дильса — Альдера катализатор. Алюминия хлорид.
Димеризация. Диенов: Алюминия хлорид — пиридин. Иодная кислота. б«с-( Кобальт гетра-
карбон и л)-цин к. Дптий — нафталин. Палладия ацетат. Родия три хлорид. Дифенилацети-
ленов: Алюминия бромид. Карбодпимидов: Тетрафторборная кислота.
Димеризация окислительная. Иодная кислота. Литий — нафталин. Палладия ацетат,
цис-Диолы. Защита: Фенилборная кислота.
Диспропорционирование. На грин дисульфид. Ренея катализаторы никелевые.
Дифторамшгирование. Тетрафторгидразин
гел-г-Дихлориды. о-Фен и леи ди окси фосфортри хлор ид.
Енаминов образование. тмрак/,'с-(,Димст11ламино)-титаи. Кальция хлорид. Молекулярные
сита. Морфолин, п-Толуолсульфокислота.
Енаминов присоединение. Трихлоруксуспаи кислота.
Егголацстилировние. Изопропенилаистат. Натрия гидрид. Сульфоуксусная кислота. м-Толу-
олсульфокнслота. Хлорная кислота.
Егюлов этерификация, 2,2-Диметокси пропан. Ортомуравьиной кислоты три этиловый эфир,
га-Толуолсульфокислота.
Замещения реакции. Алкилциаппды. Алюминия иодид. Ацетиленид лития — этилендиамин.
Бснзнлтриметпламмонпйциапид. Бензойной кислоты натриевая соль. Бензолсульфонат
натрия. Бора трифторида эфират. Бромистоводородная кислота. Бромистый водород.
Ге кс а метил ентр и а мид фосфорной Кислоты. Димстилсульфоксид. ДпЭтил-(!,2.2-трифтор-2-
хлорэтил)-амигь N,N-Диэтил-1,2,2-тр«хлорвиниламин. Иод. Ионообменные смолы. Калия
гндросульфид. Калия тиоцианат. Калия фторид. Лития бромид. Магния бромид. Меди
закись. Медь хлористая. Метилат натрия. Натрия дисульфид. Натрия иодид. Натрия
сульфид. Пиридин. Пиридина хлоргидрат. Полифосфорная кислота. Ртути ацетат. Свинца
ацетат. Серебра карбонат. Серебра нитрит. Серебра цианид. Тетраметиламмония ацетат.
Тетрацианэтилен. Тетраэтпламмония ацетат. Тцопил бромистый. Тионил хлористый.
Тиоуксусная кислота. Тноуксусиои кислоты калиевая соль. Тиофен олят натрия. Тиоциа-
нат натрия. Трпфенилфосфиндибромнд. Трпфеицлфосфит. Трифенилфосфитадибромид.
Трифеиплфосфнта иодметилат. Три хлор ацетонитрил. Уксусной кислоты серебряная соль.
Фенилфосфоновой кислоты Дихл оран гидрид (АгОН->АгС1). Фосфора хлорокись. Фосфор
красный. Фосфорный ангидрид — фосфорная кислота — К1. Фосфор пятибромистый.
Фосфор пячихлористый. Фосфор трехбромпстый. Пипка хлорид.
Зандмейера реакция. Медь бромистая. .Медь хлористая. Медь хлорная. Азота закись. Натрия
нитрит.
Защита. Аминогруппы сахара: Дпфеянлхлорфосфат. Гидроксильной группы: Адамантан-1-
карбоновой кислоты хлорапгидрид. (П Бензоплпроииоповая кислота. 4-Метокси-5,6-
дигпдро-2 Н-п:1рап. Хлоругольиой кислоты га-нитрофеннловый эфир. Этил вин иловый
эфир. Карбоксильной группы: 4-(Мети.итио)-фснол, Карбон ильной группы: Этандитиол.
А-’-З- Кетостероидов: Пирролидин. Пиррола: Угольной кислоты шрещ-бутилового эфира
азид. SH: Ацетамидокарбинол. Беизплгиометилхлорид. Серебра нитрата л-комплекс.
Цистеиновой группы:. Ацетампдокарбипол.
Защита ОН-груип. [4-Бсизо^ь'итрониоповаа кислота. Хлоругольной кислоты н-питрофенило-
выГг эфир.
Защита ОН, SH, СОаН, имидазол-Н (см. также Пептидов синтез). Дигидроппрац.
Зонна — Мюллера альдегидов синтез. Олово хлористое. Фосфор пяти Хлористый.
636
Идентификация (или выделение). Абиетиновой кислоты: Дицикл огексн лаМин. Алкилгало-
генидов: Флуорен-Э-карбоповой кислоты метиловый эфир. Аллильных спиртов: Диметил-
ацетамида диэтилацеталь. п-Фенплсульфонилбензоилхлорид. Альдегидов (см. также Кар-
бонильных соединений): Диацетила и три метил фосфита аддукт. Димедон. N, N-Диметил-п-
фенилеидиамин. 2-Метплпеита1-1диол-2,4. d, 2-1,2-бис-(Фениламиио)- 1,2-дифеннлэтан.
Альдоз: n-Аминобснзойиая кислота. ], 1-ДпфснилгиДразин. Альдопиранозы производных:
Уксусного альдегида диметил а деталь. Аминов: 2,4-Ди нитробензальдегид. Ди-л-толуил-
винная кислота. Кремния тетр а изоцианат. N-Окси метил фталимид. Рей иске соль. п-Фс-
нил азобензол сульфо хлорид. Хлоругольной кислоты бензиловый эфир. Холестерил хлор-
карбонат. Щавелевая кислота. Этилснсульфид. Гистидила: Ртуть хлорная. Дианилино-
этанов: Ортомуравьи ной кислоты триэтиловый эфир. (З-Дикетонов: МедИ(Н) ацетат, а-
Дикетонов: Триметилфосфит. Дикислот; п-Аминоазобензол. Диолов: Фосген. 1,2-Диолов:
Калия три а цетил ос мат и дикалия тетр а метил осмат. Три-н-бутилбороксин. Триметилбо-
роксин- Циклогексанон. 1,2-, 1,3- и 1,4-Диолов: Метилфосфоновой кислоты дихлор-
ангидрид. Фенилборная кислота. N-Защищенпых аминокислот: ДициКлогексиламин,
Карбонильных соединений: п-Азобензолкарбоновой кислоты гидразид. Ц.Ц-ДиметиЛгнд-
разин. N.N-Димстилглицингидразида хлоргидрат. 1.2-Диметил-4,о-ди-(меркаптометил)-
бензол. 2,4-Динитрофенилгидразин. 2-Дифснилацетил-1,3-инДандиоп-1-гидразон. J-Ме-
.тилфелилгидразин. Натрия бисульфит. Ссмикарбазида хлоргидрат. Угольной кислоты
этилового эфира гидразид. Этапдитиол. Карбоновых кислот: Сернистой кислоты N.N-
диэтиламида метиловый эфир. Фенил-(тригадогенметил)-ртуть. Кетонов (см. также Кар-
бонильных соединений): Диметиламиносульфонилметилидлнтий. N, N-Диметил глицин-
гидразида хлоргидрат. Жирара реактив. 5-Иод-2.4-динитрофенилгидразин- Р-Меркапто-
этанол. Лропаидитиол-1,3. Пропандитиола-1,3 ди-п-толуолсульфоцат. Этилен дитиол.
Кетонов летучих: Фени л гидр аз пн-п-сульфо кислота. Д г-3- Кетостероидов: Натрия мета-
бисульфит. а-Кетоэфиров: Натрия бисульфит. Левопимаровой кислоты: 2-Амино-2-метил-
пронапол-l. Метилкетонов: Иодпиридин. 2-Метил-1,4-Нафтохинона: Натрия бисульфит.
Небензоидных ароматических соединений: Борфторнстц водороды а я кислота. Оксососдигге-
пий: 2,4-ДииптрофторбензоЛ. Олефинов: Селена двуокись. а-Пиколияа: 2,4-Дипитробенз-
альдегид. Прогестерона: 2,6-Лутидин-3,5-дикарбоновоЙ кислоты гидразид. Пространст-
венно затрудненных спиртов, фенолов: Бензолсульфопилизоциапат- Сахаров: п-Нитро-
бензоил хлористый. n-ТолуолсульфониЛгидразид. Сахаров восстанавливающих: Фенил-
гидразин. Смоляных кислот: 2-Амино-2-метилпропандиоЛ-1,3. 2-Амиио-2-метилпропанол-1.
Дн-н-бутиламлн. 2,6-Диметилпппериди1Г. Пиперидин. ЭтаИоламин. Сопряженных полие-
нов: а-ФепилазоМалеинанил. Спиртов: л-Бромфенаннлбромид. Гексамстилдисилазан.
3,5-Дииптробензоил хлористый. 2,4-Динитробепзолсульфен хлорид. <1-Нафтил изоцианат.
4'-Нитроазобензол-4-карбоповой кислоты хлорангидрид. Трихлорацетнлизоцванат. п-
Фенилазомалоипаиил. rt-Фенилсульфонилбеизоилхлорид. Сульфгидрильных соединений:
. 4,4'-Динитро-3,3'-дикарбоксидифецилдисульфид. Углеводов: Феи и л изоцианат. Фенолов:
Бензолсульфокпслоты ангидрид. Бензолсульфохлорид. Формальдегида: Тстраглдрофта-
лазин. Хинонов-. Триметилфосфит. о-Хинонов замещенных: Натрия бисульфит. Хлоран-
гидридов кислот: Диацетила и трнметилфосфита аддукт. Эфиров простых: I ГолифосфорПая
кислота.
Изоксазола анпелировапие. 3, 5-Диметпл-4-хлорметилизоксазол.
Изомеризация. Алюминия бромид. Бора трпфторид — фтористый водород. Диметилсульфо-
ксид. Калия гидрид. Калия гидроокись- N-Литийэтилендиамин. Муравьиная кислота.
Ртути(П) ацетат- Хлорная кислота. Ципк, пвшь.
Изомеризация см. также Нафта,тип-2,(5-дикарбоновая кислота, получение: Альдоксимы^
Амиды: Уксусной кислоты никелевая соль, тетрагидрат. Диенов: Фенил калий- Несопря-
жекных енянов: л-Толуолсульфокислота. Олефинов {цис-транс)’. Иод. Селен. Олефинов
(миграция связи): щргпг-Бутплат калия. N-Литийэтилендиамип. Лития дпэтиламид. Нат-
рия борфторид. Тиогликолевая кислота. Полиенов: Сернистый ангидрид. Эпоксидов:
Лития диэтиламид. Магния бромида эсбират. Хлорная кислота (олеиновая кислота->-у-
стеарол актом).
Изотопная метка. Пл этим о хлористоводородной кислоты калиевая соль.
Ингибирование оксидаз. Натрия фторид.
Инертный газ. Азот.
Иодирование. щрсщ-Бутилгппоиодпт. 1.3-Дциод-5,5-диметилгидаитояи. Иод. Иод — иодная
кислота. Иода монохлорид. 1-Иодгептафторпропан. Иодморфолиновый комплекс. Иод —
серебряные соли. N-ИодсукцпнимиД. ТрифторацетилгипаиоДит. Трифторуксусноп кисло-
ты серебряная соль.
Канниццаро реакция. Формальдегид.
Карбалкоксилирование. Диэтилкарбэтоксифосфопат. Натрийтетракарбопил Кобальт.
Карбенов замещенных получение. Хлордиазомстаи-* С.НСЩ. Хлороформ,
Карбенов образование. Алюминия окись — калия гидроокись. Бромтри фтор мета и. н-Бутил-
литий Дпазоуксусный альдегид. <:«мц-Дифтортетра хлор ацетон. Дифтор хлоруксусной кис-
лоты натриевая соль, Ди-ц-хлор-л-аллилпалладий. Дихлорметил-2-хлорэтиловый эфир.
Дихлорфторуксусной кислоты метиловый эфир. Дициандиазомстан. Медц(Ц) аце'гилаце-
тонат- Мстиллитий. Окись этилена. «-Толуолсульфонилгидразин. бкс-(Трибромметил)-
ртут ь. бш-(Триметилсилилдихлорметил)-ртуть. Феиил-(трих"лорметил)-р1 уть.
Карбодиимидов димеризация. Тетрафторбориая кислота.
Карбоксигрупи защита. 4-(Метилтио)-феш;л.
Карбоксилирование. СО2 см. Метцлепмдгнийбромид (иодид). НСО2Н см. Адамантан-1-карбо-
новой кислоты хлорапгидрид. Алюминия хлорид. Натрия амальгама. Фенолят натрия,
а-Карбоксилирование кетонов, нитроалканов. А1стоксимагиийметилкарбон ат.
Карбоксиметоксилироваиие. Д и мстил карбон ат.
637
Карбоксиэтилированне. Р-Пропиолактон.
Карбониевые ионы. Фторсульфоновая кислота.
Карбонила защита. Этапднтпол.
Карбонилирование борорганических соединений. 2,3-Диметил-2-буГ!1лборац, N, N'-Карбонил-
Динмидазол. Лития трпметоксналюмогндрид. Палладия(П) хлорид. Углерода окись. Фто-
ристый водород — сурьма пятифтористая.
Карбонилирование первичных аминов. Палладий хлористый.
Карбонилов реакции конденсации. Сера чстыррхфторпстая.
Карбонилов реакции присоединения. Ацетилен. Ацетиленид лития — этилсидиамин. Ацети-
ленид натрия. Днацстнлен. Диметилсульфоксояийметилпд. Дихлорметил(трпх-лорметил)-
литпй. Карбпннлфторид. Катен. б«с.'-(Тримстилсил11л)-11атрпйам1гД. Циановая кислота
(N = СО Н).Д Изоциановая кислота (HN=--C~O).
Карбонировапие борорганических соединений. Лития трпметоксиалгомогидрид.
Карбоновых кислот ангидриды. Мстоксггацетилен, Пиридин-
Карбоэтокснлирование. Диэтггл карбонат. Хлоругольноя кислоты этиловый эфир.
Каталитическая активность. Феггплдиазометан.
Кспига— Кнорра синтез. Нитрометан. Ртути окись.
Кеталей гидролиз. Магния сульфат.
Кетализация. Адипиновая кислота (катализатор)- ДиМсгилформамнда этилен кеталь. 2-Ме-
тилФ-этилдиоксолапН ,3 (см. также Этилен кеталь метплэтилкетоиа). Окиси мезитила
этиленкеталь, л-Толуолсульфокислота. Этиленгликоль.
Кислорода поглотители. Физера раствор.
Кислот акцепторы. 2,(}-ЛутпДии. Магния окись. Мочевина. Пиридин. Ртути окись. Свинца
диацстата тригидрат. Уксусной кислоты натриевая соль.
Кислот сила см. Хлорная кислота.
Л-Кислоты. 4-Бром-2.5,7-трпнитрофлуореп. Дициаиметилеп-2,4,7-тринитрофлуорен. Медь
хлористая. Пи крил хлорид {см. Д4.о,7-Тетранптрофлуорено1-г). Пикриновая кислота.
Серебра нитрат. Тстрапптрометаи. (2.4,5,7-Тстранггтро-9-флуоренилиДенамипооксн)-
проппоновая кислота. 2,4.5,7-Тстранитрофлуоренок. ТетрацпацхиноДиметан. Тетрацпан-
этилен. 1,3,а-Тринитробензол. 2.4,“-Трвиптрофлуорепон.
Кислоты сильные минеральные: H2SO.t, HF, HCI, Hl. HNO;t. HCIO;). Органические: Метан-
сульфо к и слот a. Муравьиная кислота (рКа 3.77}. Пикриновая кислота (рК.а 0,80). п-
Толуолсульфокислота. Трнфторуксусная кислота (рКа 0,3). Трихлоруксуспая кислота
(рКа 0,08). Фторсульфоновая кислота. Щавелевая кислота (pKat 1,4G; рКа» 4,40).
Кневенагеля реакции катализатор. Ионообменные смолы. Рубидия фторид.
Кольбе электролиз. Димстилформамид.
Комплексы, d- и /-а-Бензиламин. Палладия(П) хлорид. Серебра нитрат.
л-Комплексы. Серебра иптрат.
Конденсации катализаторы. Р-Аланип. Амид лития. Аммония ацетат и формиат. Аммония
нитрат. БснзилтрнметиламмонинхлориД. Бора трифторпд. Борная кислота. Глицин. 1,5-
ДпазабиццКлО' [ 4,3,01-понен-З. 1.4-Дну }абчЦикяо-[2,2,2]-октан. Ионообменные смолы.
гцрсш-Бутцлат калия. Калия гидрид. Калия фторид. Кальция гидрид. Натрий-калиевын
силан. Натрия гидрид. Метилат натрия. Эгилат натрии. J-Окпсь 1-фенпл-З-метплфосфо-
леиа-3. Олово хлорное. Пиперидин. Пиридин. Пирролидин. Ргутн{11) цианид. Свиниа
окись. Сульфолан. Сульфомикс. Тетр а метил гуанидин. Тритон Б. Трифеи пл метнлкалнп.
Трнфторуксусная кислота. Триэтаноламин. Триэтиламин. Уксусной кислоты серебряная
соль. Хлорная кислота. Цезия фторид. Щавелевая кислота.
Конденсация по Дарзану. Амид натрия.
Конфигурации определение. «-Фен ил масляной кислоты ангидрид.
Коупа реакция элиминирования. Ди метил сульфоксид — треш-бутилат калия см. N-Оксп-
фталимид. Перекись водорода.
Красители, не содержащие солей. Уксусной кислоты натриевая соль.
Кронке реакция, п- Нитрозо-N, N-ди метил анилин. Пиридин.
Купа — Впптерштейна реакция. Фосфора дииодид.
Курциуса реакция расщепления см. Хлорноватистая кислота.
P-Лактамы и у-лактоны. Днциклогсксилкарбодиимид.
Лактонизация. Фосген-
Лейкарта — Валлаха реакция. Дпметилформамид.
Литийалкилы. Литий-натриевый сплав для получения литийалкилов.
Литийоргшгические соединения, Бепзиллитий. н-Б ути л литий. треи?-Б ути л литий.
Литийорганические соединения, активирование, трет-Б утилит калия.
Магния амальгама. Ртуть хлорная.
Малонового диальдегида предшественник. Малонового диальдегида тетраэтилацеталь.
Манниха реакция. 2-Метилфурап. Формальдегид (см. также т. IV, 229, 230).
Маслорастворимая соль. Тетр а гептил аммония хлорид.
Л1еервейна— Понндорфа реакция. МсДь бромистая.
Меервейна реакция. Медь бромистая.
Мезилаты. Мезилхлорид. Метапеульфокислоты ангидрид.
Меркаптонизация. Натрия трит иокарбон ат.
Меркаптоэтилирование. Этил-(З-мсркаптоэти л карбон ат.
Мсркурпроваггие. Ртути ацетат. Хлорная кислота.
Металлирование. Бензиллитий. я- Б ути л литий. 1,4-Дцазабицггкло-[2,2,2]-октан. Магний —
нафталин. Натрии-калиевый с план. Натр nil — нафталин. Натрия амальгама. N.N,Nr,N'-
Тетрамети.1:Н'клендиампн. ФеннлкаллЙ.
Металлоорганические, комплексы. Железа понакарбонил. Железа пентакарбонил, Серебра
цитрат (комплексы с олефинами).
638
Металлоорганические реагенты, Бензойной кислоты is ятр iieufi я соль. Винцллптий. Гриньяр и
реактивы. Днизопрон и ла ламинин гидрид. Д н мсти д а ми потри метил ста и я ан Дпметплмедь-
лптиЙ. Дп-(ц-хлор-л-аллг!л)-палладий. Дихлорметиллитий. Диутнлалюмппийцнаппд.
Диэтилцнвк метилен подпетый. Железа поп а к арбой пл. Железа пептакарбонпл. mpetn-
Бутилат калия. Кобальта гидрокарбоинл. (миЧКобальттетракарбоиилфциик. Питий —
нафталин. Лития ацетиленид. Лития диизобутплметплалктмогндрид. Лития диизопроиила-
мггд. Лития динпклогексиламнд. Лития ди этила мид. Лития три -щщ’щ-бутоксиалнтмогиД-
рид. Лития триэтокспалкк.югпдрид. Магний — нафталин. Магния метилат. Магния метнл-
карбонат. Марганца(Г1 1) /нрпс-(ацетплацетопат). Меди([Г) а цетил ацетопат. Метилли.гвй,
Метилмагвийиодид. Мстилмедь — три-н-бутплфоефнн, комплекс. Молибдена гексакарбо-
нил. Натрий —нафталин. Натрия изопропилат. Натрия метилат. Никеля карбонил
Пиридин --- л-бутилли"! ий. Салькомин. Симмонса — Смита реагент. Таллия этилат.
N, N. N',N'-Тетра мети л этил ей диамин. тсшрйкисДДимстпламнпофтнтап- metupaxtic-i^o^a-
(трп-и-бутилфосфин)1-медь. бис-(Трибромметил)-ртуть. Трп-н-бутплстаинаи. биг-(Триме-
тнлеилилдп хлорметил)-ртуть. 1 Триметилсилилпроинпиллитпй-З. Т римстнлТтрифтор-
метпл)-станиан. Три мстил фосфит — мет пл медь, комплекс. Три феи ил метил литий. Трнфе-
Н ил Станнан. (Трифенилфосфцн)-иридийтри гидрид, б ис-( Трифен илфосфппр ипкельдпхло-
рнд. (Трнфеиилфосфинфродийкарбони л хлорид. щргы-йТрпфеиилфосфнврродпйхлорид.
(Тр11фенилфосфпн)-рутепийдихлорид. Трихлорметиллитий. Трихлоруксусноп кислоты
натриевая соль. Трпэтилалюминий. Фенилтпометиллптий. Фенил-(триг'алогепметил)-
ртуть. Хлордифторуксуснои Кислоты натриевая соль.
Метилглюкозиды. Ионообменные смолы.
.Метилирование. Диазомстан — бора фторида эфнрат. Диметнлмедьлнтий. Диметилсульфо-
нийметилнд. Иод. Метил подпетый. Метилмедь -- три-и-бутнлфоефнн, комплекс. Натрия
гидрид. Серебра перхлорат. Симмонса — С.-нита реагент.
С-Метилпрование. .Метилат натрия. Метил подпетый.
N- Метилирование. Метил йодистый. Формальдегид.
О-Метилирование. Метил подпетый. Трнметплсульфоксония подпд.
и-Метилирование. Метил подпетый.
Метилирование ароматических соединений, nipe/ti-Бутила Перекись.
Метилирование восстановительное. Формальдегид.
Метилирование спиртов. Диазометан -- ВГ4 или HBF4.
Метилирование хинонов, нитроароматических соединений. Свинца тетраацетат.
Метиловые эфиры кислот. 2,2-Дпметокспнроппи.
Михаэля — Кпевенагеля конденсация. Ди мети л сульфоксид.
Михаэля присоединение. Ацетилспдикарбоновоп кислоты дпметиловый эфир. Ионообменные
смолы. Метилат магния. Тетраметцлгулпидип. Этплат натрия.
Молекулярного веса определение по Расту. Изохпнуклндон (см. Даутерм А).
Молекулярные комплексы. Дигптоппп.
Мягкий кислотный гидролиз. Левулиновая кислота.
Неясного реакция. Цинка хлорид.
Нефа реакция. Ацетиленил лития.
Нитренов образование. N-n- Нитробензол сульфоксиуретан.
Нитрование. Азота пятпокпсь. Азота четырехокись. Азотистоиодородпая кислота. Азотистый
ангидрид — бора трифторид. Амид каляя. Акстилнптрат. Ацетонциангидрина нитрат.
Изоамнлпптрат. трсгм-Бутилат калия — амилпитрат. М.едп(И) нитрат — уксусный ан-
гидрид. Нитрил хлористый. Нитрония борфторид. Полифосфориая кислота — азотная
кислота. Тетра нитрометан.
Нятрозирование. н-Бутилнитрит. Нитрозил хлористый. З-Нитро-К-нитрозокарбазол.
Нитрозпхлориды. Нитрозил хлористый.
Нуклеозидов синтез. Адамантан-1-карбоновой Кислоты хлорангидрпд. бнс-(п-Ннтрофеннл)-
гидрофосфат. .Хлоругольной кислоты РФНФтрпбром.Этиловый эфир.
Нуклеозидов фосфорилирование. Дибензил хлорфосфат. Ни трофеи нлдпхлорфосфат.
Нуклеозидфосфиты. Дн-и-толилкарбодпимид.
Нуклеозиды, защита 3' -ОН-группы. 2,4-Динитробензолсульфенхлорпд.
Нуклеозиды, защита первичной ОН-группы. 2,2-ДиметоксиПропап. 4>4'-ДнметокС-итрифенпл-
хлорметан.
Нуклеотидов синтез. Дицпклогексилкарбодпимид. Ди метил фор маМиД — тиопил хлорид.
р-Цианэтилфосфат. Этилвиниловый эфир.
Нуклеотиды, 3', Б'-межнуклеотидная связь. Дггцпклогскснл карбоДиимид. и-Толуол сульфо-
хлорид.
Нуклеофильное замещение. Гексаметилтриамид фосфорной кислоты.
Нуклеофилы. Бензойной кислоты натриевая соль. Гидроксил,тмин. Натрия гидразид. Тио-
фенолят натрия. Трнфенилфосфин.
Обесцвечивание неочищенных ароматических аминов. Цинк, пыль.
Озонидов определение. Трифеи и лфосфпн.
Озонирование. Ди Метилсульфид.
Окисление. Аллильное: mpem-Бутилхромат. Надбепзойггой кислоты шрют-бутиловый эфир.
Никеля перекись. Ртутн(11) ацетат. Свинца тетраацетат — ЬРбромсукшшпмид. Сслеиэ
двуокись, трет-Аминов: СгОа—.пиридин. Байера— Внллигера: .и-Хлирнадбепзойная
кислота. Бензильное: Палладия ацетат. Винпльное: Свинца я етраа иетат. N ,N-Диметил-
гидразинов: Перекщсь водорода. Избирательное S-соединений: Надлауриновая кислота.
Свинца тетраацетат. Катализатор: Платина. Олефинов в у-лактоны: Марганца ацетат.
Пропаргиловых спиртов: Свинца двуокись. Углеводов: СвггвЦа ’гстра-(трцфторацетат).
Окисления методы. Байера— Виллигера реакция: Каро кислота. Мононадмалепновая кисло-
та. Надуксусная кислота. Перекись водорода. 1 рпфторцадуксусная кислота, .и-Хлор-
639
Иадбензойная кислота. Бона—-Шмидта реакция: Борная кислота. Дакигга реакция:
Перекись водорода. Лемье— Джонсона окисление: Перйодат — осмия четырехокись.
Окисления перхлоратами, катализатор: Аммония метаванадат.
Окисления реактивы. Азоднкарбоповой кислоты диэтиловый эфир. Азота окнслы. Азота
четырехокись (см. 4-Фспил-1,2,4-триазолиндион-3,5). Азотистая кислота (см. [,4-Нафто-
хинон, получение). Азотная кислота. Бария перманганат, N-Бромацетамид. Броммочсви-
на. N-Бромсукцинимид. трет--Бутила гидроперекись, шрещ-Бутилгнпохлорит. трет-
Бутилхромат. Висмута трехокпсь. Гцпогалогеннтов растворы. 1,3-Дибром-5,5-Днметил-
гпдантоин. Диметилсульфокспд. Димегилсульфоксид — ДЦК (Пфитнпера — Моффата
реагент). Диметилсульфокспд — уксусный ангидрид. 4,4'-Дпнитродифепнлимипоксил.
2,3-Дихлор-5,6-Дициан-1,4-бецзохиноп. Железа (III) хлорид. Золото хлористоводородная
кислота. Иод. Иода иснтафторид. Иодозобензол. Иодозобепзола днацетат. Калия гипо-
хлорит. Калия нмпиокснлдисульфоиат. Калия манганат. Калия мононадсульфат кислый.
Кална перманганат (см. также 1,8-Нафтойный ангидрид). Калия персульфат. Калия пер-
сульфат — серебра нитрат. Калия персульфат — серебро (каталитические количества).
Калия феррицианид, Каро кислота. Кислород (см. Хейна катализатор, Ртути ацетат,
Д пизопропил f/сроке:: ди карбонат). Кислорода дпфторид. КобальТа(П) ацетат. Марган-
ца(111) аце'/ат. Марганца двуокись. Меди(И) ацетат. Меди(Н) карбонат основной. Меди(Ц)
сульфат. Медь хлорная. /X-Метилморфолина окись — перекись водорода. Мопонадмалеи-
ионая кислота. Надбензойная кислота. Надлауриновая кислота. Надуксусная кислота.
Надфталевая кислота. Натрия бихромата днгидрат (см. также Нафталин-2,3-дикарбоновая
кислота, получение). Натрия бромат. Натрия висмутат. Натрия гнпобромит. Натрия ги-
похлорита раствор. Натрия нитрит. Натрия перборат. Натрия персульфат. Натрия
хлорат. Натрия хромат безводный. Никеля перекись. Нитробензол. Нитрозил хлористый.
Озон. Осмия четырехокись. Осмия четырехокись — натрия хлорат. 11алладпя(И) ацетат.
Перекись водорода. ПеряоДаты. Пер иодаты — рутения четырехокись. Пиридина N-окись.
Ртути окись. Ртути окись — иод. Ртути трифторацетат. Рутения четырехокись. Рутения
четырехокись — натрия пернодат. Свинца двуокись. Синица тетраацетат. Свинца тетрааце-
тат — N-бромсукцинимид. Свинца тетрабензоат. Свинца тетра-(трифторацетат). Селена
двуокись (см. также Глиоксаль, получение). Серебра ацетат1 — иод. Серебра дифторид.
Серебра карбопат. Серебра(1) окись.Серебра(П) окись.Серебра перхлорат.Серебра хлорат.
Серный ангидрид. Таллия триацетат. Тетразолиевый синий. Тетраэтиламмоння перйодат.
Трифторнадуксусная кислота. Трифторнадуксусная кислота — бора трифторид. Фепан-
трсихинон. Хейна катализатор, окисление кислородом воздуха. Хлорамин, о-Хлоранил,
ж-Хлорбензойная кислота. лг-Хлорпадбепзойная кислота. 1-Хлорбеизтриазол. N-Хлор-
сукцинимид. Хромила ацетат. Хранила трихлорацетат. Хромила хлорид (реагент Этара).
Хромовая кислота: в ацетоне (реактив Джонса), в разб. НЙ5О^; двухфазное окисление;
реактив Килиани. Хромовая кислота — маргапца(] I) нитрат. Хромовый ангидрид:
безводный в уксусной кислоте (реактив Физера); водная уксусная кислота; в пиридине
(реактив Саретта); в пиридине с водой (реактив Корнфорза). Хромовый ангидрид — ди-
метплформамнд. Хромовый ангидрид — уксусный ангидрид — серная кислота. Церий,
аммиакат нитрата. Церия()У) сульфат.
Окислительная перегруппировка. Диметилсульфокспд — уксусный ангидрид.
Окислительная циклизация. Бром — окись серебра. Марганца двуокись. Медь х-дорная.
Ртути(П) ацетат. Окислительное декарбоксилирование: Калия феррицианид. Меди(П)
ацетат (катализатор). Синица двуокись. Свинца тетраацетат. Окислительное деметилиро-
вание: Калия феррицианид. Окислительный гидролиз: Серебра хромат. Оппенауэра окис-
ление: 1,4-Eeti3oxiinoi]. трет-Бутилат алюминия, трет-Бутилат калия. Изопропнлат
алюминия. Циклогексанон. Пфитцнера — Моффата реактив: см. Дпметилсульфоксид.
Фентона реактив: Перекись водорода — железа(П) сульфат, Хукера окисление: Калия
перманганат. Перекись водорода.
Окислительная конденсация ацетиленов. mpam-Бутиламин, Меди(П) ацетат безводный.
Медь хлористая.
Оксигенировапие. Платиновый катализатор.
Оксигенирования катализатор (АгН^АгОН). ДиизопропнлпероксиДикарбонат.
Оксимеркурирование. РтупЦП) ацетат.
Оксиметилирование кетонов. Бензилхлорметиловый эфир.
а-Оксимипокетоны. Изоамилнитрит. Метил нитрит.
Оксимов получение. Гидроксиламина хлоргидрат. 2-Метилбутилат-2 натрия.
Оксимов расщепление. Железа пентакарбонил.
Оксония фторирование. Перхлорилфторид.
Оксо-реакция. Дикобальтоктакарбонил.
Оксофторирование. Перхлорилфторид.
Олефинов изомеризация. N-Литийэтилендцамий. Гидратация по Марковникову: Ртути(П)
ацетат. Олигомеризация: бис- (Кобальттетр а карбон ил)-цинк.
Олефинов координация. бнс-(Бензоиитрил)-;.1алладнп(И)-.\лор!1Д.
Олефинов реакции присоединения. Альдегиды [см. Бензоила перекись (катализатор)]. Алю-
миния хлорид. Амиды (см. трет-Бутила перекись). АцетидгнПобромит. Ацетил нитрат.
Ацетонциангидрин. Бензальхлорнд (см. Трифенилстапиан). Брома азид. Брома хлорид.
N-Бромацетамид. N-Бромацетамид - ДМСО — вода. N-Бромацетамид — фтористый во-
дород. Бром(хлор)Д11П11рт1диццнт]кат. Бромуксусной кислоты этиловый эфир. н-Бутнл-
лптий. Диазометан (см. Медь бромистая). Днфторамин. 1,1 -ДифторФФ-дихлорэтилеп. Ди-
хлор в и пилен карбон ат. Ди хлор кетен. Дцхлорметпл-2-хлор метиловый эфир. N.N-Дихлор-
уретап. Изоциановая кислота (см. Циановая кислота). Иодазид. Иода изоцианат. Иода
нитрат. ИоДбензолднхлорид. I-Иодгептафторпропан. Иододибензоат Серебра. Карбонил-
фторид. Кислорода дифторид. Натрия гипоброМпт. Нике;:я Карбонил. Нитрил иодистый.
Нитрил хлористый. Нитрозил фтористый. Нитрозил хлористый. Окись углерода и водо-
род (см. Дикобальтокта карбон ил). Пикрилазпд. Родия трихлорид. Ртути ацетат. Сера
640
двухлорнстая. Серебра фторид. СимМопса — Смита реагент. Тноуксуспай кислота.
Тр’нфгоруксусной кислоты серебряная соль — под. рfiхjhjрдзетfiti.'jtП‘!iiг. Угольной кисяо-
ты этилового эфира азнд. сРснилаанд. Фсвнлдпазомеган. Формамид {под дсйетиисщспста).
Хлороформ (катализированный перекисью). Хлорсульфопзоциаиат. Хлортоцпап. Этанол
(ем. Этилат натрия).
Олефинов синтез. н-Бууиллптпн. ) .З-Дибензпл-Хмстил-1 .ЗД-дназифосфолпдип. Днфенил-
сул ьфоп ни нзсн (ропи л и д. Х-Метансз'Лы^тшл-л-то.ч ундин. Мети лтнофос фон о нон кислоты
диметиловый эфир. Мотилфосфарнон кисло гы басХднмсгпламнд). п-Толуллсульфоппл-
гпдразип. Трпфепилфосфит. Фосфора хлорокись — олово хлористое — пиридин.
Основания. Алюминия окись (см. п-Толуол сульфон пл гидразин). Амид калия. Д е гидро а б це-
тил амии . 1 .й-ДназаОп цикл о-[4.3,0 l-noiieii-б. J ,4-Дпачабицн кло- 12,2.21-оьтап. 1,5-Дназа-
бип.икло-1о,4.0]-у[,децеи-о. 2,0- Дн-юре/л-бутил пиридин. 2 ,(>-Ди мети л пн перидии. N,_X!-
Диэтнлглнцина этиловый эфир (см. Хлоруго.чьиой кислоты щрею-амиловый эфир). Калия
гидроокись. Лития диизоироппламид (см, Дифенилсуяьфопийизопропплид). Лт ня ни-
трид. Метилат магния. Метилат натрия. 2-Мети л б ути л ат-2 натрия. П-Метплморфолнп.
Пиперидин. Пиридин. Пирролидин. Тпофеполят натрия. Трифен ил фосфин (см. ]-Метил-
11 ирролидок-2). Тризтиламип. Триэтил метилат калия- Этаполамчп. Этилат таллия.
л-Основания. Тетраметоксиэтнлеи.
Основания пространственно затрудненные. а.б-Дп-п/ре.’Л-бу! и Л Пир и дни
Основания сильные. Амид калия (лития, натрия). Гидроокись те триметиламмоиия. Ионо-
обменные смолы: амберлит IPA-400. дауэкс 1-Х1О. шршп-Бутнлат калия. Калия гидро-
окись. Клайзена щелочь. Лития нитрид. Мегилат naipiin. 2-Метилбу'1 и.'нп’-и калия (нат-
рия). Тетра метила ммон и я гидроокись. Тстраэгнламмония гидроокись. Тритон Б. Трпфе-
пнлметплкалпй (литии, натрий). Феиплкалнп (литий, патрпй). Холин. Этилат калия
(лития, натрия).
Осушители. Кальция гидрид. Кальция сульфат безводный. Лития алюмогидрид (см. такще
Диглим). Магний. Магния сульфат. Молекулярные сита. Натри й-свинцовый сплав. Натрия
сульфат безводный. Хлопок абсорбент.
Отщепление боковой цепи желчной кислоты. Иодная Кислота.
Пептидной связи образования катализатор. 1,2,4-Трназдл.
Пептидной связи ферментативный гидролиз. Триэтплентетрампи.
Пептидов анализ. и-Лцетил-()-этокси-П-карбэтокспакриламнд. Бромциии. Гидразина суль-
фат. 2,4-Динитрофчорбеизол. Дпфенилфосфорилпзотпоциапат. Подуксусной кислоты амид.
Пфитцнера — Моффата реактив. Фенантренхипоп. Фенилизетпещнгл-шт. Эшдепхлорфос-
фнт.
Пептидов расщепление. Бора фторида эфпрат.
Пептидов синтез. щреш-Бутил-2,4, б-трпхлорфеиилкарбонат. Ди-(д-питрофеНг1Л)-сульфат.
Х,,Х-Днэт11л-]-ппоп11ипламиц. Мстилморфолпи. 4-Мети(ч,1нофепол. N-Окси сукцинимида
трифторацетат. Пентамезил бензол хлорид. Полигекса метилен карбодиимид. 1, Д4-Триазол.
Фсиацилбромпд. Хлоругольной кислоты шреш-ампловый эфир. Хлоругольиой кислоты
(Зпюр-бутнловый эфир. Хлоругольпой кислоты ющщ-бугилщзьш эфир. Хлоругольнои кис-
лоты изобутилопый эфир. Щавелевой кислоты хлорангидрид. М-Эгилбензпзоксозолия
борфторид. Этилена и N-оксиимида малеиновой кислоты сополимер, КГЭтоксикарбонил-2-
зтоксп-1,2-дигидрохннолип.
Пептидов синтез. Азидный метод: Бутилпптрпт. Нитрозил хлористый.
Пептидов синтез. Защита азота: 1-Адамаптилхдорформиат. АЩтилацеТОи. Бснзилтиокарбо-
нплхлорид. Щреш-Бутил-п-питрофепилкарбопат. щргщ-Бутплоного эфира угольной и дн-
этилового эфира фосфорной кислот ангидриды. шрещ-Бутилоксикарбоиплфторпд.
Бути л пента хлор фен ил карбонат. трет-Бутил-2.4,5-трихлорфеп пл карбонат. Х'-и;ре/л-Буто-
ксикарбонило'ксисукцпицмцд. ГексаметилдиСплазан. Дикетен. Димедон. 3,5-Днмотокск-
бензил-п-питрофенилкарбопа г. 12-(Дифсп ил)-щю-пропилГфеннл карбонат. N-Имидазол-
карбоновой кислоты тщю-бутпловый эфир. Х-Карбэтоксифталимид. о-Нитрофенилсуль-
феп и л хлор ид. Тногликолсвая кислота. 2- п- Толуол сульфоны датп л хлор фор ми ат. п-Толуол -
еульфохлорид. Трифсиилмстапсульфенхлорид. Трифсннлхлорметан. Трнфторуксусиой
кислоты фениловый эфир. Угольной кислоты /щитп-бутил оного эфира азид. Угольной кис-
лоты дпфепплметплового эфира азид. Уксуеномуравьиный ангидрид. Фталевой кислоты
дифениловый эфир. Фталевый ангидрид. Фторуголыюп кислоты uipeui-бутиловып эфир,
о-Хлорсалициловып альдегид. Хлоругольпой кислоты енщтп-амиловый эфир. Хлоруголь-
пой кислоты бензиловый эфир. Хлоругольной кислоты л-нитробепзиловьщ эфир. Хлор-
угольной кислоты фурфуриловый эфир. Циаиугольпоп кислоты лгрещ-бутпловый эфнр.
Защита карбоксильной группы: Изобутилен. -1-(МстплТ11о)-фспол. п-Нитробензил броми-
стый. Пенгаметплбензнлхлорпд. Уксусной кислоты трет-бутнловый эфир. Фенацилбро-
мид. N-Хлорметилфталнмид. Защита карбонильной группы: о-Метилгпдроиспламин.
Защита кислорода: Гексаметнлднсилазап. Изобутилен. Защита серы: Ацетамндокарбн-
нол. Бен зилтиометил хлорид. Беизплтрпмстиламмонпйхлорнд. Гексаметил дисил азан.
п-Мето кс и бен зил хлористый.
Конденсация активированного ангидрида: у-Хлорсахарии. Конденсация активных эфиров:
б/ю-(2,4-Дицитрофе11Ил)“Карбонат. п- Нитрофенол. Пентахлорфенол. Пиразол. Сернистый
ангидрид — диметилформамид. Тетраэтилнирофоефпт. Х.Х'-ТиопииТдннмцдазол. Голуол-
сульфокислоты п-нитробензиловый эфир. Трнфторуксусиой кислоты «-ппгрофениловый
эфир. 2,4,5-Трихлорфеиол. Угольной кислоты дп-п-нптрофениловьгй эфир. Фснилтрп-
мети л аммония этилат. Фосген. Хлор ацетонитрил. 2-Эгоксп пиридина N-окись. Конден-
сация сметанных ангидридов: I-Адамантилхлорформпат. Дифенил кетен. Дифепнлхлор-
фосфат. Триметплуксусной кислоты хлорангидрид. Трщтпламии. Угольной кислоты
бен лилового эфира гидразид. Хлоругольпой кислоты бутиловый эфир. Хдоругольпоп кис-
лоты этиловый эфир. Конденсация с отщеплением воды: П-(3-ДиметпламццоГ1ропил)-П'-
21 № 1994
64 L
этцлкарбодинмпда хлоргидрат. Дифеиилкотеиа ц-толилвмпн. 1, ) -ДихлордцэтилоЕЫй
эфир. Дицпклогексиламнп. Д11этцлхгл(1р1]юсфит. Л,иьтн.ч11иаиам11Д. Днэ'П|Лэтцле[1т1ро<|юс-
Фит. N, (V- Карбоннлдинмндазол. К, Д'-Корбопилди-сцлм-трначал. Гч-Оксипнперпдии.
3-0 к<? и и при ди п. П-ОксцсукЦннпмпд. N-Оцсифталимид. бпс-о-Фс'н нлештрофосфнт, Фос-
форной кислоты фсяилошню эфира диимидазолид. 1-Цш<логексил-3-(этил (З-.Ч-морфолцп)-
карбодиимид. 1-Этпл-З-(^-диметола мп но про) 111Л)-иарбод1П1 мида хлоргидрат. Э'пглснхлор-
фосфит. N-Этил-5-фettилIIз<л^caзoJlиii-3-cyльфoпcl';,. Этокснацегнлен- Расщепление N-
карбобензоксигрупны: Трпфзо!>укс'успая кислота. 'Гриэтплснлан- Расщепление N-фтало-
ильной группы: Гидразина ацетат. Синтез на твердой фазе: Ионообменные смолы. Цикли-
зация: Три-л-нитрофепплтиофосфнт.
Переаминпрование. Мочевина.
Переацетилирование. Сульфо сам и ни-1) он а я кислота.
Перевпнилирование эфиров. Винилацетат (реагент). Ртути ацетат (катализатор).
Перегруппировки. Бекмана: п-Ацстамндрбепзолс.ульфохлорид. Вора трпфторид. Иода пента-
фторид. Муравьиная кислота (см. Хлорноватистой кислоты эфирный раствор). Пиридина
хлоргидрат. Полифосфорпая кислота. л-Толуолсульфох;юрид. Трифаиилфоефин. Трифтор-
уксусная кислота. Фосфора хлорокись. Бензильная: Перекись водорода. Бензильная, пи-
иаколиновая: >прещ-Бутилит калия. о-Бензоилоксиацетофенона: Пиридин — ДОН (т. III,
стр. III). N-Бромсукцинимида: Р-Бромпропи он ил изоцианат. Виттита (Бензиловый
эфир^ карбинол): Калия амид. Вольфа: Меди иодид. Бензойной кислоты серебряная соль.
Диенон-> фенол: Трихлоруксуспая кислота. Дихлоркетен > циклоиептадиена аддукт:
Дихлоркетен- Клайзена: см. Ртути ацетат. Коуна: Этидин и ил кетон. Курциуса: Иминоли-
карбоповоп кислоты ди-щрещ-бутпловый эфир. Лобри де Брюипа— ван Экенштейна:
Дициклогексидкарбодиимнд: Лоссена: п-Толуолеульфоклорнд. Мезилатов (NaOCHa):
см. Мезилхлорид. Мэттокса: ФеНилгидразип. Окислительные: Перекись водорода. Пере-
кись водорода — селена двуокись. Свинца тетраацетат. Пуммерера: см. Нингидрин, по-
лучение. Тиффено: Эсилат натрия. Тиффено—-Демьянова: Цианазид. Тозилатов: Каль-
ция карбонат. Фаворского: Метилат натрия, Триэтила.ми и. Фотолитические: Медь хлори-
стая. 5,19-Циклостероидов: Диэтил-СЦа^-трпфтор-У-.хларэ'пыО-амии. Шмидта: Полифос-
форная кислота. Трифторуксуснын ангидрид. Элиминирование: л-Толуолсульфонил-
г'иДразйп. Этинилкарбиполов: Ионообменные смолы. Фосфорный ангидрид.
Перегруппировки, реактивы. Алюминия бромид. Днметилтиокарбамоилхлорид. Дпмсилнат-
рий. 1,3-Дитиан. wpcm-Бутилат калия. Кальция карбонат. Лития диэтиламид. Марганца
двуокись. Мстнлнинилкетоп. Мпхлера кетон. Норборнеи. Серебра перхлорат. Таллия
триацетат. Триэтнлоксония борфторпд. Хлорная кислота.
Перемещение карбонильной группы. Изоныплнитрат,
Перециангидринирование. Ацетонциангидрин.
Переэтерификация. Молекулярные сита, п-Толуол сульфокислота.
Перкина реакции каталнзаз'ор. Уксусной кислоты калиевая соль.
Перхлорилирование. Перхлорилфторид.
Перье процедура. Алюминия хлорид.
Пехмана синтез кумарина. Ионообменные смолы. Фтористый водород, безводный.
Пинаколиповая перегруппировка. mpm-Eyi плат калия.
Пирилиевые соли. ?црй?7-Бутил Хлор ид.
Д--Пирролидина синтез. МетплвинилкетоЦ.
Поверхностноактивные вещества. Лаурилгюлиэтпленглнколь. Цемульсол (см. Мононадяв-
тарпая кислота).
Полимеризации ингибиторы. /Лргш-Бутплппрокатехип п триэтиламип (См. 1,1-Дихлорэти-
лен). Гидрохинон (см. Муравьиная кислота). i\-Фенил-^-нафтилам и и.
Полимеризации катализаторы. Алюминия хлорид. Бензоила перекись. Диизопропплперокси-
дикарбонат. Трифенилметилиатрш).
Полимеризация— циклизация а.се-дигалмдов. Полисахаридов соли. Цетллтриметиламмоний-
бромпд.
Полоновского реакция. Уксусный ангидрид.
Понзио реакция. Азота четырсхокись.
Прево реакция. Серебра иододибепзоат.
Принса реакция. Формальдегид.
1,4-Присоединение. Акролеин. Ди мсти л медь,питий, Дифторлмин. ДпэтнлалюМинийцнанид.
/Меди ацетат. Меди(!) иодид- Медь бромна;!. Медь хлористая. Метилвпнйлкетоп. Метилмеди
и три-н-бутилфосфпна комплекс. Натрия бисульфит. Натрия этилат. Родия трихлорид.
Сера двухлористая.
1,6- Присоединение. Сернистый ангидрид.
(jHc-Присоедннение к алкинам. Днизобугилалюминийгидрид.
тр анс -При соединение к алкинам. Литии ди изобутил илГОМогидрид.
Присоединения катализатор. Мочевина.
Пуммерера перегруппировки. Иод, окисление.
Радикалы. Азодиизобутиронитри.п. Бензоила перекись. Брома азид, трет-Бутила перекись.
н-Бутиллнтии. у-Бутиролактон. Гальвиноксил. 4.4г-ДинцтроД11фснцл11МиноксиЛ- а,у-бис-
(Дифенилен)'|3-феп11лаллильны1'! радикал. N,N-Дцфеиил-N'-пикрилгидразил (радикал).
N.N-Дихлоруретан. Иодбеязола дихлорид. Иод, окисление. шрсш-Бутнлат калия. Калия
иминоксполилдисульфоиат. Калия питрозоднеульфоиат. Калия феррицианид. Марганца
трнс-(ацетилацетонат)- Меди(1) ацетат. Надбеизойной кислоты шре/ц-бутиловыв эфир.
Перекись водорода — соли н о кислы металлов н качестве катализаторов. Свинца
двуокись. Тиоуксусная кислота. Трихлормстаисульфоклорид. М-Фенил-М'-бензоилдии-
МИДиМНн,
Растворители, см. также Дильса — Альдера реакция, растворители.
642
Растворитель для экстракции. Тетрамстиленсульфоп.
Растворителя влияние. Бёрча восстановление. Диметилсульфоксид. Днмстнлсульфон.
ЦиметилфорМс!Мт[Д Н2-ДимстокоиэтсП! (Глпм) п Дцмсги/Кжый 9фир (см- 1 жгрийнафта-
лин). ДифеиилсулМюксвд. Метилаль. Метилен клористый. N-Мстилморфгкпип, N-Мстил^
пирролидон. Мети.'птил.кето!!. Нитрознл хлористый. Нитрометан. Ртути(ф) трифтораце-
тат. Тетрагидрофуран. Тетраметияеисульфонсид. Тстраметилепсульфоп. I рифторуксус-
ная кислота. Триэтаноламин. Триэтилфосфат. Этиленгликоль. N-Этилморфолпн. Фенетол.
Фосфорной кислоты гексамстилтриамид.
Расщепление, трот-Аминов: Хлоругольпой кислоты фениловый эфир. Арилциклопропанов:
Церий, аммиакат нитрата. Ацеталей: Муравьиная кислота. Ацетатов: Лития алюмогид-
рид. Мстнллнтпй. Ацетонидов: борная кислота. Уксусная кислота, 80%-ная. Этиленгли-
коль. Бенз ил амидов: Метан сульфокислота. S-Бензильной группы: Сульфурил хлористый.
^«с-Метилендиоксипроизводных: HF, 40%-пая, см. Формальдегид. Гидразидов кислот:
Хлораль. Гидразонов, оксимов: Левулиновая кислота. внц-Гликолей: Иодная кислота.
Иодозобензола диацетат. Калия персульфат — серебро (каталитические количества).
Натрия висмутат. Свинца тетраацетат. ы-Дикетонов: HSO3— Г]С1О4. 1,2-Диолов: Кобаль-
та(П) ацетат. Диэтилмеркаптален: Ртуть хлорная. Кетонов: н-БутилазиД. трет-Бутилат
калия. Перйодаты. Кислородсодержащих циклов: Бромистоводородная кислота. Фосфора
трехокись. Хлорная кислота. Цинка хлорид. Мезилатов, Тозилатов: щреш-Бутилат калия.
Метиопилпептидов: Иодуксусной кислоты амид. N-Нитрозопроизводных: Олово хлори-
стое. Оксимов: Церий, аммиакат нитрата. Натрия бисульфит. Окситоцина защищенного:
Фтористый водород. Олефинов: Натрия гидразид. Пептидов защитных групп: Фтористый
водород. Семикарбазонов: Натрий, аммиакат нитрата. Сульфамидов: Бромистоводородная
Кислота. Натрнйнафталии. Тиоэфиров: Бромциап. Фенилгидразонов: Ацетилацетон.
Формиатов и формамидов: Натрия гидрид. Циклопропанов: Таллия триацетат. Четвер-
тичного аммония солей: Этанол а мин. Эпоксидов: Бора трифторида эфират. Диметилформа-
мид — РОС1Я. Диэтилал1омпннй1шаппд. Лития диэтиламид. Полифосфорная кислота.
Триэтллалюмииип (с HCN). Хлорная кислота. Эфиров простых: Алюминия бромид. Хлю-
миния хлорид. Ацетил-о-толуолсульфонат. Бора трибромид. Бора трнфторида эфират —
уксусный ангидрид. Бора три хлорид. Бромпстонодородная кислота. Диборан. Днфеннл-
фосфиилитий Железо хлорное. Иодистоводородная кислота. Литий —Дифенил. Лития
бромид. Лития бромид — бора трифторида эфират. ^^^етилмагнпйиоДид. Натрий-калиевый
сплав. Натрия боргидрид. Натрня иодид. Пиридина хлоргидрат. Трифенилфосфиндибро-
Мид. Эфиров сложных: Лития иодица дигндрат. Лития иодид безводный. Метансульфо-
кислота.
Расщепление дигитонидов. Ди мстилсульфоксид.
Расщепление по Эмде. Натрня амальгама.
Рацематов разделение. Зр-ЛцетоКси-Д5 -этисноная кислота. п-Борбепзойная кислота. D-( — )-
Бут;п)диол-2,3. 1 -(-Н-Бутапдитиол-Э.З. Дегидроибнетпламни. Днизопнпокамфилборан.
Ди-п-толил-О-внпнаи кислота. Дита-толнл-Б-виппая кислота. «-10-Камфорсульфоки-
слота. i0-Цамфорсульфохлорид. н-Карбокснфенилссмикзрбазид. Л-Кислотьт из тетрани-
трофлуорсиона и оптически активного гидроксилами::;:. Комплексы платины(П) хлорида,
(ф-)- 1-фени,.'1-2-аминопропана п этилена d- и /-а-Метилбензнламицы. ]-Ипрролидоикарбо-
новая кислота (путем кристаллизации — уксусной кислоты серебряная соль). (-)-)- и
(—)-(i-(2,4, й,7-Тетранитро-9-ф'д yopeii илидепамипоо1<еи)-проиионовая кислота. 1 -Фенил-
этаисульфокнслота, ем. 1,3-Дибепзил-2-.мегнл-2-фосфамндазолидиц. d- и /-а-феиилэтил-
амины.
Реформатского реакция. Алюминий. Иод. .Магний. Цинк.
Роданированне. Дитиоциан.
Ррзенмунда реакция. Хинолин.
Ртутьорганические соединения. Ртуть хлорная.
Руффа расщепление. Перекись водорода.
Сапогенины, ацетолиз. Пиридина хлоргидрат.
Сахаров микроопределение. 3,4-Д ииитробензойная кислота.
Секостероидные ацетиленовые кетоны. H-Толуолсульфонилгидразин.
Серини реакция. Цинк, пыль.
Сероводорода отщепление. Свинца днацетата тригидрат.
Силилирование. N-Тримстиленлнлацетамид. Трнмстилхлорснлан.
Симмонса— Смита реакция. Диазометан. Иодметилртути иодид.
Синтез (или получение). Адамантана: Алюминия бромид. 1 Н-Азепинов: Иода изоцианат.
Азетидина, этилеяимица: Дифторамнп. Азидов; Натрия нитрит. П-Толуолсульфонилазид.
Азиридинов: N, М’-Дихлоруретан. Мта-Нитробепзолсульфокснуретап. Угольной кислоты
этилового эфира азид. Азиридином а: трст-Б утилит калия. 2Н-Азиридииов: Иода азид.
Лития алюмогидрид. Азлактонов: Гппнуровая кислота. Алкилазидов: Тетрамстилгуани-
дини(?азид. Алкилгалогенидов: Натрия боргидрид. ТрифенилфосфинДифТорид. Трифенил-
фосфин — углерод четыреххлористый. Трпфенилфосфит. Трифен и л фосфита иодметилат.
Алкилизоцнанатов: Хлорциап. Алкилсульфокислот: Тиоуксусная кислота. G-Алкил-А2-
циклогексенонов: Пиперидин. (Х-Алкоксикетонов: Бора трифторида эфират. Алленбромц-
дов: Трифенилфосфита дибромид. Алленов: н- Бутпллнтий. ДАсти л литий. Олефин аллен.
Цинка окись. Аллиллптия: Трифгэпплхлорстаннан. Альдегидов; п-Диметиламнпобеггзаль-
дегнд. Дпметнлсульфид. Днхлорметилметнловый эфир. Имидазол. N.N'-Карбоннлдиимид-
азол. Лития три -трет -бутокси алюмогидрид. Н-Метил-М-феиилкарбаминонлхлорид. Нат-
рия гипофосфит. Натрия нитрит — СГ,СО2Н — ДМСО. н-Нитрозо-N. N-ди метил а нилиН.
2-Нитропропан, натриевая соль ацм-формы. Ортомуравьиной кислоты триэтпловый эфир.
Ренея катализатор никелевый. Титан четыреххлористый. rt-Толуолсульфонат серебра.
Трпметиламина окись. Формальдоксим. Фосген. Этилат натрия. Этилен имин Этоксиме-
21 * 643
тнлгпапплпп. Амидпиоц циклических: Ортомуравытон кислоты триэтцловый эфир. Ами-
дов: Аммония ансзат (фэрми я i ) 1 (’Кеахлорциклотрпфсы^азаАрпсп. ] Гиюобмгн пые смолы.
Серным ангидрид — диме: плформа.'.н’д. «-А ми но цетинов: Меа ила г натрия. Агпидрндцв
карбоновых кислот: тр цы-1.2-Дибензоил этилен . I-xctcii. Метцкспацеаплс-н. Серо у тле pop,.
N-Т pi гфгор а цетил и индазол. Фспнлинаиат. Фосген. 2, 5-Ангидросахаров: Бром — ацетат
серебра. А рил гидразонов: /г-Карбоьснбензолдиазонийклорнд. 1-Ари л циклопропанов:
1.3-Дпхдораиетоп. Ароматических соединений: Вцпил-^З-карбметокспз'! ил)-кстон. Аце-
тилен б ром и до в: Трпфепнлфосфиаа дибромид. Ацетиленов: ТртЬснилфосфин. Ацетиленов,
диенов, енипов: 1 - Тр и метил силил пронп н и л л итп й -3. S-Ацетилпантетеина: Этил спи мин.
Ацилоинов: Ацетоуксусной кис.тс гы tupiW-бутиловый эфир. Бензоила перекись. Бром-
ангпдридов кислот: о-Фенилен Д11окспфо:'фортриброМ11Д.' /«р^т-Бутн-памина: Моченипа.
н-Бутилсульфата: Сульфурил хлористый. В и ни л л и тин: Трифепилхлорстяцнаи, Гелъ.мнп-
тоспораля: Метцлвинилкетон. Гетероциклов: Азотистоводородная кнслспа- Амг.нофтали-
мпд. Ацетилаиетоп. Ацетилеидпкарбоиовой кислоты днметплопыи эфир. Бора трихлорнд.
Бромциап. /ирст-БутилпзоциапнД. Виц:1лтрифе1-1илфосфоиц1'|бромид. Гидразин. Гидро
ксилампи. Гидр'тхспламин-О-гульфокпслота. Дпазометандисульфонат калия. Дикетен.
Димстилформампда дпэтиланеталь. Ди мстилформамцд — РОС1;!. Дифсиилдпазометап.
Дихлорформокспм. «ДпцнаиаМидж Днцнклогем'илкарбодиимид. Диэгоксиметнлаце-iат.
МЖ'-Царбодипмидазол Нитрил алюмохлорнд. Метилвипилкетоп. Моченниа. Муравьиная
кислота. Натрия нитрит. ОртомуоявьнНой кислоты триэтцловый эфир. Пиперидил. Поли-
фосфорная кислота. Полифосфорпой кислоты эфиры. Тетрациаиэтнлеп. Тпомочевина.
Тиоесмикарбазнд. Тиоцианат натрия. Трпфснплметилш-рхлорот. Фснилгидразпн. Фенпл-
диазо.четан. о-Фснплендиамин. Феиия-(тригалогенметил)-ртуть. Формальдегид. Форма-
мид. Формамндннпя ацетат. ощнсЦФормампдофмстаи. Щавелевой кислоты диациловыи
эфир. ЭтНлат натрия. Этоксиметп.ленциа11уксусиой кислоты этиловый эфир. Диазиридинов:
Хлорамин. Гидроксила мин-О-сульфокислота. Диазиринов: /(ифторампн. Дихлорамип.
Диазокетонов: Триэтиламнп. Диазососдинений: п-Карбоксибепзолеульфонилазид.
ц-Толуолсульфопилазид. Диалкилфосфнтов: Ц-Фенилнминоэтилфосфит. Диарилов: Тал-
лия(1) бромид. Диари лциклопропепонив: Феи и л-(три га л о ген мстил)-ртуть. д-Диацетил-
беизола: Аз отпето водородная кислоту. /ирмс-1,2-Днгидрофталевой кислоты: Натрии
амальгама. Диенов: Медь хлористая. 1,5-Диенов, 1-ен-5-ицов: 1-'Гриметилсилилпропицил-
литий-З. Диенов через цикле.бутаиы: Винилацетат. а-Дикарбонцльных соединений: Ук-
сусной кислоты натриевая соль. гелг-Диметилциклопропанов: 2-Диайонроиац. 1,5-Диолов:
Мстилвипнловый эфир. Дисульфидов: Азодикарбоновой кислоты диэчиловый эфир.
гелг-Дитиолов: Морфолин. [фР-Дифторстирола: Хлорднфторуксуспой кислоты натриевая
соль. Диэтилцинка; Пнпк-медпая пара. Енаминов: иыгпрам^ДДиметиламинофтг.тая. Пи-
перидин. Пирролидин. Титан чотырех’клористый. Изонитрилов: Pipem-Бугилат калия.
N, N- КарбонплдпимиДазол. 2-Феинл-3-мстил-1,3-окса зол и ди и. Фосген. Изоннтрозопроиз-
водных: Натрия нитрит. Изопреноидов: ЭтоксиацегИлсн. Изоцианатов: Толуолдиизоппа-
пат. Трцметилхлореллам- Фосген. Имицозафиров: Трнэтцлоксопня борфторид. Ипаминов:
МеДИ(1!) ацетат. Йодидов: о-ФеинлсЦхлорфосфат. Карбаматов: М-Карбонилс'ульфампноиой
кислоты Хлорангндрид. Натрин цианат. Карбонил ат о в: Феннлизоцнйпнт. Карбобензокси-
хлорида: Фосген. Карбодпимидов: Фосфорный ангидрид — трт-амин. Карбоновых кис-
лот: 1,1-Дихлорэтилеи. Карбоновых цепей: Ацетилен. Бромтрифторметан. Карбоцикличе-
ских соединений (см. также Дильса Альдера реакции): Аллен, р-Бромэтилметилкетоиа
эгилецкетадь. Внцпл-((3-карбме7оксиэтпл)-кстон. 3,5-ДимеТил-4-хлормслилизоксазол. Ди-
хлоркетеп. Железа иопакарбонпл. Никеля карбонил. биг-(ТрифеиплфосфП11)-никсль-
днкарбоипл. Каибатоксиазепина; Уголыюн кислоты этплоного эфира азид. Карденолнд-
ных йглюкопов: Диэтил Цпаимстанфосфопат. Зтоксиацстплепид лития. Каротеноидов:
Алюминия окись. Этилвиинловый эфир.Этплироисниловый эфир. Этокспацетилснпд лития.
(А-Кетоалленов и и,Р-непасыщенных кетонов: Изопроненилметпловый эфир. н-Кетоаль-
дсгидов: Азрдикарбоновон кислоты днэтнловый эфир. Натрия Нитрит. Трнфепилфосфип.
Кетонов: й.З-Дн.мстил-2-бугилборап. Железо. Имидазол. Малоновой кислоты ди-трс/??.
бутмоный эфир. I(напазпд. [3-Кетосульфоксидов: Диметилсульфоксмда производные (а),
[j-Кетосульфонов: Дпметилсульфон. а-Кетоэфиров: Диэтилкарбонат. Кумаринов: Фто-
ристый водород безводный. Кумуленов: Амид натрия. Метиллитий. Цинк, пыль. Лакта-
мов: гнрт-Бути.лэт калия. Ннтрозилеерная кислота. Лецитинов: Фенилдихлорфосфат.
Me ж нуклеотид ной связи: ЗД.й-Трпизопропилбепзолсульфохлприд. Меркаптанов: Натрия
трнтиохарбоиат. Мета циклофанов: ФенилПтрнгалоген метил )-ртутц. Метнлкетонов: /Мало-
новой кислоты дцбеизиловыц эфир. ?Метиллитнй. Метилциклогексилкетопа: Метлллптий
(и Цикдогексанкарбоповая кислота). Моноглицерндов: Борная кислота. Монохлоразири-
дина: ДихлорметиллптпЙ. Нафтазарина: Серы гпсстиокпсь. а,(3-Ненасыщенных карбо-
нильных соединений: Ацетоуксусной кислоты трет-бутиловый эфир. Калия фторид,
i -Мето кс и бутен-1 -ин-З. N - Нитраминов: Ацетонциангидрина пи грат. Нитрилов: ГнДрокснл-
амип. Гндроксиламцна хтюргидрат. N,КГ-Диметвлгпдразиц. 1-Нитронропац. Трифенид-
фосфпн. ОЖ-б?;с-(Тр11фторацстпл)-гидрог<силамцп’. Хлорсульфоннлизоццанат. ХлорЦцац.
Норборнана производных: Норборпен. Нуклеозидов: Адамантан-1-карбоновой кислоты
хлорангидрид- б£(с-(1ч-Ынтрофенил)-гидрофосфат. Нуклеотидов: Ме.зитиленсульфохлорид.
Хлоругольной кислоты пзобутилопып эфир. Оксаадамантанов: Ортомуравьитюй кислоты
Три этиловый эфир. а-Оксикетонов: Дикетец. Оксиксантонов: Цинка хлорид — фосфора
хлорокись. Оксикумаринов: Цинка хлорид - фосфора хлорокись- Оксимов: Ацстальдок-
снм. Оксиранов: ДимотилоксоеуЛ1Ц)опинмсти.’1нд (производные ДМСО). ц-Оксоэфиров:
Лития бромид. ,’<нс-9-Октадеценилбромида: Магния бромид. Олефинов: Дибромднфторме-
тан- ХЖ-Тнокарбоинлднимидазол. Трнмешлфосфит. Фосфора хлорокись. См. та клее. Оле-
финов синтез. Олигонуклеотидов: (3- Бон зоил пропионовая кислота. Параццклофапов:
Алюминия бромид. Первичных аминов: Имииодпкарбоионон кислоты Дп-щреш-бутиловый
эфир. Пиразолов-. Феи и л-(три галоген метни )-ртуть. Пиридинов: 3.5- Диметил-4-хлорметил-
изоксазол. II иридия солей; Бутил хлористый. Сульфо ухе ус и а я кислота. Пирролов:
614
2,5-Диметилтетрагидрофуран. Полиненасыщенных кетонов; Изопропенилметиловьгй
эфир. Псевдопеллетьерина: Глутаровый диальдегид. Серина: Ртути ацетат. Спироцикло-
пропаиов: Симмонса — Смита реагент. Стероидных колец А: 1,3-Дихлорбутен-2. Стероид-
ных ортоэфиров: Орто муравь и ной кислоты три этил оный эфир. Стероидов: Метилви пи л ке-
тон. р-11ропиолактон. Этилвинилкетои. Это кем ацетилен. Сульфамидов: /г-Толуолсульфо-
хлорнД. Сульфоксидов: Надмуравьиная кислота. Перйодаты. Сульфонов: Ди мети л суль-
фат. 11олифторфосфорпая кислота. Терпеноидов: Ме.тилцпклопропилкетои. Тетразолов:
ТетраметнлгуанпдинийазиД. Тнонтовой кислоты: Тиоуксусная кислота. Тиомочевины:
Беизилизотпоциапат. Тиофенолов: Днметплтиокарбоиилхлорид. D.L-Треонина: Бензил-
амин. Ртути ацетат. Трибензамида: Лития нитрид. Трифенилфосфазинов: Молекулярные
сита. Трихлорметнл-бмс-трифторметилкарбинола: Трихлорметиллитий. Тропилия солей:
трегн-Бутцл хлористый. Трифенилмстилперхлорат. Тропинона: Ацетон ди карбо нов а я кис-
лота. Тропона: Серебра борфторид. Ундециленовой кислоты: 2-Метилфурац. феназинов:
Нитробензол. Фепилнитрометана: /Метил нитрат. 4-Фенил-1,2,3-триазола: Триметил сил ил-
азид. Фенолов: м-ПнтробензолсульфоиИла перекись. Триметилборат. Фенолятов натрия:
Натрия гидрид, а-фторкетонов: Нитрознл фтористый. Фульвенов: Диметилформампд —
диметнлсульфат- Фуранов: Ди аз о уксусной кислоты этиловый эфир. Ди мсти л сульфоксида
производные. Диметоксисульфонийметилид. Фуроксаиов: Азота четырехокись. Хинонов:
Глиоксаль. Хлорангидридов: Бензоил хлористый. Диметилформамид — тионилхлорид.
1,1 -ДихлорДиЭтиловый эфир. N.N'-Карбонилдиимидазол. Оксалил хлорид. о-Фенилендиок-
снфосфортрихлорид. N-Фенилтриметилацетимидонл хлористый. Фосфор пятихлористый.
Фосфор трехХлористый. Фталевой кислоты дихлораигидрид. 4-Хлорбензфуразана: Натрия
азид. (З-Хлоргликозидов: Алюминия хлорид. «-Цефалинов: Фенилдихлор фосфат. «-Циано-
кислот: Формамид. (3-Цианоэфиров: Хлоругольной кислоты этиловый эфир. Циклических
кетонов: 1,3-Дитиан. циклобутанонов: Диметилкетеп. Циклогексадиенов-ЦЗ: транс-2,4-
Пснтадиеповой кислоты метиловый эфир. Циклопропанов: Диборан. Дифенилдиазометан.
Днхлорметиллитий. Диэтилалюмннийиодид. Диэтилцианметилфосфопат. Лития алюмо-
:идрнд. Натрия гидрид. Симмонса —Смита реагент. Трихлорметиллитий. Триэтилфос-
фоеволпируват. Циклопропанонов: Диазометап. Кетен. Цнклопропанонгндрата: о-бис-
(Оксиметпл)-бензол. Циклопропенов: Лития алюмогидрид. Натрия амид. Циклопропено-
нов: Фенил-(тригалогеи метил )-ртуть, Циклопропилалкил кетонов: Диметилсульфоксида
производные (а). Циклофанов: 1 Л-Днтиац. Циклофанов эфиров: Этил-(диметилсульфура-
нплидин)-ацстат. Эпоксидов из кстоиов: Диметилсульфоксида производные (а). |3-Эпокси-
кетонов: Никеля карбонил. Эпоксихиионов: Натрия перборат. Этилентиомочевнцы:
Этилендиамин. Этоксалоилкетонов: Щавелевой кислоты диэтиловый эфир. Эфиров;
N.N'-Карбонилдиммидазол- Эфиров (сложных) изоолефинов: Бромуксусной кислоты
этиловый эфир. Дибромуксусной кислоты этиловый эфир.
Сираупа синтез. Железа(П) сульфат.
Смешанных ангидридов синтез. Триэтила мин.
Смоляные кислоты. Пиперидин.
Соли маслорастворимые. ТетрагентиЛаммония хлорид.
Соммле реакция. Гексаметилентетрамин.
Спиртов классификация. Трихлорацетилизоцианат.
Стероидов ^ис-метилендиоксипроизводные. Формальдегид.
Стефепа альдегидов синтез. Олово хлористое.
Сульфатов получение. Серный ангидрид — пиридин.
Сульфирование. Серный ангидрид. Серный ангидрид — диоксан. Серный ангидрид — пири-
дин. Серный ангидрид — триэткламин.
Тиле реакция. Бора трифторида эфират. Серная кислота. Хлорная кислота (см. 2-Окси-1,4-
нафтохинон). Уксусиофосфорный ангидрид. Уксусный ангидрид. Цинка хлорид.
Тиоацетилирование. Тиоуксусная кислота.
Торце конденсация. Диметилсульфоксид.
Тримеризация аминов. Алюминия хлорид.
Триметилсилилирование. бис-(О.ЬКТриметилсилил)-аи,етамнд.
Трифеиил метилирование. Трифенилбромметан. Трифен ил хлор метан.
Трифторметилирование. Трифторподметан.
Трихлорметилирование ангидридов. Трихлоруксуспой кислоты натриевая соль.
Тропилия соли, трет-Бутил хлористый.
Тэйлора — Мак-Киллопа реакции. Таллия этилат,
Уайта дезаминирование. Азота четырехокись.
Углеводов комплексы. Борная кислота.
Удаление, Азотистой кислоты: Мочевина. Брома: Ацетамид. Фенол (см. также Бромистый
водород). Воды: 2.2- Ди меток с и пропан. Пропионовой кислоты этиловый эфир (см, также
Осушители). Галогенводородов; Аммония ацетат и формпат. Ацетамид. Магния окись. Про-
пилена окись. Эппхлор гидрин. 1,2-Эпокси-З-фсноксипропан. Этилена окись. Этилендиа-
мпп. Радикалов: Гальвипоксил. Ди-трй/п-бутилиминокснл. Селена и его соединений;
Свинца ацетат. Цинка ионов: Этилендиамиятетрауксусная кислота.
Улавливание. Алленов: 1.3-Дифенплизобензофуран. Альдегидов: N.N'-Дифенцлэтилендиа-
мин. Карбена: Циклогексен.
Ульмана реакция. Меди закись. Медная бронза. Медный порошок.
Фаворского квазиреакция. Серебра перхлорат.
Фаворского реакция. Серебра перхлорат.
Фендцилирование. ЭтилДиЦиклогексилаыпн.
645
Фенилирование. Дифснцлиодоинйбромпд. ДпфенилподониЙхяорид. Иодобепзол. п-Толуол-
сульфокпслота.
Фепиловьгы эфиры. Фосфора хлорокись.
Фенолов восстановление. ЬФеппл-З-хлортетразол.
Фенолы, защитная группировка. ллорметилмстплоный эфир.
ферментов титрование, N-транс-Цчипамоилимидазол.
Фильтрование. Целит.
Фишера синтез индола. Полпфосфорная кислота. Полифосфорной кислоты эфиры. Цинка
хлорид. Эти леи гл и кол ь.
С-Формил ирование. Дндютилформампд — тнонилхлорид. Дпметилформамид — фосфора
хлорокись. ЖМетнжрщФлани.тад. Муравьиная кислота. Муравьиной кислоты этиловый
эфир. Натрия гидрид. Натрия отплат. «-Ннтрозо-К.У-диметилаццлин. Ортомуравьииой
кислоты гриэталипыи эфир. Формил фтористый. Фосфора хлорокись.
N-Формулирование. Муравьиная кислота — формамид. Муравьиной кислоты п-нитрофени-
ловыи эфир. X-Формил имида зол.
О- Форматирование, Муравьиная кислота. л-'Голуолсульфохлорид — диметилформамнд.
У ксусномурдььппын ангидрид. У-Фор^цл имида зол.
Фосфорилирование. Лзидофосфориой кислоты метилового эфира натриевая соль. О-Бсизил-
фосфористь|й-0.0-дифенп.чфосфорнь1й ангидрид. а-Бромцианацетамид. Дибензилфосфат
серебра. Днброммэлопонон кислоты Цианид. Дн-ц-иитробеизнлхлорфосфат. Диоксанди-
фосфат. Дифеиилфосфат серебра. Дифенил хлор фосфат. Метафосфорная кислота. Пиро-
фосфорилтстрахлорид. Полифосфорная кислота. Тетра-л-иктрофснплнирофосфат. бис-
(з.2,2-Трихлорэтил)-хлорс])оС[Ьат- о-Феинленхдорфосфат. Фосфора хлорокись. Фосфорная
кислота без.воднап. Фосфорной кислоты .хлораигидрида диморфолид. Фосфорный ангид-
рид — фосфорная кислота, 2-Иная метилфосфат. Этокспацетилен.
фотобромирование. N-Врома нота мнд.
Фотоизомеризация. ргутМН) окись. Цнклопеитаднсноиа кетали,
фотоприсоединение. Угольной кислоты этилового эфира азид.
Фоторазложение. Железа поиакарбонил. Иода азид.
Фотосенсибилизаторы. Бензофенон (см. 2-Диазонроиап). Метиленовый синий (см. Формамид).
Михлера кетон.
Фотохимический сенсибилизатор. Мнхлера кетон.
Фотохлорирование, трет-Бутил гипохлорит. Дихлорвшитаснгтарбонат. Лития диниклогек-
силамид. ТетрагиДрофгалазии.
фотоциклизация. Тетрахлорциклопентадиенона этиленкеталь.
фотоциклофил. Дихлорвнипленкарбонат.
Фогоэлимииирование. 2-Диазопронан. Кода азид.
Фрагментация а,Р-эпоксииетоксимов. п-Толуолсульфончлгидразин.
Фракционирование водорастворимых веществ. Сефадекс.
Фриделя — Крафтса ацилирование. Алюминия бромид. Алюминия хлорид. Дифенилкарба-
миноплхлорид. Метилен хлористый.
Фриделя — Крафтса катализаторы. Алюминия бромид. Иод. Железо.
Фриделя Крафтса реакция. Алюминия хлорид. Бе изолсульфокислоты ангидрид. Бора
трифториД. у-Бутиролактон. 2.4-Динитробензолсульфенхлорид. 1.1 -Дихлордиметиловый
эФир. Иод. Натрия алюмохлорпд. Олоно хлорное. Пирокатехина днхлорметнлеиовый
эфир. Полифосфорпая кислота. Сера. Сера однохлористая. Титан четыреххлористый.
Треххлористый азот. Фтористый водород. Хлориетилмети.ловьпй эфир. Хлороформ (рас-
творитель). Цирконии четыреххлористый.
Фриделя — Крафтса типа реакции. ДиметилацетаМпд. Иодозобензол.
Фриса реакция. Алюминия хлорид. Титан четыреххлирк.стьгй.
фторирование. Дп'тгил-Д-хлор-1,2,2-трпф горэтил)-амнп. Натрия Фторид. Перхлорилфторид.
Свинца тйерйфторпд. Серо четырехфтористая. Серебра дифторид. (Трифтортио)-бензол.
Фторокситрифтор Истай.
Хипоны. Алкилирование: Лцилоь перекиси. Присоединение: Азотистоводородная кислота
(см. также Дильса — Альдера реакции).
Хинсберга проба. Бснзо.зсульфохлорнд.
Хлорангидридав киелог обмен атомов хл.ора. Цинка хлорил.
Хлорангидридов кислот удаление избытка. З-Диметиламиномропцламиц.
Хлоргидринов образование. Мочении;;.
Хлордезоксигенирование. Фосфор иятихлористый — цинк хлористый.
Хлорирование. Бензоила перекись, Ф/;с/таБутилги1ЮХлорит. Диметилформамид. Иодбензола
дпхлорнд. Медь хлорная,. Метансульфохлорид. Натрия хлорат. Селена хлорокись-
Сульфурил хлористый. Тетра-ч-бутила.ммонипиодтетрах.ториД. N-2,4,6-Тетр ах лор ацетани-
лид. Тиснил хлористый. Трифеннлфосфпидпхлорид. ТрихлорметансульфоХлорид. о-Феии-
леидиокспфоьфор^рц.хлэрпд. Фосфор п яти хтюр истый. Фосфор треххлористый. N-Хлор-
еукцииимид.
Хлористого брома источник. N-Брома нота мид — хлористый водород-
Хлоркарбонилнрование (введение СОС1). Оксалилхлорид.
Хлорметилпровапие. /Метилаль. Формальдегид.
Хлорсульфироваиие. Хлорсульфоновая кислота.
Хроматография. Серебро борфторпд.
Хунсдикера реакция. Бромтри хлор метан (растворитель) (см. Фосфор ИЯ'гибромистый). Ртути
окись. Таллия этилат.
646
Цветные реакции. Борная кислота (оксихщеоны). Галоформная проба. л-ДКгМетя.тэмипобснз-
альдегид (пирролы). Желсза(Ш) хлорид (енолы, фенолы). С.у.-.ифоуксусиья кислота
(проба Либермана — Бурхарда). 'Гстрапмтрометаи (проба па гг“пл<.'ьчг''<-1ГЕй'>ств) Фопилгид-
разни (реакция Портера — Уилбере).
Цианистого водорода присоединение. Апстопш'зпгпдрип-
Цианэтилирование. Акрилонитрил. Б-Бромиринпоин грим. Трпгои Б. Холан.
Циглера циклизация. Лития диэтпла-мГгД.
Цикла расширение. Азоткетоводородиая кислот;!. Диазол1е,:;1и. Дни юу ксусиый эфир. Иода
изоцианат. Натрия нитрат. Х„тар<,мта-1.
Цикла сужение. Хлорамин.
Циклизация. Алюминия хлорид. Бора г pi [фторида эфньат. сЪиопбмснн ыс смо/н-'', Пития ди-
этиламнд. Метаисульфо,кислота Натрия алюмохлерти'.. Натрия метилат. Никеля карбо-
нил. Олово хлорное. Полпфосфорная кислота. Птатафосфорн-;!) кислоты эфиры. 1'тутп(И)
анетат. б;ы-(Тргта1етилсилил)-патрип;:М1 Я оиФтапуксх.т:ан кислсга. Фосфорная кисло-
та — муравьиная кислота.
Циклодегидратцция. Алюминия хлорид (см. таки;:- ФдуС'реп-н- у гы а таиф: кислоты ист и.таный
эфир), ьромистонодородная кислота. Х.яут-срм А. 1 ,й-' :; a 'ста i io: зло-f 4. 3. ОБ: юн си - 5.
З.З-Дяхлор-бф-дцциан-1.4-бензоХ|И)он. I, i-Да хлор-2,гилтлеи. Дихлортатеи. Ка-
лия бисульфат. Натрия злюмохлорид. Пс'ЛНйюефорпая нытата. 1 [олпйюсфорней кислоты
эфиры. Серный апгндрцд — днмегнлформлмпд. Тног.и.ч '.topikiый. > олуод^улцфокис-
лота. Трифторуксуспая Кислота. Грифтаруксуспи,:и аогтм.'ид- биосфер;.: хлорокись. Фос-
фора хлорокись — фосфорная кислота — фосфорный загиирня. Фосфорный ангидрид.
Фтористый водород. Фторсульфоповяя ккс.-кла. Х’логч) а' । i; я слота
Циклоприсоединение. Дифсяиытн.эрбодш'мид- Д к хлорин в и ле;: карбон а'. 1 .1 -Дни лор -2. 2-
дпфторэтнден. Дихлоркетеи. N.N-Диэтал-J -прг.иыштаампи. Тетр а циан ='i плои. Трпметил-
с ил и л азид. Угольной кислоты этилового (м.етк MOHorii) эфира анид. Циан азид.
Циклопропана образование. Ди-л плцпнк — метилен подпетый.
Шимана реакция. Арплдиазоцпя гсксаТгорфцефаты. Арнлдназония тстрагалогенбораты.
Борфтористоводородная кислота.
Шмидта реакция. АзотпстоводороДная кислота. Натрня а жд.
Шоттен— Баумана метод. Мстаисульфсхлорид.
Штоббе конденсация. Азотистонодородчая кислот;’.. Янтарной ы'.сдоты ди-притн-бутиловый
эфир.
Электрофильное замещение. Пикрил х’лорпд. Серебра бор фторид. Трцфторуксуспая кислота
(растворитель).
Элиминирование HOR. НОАс. Амид натрня. ХромДП) хлор1<д.
Элиминирования реакция. д-Толуолсульфог. пл си дразня.
Эпимеризация. Тетраэтпламмокия ацет ат.
Эпимеризация вторичных спиртов. Тетра этилом г гения форМии:.
Эпоксидирование, tupc-fn-Бутила гидроперекись. Гек:'амет!)лтр:!:;;ч11Д фгшДрний кислоты.
Молибдена гексакирбоипл. Мопопадмалеиновгя k;icм?:'. Мс.ч'опа.гДталст.ая кпе.чоти. Пад-
бензойная кислота. Надуксусная кислота ГБпрпм т-рбор-ят. Натрия гипохлорит. Пере-
кись водорода. л1-X лорпадбензойпая кислот а.
Эпоксиды из кете.нов. Д метил сульфоксида прпизнодные (б) и (в). кзымспизеиия: Диизобу-
тилалюмогидрид. Магния бромида эфират. Метилирилктаг.;: (нкютп.тмзгяпй.
Этерификация (простые эфиры). Изобутилен. Молекулярные сате, Х.тарта.я нислота.
Этерификация (сложные эфиры). Алюминия окись для ’ эториф:;каики. Бори трифторнд.
Диазомета л. Димети ла пета мял Ди мсти леул ьфпт. )и мстил фс гыа у ;<д, ; (и метил формамида
динеопентила деталь. Ди мети л форма ми да дпэтвл аист аль ДиФео'Ыщиьзометан. Изобути-
лен. Ионообменные смолы. .Метансульфокислоты ангидрид. .Метил подпетый. 1 -Метял-З-я-
толилтриазеп. Молекулярные сита. Орто.мупнньпаой кислоты тупэтнлог.ый эфир. Иолц-
фосфорная кислота. HCI, 2%-пьп1 раствор в метаноле (см. Уксусной кислоты хлора о гид-
рид). Сульфосалицнловая кислота. Сульфурил хлористый. Укоип;! хлористый. н-Толуол-
сульфокислота. таТолуолсульфохдсгрид. Тр1)фторукс'Г(Т1то"| ангидрид. Тичхлорпзоциану-
ровая кислота. Триэтиламин. Хлорная кислота, ^илдкцкклогексильмин.
Этерификация (сложные эфиры) асимметрическая. о.-Фснплмпсляпоп кислоты ангидрид.
Этерификация фосфорной кислотih. Трихлорзщ’токитрсл.
Этилирование. Пентаэтокспфосфоран.
Этилирование гем-ди галогенидов. Трпэтп л фосфит.
Этилирование спиртов, фенолог, кислот. Тpiiyr;i.rioi<r,'>::ii.H боуфторкд.
Этинилирование. Лития ацетиленид.
Этинилкарбинола ацетаты алкилаллены. Мурзы.таю я там лот;:.
Этоксилирование кетонов. Щавелевой кислоты диэталотаяй эфир.
Эфиры, переход от простых к сложным. Трнхдорпэоцпапуровая кислота.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Абиепол V 37]
Ат' ,J-A6neTадненовая кислота II 98
Д8',2-АбиетаД1;еповая кислота II 146 1.4с.'
Абиетиновая кислота I 252, 27]; Ц
Ц] 244; V 122, 380, 557
Абсцизовая кислота V 73
Адамантан I 37, 110; II 34S. 349; V 7, 17
]-Адамантанкарбониной кислоты хлорангид-
рид V 7
3'- и 3’-АдамантОил-2'-дезоксп-5-фторури-
дниы
Адамаптанол-1 I 9, 418; II 349
Адамантапол-2 II 349
Лдамацтил-1-уксусная кислота I 418
5-Адамантилхлорформнат 1 9
Адамса катализатор См. Платиновые Ката-
лизаторы
Адеццн 111 147
Аденозин I 3 74; Ц] 147
3'.У-Дифосфат Ill 126, 282, 283
N -окись ] I 455
5'-фосфат IV 272
3 '-фосфат-5'-сульФатофосфат III 282,
283
Адипиновая кислота I 9, Ю, 29; II 10/,
40.]; Ц] 81
ди этиловый эфир I 207; II 394, 415, 416
Адипиновый диальдегид III 89, 198
Адкинса катализатор I 10, 11
Адреностероц II 221
7-Лзабензонорборнадиен V 473
1-Азабицикло-11,1,01-бутаны V 140
З-Аза-А-гомо-4-кетостероидьг 1)1 141
Азелаиновая кислота I] 90, 91; III 87, 162
Азслаиновьп! моноальдегид 1] 49
2.511-2,5-АзеИИнДионы ] 27
1Н-ДзепИ11Ы V 216
Азетидин I 402; II 462
Азетпдпны I 156
Авидогидрохииоп I 27
2р-Азидо-За-иодхолеетан II 39
1-АзцдоИропанол-2 Н 362
Азидофосфорной кислоты метилового эфира
натриевая соль V 9
/пг>й/а’-2-АзидоЦиклОиептанол II 362
Азпды 11 385, 415, 416
Азиридиния соли I 246
Азирнднноны И 396
Азиридины (Этилспимины) I 61; I] 39, 44,
173, 444. 452; Ill 27, 28; IV 10, 264; V 81,
] 88, 212, 215, 246, 475
стероиды 1 205
Азирины II 40; V 2)2
Азлактопы III 280; 1V 15; V 475
Азобензол 1 12, 13, 205, 212, 281; И 58,
387, 439: HI 75; IV 34, 224, 225; VIII
n-Азобензол кар боновой кислоты гидразид
I 1 I
Азобензолы Ц1 65, 467
Азодиизобугироиптрнл I 11, 170, 396; II 38
Азоди карбон она я кпслщ а
днамид I 12, 281
ди-tnpern-бутиловый эфир I 12
дикалиевая соль I 12, 13, 28], 282;
V НО
Диметиловьи! эфир IV 47
диэтиловый эфир I 12—15; V 9, 281
6,6'-Азо-5,5'-днхпнолил IV 81
Азопзобутан II 41
Азоксибензрл I, 205; HI 164, 467
Азоксибензолы ]I] 63
б.б'-Азокспхицолин IV 81
Азометипы J 74; II 348
тра/-/г-3,3'-Азо-бйс-(2-оксазолидицо1г) V 372
Азот I 15, 16, 187
Азота двуокись I 21
Азота окпслЫ ] 16, 17
Азота пятиокись (азотный ангидрид) I 17, 18
Азота трифторид см. Трифторамин
Азота четырехокись I 18 — 24; V 1 1; 213, 496
Азота четырехокись — бора трифторид 1 24
Азотистая кислота II 329, 412
Азотистоводородная кислота I 25 — 28; V 524
Азотистый ангидрид — бора трифторид I 28
Азотная кислота I 29 — 31; ![ 329, 433
дымящая I 13; V 334, 336
Азулен I 368; И 23'2; HI 100
Азулен-1,2-дикарбоновой кислоты димети-
ловын эфир I 78
Азуления борфторнды 1 124
Азулены HI 101
Акридизиний бромистый III 305
Акридин Ill 359
Акриловая кислота I 52, 364; II 328, 442; V
21
н-бутиловый эфир III 347
метиловый эфир I 131. 181, 255, 386; П
328; ]Ц 347, 392; V 22
хлорангидрид ] 100
этиловый эфир I 248
Акрилоилуксусной кислоты метиловый эфир
см. Винил-(р-карбметоксиэтил)-кетон
Акрилонитрил I 31, 248; II] 149; V 31, 91
Акролеин I 52, 70, 287; Н 466; II] 33, 71, 72,
77, 231; IV 275; V 15, 200, 347
Димер II 291, 292
Диэтилацеталь I, 70; III 35
Ь-Аланил-Ь-пролин И 150
Алании I 136; III 1 12, 207; V 475
P-Алации I 32
Алказоцы из 1,3-днокси ацетон а, эритрозы,
арабинозы, ксилозы П 294
Алкиламипборэны ] 32, 33
Ал кил галогениды II 387
Алкилсульфаты I 33
Алкилсульфокислоты IU 336
9-Ал кнл-9-флуореполь1 11 ] 393
Алкилцианиды I 33
Алкилы подпетые I 33, 34
2-Ал ки л-5-этокс ц-1,3.4-оксадиазолы IV 10
1-АлкоксигпдропереКнси 111 69
Алкокспииримидипы II 414
Аллен 1 34
синтез Н 282—284
Аллилбензол II 54; III 61
Аллил бромистый I 62; ]И 419, 420; 1V 214'
V 329; -КУ
а-Аллнл-р-бромэтплэтилавып эфир Ш 56
Аллилизотиоцианат 111 345
АллилизоЦПанат III 345, 346
648
Аллпллитий Г 35; 111 4.19, 420
Аллил магний хлористый 1 35
Аллиловый спирт I 306, 307, 362; II 219,
241, 328
Аллилтрифснплстаннан 1 35
Аллплуксусцой кислоты диметил амид I 305
Аллилфениловый эфир 1 За
Аллил хлористый 1 262; II 2'13; V ] “4
2-Аллилциклогсксанон I 62; III 76
/Зллодуинпон III 74
Аллофипавой кислоты производные IV 189
Альдегидов синтез 11 05. 96, 464, 465; И]
113, 470
Л1 -2-АльдегиДо-З-кетостеронды 1 4 Ю
Альдозы дегидратация I 375
Альдоновых кислот лактоны ]1 368, 369
Альдостерон 11216
Альдрин 1 196; П 153
Алюминий V 15
Алюминия амальгама I 35—37; III 191
Алюминия бромид I 37, 38; V 16, 50, 191
Алюминия /преиыбутилат V 18
Алюминия гидрид I 38, 39; V 19
Алюминия иодид I 39
Алюминия окись V 181
для дегидратации спиртов 1 39, 40;
V 19
для селективного гидролиза ацетатов
первичных спиртов V 19
Для хроматографии I 40, 41
Дли этерификации I 41
окрашенная морином I 41
основная (Woelm-I) IV 62; V 146
Алюминия окись — калия гидроокись («ще-
лочная окись алюминия») V 20
Алюминия фосфид V 506
Алюминия хлорид I 41—54; V 16, 21 191,
301. 357
Алюминия хлорид, эффект избытка при
бромировании I 52, 53
Альдопираноэы V 478
Амбсрлптовые смолы см. Ионообменные
смолы II 62—65
Амид калия 1 54—57; V 24
г\мид ЛИТИЯ 1 57, 58; II 272; IV 273
Амид натрия 1 58—66, 253. 437; II II, 267,
431; IV 269; V 24, 57, 175, 200, 290
Амидины II 439
циклические III 38, 39
Амидов дегидратация И 364
Амидра.зоны см Имидогидразиды
н-Амилбензол I 233
шредг-Амнл бромистый I 134
щрещ-Ампл иодистый Ill 416, 4|7
И-Амилмагнин галогениды III 33
Амилинтрат I 102, 163
н - Амилнитрит см. Изоамилпнтрит
трет-Амиловый спирт 11 73, 74; IV 158
н-Амил хлористый IV -18
] -Аминоадамантан V 429
л-Аминозэобензол I 66, 67
2-Дмино-4-а11Илипо-6-хлорметил -сялмг- триа-
зин II 260
2-Ампноантрахинон И 243
Аминоаиетофецон 1 17а; II 337. 258
п-Аминобспза.-.ьдегид I] 8
п-Аминобенаальдегид 11 410
4-Амиио-5-бензонламиио-6-мстпл пиримидин
III 139
лг-АмииобепЗойная кислота IV 16
^-А.мпнобснзойнзя кислота I 239; V 26, 235
этиловый эфир Ill 130
о-Амииобензолсмльфцшовой кислоты Na-соль
IV 27, 28
п-Ампнобензокитрил 111 42?
I-Амннобензотрпазол I 67; П1 238: V 515
2-АминобензоТриазол III 238; V 515
2-А мннобензофенон 111 363
4-Ампио-З-бром -1.2-нафтехинон V 335
Амидон иикрагы IV 235
Амипогуанидин ]V 216
2-Ами ногvаиидин, бикарбонат (двууглекис-
лый) II 329
9-(2-Амипо-2-дезокси-0-глЮКопиранозил)-
аденииы V 156
2-Амп1Ю-3-деЗокси-(3-П-глгокопиранознл-
гипоксантнн И 461
1-(2-Амино-2-дезоксп-₽-0-глюко(1Иранозид)-
тимин V 136
З-Амило-4,5-диаиетилфеноксазон IJ 103
2-АминО-2,3-дигидрофталаздисн -1,4 1 206
2-А м ин о-З, 4-диг идрохиноксалпн 1II 7 9
4-Амино -1,3-диметил -5-нитрозоурацил I 95
М-Амиг|0-2,5-диметилпиррол 1 68
3 -Амиио-2,6 -диоксиизоникотиновсй кисло-
ты этиловый эфир Ц 17, 18
4-Амино-2,6-ДлоксппиримиДИц IV 245
2-Амино-3,4-дициац-3-меркаптопиррол 111
318
а-Амипоизомасляиая кислота ] 128; 111 110
2-Амино-5-иоДбензойная кислота 1] 40
D. L-а-Аминокапролактам III 152
а-Амнпокапрономя кислота III 2г5
а-Амнвокетоны II 237
л1 - Аминокумол Ill 368
4-Амино-о-ксилол II 242
19. L-а-Аминомасляная кислота Н 304
2-Амино 6-метилбензтиазол III 292, 341,
342
9-(Аминомстилен )-флуорен 11 17
З-Аминометилпирпдин I 192
4-Амино-2 -мети л пиридин Ill 64
2-Амино-2-метмлпропапд110л-1,3 V 26
2-Амиио-2-метнлпропанол-1 I 67
2-Амино-4-метилтпазол 111 326, 327
I-(Амннометпл)-циклогексапол II 416; 111
130
З-Амино-2-нафтойная кислота IV 207
4-Амино-1-нафтол III 26
5-Амино-1 -нафтол II 82
I-Ашшонафтол-2 III 26
хлоргидрат II 8
1 -Амино -2-пафтол-4-сульф>он.ислота И 433
2-Аминопафтохинон -1,4 [ 27
5-Амнионафтохинон-1,4 II 82
2-Амипо-1,4-нафтохинон-4-11МШ1а хлоргпд-
рат II 8,9
2-Амино-4-цитрофенол I] 422
З-Амино-2-оксазолидинон V 372
2-Амчнопиридии I 58; II 397
З-Аминопиридин И 403, 404
1-АминОпириднпийиодид I 212
4-Амииоииримидо-[4,5-й1-пиримиД11и IV 74
33-Амиио-5|3-прегнанси1-20 I 94
а-Амипопропиофеиопа хлоргидрат V 28
2-Амино-3«1-4.о,95-тстрагидр10нафТ’0- [2,5] -ок-
сазол I 140, 141
4-Аминотимол 11 420
2-Амнпотиофсиол III 37
4-Амияо-],2,4-триазол II 335
N-Аминотрифснилфосфииимнп V 306
4-Аминофенантрен III 442
2-Амицо- Ц-]-фенантро-[9, 10-<£]-имидазолы
V 483
бис -(о- Аминофенил)-ди сульфид I 332
бнс-(?1-Амм:1офепил)-дисульфиД II 422; III
69
З-Амино-2-фенилипденон I 69
5-о-АмИ110фенил-4-окс)1Х1;11азолин II 3S, 39
М-(2-Аминофег1Нл)-П1шерндиц III 430
D, L-P-Ампно-р-фенИлпропиоцовая кислота I
247, 218
и-Амино-а-фенилпропионовая кислота III
НО
п-Аминофенол III 25, 80
649
2-Лм!!1|0флуореп I Oil): IV 221
2-Ампнофлуоц.'поп til ii''i
\-A 'inи';фтч.г. и '.ui;! i 27-_
.\!- (2 - A r-j j । ]; ’ ।1 ' - !^Гм> [ ь I V l('S
2-А' д:.ф.| i IV 223
Г>-Л?.п:р1.’и V 'J 3 3
z - Am при и 11 13 8, 13'3; Hl З'.А
P - Л M11 p i if: III <: । >
.м г.; л а к V ti2
.3f>:Moii иaii.e'rnT 1 68— 60
Ahmiiiiii ванадат H 423
Аммония мот авападат' f 6'2 — 70
a.mmoi-ho! нитрат 1 70
Аммония пслпеугжфкд 1 i 1 23'0, АЗО
.'.M.Mffliw Te'i’pn.'inir 6-сульфои пт Ш 302
Аммочня чиоццацат I 1 Oil
fl-JMiMffl фспнлаиетат III 260
Лимониi; формиат i (-13—69
Амэдртя .хлорид, V 32
расщепление МдХч'л-датпГ! I 232
Амфинйфтохкиок III 202
.Ангидриды .Ген.х'са II) 275
Ангидриды «спинное I) 300; ]]] 437,
136, 440
A11;' i i i. p о - 2 -1 ж с и Me p к у p • 3 -11 in ущ б ей v- а з
к ислота III 180
1С>-Л[(Грдр11г:'т<лч'11)'е’пП1 I 353
1 ,2-Aт.гилро-!. _7)-lf!)fia;jT I] i'A
i .2-A;-:i пдромноипоаит H ox
A!<>. Дн црмстадиендпсщ -3, J 7 HJ 18, 338, 339
А1:,,-.Л]|дроетадиендноч17 V 534
Д' ‘l-Лцдросгадпендио!)-.'.!, i? ! 7-утя лен кеталь
ll 155
Зк-Аидростапдпсш-3.1 7 III A'A
Андростаном -3[3 V 3>-'9
7)0-Андростаном-i 7f3 11 _222
5й.-ЛнДроелано,-;-Зг',:-о;1-j i HI J'.'iO
За-Андростаном.-3[3-ои-17, аи.стгл-ттпдоинс-
Т’н.тЬ IV oil, .j 7
Апдростацол-11 P-on -3, A’-e'im ди ацетат 11
23
Aji дрсх'таиои-З V 389
За-ЛиДростаиюп-1 1 Hl 1G4
Зи-Ацдростапон-I6 V 219
Зл-Андростанои-i 7 II 222; V 27,1)
Андростаптрпол -Зр.бб, J7₽ -3,17 - ди ацет ат Ж
227
Лидроса аптрпол-Зо.Зй.бо.-ои-17 Hi -j-3
Д’ Л -Д’ А -Л я дроса 0'1 рнои Дион-'? .17 J V 222
А'’-АнДрое'юпдп.ол-Зр. I~!1 -3-фор?шнт И 188
А ’-Андростендион-3. 1 7 I 87, 329; 11 138, 189;
IJlJUii, W; V 13 I
I Т-МОПгЩППргиДриИ 1 8?
Л"-Апдроетеиал-Зр оп-17 (Лидпостеиолон)
И 13, 21; HI -13; IV 98, 152
ацетат II 248; Ш 124; И' 88 — 88
семикарбазчп j’uci.’ia Hi 121’,.. 124
1 T-miaiii'H.'ipiiiii.-i И <:’з
Д'-За-АндроЩ'.щл;-.'-; I 335
А’-.Аидростентрнол-З'О. (и 3f>), Ир;, l?f> Н 221
Д<Лнд»остен грпов -3,11, 1 7, 1 7-std тецдщ:т;ьяь
V 31)1
гА^Аидроссптрнон-3,1 !. ЖЖтигтнксталь
111 349
Андростерон V’ 3GG
Андростерона ацетат II 24
Анетол 1П 218
<’-Aiiii;ir;piH (.-Mi-TOH'C’iaHiniiH) 1 71
н-Аннзндщ! i; 1 - Мот оРс > i a i; и л ’; г,) HI 14), 112
-АнизиДииа пикрат III НА
'г-Амнзилборнплеи - J/c/n-ди гидрид Ц1
АнИзоин III 2-1
/Анизол 1 70, Й67. ЗС9; И 37, ;53, 248; III Ий;
IV -18; V 388, 311
Аниянц ) 36. 48, 70, 2)3, 218, 282, 368. 3'8,
З'.’К. 133; И 32. 58. 2'2, -13‘.\ 445; Ш 24,
80. 4'73; IV 153; V 33. 482
ш. и о,'! стона и и с III I 12
иа 1 рщщое нрЕ.'П'.Язоднос 11 236
ащтсткн IV 2 27
AfIиеоньи; альдегид 1 217, V 403
АпнсоиыН спирт V 403
Лнис-лнровапие I 308
НОр-прудсно'ксид-Аб V 2'4
А и i Гуле пи V 273
Ain 11()Щ'1)Д;п;-(Т11 III 2(3, 133
Аптрагпдрохпноны 11 -lOl, 402
(’-Аптряльдсгнд (Антрацен-О-альдсгид) II
. 2.Hi; HI 3-1; IV 85
А игра пилон;', я; кислота I 104; П 40—4.2,
36и, 425; IV 70, 234
амид 1 205
1,4.5.8,0, Ю-.мпрэтрихнноп III 210
Аптоа.чинон I 85, 162, ‘J60, .396; II 26, 402
425: IV 179, !f;8, 197
ЛитрахnifoiiaaiiH III 356
9,! 0-7 KTpax’,nion-2.3-3HKap6oHOBoft кислоты
N-фенилвмил П) 63
Ajnрадппос-й-судьфркислоты калиевая соль
И 42 1
Литр а.хи пещ-fl-сульфокислоты натриевая
соль IV 62
Литра пси 1 45, 46, 5Н 10-4, 162, 260. 290,
339, 3 И, 396, 418; И 26, 240, 246, 391,
-Г1б; 111 16, 101. 211. 217 — 1119, 315; IV 116,
г'7, 224; V 158. 397. 398, 521
Ар.-,рацеи-О-а.нъдсГид см. 9-АитральдсгИД
Ли rpiiiten-0,10-диальдегид 11 465
Л г. т р а и.е и - 9,10 - ди и. м и и I 7 О
Аитрацеп-О, IО-дяэтилааодикарбоксилат I 70
А;(Трацеи-И-карбоновая кислота
бром;1!п'идрид Hl 13
кгоренго.дрид III 16
AnTpai'.ci; — малеиновый ангидрид III 195,
Л и тр auci-r 9 - с у л ьфок и у л о г ы н атри ен а я
соль
Аитрои II 26, 402: III 24, 29, 268, 356; IV 234
D-Арабиноза I 385; Н 369; III 79. 225
3-формпат III 225
4-форМПат III 22.5
[.-Арабинозы тозилгидразои III 359
Ь-Апабит IV 1-19
Арабоповог; кислоты 5-лактон II 369
О - Лр :1бо1то1-:ой кислоты ф-лактоп III 220
.трабоповои кислоты метиловый эфир II 369
Лрахшювая (-лНозаноная) кислота IV 91
7-Аргинин V 488, /5 44
Аргон I 187
Ар плещете,ацетаты I 283
Лрнлгалогениды фенолы III 380, 38]
Лрнлглиоксиловые кислоты II 0G
Арил ди азония
гсксафтирфосфаты ] 70 — 71
тс'Трлгалогенбораты 1 71 — 73; V 26
2-.Лр111Л11ндап;;щ,)ПЫ-1,3 III 150
^’ИЛметнлкйтоНЫ I 73
3-ApiiooKcijiipoiiHoiiOBbie кислоты 1П 139
1-Лрпл 1,3н;рониленгликоли II 222
З-Ари.тгеЕразолы 1 28
Арилгретапы II 361
/цждта — Эйстерта реакция I 247
/Ароил бе идо Иные кислоты П 224
Ащ'.орбипокия кислота ]И 80
I.-AchaparintoBoii кислоты ангидрида хлор-
г'идра? I' 418
,'ч'изин Ill 179
АурсоминггП см. ?4лортстраииклин
А-Уринтрнкарборовая кислота IV 68
Аценафтен I 41, -15: II 391; 1П 101, 218 IV
116. 117, 130; V 213
Аце:1(тфтеиол-7 III 218
650
Аиенафтенон-7 HI 218
Аценафтенхиноп И 378; V 233
.Аценафтилен 1 408; II 391; III 10, 42, 398;
V 139
1-Аценафтилуксуспая кислота HI 260
3- и Ир-Аценафтоилфпроппонов.ъ; кислота
1 44 — 45
АцеталиЗация Обменная III 291
Ацетальдокспм I 73
Ацетамид 1 73, 326; 1V 103: V 27
4, Д-'-бпсААцетамидофачобензм II 42]
п-Ацетамидобензолсульфохлорид I 74
Ацетампдокарбинол V 27
З-Ацеламидометил-Ф-цистеин V 27
/Лраус-Ацетамидоциклогексилбромкд V Al
Ацетанилид I 26, 74; ]] 448; '1V 156; V 70
L-N-Ацетиланилин V 475
4,4'-бис-(Ацетилам1шо)-азобепзол П 421
2-Ацетиламино'З-бромантрахинон 11 243
З-Аи.еттгламино-2-бугаион 11J 1)2
9-Ацетилампно-п1рсгнс-декалин Ш 140
Э-Ацетиламино-ццс-декалип 111 140
5-Ацетиламино-Й-пафто~’1 II 82
7-Ацетиламино-2-нафтол 11 82
8-Ацетиламино-2-нафтол И 82
2-Ацетиламинонафг1 охни он-1,4 И 9
7-Ацстиламнцо-1,2-на(5ггокинон II 82
8-Ацетиламиг,о-1,2-нафтохннон П 82
К-Ацетиламино-Ь-триптофан 1 128
2-Ацетиламино-З'хлораптрахпноп II 213
17а-Аце,гил-Д'’-апдростспдиол-Зр, 173 Ш
346
л-Ацетил aim зол III 1.3 7
9-Аиетилантрацен J 46; IV 133
Ацетила перекись II 127
1-Ацетилаценафтен IV 117
3-Ацетилаценафтен IV 117
Ацетил ацетон (2,4-пен.тандиои) 1 74, 75,
206, 214, 323, 324, 391, 398; II 35, 445;
V 148
Ацетилацетоуксусной кислоты этиловый
эфир II 210
у-АцетилбенЗойпая кислота V 285
п-АцетНл-й-бромгиДрО)<оричная кислота V
279
а-Ацетил-у-бутироДактон II 300
Ацетил гексафтор антимон ат I 75, 76
Лцетилгидрохиноп 1 зб
Ацетилгипобромит I 76, 77
О-Ацетплгликолсвый ангидрид II) 2 Is
Й-Ацетил глицина этиловый эфир 1 219, 250
ЗкО-Ацетил-й'-дезоксп-О-фторурпЛ',!!! V 7
9-Апетил-цмс-декалипа оксим Ш ЫО
2-Ацетил-1), I 0-дигидрофенантреп II -W
АцетцлДиГидроэбурикоегон кислоты Мети-
ловый эфир IV 139, 140
8а, 9а-эпоксид IV 130, МО
2а-Ацетнл-5,5-димет1!лбицикдо-[2,1,1 ]-гр-
Ксан V 65
6-Аи,етил-2,3'ДНметоКС11тол5'ол III 138
Ацетилен I 48, 62, 77 — 78. 289; V 29, 202
Ацетиленид лития I 79—81; V 29
Ацетиленид литият-этилсндпамин I 80, 81
Ацетиленид натрия I 79. 81
Ацетилендикарбоновая кислота 1 78, 196,
389
диамнд 1 4]8
диметиловый эфир 1 14, 78. 79, 84. 254,
29)—299, 389, 418, 421; 1П 3]]; V
28, 190
динитрил см. Дидиапацетилен
диэтилогып эфир I 79
монокалиевая соль I 78
Ацетилепдимагниидибромпд )) 214
М-Апетилимпдазол ] 81
S-Ацетилкофермепт A 1IIJ139
e-N-Ацетил-L-лизин V 4/9
S-Ацетилмсркептоянтарпой Кислоты ангид-
рид I 82
Ацетил метил ст^тфештфосфораи V 319
Ацетилметплурсолат 1И 425, 426
ЬАцетнл-З-метнлцнклонсн mu I I 204
2-Ацетпл-7-мстоксинафталии IV об
i-Ацеткдиаф галии JV 17,3
З-Анстялиафталин J 220
А Не талнитрат I 82
О-Лцетплоксн-к-пролпн Ш 275
З-Ацетоксиндол 1 57
А^-0)-Ацетнлснтн|<1вая кислота (см. «Вещест-
во царицы») 1J 117,
О-Ацетнлолеаиоловой кислоты метиловый
эфир II 197, 198
МАцстилнантетсии Ш 339; IV 263
Ацетидинровиногр одной кпслот1я этиловый
эфир IV 232
Апетилппррол (2- и 3-) I 81
К Ацетплпиррол I 8}
Ацетилсалициловая кислота 1 386
З-О- Ацетплстрофактидии II 190
3-0-Ацетил строфанта дол (3-О -Ацетил оваба-
гс1иш) 11 190
л-Лцстлтетрамовая кислота J 235
З'-О-Ацетплтпмпднц I 328
1а-Ацетилтио-А4-3-ке.тое'геропд.1,1 1И 338, 339
7а-Ацетилтио-Д4-3-кстоС'[сроиды 111 338, 339
З-Ацетилтиофеи 1)1 32
Лцетил-п-толуолсулкфопат V 29
о-АцетплфеполЫ II 240
2-Ацетдлфлуоренон II 380
2-, 4- и 5-Ацетилхризен И 277
6-- 2- к 3-Ацетилхрпзены V 203
уАцстилциклогексапол U 65; HI 186
2-Ацеталинклогексапон ) 1'3; Ill 60
1-Ац?тилци1<лс1ГексёИ 11 (>'!; II) 139; IV 100
2-Ацетил-АЗ-Циклопеитапднон II 25
а-Ацет!;л -[3 -этокси - N- карбоэтоксиякрлл-
амн,д 1 83
«-Ацетоксиакрилонитрил I 83; V 30
Зн-Аце'1 окси-2 О[1-;.1мин<1-5|3-[[регн шт IV 142
3,3-АиетоКси-йб-амнио-Д "-прегвен 1 172
.нЗ-АцетоксиаиДростап- ^-этнлемкеталь IV
5(5 57
1 7й-7а.цстокси-5 [З-апдростанон-З V 519
9-Аиетоцсиантрацеп 111 2)7 — 219
16-Ацетсксн-О-аптрон III 219
7-Ацетокси аценафтен III 218
2-Ацетоксиаиетосксмсцой кв слоты этиловый
эфир 111 212
10-Ацетоксн-1,2-бе!1:ил[Тр?цен 1)1 217
;.-1Ацетокси.-3,4-бс[['и1прс11 III 217, 2)8
.36 Ацетокс и-&г’-биснс.'рколспоцая кислота
III 363, 364; IV 161, 152
Зр-Ацетоксн-За-бром-б-кетохолестан I 322
зр-Лиет[->кс’/г-11М-бромапдрост;тон-17 IV 57
1-Ацстоксибутадпсп I 83—86
аро Аце ['оксн-йп.бр-двхэорапдросл анон-17 V
534
1-Ацетскси-2.2-дихлорбицнкло-ГЮ, 1.01- три-
декан V 49<?
З-Ацс’токси-З-П'личролнлгексил-J,4 -иафтоХп-
jjoh IV 180
«-.А иетоксп Kai"; роковой кислоты этилоиыи
Тфпр 111 214
Дна [‘окси-:’0-кстс>-21-под Дг’-прегпен V
21 -Ацсюксн-нО-кетостерояды III 455
I ц'Мл пли р-)Аиетокси-1 1 -кетогтсропды II ] о 1
On-Ацетокси-11 -Кетостсропды 111 214
3)3-Ацетокси-З-Кето-Д <4-Гер0]]дь1 ц, go
Зр-АцетоКсн-) l-wro-A'A-’-TprormjiKCH !I 212
16tz-АксТокенКиртазол-О I -нцегат 1)1 »53
у-Ацстактамасллиый ипьдеглц 1 287
е-Ацстскснмсркурфснол 1) 31
]6-Аш-локея>км11л-[,‘-М5стзаптр;^п 1)1 217
1 о-Ацеток<ц;-20-ме1Т!лхолантре!1 III 217
65!
17 р-Ацетокси-2-метокспметилен - 5 а- андро-
станоп-3 V 96
За-Ацетокси-20а-нитро-5р-прег11 ан IV 142
/-Ацетоксинорборнадпеп V 391
У-Ацетоксцнорбориеи V 391
Зр-Ацетокси-5а-оксп-6-кстохолестана оксим
V 531
,17a-Ацетокси- б -оксиметид-З-метокси-Д5»5-
прегнадиенон-20 1 410
17a-Ацетокси-6-оксн мстил-Д^^-прегпа диен-
диоц-3,20 I 410
Д12-1 1а-Аиетоксиолеан(-и V 383
3(3-Аце1Окси-20Р-оксп-5а-прегнан III 227
ЗР-Ацетокси-20р-окси-Д5-прегцеи 11 190
N-Ацетоксисукцицимид V 303
Ацетокспфлавоны V 208
Зр-Ацетокси-5и-окси-Д ^-эриостадиен I 304
3|3-Ацетокси-20-оксо-5а-прегнен V 198
З-Ацетоксипелларгоновая (нонановая) кис-
лота III 88
Я- и 3-Ацетоксипиридин I 85
21-Ацетоксипрегнацтрион-3,11,20 II 23
17а-Лцетоксн-Д^-врегнеиол-3₽-о1-[-20 I 344
17а-Ацетокги-Д’-прегненолона формпат II 27
17a-Ацетоксипрогестероп III 349
N-Ацетоксифталимид I 85 — 86
За-Ацетокси-Д ’>п-холеиновоЙ кислоты ме-
тиловый эфир I 77
ЗВ-Ацетокси-Д6-хо.Ченовой кислоты метило-
вый эфир 11 197
3(3-Ацетокси холестанол-6(3 I 168
3(5-Ацетокспхолсстанол-7а ]Ц 365
2а-Ацетоксихолестаион-3 III 302, 303
й(3-АцетоксихолеСтанон-3 III 302, 303
За-Ацетоксихолестаиоп-З III 302, 303
4й-Ацетоксихолестанон-3 III 302, 303
4|3-Ацетоксихолестапон-З II 44
"a-Ацетокси-Д М^-холестен Ш 254
Йа-Аиетоксп-Д^-холестенон-З III 142, 143
3(3-Ацетонси-Д5-холестеноп-7 V 463
4а-Ацетокси-Д 6-холестеион-3 III 212
6(а-и (3-) Ацетокси-Д1-холесаеноц-3 IV 218
33-Ацетоксп-17-цнацандростатрисн-5,14,16
V 493
33-Ацетокси- 17-циано-Д5А“-аидростадиен IV
86
Зр-Ацетокси-5а-циапхолестанон-7 V 463
2-Ацетокспциклогексацоц III 177
1-Ацетокснциклогексен V 475
Зр-Ацетокси-ба, 6а(и 5(3, 6(3)-эпокснандро-
станоц-17 II 301
3(1-Ацетокси-7a, 8а-эпоксиланостан II 147
3|3-Ацетоксц-Д5-этиеновая кислота I 86
17В-Ацетокеп-Д‘А-этиохоладиемон-З II 200
1 7р-Ацетокси-Л‘*!'а-этиохоладиенон-3 II 200
Ацетон II 93, 94, 239; III 155', IV 176;
V 16, 190, 477
ди-н-бутилкеталь см, 2,2-н-Бутоксипро-
пан
диметилкеталь см. 2,2-Дпметоксипропац
диэтилкеталь см. 2,2-Диэтокси пропан
гидразон V 95
оксим I 215
1,3- б^б,-(трифе!!11ЛфосфонИи)-хлорид 1165
фснилгидразон IV 33, 207, 208
N-фторимин V 170
З-Ацетонглицерин IV 37
Ацетойдикарбоновая кислота I 86 — 87, 227
диэткловый эфир I 86
Ацетонкетали а-гликолей IV 150
Ацетонитрил I 294; III 155, 435; V 29, 31,
271, 285, 337
Ацетонциангидрин I 87 — 88; II 315
Ацетонциангидрина нитрат I 88—89; Ц 395
Ацетоуксусной кислоты
анилид IV 16
трет-бутиловый эфир I 89 — 90. 98, 283,
284
фторангидрид I 90, 284
Ацетоуксусный эфир 1 48, 49 181, 406; II
209, 325, 393, 415; III 104, 212, 292;
IV 68, 69
Ацетофенон II 434; V 285, 481
беизоилгидразон II 353
л-ннтрофенилгидрадон V 364
оксимы III 141; V 383
фенилгидразон IV 33
этилбензол II 434
Ацилов перекиси I 90, 91, 422
Ацилоиновая конденсация I 98; II 357
Ацилы фтористые I 91 — 92
Байера — Внллигера реакция III 426, 427
БАЛ (2,3-димеркаптоиропанол) И1 337
Барбитуровая кислота II 324; IV 50
Барбитуровые кислоты I 426
Барбье — Виланда расщепление III 90
Баррелей I 418
Баррелейа производные V 191
Бария гидроокись 11 107
Бария окись II 278
Бария перманганат I 93
Бария сульфат V 222
Барта реакция II 242
Бензальазин I [98
Бензальанилины II 223
Бензальацетон IV 15, 16
Бенз а ль ацетофен он I 48, 87, 341, 342; II
407; III 130; V 488
дибромид П 257
Бензальацетофепона фенилгндразон V 263
Беизаль-н-бутиламин I 31/
Бензальдегид I 26, 93, 144, 191, 278, 331,
340, 341, 416; II 81, 100, 162, 371, 389,
439, 459; III 52, 104, 114, 394, 403, 431,
453; IV 30, 37, 48, 154, 156, 174, 184 238,
421; V 199, 250, 263, 287, 324, 340, 347, 403
производные 1 20, 288; 11 418; 111 424; IV 37;
V 350
Беизальдиацетат V 347
Бензальмалоновой кислоты диэтнловый эфир
III 104
Бензальмалононитрил I 225
Ь’-Белзальсульфаминовой кислоты хлораи-
гидрид IV' 156
Бепзадьфталид IV 15
Бензамид I 160; II 364; III 144
Бензанилид III 140; IV 105, 106
имидохлорид III 112
1,2-Бензантрахинон III 27
1,2-Вензантрацеп II 296; III 217, 218
5-альдегид II 296
1,2-Бсиз-Ю-аптроп IV 116, 117
н-Бенэгидрил III 29, 30
Бепзгидрил-п-толилкетон II 194
Бензгидрилфенилкетон И 19)4
Бецзгидроксамовая кислота I 215, 216; III
364
калиевая соль I 215
Бензгидрол 1 332; II 399; IV 8; V 403
Бензгуанамнн см. 2,4-Диамино-6-феи Ил-
енлдп-трназин
1,2-Бепз-3,4-дигидрокарбазол IV 33
Бензизоксазол I 213; IV 248
Бензизоксазолы I 213
Бензил I 31, 158, 186, 207, 327, 382; II 278
388; 1П 110, 185, 247, 294, 388, 468
дигидразон 1 382; III 185, 435
ди метил ацеталь II 278
дифенилмеркапталь 11 435, 436
моногидразон I 393; HI 185
Бензиламин I 93, 190; 11 41, 439; V 403
Метансульфам-ид I 212
а-Бензиламипо-(3-оксикислоты I 93
п-Бензиламннофенол III 153
N-Бензилакилины II 223
652
Бензилат натрия 1 94
Беплиладетатсм. Уксусной кислоты бензило-
вый эфир
Бснзялацетофенон Ill 1,30
Бензилбенмат см. Бензойной кислоты бец-
зплрнып эфир
е-Бспзилбдч-оойпа’л кислота И 434. 4.35
2-Бензил-9-бром-4, 1-дометил-1-тетрклоп III
270
Бензил бромистый Ц 117, 1G9; III 446
Бепзилгалогепиды II 464, 455
2-Бейзил-4,4-диметпл-] -ретО-1- 4-дигпдро-
нафталин III 270
К-Бензилиденапилнн I 23, 30?, 4IG; И! 373:
IV 48
БЗ-Бениилпден-Э-олеилглицерип I 121
1-Бензилпден-4,й,8-триметилазулеиия бор-
фторид I 124
Бензилиден хлористый I 415
Бензилиденциклопентан V G0
Бензил иодистым ![ 169, 412
2-Бенз ил-2-карб,метокси цн клонен та и он И
196
Бспзиллптиц- I 94; III 458
Бензплмагиийгалогсинды I 432; III 381
Бензнлморкаптан V 517, 526
N - Бензилметансульфамид 1 212
Бепзилметилкетона тозилгидразог) II! 353
Бспзилметп.лоньгй эфир I 95; 11 181
З-Бсазпл-З-метилпентапопая кислота 1
236
Бензиловая кислота I 49, 333, 393; II 38,
388, 389; IV G2, 63, 93
юрет-бутиловып эфир I 1 г>8
метиловый эфир I 158
Бензиловые спирты I 20: III 169
Бензиловый спирт I 247, 278, 307, 331; II
81, 1G2, 167, 184, 216. 421, 131, 439; III
164; IV 80, 158, 159; V 263
Бензиловый спирт -у толуол II 434
1а-Бензил окепметпл-!^-10Р-дпметил-
Д М- j - о кт ал on I 97
2-Бензнлтетралоп-1 .11 306
N-Ben3HflTt[Cno-[2,3/}]-nnppo,T IV 157
Бензплтозилат II 412
Бензнлтозилаты 11 ,398, 399
Бензнлтриметиламмонифиодпд I 01, 95;
II 2 80
Беп зил три метилам мои пймезитоат 1 9 в, 96
Бензилтриметпламмояпйхлорпд I 96
Бензплтриметиламмонппциаи ид 1 96
Бензнлтрн метил аммония гидроокись ем.
Тритон Б
Бепзилтрцэтоксифосфояпй-Хлорпд III 461
N-Бензилуретан II 410
рис-2-Бензил-3-фсп ил эти л епимпп II 178; V
247
О-Бензил фосфористый-О, О-дпфеиилфосфор-
ный ангидрид 1 S6, 97
Еен.зцл хлористый I й5, 170; И 169, 218,
367; III 464; V 70, 377
БензилХлормсаилонЫЙ эфир I 97; V 82
Бензнлхлорформиат см. Хлоругольпон Кис-
лоты бензиловый эфир
Бензилцианид см. Фен и л ацетонитрил
2-Бензилциклопентавон II 196
Бензилциклонропан I 262
Бепзилэтиловый эфир I 278
Бензимидазол II 328; IV 38, 39, 75
Бензимидазолы [ 221; III 148, 430
Бензин см. Дегндробецзол
Беиз-(с^)-индоленпн IV 266
Бензкара диен II 238
Бензнорборпен II 154
Бе113обицЦкло-[э,2,0]-гекспдпеп-2,5 V 154
е-Бен зоилампно-Ц-бромканроиовая кисло га
IV 93
е-Бензоиламинокацроновая кислота IV 93
я-Бсизоиламппокорпчиой кислоты й.злактеш
И 4 1; IV 93, 94
9-Бснзоплантрацеи IV 228
Бензоила перекись I 98 — НЮ, 284, 301, -122;
И 256, 336; 111 15, 259, 293, 291, 336;
IV 1,54; V 529
Бепзсилацетил см Фопплмо.тил-а-ди кетон
Бепзоилацетон II 400
п-Бепзоилбеизойпая кислота I 388, ,389;
I.I .231. 235, .236, 434, 435
Метиловый эфир V 90
б-Бепзоплнйлсриановая кислота IV 1S0
О-Бензоил гидроксилам и и Ш 379, 380
I- Бензоил-1,2-дпгиДрохнкалндипомя кис-
лота II 62
ампд 1I 62
Ik-iHM>itjiизотиоцианат I 100
Бепзоилпмидазол II 30
Х-Бензонл-к-напролактам III 293
Бензоилкярбен V 271
Бензоил малоновой кислоты диэтиловый эфир
II 209; III 453; IV 162
Беизоилмезитилеи II 265
<>-Бс1(зоилокспаистофеноп И! 111
3-Бензоллоксибутен -1 11 344
За - Бонзой локсн -12-кетохол<ц;овон кислоты
метиловый эфир III 251
2-Пензой доке и-1 -метилен-4-юрт -бутилцик-
логскеан II 344
I-Бекзоилпафталип I 45
2-Бецзоидпафталин I 45
1 - !3ен тоил-2-иафтол II 364
2-13снзоилокС1Н|,нк.логексапоп I 99
ББензоплоксицпклогекеапок I 159
З-БепзоидперицафтаН II 361
К-Бсцзспли<П1ер11дпп III 102: IV 111
Р-Гя'н.чшлпрапионовая кислота III 191;
IV 202; V 32, 345
Ееизоллуксуспая кислота II 305
1 -БсЕгзоплфенантрсн I 4.5
N- Бензоил-N'-феин..'тмочекниа II 108
Бепзопл фтористый 1 92
Бензоил хлористый I 41, 100 —10 Г, II 29,
35, 433; IV 1G6, 206; V 25(1
2-Бепзоплциклопропанпропионовая кислота
I 159
о-Бен.зоцлзтплтдртроионой кислоты днэтнло-
ный эфир 1 99—100
Бензоин I 31,186; II 233, 388, 389; 111 29-1, 333
еулнфнтендиол III 333
Бсниониая кислота I 101, 109, 278; II 84,
302, 439; III 23.5; V 64, 306, 10.3
о-анстнлфеп иловый эфир см. о .Окси-
нцйтофснопбеизоат
бензиловый эфир IV 238, 239
БГ.Ы-ДпметНламид I 262
диэтиламид II 386
(З-иодэтиловый эфир II 41]
кротиловый эфир II 344
метиловый эфир 1 52, 278; V 412
1-метокенвинилевын эфир II ЗЙ2
патриютая соль I 101 — 1(12; V 32, 82
серебряная соль I 102—103
фениновый эфир И 124
З-феиилэтиловый эфир II 132
4-\-лорбутиловый эфир III 300; IV 206
3-хлорэтиловый эфир II 411
3' ци клогексениловый эфир V 3(Х',
эти.'юный эфир I 345; II 167; IV 2 12;
V 285
1>ензойнотр))фторуксусный ait гидрид III 438
Бензойный ангидрид I 103; II 302; III НО,
V 82
Бсизоксазолы III 38, 138
1 - Бензоксепш) V 275
Бензол I 24, 43, 179. 213, 250, 292, Ц
Зий; IИ 79. 15 1,264,308,314 480 405'V
7, 18, 21, 32. 191, 192, 31 5,325, 381
653
металлирование II 35G
о-Бензол диазоп lift карбоксил ат (предшест-
венник дегидробепзмэ) 1 104; III 4-16;
V 33
Бснволт-малеиновып ангидрид, 1:2-пд-
дукт III 233
1-Бензолсульфамидонафтали;.- III 236
2-Бензолсульфамндонафталип III 23(3. 237
2-Бензолсульфамидо-1,4-яафтохипо11 III 23G,
237
Бензолсульфамиды I 105
М-БензолсульФанпл-! ,4-нафтох1П>он --1-имин
III 236
Бензолсульфпнилфторид III 431, 432
Бензолсульфиновой кислоты метиловый
эфир III 237
Бензолсульфокислота IV 115
Бензолсульфокислоты ангидрид I 104
Бензолсульфокнс-лоты эфиры I 105, 100
Бензолсулъфонат натрия I 164; IV 104, 105
Бепзолсульфонилизоцианат I 1 Ой
Бензол сульфохлорпд I 105 — 106; IV 104,
105, 221
1,2,4-Бензолтрикарбоновая кислота
ТриМетнЛовый эфир III 308. 369
триэтнловый эфир III 368, 369
1,3,5-Бензолтрвкарбоиовой кислоты триэти-
ловый эфир П1 368, 369
Бензонитрил I 26, 48. 278, 326; II 7, 364,
439; Ц1 75, 144, IGI, 450; V 82, 240. 403
Бензонитрила окись V 165, 322
бнс-(Бензонитрил)-паллаДий(П)-Хлорид I
106 —107
Бензосуберон см. Бенэциклогептанон
1,2,3-Бензотриазол I 213; II 419; V 515
Бензотрифторид II 207
Бензотрихлорид III 372
Бензофенон I 148, 102, 237, 303, 332, 340,
341, 396; II 29, 124, 235, 230, 30-1, 399;
III 385, 407; IV 182; V 95, 403
ацил 111 366
гидразон 1 166, 324, S85; III 184; V 322
нетил II 371
оксим I 216; III 140
Бензофепоназш! V 272
Бензофуран V 476
1,2-Бензохинон III 203, 272; IV 13); V 543
1,4-Бензохинон (п-хипсш) 1 27, 69, 107 — 108,
212, 255, 407, 408; II 375 424, 425, 432;
111 385; IV 175; V 63, 484
1,4-Вензохинон — бутадиен. 1 ; 1-аддукт II
192
1,4-Бензохинон — бутадиен, 1 ; 2-аддунт,
см. Тетрагпдроантрахнпон
1,4-Бензохиноны III 388; V 63, 5'15
Бензперилен-1',2'-дпкарбононой кислоты
ангидрид IV 127
Бензпииаколнн 1 15, 162; II 36, 184
БензпинакОн II 36; V 210
карбонат IV 182
3,4-Бенз11нрен I 379; II 364; III 101, 217, 213;
IV 117
5-альдегпд И 296
1,5-хиноп IV 117
Бензсуберанон V 237
Бемзсубероны V 259
1,2,3-Бецзтиадиазол-], 1-диокспд I 108
Бензтназол III 37, 38. 138
7,8-Бензтрицикло-14,2,01’;!04'<;]-о1<'(ен II 238
4, 5-Бензтрополон I 414
Бенз-[2,31-Тропон V 257
Бензтроиолоцхицоп-1, в В7 131, 132
Бензфуразана окись 11 т>8. ,301, 406, -Ю7
Бензфуразаны 11 361, 362; И! Б)8
Бензциклобутадиенхиноп III 43о
Бензциклобутен V 202
Бензциклогептанон II 16; Ш 392
Беизцпклогептатрнен II 238
Берна восстановление I 108—110; III 102,
103; V 33
Биксин IV 222
Биотин III 161 —162
Енснорхолапо-вая кислота V 115
Бифеинлен V 33
цнс-(и тргтас-ББифураидпоп I 289
Бицикло-12. 2,0)]-гексадпец-2,3 (бензол Дью-
ара) III 232
БпШ!Кло-[2,2,1]-гексап I 143
Бицикле-[2,2,11-гексан-5-карбо новая кисло-
та I 1 13
дне-Бнцикло-[3,1,0]-гекеанол III 288
BiWiKflO-l2.1,11-гексапои-Й V 425
Бнцккло- [2,1,1]-геКсен-2 V 425
Бицикло-[2,2,01-Дй-гексен-2,3-Дикарбоп овой
кислоты ангидрид ill 232
1.1 '-Бицнклогексенил IV 200
Гя Шик л опеке или де и 111 287
Бпци(<ло-[з,2,1 J-гептаднен см. Норборнадиен
«1пта(С-Бши1КЛо-13.2,0]-геитан-3,3-дикарбо-
повая кислота Ш 233
Бпци кло- !-!, 1,0,1-гептан-3-карбон овой кис-
лоты этиловый эфир V 174
энгЬ-дис-Бицикл о- L2,2,I ]-гсптан-2,3-ди-(ок-
епметил) I 326
Бнцикло-[2,2,1 J-ren ган-2-экда-карбоновая
кислота II 437, 438
цнс-БиЦикло-[4,1,01н'ептапол-2 III 288
Бицнкло-[.4,1,0]-ге[ттанон-2 V 236
(иранс-Бицикло-Ез.й.^-гептанон-З III 233
энсФ-^г/с-Вицикло - 112,2,1J - Дг-гептен-2,3-дц -
карбоновой кислоты ангидрид III 448
Б11Ц|1кло-12,2,1]-А--гецТепон-^ II 155
Б пп нкло-1,3.3.11-нонен-1 V 136
Бицнкло-[3,3. lJ-nonen-2-карбоновая кис-
лота-7 V 394
Бицпкло-1'1,2,0!-октадиеи-2,4-диол-7, 8-
днзцетат Г 254
Би-цикло-L2,2,2j-октан-1 -карбоновая кислота
Hi 187; IV 163
Бии.иклО'13,2,1)-октаноп-3 (новое название;
1ft, oft-ДиметиленциклогеКсапон-З) II 469;
V 338
Бццнкло-1.2,2.2]-октатриен-2,5,7 I 418; П
271, 272
Б11Ц11кло-14,2,01-октатр1!еп-2,4,7 I 366
Бицикло-[3,2,1]-октен-2 II 344
дг(с-Би11пкло-[3,3,0]-октсп-2 IV 48; V 224
этао-ннс-Бицикло фЗ,3,0]-октен - 2-карбово-
вая кислота IV 153
элзо-Бнцн кло- [3,2,11-Д ’-о «тенил бен зо ат-2
И 344
Би цк «ло-(0,2,2J-A й-октен-1 - карбоновой кис-
лоты амид IV 16'3
Бицикл о- [2,2,21-Д 2-<жтен-1 -карбоновой кис-
лоты этиловый эфир III 230
Бицикл o-[l 0,3.01-ЛД12)-ней уздецен он-13 V
427
1.1Г-Бнццклопентсц11л IV 200
транс - Бицикле- [ 8,2,21 -тетрадека-5,10,12,
13-тетрае.п V 503
Бпцмпнамвл И 438
Бишлера — Напноальского циклизация IV
100
БМ.К (ВМС)-реагент III 295
Бомбикол II 443
Бока — Шмидта реакция I 120
О-Борабииккло-ЕЗ.3,11-нонап (9-ББН) V 35
Бг;р;ш III 381
Бора трехокпсь III 380
Бора трнбромпд I 110— 111; V 37
Бори тпнфторид I 111 — 112, 123. 231, 417;
, II 270, 276: [V 252; V 15, 102, 33G
Бора трпфторнд-i метанол I 112
Бира грвфторид J- уксусная кислота, комп-
лексы I, 112 — 113
654
Бора трифторид 4- ФосФорпая кислота
И 21
Бора трифторнд + фтористый водород V 40
Бора трнфторида эфират I 113 — 116, 246,
258; II 2 18; III 378; IV 257, 2G1;V 38, 53,
92, 157, 203. 241, 370, 485
Бора трифторида эфират -г уксусный ан-
гидрид I 116; V 4 0
Бора трихдорид I 72, 116 — 118; V 37, 41
Борннкарбоцнл III 381
Б^орпадпсп I 178, 179
Борная кислота I 118--122; 263; II 421; V
42, 57
Борнен I 178
Борнил хлористый I 178
Борноуксуспый ангидрид I 118
Борный ангидрид III 380; V 42
Борфторис.товодородкая кислота I 71, 72,
122 — 124, 246; V 42, 388. 410
Брадикинин V 51]
Брауна реакция ] 139; Ill 333, 334
Бром V 51, 103, 239, 403
1-Бромадамантан 1 110; V 7
4(е)-Бромадамантаион V 304
Брома азид V 43
2-БромаК.ролеИг; V 15
N-(2-Бромаллид)-этилампн I 61
й-Бром-З-аминопропен-1 I 190
2-Броманнзол I 110
Бромацил IV 129
о-Бромаиилин I 71
н-Броманилин I 378: II 40
9-Бромаптграцен И 240
N-Бромацстампд (N1-;А) I 76, 125—126, 133;
Ill 195; V 44, 516
N-Бромацетамид пиридин + 8О; I 126
N-Бромацетамид фтоопстый водород I 126;
V 44
N-Бромацстамид -ф хлористый водород I
126 — 127
Бром — ацетат серебра I 127
1-Бромацетил-4-метилц;1клоге1<санол I 378
2-Бромацетил-7-метокСинафтал!|Ц IV 36
9а-Бром-11₽-ацстоиси-Л1и-3-ксгостсронды V
531
Бромацетон П 109
Бромацетофенон I 32, 208, 200 327: III 403,
410. 435; IV 254
,И-Бромацетофецоц 1 52
(£>-БромаЦетофенон V 45
а-Бромбенаальацетон IV I5. 16
м-Бромбецзальдегид III 26
о-Бромбензойпля кислота И 132
,и- Бромбеизопиои кислоты метиловый эфир
I 52
Бромбензол I 321 — 323; III 248
7-Бромбииикло-[4. i ,0]-гептап I 338
1-Бромбицикло-[2,'2,2]-октан III 187
а-Бром-у-бутиролактон J11 456
&-Бромвинилэтпловый эфир IV 269
3-Бромгекс.аДЩщ-1,5 (пли -2,5) IV 110
З-Бромгептацоц-2 III 350
4-Бромгептеп-2 I 08, 99
Бром дезокси бензоин I 327
1-Бромдекан И 169
43-Бромдигн'Дрокорт)13ои-21-ацстат II 204,
203
п-Бром-(М, N-Днметил)-аипл1ш V 87
3-Бром-1 а, За-димстилеп циклогексен-2 11
469
б-Бром-2.-Рдиметоксртпиримндин П 414
2-Бром-3,4-дпнитротиофеи IV 08
Бром-(хлор)-д111игридин1!итрат V 51
7-Бром-2,2-днфен ил цикл о ге и та и on V 114
Бромдп хлор метан I 38; IV 7,3
а-Бромпзомлсляпой кислоты бромангидрпд
I ЗЮ: IV 213
3-БроминдоД III 123
о-Бромиодбензол I 127 — 128
Бромнстоводородная кислота, постоянно ки-
пящая, '18%-цая I 128; IV 143; V 45
Бромистый водород 1 73, 131
безводный 1 131 — 132
~г уксусная кислота I 132
(н-Броякамфен 1 155
о-Б ром-г?-камфор а V 114
I —1-1 t-Бромкамфор-я-сульфокц слота V 46
N-Бромкапролактам I 132 — 133
п-Бромкаироновая кислота IV 111
(с-Бромкетостероиды II 113
Ю-Бром-17-кетоСтсропды I 134; II 192
4(3-Бром-3-кето-5Р-стероиды IV 11
4[3-Бром-3-кетохолановсФ кислоты метило-
вый эфир II 383
4р-Бромкопростапон-3_ I 96
4- Бром-«-ксилол II 3 /, 24'2
а."Г?ромл;1у]}И11овая кислога I 155
Броммллонового альдегида тетраэтилацеталь
ill ИЗ
Броималопонптрил III 456
а-Броммасляноп кислоты этиловый эфир I
321
О’-Броммасляный альдегид И 51
4-Бро.ч-1-метнламт1оа1прахииом III 111
2- Бром-4-мстллбе.изальдегид IV 72
1-Бром-3-метилбутадиец-1,2 I 245
Броммстилейциклооктан I 156
а-Бром-а-метиллаурпцовой кислоты бром-
ангидрид IV 1!0
Броммстпл-н-проп пл кетон II 109
2-Бром-2-метилнропионовой кислоты iftpem-
бутиламид I 164
З-Бромметилтиофен I 99
Бромметилтрифснилфосфопипбромид III 410
1,2-бнс-БроМмстилциклооктатстраеп IV 220
2-Б ром-2-метилциклопропан карбоновой ки-
слоты этиловый эфир II 396
2-Бром-6-метоксилепидин IV ЮЗ
а-Бром-Р-метокси-н-масл я пая кислота III
181
а-Бро.ммнрвстиновая кпелота I 1о5
Броммонофторид I 126
Броммочевнца I 133
1 Бромнафталпн I 346; II 40, 207, 231, 292;
III 111
4-Бром-1 -нафтол II 40
6-Бром-2-нафтол V 341
З-Бром-1.2-ндфтохинон I 27
л1 Бромнитробспзол III 276
1-Бром-1-нптрооктаи III 410. 411
Бромноватлстая кислота водная см. М-Бром-
анетам ид
7-Бромноркараи I 156; II 286
Бром — окись серебра I 133 —134
ЮВ-Сром-17а-окснпрегнснолон 1 68
Ра-Бром-1 Ю-оксштрогсстерон 1 169
9г/.-Бром-113-оксистсрондь1 IV 172
1-БромоКтап II Ю9; 111 271
Бромоль III 239; IV 1 S3
а-Бром-о-пропцоновой кислоты триэтиловый
эфир И 28[
Бромоформ I 39-1, 295; III 154
1 -Брохширеп 11 240
Бромиировипоградпой кислоты этиловый
эфир III 469
3 - Бр [)м в н ро к атехнп а диметнловый эфир I 49
21 - Бром-Д"-прсгнеиол-3|3-о1[-20-этилснке-
тальапетат IV 57
9ге-Бромнредп1)Золо11-21-ацетат IV 172
З-БроморопаноЛ-1 II 183; III 381, 382
З-Бромиропплтрифепнлфосфонийбромпд V
к46
З-Бромчропиоцилнзоцпанат 1 134
Р-Бромпрошюпптрил I 134
а-Бромuponиононан кпелота
й/’щр-бутиловыи эфир IV 212
655
этиловый эфир IV 212
Р-Бромпропногюиая кислота I 128; III 290
метиловый эфир I 131
хлорапгидрид II 183
этиловый эфир III 290
д-Бромпропнофепон V 1)4
а-Бромстеариноиая кислота II 248
3-Пролета рол I 59
М-Бромсукцпни.мид I 98, 99, 134; II 107-
IV 20; V 47, 83
7-Вром-1-тетралоц-2-карбо1ювая кислота II
30G
2-Бромтиофен П 3-13
3-Бромтиофен IV 218
о-Бромтолуол 11 132, 2'Ю
н-Бромтолуол HI <121
1-Бром-2,2,3-трПметилцпклонрогиигВ! III 372,
373
4-Бром-2,5,7-тринитрофлуорсноп I 137; II
235
Бромтрифторметай I 138; V 49
Бромтрнхлорметап I 138, 175; III 187, 415;
. v 50
Бромуксусного альдегида дпатплансталь
(бромацеталь, дпэтцлбромацетэль) I 34,
65, 155; II 29, 423
Бромуксуспая кислота
Л1рет--бу'п!ловый эфир II 210
метиловый эфир II Ilf? IV 211
этиловым эфир I 430; V 50, 340
б-Бромурнцнл II 414
9-Бромфсиаитрен III 34
таБромфенацнлалкнлксантаты I 138
н.-Бромфепаи.илбромнд I 1'33
и-Бромфенацплнитрат IV 17
Р-Бромфснетол I 184
1 -Бром-2-фен ил ацетилен V 201
6-Бром-1-фенилгексик-1 V 09
п- Бромфенилглпоксаль IV [7
20-Бром-83-фенил-гтас-Дскалсш-! II 199
1 та-Бромфенплппразол III 278
3-Бром-1 -фсиилпропан [V 215
л-Бромфепилцпклоноопац Ill '235
о-Бромфенол I 110; V 54
п- Бромфенол I 378; II 40; Ш 410
9-Бро,ифлуореп III 403
N-Бромфталимид Н 404
Бромфтор V 44
о- Бромфторбеизол I 71, 389; IV 110; V 472
1 -Бром-2-фторгсптац V 44
4-Бромхинальдин IV 103
1-Бром-4-хлорбенвол III 401
Т-Бром-Т-хлориоркаран III -373; IV 54
I-Бром-З-хлОрпропан IV 242
2-Бром-1-кл0р-1-фенилэтан I 127
Зя-Бром-бР-хлорхолеСтапол-ЗЗ 1 127; IV
145
2а-Бромколсстап III <113
2а-БромХолсстаиол-ЗР II 188
За-Бромхолестанол-Зр-ок-б-ацетат I 322
2а-Бромхолестаиои-3 I 20-1; II 18S; Ill 120,
302, 303
За-Брс)мхолсСта1!011-2 II 200
ЗР-Бромхолсстаион-з И 201
Ш-Бромхолестаион-З Ц] 302, 303; IV 1G9
ЗР-Бром-Л'-'-холесте;! III 413
Бромхолестернлбензо;г1Ы 7а- н 78- 111 389
390
Бромцнан I 138 — 141, 43G; V 5'2
а-Бромцнанацетампд V 53
З-Бромниклогексаицм II 40 I
2-Бромцнклогексаиоп III 410; V 65
1-Бромццилогексет1 V 16!
З-Бромцнклогексен-1 Ill 312
Бромцнклогсптадпеиы-1.3 IV J22
1уБромц.1[кл(Л)К1си V 391
Бромциклопроиаи III 180
4-Бром-1-циклопрошьлпеитен-! III 275
1-Бромциклотридекадиен-1,2-трпипЧ, 8 10
V 509
а-Броигаиантовьгй альдегид IV 12, 13
Бромэстрадиолы (2- it 4-) V 44
2-(и 4-)Бр()МЭстроц II 12
2-Бромэтанол см. Этилснбромгидрин
1р-Бромэтнлядамаптап I 3 7
2-Бромэтиламица бромгидрат I 123
(2-Бромэтил)-бензол I 111
Р'Бромэтилметилкетопа этилепкеталь I 141
Буллналеп V 546
Бутадиен I 51, 141, 19G, 339, 3-10, 388. 389,
<103; И 156, 432, 4G5, 469; III 211, 4)3;
IV 115. 200; V 85, И], 170, 316, 368, <101
Бутадпеч-1,4-бспзох1шон 1! 192, 432
Бутадиен -ф малеиновый ангидрид III 7,
315
Бутадиен -f- толухпноп III 235
БутаДпсиь;-1.3 V 3 17
н-Бутан 5' 67
Бутацдиол-1,3 IV 115
Бутандпол-1,4 IV 77
D-( —)-БутапДиол-2,3 I 141, 142
Бута1|дио1г-2.3 (дпацстил) V 98
Ь-(-|-)-БутапДптиол-2.3 I 142
Бутанов-2 см. Мстплэ'пглкетон
Бу ген-1,2,3,4-тетракарбоцовая кислота III 7
Бутантриол-1.2,4 III 351
Бутеп-I II 3'11, 355
НПГ-Бутен-2 V 294
Бутспапдта кислота II 379
Бу гена-1 окись I 288
Бутстг1а-2 окиси (З.-З-эпонспбУтаны) П 212;
111 374; IV 140
2-Бутсндиол-1,4 IV 171
Бутеполиды I _128. 344; III 280
Буте.ны-2 I 175, 263, 264. 266; И 156, 344
355, 4G2, 465, 466; III 61, 3)2; IV 140
З-Бутенэписульфиды см. Тиоокиси бутен он-?
лвлор-Бутила гидроперекись 1 1Ц9
и.-Бутпла гидроперекись I 219
т pent- Бутил а гидроперекись I 142 — 144
п-Бутилазид I 144-145
(Прет-Бутилазометнн I 402, 403
«Бутиламин V 306
Бути ламин II 348
трет-Бутиламин I 145, 207, 402; II 41 321 —
322; IV 235; V 54, 67
трет-Бутиламинборан I 33
н-трет-Бутиланизол I 50
гР/дад-Бутпла перекись 1 145—146; 349; IV
153
вгрспг-Бутилат алюминия I 107, 147; III 191
пгревг-Бутилат калия I 147—168, 200. 2-11,
322. 323, 324, 332, 337, 339, 340. 345,
397. 403, 415; II 16, 17, ИЗ 282 283, 327;
11! 402; IV 86, 250; V 11, 2-4, з'(), 56, 72
104, 175, 206, 238. 253, 338, 3-16
и - Бутвлацетат III 154
трет-Бути л ацетилен I 290
/дре/п-Бутилбепзонпая кислота 1[ 2-18
mpcm-Бутплбензол II) 342
н-Бупглборат IV 30
н-Бутнл бромистый I 62; III 41?,; IV 91
/;г/тап-Бутггл бромистый 1V 91, V 17
З-игре/н-Бутилбутадпеп V 171
/ирс/и-Бутнлгипобромнт I 1G8
нг/тап-Бутилгипоподит I 168—169; V 66
путал-БутилгПнохлорит I 169 —174, 304'
IV 47. 124, 125, 153; V 67
I-wpm-Бути л-Э,,Зпцимстил азиридин он I 164
н-Бутилпзоцианат 1и 53
7нрси1-Буталкзоциаппд V 67
N-и-Бутилкаирол.актам II 398
т/тан-Бутнлкарбамаt- II 42G; II- здэ
м-Бутиллнтий I 174 — 175, 363, ЗОН** 41G’
11 139, 156, 19 1, 283; Ш 338, 458
656
mpcm-Бутил литий 1 175—176
н/рст-Бутнлмагипй хлористый Ill 387
ь-Бутнлмалоповгф кислоты дцэтпловый эфир
1П 143, 214
гирст-Бутплмалоново)! кислоты диэтиловый
эфир V 2 80
Бутидмеркаптаи IV 169; V 7]
1Нрт-Бутил-5-метилтиокарбо11ат IV 7
р/рст-Бутилмолешша I 207, 208; И 321; IV
и-Бутилнптрит I 176—177
/ррст-Бутилнптрнт 1 177
/ирс/н-Бутил-п-ннтро^юпилкарбонат I 177
трет-Бутилового эфира угольной кислоты
и дпэтилового эфира фосфорной кислоты
смешанный ангидрид А' 72. 472
трет-Бутиловые эфиры II 386
егнор-Бутилоный спирт V 18
п-Бутиловый спирт I 170, 200, Э7'8- II 373;
III 155
/npm-Бутиловый спирт I 80, 98, 105, 109,
127, 168, 170 177, 178, 207, 208, 28-1, 287,
295. 311, 312, 321, ,322, 358, 301, 410;
II 18, 30, Л2, 117, 182, 200. 282. 287,
292, 293, 327, 329, 330, 426; III 77—79,
82, 191 ; iV 6,7, 128
N-ntpmi- Бутил о к с и карбон иламинокислоты
I 177
щрс/и-Бутилпирокатсхин 1 41/
ББи-Бутилинрролидин I 105
4 -тре/п-Бутилтиаи 1 172
1 -окиси I 23, 172
и-Бутилтиоцпапат 1 139
п-трет- Бутил толуол III 342
1 л ipm - Бути л-3-фенил а вир и дин он I 164
трет-Бутнлфснилоный эфир I 236, 321 —
323
л-щрет-Бутплфенол И 64, 75
9-н-Бутилфлуореп III 393
О-н-Бутплфлуорси -9-гидроперекись II ] 393
М-л/рст-Бутилформамид I Б16; IV 153; V 67
Н-нгрс/н-Бутилфталимид I 208; П 321, 322
w-Бутил .хлористый 111 294, 332, V 114
трет-Бути л хлористый I 43, 177; V 72,
205
Бутилхоланаты, н-, изо- и трет-11 386. 38/
игрет/ыБугилкромат I 178; II 496; V 73
и-Бутилцнапид I 33
З-н-Бутилциклогексннол I 178
транс-З-mpetn -Бутплциклогскеапол I 86
/г1рем/с-4-/7?рс/.т-бмтплциклогексанол I 86; II
181, 182
цис-4-трет-Б ттнл циклогексанол IV 103,
134; V 222
Й-Щргти-Бутнлцпклогексанолы III 378
3-тргт-Бугилцпклогексанон IV 133
4-п’рс/п-БутиЛНПклогекс;шон II 181, 182;
III 378, 396; IV 134; V 223, 516
pipe Бутил ни К л огекса ион-2-кар-
боновая кисло;а III 396
2-н- Бути л циклотене н л ат натрия I 178 — 179
ц;ю-4 трет-Г>р; пдцпклогексилбромид IV
103
d-Бутил-ге-этнлглутаровой кислоты метило-
вые эфиры III 14
Бутин-2 I 41”; V 23
Бути1|-2-диоЛ-1,4 Hl 188, 189; IV 171
диацетат II 436
Бутиц-2-ол-1 I G1
Бутиц-3-ол-i I 290
у-Бутиролактон 1 46, 179. 225: Il 259
N-{mpcin-Бутокспкарбояилокси.Бсукцин-
пмпд V 74
1\'-;ф1рел1-Бутоксикарбо1| нлоксп Бфталнгцнд
V 74
М-трелг-Бутокспкарбоиплциррол V 472
трет-Бутоне ц карбонил- L-треонил- е-кярбо-
бензоксилпзипбспзиловый эфир V 309
7-трет-Бутоксннорборнадиен II 345
1-н-Бутоксиэтилизоцизнат IV 190
Буфадисколиды 11 189
3-эли-Буфалнн II 189
Бюхнера расширение циклов 1 250
V-Валеролактон I 365, 314
б-Валеролактон II 347; III 427
DL-Валериаповая кислота V 403
DL-Вал ин 11 306
Ванадия пятиокись I 69; II 424, 425
Ванилин 1 50, 217; II 79, 367; III 273; IV 94,
204; V 351
о-В ан плиц I 50; III 73
Ванилиновая кислота II 79; III 137, 273
Вератрамина производное III 50
у-Всратрилмасляной кислоты , этиловый
эфир II 384; IV 241
Всратровая кислота I 110
амид III 75
нитрил 1 216
Вератроный альдегид III 73; IV 15
Вератрол Л 32; III 137, <134, 435; IV 129
Вернамипин Ва IV 199
Ветивазулен I 250
а-Ветивон V 349
Вещество царицы, см, Д2-(о-Анетилокте-
новая кислота
Внльгеродта реакция III 259, 260
Вильсмепера реагент 1 диметнлформамид -|-
— хлорокись фосфора (или фосген) I 180
Вииатикойевой кислоты метилог,ый эфир V 96
2-Вннилазирлдин V 81
Вннт-гламипы И 17
Винилацетат 1 180 — 181; II 29; Ш 179, 286
Винилацетилен II 266; IV 255
Винил-н-бутиловый эфир IV 190
Г2-Вннилгидрохинон IV 136
Випилиденкарбен I 154
Вин ил-(карбметокснметил)-кетон (метиловый
эфир акрилоилуксусной кислоты) I 181 —
182
Винил-(^-карбметоксиэтил)-кетон I 183
Впннллитнй I 183 — 184; 1[[_ 420; V 75
Винилмагний бромистый 12/2
Впиилмагницгалогеппды I 231
Виниловые эфиры 1 117
З-Впнплтиофен 111 110
Винилтрифенилфосфопипбромид 1 184—185;
V 75
Виппл хлористый I 417
й-Впннлцнклогекссн II 159
Винилцпклопропан I 340
Виннлэтилоный эфир IV 269
Винка-алкалопны Ш 178
D-Винная кислота I 381; II 27, 28, 74; IV 59
D,L-Винная кислота III 41
/чсзо-Винная кислота HI 11
Винной кислоты ди-н-бутилоиый эфир III
219, 220
Винной кислоты натрий-калнекая соль,
тетрагидрат (сегцетова соль) I 185 —186;
И 27, 175, 191; IV 24
Винный диальдегиД -г нитрометди 11 460,
461
лсзвд-Винпый диальдегид II 214
Висмута трехокись I 186
Внснагни V 323
Витамин А I 241, 242: II 176; 219, 270, 271;
[II 345; IV 52, 204
Витамин А. альдегид(Ретинен) II 219;IV 269
Витамин А. кислота III 345
Витамин Alh эфир IV 50, 51
Витамин А;, эфир IV 50, 51
Витамин D 3,5-дП[|итробензоат I 367
Витамин Оя I 1.3Й; III 175; IV 189, 190
аллофан ат, 3,5-ДИнитробепзоат IV 189.
190
657
Витамин II 76, 131; IV 230
Витамин К,, гидрохинон I 114; II 13Г
Ш 457
Воакангин I 173
Водорода (влажного) приготовление 11 11!
Воды определение IV 62
Водяной г,эз I 2В(>
Вольфа перегруппнргмзка II 231
Вольфрамовый ангидрид 111 82
Восстановление (гидрогенолиз) III 48, 49
Газы инертные I 18?
D-Галактоза I 26, 21; [1 48; III 274
4,5-Моноацетониддиметилацеталь II 49
D-Галактопамидпентанитрат I 18
Галловая кислота III 168
Галоформная проба I 187, 188
Гальвпнокеил 1 188; 11 103
Гаплофилип IV 58
Гаттермана — Коха синтезы I 51
Гвайазулен II 161; III 101, 243, 258
Гвайеп II 161; III 101, 245, 258
Гваякол I 129
Гекогенлн IV 175
тозилгидразон III 359
Гексабромциклопентадпен V 279
Гексагелпцен III 152, 171, 309
1,4, б, 8,10-Гексагпдроантрацен V 58
Гекс а гидро галлов а я Кислота III 168
Гексагидрогелииен Ill 171
1,2,3, 8.9,10-Гексагидро-3, 8-Днкетоцикло-
пент- [яфинден IV 118
2,3,4,6,7,12-ГенсагидроиндоЛ-[2,3-£!.Ьхино-
лпзпцон-4 IV 100
(±)'ГексагцдроминДальная кислота JII 169
D-Гексагидроминдальиая кислота III 169
1,2,3,10,11,12-Гексагидронерилен 1 290
7.8, 9,10.13, И-Гексагидрофенаптридин 11
466
ГеКсагпдрофлуоренопЬ! III 52, 53
г;цс-Гекса1'идрофталонитрил IV 78
(lwc-Гексагндрофтальцмид IV 78
10, 12-Гексадекадпенол-1 II 443
н-Гексадекан IV 220
Гексадеканднкарбоновой кислоты диметило-
вый эфир II 256
Ге кс а де к ац аль см. Пальмитиновый альдегид
Гексадецил метил оный эфир V 538
Гексадиен-1,3 IV 30
ГеКсадиен-1.5 см- Дпаллил
Гексадпен-2,4-аль-] IV 130
Гексадиен-1,5-ол-3 1 233; IV 110
Гексадиен-2,4-ол-1 IV 130
Гексадиин-1,5 III 270
Гекеадиин-2,4-днол-1,6 I 253
Гексаметилацетон I 176
Ге кс а ме гил бен зол I 188; III зю, 314, 315,
429; IV 60, pl; V 191
Гексаметилбензол. дьюаровский (гексаметил-
трицикло-[2,2,0]-гексадиен’2,5) V 23
I ,Сг-Гек-саметцленглик(!ль 11 384
Гексаметилендиамин IV 77
Гексамстилендииаоцнанат IV /7; V 363
Ге кс а мсти л ендис Ил аз ан (ГМДС) 1 189; III
385
Гексаметилентетрамин (уротропин) I 189 —
193
1.2,3,4,5,8-Гексаметилнафталин V 137
Гсксаметилтриамид фосфористой кислоты
I 193, 194; II 310; V 78
Ге кс а мсти л три а мид фосфорной кислоты I
195; II 310; V 78
2,3,-1,5,6,6-Гексаметил циклотексаднен-2,4-
он HI 429, 430
2,3 6П, 10,11- Гекса мето кс и трифен и лен IV
«-Гексан П1 154; V 55, 392
Гександцол-1,6 I 315; IV 102
Гексаоксадиамантан III 39
Гексаокснбснзол I 223, 224; III 29
Гексаоксициклогексан см. Инозит, Скиллит
Гсксатриен-1,3,5 IV 110
Гексафепнлбепзол I 107, 297, 298
Гексафепнлпенталип II 107
Гексафторбутин-2 I 196; V 81
1,1,1,4,4.4-Гексафтор-2.3-дихлорбутен-2 I
1 96
Гексафторпропеп II 122
Гексафторфосфориая кислота (фосфорфтори-
стоводородная кислота) I 71, 196; V 410
Гексахлорбензол 1 271
Гексахлорбутадиен I 294
Гексахлордигидрофуран III 313
Гексахлорциклонентаднен I 23, 19 6, 364;
II 153, 154; III 313, 464; IV 200; V 81,
279, 415
Гексахлоринклопропан IV 34
Гсксахлорцнклотрназатриен (фосфони-
трнлхлорид) V 82
1,2,3,4,7.7-Гексахлор-5-э«йс>- ацетоксибицик-
ло-Г.2,2,!]-гептац-'2 V 530
Гексацикло-[5,4,1,0-V ОУ’.ОМ.ОМ1]-
додеканон-4 V 415
Гексаэтнлбензол III 314, 429; IV 60, 61
Г ексаэтил три амид фосфористой кислоты I
196; V 82
Гексеп-l I 146, 262, 313, 314; V 15 36, 97,
369, 392
Гексеп-2 I 263; Ill 379
цлс-Гексец-З I 261, ,314: И 435
Д’-Гексеп-Гб-дикарбоновай кислота III 7
Д3-Гексеновая кислота 111 449
«-Гскспламин 111 159
н-ГеКсил бромистый II 108; IV 255
М-Гексплдибензиламин V 245
«Гексиловый спирт («-гексанол) I 233, 263,
278, 313; III И, 12, 65
«-Гексил фтористый И 108; IV 255
транс-2-н-Гексил циклопропан карбон опой
кислоты этиловый эфир II 117
Гексин-1 I 62, 77, 266, 314; III 337, 440; V 109
Гекспн-З I 19, 261, 266, 314; II 435
Гцксоген 1 189, 190
Гелий I 187
Гсльмиитоспораль II 270, 271
Гемимеллитовая кислота 11 428
триметиловый эфир I 78
Гемимеллитол II 367, 368
Гентизиновый альдегид см. 2,5-ДиоКсибенз-
альдегид II 98
Генциобиозы производные III 284, 285
октаацетат IV 14
Гепарин IV 185
н-Гептадекан I 287
Гептадециламиц I 26
Гептадинн-1,6 I 151
Гептален 1 123, 124; III 400
I - Гепталения фторборат I 124
н-Гептан III 154, 294
Гептандион-2,6 V 537
Гептанол-3 [V 142
Гептапон-2 II 60; III 350
Гептанон-4 V 205
Гептафторизомаслялой кислоты фторангнд-
рид II 122
Гептафтормасляной кислоты иодапгидрид V
214
Гентафульвен I 78
/^ссгкн.н-Гептахлорпропан I 48
эндо, цис, энсФ-Гептацикло-[3,3,1,1М, I4,12,
1 ‘’.".О’ЛОМ’П-тетрадекан (биснор-S) V 240
Гептен-1 I 280
Гептен-2 I 98, 99
Гептеи-З-пн-1 V 23
658
щранс-Л. 2-Гептеновой кислоты нитрил V
109
н-Гевтилампн I 21ft, 11 260
/.чр/тп-Гептилат калия V 83
н-Гептил подпетый I 32/; III 355
N-и-Гецтилмочевпиа II 260, 26Г, III 36
З-н-Геитилуреидометиленмалононитрил II
260. 261; III 36
0-ГептилфенОл IV 203
З-н-Гептил-б-циан цитозин 11 260, 261
Гераниаль V 268, 339
Герацилбромид V 497
Гераниол II 162; V 266, 389
/1,1-ГернанД1ги V 366
Гиамины 662 и 3500 I 197
Гнбберелина А14 диметиловый эфир V 343
Гпбберелиновая кислота I 182
Гидразин I II, 68, 197 — 211, 281, 309, 371;
II 332, 406; III 282; V 84, 118, 393, 623
ацетат I 211
гидрат II 33-1, 335; V 32, 84, НО
определение I 302
сульфат I 197, 206, 211; IV 13
а-ГидразииопириДин II 392
Гидразобензол I 205, 212, 281; II 41, 387; III
164, 197; IV 34
1,2-Гидразодикарбононой кислоты р$-трет-
бутиловый эфир 1 12
Гидразоны I 309; III 274, 453
Грдракрилонитрил IV 192
Гидратроповая кислота I 347
Гидридного иона отщепление III 399, 400
тр(7нс-Гидринданон 2 I 343
Гидрирования катализаторы III 433; IV
147
Гидроазулены III 258
/1,/-1'идробензоии III 389; IV 18, Ю
.иезо-Гпдробензопн 111 389
Гидроборирование I 70; II 380
Гидрокоричная кислота 1 205, 206; II 367
Гидрокоричный альдегид I 332; II 203
Гидрокоричный спирт I 332; II 175
Гидрокортизон II 418, 419
3,20'бцс-семикарбазои III 418, 419
Гидроксиламина сульфат I 215, V 85
Гидроксиламина хлоргидрат 1 215 — 219;
III 379; V 84, 565
Гидроксил амин дисульфокислоты натриевая
соль II 274
а-Гндроксиламинонитрилы I 107
4-ГиДроксилами1!ОцнридиП0 N-окись IV 35
Гидроксиламин-О-сульфокислота I 211—214
281; IV 126; V 85
б/г.с-(ГидроксиламмонНЙ)-сульфат I 211
Гидролапахол ill 282
Гидроперекиси III 59, 60
Гидроперекиси алкилов I 219
Гидрохинон I 34, 69, 84; II 274, 328 363,
375, 424, 425; 1И 72; IV 175
ди ацетат I 46
димезнлат И 232, 253
диметиловый эфир Ц 384
карбоновая кислота III 80
быс-меТокси метиловый эфир IV 136
мономезилат II 252, 253
монофосфата метиловый эфир III 388
Гидроциннамонн IV 82
Гильмаиа тест на реактивы Гриньяра I 229
230
Гипогалогеннтов растворы ] 219 — 221
Гипогалоидирование IV 148
Гиппуровая кислота I 222, 223: III 38;
IV 15
I нстамин III 188, 189
Гистидин III 192
Гитоксигенин I 353
D-Гликозилхлорид, а- и р-111 182, 183; V, 22
Гликолевая кислота I 223; III 274
виЦ'Глпколей расщепление И 48—50;
III 219 — 226
Гликоли (1,2,', 1,3-, 1,4-) см. Диолы
Гликоли, 1,4- и 1,5- I 106
Гликолонптрил (оксиацетопитрил) IV 70
Глик: см. 1,2-ДиметексиэтаН
Глиоксали IV 17
Глиоксаль I 223, 224; II 29, 372, 460, 461;
III 29, 206; IV 40
бис-бисульфитное производное III 206,
247
диметилацеталь II 49
Глиоксиловая кислота (глиоксалевая ки-
слота)
н-бутцлорого эфира н-толуолсульфимид
I 224, 225
н-бутиловый эфир I 224, 225; III 219,
220
диэтилацеталя амид V 508
этиловый эфир I 327
эфиры IV 17
Глиотокспн 1 37
Глицериды III 443
а-ГлицерилФосфорилэтаноламин IV 37
Глицерин И 328; III 155, 291; IV 91
ацетонид 111 348
а, у-дибромгидрин IV 91
моиоформиат II 328
D-Глицериновая кислота II 49, 74
Глицериновый альдегид IV 70
диэтилацеталь II 48
3-фосфаг I 400
Глицидиловые эфиры I 95; П 347
Глицидные кислоты 111 122
Глицидный альдегид III 72
Глицидонитрилы I 149
Глицин I 225
этилового эфира хлоргидрат I 249
Глицирретовая кислота III 397
L-Глутаминовая кислота III 152
L-Глутаминовой кислоты а- и у-бензгидри-
ловые эфиры V 164
Глутаровая кислота I 29, 225, 226; II 404;
IV 65, 66
ангидрид II 25
моноамид I 226
Глутаровый ди альдегид 1 227; II 390, 460,
461; IV 275
Глутатион II 56; IV 206; V 517
D-Глюкоза I 132, 134, 217, 316, 385, 425;
И 48 49; III 79, 146, 147, 225, 226, 274,
301, 359; IV 14, 24
5-лактон IV 206
тозилгидразон II 384
D-Глюкозамин I 424, 425
a-D-Глюкоза, 1-фосфат I 398, 399
D-Глюконамидпентанитрат I 18
Глюкопиранозиды III 187; V 293, 4 78
p-D-Глюкопиранозы пентаацетат V 22
D-Глюкофуранозид-5,6-карбоната этиловый
эфир III 220
Глюкулопиранозиды Ill 200
ГоломиЦнн I 285
Гомовератроиая кислота III 73
Гомогеранилиодид V 497
Гомокубанон V 545
А-Гомо-В-нор-5-кетохолестан II 113
d,/-D-Гомотестостерон V 149
3,4-Гомотропилиден V 546
Гомофталевая кислота III 7
А-Гомохолестеион I 246
Гормон роста человека (гипофизарный' I
140
Гофмана — Лефлера реакция I 105
Гофмана синтез аминов II 403, 404
Грайанотоксин-I V 495
Грамин 1 358
Гризеноны-3 III 198
659
Грнзсофульвиц III 182
Гризеофулььиноиая кислота II 205
Гриньяра реактивы I 227 — 238; V 481
анализ RMffX I 229, 230
аппаратура 1 227—229
«вовлечения» метод I 230, 231
газообразные галоидные алкилы I 230
гидролиз I 232
катализатор I 229
конденсация I 113
«обратная реакция» 1 231, 232
примеры I 232 — 237
1,4-присоединение 1 230; II 230, 243
сорастворители I 231
Гуанидин III 40; IV 245, 277
Гуаннднноуксуснаи кислота III 326
Гуанозин-б'-фосфат III 309
Гумулен III 270; V 330
Гурыонен а- и 6-III 269
Дакица реакция III 72, 73
Даутерм А I 239; II 2G9
Деаминирование I 71
Дегцдрацетовая кислота I 90
Дегидрирование см. Указатель реагентов по
типам реакций
Дегидроабиетнламин I 240
Дегидроабиетиновая кислота II 146; V 557
метиловый эфир I 165; II 153
натриевая соль IV 160
Дегидроабиетинол II 133
Дегидробензол I 108, 322, 323, 389—39;;
II 98, 308, 366; III 238, 4-16; IV 51, 116,
128, 272; V 472, 515
З-Дегидробуфалин (буфалон) II 189
Дегидрогризеофульвин И 104; III 201
З-Дегидро-З-ионол II 219
А’Ч’Ч-Дегидрокортизолацетат II 299
Дегидроноркамфен I 162
Дегидроноркамфора I 83
6-Дегидропрогестерон I 107
3,4-Дегидропролин IV 82
амид IV 82
дз (10)-Дегидрохинолизиди1[ III 177
7-Дегидрохолестерилбензоат III 389, 390
7-Дегидрохолестерпн IV 168. J89
24-Дегидрохолестернн 111 404
Дегидроэргостерин Ш 173
ацетат III 278, 279
6-ДегидроэстрадиолДиацетат III 96
9, JI-Дегидроэстрона метиловый эфир IV 128,
129
15,16-Дегидроэстрона метиловый эфир I 154
Дезил хлористый см. и-X л ор-а-фен ил ацето-
фенон
Дезоксиадепозин, 3'- и 5г-фосфнты I 381
21-Дезокси ан малин V 528
21-Дезоксиаймалин-17-ацетпт Ш 234
Дезоксианизоин III 24
Дезоксибензоин II 194, 436; III 135, 136,
247, 333, 375; IV 11 1
2-Деэокси-2-иод-P-D-мети л глюкопиранозид.
триацетат I 127
21-Дезоксикортизон II 412
Дезоксикортикостсропацетат III 13,' 14
4-ДезоКсипиридоксин ] 203
Дезокеиподокарповая кислота II 152, 153
метиловый эфир II 132, 153
1-Дезокси-Ь-сорбит II 384
Дезоксихолевая кислота I 136
Дезоксиэстрон I 435
Дезтиобпотпн III 162
Дезтиоглиотоксни 1 37
Дез-АВ-Д'ч-холестен-8-карбоповая кислота
Декагцдроацеиафтен 111 142
Аа-Декагидро-3, 8а-диметилпафто-12,3-Д1-
фурапои-2 I 278
^цс-Декагпдропзохшюлип III 170
1,9-Дек;1Д.иин 111 337
Декалин, цис- и транс II 158; 11] 49
(?7ронс-Декал1ШДИсж-1,4 III 196
ДеКалиндион-2,7 V 38
Декалиндиопы-1.5 IV }77
Декалннтриол-2,5,10,5-тозилат II 114
цжцнс-ДекалолД I 86; III 168
Декалол-2 II 451
Де к ал о л ы -1 IV 177, 178
тронс-Декалон II 333; IV 177, 178
Декаметилепдибромид I 131
н-Декап 11 169, 317
ДеканДикарбонопая кислота II 347; III 78
амид метилового эфир;; I 146
Декандиол-l, 10 И 166
Декахлор-бис-цнклопентадиспил III 465
Декстраны 1 82; III 284
Депсиды I 423, 424
Депсиды лишайников I 423, 424
Десульфуризация см. также Никель Ренея
Децен-1 I 175, 263; III 01
ц;ринс-Децеи-5 II 144, 143
«цс-Децеп-2-дии11-4,6-аль II 223
1{Цс-Децен-2-диин-4,и-овая кислота 11 222,
223
дг/с-ДеЦен-2-дипн-4,6-ол-1 И 222, 223
цпс-5-Децеи-а,ю-дикарбоцовой кислоты диме-
тиловый эфир 11 137
ДеЦнлкетена димер Ill 452
Дециллнтий II 137
Децпп-З II 144, 145
З-Децин-аи-дикарбоповой кислоты димети-
ловый эфир II 137; V 513
Децин-1,2-днкнрбоновои кислоты диэтило-
вый эфир II 118
Ай-Дециновая кислота II 246
Дженетрон-131 см. Тетрахлор-1,1-дифтор-
этан
/Джонса реагент IV 176, 177
1,5-Диазабицикло-[4,3,01-цопс1]-5 I 240 — 242;
V 88, 114
Диазальд см. N-Метил-N-нитрозо-/!-толуол-
сульфамид
11,12-Диазастероиды I 209
Диазахнпопы I 171; Ш 211
Диазиридин см. Диазометан
Дпазнридцны I 214' IV 123, 126; V 86, 514
Диазирин I 402, 103 405; IV 123, 126
Диазпрпны 1 214; IV 125. 126,; V 86, 169
Диазоалканы — никеля карбонил 11 438
9-Диазоантроц III 356
Диазоацетофенон I 102, 2 09; II 44, 45
231; V 271
1,4-6t/c-(u-Диазобензил )-бензол II 2ЭЗ
й-Диазо-З-дикетопы III 356
2-Ди азодимедон 1И 356: V 232
1-Диазо-4,5-д,нметил-1,2-беизохиноп III 358
4-Диазо-2,6-дпметил-1,4-бспзохинон III 358
З-Диазо-2,6-диокси изопикотиновой кислоты
этиловый эфир II 17, 18
2-Дпазоиндапоц-1 III 358; IV 123, 12-1
Дназокетоиы ] 14, 15; III 276, 358, 411,
412, 451, 432; IV 123, 124;
Диазометан I 123, 242 — 248, 428; II 129
1.37, -107; IV 133; V 92, 217
Диазометапдисульфон ат калия I 248, 249
Диазония борфторид II 384, 383
Диазопня борфторид — никеля карбонил II
438
Диазонпя соли I 23, 28, 71 — 73, 401; II 17;
IV 72
З-Диазоиопиной IV 124
Диазотирование апротонное II 17
9-Диазо-2,4,7-тр11[;птрофлуоре1г III 274
Дн.пзоуксуспып эфир I 249 — 252; 11 417;
V 9з, 174
660
9-Диазофлуорен I 252; IV 124
Диазоцнклопентадиеп III 356
A1 -ДиалиН II 44
3 4-дикарбоновые кислоты Ц 357, 358
Дз-Диалии И М2, 1-13; Ill 42
1.4-дикарбоновьге кислоты II 337, 358
Диаллил (гексадиен-1,5) I 233, 315; II 438;
V 328
Диаллилсульфоксид II 226
Диамантам III 39
Ди-н-амнламин I 252
Дм-к-амвловый эфир III 414
4,6-Ди амино-1-арил-1,2-дигидро-сил(л-тр па-
пины 1 420
Диаминобиурет III 462, 463
1,5-Диамино-2,6-диоксинафтал пн III 26
4,4'-ДиамнноДпфепилмета11 III 1G
2,5-Диамино-3,4-дициантиофен Ill 112, ИЗ,
318
2,4-Диаминонафтол-1 II 402
61 ic хлор гидрат II 8,9
2,4-Диамино-6-оксипиримидин IV 245
2,4-Диаминопирпмидины I 420
2,4-Диамиио-си,1ки-трназнн I 352
5,6-Диамивоурацнл II 325, 402
хлоргидрат II 325
2,4-Днамипо-6-фенИл-сд,и,м-,гриазин (бенз-
гуанамин) I 420
3,3'-Диаиизол-б«с - 4,4'-(3,5-дифе i и.ч) -тетра-
золийхлорид см. Тетразолнсньгй плубой
Диарилвнниловые спирты III 237
Диарилгндразоны II 223
Диарилдиазометаны 11 225
Диарилиодония соли II 59
Диацетил II 341; III 388
2,4-Диацетиламнионафтол-1 11 9
1,о-Диацетилантрацец IV 153
о-Диацетилбензол II 89, 90
n-Диацетилбензол II 90; V 217
5,7-Диацетилбццикло-[2,2,2]-октен-2 II 2 71,
272: 111 125
Диацетилен I 252, 253: IV 274
Диацетилены II 246
У,у-Днацетилпимелонитрил III 454
С,N-Диацетилфенилацетамид I 113
Диацетилхромат IV 182
4,16-ДиацеТилцевадпн - 12,14,17 - ортоацетат
IV 145, 146
N,S-Диацетил цистеин 1 128
1,8-Диацетокси антрахинон-3-карбоновая ки-
слота I 260
9,10-Диацетоксиантрацен III 218, 219
транс, тра«с-1,4-диацетоксибУтад!|ен I 254,
256
9,10-Днацетокси-9,10-дигидроантрацен 111
218, 219
За, 21 - Ди ацетокси-11 -кетопрегнан-20-циац-
гидрин IV 87
3,12 -Диацетокси - бис - норхолапилдифенил-
этнлен I 234
1,8-Дяаи.етокси-3-оксиметил ацтрахинон I
260
1,3-Диацетокси -2,2,5,5-тетраметилциклогек-
сан V 61
Зр, 5а-Ди ацетокси-9-эр госта диен I 304
Диацетонамин IV 230
Ди ацетон иД-D-галактопиранозида 6-тозиЛ ат
II 170
Диацстонид-Ц-фукоиираиозид II 170
Диацетоновый спирт 11 36
Диацетоуксуснын эфир II 210, 228
1,2,5,6-Дибензацтрацец II 3?2; III 217, 218
1,2,3,6-Дибенз-3,4-дпфеннл цикл ооктатет-
раен IV 272
Дибензил I 402; И 357, 391, 403; III 344:
IV 130; V 377
Дибензиламин I 402
1,1-Дибензилгидразин 111 379, 380
Дпбепзилкетоксим II 177
Дибепз ил кетой I 256; III 110, 135, 136;
/IV 59
Дибензилсульфнд 11 226, V 83
Дибепзилфосфач серебра 1 256
Дибснзилфосфнт 1 257
Днбензмлхлорфос.фат I 257
Днбензкоронен III 133
З.З-Дибензонламино-б-бромметплх-ппазолин
I 269
ЙД-т^пбснзоиламиио-б-метилхипазолин I 269
а-Дибеизонлбензол I 383, 389
1 ,4-Дибепзоплбсизолдигидразон 11 223
К.М'-Дибеизоилгндразпп I 198, 356- II 353;
Ш 210
Дибеизоклдиимид III 210
Днбензоплдисульфид II 35
Дибензоилметан II 257; IV 241, 212; V .321
трд«с-1,2-Дибензоилэтилсн ! 257, 258
1.2-ДнбеизоилЭтилен III 25
2,3,10,11-Днбспзперилсн 111 162, 163
1,3,4,5-Днбеизциклогептаи II 20
2,3,6,7-Дибепзциклогептапон II 20
),2,5,6-Дибензц!1К.чооктаиои-3 III 134
Ди-2-бпцикло-[2,2,1 J-гсптилкс'топ II 438
Диборап I 258 — 268, 313 — 315; III 370, 379;
V 15, 35, 50, 183, 535
1.3-Днбромадамднтан 1 110; V 37
2,6-Дибром-4 -амипофенол III 25
2,6-Дибромаиилии III 65
Дибромантпн См. 1,3 -Дибром-j, 5-ди метил-
гидантоин
9,10-Дибромантрацен И 240
2₽, 4 ₽-Дибром-1 /Р-ацетоксиэтиохолац II 200
о-Дибромбепзол 11 366
/7-Дпбромбензол V 61
10,10-Дибромбицикло-1. i, 1,0]-деиен-1,2 V 295
9,0-ДибромбпцпклоДб, 1,01-ионail II 283
1,4-дпбромбутан III 415
а,«'-Дибромдибензилкетоп ш 456
2,2-Дибромдкмедон 1 300
1,3-Дибром-5,5-диметилгидацтонн («дпбро-
мацтиц») I 269; V 10,3
1,12-Дкбром-З 10 - диметплдодекатриен - 2,6,
10; II 439
3,4 Р-Дибром-1 а, За-диметилен -А11 циклогек-
сен II 469
2.5-Днбром-3,4-дннитротнофеп IV 97, 98
1,4-Дибром-2,3-дифенплбутец-2 I 383
Дпбромдифепилмстан II 7
Дибром(днх-лор)дифе1Н!лмстан II 7
Д ибромдифто^рметан I 2 69, 2 70
5,10-Дибром - / Н-индецоДЗ, 1 -aj-Иидеи IV 00
Днбромкарбен I 154; 11 282, 284, 469; IV 5 3;
V 20, 430
а, а’ - Дибром-о-кс и лол II 31; V 202
Диброммалононитрнл III 239
Дибооммалононитрил — калия бромид III
314
Днброммалононого ди альдегида тетраэтил-
ацеталь III 115
Днброммалоиовой кислоты диамид I 270
Дибромметакриловой кислоты атидовый
эфир III 410
1,2-Дибромметил-3,6-диметилбсизол I) 170
5а, ба-Днбромметилсн-А '--^-эргостаднепола-
3|3 тетраг11дро[|Ираг1Иловый эфир II 155
2,6-Дибром-4-метплфенол 1 360
2,2-Дн-(бромме,['иЛ)-Ц>)Клоокта:юн IV 260
2.6-Дибром-4-цг1трофсгюл III 23; IV 132
7,7-Дибромноркаран I 286, 338; IV 54, 122;
V 20, 294, 430
2,6-ДиброМпириДин 111 430
N-окись III 430
3,5-Дибромпиркдиц 111 262
1,3-Дпбромпропап I 220; IV 242
2,3- ;-Ъ:бромпропен-1 I 100
3,3-Диброметирол I 416
661
1,1 - Дибром-2,2,3,3-тетраметил циклопропан
III 373
2,4- Дибром-1,1,5 5-тетрафен илпепта диен-1.4
I 348
2,5- Дибромтпофен IV 98
1,1-Д11бром-2,2,3-тр11метнлццклоггропан 1П
372, 373
2.5-Ди-п-бромфени,п-3,4-днфе11илфурац III
122
1,3-Дибром-1-фенилпропан IV 215
2, З-Д пбром-1-феи ил пропанол III 121
2,4-Дпбромфенрл III 410
2,6- Дибромфенол V 54
2й,4а-Дибрс,мхолсстанон-3 IV 1G9
бяДВ-Дибромходестанон-З 11 377; IV 219,
230
Дибром циклобуте в III 121, 122
1,2-Днбромциклогексац III 304; V 322
8,8-Дибромцикло-L5,1,0]-октан И 284
асл-Дибромциклопропаны III 372; V 295
2.4-Дибромэстрон II 12
Дпбромэтан I 270, 271, 294; II] 375; IV 244;
V 290
активатор при получении RMgX I 270,
271
а,|3-Дибромэтпловып эфир III 55, 56
Ди-н-бутнлакиц I 271; IV 263
3,4-Ди-и'1рОТ!-бутил анилин 1 72
о-Ди-тдет-бутилбенЗол III 164
п-Ди-тре/п-бутнлбензол I 43, 44; III 324,
342; V 245
2,6- Ди-трет-бутил-1,4-бензохпнок I 412
диметил ацеталь I 411, 412
Ди-ргре/н-бутилдиазиридинон I 161
Ди-н-бутилднвннилол'ово I 237, 272
Ди-тре/п-бутилимипоксил 1 271
Ди-н-бутилкарбинол I 233; II 332
Ди-н-бутилкетоп III 233
Ди-н-бутцлмалоиовая кислота III 233
2,6- Дн-игрет-бутил-4-метилфенол HI 11
2,6- ;1и-/дрет-бутил-4-метоксифенол 1 411,
412
Ди-н-бутплоиый эфир I 110; Ш 200; V 203
Ди-«-бутилоловоднхлорид I 27э
2,0-Ди-трет-бутнлпиридин I 272; V 104
Дп-н-бутилсульфаг III 294
Ди-«-бутилсульфид I 332; II 226; V 236
Дп-н-бутилсульфит III 294, 332, 334
Ди-н-бутилсульфоксид I 332; II S2G
Ди-м-бутил-Ь-тартрат скг. Винной кислоты
ди-н-бутиловый эфир III 219, 220
3,4-Д11-/ирет-бутиЛфеннлацетат I 72, 73
2,6- Ди-тр?/п-бутилфевол I 105
Дн-н-бутилфталат I 299
N, N'-Дн-т рррз-бутил-N-хлор мочевин а I 164
1 Д-Дн-треш-бутил-! ,3-циклогексадиен II
194
2,3-Д1[-;?гре??(-бутил-1,4-циклогексадне11 11 194
N, N-Днбутилэтмлендиамнн IV 263
Дпбутокси-1-бром-3,3,3-трихлорпрС1пилбор ан
1 145
2,2-Ди-д-бутоксипропан (ди-к-бутил кеталь
ацетона) I 272
Дивинилртуть I 272, 273
цис- и /рранс-Днвинилниклобутапы V 111
гсдсДигалогениды 11 315, 316
Дн-ц-генсиламин III 159
Дигидпоабиетиноной кислоты ф-лактон II
ISO.' 386, 387
1,3-Дигпдро-2 [’Ьазеинпон-2 IV 125; V 521
9, Ю-Дигидроантрацен I 162, 2^0; Ц ЗУ1;
III 400
1,-1-Дпгидробензопная кислота I 109
3,4-Днп1Дро-5Н-бензопнны III 147, 148
2, ИДДш'идробпКспн IV 222
Р-Дигндрогаррофолпнднацетат 111 89
Дцгвдрогексафепнлпентален I 326, 327; И
107
1.G-ДигидроГептален I 123, 124
1,10-Дигидрогептален I 123, 124
Дигпдродигитоксигенин III 376
1,4-Ди гпдро-3,5-дикарбоэтокси-2,6-диметил-
пиридин I 30; IV 69
2,5-Дигидро-2,3-диметиЛфуран I 185
Дигидродносгенин II 180
1,3-ДигидроизоинДол I 130
Дигидроизофорон (3,3,5-тр и мети л цикл о гек-
санон) III 375, 376
3,4-Дцгидроизохиполии II 331
2,3-Дигидроиндол II 82
Дигидрокатарантин III 178, 179
2.3-Дигидоо-3-кето-1 Н-пирицо-[Зт2,1-й/]-фе-
потиазин 111 441
Дигидроконесеин Ш 3G3, 364
Дигидрокоричиый спирт см. Гцдрокоричный
спирт
4,бо-Дитидрокортизон-21 -ацетат II 411; IV
Дигидрокостунолид I 40; П 202
2,5-Ди гидрокумол II 195
2,3-ДигидролизерГиповой кислоты амиды II
Дигпдронафтазарян II 364
Дигидронафталнв см. Ди ал ни
1,2-Дигндроцафталип II 132; V 211
1,4-Дигидро нафталин II 156, 358; V214
&,8-Дигидро-1,4-цафтогидрохинон II 420,
432, 433
3,4-Дигидро-1,2-нафтойный ангидрид II 428;
III 257; IV 241
5,8-Дигидро-1 -нафтол I 109
5,8-Дигидро-1,4-нафтохнцон II 420, 432, 433
ДкгиДронеотигогенин I 22
3,4-Дигидро-2-оксимино-1 -нафталинон I 140
Дигидропиран I 226, 273 — 275; II 213, 257;
III 286, 448; IV 121; V 475
1,2-Дигидропирен I 290
тетракцсДИ-ДигидропирнДил )-алюминат I
275; II 184
1,4-Дигидропиридин III 382, 383
Дигидропиридины II 403
1,2-Дигидро-ЗН-пИрролизин III 173
Ди гидрорезорцин см. Циклогександион-1,3
транс-Дигидро-а-терпине.ол II 95
Дигидротестостерон I 344
5,6-Дигидро-1,21Зг4-тетрафенилбензол III 311
Дпгядротигогенин I 22; II 130
1,3-Дигидро-3,5,7-триметил 2Н-азепинон - 2
III 461; IV 125
9.10-ДигиДрофенанТреп I Ю
10 -Дигпдрофенантреидиол-9,10 III
42. 43
9, НЬДцгидрофенантрендиолы-Э, 10 III 42,
3,4-Дигидро-4-фейилкарбостирйл III 140
Дпгидрофлавоны I 119
ДигидрофосфопнриДиннуклеотиД II 403
транс-1,2-Дигидрофталевая кислота V 318
пне-1,2-Дцгидрофталевый ангидрид III 232
2,3-Дигидрофурап II 343
1,2-Дигндрохпнолин I 277
Ди гидр ох ин олины III 147
2,3-Дпгидро-6-хлороаксепин IV 121
1,2-Дигидроцикл обута-[в]-нафталнндион-
3,8 (Новое название 2,3-Диметилен-1,4-
нафтохинон) III 63
9, |0-Дигидро-9,10-эпоксифенантрен I 194
5-Дпгидроэргостерияац.етат 1Ц 174, 175
1,4-Дигидро-4а, 9а-этаноантр ацен дион-9 11
111 63
ДигитоГенин IV 178; V 104
Днгитогеновая кислота IV 178
Дигитоксигенин III 190, 376; IV 2'3, 274
ацетат III 249. 2о0
Днгнтонин I 319, 320; V 104
Диглим (диметиловый эфир диэтиленгликоля)
662
1213 238. 275, 371; II 186. 203, 382; II I
155, 447; V 306, 471
Ди -н-децилсульфид II 148
Ди-я-дени.1сульфон II It 8
Диенон — фенол, перегруппировка III 44I
442
Диизоамиламин I 252
Диизоамилбор ан см. бис-( 1,2- ДиметнлИро-
пил-1 )-боран
Диизобутилалю.минийгпдрид I 275—278; V
108, 252
Диизо бутилен III 59
Диизоналероилметан I 63; II 228
Дипзошпюкамфилборан I 267, 279; III 376,
377
Диизопропиламнн IV 253
1,4-Диизопропилбензол I Ill
Диизопропилнатрийамид I 279, 280
ДинзопооиилпероксиДиКарбоват I 280; V
110
Диизокропилсульфоксид I 158
Диизопропоксиборан I 259
ДиимиД 1 12, 13. 70, 212. 280 — 282; V 110
1,4-Дииодбензол III 421
1,4-Дииодбутан III 229, 300; IV 102
1,6-ДиноДгсксан IV 102
1,3-Дциод-Э,5-Диметилгидянтоин I 282, 283
1,1 - Ди- (иодмстил)-циклобутан IV 260
2.6-Дииод-4-нитроанилин II 40
3,5-ДииоДтирозин II 32
Дикалийродизонат V 269
6,3-Дикарбметоксидиэтилсульфид IV 17
2.6-Дикарбметоксициклогексанон II 305
1,2-Дикарбэтокси - 1 - (2,5-диметилгексадие-
нил-2,4)-гпДразин I 13, 14
1,2-Дикарбэтокси - I -{2,5 -димстидгексадие-
нил-1, 4)-гидразин 1 13, 14
3,5-Дикарбэтокси-2,6-диметилпиридин I 30
1,2-Дикарбэтокси-4,5-диметпл 1,2,3,6-тетра-
гидропиридааип I 13
4,5-Дцкарбэтокси-1,1-дифторноркаран V 1/3
1,2-Дикарбэтокси - 1 - [1 -цпклогексадиенил-
2,5)]-гидразин 1 14
2,0-Дикарбэтоксициклогександпон -1,4 IV
194
N, N' -Дякарбэтокси-энРо-метилеитетр агидро-
пиридазин I 14
Дикетен I 89, 90, 98, 283 — 285; II 127; г7 37S
Дикетен — ацетон, аддукт I 286
Дикетен — ацетофенон, аддукт I 286
6,17-Дпке'гоандростандиол-Зр,5а-3-ацетат 11
301
бг/с-ДнкетогиДринден II 428. 429
1,3-Дикето-2,2-диметоксигидрияден И 278
3,4-Дикетокопростан I 322
7,11 -Дикетол аностан ил ацетат I 199
1,6-Дикето-8а-метил-I,2,3,4,6,7,8,8 а-октагп-
дропафтаЛин (метилокталпндиоц) II 268,
269; III 129
3',4-Дикето-7-метокси-1,2.3,4-тетрагидро-1,2-
циклопентеиофенантрен III 134
а-Дикетоны 111 468; IV 14, 17
моцокеталн И 278
1,9-Дикето-[2,2]-парациклофан IV 20
1,10-Дикето;[2,2]-парациклофаи IV 20
4,5-Дикето-[0]-парац,иклофанмоиогидразои
II 224
9,10-Дикетостеариновая кислота II 91, 92
11,12-Дикетостероиды I 186
Дикетоянтарная кислота II 28
Диэтиловый эфир III 80
Дикмана циклизация I 149
Ди кобальтгексакарбон и л —дифенил ацетилен
I 289, 290
Дикобальтоктакарбонил I 28В —291; II 132,
359; V 240
Дильса — Альдера реакция I 2о4 —256; И1
63, 158, 310, 311; IV 127, 128; V 21, 236
Дильса — Альдера реакция. растворители
I 291—299; V 31
Дильса кислота I 220, 221
Дильс;; углеводород (З'-метил-1,2-цпкло-
пентеиофепантрен) III 214, 245
Димазин см. N, К-Дпметидгидрнзин
Димедон (6,3-дпметилцнклогександиоя -1,3)
I 299-301; II 405, 406: III 356; IV 243,
244; V 130
АГ-Димедопоаминокислоты Г 300
б/ж-(Димедоп)-метилен I 300
Димезитилхлорметан Ш 266
Димеркаптомалсиповой кислоты дпнитрила
дикитриевая соль V 190
2,3-Димеркаптопроцанол см. ВАЛ
4,4 - Днметилазетидинон-2- М - сульфоклорид
IV 155
Димстилакрнлоная кислота 1 220
Диметилалленкарбеновая кислота II 437
2.2-ДимеТ11лалл11Л11денциклопропа11 V 57
Диметилаллилкарбинол IV 214
/прнс-(Диметил амидо)-фосфин I 301 см.
Гексаметнлтриамнд фосфористой кислоты
Диметиламин II 72, 141. 143; IV 67; V 303
и-Диыетиламипобензальдсгид I 301, 302,
355, 415; II 295, 456, 457: V Ш
4,4'-б/|,/'’(Д11метиламино)-бензол I 48; 1И 17
Дпмечиламиноборац I 33, 302
З-Дпмстиламиномстилеииндолепин: I 358
З-Диыетиламино-^-метилгтспТип-З II 72
З-Диметиламннопропиламин I 302, 303
N- (З-Дпметнламннопропил)-М7-этилкарбоди-
имид, хлоргидрат I 303
Дпметилами,(оукс-усной кислоты гидразида
хлормстилат 11 12
Дпмстиламиносульфоиплметилидлитий 1 303
лнлт/рймусЛДиметиламикоДшгап V 113
о-Диметиламинофен илсульфа г калия II 99
о-Диметил аминофонол II 99
о-Диметиламипофулызеп I 351, 353; V 148
З-Дпмстиламиноциклогексанол II 106
Диметиламиноцпклогексен-1 II 115
2-(Р-Диметнламиноэтил)- амипопиридин I 58
1 Диметил амино-1 -этокснэ'гилен I 306
М, А-Днметил ан ил ни I 47, 48, 303 —305,
380; II 106, 225, 456, 437; III 17, 237; IV
67; V 1 14, 236, 473
3,4-Диметиланилнн II 242
2,3-Диметнлантрахинон Д1 430
2,3-Ди метил антрацен ]А? 128
9,1 0-Диметилантрацен I 339; III 315; IV 200;
V 138
Диметилацетамид I .305, 306; V 115
днэтила деталь I 306, 307
Диметилацетнлсн Н 6; III 383
3,4-Диметил-З-ацстил-б-к.арбэтокснпиррол I
75
3,4-Диметнлбензальдегид II 295
2'.4-Димстил-1,S-бецзантрахцнон II 363, 364
9,10-ДпМетпл-1,2-бензантрацен III 27
а,а-Диметилбеизилизоци анат IV 190
а,а-Ди метилбензоилуксусной кислоты эти-
ловЫ!, эфир 111 397
и./г'-Диметилбензофенона оксим 11 330
2,5-Ди мет пл 1,4-бепзохнион I 115; III 63
2,6-Дпметил-1,4-бснзохи11О11 I 1)5; III 63,
96. 358, 427
4,л-Диметил-1,2-бензохивоц III 358
2,3-Диметплбутадпен 1 13. 129, 22-5, 307;
II 430, 446; Ш 217; IV 128, 200, 334, V 183
2.2-Днмстилбутаи II 330
3,3-Димстилбутанол-2 I 118; V 116
2.3-Диметилбутен-1 I 1)8
3,3-ДнмсТилбутен-1 I 118, ДЮ; II 433
2,З-Диметилбутен-2 I 118, 266, 307, 308; III
359
2,3-Днметилбутил-Э-боран («текенлборзн»)
(см. также Дибораи) I 266, 307, 308; V [ 15
663
2.6-Днмс1 ил-4-тдет-бутил ацетофенона ок-
сим 11 2GJ5
iripci/Jc-] Ю-ДнМетил-йдД, 10, IG, 16-генса-
гн дро-2,7-iiiipon хинон II I)
2,3-Димстпл-1,4,4а, 9, 9а, 10-гексагндро-9,10-
।[донепантрацен IV 128
2,.5-Дпметилгексиднен-2,4. I 14
2,,3’Дпметпл['екеанДнОЛ-2,5 111 78, 79
2.6-Д кмсТилгентатетраен-2,3,4. j 11 284
4,6-Димстил-Д'-гептенол-4 111 420
3. о-ДиметилгиДантоип 1 282
N 19(МГ)-Диметил1 идразин 1 190, 308, 309; V
117
М,Д-Днметнлгидрокспламин III 69
N. М-Диметилглициигидразид, ХлорГиДрат
1 ,309
[3, Д Диметил глутаровая кислота 11 405, 406;
111 85
3,3'-Д(гмет11;|-4,4'-диамииодифеГ|Ил см, о-
Толидин
2,3-Диметнл-1,4-дцгцдроантрацеп IV 128
1,6-Д имстим-7,12-ДнГндроплсйаден III 258
9,10-Д иметнлдигидрофеи аптрспднол-О,10 1 ] I
222
2.6-Днметил-3,5-Дикарбэтокси- 1,4- дигидро-
ntt рндин IV 09
1,2-Димстпл-4,5-ди- (мсркаптометнл) -бензол
I 309
3,3'-Диметил-5,5'-диметоксн-2.2'-днфснохи-
поц 1! 104
1,2-ДнМетпл-4.б-дпиитробензол III 0 4
З.З'-Диметплдпфенил IV 1)6, 07
1,1 -Ди Метил-3,3-дифсп ил аллеи III 404
З.б-Дпметил-ЗД-дпфенилДД-ппрянон-! III
135, 136
1, '2-Д1гметил-4,5-ди-( хлор метил) -бензол I 30!)
2,3-Диметпленнафталиц см. Нафто-[в]-цпк-
лобутен
2,3-Диметилеи-1,4-нафтохинон III 63
la, оа-Димстилспциклогексанон-З см. Бц-
Ц1,гкло-(3,2,1 j-oKi икон -3
7,8-Диметплсп.и.иклпоктатриен-1,3,5 IV 220
3,5-Димстнлпаоксазол I 214
2.2-Диметил-3-изонропплиденци1<лопрог|нл-
1-карбоновая кислота III 233
1,4-Димстил-6-нзопропнли!1Дан I 250
1,0-Ди мстил-! -изопропил-1 ..2,3,4-тетра1'идро-
нафталпн И 102
2,3-Диметилиндол IV 235
1,1-Димстилипдолийперхлорат II 66
Диметилкарбоиат I 294; V 119
2,3-Днметпл-5-карбэтоксипиррол IV 164
2.4-Димстил-б-карбэтокснпиррол I 235
Диметиякстси I 310—312; IV 213
димер I 310
[3,3'-Диметплкротональдазнн II 392
Дпметнлмагнии I 312, 313
Диметилмалоповая кислота I ЗЮ, 311
ангидрид I .310, 311
диметр,лк-етен а ацил аль I 311, 312
Димстилмплоиопптрил II 394
4,12-Двмстял-(2, Д-метацн клофан II 9
3,3-Диметил-1 - [2" метил.пкперидицо] - бута-
иоц-2 I 200
2.5-Диметилм1И1Дальная кислота 1Ц 32
Дз-ДиметилнафталнЕг I 408; IV 127, 130
1,6-/1иметнлнафтал!!н И 105
2,3-Днметилнафталиц II 376, ,377, 427; III 62
N, М-Диме-щл-а-нафтпе.-диг-ц 1 139
2,3-Диметплнафтохнион-1.4 IЦ 02, 236
Диметилнеопен ['илметиламцц I 40,б'
N.N-TlHMeTjin.p-aJripoaoaHiKTiin 1 345
1,2-Димстил-4-ццтр(!-3-п|1тротобе!1.-5ол III 64
1,2-Дпметил tiopoopiteti IV 26
Ди метиловый эфир II 357
З.З-Днмстил-бН-ЬО-оксазпи И 446
Дн метил о Кс ал а г I 294; IV 232
N, N'-диметилоксамид I 244
2.7-Дпмсти.’ЮКСспии I s41; IV НО, 141
3,5-Диметил-4-окспбенчальдегг1Д 1 413
а,у-Диметил-Р-окснкаприлоннй кислоты эти-
ловый эфир IV 212
2,4-Димстил-2-окси-А2-пентеновой кислоты
метилопый эфир II 429
2.2-Димет1глоктаДекановая кислота II 195
2,7-Димстплоктадиин-3,5-диол-2,7 I 253
1,10-Диметпл-А1<.91-окта,чои-2 1 97; II 265
2.5-Диметил пента диен-2.3 П 284
2,'1-Диметил Д^-пеитацимовой кислоты ме-
тиловый эфир II 429
4,4 -Димстил пентанол-2 I 314
3,5-Диметилпиразол I 75, 200
5.5-Дггметил-Д г-пнразоли!( 11 392
2,6-Диметилпиридпн см. 2,0-Лутидин
4,5-Диметплппрндиц-2-карбоновая кислота I
225
2,4-Диметияпиррол IV 164
3,4-Дкметилпиррол 11 446
2,2-Диметилпиррс1лидин II 171
5Д-Дгшетилпирролидон-2 II 171; III 159
Г\-2.5-ДиметилцИррол-М-фталимид I 68
1,6-Диметилплсйаден III 258, 259
бнс-(1,2-ДпмстнЛ[|ропг1л-1)-боран («динзо-
амилбораи») I 262, 265, 313 — 316; V 123,
242
N, М-Димстил-1,3-пропнлендиамнн IV 253
Диметилсульфат (см- также Метил Йодистый)
I 33, 291, 316—318; II 279; IV 254; V 147,
564
Диметнлсульфат — бария окись I 318
Димстилсульфат — калия карбонат I 318
Ди мети л сульфит I 294, 3 18—319
Диметилсульфоксид (ДМСО) I 33, 80, [66,
295, 318, 319 — 335, 371, 372; II 107 — 109,
231, 279, 310, 316, 366, 440, 465; III 155,
231, 264; IV 17; V 29, 48, 56, 124, 144, 293,
471, 530
Диметилсульфокснда производные
ДцметилсульфоНсоииймет илНД I 341 —
344; III 386; V 141, 144
диметилсульфоний метил ид I 339—341; Щ
366; V 139
метил суд ьф и н ил мети л и дн атрий (дим-
силнатрий) I 335—339; V 134
Дпметилсульфон 1 345: V 144
1,1-Днметилтетралин 1 408; IV 127, 130
2,4-Днметилтиазол IV 103
2,3-Диметилтииран V 294
\,N-Диметил-Н-толуидиц II 96
4,5-Ди метил-1,2,3-триазол III 383
9,10-Дпметилфен антрен III 222
N, N-Дпметил-п-фенилендиамин I 345, 346
3,5-Диметил-Ы-фецилпиразол I 74
бкЗ’Джметил-З-фенилпроционитрнл I 320, 321
Диметилфенилхлорсилан V 299
N, N-Диметил-р-фецНл-лиламин IV 68
2, ч-ДимеТилфенол III 427
2,3-Димстилфецол III 63
Э.б-Дпмстнлфснол I 105; [I! 63, 96, 427; IV
125
3,4-ДимстилфеНоЛ I 193
2,6-Диметилфенолят натрия III 97
Димстнлфопмамид I 73, ‘14о, 205, 305, 318,
346—351,’ 370, 372; II SO, 108 ИЗ, 122,
199, 205, 231, 245, 278, 279, 292, 310,310;
111 133, 234; IV 182, 205; V 146, 293, 521,
56 5
динеопентилацеталь I 35I
диэтплацеталь I 351, 352; V 147
этилендеталь I 352, 353
Диметнлформамид — ацетат натрия I 353
Диметилформамид — диметнлсульфат I 353,
354; V 148
Дпметилформамид — тиснилхлорид (реак-
тив Вильсмейера) I 354—358
664
Днметилформамид — хлорокись фосфора
(фосген) I 358 — 360; V 148
Диметплформиминпя хлорид I 358
Диметилфосфит I 360
Ди мети л фтал ат см. Фталевой кислоты диме-
тпловый эфир
3,6-Диметил-1,2-фталевый ангидрид II 168
3,6-Дпметилфталевый спирт II 168
4,7-Диметилфталид II 168
6,6-Диметилфульвеи I 83; II 67
2,5-Диметилфуран I 326
2,6-Димстил-о-хннол, димер III 428
2,6-Дмметилхинолин I 36 г
Двметилхлорметилеиаммонийхлорид см.
Днметилформамид—тион ил хлорид
З.б-Диметил-З-хлор.метмлязоксазол I 361;
II 299; V 148
4,5-ДиМетил-А5-ХолесТеиоц-3 I 153
4,4-Диметнлхолестериц [I] 149
2,3-Диметил-5-циано-2,4-бензохинон I 31
и.З-Диметнл-З-цианогидрохиион I 31
5,5-Д1шетилциклогексаидиои-1,3 см. Диме-
дон
3,5-Диметил-А2-циклогексенои III 105
N, N-Диметилциклогексилметиламин II 172;
III 68
транс, транс, траж?-Диметил цикл одоДскат-
рНен II 439
2,5-Днметилциклопентацон V 328
2.3-Диметил-9,10-эпокси-1,4,4 а, 9,9а, 10-гек-
сагидроантрацен IV 128
2.3-Диме1илэт1тлецимии, мезо- и d,l- II 462
Дпметилэтинилкарбинол (2-метиЛбутиц-З-
□л-3) I 62; 63; II 213; V 207
2,5-Днметоксианилил I 349
2,3-Диметокси-б-ацетилТОлуол III 138
2,3-Диметоксибензальдегид 111 104, 160
(3,3-Диметоксибе1ХЗил)-ацетоуксусной кис-
лоты этиловый эфир III 135
2,6-Диметокси-1 Д-Оеизохинон I 411; V 486
”,7-Диметоксибицикло-[2,2,1]-гептан П 154
7,7-Диметоксибицикл о-[2,2,1]-гентен-2 11
154
2,3-ДиметоксибутанДиол-1,4-дитозилат I 321
2,2-Диметоксибутанон-З V 287
4,4-Дим.етоксибутаион-2 IV 73
3,4-Диметокси-1,6-геКсандниитрил I 321
6,7-Диметокси-3,4-дигидро-2-нафтойная кис-
лота II 334; IV 241
2,5-Днметокси-2,5-диГидрофурап II 215, 216
3,13-Диметокси-8,16-диметил- [2,2] -метацик-
лофан II 9
2,3-ДпмеТоксидифенил 1 49
2,6-Диметоксидифенил IV 51
4,4'-Диметоксидифениламин II 342
4,4'-Диметоксидифенилиминокеил II 342
З.З'-Днметоксидифеновая кислота III 61,
62
2,3-Диметоксикорнчн ая кислота III 101
О.б-Диметокси-й-.мстплбензальдегид I 38
6,7-Дмметокси-З-метил инден-2-карбоновой
кислоты этиловый эфир III 135
1, >-Диметокси-6-метилнафталин I 174
1,2- Диметокеин афталин V 286
1,6- Ди метоксинафтали и II 2ь”
1,7- Ди,мегокси-6-нафтойняя кислота 1 174
5,6-Диметокси нафтохинон -1.2 II 8
3,3-ДиметокСипрегнандиол-17а, 21 -дпоц-11,
20,21 -ацетат III 253
2.2-Д:1метоксипропан (диметнлкеталь аце-
тона) I 272, 361—363, 373, 374, 438; II
63; V 206
Диметоксирезорцпна производные V 299
3.3-Дяметокси-5а-стероиды I 359, 360
п, п'-Диу.етокси-трлдс-стильбен 1 23'9
2,7-Ди метокси-1,4,5,8-тетрагиДронафталйн
IV 231
5,8-Диметокситетралон-1 III 51
7,7-Диметокс!1-1,2,3,4-тетрйклор 1'2,2.11-геп-
тен-2 П 154
5,5- Ди метокси - 1,2,3,4 тетра хл пр и.;! клонен-
тадпеп 1 363, 364; V 151
2,3-Диметокситолуол II I3S
4,4'-Диме гокситрифенилхлормет ан 1 364,
36S
2, “-Димстоксифепантрсч! IИ (И
3,4-Диметоксифё(шлуцстс)Н II '107
3,4-Диметоксифенилацетонитрил V 291
2,6-Ди метоксифенол I 103, 411
3,5-Диметоксифенол Ill 97
2,6-ДимеТоксихинон I 411
1,2-Дпметоксиэтап (кглим») I 104, Но. !>6,
271, 292, 205, 365, 430, 434, 437; 11 I 40, [76,
259, 357, 371, 400; III 153, 287. 28". 387.
396, 447, 448; IV 234; V 144, 152, 316, 349.
430
Дн-н а трин фен ан трен I 368; V 153
1, l'-Днн афтнл III 50, 52
2 I'; 1,2; Г',2"; 3,4-ДппафтцнК.'тогентадпен-
1,3-он-б IV 96
ц.п'-Дипитроазобепзол 1! 442; Ill 64
л.л'-ДннитроазрксибензоЛ 111 64
3.5-Ди нитро ан и зол II 258
2,3-Дпнйтроанилип II 408
2,4-ДииигроанилиН II 407, 408; 111 1-14, 423
2,,3-Д11питрос'1пили1( II 241
2,4-Ди1Штробслзалъде!'ид I 366,367; II 45.'
Дн-га-питробензилхлорфосфат I 367
3,5-Ди нитробензоил хлористый I 387; V 230
3,4-Динитробепзойная кислота 1 3t>8; IV 182
3,5-Динитробензойиая кислота [I 293
метиловый эфир II 293
.и-Динитробеизол II 33
о-Дп нитробензол II 423
к-Дипитробензол 172, 122. 123; 114 12; Ш 423
2г4-Динцтробе113олсульфспхлор11Д I 368 —
370; III 294; V 18
2,5-Динйгро-3,4-дибромтпофеп IV 98
4,4'-ДИ11нтро-3,3'-Д11карбо!<сн;ц!фе11 ил суль-
фид 1 370
1,3-Дннитро-2,6-диоксинйфталйтт III 26
2>2'-ДинитроДифеиил II 235. 236
4,6-Динитро-1,3-дихлорбензол И 409, 410
Динитродурол III 26
е-Динитрозобензол III 408
N. М''-Динигрозо-N, М'-димс тплоксампд см.
Щавелевой кислоты N,розо-Рц
диметиламнд
1,3-Динитро-5-нодбензол И 3 3
2,4-Динцтроиодбепзол II 3’0: HI 410
1.3-Диннтронафталнп 11 23.3
I, )-Дй2;итрогтафталин II 417
1. о-Дг.питронафталин III 2к (
2,4-Динитронафтол-1 I! 422; >!1 26
1,2-/Зинн тро стильбе н. (р.'с- и in ране- I 19
2,4-Динитротиофеп IV 97
2,6-Динитротиофеп IV 07
3, З-Д ппитро-о-толунитрнл II 46 1
2.4-Диннтротолуол I 306. Зоб; III I17G
3.4 -Динитротолуол 1 31; 1V I 82
:.’,4-ДиццтроФе11нлгцдрази1! I 371, 372; V
154
2,4-Динитрофенплгндразоньт I 43 1; II 135;
111 28; IV 173
Дт1-.ч-И11трофсни'Лдисульф!!;[ II 45
бпс-(2.4-Д|||111Трофенпл)-к;|ри[И[Ц1' 1 372, 373;
V 155, 529
Дн-н-нитрофенилфосфат ! 373, 374: 111 399
2,4-Д ii нитрофенол II 422
2,4-Дннитрофт'Орбензо.т (ДНФ'Г I 37-1—37G: V
156
2,4-Дйннтрохлорбензол I 368, 3,70. 371; [[
826, 4)0; III 100, 29 1
2,6-Д;нтитрс>хлорбензо..т IS 2-11
ОЛ-Дннцтро-Ьхлорнафтёлпн )1 235
2,5-Диннтроциклоцецг1аНон 1 169, 103
665
2,5-ДннптроциКлопептаноп дикалпй I 163;
II 1G
экзо, ^кзо-Дт1110рб<)1л111Л1<ето1т II 438
Диоксан 1 97, 2нЗ. 312, 376, 377; II Ill, ЗЮ:
И1 155; V 323
дпбромпд I 377, 378; У 156
Дифосфат I 378, 379
Диоксеп см- 1.4-ДноксоЦЧллогексеп-2
2,2'-Диоксп-1, I '-азоп афталии 111 357
1,1-Диоксназоциклогексан 1 212
2,4-Д1!ОКСИ-2'-£1МЩ1ОДИфрН11Л III 116. 117
1.5-Диоксиамфннафтохицоц [V 131
I, 5-Диоксиамфихпнои I V 131
Ьб-Диоксиантрихтюп 1 118, И9
1,2-Диоксиаптрах.инон-З-сульфокпслоты нат-
риевая соль III 85
Диокспацетон IV "О
фосфат 1 400
2,5-Диокспбензальдегнд II 08
2,2'-Дпокснбензог1ц IV 135
2,5-Диокс1гбензой1-1с|Я кислота III 80
1 ,'2Г-Диоксибензотрополон IV 131
2, 5-Дцоксц- 1,4-бензохиион III 72: V 288
1,4-Диок.сибицпкло-12,2,'jJ-октан IV 167
9р, 1 Оа-Дпокси-А ’Л-гексагидроиафталпн 111
224
1,5-Дио);сидеиалш1Ы IV 177
2,2'-ДиоКси-1, Г-дрнафтил V 262
4,4'-Диоксидифепил III 210
2,2'-Диокси диэтил сульфоксид II 57
ЙД-Диокспизофталевый ДиальдегпД I 308
За, 12а-диокси-7-ке'гохолановая кислота I
136
4₽,ёр-Диокснкопростанон-3 III 83
КЗ-Диоксиксантон IV 80
15,16-Диоксилииолеьая кислота III 87
Диоксималсиновая кислота III 80
mpeo-Диоксимасляная кислота III 27?’
2,5-Диокеи-4-метплбензальдегид I 38
1,3-Дноксц-5-метилбензол II 63
ЙД'-Диоксим'етнлдифеиил II 75
2,3-Ди-(оксиметил )-норборн ап I 326
За. 11 а-Диоксн-1 бР-метплпреги ан дион-11,20
III 117
1,5-Ди-(окси метил)-1, 4,5,8-тетрагпдронафта-
талин I 123, 124
1,3-Диоксинафталин II 209
2,6-Дноксицафталпн III 202
2,7-Дпокс11цафталнн V 38
11,12-Дпокси-9,10-пафтаценхипон II 429, 430
За, 1 Ю-Дпоксипрегиапон-гО I 125
трео-0,Ю-Диоксистеарнновая кислота II 51,
ЗЮ; III 23, 24
зрмтро-9,10-Дноксистеариновая кислота II
49, 54, 92. 93, 319
1бР,20а-Д.иоксистероиДы IV 1/8
5,8-Диокситетралин III 441, 4-12
2,4-Дцоксптолуол III 441
2- (2',4'-Диоксифенпл)-6-оксибензофуранкар-
боиовая-3 кислота I 318
2,6-_Диокси--1-фенил~1,3,5-триазин I 356
4а, 5а-Диоксихолестаноп-3 Ш 83
20,21 -Дионеи-1 1|3,18-эпокси-5а-прегнанон-3
ДЯацетат III 200
За, 123-й HOKCiiOTii.'iiioBoii кислоты метило-
вый эфир IV 1-16
Диолы (1,2-, 1,3-, 1,4-) IV 30
Дноегенпп II 180
Диостерин-1 I 160
Дпосфеполон 1 186
Диосфеполы I 101; II 229
Дигшвалоилмонстидразон III 190
Дппиреи V 218
2.2'-Д|1ПИрпДИЛ III 166
Дппгюн см. 1 -Мстил-1,3-дифенил-1 -пропеион-
3
Ди-н-проиилкйрбинол II 332
Ди н-пропилциклопропенон I 416, 417
Дпспиро-15,1,5,01-тридекан III 287
а-Дитпан [V 244
л.’м-Днтполы 11 316
2,6 -Дитио метоксиметил фенол I 331
Дитийциап (родан) I 379, 380; V 99
0,10-Дитиоциан антрацен I 379
ДитиоцпанциклоГексан I 380
М,0-Дптоз;)л-3-аминопропанол I 156
б’цц-Д птоз платы II 413
Дк-п-толилкарбодиимид 1 380, 381; П1 309
Ди-л-толилтиомочевина I 380
1,1-Ди-п-толилэтан I 77; III 189
Ди-Л-толуил-Э-(и L-) винная кислота I 381,
382; V 14
Дифенан I 56: П 75
Дифенил II НО; 1П 79; V 501
1,3-ДифеиилазириДицон-2 II 39S, 397
Р, |3-Дпфенилакриловая кислота II 176
хлорангидрид III 16
1,1 -Дифенилаллен IV 237
Дифениламин I 385; П 42, 155, 448; V 371
1.4-Дифеннл-5-амино-1,2,3-триазол III 122;
IV 28
Дифснилапетилен I 19, 107, 207, 289, 297,
38’2, 383, 384; II 8, 17, 241, 435, 437; III
411. 460, 468; V 17, 33, 211
2-Дифенидацетил-1,3-ИнДандион I 382, 383
2-Дцфеннлацетил-1,3-индандпон- 1 -гидразон
I 382, 383
1.1-Дифен илацетон I 382
Дифенилацетонитрил I 55; II 357
ад-Дифенялацетоуксусной кислоты этило-
вый эфир II 211
а,а-Дцфенидацетофенон II 194
N,N'-Дифенилбеизамидин III 112; IV 105, 106
2,5-Дифенил-3,4-бецзофурац см. 1,3-Дифе-
нилизобензофураа
2,2'-Дифенил-2,2'-бииндантетрон-1,Г 3,3' I
412
Дифсиилборная кислота III 380, 381
Дифенилбромметан IV 171
2,3-Дифенидбутадиен-1,3 I 257, 383, 384
гдрянс, траке-1,4-Ди фен я л бутадиен-1,3 I 384
II 177, 259; III 207, 402, 464; IV 200, 237;
Ди-(и-фен илбутадиенил)-дикетон II 340
2,.3-Днфенилбутан I 347
1,4-Дцфецилбутандион-1,4 I З26; III 25
2,3-ДифенилбутанДиол-2,3 I 383
1,4-Дифенил бутен-2-дион-1.4 III 25
Дифенилвиниламии П 17
1,6-ДифеинлгеКсадиен-1,5 см, Бнциннамил
1.6-ДифепИлгеКсатриен-1,3,5. I 36; IV 82, 83
1,7-Дифенилгептадипн-1,6 I 15!
1,1 -Дифеиилгидразин I 385, 395; V 164
1,1 -Дифенилгидразоны I 385
Дифенилглиоксалон II 326
Дифепилдиазометан I 385 — 387; III 184, 185
401; V 164, 272, 332
2,2-Дифенилдиазоциклопропан IV 237
Дифенил-2,Й'-диальдеГиД 1 194; Il 4J3, 414;
III 6
Дифенилдиацетилен II 230
5,7-Дифенилдибензо-[а, с]-цикл огептатриен I
396
1,6-Дифеннл-3,4-диоксигексадиен-1,5 см.
ГиДроциннамоин
ДифенилДИсульфид III 237, 266, 267, 431'
V 331
1,2-Дифенил-1,1 -дифторэтан 111 242
Дифенилдихлорсилан 1 396
Дифеннлдихлорстаннан I 397
1,1 -Дифенил-2,2-дихлорэтилен III 404
а, ?-бнс-(ДиФепилен)-р-фенилаллнл1>ный ра-
дикал (БДФД) I 387, 388
1,3-Дифенплизобеизофуран (2,5-дифенил-3,4-
бензофуран) I 155, 156,388 — 390; IV 27'
V 164
666
2,2 Днфенилинданднон-1,3 I 391
2,3-ДифенилпндеягиДроперекись III 393
2,3-Дифенилннденоц 1 236; Hl 71, 393; V 227
Дифенилиодонийбромид I 390: П 57
Дифенилиодоний-2-карбоксилат II 98, 308
(моногидрат) I 390, 391
Дпфенилиодонийхлорид I 391, 392; V 165
Дифенилкарбамнноилхлорид I 392; V 165
Днфенилкарбинол см. Бензгидрол
5,5-Дифенил-3-карбметоксипиразолин-2 I
386, 387
Дифенилкарбодиимид I 392; IV 46; V 163
Дифенилкарбоновая-2 кислота I 17
Днфенилкетен I 333, 393, 394, 430; Ш 185,
404, 466; IV 271
Дифеи ил кетен а n-толилимин [ 333, 394, 395;
II 412, 413
ДифенилМетан I 166, 324, 326, 337, 396; II
155, 156
8-ДифенИЛметил-1-нафтойная кислота I 410
Дифенилмочевина IV 45
2,4-Дифенилнафторезорцин V 227
Дифениловый эфир I 38, 294, 390; II 155,
357; III 116, 259, 427
Дифенилоксадиазол I ,356
9,10-Дифен ил-9,10-окси-1,2,3,4,9,10-гекса-
гидроантрацен I 390
9, Ю-Дифенил-9,10-оксидигидроантрацен I
389
а, а-Днфенил-р-оксипропионитрил III 393
Дифенилолово I 397
1,5-Дифенилпентацтрион-1.3,5, II 400
1,5-Дифенилпентенин-4-ол-3 IV 130
1,5-Д.ифенилпентенин-4-он-3 IV 130
М.М-Дяфенил-И'-пикрилгидразил I 395, 396
N.N'-Дифецилпиразолидин II 225
3,5-Дифенил’1 -пиразолин IV 37
2,6-Дифенилпиридин-4-карбоновая кислота
III 400
1,1-Дифенилпропен-1 I 335, 336; III 407
М.КГ-Дифенил -1,3-пропилен диамин (1,3-ди-
анилинопропан) И 225
а,Р-ДифенилпропиоНОвая кислота I 63
р,р-Дифенилпропиофенои I 48
2,3-(3,3-ДифеНилпсевдопиразоло-4,5)-1,4-
нафтогидрохинон I 387; II 419, 420
2,3 - (3,3 - Дифенилпсевдопиразоло - 4,5) -1,4-
нафтохнпон II 419, 420
Дифен ил ртуть I 401; V 434
Дифенилсилан I 396
Дифенилстаннан I 396, 397
Дифенилсульфид III 261, 262
Дифенилсульфоксид I 397
Дифенилтеллурид I 397
1, !-Дифенил-2-л-толилэтилена окись II 194
Дифенил-2,2', 4-три карбоновая кислота II
406
Дифенилуксусная кислота II 38; IV 93
нитрил см. Дифенилацетонитрил
хлорангидрид I 393, 395
Дифенилуксусный альдегид 1 115; И 194;
III 375, 405
М,М'-Дифенилформамидин I 397, 398; III 37
Дифенилфосфат серебра I 398, 399
Дпфенилфосфня 1 399
Дифенилфосфиплитий 1 399; V 167
Дифенилфосфорилизотионианат I 393—400
2.5-Дифенилфуран I 326
6,7-Дифенилхиноксалип IV 40
цис-N, 2-Дифенил-3-хлоразиридин I 416
ДифенилхлорМетан И 383
Дифенилхлорфосфат I 400, 401; V 168
2,2-Дифенилциклобутан дион-1,3, этиловый
эфир енола IV 271
2,2-ДифенилЦИКлргептаноц III 370; V 114
1,I-Днфенилциклопропан II 176
2,2-Дифенилциклопропанкарбоновой кисло-
ты метиловый эфир I 386, 387
Дифенилциклопропепоп 1 32; 111 436
2,3-Д11фе)гилц1п<лоиропил1;дсн (карбен) IV
237
Дпфепилцинк I 401
1,З-Дифенил-ДЗ-эпоксипрон анон-1 II 407
1.1 -Дифенилэтилен I 234 342; II 130; III
13, 15, 16. 61, 242, 385; V 285, 302
окись I 340, 341; II 194
N, М'-Дяфснилэтил'ендиампн 1 401, 402; V
169, 343
Дифенилэтннилкарбииол II 245
I,S-Днфеннлянтарная кислота III 233
Дифсиовая кислота II 406; 111 62
Дифенонла перекись III 388
Днфенохинон III 210
Диформазап, пигмент III 301
о,о\ТДформилдифенил I 194 (спь Дифенил-
2,2'-ДиальдеГид)
К, [3-Дифтал и де п этан II 428, 429, 430
Дифталилен III 465
Дпфторамшт I 402, 403, 405; V 169
Дифторампнобутаны III 312
10,10-Дифторантрон III 263
2,2- Дифтор-3,5-дн Метоксициклогексадиен-
3,5-он-1 III 97
4,4-Дифтор-,3,3-днметокспциклогексаДиен-
2.5-ОЦ-1 111 97
4,4'-Д1гфтордцфенИл I 122
1,1 -Дифтор-2,2-дихлорэтилен I 403; IV 223;
V 170
Дифторкарбен I 270, 404; III 387; V 49, 96,
172, 339
16,16-Дифтор-17-КетостероИды III 94
Дифтормалоповой кислоты днэтиловый эфир
III 92
7,7-Дифторноркаран I 404; И! 387
5а,6а-Дифторцрегнанол-3|3-он-20 III 242,
243
В,[3-Дифторстирол V 171
си.ад-Дифтортетрахлор ацетон I 403, 404;
V 171
а.а-ДифтортриметИламин П 122
Дкфторхлоруксусиой кислоты натриевая
соль I 404; III 422; V 96, 171, 300
4,4-Дифтор-Д;-холестецоп-3 III 93
1,1- Дифтарциклогексац II 122
Дихлорамин 1 404, 405
Ди-(4-хлор-2-аминофен пл )-сульфон И 58
2, о-Дн хлор анилин III 132
2,6- Дихлоранилин И 362; III 65; V 3)7, 45 8
ct, к-Дихл орбен зил литий III 299, 300
о-Дихлорбензол I 291, 292, 294; II 296
.« Дихлорбензол II 409, 410
1,3-Дихлорбутен-2 I 405—407; П 266; IV 255;
V 175
3, fl -Дихлор-трст-бутил бензол III 447
1,4-Ди.хлорбутин-2 I 253; III 188, 189; IV 274
Дихлорвиинленкарбонат V 177
1,6-Дихлоргексан III 268
1,1 -Дихлор-З-гексилцнклопропан II 283
a,V- Дихлоргидрин см - 1.3-Дихлорпропанол ’2
2,6-Дпхлор-4, Э-диампнопнримпдин I 4,38
4,4'-Днхлордибутиловый эфир III 300; IV
88
Р,Р-Дихлор-«-диметиламппостирол I 415
1,1-Дихлордиметиловый эфир 1 407
Диклордифспилметан I! 7
1,1 -Дихлор-сира нс-2,3-дпфеннициклопроиан
IV 54
2,3-Дихл он-ЗД-дици ан-1,4-бензохинон
(ДДХ) f 1(5, 20, 407-413; 1,4 171; IV 139
131; V 178
2,3- Дихлор-5,6-диЦна11гидрохицон I 16, 20,
407, 408
4-(2,3-Дихлор-5,6-дициап-1 -оксифенокси;-2,
4,6-три-л11)егл-бутилцик;!огсксаднен -2,5
он-1 I 411
1,1-Дихлордиэтиловый эфир I 413, 414
667
2,6-ДнхлорКйМфан I 1'8
Дихлоркарбец I 138, 175, 187, 415, 416;
III 417, 148; V 20, 339, 3 88, 431, 497
Днхлоркетсн 1 414; IV 213; V 18,3
М-(Дих,,111рмрт!1лек)-анилиг1 IV 43
Днх/1орметцлепдно(<си.бсизол см. Пирока-
техина дихлормстилеиовый эфир
Ди.\ЛорМетилентрНфеннлфосфора[( 1 414, 413
ДпхлорметпллИткй I 41в, 417; V 184
/Птклормстилметплог/ьш эфир V 185
2,4- Д и хлор-3-мстил-З-окси-б-карбоксп-2'-мс-
токсц-4'-оксп-6' карбметоксидифсниловый
эфир III 204
Дихлорметплфосфин V 490
2,5- Дихлорпвтробсизол III 132
2,6- Дихлориитробензол V 458
[, З-Дихлор-2-цитрозобензол II 362
7,7-Дихлорпориараи I 138, 175, 410; III
373, 445; IV 54, 55; V 21
3,5-ДихлС1р-4-оксибеизош1ая кислота I 304
3, о-Днхлор-4-окснбензойиой кислоты этило-
т.н! эфир Н 131
Д’-3,4-дихлор-5-оксидигндрофурапоп-2 см.
Мукахлорипя кислота
2,4-Дихлорпнрнмиднн II 212
2,5-ДихлорпирпмиДиц II 212
1,З-Дихлориропан III 1(59
1,3-Дихлориропанол-2 II 374, 375
(а,-у-ди хлор гидр ин)
1.3-Диклпрпропеп HI 169
2,3-Дихлорпроисн I 34; V 186
2,6-Днхлорпурии I 438
Др-Днхлорстирол I 415
2,6-Дпхлорсульфаниламид И! 65
2Л,4-Дихлортестостсро|1 III 292
си.н.к-Дихлорте графторацетон IV 190
2,6-Дихлор-9-ти абн никло-13.3,1]-нопни III
201
3',3"-Дихлор"1-ти а-4,5-диазациклогептатри-
сн-2,4Д II 58
2,5-Дпх.'юрткофен III 293
дихлоруксусная кислота 1 395; IV S-16
пеитахлор,фениловый эфир V 348
хлорапгидрид (дихлорацетидх-лопид) I
114; II 167
2,6-Дихлор-1-феиил-1,3.5-триазин I 355
Дихлор(|)с1-1Плфос<Ьш1 V 496
N, N-Дихлор-а-феиилэтиламиц II 257, 258
2,6-ДихлорфснОл I 301; III 203
ДиклорформоКсим I 417
N, N-ДИхлорцикЛогексиламин [ 172
1,1 -ДИХЛорциклопропан IV 54
1,2-ДиХлорэтап ll 2j; V, 33
2,2-Дихлорэтапол II 16'
Дихлорэгилеи I 29-1; II 290; III 154; IV 156
1,1- Ди.хлор'этилеп I 417, 418; V 190
(-г)-транс-Ди хлор-(этилен )-(а-метилбензил-
амин)-пла'гина (II) III 153
Днцианацетилеп (дпнитрил ацетнлендикар-
боноиой кислоты) I 418, 419; Щ 408; V
21. 190
ддс,г^^с-1,4-Дициапбутаднеп-1,3 II 440; V515
2,3-Диииаигцдрох'илон 1 16, 407. 408
Дициандиазометан III 239; V 191
Д.’пЦнацдиамида-М-цианг'уанидин I 419 —
421; V 192
Дццианкарбен III 239, 456; V 192
Дпци.'шкетепа этилен кеталь Ц ,322; Ш 317’
IV 257
ДнцпацметилсК-ЗДД-трЦнптрофлуорен I 421
1,2- Диц||а1шафтадип 1_419
З.'ЬДнцпантпофс!! I 2/8
2,2-Ди цнаи-1-12-(триметил аммоний)-этокси]
этр.нолят IV 257
3,'[-Дпцианфураи I 277. 278; Ш 408
аддукт с днцианацетилеиохг III 408
З.З-Дицнап-о-хлор-М-бензохиисш 1 16
32,-Дицнаи-о-хлоргидрохнпон I 1G
1,2-Ди-1-(1-циан)-циклогексилгидразин I 207
I,З- Дн-(3-цпклогексенил)-1,3-пропандион II
394, 395
N, ЬГ-ДпциклогексиламиДин N-морфолил-
карбоновой кислоты I 421; V 192
Дициклогексилампн I 422; V 253
п-Дмадклогексилбснаол I 111
Дп-О-циклогсксплндепинозит IV 195
Дшшклогскснлкарбодиимнд (ДЦК) I 328,
329, 378, 380, 381, 422-428; II 68. 247,
331, 468; III 21, 449; IV 193, 268; V 32,
130, 301, аб5
Дициклогекснлмочевииа V 130
К.Ьч'-Дициклогексилтиомочевнна I 4S2
Дициклогексилэтиламин II 359
Дицнклопентаднсн IV 26. 200
Дицнклопропнлкарбинол II 220
Дициклопропнлкетон Ц 220, 259
Дпэтилалюминнпиодид I 428
Днэтилалюминяйцианид I 428, 429; V 193
Диэтпламин 1 312; III 282; IV 63, 250; V 99
Диэт’лламиноацетонитрял II 371; IV 70
1 -Диэтиламицобутанон-3 П 267—269
1 -Днэтиламинопентанон-З, иодметилат IV 249
N, N-Диэтил анилин IV Ill, 112
.пикрат III 101
N.N'-Диэтилбензндин Щ 159
м, п-Диэтилбензол I 391
1,1-Диэтт1лгидразц(1 II 353
Диэтилентлдколк V 71
Диэтиленгликоля диметиловый эфир см.
Диглим
диэтилкарбинол III 165
Диэтилкарбоднимнд V 130
Диэтилкарбонат 1 429. 430; IV 11, 242: V 194
Днэтидкарб’этокснмеТиЛфосфонат I 430, 431,
437
Диэтилкетоц III 206; IV 31
Диэтилннтрамип III 423
Диэтилнитрозамин III 423
Дпэтиловый эфир II 111, 114, 157; II] 154
264; V 306
Дяэтилсульфат I 33, 294, 431, 432; IV 233, 254
Диэтил-(1,1,2-трифтор-2-хлорэтнл)-амин I
432, 433; V 195
N, М-Диэтил-2,2,2-трихлорацетамиД I 433’
III 374
Н,М-Днэтпл-1,2,2-трих-лорвинИламин I 433;
III 374; V 196
N, М-Диэтил-М'-фенилдихлорацетамидин II
433
б«с-(2,6-ДиэтМлфенил)-карбодииМид I 433
Диэтплфосфит I 433—435, 436; II 246, 36S;
V 197
Диэтилфосфониодунсусной КИСЛОТЫ этило-
вый эфир 1 435
Диэтилхлорфосфат I 435, 436; II 246; V 72
Днэтилхлорфосфит I 436; III 321
Днэтплцианамид I 436
Дпэтнлци ан метилфосфопат I 4 36—437; V 197
Диэтил-₽-(циклогексиламино)-винилфосфат
V 199
1,2-ДиэтилЦнклопроцал, цис- и транс- 1Ц
287
Диэтилципк IV 215
Диэтилцинк — метплеп подпетый I 437; V
199
Дпэтнлэтиленпирофосфит 1 437, 438
Диэтоксиметилацетат 1 438
2,2-Днэтоксипропап (диэтилкеталь ацетона)
I 438, 439
ДиэтоксиуксуспОЙ КИСЛОТЫ ДИЭТИЛОВЫЙ
эфир IV 246
Додскагидротрифеннлен III 244
ДодеКаД.нен-1,11 III 268
Додекан V 392
Додеканол III 108; V 393
тозилат III 108
668
Додецед-! III 89
/Пран<--Ледененкислота i 155
„Драйерит см. Кальция сульфат безводны»
Дурил-2, Д-днмс'гплфси пл кетон III 137
Дурогидрохпцон Н 6
Дурол I 196, 418; II 298; III 62
Дуролкарбоновая кислота (2,3,5.6-тетраме-
тилбензойная кислота) II 458; 111 137
Дурол карбоновой кислоты амид II 438
Дурохинон II 6: III 62: V 5-1
Дьюара бензол III 232
ДЭАЭ-целлюлоза И 70
Енамины II 189, 385; III S, 9, 350
Гнолацетплнролапие III 291, 349, 350; IV 148
Ь'нолон эфиры 1 363
Железа нонакарбонил II 5, 6; V 202
Железа оентакарбонил IJ 5, 6, 7; А7 202, 203
комплекс с димстилацетиленом II 6
Железа неитакарбопил — дифенилайетилси
11 6,7
Жслеза(П) сульфат II 7,8
Железа трикарбонил V 202, 203
Комплекс с цикл«бутадиеном V 545
Железа (II) хлорид 11 11
Жслеза(Ш) хлорид I 320; II 8—1 1, 272;
V 203
безводны!) Il И
Железо И И, 12; V 204
Желчная кислев а V 21'2, 317
Жирара реактив Р (шгридпи) I 309; II 12
Жирара реактив Т (хлорме.гплат гидразида
днметнламшюуксусной кислоты) I 309;
II 13—14
Загуститель I 197
ЗанДмейсра реакция II -417
Зео-карб, сц. Ионообменные смолы II 64
Зодотохлорнстог,«дородная кислота 11 15
Ибога-а.яхалоиды III 178, 179
Ибогаин I 173
Изатин I 218
Изатонповьр; ангидрид IV 79
Изоамил бромистый I 128
Изоамплниграт II 16; V 206
Изоамнлнитрцт I 366; II 10, 17, 417, 418; III
271; IV 234
Изоауилнитрнт — трифторуксусная кисло-
та II 17, 18
Изоамиловый спирт I 128, 287; III 155
Изобепзофуран И 18
Нзоборнеол I 279; I] 18, 20,3
Изобррнилдихлоралюминат I! 18, 19
Изобутан II 329, 330
2-Изобутепил-1,3-днтиап V 162
Изобутил бромистый IV 110
2-Изобутил-1,3-дитиан V 16!
Изобутилен (2-метилпропсн) 1 82 89, 90,
98, 312; II 20 — 22, (И, 217; 1V 155, 237, 278
Изобутнловый спирт I 333; III 134; IV 110
Изобутиропла перекись I 388
Изовалериановой кислоты хлорангиДрид
1 100; III 387
этиловый эфир 11 303; III 395
Изованилиц И 350
Изогсксан III 134
Изодегндрацстовая кислота 11 з35
Изодегидрохолсстерина л-нптробензоат III
175
ИзоДекстронимаровая Кислота V 355
ИзоДрин II 153
Изодурол I 233
Изоиервн!! Ill 50
Иэокапрояовой кислоты хлорангидрид I 48
ИзокарДеполиДЫ V 232
Пзоксазолы I 214
Изолапахол V 47, 180
d.Z-Изолизернновой кислоты гидразид I 381
Изомаслниая кислота IV 93; V 403
амггд IV 99
;пр№-бутиловЬ!Й эфир I 312
метиловый эфир V 353
нитрил I ‘288; IV 99
хлорангидрид I 310
этиловый эфир III 385, 397
Издмасляный альдегид | 333; II 212
тозилгидразон 111 358
rf-Изоментон IV 178
Изопафтазарин I 224
Изоникотиновая кислота I 355
Иэонитрилы (изоцианиды) III 363, 364, 466;
IV 78
Изонитрозоацетанилид I 218
Изоцитрозопропиофенон II 289
Изонооткатон V 350
Изооктан см. 2.2,4-ТримеТилпентан
Изопентан II 330; III 154; V 512
Изопимарадисн II 51
Изопимариповая кислота V 557
Изопрен II 2/6, 391, 392; П1 1 1, 33, 398; 1V
200; V 244
Изопропенилайетат 1 84; Н 2 2 — 2 5, 60; V
206, 475
ИзопропсНплметиловый эфир V 206
Изопропиламин II 186, 381
Изоиропилат алюминия И 2§—27
Изопропплат натрия V 322
н-Изопропилацетоуксусной кислоты этило-
вый эфир I 112
1,3-бпс-(Изорропял)-ацетоуксусной кислоты
этиловый эфир 11 393; III 395
Изопропилбензол см. Кумол
2'3'-Изопропил1)денаденозин III 126
7-Изо1тропилидеибицикло-12,2,11-гептен-3-
он-2 I 83
а-Изопропплиденгоыофталевая кислота III
74
1,2-бнс- (Изопропидидеп) -3,3- диметилцнкло*
нропап V 312
Изонропилндсималоновой кислоты ди.
бензиловый эфир И 218
Изопропилпдеимацоновой кислоты Диэтн-
ловый эфир V 349
Изопровилиденуридин IV 238
Изопроцилпзоннтрил I 332
Изоиропнлизоциаиат 1 332
ИзоцропилизопианиД 1 332
Изопропиллитнй П 139
Изопропилмсркаптап II 80
1 -Изоппопил-4-мето ксициклогексадиен-1,4
V 388
Изопропиловый спирт I .383; II 26, 207, 382,
385; Ш 155; V al б
Изопропилтиоцианат III 341
Изопробилцианид см. Изомаеляной кислоты
питрпл
4-Изопропил циклогексан карбоновые Кис -
лоты, цне- и транс- III 325; V 417
Изорезерпин о во it кислоты лактон I 425
Изосалютаридин V 264
Изотстралин 11 142
Изотиоцианаты III 323
ИзосЬиллокладсн II 55
Изофорон I 142; 11 239, 243, 266; III 71
окись 1 115
Изофталсвого альдегида бж-(1,3-пропанди-
ти or i ацеталь) V 165
Изофталеэый альдегид V 78
Изохаульмугровая кислота II 162
И.зо.хниолий IV 222
Изохнпуклндина производные II 276
Изохинукдндон-3 I 239
669
Изоцианаты II 359, 360; III 13; IV 77, 78
Изоцианиды см. Изопитрилы
1₽-Изоцнан-2а-иодтетралнн 11 44
Изоциановая кислота см. Циановая кислота
II 27
Изоэтиндифталид см. Диоксинафтацепхинон
II 429, 430
И К-полосы поглощения и скорости расщеп-
ления гликолей III 221
Имидазол [ 30, 81; II 27—30, 119, 120, 1 74;
III 323, 328; IV 98, 227; V 208
Имидазол-4,5-дикарбоновая кислота П
28, 235
Имидазолидины 1 402
Имидазолины V 264
N-Имидазолкарбоновой кислоты трет-бу-
тиловый эфир II 30
Имидаэол-2-тпол I 30
Имидазолы IV 73; V 264
Иминогидразидьт II 392
Иминоди карбоновой кислоты Ци-трерг-бутн-
ловыи эфир II 30, 31; III 380
Ицдазол II 332, 333; IV 94
Иидандиолы-1,2 III Q20
Ицдандпоц-1,2 III 358
Иц даноп-2,3-диокси-З-карбоиовая кислота
11 233
Инданои-I Н 305, 364; IV 116
ИнданоН-2-карбоповая кислота 11 305
Ицданоны V 259
Инден 1 414; III 7, 42, 95; V 187
Инден-1-карбоновая кислота Ц 357
Индикаторы pH П 31
ИндикаторырН, кислотность по Гаммету II 31
Индол I 63, 301; II 45; III 123; IV 85, 233
Индол-3-альдегид II 464
З-Индолилацетонитрил III 170
З-Индолилуксусной зсислоты хлорангидрид
V 61
М-(2-Индолнлэтил)-глутаримид IV 100
Индолины И 225
Индол-З-карбопитрил II 464
Индол-2-карбоновая кислота [V 33
этиловый эфир IV 233
Индолы II 225
Инозин II 460, 461
N-окисъ II 455
Ицозит IV 195; V 482
гексаметиловый эфир II 279
2-карбоновая кислота I 21
производные II 400, 461; V 482
(— )-Инозит-1-О-тозилат I 117; П 68
Инозиты I 274
Иод II 32—39, 423; IV 223; V 209, 212, 214
379
Иодазид II 39, 40; V 89
Иодаллены III 418
Иода моиобромид И 40; V 212
Иода монохлорид I 282; II 40, 41; V 211
п-Иоданплип II 32; HI 421
Иода пентафторид II 41
Иодацетилены III 418
1-Иод-2-ацетоксипропан V 209
I-Иод-2-ацетоксицйклогексан II 34
о-Иодбензойная кислота I 390; II 41 42,
56, 98, 237
«-Иодбензойная кислота Ц 34, 237
Иодбензол I 294, 390; II 33, 42, 53, 54, 57
353; III 279, 421
Иодбензола дихлорид I 220; II 43, 53 406-
V 213 ’ ’
4-Иодбутанол-1 I 268
4-Иодбутен-1 V 497
5-Иодванилнн II 233
4-ИоДвератрол II 32; III 434
З-Иодгептанон-2 11 60
1-ИоДГептафторпропан V 214
1-Иоддекан V 496
5-Иод-2,4-дицитрофет1Лгпдразин II 43, 44
5-Иод-2,4-дицптрохлорбензол II 43
Иодизоцнанат II 44; V 215
Иоднс'юводородпая кислота (57%-ная) II
44 — 46; V 210, 217
6-Иод-А4-3-кеТостсроиды 11 61
2-Иод-1,4-ксилол И 34
Иодметиддиэтилалюмниий I 428
Иодметплртути иодид II 46, 47
I-Иод-11-метилтридскан Ill 145
бш-(Иодметил)-цннк — иодид цинка см,
Симмонса — Смита реагент
Иодмстилииик иодистый см. Симмонса —
Смита реагент
Иодоморфолиновый комплекс II 47, 48
Иодная кислота II 48—53; V 217
дигидрат V 209
Иодная кислота — хромовая кислота V
219
2|3-Иод-За-нитрохолестан V 213
ЗР-Иод-За-нптрохолестан II 441
Йодноватая кислота II 33, 34
Иодобепзол I 220; II 53, 54, 406
Иододибензоат серебра II 54, 55
о-Иодобензойная кислота И 55, 56
Иодазобензол I 3№, И 53, 54, 56, 57
диацетат (фенилиодоводиацетат) II 56,
57 — ^9, 353
днхлорид II 56
За-Иод-23-окснхолестапа нитрат V 212
Иод — пиридин II 59
Иод — серебряные соли (CFaCOOAg или
AgF) И 69, 60
N-Иодсукцпнимид II 60, 61; V 47
щр«Л'С-2-Иод-1-теТралицизоЦианат II 44
2-Иодтиофеи II Зз; III 259
/?ггтр(?к«с-[Иод-(три-н-бутилфосфин)-медь] V
220
4-Иод-2,5,7-тринитрофлуоренон I 13/1 П 225
За-Иод-23-трнфторацетоксихолестан III 435
Иодуксусцой кислоты амид II 61, 62
1-Иодундекан V 496
Иодфенилацетилен II 47
о-Иодфенол II 34
За-Иод-2р-холестапилизоЦнанат II 44
2-Иодэтилбензоат см. Бензойной кислоты
2-иодэтиловый Эфир
1-(ИоДэтцни л)-циклогексанол И 47
23-Ионилидепэтаиол II 219
Ионол см. _2,6-Ди-трет-бутил-4-метилфенол
а-Иопон V 73
|В-Ионоц I 79
Ионообменные смолы I 374; II 62 — 71; III 80,
88, 189, 375; IV 195; V 221, 479
Йохимбин I 329, 330
Йохимбинон 1 329
Иридиевый катализатор (на сульфате ба-
рия или карбонате кальция) V 222
Иридия тетрахлорид V 222
Иридия трихлорид IV 134; V 222, 516
Исмин I 254
Итаконовая кислота IV 104
хлорангидрид IV 104
Кадинен II 161
Кадмия ацетат — цинка ацетат II 72
Казеин И 423
Каламенец И 161
Калий II 72—74; V 78, 83, 472
Калий бромноватокислый V 372
Калий йодноватокислый V 372
Калия азид V 471
Калия бисульфат И 74—76
Калия боргидрид I 389
Калия игре/н-бутилкарбонат V 72
Калия гидрид в минеральном масле И 70,
V 224
670
Калия гидроокись II 77 —SO; V 20, 224
Калия гидроокись — aileron II 80
Калия гидросульфид II 80
Калия гипохлорит I 210; П 80—81
Калия пминокснлДисульфодат (соль Фреми)
II 81—83; V 225
Калия o'-камфор-10-сульфонит V 23!
Калия карбонат 1(1 275; V 31, 146, 199, 360
Калия манганат И 83—84
Калия мопонадсульфат кислый П 84
Калия перманганат II 84 — 97, 428; V 31, 226,
233, 261
Калия пероксодисульфат V 403
Калия персульфат и аммония персульфат
II 97 — 99; V 226
Калия персульфат — серебра нитрат V 226
КалНя персульфат — серебро (каталитиче-
ские количества) II 99 — 100
Калия тиоцианат I 257; II 100; IV 264
Калия трнацетилосмат и дикалия тетраметпл-
осмат II 100 — 101
Калия трифепилметид см. Трифенилметил-
калий II 102
Кадия феррицианид I 188; II 102— 107; Ill
403; V 227
Калия фторид П 107 — 109; IV 235; V 228
Калия хлорат 11 109
Калия Цианат II 426
Калия Цианид IV 70
Кальцийгексамин II ПО
Кальций — жидкий аммиак И 110 — 111:
V 229
Кальция боргидрид V 229
Кальция гидрид I 275; II 111 —112; IV 266;
V 230
Кальция гипохлорит I 210; II 405
Кальция иодид V 229
Кальция карбид V 230
Кальция карбонат II 113 —114; V 222. 230
Кальция окись IV 66
Кальция сульфат безводный (драйерит) II
114 — 115; v 31
Кальция хлорид II 115, 427; V 50, 229
Камфен III 3511
эмЗо-Камфиц I 155, 156
Камфора 1 279, 336; II 113, 203; III 359, 407;
V 114
тозилгидразон III 359
D,L-Камфора I 142
rf-10-Камфорсульфокислота II 113; V 231
10-Камфорсульфохлорид II 116; V 34
Камфорхинон П 418
d /-Каннабидиол V 299
Каприлец I 261; III 371
Каприловая кислота II 310, 319
Каприловой кислоты этиловый эфир V 97
Каприловый альдегид I 327, 329
оксим (л'-октанальдонсим) III 424
КаприлонитриЛ 111 411, 424
Каприновая кислота II 3!9; (II 162
а-к-КапроилпропионоЕой кислоты етор-
бутиловый эфир II 11; IV 212
£-Кацролактам 1 27, 132, 316; II 398, 446;
Ill 152, 2‘J3; V 91
е-Капролактон II, 347
н-Капронитрил IV 212
«-Капроновая кислота IV 111
ангидрид 11 127
н-бутилоньгн эфир 1 278
хлорангидрид II 173
н-Капроновый альдегид! 235, 262, 314; II 371
Карбазол III 467
Карбаматы III 215, 432; IV 155
10-Карбенабицикло-(5,3,1]-декан V 428
6- Карбметоксивалериагювой кислоты хлор-
ангндрид III 452
Карбметоксидигидрокликамин Ц1 178
1-Карбметокси-2-метилазепин V 216
Карбметсжсиметилептрифепплфосфоран 11
И6--118
К-(2-Карбметоксифенил1--пиррол V 151
Карбэтоксиметн л ентрисЬенн л фосфоран I
101, II 116—118
3- Карбметоксц-2,2. К экзо-триметилбицикл о-
13,3, оЬоктеп-1 III 231
3-Карбметокси -2,2.6 - трпметилбицикло - L3,
3,0]-октен-5 III 231
транс- р-(2- Карбметоксицнклогексан)- Про-
пионовая кислота П 356
метиловый эфир И 356
Карбобеноокси-й-аспарагпн I 426; IV 77
К-КарбобснЗокси-З-бензил-Ь-цистеица гид-
разид 11 454
иис-Карбобензокси-Ь-гнг-тпдин V 523
N- Карбобе.нзсжси-е!, L-фенилаланина ангид-
рид I 423
К'арбобеизоксихлорид см. Хлоруголытой
кислоты бензиловый эфир 11 П8
Карбобензоксп-р-цнан-й-аланин I 426'
Кг- Карбобонзоксиэтаполамин IV 37
Кар боди и мнды III И, 365
2,5-бнс-[2- Карбокси апилиио]-1,4-бцнзохинон
11 425
га-Карбоксибензолсульфокислоты монока-
лиевая соль V 232
н-Карбоксибеизолсульфоинлазид V 232
I (К Карбоксп-А-биснорколеетан IV 124
о-Карбокспкоричная кислота II 340—342,
352, 434
2-Карбокси-4'-оксндифенпловый эфир III 204
4-Карбокси-18]-парациклофан II 224
N-Кнрбокси-к-пролпна ангидрид 111 456
п-Карбоксифенилборпая кислота V 233
ii- КарбоксйфенилгиДразоны V 235
л-Карбоксифенилдиазопийхлорид V 235
2-о-Карбоксифенил-3-карбоксифен антрен II
352
н-Карбоксифенилмочевина I! 119
1-[о-Карбоксифеннл1-пг1ррол II 135
3-(<)-Карбок<ы1фе1[Ил)-пропионовая кислота II
434
л-КарбоксиФенил семикарбазид II 118-
Ий
N, М'-Карбопнлдиимидазол I 143; 11 30,
119 —121, 174; IV 76, 1«0, 268; V 235
Н,М'-Карбо1|ПЛди-с((ло:-трИазиц II 121
I, I - Карбонилди-1,2,4-триазол V 236
Карбонилфторнд II 121—123
Карбонплхлорид см. Фосген
Карбоннлхлорфторнд V 473
КарбоннлцианНД V 236
Карборунд И 130
N-Карбэтоксиазепиц IV 9
10-1<арбэтоксп-1,1 - диметил-А 8-октеноло1| -7
III 129
3 - Карбэтокси - 5’, 3’ - днфенилвинилуксусная
кислота I 148; 11 394
Карбэтокснкарбеи V 96
2-Карбэтоксикумарин 111 105
1-Карбэтокси.метил- 4- карбэтоксипиперидин
IV 236
2-Карбэгокси-З-метилпиррол 11 273
Карбэтокснметилтрифенплфосфонийбромид
II 123
3 - Карбэ'гоксинафтиндазолхинон-4,9 1 251
Карбэтоксннктрен II 444; IV 9
7-Карбэтоксниоркарадиеи I 250
7-Карбэтокснноркаран И 117
3-Карбэтокс1г-5"ОКСИ-2-метнлбензофура1г И
47
2-КарбЭ1окситетрадоц-1 I 183
1 - Карбэтокси-5,5,9-триметил- транс-декалин
И 198
А1-КарбэтокС1|фталимнд II 123; III 22; IV 115
2-Карбэтоксиццкдогексацон I 431
2-Карбэтоксициклооктанон V 194
671
2-Карбэтоксициклопентанон 11 394
Карбэтоксициклопропаны II 117
М-Кароэтокси-2-этокси-1,2’Дигидрохинолин
V 236
Карбэтоксиэтилеиммин II 414
Карвакрол II 162
Карвеол II 161
Кариоментон II 270, 271
Карвон I 340, 342: II 162; V 452
Кардецолиды Н 190
А;,-Карен II [61
(1,1- Кариофиллен
производные V 495
синтез I 337, 338: V 119
Карминовая кислота 111 209
Каро кислота И 123 — 125
р-Каро'гии, синтез IV 251, 267; V 15
Каротиноиды II 37; IV 231
Катехин V 378, 491
Квадрпцикланол V 264
Квебрахитол 1 117
Кверцетин 1 119
п-Квинквифенил II 104, 105; 111 403
Келлин V 323
КеллииХинон 11 81
Кель-Ф I 91
Кермезннова кислота 111 209
Кетен I 83, 283; II 22, 23. 525 — 129; Ш 149,
226, 307; IV 22, 271; V 237
днэтилацетэль I 155; II 237
Кетен пл ндентрифеН ил фосфоран V 238
Кртепы III 438, 452
а-КетоальдегиДЫ I 14, 15; II 419
2-Кетоальдоновая кислота II1 79
е-Кетоарахидоновая кислота IV 180
а- Кетоглутароная кислота 11 129; IV 240
7-Кетодегндроабпетицовой кислоты мети-
ловый эфир I 143
6 Кетг>-3р,5а-диацетокснхолестан IV 252
1 - Кето ЗН-1, 2-дигндропиррол-[1,2 а]-пиррол
III 171
0- Кето-5,5-Диметилбицикл о-[2,1,1]-гексан 111
87
7 - Кето-За- 12а-диоксихолановая кислота 1
136
3-Кето-7а, 12а-д)1ОКсихолановоП кислоты ме-
тиловый эфир V 389
7-Кето-А-’9 КЧ-леностадиеи IV Н4, 175
7-Кето-А’-леностей IV 174, 17ё
3- Кетомас.ляного альдегида 1 -ди метил аце-
таль III 105, 106
Д': -3- Кето-17р-метил-17-изоэтиецовая кис-
лота III 14
4-Кето-7-метилкаприлоиой кислоты метило-
вый эфир I 236
15-КсТс)-20-метилхолентрен III 217
7- Кето -1 -ме гакси- 13-метил-5,6,7,9, 10; 13-гск-
сагидрофенаитрен II 267
6- Ке гононанолид IV 141; V 518
A Кето- 19-норстеронды V 532
дт,», и.;]-Кето-19-норстероиды V 178
Дд1"),11 ('Ч-З-КетоИЭ-норстсроиды V 178
Кетоны 11 115, 379
3-K.e'io-17[3 окси-4-окса-5а-андростан И 125
3-Ке го-311-о к с и стероиды II 14
1Г>- Кето-29«-оксистероп ды IV 178
у-Кетапнмелииовой кислоты днэтцловый
эфир 1 201, 202; III 449. 450
Кетоцииовая Кислота И 116
9-Кето-9Н-|[Нрроло-[1,2а]-индол III 135
2и - Кетопрегнаны II 38
Д1 в-20-Кетоирсгцаны И 275
'7 КеЧ oiipei ненолонацетат 11 426
ЗО-Кстосгеронда 17а-гидроперекнсь I 160
,3-Квчастероидов бгчс-гиДроперекнсн III 59
3 вего-5[(-стсропдь! I 160; И 16, 411, 415;
I 11 36; V 250
эфиры енолов III 94
3-Кето-5(3-стероиды I 160; И 16; V 18
5а- и 5[3-2-Кетостероиды V 520
Д'-З-Кстостеролды II 415
А1 4-3-Кстостероиды 1 469; IV 127, 128; V 243
А1 Ас-3-Кетостероиды I 409; IV 127, 128
А4-3-Кетостсроиды I 9, 142, 131, 214 363; Ц
13, 14, 16, 239, 411; Ш 292; IV ’11, Ю7
219; V 46, ё7, 178, 243, 300
A'’V-3-Кстостероиды I 409; Ц 222; IV 127, 128
А’-З-Кетостероиды I 151; II 152
Д’М-Кстостероилы V 335
Д5-7-Кетостероиды II 425, 426
А7-6-Кетостероиды V 386
6-Кето-5а-стероиды I 265
11-Кетостсроиды, восстановление I 199
17-Кетостероиды 1 340; II 13, 16; V 62
тиокетали 111 164
20-1<стостероиды I 160; II 190, 275, 351; IV
141
А1 й-20-Кетостероиды, сопряженное присое-
динение II 2-14
|3- Кетосульфоксиды 1 336; II 440
1-Кето-1,2,3,4-тетр<1Гидро-8,9-ац1ефснантрен
IV 116, 117
1 -Кетотеч рагндрофецантрсн 111 50
4-1<ето-13,4-тетрагидрохриэен 1V 211
6-Кетотигогенииацетат II 191
7-Ке'['О-7Н-5,6а, 12-триазабенЭ- [«]-антраИсн
111 39
3- Кето-113,20,21 -три оке и-5а-прет нан-1 8-кар-
боиовой кислоты 14,18-лактон диацетат
III 200
G-Кетоун декандикарбоновая кислота III 452
5-Кето-6-фенилнорборпен III 97
3-Кето- 2-фенилциклонентан- I -карбоновая
кислота IV 118
6-Кето-7а-фторэстрадиолдпацстат III 96
12-Кетохолан III 359
3-Кетохолестан-5а,6р-дпбромид II 377
6-Кетохолестандиол-ЗР,5а I 136
6-Ке1охолестанилацетат II 447; IV 216
7-КетоХолестерплацетат 1 178
7-Кетохолестерин [V 168
2- Кетоциклогексилпропионовая кислота 111
150
Кёнига соль II 385
Килиани реагент см. Хромовая кислота 11
. 129
Кинуренин желтый V 325
Кинуреновая кислота V 325
Кипятильные камешки 11 130
Кислорода дифторид II 130; V 239, 457
Кислорода поглотители I 15; IV 171
Клайзена Щелочь II 131, 379
Кобальта!! I) ацетат V 239
Кобальта(И) ацетат-бромнд II 132
Кобальта гидрокарбонил I 286, 287; II 132;
V 240
Кобальта(Н) хлорид И 132 — 133; V 377
бис-(1\облльттстра1<арбонил)-цинк V 240
Кодеин II 106; IV 57, 58; V 389
Коденнон V 389
симы-Коллидин (2,4,6-триметилпириднн) II
133, 196
Колхицин I 158
Конгрессаи см, Днамантап III 39
Коцифериловый альдегид IV 136
Копаен V 138
Копростандпола-ЗР.С!3) ди ацетат 1 265
Копростидол IV 147; V 107
КоПростаноп III 141
Коричная кислота I 205, 206. 212, 217, 218;
II 175, 367; III 61, 329, 330; V 521
дибромид II 396
нитрил III 238
фениловый эфир 111 330
хлорангндрнд IV 227
этиловый эфир 111 408; 238; V 340
672
Коричный альдегид I 39, 78, 143, 332; II
175, 203; Ill 35, 131, 207. 238, 464; IV 52,
255, 268; V 84, 199
N, N-диметилгидразои V 350
Коричный спирт I 39, 332; П 175, 176, 219;
111 131; IV 255 V 152
ацетат И 438
Корпфорса реагент IV 181
Коропаридин III 178
Коронен 111 133
Кортизол II 99; III 253; IV 171
21-ацетат Н 299
21-ацетат 3,20-бис-Этиленкеталь III 44,
45
3,20-диоксим II 99
3,20-б«с-этилон1<еталь II 382
Кортизон I 135, 153, 250, 372; II 204, 229,
1108, 411; Ш 44, 45, 251, 253; IV 32, 87,
171, 250 270
ацетат I 135, 372; II 411; III 10, И
3,20-бискеталь II 382
21-фосфат I 256
Косме-Н IV 30
Кофермент A III 126, 339
Кофермент Q Ц 399, 400
Кофермент уридин глюкозодифосфат III 418
Крахмал I 18, 134
Креатинин IV 94
rt-Крезилацетат см. Уксусной кислоты п-
крезиловый эфир III 342
о-Крезол II 435
n-Крезол III 226
Крезолы I 280
Крезорцин см. 2,4-Диокситолуол
о-Крсзотиновая кислота III 202
Кремний четырехх’лористый И 133
Кремния тетраизоцианат II 133
Креозол И! 191; IV 203, 204
Кринин V 203, 290
Кроконовая кислота V 482
диацетат V 483
тригидрат V 270
КроТилбензоат см. Бензойной кислоты кро-
тиловый эфир II 344
Кротиловый спирт II 25, 26; III 131
Кротоновая кислота Ill 181, 277; IV 117
етор-бутиловый эфир 11 243, 244
«-бутиловый эфир II 349
метиловый эфир IV 243
окись III 82
этиловый эфир II 347; IV 140; V
89
Кротоновый альдегид I 83, 84, 287; И 25,
26, 166, 274; 111 104, 107, 131; IV 270
ди-н-бу тил ацеталь II 349
Кротонолактон III 456
Кроцетиидиальдегид II 116
Ксантгидрол II 360
Ксантон II 360
Ксеноновая кислота V 241
о-Ксилцл бромистый IV 247
о-Ксилилен I 151
о-Ксилилендиамина дихлоргидрат Ц 31
п-Ксилилендибромид V 163
«-Ксилилендихлорид Ш 403
D-Кснлозы тозилгндразон III 359
о-Ксилол I 30; II 37, 295, 298
л/-Ксилол II 298; III 137, 154, 427
«-Ксилол II 34, 298; III 32
D-Ксилопирайозиды V 131
Кумариловая кислота (бензофуранкарбоно-
вая) V 476
Кумарин->3,4-Дн гидро кумар и и Ill 157
Кумарины I 285; III 432; V 510
КУмаровой кислоты метиловый эфир I 39
Кумол I Ill; III 368, 447; IV 48
Кумо.циновая кислота III 125
Кумулены I 136; II 284; IV еЗ, 223
Лаккаиновая кислота III 209
u-Лактамы 1 164; 11 446
P-Лактамы I 425
Лактоза III 301, 345
AL 8J'J)- Ланостадиеи IV 175
А"-Лаиостена производные ГН 74
5а-Ланостерил-3|3-формиат II 185
Ланостерин I 153
Лауданозин III 341
хлорметилат III 341
Лаурил бромистый I 131; Ш 323
Лаурилмеркаитан Ill 325
Лауриловый спирт I 131
Лаурилполиэтиленгликоль П 134; III 7
Лауриновая кислота 1 180; II 248 319'
III 179; V 311 ’ ’
азид II 359, 360
виниловый эфир I 180; Ш 179
К;-метил амид II 171
хлорапгидрид II 359, 360; 1Ц 452
Лаурон III 452
Левопимаровая кислота I 67; V 63
метиловый эфир V 224
Левулиновая кислота Ц 134 — 136; V 242
L-Лейцил-К-аланидглицИл-Е-вал ин II 69
L-Лейцил-Е-метнонина амид 11 467
D, L-Лейцин II 306
L-Лейцин III 263; IV 33
аминопептидаза III 453
этиловый эфир IV 191
Лемье — Джонсона окисление П 138
Лепидин И 272; IV 16
Летаргические реакции II 265
Лецитины IV 38
Либермана — Бурхарда проба III 292
Лизергиновая Кислота Ill 122, 279, 280
Лизин 11 290, 306, 331; IV 261
дихлоргидрат III 109, 110
монохлоргндрат III 109, 110
L-Лизин HI 152; V 479
Ликорин 1 84
D-Ликсозы тозилгндразон II 359
Лимонен I 161; II 160, 449, 430; III 176,
286
Лимонная кислота I 86
Линалоол II 37
R н S III 85, 86
Лиидестрен V 109
Линдлара катализатор Ц 136 — 137; IV 217
Линолевая кислота И 52, 320, 384; III 267,
337; IV 213
изомеры I 276
. этиловый эфир IV 213
Липоевая кислота II 9; III 338
Литий I 35; II 137 — 141; V 34, 78, 244
алкил- н арилпроизводные I 349; П
139—141
Лптий-алкиламиниое восстановление II 141—
150; IV 141; V 242, 295
ЛитийалюмнниймоноэтоксигидриД II 177
Литий — аммиак II 151 — 153; V 243
Литий — аммиак — ROH (см, Бёрча вос-
становление) II 153; V 33
Литий — mpem-бутанол — тетрагидрофуран
И 153—155
2-Литий— 1,3-дитиан V 160
Литий — дифенил И 155—156; V 243
Литий — N-мстиланилин И 156
Литий-натриевый сплав дни получения ли*
тийалкилов II 156 —157
Литий — нафталин V 29, 244
Литий — н-пропиламиц II 157 — 158
Л птий-тр л этилен диамин II 160
Литий — этилен диамин II 158 — 159; V 243
N-Лптинэтилендиамин П 159 — 163; V 246
Лития алкенилы I 349
Лития алюмогидрид I 275, 376, 396; II 163 —
179, 187—277, 295, 303, 362; 111 401;
22 № 1994
673
IV 92, 197, 267', V 19, 38. 149, 132, 212,
246, 349, 436
Лития алюмогидрид — алюминия хлорид II
170—183; V 249
Лития алюмогидрид — пиридин I 15; II
183—185
Лития алюмогидрид — эфират трифторида
бора II 185
Лития алюмогидрида 3-О-бензил-'1,2-О-цнк-
логс-кснлидешн-О-глюкофуранозы ком-
плекс V 247
Лития амальгама IV 234
Лития ацетилениды V 69
Лития боргидрид 1 266; II 186; V 471
Лития бромид 11 186—187; V 250
Лития бромид — эфират трифторида бора II
187
Литии тдиж-йнрец-ьбутскси)-алюмогидрид I
185; И 187—193; III 228; IV 264
Лития гидрид V 29, 252
Лития гидроокись V 347
Лития дицзобутнлметнлалюмогидрид V 252
Лития ди!1зог|ропиламид V 252
Лития дициклогексиламид V 57, 253
Лития диэтилэмпд I 179; II 193 — 195; V 254
Лития дпэтоксиалюмогидрид 11 195 — 196
Лития иодида днгидрат II 196 — 197
Лития иодид безводный II 197 —199
Лития карбонат II 199
Лития карбонат — лития бромид II 199 —
202; V 256
Лития мон оцпанбор гидрид II 292 — 203
Лития нитрид И 203; V 256
Лития три метокси алюмогидрид Ц 203 — 294;
V 257
Лития трихлорметнд см. Трихлорметил-
ЛИТИ11
Лития триэтоксиалюмогидрид II 204; V 257
Лития фторид II 107
Лития хлорид I 2">7; И 204 — 205; Ш 234; V
257
Литохолевая кислота I 201
Лонгифолен Ill 316
Лумистерин II 33S
Лупинап I 139
Лупинеп I 139
2,6-Лутпдин I 30, 96; II 197, 206; IV 68, 69, 99'
V 104
3,5-ЛутнДнн И 133
2,6-Лут!1Дин-3,5-дикарбоно1?сй е<колоты гид-
разид II 206
Лэзнра катализатор см. Меди!II) хромит
Люминол (З-амино-З.Й-Днгидрофтал аздион-
1,4) I 206
Лютеин V 331
Магний И 297 — 210, 282; V 87, 259, 287
Магний — иод — эфир II 210 — 211
Магний — нафталин 11 211; V 259
Магний — ртуть хлорная V 259
Магния амальгама II 207; Ill 19); V 292
Магния бромид безводный V 259
Магния бромида эфират II 212
Магния метилат V 287
Магния нитроацетат и 304
Магния окись II 212 — 213; V 260, 527
Магния сульфат И 213 — 214; V 55
Магнолол И 9
Малеиновая кислота III 41, 82
гидразид I 171
ди этиловын эфир 1 99
моноамид IV 165
эпокись [11 82
Малеиновый ангидрид I 34, 82, 293; II 25
363; III 51, 311, 315; IV 47, 49, 114. 165^
200, 201, 207; V 40, 544
Малеиновый ангидрид —фурап, аддукт III 83
Малеиновый диальдегид *11 214 — 216
Малоновая кислота 11 20, 217, 218; Ш 101.
109, 449: V 347, 381
диамид I 270
днанплид V 318
дпбеизиловый эфир (дибензилмалонат)
II 216-217
дичп petn-бутиловый эфир I 303, 304-
II 20, 21, 2 17
дпхлорангндрид I 304; II 217
днэтцлоиый эфир I 16, 299; II 263, 324,
415; III 104, 105; IV 65, 66, 242, 243;
V 349
изопропилнденоный эфир П 217—218
Моноэтиловын эфир II 20
Малоновый ди альдегид V 261
тетраэтнлаиеталь V 261
Малоновый эфир V 320
Малопонитрил I 32, 306, 32.3, 421; 11 394-
III ИЗ. 314, 317; IV 86, 105
Мальтоза III 301, 34 5
Маннит III 42, 43
Мапнпха реакция IV G7
D-Маннозя 1 425; И 48, 171; П1 274; IV
32
D-Мапноновой кислоты у-лактон И1 220
Манносахародилактон II 250
2,5-днмезилат II 2,50
Маргаица(Ш) и (И) ацет,ат V 261
Маргапца(И1) игрпсцацетилацетонат) V 262
Марганца двуокись активная I 209, 410; П
86, 218—227; V 227, 263
'Зар гаи ид двуокись обычная I 209; II 227 —
228
Марганца карбонат V 269
Марганца нитрат V 266, 536
Марцнуса желтый И 402
к-Масляная кислота V 205
амид 1 169
ангидрид IV 156
н-бутилоный эфир I 170; II 375; Ш 200
нитрил I 33
хлорангцдрцд II 173
этиловый эфир II 349
н-Масляпый альдегид I 287; И 96; II1 301
343
-диэтидацеталь I! 349
D,L-Мевалоновой кислоты 5-фосфат III 88
Мевалонолактоп III 85, 86; IV 181
МедиИ) ацетат V 270
Меди(П) ацетат безводный И 228; V 271
Меди(11) ацетат, моногидрат 11 228 — 230-
V '271
Медн( 11) а Це тн л ацетон ат V 92, 271
Меди закись II 230 — 231
Медн(1) иодид II 231; V 120, 272,299, 497
Медц(Ц) карбонат V 479
Медп(]1) карбонат основной II 231 —232;
IV 69
МеДи(Н) нитрат — пиридин II 232
МеДи(И) нитрат — уксусный ангидрид II
232 — 233; V 273
МеДи оКнсь IV 69
МеДН(И) сульфат II 233 — 234; V 96, 271, 357
Меди(И) сульфат, безводный V 275
Мсди(П) хромит (катализатор Лэзирз) II
234 — 235; IV 191
Меди(1) цианид II Ю; III Ш; IV 250; V 272
Медиан бронза II 235
МеДная пудра — бензойная кислота И 235
МеДиые соли II 235 — 236
Медный порошок II 236 — 237; V 96, 272, 276
Медь (или C1V+ ) — аскорбиновая кислота II
237
Медь бромистая II 237—239; V 278
Медь бромная II 36, 239—241; IV 2Гд; V 65
280
674
Медь, катализатор декарбоксилирования II
236; IV 120, 121
Медь хлористая С11аС1, I 40Г>; II 241 — 246; V
280
Медь хлористая, комплекс с хлористым ам-
монием Ц 246
Медь хлорная безводная I 280; 11 246; V 133,
281, 343
Медь хлорная (бромная) — азота окись V
284
Меервепна — 11ондорфа восстановление V 18
Мезембрин А' 2 9 0
6-О-Мези л гепта-О-ацетил трегалоза II 232
О-О-Мезил-2,3, Утуи-О-ацетнл-а-метил-П-
глюкоипранозид 11 232
2-О-Мезил-3,4,6-три-О-метил-а-D-глюкознд 1
321
б«-Мезилокси-7а-фторэстрадиолдиацета г III
Об
12а-Мезнлоксихолан I 137
Мезилхлорид см - Метансульфохлорид II 247;
V 286
Мезитальдегид II 2}8; IV 210; V 185
1-Мезитил глиоксаль-2-гидразон II 224
Мезитилен I 47; 111 Hi, '264, 427, 428; IV 68,
310; V 185
Мезитил е и сульфокислот а V 303
Мезптиленсхльфохлорид I 427; И 247; III
362—377; V 193
Мезитилидспмалоновой кислоты моноэти-
ловый эфир И 218
Мезшиллитиц II 193, 194
Мезитилмезитоат см. 2,4,6-Триметнлбензой-
ной кислоты i.-l/j-rpHMc'riuidjeiuMOBbiii
эфир III 438
Мезитойная кислота см. 2.4,6-Тр(;мегилбеп-
зойная кислота
МезоКсалсвой кислоты диэтиловый эфир I
16; III 32; V 393
Меламин (2,4,6-TpiMiMHiio-ctj,UM-Tpna3)iii) I
410, 420
«-Меланотропин 1 211
/-Ментан! I 1 70
(-'-)-Ментеи-3 III 176
Ментена-2 1.4-оКиеь V 470
/-Ментил тозил ат II 170
/-Me кто л II 3 73; IV 178
/-Ментон I 333; 11 37,3; IV 178
Меркаптаны II 84, 362
2-Меркапто-4-амипо-3-карбэтоксипирим и дин
IV 345, 276
2-Меркаптобеизимндазол IV 41
2-Мсркаптогистамип III 188, 189
2 -Мер к аптометпл тетрагидрофур ан III 340
2-Мср|<с|Пто-4-оксн-ё-цп<1пОГ1ирнмиДин IV 245,
276
2-Меркаптопирпмидина хлоргидрат III 326,
2-Меркаптотна золии IV 2.63
3(5)-Меркап го-1,2,4-триазол I 29, 30; Hi 360
Мсркаитоуксуспого альдегида диэтидаце-
таль I 65; II 422, 423
13-Меркаптоэтанол II 247—248; IV 262
Метакриловой кислоты метилового эфира
дибромид III 410
Метакролеин III 71
Мстпллплгалогеипды I 63, 153
Мсгаллилнзоцпанат 1Н 345
N-Мета и сульфин ил -л-тол ундин V 285
Мсгансульфинилхлорид А7 285
Метансульфопзоцианат II 249
Мт а исульфо кислота II 248 — 249, 336; III
58; V 286
алкиловые эфиры 11 249
ангидрид И 249 — 250
диметиламид 1 303
л-Метапсульф^илапизол Н 249
йм(Метансульфоп ил)-ацетофенон 1 3-15
Метансульфохлорид (мезилхлорид) П 249,
250 — 253; V 197, 259, 286
Метансульфохлорид — двуокись серы П
253 — 254
Метантрикарбоновой кислоты триэтиловый
эфир II 208; IV 162
Мстафсэсфорная кислота II 254—255
L11.21-Метацпклофан V 163
Метила гидроперекись 1 219
4-Метилакрнднзипийбромид III 305
2-Метилакролеин V 15
Мсгилаль II 255 — 256; V 157, 287
Метиламин II 141, 143; V 290
хлоргидрат IV 68
Мстилампнборан 1 ,33
1-Мегил<пп!цоаптрахинои III 111
1-МсТпламино-4-бромантрахинон III 111
Мег)1Л-2-амино-2-дезокси-Р-П-глюкопирано-
зиды V 168
2-Метиламино-З-метилпиразин V 148
1-Мегил -1 -аминоциклогексан III 368
транс- 1-Метил-4-ам|111оц1|Клогекеаи II 145
З-Метиламиноциклогексанол II 106
2-Метиламнноэтаиол А7 496
17а-Метнл-5п-апдросталол-17|3-он-3 V 86
6а-(и 0руМетил-Д'*-андростендион -3,17 IV
62
Гч-Мсгиланнлпл 11 173, 462; IV 43
IHIKJJtJT HI 101
9-Метилантрацен I 339, 344; V 138
Метилат лит ин Y 215
Метилат натрия 1 382, 383; II 256 — 262,
269. 333, 334; III 448; V215, 28g, 302,
349, 436
3-Мет н л аценафтилен V 139
5-Метклаценафтнлен V 139
Н-Ме'гплацетанилнд II 398; Ш 237
2-Мет ил-9-ацетокси антрацен III 219
2-Метил- Ю-ацетокси-Э-аптрон III 219
Мет нл-ЗР-ацегокси-20-кето-21-Нор-о-)дрйнс-
22-холадиенат V 232
ц-Метплацетофенон I 29, 76; II 406
Мотил-3-бе из амидо-4,6-О-бензнлидсн-З-де-
зоксп-а-П-альгрониранозид I 330, 331
10-Метнл-1,2-бензантрацен Ш 217
Метплбензиламиц 1 191
2-Метилбензнлднметиламиц I 64; V 136
1-N-Мети л-2-бензил-3-карбэтокси-4-ципери-
доп I 182
Метилбензпловып эфир II 18!
МетилбензнлсульфцД III 69
Метил бен зиле ул кфоксид III 69
Э-Метилбензямндязол IV 39
1-Мстч1.тбснзотриазол II 170
Метнлбенво-!с]-фенантрены II 376
3-М.етил-1,2-бензофлуоренон III 136
4-Метил-1,2-бензохинон II 341
З-Метилбензтиазолод-2-гнДразон, хлор-
гидрат 11 262 — 263
10-Метил-10,9-боразарофенантрен I 117
Метилборная кислота Ш 381
Мстил бромистый 11 263—264; V 293
6-Метил-2-бромнафталии J11 300
Ме.тнл- 1-бром-«-прОПНЛкетоп II 109
8-л4етил-8-бром-1,2-циклонропилциклогеп-
таи II 284
Метил- 1-бромэтнлкетон II 109
транс-1 -.Метилбутадисп IV 200
3-Метилбуганол-2 V 103
2-Метнлбуrcii-1 I 154, 266; II 435
З-Метилбутен-1 11 435
2-Метнлбутси-2 I 154, 264; III 6!
окись V 103
З-Метплбутен-2 I 265, 313; II 345
3-Men кт-2-буте н и л ацетоуксусной кислоты
этилоьын эфир 111 98
Метнл-н-сутиламип I 3)7
22'
675
2-Метилбутилат-Э калия (л»реот-амплат ка-
лия) I 81; Н 73, 264 — 265
2-Метилбутилат-2 натрия 11 265 — 266; V 289
2-Метнлбутип-3-оя-2 I 63, 77; II 244
3-Метилбутиц-1 -ол-3 II 266
2-Метил-3-бутОксн-Д2-циклогексснон-1 1 80
Й-Метил-Мвалеролактон II 234
Метилвернолат V 255
Мет ил винил кетон I 51, 287; II 266 — 274,
301; 111 33, 103, 125, 120; V 289
Метилвиниловый эфир II 274
Метилгексановая кислота III 5
2-Метилгексанол-2 I 325
5-Метидгексанол-1 III 5
2-Мети л гексен-1 I 325
2-Метилгексен-2 I 325
б-Метилгептадиен-4,5-ин-2-ол-1 11 245
6-Метилгептанол-2 III 343
6-Метилгептанон-2 III 142
6-Метилгептен-1 III 5
6-Метилгептен-5-ол-2 II! 142
6-Метилгептеи-5-он-2 IV 252
Метилгидразина сульфат 1 198
О-Метидгидроксиламин II 274 — 276
З-Метилглутаровая кислота III 14, 85
З-Метилглутаровой кислоты ангидрид IV 243
Р-Метилглутаровый диальдегид II 274
Метил-а-О-глюкоза V 492
6-О-Метил-В-глюкоза V 92
Й-(2-О-Метил-В-глюкозил)-пипериДин Н 62,
63
Метнгл-а-О-глюкопнранознд II 48 49, 252;
V 287
тетрабензиловый эфир II 399
Метил-З-О-Глюкопиранозид 11 48, 49, 399
транс- 1-Метилдекагидрохннолин III 177,
178
З-Метилдекаип-З-диол-1,5 И 74
9-Метил-ц«с-декалон-2 II 238
10-Метвл-цгрйнс-декалон-1 11 333
Ю-.Метил-т.ра«с-декалон-3 II 151
Ю-Метил-цис-декалон-З-ол-О II 269
2-Мётилдекандиол-3,5 1 236
5-Метилдецен-5-ин-3-ол-1 II 74
1-Метил-4,7-диазацидол-3-альдегид V 148
1-Метил- !-диазометилциклопентен-4 II 186
4а-Метил-ба-дигидротестостерон II 151, 132
1\’-Мётил-1,4-дигИДроникот11Нампд II 403
М-Метил-2,3-диметоксибензиламш! III 160
3-Метил-3-(3,4-днметоксинафтил)-фталид V
286
а-Метил-3,4-дцмстоксифепилаланин И 407
16 а-Метил -20|3,21 -дпокси ацето ни д-Д [,4т Э<1 J) -
прегнаггриепол-17а-3-метоксим II 274,275
16 -а-Метил-20^,2Ьдиоксиацетоннд-Д'-О
прегнатриепол-17(1-он-3 II 274, 275
N-Мстил-3,4-диоксифенилаланиц II 46, 367:
.IV 94
2-Меткл-3,3-яифенилоксазнрац V 518
1-Метил-1,3-дифенилпропеп- 1-он-З (дипнон)
1-Метил-1,2-дифенилэтиламии I 237
Метилдихлорфосфин I 99, 301
2-МетилдициклопроПиЛкарбицол [II 275
1-Метил-3,3-дпэтилацетои см. 4-Этмлгекса-
нон-3
транс-2-МетилДодецсв-2-овая кислота IV 12 J
Метиленаминоацетонитрил 1 225, 248; IV 70
7-Метиленандростанол- 17fi-on-3 И 189
4-Метилен-Д’-й-Ц-андростенон-З I 333, 334
М-Метцленбензплампн I 191
Метилен бромистый I 294, 295; V 292
1-Метилен-4-да реда-бутнлциклогексан II 344
Метилендиамин сернокислый II 407
7--Метилен-3,17-дикетоаидростан II 189
2-Метилен-5,5-диметилбицикло-[2,2, iJ-reK-
сан III 87
бис-(Метилендиоксп)-производные (БМД)
стероидов IV 70, 71
Метнлендиуретан II 276
Метилен иодистый V 292, 399
а-Метиленлауриновая кислота I 155; IV 1'10
а-Метилецлауриповой кислоты трелг-бути-
ловый эфир IV 110
МетилсНМагнийбромид (иодид) V 292
Мстиленмалоновои кислоты диэтиловый эфир
III 158
Метилен-б«с-(трифенплфосфонийбромид) V
z. 3 S
Метилеятрифенилфосфоран II 276
Метиленуретаи И 276
Метилен хлористый I 175, 292; II 277, 290,
426; III 154; IV 257; V 23, 55, 152, 293,
336. 458, 473, 524, 536
З-Метилснхолестан II 158, 159
МетиленЦпклобутаи II 355; IV 259
3-.Мети лен циклобутан-!, 2-ди карбоновой кис-
лоты ангидрид I 34
Метиленццклогексан I 174, 283 325; II 277-
III 402
окись I 245; 11 372; V 141
1,2-бнс-(экзо-Метилен)-циклогексан IV 200,
201
З-Метиленцпклогюнанон-! IV 260
Метиленциклопентан И 236
Метиленциклопропенкарбоновой кислоты
этиловый эфир II 396, 397
5а,ба-Метнле.и-Д V—-эргос.тадиенол-3{1 1Г 155
4-Метилпентаион-2 (метилизобУтилкетон)Ill
420
цис- и П1рянс-1-МеТил-2-изобутоксици1<яо-
проианы V 200
З-Метилизоксазол-5-карбоиовая кислота 1355
j-Метпдизоксазол-3-карбоновой кислоты
хлорангидрид I 354
О-МетилизомоНсвина, хлоргидрат IV 186; 187
З-Мстил-З-изооктил-Д *-1,3-цнклопснтадиено-
феиантреп IV 128
16а-Метид-20р-21 -иЗопропилидендиокси-
Д’М 'Ч'О-прегнатрценол-17а-ои-3 11 274,
273
I 7-метИловып эфир II 274, 275
1-Мстил-3-изопропил иденциклобутен 111 316
Метилизонропилкетон I 160
Метилизоиропилкетона гидроперекись II]
393, 394
S-Метнлизотиомочевины сульфат Ш 326
1-Мстилизохинолиц 11 280
1-Meтилиндол 1 63; II 66
2-Мерилиндол I 64, 301; IV 33, 207, 208
2-О-Метил-(—)-инозИт I 117
Метил иодистый 1 33; II 33, 218, 278--281;
IV 92; V 115, 293
2-Метил-6-иод-3-окснбензофуоан-3:карбоно-
вой кислоты этиловый эфир II 47
О-Мстилкапролактим 1 316
а-Метилкепроновый альдегид IV 21S
1-Метил-3-карбметоксипиридинийИ0Двд 11
65
4-МетИлкарбостприл IV 16
Метилкариолат V 255
МетилКетена диэтилацсталь Н 281—282
1 -МетМл-2-кето-8-метоксп-1,2,3,4,9,1О-гекса-
гндрофенантрен IV 249
Мет и л кетоны 1 336; 11 59
Г-Метил-3'-кето-2,3- цпклопентенаценайтген
IV 117
(З-Метилкротоновая кислота IV 270
Метпл-а (и (З)-ксилопнранозид IV 31; V 287
4-МетилкУмаркн I 48, 49
Метпллаурвламин II 171
а-Метцллауриновац кислота IV 110, 121
N-Ацетил лейцин V 321
Метиллнтпй I 95; II 282—285; V 109, 120,
252, 294
676
Метилмагнийбромид I 230; II 285 — 28G
Метил магний и о дид И 286; V 299
Метнлмалоновой кислоты диэтиловый эфир
II 263; IV 242, 243
а-Метил-Э-мапиофурянозиД Ш 220
Метилмедь — три-н-бутилфосфин, комплекс
V 299
Метил-2-О-мезил-3,4,6-три-О-метнл-а-С-глю-
козид I 321
Р-Метилмеркаитопропионитрпл II 174
в-МетИлмеркаптопропионовый альдегид II
174, 175
1 -Метил-3-метиленциклобутан III 316
2-Метил-4-метоксифснол II 104
1-Метнл-З-метокси-З-этил- 1- азациклогептац,
перхлорат 1 246
N-Метилморфолии И 106, 287
N-Метилморфолина окись — перекись водо-
рода II 287 — 288
I-Метилнафталин V 14, 529
2-МетИлнафталин III 62; IV 179
N-Метил-а-иафтилцианамиЛ I 139
2-Мети л-1,6-нафтиридин V 402
4-Метил-1,6-нафтиридин V 402
2-Метнлиафтогидрохинон-1,4 I 114; Ц 4Q2;
IV 230
диацетат III 456
1-моноацетат 11 76
2-Метили афтогидрохинси-3-сульфокислоты
натриевая соль I! 374
2^Метил-1,4-иафтохинон 1 114; III 62, 233,
236, 456; IV 150, 179; V 483
2,3-эпокись III 70
МеТйлиИтрат 11 288—283
Метилнитрит 11 289 — 290
у-Метил-у-нитровалер наповал кислота 111
392
метиловый эфир III 392
М-Метил-М-нитрозо-М'-иитрогуанидин I 244
М-Метил-Ы-нонилформамид I 146
14-Метил-Л-норкопростапон-З IV 148
Метиловые эфиры III 295
расщепление II 357
Метиловые эфиры кислот II 290
Айетиловый спирт II 310; Ш 155; V 207,
287, 457, 510
2-Метил-5-оксибензофуран-3-карбоновой ки-
слоты этиловый эфир И 47
4-Метил-7-оксикумарин II 64; V 510
3-Метилоксиидол И 112; [V 34
4-Метил-б-оксипиримиДин III 165, 326
1-Метил-Д’-октагидрохинолин II 157
1 -Метнл-Д’-октагидрохинолин II 157
9-Мстилокталиндион-1,6 1 3(31
10-Метил-Д Ч ’) -окталон-2 II 269
ЮР-Метил-Д4-окталон-3 II 151
Д4-9'-Метнлоктилиндион-3,8 И 268, 269
1-Метилоротовая кислота V 332
4-Метил-Д'-,’а-пентадиеновая кислота II 437
2-Метид пентан диол-2,4 II 090 — 292
З-Метилпентандиол-1,5 II 234, 274; III 158
З-Метилпснтсн-З, цис- и транс- IV 89, 90
4-Метилпентен-1 III 343
^пс-4-Метилпентен-2 I 313. 314; IV 8ft, 90
2-Метилпентен-1 -нн-З V 59
N-Метилпипериднн Ш 412; V 221
1 -Метилпирндиний-З-карбоксилат И 65
1-Метилпиридипия метилсульфат II 105, 106
1-Метилпиридон-2 11 105, 106
4-МетилпиримиДин IV 73
3-М.етилпирослизевая кислота 11 236; IV
120, 121
14-МетилппрролидоН-2 II 292 — 293; V 300
О-Метилподокарповой Кислоты метиловый
эфир I 1G3: I! 167
0-А1етилпоДокарповой кислоты натриевая
соль IV 166, 167
16ы-Метил-ДЬ*-прегнадиентрИол-11р, 17а, 21
дион-3,20-21-ацетат II 253
11а-Метилпрегнан III 49
1ба-Метил-Д1,,,>'' (11)-прегнатриендиол-17а,
21-он-20.21-ацетат II 253
1ба-Метил-Д4> 14л г’-прегнатриендион-3,20 V
493
Метплпропаргиловын эфир V 25
2-Метилс)ронен см. Изобутилен
1-(2-Метилпропенилиден)-2-фенИлциклопро-
пан I 134
Метил -н-пропил кетон II 109
Метил резорцин II 56
Метнлртуть подпетая I 34
а-Метилстирол I 404; IV 190; V 262
о-Мети лети рол II 367, 368
Метилсульфиды III 295
Метилсульфинилметилидлитий (димсилли-
тий) V 135
4-Метилтестостерон JI 151, 152
17а-Метилтестостерон V 230
1-Метилтетрагидрохинолин П 157
1-Метилтетралон-Й I 182
1-Мет ил-2,2,3,3,-тетр ациан-б-изопропил иден-
бицикло-[2,2,0]-гексан III 316
2-Метил-Д2-тиазолмн-4- карбоновой кислоты
этиловый эфир IV 24
Метил-2-тиеиилсульфид I 237
1-Метилтимин V 393
Метилтиометиллитий V 411
З-Метилтиофел I 98, 99; III 293; IV 82
4-(Метилтио)-фенил V 301
Метилтнофосфоновой кислоты диметиловый
эфир V 301
Метил-ге-толмлсульфон I 317
I-Метил-З-н-толилтриазен II 293; V 302
( ±)-Метил тр а хил об ан ат V 380
4-А1етил-1,2,4-триазолиндион-3,5 V 302
Мет11Л-а-Т>2,3,4-три-0-ацетилрлюкоза V 492
2-Метил-1,3,4-триаиетоксинафталин IV 150;
V 485
7-Метилтридекан П 318
.Метилтрифснилфосфонийбромид II 277, 293 —
294; III 410
3-Метил-1-(трифторметил)-бутилаМин III 263
Метилтрпцикло-12,1,1,0М]-гексан II 186
5-Метилундекап V 392
6-Метнлурацил И 325; V 385
9-Метнлфенантрен V 138
6-Метил-5(6Н}-фенантридинон V 562
Р-(М-Метил-М-фенИламино)-акролеин V 91
у-Метил-у-феиилбутиролактОн V 262
rf-МетилфенилгиДразин II 294 — 295; IV 216
[i-Метил-0-гЬеиил-а,а'-дициапглутаримид IV
246
ГУ-Метил-М-фенилкарбаминоилхлорид И 173,
295
а-Метил-fl-фен ил коричный альдегид IV 130
а-Метил-0-фенилкоричный спирт IV 130
2-Метил-З-фенилпропионитрил I 320
Метилфенилсульфоксид V 351
Метилфенилсульфон 1 106; II 248
Метилфлорацетофенон II 102
9-М.етилфлуореп II 258
N-Метилфо'рмамид V "05
N-Метилформанилид 11 225
Метилфосфонистой кислоты бис-(диэтил-
амид) V 99
Метилфосфоновой кислоты бнс-(диметил-
амид! V 303
Мстилфосфоновой кислоты дихлорангидрид
II 297; V 303
2-Метилфурац II 297—298; IV 67; V 40
З-Метнлфурап IV 120, 121
З-Метилфуран-З-карбоновая кислота, см,
З-Метнлпирослпаевая кислота
З-Метилфурфурнлдпмети ламин II 297; IV 67
З-Метилфурфурод III 27
677
4-Метилхннолины И 2/S
N-Метилхииолои-2 1 342
Mei ил-Р-хлор;|цетилкегоп II 267
Метил хлористый II 298
3-Метил-4-хлормстилнзоксазол И 298 — 299
Метилхлорсулнфит II 299 — 300
Н-1М.етил-2-хлорэтил)-бе!13ол I 1Н
Метилхолавтреи I 379; III 217, 218
л-комплексы III 101. 391
13- и 16-Метилхолантрены V 413
3-Метил холестан II 138. 159
б-Метилхолсстанс) ч-6р I 1-31
З-Метнлхолестенон-З V 556
2-Метилхромен-3 V 347
2-Метил хром он 1} 59
Р-Метнл-Ь-целлобио.зпд 11 233
Мстилцсллосольв I 420; IV 62
ЭТЦ-З-МстилНиклобутавоЛ I 279
2-Мстпли.11Клобутан;щ I _27!1
I -Метил цикл обуген 11 335
1-Метил-Д1,3-циклогекс.адион II 186
Метнлциклогнксан 1 292; 11 94, 144, 330;
III 154, 368
2--Мстилциклогександноц-1,3 1 181; II 268,
269, 280; III 103, 129, 434. 453
о-Мстилииклогсксанднон-1,3 III 85
1 -Метил циклогексан карбоновая кислот а II
330
I-Метилциклогексанол 1 283, 32-5
2-Метцлциклогексанол I 279; II 162, 330
376, 434; IV 178; V 102
){нс-2-Метилцнклогексанол I 267, 279
1 - Метил никл отеке анол II 222
З-Мстилциклогексанон I 26b; II 78. 162.
269, 376, 434; III 127, Г28. 292; IV 178; V
310, 328
<Л/-3-Мет1'1лциклогексапон II 119; V И!)
4-Метилцпклогс1<еано)1 II 223
1 -Метилциклогексен I 82, 213, 264, 266, 283,
325; И 143, 144; III 336
окись V 102
3-Метил циклогексен И 143, 144
4-Метил циклогексен II 143, 144
2-Метил-4а-цпклогексенои II 203
6-Метил-Д “-циклогексеном III 103
Метили икл о гекс ил кетон V 298
цнс-З-Мстилцнклогексилтиол III 33,6
ш.данс-Э-Метилцнклогексплтиол I f I 336
/(/<с-2-Метплциклогепта1-1ол _1 279
2-Мстилциклогептаион I 2,9
I •Метил-Аб;’--',-’-циклос>кт,'1тетраен I 156
I-Метилциклоневтанол I 326
цг','с-2'М.етилцикло11сптанол I 267
2-Метилциклопентанон 1 266
1 -Метнлцпклопеитен I 264. 325; 11! 336
З'-Метил-1.2-цпклог1ентсифеиаитрен Ш 243
цнс-2-МетилцИ1кТопр[|т11ЛТнол 111 336
^ракс-2-Мет11Лцпклопентил1 иол 111 336
Метилцпклопроиан I 2G2; HI 358
1-Метилниклокройанол 111 289
МстилциклоцроПанон V 94
1 -Метилциклопроиеп 1 63
Метнлциилонропплкетон 11 300—301; III 426
оксим III 441
Метилэщ'рнаТ I 423 — 424
Р-Метилбнантовая кислота I 236
«шор-бутиловый эфир II 244
бп-Метил-б. 19-эндоксохолестац I 134
Метил-ц(и Р) -D-эригропент апирацозиду ло-
зы-3 V 131 — 132
1р-Мсгнлзст]->еИ1;ето11-3 1 432
I -Мт нл-6-эти лазониабнци к тн>-[4.1. (1’[-геп-
тана перхлорат I 246
2-Метил-2--,Тилд11сн<С1:гЛац-1.3 II 30 1
Метил-4 j б-О-этилндсн- Р- D-Глюконпрано-
?ид V 478
.Метил эти л Кст он I 287, 288, 292; II 1()1а, 1г,5,
212, З'Ч, 410; 111 154. ‘293
фенилгидразон IV 255, □5ls
Метилэтилсульфид I 139
1 -Метцл-2-.этил-Д1 -тстрагидропириднний-
церхлорат I 246
2-Ме гцл-3-этн в ил циклогексен-2-он-1 I Й0
1.2,3-МетннциклоГептан П 284
МетноиПновые (Теитиды I 1 10; II 61; V 27, 40
Метоксиадпнинонэя кислота 1 23
амид 1 23
1 бя-Метокс|1ампно-20-кетогтре!'пань1 II 275
.Мстокспацстплеи II 301—302: V 304
3-Метокс и-6-ацетил фенол II 2 10
и; донс-1-Метокси-2-ацетокси мер ку рцнклогек-
сан HI 183
«-Метокси ацетофенон V 39
ю-Метоксиацетофеиоц I 236
r-Метоксибензальдегнд И 10
л-Me го к с ибо и зал к де гид I 337; III 52
Л-МетонсибензиЛснмий спирт Ц 302
л-МетсЖснбснзил хлористый [I 302 — 303, 412
н-Метркснбензилциавид II 411, -112
лг-Метоксибеваойнзя кислота II 248
ц-Мстокснбепзойвая кислота II 248; Щ
141, 142
л-Метокси бензонитрил I 217
1 -.М.стокспбенз-[(?.|-феп антрсн I 137
1-Метокспбутадиеи IV 200
4'Метокс11бутанои-2 II 272; IV 211
1-Метоксибутеи-1-ин-3 I 253; II 303
2-Метокс и-о-/?1рс/»-бутилбепзофеио1-1 I 50
1-Метоксивиннлбензоат см. Бензойной кис-
лоты 1 -метокенвинилоиып эфир
5-Мотокснп1Дрнндон V 508
Мэтоксигидрохинои V 351
4-Метокси-5,6-дн гцдро-2 Н-пираи V 305
I -Меткси-/, Ю<г-диметил-7-кето-5.6, 8,9, 10,
Юа, 1 1, 12-октагидрохризеи IV 249
о-Метокспдифениловый эфир II 236
З-Ме го ксиин данон-1 III 134
сэтс-7-(Метокси карбон ил амино)- иорборпен-2
IV 10
1 -Метокси-8-кето- Юа-метил-5.7,8.9,10,10 а, 11,
12-октагидрохрвзсиа этилен кеталь IV
2 56
ЗР-Метокси-3«-ji аностан II 185
Метокси магний метклкарбонат II 303 — 307;
V 305
3-Метокси-2-метил анилин II 81
О-Метокси-Ю-метилантрацеп V 283
2-Метокси-З-метил-1,4-бензохинон II 81
I-Метокси-З-мети л -1,2-Дн гидропир ан II 274
Meiоксиметилептрифепилфоефоран II 307 —
308; V 3(15, 38'2
Метоксимет илопхолестаноп V 96
Метоксиметиллитий 11 255
М.етокспметилмагнН((Хлорид II 255
Мет окси-О-мотнл в орбелл адина трифтор аце-
тат V 203
1 -Метокси -4-ме'( илпевтатриеп -1,2,3 V 25
4-Метокси-'2-метНлппроц-3 V 288
о-Мстокси-! -метилтетрадой-2 II 267
2-Метоксиметнлггииран 11 100
1-Метокси-11-мстилтрндекан III 145
Метокс и метил трифеиилфоссЬонийхл ори д 1Г
2-Метоксииафталйн (Р-нафтола метиловый
эфнр) II 313. 341
З-Р-6'-Метокси и афт и л цн к л онентан- 1-оп-2-
уксусная кис,лота III 134
6-Метокси-1-иафтониая кислота I 129
6-Метокси-«-нафтол V 256, -132
4-МеТоКсн-1.2-пафтохвнон TI 373
6-Метокед-1,2-ц афтохиноп Н 8
2-Мегок.сн-1.3-нафчохинон. II 341, 373
4'А1етокси(1прид|1Нг( N-окись III 408
4-Метоксирсзорнпн I [ ,'}5(1
б-Мс (окон ret рал он -1 V 104
6-Mci <н<сптс1 ралоп V 256
678
7-Метокситетралои-1 II 269, 370; V [94
З-Метокситетралои-? I! 307; IV 2 19
З-Метокси-2-тетр ал он-3-карбоновая кислота
II 305
н-Метокситолуол V 3*17
п-Метокспфсназни I 129
1 - (4-Мето ксифеп;1л)-2-а мн нобутан Ill 43
о-йетоксифежкпачетоп И ] 0, 372
1,4 - б ис-(п - Мето к с ифе и) i л) - 2,3 - д 11 фе н и л л афт а -
лiii[ 11 303
2,7>-бас-(д--Метокснфенил)-3,4-днфеннлцикло-
пептадиенон II 308
Мето кснфен ил пропены III 286
З-лыМетоксифенилпротюковая кислота HI
134; V 308
8-Метсжсихинолин I 129
30-Метокси-5«-холестан V .347
63-Ме,гокси-Д'1-.холесте11О11-3 11 239
Метоксициклогексан II 187’
З-Мстокси-1,2-эпоксипроПаи Ii 100
2-Метоксиэтзнол I 119. 120; И! 135
а-Метокси этил пдс и три фенилфосфоран II 30S
Ми коз а ми и IV 159
1>Миндальиая кислота III 169
( ; )-Миндальная кислота III 169
Миндальная кислота
;|итрил II 371
этиловый эфир III 332
Миоинозит V 156
Миристиновая кислота II 319
л'лорапгиДрид I 91
Миристоила перекись I 91
3-.Мир цен [I 37
Митомицин II 82; V 2’25
.Михеля реакция IV 243
Молекулярное вращение 1 320
Молекулярные сита I 196, 376; И 309 — 311,
159; V 146, 306
Молибдена гексаклрбонпл V 307
Молочной кислоты этиловый эфир Н 89; 111
332
Монобромпентатри;рнт I 128
Мопоиадмаленнонаи кислота Н 311—312
Мононадугольнои кислоты треш-бутплизо-
пропиловый эфир V 3()7
Монопадфталеная кислота II 312 — 318; V 518
Моноиадянтарная Кислота Н 313 — 314
и-Моностеарнн I 119, 120
Монохлормочении a 11 324, 42,3
Моиоэтилампнбораи I 33
Мориц 1 41
Морфин IV 57, 38
Морфолин I 88, 421; Л 141, U3, 314 — 316;
III 260; IV 98, 99
и-^'-МорфолинизомаслЯиои кислоты нитрил
И 315
З-М-Морфолин-тиетанона 1,1 -Дпокнсь II 62
Мочевина | 133; И 261; 316 — 327; III 317;
IV 245, 257; V 308. 371
соединения включении 11 316—321
Мочевины производные II 133
цис, цис-Мукодипитрил III 238
Мукохлориая кислота И 227
Муравьиная кислота I 140, 397. 398; II 314,
327 —331; III 274; V 7, 147, 187, 192, 368,
482, 517
гндразиД II 334. 335
МетилоиыО эфир (метплформн ат) II 121;
III 154; V 183
натриевая соль V 84, 480
п-ннтрофеннловый эфир II 331
триметиламмонистая соль II ,331—332
фтора и гидрид 5' 48'2
хлорангидрид II 121
З-хлорэгиловып эфир V 186
этиловый эфир II 332 —335, 305; III
154; V 67, 310
Муравьиная кислота — формамид II 331
МурамиИовая Кислота I 85
-Муснои V 12-13
Мускопирндин V 12
Мышьяковистый ангидрид I 16
Надбензоин а я кислота II 336—342; III 58,
61, 248, 249
/л/;сги-буТ)'ЛОвЫя эфир II 342—346; V 311
Натриевая соль 11 256
Пэдлаурицовая кислота V 311
Иадмуравьиная кислота II 346; III 24, См.
также Перекись водорода в кислой среде
Надуксусная кислот;; (см. также Перекись
водорода в кислой среде) 11 53, 54, 346,
•134
безводная II 346 — 351
продажная 40%-цая II 351—353
Надфталевая кислота (моно) см. Мопоиадфта-
левая кислота
Надянтарная кислота (моно)см. Мононадян-
тарная кислота
Найлон I 18с
Натрий I 108—110; II 354 — 355; V 639
диспергированный II 354
па окиси алюминия II 355
суспензия II 354
Натрий — аммиак II 355; V 71, 197, 294,
314, 517
Натрий — аммиак — этанол 1 123, 124; И
356
Натрий — /ире/п-бутаиол — тетрагндрофу-
ран см. Литий — игрт-бутаноя—-тетраш;д-
рофурая И 356; V 315
Натрий-калиевый сплав 11 356 — 357
Натриймалоновый эфир V 442
Натрий - нафталин II Зв7 —359; V 316
Натрпйтетракарбонилкобальт 11 359
Натрия азид II 369—362; III 383; IV 9; V 43,
2 11, 232, 316
Натрия алюмогидрид [[ 362;
Натрия алктоогидрищогл>(2-метокеиэтилат)
V 317
Натрия алюмохлорид II 363 —ЗС;5, 42 9, 430;
V 318
Натрия амальгама (разбавленная) 11 366 —
379; V 318
Натрия амальгама, 40% натрия, жидкая
II 370 — 371
Натрия шргг/ыацтлаа' см. 2-Лктилбутилат-2
нагрия II 371
Натрия бикарбонат У 115, 483, 527
Натрия бпеульйшт 11 45, 371 — 374, -133;
IV 70; V 915, 319
Натопи бпхромаг, дпгидрат 1 320; И 374 —
38'1, 427; III 1 ОС,. 107; IV 17.7. 178
Натрия боргпдрид I /3, 238—2(><), 265; 11
238. 381—383; IV 191); V 15 10], 229, 319,
369, 37/, 392, 471
Натрия боргпдрид — алюминия хлорид 11
385, 386
Натрия боргпдрид — палладий на угле 11
Натрия боргнлрнл. стабилизированный вод-
ный раствор II 381
Натрия боргпдрид — бора трнфторид И
386,387
Натрия бромат (пли йодат) II 388—389
Натрия лш'.мутат 11 389 — 391
Натрия вольфрамат III 81, 82
Натрия гидразид II 391—392
Плгрия гидрид I 323, 324, 434. 437; II 31
76, 273, 33'2, 392 — 401; 1V 167; V 57, 14-1
194. 293, 320, 349, ЗЮ, 546
Натрия гидрокенламнидисульфонат I 215;
Н 81, 2/4; V 225
Натрия гидросульфит I 206; II 401 —403
431; IV 62
679
Натрия гипобромит 11 403 — 405; V 49, 322
Натрия гипофосфит И 405; III 161
Натрия гипохлорит, раствор I 219 405;
II 53, 406 — 409; IV 123, 121
14 а то л я дисульфид (или полисульфид), раст-
вор II 409—4 10
Натрия дитионит см. Натрия гидросульфит
Натрия Дифенилфосфид V 37
Натрия иодид I 320, 370; II 410 — 414; V 124,
323
Натрия и свинца силан V 324
Натрии карбонат V 50, 189, 526
Натрня метабисульфит II 415
Натрии нитрат I 320
Натрия нитрит I 320; II 415 — 421
Натрия /г-питрофеполят V 479
Натрия перборат II 313, 421
Натрия персульфат IJ 421
Натрия сульфат безводный II 422
Натрия сульфид II 422 — 423
Натрия сульфит V 325
Натрия теллурид V 326
Натрия тиосульфат II 423
Натрия трцтиокарбоиат V 396
Натрия фосфат одпозамещекиый I 124
Натрия фторид 1 18; II 107, 262, 423
Натрия хлорат II 424, 425
Натрия хлорпалладинат V 174
Натрия хромат безводный II 425, 426
Натрия цианат II 426; V 326
Натрня цианид I 207, 320; IV 70; V 190, 435
Натрия цианид — Диметилсульфоксид V 326
Нафтазарин I 119; II 363, 364; ill 284
1,8-Нафталан II 76
Нафталин I 282, 407, 408; II 141, 142, 156,
238; HI 62, 101, 282, 308, 310, 314; IV 68,
117, 133, 179; V 81, 124, 219, 242, 244, 295
Нлфта тин-1,8-диаЛьДеГиДа гидрат Ill 10
Нафталин-1,5-дикарбоновая кислота I 124
Нафталин-1,6-дикарбоцоваи кислота II 105
Нафталин-2,3-дикарбоновая кислота II 376,
3/7, 427
Нафталин-2,б-дикарбоноиая кислота II 427
Нафталин-1,2-Дикарбововой кислоты диме-
тиловый эфир [ 418, 419
Нафталин-1,5-дисульфохлорид IV 204
Нафталин-1,5-дитиол IV 204
Нафталин-13-сульфо кислота II 427, 428
натриевая соль I 64, 354
(3-Нафталин сульфохлор ид I 334
Нафталин-2-тиол V 146
Нафталины р-за мешенные V 82
1-Нафтальдегид 1 192, 407; II 465; III 52
2-Нафтальдегид III 31; IV 120
Нафтацен-9,10,11,1 S-дихинон II 428—430
Нафтаценхинои II 401
Р-НафтиЛамин 111 144, 192
tt-Нафтиламина хлоргидрат V 473
2, б-Нафтилен дибензолсульфамид III 203
ci-Нафтилизотиоцианат II 430
Ц-Нафтил изоцианат II 430
о-(Р-Нафтнлметил)-бензойная кислота IV
224
N-P-Нафтилпиперидин I 64
В-Нафтилмеркурхлорид III 191
а-Нафтилтриметилеммонийбромид 1 139
1 -Нафтилуксусиой кислоты этиловый эфир
V 93
Нафт пл уретаны II 431
ин-Нафтиндазол-4,9-хинон II 401
1,5- Нафтиридин V 403
1,7- Нафтиридин V 403
1,4- НаФтогидрохинои 1 251; II 430; V 389
о-(|3-Нафтоил)-бснзойнал кислота IV 224
1,8- Нафтоилнафталин V 234
Р-Нафтоилпропиононая кислота IV 203
а-Нафтойная кислота 1 234, 271
этиловый эфир I 235
fl-Нафтойная кислота I 220; II 405; III 144
хлорангидрид IV 120
1.2-Нафтойный ангидрид II 430, 431; III 257
1,8- Нафтойиый ангидрид II 427, 43 1
ci-Нафтол I 109, 120; II 341, 342; III 168,
433; IV 177, 234; V 88
P-Нафтол II 352, 431, 433, 434, 451; 111 35;
V 262
Метиловый эфир III 313, 341
1-Нафтонитрил I 346; III Ill
р-Нафтонитрил III 31
Нафтостирил IV 266
1,12-Нафтохипон I 27; II 8, 340, 341, 431,
432; 111 20; V 485
1,4-НафтохицОп I 2/, 85, 114, 251, 255, 364,
387; 11 407, 420, 432,433; Ill 20, 62; IV 179;
V 219, 389, 485
2.6-Нафтохцн он дибеи зол сульфимид III 203
1,2- Нафтохицон-4-сульфокислоты аммоние-
вая и калиевая соли 1[ 433, 434; III 20
1,4-Наф гохийон-2 -сульфокислоты, калие-
вая соль II 373
Нафто-Ы-цнклобутен (новое название 2,3-
Диметиленнафталин) III 63
Небуларин V 337
Незукон V 388
Неоабиетиновая кислота V 26, 122
Неогексан III 151
Нсопентплгалогениды I 320; III 413, 416, 417
Неопентил йодистый III 416. 417
Неопентиловый спирт III 59, 413; IV 167
Неопентил хлористый I 320; 111 154, 413
Неоиснтилциацат IV 167
Неофплгалогениды I 320
Неиетовые кислоты V 319
Непетоиовая кислота III 204
Нерол V 266
Неролидол II 301
HGH-Гормон роста человека (гипофизарный)
I 140
Иикель-алюминиевый сплав (1:1, сплав Ре-
нея) Н 434, 435; V 38, 71, 169, 327, 328
Никеля борид II 435, 436; V 328
Никеля карбонил I 73; II 436—439
Никеля перекись II 225, 439,440; V 331
Никеля сульфат V 332
Никеля хлорида гексагидрат V 448
Никеля (II) 2-этиЛкапронат III 166
Никотин I 29; II 106
Никотинамид II 66, 403. 404; IV 99
1-окись III 66; IV 105
Никотиновая кислота I 29, 355; III 38, 170;
IV 79
ангидрид IV 80
нитрил II 66; IV 99
Нингидрин I 336, 337; П 278, 393, 440, 441;
111 80, 128; V 112
Нипекотриповая кислота III 170
Нистатин IV 159
Нитрамины III 442
Нитрил иодистый II 441; V 333
Нитрилов окиси III 390
Нитрил хлористый II 441, 442; V 333
4'-НитроазобенЗол-4-Карбоновой кислоты
ХлОрангидрид II 442, 443
1-Ннтроазулен II 232; III 308
Нитроаминогуанидин 11 445
2-Нитро-4-аминонафтол-1 Ill 26
4-Нптро-2-аминопириДин III 64
п-Нитро ан и зо л 141 386
о-НитроанИлмн II 58, 361, 406, 407, 465, 466‘
IV 38, 40, 225
ЛгНвтроанилии III 352, 353
п-Нитроанилин I 72; Ц 40; III 64, 142; V 371
о-Нитроацетзнилид IV 40
п-Нитроацетанилнд 11 448
о-Нятропцетофеноц II 208
Нитробарбитуровая кислота Ill 24
680
лгНитробензальдегид HI 26, 109; IV 15
о-Нгиробепзальдегид Н 3; HI ^53
л-Нигробензальдсгид 1 З'-’S; 11 13,3; III 52
л-Нтробензальдиацетат IV 182
гг-Нитробенэилаиетат of- V«cycH0S кигслоты
л-иптробензиловый эфир
П-Нитрэбензил бромистый (хлористый) II
443, 444; III 354, 455; 1V 17
n-Нитробензи.иовЫй спирт 1 328; 11 183
л-Нитробензоил хлористЬ1н I 354; II 444,
462: IV 104
дыНитробензойцая кислота
азид II 360
хлорангиДриД П 360
л-Нитробензойцая кислота I 344, 354; II
248, 375. 376; III 142; IV 104
этиловый эфир III 130
Нитробензол I 24, 294, 326, 344; 111 79, 276,
423; IV 225; V 333
восстановление I 36; III 197; IV 221
растворитель в реакции Фриделя —
Крафтса I 42, 43
п- Нитробензолдиазония борф'торид II 242
лнНитробензолсульфокислота V 402
N- п-Нитробензол сульфоксиуретан II 444,
445; V 334
Л<-Нитробеизолсульфоцила перекись V 334
лг-Нитробензолсульфохлорид II 45; V 334
п-Нитробензолсульфохлорид II 444
о-Нитробензонитрил I 203
п-Нитробензонитрил III 422
1-Нитробутан II 96, 304
2-Нитробутан II 348
треш-Нитробутан I 271
1-Нитробутанол-2 II 66
2-Нитробутанол-1 V 482
3-Нитробутанон-2 II 442
а-Нитро-н-бутил малоновей кислоты диэти-
ловый эфир Ш 143
П-Ннтрогидроиоричиая кислота II 63
Нитрогуанидин II 445; IV 216
1-Нитрогуанил'3,5-диметилпиразол II 445
2-Нитродифенпл I 255; III 467
3-Нитродифенил III 352, 353
2'-Нитродифецил-2-карбоновая кислота I 17
4'-Нитродифспил-2-карбоновая кислота I 17
д-Нитродифеннловый эфир II 236
6-Нитро-2,3-Дифеннлхиноксалин II 408
Нитрозпл бромистый I 72
Нитрозилсерная Кислота II 445, 446; V 334
Нитрозпл фтористый II 447; V 335
Нитрозпл хлористый I 72, 176, 177; И 447 —
456; V 242, 335
N-Нитрозоазетидин II 462
л-Ннтрозоацетанилид II 448
N-Нитрозо-N-ацетилглицина этиловый эфир
I 249, 250
N-Нитрозо-N-бензил-л-толуолсульфамид IV
36
Нитрозобензол III 467
N-Нптрозодибензиламин И 403
п-Нитрозо-N, М-днметилаиилиИ I 366, 3G7;
II 456-458; 111 113: IV 66, 67
Ы-Нитрозо-транс-а.З-дпметилэтиленлмин 11
448
2-Нптрозодифенил HI 467
М-Нитрозодифеппламин II 448
Нитрозокамфора II 418
N-Нитрозолактамы П 448
N-Нитрозо-N-метил анилин И 294; IV 216
N-Нитрозометилмочевина 1 244; Ц 458
Нитрозометил уретан I 243
)-Нитрозо-2-вафтол II 433
Н|Г1розония борфторпд I 7s; II 4,58
Нптрозоиия гекс афт прфосфят li 4о8, 459
3-Н)1трозо-2-от.сазс,лидоны И 418
5-Нитрозо-2-оксИ ^-амииопирлмидин III 65
5-Нитрозопиримидины HI 65
Нитрозопропиофенон II 418
Нитрозосоединения 11 84
Нитрозохлориды II 449--453
N-Нитрозоэтиленимив И 448
5-Нитроиндазол II 419
7- Нитроиндол II 305, 306
2-карбоновая кислота 1 305. 306
о-Нитроиодбензол II 236
2а-Нитро 3 кетостероиды II 16
413-Нитро-3-кетостероиды II 16
КЗ-Нитро-17-кетостероиды II 16
2а-Нитро-Д4-3-кетсстероиды II 16
-и-Нитрокоричиая кислота II 236; IV 15, 121
Ннтромалоновой Кислоты диэтиловый эфир
III 423
а-Нитромасляной кислоты этиловый эфир
I 321
Нитрометан 1 76 289, 294, 306; II 66, 310,
417, 469-462. 463; III 154, 279; IV 246,
267; V 336
Зу-Нитро-ф-метилвалеронитрил II 67
2- Нитро-2-метилпропандиол-1,3 V 482
2 Нитро-2-метилпропапол-1 V 482
[-(Нитрометил)-циклогексанон III 158, 169
2-Нитро-4-метокси ацетанилид 11 131
N- Нитроморфолин I 88; 11 315
Нитромочевина 11 119
п-Нитронадбензойная кислота II 462
а-Нитронафталин I 217; V 506
4-Нитро-1-иафтиламии I 217; II 417
п-Нитронитрозобепзол II 442
З-Нитро-Н-нитрозокарбазол И 462, 463
З-Нитро-4-иитрозотолуол I 31
Нитрония борфторид II 463, 464; III 303;
V 336
Нитроновые кислоты
калиевые соли II 95
эфиры III 460
Нитроны 11 457; III 113
5-Нитро-2-окси-4-аминопиримидин Ш 65
2-Нитро-З-оксшшдсн II 460, 461
1-Нитрооктадецен -I I 19
1-Нитрооктан 111 271
{ —)-2-НитроСКтан II И
З-Нитроперхлорилбеизол Ш 92
4-Нитро-З-пиколина I-окись IV 113
4-Нитропиридииа 1-окись III 408; IV 35, 113
5-Нитро пиримидины III Go
1-Нитропропап II 304, 464
2-Нитропропан II 304; III 392; IV 247; V 353
патрлевая соль оци-формы II 464, 465
5-Нитросалициловая кислота III 116
б-Нитросалициловый альдегид IV 135
Иитростирилтрополон I 205
41-Нптростирол 111 109; IV 121
f> Нитростирол I 255; II 459
Нитротирозин 111 308
5-Нитро-с-толунитрил II 463, 464
о-Нитротолуол II 105; IV 203
n-Нитротолуол II 105, 348, 375, 376, 410;
IV 182
2- Нитро-2,2,4-трпметилпснтан II 96
5-Нитро-3.4,5-трпмстс1Ксибензиловый спирт
II 398, 399
2-Нитро-3,4.5-трнметоксибензойной кислоты
метиловый эфир II 232
Нитроуксусиая кислота II 304
о- (и л-)-ПнтрофенилазиД II 361; III 100
5- НитрГ)-2 .феи илбеи вотри азол II 408
1-(о-Нптрофенил)-бутадиен-1,3 II 46,5, 466
м-Нитрофеи пл-N, N-ди метилтри азин Ш 352,
353
Нптрофенплдихлорфосфат II 466, 467
5- Нитро-2-феиилизатогсн I 19
п- Нптрофенилпзоциаиат IV 78
/I-Нитрофснилппдавол V 364
д-Нитрофен11ЛМстилсульф||д II 109
лг-Нитрофенилмочевина II 361
681
п-НптроФенилмытьяковая кислота II 243
2-Ин гро-З-фсиилнорборнеп HI 97
о-МичрофеипЛсульфенхлорнд И 467, 468
/I-Нитрофенилукстсной кислоты этиловый
эфир V 503
'З-Нцтрофенплфепнлсульфид III 467
трис- (п- Нитрофен пл)-фосфат V 337
б;/С-(г;-Нитрофснил)-фосфат кислый V 337
З'-О-к-Нитрофен оксикарбон идти мидии V
526
п-Нитрофенол I 409, 424; Il 256, 33], 468-
III 386; IV 132; V 155, 337
Нитроф'еноды III /9
2-Нптрофлуорен 1 204. 203; IV 221
З-Нитрофталевая кислота I 20G; III 180;
J V 12
2-Нмтро-э-фтор-З-фенилнорборпеи 111 9/
2-Нитрофурап 11 215
2'-Нптрохалкон Ш 467, 468
6-Нитрохпнолпн 1V 81; V 50G
1 - Нитро-2-хлоралкацы И 442
о-Г1итрохлорбснзол II 235
и-Ннтрохлорбензол П 108; III 69
'2-Нитро-6-хлорбепзоиитрил II 12
6Р-Нитрохолестандиол-3|3, Гт-З-ацетат 1 18
6а-Нитрохолестанилацетат И 387
2- Нн'1 ро-Д 2-.холестен V 335
6-Ннтрохрлестерилацстат I! 387, 450; IV
2’6; V 531
1 Ьироциклобутан 11 96
’2-Нитроциклогександкол-1,3 II 46(1, 4oi
1-Нитропиклооктен-1 I 19; V И
Нитроэтан И 10, 304
2-Нитроэтанол II 460
к,нс, инс-\0, 13-Ноиадекадненднол-1,2 V 333
Honадиен-1,2 II 283
Нонсн-4 III 61
Vlc>Hiiu-3 I 59; II 317
Нопвной V [39
Hi- Нсф-Ду’-андростадиепол-КР-ои-З 111 121
10-Нор-Д‘’(1°)-андросте1!О,г1-1 НЗ-оп-З III 121
Порбиксина диэтилоеый эфир II 116
Норборнаднен I 196; П 6, 343, 449, Ф53' 111
173; V 240
димеры II 6; V 240
Норборнадпеи + циклопентадиен III 268
Порборпадиеп-2,3-дикарбоновая кислота
V 214
7-Норборнаднснилацетат 11 345
7-НорборнаДиеиол 11 343; I7 264
экзо- Но рбори аи- 2-карбон сизая кислота II 437,
438; III 233
амид IV 73, 74
этиловый эфир II 437, 438
энЗо-Норбор[|аи-2-карбоцовая кислота III
233
(-)’экзо-Норборн анол HI 414
(|-}-.энйб-Норборнацол III 414
экэо-2-Норборцацои II 468, 469
Норбориен I 11, 213, 417, 418; 11 437, 438,
449, 469 — 470; III 183, 268, 288; IV 10, 73,
71, 126; V 188, 214, 370
эндо-Норборнен-/(Ю-3,6-ди карбоновая кис-
лота III 130
днейдрид III 448
Норбориенкарбоновая кислота V 2’4
Норборисиопа производные V 545
Норбпрнеол-d Ill 198
эюо-Норбориеол V 370
зкзя-2-Норборнеол И 468, 469
эюо-Норборнпламин I 213; II 469; IV 126
эют1-Норборн плаце! ат III 233
(-*-)-.экз(>-Норб0риилбромцд IU 4]4
экзо-Норборнилукеусиая кислота I 418
экзо - Н орбор 11 илфор.м и ат 11 '16 8
экзо- НорбориилметилКстон I II
D, L-Норпалин II 304
А-Нор- В-гомо-5-кстохолестаи II 113
Норкамфора-rf 111 198
Норкарап I 257, 428. 437; II 47, 255: III 28В
1'|-11ор-ЛД1’9-3-ке,10СТсро1*ды V 353
I 9-Нор-А4,-З-кетостеронды 355
Нор коп рост ацдиоиа-3,6, 3,6-бкс-этилен тио-
кеталь IV 261, 26'2
А-Норкортнзол III 43, 44
1 9-Норпрогестерон IV 273
D-Hopiipo; eciepoii IV 124
За, 22 (Z-c-Норспиростаи-ЗР-од-11а-аль-3-аце-
тат И 251
19-Норстероиды I 108. 406; V 341
О-Норстероиды I 1о9; IV 124
19-Нортсстостерои JI 230; II] [95
19-Нортеетостер(1на енолднацетат V 334
НортриНикланол II 195; 1V 176
Нортри циклан он 111 26.7; IV 176
НортрндиКлилииетат II 453
3- Нортрициклилбромид I И 265
Нортропнн II 106
Д2'--Норхолеи-24 V 381
ЗР-А-Норхолесэанон-З I 115
Норцсдрсвдмкарбоповой кислоты мономети-
лог.ый эфир III 231
18-Норэстронметиловый эфир III 118, Г19
Нуклеозиды I 35/, 363, 421; II 247; V 337,
463, 525
Нуклеозиды, нуклеотиды 1 357, 421, 427;
И 247, 467; IV 192, 252, 272
Нуклеозиды, производные I 381; IV 21; V
463
Озон III 5—10
Озониды И 384
определение Ill 409, 410
Озониронаине III 5—10, 316, 317
Окиси мезитила этйлевкеталь III 10, 11
Окислительное растепление кетонов II 404
Окись мезитила I 220, 299; II 36. 64; III 59,
216, 291; IV 230, 243
1-Окш.ь I-феннл-З-мстилфосфолена-З I 392;
Ш 11; V 339
Окись этилена 1 129; II 139; 11] 11, 12,
463; V 339
1-Окись 1-этил-З-метил-фосфолена-З Ш 11,
12
Оксаадамантаны 111 39
1.3,4-Оксадпазолы III 280
2-Окса-7,7-дихлорпс>ркаран I 274; II 257;
Ш 448; IV 122
Оксазирапы (птонитроны) II 348; V 518—319
Оксазолпдины IV 263
Оксазолидоны II 448
Оксазолы V 504
Оксалилбромид 111 12, 13
Оксалилуксусцов кислоты диэтиловый эфир
1 35; II 350
а-Океалил-у-фснплмасляной кислоты днэти-
лоный эфир II 428; IV 240, 24|
Оксалплхлорнд 1 47, 48. 354; III 13—19;
V 340
Оксалилянтарпой кислоты трнэтиловып
эфир И) 98, 99; IV 240
Оксантронанет ат (10-ацетокси-9-антрон) 111
217, 219
Оксастеронды 1 26I
Океании I 241
I-Окспадамавтап I 9
4-Оксиадамантанон V 394
с-Оксиадинпнодыг! альдегид II 29 L 292
4-оксн-4-аза-Д’-холестсноп-3 I 42/
1-О|<си-2-амН1Потетр длины 1 140
1 ct-0i<cn-5ct-андростан дпод-З,17 I 432
Ю-Окси-Афандростацдиоцы-,3.17 I 432
36-Окси-Д5-аидростепон-17 1 432
ир-Оксп-А’-ЗР-андростеноп-З V 452
682
170-Окси-Д1 -ба-андростеноп-З-ацетат V 172
1-Окейэнтрахи еюн I 119
2-Окспантрахпнон 1 118, 119
]7(£-Окен-21 -аиетокси-Л'1,9 ('^-премадиенди-
о и-3.20 Н 999
1о-Окгн-Д5-3-;щетокеистероиДЫ I 433
о-Окснацетофенонбеи аоат III 109
Ег-Оксибеижътьдсгид 111 273; IV 137
4-Оксш5епзЕ1НтроН II 364
^'-Окспбепзонлметплпнридинлй бромистый
II 240
н-Оксибеизопнон кислоты этиловый эфир III
293
и-Оксибензофеион I 50
З-Окси- 1,2-беизохииои II 389
10-Окси-10,9-бороксарофенацтрен V 42
З(3-0кси-3а-бромхолестан II 20!
у-Окспвалернаповый альдегид I 2G;i, 266, 314
Ео-Овснвалериацовый альдегид 1 226, 274
а-Оксиваннлцн II 223
Окснгидролапахол Ill 282
Окснгндрохинона триацетат V' 483
2-О|4Сп-2!-Д1\зовспйймалин-)7-ацетят III 234
30-Оксй-За-дейтер(.1-Д’1-стсрридь1 1 410
За-Окси-m ра нс-дек ал ин -‘2'а- у «су спая кисло-
та I 423
л-ОксидибепзоилмсТан II 11; III ill
I-Okch-7, 1 2-дцГ|;дропл(’Г|ДеиЛ11он-7,1 Й 1 246,
247
Э-Окси-О.Ю-дигидрофепантреи I Об, 57
2-Окси-З, З-дииодбеизойиак кислота II 40
2-Окс.п-3.3''-дни афтилднхиион-1,4,1 ',2' II 8
8-(а-О1<сидпфен плметпл)-1 -нафтойной кис-
лоты б-лактои 1 410, 4 Я
о-Окепдифенил (о-фепилфенол) 111 283
П' Оксидифешил Ю-феиилфенол) 111 283
1а-Оксидициклопеитадиев I 8н
Gfi, 19-ОксидоаиДростаидпоЛ-Зр, 1 / , диаиетат
III 227
6.19-Оксидостероцды III 188
На, 12а-Оксидотараксерол III 66
6,19-Оксидо\олестаж1ла11етат III 188
Окспнзофорон 111 352
2-Оксиизофтолеваи кислота III 202
о-Окениндол II 82
Ю-Океикапрциовая кислота II 384
2-Оксикарбазол III 116, 117
Оксикиротинонды V 293
З-Оксн-З'-кето-сх-кяротип V 331
Окс.пкетостеариновая кислота, 9,10- и 10,9-
II 93
2-Окси-AVJ-3-кетостерон ды I 136
,’а-Океи-Д,1-3-кетостеро|1ДЬ1 I 18G
4-Окси-А4-3-к'етостероиды I 115. !0()
12-Okcii-I 1-кетостероиды 1 186
17а-Оьси-20-кетостеронды И 63. 352
За-Оке и-12-кето-А Ф 9(ч)-холадпеновая кис-
лоте! 1V 217
За-Окси-1 2-ксто-Д 8-Холеновяя кислота IV
217
За-Оксц-12-кето-Д “1111-холен овая кислота
III 251
л-Оксикурнчный спирт 1 39
Оксиксантопы IV 209. 210
6-Окспкумлраиои-З II 128
4-ОкеиКумарин IV 80
Г2-Оксилизоргнновой кислоты амиды П 82
1-(2',5'-Окси - (3 - Р-ликсоф¥ранозкл)-ураЦ!ьт
I 94
Р-Окспмаслянон кислоты метиловый эфир 1
288
2-Окснмеркур-З-нитробев,зонной кислоты ан-
гидрид И1 180
йа-Окси-бр-метпландростандион-3.17 IV 6з
2-Окси-5-мстллЕ|Цетофенон III 342
2-Окси-З-метнлацетофонона 2,4-дннитрофе-
пилгидразои Ш 28
о-бис- (Оксиыетил)-бензол III 19
1 -Оисиметцлбензотриазол II 170
6-Оксп-4-мстплгексэикарбоиовая кислота V
9р-Окси-10[4-метилдекалоп-2 II 269
(),н'-б//с-Оксиметилдифевнл II 75
2-Оксиметилеи-З-кетостероиды I 410; 11 395
2-Окс-ИМетилен-7-метокспТетрало11-1 II 210
Оксиметилепстероиды III 420
2-Оксцметилептестостероц II 395; III 94
й-ОксиметилецхоЛестенон 1I 395
2-С)кенз’етнлепИ11КлогекгацС|П 11 332, 33.3,
393; IV 241
4-Оксймстилим1!д;пол 1V 69
7-Окси-4-метилкумарИ11 II 64
Сшс-( Окси метил )-ма л оиовоп кислоты дмэтп-
ловый эфир IV (">3, 66
б-Оксцмстил-1-метиЛ-2-тиоурацил V 332
«гр|Д>(Окспметил)-1Штромж ан V 482
10-Оксп-1-метил-Д "-октагндрохинолин III
178
3-Окси метилпмрсн II 203
'1-Оксп-6-метнлш(рон-Й V 288
11[4-Окси-11а-метил-5|3-Г1регнаидион-3,20 I
126
11|3-Оксц-12а-метцлпрегпандиои-3,20 I 312
313
5-Окслметнлура1.1лл V 226, 267
М-ОксиметилфтЕннимид III 19
4-О кс и мети лфур фу рол 1 134
2-Окси-3-мсто1<сибеи?.альдес;-(_д III 73
Й-Океп-б-мстоНсилепиднп IV 102. ЮЗ
З-Окси-4-метоксифеи и л е1Ллнине( метиловый
эфир V 22-5
3-Окс1г-4-метоксифенилфорМпат II 350
2-Оксп-7-мсто1<свфлуорен V 34
а-Окснмииокетоны I 140; II 16, 17; 1V 123,
124
Окенмииомалоиовоп кислоты диэтиловый
е.фир III 423
о.-ОкспминоиитрилЬ! I 107
2-Оксиминотетралон-1 I 140
2-Окспмино-5-пиан валериановой кислоты
Этиловый эфир II 290
Окснмочевнна I 215
Оксимы III 1,56
гидролиз 11 99
11 -Окснпафтацеи-Э, 10-хннон 1 120
1 -(2-Оксинафтпл)-ааобензол-«-сульфокисло-
ты натриевая соль II 431
2-Окси-З-нафтойная Кислоте) IV 207
б-ОкскН-иафтойнза кислота I 12 9
2-Окси-1,-1-пафтохинон I 90; II 373; III 20
Оксиидола имггиоэфир III 4G0, 401
Оксиндола эфир енола III 460
ЗР-Окси-17(3-иптро-5Р-андростЕ[И III 304
Э-Окси-5-нитробензплбромид 111 20, 21
Й-ОкСЕ1-5-1!Итрс1бенЗ|;лхлорпд II 256
транс-1 Оксинонен-4 V 70
сан- и йнт/г-Оксииорбориен V 370
GfJ-Окси-Ю-нортестостеропа 17-ацетат V 354
З-ОкСЕтоктанон-2 I 284
12-Оксиолеииоцая кислота (и ангидрид) IV
162, 163
9-Окснпеларгоновая кислота 11 384
5-Оксинергндроазуленон-8 II 114
N-Оксипнперидин III 21
2-Оксипиридин I 85
3-Окснцнридии I 85; 111 21, 22
1Оксипирролизидип III 171
За-Оксипрегнандион-11,20 II! 350
I1а-Оксипрегпандиоп-3,20 I 125
За-Оксиаф-11,12-ирегнанои-20 1 125
I 7г7."Оксп-А',-прсгнен дион-3,20 И 192
1(>а-Окси-А-'-г1реГ1-1ецол-3|3, 3-ацетЕгг IV 170
1га-Оксипрегпенолон I 68
aiie'rEiT IV 88
113-Окснирогс-стерои 1V 169, 170
Окснпролин Ш 150
683
трис-(2-Оксипропил)-амнн IV 254
5-(У-ОксипропнлиДин)- 5Н-дибензо-[а, rf]-10,
11-ди гидроцикл огептен I 315
2-(3-Окси-//-пропил)-пипериДин III 173
а-(3-Окси-ч-пропил)-пиридин III 173
2-Окси-3«-пропдлхиноксалин IV 40,41
В-Оксипропионитрилы 111 393
2-Оксипулегон I 186
Оксираны см. Эпоксиды 1 339, 341
12-Оксистеарииовая кислота II 248
За-Окси-Д4-стероиДы I 410
Зр-Окси-Д’-стероиДЬ! 1 410
ЗР-Окси-ДЬ-етероиДЫ V 345, 520
6J5-Оксистероиды III 188
I lp-Оксистероиды I ИЗ; II 24
16-Оксистероиды V 196
173-Оксистероиды IV 141
N-Оксцсукцинимид 111 22; V 74, 340
трифтор ацет ат V 340
I 1 Р-Окситестос'серон II 221
З-Окситетра гидрофуран III 351
2-Окси-1,1,3,3-тетраметилиндан-2-карбоно-
вая кислота 11 92
Окснтетрациклин 111 365
6(4-Окситигогенин-3-ацстат 11 191
2-Окситиофеи I 237; И 343
4-Окси-3,3'’,4/-триметоксибензофенои III 13/
4-Окси-5, б, 7-триметокси-2-карбэтокснхино-
лин 1 110
Оксг.тоцин IV 266, 268
11-Оксиундекацовая кислота 1 263, 266, 315
N-Оксиуретаи II 444
а-Оксифеиазнн I 129, 316, 317
у-(0-Оксифенил)-масляная кислота II 124
Р-(л-Оксифенил)-этиламин Ill 80
2-/?-Оксифеи илэти л бромид-1 V 20
Р-Оксифосфбцовой кислоты бис-(амиды) V
303
N-Оксифталимид I 85; III 22, 23
6а-Окси-7а-фторэстрадиолдиацетат III 96
4-Оксихинальдин [V 103
8-Окспхинолин I 129
4-ОКСИХЦНОЛОН-2 V 318
цис-1 -Окси-2-хлормеркурнорборнан III 183
1а-Онси-2|3-хлорциклогексан IV 175
4-Окси-Д4-холсстеноп-3 I 115; П 45
6р-Окси-Д4-холестенон-3 IV 181
24-Оксихолестер.чн IV 1 68
23-Оксихолестерин IV 168
2-Окспциклогексанои I 214, 328
транс-2-Оксициклогексансульфин и л анилид
V 285
2-Окси-3-ы-циклогексилпропцл-1,4-цафтохи-
нон I 90
1-Окси-Д2-циклододецен I 277
(Г-Оксициклопентил)-уксусная кислота И
236
трет-бутиловый эфир II 236
11 Р-Окси-5,9-цИКлопрегнандиоц-3,20 1V 169,
3[3-Оксн-5а, 10а-=страны 111 195
1,2-бнс- (о-Оксиэтил)-бензол П 89, 90
4-Окси-4-этнлгексанон-3 II 45
ЗР-Окси-Д1 Мв-этиоаллохоладиеновая кисло-
та IV 20, 21
Оксованадия ацетилацетонат (ванадила аце-
тилацетонат) V 341
NJ- (4-Оксо-1, 3- Диазаспиро- [4, 4]-нонанили-
ден-2)-Ь-орнитин V 544
D-2-Оксо-7,/ -диметил-1-винил бицикл о- [2,2,
lj-гептан V 94
Оксо-реакция 1 286
Октабромфульвален V 279
ДМа 1®а) Окта гидро 3,8а-ди мети л нафто- [2,3-
N-фуран I 278
I, 2, 3, 4, 6, 7, 8,8а-Октагидро-8а-метилнафта-
линдион-1,6 III 103
684
1,2,3,4,5,6,7,8-Оьтагндронафталиц дион-2,7
IV 231
Октагцдрофенантрсн, силя- и асимм- II 110
дне, дис-9,12-ОктаДекадиеналь-1 V 353
Д 8>13-Октадекадинналь, этилен ацеталь II 52
ДМЗ-Октадекадинновая кислота II 52
ОктаДсцеи-1 I 18
/{пс-9-Октадсценилбромид V 259
цнс-Э-Октадеценол V 259
спиро-[2,5ФОктадиеноп-3 V 20
Д’-Окталнлниниловын эфир III 179, 180
Д4(10)-Окталилуксусный альдегид Ill 179,
180
трачс-Д1-Окталин 1 122
Д!(°)-Окталин I 122; II 141 — 144, 4ol; V 410
Д’-ОкталинЧ 122; 11 141 — 144, 158, 159, 450—
452;. Ill 42; V 295, 410
Д’И-Окталин V 410
ДМО-Окталин V 242
Д 9-1-Окталицол III 179, 180
ДЧЮ-Окталон-2 II 238
Д “-траис-Окталон-1 II 192
Д9-Окталон-1 III 179, 180
Окта-О-мезилтрегалоза 11 252
2,2Г,3,3’,4,4',5,5'-Октаметилдифенилметан
III 429
Октаметилнафталии V 137
Октаметил-сия-трицикло- U,2,0,02>61-окта-
диен-3,7 V 23
м-Октан II 169
Октандион-2,4 III 440
Октанол-1 I 76, 263, 329
Октавол-2 1 247, 263; 11 454; III 23, 367
Октаион-2 III 65
Октанон-4 III 375
Октаноц-2-ол-З 1 89
ДМЛ-Октатриеналь I 79; II | [04
Октатриип-2,4,6 II 317, 318
Октеп-1 I 146, 213; II 159, 311, 312, 435; III
119, 196, 367
Октеп-2 II 159
транс-Октен-3 II 144, 145
/{«с-Октеп-4-диин-1,7 I 151
Октен-1-ин-7 II 246
п<рет-Октилазометин I 405
н-Октн ламин I 213
?/?рст-Октиламин I 405; II 96
к-Октил иодистый I 327; II 359
н-Октилмеркаптан 111 466
2-Октилнитрит II 454
ОктиН-3 II 144, 146
Октин-4 I 416
ДЗ-Октинол-2 И 219
2-ОлеилглиНерин I 121
Олеиновая кислота I 60; II 77, 84, 92 319,
320, 384; III 23, 24, 57, 61, 246, 325
дибромид 1 60
метиловый эфир II 54, 320, 321
хлораигидрид III 330
Олеодистеарин, 1- и 2- III 269
Олеум V 85
Олигорибонуклеотиды V 305
Олово III 24 — 26
Олово бромистое III 26
Олово хлористое }П 320; 111 26 — 30, 131
безводное III 31
Олово хлорное пентагидрат III 33
«-Оноцерин V 385
Оппенауэра окисление V 18
Орнитин 11 290: IV 265
Оротидинметиловый эфир II 62, 63
Оротовый альдегид V 385
Ортоацетилирование III 38; IV 145, 146
Ортомуравьиная кислота
триметиловый эфир 1 294
три/зтиловый эфир 1 70, 294, 438; Ц 214,
260, 261; III 33 — 40; IV 74, 256,257
267, 276; V 342
Ортоугольной кислоты тетраэтиловый эфир
1 294; III 40; IV 247
Ор'юфосфорная кислота 1 328; IV 101, 102,
232
Осмия четырехокись (осмиеный ангидрид) 1
142, 256; П 287; III 40—46, 198, 277
Осмия четырехокись — бария хлорат 111
46, 47
Осмия четырехокись — натрия хлорат V 343
Осмия четырехокись — перекись водорода
III 47, 82. 83
Осушители 11 111, 112, 114; III 47
/лрйчс-р-Оцимен И 37
П авин 111 25
Палладиевые катализаторы П1 48 — 53, см.
также Линдлара катализатор
Палладий — бария сульфат IV 66, 120;
Палладий на угле Ш 172
Палладий хлористый I 106; 111 53; IV 06
Палладия(П) ацетат III 53, 54
Палладия гидроокись как катализатор V 347
Пальмитиновая кислота II 77, 78, 248, 319
метиловый эфир I 19
Пальмитинового альдегида димстилацеталь
III 291
Пальмитиновый спирт 1 10
Палюстриновая кислота II 194
Панкреатин II 423
Пантетеин III 339
2',4'-гидрофосфат (кислый) IV 85
Пантотеновая кислота IV 263
Папаверин 11125,179
Парабановая кислота II 261. 325
Паральдегид I 223, 294; III ай, 206, 247, 259;
IV 22; V 478
Параформ I 361; II 269; IV- 65, 66. 71
[2,2]-Парациклофан IV 20
[10]-Параи.иклофа1|-12-альдсГид II -4G3
Парациклофаны V 16
Пеларгоновая кислота И 310, 319
N.N-диметил амид I 146
метиловый 'эфир II 310. 359
Пеларгоновый альдегид II 49
Пенициллин V I 425
Пенициллина соли V 367
Пецицнллоиновая кислота I 425
Пенициллины j 240
Пенообразования уменьшение 1И 23
Пента-О-ацетил-D, L-глюкозы диэтил меркап-
таль Ш 193
Пента-О-ацетил-О-глЮкоцовой кислоты ни-
трил 1 217
2,3,4,0,6-Пеита-О-ацетил-О“Глюкоцовой кис-
лоты хлораигидрид IV 104
Пецта-О-ацетилманнон0вая кислота II 453
амид II 453
Пен та О-ацети л-1-тио-fl-D-глюкоз а III 339
2,3,6,7,9-ПенТаацетоксиантрацен V 182
Пентаацетоксибензол V 132
А1 °>*2. j, 1 5-ПентадекадиИиолид II 228
Пентадиен-1,4 1П 54—56; IV 223
Пентадиеналь II 385
транс-2.4-Пентадиеновой кислоты метило-
вый эфир V 347
Пентаметиланетофеноца оксим 14 265
Пентаметилбензилхлорид V 348
Пентаметилбензол V 348
|3,Р-Пентаметиленглицидной кислоты этило-
вый эфир Г 149
3,3-ПентаметиленДиазириДип I 214
ПентаметилендибромнД I 129; III 102; IV ill
Пентаметилен-К’-Циклогексилоксазиран V
348
Пентан I 232; 111 154, 449.
Пентандиол-1,5 I 10; III 54,55
Пентандиол-2,3 III 425
1,2,4,5,8-Пентаокснантрахинон I 120
2,3,5,6,8-Пентаокси-1,4-нафтохинон V 63
З.Г)п7,Э',4'-Пентаоксифлавс1Н (морин) I 41
Пентафторазапропе]4 И 122
Пснгахлорбензойная кислота I 271
Пентахлорфенол I 105; III 56; IV 130; V 348
Пентахлорциклонеитенон IH 313
Пентахлорцмклопропан III 448
1,2,3,4.5- Пентахлор-5-эти л циклопентадиен
III 464
Пентацен IV 198
Пентацен-6,13-хиион IV 198
1.1,2,3,3-Пентациаппропенид, тетраметилам-
монкевая соль J11 114
Пентаэритрит I 106, 128; IV 66, 110
11еитаэритритил монобромид I 128
Пецта-эритриттетрабромид I 106; II 411;
IV 110
Пентаэритриттетранодид И 411
Пентаэтоксифосфоран V 348
Пентен-1 III 425;
окись III 425
Щцлнс-Пентен-2 II 435
Пснтен-З-ол-2 I 233; III 107
г?1олнс-Пентен-3-Ои-2 V 349
Пентин-2 V 224
4-Пентинол-1 I 61
Пергидроазулены II 113, 114
Пергидроантрацен II 148
ПергиДросквалеи III 325
Перекись водорода II 127; III 21, бб;
в кислой среде III 5 7 — 68
в нейтральной среде III 68 — 70
в щелочной среде III 70—77
Перекись водорода — пиридин 1 91
Перекись водорода — селена Двуокись III
77, 78
Перекись водорода — соли и окисли метал-
лов в качестве катализаторов III 78 — 84
Перекись мезитила III 59
Перилен I 290; III 50; IV 127
Перилловый спирт II 161
Перипафтаноцы III 400
Перинафтеноны III 400
Перйодаты III 84 — 92;
Периплогенин IV 274
Пермутиты см. Ионообменные смолы
Перопирен I 173
Перфтороиперидин V 353
Перфторпропилен II 122
Перфторциклобутанон IV 190
ПерфторциКлобутен V 353
Перфторциклопропан III 386
Перхлоргексадиен-1,5 II 80
Перх'лоргексатриен [I 80
Перхлорилбензол III 92
Перхлорилфторид [И 92—99;
Перхлорирование III 295
Перхлорпропилен П 80
Перхлортолуол III 295
Перхлорфенантрен III 295
Перхлорфульвален 111 465
Псрхлорэтилен см. Тетрахлорэтилен
ПетролейнЫй эфир III 154
Пив ал и новая кислота см, Триметилуксусная
кислота III 99
а-Пиколин I 161, 162, 367; II 87, 243
Р-Николин I 280; III 66
N-окись III 66
т-Ппколин I 280
2 (п4)-ПиКолина метнлнодид Ш 454
((-Пиколиновая кислота 11 87
Ппкрплазнд III 99, 100
1 -Пикрилазулен III 100
11нкрнлиодид IV 97
Ппкрилхлорид 1 356, 395; III 100, 101, 310
Ппк'рицовая кислота 1 356; III 101, 102; IV
154
685
л-комплексы Ill 101
соли аминов III 101
Пплгыровая кислота V 357 — 558
Пимелпповая кислота I 201, 202; 111 88,
440
Пннаколин И 130; III 350, 387;
тозилгидразон Ш 359
Пинакон I 1,30, 307; П 207; III 101
Пинаконы I 36
Пинаконы бпниклиясские III 22з
10и-Пинанол-2Р V 130
ц-Пннон I 266, 279; III 376;
р-Нинен V 246, 386
а-Пниена окись V 05
шрегнс-Пщюкарнеол V 386
Пиши ан нн I 31 о, 317; III 203
3- <'1-Пинеридил)-6-метвлц1иклогексанин III
103
Пиперидин I 64, 201, 421; III 102— 107; IV
18, 265;
ацетат II 334: III 104, 105
Пиперидпнобецзимидазол III 430
Пиперидины 111 106
Пипер плен, цис- и tnpuuc- I 403; UI 107
Пипериновая кислота IV 106, 107
/ЛПЛипернтои II 161, 15'2
Пиперональ I 217; И 87; IV I ОД, 107
Пипсроипльдоксим [V 13
Пиперониловая кислота П 87; IV 106, 107
амид IV 18
Пнразин-2,3-днкарбоновая кислота I 223;
П 88, 89
Пиразол I И 107
А:-Пиразолппы I 248; III 216
ДИнразодины I 248; 111 216
3,3-Г10]-Ппразолофан V 4^0
Пиразолы V 498
Пирен I 182, 290; П 80, 2-10, 246; 1Н 6, 314
Пирен-З-альдегид II 203, 206
ПирпдазнпДио1|-3,6 I 171: III 211
З-Ппридилдпазонпя борфторид V 26
Пиридин I 128, 137, 201, 421; II Ill, 121,
197, 218, 292; 111 107 —И4, 166, 230, 231,
262; IV 142, 156, 180, 181, 10(1, 19'2 251;
V 7, 14, 32, 67, 77, 133, ЗеЗ, 333, S55,
380, 52-1
Пирндиц-З-адьдегнд I 192, 217
а-ПпрпДииальдегидз этиленапеталь UI 305
Пиридин — алюминия хлорид А7 357
Пиридин — н-бутиллитий V 360
Пиридина М-окнсь И 333, 386- III 66, 67,
75. 1 14, 408; IV 35, ЦЗ; V 3f>8
Пиридина осушка П 310; III 361
Пиридина пербромид III Пг>
Пиридина хлоргидрат II 286; 111 115 — 118;
IV 253;
Пнридинбораи I 33: III 118, 119
Ппридин-2-гидразНд 1) 392
Пирндип-2,6-днкарбоионая кислота I 355
Пиридиния бромгндрата бромид V 353—356
Пиридиния бромид пербромид 1 382; III
1J9 —123
Пиридиния трпфтораиетат V 130
Пиридиния фосфат 1 320
Пиридиния хлорид см. Пиридина хлоргидрат
Пиридннкарбоновые кислоты I 161, 162
Пиридинов гидрогенизация III 172, 173, 196
ПнриДин-4-сульфокислота III 334
Пиридоксаль 11 227, 234, 235
З'-фосфат II 227, 234, 255
хлоргидрат V 267
Пнридоксамин ДпхлоргпДрят IV Йе, 102
Пирпдоксамннфосфат II 227
Пиридоксин II 227
хлоргидрат 1 203; V 267
Пиридон-2 V 321
Пприллия соли V 73
б-N- (2-ПирнмиДнл)-1,-орнитин V 261
Пиримидин II 212
Пиримидины V1 75. 76: V 9
Пировиноградная кислота 1 136; И 74: П1
123, 124, 202
мг/Тпловый эфир 1П 347, 388, 389
фенплгпДразон IV 33
этнлонып уфир II 89, 372
Пирогаллол II 8,3. 389; IV 131, 208
1,3-дн метиловый эфир I 193
Емонометпловый эфир 1 317; III 73, 203
Пирокатехин I 106, 129; Ш 72, 121 а72;
IV 42, 79; V 490, 5-13
карбонат [II 121
Дпбснзолсульфонат I 106
дихдорметплсновый эфир III 124
Пнромеллктпнон кислоты амид 1 336
а-Пнрон II 18, 19, 272: 111 125
а-Пнрон-6-карбоновой кислоты метиловый
эфир 1 78
Пнрослпзевая кислота
ангидрид III 110
хлорин гидрид III 110
Пирофосфорилтетрахлорид HI 125, I2Gr
V 360
Пироцен II! 171, 172
Пиррол 1 81; IV 85-, V 236, 4/2
Пнррол-2-альДсч'пда I 185, 358, 359; IV 85
Й-Г]ирролпдплпропаноЛ II 167
и- (1-Г1прролпднл)-пропиояоцоГ| кислоты эти-
ловый эфир П 167
j-FlHpponHflru'i-iVV-xoHCCTaflHeHaMHii HI 92
93
3-ПирролиДИл-А2-холестенамин III 92, 93
Пирролидин II 268; III 93, 126 —129; V 231
34ы 361
Пирролидина перхлорат V 231
L-ПирролнДовкарбоновая кислота III 152
Д'-Пирролндкноциклогексен V 2G8
Пирролнзпдип III 173
ЗН-Пирролнзнн I 18’5: III 173
Пирролнп-З V 85
Пнрролипы V 204, 290
Пнррол-2-карбоцовой кислоты амид IV 82
Пирролы 28. 151
цветная реакция I 301
Плазмадогены II 140; IV 37
Платина двух/юрпстая V 302
Платина на угле 1П 172
Платиновые катализаторы 1Ц 129 — 132; V
362, 491
Платиновый катализатор окисления см. Хей-
на катализатор IV 120
Платинохлорнстоводородной кислоты калие-
вая соль V 362
Платины сульфид на угле III 132
Подокарпннилметиловый эфир II 167
Подо кар пиная кислота Ц 166
Поли-Е-аргинин V 342
Поли-О-ацотилоксппролин Ш 275
цш-Полибутг1Диен I 261
Поливиниловый спирт 1 82
Поли-i-випнлпнридин Ш 306
Полигекс,вметиЛен карбиднимид V 363
Полиоксиметилен V 317
Полиокси-1.-иролин Ш 275
Полимеризации ингибитор [Ц 347; IV 52
Полнметилсилоксап I 29"
Полипоровая кислота V 133
Полипропилен I 91
Полнфеиолы И 421
Полифосфорная кислота (ПФК) III 132 —
146, 392: У7 14, 363, 482
Полифосфорной кислоты эфиры III 146 —
148; V Збз
Полиэтилен I 91
Полиэтилен гл иколь-300 I 33
Прево реактив см. Иододибензоат серебра
III 148
686
д-s, !,(Ы)-Прегцадиенднол-17а,21-дион-3,20-
21-ацетат III 95
д 11ре;'[гадцснднол-17а, 21 - дкэтиленке-
таль-3,20-21-ацетат IV 87
Д5> 16-Г1регнадиенол-Зр-он-20-ацетат III 94;
IV 170
5>4.1В-ПрегнаДИены V 103
Прегнацдиол За, 21-изопропилидеидиокси-
5|3, 17,20-диацетат V 477
ПреГ11апдиол-17а, 21-триоп-З,11,20-21-ацетат
II U4; 111 253
ДМП 01 °- Г [регпатр пен-3,20- диэтилен кеталь-
2*1-ацетат IV 87
Д1Л ’(‘Ч-Прегпатрпендиол-17а, 21 -дион-3,20-
21-ацетат 1 76
ДМ> '-'(>>)-г1регнатриеитриол-3,17а,21-триаце-
тат III 95
Д’-Прегнен-З.аО-б^с-этиленкеталь II 213, 214
Д’-Г1реп1ендион-3,20 IV 176
Д3-Прегнендион-3,20,20-мовоэтиленч<.еталь 11
213, 214
Прегненолон см. Д*-Прегненол-3(3-оп-20
Д&-Прегненол-Зр-он-20 1 22, 107, 172; II 23,
61; IV 151, 152, 176
ацетат 1 86; II 190; III 223, 242, 243;
IV 88, 132
А5-Пре['11енол-Зр,20-эТ1| лен кетальацетат IV
37
ДМТрегнентрцол-11Р, I 7а, 21,-3,20-дпэтнлен-
кеталь 21-эцетат IV 87
Д4-ПрегнентрнолЬ1-Зр, 17а,20 (20 а и 20Р)
II 192
Д1 М’Трегиепы V ]03
Преднизолон III 233
21-ацетдт
БМД(бьс-метилендиоксипроизводное) И
191
Преднизон III 43, 44, 253
БИД^ус-метпЛендиокснпронзводное) 11
191; III 43, 44
Пренмтол I 137; И 169. 170; Ш 429
Присоединение против правила Марковни-
кова I 98
Пробковая (субериновая) кислота III 7
Прогестерон I 94; И 23, 206; 111 8, 18, 1 Об,
349; IV 231; V 149, 359
ацетат енола II 23
3,20-бмс-этиленКеталь IV 231
D.L-Пролиц II 306
L-Пролин I 319; II 149, 150; III 128, 156, 456
Пролин желтый III 128
Пролин красный III 128
ПропанДиол-1,3 III 372; IV 31
Пропандигиол-1,3 III 148, 149; V 157
Пропандигиола-1,3 ди-л-толуолсульфонат
III 149
1,1,2,3-Пропантетракарбоновой кислоты тет-
раэтиловый эфир IV 243
1,1,3,3-Пропантетракарбонрвой кислоты тет-
раэтил овый эфир IV 65, 66
Пропаргил бромистый IV 211; V 15, 200, 280,
444
Пропаргил мети л-р-мстокспэтил карбинол IV
2! 1
Пропаргилового альдегида диэтилацеталь
V 24
Пропаргиловые спирты I 274
Пропаргиловый спирт II 2-75
н-Пропила гидроперекись I 219
цзо-Пропиламнн II 141, 14,3
Н-Пропиламнн II 141, 143
Пропилацетплен (пентпн-1) 1 417
м-Пропилбензол 1 233, 432
w-Пропил бромистый IV 171
н-Пропил-н-бутнлсульфнД I 139
Пропилеи I 288; III 61; IV П1; V 209
окись I 288; Н 361; III 465
З-н-Пропил-2-оксихнлоксэлнн IV 41
н-Пропилтиоциаиат I 139
ц-Ппоппл хлористый III 169
I-«-Пропилцпклогсксен III 7
и -1 [рои илциклопропан Г 262
Иролин I 62, 417; II /2
ИропнннлЛитпГг V 434
Р-Пропиолактон I 128; III 149, 150
Пропиоловая кислота II 358
метиловый эфир 111 368
этиловый эфир I 435; Ш 368, 369
Р-Пропиовилфсиилгидразии II 112; IV 34
Пропионовая кислота
ангидрид I 258
fi-фецилгидразид II 112; IV 34
хлораигпдрид I 100; IV 250
этиловый эфир 111 150, 151, 154
Пропионовый альдегид I 287, 347; II 66
Пропиофенон I 144; II 289, 404; III 450; V 282
Простагландиан Е V 46
Простагландин V 88. 170, 230
Протокатеховая кислота IV 107, 108
Протокатеховый альдегид I 50; IV 106 — 108
Псевдоионон V 207
Псендопельтьерин I 227
Псевдотиогидантоин III Ззб, 327
D-Псикоза 1 423, 426
Птеринов гидрирование III 433, 434
Пулегон 1 340; III 214
Пульвиповой кислоты дилактон V 133
Пурин V 337
синтез 1 95
Пурпурогаллин I 83, 389
Путресцин дихлоргидрат I 207; II 415
Пфитциера — Моффата реагент см. Диметил-
сульфоксид III 151
Разделение на оптические изомеры, реагенты
III 152, 153
D-Рамноза II 171
Растворители III 153 — 156
Расщепление альдоз I 375
Реактив ВМС III 295
Резацетофенон IV 208
Резорцин I Зй8; II 64; III 35, 157; IV 194,
208; V 510
диметиловый эфир IV 51
Рейнеке соль III 156
Ренея катализаторы кобальтовые I 286; 111
156—157
Ренея катализаторы никелевые I 205. 206;
II 100, 405; III 149, 157— 167; IV 177; V
367
Ренея никель III 167
Ренея сплав см. Никель-алюминиевый сплав
Рениевые катализаторы III 167
Рения гептаселенид III 167, 168
Ретен II 95; III 244
Ретен хинон II 05
Ретикулин V 264
Ретинен (альдегид А±) II 219; III 345
D-Рибоза 111 147, 359
тозилгидразон III 359
Рибонуклеаза IV 6; V 27
Рибонуклеозиды V 526
Рибофлаиин-4Г, 5'-фосфат IV 84
Рибофлавин-5-фосфат IV 84
Рнмоцидин IV 93
Рнциноленая кислота II 90, 9]
Родизоновая кислота I 224
Родий (5%) на окиси алюминия III 168—172
Родий (5%) на угле (норит) III 172, 173
Родия трлхлорид V 368
Розенолактом II 185
Ротенон III 15
Рошс соль см. Винной кислоты натрий-калие-
вая СОЛЬ
Ртути(II) ацетат 1 254, 320; III 173 — 184,
297; V 206, 317, 3'20
687
РтутиЦ) Карбонат V 373
Ртути(1) нитрат 'V 373
Ртути окись (желтая, красная) I 380, 383.
422; II 33; П1 184-187. 274, 433; V Об, 372
Ртути окись — иод III 187, 188
Ртути(И) сульфат III 188—190; V 176
Ртути(П) трифторацетат V 373
Ртути трифтораиетат III 190
Ртути(П) цианид III 190
Ртуть’ иодная V 67
Ртуть хлорная (сулема) П 25; 111 190—194;
V 25 9, 430
Рубидия фторид II 107; III 194
Рутениевый катализатор на активированном
угле (Дарко) III 195
Рутениевые катализаторы гидрирования III
194—197
Рутений на угле III 194
Рутения Двуокись III 194, 198; IV 177
Рутения трихлорид V 454
Рутения четырехокись III 197 — 201; V 373
Рутеноцен IV 200
Салигенин И 435
Салициловая кислота II 40; III 80, 138; IV
13, 22, 209
фениловый эфир I 299; HI 138
Салициловый альдегид I 1S4, 185, 213, 214'
II 97, 98, 435; III 72, 104, 105; IV 135
натриевая соль V 547
Салькомин V 377
Ц-Сантален V 330
Сантонин 1 40; И 202
( —).|3-Сантонин III 249
СапогенинЫ V 358
Саретта реактив IV 180, 181
Саркозина метиловый эфир III 331
Сафрол II 435
Сахароза I 134; III 27
Свинец V 377
Свинца двуокись I 188, 395, 408; III 202 —
205, 208, 217, 231; V 378
Свинца диацетата тригидрат 1 223; 111 206,
207; V 379
Свинца окись (желтая) III 207, 208; V 377
Свинца окись красная III 208
Свинца тетраацетат 11 57, 58, 439; Ц1 203,
204, '208 —242, 297, 298; V 198, 234, 377
379, 532, 545
Свинца тетраацетата пиридинат V 382
Свинца тетраацетат — N-бромсукциниммД V
383
Свинца тетрабензоат III 242
Свинца тетра- (трифторацетат) V 384
Свинца тетрафторид Ш 242, 243
СвицЦа тиоцианат I 379; IV 136
Себацил 'II 228, 229
Себациновая кислота I] 166, 321
амид монометилового эфира IV 99, 100
Диамид И 321
Дннитрил П 321
Дихлорангидрид I 202, 203; IV 196
монометиловыц эфир II 256
Себацнноин Ц 228, 229, 234; IV 220
2,3-Секо-За-холестан-2,3-ди карбоновая кис-
лота I 427
aiiГидрид I 427
5,6-Секохолестанол-ЗВ-он-5-6,6-диметилаль
III 225
3;5-Секо-4-норхолестанон-5-3-карбоНовая
Кислота I 427
5.6-Секохолестанон-5-аль-6 III 8
Селен III 24, 206, 243—246
Селена двуокись III 77, 78, 206, 246—256:
. V 385 .
Селена двуокись — перекись водорода V 386
Селена хлорокись III 237
Селенистая кислота см. Селена двуокись
Ссленофенол I 237; 111 2-15, 246
Р-Се-твнен 11 162
0-Сцлннен II 162
Семикарбазида хлоргидрат III 257
Семикарбазоны Ш 257
растеплен не I 74; II 418, 419
Сера II 428; III 52, 243, 244, 257 — 261, 284;
IV 120
Сера Двухлористая III 261, 262; V 387
Сера однохлористая III 261, 26Э
Сера четырехфтористая ! 196; II 122; III
262, 263; V 387, 447
Серебра ацетат V 379
Серебра борфторид III 264—266, V 388
Серебра дифторид III 266, 267, 431; V 457
Серебра карбонат Ш 267; V 389
Серебра нитрат III 267 — 2711 V 51, 212, 331
396, 435
Серебра нитрит Ш 271
Серебра окись Ц 218, 279; III 235, 272 — 276;
V 27, 86, 388, 393, 403, 543
Серебра перхлорат III 360; V 393
Серебра N-сукцпнимид II 60
Серебра сульфат III 276, 277
Серебра, тозилат см. д-Толуолсульфонат се-
ребра
Серебра формаиилпд IV 276
Серебра фторид Ill 264; V 395
Серебра хлорат III 277; V 396
Серебра хлорид «активный» V, 22
Серебра хромат III 277-^288
Серебра цианат I ЮЗ; V 216
Серебра Цианид III 278
Серебро III 246
Серин I 189; II 22; III 18|; V 150, 495
Серини реакция IV ЕаЗ, 224.
Серная кислота I 128; II 249. 291, 334; IV
119, 143, 256, 257; V 7, 152, 478, 482, 483
Сернистой кислоты N,N-диэтиламида мети-
ловый эфир III 278; V 397
Сернистый ангидрид III 278 — 279; IV 119
I56-; V 39/
Серный ангидрид III 279; IV 155; V 133
Серный ангидрид — диметилформамид 111
279, 280
Серный ангидрид — диоксан III 281; V 397
Серный ангидрид — пиридин III 282, 283;
V 398
Серный ангидрид — триметиламин П1 283
Сероводород III 43; V 27
Серотонин II 103
Сероуглерод I 292; III 154, 283; IV 263; V
16, 190, 490
Серы шеетиокись III 284
Сефадекс III 284, 285
Силиконовое масло 1 297
Симмонса — Смита реагент I 247; II 366;
III 286—290; V 399
Синтомицин [хлорамфеникол) III 439
Сиреневый альдегид 1 193; II 371
Скатол I 301
Сквален III 324, 325
Скополетин II 350
Слизевая кислота I 20, 21
Соласодин I 22
Соляная кислота IV 143
Соммле реакция П 465
Соина — Мюллера реакция III 31
Сорбиловый спирт IV 130
Сорбиновая кислота
вМор-бутиловый эфир 11 244
этиловый эфир IV 271
Сорбиновый альдегид IV 130
Спинахром D V 63
Спиро-[3,2]-гексан IV 260
Спиро-Дп-о-кснлилен 1 15I
Сппро-[2,2]-нентан IV 259
5а.г2аР,25-О-Спиростан-3-альдегид 11 307
688
5а-Спиростанон-12-диол-2,3-днмезилаты 11
261, 413
5а,22а-Сниростантриола-3|3,1 la, i 2fJ 11-аце-
тат-12-мезил ат II 251
Д2-22а-5а-Спиростс1[Ои-12 II 251; IV 152
Спиро-[циклогексан -1,9'-флуорен ]-он-4 1V 96
Спиро- [циклогексан-1, 9'- флуорен] - 4- он-3-
карбоновой кислоты амид III 143
Спиро- [Д’-циклОгекссн-[, 9'-флуорен] - 3-ци-
ац-4-амИи I 149
ДМ2-СтеарДииновая кислота III 267
ДС1й-Стеардиииаль III 267
Стеарил бромистый III 186
Стеариловый спирт I 287
Стеариновая кислота I 2G, 119, 299; II 319;
III 186, 200, 325, 439
амид I 169
ангидрид III 290
Метиловый эфир IV 90, 91
этиловый эфир IV 239
Стеароловая кислота I 60; И 91 152; III
288, 289
Стекло измельченное IV 232
Стеркуловая кислота III 288, 289
Стероидов ацетониды IV 150; V 477
Стероидов диосфенолы II 229
Стефена реакция III 31
Стигмастадиенон III 8, 106
Стигмастерин III 8, 106
трянс-Стильбен I 382; И 3G, 238, 259, 391;
HI 120, 165, 233, 333. 389; IV 141, 171,
219, 220; V 187, 242, 458
окись I 115; II 194, 351; III 375
цис-Стильбен II 234; III 120, 389; IV 1Э1; V
242, 458
окись II 194; III 375
Стильбенгидрохинон III 272
d.I-Стильбендибромид III 120
,иеао-Стильбендибромид I 382; III 120; IV
18, 19, 170, 171
СтильбендихлориДЫ III 298, 299
Стильбенхинон III 272
Стильбены, цис- и транс- I 17; II 39; HI 120;
V 181, 242
Стипитатовая кислота I 251
Стирол I 82, 154, 324; II 39; III 13 61, 281;
IV 25 67; V 36,187
окись I 430, 437; II 204; 111 408; V 102,
129, 134, 158
|3-сульфокислота III 281
Стирола и дивинилбензола хлорметилиро-
ванный сополимер V 221
З-Стирилантранил III 467, 468
2- (|3-Стирнл)-4-метил-1,3-диоксолан II 349
4-Стирилтрополон Ш 90
СтрогозиД V 477
Субериновой кислоты динитрил Ill 385
Субтилизин —ОН V 406
Субтилизин—SH V 496
Сукциноила перекись III 290
лерн-Сукциноилаценафтен II 364
За-СукцинОкси-7,12-Дикетохолановой кисло-
ты метиловый эфир 1 201
Сульфаминовая кислота III 290
Сульфаниламид 111 65; IV 156
СульфанилиДЫ III 295
Сульфаниловая кислота II 431
Сульфгидрила определение I 370
Сульфиды III 86, 200
N-Сульфинилаиилин V 165
N-Сульфинил-л-толуолсульфамид I 224, 225
Сульфолан см. Тетраметиленсульфоп III 290
Сульфоксиды III 86, 200
Сульфолен-З (2,5-Ди гидротиофендиоксид-1,1)
V 401
Сульфо-миКс V 402
Сульфомононадкислоты см. Каро кислоты
Сульфоновые кислоты 11 84; III 279
Сульфон ы III 200
Сульфосалпцпловая кислота 111 290, 291
Сульфоуксусная кислота И I 291, 292; V 404
Сульфохлориды III 331
Сульфмрил хлористый I 98; III 292 — 296,
341, 342; V 214, 404
Сурьма пяти фтористая IV 119
Сурьма пятихлористая 111 296
Сциллит III 39
ТаллияН) бромид V 406
ТаллияЧИ!) окись III 297
Таллия триацетат III 297, 298; V 406
Твистан II 396
Твистанон-4 V 38
Тебаин V 507
Тексилборан см. 2,3-Диметил-2-бутилборан
Теллура дибромид I 397
2-Тенил амины III 293
З-Тенил бромистый I 99
2-Тепил хлористый I 192
3-Теи ил х’лористый I 192
1-а-Теноил-2-нафтойная кислота IV 101
2-а-Тсноил- 1-нафтойная кислота IV 101
Терефталевая кислота I 29; II 248, 406;V 217
Терефталевой Кислоты бис-(N-метил-М-ни-
трозамид) 1 243
цис-1,8-Терпиц II 95
а-Тсрпицсол V 371
Терпинолен II 161
Террамицин III 365; V 564
о-Терфеннл III 50, 51
н-ТерФенил I 384; И 104, 105; III 403
д-Терфениленртуть I 366
Тестостерон I 115, 329; II 151, 152, 395;
HI 127, 252; IV 249
ацетат II 188, 189; V 375
бензоат И 21
окиси I 115
пропионат II 124, 125
формиат III 367
,'М-Тестостерон II 152
Тетрааллилстаинан 1 35
1.3,4,6-Тетр а-О-ацетил-2, З-ангидро-1-меток-
cii-D-манноза I 127
2,3,5,6-Тетр а - О - ацетил-D-гексан о-у-л актов
I 315
2,3,4,6-Тетра-О-ацетил-D-глюкоза IV 60
2,3,4,6-Тетра-О-ацетил-р-D-глюкоза 111 267;
IV 60
2,3,4,6-Тетра-О-ацетил-D-глюконовая кис-
лота IV 206
2,3,4,6-Тетра-0-ацетил-а-0-глюкопираноза
ИГ 267
1,2,3, 4-Тетра-О-ацетил-fl-D-глюкопиранозид
I 132; III 417, 418; V 92
2,3,4, 6-Тетра-О-ацетил-3-D-глюкопиранозид
V 92
2,3,4,6-Тетра-0-ацетил-а-П-глюкопираиозил-
бромпд (а-ацетобромглюкоза) I 131, 398,
399; 111 267, 339
Тетра-О-ацетил-а-Ь-глюкопнранозилхлорид
V 22
2,3,4,6-Тетра-0-ацетил-а-П-маннопирано-
зилбромид II 206; III 267
Тетра-О-ацетлл-Э-рибофураноза V 337
Тетраацетплэтап I 75; II Зл
Тетра-О-бензоилбензил-fl-D глюкоза III 190
Тетра-О-бензоилбромглюкоза 111 190
1, 1,2,2-Tciрабромбеизоцпклобутеи III 435
1,2,3,6-Тетрабром-3,4,,, 8-дибензотрицикло-
[1,2,0,03С]-октадиен IV 60
1,1,4,4-Тетрабром-1,4-дин итробутан 1 163
З.ЗТ 5,3'-Тетрабром-4.4'-диокси дифеи ил 1 16
1,1,9,9-Тетрабром-[2,2]-парацпклофаи IV 20
1,1,10,10-Тетрабром-[2,2]-парациклофан IV
20
689
Тетрабромстеарнновая кислота IV 213
Теграбромциклоироиен V 37
Тетр;'- и-оу П|ламмо!|Н|1110дтетрахлорцд 111
2Я8, 299
3,3', 5, ./-Тстра-трещ-бугил-Т.4'-дноксидн-
фенил мотан I 188; 11 103
Тетравниилсвппец. I 183
'Гстравинплстаниан I 183
Тетрагсгшкчаммоиим хлорид V 407
Тстрагидроаптрахннон Ц Ы8
Те грагидроабнетнноиия кислота V 339
транс-Ст,", 1 (}, 11-Тетрагидро-5Н- беизоцикло-
нонеи V 503
дг|С-Тетрагн,1родезоксикодеин I 375
1,2,3,4-Тетрагидро-1 ,4-диоксонафталин V 431
1,2,3, 4- Тетрагпдронзохиионолин-З- карбоно-
вая кислота III 170
Тстрагидроиидазол II 33’2, 333
4,5.6,“-Теграгидроиндапон-1 И 220; IV 05
1,2,3.4-Тетр(1гидрокарбазол IV 33
1,4.5,3-Тетрагидрон афтал ин-1,5-ди карбоно-
вая Кислота I 123. 124
ол-Тетрлгпдронафтол-1 1 109
1,2,3,4-Тетрагцдро-4-о ксо-1,3-диоксацафгал-
инспнроц1иклогексадпен-2'.5'-он-4' III 204
1,2,3,4-Те,Грагндропаиаверин III 25
Тетрагидроинран I 129
М-('1'страгидроппранил-2)-амнды 1 2/4
Те'граг!1дропираипловь|е эфиры 1 '273, 274
Тетрагндропироцен 111 171, 172
7, 8,9,10-Те'грагндрофенантриднн III 139
Тетрагидрофталазии V 407
цис- (в транс-) Д4-Тетрагидрофталевой кис-
лоты диэти.човып эфир III 347; V 1“4
11нс-А4-Тетрагидрофталевь1й ангидрид III 347
Тс'грагидрофурац 1 206, 207, 223, 239, 272,
294, 294, 424, 437; II 16, Ill. 132, 153. 169,
Ь1. 176, 255, 277- 283, 3'13, 35/ — 359;
III 153, 299—301; IV 102, 190, 268; V 15,
[9, 69, 237, 408, 472, 481. 531
расщепление 1 129, 268; II 179; Ill 415;
IV 206
Тетрагидрофуран — боран (комплекс) IV
234, 255
Тетрагидрофурфурил бромистый IV 110
Тетрагидрофурфурнловын спирт I 10, 273;
111 332; IV 110, 206
Тстрагидрофурфурилтнолацетат 111 340
Тетрагидрофурфурплтозилат III 340
Тетрагидрофурфурил хлористый I 61; III
332
1,2,3,4-ТетрагидроХинолиц I з7/
Тстрагидрохроман IV 141; V 24з, 518
Тетрадегидро- 118.!-аннулен Ш 2/0
/V-Тетрадеиецовая кислота I 1о5
Тетразолиевын синий III 301, 302
Тетраиодфталевый ангидрид II 33
1,2.4,6-ТетракарбметоКсициклооктятетраен
III 368
1,3. о.'-Тетракарбэтоксицнклооктатстраен
III 368, 369
Тетралин I 408; II 132, 158, 451; 111 4.0, 81,
302: IV 130
Тетралина 1-гидроиерекись III 302
Тетралин-1,2-дполы II] 220
Тетралиноцнклеиоиы V 17
Тетралин-п-хинол 111 14 I, 44'2
П-Тстралон I 46, 179; Ц 132, 303, 364', III
32. 8], 134, 258, 330, 43У; IV 34, 116; V
6’2, 366
(3-Тетр алой I 182; V 62
ТетрадойЫ V 259
3,3.4.6-Тстра-0-мезнл-а-метил-0-глюкопп-
ранознд И 2j2
Тетрамстилаллен V 23(1
Тетра мстил аммоний хлор исты ri HI 113
Тетраметиламмоння ацетат III 302, 303
Тетраметилам.моиия боргидрид III 303
Течраметиламмония бромид III 303
Тетрамстиламмопия гидроокись 111 73, 302
Теграметнламмопи'Л трибромнд III 304
1,1,3.3-Тстрамстилаистоукс.усно(1 кислоты
этиловый эфир (этилизобутироилнзобутн-
рат) Ill 385
2,3,4.6-Тс1раметилаЦ.етэфсноп II 263
2,2', 4,4'-Тетрамстилбеиаофспоц [II 137
3,3.4,4-Тетр а мети л бут иролактои 1 312
2,2,5,5-Тетраметпл гексан Диона-3, 4 мопогпд-
разои III 190
2.3.4,6-Тетра-О-метнл-Ц-гл:окоза I 316
Тетраметилгуанядин Ш 304
Тетраметнлгуанпдипия азид V 409
2,2,15,5-Тетраметнл-4-диазогоксаион-3 III 190
3,,'V,4.4'- Тетраметил-3.Г/- днметоксидифено-
xiiiioii II 104
2,2',6,6'-ТеТрамстил-4,4'-днфенохиион 111 96
1,1,2.3-Тетраметил-3,3-дицианоц1И<лопропан
111 4зб
Теграметилгнглнколь I 333
Тетрамстиленсульфоксцд I 158; III 304
Тетраметиленсульфон (сульфолан) I 295; П
463; III 305—306; V 228, 336, 409
3,4-ТеТраме’гиленхннолиц HI 13S
Тетраметнлеихлоргидрии 111 300
1,3,5,7’Тетраметцлоии,пклооктан I 34
ТетраметИлмочевина I 71, 153, 289, 295; 111
зое, зо7
2,2,4, -1-Тетраметилпиперидии V 353
Тетраметнлпирофосфит V 411
1.1,4,4-Тетраметилтетралиндиои II 92
1,1,4,4-Те.траметплтстралон-2 II 92
Тетраметилтцомочевина III 307
1.2,3,4-Тс'граметплфенол III 429
2,3,4,0-Тетраметилфенол III 421)
2.3,4,6-Тетраметилфенол см. Изодмпол ПГ
429
ТетраметилццклобутанДнолы-1,3 III 194
Тетраметилцпклобутандион-1,3 I 310; ЦГ
194
2,2,3,3-Тетрэметилци!<лобутанон I 312
3,3,6,6-Тетраметнлциклогексадиеи-1,4 V 61
4,5,6,6-Тетра.мстилциклогсксадпенон III 429
2,2.6,6- Тетраметплциклогексилиденвинила -
пстат IV 205
Тетраметилциклопроп/щон V 94
ТстраметпЛэтнлен I 264: II 130; III 27, 28,
316, z456;_V 92, 17’2, 183, 302, 534
N,М.К^Ы'-Тетраметилэтилеядиампн II 24 4;
V 411. .135
2,2,3,3-Тстраметилэтнлеиимин 111 27. 28
Тетраметоксиаллен V 70
1,1,4, 1-Тетраметсщспбу|’еи-2 II 215, 216
1'. 1", 4', 4”-Тетрамето(<си-3, 4,5,6-дпбензофе-
наитрен-9,10-диКарбоновой кислоты анги-
дрид III 51
Тетраметокси-0.10-диметнлаптрацен V 181
3,4,3',4'-ТетраметоксиДифенил 1 110; IV 129
2,6,2',6'-Тетраметоксиди4?енохн11О11-1,Г! 411
1,1,6,6-Тетраметокси-ДМ-циклододскаДиен
III 224
Тетраметоксиэтилец V 412
Тетранитрометаи Ш 307, 308; V 413
Тетра-л-нитрп()1еп11ЛП11рофосфат 1 374; 11] 309
и (—)-tt- (2,4,5,7-Тетранитро-9-флуоре-
;1НлнДснам1п(ооксн)- пропионовая кислота
III 152, 309; V 413
2,4.5,7-Тстр;(нитрофлуореиоН III 152, 310
2,3.6,7-ТетраоксиаНтрахнноп V 182
2.3,6,7-Тетраоксиаитраи.еи V 181
Тстраокси-1,4-бсн.чо.\п[|Он I 223, 224; II! 29
5.З^б.б'-Тетраоксииндиго IV 137
2,2,6,6-Тетра- (оксп.метил1-цнклогексанол IV
66
1,4,5,8-Тетраоксннафтаиен.хинон II 364
1,2, о, 6-Тетраоксин афта Дни IV 131
690
3fl, ,j|3. 140,21-Тетраоксппрегнаяон-ЗО 3,2 I -ди-
аиетгп IV 274
Тетрафениларсонийхлорид I 237
Тетрафенплбензол [I IS. I?: Hi 311
i, !?,3,'1-Тетрас1)енплбутаДпе» H 437
!. i, 4, 4-ТетрафеннлбутаТрПен-1,2,3 1 37
1 1,6,6-ТетрафелплгеКспдпни-2,4-диол-1.6 IV
83
1,1.б.С-Тетрафет! лгексаиептаен-1,2,3,4,5 1
37, 136; IV 83
1,1,6.6-ТетрафенилгеКсатрпен-1,3,3 1 136
1,1 .б.ё-Тетрафенилгексатстрпен-1,2,4,5 I 37
I, 1, 4, 4-ТетрафеНил- 2, 3 -Ди бе изо и л тетр аз пн
III 205
ТетррфенилДигнДрОфталевын ангидрид III
Тетрафенплкумулены I 37, 136; IV 8.3
1.2.3,4-Тетрафеи!и’1нафталин I 390, 391; II
98; III 238
Тетрифел плпен гатетраеп I .348
2,4,3,6-Тетрафедилрезорцпн V 227
Теграфенилсшшсц I 183
Тетрафенплсесквифульвален V 514
Тетрафен пл стаи в ап III -120
Тетрафелплтиофеп III 162, 163
Трифепилфосфазииы V .306
Тстрафеннлфосфонцйбромпд III 300
Тетрафепплфталеной кислоты диметиловый
эфир 1 2Щ; III 311
Тетрафенилфталецьш ангидрид щ 311
Тетрафенилциклобутадиеп — никель броми-
стый Ш 12 1, 122
Тетрафенилциклопеитадпеиилнатрпй V 514
Тетрафен пл циклопептадпспон (тетрациклоп)
1 291 —299, 390, 391; II 18, 19. 98; HI 162.
163, 310, 311; IV 59; V 227
силпи-Тетрафепилэтап IV 171; V 273
1.1,2,2-Тетрафеиплэтанол V 534
Тетрафенилэгандикалнй И 336
Тетрафеянлэтилсц И 7, 42, 356; IV 182; V
413, 539
окись II 194; IV 182
Тетрафснилэтплонокспд см. Пецзпинаколнн
I 15. 162; И 36, 18-1
Тетрафосфордекасульфвл IV 1.37, 1,38
Тетрафторгидрааин I 402; 111 312
Тетрафторэтплеп V 214
1,2,3,4-Тстр;1хлорацтрахиноп I 3,64
Н.Й.З.б-Тетрахлорацетапилид 111 312
2,3,4,5-Тетрахлорбснзойпая кислота I 364
1,2,3,4-Тетрахлорбензол I Ф54
35 4', 7А б'-Тотра.хлорбепайорбориен Н 154
1,2-Тртр;1х-лорбензохипо)1 ем. о-Хлоранил
1,4-Тетрахлорбепаохипои см. Хлоранил
Тетрахлоргидрохннопа диметилояыф эфир
V 4 1 2
Тетрахлор-1,2-дибромэтац III 312, 313
7.7,8,8-Тетрахлордпс1)11ро"[2Лз,2.1-октап V
462
Тетрахлор-1,1-днфторэтац IV 223
Те'! рахлорнпрокатеХип I 1С>
9,9,10, 10-Тетрдхлор'|р|тпкло-17,1,0,06 ь.1-де-
кан II 154, 153
Тетрахлорфурan III 1313
Тетрахлорцнклопентадиепон HI 313
Тетрах.порциклопсптаднснпна этиланкеталь
V 415
Тетрахлорц.ш<лопентрплнои-1,2 I 23
Тетрахлорциклопропеп V 37
Сй.млг-Тетра.хлорэтаи I 294, 295; Ш 186, 2%;
V 82
Тетрахлорэтилен I 48, 291, 294- II 80; Ш
154, 4-17; IV 34
1,2,4,5-Тетрациапбепэол I 356; III 409
2,3,4,5-Тетрацц;)цТ11с>фсч-[ I 278
ТетраЦианхпнодиметан I 32; III 314
Тетрацианэгилен I 3<!5, 421; II 322; III ф
112, 113,314—318; IV 257; V 236, 416. 545
Тетрациклины 1 68, 38/
Тетр ацикло 1ф1(У,"1-додеканон (II 288
Тетрациклон см. Тетрафенилциклопсптадпе-
unii III 318
Тетраэтпламмония ацетат Ill 318. 314; V 41G
ТеТ]',а-угилемм(.ц1’,г,1 боргидрид III 303
Тетраэтпламмония бромид V 33е’
Тетраэтил аммония гидроокиси III 319
Тетраэтиламмония иодат V 416
ТетрдэтллаМмопия формпат 1Ц 319, 329
Тетраэтиламмои и я хлорид III 32(1
Тетр дуги лснсу. иг.фокепд 1 332
Тетрзэтилнпрофосфпт 1 434, 4;)S; III 320, 321
Тетраэтплстаннан I 237
Тстраэтилсукцинилфосфопат IH 321
Тетраэтплте-)ратин II 353
1,1,3,3-Тетраэтокс1Шропац III 326
Тетраэтоксисилан I 294; 1V 2.52
Тетролопня кислота I (>1, 62
Тефлон 1 42. 91
9-Тиаб1ищКло-13,3, lJ-цонан III 261
Тнллолины-т>тщ|;и>,'|Ы IV 24
Тпаипклогексаи V 37-1
Тнглвновая кислота II 322
Тигливовой кислоты ХлооангиДрид Ш 321,
322
Тяготения II 180
Тпгогенои II 3()7; IV 149
Титов ин V 104
Т-З-Тиспвлмаслиная кислота П1 162
Тпеинн-1,1 -диоксид V .397
Тпстаиопа-3 1,1-днуокись II 62
Тннрапы Ш З.'.’б, 409
Тиле реактив I 114, 115; IV 1ёФ, 181, 182
•З'-Тимцдиловая кислота Hi 147
Тимидин I 3(56; V 383
З'-фосфат II 467; IV 193
Тимин V 32, 394
Тнмохипон 11 420
Тпоаннзол V 351, 496
Т и огл и кол ев а я кислота III 322, 323
^-Ц-Тпогомофталимид I 19
р-Тнс-Днгликоль 11 57, 423
0-Т|1оДипропиопово11 кислоты диметпловый
эфир [V 17
N, 19т-Тцокарбоп11Лд1|п1.|11Дазол III 323, 389;
V 417
Тиокарбопилперхлорид см. Трихлорметил-
су.пьфенхлорпд
Тпо!<е'с<шы П 362
Тиолацетаты 111 3-10
о-Тиомегокепмелилфенол I 3.31
Э-Тпо-н-метплурацвл И 281; III 165
TnoMonerHina II 261; HI 324—328; IV 245,
261, 276; V 417
соединения включения I 44; III 324,325
Тиомочевины II 133
Тпонил бромистый Н1 328
N, ЬИ-Тпри пл днями датол И 120; III 328, 329
Тпонил хлористый I 319; ill 329—335; V
135, 217, 418
Тпонил хлористый — пиридин I 58; 11 275;
IV 63, 87, 88
Тпоокисн бутенов-3 III <Н35
Тиосалициловая кислота II 409
Твосемнкарбазнд II 329; ill 335, 369
Тпоуксусияя кислота I 82; III 66, ЗЗб —З4р;
IV 264
калиевая соль III 340; IV 261
Тнофеи 1 21’2: II .33, 37; 111 ИО, 293; IV 67
68. 85
3,4-Тпофсндиальдегид I 278
М-Тнофенкарбоиовая кислота 111 а?2
«-Тиофеновый альдегид 1 ! 91, 192; II /96. 297
[3-Тиофен оный альдегид I 192; III 272
Тиофенол I 10Q, 184, 402; IV 221
Тцофеполдт натрия Ш 340, 341
Тиофосген III 323
69 L
п-ТиоциананиЗол IV 157
4-Тиоциананилин I 379
Тиоцианат натрия Ill 341, 342
5-Тиоцианацтраниловая кислота 1 379
5-Тноциан-3,4-бензпирен 1 379
4-Тиоццац-2-ме'Гпланил11Н 1 379
] 5-Тиоцианметилхолаитрен 1 379
Тиоциановая кислота II 133
L-Тирозмн Н 22, 32, 423; 111 308
L-Тирозин гидразид V 419
Титан треххлористый V 419
Титан четырехфтористый 1 196
Титан четыреххлористый III 342—344; V
185, 420
Титан четыреххлористын — триэтилалюми-
ний III 343
Тиффено перегруппировка И 416
N-Тознламинокислоты III 366
Тозилаты 1] 387, 388; HI 108, 109
Тозилгидразоны 11 38,3, 384'
N-Тозилглицина этиловый эфир И 273
N-Тозилиминоуксусной кислоты н-бутпло-
ный эфир ] 11 344, 345
о-Тозилоксибензойной кислоты метиловый!
эфир III 161
Тозилхлорид см- Н-Толуолсульфохлорид Ш
345
а-Токоферилфенол И 15
и-Токоферол 11 15
о-Толидин IV 96, 97
н-Толилборная кислота V 233
н-Толплгидроксиламин III 226
о-Толилизонитрил 1 163; II 327; [V 43, 44
86
н-Толилкарбинол IV 66
п-Толплмеркурхлорид III 192
л-Толилтиомочевина III 34], 342
Толилуксусная кислота V 262
N-о-Толилформамид 1 164; II 327; IV 44, 86
н-Толплхлорметиловый эфир И 307
l-fi-Толилциклопрочанол V 175
Толленса реактив III 345
Толугидрохинон III 441
о-Толуидия I ‘213; 11 145, 146, 227; V 34
.и-Толуидин I 213; II 146
н-Толуидин 1 368; II 146, S93, 348; III 341
342; V 33, 285
сульфат III 341
Толуидины I 213
п-Толуил-о-бецзойная кислота 1 44
о-Толуиловая Кислота I 30
амид III 74, 7о
нитрил II 463, 464; III 74, 75; V 336
«-Толуиловая кислота 1 30
хлорангидрид I 381
Толуиловые кислоты III 202
о-Толуиловый альдегид III 31: IV 106, 247
«-Толуиловый альдегид 1 51; II 242; IV 66
Толуол I 51, 151, 170, 213, 278, 280; II 84,
143, 144, 169, 240, 421, 434; III 154, 164-
IV 122, 174; V 262, 384
Толуолдиизоциапат III 345, 346
бис-(«-Толуол сульф амид)-ртуть III 346, 347
Толуолсульфамиды II 105; V 232
п-Толуолсульфиноной кислоты натриевая
соль ] 317; III 192; IV 221
л-Толуолсульфокислота 1 9, 10, 84, 89, 90,
98, 119. 274, 283, 284, 286, 318 319, ,362,
373, 374, 438; Л 21—24, 217, 249, 291. 314,
315; 111 106, ] 18, 347-354; IV 22, 190 ] 97,
251, 252, 256, 257; V 29, 207, 305, 337, 349
368
ангидрид 111 303
натриевая соль И 34
Толуол сульфокислоты п-нитробензилоиый
эфир Ш 354, 355
н-Толуолсульфонат серебра I 327; 111 354,
355; V 421
«-"Голуолсульфонилази д (тозилазид) lit
355-357; V 91, 232, 421
И-Толуолсульфонплантран[[ловая кислота
Ill 363
н-Толуолсульфоиилгидразин * I 206, 207
281; II 383; 111 357 — 360; V 423
2-(н-Толуолсуль±ю1[ил)-дигидроизоцндол I
130
1- [н-Толуолсульфоннл! -4,5-Диметил-Д4-пи -
перидии -2-карбононая кислоты «-бутило-
вый эфир 1 225
1 -О-п-Толуолсульфоиилицозит II 68
н-Толуолсульфонилметилнитрозам ид см.так-
же Диазометап 1 243, 244; II] 363; V 92
п-Толуолсульфонил перхлорат 111 360
2-«- Толуолсульфонилэтцлхлорформиат 111
360,- 361
п-Толуолсульфохлорид I 206, 207, 317, 427;
II 247, 250, 412; Ш 361-367; IV 221, 253;
V 193
н-Толуолсульфохлорид — дийетилформамид
III 367
н-Толухинол III 226, 227, 441
Толухнион И 227; V 485
Томат [[дин I 22
Тория двуокись III 367
Тотарилметиловый эфир V 245
Тота рол V 245
Трегалоза II 252
0-Треоза-2,3-моноацетонид II 49
D,L-Tpeoi[HH 1 93; III 181
Треххлористып азот 111 367, 368; V 429
мстря/с «с-(Трех хлор истый фосфор)-никель
(0) III 368, 369
Триазабензантрацен II 365
сидыг-Три азин IV 75; V 430
силнн-Трназол II 121
1,2,3-Триазол III 369
1,2,4-1 риазол 1 30; II 329; III 369, 370; V 439
Триазолидины IV 125
Триалкилбораны III j 19
Й,4,6-Тр!!аллилфенол II 131
Трнамантан V 17
2,4,3-Триаминоннтробензол II 409, 410
2,4,6-Триамино-сил1.и-триаз1щ (меламин) I
419, 420
Триамцинолон 111 44 —4б; IV 8/
Триамцинолон ацетон ид-21-фосфат IV 193
1,3,3-Триацетцлбензо,|1 II 333
3,4,6-Три-О-ацетил-D-глюк аль II 452
2,3,4-Три-О-ацетил-6-О-трифеиилметял- u-D-
глюкопиранозид V 450
1,1,1 -Триацетилэтан V 560
1,2,4-Триацетокспбензс1л V 484
1,2,4-Триацетоксцнафталин 1 114; 111 20; V
485,
1,2.3-Трпацетоксппентан IV 206
Трцбеизамид V 256
3,5,6-Три -О-бен Зил-2-О-мети л-D-глюконо-у-
лактон 1 133
3,5,6-Три-О-бензил-2-О-метил-Е>тлюкофура-
иоза I 133
Трибензилсилан III 131
Трпбензилхлорстаниан 1 95
2,4,б-Триброманпл11п II 312; 111 64
ю-Трибромацетофено и III 370
2,4,6-Трибромбецзойная кислота IV 97
1,2,4-Трцбромбензол V 61
Трнбромметиллптпй V 185
бис-,(Трибромметил)-ртуть V 430
2,4,6-Трпбром-4-метплциКлогексадпенов-1 I
360
2,4,6-Трябромяитробензол II 312; ]П 64
2,3,5-Трцбромтиофен IV 218
* В т. т. I —IV реагент был неточно назван
«п-Толуолсульфонилгидразид»,
692
Трибромуксусной кислоты натриевая соль
V 430
1,2,3-Трт1бром-1-Фенилпропан III 121
2,4,0-Трибромфенол V 431
Три-н-бутиламип II 225; 111 370
1,2,4-Трн-треш-бутилбецзол, I 290
Три-етор-бутилборан И] 37J
Три-н-бучилборан I 251 — 263; III 370, 371
Три-н-бутилбороксин III 371, 372
Три-трст-бутилкарбинол I 176
Три-н-бутилстаниан Ill 372, 373; V 184,
431
2,4,6-Три-трст-бутилфеиол 1 411; II 102
Три-м-бутилфосфат IV 84
Три-«-бутилфосфии I 257; III 374, 408; V 299
Три-н-бутилфосфина окись I 258; III 374,
375
Три-н-гексиламин III 159
Три-н-гексилборан III 379
Три-м-гексилэтиламмония гидроокись III 375
Триглим I 29р; III 155, 375
Тригонеллин II 65
Тридегидро- [18]-аннулены III 270
Тридекановая кислота И 319
Тридекановой кислоты нитрил III 160
Тридецен-10-ин-12-овой-1 кислоты метило-
вый эфир 1 24]
Тридифенилкарбинол I 429
Триизобутил алюмин ий I 275; III 375, 376
Трпизопинокамфилбораи III 376, 377
1,3,5-Триизопропилбензол III 377
2,4,6-Триизопропилбензолсульфохлорид III
377
Триизопропилуксусной кислоты метиловый
эфир I 165
Триизопропилфосфит 111 377
2,4,6-Трииодфенол II 47
Трикаприлметиламмония боргидрид Ш 303.
7,J 1,12-Трикето-Де-ланостен III 74
2', 3',5'-Тримезилоксиурндин I 101
Триметил-2,5- Н-2,5-азепинДион I 27, 28
4,6,8-Триметилазулен I 124
4,6,8-Три мети л азулен и я борфторид I 124
Триметиламин И 12; V 300
Триметиламина окись III 377, 378; V 432
Тпиметиламинборан I 33; III 378, 379
Ы,Ы,Й-Триметиламмония гидроокись V 390
3,4,5-Триметиланизол И 239
3,5,5-Триметил-3-ацетокси-1-пиразолин III
216
1,2,3-Три метил-6 - ацетокси циклогексен III
176, 177
2,4,6-Триметилацетофеноноксим II 264, 265
О-(2, 4, 6- Триметил бензоил) - гидроксиламин
III 379, 380
2,3,5-Триметил-1,4-бензохинон 1 28; III 427;
V 14
Триметилборат Л 381; III 380, 381; V 432
Триметилборокснн II 381
4,4,6-Триметйл-2-вииил-1,3-диобсаи II 291
3,5,7- Триметил- 1,3-дигидро-2- Н-азепинон-2
III 315
4,4,6-Триметил-1,3-диоксан И 291
Триметилена окись III 381, 382
2, Г-Триметиленбецзантрон-10 11 364
1,4,5,8-бас- (Триметилен Кпиридазино-
[4,5-</]-пиридазнн I 208
1,4,7-Триметиленциклононан V 329
Триметилиодстаннан 111 387
1, 1, 5-Триметил - 2 - оксим.етилциклогексен-5
111 274
1,1,5-Триметил-2-оксчметилци клогексадиен-
3,5 111 274
Триметилоксония борфторид 111 382; V 433
Триметилоксония 2,4,6-тринптробензолсуль-
фонат III 382; V 433
1,1, Ю-Триметил-Д’-окталон-2 II 265, 266
Триметилолэтан III 464
2,2,4-Триметилпентан (изооктан) I 188; 11
317; III 324
2,4,4-Три мстил пентан аль V 534
2,4,4-Триметилпентен-1 V 534
3,5,5-Триметил-2-пиразолин HI 216
2,4,6-Триметил пиридин см. сияя-Коллидин
2,4,6-Триметилпирилия перхлорат 111 291
Триметилсилан III 382, 383
Триметилсилилазид III 383
бис- (О, N-Триметил сил ил)-ацетамид III 383,
384
N-Триметилсилилацетамид III 384, 385, 391
1,2,3,4,6-пентакис- (О-Триметилсил ил)-гл ю-
коза 111 384
1,2,3, i-тешракис-О- Триметилсилилглюкоза
111 384
1-Триметилсилил-1,4-дигидропиридин III
382, 383
быс-(Триметилсилилдихлорметил) ртуть V 434
бис- (Триметилсилил)-натрийамид III 385,
386
1-ТриМетилсилилпропин-1 V 434
1-Триметилсилилпропиниллитий-З V 434
Триметил сил ил хлор карбен V 434
О-ТриметилсилильнЫе эфиры I 189
Трнметилсульфоксония иоДиД III 386
Трнметилсульфоксония хлорид I 341
Триметилсульфонийиодид Ш 386; V 294
Триметилсульфония галогениды 1 339—341
2,2,6-Триметилтетрагидропиран III 142
Триметил-(трифторметил)-станнан III 386,
387; V 436
Триметилукусная кислота 111 387; IV 55;
V 358
анилид IV 58
дихлор .метиловый эфир IV 55
хлорангидрид II 173; III 387—388
Триметилфениламмония трибромид см. Фе-
нилтриметиламмония трибромид III 388
2,3,5-Триметилфенол III 429
2,4,6-Триметилфенол (мезитол) I 412; III
428, 438; IV 125
Три метил фосфит III 388—390; IV 133, 134;
V 98, 223, 436, 516
Триметилфосфита — метилмеди комплекс V
438
3,5,5-Триметил-2-у-хлоркротил-Д2-Циклогек-
сенон-1 II 266
Триметилхлорсилан 1 189; III 383, 384,
391; V 77, 434, 439
3.5,5- Триметил цикл о гекс ан ди он-1,2 11 45
2,2,6-Трнметилциклогександион-1,4 111 352
1,3,3-Триметил циклогексанол 1 133
3,3,5-ТриметилциклогексанолЬ] III 375, 376;
TV 133
3,3,5-Триметил циклогексанон 111 375, 376;
IV 133; V 360
2,4,4-Триметил циклогексаноны II 45
2,4,4-ТриметилциклогеКсен-2-он-1 II 45
2,6,6-Триметилциклогептадиеи-2,4-ол-1 1118
3,7,7-Триметилциклогептатриеи-1,3,5 1 118
Триметилциклооктиламмонийбромид I 56;
IV 49
2,4,4-Триметил циклопентанон 1 115
1,3,3-Триметилциклопропен-1 III 359
3,4,5-Триметоксибензальдегид V 251
3,4,5-Триметоксибензоилхлорид V 251
3,4,5-Триметоксибензойной кислоты мети-
ловый эфир Ц 232
1,2,4-Триметоксибензол I 251
Триметоксиборгидриднатрий III 391
1,3,3-Триметоксибутаи П 272
2,2,2-Триметокси-4,5-диметил- 1,3-диоксафос-
фолен (диацетила и триметилфосфита
аддукт) V 98
2,4,2'- Триметоксн- 5-хлор-6,3'-диоксибензо-
фепон 111 205
693
%. 4,6-Тр|1НИтроанплцл II 31
2,4,(1-Трниитробе(|Зойпая кислота III 24,
391; IV 12
1,2,4-Трииитробензол ill 423
J,3,5-ТрилнтробеггЗол ii 258; ill 391; IV 97;
V 213
”,4,6-Трпнитро-,п-ксилол II 58; 111 236
2,3,4-Трннптротпофен IV 98
2,4,6-Трш-)Птротолуол II 58; HI 236, 391
Три-ц-ннтрофенплтиофосфнт III 391
2,4,7-Трниитрофлуоренон 1 137, 421; 111
310, 392
гидразон III 274
2,5,7-Трннитрофлуореноп 11 235
Триоксаадамантзн HI ,39
3fj, au, 6а-Триокснандростанои-17 HI 4?,
2,3,-1-Трпокспацетофенон IV 298
1 Ip, 17ц,21-Триокси-3,20-дикето-5«-прегнан-
21-ацетат II 200
3|3,5(i, 14₽-Триоксипрегпанон-20 IV 273, 274
!), 10,18-Трпокспстеарпновая кислота IV 90,
91
1,2,4-Трн-ф-оксиэтил)-бензол I 290
Триптамин III 170
Трит индан А' 197
Триптпцон I 104; IV 116
D, L-Трнптофан II 306
L-Триптофан 1 301; И 423; III 21
ацетат И 128
метилоного эфира хлоргидрат Ill 265
сгнил-Трптиаи IV 69; V 94
Тритид- см. Трифеиилметил-
Тритиловый спирт см. Трифенилкарбинол
Тритон В ] 142; 1! 2(j8, 27V |Ц 310, 392 —
394; V 54
1,2,3-Трпфенила.зулеп V1 7
Трифенплакриловой кислоты этиловый
эфир И] 401
Трифолилакрилонитрил (Р.З-дифенилкорич-
ной кислоты нитрил) I 63
Трифен [1ЛаЛ1Омии ий III 3 98
Трифениламин 11 42, 155; Ill 407
Трифениларспп HI 69, 407
окись III 69
1.3,5-Трнфеиилбензол Ш 136
Трифенилбор III 398
Трифеиилбораксол IV 31
Трнфенцлборат III 373
ТриФенплбромметан III 394
Трпфснилвпсмутиц 111 407
Трнфенилднбромфоефоран см. Трифенил-
фосфиндпбромпд III 395
Трпфенилен I 127; 111 50, 244; V 33
ТрифеннлкарбиноЛ I 234 322- II 328'
III 29, 30, 394
Трнфенилметан 1 16, .322, 339: II 184. 328'
III 296, 407; V 29
Трпфеннлметансульфенхлорид 111 305
Трнфеиил метил-ан нон I 16; Ill 407
7-(Тр11феннлмет11л)-ац1спафтен III 398, 399
Трифен илметплборфторнд П1 399—401;
V 442
б-Трифеиилметил-Н-глюкоза 1 132
Трифеиил метилкалий И 356: 111 395 — 306
Трифенплметилклрбония борфторид 1 124
гексахлорантнмоиат III 296
Трифенилметилкарбинол II 182
Трифен илметиллитий (см. также Трифеинл-
метил-анион) И 184, 356; III, 396; V 443
Трифен нлмстнлн атрий (см. также Трнфе-
иплметил-анион) И 36G; 1И 339, 397 — 399
Трнфенилметилметилопый эфир II 356
й'-О - Трифенилметил-3' - О-л-нитрофенокси-
карбопилтимпднн V 525
Трнфопилметилоные эфиры HI 394
5,5,й-Трнфенил-2-ме'П1лпентеи-1 II1. 398
Трифеннлметилперхлорат п Трифенилме-
ТИЛборфторИД 111 399 — 401
б-О-Трифец пл метил-1,2,3,4-тетра- О -ацетйл-
[i-D-глюкоза I 131, 132
>'-О-(Трифеи11Лметил)-т11миД)1н II 467; IV
192; V 525
Трифенилметилфосфонпйбромнд 1 174; III
кЗ.и-Трпфенплнафтатн 111 136
2,2,2-Трифеипл-1,2-оксафосфолаи V 443
1,1,5-Трифекилг|ентадиин-2,4-ол-3 11 245
5,5,3-ТрифепИлпептен-1 III 398
1,3,й-Трифенпл-2-п)|разол||Н V 488
Трпфенилпрогтаргплфосфоипйбромлд V 444
1,1,3-Трифе1[илцролен-1 I 162
1 АЗ-Трифепилцропенон I 326, 337; II 107
ct, а, ₽-Трнфеиилиропиоиитппл | 55
2,3.5-Тряфеинлрезорцин V 227
Трифенплстаннаи III 401, 402; V 444
Трнфеиплеурьма I 237; 111 407
2,-1,6-Трпфег-тНл-1.3.5-трпази н II 7
1,5,6 -Трифеи пл три цикло- L,3,1,0,0 й,6]- гекса-
нон-3 V 277
Трнфеиплсксуспая кислота II 166, 184- Ш
3 96
Трифепилуксуспын альдегид П 182
2; 4, (йТрифенилфеИоксил V 227
Трпфенилфосфазипы V 306
Трпфепнлфосфат V 403
Трифенплфосфпн I 18-1, 238, 415; II 116,
293, 294, 307, 308; III 402 — 413;
IV 157. 158; V 171, 300, 445—448, 454
Трпфенилфосфпна окись V 44а
ТрцфгОН1|лфос<|1И11Д1[бромнд III 413—415; V
Трпфеиилфосфпндифторид V 447
Трифенилфосфпидихлорпд III 413 — 415
бм(?-(Трпфе1[11Лфосфин)-ириднйтрпгцдрид V
44/
бис-(Трифеиилфосфи и )-н и кельдп карбонил
III 415
бис-(Трифен и лфосфин)-нш<ельдпхлорнд V
448
трис,-(Трпфе|111лфосфин)-родийхлорид 111
415; V 448, 54]
mpue-(Трифенилфосфин(-рутенийдихлорид V
434
Трифеннлфссфин — углерод четыреххло-
ристый III 415—416: V 455
(Трифеиилфосфин)-хлоркарбоннлродий V
456
ТрифенплфОсфИт III 329. 416, 436; V 403, 456
дибромид III 416; V 456
иодметилат 1Ц 4(6, 417; V 456
6w-( Трифен нлфосфит)-иикельдикарбон ил I
3-1
ТрифенИлхлорметш! II 366; III 397, 417 —
419; V 456
Трифенилхлорстаппэи 1 35: III 419 — 420
1 • 2,3-Трпфеиилцнклонентадпеп I 326, 327;
1^ 107
2,3,5-Трифеннлцпклопентаднен V 227
Трифеиплпиклоиропец II J70
ноши-Трифен илцнклопропенплбромид II 169,
I- (I, 2, 3- Трифепнлцикяопропен-2-11л)-3-диа-
аоиропанон-2 V 277
ТрифснилцпклОпропеиилперхлорат 1 408
Трпфенилэтнлена окись II 182, J 94
Трифторамин (азот трехфторпстый) I 402;
II1312
Ы’рифторацетилазулен Ш 440
- 6ttc - (Трлфторацетцл) гиДроксиламнн
Трифторацетплгнпогалогеивты 111 421
N-Трнфторацетилимидазол III 421
а.а.ц-Трифторэцетофепон I 404; III 422
1,1,1-Трифтор гептан 111 263
Трифториодметан Ill 422; V 214;
694
2.2-б(;с-(ТрифторМ!?тил;-вцннлидентрифе-
нилфосфораи V 239
Трнфторметплгииофторит V 457
бкс-(Трифтормстнл)-диязомета)1 II! 239
], е-б^с^ТрпфторметилТлпХлорэтплеи см.
1,1,1, 1,4,4-ГеКсафтор-2,3-дпхлорбу1ен-2
Трнфторметнлподпд ем. Трифториодмстан
Трифторметилировапие III 42а
N, У-бис-(.Трифторметил)-карбам1шоилфто-
рид И 122
6а-ТрцфтормеТ1!Л-А4-3-кетостероиды III -123
2-Трнфторметнл-4-Ш(Тр(>ф(-’иол III 116
б/нНТрифторметилУтрпхлормети л карбинол
V 184
Трифторнадуксусная кислота 111422—431;
V 458
Трифторнадуксусиая кислота — бора триф-
торид V 458
(Трифтортно)-бепзол III 262, 266, 267, 431,
432
Трнфторуксусная кислота I 9, 295, 329; II
21, 249, 302, 4’26: Ill 432--434; IV 9,
158; V. 27, 323, 373, 459, 524
катриспая соль V 373
;1-н трофеи иловыц эфир II] 434
серебряная соль 11 32, 39, 60; 111 434, 435
фениловый эфир III 435, 436
Трифторуксусный альдегид IV 190
Трифторуксусныв ангидрид III 420, 436 —
444; V 458, 484
<5»с-(2,2,2-Грифторэтнлфхлорфосфаг V 462
Трихлорацетнлпзоцианат V 460
Трихлорацетонитрил III 444
Трихлорбеи зол 1 364
Трихлоризоциапуровая кислота V 461
Трнхлорметансульфобромлд III 444 — 445
Трихлорметапсульфохлорид III 445
2-(Трихлор мети л )-бп Никло- [3,3, 0 Фонтан [V
133
Трихлормстилдиэтилфосфоиат 1 434
Трихлормсти л л ит nil I 416, 417; 111 445, 446;
V 184
бисфТрихлорметилуртуть V 431
Трихлорметилеульфепхлорид IV 247
2,4,6-Трихлорпирнмидпн IV 59
Трихлорсилан III 46!
1,1,2-Три хлор-1,2,2-трпфторэтац (фреон 11.3)
I 73, 76; 11 463; 111 267, V 67
Трихлоруксусная кислота I 293, 426; 111
223, 313, 44 6; V 461
натриевая соль 111 446 — 448; V 462
пентахлорфепиловь|н эфир V 348
этиловый эфир III 448, 449; IV 53
б«с-(2,4,5-Трихлорфенил)-|<арбопат V 473
2,4,5-Тркхлорфенол III 449; V 473
Трпхлорфторметан (фреон 11) I 168; 111 198
Трнхлорэтан I 417
2,2.2-Трихлорэтапол V -163
Трихлорэтилен I 99; III 44 7, 4 18
бис-12,2,0-Трцхлорэт пл)-хлорфосфат V 463
и-Тртщианш(пил-\^-Д1шетг1ла(1НЛНи 1 305;
III 317
З-Тридпаквинилпиррол Ц] 317
9-Трицианвииилфенантреи III 317
ТриДиклип III 460
грд:,ят раненое-Трицикл о- [5,3,0,02’и1-декади-
fetr-4,0-дион-3,8 III 123
бис-этилснкеталт. I 321
Трпцикло-[7,1,0.01 ’"l-декан II 154
Три цикл о-[3,2,I .О4,2" |-Декан V 4э8
ТриЦикло-ГЗ,2,1,0'Тп]-октан II 140
Тр11ЦИКло-[3,,3,0.02>с]-ок-гап II 243; V 533
Трициклоокген I 65
ТриИнклохипазолнн II 365
Триэтаноламин ; 202; III 449, 450
Триэтилалюмпниц I 428; II! 166, 4,">0, 451;
V 463
Триэтпламнн I 19, 83, 86, 102, ЮЗ. 124,
ЗЮ, 381, 41 1, 417, 432- 11 17 3. 335; Ш
22, 126, 234. 433, 451 — 158; IV ИЗ, 161,
196, 233, 254, 257, 264. 267. 268; V 30, 49
93, 151, 22], 236, 237, 300, 464, 496, 301,
522, 529
Триэтиламина хлорплатпнат III 157
Триэтилевгликоль I Ю9, 20.3, 206, 295,
37], 382; IV 224, 225
Трнэтидендпамин см. 1,4-Диазабнцикло-
[2.2,21-октан
Трпэтилептетрампн III 458, 45D
Триэтилкарбпнол I 234; V 83
Триэтнлоксония борфторид I 361; III 459 —
461, 467
Трнэтилсилан III 461, 462; V 468
Триэтил-ГФтрикарбоксилат III 462, 463;
IV 23
Триэтилфосфат 111 463
Триэтилфосфин Hl 408
Триэтнлфосфит I 270, 431, 433; II 100; III
463—468; !V 111, 1112; V 348, 468
Трнэтилфосфоенолпируват HI 4G9
Трпэтокси ал юмогпдрвдн атрий III 469
1,1,4-Тр11этоксисексадиин-2,5 V 20]
Тропцлидеи см. Цнклогептатриец-1,3,5
Тропилия борфторид 1 123, 124; III 469;
IV 108 109, Ю<)
Тропилия бромид V 514
Тропилия гексахлораптимонат I! 296
Тропилия перхлорат I 408; 11 238; IV 131
Тропилия соли III 399, 400; V 72
Тропин II 106
Тропинок I 86
Тронолон I 414; И 83; V 357
Трополон-4-карбоновая кислота [II 90
Трополоны I 251
Тропой II 5; 111 247, 248; V 9
Тропов железодикарбоц ил три фенил фосфин
И 5
Тропонжелезотрикарбонил II 5
Тубовая кислота III 15
(х)-Туйбпсен Ш 180, 288
Уабагснян V 477
Уабаин V 177
Уайлдса--Нельсона восставоьлен не 1 108,1 09
Углеводов ацетониды V 3]
Углерода двуокись V 2Й6
Углерода окись V 457, 471
Угольная кислота
бензилового эфира гидразид IV 5,6
/ирст-бут11л-л-Н11трофениловь1й эфир
(/71ре/н-бутпл-!1-11нТрофен11Лк.арбона,0
V 473
/Лрсш-бутплового эфира азид Uripein-
бутплазцдоформиат, азодикарбопоной
кислоты шреш-бутнлежып эфир) I
12; III 379; IV 6, 8; V 471, 473
w/тн-бутплового эфира гидразид (гид-
разпнкарбоновон кислоты трет-бу-
тнловы!) эфир) 1 12; IV 6,7
жреж-бутилового эфира фтораш’НДрид
V 473
nipfBi-бутнл центах;! Орфе и иловый эфир
V 473
П1рслг-бу’Тнл-2,4,5-трихлорфен11Ловын
эфир V 473
гексадедилопый эфир (гсксадецилфор-
мват) V о37
дп-п-питрофеииловый эфир IV 7,8
дпметилоный эфир см. Ди метил к арбойзт
дифенил метилового эфира азид (бенз-
гпдрилазпдоформиаг) IV 8,9
метилового эфира азид IV 9—11
695
«-метоксибензилового эфира азид IV 9
пецтахлорфениловогэ эфира хлорангид-
рид (пентахлорфецилхлорфорынат) V
473
толилизопропиловЫе эфиры ] 280
2,4.5-трихлорфснилового эфира хло-
рапгидрид (2,4,5-трихлорфеннлхлор-
миат) V 473
фепил-трет-бутиловып эфир IV 7
этилового эфира азид IV 9 — 11; V 475
этилового эфира гидразид IV 11
Уксусная кислота I 295; V 8, 32, 38, 210,
261, 368, 475, 4 86
80%-ная V 476
бензиловый эфир II! 216; V 395
N-бромамид, см- N-Бромацетамид
mpem-бутиловый эфир (mpeoi-бутилаце-
тат) V 230
ди-mpem-бутилфен иловый эфир см.
Ди-гпрст-бутил фен ил ацетат
изобутиловыц эфир IJI 154
калиевая соль (ацетат калия) 11 430;
IV 12, 13
«-крезиловый эфир 111 312
натриевая соль I 4 22; III 313; IV 13—18;
V 479
никелевая соль, тетрагидрат IV 18
«-иитробензиловый эфир IV 17
n-нитрофеииловый эфир V 479
н-октиловый эфир I <6
фторангидрид I 75, 76
серебряная соль (ацетат серебра) 1 76;
IV 18 — 20; V 479
фениловый эфир I 116; II 30; IV 20, 21
фторангидрид I 75,76
хлорангидрид (ацетил хлористый) I
280, 304, 383; IV 21; V 29, 479, 480
V-хлорпропиловый эфнр Ш 347, 38]
циклопрог.иловый эфир см. Циклопро-
пилацетат
цинковая соль III 158
этиловый Эфир 1 294, 310, 325; Н 393,
440; III 154; IV 238
Уксусцомуравьинып ангидрид IV 21, 22;
V 480
Уксусиофосфорный ангидрид V 482
Уксусный альдегид I И, 66; II 346: III 104;
IV 22
моноацетат II 349, 350
оксим см. Ацетальдоксим
диметил ацеталь (1, ]-ди метоксиэтан) V
478
Уксусный ангидрид 1 294; IV 2 2, 206; V
39, 130, 483
Ульмана реакция I 376; II 231, 235 236;
III 307
УнДекадиен-1,2 I 175
Ундекановая кислота 11 298
Д,0-Ундеиеновая кислота 1 60, 265, 315,
II 384
со-Ундеценовой кислоты метиловый эфир
1 146
Ундецилизоцианат 11 360
Д10-У1[дециновая кислота I 60
З'-бутиниловый эфир II 228
Урамил 1[ I 24
Р-Ураминокротоиовая кислота II 325
Уранилацетата днгидрат IV 266
Урацил 5-альдегид V 226 — 227
Уреиды V 522
Уретан (этилкарбамат) I 283; II 462; IV 22,
23, 180; V 187
Уретаны ] 10.5, 134
Уридин III 418; IV 25 8; V 526
Уридииглюкозоднфосфэт (кофермент) III 418
Уридшцб'-фосфат Ц1 144
Уридин-3'-фосфат-2',5'-Диацетат lj] 319
Уротропин I 189
Урушвол II 357
(i)-Усн1!новая кислота II 102
Фаворского перегруппировка II 257; II] 456
транс, трине-фарнезол V 121, 435
метиловый эфир V 221
Фелинга жидкость IV 24
гг-срелландрец II 161
Феназины V 333
Фенантразин IV 40
Фенантрен 1 10; II 36, 238, 246, 413, 414;
III 6, 42, 43, 101, 198; IV 24, 179; V 138
восстановление I I [0
сульфирование Ill 281
9-Фенантренальдегид I J35; III 34
4-Фенантренизоцианат III 442
4-Фенантренкарбоновая кислота III 442
Фенантренхинон 1 27; II 278; III 61, 222,
388; IV 24, 179; V 488
Диметилацеталь II 2/8
Фенантренхинон-2-Карбоцовая кислота II
406
Фенантриднн И 466
Фенантридоц I 27
Фенантрол-1 III 50
1, 10-Фенантролин V 112
Фенацилбензоат III 340
Фенацилгндразин 1 208
3 (и 4)-Фенацидпиридин I 280
Фепацплтрифенилфосфонпйбромид III 410
Фенетол I 399; IV 24, 25
З-ФснилЛ-азабицикло-11,1.0]-бутан V 140
5-Фенилазелаииовой кислоты динитпцл IV
50
фенилазид 11 416; IV 25 — 29; V 473
ц-Фенилазоаннлы ! 67
я-Фенилазобензоил хлористый I 41; III
330; IV 29
«-Феи ил азобензолсульфохлорид IV 29
я-Фенилазомаленнанил IV 29,30
L-Фенил ал анил-L-глутамин ил-L-гл утами л-
L-глутамиц II 467
D, L-Фенилаланиц 1 222; Ц 44, 289 306’
IV 93, 94
L-Фенилаланина фталоильное производное
III 453, 454
СЪ-Ь-Фенилаланин-2,4,5-трихлор фен о л I
347
Фенилаллен III 289
1-Фенилаллиловый спирт 111 121
а-Фен илам йн о-сю-дифен ил уксусная кислота
111 366
d,l-1,2-б«о(фениламино)-1,2-дифеНЧлэтзн IV
зе
1-Фенил-З-амицопиразолоя-5 IV 34
(л-)-1-Фснил-2-аминопропан III 153
2-Феццламицоэтамол, производные V 236
1-Фен илаценафтилен V 68
1-Фен ил ацетил ацетон I 392
Фен пл ацетилен I 59, 136; 11 47, 230, 241
404; 111 34, 383; IV Ю, ] 71, 201, 20s 272-
V 280 ’ ’
Фенилацетилены V 373
Фенилацетилизотиоцианат 1 49
1-Фепил-6-ацетокси-1-циклогексен III 176
Фенил ацетонитрил I ИЗ, 429- И 67 211
288; III 411; IV 28, 239, 242; V 290’
N-Фенилбеизамидия 1 48
Фен илбеизгидр ил кетон V 392
З-Фснил-5-бснзилгидацтоин II 306
Феиилбецзилкетон 11 436
2-Фенилбензпмпдазол III 138
Фенилбензоилдиазометан III 185
N-Фенил-N'-бензоилдиимнц iv 30
Фенцлбензоксазол II 440
1-Фенилбепзотриазол IV 28
Феннлбортгая кислота III 380, 38Г IV 30,
31; V 131, 488
696
2-Фен ил-1-бромацетплен II 245. 404
2-Феи ил-1 -бромбутан 1 56
Фенпл-1бромдихлорметил)-ртуть IV 53
транс-I-Фепилбутадиен IV 52, 200
2-Феиилбутадиен IV 200
I-Фенцлбутанол-З 1 125
)-Феинлбутанон-3 I 125; II 289
1-Фецилбутен-1 1 56
2-Фснилбутен-1 I 56
2-Феиилбутен-2 I 56
4-Фенилбутен-1 V 36S
феиил-гнрет-бутиловый эфир см. гпрет-
Бутилфениловмй эфир I 236. 322, 323
б-Фецилвалернановаи кислота II 435; III 392
б-Фенилгександцон-1,6 II 272, 273
3-Фенилгидантоиц 11 306
Фенил гидр азиды 11 224
Фенилгцдразин I 284, 285; И 294; 111 160;
IV 23, 31 -36; V 488
Феннлгидразоны I 74
N-Фенилгидроксиламин I 36: II 226; IV 221
Фенилглиоксаль 1 203, 327; II 419; III 247;
V 139
Диэтилацеталь 11 454
моногидразон I 208
Фенилглиоксиловая кислота 1 103
этиловый эфир 11 372; Ill 247
р-ФенилглццидилоЕзой кислоты этиловый
эфир 1 112; 1Н 408
fi-Фепнлглицидный альдегид I 142
Феипл-к-децилсульфид И 148
Феи и л ди азометан IV 36, 37, V 489
Фенилдпазония борфторид 1 122
нитрат I 23
л-ФенилДиазоиия сульфонат II 431
ФенилДиазония хлорид 1 122; IV 31
1-Фенил-Д'-диалнн см. I-Фенил-3,4-Дигид-
роиафталпн III 258
1-Фенил-1,3-диацетоксипропан III 298
2-Фен и л-1,3-ди ацетокси пропан III 298
Фенил-(дибромхлорметил)-ртуть IV 53
1 -Фенил-3,4-дигидронафталин I 234; HI 258
1-Фенил-4,5-Дигидро-],2,3-триазолы IV 25
Фенилдигуанида хлоргидрат Л 260
Фенилдиимид IV 30
Фенилдиметилметнлкалий II 356
Фенилдинитрометан 1 19
4-Фенил-.и-диоксаЕ1 IV 67
ФенилДихлорфосфат IV 37, 38
ФенилДихлорфосфпн I 4/; IV 112; V 496
о-Фенилендиамин I 221, 223; II 32g; Ш
. 203. 238; IV 38-41, 75, 225; V 235, 264
л-Фенилендиамин V 264
/г-Фенилен-блс-(диметилмалонат) И 36
о-Фенилендиоксифосфортрибромид V 490
О-Фемилендиоксифосфортрихлорид IV 41 —
42; V 490
о-Фенилен-бис-(изомаслЧная кислота) II 92
о,,а'-0.фенИлен-бис-(изомасл^нь1Й альдегид)
III 164
о-Фенилениодфосфат V 491
о-Фениленкарбонат IV 79
бпс-о-Феииленпирофосфит IV 42; V 491
Фенилен ртуть I 366
о-Фениленхлорфосфат IV 42, 43; V 49]
о-фениленхлорфосфит V 491
Фенплизонитрил (изоцианид) IV 43, 44
Фенилизотиоцианат IV 43, 44, 45; V 492
феиилизоцианат I 105, 434; Ц 108; III 21;
IV 45, 46, 187; V 492
N-Фенилимид азодикарбоновой кислоты
IV 46, 47; V 492
N-Фенилимидомуравьиной кислоты этило-
вый эфир 111 37
N-Фенилиминоэтилфосфит IV 47, 48
2-ФенилИНДандион-1, 3 I 69, 391, <112
2-ФениЛинДол IU 139; IV 33, 207, 255, 2о6
Фенилкалий IV 48
о-[Фенплкарбаминоил]-бепзгидроксамовая
кислота 111 364
Фепилкарбнламннохлорид V 500
3-Фен ил-5-карбометокси гидантоин II 306
цис-а-фенилкоричпая кислота II 234; IV
121
этиловый эфир V 517
пхранс-ц-Фенилкорпчная кислота II 437
G-Фенилкорпчной кислоты нитрил IV 239
Фениллитий 1 35, 183; II 139, 193, '280;
III 402; IV 48, 49; V 64, 181
Фепилмагпнп бромистый 1П 380, 381
N-Фенилмалеипнмид 111 63, 315; IV 49
Феиилмалеиповой кислоты нитрил V 21
Фе1тилмалег!ноный ангидрид III 254
а-Фенилмасляная кислота И 364; V 494
ангидрид V 494
нитрил II 211
У-Фенилмасляная кислота I 179: III 32,
134, 19], 330, 439; IV 202, 203; V 345, 365
хлорангидрид III 32
этиловый эфир II 430; IV 236, 240
Фенилмеркурбромид IV 53
Фенилмеркурхлорид IV 53
Феи ил Метан сульфофтор ид V 495
Фенил метилглицидной кислоты этиловый
эфир I 64
Фенилметил-а-дикетон II 418
N,N-ФгниЛМетилпатрийимиД IV 49, 50
1-Фенпл-З-метилпиразолон-5 I 284
2-Фенил-3-метил-2-фосфа-1,3-оксазолнДин V
496
N-Фелилморфолин IV 50,51
Фенилмочевина I 198; IV 45
Фенилнатрий I 280; IV 51, 52
1-Фенилцафталип IU 258
1-Фенилцафталин-2,3-дикарбоновой кислоты
ангидрид I 426
М-Фенил-р-иафтиламип I 383; IV 52
транс-а- Фенил-о-нитрокоричная кислота
III 453
Фенилнитрометан II 288; 111 424
1 - Фенил-2-нитроэта[1 V 451
Фенилноркаран, эндо- и экзо- Ш 401, 402;
V 200
Фенилозазоны II 294, 418
1-Фенил-3-оксипентен-1-ин-4 I 78, 234; IV
268
р-Фенил-р-окснпропионозой кислоты эти-
ловый эфир IV 212
1-Фенил-1-оксициклогексанон-З 11 272, 273
фенил-0-оксиэтилсульфид (2-фенилтиоэта-
иол) III 82
Фен ил-|3-оксиэтил сульфон (2-фенилсульфи-
нилэтанол) 111 82
ш-Фенилпеларгоиовая кислота IV 196, 197
5-ФеиИЛ-2,4-пентадиеналь II 303
6-Фенол-2,4-пентадиеновоЙ кислоты ан-
гидрид II 340
1-Фенилпентандион-2,4 V 165
2-Фенплперфториропен 1 404; 111 422
N-Фенилциперидин 1 104
1-Фенилпиразол III 276, 277
Фенилпировиноградной кислоты этиловый
эфир 1 112
З-Фенилцропанднол-1,2 II 54
1-Фенилпропаиол-1 I 326
З-Фенилпропанон-2 II 308
Фенилпропаргиловый альдегид III 34, 35
диэтилацеталь IV 201, 202
фенилпропцргиловыц спирт 11 176
1-Феннлиропен цис- и транс- I 276; V 304
Ы-Фенилпроппламиды III 147
1 -Фенилпропин-1 I 276; II 436; III 289
{i-Фсичлпроппогидроксамовая кислота V 364
фенилпропиоловая кислота I] 176, 396
производные I 426
697
Р-Фенплнропноновая кислота II 364
1-Феннлпропплеп, цис- и транс- 1 376
у-Феиилпрсн шлянтариая кислота 1 240
4-Фенилсем111<арбазид I 198
2-Фепилсульфцннл'Этацол III 82
п-Фен 11 л сульфон плоен зоил хлорид 1V S2
3-Фещ1лтеофцллин I 05
5-Феи пл-1,2,3,4-тетрахлор-7,7-диметокси-
порборнадиеп V 412
Фенплтиометиллитип V. 89, 496
2-Фенилтиоэтанол ill 82
Фенилтолил метай II 240
о-Фе1шл-о-тол5 иловая кислота II 434
2-Фсннл-1,3,5-триазпп I 356
1-Фенил-],2,,"-триазол V 473
2-Фен ил -1,2.3,2Н-трийЗол III 277
4-ФеииЛ-1,2,3-триатол III 383
<Ьенил-(триброммсТнл)-ртуть IV 52, 54; V
296
Феппл-(трягалогенметил)-птмть IV 52 — 56;
V 497 ' “
Феи в л гр [ । мети л я ммо н и й
бепзолсульфопат IV 58
бромид V 500
пербромид HI 123; IV 56, 57; V 500
этилат IV 57, 58
N-Феннлтри метилацетимидоил хлористый
IV 58
Феии.т-(трпхлормотил)-ртуть ]V 52 — 56
Фенилуксусная кислота 1 63; II 377; Ill 114,
207, 453; IV |Ц
амид I 113; III 260
N-бромамнд III 411
Метиловый ^liiip 1 102; II 23 [
хлорангидрид П 209; HI 330; IV 111
этиловый эфир IV' 24 2
Фенилуксуснып а.'п. дегид I 182: II 54; V 134
4-Фенилурачол IV 17; V 493
п-ФеиплфенЗцилхлорид III 411
4-Фенил-5-фе11ил-’гмино-1,2,3-трпа:юл 111 1 ] 2;
IV 28
л-Фецнлфенол V 301
Феннл-9-флуорг'Ннлк.арбпнол Ill 394
Феиплфосфоновон кислоты дихлорангидрид
(окиси Дп.хлорфепилфосфина) IV 59
З-Феннлфталнд 1 388, 389; II 434
2-Феп11лфталимиД1и1 1 288
Фен нл-о-фторфен ил метан I 237
Фенплфумароиой кислоты нитрил V 21
(Х-Феппл-а-хлорацетофенон (н-фенилфена-
цнлхдорпд) in 411
ЬФепил-з-хлортетразол V 500
Фрнплцпацат V 501
Фен плциануксусной кислоты ятиловып эфир
1 429; IV 2-12
Фенилдшлюгсксан II 110
тра нс- 2-феи пл циклогексан карбоновой кис-
лоты хлорацгидрпд 1 52, 53
1 - Фен н л циклогексанол IV 180
2-Фонилцнклогексанол 1 170
2-Фенилциклогексаион I 170
ЬФенилдиклогексеп III 176
N-Феннл-ГФ-цикло гексил клрбоднимид I 434
-Фенилциклогептандцол-1,2 III 58
З-Фенялииклогептацгш И 416; IV 163
1 -Фепнл циклогептец III 58
Фенилциклоп IV 59
4-Фенплц[1Клопе||Та||Д|[Г)Н-1,2 V 287
Фепилциклопропац I 262; III ‘233, 997,
298; V 84
1 -Фецилц[1КлопропяпнарбО[1оная кислота V
289
нитрил V 289
цнс-2-Фенил циклопропан карбон своя кис-
лота II 360
тра нс-2-<-Ъен ил циклопропан карбоновая ки-
слота ][ 285
2-Фен ял циклоп рои ан карбоновой кислоты
эталоныii -эфир V 141
п < инне-? Феи пл и и кдгл [ропанол II 283
Фец плцнклО|Гропилам1[Н 11 366
( — М-Фе1пыгзга11еулъф|>кнслота V 100
Б-Фенилэгцламиды 1Ц 14/
7.-Фепнл этилам и ii 11 257, 258
с'-Фсиилэтилампн, (/ п I- IV 59, 6(1; V 502
Р-ФенплэтпламШ! IV 68
(-'Ф-ц-Феиплэтилапетат 1П 318, Зра
Фенплэтилбегшоат см. Бензойной кислоты
fi-фепплэтиловый эфир 11 132
Р-Фенилагнл бромистый I 111
Феннл'этнлен гликоль 1] 99, ИЮ
(I - Фенплэтнлиден )-и,1!аиуксусной кислоты
зтплоный эфир IV 246
ц-Феннлэтиловын спирт IV 189
^-([э-Фсиилэтпл)-!, 2, 3,4-тетрагидронафтол-1
V 410
олР-ФеиилэтнлФфсннлУКсусная кислота 111
134
а-Феннлэтил хлористый 111 302, 318, 319
( —Фа-Фепилэтпл хлористый III 318
1-ФеН1[Лэтнпил-8-бромнафтал11н V 68
Феи ид янтарная кислота III 254
Феноксатин 111 259
а-Фенокснацетофенон I 305
Ц-(п-Фепоксибензоил)-пропионовая кислота
1 199
Феноксид-радпкалы II 223
1 -Феноксинафталин II 231
у-(гцФеиоксифепил)-маеляная кислота 1 199
Фе!1окситрти|»епплфосфоннйбромнд 1 184
Фепокснэтилтрцфецплфосфонинбромпд I
184
Фенол 1 48, 49, 143, 282, 295, 377, 399; II 47.
64; III <9, 1 16, 1 80, 381: IV 60, 61, ] 87
209, 210; V 54, 368, 5(10, 501, 513
Фенолы I 192, ]<)3; V 482, 510, 513
восстановление III 168
восстановление’, АгОН->АгН I 434
защита ОН-группы IV 63
окисление 111 226, 227
Фенолят натрия IV 61
Фепотиазпи Ill 467. 468
p-N-Фснотназицпропионовая кислота 111 441
Фентона реагент см. Перекись водорода —
соли н окисли металлов в качестве ката-
лизаторов
Феркеиулпп V 9—1(1
Ферроцен II 11; IV 200
Физера раствоп (для поглощения кислорода)
I 13. 415; IV 61, 62
Физера реагент IV 180
Фнзетии 1 119
Фнллокладеи II 55
Д ‘‘’-Филлокладенола-1 7 бензоат II 55
Фитол 1 114; II 76; 1V 230
Фпхтелпт V 380
Фишера реактив 111 47; IV 62
Фишера синтез индолов Ц1 139
Флаваноны 1 119
Фланопдиолы-3,4 I 362
Флавофен III 162, 163
Флориспл 1V 62,63
Флороацетофенон IV 208
Флороглюцин I |06; II) 23: IV 208, 209
({((С-Флороглкншт III 39
Флуорантрен V 140
Флуорен 1 287, 388, [] 203, 258, 3 53, 370; П1
393
9,(|,-Флуоренднпрсы)ПО|111трил 1 149
N-Флуо’реппл-л-хл<>раннлни I 114
Флуорен-9-карбоновая кислота I 49; II 203
358, 370; IV 63, 64
метиловый эф;;п IV 83—65
Флуоренон I 1 14, 287; II 13; III 393
2-карбоновая кислота II 380
698
9-карбоновой кислоты гидразон 1 200,
оксим III 111; IV 121
Фолиевая кпелотл 111 433,431
Формалин IV (io
Формальдегид 1 300, 402, 403; Il 123, 2Cr’
371; 111 130; IV 65 — 73, НЮ; V 27, 32 3 I s'
503
Формальдоксим IV 72
Формамид II 29; IV 72 —74Л 75; V 504
Формамндиция ацетат IV 74, 75; V 503
шр(дШФормамидо)-мегап IV 75, 76
Форманилид [V 276; V 482
.К'-формиламнпокислоты V J 9’2
Формплацетон 11 334
Формилацстоца натриевое производное 11260
N-Формил-дп-н-бутиламин II 223
зкзо- 1-Формил-8.9-цмс'-Диметил-4,6. 7, 8-геК-
сатидроиндсна 4,7-окись Ш 105
N-Формидимидазол II 121; IV 76
Формилкарбен V 91
2-Форм1М-А1-кетостеропды I 410
Формилметплфосфоновон кисло гы диэтило-
вый эфир V 199
Й-Формнл-З-метоисн-Д^-стероиды I 359, 360
ЗР-Формилокси-ДЛандростенон-1 7 II 188
N-Форм Ил- 1,2,3, 4-ТСТр<1['ИДрОИЗОХИ!1ОЛИЦ 11
331
О)зг'-Формилтетрац.икли11 IV 21
1-Формпл-З-тиоссмикарбазид III 369
4-Формилтроно.г1ои 111 90
5-Формил фенантрон-4-карбоновая кислота
11 80, 81; И1 6
о-Формилфевоксиуксусная кислота V 476
Формилформампдин IV 75
Формпл фтористый I 92; IV 76
Формил хлористый см. Муравьиной кисло-
ты хлорангндрид II 121
Й-Формилцпклогек’сангш 11 332, 33,3
4-Формилцннл<<гексеп V 393
а-Формилянтарной кислоты диэтиловый
Эфир 1 287
Формпминохлорпд IV 188
,Ja-Фор мо ней-11,1 2-днкетс1 холановой кисло-
ты метиловый эфир III 118
Фосген 1 9, 105, 354; И 173; Ш 12 4; IV 7,
45, 76-81. 86. 158, 159. 161, 201: 5’ 437.
41 3, 505, а 2 4. и 2 6
Фосфазины (фосфоразань:) II 419; Ill 411, 412
Фосфин IV 81; V 506
Фосфоннл иодид IV 81, 82
Фосфоп итрил хлорид см. Гекса мор цикло-
тр ифосфазатриен
Фосфора гептасульфид IV 82
Фосфора дииоднд (тетраиодднфоефнн) IV
82-84
Фосфоразаны см. Фосфазпны
Фосфора хлорокись I 47, 305; 1! 327, 328;
III 30,; IV 84—99, 102, 192; V 10, 67,
185, 337, 463. 507
Фосфора хлорокись — пиридил V 507
Фосфора хлорокись — олово хлористое —
пиридин V 50/
Фосфора хлорокись—фосфорн ан кисло fa—фо-
сфорный ангидрид V 507
Фосфор — иодьстоводородизя кислотя IV
90, 91
Фосфористая кислота I 329: V 506
Фосфор красный 11 44. 15: IV 91—9,7
Фосфорная кислота 1 3/[; И 334; V 26.7
безводная I 378; II 21; IV 9й: V 182
Фосфорная кислота — муравьиная кислота
IV 95-96
Фосфорная кислота (83 %-па и) — уксусная
кислота (1 : 1) IV 96
Фосфориоватисгая кислота IV рй—98
Фосфорной кислоты фенилового эфира дии-
мидазолцд IV 98
Фосфорной кислоты хлораигндрида днмор-
фолид IV 98, 99
Фосфорный ангидрид (пятиокись фосфора)
II 273, 332; HI 110; IV 99—101; V 147,
360, 482
Фосфорный ангидрид + лп.дай-амин V 508
Фосфорный аигидопд+фосфорная кислота
IV 101, 102
Фосфор пятибромистып IV 192, 103
Фосфор пятнсерннстьйг 1 377; IV 103
Фосфор пяти хлор ист ый I 123, За4; IV
Ю4-Ю9, 114; V 82; 185, 360
Фосфор пятихлористый — НИНК хлористый
IV 109
Фосфор трс’Хбромис.тын II! 102; IV 109 —
111; V 330, 490, 508
Фосфор треххлористый IV 111 — 113
Фреои-11 см. Тричлорфтормстли
Фреон-113 см. 1.1.2-Трихлор-1,2,3-трифтор-
этин
Фриделя — Крафтса внутримолекулярная
циклизация V 16
Фриса реакция I 16; Ш 342, .343
Фрица — Шейка реагент V 483
D-Фруктозэ I 4р5, 426; IH 27 1. 301; IV 69
ФталазН;1ДН01-1-1,4 III 211; V 609
Фталаминовая кислота IV 165
Фталгидразнд I 68, 207 — 208; II 321, 322;
111 210, 211; V 509
Фталевая кислота V 318, 566
днбутилоиый эфир см. Дн-н-бутилфгалат
диметпловый эфир I 84, 254, 382; Н
,393, 440
дифениловый эфир IV ИЗ, 114
дцхлорапгидрид IV 104. 113, 114, 207
диэтнловый эфир 11 440; V 236
моно-(7греЛ1-бут||ловЬ1й эфир III 399
Фталевый ангидрид I 44, 120, 395; 11 33,
312, 429, -130; Ш 465; IV 15, 104, 115, 116
Фталевый диальдегид 1 224; II -160, 461;
IV 198; V 124
Фталевый моноальдегид II 88
Фталид III 150; IV 214
Фталилуксусиая кислота IV 117
Фталплхлорид IV 114
Фталимид I 68; И 104; III 10, IV 214, 215
Фталоил-L-лекции IV 32
2-Фталоилпафтол-1 I 120
1,8-Фталоил нафтол-2 см. 1-Оксн-7, ]2-диги-
дроплендендион-7,12 I 246
N-Фталоил- L-фенилалянилглицина этиловый
эфир IV 277
Фталоил-Т-фепилалации IV ИЗ
N-Фталоил-1,-фенилаланин;) хлорал гидрид
IV 277
Фталоноиая кислота II 87, 88
Фтор V 457
Фторацетилен 111 407
н-Фтор-2-альдсгидтестостероп 111 94
3[ИФтор-Аг,-;н!дростеион-1 7 I 432
1иц-Фтор-А-’’-анДросгенон-17 111 94
д-Фторапплин I 349
ш-Фгоранстофенон II 130
л-Фторбсизальдегнд 1 404
н-Фторбснзойпая кислота I 71
ц-Фторбен-зопная кислота 1 122
этиловый эфир I 72
Фторбензол I 72. 122. 294; IV 10
о-Фторбромбензот! 1 71, 389; IV 116. 234
шрднс-ЬФтор-Ц-бромцгпхЛогексан 1 1 по
7-ФторгеПТ;от-1 I 30
1 Ор-Фтор-Д’-дегидро-19-нортестостсрон 111
96
К'-Фторднотшда N-t)KiiCh> I 403
6 Ф гор-н,6-Днмегилциютоге«сс1Д1!сн-2 4-он
1П 97
699
П-Фтор-|З.Р-Дифторстирол I 404
Фтордихлоруксусная кислота V 510
метиловый эфир V 510
2-Фторинданон 111 06
Фтористоводородная кислота I 122; V 27,
504
Фтористый водород I 90—92; II 309; IV 119;
V 336
безводный IV 116—118; V 510
Фтористый водород — пятифтористая сурь-
ма V 511
2а-фтор-3-кетостероиды Щ 94
ба-Фтор кортизон Ш 95
фторкурзринхлорид IV 220, 221
]'-фтор-]0-метИл-1,2-бензантрацсн Ш 134
а-Фтор-а-(3-метилбутид)-ацетоуксусной ки-
слоты этиловый эфир III 98
ФторнафталинЫ. а- и р- IV 49
2-а-11-Фторнафтил-7]-ЭтплбенЗоЙная кисло-
та III 134
ба-Фтор-б-нитриминохолестанилацетат 11
447
о-Фторнитробензол Ц 109
n-Фторцитробензол II 108
2-Фгор-2-цитро-3-фенилнорборнеи 111 97
10|i- Фтор-19-нона ндростадиен-1,4-Дион-3,17
V 458
<0-фтор олеиновая кислота 1Ц 246
N-Фторпиперидин V 333
а-Фторпиридин I 345
6а-Фтор-А4’ ’ (11)-прегнадиеидиол- 17а,21-дн-
оц-3,20-днацетат 111 95
6|3-Фтор-А4>э рЧ-прегнадиендиол-Иа.гЬди-
ои-3,20-диацетэт III 93
ба-Фторпрогестероц III 242, 243
Фторстероиды I 126
6-фторстероиды III 95
Фторсульфоновая кислота IV 118, 119; V
512, 522
5а-фтортестостерои 111 94
2-Фтортианафтеи III 98
2-Фтортиофен III 98
Фторуглеродсульфокислоты соли IV 109
Фторугольной кислоты 1 -фторциклогексило-
вый эфир 11 122
Фторхлоркарбеп 1 403’, V 171
7-Фтор-7-хлорноркарай I 404; V 510
2а-Фторхолестанон-3 III 92, 93; V 457
4-фтор-Дь-холесте110н-3 III 93
бр-Фтор-ДЛ-холестенон-З 111 94
10[3-Фтор-5,10-сгко-5,19-цикл о-Л4- андростен-
дион-3, 7 Ш 432
1-ФторцИклогеКсилфторформиат см, Фтору-
гольной кислоты 1-фторнпклогексиловый
эфир
«Фторэлаидиновая кислота III 246
7а-Фторэстрадиол И! 96
Фторянтарной кислоты диэтиловый эфир
III 98, 99
L-фукозЫ тозилгндразон III 359
Фуксоны V 266
Фульвены 1 351; II 67; V 147, 2S0
Фульвоплумиериц V 147
Фумаровая кислота I 212; II 424; III '40
бисхлорангндрид I 257; IV 1]4, 207
диамид IV 99
диметиловый эфир I 51; IV 25
диэтнловый эфир I 287
бдо-и-метоксифепиловый эфир I 239
энокись III 82
Фумаронитрил IV 99
Фунгихромин IV 92
ФуразанЫ Ill 468
Фуран П 37, 215; IV 128, 234
Фуран-3,4-ДиальдеГцД I 278
2-Фуранкарбоновая кислота V 276
производные см. Пирослизевая Кисло-
та
3-Фуранк.арбоновая кислота.см. р-Фуроиио-
вая кислота
Фуран — малеиновый ангидрид IV 26
Фурантетракарбоновая кислота V 276
Фурилакриловая кислота 1 201, 202; III
109, 449, 450; IV 13
Фуроилхлорид Ш 110
p-Фуроиновая кислота I 355
Фуроксаны Ш 468
2-Фурфурилмсркаптан Ill 326
Фурфуриловый спирт II 324; III 3S6; IV 13,
161
ацетат IV 13
Фурфурол I 134; 11 424; III 109, 449, 450;
IV 13; V 377
Хавикол II 9
Хазубанонпн V 290
Хаульмугровая кислота II 162
Хейна катализатор IV 120
Хелидоновая кислота IV 244
Хемолюминесценция I 206
а-ХиМотрипсин IV 227
Хпнацетофенои I 316; II 278
димстиловый эфир I 316
монометпловый эфир II 278
Хингидрон II 402
Хинизаркн I 120; III 209
Хинизариихинон 11! 209
Хинин I 1,59
Хининов 1 159^
Хинодиметац-7,7,8,8-тетракарбоиовой ки-
слоты тетраметиловый эфир П 35, 36
Хиноксалин 1 223; II 89; 111 171; iy 40
Хинолизидин III 177
снамии III 177
2-Хннолилаланина эфир III 156, 157
2-ХинолилпировимОградной кислоты эфира
оксим III L)6
Хинолин I 137, 277, 326; II 8; IV 120—122;
V 236, 474, 513
хинолина окись 1Ц 408
Хинолиновая кислота I 139
Хинолов эфиры III 223
п- Хиноны V 483
Хпнсберга тест 1 105
Хннуклидои IV 236
Хинуклидин III 458; IV 122
Хлопок абсорбент IV 12 2, 123
Хлор V 51, 6/, 145, 187, 189, 213
5-Хлор акридин 1П 359
$1-Хлор акр идин IV 88
Хлораль I 218; IV 123, 190
Хлорамин I 494; IV 123 — 126; V 513
N-Хлорамины IV 165
Хлорамфеникол см- Синтомицин
3-Хлор-Д1>4>5-апдростатрйеной-17 III 18
Хлоранил (тетрахлорбснзохинон-1,4) III
388; IV 127—130; V 514
о-Хлоранил (тстрахлорбензохицон-1,2) IV
129, 130—132
о-Хлораиилин II 228
и-Хлоранилин III 37, 144
«-Хлорантрахинон II 424
9-Хлорантрацен II 246
Х-Хлор-Х'-ацетпламидЫ I 171
Хлорацетплизоцианат III 17
о-Хлорацетоацетацилид I 57
,=>кзо-2-Хлор-спн-7-ацетоксинонборнан V 345
З-Хлор-З-ацетокснцпклогептсн V 479—480
Хлорацстон II 239; IV 103
Хлор ацетонитрил 1V 100, 132
й-Хлорацетоуксуснои кислоты этиловый
эфир 111 29'2
Хлорацетофенон I 177; 111 299
а-Хлор ацетофенон U1 257
л-Хлорбензальдегид I 194; Ш 26
700
N-Хлорбензамид II 108
« Хлорбагзнлидеп мористый 1V J09
л;-Хлорбензоил хлористый V 517
о-Хлорбензойная кислота И 87
и-Хлорбензойная кислота III 144
Хлорбензол I 146; II 207; III 235, 401;
IV 51
1 Хлорбензотриазол V 515
/г-Хлорбензофенон а гидразон [И 274
4-Хлорбензфуразан II 362; V 317
4- Хлорби цикло-12,2,0]-гексан-1- карбоновая
кислота V 151
1-Хлорбицикло" [2.2,21-октан III 187
Хлорбром IV 132; V 516
2-Хлорбутадиен IV 200
З-Хлорбутен-2 I 61
Хлорбутенилизофорон I! 266
N-Хлор-М-трет-бутилфенилацетамид I 164
Р-Хлорвинилизоамилкетон 1 48, 77
3-Хлорвинилэтиловый эфир IV 133, 273
2-Хлоргексан III 445
цис-1-Хлоргептадекадиен-7,10 I 276
1-Хлор-Д 7>10-гсптадекадиин I 276
2-ХлоргептаН III 445
2'-Хлоргризсоловая кислота II 205
4'-ХлоргриаеОловая кислота II 205
6-Хлор-б-дезоксигексопиранозид V 287
Хлордиазометан IV 133
3(3-Хлор-5а, 6|3-дибромхолестаН I 338
3-Хлор-Ь1,М-диметилиндолинийхлорид II 66
2-Хлор-3,3-диметилметиленциклопропан V 59
2-Хлор-1,4-ДимеТоксибензол IV 52
и-Хлордифенил I 429
иис-2- Хлор-1,3-дифен ил азиридин I 416
а-Хлор-а,а-дифенилацетанилид 11 396, 397
«Хлордифенилдиазометан III 274
а-Хлордифенил уксусной кислоты хлорал гид-
рид II 412, 413
2-Хлор-5,6-дицианбензохинон I 407, 408
3-Хлоризоисазолы I 417
ej-Хлор изонитроз о ацетофен он I 177
3- Хлориндазол IV 94
З-Хлориндол I! 45
ХлоририДиевая кислота IV 133 — 134; V516
Хлористый водород IV 257; V 516
Хлористый водород, 3% -иый раствор в ме-
таноле [V 134.
Хлоркарбен I 175; III 404; IV 133
\-(ХлорКарбонпЛ)-Ь-пролин III 456
2а-Хлор-Д’-З-кетостероиды 111 292
4-Хлор-Д,1-3-кетостероиды III 292
6-Хлор-4-кстотетрагидрохинолин III 139
2-Хлорлепидин IV 16
у-Хлормасляной кислоты хлораигидрид III
265; V 228
/МХлормеркур)-бензойная кислота II 34
д-(Хлормсркур)-толуол И 34
о-( Хлор-меркурУфенол II 31; III 180
Хлорметансульфохлорид V 93
1-Хлор-З-метилаллен I 154
N-Хлорметиламин V 514
1- ХлорЧ-метил-Д1’5’’’!1 Q)-aHflpoCTaTpHeHOH-17
9,10-б«с-(Хлорметил)-антрацен II 465
Хлорметилбензилсульфид V 517
2-Хлор-2-метилбутин-3 I 154
З-Хлор-З-метилбутин-1 1 154
Хлорметилмалеиновый ангидрид 1 158
2-X лор-2-метил:меркаптоин дан Дион -1,3 I
336; II 441
Хлорметнлметцловый эфир II 255, 307;
IV 133-137
1-Хлорметилнафталия 1 192; IV 68; V 329
З-Хлорметил-5-нитросалицилоиый альдегид
IV 135
2-Хлорметил-4-нитрофенол II 256
6- Хлорметйл-З-оксатрицикло-13,2,1,О2,4]-
октан 11 140, 141
2-Хлорметилтиофен. IV 67, . 68
2-Хлор-З-метилтиофен III 293
Хлорметилфосфоновый кислоты дихлоран-
гидрид IV 137, 138
N-Хлорметилфталимид IV 138
2-Хлор-2-метилциклоГсксаноц II 205; III 292
1,1-бис-Хлорметилэтилен V 329
5-Хлор-4-метокснбекзфуразаиа I-окись II
-И-Хлорнадбензойцая кислота III 37,5; IV
138 — 143; V 301, 313, 517
а-Хлорнафталин I 271; I] 292
Хлорная кислота Ш 291; IV 12. 143—151;
V 306, 345, 394, 483, 485, 519
2-Хлор-б-нитробензонитрил II 12
1- Хлор-2-питрозо-1,2-ди дезокси глюкоз а 11
452
1-Хлор-4-(о-нитрофенил)-бутен-2 II 465. 466
5а-Хлор-6р-нитрохолестанилацетат II 450
5а-Хлор-бР-нитрохолестанол-3|3 V 331
Хлорноватистая кислота I 13
эфирный раствор IV 151, 152
c?j«-7-Хлориоркамфохиион III 248
З-Хлорнортрициклен V 188
Хлорокс -см. Натрия гипохлорит
Хлоропрен 1 405
Хлороформ I 38, 48; III 154, 198; IV 43,
153; V 486
Хлороформ и органическая перекись IV
153—154
1 Хлорпентанон-3 IV 250
Хлорпикрин I 294, 417; III 40; IV 154, 246,
247
1-Хлорпирен II 246
2-Хлорпиридин I 345
5-Хлорпиридон-2 V 521
Хлорпировиноградная кислота 111 292
3-Хлор-Д3^-прегпадиенон-20 III 18
со-Хлорпропапол 1 29
а- Хлорпропионитрил I 149
а-Хлорпропионовая кислота
метиловый эфир II 397
этиловый эфир III 332
|3-Хлорпропионовая кислота 1 29
2- Хлорпурин-6-карбоновой кислоты этило-
вый эфир I 359
5-Хлорсалициловый альдегид IV 154
у-Хлорсахэрин IV 154, 155
16-Хлорстероиды V 196
лкХлорстирол II /5
N-Хлорсукцинимид I 96, 97, 257; IV 155;
V 520
N-Хлорсульфоизоцпар.ат IV 155; V 521
N-Хлорсульфоцилуретаны IV 155
Хлорсульфоновая кислота 1 74; III 282;
IV 156; V 232, 522
метиловый эфир Ц1 278
2а- Хлортестостероп II 292
Хлортетрациклин Ill 365
з-Хлортиирандиоксид-1,1, V 94
ХлортиоуголыюЙ кислоты метиловый эфир
IV 7,8
2-Хлортиофен II 293
Хлортиоциан IV 156, 157
м- Хлортолуол I 146
о-Хлортолуол I 146; 1] 87
п-Хлортолуол I 146; IV 109
1 О-Xлор-Д12-тридениновой кислоты мети-
ловый эфир I 241
X лор-тр«с-(трифснилфосфин)-роди й см.
шрис-(Трифен илфосфин)-родийхлорид IV
15 7, 158
2-Хлор-2,3,3-трифторипклобутнлацетат 1 is.0
Хлортрнфторэтилен I 180; IV 246
2-Хлор-1,1,2-трифтор5Тилэтнловый эфир IV
246
Хлоругольная кислота
тре»п-амиловый эфир IV 158; V 522
701
бензоловый зфнр (карбобензоксихлорид)
IV ! I, 158—160; V 523
п-бромбенанловьцТ эфир IV 160
йлюр-бутилопый эфир III 387; IV 161),
161;’V 523
/дре/н-бутиловый эфир (iripi'tii -бутпл-
хлорформиат) IV 6. 15й, 161; V 7-1, 524
нзобутпловып эфир IV 160, 11) Г V
523
«-uni робепзил овый эфир (п-ц нтрокарбо-
бензокеихлорид) IV 161
Д-нптрофениловый эфир I 177; V 150,
625
тиобензилоиый эфир V 526
р. Р, Р-трибромэтилоиын эфир V 527
З-р.р-трихлорэтнловый эфир V 527
фениловый эфир IV 7; V 185, 528
фурфуриловый эфир IV7 1ft I, 162
этиловый эфн_р I 2Й4, 431; IV 161. 162 —
16-5; V 237, 529
Хлоруксусная кислот;; I 77, 222, 225, 2(15
амид 111 17; IV 100
ангидрид IV 165
(Урвш-бутиловын эфир IV' 165, 166
виниловый эфир I 77; III ] 86
гидразида хлоргидрат 1 281; IV 166
натриевая соль И 417
хлорангидрид 1V 165. 166
этиловый эфир I 64; 1! 260
Хлоруксусный альдегид V 30
диме 1 ил а деталь II 301
днэтилацетэлъ 1 00; IV 263, 269
а-Хлор-а-фенилацетанплид II 397
н-Хлорфенилацетоцнтрил IV 2^2
и-Хлор-а-фенпл ацетофенон IV 21 0
л-Хлорфен ил метил карбинол I 233; II 73
7-Хлор-7-фенилиорКаран III 40], 402
1 - Хлор-О-фенилпропен-1, цис- и транс-
III '404
4-н-Хлорфенилтиан I 172
1-окись I 172
<) Хлорфеиилтиомочевина III 207
а-Хлорфенилуксусной кислоты этиловый
эфир 11! 332
о- Хлорфенилциаиамнд 111 207
а-Хлорфенол V 2 82
и-Хлорфечол I 1'20; V 2 82
1-Хлор-2-формило_ксп-Д:’> тр7с-цикло-
додекадпек 1 359
й-Х/тор-З-фторбеизойная кислота 111 hi]
I - Хлор-1 -футор-2-мстнл-2-фен плциклопропан
1 404
1-Хлор-ффторпептан I 80
I - Хлор-1 -фторциклопропапы III 373
3-Хлорфуцфуральдоксим II 369
о-Хлорфурфуриламин II 369
24-Хлор-’Дфхолен 111 117
З-Хлор-А’^-холестадиен IV 112, 113
оа-Хлорхолестандиола ЗР, 6р З-ацетат-6-нн-
трат V 51
Зр- Хлер-Д’-холестеп I 338
Хлорцндн IV 166, 167, 185; V7 501
2-Хлор-З-цианпирндин IV 105
2- Хлор-1-циапэтнлацетат V 30
l-Хлорцнклоалкены V 400
лумтнс-И-Хлордиклогсксанол 111 193
2-Хлорциклогсксаиои I! 237
1-Хлорцнклогексен II 220; 111 414
Хлорциклогексен I 304
2-Хлорцнклогексеналь-1 I 308
2-Хлор-1-Ц(1кло1'ексеи11лц1(анид-1 1 308
X- Хлср-Х'-циклогсКсилбенэолсульфам.иД V
520
.X- Хлорцн1<лпгексил11Деи[|М[[;! I 172
2-Xдорциклогсксилтпоцчанат 137
Хлорцяклодек.ш V 233
wpo^e-2-ХлорциклоПентацол lj 324
п-(Р-X лор этил - ai (И зол) V 512
а-Хдор-,Т[[.чбеииол Ш 445
N-p- Хлорэтпл-О. ЬНшметмл.'пдроксиламин
II 307
ti-Хлопэтнлметиловый эфир II .308
2-ia-Хлорэтил)-тпофен 111 ИО
Р Х.торэтнлтгюцнаиат IV7 156, 157
а-Хлорзтилэтнловый эфир III 55, 56; IV
251
Холан аль-?4 1 320; V 1 ‘29, 389
ХоланО|зал кислота V 381
Холановой кислогы метиловый эфир V 389
Холлнол-]? a I 157
Хол анол - 24 1 329; V' 129. 389
Холевая кислота I 136
триформнльное производное И 327
мсгплоаын эфир I 201; III 108
3.7-ли ацетат III 108
З-монокарбопат IV 163, 164
Д"-ХолсИ 1 137
А1-Холенола-2-1 тозилат III 117
Д-’^-ХолестадисН I 116, 157, 338
Ah fi- Холост ад и енол-Зр III 175
Ав»1-*-Холестадиснола-Зр ацетат II 158 338,
339
Холестан IV 147
Холестана 2a, Зи-эиокись II 250, 251
Холестана 2|1, ЗР-энокись II 250, 251
Холестапдиол-2р, 3a I 328
ХолестанД11ол-2(3, 3(3 IV 20
Хо.честаиднОл 33, 5a II 117
Холестанднол-Зр, би II 147
ди ацетат I 265
Холсстапдиол-Зр, 7р IV 163, 164
ХолсстаиДиола-Зр, 6р 3-ацетат Ш 188
Холестандиола-2а, ЗР дибеизоат П 55
Холестандиола-2Р, За дибекзоат II 55
Холестандпола-Зр, 7a 3-монокарбонат IV
163, 164
Холестацдиола-4а, 5a 4-товилат II ИЗ
Холсстандиола-5а, 6a 6-тозилат 11 113
Холестанднола-Зр,4Р 5a, ба-энокнсь IV 143
Хол ест андиол-4а, 5a-on-3 III 83
Холестанднол-4Р,5р-он-3 III 83
Холестандноп-2,3 I 328; III ИЗ
енолы 11 457, -158
ХолсС'ган ДНОН-3,6 I IB; IV 143, 217,
261, 262
3-моноэтилентиокеталь IV 261, 262
бат-этилентиокеталь 1 114; IV 261, 262
Холесгандиопы-ЗН II 45
Холестанилацетат IV 147
Холестапол-1 a I 315; II 168, I6S
Холестанол-2а I 314
Холестаяол-За II 20, 169; V" 106
Холестанол-Зр I 10. 39, 26(>, 329; II 181, 188,
376; 111 165; IV' 147. 180; V 106
говн,пат II 293
Холестаиол-3 1 123; И 376; III 269, 322;
IV 168
метиловый эфир I 123
Холестацол-ЗВ-ои-2 I 328
Холестаион-1 IV 124
Холсстанои-2 V 206, 33G
Холсстапоп-З I 10, 114. 266, 329, 336. 353;
II 13. 20, 181. 188, 376. 458; 11178,9?,
93. ИЗ. 120. 141, 165, 213; IV 133, 180,
‘261: V 206, 347
За, ба-дибромнд IV 230
окиси I 113
^тнлентноксталь 1 J 14; IV 261
Холестано(!-4 И 45
Холестантетрол-Зр, 4р. 6a, 6р IV 14'3
Хг>лестантриол-ЗР, За. Gp I 136; 11 5'2; III 58,
224, 225, 349
Холг-ст аитрнол-ЗР. 6а, Та III 224
Хо.честантрпол-ЗР. ба, /р 111 224
Холестаи грнол-Зр, СР, 7а 111 224, ‘225
Холсст;штриол'3р. 0р, 7р Ц[ 224
702
Холестантриола-Зр,
3-акетат I! 350, 251_
(гме'итяат II 350, 2;>1
3*монокарбоцат IV 163, 164
Холссчеи-1 1 315; II 168, lfi9; HI 199
а-окиеь II 168, 169
Холестен-2 I 5’04; II 39, 1 (;3, Ifj9, 441; IV
НО: 5' 213, 333
а-окнсь 11 168, 169
Холеетеш2 (я -3) 1 322
Холсстеи-4 I 200; Ц 14 7, 179, 180
Холссчеи-5 III 7,8; V 106
дч-Холестсшдпол-ЗР , -ip III 230
ДЧ'Ф-Холестендпол-ЗРыа I! 168
З-аисТат 11 339
дпайетат II 108
Д^-Холсстендиолл-ОР./а и 3р,7]3 дибензоат
II 343
Д1-Холесте1)Д)1СИ1-3,6 И 131, 23а, 378, 379;
IV 216, 217; V 539
А7-Холестерилацстат III 163, 253; IV 218,
219
Д®<14)-Холестенплице'тат III 365
Д4-Холестенол-Зр I Н>6; II 14/, 190, 191; III
179
бензоат II 117
метиловый эфир I 116
Д 7-Холестсиол-Э 1И 254, 235; IV 168
A9V Ч-Холестеиол-3[4 III 163
А4-Холеетенол-ЗР-ои-6 V 5,39
Д4-Холестеиол-6[3-О!1-3 II 379
ацетат I 322; IV7 262
Д^-Холестенои-!? П 20]
Д-’-ХолесТснои-З I 212, 221, 329; II ]32;
IV 219, 230
«-окись IV I SO, 181
Д^-Холестеныт-З I об, 18о, 216, 340; II 135,
] 79, 18.0, 190 19], ЗОй: ill 46. 83, 149,
165, 212, 213, .346, 430, 13), 47j0;
IV 112, ИЗ, 1.30, 143, 144, 218, 230;
V 556
ацетат енола И 179, 180
кеталнзация 111 348
ссмпкдрбазсж I 200
Д’-Зй-Холестепоы-З J 87
Холестеоилацстат I 18, 76, 77, 116, 178;
II 184, 447, 430; V 51
о«, 6R-Дибромид IV 179
5р, 6а-ДнбромнД. IV 17-1, 180
А7 Холестерила цстат ]1 339
Да-Холестерклац.етат Н 338, 339
Холестерилбеизоат I 135; II 34-5
Холестерил бромистый II 187
Холестерил подпетый I 39
Холестерил мет л левы li эфир 1 116; И 187
Холестерплтознлат I 157
Холестерилформиат Ш 57, 5Р.
Холустерилхлоркарбопат И' 167, 1(18
Х’олесч'ерн,ахромат II 378, 379
Холестерин I 39, 127, 1-17, 153, 170, 171, 221,
264, 329,; ]] 43, 78, 13], 147, 378, 379,
412; Ill 165, 243 — 245, 250; IV 128, 130,
147, 168,2.30; V10.5 Ж, 13]. 172, 510,
539
5а,6р-дпбро'г.[пд II 377, 412; IV 15, 168, 2] 9
5|3, Gu-дииромид II 412; IV 230
5«,Са-дихлоркд II 43
5(4, 6р-дц.хлорид II 43
дигИтонид 1 319; V7 ] 05
тпгоцпд V ]06
«-окись li 52, 147: IV 139, 180, 181
Р-окись JV 139, 186. 13]
Холин IV 169
Хризантемовая Кислота V 167
(Ф )-'/ф<7нс-Хр)К1а(1темовоп кислоты мети-
льный эфир V 167
Хризен II 277; III 244; V .293
Хрома металлического пудра IV 169
Хромал IV 111; V 242
Хроманол-4 V 275
Х'романоцы III 400
X poMaf 11) ацетат IV 169, 170; 5’ 530
Хрома(И) сульфат IV 170, 171, V 530
Хрома(I]) хлорид IV 171—173; V 531
3,4-Хромен I 135; V 27,5
Хроменоиы 1] 399, 400
Хромила аиетат IV 173; V 533
Хромила трихлорацетат IV 173, 174
Хромила хлорид IV 174, 175; V 534
Хромовая кислота И 301; IV 175—179;
V 535
Хромовый ацгпдрпд (хрома тре.хокись! J
347; IV 179—183; V 38, Г>36
Хромовы III 400
Хунига — Миндена восстановление Ш 4-50
Хукера окисление II 233
Цевздпн IV 145, 146
Пении I 186
Недр а я а окись А7 379
Цсдранол V 379
(t-Цедрен V 83
р-ЦеДрен V S3
Недрол I 150
Цезия фторид II 107. 122; IV ]84; V 228
Целит IV 184
Целлобиоза 1Ц 146, 147
а-Цсллобиозы октаацетат IV 123
Цемульсол II 3]4
Цеолиты II 309
Церии, аммиакат нитрата IV 184, 185; V 541
ЦерияЦН) ацетат II 378
Ilepiin(HI) гидроокись IV 185
Иерня сульфат V 543
Церия(111) Хлорид IV 1 8.5
Цетил подпетый 11 35; IV 91, 220
Цетилмалоновой кислоты диэтнловыИ эфир
IV 239
Цетиловый спирт ]1 35; IV 91
ЦетллтриметпламыоиииборгцДрпд III 303
Цетплтримстиламмонийбромпд IV 185
а-Цефалппы IV 38
Цефалоспорин С V 324
ЦиамелиД 1V 18В, 189
Циан азид III 100; IV 185, 186; V 543
|}-Циап акриловой кислоты этиловый эфир
1V 165
Цианамид I 436; IV 4,5, 186. 187
3-1111а||-4.ам1!посп1тро-[Д5-цнь'логексен-1,9'-
фктупрен! HI i43; IV 96
Пиаинцстнмпд V 53
о-Цванбензойной кислоты этиловый зфир
IV 165
ге-Циаибспзс-йная кислота 11 248
Б-Инаг-- 1,2-бензохнкон Н -110
ЬПиапбеизниклооктаиимин-:? IV 50
4(6)-Циаи-1, а-беизццклооктан импн-З IV 50
1 -11и;И|-3. Йгексадлпн I 253
Ц-Циан-1,1 -днметилазиридпи IV 186
2-Ц1(ап-3.6-дпмсгнл-1,-!-г5с1!зохш?он 1 31
2-Цп;т|гЗ,6"Димесцл-1,4-П1Дрохпнон I 31
18-Цнаннбси'аин I 173
Цианндииы 1V 222
11нанннорые красители IV 222
Цианистый водород I 288; IV 187, 188;
5' 286
Циатткарбоповые кпелотн! 5' 504
Цианмезпт1и!ен III 14-1
2-Цпа11мет1!л-2г,4'-диметоксмбензофснос[ V
28(1
3-Циан-6-метил-2(1 Hj-пиридон II 260. ЗЗР
III 105, 106
703
Й-Циан-З-метокснаптранол-10 V 289
Цнаимуравьицон кислоты эфиры и амиды V
236
I-Цианпафталия II 292; III 111
Циановая кислота Изоциановая кисло-
та II 133; IV 188-191
ю-Цианпеларгоновая кислота II 321
4-Цианпирокатехин II 440
17-Циан-Д17<20)-прегнендиол-За,21 IV 87
Д17-20-Цианцрегненол-21 -диоп-З,11 - ацетат
И 93, 94
Цианстероиды 111 420
Цианугольной кислоты трет-бутиловый
эфир IV 191
Циануксусная кислота 1 69, 329; II 67’ 111109
амид 1! 260, 334; Ill ]06; IV 105, 246
трем-бутиловый эфир 11 111, 112; IV
191, 192
Метиловый эфир 1 306
этиловый эфир I 32, 69, 181; И 325; III
ЮЗ, 104; IV 34, 184, 192, 245, 276
Циануровая кислота IV 188, 1S9
Цнанур хлористый IV 188, 189
I-Цнан-З-феннлмочевииа IV 45, 187
2-Циан-5-фенилциклооктг1нимиц-1 IV 50
1-Цман-6-фенилЦиклооктанимИн-2 IV 50
2-Цианформилпиррол V 236
Зсс-ЦиапхоЛестан II 292
Кх-Циан-ба-холестаноц-З I 88
ЦнанХолестанон-3,5а и 5р III 450
U-Цкацодклогептанонимпд 111 385
Цианэтилирование III 454
0-Цианэтилфосфат IV 192, 193; V 526
К-(р-ЦианЭТил)-о-хлоранилин II 228
1-(р-Цианэтил)-2-(у-циянпропил)-бензол IV
30
Циглера катализатор III 343
Циклитол I 438
Циклические 1,3-дикетоны III 85
ЦиКлоалканоны III 7
Цпклоалкины (С; — С,) IV 27
3,5-ЦиклоаНДростан V 533
5f3,19-Цикло-Д ‘-андростендион-3,17 I 432
Цпклобутадиен V 202
Циклобутадиен, комплекс с трикарбонилом
железа V 202
Циклобутан-], I-дикарбоновой кислоты ди-
этиловый эфир IV 242
Циклобутандиона-1,3 этиловый эфир енола
IV 271
Циклобутанкарбоновая кислота II 446; III
77; V 316
Циклобутанон II 96
Циклобутен III 61
Циклобутиламин V 316
Цнклогексадиен-1,2 V 164
Циклогексадиен-1,3 1 13, 14, 304; II 276;
V 322
Циклогекеадиен-1,4 II 54. ПО
Циклогексадекандиолы III 22]
8-Циклогексадеценон-1 V 536
Циклогексан 1 292 — 294; П 207, 454; III
15, 154; V 23, 67, 325
1;«с-1,2-Пиклогексан- 1,2-ди карбоновая ки-
слота III 204
Циклогександиолы-1,2 П 84, 93, 100, 101,
313, 314, 396; IJ1 58, 81, 199, 220, 221
297, 371, 372, 424; IV 30
Циклогександиолы-1,3 III 327
ЦиклогексаиДиолы-1,4 111 371, 372
Циклогексан Дион-1,2 II 10; III 78, 199,
247; V 543
дигидразон I 390
Циклогександпон-] 3 1 208; И 280; Ш 84,
168; IV 194. 197
Циклогександпон-1,4 I 32; IV 194, 198;
V 230
Циклогексанкарбоновая кислота 1 169-
11 437, 446; Ill 15, 77, 229; V 298 ’
Тф^-диметиламид II 171, 172
изопропиловый эфир I 288
Циклогексанол I 29, 170; II ]62. 377; 1(1
155; IV 115, 197; V 147
Циклогексаиолят алюминия см. Алюминия
Циклогексаиолят
Циклогексанон I 27, 62, 69, 81, 99, 149
163, 170, 174, 207, 212, 214. 245. 288, 294
335, 336, 431; II 26, 85, 115. 122, 162’
277, 290, 305, 314, 316, 332, 333. 347’
372, 377, 395, 396, 404, 460; III 77, 165.
177, 247, 402, 410; IV 61, 66, 184, 194—
196, 204, 205. 232, 241, 216; V 134, [47, 197
днадлилкеталь I 362
морфолиноепампн III 150, 350
оКсим 11 454
пинакон Ц] 222
пирролидиноепамиц III 127, 128, 232
фенйлгидразон IV 33
этиленкеталь П 1S1
Ц111<логексанон-2-глиоксиловой кислоты эти-
ловый эфир IV 232
Циклосексантриона-1,2,3 1,3-диокспм I! 290
Циклогексен 1 И6, 126, 204, 212, 261, 266,
287, 288, 304, 312, 403, 416, 437' II 39,
84, 93, 187, 384, 404, 451; 111 61,’75, 81,
89, 204, 216, 297, 312, 37], 387. 424,
440, 445; IV 49, 53, 34, 55. 102, 115, 175;
V 20, 44, 48, 200, 214, 215, 286, 311 315,
510
озонид II 384
окись 1 288, 328; II 212; 111 75; V 405
эндо-цис- 4-Цикл огексен-1,2-дикарбоновой
кислоты ангидрид V 401 — 402
Циклогексенил-З-ацетат III 176
З-Циклогексенилбеизоат V 311
Циклогексенилвинилкетон IV 95
!-Циклогексениллитий II 220
Циклогексен ил метил кетон Ill 440
N- 1-Циклогексенилморфолиц I 202 203;
11 314, 315; IV 190, 197; V 406, 461
N-Д’-Циклогексенилпиперидин I 267
3-ЦиклогеКсенилуретан П 444
[}-[]-Циклогексенил]-этпламин II 63
Циклогексеи-4-карбоновой кислоты ?иети-
ловый эфир II 394
1-Циклогексенкарбоновой кислоты этило-
вый эфир 1 343
Циклогекееиол-2 111 81, 288
Ци.клогексенол-3 V 397
Циклогексенон-3 И 166; 1Ц 81; IV 198; V 160
Циклогексил ал кил амины III 196
Циклогексиламины I 172; II 335; IV 78;
V 199
Циклогексилат алюминия IV 197, 198
ЦнКлогексилбензол 1 111
Циклогексил бромистый III 413, 445
З-Циклогексид-2-бромпропем 1 233
Циклопексилиденуксусной кислоты этило-
вый эфир I 431
Цнклогексилидеициануксусной кислоты эти-
ловый эфир IV 184
Циклогексилиденциклогексиламин II 348
Циклогексилизотиоцианат IV 198
Цнклогексилизоцианнд II 335; IV 78, 86
ЦиКлогексил иодистый I 169; III 229; IV’102
Циклогексилмагнийбромид Ш 381, 382
Циклогексилметанол I 233
Циклогексилметиловый эфир 1 116
Циклогексилокснэтапол 11 181
Циклогексилпропин I 59
Циклогексилтозилат Ц 412
с- п тЦиклогексилфенол III 137
N-Цпклогекснлформамид 11 335; IV 78, 86
Цикл огексил фор мн л перекись I 388
Циклогексил фтористый И 207
704
Циклогексил хлористый И 43, 207
2-Циклогексилциклогексанон IV 198
[-Циклогексил-3-(этил-р-Ы-морфолин)-кар-
бодиимид IV 198—199
Циклогексин I 390; IV 28
Циклогептадиен-3,5-он IV 122; V 357
Циклогептандиолы-1,2 JII 221
Циклогептандион-1,3 V 549
Циклогептанол И 428
Цяклогептанон I 163, 245, 340, 341; II
347, 372, 460; 111 77, 159; IV 246, 416;
V 357
оксим III 169
пинакон III 222
Циклогептатриен-1,3,5 (тропилиден) I 14
123; Ц 238; Ill 248, 264, 296, 400; IV 108,
122, 131, 199, 200; V 72
N-Циклогептатриенилгидразиидикарбоно-
вой кислоты диэтиловый эфир I 14
Циклогептатрненкарбоновые кислоты 1 250
Циклогептен I 287; II 428; III 61
4-Цнклогептен-1-карбоновая кислота 111 232
Циклогептиламин 111 169
Р-Циклогеранилвиниловый эфир 111 180
(1-Циклогераниол III 176, 177
цис, цис-Циклодекадиеп-1,7 V 513
ДМ-ЦиклодекаДиенДиои-1,6 III 223, 224
Циклодекадиин-1,7 V 513
Циклодекан V 253
Циклодекан диолы-1,2 III 221
Циклодекандиол-1,2, цис- и транс- И 234
Циклодекандион-1,2 II 229
Циклодеканон IV 220; V 194, 357
Циклодекадиен-1,6 V 294
Циклодекатриен-1,2,6 V 294
Циклодекатриен-1,2,3 V 297
Циклодекатриен-1,5,8 V 346
тралс-Циклодецен IV 27; V 254
Циклодецена цис- и транс-описи V 254
а-Циклодигидрокостунолид V 385
ЦиклО'Ди-о-ксилилен 1 151
Циклодо деканон ол V 504
Циклододеканон II 347; 111 78; V 194
транс, транс, цис-Циклододекатриен-1,5,9
III 335
цис, транс, транс- Цикл о до декатри ей-1,5,9
I 281; 111 142
транс, транс, тра мс-Цик л о до декатр иен -
1,5,9 111 [42, 335
цис, цис, цис-ДМ^-Циклододекатриена 1,2-
окись I 359
цис-Цикл ододецен 1 276, 281*; V 58, 253
траяс-Циклододецен V 57, 253, 285
Циклододецин 1 276
Циклононадиен-1,2 1 152, 339; 11 282, 283;
V 296
цис, цмс-Цикло1’,онадиен-1,5 V 294
цис цис,-Циклононадиены-1,2; -1,3; -1,4;
-1,5 1 152; V 294
Циклононандиолы-1,2 Ill 221
Циклононанон V 194
ЦиКлононатриен-1,2,6 V 294
цис, иис, цис-Циклононатриен ы-1,3,5 1 152
цис, ццс,цос-Циклононатриены-1,3,6 1 152
цыс,цис,цис-Циклоионатриены-1,4,7 1 152'
111 288
цас-ЦиклоНонеи V 314
транс-Циклоконен IV 27
Циклооктадиен-1,2 I 323
Циклооктадиен-1,3 I 323; IV 48; V 244, 345
Циклооктадиен-1,5 I 323; III 7, 415; V 346
цис.транс-Циклооктадиен-1,5 V 503
цпс.цис-Циклооктадиен-1,5 II 154, 155
245, 282, 283; II] 261. 294, 307, 346:
IV 155; V 315, 533
Циклооктадиен — малеиновая кислота 1 [ 84
Циклооктадиены-1,3; -1,4; -1,5 Щ 270
Циклооктан диолы-1,2 Ill 221
Циклооктанол IV 177
Циклооктанон I 163; Ц 311, 312, 347. 372;
IV 177; V 147, 194, 355
пинакон 111 222
Циклооктатетраен I 254, 366; II 391; 111 270;
V 189, 494
Циклооктатетраен, аддукт с малеиновым ан-
гидридом 111 233, 234
Циклооктатетраена окись 11 193
«Циклооктатетраендибромид» I 366
1,3,5-Циклооктатриен Ц 391
1,3,5-Циклооктатриенон-7 II 193
Циклооктен 1 19, 287; II 282, 283; 111 153;
IV 49
Циклооктен, цис- и транс- 1 56; IV 27; V 70—
71, 99, 390
4-Циклооктенкарбоновая кислота 11 [ 232
Циклооктенов цис- и транс-окиси V 254
цис-Цнклооктен-4-ол-] V 392
Циклоактенсульфид V 294
Циклооктены III 7; V 390
Циклооктин V 391
Циклопентадиениллитий Ш 356
Циклопентадиенилнатрий I 353
Циклопентадиен I 13, 14, 65, 83, 306, 41-4;
II 67, 140, 270, 271, 390, 468; III 77, 217,
315; IV 30, 47, 200; V 21, 302
Циклопептадиена моноэпоксид V 312
Циклопентадиенон V 544
Циклопентадиенона кетали (Диметил-,
диэтил-, триметилен- и этилен кетали)
V 544
4Н-Циклопента-(2,1-Ь:3,4-Ь'1-дитиофен V
283
Циклопента дитиофены V 283
Циклопентан 111 154
Циклопен тан альдегид I 287; III 297
ЦиклопентаидиолЫ-1,2 II 390, 391; 111 77,
221; IV 30
Циклопентандиолы-1,3 III 77
Циклопентандион, димер оксима I 135
Циклопентанкарбоновая кислота III 60,77
Циклопентанол I 40; IV 201
Циклопентанон I 29, 162, 163, 251, 252;
Ц 16, 107, 290, 315, 347, 390, 404; III
77, 427; IV 186. 201; V 544
пинакон III 222
пирролидина енамии II 181; III 231
Циклопентен 1 40, 287, 414; II 324, 345,
361, 362; 111 61, 77; IV 186
окись II 361, 362
Да-Циклопентенилуксусная кислота 1 162
Да-Циклопентенол II 345
Д8-Циклопентенол III 288
Циклопентилбромид III 413 445
ЦиклопентилиДенцнклопентанол-2 V 368
Циклопентилхлоркарбоиат IV 201
Циклопропан I 262, 402; Ill 308
1-ЦикЛопропанкарбоксазиридин II 173
Циклопропанкарбоксальдегид Ц 173, 220;
IV 264
Циклопропанкарбоновая кислота Ill 186
фторангидрид V 228
хлораигидрид II 173; IV 264
Циклопропанолы V 186
Циклопропанон II [29; V 94
гидрат III 19
диэтилацеталь II 237
Циклопропен I 65
Циклопропеяы III 358, 359
Циклопропиламин III 441
Циклопропил ацетат III 216, 426
Циклопропилбензол IV 215
Циклопропилметанол Ц 220
Циклопропилметилхлорид V 547
Циклопропилтрифенилфосфонийбромид V
546
5, 9-Цнклостероиды IV 172
23 № 1994
705
Цпклоундеканкарбоновая кислота III 78
трплс-ЦиклоунДеЦен 1V 27
,н-Цимол П 161; V 40
л-Цимол I 30, 143, 161; 11 161: III 50; V 40
1,8-Цинеол V 371
Цинка ацетат Ш 158
Цинка боргидрид V 179
Цинка бромид I 40Ц V 547
Цинка гидросульфит IV 201
Цинка иодид III 286, 287; IV 201, 202
Цинка окись IV 204, 205
Цинк амальгамированный IV 202—204'
V 548
Цинка хлорид Т 320, 361: Ill 35, 36; IV 89
114, 202, 205—209, 251, 276; V 337, 484,
549
Цинка хлорид — хлорокись фосфора IV 209,
210
Цинка цианид IV 188, 210
Цинк
другие формы IV 213, 214; V 229, 530,
550
пыль 1 34, 345, 383, 385, 388; II 294;
IV 133, 168, 215-227; V 240, 357, 371,
534, 550
пыль амальгамированная IV 171
фольга IV 212
для реакции Реформатского IV 210—
213; V 16
стружка 1 310, 393; IV 214
Цинк-медная пара I 76; 111 286, 287; IV
214, 215; V 399, 550
Циннамил бромистый 111 414
Циннамилиденфлуорен I 36
Циннамил хлористый 1Н 402
N-тронс-Циннамоилимидазол IV 227
4-Циннолинкарбоксальдегида гидразон II
418
Р-Циперон IV 217
Цирконий четыреххлористый IV 227,228
Цистеин I 189; II 56, 128; 111 418; IV 159,
263, 266; V 27, 112, 496
N.S-диацетат II 128
D,L-Цистин II 327
Цитидина З-Ц-окись 1V 141
Цитозина 3-N-0KHCb IV 141
Цитраль IV 252; V 383
(Й)-( + )-Цитронеллол V 352
Четырехбромистый углерод I 416; V 184, 296
Четыреххлористый углерод 1 294, 415;
III 154, 1Э8, 263; V 50, 66
<1,/-Шики!иовая кислота 1 255, 256
(±)-Шикпмовой кислоты метиловый эфир
IV 195, 196
Шимана реакция 1 122; III 299
Шиффа основания I 192, 302, 367; 11 348,
456, 457; 111 100; IV 154
восстановление Ill 378
Штоббе конденсация I 148; [V 278
Щавелевая кислота 1 9, 136; 111 274; IV 229—
232; V 514, 556
mpem-бутилэтиловый эфир 11 31
диметиловый эфир I 294; IV 232
N, М'-динитрозо-N, N'-Диметиламид 1 244
диэтиловый эфир I 294, 431; II 129, 261,
324, 428; Ш 98, 99; IV 232, 233, 239 — 241,
244; V 558
Щавелевоуксусной кислоты диэтиловый эфир
V 276
Эбурикоевая кислота 111 49
Эвомонозид 1Ц 190
Эглинтона — Галбрэйта сочетание V 21
Эйкарвон [ 340, 342
а.ы-ЭйкозапДИкарбоновая кислота I 203;
IV 196, 197
Эквиленин 11 83; IV 232
Эквилин 1 408
Экдизон V 78, 386
Экзальтолид II 228
Элаидиновая кислота 11 77, 152, 319, 3 84;
Ш 61, 246, 325
метиловый эфир II 54
Эметин V 108
Эмульгаторы III 7
Эмульсии IV 14
Энантовая кислота II 86; III 263
ангидрид Ш 110
нитрил IV 46
Энантовый альдегид I 99, 216, 327; [1 86;
111 30, 355; IV 12
ацетат енола IV 12
о-Энантоилфенол IV 203
Эна[ггоилянтарной кислоты диэтиловый эфир
Энантола оксим I 216; IV 46
1,4-Эндоксо-1,4-дигидронафталин И 18; IV
128, 234
Эпиандростерон 1 150
синтез 11 267
11-Эпикортизол II 327
11-Эпикортикостерон Ill 13, 14
Эпитестостерон I 22
Эпихлоргидрин 1 96; II] 459; IV 234, 235
Эпихолестерин 11 379
8,9-Эпокснабиетановой кислоты метиловый
эфир 11 ] 98
Эпокси-2-алл ил циклогексанон Ill 76
Эпокси- 1,4-бензохнноны V 53
2,3-Эпоксибутан, цпс- и транс см. Бутена-2
окись
Эпоксиды 1 94, 341
8а, 14а-Эпо кси-7-кетохолестанил ацетат IV
218, 219
а-Эпоксикислоты см. Глицидные кислоты
4р,5р-Эпоксикопростанон-3 III 142, 143
а-Эпоксикислоты 1 93
8а, 20-Эпоксиманоол Ill 90
2,3-Эпоксимасляной кислоты этиловый эфир
11 347
1,2-Эноксинафталин V 88
17р, 2 0-ЭпокСи-21-норпрегнаны I 340
транс- 4 -Эпоксиоктеи III 375
11Р, 1 2р-Эпоксипрегнан-3,20-бпс-этиленке-
таль I 312
16а, 17а-Эпокси-Д5-прегненол-ЗВ-он-20 IV
170
2-(1,2-Эпокси-2-фенилэтил)-4-метил-
1,3-диоксолан II 349
1,2-Эпокеи-З-феноксипропан I 327; IV 235
]а,2а-Эпоксихолестен II 168, 169
2а, За-Эпоксихолестан I 328; 11 168, 169
2(5, 3|3-Эпокси хол естаи 1 328
5а, 6а-Эпоксихолестандиол-Зр,4Р IV 143,
144
8а, 14а-ЭпоКсихолестандиол -ЗВ, 7а-3-апетат
Ц 339
5а, 6а-Эпоксихолестанилацетат Ц 250 251
5п,6а-Эпоксихолестанон-3 IV 180, 18]
7а,8а-Эпоксихолестерилацетат II 338, 339
Эпоксициклогексан см. Циклогексена окись ]
328
1,2-Эпоксициклододекан 1 277
9а, 11а-Эпоксиэргостерил-Ц-ацетат II 212
транс,транс, дис-Ю, ] ]-Эпокси-7-этил-3, 11-
диметил-2,6-тридекадиеновон кислоты ди-
метиловый эфир V 118
Д’, 22-Эргостадиенола Зр-ацетат 111 174, 175
Д7>22-Эргостадиентриол-ЗВ, 5В, 8а 111 173.
174
706
Д 71аа-Эргостадиентриола-Зр,5а,6а 6-бен-
зоат II 337
А 27вд14)’^11) г2'Эргостатетраенол-Зр III 278,
ДМ4,аа.Эргостатриентриол-ЗР, 5а,6а 11 94
Эртостер илацетат III 278, 279
Эргостерил-Вг-ацетат Ш 278, 279
Эргостерил-Э-ацетат, 9(11)-моноэпокись И
212; III 174
Эргостерилтетрагидропиран иловый эфир II
155
Эргостерин I 41; [1 94, 337; III 173, 174;
V 78
Эргостерина 5а,8а-перекись III 173, 174; IV
225
( + )-Д11-Эремофиленон-3 V 121
Эритрогеновая кислота 11 246
D-Эритрозы 2,3-диформиат 111 225, 226
D-Эритрозы 2,4-диформиат J11 225, 226
Эритроидин II 68
Эстрадиол III 96, 195; V 44, 325
диацеталь V 375
3-метиловый эфир 1 108; III 118; V 243
5а, Юа-Эстрандиол-Зр, 17р III 195
5р, Юр-Эстранднон-3,17 Ш 19В
Д5(10)-Эстреидион-3,17 II 192, 193
Д5<101-Эстренол-За-он-17 II 192
дц1°)-Эстренол-Зр-он-17 11 192
16а, 17|3-Эстриол 1 267
D-гл юк урон оз ид 1 245
метиловый эфир III 116
Эстрон I 435, 436; II 12, 155; 111 116, 227;
V 204, 250, 375
ацетат енола 1 267
метиловый эфир I 152; П 16; 111 119;
IV 128, 129; V 458
Этанол 11 382; V 31, 16]
Этаноламин 1 128; IV 235; V 557
Этара реакция IV 174, 175
Этила гидроперекись I 219
N-Этилалленимин I 61
Этиламин И 72, 141, 142, 145—148; 111 16,
17; IV 259
Этила перекись V 348
Этилат калия 11 129; IV 235, 236
Этилат лития IV 236, 237
Этилат натрия II 289, 332, 334; IV 152,
237 — 248, 276; V 519
Этилат таллия (1) V 558
Этилацетат см. Уксусной кислоты этиловый
эфир
Этилацетоаи.стат см. Ацетоуксусной кисло-
ты этиловый эфир
л-Этилацетофенон II 90, 406
N-Этилбензизоксазолня борфторид IV 248,
249; V 564
Этилбензол I 287; II 144, 159, 377, 434;
III 48; IV 202
Этил бромистый I 270; IV 91
Этилвинилкетон IV 248, 250, 252, 267
Этилви и иловый эфир IV 251 —253, 267 275;
V 244, 564
4-Этилгексанон-З 1] 45
Этилднизопропиламин IV 253
1-Этил-3-(3'-диметил аминопропил)-карбоди-
ИМиДа хлоргидрат IV 253, 254; V 564
N-Этил-б, 7-дихлорбензизоксазолийбор-
фторид V 564
Этилдициклогексиламин IV 254; V 564
Этилен I 37,212, 402, 428; 11 468; 111 61;
V 151
бромгидрин I 129, 295
хлоргидрин II 422
Этилена и малеинового ангидрида сополимер
V 565
Этилена и N-оксиимида малеиновой кислоты
сополимер V 565
Этиленамиды V 201
Этилен-1,2-б«с-[аминоборац] IV 254, 255
Этиленгликоль I 9, 370; II 29, 301; 111 317;
IV 255—258; V 415
w-бутиловый эфир IV 255
Этилендиамин I 347; II 159, 292; IV 254,
255, 259; V 235
ЭтилендиаминТетрауксусная кислота (ЭДТК)
111 81, 179; IV 259—261
Этилендитиол Ц 80; III 148, 326; IV 244,
261, 262; V 565
Этиленимин I 402; 11 173, 449, 462; IV
262—264
Этилен иминотетр ал ии II 44
Этилен карбон ат 1 195; IV 264; V 177
Этиленкеталь метилэтилкетона см. 2-Метил-
2-этилдиоксолан-1,3
3,3; 20,20-бис-(Этиленкеталь)-11р, 18-оксидо-
18-окси-А5-17-изопрегнен I 277
Этилейполутиокетали 11 247
Этиленсульфид IV 264, 265
Этилентиокетали, десульфуризация I 203
Этилентиомочевина IV 259
Этиленхлорфосфит 1 438; [V 265
Этил идеи амины II 72
Этилиденмалоновой кислоты диэтиловый
.эфир Ill 72
N-Этилиденэтиламин II 72
а-Этилизомасляной кислоты этиловый эфир
111 395, 396
Этил изоцианат IV 253, 265,266
Этил иоднстый 1 33
О-Этилкапроновой кислоты амид Ill 333
а-Этилкапрононитрил 111 333
Этилкарбамат см. Уретан
3-(М-Этйлкарбамоил)-цистеин IV 265, 266
Этилкарбиламин Ill 278
Этилкетоны II] 450
Эгилксантогенат калия IV 41
Этилмагнийбромид V 435
Этилмалоновой кислоты диэтиловый эфир 1
99, 100
Этилмеркаптан II 80; V 530
Этил-Р-меркаптоэтил карбон ат IV 266
1-Этил-2-метиленазиридин см. М-Этилаллен-
имин 1 61
Этилмикофенолат V 181
Этилмикохроменат V 181
N-Этилморфолин IV 266,267
1-Этилнафталин V 244
М-Этил-7-оксцбензизоксазолийборфторид V
564
N-Этилоксимидохлорид III 17
Этил-р-оксиэтилтиокарбонат IV 266
З-Этилпентен-2 I 263
N-Этилпиперидин III 102
N-окись 111 21
(1-Этил пропенил )-метил циан уксусной ки-
слоты этиловый эфир II 279, 280
Этилпропенилоный эфир IV 267
(1-Этилпропилидеи)-циануксусной кислоты
этиловый эфир II 279, 280, 374
Этил-тг-пропилсульфид I 139
Р-Этилстирол [ 347; III 405
Этилтиоцианат I 139
N-Этил-ЛРтолуидин Ill 28
Этилтрифенилфосфонийбромид III 407
М-Этил-5-фенилизоксазолийборфторид 11
247
М-Этил-5-фенилизоксазолий-3'-сульфонат IV
199, 267, 268; V 566
Этил-М-фенилформимидат III 37
N-Этилформанилид III 37
N-Этил-гг-хлорформанилид 111 37
Этилцианат IV 167
Этилциклогексан II 144
4-Этилциклогексанол II 375
2-Этилциклогексанон V 65
4-Этилциклогексанон II 375
23*
707
1-Этил циклогексен 1Г 144
Этин дифтал ид см. а, В-Дифталиденэтан II
429, 430
17«-Этинил-Д’-андростендиол-ЗР, 17р III
346
Этинилкарбинолы (реакция Нефа) 1 79, 80
Этинилмагнийбромид IV 268
1-Этинил- 2,2,6,6-тетраметилциклогексилаце-
тат IV 205
1-Этинилциклогексанол 1 77, 81; II 47, 64,
65; 111 186, 189; IV 100
Этоксалилкетоны IV 232
Этоксиацетилен I 60, 413; 11 247, 301; Ц|
289; IV 268—273; V 304, 566
Этоксиацетиленид лития IV 273, 274
о-Этокси ацетофенон И 314
1-Этоксибутен-1-ин-З II 303; IV 274
2-Этокси- 1,2-дигидро-1-метил-6,8-динитро-
хинолин IV 275
2-Этокси-1,2-дигидропиран I 227; IV 275
1-Этокси-7,7-дихлорноркаран IV 122
(З-Этоксикоричной кислоты этиловый эфир 11
396
Этоксимагниймалоновый эфир II 208, 209;
111 453; IV 162
Этоксиметилен анилин IV 275, 276
Этоксиметиленмалоновой кислоты диэтило-
вый эфир [Ц 35, 36
Этоксиметиленмалойодиннтрил III 36
Этоксиметиленциануксусной кислоты эти-
ловый эфир IV 276, 277
2-Этоксинафталин-1-альдегид II 296, 297
2-Этоксипиридина N-окись IV 277
р-Этоксипропионовой кислоты хлорангидрид
3-Этокси-ДМ. стер о иды 1 409
2-Этокси-1,2,3,4-тиатриазол [V 167
2-Этоксифенилацетилен IV 272
о-Этоксифенилуксусная кислота II 314
3|3-Этокси хол ест ан II 185
3-Этокси-Д3,6-холестадиен III 94
ЬЭтокси циклогексен 111 7; IV 122
З-Этоксицнклогексен-2-он II 165, 166; III 348
1-Этоксициклогептатриен-1,3,5 IV 121, 122
1-Этоксициклопропилацетат III 280
р-Этоксиэтанол IV 75, 110
p-Этоксиэтилбромид IV НО
Этоксиэтиленмалоновой кислоты диэти-
ловый эфир III 158
Этоксиэтинилпропенилкарбинол 11 220,
221
Этоксиэтин ил пропен ил кетон 11 220, 221
Юглон 11 279
эпоксид V 324
Яблочная кислота 111 125
диэтиловый эфир 1 35, 36
/-Яблочная кислота IV 59
Янгонин V 288
Янтарная кислота I 67, 395
ангидрид I 395; II 25; IV 114
ди-трет-Оутиловый эфир IV 278
Динитрил И 108
дифениловый эфир IV 86
диэтиловЫй эфир I 148; II 129; III 98,
99: IV 194, 240
Янтарный днальдегид I 86, 333; IV 77
СОДЕРЖАНИЕ
Предисловие авторов................................................... 5
А
1-Адамантанкарбоновой кислоты хлорангидрид , ........... 7
Азидофосфор ной кислоты метилового эфира натриевая соль............... 9
Азоди к ар боновой кислоты диэтиловый эфир............................ 9
Азота четырехокись................................................... II
Азотистоводородная кислота........................................... 12
Акролеин............................................................. 15
Алюминий............................................................. 15
Алюминия бромид...................................................... 16
Алюминия третг-бутилат............................................... 18
Алюминия гидрид...................................................... 19
Алюминия окись для дегидратации спиртов.............................. 19
Алюминия окись для селективного гидролиза ацетатов первичных спиртов [9
Алюминия окись — калия гидроокись («щелочная окись алюминия») ... 20
Алюминия хлорид...................................................... 21
Амид калия........................................................... 24
Амид натрия.......................................................... 24
п-Аминобензойная кислота ... ........................................ 26
2-Амино-2-метил пропандиол-1,3....................................... 26
Арилдиазония тетрагалогенбораты...................................... 26
N-Ацетамидо карбинол................................................. 27
Ацетилендикарбоновой кислоты диметиловый эфир........................ 28
Ацетиленид лития..................................................... 29
Ацетил-/i-тол уол сульфон ат......................................... 29
а-Ацетоксиакрилонитрил............................................... 30
Ацетон............................................................... 31
Ацетонитрил.......................................................... 31
Б
Бензилхлорметиловый эфир ,........................................... 32
p-Бензоилпропионовая кислота......................................... 32
Бензойной кислоты натриевая соль .................................... 32
о-Бензолдиазонийкарбоксилат ......................................... 33
Берча восстановление................................................. 33
9-Борабицикло-[3, 3, 1]-нонан (9-ББН)................................ 35
Бора трибромид...................................................... 37
Бора трифгорида эфират , . . ........................................ 38
Бора трифторида эфират — уксусный ангидрид........................... 40
Бора трифторид — фтористый водород................................... 40
Бора трихлорид....................................................... 41
Борная кислота ... 42
Борфтористоводородная кислота........................................ 42
Брома азид........................................................... 43
N-Бромацетамид....................................................... 44
N-Бромацетамид — фтористый водород................................... 44
о-Бромацетофенон (фенацилбромид)..................................... 45
709
Бромистоводородная кислота (48%-ная).................................... 45
(—)-сс-Бромкамфор-л-сульфокислота....................................... 46
N-Бромсукцинимид ....................................................... 47
Бромтрифторметан........................................................ 49
Бромтрихлорметан........................................................ 50
Бромуксусной кислоты этиловый эфир.................................... 50
Бром(хлор)дипиридиннитрат............................................... 5L
Бромциан.............................................................. 52
а-Бромцианацетамид...................................................... 53
mpem-Бутила гидроперекись............................................... 53
mpem-Бутиламин......................................................... 54
mpem-Бутилат калия ..................................................... 56
mpem-Бутилгипоиодит .................................................... 66
трет-Бутилгипохлорит.................................................... 67
mpem-Бутилизоцианид..................................................... 67
н-Бутиллитий............................................................ 68
н-Бутидмеркаптан........................................................ 71
трет-Бутилового эфира угольной и диэтилового эфира фосфорной кислот
ангидрид............................................................. 72
mpem-Ьутил хлористый....................................... . . . 72
mpem-Бутил хромат....................................................... 73
N-(mpem- Бутокси карбонил окси)-сукцинимид.............................. 74
В
Виниллитий.............................................................. 75
Винилтрифеиилфосфоиийбромид............................................. 75
Г
Гексаметилдисил азан.................................................... 77
Гексаметилентетрамин (уротропин)........................................ 77
Гексаметилтриамид фосфористой кислоты................................... 78
Гексаметилтриамид фосфорной кислоты (гексаметапол)...................... 78
Гексафторбутин-2........................................................ 8[
Гексахлорциклопентадиен................................................ 81
Гексахлорциклотрифосфазатриен (фосфонитрилхлорид)...........-. , . . 82
Гексаэтилтриамид фосфористой кислоты [трис- (диэтил а ми но)-фосфин] . . 82
mpem-Гептилат калия................................................... 83
Гидразин................................................................ 84
Гидроксиламина хлоргидрат .............................................. 84
Гидроксиламин-О-сульфокислота (ГАСК).................................... 85
Гриньяра реактивы....................................................... 87
д
1,5-Диазабйцикло-[4, 3, 0]-нонен-5 (ДБН)................................ 88
1,4-Диазабйцикло-[2, 2, 2]-октан (ДАБЦО) ............................... 89
1,5-Диазабицйкло-[5, 4, 0]-ундецен-5 (ДБУ).............................. 91
Диазоацетальдегид ........................ . . . ............ . 91
Диазометан........................................................... 92
2-Диазопропан (диметилдиа'зометан)...........................' . 95
Диазоуксусный эфир 96
Диацетила и триметилфосфита аддукт...................................... 98
1,3-Дибензйл-2-метил-2-фосфа имидазол идин............................. 99
Диборан.............................................................. 100
Диборан— бора 'трифторид.............................................. 102
Диборан — натрия (лития) боргидрид . 102
1,3-Дибром-5,5-диметилгидантоин..................................... 103
Дибромизоциануровая кислота (ДБИ) ................................... ЮЗ
Дибромуксусной кислоты этиловый эфир................................ 104
710
2,6-Ди-трет-бутилпиридин , . ......................................
Дигитонин ................................. .......................
Диизобутилалюминийгидрид...........................................
Диизопропилпероксидикарбонат .................................. . .
Диимид . . , . ,...................................................
Дильса — Альдера реакция, растворители.............................
п-Диметиламинобензальдегид , ...............................
4,4'-б«с-(Диметиламино)-бензофенон (кетон Михлера).................
Щ4-Диметиламино-3;5-динитрофенил)-имид малеиновой кислоты..........
тетракис-(Диметилзмино) -титан.....................................
Диметиламинотриметилстаннан..............-.........................
N, N-Диметиланилин.................................................
Диметила цетамид...................................................
2,3-Диметилбутил-2-боран (тексилборан).............................
Ь1,М-Диметилгидразин...............................................
Диметилкарбметоксиметилфосфонат ........................
Диметилкарбонат ...................................................
Диметил мед ьлитий (л итийди метил медь)...........................
2,6-Диметилпиперидин...............................................
бис-(1,2-Диметилпропил-1)-боран («диизоамилборап»).................
Диметилсульфид.....................................................
Диметилсульооксид (ДМСО)...........................................
Диметилсульфоксида производные, а) Метилсульфинилметилиднатрий
(димсилнатрий). б) Диметилсульфонийметилид. в) Диметилсульфоксоний-
метилид . , , . ...............................................
Диметилсульфон .... ....................................
Диметилсульфонийкарбэтоксиметилид (ДСДМ)...........................
Диметилтиокарбамоил хлорид................. .......................
Диметилформамид (ДМФА).............................................
Диметилформамида диэтил ацеталь....................................
Диметилформамид — диметилсульфат...................................
Диметилформамид — хлорокись фосфора................................
3,5-Диметил-4-хлорметилизоксазол...................................
3,5-Днметоксибензил-п-нитрофенилкарбонат.........................
2,5-Диметокситетрагидрофуран.....................................
5,5-Диметокси-1,2,3,4-тетрахлорниклопентадиен ...................
1,1-Диметоксиэтан .................. .................
1,2-Диметоксиэтан («глим»)..................; ..................
Динатрийацетиленид...............................................
Динатрийфенантрен.............................-. •..............
2,4-Динитрофенилгидразин.........................................
4,4'-Динитродифенилиминоксил.....................................
бис-(2,4-Динитрофенил)-карбонат..................................
Ди-н-нитрофенилсульфит . ..........................’.............
2,4-Динитрофторбензол (ДНФ).............. .......................
Диоксандибромид..................................................
1,3-Дитиан.......................................................
1,1-Дифенилгидразин............................ . . . . . . '. . . .
Дифенилдиазометан................................................
1,3-Дифенил изобензофуран (2,5-дифенил-3,4-бензбфуран)...........
[2-(/1-Дифенил)-изопропил]-фенилкарбонат ........................
Дифенилиодоиийхлорид .... . ......................
Дифенилкарбаминоилхлорид............’............................
Дифенилкарбодиимид ..............................................
Дифенилсульфоиийизопропилид............................ '.......
Дифенилфосфинлитий...............................................
д-Дифенилфосфинобензойная кислота................................
Дифенилфосфорил метилентрифенилфосфоран..........................
Дифенилхлорфосфат................ ....................
104
104
108
НО
1 [0
111
1L1
111
112
113
113
114
115
115
117
118
119
120
122
123
123
124
134
144
144
145
146
147
148
148
148
149
150
151
152
152
152
153
154
154
155
155
156
156
157
164
164
164
165
165
165
165
166
167
167
168
168
711
N, N'-Дифенил этилендиамин.......................................... 169
Дифторамин......................................................... 169
1,1-Дифтор-2,2-дихлорэтилен......................................... 170
силл-Дифтортетрахлорацетон.......................................... 171
Дифторхлоруксусной кислоты натриевая соль........................... 171
Ди-ц-хлор-л-аллилдипалладий......................................... 174
1,3-Дихлорбутен..................................................... 175
1,3-Дихлорбутен-2................................................... 175
Дихлорвиниленкарбонат ... ..................................... . 177
2,3-Дихлор-5,6-дициан-1,4-бензохинон (ДДХ).......................... 178
Дихлоркетен......................................................... 183
Дихлорметиллитий, трихлорметиллитий ................................ 184
Дихлорметилметиловый эфир........................................... 185
Дихлорметил-2-хлорэтиловый эфир .................................... 186
2,3-Дихлорпропен.................................................... 186
Х,Х-Дихлоруретан (ДХУ).............................................. 187
^ис-3,4-Дихлорциклобутен............................................ 189
1,1-Дихлорэтилен.................................................... 190
Дицианацетилен (динитрил ацетилендикарбоновой кислоты) . -.......... 190
Дициандиазометан.................................................. 191
«Дициандиамида-ЗМ-циангуанидин ..................................... 192
N, N'-Дициклогексиламидин N-морфолинкарбоновой кислоты.............. 192
Дициклогексил карбодиимид (ДЦК)..................................... 192
Диэтилалюминийцианид................................................ 193
Диэтилкарбонат...................................................... 194
N, N-Диэтил-1-пропинил амин (N, N-диэтиламинопропин)................ 195
Диэтил-(1, 1, 2,-трифтор-2-хлорэтил)-амин........................... 195
М,М-Диэтил-1,2,2-трихлорвиниламин................................... 196
Диэтил фосфит....................................................... 197
Диэтилцианметилфосфонат........................................... 197
Диэтил-р-(циклогексил амино)-винилфосфонат.......................... 199
Диэтилцинк — метилен иодистый....................................... 199
1,1-Диэтоксипропин-2................................................ 200
Ж
Железа нонакарбонил................................................. 202
Железа пентакарбонил................................................ 203
Железа (III) хлорид ................................................ 203
Железо.............................................................. 205
И
Изоамилнитрат....................................................... 206
Изопропенилметиловый эфир........................................... 206
Имидазол............................................................ 208
Иод................................................................. 209
Иодазид............................................................. 211
Иода монобромид..................................................... 212
Иода нитрат....................................................... 212
Иодбензола дихлорид................................................. 213
1-Иодгептафторпропан................................................ 214
Иодизоцианат ....................................................... 215
Иодистоводородная кислота .......................................... 217
Иодная кислота ..................................................... 217
Иодная кислота— хромовая кислота.................................... 219
тетракис-[Иод-(три-н-бутилфосфин)-медь]............................. 220
Ионообменные смолы.................................................. 221
Иридиевый катализатор............................................... 222
712
Иридий на сульфате бария или карбонате кальция........................ 222
Иридия тетрахлорид.................................................... 222
К
Калия гидрид........................................................ 224
Калия гидроокись.................................................. 224
Калия иминоксилдисульфонат ......................................... 220
Калия перманганат................................................... 226
Калия персульфат.................................................... 226
Калия персульфат — серебра нитрат................................... 226
Калия феррицианид.................................................. 227
Калия фторид...................................................... 228
Кальций — жидкий аммиак............................................. 229
Кальция бор гидр ид................................................. 229
Кальция гидрид ..................................................... 230
Кальция карбонат.................................................... 230
d-10-Камфорсульфокислота............................................ 231
Карбметоксиметилентрифенилфосфоран.................................. 232
гс-Карбоксибензолсульфонилазид...................................... 232
п-Карбоксифенилборная кислота....................................... 233
га-Карбоксифенилдиазонийхлорид...................................... 235
N,N'-Карбонилдиимидазол............................................. 235
1,1 -Карбонилди-1, 2, 4-триазол..................................... 236
Карбонилцианид ..................................................... 236
Ы-Карбэтокси-2-этокси-1,2-дигидрохинолин............................ 236
Кетен............................................................... 237
Кетенилидентрифенилфосфоран......................................... 238
Кислорода дифторид ................................................. 239
Кобальта (II) ацетат................................................ 239
Кобальта гидрокарбонил ............................................. 240
бис-( Кобальттетра карбонил) цинк................................... 240
Ксеноновая кислота ................................................. 241
Л
Левулиновая кислота............................................... 242
Литий-алкиламинное восстановление . ................................ 242
Литий — аммиак.................................................... 243
Литий — дифенил................................................... 243
Литий — нафталин.................................................. 244
Литий — этилендиамин.............................................. 245
N-Литийэтилендиамин................................................. 246
Лития алюмогидрид................................................... 246
Лития алюмогидрида и З-О-бензил-1,2-0-циклогексилиден-а-0-глюкофура-
нозы комплекс...................................................... 247
Лития алюмогидрид — алюминия хлорид ................................ 249
Лития бромид........................................................ 250
Лития трмс-(трет-бутокси)-алюмогидрид............................... 250
Лития гидрид........................................................ 252
Лития ди изобутил метил алюмогидрид................................. 252
Лития диизопропиламид . . ................................... 252
Лития ди циклогексила мид........................................... 253
Лития диэтиламид.................................................... 254
Лития карбонат — лития бромид....................................... 256
Лития нитрид........................................................ 256
Лития триметоксиалюмогидрид......................................... 257
Лития триэтоксиалюмогидрид.......................................... 257
Лития хлорид........................................................ 257
713
м
Магний............................................................. 259
Магний — нафталин.................................................. 259
Магний — ртуть хлорная......................................... . . 259
Магния бромид безводный .................................. -. . . 259
Магния окись ...................................................... 260
Малонового диальдегида тетраэтил а деталь........................ 261
Марганца ацетат . . . ............................................. 261
Марганца триста цетила цетонат) (МТ А)............................. 262
Марганца двуокись активная . . .................................. 263
Меди (I) ацетат.................................................... 270
Меди (II) ацетат.............................................. . 271
Меди (II) ацетил ацетон ат....................................... 271
Меди (I) иодид..................................................... 272
Меди (II) нитрат — уксусный ангидрид............................... 273
Меди (II) сульфат безводный........................................ 275
Медный порошок..................................................... 276
Медь (I) бромистая................................................. 278
Медь (II) бромная.................................................. 280
Медь (I) хлористая................................................. 280
Медь (II) хлорная................................................ 281
Медь хлорная (бромная) — азота окись............................... 284
N-Метансульфинил-п-толуидин........................................ 285
Метансульфокислота................................................. 286
Метансульфохлорид (мезилхлорид).................................... 286
Метилаль........................................................... 287
Метилат магния..................................................... 287
Метилат натрия..................................................... 289
2-Метилбутилат-2-натрия (mpem-амилат натрия)....................... 289
Метилвинилкетон.................................................... 289
Метиленмагнийбромид (иодид) ... ................................... 292
Метилен хлористый.................................................. 293
Метил иодистый .................................................... 293
Метиллитий......................................................... 294
Метил магнийиодид............................................... 299
Метилмедь — три-я-бутилфосфин, комплекс............................ 299
N-Метилморфолин.................................................... 300
М-Метилпирролидон-2.............................................. 300
4-(Метилтио)-фенол................................................. 301
Метилтиофосфоновой кислоты диметиловый эфир........................ 301
1-Метил-З-п-толилтриазен.......................................... .302
4-Метил-1,2,4-триазолиндион'3,5................................... " 302
Мети л фосфоновой кислоты бис- (ди метил амид)..................... 303
Метоксиацетилен.................................................... 304
4-Метокси-5,6-дигидро-2Н-пиран.................................... 305
Метоксимагнийметил карбонат........................................ 305
а-Метоксиметилентрифенилфосфоран................................. 305
Молекулярные сита ... . .................................... 306
Молибдена гекса карбон ил........................................ 307
Мононадугол иной кислоты /лрет-бутил изопропиловый эфир............ 307
Мочевина........................................................... 308
Муравьиная кислота................................................. 308
Муравьиной кислоты этиловый эфир . . . ............................ 310
Н
Надбензойной кислоты mpem-бутиловый эфир .......................... 311
Надлауриновая кислота ............................................. 311
714
Надуксусная кислота................................................. 312
Натрий — аммиак...................................................... 314
Натрий-трат-бутанол — тетрагидрофуран................................ 315
Натрий--нафталин................................................... 316
Натрия азид.............................. . .................... 316
Натрия алюмодигидрид-бис- (2-метоксиэтил ат) . . , , ............. 317
Натрия алюмохлорид................................................ 318
Натрия амальгама.................................................. 318
Натрия бисульфит..................................................... 319
Натрия боргидрид..................................................... 319
Натрия гидрид..................................................... 320
Натрия гипобромит ................................................... 322
Натрия изопропилат................................................... 322
Натрия иодид ... ................................................... 323
Натрия нитрит. ...................................................... 323
Натрия перборат ..................................................... 324
Натрия и свинца сплав................................................ 324
Натрия сульфит....................................................... 325
Натрия теллурид...................................................... 326
Натрия тритиокарбонат ............................................... 326
Натрия фторид ....................................................... 326
Натрия цианат ....................................................... 326
Натрия цианид — диметилсульфоксид.................................... 326
Никель-алюминиевый сплав . ....................................... 327
Никеля борид......................................................... 328
Никеля карбонил ..................................................... 328
Никеля перекись ..................................................... 331
Нитрил иодистый...................................................... 333
Нитрил хлористый..................................................... 333
Нитробензол.......................................................... 333
N-n-Нитробензолсульфоксиуретан....................................... 334
л/-Нитробензолсульфонила перекись.................................... 334
Нитрозилсерная кислота .............................................. 334
Нитрозил фтористый.................................................. 335
Нитрозил хлористый.................................................. 335
Нитрония борфторид.................................................. 336
бис-(тг-Нитрофенил)-фосфат кислый.................................... 337
n-Нитрофенол , ..................................................... 337
Норборнен............................................................ 338
О
1-Окись 1-фенил-З-метилфосфолена-З ... . ........................... 339
Окись этилена..................................................... 339
Оксалилхлорид.....................................................' 340
N-Оксисукцинимида трифторацетат...................................... 340
Оксованадия ацетилацетонат .......................................... 341
Олово................................................................ 341
Олово хлористое..................................................... 342
Ортомуравьиной кислоты триэтиловый эфир.............................. 342
Осмия четырехокись (осмиевый ангидрид).............................. 343
Осмия четырехокись — натрия хлорат................................... 343
П
Палладиевые катализаторы............................................ 345
Палладий хлористый .................................................. 345
Палладия (11) ацетат................................................. 347
Палладия гидроокись как катализатор.................................. 347
транс-2,4-Пентадиеновой кислоты метиловый эфир...................... 347
715
Пентаметилбензил хлорид........................................... 348
Пентахлорфенол.................................................... 348
Пентаэто кс и фосфор ан........................................... 348
транс- Пен те н-З-он-2.......................................... 349
Перекись водорода в нейтральной среде............................. 350
Перекись водорода в щелочной среде................................ 351
Перйодаты......................................................... 351
Перхлорилфторид................................................... 353
Пиперидин......................................................... 355
Пиридин........................................................... 355
Пиридин — алюминия хлорид....................................... 357
Пиридина N-окись.................................................. 358
Пиридина хлоргидрат .............................................. 358
Пиридин — н-Бутиллитий............................................ 360
Пирофосфорилтетрахлорид (ПФТХ).................................... 360
Пирролидин . 361
Платиновые катализаторы......................................... 362
Платинохлористоводородной кислоты калиевая соль................... 362
Полигексаметилен карбодиимид...................................... 363
Полифосфорная кислота (ПФК)...................................... 363
Полифосфорной кислоты эфиры (ПФЭ)............................... 365
Р
Ренея катализаторы никелевые...................................... 367
Родия трихлорид................................................... 368
Ртути (II) ацетат................................................. 368
Ртути окись (желтая) ............................................. 372
Ртути (I) три фтор ацетат......................................... 373
Рутения четырехокись ............................................. 373
С
Салькомин .......... ........... ................................. 377
Свинец ..................................... . ............... 377
Свинца двуокись .................................................. 378
Свинца диацетата тригидрат........................................ 379
Свинца тетраацетат................................................ 379
Свинца тетраацетат — N-бромсукцинимид............................. 384
Свинца тетра-(трифторацетат)...................................... 384
Селена двуокись............................................... 385
Селена двуокись — перекись водорода........................... . 386
Сера двухлористая ... ........................................... 387
Сера четырехфтористая............................................. 387
Серебра борфторид................................................. 388
Серебра карбонат ................................................. 389
Серебра нитрат................................................ 390
Серебра окись ........................... .............. ....... 393
Серебра (II) окись................................................ 393
Серебра перхлорат ................................................ 394
Серебра фторид.................................................... 396
Серебра хлорат ................................................... 397
Сернистой кислоты N, N-диэтиламида метиловый эфир................. 398
Сернистый ангидрид............................................... 398
Серный ангидрид — ди оке ан ...................................... 398
Серный ангидрид — пиридин ........................................ 399
Симмонса — Смита реагент.......................................... 400
Сульфолен-3 (2,5-дигидротиофен диокси д-1,1, «бутадиенсульфон»)... 402
«Сульфо-микс» (раствор ж-нитробензол сульфокислоты в серной кислоте) . 403
716
Сульфоуксусная кислота........................................... 404
Сульфурил хлористый.............................................. 404
Т
Таллия (1) бромид................................................... 406
Таллия триацетат.................................................... 406
Тетрагептиламмоиия хлорид........................................... 407
Тетрагидрофталазин.............................................. . 407
Тетрагидрофуран..................................................... 408
Тетраметилгуанидиния азид........................................... 409
Тетраметиленсульфон (сульфолан)..................................... 409
Тетраметил пирофосфит............................................... 411
N, N, N', N', -Тетраметилэтилендиамин (ТМЭДА)............. 411
Тетраметоксиэтилен ................................................. 412
Тетра нитрометан................................................. 413
(_i_). и (—)-а-(2, 4, 5, 7-Тетранитро-9-флуоренилиденаминоокси)-пропионо-
вая кислота....................................................... 413
Тетрафенилэтилен ................................................... 413
Тетрахлорциклопентадиёнона этиленкеталь............................. 415
Тетрацианэтилен . . 416
Тетраэтиламмония ащтаг.............................................. 416
Тетраэтиламмония иодаг.............................................. 416
N, N'-Тиокарбонилдиимидазол......................................... 417
Тиомочевина ........................................................ 417
Тионил хлористый.................................................... 418
L-Тирозингидразид................................................... 419
Титан треххлористый ................................................ 419
Титан четыреххлористый.......................................... 420
п-Толуолсульфонат серебра........................................... 421
ц-Толуолсульфонилазид (тозилазид).................................. 421
n-Толуолсульфонилгидразин (тозил гидразин).......................... 423
Треххлористый азот.................................................. 429
силш-Триазин........................................................ 430
1, 2, 4-Триазол..................................................... 430
био(Трибромметил)-ртуть............................................. 430
2, 4, 6-Трибромфенол................................................ 431
Три-н-бутилстаннан.................................................. 431
Триметиламина окись................................................. 432
Триметил борат...................................................... 432
Триметилоксония борфторид........................................... 433
Триметилоксония 2, 4, 6-тринитробензолсульфонат................. . 433
бис-(Триметилсилилдихлорметил)-ртуть................................ 434
1-Триметилсилилпропиниллитий-З...................................... 434
Триметил-(трифторметил)-станнан..................................... 436
Триметилфосфит.... ................................................. 436
Триметил фосфита — метил меди комплекс.............................. 438
Триметил хлорси ла н ... ........................................... 439
Трифенил метил борфторид............................................ 442
Трифенил металл итий................................................ 443
2, 2, 2-Трифенил-1, 2-оксафосфолан.................................. 443
Трифенил пропаргилфосфонийбромид.................................... 444
Трифенилстаннан .................................................... 444
Трифенилфосфин...................................................... 445
Трифенилфосфиндибромид.............................................. 447
Трифенилфосфиндифторид............................................. 447
бис-(Трифенилфосфин)-ирндий (III) тргггидрид . . . '................ 447
быс-(Трифенилфосфин)-никельдцхлорид................................. 448
трис-(Трифенилфосфин)-родийхлорид................................... 448
717
тр«с-(Трифенилфосфин)-рутенийдихлорид . . .
Трифен ил фосфин-углерод четырех хлор исты fl ,
быс-(Трифенилфосфин)-хлоркарбонилродий . .
Трифенилфосфит ..........
Тр не зенил фосфита дибромид .
. Трифен и л фосфита подметил ат
Трифенилхлорметан .......
Трифторметилгипофторит . .
Трифторнадуксусная кислота
Трнфторуксусная кислота . .
Трихлорацетилизоцианат......................................
Трихлоризоциануровая кислота (трихлорфульминуровая кислота)
Трихлоруксусная кислота ....................................
Трихлоруксусной кислоты натриевая соль
б«с-(2, 2, 2-Трихлорэтил)-хлорфосфат
Триэтилалюминий......................
Триэтиламин .... ....................
Триэтилендиамин .....................
Триэтилоксония борфторид..............
Триэтилсилан ................. ......
Триэтилфосфит.........................
454
455
456
456
456
456
456
457
458
459
460
461
461
462
462
463
464
466
467
468
468
V
Углерода окись................................................. . 471
Угольной кислоты mpem-бутилового эфира азид......................... 471
Угольной кислоты mpem-бутилового эфира фторангидрид................. 473
Угольной кислоты тре/и-бутилпентахлорфениловый эфир................. 473
Угольной кислоты трст-бутил-2, 4, 5-трихлорфениловый эфир........... 473
Угольной кислоты этилового эфира азид..................... 475
Уксусная кислота.................................................... 475
Уксусная кислота 80%-ная............................................ 476
Уксусного альдегида ди метил ацеталь (1, 1-диметоксиэтан)........... 478
Уксусной кислоты л-нитрофениловый эфир.............................. 479
Уксусной кислоты серебряная соль.................................... 479
Уксусномуравьиный ангидрид.......................................... 480
Уксуснофосфорный ангидрид.......................................... 482
Уксусный ангидрид................................................... 483
Ф
Фенантренхинон...................................................... 488
Фенилборная кислота ................................................ 488
Фенилгидразин ..................................................... 488
Фенилдиазометаи................................................... 489
о-Фенилендиоксифосфортрибромид ..................................... 490
о-Фенилендиоксифосфортрихлорид ..................................... 490
бис-о-Фениленпирофосфит .... 491
о-Фениленхлорфосфат................................................. 49!
о-Фениленхлорфосфит................................................. 491
Фенилизотиоцианат .................................................. 492
Фенилизоцианат.................................................... 492
N-Фенилимид азодикарбоновой кислоты................................. 492
сс-Фенилмасляной кислоты ангидрид .................................. 494
Фе нил метансульфофторид.......................*.................... 495
2-Фенил-3-метил-2-фосфа-1,3-оксазолидин............................. 496
Фе ни л тиометил литий............................................ 496
Фенил-(тригалогенметил) -ртуть...................................... 497
Фенилтриметиламмония пербромид..................................... 500
1-Фе ни л-5-хлортетразол............................................ 500
718
Фенилцианат...................................................... 501
d- и Z-a-Фенилэтиламины........................................... 502
Формальдегид.................................................... 503
Формамид.......................................................... 504
Формамидиния ацетат............................................... 505
Фосген............................................................ 505
Фосфин (фосфористый водород).......................'.............. 506
Фосфора хлорокись ................................................ 507
Фосфорный ангидрид — mpem-амин.................................... 508
Фосфор трехбромистый.............................................. 508
Фталазиндисн-1,4............................................... . 509
Фтордихлоруксусной кислоты метиловый эфир........................ 510
Фтористый водород безводный....................................... 510
Фтористый водород — пятифтористая сурьма.......................... 511
Фторсульфоновая кислота.......................................... 512
X
Хинолин......................................................... 513
Хлорамин.......................................................... 513
Хлоранил.......................................................... 514
1 Хлорбензотриазол............................................ 515
Хлорбром.......................................................... 516
Хлориридиевая кислота и иридия трихлорид.......................... 516
Хлористый водород безводный ...................................... 516
Хлорметилбензилсульфид............................................ 517
м-Хлорнадбензойная кислота . ..................................... 517
Хлорная кислота.................................................. 519
N-Хлорсукцинимид.................................................. 520
Хлорсульфоизоцианат .... .................................... 521
Хлорсульфоновая кислота .......................................... 522
Хлоругольной кислоты mpem-амиловый эфир........................... 522
Хлоругольной кислоты бензиловый эфир (карбобензоксихлорид) .... 523
Хлор\тольной кислоты изо и emop-бутиловые эфиры................... 523
Хлоругольной кислоты mpem-бутиловый эфир.......................... 524
Хлоругольной кислоты изобутиловый эфир........................... 524
Хлоругольной кислоты n-нитрофениловый эфир........................ 525
Хлоругольной кислоты тиобензиловый эфир.......................... 526
Хлоругольной кислоты 6, |3, fl-трибромэтиловый эфир............... 527
Хлоругольной кислоты р, jJ, jJ-трихлорэтиловый эфир............... 527
Хлор угольной кислоты фениловый эфир (фенил хлорформнат).......... 528
Хлоругольной кислоты этиловый эфир................................ 529
М-Хлор-М-циклогексилбензолсульфамид............................... 529
Хрома (II) ацетат................................................. 530
Хрома (II) сульфат................................................ 530
Хрома (II) хлорид................................................. 531
Хромила ацетат.................................................... 533
Хромила хлорид ................................................... 534
Хромовая кислота............................................ 535
Хромовый ангидрид ................................................ 536
ц
Церий, аммиакат нитрата (ЦАН) ................................... 541
Церия сульфат..................................................... 543
Цианазид.......................................................... 543
Циклогександпон-1,2............................................. 543
Циклопентадиенона кетали (диметил-, диэтил-, триметилен- и этиленкетали) 544
Циклопропилтрифенилфосфонийбромид................................. 546
719
Цинка бромид........................................................ 547
Цинк амальгамированный.............................................. 548
Цинка хлорид........................................................ 549
Цинк, другие формы.................................................. 550
Цинк-медная пара.................................................... 550
Цинковая пыль....................................................... 550
Щ
Щавелевая кислота................................................... 556
Щавелевой кислоты диэтиловый эфир................................... 556
Э
Этаноламин.......................................................... 557
Этилат таллия (I)................................................... 558
N-Этилбензизоксазолия борфторид..................................... 564
Этилвинилрвый эфир.................................................. 564
1-Этил-3-(у-диметиламинолропил)-карбодиимида хлоргидрат............. 564
Этилдициклогексиламин............................................... 564
Этилена и N-оксиимида малеиновой кислоты сополимер ................. 565
Этилендитиол ....................................................... 565
М-Этил-5-фенилизоксазолий-3'-сульфонат.............................. 566
Этокси ацетилен..................................................... 566
Авторский указатель................................................ 567
Указатель реагентов по типам реакций................................ 631
Предметный указатель................................................ 648
Л. Физер, М. Физер
РЕАГЕНТЫ ДЛЯ ОРГАНИЧЕСКОГО СИНТЕЗА
Том V
Редактор И. В. Алексеева. Художник К. П. Саратов. Художественный редактор
Н. Г. Блинов. Технический редактор А. Г. Резоухова
Сдано в набор 9/1V 1971 г. Подписано к печати 10/1Х 1971 г.
Бумага № 1 60X90J/le — 22,5 бум. л. 45 печ. л. Уч.-изд. л. 53,85. Изд. № 3/5956
Цена 4 р. Об к Заказ № 1994
ИЗДАТЕЛЬСТВО «МИР», Москва, 1-й Рижский пер., 2
Ордена Трудового Красного Знамени П-рвая Образцовая типография имени
А А. Жданова Главполиграфпрома Комитета по печати при Совете Министров СССР
Москва, М-54, Валовая, 28