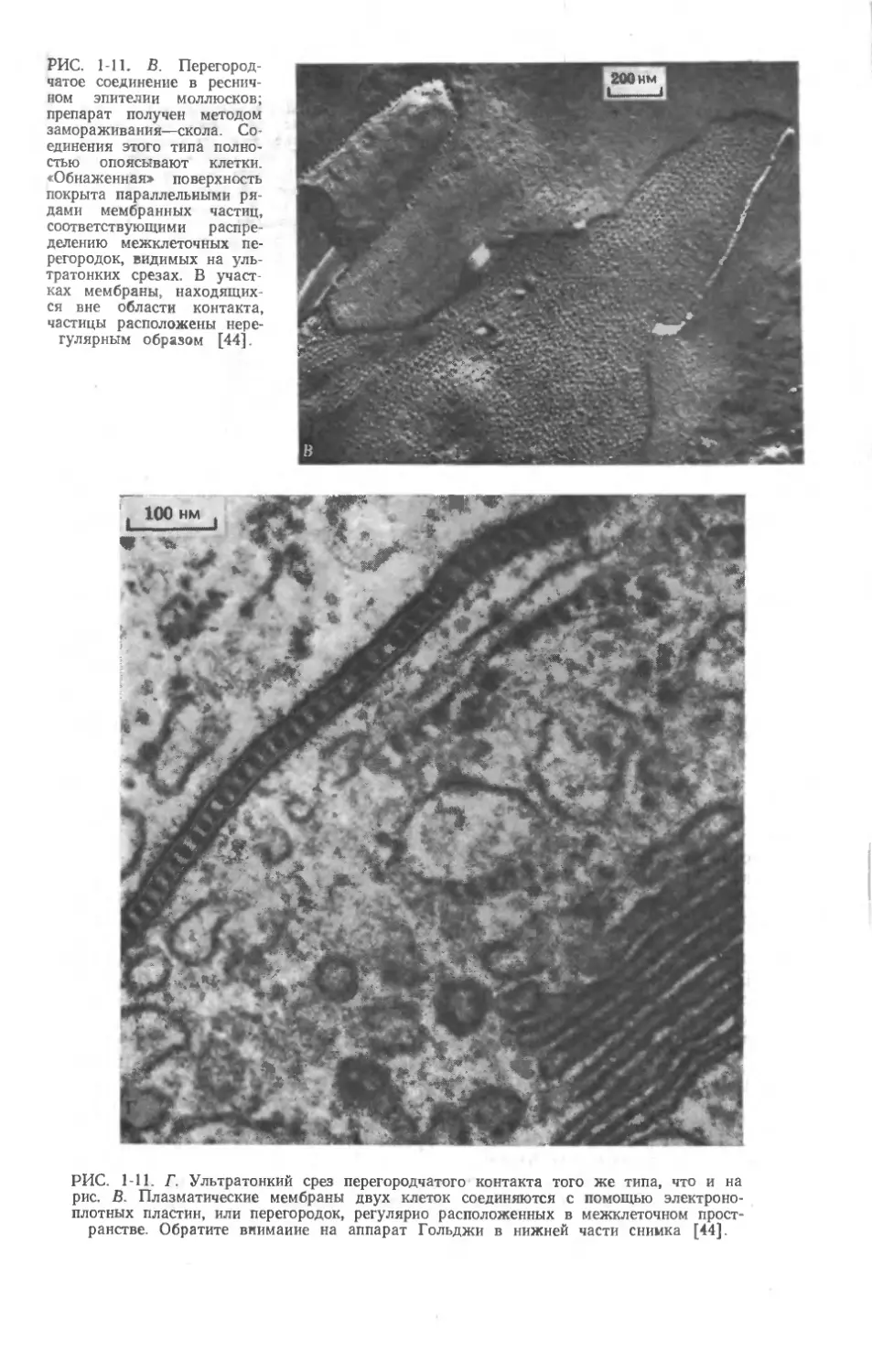
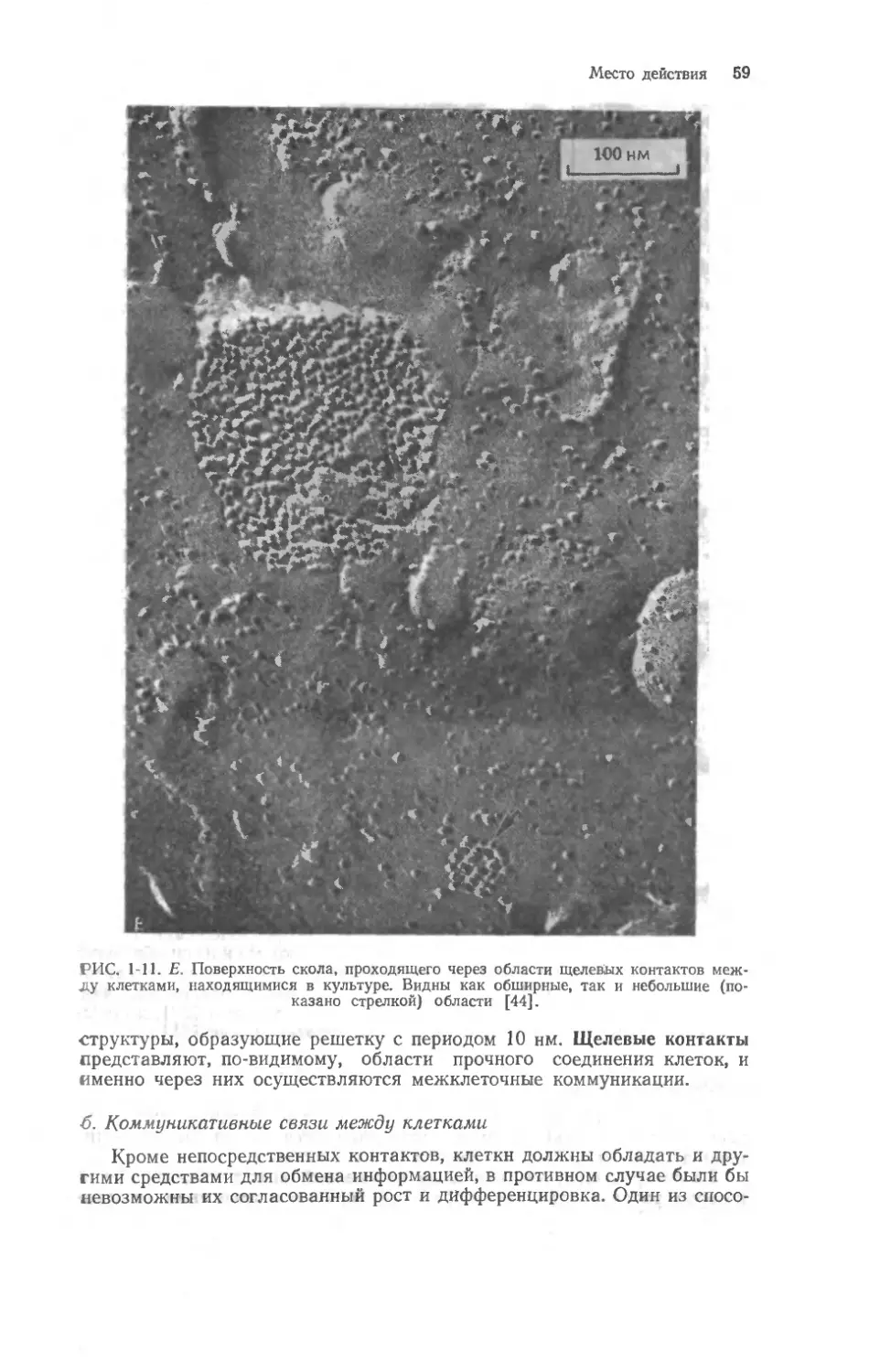
Автор: Мецлер Д.
Теги: материальные основы жизни биохимия молекулярная биология биофизика химия биология
Год: 1980
Текст
BIOCHEMISTRY
THE CHEMICAL REACTIONS
OF LIVING CELLS
David E. Metzler
IOWA STATE UNIVERSITY
Academic Press
New York San Francisco London
A SUBSIDIARY OF HARCOURT BRACE JOVANOVICH,
PUBLISHERS
Д. Мецлер
БИОХИМИЯ
Химические реакции
в живой клетке
том
1
Перевод с английского
под редакцией
акад. А. Е. Браунштейна,
д-ра хим. наук Л. М. Гинодмана,
д-ра хим. наук Е. С. Северина
Издательство
«Мир»
Москва
1980
УДК 577.1
Новейшее и наиболее современное руководство по биохимии, напи-
санное известным американским ученым, работающим в области биохи-
мии, молекулярной биологии и энзимологии. Отличительной чертой книги
является рассмотрение материала в соответствии с химическими реакция-
ми, происходящими в живой клетке, а не традиционно — по основным
классам соединений.
На русском языке книга выходит в трех томах.
В настоящий, первый, том вошли главы, посвященные общим вопро-
сам, структуре биополимеров, энергетике и функциям клеточных мембран.
Во втором томе изложены основы ферментативного катализа, описаны
пути синтеза и распада молекул в живых организмах. В третьем томе
рассмотрены вопросы биохимической генетики, роста и дифференцировки
тканей, химического взаимодействия клеток, а также влияния внешних
факторов на процессы обмена веществ.
Предназначена для биохимиков, молекулярных биологов, физиологов,
генетиков, микробиологов, цитологов, фармакологов, химиков, медиков,
для студентов, аспирантов и преподавателей биологических, химических
и медицинских специальностей.
Редакция литературы по биологии
200«040000
21005-395 © 1977, Academic Press, Inc.
041(01)-80 П^Щ. ИЗД. 198 © Перевод на русский язык, «Мир», 1980
Предисловие редакторов
перевода
Предлагаемый вниманию читателя учебник написан известным аме-
риканским биохимиком Д. Мецлером. Автор поставил перед собой цель
дать анализ структур, функций и процессов, характерных для живой
клетки, с позиций современной биоорганической химии и молекулярной
физики. Он концентрирует внимание на всестороннем рассмотрении про-
текающих в клетках химических реакций, на ферментах, катализирую-
щих эти реакции, основных принципах обмена веществ и энергии.
Впервые приведена классификация химических механизмов фермента-
тивных реакций (нуклеофильное замещение, реакции присоединения,
реакции элиминирования, реакции изомеризации и др.). В этом наибо-
лее наглядно проявилась особенность рассмотрения биохимических
проблем с позиций биоорганика. Обстоятельно изложены многие вопро-
сы, которым прежде не уделяли должного внимания в курсе биохимии.
Это касается в частности количественной оценки сил межмолекулярно-
го взаимодействия, принципов «упаковки» молекул в надмолекулярных
структурах (самосборка), кооперативных структурных изменений мак-
ромолекул и их комплексов. Приведены основные сведения о структуре
и функциях клеточных мембран, об антигенах и рецепторах клеточных
поверхностей. Весьма подробно рассмотрены также вопросы фотосин-
теза, зрения и ряда других биологических процессов, связанных с по-
глощением света; при этом охарактеризована природа некоторых физи-
ческих явлений, наблюдаемых при взаимодействии света и вещества.
Особое место занимают в монографии главы, посвященные биохими-
ческой генетике и проблемам роста и дифференцировки.
Большим достоинством книги является то, что всюду (где это воз-
можно) автор стремится проследить взаимосвязь между физиологиче-
ским феноменом и лежащими в его основе химическими реакциями, а
также структурными перестройками надмолекулярных комплексов.
Книга хорошо иллюстрирована. Каждая глава сопровождается от-
носительно небольшим, но хорошо подобранным списком литературы.
Следует отметить, что автор использует самые последние данные. В кон-
це глав приведены вопросы и задачи, позволяющие студентам прове-
рить, насколько они усвоили материал.
В книге объективно отражен вклад различных авторов, в том числе
советских ученых, в развитие биохимии. Автор несколько раз посещал
СССР, изучил русский язык и поддерживает постоянные научные кон-
такты с советскими биохимиками.
Учебник Д. Мецлера весьма существенно отличается от переведен-
ных в последние годы на русский язык учебников — А. Ленинджера,
Г. Малера и Л. Кордеса. Он несомненно будет весьма полезен студен-
там и аспирантам, изучающим биологическую и биоорганическую хи-
мию, преподавателям и научным сотрудникам, работающим в этой
области. Ряд разделов учебника представляет несомненный интерес для
биофизиков, физиологов и фармакологов.
А. Е. Браунштейн
Л. М. Гинодман
Е. С. Северин
Предисловие автора
к русскому переводу
я очень рад тому, что мои коллеги — советские биохимики — пере-
вели на русский язык эту книгу и она стала доступной для студентов
Советского Союза. Я имел длительный контакт с одним из ее редакто-
ров, академиком А. Е. Браунштейном, С его работами я познакомился
еще в 1948 г., когда стал аспирантом-биохимиком и начал изучать хи-
мию пиридоксальфосфата. Позднее, в 1965 г., мне посчастливилось
провести пять месяцев в его лаборатории, где я работал с профессора-
ми Р. М. Хомутовым, Е. С. Севериным (также одним из редакторов
настоящей книги) и другими молодыми, увлеченными своим делом био-
химиками. Этот период был очень полезен для моего научного роста.
Некоторые идеи, зародившиеся в то время в дискуссиях с советскими
биохимиками, сыграли важную роль в моем понимании вопросов энзи-
мологии, и сейчас они нашли многообразное отражение в этой книге.
В последние 15 лет сохранялась большая общность научных инте-
ресов моей лаборатории и исследователей из Института молекулярной
биологии. Наша собственная «программа научного обмена» осуществ-
лялась путем личных посещений, переписки и другими способами. Все
это было для меня очень полезно, и достижения московских коллег
представляются мне весьма внушительными; мне особенно хотелось бы
поздравить их в связи с установлением первичной структуры аспартат-
аминотрансферазы сердца, а позже — и трехмерной структуры этого
фермента.
Контакты с советскими учеными важны для меня и в другом плане.
Мне давно уже представляется, что необходимы прочные личные дру-
жеские связи между американцами и гражданами Советского Союза.
Я убежден, что наши два народа очень схожи по своему характеру и
что мы можем и должны жить в мире, уважая друг друга. То, что я
имел возможность пробыть в Советском Союзе несколько месяцев и
«оставить там кусок своей жизни»1, явилось для меня привилегией. Сей-
час в моей стране я пытаюсь способствовать делу мира и бороться с
международной гонкой вооружений, которая представляет угрозу для
нас всех.
Дэвид Э. Мецлер
15 июня 1979 г.
1 Слова, набранные курсивом, были написаны автором по-русски. — Прим. ред.
Предисловие
Современная биохимия, занимающаяся исследованием химических
реакций, которые протекают в живых клетках, представляет настолько
широкую и сложную область, что включает в себя почти все отрасли
химии и биологии. Создание вводного курса по этому предмету — весь-
ма нелегкая задача, и я никогда бы за нее не взялся, если бы стремил-
ся только улучшить существующие учебники. Но я убежден, что курс
биохимии, предназначенный для широкого круга студентов и препода-
вателей, должен быть создан на принципиально новой основе. Вместо
того, чтобы делить книгу на части, посвященные описанию отдельных
классов химических соединений — белков, нуклеиновых кислот, липидов
и углеводов, — я опирался при таком разделении на типы химических
реакций, протекающих в клетках. Неизменно подчеркивая биологиче-
ские аспекты рассматриваемых явлений, я стремился проследить хими-
ческую основу различных физиологических явлений.
Биохимия во всей ее сложности и многообразии нередко представ-
ляется чрезвычайно трудным предметом. Я старался максимально об-
легчить студентам их задачу, ориентируясь при этом на лиц с самым
разным уровнем подготовки. Так, основная часть текста представляет
собой четкое, без излишних деталей изложение принципов биохимии.
Дополнительные сведения, касающиеся витаминов, металлов, ядов, ме-
тодов исследования, болезней, обусловленных нарушением обмена ве-
ществ, могут быть очень интересными для одних студентов и менее ин-
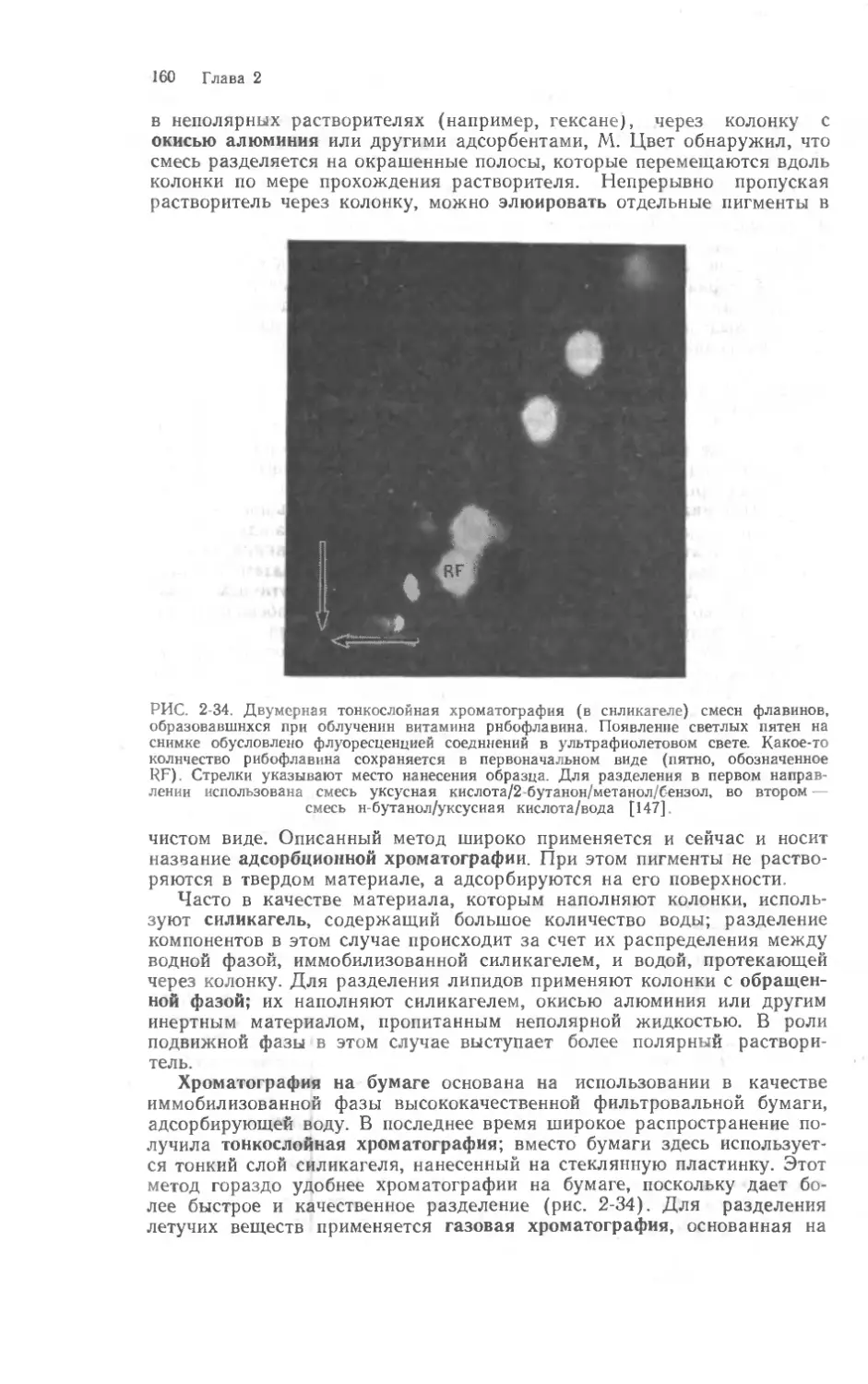
тересными для других. Поэтому такая информация вынесена из текста
в специальные дополнения с тем, чтобы не прерывать изложение фун-
даментальных вопросов (эти дополнения включены в подробно состав-
ленное оглавление; кроме того, их перечень приведен отдельно в конце
книги). В этом учебнике я стремился не только четко и доступно изло-
жить основы биохимии, но и привести ссылки на литературу, которая
пригодится студентам в будущем. В учебнике цитируется следующая
литература: 1) справочники (например, «Enzymes» в 13 томах, под
ред. Р. Boyer, Academic Press, New York); 2) статьи, имеющие принци-
пиальное значение (как старые, так и недавно опубликованные); 3) те-
кущая литература, которая поможет студентам разобраться в работах
по конкретной научной проблеме. В конце каждой главы помещены во-
просы и задачи.
Короче говоря, я надеюсь, что эта книга представит собой удобочи-
таемое введение в проблемы химической структуры живых клеток и
протекающих в них реакций, рассчитанное на студентов. В конечном
счете мне при этом не пришлось резко отступать от принципов, приня-
тых в традиционных учебниках, но оказалось возможным применить
ряд новых подходов.
Первая часть книги (гл. 1—3) содержит вводный материал по струк-
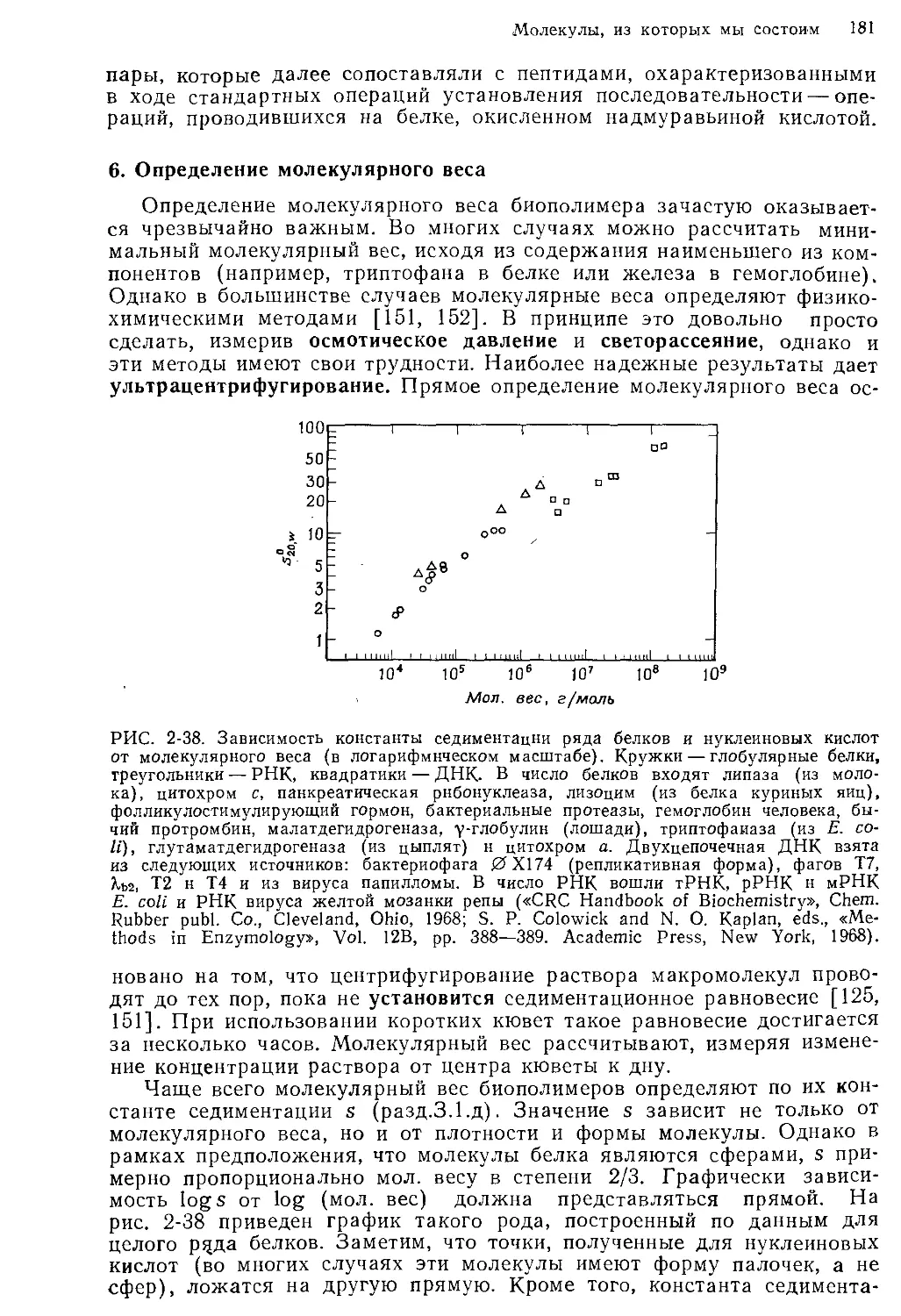
туре клеток, строению молекул и энергетике. В гл. 1 приведены данные
о размерах клеток и клеточных органелл и о генетической сложности
организмов; охарактеризованы основные биологические виды, рассмат-
риваемые в последующих разделах книги. Эта глава рассчитана главным
Предисловие
образом на студентов с минимальной биологической подготовкой, одна-
ко может оказаться полезной и для более подготовленных читателей.
В ней, как и далее во всей книге, описаны микроорганизмы, растения и
животные. В гл. 2 вкратце обсуждаются принципы структурной орга-
низации молекул и затем систематически рассматриваются структура
и химические свойства белков, нуклеиновых кислот, углеводов и липи-
дов. В соответствии с современными данными акцентируется внимание
на значении конформационных свойств и взаимосвязи между структу-
рой и функцией молекул. В раздел о неорганических элементах вклю-
чен обзор методов, применяемых для определения структуры молекул
(в частности, рассмотрен метод ЯМР).
В гл. 3, начинающейся с рассмотрения уравнений термодинамики,
приведены практические сведения по определению термодинамических
параметров биохимических процессов и ряд табличных данных, в част-
ности все упоминаемые далее значения свободной энергии и энтальпии.
Я всюду выражал их в единицах системы СИ, т. е. в килоджоулях на
моль (кДж-моль-1), поскольку именно эти единицы используются те-
перь в биохимической литературе. Перевести эти единицы в более при-
вычные килокалории на моль не составляет труда. Новой величиной,
которую я ввел в этой книге, является свободная энергия сгорания под
действием NAD+; использование ее упрощает расчет изменения свобод-
ной энергии в процессах метаболизма.
Вторая часть книги (гл, 4 и 5) посвящена проблеме соединения био-
логических молекул друг с другом. В гл. 4 рассмотрены количествен-
ные параметры связывания для различных структур — олигомерных
ферментов, микротрубочек, вирусов, мышц, что составляет одно из са-
мых современных направлений биохимии. Дается также систематизи-
рованный количественный анализ аллостерических эффектов. В гл. 5
описаны структура и химические свойства клеточных мембран и обо-
лочек. Основная цель этой и других глав состоит в том, чтобы дать сту-
дентам возможность приобрести запас знаний, достаточный для чтения
специальной периодической литературы без помощи учебников.
В третьей части книги (гл. 6—8) обсуждаются общие свойства фер-
ментов, вопросы кинетики химических реакций и различные механизмы
ферментативного катализа. В гл. 6 достаточно подробно изложены ос-
новы ферментативной кинетики, а также рассмотрены механизмы регу-
ляции ферментативных реакций в клетках. В гл. 7 дана рациональная
система классификации ферментативных реакций, включающая сведе-
ния о различных ферментах и методике их исследования. Гл. 8 посвя-
щена химическим свойствам и специфической роли коферментов, при-
чем эти свойства рассматриваются в связи с типами реакций, описан-
ными в предыдущих главах. В этих главах много справочного материа-
ла, и их можно не читать целиком. Для студентов и преподавателей
будет совсем нетрудно разобраться в изложенном здесь материале и
применять его. При желании эту часть книги можно легко объединить
с материалом гл. 2, где обсуждаются свойства белков, углеводов, нук-
леиновых кислот и липидов.
Четвертая часть книги (гл. 9—14) посвящена описанию последова-
тельностей метаболических реакций. В гл. 9 обсуждается «логическая
основа» метаболических циклов и других путей обмена веществ. Пока-
зано, что характер процесса обмена определяется теми химическими
превращениями, которые необходимы для образования нужного вещест-
ва из данного метаболита. Мне кажется, что такой подход имеет опре-
деленные преимущества по сравнению с общепринятым. В гл. 10 обсуж-
даются механизмы транспорта электронов и окислительного фосфори-
лирования, а также вопросы энергетического обмена у хемиавтотрофов.
предисловие
В гл. И показано, что многие на первый взгляд сложные процессы ме-
таболизма можно легко понять, если рассматривать их как этапы, необ-
ходимые для сопряжения расщепления АТР с реакциями биосинтеза.
Именно с этой точки зрения анализируются процессы обмена угле-
водов и липидов (гл. 12), что значительно облегчает понимание их ме-
ханизма.
В специальной главе «Свет в биологии» (гл. 13) обсуждаются не
только проблемы фотосинтеза, зрения и других биологических реакций
на свет, но и природа поглощения света, флуоресценции и кругового
дихроизма. В гл. 14 подробно рассматриваются процессы биосинтеза и
распада множества азотистых соединений. Эта глава может быть по-
лезна как студентам-биохимикам — при работе над литературными об-
зорами, так и преподавателям курсов химии природных соединений.
Последняя часть (гл. 15 и 16) посвящена проблемам биохимической
генетики и гормональной регуляции обмена веществ и развития орга-
низмов, а также деятельности мозга. Гл. 15 охватывает не только во-
просы биосинтеза нуклеиновых кислот и белков, но и дает представле-
ние о методах, используемых в биохимической генетике. Указанные
сведения помещены в конце книги, но преподаватели могут их исполь-
зовать (частично или целиком) в начале чтения курса. Последняя глава
представляет собой краткое введение в проблемы межклеточных ком-
муникаций, нейрохимии, дифференцировки клеток, а также экологии.
Я хочу поблагодарить многих своих сотрудников, помогавших мне
при подготовке этой книги, среди них — коллег по Университету штата
Айова, особенно Джона Фосса и Бернарда Уайта, а также ученых из
других институтов. Я особенно обязан фонду Дж. С. Гугенхейма, а так-
же сотрудникам и студентам биохимического факультета Калифорний-
ского университета (Беркли) за неоднократное полезное обсуждение и
критические замечания. Пегги Джонстон, Жанне Петерс и Вильме
Холдрен я благодарен за неоценимую помощь при подготовке рукописи,
Кэрол Харрис — за проведение расчетов, проверку всех цифровых дан-
ных и чтение корректуры. Наконец, я хочу поблагодарить студентов-ди-
пломников, проверивших каждое уравнение и литературные ссылки.
Я весьма признателен работникам издательства Academic Press за их
терпение и поддержку; общение с ними было для меня очень приятным.
Д. Мецлер
Благодарности
Я хочу выразить свою признательность следующим рецензентам,
прочитавшим рукопись (полностью или частично) и высказавшим свои
критические замечания: М. Чемберлину, университет штата Калифорния,
Беркли; Э. Конну, университет штата Калифорния, Дэвис; Ч. Дёрингу,
Стэнфордский университет; X. Эколсу, университет штата Калифорния,
Беркли; Л. Ингрэму, университет штата Калифорния, Дэвис; М. Камену,
Южно-Калифорнийский университет; Э. Хайраллаху, университет штата
Коннектикут; Д. Кошланду мл., университет штата Калифорния, Беркли;
К. Мэтьюзу, университет штата Аризона; Д. Мак-Кормику, Корнелльский
университет; Дж. Нейлендсу, университет штата Калифорния, Беркли;
Л. Пэкеру, университет штата Калифорния, Беркли; Д. Пьюричу, уни-
верситет штата Калифорния, Санта-Барбара; П. Штумпфу, университет
штата Калифорния, Дэвис; Р. Уолфу, университет штата Орегон; А. Ву-
ду, университет штата Мичиган.
Место действия
Эта книга — о непрерывных, сложных последовательностях химиче-
ских реакций, благодаря которым клетки растут и делятся, питаются и
выделяют шлаки, движутся и сообщаются друг с другом. Тысячи реак-
ций, каждую из которых катализирует свой специфический фермент,
связаны между собой в разветвленные и переплетающиеся последова-
тельности, составляя в итоге сложнейшую сеть. Описанию совокупности
этих реакций, называемой метаболизмом или обменом веществ, и по-
священа в основном данная книга.
Не менее важным, однако, является вопрос о структуре своеобразных
молекул, из которых построены клетки. Белки, нуклеиновые кислоты,
углеводы, липиды, коферменты-—все эти вещества необходимы для
жизнедеятельности живых систем. Каждое из них имеет строго опреде-
ленную структуру, соответствующую той специфической роли, которую
они играют в живых клетках. Эти соединения непрерывно образуются и
разрушаются и при этом удивительнейшим образом взаимно регулиру-
ют реакции, протекающие с их участием.
Обмен веществ включает как синтез, так и распад многих химиче-
ских соединений в клетках. У животных расщепление компонентов пи-
щи до более простых веществ обеспечивает организм не только энерги-
ей, но и химическими соединениями, которые используются затем при
синтезе молекул, необходимых для роста. Подобным же образом каж-
дая отдельная клетка любого живого организма синтезирует или погло-
щает из окружающей среды низкомолекулярные вещества и из них, как
из кирпичиков, строит крупные молекулы. В то же время в клетках
имеются ферменты, расщепляющие любые синтезированные организмом
соединения. В итоге устанавливается стационарное состояние, при кото-
ром сложные соединения непрерывно синтезируются в ходе одних про-
цессов и распадаются в ходе других. На этом основана замечательная
система самообновления наших тканей.
Человек живет на Земле не один, а в окружении множества других
живых существ, и их метаболизм для нас жизненно важен. Фотосин-
тезирующие организмы используют энергию солнечного света и выраба-
тывают вещества, которые необходимы для человека, но не синтезиру-
ются в его организме. Микроорганизмы, получая энергию за счет раз-
личных реакций, разлагают сложные органические соединения до форм,
которые могут затем использоваться растениями. В этой книге мы опи-
шем химические реакции, протекающие в самых разнообразных живых
системах. Наряду с метаболическими путями, общими для большинст-
ва организмов, будут рассмотрены и некоторые своеобразные, необыч-
ные процессы.
Биологи описали более миллиона видов живых организмов. Многие
из них ведут сугубо специализированный образ жизни, и тем удивитель-
12 Глава 1
нее, что в химии живого есть много общего. Так, образование молоч-
ной кислоты и в бактериях, и в мышцах человека требует участия одних
и тех же ферментов. Белки растений, животных и микроорганизмов со-
стоят из 20 аминокислот. Генетический код, по-видимому, универсален.
Мы видим, что жизнь едина, и потому можно изучать обмен веществ
в целом как совокупность химических превращений, протекающих во
всех живых организмах.
Но как бы ни впечатляло сходство между живыми существами, раз-
личие между ними не менее поразительно. Отдельные особенности об-
мена веществ живых систем так же разнообразны, как их форма и раз-
меры. Все это разнообразие обусловлено различиями между генами —
участками молекулы ДНК, несущими закодированную информацию.
Генетические различия ведут к разнообразию молекулярной структуры
белков, синтезируемых клетками. Среди этих белков имеются фермен-
ты — сложные миниатюрные аппараты, каждый из которых катализи-
рует специфическую химическую реакцию.
Рассмотрим какую-нибудь химическую реакцию, свойственную прак-
тически любой живой клетке (таких реакций очень много). Выделим
фермент, катализирующий эту реакцию, из тканей разных организмов;
при этом мы, по всей вероятности, обнаружим, что выделенные фермен-
ты имеют сходные свойства и механизм действия, но несколько разли-
чаются по аминокислотному составу. Обычно видовые различия каса-
ются только внешней формы молекулы фермента, а механизм катали-
тического действия остается в принципе тем же. Но в некоторых случа-
ях видовые вариации затрагивают структуру активного центра фермен-
та, а это уже влечет за собой изменения в процессах обмена веществ.
Особенности метаболизма живых существ приводят к различиям в их
форме и поведении. Возможно, причину разницы между лошадью и ко-
ровой нужно искать в совокупности едва заметных особенностей в
структуре их ферментов и других белков.
Различия в структуре белков обусловливают не только видовые осо-
бенности; индивидуумы, относящиеся к одному и тому же виду, также
могут быть неодинаковыми в этом отношении. Тяжелые наследственные
болезни (например, серповидноклеточная анемия) возникают иногда
из-за замены в определенном белке только одной аминокислоты.
Генетически обусловленные отклонения от «нормальной» структуры
белков являются результатом мутаций. Большинство мутаций (незави-
симо от того, возникли ли они в наших собственных клетках или в клет-
ках наших предков) вредны. Но в то же время именно мутации созда-
ют внутривидовую индивидуальную изменчивость, что составляет основ-
ную движущую силу эволюции. Поэтому далее мы уделим особое вни-
мание химической природе мутаций и их последствиям.
Дополнение 1-А
О единицах измерения
В I960 г. Генеральная конференция по мерам и весам при-
няла единую Международную систему единиц (СИ). Едини-
цами измерения массы, длины и времени в этой системе яв-
ляются соответственно килограмм (кг), метр (м) и секунда
(с). Для образования десятичных и дольных единиц исполь-
зуются следующие множители и приставки:
место действия io
Множитель Приставка Обозначение
Ю12 тера т
ю9 гига г
106 мега м
103 кило к
ю-3 милли м
10-6 микро мк
I0-9 нано н
Ю-12 ПИКО п
ю-15 фемто ф
I0-18 ат то а
Укажем на одно отступление от принятого правила: в ме-
рах массы приведенные выше приставки применяются не к
основной единице-—килограмму, а к грамму.
В этой книге мы старались всюду, где это возможно, поль-
зоваться единицами системы СИ. Читатель не найдет здесь
футов, микрон, миль, тонн. Размеры молекул повсеместно
даны в нанометрах, а не в ангстремах (А). (Напомним, что
1 А=0,1 нм). Единицы энергии — калории и килокалории —
заменены принятой в системе СИ единицей — джоулем (Дж).
Большинство журналов уже заменило два наименования в
соответствии с системой СИ, а именно: вместо употреблявше-
гося ранее названия микрон (мк) применяется микрометр
(мкм), а вместо миллимикрона (ммк)—нанометр (нм).
Не следует путать единицы мкм (новая) и ммк (старая).
В книге часто используются следующие символы:
ж означает «примерно равно»;
~ означает «примерно» или «около».
Дополнение 1-Б
Молекулярные веса и массы (дальтоны)
Массы атомов и молекул выражаются в единицах массы
изотопа углерода 12С, атомный вес которого принят равным
12. Масса одного атома 12С равна в точности 12 дальтонам, а
1 дальтон равен 1,661-10-24 г. Массы молекул выражают в
дальтонах, и численно они равны молекулярному весу. Одна-
ко под молекулярным весом понимают молярную массу
(граммы на моль), и потому употреблять дальтон в качестве
единицы молекулярного веса не корректно. В то же время
дальтоны очень удобно использовать в случае таких струк-
тур, как хромосомы, рибосомы, митохондрии, вирусы и целые
клетки, к которым не применим термин «молекулярный вес»а.
а Edsall J. Т., Nature (London), 228, 888, 1970.
А. Простейшие живые организмы
Простейшие организмы на Земле — это бактерии и сине-зеленые
водоросли; они составляют царство прокариот (Procariotae, Мопега)
[1, 2]. Основным отличительным признаком прокариот является отсут-
ствие у них отграниченного мембраной клеточного ядра. Клетки всех
остальных организмов, называемых эукариотами, содержат ядра, отде-
ленные от цитоплазмы мембраной. Некоторые биологи относят к живым
организмам также и вирусы, однако эти поразительные объекты (до-
полнение 4-В) не могут считаться живыми в полном смысле этого сло-
ва, поскольку у них нет, как правило, собственного обмена веществ.
1. Микоплазмы
Микоплазмы относятся к простейшим прокариотам и являются са-
мыми примитивными из всех известных живых организмов. Эти мель-
чайшие бактерии в отличие от большинства других бактерий лишены
жесткой клеточной стенки. Благодаря этому они легко меняют форму и
часто проходят через фильтры, задерживающие другие бактерии.
В отношении питания микоплазмы довольно капризны и обычно
(если не всегда) паразитируют. Некоторые из них обитают в слизистых
оболочках человека, не причиняя ему никакого вреда, тогда как другие
вызывают заболевания, например первичную атипичную пневмонию
(возбудитель — Mycoplasma pneumoniae).
Клетки микоплазм обычно имеют форму сферы диаметром 0,33 мкм
(0,0003 мм) [3] и ограничены тонкой клеточной мембраной толщиной
около 8 нм (80 А). Внутри находится цитоплазма — жидкая субстан-
ция, в которой растворено множество различных веществ, а также со-
держатся субмикроскопические частицы. В центре клетки локализована
одна чрезвычайно плотно свернутая молекула ДНК, составляющая бак-
териальную хромосому. Часть клетки, содержащую хромосому и приле-
гающую к ней область, можно назвать ядром1 или нуклеоидом. Помимо
ДНК, в клетке имеется около 400 примерно сферических частиц диамет-
ром ~20 нм, называемых рибосомами2. Это центры синтеза белков.
В цитоплазму включены также различного рода белки, но их число
не превышает 50 000. Имеется также несколько типов РНК и множест-
во соединений меньшего молекулярного веса.
Каково минимальное количество белков, ДНК и других макромоле-
кулярных структур, достаточное для обеспечения жизнедеятельности
клетки? Это пока неизвестно, но совершенно ясно, что в крошечной
клетке микоплазмы этих соединений достаточно.
2. Escherichia coli
«Лучший друг» биохимиков-—бактерия Escherichia coli — типичный
безобидный обитатель кишечного тракта человека и животных. Эту бак-
терию легко культивировать в лабораторных условиях, благодаря чему
она лучше всех других организмов изучена на молекулярном уровне
[4]. Е. coli можно считать типичным представителем истинных бакте-
рий. Клетки Е. coli имеют форму палочек. Их длина ~2 мкм, ди-
аметр— 0,8 мкм, объем ~1 мкм'1, плотность ~1,1 г-см-3, масса
1 Многие биологи употребляют термин ядро только применительно к клеткам
эукариот.
2 Указанное число частиц есть только грубая оценка, основанная на сравнении
размеров микоплазм и Е. coli и содержания у них РНК.
iviecTO действия
E. coll
-0,8 * 0,8 x 2,0 мкм
0,5mkm
Клеточная мембрана, — 8нм
Клеточная стенка, ~ 10 нм
рибосомы, прикрепленные
к нитям мРНК
ДНК длиной 103мкм.
"Здесь изображен только
1% суммарного количества
ДНК
Пиль (фимбрия). Некоторые бактерии
Е. coll покрыты сотнями пилей
различной длины
13-14 нм
Микоплазма
Bdellovibrio, паразит, живущий
внутри бактерии Е. coll 1
РИС. 1-1. Escherichia coli и некоторые более мелкие бактерии.
См. рисунок в работе Burnham J. С., Hashimoto Т., Conti S. F., J. Bacteriol., 96, 1366 (1968).
Рибосомы
диаметром-' 20 нм
Некоторые штаммы Е. colt
имеют до 8 жгутиков, но обычно
их меньше
Мезосома,
мембранная
структура, свойственная
многим бактериям .
Длина жгутиков варьирует,
но обычно они в 4 раза длиннее
самой клетки
Жгутик
в чехлике,
28 нм
~1-10-12 г (1 пг, или 0,7-1012 дальтон) [5]. Е. coli примерно в 100 раз
больше мельчайшей микоплазмы, но, как показали электронно-микро-
скопические исследования, по структуре она очень проста и чрезвычай-
но сходна в этом отношении с микоплазмой (рис. 1-1 и 1-2,Л).
Каждая клетка Е. coli содержит от 1 до 4 идентичных молекул ДНК
(это число зависит от того, насколько быстро клетка растет), а также
16 Главг 1
РИС. 1-2. А. Электронная микрофотография интактной клетки Е. coli; напыление
платиной. Видны жгутики (изогнутые) и пили (прямые). Обратите внимание, что
F-пили (половые) отсутствуют. (С любезного разрешения Williams F. D., VanderMo-
len Gail E., Amstein C. F.) Б. Электронная микрофотография клетки Spirillum-, негатив-
ное контрастирование фосфовольфрамовой кислотой. Обратите внимание на пучки жгу-
тиков на концах, шероховатую на вид наружную поверхность, темные включения по-
ли-р-оксимасляной кислоты и светлые гранулы неизвестной природы. (С любезного
разрешения Williams F. D., VanderMolen Gail Е., Amstein С. F.)
~ 15 000—30 000 рибосом. Иногда внутри клетки выявляются и другие
образования, например запасы питательных веществ—капельки жира и
гранулы поли-0-оксимасляной кислоты (рис. 1-2,Б), составляющей до
25% веса клетки Bacillus megaterium, и иногда гранулы гликогена. Ча-
сто присутствуют гранулы высокополимеризованной фосфорной кисло-
ты (полиметафосфат), называемые обычно метахроматическими грану-
лами. Обнаруживаются также вакуоли, т. е. капельки изолированной
водной фазы.
РИС. 1-2. В, Электронная микрофотография ультратонкого среза (~60 нм) пресно-
водной грамотрицательной бактерии Aquaspirillum fasciculus. Видны ДНК (светлая
область), темные рибосомы, двойная мембрана, характерная для грамотрицательных
бактерий (гл. 5, разд. Г.1), и клеточная стенка. У полюса клетки видна внутренняя
«полярная мембрана», которая, возможно, имеет какое-то отношение к движению
жгутиков. (С любезного разрешения Williams F. D., VanderMolen Gail Е., Amstein С. F.)
Г. Электронная микрофотография ультратонкого среза делящейся клетки грамполо-
жительного стрептококка Streptococcus. Обратите внимание иа светлоокрашенную
нить ДНК. В центре клетки видна часть мезосомы; видно также начало образования
межклеточной перегородки. (С любезного разрешения Williams F. D., VanderMolen
Gail Е., Amstein С. F)
£-1821
18 Глава 1
3. Геном
Все генетические «приказы», отдаваемые клетке, исходят от ДНК-
Молекулы как ДНК, так и белков построены в виде цепочек, состоящих
в первом случае из нуклеотидов, а во втором —из аминокислот. Моле-
кулы ДНК, как правило, двухцепочечные, т. е. состоят из двух обра-
зующих двойную спираль полинуклеотидных цепочек; комплементарные
основания противоположных цепочек образуют нуклеотидные пары
(рис. 2-21). В настоящее время твердо установлено, что большая часть
генетических сообщений в ДНК представляет собой последовательность,
кодовых «слов», или кодонов. Каждый кодон состоит из трех нуклео-
тидов (или трех нуклеотидных пар, если ДНК двухцепочечная) и соот-
ветствует одной из 20 аминокислот, из которых построены белки. По-
следовательность кодонов в ДНК определяет, в каком порядке должны
соединяться аминокислоты при синтезе каждого из многочисленных
белков.
Допустим, что «средняя» белковая молекула — это свернутая це-
почка, состоящая из ~300 аминокислот. Стало быть, участок молекулы
ДНК (один ген), кодирующий синтез этого белка, должен включать
около 900 пар нуклеотидов. Добавив сюда еще некоторое количество,
нуклеотидов для образования промежутков между генами, мы получим,
что число нуклеотидных пар, составляющих 1 ген, в среднем равно 1000.
Геномом называют полное количество ДНК, несущее всю сумму ге-
нетической информации для данного организма. У бактерий геном
представлен единственной хромосомой, состоящей из одной двухцепо-
чечной молекулы ДНК. У Mycoplasma arthritidis масса ДНК состав-
ляет 0,5-109 дальтон (мол. вес = 0,5-109). Содержание ДНК у Е. coli
примерно в 5 раз больше (мол. вес = 2,5-109).
Средний мол. вес пары нуклеотидов (находящихся в виде натрие-
вой соли) равен 664. Следовательно, ДНК М. arthritidis содержит
0 5-109
—^04— = 8-105 пар нуклеотидов, что достаточно для кодирования 800
различных белков среднего размера. ДНК Е. coli состоит из 3,8-108,
нуклеотидных пар, что позволяет закодировать '-'-'4000 различных
белков. Поскольку некоторые гены ДНК выполняют другую функ-
цию, реальное число генов, кодирующих белки, несколько меньше. Дли-
на бактериальных хромосом поразительна. Расстояние между нуклео-
тидными парами 0,34 нм; следовательно, полная длина молекулы ДНК
в хромосоме Е. coli равна 1,3 мм, что в 600 раз превышает длину клет-
ки, в которой эта ДНК находится. Отсюда ясно, что молекула ДНК в
клетке плотно упакована, в результате под электронным микроскопом
она выглядит как плотное «ядро», занимающее только лишь Vs объема
клетки (рис. 1-2, В, Г). Каждое бактериальное ядро содержит полный
набор генетических «матриц» и функционирует более или менее неза-
висимо. Эти ядра гаплоидные, т. е. имеют один набор генов1.
4. Рибонуклеиновые кислоты (РНК), транскрипция
и трансляция генетической информации
Генетическая информация, заключенная в ДНК, не может непосред-
ственно передаваться белок-синтезирующей системе клетки. Сначала в
соответствии с правилами, закодированными в ДНК, синтезируются
1 Для прокариот характерны гаплоидные ядра, хотя при половой конъюгации
бактерий, а также в некоторых экспериментальных условиях образуются «частично
диплоидные» клетки, содержащие двойной набор отдельных генов.
Место действия
молекулы рибонуклеиновой кислоты (РНК); этот процесс называется
транскрипцией. Установлено, что молекулы РНК несут в точности ту
же информацию, что и соответствующие участки ДНК. Таким образом,
если ДНК — это первичная матрица, то РНК—вторичная. Эта концеп-
ция нашла свое отражение в термине матричная, или информационная,
РНК (мРНК): им обозначают небольшие, быстро обновляющиеся фрак-
ции РНК, которые несут информацию, определяющую последователь-
ность аминокислот в белках. Матричная РНК переносит генетическую
информацию от генов к рибосомам, на которых собственно синтезиру-
ются белки.
Рибосомы представляют собой миниатюрные, но чрезвычайно слож-
ные белок-синтезирующие системы. Каждая рибосома Е. coll обладает
массой 2,7-106 дальтон и состоит на ~65% из особой рибосомной РНК
и на ~35% из белка. В структуру рибосомы входит около 50 различных
белков. Рибосомы способны считывать генетическую информацию с
мРНК и точно собирать именно такую белковую молекулу, которая
детерминируется соответствующим геном (трансляция генетической ин-
формации) .
Дополнение 1-В
Электронный микроскоп, ультратонкие срезы
и реплики
Первые электронные микроскопы появились в продаже в
1939 г. и с тех пор стали одним из важнейших приборов, при-
меняющихся при изучении биологии клетки. Обладая разре-
шением ~0,4 нм, электронный микроскоп позволяет «увидеть»
молекулы белков и нуклеиновых кислот, а также детали
строения клеточных органелл. Еще более широко электрон-
ный микроскоп стал использоваться с 1950 г., когда были
сконструированы микротомы и ножи, позволяющие делать
ультратонкие (20—200 нм) срезы тканей, предварительно за-
литых в пластмассу.
Исследование срезов свежей (замороженной) ткани непо-
средственно, без предварительной обработки, мало что дает,
поскольку большая часть атомов в клетке обладает низким
атомным весом и рассеивает электроны слабо и в одинаковой
степени. Следовательно, ультрасрезы необходимо «окрасить»
атомами с высоким атомным весом, например обработав их
перманганатом калия. Ткани следует также зафиксировать,
чтобы предотвратить разрушение клеточных структур в про-
цессе обезвоживания и заливки в пластмассу. Фиксирующие
вещества (например, формальдегид) реагируют с аминогруп-
пами и другими группами белков и нуклеиновых кислот. Не-
которые белки при этом преципитируют, оставаясь фиксиро-
ванными на своих местах, а протеолитические ферменты,
которые могли бы существенно нарушить тонкую структуру
клетки, инактивируются. Широко используется также глутар-
альдегид (пятиуглеродный диальдегид) — прекрасное фикси-
рующее средство, образующее поперечные связи между моле-
2*
кулами белков в ткани. В качестве фиксирующего средства и
окрашивающего агента часто применяют четырехокись осмия
(гл. 5, разд. А.1). Следует отметить, что при работе с фикси-
рованными тканями всегда стоит вопрос о том, не являются
ли некоторые структуры, видимые на срезах, артефактами,
возникающими при фиксации и окрашивании.
Из одной бактериальной клетки, скажем Е. coli, можно
получить целых 10 ультратонких продольных срезов (рис. 1-2),
а из клетки эукариот диаметром 10 мкм — до 100 срезов. Толь-
ко с такими ультратонкими срезами получаются четко сфо-
кусированные изображения. Для изучения трехмерных струк-
тур используют серийные срезы2.
Частицы небольшого размера, в том числе макромолеку-
лы, выявляют методом напыления. Для этого металл —хром
или платину—испаряют в вакууме и напыляют под опреде-
ленным углом на поверхность исследуемого образца. Так
можно «увидеть» отдельные молекулы ДНК, хотя и при срав-
нительно низкой разрешающей способности. Собственно, вид-
ны не сами молекулы, а только их «тени», которые в 2—3 ра-
за шире. При исследовании белков часто применяют метод
негативного контрастирования. Суть метода состоит в сле-
дующем: тонкий слой раствора, содержащего исследуемые
белки и электроноплотное вещество (например, фосфоволь-
фрамовокислый натрий в концентрации 1%), наносят на угле-
родную пленку-подложку и высушивают. Образуется одно-
родный электроноплотный слой, характеризующийся тем, что
в местах локализации молекул белка отсутствует соль фос-
фовольфрамовой кислоты; отсюда и термин «негативный конт-
раст».
Если поверхность клетки, срез или бактерию покрыть сло-
ем платины или углерода, а затем отделить это покрытие, мы
получим негативный слепок — реплику, которую можно иссле-
довать под электронным микроскопом. Изготовляют также
тонкие реплики из пластмассы, которые дополнительно напы-
ляют (оттеняют).
К числу важнейших методов получения реплик относится
метод замораживания—скалывания и замораживания—трав-
ления. Свежую ткань (которую можно предварительно обра-
ботать глицерином, чтобы предотвратить образование боль-
ших кристаллов льда) быстро замораживают. Поскольку та-
кие замороженные клетки нередко удается потом оживить,
их можно рассматривать как живые. Замороженную ткань
помещают в вакуумную камеру, где делают сколы или срезы
охлажденным ножом. Иногда образец какое-то время выдер-
живают в вакууме при —100 °C, чтобы дать испариться моле-
кулам воды с поверхности. В результате такого травления
под вакуумом выявляется в виде четкого рельефа тонкая
структура клеточных органелл и мембран. После травления
тем или иным методом снимается реплика, которую и иссле-
дуют под микроскопом (рис. 1-11). Последние работы свиде-
тельствуют, что скол проходит большей частью по липидному
слою клеточных мембран.
Каждый биохимик должен обязательно ознакомиться с
прекрасными электронными микрофотографиями, которые
помещены в основных книгах по данном тематике б-ж, а так-
Место действия 21
же в ряде журналов: «Journal of Cell Biology», «Journal of
Ultrastructure Research» и «Journal of Bacteriology».
a Сравнительно недавно опубликованная работа по этому вопросу: Hoff-
mann Н. Р., Avers С. J., Science, 181, 74&—751 (1973).
6 Ledbetter М. С., Porter К. R., Introduction to the Fine Structure of
Plant Cells, Springer-Verlag, Berlin and New York, 1970.
“ Fawcett D. W., An Atlas of Fine Structure, The Cell, its Organelles, and
Inclusions, Saunders, Philadelphia, Pennsylvania, 1966.
r Haggis G. H., The Electron Microscope in Molecular Biology, Wiley (In-
terscience), New York, 1967.
д Porter K. R., Bonneville M. A., The Fine Structure of Cells and Tissues,
3rd ed., Lea & Febiger, Philadelphia, Pennsylvania, 1968.
e Wischnitzer S., Introduction to Electron Microscopy, 2nd ed., Pergamon,
New York, 1970.
ж Hayat M. A., Basic Electron Microscopy Techniques, 2 vols., Van Nost-
rand-Reinhold, Princeton, New Jersey, 1972.
5. Мембраны и клеточные стенки
Подобно микоплазмам, клетки Е. coli окружены тонкой (~8 нм)
мембраной, в состав которой входят белки (~50%) и липиды (~50%)'.
Под электронным микроскопом окрашенная (например, перманганатом)
мембрана имеет вид двух тончайших (~2,0 нм) темных линий, разде-
ленных неокрашиваемым слоем (~3,5 нм) (рис. 1-2, В). Мембраны при?
мерно такой толщины и таким же образом прокрашивающиеся имеют-
ся во всех клетках, как у бактерий, так и у эукариот.
Клеточная мембрана — это не просто мешок. Она регулирует пере-
нос низкомолекулярных веществ в клетку и из клетки. У бактерий с
внутренней поверхностью мембраны связаны ферменты, катализирую-
щие процессы окисления. Нередко бактериальные мембраны образуют
складчатые участки, имеющие в разрезе вид многослойных структур,;
это так называемые мезосомы (рис. 1-1 и 1-2, Г). Предполагается, что
в мезосомах протекают специализированные процессы обмена веществ
и репликация ДНК. В клетках Е. coli мезосомы выявляются не всегда,
и все же, видимо, репликация ДНК у этого организма происходит на
определенных участках поверхности мембраны и регулируется связан-
ными с мембраной ферментами. Образование новой мембраны (перего-
родки) между делящимися клетками происходит синхронно с синтезом
Отличительной особенностью истинных бактерий является наличие
у них жесткой клеточной стенки, окружающей клеточную мембрану.
У Е. coli стенка имеет толщину ~40 нм и сложную многослойную
структуру (химический состав стенки Е. coli рассмотрен в гл. 5). У не-
которых бактерий толщина стенки может достигать 80 нм; кроме того,
она бывает окружена толстой капсулой или слизистым слоем. Основная
функция клеточной стенки заключается, по-видимому, в предотвраще-
нии осмотического набухания и разрыва клеток при попадании бакте-
рии в бессолевую среду. При достаточном осмотическом давлении среды
стенка бактерии может раствориться, и клетку будет окружать только
мембрана. Такие протопласты можно получить, обработав ферментом
лизоцимом грамположительные бактерии, например Bacillus megate-
1 Мембраны истинных бактерий не содержат холестерина, но, как нн парадоксаль-
но, в мембранах большинства микоплазм, как и у человека, холестерин присутствуем.
Представители рода Mycoplasma ведут паразитический образ жизни и получают необ-
ходимый холестерин от организма-хозяина.
22 Глава 1
rium. Протопласты — удобный объект для биохимических исследований,
поскольку в этом случае многие вещества проникают в клетку быстрее
и легче из-за отсутствия клеточной стенки. Термин сферопласт обычно
применяется для клеток грамотрицательных бактерий с частично раз-
рушенной клеточной стенкой. Пенициллин (который нарушает синтез
клеточных стенок у многих бактерий) превращает Е. coli и ряд других
грамотрицательных бактерий в сферопласты. Штаммы бактерий, ли-
шенные жестких стенок, называют L-формами.
6. Жгутики и пили
Большинство бактерий плавает, в чем легко убедиться, рассматри-
вая их в микроскоп. Движение осуществляется с помощью очень тонких
нитевидных жгутиков диаметром 10—20 нм. Иногда такой жгутик толь-
ко один, в других случаях имеется два или несколько жгутиков на од-
ном или противоположных полюсах клетки; все жгутики данной бакте-
рии движутся синхронно. У штопорообразной бактерии Spirillum
(рис. 1-2) пучок жгутиков иа каждом конце клетки вращается со ско-
ростью 50 оборотов в секунду; при этом вся клетка медленно повора-
чивается в противоположном направлении и продвигается вперед со
скоростью до 50 мкМ'С4 [6]. У одних штаммов Е. coli жгутики отсут-
ствуют, в то время как у других их число достигает 8 на клетку, причем
они распределены по ее поверхности более или менее случайно. Когда
клетка плывет, жгутики обычно тянутся пучком сзади.
О другом виде выростов у бактерий даже не подозревали, пока не
стали применять в этой области электронный микроскоп. Это тончай-
шие (толщиной всего от 3 до 25 нм) длинные нити— так называемые
пили (или фимбрии) (рис. 1-2, А). Функция их во многих случаях неиз-
вестна, хотя показано, что клетки с большим количеством этих придат-
ков легко соединяются друг с другом. Некоторые пили (F-пили) у
Е. coli и родственных организмов играют, по-видимому, специфическую
роль при конъюгации.
7. Высокая скорость обмена веществ у бактерий
Наиболее удивительная особенность бактерий заключается в неве-
роятно высокой скорости их обмена веществ и роста. В благоприятных
условиях бактериальная клетка удваивает свои размеры и делится на-
двое всего за 20 мин. Животные клетки проходят этот цикл за 24 ч.
Не меньшее удивление вызывает то, с какой скоростью бактерии пре-
вращают компоненты пищи в другие вещества. Высокую интенсивность
обмена веществ у бактерий объясняют большим значением отношения
поверхности к объему (см. также гл. 3, разд. А.5). Для мелких бакте-
рий сферичесой формы (кокков) диаметром 0,5 мкм отношение поверх-
ности к объему составляет 12-10s м-1, а у амебы диаметром 150 мкм
это отношение равно всего 4-104 м-1, но быстро возрастает, если амеба
образует псевдоподии. У человека весом 90 кг, по оценкам Тимана [7],
отношение поверхности к объему составляет только 30 м-1.
8. Споры
При определенных условиях некоторые бактерии (например, Bacil-
lus subtilis) образуют споры (эндоспоры). Спора представляет собой
компактную маленькую клетку, формирующуюся внутри вегетативной
клетки и составляющую иногда только 7io ее объема. Содержание воды
Место действия 23
в споре очень низко, интенсивность обмена веществ близка к нулю,
устойчивость к нагреванию и высушиванию исключительно высока.
В благоприятных условиях споры прорастают и возобновляют вегета-
тивный рост. Процесс спорообразования интенсивно изучается, посколь-
ку это позволяет получить сведения о способах регуляции жизнедея-
тельности клеток в зависимости от условий окружающей среды.
9. Классификация бактерий
Бактерии крайне разнообразны по химическому составу и характеру
обмена веществ, поэтому разработать их рациональную классификацию
очень трудно. Для высших организмов понятие «виды» можно опреде-
лить как нескрещивающиеся формы. В случае бактерий этот критерий
лишен смысла, поэтому подразделение их на виды и роды нередко про-
извольно. Используемая в настоящее время схема (табл. 1-1) делит
царство прокариот на 19 групп. В основу деления положены различные
признаки, включая форму, отношение к красителям и химические свой-
ства. В таблицу включены названия родов всех бактерий, упоминаемых
в тексте книги.
Бактерии имеют форму сфер или палочек — прямых либо изогнутых.
Некоторые из них (например, актиномицеты) растут в виде разветвляю-
щихся нитевидных образований.
Названия бактерий часто отражают их форму: coccus — это сфера,
bacillus — палочка, vibrio — изогнутая палочка со жгутиком на одном
•конце. Название spirillum относится к винтообразно закрученным бак-
териям с пучком жгутиков на одном или обоих полюсах. В целом вопрос
о классификации бактерий остается нерешенным, так как одни и те
же названия нередко употребляются для наименования как отдельных
видов, так и семейств. Ряд названий отражает особенности химических
свойств описываемых бактерий.
10. Питание бактерий
Автотрофные («самопитающиеся») бактерии синтезируют все орга-
нические компоненты своих клеток из углекислого газа, воды и неорга-
нических соединений азота и серы. Источником энергии для фотоавто-
трофных бактерий служит солнечный свет, а для хемоавтотрофов —
энергия, выделяющаяся в ходе превращений неорганических соедине-
ний. Например, водородные бактерии окисляют Н2 до Н2О, а серные
бактерии (живущие в серных источниках) окисляют H2S до H2SO4.
Большинство видов бактерий, подобно грибам и животным, по типу
питания относится к хемогетеротрофам, т. е. используют энергию, вы-
деляющуюся при распаде органических веществ. Некоторые гетеро-
трофные бактерии — анаэробы. Это означает, что они разлагают слож-
ные органические соединения (например, сахара) при полном отсутст-
вии кислорода. Указанный процесс называется брожением. Некоторые
анаэробы окисляют органические соединения, используя неорганиче-
ские окислители, в частности нитрат (денитрифицирующие бактерии)
или сульфат (сульфатредуцирующие бактерии). Для ряда анаэробных
бактерий, относящихся главным образом к роду Clostridium, кислород
токсичен, их называют облигатными анаэробами. Другие, в том числе
Е. coli, относятся к категории факультативных анаэробов; это означает,
что они способны расти как в присутствии, так и в отсутствие кислоро-
да. Облигатные аэробы используют в качестве источника энергии про-
цессы окисления органических соединений кислородом воздуха.
24 Глава 1
Таблица 1-1
Схема современной классификации бактерий а> * 6
Царство прокариот
Подцарство I: цианобактерии (ботаническое название — цианофиты, сине-зеленые
водоросли)
Подцарство II: бактерии
Бактерии делятся далее иа 19 групп; среди них некоторые роды объединены в се-
мейства и порядки, тогда как «родственные связи» других не определены. В таблице
приводятся названия отдельных родов, причем в основном тех, которые упоминаются
в данной книге. Представители одного семейства перечисляются подряд, через запя-
тую, н отделяются от членов других семейств точкой с запятой.
1. Фотосинтезирующие (фототрофные) бактерии
Rhodospirillum, Rhodopseudomonas (пурпурные несерные бактерии); Chromatium,
Thiospirillum (пурпурные серные бактерии); Chlorobium (зеленые серные бак-
терии)
2. Скользящие бактерии
Beggiatoa (нитевидная бактерия, содержащая гранулы серы)
3. Бактерии, образующие чехлы
4. Почкующиеся и стебельковые бактерии
5. Спирохеты (длинные извитые бактерии, достигающие 500 мкм в длину и способ-
ные продвигаться вперед при помощи аксиальных нитей, которые находятся меж-
ду наружной оболочкой и телом клетки)
Treponema (Т. pallidum — возбудитель сифилиса), Leptospira
6. Спиралевидные и изогнутые бактерии
Spirillum, Bdellovibrio
7. Грамотрицательные палочки и кокки, аэробы
Pseudomonas, Gluconobacter; Azotobacter; Rhizobium; Acetobacter; Brucella
(B. abortus — возбудитель бруцеллеза), Halobacterium
8. Грамотрицательные палочки, факультативные анаэробы
Escherichia, Salmonella (S. typhi— возбудитель брюшного тифа), Shigella (S. dy-
senteriae -—возбудитель бактериальной дизентерии), Klebsiella, Serratia; Proteus,
Yersinia (У. pestis — возбудитель чумы), Enterobacter3, Vibrio (V. choleras—воз-
будитель холеры), Zymomonas; Flavobacterium, Haemophilus
9. Грамотрицательные палочки, анаэробы
Desulfovibrio, Butyrivibrio
10. Грамотрицательные кокки и коккобациллы, аэробы
Neisseria (N. gonorrhea — возбудитель гонореи)
11. Грамотрицательные коккн, анаэробы
Veillonella
12. Грамотрицательные хемилитотрофные бактерии
Nitrobacter, Nitrosomonas; Thiobacillus
13. Метанообразующие бактерии
Methanobacterium
14. Грамположительные кокки
Micrococcus, Staphylococcus (S. aureus — возбудитель фурункулеза, воспалитель-
ных процессов); Streptococcus (S. pyogenes — возбудитель скарлатины, ангины;
S. pneumoniae—возбудитель пневмонии), Leuconostoc; Peptococcus
15. Спорообразующие палочки и кокки
Аэробы: Bacillus (В. anthracis — возбудитель сибирской язвы)
Анаэробы: Clostridium (С. tetani — возбудитель столбняка; С. botulinum — возбу-
дитель ботулизма)
16. Грамположительные палочковидные бактерии, не образующие спор
Lactobacillus
17. Актиномицеты и родственные организмы
Corynebacterium (С. diphtheriae—возбудитель дифтерии); Propionibacterium; Ac-
tinomyces, Bifidobacterium; Mycobacterium (M. tuberculosis — возбудитель тубер-
кулеза) ; Streptomyces
18. Риккетсии (паразитирующие бактерии со строго определенными потребностями в
питательных веществах, а также малым размером генома)
Rickettsia (R. rickettsii — возбудитель пятнистой лихорадки Скалистых гор); Chla-
mydia (С. trachomatis — возбудитель трахомы)
19. Микоплазмы
Mycoplasma; Acholeplasma; Thermoplasma
а Данные взяты из Bergey’s Mannual of Determinative Bacteriology, 8th ed. Wil-
liams and Wilkins, Baltimore, Maryland, 1973.
6 Перечислен ряд болезней человека, вызываемых некоторыми видами бактерий.
• Прежнее название — Aerobacter.
Одна из самых больших групп строго аэробных гетеротрофных бак-
терий— псевдомонады (Pseudomonas и близкие роды); они очень инте--
ресны для биохимиков благодаря своей способности окислять органи-
ческие соединения типа алканов, ароматических углеводородов и сте-
роидов, которые не используются большинством других видов бактерий.
Как правило, каждый данный вид бактерий использует лишь неболь-
шое число окислительных реакций. Например, уксуснокислые бактерии;
всю необходимую энергию получают за счет реакции окисления этило-
вого спирта в уксусную кислоту:
СН3СН2ОН + О2 > СН3СООН + Н2О. (1.1 у
Важным критерием при классификации бактерий является их спо-
собность окрашиваться по Граму. В зависимости от способности связы-
вать основный краситель кристаллический фиолетовый, применяемый в.
виде комплекса с иодом, бактерии делятся на грамположительные и
грамотрицательные. Указанная способность определяется структурой
клеточных стенок (гл. 5). Большинство актиномицетов, кокков, а также
спорообразующие палочки относятся к категории грамположительных
бактерий, тогда как Е. coli, другие кишечные бактерии и псевдомона-
ды— грамотрицательные (табл. 1-1).
11. Фотосинтезирующие и азотфиксирующие прокариоты
Считается, что некогда атмосфера Земли была полностью анаэроб-
ной; она содержала метан, формальдегид и более сложные органиче-
ские соединения. В таких условиях первые живые организмы должны,
были напоминать современные бактерии типа Clostridium [8].
На следующей стадии эволюции появились, видимо, организмы,
родственные современным фотосинтезирующим бактериям (пурпурным
и зеленым): они могли использовать энергию солнечного света. Любо-
пытно, что большинство этих (грамотрицательных) фотосинтезирующих
бактерий — строгие анаэробы. В отличие от высших растений ни один
из указанных микроорганизмов не выделяет кислорода. Напротив, для,
восстановления двуокиси углерода в процессе фотосинтеза им необхо-
дим водород, который они получают либо путем расщепления неорга-
нических соединений типа H2S, тиосульфата или Н2, либо из органиче-
ских веществ.
У всех фотосинтезирующих организмов, включая высшие растения,,
фотосинтез протекает в мембранных структурах. У пурпурных бактерий
поглощающие свет пигменты (бактериальные хлорофиллы и каротины)
встроены в мембраны, которые представляют собой складки наружной
клеточной мембраны. Эти участки имеют характерную структуру и на-
зываются хроматофорами. Они состоят из соединяющихся между собой
полых пузырьков, параллельно расположенных трубочек или парал-
лельных пластинок (ламелл); диаметр всей структуры — 50—100 нм.
У зеленых бактерий пигменты выстилают внутриклеточные пузырьки.
В настоящее время фотосинтезирующие бактерии обитают только в
серных источниках и глубоких озерах, но когда-то они были, вероятно,
распространены гораздо более широко и являлись единственными фото-
синтезирующими организмами на Земле.
Для выделения кислорода путем расщепления Н2О до О2 в клетках
должна была возникнуть другая система фотосинтеза (гл. 13). Про-
стейшими выделяющими кислород организмами, существующими в на-
стоящее время, являются сине-зеленые водоросли (цианобактерии) [9].
Некоторые из этих простейших растений — одноклеточные; по структу-
:26 Глава
ре они сходны с бесцветными бактериями. Другие, например Oscillato-
ria, слизистое растение, нередко покрывающее внутренние стенки до-
машних аквариумов, образуют длинные нити диаметром около 6 мкм
(рис. 1-9). Эти нити совершают медленные скользящие движения, по-
средством которых перебираются на чистые участки стенок аквариума.
Все сине-зеленые водоросли содержат 2 пигмента, не встречающиеся
у других прокариот: хлорофилл а и (J-каротин. Эти же пигменты име-
ются у истинных водорослей и у высших растений. Нити некоторых
•сине-зеленых водорослей, в частности Nostoc, помимо пигментирован-
ных клеток, содержат еще слабоокрашенные клетки, называемые гете-
роцистами; последние, по-видимому, выполняют специализированную
функцию — фиксируют молекулярный азот. Развитие способности ис-
.пользовать N2 для образования органических азотистых соединений
представляет собой еще один важный шаг в эволюции. Благодаря своей
•способности фиксировать азот и осуществлять фотосинтез сине-зеленые
водоросли — самые нетребовательные в отношении питания организмы.
.Для роста им необходимы только N2, СО2, вода, свет и минеральные
вещества.
Образование молекулярного кислорода из воды в процессе фотосин-
теза явилось, несомненно, важнейшим событием в эволюции и имело
далеко идущие последствия. По мере накопления кислорода в атмосфе-
ре Земли облигатные анаэробы (для которых кислород токсичен) оста-
лись только в строго анаэробных средах, уступив место новым классам
-бактерий, обладающих механизмами детоксикации кислорода и исполь-
зования его для окисления сложных органических соединений с целью
лолучения необходимой энергии.
Б. Клетки эукариот
Вторая основная категория живых существ — это эукариоты, т. е.
организмы, клетки которых содержат истинное ядро. Клетки эукариот
крупнее и сложнее по строению, чем клетки прокариот. В ядре, окру-
женном мембраной, заключена большая часть ДНК, которая таким об-
разом отделена от цитоплазмы. В цитоплазме содержатся различные
•органеллы, каждая из которых обладает характерной структурой, — ми-
тохондрии, лизосомы, центриоли. Клетки эукариот так разнообразны
по размерам и форме и настолько специализированы, что описать «ти-
пичную» клетку практически невозможно. Все же на рис. 1-3 мы попы-
тались изобразить некую «усредненную» клетку1, отчасти животную, от-
части растительную.
1. Размеры и строение клеток эукариот
Как видно из табл. 1-2, где приводятся диаметр и объем некоторых
клеток, близких по форме к сфере, диапазон изменений клеточных раз-
меров огромен. И тем не менее можно считать, что типичный диаметр
как растительных, так и животных клеток равен 10—20 мкм. Что ка-
сается крупных клеток типа яйцеклетки, то в синтезе питательных ве-
ществ, которые затем переносятся в развивающееся яйцо, принимают
участие большое число окружающих ее клеток.
Многие клетки имеют далеко не сферическую форму. Например,
эритроциты человека представляют собой диски размером 8х8х(1—2)
мкм и объемом 80 мкм3. Клетки растительных волокон достигают не-
1 См. знаменитый рисунок Браше (J. Brachet, Sci. Am., 205, 55, Sep. 1961).
тесто деис1вим
РИС. 1-3, Схематическое изображение «усредненной» эукариотической клетки. На ри-
сунке показаны основные органеллы как животных, так и растительных клеток (при-
мерно в одном масштабе). Сокращения: БМ — базальная мембрана; ЭР — эндоплаз-
матический ретикулум (шероховатый — с прикрепленными рибосомами; гладкий ЭР —
около ядра и в правой стороне клетки); ГС—глубокая складка плазматической мем-
браны; ГГ — гранулы гликогена; щель — пространство шириной ~10—20 нм между
соседними клетками; М—митохондрии; Мт — микротельца; Л — лизосома; Д — дес-
мосома; ПС — плотное соединение; Мв — микроворсинки; Р — ресничка; СГ — секре-
торные гранулы; Г — аппарат Гольджи; В — вакуоль; КС — клеточная стенка (у рас-
тений); Цт — центриоль; П — плазмадесмы; Я — ядро; Яд — ядрышко; Хл — хлоро-
пласт; Кр — гранулы крахмала. (По рисунку Michael Metzler.)
28 Глава 1
Таблица 1-2
Приблизительные размеры некоторых клеток
Клетка Диаметр, мкм Примерный объем, МКМ3
E. coli 1 1,0
Малая клетка тимуса 6 120
Клетка печени 20 4000
Яйцеклетка человека (зрелаи) 120 500 000
Куриное яйцо (без белка) 20 000 4-Ю12-
Клетка дрожжей 10 500
Корешок лука, клетка меристемы 17 2600
Клетка из паренхимы плода растения 1000 1 • 10а
скольких миллиметров в длину. Нервные клетки животных имеют длин-
ные отростки, аксоны; у человека их длина достигает 1 м.
В табл. 1-3 приведены размеры геномов некоторых клеток эукариот;,
здесь же для сравнения указаны размеры генома Е. coli.
Как видно из таблицы, у дрожжей количество генетического мате-
риала примерно в 5 раз больше, чем у Е. coli, а у человека (и мыши) —
в 600 раз. Нужно сказать, однако, что у высших организмов гены неред-
ко дублированы и в клетке присутствуют многократно повторяющиеся!
последовательности ДНК. Функция таких повторов неизвестна (у неко-
торых амфибий содержание ДНК в расчете на одну клетку в 25 раз;
больше, чем у человека). Уотсон [10] высказал предположение, что-
количество собственно генетического материала в клетках позвоночных
по крайней мере в 20—50 раз выше, чем у Е. coli. Следовательно, число
генов в клетке человека составляет величину порядка 105.
2. Ядро
Диаметр ядра обычной клетки животного равен ~5 мкм, а объем
'-'65 мкм3. За исключением того периода, когда клетка делится, ядро
плотно и почти равномерно заполнено ДНК. Даже с помощью элект-
Таблица 1-3
Размеры гаплоидных геномов у ряда организмов
Организм Масса в дальтонах3» Число нуклеотидных пар
Е. coli 2,5- 10е 3,8-10s
Saccharomyces cerevisiae (дрожжи) 13- 10э 20-10®
Морской еж 600-10® 900-10®
Drosophila melanogaster (плодовая мушка) 60-10® 90-10®
Человек н мышь 1500-Ю3 2300-10®
а Thomas С. A., Jr., MacHattie L. A., Annu. Rev. Biochem., 36, 485—518, 19671
6 Mahler H. R., Cordes E. H., Biological Chemistry, 2nd ed., p. 187, Harper, New
York, 1971.
ivieciu дспсюпл
донного микроскопа не удается различить в ядре какой-либо определен-
ной структуры. Вследствие своих кислотных свойств ДНК окрашивает-
ся основными красителями. Задолго до возникновения современной био-
химии ядерное вещество, окрашивающееся этими красителями, получи-
ло название хроматин. Во время деления клетки хроматин организуется
в отдельные хромосомы, содержащие помимо ДНК (15%) еще и РНК
(около 10%), и белок (75%). Почти вся РНК клетки синтезируется
(транскрибируется) в ядре в соответствии с инструкциями, закодиро-
ванными в ДНК- Далее в большинстве случаев РНК выходит из ядра в
цитоплазму, где непосредственно участвует в синтезе белков (трансля-
ция генетической информации), а также, вполне возможно, и в других,
еще не известных нам процессах.
Клеточное ядро содержит одно или несколько плотных ядрышек—
областей, чрезвычайно обогащенных РНК (здесь присутствует 10—20%
суммарного количества РНК клетки). Ядрышки — это места синтеза и
временного накопления рибосомной РНК, которая в больших количест-
вах идет на сборку рибосом.
Ядерная оболочка состоит из двух мембран, разделенных слоем в
несколько десятков нанометров; оболочка окружает ядро и отделяет
перинуклеарное (околоядерное) пространство. В мембранах имеются
поры диаметром 40—100 нм, так что по структуре она напоминает сито.
Поры представляют собой трубчатые канальца диаметром ~4,5 нм, по
которым из ядра в цитоплазму проходят РНК и другие вещества [И].
3. Плазматическая мембрана
Тонкая (~8 нм) наружная клеточная мембрана — плазмалемма
(рис. 1-4)—регулирует поток веществ в клетку и из клетки, проводит
импульсы в нервных и мышечных волокнах, а также участвует в хими-
ческих взаимодействиях с другими клетками. Складки наружной мем-
браны нередко вдаются глубоко внутрь клетки, в цитоплазму; так, на-
.пример, в клетках поперечнополосатых мышц они образуют трубочки
Т-системы, которая участвует в проведении возбуждения, инициирую-
щего процесс сокращения (гл. 4). Складки плазматической мембраны
могут соединяться с ядерной оболочкой, создавая прямые каналы (один
или несколько) между внеклеточной средой и перинуклеарным прост-
ранством [12].
Образованные плазматической мембраной пузырьки в некоторых
случаях отшнуровываются в цитоплазму и сливаются с лизосомами.
Таким путем клетка может заглатывать плотные частицы (фагоцитоз)
или капельки (пиноцитоз) из окружающей среды. На поверхности кле-
ток, функция которых состоит в секреции или поглощении определен-
ных веществ из внеклеточной среды (например, клетки, выстилающие
почечные канальцы, или секреторные клетки поджелудочной железы),
обычно имеются тончайшие выросты — микроворсинки, которые значи-
тельно увеличивают клеточную поверхность. В некоторых случаях от-
ростки соседних клеток соприкасаются друг с другом, обеспечивая тем
самым более тесный контакт между клетками.
4. Цитоплазматические мембраны
Хотя цитоплазма представляет собой жидкость (рассматривая неко-
торые организмы, можно видеть, как она быстро течет), все же с по-
мощью электронного микроскопа выявилось, что жидкая субстанция—
цитозоль — пронизана множеством мембран, образующих так называе-
30 Глава I
РИС. 1-4. А. Электронная микрофотография ультратонкого среза молодой эпидермаль-
ной клетки подсолнечника. Ткань фиксировали и окрашивали уранилацетатом и цитра-
том свинца. Ясно видны ядро, митохондрии, хлоропласты, тельце Гольджи (диктиосо-
ма, слева около ядра), эндоплазматический ретикулум, клеточная стенка, плазмадес-
мы и кутикула (наверху справа в виде тонкого темного слоя). (С любезного разре-
шения Horner Н. Т.)
мый эндоплазматический ретикулум (ЭР), который состоит из сложной
сети трубочек, пузырьков и уплощенных мешочков (цистерн). Внутрен-
няя полость цистерн ЭР соединяется, по-видимому, с перинуклеарным
пространством и с рядом (обычно 3—12) уплощенных, слегка изогну-
тых дискообразных мембран, называемых аппаратом Гольджи [13].
Эта структура (рис. 1-3) была впервые описана Камилло Гольджи
[13а] в 1898 г., но ее существование долгое время ставилось под сомне-
ние. Часть ЭР (шероховатый эндоплазматический ретикулум) выстлана
множеством рибосом диаметром ~21—25 нм. Хотя рибосомы эукариот
сходны с бактериальными рибосомами, они примерно на 50% тяжелее
Место действия 31
РИС. 1-4. Б. Две диктиосомы (тельца Гольджи) из клетки железистого волоска рас-
тения Psychotria Обратите внимание на сетчатость структуры днктносом
___________________(от греч. диктион— сеть).
Глава 1 32
РИС, 1-4. В. Слоистые фотосинтезирующие структуры —
.граны нз хлоропласта листа люцерны. Микрофотография
получена при большем увеличении.
(4-106 дальтон). Глад-
кий эндоплазматиче-
ский ретикулум не не-
сет рибосом, однако он
способен, по-видимо-
му, вносить изменения
в молекулы белка, син-
тезированного на рибо-
сомах шероховатого
ЭР, например присое-
динять к ним углевод-
ные цепи.
Мембраны Гольд-
жи расположены в не-
посредственной близо-
сти к гладкому ЭР со
стороны, обращенной к
центру клетки. Наруж-
ные края мембран
Гольджи образуют
вздутия, из которых за-
тем формируются ва-
куоли, нередко обильно
наполненные фермен-
тами и другими соеди-
нениями. Такие секре-
торные гранулы про-
двигаются к поверхно-
сти клетки и выделя-
ются во внеклеточную
среду. В ходе указан-
ного процесса (экзоци-
тоза) мембраны, окру-
жающие секреторные
гранулы, сливаются с
наружной клеточной
мембраной [14, 15].
Аппарат Гольджи
представляет собой не
просто место «упаков-
ки» белков — в нем
также протекают раз-
личные реакции синте-
за. Как и в гладком
ЭР, в мембранах
Гольджи идет присое-
динение углеводов к
белкам (с образовани-
ем гликопротеидов) и
сульфатных групп к
полисахаридам [16,
17]. В клетках печени
аппарат Гольджи уча-
ствует в процессе вы-
деления в кровь липо-
протеидов, а также, возможно, жирорастворимых витаминов (в част-
ности, витамина А) [18]. Таким образом, ЭР, мембраны Гольджи и
секреторные гранулы представляют собой организованную систему
структур, выполняющую биосинтетические функции.
Эта система участвует не только в синтезе ферментов, которые сек-
ретируются клеткой, но и в образовании новых мембран. По-видимому,
шероховатый ЭР поставляет мембранный материал гладкому ЭР и ап-
парату Гольджи, а компоненты мембран Гольджи включаются в состав
наружной клеточной мембраны. В растительных клетках наружные
мембраны митохондрий и мембраны, окружающие вакуоли, также об-
разуются непосредственно из ЭР [19]. Компоненты наружных клеточ-
ных мембран, вероятно, могут использоваться повторно, включаясь в со-
ответствующую структуру в ходе эндоцитоза [20].
Микросомы (термин, часто встречающийся в биохимической литера-
туре) — это мелкие частицы диаметром 50—150 нм, которые представ-
ляют собой фрагменты в основном ЭР и частично плазматической мем-
браны. Микросомы образуются в процессе растирания или гомогени-
зации клеток. При центрифугировании разрушенных клеток сначала
оседают ядра и другие крупные фрагменты, затем — митохондрии. При
очень высоких скоростях (например, при 100 000 g) оседают микросомы
(их масса составляет ~108—109 дальтон). На электронных микрофото-
графиях видно, что в микросомах фрагменты мембран замыкаются с
образованием небольших мешочков, на наружной поверхности которых
сохраняются рибосомы:
Эндоплазматический • Микросомы
ретикулум
Способность к образованию замкнутых структур присуща, по-види-
мому, фрагментам любых мембран. Так, при гомогенизации нервных
клеток из их синаптических окончаний образуются замкнутые структу-
ры— синаптосомы. Правда, последние формируются из фрагментов
плазматической мембраны, а не ЭР и часто содержат митохондрии.
5. Митохондрии и пластиды
Характерной особенностью клеток эукариот является присутствие
митохондрий — сложных образований с двойной мембраной, близких по
величине к бактериям (рис. 1-3 и 1-4). Внутренняя мембрана митохонд-
рий образует многочисленные глубокие складки, так называемые кри-
сты (гребневидные выросты). Наружная мембрана проницаема для
соединений с небольшим молекулярным весом, но проникновение ве-
ществ во внутреннее пространство митохондрий (в матрикс) и выход из
него находятся под строгим контролем внутренней мембраны. Хотя от-
дельные окислительные реакции протекают в ЭР, все же основные про-
цессы, связанные с образованием и накоплением энергии, у аэробных
организмов локализованы в митохондриях; именно в этих органеллах
происходит утилизация основной части кислорода. В свое время многие
биохимики были крайне удивлены, обнаружив в митохондриях кольце-
вую ДНК с небольшим молекулярным весом. Далее оказалось, что ми-
3—1821
34
Глава 1
тохондрии содержат рибосомы, по размеру сходные с бактериальными^
но меньшие, чем рибосомы, прикрепляющиеся к шероховатому ЭР.
Митохондрии присутствуют во всех клетках эукариот, использующих
для дыхания кислород. Число митохондрий на клетку варьирует от 1
(у мельчайших трипаносом) до 3-105 (в некоторых ооцитах). Типичная
клетка печени содержит более 1000 митохондрий [21]. Новые интерес-
ные данные получены при изучении митохондрий дрожжей [22]. Иссле-
дование серийных срезов через одну клетку (дополнение 1-В) показало,,
что все митохондрии связаны между собой. Таким образом, митохонд-
рии дрожжевых клеток — это не отдельные органеллы, а единая сооб-
щающаяся внутриклеточная структура. Насколько верно это для других,
организмов — пока неясно.
Пластиды — это органеллы клеток растений, выполняющие различ-
ные функции. Наиболее важную роль играют хлоропласты, содержащие-
хлорофилл структуры, в которых протекает фотосинтез. Как и в мито-
хондриях, в хлоропластах имеется складчатая внутренняя мембрана а
некоторое количество ДНК небольшого молекулярного веса.
6. Лизосомы и микротельца
Лизосомы представляют собой пузырьки, окруженные одиночной
мембраной и содержащие полный набор ферментов для расщепления
практически любого компонента клетки. Лизосомы, по-видимому, обра-
зуются из мембран Гольджи. В клетках, способных захватывать частич-
ки пищи (например, у амеб), лизосомы являются источником фермен-
тов для ее расщепления. Лизосомы переваривают также «отработан-
ные» или излишние клеточные компоненты, в том числе митохондрии..
Лизосомы — жизненно необходимые клеточные органеллы [23, 24]; не-
которые серьезные болезни человека обусловлены отсутствием именно'
специфических лизосомных ферментов.
Во многих клетках встречаются микротельца [24, 25], в зеленых,
листьях их число достигает иногда */з числа митохондрий. Микротельца,
по величине близки к митохондриям, но окружены однослойной мем-
браной и иногда имеют кристаллическую по виду «сердцевину» («core»).
Мембрана микротелец проницаема для низкомолекулярных соединений
(например, для сахарозы), что позволяет отделить эти органеллы от
митохондрий путем центрифугирования в градиенте сахарозы, где мик-
ротельца имеют плотность около 1,25 г-см-3, а непроницаемые для са-
харозы митохондрии— 1,19.
В микротельцах находится большое количество ферментов, катали-
зирующих образование и разложение перекиси водорода. Описаны два.
типа микротелец: пероксисомы, присутствующие в клетках печени, по-
чек и зеленых листьев, и глиоксисомы, обнаруженные в прорастающих
семенах масличных культур. Глиоксисомы играют особую роль, а имен-
но катализируют реакции глиоксилатного цикла (гл. 11, разд. Г.4).
7. Центриоли, реснички, жгутики и микротрубочки
Во многих клетках присутствуют центриоли; это маленькие цилинд-
ры диаметром около 0,15 мкм и длиной 0,5 мкм, не связанные с мем-
бранами. Каждая центриоль содержит набор тонких микротрубочек ди-
аметром 20 нм. Практически во всех животных клетках вблизи ядра,
расположена пара центриолей, которые играют важную роль в клеточ-
ном делении. В клетках растений центриоли не обнаружены.
Длина этой реснички около 8мкм.
Длина ресничек варьирует
от 2мкм до 2 мм, чаще всего
составляя 10-20 мкм
0 0,5 мкм
\20
50 40
Поперечный разрез (* 2?)
А
Поперечный
разрез
Мембрана
Микротрубочки ( диаметром 24 нм),
организованные по схеме 9+2
„Ручки" на микротрубочках,
I расположенные с интервалом
' в 17-22 нм
Вторичное
волокно
10
Диаграмма движения
длинного жгутика
Базальное тельце
(кинетосома)
Наружная „ручка"
Субфибрилла В
Субфибрилла А
Б
Центральная
капсула
Мостик между
парными субфибриллами
Основание'
мостика
№1
'иальныи
мостик
Внутренняя
„ ручка ”
РИС. 1-5. А. Структура ресничек и жгутиков эукариот. (Satir Р., Sci. Am. 204, 108— 116, Feb. 1961. Copyright 1961 by Scientific American, Inc.
All rights reserved.) Б. Схематическое изображение участка типичной, построенной по схеме 9+2 аксонемы (части реснички, выступающей над по-
верхностью клетки); вид снизу — от основания к вершине кончика. Наружные двойные трубочки (№ 1, 2 и 9) присоединены к центральной капсу-
ле, образующей парные выступы (а и Р), каждый из которых прикреплен к одной из двух центральных микротрубочек (ЦМ8 и ЦМ3). Микротру-
бочки состоят из 13 нитей, причем каждая нить представляет собой цепочку белковых субъединиц (см. также гл. 4, разд. Г.2). Все детали изо-
бражены примерно в одном масштабе (Sleigh М. A., Cilia and Flagella, р. 14, Acad. Press, New York, 1974). Диаграмма движения жгутика на
рис. А взята из работы Sleigh М.. A., Endeavour, 30, И, 1971.)
РИС. 1-6. Поперечный срез реснички ротовой мембранеллы Tetrahytnena. Такие реснички направляют пищу в ротовое отверстие. Срез прошел
(слева направо) через основания ресничек (9 тройных микротрубочек) и собственно реснички (9 двойных микротрубочек). На срезах ресничек,
расположенных в левой части рисунка, центральные микротрубочки отсутствуют; на срезах, расположенных правее и ближе к центру (что соот-
ветствует более дистальному расположению ресничек), обнаруживаются одна и затем две центральные микротрубочки. Окрашивание уранилаце-
татом и цитратом свинца. (Elliot А. М., Outka D. Е., Zoology, 5th ed., р. 122. Copyri ght 1976. Reproduced by permission of Prentice-Hall, Inc.,
Englewood Cliffs, New Jersey.)
Место действия 37
По структуре центриоли сходны со жгутиками или более короткими
образованиями — ресничками (эти термины, в сущности, синонимы),
обычно находятся на поверхности клеток эукариот и являются органами
движения. Неподвижные клетки тела человека также нередко имеют
реснички. Например, эпителий бронхов несет 10В. 9 ресничек на 1 см2
[26]. Модифицированные жгутики образуют светочувствительные ре-
цепторы нашего глаза и рецепторы вкуса на языке. Жгутики и реснички
несколько больше по диаметру (около 0,2 мкм), чем центриоли, и об-
ладают характерной внутренней структурой: они состоят из И полых
микротрубочек диаметром ~24 нм, организованных по схеме «9 + 2»
(рис. 1-5 и 1-6). Каждая микротрубочка внешне похожа на жгутик бак-
терии, но существенно отличается от него по химическому составу. Ба-
зальное тельце, называемое также кинетосомой (рис. 1-5), по структу-
ре, размерам и способу воспроизведения сходно с центриолью. Микро-
трубочки, подобные тем, которые входят в состав жгутиков, обнаруже-
ны также в цитоплазме клеток [27]. Они выглядят как маленькие ка-
нальцы, но действительно ли играют такую роль — неясно. Скорее все-
го микротрубочки выполняют опорную функцию «цитоокелета». В аксо-
не нерва микротрубочки расположены по всей длине аксона и, вероят-
но, составляют часть механической системы переноса клеточных компо-
нентов.
8. Клеточные оболочки, стенки и раковины
Подобно бактериям, клетки высших растений и животных часто по-
крыты внеклеточным материалом. Так, растительные клетки имеют
жесткую стенку, содержащую в большом количестве целлюлозу и дру-
гие полимерные углеводы. Клетки, расположенные на наружных поверх-
ностях растений, бывают покрыты восковым слоем. Клетки животных
снаружи обычно защищены гликопротеидами — комплексами углеводов
со специфическими белками клеточной поверхности. Пространство меж-
ду клетками заполнено такими «цементирующими веществами», как
пектины у растений и гиалуроновая кислота у животных. Нераствори-
мые белки — коллаген и эластин — секретируются клетками соедини-
тельной ткани. Клетки, лежащие на поверхности (эпителиальные или
эндотелиальные), нередко граничат с другой стороны с тонкой, содер-
жащей коллаген базальной мембраной (рис. 1-3). Часто в результате
совместного действия клеток различного типа происходит отложение
неорганических соединений — фосфата кальция (в костях), карбоната
кальция (скорлупа яиц и спикулы губок), окиси кремния (раковины
Диатомовых водорослей) и т. и. Таким образом, обмен веществ в зна-
чительной мере протекает вне клеток.
В. Эволюция сложных организмов
Огромные различия между клетками про- и эукариот породили мно-
жество предположений относительно характера эволюционных взаимо-
отношений между этими двумя основными категориями живых существ.
Согласно одной из популярных теорий, митохондрии ведут свое проис-
хождение от аэробных бактерий. Предполагается, что после появления
сине-зеленых водорослей и накопления в атмосфере достаточного коли-
чества кислорода возник симбиоз между мелкими аэробными и более
крупными облигатно анаэробными бактериями. При этом аэробные
бактерии, поселившись внутри клеток анаэробов, поглощали весь кис-
лород и защищали тем самым организм хозяина, для которых кислород
38
Глава 1
был токсичным. Со временем эти отношения закрепились, что привело к
возникновению клеток эукариот, содержащих митохондрии [28, 29].
В дальнейшем симбиоз с сине-зелеными водорослями мог аналогичным
образом привести к появлению хлоропластов в клетках растений-эука-
риот.
В пользу рассмотренной выше точки зрения говорит тот факт, что
симбиотические отношения существуют и между современными орга-
низмами. Так, в цитоплазме зеленой парамеции (Paramecium bursa-
ria) присутствует одноклеточная водоросль хлорелла (Clorella) —обыч-
ное зеленое растеньице, которое может жить и самостоятельно.
Вероятно, сожительство хлореллы с парамецией возникло случайно
[28]. Биологи и биохимики сразу приняли симбиотическую теорию воз-
никновения митохондрий. Однако Рафф и Малер выдвинули другую
гипотезу, предположив, что митохондрии возникли скорее из мезосом-
ных мембран, а ДНК в них происходит из внехромосомного генетиче-
ского материала (из плазмид или эписом; гл. 15, разд. Г.7), который
часто встречается в клетках прокариот [30]. Этот вопрос так и остает-
ся открытым и широко обсуждается [30—-32].
Ископаемые остатки бактерий и сине-зеленых водорослей были най-
дены в отложениях, возраст которых, по геохимическим данным, пре-
вышает 3 млрд. лет. Возможно, в это же время появились первые эука-
риоты, давшие в результате эволюции свыше миллиона известных ныне
видов.
1. Дупликация генов
Каким образом увеличивался размер генома клеток при эволюции
организмов от низших форм к высшим? Изменения формы и поведения
организмов обусловлены мутациями, меняющими последовательность
аминокислот в белках. Однако такие мутации не могли увеличить коли-
чества генетического материала в процессе эволюции. Вполне возмож-
но, что в ряде случаев в клеточное ядро случайно включалась копия од-
ного или нескольких генов [32а]. Тогда при наличии дополнительной
копии гена клетка могла выжить, даже если в результате мутации в од-
ном из парных генов нарушались структура и функция кодируемого им
белка; если парный ген оставался неповрежденным, организм был спо-
собен расти и размножаться. Дополнительный, несущий мутацию ген
мог оставаться в нефункционирующем состоянии много поколений. До
тех пор, пока этот ген продуцировал безвредные, нефункционирующие
белки, он не элиминировался под давлением естественного отбора и со
временем мог опять мутировать. Вполне возможно, что в конце концов
белок, кодируемый этим многократно мутировавшим геном, оказывался
в каком-то отношении полезным для клетки.
Примером результата эволюции, идущей через дупликацию генов,
служат белки крови, переносящие кислород. Предполагается, что около
миллиарда лет тому назад ген белка-предшественника (глобина) дуп-
лицировался. Далее в результате эволюции один из парных генов пре-
вратился в ген, кодирующий гемоглобин, а второй — в ген мышечного
миоглобина. Затем ген гемоглобина вновь дуплицировался, что привело
к существованию в настоящее время а- и 0-цепей этого белка (гл. 4,
разд. Г.8). Последние представляют собой родственные, но отчетливо
различающиеся белковые субъединицы; кодирующие их гены располо-
жены даже в разных хромосомах.
Место действия
39
2. Пол, хромосомы и клеточное деление
Бактерии размножаются обычным путем бинарного деления. При
этом единственная молекула ДНК бактериальной хромосомы удваивает-
ся, и в результате дочерние клетки получают по идентичной хромосо-
ме. Однако у некоторых бактерий обнаруживаются зачатки полового
размножения. Процессом, «перемешивающим» бактериальные гены, яв-
ляется при этом генетическая рекомбинация (гл. 15, разд. Ж).
Половое размножение получает окончательное развитие у эукариот,
где рост многоклеточного организма начинается со слияния двух гапло-
шдных гамет—яйцеклетки и сперматозоида. Каждая гамета несет пол-
ный набор генетических инструкций; образовавшееся после слияния
ядер оплодотворенное яйцо (зигота) является диплоидным. Диплоидная
клетка содержит два полных набора генетических матриц, полученных
ют двух совершенно разных родителей. Это дает развивающемуся орга-
низму огромные преимущества. В самом деле, если какой-либо ген,
полученный от одного из родителей, окажется дефектным, то весьма
мало вероятно, что соответствующий ген от второго родителя будет то-
же дефектным. Кроме того, половое размножение — это средство смеши-
вания генов, и каждый из нас получает не просто половину генов от
матери и половину от отца, но также какие-то гены от дедушек и бабу-
шек, от прадедушек и прабабушек и т. д.
Перед началом деления клеток молекулы ДНК в ядре, которые до
этого были распределены по всему объему, начинают концентрировать-
ся, образуя вместе с белками и другими соединениями плотные тель-
ца— хромосомы. У некоторых организмов, например у Ascaris (круг-
лый червь), имеется только 2 хромосомы. Одна хромосома содержит ге-
нетическую информацию, которую «малышка» Ascaris получает от от-
ца, а другая—от матери. Таким образом, в этом случае имеется только
одна гомологичная пара хромосом, каждая из которых несет весь необ-
ходимый комплект генетических инструкций. Обе хромосомы этой пары
распределяются при каждом клеточном делении так, что все клетки
•организма имеют гомологичную пару. Клетки тела человека, подобно
клеткам Ascaris, диплоидные, но в них не одна, а 23 гомологичные пары
хромосом1. Размеры хромосом человека различны, но в среднем их дли-
на составляет 4—6 мкм, диаметр ~ 1 мкм.
•3. Митоз и мейоз
Процесс клеточного деления, называемый митозом, начинает и за-
вершает клеточный цикл, в ходе которого делится отдельная диплоидная
клетка. С биохимической точки зрения митоз представляет собой удвое-
ние числа генетических матриц с последующим формированием из них
компактных образований — хромосом. Последние распределяются по-
ровну между двумя новыми клетками (подробно этот процесс описан в
гл. 15, разд. Г.9).
Что происходит во время митоза с митохондриями? Они, как и хло-
ропласты в растительных клетках, делятся. Следовательно, на опреде-
ленных стадиях клеточного цикла в этих органеллах происходит репли-
кация ДНК- По крайней мере в ряде случаев деление митохондрий так
связано с клеточным делением, что среднее число митохондрий в рас-
чете на дочерние клетки остается строго постоянным. Аналогичное яв-
ление наблюдается и в клетках низших организмов, содержащих водо-
1 Число хромосом у некоторых других организмов следующее: у мыши — 20, у жа-
<бы — 11, у лука — 8, у москита — 3, у плодовой мушки Drosophila — 4.
40 Глава 1
росли-симбионты, несмотря на то что такие водоросли могут жить и са-
мостоятельно вне клеток организма-хозяина. Что заставляет водоросли,
живущие внутри клеток хозяина, делиться синхронно с этими клетками,
остается для биохимиков загадкой.
Путем последовательных митотических делений из одной оплодо-
творенной яйцеклетки формируется взрослый организм. Для формиро-
вания организма человека достаточно всего 40—50 последовательных
митозов. Однако образование гамет (половых клеток), имеющих гапло-
идный набор хромосом, осуществляется путем мейоза — специального
процесса, в ходе которого число хромосом делится надвое. При мейозе
одна хромосома из каждой гомологичной пары, содержащейся в дипло-
идной клетке, переходит в одну из образующихся гамет. В организме,
подобном Ascaris, который содержит единственную пару хромосом, га-
мета получает хромосому либо от отцовского организма, либо от мате-
ринского, но не от обоих сразу. В организмах, имеющих несколько пар
хромосом, хромосомы при мейозе распределяются случайным образом,
так что в каждой гамете имеются как материнские, так и отцовские хро-
мосомы.
Более подробно мейоз рассматривается в гл. 15, где особое внима-
ние уделено кроссинговеру. В ходе этого процесса, составляющего очень
важную особенность мейоза, происходит разрыв связей между генами,
что обеспечивает «перестановку» генов в хромосомах. Кроссинговер
весьма сходен с генетической рекомбинацией у бактерий и на молеку-
лярном уровне, видимо, неотличим от нее.
Дополнение 1-Г
Наследственные нарушения обмена веществ
В 1908 г. Арчибальд Гаррод (A. Garroda) предположил,
что цистииурия (гл. 5, разд. Б.2.6), а также некоторые другие
нарушения обмена аминокислот и сахаров являются наслед-
ственными заболеваниями. С тех пор число обнаруживаемых
наследственных нарушений обмена веществ у человека увели-
чивается с возрастающей скоростью и превышает в настоящее
время 15006. Примерно для 100 из них выявлено, в чем состо-
ит изменение структуры белка, ответственного за нарушение
обменав-е; в качестве примера можно привести серповидно-
клеточную анемию (дополнение 4-Г). Однако в большинстве
случаев нарушения метаболизма обусловлены потерей актив-
ности какого-либо необходимого фермента.
Многие генетические болезни очень редки и встречаются
не чаще чем у одного человека из 10 000, но некоторые, на-
пример кистозный фиброз, поражают одного из 2500. Общее
число страдающих наследственными болезнями превышает,
как полагают, 2% от числа рождающихся. Многие из них
погибают в младенчестве. Еще большее число людей (более
5%) страдает от диабета и психических заболеваний, также
отчасти генетически обусловленных. Поскольку появление но-
вых мутаций — непрекращающийся процесс, генетические за-
болевания представляют все более и более злободневную про-
блему.
Какова частота появления новых мутаций? Исходя из дан-
ных по содержанию гаплоидной ДНК (табл. 1-3), можно рас-
Место действия 4В
считать, что общая кодирующая емкость ДНК клетки чело-
века превышает 2 млн. генов (точнее, два миллиона пар ге-
нов для диплоидной клетки). Однако белки кодируются толь-
ко частью ДНК- По оценкам разных авторов, число пар-
структурных генов у человека колеблется от 20 000 до 100 000.
Обращаясь в поисках какого-то ориентира к бактериям, мож-
но отметить, что частота легко выявляемых мутаций у бакте-
рий составляет около 10~6 на 1 ген, или 10~9 на пару основа-
ний при каждом делении6. Следовательно, можно ожидать,,
что при репликации 2-Ю9 пар оснований (столько их содер-
жится в хромосомах человека) произойдет примерно 2 ошиб-
ки за каждое деление. Поскольку от одного поколения людей
до другого зародышевые клетки претерпевают несколько деле-
ний, число мутаций в каждом поколении должно быть весьма,
значительным. Другой источник новых мутаций — это повреж-
дение двухцепочечной ДНК, которое может возникнуть за
одно поколение (примерно 20 лет). Без сомнения, большая
часть повреждений исправляется с помощью сложной системы
репарации (гл. 15), но некоторые остаются. По счастью, мно-
гие мутации оказываются безвредными или почти безвредны-
ми, а некоторые могут быть даже полезными. Возможно-
также, что система репликации (воспроизведения ДНК) У
эукариот допускает меньше ошибок, чем у бактерий. С другой
стороны, загрязнение окружающей среды мутагенными хими-
ческими веществами не может не вызывать серьезного беспо-
койства, поскольку является новым источником возникнове-
ния мутаций.
Многие мутации легальны. Несущая летальную мутацию-
гомозигота не выживает — происходит спонтанный аборт (что
остается обычно незамеченным). Имеются данные, что у впол-
не здоровых людей можно обнаружить до 10 рецессивных ле-
тальных мутаций, а также по крайней мере 3—5 аутосомных
рецессивных мутаций, влекущих за собой серьезные генетиче-
ские дефекты. Вредные для организма доминантные мутации
тоже часто встречаются в популяции. В частности, они прояв-
ляются в виде повышения уровня липопротеидов в крови и по-
вышения концентрации холестерина, что в свою очередь при-
водит к повышению частоты сердечно-сосудистых заболеваний
в молодом возрасте.
Биохимические нарушения представляют большой теоре-
тический интерес в связи с тем, что они проливают свет на
значение отдельных процессов обмена веществ; в этой книге
мы нередко будем говорить о такого рода заболеваниях. Ра-
зумеется, основная цель изучения этих болезней состоит в
поиске средств их лечения. В некоторых случаях, например
при фенилкетонурии (гл. 14, разд. 3.5) или при галактоземии-
(гл. 12, разд. А.1), своевременно изменив диету больного,
удается предотвратить необратимое повреждение головного-
мозга— органа, который при этих заболеваниях обычно стра-
дает в первую очередь. Во многих других случаях соответст-
вующих методов лечения до сих пор не существует; поиски
путей введения в организм недостающего фермента — своего-
рода «генная хирургия» — относится к одной из наиболее ув-
лекательных областей современной медицинской биохимии
(гл. 15, разд. 3.4).
42
Глава 1
а Garrod А. Е., Inborn Errors of Metabolism, Oxford, London, 1909.
6 Friedmann T., Roblin R., Science, 175, 949—955 (1972).
B Stanbury J. B., Wyngaarden J. B., Fredricksen D. S. eds., The Metabolic
Basis of Inherited Disease, 3rd ed., McGraw-Hill, New York, 1972.
r Brock D. J. H„ Mayo O., eds., The Biochemical Genetics of Man, Acade-
mic Press, New York, 1972.
д Thompson R. H. S., Wootton I. D. P., Biochemical Disorders in Human
Disease, 3rd ed., Academic Press, New York, 1970.
e Watson J. D., Molecular Biology of the Gene, 3rd ed., p. 254, Benjamin,
Menlo Park, California, 1976.
4. Половые хромосомы и аутосомы
Диплоидные клетки большинства высших организмов содержат одну
пару хромосом, которые, помимо всего прочего, определяют пол особи.
У женщин клетки содержат пару «Х-хромосом», а у мужчин — одну
«Х-хромосому» и парную ей короткую, похожую на обрубок «Y-хромо-
сому»1.
О генах, расположенных в половых хромосомах, говорят, что они
сцеплены с полом. Поскольку большая часть таких генов локализована
в длинной Х-хромосоме, а не в Y-хромосоме, генетические дефекты про-
являются у мужчин, имеющих только одну копию этих генов, гораздо
чаще, чем у женщин. Так, гемофилия и цветовая слепота поражают по
преимуществу мужчин. Женщины в большинстве случаев гетерозиготны
по дефектному гену, т. е. у них имеется нормальный ген на второй
Х-хромосоме2.
При этом если поврежден только один ген из пары (как обычно и бы-
вает), то человек практически здоров. В этой ситуации о дефектном
генетическом признаке говорят как о рецессивном. Например, и гемофи-
лия, и цветовая слепота связаны с полом и являются рецессивными
признаками.
Все хромосомы, кроме половых, принято называть аутосомами, а
расположенные на них гены — аутосомными.
5. Гаплоидные и диплоидные клетки
У человека и высших животных в результате мейоза образуются га-
меты— яйцеклетка и сперматозоиды. При их слиянии возникает снова
диплоидное ядро, из которого путем последовательных митозов разви-
вается взрослый организм. Стадия мейоза характерна для жизненного
цикла всех эукариот, однако отнюдь не всегда этот процесс протекает в
период, аналогичный соответствующему моменту жизненного цикла че-
ловека. Так, клетки многих простейших и грибов обычно гаплоидны.
После слияния двух гаплоидных ядер с образованием диплоидной клет-
ки быстро наступает мейотическое деление, в результате которого вновь
возникают гаплоидные особи. Чередование гаплоидных и диплоидных
фаз жизненного цикла часто встречается у низших растений и прими-
тивных животных. Например, гаметы папоротника падают на почву и
1 У млекопитающих наличие или отсутствие Y-хромосомы определяет пол живот-
ного, а у других организмов Y-хромосома может вообще отсутствовать. Например,
у одних насекомых (Orthoptera) самки имеют пару хромосом XX, а самцы — ХО, в то
время как у других (Lepidoptera), а также у ряда позвоночных (например, у птиц)
самцы несут пару хромосом XX, а самки — XY.
2 У женщин синтез матричной РНК идет только на одной из двух Х-хромосом,
присутствующих в клетках. При этом в одних клетках функциональной активностью
обладает Х-хромосома материнского происхождения, в других — отцовского. В ре-
зультате в организме в целом проявляются гены от обоих родителей.
Место действия 43
прорастают в виде маленького зеленого, напоминающего мох, гаплоид-
ного растеньица (заростка), или гаметофита. На нем образуются под-
вижные гаплоидные гаметы, сливающиеся в диплоидную зиготу, из ко-
торой вырастает большая по величине, знакомая всем спорофитная
.форма папоротника.
По всей вероятности, доминирование диплоидной фазы у высших
растений и животных обусловлено способностью гетерозиготы выживать
даже при возникновении одной или нескольких крайне вредных мута-
ций. Для ученых, занимающихся биохимической генетикой, использова-
ние гаплоидных организмов дает огромные методические преимущества,
дозволяя с легкостью выявлять рецессивные мутации.
Г. Царство протистов
К царству протистов (Protista) обычно относят как одноклеточные
-эукариоты, так и многоклеточные организмы, у которых все клетки вы-
полняют сходные функции (т. е. отсутствует или слабо выражена тка-
невая дифференциация). Сюда же можно отнести грибы, но иногда их
..выделяют в отдельное царство.
1. Простейшие
К числу наиболее известных простейших, сходных с животными, от-
носится амеба [подтип саркодовых (Sarcodina), или корненожек (Rhi-
..zopoda)]. Самое удивительное у амебы (рис. 1-7) —это способ ее пере-
движения, который сопряжен с переходом цитоплазмы из жидкого со-
стояния в полутвердый гель. При движении амебы цитоплазма в задней
•части клетки разжижается и перетекает в переднюю часть и в вытяги-
вающиеся псевдоподии, где затем затвердевает по краям. Этот организм
ставит перед биохимиками ряд принципиальных вопросов. Какова хи-
мическая природа обратимого перехода цитоплазмы из жидкого со-
стояния в гель? Какие химические процессы заставляют сократитель-
ные вакуоли [33] периодически выбрасывать избыток жидкости, т. е.
.действовать наподобие зачаточной выделительной системы внутри от-
дельной клетки? Наконец, каким образом происходит быстрый разрыв и
.восстановление клеточных мембран при заглатывании амебой частичек
пищи?
Родственными амебе организмами являются радиолярии (Radiola-
:ria)—морские простейшие, чрезвычайно симметрично организованные
•существа со сложным внутренним скелетом, образованным углеводным
полимером хитином и окисью кремния (SiO2) или сульфатом стронция.
Фораминиферы (Foraminifera) —мелкие амебы, имеющие наружные ра-
ковины из карбоната кальция или двуокиси кремния. В настоящее вре-
мя их известно свыше 20 000 видов и до сих пор, как и в отдаленном
-прошлом, их крошечные скелеты падают на дно океанов и формируют
известняковые отложения.
Мельчайшие простейшие, относящиеся к подтипу споровиков (Sporo-
zoa), паразитируют на животных всех типов. Несколько родов пато-
генных кокцидий (Coccidia) паразитирует на кроликах и домашней
птице, принося огромные убытки.
Человек часто оказывается жертвой простейших, относящихся к роду
Plasmodium (рис. 1-7), которые проникают в кровь и другие ткани и
вызывают малярию, одну из наиболее распространенных болезней чело-
века на земном шаре. От малярии за всю историю человечества погиб-
ло, вероятно, больше людей, чем от любой другой болезни.
44 Глава 1
Trichonympha, обитающая
в кишечнике термитов
Древесные
— которые пе,___,___...
\ с помощью бактерий-
симбионтов
Е. coli—пища
Ъля простейших
частички.
Euglena viridis
Растение это
или животное 2
Хлоропласт
50 мкм-
О
Представитель
панцирных жгутиковых
Второй жгутик
расположен
в специальном,
желобке
Trypanosoma yambiense
(вызывает африканскую
сонную болезнь)
РИС. 1-7. Широкоизвестные представители протистов.
Другой подтип простейших, жгутиковые (Mastigophora), передви-
гающиеся с помощью небольшого числа жгутиков, служит связующим'
звеном между животными и водорослями. Euglena viridis (эвглена),
маленький пресноводный организм с гибким конусовидным телом и
длинным жгутиком на переднем конце, содержит зеленые хлоропласты,
и имеет светочувствительное «глазное пятно», благодаря которому кон-
центрируется в освещенных солнцем местах (рис. 1-7). В отсутствие
света эвглена ведет образ жизни, свойственный животному организму.
При обработке стрептомицином (дополнение 12-А) у эвглены исчезают
хлоропласты, и она необратимо превращается в животное. В морском
планктоне содержатся в большом количестве панцирные жгутиковые
(динофлагелляты, Dinoflagellata) (рис. 1-7), среди которых встречают-
ся как бесцветные, так и зеленые формы.
Гемофлагелляты (Haemoflagellata) являются возбудителями ряда
самых страшных болезней человека. Трипаносомы (род Trypanosoma)
проникают в клетки нервной системы, вызывая сонную болезнь. Неко-
торые жгутиковые находятся в симбиотических отношениях с другими
организмами. Наиболее сложные из известных в настоящее время жгу-
тиковых (рис. 1-7) обитают в пищеварительном тракте термитов и тара-
канов. В клетках этих простейших в свою очередь живут бактерии-сим-
бионты, которые обеспечивают термитов ферментами, необходимыми
для переваривания целлюлозы древесины.
Представители подтипа ресничных инфузорий (Ciliophora) — самые
сложные в структурном отношении простейшие. Они несут большое чис-
ло ресничек, синхронное биение которых служит способом передвиже-
ния этих организмов. Сразу же возникает вопрос: как осуществляется
связь между ресничками, обеспечивающая эту согласованность? Биохи-
мики чаще всего используют в своих исследованиях двух представите-
лей данного подтипа — Tetrahymena [34] (рис. 1-7), наиболее просто
устроенную инфузорию, и Paramecium, более сложноорганизованную.
Миксомицеты (Myxomycetes), или слизевики, вероятно, ближе к про-
стейшим, чем к грибам. Члены семейства Acrisieae, из которых наиболее
изучен вид Dictyostelium discoideum, начинают свою жизнь как мелкие
амебы. Спустя некоторое время, когда запасы пищи истощаются, отдель-
ные амебы начинают выделять небольшими порциями химический
аттрактант — циклический АМР (гл. 6, разд. Е.5). Находящиеся побли-
зости амебы отвечают на этот сигнал спустя примерно 15 с, также вы-
деляя порцию циклического АМР, и затем начинают перемещаться к
исходному источнику аттрактанта [35]. В конце концов все амебы
группируются вокруг нескольких центров, агрегируют и формируют
плодовые тела, напоминающие грибы. В них вегетативным путем обра-
зуются споры, и весь цикл начинается сначала. Другие миксомицеты
растут в виде многоядерного (диплоидного) плазмодия, содержащего
тысячи ядер, не разделенных клеточными мембранами.
2. Грибы
Не обладающие способностью к фотосинтезу, живущие преимущест-
венно в почве, но иногда также в воде, грибы представлены огромным
числом видов: их около 10s, что только вдвое меньше числа видов сосу-
дистых растений. Грибы характеризуются двумя отличительными при-
знаками: у них нет хлорофилла и они растут в виде скопления множе-
ства разветвленных трубочек (обычно 6—8 мкм диаметром); эти тру-
бочки называются гифами, а образованное ими скопление — мицелием.
Грибы в большинстве случаев являются ценоцитными организмами, т. е.
гифы состоят не из отдельных клеток, а из массы протоплазмы с мно-
жеством ядер, и лишь изредка трубочка разделена перегородкой. По
способу питания грибы в основном относятся к сапрофитам, но неко-
торые паразитируют, вызывая у человека серьезные, трудноизлечимые
заболевания. Серьезной медицинской проблемой является отсутствие
антибиотиков, способных справиться с грибковой инфекцией (микоза-
46 Глава I
О
20 мкм.
Макроконидии
Микроконидии
Аск с 8
аскоспорами
Saccharomyces cerevisiae
Аск
Х1О
Протоперитпеции
0о®
оо
РИС. 1-8. Часто используемые в лабораторных исследованиях грибы Neurospora cras-
sa и дрожжи Saccharomyces ' ’ ' - - ... —
Univ.
Прохождение
ядра через
пору в
перегородке
cerevisiae. (Webster I., Introduction to Fungi, Cambridge
Press, London, New York, 1970.)
именно грибы синтезируют многие важнейшие
пенициллин. В грибах же образуются самые
ми). С другой стороны,
антибиотики, например
мощные известные токсины.
Место действия 47
Низшие грибы (Phycomycetae) —это простые пресноводные слизи и
плесени. Высшие грибы в зависимости от способа образования половы^
спор делятся на аскомицетов (Ascomycetae) и базидиомицетов (Basidio-_
mycetae). У аскомицетов споры формируются в маленьких мешочках,
называемых асками (рис. 1-8). В аске содержится четыре или восемь,
спор, расположенных в ряд, причем каждая четверка представляет со-
бой результат одной пары мейотических делений (в случае последующе-
го митоза образуются уже восемь спор). Благодаря такому способу
спорообразования один из аскомицетов, Neurospora crassa (рис. 1-8),
стал излюбленным объектом генетических исследований [36]. Аскоспо-
ры можно в строгом порядке извлекать из аска и выращивать по от-
дельности, чтобы выявить результаты кроссинговера, происшедшего во
время меиоза.
Нейроспора может размножаться и посредством гаплоидных спор —
конидий. Гаплоидные мицелии представлены двумя типами, и конидии
или мицелии одного типа способны оплодотворять клетки другого типа,
(находящиеся в специальном образовании — протоперитециуме) с обра-.
зованием зигот. Последние немедленно проходят мейоз и митоз, форми-.
руя восемь аскоспор.
К числу аскомицетов относятся очень ценные съедобные трюфели ц
сморчки. Однако большинство съедобных грибов представляют собоц
плодовые тела базидиомицетов. К базидиомицетам относятся также,
ржавчинные грибы, наносящие колоссальный ущерб урожаю пшеницы
и других зерновых культур.
Дрожжи — это грибы, приспособившиеся к существованию в среде,
с высоким содержанием сахара; они остаются обычно одноклеточными
и размножаются путем почкования (рис. 1-8). Время от времени их
гаплоидные клетки попарно сливаются и образуют диплоидные клетка
и половые споры. Одни дрожжи относятся к аскомицетам, другие — к
базидиомицетам. Saccharotnyces cerevisiae, активное начало как пекар-
ских, так и пивных дрожжей, является аскомицетом, способным к неог-.
раниченному росту как в диплоидной, так и гаплоидной фазе, причем,
диплоидные клетки несколько крупнее гаплоидных [37].
3. Водоросли
Водоросли представляют' собой весьма разнообразную группу хло-
рофиллсодержащих эукариот, представленных как одноклеточными, таю
и колониальными формами. Колониальные водоросли обычно имеют вид
длинных нитей, прямых или разветвленных; иногда они образуют пла-
стинки, напоминающие листья. Клеточная дифференциация, однако,
практически отсутствует. Золотисто-бурые, бурые и красные водоросли
помимо хлорофилла содержат ряд специфических пигментов.
Эвглениды (Euglenophyta) и панцирные жгутиковые (Pyrrophyta),
упоминавшиеся в разделе о простейших, можно с равным основанием
считать водорослями. Однако ярко-зеленые водоросли (Chlorophyta),
одноклеточные или нитчатые, несомненно, относятся к растениям.
С другой стороны, часто используемая биохимиками хламидомонада
(Chlamydomonas), обладающая двумя жгутиками и содержащим каро-
тиноид глазным пятном, или стигмой, больше напоминает животную,
клетку (рис. 1-9). Хламидомонада содержит единственный хлоропласт.
Внутри хлоропласта наряду с глазным пятном имеется пиреноид —
центр синтеза крахмала. Гаплоидные клетки хламидомонады представ-
лены двумя типами — «плюс» и «минус». Зиготы, рбразующиеся прю
чо 1 лава i
РИС. 1-9. Некоторые виды водорослей.
слиянии подвижных гамет, немедленно претерпевают мейотическое де-
ление с формированием гаплоидных спор. Хромосома хламидомонады
довольно подробно картирована, и этот организм часто используется в
биохимических генетических исследованиях.
Относящийся к нитчатым водорослям Ulothrix образует вегетативные
споры с четырьмя жгутиками и гаметы с двумя жгутиками, напоминая
Место действия
49
этим животные клетки. Диплоидной является только зигота. С другой
стороны, клетки на редкость красивой спирогиры (Spirogyra) (рис. 1-9)
неподвижны, а амебоидная мужская гамета продвигается по трубочке,
соединяющей две спаривающиеся клетки. Такая особенность размноже-
ния указывает на связь спирогиры с высшими зелеными растениями.
Некоторые одноклеточные водоросли достигают значительных раз-
меров. Примером может служить Acetabularia (рис. 1-9), произрастаю-
щая в теплых водах Средиземноморья и других тропических морей.
Клетка этой водоросли содержит одно ядро, расположенное в ее осно-
вании (ризоиде). У взрослой водоросли, жизненный цикл которой
длится от 6 месяцев (в лабораторных условиях) до 1 года (в природе),
формируется характерного вида вырост (шляпка). По завершении раз-
вития этого образования ядро делится примерно на 104 вторичных
ядер, которые мигрируют вверх по стебельку и в радиальные лучи
шляпки, где образуются цисты. Затем шляпка отмирает и цисты высво-
бождаются; в них происходит мейоз, и образовавшиеся жгутиковые га-
меты попарно сливаются, формируя зиготу, из которой вновь вырастает
диплоидная водоросль.
Благодаря своим большим размерам и локализации ядра в основа-
нии клетки ацетабулярия оказалась удобным объектом для исследова-
ния морфогенеза [38, 39]. Растущую водоцосль разрезали на отдельные
части — ризоидную, базальную и апикальную, затем удаляли ядро и
трансплантировали его из одной части в другую; отрезанные части раз-
ных растений сращивали и получали водоросль с несколькими ядрами;
апикальную часть от одного вида соединяли с ризоидной частью друго-
го и т. д. Опыты такого рода показали, что морфология (форма) шляп-
ки определяется информацией, поступающей из ядра. Однако синтез
белка и рост клетки идут даже в отсутствие ядра. Отсюда следует, что,
по-видимому, несущие информацию молекулы (предположительно мат-
ричной РНК) перемещаются из ядра в зону роста на очень ранней ста-
дии развития водоросли. Для синтеза белка в остальной части клетки
постоянного участия ядра не требуется.
Рассматривая любую пробу водорослей из пруда или аквариума под
микроскопом, всегда можно обнаружить крошечные диатомеи, медлен-
но, как лодочки, скользящие в воде. Диатомовые водоросли, относящие-
ся к группе Chrysophyta, широко известны из-за наличия у них на-
ружной «раковины» из двуокиси кремния. Эти кремниевые скелеты,
ажурные, нередко поразительно красивые (рис. 1-9), отличаются чрез-
вычайной прочностью; они образуют обширные древние отложения
«диатомовой земли». Передвигаются диатомеи очень медленно, причем
самым необычным способом—посредством перетекания протоплазмы
по желобку на поверхности клетки. Диатомовые водоросли составляют
существенную часть морского планктона. По оценкам, три четверти ор-
ганических веществ в мире продуцируется диатомовыми водорослями и
панцирными жгутиковыми. Подобно бурым водорослям, хризофиты со-
держат пигмент фукоксантин.
Есть еще две группы водорослей — бурые (Phaeophyta) и красные
(Rhodophyta). К первым относятся гигантская бурая водоросль, из ко-
торой получают полисахарид альгин. Вторые представлены растениями
с многочисленными тонкими веточками, содержащими красный пигмент
фикоэритрин. Полисахариды — агар и каррагенин, — часто добавляемые
в шоколадные напитки и другие пищевые продукты, вырабатывают
именно из красных водорослей.
50 Глава 1
4. Лишайники
На скалах и в других сухих местах (часто с холодным климатом}
произрастает свыше 15 000 разновидностей лишайников. Лишайники
представляют собой сожительство (симбиоз) гриба с истинной водо-
рослью или с сине-зеленой водорослью, относящейся к прокариотам.
Водоросли, по-видимому, не имеют особых выгод от этого симбиоза, но
грибы, проникая внутрь клетки водоросли, получают от нее питательные
вещества [40]. Каждого из партнеров, составляющих лишайник, можно
вырастить по отдельности, однако в комбинации они приобретают новые
свойства. Так, лишайники (но не составляющие его организмы) выра-
батывают специальные пигменты и фенольные вещества, называемые
депсидами.
Д. Многоклеточные организмы
В данном разделе мы не собираемся описать все разнообразие мно-
гоклеточных животных (Metazoa) и растений (Metaphyta), а хотим
только рассмотреть некоторые вопросы, представляющие интерес для
биохимии.
1. Разнообразие форм животных
До недавнего времени внимание биохимиков было направлено глав-
ным образом на изучение высших позвоночных. Однако теперь все
больший интерес вызывают многообразные низкоорганизованные фор-
мы. Простейшими из них являются крошечные симбиотические1 черве-
образные животные, принадлежащие к типу Mesozoa и обитающие в
почках глубоководных головоногих моллюсков [41]. Они состоят всего-
из 25 клеток, которые располагаются в один слой и окружают одну или
несколько аксиальных клеток (рис. 1-10). Было бы очень интересно ис-
следовать природу химической коммуникации между этим небольшим
числом клеток.
Самыми примитивными многоклеточными животными являются
губки (Porifera). У них отсутствует дифференциация на ткани, однако
имеется несколько специализированных видов клеток. Тело губок обра-
зовано неподвижными клетками, которые всасывают воду через поры
и извлекают из нее необходимые питательные вещества. Внутри тела
губок имеются амебоциты, функционирующие согласованно и образую-
щие спикулы (иглы) из углекислого кальция, двуокиси кремния или из
белка спонгина (рис. 1-10). Элементы нервной системы у губок, по-ви-
димому, отсутствуют.
Следующий очень разнообразный и важный тип животных — книда-
рии (Cnidaria, ранее называвшийся Coelenterata-—кишечнополост-
ные)— включает организмы, обладающие радиальной симметрией и
состоящие из двух четко различающихся слоев клеток — эктодермы и
энтодермы. Многие виды существуют одновременно как в форме поли-
пов, или гидр (рис. 1-10), так и в форме медуз. Насколько известно, у
медуз отсутствует мозговой ганглий, но несомненный интерес представ-
ляет способ соединения нейронов, образующих примитивную радиаль-
ную сеть.
1 Представителей типа Mesozoa обычно считают паразитами, но, по-видимому,,
они облегчают выведение NH3 из организма хозяина путем повышения кислотност»
мочи [40а]. Некоторые биологи рассматривают Mesozoa как подцарство, а не как тип.
Место действия 51
Полярные
клетки
Аксобласты
А
1 у
| Головной
I капюшон
Ядро
аксиальной
клетки
Dlcyema, представитель
типа Mesozoa
^Клетки,
(Язразую-'#
Клетки, способствующие
затвердеванию спикул
Пинакоцит
Б
Спермой
Стрекательная
клетка
Пора для всасывания
жидкости
Железистая
клетка
I оскулум
^-(устьв)
Спикула.
Лил (игла)
У\ Хоаноцит
Полость гудки
Пороцит
Железистая
плетка
Мышечная
клетка
наружного
слоя
Интерстициальная
клетка
РИС. 1-10. Некоторые низшие формы многоклеточных животных. А. Тип Mesozoa
(25 клеток). (Hickman С. Р., Biology of Invertebrates, Mosby, St. Louis, Missouri,
1573.) Б. Мелкая мешковидная губка. (Villee C. A., Walker W. E., Barnes R. D„
General Zoology, Saunders, Philadelphia, Pennsylvania, 1973.) В. Амебоидные клетки
губки, образующей спикулы. (Hickman, 1967.) Г. Гидра. (Loomis М. F., Sci. Am., 200,
150. Apr. 1959.)
Мышечная клетка
наружного слоя
Мышечная
клетка
внутреннего
слоя
Мышечная
клетка
внутреннего <=.-
слоя
Мезенхима ишперстициальныГ-
, клетка
Амебоцит
Книдарии устроены исключительно просто и обладают поразительной
способностью к регенерации. Одним из важных объектов биологических
исследований стала пресноводная гидра — организм длиной около сан-
тиметра (рис. 1-10). Целая гидра, состоящая примерно из 105 клеток,
может регенерировать из маленького кусочка ткани, если только в нем
сохранились клетки как наружного, так и внутреннего слоев [42].
Тело плоских червей (тип Platyhelminthes) состоит из двух наруж-
ных слоев (эндодермы и эктодермы) и расположенного между ними
третьего слоя. У плоских червей есть обособленная выделительная си-
стема. В дополнение к нервной сети, напоминающей нервную сеть у
книдарий,'имеются головной ганглий и органы зрения. Большая группа
плоских червей — планарии (обычно около 15 мм в длину) —обитает в
Ручьях. По-видимому, это наиболее просто устроенные существа, на
которых можно изучать поведенческие реакции.
52 Глава 1
Манубриум (рукоятка)
Гонада
Радиальный
^канал
Медуза
РИС 1-10, Д. Стадия медузы у гидроидного кишечнополостного Obelia. Е. Планария
длиной 15 мм. (Hickman, 1973.) а — схема пищеварительной и нервной систем; часть
правой стороны тела удалена так, что виден рот, расположенный на брюшной сторо-
не (вентрально); б — глотка, высовывающаяся изо рта. Ж- Коловратка Philodina
( ~ 103 клеток). (Villee С. A. et al., General Zoology, 1973.) 3. Круглый червь Rhabdl-
tis. Сходный внешний вид имеет аскарида Ascaris (Hickman, 1973).
Среди плоских червей имеется много паразитических форм (тремато-
ды и ленточные черви), поражающих высшие организмы. Так, крошеч-
ные черви рода Schistosoma передаются человеку через улиток и по-
вреждают кровеносные сосуды. Возникающий при этом шистосомоз в
настоящее время представляет собой одно из наиболее распространен-
ных заболеваний, которым страдают более 200 млн. человек.
Круглых червей (Nematoda) и коловраток (Rotifera) выделяют иног-
да в отдельные типы, а иногда объединяют в один тип Aschelminthes.
Эти организмы отличаются тем, что в дополнение к кишечной трубке у
них есть еще полость тела. Среди круглых червей встречаются как сво-
бодно живущие в воде и почве виды, так и паразиты. Последние наносят
огромный вред растениям, а некоторые виды, например трихины, цепни
и ришта, поражают человека.
Коловратки с их подвижным ореолом ресничек на головном конце и
прозрачным телом доставляют истинное удовольствие микроскопистам.
Для специалистов по биологии клетки коловратки особенно интересны
с точки зрения их клеточного постоянства: показано, что у этих орга-
низмов как суммарное число клеток, так и число клеток в каждой части
тела строго постоянно.
Аннелиды (Annelida, кольчатые черви) считаются эволюционными
предками членистоногих. Существующие в настоящее время виды этого
типа включают дождевых червей, пиявок и около 106 видов морских
полихет (многощетинковых червей). У кольчатых червей имеется по-
лость тела, отделенная от пищеварительного тракта и выстланная спе-
циальным слоем эпителиальных клеток. Они обладают также хорошо
развитой кровеносной системой, причем в их крови обычно содержится
гемоглобин или родственное соединение — эритрокруорин.
Членистоногие (Arthropoda) насчитывают ~106 видов, т. е. состав-
ляют около 80% всех известных ныне животных. К этим существам,
имеющим членистый наружный скелет из хитина или других веществ,
относятся мечехвосты, паукообразные (скорпионы, пауки, клещи), рако-
образные, многоножки (губоногие и двупарноногие) и насекомые. Ряд
важных биохимических проблем в этой области возник с изобретением и
использованием инсектицидов. Большой интерес представляет изучение
процесса метаморфоза при развитии многих членистоногих [43].
Среди моллюсков (тип Mollusca) наибольший интерес для биохими-
ков представляют головоногие—кальмары и осьминоги. У кальмара
имеются нервные клетки (нейроны) с гигантским аксоном, изучение ко-
торого внесло большой вклад в развитие наших представлений о меха-
низме проведения нервных импульсов. У осьминогов есть зачатки ра-
зумного -поведения, не свойственные другим беспозвоночным, нервные
реакции которых полностью «запрограммированы». Мозг некоторых
брюхоногих моллюсков состоит всего из 104 нейронов; отдельные из них
необычайно велики. Мозг моллюсков является объектом интенсивного
исследования, направленного на изучение его организации и механизма
функционирования.
Иглокожие (Echinodermata), к которым относятся морские звезды,
морские ежи и голотурии, рассматриваются как тип животных, достиг-
ших высокой ступени эволюционного развития1. Особенно тщательно
исследован процесс их эмбриогенеза.
Тип хордовых (Chordata), к которому относимся и мы с вами, вклю-
чает не только позвоночных, но и более примитивных морских живот-
ных. к этим примитивным формам, которые, по-видимому, родственны
вымершему общему предку хордовых, принадлежат оболочники (Tuni-
cata), в частности асцидии. Данные организмы примечательны тем, что
в крови у них содержится много ванадия.
2. Типы клеток и тканей животных
Клетки тканей, даже высокодифференцированные, при выращивании
в культуре имеют тенденцию быстро утрачивать дифференциацию и
превращаться в клетки одного из трех основных типов — эпителиоциты,
механоциты или амебоциты. Эпителиоциты представляют собой тесно
прилегающие друг к другу клетки, происходящие из эпителиальных
тканей; полагают, что они являются производными двух поверхностных
слоев эмбриональной бластулы. Механоциты, часто называемые также
' Взрослые иглокожие характеризуются пятилучевой радиальной симметрией, и
может показаться, что оии родственны примитивным книдариям. Однако личинки иг-
локожих обладают двусторонней симметрией, и, таким образом, не следует придавать
принципиального значения радиальной организации тела взрослых форм.
фибробластами или фиброцитами, — это клетки, растущие при культи-
вировании мышечной или соединительной тканей. Подобно амебоци-
там, они происходят из клеток эмбриональной мезенхимы, мигрировав-
ших внутрь из нижнего слоя бластулы (гл. 16, разд. В.2). Как отдель-
ные типы клеток рассматривают также нейроны, нейроглию и лимфо-
циты.
а. Ткани
Объединяясь, клетки образуют ткани четырех основных типов. Эпи-
телий выстилает поверхности тела и внутренних органов: кожу, пище-
варительный тракт, мочеполовой тракт и железы. Существуют два ос-
новных типа эпителия: плоский и цилиндрический. Эпителиальные клет-
ки входят в состав желез (потовые, жировые, молочные и железы внут-
ренней секреции), а также некоторых органов чувств. Эти клетки по-
лярны: одна сторона их обращена наружу, в воздушную или водную
среду, другая, как правило, прилегает непосредственно к базальной
мембране.
К соединительной (опорной) ткани относятся жировая, хрящевая
и костная. Последние два вида тканей содержат большое количе-
ство межклеточного вещества, называемого основным и состоящего по
преимуществу из сложных полисахаридов. Эмбриональные фибробла-
сты дифференцируются в два типа клеток: белые продуцируют белок
коллаген, а желтые образуют эластин. Оба эти белка накапливаются
во внеклеточном пространстве и включаются в состав основного веще-
ства. Остеобласты образуют кости путем отложения (слоя-ми в 3—
7 мкм толщиной) фосфорнокислых и углекислых солей кальция, а так-
же органических «цементирующих» веществ.
Третий тип — это мышечная ткань. Различают поперечнополосатые
(произвольные скелетные мышцы) и гладкие (непроизвольные) мыш-
цы; особняком стоит сердечная (непроизвольная поперечнополосатая)
мышца.
Четвертый тип тканей — нервная ткань — состоит по преимуществу
из клеток двух основных видов. Нейроны — главные элементы нервной
системы, с которыми связаны возникновение и проведение импульса, и
глиальные клетки, которые лежат между нейронами и создают для
них опору.
б. Клетки крови
Кровь и клетки, выстилающие кровеносные сосуды, иногда рассмат-
риваются как ткань пятого типа. У человека в 1 мл крови содержится
5-109 эритроцитов (красных кровяных клеток), что в пересчете на об-
щее количество крови в организме (5 л) составляет 2,5-1013 клеток.
Эритроциты быстро синтезируются в костном мозге. Зрелые эритроци-
ты человека и других млекопитающих лишены ядра и почти целиком
заполнены гемоглобином. Средняя продолжительность жизни этих кле-
ток составляет 125 дней; они разрушаются лейкоцитами в селезенке и
печени.
Лейкоцитов (белых кровяных клеток) в 1 мл около 7 • 106, т. е. почти
в тысячу раз меньше, чем эритроцитов. Лейкоциты представлены клет-
ками трех типов: лимфоциты (~26% от общего числа лейкоцитов),
моноциты (~7%) и полиморфноядерные лейкоциты, или гранулоциты
(~70—75%). Лимфоциты имеют примерно такие же размеры, как
эритроциты, но образуются в лимфатической ткани. Продолжительность
жизни отдельных лимфоцитов достигает 10 лет. Их функция состоит в
образовании антител, и именно благодаря этим клеткам поддерживает-
ся длительный иммунитет. Моноциты вдвое крупнее лимфоцитов; они
способны переваривать клетки бактерий. Гранулоциты, имеющие ди-
аметр 9—12 мкм, образуются в красном костном мозге и выполняют
различные функции. При окрашивании разными красителями выявля-
ются три типа гранулоцитов: нейтрофилы, эозинофилы и базофилы.
Нейтрофилы, подобно моноцитам, заглатывают бактериальные клетки;
функция двух других типов гранулоцитов не столь ясна. Известно, что
число эозинофилов возрастает при сенной лихорадке, астме и в при-
сутствии некоторых паразитирующих организмов, а число базофилов
резко повышается при лейкемии, а также при воспалительных процес-
сах. Кровяные пластинки (тромбоциты) представляют собой крошечные
(2—3 мкм в диаметре), напоминающие клетки тельца, которые обра-
зуются из цитоплазмы мегакариоцитов костного мозга; из одного зре-
лого мегакариоцита образуется до 3000 тромбоцитов, а общее содержа-
ние кровяных пластинок составляет 1—3-108 в 1 мл цельной крови.
Тромбоциты играют важную роль в процессе свертывания крови.
б. Культура клеток
Все большее значение в биохимических исследованиях приобретает
выращивание в лабораторных условиях изолированных клеток живот-
ных. В некоторых случаях это необходимо для получения достаточного
количества клеток, обладающих максимально близкой генетической ин-
формацией. В случае бактерий такие клетки получают путем высева-
ния бактерий и отбора небольшой колонии, выросшей из одной клетки
и представляющей собой «чистый штамм». Подобным же образом из
одной клетки эукариот можно вырастить тканевую культуру, получив
клон генетически идентичных клеток, которые будут оставаться таковы-
ми до тех пор, пока не произойдет их изменения под влиянием мута-
ций.
Важным достижением в этой области оказалась разработка метода
культивирования фибробластов эмбриона с целью проведения внутри-
утробной (пренатальной) диагностики наследственных нарушений мета-
болизма (дополнение 1-Г). Легче всего удается культивировать эмбрио-
нальные или раковые клетки, но в определенных условиях можно полу-
чить культуры многих других тканей. Следует иметь в виду, что клетки,
которые лучше всего растут, не вполне нормальны; например, широко-
известная линия клеток HeLa (клеток рака человека, которых выра-
щивают уже много лет в лабораториях всего мира) содержит 70—80
хромосом вместо обычных 46.
3. Межклеточные контакты и взаимодействия
Изучая многоклеточные организмы, мы сталкиваемся с двумя прин-
ципиальными вопросами: во-первых, как клетки соединяются друг с
другом и, во-вторых, как они специфически взаимодействуют?
Чтобы ответить на первый вопрос, обратим внимание, что клетки
растений окружены толстой клеточной стенкой, которая скрепляет их
между собой и удерживает на месте. У животных жестких клеточных
стенок нет, но клетки все же соединены, причем сугубо специфическими
способами. В противном случае все мы просто развалились бы.
РИС. 1-11. Электронные
микрофотографии трех
типов межклеточных со-
единений. А. «Зона сли-
пания» (zona occludens)
между эпителиальными
клетками тонкого кишеч-
ника крысы; препарат
получен методом замора-
живания—скола Плот-
ные соединения выгля-
дят как сеть валиков и
желобков. Она представ-
ляет собой участки слия-
ния мембран В нижней
части рисунка видны
микроворсиики. (Friend
D. S, Gilula N В., J.
Cell Biology, 53, 771,
1972.)
РИС. 1-11. Б. Ультратонкий срез
через плотное соединение между
гепатоцитами мыши. Стрелками
указаны участки слияния мембран
(Gilula N. В., in Cellular Memb-
ranes and Tumor Cells, p. 221.
Copyright 1975 by the Williams
and Wilkins Co., Baltimore.)
РИС. 1-11. В. Перегород-
чатое соединение в реснич-
ном эпителии моллюсков;
препарат получен методом
замораживания—скола. Со-
единения этого типа полно-
стью опоясывают клетки.
«Обнаженная» поверхность
покрыта параллельными ря-
дами мембранных частиц,
соответствующими распре-
делению межклеточных пе-
регородок, видимых на уль-
тратонких срезах. В участ-
ках мембраны, находящих-
ся вне области контакта,
частицы расположены нере-
гулярным образом [44].
РИС. 1-11. Г. Ультратонкий срез перегородчатого контакта того же типа, что и на
рис. В. Плазматические мембраны двух клеток соединяются с помощью электроно-
плотных пластин, или перегородок, регулярно расположенных в межклеточном прост-
ранстве. Обратите внимание на аппарат Гольджи в нижней части снимка [44].
58 Глава 1
РИС. 1-11. Д Десмосомы (macula adhe-
rens) в эпителии кишечника крысы.
Видны широкое межклеточное простран-
ство (25—35 нм), содержащее плотный
материал, две параллельные клеточные
мембраны, плотная пластинка с конвер-
гирующими на ней тонофиламентами,
пронизывающими цитоплазму [44].
а. Контакты и соединения между клетками
Многие эпителиальные клетки, например клетки почечных канальцев
или желез, образуют между собой плотный контакт. В таких контактах
наружные участки мембран местами сливаются (рис. 1-3) [44, 45].
Электронно-микроскопические исследования поверхности сколов замо-
роженных тканей (дополнение 1-В) показывают, что есть области, где
клетки опоясаны лентой плотного контакта, иногда называемого «зоной
слипания» (zonula occludens) или терминальными замыкающими пла-
стинками (рис. 1-11). Плотные контакты между эндотелиальными клет-
ками капилляров головного мозга препятствуют свободной диффузии
веществ из крови в клетки мозга, создавая таким образом гемато-эн-
цефалический барьер [46].
Клетки эпителия беспозвоночных опоясывают контакты другого ти-
па. Это так называемые перегородчатые десмосомы, или диски адгезии.
В этом случае пространство между мембранами соседних клеток, со-
ставляющее ~ 18 нм, перегорожено во многих местах тонкими перемыч-
ками. В области десмосом к мембранам контактирующих клеток приле-
гают скопления электроноплотного материала, к которым прикрепляет-
ся множество тонких нитей (микрофиламентов) диаметром ~6—10 нм
[47]. 1
Помимо плотных контактов часто встречаются обширные межкле-
точные зоны со щелью между соседними клетками шириной 10—20 нм.
В этой области к мембране со стороны цитоплазмы прилегают микро-
филаменты диаметром 6,0 нм.
На препаратах, полученных методом замораживания — скола, в об-
ласти таких щелевых контактов выявляются правильные полигональные
Место действия 59
РИС. 1-11. Е. Поверхность скола, проходящего через области щелевых контактов меж-
ду клетками, находящимися в культуре. Видны как обширные, так и небольшие (по-
казано стрелкой) области [44].
структуры, образующие решетку с периодом 10 нм. Щелевые контакты
представляют, по-видимому, области прочного соединения клеток, и
именно через них осуществляются межклеточные коммуникации.
б. Коммуникативные связи между клетками
Кроме непосредственных контактов, клетки должны обладать и дру-
гими средствами для обмена информацией, в противном случае были бы
невозможны их согласованный рост и дифференцировка. Один из спосо-
60
Глава J
бов коммуникации со-
стоит в обмене химиче-
скими веществами че-
рез специальные участ-
ки, где клетки контак-
тируют друг с другом
[48]. Среди многочис-
ленных примеров, ука-
зывающих на значение
коммуникативных свя-
зей, можно привести
явление «электрическо-
го сопряжения» кле-
ток. Обычно мембраны
клеток обладают очень
высоким электриче-
ским сопротивлением,
однако в мембранах
соприкасающихся кле-
ток имеются участки с
низким сопротивлени-
ем — по-видимому, об-
ласти щелевых контак-
тов [49]. Одна из наи-
более совершенных
форм коммуникативной
связи—это синапс, спе-
циализированный кон-
такт между нейронами.
Нервный импульс, про-
ходящий по мембране
одного нейрона, стиму-
лирует выделение кван-
та химического веще-
ства (медиатора), ко-
торый проходит через
щель синапса и иници-
ирует возникновение
нервного импульса во
втором нейроне.
Высказывалось
предположение, что ра-
ковые клетки образуют
РИС. 1-11. Ж- Щелевые контакты; ультратонкий срез меньше коммуникатив-
ных соединении, чем
здоровые [501, но опы-
ты с культурами тканей не подтверждают эту точку зрения [51].
в Узнавание клеток
Для клеток высших организмов совершенно необходимо уметь «уз-
навать» другие клетки, чтобы выяснить, являются ли они идентичными,
принадлежат ли другим тканям или же «чужеродны».
Рассмотрим один исключительно интересный опыт с губками, клетки
которых разъединяли путем обработки ферментом трипсином (перева-
Место действия 61
ривающим белковый межклеточный «цемент»). При смешивании разъ-
единенных клеток оранжевых и желтых губок происходит их воссоеди-
нение с постепенным формированием новых маленьких губок, причем
оранжевые клетки соединяются с оранжевыми, а желтые — с желтыми
[52, 53]. Аналогичные результаты были получены с культивируемыми
клетками печени, почек и мозга эмбриона. При смешивании указанных
культур клетки печени слипались только с клетками печени, а клетки
почек — с клетками почек. Как же клетки «узнают» друг друга? Ответ
на этот вопрос должны дать биохимические исследования, проводящие-
ся в настоящее время.
При заживлении ран клетки эпителия растут и продвигаются по ра-
невой поверхности до тех пор, пока не соприкоснутся друг с другом.
Подобное так называемое контактное торможение испытывают клетки и
тканевые культуры, растущие на поверхности стекла, в силу чего обра-
зуется слой толщиной только в одну клетку (монослой). Культивируе-
мые опухолевые клетки, напротив, не прекращают роста при соприкос-
новении и громоздятся друг на друга, видимо, из-за отсутствия механиз-
ма узнавания и связи между клетками. Выяснение биохимического ме-
ханизма этого явления имело бы колоссальное значение для медицины.
4. Высшие растения и растительные ткани
Ботаники делят высшие растения на две основные группы. Briop-
hyta, или мохообразные, состоят из мхов (Musci) и печеночников
(Hepaticae). Эти растения, преимущественно наземные, характеризуют-
ся наличием плавающих сперматозоидных клеток и доминированием
гаметофитной (гаплоидной) фазы. Вторая группа — это Tracheophyta,
или сосудистые растения, имеющие проводящие ткани. К ним
относится около 2-105 видов. Папоротники (класс Filicinea, ранее назы-
вавшийся Pteridophyta) характеризуются доминированием диплоидной
фазы, сменяемой в ходе жизненного цикла гаплоидной (разд. В.5).
Семенные растения представлены двумя классами: Gytnnospertnae
(голосеменные, к которым относятся деревья, образующие шишки) и
Angiospermae (покрытосеменные, истинные цветковые растения).
Различают несколько видов растительных тканей. Недифференци-
рованные эмбриональные клетки, расположенные в быстрорастущих
частях стебля и корня, составляют ткань меристемы. В результате диф-
ференцировки клеток из меристемы формируются простые ткани: па-
ренхима, колленхима и склеренхима. Паренхима представляет собой
наиболее распространенный и наименее специализированный вид рас-
тительной ткани. В ходе дальнейшей дифференцировки из нее получает-
ся камбий — растущий слой корней и стеблей. Из паренхимы образу-
ются также клетки, в которых растение запасает питательные вещества
и которые составляют сердцевину, или мякоть стебля и корня.
Колленхима, имеющаяся в травянистых растениях, состоит из удли-
ненных опорных клеток; склеренхима, свойственная деревьям, образо-
вана опорными клетками с прочными лигнифицированными стенками и
низким содержанием воды. К склеренхиме относятся также волокни-
стые клетки, имеющие иногда очень большую длину: например, в стволе
сосны есть волокнистые клетки диаметром 40 мкм и длиной 4 мм.
Два вида сложных тканей — ксилема и флоэма — составляют про-
водящую сеть, или «циркуляторную систему» растения. Клетки, обра-
зующие ксилему, или деревянистую ткань, в основном мертвы, а тол-
стостенные сосуды (трахеиды) служат для переноса воды и растворен-
ных в ней минеральных веществ от корней к стеблю и листьям. Клетки
62 Глава 1
РИС. 1-12. Стебель покрытосеменного растения в разрезе. Внизу в увеличенном мас-
штабе показаны в разрезе сосуды флоэмы (слева) и ксилемы (справа) (Biddulph S.,
Biddulph О., Sci. Am. 200, 44—49, Feb. 1959.)
флоэмы обеспечивают отток питательных веществ от листьев вниз по
стеблю. Они соединены торцами посредством ситовидных пластинок,
пронизанных множеством мельчайших пор, через которые, по-видимому,
сообщается цитоплазма соприкасающихся клеток, образуя здесь нити
диаметром 5—9 мкм [54]. В зрелых ситовидных клетках ядро отсутст-
вует, однако у каждой из них есть «пара» — сопутствующая клетка, со-
держащая ядро.
Эпидермис растений состоит из плоских клеток с толстой наружной
стенкой, как правило, покрытой плотной восковидной кутикулой тол-
щиной около 2 мкм. Хлоропласты в этих клетках обычно отсутствуют.
В эпидермальной ткани встречается только несколько видов специали-
Место действия 63-
зированных клеток. К их числу относятся парные замыкающие клетки,,
которые окружают маленькие отверстия, называемые устьицами, на
нижней поверхности листа; замыкающие клетки регулируют интенсив-
ность испарения воды растением. Специализированные клетки эпидер-
миса корня образуют корневые волоски—-длинные (~1 мм) образо-
вания диаметром 5—17 мкм. Каждый корневой волосок — это одна клет-
ка с ядром, расположенным у кончика волоска.
На рис. 1-12 показан участок стебля цветкового растения. Обратите
внимание на тонкий слой камбия между флоэмой и ксилемой. Клетки
камбия по мере роста дифференцируются и образуют новые слои кси-
лемы, увеличивая таким образом деревянистую часть стебля. Одновре-
менно образуются также клетки флоэмы. По мере утолщения стебля
все ткани, расположенные кнаружи от камбия, обновляются, а старые
клетки превращаются в кору.
Семена растений состоят из трех четко различающихся частей. За-
родыш развивается из зиготы, образованной в результате слияния ядра
спермия, происходящего из пыльцевой клетки, с ядром яйцеклетки.
Оплодотворенная яйцеклетка у голосеменных окружена питательным
слоем, или эндоспермом, происходящим из той же гаметофитной ткани,
что и яйцеклетка, и потому гаплоидным. У покрытосеменных в спермин
формируются два ядра; одно из них оплодотворяет яйцеклетку, тогда
как другое сливается с двумя гаплоидными полярными ядрами, обра-
зующимися в женском гаметофите. (Эти полярные ядра формируются
в ходе того же митотического деления, при котором образуется яйце-
клетка.) В результате развивается триплоидный (Зп) эндосперм.
Е. Регуляция химических процессов в клетке
Биологов уже с давних пор изумляла способность живых организмов
поддерживать постоянным состав внутренней среды вопреки резким
изменениям внешних условий. Например, pH нашей крови всегда равен
7,40±0,05. Концентрация глюкозы в крови может кратковременно воз-
расти после еды, но в целом это строго постоянная величина (5 мМ).
То же можно сказать о содержании большинства других компонентов
жидкостей тела и внутриклеточной среды. Этот феномен, называемый
гомеостазом, обусловлен деятельностью сложной системы регулятор-
ных механизмов.
Представим себе, что в клетку попадает питательное вещество А.
Если это вещество просто поступает в клетку и участвует в ряде реак-
ций, но ни один продукт реакций не выходит из клетки, то вскоре будет
достигнуто состояние равновесия. Такая система не имеет ничего об-
щего с живой клеткой. Живая клетка потребляет питательные вещест-
ва и выбрасывает (экскретирует) продукты распада. Превращения ве-
ществ внутри клетки протекают в ходе сложных, нередко разветвлен-
ных и пересекающихся последовательностей реакций. Ниже изображе-
на простая гипотетическая последовательность реакций с одним раз-
ветвлением.
Уже в такой простой открытой системе видны некоторые особенно-
сти гомеостаза [55]. Если скорости образования и распада промежу-
С ?=^D\
д д .-----» Е -JL Выделение (1-3)
Клеточная ___» D' —^4 иммобилизация
мембрана
64
Глава 1
точных продуктов равны, устанавливается стационарное состояние (не
являющееся, однако, равновесным). Изменение скорости поступления
вещества А в клетку или скорости выведения продукта реакции, изме-
нение активности одного из ферментов, катализирующего необратимый
этап в цепи реакций, — любой из этих факторов может значительно из-
менить стационарные концентрации компонентов системы.
Живые клетки значительно сложнее изображенной выше схемы по
крайней мере в том отношении, что у них есть чувствительные механиз-
мы, которые выявляют и компенсируют сдвиги концентраций, нарушаю-
щие стационарное состояние. В большинстве случаев эти механизмы
действуют по принципу обратной связи, совершенно аналогично тому,
как работает терморегулятор в нагревательной системе.
Активный, или каталитический, центр фермента — это сравнительно
небольшой участок молекулы белка. Аминокислотный состав остальной
части молекулы, особенно тех ее участков, которые находятся на по-
верхности структуры, может довольно сильно меняться в результате
мутаций без изменения каталитической активности фермента. Тем не
менее присоединение к различным участкам поверхности фермента
других молекул может косвенно повлиять на катализ. В концентриро-
ванных растворах, каким является цитоплазма, молекулы могут агреги-
ровать. Присоединение какой-либо молекулы к определенному участку
на поверхности фермента способно изменить его структуру и в свою
очередь вызвать увеличение или уменьшение каталитической активно-
сти. Так, при избыточном накоплении продукта какого-либо метаболи-
ческого пути ингибитор, действующий по принципу обратной связи,
взаимодействует указанным образом с ферментами и «выключает» их.
Взаимодействия такого рода составляют один из распространенных
способов регуляции.
Подобный же механизм лежит в основе связывания гормонов со спе-
цифическими рецепторами, расположенными на мембранах клетки или
в цитоплазме. Гормоны — это соединения с регуляторной функцией,
которые выделяются клетками определенной ткани и регулируют обмен
веществ в клетках-мишенях, принадлежащих другой ткани. Предпола-
гают, что связывание гормонов с рецепторами изменяет структуру (кон-
формацию) последних, и это событие инициирует цепь реакций, приво-
дящих к биологическому ответу на действие гормона.
Вопросы и задачи
1. Опишите принципиальные различия в структуре и организации кле-
ток прокариот и эукариот.
2. Каковы две основные функции белков в клетке, одна функция ДНК,
две функции РНК, одна функция липидов?
3 . Сравните химический состав рибосом, клеточных мембран и жгути-
ков бактерий.
4. Предположим, что мы имеем несколько микроорганизмов и клеток,
характеризующихся следующими размерами: микоплазма — сфера
диаметром 0,33 мкм; Е. coli — цилиндр диаметром 0,8 мкм и длиной
2 мкм; клетка печени — сфера диаметром 20 мкм; корневой воло-
сок— цилиндр диаметром 10 мкм и длиной 1 мм.
а. Рассчитайте для каждой из указанных клеток объем, массу в
граммах и в дальтонах (приняв удельный вес равным 1,0).
б. Приняв, что бактериальные рибосомы имеют форму сферы ди-
аметром 23 нм, рассчитайте их объем. Если масса бактериальных
рибосом 2,7-10е дальтон (гл. 15, разд. В.1), то какова их кажу-
щаяся плотность (разделите массу на объем)? Экспериментально
определяемая в градиенте концентрации хлористого цезия плот-
ность бактериальных рибосом (гл. 2) равна примерно 1,6 г-см-3.
Как объяснить получаемую разницу? Если линейные размеры
рибосом эукариот в 1,17 раза больше, чем у бактериальных рибо-
сом, то каков объем рибосом эукариот?
в. Какую часть объема клетки Е. coli составляют клеточная стенка,
' плазматическая мембрана, рибосомы (примем их число равным
15 000)? Исходя из того, что клетка Е. coli на 80% состоит из
воды, определите, какая часть веса сухой клетки приходится на
долю рибосом? ДНК (в одной клетке имеется 2 хромосомы)?
г. Какую часть объема клетки печени составляют рибосомы, ядро,
плазматическая мембрана, митохондрии (примем, что в клетке
1000 митохондрий)?
5. а. Какова молярная концентрация фермента, имеющегося у Е. coli
в количестве только одной молекулы на клетку?
б. Концентрация К+ в клетке Е. coli составляет 150 мМ. Рассчитай-
те число ионов калия в одной клетке.
в. Если pH внутри клетки равен 7,0, то сколько в ней ионов Н+?
6. Если хромосомы (и хроматин) состоят на 15% из ДНК, то чему
равна масса 23 пар хромосом в диплоидной клетке человека? Если
диаметр ядра равен 5 мкм и плотность 1,1 г-см-3, то какая часть
ядра по весу приходится на долю хроматина?
7. Сравните соотношения поверхности и объема для клеток Е. coli и
печени, для ядра клеток эукариот, для корневого волоска. Если по-
верхность клетки диаметром 20 мкм на 20% покрыта ворсинками
диаметром 0,1 мкм и длиной 1 м.км и при этом каждая ворсинка
расположена в центре квадрата 0,2X0,2 мкм, то насколько это уве-
личит отношение поверхности к объему?
8. Установлено, что каждая аминокислота кодируется последователь-
ностью из трех нуклеотидов в цепочке ДНК (кодон). В ДНК имеет-
ся четыре вида нуклеотидов. Сколько кодонов может быть из них
составлено? Заметим, что рассчитанное число кодонов больше, чем
число аминокислот (20), включающихся в белки, плюс три терми-
нирующих кодона, прекращающих синтез полинептидной цепи.
(Список кодонов приведен в табл. 15-2 и 15-3.)
9. Отметьте по две черты сходства и различия между сине-зелеными и
зелеными водорослями.
10. Сравните размеры и строение жгутиков бактерий и эукариот.
11. Сравните химический состав внеклеточных образований — наружных
оболочек или внеклеточного основного вещества («матрикса»), сек-
ретируемых следующими клетками: бактериями, фибробластами,
остеобластами, растительными клетками, грибами.
12. Определите понятие «стационарное состояние» для живых клеток и
сравните его с понятием химического равновесия.
СПИСОК ЛИТЕРАТУРЫ
1. Stanier R. У., Doudoroff М., Adelberg Е. A., The Microbial World, 3rd ed., Prentice-
Hall, Englewood Cliffs, New Jersey, 1970.
2. Mandelstam J., McQuillen K-, Biochem. of Bacterial Growth, Wiley, New York, 1968.
3. Maniloff J., Morawitz H. J., Bacteriol. Rev., 36, 263—290 (1972).
4. 'Watson J. D., Molecular Biology of the Gene, 3rd ed., p. 61, Benjamin, Menlo Park,
California, 1976. [Имеется перевод: Уотсон Дж. Молекулярная биология гена. —
М.: Мир, 1978.]
5. Luria S. Е. In: The Bacteria (Gunsalus I. C., Stanier R. Y., eds.), Vol. 1, p. 1,
Academic Press, New York, 1960.
5 — 1821
66
Глава 1
6. Berg Н. С., Nature (London), 254, 389—392 (1975).
7. Thimann К- V., The Life of Bacteria, 2nd ed., Macmillan, New York, 1963.
8. Decker K-, Jungermann K-> Thauer R. R., Angew. Chem., Int. Ed. Engl., 9, 138—158
(1970).
9. Stonier R. Y., Kunisawa R., Mandel M., Cohen-Bazire G., Bacteriol. Rev., 35, 171 —
205 (1971).
9a. Wagner G., J., Siegelman H. W., Science, 190, 1298—1299 (1975).
10. Watson J. D., Molecular Biology of the Gene, 3rd ed., p. 499, Benjamin, Menlo Park,
California, 1976.
11. Paine P. L., Moore L. C., Horowitz S. B., Nature (London), 254, 109—114 (1975).
12. Carothers Z. B„ Science, 175, 652—654 (1972).
13. Northcote D. H., Endeavour, 30, 26—33 (1971).
13a. Golgi C„ Arch. Ital. Biol., 30, 60 and 278 (1898).
14. Palade G„ Science, 189, 347—358 (1975).
15. Satir B., Sci. Am., 233, 29—37 (Oct. 1975).
16. Neutra M., Leblond C. P., Sci. Am., 220, 100—107 (Feb. 1969).
17. Whaley W. G., Dauwalder M„ Kephart J. E., Science, 175, 596—599 (1972).
18. Nyquist S. E„ Crane F. L., Morre D. J., Science, 173, 939—941 (1971).
19. Reinert J., Ursprung H., eds., Origin and Continuity of Cell Organelles, Springer-
Verlag, Berlin and New York, 1971.
20. Orel L., Malaisse-Lagae F., Ravazzola M„ Amherdt M., Renold A. E., Science, 181,
561—562 (1973).
21. Loud A. V., J. Cell Biol., 37, 27—46 (1968).
22. Hoffmann H. P., Avers C. J., Science, 181, 749—751 (1973).
23. Dingle J. T., Lysosomes, A Laboratory Handbook, North-Holland Publ., Amsterdam,
1972.
24. de Duve C„ Science, 189, 186—194 (1975).
25. Tolbert N. E., Annu. Rev. Plant Physiol., 22, 45—74 (1971).
26. Sleigh M. A., Endeavour, 30, 11—17 (1971).
27. Olmsted J. B., Borisy G. G., Annu. Rev. Biochem., 42, 507—540 (1973).
28. Margulis L., Sci. Am., 225, 49—57 (Aug. 1971).
29. John P., Whatley F. R., Nature (London), 254, 495—498 (1975).
30. Raff R. A., Mahler H. R., Science, 177, 575—582 (1972).
30a. Cavalier-Smith T., Nature (London), 256, 463—468 (1975).
31. Uzzell T., Spolsky C„ Science, 180, 516—517 (1973).
32. Raff R. A., Mahler H. R„ Science, 180, 517 (1973).
32a. Markert C. L., Shaklee J. B„ Whitt G. S., Science, 189, 102—114 (1975).
33. McKanna J. A., Science, 179, 88—90 (1973).
34. Hill D. L., Biochemistry and Physiology of Tetrahymena, Academic Press, New
York, 1972.
35. Robertson A., Drage D. J., Cohen M. H., Science, 175, 333—335 (1972).
36. Davis R. H., deSerres F. J. In: Methods in Enzymology (Tabor H., Tabor C. W.,
eds.), Vol. 17A, p. 79, Academic Press, New York, 1970; a summary of techniques.
37. Fink G. R. In: Methods in Enzymology (Tabor H., Tabor C. W., eds.), Vol. 17A,
p. 59, Academic Press, New York, 1970.
38. Bracket J. L. A., Endeavour, 24, 155—161 (1965).
39. Rickter G. In: Physiology and Biochemistry of Algae (Lewin R. A., ed.), Vol. 2,
pp. 633—652, Academic Press, New York, 1962.
40. Ahmadjian V. In: Physiology and Biochemistry of Algae (Lewin R. A., ed.), Vol. 2,
p. 817, Academic Press, New York, 1962.
40a. Lapan E. A., Comp. Biochem. Physiol., 52A, 651—657 (1975).
41. Lapan E. A., Morawitz H., Sci. Am., 227, 94—101 (Dec. 1972).
42. Loomis W. F., Sci. Am., 200, 145—146 (Apr. 1959).
43. See Florkin M., Scheer В. T. eds., Chemical Zoology, Vols. 5 and 6, Academic
Press, New York, 1970, 1971.
44. Gilula N. B. In: Cell Communication (Cox R. P., ed.), Wiley, New York, 1974,
pp. 1—29.
45. McNutt N. S„ Weinstein R. S„ Prog. Biophys. Mol. Biol., 26, 47—101 (1973).
46. Reese T. S„ Karnovsky M. J., J. Cell Biol., 34, 207—217 (1970).
47. Hudspeth A. J., Revel J. P., J. Cell Biol., 50, 92—101 (1971).
48. Loewenstein W. R„ Sci. Am., 222, 79—86 (May 1970).
49. Payton B. W., Bennett M. V. L., Pappas G. D„ Science, 166, 1641—1643 (1969).
50. Loewenstein W. R., Kanno Y., J. Cell Biol., 33, 225—234 (1967).
51. Johnson R. G., Sheridan J. D„ Science, 174, 717—719 (1971).
52. Humphreys T„ Dev. Biol., 8, 27—47 (1963).
53. Moscona A. A., Sci. Am., 205, 143—162 (Sep. 1961).
54. Jarvis P., Thaine R., Nature (London), New Biol., 232, 236 (1971).
55. von Bertalanffy L„ Science, 113, 23—29 (1950).
Глава 2
Молекулы,
из которых МЫ СОСТОИМ
С биохимической точки зрения жизнь начинается с небольших хи-
мических «строительных блоков», которые клетки либо делают сами,
либо берут откуда-нибудь в готовом виде. В качестве сырья использу-
ются 20 с лишним аминокислот, несколько сахаров, уксусная кислота и
ряд жирных кислот с чуть более длинными цепочками, глицерин, 2 пу-
риновых и 3 пиримидиновых основания, а также фосфорная кислота:
из этих «блоков» строятся тысячи других, значительно более сложных
соединений. Кроме того, во всех организмах неизменно присутствует
еще около дюжины разнообразных веществ — витамины да плюс к тому
несколько сортов неорганических ионов.
Малые строительные блоки, мономеры, в клетке соединяются в ги-
гантские макромолекулы, или полимеры, в которых мономерные звенья
связаны прочными ковалентными связями. Одни полимеры состоят все-
го лишь из нескольких мономерных звеньев (олигомер), другие из со-
тен, тысяч и даже миллионов. Типичный белок содержит от 100 до не-
скольких сотен аминокислот, молекула ДНК Д. coli состоит из.
~4-10б пар нуклеотидов, а сильно разветвленная молекула крахмала
содержит свыше миллиона сахарных звеньев. Одни молекулы биополи-
меров представляют собой линейные цепочки, другие — разветвленные..
Иногда цепи полимера скручиваются с образованием жесткой цилинд-
рической спирали, стабилизированной большим числом слабых вторич-
ных связей. Но, как правило, такие структуры имеют значительно бо-
лее сложную и нерегулярную конформацию. Довольно часто цепи поли-
мера прилегают одна к другой, образуя сетчатые структуры, волокна,,
мембраны. В отдельных случаях (например, в коллагене соединитель-
ной ткани) молекулы белка «прошиты» в поперечном направлении
сильными ковалентными связями. Однако обычно макромолекулы в
клетках связаны друг с другом более слабыми электростатическими и
вандерваальсовыми силами.
Особую роль в биохимии приобретают форма и размеры молекул.
В следующем разделе мы рассмотрим основные принципы, которыми
здесь следует руководствоваться.
А. Принципы построения малых молекул
Целостность устойчивых органических молекул обусловлена обра-
зованием ковалентных связей. Как правило, это очень сильные связи:
стандартная свободная энергия их образования (AGf)—около
—400 кДж •моль"1. Они имеют определенное направление (задаваемое
значениями валентных углов) и определенную длину.
t>s 1 лава 2
1. Валентные углы
Одинарные связи, образуемые углеродными атомами, а также боль-
шей частью атомов фосфора, обычно характеризуются тетраэдрической
конфигурацией. У таких атомов углерода все 6 валентных углов при-
мерно одинаковы и равны углу тетраэдра, 109,5°. Этот угол полезно за-
помнить. В органических соединениях вдоль цепи атомов углерода ва-
лентные углы очень мало отличаются от этого значения. Близкие зна-
чения обычно характерны даже для атомов, соединенных меньше чем
с четырьмя другими атомами; например, угол Н—О—Н в молекуле
воды равен 105°, в молекуле аммиака углы Н—N—Н равны 107°. Эфи-
ры характеризуются углом С—О—С, равным 111°. Вместе с тем в не-
которых простых соединениях есть валентные углы, близкие к 90°
(например, 92° в молекулах H2S и РН3 и ЮГ в молекуле Н2О2).
Присутствие двойных связей делает конфигурацию плоской, а ва-
лентные углы принимают значения ~ 120° (угол при вершине правиль-
ного шестиугольника). Во многих случаях группы, которые на первый
взгляд не должны быть плоскими, являются таковыми вследствие ре-
Размеры некоторых атомов3 •6
Таблица 2-1
Элемент Ковалентный радиус, нм Вандерваальсов радиус, нм
H 0,030 0,12
F 0,064 0,135
C 0,077 0,16
N 0,070 0,15
О 0,066 0,145
Cl 0,099 0,180
Si 0,117 —.
p 0,110 0,19
s 0,104 0,185
Br 0,114 0,195
I 0,133 0,215
«Радиус» метильной группы 0,20
Полутолщина ароматических молекул 0,170
а Pauling L., The Nature of the Chemical Bond, 3rd ed., pp. 224—227 and 260.
Cornell Univ. Press, Ithaca, New York, 1960.
6 Межатомное расстояние определяется путем сложения двух ковалентных радиу-
сов. Вандерваальсовы радиусы показывают, как плотно могут быть упакованы моле-
кулы. Так, наименьшее расстояние между атомами в макромолекулах примерно на
0,02 нм меньше суммы вандерваальсовых радиусов. [Sasisekharian V., Lakshmina-
rayanan А. V., Ramachandran G. N., in: Conformation of Biopolymers (G. N. Rama-
chandran, ed.), Vol. 2, p. 641, Academic Press, New York, 1967.]
зонанса: например, все атомы, участвующие в образовании пептидной
группы (рис. 2-4), лежат практически в одной плоскости, валентные
углы отличаются от 120° не более чем на 4°.
2.. Длины связей
В химии под длиной связи понимают расстояние между ядрами свя-
занных атомов. Напомним, что одинарная С—С-связь имеет длину
0,154 нм (1,54 А). Связь С—О на ~0,01 нм короче (0,143 нм), а длина
типичной С—Н-связи равна ~0,109 нм. Связь С—N имеет длину, про-
межуточную между длинами С—С и С—О-связей (0,149 нм). Длины
других связей, таких, как О—Н, можно оценить, исходя из значений
ковалентных радиусов, приведенных в табл. 2-1.
Длина двойной связи между двумя данными атомами (например,
С = С) почти на 0,020 нм короче одинарной связи между теми же ато-
мами. При наличии резонанса, вследствие которого связь становится
двойной лишь частично, ее длина также становится промежуточной. На-
пример, длина С—С-связи в бензоле равна 0,140 нм; длины связей
С—О в карбоксилат-анионе равны 0,126 нм.
Карбоксилат-ион
Полный размер молекулы легко рассчитать, исходя из элементар-
ней геометрии. Полезно запомнить два расстояния:
1^0,254-^
I им I
Расстояние между атомами
углерода, стоящими через один
в вытянутой углеводородной цепи
Поперечный размер
молекулы бензола1
1 Химики часто пользуются упрощенными формулами, подобными приведенной
выше формуле бензола, где шесть водородных атомов не указываются. Резонанс меж-
ду двумя возможными вариантами расположения трех двойных связей обозначается
кружком. Далее на протяжении всей книги используются также следующие приемы
сокращенной записи (атомы кислорода и азота указываются всегда):
— СООН —С — CONHR == —С
ОН R
(р) ~ —Р—ОН = Фосфорильная группа
Н
I
,снг
хси3
н
о*
3. Контактные расстояния
Длины ковалентных связей и валентные углы говорят нам о взаим-
ном расположении атомных ядер относительно друг друга, но не дают
никакого представления о внешних очертаниях молекул. Расстояние
от центра атома до точки, в которой он «контактирует» с соседним ато-
мом в случае их плотной упаковки (как в кристалле), называют ван-
дерваальсовым радиусом. Взаимное расположение биологических моле-
кул, находящихся по соседству друг с другом, в основном определяется
значением этих радиусов, которые также приведены в табл. 2-1. В каж-
дом случае они приблизительно равны ковалентному радиусу плюс
0,080 нм. Вандерваальсовы радиусы несколько менее постоянны, чем
ковалентные, поскольку атомы можно чуть-чуть «сжать», но так, чтобы
при этом длина контактного расстояния уменьшилась не более чем на
0,005—0,01 нм.
4. Асимметрия: правые и левые молекулы
Левая и правая руки выглядят почти одинаково, но все же отлича-
ются друг от друга — одна является зеркальным отображением другой.
Практически эта разница выражается в том, что на правую руку нель-
зя надеть левую перчатку. Однако, хотя мы ежедневно сталкиваемся
с различиями между левым и правым, объяснить на словах, чем имен-
но правая рука отличается от левой, очень нелегко. Вместе с тем, по-
скольку биохимические соединения — и мономеры, и полимеры — по
большей части асимметричны, понимать, что такое молекулярная асим-
метрия, чрезвычайно важно. Надо уметь представлять, как пространст-
венно выглядят асимметричные молекулы, и уметь изображать их
структуру на бумаге. Чтобы научиться этому, надо постоянно работать
с молекулярными моделями, а еще лучше делать такие модели своими
руками (см. Приложение).
Когда к центральному атому углерода присоединены четыре разные
группы, молекула обязательно асимметрична. Упомянутые четыре груп-
пы могут располагаться двумя способами, что дает две разные конфи-
гурации. Рассмотрим а-аминокислоту
NH2
R—Lcooh
н
а-Аминокислота
Чтобы отобразить трехмерную структуру молекулы на плоскости, связи,
которые направлены от плоскости рисунка к читателю, часто изобража-
ют в виде треугольников, а связи, уходящие за плоскость рисунка —
тонкими сплошными или пунктирными линиями:
R
I
= H..N—С—СООН =
I
н
ноос
н nh2
L-аминокислота
Аминокислоты, у которых конфигурация относительно атома а-угле-
рода такая же, как на приведенных выше формулах, называют L-ами-
нокислотами. Аминокислоты, являющиеся зеркальным отображением
L-аминокислот, называются D-аминокислотами1. L- и D-формы одного
и того же соединения называют его энантиоморфными формами или
энантиомерами.
Структура L-аминокислоты была изображена выше четырьмя раз-
личными способами. Чтобы показать, что мы имеем дело с одной и
той же структурой, нужно повернуть молекулу в пространстве так, что-
бы карбоксильная группа оказалась сверху, а боковая цепь (радикал
R)—снизу (уходя за плоскость рисунка); при этом аминогруппа и
атом водорода должны оказаться по разные стороны от атома углерода,
выступая вперед из плоскости рисунка. По соглашению, предложенно-
му Э. Фишером, аминокислота находится в L-конфигурации, если в ука-
занной выше ориентации ее аминогруппа оказывается слева, и в D-koh-
фигурации, если она оказывается справа.
СООН
Н—С—NH2
R
D-аминокислота
Одновременно Фишер предложил изображать аминокислоты всегда
именно в этой ориентации, указывая все связи обычными линиями, как
на приведенной ниже проекционной формуле Фишера для L-аланина.
По терминологии Кана — Ингольда — Прелога (разд. 5), такая конфи-
гурация обозначается как S.
СООН
H,N—С-Н
I
сн3
Биохимические реакции, как правило, высокостереоспецифичны; фер-
мент, выступающий в качестве катализатора реакции, оказывает свое
действие лишь в том случае, если молекула находится в одной из двух
конфигураций. Близко связанный факт заключается в том, что белки
обычно целиком состоят из L-аминокислот.
В старой литературе, когда речь шла об оптической изомерии, про-
являющейся в существовании D- и L-соединений, пользовались терми-
нами «асимметрический атом углерода» или асимметрический центр.
В настоящее время чаще используются термины хиральные молекулы,
хиральные центры, хиральность (что в переводе с греческого означает
«принадлежность к правому или левому»). Соединения с одним хираль-
ным центром дают одну энантиоморфную пару, а молекулы с двумя и
более хиральными центрами образуют семейство диастереомеров. Диа-
стереомеры образуют пары изомеров, противоположных по конфигура-
ции при одном или нескольких хиральных центрах, но не являющихся
1 D- и L-коифигурации соответствуют определенному расположению атомов мо-
лекулы в пространстве. Экспериментально измеряемой величиной, которая связана с
асимметрией молекул, является оптическое вращение (гл. 13, разд. Б.5). Иногда од-
новременно с названием соединения указывают знак оптического вращения (+ или —),
например D (+)-глюкоза. Старые обозначения d (dextro — правый) и I (levo — левый)
имеют тот же смысл. Вместе с тем соединение в D-коифигурации может иметь любой
знак оптического вращения: либо «+», либо «—».
72
Глава 2
зеркальным отображением один другого. Примером могут служить
L-треонин* 1, обладающий 2(S) ,3(Я)-конфигурацией, и его диастереомер,
L-алло-треонин, обладающий 2(5),3(5)-конфигурацией.
5. Описание конфигурации с использованием /^-обозначений
В 1956 г. Каи, Ингольд и Прелог предложили однозначный способ
описания конфигурации относительно любого хирального центра [1].
Этот способ особенно полезен для тех классов соединений, для которых
нет твердо установленной системы разделения на D- и L-конфигурации.
Четыре группы, окружающие атом углерода (или другой центральный
атом), располагаются в порядке их приоритета. Приоритет каждой кон-
кретной группы устанавливается в соответствии с набором правил, из
которых наиболее важным является такое: больший атомный номер
ставится перед меньшим. В приведенном ниже примере, взятом для
иллюстрации, приоритет групп молекулы D-аланина указан так: а>Ь>
>c>d. Наивысший приоритет приписывается NH2-rpynne, в которой
с центральным атомом связан атом азота. Чтобы установить конфигу-
рацию, наблюдатель смотрит на молекулу вдоль оеи, соединяющей
центральный атом с группой, имеющей низший приоритет, т. е.
с группой d. В этом случае последовательность групп а, Ь, с может рас-
полагаться либо по часовой стрелке, как в нашем случае, либо против.
d Н
!>
л .___Наблюдатель
О-алани!
Расположению по часовой стрелке соот-
ветствует конфигурация 7? (rectus — пра-
вый), а против часовой — конфигурация S
(sinister — левый).
Чтобы установить приоритет групп, сначала смотрят на атомы, не-
посредственно связанные с центральным атомом, располагая их в по-
рядке уменьшения атомного номера. Затем, если необходимо, переходят
к следующему набору атомов и сравнивают их атомные номера. Именно
так приходится поступать для определения приоритета групп Ь и с
аланина, поскольку обе они связаны с центральным атомом через атом
углерода. Если атомы участвуют в образовании двойных связей, приме-
ром чему служит карбоксильная группа аланина, то они учитываются
1 Иногда к буквам D п L добавляют индексы s или g, указывающие, какое соеди-
нение использовано в качестве эталона конфигурации — серин или глицеральдегид
(разд. В.1). Обычный треонин является Ls- или Ьг-треонином. Конфигурация право-
вращающей ( + )-винной кислоты обозначается 2(/?), 3(/?) или ЕЦ или Lg.
СООН
ИСОН
I
носн
соон
2(R) ,.3(К)-винная кислота
дважды — второй раз как воображаемые атомы, продолжающие цепоч-
ку связей:
/О М) -«-- „ ,
// ’ Воображаемые атомы
-С -------> —С—О—(С) <----
\он ^он
Мы не будем рассматривать здесь полный набор всех правил; укажем
лишь последовательность, в которой приводимые ниже функциональные
группы расположены в порядке уменьшения их приоритета [2]: SH>
> OR > ОН > NHCOCH3 > NH2 > COOR > СООН > ОНО >
>СН2ОН>СбН5>СН3>3Н>2Н>>Н. Хотя RS-система вполне одно-
значна, зачастую два близко родственных соединения, принадлежащих к
одной конфигурации в DL-системе, в RS-системе имеют противополож-
ную конфигурацию. Поэтому при определении конфигурации аминокис-
лот и сахаров применяется обычно DL-система.
6. Конформации: различные формы, которые может принимать
молекула
Помимо определенного расположения ковалентно связанных атомов
(конфигурация), не менее важна в биохимии конформация молекулы,
которая определяется ориентацией групп, обусловленной вращением их
вокруг одинарных связей [3]. Многие группы свободно вращаются да-
же при комнатной температуре; к примеру, —СНз-группу можно пред-
ставлять себе чем-то вроде крыла ветряной мельницы, которое случай-
ным образом поворачивается то в одну, то в другую сторону. Однако
даже простейшие молекулы имеют какую-то преимущественную кон-
формацию, а в более сложных структурах вращение, как правило, в
значительной степени затруднено.
Рассмотрим молекулу, в которой две группы, А и В, соединены
мостиком из двух СН2 (метиленовых)-групп. Если раздвинуть эти груп-
пы на максимально возможное расстояние, то молекула примет пол-
ностью вытянутую, или анти-конформацию:
В
А
Вий вйолб линии связи между атомами углерода
(проекция Ньюмена)
В такой молекуле не только группы А и В, но и все атомы водорода
находятся на максимально возможном расстоянии один от другого.
В этом легко убедиться, если взглянуть на молекулу вдоль оси, соеди-
няющей атомы углерода (проекция Ньюмена). Поворот второго атома
углерода на 180° вокруг одинарной связи переводит молекулу в засло-
ненную конформацию. Если группы А и В достаточно велики, они при
таком повороте будут «наталкиваться» друг на друга, так что заслонен-
ная конформация практически не сможет реализоваться—поворот во-
круг упомянутой связи будет крайне затруднен. Даже если А и В — это
74 Глава 2
просто атомы водорода (этан), переход к заслоненной конформации
связан с преодолением вращательного барьера величиной до
~13 кДж-моль-1; он возникает из-за стерических затруднений при
сближении атомов водорода [3] (это можно без труда продемонстриро-
вать с помощью полных объемных моделей).
А в
Заслоненная конформация
Если А и В — метильные группы (молекула бутана), стерические
препятствия приводят к возникновению вращательного барьера около
25 кДж-моль-1 (~6 ккал• моль-1). Именно по этой причине во многих
биологических молекулах цепочки из СН2-групп стремятся принять
полностью вытянутую конформ,ацию. Такого рода зигзагообразную
структуру углеродной цепи можно обнаружить в полиэтилене, состоя-
щем из длинных цепочек СН2-групп.
Пом.имо полностью вытянутой конформации возможны также две
скошенные (гош-) конформации, которые почти так же устойчивы, как
и анга-конформация, и для которых стерические затруднения возникают
лишь в том случае, если группы А и В очень велики. В одной из этих
двух конформаций группа В лежит справа от А, если смотреть вдоль
Одна из двух скошенных конформаций
оси молекулы, а в другой В оказывается слева от А. Данные конфор-
мации можно рассматривать по аналогии с правым и левым винтом
(в обычных правых винтах нарезка, если смотреть на нее сверху вдоль
оси — неважно с какого конца, — идет от наблюдателя слева направо,
и точно таким же образом на рисунке показан переход от группы А к
группе В). Угол <р — это торсионный угол. Для правых конформаций он
имеет положительное значение (правую конформацию называют также
Р- или « + »-конформацией в отличие от М- или «—»-конформации,
означающей левую конформацию). Скошенные конформации занимают
важное место среди возможных конформаций многих биологических
молекул; например, молекула сахарного спирта рибита в кристаллах
имеет вид серпа [4] —цепь сначала (слева) образует зигзаг, но затем,
начиная с четвертого атома углерода, приобретает скошенную конфор-
мацию, что сводит к минимуму стерические затруднения, обусловлен-
Молекулы, из которых мы состоим
ные взаимодействием между ОН-группами при втором и четвертом ато-
мах углерода.
Pufium в „серповидной" конформации
Многие молекулы содержат кольца из 3, 4, 5, 6 и более атомов угле-
рода. Если кольца, в которых имеется две и более двойные связи, в
большинстве случаев остаются почти плоскими, то с пяти- и шестичлен-
ными кольцами, построенными на одинарных связях, дело обстоит
иначе. Шестичленные кольца из одинарных связей, какие мы встречаем
в циклогексане и в сахарах, как правило, принимают конформацию
скресла», как это видно на примере глюкозы.
Обратите внимание, что все
крупные замещающие гриппы,
—ОН и
он
н |
НО
сн
Н
н
он
но
/3 -D-глюкоз а.
Пиранозное кольцо
имеет форму кресла
—СН2ОН,
находятся в экваториальном
положении с внешней
стороны кольца
и в результате
контактируют
друг с другом
минимально
Все атомы водорода, присоединенные
к кольцевым атомам углерода,
отходят вниз или вверх
в аксиальном направлении
Помимо этого, шестичленные кольца могут принимать менее устой-
чивую конформацию «лодки» [3, 5, 6]. Шесть возможных вариантов
конформации «лодки» свободно переходят одна в другую через проме-
жуточные скошенные конформации.
Скошенная конформация
Поскольку внутренний угол правильного пятиугольника равен 108°
(что очень близко к углу тетраэдра), можно было бы ожидать, что пя-
тичленные кольца образуют плоские структуры. Однако в плоской
го 1 лава 2
структуре атомы водорода при соседних углеродах мешали бы друг
другу; поэтому один из атомов углерода выходит из плоскости осталь-
ных четырех на расстояние около 0,05 нм, в результате чего образует-
ся конформация «конверта» (см. рис. 2-14, на котором изображены
этот и другие типы конформации).
7. Водородные связи и гидрофобные взаимодействия
Хотя целостность молекулы поддерживается ковалентными связями,
многие важнейшие свойства биологических соединений определяются
значительно более слабыми связями. Среди этих нековалентных связей
особенно важны водородные и гидрофобные. Водородные связи обус-
ловлены электростатическим притяжением, возникающим нз-за нерав-
номерного распределения электронов между атомами, участвующими в
образовании ковалентной связи: например, в молекуле воды электроны,
образующие связь Н—О, немного смещены к атому кислорода. В ре-
зультате на атоме водорода создается небольшой нескомпенсированный
положительный заряд, а на атоме кислорода — небольшой отрицатель-
ный. Наличие такой поляризации иногда указывают стрелками, заме-
няющими изображение химических связей; используются также обозна-
чения б+ и б-. Молекулы с сильно поляризованными связями называют
полярными, как и функциональные группы, в которых имеются такие
связи. Им противопоставляют неполярные группы, такие, как
—СНз-группа; здесь образующие связь электроны почти равномерно
распределены между атомами углерода и водорода.
Л-
Водородная связь образуется в тех случаях, когда положительно за-
ряженный конец одного из диполей (одной из поляризованных связей)
притягивается к отрицательно заряженному концу другого диполя. Спо-
собность к образованию водородных связей ярко выражена у молекул
воды; при этом каждый атом кислорода может образовывать водород-
ные связи с двумя другими молекулами воды. Водородные связи имеют
резко выраженный направленный характер: наиболее сильной связь
бывает в том случае, когда все три атома оказываются на одной пря-
мой. Энтальпия образования водородной связи вдоль прямой, Д//°, мо-
жет достигать —20 кДж-моль-1 (—5 ккал • моль-1).
Атом кислорода
в молекуле воды образует
водородные связи с двумя
другими молекулами воды.
Обратите внимание на
тетраэдрическое расположение
связей вокруг атома кислорода
Водородные связи длиннее ковалентных, но заметно короче (на
~0,06—0,08 нм) расстояний, которые соответствуют межатомным кон-
тактам, определяемым значениями вандерваальсовых радиусов. Следует
помнить, что водородные связи всегда образуются между парами групп,
одна из которых обращена к другой отрицательным концом диполя, а
другая служит донором протона. Группа, являющаяся акцептором про-
тона, может также рассматриваться как донор неподеленной пары
электронов. При обсуждении механизмов органических реакций принято
стрелками указывать направление смещения электронов. В этой книге
мы тоже иногда будем указывать направление водородных связей
стрелками, идущими от доноров электронов к атомам водорода (как
это было сделано выше, когда мы рассматривали образование водород-
ных связей между молекулами воды).
Жиры, углеводороды и другие вещества, молекулы которых состоят
в основном из неполярных групп, плохо растворимы в воде и хорошо
растворяются в неполярных растворителях. В водной среде неполярные
группы стремятся ассоциировать — это явление часто называют гидро-
фобным взаимодействием. В то же время сахара и другие соединения,
содержащие много полярных групп, напротив, очень хорошо растворя-
ются в воде и не ассоциируют.
Растворимость сахара в воде объясняется способностью многочис-
ленных гидроксильных групп этого соединения к образованию водород-
ных связей с молекулами воды. Природу гидрофобного связывания, о
котором будет говориться в гл. 4 (разд. Б.4), понять несколько труд-
нее, но обусловлено оно главным образом сильным взаимным притя-
жением молекул воды, вовлеченных в густую сеть водородных связей
[7]-
Многие молекулы, имеющие в своем составе кольцевые структуры
(например, пурины или пиримидины), довольно слабо растворяются как
в воде, так и в органических растворителях. Молекулы этих соедине-
ний, содержащие полярные и неполярные участки, не оказывают пред-
почтения ни одному из растворителей и плотно упаковываются в струк-
туре твердого кристалла.
8. Таутомерия
Многие простые органические соединения существуют в виде смеси
двух и более изомеров, или таутомерных форм, быстро переходящих
одна в другую. Таутомеры, по крайней мере в принципе, можно разде-
лить при низких температурах, когда переход из одной формы в другую
затруднен.
Классическим примером явления такого рода служит кето-енольное
равновесие
О . ОН
Н II н I
R—С—С—R' -<----- R—С=С—R' (2-1)
Н
Кето-форма Енол
Хотя енол обычно менее устойчив, чем кето-форма, он все-таки всегда
присутствует в системе, хотя и в малых количествах. Енол легко обра-
зуется из кето-таутомера благодаря тому, что атомы водорода при уг-
лероде, связанном с карбонильной группой (С = О), имеют отчетливо
выраженные кислотные свойства. Одним из основных факторов, порож-
дающих таутомерию, является наличие легко диссоциирующего прото-
на. Однако обычно атомы водорода, связанные с атомами углерода,
слабо диссоциируют, и поэтому таутомерия возникает лишь в присут-
ствии карбонильной или какой-либо другой «активирующей группы».
Как правило, легко диссоциируют протоны, связанные с атомами
кислорода или азота, предопределяя возможность таутомерии в амидах
78 Глава 2
и кольцевых системах, содержащих атомы О и N [уравнения
(2-2)-(2-5)].
О о—н
11 ->• 1 ,
R—N—С—R' <----- R—N=C—R (2-2)
Н
А В
Пиридоксин
( витамин Bg)
А
(2-4)
(2-5)
Таутомерия, описываемая уравнением (2-2), близка к кето-енольно-
му превращению. Форма В изредка присутствует в пептидах. Пиридок-
син [уравнение (2-3)] в водном растворе находится преимущественно
в форме биполярного ионного таутомера В, но в метаноле принимает
форму незаряженного таутомера А. Пиримидины [уравнение (2-4)] и
пурины [уравнение (2-5)] способны образовывать множества таутоме-
ров. Существование формы D [уравнение (2-4)] послужило основанием
к тому, что урацил называют также диоксипиримидином (правда, здесь
преобладает все же дикето-таутомер А). В паре таутомеров один из
атомов водорода всегда переходит из одного положения в другое, что
сопровождается изменением длин и характера других связей.
Константа равновесия для таутомерного перехода равна отношению
мольных долей двух форм. Например, для енольной и кето-форм ацето-
на в воде это отношение равно ~2-10-6 [8]; для биполярных ионов и
незаряженного пиридоксина [уравнение (2-3)] при 25 °C оно равно
~4 [9]. Относительное содержание таутомеров урацила В, С и D по
сравнению с таутомером А предположительно невелико, но количест-
венные измерения здесь провести трудно [10, 11]. Таутомерные отно-
шения (определяемые для полностью протонированных форм) не зави-
сят от pH, но меняются с изменением температуры, зависят от раство-
рителя и весьма чувствительны к связыванию таутомеров с молекулами
белка или другими молекулами.
9. Резонанс
Необходимо отличать таутомерию от явления резонанса, о котором
говорят в тех случаях, когда свойства молекул оказывается невозможно
описать на основе одной валентной структуры и приходится прибегать
к гибридизации двух или нескольких структур, в которых все ядра оста-
ются на прежних местах. Переход из одной резонансной формы в дру-
гую связан лишь с перераспределением валентных электронов. Приме-
ром может служить енолят-анион, который можно рассматривать как
гибрид структур А и В. Чтобы подчеркнуть, что изображены именно
резонансные структуры, а не таутомеры или какие-либо другие изоме-
ры, стрелки, изображающие переход между соответствующими форма-
ми, делают двунаправленными:
О о-
Н || HI
R—С—С—R' <—> R—С=С—R'
А В
Енолят-анион
Хотя таутомерия и резонанс — явления разные, они все же тесно
связаны. Так, кислотные свойства атомов водорода при атомах углеро-
да в кетонах, приводящие к образованию енольных таутомеров, являют-
ся прямым следствием резонансной стабилизации енолят-аниона, обра-
зующегося при диссоциации одного из этих атомов водорода.
Подобным же образом таутомеризация имидазольной группы, при-
сутствующей в большинстве белков, связана с резонансом имидазолий-
катиона. Представим себе, что протон при взаимодействии со структу-
рой А [уравнение (2-6)] присоединится к атому азота, находящемуся
в 1-м положении; тогда вследствие резонанса положительный заряд не-
медленно распределится между обоими атомами азота. Это придаст
кислотные свойства протону при атоме азота, находящемся в 3-м поло-
жении, протон диссоциирует и образуется таутомер В. Таутомеризации
Н+ — NT NH HN NH HN XN+H
А
Имидазол
Имидазолий-катион
HN N + Н+ (2-6)
В
имидазольной группы приписывают важную роль в функционировании
многих ферментов и других белков; например, если атом азота, нахо-
дящийся в 3-м положении, в структуре А обращен внутрь молекулы
белка, то присоединение протона с внешней стороны может вызвать
таутомерный переход, приводящий к высвобождению протона внутри
молекулы, возможно, в области активного центра фермента (гл. 7,
разд. К-2).
Б. Белки
Мономерными единицами, из которых построены белки, являются
20 а-аминокислот. Эти малые молекулы наделены свойством, общим для
всех молекул, способных к полимеризации: они содержат по меньшей
мере две разные химические группы, способные реагировать друг с дру-
гом с образованием ковалентной связи. У аминокислот такими группами
служат аминогруппа (—NH2) и карбоксильная группа (—СООН), а
связь, которой определяется образование белкового полимера, пред-
ставляет собой пептидную (амидную) связь. Образование пептидной
связи можно представлять себе как отщепление молекулы воды от при-
соединяющихся друг к другу —СООН- и —NH2-rpynn [уравнение
(2-7)]. В водной среде равновесие в реакциях такого типа сдвинуто в
сторону образования свободных аминокислот, а не пептида. Следова-
тельно, синтез пептидов (как в естественных условиях, так и в лабора-
тории) осуществляется непрямым путем и не сводится к простому от-
щеплению воды.
H2N—CH—C-j-QH + Н—N—СН—СООН •
К н
а-Аминокислоты
О R
H2N — СН —с—N — СН— СООН + Н2О (2-7)
R Н
Пептидная связь
в дипетипиде
Поскольку дипептид в уравнении (2-7) также содержит реакционно-
способную карбоксильную и аминогруппу, то к нему с помощью новых
пептидных связей могут присоединиться другие аминокислотные моно-
меры; в результате образуется полипептид (белок).
1. а-Аминокислоты
Для понимания свойств аминокислот как свободных метаболитов
и как компонентов белковых молекул нужно прежде всего запомнить
три простых факта.
1. Аминокислоты существуют преимущественно в форме биполярных
ионов (цвиттерионов).
ни
HjN—С—Сч , а не H2N—С—С—ОН
I хо- |
R R
1 аилица
Структура и химические свойства боковых цепей аминокислот
а. Глицин; «боковая цепь» = —H(GlyG)
Выступает в роли простейшего
связующего звена в цепи белка,
обеспечивая минимальные стериче-
ские препятствия при вращении и
размещении соседних групп
б. Аминокислоты с алкильными боковыми цепями
я ,н
\ 'н
с-н
: чн
н
Валин
(Vol , V)
Аланин
(Ala,А)
,н/н
н —С \
14 \ н н
с—с—н
н н' н н
Лейцин Изолейцин
(Leu,L) (Ие,1)
Эти объемные группы разной
формы очень важны для гидро-
фобной стабилизации белка и для
формирования центров связыва-
ния в ферментах
* Заметьте, что в изолейцине
имеется еще один хиральный
центр
в. Пролин (поскольку его боковая цепь замыкается на аминогруппу, дана полная
структурная формула аминокислоты)
о « Н н но-с L /^н / \ Л Н—N С . Л. ® н н Пролин Заслуживает внимания вторич- ный характер аминогруппы (про- лин иногда называют имииокис- в аксипролине, который лотой) и жесткая конформация аминокислоты. Присутствие ос- на — он-группу татков пролина оказывает сущест- венное влияние на характер ук- ладки полипептидной цепи
(Pro , Р)
г. Ароматические аминокислоты
Фенилаланин
(Phe, F)
Тирозин
(Туг, О)
Триптофан
( Trp . W)
Легко диссоциирующий про-
тон, р/(а ~9,5—10,9. Донор про-
тона в водородных связях и
функциональная группа в фермен-
тативном катализе
Тирозин, фенилаланин и трипто-
фан способны образовывать гид-
рофобные связи и особенно эф-
фективно связываются с другими
плоскими молекулами
6—1821
82
Продолжение
д. Аминокислоты-спирты
/°Н
-с<Н
н
Серин
(Ser, S)
_СЛ-ОН
'сн3’~~
Треонин
(Thr, Т)
—ОН-группа имеет очень сла-
бые кислотные свойства (рАа —
—13,6). Способна к образованию
эфиров фосфорной и органических
кислот и служит местом присо-
единения сахарных колец в глико-
протеидах. Гидроксильные группы
серина обнаружены в активных
центрах ряда ферментов
Обратите внимание на второй
хиральный центр. Здесь показана
конфигурация боковой цепи
L-треонина; D-треонину соответ-
ствует противоположная конфи-
гурация. L-аминокислота с проти-
воположной конфигурацией боко-
вой цепи называется L-алло-трео-
нином
е. Аминокислоты с
боковыми цепями, обладающими кислотными свойствами
— с'-^Н
Хс=о
/
ОН
Аспарагиновая
кислота
(Asp,D)
г-‘>Н
\ Z
X—С
"А он
Глутаминовая
кислота
(Glu, Е)
Карбоксильные группы этих бо-
ковых цепей при нейтральных pH
находятся в диссоциированном
состоянии (рАа = 4,3—4,7). Обус-
ловливают присутствие отрица-
тельного заряда на поверхности
белка
ж. Амиды аспарагиновой
и глутаминовой кислот
Н ,
-С^-Н н
)с—NZ
с/ \
Аспарагин
(Asn , N )
Амидная группа не обладает
кислотными свойствами, но поляр-
на и может участвовать в образо-
вании водородных связей
,Н
~СГ“Н О
Х-с(
н A N~H
н
Глутамин
(Gin, Q)
Если неизвестно, какая амино-
кислота стоит в цепи белка —
аспарагин или аспарагиновая кис-
лота — используют обозначение
Asx или В. В случае глутамина
или глутаминовой кислоты при-
меняется обозначение Glx или Z
з. Серусодержащие аминокислоты
Н
—С —н
S—н
Цистеин
(Cj/s, С)
«---Слабая кислота
рКа -8,3-8,6
Н
— С—Н
Н''Д ,с—Н
Н''А
Метионин
(Met, М)
Наиболее характерная особен-
ность цистеина — его способность
к самопроизвольному окислению
в присутствии О2 с образованием
«двойной» аминокислоты — цисти-
на; этот процесс часто приводит
к образованию поперечных ди-
сульфидных связей между пептид-
ными цепями:
2 —СН2—SH
-Н2С
XS—S.
ХСН,—
Молекулы, из которых мы состоим
83
Продолжение
и. Основные аминокислоты
Гистидин
( His, И)
Н Н Н Н
Лизин
HUS, К')
Н
,:N—Н
ч
/Ч-
N <,N—Н
I I
н н
Аргинин
'Arg ,R)
Эта основная группа несет на
себе положительный заряд и мо-
жет служить акцептором протона;
сопряженная кислота имеет
р7<а~6,4—7,0
Имидазольные группы боковых
цепей гистидина составляют часть
активного центра многих фермен-
тов. Как и другие основные груп-
пы белков, они могут также свя-
зывать ионы металлов
Гибкая боковая цепь с реакци-
онноспособной аминогруппой на
конце. Высокое значение рКа
(~ 10,5) указывает, что боковые
цепи лизина в нейтральных рас-
творах всегда протонированы
Гуанидиниевая группа имеет
рКа выше 12 и в большинстве
случаев остается протонирован-
ной. Стабилизируется резонансом
(как показано кривыми стрелка-
ми). Гуанидиниевые группы при-
обретают иногда важное значение
как центры связывания фосфат-
ных групп
3 В скобках даны трехбуквенные и однобуквенные обозначения аминокислотных,
остатков, входящих в состав пептидов н белков.
2. Аминокислоты асимметричны и образуют два семейства: D и L
(разд. А.4).
3. Аминокислоты отличаются друг от друга структурой боковых
групп (боковых цепей), которые в приведенных выше формулах обозна-
чались через R. Эти группы имеют разную химическую структуру. Они
выступают из основной цепи и формируют в значительной степени по-
верхность полимера, определяя многие химические и физические свой-
ства белков.
В табл. 2-2 приведены структурные формулы боковых цепей амино-
кислот, обычно встречающихся в белках (формула пролина приведе-
на полностью). Даны также сокращенные трехбуквенные обозначения
аминокислот, используемые при выписывании аминокислотных после-
довательностей пептидов и белков, а также однобуквенные сокращения,
принятые в работах по эволюции белков и при составлении программ
для вычислительных машин.
При обсуждении вопросов, связанных со структурой белков, амино-
кислоты, входящие в группы а, б и в, а также фенилаланин и метионин
принято объединять в категорию неполярных аминокислот. Они стре-
84
Глава 2
мятся попасть в гидрофобное окружение «внутри» молекулы белка.
Противоположную по свойствам категорию составляют полярные заря-
женные молекулы (группы е и и), которые обычно выступают наружу,
в водное окружение белка. Остальные образуют категорию полярных
незаряженных аминокислот.
Знакомство со структурой аминокислот лучше всего начать с глици-
на, аланина, серина, аспарагиновой кислоты и глутаминовой кислоты.
Отметим, что структуру многих аминокислот можно получить из струк-
туры аланина заменой одного из атомов водорода на другую группу.
Так, замена p-водорода аланина дает:
Замена на фенил
на —ОН
на —SH
на —СООН
Фенилаланин
Серин
Цистеин
Аспарагиновую кислоту
Метаболические взаимоотношения между аминокислотами, о которых
речь пойдет позднее, помогут запомнить структуру остальных амино-
кислот.
В табл. 2-2 включены также значения рКа (см. гл. 4, разд. Б) боко-
вых групп аминокислот. Если концевые амино- и карбоксильные группы
свободны, они тоже могут участвовать в кислотно-основных реакциях;
р/(а этих групп имеет следующие значения:
Концевая —СООН-группа, рКа=3,6—3,7;
Концевая —NHg-группа, рКа = 7,5—7,9.
Поскольку при нейтральных pH —СООН-группы глутаминовой и ас-
парагиновой кислот полностью диссоциированы, в биохимической лите-
ратуре их принято называть глутаматом и аспартатом независимо от
природы присутствующих в среде катионов. Такое же окончание (— ат)
применяется и в случае других кислот — например, малат, оксоалаце-
тат, фосфат, аденилат, что находит отображение и в названии фер-
ментов, например лактатдегидрогеназа.
2. Полипептиды
Последовательность, в которой соединяются мономерные звенья при
полимеризации 100 и более аминокислот, представляет собой первичную
структуру белков. Мономерные звенья цепи называются аминокислот-
ными остатками — в ходе полимеризации каждая аминокислота теряет
молекулу Н2О1. Полипептидная цепь обычно имеет одну свободную ами-
ногруппу на одном конце цепи и свободную карбоксильную группу —
на другом. Однако иногда эти группы связываются одна с другой, что
приводит к образованию циклического пептида. Пептиды называются в
соответствии с составляющими их аминокислотными остатками, начи-
ная от остатка, несущего концевую аминогруппу. Так, Ь-аланил-Ь-ва-
лил-Ь-метионин представляет собой пептид со следующей структурой:
1 Строго говоря, теряется одна молекула воды на пептидную связь, т. е. в сумме
получается на единицу меньше числа аминокислотных остатков.
Молекулы, из которых мы состоим
85
10 20
Ala-Pro-Pro-Ser-Val-Phe-Ala-Glu-Val-Pro-Gin-Ala-Gin-Pro-Vai- Leu-Val-Phe-Lys-Leu- He-Ala-Asp-Phe- Arg'*
30 40 50
GIu-Asp-Pro-Asp-Pro-Arg-Lys-Val-Asn-Leu-Gly-Val-Gly-Ala-Tyr-Arg-Thr-Asp-Asp-Cys-Gln-Pro-Trp-Val-Leu—
60 70
Pro-Vai-Vai-Arg-Lys-Val-Glu-Gln-Arg-Пе-Ala-Asn-Asn-Ser-Ser-Leu-Asn-His-Glu-Ту r-Leu-Pro-lle-Leu-Gly-
80 90 100
Leu-Ala-Glu-Phe-Arg-Thr-Cys-Ala-Ser-Arg-Leu-Ala-Leu-Gly-Asp-Asp-Scr-Pro-Ab-Leu-Gln-Glu-Lys-Arg-Val-
110 120
Gly-Gly-Val-Gln-Ser-Leu-Gly-Gly-Thr-Gly-Ala-Leu-Arg-lle-Gly-Ala-Glu-Phe-Leu-Ala-Arg-Trp-Tyr-Asn-Gly-
130 140 150
Thr-Asn-Asn-Lys-Asp-Thr-Pro-Val-Tyr-Val-Ser-Ser-Pro-Thr-Trp-Glu-Asn-His-Asp-Gly-Val-Phe-Thr-Thr-Ala-
160 170
Gly-Phe-Lys-Asp-Ile-Arg-Ser-Tyr-Arg-Tyr-Trp-Asp-Thr-GIu-Lys-Arg-Gly-Leu-Asp-Leu-GIn-Gly-Phe-Leu-Ser-
180 190 200
Asp-Leu-Glu-Asn-Ala-Pro-Glu-Phe-Ser-lle-Phe-Val-Leu-His-Ala-Cys-Ala-H is-Asn-Pro-Thr-GIy-Thr-Asp-Pro-
210 220
Thr-Pro-Glu-Gln-Trp-Lys-Gln-Ile-Ala-Ser-Val-Met-Lys-Arg-Arg-Phe-Leu-Phe-Pro-Phe-Phe-Asp-Ser-Ala-Tyr-
230 240 250
Gln-Gly-Phe-Ala-Ser-Gly-Asn-Leu-Glu-Lys-Asp-Ala-Trp-Ala-Ile-Arg-Tyr-Phe-Val-Ser-GIu-Gly-Phe-Glu-Leu-
260 270
Phe-Cys-Ala-GIn-Ser-Phe-Ser-JTyvj-Asn-Phe-Gly-Leu-Tyr-Asn-Glu-Arg-Va!-Glv-Asn-Leu-Thr-Val-Val-Aia-Lys-
280 290 300
Glu-Pro-Asp-Ser-lle-Leu-Arg-Val-Leu-Ser-Gln-Met-Gln-Lys-lle-Val-Arg-Val-Thr-Trp-Ser-Asn-Pro-Pro-Ala-
310 320
Gln-Gly-Ala-Arg-lle-Val-Ala-Arg-Thr-Leu-Ser-Asp-Pro-Glu-Leu •Phe-His-Glu-Trp-Thr-Gly-Asn-Val-Lys-Thr-
330 340 350
Met-Ala-Asp- Arg-Ile-Leu-Ser-Met-Arg-Ser-Glu-Leu- Arg- Ala- Arg-Leu-Glu-Afa-Leu-Lys-Thr-Pro-Gly- Thr-Trp-
360 370
Asn-His-lle-Thr-Asp-Gln-lle-Gly-Met-Phe-Ser-Phe-Thr-Gly-Leu-Asn-Pro-Lys-Gln-Val-GIu-Tyr-Leu-lle-Asn-
380 390 400
Glu-Lys-His-Ue-Tyr-Leu-Leu-Pro-Ser-Gly-Arg-lJe-Asn-Met-Cys-Gly-Leu-Thr-Thr-Lys-Asn-Leu-Asp-Tyr-Val-
410
Ala-lKr-Ser-Ile-His-Glu-Ala-Val-Thr-Lys-He-Gln
РИС. 2-1. Полная аминокислотная последовательность цитоплазматической аспартат-
аминотрансферазы из сердца свиньи. Состав полипептида: Lys19, His8, Arg26, (Asp+
+Asn)42, Thr26, (Glu+Glnjn, Pro24, Gly28, Ala32, Cys5, Val29, Met6, Uei9, Leu3S, Tyri2,
Phe23, Trp9. Мол. вес одной цепи равен 46 344. Молекула холофермента представляет
собой димер с мол. весом 93 147. Она содержит 2 молекулы связанного с белком ко-
фермента пиридоксальфосфата (гл. 8, разд. Д), присоединенного к лизину, который
заключен на рисунке в рамочку. (Овчинников Ю. и др., FEBS Lett., 29, 31—33, 1973;
Doonan S. et al„ FEBS Lett., 38, 229—233, 1974.)
Заметим, что этот трипептид, как и каждая аминокислота, является
биполярным ионом. Та же структура в сокращенном виде записывает-
ся следующим образом: Ala-Vai-Met. В такой записи N-концевой ами-
нокислотный остаток ставится слева, а С-концевой — справа.
Напомним, что последовательности аминокислот в цепях белков
всегда точно заданы генетически. Знание аминокислотной последова-
тельности очень важно для понимания поведения специфических бел-
ков. По этой причине в последнее время усилия многих биохимиков
направлены на определение последовательностей сотен белков. Одним
из крупных белков, для которых эта задача решена, является у-имму-
ноглобулин человека, содержащий 446 остатков в одной цепи и 214 —
в другой. Полная аминокислотная последовательность другого белка
приведена на рис. 2-1. На рис. 2-2 даны последовательности некоторых
небольших пептидных гормонов и антибиотиков.
86 Глава 2
•S---S-
Cys—Tvr — He—Gin — Asn—Cvs—Pro—Leu—Cly NH2
N-конец С-концевои глицинамид
Окситоцин человека
J' Cvs — Tyr—Phc—Gin — Asn—Cys — Pro—Arg — GIyNH2
Вазопрессин человека
1 Ser — Tvr—Ser — Met — Glu — His—Phc — Arg—Trp—Gly—Lvs — Pro—Vai—Gly — Lys 1?
I
30 Glu—Asp—Glu — Ala —Gly — Asn — Pro—Tyr — Vai — Lys—Vai—Pro—Arg—Arg — Lys
Sei—Ala — Glu — Ala — The — Pro — Leu—Glu — Phe 39
Адренокортикотропин человека (АКТГ)
Тиролиберин (пироглутамил —
гистидилпролинамид ),
вырабатываемый в гипоталамусе
Пироглутамил —His — Trp — Ser — Туг
I
Pro—Arg—Leu—Gly
GlyNH,
Люлиберин
d i Lc—*l-Lcu—>L-Orn—>L-Val—*L-Pro
I 1
L-Pro*—L-Val«— L-Orn-~L-Leu-—D-Phe
Грамицидин S
C—l-G1u—»L-Leu—>D-Leu
L-Val
L-Asp
Сурсрактин
РИС. 2-2. Структура нескольких природных пептидов. Окситоцин и вазопрессин — гор-
моны нейрогипофиза (задней доли гипофиза); адренокортикотропин — гормон адено-
гипофиза (передней доли гипофиза). Гормоны аденогипофиза выделяются под дейст-
вием особых стимулирующих факторов (releasing factors), которые синтезируются в
гипоталамусе в ответ на нервную стимуляцию. Здесь приведена структура двух сти-
мулирующих факторов. Обратите внимание, что у-карбоксильные группы N-концевых
глутаматов в результате взаимодействия с соседней концевой —\тН2-группой образуют
циклические амидные (пироглутамильные) группы. (Guillemin R., Burgus R., Sci. Am..
227, 24—33, Nov. 1972.) Грамицидин S—это антибиотик, синтезируемый бактериями
Bacillus brevis. Сурфактин представляет собой депсипептид (содержащий сложноэфир-
иую связь); это поверхностно-активный антибиотик, синтезируемый бактериями Bacil-
lus subtilus. (Hochster R. M., Kates M., Quastel J. H., eds., Metabolic Inhibitors, Vol. 3,
p. 312, Academic Press, New York, 1973.)
Молекулы, из которых мы состоим
87
3. Конформации пептидных цепей
Рассмотрим цепочку из —СН2 (метиленовых) -групп — такие цепоч-
ки составляют синтетический полимер полиэтилен. Атомы водорода при
углеродах, стоящих в цепи через один, в полностью вытянутой цепи
фактически соприкасаются друг с другом — никаких более крупных
атомов сюда поместить нельзя.
Даже при замещении атомов водорода (вандерваальсов радиус 0,12 нм)
атомами фтора (радиус 0,135 нм) цепь полимера не может остаться
полностью вытянутой. Торсионный угол, равный в полиэтилене 180°, в
полифторэтилене принимает значение 166° — этого изменения достаточ-
но для снятия напряжения в контактах между атомами фтора, и при
этом атомы фтора и соседние атомы углерода еще не мешают друг дру-
гу. Сформировавшаяся в результате спиральная структура напоминает
структурные элементы, встречающиеся в белках и других биополиме-
рах. Итак, образование спиральной конформации — это естественное
следствие взаимного стерического «вытеснения» одних групп атомов
другими [12, 13].
Цепь
Торсионный
Полиэтилен
Торсионный
угол
ровен 166°
Полифторэтилен
Конформационные свойства биополимеров носят сложный характер,
однако все же их значительно упрощает жесткость структуры большин-
ства мономерных звеньев.
а. Пептидное звено
Жесткость полипептидов обусловлена плоским характером пептид-
ных групп, что связано с наличием резонанса
Ожидаемое из-за этого резонанса укорочение связи С—N и удлинение
связи С = О получило экспериментальное подтверждение при рентгено-
структурном анализе данных структур. Каждое пептидное звено можно
изобразить в виде жесткого плоского листка, размеры которого указа-
ны в верхней части рис. 2-3. Правда, расположение связей вокруг ато-
ма азота отчасти сохраняет пирамидальный характер [14, 15] (рис. 2-3,
внизу}.
Глава 2
Этот угол может достигать
значения ±15°.х
Bud вдоль линии С—N-связи
(жирная стрелка в верхней части рисунка)
'ИС. 2-3. Размеры пептидной группы. Указаны межатомные расстояния, а также
лина водородной связи, образуемой с соседней пептидной группой. Все атомы внут-
и пунктирной рамки лежат примерно в одной плоскости. Однако, как показано в
ижней части рисунка, расположение связей вокруг атома азота отчасти сохраняет
пирамидальный характер.
Наиболее распространена трамс-пептидная связь (рис. 2-3), но
стречается и цпс-пептидная связь (она примерно на 8 кДж-моль-1
[енее устойчива, чем первая); цпс-связь чаще всего образуется при
томе азота пролина [16, 17].
цис-Пептидные связи
Полипептид можно рассматривать как цепочку из связанных друг с
ругом плоских пептидных звеньев (рис. 2-4). Каждое пептидное звено
рисоединяется к другому через а-углерод аминокислоты. Этот углерод
бусловливает присутствие в цепи двух одинарных связей, вокруг кото-
ых возможно вращение (исключением служит циклический остаток
ролина). Конформация аминокислотного звена в цепи белка опреде-
яется торсионными углами относительно каждой из упомянутых оди-
арных связей. Эти углы обозначаются через <р и ф и для полностью
ытянутой цепи принимаются равными 180°’, как это показано на
1 Широко используется и другое соглашение, согласно которому в полностью вы-
гнутой цепи ср = ip = 0 [13].
Молекулы, из которых мы состоим 89
рис. 2-4 [18]. Поскольку и ср
и ф могут меняться, аминокис-
лотный остаток в принципе
способен принимать самые
разные конформации. Многие
из них, однако, сразу исключа-
ются, являясь стерически не-
возможными; в этом легко
убедиться с помощью молеку-
лярных моделей.
В наши дни стало привыч-
ным просматривать целиком
всю область возможных зна-
чений <р и ф, используя вычис-
лительные машины. Расчеты
конформации пептидной груп-
пы выполнил Рамачандран.
Результаты такого анализа
часто представляют в виде
графиков зависимости ф от ф
(графиков Рамачандрана, или
конформационных карт), на
которых обводят рамками об-
ласти возможных комбинаций
двух углов. Конформационные
карты пептидов (рис. 2-5) по-
казывают, что число возмож-
ных комбинаций торсионных
углов довольно велико. Су-
щественная часть этих комби-
РИС. 2-4. Две пептидные группы в полностью
вытянутой p-конформации. Торсиовные углы
(ft, ф,- и и, считаются равными 0°, если атомы
главной цепи находятся в заслоненной, или
цис-конформации. В полностью вытянутой це-
пи все эти углы равны 180°.
наций действительно реализуется в белках. Вместе с тем гораздо боль-
ше таких пар углов, которые совершенно исключаются, если не рассмат-
ривать более гибких пептидов, содержащих глицин (рис. 2-5, Б).
В табл. 2-3 приведены приблизительные значения торсионных углов
для ряда пептидов с регулярной структурой.
б. ^-Структура, образуемая вытянутыми участками цепи
Как впервые указал Лайнус Полинг, одним из важных принципов
формирования структуры белков является образование как можно боль-
шего числа водородных связей между группами С = О и N—Н основной
цепи. Простым примером может служить слой уложенных рядом вытя-
нутых цепей (ф=ф=180°), между которыми образованы водородные
связи. Подобную структуру имеет полиглицин — ее до некоторой степе-
ни иллюстрирует рис. 2-6 (вверху слева). Обратите внимание, что на
этом рисунке соседние цепи идут в противоположных направлениях, от-
сюда и название — антипараллельная p-структура. Помимо того что
антипараллельность цепей создает наиболее благоприятные условия
для образования водородных связей между цепями, она еще способст-
вует тому, чтобы цепь повернула и шла назад вдоль самой себя. Это
очень важный фактор при формировании клеточных структур.
Беспрепятственное образование ^-структуры из полностью вытяну-
тых цепей возможно лишь для полиглицина; присутствие боковых (R)
цепей в других аминокислотах неизбежно вызывает искажение струк-
туры. Например, фиброин шелка характеризуется периодичностью
90 Глава 2
РИС. 2-5. А. Рассчитанная Рамачандраном диаграмма (конформационная карта) до-
пустимых значений углов <р и ф. Для двух расположенных слева областей, заключен-
ных в сплошные рамки, стерические ограничения отсутствуют. Обратите внимание,
что в эти области попадают складчатый p-слой, коллагеновая структура и а-спираль.
Области, отмеченные точками, характеризуются наличием небольших стерических
барьеров, однако соответствующие конформации все же могут реализоваться. Б. Гра-
фик Рамачандрана для В-цепей инсулина (гл. 4, разд. Г.7); значения углов ср и ф
получены с помощью построения молекулярных моделей по данным рентгеноструктур-
ного анализа с разрешением 0,19 нм. Большая часть конформаций соответствует ис-
каженной а-спирали или близка к p-структуре. 8, 20 и 23—-.это остатки глицина.
(Blundell Т„ Dodson G., Hodgkin D., Mercola D., Adv. Protein Chem., 26, 279—402,
1972.)
Таблица 2-3
Примерные значения торсионных углов для некоторых
регулярных пептидных структур®
Структура ф Ф
Гипотетическая полностью вытянутая цепь полиглицина —180- + 180°б
р-Поли(L-аланин) в антипараллель- ном складчатом слое —139° + 135°
Параллельный складчатый слой —119° + 113°
Полиглицин II -80° + 150°
Полн(Ь-пролин) II —78° + 149°
Коллаген® —51°, —76°, —45° + 153°, +127°, +1483 4
Правая а-спираль —57° —47°
3 По материалам комиссии IUPAC-IUB по биохимической номенклатуре, Bioche-
mistry, 9, 3471—3479, 1970.
6 Торсионные углы для полностью вытянутой цепи могут быть равным образом
обозначены как +180° или —180°, что полностью эквивалентно одно другому. Для
более удобного сравнения с другими структурами здесь принято, что <р = —180°,
Ф= + 180°.
° Набор из трех углов соответствует трем остаткам, образующим преобладающую
в коллагене повторяющуюся последовательность (Pro-Gly-Pro) n (Yonath A., Traub W.,
JMB, 43, 461—477, 1969.)
Антпипараллельная Параллельная p-стру^ура
РИС. 2-6. Структура складчатого P-слоя, образованного вытянутыми цепями. Слева
показана антнпараллельная структура в фиброине шелка. Периодичность — 0,70 нм —
несколько меньше, чем в полностью вытянутой цепи. Боковые цепи аминокислот (R)
располагаются поочередно то выше, то ниже изображенных на рисунке складок (на-
поминающих меха аккордеона). Пары водородных связей между цепями придают
структуре большую прочность. Цепь может повернуть назад (P-поворот, плп р-изгнб)
н идти вдоль самой себя. В средней точке P-поворота пептидная группа ориентирова-
на почти перпендикулярно плоскости складчатого слоя. Аналогичная структура обра-
зуется из параллельных цепей (справа), хотя в этом случае расположение водород-
ных связей чуть менее выгодно. Внизу приведено стереоизображение пептидного осто-
ва фермента карбоксипептндазы А [26]. Хотя на этом рисунке водородные связи не
показаны п даны лишь положения а-углеродных атомов, все же можно различить во-
семь участков цепи, идущих из левой верхней части молекулы направо вниз. Эти
цепи (среди которых есть и параллельные, и антипараллельные) связаны единой сетью
водородных связей. Рисунок можно рассматривать через специальные стереоскопиче-
ские очки', но после небольшой тренировки стереоизображение удается увидеть и без
очков (этому очень полезно научиться, так как множество молекулярных структур
публикуется теперь в журналах в виде стереоизображений). Поместите хорошо осве-
щенный рисунок на расстоянии 20—30 см от глаз. Расслабьте глаза так, как будто
вы смотрите в бесконечность. Из четырех возникающих изображений два централь-
ных нужно свести в одно, что и дает стереоскопический эффект. Довольно удачная
схема остова цепи в области ^-структуры приведена в книге Днккерсона и Гейса
(стр. 89) [13].
92
Глава 2
0,70 нм, тогда как полностью вытянутая цепь имеет периодичность
0,72 нм (рис. 2-4). Как показали Полинг и Кори, это укорочение цепи
может быть обусловлено изменением угла <р на ~40° (до значения
—140°) и изменением угла ф в противоположном направлении на ~55°
(до значения +135°), в результате чего образуется как бы «гофриро-
ванная» многоцепочечная структура, названная складчатым слоем
(рис. 2-6). В белках нередко встречается и параллельная p-структура.
в. Полиглицин II и коллаген
Известна и другая форма полиглицина, в которой каждый аминокис-
лотный остаток повернут на 120° относительно предыдущего вокруг
винтовой оси 3-го порядка (вид с торца показан на рис. 2-7,Л). Угол
ф для каждого остатка равен примерно 150°, а <р----80°. Смещение
вдоль оси составляет 0,31 нм на остаток, периодичность — 0,93 нм. Мо-
лекулы могут образовывать как правую, так и левую спирали. Группы
N—Н и С=О в такой структуре выступают из спирали перпендикуляр-
но ее оси. При этом, как и в [3-структуре, между соседними цепочками
образуются водородные связи.
Весьма сходную с полиглицином II спиральную структуру имеет
поли (L-пролин). Из-за присутствия больших по размеру боковых групп
более предпочтительной оказывается левая спираль. Надо сказать, что
для полипептидной цепи из L-аминокислот любой способ укладки в спи-
раль будет приводить к разной стабильности правой и левой спиралей.
В организмах животных в очень большом количестве присутствует
коллаген — главный белковый компонент соединительной ткани, базаль-
ных мембран и других структур. Структурной единицей коллагена слу-
жит тропоколлаген, который, как считают, представляет собой отрезок
тройной спирали размером 1,5X280 нм. Он напоминает полиглицин II
(рис. 2-7,Л), но содержит только три цепи. При этом индивидуальные
левоспиральные цепочки оказываются далее скрученными в правую су-
перспираль.
Преобладание в белках какой-то одной аминокислоты — довольно
редкое событие. Коллаген же содержит 33% глицина, 21% приходится
на пролин +оксипролин и 11% составляет аланин. Все дело в том, что
крупные по размеру боковые группы не могут уместиться внутри трой-
ной спирали. То же самое относится и к фиброину шелка, который со-
стоит в основном из периодически повторяющейся последовательности
(—G1 у—Ser—G1 у—А1 а—G1 у—А1 а—) „.
В этом случае при образовании складчатого слоя все боковые группы
серина и аланина оказываются по одну сторону слоя, а в другую обра-
щены лишь атомы водорода глицина. В результате слои прилегают друг
к другу более тесно — боковые цепи аланина и серина одного слоя
встраиваются в промежутки между боковыми цепями аланина и серина
соседнего слоя [19].
г. а-Спираль
Весьма интересный набор конформаций реализуется в том случае,
когда оба угла, <р и ф, близки к —60°. Этой области углов соответству-
ют спиральные структуры, стабилизированные внутрицепочечными во-
дородными связями. Наибольший интерес представляет а-спираль
(рис 2-8), причем правая спираль из L-аминокислот намного стабиль-
нее левой. Пока в природе обнаружены только правые а-спирали. Об-
РИС. 2-7А Структура полиглици
на II и коллагена. Л. Вид на
структуру полиглицина II вдоль
оси спирали. Обратите внимание
иа наличие винтовой оси 3-го по-
рядка. Сходную структуру обра-
зует полипролин, а коллаген, по-
видимому, представляет собой
тройной «канат» из трех пептид-
ных цепей, структура которых то-
же близка к той, что здесь изо-
бражена, однако при этом наблю-
дается правая суперспирализация.
Б. Электронная микрофотография
базальной мембраны (между стрел-
ками) н расположенных ниже кол-
лагеновых фибрилл на срезе ко-
жи земноводного. Нити диамет-
ром 1,5 нм в области базальной
мембраны (указаны стрелками),
по-вндимому, представляют собой
отдельные молекулы тропоколла-
гена, уложенные параллельно, но
с «отставанием на четверть», из-
за чего и возникает периодичность
в 64 нм. Некоторые фибриллы
видны в поперечном сечении (по-
мечены крестиком). (С любезно-
го разрешения Elizabeth D. Нау.)
94
Глава 2
ратите внимание, что в а-спирали все С = О и N—Н-группы, образующие
пептидные связи, примерно параллельны оси спирали; при этом каждая
карбонильная группа образует водородную связь с четвертой по ходу
цепи N—Н-группой. Число аминокислотных остатков на виток спирали
равно 3,61. Шаг спирали (поддающийся экспериментальному определе-
нию с помощью ренпеноструктурного анализа) составляет 0,541 нм.
Роговой слой кожи, волосы, ногти, иглы дикобраза — все эти струк-
туры построены из ряда белков, известных под общим названием кера-
тин. Один из главных компонентов кератина1, так называемый «белок с
низким содержанием серы», состоит из а-спиралей, шаг которых равен
не 0,54 нм, а только 0,51 нм. Такое уменьшение шага объясняется тем,
что две или три правые а-спирали обвиваются одна вокруг другой, фор-
мируя левую суперспираль, которая образует микрофибриллы диамет-
ром около 2,0 нм [19—21]. Считают, что такая же структура лежит в
основе мышечных белков — миозина [22] и тропомиозина [23] (гл. 4,
разд. Е.1). Обычно оба эти белка изображают в виде двунитевых «ка-
натов», в которых гидрофобные боковые группы одной цепи располо-
жены в углублениях на поверхности соседней цепи2.
Встречаются и другие спиральные структуры, диаметр которых мо-
жет быть как больше, так и меньше, чем диаметр а-спирали; они также
играют определенную роль в формировании структуры белков [13].
В спирали Зю на один виток приходится ровно три остатка; каждый
карбонил связан водородной связью с третьей по ходу цепи N—Н-груп-
пой. Таким образом, эта спираль закручена сильнее, чем а-спираль.
л-спираль содержит 4,4 остатка на виток и по диаметру превосходит
а-спираль. Хотя Зю- и л-спирали не относятся к основным структурным
элементам белков, они тем не менее встречаются в них, чаще всего об-
разуя по одному витку на концах спиралей.
4. Глобулярные белки
Большинство белков живой клетки характеризуется значительно
более сложным способом свертывания цепи по сравнению с фибрилляр-
ными белками3. Первым белком, для которого методом рентгенострук-
турного анализа была установлена полная трехмерная структура, стал
миоглобин — небольшой (мол. вес 17 500) кислород-связывающий бе-
лок, присутствующий в мышцах. 153 аминокислотных остатка миоглоби-
на распределено в основном по 8 а-спиральным участкам различной
длины, содержащим от 7 до 26 остатков. Спиральные участки, имеющие
вид прямолинейных стержней, расположены в пространстве весьма не-
регулярным образом, как это показано на рис. 2-8. Рисунок не дает
полного представления о строении белка, поскольку пространство меж-
' Принято считать, что другие белки, входящие в состав кератина, образуют аморф-
ную «матрицу», пронизанную микрофибриллами. Одним из белков «матрицы» является
1«белок с высоким содержанием серы», богатый цистеином и имеющий большое число
поперечных связей. Наиболее богаты цистеином волосы человека.
2 Тенденция к сплетанию и образованию структуры типа «каната» определяется
Тем, что стабилизирующие структуру периодически повторяющиеся связи между це-
почками могут образоваться лишь в том случае, если цепочки обвиваются одна во-
круг другой [23а].
3 Способ укладки пептидной цепи (образование спирали или 0-структуры) часто
Называют вторичной структурой белка. Дальнейшая укладка молекулы, основанная на
взаимодействии групп, далеко отстоящих друг от друга вдоль цепи, приводит к фор-
мированию третичной структуры. Агрегация мономерных белковых субъединиц в оли-
Ьомеры (гл. 4) определяет четвертичную структуру белка.
Молекулы, из которых мы состоим
95
РИС. 2-8. а-Спираль. А. Правая спираль с вер-
тикально расположенными водородными свя-
зями, изображенными в виде пунктирных ли-
ний. Положения боковых цепей аминокислот
указаны цифрами в порядке возрастания от
С-конца к N-концу полипептидной цепи (об-
щепринятым для пептидной цепи является об-
ратное направление — от N-конца к С-кон-
цу. — Перев.) Б. Конформация пептидного ос-
това миоглобина (Kendrew J. С., Sci. Am.,
205, 96—ПО, Dec. 1961). Пять длинных а-спи-
ралей изображены в виде цилиндрических
стержней. Видно еще несколько более корот-
ких спиралей. Полный размер молекулы —
приблизительно 4,4X4,4X2,5 нм.
Шаг спирали равен смещению вдоль оси спирали,
приходящемуся на один витон. Смещение вдоль оси
на один остаток равно шагу спирали, деленному на
число остатков в пределах одного витка; для а-с.лирали
эта величина равна 0,54 /3,6 == 0,15нм
96
Глава 2
ду стержнями и внутри молекулы в действительности целиком заполне-
но боковыми цепями аминокислот, причем почти все они имеют гидро-
фобный характер. Большинство же полярных боковых цепей выступают
из спиралей наружу, в окружающую водную среду.
По мере расшифровки структуры различных белков (особенно в
последние годы) становилось все более очевидным, что глобулярные
белки, как и миоглобин, сохраняют свою структуру преимущественно
благодаря взаимодействию между гидрофобными остатками. Внутри
молекулы белка боковые группы уложены исключительно компактно.
Если где-нибудь в структуре остается свободное пространство, оно
обычно заполняется водой [24, 25]. Например, плотность упаковки (от-
ношение объема, ограниченного вандерваальсовой оболочкой, к полному
объему) молекул лизоцима и рибонуклеазы составляет ~0,75; для
сравнения укажем, что для плотно упакованных сфер теоретическое
значение плотности упаковки равно 0,74. Полярные группы обычно на-
ходятся на поверхности, но иногда бывают «утоплены» внутрь, образуя
водородные связи с другими группами внутри молекулы белка. На от-
дельных участках поверхности встречаются и неполярные боковые цепи,
которые в ряде случаев сгруппированы в гидрофобные кластеры. По-
следние могут обусловливать взаимодействие с другими белками или с
липидными участками мембран.
Миоглобин является в каком-то смысле исключительным белком, по-
скольку у большинства других глобулярных белков содержание «-спи-
ральных участков оказывается сравнительно невысоким. Например, со-
ставленная из 129 остатков цепь лизоцима (рис. 2-9), одного из самых
небольших ферментов (мол. вес 14 600), содержит лишь несколько ко-
ротких спиралей. Цепь лизоцима уложена по большей части сложным и
нерегулярным образом. Обратите внимание на область, содержащую
антипараллельный складчатый [3-слой. Он начинается с участка между
остатками 42 и 45, далее цепь поворачивает назад, формируя петлю
наподобие шпильки, и между остатками 51—54 и 42—45 образуются
водородные связи. Складчатая структура просматривается и в некото-
рых других частях цепи.
Характерной особенностью молекул более крупных белков является
наличие четко выраженной 0-структуры в центральной части молекулы.
Примером может служить фермент карбоксипептидаза А, состоящий из
307 остатков (рис. 2-6, внизу) [26]. 0-Структура, изогнутая в виде лопа-
сти левого пропеллера, образует своеобразную жесткую «основу», к ко-
торой прикрепляются остальные части молекулы. Многие белки содер-
жат как участки, имеющие параллельную 0-структуру, так и участки с
антипараллельной 0-структурой. Для ряда крупных белков, например
для глицеральдегидфосфатдегидрогеназы (334 остатка), характерно
присутствие четко различимых доменов (двух или более), соединенных
друг с другом «шарнирными» участками . [27]. Преобладающей струк-
турой в каждом из двух доменов является складчатый 0-слой
(рис. 2-10). Обратите внимание, что ЫАП+-связывающий домен имеет
почти всюду параллельную 0-структуру, тогда как «каталитический»
домен содержит как параллельные, так и антипараллельные цепи. Оба
домена имеют а-спиральные участки, расположенные по обе стороны
от центрального слоя.
Если трехмерную структуру лучше всего изображать в виде стерео-
пар, то характер распределения водородных связей внутри молекулы
яснее всего виден на двумерных диаграммах, одна из которых представ-
лена на рис. 2-11.
Молекулы, из которых мы состоим
97
6S
РИС. 2-9. Укладка полипептидиой цепи фермента лизоцима. (Dickerson R. Е., Geis J,
The Structure and Action of Proteins, p. 71. Benjamin, New- York, 1969.) Для большей
части молекулы показаны только места присоединения боковых цепей (атомы а-уг-
лерода). На одном из участков изображены также атомы, участвующие в образова-
нии пептидной связи, что позволяет видеть расположение водородных связей в аити-
параллельиой ф-структуре в центральной части молекулы. Указана одна из а-спира-
лей. Шестиугольники, заштрихованные в средней части, изображают остов полисаха-
ридного субстрата, связанного в «активном центре». Предполагается, что карбоксиль-
ная группа остатка 35 способствует разрыву О—С-связи (жирные стрелки) (гл. 7,
разд. В.4.а). Стрелка слева указывает положение одного из трех дисульфидных мо-
стиков. (В действительности в молекуле лизоцима имеется четыре дисульфидных
мостика. Кроме трех, указанных на рисунке, есть еще мостин между остатками 76 и
94 — на рисунке он должен был бы проходить под молекулой субстрата. — Перев.)
Видны и остальные два мостика — одни находится правее и выше, а другой — левее
и ниже центральной части молекулы.
Исследование синтетических полипептидов, а также анализ извест-
ных белковых структур, полученных с помощью рентгеновской кристал-
лографии, показали, что некоторые аминокислоты, например глутами-
новая кислота, аланин и лейцин, способствуют образованию а-спирали.
Другие аминокислоты, в частности метионин, валин и изолейцин, чаще
|8
Глава 2
РИС. 2-10. Схематическое изображение двух доменов в молекуле глицеральдегидфос-
фатдегидрогеназы (из мышц омара). А. МАО+-связывающий домен. Цифры указыва-
ют номера аминокислотных остатков в последовательности; аВ, аС и т. д., £А, £В
и т. д. обозначают соответственно а-спирали и цепи складчатого fj-слоя. Б. Катали-
тический домен, ориентированный так, чтобы был лучше виден складчатый слой в
области контакта между субъединицами [27].
встречаются в составе ^-структуры, тогда как глицин, пролин и аспа-
рагин обычно расположены в местах изгиба цепи. Напрашивается вы-
вод, что способ укладки полипептида прямо определяется его последо-
вательностью. Так, если в каком-то месте цепи сосредоточено несколько
остатков, способствующих образованию спирали, то образуется спи-
раль. Эта спираль растет в обоих направлениях до тех пор, пока не
«натолкнется» на остатки (например, пролин), препятствующие ее об-
разованию. Подобным же образом, если сгруппированы соответствую-
Молекулы, из которых мы состоим
99
РИС. 2-11. Схематическое изображение системы водородных связей между группами
главной цепи в НАВ+-связывающем домене (остатки 1 —149) глицеральдегидфосфат-
дегидрогеназы [27].
щие остатки, образуется [3-структура. Нерегулярная укладка других
участков цепи приводит к образованию дополнительных водородных
связей и большого числа гидрофобных связей, в особенности характер-
ных для внутримолекулярных областей глобулярных белков.
Теперь, когда известна трехмерная структура многих белков, пыта-
ются предсказывать способ укладки других белковых молекул, исходя
100 Глава 2
из их аминокислотной последовательности [28—30]. Один из таких
методов основан на определении численным методом значений «конфор-
мационных параметров», дающих вероятность нахождения данного ос-
татка в составе спирали, ^-структуры и p-изгиба (табл. 2-4). Согласно
Чоу и Фасману [29], если из шести сгруппированных остатков четыре
способствуют образованию спирали, данную группу можно рассматри-
вать как центр спирализации. От этого центра спираль разрастается в
Таблица 2-4
Классификация аминокислотных остатков по их способности к образованию
1 а-спирали, (3-структуры и |3-изгибаа
Аминокислота P« Тенденция к обра- зованию спирали Тенденция к образо- ванию ft-структуры pt
Glu- 1 ,53 ++ 0,26 анти.-р 0,44
Ala 1 ,45 ++ 0,97 СЛ. 0,57
Leu 1 ,34 1,22 + 0,53
His+ 1,24 + 0,71 анти. 0,69
Met 1,20 + 1 ,67 ++ 0,67
Gin 1 ,17 + 1 ,23 + 0,56
Trp 1,14 + 1 ,19 + 1,11
Vai 1,14 + 1 ,65 ++ 0,30
Phe 1,12 + 1 ,28 + 0,71
Lys+ 1 ,07 сл. 0,74 анти. 1,01
He 1,00 » 1 ,60 ++ 0,58
Asp- 0,98 безр. 0,80 ++ 1,26
Thr 0,82 » 1 ,20 + 1,00
Ser 0,79 » 0,72 анти. 1,56
Arg+ 0,79 » 0,90 безр. 1,00
Cys 0,77 1,30 + 1,17
Asn 0,73 анти. 0,65 анти- 1,68
Tyr 0,61 » 1,29 + 1,25
Pro 0,59 анти. -|- 0,62 анти. 1,54
Gly 0,53 » 0,81 безр. 1,68
• Конформационные параметры Ра, и Pt представляют собой частоты встре-
чаемости данной аминокислоты в составе а-спирали, (3-структуры или (3-изгиба (по
данным для 15 белков с известной структурой), деленные на среднюю частоту встре-
чаемости данной аминокислоты в молекуле. Аминокислотные остатки в таблице рас-
положены в порядке убывания их способности образовывать спираль. Символы «-(—
« + », «сл.», «безр.», «анти.» и «анти.-р» означают, что аминокислота характеризуется
соответственно сильной тенденцией к образованию данной структуры, умеренной тен-
денцией, слабой тенденцией, что ей безразлично, в какой структуре она будет нахо-
диться, что она противодействует нли сильно противодействует образованию структу-
ры данного типа [29].
обоих направлениях, пока ей не встретится тетрапептид из остатков,
препятствующих образованию спирали. Подобным же образом три
остатка из пяти, способствующие образованию (3-структуры, играют
роль затравки для формирования |3-слоя. В этом случае большое зна-
чение имеет возможность образования связей с другими участками це-
пи, отделенными от растущего (3-слоя p-изгибами или участками с нере-
Молекулы, из которых мы состоим 101
гулярной конформацией (статистический клубок). Устраивались даже
своего рода конкурсы, в ходе которых разные группы исследователей
пытались предсказать способ укладки цепи в белках непосредственно
перед определением их структур кристаллографическими методами [31].
Недавно Левитт и Хотиа провели классификацию группы белков, в
которую они включили 31 белок с известной структурой; получились
четыре четко различающиеся структурные группы. (I)- а-Белки, в кото-
рых, как в гемоглобине и миоглобине, преобладают а-спирали.
(II) Белки, построенные из |3-слоев, расположенных один над другим
и образующих многослойную структуру; в эту категорию, в частности,
попадает небольшой белок рубредоксин (рис. 10-4), а также конкана-
валин А (рис. 5-7). (III) (а + р)-Белки, у которых в состав одной и той
же полипептидной цепи входят участки, целиком построенные из
а-спиралей, и участки, целиком состоящие из [3-слоев (как правило, ан-
типараллельных). Примерами таких белков могут служить папаин и
термолизин (гл. 7). (IV) а/р-Белки, в которых а-спирали и p-цепи че-
редуются по ходу полипептидной цепи. Обычно здесь имеется один
центральный p-слой, по обе стороны которого располагаются спираль-
ные участки; такая ситуация имеет место, например, в карбоксипепти-
дазе (рис. 2-6), глицеральдегидфосфатдегидрогеназе (рис. 2-10), а так-
же в гексокиназе и фосфоглицераткиназе (рис. 7-5).
5. Дисульфидные мостики
К характерным особенностям структуры молекулы лизоцима
(рис. 2-9) относится также присутствие четырех поперечных дисульфид-
ных связей (дисульфидных мостиков) между различными участками
цепи. Эти мостики возникают самопроизвольно в тех случаях, когда
—SH-группы двух боковых цепей цистеина подходят близко друг к
другу и окисляются в присутствии О2 или некоторых других реагентов
[уравнение (2-8)]. Дисульфидные связи довольно часто встречаются в
белках, секретируемых клетками, и значительно реже образуются во
внутриклеточных ферментах. Вероятно, внутри клеток ферменты защи-
щены от многих внешних воздействий и не нуждаются в дополнительной
стабилизации.
2—СН2—SH >— Н2С СН2— (2-8)
Xs—S
Один из белков, обладающих наибольшей концентрацией попереч-
ных связей, присутствует в так называемой кератиновой «матрице».
Разрушение дисульфидных связей в этом белке лежит в основе химиче-
ской завивки волос (перманент). Для этого используется какое-либо
тиоловое соединение, под действием которого осуществляется восстано-
вительный разрыв поперечных дисульфидных связей. После укладки
волос окисление на воздухе приводит к образованию новых поперечных
связей.
Немаловажное значение имеет геометрия дисульфидных мостиков.
Торсионный угол при S—S-связи равен, как правило, ^90°, но бывают
и довольно заметные отклонения от этой величины.
^СНг
I
(?)---- СН2
Bud вдоль линии связи S—S
102 Глава 2
6. Размеры и форма молекул белка
Как внутренняя структура белков, так и их размеры и форма могут
сильно различаться. Некоторое представление об имеющихся здесь воз-
можностях дает рис. 2-12, на котором показано несколько способов ук-
ладки полипептидной цепи из 300 аминокислотных остатков. В пол-
ностью вытянутой конформации цепь растягивается до ~ 100 нм. Если
ее сложить 13 раз, то образовавшийся складчатый слой будет иметь
форму квадрата со стороной 7 нм и толщиной около 0,5 нм. Из той же
полипептидной цепи можно получить тонкий а-спиральный стержень
длиной 45 нм и толщиной ~ 1,1 нм. Вместе с двумя другими такими же
цепями (при наличии соответствующего аминокислотного состава) эта
20 НМ
РИС. 2-12. Формы, которые может иметь молекула белка из 300 аминокислотных
остатков (мол. вес —34 500).
Молекулы, из которых мы состоим ЮЗ
цепь может дать тройную спираль коллагенового типа длиной 87 нм и
диаметром ~ 1,5 нм. (Заметим, что это составляет около '/з длины мо-
лекулы тропоколлагена.)
Глобулярные белки заметно различаются по плотности упаковки и
по содержанию гидратационной воды [24, 25]. Однако наиболее типична
для них плотность ~ 1,4 г-см“3. При средней массе остатка в 115 даль-
тон наш полипептид из 300 остатков составит по массе 34 500 дальтон,
или 5,74-10”20 г, и займет объем в 41 нм3. Это может быть куб с ребром
3,45 нм, параллелепипед размерами 1,8X3,6x6,3 нм, сфера диаметром
4,3 нм или же какое-то геометрическое тело весьма неправильной
формы. При расчетах молекулу белка чаще всего представляют в виде
идеализированного эллипсоида или цилиндра.
Полезно сравнить эти размеры с размерами самых мелких клеточ-
ных структур; например, жгутик бактерии имеет диаметр ~ 13 нм, а
толщина клеточной мембраны составляет ~8—10 нм. Из кирпичиков,
эквивалентных по размеру цепи из 300 остатков, могут быть построены
жгутики бактерий или микротрубочки эукариот. а-Спиральный полипеп-
тид может пройти сквозь клеточную мембрану, выступая с обеих сто-
рон, тогда как глобулярный белок с той же длиной цепи целиком
уместится внутри мембраны.
Дополнение 2-А
Белки плазмы крови
Из всех белков лучше всего изучены белки, присутствую-
щие в плазме кровиа’б-в. Простота их выделения и большое
клиническое значение привели к тому, что уже в ранний пери-
од их исследования эти белки были разделены электрофорети-
чески. Электрофорез при pH 8,6 (в барбиталовом буфере)
указывает на присутствие шести главных компонентов. Быст-
рее всех перемещается присутствующий в наибольших количе-
ствах сывороточный альбумин. Далее следуют аг, аг- и р-гло-
булины, фибриноген и у-глобулины. Электрофорез в крах-
мальном геле приводит к расщеплению каждой из этих полос,
так что в конце концов их получается примерно 20. Каждая
из полос содержит, как правило, более одного белка. В общей
сложности выделено и хорошо охарактеризовано свыше 50
белков плазмы крови. В плазме обнаружено примерно 60 фер-
ментов, содержание некоторых из них очень мало — по-види-
мому, их наличие связано с выходом в плазму небольшого ко-
личества внутриклеточных белков.
В норме общее содержание сывороточных белков лежит в
интервале 5,7—8,0 г на 100 мл (~1 мМ). Содержание инди-
видуальных белков варьирует от 3,5—4,5 г на 100 мл для аль-
бумина до нескольких миллиграммов и менее для некоторых
других белков. На втором месте по количеству идут иммуно-
глобулины (дополнение 5-Е); содержание одного из них
(IgG) достигает 1,2—1,8 г на 100 мл. ai-Антитрипсин, аг-мак-
роглобулин, а- и p-липопротеиды, гаптоглобулин, трансфер-
рин и фибриноген присутствуют в количестве более 200 мг на
100 мл.
104 Глава 2
Белки плазмы выполняют множество функций. Одна из
них, присущая в основном сывороточному альбумину, состоит
в поддержании в плазме достаточно высокого осмотического
давления, сравнимого с давлением в цитоплазме клеток. Сы-
вороточный альбумин человека состоит из одной цепи, содер-
жащей 584 аминокислотных остатка; его мол. вес равен
69 000. В молекуле имеются три повторяющиеся гомологичные
области — три домена, каждый из которых содержит шесть
дисульфидных мостиков. Можно предположить, что в ходе
эволюции ген, детерминирующий этот белок, дважды дупли-
цировался1'. Сравнительно низкий молекулярный вес и высокая
плотность отрицательных зарядов на поверхности молекулы
очень помогают сывороточному альбумину в выполнении его
функции, связанной с поддержанием осмотического давления.
Другой важной функцией сывороточных белков является
их транспортная функция. Так, сывороточный альбумин свя-
зывает и переносит многие слаборастворимые продукты мета-
болизма. Трансферрин переносит железо, а церулоплазмин
(аг-белок, см. дополнение 10-3)—медь. Транскортин — это
переносчик стероидных гормонов, в частности кортизола; бе-
лок, связывающий ретинол, является переносчиком витами-
на А, а белки, связывающие кобаламин, переносят витамин
В12. Липопротеиды, подразделяющиеся на три основных клас-
са, переносят фосфолипиды, нейтральные липиды и эфиры
холестеринад. Главным компонентом этих веществ служит ли-
пид. Фракция ai сыворотки содержит липопротеид с высокой
плотностью6. Фракция, идущая непосредственно перед p-бел-
ками, содержит липопротеид с очень низкой плотностью, а в
p-фракции присутствует липопротеид с низкой плотностью.
Все эти белки сейчас интенсивно исследуются. Большой инте-
рес к ним обусловлен их связью с сосудистыми заболевания-
ми, а также с отложением холестерина и других липидов, пе-
реносимых белками плазмы, в атеросклеротических бляшках.
Иммуноглобулины, ингибитор трипсина ai (дополнение
7-В), десяток или больше факторов свертывания крови
(рис. 6-16) и белки системы комплемента (дополнение 5-Ж)
несут защитные функции; этот вопрос будет рассмотрен не-
сколько позже. Гормоны, многие из которых являются белка-
ми (табл. 16-1), присутствуют в крови в процессе их перено-
са к органам-мишеням. Функции целого ряда сывороточных
белков пока не известны. К ним, в частности, относятся мно-
гие гликопротеиды. Концентрация некоторых из них, напри-
мер гаптоглобина (а также аг-макроглобулина), имеет тен-
денцию повышаться при самых разнообразных патологиче-
ских состояниях организма.
а Putnam F. W. ed., The plasma Proteins, 2nd ed., Vols. 1 and 2, Acade-
mic Press, New York, 1975.
6 White A., Handler P., Smith E. L., Principles of Biochemistry, 5th ed.,
Chapter 30, McGraw-Hill, New York, 1973.
B Turner M. W., Hulme B„ The Plasma Proteins: An Introduction, Pitman,
London, 1971.
r Behrens P. Q., Spiekerman A. M., Brown J. R., Fed. Proc., 34, 591
(1975).
д Morrisett J. D., Jackson R. L., Gotto A. M., Jr., Annu. Rev. Biochem.,
44, 183—207 (1975).
e Schonfeld G., Pfleger B„ Roy R., JBC 250, 7943—7950 (1975).
Молекулы, из которых мы состоим 105
7. Конформационные изменения в полипептидах
Полипептидные цепи могут принимать вытянутую конформацию с
образованием водородных связей между участками одной и той же цепи
(p-структура) или находиться в одной из нескольких спиральных форм.
Иногда данный белок принимает то одну, то другую конформацию. До-
вольно характерным примером такого рода служит а-спиральный белок
с низким содержанием серы, входящий в состав волос (разд. Б.З.г). Во-
лос можно очень сильно вытянуть — в этом случае а-спирали раскручи-
ваются и цепь переходит в p-конформацию, причем вместо водородных
связей внутри одной и той же цепи образуются водородные связи меж-
ду цепями.
С растворимыми белками ситуация более сложна, по и в этом слу-
чае цепь может складываться по-разному; здесь также происходит со-
ответствующая перестройка системы водородных связей и гидрофобных
взаимодействий между боковыми группами. Одни конформации, в прин-
ципе возможные для глобулярного белка, более устойчивы, чем дру-
гие, и обычно белок принимает одну из энергетически наиболее выгод-
ных конформаций. Не исключено, однако, и наличие других конформа-
ций с почти той же энергией1. Отсюда следует, что многие белки могут
почти беспрепятственно переходить из одной конформации в другую —
этот факт имеет очень большое биологическое значение.
Конформационные изменения в белках, по всей вероятности, облег-
чаются тем, что некоторые группы, связанные водородными связями,
находятся во внутренней гидрофобной области молекулы белка. Обычно
все «внутренние» атомы водорода, определяющие возможность образо-
вания водородных связей, связаны с соответствующей группой — доно-
ром электронов. Однако, как правило, таких групп больше, чем доступ-
ных атомов водорода, что порождает конкуренцию электроотрицатель-
ных центров за протоны и создает основу для инициации конформаци-
онных изменений [32].
Крайний случай конформационного изменения — денатурация бел-
ков, которая может быть вызвана нагреванием или обработкой различ-
ными реагентами, например сильными кислотами и основаниями, моче-
виной, гуанидингидрохлоридом и додецилсульфатом натрия. Денатура-
ция приводит к развертыванию молекулы белка, и он переходит в бо-
лее или менее разупорядоченное состояние (здесь уже почти нет ни спи-
ралей, ни 0-слоев, ни любых других типов регулярной укладки цепи).
В денатурированном состоянии амидные группы пептидной цепи обра-
зуют водородные связи с окружающими их молекулами воды; таких во-
дородных связей значительно больше, чем внутримолекулярных. Специ-
фическая биологическая активность белка при денатурации теряется,
изменяются и физические свойства, например меняется константа седи-
ментации, вязкость и поглощение света. Легкость, с которой происходит
денатурация белка, и тот факт, что денатурация в принципе обратима,
свидетельствуют о том, что различия в энергии между свернутыми кон-
формациями и открытой конформацией статистического клубка неве-
лики.
Полная денатурация белка долгое время считалась необратимой, но
в 1956 г. Анфинсен показал, что денатурированная рибонуклеаза (гл. 1,
1 Ни одна из вычислительных машин не обладает мощностью, достаточной для
систематического исследования энергий всех конформаций, в которых может находить-
ся простейший белок. Следовательно, высказанное нами утверждение нельзя выразить
количествеиио.
106 Глава 2
разд. Д.2) может самопроизвольно возвращаться к исходному состоя-
нию [33]. Молекула рибонуклеазы, состоящая из 124 остатков, содер-
жит четыре дисульфидных мостика, которые делают ее структуру очень
прочной. Когда эти мостики разрываются в присутствии восстановителя
(разд. 3.3.а), фермент легко денатурирует и инактивируется. Однако
Анфинсен обнаружил, что окисление в соответствующих условиях при-
водит к полному восстановлению активности рибонуклеазы. Очевидно,
молекула способна самопроизвольно свертываться с образованием пра-
вильной конформации — именно той, при которой осуществляется
единственный из 28 возможных способов попарного соединения восьми
—SH -групп, приводящий к образованию нужной четверки дисульфид-
ных мостиков. Этот факт оказал сильное влияние на наши представле-
ния о синтезе белка и свертывании полипептидных цепей с образовани-
ем биологически активных молекул [34, 34а].
Обычно предполагают, что специфическое свертывание полипептид-
ной цепи начинается еще во время ее синтеза на рибосоме. Растущая
цепь свертывается случайным образом и в конце концов принимает наи-
более устойчивую конформацию. По окончании синтеза пептидной це-
пи молекула самопроизвольно складывается в «нативную» конформа-
цию. Однако специфическую биологическую активность белок чаще все-
го приобретает лишь после его модификации другими ферментами, что
иногда приводит к дальнейшему изменению конформации.
В. Сахара и полисахариды
Простейшие сахара (моносахариды) и их олигомеры и полимеры
(полисахариды) составляют один из главных классов клеточных ком-
понентов, объединяемых под общим названием углеводов. Типичным
мономерным звеном служит a-D-глюкоза (а-глюкопираноза)—цик-
лическая форма глюкозы:
Обратите внимание, что этот
атом углерода непосредственно
связан с двумя атомами кис-
лорода; он находится в центре
полуацетальной группы, и его
Ф 11 часто называют аномерным
С атомом углерода
Реакционноспособный
полуацетальный гидроксил
Реакционноспособными группами, участвующими в образовании
связи между мономерами, являются два типа —ОН-групп: полуацеталь-
ная гидроксильная группа плюс еще один гидроксил при любом из
атомов углерода. Разнообразие в типах мономеров и в положениях, по
которым осуществляется связь между ними, приводит к необозримому
множеству полисахаридных структур.
Молекулы, из которых мы состоим Ю7
Сахарные звенья в полисахаридах соединяются посредством
гликозидных (апетальных) связей [уравнение (2-9)]. Уравнение
(2-9) описывает образование дисахарида мальтозы из двух молекул
глюкозы. Дальнейшее присоединение глюкозы в конце концов дает по-
лимер. Символ а-1,4 означает, что в мальтозе гликозидная связь соеди-
няет атом С-1 (аномерный атом углерода) одного сахарного кольца
с атомом С-4 другого кольца, причем конфигурация относительно ано-
мерного атома углерода относится к a-типу (см. следующий раздел).
Функциональными группами полисахаридов являются многочис-
ленные свободные гидроксильные группы, которые иногда вовлекаются
в образование дополнительных гликозидных связей, в результате чего
формируются разветвленные цепи. Кроме того, наличие гидроксильных
групп обеспечивает возможность структурной модификации сахарного
основания еще до полимеризации. В результате полисахарид наряду
с гидроксильными группами может содержать группы •—СООН,
—NH2, сульфат, —NHCOCH3 и другие функциональные группы.
1. Структура и свойства сахаров
Сахара подразделяются на полиоксиальдегиды (альдозы) и полиок-
сикетоны (кетозы). Карбонильная группа обладает высокой реакцион-
ной способностью; типичной реакцией является присоединение групп,
содержащих избыточные электроны, в частности —ОН-группы (гл. 7,
разд. 3). Если сахарная цепочка достаточно длинна (4—6 атомов уг-
108 Глава 2
лерода), к карбонильной группе может присоединяться одна из гидрок-
сильных групп той же молекулы с образованием циклического полуаце-
таля— кольцевой формы, находящейся в равновесии со свобод-
ной альдегидной или кетонной формой [уравнение (2-10)]. Образован-
ные таким образом шестичленные кольца (пиранозные кольца) особен-
но устойчивы, но в некоторых углеводах встречаются и пятичленные
фуранозные кольца. Естественная тенденция пяти- и шестиуглеродных
сахаров (пентоз и гексоз) к циклизации обеспечивает образование ус-
тойчивых полимеров из чрезвычайно реакционноспособных неустойчи-
вых мономеров.
При циклизации сахара возникает новый хиральный центр при ато-
ме углерода (аномерном атоме углерода), ранее входившем в со-
став карбонильной группы. Две конфигурации относительно этого ато-
ма обозначаются как а- и p-конфигурации [уравнение (2-10)]. Равно-
весие для большинства сахаров сдвинуто в сторону образования цикли-
ческих форм. Так, для глюкозы при 25 °C в воде в равновесии содер-
жится ~0,02% свободного альдегида, 38% а-пиранозной формы, 62%
p-пиранозной формы и менее 0,5% каждой из гораздо менее устойчи-
вых фуранозных форм. Хотя полисахариды образованы, как правило,
из циклических остатков, промежуточными метаболическими соедине-
ниями являются иногда формы с открытой цепью.
Сахара содержат несколько хиральных центров, и различным диа-
стереомерам даны разные названия. Так, глюкоза, манноза и галакто-
за— это попросту три из восьми возможных диастереомерных альдо-
гексоз (другими являются аллоза, альтроза, гулоза, идоза и талоза)
[6]. Каждый из этих сахаров представлен парой форм (энантиоме-
ров)— D и L, являющихся зеркальным отображением одна другой.
Для иллюстрации взаимоотношений между сахарами часто пользуются
проекционными формулами Фишера (разд. А.4), как это показано на
рис. 2-13. Проекционные формулы удобны для сопоставления структур
сахаров, но они дают весьма смутное представление о их трехмерной
структуре. Согласно указанию Фишера, вертикальные связи при каж-
дом атоме углерода следует представлять уходящими за данный атом.
В действительности молекула такую конформацию иметь не может.
Сравните, например, трехмерную структуру рибита (разд. А.6), обра-
зующегося при восстановлении глюкозы, с его формулой Фишера.
Молекулы, из которых мы состоим 109
сно
Н — 2С — ОН *----v-манноза (Man) имеет
| противоположную конфигу-
ЫО— 3(р—]-[ рацию относительно
| атома С-2
Н—4С—ОН «--------D -галактоза (Gal) имеет
| противоположную конфигу-
__5Q — ОН рацию относительно
| атома С-4
6СН2ОН
D-глюкоза (Glc);
дана нумерация
атомов
СНО
I
но—с—н
I
н—с—он
I
но—с—н
но—с—н
I
СН2ОН
L-глюкоза
Сахара относят к ъ-
или ъ-семейству
в зависимости от кон-
фигурации относительно
этого атома углерода,
предпоследнего в цепи
СН2ОН
I
С=О
I Ъ-фруктпоза (Рги)-кетоза, близкая по структуре
носн и метаболически родственная п-глюкозе.
| В составе сахарозы (столовый сахар) присутствует
НСОН в виде пятичленного фуранозного кольца
неон
I р
СН2ОН /
СНО СНО 1 сно СНО
1 НСОН НСОН носн НСОН
НСОН носн 1 НСОН носн
1 НСОН 1 НСОН НСОН носн
1 СН2ОН 1 СН2ОН 1 СН2ОН СН2ОН
ъ-рибоза (Rib), компонент РНК п-ксилоза (Xyl), входит в состав древесины п-ара^иноза (Ага) Р-араёиноза, широко распространенная пентоза, имеющая „ неестественную"
и-конфигу рацию
РИС. 2-13. Структурные формулы некоторых сахаров (моносахаридов) согласно пра-
вилу Фишера.
Моносахариды относятся к D- или L-форме в зависимости от кон-
фигурации относительно хирального центра, наиболее удаленного от
карбонильной группы (рис. 2-13). Если в молекуле сахара, ориентиро-
ванной по правилу Фишера, —ОН-группа при этом атоме углерода на-
ходится справа, то сахар относят к D-семейству. Простейшим из всех
хиральных сахаров является глицеральдегид.
7,О
НС'
I
н—с—он
I
сн2он
D-глицеральдегид
110 Глава 2
Циклические формы сахаров часто тоже изображают в соответствии с
правилом Фишера. Например, a-D-глюкопираноза выглядит так:
Н — С—ОН
I
н—с—он
но—с—н °
н—с—он
н— с-------
снрн
ос-ъ-глюкопираноза
При данном способе изображения гидроксил при аномерном атоме уг-
лерода в молекуле a-формы у семейства D-сахаров находится справа,
а у семейства L-сахаров — слева. Таким образом, a-D-глюкопираноза
л a-L-глюкопираноза являются энантиомерами.
Чтобы упростить изображение конфигурации циклических сахаров,
часто применяют структурные формулы Хеуорса:
он
а- п-глюкопираноза
( хеуорсова структурная
формула)
Нижнюю часть кольца (жирные линии) нужно представлять выступаю-
щей к наблюдателю, противоположный же край — лежащим за плос-
костью рисунка. Структуры Хеуорса довольно просто рисовать, они од-
нозначно указывают конфигурацию, но не отображают взаимного про-
странственного расположения групп, присоединенных к кольцу. По
этой причине часто применяются конформационные формулы, представ-
ленные на рис. 2-14.
Большинство сахаров имеет конформацию кресла, при которой
большая часть замещающих групп располагается в экваториальной
плоскости. Для D-альдоз обычно наблюдается «С1»-конформация
(стр. 108), тогда как для L-альдоз характерна иная форма кресла
(форма «1С»), Из этого правила имеются исключения. Так, a-D-идо-
пираноза, по-видимому, принимает 1С-конформацию. Полезно также
отметить, что в кольцах для замещающих групп при аномерном атоме
углерода предпочтительной оказывается аксиальная ориентация [35].
Молекулы, из которых мы состоим
111
НО *— Разветвленные цепи крахмала (в амилопектине и гликогене)
i 6 | имеют точки ветвления в этих положениях
сх-Р-глюкоза (Glc)
Амилоза, линейный крахмал, содержит только
а-1,^-гликозидные связи, в образовании
которых участвуют группы, указанные
стрелками
р-ъ-глюкуроновой кислоты (GlcUA), входящей
многих мукополисахаридов, обведенная
группа замещена на С00*
Зта —ОН-группа в 2-ацетамид - 2-дезокси-
-D-глюкозе ( Ы-ацетилглюкозамине, GlcNAc),
/З-Ъ-глюкоза
(в целлюлозе)
мономерном звене хитина, замещена на
—
\
сна
/3-р-ксилоза
Анион мурамовой кислоты,
О-лактил-GlcNAc (Mur)
растительных ксиланов
З-о-фруктофураноза (Fru)
N-а цетил ней ра миновал
(сиаловая) кислот'1
РИС. 2-14. Структура некоторых циклических сахаров, входящих в состав полисаха-
ридов.
Восстановление карбонильной группы сахара (например, боргидри-
дом натрия) приводит к образованию сахарного спирта, например ри-
бита (разд. А.6) или сорбита [он получается при восстановлении глю-
козы; уравнение (11-8)]. Альдегидные группы альдоз могут окислять-
112 Глава 2
ся множеством реагентов, образуя карбоновые кислоты, известные как
альдоновые кислоты. Этим объясняется редуцирующий характер аль-
доз. Например, в щелочной среде альдозы восстанавливают ионы одно-
валентной меди до закиси меди, ионы серебра — до свободного метал-
ла, феррицианид — до ферроцианида. Последняя реакция может послу-
жить основой для создания чувствительного аналитического метода.
Даже с учетом того, что альдозы в основном существуют в форме по-
луацеталей [уравнение (2-10)], их восстановительные свойства совер-
шенно очевидны. В то время как восстановление реагентами, содержа-
щими металл, обычно проходит через образование свободного альдеги-
да, окисление гипобромитом (Вг2 в щелочной среде) приводит к обра-
зованию лактона, как это наблюдается, например, в ферментативной
реакции, описываемой уравнением (а), табл. 8-4.
Многие производные сахаров встречаются в природе. Среди них
можно назвать альдоновые кислоты [например, 6-фосфоглюконовая
кислота; уравнение (9-12)], а также уроновые кислоты, содержащие
—СООН-группу в концевом положении (в положении 6 глюкуроновой
кислоты; рис. 2-14). Группа —ОН во 2-м положении молекулы глюко-
зы может быть замещена на —NH2-rpynny с образованием 2-амино-2-
дезоксиглюкозы, обычно именуемой глюкозамином (GlcN), или на
—NH—СО—СНз-группу с образованием N-ацетилглюкозамина
(GlcNAc). Аналогичные производные есть и для других сахаров. Во
многих полисахаридах к сахарным звеньям посредством эфирной связи
присоединены сульфатные группы.
Широко распространены два 6-дезоксисахара (лишенные кислорода
при атоме С-6)—рамноза и фукоза1. Оба имеют «неестественную»
L-конфигурацию, хотя метаболически происходят соответственно от
D-глюкозы и D-маннозы.
СНО СНО
I I
Н—С—ОН НО—С—Н
I I
Н—С—ОН Н—С—он
I I
но—С—Н Н—С—он
но—С—Н но—с—н
СН3 (1нз
L-рамноза (Rha) L-фукоза (Fuc)
2. Олигосахариды
Для метаболизма растений и животных большое значение имеют
дисахариды и другие олигосахариды, состоящие из небольшого числа
мономерных звеньев. Примерами служат лактоза (содержащаяся в мо-
локе), сахароза (в зеленых растениях) и трегалоза (в грибах).
Если в свободных сахарах циклические а- и p-формы легко превра-
щаются одна в другую, то при образовании гликозидной связи конфигу-
рация относительно аномерного атома углерода становится «заморо-
женной». Для описания гликозидной связи требуется указать эту кон-
фигурацию и те положения, по которым соединяются кольца [см.
уравнение (2-9)]. Так, лактозу можно представить как дисахарид, со-
держащий одно галактозное звено в ^-пиранозной циклической форме,
1 Этот тип соединений называется также 5-метилпеитозами. — Прим. ред.
Молекулы, из которых мы состоим 113
соединенное через аномерный атом углерода (С-1) с 4-м положением
глюкозы (р-1,4-связь):
но он
D-галактоза D-глюкоза
се-Лактоза
Обратите внимание на а-конфигурацию
указанного стрелкой „редуцирующего
конца" сс-лактозы
Систематическое наименование а-лактозы — O-p-D-галактопиранозил-
(1—М)-a-D-глюкопираноза —полностью описывает стереохимию соеди-
нения, указывает размеры колец и способ их соединения. Сокращенная
запись имеет следующий вид: p-D-Galp-(l—>4)-a-D-Glcp. Мальтоза
записывается как a-D-Glcp-(l—>4)-a-D-Glcp. Поскольку чаще всего
встречаются именно пиранозные кольца и при этом большая часть при-
родных сахаров относится к D-семейству, символы D и р в таких запи-
сях обычно опускаются. Далее в этой книге (если отсутствуют специ-
альные указания) мы будем рассматривать только D-сахара. Иногда
даже после установления последовательности сахарных остатков в по-
лисахариде способ их связывания остается неопределенным: в этом слу-
чае пользуются неполными сокращенными формулами.
Обратите внимание, что на рисунке, изображающем структуру лак-
тозы, кольцо глюкозы «перевернуто» по отношению к галактозному
кольцу — это обусловлено наличием между ними р-1,4-связи. При изо-
бражении мальтозы, у которой связь относится к типу а-1,4, оба коль-
ца даются в одной и той же ориентации [уравнение (2-9)].
В молекуле лактозы кольцо глюкозы может раскрыться с перехо-
дом в альдегидную форму, которая (в растворе) находится в равнове-
сии с другими кольцевыми формами. Поэтому само по себе название
«лактоза» не означает, что глюкозная часть молекулы имеет фиксиро-
ванную циклическую структуру. Таким образом, формула лактозы со-
кращенно может быть записана так: pGall-(1—>4)-Glc. (Отметим, что
в кристаллической форме лактоза находится либо в а-, либо в р-конфи-
Сахароза [а61ср-( !—2)-/3Fruf]
сс.а-Трегалоза [aGlc/>-(T~.1)aGlc/>]
Q__1Я91
114 Глава 2
гурации1.) С другой стороны, в сахарозе и трегалозе два кольца соеди-
нены через редуцирующие группы. Эти молекулы находятся в какой-то
одной форме.
3. Полисахариды
Полимеры сахаров присутствуют во всех клетках и выполняют мно-
жество функций. Так, целлюлоза придает прочность зеленым растени-
ям, хитин обусловливает прочность скелета членистоногих. Гиалуроно-
вые кислоты и другие мукополисахариды образуют защитную прослой-
ку между животными клетками, а пектины и родственные полисаха-
риды играют аналогичную роль в растениях. Клеточные поверхности
обычно покрыты слоем полисахаридов самой разной структуры. Разли-
чия в структуре полисахаридов, составляющих этот наружный слой,
весьма важны, поскольку обусловливают иммунологическую индивиду-
альность организмов. Крахмал, гликоген и другие запасные полисаха-
риды представляют собой легко мобилизуемые пищевые ресурсы кле-
ток [35 а].
Один из компонентов растительного крахмала, амилоза, — это ли-
нейный полимер, состоящий из многих a-D-глюкопиранозных звеньев,
которые соединены друг с другом посредством 1,4-связи. В гранулах
крахмала всегда содержится и второй компонент, амилопектин2. И ами-
лопектин, и гликоген (животный крахмал) состоят из сильно разветв-
ленных молекул. Ветви присоединены к а-1,4-цепям посредством а-1,6-
связей (рис. 2-14 и 2-15). Некоторые бактерии, например Leuconostoc
mesenteroides, синтезируют линейную (1—*6)-поли-П-глюкозу, или дек-
стран; ряд видов присоединяет ветви посредством а-1,4- или а-1,3-свя-
зей. Декстраны, синтезируемые бактериями, обитающими на поверхно-
стях зубов, являются компонентами налета на зубах. Декстраны про-
изводятся в промышленном масштабе; после химической обработки,
«наделяющей» их множеством поперечных связей, образуются гели
(коммерческое название их «сефадекс»), широко используемые в био-
химических лабораториях для разделения смесей разных молекул
(разд. 3.1.г).
Целлюлоза — это, пожалуй, самый распространенный на земле угле-
вод (растения производят ее в количестве ~1014 кг в год); он пред-
ставляет собой полиглюкозу, образованную с помощью р-1,4-связей.
Хитин, другой весьма распространенный полисахарид, содержится в
клеточных стенках грибов и в наружном скелете членистоногих. Это
линейный р-1,4-полимер N-ацетилглюкозамина, структурно сходный с
целлюлозой. Пектины представляют собой р-1,4-полигалактуроновые
кислоты, в которых ряд карбоксильных групп метилирован.
Клеточные стенки дрожжей содержат полимеры маннозы (манна-
ны); в них от главной а-1,6-цепи отходят короткие ветви (из 1—3 ман-
нозных звена), соединенные а-1,2- и а-1,3-связями. Кроме целлюлозы,
все растения содержат ксиланы, которые состоят преимущественно из
Р-1,4-ксилопиранозных цепей. Отметим, что ксилоза, представляющая
собой пятиуглеродный сахар, в этом полимере принимает форму шести-
членного пиранозного кольца. С другой стороны, фруктоза, шестиугле-
родный сахар, в инулине, запасном полисахариде иерусалимского арти-
1 a-Лактоза более растворима и имеет более сладкий вкус, чем р-лактоза. В мо-
роженом при продолжительном хранении р-лактоза может кристаллизоваться, отчего
оно становится «рассыпчатым».
2 Некоторые виды крахмала, в частности крахмал «восковой» кукурузы, содер-
"',”р „ишь амилопектин и не содержат амилозы.
Молекулы, из которых мы состоим 115
шока, присутствует в форме пятичленных фуранозных колец. Эти раз-
личия обусловлены различиями в путях биосинтеза. Пиранозные коль-
ца термодинамически более устойчивы, чем фуранозные. Последние
образуются в инулине и сахарозе, поскольку их биосинтез проходит
через 6-фосфатный эфир фруктозы.
РИС. 2-15. Схематическое изображение молекулы гликогена. А. Структура участка мо-
лекулы гликогена по Мейеру (Meyer К- Н., Adv. Enzymol., 3, 109—136, 1943). Круж-
ки обозначают остатки глюкозы, соединенные а-1,4-связями или (в точках ветвления)
а-1,6-связями. Перечеркнутый кружок обозначает редуцирующую группу. [French D.r
in: Symposium on Foods: Carbohydrates and Their Roles (H. W. Schulz ed.), pp. 26—
54. Avi Pub]., Westport, Connecticut, 1969.] Б. Двумерная схема молекулы гликогена
с мол. весом 760 000, содержащей ~4700 остатков глюкозы (штриховая линия —
внешние контуры молекулы). При обработке Р-амилазой (гл. 7, разд. В.6) получается
«остаточный декстрин» с мол. весом ~410 000, который на рисунке представлен круж-
ками и соединяющими их линиями. Буквами М обозначены сильно ветвящиеся участ-
ки, которые соединены друг с другом участками с малым числом точек ветвления. Под.
действием а-амилазы (гл. 7, разд. В.6) М-участки частично разрушаются с образова-
нием остаточных декстринов, содержащих в среднем по 34 остатка глюкозы. (Bram-
mer G. A., Rougvie М. A., French D., Carbohyd. Res., 24, 343—354, 1972.)
Ряд полисахаридов, включая различные виды крахмала, содержит
один редуцирующий конец, что обусловливает возможность раскрытия-
кольца и образования свободной альдегидной группы, обладающей вос-
становительными свойствами. В других случаях редуцирующий коней,
«заблокирован». Один из видов такой блокировки (реализуемой, как
предполагается, в инулине) состоит в том, что конец цепи имеет струк-
туру сахарозы. В других полисахаридах возможно присутствие конце-
вой трегалозы. Встречаются циклические полисахариды, сахарные цепи
которых замкнуты в кольцо и вообще не имеют свободного редуцирую-
щего конца. Эти полисахариды, как правило, присоединены к молеку-
лам белка или липида.
Во многих полисахаридах повторяющимися единицами являются
мономеры разного типа. В некоторых из таких гетерополисахаридов:
имеет место простое чередование двух сахаров [36, 37]. Примерами
служат гиалуроновая кислота, хондроитинсульфаты и дерматансуль-
фат— важные компоненты основного вещества, присутствующего в
межклеточном пространстве соединительной ткани и выполняющего
роль цементирующего материала. Гиалуроновая кислота — это поли-
мер, в котором чередуются глюкуроновая кислота и N-ацетилглюкоза-
мин; структура этого полимера изображена на рис. 2-16, Хондроитин-
116 Глава 2
В дерматансульфате
имеет место обратная
конфигурация \
В хондроитине и дерматане имеет месте
обратная конфигурация;
в хондроитин-4-сульфате и дерматансульфате здесь
имеется сулыроэфирная связь
В хондроитин-6-сульфате здесь
имеется сульфоэфирная связь
ООС
СН2!ОН1
NH
т>-глн>куроновая кислота
N-оцетил -р-глюкозамин
Гиалуроновая кислота [-/JGlcUA (1—»3)j3GlcNAc-(l~»4)-]„
Хондроитин [jBGlcU А-(1—> 3)-/3GalN Ас-(1~> 4)-]п
Дерматансульфат ^-a-L-идуроновся кислота-(\—3)-GalNAc-4-cyawpcm-(l— 4)-]п
А
Гиалуроновая
кислота
— Связующий
белок
Кератансульфат
Хондроитинсульфат
ши*
Субъединицы
*— Центральный
белок
Б
РИС 2-16 А Повторяющиеся дисахаридные звенья гиалуроновой кислоты и родст-
венных мукополисахаридов. Б. Предполагаемая схема строения протеогликановых
агрегатов в хрящевых тканях, на которой указано расположение молекулы гиалу-
Молекулы, из которых мы состоим 117
сульфаты и дерматансульфат имеют аналогичное строение, но в первом
случае в состав полисахарида входит N-ацетилгалактозамин, а во вто-
ром— a-L-идуроновая кислота; кроме того, в положениях, указанных
на рис. 2-16, находятся сульфоэфирные группы.
Гепарин представляет собой мукополисахарид с антикоагуляцион-
ными свойствами, секретируемый в кровь тучными клетками, присут-
ствующими в легких, печени и других тканях. Этот линейный полиса-
харид, по всей вероятности, содержит дисахаридные звенья следующего
типа: [—уроновая кислота-(1—>4)-С1сМ-2,6-дисульфат-(1—>4)—]„.
Обе аминогруппы и 6-гидроксилы остатков глюкозамина несут сульфат-
ные группы. В некоторых звеньях встречается D-глюкуроновая кисло-
та, присоединенная посредством а-1,4-связи, однако наиболее часто в
роли первого звена дисахарида выступает (L-идуроновая кислота)-2-
сульфат [38].
Кератаны кожи в качестве повторяющегося звена содержат
[—0Gal-(l—>14)-рGlcNAc-6-сульфат-(1—>3)—]п или точно такую же
структуру, но содержащую галактозаминсульфат. Из-за присутствия
карбоксилатных и сульфатных групп все эти полимеры несут большое
число отрицательных зарядов.
4. Пептидогликаны и гликопротеиды
Многие простые гетерополисахариды в действительности являются
протеогликанами, в которых концевое звено полисахарида ковалентно
присоединено через О-гликозидную связь к сериновому остатку в бел-
ке [39—43]. Так, полная структура хондроитинсульфата имеет следую-
щий вид:
Повторяющаяся единица
y3GlcllA-(t—*3)-GalNAc-(1-4)/3GlcUA-(l->3)-y3Gal- (1— 3)-/3Gal- (1 -^4)-/3Xyl/>
Серия
(в белке)
Таким же образом присоединены к белкам дерматансульфат и гепа-
рин [43].
Небольшие олигосахаридные группы часто присоединены к белкам,
находящимся на поверхности клеток, а также к секретируемым бел-
кам. Сахарные цепи прикреплены через О-гликозидную связь к —ОН-
группам остатков серина, треонина и оксилизина (только в коллагене)
или через N-гликозидную связь к амидному азоту аспарагина [43а].
Среди таких гликопротеидов встречаются ферменты, гормоны и струк-
роновой кислоты, а также хондроитинсульфата и кератансульфата. Последние кова-
лентно связаны с белком, образующим центральную часть субъединицы протеогли-
кана; единый протеогликановый агрегат образуется путем присоединения этих субъ-
единиц к молекуле гиалуроновой кислоты. Рисунок выполнен с примерным соблюде-
нием пропорций, за исключением того, что длины цепей хондроитинсульфата изобра-
жены почти наполовину укороченными. [Rosenberg L., in: Dynamics of Connective
Tissue Macromolecules (P. M. C. Burleigh and A. R. Poole, eds.), p. 107, North-Holland,
Amsterdam, 1975.] Такие мукополисахаридные цепи могут электростатически взаимо-
действовать с находящимся в хрящах коллагеном. В. Электронная микрофотография
(негативный контраст) протеогликанового агрегата из бычьего суставного хряща
(расположенного на несущих поверхностях суставов). Волокнистый остов состоит из
гиалуроновой кислоты (см. рис. 5), от остова отходят протеогликановые субъединицы
(индивидуальные полисахаридные цепи не видны). [386]. (С любезного разрешения
L. Rosenberg.)
118 Глава 2
турные белки. В большинстве случаев функция этой углеводной части
остается неизвестной, но в муцинах, выполняющих роль смазки, при-
сутствие большого числа отрицательно заряженных групп сиаловой
кислоты, по-видимому, обусловливает образование жесткой разверну-
той структуры, что сильно повышает вязкость белка [41].
В некоторых муцинах содержание углеводов превышает 50%; напри-
мер, в подчелюстной железе овцы на молекулу белка приходится до
800 цепей вида [a-D-N-ацетилнейраминовая кислота-(2—>-6)-a-D-
GlcNAc-], присоединенных к белку через остатки серина и треонина
[40]. Другие гликопротеиды содержат только одну или несколько угле-
водных цепей. Молекулы яичного альбумина (мол. вес. ~44 500) из ку-
риных яиц имеют каждая по одной углеродной цепи. При этом встреча-
ется по меньшей мере пять различных олигосахаридов следующего ти-
па [39]:
aMan-(l->4)-pGlcNAc-(l->4)-flGlcNAc-N-Asp (белок)
I н
(GlcNAc)---------(Man) 4 или 5
0,1 или 2 |
(GlcNAc) 0 или 1
Подобные углеводные группы присутствуют в таких ферментах, как
бычья рибонуклеаза и рибонуклеаза свиньи, а-амилаза (Aspergillus
oryzae) и бромелаин (ананас) [44]. Гликопротеиды, входящие в состав
сыворотки антарктических рыб, оказываются необыкновенно эффектив-
ными антифризами [45—47].
5. Конформация полисахаридных цепей
Несмотря на все многообразие мономерных звеньев и типов их свя-
зывания, конформационные возможности углеводных цепей довольно
ограниченны. Сахарное кольцо представляет собой жесткую структур-
ную единицу, и соединение двух колец может быть описано двумя тор-
сионными углами, (риф, подобно тому как это делается для пептидов
[48, 49]. Правда, четкие соглашения по поводу того, какой конформа-
ции полисахарида должны соответствовать значения (риф, равные 0°,
отсутствуют. Вообще говоря, имеется примерное общее правило такого
рода для всех полимеров [18], но оно очень неудобно, когда речь идет
о полисахаридах. По-видимому, лучше всего считать, что ф и ф равны
0°, если плоскости, разделяющие сахарные кольца пополам, копла-
нарны:
Эти плоскости проходят через атомы, отмеченные на рисунке звездоч-
ками, и в общем случае не перпендикулярны плоскости колец. Систе-
матическое исследование возможных значений <р и ф для целлюлозы
Молекулы, из которых мы состоим 119
(поли-р-П-глюкозы) показывает, что эти углы ограничены очень узким
интервалом значений, при которых расположение мономерных звеньев
отвечает почти полностью вытянутой конформации.
Целлюлоза
Каждое звено глюкозы оказывается повернутым относительно пре-
дыдущего на 180°. Полимер имеет винтовую ось второго порядка,
причем плоскости колец идут с небольшим зигзагом [50, 51]. Напом-
ним, что у глюкозы в конформации кресла все ОН-группы лежат в эк-
ваториальной плоскости и способны образовывать водородные связи с
соседними цепями. Эта особенность вместе с жесткостью конформации,
обусловленной p-конфигурацией мономерных звеньев, несомненно, объяс-
няет способность целлюлозы к формированию прочных волокон.
В крахмале и гликогене цепь тоже образована остатками глюкозы,
но на этот раз используется а-1,4-связь. Вытянутая конформация уже
невозможна, и цепи скручиваются в спираль. Из спиральных структур,
образуемых биополимерами, одной из первых (в 1943 г.) [52] была от-
крыта левая спираль амилозы, идущая вокруг молекул иода (12) в хо-
рошо известном комплексе иода с крахмалом (рис. 2-17). Число остат-
ков на виток равно 6, шаг спирали — 0,8 нм, диаметр — около 14 нм
[53, 54].
Для амилозы была предложена еще одна структура — более сильно
закрученная двойная спираль [55]. Предполагается, что в такой спи-
рали каждая цепь содержит 6 остатков на виток и обе цепи идут либо
в том же, либо в противоположных направлениях. Молекула амилозы
содержит в среднем 1000 остатков глюкозы и может быть вытянута в
тонкую цепь 500 нм длиной, что превышает размеры кристаллических
областей в гранулах крахмала. Следовательно, цепи в гранулах долж-
ны как-то складываться (например, в виде шпилек):
Укладка перазветвленных молекул крахмала
в виде шпилек с образованием кристаллической
структуры [56]
Агароза (мол. вес. ——120 000) представляет собой углеводный поли-
мер с чередующейся последовательностью звеньев.
Агароза
—/З-D-Gal - (1 —* 4) -3,6 -ангидро -«-i.-Gal-(l — 3)—]—
120 Глава 2
Она является главным компонентом агара и определяет в значительной
мере способность этого замечательного вещества образовывать гель.
Возможно образование твердого агарового геля, содержащего 99,5%
воды. Молекулярная структура агарозы строится на основе левой двой-
ной спирали, имеющей винтовую ось третьего порядка; шаг спирали
РИС. 2-17. А. Структура спирального комплекса амилозы с иодом (12). Молекулы
иода располагаются вдоль оси спирали, образуемой остатками глюкозы, по шесть
остатков на виток. Б. Модель двойной спирали, составленной из двух параллельных
цепей. В каждой цепи содержится по 6 остатков глюкозы на виток. Периодичность,
согласно модели, равна 2,1 нм (через 6 остатков глюкозы вдоль любой цепи). (С лю-
безного разрешения D. French.)
равен 1,90 нм, ее внутренняя полость заполнена водой [57]. Сходную
структуру имеют гельобразуюшие карагенаны из красных морских во-
дорослей. По рентгеновским данным, в этом случае три дисахаридных
звена образуют один виток правой спирали с шагом 2,6 нм. Вторая
цепь идет параллельно, но со сдвигом на полоборота, накручиваясь на
первую спираль [58]. В местах пересечения двуспиральных областей
образуются «узлы», которые представляют собой центры гелеобразо-
вания [59] (рис. 2-18). В боковом направлении попарно отходят суль-
фатные группы, служащие местом связывания ионов кальция, которые
стабилизируют гель.
Молекулы, из которых мы состоим 121
РИС.2-18. Схематическое изображение сетчатой структуры агарозного геля (справа)
и показанной для сравнения сетки из беспорядочно свернутых цепей (такая сетка,
в частности, характерна для сефадекса). Агарозные гели содержат агрегаты из 10—
104 спиралей; меньшее же число спиралей, как это показано здесь, обычно не наблю-
дается [58].
Эпизодическое появление в этих полимерах избыточных сульфатных
групп порождает изломы цепи (так как модифицированные пиранозные
кольца принимают конформацию кресла другого типа). Эти изломы
препятствуют образованию полисахаридом единой регулярной спира-
ли [59а].
L-карагенан: —^-/З-о-вгЛ-Л-сульфат-
(I —4)-3/6-a?7SLtdpo-oc-D-GaI-2-сульфот-(1 — 3) Тг'
Ксилан высших растений, р-1,3-полимер D-ксилозы, по-видимому,
представляет собой трехцепочечную правую тройную спираль [60].
Предполагается, что гиалуроновая кислота имеет двуспиральную
структуру [61]. Хондроитинсульфаты состоят из одиночных спиралей
различного типа [62].
Дополнение 2-Б
Кремний — необходимый микроэлемент
Общеизвестно, что в клетках диатомовых водорослей, ске-
лет которых построен из S1O2, идет активный метаболизм
кремния. Накапливать кремний способны радиолярии, неко-
торые высшие растения и губки; у моллюсков, именуемых
блюдечками, он составляет основу зубцов3. Несмотря на все
122 Глава 2
эти факты, метаболизм кремния не очень интересовал иссле-
дователей, и лишь недавно было показано, что этот элемент
-жизненно важен для роста и развития высших животных6 ^,
в частности у цыплят кремний обнаружен в местах активно-
го обызвествления формирующихся костейг. Во внутренних
органах млекопитающих кремний присутствует лишь в не-
больших количествах, однако в коже, хрящах и связках его
содержание достигает —0,01 %. Шварца установил, что крем-
ний входит в состав мукополисахаридов, таких, как хондрои-
тин-4-сульфат, дерматансульфат и гепаринсульфат. Все они
содержат ——0,04% кремния, т. е. на 130—280 повторяющихся
звеньев полисахаридов приходится один атом этого элемента.
У представителей растительного царства содержание крем-
ния в пектинах примерно в пять раз выше. Кремний в поли-
сахаридах очень прочно связан, по-видимому, посредством
эфирной связи. Шварц предположил, что ортокремневая кис-
лота Si (ОН) 4 реагирует с гидроксильными группами углево-
дов, в результате чего образуются эфирные связи, которые
могут играть роль мостиков между цепями:
ОН ОН ОН
I I I
Rj—О—Si—О—R2 R,—О—Si—О—Si—О—R2
I X * 1
он он он
Отметим, что в каждой из этих структур имеются незамещен-
ные ОН-группы при атоме кремния, вследствие чего сразу
между несколькими полисахаридными цепями могут образо-
вываться поперечные связи. Исходя из этих результатов, но-
сящих, правда, предварительный характер, можно предполо-
жить, что биологическая роль кремния в соединительной тка-
ни состоит в его способности обеспечивать образование попе-
речных связей (см. также гл. 11, разд. Д.З).
а Schwarz К-, PNAS, 70, 1608—1612 (1973).
6 Schwarz К- In: Trace Element Metabolism in Animals (Mills F., ed.),
pp. 25—38, Livingstone, Edinburgh, 1970.
° Schwarz K-, Milne D. B„ Nature (London), 239, 333—334 (1972).
r Carlisle E. M„ Science, 178, 619—621 (1972).
д Hoekstra W. H., Suttle J. W., Ganther H. E., Mertz W. eds., Trace Ele-
ment Metabolism in Animals — 2, Univ. Park Press, Baltimore, Maryland,
1974.
Г. Нуклеиновые кислоты
Нуклеиновые кислоты — ДНК и РНК-—это полинуклеотиды. Их мо-
номерные звенья (нуклеотиды) в свою очередь состоят из трех частей:
1. Пуринового или пиримидинового основания (их структурные фор-
мулы представлены на рис. 2-19).
2. Сахара — D-рибозы или D-2-дезоксирибозы.
3. Фосфорной кислоты.
Молекулы, из которых мы состоим 123
5Г<^?№
ед
N
1
Пиримидин
В тимине, входящем в ДИК,
в этом положении находится
метильная группа О
/V
Атомы Н, заключенные ' '
в кружочки, при присоеди—^^^
нении оснований к сохарным^~~~* [ { :
остаткам высвойождо-отся
Урацил
Аденин
Заметьте , что все эти
молекулы практически
плоские
Л.
IH j
Цитозин
О
Гуанин
РИС. 2-19. Структурные формулы пиримидиновых и пуриновых оснований. Обычно
в монографиях и справочных изданиях кольца изображают в другой ориентации —
атом С-5 пиримидинового кольца и атом С-8 пурина оказываются справа. Мы же оста-
новились на таком способе изображения для того, чтобы было соответствие между
данным рисунком и рис. 2-20.
Эти части соединяются друг с другом с высвобождением двух моле-
кул воды (рис. 2-20). Нуклеотиды связаны фосфодиэфирными связями,
образующимися между б'-гидроксилом сахара одного нуклеотида и
З'-гидроксилом другого [уравнение (2-11)]. Структура пары коротких
полинуклеотидных цепей изображена на рис. 2-21.
1. Названия и сокращения
Пуриновые и пиримидиновые циклические соединения, входящие в
состав нуклеиновых кислот, называют попросту основаниями, хотя у не-
которых из них основные свойства практически отсутствуют. N-гликози-
ды (или N-гликозильные производные) оснований, содержащие рибозу
или дезоксирибозу, называются нуклеозидами, а фосфатные эфиры нук-
леозидов— нуклеотидами. Подобным образом называются и родствен-
ные биохимические соединения, которые не входят в состав ДНК или
РНК-
Названия нуклеозидов и нуклеотидов связаны с названиями основа-
ний не вполне логичным образом. (Названия главных нуклеотидов,
из которых построены нуклеиновые кислоты, приведены в табл. 2-5.)
124 Глава 2
НО П
Фосфатный
ион /
-О /'он'
'\Н Z
О
О
NH
Урацил, одно из
пиримидиновых
оснований
N О
Уридиновая кислота
(UMP, уридинмонофосфат)}
один из нуклеотидов,
входящих в состав РНК
Жирными стрелками указаны
реакционноспособные группы,
участвующие в полимеризации
1
Н2С
но
Сахар—
D-рибоза
н
Плоскость
основания
Н2С5'
—к Этими пунктирными
! Н\ кружочками подчеркивается
\ОН/ тот факт, что при образо-
вании нуклеотида отщепля-
ется молекула воды
В D-2-дезоксирибозе,
входящей в ДНК,
здесь вместо ОН находится Н
Это
' анти-конформация
Следует помнить, что в 5-членном
Н кольце из одинарных связей один из атомов
углерода (в нуклеотидах это чаще всего С-2 )
примерно на 0,05нм выходит из плоскости
остальных четырех атомов. Это кольцо
находится в С-25эндо-конформации
Н
Н
Н
Н
РИС, 2-20. Образование нуклеотида из пиримидинового основания, D-рибозы и фос-
фатного иона. Показано, что в ходе реакции образуются молекулы воды. Отметим,
что атомы углерода оснований нумеруются от
мы углерода сахаров
1 до 6 или от 1 до 9 (рис, 2-19), а ато-
— от Г до 5'.
НО3Г—о—сахар—основание
---------il 5'
4. p[Q—-р — q—сахар—основание
3'1
ОН
О"
J-JQ р—о— сахар— основание
°х°
О О—сахар—основание
3' I
О—Н
(2-11)
Молекулы, из которых мы состоим 125
РИС. 2-21. Схематическое плоское изображение структуры
ДНК по Уотсону и Крику.
В наибольшей степени это относится к гипоксантину, образующемуся
путем замещения —МН2-группы аденина на —ОН-группу с последую-
щей таутомеризацией группы оксипурина
ОН
ч форму
О
II Н
—С—N—
126 Глава 2
Таблица 2-5
Названия пиримидиновых и пуриновых оснований, нуклеозидов
б'-нуклеотидов и их обозначения
А. Нуклеотидные звенья РНКа
Основания Урацил Ura(U) Цитозин Cyt(C) Аденин Ade(A) Гуанин Gua (G)
Нуклеозиды Уридин Urd Цитидии Cyd Аденозин Ado Гуаиозии Guo
5'-нуклеотиды Уридин-5'-фос фат или 5'-уридиловая кислота Urd-5'-P или UMP Цитидии-5'- фосфат или 5'-цитидиловая кислота Cyd-5'-P или СМР Адеиоз ин-5'-фос- фат или 5'-адениловая кислота Ado-5'-P или АМР Гуанозин-5'- фосфат или 5'-гуаииловая кислота Guo-5'-P или GMP
Б. Нуклеотидные звенья ДНК
ДНК вместо оксирибозы содержат 2-дезоксирибозу, поэтому соответствующие
нуклеозиды и нуклеотиды ДНК называются дезоксиаденозином (dAdo) дезоксиадено-
зин-5'-фосфатом (dAMP) и т. д.
Вместо урацила в ДНК присутствует тимин (Thy). Дезоксирибозными производ-
ными в этом случае являются тимидин (dThd) и тимидин-5'-фосфат. Рибозными про-
изводными тимина являются нуклеозид рибозилтимидин (Thd) и рибозилтимидин-5'-
фосфат (Thd-5'-P).
3 Изомеры 5'-нуклеотидов, в которых фосфат связан с кислородом при С-3', на-
зываются З'-иуклеотидами. Такие изомеры встречаются довольно часто, и нужно из-
бегать путаницы в этом вопросе. Простые сокращения UMP, СМР, АМР и GMP всегда
относятся к 5'-нуклеотидам.
Нуклеозид, состоящий из гипоксантина и рибозы, назван инозином (I),
а соответствующий нуклеотид—инозиновой кислотой.
В обычно используемых сокращенных формулах нуклеиновых кис-
лот сахара изображают вертикальными линиями. Сверху над этими ли-
ниями ставят символы, соответствующие определенным основаниям А,
С, U, Т и G или пуринам (Ри) и пиримидинам (Ру); 3'—б'-фосфоди-
эфирные связи изображаются косыми линиями с буквой Р посередине:
ОН
Концевая
З'—ОЦ-группа
Концевой
5-фосфатц
Структурная формула этого же полинуклеотида может быть записана
еще короче:
pApUpGpPupPy
5'-конец или З'-конец
A-U-G-Pu-Py
5'-конец нуклеотида в таких
формулах принято располагать слева.
2. Функциональные группы нуклеиновых кислот
Ионизированные фосфатные группы полимерного «остова» сообща-
ют молекулам нуклеиновых кислот большой отрицательный заряд. По
этой причине в клетках ДНК обычно присутствует в комплексе с 1) ос-
Молекулы, из которых мы состоим 127
нбвными белками — гистонами или протаминами (в сперматозоидах
рыб); 2) поликатионами аминов типа спермидина (H3N—
СН2СН2СН2СН2—NH2—СН2СН2СН2—NH3 ) или 3) щелочноземельны-
ми катионами, например Mg2+.
В РНК во 2-м положении рибозных остатков имеются свободные
гидроксильные группы, которые сильно влияют на конформацию поли-
мера. Отсутствие 2-ОН-группы в дезоксирибозе делает ДНК более ус-
тойчивой к щелочной деградации.
Пуриновые и пиримидиновые основания — это «боковые цепи» нук-
леиновых кислот. Присутствующие в основаниях полярные группы
ХС=О, XNH ц NH2
способны к образованию водородных связей как с другими цепями нук-
леиновых кислот (в частности, в двуспиральной структуре ДНК), так
и с белками. Между плоскими основаниями осуществляется так назы-
ваемое стэкинг-взаимодействие; кроме того, основания могут взаимодей-
ствовать с ароматическими боковыми цепями аминокислот, с лекарст-
венными и мутагенными химическими соединениями.
3. Химические реакции, в которые вступают полинуклеотиды [63]
Как ДНК, так и РНК легко гидролизуются под действием кислот
(разд. 3.2). Гликозидные связи в ДНК более лабильны, чем в РНК-
Пуриновые нуклеотиды гидролизуются легче, чем пиримидиновые. И все
же, несмотря на легкость, с которой деградируют нуклеиновые кисло-
ты под действием кислот и щелочей, ковалентная структура этих моле-
кул сравнительно устойчива, что предопределяет их способность слу-
жить генетическим материалом. Однако как ДНК, так и РНК вступают
во множество химических реакций.
Азотистая кислота реагирует с аминогруппами оснований, превра-
щая их в —ОН-группы. Образующаяся в результате группировка
I
—N=C—ОН
подвергается таутомеризации и принимает вид
О
II
_ NH—С—
Таким образом, азотистая кислота при взаимодействии с нуклеиновы-
ми кислотами превращает цитозин в урацил и, следовательно, является
эффективным химическим мутагеном (гл. 15, разд. 3.1). Аналогичным
образом аденин превращается в гипоксантин, а гуанин — в ксантин.
Другое мутагенное соединение, гидроксиламин (H2N—ОН), реагирует
с карбонильными группами (особенно в пиримидинах), даже несмотря
на то, что эти карбонильные группы являются частью циклической
амидной структуры и поэтому имеют сравнительно низкую реакцион-
ную способность.
Пиримидины легко восстанавливаются боргидридом натрия NaBH4
[уравнение (2-12)]. Уридин, тимидин и (в меньшей степени) цитозин в
128 Глава 2
составе нуклеиновых кислот димеризуются при УФ-облучении и гидри-
руются [уравнения (13-22) и (13-23)].
(2-12)
Формальдегид вступает в реакцию с аминогруппами пуриновых и
пиримидиновых оснований (гл. 7, разд. 3.3) [64].
4. Конформации нуклеотидов
Фуранозное кольцо рибозы и дезоксирибозы может принимать це-
лый ряд конформаций типа «конверта» и других неплоских «скошен-
ных» конформаций. Обычно либо атом С-2', либо атом С-3' выходят из
плоскости других четырех атомов кольца. Если этот атом углерода рас-
положен выше кольца, т. е. находится от него со стороны основания, то
конформацию кольца называют эндо, если же он лежит ниже кольца,
то получаетсяэкзо-конформация (рис. 2-22,А). Свободные нуклеотиды
находятся преимущественно в С (2')-эндо- и С(3')-эндо-конформациях,
однако в В-форме ДНК, по всей вероятности, реализуется конформация
С (3') -экзо [65]. Скошенные конформации типа С(2')-эндо-С(3')-экэо
(рис. 2-22,А) и конформации конверта легко переходят одна в другую
[66, 67].
Ориентация основания относительно сахара определяется значением
торсионного угла % (рис. 2-22, В и В). Для нуклеотидов единая
система обозначений торсионных углов пока отсутствует, нет и единого
соглашения относительно того, какие углы принимать за 0°. Так, угол %
задается по меньшей мере двумя способами, как это видно из рис. 2-22.
Часто считается, что угол равен 0° при такой конформации, в которой
связь С(2)—N(l) пиримидина или С(4)—N(9) пурина находится в
цис-положении относительно связи С(1')—0(1') в сахаре [66], при-
чем значения угла (обозначенного через %' на рис. 2-22,В) лежат в ин-
тервале от 0 до 360°. В другом варианте нулевой угол соответствует
цис-положению указанной выше связи в основании относительно связи
С(1')—С (2') в сахаре; в этом случае угол % изменяется в пределах от
— 180° до 4-180° (рис. 2-22,В) [65].
Измеренные значения угла % различны для разных нуклеотидов;
наиболее типично значение ~ 127°. В такойаити-конформации группы
СО и NH во 2-м и 3-м положениях пиримидинового кольца (или в по-
ложениях 1, 2 и 6 пуринового кольца) смещены в сторону от сахарного
кольца, тогда как в с«м-конформации (что соответствует повороту на
180°) эти группы располагаются над кольцом. Нуклеотиды как в сво-
бодном состоянии, так и в составе нуклеиновых кислот находятся в ос-
новном в анти-конформации.
Чтобы задать конформацию остова полинуклеотида, требуется еще
пять торсионных углов [65—70] (рис. 2-22,Г). Углы ©, g и 0 определя-
ют расположение групп в молекуле нуклеотида, а ср и ф имеют тот же
смысл, что и в полипептидных и полисахаридных цепях. Набор значе-
ний, которые могут принимать углы и, | и 0, крайне ограничен. Еще
один торсионный угол о располагается внутри сахарного кольца
Молекулы, из которых мы состоим 129
А
Син
300°
0°
108°йля X
В
РИС. 2.22. Конформационные свойства нуклеозидов. А. Несколько возможных конфор-
маций рибозного или дезоксирибозного кольца нуклеозида [66]. Б. Вид на нуклеозид
вдоль линии связи N—С, соединяющей пиримидиновое основание с сахарным кольцом.
Угол %' может пробегать значения от 0 до 360°. К сцн-конформациям относят те
конформации, для которых % принимает значения, расположенные на жирной полу-
окружности [66]. В. Второй вариант соглашения определений торсионного угла отно-
сительно гликозидной связи С—N. Угол % меняется от 0 до ±180°. Показана анти-
конформация нуклеозида. Г. Обозначения конформационных углов остова полинук-
леотида [68]. (Отметим, что имеются еще по меньшей мере четыре другие системы
обозначения этих углов [70].)
(рис. 2-22,Г) и определяет положение атома С-3'. В С(3')-эндо кон-
формации <т = 80±10°, а в С(3')-экзо конформации В-формы ДНК он
составляет ~156°.
5. Двойные спирали
Одно из наиболее впечатляющих открытий в биологии в нашем ве-
ке было сделано в 1953 г., когда Джеймс Уотсон и Фрэнсис Крик уста-
новили, что ДНК представляет собой двойную спираль, составленную
130 Глава 2
0
Вид сверху
Плоскости комплементарных
оснований повернуты одна отно-
сительно другой на 2°
А
-А
Большая
бороздка
„Стэкинг'-взаимодействие между
парами оснований, расположенных
одна над другой на расстоянии
вандерваальсового радиуса
Пару оснований можно распознать
по группам, обращенным в сторону
бороздок. Здесь показана GC-napa
Ось спирали
Т-А
Т-А
А
Большая
бороздка
Поверхность ваниерваальсовыХ
\ контактов
Радиу
—1,0 нм
W0A
Малая оороздка
“О
сн, \
VI
Шаг
3.46 нм
Малая
” бараздка
Молекулы, из которых мы состоим
131
РИС. 2-23. А. Двойная спираль ДНК; В-форма. (Arnott S., Hukins D. W. L., JMB,
81, 93—105, 1975.) Б. Электронная микрофотография молекулы ДНК бактериального
вируса (бактериофаг Т7) в момент ее репликации. Вирусная ДНК представляет со-
бой длинный (~14 мкм) дуплексный стержень, содержащий около 40 000 пар осно-
ваний. Виден небольшой репликативный «глаз» — участок, где происходит удвоение
ДНК. Синтез ДНК начинается в особой точке (точке инициации), расположенной на
расстоянии, равном 17% длины молекулы, от одного из концов дуплекса. Окраска
уранилацетатом; негативное контрастирование. (С любезного разрешения Т. Wolfson
и D. Dressier.)
из двух антипар аллельных полинуклеотидных цепей1. Наиболее важной
особенностью предложенной структуры было спаривание оснований про-
тивоположных цепочек путем образования между ними водородных свя-
зей. Водородные связи (на рис. 2-21 они указаны пунктирными стрелка-
ми) могут образоваться лишь в том случае, если всюду вдоль структу-
ры ДНК аденин образует пару с тимином (две водородные связи), а
цитозин — с гуанином (три связи). Таким образом, последовательность
нуклеотидов в одной цепи оказывается комплементарной, но не иден-
тичной последовательности в другой цепи. Далее почти сразу же стало
очевидно, что последовательность оснований в цепи ДНК содержит в
себе закодированную генетическую информацию. Комплементарность
двух цепей приводит к очень простому механизму репликации генов на
протяжении всех клеточных делений. По этому механизму две цепи ДНК
разделяются и вдоль каждой из них синтезируется новая комплемен-
тарная цепь, что дает в результате две молекулы ДНК, по одной на
каждую из двух дочерних клеток. Принципиальную правильность этой
схемы сейчас уже можно считать доказанной.
Геометрия двойной спирали представлена на рис. 2-23, Л. В волок-
нах молекулы ДНК могут находиться в двух конформациях: А и В.
A-форма1 характеризуется тем, что плоскости пар оснований отклонены
1 Эта структура была найдена в результате построения молекулярных моделей
с привлечением рентгеновских дифракционных данных, полученных Уилкинсом н Франк-
лин при исследовании ориентированных волокон ДНК. За это открытие Уотсон, Крик
н Уилкинс в 1962 г. были удостоены Нобелевской премии.
9*
132 Глава 2
54«шеч -*• pG
с
G
G
А
U
U
и
G А А
hU С U С m2G
hU ....
(Ы1)2-петля С
А
G
А
Ст
, 3-ОИ-акцепторный
/ KOHBif
А
С
С
А
• С
» G
• С
U
• U ТфС-петля
• А \
•А
G А С А С U
т1/.
.............. G
т5С U G U G ф С
С U
m’G
_ -•—Добавочная
„ А “ петля
• G А
• G
• U
• т5С
• Ф
А
А
Петля антикодона
Молекулы, из которых мы состоим 133
РИС. 2-24. Структура фенилаланиновой транспортной РНК из дрожжей. А. Последо-
вательность нуклеотидов, образующая традиционную структуру «клеверного листа».
Б. Схема пространственной укладки полинуклеотидной цепи. Рибозофосфатиый остов
изображен в виде протяженной непрерывной ленты; прямолинейные полосы, соединяю-
щие разные участки ленты, — это пары оснований, связанные водородными связями.
Одиночные основания изображены в виде укороченных полосок. ТфС-петля выделена
точками, лнтикодоиовая петля — вертикальной штриховкой. Взаимодействия на уровне
третичной структуры отмечены черными полосками. (Quigley G. J., Rich A., Science,
194, 796—806, 1976.) В. Стереоизображение структуры дрожжевой фенилаланиновой
тРНК по данным рентгеноструктурного анализа. Акцепторный участок с выступающей
З'-коицевой последовательностью АССА расположен справа, антикодон GAA — в пра-
вой иижней части рисунка. Особенно хорошо видно гуаниновое кольцо в самой нижней
части рисунка. Плоскость среднего аденина антикодона расположена строго перпенди-
кулярно плоскости рисунка, как и для «гипермодифицироваиного» основания Y (см.
рис. 15-10), которое расположено непосредственно над антикодоном. Его боковая
цепь находится в дальней от нас части изображения. Непосредственно перед антико-
доном, в 5'-«половине» молекулы, расположены два неспаренных основания (С и U).
2'-гидроксильные группы цитидина и входящего в состав антикодона гуанозина мети-
лированы. Двигаясь вверх вдоль петли антикодона, мы проходим два триплета осно-
ваний, в которых реализуется схема спаривания как Уотсона — Крика, так и Хугстена.
Рекомендации относительно того, как рассматривать такие рисунки, даны в подписи к
рис. 2-6. (С любезного разрешения A. Rich.)
от нормали к оси спирали примерно на 20°, тогда как в В-форме, реа-
лизуемой при высокой влажности, плоскости почти перпендикулярны
оси спирали (торсионные углы остова составляют ©=155°, g = 36°,
0 = —146°, <р = —96° и ф = 46°) [65] Считается, что ДНК внутри клеток
находится в основном в В-форме.
Если пренебречь асимметрией пары оснований, то можно заметить,
что в составе двойной спирали одна нуклеотидная цепь связана с другой
осью симметрии 2-го порядка. Этот элемент симметрии, порождаемый
антипараллельным расположением цепей, делает молекулу ДНК с обо-
их концов одинаковой — как с точки зрения человека, рассматриваю-
щего модель, так и с точки зрения фермента, вступающего с молеку-
лой во взаимодействие. В действительности две цепи не идентичны, а
генетическая информация может считываться с тех участков, которые
располагаются на поверхности в районе большой бороздки
(рис. 2-23, А).
’ В действительности мы имеем здесь дело с семейством близких форм.
134 Глава 2
Приведем некоторые данные о размерах двойной спирали (рис. 2-23).
Диаметр ее, определяемый расстоянием между атомами фосфора, равен
в точности 2,0 нм. Шаг спирали—3,4 нм, на один виток приходится де-
сять пар оснований. Таким образом, расстояние между плоскостями
оснований равно 0,34 нм, что примерно эквивалентно сумме вандерва-
альсовых радиусов ароматических колец (табл. 2-1). Таким образом,
основания уложены в виде стопки в центре спирали. Типичный ген в
1000 оснований — это участок ДНК около 340 нм длиной (рис. 2-23, Б).
Как и подобает матрице, с которой снимаются копии, двойная спи-
раль ДНК исключительно стабильна. Несмотря на большую длину, в
природных условиях она расщепляется крайне редко. Такая стабиль-
ность структуры обусловлена несколькими факторами: 1) наличием во-
дородных связей между основаниями; 2) вандерваальсовым притяже-
нием плоских оснований, уложенных параллельно одно над другим;
3) присутствием на поверхности молекулы многих атомов кислорода,
отрицательно заряженных и нейтральных, способных к образованию
водородных связей с водой или со специфическими белками, окружаю-
щими молекулу; 4) способностью к образованию различного рода су-
перспиралей (см. ниже).
Как мы отмечали выше, ДНК может переходить в паракристалличе-
скую A-форму (с наклонным расположением оснований и 11 парами
оснований на виток). Напрашивается вывод, что и в природных услови-
ях эта конформация не менее важна, чем В-форма. Хотя молекулы
РНК обычно одноцепочные, они часто образуют шпильки — двухце-
почечные участки, находящиеся в А-форме [71]. В-конформация в этом
случае исключается присутствием 2'-гидроксильных групп в рибозе
РНК. Считается, что в клетках образуется также и переходная «гибрид-
ная» двойная спираль, составленная из молекул ДНК. и РНК, которая,
по всей видимости, тоже ограничена рамками A-формы. Следует отме-
тить, что A-форма отличается от В-формы еще и тем, что имеет доволь-
но большую (~0,8 нм в диаметре) полость вдоль оси спирали, а боль-
шая бороздка у нее более глубокая [71а]. В отличие от структуры,
изображенной на рис. 2-23, в A-форме плоскости пар оснований не пе-
ресекают оси спирали.
Наиболее тщательно изучена структура низкомолекулярной тРНК-
Во всех этих молекулах существуют двухцепочечные участки, стабили-
зированные водородными связями с образованием трех шпилек, к кото-
рым иногда добавляется четвертая .(«клеверный лист»). Структура од-
ной из тРНК установлена методом рентгеноструктурного анали-
за [72—74] (рис. 2-24). Нерегулярность и сложность формы молекулы
ставит ее в один ряд с молекулами глобулярных белков. Обратите вни-
мание на расположенный в нижней части рисунка антикодон (трип-
лет оснований), структура которого обеспечивает спаривание с тремя
основаниями кодона, детерминирующего определенную аминокислоту,
в данном случае фенилаланин.
6. Пары оснований
Структура пар оснований в том виде, как это было предложено Уот-
соном и Криком, изображена на рис. 2-21. Хотя дифракционные данные
показывают, что в ДНК присутствуют именно такие пары оснований,
рассматривались и другие варианты. На рис. 2-25 изображены очерта-
ния пар оснований с указанием групп, способных к образованию водо-
родных связей. Число групп, которые в качестве доноров или акцепто-
ров электронов могли бы участвовать в этом процессе, получается до-
Молекулы, из которых мы состоим
1ОО
РИС. 2-25. Внешние очертания пуриновых и пиримидиновых оснований нуклеиновых
кислот. Изображены поверхности, определяемые вандерваальсовыми радиусами; от-
мечены также некоторые из возможных направлений, вдоль которых могут быть об-
разованы водородные связи. Толстыми стрелками указаны водородные связи, соот-
ветствующие схеме спаривания оснований по Уотсону и Крику.
вольно большим, а следовательно, может быть несколько вариантов
спаривания оснований. Один из таких вариантов предложил Хугстен
(здесь показана соответствующая этой схеме пара А—Т). Обратите
Н
I
” ‘-------0,88 нм--------
Пара основании по Хугстену
внимание, что расстояние, «покрываемое» данной парой (между атома-
ми сахара С-1'), равно 0,88 нм, что заметно меньше значения 1,08 нм
для пар Уотсона — Крика. В двуспиральных структурах таких пар не
обнаружено, однако не исключается возможность образования тройных
спиралей, в которых присоединяемое к паре третье основание распола-
гается по схеме Хугстена [75]. И действительно, именно такие трипле-
ты оснований недавно обнаружены в некоторых участках молекулы
тРНК [74].
136 Глава 2
В живых системах пуриновые и пиримидиновые основания взаимо-
действуют не только между собой, но и с белками. Они связываются
с ферментами, участвующими в метаболизме нуклеиновых кислот и ну-
клеотидов, и выполняют роль своеобразных «держателей», с помощью
которых к белкам прикрепляются многие промежуточные продукты ме-
таболизма, а также коферменты (гл. 8).
Насколько сильны связи, образуемые между парами оснований в
ДНК? На этот вопрос ответить трудно, поскольку всегда имеет место
сильное взаимодействие молекул с полярными растворителями. Неко-
торое представление об энергии этих связей дают исследования, прово-
димые в неполярных растворителях. Так, было показано, что 1-цикло-
гелсилурацил образует димеры, стабилизированные или водородными
связями, или стэкинг-взаимодействием, но энергия ассоциации при этом
невелика, AG0 равно -~5 кДж-моль-1. В смеси этого соединения с
9-этиладенином получается комплекс — пара оснований — с константой
образования [см. уравнение (4-2)], более чем в 10 раз превышающей
Комплекс (пара оснований)
константу образования димеров [уравнение (2-13)] [68]. Когда атом
водорода, который в уравнении (2-13) заключен в кружок, заменили
на группу —СН3, блокирующую образование пар, константа 7G стала
меньше 1 (AG°>0). Различие в свободной энергии образования в этих
двух случаях составляет всего 7 кДж-моль-1, однако даже такая не-
большая энергия, суммированная по многим парам оснований в моле-
куле ДНК, заметно повышает устойчивость структуры.
Выполненные недавно измерения энергии образования пар между
всеми возможными нуклеотидами позволяют провести количественную
оценку свободной энергии образования спиральных областей в молеку-
лах РНК [76]. В табл. 2-6 приведены приращения свободной энергии
образования таких спиралей из одноцепочечных структур в пересчете
на одну пару оснований, присоединяемую к концу уже существующей
спирали. При добавлении пары AU вклад в AG° составляет всего от —5
до —7 кДж. Точное значение зависит от того, какое из оснований —
А или U-—находится на б'-конце предсуществующей спирали. Добав-
ление пары AU к спирали, оканчивающейся парой CG или GC, дает
вклад —9 кДж-моль-1. Большие приращения энергии имеют место при
Молекулы, из которых мы состоим 137
Таблица 2-6
Изменение свободной энергии AGj! при присоединении одной пары
оснований к предсуществующей спирали РНК (при 25°С)аб
Пара оснований на конце рредсуществующей спирали Присоединяемая пара оснований Д(7^, ккал моль—1 (±Ю%) кДж-моль—1 (±Ю%)
А А —1,2 -5,0
и и
ив А — 1,8 —7,5
А и
С . илн Gr А —2,2 —9
G 3 и
С G —3,2 — 13
G С
G С , G -5,0 — 21
. или .
С G С
G и —0,3 — 1
и G
Шпильки из 4—5 оснований
оканчиваются парой GC +5 +21
оканчиваются парой AU +7 +29
Боковые петли
1 основание + 3 + 12
4—7 оснований +5 +21
а Таблица с некоторыми изменениими заимствована из работы [76 ]
6 Все пары оснований соответствуют следующей ориентации:
5' А > 3'
3' ч— и 5'
U А
8 1е же значения получаются при присоединении пары д к у -концу.
С G А
г Ге же значения получаются при присоединении пар • или • G С к -концу.
добавлении GC-nap, в которых между основаниями имеются три водо-
родные связи, а не две, как в AU-napax.
Пары UG также стабилизируют двойные спирали РНК, хотя и весь-
ма незначительно. Присутствие же неспаренных оснований оказывает
дестабилизирующий эффект. Наиболее прочные шпильки содержат до
4—5 оснований. В зависимости от того, какой парой заканчивается
шпилька — GC или AU, — спираль дестабилизируется на 20—30 кДж-
•моль'4. «Малые петли», отходящие с одной стороны спирали, вносят
меньший дестабилизирующий эффект. Рис. 2-26 дает пример того, как
с помощью табл. 2-6 можно оценить энергию образования петель в ли-
нейной цепи РНК.
138 Глава 2
А
А С 1
1 и 1 и /
и • А
А . и
А . и
G • с
С . с
• А
Л-и • А
А . и 1
А * У
А / и । и \ . и и 1 с /
с 1 • G^ "с
А . и
и . А »
G • с
С . G 1
и 1 • А 1
и • А
G С \ • С \ и Z
G 1 . С
G • с 1
и / 5' • с \ 3'
+ 25 кДж-моль'
— 7,5
-5,0
— 9
-21
—9
-5,0 + 12
-7,5
-5,0
-5,0
+ 8
-9 + 13
-7,5
-9
-13
-9
-5,0
-9
+ 8
-21
О
2 =~91 кДж-моль’1
7. Таутомерия и спаривание оснований
Образование двух и трех водо-
родных связей между основаниями в
ДНК имеет интересную связь с тауто-
мерией. Каждое основание находится
по большей части в какой-то одной
таутомерной форме, однако в любой
момент хотя бы несколько оснований
оказывается в менее устойчивой фор-
ме. Этим, в частности, можно объяс-
нить возникновение некоторых мута-
ций. Так, таутомер В в уравнении
(2-5) уже не может образовать пару с
тимином, своим «законным» партне-
ром, но зато способен образовать во-
дородные связи с цитозином. Если это
случится в ходе репликации гена, то
получится неправильная копия, в ко-
торой заменена одна «буква» генети-
ческого кода.
8. Нуклеотидный состав ДНК и РНК
Диапазон изменений нуклеотид-
ного состава ДНК на удивление ши-
рок. Суммарное процентное содержа-
ние цитозина и гуанина (GC-содержа-
ние) в различных бактериях меняется
от 22 до 74%. (GC-содержание в ДНК
Е. coli равно 51,7%). Для эукариот
этот диапазон более узок (от 28 до
58%). Тот факт, что у бактериальных
ДНК нуклеотидный состав меняется
в гораздо более широких пределах,
чем у высших организмов, удивления
не вызывает. Прокариоты существуют
на Земле почти столько же миллионов
РИС. 2-26. Распределение баланса
свободной энергии при образовании
предполагаемой вторичной структу-
ры по парам оснований и петлям
для фрагмента РНК вируса R17, со-
держащего 55 оснований. Показан-
ная здесь петля является частью бо-
лее крупной петли, приведенной в
работе [76].
лет, сколько и мы. Но из-за их более
простой структуры и высокой скорости
деления природа совершила над их ге-
нетическим материалом значительно
больше экспериментов и внесла в не-
го значительно больше изменений, чем
в наш.
Сравнение организмов по их GC-
содержанию иногда используют как
основу для установления филогенетического родства. Нужно, однако,
учесть, что тимин под действием УФ-света претерпевает ряд фотохими-
ческих превращений, поэтому бактерии с высоким GC-содержанием
могут чаще встречаться там, где мцого солнечного света, тогда как бо-
лее низкое GC-содержание может указывать на то, что местообитани-
ем данного организма являются более защищенные от солнца места
[77].
Представление о ДНК как о цепи, содержащей только четыре вида
нуклеотидов, немного упрощено. В ДНК из разных источников присут-
Молекулы, из которых мы состоим 139
ствует значительное число метилированных оснований. К ним относятся
5-метилцитозин и 6-метиладенин. По всей вероятности, эти метилиро-
ванные основания служат маркерами каких-то специфических участков
генетических копий. Метилирование происходит после синтеза полинук-
леотида. Кроме того, метилирование защищает ДНК от воздействия
ферментов, образующихся при попадании в клетку вирусов (гл. 15,
разд. Е). Некоторые вирусы, в особенности Т-четные бактериофаги, по-
ражающие Е. coli (дополнение 4-Д), выработали собственные защитные
механизмы. Они вместо цитозина содержат оксиметилцитозин. Появля-
ющиеся при этом лишние гидроксильные группы часто несут еще один
или два остатка глюкозы, присоединенные гликозидной связью [78].
Один из бактериофагов, поражающих Bactillus subtilis, содержит вме-
сто урацила оксиметилурацил, а вместо тимина—5-диоксипентилура-
цил [79].
Модификации, встречающиеся в молекулах РНК, значительно бо-
лее распространены и разнообразны, чем в ДНК, и о них будет идти
речь в гл. 15.
9. Кольцевые и суперспиральные структуры; интеркаляция
Молекулы ДНК могут существовать не только в виде открытых, не-
замкнутых молекул; часто их концы ковалентно соединяются друг с
другом. Так, хромосома Е. coli представляет собой единое замкнутое
кольцо. Кольцевые молекулы ДНК часто обнаруживаются в митохонд-
риях, а также в некоторых вирусах [80].
Как и у белков, структуру ДНК можно значительно исказить путем
внесения дополнительных супервитков (суперспиралей). Чтобы полу-
чить такой эффект, к одному из концов цепи необходимо приложить
крутящий момент. Так, если взять слегка скрученное свободно прови-
сающее резиновое кольцо и закрутить его сильнее (как это делают при
подготовке к полету аэромоделей), произойдет положительная супер-
спирализация. Аналогичная ситуация — образование положительных
(или отрицательных) суперспиралей (третичная спирализация)— мо-
жет иметь место и в ДНК. Суперспирали часто встречаются в кольце-
вых молекулах ДНК. При «закручивании» нормального двуспирального
комплекса (дуплекса) общее число оборотов a (the winding number)
одной нити относительно другой равно числу витков во вторичной
структуре р, которое соответствует ненапряженному спиральному дуп-
лексу (т. е. структуре Уотсона — Крика), плюс число супервитков т:
а=т-|-Р. (2-14)
Величина р всегда положительна, но т может быть и отрицательным—
в этом случае образование полностью сформированной вторичной струк-
туры (спираль Уотсона — Крика) сопровождается появлением некото-
рого числа левоспиральных супервитков [81].
Плотность супервитков (степень суперспиральности) молекулы ДНК
обычно выражают величиной а, равной числу супервитков на 10 пар
оснований [80, 82]. Для встречающихся в природе кольцевых молекул
ДНК о чаще всего отрицательна; наиболее типичное ее значение —0,05
(~5 супервитков на 1000 пар оснований). Присутствие супервитков в
кольцевых молекулах ДНК можно легко установить, поскольку при
этом меняется константа седиментации ДНК [81]. Так, суперспираль-
ная природная ДНК вируса полиомы седиментирует довольно быстро.
После внесения разрыва в одну из цепей двойной спирали посредством
кратковременной обработки ее ферментом образуется «релаксирован-
140 Глава 2
РИС. 2-27. А. Электрофорез препарата ДНК вируса SV 40 (дополвеиие 4-В), пред-
ставляющего собой смесь молекул с различным числом супервитков. Молекулы на-
тивной ДНК (электрофореграмма 1) быстро движутся к аноду в виде серии полос,
каждая из которых отличается от соседней по числу супервитков в соответствующей
ДНК на 1. Среднее число супервитков равно 25. Инкубация ДНК в присутствии «ре-
лаксационного» фермента (гл. 15, разд. Д.1) вызывает последовательное уменьше-
ние числа супервнтков; фермент вносит одноцепочечные разрывы и тут же снова сши-
вает цепь. Инкубация ДНК с этим ферментом при 0°С в течение 1, 3, 6, 10 и
30 мин (электрофореграммы 2—6) постепенно переводит ДНК в форму со средним
числом супервитков, равным нулю [82]. Электрофорез проводили в смеси 0,5%-ио-
го агарозного геля и 1,9%-ного полиакриламидного геля; размер пластинки—17Х
X 18X0,3 см. Для выявления полос электрофореграммы окрашивали флуоресциру-
ющим интеркалирующим красителем этидиумбромидом. (С любезного разрешения
W. Keller.)
ная» форма молекулы, которая седиментирует медленнее. Суперспи-
ральность сказывается на вязкости растворов ДНК, а также на элект-
рофоретической подвижности молекул (рис. 2-27, А) [82а]. В некото-
рых случаях наличие супервитков можно наблюдать с помощью элект-
ронного микроскопа.
Чем обусловлено образование супервитков в природных ДНК? Ключ
к решению этого вопроса дают исследования интеркаляции [83—86] —
встраивания плоских ароматических колец между парами оснований
ДНК. Способностью к такой интеркаляции обладают многие лекарст-
венные препараты (в частности, антибиотики), красители и другие ве-
щества. К их числу относятся дауиомицин, профлавин, этидиумбромид
и гикантон (рис. 2-27, £>). Гикантон, одно из наиболее широко приме-
няемых в мире лекарств, употребляется при лечении шистосомоза (гл. 1,
разд. Д.1). Поскольку интеркалирующие соединения обладают мута-
генным действием, применение таких лекарств связано с определенным
риском.
Молекулы, из которых мы состоим
141
Интеркаляция часто исполь-
зуется для оценки степени отри-
цательной суперспиральности мо-
лекул ДНК- Добавляя возраста-
ющие количества интеркалирую-
щего агента, следят за тем, как
изменяется константа седимен-
тации (или другие свойства)
ДНК- По мере возрастания сте-
пени интеркаляции происходит
раскручивание витков вторичной
структуры ДНК [₽ в уравнении
(2-14)]. Каждое интеркалирую-
щее кольцо вызывает раскручи-
вание спирали на ~26°. По-
скольку для замкнутого ковалент-
ного дуплекса значение а [урав-
нение (2-14)] постоянно, пони-
жение [3 при возрастании интер-
каляции ведет к увеличению т.
Когда интеркаляция достигнет
уровня, при котором т повысится
до 0, будет наблюдаться мини-
мальная скорость седиментации.
Дальнейшее добавление интерка-
лирующего агента приведет к по-
ложительной суперспирализации.
«Репликативная форма»
ДНК вируса 0 Х174 (дополне-
ние 4-В)—небольшая кольцевая
молекула из ~5000 пар основа-
ний— обрабатывалась профлави-
ном [82]. Связывание 0,06 молей
профлавина на моль нуклеоти-
дов сводило г к нулю. Отсюда
была получена оценка1 6 = 0,055;
это означает, что при температу-
ре 25°, pH 6,8 и ионной силе
~0,2 в молекуле содержится
—26 супервитков. На плотность
супервитков сильно влияют тем-
пература, pH и ионный состав.
В общем случае о становится
менее отрицательной на ~ 3,ЗХ
X 10-4 при повышении температу-
ры на 1° [86с]. Например, для
ДНК вируса 0 Х174 при ионной
РИС. 2-27. Б. Структурные формулы ряда
интеркалнрующих соединений (см. также
структуру комплекса актиномицин — ДНК
(дополнение 15-Б).
силе 0,2 а получалась равной —0,059 при 15 °C и —0,040 (—19 супер-
витков) при 75°С.
1 Приведенная здесь оценка основана на том, что интеркаляция одной молекулы
профлавина дает угол раскручивания ~16°; для сравнения отметим, что этидиумбро-
мид приводит к раскручиванию на 26°. В более ранней литературе угол раскру-
чивания для этидиумбромида принимался равным 12° и получавшаяся в результа-
те плотность супервитков (12о) оказывалась ниже приводимых теперь (26о) [84, 86а, Ь].
142 Глава 2
Недавно выполненные исследования показали, что при электрофоре-
тическом разделении как природных, так и искусственно полученных
суперспиральных молекул ДНК часто выявляется примерно 10 форм,
каждая из которых отличается от другой на один виток суперспирали
(рис. 2-27,Л). Относительное содержание этих топологически изомер-
ных форм примерно соответствует гауссову распределению. Считается,
что изомеры появляются в результате тепловых флуктуаций степени
суперспиральности в момент ферментативного замыкания цепи ДНК
в кольцо.
Сопряжена ли интеркаляция плоских молекул в цепи нуклеиновых
кислот с какой-либо биохимической функцией? По-видимому, да. На-
пример, в белках, взаимодействующих с нуклеиновыми кислотами, аро-
матические кольца боковых цепей аминокислот могут встраиваться
между плоскостями оснований в спиральной структуре ДНК наподо-
бие закладок внутри книги [85, 86]. Изменения в плотности супервит-
ков, вызванные интеркаляцией или изменением ионного окружения, мо-
гут играть роль в соблюдении нужной последовательности во взаимо-
действии ДНК с внутриклеточными ферментными системами.
10. Денатурация и гибридизация
Подобно белкам, нуклеиновые кислоты могут денатурировать. Этот
процесс состоит в расхождении цепей двойной спирали ДНК и двухспи-
ральных участков молекулы РНК (в частности, тРНК; рис. 2-24). Де-
натурацию можно вызвать добавлением кислоты, щелочи, спиртов или
удалением стабилизирующих структуру молекулы противоионов, напри-
мер Mg2+. В результате денатурации каждая из цепей молекулы приоб-
ретает форму беспорядочно свернутого клубка, поэтому данный процесс
называют переходом спираль — клубок. Тепловая денатурация нуклеи-
новых кислот, как и белков, носит кооперативный характер (гл. 4,
разд. В.7) и происходит в довольно узком интервале температур; ха-
рактерным параметром процесса является температура плавления.
Температурная зависимость поглощения УФ-света при 260 нм (дли-
на волны, при которой свет поглощается нуклеиновыми кислотами эф-
фективнее всего) называется кривой плавления (рис. 2-28). В нативном
состоянии нуклеиновые кислоты поглощают свет менее интенсивно, чем
в денатурированном. Этот так называемый гипохромный эффект (гл. 13,
разд. Б.4.д) обусловлен стэкинг-взаимодействием между основаниями,
плотно уложенными стопками в структуре нативной молекулы. Темпе-
ратура плавления, Тпл, — это точка, при которой прирост поглощения
составляет половину максимального (рис. 2-28). Чем выше GC-содер-
жание нуклеиновой кислоты, тем более устойчива она к денатурации,
причем зависимость Тпл от GC-содержания почти линейна. Для раство-
ра, содержащего 0,15 М NaCl + 0,015 М цитрата натрия, pH 7,0, спра-
ведливо уравнение (2-15). Точное соотношение между GC-содержани-
ем ДНК и Тпл очень сильно зависит от ионного состава и pH среды
[87, 88].
GC-содержание (%) =2,44 (Т^- 69,3) °C/ (2-15)
Полная денатурация молекулы ДНК приводит к расхождению комп-
лементарных цепей. При быстром охлаждении раствора денатурирован-
ной ДНК цепи остаются в разделенном состоянии. Однако, если в тече-
ние какого-то времени поддерживать температуру чуть ниже значения
Тпл (этот процесс называют отжигом), может вновь восстановиться на-
тивная структура. Этот факт дает в руки ученым очень важный метод
молекулы, из которых мы сосюим
Температура, °C
РИС. 2-28. Кривые плавления ДНК из двух разных источников — Pneumococcus (кри-
вая /) и Serratia (кривая //). (Davidson J. N„ The Biochemistry of Nucleic Acids,
7th ed., p. 148, Academic Press, New York, 1972).
исследования нуклеиновых кислот, основанный на образовании гибрид-
ных дуплексов [89, 90].
Одним из типов двойных спиралей, которые получают искусствен-
ным путем, является гибрид ДНК—РНК. Оказалось, что молекулы
информационной (матричной) РНК (мРНК) гибридизуются только с
одной из двух разделившихся цепей ДНК, несущей участки, компле-
ментарные мРНК. Метод гибридизации используется также для получе-
ния гетеродуплексов ДНК, в которых две цепи молекулы происходят
от двух разных генетических линий одного и того же вида организмов.
Известно, что некоторые мутации состоят в делении (выпадении) или
вставке одного или нескольких оснований в цепь ДНК. Гетеродуплексы,
в которых одна из цепей нативная, а другая — со вставкой или делеци-
ей, имеют по всей своей длине нормальную структуру по Уотсону—Кри-
ку, за исключением тех участков, где делении или вставки нарушают
комплементарность и образуются одноцепочечные петли (рис. 15-24).
Опыты по гибридизации позволили исследовать гомологичность нук-
леиновых кислот из разных источников. Вначале молекулы расщепляют
(например, с помощью ультразвука) на фрагменты длиной ~ 1000 нук-
леотидов и подвергают денатурации. Фрагменты денатурированной
ДНК смешивают с денатурированной ДНК из другого источника. Уча-
стки ДНК разных видов, имеющие близкие нуклеотидные последова-
тельности, в той или иной степени гибридизуются, тогда как участки
с сильно различающимися последовательностями гибридизации не под-
даются. Рассмотрим один из вариантов постановки таких эксперимен-
тов. Денатурированную ДНК определенного организма, не подвергав-
шуюся деградации, заключают в агаровый гель [90] или наносят на
нитроцеллюлозный фильтр [91]. Фрагменты ДНК из другого источни-
ка пропускают через колонку с ДНК-содержащим агаром или через
фильтр с абсорбированной ДНК. Комплементарное спаривание соот-
ветствующих фрагментов задерживает их на колонке или фильтре,
тогда как фрагменты, не нашедшие себе «партнеров», свободно про-
ходят дальше.
144 Глава 2
А
Число пар нуклеотидов
11 10 1 02 103|Ю4 105 10в|107 108 10Ч 10'°
f---1---1---1——I---+----1——f----1----1-2-
Coi, M-c-'
Б
РИС. 2-29. Кривые реассоциации ДНК (Britten R. J., Kohne D. E., Science, 161, 1968;
Britten R. J., Smith J.). А. Временной ход идеальной реакции второго порядка с ука-
занием основных характеристик графика, построенного в указанных координатах.
Уравнение дает долю одноцепочечных молекул ДНК в данный момент времени после
начала реакции. В начале реакции эта доля принята равной единице, и далее показа-
на ее зависимость от произведения суммарной концентрации ДНК на время (лога-
рифмическая шкала). Б. Кривые реассоциации двухцепочечных молекул нуклеиновых
кислот из разных источников. Размер генома указан стрелками на шкале вверху.
Вплоть до 109 эта величина пропорциональна Cot в момент, когда реакция прошла
наполовину. ДНК фрагментирована (длина фрагмента ~400 нуклеотидов в цепи).
При построении кривых введена поправка, приводящая скорости реакции к тем, ка-
кие имели бы место при концентрации ионов натрия 0,18 М. Реассоциация проводи-
лась при оптимальной температуре, т. е. на ~30° ниже Тлл. Степень реассоциации
определяли по оптическому вращению (ДНК тимуса теленка), устойчивости к рибо-
нуклеазе (MS-2) и гипохромному эффекту.
Очень ценным является изучение кинетики реассоциации фрагменти-
рованной денатурированной ДНК [92—95]. Этот процесс подчиняется
кинетике второго порядка (гл. 6, разд. А.З), описываемой уравнением
(2-16). Его легко получить, проинтегрировав уравнение (6-8) в интер-
вале от 0 до t при [А] = [В] =С.
С/С0=1/(1 + /гС0/). (2-16)
Это соотношение связывает начальную концентрацию денатурирован-
ной ДНК Со с концентрацией С молекул ДНК, оставшихся диссоции-
рованными к моменту времени t. Данные по реассоциации удобно пред-
ставлять в виде графика зависимости относительного числа реассоции-
Молекулы, из которых мы состоим 145
рованных молекул от Cot в логарифмическом масштабе (рис. 2-29,А).
Как видно из рис. 2-29, Б, Cot увеличивается прямо пропорционально
длине генома ДНК, но иногда наблюдается сильное отклонение от
этой зависимости, обусловленное наличием в молекуле большого числа
повторов [поли(Н) или поли (А)]. Наклон кривых в средней точке ха-
рактеризует степень гетерогенности фрагментов ДНК в растворе (гл. 15,
разд. И.1).
11. Конформация ДНК в палиндромах
Вопрос о том, что биологическое значение имеют обе конформации
ДНК — А и В, — уже обсуждался нами ранее. Другой тип конформа-
ционных перестроек связан с присутствием палиндромов1 — последова-
тельностей ДНК, которые одинаково читаются как в прямом, так и в
обратном направлении [95]. Такие последовательности обнаружены в
ДНК многих вирусов и бактерий. Рассмотрим, например, ген, опреде-
ляющий последовательность нуклеотидов в молекуле тРНК, изображен-
ной на рис. 2-24. Он представляет собой участок двуспиральной ДНК,
в котором одна цепь имеет ту же последовательность, что и цепь на
рис. 2-24, за исключением того, что вместо Т стоят U и ф (псевдоури-
5’-TGGTGCGAATTCTGTGGATCGAACACAGGAC.-3'
З'-ACCACGC TTAAGACACCTAGCT TGTGTCCTG-5'
С<ЛТ
-----------ТфС-петля ----- -
Т
А
G
G
Т
G
Т
С
5'-TGGTGCGA АТТ
3' -А С С А С G С Г ТАА
G
А
С
А
> С
С
т
А
• G
G А С- 3*
С Т G- 5'
• С
• Г
• G
• Т
• G ”
Т
т
РИС. 2-30. Две конформации участка гена, детерминирующего дрожжевую фенилала-
ниновую тРНК. Участок кодирует последовательность нуклеотидов на З'-конце моле-
кулы тРНК, изображенной на рис. 2-24, включая область ТфС-петли.
1 Составлением палиндромов — перевертышей на русском языке — с увлечением за-
нимаются многие люди. Приведем два примера таких перевертышей: «Умер — и мир
ему», «Нажал кабан на баклажан». Имеется и много других забавных, хотя и более
специфических перевертышей. — Прим, перев.
146 Глава 2
дин,рис.15-10)стоитТИотсутствуютметилированныеили иным образом мо-
дифицированные основания. Вторая цепь в точности комплементарна
первой. На рис. 2-30 изображена часть этого гена, соответствующая
З'-концу молекулы тРНК вплоть до отметки «добавочная петля» на
рис. 2-24. Этот участок ДНК может иметь и другую конформацию — с
петлями по обе стороны молекулы (рис. 2-30). Обратите внимание, что
«стержни» обеих петель в этой «крестообразной» конформации совер-
шенно идентичны и расположены симметрично относительно центра мо-
лекулы.
Данные, свидетельствующие о существовании крестообразных кон-
формаций ДНК в клетках, отсутствуют, и многие биохимики сомнева-
ются, есть ли они на самом деле. Однако совершенно очевидно, что
палиндромные последовательности в ДНК независимо от того, нахо-
дятся ли они в линейной или петлеобразной конформации, имеют очень
большое значение для взаимодействия нуклеиновых кислот с симмет-
ричными димерными или тетрамерными молекулами белков, примеры
которых будут рассмотрены в гл. 4 [95а].
Читатели, желающие более подробно узнать о биологической роли
нуклеиновых кислот, могут сразу же обратиться к гл. 15.
Д. Липиды [96—99]
Термином липиды называют очень большую и крайне разнородную
группу веществ. В основе отнесения этих веществ к единой категории
лежит их высокая растворимость в неполярных растворителях или
близость к соединениям, которые обладают таким свойством. Большин-
ство липидов не является высокополимерными соединениями и состоит
всего из нескольких связанных одна с другой молекул. Некоторые из
этих «строительных блоков» представляют собой линейные цепи ряда
карбоновых кислот, образующихся в ходе сложных реакций полиме-
ризации. Полученные в результате молекулы, например молекулы жир-
ных кислот, имеют по большей части гидрофобный характер, однако
обычно содержат как минимум одну полярную группу, которая может
служить местом связывания с другими компонентами. Довольно часто
присутствуют ионные группы (фосфат, —NHs) или полярные углевод-
ные компоненты. Липиды, содержащие как полярные, так и неполярные
группы, обычно встречаются в мембранах и на других поверхностях
раздела между водной средой и гидрофобными областями внутри кле-
ток.
1. Строительные блоки липидов
Структурные формулы некоторых липидов приведены на рис. 2-31.
а. Производные уксусной кислоты СН3СООН
Обычные жирные кислоты (с четным числом атомов углерода),
спирты жирного ряда, иногда содержащие двойные связи; они почти
всегда имеют ^пс-конфигурацию (табл. 2-7).
Жирные кислоты с нечетным числом атомов углерода.
Разветвленные, циклопропансодержащие и другие специфические
жирные кислоты.
Полипреновые производные: терпены, каротиноиды, стеролы и сте-
пг.и-ти обпазуюшиеся из ацетата путем восстановительной конденсации
Молекулы, из которых мы состоим 147
и декарбоксилирования, Б структурном отношении их можно рассмат-
ривать как продукт полимеризации изопрена
СН3
I
сн2=с—сн=сн2,
отсюда и их старое наименование — изопреноиды.
б. Полярные компоненты, не являющиеся производными
ацетата
Глицерин.
Серин, этаноламин, холин (эти соединения структурно взаимосвя-
заны, поскольку этаноламин и холин образуются из серина).
Сфингозин (частично является производным жирной кислоты).
Неорганический фосфат и сульфат, а также органические сульфона-
ты и фосфонаты.
Инозит, сахара.
НО СН2ОН
хс
н СН2ОН
Глицерин
Стеаринозая 'кислота,
главный компонент животных
триглицеридов; содержит
18 атомсв углерода
НО СН2ОН
\ / зп-Глицеро-З-фосфат
(ъ-а-глицерофосфот)
Н СН2О
РО32-
Воск (сложный эфир жирной
кислоты и жирного спирта)
Структурные формулы некоторых липидов.
РИС. 2-3]
148 Глава 2
Н
Сфингозин
пигмент моркови центра симметрии в этой 40-дглеродной
и других растений молекуле, построенной из /8 пренильных
звеньев
РИС. 2-31. (продолжение)
Пренилпирофосфат (изопенгпенилпирофосфат),
предшественник стероидных, каротиноидных
и других изопреноидных соединений
2. Соединение компонентов
Компоненты сложных липидов соединяются друг с другом самыми
разными путями; некоторые из них показаны на рис. 2-31 и 2-32. В ро-
ли центрального звена нередко выступает глицерин, который, в частно-
сти, посредством сложноэфирных связей может быть связан с тремя
жирными кислотами, образуя триглицериды (обычные жиры, присутст-
вующие в жировых тканях и входящие в состав растительных масел).
Углеводородные цепи жирных кислот стремятся находиться в вытяну-
той конформации, однако присутствие двойных связей вызывает изло-
мы и изгибы в их структуре. Фосфатиды (табл. 2-8) представляют со-
бой производные sn-глицеро-З-фосфата1 (L-a-глицерофосфата); их ти-
1 Система стереоспецифической нумерации (sn) из двух эквивалентных групп при-
писывает первое положение группе, находящейся в положении npo-S (см. гл. 6,
разд. Г.2).
Молекулы, из которых мы состоим 149'
Таблица 2-7
Некоторые наиболее важные жирные кислоты
Число атомов углерода Систематическое название Обычное название Сокращенное обозначение3 Обычное название ацильной группы
Насыщенные жирные КИСЛОТЫ
1 Метановая Муравьиная Формил
2 Этановая Уксусная Ацетил
3 Пропановая Пропионовая Пропионил
4 Бутановая Масляная 4:0 Бутирил
12 Додекановая Лауриновая 12:0 Лауроил®
14 Тетрадекановая Миристиновая 14:0 Миристоил
16 Гексадекановая Пальмитиновая 16:0 Пальмитоил
18 Октадекановая Стеариновая 18:0 Стеароил
20 Эйкозановая Арахнновая 20:0
22 Докозановая Бегеновая 22:0
24 Тетракозановая Лигноцериновая 24:0
Ненасыщенные жирные кислоты®
4 Кротоновая 4:12(2t) Кротоноил
16 Пальмитолеиновая 16:1(9с)
18 Олеиновая 18:1 (9с) Олеоил
Вакценовая 18:1 (Нс)
18 Линолевая 18:2(9с, 12с)
18 Линоленовая 18:3(9с, 12с, 15с)
20 Арахидоновая 20:4(5с, 8с, Нс, 14с)
а Первым идет число атомов углерода, затем число двойных связей. В скобках
указывается номер первого из углеродов при двойной связи и тип связи — цис (с)
или транс(t).
6 Официальные названия этой н других ацильных групп были предложены Ко-
миссией IUPAC по номенклатуре в органической химии, Pure and Applied Chemistry,
10, ill —125, 1965. В ряде случаев условились добавлять в ранее употреблявшееся на-
звание букву «о», например, пальмитпл стал пальмитоилом, кротонпл — кротоноилом.
Название «ацетил» оставлено без изменения. Логика этого предписания не вполне яс-
на, и многие авторы продолжают употреблять старые названия. Часто бывает удобно
использовать систематические наименования (например, гексадеканоил — радикал гек-
садекановой кислоты). Для алкильных радикалов IUPAC-IUB рекомендует всегда ис-
пользовать систематические наименования (например, говорить «гексадециловый», а не
«пальмитиловый» спирт). Действительно, в старой литературе пальмитил нередко озна-
чал и ацильный, и алкильный радикал, что и побудило IUPAC ввести новые названия
ацильных радикалов.
8 Систематические названия в этом случае очень сложны и почти не употребляют-
ся; например, название линоленовой кислоты — цис,цис,цис-9,12,15-октадекатрпеновая
кислота.
личный представитель — фосфатидилхолин, или лецитин. Электрически
заряженные фосфатная и холиновая группы образуют полярную «го-
ловку» молекулы. В фосфолипидах второй группы, сфингомиелинах, в
качестве центрального звена присутствует особое основание с длинной
цепью — сфингозин. В отличие от триглицеридов, которые при темпера-
туре тела представляют собой жидкость, фосфолипиды находятся в
150 Глава 2
СООН
Арахидоновая кислота,
одна из незаменимых
жирных кислот
сн2
о
н—С
,сн2
•2
Сулыролипид
хлоропластов
ОН в-сульфо-Б-дезокси-а-Р-
глюкопиранозилдиглицерид
Разветвленные жирные кислоты анти-изо-ряда
имеют здесь точку ветвления; началом второй
ветви служит пятиуглеродный „ стартовый
участок" образующийся из изолейцина
Разветвленные жирные кислоты иза-ряда содержат
пятиуглеродный „стартовый участок',' образующийся
из лейцина , или четырехуглеродный участок,
п^пазующийся из валина
о
о
Молекулы, из которых мы состоим 151
Крепининовая кислота 18-2 (9с,12а) составляет 60%
жирных кислот в семенах Crepis foetida, представителя
семейства Compositae
Рицинолевая кислота (12-оксиолевая кислота),
составляет до 90% жирных кислот касторовых
бобов, Ricinus communis
Лактобацилловая кислота, главная жирная
киспота молочнокислых бактерий
РИС. 2-32. Структурные формулы еще нескольких липидов.
твердом состоянии, что, несомненно, предопределяет их участие в по-
строении биологических мембран (гл. 5).
Цереброзиды и ганглиозиды — это сфингозинсодержащие липиды
(сфинголипиды), в которых полярным компонентом является не фос-
фат, а сахар. Другие гликолипиды, обнаруженные в бактериях и зеле-
ных растениях, содержат глицерин и жирные кислоты, а также a-D-ra-
лактозу, глюкозу и маннозу. В хлоропластах в большом количестве со-
держится специфический сульфолипид (рис. 2-32).
3. Жирные кислоты липидов
За исключением нескольких первых членов ряда, растворимых в
воде, жирные кислоты имеют сильно выраженные гидрофобные свойст-
ва. Однако все они являются кислотами, их р/Са~4,8. Встречающиеся
в природе свободные жирные кислоты, как правило, находятся на по-
верхности раздела липидов и воды и содержат диссоциированные кар-
боксильные группы, выступающие в водную среду. Однако обычно при-
родные жирные кислоты этерифицированы или посредством амидной
связи соединены с другими компонентами сложных липидов.
При всем многообразии жирных кислот, встречающихся в том или
ином организме, преобладающими обычно являются лишь некоторые
из них. В высших растениях присутствуют в основном пальмитиновая
кислота (Cie-кислота) и две С^-ненасыщенные кислоты — олеиновая и
линолевая. С!8-насыщенная стеариновая кислота в растениях почти не
встречается, а кислоты от С20 до С24 встречаются редко (за исключени-
ем эпидермиса листьев). В то же время члены некоторых таксономиче-
ских групп содержат необычные жирные кислоты, что и позволяет от-
носить эти организмы именно к данной группе; например, представите-
ли семейства Compositae (сложноцветные, к которым, в частности, от-
носятся маргаритки) содержат ацетиленовые жирные кислоты, а бобы
клещевины — особую жирную оксикислоту (рис. 2-32).
Таблица 2-8
Структура некоторых фосфатидов и сфинголипидов
В плазмалогенах в этом
положении вместо жир-
ной кислоты находится
винил-окси-группа
\ Z../\/R
о
в этерифицированных
фосфатидах здесь нахо-
дится алкокси-группа
Фосфатиды (фосфоглицеролнпиды)
У=—ОН, фосфатидная кислота
—ОН—СН2СН2—N+(CH3)3 фосфатидилхолин (лецитин)
—О—СН2—СН—NH3 фосфатидилсерин
соо-
—О—СН2СН2—NH3 фосфатидилэтаноламии
но
о
фосфатидилинозит
Сокращения
PC
S
РЕ
PI
—О—СН2—СН—СН2ОН
Ан
—о—сн2—сн—сн2—о
I
Он
фосфатидилглицерин
дифосфатидилглицерии (кардиоли-
пин), специфический компонент бак-
терий и митохондрий
В некоторых- цереброзидах мозга в этом положении
находится ОН-группа
О
I
Соединения, в ко-
торых Y=H, на-
зываются церами-
дами. Сфинголи-
пиды часто назы-
вают производны-
ми церамидов
Сфинголипиды
о
V = —(р)— холин (— О—Р—О—CHjCH,-N'tCHj),),
о-
О
II
—Р—CH2CH2NHt,
о-
—p-D-Gal- или P-D-Gal-(1 -► 4)-Glc—;
В цереброзидсульфатидах, например в
на 3-сульфатная группа
GalNAc-(l 3)-Gal-(l — 4)-
-Gal (1 —4)-G]c—;
сфингомиелины
церамидаминоэтилфосфонаты
цереброзиды или церамидмоно- и
олигосахариды
лактозилцерамидсульфате, с галактозой связа-
входит в состав сфинголипида, при-
сутствующего в мембранах эритроци-
тов
I
Молекулы, из которых мы состоим
153
В организме животных тоже содержатся пальмитиновая и олеино-
вая кислоты, но помимо этого в них присутствует в больших количе-
ствах стеариновая кислота. Встречаются также С20-, С2г-, и С24-кисло-
ты, да и вообще набор жирных кислот у животных значительно богаче,
чем у растений. Удивительно, что ненасыщенные жирные кислоты боль-
шинства организмов содержат двойные связи только в цпс-конфигура-
ции. В табл. 2-9 приведен состав жирных кислот в одной из типичных
смесей триглицеридов.
Таблица 2-9
Состав жирных кислот в некоторых жирах и маслах3
Жиры и масла Число атомов углерода и (через двоеточие) число двойных связей
14 16 18 16:1 18:1 18 : 2
Жировая клетчатка у человека 3 23 4 8 45 10
Говяжий жир 4 30 25 5 36 1
Кукурузное масло 13 2 31 54
Топленый свиной жир 1 28 15 3 42 9
3 Gunstone F. D., An Introduction to the Chemistry
Acids and Their Glycerides, 2nd ed., Chapter 6. Chapman
and Biochemistry of Fatty
and Hall, London, 1967.
У бактерий полиненасыщенные жирные кислоты, как правило, от-
сутствуют, но часто встречаются разветвленные жирные кислоты, рав-
но как и циклопропансодержащие кислоты, оксикислоты и свободные
неэтерифицированные жирные кислоты. Содержание жирных кислот в
различных органах одного и того же организма неодинаково. Напри-
мер, липидный компонент биологических мембран может быть на 90%
представлен фосфолипидами. Фосфолипиды в свою очередь характери-
зуются более высоким содержанием ненасыщенных жирных кислот,
чем триглицериды.
4. Поли-р-оксибутират
Липиды не являются полимерами в буквальном смысле этого слова,
однако как в метаболическом, так и в структурном отношении они
близки к присутствующей в бактериях полиоксимасляной кислоте —
важному запасному веществу. Этот сильно восстановленный полимер
состоит исключительно из звеньев D-p-оксимасляной кислоты, соединен-
ных сложноэфирной связью. Каждая цепь содержит около 1500 остат-
ков. Структура представляет собой компактную правую спираль с вин-
Связующие
группы
в полимере
Ъ~р-оксимасляная кислота
154 Глава 2
товой осью 2-го порядка и шагом 0,60 нм [100]. В бактериальных клет-
ках эти цепи уложены с образованием тонкого слоя толщиной ~ 5,0 нм.
Поскольку длина цепи из 1500 остатков в вытянутом состоянии равна
440 нм, цепь должна быть сложена примерно 88 раз.
Е. Некоторые малые молекулы и ионы
В клетках содержится большое количество малых органических мо-
лекул и ионов металлов. К ним относятся коферменты (гл. 8) — специ-
фические соединения, катализирующие в комплексе с ферментами хи-
мические реакции, которые в их отсутствие практически не идут.
Часто они выступают в роли окислителей, принимая в ходе окисле-
ния электроны от восстановленных органических соединений и переда-
вая их далее кислороду. Коферменты переносят также электроны, необ-
ходимые для процессов восстановления, например в ходе идущего под
действием света фотосинтеза. Исключительно велика во внутриклеточном
энергетическом обмене роль аденозин-5'-трифосфата (АТР) и родст-
венных ему соединений (дополнение 3-А). Важные функции внутри
клеток выполняют гормоны и другие низкомолекулярные регуляторные
соединения, а также целый ряд промежуточных продуктов метаболиз-
ма (промежуточных метаболитов).
1. Неорганические компоненты
Твердые компоненты клеток состоят главным образом из элементов
С, Н, О, N, S и Р. Однако после сжигания отдельной ткани или всего
организма в образующейся золе (обычно она составляет по весу 3—5%
всего твердого вещества, но в минерализованных тканях ее значитель-
но больше) присутствуют и многие другие химические элементы. Сре-
ди катионов относительно высоко содержание Na+, К+, Са2+ и Mg2+.
В организме человека при весе 70 кг содержится 1050 г Са (в основ-
ном в костях), 245 г К, 105 г Na и 35 г Mg. Далее идут железо (3 г),
цинк (2,3 г) и рубидий (1,2 г). Из этих трех элементов жизненно важ-
ными являются железо и цинк, а рубидий, вероятно, необязателен.
Другие элементы, относящиеся к металлам, в организме человека
присутствуют в количестве менее 1 г каждый, но по крайней мере семь
из них играют существенную роль. К ним относятся медь (100 мг),
марганец (20 мг) и кобальт (~5 мг). Роль других элементов — хрома
(<6 мг), олова и ванадия — для высших животных была выявлена
лишь недавно [101 —103]. По всей вероятности, необходимыми являют-
ся также никель, свинец и ряд других элементов [ЮЗ].
Среди металлоидов в золе преобладают фосфор (700 г для челове-
ка), сера (175 г) и хлор (105 г). Помимо этих трех элементов, жизнен-
но важных для всех организмов, высшим животным необходимы се-
лен, фтор, кремний (дополнение 2-Б) и иод, а растениям—бор
(рис. 2-33).
Какова вероятность того, что жизненно важными окажутся и дру-
гие элементы? Рассмотрим эритроцит человека — диск объемом
~80 мк3, содержащий около 3-108 молекул белка (преимущественно
гемоглобина). В одном эритроците находится 7-Ю5 атомов меди и
10s атомов жизненно необходимого элемента олова. Присутствуют
также 2-104 атомов серебра — металла, обладающего токсическим дей-
ствием- Его концентрация — свыше 10~7 М — достаточно высока, чтобы
предположить, что серебро выполняет какую-то важную каталитиче-
rifvin Тяк пи чтп — нризнестно. и скопее всего сепебцо попа-
Молекулы, из которых мы состоим 155
дает в наш организм попросту от того, что мы имеем дело с серебря-
ными предметами — монетами, ювелирными изделиями, посудой и т. д.
В эритроците содержатся также бор и алюминий (по 3-105 атомов
каждый), мышьяк (7-105 атомов), свинец (7-104 атомов) и никель
(2-Ю4 атомов). Из всех элементов периодической таблицы (кончая ура-
РИС. 2-33. Жизненно важные для живых организмов элементы [102] (они располо-
жены в закрашенных клетках). 11 элементов — С, Н, О, N, S, Р, Na, К, Mg, Са
и С1 — составляют 99,9% массы тела человека. Для жизнедеятельности высших орга-
низмов необходимо присутствие в следовых количествах еще 13 элементов. Высшим
растениям необходим бор; для животных, микроорганизмов и водорослей этот эле-
мент, по-видимому, иеобязателеи.
ном) лишь четыре (Ас, Ро, Ра и Ra) присутствуют в среднем в количе-
стве менее 1 атома на клетку [101].
Некоторые из элементов, считающиеся несущественными, в частно-
сти Cs, Rb, Sr и Ni (последний, возможно, существен), относительно
нетоксичны. Другие же высокотоксичны, например Sb, As, Ba, Be, Cd,
Pb, Hg, Ag, T1 и Th.
Ионный состав тканей и жидкостей тела сильно варьирует. Кровь
морских организмов по содержанию Na+, СК, Са2+ и Mg2+ близка к
морской воде. Кровь пресноводных и наземных организмов содержит
почти в 10 раз меньше Na и Cl и в несколько раз меньше Са и Mg, и
тем не менее она сравнительно богата этими ионами.
Вообще клетки богаты К+ и Mg2+ (особенно К+), но содержат мало
Na+ и Са2+. Из неорганических анионов главное место принадлежит
хлориду, но большую часть отрицательных зарядов привносят органиче-
ские карбоксилатные и фосфатные группы (табл. 2-10), многие из кото-
рых входят в состав белков и других макромолекул. По оценкам Лин-
га, концентрация аминокислотных остатков, принадлежащих внут-
риклеточным белкам, обычно составляет 1,66 М. Из этих остатков 10%
имеет отрицательно заряженные боковые группы и 8%—положитель-
но заряженные. Получающийся в итоге суммарный отрицательный за-
ряд достигает концентрации 38 мМ [104].
2. Избирательное накопление ионов
Живые организмы часто способны концентрировать многие присут-
ствующие в воде элементы в 104 и более раз. Даже морские виды кон-
центрируют почти все элементы, за исключением натрия и хлора. Не-
редко какой-то один вид или группа организмов имеют особое сродст-
во к определенному элементу, выступая по отношению к нему в роли
накопителя [101]. Так, плауны накапливают А1, бурые водоросли и
кишечнополостные — As; в бурых водорослях и губках накапливается В;
у позвоночных (в составе скелета) концентрируется F; некоторые бак-
терии, планктон и хвощи накапливают Fe. Кремний накапливается хво-
щами, диатомовыми водорослями, некоторыми простейшими и губками;
156 Глава 2
бурые водоросли вместо Са используют Sr; V накапливается некоторы-
ми видами асцидий, Y—папоротниками, Zn — кишечнополостными. Из-
вестны виды, специфически накапливающие Ba, Со, Li, Ni, Ti, Se, La и
Nd.
Ткани млекопитающих тоже нередко способны концентрировать оп-
ределенные ионы. Так, в составе волос и ногтей накапливаются Al, As,
I и V, в почках — Cd, Hg и Мп, в тканях кишечника — Sn, в предста-
тельной железе—Zn и Sr, в мозге Си, а в слизистой глаз накапливает-
ся В а [101].
Внутри клеток содержание неорганических ионов в разных органел-
лах и отсеках существенно различается. Так, в ткани сердца быка кон-
центрация меди в 10—15 раз меньше, чем в митохондриях [105].
3. Функции неорганических ионов
Очень часто присутствие того или иного нона металла или аниона
(например, С1 ) оказывается необходимым для работы фермента.
В ряде случаев ион металла связывается с ферментом в определенном
центре на его поверхности или внутри молекулы. Влияние иона на ка-
тализируемую реакцию может быть обусловлено присутствием сильно-
го электрического заряда. Некоторые ионы металла способны обратимо
окисляться и восстанавливаться. Благодаря этому свойству железо,
медь и кобальт входят в состав активных центров многих ферментов,
катализирующих окислительно-восстановительные процессы. Важное
значение имеет также способность ионов металлов влиять на взаимную
ориентацию разных участков молекулы белка или других макромоле-
кул. Связывание иона металла может вызывать радикальные измене-
ния в конформации молекулы (гл. 4, разд. В. 8.в).
Ж. Химический состав клеток
Какое количество белков, нуклеиновых кислот, углеводов, липидов
и других веществ присутствует в живой клетке? Однозначно ответить
на этот вопрос нельзя, поскольку клетки сильно отличаются одна от
другой. Так, некоторые специализированные клетки накапливают в
большом крличестве триглицериды или углеводы. Железистые клетки
часто характеризуются необычно высоким содержанием белка и РНК.
Состав организма меняется с возрастом. Например, в организме эмб-
риона свиньи содержится 97% воды, а к моменту рождения ее остается
89%; для неоткормленной свиньи весом 45 кг этот показатель состав-
ляет 67%, тогда как для очень жирного животного в 135 кг весом он
не превышает 40%.
Простой приближенный анализ состава ткани проводят следующим
образом. Ткань полностью высушивают в вакууме при низкой темпера-
туре и из полученного твердого материала соответствующими раство-
рителями экстрагируют липиды. После выпаривания растворителя взве-
шивают оставшиеся липиды. Этим методом показано, что в молодых
зеленых овощах содержится 2—5% липидов в пересчете на сухой вес.
Даже в очень постном мясе содержание липидов составляет 10—30%.
Содержание белка часто оценивают по содержанию азота, умножив по-
следнее на 6,25. В молодых зеленых растениях белок может составлять
20—30% сухого веса, но очень постное мясо содержит его до 50—70%.
Мерой содержания в ткани неорганических компонентов служит вес
золы, образовавшейся после сжигания образца ткани при высокой тем-
пературе. Обычно зола составляет 3—10% веса ткани; при сжигании
Молекулы, из которых мы состоим 157
специализированных тканей (в частности, костей) этот процент больше.
В рамках такого приближенного анализа содержание углеводов оце-
нивается вычитанием всего остального из 100%- В молодых зеленых
растениях содержится до 50—60% углеводов, а в типичных животных
тканях — лишь 2—10%. В исключительных случаях содержание угле-
водов в животных тканях оказывается более высоким. Так, в устрицах
гликоген составляет 28%.
Содержание нуклеиновых кислот в клетках колеблется от 0,1% в
дрожжах и 0,5—1% в мышцах и бактериальных клетках до 15—40%
в тимусе (вилочковой железе) и в клетках спермы. Очевидно, в этих
двух последних случаях из-за высокого содержания нуклеиновых кис-
лот умножение содержания азота (в %) на 6,25 не дает правильной
оценки содержания белка.
Таблица 2-10
Примерный состав метаболически активных клеток и тканей
Компонент Е. coli3, % Зеленое расте- ние (шпинат, Spinaci а oleracea)6, о/ /и Печень крысыв, %
H2O Белок Аминокислоты ДНК РНК Нуклеотиды Углеводы Целлюлоза Гликоген Липиды Фосфолипиды Нейтральные липиды Стеролы Другие малые молекулы Неорганические ионы К+ 70 15 0,4 1 6 0,4 3 2 0,2 1 93 2,3 3,2 0,6 0,3 1,5 69 21 0,2 1,0 3,8 6 3,1 1,6 0,3 0,4
Компонент Концентрация крысы, в печени М
Аминокислотные остатки Нуклеотидные звенья Гликоген К+ 2,1 0,03 0,22 ОД
11 Watson J. D., Molecular Biology of the Gene, 3rd ed., p. 69, Benjamin, New York,
1976. В процентное содержание аминокислот, нуклеотидов, углеводов и липидов вклю-
чено содержание их предшественников, присутствующих в клетках.
6 Burton В. Т., Human Nutrition, 3rd ed., р. 505, McGraw-Hill, New York, 1976.
B Long C. ed., Biochemists’ Handbook, pp. 677—679, van Nostrand-Reinhold, Prince-
ton, New Jersey, 1961.
158 Глава 2
В табл. 2-10 приведен сравнительный состав бактерии (£. coli). зе-
леного растения (шпината) и функционально активной животной тка-
ни (печени крысы).
3. Как мы изучаем структуру молекул
Каким образом химики установили те тысячи структурных формул,
которые мы используем для описания встречающихся в природе мо-
лекул? Этот вопрос слишком сложен, чтобы обсуждать его здесь под-
робно. Но поскольку разделение соединений, анализ смесей и установ-
ление структуры молекул по-прежнему занимают важное место в сов-
ременной биохимии, далее мы даем «мини-обзор» и сопровождаем его
рядом ссылок, чтобы помочь читателю ориентироваться в литературе
по этим вопросам.
1. Разделение
Прежде чем начинать работу над выяснением структуры того или
иного вещества, необходимо выделить его в чистом виде из тех слож-
ных смесей, в составе которых оно находится в клетках и тканях, при-
чем зачастую концентрация этого вещества в ткани бывает весьма низ-
кой. Затем молекулы соединения необходимо разрушить и полученные
фрагменты разделить, очистить и идентифицировать. Для определения
относительного содержания компонентов проводят точный количествен-
ный анализ. Далее уже нужна известная изобретательность, чтобы со-
брать из всех фрагментов единое целое и установить структуру исход-
ных молекул.
а. Фракционирование клеток [105—ПО]
Исходным материалом при фракционировании может служить све-
жая ткань или осадок спрессованных клеток микроорганизма, обычно
получаемый с помощью центрифугирования.
Ткань измельчают либо в мясорубке, либо, если нужна более мяг-
кая обработка, в гомогенизаторе'. Клетки микробов чаще всего разру-
шают с помощью ультразвука или продавливанием через пресс под вы-
соким давлением. При фракционировании очень важно подобрать нуж-
ное значение pH и состав буфера, а при выделении субклеточных орга-
нелл— осмотическое давление. Для сохранения целостности органелл
часто в качестве суспендирующей среды используют 0,25 М. сахарозу, к
которой добавляют A4gCl2, а также реагент, образующий комплекс с
металлами, например этилендиаминтетраацетат (ЭДТА) (табл. 4-2).
Растворимые ферменты обычно экстрагируют без добавления сахарозы,
но при этом используют восстановители — глутатион (дополнение 7-Б),
меркаптоэтанол или дитиотреитол (разд. 3.3.а).
Полученный сырой гомогенат процеживают и обычно центрифугиру-
ют непродолжительное время, чтобы удалить фрагменты клеток и про-
чие «осколки». Клеточные органеллы, как правило, отделяют центрифу-
гированием [106, 107]. Одна из методик подобного рода состоит в сле-
дующем. Гомогенат в 0,25 М сахарозе (изотоничной по отношению к
большей части клеток) центрифугируют в течение 10 мин при 600—
1 Наиболее широко используется гомогенизатор, представляющий собой цилинд-
рический патрон, внутри которого вращается довольно плотно прилегающий к стен-
кам стеклянный или пластиковый поршень.
Молекулы, из которых мы состоим 159
1000 g, что позволяет осадить ядра и целые клетки. Затем надосадоч-
ную жидкость центрифугируют еще 10 мин при -—10 000 g, в результа-
те чего осаждаются митохондрии и лизосомы. Наконец, центрифугиро-
вание в течение часа при —-100 000 g дает микросомный осадок. Каж-
дый из разделенных компонентов можно затем снова суспендировать
и повторно центрифугировать, чтобы получить более чистый препарат
органелл данного типа. Осажденные частицы во многих случаях рас-
творяют с помощью химической обработки, например добавляя детер-
генты. Супернатант (надосадочная жидкость), остающийся после цент-
рифугирования с максимальной скоростью, служит исходным материа-
лом для выделения растворимых ферментов и многих низкомолекуляр-
ных соединений.
б. Разделение, основанное на разной растворимости
компонентов системы
Некоторые фибриллярные белки практически нерастворимы в воде,
так что все остальные компоненты препарата можно удалить растворе-
нием. Растворимые белки чаще всего осаждают из водных растворов
путем высаливания, которое сводится к добавлению большого количе-
ства соли, например сульфата аммония. Разные белки осаждаются при
разных концентрациях соли, поэтому можно отделить фракцию белков,
осаждающихся в заданном интервале концентраций, а затем очищать
эту фракцию дальше. Методы, основанные на таком поэтапном осаж-
дении, широко используются как первый шаг очистки, поскольку они
позволяют получать сразу большие количества материала.
РНК чаще всего получают обработкой препарата фенолом, насы-
щенным водой, в котором осаждаются все белки. При определенных
условиях иногда удается удалить и ДНК. Последовательные стадии
осаждения и экстрагирования позволяют отделить РНК от полисаха-
ридов (в водном слое), ДНК (если она имеется) и других компонентов
[111 —113]. Нуклеиновые кислоты можно отделить от белков, удаляя
последние с помощью протеолитических ферментов.
Некоторые углеводы, например целлюлоза и гликоген, устойчивы к
кипячению в щелочи, и это позволяет удалить все другие компоненты
смеси. Липиды экстрагируют из тканей неполярными растворителями
[114], например смесью СНС13 и СН3ОН в соотношении 2:1.
в. Разделение, основанное на распределении соединений
между разными фазами
Многие наиболее важные методы разделения основаны на много-
кратном распределении соединений между двумя разными фазами, из
которых хотя бы одна обычно является жидкой. Малые молекулы мож-
но разделить с помощью противоточного распределения, когда препа-
рат многократно уравновешивается между двумя жидкими фазами,
причем одна из фаз более полярна, чем другая. После каждого уравно-
вешивания с помощью специального устройства «противоточным» обра-
зом вводятся новые порции обеих жидкостей [115].
В качестве одной из фаз можно использовать порошок или мелкие
частицы; ими заполняют вертикальную колонку или наносят их тонким
слоем на стеклянную пластинку. Все эти методы называются хромато-
графическими— термин, предложенный М. Цветом, который впервые в
1903 г. описал разделение пигментов, присутствующих в листьях рас-
тений (хлорофилла и каротинов). Пропуская пигменты, растворенные
160 Глава 2
в неполярных растворителях (например, гексане), через колонку с
окисью алюминия или другими адсорбентами, М. Цвет обнаружил, что
смесь разделяется на окрашенные полосы, которые перемещаются вдоль
колонки по мере прохождения растворителя. Непрерывно пропуская
растворитель через колонку, можно элюировать отдельные пигменты в
РИС. 2-34. Двумерная тонкослойная хроматография (в силикагеле) смеси флавинов,
образовавшихся при облучении витамина рибофлавина. Появление светлых пятен на
снимке обусловлено флуоресценцией соединений в ультрафиолетовом свете. Какое-то
количество рибофлавина сохраняется в первоначальном виде (пятно, обозначенное
RF). Стрелки указывают место нанесения образца. Для разделения в первом направ-
лении использована смесь уксусная кислота/2-бутанон/метанол/бензол, во втором —
смесь н-бутанол/уксусиая кислота/вода [147].
чистом виде. Описанный метод широко применяется и сейчас и носит
название адсорбционной хроматографии. При этом пигменты не раство-
ряются в твердом материале, а адсорбируются на его поверхности.
Часто в качестве материала, которым наполняют колонки, исполь-
зуют силикагель, содержащий большое количество воды; разделение
компонентов в этом случае происходит за счет их распределения между
водной фазой, иммобилизованной силикагелем, и водой, протекающей
через колонку. Для разделения липидов применяют колонки с обращен-
ной фазой; их наполняют силикагелем, окисью алюминия или другим
инертным материалом, пропитанным неполярной жидкостью. В роли
подвижной фазы в этом случае выступает более полярный раствори-
тель.
Хроматография на бумаге основана на использовании в качестве
иммобилизованной фазы высококачественной фильтровальной бумаги,
адсорбирующей воду. В последнее время широкое распространение по-
лучила тонкослойная хроматография; вместо бумаги здесь использует-
ся тонкий слой силикагеля, нанесенный на стеклянную пластинку. Этот
метод гораздо удобнее хроматографии на бумаге, поскольку дает бо-
лее быстрое и качественное разделение (рис. 2-34). Для разделения
летучих веществ применяется газовая хроматография, основанная на
Молекула, из которых мы состоим 16 1
установлении динамического равновесия между газовой и неподвижной
фазами при сравнительно высоких температурах; область применения
этого метода расширяется в связи с возможностью образования лету-
чих производных разделяемых соединений (например, метиловых эфи-
ров или триметилсилильных производных сахаров).
Весьма важное место принадлежит аффинной хроматографии [116,
117]. Она основана на использовании особых адсорбентов, специфиче-
ски взаимодействующих с макромолекулами и избирательно удержи-
вающих данный вид макромолекул (отсюда и название метода). При-
мером, о котором уже говорилось в разд. Г.10, служит адсорбция комп-
лементарных фрагментов молекулы нуклеиновой кислоты на иммоби-
лизованной ДНК. Аффинная хроматография используется также для
очистки ферментов, антител и других белков, способных прочно связы-
ваться со специфическими малыми молекулами.
Открытый характер структуры в гелях (рис. 2-18), образуемых про-
изводными агарозы, делает крупнозернистые порошки этих гелей удоб-
ной твердой основой для приготовления адсорбентов. Гидроксильные
группы агарозы часто модифицируют присоединением к ним аминов.
Вначале агарозу обрабатывают бромцианом (Вг—C = N) в щелочной
среде, «активируя» тем самым углеводную цепь (химическая сторона
этого вопроса обсуждается в работе [118]), а затем добавляют амины.
Полная реакция описывается следующим уравнением:
Вг-
Агароза—ОН -f- BrCN -f- R—NH2 -->
NH О
! II
Агароза—О—С—NH—R-p Агароза—О—С—NH—R — Другие продукты. (2-17)
Таким образом можно приготовить адсорбенты, содержащие множест-
во разных R-групп. Кроме того, присоединив к активированной агарозе
диамин [R=(CH2)«—NH2], с полученной в результате со-аминоалкил-
агарозой можно далее связать другие соединения. Для этого исполь-
зуется реакция с растворимым в воде карбодиимидом:
О
II Растворимый в воде
Агароза—О—С—NH—СН2—СН2—NH, + R—СООН-----------------
карбодиимид
О о
II н II
--->- Агароза—О—С—NH—СН2—СН2—N—С—R. (2-18)
Карбодиимиды широко применяются в лабораторной практике для об-
разования амидных и фосфодиэфирных связей. Процесс образования
амида, фигурирующего в уравнении (2-18), можно изобразить в виде
схемы (2-19). Для реакций, протекающих в неводной среде, часто ис-
пользуют дициклогексилкарбодиимид (R"= циклогексил; см схему),
однако для последующего присоединения каких-либо групп к сахарозе
лучше брать растворимый в воде реагент, например 1-этил-3-(диметил-
аминопропил)-карбодиимид [119].
Помимо описанных выше, известно также много других способов
приготовления адсорбентов для аффинной хроматографии.
Примером применения аффинной хроматографии для очистки фер-
ментов может служить выделение стафилококковой нуклеазы (фермен-
162 Глава 2
та, гидролизующего ДНК) с помощью хроматографии на колонке с
агарозой, содержащей следующую труппу [120]:
Агароза
Эта ЬифосфонуклеозиЬная группа
комплементарна активному
центру фермента
Тимин
г. Разделение, основанное на размерах молекул
Диализ [121] и ультрафильтрация [122] основаны на применении
в качестве полупроницаемого барьера тонкой мембраны (например, из-
ацетата целлюлозы — целлофана), имеющей поры диаметром 1—10 нм
(чаще всего 5 нм). Малые молекулы такая мембрана пропускает, а
крупные задерживает. Диализ определяется диффузией, и его можно'
ускорить перемешиванием раствора, а скорость фильтрования зависит
от разности давлений по разные стороны мембраны. Более сложный
.характер имеет гель-фильтрация [123]. Колонку наполняют материа-
лом типа декстрана с большим числом поперечных сшивок (сефадекс1);,
обычно он имеет вид спрессованных мягких шариков. Шарик представ-
ляет собой трехмерную сеть из углеводных цепей (рис. 2-18). Прост-
ранство между цепями (оно зависит от числа сшивок, образующихся
в геле при его химической обработке) недостаточно для проникновения
туда крупных молекул, но в нем вполне могут задерживаться малые
молекулы. При пропускании через такую колонку смеси разных моле-
1 Коммерческое название продукта, производимого Фирмой Pharmacia Fine Chemi-
cals, Uppsala, Sweden.
Молекулы, из которых мы" состоим 163
кул малые молекулы диффундируют внутрь частиц геля и задержива-
ются там, а крупные проходят беспрепятственно (рис. 2-35). Сефадекс
G-25 не задерживает ничего, кроме низкомолекулярных солей и соеди-
МЛ
РИС. 2-35. Разделение олигосахаридов с помощью гель-фильтрации. Сахара, раство-
ренные в дистиллированной воде, пропускали через колонку, заполненную сефадексом
G-25. Пики (справа налево) соответствуют глюкозе, целлобиозе, целлотрнозе и т. д.
(Flodin Р., Aspberg К.-, Biol. Struct. Funct. 1st., Proc. IUB/IUBS Int. Symp., 1960, 1,
345, 1961.)
нений типа простых циклических сахаров. Сефадекс G-200 с гораздо
меньшим числом поперечных сшивок применяется для разделения
макромолекул, мол. вес которых лежит в интервале 5000—200 000.
д. Центрифугирование
Самые разнообразные методы разделения связаны с использованием
препаративных центрифуг [124, 125]. Скорость седиментации молекул
в центробежном поле зависит от формы и размеров молекул. Каждая
молекула характеризуется своей константой седиментации s, выражае-
мой в единицах Сведберга, S. Когда же в центрифуге устанавливается
седиментационное равновесие, то главным фактором, определяющим,
где в итоге окажутся частицы, становится их плотность.
Для грубого предварительного разделения клеточных фрагментов
достаточно кратковременного последовательного центрифугирования
при нескольких разных скоростях (с разным центробежным ускорени-
ем) (разд. 3.1. а). Однако, чтобы получить максимально чистые препа-
раты органелл или молекул, используют центрифугирование в градиен-
те плотности. Например, для разделения РНК на несколько фракций,
различающихся по константам седиментации, сначала в пластмассовой
центрифужной пробирке создают градиент концентраций раствора са-
харозы (от 25% на дне до 5% на поверхности). Затем сверху аккурат-
но наслаивают препарат РНК и проводят центрифугирование с очень
высокой скоростью в течение нескольких часов. Препарат РНК разде-
ляется на ряд медленно седиментирующих резких полос, стабилизируе-
мых градиентом сахарозы. Затем пробирку прокалывают снизу и соби-
рают фракции по каплям в пробирки с помощью коллектора фракций.
Далее определяют положение каждой фракции и содержание в ней
РНК.
При достаточно большом времени центрифугирования частицы до-
стигают в градиенте плотности равновесных положений. Именно та-
щим образом в соответствии с их плотностью в градиенте сахарозы раз-
деляют клеточные органеллы (гл. 1, разд. Б.6). Макромолекулы (на-
164 Глава 2
пример, ДНК) чаще всего разделяют в градиенте CsCl [126]. В плот-
ных солевых растворах градиенты достаточно устойчивы, и для лучше-
го разделения применяются очень сильные центробежные поля. В ре-
зультате можно отделить одноцепочечную ДНК от двухцепочечной или
разделить препараты ДНК с разным GC-содержанием. Последнее ос-
новано на различиях в плавучей плотности р таких ДНК в растворе
CsCl, которая меняется с GC-содержанием в соответствии со следую-
щим приближенным уравнением:
р= 1,660 +0,098-(мольная доля GC-nap).
е. Электрический заряд
В основе ряда методов разделения молекул лежит различие в сум-
марном заряде, который они несут при данном pH среды. Этот суммар-
ный заряд для многих соединений легко оценить по числу содержащих-
ся в них кислых и основных групп. Предположим, что нам известны
значения рЛа каждой группы и степень ее диссоциации при данном pH.
При некотором pH, называемом изоэлектрической точкой, суммарный
заряд молекулы становится равным нулю — в электрическом поле она
не перемещается. При любом другом значении pH молекула будет дви-
гаться к аноду ( + ) или катоду (—).
Электрофорез, процесс разделения молекул, основанный на разной
скорости перемещения их в электрическом поле, проводят самыми раз-
ными способами. Очень небольшое количество раствора, содержащего
смесь белков (например, белков сыворотки крови), наносят в виде
тонкой полоски на лист фильтровальной бумаги или ацетата целлюло-
зы. Лист насыщают буфером и пропускают через него электрический
ток. Напряжения в несколько сот вольт достаточно для разделения
белков сыворотки в течение 1 ч. Для ускорения процесса и снижения
диффузии низкомолекулярных веществ широко используют высоко-
вольтный электрофорез. Прикладываемое напряжение составляет в этом
случае 2—3 тыс. вольт. Образец постоянно охлаждают с помощью
термостатируемых пластин; иногда для той же цели всю систему погру-
жают в сосуд с керосином. Электрофоретическое разделение больших
количеств материала проводится в плоских лотках, заполненных крах-
мальным или каким-либо другим гелем. Одним из наиболее распрост-
раненных и чувствительных методов разделения белков является элект-
рофорез в колонке, заполненной полиакриламидным гелем. Этот метод,
в настоящее время сильно усовершенствованный, позволяет проводить
разделение молекул одновременно и по размеру, и по электрическому
заряду; его называют методом электрофоретического молекулярного си-
та [127, 128].
При изоэлектрическом фокусировании в вертикальной колонке меж-
ду анодом и катодом электрохимически создается градиент pH. Гра-
диент pH стабилизируется градиентом плотности, чаще всего сахароз-
ным; вся система тщательно термостатируется. Белки в колонке дви-
жутся в направлении, соответствующем их изоэлектрической точке, где
«фокусируются» в виде очень узкой полосы. Две соседние полосы мо-
гут быть разделены интервалом всего лишь в 0,01 единицы pH. Счита-
ется, что изоэлектрические точки белков в обычных экспериментальных
условиях близки к их изоионным точкам, т. е. к тем значениям pH, при
которых белки остаются изоэлектрическими в условиях полного отсут-
ствия добавленного электролита [129].
Чрезвычайно важным методом разделения, связанным с наличием
электрических заряженных групп, является ионообменная хромато-
Молекулы, из которых мы состоим 165
графия. Обычно применяются водные растворы смесей и колонки, на-
полненные ионообменной смолой — пористым веществом, содержащим
связанные ионные группы, например —SO3, —ООО', —NH3, или чет-
вертичные атомы азота. Для разделения малых молекул, как правило,
берут синтетические смолы, основу которых составляет полистирол с
поперечными сшивками. Для крупных молекул больше подходят произ-
।________।________i_
О 10 20
_1_____|_______I______I_______I_____।-------1-------1-----1--------1—
30 40 50 60 70 80 90 100 110 120
Время элюирования, мин
РИС. 2-36. Результат ионообменной хроматографии смеси аминокислот в аминокислот-
ном анализаторе. Смесь аминокислот (по 0,5 нмоль каждой) нанесли на колонку диа-
метром 0,9 см и длиной 58 см, заполненную мелкими частицами полнстирол-сульфона-
та (Durrum тип DC-4A), и элюировали ее цитратным буфером при трех значениях pH.
последовательно возраставших от 3,5 до 6,4. Проходящий через колонку раствор об-
рабатывали флуорескамином (стр. 180) и затем непрерывно регистрировали флуорес-
ценцию образовавшегося продукта. (С любезного разрешения Durrum Chemical Corp.)
водные целлюлозы или поперечносшитых декстранов (сефадекс). Со-
единения с положительно заряженными группами, например аминокис-
лоты в кислом растворе, наносят на колонку с катионообменной смо-
лой, скажем дауэкс 50, которая содержит диссоциированные группы
сульфоновой кислоты. Адсорбированные аминокислоты элюируют рас-
твором НС1 или буфером с возрастающим значением pH. Процесс тако-
го типа лежит в основе автоматического количественного анализа сме-
сей аминокислот, образующихся в результате гидролиза белков или
пептидов (рис. 2-36). На сульфонат-замещенном полистироле можно
разделять также пуриновые и пиримидиновые основания. Отрицатель-
но заряженные нуклеотиды обычно разделяют на смолах, содержащих
четвертичные основания [130]. Разработан вариант этого метода для
166 Глава 2
разделения очень малого количества материала; например, можно ко-
личественно определять содержание каждого из нуклеотидов в препара-
те митохондрий из печени крысы, содержащем 5—8 мг белка [131].
2. Гидролиз
Почти все биополимеры по своей природе нестабильны и в реакции
с водой распадаются на мономерные звенья (гидролизуются). Гидро-
лиз катализируют протоны, ионы гидроксила и ферменты. Механизмы
гидролиза рассматриваются в гл. 7. Гидролиз может быть полным или
частичным, неспецифическим или, напротив, направленным на опреде-
ленные связи в молекуле полимера.
Полный гидролиз белков обычно проводят путем нагревания при
температуре около 110° в атмосфере Ns в присутствии 6 н. НС1 в тече-
ние 12—96 ч. Некоторые аминокислоты, в особенности триптофан, при
этом разрушаются. По существу, методика проведения идеального
полного гидролиза отсутствует1. Полный гидролиз белков можно осу-
ществить с помощью основных катализаторов, но при этом наблюдает-
ся значительная рацемизация аминокислот.
Нуклеиновые кислоты тоже гидролизуют сильной кислотой. Напри-
мер, нагревания в течение 1 ч при 100 °C в 12 н. хлорной кислоте доста-
точно для расщепления молекулы до составляющих ее оснований.
В ДНК N-гликозидные связи более лабильны, чем в РНК, связи с пу-
ринами более лабильны, чем с пиримидинами. Последнее обстоятельст-
во позволяет провести весьма полезную операцию: если оставить ДНК
на ночь на холоду при pH 2, произойдет полная ее апуринизация. Об-
разующийся полимер известен как апуриновая кислота (табл. 2-11).
Щелочной гидролиз РНК Дает смесь 2'- и З'-нуклеотидов. Механизм
этого процесса связан с участием свободных 2'-ОН-групп рибозы и
образованием циклических 2',3'-фосфатов и аналогичен механизму
действия панкреатической рибонуклеазы (гл. 7, разд. Д.2). Поскольку
у дезоксирибозы нет свободной 2'-ОН-группы, ДНК в щелочной среде
не разрушается.
Ферментативные методы гидролиза особенно ценны благодаря при-
сущей им во многих случаях специфичности. Трипсин, представляющий
собой так называемую эндопептидазу, быстро расщепляет пептидные
связи лишь в том случае, если карбонильная группа расщепляемой
амидной связи принадлежит одной из основных аминокислот — лизину
или аргинину. Таким образом, трипсин превращает белок в сравнитель-
но малое число триптических пептидов, которые можно разделить и
охарактеризовать. Трипсин расщепляет только денатурированные бел-
ки, причем для получения хороших результатов нужно предварительно
разорвать дисульфидные мостики.
1 Недавно сообщалось, что лучшие результаты дает полный гидролиз в 4-1У-метан-
сульфоновой кислоте в присутствии 3-(2-аминоэтил)-индола [131а].
Молекулы, из которых мы состоим
Таблица 2-11
Некоторые реакции гидролитического расщепления олигонуклеотидов’
Основание
В РНК и других рибонуклеотидах расщепление
b-rnuna мотет идти с участием свободных
2-ОМ-групп за счет нуклеофильной отопи фосфора
Расщепление этой связи под действием
.-слабых кислот (р\12)'дает апуриновую
: кислоту
Ри/ ‘ Pv Основание
5-ионеч
Панкреатическая рибонуклеаза
делает b-разрыв справа от
Пиримидина
А. Расщепление в точках а осуществляется:
1. Эндонуклеазами (по всей длине молекулы)
Панкреатическая дезоксирибонуклеаза I
2. Экзонуклеазами (только с З'-конца)
Неспецифическая диэстераза змеиного яда, атакует ДНК и РНК.
Реакция идет с обязательным участием свободной З'-ОН-группы
Б. Расщепление в точках b осуществляется:
1. Случайным образом вдоль всей молекулы эндонуклеазами и щелочами (нефер-
ментативный гидролиз)
Панкреатическая рибонуклеаза расщепляет цепь только справа от
пнримидинсодержащих нуклеотидов
Рибонуклеаза TI из Aspergillus oryzae расщепляет цепь справа от
гуаиинсодержащих остатков (З'-гуанилат)
Рибонуклеаза Т2 из Aspergillus oryzae расщепляет цепь справа от
аденинсодержащих остатков (З'-аденилат)
Панкреатическая дезоксирибонуклеаза (ДНКаза) II
Микрококковая ДНКаза
2. Экзонуклеазами (только с 5'-конца)
Фосфодиэстераза из селезенки быка гидролизует как полирибо-, так
и полидезоксирибонуклеотиды
а В таблицу включены реакции, затрагивающие как РНК, так и ДНК
6 Символ Р в кружочке здесь означает группу—РО»—.
Другие ферменты, например химотрипсин и пепсин (гл. 7, разд Г.2),
менее избирательны, но все же их тоже можно использовать для рас-
щепления пептидной цепи на фрагменты с последующим определением
структуры этих фрагментов. Для установления полной аминокислотной
последовательности белка нужно найти «перекрывающиеся» фрагмен-
ты, содержащие последовательности, в которые входят концы двух
разных триптических фрагментов. Таким путем можно «выстроить»
пептиды в том порядке, в котором они расположены в нативном белке.
Рассмотрим теперь метод пептидных карт. Его первый этап состоит
в разрыве дисульфидных связей, далее белок денатурируют и расщеп-
ляют ферментами, например трипсином или пепсином. В результате по-
лучается набор пептидов, размер и аминокислотный состав которых ха-
рактерен для каждого отдельного белка. Смесь пептидов наносят на
лист хроматографической бумаги и проводят в одном направлении хро-
матографию, а в другом — электрофорез. Пептиды локализуются в ви-
де отдельных пятен, образуя характерную картину («отпечатки паль-
цев»), Метод пептидных карт особенно полезен для выявления малых
168 Глава 2
различий в структуре белка, например различий между генетическими
разновидностями одного и того же белка (рис. 4-20).
Некоторые ферменты катализируют последовательное отщепление
аминокислот с одного или другого конца пептидной цепи. Карбоксипеп-
тидазы отщепляют аминокислоты с карбоксильного конца, а аминопеп-
тидазы атакуют противоположный конец. Используя хроматографиче-
ские методы, можно определить, какие аминокислоты были отщеплены
этими ферментами в заданные моменты времени, и получить представ-
ление о последовательности аминокислот на концах цепи.
Полное ферментативное расщепление белков проводят с помощью
смеси ферментов, которую составляют протеазы, синтезируемые гри-
бами (проназы). Однако ферменты смеси расщепляют еще и друг дру-
га, так что в общем случае для количественного расщепления белка на
составляющие его аминокислоты ферментативный гидролиз не годится.
Один из новых методов основан на применении гидролитических фер-
ментов, иммобилизованных на колонках с агаровым гелем. Гидролизуе-
мый белок пропускают через гель, после чего на дне колонки скапли-
ваются составляющие его аминокислоты [132].
Экзонуклеазы отщепляют нуклеотиды с концов полинуклеотидных
цепочек, в то время как эндонуклеазы делают разрывы внутри цепи.
Одни из них гидролизуют лишь одноцепочечные молекулы, другие—
двухцепочечные. Некоторые нуклеазы разрывают обе цепи ДНК, тогда
как другие «надрезают» молекулу, внося разрыв лишь в одну из це-
пей. Специфичность ряда нуклеаз отражена в табл. 2-11. Частичный
ферментативный гидролиз РНК дает расщепление молекулы на корот-
кие нуклеотидные последовательности, позволяющие далее определить
полную последовательность РНК. (Первой РНК, для которой установ-
лена последовательность, была аланиновая тРНК- Расщепление про-
водили с помощью панкреатической рибонуклеазы и рибонуклеазы Т1
[133]. Очень полезным методом получения нуклеотидных карт оказал-
ся двумерный электрофорез в полиакриламидном геле [134].
Дополнение 2-В
Изотопы в биохимических исследованиях
Как стабильные3, так и радиоактивные б~г изотопы широ-
ко используются в химических и биологических исследовани-
ях. Введение изотопных меток произвело целую революцию
в изучении метаболизма. В одном из первых биологических
экспериментов, основанных на использовании стабильного
изотопа 15N (регистрируемого масс-спектрометрически), Шен-
геймер с сотрудниками в 1937 г. обнаружили неожиданно
высокую скорость обновления белков в живых тканях (гл. 14,
разд. Б). Используя 14СО2, Кэлвин и др. впервые проследи-
ли путь углерода в процессе фотосинтеза (дополнение 11-А).
Аналогичным образом применение изотопов 32Р и 35S позво-
лило изучить метаболизм фосфора и серы; тритий (3Н) на-
шел широкое применение для мечения разнообразных органи-
ческих соединений, например тимина. Использование радиоак-
тивных изотопов лежит в основе чувствительных аналитиче-
ских методов, к числу которых относится радиоиммуноанализ
Молекулы, из которых мы состоим 169*
Изотоп Период полураспада Энергия излучения, МэВ
(3 V
2Н (дейтерий) Стабильный
3Н (тритий) 12,26 года 0,018
13С Стабильный
“С 5760 лет 0,159
15N Стабильный
1»О »
22Na 2,6 года 0,54 1,28
32р 14,3 дня 1,17
35S 87,2 дня 0,167
звС1 4-105 лет 0,716
40К 1,4 Ю9 лет 1,4 1,5
45Са 152 дня 0,255
59Fe 45 дней 0,467 7,70
e5Zn 250 дней 0,32 1,14
"Sr 25 лет 0,54
125 J 60 дней 0,035 0,030
131J 8,07 дня 0,606 0,365
гормонов, присутствующих в микроколичествах (дополнение
16-А). В рамках приложений, которые находит радиоавтогра-
фия, изотопы облегчают проведение многочисленных анали-
тических исследований (см. прилагаемый снимок) и составля-
ют основу ценного метода определения концевых групп, выяв-
ляющего последовательность нуклеотидов (рис. 2-37).
Различие в массе изотопов, особенно при переходе от 'Н к
2Н и далее к 3Н, часто сильно влияет на скорости реакций;
проводимое на этой основе изучение кинетических изотопных
эффектов позволило лучше понять механизм многих фермента-
тивных реакций и все детали их стереохимии. Ярким приме-
ром тому служит синтез и дальнейшее использование хираль-
ного ацетата (гл. 7, разд. К. 2.ж). За эти исследования
Дж. В. Корнфорт в 1975 г. был удостоен Нобелевской пре-
мии6. Специфические свойства изотопов лежат в основе ЯМР-
спектроскопии (разд. И).
Некоторые из изотопов, нашедших широкое применение в-
биохимии, указаны в приведенной выше таблице. Для радио-
активных изотопов даны периоды полураспада, а также тип
испускаемых частиц и их энергия. Лучи, испускаемые, напри-
мер, при распаде 1251 и 13Ч, обладают сильной проникающей
способностью; их интенсивность, как и интенсивность сильно-
го p-излучения изотопа 32Р, очень легко определить. Другой
изотоп, 3Н (тритий), регистрировать гораздо труднее*5, однако
испускаемая им слабая р-частица с малой длиной пробега де-
лает тритий уникальным для использования в микрорадиоав-
тографии. Зная период полураспада данного изотопа (уравне-
ние 6-4), можно определить то его количество, которое необ-
170 Глава 2
ходимо для получения данной скорости распада; это имеет
важное практическое значение, поскольку позволяет найти,
какое число распадов в минуту необходимо иметь, чтобы вести
счет импульсов с достаточно малой статистической ошибкой.
Радиоактивность, при которой в 1 с происходит 3,7-1010 распа-
дов (такова радиоактивность 1 г чистого радия, 0,3 мг изотопа
Радиоавтограмма, иллюстрирующая разделение белков Escherichia coli с включен-
ными в них 14С-аминокислотамид. 25 мкл образца (180 000 имп-мин-'), содержащего
~10 мкг белка, нанесли на колонку с полиакриламидным гелем (размер колонки
2,5X130 мм) и провели изоэлектрическое фокусирование (разд. 3.1.е). В результате
белки разделились в соответствии с их изоэлектрическими точками. Затем гель из-
влекли из колонки и поместили на край пластинки из полиакриламидного геля. По-
следующи электрофорез в растворе додецилсульфата натрия в перпендикулярном на-
правлении привел к разделению белковых молекул по размерам. На радиоавтограм-
ме, полученной наложением на пластинку геля фотографической пленки (в течение
875 ч), можно различить свыше 1000 пятен.
3Н или 0,22 г изотопа 14С) составляет один кюри (Ки). Один
милликюри (мКи) —это 2,22-10® расп.-мин-1. Меченое соеди-
нение обычно содержит сравнительно мало радиоактивного
изотопа по сравнению со стабильным изотопом того же эле-
мента. Радиоактивные препараты характеризуют их суммар-
ной радиоактивностью, выражаемой в милли- или микрокюри,
и удельной активностью — мКи-ммоль-1. Например, если со-
единение содержит в каком-то одном положении изотоп 3Н и
обладает удельной активностью 50 мКи-ммоль-1, то 3Н содер-
жится в этом положении в количестве 0,17%.
Молекулы, из которых мы состоим 171
а Matwiyoff N. A.. Ott D. G., Science, 181, 1125—1132 (1973).
6 Wang С. И., Willis D. L., Loveland W. D., Radiotracer Methodology in
the Biological, Environmental and Physical Sciences, Prentice-Hall, En-
glewood Cliffs, New Jersey, 1975.
B Wang Y. ed., Handbook of Radioactive Nuclides, The Chemical Rubber
Co., Cleveland, Ohio, 1969.
r Thornburn С. C., Isotopes and Radiation in Biology, Butterworth, Lon-
don, 1972.
« O’Farrell P. H„ JBC, 250, 4007—4021 (1975).
e Cornforth J. W., Science, 193, 121—125 (1976).
ж Bransome E. D., Jr. ed., Liquid Scintillation Counting, Grune and Strat-
ton, New York, 1970.
Методы определения нуклеотидных последовательностей ДНК раз-
рабатывались медленнее, и тем не менее к настоящему времени они
уже достаточно хорошо освоены [134а]. Разрыв молекулы ДНК вбли-
зи участка с определенной последовательностью (обычно палиндром-
ной, разд. Г.11) осуществляют с помощью специфических эндонуклеаз
рестрикции (гл. 15, разд. Е.1). Полученные фрагменты далее подвер-
гают депуринизации или обрабатывают экзонуклеазами [135]. Отлич-
ные результаты дает электрофорез на ацетате целлюлозы с последую-
щим применением особой тонкослойной «гомохроматографии»1 на
ДЭАЭ-целлюлозе [136]. Если олигонуклеотиды несут радиоактивную
метку на одном конце, последовательность можно определить, частично
гидролизуя их с помощью экзонуклеазы (см. следующие параграфы) и
проводя затем электрофорез и гомохроматографию (рис. 2-37). Наи-
меньший по длине олигонуклеотид в ходе гомохроматографии продвига-
ется дальше всех; каждое из следующих расположенных ниже пятен
отвечает соединению, содержащему на один нуклеотид больше, чем
предыдущее. По смещению одного пятна относительно другого в ходе
электрофореза можно восстановить примерную нуклеотидную последо-
вательность [137, 137а]. Так, на рис. 2-37 самое верхнее пятно отвечает
олигонуклеотиду неизвестного состава, а нуклеотид, находящийся непо-
средственно ниже его, содержит на один остаток тимина больше, о чем
ясно свидетельствует его более высокая электрофоретическая подвиж-
ность при pH 3,5. Присоединение гуанина увеличивает электрофорети-
ческую подвижность не так сильно, а присоединение аденина почти
совсем на нее не влияет. Присутствие лишнего цитозина, напротив, сни-
жает электрофоретическую подвижность. Последовательность может
быть прямо считана с нуклеотидной карты: (5') -TTATTAGCCAGAAGT-
-(3'). Эти данные были подтверждены дальнейшими исследованиями,
в ходе которых проводилось отщепление пуринов и определение бли-
жайших соседей. Другой недавно разработанный метод быстрого опре-
деления последовательности ДНК описан в работе [137b].
Существует целая группа специфических ферментов, расщепляющих
полисахариды. Обычно эти ферменты специфичны по отношению к ка-
кому-то конкретному сахару, встроенному в цепь с помощью определен-
ного типа гликозидной связи. Примерами такого типа являются фермен-
ты, расщепляющие крахмал. а-Амилазы из слюны и поджелудочной
железы разрывают молекулы крахмала случайным образом, тогда как
1 Разделение меченых олигонуклеотидов проводят в растворителе, содержащем
произвольную смесь немеченых нуклеотидов (продукты гидролиза РНК). В ходе про-
явления пластинки немеченые нуклеотиды становятся на место исследуемых меченых
нуклеотидов и перемещаются вдоль пластинки на расстояния, примерно соответствую-
щие их размерам.
172 Глава 2
растительные р-амилазы последовательно отщепляют мальтозу с кон'
нов неразветвленных цепей (гл. 7, разд. В.6).
Сложные липиды расщепляются липазами. Панкреатическая липаза
удаляет 1- и 3-ацильные группы триглицеридов с образованием 2-моно-
глицеридов. Фосфолипаза А, присутствующая в различных тканях и
бактериях, а также входящая в состав змеиного яда, избирательно от-
т
А
РИС. 2-37. Двумерная нуклеотид-
ная карта, полученная в резуль-
тате частичного гидролиза 32Р-
олигонуклеотнда, отщепленного от
кольцевой копни ДНК, синтезиро-
ванной на цепи глобиновой мРНК
(гл. 15, разд. Ж-4). Олигонуклео-
тид обрабатывали экзонуклеазой
из змеиного яда (фосфодиэстера-
зой, табл. 2-11), отщепляющей
нуклеотиды последовательно с 3'-
конца. Самое верхнее пятно соот-
ветствует нуклеотиду неизвестно-
го состава; каждое следующее
расположенное ниже пятно содер-
жит на одно нуклеотидное звено
больше. По относительной подвиж-
ности промежуточных продуктов
(см. текст) была восстановлена
последовательность: (5')-
T'IATTAGCCAGAAGT-(3') [137].
Электрофорез при pH 35
щепляет от фосфолипидов ацильную группу, стоящую в 1-м или 2-м по-
ложении. В бактериях и растительных тканях присутствуют фосфоди-
эстеразы, известные под названием фосфолипаз С и D соответственно;
они разрывают цепь по разные стороны от фосфодиэфирной связи, как
показано ниже.
Для избирательного расщепления карбоксилатных эфирХр (в поло-
жениях, обозначенных на схеме через Ai и А2) используется мягкий
гидролиз в присутствии основных катализаторов. Получающиеся в ре-
Молекулы, из которых мы состоим 173
зультате фосфодиэфиры, амиды (сфинголипиды) и эфиры можно раз-
делить и идентифицировать.
3. Избирательное расщепление химических связей
В руках химиков, занимающихся определением структуры различ-
ных соединений, имеется множество самых разных химических реаген-
тов, как подобранных эмпирическим путем, так и специально синтезиро-
ванных. Здесь мы рассмотрим лишь немногие из них.
а. Разрыв дисульфидных мостиков в молекулах белков
Прежде чем проводить расщепление полипептидной цепи, обычно
сначала разрывают дисульфидные мостики [138—141]. Для этой цели
можно использовать три реакции [см. уравнения (2-20) — (2-22) ]. При
работе с рибонуклеазой использовалось окисление надмуравьиной кис-
лотой:
о
II
н—с—о—он
Pj—сн2—s—S—сн2—р2--------->- Pj—сн2—so7+p2—сн2—so; (2-20)
Однако этот метод не нашел широкого применения, поскольку надму-
равьиная кислота окисляет также остатки триптофана. Свои недостат-
ки имеет и расщепление мостиков в присутствии сульфита:
Pj—СН2—S—S—СН2—P2-|-SO|-+ Н+---►
---► P1-CH2-S-SO;+HS-CH2-P2 (2-21)
Вероятно, лучшим из трех методов является восстановление дитиотреи-
толом или дитиоэритритолом:
СН2—SH
Н— С—ОН
P1-CH2-S--S-CH2-P2 + | ---► 2Р—СН2—SH + I I (2-22)
н-с-он ho>\/s
CH2—SH
Дитиоэритритол
Эти два дитиола при окислении циклизуются, давая устойчивые ди-
сульфиды. Указанные реагенты оказываются полезными не только для
разрыва дисульфидных мостиков в белках, но и для защиты имеющих-
ся в ферментах SH-групп от случайного окисления кислородом. Для
той же цели используется и меркаптоэтанол HS—СН2—СН2—ОН, но
обычно он несколько менее эффективен.
После того как дисульфидные мостики разорваны, необходимо пред-
отвратить их воссоединение, для чего надо перевести образующиеся
тиоловые группы в устойчивые производные. Обычно для этой цели ис-
пользуют иодацетат или иодацетамид:
Р—СН2—SH + 1СН2СОО" > р—сн2—S—СН2—COO- + Н+ + I- (2-23)
(ICH2CONH2) (Р—СН2—S—СН2—CONH2)
Еще лучшим реагентом является акрилонитрил:
Р—СН2—SH+CH2=CH—CN ------► Р—СН2—S—СН2СН2—CN (2-24)
Акрилонитрил
174 Глава 2
б. Реагенты, избирательно расщепляющие пептидные цепи
Одним из самых ценных реагентов при работе с белками является
фенилизотиоцианат, впервые примененный П. Эдманом. Это соедине-
ние реагирует с N-концевой аминогруппой пептидов [уравнение (2-25)].
Образующийся продукт циклизуется, что в кислой среде влечет за
собой разрыв пептидной цепи (2-25). В итоге образуется соответствую-
щий N-концевой аминокислоте фенилтиогидантоин, который можно
идентифицировать. Проделав ту же операцию с укороченной указан-
ным путем пептидной цепью, можно определить следующий аминокис-
лотный остаток. При тщательной постановке эксперимента с помощью
реакции Эдмана можно «пройти» вдоль пептидной цепи несколько де-
сятков остатков. Есть специальные приборы — так называемые секвена-
торы, в которых все необходимые операции осуществляются автомати-
чески.
=S + H2N—CH—С
R;
фенилизотиоциаяат
Фенилтиогидантоин. соответствуют ии
N-концевой аминокислоте
(2-25>
Существует множество других реагентов, расщепляющих пептидные
связи внутри цепи в специфических местах [138]. Особенно ценен бром-
циан, N=C—Вг, разрывающий цепь вслед за остатками метионина. Как
показывает уравнение (2-26), сера метионина замещает ион брома.
Пространственная конфигурация образующегося сульфониевого соеди-
нения благоприятствует разрыву С—S-связи, протекающему с участием
соседней пептидной группы. Гидролиз связи C = N в полученном про-
дукте обусловливает разрыв пептидной цепи (уравнение 2-26).
Обработка гидроксиламином при высоких значениях pH часто при-
водит к избирательному разрыву связей Asp—Gly. Возможный меха-
низм этого процесса обсуждается в работе [142].
4. Методы, основанные на включении метки в концевые звенья
В 1957 г. Ф. Сэнгеру за определение первичной структуры инсулина
была присуждена Нобелевская премия по химии. Это был первый бе-
лок, для которого удалось установить аминокислотную последователь-
Молекулы, из которых мы состоим
175
ность; этой работе Сэнгер посвятил 10 лет. В основе его подхода ле-
жал частичный гидролиз пептидных цепей, предварительно помеченных
I
HN-----
ПептиЬилгомосеринлактон
в ходе реакции свободной аминогруппы с фтординитробензолом [урав-
нение (2-27)].
Динитрофенилированньш пептиЬ
Связь с динитрофенильной группой устойчива к кислоте, и поэтому
после полного кислотного гидролиза меченого пептида высвобождалась-
динитрофенилированная аминокислота (соединение, имеющее желтую-
окраску), которая находилась ранее на N-конце цепи. Кроме того, Сэн-
гер использовал меченые в-аминогруппы остатков лизина. Частичный,
кислотный гидролиз меченых пептидов приводил в этом случае к обра-
зованию небольших фрагментов, для которых затем определяли ами-
нокислотный состав. В конце концов Сэнгер сложил фрагменты полу-
ченной аминокислотной мозаики и установил последовательность двух
цепей молекулы инсулина, содержащих 21 и 30 остатков и связанных
между собой в цельной молекуле дисульфидными мостиками (рис. 4-13).
В последние годы вместо фтординитробензола чаще применяют дансил-
176 Глава 2
хлорид. Получающиеся в результате пептидные производные сильно
флуоресцируют, что позволяет проводить анализ концевых групп со
значительно меньшим количеством пептидов.
Дансилхлорид
(З-диметиламинонафтпилсульфонилхлориЬ)
Существует ряд способов маркировки SH-группы боковых цепей
белка. Один из наиболее распространенных основан на использовании
реагента Элмана •— 5,5/-дитиобис-(2-нитробензойная кислота), ДТНБ
[уравнение (2-28)].
O2n
Реагент Элмана
(2-28)
Тиоловый анион
Этот реагент количественным образом взаимодействует с —SH-rpyn-
пами, образуя смешанные дисульфиды и высвобождая тиоловый анион,
поглощающий свет при 412 нм, что позволяет определить содержание
—SH-групп в белке. При этом, к сожалению, могут параллельно про-
текать дисульфидные обменные реакции с участием дополнительных
молекул ДТНБ, приводящие к разрыву дисульфидных связей в белке
[143]. Помимо указанных выше, имеется множество других реагентов,
позволяющих модифицировать разные боковые группы в молекуле бел-
ка [138, 143а].
В случае углеводов классическим методом идентификации концевых
групп служит исчерпывающее метилирование. Многократная обработка
метилирующим реагентом, например диметилсульфатом, превращает все
свободные ОН-группы в ОСН3-группы. Полный кислотный гидролиз с
последующим разделением метилированных сахаров и их количествен-
ным определением позволяет оценить число концевых звеньев (содер-
жащих четыре метоксильные группы), число звеньев в неразветвленных
участках цепи (содержащих по три метоксильные группы) и число то-
чек ветвления (содержащих по две метоксильные группы). Кроме того,
Молекулы, из которых мы состоим
177
структура метилированных производных дает информацию о располо-
жении связей в сахарных кольцах.
Сравнительно новым методом маркировки редуцирующих концов
углеводных цепей является восстановление альдегидных групп бортри-
тидом натрия (NaB3H4). Введенная таким способом радиоактивная
метка дает возможность по радиоавтографам хроматограмм определять
положение фрагментов, отщепленных от редуцирующих концов.
Одним из наиболее ценных реагентов, используемых для установ-
ления структуры углеводов, является иодная кислота (или ее натриевая
соль, перйодат натрия). Под действием иодной кислоты расщепляются
С—С-связи, по обе стороны от которых расположены ОН-группы, с об-
разованием диальдегидов.
НЮ,
НОСН2
н^/ V
\/С\ Л-R' (2'29)
° с==о НС
Н II
о
Метод позволяет проводить количественные измерения. Через не-
сколько часов после начала реакции избыток перйодата удаляют эти-
ленгликолем; можно также определить количество перйодата, затра-
ченное в процессе окисления. Если гидроксильные группы связаны с
тремя идущими подряд атомами углерода, то центральный атом отщеп-
ляется в составе муравьиной кислоты, количество которой тоже можно
точно определить. Помимо этого, после удаления избытка перйодата
диальдегид можно восстановить добавлением твердого боргидрида нат-
рия с образованием устойчивых CHzOH-групп и далее с помощью мяг-
кого кислотного гидролиза расщепить ациклические ацетальные связи,
разделить полученные фрагменты и провести их модификацию. Эту по-
следовательность реакций называют деградацией по Смиту [144].
Пример комплексного использования нескольких методов для опре-
деления структуры сложного полисахарида приведен в табл. 2-12.
Концевые группы полирибонуклеотидов тоже отщепляют перйода-
том, предварительно удалив с помощью фосфомоноэстеразы фосфатные
группы на З'-гидроксилах. Образующиеся диальдегиды восстанавлива-
ют далее бортритидом натрия. Другой метод включения в полинуклео-
тиды радиоактивной концевой группы основан на переносе фосфориль-
ной группы с молекул АТР под действием неспецифической полинуклео-
тидкиназы с образованием свободной 5'-гидроксильной группы полири-
бо- или полидезоксирибонуклеотида [145].
Ценным методом изучения структуры ДНК является метод бли-
жайших соседей. Он разработан А. Корнбергом с сотр. и состоит в сле-
дующем [146]. В качестве предшественников для синтеза ДНК берут
какой-нибудь один радиоактивный 32Р-содержащий нуклеозидтрифос-
фат [в уравнении (2-30) это дезоксиаденозинтрифосфат], а три других
178 Глава 2
Таблица 2-12
Определение структуры содержащего 6-О-метилглюкозу липополисахарида
из Mycobacterium рШеИ5
1. Эту связь избирательно расщепляет а-амилаза.
2. В результате частичного гидролиза образуется ряд 6-О-метилглюкозныя
олигомеров.
3. Отщепление D-глицериновой кислоты и восстановление образовавшего-
ся конца с помощью NaB3Hi позволяет в ходе последующего расщеп-
ления цепи (путем частичного кислотного гидролиза) получить набор'
радиоактивных фрагментов.
4. Превращение в сложный эфир и восстановление с помощью ПаВ~Н±
в спирт (глицерин) позволяет после частичного кислотного гидролиза
получить другой набор радиоактивных фрагментов.
5. Метилирование устанавливает наличие разветвления, а пропилирование
невосстанавливающих концевых группировок — положение глюкозы:
и 3-метилглюкозы.
6. По другой методике проводилось замещение О-ацильных групп на
—ОСН3. Последующее окисление перйодатом, восстановление с по-
мощью NaB-'Н/, и гидролиз (деградация по Смиту) приводили к обра-
зованию метилированных фрагментов, идентификация которых позво-
лила определить положение исходных ацильных групп.
а Saier М. Н„ Jr., Ballou С. Е„ J. Biol. Chem., 243, 4332, 1968; Smith W. L„ Bal-
lou C. E„ J. Biol. Chem., 248, 7118—7125, 1973; Gray G. R„ Ballou C. E„ J. Biol'.
Chem., 247, 8129—8135, 1972.
6 В положениях, обозначенных зачерненным треугольником, находятся жирные
кислоты: 3 ацетила, 1 пропионил, 1 изобутирил и 1 октаноил; в положениях, обозна-
ченных светлым треугольником, находятся сукцинильные группы. Метильные группы
обозначены зачерненным кружком.
нуклеозидтрифосфата оставляют немечеными. В присутствии ДНК-по-
лимеразы, катализирующей рост цепи, цепь затравочной ДНК удлиня-
ется с З'-конца (гл. 15, разд. А.З.а). Присутствующая матричная цепь
[в уравнении (2-30) она не представлена] обеспечивает включение в
растущую цепь именно того нуклеотида, какой необходим для образова-
ния двуепиральной структуры Уотсона — Крика. Химическая сторона
этого процесса будет рассматриваться позже (гл. 15, разд. А.З.а) и в
данном случае значения не имеет. Важно лишь то, что 32Р попадает в
фосфатный мостик, который соединяет нуклеотид, первоначально содер-
жавший 32Р, с З'-гидроксилом соседнего нуклеотида.
Продукт, содержащий 32Р, далее гидролизуют с помощью микрокок-
ковой ДНКазы и фосфодиэстеразы селезенки (табл. 2-11) и получают
фрагменты, представленные в уравнении 2:30. Поскольку данные гид-
ролитические ферменты катализируют, только разрывы Ь-типа
Молекулы, из которых мы состоим 179
(табл. 2-11), 32Р оказывается теперь в составе нуклеотида, который
был ближайшим соседом аденозина в структуре ДНК. Измеряя радио-
активность З'-нуклеотидов аденина, тимина, цитозина и гуанина, мож-
но узнать частоты встречаемости в ДНК пар АА, ТА, СА и GA. Исполь-
зуя другие радиоактивные нуклеозидтрифосфаты (по одному типу в
каждом опыте), получают такие частоты для всех возможных пар. Ре-
зультаты описанного выше эксперимента показывают, что цепи двой-
X Y Z л А
Затравочная
цепь
Р—Р—Р
ОН
dATP
X Y Z А
Микрококковая ДНКаза
и фосфодиэстераза селезенки
(2.30)
А
Y
ной спирали действительно антипараллельны, как это предсказывали
Уотсон и Крик (подробнее об этом см. в книге Дэвидсона [146]), в про-
тивном случае частоты ближайших соседей должны были оказаться
другими.
Аналогичным образом, но используя расщепление d-типа под дейст-
вием щелочи, были определены частоты встречаемости различных пар
в цепи РНК, синтезированной на ДНК-матрице [145]. 5 * * * * * * * * * * * * * *
5. Анализ продуктов
Практически в любом биохимическом исследовании очень важно
уметь обнаруживать и точно определять ничтожные количества специ-
фических соединений. Чаще всего для этого используют особые реаген-
ты— индикаторы, которые при взаимодействии со специфическими сое-
динениями определенным образом окрашиваются. Например, для выяв-
ления на хроматограмме аминокислот или пептидов, присутствующих
в очень малых количествах (доли микромоля), хроматограмму опрыс-
кивают нингидрином (дополнение 8-Е). Если выявляемое соединение
находится в растворе, то по интенсивности окрашивания можно опреде-
лить его количество. Фенолы и концентрированная серная кислота ок-
рашивают сахара (в растворе или на хроматографической бумаге) в
красный цвет. Эта реакция лежит в основе колориметрического анализа
углеводов. Восстанавливающие сахара выявляют на хроматограммах,
опрыскивая последние раствором нитрата серебра.
180 Глава 2
Нуклеотиды, как и многие другие поглощающие свет соединения,
определяют количественно по их спектрам поглощения (рис. 13-11 и
13-12) [146]. Еще более чувствительным методом является флуорес-
центный анализ. Например, он позволяет обнаружить на тонкослойной
хроматограмме рибофлавин в количестве 3 пикомоль (1 нг) (рис. 2-34)
'[147]. Один из новых реагентов, флуорескамин, взаимодействует с лю-
бым первичным амином, образуя интенсивно флуоресцирующие про-
дукты. С его помощью можно обнаружить очень малые количества ами-
нокислот— менее 50 пикомолей (рис. 2-36) [148].
Флу оре с кам ин
Флуоресцирующее
соединение
(2-31)
Чрезвычайно чувствительны методы обнаружения летучих соедине-
ний с помощью газовой хроматографии. Применяя пламенные иониза-
ционные детекторы, можно определить содержание практически любого
соединения в количестве, не превышающем несколько пикомолей. Вряд
ли стоит говорить, насколько важна разработка новых, еще более чув-
ствительных методов. Применение наиболее чувствительных из них (в
частности, масс-спектрометрии) позволяет теперь в некоторых случаях
обнаружить вещество, когда его содержание не превышает нескольких
фемтомолей! Анализ выхода нейромедиаторов из одиночных нейронов
мозга может иметь принципиальное значение для понимания работы
нервных клеток, точно так же как анализ содержимого отдельных кле-
ток может оказаться весьма полезным для выяснения многих вопросов
биохимии высших организмов.
Весьма ценной разновидностью обычной тонкослойной или бумаж-
ной хроматографии является диагональная хроматография. Сначала
нанесенный материал хроматографируют в одном направлении, затем
в тонком слое на пластинке или бумаге проводят определенную хими-
ческую реакцию, после чего осуществляют разделение в другом направ-
лении. Немодифицированные соединения располагаются по диагонали
пластинки, тогда как продукты реакции оказываются смещенными по
отношению к ней. Этим методом исследовали фотохимические [149] и
другие {147] реакции флавинов. Аналогичный диагональный электро-
форез применялся для идентификации пар —SH-групп, образующих в
белках дисульфидные мостики [150]. Пептидные фрагменты, содержа-
щие S—S-мостики, разделяли с помощью электрофореза на бумаге, за-
тем обрабатывали бумагу парами надмуравьиной кислоты, разрываю-
щей мостики [уравнение (2-20)], и после электрофореза в перпендику-
лярном направлении опрыскивали бумагу нингидрином. Пятна, распо-
ложенные вне диагонали, соответствовали фрагментам, которые участ-
вовали в образовании S—S-мостиков. По положению пятен подбирали
Молекулы, из которых мы состоим 181
пары, которые далее сопоставляли с пептидами, охарактеризованными
в ходе стандартных операций установления последовательности — опе-
раций, проводившихся на белке, окисленном надмуравьиной кислотой.
6. Определение молекулярного веса
Определение молекулярного веса биополимера зачастую оказывает-
ся чрезвычайно важным. Во многих случаях можно рассчитать мини-
мальный молекулярный вес, исходя из содержания наименьшего из ком-
понентов (например, триптофана в белке или железа в гемоглобине).
Однако в большинстве случаев молекулярные веса определяют физико-
химическими методами [151, 152]. В принципе это довольно просто
сделать, измерив осмотическое давление и светорассеяние, однако и
эти методы имеют свои трудности. Наиболее надежные результаты дает
ультрацентрифугирование. Прямое определение молекулярного веса ос-
РИС. 2-38. Зависимость константы седиментации ряда белков и нуклеиновых кислот
от молекулярного веса (в логарифмическом масштабе). Кружки — глобулярные белки,
треугольники — РНК, квадратики — ДНК. В число белков входят липаза (из моло-
ка), цитохром с, панкреатическая рибонуклеаза, лизоцим (из белка куриных яиц),
фолликулостимулирующий гормон, бактериальные протеазы, гемоглобин человека, бы-
чий протромбин, малатдегидрогеназа, у-глобулин (лошади), триптофаиаза (из Е. co-
li), глутаматдегидрогеназа (из цыплят) н цитохром а. Двухцепочечная ДНК взята
из следующих источников: бактериофага 0X174 (репликативная форма), фагов Т7,
Хъ2, Т2 н Т4 и из вируса папилломы. В число РНК вошли тРНК, рРНК н мРНК
Е. call и РНК вируса желтой мозанки репы («CRC Handbook of Biochemistry», Chem.
Rubber publ. Co., Cleveland, Ohio, 1968; S. P. Colowick and N. O. Kaplan, eds., «Me-
thods in Enzymology», Vol. 12B, pp. 388—389. Academic Press, New York, 1968).
ковано на том, что центрифугирование раствора макромолекул прово-
дят до тех пор, пока не установится седиментационное равновесие [125,
151]. При использовании коротких кювет такое равновесие достигается
за несколько часов. Молекулярный вес рассчитывают, измеряя измене-
ние концентрации раствора от центра кюветы к дну.
Чаще всего молекулярный вес биополимеров определяют по их кон-
станте седиментации s (разд.ЗЛ.д). Значение s зависит не только от
молекулярного веса, но и от плотности и формы молекулы. Однако в
рамках предположения, что молекулы белка являются сферами, s при-
мерно пропорционально мол. весу в степени 2/3. Графически зависи-
мость logs от log (мол. вес) должна представляться прямой. На
рис. 2-38 приведен график такого рода, построенный по данным для
целого рцда белков. Заметим, что точки, полученные для нуклеиновых
кислот (во многих случаях эти молекулы имеют форму палочек, а не
сфер), ложатся на другую прямую. Кроме того, константа седимента-
182 Глава 2
ции с увеличением молекулярного веса изменяется быстрее, чем это
характерно для сферических молекул.
В настоящее время имеется ряд новых методов определения молеку-
лярного веса, которые могут соперничать с ультрацентрифугированием.
Один из них — это простая гель-фильтрация. Колонку тщательно запол-
няют гелем (например, сефадексом) и калибруют, пропуская ряд бел-
ковых растворов. Измеряют Ке — объем элюата, собранного с момента
нанесения вещества на колонку до момента его выхода из колонки, и
делят этот объем на Vo — объем элюата для очень крупных частиц, со-
вершенно не проникающих внутрь частиц геля. Далее строят зависи-
мость Ve/Ко от логарифма мол. веса для ряда белков с известным мо-
лекулярным весом. Как и при оценке молекулярных весов по констан-
там седиментации, здесь предполагается, что молекулы всех белков
имеют примерно сферическую форму; для неизвестного белка значение
молекулярного веса определяют по местоположению отвечающей ему
точки на описанном выше графике [153, 154]. Модификацией этого ме-
тода служит хроматография при высоких концентрациях гуанидинхло-
рида— соли, вызывающей денатурацию белков. Предполагается, что в
таком растворителе белковая молекула представляет собой статистиче-
ский клубок {154]. +
H,N—С1-
\nh2
Гуанидинхлорид
Пожалуй, самым ценным новым методом определения молекулярно-
го веса является гель-электрофорез в присутствии денатурирующего
РИС. 2-39. А. Оценка молекулярного веса азоферредоксина в «нативном» состоянии
с помощью фильтрации через сефадекс G-200. Черные кружки указывают положение
средней точки пика для белков известного молекулярного веса. Стрелкой отмечено
положение азоферредоксина. Материал пика для каждого из белков элюирован в 5—
7 пробирок. Скорость элюции составляла 3,2 мл-час-1. Элюат в коллекторе фракций
распределяли по фракциям объемом в 1,6 мл. Б. Оценка молекулярного веса полппеп-
тидной цепи азоферредоксина с помощью электрофореза в полиакриламидном геле, со-
держащем додецилсульфат натрия. Каждая точка получена из четырех стандартных
кривых. Маркерными белками служили каталаза (1), фумараза (2), альдолаза (3),
глицеральдегидфосфатдегидрогеназа (4), а-химотрипсиноген А (5) и миоглобин (6).
Светлый кружок указывает положение азоферредоксина (Nakos G., Mortenson L.,
Rinrhomi^trv 10 457. 1971).
Молекулы, из которых мы состоим 183
детергента додецилсульфата натрия. Под действием этого соединения
белки не только денатурируют, но и покрываются более или менее
ровным слоем детергента [155]. Для получающихся в результате па-
лочковидных молекул обычно характерна примерно одинаковая зави-
симость электрофоретической подвижности от молекулярного веса.
Один из примеров такого рода приведен на рис. 2-39, Б. Здесь тоже
молекулярный вес исследуемого белка определяется из сравнения ско-
рости его перемещения со скоростями для ряда белков с известным
молекулярным весом [153, 156].
7. Конформация макромолекул
Многие физические методы, упоминавшиеся в предыдущем разделе,
сводятся к измерению величин, зависящих как от молекулярного веса,
так и от формы молекул. Следовательно, те же методы могут использо-
ваться и для определения конформации. Однако намного более ценны-
ми в этом отношении являются два других метода: рентгеноструктур-
ный анализ кристаллических соединений и получение спектров ядерно-
го магнитного резонанса (ЯМР) соединений, находящихся в растворе.
•а. Рентгеноструктурный анализ
Вскоре после открытия рентгеновых лучей по дифракционным кар-
тинам, получаемым при прохождении через кристалл рентгеновского
пучка, стали определять межатомные расстояния и устанавливать
структуру кристалла. Этот метод был настолько усовершенствован, что
позволял устанавливать структуру довольно сложных органических
•соединений, затрачивая на эксперимент всего несколько дней. При
этом наиболее серьезной проблемой, затрудняющей применение рентге-
ноструктурного метода, часто оказывалось приготовление достаточно
крупных и совершенных кристаллов.
В последние годы рентгеноструктурный анализ широко применяется
Для определения структуры молекул белков и нуклеиновых кислот.
Длины и углы связей, точно установленные для малых молекул, ис-.
пользуются как стандартные значения в предположении, что они сохра-
няются такими же и в более сложных полимерных структурах. Одним
из этапов определения структуры белков и нуклеиновых кислот являет-
ся построение молекулярных моделей полимеров, согласующихся с
рентгеновскими данными и сохраняющих стандартные значения длин
связей и валентных углов (рис. 4-19, Б) [71].
б. Ядерный магнитный резонанс (ЯМР) {157—162]
В основе ЯААР-спектроскопин лежит поглощение электромагнитных
волн в радиочастотном диапазоне ядрами, обладающими магнитным
моментом. Все ядра с нечетными массовыми числами (например, *Н,
13С, 15N, 17О, 19F и 31Р), равно как и ядра с четным массовым числом,
но нечетным атомным номером, обладают магнитными свойствами,
в то время как 12С и 16О немагнитны. Поглощение кванта энергии
E = hv происходит лишь в том случае, когда ядра находятся в сильном
магнитном поле ЯМР-спектрометра. В спектрометре с рабочей частотой
100 МГц (v=100 МГц) энергия кванта составляет всего £ = 6,625-
• 10-34-108 = 0,04 Дж-моль-1, что на пять порядков ниже среднего зна-
чения энергии теплового движения молекул (3,7 кДж-моль-1). Таким
184 Глава 2
образом, спиновый переход, индуцированный в ЯМР-спектрометре, не
оказывает заметного влияния на химические свойства молекул.
Резонансная частота v, при которой в спектрометре происходит по-
глощение энергии, есть
v=\iH0/h, (2-32}
где Но — напряженность внешнего магнитного поля, ц — магнитный
момент исследуемых ядер, h — постоянная Планка.
В принципе спектр ЯМР можно получить, поддерживая магнитное
поле Но постоянным и определяя, при какой частоте произойдет погло-
щение, как это делается при снятии ультрафиолетовых, видимых и ин-
фракрасных спектров (гл. 13). Однако ЯМР-спектрометры работают
РИС. 2-40. Спектр ПМР для пиридоксаль-5'-фосфата; спектр снят при 60 МГц; pD =
= 7,05. Внутренним эталоном служит соль Тьера. Над каждым пиком указана величи-
на химического сдвига в герцах, внизу изображена шкала 6. Для усреднения неодно-
родностей магнитного поля ампула с образцом в ходе измерений быстро вращается-
вокруг своей оси. Неполное усреднение приводит к появлению так называемых боко-
вых сигналов; на нашем рисунке это два пика, обозначенные SSB. (С любезного раз-
решения J. Likos.)
при фиксированной частоте (чаще всего 60, 100 и 220 МГц), наиболее
мощные из них—на частотах свыше 300 МГц. При снятии спектра
магнитное поле, создаваемое мощным электромагнитом спектрометра,
изменяют с постоянной скоростью. Тем не менее ЯМР-спектры всегда
выражают в виде сдвигов частоты в герцах, как будто изменялась час-
тота генератора.
На рис. 2-40 показан протонный спектр ЯМР (спектр ПМР) кофер-
мента пиридоксальфосфата в растворе 2Н2О (окись дейтерия); спектр^
снят в спектрометре с рабочей частотой 60 МГц (см. также работу
[163]). Из такого спектра можно определить четыре параметра. 1. Ин-
тенсивность (площадь пика). В протонных спектрах ЯМР эти площади,
обычно пропорциональны числу химически эквивалентных протонов,.
Молекулы, из которых мы состоим 185-
дающих данный пик. 2. Химический сдвиг—разницу в частотах пиков,
отвечающих данному протону и какому-то эталонному соединению. На
рис. 2-40 эталонный пик расположен в правой части спектра и отвечает
соли Тьера (З-триметилсилил-1-пропансульфонат натрия). 3. Ширину
пика (в герцах) на половине его высоты. Для быстро движущихся в
растворе молекул ширина протонного пика равна ~0,1 Гц. 4. Констан-
ты спин-спинового взаимодействия, которые являются мерой взаимодей-
ствия между соседними ядрами, обладающими магнитным моментом.
При Яо = 14ООО Гс и частоте 60 МГц протонные сигналы от органи-
ческих соединений растягиваются на интервал примерно в 700 Гц. По-
ложение сигналов всегда определяется по отношению к пику для неко-
торого эталонного соединения, расположенному в высокочастотной об-
ласти. Для протонов эталонным соединением служит чаще всего тетра-
метилсилан (ТМС), инертное вещество, которое можно добавлять пря-
мо в ампулу с образцом. Поскольку биохимики в качестве растворителя
обычно используют D2O, эталоном служит водорастворимая соль Тьера.
Положения пиков для двух соединений различаются лишь незначи-
тельно.
При снятии спектра ЯМР в D2O часто бывает необходимо знать,
значение «pD» среды. Обычно в этом случае к показаниям рН-метра
прибавляют 0,40.
В молекулах, подобных ТМС, ядра экранированы от внешнего маг-
нитного поля окружающими их электронами, поэтому сигналы распо-
ложены в области более высоких частот (более высоких энергий). Про-
тоны, связанные с атомом углерода или каким-либо другим атомом,
имеющим дефицит электронов (из-за того, что они связаны с атомами
или группами, оттягивающими электроны на себя), такой экранировки
не имеют (разэкранированы). Чем сильнее разэкранировка, тем сильнее
слабопольный сдвиг пика ЯМР от положения сигнала ТМС. В спектре,
изображенном на рис. 2-40, пик, соответствующий 2-метильным прото-
нам, расположен на 147 Гц левее пика от соли Тьера, но все же соот-
ветствуют сравнительно высокому полю. В ароматических кольцах про-
тоны очень сильно разэкранированы за счет кольцевого тока, обуслов-
ленного л-электронами. Так, пики, соответствующие 5-метиленовым
протонам, которые расположены вблизи ароматического кольца, сме-
щены на 303 и 310 Гц в слабое поле. Протон, непосредственно связан-
ный с кольцом, разэкранирован еще сильнее, и его пик смещен в слабое
поле на 463 Гц. 4'-водород альдегидной группы разэкранирован вслед-
ствие электронных токов в карбонильной группе; его пик расположен
в еще более слабом поле.
Величину такого химического сдвига, т. е. смещение резонансных
частот химически неэквивалентных ядер относительно, частоты стан-
дартного вещества, можно выражать прямо в герцах, но тогда химиче-
ский сдвиг будет возрастать с увеличением магнитного поля — в спект-
рометре на 100 МГц он будет больше, чем в спектрометре на 60 МГц.
Чтобы этот параметр не зависел от типа прибора, вводится величина б,
измеряемая в миллионных долях (м. д.):
б== Ду (Гц)-10е . (2-33);
v (Гц) генератора
б представляет собой относительный сдвиг частоты и не зависит от
напряженности поля. Однако зависимость от эталонного соединения
остается, поэтому, приводя значение б, указывают, относительно какого
соединения оно определялось. Несколько реже используют шкалу т
т=10—б (относительно ТМС). (2-34)
386 Глава 2
На энергию спинового перехода протона сильное влияние оказывают
локальные поля, создаваемые другими магнитными ядрами, в частности
другими протонами. Такое спин-спиновое взаимодействие (связь) при-
водит к расщеплению сигналов протонного спектра ЯМР на несколько
близко расположенных линий. Так, этильная группа чаще всего пред-
ставлена четырьмя расположенными на одинаковом расстоянии друг
ют друга линиями, соответствующими СН2-группе, и тремя линиями от
СНз-протонов. Протоны, присоединенные к одному и тому же атому уг-
лерода, обычно не дают расщепления собственных линий, но зато при-
водят к расщеплению сигналов от протонов, связанных с соседними
атомами углерода. Эти соседние протоны могут находиться в любом
из двух спиновых состояний, что проявляется в разнице энергии рас-
сматриваемых ЯМР-переходов, которую легко измерить [157—161].
Константа спин-спинового взаимодействия / представляет собой рас-
стояние в герцах между соседними пиками мультиплета. Эта величина
не зависит от напряженности поля, а следовательно, и от частоты спек-
трометра. Представленный на рис. 2-40 сигнал от 5'-метиленовых про-
тонов расщепляется вследствие 1Н-31Р-взаимодействия с J Гц. Чем
ближе расположены ядра друг к другу, тем сильнее спин-спиновое
взаимодействие, однако иногда оно может проявляться и на расстоя-
нии пяти ковалентных связей.
При наличии подозрения на взаимодействие часто применяют техни-
ку двойного облучения, или спиновой развязки. Образец облучают при
резонансной частоте одного из участвующих в спин-спиновюм взаимо-
действии ядер, а спектр снимают в интервале резонансных частот дру-
гого ядра пары. При этих условиях мультиплет вырождается в синг-
лет, что и свидетельствует о взаимной связи двух ядер.
Константа спин-спинового взаимодействия между двумя протонами,
связанными с соседними атомами углерода (или другими атомами),
зависит от торсионного угла <р [уравнение (2-35)]*.
Н Н'
хс^-сх
7н.н' ~ A cos2 (р + В cos tp + С (2-35)
Уравнение Карплуса (2-35) получено теоретическим путем, но констан-
ты А, В и С подбираются эмпирически [164]. В выписанных ниже при-
ближенных уравнениях (2-36)—(2-38) [164] средний член уравнения
(2-35) опущен:
Н—С—С—Н' 7 = 17cos3<p-L 1,1 (2-36)
Н— С— N—Н' 7 = 12 cos2 ф + 0,2 (2-37)
Н— С— О—Н' 7 = 10 cos2 ф — 1,0 (2-38)
Поскольку второй член в этих уравнениях равен 1 Гц или меньше, час-
то используют одночленное уравнение Карплуса.
Спектры ЯМР позволяют определять торсионный угол между ато-
мами водорода при «-углероде аминокислотного остатка и соседнем
атоме азота пептидной связи (<р', но не <р)2; это позволяет установить,
1 Уравнение можно записать и в таком виде: J asA'-J-B'cos ф+C'cos 2ф (М. Кат-
plus, JACS, 85, 2870—2871, 1963). Поскольку cos 2<p=2cos2<p—1, это эквивалентно урав-
нению (2-35), но константы А', В' и. С' получаются иными. Встречается также форма
записи через sin2<p.
2 Если <р (разд. Б.З) = 180°, ф'—-|-120о.
Молекулы, из которых мы состоим
187
в какой конфигурации находится
если
если
или транс.
— 8,5 cos2<p',
=9,5 cos2<p',
малых пеп-
нуклео-
присут-
(Еи) и
Рибонуклеаза
11% в D2O
60 МГц
38°С
pD 7,5
HDO
DSS
8
6
О
Рибонуклеаза
11% в D2O
4 2
3, м. э
А
пептидная группа — цис
<р' лежит между 0 и 90°
Ф' лежит между 90 и 180°
Метод ЯМР использовался для определения конформации
дидов и полиэфиров [165—167] и структуры углеводов [168] и
тидов.
Весьма ценную информацию дают спектры ЯМР, снятые в
ствии парамагнитных ионов лантанидов, таких, как европий
празеодим (Рг) [169, 169а]. Эти
ионы индуцируют существенные
сдвиги многих сигналов ЯМР,
что при наличии определенных
эмпирических соотношений помо-
гает определить структуру того
или иного соединения.
Спектры ПМР белков чрезвы-
чайно сложны, однако в их рас-
шифровке достигнуты весьма зна-
чительные успехи [170—175]. На
рис. 2-41 приведены спектры ПМР
фермента рибонуклеазы, полу-
ченные при 60 и 220 МГц. Как
легко видеть, при более высокой
частоте разрешение выше. Обра-
щает на себя внимание и тот
факт, что после тепловой дена-
турации фермента (до 72,5°С)
многие сигналы спектра, снятого
при 220 МГц, оказываются более
узкими. Это означает, что в ре-
зультате денатурации все одно-
дипные боковые группы белка
попадают в примерно эквивален-
тное окружение. Кроме того, бы-
ло показано, что спектры ПМР
для белков, находящихся в кон-
формации статистического клуб-
ка, хорошо соответствуют спект-
рам, которые можно получить,
исходя из стандартных химиче-
ских сдвигов отдельных амино-
кислот [171], что согласуется с
изложенным выше.
Как правило, спектры ПМР
снимают в D2O, поскольку сиг-
нал Н2О накладывается на боль-
шую часть спектра. Все же при
снятии спектров в Н2О на дале-
ком слабопольном конце спектра
(д>10) видны слабые пики от
NH-протонов имидазольных боковых цепей (рис. 2-42). Спектры, сня-
тые при трех разных значениях pH, показывают, что при повышении
pH от 4,4 до 8,9 сигнал, соответствующий наименьшей энергии, смеща-
ется от 12,9 до 11,1 м. д. При промежуточном значении pH (5,31) пик
б, м. о
В
РИС. 2-41. Спектр ПМР для нативной ри-
бонуклеазы, снятый при 60 МГц (А) и
220 МГц (Б) и для денатурированного
фермента, снятый прн 220 МГц (В). Кон-
центрация фермента в 2НгО составляла
11 %, pD = 7,5 (А) н 6,8 (Б). Эталон —соль
Тьера (MacDonald С, С., Phillips W. D.,
J. Am. Chem. Soc., 89, 6333, 1967).
188 Глава 2
занимает промежуточное положение, довольно близкое к положению,
пика при pH 4,4. Снимая зависимость химического сдвига от pH, полу-
чают S-образную кривую титрования (гл. 4, разд. В), по которой мож-
но оценить значение р'Кл диссоциирующих групп. Для гистидина (кото-
РИС. 2-42. Спектр ПМР для рибонуклеазы А в растворе 0,1 М NaCl при температу-
ре 22°. Три спектра соответствуют трем значениям pH: 4,4; 5,3 и 8,9. Каждый спектр,
есть результат усреднения нескольких измерений; операция усреднения проводилась.
на ЭВМ Varian С1024 (Griffen J. Н. et al., Biochemistry, 12, 2097, 1973).
рый считается функциональной группой активного центра фермента;,
см. гл. 7, разд. Д. 2) полученное таким образом рК& равно 5,8.
В протонных спектрах ЯМР (до 360 мгц) молекул тРНК удалось,
идентифицировать 26 резонансных линий, соответствующих двадцати:
протонам, участвующим в образовании водородных связей между па-
рами оснований (N—Н—N, рис. 2-24) и водородных связей, стабилизи-
рующих третичную структуру (в частности, водородных связей в три-
плетах оснований по схеме Хугстена; разд. Г.6) [176],.
в. Магнитный резонанс на ядрах 13С (13С-ДМР)
Использование ядер 13С в ЯМР-спектроскопии довольно ограничен-
но в связи с малым природным содержанием этого изотопа. Еще одна
трудность связана с наличием спин-спинового взаимодействия между
13С и 1Н, поскольку в органических соединениях в нем участвует боль-
шое число протонов. Поразительные успехи в развитии 13С-ЯМР-спект-
роскопии были достигнуты благодаря использованию «широкополосно-
го подавления связи 13С—‘Н» (шумовой развязки). Поскольку природ-
ное содержание 13С составляет всего 1,1%, этот изотоп редко занимает
в молекуле соседние положения. Таким образом, (13С—13С)-взаимодей-
ствие не вносит никаких осложнений и в 13С-ЯМР-спектре с примене-
нием шумовой развязки каждый атом углерода дает одиночный пик.
Однако даже и в таком виде 13С-ЯМР-спектроскопия не находила ши-
рокого практического применения до тех пор, пока не появились им-
пульсные спектрометры, основанные на использовании Фурье-преобра-
зования [181]. В таких приборах образец облучают сильным радиоча-
стотным импульсом длительностью в несколько микросекунд. Каждый
следующий импульс поступает через 1—2 с, так что за 1—2 с снимается
эквивалент обычного спектра ЯМР- Данные поступают на ЭВМ, где
накапливаются спектры, многократно зарегистрированные в течение не-
Молекулы, из которых мы состоим 189
скольких минут, часов или даже дней. Это позволяет получать спектры
13С-ЯМР с большой точностью.
Химические сдвиги в спектрах 13С-ЯМР часто составляют 100 м. д.
и даже больше относительно ТМС. Присутствие при атоме углерода не-
о
II
—C-NH
—ГОСТ,
Кольцевые Кольцевые
углероды углероды
(с присоединен- 1455
ными ОН-группа-
ми
п-Диоксан
( зтпа'лонное
соединение)
QH2—О—
ш «= 180°
<р *= 60°
Ф = 100°
X *= 162°
Ga3+
он
L - - I___1_____|____|____J_____I t__
120 100 80 60 40 20 0 -20
S, м д. относительно п-диоксана
РИС. 2-43. Спектр ЯМР ядер 13С с шумовой развязкой 13С—44. А. Мономер эитеро-
•бактина [Ы-(2,3-диоксибеизоил)-Ь-серии]. Б. Свободный эитеробактии. В. Са3+-эите-
робактии. Препараты растворяли в (CDs)2SO при ~50°. Химический сдвиг отсчитывал-
ся от внутреннего эталона, n-диоксаиа. Приведенные результаты есть результат усред-
нения от 17 000 до 49 000 спектров (Llinas М. et al., Biochemistry, 12, 3840, 1973).
скольких групп-заместителей чаще всего дает аддитивный эффект
[I77].
На рис. 2-43 приведен спектр 13С-ЯМР соединения, синтезируемого
•бактерией Е. coli, — энтеробактина, который образует комплекс с желе-
1РИС. 2-44. Структура энтеробактина из Е. coli, способного образовывать комплекс
с железом, а также структура его комплекса с ионом галлия Ga3+ [167].
190 Глава 2
зом. Он представляет собой циклический тример 2,3-диокси-Ы-бензоил-
L-серина (рис. 2-44). Статья [167], из которой взят рис. 2-43, помимо
того, что иллюстрирует применение спектров ЯМР для установления
структуры, очень интересна с биохимической точки зрения. Образова-
ние комплекса с трехвалентными ионами вызывает в молекуле энтеро-
бактнна сильные конформационные изменения. Сравнение свободного
энтеробактина с его таллиевым хелатом показывает, что угол ф почт»
не меняется; ср вместо 60° становится равным —150°, а соответствую-
щий боковой цепи угол % принимает значение 60° (вместо прежних
162°). В свободном энтеробактине амидная группа почти плоская, в хе-
лате же торсионный угол w меняется до —133°.
13С-ЯМР применяется и для исследования структуры белков. На
рис. 2-45 показана часть 13С-ЯМР-спектра цитохрома с (гл. 10,.
разд. Б.5). Многие из резонансных линий удалось идентифицировать —
РИС. 2-45. Часть 13С-ЯМР-спектра цитохрома с из сердца лошади, где расположены
полосы резонансного поглощения ароматических углеродов и атомов аргинина.
Спектр снят с применением шумовой протонной развязки при pH 6,7; температура
41 °C, частота 15,18 МГц. Л. Феррицитохром с, 14,4 мМ (результат усреднения!
46 000 спектров, снятых в течение 14 ч). Б. Ферроцитохром с, 11,5 мМ (результат
усреднения 16 384 спектров) [178].
они принадлежат атомам углерода, входящим в состав ароматических,
аминокислот или порфиринового кольца. Обратите внимание на пора-
зительные изменения спектра при восстановлении железа из ферри- а
ферро-состояние.
г. Магнитный резонанс на ядрах 31Р
Чувствительность ЯМР на ядрах фосфора составляет всего 1/15 от
чувствительности протонного ЯМР, однако в биохимии такие спектрьи
ЯМР применяются довольно широко. Особый интерес представляет
возможность измерить pH во внутриклеточной среде по химическому
сдвигу сигнала ЯМР от ортофосфата (неорганического фосфата, Pi)
[182]. ЯМР на ядрах 31Р позволяет следить за ходом химических реак-
ций с участием фосфорилированных субстратов, протекающих внутри
Молекулы, из которых мы состоим 19Е
клеток [183—185]’. Недавно при исследовании белков и других биохи-
мических соединений стали применять ЯМР на ядрах 15N естественного-
содержания [186].
д. Оптические методы исследования конформации
О конформационных изменениях полимеров часто можно судить по-
изменению спектров поглощения ароматических боковых цепей амино-
кислот, а также пуриновых и пиримидиновых оснований (рис. 2-28).
Другими ценными методами являются инфракрасная спектроскопия,
раман-спектроскопия, флуоресцентный анализ и КД-спектроскопия; все
эти методы рассматриваются в гл. 13.
Вопросы и задачи
1. Нарисуйте следующие структуры, стабилизированные водородны-
ми связями:
а. димер уксусной кислоты;
б. тирозин-карбоксилатную группу в молекуле белка;
в. ионную фосфат-гуанидиниевую пару в фермент-субстратном ком-
плексе;
г. пары оснований GC и GU (напомним, что пара GU не уклады-
вается в схему Уотсона — Крика).
2. Нарисуйте структуры возможных таутомерных форм катиона, обра-
зующегося при протонировании 9-метиладенина.
3. Заполните следующую таблицу:
Название Мономер Тип связи Примерный молекулярный вес
Белок
Полисахарид
Нуклеиновая кислота
Тейхоевая кислота
Поли-0-оксибутираг
4. Попробуйте предсказать, в какой конформации скорее всего окажут-
ся приведенные ниже пептидные фрагменты в белке — в а-спирали
или в составе ^-структуры.
а. поли-Ь-лейцин;
б. поли-Ь-валин;
в. Pro-Glu-Met-Val-Phe-Asp-Ile;
г. Pro-Glu-Ala-Leu-Phe-Ala-Ala.
5. Сравните растворимость в воде и в эфире аминокислот и насыщен-
ных жирных кислот и их физическое состояние. Как эти различия
связаны со структурой указанных соединений?
6. Какие функциональные группы встречаются в боковых цепях бел-
ков? Каково структурное и функциональное значение а) гидрофоб-
ных групп; б) кислых и основных групп; в) сульфгидрильных ррупп?
7. Составьте таблицу значений рКя для кислых и основных групп,
входящих в состав белка. Какие из этих групп больше всего влия-
ют на кривые титрования белков?
1192 Глава 2
8. рЛа Для трипептида L-Ala—L-His—L-Gln имеет следующие значе-
ния: 3,0 (а-СООН), 9,1 (a-NHjj), 6,7 (имидазол).
а. Какова изоэлектрическая точка трипептида — значение pH, при
котором его суммарный заряд равен нулю? Указание: для ами-
нокислот р! обычно является среднеарифметическим двух зна-
чений р/Са (см. Е. J. Cohn and J. Т. Edsall, «Proteins, Amino Acids
and Peptides», pp. 90—93. Reinhold, New York, 1943).
б. Нарисуйте структуры ионных форм, которые пептид принимает
при pH 5 и pH 9. При каждом из этих значений pH рассчитайте
процентное содержание каждой ионной формы. Указание-, опреде-
ление понятий pH и р/Са можно найти в гл. 4, где подробно объ-
ясняется их смысл и рассматриваются свойства буферов.
9. Перечислите названия всех изомерных трипептидов, содержащих
по одному остатку тирозина, аланина и валина.
10. а. Напишите структурную формулу глицил-Ь-триптофанил-Е-про-
лил-Ь-серил-Ь-лизина.
б. Какие аминокислоты можно получить из этого пептида в резуль-
тате кислотного гидролиза?
в. В результате щелочного гидролиза?
г. В результате обработки азотистой кислотой с последующим кис-
лотным гидролизом?
д. Куда будет смещаться этот пептид в электролитической ванне
при pH 7,0 — к катоду или к аноду? Чему примерно равна его
изоэлектрическая точка?
е. Если раствор этого пептида привести к pH 7, а затем титровать
гидроокисью натрия в присутствии 10% формальдегида, то сколь-
ко эквивалентов основания на моль пептида потребуется для то-
го, чтобы повысить pH до 10?
.11. Сравните структурные особенности и свойства следующих белков:
фиброина шелка, а-кератина, коллагена, бычьего сывороточного
альбумина.
.12. Как обычно меняется растворимость белков с изменением pH? По-
чему?
43. Известно, что пептид содержит только L-лизин и L-метионин. Из
данных по титрованию следует, что на каждую свободную карбок-
сильную группу пептида приходятся 3 свободные аминогруппы. При
обработке пептида азотистой кислотой (HNOo) в аппарате Ван-
Слайка каждая аминогруппа освобождает 1 моль N2. Если прове-
сти полный кислотный гидролиз дезаминированного пептида и вновь
обработать гидролизат HNO2, то высвобождается то же количество
N2, что и из исходного пептида. Обработка исходного пептида из-
бытком динитрофторбензола дает динитрофенильный (ДНФ-) пеп-
тид, который по спектрофотометрическим данным содержит по три
ДНФ-группы на каждую свободную карбоксильную группу. После
полного гидролиза этого ДНФ-пептида выявляются следующие про-
дукты: бесцветное соединение, содержащее S (Ai); соединение жел-
того цвета, содержащее S (А2), и соединение желтого цвета, не со-
держащее S (А3). При частичном гидролизе ДНФ-пептида обра-
зуются Ai, А2 и А3 и еще четыре соединения, имеющие желтую
окраску — Bi, В2, В3 и В4. При полном гидролизе из Bi образуется
Аь А2 и А3; из В2 — Ai и А2; из В3 —At и А3, а из В4— только А3.
Какова наиболее вероятная структура исходного пептида?
14. Дисахарид, не обладающий редуцирующими свойствами, при обра-
ботке его диметилсульфатом и щелочью дает октамегильное произ-
водное. Кислотный гидролиз этого производного приводит к обра-
Молекулы, из которых мы состоим 193
зованию 1 моля 2,3,4,6-тетраметил-В-глюкозы и 1 моля 2,3,4,6-тет-
раметил-В-галактозы. Дисахарид быстро гидролизуется мальтазой
или лактазой (р-галактозидазой).
Дайте этому дисахариду подходящее описательное наименова-
ние и изобразите его хеуорсову проекционную формулу.
15. Альдопентоза (А) в D-конфигурации при окислении концентриро-
ванной азотной кислотой дает 2,3,4-триоксипентандиоловую кислоту
(триоксиглутаровую кислоту, В), не обладающую оптической актив-
ностью. При добавлении к A HCN с последующим гидролизом, лак-
тонизацией и восстановлением образуются две стереоизомерные
альдогексозы (С и D). Окисление D дает оптически неактивную
2,3,4,5-тетраоксигександиоловую кислоту (сахариновая кислота, Е).
Напишите структурные формулы соединений А—Е.
16. Какие продукты образуются в результате реакции иодной кислоты
с сорбитом?
17. 10,0 г гликогена после метилирования и кислотного гидролиза да-
ют 6,0 миллимолей 2,3-ди-О-метилглюкозы.
а. Какой процент остатков глюкозы в гликогене содержат замещен-
ные группы в а-(1—>6)-положении?
б. Чему равно среднее число остатков глюкозы на каждый нераз-
ветвленный отрезок цепи?
в. Сколько миллимолей 2,3,6-три-О-метилглюкозы могло бы обра-
зоваться из этого полимера?
г. Сколько остатков глюкозы содержит полисахарид, если его мол.
вес равен 2-106?
д. Сколько нередуцирующих концов приходится на молекулу, или,
иными словами, сколько цепей содержит молекула?
18. Что такое температура плавления (7’пл) препарата ДНК? Как Тал
зависит от нуклеотидного состава и как это можно объяснить?
19. Нарисуйте схему полинуклеотидных фрагментов молекул ДНК и
РНК и укажите места разрыва цепи при следующей обработке:
а) НС1, мягкий гидролиз;
б) НС1, более жесткий гидролиз;
в) NaOH, мягкий гидролиз;
г) NaOH, более жесткий гидролиз;
д) панкреатической рибонуклеазой;
е) панкреатической ДНКазой;
ж) ДНКазой селезенки;
з) фосфодиэстеразой селезенки;
и) фосфодиэстеразой змеиного яда;
к) микрококковой ДНКазой.
20. Кислотный гидролиз препарата ДНК дал следующий состав осно-
ваний (в %): аденин — 24,0; тимин —33,0; гуанин — 23,0; цито-
зин— 20,0. Это весьма необычный результат. Укажите две его осо-
бенности и предложите возможные объяснения этого факта, исходя
из особенностей структуры ДНК-
21. Иодное число соединения определяется как количество 12 в грам-
мах, поглощенное одним граммом жира при насыщении С = С-свя-
зей (с образованием дииодпроизводных). Примечание-, обычно при-
меняют галогенизирующие реагенты иодистый монохлорид (IC1) и
иодистый монобромид (1Вг), однако подное число выражают
именно в граммах 12. Число омыления — это количество КОН в
граммах, необходимое для полного омыления (гидролиза и после-
дующей нейтрализации жирных кислот) 1 г жира. Имеется чистый
триглицерид с числом омыления 198 и иодным числом 59,7.
194 Глава 2
а. Каков его молекулярный вес?
б. Чему равна средняя длина цепи жирных кислот?
в. Сколько двойных связей содержится в молекуле триглицерида?"
22. Спермацет (воск, извлекаемый из головы кашалота) как по физи-
ческим свойствам, так и по инертности по отношению к таким ре-
агентам, как Вгг/СНС1з и КМпО4, напоминает высокомолекулярные-
углеводороды; качественный анализ позволяет определенно говорить-
лишь о присутствии в спермацете углерода и водорода. Однако-
ИК-спектры свидетельствуют о наличии в структуре сложноэфир-
ной связи, а количественный анализ дает эмпирическую формулу
С1бНз2О. Титрование пробы раствора, полученного в результате дли-
тельного перемешивания воска в спиртовом растворе КОН, показы-
вает, что на каждые 475 г воска приходится один эквивалент осно-
вания. При добавлении к охлажденной смеси воды и эфира она
разделяется на два слоя — водный и эфирный. Подкисление водно-
го слоя дает твердый продукт А, эквивалент которого по реакции;
нейтрализации составляет 260±5. После испарения эфира образует-
ся твердое, нетитрующееся вещество В. Восстановление как сперма-
цета, так и вещества А литий-алюминий-гидридом дает в качестве-
единственного продукта вещество В.
Какова наиболее вероятная структура спермацета?
23. а. Объясните вкратце два преимущества метода изотопного разве-
дения.
б. Исходя из приводимых ниже данных, рассчитайте количество-
сАМР (циклического АМР), присутствующего в 1 мл клеток се-
далищной мышцы человека. Клетки обрабатывали 32Р-сАМР с
удельной активностью 50 мкКи-мкмоль-1 в течение 0,2 ч (при:
этом весь сАМР был поглощен клетками). Далее клетки подвер-
гали гомогенизации, после чего выделяли и очищали раствори-
мый сАМР. Удельная активность выделенного сАМР оказалась
равной 10 мкКи-мкмоль-1. Суммарное количество добавленного-
сАМР составляло 1,0-10—7 молей на 1 мл клеток.
24. Рисунок в дополнении 2-В иллюстрирует высокоэффективное разде-
ление растворимых белков Е. coli. В белки были включены ^-ами-
нокислоты.
а. Как бы вы поставили эксперимент с введением метки?
б. Какие другие изотопы можно использовать для мечения белков?
Какие химические формы изотопа вы бы предпочли? Какие здесь
возможны ограничения?
в. Какие растворимые компоненты клеток Е. coll, обработанных
ультразвуком, могут помешать проведению подобного двумерного-
разделения и как их можно удалить?
г. Какие еще методы (помимо использования радиоактивных изо-
топов) можно применить для выявления локализации белков?
д. Если бы можно было обнаружить все растворимые белки Е. co-
ll, то сколько отдельных белков вы ожидали бы увидеть?
е. Укажите по крайней мере два наиболее важных качества, кото-
торыми должен обладать метод разделения, для того чтобы его
можно было применить к системам, содержащим очень большое
число белков.
25. 35S испускает только р-частицы; процесс распада характеризуется
следующими параметрами:Zi/2 =86,7 дня, еМакс = 0,168 МэВ.
а. Напишите уравнение радиохимического распада 35S.
б. Рассмотрите преимущества и ограничения, связанные с исполь-
эппяппрм ass R качестве изотопной метки.
Молекулы, из которых мы состоим 195
26. Располагая некоторым количеством агарозы, бромциана, 6-амино-
гексановой кислоты и другими компонентами, необходимыми для
проведения аффинной хроматографии, укажите, какие химические
реакции должны обеспечить связывание триптофана через его ами-
ногруппу.
СПИСОК ЛИТЕРАТУРЫ
1. Chan R. S„ J. Chem. Educ., 41, 116—125 (1964).
2. Bentley R., Molecular Asymmetry in Biology, Vol. 1, pp. 49—56, Academic Press,
New York, 1969.
3. Lambert J. B., Sci. Am., 222, 58—70 (Jan 1970).
4. Strahs G., Adv. Carbohydr. Chem. Biochem., 25, 53—107 (1970).
5. Angyal S. J., Angew. Chem., Int. ed. Engl., 8, 157—166 (1969).
6. Pigman IV'. W., Horton D., eds., «The Carbohydrates», 2nd ed., Vol. 1A, pp. 56—
57, Academic Press, New York, 1972.
7. Jencks IV'. P., Catalysis in Chemistry and Enzymology, pp. 4 and 7, McGraw-Hill,
New York, 1969.
8. Cram D. J., Hammond G. S., Organic Chemistry, 2nd ed., p. 221, McGraw-Hill,
New York, 1964.
9. Metzler D. E., Harris С. M., Johnson R. J., Siano D. B., Thomson J. A., Bioche-
mistry, 12, 5377—5392 (1973).
10. Органическая химия нуклеиновых кислот. (Под ред. Н. К- Кочеткова и Э. И. Бу-
довского. — М.: Химия, 1970.)
11. Daniels М„ PNAS, 69, 2488—2491 (1972).
12. Rich A. In: Biophysical Science, A Study Program (Oncley J. L., ed.), p.p. 50—60,
Wiley, New York, 1959. This article also appeared in Rev. Mod. Phys., 31, 50—60
(1959).
13. Dickerson R. E„ Geis J., The Structure and Action of Proteins, Benjamin, New
York, 1969.
14. Ramachandran G. N., Lakshminarayanan A. V., Kolaskar A. S., BBA, 303, 8—13
(1973).
15. Ramachandran G. N., Kolaskar A. S., BBA, 303, 385--388 (1973).
16. Huber R., Steigemann W., FEBS Lett., 48, 235—237 (1974).
17. Rarle I. L., Biochemistry, 13, 2155—2162 (1974).
18. IUPAC-IUB Commission on Biochemical Nomenclature, Biochemistry, 9, 3471—
3479 (1970).
19. Dickerson R. E., Geis I., The Structure and Action of Proteins, pp. 33—43, Benjamin,
New York, 1969.
20. Fraser R. D. B., Gillespie J. M., Nature (London), 261, 650—654 (1976).
21. Suzuki E., Crewther W. G., Fraser R. D. B., MacRae T. P., McKern N. M., JMB,
73, 275—278 (1973).
22. Cohen C„ Holmes К. C.. JMB, 6, 423—432 (1963).
23. Sodek J., Hodges R. S., Smillie L. B„ Jurasek L., PNAS, 69, 3800—3804 (1972).
23a. Crick F. H. C„ Acta Crystallogr., 6, 689—697 (1953).
24. Richards F. M., JMB, 82, 1—14 (1974).
25. Chothia C., Nature (London), 254, 304—308 (1975).
26. Quiocho F. A., Bethge P. H., Lipscomb W. N., Studebaker J. F., Brown R. D.,
Koenig S. H., Cold Spring Harbor Symp. Quant. Biol., 36, 561—567 (1971).
27. Buehner M., Ford G. C., Moras D., Olsen K. W., Rossmann M. G., JMB, 90, 25—
49 (1974).
28. Nagano K-, JMB, 75, 401—420 (1973).
29. Chou P. Y„ Fasman G. D., Biochemistry, 13, 222—245 (1974).
30. Wu T. T„ Rabat E. A., JMB, 75, 13—31 (1973).
31. Schulz G. E. et al., Nature (London), 250, 140—141 (1974).
31a. Levitt M„ Chothia C„ Nature (London), 261, 552—558 (1976).
32. Kretsinger R. H„ Nockolds С. E., JBC, 248, 3313—3326 (1973).
33. Anfinsen С. B., Science, 181, 223—230 (1973).
34. Mahler H. R., Cordes E. H., Biological Chemistry, 2nd ed., pp. 235—245, Harper,
New York, 1971.
34a. Anfinsen С. B., Scheraga H. A., Adv. Protein Chem., 29, 205—300 (1975).
35. Guthrie R. D., Guthrie and Honeyman’s Introduction to Carbohydrate Chemistry,
4th ed., p. 17, Oxford Univ. Press (Clarendon), London and New York, 1974.
35a. French D., Chemistry and Biochemistry of Starch, MTP Int. Ser. Sci. Vol. 5,
pp. 267—335, Butterworths, London, 1975.
36. White A., Handler P„ Smith E. L„ «Principles of Biochemistry», 5th ed., pp. 52—
58, McGraw-Hill, New York, 1973.
196 Глава 2
37. Jeanloz R. W. In: The Carbohydrates (Pigman W., Horton D., eds.), 2nd ed..
Vol. 2B, pp. 589—625, Academic Press, New York, 1970.
38. Silva M. E., Dietrich С. P., JBC, 250, 6841—6846 (1975).
38a. Woodhead-Gallow ay J., Hukins D. W. L., Endeavour, 35, 73—78 (1976).
38b. Rosenberg L., Hellmann W., Kleinschmidt A. K., JBC, 250, 1877—1883 (1975).
39. Montgomery R. In: The Carbohydrates (Pigman W., Horton D., eds.), 2nd ed.,
Vol. 2B, pp. 627—709, Academic Press, New York, 1970.
40. Heath E. C., Annu. Rev. Biochem., 40, 29—56 (1971).
41. Spiro R. G., Annu. Rev. Biochem., 39, 599—638 (1970).
42. Marshall R. D., Annu. Rev. Biochem., 41, 673—702 (1972).
43. Stern E. L„ Lindahl B„ Roden L., JBC, 246, 5707—5715 (1971).
43a. Hallgren P., Lundblad A., Svensson S., JBC, 250, 5312—5314 (1975).
44. Lee У. C., Scocca J. R., JBC, 247, 5753—5758 (1972).
45. DeVries A. L„ Science, 172, 1152—1155 (1971).
46. Vandenheede J. R., Ahmed A. I., Feeney R. E„ JBC, 247, 7885—7889 (1972).
47. Pessac B., Defendi V., Science, 175, 898—900 (1972).
48. Rao V. S. R., Yathindra N„ Sundararajan P. R., Biopolymers, 8, 325—333 (1969).
49. Sathyanarayana В. K-, Rao V. S. R., Biopolymers, 11, 1379—1394 (1972).
50. Rees D. A., Adv. Carbohydr. Chem. Biochem., 24, 267—332 (1969).
51 Poppleton В. J., Mathieson A. McL., Nature (London), 219, 1046—1048 (1968).
52. Rundle R. E., French D., JACS, 65, 1707—1710 (1943).
53. French D„ J. Anim. Sci., 37, 1048—1061 (1973).
54. Hybl A., Rundle R. E„ Williams D. E„ JACS, 87, 2779—2788 (1965).
55. Kainuma K-, French D., Biopolymers, 11, 2241—2250 (1972).
56. French D., Dempun Kagaku, 19, 8—25 (1972).
57. Arnott S., Fulmer A., Scott W. E., Dea I. С. M., Moorehouse R., Rees D. A., JMB,
90, 269—284 (1974).
58. Arnott S., Scott W. E„ Rees D. A., McNab C. G. A., JMB, 90, 253—267 (1974).
59. Rees D. A., BJ, 126, 257—273 (1972).
59a. Kirkwood S., Ann. Rev. Biochem., 43, 401—417 (1974).
60. Preston R. D., Sci. Am., 218, 102—108 (June 1968).
61. Atkins E. D. T., Sheehan J. K-, Science, 179, 562—564 (1973).
62. Arnott S., Guss J. M., Hukins D. W. L., Mathews M. B., Science, 180, 743—745
(1973).
63. Brown D. M. In: Basic Principles in Nucleic Acid Chemistry (P. О. P. Ts’o, ed.).
Vol. 2, pp. 1—90, Academic Press, New York, 1974.
64. Feldman M. Ya., Prog. Nucleic Acid Res. Mol. Biol., 13, 1—49 (1973).
65. Arnott S., Hukins D. W. L„ JMB, 81, 93—105 (1973).
66. Saenger W., Angew Chem., Int. Ed. Engl., 12, 591—601 (1973).
67. Altona C., Sundaralingam M., JACS, 94, 8205—8212 (1972).
68. Voet D., Rich A., Prog. Nucleic Acid Res. Mol. Biol., 10, 183—265 (1970).
69. Arnott S„ Prog. Biophys. Mol. Biol., 21, 265—319 (1970).
70. Ts’o P. О. P. ed., Basic Principles in Nucleic Acid Chemistry, Vol. 2, pp. 305—
469, Academic Press, New York, 1974.
71. Arnott S., Hukins D. W. L„ Dover S. D„ Fuller W„ Hodgson A. R., JMB, 81, 107—
122 (1973).
71a. Rosenberg J. M„ Seeman N. C., Day R. 0., BBRS, 69, 979—987 (1976).
72. Kim S. H., Suddath F. L., Quigley G. J., McPherson A., Sussman J. L., Wang A. H. J.,
Seeman N. C., Rich A., Science, 185, 435—440 (1974).
73. Robertas J. D., Ladner J. E., Finch J. T„ Rhodes D., Brown R. S., Clark B. F. C.,
Klug A., Nature (London), 250, 546—551 (1974).
73a. Rich A., Raj Bhandary U. L., Annu. Rev. Biochem., 45, 805—860 (1976).
74. Kim S. H., Sussman J. L., Suddath F. L., Quigley G. L, McPherson A.,
Wang A. H. I., Seeman N. C„ Rich A., PNAS, 71, 4970—4974 (1974).
75. Arnott S., Bond P. J., Nature (London), New Biol., 244, 99—101 (1973).
75а. De Clercq E., Torrence P. F., De Somer P„ Witkop B., JBC, 250, 2521—2531
(1975).
76. Tinoco L, Jr., Borer P. N., Dengler B., Levine M. D., Uhlenbeck О. C., Crot-
hers D. M„ Gralla J., Nature (London), New Biol., 246, 40—41 (1973).
77. Singer С. E„ Ames B. N„ Science, 170, 822—826 (1970); 175, 1393 (1972).
78. Davidson J. N., The Biochemistry of the Nucleic Acids, 7th ed., pp. 204—205, Aca-
demic Press, New York, 1972.
79. Krasuski C., Hayashi H., Nakanishi K-, Fed. Proc., 31, 444 (abstr.) (1972).
80. Helinski D. R., Clewell D. B., Annu. Rev. Biochem., 40, 899—942 (1971).
81. Vinograd J., Lebowitz J., Watson R., JMB, 33, 173—197 (1968).
82. Campbell A. M„ Jolly D. J., BJ, 133, 209—226 (1973).
82a. Keller W., PNAS, 72, 2550—2554 (1975).
83. Pigram W. J., Fuller W., Davies M. E„ JMB, 80, 361—365 (1973).
84. Liu L. F„ Wang J. C„ BBA, 395, 405—412 (1975).
Молекулы, из которых мы состоим 197
85. Gabbay Е. J., Sanford К-, Baxter С. S., Kapicak L., Biochemistry, 12, 4021—4029
(1973).
86. Gabbay Е. J., Scofield R. E., Baxter C. S., JACS, 95, 7850—7857 (1973).
86a. Keller W„ PNAS, 72, 4876—4880 (1975).
86b. Share M., Vinograd J., Cell, 8, 215—226 (1976).
86c. Depew R. E„ Wang C., PNAS, 72, 4275—4279 (1975).
87. Felsenfeld G., Proced. Nucleic Acid Res., 2, 233—244 (1971).
88. Kennell D. E„ Prog. Nucleic Acid Res. Mol. Biol., 11, 259—301 (1971).
89. Borre K., Szybalski N. In: Methods in Enzymology (Grossman L., Moldave K.
eds.), Vol. 21D, pp. 350—383, Academic Press, New York, 1971.
90. Bendich A. I., Bolton E. T. In: Methods in Enzymology (Grossman L., Moldave K.
eds.), Vol. 12B, pp. 635—640, Academic Press, New York, 1968.
91. Gillespie D. In: Methods in Enzymology (Grossman L, Moldave K., eds.), Vol. 12B,
pp. 641—668, Academic Press, New York, 1968.
92. Britten R. J., Kohne D. E., Carnegie Inst. Washington, Yearb., 65, 78—106 (1967).
93. Britten R. I., Kohne D. E„ Science, 161, 529—540 (1968).
94. Britten R. I., Smith J., Carnegie Inst. Washington, Yearb., 68, 378—391 (1970).
94a. Wetmur J. G., Ann. Rev. Biophys. Bioeng., 5, 337—361 (1976).
95. Wilson D. A., Thomas C. A., Jr., JMB, 84, 115—144 (1974).
95a. Sobell H. M., Ann. Rev. Biophys. Bioeng., 5, 307—335 (1976).
96. Christie W. W., Lipid Analysis; Isolation, Preparation, Identification and Struc-
tural Analysis of Lipids, Pergamon, Oxford, 1973.
97. Hitchcock C., Nichols B. W., «Plant Lipid Biochemistry», Academic Press, New
York, 1971.
98. Kates M. In: Laboratory Techniques in Biochemistry and Molecular Biology
(Work T. S., Work E., eds.), Vol. 3, Part II, North-Holland Publ., Amsterdam,
1972.
99. Garr M. I., James A. T., Lipid Biochemistry, an Introduction, Cornell Univ. Press,
Ithaca, New York, 1971.
100. Okamura K-, Marchessault R. H. In: Conformation of Biopolymers (Ramachand-
ran G. N., ed.), Vol. 2, p. 709—720, Academic Press, New York, 1967.
101. Bowen H. J. M., Trace Elements in Biochemistry, Academic Press, New York,
1966.
102. Frieden E., Sci. Am., 227, 52—60 (Jul 1972).
103. Hoekstra W. G., Suttie J. W., Ganther H. E., Mertz W., eds., Trace Element Meta-
bolism in Animals — 2, Univ. Park Press, Baltimore, Maryland, 1974.
104. Ling G. N., A Physical Theory of the Living State, Ginn (Blaisdell), Boston, Mas-
sachusetts, 1962.
105. Wester P. О., BBA, 109, 268—283 (1965).
106. Birnie G. D., Fox S. M. eds., Subcellular Components, Butterworth, London, 1969.
107. Mahler H. R., Cordes E. H., Biological Chemistry, 2nd ed., pp. 441—457, Harper, New
York, 1971.
108. Некоторые методы получения препаратов митохондрий рассмотрены в издании
Estabrook R. W., Pullman М. Е. eds., Methods in Enzymology, Vol. 10, Academic
Press, New York, 1967.
109. Методы получения препаратов плазматических мембран и аппарата Гольджи рас-
смотрены в книге Jakoby W. В. ed., Methods in Enzymology, Vol. 22, pp. 99—
148, Academic Press, New York, 1971.
НО. Методы выделения лизосом рассмотрены в книге Dingle J. Т., Lysosomes, A La-
boratory Handbook, North-Holland Publ., Amsterdam, 1972.
111. Davidson J. N., The Biochemistry of Nucleic Acids, 7th ed., pp. 73—82, Academic
Press, New York, 1972.
112. Grossman L., Moldave K. eds., Methods in Enzymology, Vol. 12A, pp. 531—708,
Academic Press, New York, 1967.
113. Kirby K. S. In: Methods in Enzymology (Grossman L., Moldave K., eds.), Vol. 12B,
pp. 87—99, Academic Press, New York, 1968.
114. Gurr M. I., James A. T., Lipid Biochemistry, an Introduction, Cornell Univ. Press,
Ithaca, New York, 1971.
115. Morris C. J. O. R., Morris P., Separation Methods in Biochemistry, Wiley (Inter-
science), New York, 1963.
116. Cuatrecasas P., Anfinsen С. B. In: Methods in Enzymology (Jakoby W. B., ed.),
Vol. 22, pp. 345—378, Academic Press, New York, 1971.
117. Jakoby W. B„ Wilchek eds., Methods in Enzymology, Vol. 34, Academic Press, New
York, 1974.
118. Porath J., Nature (London), 218, 834—838 (1968).
119. Inman J. K., In: Methods in Enzymology (Jakoby W. B., Wilchek M., eds.), Vol. 34,
pp. 30—58, Academic Press, New York, 1974.
120. Cuatrecasas P„ Wilchek M., Anfinsen С. B„ PNAS, 61, 636—643 (1968).
198 Глава 2
121. McPhie Р. In: Methods in Enzymology (Jakoby W. B., ed.), Vol. 22, pp. 23—32,
Academic Press, New York, 1971.
122. Blatt W. F. In: Methods in Enzymology (Jakoby W. B„ ed.), Vol. 22, pp. 39—49,
Academic Press, New York, 1971.
123. Reiland J. In: Methods in Enzymology (Jakoby W. B., ed.), Vol. 22, pp. 287—321,
Academic Press, New York, 1971.
124. Cline G. B., Ryel R. B. In: Methods in Enzymology (Jakoby W. B., ed.), Vol. 22,
pp. 168—204, Academic Press, New York, 1971.
125. Bowen T. J., An Introduction to Ultracentrifugation, Wiley (Interscience), New
York, 1970.
126. Davidson I. N„ The Biochemistry of Nucleic Acids, 7th ed., p. 132, Academic Press,
New York, 1972. [Имеется перевод: Дэвидсон Дж. Биохимия нуклеиновых кис-
лот.— М.: Мир, 1976.]
127. Shuster L. In: Methods in Enzymology (Jakoby W. B., ed.), Vol. 22, pp. 412—433,
Academic Press, New York, 1971.
128. Chrambach A., Rodbard D., Science, 172, 440—451 (1971).
129. Vesterberg O. In: Methods in Enzymology (Jakoby W. B., ed.), Vol. 22, pp. 389—
412, Academic Press, New York, 1971.
130. Cohn W. E. In: Methods in Enzymology (Colowick S. P., Kaplan N. O., eds.),
Vol. 3, pp. 724—743, Academic Press, New York, 1957.
131. Heldt H. W., Klingenberg M., In: Methods in Enzymology (Estabrook R. W., Pull-
man M. E., eds.), Vol. 10, pp. 482—487, Academic Press, New York, 1967.
131a. Simpson R. J., Neuberger M. R„ Liu T.-Y., JBC, 251, 1936—1940 (1976).
132. Chin С. C. Q„ Wold F„ Anal. Biochem., 61, 379—391 (1974).
133. Holley R. W. et al., Science, 147, 1462—1465 (1965).
134. Weissman C., Billeter M. A., Goodman H. M., Hindley J., Weber H., Annu. Rev.
Biochem., 42, 303—328 (1973).
134a. Wu R., Bambara R., Jay E., CRC Grit. Rev. Biochem., 2, 455—512 (1975).
134b. Mandeles S., Nucleic Acid Sequence Analysis, Columbia Univ. Press, New York,
1972.
135. Ziff E. B., Sedat J. W., Galibert F., Nature (London), New Biol., 241, 34—37
(1973).
136. Brownlee G. G., Sanger F„ EJB, 11, 395—399 (1969).
137. Proudfoot N. J., Brownlee G. G., Nature (London), 252, 359—362 (1974).
137a. Ling V., JMB, 64, 87—102 (1972).
137b. Sanger F., Coulson A. R., JMB, 94, 441—448 (1975).
138. Barker R., Organic Chemistry of Biological Compounds, Prentice-Hall, Englewood
Cliffs, New Jersey, 1971.
139. Торчинский Ю. M., Сульфгидрильные и дисульфидные группы белков. — М.: Нау-
ка, 1971; Plenum, New York, 1973 (in English).
140. Friedman M., The Chemistry and Biochemistry of the Sulfhydryl Group in Amino
Acids, Peptides and Proteins, Pergamon, Oxford, 1973.
141. Jocelyn P. C., Biochemistry of the SH Group, Academic Press, New York, 1972.
142. Bornstein P., Biochemistry, 9, 2408—2421 (1970).
143. Ackerman R. J., Robyt J. F., Anal. Biochem., 50, 656—659 (1972).
143a. Means G. E., Feeney R. E., Chemical Modification of Proteins, Holden-Day, San
Francisco, California, 1971.
144. Sloneker J. H., Orentas D. G., Knutson C. A., Watson P. R., Jeanes A., Can. J.
Chem., 46, 3353—3361 (1968).
145. Szekely M., Proced. Nucleic Acid Res., 2, 780—795 (1971).
146. Davidson J. N., The Biochemistry of the Nucleic Acids, 7th ed., pp. 242—245, 294
and 295, Academic Press, New York, 1972.
147. Treadwell G. E., Cairns W. L., Metzler D. E., J. Chromatogr., 35, 376—388
(1968).
148. Udenfriend S., Stein S., Bohlen P„ Dairman W., Leimgruber W., Weigele M.,
Science, 178, 871—872 (1972); см. также Benson J. R., Hare P. E. [PNAS, 72.
619—622 (1975)].
149. Sicbodova S„ Hais I. M., Kostir J. V., Chem. Listy, 47, 205—212 (1953).
150. Brown J. R., Hartley B. S., BJ, 101, 214—228 (1966).
151. Van Holde К. E., Physical Biochemistry, Prentice-Hall, Engelwood Cliffs, New
Jersey, 1971.
152. Mahler H. R., Cordes E. H., Biological Chemistry, 2nd ed., pp. 75—91, Harper, New
York, 1971.
153. Nakos G„ Mortenson L., Biochemistry, 10, 455—458 (1971).
154. Mann K. G„ Fish W. W. In: Methods in Enzymology (Hirs С. H. W., Tima-
sheff S. N., eds.), Vol. 26C, pp. 28—42, Academic Press, New York, 1972.
155. Igou D. K., Lo J.-T., Clark D. S., Mattic.e W. L., Younathan E. S„ BBRC, 60,
140—145 (1974).
Молекулы, из которых мы состоим 199
«356. Weber К., Pringle J. R., Osborn М. In: Methods in Enzymology (Hirs С. H. W.,
Timasheff S. N., eds.), Vol. 26C, pp. 1—27, Academic Press, New York, 1972.
156a. Collins D. M., Cotton F. A., Hazen E. E., Jr., Meyer E. F., Jr., Morimoto C. N.,
Science, 190, 1047—1053 (1975).
J57. Roberts J. D., Nuclear Magnetic Resonance, McGraw-Hill, New York, 1959.
158. Roberts G. С. K., Jardetzky 0., Adv. Protein Chem., 24, 447—545 (1970).
159. Jardetzky O., Wade-Jardetzky W. G., Annu. Rev. Biochem., 40, 605—634 (1971).
160. Bovey F. A., Nuclear Magnetic Resonance Spectroscopy, Academic Press, New
York, 1969.
161. Emsley J. W., Feeney J., Sutcliffe L. H., High Resolution Nuclear Magnetic Reso-
nance Spectroscopy, Vols. 1 and 2, Pergamon, Oxford, 1965, 1966.
162. James T. L., Nuclear Magnetic Resonance in Biochemistry: Principles and Applica-
tions, Academic Press, New York, 1975.
163. Rorytnyk W., Ahrens H. In: Methods in Enzymology (McCormick D. B.,
Wright L. D., eds.), Vol. 18A, pp. 475—483, Academic Press, New York, 1970.
164. Barfield M., Rarplus M., JACS, 91, 1 — 10 (1969).
165. Tonelli A. E., Biochemistry, 12, 689—692 (1973).
166. Bovey F. A. In: Chemistry and Biology of Peptides (Meienhofer J., ed.), pp. 3—
28, Arbor Sci. Publ., Ann Arbor, Michigan, 1972.
167. Llinas M., Wilson D. M., Weilands J. B., Biochemistry, 12, 3836—3843 (1973).
168. Durette P. L., Horton D., Adv. Carbohydr. Chem. Biochem., 26, 49—125 (1971).
169. Horrocks W. DeW. Jr., Sipe J. P., HI, JACS, 93, 6800—6804 (1971).
169a. Willcott M. R„ III, Davis R. E., Science, 190, 850—857 (1975).
170. McDonald С. C„ Phillips W. D„ JACS, 89, 6332—6341 (1967).
171. McDonald С. C„ Phillips W. D., JACS,91, 1513—1521 (1969).
172. Cohen J. S„ Fisher W. R„ Schechter A. W., JBC, 249, 1113—1118 (1974).
173. Griffin J. H., Cohen J. S., Schechter A. N„ Biochemistry, 12, 2096—2099 (1973).
174. Markley J. L., Biochemistry, 14, 3546—3554 and 3554—3561 (1975).
174a. Wiirthrich R., NMR in Biological Research: Peptides and Proteins, North-Holland,
Amsterdam, 1976.
I74b. Shindo H., Hayes M. B„ Cohen J. S., JBC, 251, 2644—2647 (1976).
175. Hayes M. B., Hagenmaier H., Cohen J. S., JBC, 250, 7461—7472 (1975).
176. Reid B. R., Robillard G. T., Nature (London), 257, 287—291 (1975).
177. Anet F. A. L„ Levy G. C., Science, 180, 141—148 (1973).
178. Oldfield E., Allerhand A., PNAS, 70, 3531—3535 (1973).
179. Oldfield E„ Worton R. S„ Allerhand A., JBC, 250, 6381—6402 (1975).
180. Oldfield E„ Allerhand A., JBC, 250, 6403—6407 (1975).
181. Becker E. D., Farrar T. C„ Science, 178, 361—368 (1972).
182. Moon R. B„ Richards J. H„ JBC, 248, 7276—7278 (1973).
183. Hotilt D. I., Busby S. J. W., Gadian D. G., Radda G. R„ Richards R. E., Seeley P. J.,
Nature (London), 252, 285—287 (1974).
1'84. Salhany J. M., Yamane T., Shulman R. G., Ogawa S., PNAS, 72, 4966—4970
(1975).
E85. Burt G. T„ Glonek T„ Barany M„ JBC, 251, 2584—2591 (1976).
Л86. GustD., Moon R. B„ Roberts J. D., PNAS, 72, 4696—4700 (1975).
Глава 3
Энергетика биохимических
реакций
Все мы знаем из собственного опыта, насколько важна для жизни
энергия. Известно, что нельзя жить без еды, что после тяжелой работы
мы испытываем не только усталость, но и чувство голода. Наше тело
вырабатывает тепло—-уже одно это наблюдение привело Лавуазье
примерно в 1780 г. к заключению, что дыхание представляет собой
медленное сгорание питательных веществ в организме. Позднее, после
открытия первого и второго законов термодинамики, было установлено
точное количественное соотношение между теплотой, энергией и рабо-
той. Современная биохимическая литература пестрит ссылками на тер-
модинамические величины — энергию Е, энтальпию Н, энтропию S и
свободную энергию Гиббса G.
Эта глава ставит перед собой три задачи: 1) привести и конспек-
тивно изложить смысл термодинамических уравнений; 2) дать табли-
цы значений термодинамических величин для различных биохимических
соединений и объяснить, как использовать эти данные применительно к
равновесным состояниям биохимических систем; 3) описать аденилат-
ную систему (включающую в себя аденозинтрифосфат, аденозиндифос-
фат, аденозинмонофосфат и неорганический фосфат) и указать на цент-
ральную роль этой системы в процессах энергообмена.
По термодинамике имеется множество книг, которые можно исполь-
зовать для более глубокого изучения этого предмета. Некоторые из них
указаны в библиографии [1—5].
А. Термодинамика
Термодинамика [1—5] занимается количественным описанием изме-
нений энергии и теплоты системы, связанных, в частности, с достижени-
ем химического равновесия. Зная изменение термодинамических вели-
чин, таких, как Н и S, можно предсказать, пойдет ли в данных усло-
виях реакция или нет, и описать состояние равновесия. Более того, ана-
лиз значений термодинамических величин иногда может раскрыть при-
роду сил, связывающих молекулы друг с другом.
Наиболее серьезное ограничение при использовании положений
классической термодинамики определяется тем, что эта наука всегда
имеет дело с равновесным состоянием и ничего не говорит о кинетике
процессов. Отсюда иногда делают вывод, что термодинамика не имеет
отношения к биохимии. Это, безусловно, не так; нам важно знать энер-
гетические соотношения для биохимических реакций. Вместе с тем
очень опасно впасть в другую крайность и считать, что термодинами-
ческие расчеты, выполненные для состояния равновесия, можно прямо
перенести на случай стационарного состояния, которое характерно для
живой клетки (гл. 1).
Энергетика биохимических реакций 201
1. Система и ее окружение
Применяя термодинамические уравнения, необходимо точно опре-
делить, какую систему мы рассматриваем. Такой системой может быть
раствор в колбе, помещенной в термостатированную баню. Колба, баня
и все остальное будут представлять собой внешнее окружение. Систему
плюс ее окружение в термодинамике иногда называют вселенной.
2. Первый закон термодинамики
Первый закон термодинамики—это закон о сохранении энергии и
об эквивалентности работы и теплоты. Работа и теплота представляют
собой разные формы энергии и переходят одна в другую. Система мо-
жет поглощать тепло из внешней среды или выделять его. В процессе
взаимодействия с окружением система может совершать работу. Пер-
вый закон постулирует, что существует функция Е (иногда ее обозна-
чают как [/), называемая внутренней энергией, которая определяется
только состоянием системы в данный момент и не зависит от ее преды-
стории. Согласно первому закону, Е может измениться только в про-
цессе передачи энергии в виде теплоты или при совершении работы.
Другими словами, этот закон утверждает, что энергию нельзя ни соз-
дать, ни уничтожить.
Таблица 3-1
Единицы энергии и работы и значения некоторых физических постоянных
Джоуль, единица энергии в системе СИ
1 Дж=1 кг-м2-с-1 =
= 1 H-м (ньютон-метр) =
= 1 Вт-с (ватт-секунда) =
= 1 К.Л-В (кулон-вольт)
Термохимическая калория
1 кал = 4,184 Дж
Большая калория
1 Кал=1 ккал = 4,184 кДж
Работа, которую необходимо совершить, чтобы поднять груз весом 1 кг на высоту
1 м (над уровнем моря) =9,807 Дж
Свободная энергия гидролиза 1 моля АТР при pH 7 и миллимолярных концеитра-
циях =—12,48 ккал = —52,2 кДж
Работа, которую необходимо совершить для повышения концентрации вещества
в 1000 раз (например, от 10-в до 10-3 М)=4,09 ккал =17,1 кДж
Число Авогадро — число частиц в одном моле вещества
N = 6,0220-1023
Число Фарадея If=96 485 Кл-моль-1
Кулой 1 Кл=1 А-с (ампер-секунда) =6,241 • 1018 (элементарных зарядов)
Постоянная Больцмана
6=1,3807-10-23 Дж-град-1
Газовая постоянная 7? = N-6
^ = 8,3144 Дж-град-1-моль-1 =
= 1,9872 кал-град-1-моль-1 =
= 0,08206 л-атм-град-1-моль-1;
при 25° RT = 2,479 кДж-моль-1
Единица измерения температуры, градус Кельвина, К; 0°С = 273,16 К
1g х = 2,3026 1п х
'202 Глава 3
Математически первый закон записывается так:
ДЕ=Е (продуктов)—Е (реагентов) = Q—W, (3-1)
где Q — теплота, полученная системой из внешней среды, a W — рабо-
та, совершенная системой над ее окружением. Энергия, теплота и ра-
бота измеряются в одних и тех же единицах. Для химиков более при-
вычными все еще остаются калории (кал) или килокалории (ккал);
в системе СИ единицей энергии является джоуль (табл. 3-1). Работа,
выполняемая системой, может быть механической (например, работа
по изменению внешнего объема), электрической (зарядка аккумулято-
ра) или химической (синтез полипептида из аминокислот).
3. Изменение энтальпии и термохимия
При изучении химических реакций мы чаше всего интересуемся из-
менением термодинамических функций; например, тепло, поглощенное
системой внутри калориметрической бомбы при постоянном объеме, Qv,
является прямой мерой изменения энергии Е
QV=EE. (3-2)
Чтобы измерить ДЕ при сгорании биохимического соединения, пуж-
шо поместить его в калориметрическую бомбу вместе с газообразным
кислородом и поджечь смесь с помощью электрической искры. В этом
случае бомба будет выделять в окружающую среду тепло: Qv и ДЕ
будут отрицательными. Калориметр позволяет измерить Qv и, следо-
вательно, ДЕ в ходе реакции.
4. Энтальпия и процессы, протекающие при постоянном давлении
Химические и биохимические реакции значительно чаще протекают
при постоянном давлении (обычно равном 1 атм), чем при постоянном
•объеме. Поэтому химикам удобнее использовать в качестве термодина-
мической функции не внутреннюю энергию Е, а энтальпию Н
H=E+PV. (3-3)
Из уравнения (3-3) следует, что при постоянном давлении АНР=^ЕР +
-r-P&V. В этом случае PW равно работе по изменению объема окру-
жения, а теплота, поглощаемая при постоянном давлении, QP, равна
ЛНР:
Ср=ДЕр-|-РДУ=ДЯр. (3-4)
Термин «энтальпия» введен для того, чтобы отличать Н от Е, но хи-
мики часто не слишком заботятся о терминах, и многое из того, что
в литературе говорится об энергии, фактически относится к энтальпии.
Разница часто оказывается незначительной: если работа по изменению
объема пренебрежимо мала, Е равно Н.
5. Энтальпия сгорания и калорийность «физиологического топлива»
Изменение энтальпии можно определить прямым измерением коли-
чества теплоты, поглощенной системой при постоянном давлении. По-
этому изменения в энтальпии, сопровождающие окисление питательных
веществ, уже с давних времен привлекали внимание как химиков, так
и физиологов. Теплота сгорания (—Д//с) обычно определяется по ДЕС,
Энергетика биохимических реакций 203
измеряемому калориметрически. Поскольку /\EV и ДЕР почти одинако-
вы, то &Нр=ДЕу + Р&V, где AV— изменение объема, которое имело
бы место, если бы реакция шла при постоянном давлении—эту вели-
чину легко рассчитать. Так как интерес представляет ДИ процесса, при
котором продуктами сгорания являются углекислый газ, вода, элемен-
тарный азот (N2) и сера, нужно вводить поправку на образование оки-
сей двух последних элементов. В итоге можно получить с очень хоро-
шей точностью значения ДНС как для биохимических соединений, так
и для многокомпонентных пищевых продуктов. В последние годы опре-
деление с помощью микрокалориметра довольно малых значений ЕН
для различных химических или биохимических реакций стало рутин-
ной процедурой [6, 7].
При обсуждении вопросов, связанных с питанием, величину — ДНС
иногда называют полной энергией. Соответствующие значения обычно
выражают в килокалориях; в биохимической литературе килокалории
обозначают сокращенно ккал, а в литературе по вопросам питания —
Кал.
Калорийностью пищевых продуктов называют скорректированную
величину энтальпии сгорания (ДНС), взятую с обратным знаком. По-
скольку энтальпия сгорания пищи всегда отрицательна, калорийность
выражается положительным числом. Калорийность некоторых веществ
дана в приводимой ниже таблице.
Калорийность 1 г вещества
Углеводы
‘Чистая глюкоза
Липиды
Белки3
4,1 ккал
3,75 ккал
9,3 ккал
4,1 ккал
17 кДж
15,7 кДж
39 кДж
17 кДж
а Азот переходит в состав мочевины.
Для белков расчет ведется исходя из того, что азот переходит не
в КС, а в мочевину (основное азотистое соединение, выделяемое млеко-
питающими) .
Можно ли-—с чисто термохимической точки зрения—-рассматривать
•организм человека или животного как катализатор процессов сгорания
пищевых продуктов? Чтобы ответить на этот вопрос, были построены
большие калориметры, в которые можно поместить человека или жи-
вотное. Если человек, находясь в калориметре, не теряет и не прибав-
ляет в весе, то выделяемое им тепло как раз и должно быть равно
~ДН сгорания пищевых продуктов, превращающихся в ССб, воду и
мочевину. Тот факт, что это положение подтвердилось эксперименталь-
но, у нас удивления не вызывает, однако в начале нынешнего столетия,
когда такие эксперименты ставились впервые, многие ученые сомнева-
лись в применимости первого закона термодинамики к живым орга-
низмам.
На практике калориметрические измерения на животных сопряже-
ны с множеством трудностей, связанных с невозможностью точно изме-
рить количество выделившегося тепла, с неопределенностью в количе-
•стве запасенных питательных веществ, а также с необходимостью вве-
дения поправок в АЯС в связи с образованием продуктов обмена, под-
204 Глава 3
лежащих выделению. Тем не менее такие измерения энергообмена име-
ют важное значение для организации питания и для медицины. Разра-
ботаны косвенные калориметрические методы, позволяющие измерять,
уровень основного обмена у человека. Эти вопросы хорошо изложены
в книге Уайта и др. [8]|.
Основным обменом называют скорость выделения организмом теп-
ла в покоящемся состоянии по прошествии значительного времени?
после приема пищи. В этих условиях организм человека получает
энергию за счет запасенных ранее питательных веществ, причем ско-
рость их потребления оказывается приблизительно постоянной. Основ-
ной обмен, как правило, пропорционален площади поверхности тела',
для девушек эта величина составляет в среднем ~154 кДж-ч-1-м 2,
для юношей ~172 кДж-ч-1-м-2. Для человека весом 70 кг это соот-
ветствует ~320—360 кДж-ч-1. Заметим, что 360 кДж-ч-1 эквивалент-
ны мощности 100-ваттной лампочки. Хотя обмен у разных людей зна-
чительно варьирует, слишком сильные отклонения в ту или иную сто-
рону свидетельствуют о каких-то нарушениях, связанных, например»,
с недостатком или избытком гормона щитовидной железы тироксина.
Скорость метаболизма немного падает во время сна и сильно повыша-
ется при совершении тяжелой физической работы. Иногда у человека
интенсивность обмена возрастает до 2500 кДж-ч-1 (600 ккал-ч-1). При:
интенсивности 320 кДж-ч-1 (76 ккал-ч-1) человек каждые 24 ч дол-
жен получать 7680 кДж (1835 ккал) энергии для поддержания основ-
ного обмена и еще какое-то дополнительное количество энергии для
совершения мышечной работы. Обычная конторская или нетяжелая до-
машняя работа повышает интенсивность обмена примерно вдвое.
6. Энтропия и теплопередача
Почему тепло всегда переходит от теплого тела к холодному и ни-
когда не наблюдается обратного процесса? Мы знаем, что направление-
потока тепла контролируется разностью температур, но тогда возника-
ет другой вопрос: что такое температура? Размышления по этому пово-
ду, а также по поводу взаимных превращений работы и теплоты при-
вели к открытию второго закона термодинамики и к введению новой:
термодинамической функции — энтропии S.
Рассмотрим фазовый переход при постоянных температуре и давле-
нии, например плавление льда. При температуре чуть выше 0 °C лед.
плавится полностью, а при температуре чуть ниже 0°С он вообще не-
плавится. При 0 °C наблюдается равновесие: на языке термодинамики
плавление льда при 0 °C представляет собой обратимый процесс. Исхо-
дя из каких критериев можно было бы предсказать такое поведение
воды? Для многих знакомых нам процессов, например для горения, ха-
рактерно то, что самопроизвольное протекание реакции сопровождает-
ся выделением большого количества тепла, т. е. АД в этом случае от-
рицательно. Однако при плавлении льда тепло поглощается. При 0 °C.
\Н процесса составляет 6,008 кДж-моль-1; почти то же значение полу-
чается и чуть ниже 0 °C, когда лед вообще не плавится, и чуть выше
0 °C, когда лед плавится полностью. В последнем случае плавление
льда представляет собой самопроизвольный процесс, для которого ДЯ
положительно. Принимая во внимание эти факты, можно ясно видеть,,
что знак изменения энтальпии сам по себе не мол(ет служить критери-
ем самопроизвольности реакции.
Понять природу перехода лед — вода удалось лишь после осозна-
ния того факта, что при плавлении льда помимо увеличения Н Hai
Энергетика биохимических реакций 205
<5,008 кДж • моль 1 (в результате чего увеличивается внутренняя энер-
гия молекул — поступательная, колебательная и вращательная) проис-
ходит уменьшение упорядоченности системы. Хотя исторически энтропия
была введена из других соображений, сейчас ее понимают как меру
«микроскопического беспорядка». Когда лед плавится, энтропия S воз-
растает, поскольку структура становится менее упорядоченной.
7. Второй закон термодинамики
Второй закон термодинамики формулируется по-разному, но в обыч-
ной математической формулировке он гласит, что во «вселенной» (илн
в замкнутой системе)
AS (системы ф-ее окружения) = 0 для обратимых процессов,
AS > 0 для реальных (необратимых) процессов.
Иногда второй закон формулируют иначе: энтропия вселенной всегда
возрастает.
Второй закон определяет одновременно S и термодинамическую
шкалу температур:
dS обратим — 7/^, (3*5)
где q — бесконечно малое количество поглощенного тепла. Для обра-
тимого фазового перехода, каким является плавление льда при посто-
янных давлении и температуре, изменение энтропии Н2О равно в точ-
ности &HIT [уравнение (3-6)]. Энтропия измеряется в джоулях на 1 К
или в калориях на 1 К-
^SP^06pa^=Q/T=\H/T. (3 6)
В последнем случае часто пользуются сокращением э. ед. (энтропийные
единицы). Поскольку плавление льда является обратимым процессом,
второй закон утверждает, что энтропия окружения уменьшается на ту
же величину, на которую возрастает энтропия воды. Заметим, что для
воды при 0 °C Г AS численно равно теплоте плавления,
6,008 кДж-моль-1. Таким образом, повышение энтропии льда в ходе
его плавления при 0 °C равно 6,008-103 Дж/273,16 К = 22,0 Дж-град-1.
Определение термодинамической температуры [уравнение (3-7); бо-
лее подробно см. об этом в учебниках по термодинамике]' тоже сле-
дует из уравнения (3-5):
Т (K) = (dE/dS')v=(dH/dS)P. (3-7)
Энтропию можно точно описать математически через степень раз-
упорядоченности системы
5=61пЙ. (3-8)
Здесь k — постоянная Больцмана (табл. 3-1), а й— число микроскопи-
ческих состояний (различных расположений частиц) системы, соответ-
ствующее данному макроскопическому состоянию, т. е. состоянию с
данной температурой, давлением и данным числом молекул. Й возра-
стает с увеличением объема или повышением температуры, а также при
переходе вещества из твердого в жидкое и далее в газообразное со-
стояние. Уравнение (3-8) не является уравнением классической термо-
динамики, которая имеет дело только с макроскопическими системами,
т. е. с большими совокупностями молекул. Однако, используя методы
206 Глава 3
статистической термодинамики [9]', с его помощью можно довольно-
точно определить энтропию газов.
Примером из области биохимии, который можно непосредственно
связать с уравнением (3-8), служит рацемизация аминокислот. Раствор
L-аминокислоты можно легко превратить в рацемическую смесь, когда
50% аминокислоты находится в D-форме и 50%—-в L-форме, с по-
мощью особого фермента рацемазы, причем этот процесс не будет со-
провождаться ни поглощением, ни выделением тепла. Таким образом,.
Д77 = 0 и единственным изменяющимся параметром системы является
энтропия. Обозначим Q чистого изомера через Q'. Принимая во вни-
мание, что каждая из N молекул 1 моля рацемата может находиться
в одной из двух конфигураций, для рацемической смеси можем запи-
сать
Й=2ЛГИ'. (3-9>
Исходя из уравнения (3-8), получаем
AS =k (In 2W + In Q') —k In Q' =Nk In 2 = 7? In 2 =
= 5,76 Дж-моль-1,
(3-10>
8. Определение энтропии через теплоемкость
Из уравнения (3-8) следует, что для идеального кристалла, в кото-
ром молекулярный беспорядок отсутствует, при Т--0 S = 0. Третий за-
кон термодинамики утверждает, что для идеальных кристаллов по ме-
ре приближения термодинамической температуры Т и ОК энтропия
S стремится к нулю. Отсюда следует, что при любой температуре выше
Таблица 3-2
Энтропия ряда веществ3
Вещество Состояние Энтропия
Э. ед. кДж К—1 ’МОЛЬ—1
С (алмаз) Твердое 0,55 2,3
С (графит) » 1,36 5,7
Си 8,0 33
Na » 12,2 К1
Н2О (лед) » 9,8 41
Н2О Жидкое 16,7 70
Н2О Газообразное (1 атм) 45,1 189
Не То же 30,1 126
н2 » 31,2 131
N2 » 45,8 192
со2 » 51,1 214
Бензол » 64,3 269
Циклогексан » 71,3 298
3 Все величины выражены в энтропийных единицах И в кДж-К-1-моль-1 для 25 °C (298,16 К). (э. ед.), т. е. в кал-К-1-моль-1,
Энергетика биохимических реакций 207'
0 К энтропия задается следующим уравнением:
т
S = ^Cpd\nT. (3-11).
6
В этом уравнении Ср — это теплоемкость при постоянном давлении:
СР=(дН/дТ)р. (3-12)
Измерив Ср при низких температурах, приближающихся к 0 К, с по-
мощью уравнения (3-11) можно оценить абсолютное значение энтро-
пии S. Если по мере повышения температуры наблюдается фазовый пе-
реход, то к величине, задаваемой уравнением (3-11), надо прибавить
AS, определяемое из уравнения (3-6), Для некоторых соединений (на-
пример, для воды; гл. 4, разд. Б.4) молекулярный беспорядок сохра-
няется даже в кристаллическом состоянии при 0 К. В этом случае в
уравнение (3-11) надо ввести член, соответствующий энтропии при 0 К.
Энтропия ряда веществ приведена в табл. 3-2. Обратите внимание,
как возрастает эта величина с усложнением структуры, с переходом из
твердого состояния в жидкое и далее в газообразное и с уменьшением
твердости материалов,
9. Критерий самопроизвольности процесса
Как мы видели, одни самопроизвольные процессы, например горение
органических соединений, сопровождаются выделением тепла (АД от-
рицательно), а другие идут с поглощением тепла из окружающей сре-
ды (АД положительно). Примером процессов второго типа служит
плавление льда при температуре чуть выше 0 °C. В этом случае в про-
цессе плавления происходит большое изменение энтропии воды, а в.
равновесии при 0 °C численное значение TAS оказывается в точности,
равным —АД [уравнение (3-6)].
Тот факт, что в равновесии АД—TAS = 0, навел Дж. Гиббса на-
мысль, что можно ввести термодинамическую функцию, позволяющую
получить критерий самопроизвольного процесса, — теперь эта функция
известна как свободная энергия Гиббса
G=H— TS. (3-13)
Для процессов, протекающих при постоянных температуре и давлении,,
изменение G есть
АОГР=ДД—TAS. (3-14)
Более того, для обратимых (равновесных) процессов, в ходе которых со-
вершается только работа по изменению объема,
^GTMliK=AH-TAS=0. (3-15)
Можно легко показать, что для любого самопроизвольного (необра-
тимого) процесса AG отрицательно. Такие процессы называются экзер-
гоническими. Если же AG положительно, то реакция сама не пойдет;
такие реакции называются эндергоническими. Понижение свободной
энергии (—AG) —это мера максимального количества работы, которую
можно совершить с помощью данной реакции, если, конечно, реакция
как-то сопряжена с системой, способной в ходе обратимого процесса
совершать работу. Эта работа может быть электрической, мышечной
или осмотической, совершаемой за счет реакций, протекающих в био-
логических системах. В любой реальной системе совершаемая работа
208 Глава b
неизбежно меньше —AG, поскольку реальные процессы необратимы,
т. е. сопровождаются возрастанием энтропии.
Возвращаясь к высказанному ранее предположению о том, что АН
может служить мерой совершаемой работы, заметим, что TAS для
большинства реакций составляет лишь несколько килокалорий. Следо-
вательно, если А// велико (например, при сгорании питательных ве-
ществ), то оно не слишком сильно отличается от AG для того же про-
цесса. Этим оправдывается использование калорийности пищи как при-
близительной меры работы, совершаемой в результате усвоения пищи
организмом.
10. Стандартные состояния
Чтобы термодинамические данные можно было использовать при
химических расчетах, необходимо какие-то состояния элементов или со-
единений принять за стандартные. Например, если мы говорим об из-
менении свободной энергии при превращении одного или нескольких
чистых соединений в другие, необходимо указать, к какому состоянию
относятся, эти данные (кристаллическому, жидкому, газообразному
или состоянию в растворе) и при каком давлении они получены (осо-
бенно если в реакциях участвуют газообразные вещества). Стандарт-
ное давление — это обычно давление в 1 атм. Стандартным состояниям
элементов отвечают чистые кристаллические, твердые или газообразные
вещества, например С (графит), S (кристаллическая ромбическая),
Р (кристаллический белый), Ыг, Ог и Н2 (газообразные). Необходимо
также указать температуру. Приводимые значения термодинамических
величин чаще всего соответствуют 25°C.
Обычно для химических реакций гораздо важнее знать не сами
величины G или Н, а их изменение-—AG и АН. При составлении таб-
лиц значений свободной энергии принято считать, что для всех элемен-
тов в стандартном состоянии G равно нулю. Тогда можно получить
значения AG образования любого вещества путем соединения элемен-
тов в нужном соотношении (например, измерив АН при сгорании ве-
щества и определив энтропию из измерений теплоемкости). Получае-
мую таким образом стандартную свободную энергию образования обо-
значают через AG°i.
11. Суммирование изменений свободной энергии
Важной особенностью термодинамических расчетов является то,
что AG для совокупности нескольких химических реакций попросту
равно сумме значений AG для отдельных реакций [см. уравнения
(3-16) — (3-19)]. То же относится к АН и AS.
СН3СООН(ж) ------------------------->- 2С + 2Н2 + О2 (3-16)
—AG’ для уксусной кислоты = -f-396,4 кДж-моль-1
2О2+2С ---------------->- 2СО2 (3-17)
2AG^ для СО2 = —788,8 кДж-моль-1
О2+2Н2 --->- 2Н2О (3-18)
2AGj для Н2О =—474,4 кДж-моль-1
СН3СООН (ж) + 2О2 ---> 2СО2 + 2Н2О (ж) (3-19)
AG0 сгорания уксусной кислоты =—866,8 кДж-моль-1
Энергетика биохимических реакций 209
В этом примере уравнение (3-16) разложения уксусной кислоты на
элементы суммируется с уравнениями (3-17) и (3-18), описывающими
образование нужного числа молекул СО2 и Н2О. Суммирование этих
трех уравнений дает уравнение сгорания уксусной кислоты с образова-
нием СО2 и воды, а сумма значений ДО для каждого из трех уравне-
ний дает AG сгорания уксусной кислоты. Заметим, что полученное в ре-
зультате значение AG соответствует сгоранию чистой жидкой уксусной
кислоты в кислороде при давлении в 1 атм, а в качестве продуктов
образуются СО2 при давлении в 1 атм и чистая жидкая вода — и ре-
агенты, и продукты находятся в стандартном состоянии.
Описанную выше процедуру можно представить уравнением
(3-20) — общим уравнением, позволяющим рассчитать AG° любой реак-
ции, зная AG продуктов и реагентов:
AG0 = 2 (продуктов) — AG? (реагентов). (3-20)
Как меняется приращение свободной энергии при переходе соеди-
нения от стандартного к какому-либо другому состоянию? Рассмотрим
случай, когда меняется давление газа. Легко показать (см. любой учеб-
ник термодинамики), что
(dG/dP)r=V. (3-21)
Используя уравнение (3-21) совместно с уравнением состояния идеаль-
ного газа, получим соотношение между свободной энергией G 1 моля
вещества1 при давлении Р и стандартной свободной энергией G0 при
давлении Р°:
G—G°=RT In -ir=RT In P. (3-22)
Поскольку P° по определению равно 1 атм, изменение свободной энер-
гии 1 моля вещества при изменении давления от Р° до Р просто равно
RTkiP. Обычно в термодинамике вывод наиболее важных термодина-
мических уравнений иллюстрируется на примере идеальных газов, од-
нако применительно к биохимическим системам более близким приме-
ром являются растворы.
12. Реакции в растворе
Биохимиков обычно интересуют свойства соединений в достаточно
разбавленных водных растворах (например, в цитоплазме), хотя в от-
дельных случаях приходится иметь дело и с неводными растворами.
В каждом из этих случаев необходимо определить, что такое стандарт-
ное состояние растворенного вещества. За стандартное состояние ве-
щества в водном растворе обычно принимается его состояние в гипо-
тетическом моляльном растворе (1 моль растворенного вещества на
1 кг воды), свойства которого идентичны свойствам растворенного ве-
щества при бесконечном разбавлении. В этом случае можно написать
уравнение, аналогичное уравнению (3-22), которое выражает свобод-
ную энергию 1 моля растворенного вещества, Gj, через свободную энер-
1 Черточка над символами G или AG всегда указывает, что свободная энергия или
ее изменение относятся к 1 молю вещества.
210 Глава 3
гию G°i в гипотетическом стандартном состоянии с единичной активно-
стью и через активность растворенного вещества1:
Gt^Gt+RTlncii. (3-23)
В уравнение (3-23) и в уравнения, которые из него следуют, входят
моляльные активности. Однако для очень разбавленных растворов,
когда свойства растворенных молекул очень близки к свойствам их в
гипотетическом идеальном растворе (стандартное состояние), вместо
активностей можно использовать концентрации. Для любого реального
раствора активность равна произведению коэффициента активности на
концентрацию
а=ус, (2*24)
где а — активность, у — коэффициент активности, а с — моляльная кон-
центрация. Таким образом, чтобы с помощью таблиц термодинамиче-
ских функций для веществ в растворе предсказать поведение этих ве-
ществ в не слишком разбавленных растворах, нужно умножить кон-
центрацию каждого компонента на соответствующий коэффициент ак-
тивности. Для очень грубых расчетов, которые часто вполне устраива-
ют биохимиков, принято приравнивать активности концентрациям. Кро-
ме того, для разбавленных растворов более привычные молярные кон-
центрации (количество вещества в молях на 1 л раствора) почти рав-
ны моляльным2.
Из уравнения (3-23) следует, что изменение свободной энергии при
разбавлении раствора от состояния с активностью щ до состояния с
активностью а2 есть
AG=/?7’ln(a2/a1). (3-25)
13. AG° и константа равновесия
Рассмотрим следующее обобщенное химическое уравнение, описы-
вающее реакцию, в ходе которой а молей вещества А реагируют с b мо-
лями вещества В, давая продукты С, D и т. д.:
аА + ЫВН----=cC-|-dD-1-----. (3-26)
Изменение стандартной свободной энергии для этого процесса равно
AG°=cG° (С) + dG° (D) -|---aG° (А) — bG° (В) • • -. (3-27)
G°(A) обозначает здесь свободную энергию вещества А и т. д. Значе-
ние AG для любых заданных концентраций реагентов и продуктов мож-
но получить из AG°, используя уравнение (3-23) применительно к каж-
дому из компонентов. В результате мы получим
nd
С1{-> Qn, s •
AG=AG° + 7?7’ln-^— (3-28)
Здесь Нс — активность компонента С и т. д. Это полезное соотношение
позволяет рассчитывать AG при низких концентрациях веществ, что
обычно имеет место в биохимических системах (чаще всего эти концент-
рации близки к миллимолярным и существенно ниже концентрации ги-
1 Индекс i относится здесь к одному из компонентов раствора, в котором наряду
с растворителем могут присутствовать я другие вещества. Если быть точным, G; —
это парциальная молярная свободная энергия, т. е. изменение полной свободной энер-
гии очень большого объема раствора при добавлении в раствор 1 моля данного ком-
понента.
2 Те же уравнения можно относить и к мольным долям.
Энергетика биохимических реакций 211
потетического стандартного раствора, равной 1 М). В уравнение (3-28)
обычно прямо подставляют концентрации
AG^AG° + 7?71n [ClC[g]i. • (3-29)
[А]« [B]ft '
Уравнение (3-28) ценно и в другом отношении. Если система нахо-
дится в равновесии, то AG = 0, а отношение acctZp.../«^... есть попросту
константа равновесия Л’. Отсюда следует, что
AG° —— RT\nK^ — 2,303RT lgK=—19,1457 ^КДж-моль’^
=—5,7081g К кДж-моль-1 при 25°C =
=—1,364 IgK ккал-моль-1 при 25 °C. (3-30)
Заметим, Что хотя AG0 измеряется ё кДж-моль-1, изменение свобод-
ной энергии, определяемое уравнением (3-30), относится к реакции, в
которой участвуют а молей вещества А, b молей вещества В и т. д.
14. Коэффициенты активности и кажущаяся
константа равновесия
Строго говоря, уравнение (3-30) применимо только к термодинами-
ческим константам равновесия, т. е. к константам, рассчитываемым с
использованием активностей, а не концентраций. Для эксперименталь-
ного определения таких констант необходимо измерить кажущиеся кон-
станты равновесия К7 для ряда концентраций и далее экстраполировать
полученную зависимость к бесконечно малым концентрациям.
ь-z / х [С]е [D]d /о nix
л (кажущаяся константа равновесия) = ‘д в равновесии. (3-31)
Обычно провести экстраполяцию R' к бесконечно малым концентраци-
ям не составляет труда, поскольку коэффициенты активности для мно-
гих ионных соединений связаны простым соотношением с ионной силой
и в очень разбавленных растворах (при ионной силе <0,01) подчиня-
ются уравнению Дебая—Хюккеля:
1g у=—0,5092^(3-32)
Целые числа Zi и Z2 означают число зарядов (валентностей) катиона
и аниона, образующих молекулу соли. Ионная сила ц равна
(3’33)
i
Здесь С; —молярная концентрация соответствующего иона; суммиро-
вание ведется по всем ионам. Коэффициент активности [уравнение
(3-32)] является средним коэффициентом активности катиона и
аниона.
Как видно из уравнения (3-32), для экстраполяции К.' к бесконечно
малым концентрациям удобно использовать график зависимости 1g К'
от У(1. Такой график [10] представлен на рис. 3-1. Здесь приведено из-
менение рКа для диссоциации Н2РО4, AMP-, ADP2- и АТР3-. Для низ-
ких концентраций зависимость p/G от Ур находится с помощью урав-
нения Дебая—Хюккеля [уравнение (3-32)]:
рК;=рКа-0,509 (Za —Zha) (3-34)
212 Глава 3
Графически эта зависимость изображается прямой с наклоном, рав-
ным —0,509 (Z а—Zha).
Наблюдаемый (отрицательный) наклон кривых (рис. 3-1) равен
— 1,5 для Н2РО; и АМР- — 2,5 для ADP2- и —3,5 для АТР3- Для
всего интервала изменения ионной силы такие кривые описываются эм-
пирическими соотношениями типа
рА’а=Р-^а—af/p-j-bp (для ц<0,2),
(3-35)
где а и b подбираются эмпирически. Например, для Н2РО4 а=1,52,
1,96. Значение рДа получается равным 7,18, что на 0,22 больше, чем
ПрИ ц = о,2, т. е. при ионной силе, чаще всего используемой в лабора-
торной практике, и близко к соответствующему значению в тканях. За-
метим, что для АТР3~ разница
\fil~ 102
РИС. 3-1. График зависимости от Уц ка-
жущихся значений рК вторичной иониза-
ции АМР (/), ADP (II), Н3РО4 (III) и
ATP (/V). Данные получены при темпера-
туре 25 °C. (Phillips et al.. Biochemistry, 2,
503, 1963.)
между значением p/G = 7,68, по-
лученным путем экстраполяции,
и значением —7,04 при ц = 0,2
оказывается еще больше. Исполь-
зование в расчетах экстраполи-
рованных значений К примени-
тельно к растворам с высокой
ионной силой может привести к
серьезным ошибкам. При этом,
чем больше заряд иона (АТР3-,
АТР4-), тем больше ошибка.
Еще одна трудность опреде-
ления константы равновесия ре-
акций, в ходе которых потребля-
ются или высвобождаются ионы
водорода, связана с отсутствием
точного соотношения между pH
и йц+ или [Н+]. Действительно,
с точки зрения термодинамики
понятие активности одного иона
практически лишено смысла.
Тем не менее в интервале зна-
чений pH, представляющих ин-
терес для биохимиков, в предпо-
ложении, что рН-мегр измеряет
активность ионов водорода, по-
лучаются результаты, очень близкие к тем, которые дают более стро-
гие методы. В биохимической практике почти повсеместно считается,
что показания pH-метра, полученные с помощью стеклянного электро-
да, дают значения— и вместо получаемой отсюда величины
«н4 всегда подставляют [Н+], определяя тем самым кажущиеся кон-
станты равновесия.
Часто данные, полученные для состояния равновесия, не могут быть
экстраполированы к ц = 0, и тогда используются значения К', опреде-
ляющие кажущееся изменение свободной энергии AG7.
15. Изменение равновесия с температурой
При постоянном давлении AG изменяется с изменением температу-
ры согласно следующему уравнению:
rf(AG/T) =^Н/Т2 (3-36)
Энергетика биохимических реакций 213
Соответствующие изменения К описываются уравнением Вант-Гоффа
d In К _ ЛЯ»
dT ~ RT2 ’
или
—• (3-37>
Я(1/П R
«ли
ДЯо(кДж) = -О,1914-^-.
Если в интервале температур, соответствующем условиям эксперимен-
та, ДЯ° можно считать постоянным, то график зависимости 1п/( от
l/r позволяет определить А№ (или кН', если график построен для
In К'): наклон прямой равен —AH°/R. Поскольку, зная К, можно рас-
считать AG0, с помощью уравнения (3-14) можно определить далее
AS0. Однако этот метод дает низкую точность, и поэтому лучше прямо
измерять ДЯ калориметрически. Кроме того, предположение о постоян-
стве ДЯ° в значительном интервале температур, в особенности для бел-
ков, может оказаться неверным.
Б. Таблицы значений ДО0 для биохимических соединений
1. Свободная энергия образования
В табл. 3-3 в первой колонке приведены значения ДО? —стандарт-
ной свободной энергии образования из элементов целого ряда чистых
твердых, жидких и газообразных веществ, а также аналогичные зна-i
чения для соединений в растворе при гипотетической моляльной актив-
ности. Остановимся несколько подробнее на последнем случае.
Значение AGf° для чистой уксусной кислоты, находящейся в жид-
ком состоянии, равно —389,1 кДж-моль-1. Уравнение реакции образо-
вания этого соединения из элементов имеет вид
2С (тв)-|-2Н2 (г, 1 атм)-[- О2(г, 1 атм) ->- С2Н4О2(ж),
AG?=—389,1 кДж-моль"1. (3-38)
Чтобы получить свободную энергию образования в водном растворе,
мы должны знать растворимость и коэффициент активности уксусной
кислоты при разных концентрациях. Из этих данных нужно рассчитать
изменение свободной энергии в процессе растворения жидкой уксусной
кислоты в воде, так чтобы получился гипотетический модялялцный вод-,
ный раствор уксусной кислоры в стандартном состоянии:
Уксусная кислота (ж) -► Уксусная кислота (води),
AG= — 7,3 кДж-моль-1. (3-39)
Из уравнений (3-38) и (3-39) получаем
2С-Г 2Н2+О2 --->- Уксусная кислота (водн),
ДС“=—396,4 кДж-моль-1. (3-40)
Во многих расчетах удобно иметь значения AG для ионов одного
сорта, например для ацетата-. Значение AG? ацетата- (водн) можно
Таблица 3-3
Свободные энергии образования я окисления при 25°C ряда соединений3'6
Соединение Формула AG®, кДж-моль-1 AG^, кДж-моль—1 с Окисление с участием NAD+ | Число электронов |
AG° , ox кДж-моль—1 1 AGox(PH7), кДж-моль—1
Ацетальдегид С2Н4О — 139,7 — 1123,5 171 ,5 -28,3 10
Уксусная кислота С2Н4О2 —396,4 —866,8 169,2 9,3 8
Ацетат- —369,2 —894,0 142,0 22,1 8
Ацетил-СоА —374,1* —889,1* 146,9* — 13,0* 8,
Ацетилфосфат — 1218,4 —901 ,7 134,3 —25,6 8
Ацетилен8 с2н2 209,2 — 1235,2 59,8 — 140,0 10
Ацетоацетат- С4Н5О;Г —493,7 — 1795,4 . 276,5 -3,2 16
Ацетон С3н6о —161,2 — 1733,6 338,4 18,7 16
цис-Аконитат3- С6Н3О1- —920,9 —2157,0 173,9 -65,8 18
L-аланин C3H7O2N —371 ,3 —1642,0 300,4 0,8 15
L-аспарагин C4HsO3N2 —526,6 —1999,7 331 ,2 —28,4 18
L-аспартат- c4h6o4n- —700,7 — 1707,0 235,4 —24,3 15
н-Бутанол С4Н10О -171,8 —2591 ,7 516,2 36,7 24
н-Масляная кислота C4HSO2 —380,2 —2146,1 443,8 44,2 20
н-Бутират- с4н7о2 —352,6 —2173,7 416,2 56,6 20
Бутирил-СоА —357,5* —2168,8* 421,1* 21,5* 20
|3-Оксимасляная кислота C4HSO3 —531,4 — 1994,9 336,0 —23,6 18
Р-Оксибутират- С4Н-О7 —506,3 —2020,0 310,9 —8,8 18
L-валин C8HnO2N —360,0 —2916,5 579,9 40,5 27
a-D-галактоза СбН12О$ —923,5 —2865,9 242,0 —237,5 24
a-D-глюкоза C6H12O6 —917,2 —2872,2 235,6 —243,8 24
Гипоксантин С5н6о 89,5 —2773,0 334,8 — 144,6 24
Гликоген СвН10О5 —665,3 —2887,0 220,9 —258,6 24
Гликолат- С^НдОз —522,4 —739,7 37,2 —42,7 6
Глиоксилат- С2НО3” —461,1 —564,9 —46,9 —86,9 4
Глицерии С3Н8О3 —488,5 —1643,4 169,5 —110,2 14
Глицерофосфат —1336,2 — 1652,6 160,3 —119,4 14
3-фосфоглицер ат-г — 1515,7 — 1235,9 59,0 — 100,8 10
2-фосфоглицерат-г —1509,9 —1241,8 53,2 — 106,6 10
Глицеральдегид-3-фосфатг —1285,6 —1466,0 87,9 —151,8 12
Глицин c2h6o2n —373,5 — 1008,3 157,2 —22,6 9
L-глутамат- c5h8o4n- —696,8 —2342,5 376,9 —2,7 21
L-глутамин c5h10o3n2 —524,8 —2633,1 474,8 -4,7 24
Диоксиацетонфосфатг — 1293,2 — 1458,4 95,5 —144,2 12
Капроат- СвНцРг —329,7 —3459,7 684,1 84,7 32
а-Кетоглутарат2- C5H40i- -798,0 — 1885,5 186,4 —53,3 16
Креатин c4h9o2n3 —264,3 —2380,6 338,8 —80,8 21
Креатинин c4h,on3 —28,9 —2378,8 340,6 —79,0 21
Кротонат- c4h5o; —275,7 —2013,4 317,5 —2,1 18
Продолжение
Создинекие Формула X ч о S Й ‘З «3 AG^, кДж-моль—1 Окисление с участием NAD+ Число электронов
1 ’’ ч о - S о о Ж <2 cj <3 X AG' (pH 7), ох кДж-моль—1
Ксантин' -139,3 —2425,6 293,8 —125,7 21
D-ксилулоза С5н10о5 —748,1 —2409,8 180,1 —219,5 20
Лактат- С3НбО3" —516,6 —1378,1 175,9 —23,9 12
а-Лактоза ^12^22^11 —1515,2 —5826,5 389,3 —569,7 48
L-лейцин c6h13o2n —356,3 —3551,7 721 ,6 62,3 33
Малат2- слог —845,1 —1444,0 109,9 —49,9 12
Маннит СвНнО6 —942,6 —3084,0 282,8 —236,6 26
Метан (г) сн4 —50,8 —818,0 218,0 58,2 8
Метанол сн,о — 175,2 -693,5 83,4 —36,4 6
Мочевая кислота csh4o3n4 —356,9 —2089,4 241,5 —118,1 18
Мочевина ch4on2 —203,8 —664,9 112,0 —7,8 6
Оксалат2- C2Of- -674,9 —351,1 —92,1 —52,1 2
Оксалоацетат2- слог -797,2 —1254,7 40,2 —79,7 10
Пируват- C3H3O3 —474,5 —1183,1 111,9 —47,9 10
Оксипируват с3нл —615,9 -1041,6 -5,7 —165,5 8
н-Пропанол с3н8о —175,8 —1956,1 374,8 15,2 18
Изопропаиол С3Н8О —185,9 — 1946,0 384,9 ’ 25,3 18
Пропионат- слог —360,0 —1534,7 278,2 38,5 14
Рибозо5-фосфатг —1599,9 —2414,9 175,0 —224,6 20
Рибулозо-5-фосфатг —1597,6 —2417,1 172,8 —226,8 20
Седогептулозо-7-фосфатг —1913,3 —3364,6 " 261,2 —298,2 28
Седогептулозодифосфатг —2755,8 —3379,0 246,9 —312,5 28
Сахароза ^12^22^11 —1551,8 —5789,9 425,9 —533,1 48
Сорбит С6Н14О6 —942,7 —3083,9 282,9 —236,5 26
Сукцинат2- слог -690,2 —1598,9 214,1 14,3 14
Сукцинил-СоА —686,7* —1602,4* 210,6* —69,2* 14
L-тирозии С8НцО3Ц —387,2 —4466,8 842,5 23,4 41
L-треонин C4H9O3N —514,6 —2130,3 330,1 —49,5 19
Формальдегид сн2о —130,5 — 501,0 16,9 —63,0 4
Муравьиная кислота СН2О2 —356,1 —275,5 —16,5 —56,5 2
Формиат- СНОГ —350,6 —281,0 —22,0 —22,0 2
Фосфоенолпируват- —1269,5 —1245,0 50,0 —109,8 10
Фруктоза СвН12Об —915,4 —2874,1 233,8 —245,7 24
Фруктозо-6-фосфатг —1758,3 —2888,1 219,8 —259,7 24
Фруктозо-1,6-фосфатг —2600,8 —2902,5 205,4 —274,1 24
Фумаровая кислота С,Н,О4 . —647,1 —1404,8 149,2 —90,6 12
Фумарат- С4Н3О4 —604,2 —1447,7 106,2 —93,6 12
Цистеин c3h,o2ns —339,8 —2178,3 541,1 121,5 21
Цистин CeH12O4N2S2 —665,3 —4133,8 1046,0 246,9 40
Цитрат3- — 1166,6 —2148,4 182,5 —57,3 18
П родолжение
Соединение Формула AG®, кДж-моль-1 AG°. кДж-моль-1 с Окисление с участием NAD+ 1 Число электронов |
AG® , OX кДж «моль-1 &g'o*. (pH 7) кДж • мо ль—1
Изоцитрат3- ceH5o?- — 1160,0 —2155,1 175,8 —63,9 18
Эритрозо-4-фосфатг —1439,1 — 1944,1 127,8 — 191,9 16
Этанол C2HeO —181,5 — 1318,8 235,1 —4,6 12
Этилен (г)в c2H4o 68,1 —1331,3 222,7 —17,1 12
СО2 (г) —394,4 0,0 0,0 0,0 0
СО2 (води) —386,2 —8,2 -8,2 —8,2 0
нсо; —587,1 —44,5 —44,5 —4,6 0
со (г) — 137,3 —257,1 1,9 —38,1 2
Н2О (ж) —237,2 0,0 0.0 0,0 0
он- — 157,3 —79,9 —79,9 —39,9 0
н+ 0,0 0,0 0,0 0
н2 (г) o.o —237,2 21,8 — 18,2 2
Н2О2 —136,8 — 100 —359,4 -319,4 —2
H2S — 27,4 —714,6 321,3 161,5 8
HS- 12,6 —754,5 281,4 161,5 8
Н3РО< (водн)Д — 1147,3 0,0 0,0 0,0 0
Н2РО4 (води)д — 1135,1 — 12,1 —12,1 27,8 0
11РО4- (водн)Д — 1094,1 —53,1 —53,1 26,8 0
NH4 —79,5 —276,3 112,0 12,3 3
no; —34,5 —84,1 —472,6 —372,7 —3
NO (г) 86,7 —86,7 -345,7 —305,7 —2
no; —110,5 —8,1 -655,6 -515,7 —5
SO*- —742,0 0,0 0,0 79,9 0
SO'- --497,1 —244,9 14,1 54,0 2
so*- —513,4 —733,4 302,5 222,6 8
а Приведенные в таблице величины представляют собой AG°— стандартные сво-
бодные энергии образования соединений из элементов; AG°— стандартные свободные
энергии сгорания; AG®X— стандартные свободные энергии окисления под действием
NAD+ с образованием NADH+H+, СО2, Н2О, N2, НРО£~ и SO’-; AG'0X (pH 7) —
кажущиеся изменения свободной .энергии при pH 7.’Все величины выражены в кДж-
•моль-1 и, если специально не оговорено, относятсн к водному раствору при 25 °C.
Символ (г) означает, что вещество находится в газообразном состоянии при давле-
нии 1 атм. В последней колонке указано число электронов, участвующих в полном
окислении вещества до СО2, Н20, N2 и H2SO4. Если оно отрицательно, это означает,
что для получения указанных продуктов вещество должно быть восстановлено (на-
пример, 2NO3 + 10e_+ 12Н+—>N2+6H2O). Данные для фосфорных эфиров относятся
к соединениям с полностью диссоциированными фосфатными группами (—О—РО|~).
Значения AG® для многих из этих соединений рассчитывались по формуле: AG®
(нефосфорилнрованного соединения)—AG° гидролиза (до HPOj-, табл. 3-5) —AG®
(на молекулу фосфорного эфира образуется одна молекула воды)+АО®НРО|- (берется
из данной таблицы). Данные Бассхэма и Краузег использованы в таблице без измене-
ний. Для производных ацил-СоА Группа СоА(—SH) рассматривается как «элемент»;
Энергетика биохимических реакций 217
в этом случае значение AGj отмечено звездочкой и относится к образованию соеди-
нения из соответствующих элементов и свободного СоА; при этом значения AG^
и AGox соответствуют окислению с образованием обычных продуктов плюс СоА. Зна-
чения AG ° для каждого из этих соединений рассчитаны из AG® соответствующего
спирта или карбоксилат-аниона с использованием значений AG^ гидролиза (табл. 3-5).
Еще одна весьма полная таблица значений свободной энергии приведена в издании.
Biochemical Microcalorimetry (Brown Н. D., ed.), pp. 305—317, Academic Press, New-
York. 1969.
6 Основной источник данных: Long C., ed., Biochemists Handbook, pp. 90—92.
Van Nostrand, Reinhold, Princeton, New Jersey, 1961. Многие данные взяты из работы:
Burton К., Ergeb. Physiol., Biol. Chem. Exp. Pharmakoi., 49, 275—298, 1957.
8 Stull D. R., Westrum E. F., Jr., Sinke G. C., The Chemical Thermodynamics of
Organic Compounds, Wiley, New York, 1969.
r Bassham J. A., Krause G. H., BBA, 189, 207—221, 1969.
д Van Wazer J. R„ Phosphorus and Its Compounds, Vol. I, p. 889, Wiley (Inter-
science), New York, 1958.
получить из AG“ уксусной кислоты(водн), привлекая AG° диссоци-
ации:
Уксусная кислота ->• Н+ 4- Ацетат",
AG° =—5,708 lgK=5,708pK= -|-27,2 кДж-моль"1 при 25 °C. (3-41}
Свободная энергия образования ионов Н+ принята равной нулю.
Суммируя уравнения (3-40) и (3-41), получаем AG? ацетата_ =
—'—369,2 кДж-моль"1.
2. Свободная энергия диссоциации протонов
В табл. 3-4 приведены термодинамические константы диссоциации н
значения AG° и Д№ для ряда кислот, представляющих биохимический
интерес. Некоторые из этих значений были использованы при опреде-
лении AG? для ионов при составлении табл. 3-3. Данные табл. 3-4 поз-
воляют оценить изменения свободной энергии для реакций, протекаю-
щих с участием ионных форм, не представленных в табл. 3-3.
3. Потенциалы переноса групп
Напомним, что равновесие в реакциях синтеза биополимера из мо-
номеров (будь то амиды, эфиры, фосфодиэфиры или гликозиды) обыч-
но сдвинуто в сторону расщепления, а не образования полимера. Поло-
жение равновесия зависит от конкретных структур. Некоторые связи
при достаточно высоких концентрациях мономеров образуются легко,,
другие практически никогда не образуются в сколько-нибудь заметном
количестве. Соответственно и гидролиз в равновесии может быть лишь
частичным, а может достигать 99,9%.
Рассмотрим гидролиз двух органических фосфатов — аденозинтри-
фосфата (АТР) и глюкозо-6-фосфата (структурные формулы этих со-
единений приведены на рис. 7-1).
НАТР3"+Н2О ----> HADP2- + Н2РО7;
ДС° х—32,9 кДж-моль"1; (3-42}
ДЯ° «—22,6 кДж-моль"1 при 25 °C и р.=0,25.
tz-D-глюкозо-б-фосфат"Н2О -► Глюкоза + 112РО7;
AG° = —16,4 кДж-моль"1 при 25°C. (3-43}
‘ г Таблица 3-4
Значения рЛ'.,, AG° и Д/7° для ионизации кислот при 25°Са 0
Кислота Р*а АО11, кДж-моль—1 •• АН0, кДж -МОЛЬ—1
Муравьиная кислота 3,75 21 ,4 0,04
Уксусная кислота 4,76 27,2 —0,1
Пропионовая кислота 4,87 27,8 —0,6
Молочная кислота 3,97 (35 °C) 23,4 2,2
Пировиноградная кислота 2,49 14,2 12,1
NHj 9,25 52,8 52,2
CH3NHt 10,59 60,4 55,4
Аланин
-соон 2,35 13,4 3,1
—NHJ 9,83 56,1 45,4
(5-Аланин
—СООН 3,55 20,3 4,5
—NH3 (кажущееся) 10,19 58,2
L-алаиил-Е-а ланин 3,34 19,1 —0,5
Аспарагиновая кислота
—СООН 2,05 П,7 7,7
—соон 3,87 22,1 4,0
-NH* 10,60 60,5 38,8
Н2СО3 6,35° 36,2 9,4
Н3РО4 10,33 59,0 15,1
рК1 2,12 12,1 —7,9
рК2 7,18г 41,0 3,8
(кажущееся) 6,78^ 38,7 3,3
рАз 12,40 70,8 17,6
Глицеро-1-фосфат, рА2 6,66 38,0 —З,1
Глюкозо-6-фосфат 6,50 37,1 -1 ,8
Пирофосфорная кислота, Н4Р2О7
рАз 6,7 38,1 — 1 ,3
(кажущееся) 6,121 34,9 0,5
рА4 9,4 53,6 —7,1
(кажущееся) 8,951 51,2 1,7
Аденозин 3,5 20,1 13,0
АМР
pAi (кольцо; кажущееся) 3,74д 21,3 4,2
рА2 (фосфат) 6,67г 38,1 3,6
(кажущееся) 6,451 36,8 3,6
ADP
рА2 (кольцо; кажущееся) 3,93д 22,4 4,2
рАз (дифосфат) 7,20г 41,1 —5,7
(кажущееся) 6,83е 39,0 —5,7
Энергетика биохимических реакций 219
П родолжение
Кислота Р*а дс°, кДж-моль 1 дн°, кДж. «моль—I
АТР рКз (кольцо; кажущееся) 4,06 23,2 0
рК< (трифосфат) 7,68г 43,8 —7,0
(кажущееся) 7,06г 40,2 —7,0
Пиридин 5,17 29,5 20,1
Фенол 9,98 56,9 23,6
а Приведены значения термодинамических величин, соответствующие бесконечно
разбавленным растворам, если специально не оговаривается, что это — кажущиеся
значения. Последние соответствуют ионной силе 0,2—0,25.
6 Большая часть данных взята из издания Handbook of Biochemistry and Molecu-
lar Biology, 3rd ed., Vol. I (G. D. Fasman, ed.), pp. 305—351, © CRC Press, Inc., Cle-
veland, 1976.
в В этом случае pKi соответствует Ki= [Н+]{НСОз]/([СО2] +[Н2СОз]); Fors-
ter R. E., Edsall J. T., Otis A. B,, Roughton F. J. W., eds., NASA, Spec. Publ., 188,
1969.
r Phillips R. C., George P., Rutman R. J., Biochemistry, 2, 501—508, 1963.
д Alberty R. A., JBC, 244, 3290—3302, 1969.
e Данные, которыми пользуется Alberty R. (Alberty R. A., in: Horizons of Bio-
energetics, pp. 135—147, Academic Press, New York, 1972), вычислены для иоиной си-
лы 0,2 с помощью уравнений, приведенных в статье Phillips R. С., George Р., Rut-
man R. J., JACS, 88, 2631—2640, 1966.
Обратите внимание, что уменьшение свободной энергии в ходе гидро-
лиза для АТР вдвое больше, чем для глюкозо-6-фосфата. Глюкозофос-
фат термодинамически более устойчив, чем АТР. По сравнению с АТР
его легче получить с помощью реакции, обратной гидролизу, и биосин-
тез его тоже должен протекать легче. Кроме того, как это следует из
свободной энергии гидролиза, в присутствии соответствующего катали-
затора фосфорильная группа может самопроизвольно перейти с АТР
на глюкозу, но не наоборот.
Поскольку уменьшение свободной энергии в процессе гидролиза
служит количественной термодинамической характеристикой способно-
сти группы к переносу на другой нуклеофил (гл. 7), ее иногда называ-
ют потенциалом переноса. Так фосфорильная группа
—Р—о-
\он
АТР в процессе гидролиза переносится на гидроксил-ион воды с потен-
циалом переноса 32,9 кДж-моль-1. Вода — это произвольно выбранный,
но общепринятый стандартный нуклеофил, относительно которого опре-
деляется потенциал переноса. Перенос групп играет важную роль в про-
цессах энергообмена и биосинтеза биополимеров; поэтому биохимики
довольно часто пользуются потенциалом переноса (отрицательной сво-
бодной энергией гидролиза) биохимических соединений. Значения этой
величины для ряда соединений приведены в табл. 3-5.
Таблица 3-5
Свободная энергия гидролиза некоторых соединений при 25 °C (в кДж-моль-’)
Соединение Продукты АС ° &.G' (рн 7) ДН°
ATP4- ADP3--f-HPO l~ +Н+ 5,416 —34,54 — 19,71
ATP4- АМР2-фНР2О?" +Н+ 2,54в —37,4 —19,0
MgATP2- MgADP-+HPOl- +Н+ 16,0г —24,0 — 14,2
ADP3- АМР2-+НРО|" + Н- 3,67в —36,3 —13,5
AMP2- Аденозин + НРО2- —9,6’ —9,6 0
ATP4- Адеиозин-(-НР301о —36,0’ —36,0 —7,9-
HP2O3- 2НРО l~ ф Н+ 6,54в —33,4 -12,6.
Ацетнлфосфат2- Ацетат-НРО I- +Н+ —7,7е —47,7
1,3-дифосфоглице- рат4- 3-фосфоглицерат3- + HPO^- ф фН+ —14,5Ж —54,5
Фосфоеиолпируват3- Пируват-фНРО|- О -61,9 —61,9 -25,1
Карбамоилфосфат2- II H2N—с—O- + HPOI- +Н+ — 11,5 —51,5
Креатнифосфат- Креатнн+фНРО3- —43,1 -43,1
Фосфоаргинин- АргиниифНРО!- —38, Р (в присутст^ внн Mg24)
Г лнцерофосфат2- Г лнцер ии + HPOl- —9,2 —9,2
a-D-глюкозо-б-фос- a-D-глюкозафНРО^- — 13,8 —13,8 —2,5
фат2-
Глюкозо-1-фосфат2- Глюкоза+ НРО4- —20,9 —20,9
Мальтоза (или глико- ген) 2 Глюкоза — 16,7 — 16,7
Сахароза Г люкоз а ф Ф р у ктоз а --29,3 —29,3
UDP-глюкоза2- ГлюкозафивР3- + Н+ 9,4 —30,5
№°-формилтетрагнд- рофолиевая кисло- Формнат-фН+ + Тетрагндро- фолневая кислота 14,1 —25,93
та
Уксусный ангидрид 2 Ацетат-+ 2Н+ 31,1 —48,9
Ацетил-СоА Ацетат-фН+ + СоА 4,9 —35,1й
Сукцниил-СоА- Сукцинат2- + Н+фСоА —3,5 —43,5К
Этнлацетат Этанол+Ацетат-фН+ 20,2 —19,7
Аспарагин Аспартат-фНН£ — 15,1 — 15,1
Глнцинэтнловый Г лнцннфЭтанол+Н+ 4,9 —35,1
эфир+ (39 °C)
Валил-тРНК+ Валин фтРНК+Н+ 4,9 —35,1
а Все данные (если нет специальных указаний) взяты нз статьи Jencks W. Р., inr
Handbook of Biochemistry and Molecular Biology, 3rd ed., Vol. I (G. D. Fasman, ed.),
pp. 296—304, CRC Press, Inc., Cleveland, 1976. В случае высвобождения в ходе реакции-.
одного протона ДО0 составляет —39,96 кДж-моль-1.
6 Guynn R. W„ Veech R. L„ JBC, 248, 6966—6972, 1973.
в При расчете использовано ДО°= +11,80 ккал-моль-1 для гидролиза до Р2О7-
плюс ДО0 диссоциации НР2О3-, взятое нз статьи Alberty R. A., JBC, 244, 3290—3324,
1969. Однако к 11,80 ккал-моль-1 прибавлено еще 1,017 ккал-моль-1, чтобы приве-
сти данные в соответствие с данными по гидролизу АТР до ADP.
г Alberty R. A., Horizons of Bioenergetics, Academic Press, New York, 1972,.
pp. 135—147.
д George P., Witonsky R. J., Frachtman M„ Wu C., Dorwart W., Richman L., Rich-
man W., Shurayh F., Lentz B., BBA, 223, 1—15, 1970.
Энергетика биохимических реакций 221
е Расчет основан на значении AGObs = 3,0 ккал-моль-1 для реакции Ацетилфос-
фат+СоА—“-Ацетил-СоА+Р] [Stadtman Е. R., in: The Enzymes (Р. D. Boyer, ed.),
3rd ed., Vol. 8, pp. 1—49, Academic Press, New York, 1973], а также на значении AG'
(pH 7) для гидролиза ацетил-СоА.
ж Оценка получена из AG° гидролиза АТР и AG' = —19,9 кДж-моль-1 для реак-
ции, катализируемой 3-фосфоглицераткиназой (Burton К-> Krebs Н. A., BJ, 54, 94—
107, 1953; 59, 44—46, 1955).
3 Оценка получена по данным при pH 7,7 и 8,0 (из таблиц Дженкса).
я В работе Guynn R. W., Gelberg- Н. J., Veech R. L., JBC, 248, 6957—6965, 1973
значение AG°=—35,75 кДж-моль-1 дано для 38 °C. Не зная А//, ввести соответствую-
щую поправку, чтобы получить AG° для 25 °C, очень трудно. Согласно работе Burton К.,
BJ, 59, 44—46, 1955,_ AG' (pH 7) для реакции АТР4-4-Ацетат- + СоА—‘ADP3--]-
+ Ацетнл-СоА4-НРО! для 25 °C примерно равно 0. В работе [11] для этой реакции
при 38°C получили значение —0,56 кДж-моль-1. Именно эта величина при 25°C
использована для получения приведенного здесь значения. Это эквивалентно мало
обоснованному предположению, что АН гидролиза АТР и ацетил-СоА примерно оди-
наковы.
к Эта величина, как и в таблицах Дженкса, на 2 ккал-моль-1 более отрицатель-
на, чем для ацетил-СоА.
Дополнение 3-А
Аденилатная система
Центральную роль в энергообмене клеток всех типов иг-
рает аденилатная система, которая включает в себя трифос-
фат, дифосфат и 5'-монофосфат аденозина (АТР, ADP и АМР
соответственно), а также неорганический фосфат (Л) и ионы
магния. Аденозинтрифосфат является термодинамически не-
устойчивой молекулой и гидролизуется с образованием ADP
Аденозинтрифосфат
НАТР4’
дает АМР +
оирофосфат (РРр
Гидролиз этой связи дает АВР
+ неорганический фосфат (РА
или АМР, как это изображено на приведенной выше схеме.
Именно эта неустойчивость (высокий потенциал переноса)
позволяет АТР выполнять функцию переносчика химической
энергии, необходимой для удовлетворения большей части
энергетических потребностей клеток, включая и энергию,
нужную для совершения мышечной работы.
Фосфоангидридная (пирофосфатная) связь в молекуле
АТР образуется путем соединения ADP и неорганического
фосфата, которое осуществляется в ходе ряда специфических
реакций фосфорилирования. Наиболее важными из них яв-
ляются реакции, протекающие в фотосинтезирующих мембра-
нах хлоропластов, а также реакции в мембранах бактерий и
222 Глава 3
митохондрий, сопровождающиеся потреблением кислорода'.
Превращение АМР в ADP осуществляется путем переноса
концевой фосфорильной группы с АТР на АМР (гл. 7) в ходе
реакции, катализируемой присутствующим во всех клетках
необычайно активным ферментом аденилаткиназой. Ниже
схематически изображены специфические реакции фосфори-
лирования, которые в два этапа превращают одну молекулу
АМР в молекулу АТР.
. ч Фосфорилирующая
Аоенилаткиназа Л.
система
Для оценки потенциала фосфорилирования аденилатной
системы внутри клеток предлагалось использовать несколько
разных показателей. В качестве одного из них было взято
соотношение [ATP]/[ADP]![Pj] (названное степенью фосфо-
рилирования Rp). Оно непосредственно связано со свободной
энергией гидролиза АТР [уравнение (3-28)]. Величина А\>
внутри клетока может достигать значения 103 М-1, что дает
вклад в AG гидролиза АТР, равный —22,8 кДж-моль-1. Ат-
кинсон с сотр.б-г предложили другую величину, так называе-
мый «энергетический заряд», представляющий собой моль-
ную долю адениловой кислоты, «заряженной» путем превра-
щения ее в АТР. При этом ADP рассматривается как «полу-
заряженная» форма.
Энергетический заряд =
[АТР] + 1/2 [ADP]
[АТР] + [ADP] + [АМР] '
Энергетический заряд может меняться от нуля, когда при-
сутствует только АМР, до 1,0, что означает превращение в
АТР всех молекул АМР. Измерения, выполненные на целом
ряде клеток и тканейг, показывают, что энергетический заряд
обычно лежит в пределах от 0,75 до 0,90. Найти численное
значение этой величины не составляет труда, однако, к со-
жалению, она оказывается не связанной с химическими урав-
нениями. Предположение о важной роли энергетического за-
ряда клетки в регуляции метаболизма весьма сомнительно»
Замечания по поводу сокращений. Следует помнить, что
через Pi обозначают смесь ионных форм фосфорной кислоты,
присутствующих в растворе при данных условиях. В интер-
вале pH от 4 до 10 это Н2РО4 (pRa=6,8) и HPOf". То же
относится и к обозначениям AMP, ADP и АТР; под PPi под-
разумевают смесь ионов пирофосфорной кислоты. Выше
pH 4,4 в заметном количестве присутствуют только Н2Р2О у"
(рД'=б,1), нр2оз- (Рл;=9,о) и р2ог.
Насколько известно, пирофосфат в клетках обычно быст-
ро гидролизуется под действием пирофосфатазы на две мо-
лекулы Pi. Это тоже одна из важных функций аденилатной
системы (гл. 7, разд. Д.1).
Энергетика 'биохимических реакций 223
Как положения равновесия, так и скорости реакций аде-
нилатной системы зависят от концентраций ионов металлов.
Особенно велика роль ионов магния, причем для многих фер-
ментов, катализирующих реакции с участием АТР, истинны-
ми субстратами считаются комплексы MgATP2-.
а Eilerman L. J., Slater Е. С., ВВА, 216, 226—228 (1970).
6 Swedes J. S., Sedo R. J., Atkinson D. E., JBC, 250, 6930—6938 (1975).
B Shen L. C., Fall L., Walton G. M., Atkinson D. E., Biochemistry, 7,
4041—4045 (1968).
r Chapman A. G., Fall L., Atkinson D. E., J. Bacteriol., 108, 1072—1086-
(1971).
Д Purich D. L., Fromm H. J., JBC, 248, 461—466 (1973).
4. «Константы», изменяющиеся с изменением pH
В уравнении (3-42), описывающем гидролиз НАТР3- с образовани-
ем HADP2- и Н2РО , указанная стехиометрия имеет место лишь при
значениях pH вблизи 6. При pH выше ~7 большая часть АТР нахо-
дится в форме АТР4- и распадается до НРО|_ согласно следующему
уравнению:
АТР4- + Н3О --> ADP3- + НРО£- + Н+; (3-44)
AG° ~ +5,4 кДж-моль"1 при 25 °C и р=0,25;
А//0»—19,7 кДж-моль"1.
Значение AG° = + 5,4 кДж-моль-1 для этой реакции вовсе не является
тем большим отрицательным числом, каким оно должно быть для са-
мопроизвольной реакции. Все дело здесь в том, что в числе продуктов
реакции оказались ионы водорода, а стандартным состоянием для Вы-
является не 10-7 М, а 1 М раствор. Поэтому биохимики часто предпо-
читают пользоваться кажущимися константами диссоциации и кажу-
щимися AG; в этом случае за стандартное состояние для ионов водоро-
да принимается состояние, соответствующее значению pH, при котором
проводится эксперимент, обычно pH 7. Получаемая таким образом
pH-зависимая константа равновесия обозначается К' и определяется
так:
Если в ходе реакции высвобождается один протон, как в уравнении
(3-44), то будет выполняться следующее соотношение:
AG'=AG°— 5,708-pH кДж-моль"1 при 25 °C. (3-46)
Вспомним, что AG' =—RT In К', и еще заметим, что [Н+] не входит в
выражение для К' [уравнение (3-45)]. При AG°=+5,4 кДж-моль-1
получаем, что в ходе гидролиза АТР при 25 °C и ц = 0,25, согласно
уравнению (3-46),
AG'(pH7) =—34,5 кДж-моль-1 = —8,26 ккал-моль"1. (3-47)
В биохимической литературе нередко используется ряд других стан-
дартных состояний. Константа равновесия, часто обозначаемая в ли-
тературе через /Cots [наблюдаемая (observed) константа], связана с
~224 Глава 3
-суммарной концентрацией всех ионных форм каждого из компонентов,
существующих при данном pH. Так,
[ADP, все формы] [фосфат, все формы]_,о до\
A°bs_______________________________________________[АТР, все формы] '
AGobs = -/?Tlntfobs. (3-49)
Изменение свободной энергии AGobs можно связать с AG', исходя из со-
отношений между Коъа и К'- Для гидролиза АТР в интервале значений
pH 2—10 7(obs есть
к Л , [н+] , т2 ) Л , [НЧ \
А 1 + к 1- i К 2--К - / (1 К 2_ I
V \ aHADP VHADP /xHaADP / \ 'ХНРО4 > /о пл\
Aobs —-------[Н+] [Н+]8 \ • 1,3
\ АНАТр3 ^натр3'Ч^н2атр2~ /
В этом уравнении Ahadp2“ и т. д. — константы отдельных стадий дис-
социации (табл. 3-4). Выражения в скобках — это pH-функции Михаэ-
лиса (см. также гл. 6, разд. Д.5). Они связывают полную концентра-
цию данного компонента с концентрацией наиболее диссоциированной
формы. Так, при pH в интервале от 2 до 10
[ЛЪюлн = [НРОГ] (1 + [Н+]/АН2р0;). (3-51)
Используя кажущиеся значения рАа (ц = 0,2) для Н2РО4, HADP2- и
НАТР3-, равные соответственно 6,78; 6,83 и 7,06 (табл. 3-4), мы полу-
чим, что при pH 7 AGObs = —35,0 кДж-моль^1 (приняв при этом, чго
при pH 7 AG' = —34,5 кДж-моль-1). Различие между AG' и AGObs в
этом примере невелико, но оно было бы заметно больше, если бы ион-
ные формы, фигурирующие в уравнении (3-44), при pH 7 не являлись
преобладающими.
Чтобы найти изменение свободной энергии реакции в условиях, от-
личных от стандартных, следует применить уравнение (3-28). Так, при
pH 7 и 0,01 М активностях ADP3-, АТР4- и НРО^~ AG гидролиза АТР,
согласно уравнению (3-44), равно —34,5—2-5,71=—45,9 кДж-моль-1 =
= —11,0 ккал-моль-1. Следовательно, для концентраций, имеющих ме-
сто в клетках (как правило, это миллимоли), потенциал переноса АТР
существенно выше, чем при стандартных условиях.
Чтобы найти AG для температуры, отличающейся от 25 °C, необхо-
димо знать АТ/ реакции. Используя уравнение (3-37), легко показать,
что AG для температуры Т2 связано с AG для температуры 7\ следую-
щим соотношением:
AG2 « (3_52)
ч
Энтальпия гидролиза АТР, согласно уравнению (3-44), равна
—19,7 кДж-моль-1. Используя это значение и применяя уравнение
(3-52), находим1, что AG' (pH 7) гидролиза АТР для 38 °C равно
—35,2 кДж-моль-1. Следует помнить, что все указанные здесь измене-
ния свободной энергии — это кажущиеся величины, относящиеся к рас-
творам с ионной силой ~0,25.
1 Точное значение AG' (pH 7) для 25 °C, использованное для получения приведен-
ного здесь результата, равно •—34,54 кДж-моль-1. Почти такое же значение получил
автор этой книги, исходя из AG' =—35,19 кДж-моль-1 для 38 °C, приведенного в ра-
боте [11].
Энергетика 'биохимических реакций 225
5. Роль ионов металлов
И АТР, и ADP, и неорганический пирофосфат образуют комплексы
с ионами металлов. В физиологических условиях преобладают комп-
лексы ADP и АТР с ионами магния; рассмотрим уравнения соответст-
вующих реакций и изменения свободной энергии.и-энтальпии [12] (при-
ведены кажущиеся значения для 25 °C и ц = 0,2, выраженные в
кДж-молы1).
АТР4- + Mg2+ --► MgATP2*, . (3-53)
AG° = —26,3; ЛД° = 13,8.
ADP3-+Mg2+ ----«-MgADP-, • (3-54)
AG°=—19,8; Л№ = 15,1.
РИС. 3-2. pH-зависимость "кажущейся свободной
энергии AGobs гидролиза АТР при различных кон-
центрациях свободных ионов магния (числа у
кривых — концентрация Mg2+ в мМ). Кривые
построены с помощью ЭВМ и приводятся с лю-
безного разрешения Carol. М. Harris.
Используя кажущиеся значения AG° из уравнений (3-53) и (3-47), по-
лучаем
MgATP2- + Н2О ---> MgADP- + Н2РО2- + Н+, (3.55)
AG' (рН7) = — 28,0 кДж-моль-1.
Стехиометрия уравнения (3-55) никогда в точности не выполняется;
какое-то количество Mg2+ уходит в раствор в результате диссоциации
MgADP-; как протоны, так и ионы Mg2+ связываются с Н2РО7; в среде
присутствуют также НАТР3-
и HADP2-, слабо связываю-
щие Mg2+ [13]. Таким об«.
разом, наблюдаемые значе»
ния AGobs меняются с из-
менением как pH, так и
концентрации магния, а так-
же зависят от ионной силы.
Олберти [13] и Филлипс и
ДР- [И] составили таблицы
и графики кажущихся зна7.
чений AGQbs для различных
условий. На рис. 3-2 пред-
ставлен один из графиков,
построенный исходя из кон-
стант и уравнений Олберти1.
Определяемое из этого гра-
фика AGObs для гидролиза
АТР при pH 7, 25°С, р, = 0,2
и 1 мМ Mg2+ (сравнительно
высокая концентрация [ 15])
равно —30,35 кДж-моль-1
(—7,25 ккал • моль-1).
Мы видим, что образо-
вание комплекса с Mg2+ не-
много снижает потенциал
переноса фосфорильной
группы АТР. СущесФвенноё влияние может оказывать ‘непостоянство
концентрации Mg2+ во времени, а также-неоднородность концентрации
1 Однако значение AG' гидролиза АТР = 35,54 кДж-моль-1 при [Mg2+]=0 полу-
чено по данным работы [.11]. Значения рАя и-.константы образования комплексов с
Mg2+ взяты у Олберти [13]. Интересно отметить, что Джордж и, др. [15] определяли
для этих же комплексов константы образования при- бесконечном разбавлении и по-
лучили гораздо более отрицательные значения AGj, чем приведенные в уравнениях
(3-53) — (3-55).
15—1821
226 Глава 3
внутри клетки [16]. В тканях магний является главным, однако да-
леко не единственным катионом. На равновесие полифосфатов (напри-
мер, АТР) заметное влияние оказывают Са2+, Мп2+ и даже К+.
6. Несоответствие данных, полученных разными авторами
Потенциал переноса АТР измерить непросто, и его значения, полу-
ченные разными авторами, сильно различаются. Согласно Джорджу
и др. [15], AG0 для реакций (3-42) равно —39,9 кДж-моль-1 при 25ОС„
р = 0,2 и —41,25 кДж-моль1 при бесконечном разбавлении. Они оце-
нили точность своих данных как ±4 кДж-моль1. Однако, по оценкам
многих других авторов [17—21], в том числе и по данным, полученным
недавно Гуинном и Вичем [11], эти значения по меньшей мере на
4 кДж-моль"1 менее отрицательны. Внутренне непротиворечивый на-
бор термодинамических данных, используемых всюду в этой книге, ча-
стично основан на значении AG гидролиза АТР, которое получено в ра-
боте [11].
7. Энергии связей и приближенные методы оценки
термодинамических величин
Для приближенных оценок изменения энтальпии той или иной ре-
акции можно использовать эмпирические значения энергии связей
(табл. 3-6), которые представляют собой приблизительные изменения
энтальпии при образовании соединений в газообразном состоянии из-
атомов, находящихся в газовой фазе.
Таблица 3-6
Типичные энергии связейа, кДж-моль-1
Значения энергии одинарных связей
н—н 436 Si—Н 295 С—0 351
с—с 346 N—Н 391 С—S 259
Si—Si 177 Р— Н 320 С—F 441
N—N 161 0-Н 463 С—С1 328
0—0 139 S—н 339 С—Вг 276
s—s 213 С—Si 290 С—I 240
C—H 413 C-N 292 Si—0 369
Значения энергии кратных связей
с=с 615 c=s 477
N=N 418 с==с 812
0=0 402 ('Д-состояние) N=N 946 (N2)
C=N 615 C=N 866 (HCN)
с=о 686 (формальдегид) 891 (нитрилы)
715 (альдегиды)
728 (кетоны)
Энергетика биохимических реакций 227
Продолжение
Эмпирические значения энергии связи в резонансных структурах
Бензол 155 О
Нафталин 314 —С—ОН О 117
Стирол Фенол 155 4- 21 155+29 —С—OR О 100
Бензальдегид 155+ 17 —с—nh2 88
Пиридин 180 Мочевина 155
Пиррол 130 СО 439
Индол 226 со2 151
а Pauling L., The Nature of the Chemical Bond, 3rd ed., pp. 85, 189,
195—198, Cornell Univ. Press, Ithaca, New York, 1960.
8. Свободная энергия сгорания в присутствии О2 и NAD+
Ввиду исключительной важности процессов окисления для метабо-
лизма у аэробных организмов часто бывает весьма полезно знать сво-
бодную энергию сгорания того или иного соединения. Эти данные лег-
ко получить из свободной энергии образования. Например, AGC ацета-
та (водн) можно найти следующим образом:
Ацетат" + Н+ -► 2 С + 2 Н2 + 02
AG°= 4-369,2 кДж-моль-1 =—AG° ацетата (табл. 3-3).
2Н2+ О2 ---->- 2Н2О
AG°=2-(—237,2)=—474,4 кДж-моль"1 =2AG° воды
2 С + 2 О2 -► 2 СО2
AG” = 2 • (—394,4)=—788,8 кДж • моль"1=2AG" СО2
Ацетат" (1 М) + Н+ (1 М) + 2 О2 (1 атм) -► 2СО2(1 атм)-f-Н2О (ж) (3-56)
AG°=—894,0 кДж-моль"1 = AG? ацетата"
В табл. 3-3 наряду со значениями AG” приведены и значения AG?.
Очень многие процесы окисления в клетках идут с участием особо-
го окислителя никотинамидадениндинуклеотида (NAD+) или родствен-
ного ему соединения NADP+ (гл. 8). Поэтому удобно иметь таблицы
значений AG0 для полного окисления соединений до СО2, происходяще-
го под действием не О2, a NAD+1. Эти значения, обозначенные AG?X и
AGoX (pH 7), тоже приведены в табл. 3-3. Обратите внимание, что зна-
чения эти сравнительно малы и, следовательно, окисление с участием
NAD+ дает клеткам мало энергии. Рассмотрим, например, такую ре-
акцию:
Ацетат" + 2 Н20 + 4 NAD+ > 2 С02 + 4 NADH + 3 Н+ (10"’ М), (3-57)
AGox (pH 7) = 4-22,1 кДж • моль"1.
Когда NADH, образовавшийся в результате восстановления NAD+,
снова окисляется в митохондриях [уравнение (3-58)], клетки получают
1 Близкий подход применили Деккер и др. [22].
15’
228 Глава 3
большое количество энергии:
4 NADH + 4 Н+ 4- 2О2 -> 4 Н2О + 4 NAD+, (.3-58)
AGoX(pH7) = —876,1 кДж-моль-1.
Уравнения (3-57) и (3-58) в сумме дают уравнение сгорания ацетата
в О2, а два значения AG в сумме равны AGC ацетата-.
Ацетат' + Н+ + 2 О2 --> 2 СО2 Д- 2 Н2О, (3-59)
AG? =—894,0 кДж-моль-1,
AGc(pH7) =—854,0 кДж-моль"1.
Значения AG0X (табл. 3-3) не только сразу дают относительное ко-
личество энергии, высвобождаемой при окислении субстратов с уча-
стием NAD+, но и оказываются весьма удобными для оценки AG реак-
ций брожения. Рассмотрим, например, процесс сбраживания глюкозы
в этанол:
a-D-глюкоза -> 2СО24-2 Этанол. (3-60)
Изменение свободной энергии AG' (pH 7) для сбраживания глюко-
зы с образованием этанола и СО2 можно сразу получить из табл. 3-3:
AG'(pH7)=—243,8—2-(—4,6) = —234,6 кДж-моль'1 (3-61)
(значения AG0X для Н2О, СО2 и Н+ всегда равны нулю). Те же вычис-
ления можно проделать, используя значения AG”, (что неудобно, по-
скольку они слишком велики) или AG“. Последние тоже достаточно
велики, к тому же надо вводить в расчеты данные для СО2 и воды.
С помощью табл. 3-3 можно получить значения AG0 для многих мета-
болических реакций, которые мы рассмотрим далее. Для этой цели под-
ходят данные любой из колонок таблицы, но для простоты лучше поль-
зоваться значениями AGqX.
Заметим, однако, что для реакций окисления под действием кисло-
рода или любого другого окислителя, отличного от NAD+ и не включен-
ного в табл. 3-3, нельзя использовать непосредственно значения AGOX.
’В этом случае поступают следующим образом. Сначала из значений
AG0X рассчитывают AG° или AG' для рассматриваемой реакции, считая,
что окислителем является NAD+, а затем к полученному значению при-
бавляют свободную энергию окисления кислородом (или другим окис-
лителем) образовавшегося NADH. Такого типа величины для О2 приве-
дены в табл. 3-7; основываясь на данных этой таблицы, можно оценить
их значение и для ряда других окислителей, таких, как Fe3+ и цито-
хром с.
•В. Электродные потенциалы и изменение свободной энергии
для окислительно-восстановительных
реакций
Мы живем в среде, содержащей мощный окислитель О2. В процес-
сах дыхания, идущих в клетках, кислород восстанавливается до Н2О,
очень слабого восстановителя. На другом конце шкалы окислителей на-
ходится Н1-—-очень слабый окислитель, который отдельные бактерии
’•способны превращать в сильный восстановитель Н2. Пары О2—Н2О и
Н+—Н2 — это две очень важные в биологическом отношении окисли-
тельно-восстановительные систе.мы. Между ними находится множест-
Энергетика биохимических реакций 229
во других пар соединений, которые участвуют в окислительно-восста-
новительных реакциях, протекающих внутри клетки, и имеют большое
значение для метаболизма.
Известно два общепринятых метода количественной оценки окис-
лительных и восстановительных свойств сопряженных окислительно-
восстановительных пар. С одной стороны, можно Выписать значения
Дб для окисления восстановленной формы кислородом Ог и превраще-
ния ее в окислительную форму. Соединение с большим значением —AG
будет хорошим восстановителем. Примером служит Н2, для которого
Л б сгорания при pH 7 (табл. 3-3) равно —237 кДж-моль-1. Слабые вос-
становители, такие, как Fe3+, характеризуются малыми значениями Лб
окисления (—8,5 кДж-моль-1 для реакции 2Fe2+—>-2Fe3jj. Свободные
энергии окисления биологических переносчиков водорода (о которых
речь пойдет в гл. 8), как правило, оказываются между упомянутыми
значениями для Н2 и Fe2+.
Второй способ выражения той же информации связан с использо-
ванием электродных потенциалов (табл. 3-7). Электродные потенциалы
важны еще и потому, что их прямое измерение иногда позволяет подой-
ти к изучению окислительно-восстановительных реакций внутри клеток.
1. Измерение электродных потенциалов
Для измерения электродного потенциала нужно, чтобы окислитель
сопряженной окислительно-восстановительной пары мог восстанавли-
ваться потоком электронов [уравнение (3-62)], «стекающих» с поверх-
ности электрода, во многих случаях покрытого слоем специально об-
работанной платины.
А 4- 2Н++ 2е" АН2. (3-62)
Уравнение (3-62) описывает реакцию, протекающую на одном электро-
де. Электрохимический элемент имеет два электрода, и полная реакция
является суммой двух полуреакций. Электродный потенциал данной
полуреакции определяется путем измерения электродвижущей силы,
создаваемой элементом, в котором одна из полуреакций протекает на
стандартном электроде с известным потенциалом. На рис. 3-3 схемати-
чески изображена экспериментальная система для измерения электрод-
ного потенциала. Стандартный водородный электрод представляет со-
бой платиновый стержень, заключенный в стеклянную трубку, через
которую подается газообразный водород под давлением 1 атм. Элект-
род погружен в раствор, содержащий ионы водорода с единичной ак-
тивностью (пн+ = 1). Потенциал этого электрода условно принят за
нуль. На практике в качестве стандартного электрода чаще всего ис-
пользуют каломельный или какой-либо другой электрод с точно из-
вестным, постоянным потенциалом. Цепь между растворами, куда по-
гружены электроды, замыкается с помощью мостика, заполненного
электролитом. В исследуемом полуэлементе на поверхности другого
электрода (чаще всего платинового) протекает реакция, описываемая
уравнением (3-62). Разность потенциалов между двумя электродами
регулируется потенциометром. Вычитая из этсй разности потенциалов
потенциал стандартного электрода, получают электродный потенциал
исследуемой окислительно-восстановительной пары. Важно, чтобы ин-
тересующая нас электродная реакция была полностью обратима. Пере-
двигая движок потенциометра таким образом, чтобы электродвижущая
сила (э. д. с.) исследуемой системы была точно уравновешена внешним
230 Глава 3
источником напряжения, можно добиться того, чтобы ток через элемент
стал равен нулю. Если реакция обратима, то небольшое изменение на-
пряжения приведет к тому, что через элемент пойдет ток. Повышая или
понижая напряжение, можно изменять направление тока.
Обратимость реакции имеет место не для всех окислительно-восста-
новительных пар. Особенно это относится к органическим соединениям:
например, для пары альдегид — спирт прямо измерить электродный
потенциал невозможно. В ряде случаев, в частности при работе с
Н2^±2Н+- + 2е-
А + 2Н* + 2е-^ГАН2
РИС. 3-3. Устройство для измерения электродных потенциалов. Внизу приведены урав-
нения реакций, протекающих в каждом из полуэлемептов. Максимальная электриче-
ская работа, которую может выполнить такой элемент над окружением, равна —AG =
— nEF, где £=14—К (разность потенциалов, измеренная с помощью потенциометра).
Если вещество А, реагируя с Н2, восстанавливается до АН2, электроны во внешней
цепи будут течь в направлении, указанном на рисунке. При этом в правом полуэле-
менте будет идти восстановление А, а в левом Н2 будет окисляться до Н+. Протоны
будут перетекать слева направо через мостик из геля, насыщенного электролитом, вы-
полняя роль носителей тока во внутренней цепи.
ферментами, помогает добавление в систему легко восстанавливаемого
красителя с потенциалом, близким к потенциалу измеряемой сопря-
женной пары (список соответствующих красителей приводится в ра-
боте [23]). Если краситель может легко обмениваться электронами с
измеряемой парой, то удается прямо измерить электродный потенциал.
Во многих случаях электродные потенциалы, указываемые в таблицах,
рассчитываются по данным для свободных энергий (многие из потен-
циалов, указанных в табл. 3-7, можно рассчитать из данных, приве-
денных в табл. 3-3; советуем читателю проверить это). Когда в иссле-
дуемой системе А, Н+ и АН2 имеют единичные активности, наблюдае-
мый потенциал полуреакции представляет собой стандартный электрод-
ный потенциал Е°. Если э. д. с. гипотетической электродной системы,
в которую входит стандартный водородный электрод, оказывается по-
ложительной, когда ток течет в направлении, указанном стрелкой на
рис. 3-3, то потенциал сопряженной пары А/АН2 также считается по-
ложительным (его часто называют восстановительным потенциалом)
Именно такому предположению соответствуют данные табл. 3-7, однако
следует иметь в виду, что некоторые химики используют такие же по
абсолютной величине, но противоположные по знаку окислительные
потенциалы. Во избежание путаницы рекомендуем запомнить значение
одного-двух потенциалов, например потенциалов пар О>—Н2О и
NAD+—NADH.
Таблица 3-7
Восстановительные потенциалы некоторых биологически важных систем3'6
Полуреакция £°, в Е°' (pH 7), В —AG' (pH 7) для окисления кислородом (в расчете иа два электрона), кДж-моль—1
Ю2+4Н++4е-—>2H2O +1,229 +0,815 0,0
Fe3+ + e-—>Fe2+ 0,771 0,771 8,5
NO^ +2H++2e~—+NO; +H2O 0,421 76,0
Цитохром f (Fe3 * * 6+)+e~—>-Цитохром f (Fe2+) 0,365 86,8
Fe(CN) (феррицианид) + e~—>-Fe(CN)j“ 0,36 87,8
O2+2//+ +2e-—+H2O2 0,709 0,295 100,3
Цитохром a (Fe3+)+e-—>-Цитохром a (F2+) 0,29 101,3
п-Хинон+2Н+ + 2е~—^Гидрохинон 0,699 0,285 102,3
Цитохром c (Fe3+)+е-—э-Цитохром с (Fe2+) 0,254 108,3
Адренодоксин (Fe3+)+e~—>-Адренодоксин (Fe2+) 0,15 128,3
Цитохром b2 (Fe3+)+e~—^Цитохром &2 (Fe2+) 0,12 134,1
Убихинон+2Н+ + 2е-—>-Убихинон • Н2 0,10 138,0
Цитохром & (Fe3+)+е~—> Цитохром b (Fe2+) 0,075 142,8
Дегидроаскорбиновая кислота + 2Н+ + 2е* —>- —^Аскорбиновая кислота 0,058 146,1
Фумарат2-+2Н++2е~—>-Сукцинат2- 0,031 151,3
Метиленовый синий+ 2Н ++2е-—>Лейкометиле- новый синий (бесцветный) 0,011 155,2
Кротонил-СоА+2Н+4-2е-—>Бутирил-СоА —0,015 160,2
Глутатион+2Н + + 2е“—> Дважды восстановлен- ный глутатион 0,10 176,6
Оксалоацетат2- + 2Н++2е-—>Малат2- —0,166 189,3
Пируват-+2Н++2е-—>Лактат2- —0,185 193,0
Ацетальдегид+2Н++2е~—>Этанол —0,197 195,3
Рибофлавин + 2Н + +2е-—> Дигидрорибофлавнн —0,208 197,4
Ацетоацетил-СоА-|-2Н+ + 2е~-—>-(5-Оксибути- рил-СоА —0,238 (38 °C) 203,2
S + 2H++2e~—>H2S 0,14 —0,274 210,2
Липоевая кислота-|-2Н+ +2е_—>Дигндролипоевая кислота -0,29 213,2
NAD++H++2e-—э-NADH —0,113 —0,32 219,0
NADP++H++2e-—>NADPH —0,324 219,8
Ферредоксин (Fe3+)+e-—^Ферредоксин (Fe2+) (Clostridia) —0,413 237,0
2H+ + 2e-—>H2 0 —0,414 237,2
СО2+Н++2е-—>-Формиат- —0,42 (30 °C) 238,3
Ферредоксин (Fe3+)+e-—^-Ферредоксин (Fe2+) (шпинат) —0,432 240,6
3 Соединение с более положительным потенциалом будет окислять восстановлен-
ную форму вещества с более низким потенциалом с изменением стандартной свобод-
ной энергии ДС°=—nFAE°=—raA£°-96,49 кДж-моль-1, где п — число электронов, пе-
редаваемых от восстановителя к окислителю. Если нет специального указания, тем-
пература считается равной 25 °C. Е° относится к стандартному состоянию, при кото-
ром активность водородных ионов равна 1; Е°' относится к стандартному состоянию
яри pH 7, при котором все остальные активности равны единице.
6 Основной источник данных: Loach Р. A., in: Handbook of Biochemistry and Mo-
lecular Biology, 3rd ed., Vol. I (G. D. Fasman, ed.), pp. 122—130, © CRC Press, Inc.,
Cleveland, 1976.
232 Глава 3
Максимальная работа (—AG), которую может совершить поток
электронов во внешней цепи, обусловленный электрохимической реак-
цией (в расчете на моль вещества), есть
—\G=nEF=(nE-96,487) кДж-моль-1 —
= («£•23,061) ккал-моль-1, (3-63)
где £ —заряд моля электронов в кулонах1 (заряд электрона, помно-
женный на число Авогадро, т. е. 96 487 кулонов), а Е — измеренная
разность электродных потенциалов двух полуэлементов (в вольтах).
Если одним из полуэлементов является стандартный водородный элек-
трод, то Е — электродный потенциал сопряженной пары. Число молей
электронов, перенесенных в ходе реакций («), для обычных биохими-
ческих реакций равно 1 или 2 [в уравнении (3-62) оно равно 2].
Поскольку реагенты и продукты не всегда имеют единичную актив-
ность, нам нужно найти зависимость наблюдаемого электродного по-
тенциала от Е° и активностей (концентраций) А, АН2 и Н+. Эта зави-
симость имеет следующий вид:
In 1^ = («=2)
=£° + 0,02961g В при 25 °C. (3-64)
lAri2J
В биохимической литературе обычно вместо Е° Приводят значения
кажущихся стандартных электродных потенциалов при pH 7 (Е°',
табл. 3-7, второй столбец). Заметьте, что Е0' (pH 7) для водородного
электрода равно не 0, а —0,414 В. Связь между Е и Е°' определяется
уравнением (3-64), в котором в числителе отсутствует сомножитель
[Н+]2, поскольку в Е°' уже входит член с 1g [Н+]. По шкале значений
Е°' (pH 7) потенциал пары кислород — вода равен 0,815 В, а потенци-
ал пары NAD+—NADH равен —0,32 В.
Г. Термодинамика и процессы жизнедеятельности
Применимы ли законы термодинамики к живым организмам? Клас-
сическая термодинамика имеет дело с равновесными системами, а жи-
вые существа никогда таковыми не являются. Законы термодинами-
ки— это статистические законы. Могут ли они рассматриваться в при-
менении к живым существам, среди которых есть организмы, чья ге-
нетическая информация заключена в единственной молекуле ДНК?
Скорость идеальных обратимых реакций классической термодинамики
бесконечно мала. Как же может термодинамика прилагаться к быст-
рым химическим реакциям, протекающим в организме? В ответ на это
можно сказать, что термодинамика (даже если она ни на что другое
не пригодна) по крайней мере позволяет решить, может идти реакция
в данных условиях или не может. Таким образом, если нам известны
стационарные концентрации реагентов и продуктов внутри клетки, мы
можем сказать, в каком направлении пойдет реакция.
Вместе с тем многие ученые полагают, что должны существовать
некие положения общего характера типа законов термодинамики, при-
менимые к стационарному состоянию — своего рода «динамическому
равновесию», характерному для живых организмов. Термодинамика
Число Фарадея. — Прим, перев.
Энергетика биохимических реакции
неравновесных, необратимых процессов представляет собой в настоя-
щее время довольно развитую область физической химии.
Характерной особенностью термодинамики необратимых процессов
является то, что в нее в явном виде входит время. При этом рассмат-
риваются открытые системы, т. е. системы, которые обмениваются с
окружающей средой различными веществами. Вполне очевидно, что
живые организмы не могут считаться замкнутыми системами, с кото-
рыми оперирует классическая термодинамика, и являются открытыми
системами. Для любой открытой системы характерно наличие непре-
рывного потока вещества в каком-то направлении. За счет этого в си-
стеме устанавливается градиент концентраций и одно из первостепен-
ных значений приобретают явления переноса. Серьезной проблемой,
ограничивающей применение в биологии термодинамики необратимых
процессов, является то, что большая часть соотношений этой науки
справедлива лишь для состояний, близких к равновесию, в то время
как живые существа чаще всего весьма далеки от него. Поскольку био-
химические реакции могут протекать очень быстро, не вполне ясно,
может ли термодинамика необратимых процессов в том виде, как она
сейчас существует, помочь в решении большинства биохимических за-
дач. Однако в любом случае подход этот достаточно важен и при серь-
езном изучении биохимии без его рассмотрения никак нельзя обой-
тись.
Для ознакомления с неравновесной термодинамикой и соответст-
вующей дитературой можно обратиться к работе [24|; рекомендуем
также книги Пригожина [25]' и Качальского и Куррана [26].
В основе несколько иного подхода, развиваемого Мак-Кларом [27—
29], лежит представление о том, что второй закон термодинамики не
является, как это обычно считают, статистическим. Если его соответ-
ствующим образом сформулировать, он может быть применим и к бак-
териям, обладающим единственной молекулой ДНК- Следовательно,
классическая термодинамика применима и к живым клеткам. Автор
указывает, что характерной особенностью живых организмов, отличаю-
щей их от систем, которыми обычно занимается термодинамика, яв-
ляется то, что все реакции в них протекают очень быстро. Например,
в случае превращения внутримолекулярной энергии в мышцах в меха-
ническую энергию очень важно, чтобы процесс совершался достаточно
быстро и энергия не успевала рассеиваться в виде тепла. Мак-1<лар>
полагает, что для метаболических реакций большее значение имеет из-
менение энтальпии, нежели свободной энергии или энтропии.
Другая интересная идея, высказанная Моровицем [30], сводится
к тому, что поток энергии через любую открытую систему уже сам. по
себе «организует» эту систему. Так, если поставить колбу с водой на
горячую плиту, в ней будет протекать циклический процесс — в резуль-
тате потока энергии через систему в воде возникнут циклические кон-
векционные потоки. Как считает Моровиц, те (6±3)-1018 кДж солнеч-
ной энергии, которые ежегодно попадают на Землю, и составляют ор-
ганизующую основу жизни. Подобно тому как эта энергия вызывает
широкомасштабные циклические перемещения в атмосфере и морях,
она приводит к возникновению различных взаимосвязанных и крайне
разветвленных метаболических циклов. Возможно, этот подход помо-
жет понять происшедшее в ходе эволюции спонтанное развитие из не-
живых предшественников тех организованных систем, которые мы на-
зываем живыми.
234 Глава 3
1. Эффективность роста бактерий
Параллельно с не слишком плодотворными попытками построить
обобщенную термодинамическую теорию, применимую к живым систе-
мам, проводились чисто эмпирические наблюдения над процессами ро-
ста живых систем и потребления ими энергии, выявившие ряд интерес-
ных фактов. Довольно хорошо изучены многие анаэробные процессы
брожения, в ходе которых энергия химических реакций используется
клетками для синтеза АТР (гл. 9). Как правило, стехиометрия этих
реакций известна, и поэтому можно с хорошей точностью оценить ко-
личество АТР, синтезированного при сбраживании данного количества
субстрата. Нетрудно измерить и количество образовавшейся в ходе
брожения биомассы; например, можно собрать культуру клеток быстро
растущих бактерий, промыть, высушить и взвесить ее. Оказалось, что
независимо от того, какой именно субстрат сбраживается (за редким
исключением), величина Удтр — вес высушенных клеток в граммах на
моль синтезированного АТР — остается почти постоянной [22, 31]' и
приблизительно равной 10,5. Другой факт состоит в том, что для бак-
терий, рост и деление которых (в аэробных условиях) сопровождается
выделением только СОг и воды, 40±5 % потребляемого углерода и во-
дорода окисляется до СО2 и воды, а 60±5% ассимилируется клетками.
Отметим, что такой процент ассимилированного материала значитель-
но выше, чем для анаэробного брожения, при котором подавляющая
часть материала сбраживается, а не ассимилируется. Как мы увидим
позднее, это различие обусловлено тем, что окисление дает значитель-
но больший выход АТР, нежели брожение.
Из свободной энергии окисления субстратов ~62% представляет
собой свободную энергию сгорания компонентов, входящих в состав
высушенных бактерий. Таким образом, —AGj^AHc^22 кДж на 1 г
сухого веса бактерии [31].
Д. Линейные соотношения, в которые входит свободная
энергия
Органические функциональные группы определенным образом влия-
ют на распределение электронов в тех группах, к которым они присо-
единены, Выражение этих эффектов в виде линейных соотношений,
в которые входит свободная энергия, позволяет получить весьма по-
лезную связь между определенными химическими свойствами. Наибо-
лее известным из таких линейных соотношений является уравнение
Гаммета, которое связано с передачей влияния на распределение элек-
тронов через бензольные и другие ароматические кольца. Рассмотрим
константы диссоциации соединений трех классов;
Бензойные Фенилуксусные Фенолы
кислоты кислоты
В табл. 3-8 приведены значения рКа как для исходных соединений, так
и для их мета-хлор- и лета-нитрозамещенных производных.
Напомним, что р/<а— это отрицательный логарифм константы дис-
социации. Как следует из уравнения (3-30), рКа прямо пропорциональ-
но AG0 для диссоциации протонов. Гаммет рассматривает различия в
Энергетика биохимических реакций
zoo
Таблица 3-8
Значения р/(а для незамещенных и замещенных бензойных кислот,
фенилуксусных кислот и фенолов
Merna-замещение Бензойные кислотыа Фенилуксусные кислоты Фенолы
—Н (исходное соединение) 4,202 4,31 9,92
—С1 3,837 4,13 9,02
—no2 3,460 3.97 8,39
а Значения рКа для замещенных бензойных кислот недавно приведены в статье
Bolton Р. D., Fleming К. A., Hall F. М., JACS, 94, 1033—1034, 1972. Вычисленные ис-
ходя из них значения о немного отличаются от тех, что приведены в табл. 3-9.
рКа- Замещение атома водорода, стоящего в лета-положении бензойной
кислоты, на С1 или МОг-группу, «оттягивающие» на себя электроны,
снижает рДа, т. е. основность сопряженного основания. Уменьшение
рАа составляет —0,365 и —0,742 для лега-хлорбензойной и лега-нит-
робензойной кислот соответственно. Утверждение Гаммета состоит в
том, что это изменение рАа является мерой способности л/ета-замести-
теля оттягивать на себя электроны [32]. Таким образом, МОг-группа
в этом отношении почти вдвое превосходит С1. Численные значения
изменений константы диссоциации бензойной кислоты определяют кон-
станту замещения а, которая входит в уравнение Гаммета (табл. 3-9).
рА0—рА=о (для замещенной бензойной кислоты). (3-65)
Уменьшение рАа фенилуксусной кислоты, вызванное замещением
мета-водорода на Ci или NO2, составляет соответственно —0,18 и
—0,34, что существенно меньше, чем для бензойной кислоты. Для фе-
нолов же эти различия достигают —0,90 и —1,53, т. е. гораздо больше,
чем для бензойной кислоты. Согласно уравнению Гаммета (3-66) для
таких реакций, как диссоциация протонов в фенилуксусных кислотах
и фенолах, изменение AG, вызванное мета-замещением, пропорциональ-
но о, т. е. изменению AG в ходе стандартной реакции диссоциации про-
тона бензойной кислоты [32—-34]1.
1ё(Л7Ко)=рАо-рА=ро. (3-66)
Фигурирующий в уравнении коэффициент пропорциональности являет-
ся мерой «чувствительности» реакции к присутствию замещающих
групп, способных отдавать или принимать электроны. Для бензойной
кислоты р принято равным 1,00. По данным табл. 3-8, а также соглас-
но многим другим данным, для фенилуксусных кислот среднее значе-
ние р = 0,49; для фенолов р = 2,23, а для отщепления протонов от за-
мещенных пиридиниевых ионов р = 5,7. Чувствительность к замещению
оказывается самой высокой (р максимально) в последнем случае, ког-
да диссоциирует протон, присоединенный непосредственно к атому коль-
ца, и самой низкой, когда протон наиболее удален от кольца (фенил-
уксусная кислота).
1 Это уравнение может быть записано в более общем виде [32]: Igfeij—lgfeoj =
= р;о.-, где k может быть либо константой равновесия, либо константой скорости. Ин-
декс j соответствует рассматриваемой реакции, a i — замещению, оказывающему влия-
ние на ход этой реакции.
236 Глава 3
Таблица 3-9
Константы замещения, входящие в уравнения Гаммета и Тафта®
Замещающая группа ам ап °п а+ О* (из уравнения Таф га)
—о- —0,71 —0,52
-nh2 —0,16 -0,66 — 1,11 0,62
—он 0,121 —0,37 —0,85 1 ,34
—ОСНз 0,115 —0,27 -0,78 1,81
-СНз 0,069 —0,17 —0,31 0,00
--NH—СОСНз 0,2! —0,01 —0,25
—н 0 0 0 0,49
—сн2он 0,08 0,08 0,56
—соо- —0,10 0,00 0,11 — 1,06
- SOs 0.05 0,09 0,12
—SH 0,25 0,15 0,019 1,68
—СН2С1 0,18 1,05
—conh2 0,28 0,36
—F 0,337 0,06 0,02 —0,07
—I 0,352 0,18 0,135
— Cl 0,373 0,227 0.114
—сно 0,36 0,22 0,37
—СОСНз 0,376 0,502 0,85
—соон 0,37 0,45 0,42 2,08
—СООСНз 0,39 0,31 0,49
—SO2NH2 0,55 0,62 0,61
—CN 0,56 0,66 0,89 0,66
—с=сн 2,18
—CF3 0,43 0,54 0,61 2,61
-СС1з 2,65
no2 0,710 0,778 1,25 0,790 4,0
- NH3+ 1,13 1,70 3,76
N(пиридин) 0,73 0,83
NH+ (пиридин) 2,18 2,42 4,0
а Источники данных: Hammett L. Р., Physical Organic Chemistry, 2nd ed., p. 356r
McGraw-Hill, New York, 1970, Swain C G„ Lupton E. C„ Jr., JACS, 90, 4328—4337,
1968; Jaffe H. H„ ibid., 77, 4445—4448, 1955; Barlin G. B., Perrin D. D„ Q. Rev. Chem.
Soc„ 20, 75—101. 1966.
Зная p для данной реакции и имея таблицы значений ст, можно
предсказывать, как изменится рКа под влиянией той или иной заме-
щающей группы. Во многих случаях многократные замещения дают ад-
дитивный эффект;
р7У=рК0—р2ст.
(3-67>
Энергетика биохимических реакций 237
Хотя приведенные здесь примеры касаются лишь диссоциации про-
тонов, уравнение Гаммета справедливо и для многих других процес-
сов. Более того, поскольку скорость реакции связана со свободной
энергией активации, можно установить корреляцию между константа-
ми скорости (гл. 6, разд. Д.5.д).
Так как замещения в орто-, мета- и пара-положениях оказывают
количественно разное влияние, то для каждого положения определя-
ются свои значения о. Заметим, что замещения в орто-положении со-
провождаются дополнительными эффектами, поэтому таблицы значе-
ний о обычно составляются только для мета- и пара-положений1 (а_н и
а„). Еще одно осложнение связано с тем, что некоторые реакции ока-
зываются настолько чувствительными к пара-замещению, что возни-
кает резонанс, охватывающий всю циклическую систему. Примером
служит кислотная диссоциация фенолов. оп для нитрогруппы обычно
составляет 0,778, но, чтобы правильно предсказать влияние пара-нит-
рогруппы на диссоциацию фенола, нужно взять оп, равное 1,25. Это
значение о обозначается через о^. Такое более сильное влияние заме-
щения на нитрогруппу может быть обусловлено резонансом фенолят-
иона:
(Кривые стрелочки указывает направление перехода электронов, при-
водящее к превращению одной резонансной формы в другую.) По
аналогичным причинам для некоторых реакций приходится вводить
о‘п— константы, отвечающие присоединению сильных электронодонор-
ных замещающих групп, таких, как ОН, которые тоже могут вызвать
резонанс в циклической системе. Так, <т,> для ОН-группы равно —0,37,
а Оп = —0,85 [35]. Для метоксильной группы (—ОСНз) ап—-—0,27,
с* =—0,78 и ом = +0,12.
Наличие различных типов констант замещения усложняет примене-
ние уравнения Гаммета. Действительно, сейчас используется свыще
20 различных наборов значений о. Для упрощения ситуации констан-
ты замещения выражают в виде суммы двух слагаемых; одно из них
учитывает «полевые», или «индуктивные», эффекты, а другое — резо-
нансные [35, 36]. Для конкретного заместителя в пара-положении кон-
станты замещения для некоторой серии реакций задаются следующим
уравнением:
(3-68)
В этом уравнении коэффициенты far являются параметрами, харак-
теризующими серию реакций, a F и R соответствуют конкретной заме-
щающей группе. Так, оя обычного уравнения Гаммега оказывается
равной
a„=0,56F+fl. (3-69)
Значения R и F для некоторых замещающих групп даны в приводимой
ниже таблице.
Для орто-замещения в литературе можно найти кажущиеся значения о [34].
238 Глава 3
R F
-nh2 —0,68 0,04
—он —0,64 0,49
-ОСНз —0,50 0,41
-сн3 -0,14 —0,05
—СООН +0,14 0,55
-no2 +0,20 1,11
Группы расположены в порядке убывания количества отдаваемых ими
электронов, создающих резонанс. Замещающие —СООН- и ЫОг-груп-
пы, имеющие положительные значения Р, являются акцепторами элек-
тронов. Как видно из таблицы, все заместители, исключая метильную
группу, дают электронакцепторный индуктивный эффект.
Значения <зм в какой-то мере отражают нерезонансное влияние
группы и поэтому отчасти коррелируют с F-компонентой, тогда как
в основном коррелируют с R.
Существуют и другие линейные соотношения, включающие зависи-
мость от свободной энергии; например, кислотность алифатических со-
единений связана с «константой полярного замещения по Тафту» а*
следующим уравнением:
lg(F//Q=p*o*. (3-70)
Хорошее приближение для оценки значений рКа дают уравнения (3-71)
и (3-72) [34]:
для R—СООН рКа = 4,66— 1,62о*, (3-71)
для R—СН2—СООН рХа = 5,16 —0,73о*. (3.72)
Вопросы и задачи
1. а. Исходя из значения AG0 гидролиза сахарозы (табл. 3-5), рассчи-
тайте константу равновесия
[Глюкоза] [Фруктоза]
~ [Сахароза]
для 25 °C. Назовем эту реакцию гидролиза реакцией 1.
б. Устойчива ли сахароза в 1 М растворе? Объясните почему.
в. Если к 1 М раствору сахарозы добавлена кислота, катализи-
рующая процесс гидролиза, какова будет конечная равновесная
концентрация сахарозы? (Расчет проводите в предположении,
что концентрации равны активностям.)
г. Реакцией 2 является гидролиз а-О-глюкозо-1-фосфат а с образо-
ванием глюкозы и неорганического фосфата (А). Используя зна-
чение AG0 этой реакции (табл. 3-5), рассчитайте константу рав-
новесия.
д. Сахарозофосфорилаза из бактерий Pseudomonas saccharophila
катализирует следующую реакцию (реакция 3):
Сахароза + Р, -а-О-глюкозо-1-фосфат -]- Фруктоза.
Рассчитайте константу равновесия и изменение стандартной сво-
бодной энергии при 25 °C для реакции 3, исходя из полученных
выше значений констант равновесия реакций 1 и 2. Покажите,
что AG0 реакции 3 равно AG0 реакции 1 минус AG0 реакции 2.
е. Могут ли бактерии осуществлять реакцию 3 в две указанные
ниже последовательные стадии? Объясните почему.
Сахароза ---> Глюкоза-j-Фруктоза,
ГлюкозаФосфат -----> Глюкозо-1-фосфат.
2. Для каждой из приведенных ниже реакций укажите, в каком ин-
тервале находится константа равновесия — между 0,1 и 10 (т. е.
около единицы), больше 100 или меньше 0,01. Считайте, что pH
постоянно и равно 7,0.
a. 2ADP3- --> АТР4-4-АМР2-;
б. АТР3-Jr Глюкоза ----> Глюкозо-б-фосфат2- -|- ADP2- -|- Н+;
в. ADP2- + HPOJ- + Н+ --> АТР3-;
г. Глюкозо-б-фосфат2- -> Фруктозо-б-фосфат2~;
д. Фосфоенолпируват3-Глюкоза --->• Глюкозо-1 -фосфат2- -J- Пируват-.
3. В результате сгорания в калориметрической бомбе при 25 °C (при
постоянном объеме) 1 моля твердой мочевины с образованием во-
ды (в жидком состоянии), углекислого газа и газообразного азота
(Na) выделилось 666 кДж тепла. Рассчитайте АД—шзмепение теп-
лосодержания (энтальпии) реакции.
4. По данным табл. 3-3 рассчитайте AG' (pH 7) следующих реакций:
а. Глюкоза ---► 2Лактат--|- 2Н+;
б. 2NHa-]-HCO7 ----> Мочевина-j-2Н2О-|-Н+;
в. а-Кетоглутарат2- 4—О2СоАН+ ---------> Сукцинил-СоА-]- H2O_j- СО2.
5. Какова ионная сила 0,2 М раствора NaCl? 0,2 М NaaSOj?
6. Отношение [АТР]/[ADP] для активно дышащей дрожжевой клетки
равно ~10. При каком отношении [3-фосфоглицерат]/[1,3-дифос-
фоглиперат} в клетке фосфоглицераткиназная реакция (рис. 9-7;
реакция 7) будет смещена в сторону синтеза 1,3-дифосфоглицерата
(при 25 °C, pH 7) ?
7. а. По данным табл. 3-7 определите константу равновесия реакции
между малатом и метиленовым синим, предполагая, что все ре-
агенты вначале присутствовали в равных концентрациях. Четко
укажите, какому направлению реакции соответствует получен-
ное значение изменения свободной энергии.
б. Рассчитайте процентное содержание восстановленной (лейко-)
формы метиленового синего при pH 7 и температуре 25 °C в си-
стеме, электродный потенциал которой равен 0,065 В.
8. NAD+ является коферментом как пируватдегидрогеназы, так и эта-
нолдегидрогеназы. Используя значение Е°' из табл. 3-5, рассчитай-
те изменение свободной энергии и константу равновесия реакции
Лактат- Ацетальдегид --->• Пируват- -|- Этанол.
9. Рассмотрим окисление ацетата при 25 °C:
СН3СОО-(0,1 М) + 2О2 (г, 0,2 атм) + Н+(10-’М) ->- 2Н2О (ж) + 2СО2 (г).
а. Чему равно равновесное давление СО2, если реакция не сопря-
жена ни с какими другими реакциями?
240 Глава 3
б. Чему равно равновесное давление СОо, если реакция сопряжена
с образованием 0,01 М АТР из 0,01 М ADP и НРО*- в цикле
трикарбоновых кислот?
в. Какие выводы вы можете сделать из выполненных выше расче-
тов о возможности 100%-ной эффективности запасания энергии
в виде АТР в ходе цикла трикарбоновых кислот?
г. Если давление СО2 равно 0,01 атм, какова будет эффективность
запасания энергии в условиях, описанных в пункте б?
10. Константа равновесия приводимой ниже реакции, катализируемой
АТР-креатинтрансфосфорилазой, была определена путем непосред-
ственного химического анализа. Данные анализа представлены ни-
же. [Kuby S. A., Noltman Е. A., in: The Enzymes, 2nd ed.
(P. D. Boyer, H. Lardy, K. Myrback, eds.), Vol. VI, pp. 515—602,
Academic Press, New York, 1962].
ATP4- 4- Креатин -> ADP3- 4- Креатинфосфат2- 4- H+
t (°C) к
20 6,30.10-»
30 5,71.10-»
38 5,47.10-»
а. Каковы значения AG°, ЛН° и AS0 реакции при 25°C?
б. Каковы значения AG', АН' и AS' (pH 7) реакции при 25 °C?
в. Каковы значения AG', АН' и AS' (pH 7) реакции гидролиза
креатинфосфата при 25 °C?
11. В калориметре при 25 °C в 0,1 М фосфатном буфере (pH 7,4) в
присутствии суспензии частичек, содержащих митохондриальную
систему транспорта электронов, была проведена следующая реак-
ция (Рое М., Gutfreund Н., Estabrook R. W., ABB, 122, 204—211,
1967):
NADH 4- Н+4- *2~О2 (насыщ. водн. раств.) — » NAD+-j- Н2О.
Количество потребляемого кислорода непрерывно регистрировалось
с помощью кислородного электрода. Температура контролировалась
погруженной в раствор термопарой. Перед началом реакции в
29,0 мл буфера, содержащего О2, было добавлено 96 мкмолей
NADH. Реакция оказалась очень близка к реакции нулевого по-
рядка, скорость потребления О2 составляла 6,87 мкмоль-мин-1,
а скорость повышения температуры—-0,01171 град-мин4. Теплоем-
кость калориметра вместе с содержимым была равна 254,6 Дж-К-1.
Чему равно АН рассматриваемой реакции? Указание-, источником
Н+ служил фосфатный буфер, имевший АН диссоциации
5,4 кДж-моль-1.
12. Изменения энтальпии и свободной энергии при 25 "С для приводи-
мой ниже реакции даны в табл. 3-5:
АТР4-(1 М) 4-Н2О -> ADP3-(1 М)4-Н+(Ю~’М)4-HPOJ-(1 М).
а. Сколько тепла выделится при постоянных температуре и давле-
нии, если реакция будет идти в пробирке и-не будет совершать-
ся никакой работы, помимо работы по увеличению объема РАК?
б. Сколько тепла выделится или поглотится в ходе этой реакции,
если она с эффективностью 100% будет сопряжена с эндергони-
ческой реакцией?- - .
в. Какой должна быть эффективность сопряжения с эндергони-
ческой реакцией, чтобы приведенная выше реакция Не Сопровож-
далась ни выделением, ни поглощением тепла?
Энергетика биохимических реакций 241
СПИСОК ЛИТЕРАТУРЫ
I. Mahan В. Н., Elementary Chemical Thermodynamics, Benjamin, New York, 1963.
2. Lewis G. N., Randall M., Thermodynamics and the Free Energy of Chemical Sub-
stances (rev. by Pitzer K. S., Brewer L.), 2nd ed., McGraw-Hill, New York,
1961.
3 Everdell M. H., Introduction to Chemical Thermodynamics, Norton, New York
1965.
4. Denbigh K. G., The Principles of Chemical Equilibrium, Cambridge Univ. Press,
London and New York, 1955.
5. Dickerson R. E., Molecular Thermodynamics, Benjamain, New York, 1969.
6. Sturtevant J. M. In: Techniques of Chemistry (Weissberger A., ed.), Vol. I, Part V,
pp. 347—425, Wiley (Interscience), New York, 1971.
7. Brown H. D., ed., «Biochemical Microcalorimetry», Academic Press, New York,
1969.
в. White A., Handler P., Smith E. L., Principles of Biochemistry, 4th ed., pp. 291—
301, McGraw-Hill, New York, 1968.
9. Gurney R. W., Introduction to Statistical Mechanics, Chapter 1, McGraw-Hill, New
York, 1949.
10. Phillips R. C., George P., Rutman R. J., Biochemistry, 2, 501—568 (1963)
11. Guynn R. W., Veech R. L„ JBC, 248, 6966—6972 (1973).
12. Alberty R. A., Horizons of Bioenergetics (San Pietro A., Gest H., eds.), pp. 135—
147, Academic Press, New York, 1972.
13. Alberty R. A., JBC, 244, 3290—3302 (1969).
14. Phillips R. C., George P., Rutman R. J., JBC, 244, 3330—3342 (1969). (Обратите
внимание, что все термодинамические величины в этой работе приведены для слу-
чая бесконечного разбавления.)
15. George Р., Phillips R. С., Rutman R. J., Biochemistry, 2, 508—512 (1963).
16. Purich D. L., Fromm H. L, Curr. Top. Cell. Regul., 6, 131—167 (1972).
17. Jencks W. P. In: Handbook of Biochemistry (Sober H. A., ed.), p. J-148, Chem.
Rubber Publ. Co., Cleveland, Ohio, 1968.
18. Atkinson M. R., Morton R. K., Comp. Biochem., 2, 1—95 (1960).
19. Bassham J. A., Krause G. H., BBA, 189, 207—221 (1969).
20. Владимиров Г., Власова В., Колотилова А., Лизлова С., Пантелеева Н., Nature
(London), 179, 1350—1351 (1957).
21. Rosing Slater E. C„ BBA, 267, 275—290 (1972).
22. Decker K-, Jungermann K., Thauer R. K., Angew. Chem., Int. Ed. Engl., 9, 138—
158 (1970).
23. Dutton P. L„ BBA, 226, 63—80 (1971).
24. Caplan S. R., Curr. Top. Bioenerg., 4, 1—79 (1971).
25. Prigogine I., Introduction to Thermodynamics of Irreversible Processes, 3rd ed.,
Wiley, New York, 1967.
26. Katchalsky A., Curran P. F., Nonequilibrium Thermodynamics in Biophysics, Har-
vard Univ. Press, Cambridge, Massachusetts, 1965.
27. McClure C. W. F„ J. Theor. Biol., 30, 1—34 (1971).
28. McClure C. W. F, J. Theor. Biol., 35, 233—246 (1972).
29. McClure C. W. F„ J. Theor. Biol., 35, 569—595 (1972).
30. Morowitz H. I., Energy Flow in Biology, Academic Press, New York, 1968.
31. Payne W. J., Annu. Rev. Microbiol., 24, 17—52 (1970).
32. Hammett L. P., Physical Organic Chemistry, 2nd ed., pp. 347—390, McGraw-Hill,
New York, 1970.
33. Wells P. R„ Chem. Rev., 63, 171—219 (1963).
34. Barlin G. B., Perrin D. D., Jr., Rev. Chem. Soc., 20, 75—101 (1966).
35. Swain C. G., Lupton E. C„ Jr., JACS, 90, 4328—4337 (1968).
36. Hansen L. D., Hepler L. G., Can. J. Chem., 50, 1030—1035 (1972).
Глава 4
Как молекулы соединяются друг
с другом
Все клетки построены из молекул, поэтому ясно, насколько велика
роль механизмов, при помощи которых эти молекулы достаточно проч-
но «состыковываются» друг с другом. Известно, что связывание малых
молекул с большими лежит в основе многих биологических процессов,,
например метаболизма питательных веществ и действия гормонов. Вза-
имодействие между макромолекулами является составной частью таких
явлений, как движение жгутиков, мышечное сокращение, действие ан-
тибиотиков, передача нервных импульсов и многих других.
А. Принцип комплементарности
Поскольку межмолекулярные взаимодействия слабы, молекулы спо-
собны достаточно прочно связываться друг с другом, только если есть
соответствие между их поверхностями, а во взаимодействии участвует
большое число атомов. Для образования прочного комплекса соответ-
ствие должно быть достаточно точным, т. е. поверхности молекул долж-
ны быть комплементарными. Так, если на поверхности одной молеку-
лы имеется выступ (например, группа —СН3), то на комплементарной
ей поверхности другой молекулы должно быть углубление; напротив
положительного заряда должен быть расположен отрицательный.
Группа, способная отдавать протон, может образовать водородную
связь только в том случае, если есть комплементарная группа, содер-
жащая неподеленные электроны. Для образования гидрофобных свя-
зей неполярные (гидрофобные) группы должны располагаться одна
против другой. Один из наиболее важных принципов биохимии гласит:
две молекулы, поверхности которых комплементарны, стремятся взаи-
модействовать и соединяться друг с другом, тогда как молекулы, не
содержащие комплементарных поверхностей, не взаимодействуют. Уот-
сон назвал это принципом избирательной «слипаемости» молекул [1].
Он лежит в основе самосборки нитей, трубочек, мембран и полиэдри-
ческих структур из взаимно комплементарных биологических макромо-
лекул. Принцип комплементарности ответствен также за специфическое
спаривание оснований в процессе репликации ДНК.
Комплементарность поверхностей не менее важна и для множества
химических реакций, протекающих в клетке. Эти реакции катализиру-
ются, или «направляются», ферментами, содержащими реакционноспо-
собные химические группы, которые расположены в строго определен-
ном месте и ориентированы таким образом, чтобы иметь возможность
взаимодействовать с другими молекулами — субстратами и химически
модифицировать их. Избирательный катализ — это характерная осо-
бенность биологических систем; основные усилия биохимиков направле-
ны на изучение именно этого вопроса. Изменения структуры клетки то-
Как молекулы соединяются друг с другом
243
же в конечном счете обусловлены химическими реакциями. Прекрасны-
ми примерами таких изменений могут служить сокращение мышечных
волокон и движение цитоплазмы у амебы.
Б. Силы, действующие между молекулами
Характеризуя количественно межмолекулярные взаимодействия,
биохимики говорят обычно о вандерваальсовых силах, электростатиче-
ских взаимодействиях, водородных связях и гидрофобных силах. Коли-
чественными характеристиками суммарного действия всех сил являют-
ся константа равновесия и изменение энтальпии и энтропии рассматри-
ваемой системы.
1. Константы образования и константы диссоциации
Прочность связи между двумя частицами можно охарактеризовать
с помощью константы образования Kt-
Рассмотрим присоединение молекулы X к другой молекуле Р, ко-
торая может представлять собой молекулу белка, нуклеиновой кисло-
ты, ион металла или любую другую частицу. Если на поверхности Р
имеется лишь один центр связывания для X, то взаимодействие мо-
жет быть описано уравнением (4-1), а константа равновесия Kt опре-
деляется уравнением (4-2):
Х + Р^=^РХ, (4-1)
tff=[PX]/|P][Xj. (4-2)
Константа образования выражается обычно в литрах на моль (или
М-1); она является прямой мерой прочности связи — чем больше кон-
станта, тем сильнее взаимодействие. Прочность связи характеризуется
также изменением стандартной свободной энергии AG0 реакции — чем
более отрицательна AG0, тем прочнее связь.
AG? =—RT In Ks=—2,303/?Т 1g Kf =
=—5,708 lg Ks кДж-моль-1 при 25 °C. (4-3)
Чтобы избежать недоразумения, важно помнить, что наряду с констан-
той образования (ассоциации) часто (особенно в энзимологии и при
определении кислотности) используют константу диссоциации К<Г.
tfd=l/Kf. (4-4)
К сожалению, в разных областях химии одинаково часто пользу-
ются и константами образования (или ассоциации), и константами дис-
социации; постарайтесь не путать эти два понятия.
Часто удобнее пользоваться не самими константами образования,
а их логарифмами, поскольку они пропорциональны соответствующим
изменениям свободной энергии. Запомните следующее соотношение:
lgKf=- lgKd=PKd. (4-5)
Логарифм константы образования равен рКа и характеризует уменьше-
ние стандартной свободной энергии в ходе реакции ассоциации. Заме-
тим далее, что изменение стандартной свободной энергии AG0, соответ-
ствующее изменению lg Kt и рАД на единицу, составляет
—5,7 кДж-моль-1. Эту величину тоже следует запомнить.
244 Глава 4
Средняя кинетическая энергия движения молекул в растворе рав-
з
на приблизительно -^Т, где k — константа Больцмана; для 1 моля при
25° эта величина составляет ^-RT, т. е. 3,7 кДж (0,89 ккал). Например,
если /Q=10 (AG°=—5,7 кДж • моль-1, или —1,36 ккал • моль-1), то
энергия связи лишь незначительно превышает энергию теплового дви-
жения молекул и образующийся комплекс непрочен. Если концентра-
ции X и Р в этом примере составляют 10-4 М (типичные значения кон-
центраций для биологических систем), то это означает, что в виде
комплекса будет находиться лишь 0,1% всех молекул ([комплекс] =
= Kt[Х]1[Р]). Если константа образования в 1000 раз больше, т. е.
Kt = 104 (AG° =—22,8 кДж-моль-1), то в составе комплекса находится
38% всех молекул, а при Ю=107 (очень сильное взаимодействие,
AG° = —40 кДж-моль-1, или —9,55 ккал-моль-1), эта величина состав-
ляет 97%.
2. Вандерваальсовы силы
Все атомы в той или иной степени притягиваются друг к другу, вот
почему даже гелий при достаточно низкой температуре переходит в
жидкое состояние. Эти так называемые вандерваальсовы силы очень
короткодействующие. Они обусловлены электростатическим притяже-
нием отрицательно заряженных электронов одного атома положитель-
но заряженным ядром другого. Поскольку ядра атомов экранированы
окружающими электронами, эти силы неодинаковы и весьма невели-
ки. Например, растворение газа метана (СН4) в инертном углеводород-
ном растворителе сопровождается небольшим уменьшением энтальпии
(Д/7° = —2,0 кДж-моль-1); это уменьшение характеризует вандервааль-
совы силы притяжения между четырьмя атомами водорода метана и
атомами растворителя [2]|.
3. Притяжение между заряженными группами
(электростатические силы)
Фиксированные положительные и отрицательные заряды сильно при-
тягиваются друг к другу. Рассмотрим в качестве примера взаимодей-
ствие карбоксилат-иона с ионом —NHJ или с Са2+:
Исходя из значений вандерваальсовых радиусов (табл. 2-1) и ради-
уса иона Са2+ в кристалле (0,10 нм), можно оценить расстояние меж-
ду центрами положительного и отрицательного зарядов: оно составля-
ет в обоих случаях 0,25 нм. (Если, однако, заряженные группы окру-
жены гидратными оболочками из ориентированных молекул воды, рас-
стояние между центрами может быть значительно больше.) Вычислим,
исходя из закона Кулона, силу притяжения F между двумя заряжен-
ными частицами, почти соприкасающимися друг с другом (находящи-
Как молекулы соединяются друг с другом 245
мися, например, на расстоянии 0,30 нм):
Е=8,9875-10»- (4-6)
Здесь г — расстояние в метрах, q и q'— заряды в кулонах (элемен-
тарный заряд, т. е. заряд одного электрона= 1,6021 • 10-19 кулонов); е —
диэлектрическая постоянная; F — сила в ньютонах. В расчете на один
моль вещества эта сила равна NF, где N — число Авогадро.
Весьма неопределенной величиной здесь является диэлектрическая
постоянная е, которая для вакуума равна 1,0, для углеводородов ~2,0,
а для воды при 25 °C — 78,5. Если принять е равной 2, то сила притя-
жения на расстоянии г = 0,30 нм составит 7,7-1014 Н-моль-1 (для Са2+
и СОО- она будет вдвое больше). Это означает, что увеличение рас-
стояния между зарядами на 0,01 нм требует затраты значительного
количества энергии, а именно 7,7 кДж-моль-1. В случае воды, для ко-
торой диэлектрическая проницаемость велика, эта величина будет поч-
ти в 40 раз меньше, и сила электростатического притяжения перестанет
играть столь существенную роль.
Часто бывает необходимо определить работу, которую нужно со-
вершить, чтобы разнести на бесконечно большое расстояние два заря-
да, находящиеся на данном расстоянии друг от друга (например, на
расстоянии 0,30 нм). Эта работа равна
W (кДж • моль’1) =8,9875 • 106 • N = 138’94.-. (4-7)
' ’ re е.г (в нм) ' '
Если е = 2, то для элементарных зарядов, находящихся на расстоянии
0,30 нм друг от друга, 1)7 = 232 кДж-моль-1; при г=1 нм W=
= 69 кДж-моль-1, а при г—10 нм (т. е. на расстоянии, соответствую-
щем толщине клеточной мембраны) работа составляет всего лишь
6,9 кДж-моль-1. Результаты этих расчетов потребуются нам дальше,
а сейчас достаточно заметить, что между близко расположенными за-
рядами действуют огромные силы.
Электростатические силы играют очень важную роль во взаимодей-
ствиях между молекулами и часто являются причиной изменения их
конформации; например, притяжение между группами —СОО~ и
—NH3 весьма существенно для взаимодействий между молекулами
белка. С карбоксильными группами белков и углеводов в растворе ча-
сто взаимодействуют ионы кальция, что иногда приводит к переходу
растворов этих веществ в гелеобразное состояние (примером может
служить агароза, гл. 2, разд. В.5). Катион Са*', обладающий двойным
зарядом, может играть роль «мостика», соединяющего две карбоксиль-
ные или иные полярные группы.
Важным аспектом всех электростатических взаимодействий в вод-
ных растворах является гидратация ионов. Каждый ион в воде окружен
оболочкой ориентированных определенным образом молекул воды, об-
разующейся за счет притяжения диполей воды к заряженному иону.
Гидратация ионов оказывает сильное влияние на электростатическое
взаимодействие всех ионов в растворе и во многом определяет такие
параметры, как сила кислот и оснований, свободная энергия гидролиза
АТР, прочность связи иона металла с отрицательно заряженными груп-
пами.
Количественно оценить влияние гидратации очень сложно. Заметим,
например, что AG° диссоциации уксусной кислоты составляет
27,2 кДж-моль-1 (табл. 3-4), а это значительно меньше работы по раз-
делению двух зарядов в среде с е = 2, которая по расчетам составляет
246 Глава 4
232 кДж • моль-1. Значение АД0 для процесса диссоциации уксусной
кислоты близко к 0 (—0,1 кДж • моль-1), a AS, следовательно, равно
—91,6 Дж • К-1. Столь сильное уменьшение энтропии свидетельствует об
увеличении числа молекул воды, образующих гидратные оболочки про-
тонов и ацетат-ионов — продуктов диссоциации. В отличие от этого
^табл. 3-4) диссоциация иона NH4 на NH3 и Н+, в результате которой
вместо одного положительно заряженного иона образуется другой, ха-
рактеризуется величиной АД0, равной +52,5 кДж-моль-1, и сравнитель-
но небольшим изменением энтропии: AS°= —2,0 Дж-К-1.
4. Водородные связи и структура воды
Одним из наиболее важных типов слабых связей между биологиче-
ски активными молекулами является водородная связь (гл. 2,
разд. А.7). Мы уже говорили о том, какова роль дитюль-дитюльного
взаимодействия этого типа для формирования структуры белков, угле-
водов и нуклеиновых кислот. Рассмотрим теперь значение водородных
связей для биологического растворителя — воды.
Биохимики часто пользуются понятием
виду способность больших групп молекул
«структура воды», имея в
воды, находящейся в жид-
ком состоянии (кластеров), образовывать льдоподобные структуры с
помощью водородных связей. В обычном льду все молекулы воды свя-
заны друг с другом водородными связями, причем каждые шесть мо-
лекул образуют шестичленное кольцо, напоминающее кольцо циклогек-
сана. Такая структура характерна для всего кристалла льда, посколь-
ку между молекулами воды соседних колец тоже образуются водород-
ные связи. Каждый атом кислорода связан ковалентно с двумя атома-
ми водорода и, кроме того, образует водородные связи с двумя атома-
ми водорода других молекул воды. (Некоторые из таких водородных
связей указаны на приведенном ниже рисунке пунктирными стрел-
ками.)
Как молекулы соединяются друг с другом 247
Молекулы воды в кристаллах льда могут быть ориентированы раз-
личным образом в пределах гексагональной структуры (см. рисунок).
Они сохраняют свободу вращения и способны поэтому образовывать
водородные связи в разных направлениях. Такого рода неупорядочен-
ность сохраняется и при пониженных температурах, в связи с чем
лед — одно из немногих веществ, обладающих остаточной энтропией
при абсолютном нуле. Необычным свойством льда является также то,
что молекулы воды в кристалле упакованы не наиболее плотным об-
разом, а образуют «открытую» структуру. Диаметр полости внутри ше-
стиугольника, проходящей также через центры шестиугольников, рас-
положенных ниже, составляет приблизительно 0,06 нм.
Хотя многие вопросы, касающиеся структуры жидкой воды, все еще
остаются неясными, наличие льдоподобных кластеров, непрерывно рас-
падающихся и образующихся вновь, можно считать твердо установлен-
ленным; эти кластеры часто называют мерцающими структурами.
Молекулы воды образуют водородные связи не только друг с дру-
гом, но и с полярными группами растворенных соединений. В го же
время любая группа, способная образовывать водородные связи с дру-
гой группой, может образовать водородные связи примерно такой же
прочности и с молекулами воды. Именно поэтому водородные связи да-
леко не всегда способствуют ассоциации малых молекул в водных рас-
творах. Если в неполярном растворителе какие-либо полярные молеку-
лы прочно связываются друг с другом за счет водородных связей, это
отнюдь не означает, что они будут ассоциировать и в воде. Что же в
таком случае позволяет биохимикам утверждать, что водородные связи
играют огромную роль в формировании структуры макромолекул и при
взаимодействии биологически важных соединений? Дело в том, что рав-
новесие между состояниями, при которых пары взаимодействующих мо-
лекул в воде связаны друг с другом водородными связями или диссо-
циированы, легко смещается в ту или другую сторону. Так, например,
белки и нуклеиновые кислоты могут образовывать компактные струк-
туры за счет внутримолекулярных водородных связей между опреде-
ленными группами или же денатурировать вследствие образования во-
дородных связей между данными группами и молекулами воды, при-
чем разница в свободных энергиях этих двух состояний сравнительно
невелика.
Пожалуй, основная причина той огромной роли, которую играют в
биохимии водородные связи, состоит в том, что они часто обеспечивают
комплементарность поверхностей взаимодействующих молекул Други-
ми словами, места расположения групп, образующих водородные свя-
зи, на поверхностях взаимодействующих молекул служат важными
«ориентирами», обеспечивающими точное совмещение поверхностей
этих молекул. Однако силы, обусловливающие агрегацию многих орга-
нических молекул и их связывание друг с другом в водных растворах,
не ограничиваются водородными связями.
5. Гидрофобные связи [2,3,3а]
Как объяснить агрегацию неполярных групп, имеющую место в ми-
целлах, во внутренних областях белковых молекул и в клеточных мем-
бранах? Попытаемся сделать это, воспользовавшись соображениями,
высказанными Дженксом [2].
Рассмотрим процесс перехода гидрофобной молекулы из инертного
растворителя (например, четыреххлористого углерода) в воду, выделив
две основные стадии. 1. В воде образуется «полость», размер которой
248 Глава 4
примерно соответствует размеру растворенной молекулы. Свободная
энергия образования такой полости довольно велика, поскольку этот
процесс сопровождается разрывом большого числа водородных связей.
В основном это энтальпийный (А//) эффект. 2. Теперь молекулы воды
будут стремиться изменить свою ориентацию, приспосабливаясь к при-
сутствию в полости неполярной молекулы. Ясно, что они переориенти-
руются таким образом, чтобы обеспечить оптимальные условия для
вандерваальсовых взаимодействий и образовать максимальное число
водородных связей. В результате такой переориентации число водород-
ных связей может даже увеличиться, поскольку водородные связи в во-
де могут образовываться самым разным образом. Особенно это отно-
сится к низким температурам, когда в воде присутствуют в значитель-
ном количестве льдоподобные структуры. Во многих случаях ограниче-
ние подвижности молекул воды, окружающих гидрофобные группы,
т. е. возрастание структурированности воды, оказывается самым важ-
ным результатом действия гидрофобных сил. При растворении углево-
дородов энтальпия образования новых водородных связей почти пол-
ностью компенсируется энтальпией образования полости. В результа-
те суммарное изменение энтальпии (ДН) при переходе неполярных мо-
лекул из инертного растворителя в воду обычно близко к нулю (как
правило, это небольшая положительная или отрицательная величина).
Вместе с тем уменьшение подвижности молекул воды приводит к зна-
чительному уменьшению энтропии, т. е. дает отрицательное значение
AS. Поскольку &G = AH—TAS, а член TA.S положителен, изменение сво-
бодной энергии при переходе гидрофобной молекулы из инертного рас-
творителя в воду также является величиной положительной, т. е. такой
переход невыгоден с энергетической точки зрения. Именно этим объ-
ясняется плохая растворимость углеводородов в воде.
По тем же причинам молекулы углеводородов стремятся агрегиро-
вать в воде. Процесс образования гидрофобной связи можно предста-
вить себе как перемещение неполярных частей молекул из воды в
«гидрофобные» области, образуемые за счет ассоциации этих частей.
В результате неполярные части оказываются в непосредственной бли-
зости друг от друга, т. е. как бы в окружении неполярного раствори-
теля. Вследствие такого перемещения происходит уменьшение числа
молекул воды, контактирующих с гидрофобными участками растворен-
ного вещества, т. е. разрушение части областей структурированной во-
ды, окружающих гидрофобные поверхности, в результате чего энтропия
раствора возрастает. Следовательно, образование гидрофобной связи
между двумя углеводородными молекулами или алкильными группами
сопровождается обычно увеличением энтропии. Поскольку энтропийный
член TAS чаще всего вносит наибольший вклад в величину свободной
энергии, определяющую значение константы Kt, часто говорят, что гид-
рофобное связывание имеет энтропийную природу. Однако, как под-
черкивал Дженкс, важную роль в гидрофобном взаимодействии игра-
ет сильно выраженная способность молекул воды «сцепляться» друг с
другом, вследствие чего заметный вклад может вносить не только эн-
тропийный член, но и энтальпийная составляющая свободной энергии.
В зависимости от характера взаимодействия растворенного вещест-
ва с водой энтропия образования гидрофобных связей (ASf) может
быть иногда равной нулю или даже отрицательной. Именно это имеет
место в случае гетероциклических соединений, которые содержат как
гидрофобные участки, так и полярные группы, способные образовывать
водородные связи с водой. Хотя эти группы действительно образуют
водородные связи, тем не менее они все же вызывают уменьшение
Как молекулы соединяются друг с другом 249
структурированности окружающей их воды. Это уменьшение иногда
компенсирует или даже превышает то возрастание структурированно-
сти, которое имеет место в областях, окружающих гидрофобные участ-
ки. Следовательно, изменение энтропии при переносе гетероцикличе-
ских молекул в воду может быть положительным. И наоборот, измене-
ние энтропии при ассоциации гетероциклических молекул в воде может
быть отрицательным.
Поскольку структурированность воды, окружающей гетероцикличе-
ские основания, меньше, чем воды, окружающей полностью неполярные
молекулы, изменение энтальпии, которое сопровождает гидрофоб-
ную ассоциацию гетероциклических молекул, может быть достаточно
отрицательным, чтобы ассоциация оказалась выгодной, даже несмотря
на уменьшение энтропии [см. уравнение (2-13), табл. 2-6]. Именно
поэтому основным фактором, определяющим стабилизацию двойной
спирали ДНК, является стопкообразное расположение оснований (стэ-
кинг), обусловленное опять-таки гидрофобным взаимодействием, сопро-
вождающимся в данном случае уменьшением энтропии (AS~
—30 Дж-К-1 на пару оснований) и понижением этальпии от —14 до
—30 кДж-моль-1 (табл. 2-6) [4].
Константа образования Kt при гидрофобной ассоциации часто воз-
растает с ростом температуры, что отличает процесс гидрофобного
взаимодействия от большинства реакций ассоциации с участием по-
лярных молекул. Из уравнения /?lnKf = —ДО°/Т=—&.H°/T+ASa видно,
что для образования прочных ассоциатов необходимо, чтобы либо ве-
личина ДЯ° имела достаточно большое отрицательное значение, либо
AS0 было достаточно большой положительной величиной. Если ДЯ от-
рицательно, как это имеет место для большинства экзергонических ре-
акций (например, при протонировании NH3 ДД° = —52 кДж-моль-1),
то Kt будет уменьшаться с повышением температуры. Однако если
Д5° — это большая положительная величина, то ДД° может быть и по-
ложительным, что часто наблюдается при образовании гидрофобных
ассоциатов. В этом случае Kt будет возрастать с ростом температуры.
Возрастание стабильности при повышении температуры иногда ис-
пользуют в качестве показателя гидрофобной природы связывания.
Следует, однако, отметить, что эта закономерность не характерна для
стэкинг-взаимодействия между комплементарными парами оснований в
полинуклеотидах, которые при высоких температурах становятся менее
стабильными (гл. 2, разд. Г. 10).
В. Количественная оценка прочности связывания
При проведении биохимических исследований постоянно возникает
необходимость оценить прочность связывания различных молекул друг
с другом. Например, для выяснения физиологического значения таких
процессов, как взаимодействие гормона с клеточной мембраной или ин-
гибирование фермента по принципу обратной связи, могут помочь дан-
ные о том, насколько прочны связи гормона с мембраной или фермен-
та с ингибитором. Поэтому важно понимать, каким образом можно
определять прочность связывания и какие трудности при этом возни-
кают.
1. Анализ данных
Способность молекулы X связываться с молекулой Р [уравнение
(4-1)] можно оценить, варьируя концентрации X и Р и определяя, как
250 Глава 4
меняется при этом концентрация комплекса РХ. Прежде всего необхо-
димо выбрать какое-то свойство, которое можно количественно оха-
рактеризовать и по которому комплекс отличается от исходных ком-
понентов. Например, комплекс может быть окрашен, а исходные ком-
поненты бесцветны. Чаще всего комплекс и исходные компоненты по-
разному поглощают свет определенной длины волны, иногда они имеют
.разные спектры кругового дихроизма или разные химические сдвиги
сигналов ЯМР. Если Р — это фермент, то только распад комплекса РХ
.приводит к образованию продуктов реакции. Иногда скорость распада
РХ (фермент-субстратного комплекса) мала по сравнению со скоро-
стью установления равновесия между X, Р и РХ. В этом случае наблю-
даемая скорость образования продукта пропорциональна концентрации
комплекса.
Независимо от того, изменение какого свойства измеряется экспе-
риментально, величина этого изменения должна возрастать по мере
увеличения концентрации X при сохранении концентрации молекул Р
постоянной. Обычно молярная концентрация Р в опытах бывает мала,
а концентрацию X варьируют в весьма широких пределах. В этих усло-
виях при достаточно больших значениях [X] большая часть молекул Р
переходит в РХ и изменение какого-то свойства (допустим ДА) пере-
стает возрастать. Этот эффект, известный под названием насыщение,
наблюдался в большинстве работ по исследованию процесса связыва-
ния, а также во многих физиологических процессах.
Свойство или изменение свойства, которое количественно характери-
зуют (ДА), при насыщении (т. е. когда все вещество Р переходит в РХ)
достигает максимального значения — ЛАтах. Отношение [РХ] к суммар-
ной концентрации всех форм Р, присутствующих в растворе [Р]Поли, на-
зывается степенью насыщения и обозначается через у. Если молекула Р
•имеет более одного центра связывания для X, то величина у характе-
ризует долю занятых центров от общего числа центров связывания.
Если обозначить через п число центров связывания в расчете на одну'
молекулу, то общее число центров связывания будет равно и-[Р]. Ве-
личину у часто принимают равной ДА/ДАтах. Для макромолекул с не-
сколькими центрами связывания это равенство соблюдается только при
условии, что добавление каждой новой молекулы X приводит к оди-
наковому изменению А. Это условие выполняется не всегда, однако ес-
ли оно выполняется, то должно выполняться и следующее соотно-
шение:
V i № -77- АЛ и я>
п [Р]полн — У — ддтах ’
с
Индекс i обозначает число лигандов X, связанных с Р; он может
меняться от 0 до п. При п=1 степень насыщения у и величину ДА мож-
но выразить через концентрацию несвязанного X и константу образо-
вания. Соответствующие соотношения имеют вид
— — Kt [X] д.__A4maxKf [X] ..
1-t-KffX] ’ l-|-Kf[X]
На рис. 4-1 приведена кривая, характеризующая зависимость у
(или ДА) от [X] для некоторой гипотетической реакции (эту кривую
иногда называют изотермой адсорбции, поскольку для получения досто-
верных результатов эксперименты следует проводить при постоянной
температуре). Из рис. 4-1 и уравнения (4-9) можно видеть, что когда
величина [X] в точности равна l/Kt (или Ко), то у = 0,5. Видно также.
Как молекулы соединяются друг с другом 251
что насыщение достигается медленно, и даже в точке, соответствующей
наибольшей концентрации X (8/Kt), степень насыщения не превышает
90%. Поскольку обычно в опытах измеряется ДА (а не у), из кривой
такого типа трудно определить предельное значение ДАшах (за исклю-
чением случаев, когда величина Kt очень велика). Однако для опреде-
ления Kt необходимо знать именно ДАтах. В связи с этим графики,
подобные представленному на рис. 4-1, используются редко, и он при-
РИС. 4-1. Изотерма адсорбции—зависимость степени насыщения у (или изменения
какого-нибудь свойства ДА) от концентрации вещества [X], обратимо связывающего-
ся с макромолекулой. Кривая иосит гиперболический характер; при р=0,5 [Х]=^у
веден нами здесь в основном для иллюстрации вводимых определений.
Кривая, изображенная на рис. 4-1,—это равнобочная гипербола в ко-
ординатах {[X]; у}', кривые насыщения такого типа часто называют
поэтому гиперболическими. Это название подчеркивает отличие изо-
lg[X] —*
РИС 4-2. Кривая насыщения в полулогарифмическом масштабе, построенная по тем
же точкам, что и кривая рис. 4-1.
термы адсорбции от кривых связывания несколько другого вида
(разд. В.7), которые в тех же координатах носят сигмоидный (S-образ-
ный) характер.
Зачастую более удобно строить графики в других координатах,
а именно {lg[X]; у} (рис. 4-2). Перечислим причины, по которым эти
координаты более удобны. 1. Кривая становится симметричной отно-
сительно средней точки, где lg[X]=—lg Kt. 2. Независимо от того, на-
сколько велик диапазон используемых концентраций X, всегда можно
выбрать масштаб, при котором все точки уместятся на одном листке
252 Глава 4
бумаги. 3. Расстояния между точками на кривой, построенной в ука-
занных координатах, приблизительно одинаковы в отличие от графика,
построенного в координатах {[X]; у} (сравните графики, приведенные
на рис. 4-1 и 4-2, на которых экспериментальные точки соответствуют
одним
ДЛт,.ч
к,
и тем же данным, причем каждое последующее значение [X]
ДА
[X]
РИС. 4-3. График Скэтчарда, построенный по
тем же точкам, что и кривые рис. 4-1 и 4-2.
Это самый удобный линейный график для ана-
лиза данных по связыванию.
в два раза больше предыду-
щего). 4. Логарифмическая
шкала такого типа может быть
использована для всех соеди-
нений независимо от прочности
связывания, и форма кривых
для всех комплексов с соот-
ношением компонентов 1:1
одинакова. Наклон кривой
dyld\g[X] в средней точке ра-
вен 0,576; изменение величины
lg[X] при переходе от степени
насыщения 10% к степени на-
сыщения 90% составляет
1,81. Аналогичные кривые хо-
рошо знакомы химикам, по-
скольку они напоминают по
форме кривые титрования, в
которых вместо —lg [X] ис-
пользуется pH. При переходе
от более слабого комплекса к
более прочному кривая смещается влево, и наоборот. Кривые такого
типа очень удобно описывать математически с помощью гиперболиче-
ских функций [4а].
Для графического представления данных по насыщению часто ис-
пользуют другую систему координат, известных под названием коорди-
нат Скэтчарда1 (рис. 4-3). При этом по одной оси_откладывают величи-
ну АА/[Х] (или у/[Х], а по другой — ДА (или у), в результате чего
точки ложатся на прямую. Из уравнения (4-10), непосредственно выте-
кающего из уравнения (4-9), следует, что отрезок, отсекаемый прямой
на оси абсцисс, и наклон прямой непосредственно дают значения ДАтах
и Kt. ;
y/[X]=Af—z/Af,
дд/[Х]=ДАтаЛг-ДЖ- (4-ю>
Прежде чем приступать к получению кривых насыщения, каждому
стоит прочесть прекрасную статью Деранле [5], а для того чтобы луч-
ше понять изложенный далее материал, нужно ознакомиться с работой
Дауда и Риггса [6].
2. Несколько центров связывания в одной молекуле
Из названия этого раздела может показаться, что его тема не столь
уж актуальна, однако в действительности это не так, поскольку моле-
кулы в живых организмах очень часто взаимодействуют более чем с
одной молекулой, и именно это обстоятельство позволяет им функцио-
нировать. Сначала рассмотрим простейшую ситуацию, когда макромо-
1 График Скэтчарда является наилучшим из всех линейных преобразований урав-
нения насыщения, и в частности графика двойных обратных координат (рис. 6-3).
Как молекулы соединяются друг с другом 253
лекула Р последовательно связывается с одной молекулой X, затем со
второй, с третьей и т. д. до п молекул.
Обозначим константы образования, соответствующие каждой из
этих стадий, через Ль К2, Кп-
Р + X <—> РХ,
Кг
РХ-Г X РХ2,
(4-П)
PXn-j+X РХ„.
Выражение для константы образования, соответствующей i-й ста-
дии, имеет вид
К- =----——— (4-12)
1 [РХг-11 [X] v*
Напомним, что величина у — это доля центров, занятых лигандами.
Число молей X, связанных с одним молем Р, равно пу\ оно получается
суммированием концентраций [РХ]+Й[РХ2]+... и делением получен-
ной суммы на сумму концентраций всех форм макромолекулы Р.
Для двух центров связывания (и=2)
[РХ]+2[РХ2] , 13
У~ [Р] + [РХ] + [РХ2] V* °'
В общем случае
(п \ / / п \
£([РХг] / [Р] + £[рХ£] . (4-14)
‘=1 7/ \ i=i J
Суммирование проводится по всем i от 1 до п. Выражая концентра-
цию каждого компонента [РХ,] через концентрации свободных форм
[X] и [Р] и через константы образования, соответствующие отдельным
стадиям, получаем (для и = 2)
кдхн-гклдх]* ,4.15)
^-l + KHXJ+K^IXp- '
Аналогичное уравнение может быть записано и для общего случая.
Обратите внимание, что концентрация Р не входит в уравнение (4-15),
т. е. у является функцией только [X] и констант образования, соответ-
ствующих отдельным стадиям. Такие уравнения описывают изотермы
связывания двух или большего числа молекул X с Р. Из эксперимен-
тально полученного графика, построенного в координатах {[X] (или
lg[X]); у (или ДА)} иногда удается определить константы образования
для соответствующих стадий —Ль 1\2, Кз ... Л». Однако реально решить
такую задачу оказывается довольно сложно. Чтобы упростить уравне-
ние (4-15) и соответствующее уравнение для общего случая, сгруппи-
руем константы образования и обозначим произведения констант (Ль
Л1Л2, Л1Л2Л3... и т. д.) соответственно через фь ф2, фз и т. д. При этом
наши уравнения примут следующий вид:
для п=2
977 Ф1 [X] -[- 2ф2 ]Х]2 С4-16)
У~ Ц-ФПХН-ФИХР ’ 1 '
254 Глава 4
в общем случае
l + S'MXl'Y (4-17>
i=l I \ i—1 /
Из экспериментальных данных часто легче сначала определить про-
изведения констант образования ф (их всего п), а затем вычислить сами-
константы. Например,
#1—фх, ^2=ф2/^1 и т. д. (4-18)
С первого взгляда может показаться, что уравнение (4-17) (уравнение
Эдера) полностью описывает процесс связывания, однако, как правило,
это не так. Зачастую в макромолекуле имеются центры связывания
более чем одного типа, а уравнение (4-17) ничего не говорит нам о ха-
рактере распределения лиганда X между различными центрами в комп-
лексе РХ. Более того, если п велико, то невозможно экспериментально
определить все п констант. Чтобы проанализировать оба вопроса,
рассмотрим микроскопические константы связывания.
3. Микроскопические константы связывания1
Микроскопическая константа относится к определенному центру свя-
зывания. Рассмотрим, например, связывание протона с карбоксилат-
ионом:
R—СОСГ + Н+ у-т* R—СООН. (4-19>
Константа ассоциации2 3 At~6-104 * * (lgKf=4,8). Поскольку карбоксилат*
ион обладает только одним центром связывания, наблюдаемая величи-
на Kf и является микроскопической константой связывания.
Рассмотрим теперь анион пиридоксина, обладающий двумя основны-
ми центрами связывания, а именно —О- и N3).
сн,он
Пиридоксин
(витамин В6)
lg К,* = 8,20 =
К,* = 1,6 • 10*
Р*а*
1g К,* = 8,79 = pKb*
К,* = 6,2 • 108
Протон может присоединиться к каждому из этих двух центров,,
однако микроскопические константы связывания К\ для этих центров-
сильно различаются. Атом азота обладает большим сродством к прото-
ну, т. е. более сильной основностью. Так, например, при 25°C 80% моле-
кул нейтральной (монопротонированной) формы несут протон на атоме-
азота, а остальные 20% протонированы по менее основному кислороду
1 Микроскопические константы иногда называют «истинными» константами, од-
нако последний термин используется в этой книге в более узком смысле. Микроскопи-
ческие константы обозначаются звездочкой.
2 В химии обычно пользуются константой диссоциацией протона Ка (в случае
кислот ее обозначают через /С), которая для R—СООН составляет 1,7-10-5; величина-
рКа равна 4,8 Однако, чтобы не нарушать единообразия, мы будем пользоваться толь-
ко константой ассоциации (связывания).
3 Индексы а н b используются здесь, а также часто и в других учебниках ве для
того, чтобы указать, что соответствующие константы относятся к кислоте или осно-
ванию, а просто для обозначения отдельных стадий ассоциации в соответствии с урав-
нением (4-21).
Как молекулы соединяются друг с другом 255
4. Таутомерия и связывание протона
Две монопротонированные формы пиридоксина представляют собой»
таутомерную пару [см. уравнение (2-3)]. Таутомерное отношение
п__ [Биполярный иои]
[Нейтральная форма]
представляет собой pH-независимую константу равновесия, равную-
при 25 °C 0,796/0,204 = 3,9 [7]. Следует отметить, что для оценки микро-
скопических констант, характеризующих связывание протонов с молеку-
лами, содержащими неодинаковые группы, необходимо знать таутомер-
ное отношение (или отношения, если речь идет о более чем двух цент-
рах связывания). В случае пиридоксина величина R была определена-
спектрофотометрически.
Используя уравнение (4-20), в котором [РХ]д и [РХ]В представля-
ют собой концентрации двух таутомерных форм пиридоксина, можно
рассчитать значение микроскопических констант.
= [РХ1грпхГ]В =^+ ^ь. (4-20)-
Видно, что величина Кл представляет собой просто сумму двух микро-
скопических констант для процессов присоединения протона, приводя-
щих к образованию двух таутомерных форм РХ(А) и РХ(В). Аналогич-
ным образом можно показать, что величина /С2 прямо связана с микро-
скопическими константами, характеризующими присоединение второй-
молекулы X [уравнения (4-21) и (4-22)] °:
1/А2=1/л;+1/№
(4-21)»
(4-22).
Поскольку таутомерное отношение R равно [РХ]д/[РХ]в, уравнения-
(4-20) и (4-22) можно записать в следующем виде:
Х1==Л;(1 + 1/7?) и (4-23)
1/Х2=(1 + 1//?)/Х- и Ka=RK'c. (4-24)
Спектрофотометрические измерения показали, что в случае пиридок-
сина lg /(i=8,89, a 1g/<2=4,94. Эти значения в сочетании с эксперимен-
тально определенной величиной таутомерного отношения R позволили,
определить микроскопические константы.
Поскольку определить таутомерные отношения обычно довольна
трудно, микроскопические константы аппроксимируют константами-
связывания, измеренными для соответствующих соединений, у которых
одна из основных групп метилирована, этерифицирована или блокиро-
1 В химической литературе чаще всего используют коистаиты диссоциации, а ие
коистаиты связывания (ассоциации). Так, например, если X — это протон, то в урав-
нении (4-21) стрелки имеют обратное направление. При этом микроскопические кои-
стаиты диссоциации РНа обозначают Ка и Кь, а константу диссоциации, характеризую-
щую стадию отщепления первого протона, — Ki-
256 Глава 4
вана каким-нибудь иным способом. Рассмотрим протонирование двух
таутомерных форм очень слабого основания 1-метилурацила:
Были измерены кажущиеся константы (lg 7(f) протонирования двух
приведенных ниже диметилированных производных [8]. В обоих слу-
чаях получаются катионы, аналогичные приведенным в уравнении
(4-25).
С полным основанием можно считать, что полученные значения р/Са
примерно равны 1g Кс и lg Ка (что и указано выше). Отсюда, используя
уравнение (4-24), получаем, что lgRяз0,65 + 3,25=3,9. Это значит, что
большая часть молекул 1-метилурацила [уравнение (4-25)] находится
в таутомерной форме А1.
Наряду с таутомерией, сопровождающей связывание протонов и дру-
гих небольших лигандов с белками [10, 11], внимание биохимиков всег-
да привлекал вопрос о таутомерии монопротонированных форм цистеи-
на, глутатиона и других аминокислот и пептидов [9, 9а].
5. Статистические эффекты
Рассмотрим дикарбоновую кислоту с неразветвленной цепью, содер-
жащую два идентичных центра связывания. Если цепь, соединяющая
два карбоксилат-аниона, достаточно велика, то карбоксильные группы
1 Этот результат позволяет предположить, что в пределах ошибки измерения ве-
личина рКа (lg Кг) для 1-метилурацила равна 1g К'с, а именно —3,25. Хотя она дей-
ствительно оказалась близкой к этому значению (—3,40), однако не настолько, чтобы
можно было уверенно использовать ее для точной количественной оценки R. Авторы
работы [8] определили значение R также и независимым способом.
Как молекулы соединяются друг с другом 257
будут находиться настолько далеко друг от друга, что действием элек-
тростатических сил между ними можно пренебречь.
-ООС—
К* = 5 104
СОСГ
к* = 5 • 104
Каждая группа характеризуется микроскопической константой свя-
зывания (К*), равной 5-Ю4 (которую можно назвать также истинной
константой связывания, так как она относится к карбоксильной группе,
не взаимодействующей с другими группами). Интуитивно ясно, что
в отношении связывания протонов раствор дианиона дикарбоновой кис-
лоты должен вести себя точно так же, как раствор моноаниона
R—СОО~ вдвое большей концентрации. Если это действительно так, то
для характеристики обоих центров связывания достаточно знать одну
истинную константу. Тем не менее, как это ни странно, константы обра-
зования Ki и Кг, соответствующие связыванию первого и второго про-
тонов, оказываются неодинаковыми: Ai=10-104; /<2=2,5-104. Этот
факт обусловлен так называемым статистическим эффектом. На первой
стадии протон может присоединиться к любой из двух карбоксильных
групп, и образующиеся при этом молекулы будут неразличимы:
СОСГ
р/
СОО'
соон
В
\оон
(4-26),
Р PH РНг
Если обозначить две формы PH через А и В [уравнение (4-26)] и
считать, что каждая из них связана с Р независимой равновесной ста-
дией, характеризуемой микроскопической константой образования К*,
то из уравнений (4-23) и (4-24) будет следовать, что
К1== 'Р~[Р]Тй^В =2К* и
(4-27)
Природа рассмотренного эффекта носит чисто вероятностный характер.
В ее основе лежит та же причина, по которой пару шаров разного цве-
та вытаскивают из урны, содержащей 50% белых и 50% черных шаров,
в среднем в 2 раза чаще, чем пару шаров одного цвета. В общем случае,
когда молекула Р содержит п центров связывания, соотношение между
микроскопическими константами образования К* и константами Ki,
характеризующими отдельные стадии связывания, имеет следующий
вид [12, 13]:
(4-28)
258 Глава 4
Используя уравнения (4-17) и (4-28), легко показать также, что для
идентичных и независимых центров связывания справедливы следующие
соотношения:
- К*[Х] (1 + К* [Х1)л-*
у ~ (1 + К* [X])"
или
- . к* [X]
у~ 14-К*[Х] ’
(4-29)
(4-30)
В этом случае все микроскопические константы образования оказывают-
ся равными и представляют собой одну истинную константу, относя-
щуюся ко всем центрам связывания. Действительно, уравнение (4-30)
совпадает с аналогичным уравнением, описывающим присоединение
одного протона (или какого-нибудь другого лиганда) к молекуле, обла-
дающей одним центром связывания. Это согласуется с нашим, уже упо-
минавшимся выше интуитивным представлением, согласно которому
раствор вещества, молекулы которого содержат п независимых центров
связывания, должен вести себя точно так же, как в п раз более кон-
центрированный раствор вещества с одним центром на молекулу. Таким
образом, все наши расчеты только подтверждают выводы, и так логиче-
ски вытекающие из физических представлений. Однако в действитель-
ности центры связывания в одной макромолекуле редко бывают абсо-
лютно независимыми; почти всегда между ними есть какое-то взаимо-
действие, и для этих случаев вполне применимы уравнения, выведенные
нами для определения констант, относящихся к отдельным стадиям
процесса связывания, н истинных констант.
6. Электростатическое отталкивание. Антикооперативность
Как уже говорилось выше, гипотетическая дикарбоновая кислота
с бесконечно удаленными друг от друга карбоксильными группами, для
которой lgK* = 4,8, характеризуется двумя константами связывания;
различия между ними (см. первую строчку табл. 4-1) обусловлены ста-
тистическим фактором (1g 4 = 0,6). Наблюдаемые значения констант
связывания протонов дианионами кислот, содержащих 7, 4, 2 и 1
СН2-группу, приведены в табл. 4-1. Для кислоты с самой длинной
Таблица 4-1
Коистаиты связывания протонов дикарбоиовыми кислотами3
Дяавион кислоты Число СНг-групп 1g Ki 1g Кг
Гипотетический диаииои с 1g А*=4,8 оо 5,1 4,5
Диаиион азелаиновой кислоты 7 5,41 4,55
Диаииои адипиновой кислоты 4 5,41 4,42
Диаииои янтарной кислоты 2 5,48 4,19
Диаиион малоновой кислоты 1 5,69 2,83
а Из Bell R. Р., The Proton in Chemistry, 2nd ed., p. 96. Cornell Univ. Press.,
Ithaca, New York, 1973.
цепью (азелаиновая кислота) значения lg^ близки к таковым для гипо-
тетической кислоты с бесконечно длинной цепью. Однако, чем ближе
друг к другу расположены карбоксильные группы, тем сильнее отли-
Как молекулы соединяются друг с другом 259
чается их поведение от предсказанного на основании гипотетической
модели. Первая константа связывания заметно возрастает из-за допол-
нительного электростатического притяжения, а вторая уменьшается1.
Взаимодействие между центрами связывания приводит к тому, что раз-
ница между двумя значениями 1g К возрастает от 0,6 до 2,9. Таким
образом, присоединение первого протона затрудняет присоединение
РИС. 4-4 Связывание протонов с ацетат-аиионом, сукцинат-дианноиом и тиамии-анио-
ном. Кривая, относящаяся к связыванию одного протона ацетат-анионом (пунктир),
имеет обычный для таких процессов наклон. Связывание двух протонов сукцинат-ди-
анионом является антикооперативным процессом, поэтому кривая становится более
растянутой. Связывание двух протонов тиамии-анионом [уравнение (4-31)]—это пол-
ностью кооперативный процесс; кривая более крутая.
второго. Такое отрицательное взаимное влияние, или антикооператив-
ность, во взаимодействиях между центрами связывания встречается
очень часто; оно всегда приводит к увеличению разницы между констан-
тами образования, что проявляется в «растягивании» кривой, характе-
ризующей зависимость у от lg X. На рис. 4-4 в качестве примера сопо-
ставлены кривые связывания протона ацетат-анионом и сукцин<ат-диа-
нионом.
Антикооперативность при связывании протонов естественно вытекает
из элементарных соображений электростатики. Соответствующие расче-
ты можно провести, исходя из уравнения (4-7), если известно значение
константы диэлектрической проницаемости среды. Разность между
значениями логарифмов двух последовательных констант 1g К, за выче-
том 0,6 (статистический фактор) может служить мерой влияния элек-
тростатических сил. Для малоновой кислоты величина АрА составляет
2,25, а для янтарной — 0,69 (табл. 4-1). В 1923 г. Н. Бьерум предполо-
жил, что АрА можно прямо связать с работой, затрачиваемой на сбли-
1 Заметим, что в случае малоновой и янтарной кислот первый присоединившийся
протон может оказаться общим для обеих карбоксильных групп из-за образования
водородной связи. В случае же щавелевой кислоты, где карбоксильные группы непо-
средственно примыкают друг к другу, действуют дополнительные факторы, в связи
с чем значения рК для нее равны 4,19 и 1,23.
17*
260 Глава 4
жение двух отрицательных зарядов до расстояния между зарядами
в дианионе малоната:
Из уравнения (3-30) получаем, что AG для аниона малоновой кислоты
равно 5,708-Др7< кДж-моль-1 = 12,84 кДж-моль-1. Приравняв это зна-
чение работе W [уравнение (4-7)] и приняв диэлектрическую постоян-
ную равной 78,5 (диэлектрическая постоянная для воды), получим, что
расстояние между зарядами г составляет 0,138 нм. Поскольку это зна-
чительно меньше реального расстояния между зарядами, Вестхаймер
и Кирквуд внесли поправку в расчет, предположив, что диэлектрическая
постоянная внутри молекулы равна 2. Приняв, что молекула имеет фор-
му эллипсоида вращения, им удалось достаточно точно рассчитать влия-
ние электростатических сил на рКа [15]. Так, например, для дианиона
малоновой кислоты в работе [16] получено значение г=0,41 нм.
Законы электростатики были с успехом использованы также при
интерпретации кривых титрования белков, суммарный отрицательный
или положительный заряд поверхности которых непрерывно меняется
по мере роста числа присоединившихся протонов при переходе от высо-
ких значений pH к низким [17].
Электростатические эффекты могут передаваться с высокой эффек-
тивностью через систему ароматических колец. Это обстоятельство, не-
сомненно, очень важно для функционирования биологически активных
молекул, содержащих гетероциклические ароматические системы.
Рассмотрим влияние степени протонирования азота пиридинового коль-
ца на величину микроскопической константы связывания протона фе-
нолят-анионом пиридоксина:
1g К,* = 8,20
lg Kt* = 4.94
Мы видим, что Др7<=3,26; это превышает даже значение Др/С для ма-
лоновой кислоты.
Электростатические эффекты в таких ароматических системах, как
правило, удовлетворительно описываются уравнением Гаммета. В каче-
стве упражнения можно сначала рассчитать четыре микроскопические
константы диссоциации для 3-оксипиридина, используя значения кон-
стант, соответствующих разным стадиям, /?/(а = 4,91 и 9,62, а также зна-
чение таутомерного отношения [7]
r___ [БИПОЛЯРНЫЙ ИОН] । Qg
[Незаряженный таутомер] ’ ’
Как молекулы соединяются друг с другом
261
а затем вычислить те же константы на основании уравнения Гаммета
[уравнение (3-66)] и сравнить полученные результаты [18].
7. Кооперативные процессы
Может ли взаимодействие между группами приводить к увеличению
значений констант, характеризующих последовательные этапы присо-
единения лигандов? С первого взгляда это кажется невозможным,
поскольку означает, что истинная константа связывания для второго
протона больше, чем для первого, а здравый смысл подсказывает нам,
что первый протон будет соединяться с тем центром, для которого кон-
станта связывания больше, а не меньше. Посмотрим, однако, на экспе-
риментальную кривую связывания протонов с анионом тиамина
(рис. 4-4). По сравнению с аналогичной кривой для ацетат-иона она
не только не растягивается, а, напротив, становится вдвое более крутой.
Это явление объясняется некоторыми удивительными особенностями
химического строения тиамина (витамина В]). При определенных усло-
виях этот витамин может кристаллизоваться в виде натриевой соли
желтого цвета; структура соответствующего аниона показана ниже.
Слабое связывание протона с одним из атомов азота [уравнение (4-31)]
приводит к уменьшению электронной плотности на соседнем атоме
углерода, к которому присоединяется отрицательно заряженный атом
серы, замыкая кольцо неустойчивой трициклической формы тиамина1.
•В результате раскрытия кольца
зЬесь образуется центр связывания
протона с сильно выравненными
Основными свойствами
„ Трициклическая ”
нестабильная форма
Эта циклическая форма устойчива в метаноле и может быть выделена
в кристаллическом виде. В воде же она очень неустойчива, поскольку
центральное кольцо в этом растворителе может раскрываться; после-
дующее смещение электронов (как это показано маленькими стрелка-
' Подробнее этот вопрос рассмотрен в гл. 8, разд. Г, а также в работах [19]
и [20]
262 Глава 4
ми) к атому азота сильно повышает его основность. Затем с этим
основным атомом азота очень прочно связывается второй протон, в ре-
зультате чего образуется катион. Таким образом, причиной обратного
порядка изменения констант связывания является внутримолекулярная
перегруппировка, происходящая в период между связыванием первого
и второго протонов. В данном конкретном случае мы, по существу, не
можем измерить константы последовательного связывания Л1 и Х2, по-
скольку Кг намного больше Кх (вероятно, на один или более порядков).
Вследствие этого наклон средней части кривой связывания (рис. 4-4)
в пределах ошибки измерения увеличивается в два раза (2-0,576) по
сравнению с соответствующей кривой для _ацетат-аниона. Эта кривая
точно описывается уравнением (4-32), где К—^КхКг- Сравнение урав-
нений (4-32) и (4-15) показывает, насколько проще первое из них.
Связано это с тем, что при наличии кооперативности концентрация
продукта, образующегося при присоединении первого лиганда, РХ,
пренебрежимо мала.
- Л? [XI3
У 1 + Я®[Х]г ’
(4-32)
Связывание протона анионом тиамина — это пример кооперативного
процесса, названного так потому, что присоединение первого протона
облегчает присоединение второго. При связывании небольших молекул
кооперативные процессы встречаются сравнительно редко, однако в био-
химии они распространены чрезвычайно широко и играют большую
роль. Кривую кооперативного связывания называют сигмоидной (S-об-
разной), поскольку график зависимости у от [X] (изотерма связывания)
имеет S-образную форму. Процесс связывания называется полностью
кооперативным, если возможная степень кооперативности максимальна
Это значит, что /?-й центр связывания с лигандом X практически не об-
ладает сродством к X до тех пор, пока не заняты остальные (п—1)
центров. Однако после того как эти центры будут заняты, сродство
п-го центра к X возрастает настолько сильно, что в любой равновесной
смеси присутствуют в значительных количествах только Р и РХ„.
Легко показать, что степень насыщения у для случая полностью
кооперативного связывания на п центрах есть
-= кп [х]»
У~~ 1 + Кп [ХР ’
где К = (Кх— КпУ/п. Тангенс угла наклона в средней части кривой, по-
строенной в координатах {lg[X]; у}, равен 0,576 п, а изменение lg[X]
при изменении у от 0,1 до 0,9 составляет 1,81/п.
Уравнение (4-33) можно переписать в следующем виде:
р/(1-^) = КПХр. (4-34)
Прологарифмировав его, получаем
lg[?/(l— У)}=п lgK+nlg[X], (4-35)
Прямая, являющаяся графическим представлением зависимости
lg[l//(l— £/) ] от 1g [X] , называется графиком Хилла; ее наклон равен п.
Напомним, что уравнение (4-34) было вывезено для идеального
случая полной кооперативности связывания лиганда всеми п центрами.
Тем не менее биохимики часто пользуются графиками Хилла для ана-
Как молекулы соединяются друг с другом 263
лиза процессов, кооперативность которых не является полной. В этих
случаях экспериментально получаемый тангенс угла наклона прямой
Хилла (пхилла) будет меньше числа центров связывания.
Отличие Их илла от и часто используют в качестве показателя степени
кооперативности. Для полностью кооперативных процессов отношение
«хилла/n равно 1,00, а для случаев неполной кооперативности оно мень-
ше 1. Чтобы определить Пхилла, не обязательно строить график Хилла.
Для этого достаточно точно измерить тангенс угла наклона в средней
части обычной кривой связывания, построенной в координатах {lg[X]; у
(или ДА)}. Помимо этого, можно определить Alg[X], соответствую-
щее изменению у от 0,1 до 0,9, и далее из уравнения (4-36) рассчитать
^Хилла-
tg угла наклона в средней части кривой 1,81 /Л
«Хилла =-------------оЗгё-------------- ' <4’36)
Отметим, что иногда графики Хилла не имеют форму прямых и не мо-
гут использоваться для определения степени кооперативности.
Вторым примером кооперативного процесса служит обратимая дена-
турация свернутых полипептидных цепей. Значение pH среды растворов
некоторых белков можно довести приблизительно до 4 добавлением
кислоты без протонирования при этом групп, «упрятанных» внутрь бел-
ковой глобулы, для которых р/С>4. При дальнейшем добавлении не-
большого количества кислоты происходит протонирование какой-то ме-
нее основной группы, что вызывает разворачивание полипептидной цепи
и делает доступными для протонирования ранее упрятанные в структуре
более основные группы. Таким образом, связывание протона в данном
случае является кооперативным процессом, причем, как и для тиа-
мина, причиной кооперативности служит конформационное изменение,
вызываемое протонированием определенной группы.
Другой тип кооперативности в молекуле белка обнаруживается при
обратимом конформационном переходе между а-спиралью и беспоря-
дочным клубком. Если создать условия, при которых более устойчивой
является спиральная конформация, то все молекулы, которые находятся
в состоянии беспорядочного клубка, быстро примут форму спирали.
Аналогичным образом в условиях, при которых более устойчивой кон-
формацией является беспорядочный клубок, все спирали расплетутся и
произойдет полное их превращение в клубки. Плавление ДНК (гл. 2,
разд. 10), как и любого кристалла, происходит кооперативно [21].
Формирование новой полинуклеотидной цепи на комплементарной мат-
рице, приводящее к возникновению стэкинг-взаимодействий, также мо-
жет быть кооперативным процессом. Так, например, формирование цепи
полиадениловой кислоты на двух цепях полиуридиловой кислоты приво-
дит к кооперативному образованию комплекса, представляющего собой
тройную спираль (гл. 2, разд. Г.6). Наличие стэкинг-взаимодействия
делает рост спирали энергетически более выгодным, чем инициацию
новых спиральных участков [22]. Проблеме кооперативности посвящена
обширная литература, в частности работы [23—25].
8. Связывание ионов металлов
Состояние равновесия при образовании комплексных ионов с метал-
лами описывается точно так же, как и при связывании малых молекул
и ионов с макромолекулами [26—28]. Для образования комплексов,
содержащих один, два или большее число лигандов X, связанных
с центральным ионом металла, определяются соответствующие констан-
264 Глава 4
Таблица 4-2
Логарифмы констант связывания для некоторых комплексов
металлов при 25 °Са
Лиганд н+ Mg2+ Са2+ Мп2+ Си2+ Zn2+
Гидроксил-иои, ОН- 14,0 2,5 1,4 6,5 4,4
Ацетат- 4,7 ~0,65 0,5 ~1 ,0 2,0 1,5
Лактат- 3,8 ~1,0 ~1,2 1,3 3,0 2,2
Сукцинат2- 5,2 1,2 1 ,2 3,3 2
NH3 9,3 ~0 —0,2 0,8 4,0 2,4
Этилендиамин 10,2 0,4 2,8 10,8 6,0
Глицин- 9,6 2,2 1,4* 2,8 8,2 5,0
Глицинамид 8,1 -—1,5 5,3 3,3
Аланин- 9,7 2,0* 1 ,2* 3,0* 8,1 4,6
Аспартат2- 9,6 2,4 1 ,6 8,6 5,8
Глицилглицни- 8,1 1 2* 2,2* 5,5 3,4
Пиридин 5,2 0,1 2,5 1
Имидазол 7,5 1,6 4,6 2,6
Гистидин 9,1 3,3 10,2 6,6
Аденин 9,8 8,9 6,4
Цитрат3- 5,6 3,2 4,8 3,5 —4 4,7
ЭДТА4- 6 10,2 8,8 10,6 13,8 18,7 16,4
ЭГТА4- в 9,4 5,3 10,9 12,2 17,6 12,6
АТР4- 6,5 4,2 3,8 4,8 6,1 4,9
а Все значения относятся к lg Ki. Для протонов приведены максималь-
ные значения. Данные для аминокислот взяты из работы [28], остальные
данные — из работы [28а]. Большая часть констант для аминокислот отно-
сится к растворам с ионной силой 0,1, а некоторые, отмеченные звездочкой,—
к растворам с ионной силой, равной 0. Значения, приведенные для других
лигандов, отобраны из большого числа имеющихся в литературе значений
без указания первоисточника.
6 Этилендиаминтетрауксусная кислота (ЭДТА)
-ООС— Н2С\ /СН2—соо-
N—СН2—СН2—N
-оос—н2с/ \сн2—соо-
— комплексообразующий агент, широко используемый биохимиками для
предотвращения нежелательного влияния ионов двухвалентных металлов.
Благодаря высоким константам связывания ионов металлов этим агентом
большинство из них в растворе связывается с ЭДТА.
3 ЭГТА — соединение, аналогичное ЭДТА; но в молекуле ЭГТА атомы
азота связаны через —СН2—СН2—О—СН2—СН2—О—СН2—СН2-группу, а не
через —СН2—СН2-группу. Обратите внимание, что ЭГТА обладает большей
избирательностью по отношению к ионам Са2+ по сравнению с ионами Mg2+,
чем ЭДТА.
ты. При этом вместо буквы Р, которой мы пользовались в предыдущих
уравнениях, обычно употребляют букву М (металл), вместо X — L (ли-
ганд), а вместо ф — (3. Таким образом,
₽П=К1К2...К„. (4-37)
Как молекулы соединяются друг с другом 265-
Многие важные вопросы, касающиеся связывания ионов металлов
в живых клетках, до сих пор остаются неясными. Например, какая
доля ионов данного металла, присутствующего в клетке, находится
в свободном виде, а какая связана с органическими молекулами?
С какими лигандами связывается металл? Поскольку многие металлы
токсичны в больших количествах, ясно, что должны существовать ка-
кие-то механизмы гомеостаза. На чем может быть основана чувстви-
тельность этих механизмов к изменению концентрации свободных ионов
металла в клетке? Каким образом организму удается избавиться от
ненужных ионов металлов? Чтобы ответить на все эти вопросы, необхо-
димо понять количественные закономерности, определяющие связыва-
ние ионов с потенциальными центрами связывания в молекулах различ-
ных веществ, содержащихся в клетке.
В табл. 4-2 приведены значения логарифмов констант образования
комплексов между нонами некоторых металлов и органическими н неор-
ганическими лигандами при соотношении 1 : 1 [28, 28а]. Когда известно
несколько констант, соответствующих последовательным стадиям свя-
зывания, приводится только значение 1g Kt. Во многих случаях, однако,
с одним ионом может связываться два или большее число лигандов.
Так, например, известно, что взаимодействие между ионом двухвалент-
ной меди и аммиаком характеризуется четырьмя константами
Cu2+-j-NH3,
JgK.=4,0; 3,3; 2,7; 2,0.
Следует отметить, что различия между последовательными значе-
ниями логарифмов констант превышают те различия, которые можно
было бы ожидать, учитывая статистический эффект для случая эквива-
лентных центров. Как отмечалось выше, для двух таких центров это
различие равно 0,6, а в данном случае оно должно быть еще меньше.
Таким образом, при последовательном присоединении лигандов в рас-
сматриваемом примере, как и во многих других, имеет место антикоопе-
ративный эффект.
Большинство ионов металлов может последовательно связываться
с двумя или тремя аминокислотами. С ионом меди, для которого коор-
динационное число чаще всего равно 4, могут связываться два лиганда.
В этом случае имеет место четко выраженная антикооперативность,
которая проявляется в большом различии между значениями первой и
второй констант связывания.
Си2+ 4- Аланин,
1g к.=8,1; 6,8.
а. Факторы, влияющие на прочность связывания металла в комплексе
Важным фактором, влияющим на связывание металла, является
основность лиганда. Чем выше основность, тем легче лиганд связывает
ионы металла, совершенно аналогично тому, как при связывании про-
тонов. Однако в случае нонов металлов прочность связывания пропор-
циональна не основности, а нуклеофильности лиганда, лишь частично
определяемой основностью (гл. 7, разд. В.1).
Сильное влияние на связывание металлов оказывает pH среды.
Конкуренция металла с протоном приводит к тому, что стабильность
комплексов металлов уменьшается по мере понижения pH. Например,
анионы карбоновых кислот при рН<4 практически полностью протони-
рованы, и ионы металла могут связываться с ними, лишь вытесняя
266 Глава 4
«ротоны, а при рН^г7 конкуренция с протонами отсутствует. В случае
же этилендиамина, для которого рКа равны 10,7 и 7,5 (табл. 4-2), про-
тоны при этих значениях pH весьма успешно конкурируют даже с таким
сильным комплексообразующим ионом, как Си2+. При высоких значе-
ниях pH в качестве конкурента лиганда начинает выступать гидрок-
сильная группа. Так, например, при pH 7 приблизительно половина
находящихся в растворе ионов Си2+ оказывается в форме комплекса
СиОН+.
Одним из основных факторов, определяющих сродство органических
молекул к ионам металла, является хелатный эффект1. Под этим тер-
мином понимается четко выраженная способность органической моле-
кулы связывать ионы металлов при наличии в ней двух или большего
•числа групп, способных к комплексообразованию. Природа с успехом
использовала хелатный эффект при создании таких важных металлсо-
держащих молекул, как порфирины (рис. 10-1), хлорофилл (рис. 13-19),
энтеробактин (рис. 2-44), кальций-связывающие белки (разд. В, 8, в)
« т. д. Данные, приведенные в табл. 4-2, показывают, что прочные хе-
латные комплексы образуют также многие относительно простые со-
единения, такие, как а-аминокислоты или лимонная кислота.
•б. Влияние природы иона металла на образование хелатных
комплексов
Константы образования хелатных комплексов зависят от заряда,
радиуса (табл. 4-3), степени гидратации иона металла и формы его
электронных орбиталей, участвующих в образовании ковалентной свя-
зи с хелатной группой. Многозарядные ионы образуют, как правило,
«более прочные комплексы, чем однозарядные ионы, обладающие мень-
Таблица 4-3
Мойные радиусы некоторых ионов металлов и неметаллов8, нм
L1+ 0,060 Mn2+ Fe2+ 0,080 0,076 H- 0,21
Na+ 0,095 Co2+ 0,074 F" 0,136
К+ .0,133 Ni2+ 0,069 Br- 0,195
Rb+ 0,148 Cu2+ 0,0726 I- 0,216
Zn2+ 0,074
Cd2+ 0,097
Ве2+ 0,031
Mg2+ 0,065 AP+ 0,050
Са2+ 0,099 Fe3+ 0,064
Sr2+ 0,113 Mo4+ 0,070
Ва2+ 0,135 Mo6+ 0,062
• Приведенные значения ионных радиусов рассчитаны по методу По-
линга н взяты нз книги Cotton F. A., Wilkinson G., Advanced Inorganic
Chemistry, 3rd ed. Wiley (Interscience), New York, 1972.
6 По данным Ahrens L.; нз Sienko M. J., Plane R. A., Physical Inor-
ganic Chemistry, pp. 68—69, Benjamin, New York, 1963.
1 Слово «хелат» греческого происхождения н в переводе означает «клешня
«раба».
Как молекулы соединяются друг с другом 267
шей плотностью заряда. Чем меньше радиус иона, тем при данной вели-
чине заряда (например, Na+ и К+; Mg2+ и Са2+) сильнее гидратирован
этот ион по сравнению с более крупными ионами, в которых заряд рас-
пределен по большей поверхности.
Большинство катионов, за исключением самых крупных, имеет
первичную гидратную оболочку, образованную примерно шестью моле-
кулами воды. Четыре из них располагаются в одной плоскости вокруг
иона, как это показано для случая иона Mg2+ на приведенном ниже
рисунке [29].
Сверху и снизу с помощью координационных связей присоединяются
еще две молекулы воды, в результате чего образуется октаэдрическая
структура. Далее формируется менее плотная вторичная сферическая
оболочка. В опытах по электрохимическому переносу было показано,
что вокруг иона Na+ находится в сумме ~16 молекул воды, а вокруг
иона К4" ~ 10 молекул.
Для образования хелатного комплекса ион металла должен, как
правило, потерять большую часть своей гидратной оболочки.
По этой причине крупные и менее гидратированные ионы металлов
часто связываются с лигандами прочнее, чем небольшие, сильно гидра-
тированные ионы. Так, например, ионы Са2+ связываются с ЭДТА
прочнее, чем ионы Mg2+ (табл. 4-2). Однако иногда наблюдается и об-
ратная картина, особенно когда имеются отрицательно заряженные
лиганды (например, ОН-), обладающие более высокой плотностью за-
ряда. Заметим, что ионы Mg2+ связываются с АТР4- (табл. 4-2; гл. 3,
разд. Б. 5) более прочно, чем ионы Са2+. Такого типа особенности
лежат в основе очень важных различий биологического поведения раз-
ных ионов.
Ниже приведен хорошо известный ряд металлов первой переходной
группы
Мп2+ < Fe2+ < Со2* <Ni2+ < Cu2+ > Zn2+
На основании законов электростатики, учитывая потенциалы иони-
зации или электроотрицательность ионов, можно было бы ожидать, что
стабильность хелатных комплексов при переходе от марганца к цинку
будет монотонно возрастать. В действительности же самые прочные
комплексы с азотсодержащими лигандами образуют ионы Си2+
(табл. 4-2). Ионы кобальта, никеля и железа также образуют весьма
прочные комплексы с такими лигандами, что объясняется, по-видимому,
способностью переходных металлов предоставлять свои d-орбитали для
образования координационных связей за счет акцептирования электро-
нов лигандов. Весьма важным представляется тот факт, что ионы желе-
за, меди и кобальта часто располагаются в центрах специфических азот-
содержащих структур, например гема (рис. 10-1) и витамина Bi2
(дополнение 8-Л).
268 Глава 4
С какими лигандами преимущественно связываются ионы в клет-
ках? Ионы щелочных металлов (Na+ и К+) присутствуют в основном
в свободном виде, однако часть из них связана со специфическими
участками в белках. Аналогично Са2+ и Mg2+ существуют как в свобод-
ном виде, так и в виде комплексов с присутствующими в клетках много-
численными фосфатными и карбоксилатными ионами. Что же касается
ионов более тяжелых металлов (таких, как цинк, медь, железо и другие
переходные металлы), то они лучше всего связываются с атомами азота
и серы, часто в таких специфических молекулах, как, например, пор-
фирины.
в. Центры связывания металлов в белках
Многие металлопротеиды содержат особые металл-связывающие-
простетические группы, примером которых может служить порфирино-
вая группа в гемоглобине (рис. 10-1). Иногда специфический центр свя-
зывания создается кластерами из карбоксильных, имидазольных или
других групп. В качестве одного из лигандов в некоторых белках может
выступать NH-группа пептидной связи, которая утратила протон. Не-
большие пептиды реагируют с ионами Си2+, образуя комплексы [30,
31]; в некоторых из них ион меди ковалентно связан с азотом амидной
группы [уравнение (4-38), стадия б].
Н2
Си(Н2О)
Глицил глицин-анион
(4-38)
В специальных кальций-связывающих белках, или «парвальбуми-
нах», ион Са2+ связан как с амидной группой, так и с кластером карбок-
силат-ионов. Установлена трехмерная структура такого белка из мышцы
карпа (рис. 4-5). В этом белке имеется два центра связывания для
кальция. В одном из них (рис. 4-5, А, слева) ион Са2+ связан с четырь-
мя карбоксильными группами боковых цепей остатков аспарагиновой и
глутаминовой кислот, с гидроксильной группой остатка серина, а также-
с карбонильным кислородом 57-го остатка пептидной цепи. Заметим,
что эта же самая пептидная группа связана водородной связью с кар-
бонильной группой другого сегмента полипептидной цепи, расположен-
ного рядом со вторым центром связывания иона Са2+ (рис. 4-5,Аг
справа). Этот центр содержит четыре карбоксилат-иона (один из кото-
рых осуществляет координационное связывание иона Са2+ обоими ато-
мами кислорода) и карбонильную пептидную группу. Значение данной
Как молекулы соединяются друг с другом 269
н
Б
РИС. 4-5. А. Часть полипептидной цепи кальций-связывающего белка мышцы карпа,
содержащей 108 аминокислотных остатков. Показаны две петли, связывающие ионы
кальция, и водородная связь между ними. Б. Система водородных связей, связываю-
щих два сегмента полипептидной цепи внутри молекулы. Обратите внимание на связь
между гуанидиновой группой остатка аргинина (75) и карбоксилатом остатка глута-
миновой кислоты (81), а также карбонильной группой пептидной связи 18-го остатка.
Обратите внимание и на то, что карбоксилат взаимодействует также с двумя пептид-
ными ЫН-группами [32, 32а].
270 Глава 4
структуры не совсем ясно, однако анализ схемы, представленной на
рис. 4-5, приводит к выводу, что образование хелатных комплексов мо-
жет обусловливать значительные конформационные изменения в струк-
туре белка за счет сближения некоторых основных групп. Образование
таких комплексов делает также структуру молекулы более жесткой, что
может иметь большое значение для ее биологической активности.
Хорошо известно, что ионы кальция поступают в цитоплазму в ответ
на нервную стимуляцию и что именно они вызывают различные ответ-
ные реакции в организме, такие, например, как мышечное сокращение.
Весьма вероятно, что в результате присоединения ионов Са2+ к специ-
фическим центрам связывания (как это имеет место, например, в каль-
ций-связывающем белке карпа) в молекуле происходят конформацион-
ные изменения, инициирующие биологические ответные реакции.
Кальций-связывающий белок содержит интересную систему внутренних
полярных групп, связанных между собой специфическим образом с по-
мощью водородных связей (рис. 4-5,5). Присоединение ионов кальция
может вызывать перестройку этих внутренних связей (гл. 2, разд. Б.7)
и изменять тем самым характер взаимодействия этого белка (функция
которого точно не известна) с другим белком (ср., например, с дейст-
вием тропонина С, разд. Е.1). В других кальций-связывающих центрах
в белках содержатся остатки у-карбоксиглутаминовой кислоты, способ-
ной образовывать хелатные комплексы (дополнение 10-Г).
Г. Упаковка макромолекул
Аналогично тому как аминокислоты, сахара и нуклеотиды служат
«строительными блоками» для белков, полисахаридов и нуклеиновых
кислот, так и сами эти макромолекулы в свою очередь являются едини-
цами, из которых собираются более сложные структуры. Волокна, мик-
ротрубочки, оболочки вирусов и небольшие симметричные группы
субъединиц в олигомерных ферментах — все это варианты строго
упорядоченной упаковки макромолекул (которую иногда называют
четвертичной структурой). Рассмотрим сначала наиболее простой слу-
чай агрегации идентичных белковых субъединиц. Известно, что, хотя
форма многих белков близка к сферической, тем не менее они не совсем
симметричны. На приведенных ниже рисунках это их свойство несколь-
ко преувеличено, чтобы более четко проиллюстрировать общие прин-
ципы упаковки.
1. Олигомеры, обладающие циклической симметрией
На рис. 4-6 схематически изображены субъединицы (протомеры),
содержащие взаимно комплементарные участки а и /. Две такие моле-
кулы стремятся соединиться друг с другом так, чтобы участок а одного
протомера оказался связанным с участком j другого. При этом с одной
стороны димера остается свободный участок а, а с другой — свободный
участок /, к которым могут присоединяться другие протомеры. В некото-
рых случаях таким способом образуются длинные цепи.
Если геометрия молекул соответствует схеме, показанной на
рис. 4-6, А, то к димеру может легко «пристроиться» третья субъедини-
ца и замкнуть кольцо с образованием тримера. В зависимости от геомет-
рии субъединиц кольцо может быть меньшим (димер) или большим
(тетрамер, пентамер и т. д.). Связь, в которой участвуют различные
участки (а и j) субъединицы, иногда называют гетерологической [33].
Для образования замкнутого кольца, состоящего из нескольких субъеди-
Как молекулы соединяются друг с другом 271'
ниц, необходимо, чтобы между связывающимися участками (a, j) был
вполне определенный угол.
Кольцо, образованное за счет только одних гетерологических взаимо-
действий, должно обладать циклической симметрией. Так, например,
показанный на рис. 4-6, А тример имеет ось симметрии третьего поряд-
ка. Это означает, что каждая субъединица может быть совмещена со-
РИС. 4-6. Гетерологическое связывание субъединиц. А — кольцо; Б — спираль; В —
«радиальная проекция» субъединиц, образующих спираль Б. Участки связывания субъ-
единиц обозначены буквами а, Ъ, с, j, k и I.
следующей поворотом вокруг оси симметрии на 360°/3. Симметрия та-
кого олигомера обозначается символом Сз. Субъединичная структура
многих природных белков, включая все белки, состоящие из трех, пяти
илн любого другого нечетного числа одинаковых протомеров, обладает,
по-видимому, циклической симметрией.
Рассмотрим теперь количественные аспекты гетерологических взаи-
модействий, приводящих к образованию замкнутых колец. Пусть К—
константа образования, a AG0 — изменение стандартной свободной энер-
гии для присоединения /-конца протомера Р к a-концу другого прото-
мера Р, в результате чего образуется димер Р2 [уравнение (4-39}].
На второй стадии присоединяется третий протомер. Заметим, что при
этом возникают два новых а/-контакта, в связи с чем AG? для второй
стадии равно 2AG°, a Kt — К2. Результирующая константа образования
для процесса сборки тримера из трех протомеров и изменение свобод-
ной энергии равны1
ЗР----> р3;
Kf=№, (4-40}
AGf=3AG°.
1 Предполагается, что значения AG0 образования обеих новых а/-связей в тримере
одинаковы и равны AG0 образования а/-связи в димере. Читатель вправе усомниться
правильности такого предположения н подумать о том, при каких условиях значе-
ние Kt, вычисленное для тримера в соответствии с уравнением (4-40), окажется завы-
шенным иля заниженным.
^14- Глава 4
Стадия 2
К, = К2 AGf° = 2AG0
Рассмотрим теперь гипотетический случай, когда протомер Р непрерыв-
но синтезируется в клетке и сразу же распадается в результате парал-
лельно протекающей метаболической реакции на неспособные к ассо-
циации продукты. При этом обе реакции сбалансированы таким обра-
зом, что стационарная концентрация протомера [Р] остается все время
равной 10~5 М. Предположим, что значение К для единичного «/-взаи-
модействия, приводящего к образованию димеров и тримеров (колец),
равно 104 (или AG’° = —22,8 кДж-моль-1). Спрашивается: чему будет
равна концентрация димеров и тримерных колец в клетке в равновесии,
если концентрация Р равна 10~5 М? Используя уравнение (4-39), полу-
чаем, что концентрация димеров Рг равна 104-(10-5)2 = 10-6 М. (Заме-
тим, что при такой концентрации димеров концентрация составляющих
их мономеров эквивалентна 2-10_6 М.) Концентрация колец, [Р3],
равна (104)3-(Ю-5)3 = 10~3 М (концентрация соответствующих моно-
мерных единиц эквивалентна 3-Ю-3 М). Таким образом, 99,6% суммар-
ного количества протомеров Р, присутствующих в клетке, будет входить
в состав тримеров (10~5+0,2-10~5+300-10-5 М), 0,33%—в состав
мономеров и только 0,07% —в состав димеров. Следовательно, одновре-
менное образование двух гетерологических связей, приводящее к замы-
канию кольца, делает реакцию ассоциации, описываемую уравнением
Как молекулы соединяются друг с другом 273
(4-39), высококооперативным процессом. В клетке мы обнаружим в ос-
новном кольца и мономеры, но не димеры.
Как изменится относительное содержание небольших колец внутри
клетки, если скорость превращения протомера Р в форму, не способную
к ассоциации, вдруг сильно возрастет, так что концентрация Р упадет
до 10-6 М? Определите сами равновесные концентрации мономерных
единиц Р, димеров Р2 и тримеров Рз, если К останется при этом рав-
ной 104. Здесь и проявится особенность кооперативных процессов, кото-
рая состоит в том, что они характеризуются зависимостью от концент-
рации не в первой, а в более высокой степени.
2. Спиральные структуры
Если угол, образуемый двумя субъединицами при связывании а с /,
несколько отличается от угла, соответствующего замкнутому кольцу, то
образуется структура типа спирали, изображенная на рис. 4-6, Б.
На один виток спирали может приходиться как целое число субъединиц,
так и не целое (как в спиральной структуре, показанной на рисунке).
Каждая последующая субъединица присоединяется к предыдущей за
счет тех же гетерологических контактов типа aj, однако в этом случае
могут иметь место и другие взаимодействия. Если поверхности субъеди-
ниц комплементарны и их геометрия благоприятствует образованию до-
полнительных контактов, то группы, расположенные в разных
частях молекулы (например, b и k), могут соединиться друг с другом,
образуя другую гетерологическую связь. Возможно образование и
третьей гетерологической связи, cl, между двумя другими участками
поверхностей субъединиц. Если контакты aj, bk и cl достаточно прочны
(т. е. если площади комплементарных поверхностей субъединиц доста-
точно велики, а сами поверхности высококомплементарны), то могут
образовываться чрезвычайно прочные структуры из микротрубочек (на-
пример, жгутики у эукариот, рис. 1-5). Когда взаимодействия не столь
сильны, то образуются часто обнаруживаемые в клетках лабильные
структуры из микротрубочек, которые возникают и вновь распадаются.
Геометрию субъединиц внутри спиралей можно представить, по-
строив проекцию развернутой поверхности структуры, как это показано
на рис. 4-6, В. На приведенном рисунке субъединицы, образующие спи-
раль, которая изображена на рис. 4-6, В, лежат на плоскости, получен-
ной мысленным разрезанием цилиндра вдоль оси и распрямлением ци-
линдрической поверхности. В рассматриваемом примере число субъеди-
ниц на один виток спирали составляет приблизительно 4,3, однако это
число может быть и целым. Взаимодействия bk между субъединицами
вдоль оси волокна иногда могут оказаться более сильными, чем взаи-
модействия типа aj. В этих случаях микротрубочка «разрывается» на
концах за счет разрыва «/-связей. Если это явление имеет место в мик-
ротрубочках флагеллы эукариот, его можно непосредственно наблю-
дать при помощи электронного микроскопа.
На рис. 4-7 приведены красивые спиральные структуры четырех раз-
ных типов, образованные из отдельных молекулярных фрагментов. Это
пиль Е. coli, нить актина (F-актин) из мышечного волокна, жгутик
бактерии (Е. coli} и вирион вируса табачной мозаики. Считается, что
каждая из этих структур состоит из большого числа протомеров одного
типа. Наиболее детально изучена структура вирусной частицы. Извест-
на, в частности, последовательность 158 аминокислотных остатков, обра-
зующих каждую из субъединиц вирусного белка (мол. вес=17 500);
число субъединиц на частицу равно примерно 2200, из них сформирова-
274 Глава 4
7,0 нм
А
расположена молекула РНК
РИС. 4-7. Некоторые спиральные структуры, построенные из белковых субъединиц.
А. Пиль Е. coli: шаг спирали 2,3 нм, диаметр отверстия 2,0—2,5 нм; мол. вес одной
субъединицы 17 000; на виток спирали приходится 3субъединицы. Б. — F-актин
8
мышцы: шаг спирали 70 им; две цепочки; мол. вес одной субъединицы 60 000; иа один
виток спирали приходится 13 субъединиц. В. Жгутик бактерии: шаг спирали 25 нм;
диаметр отверстия 6 нм; пять цепочек; мол. вес одной субъединицы 40 000; иа виток
спирали приходится 11 субъединиц. Г. Вирус табачной мозаики: длина 300 нм (при-
близительно 2200 субъединиц); шаг спирали 2,5 нм; мол. вес одной субъединицы
17 500; на виток спирали приходится 16,3 субъединицы.
на палочка длиной ~300 нм. В бороздке спирали располагается цепь
РНК, содержащая приблизительно 6600 нуклеотидов (таким образом,
на одну субъединицу белка приходится 3 нуклеотида) [34—36а]. Как
и в более простой спиральной структуре пиля бактерии [37], белковые
субъединицы вирусной частицы, по-видимому, связаны друг с другом
только гетерологическими связями.
Сравнительно недавно была детально изучена структура белковой
оболочки нитевидного бактериофага Pfl [38, 39]. Мол. вес белковых
субъединиц этого бактериофага (дополнение 4-В) равен ~5000. Они
имеют форму а-спирален длиной 7 нм, образующих в составе бактерио-
фага структуру типа левой спирали с шагом 1,5 нм, на один виток кото-
рой приходится 4,4 субъединицы (рис. 4-8). Белковые «палочки» распо-
Как молекулы соединяются друг с другом 275
О
РИС. 4-8. А. Предполагаемое расположение а-спиральных белковых палочек разме-
ром 1,0X7,0 нм в белковом чехле нитчатого бактериофага Pfl [38]. Пунктирная ли-
ния в верхней части рисунка — левая а-спираль, на которой предположительно рас-
полагаются N-концы палочек. Б. Схематическое представление расположения а-атомов
углерода в смежных а-спнральных палочках; атомы спроектированы на плоскость,
параллельную оси вирусной частицы. Числа в кружочках—номера аминокислотных
остатков. На примере трех субъединиц показано взаимное расположение одной нз
них (0) и находящихся ниже по ходу спирали субъединиц — пятой (—5) и девятой
(-9) [39].
276
Глава 4
ложены под углом к оси спирали и направлены внутрь спирали. Каж-
дая палочка соприкасается с двумя другими, находящимися на 5 (—5)
и на 9 (—9) единиц ниже по ходу спирали (рис. 4-8, А, Б). Такое рас-
положение приводит к тому, что между субъединицами осуществляется
гидрофобное взаимодействие типа ключ — замок (гл. 2, разд. Б.3,г)
Весьма вероятно, что бактериальные пили и жгутики имеют именно
такую структуру, а не структуру, изображенную на рис. 4-7.
Как спиральные вирусы, так и пили бактерий могут рассматриваться
как одиночные спирали из субъединиц, которые иногда называют спи-
ралями с одним доступным концом. Актиновая нить (рис. 4-7) состоит
из двух цепей, построенных из субъединиц; эти цепи закручены одна
вокруг другой [40], т. е. структура имеет два доступных конца. Жгути-
ки бактерий Е. coll и Salmonella (рис. 4-7, В) можно представить себе
как пять цепочек, закрученных вместе вокруг Одной и той же оси (одна
из цепочек на рисунке для наглядности заштрихована). Те же жгутики
можно, однако, рассматривать и как структуры, образованные 11 па-
раллельными нитями, закрученными в спираль со значительно большим
шагом [41]. Жгутики бактерий обладают многими удивительными свой-
ствами (см. дополнение 4-Б). Так, например, на электронно-микроско-
пических фотографиях они обычно выглядят как «надспирали» с шагом,
равным ~2,5 мкм. О каких особенностях молекулярной упаковки может
свидетельствовать этот факт? Было бы очень хорошо, если бы читатель
подумал и сам решил этот вопрос, но не слишком спешил с ответом.
Дополнение 4-А
Микротрубочки и действие колхицина
Важной составной частью цитоплазмы являются микро-
трубочки— полые стерженьки, наружный диаметр которых
составляет 24±2 нм, а внутренний 13—15 нм. Наиболее уди-
вительна их форма в жгутиках и ресничках эукариотических
клеток (рис. 1-5). Устойчивые микротрубочки ресничек яв-
ляются, по-видимому, неотъемлемой частью аппарата, обес-
печивающего движение жгутиков3’6. (Приведенный справа
рисунок взят из работы6.) Лабильные (т. е. образующиеся, а
затем распадающиеся) микротрубочки обнаруживаются ча-
ще всего в цитоплазме клеток, способных к перемещению
(например, в псевдоподиях амеб). Митотическое веретено
(гл. 15, разд. Г.9) представляет собой набор микротрубочек,
обеспечивающих перемещения хромосом в делящейся клетке.
Микротрубочки обнаруживаются также в плоскостях деле-
ния растительных клеток.
Большое число микротрубочек содержится в длинных
аксонах нервных клеток. Здесь они, вероятно, обеспечивают
быстрый перенос белков и других веществ из тела клетки в
аксон Микротрубочки, функция которых неизвестна, обна-
ружены и во многих сенсорных клетках. Недавно было по-
казано, что микротрубочки содержатся в цитоплазме самых
разных клеток. Используя непрямой метод флуоресцирую-
щих антител, Вебер и др.в получили приведенную ниже
Как молекулы соединяются друг с другом 277
(с любезного разрешения автора) микрофотографию фиб-
робластов мышиного эмбриона.
Клетки фиксировали формальдегидом, обезвоживали и
подвергали воздействию антител, полученных путем иммуни-
зации кроликов белком микротрубочек. Затем клетки обра-
батывали флуоресцирующими антителами козы, специфичны-
ми в отношении кроличьего у-глобулина (дополнение 5-Е), и
278 Глава 4
фотографировали в свете их собственной флуоресценции.
Предполагается, что движения в системах, содержащих мик-
ротрубочки, осуществляются с участием других белков. Так,
например, «ручки» на микротрубочках ресничек (рис. 1-5)
катализируют гидролиз АТР, напоминая в этом отношении
мышечный белок миозин. Движение ресничек осуществляет-
ся, вероятно, за счет скольжения микротрубочек по типу
скольжения фибрилл в скелетной мышце (разд. Е).
Все микротрубочки построены из тубулинов — димеров,
состоящих из близких по структуре субъединиц (а, р) с
мол. весом 60 000; в состав микротрубочек входит также в
незначительном количестве белок с большим мол. весомг.
Сами микротрубочки представляют собой, вероятно, группы
параллельно расположенных нитей из соединенных друг с
другом (конец в конец) молекул тубулина. Каждая димер-
ная молекула тубулина связывает две молекулы GTP, при-
чем одну из них прочнее. В этом отношении тубулин напо-
минает актин, субъединицы которого имеют приблизительно
такие же размеры. Однако аминокислотные последователь-
ности этих белков существенно различаются.
Обычно считается, что лабильные микротрубочки цито-
плазмы находятся в динамическом равновесии с мономерны-
ми или димерными единицами. Известно, например, что мик-
ротрубочки могут образовываться или распадаться в зави-
симости от метаболических условий. Для их сборки нужен
GTP, гидролиз которого, по-видимому, является существен-
ной частью процесса сборкиД. Недавно опубликованные дан-
ные о фосфорилировании белков микротрубочек указывают
на то, что процесс этот очень сложен.
Особый интерес представляет взаимодействие микротру-
бочек с алкалоидом колхицином, который продуцируется раз-
личными членами семейства Liliaciae.
Это соединение, содержащее в своем составе трополоновое
кольцо, специфически и прочно связывается с тубулином.
Поразительным следствием такого связывания в живой клет-
ке является разрушение лабильных микротрубочек, в том
числе участвующих в образовании митотического веретена.
При обработке делящихся клеток колхицином процесс деле-
ния задерживается на стадии метафазы (гл. 15, разд. Г.9),
и образующиеся дочерние клетки обладают высокой сте-
пенью плоидности. Все это позволило широко использовать
колхицин в качестве агента для получения тетраплоидных
сортов цветущих растений. Аналогичное влияние на микро-
Как молекулы соединяются друг с другом 279
трубочки оказывают противоопухолевые агенты винкристин
и винбластин — алкалоиды, синтезируемые малым барвин-
ком (Vinca minor)™.
Микротрубочки ресничек (и жгутиков) эукариот имеют
другую структуру. В большей части реснички они находятся
в форме слившихся пар: А-трубочка содержит «ручку», и
В-трубочка присоединяется к ней за счет общих субъединиц,
расположенных в центре структуры. Как и из лабильных
микротрубочек, было выделено два типа молекул тубулина,
однако вопрос о том, как они вписываются в структуру спа-
ренных микротрубочек, остается открытым.
“ Snyder J. A., McIntosh I. R., Annu. Rev. Biochem., 45, 699—720 (1976).
6 Bryan I., Fed. Proc., Fed. Am. Soc. Exp. Biol., 33, 152—157 (1974).
B Weber K„ Pollack R„ Bibring T„ PNAS, 72, 459—463 (1975).
r Murphy D. B., Boris у G. G., PNAS, 72, 2696—2700 (1975).
A Jacobs M„ Smith H., Taylor E. W., JMB, 89, 455—468 (1974).
e Margulis T. N„ JACS, 96, 899—902 (1974).
ж Wilson L, Bamberg J. R., Mizel S. B., Grisham L. M., Creswell К. M.,
Fed. Proc, Fed. Am. Soc. Exp. Biol., 33, 158—166 (1974).
3. Изологические связи: парные взаимодействия
Пару субъединиц, которые удерживаются вместе за счет контактов
типа а] и связаны осью симметрии второго порядка (рис. 4-9, А), мы
будем называть изологическим димером. Каждая точка одной субъ-
единицы (например, а) может быть совмещена с такой же точкой дру-
гой субъединицы при повороте вокруг оси симметрии на 180°. Точки с
и с' одной субъединицы (см. рис. 4-9, А) расположены точно напротив
соответствующих точек другой субъединицы. В центре структуры, изо-
браженной на рис. 4-9, А, имеется полость, поэтому группы с и с’ в дей-
ствительности нс соприкасаются и основной вклад в связывание между
субъединицами вносят парные взаимодействия типа а] между группа-
ми, удаленными от оси симметрии. Однако реальный белковый димер
может и не иметь такой полости. Пара идентичных связей в изологи-
ческом димере называется обычно одиночной изологической связью.
Такого рода связь включает парные взаимодействия между комплемен-
тарными группами (aj) и образуется за счет наличия пар идентичных
групп, расположенных вдоль оси1. Изологическое связывание играет
исключительно большую роль в олигомерных ферментах, причем вы-
сказывалось даже предположение, что оно возникло на самых ранних
стадиях эволюции ферментов. Вполне возможно, что сначала практи-
чески никакой комплементарности между взаимодействующими субъ-
единицами не существовало и они соединялись за счет неспецифических
взаимодействий в результате контактирования двух гидрофобных
участков [42], однако в дальнейшем эволюция привела к появлению
более специфических парных взаимодействий.
Изологические димеры могут выступать в роли субъединиц при
образовании более крупных замкнутых олигомеров и спиралей, напри-
мер в том случае, если изологическая пара типа изображенной на
рис. 4-9, А наложится на другую аналогичную пару (рис. 4-9,5 и В).
1 Чтобы парные взаимодействия назывались нзологическими, они не обязательно
должны быть высокоспецифичными и осуществляться между комплементарными по-
верхностями.
РИС. 4-9. А. Изологическое связывание между парами субъединиц. Б. Расположение
субъединиц по типу «изологического квадрата». В. «Тетраэдрическое» расположение
субъединиц. Обратите внимание на наличие трех осей симметрии 2-го порядка.
Как молекулы соединяются друг с другом 281
И опять если поверхности димеров окажутся в достаточной сте-
пени комплементарными, то между ними образуются свя-
зи (bk на рис. 4,9,5 и bk и cl на рис. 4-9,5). Обе изображенные струк-
туры обладают диэдрической симметрией (D2) [43]. Из рисунков вид-
но, что, кроме оси второго порядка, перпендикулярной плоскостям обо-
их колец, есть еще две оси симметрии второго порядка. Обратите вни-
мание, что и в этом случае взаимодействия оказываются парными, т. е.
каждая пара субъединиц связана двумя контактами типа bk и дву-
мя— типа cl. Таким образом, новые контакты также являются изоло-
гическими. Всего для каждой комбинации двух субъединиц имеется
шесть пар контактов. На рис. 4-9, В все это видно более четко, чем
на рис. 4-9, Б, поскольку в последнем случае конфигурация субъеди-
ниц в структуре более или менее близка к квадратной. Тем не менее-
изологические взаимодействия между левой субъединицей верхнего-
кольца и правой субъединицей нижнего имеют место; они могут но-
сить чисто электростатический характер, если субъединицы находятся
друг от друга на некотором расстоянии.
Примером тетрамерного фермента, т. е. фермента, состоящего из
четырех субъединиц, с показанной на рис. 4-9, Б ярко выраженной ди-
эдрической симметрией может служить лактатдегидрогеназа (гл. 8,
разд. 3.2). Структура же растительного агглютинина конканавалина А.
напоминает структуру, изображенную на рис. 4-9,5 [44, 45].
Дополнение 4-Б
Жгутики бактерий
Одной из нерешенных проблем биологии является меха-
низм превращения химической энергии в механическую ра-
боту. Самыми маленькими движущимися органами являются
жгутики бактерий, и можно думать, что исследования дан-
ного объекта помогут хотя бы отчасти проникнуть в эту тай-
ну. Жгутики прокариот построены из белка одного типа —
флагеллина. Молекулы флагеллина совсем не содержат
остатков цистеина и триптофана, а остатки фенилаланина,
пролина и гистидина присутствуют в них лишь в небольших
количествах. Этот белок характеризуется высоким содержа-
нием гидрофобных аминокислот и имеет один остаток не-
обычной аминокислоты — s-N-метиллизина. Субъединицы
жгутиков образуют спиральную структуру (рис. 4-7), фор-
мируя в ней также 11 почти параллельных оси опирали ря-
дов— «надспиралей» с шагом 2,3 мкма-д. Эта последняя осо-
бенность жгутиков очень важна для понимания механизма их.
функционирования. Мутантные бактерии, жгутики которых,
имеют линейную структуру, неподвижны.
Предполагается, что образование «надспиральной» струк-
туры обусловлено конформационными различиями субъеди-
ниц, расположенных в одном продольном рядуг. Здесь, как и
в случае вирусов с икосаэдрической оболочкой, квазиэквива-
282 Глава 4
лентность позволяет образоваться структуре, неосуществи-
мой при полной идентичности субъединиц.
Микрофотография концевой части бактериального жгутика внутри чехла (негативное
контрастирование фосфовольфрамовой кислотой). Жгутик принадлежит неидентифи-
цированной бактерии, обнаруженной в пруду. Назначение неплотно прилегающего чех-
‘ла неясно. (С любезного разрешения F. D. Williams.)
Как движется бактериальный жгутик? Отдельные жгу-
тики, к сожалению, слишком малы, чтобы за ними можно бы-
ло наблюдать при помощи светового микроскопа; получить
электронно-микроскопическую фотографию функционирую-
щего жгутика также пока не удалось никому. Однако нали-
чие «надспиральной» структуры дает возможность высказать
некоторые предположения о механизме движения этого ор-
гана. Поскольку субъединицы жгутика идентичны, в нем мо-
жет индуцироваться периодическое последовательное сокра-
щение «продольных» рядов (сначала одного, потом друго-
го и т. д.)е. Энергия, необходимая для этого процесса, может
поставляться конформационным изменением, индуцируемым
в бактериальной клетке у основания жгутика.
Эта идея весьма привлекательна, однако самые разные
экспериментальные данные указывают на то, что жгутик
напоминает жесткий «пропеллер», который вращается при
помощи некоего «мотора», находящегося у основания®. Об
этом, в частности, свидетельствует тот факт, что бактерия,
искусственно связанная (при помощи антител) с коротким
выступом жгутика другой бактерии, может вращаться с по-
мощью этой второй бактерии. Интересные результаты были
получены при изучении мутантного штамма Salmonella, об-
ладающего как бы «завитыми» жгутиками с вдвое меньшим
шагом «надспирали», чем у нормального штамма. Оказалось
также, что к появлению «завитых» жгутиков приводит на-
личие в инкубационной среде n-фторфенилаланина, а нор-
мальные жгутики превращаются в «завитые» соответствую-
щим изменением pH.
Увидеть отдельные жгутики на живой бактерии невоз-
можно, однако в темном поле светового микроскопа удается
наблюдать пучки жгутиков. Если нормальные жгутики име-
ют, по-видимому, форму левых спиралей, то для «завитых»
жгутиков характерны правые спирали3. Нормальные бакте-
рии плывут по прямой, но периодически как бы спотыкают-
ся, после чего меняют случайным образом направление свое-
го движения. (Это поведение бактерий является частью си-
стемы хемотаксиса, при помощи которого организм движет-
ся в направлении источника пищи; гл. 16, разд. Б.7). «Зави-
тые» мутанты «спотыкаются» непрерывно. Предполагается,
что когда бактерия «спотыкается», ее жгутик из нормально-
Как молекулы соединяются друг с другом 283
го превращается в «завитой». При этом «надспираль» меня-
ет свое направление, а ее шаг уменьшается. Возможное объ-
яснение механизма изменения шага «надспирали» основано
на предположении о распространении конформационных из-
менений на смежные ряды субъединиц жгутиковг.
10 нм
На базальных концах жгутиков грамотрицательных бактерий имеются два дополни-
тельных кольца. На этой электронно-микроскопической фотографии" показан жгутик
Е. coli (контрастирование уранилацетатом). На конце жгутика видны N- и S-кольца.
Выше их имеются P-кольцо (которое служит, вероятно, для прикрепления жгутика к
пептидогликановому слою) и L-кольцо (с помощью которого жгутик, по-видимому,
прикрепляется к наружной мембране или к липополисахаридному слою) (рис. 5-8).
Стрелка указывает место присоединения «крючка» к более тонкой части нити. Крю-
чок часто изгибается, принимая форму угольника.
Что же за «мотор» приводит в движение бактериальные
жгутики? На представленной выше электронно-микроскопи-
ческой фотографии виден «крючок», прикрепленный к про-
ходящей сквозь клеточную стенку палочке, которая в свою
очередь прикреплена к тонкому диску (М-кольцу), погру-
женному в цитоплазматическую мембрану. Схематически это
устройство у грамположительных бактерий показано вышеж.
По-видимому, между M-кольцом и S-кольцом, укрепленным
в клеточной стенке, возникает крутящий момент. Данные о
наличии в «моторе» белков типа мышечных отсутствуют, и
было высказано предположение о том, что из внутриклеточ-
284 Глава 4
ного пространства бактерии на поверхность М-кольца пере-
носятся ионы, которые, взаимодействуя с зарядами на S-
кольце, создают крутящий момент.
Как жгутик растет? Линоа добавил n-фторфенилаланин к
суспензии бактерий, от которых были оторваны жгутики на
разном расстоянии от основания. По мере роста жгутиков,
появлялись завитые концы11. Оказалось, что в отличие от
волос на нашем теле жгутики растут с другого конца. По-
скольку в окружающей среде отсутствовал свободный фла-
геллин, рост жгутиков можно было объяснить только тем,,
что мономеры флагеллина диаметром 4,0—4,5 нм синтези-
руются внутри бактерии, а затем проходят внутри жгутиков
через канал диаметром ~6 нм и присоединяются к их кон-
цам. Сначала скорость роста составляет ~ 1 мкм в 2—3 мин,
затем процесс замедляется и останавливается, когда длина
жгутика достигает ~ 15 мкм (Salmonella). Теперь два во-
проса читателю. Во-первых, почему молекулы флагеллина,
проходящие сквозь канал, не выходят в окружающую среду?
И во-вторых, почему жгутики прекращают расти после то-
го, как их длина достигает приблизительно 15 мкм?
° Lino Т., Bacterio!. Rev., 33, 454—475 (1969).
6 Bode W., Angew. Chem. Int. Ed. Engl., 12, 683—693 (1973).
3 O’Brien E. J., Bennett D. M„ JMB, 70, 133—152 (1972).
r Calladine C. R., Nature (London), 255, 121—124 (1975).
д Gonzales-Beltran C., Burge R. E., JMB, 88, 711—716 (1974).
6 Harris W. F., J. Theor. Biol., 47, 295—308 (1974).
ж Berg H. C„ Nature (London), 254, 389—392 (1975).
3 Shimada K., Kamiya R., Asakura S., Nature (London), 254, 332—334=.
(1975).
“ DePanthlis N. L„ Adler J., J. Bacteriol., 105, 384—395 (1971).
4. Олигомеры, содержащие как гетерологические,
так и изологические связи
Упаковка четырех субъединиц с образованием структуры типа квад-
рата может осуществляться за счет как изологических, так и гетероло-
гических контактов. В крупных агрегатах могут иметь место оба типа
контактов. Например, ассоциация двух гетерологических тримеров ти-
па показанных на рис. 4-6 приводит к образованию гексамера с диэд-
рической (Д3) симметрией; гетерологический «квадратный тетрамер»
может димеризоваться с образованием диэдрического (ДД октаме-
ра [43].
Фермент глутаминсинтетаза представляет собой двойное кольцо, со-
стоящее из 12 субъединиц. Возможно, верхнее кольцо расположено от-
носительно нижнего таким образом, что образующаяся структура об-
ладает диэдрической симметрией (Д6) с одной осью симметрии 6-го по-
рядка и шестью перпендикулярными к ней осями 2-го порядка.
Изологические связи могут образовываться и в спиралях. Мономе-
ры актина формируют как цепи, так и димеры. Таким образом, субъ-
единицы в структуре, приведенной на рис. 4-7, могут быть составлены
из изологических димеров, образованных парами, расположенными по
разные стороны оси. Возможно, теперь читателю интересно самосто-
ятельно рассмотреть вопрос о том, могут ли бактериальные жгутики
состоять из изологических димеров.
1\аК МОЯ ОДулы Сиидппшикл др-ji
5. Олигомеры с кубической симметрией (многогранники)
Если симметричные структуры имеют более одной оси симметрии,
порядок которых выше двух, то говорят, что имеет место кубическая
симметрия. Наиболее простым примером такой структуры является
проходящих через
симметрия. Наиболее простым примером такой
тетраэдр; у него 4 оси симметрии
вершины и центры граней,
и 3 оси симметрии 2-го по-
рядка, проходящих через
середины шести ребер. По-
скольку белковые субъеди-
ницы всегда асимметричны,
тетрамерный белок не мо-
жет обладать кубической
симметрией1. Однако гете-
рологический гример с осью
симметрии 3-го порядка мо-
жет образовывать грань те-
траэдра, содержащего всего
12 асимметричных субъеди-
ниц (рис. 4-10). Вокруг каж-
дой вершины образуется
второй тип гетерологическо-
го тримера с участием bk-
контактов, а пары субъеди-
ниц у оси второго порядка
образуют изологический cl-
контакт [43].
В результате взаимо-
действия 24 субъединиц
может образоваться куб, в
котором через центры гра-
ней проходят 3 оси симмет-
рии 4-го порядка, через вер-
шины — 4 оси 3-го порядка,
а через ребра — 6 осей 2-го
порядка (рис. 8-17). Самой
большой структурой, обла-
дающей кубической симмет-
рией, которую можно по-
строить, является икосаэдр
(двадцатигранник) — сим-
метричная фигура с 20 тре-
угольными гранями. Для ее построения требуется шестьдесят субъеди-
ниц, которые образуют в каждой из вершин гетерологические пента-
меры. Как и в случае тетраэдра, каждая грань содержит гетерологиче-
ский тример, а в результате взаимодействий поперек ребер образуются
изолопические димеры.
3-го порядка,
РИС. 4-10. Расположение
кубической симметрии. Тетраэдр, построенный из
12 идентичных, асимметрично расположенных
субъединиц. Указаны оси симметрии 3-го и 2-го
порядка. Участки связывания обозначены теми же
буквами, что и на рис. 4-9. (См. также рис. 8-17.)
Ось симметрии
2-го порядка
субъединиц по типу
1 Как мы уже видели, тетрамерные белкн обладают диэдрической симметрией.
Таким образом, многие публикуемые в текущей литературе теоретические схемы,
предсказывающие поведение четырех субъединиц исходя из их тетраэдрического рас-
положения, не совсем верны.
286 Глава 4
Дополнение 4-В
Вирусы3-1*
Нуклеопротеидные частицы, известные под названием ви-
русов, «атакуют» самые разные живые организмы—от мель-
чайшей микоплазмы до человека. Они не обладают собствен-
ным метаболизмом и «оживают», лишь когда содержащаяся
в них нуклеиновая кислота проникает в живую клетку. Ви-
русы привлекают к себе большое внимание не только в связи
с тем, что они являются болезнетворными агентами, но так-
же и потому, что широко используются в молекулярно-био-
логических исследованиях. Зрелая вирусная частица, или
вирион, состоит из одной или нескольких молекул нуклеи-
новых кислот и белковой оболочки — капсида, которая име-
ет обычно спиральную или икосаэдрическую форму. Капсид
построен из «морфологических субъединиц», или капсомеров,
иногда хорошо различимых под электронным микроскопом.
Капсомеры в свою очередь состоят из большого числа бел-
ковых субъединиц меньшего размера. Некоторые крупные
вирусные частицы имеют мембраноподобную оболочку. Дру-
гие, например Т-четные бактериофаги, инфицирующие
Е. coli, весьма необычны по форме (дополнение 4-Д).
Геном большинства вирусов представлен или двухцепо-
чечной ДНК, или одноцепочечной РНК, однако у некоторых
мелких вирусов ДНК одноцепочечная, а другие содержат
двухцепочечную РНК- Число нуклеотидов в вирусном гено-
ме варьирует от нескольких тысяч до нескольких сотен ты-
сяч, а число генов —от 3 до 200 и более. Иногда молекулы
нуклеиновой кислоты в вирионе имеют форму замкнутого
кольца, в других случаях они линейны.
В приведенной ниже таблице охарактеризованы некото-
рые известные нам типы вирусов и ряд отдельных вирусов.
Форма вирусных частиц обозначена буквами И (икосаэдр),
С (спираль) и Сл (более сложная). Для некоторых спираль-
ных вирусов и вирусов с более сложным строением приве-
дена длина частиц в нм. Указана также длина молекулы
нуклеиновой кислоты в тысячах оснований (для одноцепо-
чечных ДНК или РНК) или в тысячах нуклеотидных пар
(для двухцепочечных нуклеиновых кислот). Число генов,
содержащихся в вирусной частице, иногда несколько превы-
шает это число.
Среди множества очень мелких вирусов имеются спи-
ральные бактериофаги, например fd, fl и М.-13 (рис. 4-8),
которые напоминают пили бактерий. Эти вирусы, содержа-
щие молекулы одноцепочечной кольцевой ДНК с мол. ве-
сом ~2-106, прикрепляются к половым пилям бактерий
«мужского пола» (например, Е. coli) и могут вводить через-
них свою ДНК внутрь бактерии (гл. 15, разд. А.1). Бак-
териофаг 0X174 представляет собой икосаэдрический ДНК-
содержащий вирус диаметром 25 нм, что всего в три раза
толще самой тонкой клеточной мембраныг. Его одноцепо-
чечная ДНК состоит только из ~5000 нуклеотидов; число
генов, по-видимому, не превышает 9Г. Интересно, что такой
мельчайший вирус способен нарушать нормальный метабо-
Как молекулы соединяются друг с другом 287
Таблица к дополнению 4-В
Тип генома и название группы вирусов или отдельного вируса Форма вирусной частицы Диаметр, нм Масса в дальто- нах«10-б Число тысяч Оснований или пар оснований
суммарная ДНК или РНК
Одноцепочечная ДНК
Бактериофаги fd, fl, с 60.(1— 2,0 6,0
М13 2) мкм
Бактериофаг 0X174 и 25 6,2 1,8 5,5
Парвовирусы Двухцепочечная ДНК » 18—25 1,8 5,5
Пановавирусы и 35—55
SV 40 (обезьяна) » 17,3 3,4 5,2
Вирус полиомы мыши » 23,6 3,0 4,5
Вирусы папилломы » 5,3 8,0
человека
Аденовирусы » 70 20—25 30—38
Вирус полиэдроза на- » 70—130
секомых
Вирус герпеса » —1000 76—136
сердцеви- 78 50-90
на
оболочка 150—200
Вирусы оспы (напри- Сл 160x250 ~4000 160—240 240—360.
мер, вирус ветря- ной оспы)
Т-четные бактериофаги Одноцепочечная РНК » 215 130 197
Мелкие бактериофаги и 23—26 3,6-4,0 1,2-1,5 3,5—4,6
(R17, MS2, QP)
Пикорнавирусы 8,4 2,6 7,9
Полиовирусы » 27 6,8 2 6,1
Риновирусы » 27—30 7—8 2,2—2,8 6,7-8,5
Вирус желтой мо- 28 5,0—6,0 2,0 6,1
заики турнепса
Вирус табачной мо- с 18X300 40 2,2 6,7
заики
Вирус гриппа Пулевидные вирусы и 80—100 200 2,0 6,1
Рабдовирусы Сл 20Х 130
Двухцепочечная РНК Реовир усы «Голая» РНК И 55—60
Вироид — возбудитель 0,1 0,30
веретено видности клубней картофеля
лический контроль в бактериальной клетке и направленно
изменять ее метаболизм в сторону синтеза новых вирусных
частиц. Ясно, что при этом вирус использует не только свои
288 Глава 4
собственные гены, но также многие гены и другие компонен-
ты инфицируемой им клетки.
Большая группа вирусов животных, парвовирусы, сходна
по размерам и строению с бактериофагом 0X174. Некоторые
из вирусов этой группы не способны размножаться в клетке,
если эта клетка не инфицирована аденовирусом, частица
которого имеет больший размер.
Среди икосаэдрических вирусов, содержащих двухцепо-
чечную ДНК, имеются так называемые паповавирусы, от-
дельные виды которых вызывают появление бородавок и да-
же злокачественных опухолей. Наиболее хорошо изучен био-
химиками обезьяний вирус 40 (SV40), способный вызывать
опухоли и у некоторых других видов. Еще одним опухолевым
вирусом является вирус полиомы мыши. Несколько боль-
шие размеры имеют папилломавирусы; один представитель
этой группы вызывает появление бородавок у человека. Еще
большие размеры (диаметр 70 нм) имеют аденовирусы; из
них 32 вида вызывают различные инфекционные заболева-
ния у человека. Герпесвирусы — очень крупные вирусы, окру-
женные липидсодержащей мембраной, а самыми крупными
из икосаэдрических вирусов являются вирусы, вызывающие
полиэдрозы у насекомых. Один из них, поражающий мух
Tipula, имеет диаметр 130 нм. Другой группой крупных
ДНК-содержащих вирусов являются бактериофаги с отрост-
ками (к их числу относятся, в частности, Т-четные фаги; до-
полнение 4-Д).
Самыми мелкими из РНК-содержащих вирусов являют-
ся бактериофаги R17, MS2 и Qp, нуклеиновые кислоты ко-
торых содержат 3500—4500 нуклеотидов и имеют всего три
гена. Их нуклеотидная последовательность полностью рас-
шифрована (гл. 15, разд. В.2.И)1 *.
Несколько крупнее пикорнавирусы (от англ. «PicoRNA»,
указывающего на очень малое содержание РНК). Среди
этих мелких икосаэдрических вирусов диаметром 15—30 нм
имеется немало таких, которые вызывают инфекционные за-
болевания у человека. К ним относятся, в частности, энте-
ровирусы — группа, включающая полиовирусы, вирусы Кок-
саки и некоторые из ЕСНО-вирусов. В другую группу пикор-
навирусов входят риновирусы, характерные для обычных
простудных заболеваний. В настоящее время известно уже
~200 различных типов таких вирусов. Многие РНК-содер-
жащие вирусы поражают растения; примером может слу-
жить вирус желтой мозаики турнепса (диаметр вириона 28—
30 нм).
Крупные вирусы диаметром 80—100 нм, имеющие по 8—
10 выступов в вершинах икосаэдра, вызывают грипп, свинку
и некоторые другие острые инфекции. Внутренняя структура
таких вирусов, по-видимому, очень сложна. РНК составляет
только 1 % от массы всего вируса и состоит из нескольких
фрагментов относительно небольшого молекулярного веса
( — 0,5-106).
1 Недавно расшифрована нуклеотидная последовательность ДНК бактериофага
0X174 и вируса SV40, а также некоторых других вирусов. — Прим, перев.
г\ак молекулы сосдипшикм дру1
Apyi
Лучше всего изучен спиральный РНК-содержащий вирус
табачной мозаики (разд. Г.2)я. Более сложное строение име-
ют вирусы, у которых вирионы напоминают по форме пулю;
примером может служить вирус бешенства — его диаметр
равен 65—90 нм, а длина— 120—500 нм. Нуклеопротеид
внутри частицы у таких вирусов уложен в виде спирали.
Геном некоторых вирусов, например реовирусов, пред-
ставлен довольно редко встречающейся в природе двухце-
почечной РНК. В инфицированной клетке РНК реовируса
фрагментируется примерно на 10 сегментов.
Некоторые болезни растений, включая веретеновидность
клубней картофеля, вызываются очень маленькими сверну-
тыми молекулами РНК с мол. весом 120 000 или даже мень-
ше6. Белок, кодируемый такой РНК, должен был бы содер-
жать не более 100 аминокислотных остатков. Поэтому мало
вероятно, что вирус (или, как его часто называют, вироид)
является носителем гена, детерминирующего какой-либо бе-
лок. Какой бы ни была вносимая вироидом генетическая ин-
формация, она заставляет растительную клетку воспроизво-
дить большое число копий молекулы РНК, которые затем
могут переноситься на другие растения тлями или челове-
ком через сельскохозяйственные инструменты.
3 Horne R W, Sci. Am, 208, 48—56 (Jan. 1963).
6 Maramorosch К, Kurstak E. (eds), Comparative Virology, Academic
Press, New York, 1971.
B Knight C A , Chemistry of Viruses, 2nd ed., Springer Publ., New York,
1975.
r Benbow R M, Mayol R. F., Picchi J. C., Sinsheimer R. L, J Virol, 10,
99—114 (1972)
д Fraenkel-Conrat H., Sci. Am., 211, 47—54 (Oct. 1964).
e Marx J L, Science, 178, 734 (1972).
6. Икосаэдрические вирусные частицы [47]
Многие вирусы обладают белковым чехлом, близким по форме к
сфере; внутри него содержится ДНК или РНК (дополнение 4-В)- Че-
хол состоит обычно из большого числа идентичных субъединиц — факт,
который можно понять, исходя из соображений экономии генетического
материала. Действительно, для формирования специфической структу-
ры из большого числа идентичных субъединиц достаточно одного гена
[48]. Электронно-микроскопические данные показывают, что вирусные
частицы часто имеют форму икосаэдров (рис. 4-11), а согласно хими-
ческим исследованиям, число белковых субъединиц в вирусной частице
кратно 60. Например, чехол РНК-содержащего вируса хлоротической
пятнистости коровьего гороха диаметром ~25 нм состоит из 180 бел-
ковых субъединиц с мол. весом 19 600; каждая из субъединиц содержит
183 аминокислотных остатка [49]. Небольшой РНК-содержащий бак-
териофаг f2 имеет чехол из 180 субъединиц [50] с мол. весом ~ 13 750,
в который заключена молекула РНК с мол. весом ~ 1,1-10е.
Чехол вируса кустистой карликовости томатов диаметром ~33 нм так-
же состоит из 180 субъединиц, тогда как у вируса бородавок человека
диаметром ~56 нм их 420, что в семь раз превышает число частиц в
правильном икосаэдре. Согласно концепции квазиэквивалентности субъ-
19—1821
290 Глава 4
РИС. 4 11 Бактериофаг L07, инфицирующий Е. coli (подобен фагу 0X174). (С лю-
безного разрешения А. С. Тихоненко, Институт молекулярной биологии АН СССР,
Москва.)
единиц [47] (см. сл. разд.), расстояния между центрами субъединиц в
семействе икосадельтаэдров с числом субъединиц, кратным 20, сохра-
няется, однако углы должны несколько отличаться от углов в правиль-
ном икосаэдре (ср. с геодезическими оболочками, в которых углы оста-
ются постоянными, а некоторые расстояния меняются). В вершинах
икосадельтаэдров содержатся как гексамеры, так и пентамеры из субъ-
единиц. Например, белковые чехлы вирусов, состоящих из 180 субъеди-
ниц, содержат 12 пентамеров, 20 гексамеров, 60 тримеров (на гранях)
и 90 димеров (у ребер).
В чехлах некоторых сферических вирусов присутствуют белки раз-
ных типов. Например, чехол полиовирусов (диаметр 25 нм) состоит из
трех главных белков (а, ₽ и у) —продуктов расщепления одного белка-
предшественника на четыре или более фрагментов [51]. Три из них,
самые большие (мол. вес. 33 000, 30 000 и 25 000), соединяются друг с
Как молекулы соединяются друг с другом 291
другом, образуя комплекс, состав которого описывается, по-видимому,
формулой (а, р, у) бо. На вершинах икосаэдрического белкового чехла
небольшого бактериофага 0X174 (диаметр 25=3=1 нм), содержащего
одноцепочечную ДНК, имеются небольшие пустотелые выступы
(рис. 4-11) [52].
7. Квазиэквивалентность конформации субъединиц
Вполне разумное предположение о симметричной упаковке субъеди-
ниц и электронно-микроскопические данные об их квадратном, пента-
гональном и гексагональном расположении позволили сделать вывод,
что протомеры стремятся объединяться с образованием симметричных
структур. Рассмотрим предсывленный на
рис. 4-12 процесс соединения двух молекул.
Ясно, что эти молекулы могут «состыко-
ваться», образуя изологический димер,
только при условии, если они не упрутся
«носами» друг в друга (рис. 4-12, Л). Од-
нако, несмотря на очевидные стерические
препятствия, изологический димер может
образоваться и в этом случае, если одна из
субъединиц немного изменит свою конфор-
мацию (рис. 4-12, Б). В такой структуре
субъединицы будут не эквивалентными, а
квазиэквивалентными.
Несимметричная димеризация белков
представляет собой, по-видимому, весьма
распространенное явление. Например, фер-
менты малатдегидрогеназа [53] и глице-
ральдегидфосфатдегидрогеназа (рис. 2-10)
являются тетрамерами и обладают симмет-
рией, близкой к диэдрической. При уста-
новлении структуры кристаллов этих фер-
ментов исходили из предположения о рав-
ноценности всех субъединиц. Однако не-
РИС. 4-12. Несимметричное свя-
зывание в днмере А. Две мо-
лекулы, не способные димери-
зоваться. Б. Проблема реше-
на: конформация полипептид-
ной цепи молекулы 1 немного
изменилась, и теперь молеку-
лы «состыковываются»
ожиданно выяснилось, что они не совсем
симметричны, поскольку связывать кофер-
мент NAD+ способна только одна из двух
полипептидных цепей малатдегидрогеназы.
Структура другого центра связывания,
по-видимому, настолько изменена, что он
не способен связывать этот необходимый
кофермент. Аналогичное явление имеет ме-
сто и в случае глицеральдегидрофосфатдегидрогеназы (гл. 8, разд. 3 3
и 3.5).
Гормон инсулин — это небольшой белок, состоящий из двух поли-
пептидных цепей (обозначаемых латинскими буквами А и В), которые
связаны друг с другом дисульфидными мостиками (рис. 4-13, А). На
рис. 4-13,5 схематически изображена структура этого белка согласно
рентгеноструктурным данным; представлены только остовы полипеп-
тидных цепей и несколько боковых групп [54, 55]. На этом рисунке
В-цепь расположена за A-цепью. Начиная от N-концевого фенилала-
нина-1, пептидная цепь делает плавный поворот, затем примерно в
центре молекулы образует три а-спиральных витка, и наконец после
крутого разворота направляется в верхний левый угол рисунка, обра-
19*
•s-
s
Д-цель. Gly• Ile*Val,Glu*GlrvCysX J?ys-Ser*Leu*TyrGln-Leu
^Cys —Ту r—Se г "^Ie
S'
Gin
S
В-цепь. Phe • Vai • Asn • Gin • His• Leu • Cys
Gin
Vai
Leu
GlySer-His
Tyr
Leu
Vai
Cys'
Gly
Gin
Asn
Tyr
'Cys
Asn
Arg
Gly
Phe
Phe
Tyr
Thr
Pro
Lys
Ala 30
21
Ось симметрии
3-го порядка
РИС. 4-13. Структура инсулина свиньи. А. Аминокислотная последовательность А- н В-цепей, связанных друг с другом дисульфидными мостика-
ми. Б. Пространственное расположение остовов полипептидных цепей в молекуле инсулина по данным рентгеноструктурного анализа. На рисунке
указано также расположение некоторых боковых ароматических групп (см. также рис. 4-14 и 4-15). В. Схема, иллюстрирующая упаковку шести
молекул инсулина с образованием гексамера, стабилизируемого двумя атомами цинка.
Как молекулы соединяются друг с другом
зуя почти полностью вытянутую p-структуру. A-цепь имеет U-образную
форму с двумя участками, напоминающими спирали. Эта конформация
частично реализуется за счет образования дисульфидного мостика
между двумя частями A-цепи. А- и Вщепи связаны двумя дисульфид-
ными мостиками (один из которых расположен в верхней части ри-
сунка, а другой — ближе к нижней его части); стабилизирует всю
структуру гидрофобное взаимодействие между боковыми группами
аминокислотных остатков, расположенных во внутренней части моле-
кулы.
В растворе инсулин легко димеризуется, причем субъединицы за-
нимают квазиэквивалентные положения. В определенных условиях три
димера образуют гексамер, обладающий симметрией, близкой к ди-
эдрической (D3); эта структура стабилизируется двумя ионами цинка.
На рис. 4-13, В приведено схематическое изображение гексамера; он
обладает тремя осями симметрии 3-го порядка и двумя осями симмет-
рии псевдо-2-то порядка, одна из которых проходит между двумя субъ-
единицами димера, а другая — между соседними димерами.
Атомы цинка расположены на оси симметрии 3-го порядка и свя-
заны с тремя имидазольными кольцами гистидинов В-10. Роль атомов
цинка не совсем ясна. Гексамеры легко образуют ромбические кристал-
лы даже внутри панкреатических клеток, синтезирующих инсулин.
Структура инсулина воплощает в себе основные особенности строения
олигомерных ферментов, обладающих циклической или диэдрической
симметрией. Как и в случае гексамера инсулина, центральные части
таких молекул часто открыты и «торчащие» боковые группы амино-
кислотных остатков (в случае инсулина имидазольные группы) образу-
ют как бы «гнезда», в которые могут входить ионы или молекулы, ре-
гулирующие активность белков. Однако функциональная роль цинка
при действии инсулина остается пока неизвестной.
На рис. 4-14 показано более детально, как связываются между со-
бой субъединицы в димере инсулина, если смотреть на молекулу при-
мерно вдоль оси симметрии 2-го порядка (отмеченной крестиком в
центре кольца фенилаланина-25). Видно, что С-концы В-цепей вытяну-
ты. Две антипараллельные цепи образуют p-структуру с двумя пара-
ми водородных связей. Если бы связывание было строго изологическим,
эти две пары связей были бы полностью эквивалентными и располага-
лись бы симметрично одна относительно другой. Прямая, проведенная
через определенную точку на одной цепи и через ось симметрии 2-го
порядка, должна была бы пройти через соответствующую точку на дру-
гой цепи. Однако, как показывает тщательный анализ, структура да-
леко не симметрична.
По-видимому, наиболее ярко асимметрия структуры, изображен-
ной на рис. 4-14, проявляется в центре, где фенилаланин-25 правой це-
пи выступает из структуры вверх и влево. Если бы симметрия была
идеальной, то соответствующая боковая группа левой цепи выступала
бы вверх и вправо и эти два фенилаланина столкнулись бы «носами»,
как это схематически показано на рис. 4-12, А. В действительности же
в инсулине боковая группа одного из фенилаланинов как бы откло-
няется, освобождая место для другой.
На рис. 4-15 представлен разрез олигомера инсулина вдоль плос-
кости, проходящей приблизительно через обе оси симметрии 2-го по-
рядка (рис. 4-13, В). Обратите внимание на расположение боковых
групп вдоль обеих осей. Эти группы соответствуют группам с и с на
рис. 4-9. Заметим, что они идентичны, как и необходимо при изологи-
ческом связывании, причем в основном это гидрофобные, ароматиче-
294 Глава 4
РИС. 4-14. Спаренные С-концевые участки В-цепей в димере инсулина. Вид примерно
вдоль оси симметрии 2-го порядка.
ские или алкильные группы (главным образом лейцина). Симметрия
оказывается не идеальной и метильные группы лейциновых остатков
стремятся как бы переплестись, прилегая друг к другу более тесно,
чем это должно было бы быть при полной симметрии. Таким образом,
результаты детального анализа димерной и гексамерной структур ин-
сулина, с одной стороны, могут служить наглядной иллюстрацией
принципов изологического связывания протомеров, а с другой ясно
показывают, что два протомера часто связываются друг с другом не
строго симметрично.
Как молекулы соединяются друг с другом 295
Как мы уже отмечали, субъединицы оболочек икосаэдрических ви-
русов и некоторых ферментов могут быть квазиэквивалентными. Эта
особенность ответственна за спирализацию жгутиков бактерий, она же
лежит в основе некоторых интересных структурных особенностей ви-
руса табачной мозаики. Белковые субъединицы вируса могут быть уло-
жены либо в спираль с числом субъединиц на один виток, равным 16,3
(рис. 4-7), либо в плоские кольца из 17 субъединиц каждое [36а]. При
этом конформационные различия очень малы. Кольца способны диме-
ризоваться, однако крупных агрегатов они не образуют. Удивительно,
что димерные кольца не обладают диэдрической симметрией. Все субъ-
единицы в них ориентированы одинаково, но находятся в двух разных
конформациях. Есть предположение, что такие диски являются
промежуточной структурой при оборке вирусной частицы. Согласно
рентгеноструктурным данным, внутренние участки квазиэквивалентных
субъединиц диска играют роль своего рода ловушек, ожидающих мо-
мента, когда в состав вируса включится РНК. После этого диски ме-
няют конформацию и образуют «завиток», инициируя рост спиральных
вирусных частиц [36а]. Эти и многие другие интересные данные позво-
лили предположить, что квазиэквивалентность белковых субъединиц в
сочетании с их способностью менять свою конформацию лежит в осно-
ве многих биологических явлений.
РИС. 4-15. Разрез молекулы инсулина вдоль плоскости, проходящей через оси сим-
метрии 2-го порядка__________________________________[54L
296 Глава 4
8. Олигомеры, содержащие субъединицы разных типов
Многие ферменты, чехлы вирусов и более сложные молекулярные
структуры построены из протомеров двух или большего числа типов.
Наиболее детально изучен гемоглобин — тетрамерный белок (агРг),
построенный из двух хотя и похожих, но не идентичных субъединиц,
аир (обе имеют мол. вес, равный 16100). Аминокислотные последо-
вательности субъединиц весьма сильно различаются, и тем не менее
укладка полипептидных цепей в обеих субъединицах гемоглобина поч-
ти одинакова (и весьма сходна с укладкой полипептидной цепи в мо-
номерном миоглобине) [56]. Если бы не эти различия, молекула гемо-
глобина была бы высокосимметричной с указанным на рис. 4-9, В
типом взаимодействий и тремя осями симметрии 2-го порядка. Приня-
то говорить, что молекула гемоглобина имеет одну истинную ось сим-
метрии 2-го порядка и две оси псевдо-2-го порядка. В ней имеется два
набора чисто изологических взаимодействий (между двумя а-субъеди-
ницами и двумя р-субъединицами) и две пары несимметричных взаи-
модействий (между а- и р-субъединицами). На прекрасных рисунках
Дикерсона и Гейса [57] ясно видна почти симметричная ориентация
различных участков полипептидной цепи.
Контакт между субъединицами у одной пары (aipi) несколько бо-
лее прочный, чем у другой. В первом случае в тесном контакте друг
с другом находятся боковые группы 34 аминокислотных остатков и в
общей сложности НО атомов [55]. Основной вклад в силы, связываю-
щие субъединицы, вносят гидрофобные взаимодействия, а число кон-
тактов типа тех, которые имеют место при чисто изологическом свя-
зывании, весьма невелико. Во взаимодействии другой пары субъединиц,
aiP2, участвует только 19 аминокислотных остатков и в общей сложно-
сти всего 80 атомов. Поскольку этот контакт слабее, чем первый, ге-
моглобин относительно легко диссоциирует на ap-димеры, где субъ-
единицы удерживаются вместе за счет aiPi-контактов, а взаимные их
перемещения, происходящие в процессе оксигенации, осуществляются
в области афг-контактов (разд. Д.5.а). Истинно изологические контак-
ты (т. е. аа и рр) непрочны, поскольку идентичные протомеры стериче-
ски не соответствуют друг другу.
Аспартаткарбамоилтрансфераза (мол. вес=310000)—фермент, вы-
деленный из Е. coli, — может диссоциировать на два тримера, на-
зываемых обычно каталитическими субъединицами (мол. вес триме-
ра 100 000), и три димера, называемых регуляторными субъединицами
(мол. вес димера 34 000). Молекула этого фермента напоминает по
форме треугольную пластинку [58, 59], толщина которой равна 9,2±
±1,0 нм, а длина стороны — 10,5 ±1,0 нм. Она имеет симметрию 3:2,
т. е. это диэдрическая структура с одной осью симметрии 3-го порядка
и тремя осями 2-го порядка. Два тримера и находящиеся между ними
димерные субъединицы расположены, по-видимому, «спиной к спине»;
последние плотно уложены в бороздках, идущих по краям тримеров.
Димеры уложены не строго параллельно оси симметрии 3-го порядка:
чтобы не наталкиваться друг на друга, верхняя и нижняя половины
поворачиваются друг относительно друга вокруг оси симметрии 3-го
порядка. В центре имеется заполненная водой полость размером
— 2,5x5,0X5,0 нм. Активные центры фермента расположены, по-ви-
димому, внутри этой полости, в которую можно попасть через шесть
расположенных по бокам структуры отверстий диаметром 1,5 нм.
Известно множество других олигомерных ферментов и различных
сложных структур, содержащих белковые субъединицы более одного
Как молекулы соединяются друг с другом 297
типа. В качестве примера можно указать на дегидрогеназы а-кетокис-
лот, представляющие собой огромные, имеющие форму куба комплек-
сы с мол. весом ~2—4 млн, содержащие три разных белка (рис. 8-18).
Волокна поперечнополосатой мышцы (разд. Е), антитела (дополне-
ние 5-Е), комплемент крови (дополнение 5-Ж) и удивительный по сво-
ей форме бактериофаг с отростком (дополнение 4-Д) •—все это чрезвы-
чайно сложные и красивые молекулярные структуры.
Д. Кооперативные изменения конформации
Известно, что в одном конформационном состоянии фермент лучше
связывается с субстратом, чем в другом. Этот простой факт, а также
тенденция мономеров белков ассоциировать приводит к ряду интерес-
ных эффектов, природа которых долгое время оставалась загадкой
для ученых. Сейчас мы знаем, что кооперативные изменения конформа-
ции в олигомерных белках лежат в основе многих важных аспектов
регуляции активности ферментов и метаболизма. Эти изменения вно-
сят элемент кооперативности в связывание малых молекул (например,
кислорода гемоглобином), а также субстратов и регуляторных моле-
кул с ферментами. Вполне возможно, что многие фундаментальные
свойства живых организмов непосредственно связаны с кооператив-
ными изменениями в фибриллах, мембранах и других структурах клет-
ки. По этим причинам было бы весьма полезно рассмотреть этот во-
прос (в частности, его количественную сторону) более подробно.
Кооперативность связывания кислорода с гемоглобином была от-
крыта очень давно, и, несмотря на это, важность данного явления не-
дооценивали. Оно вновь привлекло к себе широкое внимание в 1965 г.,
когда Моно, Уаймен и Шанжё [33] описали его математически. По-
скольку для многих случаев предложенная авторами модель является
сильным упрощением, ниже мы остановимся на более общем подходе
к этому вопросу, разработанном Кошландом [60—62].
Рассмотрим равновесный переход между молекулами белка, нахо-
дящимися в двух разных конформациях, А и В (по терминологии Моно
и др. — Т и Р) и содержащих лишь один центр связывания для моле-
кулы X: , _
\ / \ I (4'41)
• Конформер А(илиТ) Конформер В (или В)
Kt=[B]/[A] (4-42)
Если константа равновесия Kt — 1, то два конформера обладают одина-
ковой энергией, если же Kt< 1, то конформер А более стабилен, чем В.
1. Неравноценное связывание субстрата и индуцированное соответствие
Допустим, что конформер В связывается с X прочнее, чем конфор-
мер А (это отражено на приведенной выше схеме, где форма центров
связывания конформеров различается). Истинные константы связыва-
ния конформеров А и В с молекулой X — Ках и Къх (или Кт и Kr) —
соответственно равны
Ках=[АХ1/[А][Х], Квх = [ВХ]/|В][Х]. (4-43)
298 Глава 4
Ниже представлены все равновесные процессы, протекающие в этой
системе. к(
А«-----=±В
АХ-----А <__>ВХ
К(Квх/ХАХ
’Обратите внимание, что константа, характеризующая равновесие меж-
ду АХ и ВХ, является функцией трех других констант, а именно
ЛгКвх/Кдх. Теперь рассмотрим следующую ситуацию. Предположим,
что в отсутствие X преобладает А, однако X более прочно связывается
с В, чем с А. Тогда в равновесной смеси будут преимущественно при-
сутствовать или свободный А, или ВХ (в меньших количествах будут
находиться также АХ и В). Возникает интересный с точки зрения
кинетики вопрос: по какому из двух возможных путей будет протекать
реакция перехода от А к ВХ [уравнение (44)]? Первый вариант, рас-
сматриваемый в модели Моно—Уаймена—Шанжё, предполагает, что X
связывается только с В, небольшое количество которого присутствует
в смеси в равновесии с А. Согласно второму варианту, X связывается
с А, но АХ затем быстро переходит в ВХ. Можно сказать, что X вызы-
вает (индуцирует) конформационное изменение в белке А, облегчаю-
щее «состыковку». Именно на этом основана концепция Кошланда, из-
вестная под названием концепции индуцированного соответствия. Сле-
дует иметь в виду, что, зная константы равновесия, можно определить
только равновесные концентрации всех четырех форм, присутствующих
в уравнении (4-44). Однако при изучении метаболизма нас чаще инте-
ресуют скорости тех или иных реакций, а не равновесное состояние, а
исходя только из данных для равновесной системы, a priori нельзя ска-
зать, по какому из двух возможных путей будет реально протекать дан-
ная реакция.
Заметим, что, если отношение Авх/Аах очень велико, то в равно-
весной смеси будет присутствовать лишь незначительное количество
АХ. В этом случае определить экспериментально величину /(ах не
удается, но для описания состояния равновесия достаточно знать две
константы — Кт и Къх-
2. Образование олигомеров
Рассмотрим теперь процесс ассоциации А с В с образованием оли-
гомеров, для которых истинные константы связывания Ках и Къх име-
ют те же значения, что и для мономеров. Поскольку наиболее рас-
пространенной олигомерной формой ферментов является изологиче-
ский димер [63], целесообразно более подробно проанализировать по-
ведение именно димеров. Моно и др. подчеркивали, что оба конформе-
ра А и В (Т и R) могут ассоциировать, образуя изологические диме-
ры, в которых сохраняется симметрия:
Как молекулы соединяются друг с другом
В то же время ассоциация В и А должна приводить к образованию
несимметричного димера, в котором субъединицы слабо связаны друг
с другом:
Смешанный АВ-димер
В модели Моно—Уаймена—Шанжё сделано допущение о том, что
образованием смешанного димера АВ можно полностью пренебречь,
•однако общий подход требует рассмотрения всех димерных форм [64],
Константы образования Ааа, Квв и Лав определяются следующими
уравнениями:
2А^А2 Каа = -^, (4-46)
2В В2 КВв=-^= (4 47)
А + В^АВ Kf=2^=-^=^^. (4-48)
(Обратите внимание, что константу ассоциации Kt связывает с Кав
статистический множитель 2.)
3. Равновесия связывания для димеризующегося белка
Все описанные в уравнениях (4-42) — (4-48) равновесные процес-
сы, в ходе которых образуются димеры Аг, АВ и В2 или к димеру при-
соединяется одна или две молекулы X, представлены схематически на
рис. 4-16. Над каждой стрелкой приведена характеризующая эту ста-
дию микроскопическая константа, умноженная на соответствующий
статистический множитель. Степень насыщения у задается следующим
уравнением:
2у (для случая димера) =
__ [АХ] + [ВХ] + [АаХ] + 2[А2Х2] + [АВХ] + [АХВ] + 2[АВХ2] + [В2Х] + 2[В2Х2] (4 49)
4- ([А] + [АХ] + [В] + [ВХ]) + [Аа] + [А2Х] + [А2Х2] + [АВ] + [АВХ] +
+ [АХВ] + [АВХ2] + [В2] + [В2Х] + [В2Х2]
Каждый из девяти слагаемых в числителе представляет собой кон-
центрацию одного из девяти комплексов, содержащих X (рис. 4-16).
Четырнадцать слагаемых в знаменателе — это концентрация белка в
каждой из форм (включая те, которые не содержат X). Приведенные
концентрации белка соответствуют молекулярному весу димеров, в
связи с чем некоторые члены знаменателя умножены на х/2.
Все члены числителя и знаменателя уравнения (4-49) можно выра-
зить через ГХ], используя микроскопические константы, приведенные
на рис. 4-16. Для этого надо составить уравнение [аналогичное урав-
300 Глава 4
X
ВХ
РИС. 4-16. Возможные формы димеризующихся белков, существующих в двух кон-
формационных состояниях; в каждом протомере имеется один центр связывания с
лигандом X. Пунктирными стрелками указаны равновесные процессы, рассмотренные
Моно, Уайменом и Шанжё, а сплошными — Кошландом и др. [61, 62]. Жирные стрел-
ки относятся к простейшей модели индуцированного соответствия, не учитывающей
диссоциации димера. (Заметим, что, хотя все стрелки имеют только одно направление,
соответствующие процессы обратимы.) Величины Клх и Л’вх считаются одинаковыми
для всех субъединиц независимо от того, в какой форме они находятся — в мономер-
ной или димерной.
нению (4-15)], связывающее у с [X], /Сах и /Свх, /Ct и с константами
взаимодействия /Саал /Сав и /Свв- Поскольку такое уравнение в общем
виде очень громоздко, рассмотрим некоторые частные случаи, когда
оно имеет более простой вид.
а. Диссоциация олигомеров отсутствует
Если обе константы — /Саа и /Свв — достаточно велики, то диссо-
циация на мономеры происходить не будет. Тем не менее переход меж-
ду конформациями А и В внутри димера или олигомера более высокого
порядка все-таки может осуществляться и математические соотноше-
ния, приведенные на рис. 4-16, остаются применимыми. Для описания
наиболее распространенных моделей олигомерных ферментов необхо-
димо ввести дальнейшие упрощения.
1. Модель Моно—Уаймена—Шанжё [33]. Если принять, что обра-
зуются только симметричные димеры, т. е. /Саа и /Свв/Сав [уравне-
Как молекулы соединяются друг с другом 301
ние (4-45)], то можно ограничиться рассмотрением лишь тех равновес-
ных процессов, которые обозначены на рис. 4-16 пунктирными стрелка-
ми. В отсутствие лиганда X отношение [В2]/[А2] =const [1/Е в обозна-
чениях Моно—Уаймена—Шанжё; см. также уравнение (4-45)]:
[В2] _ 1 Л’вв
[А2] L КАА 41
(4-50)
На положение равновесия влияют как константы ассоциации Каа и
Авв, так и константа перехода At- Отношение [В2] к [А2] может быть
мало, если Каа и Авв близки, a Kt невелика. Если At —1, это отноше-
ние тоже может быть мало при условии, что Аал Ав в, т. е. когда в
комплексе А2 субъединицы связаны прочнее, чем .в В2. Для этого слу-
чая уравнение (4-49) упрощается и принимает следующий вид:
о~ _ [АаХ] + 2[А2Х2] + [В3Х] + 2[В2Х2]
* [А2] + [А2Х] + [А2Х21 + [В3] + [В2Х] + [В2х2]
2КааКах [X] + 2КааА3ах [X]2 + 2АВвАвхА2 [X] + 2КВВКВХК2 Iх!2
Ада-Е ZKaaKax [X] + АааАдх 1х12+ АввА2 4* 2АввАВхА2 [X] + КввАвхК2 [X]2
(4-51)
Подставляя выражение для —113 (4-50) в (4-51), получаем
w 1лпя лим₽пщ_ L-Aax[x](1+Aax[x]) + Abx[X](1+Abx[X])
у (для димера)---------А (1 + Ках [Х])2+(1 + Квх [X])2---<4 52)
В случае олигомера из п субъединиц Моно и др. делают допущение о
том, что все центры связывания в данном конформере независимы и
равноценны. Уравнение для у, вытекающее из (4-29), имеет в этом
случае следующий вид:
- ЕАах[Х](1 + Аах[Х])'!-1+Квх[Х](1 +Авх[Х]) ,4
у~ А (1 + Кдх [X])rt+(1 + КВх [Х])п ' ’
Первоначально мы предполагали, что В2 связывается с X прочнее,
чем А2. Следовательно, если равновесие в уравнении (4-50) сильно
смещено в сторону образования В2 (Е мало), то добавление X не по-
влияет на равновесие между двумя конформерами и связывание будет
некооперативным. Уравнение (4-53) сводится в этом случае к (4-30).
Если, однако, равновесие смещено в сторону образования А2 (Е вели-
ко), то добавление X приведет к сдвигу равновесия в сторону образо-
вания В2 (который прочнее связывается с X). Более того, поскольку
выражение для у (4-52) содержит в знаменателе член Авх [X]2, свя-
зывание начнет становиться кооперативным. В предельном случае,
когда L велико и Ках — 0, большинство членов в уравнении (4-52) ста-
нет равным 0 и оно примет вид приведенного ранее уравнения (4-33),
относящегося к случаю полностью кооперативного связывания, когда
А=Авх Е. При других значениях Ках, Авх и Е наблюдается неполная
кооперативность [60].
Модель индуцированного соответствия Кошланда [61, 62]’ В этой
модели рассматриваются только формы А2, АВХ и В2Х2 (жирцые
302 Глава 4
стрелки на рис. 4-16). Выражение для 2у имеет следующий вид1:
[АВХ] 4-2[В2х2] =
у (А2]+[АВХ]+[В2Х21
_ , (464>
1 + 2KBXKt [X] + (XBxXt)2 [Х]«
Если йеличина Хав мала (нет «смешанного» димера), это выраже-
ние также сводится к уравнению (4-33), описывающему полностью ко-
оперативное связывание, причем К определяется в этом случае следу-
ющим образом:
' (4-55)
''АА
Если же Кав много больше Каа и Квв, то будет иметь место антико-
оперативность (отрицательная кооперативность). В этом случае кри-
вая насыщения, как и кривая связывания протонов дианионом сукци-
ната (рис. 4-4), будет двухступенчатой.
б. Случай, когда в одной из конформаций белок диссоциирует
Рассмотрим случай, когда константа Авв очень мала и В2 легко
диссоциирует на мономеры. Тогда присоединение X приведет к дис-
социации димера. Хорошо известным примером белка такого рода мо-
жет служить гемоглобин миноговых, который представляет собой ди-
мер и после связывания кислорода диссоциирует на мономеры [64].
В этом случае уравнение (4-49) сводится к такому виду: i
2у=------. (4-56)
[А2] -Е -g- [ВХ]
Читателю предоставляется интересная возможность проанализировать,
можно ли на основании этого уравнения предсказать слабое коопера-
тивное связывание кислорода гемоглобином миноговых.
Посмотрите еще раз на выражение для константы L, определяю-
щей отношение между количествами белка, находящегося в конфор-
мациях А и В в отсутствие лиганда. Из уравнения (4-50) следует,
что L может достигать больших значений (преимущественно присутст-
вует конформер А) либо при очень малой Kt, либо при Авв<САаа-
Так, если Kt— 1 и L велико, это означает, что связь между субъедини-
цами в В2 значительно слабее, чем в А2, и вполне возможно, что при-
соединение X приведет к диссоциации молекулы, как это имеет место в
случае гемоглобина миноговых. Если же Kt мала (это означает, что
молекулы белка находятся преимущественно в конформации А за
счет большей стабильности этой формы), Квъ может быть значительно
больше, чем Каа', если Каа при этом достаточно мала, димер А2 пол-
1 Иногда Кошланд произвольно принимает Каа=1, считая, что Квв— это констан-
та взаимодействия, равная Авв/Ааа. Хотя это условие и упрощает алгебраические
преобразования, оно правомерно лишь в случае полностью ассоциированных систем,
поэтому в данной книге мы будем пользоваться константами, определяемыми уравне-
ниями (4-46) — (4-48).
Как молекулы соединяются друг с другом 303
ностью диссоциирует. Присоединение лиганда приведет к ассоциации
и кооперативному связыванию. Это можно легко показать, выписав-
соответствующие члены из уравнения (4-49).
4. Олигомеры более высокого порядка
Математический анализ кривых связывания для олигомеров с чис-
лом субъединиц >2 более сложен, однако можно привлечь численные
методы. Пользуясь уравнениями, приведенными в литературе для опи-
сания той или иной системы, необходимо соблюдать осторожность и
быть уверенным, что они действительно применимы к данной ситуа-
ции. Рассмотрим две тетрамерные структуры:
Каждая
поверхность
раздела
содержит
)Ъин aj-контакт
Гетерологический квадрат
Свободная энергия образования изологичеокого квадрата (изображен-
ного также на рис. 4-9,5) определяется энергией aj- и ^-взаимо-
действий.
Таким образом, согласно Корниш-Боудену и Кошланду [62], для
тетрамера в целом справедливы следующие соотношения:
AGf=2AGa7-AA+ 2AGwaa,
(4-57)
Kf =KajAAKbkAA-
Поскольку величины свободных энергий аддитивны, константа обра-
зования тетрамера будет равна произведению констант образования,
соответствующих отдельным взаимодействиям; так, KajAA представляет
собой константу образования димера, в котором имеется лишь одна
связь aj.
В изологическом тетраэдре (рис. 4-9, В) должен учитываться тре-
тий набор парных взаимодействий — cl. (Однако третья константа
взаимодействия в отличие от констант типа KajAA и Къьаа представляет
собой безразмерную величину). Гетерологический же квадрат харак-
теризуется лишь одной константой взаимодействия.
Рассмотрим теперь присоединение одной молекулы X к изологиче-
скому тетрамеру, сопровождающееся конформационным переходом в
304 Глава 4
одной субъединице:
а4 + х
А3ВХ
(4-58)
При этом несколько изменяется одно а/-взаимодействие и одно bk.
Константа равновесия для связывания X с тетрамером будет опреде-
ляться следующим уравнением:
А=4 *°Мв*мав, (4-59)
aj А bk А А
Появление в уравнении статистического множителя 4 обусловлено тем,
что комплекс А3ВХ можно образовать четырьмя способами. При при-
соединении второй молекулы X возможно такое геометрическое рас-
положение субъединиц:
Каждая из форм может образоваться двумя способами. Нетрудно за-
писать микроскопические константы для связывания второй молеку-
лы X как сумму трех членов. Ясно, что три варианта связывания вто-
рой молекулы X не равновероятны, поскольку константы, соответст-
вующие взаимодействиям aj и bk, различаются. Таким образом, оли-
гомер будет связываться с лигандом X преимущественно каким-то од-
ним способом.
Гетерологический тетрамер А2В2Х2 может быть представлен двумя
геометрическими формами. И опять различные варианты упаковки не
равновероятны. Вероятность их реализации зависит от конкретных зна-
чений констант взаимодействия1.
Все изложенное выше может (показаться просто длинным и не
слишком нужным упражнением, однако оно закладывает основы, ко-
торые необходимы для решения конкретных задач. Следует, однако,
помнить, что для применения математических моделей необходимо
вводить некоторые упрощения. Реальные белки могут существовать
более чем в двух стабильных конформациях [И], а на их наружной
поверхности имеется множество участков, потенциально способных свя-
зывать самые разные молекулы — как крупные, так и мелкие. Запол-
нение практически любого из этих участков может влиять на функ-
циональные свойства белка.
5. Гемоглобин
Рассмотрим теперь вопрос о природе кооперативного связывания
кислорода с тетрамерной (а202) молекулой гемоглобина (разд. Г.8) и
физиологическое значение этого процесса [65]. Полипептидная цепь
1 Заметим, что в гетерологическом тетрамере А4 имеет место лишь один тип взаи-
модействия между субъединицами. Однако, как только происходит присоединение од-
ной молекулы X и одна субъединица переходит в конформацию В, сразу появляются
два варнаита aj-взаимодействий. (В первом из них группа а находится в конформере А,
а во втором — в конформере В). Поскольку число этих типов взаимодействий одина-
ково, их можно рассматривать вместе.
Как молекулы соединяются друг с другом 305
каждой из субъединиц гемоглобина специфическим образом уложена
вокруг большого плоского железосодержащего кольца гема (рис. 4-17).
Характер укладки полипептидной цепи в а- и р-субъединицах всех ге-
моглобинов, как и в мономерном связывающем кислород мышечном
белке миоглобине, по существу, одинаков. Имидазольная группа гисти-
0'4бнк ->Asp(ffiroshima)
Cys( Rainier)
|F-4 Leu |
HjN
|H-9Lys
^io»Asn _/Thr(Kansas)
—> Lys(Richmond)
|c 4 Thrj
|C-2 Pro|
|E 7Hisj Saskatoon)
фенольная s |F8 His| -g"^Tyr(M Iwate)
/ группа, связанная / \ оэа
водородной связью ’ __________
с С=О группой F65
| B-6 Gly|
В p u у-цепях отсутствует
Gln(D Punjab)
в у-цепи)
| Е-8 Gly или Ala]
f»7\ai _>GIy(M Milwaukee)
k ^121 Glu
Val(S)
Lys(C, F Galveston
О=С
J37G|U Gly(G San Jose)
>Tyr(M Boston>
В a-цепи отсутствует
Пять остатков этой петли
в a-цепи отсутствуют
РИС 4-17. Схематическое изображение структуры мономера гемоглобина. На этом
рисунке изображена p-цепь гемоглобина человека Указаны некоторые различия между
данной цепью, а цепью и миоглобином Инвариантные аминокислотные остатки за-
ключены в прямоугольные рамки Отмечены также остатки, которые заменены в не-
которых аномальных гемоглобинах человека Инвариантные остатки пронумерованы
в соответствии с их местоположением в одной из спирален (от А до И), для остат-
ков, обнаруженных в мутантных гемоглобинах, указаны положения, по которым про-
исходят замещения в а- нлн Р-цепях
дина F-8 связана координационной связью с атомом железа, располо-
женным в центре гема. С другой стороны к атому железа присоединяет-
ся молекула О2.
Кооперативный характер связывания О2 гемоглобином иллюстриру-
ется кривыми, приведенными на рис. 4-18. Значение пХилл [уравнение
(4-35)] зависит от условий и может достигать трех. Физиологическое
значение кооперативного связывания ясно. В капиллярах легких при
парциальном давлении кислорода, равном ~100 мм рт. ст., гемоглобин
почти полностью насыщен кислородом, однако когда эритроциты прохо-
дят через капилляры тканей, потребляющих кислород, его парциальное
давление падает примерно до 5 мм рт. ст. Кооперативность приводит к
306 Глава 4
тому, что гемоглобин «разгружается» более полно, чем в том случае,
если бы четыре гемогруппы действовали независимо.
Дезоксигемоглобин обладает слабым сродством к О2, однако после
оксигенации одной или большего числа субъединиц сродство остальных
lg рО2, мм рт ст.
А
-0,2 Q2 0.6 1,0
1g рО2 мм рт ст.
Б
РИС. 4-18. Кооперативное связывание кис-
лорода гемоглобинами. А. Кривые связыва-
ния для миоглобина (отсутствие коопера-
тивности) (7), для гемоглобина в цельной
крови (II) и в отсутствие 2,3-дифосфогли-
церата (III) [75]. Обратите внимание на
уменьшение сродства гемоглобина к кисло-
роду, обусловленное дифосфоглицератом
Б. Кривая насыщения для эритрокруорина
Arenicola — кольчатого червя. Молекула
содержит 192 субъединицы и 96 гемов
Форма кривой свидетельствует об очень
высокой степени кооперативности («хилл»
«6) (Waxman L„ JBC, 246, 7318—7327,
1971).
субъединиц к кислороду возрас-
тает приблизительно в 500 раз1 *.
Мономерный миоглобин, как и
аномальный гемоглобин Н, моле-
кулы которого состоят из четырех
р-субъединиц, обладает высоким
сродством к кислороду, причем
связывание для последнего не
носит кооперативного характера
[66]. Эти результаты можно объ-
яснить, исходя из того, что де-
зоксигемоглобин находится в
А(Т)-конформации, а оксигемо-
глобин— в В (R)-конформации.
Разделенные же субъединицы и
миоглобин в обоих состояниях
оксигенации находятся в В-кон-
формации. Субъединицы гемо-
глобина Н также, по-видимому,
«заморожены» в В-конформации,
хотя его четвертичная структура
аналогична четвертичной струк-
туре дезоксигемоглобина [66].
Исходя из данных по оксигена-
ции гемоглобина при pH 7, были
рассчитаны параметры, характе-
ризующие этот процесс [67], в
рамках модели Моно—Уайме-
на—Шанжё: Л = 9-103, с =
= Лла/Ллв;= 0,014 [см. уравнение
(6-52)].
Если в случае дезоксигемо-
глобина никакой заметной диссо-
циации тетрамера на субъедини-
цы не наблюдается, то оксиге-
моглобин слабо диссоциирует на
сф-димеры (А=2-10“6). Вопро-
су связывания гемоглобинов с
кислородом посвящено огромное
количество работ. Последние
данные рассмотрены в обзорах [67, 68, 68а].
а. Структурные изменения, сопровождающие связывание кислорода
С помощью рентгеноструктурного анализа Перутц с сотрудниками
обнаружили, что конформации субъединиц дезокси- и оксигемоглобина,
хотя и слабо, но вполне достоверно различаются [69, 70]. Более удиви-
тельным оказался тот факт, что в процессе оксигенации как а-, так и
1 Имеется в виду присутствие эффектора 2,3-дифосфоглицерата в физиологиче-
еких концентрациях.
Как молекулы соединяются друг с другом 307
р-субъединицы поворачиваются друг относительно друга, в результате
чего гемы обеих Р-субъединиц оказываются в окси-форме примерно на
0,07 нм ближе друг к другу, чем в дезокси-форме. Изменения в обла-
сти aiPi-контакта (рис. 4-19) невелики, зато изменения в области
афг-контакта очень значительны. По выражению Перутца, здесь имеет
место «плотное схлопывание» CD-участка а-субъединицы с FG-участ-
ком р-субъединицы, сопровождающееся перестройкой всей системы во-
дородных связей.
Другое очевидное различие между окси- и дезоксигемоглобином со-
стоит в наличии на концах молекул последнего ионных связей.
Группа —NH3 Lys Н-10 каждой из а-субъединиц связана при
помощи водородной связи с карбоксильной группой С-концевого арги-
нина противоположной a-цепи, гуанидиниевая же группа каждого
С-концевого аргинина связана с карбоксильной группой аспарагиновой
кислоты Н-9 в противоположной a-цепи. Кроме того, она связана водо-
родной связью с неорганическим анионом (фосфатом или ионом С1_),
который в свою очередь связан (также при помощи водородной связи)
с а-аминогруппой валина-1 противоположной a-цепи (пара изологиче-
ских взаимодействий). На другом конце молекулы С-концевая группа
гистидина-146 каждой p-цепи связана с аминогруппой лизина С-6 а-це-
пи, а имидазольная боковая цепь — с аспарагиновой кислотой FG-1 той
же самой p-цепи. По-видимому, именно эти ионные связи обусловлива-
ют повышенную устойчивость дезоксигемоглобина и ответственны за
высокое значение константы L.
Остаток тирозина НС-2, расположенный на втором месте со стороны
С-конца, является одним из немногочисленных инвариантных остат-
ков в молекуле гемоглобина. Положение его сохранилось в процессе
эволюции в гемоглобинах и миоглобинах всех изученных видов. В де-
зоксигемоглобине тирозин НС-2 лежит как бы в «кармане», образуемом
Н- и F-спиралями, и связан водородной связью с карбонильной груп-
пой полипептидной цепи у остатка FG-5 (рис. 4-17 и 4-19). Перутц и его
сотрудники обнаружили, что при оксигенации этот тирозин выходит из
кармана, солевые мостики на концах молекул разрываются и субъеди-
ницы смещаются, образуя новую систему связей, характерную для ок-
сигемоглобина. Оксигенация двух гемов (Перутц считает, что ими явля-
ются гемы a-цепей) приводит к кооперативному конформационному из-
менению всех четырех субъединиц [71, 72].
Каким образом присоединение О2 к гемовому железу вызывает
конформационное изменение гемоглобина? Как указано в гл. 10
(разд. Б.4), при связывании с кислородом атом железа в геме, по-види-
мому, смещается в плоскости гемогруппы приблизительно на 0,06 нм
[73]. Это смещение передается через гистидин F-8, и спираль F смеща-
ется в сторону гема; в результате происходит изменение третичной
структуры, приводящее к ослаблению водородных связей в области
афг-контактов и солевых мостиков между субъединицами. Несмотря
на тщательные рентгеноструктурные исследования, детали механизма,
инициирующего конформационные изменения при присоединении О2,
остаются неясными. Необходимо иметь в виду, что разрешение, которое
удается получить при рентгеноструктурном исследовании кристаллов
белков, позволяет установить локализацию легких атомов с достаточ-
ной точностью, в результате чего механизм передачи кооператив-
ных эффектов не поддается непосредственному изучению и его прихо-
дится выяснять, исходя из изменений третичной структуры субъединиц
при отщеплении лиганда от Р(т. е. окси-)- или при присоединении его
308 Глава 4
Центр связывания для 2 3 дифосфоглицерата
в дезокси^-емоглоо ine
се}/32-Контакт значительно
изменяющийся при оксигенации
«,/3, Контакт слабо
меняющийся при
оксигенации
Ионная связь между
С концевой —СОО группой
/3 цепи и—NbQ-apynnou С 6
лизина а-цепи
В Ъезоксигемоглобине
тирозины НС 2
в кармане а в
они выходят из
находятся
оксигемоглобине
кармана
При оксигенации эта ионная связь
разрушается и происходит отщепление
протона от гистидина ¥{С-3 (эффект Бора)
А
РИС 4 19 Л Структурные изменения происходящие в гемоглобине при оксигенации
[71, 72] «Поворот в области контакта афг приводит к более плотной «подгонке»
CD области со субъединицы и FG области р2 субъединицы и быстрой перестройке всей
системы водородных связей» (Перутц)
Как молекулы соединяются друг с другом 309
«
। 1
<«
11
hiii
ii nt
«
•
НИИ
i • •
• ••1И ₽•«’
i nt» inu i
• tail — jhm •
••••• ti
nt in
i. • • i 't
РИС. 4-19. Б. Рентгенограмма, используемая при определении структуры гемоглобина.
Дифракционная картина получена от кристалла дезоксигемоглобина человека; крис-
талл вращали определенным образом вокруг двух разных осей, пропуская через него
пучок рентгеновских лучей. При этом синхронно перемещалась и рентгеновская плен-
ка. Наблюдаемая на рентгенограмме периодичность является следствием дифракции
рентгеновских лучей на периодически расположенных атомах в кристалле. Расстояния
рефлексов от начала координат (центра) обратно пропорциональны расстояниям меж-
ду плоскостями атомов в кристалле. На этой фотографии (которая показывает только
два измерения трехмерной дифракционной картины) рефлексы, расположенные на пе-
риферии, соответствуют расстоянию 0,28 нм. Измерив интенсивности рефлексов и оп-
ределив фазы гармонических функций, необходимых для проведения обратного Фурье-
преобразования, из полного набора аналогичных дифракционных картин можно уста-
новить структуру с разпешением 0,28 нм. Для дезоксигемоглобина человека полный
набор должен включать примерно 27 000 рефлексов. (С любезного разрешения
A. Arnone.)
tat it
i
i
ti
*
in
♦
it
• i
<i
I
• •
i
а
t
i
«t iitit ti
tie •••
it* мним**
• i
• uni
i i
* «
i
i <
hr г
«i
i •
*
: i
«Mu
i *
*
t <
РИС. 4-19 В. Карта электронной плотности дезоксигемоглобина человека, построенная по рентгеноструктурным данным; разрешение 0,35 нм. Кон-
турные линии указывают области высокой электронной плотности в отдельных участках молекулы гемоглобина. На этой карте показано сечение,
сделанное в основном по Р-субъединнцам перпендикулярно оси симметрии 2-го порядка на уровне остатка глутаминовой кислоты в 6-м положе-
нии, т. е. в месте, по которому происходит замещение в молекуле гемоглобина при серповидноклеточной анемии. Видны части спиралей А, Е и
F, а также остатки Val-1, Glu-6, Lys-82 и His-143. Максимум, обозначенный через X-, соответствует неорганическому аниону, вероятно сульфату
нли фосфату.
РИС. 4-19. Г. Дифференциальная карта, показывающая изменение электронной плотности при связывании гемоглобина с 2,3-дифосфоглицератом
(ДФГ) (светлые контуры), наложена на карту, изображенную на рис. 4-19, В. Области, где электронная плотность увеличивается, обведе-
ны сплошными светлыми линиями и обозначены заглавными буквами; области, где электронная плотность уменьшается, обведены
светлыми пунктирными линиями и обозначены прописными буквами. Молекула ДФГ с «усредненной симметрией» наложена на карту таким обра-
зом, чтобы она совпала с областью максимального увеличения электронной плотности на осп 2 го порядка Наличие двух пар областей с увеличен-
ной и уменьшенной электронной плотностью, обозначенных через Pl, pl и Р2, р2, показывает, что при связывании гемоглобина с ДФГ N-концевые
а-аминогруппы и гистидины Н-21 перемещаются внутрь структуры. Сильное уменьшение электронной плотности в области р4 указывает на то, что
при связывании с ДФГ анион смещается в соседнее положение.
312 Глава 4
10 Л
РИС. 4-19 Д. Интерпретация карт электронной плотности, представленных на рис.
4-19, В и 4-19, Г. Фосфатные группы 2,3-дифосфоглицерата образуют ионные связи с
остатками валинов-1 н гистидинов-2 и 143 обеих p-цепей и с остатком лизина-82 од-
ной из цепей. Это связывание смещает А-спираль и остаток 6 в направлении Е-спира-
ли, что приводит к появлению пар областей с увеличенной и уменьшенной электрон-
ной плотностью, обозначенных на рис. 4-19, Г Pl, pl и Р2, р2 [74].
к Т (т. е. дезокси-)-структуре. Ясно, что выяснение столь тонкой вещи,
как молекулярный механизм кооперативного связывания кислорода ге-
моглобином, представляет собой весьма сложную задачу.
б. Эффект Бора
Разрушение солевых мостиков на концах молекулы гемоглобина при
оксигенации приводит к другому интересному эффекту. Значения р/С»
N-концевых валинов а-субъединиц и гистидинов НС-3 р-субъединиц в
дезокси-форме гемоглобина аномально высоки, поскольку остатки этих
аминокислот участвуют в образовании солевых мостиков. В окси-фор-
ме эти группы не принимают участия в образовании мостиков и их рЛэ
ниже. Если гемоглобин находится в среде с постоянным значением pH,
равным 7, то при оксигенации происходит высвобождение протонов.
Это явление, получившее название эффект Бора, имеет важное значе-
ние, поскольку подкисление раствора гемоглобина способствует стаби-
лизации дезокси-формы. В капиллярах, где парциальное давление кис-
лорода невелико и может накапливаться двуокись углерода и молочная
кислота, понижение pH приводит к тому, что оксигемоглобин отдает
свой кислород более эффективно.
Как м&лекулы соединяются друг с другом 31&
6. Аллостерические регуляторы
На положение конформационных равновесий в гемоглобине влияет
не только присоединение кислорода к гемогруппам, но и связывание с
различными участками молекулы других соединений. Такие соединения
носят название аллостерические эффекты или регуляторы, поскольку
они связываются не с активным центром, а с другими участками белко-
вых молекул. Более подробно они рассмотрены в гл. 6 (разд. Б.6).
Важным аллостерическим эффектором для гемоглобина является 2,3-
дифосфоглицерат — соединение, присутствующее в необычно высокой
концентрации в эритроцитах человека (приблизительно в эквимолярном
количестве по отношению к гемоглобину).
2,^~Ьи<россроглицерат
Одна молекула 2,3-дифосфоглицерата связывается с одним тетрамером
гемоглобина в дезокси-форме с константой Af = 1,4-Ю5. Но сравнению
с окси-формой она обладает приблизительно вдвое меньшим сродст-
вом [74]. Рентгеноструктурные данные указывают на то, что 2,3-ди-
фосфоглицерат присоединяется между двумя 0-цепями дезоксигемогло-
бина непосредственно в том месте, где проходит ось симметрии 2-го
порядка (рис. 4-19) [71]. Уже давно известно, что гемоглобин цельной
крови обладает меньшим сродством к кислороду, чем изолированный
[75, 76] (рис. 4-18). Теперь мы видим, что такое различие обусловлено
присутствием в эритроцитах 2,3-дифосфоглицерата. Этот факт очень
важен, поскольку эритроциты могут при этом отдавать тканям большую
долю переносимого ими кислорода. Содержание дифосфоглицерата в
эритроцитах варьирует в зависимости от физиологических условий —
у людей, живущих в высокогорных районах, его концентрация выше
[76]. Высказывалось предположение, что искусственное изменение кон-
центрации этого регуляторного вещества в эритроцитах можно исполь-
зовать в клинике при нарушениях в системе переноса кислорода. При-
сутствие 2,3-дифосфоглицерата в эритроцитах характерно не для всех
видов; у птиц и черепах его заменяет, по-видимому, инозитпентафос-
фат.
Другой пример аллостерического действия в случае гемоглобина
был уже рассмотрен в предыдущем разделе. Эффект Бора можно счи-
тать результатом действия протонов, играющих в данном случае роль
аллостерических эффекторов, присоединяющихся к амино- и имидазоль-
ным группам, которые участвуют в образовании солевых мостиков.
Физиологическим эффектором является также двуокись углерода, обра-
тимо связывающаяся с концевыми ЫН2-группами а- и 0-субъединиц с
образованием карбамино (карбамат, —NH—СОО-)-групп [77, 78].
Сильнее сродство к С02 выражено у дезокси-формы гемоглобина.
Вследствие этого отдача кислорода оксигемоглобином облегчается в
тканях, богатых С02. Гемоглобин переносит значительную часть С02
к легким, где его оксигенация облегчает отщепление СО2 от карбами-
но-групп.
314 Глава 4
7. Сравнительная биохимия гемоглобина: аномальные гемоглобины
Даже у человека существует несколько типов гемоглобина. Кроме
миоглобина и гемоглобина А (агрг) у взрослых, известен также минор-
ный гемоглобин Аг (агбг). В крови человеческого плода содержится
другой тип гемоглобина — гемоглобин F (агуг). В присутствии 2,3-ди-
фосфоглицерата он обладает более высоким сродством к кислороду, чем
гемоглобин А, что способствует выполнению его функции — снабжению
плода кислородом. Через несколько месяцев после рождения гемогло-
бин F исчезает и заменяется гемоглобином А. Гемоглобины человека
различаются по аминокислотному составу и последовательности. У дру-
гих видов аминокислотный состав гемоглобинов различается еще силь-
нее. Взаимодействия между субъединицами также варьируют, а у одно-
го из типов гемоглобинов, эритрокруоринов, обнаруживаемых у некото-
рых беспозвоночных, имеется 192 субъединицы [79].
Что же общего между всеми гемоглобинами? Прежде всего для них
характерен один и тот же способ укладки полипептидных цепей вокруг
идентичных для всех гемоглобинов (или очень сходных) гемогрупп.
Однако наиболее поразительным является тот факт, что, несмотря на
четко выраженное единообразие общей структуры всех гемоглобинов,
имеется всего девять инвариантных аминокислотных остатков и один
почти инвариантный. Эти десять остатков заключены на рис. 4-17 в пря-
моугольные рамки. Два глицина (или аланина) в положениях В-6 и
Е-8 инвариантны потому, что тесный контакт между спиралями В и Е
не позволяет находиться в этих положениях аминокислотным остаткам
большего размера. Пролин С-2 обеспечивает изгиб молекулы. Четыре
других инвариантных остатка непосредственно связаны с гемогруппой.
Два из них, His Е-7 и His F-8, являются «гем-связанными» гистидина-
ми. Девятый остаток, Туг НС-2, о котором уже шла речь в разд. 5.а,
играет основную роль в кооперативном связывании кислорода. И толь-
ко Lys Н-9 расположен с наружной стороны молекулы. Причины, по
которым этот остаток инвариантен, не ясны [80].
Дополнение 4-Г
Серповидноклеточная анемия
Ген, нередко встречающийся у лиц африканского проис-
хождения, вызывает (в случае гомозиготности) тяжелое, ча-
сто летальное заболевание, получившее название серповид-
ноклеточная анемия3. В 1949 г. Полинг и Итано с сотрудни-
ками обнаружили, что гемоглобин больных серповидноклеточ-
ной анемией имеет необычно высокую электрофоретическую
подвижность6. Позднее, в 1957 г., Ингрем® разработал метод
пептидных карт (гл. 2, разд. 3.2, рис. 4-20) и применил его
для исследования гемоглобина. Он расщепил молекулу гемо-
глобина трипсином на 15 пептидов и разделил полученную
смесь с помощью электрофореза и хроматографии. Ему уда-
лось показать, что аномалия, характерная для серповидно-
клеточного гемоглобина (гемоглобина S), локализована в
P-цепи (в шестом положении) (рис. 4-17). Глутаминовая кис-
лота, находящаяся в этом положении в нормальном гемогло-
бине, оказалась замещенной в гемоглобине S на валин. Это
Как молекулы соединяются друг с другом 315
был первый случай, когда причина генетического заболевания
была прослежена до молекулярного уровня и обнаружена
замена одной аминокислоты в специфическом белке.
При низком парциальном давлении О2 гемоглобин S в
эритроцитах кристаллизуется. Кристаллизация приводит к
нарушению структуры эритроцитов, они приобретают серпо-
видную форму и легко разрушаются, что приводит к анемии.
Появление остатка гидрофобной аминокислоты, валина, в 6-м
положении, находящемся недалеко от конца молекулы, спо-
собствует образованию нового связывающего центра. В ре-
зультате тетрамеры гемоглобина ассоциируют, образуя длин-
ные микротрубчатые структуры1-, которые кристаллизуются
внутри эритроцитов.
В чем причина высокой частоты встречаемости серповид-
ноклеточного гена (известно, что его носителями являются
примерно 3 млн. американцев)? Тот факт, что этот ген «вы-
жил» и встречается чаще всего среди африканского населе-
ния, можно объяснить, по-видимому, тем, что наряду с вред-
ным воздействием он оказывал также и определенное поло-
жительное влияние. Дело в том, что возбудитель малярии, яв-
лявшийся во все времена причиной высокой смертности лю-
дей, часть своего жизненного цикла проводит в эритроцитах
(рис. 1-7). При этом оказалось, что в эритроцитах, которые
наряду с гемоглобином А содержали гемоглобин S, условия
для роста возбудителя малярии менее благоприятны, чем в
клетках, содержащих только гемоглобин А. Благодаря этому
гетерозиготные носители гена серповидноклеточности выжи-
вали при эпидемиях малярии, однако давалось это дорогой
ценой — одна четверть их потомства погибала от серповидно-
клеточной анемии.
Каковы перспективы борьбы с этим заболеванием? Прод-
лить жизнь больным можно, переливая кровь, но эти меры
не являются радикальными. Недавно проведенные исследова-
ния показали, что цианат реагирует с концевой аминогруп-
пой валина в р-субъединицах гемоглобина S; это снижает ве-
роятность образования серповидных клеток. Реакция описы-
вается следующим уравнением:
Н3С СН3 Н3С СН3
О ''''с'
, I И I
H3N—С—R4- NsC— О’ -----> H,N—С— N—С—R
Н НН
Препарат был с большой осторожностью испытан на лю-
дях, однако оказался слишком токсичным. И все же можно
надеяться, что удастся найти новые лекарственные средства,
препятствующие кристаллизации гемоглобина S.
° The much more numerous heterozygotes carry one hemoglobin S gene
but have, at most, minor problems.
6 Pauling L, Itano H. A., Singer S. J., Wells I. C„ Science, 110, 543—548
(1949).
° Ingram V. M„ Nature (London), 180, 326—328 (1957).
r Wishner В. C., Ward К. B., Lattman E. E., Love W. E., JMB, 98, 179—
194 (1975).
д Harkness D R, Trends Biochem. Sci., 1, 73—76 (1976).
316 Глава 4
Многие изменения в структуре гемоглобина человека обусловлены!
мутациями. Установлено, что в крови одного человека из 600 содержит-
ся мутантный гемоглобин, в котором обычно одна из аминокислот без
всяких последствий заменена на другую (рис. 4-20). Однако замены.
РИС. 4-20. Пептидные карты гемоглобинов человека. Денатурированный гемоглобин,
обрабатывали трипсином и образовавшуюся смесь из 28 пептидов разделяли ка бу-
маге с помощью электрофореза (в горизонтальном направлении; анод слева) и хро-
матографии (в вертикальном направлении). Местоположение пептидов определяли:
опрыскиванием бумаги нингидрином или специфическими реагентами на остатки гис-
тидина или тирозина. А. Пептидная карта гемоглобина А здорового взрослого чело-
века. Б. Пептидная карта гемоглобина S. Легко видеть, что один гистидинсодержа-
щий пептид (1) отсутствует, но зато появляется новый пептид (2). Он содержит пер-
вые 8 остатков N-конца цепи субъединицы белка. (Lehman Н., Huntsman R., Man’s
Haemoglobin, North-Holland, Amsterdam, 1&74.)
вблизи гемовой группы часто неблагоприятно влияют на связывание
кислорода, а замены в области одной из поверхностей раздела между
субъединицами могут привести к нарушению кооперативного взаимо-
действия между ними [81]. Одним из наиболее широко распространен-
ных аномальных гемоглобинов с серьезно нарушенной функцией являет-
ся гемоглобин S, обнаруженный у лиц, страдающих серповидноклеточ-
ной анемией (дополнение 4-Г). В гемоглобине S остаток глутаминовой
кислоты в 6-м положении 0-цепи заменен остатком валина. Интересно,
Как молекулы соединяются друг с другом 317
что замена того же остатка глутаминовой кислоты на остаток лизина
дает гемоглобин С, наличие которого не связано с такими серьезными
патологическими нарушениями, как при серповидноклеточной анемии.
Ряд других замен, которые удалось выявить и идентифицировать, при-
веден на рис. 4-17.
Представляет интерес семейство гемоглобинов М. Присутствие та-
кого гемоглобина в крови приводит к серьезным нарушениям; выжива-
ют только гетерозиготы по данному аномальному признаку. Кровь в
этих случаях темная, поскольку железо в половине субъединиц гемогло-
бина М необратимо окислено до трехвалентного (метгемоглобин).
В нормальной крови содержание метгемоглобина не превышает ~1%.
В норме метгемоглобин восстанавливается специальной метгемоглобин-
редуктазной системой (дополнение 10-А), тогда как метгемоглобины М
не восстанавливаются. У всех пяти гемоглобинов М имеются замены
в местах, расположенных вблизи гемогруппы. В четырех из них один
из гистидинов, связанных с гемом (F-8 или Е-7) либо в а-, либо в
.р-субъединице, заменен на тирозин. В пятом валин-67 в р-субъединицах
заменен на глутаминовую кислоту. Два гемоглобина М, имеющие заме-
ны в а-субъединицах (MBoston и Miwate), «заморожены» в Т (дезок-
си)-форме; они обладают низким сродством к кислороду и связывают
его некооперативно.
В гемоглобине Rainier1 инвариантный тирозин Н-22 заменен на ци-
стеин. Сродство к кислороду у этого гемоглобина очень велико, однако
кооперативность отсутствует. Гемоглобин Kansas, в котором аспара-
гин-102 в р-субъединице заменен на треонин, также лишен кооператив-
ности и обладает очень низким сродством к кислороду, тогда как ге-
моглобин Richmond, в котором тот же аспарагин заменен на лизин,
функционирует нормально. В гемоглобине Hiroshima С-концевой гисти-
дин в р-субъединице заменен аспарагиновой кислотой. Этот С-концевой
тистидин является одной из аминокислот, которая дает бор-протон, в
связи с чем в мутантном гемоглобине Hiroshima сродство к кислороду
повышено в три раза, а эффект Бора наполовину уменьшен [82].
Е. Мышцы
Среди большого числа сложных структур, построенных из белковых
субъединиц, ни одна не привлекла к себе большего внимания, чем спо-
собные к сокращению мышечные волокна. В организме человека суще-
ствует несколько типов мышц. Поперечнополосатые скелетные мышцы
действуют под произвольным контролем. Близка к ним по структуре
сердечная мышца с характерной поперечной исчерченностью; она конт-
ролируется непроизвольно. К третьему типу относятся непроизвольные
гладкие мышцы. У других видов встречаются мышцы особого типа.
Так, например, асинхронные летательные мышцы некоторых насекомых
позволяют им махать крыльями с частотой ~100—1000 взмахов в се-
кунду. В этих мышцах нервные импульсы используются только для
того, чтобы «запускать» и останавливать движение крыльев; что же
жасается цикла сокращение — релаксация, то он осуществляется авто-
матически.
1 Названия (большинства аномальных гемоглобинов происходят обычно от назва-
ний городов или больниц, в которых онн были впервые обнаружены Сначала эти ге-
моглобины пытались обозначать разными буквами, однако, когда их число стало
настолько большим, что букв уже не хватало, вернулись к старым обозначениям.
В тексте и на рис. 4-17 сохранены английские названия, под которыми они фигуриру-
ют в научной литературе, чтобы читатель мог точно знать, о каком гемоглобине идет
речь — Прим перед.
318 Глава 4
1. Структурная организация поперечнополосатой мышцы
Поперечнополосатые мышцы состоят из пучков длинных нитей (во-
локон) диаметром 10—100 мкм, которые образуются обычно в резуль-
тате слияния большого числа эмбриональных клеток. Длина таких во-
локон у млекопитающих составляет, как правило, 2—3 см, однако иног-
да достигает 50 см. Каждое волокно можно рассматривать как клетку,
содержащую до 100—200 ядер. В клетках присутствуют обычные кле-
точные органеллы, имеющие, однако, специальные названия. Например,
плазматическая мембрана (плазмалемма) мышечных клеток (волокон)
носит название сарколеммы; их цитоплазма называется саркоплазмой,
а митохондрии — саркосомами.
Наиболее характерной особенностью мышечных клеток является на-
личие в них сократительных миофибрилл, представляющих собой спе-
циальным образом организованные пучки белковых молекул.
В световом микроскопе в миофибриллах видны поперечные линии,
отстоящие друг от друга на расстоянии примерно 2,5 мкм (рис. 4-21 и
4-22). Область между двумя плотными Z-пластинками, называемая
саркомером, является главным сократительным элементом мышечной
клетки. В центре саркомера имеется плотная анизотропная полоса (об-
ладающая сильным двойным лучепреломлением), получившая название
A-диска. Продолжением Z-пластинок являются менее интенсивные
1-диски. Их название происходит от английского слова isotropic и не
является удачным, поскольку, хотя 1-диски и не обладают двойным лу-
чепреломлением, они не являются изотропными. Слабо окрашенные
М-линии, которые можно наблюдать только при помощи электронного
микроскопа, расположены в центре A-дисков и саркомеров.
Детальная структура саркомера оставалась неясной до 1953 г., ког-
да Г. Хаксли, исследуя тонкие срезы мышц под электронным микроско-
пом, обнаружил, что белковые нити расположены строго упорядоченным
образом [83]. Оказалось, что толстые нити диаметром 12—16 нм и дли-
ной ——1,5 мкм уложены в форме шестиугольника диаметром 40—50 нм
и проходят через весь A-диск (рис. 4-21,5). Между этими толстыми ни-
тями проходят тонкие нити диаметром 8 нм, простираясь от Z-пластин-
ки на расстояние ~ 1,0 мкм. Исследование мышцы в состоянии сокра-
щения показало, что 1-диски в ней почти исчезают, а область перекры-
вания толстых и тонких нитей увеличивается; это означает, что в про-
цессе сокращения тонкие и толстые нити скользят друг относительно
друга. В скелетной мышце саркомер укорачивается до ~1,7—1,8 мкм;
в летательной мышце насекомых это укорочение не столь велико, одна-
ко процесс сокращения многократно повторяется с очень высокой ча-
стотой.
Миофибриллярные белки составляют 50—60% общего количества
белков мышечных клеток. При низкой ионной силе эти белки нераство-
римы, а при повышении ее до ~ 0,3 становятся растворимыми и могут
быть экстрагированы. Главный белок мышцы миозин составляет осно-
ву толстых нитей. Другой белок, актин, является главной составной
частью тонких нитей (рис. 4-7). С нитями актина связаны «регулятор-
ные белки» мышцы — тропомиозин и тропонин [84], а в Z-пластинке
имеется а-актин. Не так давно в составе М-линий обнаружен белок,
который был назван М-белком [85].
Молекулы миозина имеют форму очень длинных тонких нитей разме-
ром ~ 160x2 нм (рис. 4-23). Большая часть молекулы состоит из двух,
вероятно идентичных полипептидных цепей, находящихся в форме
а-спиралей [86]. Эти цепи закручены одна относительно другой (гл. 2,
разд. Б.З.г). С-концевой участок молекулы по форме напоминает па-
Как молекулы соединяются друг с другом 31S>
О 200 нм
1 I
1мкм Мономер миозина
Мономер октина
Б
РИС. 4-21. Д. Схематическое изображение структуры типичного саркомера скелетной
мышцы. Приведенный продольный разрез соответствует электронно-микроскопической
фотографии рис. 4-22. Б. Схема, иллюстрирующая расположение толстых и тонких
нитей в поперечнополосатой мышце (поперечное сечение). В. Слева: электронно-мик-
роскопическая фотография поперечного среза мышцы кролика, обработанной глице-
рином. В центре кружка можно видеть, что шесть тонких нитей расположены по вер-
шинам шестиугольника вокруг толстой нити. Остальные шесть толстых нитей распо-
ложены в вершинах шестиугольника большего размера. Справа: поперечный срез-
гладкого мышечного волокна. Толстые н тонкие нити расположены неупорядоченно.
Видны нити промежуточной толщины, образующие скопления в виде «плотных телец*
(1), наличие которых является характерной особенностью гладких мышц.
РИС. 4-22. А Электронно-микроскопическая фотография продольного среза скелетной мышцы млекопитающего (двуглавой мышцы свиньи) Ткань
фиксирована дважды — сначала формальдегидом н глутаральдегидом, а затем тетраокисью осмия. Далее обработана ураннлацетатом и цитратом
свинца. На фотографии видно волокно белой мышцы, содержащее несколько митохондрий, н тонкие Z-пластннкн. Видны М линия, А- н I диски
а также толстые н тонкие нити. Обратите внимание на периодичность (~ 40 нм) вдоль тонких нитей. Это расстояние соответствует длине молекулы
тропомиозина, а поперечная исчерчеииость обусловлена, по-видимому, связываниемтропомиозина и тропонина. Множество плотных частиц в
верхней части фотографии—это гранулы гликогена, а горизонтальные мембраноподобные структуры — поперечные трубочки саркоплазматическо-
го (эндоплазматического) ретикулума. Они расположены вблизи трубочек, идущих от поверхности мышечного волокна. В верхнем левом углу фо-
тографии по обе стороны от Z-пластинки видны продольные срезы Т-трубочек, а в верхнем правом углу — поперечные срезы Видно, что Т-трубоч-
ка лежит между двумя боковыми цистернами саркоплазматического ретикулума. ’
21-1821
РИС 4-22 Б. Продольный срез гладкой мышцы (мускульного желудка цыпленка); препарат фиксирован так, как это указано в подписи под рис.
4-22, А. Видны толстые нити (1), которые значительно толще толстых нитей поперечнополосатой мышцы и расположены менее упорядоченно. Они
окружены большим числом тонких нитей, часто связанных с «плотными тельцами» (2). В центре фотографии вндиа мнтохоидрия (3), а внизу
проходит граница раздела между двумя соседними клетками. Обратите внимание на пиноцнтозные пузырьки, содержащиеся в больших количест-
вах в плазматических мембранах и высокоактивные в гладких мышцах. (С любезного разрешения Marvin Stromer, Iowa State University.)
С-конец
-—-43 нм
Л ММ, 90 нм
X
— тмм
Соседняя молекула
миозина
Л
трипсином
S2, 50 нм
S1 „Головки"
322 Глава 4
РИС. 4-23. А. Схема молекулы миозина. На расстоянии 90 нм от С-конца
расположен участок, по которому расщепляется молекула при кратко-
временной обработке трипсином. В результате расщепления образуются
два фрагмента—легкий и тяжелый меромиозины (ЛММ и ТММ). Общая
длина молекулы миозина 160 нм, мол. вес ~470 000; молекула состо-
ит из двух тяжелых цепей (мол. вес 200 000) и двух пар легких цепей
головок (мол. вес 16 000—21 000), размером ~ 15X4X3 нм. Б. Предло-
женная Сквайром [87] схема строения толстых нитей скелетной мышцы
Позвоночных. Показана лишенная головок (оголенная) область вблизи
М-линии. Темными кружками обозначены головки на концах миозиновых
молекул (палочек), а темными треугольниками — противоположные концы
миозиновых палочек. Взаимодействие между антнпараллельно расположен-
ными молекулами на протяжении 43 и 130 нм отмечено соответственно
одинарной и тройной поперечными линиями. Встречными стрелочками
(треугольниками) обозначены места соединения миозиновых молекул (па-
лочек) «хвост к хвосту». Молекулы простираются от середины структуры,
ГДе расположены их С-концы, к поверхности нитей, где находятся их" го-
ловки. На уровнях, обозначенных буквой В, к миозиновой нити присоеди-
няется М-мортик. Уровень М—М —это центр М-лцнци ц всей нити.
Место расщепления Место расщепления
молекулы при кратко- молекулы при продоткитель-
временпой обработке ной обработке трипсином
Область, еде головни
отсутствуют
~ 160 нм
У молекул, головки
которых расположены
на этом уровне,
С-концы находятся
на М-линии
14,4 нм
Как молекулы соединяются друг с другом 323
лочку; со стороны N-конца с обеими тяжелыми цепями связаны четыре
субъединицы с мол. весом ——16 000—21 000, образующие пару «голо-
вок». Кратковременная обработка трипсином расщепляет молекулу
миозина на два фрагмента. Из хвостового участка образуется легкий
меромиозин (ЛММ) — фрагмент длиной 90 нм, а из остальной части,
включающей «головки», — тяжелый меромиозин (ТММ). Тяжелый ме-
ромиозин можно расщепить далее путем более длительной обработки
трипсином, в результате чего получается один 52-фрагмент длиной
40 нм с мол. весом—'62 000 и два идентичных S1-фрагмента с мол. ве-
сом — 110 000, представляющих собой «головки» (рис. 4-23).
Растворенные молекулы миозина могут агрегировать, образуя па-
лочки, аналогичные толстым мышечным нитям. Поскольку диаметр та-
ких нитей составляет — 14 нм, в них должно быть упаковано большое
число молекул миозина (их диаметр 2 нм). Электронно-микроскопиче-
ские исследования показали, что из толстых нитей выступают головки,
интервал между которыми —43 нм. Однако в области М-линии голов-
ки отсутствуют; это дает основание думать, что агрегация мономеров
миозина происходит здесь по принципу «хвост к хвосту». Предполагает-
ся, что в миозиновых нитях скелетной мышцы [87] плотно упакованы
300 молекул миозина (до 30 палочек в поперечном сечении нити); в
центре имеется небольшая полость (рис. 4-23). На самом деле струк-
тура может быть несколько иной — на каждый повторяющийся участок
спирали длиной 14,3 нм может приходиться 3 (а не 4) головки [88].
В миозиновых нитях содержится также в небольших количествах дру-
гой белок, С-белок [88]. В летательных мышцах насекомых способ
упаковки миозиновых палочек иной.
Белок актин обладает специфическими, только ему присущими свой-
ствами. Нативный фибриллярный F-актин (рис. 4-7) построен из моно-
мерных субъединиц с мол. весом —43 000, каждая из которых состоит
из 374 аминокислотных остатков. Интересно, что в молекулах актина
в положении 73 содержится остаток Ыт-метилгистидина. В среде с низ-
кой ионной силой в присутствии АТР нити актина могут растворяться,
образуя мономерный G-актин. Каждая молекула G-актина содержит
обычно одну молекулу связанного АТР и ион кальция. Добавление в
раствор Mg2+ до концентрации 1 мМ или КС1 (0,1 М) приводит к спон-
танному образованию нитей, сходных с тонкими нитями мышцы, каж-
дая из которых содержит 340—380 мономерных молекул актина. АТР
при этом гидролизуется, a ADP остается связанным с нитями F-актнна.
Поражает удивительное сходство этого процесса со связыванием нук-
леотидов с субъединицами микротрубочек (дополнение 4-А) и события-
ми, происходящими при сокращении отростка фага (дополнение 4-Д).
Тот факт, что комплекс актина и миозина ответствен за сокращение
мышцы, был известен задолго до выяснения тонкой структуры миофнб-
рилл. Уже примерно в 1929 г. было установлено, что источником энер-
гии при мышечном сокращении является АТР, однако только спустя
10 лет Энгельгардт и Любимова показали, что выделенные из мышцы
препараты миозина катализируют гидролиз АТР [88а], доказав тем са-
мым, что энзиматические механизмы, обеспечивающие использование
свободной энергии, которая высвобождается при гидролизе АТР, связа-
ны с основными белками, образующими мышечные волокна. Позднее
А. Сент-Дьерди [88 Ь, с] показал, что для стимулируемого ионами Mg2+
гидролиза АТР (АТРазная активность) необходим комплекс двух бел-
ков— актина1 и миозина (актомиозин). Он обнаружил также явление
1 Актин был открыт Ф. Штраубом [884].
324 Глава 4
суперпреципитации, заключающееся в быстром сокращении актомио-
зина в пробирке при добавлении АТР. Хотя вопрос о том, имеет ли от-
ношение суперпреципитация к мышечному сокращению, до сих пор не-
ясен, тем не менее открытие этого явления сыграло в свое время важ-
ную роль, поскольку оно привлекло внимание ученых к кооперативному
взаимодействию актина и миозина в процессе функционирования
мышцы.
Химические исследования миозина показали, что индуцируемая ак-
тином АТРазная активность локализована в его «головках». На элект-
ронно-микроскопических фотографиях нередко видно, что головки мио-
РИС. 4-24. Гипотетическая структура комплекса актомиозин—тропомиозин (если смот-
реть на него сверху вниз, вдоль оси актиновой нити) [92, 94]. Взаимодействие акти-
на с головкой миозина S1 и АТР блокируется тропомиозином (сплошные кружки).
Предполагается, что в присутствии Са2+ тропомиозин перемещается в положения,
указанные пунктирными кружками, и блокировка снимается [93, 94].
зина соединены с расположенными поблизости актиновыми нитями, об-
разуя поперечные мостики. Когда скелетная мышца находится в релак-
сированном состоянии (не активирована нервным импульсом), попереч-
ные мостики разомкнуты (в этом состоянии мышца способна свободно
растягиваться). Когда же мышца активирована и находится в напря-
жении, то на фотографиях часто видны поперечные мостики. После ис-
тощения запаса АТР (т. е. после энергетической смерти) мышца пере-
ходит в состояние окоченения. Почти все поперечные мостики присое-
динены при этом к тонким актиновым нитям, следствием чего и явля-
ется полная неподвижность мышцы. Из этих данных следовало, что в
процессе сокращения головки миозиновых нитей присоединяются к
тонким актиновым нитям. Затем гидролиз АТР сопрягается неизвестным
пока образом с генерацией натяжения. Далее головки освобождаются
и присоединяются к новым местам. Повторение этого процесса приво-
дит к скольжению нитей друг относительно друга. Химические меха-
низмы, лежащие в основе этих событий, еще мало изучены [89, 90].
Все, что о них известно, изложено в дополнении 10-Е.
Механизмы, обеспечивающие регуляцию произвольного сокращения
мышц, не менее удивительны, чем сам процесс сокращения. Эндоплаз-
матический (саркоплазматический) ретикулум в клетках мышц харак-
теризуется высокой степенью упорядоченности [91, 92]. Соединительные
трубочки проходят вдоль нитей, располагаясь среди пучков сократитель-
ных элементов, и через строго определенные интервалы тесно контакти-
руют со складками наружной клеточной мембраны (Т-система мембран,
рис. 4-22,А). Нервный импульс попадает в мышечное волокно, прохо-
Как молекулы соединяются друг с другом 325
дящее вдоль плазмалеммы, и достигает Т-трубочек. В областях тесно-
го контакта сигнал каким-то образом передается соединительным тру-
бочкам саркоплазматического ретикулума, содержащим ионы кальция
в высокой концентрации, и вызывает проникновение этих ионов в цито-
плазму и в миофибриллы. Здесь кальций связывается с С-субъединицей
тропонина, олигомерного белка, который вместе с тропомиозином (гл. 2,
разд. Б.З.г) образует регуляторный комплекс. Именно этот комплекс
присоединяется к фибриллам актина (рис. 4-24).
Если полностью удалить регуляторные белки из актиновых фибрилл,
то сокращение будет продолжаться до тех пор, пока не истощится за-
пас АТР. В присутствии же регуляторных белков и в отсутствие каль-
ция блокируется как сокращение, так и гидролиз АТР. Рабочая гипо-
теза, объясняющая функционирование этой системы [93, 94], постули-
рует, что вытянутые палочки тропомиозина входят в бороздки между
актином и миозиновыми головками [92]. На рис. 4-24 схематически
представлена структура комплекса актомиозин-тропомиозин (вид свер-
ху). Головка (S1) молекулы миозина присоединена к одной из субъеди-
ниц актина. В покоящейся мышце тропомиозин присоединен к акти-
ну около того места, с которым связан S 1-участок миозина. В резуль-
тате палочка тропомиозина блокирует присоединение Sl-поперечных
мостиков миозина к актину и предотвращает стимулируемый актином
гидролиз АТР. Молекула тропомиозина, длина которой составляет
~41 нм, контактирует одновременно с семью субъединицами актина
[95]. Таким образом, комплекс тропомиозин-—тропонин синхронно
контролирует работу семи субъединиц актина.
Молекула тропонина состоит из трех полипептидных цепей с мол.
массами от 18 000 до 37 000 дальтон. Один полипептид (Т) прочно
связывает тропонин с тропомиозином в участке, расположенном приб-
лизительно на одной трети расстояния от С- до N-конца, со стороны
С-конца. Второй полипептид (I), входящий в состав тропонина, взаи-
модействует с актином в отсутствие ионов Са2+ и «работает» вместе с
остальными двумя полипептидами, удерживая тропомиозин в таком по-
ложении, в котором он ингибирует гидролиз АТР. Когда третий поли-
пептид (С-субъединица) присоединяет ионы кальция, то ингибирование
прекращается и может начаться сокращение. Однако общая картина
функционирования всей этой «машины» остается непонятной. По дан-
ным рентгеноструктурного анализа и электронной микроскопии [93,
94], при связывании кальция с тропонином тропомиозин отклоняется
от S1 примерно на 20°, открывая активный центр для взаимодействия
миозин — АТР—актин (рис. 4-24). Возможно, тропомиозин «катится»
наподобие ролика вдоль поверхности актина, открывая центры одновре-
менно в семи молекулах актина? Если это действительно так, то какого
рода «мотор» используется при этом и что не позволяет ролику
«упасть» с актина? Обо всем этом мы может только догадываться. Впол-
не возможно, что боковые цепи отдельных аминокислотных остатков
тропомиозина, выступающие наподобие зубцов на субмикроскопической
шестеренке, входят в комплементарные углубления актина1. Тогда воз-
никает вопрос: почему связывание иона кальция с тропомиозином при-
водит к тому, что тропомиозин начинает «катиться», как ролик, по ак-
тину? Мы знаем, что присоединение металлов к белкам может приво-
дить к очень сильным конформационным изменениям (разд. В.8.в). Не
исключено, что конформационное изменение С-субъединицы тропонина
1 Было высказано предположение о существовании серии мостиков из иоиов маг-
ния между отрицательно заряженными участками тропомиозина н актниа [95а].
326 Глава 4
может каким-то образом трансформироваться в энергию, необходимую
для такого движения.
2. Сокращение в немышечных клетках
Движение жгутиков эукариот основано, по-видимому, на скольже-
нии нитей микротрубочек (дополнение 4-А), в какой-то мере аналогич-
ном скольжению мышечных нитей [96]. На сходство с мышцей указы-
вает и наличие белка, обладающего АТРазной активностью. Белки ти-
па актомиозина были недавно обнаружены во многих других клетках.
Возможно, сократительный белок, содержащийся в головном мозге, от-
ветствен за быстрое высвобождение нейромедиаторов из пузырьков в
5
РИС 4-25. А. Схематическое изображение саркомера поперечнополосатой мышцы
Б Схема взаимодействия между миозином и связанным с мембраной актином, при-
водящего к направленному движению в иемышечных клетках На схеме показано,
как связанный с мембраной пузырек перетягивается в направлении другой мембраны,
например плазматической. Существенной особенностью этой модели является биполяр-
ная природа миозиновых агрегатов [98]
синаптических окончаниях [97]. Актин был выделен из примитивного
организма Dictyostelium и является, по-видимому, универсальным ком-
понентом эукариотических клеток [98]. Цитоплазматические микрофи-
ламенты часто состоят из актина. В фибробластах эти волокна образуют
трехмерные матриксы толщиной около 100 нм, расположенные непосред-
ственно под клеточной мембраной. Микрофиламенты другого типа аг-
регируют, образуя «напряженные нити» вдоль краев клеток. Получение
специфических по отношению к актину флуоресцирующих антител поз-
волило локализовать актин с помощью ультрафиолетового микроскопа
[99] (дополнение 4-А). Миозин может считаться сейчас не менее рас-
пространенным белком [98, 100]. Возможный механизм функциониро-
вания немышечных сократительных систем [98] изображен схематиче-
ски на рис. 4-25.
Ж. Самосборка макромолекулярных структур
Если рост жгутиков бактерий (дополнение 4-Б) можно легко пред-
ставить как результат прохождения субъединиц через центральную по-
лость, то понять, как образуются более сложные структуры, например
Как молекулы соединяются друг с другом 327
мышечные саркомеры, довольно трудно. Недавно в этой области был
достигнут значительный прогресс, главным образом благодаря наблю-
дениям за процессом самосборки бактериофагов. На рис. 4-8 в качест-
ве примера изображен процесс сборки нитчатого фага из молекул гид-
рофобного белка и ДНК. Белковые субъединицы синтезируются и со-
храняются в бактериальной мембране. Небольшие а-спирали легко
умещаются в мембране и могут оставаться там до тех пор, пока в мем-
брану не попадет молекула ДНК. Мы не знаем, как инициируется про-
цесс самосборки, однако, судя по всему, каждая субъединица имеет
участок связывания с ДНК. Участки поверхности субъединиц облада-
ют гидрофобными свойствами и, взаимодействуя между собой, субъеди-
ницы самопроизвольно «покрывают» поверхность ДНК- После оконча-
ния сборки «палочки» гидрофобные группы оказываются «утопленными»
внутри структуры. Предполагается, что группы, расположенные на на-
ружной поверхности вирусной частицы, обладают гидрофильными свой-
ствами и что образование такой гидрофильной «палочки» и является
движущей силой, обеспечивающей автоматическое выталкивание фага
из мембраны {39]. Аналогичным путем могут выталкиваться и пили
бактерий. Они образуются очень быстро и могут, вероятно, втягиваться
обратно в бактериальную мембрану.
Наиболее ярким примером самосборки служит процесс сборки Т-чет-
ных фагов (дополнение 4-Д) [101—103]. Результаты тщательного гене-
тического анализа (гл. 15, разд. Г.2) показали, что для образования
головки требуется по крайней мере 18 генов, для образования отрост-
ка— 21 ген, а для образования нитей — 7 генов. Большинство этих ге-
нов кодирует белки, которые непосредственно включаются в зрелую
вирусную частицу, однако несколько генов детерминируют специфиче-
•ские ферменты, необходимые для процесса сборки. Получены мутантные
штаммы вируса, способные синтезировать все структурные белки, кро-
ме одного. В этом случае все синтезированные белки скапливались
внутри хозяйской бактериальной клетки и не агрегировали. Однако
при добавлении недостающего белка (синтезированного бактерией, ин-
фицированной вирусом другого штамма) быстро осуществлялась сбор-
ка полноценных вирусных частиц. Эти и другие данные позволили сде-
лать вывод, что белки присоединяются к растущей структуре в строго
определенной последовательности. Присоединение одного белка форми-
рует связывающий участок для следующего.
Дополнение 4-Д
Т-четные бактериофаги
Одним из наиболее интересных объектов, которые удается
наблюдать под электронным микроскопом, являются Т-четные
бактериофаги (Т2, Т4 и Тб), инфицирующие бактерии Е. со-
Путь проникновения многих вирусов в клетку неизве-
стен, и Т-четные фаги являются редким исключением Эти ча-
стицы действуют как своего рода «молекулярные шприцы»,
прокалывая клеточную стенку бактерий-хозяев и впрыскивая
в них свою ДНК. Вирусная частица, длина которой 200 нм,
а масса ~255-106 дальтон, содержит в своей головке, имею-
щей форму вытянутого икосаэдра размером 100X70 нм, при-
близительно 130-606 дальтон ДНК. Поверхность головки бак-
328 Глава 4
териофага построена из ~840 одинаковых белковых молекул
с мол. весом 45 000 (кодируемых геном 23), организованных
в виде 140 гексамеров, и из ~55 молекул другого белка, об-
разующих 11 пентамеровг. Головка содержит по крайней мере
девять других белков, включая три внутренних основных
белка, которые проникают внутрь бактерии вместе с ДНК-
Фаг с отростком, инфицирующий Bacillus subtilis. (С любезного разрешения А. С. Ти-
хоненко.)
Отросток фага имеет внутренний стержень с отверстием
2,5 нм, диаметр которого достаточен для того, чтобы моле-
кула ДНК могла проникнуть через него внутрь бактерии. Ок-
ружающий стержень чехол (его масса 8-Ю6 дальтон) пост-
роен из 144 белковых субъединиц с мол. весом ~ 55 000, соб-
ранных в виде 24 колец, каждое из которых состоит из ше-
сти субъединиц. Чехол способен сокращаться, уменьшая свою
длину от 80 до 30 нм; он продавливает стержень сквозь стен-
ку бактерии. На конце отростка имеется базальная пластин-
ка шестиугольной формы, несущая ряд коротких шипов, а
также шесть длинных нитей, каждая из которых состоит из
шести субъединиц с мол. весом ~ 100000. Среди 10 белков,
Как молекулы соединяются друг с другом
образующих базальную пластинку, был обнаружен специфи-
ческий белок лизоцимд. Помимо всего прочего, вирусная ча-
стица содержит ряд небольших молекул. Например, около
30% отрицательно заряженных групп ДНК нейтрализованы
полиаминами — путресцином и спермидином (гл. 14, разд.
В.4). В базальной пластинке отростка содержится шесть мо-
лекул кофермента — 7,8-дигидроптероилгексаглутамата (гл. 8,.
разд. Л).
Как происходит заражение бактерии Т-четным фагом?
Процесс начинается с присоединения нитей отростка к спе-
цифическим рецепторным участкам на поверхности бактерии.
Это вызывает ряд конформационных изменений в нитях, ба-
зальной пластинке и чехле. При этом из базальной пластин-
ки высвобождается лизоцим и разрушает стенку бактерии.
Сокращение чехла начинается с базальной пластинки и да-
лее распространяется к основанию. После того как стержень,
проникнет в бактерию, ДНК быстро впрыскивается в клетку
хозяина.
В процессе сокращения субъединицы чехла перестраива-
ются, образуя структуру из 12 колец большего размера, каж-
дое из которых состоит из 12 субъединиц6. Происходит своеоб-
разное взаимное проникновение субъединиц (интеркаляция).
Строго определенная направленность и необратимый харак-
тер этой структурной перестройки отличают укорочение от-
ростка фага от процесса сокращения мышцы. Вполне воз-
можно, что в чехле фага белковые субъединицы находятся-
в нестабильном высокоэнергетическом состоянии и запасен-
ная в процессе сборки энергия используется затем для реали-
зации процесса сокращения.
° Wood W. В., Edgar R. S„ Sci. Am., 217, 60—72 (Jul. 1967).
6 Mathews С. K, Bacteriophage Biochemistry, Van Nostrand-Reinhold,.
Princeton, New Jersey, 1971.
B Cummings D. I., Couse N. C., Forrest C. L., Adv. Virus Res., 16, 1—41’
(1970).
r Branton D„ Klug A., JMB, 92, 559—565 (1975).
д Not to be confused in its catalytic properties with the better known lyso-
zyme of egg white (Fig. 2—9 and Chapter 7, Section C, 4, a).
e Moody M. F„ JMB, 80, 613—635 (1973).
Детально изучен процесс сборки отростка фага. Шесть копий каж-
дого из трех белков собираются в одной последовательности, образу®
«втулку», обладающую гексагональной симметрией (рис. 4-26). Парал-
лельно семь других белков соединяются друг с другом, образуя струк-
туру, напоминающую по форме клин. Затем шесть таких клиньев соби-
раются вокруг «втулки», образуя шестиугольную базальную пластинку.
Только после этого к поверхности базальной пластинки присоединяются
еще два белка, которые активируют ее, в результате чего начинается
сборка стержня отростка. По завершении этого процесса начинается
сборка чехла отростка из структурных единиц и только после того, как
трубчатая структура достигает требуемой длины, к ее вершине присое-
диняется белок головки. Затем над отростком формируется «головка»
и далее начинают присоединяться нити отростка, сборка которых осу-
ществляется отдельно.
Представить себе, каким образом каждая стадия этого сложного»
процесса сборки создает предпосылки для реализации последующей
330 Глава 4
•стадии, очень трудно. Тем не менее имеющиеся данные весьма убеди-
тельны. Вероятно, структура очередного присоединившегося белка ос-
тается устойчивой только до тех пор, пока не произойдет специфическо-
го присоединения к нему другого белка. Энергия взаимодействия оказы-
вается достаточной для того, чтобы вызвать конформационное измене-
ние. 4-26. Последовательные стадии процесса сборки отростка бактериофага Т4. Чис-
ла соответствуют номерам генов на хромосомной карте фага Т4 (см. рис. 15-19). Бук-
ва Р при числе означает, что соответствующий белок непосредственно включается в
отросток Если буква Р отсутствует, значит продукты соответствующих генов в отро-
сток не включаются и играют, по-внднмому, каталитическую роль [101, 102].
ние в другой части белковой молекулы, приводящее к появлению участ-
ка, комплементарного участку связывания следующего белка. Замеча-
тельно, что способностью к самоактивации должен обладать каждый
из белков базальной пластинки.
Изменение конформации белка в результате его взаимодействия с
другим белком происходит не только в таких экзотических объектах,
как фаги с отростком. Это некий принцип, безусловно играющий важ-
ную роль в процессах самосборки микротрубочек, миофибриллярных
ансамблей мышцы и многих других более лабильных, но не менее важ-
ных каскадных систем, в которых имеют место белок-белковые взаимо-
действия, например системы, обеспечивающей свертывание крови (рис.
'6-16). Формирование мембран также осуществляется за счет самосбор-
ки, причем в ходе этого процесса в них должны включаться рецепто-
ры, способные надежно реагировать (хотя и не совсем ясно, каким об-
разом) на химические сигналы, поступающие из окружающей среды.
Если посмотреть на все эти процессы с единой точки зрения, то стано-
вится ясно, что между белок-белковыми взаимодействиями, которые ве-
Как молекулы соединяются друг с другом 331
дут к образованию небольших белковых агрегатов, и сложными явле-
ниями, разыгрывающимися в интактных клетках в ответ на действие
гормонов и других внешних стимуляторов, есть нечто общее.
Вопросы и задачи
1. Примечание: В этой задаче используется константа диссоциации,
а не константа образования, с которой мы в основном имели дело
в данной главе. Кажущаяся константа диссоциации для иона
Н2РО4 при 25°C и суммарной концентрации фосфата 0,05 М равна
1,380-10-7 (это соответствует буферу Национального бюро стан-
дартов, представляющему собой раствор 0,025 М КН2РО4 и 0,025 М
NaH2PO4) (см. Bates R. G., Determination of pH, 1964).
а. Рассчитайте значение отрицательного логарифма Ка (т. е. рЛа).
Нанесите полученную величину на кривую зависимости рКа от
Уц (рис. 3-1).
б. Из выражения для константы диссоциации кислоты НА получи-
те логарифмическую форму:
pH—рКа = 1g [A~J/[HA] = 1g а/( 1 — а),
где а — доля молекул кислоты в ионизированной форме.
в. Предположим, что вы хотите приготовить буфер с pH 7,00 при
25 °C из безводных КН2РО4 (мол. вес. 136,09) и Na2HPO4 (мол.
вес 141,98). Если Вы насыпали в мерную колбу емкостью 1 л
3,40 г КН2РО4, то сколько безводного Na2HPO4 нужно отвесить
перед добавлением воды до метки, чтобы получить раствор с тре-
буемым значением pH? Если Вы хотите получить буфер с pH
7±0,01, то какова должна быть точность навесок солей?
Примечание: таким способом можно приготовить буфер с точным
значением pH быстрее, чем путем титрования кислотного ком-
понента буферного раствора с помощью NaOH до требуемого
значения pH.
2. Кажущееся значение рКа для 0,1 М раствора муравьиной кислоты
при 25°C равно 3,7.
а. К 1 л 0,1 М раствора муравьинокислого натрия добавляют кон-
центрированную НС1 до тех пор, пока значение pH не станет рав-
ным 1,9. Каковы будут концентрации формиат-иона и неионизи-
рованной муравьиной кислоты в полученном растворе?
б. Вычислите концентрацию ионов водорода.
в. Сколько эквивалентов НС1 пришлось добавить к 1 л 0,1 М рас-
твора муравьинокислого натрия для получения pH 1,9, т. е. в
задаче (а)?
3 В мерные колбы емкостью 100 мл поместили по 0,01 моль глици-
на, а затем добавили указанные ниже количества НС1 или NaOH.
Колбы заполнили водой до меток и полученные растворы тщатель-
но перемешали, после чего измерили их pH. Исходя из полученных
значений pH, вычислите рКа для карбоксильной группы и амино-
группы, произведя при этом столько независимых расчетов рК,
сколько позволяют имеющиеся данные. Напомним, что при низких
значениях pH необходимо учитывать концентрацию свободных ио-
нов водорода (см задачу 26).
332 Глава 4
V колбы НС1,‘ моль NaOH, моль pH
1 0,010 1 ,71
2 0,009 1 ,85
3 0,006 2,25
4 0,002 2,94
5 0,002 9,00
6 0,004 9,37
7 0,005 9,60
4. Используя значения p^a, полученные в задаче 3, постройте теоре-
тическую кривую титрования, изображающую зависимость числа
эквивалентов Н- и ОН-, реагирующих с 1 молем глицина, от pH.
Заметим, что форма такой кривой не зависит от р7Са. Постройте ана-
логичные кривые для глутаминовой кислоты (рЛа для которой рав-
ны 2,19; 4,25 и 9,67), гистидина (р/G равны 1,82; 6,00 и 9,17) и ли-
зина (рТСа равны 2,18; 8,95 и 10,53).
Сравните построенную Вами кривую для глицина с кривой, полу-
ченной при добавлении 1 н. кислоты или основания к раствору,,
содержащему 0,01 моль глицина на 100 мл воды. Сравните также
Ваши кривые с кривыми для глицина, приведенными в других учеб-
никах.
5. Ниже приведены уравнения обратимых реакций между алифатиче-
скими аминами и формальдегидом.
R—NH2 - НСНО <—> R—NH—СН2ОН
СН2ОН
R—NH—СН2ОН-р НСНО <—> R—
\СН2ОН
ZCH2OH /СН2—СХ
R—N' + НСОН ч—>- R—NZ ХСН2 4- Н20
\сн2он \сн2—о/
Укажите (в качественной форме), как изменились бы кривые титро-
вания, о которых шла речь в задаче 4, если бы в растворе содержа-
лось 9% формальдегида.
6. Значения рЛа для боковых групп аминокислотных остатков в бел-
ках иногда немного отличаются от значений, приведенных в табл.
2-2. Чаще всего такие отклонения имеют место в случае «упрятан-
ных» в структуре, т е. недоступных для растворителя групп или же
для групп, расположенных очень близко от других ионизированных
групп. Попробуйте объяснить следующие факты:
а. Необычно высокое значение рЛа для карбоксильной группы ос-
татка аспарагиновой кислоты (гл. 5, разд. В.4.а).
б. Необычно низкое значение p^a для карбоксильной группы остат-
ка аспарагиновой кислоты.
в. Необычно высокое значение рДа для фенольной группы остатка,
тирозина.
7. Перепишите уравнения (4-20) — (4-25), используя константы диссо-
циации. Их было бы удобно обозначить через Ki, К2, Ка и т. д., но,
чтобы избежать путаницы, лучше использовать обозначения Kid,
K^d, Kad И Т. Д.
Как молекулы соединяются друг с друюм 333
В. а.Опишите два способа определения или оценки таутомерного отно-
шения /? [уравнение (4-21)].
б. Рассчитайте значение рЛ'с для уравнения (4-21) и сравните его
со значением рЛ'ь и соответствующим значением рЛ' для фенола.
Проанализируйте различия.
9. Молекула имеет два идентичных центра связывания для лигандаХ.
Свободная энергия взаимодействия между лигандами, связанными
с одной и той же молекулой, е, определяется как изменение свобод-
ной энергии связывания лиганда с молекулой, обусловленное связы-
ванием первого лиганда с соседним центром. Покажите, что если
степень насыщения z/=g-, то из уравнения, характеризующего изо-
терму связывания, следует, что
dy/d 1п[Х]=4(1+^//2«г)-
10. На рис. 4.4 приведена кривая связывания иона водорода сукцина-
том. Оцените отсюда значение е и микроскопические константы свя-
зывания.
И. Линейная молекула имеет очень большое число идентичных центров
связывания лиганда X. Свободная энергия взаимодействия между
лигандами, связанными с расположенными по соседству друг с дру-
гом центрами, равна е. Считается, что взаимодействие между ли-
гандами, не являющимися ближайшими соседями, пренебрежимо
мало. Если обозначить константу связывания с центром, располо-
женным рядом с незанятыми центрами, через Кг, то выражение для
изотермы связывания будет иметь вид
-__1___________К [X] е~Ё/д;7~ — 1__
У~~ 2 +2 ((К[Х]е“Ё/л:г-l)2+4K[X]'j1/2
[J. Applequist, J. Chem. Ed. in press (1977).]
Покажите, что при г/ = уиз приведенного выше соотношения следу-
ет, что
dy/d In [Х]=^-<?Ё/2«Г.
12. Связывание аденозина с поли(П) было изучено методом равновес-
ного диализа (Huang, Ts’o, JMB, 16, 523, 1966). В приведенной ни-
же таблице указаны доли занятых центров в молекулах поли(П),
т. е. значения у при разных молярных концентрациях свободного
аденозина (А) в растворе при 5 °C. Определите истинную констан-
ту ассоциации для присоединения аденозина к поли(П) и свобод-
ную энергию взаимодействия между расположенными по соседст-
[А]-103 У [А]-103 У
0,51 0 3,07 0,72
2,10 0 4,00 0,92
2,70 0,15 6,50 0,93
2,96 0,36 8,50 0,93
3,01 0,52 10,00 1,00
334 Глава 4
ву аденозинами при условии, что взаимодействием между аденози-
нами, не являющимися ближайшими соседями, можно пренебречь.
Притягиваются или отталкиваются друг от друга соседние моле-
кулы?
СПИСОК ЛИТЕРАТУРЫ
1. Watson J. D., Molecular Biology of the Gene, 3rd ed., p. 98, Benjamin, New York,
1976. [Имеется перевод: Уотсон Дж., Молекулярная биология гена. — М.: Мир,
1978.]
2. Jencks W. Р., Catalysis in Chemistry and Enzymology, pp. 393—436, McGraw-Hill,
New York, 1969.
3. Tanford C., The Hydrophobic Effect: Formation of Micelles and Biological Membra-
nes, Wiley, New York, 1973.
3a. Chothia C., Janin J., Nature (London), 256, 705—708 (1975).
4. Shiao D. D. F., Sturtevant J. M., Biopolymers, 12, 1829—1836 (1973).
4a. Dixon H. B. F., BJ, 137, 443—447 (1974).
5. Deranleau D. A., JACS, 91, 4044—4049 (1969).
6. Dowd J. E„ Riggs D. S., JBC, 240, 863—869 (1965).
7. Metzler D. E., Harris С. M., Johnson R. J., Siano D. B., Thomson J. A., Bioche-
mistry, 12, 5377—5392 (1973).
8. Katritzky A. R., Waring A., J. Chem. Soc., pp. 1540—1548 (1962).
9. Vander Jagt D. L., Hansen L. D., Lewis E. A., Han L. B., ABB, 153, 55—61
(1972).
9a. Dixon H. B. F., Tipton K. F., В J, 133, 837—842 (1973).
10. Klotz I. M., Hunston D. L., JBC, 250, 3001—3009 (1975).
11. Weber G., Adv. Protein Chem., 29, 1—83 (1975).
12. Steinhardt J., Reynolds J. A., Multiple Equilibria in Proteins, Academic Press, New
York, 1969.
13. Koshland D. E., Jr. In: The Enzymes (Boyer P. D., ed.), 3rd ed., Vol. 1, pp. 341 —
396, Academic Press, New York, 1970.
14. Tanford C., Physical Chemistry of Macromolecules, pp. 533—534, Wiley, New York,
1961.
15. Edsall J. T., Wyman J., Biophysical Chemistry, Vol. I, pp. 457—476, Academic Press,
New York, 1958.
16. Westheimer F. H., Shookhoff M. W„ JACS, 61, 555—560 (1939).
17. Tanford C., Physical Chemistry of Macromolecules, Chapter 8, Wiley, New York,
1961.
18. См. также Jaffe H. H., JACS, 77, 4445—4448 (1955).
19. Metzler D. E. In: The Enzymes (Boyer P. D., Largy H., Myrback K., eds.), 2nd ed..
Vol. 2, pp. 295—337, Academic Press, New York, 1960.
20. Hopmann R. F. W., Brugnoni G. P., Nature (London), New Biol., 246, 157—158
(1973).
21. Crothers D. M., Biopolymers, 10, 2147—2160 (1971).
22. Damle V. N„ Biopolymers, 11, 1789—1816 (1972).
23. Hill T., Introduction to Statistical Thermodynamics, pp. 235—241, Addison-Wesley,
Reading, Massachusetts, 1962.
24. Schwarz G„ EJB, 12, 442—453 (1970).
25. Bloomfield V., Crothers D. M., Tinoco I., Physical Chemistry of Nucleic Acids,
Harper, New York.
26. Bjerrum J., Metal Amine Formation in Aqueous Solution, Haase and Son, Copen-
hagen, 1941.
27. Eichhorn G. L. ed., Inorganic Biochemistry, 2 vols., Elsevier, Amsterdam, 1973.
28. Martell A. E., Smith R. M., Critical Stability Constants, 3 vols., Plenum, New
York, 1974, 1975.
28a. Sillen L. G., Martell A. E., Stability Constants of Metal-Ion Complexes, Spec. Publ.
No. 17, Chemical Society, London, 1964.
29. Edward J. T. In: Intestinal Absorption of Metal Ions, Trace Elements and Radio-
nuclides (Skoryna S. C., Waldron-Edward, eds.), pp. 3—19, Pergamon, Oxford,
1971.
30. Freeman H. C. In: Inorganic Biochemistry (Eichhorn G. L., ed.), Vol. 1, pp. 121—
166, Elsevier, Amsterdam, 1973.
31. Angelici R. J. In: Inorganic Biochemistry (Eichhorn G. L., ed.), Vol. 1, pp. 63-—
101, Elsevier, Amsterdam, 1973.
32. Kretsinger R. H., Nockolds С. E„ JBC, 248, 3313—3326 (1973).
32a. Kretsinger R. H., Annu. Rev. Biochem., 45, 239—266 (1976).
33. Monod J., Wyman J., Changeux J.-P., J. Mol. Biol, 12, 88—118 (1965).
Как молекулы соединяются друг с другом 335-
34. Lauffer М. A., Stevens С. L., Adv. Virus Res., 13, 1—63 (1968).
35. Holmes К. C., Stubbs G. J., Mandelkow E., Gallwitz U., Nature (London), 254,
192—196 (1975).
36. Sperling R„ Amos L. A., Klug A., JMB, 92, 541—558 (1975).
36a. Champness J. N., Bloomer A. C., Bricogne G., Butler P. J. G., Klug A., Nature
(London), 259, 20—24 (1976).
37. Brinton С. C., Jr. In: The Specificity of Cell Surfaces (Davis B. D., Warren L.,
eds.), p. 37, Prentice-Hall, Englewood Cliffs, New Jersey, 1967.
38. Marvin D. A., Wachtel E. J., Nature (London), 253, 19—23 (1975).
39. Nakashima Y., Wiseman R. L., Konigsberg W., Marvin D. A., Nature (London),,
253, 68—70 (1975).
40. Hanson J., Nature (London), 213, 353—356 (1967).
41. Bode W„ Angew. Chem., 12, 683—693 (1973).
42. Valentine R. C. In: Symmetry and Function of the Biological Systems at the Mac-
romolecular Level (Engstrom A., Strandberg B., eds.), 11th Nobel Symp., pp. 165—
180, Wiley, New York, 1969.
43. Klotz I. M., Darnall D. W., Langerman N. R. In: The Proteins, 3rd ed. (Neurath H.,
Hill R. L., eds.), Vol. 1, pp. 293—411, Academic Press, New York, 1975.
44. Edelman G. M., Cunningham B. A., Reeke G. N„ Jr., Becker J. W., Waxdal M. J.,
Wang J. L„ PNAS, 69, 2580—2584 (1972).
45. Hardman K. D., Ainsworth C. F., Biochemistry, 11, 4910—4919 (1972).
46. Eisenberg D., Heidner E. G., Goodkin P., Dastoor M. V., Weber В. H., Wedler F.,.
Bell J. O., Gold Spring Harbor Symp. Quant. Biol., 36, 291—294 (1971).
47. Crowther R. A., Endeavour, 30, 124—129 (1971).
48. Watson J. D., Molecular Biology of the Gene, 3rd ed., p. 107, Benjamin, New York,.
1976.
49. Bancroft J. B., Adv. Virus Res., 16, 99—134 (1970).
50. Hohn J., Hohn B., Adv. Virus Res., 16, 43—98 (1970).
51. Rueckert R. R. In: Comparative Virology (Maramorosch K., Kurstak E., eds.),.
pp. 255—306, Academic Press, New York, 1971.
52. Тихоненко A. C., Ultrastructure of Bacterial Viruses, Plenum, New York, 1970.
53. Tsernoglou D., Hill E., Banaszak L. J., Cold Spring Harbor Symp. Quant. Biol.,
36, 171—178 (1971).
54. Blundell T. L., Cutfield J. F., Dodson E. J., Dodson G. G., Hodgkin D. C„ Merco-
la D. A., Cold Spring Harbor Symp. Quant. Biol., 36, 233—241 (1971).
55. Hodgkin D. C., Nature (London), 255, 103 (1975).
56. Perutz M. F., Muirhead H., Cox J. M., Goaman L. C. G., Nature (London), 219,
131—139 (1968).
57. Dickerson R. E., Geis I., The Structure and Action of Proteins, p. 56, Harper, New
York, 1969.
58. Wiley D. C., Evans D. R„ Warren S. G., McMurray С. H., Edwards B. F. P-,
Franks W. A., Lipscomb W. N., Cold Spring Harbor Symp. Quant. Biol., 36, 285—
290 (1971).
59. Evans D. R., Warren S. G., Edwards B. F. P., McMurray С. H., Bethge P. H.,
Wiley D. C., Lipscomb W. N., Science, 179, 683—685 (1973).
60. Cm. Hammes G. G., Wu C.-W., Science, 172, 1205—1211 (1971).
61. Koshland D. E., Jr. In: The Enzymes (Boyer P. D., ed.), Vol. I, p. 341, Academic
Press, New York, 1970.
62. Cornish-Bowden A. J., Koshland D. E., Jr., JBC, 245, 6241—6250 (1970): 246,
3092—3102 (1971).
63. Darnall D. W., Klotz I. M„ ABB, 149, 1—14 (1972).
64. Dochi Y., Sugita Y., Yoneyama Y., JBC, 248, 2354—2363 (1973).
65. Anionini E., Brunori M„ Hemoglobin and Myoglobin in Their Reactions with Li-
gands, North-Holland Publ., Amsterdam, 1971.
66. Benesch R., Benesch R. E., Science, 185, 905—908 (1974).
67. Edelstein S. J., Annu. Rev. Biochem., 44, 209—232 (1975).
68. Herzfield J., Stanley H. E„ JMB, 82, 231—265 (1974).
68a. Baldwin J. N., Prog. Biophys. Mol. BioL, 29, 225—320 (1975).
69. Perutz M. F., Ten Eyck L. F., Cold Spring Harbor Symp. Quant. Biol., 36, 295—
310 (1971).
70. Perutz M. F., Muirhead H., Cox J. M., Goaman L. C. G., Mathews F. S., McGan-
dy E. L., Webb L. E., Nature (London), 219, 29—32 (1968).
71. Perutz M. F„ Nature (London), 228, 726—734 (1970).
72. Dickerson R. E., Annu. Rev. Biochem., 41, 815—841 (1972).
73. Hoard J. L„ Scheldt W. R„ PNAS, 70, 3919—3922 (1973).
74. Arnone A., Nature (London), 237, 146—149 (1972).
75. Benesch R., Benesch R. E., Nature (London), 221, 618—622 (1969).
76. Brewer G. J., Eaton J. W., Science, 171, 1205—1211 (1971).
77. Bauer C., Baumann R., Engels U., Pacyna B., JBC, 250, 2173—2176 (1975).
336 Глава 4
78. Perrella М., Bresciani D., Rossi-Bernardi L., JBC, 250, 5413—5418 (1975).
79 Waxman L., JBC, 250, 3790—3795 (1975).
80. Zuckerkandl E., Sci. Am., 212, 110—118 (May 1965).
81 Perutz M. F., Lehmann H., Nature (London) 219, 902—909 (1968).
82. Olson J. S., Gibson Q. H„ Nagel R. L., Hamilton H. B„ JBC, 247, 7485—7493
(1972).
83. Huxley H. E., Sci. Am., 199, 67—82 (Nov. 1958).
84. Murray J. M„ Weber A., Sci. Am., 230, 59—71 (Feb. 1974).
85. Landon M. F„ Oriol C„ BBRC, 62, 241—245 (1975).
86. Huxley A. E., Cold Spring Harbor Symp. Quant. Biol., 37, 689—693 (1972). Весь
том посвящен механизму мышечного сокращения.
87. Squire J. M„ JMB, 77, 291—323 (1973).
88. Morimoto K-, Harrington W. F., JMB, 83, 83—97 (1974).
88a. Engelhardt W. A., Ljubimowa M. N., Nature (London), 144, 668—669 (1939).
88b. Szent-Gybrgyi A., Studies Inst. Med. Chem., Univ. Szeged, 1, 17—26 (1941)
[reprinted in Kalckar H. M„ Biological Phosphorylations, pp. 465—472, Prentice-
Hall, Englewood Cliffs, New Jersey, 1969].
88c. Szent-Gyorgyi A., Chemistry of Muscular Contraction, Academic Press, New York,
1947.
88d. Straub F. B., Studies Inst. Med. Chem. Univ. Szeged, 2, 3—15 (1942) [reprinted
in Kalckar H. M., Biological Phosphorylation, pp. 474—483, Prentice-Hall, Engle-
wood Cliffs, New Jersey, 1969].
89. Elzinga M., Collins J. H., Cold Spring Harbor Symp. Quant. Biol., 37, 1—7
(1973).
90. Tonomura Y., Oosawa F., Annu. Rev. Biophys. Bioeng., 1, 159—190 (1972).
91. Porter K- R-, Franzini-Armstrong C., Sci. Am., 212, 73—80 (Mar. 1965).
92. Hoyle G„ Sci. Am., 222, 85—93 (Apr. 1970).
93. Cohen C., Sci. Am., 233, 36—45 (Nov. 1975).
94. Wakabayashi T., Huxley H. E., Amos L. A., Klug A., JMB, 93, 477—497 (1975).
95. Stewart M„ McLachlan A. D., Nature (London), 257, 331—333 (1975).
95a. Stewart M., McLachlan A. D., Nature (London), 257, 331—333 (1975).
96. Brokaw C. J., Science, 178, 455—562 (1972).
97. Berl S., Puszkin S, Nicklas W. J., Science, 179, 441—446 (1973).
98. Spudich J. D., Lord K., JBC, 249, 6013—6020 (1974).
99. Pollack R., Osborn M., Weber K-, PNAS, 72, 994—998 (1975).
100. Painter R. G., Sheetz M„ Singer J. J., PNAS, 72, 1359—1363 (1975).
101. King J., Mykolajewycz NJMB, 75, 338—358 (1973).
102. Kikuchi Y„ King J., JMB, 99, 645—672 (1975).
403. Casjens S., King T., Annu Rev. Biochem., 44, 555—611 (1975).
Глава 5
Мембраны и клеточные оболочки
Ранее мы рассмотрели способы, при помощи которых белковые
субъединицы могут соединяться друг с другом, образуя замкнутые
олигомеры и длинные спирали. Другой чрезвычайно важный способ
упаковки белков и липидов приводит к образованию пластинчатых
структур, или мембран [1—10], которые с молекулярной точки зрения
можно рассматривать как практически безграничные двумерные по-
верхности. Эта глава посвящена строению, химическим свойствам и
функциям биологических мембран, а также клеточных стенок бактерий,
грибов и растений.
Мембраны выполняют в клетке большое число функций. Наиболее
очевидной из них является разделение внутриклеточного пространства
на компартменты. Плазматические мембраны, например, ограничивают
содержимое клетки, а митохондриальные — отделяют митохондриаль-
ные ферменты и метаболиты от цитоплазм этических. Полупроницае-
мость мембран и позволяет им регулировать проникновение внутрь
клеток и клеточных органелл как ионов, так и незаряженных соедине-
ний. Проникновение многих из них внутрь клетки осуществляется
против градиента концентрации. Таким образом, в процессе, известном
под названием активный транспорт, совершается осмотическая рабо-
та. Протекающий в мембранных структурах бактерий и митохондрий
процесс окислительного фосфорилирования служит источником энергии
для организма. В хлоропластах зеленых листьев имеются мембраны с
очень большим числом складок, которые содержат хлорофилл, обла-
дающий способностью поглощать солнечную энергию. Тонкие мембра-
ны клеток глаза содержат фоторецепторные белки, воспринимающие
световые сигналы, а мембраны нервных клеток осуществляют передачу
электрических импульсов.
Значительная часть наших знаний о мембранах сложилась благо-
даря интенсивным многолетним исследованиям, проведенным на мемб-
ранах определенных типов. К их числу относятся следующие: 1. Мие-
линовая оболочка, состоящая из плазматических мембран, образуемых
шванновскими клетками, которые прилежат ко многим нейронам.
Шванновские клетки как бы наматываются на аксоны нейронов, при-
чем цитоплазма из них «выдавливается» и образуются тонкие, но плот-
но упакованные мембранные слои, окружающие аксоны и служащие
для них прекрасным «изолятором». Из всех известных мембран миели-
новые обладают наибольшей устойчивостью и содержат наибольшее
количество липидов (80%). 2. Плазматические мембраны эритроцитов
человека, которые могут быть получены путем осмотического шока
этих клеток. Образующиеся при этом тени эритроцитов содержат око-
ло 1 % сухого вещества клетки; по сравнению с другими мембранами
они изучены, пожалуй, наиболее полно. 3. Мембраны бактерий, и в
первую очередь Е. coli. 4. Наружный членик рецепторных клеток сет-
338 Глава 5
чатки глаза, известных под названием палочек (гл. 13), состоящий ив
множества упорядоченно расположенных и плотно упакованных плос-
ких дисков, каждый из которых в свою очередь включает две мембра-
ны 5 Двухслойные мембраны митохондрий сердца быка. 6. Регуляр-
но упакованные мембраны (граны) хлоропластов растений (гл. 13).
А. Строение мембран
Мембраны состоят в основном из белков и липидов1 [10], весовое
соотношение между которыми колеблется приблизительно от 1:4 в
миелине до 3:1 в мембранах бактерий. Наиболее типичным можно»
считать, однако, весовое соотношение этих компонентов 1:1. В мемб-
ранах иногда присутствуют также в незначительных количествах уг-
леводы (менее 5 %) и следы РНК (менее 0,1%). Наличие липидных
компонентов обусловливает такие свойства мембран, как высокое
электрическое сопротивление, непроницаемость для ионов и других по-
лярных соединений и проницаемость для неполярных веществ Так, на-
пример, для большинства анестезирующих препаратов характерна вы-
сокая растворимость в липидах, обеспечивающая возможность их про-
никновения через мембраны нервных клеток.
По данным электронной микроскопии, толщина большинства мемб-
ран составляет приблизительно 7 нм; согласно данным по малоуглово-
му рассеянию рентгеновских лучей, эта величина близка к 11 нм. Та-
ким образом, мембраны очень тонки — их толщина соизмерима с раз-
мерами крупных молекул.
1. Модель строения мембраны в виде липидного бислоя
Гортер и Грендел в 1926 г. рассчитали, что содержание липидов в.
мембранах теней эритроцитов достаточно для образования вокруг
клетки липидного слоя толщиной 3,0—4,0 нм2. Результаты этих рас-
четов в совокупности с данными о том, что липиды способны агреги-
ровать в водных растворах с образованием «мицелл», в которых угле-
водородные «хвосты» липидных молекул собраны вместе, а полярные
«головы» как бы выходят в окружающий раствор, позволили Дж. Да-
ниэлян в 1930 г. предложить ставшую впоследствии широкоизвестной
модель мембран в виде липидного бислоя [12а] Основные черты этой
модели представлены на рис. 5-1. За счет гидрофобных взаимодействий
углеводородные цепочки липидных молекул удерживаются друг возле
друга в вытянутом состоянии, тогда как полярные группы фосфолипид-
ных молекул взаимодействуют с белковыми молекулами, расположен-
ными по обе стороны от липидного бислоя.
В дальнейшем было предложено большое число других моделей,
однако в качестве исходной идеи во всех этих моделях использовалось
представление о липидном бислое [1]. Прямое и надежное подтверж-
дение существования липидного бислоя дали электронно-микроскопи-
ческие исследования. При окрашивании большинства мембран четы-
рехокисью осмия или перманганатом калия можно наблюдать харак-
1 Исключение составляют мембраны газовых вакуолей, встречающиеся в некото-
рых бактериях и сине зеленых водорослях Эти тонкие мембраны (их толщина состав-
ляет приблизительно 2 нм) почти целиком состоят из белков [10а]
2 Гортер и Грендел смогли сделать правильное заключение лишь благодаря взаим-
ной компенсации ошибок в их опытах по измерению поверхностного давления иле-
Мембраны и клеточные оболочки 339
СН3
Размер для полностью
вытянутых С16-целей
4,0 нм
Лолярные
vголовки ’
Схематическое изображение
фосфолипидного бислоя
Вид мембраны
окрашенной осмием,
в электронном
микроскопе
РИС 5 1. А. Бимолекулярные липидные слои и мембраны
терную трехслойную структуру (рис. 5-1), состоящую из двух темных
полос толщиной ~2—2,5 нм и светлой полосы между ними толщиной
~2,5—3,5 нм
Как в миелине, так н в наружных члениках палочек сетчатки
на электронно-микроскопических фотографиях видны близко приле-
гающие друг к другу пары таких мембран, суммарная толщина которых
составляет 18 нм Аналогичные структуры можно наблюдать при по-
мощи электронного микроскопа после окраски и фиксации фосфолипи-
дов, находящихся в ламеллярной «жидкокристаллической» фазе Для
корректной интерпретации этих результатов необходимо ответить еще
340 Глава 5
РИС. 5-1. Б. Электронно-микроскопическая фотография мембран теней двух эритро-
цитов, полученная методом замораживания — скалывания. На верхней части рисунка
видна часть мембраны, прилегающая к цитоплазме. Гладкая область — это липиды;
видны многочисленные частицы. В нижней части представлена наружная часть мем-
браны, которая содержит меньшее количество частиц. Пространство между мембра-
нами заполнено оставшимся льдом. Электронные микрофотографии биологических мем-
бран приведены также на рис. 1-2; 1-4 и в дополнении 1-В (С любезного разрешения
К. Fisher.)
на ряд вопросов. Почему, например, OsO4 окрашивает лишь внешний
белковый слой, в то время как известно, что он реагирует по двойным
связям углеводородных цепей липидов, образуя эфиры осмистой кис-
лоты, которые в дальнейшем легко восстанавливаются до диолов и ос-
мия? Почему мембраны, из которых экстрагирована большая часть
липидов, не утрачивают способности окрашиваться четырехокисью ос-
мия и имеют трехслойную структуру?
Н Н
—С—С—
О
Os
О О
Эфир осмистой кислоты
Обнаружение трехслойной структуры само по себе, по-видимому, мало
о чем говорит. Очень трудной задачей является даже точное определе-
ние толщины мембран, не говоря уж о полной расшифровке структуры
объекта, толщина которого составляет всего лишь 6—10 нм.
2. Искусственные мембраны
Наиболее надежные доказательства адекватности модели мембра-
ны в виде липидного бислоя были получены в результате исследования
очень тонких искусственных мембран, которые получают обычно из
раствора фосфолипида (например, фосфатидилхолина или смеси фос-
фолипидов с холестерином) в углеводородном растворителе. Каплю
Мембраны и клеточные оболочки 341
гакого раствора помещают в маленькое отверстие в полимерной пла-
стинке, разделяющей две емкости, заполненные водным раствором. По-
мещенный в отверстие раствор быстро «высыхает», подобно тому как
это происходит при образовании мыльного пузыря, причем образую-
щаяся пленка получается настолько тонкой, что характерная для по-
добных пленок разноцветная окраска исчезает и образуется «черная
мембрана» [12]. Такого рода мембраны, но в отсутствие углеводород-
ного растворителя были получены при совмещении двух липидных
монослоев, образованных на поверхности раздела воздух-—вода [13].
Толщина таких мембран, по-видимому, не превышает 6—9 нм. Они
эластичны и способны к самовосстановлению, поэтому их удается
окрасить четырехокисью осмия и получить характерную для природ-
ных мембран трехслойную картину.
Биологические мембраны служат своего рода барьером на пути
полярных молекул и ионов, что связано с их высоким электрическим
сопротивлением и большой электрической емкостью. Так, сопротивле-
ние мембран составляет обычно около 103 Ом-см^2, а емкость — 0,5—
1,5 мкФ-см~2. Соответствующие значения для искусственных мембран
равны приблизительно 107 Ом-см~2 и 0,6—0,9 мкФ-см-2. Более низкое
сопротивление биологических мембран по сравнению с искусственными
можно объяснить тем, что они содержат белки и другие переносчики
ионов, а возможно, просто наличием «пор». Величины, характеризую-
щие емкость мембран обоих типов, поразительно близки к значениям,
предсказываемым на основании бислойной модели [14—16].
3. Липидные компоненты мембран
В миелине из структур центральной нервной системы человека было
обнаружено около 1500 различных липидов, 30 из которых присут-
ствуют в значительных количествах [12]. Изучение общих закономер-
ностей состава мембран сильно затрудняется тем, что мембраны раз-
ного происхождения очень сильно различаются по содержанию в них
липидов разного типа. Однако практически во всех мембранах незави-
симо от их происхождения имеются фосфолипиды, содержание которых
составляет от 40 до 90% общего количества липидов в мембране
(табл. 5-1).
В мембранах доминируют фосфолипиды пяти типов: фосфатидилхо-
лин, фосфатидилэтаноламин, фосфатидилсерин, кардиолипин (дифос-
фатидилглицерин) и сфингомиелин; в небольших количествах встреча-
ется также фосфатидилинозит. Значительные количества кардиолипина
обнаруживаются только в мембранах бактерий и во внутренних мемб-
ранах митохондрий. Сфингомиелин в мембранах митохондрий отсут-
ствует. Характерным сфинголипидом для беспозвоночных является
церамидаминоэтилфосфонат. В мембранах хлоропластов содержится
особый сульфолипид с отрицательно заряженными группами «голо-
вок» (его строение см. в гл. 2, разд. Д).
Важными компонентами плазматических мембран, миелина (кото-
рый образуется из плазматических мембран), а также мембран эндо-
плазматического ретикулума и хлоропластов являются гликолипиды.
Особенно много цереброзидов обнаруживается в миелине; он содержит
также сульфатные эфиры цереброзидов (сульфатиды). В состав мем-
бран растительных клеток входят в основном производные глицерина
(галактозилдиглицериды), а не сфингозина.
В плазматических мембранах имеется также холестерин, его содер-
жание в миелине достигает 17%. В митохондриях же холестерин обна-
342 Глава 5
Таблица 5-1
Примерный химический состав некоторых мембран
Соединение % общего сухого веса мембраны3 4 *
миелин (бы— I чий) палочка сет- чатки плазматиче- ская мембрана (эритроцит человека) мембраны митохондрий Е. со«б,в,г (внутренняя и наружная мембраны) хлоропластыд
Белок 22 59 60 76 75 48
Липиды (общее количество) 78 41 40 24 25 52е
Фосфатидилхолин 7,5 13 6,9 8,8
Фосфатидилэтаиоламии 11,7 6,5 6,5 8,4 18
Фосфатидилсерии 7,1 2,5 3,1
Фосфатидилииозит Фосфатидилглицерии 0,6 0,4 0,3 0,75 4
Кардиолипин® 0,4 4,3 3
Сфиигомиелии 6,4 0,5 6,5
Гликолипид 22,0 9,5 Следы Следы 23
Холестерин 17,0 2,0 9,2 0,24
Фосфолипиды (общее количество) 33 27 24 22,5 25 4,7
Фосфолипиды (% общего количе- ства липидов) 42 66 60 94 >90 9
а Dewey М. М., Barr L., Curr. Top. Membr. Transp., 1, 6 (1970). 6 Kaback H. R., Curr. Top. Membr Transp., 1, 35—99 (1970). B Mizushima S., Yamada H., BBA, 375, 44—53 (1975). r Yamato I., Anraku Y., Hirosawa H., J. Biochem. (Tokyo), 77, 705—718, 1975. Эти авторы обнаружили 67% белка, 21% липидов, 10% углеводов и 2% РНК д Lichtenthaler Н. К., Park R. В., Nature (London), 198, 1070—1072 (1963). е Около 14% приходится на долю хлорофилла, каротиноидов и хинонов. ж Дифосфатидилглицерин (табл. 2-8).
руживают лишь в следовых количествах, а в мембранах бактерий ан
практически отсутствует. Эфиры стеринов, в форме которых осуществ-
ляется транспорт стеринов, в мембранах не встречаются. В мембранах
нет также триглицеридов — эти соединения обнаруживаются в форме
капель только в цитоплазме. К числу минорных компонентов мембран
(о которых известно, что они, хотя и содержатся в незначительных ко-
личествах, выполняют тем не менее важные биологические функции)
относится убихинон, который локализован во внутренней мембране ми-
тохондрий (гл. 10, разд. Г), токоферолы (гл. 10, разд. Г) и полипрени-
ловые спирты (гл. 12, разд. 3). Хлоропластные мембраны растительных
клеток содержат хлорофилл, каротины и ряд других жирорастворимых
пигментов.
4. Физические свойства мембран, обусловленные наличием
в них липидов
Полностью вытянутая цепочка жирной кислоты, содержащей 18 ато-
мов углерода (рис. 5-1), имеет длину приблизительно 2 нм. Площадь,
занимаемая такой молекулой в проекции «с торца», составляет 0,20 нм2.
Следовательно, толщина углеводородного слоя в липидном бислое, со-
Мембраны и клеточные оболочки 343
держащем такие цепочки жирных кислот, должна быть равна ~4 нм.
Экспериментально же измеренная толщина миелиновых мембран ока-
залась равной ~3,5 нм, однако в случае мембран наружного членика
палочек сетчатки глаза она не превышала 1,8 нм, а в искусственных
черных пленках, полностью лишенных растворителя, составляет 3,1 нм
[15]. Эти, а также многие другие результаты позволяют считать, что
углеводородные цепочки в мембране полностью не распрямлены, вслед-
ствие чего площадь, занимаемая мембраной, несколько больше, чем это
можно было предполагать, исходя из элементарной модели, согласно
которой цепочки жирных кислот полностью вытянуты. Преобладание
в мембране ^ис-изомеров ненасыщенных жирных кислот и других мо-
лекул типа стеринов или белков способствует образованию складок,
благодаря чему уменьшается толщина мембраны. Предположение о
том, что толщина биологических мембран больше той, которую им
следовало иметь, если бы их строение соответствовало элементарной
модели, подтверждается результатами измерений толщины липид-
ных монослоев в плазматических мембранах. Согласно полученным дан-
ным, поперечное сечение молекулы фосфолипида составляет в среднем
0,52 нм2, тогда как в случае компактной упаковки оно должно было бы
составлять ~0,40 нм2 (2Хпоперечное сечение одной вытянутой це-
почкой) [16].
При достаточно низких температурах липидные бислои ведут себя
как твердые тела. Согласно рентгеноструктурным данным, толщина
бислоя составляет 0,42 нм, что соответствует гексагональной упаковке
цепочек жирных кислот. При температуре, превышающей температуру
перехода (Tt), толщина бислоя возрастает до 0,46 нм. Структура би-
слоя при этом сохраняется, однако жирные кислоты «плавятся», в ре-
зультате чего вращение и скручивание молекул происходит легче, чем
при низких температурах [16а]. Плавление мембранных липидов бы-
ло непосредственно продемонстрировано несколькими методами. На-
пример, при температурах, превышающих Tt, атомы водорода метиль-
ных и метиленовых групп боковых цепей жирных кислот дают узкие
сигналы в протонных и в 13С-ЯМР-спектрах мембран.
Резкое уширение этих полос при температуре ниже Л обусловлено
потерей подвижности углеводородных цепей (дополнение 5-А). Анало-
гичные выводы были сделаны при исследовании спин-меченых бислоев,
содержащих ковалентно связанные стабильные свободные радикалы,
неспаренные электроны которых можно обнаружить методом электрон-
ного парамагнитного резонанса (ЭПР, см. дополнение 5-Б).
Температура перехода, или «плавления», липидных бислоев зависит
от состава содержащихся в них жирных кислот. Для насыщенных
жирных кислот с длинной цепью характерны высокие температуры пе-
рехода. Миелину присуще особенно высокое содержание сфинголипи-
дов с длинными цепями и холестерина, которые, как известно, повыша-
ют стабильность искусственных бислоев. В сущности, состояние мие-
линовых мембран в организме человека приближается к твердому.
Температура перехода бислоев часто может быть достаточно чет-
кой. Однако тщательные исследования показали, что, как и в случае
кристаллов с примесями, плавление начинается, по существу, задолго
до Tt. Так, более высокая растворимость парамагнитного 2,2,6,6-тетра-
метилпиперидин-1-оксида в жидких участках бислоя по сравнению с
твердыми позволяет изучать процесс плавления бислоев путем нагре-
вания мембраны непосредственно в ЭПР-апектрометре по изменению
растворимости этого спин-меченого соединения (дополнение 5-Б). Для
дипальмитоилфосфатидилхолина (лецитина) величина Tt равна 40,5° С,
344 Глава 5
однако первые признаки плавления можно заметить значительно рань-
ше— при температуре 29,5 °C [17]. Аналогичные данные были получе-
ны методом «флуоресцентного зонда», с помощью которого измеряли
интенсивность флуоресценции N-фенилнафтиламина, зависящую от по-
2,2,6,6-Тетраметиллиперй&ин-1-оксй1)
лярности его окружения (гл. 13, разд. В.1). При включении этого со-
единения в мембрану интенсивность его флуоресценции значительно'
возрастает. Полученные данные указывают на то, что и при темпера-
туре <Tt внутри бислоя одновременно существуют жидкие и твердые
области [17а]. Это явление носит название латеральное разделение
фаз [17]. Равновесие между твердыми и жидкими состояниями являет-
ся динамическим и в значительной степени зависит от ионного состава
среды, окружающей бислой. Имеются основания предполагать, что яв-
ление латерального разделения фаз играет фундаментальную роль в
процессе проведения нервных импульсов [18].
Дополнение 5-А
Времена релаксации в спектроскопии магнитного
резонанса
В современной литературе, посвященной исследованию
мембран, ферментов и конформации небольших молекул,
часто встречаются термины время продольной и поперечной
релаксации и время корреляции. Для того чтобы понять зна-
чение этих терминов, необходимо ознакомиться с оригиналь-
ными работамиа~д; написанное ниже следует рассматривать
лишь как краткое введение.
Первоначальной целью ЯМР-спектроокопии было полу-
чение спектра высокого разрешения, в котором магнитный
момент каждого ядра регистрировался бы в виде четкого'
сигнала или сигналов поглощения. Минимальная ширина
сигналов ограничивается принципом неопределенности Гей-
зенберга, согласно которому &E-kt = hl'2.a, где h — постоян-
ная Планка, АД — неопределенность в энергии, а 41 — время
жизни возбужденного магнитного состояния. Поскольку для
электромагнитного излучения E=hv, величина АД прямо
пропорциональна ширине сигнала. Ядро, обладающее собст-
венным магнитным моментом, хорошо экранировано от
внешних воздействий, и время его жизни в возбужденном
состоянии может быть сравнительно велико. Отсюда следу-
ет, что величина Av должна быть мала, часто она составляет
менее 0,2 Гц. Это обстоятельство способствует успешному
Мембраны и клеточные оболочки 345
использованию протонного магнитного резонанса высокого
разрешения (см., например, рис. 2-40 и 2-41).
Если приложить к образцу в спектрометре ЯМР очень
мощный импульс электромагнитного излучения, то практи-
чески все ядра могут перейти в возбужденное магнитное со-
стояние. Если сразу вслед за этим приложить еще один им-
пульс, то поглощение энергии будет невелико, так как си-
стема насыщена. В наиболее широко применяемых спектро-
метрах ЯМР для уменьшения эффекта насыщения исполь-
зуют радиочастотное поле малой интенсивности. Однако в
импульсных ЯМР-спектрометрах с фурье-преобразованием.
применение мощных импульсов приводит к высокой степени
насыщения. Использование повторных импульсов не позво-
ляет получать полезную информацию, если возбужденные
ядра не релаксируют достаточно быстро в состояние, харак-
теризующееся равновесным распределением энергии. Релак-
сация происходит за счет взаимодействий ядер с флуктуи-
рующими магнитными полями окружения. Релаксация орга-
нических молекул в растворе происходит в основном за счет
флуктуаций, обусловленных движением электрических дипо-
лей, находящихся в непосредственной близости. Однако да-
же при наличии таких взаимодействий времена релаксации
протонов в воде могут измеряться секундами.
Релаксацию магнитных состояний ядра характеризуют
двумя временами. Время продольной релаксации, или время
спин-решеточной релаксации Tlt определяет скорость релак-
сации суммарного магнитного вектора ядер в направлении
магнитного поля спектрометра (Но). Время поперечной, или
спин-спиновой релаксации Т2, характеризует релаксацию
в плоскости, перпендикулярной направлению Но. При
определенных условиях два времени релаксации могут быть
измерены независимо. В общем случае Для твердых
тел время Т2 невелико (оно составляет приблизительно
10-5 с), тогда как для растворов, как уже упоминалось, оно
может измеряться секундами. Столь значительное увеличе-
ние времени жизни возбужденного состояния при переходе
от твердого состояния к жидкому приводит к сужению сиг-
налов поглощения, что играет важную роль в ЯМР-спектро-
скопии. Это объясняет, почему обычно узкие для жидкостей
сигналы ЯМР-спектров уширяются при увеличении вязкости
или уменьшении текучести мембраны.
Как можно измерить Т2 и Л? В первом приближении для
жидкостей Т2 часто оценивают по ширине сигнала Av на его
полувьисоте:
Однако обычно для этого используют специальные им-
пульсные методы ЯМР. Проще всего величину Т\ измерить
на спектрометре с фурье-преобразованием в присутствии
изотопа 13С. Часто времена Т\ и Т2 пытаются использовать.
для получения информации о динамических характеристиках
системы. В этом случае определяют взаимосвязь между Tt
или Т2, с одной стороны, и временем корреляции тс для ис-
следуемых ядер — с другой. Величина тс — это временная
•346 Глава 5
константа, характеризующая экспоненциальное затухание
флуктуаций в среде, ответственных за релаксацию магнитных
ядер. В общем случае 1/тс можно рассматривать как констан-
ту скорости, представляющую сумму всех констант скоростей
для различных независимых процессов, приводящих к ре-
лаксации. Наиболее важный из этих процессов— молекуляр-
ная переориентация, для которой 1/тг = (3kT) (4лцг3). Обра-
тите внимание на сходство этого уравнения с уравнением,
описывающим вращательную диффузию [уравнение (6-32)].
Другим параметром является величина, обратная времени
контакта (residence) тт, характеризующая среднее время,
в течение которого пара диполей находится достаточно близ-
ко друг от друга, для того чтобы могла произойти релакса-
ция.
В обычных растворителях при комнатной температуре тс
составляет 10~12 с. Следовательно, скорости релаксации
в растворе значительно выше, чем частоты излучения, по-
глощаемого в ЯМР-спектрометре (~108 с-1). В этих услови-
ях релаксация относительно неэффективна, а времена Т{ и
Т2 велики и в большинстве случаев равны друг другу. Сиг-
налы при этом остаются узкими. С увеличением времени кор-
реляции (например, при увеличении вязкости) времена Т{
и Т2 уменьшаются; время Ti достигает минимума, когда ве-
личина Тс1 равна частоте поглощаемого излучения v. В этих
условиях сигналы уширяются и сверхтонкие линии (обус-
ловленные взаимодействием магнитных спинов различных
ядер) сливаются и не могут быть разрешены. По мере даль-
нейшего увеличения тс время Т2 уменьшается и достигает по-
стоянного Минимального значения, тогда как время Т\ вновь
увеличивается. Измерения методам ЯМР могут проводиться
в области, в которой т^больше v. Эта возможность реализу-
ется в высокочастотных спектрометрах, чем и обусловлено
их преимущество. Вместе с тем с жидкостями обычно приня-
то работать при условии сильного сужения, связанного с
высокой подвижностью, при низких значениях т?1. С увели-
чением подвижности молекул возрастают значения как Tlt
так и Т2.
Серьезное ограничение при использовании методов
ЯМР для исследования белков связано с увеличением вре-
мени корреляции молекулярной переориентации для боль-
ших молекул. Поскольку наибольший вклад в константу
скорости релаксации вносит чаще всего 1/тг, узкие сигналы
в спектре ЯМР появляются лишь при исследовании неболь-
ших белков, мол. вес которых не превышает 20 0006.
Практическая трудность, возникающая при исследовани-
ях методом ЯМР с использованием изотопа 13С, связанная с
медленной релаксацией (большим значением T’J, обуслов-
лена частичным насыщением. В результате на тех атомах
углерода, для которых релаксация особенно неэффективна,
наблюдаются сигналы меньшей интенсивности. Времена ре-
лаксации -могут быть измерены отдельно для каждого атома
углерода в молекуле. Правильная интерпретация получен-
ных данных дает ценную информацию о подвижности опре-
деленных фрагментов и групп внутри молекулы. Следует от-
метить, что соотношения между временами релаксации и
Мембраны и клеточные оболочки 347
внутримолекулярными движениями носят сложный харак-
тер, однако ситуация часто упрощается при использовании
13С-ЯМР. Поскольку атомы углерода обычно окружены свя-
занными с ними водородными атомами, релаксация ядер в
значительной мере определяется диполь-дипольными взаи-
модействиями с этими атомами. Для атома углерода, свя-
занного с N эквивалентными протонами, для которых харак-
терна очень быстрая молекулярная переориентация,
1/Т ~ Л^27с?Нтэфф
1 /1 1 ~ ’
где п=п12л, а ус и ун-—гиромагнитные отношения ядер уг-
лерода и водорода. Это соотношение позволяет рассчитать
эффективное время корреляции т для каждого углеродного
атома.
Примером такого рода интерпретации служит работа Гуд-
мена и сотр.ж. Некоторые проблемы, связанные с интерпре-
тацией ширины сигналов в спектрах ЯМР мембран, рассмот-
рены в работе Сейтера и Чена3.
а Bovey F. A., Nuclear Magnetic Resonance Spectroscopy, Academic Press,
New York, 1969.
6 Farrar T. C., Becker E. D., Pulse and Fourier Transform NMR, Academic
Press, New York, 1971.
3 Swift J. T„ Tech. Chem., 6, Part II, 521—563 (1974).
r Lyerla J. R„ Jr., Grant D. M. In: Magnetic Resonance, (McDowell C. A ,
ed.), MTP Int. Rev. Sci. No. 4, pp. 155—200, Butterworth, London, and
Univ. Park Press, Baltimore, 1972.
д Lee A. G., Birdsall N. J. M., Metcalfe C. In: Methods in Membrane Bio-
logy (Korn E. D., ed.), Vol. 2, pp. 1—156, Plenum, New York, 1974.
e Gray G. A., CRC Cnt. Rev. Biochem., 1, 247—364 (1973).
ж Goodman R. A., Oldfield E., Allerhand A., JACS, 95, 7553—7558 (1973).
3 Setter С. H. A., Chan S. I., JACS, 95, 7541—7553 (1973).
Считают, что во всех организмах при физиологической температуре
липидные компоненты большинства мембран частично находятся в
жидком состоянии [19]. Жидкое состояние липидов в мембране объ-
ясняется по крайней мере тремя причинами. 1. В организме человека
(так же как и у Е. coli) имеются ненасыщенные жирные кислоты, по-
нижающие температуру плавления; мутанты Е. coli, не способные син-
тезировать ненасыщенные жирные кислоты, не могут жить в среде,
лишенной этих соединений [20]. 2. у Bacillus subtilis, которые не со-
держат ненасыщенных жирных кислот при выращивании при 37 °C, и
у других грамположительных бактерий более 70% жирных кислот в
мембране содержит дополнительные метильные группы (гл. 12,
разд. Д) [21]. Подобно двойным связям в цпс-конфигурации, допол-
нительные метильные группы способствуют понижению температуры
плавления и увеличению площади поверхности монослоя в 1,5 раза.
3. Понижение температуры плавления липидов может быть обуслов-
лено также тем, что в их состав входят циклопропансодержащие жир-
ные кислоты (гл. 12, разд. Д.1).
Вместе с тем наличие в мембранах холестерина приводит к огра-
ничению подвижности молекул и к уменьшению площади, занимаемой
молекулами фосфолипидов [22].
348 Глава 5
Почему мембранные липиды должны обладать подвижностью? Од-
на из причин связана, вероятно, с участием мембран в жизненно важ-
ных процессах транспорта. Биологические мембраны характеризуются
довольно высокой проницаемостью для нейтральных молекул (в том.
числе Н2О), причем при температурах, превышающих Л, цепи жирных
кислот могут свободно поворачиваться вокруг одинарных связей на
120 °C, переходя из транс- в скошенную (гош-) конфигурацию. В ре-
зультате такого вращения вокруг соседних или близко расположенных
связей возникают «изломы» цепочек жирных кислот. Если излом обра-
зуется вблизи поверхности бислоя (как это чаще всего и происходит),,
то в образовавшуюся полость легко может проскочить небольшая мо-
лекула. Поскольку излом легко перемещается по бислою, небольшие-
молекулы могут свободно проникать через мембрану [23]. Не исклю-
чено, что эти же факторы обеспечивают перенос и более крупных мо-
лекул, играющих роль переносчиков в мембранном транспорте.
Молекулы липидов и белков, входящих в состав мембран, способ-
ны перемещаться друг относительно друга. Скорость латеральной диф~
фузии липидов в бислоях и антигенов (белков) на поверхностях кле-
ток весьма высока. Если предположить, что диффузия фосфолипидов-
происходит за счет взаимного обмена соседних молекул, то частотах
таких обменов может достигать 107 с-1 [24].
Экспериментальные данные, полученные методами ЯМР и ЭПР,
показывают, что наружные участки бислоев находятся как бы в более
твердом состоянии, чем внутренние. По-видимому, не случайно первая,
двойная связь в полиненасыщенных жирных кислотах встречается
обычно между 9-м и 10-м углеродными атомами. В результате двойные
связи в жирных кислотах галактозилдиглицеридов в хлоропластах
оказываются на таком же расстоянии от поверхности мембраны, как и.
метильные группы цепей фитола в хлорофилле. Считают, что в «рас-
плавленном» центре бислоя находятся области с нерегулярной структу-
рой, образующиеся за счет метильных групп цепей фитола (рис. 13-19).
Последние входят в мембраны хлоропластов [25] и фиксируют там.
молекулы хлорофилла1.
Дополнение 5-Б»
Спектры электронного парамагнитного резонанса
(ЭПР) и спиновые метки
Поскольку неспаренные электроны обладают магнитны-
ми моментами, они являются удобными объектами для маг-
нитно-резонансной спектроскопии. Ее методическая часть в
принципе сходна с ЯМР-спектроскопией, однако в ЭПР-
спектроскопии используют электромагнитные волны с ча-
стотами ~1010 Гц (диапазон СВЧ), энергия которых при-
близительно в 100 раз превышает энергию волн, используе-
мых в ЯМР-спектроскопииа-в. Неспаренные электроны име-
ются у свободных радикалов органических молекул, а также
у некоторых переходных металлов. Оба этих класса соедине-
1 Эта точка зрения отражает лишь одну из предложенных теорий; другие воз-
можные объяснения рассмотрены в гл 3, разд. Д 3.
Мембраны и клеточные оболочки 349
иий имеют важное значение для ряда ферментативных про-
цессов. Кроме того, к различным участкам макромолекул
можно присоединить спиновые метки — стабильные органи-
ческие радикалы. При помощи методов ЭПР или ЯМР часто
удается регистрировать взаимодействия неспаренных элект-
ронов таких искусственно встроенных радикалов с магнитны-
ми моментами неспаренных электронов или ядер.
Условия поглощения энергии в ЭПР-спектрометре зада-
ются уравнением
hv=g^H0,
которое по форме идентично основному уравнению ЯМР-
спектроскопии. Здесь 0 — константа, которую называют маг-
нетоном Бора. Величина g— фактор спектроскопического
расщепления—представляет собой одну из наиболее важ-
ных характеристик, используемых при описании спектра
ЭПР. Для свободного электрона значение g-фактора рав-
но 2,000, для радикалов оно может быть несколько иным,
а для ионов переходных металлов отличие иногда весьма
значительно. Одним из факторов, обусловливающих зависи-
мость g-фактора от окружения, является спин-орбитальное
взаимодействие, связанное с несимметричностью р- и d-ор-
биталей атомов. По той же причине g-фактор иногда прини-
мает три дискретных значения для трех разных направлений
(анизотропия g-фактора). В других случаях значение g-фак-
тора в направлении, параллельном H0(.gi\), отличается от
его значения в перпендикулярном направлении (gi). Оба
этих значения могут быть определены экспериментально.
Еще одной характеристикой спектра ЭПР является сверх-
тонкая структура, происхождение которой связано с взаимо-
действием между магнитным моментом неспаренного элект-
рона и спинами ядер. Это взаимодействие аналогично спин-
спиновому взаимодействию в ЯМР (гл. 2, разд. 3). Констан-
та сверхтонкого расщепления А, так же как и константа
взаимодействия J в ЯМР-спектроскопии, выражается в гер-
цах Расщепление обусловлено наличием магнитного момен-
та у ядра, вокруг которого вращается электрон, или у рас-
положенного поблизости ядра, а также присутствием друго-
го неспаренного электрона. Иногда наличие или отсутствие
расщепления позволяет делать важные в химическом плане
заключения Так, в спектре ЭПР иона металла в комплексе
расщепление под воздействием ядер лиганда будет наблю-
даться только в том случае, если лиганд связан с ионом ко-
валентной связью
Обычно в ЭПР-спектроскопии используют не кривую по-
глощения, а ее первую производную. Например, в случае
иминоксильной спиновой метки спектр ЭПР состоит из трех
равно отстоящих друг от друга линий. Их центры находятся
1
О
Мминоксильная спиновая метка
350 Глава 5
в точках, где производные кривых поглощения пересекают
горизонтальную ось. Взаимодействие со спином ядра 14М
приводит к расщеплению на три линии, как это показано на
представленном ниже рисунке.
Спектр ЭПР тетра метил пиперидин -1-оксида
(разд А 4), растворенного в водной эмульсии
фосфолипидов. Вверху— при температуре
выше Tt; в центре —между Tt и .предпереходной "
температурой, внизу —при температуре ниже
„ предпереходной”1.
(Напечатано с разрешения American Chemical
Society Biochemistry , 12,2353, 1973.)
Нижний из трех спектров приближается к спектру спи-
новой метки в воде, тогда как два других являются более
сложными спектрами, характерными для состояний, при ко-
торых часть метки растворена в фосфолипидных бислоях.
Поскольку частоты, используемые в ЭПР-спектроскопищ
приблизительно в 100 раз выше, чем в ЯМР-спектроскопищ
для получения четких спектров времена корреляции (допол-
нение 5-А) не должны превышать 10-9 с. Хотя четкие спект-
ры можно получить и для растворов, все-таки, чтобы затор-
мозить движение молекул, образцы замораживают и изме-
рения проводят при очень низких температурах. При иссле-
довании спиновых меток в липидных бислоях ширина и вид
линий служат чувствительными критериями характера дви-
жения молекул, которое может быть как хаотичным, так и
направленным. Для сопоставления формы линий, получен-
ных при различных условиях, с предсказанными на основа-
нии определенных теорий уширения линий часто с успехом
Мембраны и клеточные оболочки 351
используют вычислительные машины^’е. К числу спиновых
меток, включающихся в липидные бислои, относятся следую-
щие соединения:
с-(сн2)„—-с----(СН2)т—сн3
но
Интерпретация наблюдаемых изменений в ЭПР-спектрах.
спиновых меток носит в большинстве случаев чисто эмпири-
ческий характер. Например, при интерпретации спектров,,
показанных на представленном выше рисунке, можно счи-
тать, что при высоких температурах в липиде растворяется
большее количество спиновой метки, чем при более низких.
Отношение, указанное на рисунке, представляет собой эм-
пирический параметр, температурную зависимость которого’
можно оценить из опытов, проведенных при разных темпера-
турах. Графики, отражающие зависимость f от Т, были ис-
пользованы для определения температуры перехода и пред-
переходной температуры в бислояхг.
а Knowles Р. F., Essays Biochem., 8, 79—106 (1972).
6 Chen К. S., Hirota N„ Tech. Chem., 6, Part II, 565—636 (1974).
B Griffith О. H., Waggoner A. S., Acc. Chem. Res., 2, 17—24 (1969).
r Shimshick E. I., McConnell H. M., Biochemistry, 12, 2351—2360 (1973).
д Deraux P., McConnell H. M., JACS, 94, 4475—4481 (1972).
e Sackmann E., Trauble H., JACS, 94, 4482—4498 and 4499—4510 (1972).
5. Две стороны мембраны
Существует много экспериментальных данных, свидетельствующих
в пользу того, что свойства внутренней и внешней поверхностей мемб-
ран существенно различаются. Данные, полученные Бретсчером [3, 26]г
указывают на то, что наиболее типичным фосфолипидом в мембранах
эритроцитов многих млекопитающих является фосфатидилхолин, тогда
как у жвачных он заменен сфингомиелином. Эритроциты овец устойчи-
вы к действию фосфолипазы А из яда кобры (гл. 2, разд. 3.2), кото-
рая, как известно, отщепляет жирную кислоту во втором положении в-
молекуле фосфатидилхолина, что приводит к лизису клеток. Устойчи-
вость эритроцитов овец к действию фосфолипазы А позволяет предпо-
ложить, что сфингомиелин расположен на внешней поверхности мемб-
раны, в то время как фоофатидилэтаноламин и другие фосфолипиды —
на внутренней. Можно полагать, что в мембранах, содержащих фос-
фатидилхолин, последний находится на внешней поверхности. С этил®
352 Глава 5
согласуются данные о том, что большая часть реакционноспособных
аминогрупп обнаруживается на внутренних поверхностях мембран. Тот
факт, что общее содержание фосфатидилхолина и сфингомиелина в
мембранах часто превосходит общее содержание фосфатидилэтанол-
амина и фосфатидилсерина, свидетельствует о некоторой «неукомплек-
тованности» внутренней поверхности мембраны. Это в свою очередь
позволяет предсказать, что белки должны присоединяться преимуще-
ственно к внутренним поверхностям мембран, а не к внешним.
Гликолипиды располагаются, по-видимому, на внешних поверхно-
стях мембраны таким образом, что углеводные цепи оказываются на-
правленными в сторону окружающего раствора. Вообще, вероятно,
углеводные группы, присоединенные к липидам или белкам, стремятся
расположиться на внешних поверхностях клеток или комплексов,
транспортируемых из клеток.
-6. Мембранные белки
Поскольку мембранные белки легко денатурируют, их довольно
.долго не удавалось выделить и изучить. Преодолеть эти трудности по-
могло использование принципиально новых подходов. Оказалось, что
.ряд белков можно солюбилизировать с помощью детергентов. Напри-
мер, родопсин — светочувствительный пигмент и основной белковый
компонент наружных члеников палочек сетчатки—может быть полу-
чен в солюбилизированном виде, в котором он нормально обесцвечи-
вается на свету (гл. 13, разд. Е). Несколько ферментов удалось выде-
лить из мембран и очистить фракционированием в органических рас-
творителях, например в метаноле. Мембранные белки обычно нерас-
творимы в воде. Однако мембраны эритроцитов удалось практически
полностью солюбилизировать в воде, используя хелатобразующий
агент ЭДТА в концентрации 5-Ю-3 М (табл. 4-2) или 0,1 М тетраме-
тиламмонийбромид [27]. Результаты этих опытов указывают, что в
поддержании стабильности мембран важную роль играют ионные
взаимодействия между белками (или между белками и фосфолипи-
дами) .
При электрофорезе белков плазматических мембран в полиакрил-
амидном геле с додецилсульфатом натрия (гл. 2, разд. 3.6) получают
от 1 до 6 четко выраженных полос и, как минимум, еще 35 менее ин-
тенсивных полос, соответствующих мол. весам в интервале от 10 000
до 360 000 [28]. Однако некоторые очень важные мембранные белки,
например (Na++К+)-зависимая АТРаза (разд. Б.2.в), присутствуют в
столь незначительных количествах (в одном эритроците их содержится
всего несколько сотен молекул [3, За]), что эти белки не удается иден-
тифицировать на электрофореграмме. Митохондриальные мембраны
могут иметь еще более сложный состав, чем плазматические, тогда как
состав миелина несколько проще.
Около одной трети белка в мембране эритроцитов приходится на
долю двух гидрофобных белков, получивших название спектрин (или
тектин). Их мол. вес составляет 220 000—250 000 и вместе с более низ-
комолекулярным белком (мол. вес 43 000) они образуют палочковид-
ные структуры, имеющие размер ~ 3x200 нм. В эритроците содержит-
ся около 2,2-105 таких палочек, и если их расположить рядом друг с
другом, то они полностью покроют внутреннюю поверхность эритроцита
(130 мкм2). Поскольку после обработки различными химическими ре-
агентами [28а], модифицирующими аминокислотные остатки белков,
находящихся на внешней поверхности мембран (например, иодирова-
Мембраны и клеточные оболочки 353
ние лактопероксидазой, гл. 10, разд. Б.6), спектрины не метятся, счи-
тают, что они расположены с внутренней стороны мембран [3, 29].
Предположение о сходстве этих белков с миозином еще требует дока-
зательств, а их роль в функционировании мембраны остается неясной.
Другой важный компонент мембран эритроцитов — это гликопроте-
ид с мол. весом ~ 100 000, который сравнительно прочно закреплен
внутри мембраны и имеет углеводные цепи, выступающие в окружа-
ющий раствор [29]. На электронно-микроскопических фотографиях по-
верхностей мембранного бислоя, полученных методом заморажива-
ния— скалывания (рис. 5-1, Б), видно, что в мембране на площади
1 мкм2 хаотично расположено приблизительно 4200 частиц диаметром
8 нм Не исключено, что эти частицы являются рассматриваемым гли-
копротеидом. Значение этого белка остается неясным. Однако было вы-
сказано предположение, что его молекулы содержат «каналы», необ-
ходимые для транспорта воды [29а] и анионов [29b] (обмен бикарбо-
натов и хлоридов через мембраны эритроцитов происходит очень ак-
тивно и связан с функционированием гемоглобина в транспорте кис-
лорода). О том, что гликопротеид пронизывает мембрану, свидетельст-
вует тот факт, что при обработке трипсином интактных эритроцитов
происходит частичный протеолиз этого гликопротеида без разрушения
мембраны. Кроме того, в результате целого ряда химических реакций
удается модифицировать именно этот белок, в то время как большая
часть мембранных белков остается интактной [3, За].
Особый интерес представляет еще один гликопротеид, содержащий-
ся в эритроцитах, — гликофорин (обозначаемый иногда PAS-1) [30,
31]. Он имеет мол. вес ~31 000 и также встроен в мембрану. Замеча-
тельно, что около 60% его веса составляют углеводы. Белковая часть
гликофорина, первичная структура которой известна, представлена еди-
ничной пептидной цепью, содержащей приблизительно 131 аминокислот-
ный остаток [31] В 50-членном N-концевом фрагменте очень велико
содержание треонина и серина. Считают, что N-концевая часть, с ко-
торой связано около 16 олигосахаридных разветвленных цепей, высту-
пает из клеточной мембраны; всего на одну полипептидную цепь при-
ходится ~160 молекул сахара (рис. 5-2). Из-за высокого содержания
сиаловой кислоты (рис 2-14) гликопротеид имеет большой отрица-
тельный заряд. Молекула гликофорина состоит из 3 частей («доме-
нов»), К N-концевой части молекулы, связанной с углеводными остат-
ками, примыкает цепь из 32 гидрофобных остатков, которые, по-види-
мому, образуют а-спиральный Участок, пронизывающий бислой. Тре-
тий участок, расположенный на С-конце, гидрофилен и обогащен
остатками пролина, глутаминовой и аспарагиновой кислот. Он может
достигать цитоплазмы (рис. 5-2) и связывать ионы кальция или взаи-
модействовать с —NHj-группами фосфолипидных головок.
Если бы все углеводные остатки гликофорина оказались равномер-
но распределенными на поверхности клетки, то они могли бы покрыть
около 7s ее поверхности, образовав редкую сетку. В действительности
же они распределены, по-видимому, неравномерно и образуют высту-
пающие из мембраны локальные скопления. Было показано, что угле-
водные выступы являются носителями антигенов групп крови MN-типа
(разд. В 1) и ряда других иммунологических детерминант. Они служат
также рецепторами для вирусов гриппа и местами присоединения рас-
тительных агглютининов (разд В.З).
20 или даже большее число гликопротеидов встроено в мембрану
эритроцитов ф28Ь]; их иногда называют внутренними или интеграль-
ными белками. Белки, менее прочно связанные с мембраной и располо-
354 Глава 5
женные главным образом на внутренней поверхности, носят название
периферических [32].
Миелин содержит простой и вместе с тем весьма интересный набор
белков. Около 30% общего количества белка приходится на долю силь-
но основного белка А-1 [33] с мол. весом ~ 18 000. Для белка А-1 че-
ловека установлена аминокислотная последовательность. Считают, что
этот белок находится в вытянутой p-конформации, причем близко рас-
С наружи
Внутри
0 20 40 60 80 100 120 131
I---1---1----1---|---1---1----1---1---।---1----1---1---Н
Гликозилированные
остатки
NH2-
Ш////А г
Гидрофобная область
U------------------------соон
ЙипнЗт/и] Внутри
Снаружи (цитоплазма)
Б
РИС. 5-2. А. Схематическая модель мембраны эритроцита. 1 — гликопротеид с мол. ве-
сом 100 000; 2 — сиалогликопротеид (гликофорин); 3 — спектрин; 4 — глицеральдегид-
3-фосфатдегидрогеназа; 5—(Na++K+)-зависимая АТРаза; 6 — ацетилхолинэстераза.
Данные, приведенные на рисунке, не соответствуют истинному содержанию соответ-
ствующих полипептидиых цепей в мембране. Палочкообразные структуры (Y) обозна-
чают углеводы. (Juliano R., ВВА, 300, 341—348, 1973.) Б. Схематическое изображение
молекулы гликофорина. Ромбы — О-гликозидные звенья, шестиугольники — N-глико-
зидные звенья [31].
положенные друг к другу четыре пролиновых остатка в середине поли-
пептидной цепи позволяют ей образовать шпилечную петлю. Значи-
тельный интерес к изучению этого белка объясняется тем, что он вызы-
вает у животных аутоиммунное заболевание — экспериментальный ал-
лергический энцефаломиелит, которое служит моделью известного в
клинике заболевания нервной системы, характеризующегося демиели-
низацией (рассеянный склероз). Это позволяет считать, что белок А-1
в интактном миелине взаимодействует с циркулирующими антителами,
и свидетельствует о расположении этого белка на поверхности миели-
новой мембраны. Однако функция его не известна.
Другим важным белковым компонентом миелина является протео-
липид, сильно обогащенный остатками гидрофобных аминокислот; он
содержит жирные кислоты, присоединенные, вероятно, сложноэфирны-
МИ связями [9]. Подобные протеолипиды встречаются достаточно ча-
сто [33а]. Из эндоплазматического ретикулума мышечных клеток был
экстрагирован белок с мол. весом 12 000, растворимый в смеси хлоро-
форм— метанол (2:1). Субъединицы F-пилей Е. coli (гл. 1, разд. А.6)
примерно такого же размера находятся (в растворенном состоянии) в
наружной мембране клеточной стенки бактерий [ЗЗЬ].
Многие белки в мембранах выполняют ферментативные функции.
Так, например, система транспорта электронов в митохондриях лока-
лизована в мембранах (гл. 10), и ряд ферментов, обладающих высокой
Мембраны н клеточные оболочки 355
растворимостью в липидах, уже выделен. Примером может служить
фосфатидилсерин—декарбоксилаза, катализирующая превращение фос-
фатидилсерина в фосфатидилэтаноламин (гл. 12, разд. Е.2) в про-
цессе биосинтеза последнего. Гликозилтрансферазы, необходимые для
биосинтеза липополисахаридов наружной мембраны бактериальной
клетки, по-видимому, также встроены в плазматическую мембрану.
Эти ферменты не активны в отсутствие липидов, но восстанавливают
активность в присутствии фосфатидилэтаноламина [34]. Особый инте-
рес представляет белок с мол. весом 26 000, обнаруженный в пурпур-
ных мембранах Halobacterium halobium (гл. 13, разд. Е. 6). Этот белок,
структуру которого удалось выяснить с помощью электронной микро-
скопии с разрешением 0,7 нм, по-видимому, обеспечивает работу свето-
чувствительного протонного насоса [35]. Каждая молекула белка со-
стоит из семи плотно упакованных а-спиральных участков, располо-
женных почти перпендикулярно к поверхности мембраны. В совокуп-
ности эти молекулы образуют высокоупорядоченные структуры, проме-
жутки между которыми заполнены фосфолипидами.
В этом разделе очень кратко рассказано о том, что в настоящее
время известно о составе и строении белков клеточных мембран. Нет
сомнения, что в ближайшем будущем при изучении мембранных бел-
ков будут получены новые интересные результаты.
Б. Метаболизм и функции мембран
Чем определяется важная роль мембран в клетках? Прежде всего
мембраны окружают клетки и ограничивают их размеры. При этом
они являются естественными агрегатами амфипатических молекул, т. е.
молекул, один из концов которых является гидрофобным, а другой —
гидрофильным. Способ упаковки таких молекул в бислое обеспечива-
ет создание упорядоченного пограничного слоя между двумя жидкими
фазами. Кроме того, мембраны представляют собой естественное «ме-
стообитание» для значительного числа относительно неполярных соеди-
нений, образующихся в процессе метаболизма. В мембраны включены
многие белки, поверхности которых обладают гидрофобными свойства-
ми. У некоторых белков, например у цитохрома Ь$ (гл. 10, разд. Б. 5),
имеются специальные гидрофобные участки, при помощи которых бел-
ки прикрепляются к поверхности мембраны. Благодаря полужидкому
состоянию внутренней части мембраны в бислой могут входить и из
него могут выходить белки и низкомолекулярные компоненты в ответ
на метаболические процессы, протекающие в близлежащих участках
цитоплазмы.
Было высказано предположение [36], согласно которому стабиль-
ность структуры макромолекул и мембран обеспечивается главным об-
разом гидрофобными взаимодействиями углеводородных фрагментов,
в результате чего молекулы липидов, белков и других соединений мо-
гут образовывать в водной цитоплазме олигомерные агрегаты и мемб-
раны. Вместе с тем наиболее активные катализаторы, т. е. большин-
ство ферментов, растворимы в воде. Таким образом, мембраны пред-
ставляют собой сравнительно стабильные тонкие пленки, примыкаю*
щие к водным участкам клетки, в которых легко протекают химиче-
ские реакции и которые содержат полярные молекулы, растворимые в
воде.
Следует также отметить, что благодаря стабильности мембранной
Поверхности становятся возможными более тесные контакты между
реагирующими веществами и ускоренное протекание последователь-
356 Глава 5
ных биохимических реакций. Именно поэтому на границе между мемб-
раной и цитоплазмой метаболические процессы наиболее активны.
Несмотря на относительную стабильность, мембранные компоненты
химически не инертны. Они сами подвержены метаболическим превра-
щениям под действием окислительных ферментов, локализованных
внутри мембран или на их поверхности. Мембраны содержат также
хиноны и другие низкомолекулярные катализаторы. Окислительные
реакции играют важную роль в модификации гидрофобных компонен-
тов мембран. Например, стерины, простагландины и другие веще-
ства, обладающие регуляторными свойствами, первоначально синте-
зируются в форме гидрофобных цепей, связанных с водорастворимы-
ми переносчиками (гл. 12). В мембранах могут накапливаться гид-
рофобные продукты биосинтеза (так, предшественниками простаглан-
динов служат полиненасыщенные жирные кислоты фосфолипидов).
Однако при взаимодействии с кислородом в молекулах этих соедине-
ний образуются гидроксильные группы, что приводит к постепенному
увеличению их способности растворяться в воде. По мере того как
гидрофильность соединения возрастает благодаря последовательному
гидроксилированию, гидрофобные компоненты мембран неизбежно пе-
реходят в водный раствор и полностью включаются в процесс мета-
болизма. Другим процессом, в котором липиды мембран активно раз-
рушаются, является гидролиз под действием фосфолипаз.
1. Текучесть мембранных компонентов
Изучение фотографических изображений клетки, полученных при
помощи микроскопа в разные моменты времени, позволили увидеть,
что плазматическая мембрана, так же как и митохондрии и другие
органеллы, постоянно находится в движении. Митохондрии скручива-
ются и поворачиваются, а поверхность мембраны постоянно совершает
волнообразные движения. Пузырьки освобождают свое содержимое
в окружающую среду, выводя его из клеток, а перенос веществ внутрь
клетки осуществляется за счет процесса эндоцитоза (гл. 1, разд. Б.4).
При помощи химических методов было показано также, что составля-
ющие мембраны вещества транспортируются из эндоплазматического
ретикулума в пузырьки аппарата Гольджи, в экскреторные гранулы
и в плазматическую мембрану. Важным этапом биосинтетических про-
цессов, протекающих в клетке, является присоединение углеводных
(гликозильных) остатков к молекулам белка с образованием глико-
протеидов и гликолипидов. Ферменты, катализирующие эти реакции, —
гликозилтрансферазы (гл. 12)-—обнаружены в эндоплазматическом
ретикулуме и в пузырьках аппарата Гольджи. Эти ферменты катали-
зируют присоединение углеводных единиц (по одной в каждом акте
реакции) к определенным местам молекул белков, липидов и других
соединений, экскретируемых из клеток. Другие ферменты катализиру-
ют присоединение сульфатных и ацетильных групп к углеводным фраг-
ментам молекул гликопротеидов.
Гликопротеиды и гликолипиды наружной поверхности плазматиче-
ской мембраны также, по-видимому, образуются в эндоплазматическом
ретикулуме и в пузырьках аппарата Гольджи. Эти компоненты мемб-
ран должны транспортироваться из внутренней части клетки в плазма-
тическую мембрану. В процессе транспорта вновь синтезируемые со-
единения подходят к внутренней стороне мембраны, где ферменты,
находящиеся в пузырьках, осуществляют присоединение гликозильных
фрагментов и другие превращения. Если описанная картина верна, то
Мембраны и клеточные оболочки 357
плазматическая мембрана должна достаточно быстро обновляться и
пополняться новыми соединениями. Ясно, что для компенсации этого
процесса должен существовать другой процесс, обеспечивающий уда-
ление определенных компонентов с мембранной поверхности. Вполне
возможно, что звеном, дополняющим «круговорот» мембранных ком-
понентов, является весьма активно протекающий процесс эндоцитоза
клетками жидких и твердых веществ. Было высказано предположе-
ние, что плазматические мембраны эукариот играют роль молекуляр-
ных фильтров по отношению к быстрому и определенным образом на-
правленному потоку липидных молекул [36а]. Как мы увидим даль-
ше, клетки нуждаются в многочисленных лизосомных ферментах. Одна
из функций этих ферментов заключается, по-видимому, в деградации
избытка мембранных компонентов, в том числе сложных полисахари-
дов, попадающих с наружной поверхности мембраны обратно в клетку.
Важное свойство мембран состоит в способности небольших уча-
стков их поверхности сворачиваться и образовывать структуры, близ-
кие по форме к сферическим. Электронно-микроскопическое исследо-
вание водных суспензий фосфолипидов показало, что образуются кон-
центрические многослойные структуры (липосомы). Ультразвук разру-
шает эти структуры на более мелкие пузырьки, окруженные фосфоли-
пидными бислоями, аналогичными бислоям мембран. При определен-
ных условиях маленькие пузырьки сливаются, образуя более крупные.
Клетки тоже иногда сливаются друг с другом, образуя полиядерные
клетки, что может быть связано, в частности, с повышенной текучестью
мембран, а также с изменением ориентации полярных групп фосфоли-
пидов [37]. Это явление имеет важное практическое значение для се-
лекции растений и при изучении хромосом человека (гл. 15).
2. Транспорт молекул через мембраны [38, 39]
Исключительно большое значение имеет способность клеток погло-
щать питательные вещества и выделять различные соединения. Как
уже упоминалось в разд. А.4, небольшие нейтральные молекулы могут
проникать через мембраны просто за счет обычной диффузии. Скорость
диффузии вещества определяется его растворимостью в мембране, ко-
эффициентом диффузии в мембране (гл. 6, разд. А.7) и разностью кон-
центрации вещества снаружи и внутри клетки. Эту разность называют
обычно градиентом концентрации. При транспорте заряженных частиц
существенное влияние на процесс диффузии оказывает также разность
электрических потенциалов, возникающая в результате накопления в
клетке избытка отрицательно заряженных ионов.
Путем обычной диффузии в клетки проникают вода, двуокись угле-
рода, кислород и молекулы анестезирующих веществ. Значительно бо-
лее широко распространен процесс облегченной диффузии [40]. По-
добно обычной диффузии, облегченная диффузия зависит от градиента
концентраций — в ходе этого процесса молекулы всегда перемещаются
из области с более высокой концентрацией в область с более низкой
концентрацией. Для облегченной диффузии характерен эффект насы-
щения, который заключается в том, что по мере увеличения концент-
рации диффундирующего вещества (со стороны большей концентра-
ции) скорость потока вещества через мембрану стремится к некоторо-
му максимуму. Эффект насыщения наблюдается также в фермента-
тивных реакциях (гл. 6, разд. А.2), что указывает на некоторые об-
щие черты в механизмах этих двух процессов. Очевидно, при облегчен-
ной диффузии транспортируемое вещество соединяется с подвижным
358 Глава 5
переносчиком (чаще всего белком). Переносчик далее диффундирует
на короткое расстояние к противоположной стороне мембраны, где
освобождается от связанной с ним молекулы или иона. В случае если
скорости ассоциации и диссоциации вещества с переносчиком превы-
шает скорость диффузии, перенос молекул может быть описан урав-
нением Михаэлиса — Ментен (гл. 6, разд А 5), а «кинетические па-
раметры» процесса диффузии, т. е. величины Vmax (максимальная ско-
рость) и Км (константа Михаэлиса), определяются с помощью урав-
нения (6-15).
Наибольший интерес представляет активный транспорт, при кото-
ром вещество переносится через мембрану против градиента концент-
рации, т. е. из области с более низкой концентрацией в область с бо-
лее высокой концентрацией. Этот процесс сопровождается увеличени-
ем свободной энергии, которое составляет 5,71 lg с21с{ кДж-моль-1
[уравнение (3-25)], где с2 и z?i— соответственно более высокая и бо-
лее низкая концентрации Это обстоятельство делает необходимым со-
пряжение процесса активного транспорта с какой-нибудь самопроиз-
вольно протекающей экзергонической реакцией. Такое сопряжение мо-
жет осуществляться по меньшей мере двумя путями. При первичном
активном транспорте имеет место непосредственное сопряжение с реак-
цией типа гидролиза АТР и «накачиванием» растворенного вещества
через мембрану, тогда как при вторичном активном транспорте исполь-
зуется энергия электрохимического градиента, возникающего для дру-
гого растворенного вещества. Во втором случае одно растворенное ве-
щество «накачивается» против градиента концентраций, а затем вто-
рое переносится через мембрану в результате обмена с первым. Еще
одна разновидность активного транспорта известна под названием
групповая транслокация [41]. В этом процессе транспортируемое ве-
щество сначала подвергается ковалентной модификации, и образую-
щийся при этом продукт проникает в клетку.
Процессы транспорта, будь то облегченный или активный транс-
порт, представляются весьма сложными и протекают с участием не-
скольких мембранных белков. Иногда для описания транспортной си-
стемы используют термин пермеаза. В связи с тем что количества бел-
ков, вовлеченных в транспорт веществ, незначительны, для изучения
транспортных систем были использованы методы генетического ана-
лиза. Можно надеяться, что с помощью этих методов удастся опреде-
лить число генов, детерминирующих белки, которые участвуют в пе-
реносе конкретных соединений через мембраны.
а. Связывающие белки
В последнее время достигнуты значительные успехи в выделении
связывающих белков, которые принято считать компонентами пермеаз-
ных систем. Большая часть этих белков была извлечена с поверхно-
сти бактерий разными методами, и в частности путем резкого изме-
нения осмотического давления среды (осмотический шок) [42—44].
Например, если в течение 10 мин клетки Е. coli, суспендированные в
0,5 М сахарозе, обрабатывать раствором ЭДТА (10-4 М), а затем раз-
бавить холодной водой, то из них извлекаются белки, связывающие
сахара, аминокислоты, ионы металлов и другие вещества. Один из бел-
ков с мол. весом ~ 35 000 специфически связывает галактозу. Локали-
зация связывающих белков в бактериальных клетках точно не уста-
новлена Связывающие белки обычно относят к «периплазматическим»
(разд. Г), однако они могут быть непрочно связаны с плазматической
мембраной.
Мембраны и клеточные оболочки 359
Связывающие белки подошли бы на роль подвижных переносчиков
в процессе облегченной диффузии, однако большая часть выделенных
белков принадлежит, по-видимому, к системам активного транспорта,
и их функция в процессах переноса до сих пор окончательно не уста-
новлена. Согласно одному из предположений, связывающий белок
обладает сильным сродством к транспортируемому веществу (субстра-
ту) и прочно связывается с ним на наружной поверхности клетки. Об-
разовавшийся комплекс белок — субстрат далее диффундирует к внут-
ренней стороне мембраны. Здесь в результате процесса, сопряженного
с самопроизвольно протекающей экзергонической реакцией, например
с гидролизом АТР, конформация белка меняется таким образом, что
его сродство к субстрату уменьшается. В результате транспортируемое
вещество переходит в клетку, а связывающий белок диффундирует об-
ратно к наружной поверхности. Там его конформация возвращается к
исходной, вероятно, под влиянием химических воздействий.
Какие классы молекул и ионов транспортируются через мембраны?
Из окружающей среды в клетку поступают неорганические ионы, при-
чем в результате переноса иногда они сильно концентрируются (гл. 2,
разд. Е.2). Например, корни зеленых растений могут экстрагировать
необходимые вещества из очень разбавленных растворов. Аналогичной
способностью наделены микроорганизмы, например дрожжи и бакте-
рии, у которых обнаружены системы, способные избирательно концент-
рировать многие ионы, в том числе К+, Са2+, сульфаты и фосфаты.
Кожа лягушки в состоянии поглощать ионы Na+ из среды с концент-
рацией NaCl, равной 10-5 М, и переносить их во внутреннюю среду,
где концентрация NaCl превышает 0,1 М. Клетки слизистой оболочки
желудка могут концентрировать ионы водорода в желудочном соке
примерно до 0,16 М.
В клетки животных и бактерий активно транспортируются амино-
кислоты [38, 39]. У Е. colt существуют специфические системы пере-
носа почти для каждой аминокислоты, а для некоторых аминокислот
таких систем даже несколько. Обычно наряду с системой, для которой
характерны высокое сродство к аминокислоте и способность «перека-
чивать» ее из областей с очень низкой концентрацией, существуют па-
раллельно функционирующие системы с рецепторами, не обладающи-
ми столь высоким сродством к субстрату. Системы транспорта амино-
кислот, а также сахаров достаточно хорошо исследованы у бактерий
[38, 45, 46]. В одной из таких систем, детально изученной с помощью
химических и генетических методов, процесс проникновения различ-
ных сахаров (в том числе альдогексоз) внутрь клетки сопряжен с рас-
падом фосфоенолпирувата (табл. 3-5). Судя по всему, сахара при
функционировании этой системы проходят через внутреннюю мембра-
ну в виде фосфатных эфиров (групповая транслокация) [46а, 46b].
В другой системе транспорт аминокислот и лактозы сопряжен с систе-
мой переноса электронов (гл. 10) в связанной с мембраной окисли-
тельно-восстановительной цепи. Считают, что эта система не зависит
от синтеза АТР.
Внутриклеточные органеллы имеют собственные системы, концент-
рирующие ионы. Так, митохондрии могут концентрировать ионы К+,
Са2+, Mg2+ и других двухвалентных металлов, а также и дикарбоновые
кислоты (гл. 10). У митохондрий транспорт многих веществ происходит
•скорее всего за счет обменной диффузии, т. е. путем вторичного актив-
ного транспорта.
360 Глава 5
б. Генетические аспекты транспорта
У микроорганизмов выявлено огромное число мутаций, которые
влияют на их способность изменять поглощение питательных веществ
[38]. Здесь мы ограничимся рассмотрением системы, обеспечивающей
транспорт калия в Е. coli [45, 47]. Один из мутантов Е. coli нормально
живет в 0,1 М растворе К+, но не может существовать при значительно
более низких концентрациях этого иона, хотя большинство других
штаммов легко переносят такие условия. У штамма Е. coli К 12 обна-
ружено по крайней мере 6 генов, необходимых для функционирования
трех разных систем, обеспечивающих поглощение калия. Две такие
системы транспортируют калий внутрь клетки (против градиента кон-
центрации) при сравнительно высоких концентрациях ионов К+ в ок-
ружающей среде. Третья система способна «накачивать» ионы К+ в
клетку из среды с очень низкой концентрацией: значение, характери-
зующее полунасыщение системы (Ам), составляет приблизительно
10-6 М. Интересно отметить, что если бактерия растет в среде с высо-
ким содержанием К+, то система, характеризующаяся высоким срод-
ством к ионам К+, не активна, т. е. соответствующий ген «выключен»
(репрессирован). Однако, если эту бактерию культивировать в среде
с очень низкой концентрацией ионов К+, то происходит экспрессия гена
и транспортная система начинает функционировать.
Большое число нарушений в системах переноса было отмечено не
только у бактерий. У человека описан целый ряд заболеваний, связан-
ных с дефектами мембранного транспорта [48]. При некоторых таких
заболеваниях нарушаются реабсорбция веществ в почечных канальцах
и процесс всасывания в тонком кишечнике. Например, при цистинурии
наблюдается образование камней из цистина в почках и мочевом пу-
зыре. Такие больные выделяют за сутки до 1 г цистина при норме при-
близительно 0,05 г. Известны также случаи выделения больших коли-
честв лизина, аргинина и орнитина. Существование подобных наследст-
венных заболеваний свидетельствует о том, что и у человека клетки,
подобно бактериальным, обладают способностью концентрировать раз-
личные аминокислоты (см. также гл. 14, разд. Б.З) и другие вещест-
ва. В клетках почечных канальцев вещества поглощаются на одной
стороне клетки (на рис. 1-3 это нижняя часть клетки) и выделяются в
кровоток с другой ее стороны. Еще одно хорошо изученное, но очень
редко встречающееся нарушение абсорбционных процессов у человека
приводит к развитию почечной гликозурии. В этот процесс также во-
влечены проксимальные почечные канальцы. Такая аутосомная доми-
нантная мутация может быть неправильно диагностирована как сахар-
ный диабет. В действительности же люди с подобным дефектом чувст-
вуют себя, как правило, хорошо, и это состояние не считают болезнью.
в. Натриевый, калиевый и кальциевый насосы
Почти во всех клетках концентрация натрия сравнительно невелика,
тогда как калия — достаточно высока (табл. 5-2, дополнение 5-3). Со-
гласно одной из гипотез [49], цитоплазма по своим свойствам напо-
минает ионообменные смолы, несущие фиксированные заряды. Ионооб-
менные смолы с большим числом сшивок избирательно связывают оп-
ределенные ионы. Например, смолы, содержащие остатки сульфокис-
лот, связывают калий, а смолы, содержащие остаток фосфиновой кис-
лоты,— натрий. В пользу этой гипотезы свидетельствуют данные ЯМР,
указывающие на изменение времен релаксации протонов внутриклеточ-
Мембраны и клеточные оболочки 36J
Таблица 5-2
Содержание основных ионов (в миллимолях на 1 кг Н2О)
в плазме кровн человека и внутриклеточной жидкости
скелетной мышцы8
Ион Плазма крови Скелетная мышца (внутриклеточная жидкость)
Na+ 150 14
К+ 5 150
Mg2+ 0,9 8
Са2+ 2,5 1
ci- 105 16
нсо; 27 10
Белок- 176 50б
Другие анионыв 6 146
а По данным работ Muntwyler Е., Water and Electrolyte Metabolism
and Acid-Base Balance, p. 14, Mosby, St. Louis, Missouri, 1968; White A.,
Handler P., Smith E. L., Principles of Biochemistry, 5th ed , p. 802, McGraw-
Hill, New York, 1973; Long C., Biochemist’s Handbook, p. 670, Van Nost-
rand, Princeton, New Jersey, 1961. Следует иметь в виду, что данные, при-
водимые для некоторых ионов, могут варьировать в весьма широких
пределах.
6 Миллиэквиваленты на 1 кг Н2О.
° Фосфаты и другие небелковые анионы.
ной воды и ионов 39К+ и 23Na+ внутри клеток [50]. Однако экспери-
ментальные измерения такого рода очень сложны, и доказательства,
полученные с их помощью, оспариваются [51].
В настоящее время более общепринятой является не ионообменная
гипотеза, а гипотеза существования в клетках ионного насоса, выкачи-
вающего из клеток ионы Na+ и накачивающего в них ионы К+. Для
изучения этого процесса были использованы различные методические
подходы. Из гигантского аксона кальмара можно, например, удалять
всю цитоплазму, а оставшуюся клеточную оболочку заполнять различ-
ными ионными растворами. Сходным образом можно заполнить и тени
эритроцитов. Наличие переноса ионов внутрь клеток и из клеток в
окружающую среду наблюдалось как на указанных выше объектах,
так и на различных интактных клетках других типов. Оказалось, что'
перенос ионов блокируется ингибиторами, например цианидом, кото-
рый, как известно, нарушает почти все процессы окислительного мета-
болизма в клетках. Однако блокирование цианидом снимается при до-
бавлении к клеткам АТР или других фосфатных соединений, характе-
ризующихся высоким значением потенциала переноса групп.
Поскольку в клетках эукариот самым активным соединением тако-
го рода является АТР, предполагают, что именно он служит естествен-
ным источником энергии при концентрировании ионов. Однако, как ука-
зано в разд, а, бактерии (и митохондрии) могут использовать энергию
и из других источников.
Поглощение клетками ионов К+ и выделение ионов Na+ специфиче-
ски блокируется некоторыми сердечными гликозидами. Наиболее ча-
сто в этих целях используют уабаин (рис. 12-18). Меченный тритием;
уабаин связывается с наружной поверхностью клеток, и из данных,.
362 Глава 5
характеризующих такое связывание, удается рассчитать число мест
перекачки ионов в расчете на одну клетку [52]. В случае эритроцитов
оно составляет 100—200 на клетку (или приблизительно 1 место на
1 мкм2), тогда как в клетках HeLa (широко используемая в лабора-
ториях всего мира линия раковых клеток человека, растущих в культуре
на протяжении многих лет) число таких мест составляет 105—106
(т. е. ~103 мест на 1 мкм2). В результате дальнейших исследований
было установлено, что при избытке ионов Na+ внутри клетки, а ионов
К+ во внешнем окружении происходит гидролиз АТР. Скорость гидро-
лиза определяется концентрацией ионов обоих щелочных металлов и
числом мест, связывающих уабаин; для этого процесса необходимо
наличие ионов магния.
Рассмотренные выше факты привели к концепции, предполагающей,
что (Na++К+)-зависимая АТРаза и является, по существу, мембран-
ным ионным насосом. Для активации ферментной системы ионы К+ и
Na+ должны находиться по разные стороны от мембраны. Вместе с
тем очищенный фермент должен гидролизовать АТР в пробирке в при-
сутствии Na++K++Mg2+. Этот бе ток удалось выделить в очищенном ви-
де [53—56]. При гель-электрофорезе в присутствии додецилсульфата
натрия очищенная (Na++K+) -зависимая АТРаза разделяется на две
субъединицы. Большая из них представляет собой полипептидную цепь
с мол. весом ~ 95 000—100 000, а меньшая является гликопротеидом с
мол. весом ~ 50 000. Антитела к изолированной большой субъединице
связываются с фрагментами мембран, принадлежащими, по-видимому,
участкам внутренней поверхности плазматической мембраны [57]. Ло-
гично предположить, что гликопротеидная субъединица фермента рас-
положена на наружной поверхности мембраны.
Дополнение 5-В
Ионы щелочных металлов
Несмотря на то что в земной коре натрий и калий при-
сутствуют в примерно одинаковых количествах, все живые
клетки накапливают только ионы калияа~в. Оказывается,
ионы натрия нужны лишь некоторым морским организмам и
многоклеточным животным для регуляции состава жидко-
стей тела. Большинство неморских растений не проявляет
явной потребности в натрии.
Тенденция к накоплению ионов калия интересна в связи
с тем, что в морской воде концентрация Na+ составляет
~0,46 М, тогда как К+—лишь 0,01 М. Другие щелочные ме-
таллы в морской воде содержатся в еще меньших количест-
вах; так, например, концентрация Li+ равна 0,026 мМ,
Rb+ — 0,001 мМ, a Cs+ содержится в следовых количествах.
В грунтовых водах концентрация К+ примерно 0,1 мМ, а
Na+ — 0,65 мМ, причем известно, что растения также от-
дают явное предпочтение калию.
Внутриклеточная концентрация К+ меняется от 200 мМ
у Е. coli и 150 мМ в мышцах млекопитающих до ~30 мМ у
пресноводных беспозвоночных (двустворчатых моллюсков,
гидр) и некоторых простейших. У последних обнаружены са-
Мембраны и клеточные оболочки 363
мне низкие концентрации этого иона. К+ не может быть за-
менен на Na+, однако обычно возможна частичная замена
К+ на Rb+ и в меньшей степени — на Cs+. У некоторых мик-
роорганизмов рубидий может практически полностью заме-
щать калий, и даже крыса может прожить в течение корот-
кого отрезка времени при почти полной замене К+ на Rb.
У бурых водорослей большая часть ионов К+ заменена про-
тонами1’. Потребность человека в калии весьма высока; она
достигает примерно 2 г/сут. Было высказано предположение,
что современное человечество страдает от хронической не-
хватки калия, возникающей в результате приготовления пи-
щи и варки овощейд.
Натрий также необходим высшим животным. На безнат-
риевом рационе крысы погибают. Содержание натрия внут-
ри клеток отличается у разных видов животных, однако
обычно оно в 5—10 раз меньше содержания калия. В крови
отношение обратное: концентрация Na+ в плазме крови че-
ловека 0,15 М, а К+—0,00|5 М. Любопытно, что вкус соли в
пище один из самых необходимыхе.
Причины избирательности клеток в отношении К+ дале-
ко не очевидны; возможно, все дело в различной степени
гидратации ионов К+ и Na+ (гл. 4, разд. В.8.б). Эти ионы
могут иметь первостепенное значение для обеспечения воз-
будимости мембран (разд. Б.З) даже у бактерий. Различ-
ные концентрации двух данных ионов по разные стороны от
мембраны обеспечивают существование легкодоступного ис-
точника энергии для многих связанных с функционировани-
ем мембран процессов.
Ионы К+ необходимы для функционирования многих
внутриклеточных ферментов6’в. К их числу относятся фер-
менты, катализирующие фосфорилирование карбоксильных
групп или енольных анионов, а также реакции элиминиро-
вания с образованием енолов.
3 Kernan К- Р-, Cell К, Butterworth, London, 1965.
6 Suelter С. Н. In: Metal Ions in Biological Systems (Sigel H., ed.), Vol. 3,
pp. 201—251, Dekker, New York, 1974.
8 Suelter С. H., Science, 168, 789—795 (1970).
r Steinbach H. В , Comp. Biochem, 4, pp. 677—720 (1962).
» IFeber C. E„ J. Theor. Biol., 29, 327—328 (1970).
e Kaunitz H., Nature (London), 178, 1141—1144 (1956).
Стехиометрические соотношения в натрий-калиевом насосе весьма
своеобразны. При распаде каждой молекулы АТР из клетки выкачива-
ются 3 иона натрия, а извне в клетку накачиваются 2 иона калия. По-
скольку из клетки выкачивается больше положительно заряженных ио-
нов, чем попадает в нее, внутри клетки создается избыточный отрица-
тельный заряд. Наличие отрицательного заряда внутри клетки было
установлено уже давно путем измерения электрического мембранного
потенциала (разд. Б.З). Поскольку клеточная мегмбрана все же про-
ницаема для ионов К+, возникновение мембранного потенциала приво-
дит к диффузии этих ионов через мембрану внутрь клетки, что обус-
ловливает частичную нейтрализацию отрицательного заряда на мемб-
ране. Когда скорость пассивной диффузии уравновешивает мембран-
364 Глава 5
ный потенциал, образую-
щийся за счет активного
транспорта, устанавливает-
ся стационарное состояние.
Достоверно установле-
но, что транспорт Na+ и
К+ ионным насосом обеспе-
чивается энергией гидроли-
за АТР1. Функция (Na++
+К+)-зависимой АТРазы!
состоит не просто в гидро-
лизе АТР, и в этом смысле-
термин АТРаза употребля-
ется не совсем корректно.
Процесс расщепления АТР'
должен быть сопряжен с
каким-то конкретным меха-
низмом, обеспечивающим
перекачку ионов, который
до сих пор остается невыяс-
ненным. Сугубо гипотетиче-
ская модель такого механиз-
ма приведена на рис. 5-3.
Предполагается, что белки
ионного насоса находятся в
двух конформациях. В од-
ной конформации (А) белрк.
прочно связывает 3 иона
Na+, а в другой (В)—2 иона;
к+. АТР играет роль «мо-
тора», осуществляющего
конформационные измене-
ния белка, и, кроме того,,
может принимать непосред-
ственное участие в форми-
ровании участков связыва-
Внутри
А
Б
В
Г
Д
Е
Ж
3
ния ионов. Изображенный
на рис. 5-3 насос встроен в.
мембрану таким образом,
что большие субъединицы
фермента смотрят внутрь
клетки, а гликопротеидные
субъединицы торчат нару-
жу. В центре (который мо-
жет быть расположен на
поверхности раздела между
двумя субъединицами ди-
(Na++
каиала
и чере-
РИС. 5-3. Чисто гипотетическая модель
+К+)-иасоса. Открывание и закрывание
иа противоположных сторонах мембраны
дующееся изменение эффективности связывания
Na+ и К+ обеспечиваются энергией гидролиза
АТР. А. Конформация А, при которой связывает-
ся Na+. Выступающие группы образуют в цент-
ральной полости связывающие участки размером
0,1 нм Б. Связано три иона Na+. В. Группа Y
фосфорилирована. Возможно, за счет отрицатель-
ного заряда ионы Na+ связываются более проч-
но. Г. Происходит конформационный переход
Фосфорильная группа переходит на другой акцеп-
тор— X. Д. Конформация В, при которой свя-
зывается К+. Образуются К+-связывающие уча-
стки размером 0,13 нм; ионы Na+ диффундируют
наружу. Е. Связаны 2 иона калия Ж. За счет
гидролиза связи между X н фосфорилом проис-
ходит переход в исходную конформацию А.
3. Ионы калия диффундируют внутрь клетки
щихся мышцах на это уходит половина образующегося АТР, а в нервных клетках еще
больше. Таким образом, этот процесс составляет весьма существенную долю в общем,
энергетическом балансе метаболизма (гл. 3, разд. А.5).
1 Перекачивание ионов нат-
рия и калия является одинм нз>
тех клеточных процессов, которые
требуют большого количества
энергии. Считается, что в покоя-
Мембраны и клеточные оболочки
365
мера, как это показано на рис. 4-9) имеется узкая полость, в которую
выступают хелатообразующие группы (например, группа С = О пептид-
ной цепи). Эти группы образуют три связывающих участка для ионов
Na+, диаметр которых составляет 0,095 нм. Самопроизвольное связыва-
ние ионов натрия запускает реакцию фосфорилирования, в результате
которой фосфорильная группа комплекса Mg — АТР2- переносится на
группу Y. Фосдорнлирование в свою очередь инициирует переход белка
в конформационное состояние В, при котором канал становится откры-
тым с наружной стороны и закрытым — с внутренней. Одновременно
уменьшается сродство по отношению к ионам Na+, и эти ионы выходят
наружу.
На следующем этапе связываются 2 иона К+. Для конформации В
характерно высокое сродство к ионам К+- Обратный переход в кон-
-формацию А, сопровождающийся освобождением ионов К+ во внут-
реннее пространство клетки, инициируется гидролитическим отщепле-
нием фосфорильной группы в виде неорганического фосфата (Pi).
Может возникнуть вопрос, каким образом открытие и закры-
тие канала синхронизируется с изменениями числа и специфичности
участков связывания ионов. Напомним, однако, о тех структурных из-
менениях, которые происходят при оксигенации гемоглобина
(рис. 4-19). Хотя поворот субъединиц друг относительно друга вызыва-
ет лишь незначительные изменения в геометрическом расположении
групп, выступающих в центральный канал, это обусловливает весьма
существенные изменения в связывании 2,3-дифосфоглицерата. Анало-
гичным образом в нашем случае благодаря незначительным переме-
щениям могут стать недоступными участки связывания ионов Na+ и
сформироваться новые участки связывания для более крупных ионов
к+; при этом могут использоваться те же самые группы, способные к
образованию хелатных комплексов, что и в случае с Na+.
Вопрос о том, каким образом фосфорилирование вызывает конфор-
мационные изменения, рассмотрен в гл. 7, разд. Е.5. Поскольку пере-
нос фосфорильного остатка между различными боковыми группами
белка вполне возможен, вероятно, именно он обусловливает конфор-
мационный переход А—нВ; это показано на рис. 5-3 (перенос фосфо-
рильной группы с Y на X).
Химическая природа участков связывания ионов Na+ и К+ в ион-
ном насосе неизвестна. Однако некоторые соображения на этот счет
позволяют высказать данные, полученные при изучении антибиотиков
пептидной природы, многие из которых связывают ионы металлов и
катализируют их диффузию через мембраны [58]. Примером соеди-
нения такого рода может служить циклический депсипептид (пептид,
который наряду с амидными содержит также и сложноэфирные свя-
зи) — валиномицин. В состав этого антибиотика входят остатки D- и
L-валина, L-молочной кислоты и D-оксиизовалериановой кислоты.
L-Val
d Vai
и-оксиилозалериановая
кислота
L молочная кислота
Валиномицин
366 Глава 5
Включение такого ионофора в состав искусственной мембраны при ин-
кубации в К+-содержащей среде приводит к резкому увеличению про-
водимости мембраны1. Была тщательно исследована структура вали-
Б
РИС 5-4. Строение свободного валиномицина (Л) и его комплекса с К+ (5). ПреД'-
полагают, что экспонированные атомы кислорода Р, Р', М и М' карбонильных груш»
образуют исходный комплекс с К+ Затем водородные связи 1 и 2 разрываются, что
позволяет кислородным атомам R и R' также принять участие в связывании ионов К+
(в результате образуется 6 координационных связей). «Свертывание» молекулы, вы-
званное связыванием иона К+, сопровождается небольшими конформационными пе-
рестройками. Благодаря этому атомы кислорода Q и Q' завершают образование внут-
римолекулярных водородных связей в К+-содержашем комплексном ионе (Duak et al,
Science, 176, 911, 1972, copyright 1972 by the American Association for the Advancement
of Science.)
номицина [58, 60—63а]. Показано, что при связывании с ионом калия
молекула приобретает более компактную конформацию. Изменение
конформации происходит в результате разрыва двух водородных свя-
1 Следует отметить, что нет никаких доказательств того, что эти антибиотики иг-
рают аналогичную роль в спорулирующих клетках, в которых они синтезируются.
Предполагают, что бацитрацин обладает способностью повышать скорость диффузии,
ионов Мп!+ через мембраны [59].
Мембраны и клеточные оболочки 367"
зей и образования новых водородных связей, что сопровождается
«свертыванием» молекулы вокруг иона калия (рис. 5-4). Перенос ка-
лия при помощи валиномицина происходит пассивно, однако он со-
провождается, как это видно, циклическими переходами между двумя,
конформациями переносчика, когда он проходит через стадии взаимо-
действия с ионом, диффузии через мембрану и освобождения иона с
противоположной стороны мембраны. Скорость такого переноса чрез-
вычайно велика — каждая молекула валиномицина способна перено-
сить через мембрану приблизительно 104 ионов калия в 1 с. Поэтому
даже очень незначительные количества ионофора могут вызвать очень
сильные изменения проницаемости и проводимости мембраны.
Дополнение 5-Г
Антибиотики
Многие организмы продуцируют химические вещества,
токсичные для других организмов. Корни или листья неко-
торых растений секретируют соединения, блокирующие рост
других растений. Нам более знакомы используемые в меди-
цине антибиотики, продуцируемые грибами и бактериями.
О способности одних организмов ингибировать рост других
было хорошо известно уже в прошлом столетии, однако ши-
рокий интерес к этой проблеме возник лишь в 1929 г., когда
Александр Флеминг обнаружил, что Penicillium notatum ин-
гибирует рост стафилококков. Это наблюдение непосредст-
венно привело к выделению пенициллина, который был
впервые использован для лечения больных в 1941 г. Несколь-
кими годами позже Ваксман выделил из почвенных актино-
мицетов (стрептомицетов) актиномицин (дополнение 15-Б)
и стрептомицин (дополнение 12-А); он же предложил для.
этих соединений название антибиотики. Применение стрепто-
мицина оказалось эффективным при лечении туберкулеза.
Это открытие стимулировало поиски других веществ с ана-
логичными свойствами. С тех пор каждый год открывают
примерно 50 новых антибиотиков. Уже налажено производст-
во более 60 антибиотиков.
Известны следующие основные классы антибиотиков:
1) пептиды типа грамицидинов и тироцидинов (их известно
более 200); 2) пенициллин и цефалоспорины (дополнение
7-Г); 3) тетрациклины (рис. 12-10); 4) макролиды, макро-
циклические лактоны, такие, например, как эритромицины
(рис. 12-10); 5) полиеновые антибиотики (рис. 12-10).
Как действуют антибиотики? Некоторые, подобно пени-
циллину, блокируют работу определенных ферментов (допол-
нение 7-Г). Пептидные антибиотики (разд. Б.2.в) часто об-
разуют комплексы с ионами металлов и нарушают, по-види-
мому, регуляцию ионной проницаемости в мембранах бакте-
рий. Полиеновые антибиотики влияют на транспорт прото-
нов и ионов в мембранах грибов. Тетрациклины, так же как
многие другие антибиотики, нарушают непосредственно син-
тез белка (гл. 15, разд. В.2з). Некоторые другие антибио-
368 Глава 5
тики встраиваются в молекулы ДНК (гл. 2, разд. Г.9; до-
полнение 15-Б). Таким образам, единого механизма дейст-
вия для всех антибиотиков нет. Поиск необходимого анти-
биотика состоит в выборе соединения, обладающего высо-
кой токсичностью для носителя инфекции, но малотоксично-
го для клеток человека.
Нуждаемся ли мы в новых антибиотиках? Да. Необходи-
мы более эффективные антибиотики против грамотрицатель-
ных бактерий типа Salmonella, которые вызывают иногда
тяжелые инфекционные заболевания. Современные противо-
грибковые препараты не удовлетворяют нашим требованиям,
очень нужны более эффективные антибиотики против про-
стейших. Поиск антибиотиков среди смешанных популяций
микробов почв, болот и озер, бесспорно, будет продолжать-
ся. Однако, по мнению Перлмана, все более возрастающее
значение для получения новых, более эффективных антибио-
тиков будет приобретать химическая модификация уже из-
вестных антибиотиков. Сейчас полусинтетические пеницил-
лины играют важную роль в медицине, а химическая моди-
фикация антибиотиков типа рифамицина (дополнение 15-А)
привела к появлению нового ряда эффективных лекарствен-
ных препаратов.
а Perlman D. In: Medicinal Chemistry (A. Burger, ed.), 3rd ed., Part I,
pp. 305—370. Wiley, New York, 1970.
Уникальное свойство валиномицина состоит в его способности об-
разовывать с калием значительно более стабильные комплексы, чем с
натрием. Это позволяет считать валиномицин специфическим ионофо-
ром для калия. При добавлении к суспензии митохондрий он включа-
ется в мембраны и специфически ускоряет поглощение ионов калия1.
В отличие от валиномицина выделенный из грибов пептид антаманид
(дополнение 15-В) избирательно связывает не ионы калия, а ионы
натрия, что обусловлено различиями в геометрии связывающих участ-
ков. Строение Па+-антаманидного комплекса показано на рис. 5-5.
Другой ионофор, о котором шла речь в гл. 2, энтеробактин (рис. 2-44),
служит переносчиком железа. Заметим, что и в этом случае связыва-
ние иона металла также сопровождается значительными конформа-
ционными изменениями пептида. Предполагают, что роль ионофоров
могут играть некоторые фосфолипиды [64а].
Ионы кальция также активно выкачиваются из большинства кле-
ток при помощи системы, напоминающей во многих отношениях
(Na++K+) -зависимую АТРазу [65, 66]. Из слизистой кишечника был
выделен белок, связывающий кальций, синтез которого зависит от ви-
тамина D [14, 67] (дополнение 5-Д). Этот белок имеет большой мо-
лекулярный вес и сходен с мышечным кальций-связывающим белком
(гл. 4, разд. В.8.®).
Вполне возможно, что существуют транспортные системы и для
многих других ионов. Единственный ион, который, по-видимому, не
1 При добавлении валиномицина к суспензии клеток Streptococcus faecalis отно-
шение [К+]внутри/[К+]снаружи быстро уменьшается [64]. Считают, что антибиотическая
активность валиномицина объясняется выходом из клеток ионов К+ (или Rb+).
Мембраны и клеточные оболочки 369
переносится активно, — это ион хлора. Мембраны относительно про-
ницаемы для этих ионов (разд. А.6), которые являются основными
анионами плазмы (табл. 5-2).
В большинстве случаев ионы хлора распределяются пассивно в со-
ответствии с уравнением Доннана [68, 69]:
[К+]В[СГ]В = [К+1н[С1-]н. (5-1)
Индексы «в» и «н» означают, что концентрации относятся соответст-
венно к внутренней и наружной сторонам клеточной мембраны. Из
уравнения (5-1) следует, что, поскольку концентрация ионов калия в
80
0>
R<
РИС. 5-5. Предполагаемое строение
комплекса Na+ — антаманид [60].
клетке поддерживается на высоком уровне благодаря работе (Na++
+ К+)-насоса, в присутствии не способных к диффузии анионов кон-
центрация ионов хлора внутри клетки должна быть низкой. В соответ-
ствии с постоянством произведения концентраций ионов с наружной
стороны клетки, где концентрация К+ невелика, концентрация Cl-
должна быть высокой.
3. Проведение нервных импульсов
Способность мембран поддерживать разность концентраций ионов
между цитоплазмой и внеклеточной средой обусловливает их возбуди-
мость, что имеет важное практическое значение. Разделение зарядов
- создает как бы «аккумулятор» легко доступной энергии, которая мо-
жет быть использована для проведения электрических сигналов через
клеточную мембрану. Эта способность клеток проводить сигналы про-
является в наиболее яркой форме в нервных волокнах, однако она
свойственна не только нервным клеткам и обнаруживается даже у
простейших, например у Paramecium [70, 70а], а также, вероятно, у
бактерий.
В настоящее время еще мало известно о химической природе про-
ведения нервных импульсов, однако электрические характеристики
этого процесса детально изучены и описаны. Если ввести в клетку че-
рез мембрану микроэлектрод, то можно измерить разность потенциа-
лов между внешней средой и содержимым клетки. Эта разность по-
тенциалов, получившая название потенциала покоя, достигает в нерв-
ных клетках 90 мВ. Своим происхождением она обязана, по-видимому,
Глава 5
различиям в концентрациях ионов. Исходя из величины ДО для раз-
бавления раствора иона [уравнение (3-25) ] и соотношения между AG
и электродным потенциалом [уравнение (3-63)], можно легко полу-
чить уравнение Нернста:
£ = при 25 °C. (5-2)
nF \сг ) п\Сг)
Согласно этому уравнению, которое применимо к системе, содержа-
щей ионы только одного типа, при 10-кратной разнице концентраций
однозарядного иона (п=1) по разные стороны от мембраны будет воз-
никать потенциал, равный 59 мВ. Поскольку мембраны относительно
мало проницаемы для ионов натрия, принято считать, что мембран-
ный потенциал образуется главным образом за счет разницы концент-
раций ионов калия. Наряду с уравнением (5-2) получено также и бо-
лее полное уравнение, учитывающее как концентрации ионов К+, Na+
и С1~, так и их способность проникать через мембрану [69, 71, 72].
Если на каком-нибудь участке мембраны проницаемость для ионов
натрия увеличивается, то эти ионы устремляются внутрь клетки, ней-
трализуя ее отрицательный заряд. Клеточная мембрана при этом депо-
ляризуется. При деполяризации по поверхности мембраны распростра-
няется затухающий электрический сигнал, аналогично тому как это
имеет место при прохождении тока по коаксиальному кабелю Счита-
ют, что включение нервного импульса часто связано с локальным уве-
личением проницаемости мембраны для ионов натрия. В этом процес-
се могут играть определенную роль также и другие ионы, в частности
Са2+. Пассивное распространение электрических сигналов, обуслов-
ленное локальной деполяризацией мембраны, происходит, однако,
только в случае очень коротких нервных клеток; на длинные расстоя-
ния этим способом сигнал распространяться не может. В большинстве
аксонов нервных клеток используется более эффективный способ про-
ведения импульса, основанный на развитии потенциала действия. По-
тенциал действия — это импульс, проходящий вдоль аксона и специфи-
чески изменяющий за доли секунды (в нервах млекопитающих прибли-
зительно за 0,5 мс) мембранный потенциал (рис. 5-6). Исходный от-
рицательный потенциал ~50—70 мВ быстро падает до нуля, затем
достигает положительного значения 40—50 мВ, после чего снова уста-
навливается потенциал покоя. Поразительная особенность потенциала
действия состоит в том, что он распространяется вдоль аксонов со ско-
ростью 1—100 м/с без снижения интенсивности.
Для изучения химической природы потенциала действия в 50-х го-
дах А. Ходжкин и А. Хаксли разработали метод фиксации потенциала.
С помощью этого остроумного метода можно измерять трансмембран-
ный ток, поддерживая мембранный потенциал на требуемом уровне с
помощью системы, работающей по принципу обратной связи [69, 71,
73]. Использование фиксации потенциала позволило измерять зависи-
мость проводимости мембраны от мембранного потенциала и от вре-
мени. Оказалось, что сразу же после того, как с помощью фиксации
потенциала мембранный потенциал устанавливается на пониженном
уровне, проницаемость мембраны для ионов натрия резко возрастает.
Увеличение проницаемости автоматически приводит к деполяризации
прилежащей области мембраны и соответственно к образованию само-
распространяющейся волны, движущейся вдоль аксона. Химическая
природа процессов, изменяющих проницаемость мембраны, остается
неясной. С помощью фиксации потенциала было установлено, что че-
рез доли миллисекунды проницаемость мембраны возрастает также и
Мембраны и клеточные оболочки 371
для ионов калия. При этом проницаемость для ионов натрия снова
уменьшается, и через некоторое время вновь восстанавливается обыч-
ный мембранный потенциал1. Последовательность событий в этом про-
цессе можно представить следу-
ющим образом сначала открыва-
ются натриевые «каналы» (это
не то же самое, что поры в Na+-
насосе), а затем — калиевые ка-
налы, после чего каналы закры-
ваются в той же последователь-
ности Результаты этих исследо-
ваний позволили Ходжкину и
Хаксли вывести уравнения, по-
зволяющие количественно оцени-
вать потенциалы действия и пред-
сказывать наблюдаемые на опы-
те скорости проведения и ряд
других характеристик нервных
импульсов.
Отличительным свойством
нервных волокон, обладающих
способностью очень быстро про-
водить импульсы, является нали-
чие миелиновой оболочки. Мие-
линовые мембраны надежно изо-
лируют аксон от окружающей
среды на всем протяжении, кро-
ме специальных участков, пере-
хватов Ранвье, которые распола-
гаются по ходу аксона на рас-
стоянии 1—2 мм друг от друга
За счет этого нервный импульс
Б
РИС 5-6 А Потенциал действия, записан-
ный с помощью электрода, введенного в
аксон, который был предварительно осво-
божден от цитоплазмы, а затем заполнен
обретает способность как бы пе-
рескакивать с одного участка на
другой. Такое сальтаторное (ска-
чками) проведение происходит
со значительно большей скоро-
стью (до 100 м/с) по сравнению
со скоростью проведения в не-
раствором сульфата калня (18°C). Б. По-
тенциал действия интактного аксона, запи-
санный с тем же усилением и той же вре-
менной шкалой (18°C). На шкале напря-
жения указана разность потенциалов меж-
ду внутренним электродом и таким же
электродом, погруженным во внешний рас-
твор (без поправки на контактный потен-
циал) (Hodgkin А, Conduction of Ner-
vous Impulses, 1964; с любезного разреше-
ния Charles С. Thomas, Publisher, Spring-
field, Illinois )
миелинизированных аксонах.
Что же известно о каналах,
проводящих ионы Na+ и К+ при
возбуждении нерва? С помощью
тетродотоксина иглобрюхих (рис. 16-7) было убедительно показано,
что для этих двух ионов существуют раздельные каналы. Этот вывод
был сделан на основании того, что токсическое действие тетродотокси-
на сопровождалось блокированием натриевых каналов, тогда как про-
ведение ионов К+ при этом не нарушалось. В то же время калиевые
каналы блокировались при помощи различных четвертичных аммоние-
вых солей. Высокое значение константы связывания тетродотоксина
(приблизительно 3-108 М-1) позволило определить число натриевых
каналов путем титрования. Хотя данные, полученные разными автора-
1 Однако в период абсолютной рефрактерности (длящейся приблизительно 0,5 мс)
проведение нервного импульса невозможно.
372 Глава 5
ми, различались, тем не менее даже максимальные значения свидетель-
ствуют об относительно небольшом числе натриевых каналов — 40—75
на 1 мкм2 поверхности мембраны [74] (для сравнения напомним, что
в мембране на той же площади расположено 2-Ю6 фосфолипидных мо-
лекул). Число каналов, проводящих ионы натрия, по-видимому, в 10 раз
меньше числа «насосных» каналов, т. е. каналов, используемых (Na+ +
+ К+) -зависимой АТРазой [75]. Число калиевых каналов не известно
Поскольку число каналов, проводящих ионы, мало, скорость про-
хождения натрия через открытые каналы должна быть чрезвычайно
высокой; по оценкам, она равна ~ 108 ионов в 1 с. Отсюда следует, что
эти каналы не могут работать с помощью ионофорных переносчиков,
а должны представлять собой просто «поры», открывающиеся и закры-
вающиеся в соответствии с изменениями мембранного потенциала. Бы-
ло высказано предположение, что, прежде чем пройти через каналы,
образованные, судя по всему, встроенными в мембрану белковыми мо-
лекулами, ионы калия и натрия избавляются от сольватной оболочки.
Как открываются «ворота» ионных каналов? Характер роста ско-
рости проводимости при изменении мембранного потенциала явно ука-
зывает на кооперативный характер этого процеоса [74, 76]. Вряд ли
можно что-либо добавить в настоящее время к тому, что сказано в
этом разделе о проведении нервных импульсов. Выяснение химических
основ ионной проводимости в возбудимых мембранах является одной
из самых актуальных задач биохимии.
В. Антигены и рецепторы на поверхности клетки
Внимание многих биохимиков в настоящее время сосредоточено на
вопросе о том, каким образом поверхности клеток взаимодействуют с
другими биологическими объектами. На поверхности мембран, напри-
мер, содержатся группировки, играющие роль антигенов. Антигены —
это специфические химические структуры, которые вызывают образо-
вание антител, способных специфически связываться с ними. На по-
верхности эритроцита уже обнаружено около 250 различных антиген-
ных группировок (детерминант). Эти детерминанты определяют груп-
пу крови, а аналогичные детерминанты, содержащиеся на поверхно-
стях других клеток, определяют, будет ли отторгнута трансплантиро-
ванная ткань. Различные белки из растений и из других источников
действуют как агглютинины, связываясь, подобно антителам, с поверх-
ностными группировками. Вирусы, атакующие клетки, адсорбируются
на специфических поверхностных рецепторах, которые могут быть иден-
тичны определенным антигенным детерминантам. Особенно интересно
выяснить, каким образом одни клетки «решают», что другие клетки
являются «чужеродными». Повышенный интерес к этой проблеме
обусловлен тем, что ее решение может открыть путь к предотвраще-
нию реакций отторжения тканей и к лечению серьезных аутоиммунных
заболеваний (гл. 16, разд. В.7).
Дополнение 5-Д
Кальций
Необходимость ионов кальция для живых существ впер-
вые выявил в прошлом столетии Рингер, который установил,
что для поддержания сокращений перфузируемого сердца
Мембраны и клеточные оболочки 373
лягушки необходимы ионы Са2+ в концентрации ~ 1 мкМ.
Позже была показана важная роль кальция при восстанов-
лении повреждений клеточной мембраны простейших Stentor
и при движении амеб. В отсутствие кальция животные быст-
ро погибают. Исследования на сердце лягушки позволили
установить, что ионы Са2+ участвуют в передаче нервного
импульса с нерва на сердечную мышцу.
Подобно ионам Na+, ионы Са2+ активно выводятся из
клетока'б. Основная масса кальция в организме человека
содержится в костяхв-д. В сыворотке крови человека кон-
центрация ионов Са2+ составляет 2,5 мкМ, из которых при-
близительно 1,5 мкМ находится в свободной форме, а осталь-
ная часть связана с белками, углеводами и другими соеди-
нениями. Внутри клеток концентрация свободного кальция
ниже. Так, например, общая концентрация ионов Са2+ в ци-
топлазме эритроцитов составляет около 3 мкМ, однако на
свободные ионы приходится менее 1 мкМ. Градиент кон-
центрации ионов Са2+ по разные стороны от мембраны (от
102 до 105) поддерживается при помощи кальциевого насоса.
Работе насоса противодействует очень медленная обратная
диффузия ионов внутрь клетки.
Характерная функция ионов Са2+ у живых существ со-
стоит в способности активировать различные метаболические
процессы. Это происходит при резких изменениях проницае-
мости плазматических мембран или мембран эндоплазмати-
ческого ретикулума, в результате которых становится воз-
можной диффузия ионов Са2+ в цитоплазму. Так, например,
при сокращении мышцы в результате освобождения ионов
Са2+ из эндоплазматического ретикулума его концентрация
увеличивается приблизительно от 0,1 до 10 мкМе. Связыва-
ние ионов Са2+ с тропонином С инициирует сокращение
(гл. 4, разд. Е.1)ж. Мембраны эндоплазматического ретику-
лума мышечного волокна содержат большое количество бел-
ка кальциевого насоса, а также ряд белков, связывающих
кальций (гл. 4, разд. В.8.в)3. Один из Са2+-связывающих бел-
ков мышцы кролика, кальсеквестрин (мол. вес 46 500), спо-
собен связывать до 43 молей Са2+ на моль белка11’к.
Другая триггерная функция кальция заключается в осво-
бождении медиаторов из нервных окончаний (в синапсах).
В большинстве случаев инициации импульса в постсинап-
тическом нейроне предшествует повышение концентрации
ионов Са2+ в синапсе (гл. 16, разд. Б.4). Было высказано
предположение, что освобождение ионов Са2+ является од-
ним из двух основных элементов общего механизма, при по-
мощи которого клетки реагируют на внешние раздражители.
Другим элементом является освобождение циклического
АМР (гл. 6, разд. Е.5)е’л’м.
Главная роль в метаболизме кальция в организме чело-
века принадлежит костной ткани. В состав плотного матрик-
са кости наряду с белком коллагеном входит фосфат каль-
ция— кристаллическое минеральное соединение, близкое к
гидроксилапатиту Саю(РО4)6(ОН)2. Часть ионов Са2+ заме-
щена ионами Mg2+, а очень незначительная часть ионов ОН~
замещена ионами фтора, которые повышают прочность ко-
сти. Внутри основного материала кости находятся остеоци-
374 Глава 5
ты, к которым относятся, в частности, остеобласты, секрети-
рующие вещество, из которого затем строятся волокнистые
структуры, и способствующие отложению фосфата кальция.
Минеральные компоненты костной ткани находятся практи-
чески в состоянии химического равновесия с ионами кальция
и фосфата сыворотки крови. Клетки костной ткани могут
легко ускорять либо отложение, либо растворение минераль-
ных компонентов при локальных изменениях pH, концентра-
ции ионов Са2+ или HPOf* и хелатообразующих соединений.
Крупные многоядерные клетки — остеокласты — реабсорби-
руют кальций.
Са
Вид с торца кристалла гидроксилапатита.
Покрытые пунктиром атомы Са,Р и О расположены
за плоскостью рисунка. ОН-группы образуют систему
водородных связей, расположенную в центре3.
О
Гомеостаз ионов кальция регулируется сложным путем.
Ключевые роли в этом процессе играют паратиреоидный гор-
мон (ПТГ) и тиреоидный гормон кальцитонин. При умень-
шении концентрации ионов Са2+ возрастает секреция ПТГ —
пептидного гормона, содержащего 83 аминокислотных остат-
ка. Непосредственно под влиянием этого гормона остеокла-
сты увеличивают растворение содержащихся в костях мине-
ральных соединений. ПТГ увеличивает также реабсорбцию
ионов Са2+ в почечных канальцах. Суммарный эффект про-
является в повышении уровня кальция в сыворотке крови.
В свою очередь при увеличении содержания ионов Са2+ сек-
ретируется гормон кальцитоцин, действие которого состоит
в снижении концентрации ионов Са2+засчет ускорения отло-
жения кальция в результате деятельности остеобластов. Та-
ким образом, эти два гормона действуют по системе «пуш-
пул (push-pull) с обратной связью» (гл. 6, разд. Е.4). В про-
цессе регуляции концентрации ионов кальция принимает
участие также витамин D (дополнение 12-Г), который, судя
по всему, требуется для синтеза Са2+-связывающих белков,
необходимых для всасывания ионов Са2+ в кишечнике, реаб-
сорбции его в почках и растворения костной ткани. Своевре-
менное поступление нужных количеств витамина D является
Мембраны и клеточные оболочки 375
необходимым условием для нормального течения процессов
кальцификации.
Кроме специфических Са2+-связывающих белков, ион
Са2+ связывают также и другие белки. К их числу относятся
а-амилазы (гл. 7, разд. В.6), термолизин (гл. 7, разд. Г.4),
стафилококковая нуклеаза (гл. 7, разд. Д.5), конканавалинА
(рис. 5-7) и некоторые белки системы свертывания крови
(рис. 6-16). Последние представляют особый интерес, по-
скольку они содержат специфические Са2+-связывающие уча-
стки, образование которых зависит от витамина К (допол-
нение 10-Г). Ионы кальция связываются также с различны-
ми углеводами, например с карагениновыми гелями (гл. 2,
разд. В.5).
Концентрация свободных ионов кальция в тканях чрез-
вычайно низка, и до последнего времени не существовало на-
дежного метода для ее количественной оценки. Сейчас в этих
целях используют метод, основанный на измерении интенсив-
ности кальций-зависимой флуоресценции белка экворина
(гл. 13, разд. 3).
а Bianchi С. Р., Cell Са2+, Appleton, New York, 1968.
6 Cuthbert A. W., Calcium and Cellular Function, St. Martins, New York,
1970.
B Zipkin I., ed, Biological Mineralization, Wiley, New York, 1973.
r Bourne G. H. ed., The Biochemistry and Physiology of Bone, 2nd ed.,
Vol. 1, Academic Press, New York, 1972
« Teo T. S„ Wang J. H., JBC, 248, 5950—5955 (1973).
e Mani R. S., McCubbin W. D., Kay С. M, Biochemistry, 13, 5003—5007
(1974).
ж Rubin R. P., Calcium and the Secretory Process, Plenum, New York,
1974.
3 Siegel F. L., Struct. Bonding (Berlin), 17, 221—268 (1973).
" Ostwald T. J., MacLennan D. H., JBC, 249, 974—979 (1974).
K Ostwald T. J., MacLennan D. H., Dorrington К. J., JBC, 249. 5867—5871
(1974).
л Rasmussen H., Science, 170, 404—412 (1970).
M McMahon D., Science, 185, 1012—1021 (1974).
H Dorrington K. J., Hui A., Hofmann T., Hitchman A. J. W., Harrison J. E.,
JBC, 249, 199—204 (1974).
1. Антигены групп крови
Поразительная генетическая изменчивость поверхности эритроцитов
отчетливо видна на примере групп крови человека [77]. Особенно ясно
это проявляется в системе АВО, впервые описанной Ландштейнером в
1900 г. Согласно этой системе, люди делятся на четыре группы: А, В,
АВ и О. При смешении крови людей одной и той же группы клетки не
слипаются, однако в сыворотке людей группы О содержатся антитела,
способные агглютинировать эритроциты людей, принадлежащих к груп-
пам А и В1. Сыворотка крови группы В вызывает слипание эритроци-
тов группы А, и наоборот. Это явление обусловлено присутствием на
клеточной поверхности специфических антигенов, состоящих из сильно
разветвленных олигосахаридов, содержащих L-фукозу. Такие антигены
1 Широко распространенное, но неправильное отнесение людей группы О к «уни-
версальным донорам» основано на том, что сыворотки людей, принадлежащих к груп-
пам А, В и АВ, не содержат антител к эритроцитам группы О.
376 Глава 5
обнаруживаются не только у поверхностных белков эритроцитов (т. е.
в составе гликофорина), но также у белков и липопротеидов других
клеток. В большом количестве они содержатся, в частности, в глико-
протеидах слюны.
Многие сложные вопросы в этой области все еще остаются нере-
шенными, однако в результате проведенных исследований удалось уста-
новить как структуру антигенных детерминант, так и генетическую
основу групп крови системы АВО. Молекулы антигенных детерминант
имеют невосстанавливающие концы двух типов (1 и 2), которые отли-
чаются друг от друга характером связи с последующим остатком саха-
ра: эти связи могут быть либо 1—>-3, либо 1—>-4 (см. приведенную ни-
же схему). У людей с группой крови А цепи обоих типов оканчиваются
остатками а,Ы-ацетилгалактозам!ина, а у людей группы В — остатками
галактозы. Для людей группы О характерен антиген Н, у которого от-
сутствует этот концевой остаток моносахарида, и его цепи, следова-
тельно, на один остаток короче, чем цепи в антигенах, принадлежащих
группам А и В. Люди с группами крови АВ гетерозиготны и содержат
антигены, свойственные как группе А, так и группе В.
У людей с группой крови В концевым остатком являет-
ся aGal, а у людей с группой О он отсутствует
Это связь 1—>-3 для це-
пей типа 1 н 1—>-4—
для цепей типа 2
aGalNAc-(l ---> 3)-₽Gal-(l —> 3,4)-PGlcNAc—
Антиген
группы
крови А
,,2
1
a-L-фукоза
t
У людей с группой кро-
ви Lea этой фукозы нет.
У людей с группой кро-
ви I фукозных остатков
нет совсем.
У людей с группами кро-
ви Leb и Lea в этом ме
сте связью а-1,4 присо-
единен остаток фукозы
Генетическая основа системы АВО довольно проста. Синтез гликозил-
трансферазы кодируется тремя аллелями (разными формами одного и
того же гена). У людей группы А этот фермент переносит на концевой
участок антигена группы крови N-ацетилгалактозамин; фермент, спе-
цифичный для В-аллеля, переносит остаток галактозы. Структурные
различия этих двух ферментов, обусловливающие специфичность к суб-
стратам, могут быть весьма незначительными. Ген О, по-видимому, ко-
дирует синтез неактивного фермента. Ген Н отвечает за синтез фуко-
зилтрансферазы, которая достраивает антиген, присоединяя a-L-фуко-
зу к галактозе в предшествующей структуре. Люди с неактивным ге-
ном Н либо имеют редкую группу крови I, либо содержат другой ак-
тивный ген Le, кодирующий трансферазу, которая обеспечивает при-
соединение фукозы связью а-1,4 к N-ацетилглюкозамину. Такие люди
имеют группу крови Lea, тогда как люди с двумя активными генами
Н и Le имеют группу крови Leb.
У людей с активным геном Se (от англ, secretion — секреция) гли-
копротеиды, несущие антигены групп крови, секретируются в слюну и
другие жидкости. Растворимые антигены групп крови удалось выде-
лить в больших количествах из кист яичников, что позволило опреде-
лить их структуру. Предполагаемая полная структура антигена Leb,
Мембраны и клеточные оболочки 377
полученного
[78, 79]:
Цепь типа 2
из такого гликопротеида, выглядит
следующим образом
a-L-Fuc a-L-Fuc
PGal-(l->4)-₽GlcNAc
1
PGal-(l-*3)-pGlcNAc-(1^4)-₽Gal-(l->3)-GlcNAc-PGaI-(l->3)-GalNAc-Ser или Thr
АЗ Аб
Цепь типа 1
1
₽Gal-(l-*3)-pGlcNAc
12 14
1 1
a-L-Fuc a-L-Fuc
i
pGlcNAc
13
i
pGal
Сходные антигены, выделенные из слизистого секрета желудка свиньи,
содержат сульфогруппы, связанные с углеводными остатками [30].
Считают, что антигены А и В, ответственные за агглютинацию зре-
лых эритроцитов под действием специфических антител, связаны глав-
ным образом с гликопротеидами [81, 82], однако известны также ан-
тигены, связанные с гликосфинголипидами (табл. 2-8) наружной кле-
точной мембраны [83—85]. При болезни Фабри (гл. 12, разд. Г.1)
[84] в числе прочих продуктов в избытке накапливается гликолипид,
проявляющий свойства антигена В.
aGal-(l ->3)-pGal-(l -3,4)-pGlcNAc-(l—3)-[Юа1-(1->4)-С1с-церамид
+2
I
Fuc
Гликолипид, проявляющий свойства антигена В
Другие группы эритроцитарных антигенов определяют специфич-
ность типа MN. В этом случае антигены также представлены, по-види-
мому, олигосахаридами, связанными с остатками серина, треонина и
аспарагина молекул гликофорина (рис. 5-2). Два идентифицированных
антигена имеют следующее строение [86]:
aNeurNAc-(2^6)-₽Gal-(I^3,4)-GlcNAc
Gal-pGlcNAc-(pMan)3-GlcNAc-Asn
aFuc-(l -*2,6)-aGal—pGlcNAc
И
aNeurNAc-(2-*-3)-[5Gal-(l -*3)-GalNAc-Ser (Thr)
16
2
aNeurNAc
Следует отметить, что цепи оканчиваются N-ацетилнейраминовой
кислотой (рис. 2-14). Это отрицательно заряженное соединение, произ-
водное сахара, является важным компонентом полисахаридов, располо-
378 Глава 5
женных на поверхности клеточных мембран. Вместе с N-гликолилнейра-
миновой кислотой и метилированными производными нейраминовой
кислоты оно относится к группе сиаловых кислот.
2. Антигены гистосовместимости
Между мышами одной и той же генетически чистой линии может
быть успешно проведена пересадка ткани (например, кусочков кожи).
Пересаживаемые при этом кусочки ткани, называемые изотранспланта-
тами, не отторгаются, тогда как трансплантаты, обмениваемые между
представителями разных линий (аллотрансплантаты), приблизительно
через 2 нед после пересадки отторгаются. Опухоли, пересаженные от
животных одной линии животным другой линии, также разрушаются.
Совместимость тканей у мышей определяется группой генов, называе-
мой главным комплексом тканевой совместимости (комплексом МНС
или Н-2) [87]. Однако отторжение пересаженной ткани, хотя и мед-
ленное, может вызываться также различиями других генов. Посколь-
ку существует много различных генов МНС, успешная трансплантация
возможна лишь в пределах генетически чистых линий. Выяснение при-
роды МНС-системы у мышей позволило перейти к изучению соответст-
вующего генного комплекса у людей, обозначаемого HLA. Подобно
мышиному, он содержит много генов, причем каждый из них может
иметь много аллелей. Поэтому вероятность того, что у двух людей ге-
ны тканевой совместимости будут одинаковы, крайне мала.
Отторжение ткани—иммунологическая реакция, протекающая с
участием лимфоцитов (гл. 2, разд. Д.2). Существуют лимфоциты двух
типов: В- и Т-клетки. Эмбриональные клетки костного мозга мигриру-
ют для размножения в разные части лимфоидной системы. Клетки, по-
павшие в вилочковую железу (тимус), размножаясь, образуют Т-клет-
ки, а клетки, размножающиеся в некоторых других местах, — В-клетки.
Т-клетки одного класса (Т-киллеры) ответственны за отторжение тка-
ни, однако механизм этого процесса еще не выяснен.
Какова природа поверхностных антигенов, ответственных за оттор-
жение клеток Т-лимфоцитами? Очевидно, они представляют собой гли-
копротеиды [30, 88—89а], причем с Т-клетками взаимодействуют ско-
рее всего белковые, а не углеводные участки антигена. Антигены HLA
содержат две тяжелые полипептидные цепи с мол. весом ~ 46 000 и
две легкие — с мол. весом 12 000 [89Ь]. Легкие цепи идентичны р2-мик-
роглобулину — белку, встречающемуся обычно в небольших количест-
вах в сыворотке крови и в моче. Последовательность аминокислот в
Рг-микроглобулине очень близка к последовательности константных
участков иммуноглобулина G (дополнение 5-Е), в связи с чем напра-
шивается предположение о структурном сходстве антигенов тканевой
совместимости и антител. Однако изучение аминокислотных последо-
вательностей антигенов Н-2 мыши и HLA человека только начинается
[89с—d], и делать выводы об их строении еще рано.
3. Белковые агглютинины (лектины) [90, 91]
Объектами интенсивных исследований в последние годы явились
некоторые белки растительного происхождения, обладающие уникаль-
ной способностью вызывать агглютинацию эритроцитов. Эти белки —
лектины — привлекли внимание не только потому, что они являются
специфическими белковыми реагентами на сахара и с успехом исполь-
зуются при изучении поверхности клеток, но также и потому, что неко-
Мембраны и клеточные оболочки 379
торые из них, в частности конканавалин А (на долю которого прихо-
дится до 2—3% белка в семенах канавалии мечевидной), вызывают
преимущественно агглютинацию раковых клеток. Конканавалин А и
некоторые другие лектины обладают митогенной активностью, т. е.
стимулируют процесс митотического деления и размножения покоя-
щихся лимфоцитов. Связывающие участки лектинов специфичны к оп-
ределенным сахарам. Так, конканавалин А связывается с остатками
a-D-маннопиранозы и a-D-глюкопиранозы, содержащими немодифици-
рованные гидроксильные группы в положениях С-3, С-4 и С-6 [92].
В этом белке есть также специфические участки связывания для ио-
нов Са2+ и переходных металлов, например Мп2+. Лектин из бобов
сои связывается с остатками D-N-ацетилгалактозамина и D-галактозы,
а лектин из семян пшеницы специфичен к D-N-ацетилглюкозамину.
Полная структура конканавалина А была установлена методом
рентгеноструктурного анализа [93, 94] (рис. 5-7). Этот белок пред-
ставляет собой тетрамер, состоящий из субъединиц с мол. весом 27 500.
При pH^5,8 он диссоциирует на димеры. Строение конканавалина А
не совсем обычно, поскольку он не содержит a-спиральных участков.
Каждый мономер состоит из 237 остатков, 57% которых образуют
трехслойную p-структуру (рис. 5-7, В). Белок не связывает углеводы
до тех пор, пока не будут заняты два участка, связывающие металл.
Возможно, что для образования участка, связывающего углевод, необ-
ходимо конформационное изменение белка, которое происходит толь-
ко в процессе его связывания с ионами.
Какую роль играют лектины в растениях и в других организмах,
в которых они образуются? Служат ли они в растениях аналогами ан-
А
РИС 5-7. Строение конканавалина А — лектина нз канавални мечевидной А. Схе-
матическое изображение тетрамерной структуры белка [93]. Отмечены места связы-
вания ионов Са2+ и Мп!т, а также углевода (У). (Edelman G., Becker I., Reeke G.,
Jr., Cunningham В., личное сообщение.)
380 Глава 5
В
РИС. 5-7. Б. Стереограмма положений а-углеродных атомов 237 аминокислотных
остатков одной субъединицы белка [94а]. Обозначения СА н MN соответствуют по-
ложениям участков, связывающих металлы. Участок, связывающий углевод, обозна-
чен СНО, неполярный связывающий участок — NP, a N- и С-концы полипептидной
цепи — N и С. В. Стереограмма участков связывания ионов Са2+ и Мп2+. Оба нона
образуют, по-видимому, по 6 координационных связей. Обратите внимание, что ато-
мы кислорода карбоксильных групп 10-го и 19-го остатков являются лигандами для
обоих ионов. В число других лигандов входят карбонильная группа пептидной связи
и имидазольная боковая цепь. Атом N-3 последней участвует в координационном
связывании с Мп2+ и образует, по-вндмому, водородную связь с пептидной карбо-
аильной группой. Маленькими кружками, связанными с Мп2+ и Са2+, обозначены
молекулы воды; буквами СНО обозначено место присоединения углевода. (С любез-
ного разрешения К. Hardman.)
Мембраны и клеточные оболочки 381
тител, обеспечивающими защиту от бактерий и грибов? Можно ли,
учитывая их способность ускорять митоз, приписывать им определен-
ную роль в регулировании клеточного деления и прорастания семян?
В настоящее время мы еще не в состоянии ответить на эти вопросы.
Образование лектиноподобных белков миксомицетами [95] и белков с
агглютинирующими свойствами фибробластами эмбриона цыпленка
[96] указывает на то, что лектины могут представлять собой компонен-
ты систем, ответственных за узнавание клеток; не исключено, что они
соединяют клеточные поверхности друг с другом, связывая полисаха-
ридные группы двух соседних клеток.
Дополнение 5-Е
Антитела
К числу наиболее интересных растворимых сывороточных
белков относятся иммуноглобулины (у-глобулины), которые
выполняют функцию антител, защищающих организм от
опасностей вторжения чужеродных вещества> б. Различия в
молекулярных весах и химических свойствах позволяют раз-
делить иммуноглобулины на пять классов. Первые три из
них — IgG, IgM и IgA—в количественном отношении наибо-
лее существенны, однако важное значение имеют и осталь-
ные два — IgD и IgE. Например, у лиц, склонных к аллер-
гическим реакциям, отмечено повышенное содержание IgE.
Основу строения всех иммуноглобулинов составляет ква-
зисимметричный димер, состоящий из двух легких и двух
тяжелых цепей, длина которых у иммуноглобулинов разных
классов различна. В антителах человека обнаруживают два
класса легких цепей х и Л. Тяжелые цепи обозначают грече-
скими буквами у, ц, а, 6 и е (см. прилагаемую таблицу). Им-
муноглобулины IgM и IgA содержат дополнительную .1-цепьв.
Обозначение Мол. вес Формула
IgG 150 000 х2у2 или Х2у2
IgM 950 000 (и2ц2)3 или (Х2Ц2)£
IgA 300 000 или больше (и2а2)„ или (A.2oc2)j
IgD 160 000 х262 или Х262
IgE 190 000 х2е2 или Х2е2
Обработка антител меркаптоэтанолом приводит к разры-
ву дисульфидных связей, при помощи которых цепи связа-
ны друг с другом, и позволяет получить препараты мономер-
ных легких и тяжелых цепей. При ферментативном гидроли-
зе пептидных цепей иммуноглобулинов появляются чрезвы-
чайно гетерогенные пептидные фрагменты. Этот результат
не был неожиданным, поскольку уже давно известно, что в
организме содержатся буквально тысячи различных антител,
каждое из которых имеет специфический участок связывания
для различных антигенных детерминант. Если раньше было
неясно, как формируются различные участки связывания, то
382 Глава 5
обнаружение гетерогенности аминокислотных последователь-
ностей позволило сделать предположение, что для каждого
антитела характерна своя аминокислотная последователь-
ность.
Значительным успехам в понимании детального строения
антител способствовал тот факт, что у больных с опухоля-
ми лимфатической системы (например, при опухоли костно-
го мозга — множественной миеломе) была обнаружена сек-
реция огромных количеств гомогенных иммуноглобулинов
или их фрагментов. В скором времени подобные опухоли бы-
ли найдены у мышей, которые стали источником экспери-
ментального материала. Оказалось, что белки Бенс-Джонса,
секретируемые в мочу у больных миеломой, представляют
собой легкие цепи иммуноглобулинов. Определение амино-
кислотной последовательности показало, что у каждого боль-
ного белок Бенс-Джонса гомогенен, однако не было обна-
ружено даже двух больных, секретирующих один и тот же
белок. Позже были получены также интактные гомогенные
миеломные глобулины и макроглобулины (IgM).
Первое сообщение о расшифровке полной аминокислот-
ной последовательности IgG появилось в 1969 г.г Оказа-
лось, что обе тяжелые цепи белка содержат по 446 амино-
кислот, а обе легкие — по 214. Таким образом, всего в мо-
лекуле IgG содержится 1320 аминокислот. Исследование им-
муноглобулина IgM показало, что более длинные тяжелые
цепи этого белка содержат по 576 аминокислот^ У всех им-
муноглобулинов тяжелые и легкие цепи связаны между со-
бой дисульфидными связями. Наличие дисульфидных связей
внутри цепей заставляет их складываться в петли. Для
IgM характерна полимеризация, обусловленная наличием
дополнительных дисульфидных связей между молекулами
этого белка и приводящая к образованию пентамеров, ко-
торые можно легко увидеть при помощи электронного микро-
скопа.
К тяжелым цепям присоединены олигосахаридные фраг-
менты. Как видно из приведенного рисунка, у IgM их пять.
S—S
Сх
S
взывающие
участки <
антитела
L S —S
rS—S
S—S-
S,
С
К следующей х2р2-суёъеЪинице
Олигосахаридные
группы
S
S—S-1 S , s-s
S—S-j s |~S—s
S
s— S-
Шарнирная
область
К следующей
субъединице
о 100 200 300 400 500 600 Остатки
L - . .1___I____I____1-----1---L , I 1 I
Симметричная структура 1/5 части IgM
Мембраны и клеточные оболочки 383
Они состоят из остатков маннозы и N-ацетилглюкозамина,
связанных с аспарагином. В состав других иммуноглобули-
нов (IgA, IgE и IgG) входят также остатки фукозы, галак-
тозы и N-ацетилнейраминовой кислоты6.
Обработка интактной молекулы IgG ферментом папаи-
ном приводит к расщеплению обеих тяжелых цепей в участ-
ке, расположенном рядом с внутрицепочечным дисульфид-
ным, мостиком, в так называемой шарнирной области. При
этом молекула распадается на три части — на два фраг-
мента, несущих участки, связывающие антитела (Fab-фраг-
менты), каждый из которых содержит N-концевой участок
тяжелой цепи и связанную с ним легкую цепь, и один Fc-
фрагмент. Двухвалентность антитела, т. е. способность свя-
зываться с двумя антигенами, была известна еще до того,
как установили, что его можно разделить на два Fab-фраг-
мента.
Данные о форме и строении молекул IgG были подтверж-
дены результатами электронно-микроскопического и рентге-
ноструктурного анализа®.
Определение аминокислотной последовательности имму-
ноглобулинов привело к неожиданным результатам. Одни
участки молекул разных антител имеют сильно различаю-
щиеся последовательности (вариабельные участки), тогда
как последовательность других участков у них почти не ме-
няется (константные участки). Молекулу антитела можно в
соответствии с этими данными разделить на участки, или до-
мены. Вариабельные участки, у N-концов легких и тяжелых
цепей, принято обозначать соответственно Vl и Vh, а кон-
стантные участки — Cl и Сн- При исследовании Сн-участков
было обнаружено, что приблизительно через ПО остатков
большая часть аминокислотной последовательности повторя-
ется. Константный участок тяжелой цепи молекулы IgG со-
стоит из трех таких доменов (Сн1, Сн2 и СнЗ), аминокислот-
ная последовательность которых весьма сходна. В молекуле
IgM имеется еще и четвертый Сн-домен. Эти данные позво-
ляют предполагать, что в процессе эволюционного развития
иммуноглобулинов происходила последовательная дуплика-
ция короткого гена, кодирующего синтез последовательности
приблизительно из НО аминокислот.
В пределах вариабельных участков цепей иммуноглобули-
нов находятся так называемые гипервариабельные участки.
Считают, что именно они формируют участки связывания ан-
тигенов, расположенные на концах Fab-фрагментов и обра-
зованные как легкими, так и тяжелыми цепями.
Результаты кристаллографических исследований свиде-
тельствуют о близком сходстве складчатых структур, фор-
мируемых во всех доменах. Семь вытянутых участков цепи
образуют два складчатых слоя с преимущественно антипа-
раллельным расположением цепей; в промежутках между
слоями упакованы гидрофобные боковые цепи. Общие раз-
меры структурной единицы — 4,0X2,5X2,5 нм. В центре
каждого домена имеется S—S-мостик, связывающий два
слоя друг с другом.
Структура вариабельных доменов несколько сложнее.
Различные домены связаны между собой участками вытяну-
384 Глава 5
тых пептидных цепей, которые иногда называют участками
включения (switch region)3-0.
В последнее время появилась возможность точно устано-
вить, каким образом Fab-фрагменты связывают специфиче-
ские гаптены. Гаптены — это небольшие молекулы, которые
могут связываться с антителами наподобие антигенных де-
терминант, но сами не способны вызывать образования ан-
тител при введении в организм животного. Было показано,
что в связывании гаптена фосфорилхолина с одним Fab-
фрагментом3 и витамина К — с другим11 принимают участие
гипервариабельные участки как тяжелых, так и легких це-
пей.
131 1
Складчатое строение одной цепи в константном и вариабельном доменах
белка Бенс-Джонса ”.
Как функционируют иммуноглобулины? Одна из реакций,
агглютинация, происходит в результате взаимодействия по-
ливалентного антитела с двумя клетками. Чаще, однако,
взаимодействие антитела с антигеном вызывает другие эф-
фекты. Один из таких эффектов — связывание белка Clq,
входящего в состав комплемента (дополнение 5-Ж). Было
установлено, что с белком Clq связывается Сн2-домен Fc-
Мембраны и клеточные оболочки S85
фрагмента IgGn. Связывание происходит лишь после того,
как соответствующий антиген (но не гаптен) свяжется с им-
муноглобулином. Кроме того, для активации системы комп-
лемента необходимо наличие агрегата, состоящего из двух
или из большего числа молекул IgG (или одной молекулы
пентамерного IgM). Было высказано предположение, что в
процессе связывания с антигеном молекула иммуноглобули-
на претерпевает конформационное изменение, в результате
которого формируется участок связывания Clq. Странно, од-
нако, что связывание комплемента с антителом могут вы-
зывать только поливалентные антигены (т. е. антигены, спо-
собные связываться более чем с одним антителом), тогда
как гаптены не способны индуцировать связывание с комп-
лементом и даже не вызывают заметных конформационных
изменений в Fab. Таким образом, ряд важных аспектов
функционирования антител остается еще не выясненным.
а Edelman G. М., Science, 180, 830—840 (1973).
6 Porter R. R„ Science, 180, 713—716 (1973).
• Hauptman S. P„ Tomasi T. B., JBC, 250, 3891—3896 (1975).
r Edelman G. E., Cunningham B. A., Gall W. E„ Gottlieb P. D., Rutishau-
ser U., Waxdal M. J., PNAS, 63, 78—85 (1969).
д Putnam F. W., Florent G., Paul Q., Shinoda T., Shimizu A., Science, 182,
287—291 (1973).
e Baenziger J., Rornfeld S., Kochwa S., JBC, 249, 1889—1896 (1974).
ж Sarma V. R., Silverton E. W., Davies D. R, Terry W. D., JBC, 246,
3753—3759 (1971).
s Segal D. M., Padlan E. A, Cohen G. H., Rudikoff S., Potter M., Da-
vies D. R„ PNAS, 71, 4298—4302 (1974).
" Amzel L. M., Poljak R. J., Saul F., Varga J. M., Richards F. F., PNAS,
71, 1427—1430 (1974).
K Schiffer M., Girling R. L, Ely K. R, Edmundson A. B., Biochemistry,
12, 4620—4631 (1973).
л Epp O., Colman P., Fehlhammer H., Bode Schiffer M., Huber R.,
Palm W., EJB, 45, 513—524 (1974).
и Blake С. C. F„ Nature (London), 253, 158 (1975).
" Nisonoff A., Hopper J. E., Spring S. B., The Antibody Molecule, Academic
Press, New York, 1975.
° Davies D. R., Padlan E. A., Segal D. M., Annu. Rev. Biochem., 44, 639—
667 (1975).
" Low T. L. K„ Liu Y.-S. V., Putnam F. W., Science, 191, 390—392 (1976).
4. Связывание антител с клеточными поверхностями
Широко известно, что иммуноглобулины (дополнение 5-Е) представ-
ляют собой циркулирующие в крови антитела, способные к агглюти-
нации чужеродных клеток и «фиксации» комплемента (дополнение
5-Ж). Другая менее известная функция антител состоит в «запуске»
активного функционирования специализированных клеток. На поверх-
ности многих клеток имеются рецепторы (Fc-рецепторы), связывающие
С-концевые фрагменты молекул иммуноглобулинов. Большая часть мо-
лекул IgE, например, связана в крови с базофилами (гл. 1, разд. Д.2.6),
а в тканях — с тучными клетками. Взаимодействие антигена (аллерге-
на) с такими связанными молекулами IgE стимулирует освобождение
гранул, содержащих гистамин, и может служить причиной аллергиче-
ских реакций.
ЗЬ<у Глава 5
Иммуноглобулины находятся также на поверхности В-лимфоцитов.
Связывание специфических антигенов с этими поверхностными антите-
лами заставляет В-клетки размножаться и продуцировать значитель-
ные количества антител в ответ на инфекцию. Для образования моле-
кул IgG необходимы также Т-клетки (существует несколько их типов);
в отсутствие последних образуются только молекулы IgM. Считают,
что некоторые Т-клетки также распознают антигены, после чего они
стимулируют деление В-клеток. Перед тем как лимфоциты начинают
делиться, на их поверхности происходят интересные процессы. Если
пометить лимфоцит флуоресцирующими антигенами, то видно, что
комплексы антитело — антиген сначала располагаются на поверхности
клетки относительно равномерно, но вскоре антигены начинают агреги-
ровать, образуя «пятна», которые затем мигрируют к одному из краев
клетки, где в конце концов из них формируется «шапочка». Через не-
которое время после этого содержимое «шапочки» проникает внутрь
лимфоцита.
Никаких доказательств того, что процесс образования «пятен» и
«шапочки» имеет какое-то отношение к стимуляции синтеза антител,
не существует. Тем не менее этот процесс интенсивно изучается, по-
скольку, возможно, полученные при этом сведения помогут понять
причины высокой подвижности связанных иммуноглобулинов и других
рецепторов в клеточных мембранах. Существует предположение, что
рецепторные молекулы (например, гликофорин) проходят через мемб-
рану и связываются с «цитоскелетом», образованным микрофиламента-
ми и микротрубочками [97]. Рецептор, находясь в одном из состояний,
должен быть свободным, чтобы диффундировать в плоскости мембраны
с образованием «пятен», этот процесс не требует затраты энергии.
В другом состоянии рецептор должен быть связан с микрофиламента-
ми и микротрубочками, движения которых могли бы обеспечивать про-
цесс образования «шапочки», требующий энергии. В некоторых случа-
ях инициация синтеза антител в лимфоцитах может происходить при
связывании лектинов. Поскольку структура конканавалина А и харак-
тер его связывания с углеводными группами (разд. В 3) уже известны,
мы надеемся, что исследование взаимодействия лектинов с клеточными
поверхностями приблизит нас к пониманию сложных процессов, лежа
щих в основе ответа на антиген [98, 99].
Другое объяснение образования «шапочек» основано на предполо-
жении о том, что в мембранах существуют ориентированные потоки
жидкости (разд. Б.1) [36а].
5. Рецепторы гормонов
Многие гормоны, например инсулин, глюкагон, АКТГ (адренокор-
тикотропный гормон) и эпинефрин (адреналин), не проникают в клет-
ки, а связываются со специфическими белковыми рецепторами на по-
верхности мембран [99а]. Было установлено, например, что на жировой
клетке (из жировой ткани) диаметром '—50 мкм содержится 160 000
рецепторных участков для инсулина; это соответствует 21 рецептору на
1 мкм2 клеточной поверхности [100, 100а].
Как может связывание гормона с рецептором на наружной поверх-
ности клеточной мембраны влиять на химические процессы внутри
клетки? Весьма вероятно, что в некоторых случаях рецептор пронизы-
вает мембрану насквозь и контактирует с ферментом, связанным с
внутренней поверхностью мембраны Изменение конформационного со-
стояния рецепторного белка, обусловленное связыванием гормона, мо-
Мембраны и клеточные оболочки 387
жет непосредственно передаваться на фермент, переводя его в актив-
ное состояние. Это можно проиллюстрировать на примере фермента,
катализирующего образование циклического АМР (гл. 6, разд. Е.5) в
ответ на связывание ряда гормонов с мембранными рецепторами. Об-
разующийся циклический АМР распространяется внутри клетки путем
обычной диффузии, влияя на многие метаболические процессы. В дру-
гих случаях гормоны (и в частности, стероидные гормоны) проникают
через мембрану и связываются с рецепторами в цитоплазме. Однако
даже здесь нельзя исключить, что на поверхности клеток существуют
специальные участки, которые связывают свободный гормон или гор-
мон-белковый комплекс, прежде чем последние проникают внутрь
клетки.
В клеточных мембранах могут также находиться ферменты, разру-
шающие гормоны. Так, например, полипептидный гормон глюкагон
(синтезируемый специальными клетками поджелудочной железы) по-
падает в кровь и в значительной степени разрушается клетками пече-
ни, которые служат клетками-мишенями для данного гормона. Благо-
даря этому концентрация глюкагона в крови необычайно низка (от
10-10 до 10-9 М), а время его полужизни в организме человека состав-
ляет всего лишь 10 мин [401].
Дополнение 5-Ж
Комплемент
Комплемент — это группа, включающая около десятка
белков, находящихся в сыворотке крови. Каскадный меха-
низм их активации запускается при взаимодействии антиге-
на с антителома~Д.
Антитело + антиген
| Комплемент
Комплекс------------* Лизис клеток, фагоцитоз и т. д.
В конечном счете действие комплемента приводит к разру-
шению клеток путем их лизиса и к активации лейкоцитов,
поглощающих чужеродные клетки в результате фагоцитоза.
Комплемент индуцирует также освобождение хемотаксиче-
ских факторов, которые обеспечивают перемещение поли-
морфноядерных лейкоцитов в соответствующую зону (гл. 1,
разд. Д-2). Внимание биохимиков было сконцентрировано
на распознающем компоненте комплемента С1, который со-
стоит из 3 белков, обозначаемых Clq, С1г и Cis. Белок
Clq взаимодействует с Сн2-доменом антител, связавших ан-
тигены. Однако (дополнение 5-Е) для активации Clq необ-
ходим по крайней мере димер IgG или самопроизвольно об-
разующийся пентамер IgM. Структура фактора Clq (его
мол вес равен 400 000)г довольно необычна. К центральной
части молекулы, диаметр которой составляет 3—6 нм, а дли-
на— 10—12 нм, присоединены шесть очень тонких соедини-
тельных нитей длиной 10—13 нм и диаметром около 1,5 нм,
заканчивающихся глобулами, имеющими диаметр ~6 нм.
388 Глава 5
Считают, что именно эти глобулы являются местами взаи-
модействия с иммуноглобулинами.
При изучении химического состава тонких соединитель-
ных нитей в них неожиданно обнаружили высокое содержа-
ние оксипролина и оксилизина. Каждая нить состоит из трех
цепей и имеет, по-видимому, коллагеновую структуру (гл. 2,
разд. Б.З.в). Глобулярные же концы имеют, вероятно, более
типичную белковую структуру. Таким образом, белок Clq
представляет собой еще одну молекулярную «машину», сек-
реты которой предстоит раскрыть. Связываясь с антителами,
антигены активируют их участки, связывающие комплемент.
Активированные антитела связываются белком Clq; это свя-
зывание каким-то образом его активирует, и он в свою оче-
редь активирует С 1г. Считают, что последний связывается с
центральной частью Clq, тогда как антитела связываются с
наружными концами этой сложной молекулы. Возникает во-
прос: каким же образом «информация» об активации пере-
носится с наружных частей на центральную часть молекулы?
Известно, что активированный белок С 1г превращает
Cis (профермент) в активную эстеразу, которая атакует
компоненты комплемента С2 и С4 и инициирует разветвлен-
ный каскад реакций, приводящих к лизису, хемотаксису и
другим ответным реакциям, наблюдаемым уже на клеточ-
ном уровне и на уровне организма.
а White A., Handler Р., Smith Е., Principles of Biochemistry, 5th ed,
pp. 830—832, McGraw-Hill, New York, 1973.
6 Mayer M. M., Sci. Am., 229, 54—66 (Nov. 1973).
B Schultz D. R., The Complement System, Karger, Basel, 1971.
r Shelton E., Yonemasu K., Stroud R. M., PNAS, 69, 65—68 (1972).
д Muller-Eberhard H. J., Annu. Rev. Biochem., 44, 697—724 (1975).
Г. Строение клеточных стенок бактерий
Плазматическая мембрана бактериальных клеток (кроме мико-
плазм) окружена многослойной стенкой, которая может быть отделе-
на от мембраны узким периплазматическим пространством. Толщина
этого пространства, которая зависит от осмотического давления среды,
в обычных условиях очень мала. Самый внутренний слой стенки
(рис. 5-8) состоит из пептидогликана, или муреина. Основу пептидо-
гликана составляет полимер, построенный из чередующихся остатков
*42
НМ
20 нм
Цепи 0-антигена
Гидрофобный белой и
главный белок оболочки
Слой муреина
Лери плазматическое
пространство
Плазматическая
мембрана
РИС. 5-8. Строение клеточной оболочки бактерий. Схема плазматической мембраны
и стенки грамотрицательиой бактерии (см. Schaitman С., J Bacteriol., 108, 553—563,
1971, а также рис. 1-2, В и Г).
Мембраны и клеточные оболочки 389
N-ацетилглюкозамина и N-ацетилмурамсхвой кислоты, связанных меж-
ду собой р-1,4-связями. Остатки N-ацетилмурамовой кислоты образо-
вавшейся хитиноподобной молекулы связаны своими лактильными
группами с необычным пептидом. На рис. 5-9 можно видеть, как боко-
вые пептидные цепи связаны олигопептидными фрагментами. У Е. coli
и других грамотрицательных бактерий пептидогликан образует тон-
Эта NHz-zpynna связана
с — СООН-группой т>-аланина
в другой цепи. У Е coll и других
грамотрицательных бактерий
подобная связь образуется
непосредственно, вместе с тем
у многих бактерий здесь может
быть встроена небольшая пептидная
цепь (до 5 аминокислот)
он
ун
^С.
Н — N сн;
О=С
В некоторых
случаях * “ОС
превращается в группу
— CONH2
H2N Н
?с /СН2,
С=О
•2
Н
сн2 NH
мезо-Диоминопимелиновая Кислота
иногда заменяется на ь.с-диаминопи-
мелиновую кислоту, лизин, орнитин,
диаминомасляную кислоту или гомосерин
— СОСУН-группа этого
D-оланина связана со свобод-
ной —ЫН2-группой
диаминокислоты другой
цепи
о-Ала
о=с
\ У
сн2
X
Н2С^ ,СОО“
/с\
Н —N Н
Обратите внимание на необычную
пептидную связь, образованную при
участии у-СООН глутаминовой
кислоты
d-G1u; иногда
заменен на o-Gln
или 3-OKCU-D-Gln
ь-А1а; иногда заменен
на ь-Ser или Gly
' Н с=о
/с\
н3с NH
---[)3-D-GlcNAc-(1^4)-j8-t>-MurNAc-(l-^4)]5-(« = 10-70)
РИС. 5-9 А. Строение повторяющейся единицы пептидогликана (муреина). Роль свя-
зующих звеньев играют пентаглиции (Staphylococcus aureus), трналаиилтреоиин (mic-
rococcus roseum) и полисерин (Staphylococcus aureus).
390 Глава 5
кую (2 нм) непрерывную сетку, окружающую клетку. У грамположи-
тельных бактерий пептидогликан с большим количеством поперечных
связей образует слой, толщина которого достигает 10 нм [402—104].
1. Стенка грамотрицательных бактерий
С наружной стороны муреинового слоя у Е. coli и других грам-
отрицательных бактерий находится слой, содержащий фосфолипид,
или наружная мембрана, сходный по толщине, а возможно, и по струк-
туре с типичными биологическими мембранами (рис. 5-8). По-видимо-
му, эта мембрана соединена с муреиновым слоем следующим образом.
Небольшой гидрофобный белок, состоящий из 57 аминокислотных
остатков, связывается с муреином амидной связью. Она образуется
между аминогруппой боковой цепи С-концевого лизина белка и остат-
ком диаминопимелиновой кислоты муреина [105]. Таким образом,
белок заменяет один из концевых остатков D-аланина в среднем у од-
ного из десяти пептидов муреина. Расположенный на N-конце белка
серин в свою очередь ковалентно связывается с липидом, который, по-
видимому, включен в состав наружной мембраны. На клетку прихо-
дится около 105 молекул гидрофобного белка, которые располагаются
на поверхности пептидогликана площадью ~3 мкм2. Следовательно,
Мембраны и клеточные оболочки 391
расстояние между белковыми молекулами должно составлять в сред-
нем нм.
У Е. coli между мембранами находится еще один, более крупный
белок в количестве приблизительно 105 молекул на клетку. Молекулы
этого белка оболочки (мол. вес ~ 36 500) образуют на внешней по-
верхности пептидогликана гексагональные структуры с расстоянием
между молекулами 7,5 нм [106]. Возможно, белок оболочки придает
жесткость палочковидным бактериям. В образовании упорядоченных
структур на поверхности многих бактерий принимают участие и более
крупные белки (мол. вес. 65 000—150 000)1 [106а].
Наружная поверхность внешней мембраны грамотрицательных бак-
терий покрыта удивительно сложно устроенным липополисахаридом
[107, 108]. Внешний слой липополисахарида представляет собой сово-
купность длинных вытянутых полисахаридных цепочек, состоящих из
повторяющихся специфических единиц, обладающих антигенными
свойствами и получивших название О-антигенов. К этим полисахари-
дам могут быть получены специфические антитела. Структура полиса-
харидов характеризуется большим разнообразием — известно 1000 «се-
ротипов» сальмонелл. Согласно существующей классификации, их раз-
деляют на 17 основных групп. В группу ЕЗ, например, входят сероти-
пы, которые состоят из повторяющихся единиц
ocGlc
i:
—[>/3Gal-(l—>6)-Man-(l—>-4)-рамноза-]—»
где число п в среднем равно ~50. Серотипы групп А, В и D содержат
повторяющуюся единицу
X
r 1
-—[ Man »рамноза ► Gal
где X — это 3,6-дидезоксигексоза : паратоза в группе А, абеквоза в
группе В и тивелоза в группе D (рис. 5-10). Существование большого
числа серотипов определяется изменчивостью компонентов, типами свя-
зей в повторяющихся единицах и структурными особенностями конце-
вых участков цепей.
Часть О-антигена, обращенная к мембране, представляет собой бо-
лее короткую полисахаридную цепочку, строение которой по сравнению
с внешней частью характеризуется не столь сильным разнообразием.
Однако в ее состав входят два сахара, обнаруживаемые только в стенках
бактерий, а именно гептоза, содержащая 7 углеродных атомов, и а-ке-
тосахарная кислота кетодезоксиоктонат, содержал 8 углеродных ато-
мов. Структурные формулы этих сахаров приведены на рис. 5-10, а их
расположение в липополисахаридах сальмонелл — на рис. 5-11. На
последнем рисунке показано также, каким образом О-антиген соеди-
няется с повторяющейся единицей, состоящей из двух молекул N-аце-
тилглюкозамина, связанных .между собой р-1,6-связью. Эти дисахарид-
ные фрагменты соединены друг с другом при помощи пирофосфатных
1 Кроме двух упомянутых выше белков в клеточной оболочке Е. coli имеется один
белок, содержание которого сопоставимо с содержанием белка оболочки. См. обзор
Гартеиа и др. [106Ь].
392 Глава 5
мостиков. Далее к свободным гидроксильным группам в дисаха-
риде присоединены при помощи сложноэфирных связей остатки жир-
ных кислот, которые, вероятно, проникают во внешнюю мембрану и
играют роль якоря для всего липополисахарида. Соотношение жирных
кислот — лауриновой, миристиновой и пальмитиновой — в дисахарид-
он
Паратоза
(3,6-йийезокси-п-рибогексоза)
Тивелоза
(3,6-г',Лезокси-1>-арабогексоза)
q Стереоизомер абеквозы
\ - сахар коли таза
\ обнаружен в поверхностных
/I антигенах Е. coll
/он
Абеквоза * В некоторых антигенах
(З.б-ЪиЪезокси-л-хсилогексозо) абеквоза в этом
положении
ацетилирована
Стереоизомер тивелозы-аскарилоза
обнаружена не только в некоторых
бактериальных антигенах, но и в яйцах
Ascaris
1.-глицеро-т>-монногептоза
ОН
З-Ьезокси-т>-манноокту лозоновая кислота,
называемая также 2-кето-3-1)езоксиоктонатом
РИС. 5-10. Некоторые «редкие» сахара, входящие в состав «антигенов» наружной
клеточной стенки грамотрицательных бактерий.
ных единицах составляет 1:1:1. Кроме того, с дисахаридными едини-
цами связаны три молекулы З-В-оксимиристиновой кислоты. Два ее
остатка связаны амидными связями с аминогруппами единиц GlcN,
а третий образует за счет гидроксильной группы сложноэфирную связь
с другой молекулой жирной кислоты. Считают, что .именно эта специ-
фическая структура ответственна за необычайно сильно выраженное
пирогенное действие липополисахарида.
Почему у сальмонелл так много различных поверхностных антиге-
нов? Ключом к ответу может служить тот факт, что концы описанных
выше углеводных цепей являются именно теми группами, к которым
присоединяются антитела животных при попадании бактерий в кровь.
У ряда мутантов, известных под названием «R-формы» (от англ, ro-
ugh— шероховатый, так как они образуют шероховатые колонии на
агаре), внешний О-антиген отсутствует. R-мутанты сальмонеллы не па-
тогенны, тогда как «гладкие» (не шероховатые) штаммы, содержащие
интактный О-антиген, часто служат причиной болезни. Не исключено,
что при определенном расположении сахарных колец иа конце О-ан-
тигена организм хозяина не воспримет этот антиген как опасный. Так
Мембраны и клеточные оболочки 393
(Повторяющиеся е/'иницы , „
О-онтигена )п п ’°
I
GlcA
I
Glc
I
Gal
I
Glc—Gal
I
Hep
Hep = ь-глицеро-р-маниогептоза (рис. 5-8)
KDO
KDO—KDO P
Остатки оксимиристиновои
кислоты
Из трех представленных остатков жирных кислот
один принадлежит пальмитиновой, другой-лоуриновой t
а третий—миристинилоксимиристиновой кислоте
< с
О
РИС. 5-11. Повторяющаяся единица наружного гликолипидного слоя клеточной стенки
Salmonella [108].
или иначе', ясно, что углеводные группы, расположенные на поверхно-
стях клетки, играют важную роль в механизмах, при помощи которых
клетки узнают друг друга.
Интересные результаты были получены при исследовании умерен-
ных бактериофагов — бактериальных вирусов, генетический материал
которых может включаться в геном бактерий (гл. 15, разд. Г.8). Иног-
да включение вирусных генов в энтеробактерию вызывает изменение
структуры О-антигена. Заражение одним вирусом приводит к потере
О-ацетильных групп некоторыми сахарными остатками; другие вирусы
вызывают появление дополнительных заместителей. Под влиянием ряда
вирусов в определенных местах молекул олигосахаридов a-связи ме-
няются на p-связи или связи 1,4 на связи 1,6. Очевидно, вирусные гены
ЙП—1821
394 Глава 5
могут, с одной стороны, кодировать синтез новых ферментов, гликозил-
трансфераз, участвующих в построении О-антигенов, а с другой—-по-
давлять синтез трансфераз хозяина. Интересно также, что патогенный
микроорганизм — возбудитель брюшного тифа Salmonella typhi—•
представляет опасность лишь в том случае, если он заражен опреде-
ленным умеренным бактериофагом. Здесь напрашивается явная ана-
логия с индукцией трансформации клеток млекопитающих в культуре
онкогенными вирусами, при которой изменяются их поверхностные ан-
тигены.
Исследования умеренных фагов сальмонелл позволили понять не-
которые особенности механизмов, с помощью которых эти бактериаль-
ные вирусы связываются со стенками клеток-хозяев. Местом первич-
ного присоединения являются, по-видимому, сами О-антигены. Тонкие
нити, расположенные на отростке фага (дополнение 4-Д), действуя на-
подобие антител, связываются со специфическими группировками по-
лисахарида. Однако в результате включения генома фага и измене-
ния строения О-антигена последующее присоединение вирусов блоки-
руется. В то же время клетки бактерий становятся восприимчивыми
к вирусам другого штамма [109].
2. Тейхоевые кислоты
Тейхоевые кислоты связаны с пептидогликановым слоем и клеточ-
ной стенкой грамположительных бактерий, причем у некоторых штам-
мов на их долю приходится до 50% сухого веса клеточных стенок
[НО, 111]. Тейхоевые кислоты представляют собой высокомолекуляр-
ные полимеры, структура которых в общем виде выглядит следующим
образом.
У Bacillus subtilis,
по крайней мере у
I половины остатков,
ОН J к из этих—ОН групп
q присоединен D-аланин
1 Рибитолтейхоевые кислоты
НО
У В subtilis здесь
а-ъ-глюкоза
О—
'о
/ п
присоединена
2. Глицеролтейхоевые кислоты
У Lactobacillus arabinosus в этом
месте сложноэфирной связью
присоединен т>-аланин, однако
приблизительно у одного из 9 остатков
вместо п-аланина в цепи стоит
ft-р^глюкоза
Мембраны и клеточные оболочки 395
В клеточных стенках тейхоевые кислоты ковалентно связаны
фосфодиэфирными связями с остатками мурамовой кислоты пеп-
тидогликана. Было предложено два возможных типа их расположения
[412]. Согласно одному из них, цепи пептидогликана расположены
перпендикулярно по отношению к внешним концам тейхоевых кислот.
В соответствии с этой моделью клеточная стенка состоит из слоя пеп-
тидогликана толщиной 10 нм, снаружи от которого находится слой
тейхоевых кислот толщиной 12 нм. Согласно другому предположению,
цепи пептидогликана ориентированы параллельно поверхности бакте-
риальной клетки. При равномерном распределении связей тейхоевой
кислоты с пептидогликаном она оказывается тесно связанной с по-
следним на всем протяжении стенки.
Другие тейхоевые кислоты ковалентно связаны с гликолипидами
(например, с олигосахаридом, присоединенным гликозидной связью к
диглицериду), входящими в состав плазматической мембраны [111].
Д. Стенки растительных клеток
Толстая стенка растительной клетки (рис. 1-3) устроена необычай-
но сложно [113—116]. Благодаря ее сложному строению растения
обладают прочностью и жесткостью, а их клетки способны к быстро-
му удлинению в период роста. Норткот [113] сравнил строение стенки
растений с фибраглассом — пластиком, армированным стекловолокном.
Так, в стенке клетки находятся микрофибриллы, состоящие из целлю-
лозы и других полисахаридов, которые погружены в матрикс, также
состоящий в основном из полисахаридов. На ранних стадиях роста зе-
леных растений закладывается первичная клеточная стенка, содержа-
щая свободно переплетенные целлюлозные волокна диаметром прибли-
зительно 10 нм, центральная часть которых (~4 нм) имеет кристалли-
ческую структуру. Такие целлюлозные волокна содержат 8000—12 000
остатков глюкозы.
В процессе роста растения под первичной стенкой образуется вто-
ричная клеточная стенка, которая построена из многочисленных слоев
плотно упакованных микрофибрилл, имеющих различное направле-
ние в соседних слоях. Микрофибриллы зеленых растений чаще всего
состоят из целлюлозы, однако могут содержать также и другие поли-
сахариды. Фибриллы некоторых водорослей богаты ксиланом и ман-
наном.
В период роста растения состав матрикса меняется. На начальных
стадиях развития матрикс в основном состоит из пектиновых веществ
(производных полигалактуроновой кислоты), однако в дальнейшем в
нем появляются ксиланы и различные нейтральные полисахариды
(«гемицеллюлоза»). В состав первичной клеточной стенки двудольных
растений входят ксилоглюканы (содержащие линейную глюкановую
цепь и боковые цепи из остатков ксилозы, .галактозы и фукозы), ара-
биногалактаны и рамногалактоуронаны (состоящие из прямых цепей,
построенных из остатков галактуроновой кислоты, между которыми
через определенные интервалы включены рамнозные кольца). Эти три
сложных полисахарида ковалентно связаны друг с другом и с целлю-
лозными микрофибриллами [114] (рис. 5-12).
Главными компонентами клеточных стенок растений являются уг-
леводы. Однако кроме углеводов в них содержатся небольшие количе-
ства гликопротеида, получившего название экстензии [117]. Это соеди-
нение, подобно коллагену внутриклеточного матрикса тканей живот-
ных, содержит в большом количестве 4-оксипролин. В него входят так-
396 Глава 5
РИС. 5-12. Предполагаемое строение стенки растительных клеток. Относительные раз-
меры различных компонентов стенки не соблюдены, однако соотношения между ними
близки к истинным. Расстояние между пучками целлюлозных волокон увеличено, что-
бы можно было изобразить соединяющие структуры В первичной клеточной стенке
одной клетки может находиться от 10 до 100 пучков целлюлозных волокон [115]
же арабиноза и галактоза, присоединенные в форме олигосахаридов
(состоящих приблизительно из 9 остатков) к гидроксильным группам
белка. На более поздних стадиях развития, когда стенки затвердева-
ют до состояния древесины, в клетках растений откладываются значи-
тельные количества лигнинов (гл. 14, разд. 3.6). Эти химически устой-
чивые полимеры содержат большое число ароматических колец.
Биосинтез пектинов и гемицеллюлоз происходит, вероятно, в пу-
зырьках аппарата Гольджи, откуда эти соединения транспортируются
Мембраны и клеточные оболочки зу/
наружу путем экзоцитоза. Что же касается целлюлозных волокон, то
они могут выталкиваться через плазматическую мембрану. Интерес-
ным свойством первичных клеточных стенок растений является их спо-
собность черзвычайно быстро удлиняться во время роста клетки. Уве-
личение размера клеточных стенок, так же как и общее увеличение
объема клетки, обусловлено ростом давления внутри клетки. Характер
увеличения строго регулируется после определенного этапа развития;
под влиянием ряда гормонов растений клетки начинают удлиняться
только в одном направлении. Наиболее сильно выраженным действием
такого рода обладают гиббереллины (гл. 12, разд. 3.1), способные вы-
зывать очень быстрое удлинение клеток.
Удлинение клеток растений, несомненно, связано с разрывом ста-
рых и образованием новых связей между полисахаридами. Однако
при этом сохраняется целостность целлюлозных волокон и их способ-
ность скользить друг относительно друга [114].
Клеточные стенки дрожжей и грибов состоят из глюканов, хитина
и маннан-белкового комплекса. Некоторые сильно разветвленные ман-
нановые цепи играют роль видоспецифичных антигенов [118]. Подобно
антигенам поверхностей животных и бактериальных клеток, антигены
растительных клеток характеризуются огромным структурным много-
образием, что имеет важное значение для медицины. Удобным объек-
том для изучения генетических аспектов биосинтеза ферментов, участ-
вующих в синтезе маннанов, являются дрожжи. Их можно выращи-
вать как в гаплоидных, так и в гибридно-диплоидных формах, что зна-
чительно облегчает генетический анализ.
Вопросы и задачи
1. Стеариновую кислоту (1,16 г) растворили в 100 мл этанола. 10 мкл
полученного раствора нанесли пипеткой на чистую поверхность
разбавленного раствора НС1 (в неглубоком лотке), так, чтобы об-
разовался монослой стеариновой кислоты. Этот слой сжимали (пу-
тем перемещения тефлоновой пластинки) до тех пор, пока поверх-
ностное давление л, резко возрастая, не достигало значения
20 дин-см-1. Заметим, что л = у0—Т, где у — поверхностное натяже-
ние, измеряемое при наличии пленки, а у0 — более высокое поверх-
ностное натяжение чистой воды. Сжатая пленка покрыла площадь
20X24 см. Рассчитайте поперечное сечение алкильной цепи в
стеариновой кислоте. (См. Davenport J. В , in: Biochemistry and
Methodology of Lipids (Johnson A. S., Davenport J. B, eds.),
pp. 47—83. Wiley-Interscience, New York, 1971; and Phillips M. C , in:
Progress in Surface and Membrane Science (Danielli J. F.), Rosen-
berg D. M., Cadenhead D. A, eds.), Vol. 5, pp. 139—221, Academic
Press, New York, 1972.
2. В 1925 г. Э. Гортер и Ф. Грендел (J. Exp. Med, 41, 439) описали
эксперименты, в которых они экстрагировали ацетоном липиды из
мембран эритроцитов и получили из них манослой, после чего из-
меряли площадь сдавленного монослоя. Далее они оценили пло-
щадь поверхности эритроцитов и рассчитали, что отношение пло-
щади липидов (в виде монослоя) к площади поверхности эритро-
цита составляет 1,9—2,0. В ходе более поздних экспериментов [11]
было установлено, что в каждой мембране эритроцита содержится
4,5-10 16 моль фосфолипидов и 3,1-Ю-16 моль холестерина.
а. Какую площадь будет занимать монослой, если принять, что по-
перечные сечения молекул фосфолипида и холестерина в мембра-
не равны соответственно 0,70 и 0,38 нм2?
398 Глава 5
б. Чему будет равно отношение площади, рассчитанной в а), к пло-
щади поверхности эритроцита, если измеренная площадь его по-
верхности равна 167 мкм2?
в. Как вы объясните разницу между полученной величиной и соот-
ветствующей величиной, приведенной в работе Гортера и Грен-
дела? (см. [11]).
3. Ниже приведены экспериментальные данные, полученные при изу-
чении строения и функции биологических мембран. Объясните связь
приведенных данных со строением мембран.
а. Многие макроциклические антибиотики (нонактин, валиноми-
цин и др.) с высокой степенью избирательности связываются с
катионами щелочных металлов, образуя комплексы с отноше-
нием 1 : 1. Эти комплексы хорошо растворимы в неполярных ор-
ганических растворителях. Указанные антибиотики повышают
электропроводность и проницаемость искусственных фосфолипид-
ных мембран для катионов щелочных металлов. Валиномицин
повышает электропроводность тилакоидных мембран хлоропла-
стов в присутствии ионов К+, но не Na+; он также разобщает
окислительное фосфорилирование в митохондриях (см. гл. 10).
б. При обработке интактных хлоропластов галактолипазой из га-
лактозилдиглицеридов освобождается галактоза. При обработке
теней эритроцитов фосфолипазой С освобождается около 75%
липидного фосфора в водорастворимой форме. Ни в одном из
случаев структурная целостность мембраны не нарушается.
в. Используя в качестве гаптена сфингомиелин, можно получить
специфические антитела к этому липиду. Можно показать, что ан-
титела взаимодействуют с тенями эритроцитов, но только с од-
ной из сторон мембраны.
4. Опишите строение биологических мембран и специфические функ-
ции липид-, белок- и углевод-содержащих компонентов. В чем
состоят различия между внутренней и наружной поверхностями
мембраны?
5. Сравните распределение триглицеридов, фосфатидилхолина, фос-
фатидилэтаноламина, сфингомиелина, гликолипидов и холестерина
внутри клеток. Оцените различия между разными сторонами мемб-
ран.
6. На каких химических принципах основана модификация компонен-
тов клеточной поверхности с использованием в качестве реагентов
следующих соединений: а) лактопероксидазы, б) галактозооксида-
зы, в) формилметионилсульфонметилфосфата, г) диазониевой соли
дииодосульфаниловой кислоты, д) флуоресцирующих антител,
е) антител, связанных с ферритином. Напишите уравнения соответ-
ствующих химических реакций. Укажите, какие поверхностные
группы модифицируются. Перечислите преимущества указанных ре-
агентов.
7. Какой из детергентов будет более эффективен в диапазоне pH от
2 до 3 — лаурилсульфонат натрия или лаурат натрия? Почему?
8. Какое количество энергии потребуется для транспорта 3 эквивален-
тов Na+ из клетки в среду и 2 эквивалентов К+ из внешней среды
внутрь клетки, если в клетке концентрации этих ионов равны соот-
ветственно 10 мМ и 100 мМ, а в жидкой среде, в которой нахо-
дятся клетки, 100 мМ и 5 мМ? Сравните полученную величину с
AG' гидролиза АТР при pH 7. Считайте, что мембрана проницаема
для ионов С1~.
9 Считают, что клетка Е. coli содержит приблизительно 105 молекул
Мембраны и клеточные оболочки 399
белка оболочки, мол. вес которого 36 500. Какая часть поверхности
бактерии будет покрыта белком, если молекулы белка имеют фор-
му сфер, причем эти сферы плотно упакованы в гексагональные
структуры? Каков диаметр молекулы белка? Какой должна быть
площадь белковой молекулы, если 105 молекул покрывают полно-
стью всю поверхность? Предложите форму белковой молекулы,
удовлетворяющую этому требованию.
10. Проследите за перемещением ионов Са2+ внутри клетки, благода-
ря которым запускается процесс сокращения миофибрилл начиная
с момента, когда нервный импульс достигает мышечной клетки
(в скелетной мышце млекопитающего), и кончая завершением про-
цесса сокращения. Назовите специфические белки и (или) струк-
туры, участвующие в рассматриваемых процессах.
СПИСОК ЛИТЕРАТУРЫ
1. Rouser G., Nelson G. J., Fleischer S., Simon G., in «Biological Membranes» (Chap-
man D., ed.), p 5, Academic Press, New York, 1968.
la. Quinn P. J., Molecular Biology of Cell Membranes, University Park Press, Balti-
more, Maryland, 1976.
2 Fox C. F., Keith A. D., eds., Membrane Molecular Biology, Sinauer Assoc., Stam-
ford, Connecticut, 1972.
3. Bretscher M. S, Science, 181, 622—629 (1973).
3a. Bretscher M. S., Raff M. C., Nature (London), 258, 43—49 (1975).
4. Robertson J. D. In: Cell Biology in Medicine (Bittar E. E., ed.), pp. 3—48, Wiley,
New York, 1973.
5. Capaldi R. A., Sci. Am., 230, 27—33 (Mar. 1974).
6. Machtiger N. A., Fox C. F., Annu. Rev. Biochem., 26, 575—600 (1973).
7. Jain M. K., The Bimolecular Lipid Membrane, Van Nostrand-Reinhold, Princeton,
New Jersey, 1972.
8. Oseroff A. R., Robbins P. W., Burger M. M., Annu. Rev. Biochem., 26, 647—682
(1973).
9. Guidotti G., Annu. Rev. Biochem, 41, 731—752 (1972).
9a. Tien H. T., Bilayer Lipid Membranes, Dekker, New York, 1974.
10 Nicolson G. L„ BBA, 457, 57—108 (1976).
10a. Jones D. D., Jost M., Arch. MikrobioL, 70, 43—64 (1970).
11. Korn E. D„ Science, 153, 1491 — 1498 (1966).
12. Mueller P„ Rudin D. O., Tien H. T„ Wescott W. C., Nature (London), 194, 979—
980 (1962).
12a. Tanford C., The Hydrophobic Effect, Wiley, New York, 1973.
13. Montal M„ Mueller P„ PNAS, 69, 3561—3566 (1972).
14. O’Brien J. S„ FEBS Symp., 20, 33—38 (1970).
15. Fettiplace R., Andrews D. M., Haydon D. A., J. Membr. Biol., 5, 277—296
(1971).
16. Wolff D., Canessa-Fischer M., Vargas F., Diaz G., J. Membr. Biol., 6, 304—314
(1971).
16a. Melchior D. L., Steim J. M., Annu. Rev. Biophys. Bioeng., 5, 205—238 (1976).
17. Shimshick E. J., McConnell H. M., Biochemistry, 12, 2351—2360 (1973).
17a. Hui S. W., Parsons D. F., Science, 190, 383—384 (1975).
18. Trouble H„ Eibl H„ PNAS, 71, 214—219 (1974).
19. Engelman D. M., JMB, 47, 115—117 (1970).
20. Overath P., Schairer H. U„ Stoffel W„ PNAS, 67, 606—612 (1970).
21. Willecke K., Pardee A. B., JBC, 246, 5264—5272 (1971).
22. Jain M. K-, Curr. Top. Membr. Transp, 6, 1—57 (1975).
23 Trouble H., Membr. Biol., 4, 193—208 (1971).
24. Devaux P., McConnell H. M., JACS, 94, 4475—4481 (1972).
25. Rosenberg A., Science, 157, 1191—1196 (1967).
26. Bretscher M. S., Nature (London), New Biol., 236, 11 —12 (1972).
27. Reynolds J. A., Trayer H., JBC, 246, 7337—7342 (1971).
28. Neville D. M., Jr., Glossmann H., JBC, 246, 6335—6338 (1971).
28a. Carraway K. L„ BBA, 415, 379—410 (1975).
28b. Gahmberg C. G., JBC, 251, 510—515 (1976).
29. Reichstein E., Blostein R., JBC, 250, 6256—6263 (1975).
400 Глава 5
29а. Brown Р. A., Feinstein М. В., Sha'afi В. I., Nature (London), 254, 523—525
(1975).
29b. Rothstein A., Cabantchik Z. I., Knauf P., Fed. Proc., Fed. Am. Soc. Exp. Biol, 35,
3—10 (1976).
30. Steck T. L„ Dawson G„ JBC, 249, 2135—2142 (1974).
31 Marchesi V. T„ Furthmayr H„ Tomita M., Annu. Rev. Biochem., 45, 667—698
(1976).
32. Singer S. J., Nicolson G. L., Science, 175, 720—731 (1972).
33 Eylar E. H., Brostoff S., Hashim G., Caccam J., Burnett P., JBC, 246, 5770—5784
(1971).
33a. Laggner P„ Nature (London), 255, 427—428 (1975).
33b. Beard J. P., Connally J. C., J. Bacteriol, 122, 59—65 (1975).
34. Endo A., Rothfield L., Biochemistry, 8 , 3508—3515 (1969).
35 Henderson R., Unwin P. N. T., Nature (London), 257, 28—32 (1975).
36. Black S„ Adv. Enzymol., 38, 193—234 (1973).
36a. Bretscher M. S., Nature (London), 260, 21—23 (1976).
37. Ahkong Q. F., Cramp F. C., Fisher D., Howell J. I., Tampion IF., Veninder M„
Lucy J. A., Nature (London), New Biol., 242, 215—217 (1973).
38. Hokin L. E. ed., Metabolic Pathways, 3rd ed., Vol. 6, Academic Press, New York,
1972.
39. Christensen H. L., Biological Transport, 2nd ed., Benjamin, New York, 1975.
40. Wyman J. In: Structure and Function of Oxidation-Reduction Enzymes (Akeson A.,
Ehrenberg A., eds.), pp. 133—138, Pergamon, Oxford, 1972
41. Roseman S. In: Metabolic Pathways (Hoken L. E., ed.), 3rd ed., Vol. 6, pp. 41 —
89, Academic Press, New York, 1972.
42. Kalckar H. M„ Science, 174, 557—565 (1971).
43. Aksamit R. R., Koshland D. E., Jr., Biochemistry, 13, 4473—4478 (1974).
44. Oxender D. L. In: Biomembranes (Manson L. A., ed.), Vol. 5, pp. 25—79, Plenum,
New York, 1974.
45. Oxender D. L., Annu. Rev. Biochem, 41, 777—809 (1972).
46. Kaczorowski G., Shaw L., Fuentes M., Walsh C., JBC. 250, 2855—2865 (1975).
46a. Anderson B., Weigel N., Kundig W., Roseman S., JBC, 246, 7023—7033 (1971).
46b. Saier M. H., Jr., Feucht B. U., Hofstadter L. J., JBC, 251, 883—892 (1976).
46c. Boonstra J., Huttunen M. T., Konings W. N., Kaback H. R., JBC, 250, 6792—6798
(1975).
47. Harrold F. M., Altendorf K-, Curr. Top. Membr. Transp., 5, 1—50 (1974).
48. Rosenberg L. E. In: Biological Membranes (Dowben R. M., ed.), pp. 255—295,
Little, Brown, Boston, Massachusetts, 1969.
49. Ling G. N., A Physical Theory of the Living State, Ginn (Blaisdell), Boston, Mas-
sachusetts, 1962.
50. Damadian R., Biophys. J., 11, 773—785 (1971).
51. Cooke R., Kuntz I. D., Annu. Rev. Biophys. Bioeng., 3, 95—126 (1974).
52. Baker P. F„ Willis J. S„ Nature (London), 226, 521—527 (1970).
53. Perrone J. R„ Hackney J. F., Dixon J. F., Hokin L. E., JBC, 250, 4178—4184 (1975).
54. Taniguchi K-, Post R. L., JBC, 250, 3010—3018 (1975).
55. Lane L. K., Copenhaver J. H., Jr., Lindenmayer G. E., Schwartz A, JBC, 248,
7197—7200 (1973).
56. Blostein R„ JBC, 250, 6118—6124 (1975).
57. Kyte J., JBC, 249, 3652—3660 (1974).
58. Pressman В. C., Annu. Rev. Biochem., 45, 501—530 (1976).
59. Haavik H. J., Froyshov 0, Nature (London), 254, 79—81 (1975).
60. Овчинников JO. A., Mitochondria Biomembr., Proc. Fed. Eur. Biochem. Soc., Meet.,
8th, 1972, Vol. 28, pp. 279—306 (1972).
61. Lauger P„ Science, 178, 24—30 (1972).
62. Simon W., Morf W. E., Meier P. C., Struct. Bonding (Berlin), 16, 113—160
(1973).
63. Duax W. L., Hauptman M., Weeks С. M., Norton D. A., Science, 176, 911—915
(1972).
63a. Smith G. D., Duax W. L., Langs D. A., DeTitta G. T., Edmonds J. W., Rohrer D. C.,
Weeks С. M„ JACS, 97, 7242—7247 (1975).
64. Harrold F. M., Baarda J. R., J. Bacteriol., 94, 53—60 (1967).
64a. Tyson C. A., Vande Zande H., Green D. E., JBC, 251, 1326—1332 (1976).
65. Bastide F., Meissner G„ Fleischer S., Post R. L., JBC, 248, 8385—8391 (1973).
66. Schatzmann H. J., Curr. Top. Membr. Transp., 6, 125—168 (1975).
67. Dorrington K. J., Hui A., Hofmann T„ Hitchman A. J. W., Harrison J. E., JBC,
249, 199—204 (1974).
68. Bull H. B., An Introduction to Physical Biochemistry, 2nd ed., pp. 174—178, Davis
Co , Philadelphia, Pennsylvania, 1971.
Мембраны и клеточные оболочки 401
69. Aidley D. J., The Physiology of Excitable Cells, Cambridge Univ. Press, London
and New York, 1971.
70. Eckert R., Science, 176, 473—480 (1972).
70a. Browning J. L., Nelson D. L., Hansma H. G„ Nature (London), 259, 491—494
(1976).
71. Adelman W. J., Jr., ed Biophysics and Physiology of Excitable Membranes, Van
Nostrand-Reinhold, Princeton, New Jersey, 1971.
72. Nystrom R. A., Membrane Physiology, Prentice-Hall, Englewood Cliffs, New Jer-
sey, 1973.
73. Hodgkin A. L., The Conduction of the Nervous Impulse, Thomas, Springfield, Il-
linois, 1964.
74. Keynes R. D., Nature (London), 239, 29—32 (1972).
75. Ritchie J. M., Prog. Biophys. Mol. Biol., 26, 149—187 (1973).
76. Lefever R-, Deneuborg J. L., Adv. Chem. Phys , 29, 349—374 (1975).
77. Ginsburg V., Adv. Enzymol., 36, 131 —149 (1972).
78. Lloyd R. O.,Rabat E. A., PNAS, 61, 1470—1477 (1968).
79. Rabat E. A. In: Blood and Tissue Antigens (Aminoff D., ed.), pp. 187—198, Acade-
mic Press, New York, 1970.
80. Slomiany B. L„ Meyer R„ JBC, 248, 2290—2295 (1973).
81. Takasaki S„ Robata A., JBC, 251, 3610—3615 (1976).
82. Slayter H. S., Cooper A. G., Brown M. C., Biochemistry, 13, 3365—3371 (1974).
83. Roscielak J., Piasek A., Gorniak H., Gardas A., Gregor A., EJB, 37, 214—225
(1973).
84. Wherret J. R., Hakomori S, JBC, 248, 3046—3051 (1973).
85. Slomiany A., Horrowitz M. I., JBC, 248, 6232—6238 (1973).
86. Hughes R. C., Prog. Biophys. Mol. Biol., 26, 189—268 (1973).
87. Rlein J., Biology of the Mouse Histocompatibility-2 Complex, Springer-Verlag, Ber-
lin and New York, 1975.
88. Reisfeld R. A., Rahan B. D., Sci. Am., 226, 28—37 (Jun. 1972).
89. Isenman D. E., Painter R. H., Dorrington R. J., PNAS, 72, 548—552 (1975).
89a. Raff M. C„ Nature (London), 254, 287—288 (1975).
89b. Henning R., Milner R. J., Reske R., Cunningham B. A., Edelman G. M., PNAS,
73, 118—122 (1976).
8Sc. Vitetta E. S., Capra J). D„ Rlapper D. G„ Rlein J., Uhr J. W„ PNAS, 73, 905—909
(1976).
89d. Bridgen J., Snary D., Crumpton M. J., Barnstable C., Goodfellow P., Bodmer W. F.,
Nature (London), 261, 200—205 (1976).
89e. Strominger J. L., Humphreys R. E., McCune J. M., Parham P., Robb R., Sprin-
ger T., Terhorst C., Fed. Proc., 35, 1177—1182 (1976).
90. Sharon N., Lis H., Science, 177, 949—958 (1972).
91. Lis H., Sharon N., Annu. Rev. Biochem., 42, 541—574 (1973).
92. Rornfeld R., Ferris C., JBC, 250, 2614—2619 (1975).
93. Becker J. W., Reeke G. N., Jr. Cunningham B. A., Edelman G. M., Nature (Lon-
don), 259, 406—409 (1967).
94. Hardman R. D., Ainsworth C. F., Biochemistry, 15, 1120—1128 (1976).
94a. Hardman R. D., Goldstein I. J., in «Immunochemistry of Proteins» (Atassi M Z.,
ed.), Plenum, New York, 1977.
95. Frazier W. A., Rosen S. D., Reitherman R. W., Barondes S. H., JBC, 250, 7714—
7721 (1975).
96. Yamada R. M., Yamada S. S., Pastan I., PNAS, 72, 3158—3162 (1975).
97. Yahara I., Edelman G. M„ PNAS, 72, 1579—1583 (1975).
98. Edelman G. M„ Science, 192, 218—226 (1976).
99. Bourne H. R., Lichtenstein L. M., Melmon K. L., Henney C. S., Weinstein Y.,
Shearer G. M., Science, 184, 19—28 (1974).
99a. Cuatrecasas P., Hollenberg M. D., Adv. Prot. Chem., 30, 251—451 (1976).
100. Rono T„ Barham F. W„ JBC, 246, 6210—6216 (1971).
100a. Jarett L., Smith R. M., PNAS, 72, 3526—3530 (1975).
101. Pohl S. L., Michiel H., Rrans J-, Birnbaumer L., Rodbell M., JBC, 247, 2295—2301
(1972).
102. Reaveley D. A., Burge R. E., Adv. Microb. Physiol., 7, 1—81 (1972).
103. Lennarz W. J., Acc. Chem. Res., 5, 361—367 (1972).
104 Costerton J. W., Ingram J. M., Cheng R.-J., Bacteriol. Rev, 38, 87—110 (1974).
105 Braun V., BBA, 415, 335—377 (1975).
106. Rosenbusch J. P„ JBC, 249, 8019—8029 (1974).
106a. Sleytr V. B„ Nature (London), 257, 400—402 (1975).
106b. Garten W., Hindennach L, Henning U., EJB, 59, 215—221 (1975).
107. Osborn M. J., Annu. Rev. Biochem.. 38, 501—538 (1969).
108. Rietschel E. T„ Gottert H„ Luderitz O„ Westphal O„ EJB, 28, 166—173 (1972).
109. Losick R-, Robbins P. W., Sci. Am., 221, 121—124 (Nov. 1969).
402 Глава 5
110. Baddiley J., Essays Biochem., 8, 35—77 (1972).
Ill. Wicken A. J., Knox K- W., Science, 187, 1161 —1167 (1975).
112. Archibald A. R., Baddiley J., Heckels J. E., Nature (London), New Biol., 241, 29—
31 (1973).
113. Northcote D. H„ Annu. Rev. Plant Physiol., 23, 113—132 (1972).
114. Albersheim P„ Sci. Am., 232, 80—95 (Apr. 1975).
115. Albersheim P., Bauer W. D., Keestra K., Talmadge K- W., in «Biogenesis of Plant
Cell Wall Polysaccharides» (Loewus F., ed.), pp. 117—147, Academic Press, New
York, 1973.
115a. Preston R. D. In: Dynamic Aspects of Plant Ultrastructure, (Robards A. W., ed.),
p. 256—309, McGraw-Hill, New York, 1974.
115b. Preston R. D., The Physical Biology of Plant Cell Walls, Halsted Press, New
York, 1974.
116. Preston R. D., The Physical Biology of Plant Cell Walls, Chapman & Hall, London,
1974.
117. Heath M. F„ Northcote D. H„ BJ, 125, 953—961 (1971).
118. Ballou С. E., Raschke IF. C., Science, 184, 127—134 (1974).
Оглавление
Предисловие редакторов перевода ...................... 5
Предисловие автора к русскому изданию................. 6
Предисловие........................................... 7
Благодарности ........................................ ю
Глава 1
Место действия (перевод М. Д. Гроздовой) . . . ц
А. Простейшие живые организмы . . . . •.................14
1. Микоплазмы................................................. 14
2. Escherichia coli........................................... 14
3. Геном...................................................... 18
4. Рибонуклеиновые кислоты (РНК), транскрипция и трансляция
генетической информации....................................... 18
5. Мембраны и клеточные стенки.................................21
6. Жгутики и пили..............................................22
7. Высокая скорость обмена веществ у бактерий..................22
8. Споры.......................................................22
9. Классификация бактерий......................................23
10. Питание бактерий...........................................23
'1’1. Фотосинтезирующие и азотфиксирующие прокариоты ... 25
Б. Клетки эукариот ............................................26
il. Размеры и строение клеток эукариот.........................26
2. Ядро........................................................28
3. Плазматическая мембрана....................................2У
4. Цитоплазматические мембраны.................................29
5. Митохондрии и пластиды......................................33
6. Лизосомы и микротельца......................................34
7. Центриоли, реснички, жгутики и микротрубочки................34
8. Клеточные оболочки, стенки и раковины.......................37
В. Эволюция сложных организмов.................................37
1. Дупликация генов............................................38
2. Пол, хромосомы и клеточное деление..........................39
3. Митоз и мейоз...............................................39
4. Половые хромосомы и аутосомы................................42
5. Гаплоидные и диплоидные клетки......................• • 42
Г. Царство протистов...................-
1. Простейшие........................................
2. Грибы.............................................
3. Водоросли.........................................
4. Лишайники.........................................
Д. Многоклеточные организмы...........................
1. Разнообразие форм животных........................
2. Типы клеток и тканей животных..................
404 Оглавление
3. Межклеточные контакты и взаимодействия.......................55
4. Высшие растения и растительные ткани.........................61
Е. Регуляция химических процессов в клетке.......................63
Вопросы и задачи.................................................64
Список литературы...............................................65
Дополнение 1-А. О единицах измерения........................... 12
Дополнение 1-Б. Молекулярные веса и массы (дальтоны) ... 13
Дополнение 1-В. Электронный микроскоп, ультратонкие срезы и
реплики .................................................. Ю
Дополнение 1-Г. Наследственные нарушения обмена веществ . . 40
Глава 2
Молекулы, из которых мы состоим (перевод В. В. Бори-
сова) . .........................................67
А. Принципы построения малых молекул........................ 67
1. Валентные углы.............................................68
2. Длины связей...............................................69
3. Контактные расстояния......................................70
4. Асимметрия: правые и левые молекулы........................70
5. Описание конфигурации с использованием RS-обозначений . . 72
6. Конформации: различные формы, которые может принимать мо-
лекула .......................................................73
7. Водородные связи и гидрофобные взаимодействия .... 76
8. Таутомерия.................................................77
9. Резонанс...................................................79
Б. Белки..........................................• . . . 80
1. а-Аминокислоты.............................................80
2. Полипептиды................................................84
3. Конформации пептидных цепей................................87
4. Глобулярные белки......................................... 94
5. Дисульфидные мостики.................................... 101
6. Размеры и форма молекул беЛка '....................... 102
7. Конформационные изменения в полипептидах 105
£
В. Сахара и полисахариды........................ . Q 106
ь
il. Структура и свойства сахаров..................д . . 107
2. Олигосахариды..................................ч 112
3. Полисахариды..............................................114
4. Пептидогликаны и гликопротеиды............................117
5. |Конформация полисахаридных цепей.........................118
Г. Нуклеиновые кислоты.......................................122
1. Названия и сокращения.....................................123
2. Функциональные группы нуклеиновых кислот..................126
3. Химические реакции, в которые вступают полинуклеотиды . . 127
4. Конформации нуклеотидов . 128
5. Двойные спирали...........................................129
6. Пары оснований............................................134
7. Таутомерия и спаривание оснований.........................137
8. Нуклеотидный состав ДНК и РНК.............................137
9. Кольцевые и суперспиральные структуры; интеркаляция . . 139
40. Денатурация и гибридизация................................142
41. Конформация ДНК в палиндромах........................... 145
Д- Липиды.................................. ... 146
1. Строительные блоки липидов................................146
2. Соединение компонентов . . ..........................148
Оглавление 405
3. Жирные кислоты липидов......................................151
4. Поли-Р-оксибутират..........................................153
Е. Некоторые малые молекулы и ионы............................. 154
1. Неорганические компоненты...................................154
2. Избирательное накопление ионов........................ . . 155
3. Функции неорганических ионов................................156
Ж. Химический состав клеток................................. . 156
3. Как мы изучаем структуру молекул •...........................158
1. Разделение....................................................158
2. Гидролиз.....................................................166
3. Избирательное расщепление химических связей..................173
4. Методы, основанные на включении метки в концевые звенья . . 174
5. Анализ продуктов.............................................179
6. Определение молекулярного веса.............................. 181
7. Конформация макромолекул..................................... 183
Вопросы и задачи.............................................191
Список литературы.............................................195
Дополнение 2-А Белки плазмы крови.............................103
Дополнение 2-Б. Кремний — необходимый микроэлемент ... 121
Дополнение 2-В. Изотопы в биохимических исследованиях . . . 168
Глава 3
Энергетика биохимических реакций (перевод В. В. Бо-
рисова) ..........................................200
А. Термодинамика . •. . • 200
1. Система и ее окружение 201
2. Первый закон термодинамики 201
3. Изменение энтальпии и термохимии 202
4. Энтальпии и процессы, протекающие при постоинном давлении *02
5. Энтальпии сгорании и калорийность «физиологического топлива» 202
6. Энтропия и теплопередача 2U4
7. Второй закон термодинамики 205
8. Определение энтропии через теплоемкость 206
9. Критерий самопроизвольности процесса 207
10. Стандартные состоянии 208
14. Суммирование изменений свободной энергии . 208
12. Реакции в растворе 209
13. AG0 и константа равновесии 210
14. Коэффициенты активности и кажущаяся константа равновесии *11
15. Изменение равновесии с температурой 212
Б. Таблицы значений AG0 дли биохимических соединений . . . 212
1. Свободная энергия образовании .... 213
2. Свободней энергия диссоциации протонов 217
3. Потенциалы переноса групп г г , • • 217
4. «Константы», изменяющиеси с изменением pH 223
5. Роль ионов металлов 225
6. Несоответствие данных, полученных разными авторами . . . 420
7. Энергии связей и приближенные методы оценки термодииамиче-
8. Свободная энергии сгорания в присутствии Оз и NAD+ ... 227
В. Электродные потенциалы и изменение свободной энергии для
окислительно-восстановительных реакций .....•• 228
1. Измерение электродных потенциалов.............................229
406 Оглавление
Г. Термодинамика и процессы жизнедеятельности.................232
1. Эффективность роста бактерий.............................234
Д. Линейные соотношения, в которые входит свободная энергия . 234
Вопросы и задачи......................................... . . 238
Описок литературы . . . ..........................241
Дополнение 3-А. Аденилатная система ........................221
Глава 4
Как молекулы соединяются друг с другом (перевод
М. Я. Варшавской).............................................242
А, Принцип комплементарности . . . . •...............242
Б. Силы, действующие между молекулами........................243
1. Константы образования и константы диссоциации .... 243
2 Вандерваальсовы силы......................................244
3. Притяжение между заряженными группами (электростатические
силы)........................... ............................244
4. Водородные связи и структура воды ........................ 246-
5 Гидрофобные связи.........................................247
В. Количественная оценка прочности связывания.................240
1. Анализ данных............................................. 249
2. Несколько центров связывания в одной молекуле .... 252
3 Микроскопические константы связывания.....................254
4. Таутомерия и связывание протона........................... 255-
5. Статистические эффекты....................................256
6. Электростатическое отталкивание. Антикооперативность . . . 258
7. Кооперативные процессы . . 4...........................261
8. Связывание ионов металлов.................................263
Г- Упаковка макромолекул............................. 270-
1. Олигомеры, обладающие циклической симметрией .... 270
2 Спиральные структуры...................................273
3. Изологические связи: парные взаимодействия.............279
4. Олигомеры, содержащие как гетерологические, так и изологиче-
ские связи................................................284
5. Олигомеры с кубической симметрией (многогранники) . . . 285
6 Икосаэдрические вирусные частицы........................289
7. Квазнэквивалентность конформации субъединиц.............291
8. Олигомеры, содержащие субъединицы разных типов .... 296
Д. Кооперативные изменения конформации......................297
1. Неравноценное связывание субстрата и индуцированное соответ-
ствие .......................................................297
2. Образование олигомеров....................................298
3 Равновесия связывания для димеризующегося белка . . . 299
4 Олигомеры более высокого порядка........................ 303
5. Гемоглобин.................................................304
6. Аллостерические регуляторы.................................313
7, Сравнительная биохимия гемоглобина; аномальные гемоглобины 314
Е. Мышцы....................................-..................317
1. Структурная организация поперечнополосатой мышцы . . . 318
2. Сокращение в немышечных клетках............................326
Ж- Самосборка макромолекулярных структур ... ... 326
Вопросы и задачи . ............................................331
Оглавление 407
Список литературы ... ........................., 334
Дополнение 4-А Микротрубочки и действие колхицина .... 276
Дополнение 4-Б. Жгутики бактерий............................281
Дополнение 4-В. Вирусы......................................286
Дополнение 4-Г. Серповидноклеточнаи анемия..................314
Дополнение 4-Д. Т-четные бактериофаги.......................327
Глава 5
Мембранные и клеточные оболочки (перевод С. Н. Пре-
ображенского) .........................................337
А. Строение мембран............................................338
1. Модель строении мембраны в виде липидного бнслои . . . 338
2. Искусственные мембраны......................................340
3. Липидные компоненты мембран................................341
4. Физические свойства мембран, обусловленные наличием в них
липидов.......................................................342
5. Две стороны мембраны........................................351
6. Мембранные белки............................................352
Б. Метаболизм и функции мембран ................................355
I. Текучесть мембранных компонентов............................356
2. Транспорт молекул через мембраны...........................357
3. Проведение нервных импульсов...............................369
В. Антигены и рецепторы на поверхности клетки..................372
il. Антигены групп крови.......................................375
2. Антигены гистосовместимости................................378
3. Белковые агглютинины (лектины).............................378
4. Связывание антител с клеточными поверхностями .... 385
5. Рецепторы гормонов.........................................386
Г. Строение клеточных стенок бактерий................... . 388
1. Стенка грамотрицательных бактерий...........................390
2. Тейхоевые кислоты...........................................394
Д. Стенки растительных клеток...................................395
Вопросы и задачи ...............................................397
Список литературы..............................................399
Дополнение 5-А. Времена релаксации в спектроскопии магнитного
резонанса.....................................................344
Дополнение 5-Б. Спектры электронного парамагнитного резонанса
(ЭПР) и спиновые метии........................................348
Дополнение 5-В. Ионы щелочных металлов.........................362
Дополнение 5-Г. Антибиотики....................................367
Дополнение 5-Д. Кальций........................................372
Дополнение 5-Е. Антитела.......................................381
Дополнение 5-Ж. Комплемент.....................................387
Д. Мецлер
биохимия
Том 1
Научный редактор Н Н Шафрановская
Мл. науч. ред. 3. В. Соллертинская
Художник Ю С Урманчеев
Художественный редактор Б. Н. Юдкин
Технический редактор Л. П. Бирюкова
Корректор В. И. Постнова
ИБ № 1881
Сдано в набор 20 09.79. Подписано к печати 02.01.80.
Формат 70X108’/ie. Бумага типографская № 1.
Гарнитура литературная. Печать высокая.
Объем 12,75 бум. л. Усл печ. л. 35,70. Уч.-изд. л. 33,52.
Изд 4/0299 Тираж 25000 экз.
Зак. 1821. Цена 2 р. 80 к.
ИЗДАТЕЛЬСТВО «МИР»
Москва, 1-й Рижский пер , 2.
Московская типография № 11 Союзполиграфпрома
при Государственном комитете СССР по делам
издательств, полиграфии и книжной торговли.
Москва, 113105, Нагатинская ул , д. I.
Опечатки, отмеченные в общей таблице опечаток (3-й том) исправлены в тексте.
Отсканировал Семенкченко Владимир
chem_vova@mail.univ.kiev.ua; vovaS 00 2@mail.ru