Автор: Кудряшов Ю.Б.
Теги: ядерная, атомная и молекулярная физика физика биофизика
ISBN: 5-9221-0388-1
Год: 2004
Текст
УДК 539.16
ББК 22.383
К 88
Кудряшов Ю. Б. Радиационная биофизика (ионизирующие
излучения) / Под ред. В.К. Мазурика, М.Ф. Ломанова. — М.:
ФИЗМАТЛИТ, 2004. - 448 с. - ISBN 5-9221-0388-1.
В учебнике последовательно описываются этапы развития лучевого по-
поражения биологических систем от первичной стадии поглощения энергии
ионизирующих излучений биомолекулами до гибели клетки и организма.
Специальная глава посвящена вопросу единиц измерения доз и мощностей
доз облучения биологических объектов и систем. Значительное внимание
уделено современным представлениям о механизмах действия ионизирую-
ионизирующих излучений на клетку и организм в больших и малых дозах. Проблема
радиационной биофизики в настоящее время особенно актуальна в связи с
последствиями чернобыльских событий и других радиационных аварий, а
также острой необходимостью освоения читателем биологических и меди-
медицинских аспектов действия ионизирующих излучений на живые организмы
и человека.
Для студентов биологов, медиков, физиков, химиков, специализирую-
специализирующихся по радиационной биологии и медицине, а также тех, кто работает на
АЭС, на предприятиях и в учреждениях, использующих источники ионизи-
ионизирующих излучений и людей, проживающих в условиях повышенного фона
радиоактивности.
ISBN 5-9221-0388-1 © физматлит, 2004
ОГЛАВЛЕНИЕ
Предисловие автора 9
Введение 13
Глава I
Ионизирующие излучения, их характеристика,
дозиметрия и дозовые величины
1. Виды ионизирующих излучений, их энергия 35
2. Линейная передача энергии излучения 36
3. Международная система единиц СИ 37
4. Единицы активности радионуклидов и доз радиации 38
4.1. Активность радионуклида 38
4.2. Доза излучения (экспозиционная доза) 40
4.3. Доза облучения (поглощенная доза) 41
5. Методы дозиметрии 43
5.1. Метод ионизационной камеры 43
5.2. Калориметрический метод 43
5.3. Сцинтилляционный метод 44
5.4. Химические методы дозиметрии 44
6. Эквидозиметрия и концепция риска 44
6.1. Качество излучения 45
6.2. Эффективная доза облучения 47
6.3. Ожидаемые индивидуальные дозы 47
6.4. Концепция риска облучения 48
Глава II
Поглощение энергии ионизирующих излучений
1. Общий принцип Гроттгуса. Дискретный характер поглощения энер-
энергии ионизирующих излучений 54
2. «Энергетический парадокс» в радиобиологии 55
3. Относительная биологическая эффективность (ОБЭ) разных видов
ионизирующих излучений 56
4. Механизмы процессов поглощения энергии излучений 58
4.1. Поглощение рентгеновского и 7-излучений 58
ОГЛАВЛЕНИЕ
4.2. Поглощение нейтронного излучения 64
4.3. Ионизация в тканях косвенно ионизирующими частицами ... 66
4.4. Поглощение ускоренных заряженных частиц 68
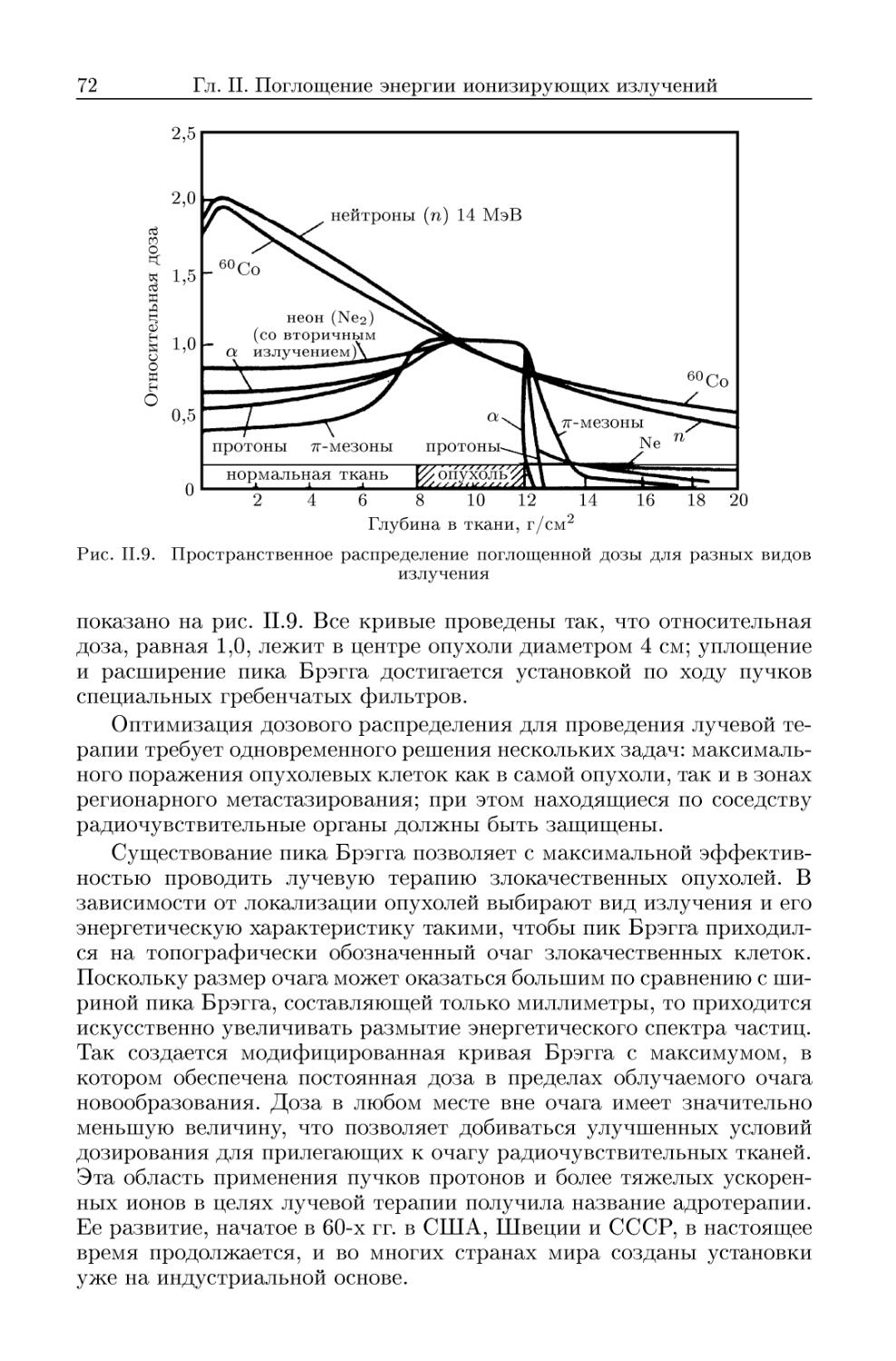
5. Пространственное распределение ионов 73
5.1. Ионизация в тканях при действии тяжелых заряженных ча-
частиц 75
5.2. Ионизация в тканях при действии ускоренных электронов . . 77
6. Локальные характеристики поглощения энергии веществом. Про-
Проблемы микродозиметрии (М. Ф. Ломанов) 78
6.1. Зависимость ОБЭ от локального распределения энергии излу-
излучения 81
6.2. Моделирование в микродозиметрии 84
Глава III
Зависимость биологического эффекта от поглощенной
дозы излучения
1. Принцип попадания и концепция мишеней 87
1.1. Зависимость «доза-эффект». Количественные закономерно-
закономерности 87
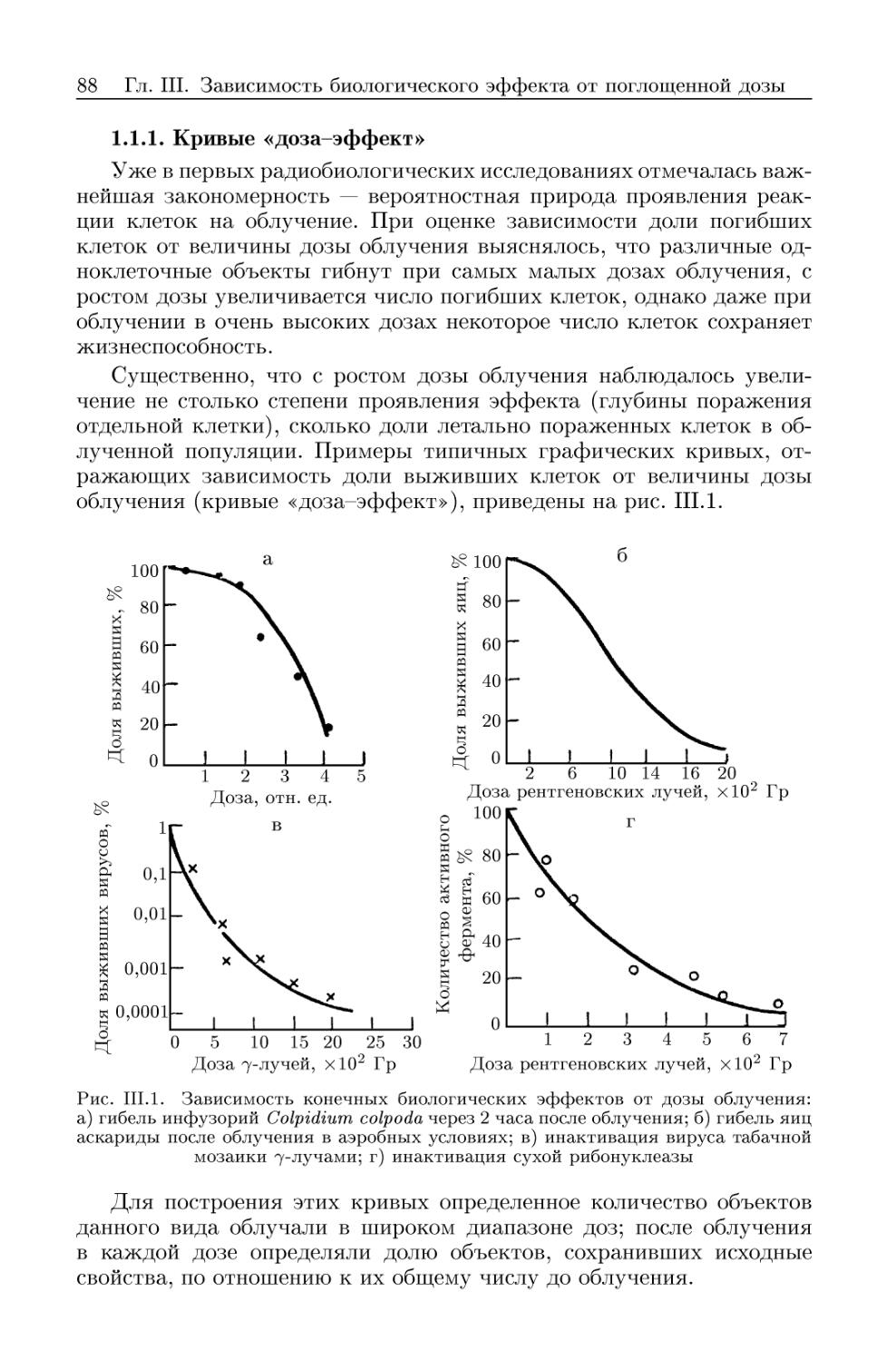
1.1.1. Кривые «доза-эффект» 88
1.1.2. Гипотеза «точечного нагрева» 90
1.2. Принцип попадания и концепция мишеней 92
1.2.1. Одиночные и множественные попадания в мишень 92
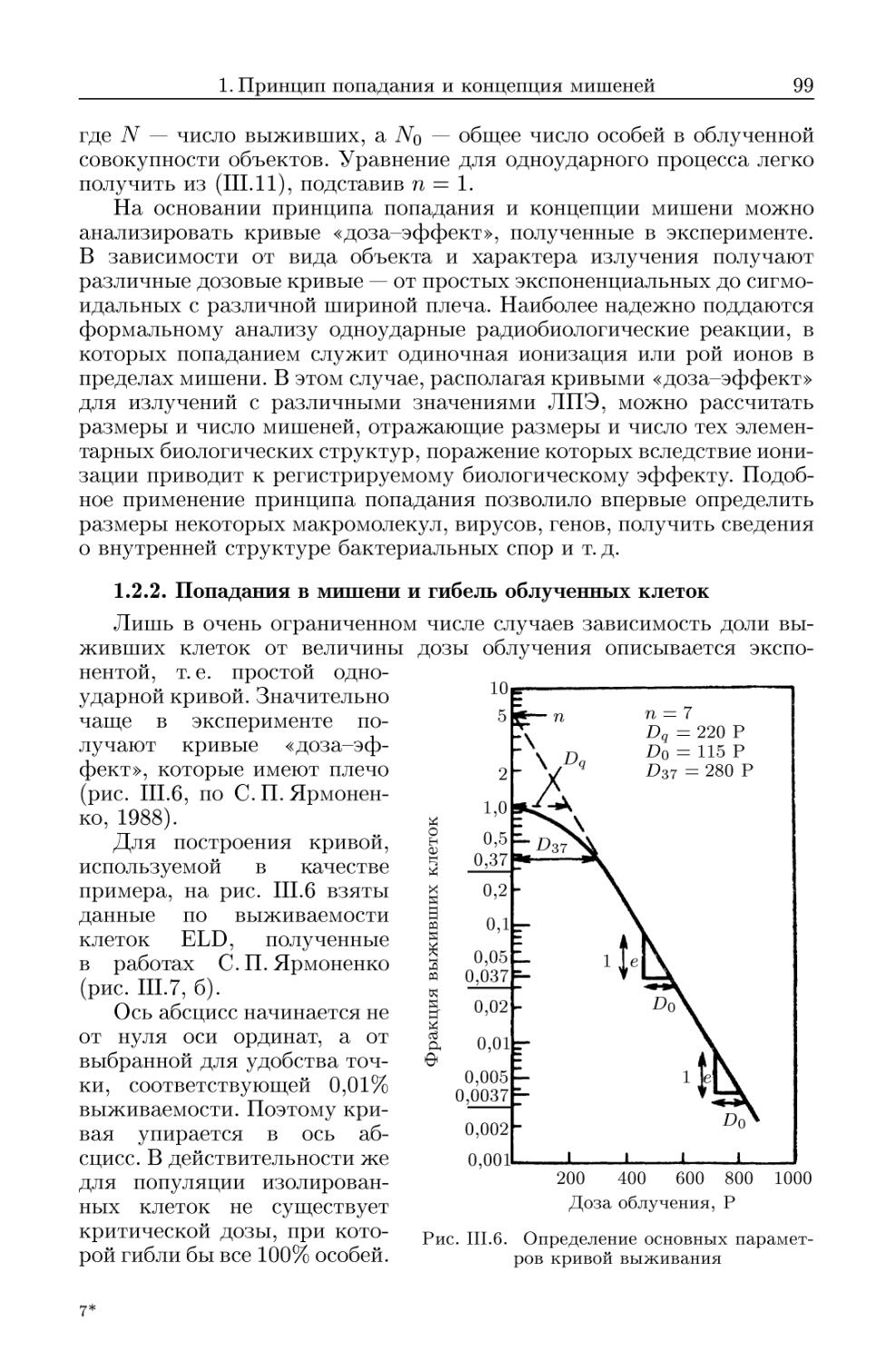
1.2.2. Попадания в мишени и гибель облученных клеток 99
2. Математическое моделирование радиобиологических эффектов
(С. В. Мамихин) 102
2.1. Краткое описание метода математического моделирования и
его применение в биологии 103
2.1.1. Типы моделей 104
2.1.2. Подтипы моделей 106
2.2. Специфика моделирования в радиационных исследованиях . . 108
2.3. Эволюция математических моделей, описывающих инактива-
инактивацию облученных клеток 110
2.4. Некоторые нетрадиционные подходы к построению радиобио-
радиобиологических моделей 112
2.4.1. Имитационное моделирование в радиобиологии 112
2.4.2. Стохастические модели, основанные на теории марковских
случайных процессов 113
2.5. Примеры построения радиобиологических математических мо-
моделей 115
2.5.1. Моделирование нарушений системы гемопоэза при лучевом
поражении 115
2.5.2. Клеточные модели, применяемые в радиотерапии 119
2.5.3. Разноуровневые («системные») модели 122
ОГЛАВЛЕНИЕ
Глава IV
Прямое действие ионизирующих излучений
1. О прямой и непрямой радиационной инактивации макромолекул . 126
2. О структурных повреждениях и радиационной инактивации макро-
макромолекул 127
3. Феноменологический анализ радиационного повреждения макро-
макромолекул 128
3.1. Прямое действие излучения на ферменты 129
3.2. Прямое действие излучения на нуклеиновые кислоты 132
3.2.1. Инфекционность нуклеиновых кислот 132
3.2.2. Трансформирующая активность 132
3.2.3. Затравочная активность ДНК 133
3.2.4. Способность ДНК к образованию гибридов с мРНК 133
3.2.5. Способность транспортных РНК связывать соответствующие
аминокислоты 134
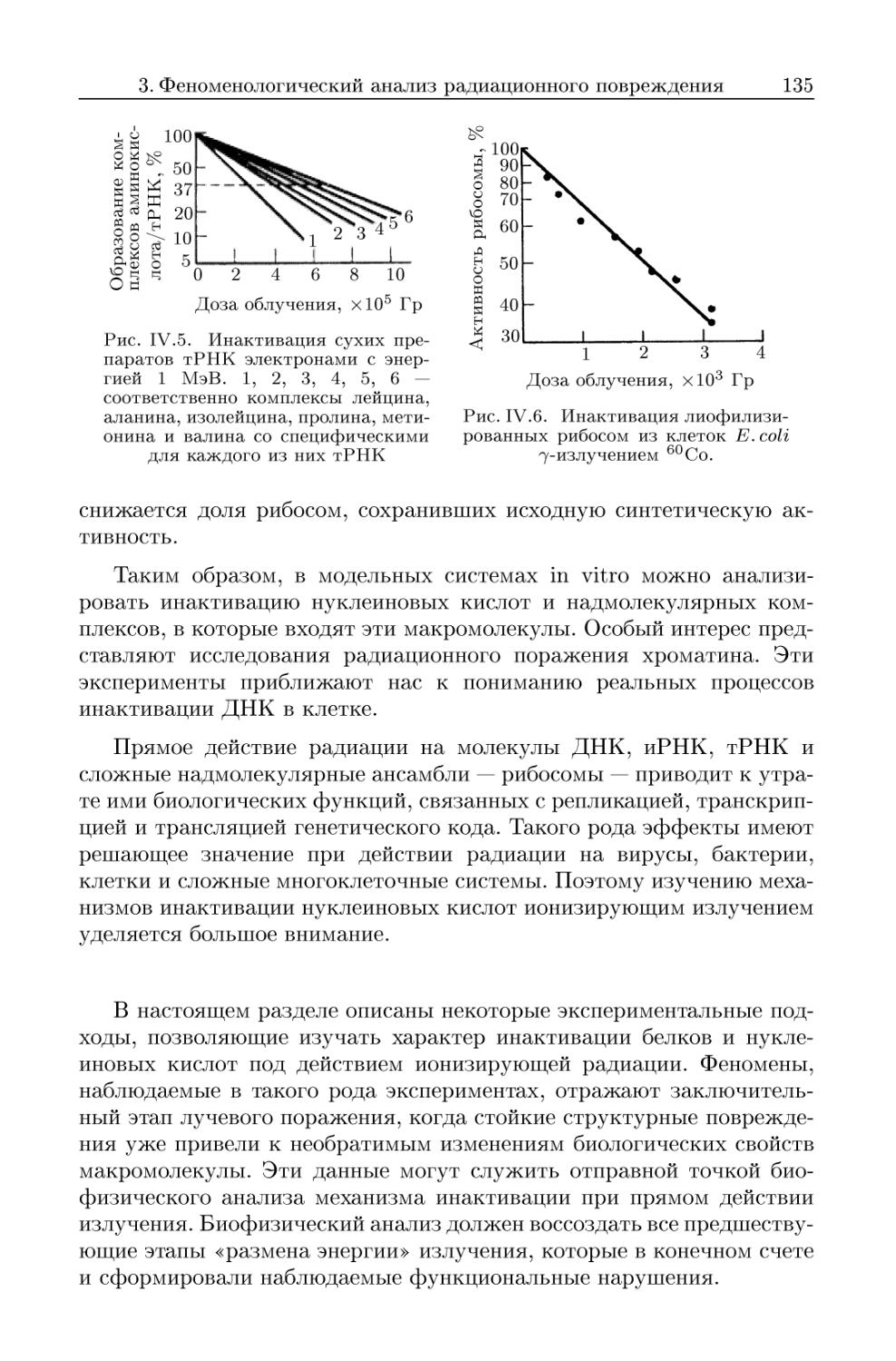
3.2.6. Функциональная активность рибосом 134
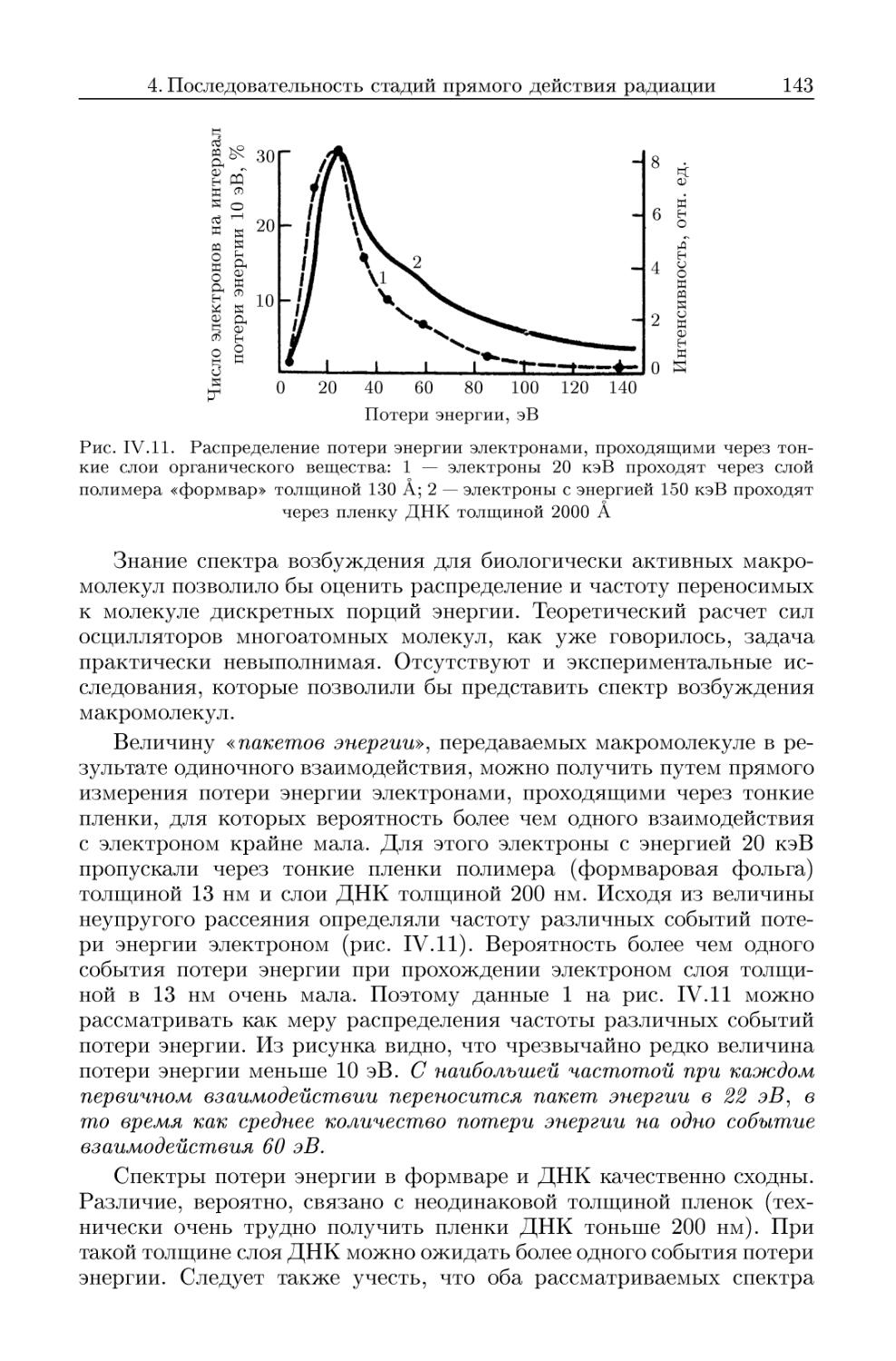
4. Последовательность стадий прямого действия радиации 136
4.1. Первичные физические процессы 137
4.1.1. Первичные продукты радиационного превращения молекул 139
4.2. Физико-химическая стадия действия излучения 144
4.2.1. Сверхвозбужденные молекулы 146
4.2.2. Ионизированные молекулы 146
4.2.3. Судьба электронов, испущенных молекулой 147
4.2.4. Последовательность образования промежуточных активных
частиц 148
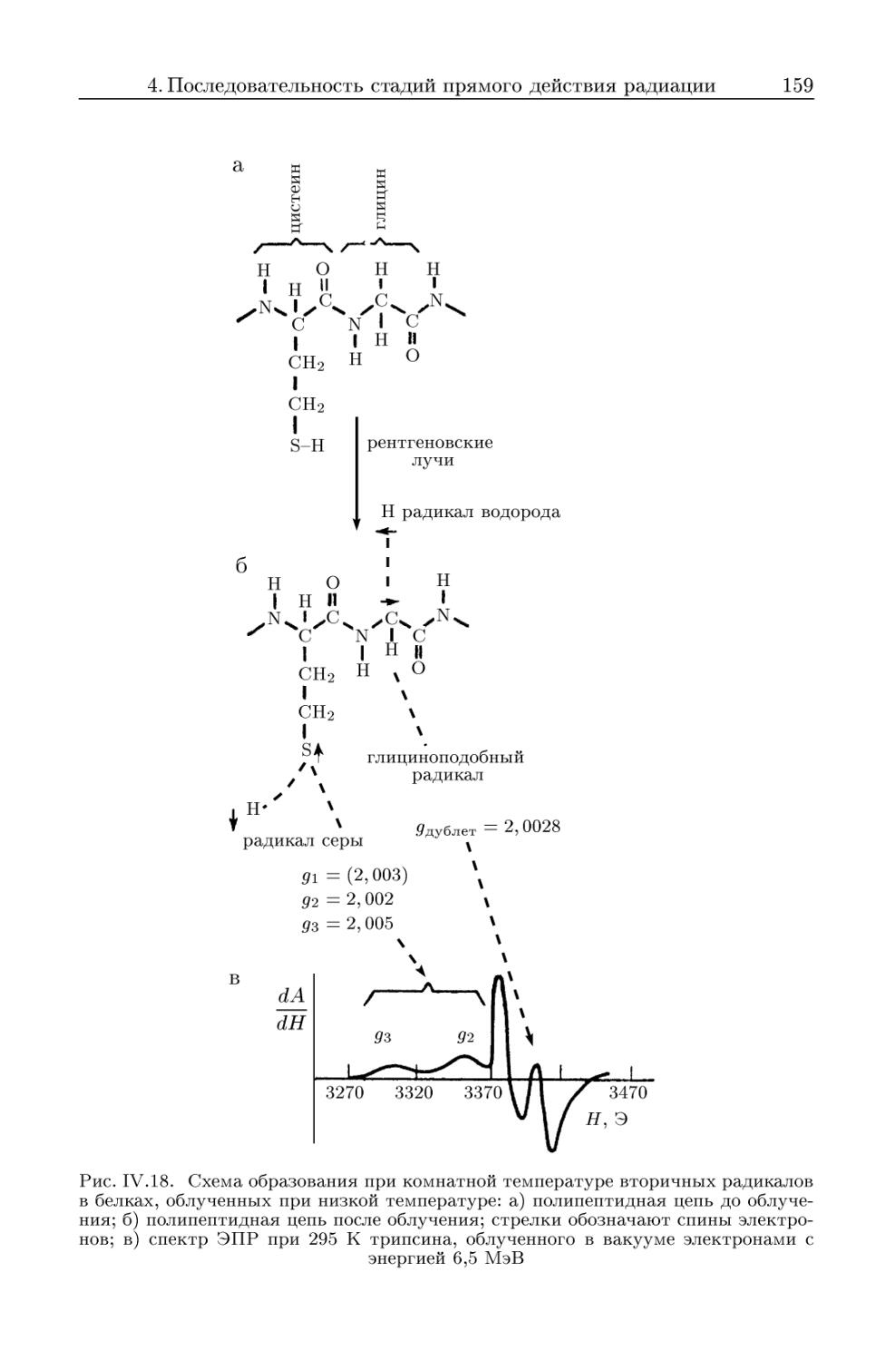
4.3. Химическая стадия 149
4.3.1. Структурные повреждения, возникающие в облученных ма-
макромолекулах 149
4.3.2. Миграция энергии излучения в биологических структурах . 157
5. Модификация лучевого повреждения макромолекул 160
5.1. Модифицирующее действие кислорода 161
5.1.1. Кислородное последействие 162
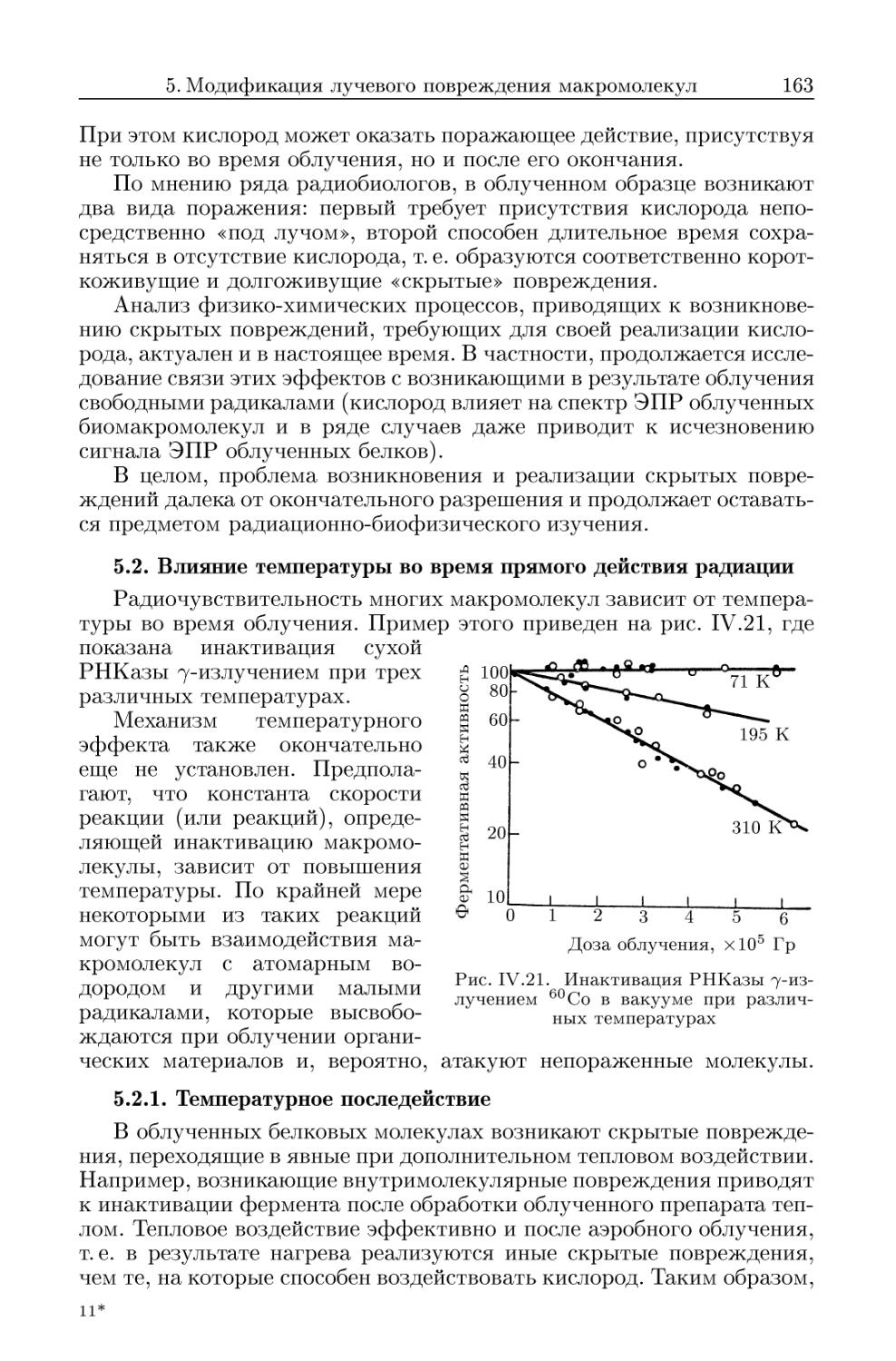
5.2. Влияние температуры во время прямого действия радиации . 163
5.2.1. Температурное последействие 163
5.3. Роль молекул-примесей 164
Глава V
Непрямое действие ионизирующего излучения
1. Общая характеристика непрямого действия ионизирующих излуче-
излучений на макромолекулы в водных растворах 169
2. Биофизический анализ радиационной инактивации молекул в рас-
растворах 171
2.1. Радиационно-химические превращения молекул воды 171
2.2. Роль продуктов радиолиза воды в инактивации биоорганиче-
биоорганических молекул 176
2.3. Реакции радикалов органических молекул, ведущие к образо-
образованию стабильных продуктов 178
ОГЛАВЛЕНИЕ
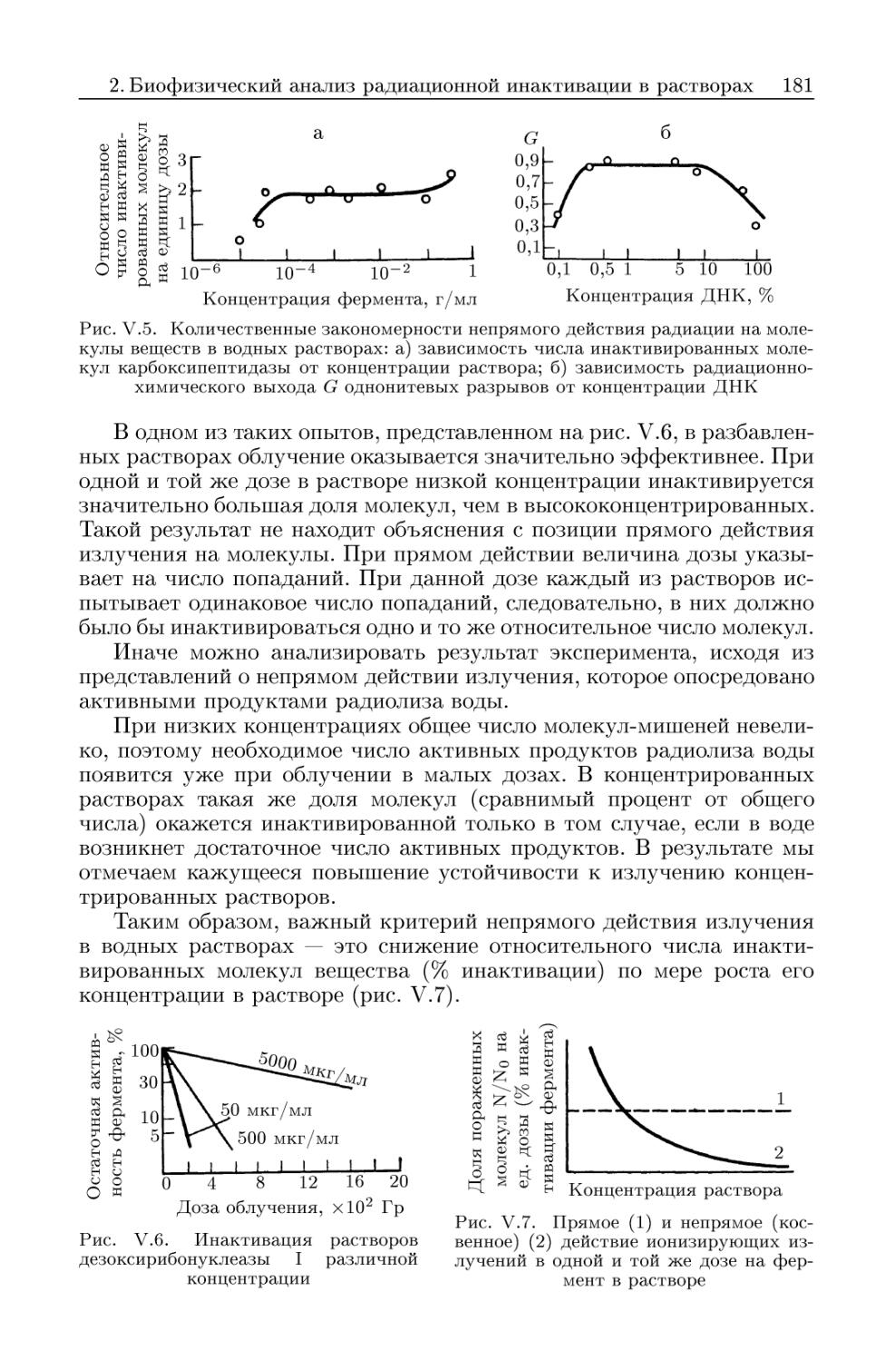
2.4. Количественные характеристики непрямого действия радиа-
радиации в водных растворах. Эффект Дейла 180
2.5. Модификация радиолиза молекул в водных растворах 182
3. Радиационно-обусловленные изменения и радиочувствительность
биоорганических молекул в растворах 185
3.1. Радиационно-обусловленные изменения молекул 185
3.1.1. Изменения белковых молекул (ферментов) 185
3.1.2. Радиационно-химические изменения нуклеиновых кислот . . 187
3.1.3. О радиационно-химических изменениях фосфолипидов ... 189
3.2. Радиочувствительность биомолекул 190
3.2.1. Радиочувствительность белков 191
3.2.2. Радиочувствительность нуклеиновых кислот 193
3.2.3. Радиочувствительность фосфолипидов 195
3.2.4. Сравнительная оценка радиочувствительности 196
4. Непрямое действие радиации в липидных растворах 197
4.1. Цепные свободнорадикальные реакции перекисного окисления
в облучаемых липидах 197
4.1.1. Стадия инициирования цепи 198
4.1.2. Стадия развития цепной реакции (продолжение цепи) .... 199
4.1.3. Стадия обрыва цепи 199
4.1.4. Коррекция цепных реакций 200
4.2. Роль свободных радикалов липидов в непрямом эффекте инак-
инактивации биоорганических молекул 201
Глава VI
Реакции клетки на действие ионизирующих излучений
1. От изолированных молекул к клетке 206
2. Об усилении первичных молекулярных повреждений 210
3. Прямое и непрямое действие излучений в клетках 211
4. Свободные радикалы в облученной клетке и методы их определения 214
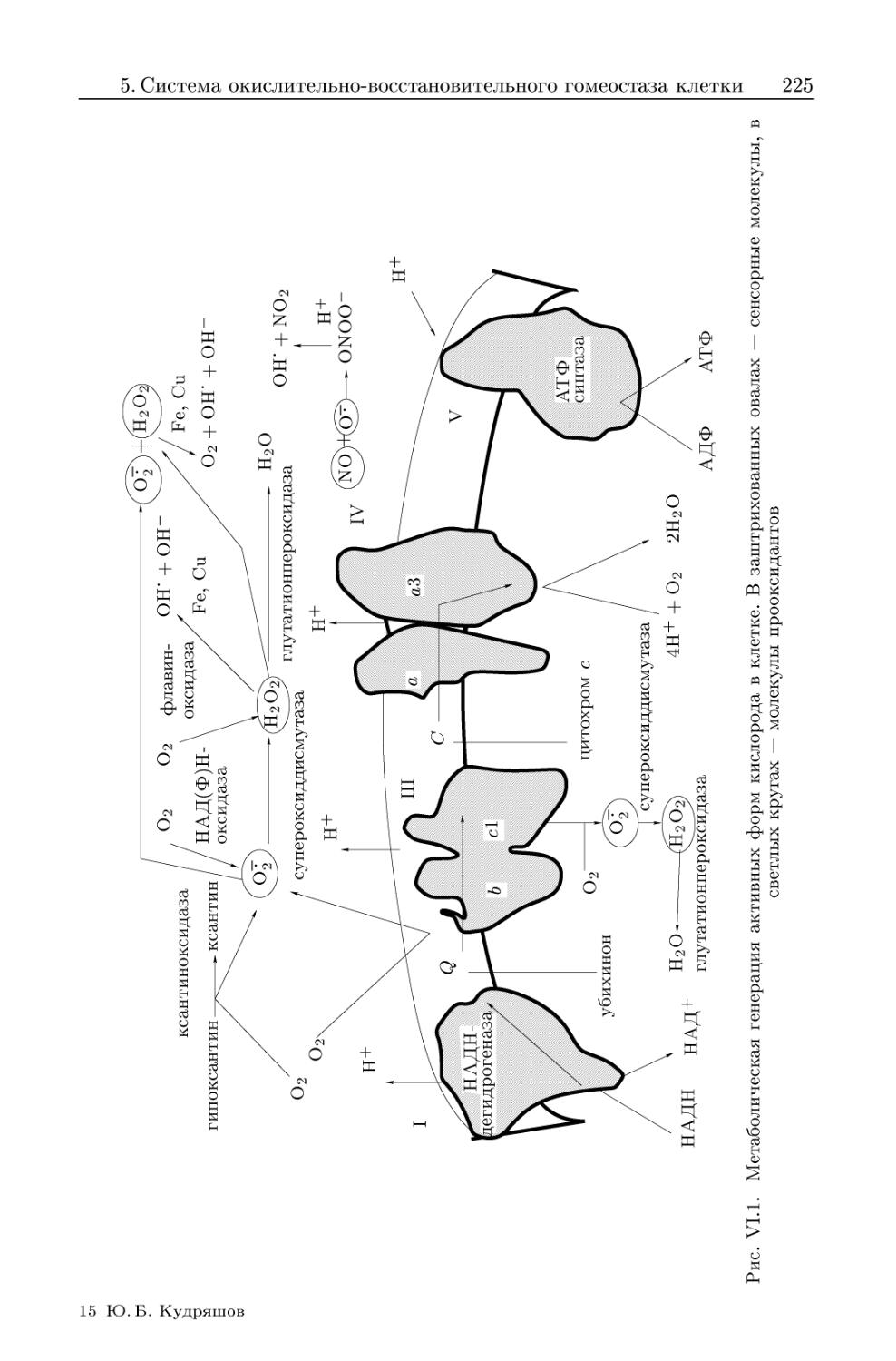
5. Система окислительно-восстановительного гомеостаза клетки и ее
изменения после облучения 220
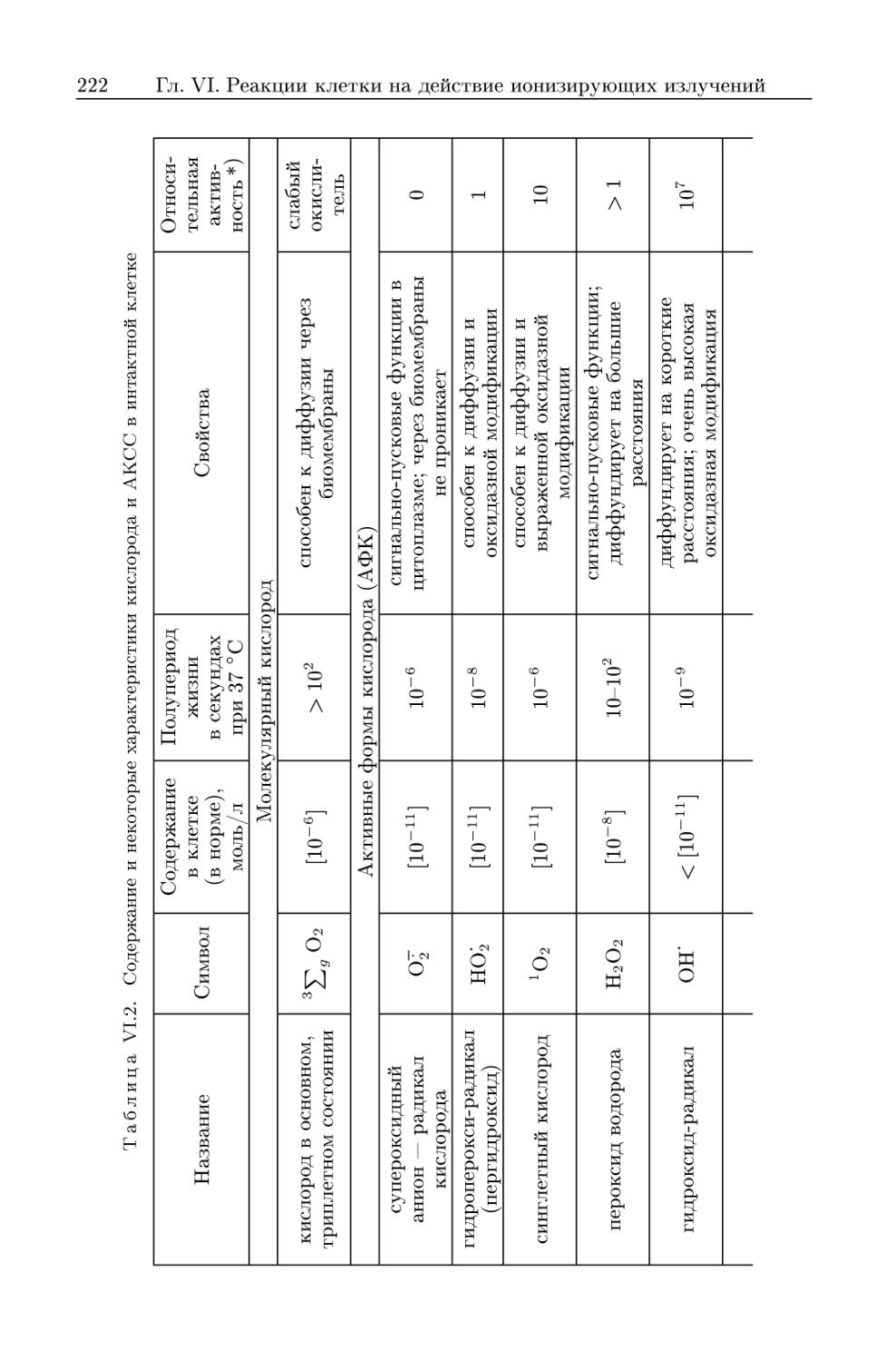
5.1. Активные кислород-содержащие соединения — образование и
биологическое действие в клетке в норме и после облучения . 221
5.1.1. Активные формы кислорода 224
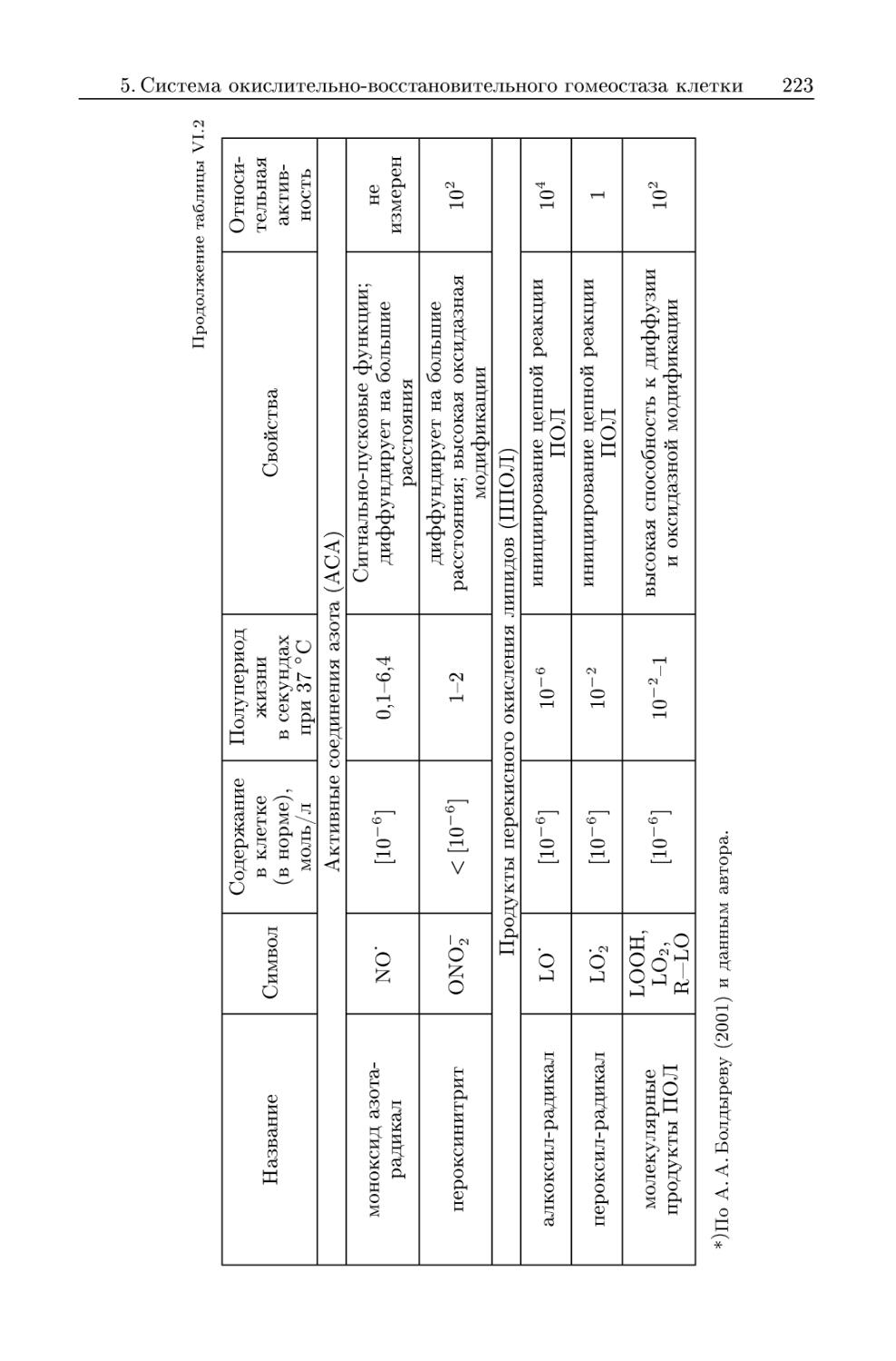
5.1.2. Активные соединения азота 229
5.1.3. Продукты цепных реакций перекисного окисления липидов 232
5.1.4. Окислительные процессы в облученной клетке 238
5.1.5. Радиотоксины 239
5.1.6. Оксиаддукты ДНК 242
5.2. Антиокислительные механизмы защиты облученной клетки . 243
5.2.1. Снижение содержания молекулярного кислорода и АФК . . 243
5.2.2. Снижение уровня и активности радиотоксинов 247
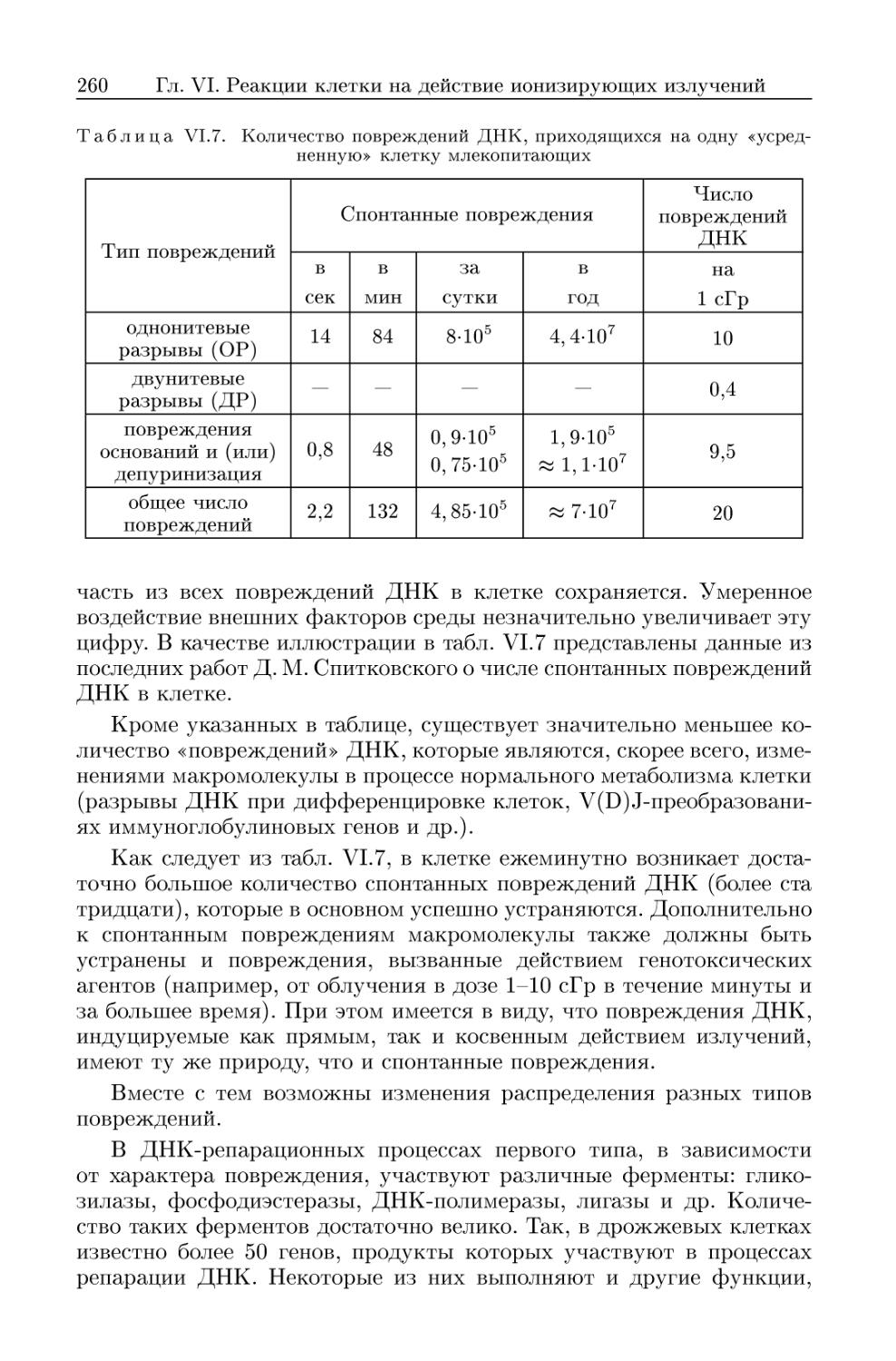
6. Повреждения и процессы восстановления ДНК в облученной клетке 250
6.1. Повреждения ДНК 251
6.1.1. Повреждения ДНК при внешнем облучении клетки 252
6.1.2. Повреждения ДНК при внутреннем облучении 252
6.2. Репарация ДНК от повреждений 254
ОГЛАВЛЕНИЕ
6.2.1. Ранние исследования 255
6.2.2. Репарация ДНК от повреждений в облученной клетке
(Д. М. Спитковский) 259
6.3. Некоторые представления о надежности генома 264
6.4. Повреждения и процессы восстановления ДНК-мембранного
комплекса в облученной клетке (Н. Ю. Кудряшова) 265
6.4.1. Повреждения ДНК-МК 266
6.4.2. Процессы восстановления ДНК-МК 267
7. Механизмы гибели и процессы восстановления клеток от радиаци-
радиационного поражения 269
7.1. Два типа гибели облученных клеток — различия в зависимости
от стадии клеточного цикла 269
7.1.1. Репродуктивная и интерфазная гибель облученных клеток . 269
7.1.2. Модификация лучевого поражения клеток 272
7.2. О механизмах радиационной гибели клеток 275
7.2.1. Механизм некротической гибели клеток (некроза) 279
7.2.2. Механизмы апоптоза 280
7.2.3. Общий биологический закон самоликвидации — биологиче-
биологический смысл апоптоза 289
7.3. Процессы восстановления облученных клеток 290
Глава VII
Биологические эффекты малых доз ионизирующих
излучений. Отдаленные последствия облучений
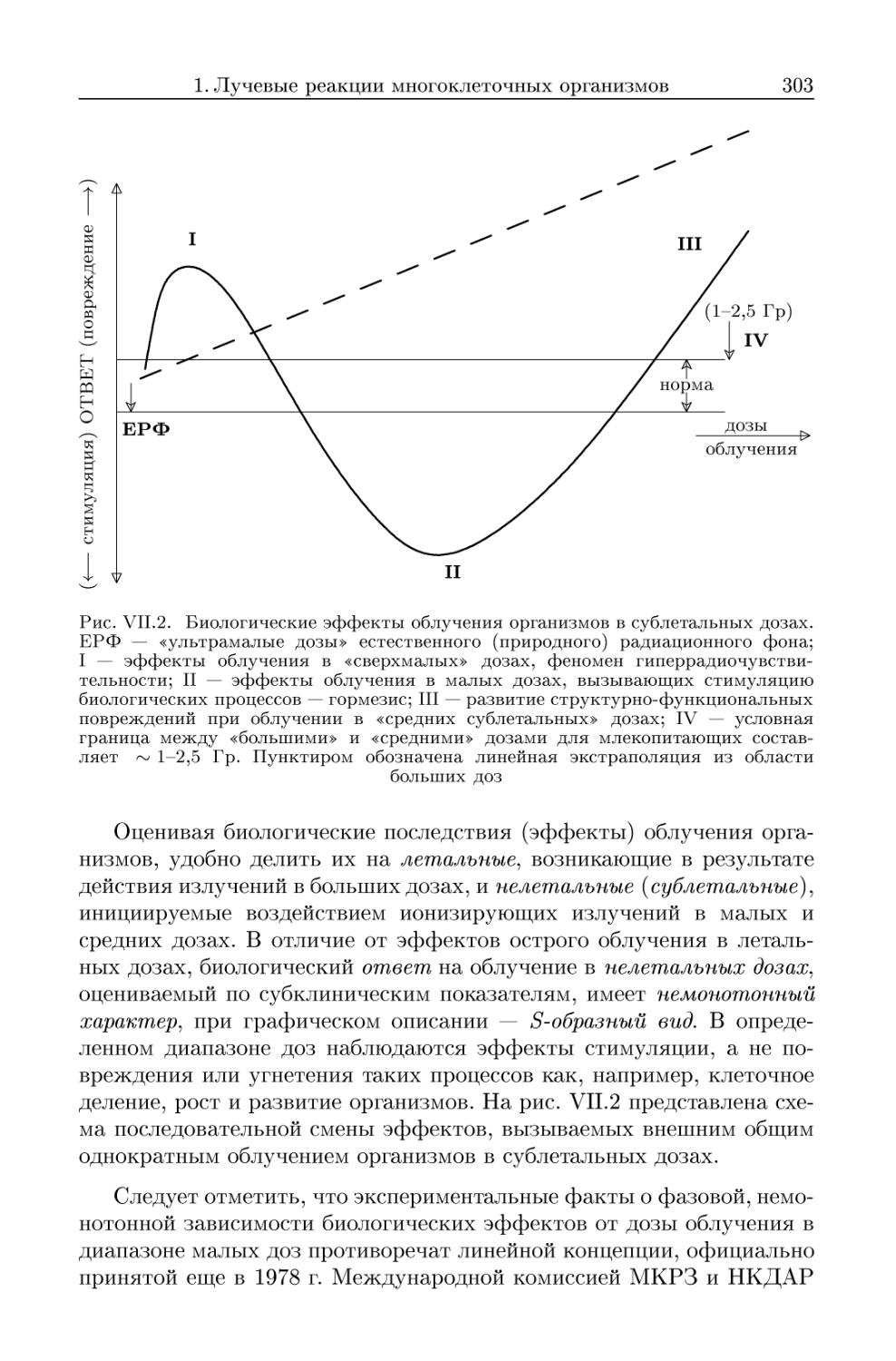
1. Лучевые реакции многоклеточных организмов 296
1.1. От больших (летальных) доз облучения к малым (нелеталь-
(нелетальным) дозам 296
1.2. Характеристика биологических эффектов облучения в малых
дозах 305
1.2.1. Значение ультрамалых мощностей доз естественного радиа-
радиационного фона 305
1.2.2. Эффект воздействия излучений в сверхмалых дозах. Гипер-
Гиперрадиочувствительность 307
1.2.3. Радиационный гормезис 308
1.3. Некоторые особенности действия радиации в нелетальных до-
дозах 310
1.3.1. Радиационно-индуцированный адаптивный ответ 311
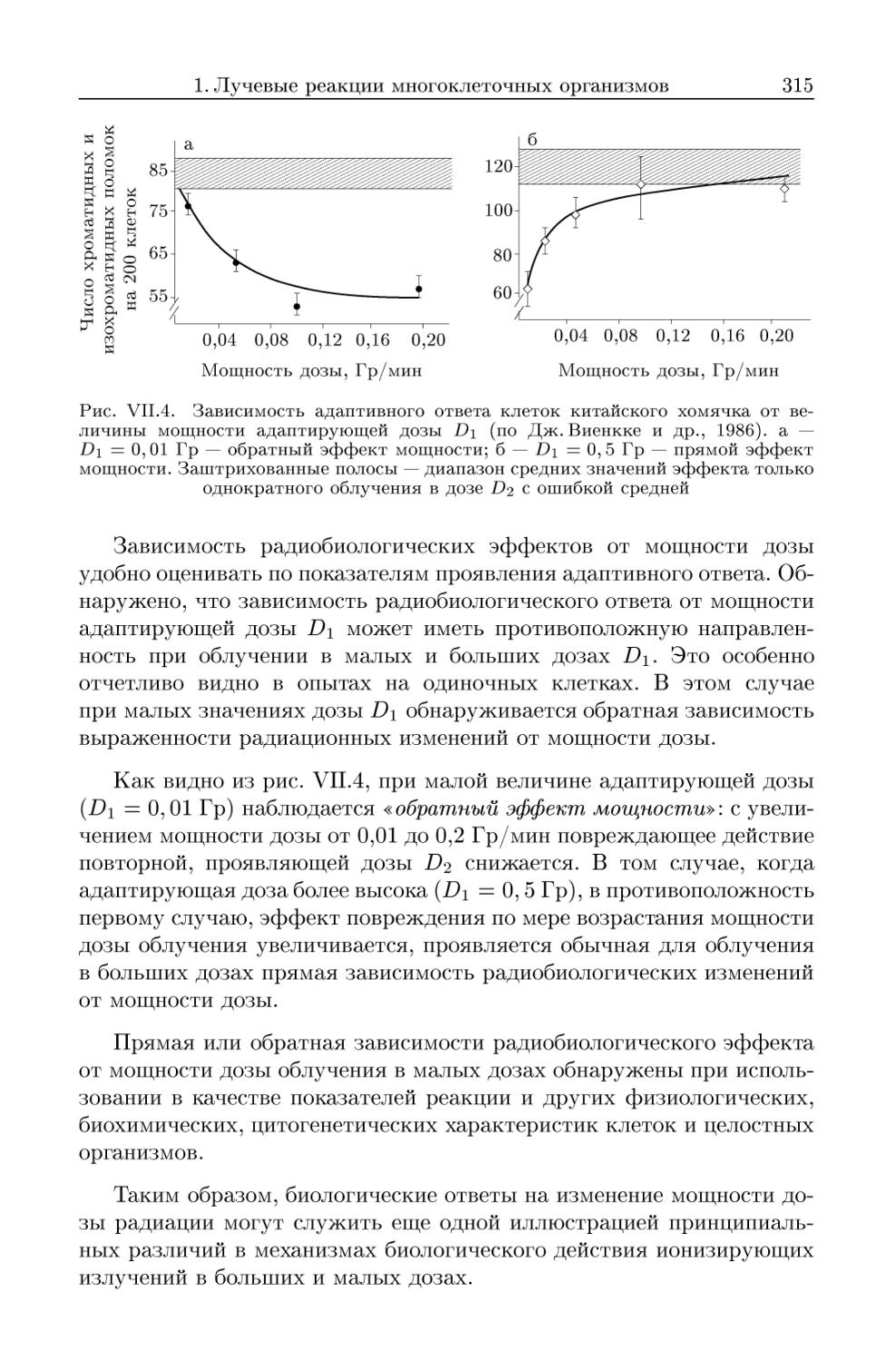
1.3.2. Зависимость наблюдаемых изменений от мощности дозы из-
излучения. Эффект Петко 313
1.4. Общая неспецифическая реакция организмов на облучение . . 316
1.4.1. Стресс 316
1.4.2. Синдром липопероксидации 318
1.5. Отдаленные последствия облучения организмов 319
2. О количественной оценке биологического действия излучений в
малых дозах 321
2.1. О биологических критериях (показателях), используемых для
оценки эффектов малых доз 323
ОГЛАВЛЕНИЕ
2.2. Биофизический подход в оценке диапазона малых доз по
характеру поглощения энергии излучений (Д. М. Спитков-
ский) 329
2.2.1. Анализ прохождения частицы через гетерогенную структуру
клетки 330
2.2.2. Диапазоны доз, отличающихся по событиям поглощения
энергии (малые, низкие и средние дозы) 333
3. Механизмы действия ионизирующих излучений в малых дозах на
клетки 339
3.1. Мембраны в механизме действия радиации в малых дозах . . 341
3.1.1. Биологические мембраны — особый принцип организации
структур в живых системах 341
3.1.2. Радиочувствительность мембран. Гиперрадиочувствитель-
Гиперрадиочувствительность 342
3.1.3. «Эффект свидетеля» («bystander effect») 346
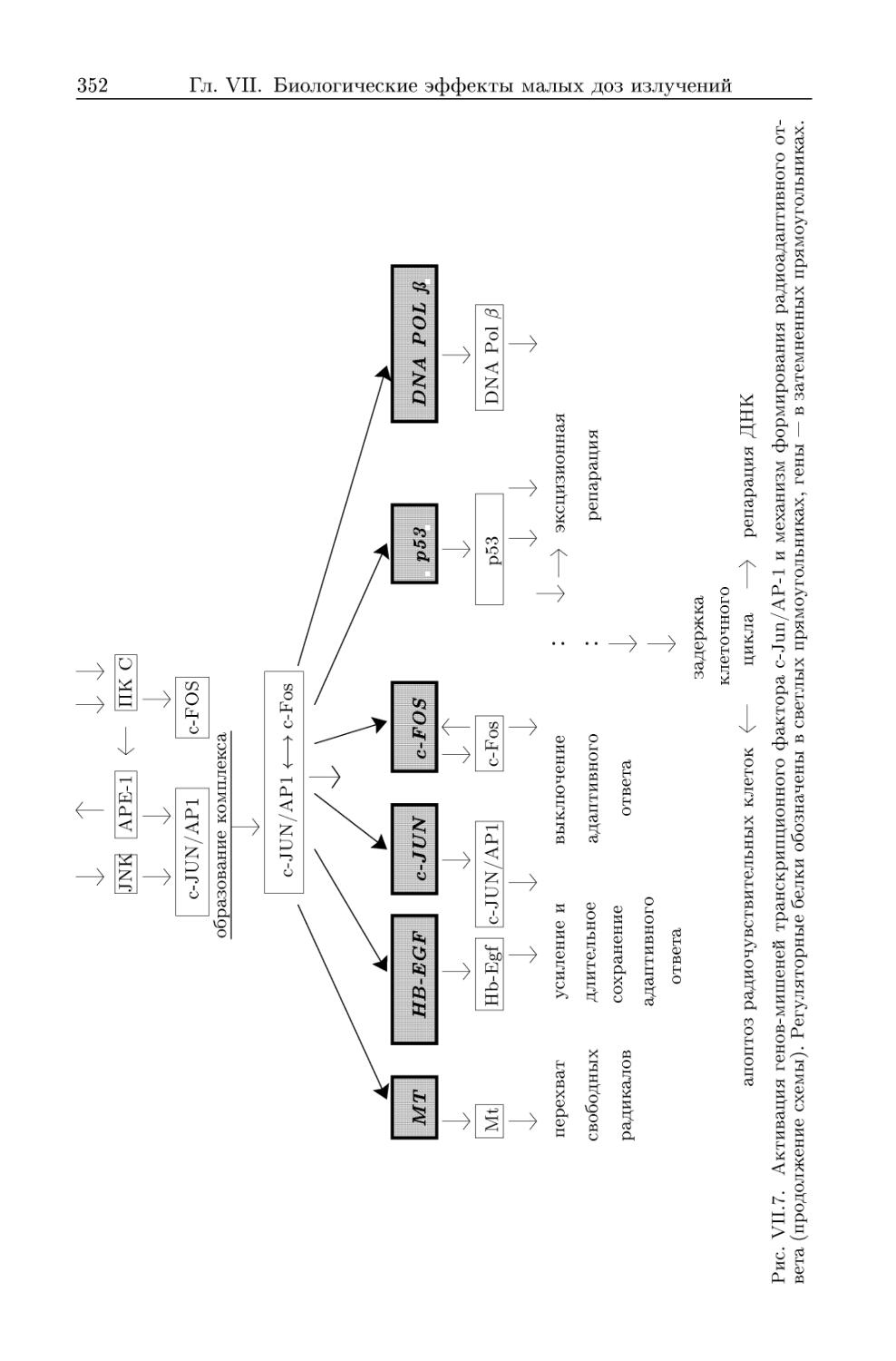
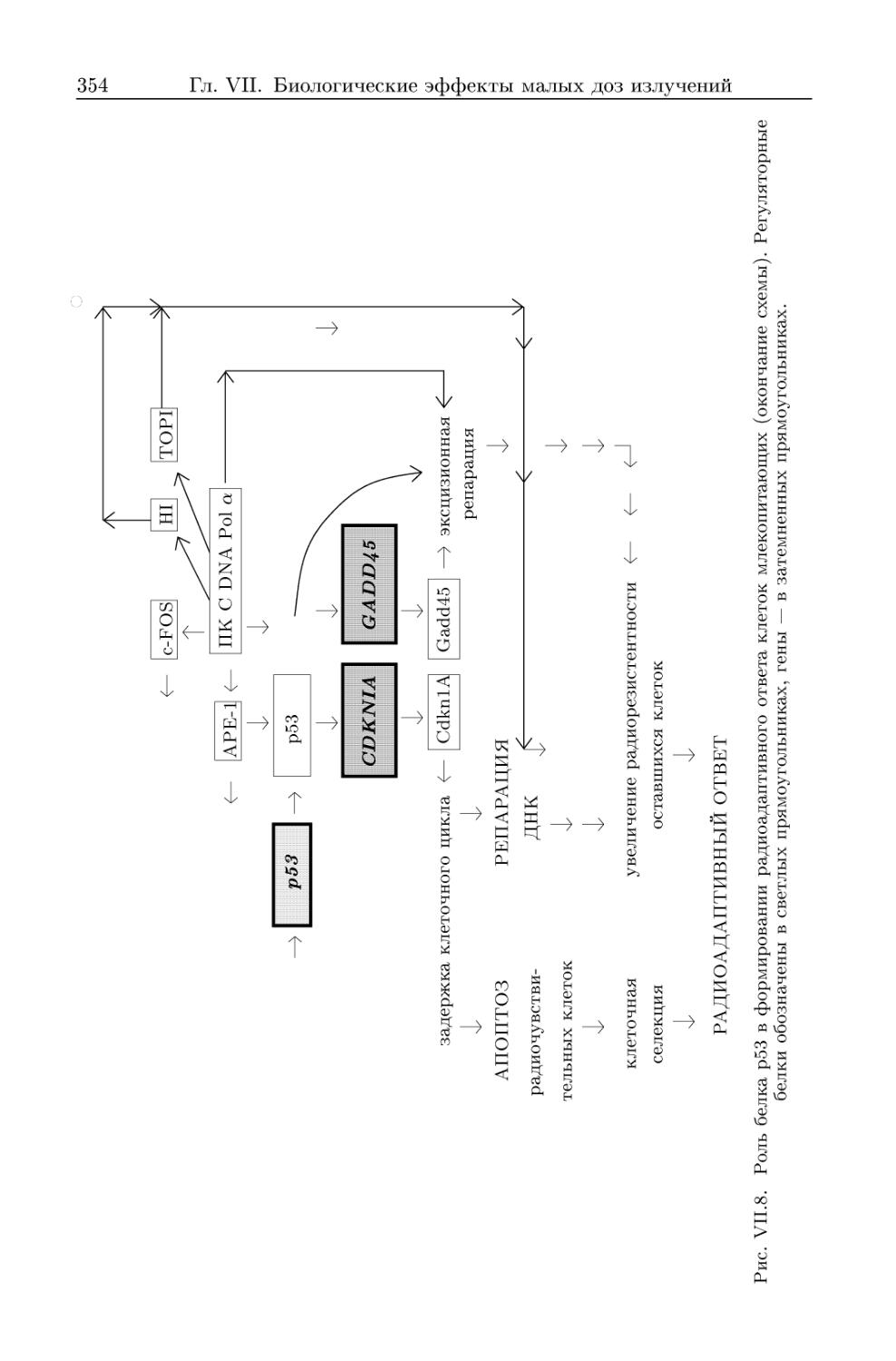
3.1.4. Мембранный механизм индукции радиоадаптивного ответа . 348
3.2. Неспецифическая реакция биомембран и клеток на действие
ионизирующих излучений 356
3.2.1. Неспецифическая реакция биологических мембран 356
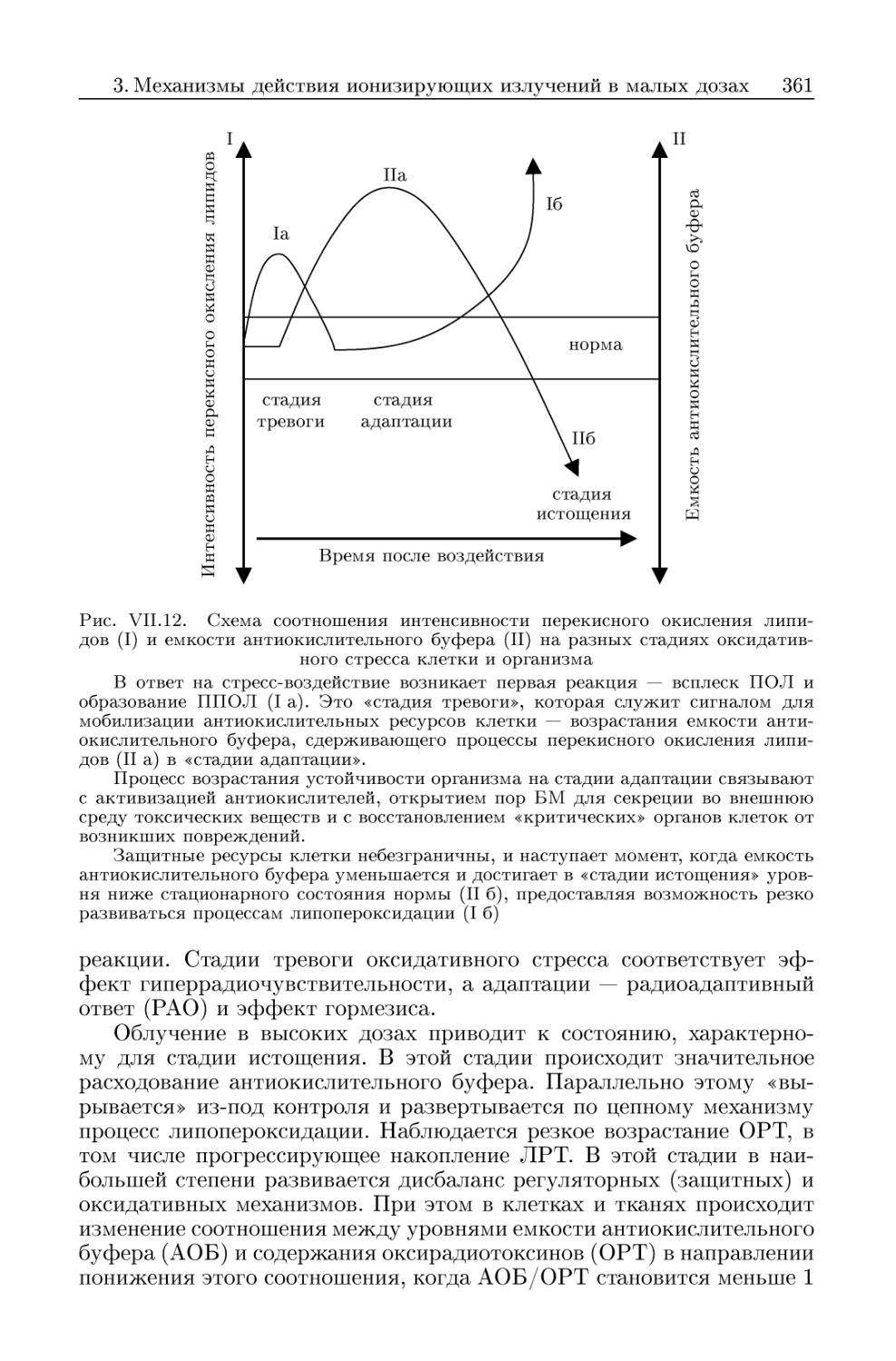
3.2.2. Стадии неспецифической оксидативной реакции клетки . . . 360
4. Радиационно-индуцированная нестабильность генома (В. К. Мазу-
Мазурик, В. Ф. Михайлов) 362
4.1. Варианты проявления нестабильности генома 363
4.1.1. Соматические клетки и спонтанные мутации 363
4.1.2. В-лимфоциты — представители клеток с функциональной
нестабильностью генома 366
4.1.3. Перманентная (генетически наследуемая) нестабильность ге-
генома 367
4.2. Характеристика некоторых проявлений радиационно-индуци-
руемой нестабильности генома 368
4.2.1. Эпигенетическое наследование при радиационно-индуциро-
ванной нестабильности генома 369
4.2.2. Возможная роль «эффекта свидетеля» 371
4.2.3. Механизмы реализации нестабильности генома 374
4.3. Биологическое значение радиационно-индуцированной неста-
нестабильности генома 377
Заключение 379
Рекомендованная литература 394
Материалы международных конгрессов, съездов, конференций по
радиобиологии 414
Список сокращений, символов и некоторых условных терминов .... 417
Предметный указатель 421
Указатель имен 440
Предисловие автора
Настоящий учебник содержит фактический материал, апробиро-
апробированный мною в результате преподавания радиационной биофизики,
начиная с 1953 г. — года становления кафедры биофизики на био-
биологическом факультете Московского государственного университета
им. М. В. Ломоносова. За этот полувековой период была организована
лаборатория радиационной биофизики, постоянно проводился радио-
радиобиологический практикум и читались общие и специальные курсы лек-
лекций по биофизике, радиобиологии и радиоэкологии в МГУ и во многих
других отечественных и зарубежных университетах и институтах.
В связи с отсутствием учебной литературы остро чувствовалась
необходимость в радиобиологических и биофизических учебниках и
учебных пособиях. Поэтому в 1962 и 1964 гг. были впервые изданы
Практикумы по радиобиологии [29, 168], а в 1979 и 1982 гг. — лек-
лекции [30] и учебник [31] по радиационной биофизике. Мой ученик и
соавтор Борис Семенович Беренфельд уехал преподавать биологию в
Гарвардский университет, и я с грустной благодарностью вспоминаю
сейчас то время, когда мы, полные энтузиазма, работали над создани-
созданием учебника.
Итак, прошло два десятилетия со времени написания предыдущего
учебника. Других учебников по радиационной биофизике в миро-
мировой литературе не выходило*).
Невольно задаешься вопросом — много это или мало — прошедшие
двадцать лет?
Для написания современного учебника — очень много, так как за
это время произошли принципиально важные события, открывшие
новый, современный период в истории радиобиологии. Прежде всего
к ним можно отнести открытия в области молекулярной и клеточной
биологии и поворот радиобиологии к малым «техногенным» дозам ра-
радиации, возникший вследствие радиоэкологического кризиса на нашей
планете.
Не останавливаясь здесь на многих исключительно важных при-
приоритетных достижениях радиобиологии и радиационной биофизики,
которые внесли крупный вклад в фундаментальную биологию (они
подробно изложены в данной книге), отмечу лишь то, что скромный
*) Очень важным и своевременным в радиобиологическом образова-
образовании была публикация в трех изданиях A977-1988) учебника профессора
С. П. Ярмоненко «Радиобиология человека и животных» [71].
10 Предисловие автора
вклад нашей лаборатории радиационной биофизики и кафедры био-
биофизики сумел успешно пройти проверку временем. Например, приори-
приоритетные исследования лаборатории: гипотезы «радиотоксинов» A956-
1987), «эндогенного фона радиорезистентности и общей резистентно-
сти» A980—2002). И, конечно, речь идет о триумфе идей покойного
профессора Бориса Николаевича Тарусова — моего дорогого учителя
и друга, основателя кафедры биофизики, выдвинувшего и развившего
(в период 1954-1962) теорию первичных цепных механизмов лучевого
поражения.
Еще двадцать лет назад эти идеи продолжали с трудом проби-
пробивать себе дорогу, а сейчас и вопрос о ключевой роли липопероксида-
ции («липидных радиотоксинов») в лучевой патологии и стрессе, и
непрямое действие излучений посредством липидных оксирадикалов,
и участие «эндогенного фона» в формировании устойчивости био-
биологических объектов и систем к ионизирующим и неионизирующим
воздействиям, и роль биологических мембран (БМ) уже в качестве
«критической мишени» заняли в радиобиологии достойное место.
Беспристрастное его величество Время расставило свои акценты
в радиобиологии, вдохнув в нее также и новое мышление о нели-
нелинейности процессов в живой системе. Пожалуй, первый фунда-
фундаментальный в этом направлении шаг сделала общетеоретическая на-
наука — термодинамика, провозгласив нелинейность и неравновесность
открытых систем. Ответ живой материи на возмущения, в том числе
и на действие ионизирующих излучений, выход ее из стационарного
состояния также происходит по нелинейным законам.
Последние экспериментальные достижения молекулярной биоло-
биологии и радиобиологии позволили переосмыслить укоренившееся ранее
представление о линейной зависимости биологических эффектов от
дозы облучения («т. е. большие дозы вызывают сильные повреждения,
а малые дозы — якобы те же, но менее значительные повреждения»).
Исследования эффектов малых доз показали качественно иной и немо-
немонотонный характер системного биологического ответа на облучение,
в отличие от действия высоких летальных доз ионизирующих излу-
излучений. Необычно высокая чувствительность при сверхмалых дозах
(«эффект колокола»), противоположный, стимулирующий эффект
радиации («гормезис») и «адаптивный ответ», «обратный эффект»
мощности доз, квазилучевое действие секретируемых облученными
клетками в микросреду токсических веществ («эффект свидетеля»),
нестабильность генома и отдаленные последствия облучений — все
это открыло новый мир изменений живой системы в ответ на
низкоинтенсивные ионизирующие излучения.
Однако и нелинейная термодинамика не все смогла предусмот-
предусмотреть. В классическом варианте она рассматривает только тепловые
эффекты. С ее позиций оказалось невозможным объяснить, напри-
например, энергетический парадокс в радиобиологии, характер поглощения
энергии ионизирующих излучений биологическими структурами и их
ответные реакции на воздействия.
Предисловие автора 11
Учитывая все сказанное, становится понятным необходимость и
своевременность описания последовательности лучевых изме-
изменений на разных уровнях организации живой материи и по-
попытки выстроить воедино основные принципы радиобиологии.
Этим задачам посвящен настоящий учебник.
Приведенный в данном учебнике список рекомендуемой литерату-
литературы, как это можно видеть, делится на основную и общую библиогра-
библиографию. Знакомство с основной литературой поможет читателю расши-
расширить круг вопросов, изложенных в главах учебника. Дополнительная
литература — библиография включает книги и оригинальные статьи,
знакомство с которыми позволит углубить специальные вопросы ра-
радиационной биофизики, биохимии и генетики, радиоэкологии и общей
радиобиологии при выполнении задач на практикумах, а также курсо-
курсовых, дипломных и диссертационных работ. Считаю, что предлагаемая
библиография может оказаться полезной для любого специалиста-
радиобиолога и биофизика. В конце библиографии приведен выбороч-
выборочный перечень основных международных форумов по радиобиологии,
материалы которых создают представление о безусловно громадном
интересе мировой науки к важным проблемам радиобиологии
на разных этапах ее развития с середины прошлого столетия.
Написание учебника потребовало привлечения специалистов-про-
специалистов-профессионалов разных, подчас далеких друг от друга областей знания.
Многие любезно согласились внести свою лепту в данную книгу. Я сер-
сердечно благодарю за это следующих моих глубокоуважаемых коллег:
профессора Виктора Константиновича Мазурика, взявшего на себя
тяжелый и кропотливый труд научного редактора учебника и напи-
написавшего совместно с профессором В.Ф.Михайловым раздел «Неста-
«Нестабильность генома»;
профессора Михаила Федоровича Ломанова, редактировавшего
первые три «физические главы» книги; очень уместным считаю кри-
критически осмысленный им материал по микродозиметрии — дисципли-
дисциплины, которая пыталась создать базу для взаимного обмена идеями
между физикой и радиобиологией (все успехи или неудачи этого
направления ощутимо отражаются сегодня на решении насущных
практических вопросов);
профессора Давида Михайловича Спитковского, написавшего важ-
важные фрагменты по биофизической оценке малых доз ионизирующих
излучений, а также по лучевым изменениям и репарации классической
радиобиологической мишени — ДНК;
профессора Сергея Витальевича Мамихина за его раздел «Матема-
«Математическое моделирование в радиобиологии»; «легкое перо» его компью-
компьютера и необычайно четкое и критическое выполнение задачи вселяло
в меня дух оптимизма и веры в более полный охват многогранной
работы. В данном разделе он особо подчеркнул, что последние 20 лет
периода ускоренного развития компьютерных технологий оказали
большое воздействие на радиобиологические исследования и анализ их
результатов. Широкая доступность информационно-вычислительных
12 Предисловие автора
средств придала новый импульс применению такого традиционного
для радиационной биофизики метода как математическое моделиро-
моделирование. Вместе с тем наблюдается и определенное отставание в данной
области, связанное как со спецификой радиационных исследований,
так и с рядом проблем иного рода. Все это нашло отражение в упомя-
упомянутом разделе настоящего учебника.
Благодарю также кандидата биологических наук Нину Юрьевну
Кудряшову, предоставившую материал по ДНК-мембранному ком-
комплексу и его изменениям при лучевом поражении клеток.
Особую благодарность выражаю заведующему кафедрой биофи-
биофизики биологического факультета МГУ члену-корреспонденту РАН РФ
А. Б. Рубину за многолетнюю высоко профессиональную и дружескую
помощь в напряженной педагогической работе и творчестве; без такой
помощи работа над учебником была бы невозможна.
Выражаю глубокую благодарность зам. директора института
биохимической физики РАН РФ, председателю научного Совета РАН
по радиобиологии, члену-корреспонденту РАЕН РФ, профессору
Е. Б. Бурлаковой за постоянное внимание и поддержку. Совместная с
нею работа в Совете являлась мощным положительным стимулом в
моей научной деятельности.
Искренне благодарю также многих моих близких, друзей и коллег:
профессора Е. Н. Гончаренко, которая является постоянной помощ-
помощницей и соавтором многих совместных радиобиологических работ;
благодарю ее за многократный и тщательный просмотр рукописи
данного учебника и чрезвычайно важные советы;
профессора И. И. Пелевину, добрые замечания и советы которой
всегда очень помогали при работе над книгой;
профессоров и преподавателей О.И.Василенко, А. А. Касьяненко,
О. Р. Колье, И. Н. Острецова, Г. Ю.Ризниченко, К.Н.Тимофеева,
Д. С. Чернавского, В. А. Шарпатого за ценные замечания при про-
прочтении фрагментов рукописи учебника;
кандидатов биологических наук, моих учеников, старших научных
сотрудников Л.И.Деева и А.Г.Платонова за обсуждение отдельных
фрагментов учебника;
студента С.Ю.Перова и, конечно, моего внука Александра Шило
(еще школьника) за помощь в компьютерном оформлении некоторых
рисунков к учебнику, а также
коллектив издательства ФИЗМАТЛИТ».
Выход в свет этого учебника совпадает с юбилейными датами — 50-
летия кафедры биофизики биологического факультета B003) и 250-ле-
тия Московского государственного университета им. М.В.Ломоносо-
М.В.Ломоносова B005). Хочется верить, что этот учебник послужит своевременным
вкладом в общий мощный поток университетского образования.
Введение
Радиационная биофизика — научная дисциплина, изучающая мо-
молекулярные механизмы биологического действия ионизирующих и
неионизирующих излучений, выясняющая последовательную картину
изменений, начиная от поглощения энергии радиации отдельными мо-
молекулами до сложных биологических изменений в клетке и организме.
По существу, радиационная биофизика решает радиобиологические
проблемы с позиций биофизики, так как радиобиология изучает вли-
влияние излучений на биологические объекты и системы, а биофизика —
молекулярные взаимодействия, лежащие в основе нормальных жиз-
жизненных явлений и патологии.
Данный учебник посвящен радиационно-биофизическим механиз-
механизмам действия ионизирующей радиации.
Ионизирующие излучения являются наиболее изученной частью
широкого спектра электромагнитных излучений, встречающихся в
природе или генерируемых искусственными источниками, созданными
в результате деятельности человека. Место, занимаемое ими в указан-
указанном спектре, а также основные свойства их даны в табл. 1, где в виде
краткой схемы представлена область электромагнитного спектра из-
излучений от 7-лучей до низкочастотных радиоволн, указаны основные
физические параметры излучений и генерирующие их источники.
Что касается биологических эффектов, вызываемых излучениями,
представленными в табл. 1, то, как уже отмечено, в настоящее время
наиболее полная информация получена по действию ионизирующих
излучений, а также ультрафиолетового и видимого света. Расширя-
Расширяется фронт исследований механизмов действия инфракрасного, длин-
длинноволнового электромагнитного излучений и «нулевых», т. е. постоян-
постоянных электрических и магнитных полей.
Интерес физиков и биологов к различным типам излучений офор-
оформился в виде таких научных разделов, как радиационная биология
ионизирующих излучений, фотобиология (изучается действие опти-
оптического спектра, например фотосинтез, фотопериодизм, фотодинами-
фотодинамический эффект) и электромагнитная биология (исследуются эффекты
радиации радиочастотного диапазона).
Различные виды электромагнитных и корпускулярных излуче-
излучений — важнейший инструмент познания живой материи. Современ-
Современная биология немыслима без методов рентгеноструктурного анализа,
ультрафиолетовой, видимой и инфракрасной спектроскопии, радио-
радиоспектроскопии, лучевой ультрамикрометрии, световой, электронной
14
Введение
sjsj
к
а;
сб
I
о
о
со
•I-
•I-
со
•I-
о
1—1
•I-
CO
О
о
•I-
00
о
К CD
? P
s
4
1
u W ffl
Введение 15
и протонной микроскопии, широкого использования радиоактивных
изотопов. В последнее время принципиально новые методические усо-
усовершенствования (использования радиоактивных индикаторов, при-
применение рентгеноэлектронной и атомной спектроскопии, селективной
ион- и масс-спектрометрии, криоэлектронной томографии клетки и
других современных методов) создали основу для высокочувстви-
высокочувствительной и специфической идентификации лабильных биологических
структур, в том числе оксирадикалов и оксиаддуктов с биомакромо-
биомакромолекулами в норме и патологии. Большинство наиболее впечатляющих
успехов в познании структуры и свойств живой материи достигнуто
благодаря широкому внедрению методов исследований радиационной
биофизики. Решение этой проблемы требует комплексного подхода,
основанного, с одной стороны, на учете физических принципов переда-
передачи энергии излучений, их дискретной природы и характера взаимодей-
взаимодействия с атомами и молекулами биологических структур, а с другой —
на знании уникальных особенностей структурной и функциональной
организации живого.
Как видно из табл. 1, ионизирующие излучения составляют узкий
участок электромагнитного спектра. Это наиболее коротковолновые,
высокочастотные излучения, кванты которых несут огромную энер-
энергию, достигающую многих тысяч и миллионов электрон-вольт. Благо-
Благодаря своим физическим свойствам, они обладают высокой проника-
проникающей способностью через вещество, и поэтому такие ионизирующие
излучения часто называют «проникающей радиацией». Термин «иони-
«ионизирующие излучения» выбран для наименования разнообразных по
физической природе типов излучений для того, чтобы подчеркнуть
наиболее характерное, общее их свойство — способность непосред-
непосредственно или косвенно ионизировать атомы и молекулы поглотителя.
К ионизирующим излучениям относят электромагнитные и кор-
корпускулярные излучения, энергия которых превышает величину «по-
«потенциала ионизации», т.е. 10-12 эВ. Электромагнитные ионизирую-
ионизирующие излучения — это рентгеновское излучение, а также 7~излучение
радионуклидов. Оптический спектр излучений и радиоволны тоже от-
относятся к электромагнитным излучениям, но они называются неиони-
зирующей радиацией, поскольку из-за присущей им низкой энергии (и
соответственно, высоких длин волн) не способны к ионизации молекул
и лишены высокой проникающей способности.
К корпускулярным излучениям относят заряженные частицы — /?-
частицы (электроны и позитроны); ядра атомов водорода (протоны),
дейтерия (дейтроны), гелия (а-частицы) и других элементов; ядерные
частицы, не имеющие зарядов — нейтроны, а также многие нестабиль-
нестабильные частицы, например, тг+, тг~ и тг° мезоны и др.
Актуальность исследований биологического действия ионизиру-
ионизирующих излучений продиктована многими научными и социальными
задачами.
16 Введение
Во-первых, известно, что все живое постоянно подвергается дей-
действию естественного радиационного фона A—2 мЗв/год), который со-
составляют космическая радиация и излучения радиоактивных элемен-
элементов, залегающих в поверхностных слоях земной коры и входящих в
состав самих живых организмов и их продуктов питания.
Во-вторых, в связи с техногенной деятельностью человека, ядер-
ядерными взрывами и авариями на АЭС и атомных промышленных пред-
предприятиях радиационный фон во многих регионах нашей планеты зна-
значительно возрос. Если учитывать возможное экстремальное действие
ионизирующих излучений, особенно в сочетании с другими загрязне-
загрязнениями среды, то такие условия существенно сказываются на экологии
живой Природы и состоянии здоровья и жизни человека. Поэтому воз-
возникла необходимость развития исследований в области радиобиологии
и радиационной экологии.
И наконец, хорошо известно значение ионизирующих излучений
как диагностического и терапевтического средства при многочислен-
многочисленных заболеваниях. Применение и дальнейшие разработки радиацион-
радиационной терапии невозможны без глубоких знаний в области радиобиоло-
радиобиологии и радиационной биофизики — механизмов взаимодействия излу-
излучений с веществом и лучевых изменений клеток, тканей и целостного
организма.
Радиобиология — это комплексная наука. Она требует объеди-
объединенных усилий физиков, химиков, математиков, медиков, биофизи-
биофизиков, молекулярных биологов, представителей различных классиче-
классических биологических направлений. В связи с этим в настоящее время
развиваются многие направления: радиационная экология и генетика,
радиационная биохимия и цитология, радиационная медицина и гиги-
гигиена. В ряду этих исследований особое место принадлежит радиацион-
радиационной биофизике, так как ее основная задача — выяснение физико-хи-
физико-химических и молекулярных механизмов первичных процессов лучевых
изменений, протекающих с момента возникновения ионизированных и
возбужденных атомов и молекул до появления видимых структурных
и функциональных изменений. Для решения такой задачи необходим
углубленный анализ процессов, происходящих на каждом этапе «раз-
«размена энергии» излучения в живой системе, описание этих этапов в
терминах молекулярных изменений и создание единой картины, отра-
отражающей всю последовательность реакций, приводящих, в зависимости
от дозы облучения, к лучевым изменениям или лучевому поражению.
Чтобы определить круг задач, стоящих перед современной радиаци-
радиационной биофизикой, следует рассмотреть основные исторические пе-
периоды развития радиобиологии, становление и развитие радиацион-
радиационной биофизики и появление конкретных направлений в исследовании
биологического действия ионизирующей радиации, многие из которых
продолжаются и поныне.
Радиобиология — это наука XX века. Время ее рождения определя-
определяется открытием Х- (рентгеновских) лучей, радиоактивности и первы-
первыми упоминаниями их действия на живой организм. В декабре 1895 г.
в Германии заведующий кафедрой физики физического факультета,
Введение 17
ректор Вюрцбургского университета профессор Вильгельм Конрад
Рентген передал физико-медицинскому обществу первый рентгенов-
рентгеновский снимок кисти своей руки и рукопись на 17 страницах с изложе-
изложением об открытии катодных проникающих Х-лучей, которые вскоре
стали называться именем их открывателя. Уже в январе 1896 г. бро-
брошюра Рентгена под названием «Новый род лучей» вышла в свет на
русском, английском, французском и итальянском языках — открытие
быстро стало достоянием мировой общественности.
Открытие Рентгена стимулировало новые исследования в физике,
а также в биологии и медицине. В марте 1896 г. профессор физики
Парижского музея естественной истории Анри Беккерель обнаружил
новое явление — самопроизвольное испускание невидимых глазу про-
проникающих излучений (а-, /3- и 7-излучений), исходящих от солей ура-
урана. Через два года Мария и Пьер Кюри выделили из урановой смолы
ранее не известные элементы, так же, подобно урану, испускающие
излучения, которым они дали название радий и полоний. Для явления,
свойственного этим, а в последующем другим подобным элементам
был предложен термин радиоактивность.
Открытие урановых, а затем и ториевых лучей послужило началом
исследований естественной (природной) радиоактивности.
В дальнейшем, в 1934 г. Ирен и Фредерик Жолио-Кюри при ис-
исследовании ядерной реакции 27А1(а, пK0Р обнаружили образование
нового, не встречающегося ранее в природе радионуклида — фосфора
30Р. Так произошло открытие нового явления — искусственной
радиоактивности.
Открытия в физике нашли очень быстрый отклик в биологических
исследованиях. Дата рождения радиобиологии — начало 1896 года —
как видно, почти совпадает с датой открытия рентгеновских лучей. В
это время петербургский физиолог Иван Романович Тарханов (Тар-
ханишвили) провел первые исследования на лягушках и насекомых,
облученных лучами Рентгена, и пришел к выводу, что «Х-лучами
можно не только фотографировать, но и влиять на ход жизненных
функций» [328].
Другим пионером в радиобиологии был также наш соотечествен-
соотечественник Ефим Семенович Лондон, который начал в 1896 г. многолетние
широкие исследования по рентгенорадиологии и экспериментальной
радиобиологии.
Первая официальная информация о патологическом влиянии ра-
радиации на кожу была опубликована только в 1901 г. в работе П. Кюри
и А. Беккереля, в которой авторы сообщили, что неосторожное обра-
обращение с радием вызывало у них ожоги кожи.
Основной и очень важной задачей радиобиологии в то время
была необходимость точной количественной оценки дозы радиации.
Вполне понятно, что к необходимости дозировать излучения пришли
в первую очередь рентгенологи, вынужденные эмпирически устанав-
устанавливать хотя бы условные единицы биологических доз рентгеновских
лучей. Так появилась первая единица измерения дозы — Haut Erythem
2 Ю. Б. Кудряшов
18 Введение
Dosis (нем.) — HED — «кожно-эритемная доза»), которая регистри-
регистрировалась спустя несколько суток и недель после облучения.
Дозиметрия как раздел физики, задачей которого является
количественная оценка испускаемой (экспозиционной) и поглощенной
энергий излучения, а также активности радиоизотопов, появилась
значительно позднее. Отсутствие научно обоснованных дозиметров
и невозможность количественно оценивать дозы облучения, а также
незнание (или часто пренебрежение опасностью) было причиной
гибели первых рентгенологов от лучевой болезни, вызванной
интенсивным их облучением.
Понимая необходимость элементарных дозиметрических знаний,
Е. С. Лондон и его сотрудник врач-хирург СВ. Гольдберг проводили
экспериментальные исследования действия радия на себе. Вот описание
одного из таких наблюдений, проведенного в Институте экспериментальной
медицины в Петербурге. СВ. Гольдберг прибинтовал к своему предплечью
коробочку с 75 мг бромистого радия на 3 часа. После удаления препарата
участок кожи, соприкасавшийся с ним, оставался как бы интактным,
однако на 4-й день на этом месте появилось красное пятно. Постепенно
увеличиваясь в размерах, оно приобретало все более интенсивную окраску и
окаймлялось зоной нарастающей инфильтрации. Еще через 2 дня развился
некротический процесс, зона инфильтрации стала больше и к 14 дню
представляла собой некротическую язву, дно которой было покрыто
гноем и отторгающимися тканями. На 14-16 день после облучения начали
появляться новые очаги повреждения в местах, куда препарат радия не
был приложен (на подбородке, бедре, на другой руке). Эти эритемы имели
сходство по циклам развития с радиогенными. Облучая различные участки
кожи на себе, Е. С. Лондон пришел к выводу, что скрытый (латентный)
период кожного радиогенного дерматита, а также степень его выраженности
находятся в прямой зависимости от активности препарата и длительности
его действия.
В 1901 и в последующие годы появилось множество зарубежных
и отечественных работ о лучевом поражении кожи (дерматиты, эри-
эритемы, лучевые ожоги и язвы, выпадение волос), а в 1902 г. описан
первый случай лучевого рака кожи.
Постепенно стало выясняться, что проникающая радиация, будучи
невидимой и неощутимой, не только воздействует на кожу, но и вызы-
вызывает лучевое поражение внутренних органов и тканей, а также гибель
живых организмов и человека (эксперименты Е. С. Лондона в России,
Г. Хейнеке в Германии и др.).
В последующие годы обнаруживаются лучевые изменения различ-
различных биохимических процессов: нарушения активности ферментов в
органах и тканях, появление токсических веществ в крови (лейкоток-
синов). Таким образом, сведения о высокой биологической эффектив-
эффективности нового вида излучений стимулировало мощный взрыв радиобио-
радиобиологических работ, характеризующий начальный, описательный
период в истории радиобиологии.
Введение 19
Постепенно накапливаются данные о различии в устойчивости
отдельных облучаемых биологических объектов и систем к леталь-
летальному облучению и о высокой радиочувствительности процессов кле-
клеточного деления. В 1906 г. французские радиобиологи И. Бергонье
и Л. Трибондо сформулировали фундаментальный закон (правило)
радиочувствительности клеток: ионизирующее излучение оказывает
тем большее повреждающее действие на клетки, чем интенсивнее
те делятся и чем менее определенно выражены их морфология и
функция, т. е. чем менее они дифференцированны.
По мере накопления фактов становилось ясным, что ионизирую-
ионизирующие излучения, в зависимости от интенсивности источника радиации
и длительности облучения, способны вызывать повреждения и гибель
любого биологического объекта, любой биологической системы.
Начиная с 1910 г. М.И. Неменов и сотрудники публикуют работы
по выяснению изменений обмена веществ при лучевом поражении
и о сходстве лучевых изменений с процессами патологии раннего
старения. Появляются отдельные сообщения об угнетающем действии
облучения на иммунную систему, эмбриогенез, половые функции (бес-
(бесплодие). Все чаще появляются сведения о лучевом канцерогенезе.
Возникла необходимость обобщить накопившийся фактический
материал мировой литературы по радиобиологии и радиационной ме-
медицине.
Лейпцигское издательство выбрало для этой цели профессора
Е.С.Лондона. Первая в мире монография (Е.С.Лондон «Радий в
биологии и медицине») вышла в свет в 1911 г. на немецком языке,
а в 1968 г. переведена на русский язык в издательстве «Медицина».
Важное место в монографии занимают описание различной радио-
радиочувствительности биологических объектов и систем, первичных фи-
физиологических и биохимических процессов лучевого поражения, рас-
рассмотрение медицинских и биологических аспектов лучевой болезни,
практического применения радиации в медицине.
В 1918 г. в Петербурге был открыт первый в стране радиобио-
радиобиологический Государственный институт рентгенологии и радиологии,
организатором и директором которого стал известный рентгенолог
М.И. Неменов.
В 1925 г. была наглядно показана важная роль биохимических
процессов в развитии лучевого поражения. Анцель и Винтенбергер
в опытах на куриных эмбрионах обнаружили, что у облученного
эмбриона, помещенного в холодильник, радиационные нарушения не
проявляются, в отличие от выраженных их признаков, которые обна-
обнаруживаются у эмбриона, облученного в той же дозе, но находящегося
в инкубаторе. Выясняется, что интенсивность обменных процессов
оказывается основополагающей в формировании проявлений лучевого
поражения.
Это наблюдение позволило авторам предсказать участие трех су-
существенных моментов в развитии лучевого поражения:
- наличие первичного радиационного повреждения;
20 Введение
— существование факторов, способствующих усилению этого по-
повреждения;
- влияние восстанавливающих факторов.
Так постепенно формировалось представление, согласно которому
степень лучевого поражения определяется не только интенсивностью
первичного повреждения, но и физиологическим состоянием организ-
организма и характером метаболических процессов в нем.
Многочисленные исследования развития лучевого поражения орга-
организмов позволили радиобиологам прийти к общему выводу о том, что
для возникновения острой лучевой болезни должен произойти слож-
сложный комплекс взаимосвязанных изменений в организме, появление
которых зависит от величины дозы, характера и способа облучения,
от времени, прошедшего после лучевого воздействия и биологической
особенности организма (его радиочувствительности).
Попытки найти какое-либо действующее начало, специфическое
только для лучевого поражения, так и не увенчались успехом. Поиски
в облученном организме радиационно-индуцированных токсических
веществ (радиотоксинов) показали, что последние представляют со-
собой не что иное, как результат избыточного накопления продуктов
нормально протекающих процессов, усиленного действием облучения.
Исследование динамики и механизмов формирования биохимических
нарушений при лучевых поражениях заняло все дальнейшие годы
развития радиобиологии и позволило собрать ценнейший материал
для характеристики и классификации клинических проявлений ра-
радиационного эффекта.
Изучение ионизирующего действия проникающей радиации на эле-
элементарные единицы вещества, создание количественной дозиметрии
привело исследователей к установлению количественных принципов,
связывающих радиобиологические эффекты с дозой облучения. Этим
в 20-е годы XX в. был открыт следующий, второй период в разви-
развитии радиобиологии — период изучения механизмов действия
ионизирующих излучений на биологические объекты и си-
системы и полоснсено начало формированию количественной
радиобиологии.
Начались интенсивные поиски критических биологических молеку-
молекулярных и клеточных структур, а также органов и тканей облучаемых
организмов, ответственных за развитие лучевого поражения, ведуще-
ведущего к смертельному исходу. Одновременно шло изучение и анализ ко-
количественных закономерностей зависимости биологических эф-
эффектов от величины доз облучения.
В этот период произошло осознание одной из важнейших особенно-
особенностей биологического действия ионизирующих излучений — существо-
существования так называемого радиобиологического парадокса, состоящего
в том, что энергия ионизирующих излучений при ее выражении в
тепловом эквиваленте оказывается несопоставимо малой по сравнению
с тем биологическим эффектом, который она вызывает.
Введение 21
Середина двадцатых годов ознаменовалась крупным открытием
в радиобиологии. Речь идет об обнаружении в 1925—1927 гг. совет-
советскими учеными Г. А. Надсоном и Г.С.Филипповым в экспериментах
на дрожжевых клетках, а позднее Г. Мёллером (США) на дрозофиле
эффекта радиационного мутагенеза, проявляющегося не только
в повреждении «вещества наследственности», но и в образовании
стойких необратимых изменений в нем, передающихся по наследству.
Были получены строгие доказательства возникновения мутаций под
влиянием облучения. Впервые биологи получили возможность экспе-
экспериментально воспроизвести наследственную изменчивость.
С открытием мутагенного действия излучений многие радиобио-
радиобиологи перешли к изучению единичной реакции дискретных биологиче-
биологических структур (генов, хромосом) на радиационное воздействие. В это
же время значительно совершенствуются методы дозиметрии излуче-
излучений, вводится ионизационная единица дозы — рентген. Появляется
возможность количественного анализа биологического действия излу-
излучений, основанного на выяснении зависимости между наблюдаемым
биологическим эффектом и дозой радиации, поглощенной изучаемой
системой. Такие эксперименты проводились не только на ядерных
наследственных структурах, но и на колониях клеток, вирусных ча-
частицах, препаратах ферментов.
Результаты, полученные в точных количественных опытах, свиде-
свидетельствовали о вероятностном характере проявления единичной
реакции объекта в ответ на облучение в данной дозе радиации. Иначе
говоря, при облучении однородных объектов (клетки одной линии,
молекулы одного типа и т.д.) наблюдали, что при любой малой дозе
радиации некоторое число объектов оказывается пораженным, а дру-
другие сохраняют исходные свойства; при самой большой дозе радиации
небольшая доля объектов все еще остается непораженной. Кривые
«доза-эффект» в этих случаях имели экспоненциальный характер и
их можно было надежно экстраполировать к нулевой точке.
Обнаруженный эффект нельзя было объяснить естественной ва-
вариабельностью: речь шла о генетически однородных клетках и вирус-
вирусных частицах или молекулах одного типа. Его трактовка потребовала
привлечения фундаментальных физических концепций, прежде всего,
представлений о вероятностном характере поглощения энергии излу-
излучений, о дискретной природе частиц, составляющих ионизирующие
излучения, о физически микрогетерогенной организации биологиче-
биологических структур.
По-видимому, начало исследований в области количествен-
количественной радиобиологии B0-е гг.) и стало рождением радиацион-
радиационной биофизики, так как впервые для объяснения радиобиологиче-
радиобиологических феноменов и создания общей теории биологического действия
ионизирующих излучений в качестве отправных концепций потребо-
потребовалось использовать теоретические положения квантовой механики и
ядерной физики.
Одним из первых это сделал в 1922 г. Ф. Дессауэр, предложив тео-
теорию «точечного нагрева». Ионизирующие излучения обладают малой
22 Введение
объемной плотностью, однако отдельные фотоны несут гигантский
запас энергии. Исходя из этого, Ф.Дессауэр предположил, что при
поглощении системой относительно небольшой общей энергии (смер-
(смертельная для человека доза облучения вызывает нагрев тела всего
на 0,001 °С) некоторые дискретные микрообъемы поглощают настоль-
настолько большие порции энергии, что действие ионизирующих излучений
можно сравнить с таким микролокальным нагревом, который вызыва-
вызывает глубокие структурные изменения и в конечном счете биологическое
поражение. Вероятностный характер проявления эффекта у отдель-
отдельных объектов автор гипотезы объяснял статистическим распределе-
распределением «точечного тепла».
Так впервые физический принцип попадания был использован в
исследованиях количественной радиобиологии. Дальнейшее его разви-
развитие связано с работами Дж. Кроутера, Д. Ли, К. Г. Циммера, Н. В. Ти-
Тимофеева-Ресовского, В. И. Корогодина и др.
Работы этого периода оказали большое влияние на дальнейшее
развитие радиационной биофизики, превратили ее в одну из самых
точных биологических дисциплин. Математический аппарат, разви-
развитый в этих работах, позволил с достаточной надежностью судить о
«пусковых событиях», приводящих к регистрируемым в эксперименте
биологическим реакциям (мутации, гибель клетки и др.) и оценивать
параметры «мишени», ответственной за наблюдаемый радиобиологи-
радиобиологический эффект.
Согласно принципу попадания, начальный физический пуско-
пусковой механизм, необходимый для возникновения конечной биологиче-
биологической реакции, обусловлен случайным взаимодействием ионизирую-
ионизирующего излучения с веществом. В силу этого в каждую молекулу или
клетку происходит неодинаковое число попаданий. С принципом по-
попаданий тесно связана теория мишени, основанная на принципе
гетерогенности строения снсивых систем,, поражение излу-
излучением отдельных элементов которых имеет не одинаковое значение
для данной системы. Например, необратимое повреждение уникаль-
уникальной клеточной структуры фатально для клетки, тогда как такое же
повреждение иных, множественных структур для судьбы клетки мо-
может иметь существенно меньшее значение. В многочисленных работах
получены новые факты высокой радиочувствительности делящихся
клеток, клеточного ядра, молекулы ДНК.
Сейчас хорошо известно, что лучевые нарушения генетических
структур могут проявляться как сразу после облучения, так и от-
отдаленно, в потомках, даже спустя нескольких поколений, становясь
в организме причиной возникновения злокачественных опухолей, а
также различных уродств развития.
При облучении биологического объекта ионизирующая радиация
поглощается не избирательно, а любыми молекулами, клетками, ор-
органами и тканями. Даже при облучении в малых дозах происходит
много тысяч актов ионизации молекул, а это может привести к разно-
разнообразным нарушениям структуры и функции клеток. И лишь только
некоторые из этих нарушений приводят клетку к потере способности
Введение 23
к делению и к гибели. Такой «критической структурой», мишенью в
клетке является уникальная макромолекула ДНК, несущая генетиче-
генетическую информацию.
Впоследствии оказалось, что применение теории мишени весьма
ограничено и позволяет количественно интерпретировать зависимость
эффекта от дозы лишь для элементарных или сравнительно простых
реакций биологических систем. Конечная ответная реакция на облуче-
облучение сложной системы (например, гибель клетки) зависит не только от
событий попадания в ДНК. Она зависит от системного ответа
клетки и целостного организма на облучение, т. е. от ряда свойств
самого биологического объекта, например от способности устранять
или восстанавливать повреждения. Системный ответ также носит
стохастический характер, определяющий меру нестабильности биоло-
биологической системы, усиливаемой действием излучения. Отсюда
следует вывод, что количественная оценка системного ответа в за-
зависимости от дозы облучения должна учитывать множественные
стохастические взаимоотношения,.
Важным направлением радиационной биофизики является
создание математических моделей, которые являются форма-
формализованным выражением большинства теоретических закономерно-
закономерностей в радиобиологии. Математические модели лежат в основе объяс-
объяснительного аппарата и в радиационной биофизике. Накопление исход-
исходной экспериментальной информации и развитие теоретических пред-
представлений сопровождалось, а иногда и предвосхищалось появлением
соответствующих моделей.
Насколько широк спектр объектов, процессов и проблем, которые
решаются в радиационной биофизике с помощью метода математиче-
математического моделирования, настолько разнообразны используемые модели.
Первые модели были основаны на принципах попаданий и мише-
мишени. Появление «стохастической концепции» биологического действия
ионизирующих излучений привело к созданию моделей, более адекват-
адекватно отражающих сложный вероятностный характер процессов, проис-
происходящих в живом объекте при облучении. Дальнейшим развитием
математической интерпретации радиобиологических эффектов стало
создание так называемой «вероятностной» модели, представляющей
синтез двух вышеупомянутых подходов.
Появление моделей следующего поколения было напрямую связано
с резким скачком в информационно-технической области и с повы-
повышением доступности и быстродействия компьютеров. К концу про-
прошлого столетия математические модели в биологии характеризуются
большим разнообразием подходов и широким спектром возможностей.
Они позволяют изучать и прогнозировать динамику отдаленных по-
последствий облучения в условиях, которые варьируют во времени и
пространстве, учитывать сочетанное или комбинированное влияние
облучения и других факторов, проводить численные эксперименты
на виртуальных объектах и т.д. «Компьютеризация» математическо-
математического моделирования в радиационной биофизике позволяет реализовать
24 Введение
многие сформулированные ранее перспективные идеи в этой области,
например, создание моделей на основе цепей Маркова.
Однако следует всегда помнить также и о том, что моделирование
зависимости ответной реакции живой системы от дозы облучения не
является самоцелью, поскольку оно не дает нового фактического ма-
материала о конкретных физико-химических молекулярных изменениях
при облучении. Для этого необходимо проведение только эксперимен-
экспериментальных исследований.
В середине XX столетия стали известны трагические последствия
для жителей Хиросимы и Нагасаки атомных бомбардировок авгу-
августа 1945 г., сопровождавшихся помимо прочего высокими дозами об-
облучения. Этот год стал рубеснсным для вступления радио-
радиобиологии в третий этап своего развития.
Как писал академик Н.П.Дубинин, "... в 1945 году были взорва-
взорваны атомные бомбы в Хиросиме и Нагасаки. Стало ясно, какую угрозу
таит в себе радиация, если ее обрушить на ... человека". Возникшую
ситуацию в науке довольно точно охарактеризовал А. М. Кузин: "На
первое место выдвигается проблема изучения тотального облучения
высших организмов, проблема защиты организмов от вредного действия
ионизирующей радиации, создание теоретических основ профилактики и
лечения лучевой болезни. Возникает необходимость установления точных
количественных закономерностей зависимости между биологическими
проявлениями действия ионизирующей радиации и дозой, мощностью
облучения, энергией элементарных частиц и видом радиации." Среди
перечисленных проблем особое внимание радиобиологов привлекает
изучение первичных и начальных физико-химических процессов в
облученном организме и, в связи с расширением масштабов испытания
ядерного оружия, радиоэкологическая проблема глобального изменения
радиационного фона.
Действительно, вскоре создаются мощные арсеналы ядерного ору-
оружия, расширяются масштабы его испытания. В атмосферу выбрасы-
выбрасывается большое количество искусственных радионуклидов, выпада-
выпадающих с осадками на поверхность Земли и распространяющихся на
значительные расстояния, создавая обширные очаги радиоактивного
загрязнения. В 1955 г. при ООН создается специальный Научный
комитет по изучению действия атомной радиации на человека —
НКДАР. В результате своей деятельности НКДАР собрал и обобщил
огромный фактический материал по поражающему действию атомной
радиации на человека. Как отметил в 1987 г. Л. Саган, на основе
этого материала в радиобиологии сложилась «парадигма», согласно
которой в любых дозах «атомная радиация вредна и только
вредна для живых организмов».
С середины столетия происходит перенос акцентов в развитии
радиобиологии и радиационной биофизики — получают импульс ис-
исследования молекулярных механизмов действия излучений. Этому
Введение 25
предшествовал ряд достижений в области биофизики и молекуляр-
молекулярной биологии, в частности, получение доказательства биологической
роли ДНК как главного вещества наследственности и расшифровка ее
структуры.
Еще в 40-е гг. при анализе физико-химической природы процессов,
происходящих в период между первичной абсорбцией энергии излу-
излучения и конечным биологическим эффектом, было обнаружено заро-
зарождение в облучаемом растворе высокоактивных продуктов радиолиза
воды — свободных радикалов, способных диффундировать на значи-
значительные расстояния и поражать биологические структуры. Радиаци-
Радиационная биофизика начинает оперировать представлениями
о «непрямом действии» излучения, опосредованном активны-
активными продуктами радиолиза воды. Были изучены физико-химические
свойства первичных продуктов радиолиза воды и характер их взаи-
взаимодействия с макромолекулами клетки.
Это дало возможность приступить к исследованиям химических
средств защиты (радиопротекторов) от действия ионизирую-
ионизирующих излучений.
Так, в 1942 г. В. Дейлу удается снизить поражающее действие ради-
радиации на ферменты введением в раствор ряда веществ — перехватчиков
радикалов.
Проблемы, связанные с реальной угрозой гибели человечества от
ядерного оружия и радионуклидных загрязнений биоты, привели к
интенсивному развитию исследований в области химической защи-
защиты организма от ионизирующих излучений.
В 1948 г. был получен защитный эффект в опытах с бактерио-
бактериофагами. Эти работы логически привели радиобиологов к открытию,
практическую важность которого трудно переоценить: в 1949 г. была
доказана способность ряда веществ защищать млекопитающих от
лучевого поражения. В опытах X. Патта с соавторами введение ци-
стеина за 10 мин до облучения защищало крыс от неминуемой гибели
(т. е. действия радиации в «минимальной абсолютно летальной дозе»);
3. Бак и А. Эрв обнаружили аналогичное действие цианида на мышах.
Во многих лабораториях мира начинается интенсивный поиск эф-
эффективных радиозащитных препаратов. Формируется самосто-
самостоятельное направление радиационной биофизики — выясне-
выяснение механизмов модифицированной радиочувствительно-
радиочувствительности биологических объектов. Помимо практической значимости,
эти работы представляли теоретический интерес, поскольку были де-
детально исследованы многие физико-химические процессы как возмож-
возможная точка приложения активности радиозащитного агента.
Так, наблюдения, согласно которым многие эффективные ра-
радиозащитные препараты понижают содержание кислорода в тканях
животных, стимулировали углубленные исследования ряда новых
противолучевых средств (работы Н. Н. Суворова, П. Г. Жеребченко,
С. П. Ярмоненко в нашей стране; Л. Грея, Д. Кейтера, X. Лангендорфа
и других авторов за рубежом).
26 Введение
Первоначально были высказаны гипотезы, связывающие защиту
исключительно с инактивацией свободных радикалов и торможением
свободнорадикальных окислительных процессов. Эти гипотезы нахо-
находили хорошее подтверждение в модельных экспериментах на простых
молекулярных системах. Однако для сложных биологических систем
такого объяснения было явно недостаточно.
Анализ физиологических и биохимических изменений, возникаю-
возникающих в тканях животных после введения радиозащитных соединений,
привел в середине 60-х гг. 3. Бака и П. Александера к формулиро-
формулированию гипотезы «биохимического шока», согласно которой различ-
различные радиопротекторы однотипно изменяют метаболические процессы,
переводя клетки в состояние повышенной устойчивости к действию
ионизирующей радиации.
В дальнейшем появился ряд обширных исследований, посвящен-
посвященных анализу конкретных биохимических изменений, возникающих
под влиянием радиозащитных агентов и модифицирующих радиоре-
радиорезистентность организма. Возникли гипотезы «комплексного биохими-
биохимического механизма действия радиозащитных средств» (Е. Ф.Роман-
цев, 1968), «сульфгидрильная гипотеза» (Э. Я. Граевский, 1969) и др.
Несмотря на стремление некоторых исследователей придать исклю-
исключительное значение какому-то одному фактору, экспериментальные
данные указывали на существование альтернативных путей реализа-
реализации защитного эффекта даже для одного и того же радиопротектора.
В 70-е гг. Е. Н. Гончаренко и Ю. Б. Кудряшов установили, что раз-
различные радиозащитные агенты к моменту своей максимальной эф-
эффективности снижают в тканях животных уровень продуктов пере-
кисного окисления липидов — природных сенсибилизаторов лучевого
поражения — и увеличивают содержание биогенных аминов, кото-
которые, наряду с тиолами и другими антиокислителями, относятся к
природным противолучевым веществам. На основании этих данных
авторы предложили гипотезу «эндогенного фона радиорезистентно-
радиорезистентности» A980).
Эти исследования привели к накоплению обширного фактического
материала по общей картине лучевого поражения и его модификации,
позволили наметить пути к выяснению основных закономерностей
зарождения «пусковых», «запальных» физико-химических процессов,
механизмов ослабления или усиления первичных лучевых реакций. В
результате на первый план вышли исследования, посвященные анали-
анализу физико-химических процессов, протекающих в клетке от момента
возникновения начальных структурных повреждений до проявления
выраженных биохимических и морфологических изменений.
Анализируется модифицирующее действие кислорода, температу-
температуры и других агентов, влияющих на развитие лучевого поражения
биологических объектов. Большое число работ посвящается пробле-
проблеме миграции энергии и заряда в облученной системе. Проводится
также изучение роли свободных радикалов, относительного вклада
прямого и непрямого действия ионизирующей радиации, накопления
Введение 27
оксирадиотоксинов в формировании радиобиологического эффекта и
эффекта защиты.
Значительный вклад в расшифровку первичных молекуляр-
молекулярных механизмов лучевого поражения внесли пионерские работы
Б. Н. Тарусова и его школы.
Согласно выдвинутой им теории, немногочисленные первичные
повреждения инициируют цепные процессы окисления, в кото-
которые вовлекаются множественные субклеточные структуры. Такая те-
теория физико-химического механизма и принцип усиления
начального радиационного повреждения позволили объяснить
многие радиобиологические феномены: развитие лучевого поражения
во времени, влияние на этот процесс температуры, газового состава
атмосферы и т. д.
В середине 50-х гг. в лаборатории Б. Н. Тарусова обнаружено, что
высшие ненасыщенные жирные кислоты, входящие в состав клеточ-
клеточных липидов, обладают значительной уязвимостью к радиационному
воздействию, а продукты перекисного окисления липидов во многом
имитируют действие излучения на разнообразных биологических объ-
объектах и системах: например, продукты окисления высших ненасы-
ненасыщенных жирных кислот обладают радиомиметическими и радиосен-
сибилизирующими свойствами. Эти и другие исследования позволи-
позволили предположить, что в результате облучения происходит активное
вовлечение липидов биомембран в процессы перекисного окисления,
что впоследствии приводит к множественному поражению и гибели
клетки.
Б. Н. Тарусов обосновал предположение о том, что в норме окисли-
окислительные процессы в тканевых липидах протекают на низком уровне
и находятся в стационарном режиме. После облучения эти процессы
могут переходить в нестационарный режим и вовлекать в окислитель-
окислительные изменения различные компоненты внутриклеточных мембранных
структур, обусловливая этим динамику лучевого поражения.
Для развития этих представлений большое значение имели клас-
классические исследования механизмов окислительных реакций, прове-
проведенные Н. Н. Семеновым и его школой. Появилось значительное ко-
количество работ Н.М.Эмануэля, Е. Б. Бурлаковой и ряда других ав-
авторов, посвященных выяснению механизмов окисления липидов,
индуцированного ионизирующей радиацией, и антиокисли-
антиокислительных защитно-восстановительных процессов в биоло-
биологических мембранах (БМ) клетки.
Открытие и изучение биохимической системы антиокислительной
защиты, состоящей из ферментов и низкомолекулярных антиоксидан-
тов, играющей важную роль в формировании радиорезистентности
клетки и организма, явилось значительным вкладом радиобиологии
и радиационной биофизики в биологическую науку. Было установле-
установлено, что активные формы кислорода (так называемые оксирадикалы)
возникают не только после облучения, но и продуцируются метаболи-
метаболически, вызывая повреждения клеточных структур и патологические
состояния организма. Предложенная защита от таких повреждений
28 Введение
стала важным способом лечения, используемым при многих заболева-
заболеваниях. Радиобиологи и биофизики (Н. М. Эммануэль и Б. Н. Тарусов —
руководители коллектива*)) за цикл работ «Физико-химические ме-
механизмы свободно-радикального перекисного окисления липидов в
биологических мембранах», опубликованных в 1954-1981 гг., в 1984 г.
стали лауреатами Государственной премии.
В последние два-три десятилетия в молекулярной биологии и ра-
радиационной биофизике происходит совершенствование методических
приемов и высокочувствительной аппаратуры для тонкой идентифи-
идентификации лабильных биомолекул: находят применение селективная ион-
ионная масс-спектрометрия, рентгеноэлектронная и атомная спектроско-
спектроскопия, ЭПР, различные виды хроматографии, активированная хеми- и
биолюминесценция, использование радиоактивных индикаторов, мо-
модификаторы свободнорадикальных состояний и др.
Благодаря этому возникает значительный сдвиг в направлении
изучения образования и биологической роли низкомолеку-
низкомолекулярных оксирадикалов и биогенных продуктов окисления —
активных кислородсодержащих соединений (АКСС): активных форм
кислорода, моноксида азота, продуктов свободнорадикального пере-
перекисного окисления липидов. В результате показана принципиальная
возможность образования в интактных и облученных клетках ок-
сиаддуктов ДНК с перекисями, эпоксидами, альдегидами ненасы-
ненасыщенных липидов, т. е. оксиаддуктов, обладающих цито- и геноток-
сическим действием, способностью вызывать в клетках активацию
апоптоза и мутации.
В 1960-е годы значительных успехов в расшифровке механизма
лучевой инактивации ферментов и нуклеиновых кислот добилась
молекулярная радиобиология, использовавшая весь эксперименталь-
экспериментальный арсенал, накопленный ею за два десятилетия бурного развития.
Сформировалось новое, молекулярное направление радиаци-
радиационной биофизики системного ответа на действие излуче-
излучений, которое основывается на фундаментальных физических и кван-
тово-механических принципах, опыте количественной радиобиологии
и новейших открытиях молекулярной биологии о причинно-следствен-
причинно-следственных отношениях между структурой и биологическими функциями
макромолекул.
Феномен клеточного восстановления от радиационного по-
поражения, описанный в 1960-е годы благодаря развитию методов куль-
культивирования клеток, начинает приобретать объяснение на молеку-
молекулярном уровне: открыты и детально проанализированы механиз-
механизмы восстановления ДНК от радиационных повреэюдений.
Это стало крупнейшим вкладом радиобиологии в науку о живом.
*) А. И. Арчаков, Ю.А.Владимиров, Д. И. Рощупкин, Е. Б. Бурлакова,
Е. А. Нейфах, Н. П. Пальмина, Ю. П. Козлов, Ю. Б. Кудряшов, И. И. Иванов,
В. Е. Каган.
Введение 29
Оказалось, что в клетках функционирует сложнейший комплекс фер-
ферментных систем, поддерживающих структурную целостность генома.
К одной из них относят разнообразные ферменты репарации ДНК,
распознающие дефекты ее структуры, «ремонтирующие» ее при лу-
лучевых повреждениях путем специфического устранения различных
повреждений и восстановления структуры и функций ДНК, а вместе
с тем и нормального клеточного деления.
Были обнаружены несколько механизмов восстановления ДНК от
повреждений: фотореактивация; эксцизионная репарация нуклеоти-
дов и оснований; рекомбинационная репарация и репарация путем
некомплементарного сшивания концов ДНК. Показано, что функци-
функционирование систем восстановления ДНК зависит от состояния вну-
внутриклеточного метаболизма, интенсивности энергетических процессов
клетки. Таким образом, стал понятным молекулярный механизм из-
известных радиобиологических эффектов, таких как зависимость лу-
лучевого поражения от условий пострадиационного культивирования
клеток, состояния метаболических систем и других физиологических
факторов. В зависимости от величины дозы облучения, восстановле-
восстановление ДНК может оказаться полным или частичным, и от этого зависит
выживаемость пораженной клетки.
Для радиационной биофизики становится общепринятым рас-
рассмотрение конечного радиобиологического эффекта как результата
интерференции двух противоположно направленных процессов: реа-
реализации первичного поражения и восстановления от него внутри-
внутриклеточных структур при помощи систем репарации.
Важную роль в развитии радиобиологии и радиационной биофизи-
биофизики сыграла структурно-метаболическая теория лучевого поражения,
сформулированная и развивавшаяся A.M. Кузиным. Последняя пред-
предполагает, что множественные структурные повреждения клеточных
органелл приводят к дезорганизации метаболизма в клетке. Резуль-
Результатом этого может быть не только гибель облученной клетки, но и
нарушение жизнедеятельности и гибель соседних и даже находящихся
на удалении от нее клеток (так называемый дистанционный эффект
радиации).
Исследование механизмов радиационного повреждения ДНК, про-
процессов репарации ДНК, направленных на его устранение, их роли
в формировании закономерностей лучевого поражения клеток лим-
фоидной ткани стали основополагающими в понимании «запрограм-
«запрограммированности» процесса интерфазной гибели клеток при действии
ионизирующей радиации. Полученные результаты в этом направлении
стали предтечей открытия в 1972 г. такой формы гибели клеток, как
апоптоз, принципиально отличный от другой формы — некроза. За
почти четвертьвековой цикл работ в этом направлении коллектив
30 Введение
авторов во главе с А.М.Кузиным и П. Д. Горизонтовым *) в 1987 г.
был удостоен Государственной премии «за разработку теоретических
основ радиационной гибели лимфоидных клеток и их использование
для выяснения патогенеза лучевой болезни».
Было высказано предположение, что ведущим механизмом гибели
неделящихся или медленно делящихся клеток организма (нервные
клетки, клетки мышц и паренхиматозных тканей и др.) является
поражение уже других критических структур, например, биологиче-
биологических мембран. Эта интерфазная гибель свойственна клеткам, отно-
относительно устойчивым к облучению. Само лучевое воздействие на ДНК
или БМ при определенных уровнях доз не всегда оказывается для
этих структур и клетки повреждающим, поскольку в клетке имеются
собственные системы противодействия образуемым в ходе облучения
оксирадикалам.
Так, было обнаружено, что помимо систем, репарирующих струк-
структуры от лучевых повреждений, в любой клетке имеются иные соб-
собственные защитные ресурсы, способные предохранять от по-
повреждения такие структуры, как ДНК и биологические мембраны.
К превентивным системам такого рода относится ряд биологически
активных молекул и ферментов, составляющих «эндогенный фон
радиорезистентности», определяющий окислительно-восстано-
окислительно-восстановительный гомеостаз клетки.
Открытие механизмов программируемой гибели клетки — апо-
птоза — явилось одним из выдающихся достижений молекулярной
биологии и радиобиологии. Биологический смысл этого процесса, осу-
осуществляемого многоэтапным каскадом биохимических реакций, со-
состоит в уничтожении клеток, выработавших свой «ресурс», ставших
нежизнеспособными или чужеродными для организма в результате
мутационных изменений.
В последнее время установлено, что механизмы апоптоза свой-
свойственны не только клеткам, но они также присущи субклеточным
и надклеточным структурам. В.П.Скулачев сформулировал общий
биологический закон самоликвидации: любая живая система
(от органеллы и выше) уничтожает себя, если становится опасной
для жизнедеятельности системы, занимающей более высокую сту-
ступень в иерархии организации жизни. Самоликвидация митохондрий
была названа митоптозом, а органов и тканей — органоптозом.
При лучевом поражении происходит клеточное опустошение кри-
критических органов и тканей, наблюдаемое при развитии, например,
костномозгового и кишечного синдромов. Высокие дозы острого облу-
облучения приводят к некротической гибели (например, при ЦНС-синдро-
ме). Показано, что одним из сигнальных механизмов, приводящих к
апоптозу или некротической гибели клетки при лучевом воздействии,
*) Е. Ф. Романцев, В. К. Мазурик, И. В. Филиппович, Н. В. Ермолаева,
Е. А. Жербин, К. П. Хансон, Б. Д. Животовский, С. Р. Уманский, А. М. По-
Поверенный, Н. И. Рябченко.
Введение 31
является избыточное образование активных форм кислорода и про-
продуктов перекисного окисления липидов.
На фоне исследований механизмов повреждения и восстановле-
восстановления критических структур периодически, начиная с работ 3. Бака
и П. Александера A955 г.), обсуждался вопрос о том, являются ли
эти механизмы специфичными только для ионизирующих излучений
или данный системный ответ является общебиологическим явлением,
свойственным любой клетке, реагирующей на любые внешние воздей-
воздействия?
В 60-е гг. В.П.Парибок высказал предположение, согласно кото-
которому известная способность репаративных систем устранять ради-
радиационные повреждения ДНК — это лишь одно из проявлений неспе-
неспецифической реакции снсивой системы на повреждающее воздей-
воздействие. Иначе говоря, отмечается, что в клетках «заложены» системы,
поддерживающие нормальную, стационарную динамику состояния ее
структур и стандартно реагирующие изменением на любое поврежда-
повреждающее воздействие. В исследованиях Л. X. Эйдуса, начавшихся еще
в 1979 г., проанализирован биофизический механизм неспецифической
реакции клеток на повреждающие воздействия, к которым автор
наряду с ионизирующей радиацией относит и действие различных
физических и химических раздражителей. Согласно развиваемой им
гипотезе, под влиянием повреждающего агента возникают однотип-
однотипные изменения, включающие нарушение мембранного транспорта и
соответствующих градиентов концентрации низкомолекулярных со-
соединений, которые локально накапливаются в компартментах клеток,
сорбируются на макромолекулах и изменяют их конформационную
подвижность.
Имеющийся в настоящее время большой фактический материал
отечественных и зарубежных школ позволяет говорить о конкретных
механизмах стрессовой реакции, развивающейся в результате измене-
изменений окислительно-восстановительного гомеостаза в клетке при ради-
радиационном воздействии.
Облучение, так же, как и любой раздражитель, вызывает в клетке
«оксидативный стресс», проявления которого зависят от величины
дозы и продолжительности воздействия. Он состоит из двух основ-
основных взаимосвязанных процессов: оксидативного, развивающегося в
результате накопления прооксидантов, и сдерживающего его процесса
с помощью мобилизации запасов защитных ресурсов клетки — систе-
системы ферментных и низкомолекулярных антиоксидантов. Соотношение
скоростей конкурирующих между собой процессов окисления и вос-
восстановления в уникальных клеточных структурах определяет степень
развития той или иной стадии стрессовой реакции и, в конечном счете,
при исчерпании «емкости» антиоксидантной системы ферментов и
низкомолекулярных соединений вносит вклад в вероятность развития
радиационно-обусловленного патологического процесса.
32 Введение
Проблемы, возникшие после Чернобыльской катастрофы
{современный период)
Казалось бы, в почти вековой истории радиобиологии фунда-
фундаментальные исследования в основном завершились, и радиационным
биофизикам остались лишь «отделочные», «косметические» работы.
Однако, как это бывало и ранее, социальные проблемы внезапно поста-
поставили перед радиобиологами принципиально новые задачи. Так, можно
считать, что авария на Чернобыльской АЭС в 1986 г., снятие секре-
секретов с информации о ее последствиях, а также последствиях других
радиационных аварий и ядерных испытаний открыли новый, чет-
четвертый период в истории радиобиологических исследований.
Как известно, на ЧАЭС произошла крупнейшая техногенная ката-
катастрофа глобального масштаба: следы ее фиксировались от Филиппин
до Канады и Южной Америки. Миллионы кюри искусственных ради-
радионуклидов, поступивших в биосферу за короткое время, практически
впервые после запрета, введенного в начале 1960-х гг. на проведения
ядерных испытаний в атмосфере (если не считать глобальные ра-
радиоактивные загрязнения атмосферы в тот же период от испытаний,
проводившихся в Китае), явились тем фактором, с которым нельзя
не считаться и в настоящее время. Формы поступления, характер ми-
миграции, пути накопления и рассеивания чернобыльских радионукли-
радионуклидов, особенности их хронического действия в малых дозах на живые
организмы и человека — все это потребовало незамедлительного и
тщательного изучения.
Глобальный характер наступившего радиоэкологического кризиса
оказался связанным также и с постоянным загрязнением биосферы в
результате других техногенных катастроф, промышленных аварий, с
существованием большого числа могильников радиационных и хими-
химических отходов, с появлением других ядерных ситуаций, таящих угро-
угрозу постепенного истощения экологического потенциала и генофонда в
различных регионах нашей планеты.
Стало очевидно, что для решения проблем, возникших после Чер-
Чернобыльской катастрофы, накопленные знания и имеющийся опыт
традиционной радиобиологии и медицины оказываются явно недо-
недостаточными, и поэтому в современной радиобиологии стали быстро
развиваться новые направления. К ним можно отнести, по крайней
мере, следующие:
- изучение биологического действия излучений в малых дозах и
отдаленных последствий облучения;
- исследование комбинированного действия широкого спектра ра-
радионуклидов с химическими загрязнителями среды;
- поиск принципиально новых средств защиты от хронического
облучения.
Введение 33
Поскольку современный период развития радиобиологии начался
недавно, разрешение возникших проблем находится еще в начальной
стадии. Наряду с традиционными фундаментальными дисциплина-
дисциплинами — общей радиобиологией и медицинской радиобиологией — бы-
быстрое развитие получила радиоэкология, изучающая ответные реак-
реакции биологических объектов на действие ионизирующей радиации в
загрязненной среде.
Перед радиационной биофизикой возникли новые задачи. Наибо-
Наиболее важными оказались фундаментальные исследования механизмов
радиобиологических эффектов, вызываемых слабыми воздействиями,
поскольку оказалось, что эффекты, вызываемые ионизирующи-
ионизирующими излучениями в малых дозах, нельзя оценивать путем простой
экстраполяции в область малых доз данных, полученных при больших
дозах. Действительно, открылись принципиально новые явления при
изучении эффектов малых доз.
Это и повышенная чувствительность биообъектов к воздействию
радиации в сверхмалых дозах, переходящая к повышенной радиорези-
радиорезистентности — адаптивному ответу — при более высоких нелетальных
дозах. Это и стимулирующее действие излучений на рост, развитие
и другие физиологические показатели (эффект гормезиса), а также
«необычное» снижение выраженности радиобиологических эффектов
по мере увеличения мощности малой дозы (обратный эффект мощ-
мощностей доз).
Вместо априорно принятой ранее концепции линейной зависимости
радиобиологических изменений от изменения низкоинтенсивных доз
облучения, радиобиологи пришли к выводу о немонотонной, сину-
синусоидальной кривой зависимости «доза-эффект» в этом диапазоне.
Неудачными оказались и некоторые попытки объяснить особенности
действия радиации в малых дозах с традиционных позиций первич-
первичного повреждения ДНК. Ряд радиобиологов в связи с этим стали
рассматривать БМ в качестве основной радиобиологической мишени
в эффектах малых доз.
До недавнего времени считалось, что такие лучевые реакции кле-
клеток как их гибель, мутации, хромосомные аберрации, а также опухо-
опухолевая трансформация тканей являются следствием только прямых и
необратимых повреждений первичной структуры ДНК. Достижения
современной молекулярной биологии и радиационной биофизики при-
привели к выводу о более сложных изменениях, происходящих в радиаци-
радиационных мишенях в связи с оксидативными реакциями. В результате все
большее значение приобретают исследования механизмов регуля-
регуляции изменений, происходящих в БМ и ДНК и образующихся
в них под влиянием ионизирующих излучений оксирадика-
лов, оксиаддуктов и других продуктов окисления.
На рубеже двух столетий внимание радиобиологов привлекло еще
одно принципиально важное радиобиологическое явление — способ-
способность облученной клетки передавать путем контактов или секреции
3 Ю. Б. Кудряшов
34 Введение
в межклеточные пространства цито- и генотоксических веществ сиг-
сигналы, действующие на соседние необ л ученные клетки подобно облу-
облучению. Это явление, получившее название «эффекта свидетеля»,
давно было замечено при исследовании радиотоксинов, экстраги-
экстрагированных из органов и тканей тотально или локально облученных
животных и растений, а также из одиночных клеток.
Важно отметить, что цито- и генотоксический эффект «свидете-
«свидетеля» отмечен при облучении клеток в малых дозах а- и 7-излучения и
свойственен как непосредственно облученным клеткам, так и части их
потомков в последующих поколениях. В настоящее время ведутся ин-
интенсивные исследования химической природы секретируемых веществ
и механизма их действия.
Современный период, связанный с проблемами радиоэкологическо-
радиоэкологического кризиса, диктует также новые подходы и в разработке методов хи-
химической защиты от ионизирующей радиации. Появилась необходи-
необходимость в исследованиях природных пищевых продуктов и препаратов,
способных, не оказывая вредного побочного действия на организм,
снижать или предотвращать эффекты хронического низкоинтенсив-
низкоинтенсивного облучения в сочетании с другими экстремальными природными
и техногенными факторами. Большое внимание также уделяется ис-
исследованию средств, способствующих выведению радионуклидов из
организма. Не менее актуальны и остры задачи проведения программ
медицинской реабилитации облученного населения.
Накопив данные по изучению лучевой патологии, радиобиологи
обратились к идеям древней народной медицины: помочь организму
мобилизовать собственные защитные ресурсы, способствующие повы-
повышению общей устойчивости к ионизирующей радиации и вредным
факторам среды. Благодаря этим идеям уже сейчас используется
значительное количество препаратов, пищевых добавок и веществ,
многие из которых хорошо известны в народной медицине, но впер-
впервые применяются в целях защиты организма от вредных последствий
хронического облучения. Нетрудно видеть, что и это актуальное на-
направление должно получить дальнейшее развитие, но оно уже далеко
выходит за рамки одной только радиационной биофизики.
В кратком обзоре актуальных проблем трудно охватить все на-
направления, по которым развиваются сегодня и будут развиваться зав-
завтра радиационная биофизика и радиобиология. Однако в настоящее
время появились все основания для того, чтобы, используя имею-
имеющийся фактический материал многогранной науки, сформу-
сформулировать основные принципы радиобиологии. Этому посвя-
посвящена заключительная часть данного учебника.
Глав а I
ИОНИЗИРУЮЩИЕ ИЗЛУЧЕНИЯ,
ИХ ХАРАКТЕРИСТИКА, ДОЗИМЕТРИЯ И
ДОЗОВЫЕ ВЕЛИЧИНЫ
1. Виды ионизирующих излучений, их энергия
К ионизирующим излучениям относят фотоны электромагнитного
излучения G- и рентгеновское излучение с длиной волны менее 19 нм)
и корпускулярные излучения (ускоренные частицы и ядра различных
элементов).
В радиационной физике и химии за единицу энергии ионизиру-
ионизирующих излучений принимается электрон-вольт (эВ, eV). 1 эВ — это
энергия, приобретаемая одним электроном, движущимся в постоянном
поле с разностью потенциалов в один вольт; 1 эВ = 1, 602-10~19 Дж *).
Фотонное излучение с энергией от 50 эВ до 500 кэВ называют
рентгеновским излучением, а при более высоких энергиях принято
говорить о 7-излучении.
Рентгеновское излучение разделяют на мягкое (Е < 50 кэВ) и
жесткое (Е > 50 кэВ). Энергии 7-квантов лежат в диапазоне от десят-
десятков кэВ до нескольких МэВ. В определении этих несколько перекры-
перекрывающихся диапазонов энергии излучений нет путаницы: слово «гамма-
лучи» принадлежит Марии Кюри и возникло в результате наблюдения
ею излучения радиоактивного распада, имевшего высокое значение
энергии; наоборот, в зарубежной литературе любые фотоны с высокой
энергией часто называют Х-лучами, хотя В. К. Рентген называл так
открытое им излучение с энергиями в более низкой энергетической
области.
Термин «корпускулярное излучение» применяют к любым части-
частицам с ненулевой массой. К этому виду излучений относят электроны,
позитроны, нейтроны, а-частицы, протоны, ускоренные ионы, ядер-
ядерные фрагменты и осколки деления ядер, а также многие нестабильные
частицы.
К электронному излучению относят /^-частицы (электроны с энер-
энергией 0,002-2,3 МэВ, возникающие при распаде радиоактивных ядер) и
*) См. табл. 1.2. Энергию частиц принято измерять в следующих едини-
единицах, производных от электрон-вольта: тысячах эВ — кэВ; миллионах эВ —
МэВ; миллиардах эВ — ГэВ.
36 Гл. I. Ионизирующие излучения, их характеристика, дозиметрия
ускоренные электроны, которые создаются ускорителями электронов
(с энергией от кэВ до сотен МэВ).
Ядра атома гелия называются а-частицами, когда они образуются
при распаде некоторых радионуклидов и несут энергию до ~10 МэВ.
Те же ядра, ионизированные и ускоренные, образуют пучки ионов ге-
гелия. Эти и другие пучки заряженных частиц — протонов, дейтронов и
вообще любых многозарядных тяжелых ионов (например, углерода) —
получают в протонных и ионных ускорителях. На них при облучении
мишеней получают также пучки нейтральных частиц — фотонов и
нейтронов, и даже пучки радиоактивных ионов.
Наиболее интенсивные потоки нейтронов получают при делении
ядер урана и плутония в ядерном реакторе, а также в нейтронных
генераторах. Нейтроны деления имеют широкий спектр энергий с
максимумом при 1—2 МэВ.
2. Линейная передача энергии излучения
Когда отдельная частица или пучок частиц излучения воздейству-
воздействует на вещество, то их путь можно наблюдать по произведенным ими
эффектам. Ионизационный след заряженной частицы в веществе, или
ее путь, называется треком. В отличие от непосредственно ионизи-
ионизирующих частиц, косвенно ионизирующие частицы такого следа не
образуют, и он может проявиться лишь под действием вторичных
частиц, если они несут электрический заряд.
Действие ионизирующих излучений на вещество связывают с вели-
величиной линейной передачи энергии— ЛПЭ (linear energy transfer, LET),
которая определяет величину средних потерь энергии на единицу пути
первичной заряженной частицы в пределах объема ее трека. Обычно
принимается, что вещество — это вода с плотностью 1 г/см3, и поэтому
ЛПЭ измеряется в единицах кэВ/мкм. Таким образом, вводится раз-
различие между ЛПЭ и удельными ионизационными потерями энергии
частицы, в которых учитывается не только выделенная локально,
но и вся энергия, потерянная при прохождении частицей 1 г/см2
вещества. Характерной величиной ЛПЭ является 0,2 кэВ/мкм — к
этой минимальной величине довольно близки ЛПЭ в очень широком
диапазоне — для электронов всех энергий и фотонов выше 0.5 МэВ.
Еще одно различие: по мере прохождения частиц вглубь среды
их энергия изменяется как бы непрерывно, то есть часто теряется
малыми порциями за счет ионизации атомов среды.
Иначе происходит изменение энергии фотонов и нейтронов — это
более редкие события, обычно с большой передачей энергии сразу,
без образования треков, и проследить, как меняется энергия частицы,
становится трудно. Поэтому к ним вообще не применяется понятие
ионизационных потерь энергии, а говорить об ЛПЭ фотонов или
нейтронов можно всегда, это практически удобно. В этом и заключа-
заключается причина, почему радиационная физика перешла на «язык ЛПЭ»
(линейных передач энергии).
3. Международная система единиц СИ 37
Когда говорят просто об удельных потерях энергии частицы
(—dE/dx; знак минус часто не ставится), то обычно подразумевают,
что это «ионизационные потери», хотя лучше всего это уточнять.
Тормозная способность вещества, как правило, численно имеет то
же самое значение, но в принципе она должна объединять все ви-
виды потерь энергии, в том числе на ядерные превращения частиц.
Строго говоря, необходимо указывать, что рассматривается, допу-
допустим, тормозная способность среды относительно процесса ионизации
и возбуждения электронами, и тогда недостаточно строгое применение
термина устраняется [56].
При делении линейных потерь энергии на плотность вещества р
получаем значение (—dE/dx)/p, которое не зависит от плотности. Эту
величину тоже можно называть тормозной способностью вещества,
или даже ЛПЭ, и тогда она измеряется в МэВ/см2 • г. Как видно
из определения, величина ЛПЭ характеризует распределение энергии,
переданной веществу, вдоль трека частицы. Зная ЛПЭ, легко опреде-
определить среднее число ионов, образованных на единицу пути частицы.
Для этого достаточно разделить значение ЛПЭ на величину энергии,
необходимой для образования одной пары ионов (W). Отношение
L/W называют линейной плотностью ионизации (ЛПИ).
Точное значение W тканей определить трудно. Для газов зна-
значение W было измерено многими исследователями, оно составляет
около 34 эВ. Для приблизительной оценки плотности ионизации в
конденсированных системах обычно используют соотношение:
ЛПИ = ЛПЭ/34 (пар ионов на мкм пути), A.1)
(здесь ЛПЭ в эВ/мкм). Чем выше значение ЛПЭ, тем больше энергии
теряет частица на единицу пути, тем плотнее распределены создавае-
создаваемые ею ионы вдоль трека.
3. Международная система единиц СИ
В I960 г. на Генеральной конференции по мерам и весам в Париже
принята Международная система единиц измерения (Systeme Inter-
International, сокращенно SI, или Система Интернациональная — СИ). В
СССР она введена в 1963 г. в качестве государственного стандарта
(ГОСТ). В научно-технической литературе системные и внесистемные
единицы измерения встречаются и сейчас, поэтому мы приводим и
те и другие, а также будем приводить соотношения между ними.
Кроме обычных единиц удобно употреблять кратные или дольные их
значения (табл. 1.1).
Для оценки эффективности действия ионизирующих излучений на
физический или биологический объект принято учитывать:
— активность нуклида в радиоактивном источнике,
- экспозиционную дозу (дозу излучения), когда речь идет о погло-
поглощении ионизирующего излучения в воздухе,
38 Гл. I. Ионизирующие излучения, их характеристика, дозиметрия
— поглощенную дозу (дозу облучения), при поглощении энергии
излучения в облучаемом объекте.
Таблица 1.1. Множители и приставки для образования десятичных кратных и
дольных единиц и их обозначения
Множи-
Множитель
1018
1015
ю12
ю9
106
103
ю2
101
ю-1
10~2
КГ3
10
ю-9
ю-12
ю-15
10-18
При-
Приставка
экса
пета
тера
гига
мега
кило
гекто
дека
деци
санти
МИЛЛИ
микро
нано
пико
фемто
атто
Обозначение
рус-
русское
Э
п
т
г
м
к
г
да
д
с
м
мк
н
п
ф
а
между-
нар.
Е
Р
Т
G
М
к
h
da
d
с
m
n
P
f
a
4. Единицы активности радионуклидов и доз радиации
4.1. Активность радионуклида
Количество радиоактивного вещества определяется не только его
массой (в миллиграммах, граммах и т. д.), но и активностью, т. е. коли-
количеством атомных ядер, распадающихся в единицу времени. Поскольку
скорости распадов разных радионуклидов не одинаковы, равные ве-
весовые количества радионуклидов имеют различную активность.
Активность (А) — мера радиоактивности какого-либо количе-
количества радионуклида, находящегося в данном энергетическом состо-
состоянии в данный момент времени:
A=d4, A-2)
4. Единицы активности радионуклидов и доз радиации
39
Таблица 1.2. Единицы активности радионуклидов и их соотношения
Физическая
величина
Активность
нуклида
Плотность
радиоактив-
радиоактивного
загрязнения
Наименование единицы
и ее обозначение
внеси-
внесистемное
Ки (Ci)
Ки/км2
(Ci/km2)
систем-
системное (СИ)
Бк (Bq)
кБк/м2
(kBq/m2)
Соотношение между
единицами
1 Ки = 3,7-1010 Бк
1 Бк = 2,7-10~п Ки
1 Ки/км2 = 37 кБк/м2
1 кБк/м2 = 27-КГ3 Ки/км2
где dN — ожидаемое число спонтанных ядерных превращений из
данного энергетического состояния за промежуток времени dt.
Таким образом, активность — это физическая величина, характе-
характеризующая число распадов в единицу времени. Единицей активности
в СИ служит Беккерель (Бк, Bq). Беккерель — это такая актив-
активность радионуклида, при которой в нем за 1 с происходит 1 акт
распада: 1 Бк = 1 расп/с. Наиболее распространенной внесистемной
международной единицей до введения системы СИ являлась едини-
единица Кюри (Ки, Ci). Такой активностью обладает 1 г радия 226Ra.
1 Ки = 3, 7 • 1010 Бк (табл. 1.2).
Концентрация активности радиоактивного вещества часто опре-
определяется величиной удельной Аш (или объемной Ау) активности,
представляющей отношение активности (А) радионуклида в исследу-
исследуемом веществе к его массе (т) или объему (V). Например, удельная
активность Кп в воздухе:
А -А-
т
A.3)
A.4)
Для оценки радиоактивного загрязнения территории (плотности
радиоактивного загрязнения), т.е. присутствия радиоактивных ве-
веществ на поверхности предметов, в почве, внутри материала или
в другом месте в количестве, превышающем уровни, установленные
ныне действующими «Нормами радиационной безопасности 1999 го-
года» — НРБ-99, применяют величины радиоактивности, отнесенные к
единице площади — Ки/км2 или кБк/м2 (табл. 1.2). В связи с тем, что
единица Бк — величина незначительная, а Ки — подчас «громоздкая»,
удобно употреблять кратные или дольные их значения в соответствии
с табл. 1.1. Например, единицы удельной концентрации обозначаются:
кБк/кг, МБк/кг, ГБк/кг; мКи/т, мкКи/т и т.п., а объемной концен-
концентрации в жидкостях и газах — МБк/л, кБк/мл, нКи/см3 и т. д.
40 Гл. I. Ионизирующие излучения, их характеристика, дозиметрия
Таблица 1.3. Единицы экспозиционных доз ионизирующих излучений и их со-
соотношения
Физическая
величина
Экспозиционная
доза излучения
Мощность
экспозиционной
дозы излучения
Наименование единицы
и ее обозначение
внеси-
внесистемное
Р
(R)
Р/с
(R/s)
систем-
системное (СИ)
Кл/кг
(C/kg)
А/кг *)
(A/kg)
Соотношение между
единицами
1 Р = 2, 58-Ю Кл/кг
1 Кл/кг = 3876 Р
1 Р/с = 2, 58-Ю А/кг
1 А/кг = 3876 Р/с
*) А/кг — ампер на килограмм. По мнению В.И.Иванова с сотрудника-
сотрудниками [161, с. 5], такое обозначение единицы мощности дозы ошибочно: ампер —
единица силы тока, а ни о каком токе здесь речь не идет. Правильно: «кулон
на килограмм в секунду — Кл/(кг • с)».
4.2. Доза излучения (экспозиционная доза)
Для получения представления о количестве энергии ионизирую-
ионизирующего излучения, падающей на объект за время облучения, измеряют
величину экспозиционной дозы. Единицы ее измерения представлены
в табл. 1.3 вместе с единицами физической величины, производной
от дозы по времени — мощности дозы. Обратим внимание на раз-
размерность экспозиционной дозы — это заряд, возникающий в единице
массы поглотителя (к этому вопросу мы еще вернемся при опреде-
определении поглощенной дозы).
Экспозиционная доза (X) - это количественная характеристика
ионизирующей способности рентгеновского или ^f-излучения в возду-
воздухе (в диапазоне энергий излучения от десятков кэВ до 3 МэВ), из-
измеренная по количеству образованных зарядов {пар ионов) в воздухе
по формуле
y
где da — полный заряд ионов одного знака, возникающих в сухом
воздухе при торможении всех вторичных электронов, образованных
фотонами в малом объеме воздуха; dm — масса воздуха в этом объе-
объеме. Единица экспозиционной дозы в Международной системе единиц
(СИ) выражается в Кулонах на килограмм воздуха — Кл/кг (C/kg).
На практике все еще применяют установленную еще в 1928 г. Меж-
Международной комиссией по радиологическим единицам (МКРЕ) внеси-
внесистемную единицу Рентген — Р (R).
Для характеристики распределения во времени экспозиционной (а
также и любой другой) дозы используют величину мощности дозы.
Тогда расчет ведется на единицу времени (табл. 1.3).
Общая формула, связывающая величину экспозиционной дозы
излучения X с активностью препарата А, представлена следующим
4. Единицы активности радионуклидов и доз радиации 41
выражением:
R2, A.6)
где активность А выражается в мКюри, t — время облучения — в
часах; К1 — 7-постоянная данного изотопа — в Р/ч; расстояние от
источника излучения до измеряемого объекта R — в см. При этом
доза излучения будет выражена в рентгенах*).
4.3. Доза облучения (поглощенная доза)
Хотя использование экспозиционной дозы учитывает полную по-
потерю энергии излучения, но тогда неточно оценивается степень пора-
поражения объекта, поскольку лучевое повреждение вызывается энергией,
поглощенной объектом; часть потерянной энергии излучения, прони-
пронизывая облучаемый объект и не испытывая поглощения, не оказывает
на него действия. Например, при дозе излучения в воздухе в 1 Р энер-
энергия, поглощенная в воздухе, составляет 88 эрг/г, тогда как в мягких
тканях животных 92-97 эрг/г, но только после того, как процессы
рождения и поглощения вторичных электронов придут в равновесие.
Практически это соблюдается далеко не всегда.
Эта трудность преодолевается, если перейти к понятию погло-
поглощенной дозы. Кроме этого для оценки действия тех или иных доз
облучения на живые системы возникла необходимость учитывать не
только поглощенную энергию рентгеновского и 7"излУчения5 н0 и
других видов радиации, а также функциональную специфику живого
облучаемого объекта (его радиочувствительность). Доза поглощенная
D — это величина энергии ионизирующего излучения, переданная
веществу:
где de — средняя энергия, переданная ионизирующим излучением ве-
веществу, находящемуся в элементарном объеме, a dm — масса вещества
в этом объеме.
На пучке заряженных частиц (электроны, протоны и др.) погло-
поглощенная доза рассчитывается из следующего соотношения:
D = 1,602- 1(П10?Ф Гр, A.8)
где L — средняя ЛПЭ в единицах МэВ • г см2, Ф — флюенс частиц,
то есть отношение dN/dS, если dN — количество частиц, падающих
на площадку dS см2. Множитель 1,602 • 10~10 численно равен заряду
электрона, что понятно, если перевести энергию (МэВ) в систему СИ
как 1 эВ = 1,602 • 10~19 Дж (нужно еще учесть множители 106 для
*) Вопреки принятым международным рекомендациям, эта формула
все еще используется для практического применения без перехода в систему
СИ. Авторы оправдывают такие действия «удобством», основываясь на том,
что внесистемные единицы Р для экспозиционной дозы и рад для эквива-
эквивалентной дозы по численному выражению почти совпадают — значение дозы
в рентгенах больше всего на 4%, чем в радах.
42 Гл. I. Ионизирующие излучения, их характеристика, дозиметрия
Таблица 1.4. Единицы поглощенных доз ионизирующих излучений и их соот-
соотношения
Физическая
величина
Поглощенная
доза
Мощность
поглощенной
дозы
Наименование единицы
и ее обозначение
внеси-
внесистемное
рад (rad)
рад/с
(rad/s)
систем-
системное (СИ)
Гр (Gy)
Гр/с
(Gy/s)
Соотношение между
единицами
1 рад= МО Гр
1 Гр = 100 рад
1 рад/с = 1-Ю Гр/с
1 Гр/с = 100 рад/с
перевода из МэВ в эВ и 103 из кг в г; в показателе формулы A.8)
остается 19 — б — 3 = 10).
Энергия моснсет быть усреднена по любому определенно-
определенному объему, и в этом случае средняя доза будет равна полной
энергии, переданной объему, деленной на массу этого объ-
объема. Единицы поглощенных доз радиации представлены в табл. 1.4.
В Международной системе единиц (СИ) принята единица Грей (Гр,
Gy), предложенная в честь английского физика-радиобиолога Луи
Гарольда Грея. Один Грей — это поглощенная доза ионизирующего
излучения любого вида, при которой е 1 кг массы вещества погло-
поглощается 1 Дж энергии излучения A Гр = 1 Дж/кг = 100 рад).
В лучевой терапии применяется также так называемая инте-
интегральная доза, т. е. энергия, суммарно поглощенная во всем объеме
облучаемого объекта при локальном облучении.
Единицей СИ энергии ионизирующего излучения является Джо-
Джоуль (Дж, J). Внесистемной международной единицей поглощенной
дозы является рад (rad, «radiation absorbed dose»). 1 рад — это по-
поглощенная доза любого вида ионизирующих излучений, при которой
в 1 г массы вещества поглощается энергия излучения, равная 100 эрг
A рад = 100 эрг/г = 10~2 Дж/кг).
Мы уже заметили, что экспозиционная доза определена в рент-
рентгенах так, что она имеет физическую размерность удельного заряда
(на единицу массы). Размерность поглощенной дозы другая — это
величина энергии на единицу массы. Размерность третьего типа имеет
интегральная доза, которая фактически сохраняет размерность энер-
энергии, а не дозы, в привычном смысле этого слова.
Доза для отдельных органов или тканей Dt рассчитывается как
средняя поглощенная в них доза:
DT = —
тт
D dm,
A.9)
где тпт — масса органа или ткани, a D — поглощенная доза в элементе
массы dm.
5. Методы дозиметрии 43
5. Методы дозиметрии
Объективные методы количественной оценки поглощенной энергии
ионизирующих излучений разрабатываются специальной областью
измерительной техники — дозиметрией ионизирующих излучении *).
Дозы ионизирующих излучений измеряются с помощью различных
физических и химических методов: ионизационного, калориметри-
калориметрического, химического, люминесцентного, сцинтилляционного, твердо-
твердотельного, трекового.
Рассмотрим принципы, лежащие в основе некоторых из перечис-
перечисленных методов дозиметрии.
5.1. Метод ионизационной камеры
Заряды ионов, образованные в газе, помещенном в поле электриче-
электрического конденсатора, собираются на его электродах и создают электри-
электрический ток ионизационной камеры. Такой детектор может измерять
поглощенную дозу на основании принципа Брэгга-Грел. Так, если сре-
среда пересекается пучком фотонов и в ней имеется небольшая полость,
размеры которой достаточно малы по сравнению с пробегом возни-
возникающих электронов, то ионизация, происходящая в такой полости,
связана с энергией, поглощенной в окружающем полость веществе,
соотношением:
АЕ
где —— — энергия, поглощенная единицей массы вещества среды,
/\т
окружающей полость; N — число пар ионов, образованных в единице
массы полости; и — средняя энергия, затрачиваемая на образование
одной пары ионов в газе, которым заполнена полость. Величины Sm
и Sq — массовые тормозные способности (в единицах МэВ • г см2)
соответственно среды и газа, которым заполнена полость. При из-
измерениях на пучке быстрых нейтронов действует тот же принцип,
только речь идет не о пробегах электронов, пересекающих полость,
а о пробегах нейтронов.
5.2. Калориметрический метод
Этот метод основан на измерении количества тепла, создаваемого
поглощенной энергией излучения.
Образец из углерода или воды с помещенным в него полупровод-
полупроводниковым детектором помещается в термостат и калибруется по току
электрического нагревателя с помощью высокочувствительного элек-
электрометрического прибора. Выбор материала зависит от требований к
эксперименту: вода по тканеэквивалентности лучше, чем графит, но
возможность затраты части энергии излучения на электролиз требует
особых предосторожностей. Так или иначе, калориметрический метод
лучше других удовлетворяет требованиям так называемой абсолютной
*) Подробнее о методах дозиметрии см. [17, 41].
44 Гл. I. Ионизирующие излучения, их характеристика, дозиметрия
дозиметрии. Нагрев тел чрезвычайно мал: так, доза 5 Гр повышает
температуру тела только на 10~3 °С. Отсюда, кстати, понятно, что
нагрев организма не определяет биологического действия излучений.
Необходимость измерять чрезвычайно малые изменения темпера-
температуры ограничивает применимость метода лабораторными условиями.
5.3. Сцинтилляционный метод
Световой выход ряда веществ (сцинтилляторов) линейно зависит
от поглощенной дозы в достаточно широком диапазоне доз. Такие
вещества в сочетании с фотоэлектронным умножителем используют
в качестве дозиметров. В каждом случае стараются максимально при-
приблизить химический состав вещества-поглотителя и сцинтиллятора,
т.е. сделать его «тканеэквивалентным».
5.4. Химические методы дозиметрии
Любую радиационно-химическую реакцию, выход которой зависит
от дозы ионизирующего излучения, можно использовать для опреде-
определения поглощенной дозы. Необходимо, чтобы такая реакция не зави-
зависела от мощности дозы, от плотности ионизации и могла происходить
в системах, по составу близких к биологическим тканям. Тип выби-
выбираемой реакции определяется диапазоном измеряемых доз. Так, дозы
более 106 Гр определяют по окрашиванию кристаллов и стекол, дозы
от 104 до 105 Гр — по реакциям в жидкой фазе, дозы менее 104 Гр —
по обесцвечиванию ряда красителей. В последнее время для дозимет-
дозиметрии в широком диапазоне доз A0-105 Гр) используется образование
свободных радикалов в аланине, которые измеряются методом ЭПР
(Л. А. Блюменфельд, А.Н.Тихонов, 1997).
Один из наиболее распространенных химических дозиметров —
«дозиметр Фрике» — обеспечивает измерение доз в диапазоне 4—
400 Гр. Мерой поглощенной дозы служит концентрация соли трех-
трехвалентного железа, в которую при облучении водного раствора пере-
переходит соль двухвалентного железа. Применяются также цериевый, би-
хроматный, хлорбензольный, щавелевокислотный, глюкозный и дру-
другие дозиметры.
6. Эквидозиметрия и концепция риска*)
Несмотря на широкие возможности повышения точности методов
дозиметрии, трудно установить связь между измеряемой физической
величиной и ожидаемым радиационным эффектом. Для понимания
механизмов этих эффектов еще предстоит узнать многое, чему посвя-
посвящены другие главы учебника. Нельзя также составить представление
о радиационном эффекте, не зная пространственного распределения
поглощенной энергии, вида и энергии ионизирующего излучения и
*) Данный раздел дополнен научным редактором профессором
М. Ф. Ломановым.
6. Эквидозиметрия и концепция риска 45
других факторов, которые позволили бы определить эквивалент дозы
с поправкой на действие излучения на ткани живого организма. Сово-
Совокупность принципов и методов определения таких дозиметрических
величин объединяется емким термином «эквидозиметрия», который
впервые был введен И. Б. Кеирим-Маркусом A980). Эквидозиметрия
вводит нас в круг вопросов, позволяющих формулировать критерии
безопасности обращения с источниками ионизирующих излучений.
В задачи эквидозиметрии входит также создание аппаратуры для
измерения эквивалентных доз. Поначалу это делалось на основе уже
рассмотренных методов дозиметрии, а в настоящее время эту цель вы-
выполняют методы экспериментальной микродозиметрии, которые будут
описаны в конце гл. III.
6.1. Качество излучения
Величина поглощенной дозы учитывает только энергию, абсорби-
абсорбированную облучаемым объектом, и не оценивает «качество излуче-
излучения». Понятие качества излучения выражает его способность про-
производить различные радиационные эффекты в зависимости как от
сорта частиц, так и в первую очередь от его ЛПЭ. С возрастанием
плотности ионизации меняется степень повреждения живых систем.
Из-за различия характера радиационного эффекта, зависимостей
от состава излучения и временных характеристик процесса облучения
и т. д., казалось бы трудно сводить качество излучения к одной только
характеристике, допустим, к ЛПЭ. Однако во многих случаях это
просто необходимо — сюда относится широкий круг проблем эколо-
экологии, радиационной безопасности и защиты от излучений. Нередко нет
возможности определить состав излучения и многие другие факторы,
а обстоятельства требуют предвидеть или оценить эффекты хотя бы
в среднем.
Поэтому в целях противорадиационной защиты используются не
конкретные значения биологической эффективности того или иного
действия излучений, (в этом нам еще предстоит разбираться в даль-
дальнейшем), а так называемый коэффициент качества (КК, quality factor)
излучения. Такой «фактор качества» (ныне принято выражать его в
виде «взвешивающих коэффициентов») является регламентированной
величиной, его значения определены специальными комиссиями и
включены в международные и национальные нормы, предназначен-
предназначенные для контроля радиационной опасности. КК зависит только от
интервала значений ЛПЭ, а его детализация в виде взвешивающих
коэффициентов зависит также от того, какой орган или часть тела
подвергается облучению.
Существует два типа взвешивающих коэффициентов. Первый Wr
предназначен для учета ЛПЭ излучений в целом (табл. 1.5).
Основным в дозиметрии ионизирующих излучений является выра-
выражение дозы в терминах эквивалентной дозы Ht.r — поглощенной
46 Гл. I. Ионизирующие излучения, их характеристика, дозиметрия
Таблица 1.5. Значения взвешивающих коэффициентов Wr для отдельных ви-
видов ионизирующих излучений при расчете эквивалентной дозы
1.
2.
3.
За.
36.
Зв.
Зг.
Зд.
4.
5.
Ионизирующие излучения
Фотоны любых энергий
Электроны и мюоны любых энергий
Нейтроны с энергиями:
менее 10 кэВ
от 10 кэВ до 100 кэВ
от 100 кэВ до 2 МэВ
от 2 МэВ до 20 МэВ
Более 20 МэВ
Протоны с энергиями более 2 МэВ,
кроме протонов отдачи
а-частицы, осколки деления,
тяжелые ядра
Wr
1
1
5
10
20
10
5
5
20
в органе или ткани дозы, умноженной на соответствующий взве-
взвешивающий коэффициент для данного вида излучения Wr:
Ht.r =
A.11)
где Dt.r — средняя поглощенная доза в органе или ткани Т, a Wr —
взвешивающий коэффициент для излучения типа R (тип ткани Т в
этом случае не учитывается). Таким образом, взвешивающие коэффи-
коэффициенты для отдельных видов ионизирующих излучений учитывают
относительную эффективность радиации в индуцировании биологи-
биологических эффектов и используются в расчетах радиационной защиты.
При воздействии различных видов излучения эквивалентная доза
определяется как сумма эквивалентных доз для этих видов излучения
с их взвешивающими коэффициентами:
= у ;
A.12)
В международной системе единиц СИ для эквивалентной дозы
принята специальная единица Зиверт (Зв, Sv), названная по имени
известного шведского специалиста в области дозиметрии и радиаци-
радиационной безопасности Рольфа Максимилиана Зиверта. Как и для по-
поглощенной дозы, его эквивалентом является 1 Дж/кг. Внесистемной
международной единицей эквивалентной дозы является бэр (биологи-
(биологический эквивалент рада). 1 Зв = 100 бэр.
Приведем в табл. 1.6 единицы эквивалентных доз и их соотноше-
соотношения.
6. Эквидозиметрия и концепция риска
47
Таблица 1.6. Единицы эквивалентных доз ионизирующих излучений и их со-
соотношение
Физическая
величина
Эквивалентная
доза
Мощность
эквивалентной
дозы
Наименование единицы
и ее обозначение
внеси-
внесистемное
бэр (rem)
бэр/с
(rem/s)
систем-
системное (СИ)
Зв (Sv)
Зв/с
(Sv/s)
Соотношение между
единицами
1 бэр = 1-Ю Зв
1 Зв = 100 бэр
1 бэр/с = 1-Ю Зв/с
1 Зв/с = 100 бэр/с
6.2. Эффективная доза облучения
При общем однократном облучении организма разные органы и
ткани (а в клетке — органеллы, макромолекулы) обладают различ-
различной чувствительностью к действию радиации. Так, при одинаковой
эквивалентной дозе риск генетических повреждений наиболее веро-
вероятен при облучении репродуктивных органов. Риск возникновения
рака легких при воздействии, например, а-излучения радона в рав-
равных условиях облучения более вероятен по сравнению, например, с
раком кожи и т. п. Поэтому понятно, что дозы облучения отдельных
элементов живых систем также следует рассчитывать с учетом еще
одного типа взвешивающих коэффициентов Wt для оценки радио-
радиочувствительности биологических систем (табл. 1.7).
Эффективная доза Е — это величина, используемая как мера
риска возникновения отдаленных последствий облучения всего тела
человека и отдельных его органов и тканей с учетом их радио-
радиочувствительности. Она представляет сумму произведений эквива-
эквивалентной дозы в органах и тканях на соответствующие взвешивающие
коэффициенты:
где Нт — эквивалентная доза в органе или ткани Т, Wt — взвешива-
взвешивающий коэффициент для органа или ткани Т.
Эффективные дозы измеряются так же, как и эквивалентные, в
бэрах и зивертах.
6.3. Ожидаемые индивидуальные дозы
Применяются также эквивалентная Нт{т) и эффективная Е(т)
дозы, ожидаемые при внутреннем облучении за время т, прошедшее
после поступления радиоактивных веществ в организм:
to+т
Нт(т) = [ HT(t) dt (I.14)
to
48 Гл. I. Ионизирующие излучения, их характеристика, дозиметрия
Таблица 1.7. Значения взвешивающих коэффициентов Wt для разных органов
и тканей при расчете эффективной дозы
Органы и ткани
Гонады
Костный мозг (красный)
Тонкая кишка
Легкие
Желудок
Мочевой пузырь
Грудная железа
Wt
0,20
0,12
0,12
0,12
0,12
0,05
0,05
Органы и ткани
Печень
Пищевод
Щитовидная железа
Кожа
Клетки костных
поверхностей
Остальное
WT
0,05
0,05
0,05
0,01
0,01
0,05 *)
*) При расчетах учитывается, что «остальное» включает надпочеч-
надпочечники, головной мозг, экстраторакальный отдел органов дыхания,
тонкую кишку, почки, мышечную ткань, поджелудочную железу,
селезенку, вилочковую железу и матку. В тех исключительных
случаях, когда один из перечисленных органов или тканей получает
эквивалентную дозу, превышающую самую большую дозу, полу-
полученную любым из двенадцати органов или тканей, для которых
определены взвешивающие коэффициенты, следует приписать это-
этому органу или ткани взвешивающий коэффициент, равный 0,025,
а оставшимся органам или тканям из рубрики «Остальное» припи-
приписать суммарный коэффициент, равный 0,025.
A.15)
где to — момент поступления, а Нт{Ь) — мощность эквивалентной дозы
к моменту времени t в органе или ткани Т. Когда т не определено, то
его принимают равным 50 лет для взрослого человека и 70 — to для
ребенка.
Иногда в радиобиологических расчетах ожидаемых индивидуаль-
индивидуальных доз используют так называемую эффективную годовую дозу,
представляющую собой сумму эффективных доз внешнего облучения,
полученных за календарный год, и ожидаемой эффективной дозы
внутреннего облучения, обусловленной поступлением в организм ра-
радионуклидов за этот же год.
6.4. Концепция риска облучения
Ионизирующие излучения являются одним из множества источни-
источников риска для здоровья человека.
Следует различать два вида этого риска: в случае, когда речь идет
о непосредственном вреде, наносимом организму человека и проявля-
проявляющемся при той или иной патологии; можно говорить о соматическом
действии излучения, которое может возникать как при остром, так
и при хроническом облучении в больших дозах. Но опасность пред-
представляют и относительно малые дозы, когда облучению подвергаются
6. Эквидозиметрия и концепция риска 49
те или иные контингенты населения и можно опасаться накопления
генетических последствий, или популяционных эффектов у будущих
поколений.
Однако популяционные эффекты свойственны не только «населе-
«населению» в целом, но и клеточным популяциям внутри отдельного орга-
организма. Для того, чтобы различать эти варианты, необходимо иметь в
виду прежде всего конкретные проявления действия радиации на жи-
живые клетки и организм, что и интересует в первую очередь биологов.
Сначала рассмотрим эти вопросы, а затем перейдем к подходам, когда
концепции «генетического» характера могут ставиться на первое ме-
место (но не только они), что определяется нормативными документами
радиационной безопасности, которые выработаны для радиационной
защиты и безопасности персонала установок и населения.
Основными документами, как и входящими в законодательство
многих стран, в России являются «Нормы радиационной безопас-
безопасности» — НРБ-99 [38] и соответствующие им санитарные правила
ОСПРБ-99 [42]. Именно обеспечение мер радиационной безопасности
и научное обоснование необходимых для этого средств и методов
и является конечной целью дозиметрии ионизирующих излучений,
рассмотренной в этой главе.
Представленная в ней многоступенчатая иерархия измерений ра-
радиоактивности, доз излучения и облучения отражает логическую цепь
последовательно развивающихся во времени и пространстве событий,
начинающихся с момента эмиссии ионизирующей радиации и затем
включающих поглощение энергии излучений единицей массы облуча-
облучаемого объекта, эффекты, зависящие от вида радиации, и, что не менее
важно, от радиобиологического эффекта, т. е. от чувствительности
живой системы к ионизирующим излучениям.
И еще один аспект всегда учитывается при количественной оценке
лучевых воздействий. Оказывается, мало знать только активность
источника излучения и величину поглощенных доз облучения. Для
оценки степени поражения живого объекта не менее важен учет харак-
характера, способа его облучения, т. е. распределение поглощенной энергии
во времени и пространстве.
Так при облучении организма различают: кратковременное и дли-
длительное; однократное и многократное (фракционированное, дробное);
общее и локальное; равномерное и неравномерное; внешнее и внутрен-
внутреннее (инкорпорированное), острое и хроническое облучения.
Например, в биологическом плане важно знать не только дозу,
которую получил объект, но и дозу, отнесенную к единице времени,
т. е. мощность дозы, интенсивность самого облучения. Известно,
что при летальных дозах чем больше мощность дозы, тем с большей
скоростью возрастает доза облучения, а выживаемость биологических
объектов снижается. Обнаружено, что при высокой мощности дозы об-
облучения репарирующая активность биологических систем не успевает
проявиться в полной мере.По временному критерию все виды общих
облучений можно разделить на три разновидности: кратковременное
(острое), протяженное (пролонгированное) и хроническое.
4 Ю. Б. Кудряшов
50 Гл. I. Ионизирующие излучения, их характеристика, дозиметрия
Кратковременным (острым) облучением считают такое лучевое
воздействие, при котором поражающую дозу организм получает за
короткий промежуток времени, исчисляемый минутами. В радиобио-
радиобиологических исследованиях это требование в отношении j- и рентгенов-
рентгеновских излучений может быть реализовано в условиях внешнего общего
равномерного облучения мелких лабораторных животных при мощ-
мощности дозы 0,15—5,0 Гр/мин., а крупных животных — 0,2—6,0 Гр/мин.
Однако конкретные величины мощности дозы, при которых начинает
сказываться зависимость биологического эффекта от этих показате-
показателей, будут в определенной степени условными, так как они зави-
зависят не только от процессов степени восстановления систем, но и от
других биохимических и физиологических особенностей облучаемых
организмов.
Протяженное (пролонгированное) облучение — это такое лучевое
воздействие, при котором облучение животных в абсолютно леталь-
летальной дозе (LDioo) длится от нескольких часов до нескольких суток.
Протяженные воздействия могут осуществляться с постоянной или
переменной мощностью дозы.
Хроническая лучевая болезнь развивается при суммарных дозах
поглощенной энергии 0,7-1,0 Дж/кг и мощности дозы излучения
0,001-0,005 Дж/кг за одни сутки. Лучевая болезнь возникает и при
длительном локальном или неравномерном облучении.
В международных документах, в том числе и в нашем националь-
национальном НРБ-99, все эффекты, не имеющие генетического (популяцион-
ного) или канцерогенного свойства, получили название «детермини-
«детерминированных». В том же смысле, как и в Нормах, термин употреблять
начали в лучевой терапии. Поэтому ранние реакции на облучение,
когда процессы восстановления клеток еще не так сильно выражены,
тоже оказываются более стохастическими, чем поздние реакции*).
Детерминированными**) называют клинически выявляемые био-
биологические эффекты, когда предполагается существование порога,
ниже которого эффект отсутствует, а выше — зависит от дозы.
Эффекты излучения стохастические — это биологические эф-
эффекты, не имеющие дозового порога возникновения, когда лучевые
изменения, в частности тяжесть их проявления, не зависят от дозы.
При радиозащитных оценках вероятность их возникновения предпо-
предполагается пропорциональной дозе.
Таким образом, чтобы избежать вредного действия радиации, при-
приходится учитывать любые возможные лучевые последствия и толь-
только разумно выбрать нижнюю границу для них. В качестве такой
*) Это подробно обсуждается в недавно изданной монографии [137].
**) Понятие детерминированности применяется по-разному, в зависимо-
зависимости от традиции и сложившихся представлений о причинной связи изучае-
изучаемых явлений. Детерминированы не значения переменных, а только наличие
определенного эффекта с вполне предсказуемой степенью тяжести. В даль-
дальнейшем (например, в гл. III) этот термин применяется в более «жестком»
смысле как определенность зависимости результата от исходных данных.
6. Эквидозиметрия и концепция риска
51
Таблица 1.8. Основные пределы доз
Нормируемые
величины
Эффективная
доза
Эквивалентная
доза за год в:
хрусталике глаза,
коже,
кистях и стопах
Пределы доз
Персонал (группа А)
20 мЗв в год в
среднем за любые
последовательные
5 лет, но не более
50 мЗв/год
150 мЗв
500 мЗв
500 мЗв
Население
1 мЗв в год в среднем
за любые
последовательные
5 лет, но не более
5 мЗв/год
15 мЗв
50 мЗв
50 мЗв
границы в настоящее время выбран предел дозы (ПД). Так называется
величина годовой эффективной или эквивалентной дозы техногенного
облучения, которая не должна превышаться в условиях нормальной
работы. Соблюдение годового ПД предотвращает возникновение де-
детерминированных эффектов, а вероятность стохастических эффектов
сохраняется на приемлемом уровне исключения возможности их появ-
появления на действующем фоне естественной радиоактивности и других
экологических факторов. Для технического персонала, работающего
в сфере действия источников ионизирующих излучений, из-за его от-
относительной малочисленности накопление популяционных эффектов
намного менее вероятно, чем для населения в целом. Поэтому НРБ-99
устанавливают различные пределы доз для персонала и населения.
Имеется в виду, что персонал — это две группы лиц: работающие с
техногенными источниками излучения (группа А) и находящиеся по
условиям работы в сфере их воздействия (группа Б). Понятно, что
все лица, включая и персонал, вне работы с источниками излучения
условно относятся к категории «населения».
Естественно, более высокий предел дозы устанавливается для ра-
работников атомной промышленности, или, если выражаться более точ-
точно, для персонала группы А. Для группы Б все пределы доз установ-
установлены ровно вчетверо меньше, чем для группы А. Для населения —
уже в 10-20 раз. Более точные значения приводятся в табл. 1.8.
Таким образом, при общем хроническом облучении организм мо-
может временно подвергаться воздействию ионизирующих излучений
в дозах, превышающих предел дозы, достигающий для персонала
группы А 50 мГр/год (по прежним нормам это допускалось при
любом сроке воздействия). Однако в период постоянного длительного
облучения это должно быть скомпенсировано так, чтобы в среднем
за любые последовательные 5 лет доза не превысила нормы 20 мЗв
в год. В этом состоит существенное ужесточение современных норм
радиационной безопасности от действовавших прежде.
52 Гл. I. Ионизирующие излучения, их характеристика, дозиметрия
В Нормах уделено внимание и природным источникам излуче-
излучения: излучению изотопов радона и продуктов их распада в воздухе
помещений, природных радионуклидов в питьевой воде и т.п. Если
эффективная доза не превышает 2 мЗв в год, то облучение не пре-
превышает средних значений доз, допустимых для населения страны от
природных источников. Как и при техногенном облучении, высоким
считается уровень облучения более 5 мЗв/год.
Известная радиофобия у части населения многих стран не призна-
признает никаких дозовых пределов. Однако уже приведенные нами выдерж-
выдержки из действующих норм оценки радиационной опасности позволяют
понять, что принятые уровни допустимой техногенной, медицинской и
природной лучевой нагрузки являются глубоко продуманными. Само
собой разумеется, что ориентация норм на генетическую защиту от
облучения заведомо учитывает и любую соматическую опасность.
Выше приводились две цифры: для населения вообще допускается
предел дозы 1 мЗв/год по техногенным источникам, а при рентгенов-
рентгеновских обследованиях — 2 мЗв/год. Кажущееся противоречие устраня-
устраняется, если вспомнить, что эти обследования резко ограничиваются в
двух случаях: для женщин в репродуктивный период и для детей. Со-
Соматическая опасность облучения этих двух контингентов значительно
возрастает. В то же время очевидно, что при обычной техногенной
нагрузке эту часть населения специально оградить от дополнительно-
дополнительного облучения невозможно. Впрочем, ряд изменений сделан и в этом
направлении: совсем недавно положение было иным — до принятия
новых норм радиационной безопасности в 1999 году предельно допу-
допустимая доза (ПДД) была в 2,5 раза более высокой, чем ПД в настоящее
время.
Необходимо подчеркнуть, что в рамках эквидозиметрии мы можем
пользоваться только физическим подходом к определению заведомо
усредненных факторов риска облучения, выводя за скобки конкрет-
конкретные биологические данные. По сравнению с обычной дозиметрией,
эквидозиметрия делает шаг вперед — пользуется концепциями риска
облучения, вводит усредненные факторы популяционного характера и
т. п. Но нельзя забывать, что вводимые ею понятия типа эквивалент-
эквивалентной дозы представляют собой прежде всего физические, а не биологи-
биологические величины, так как непосредственные измерения в эквидозимет-
эквидозиметрии выполняются только физическими методами. Биологический ре-
результат входит в них как абстрактная формула, касающаяся в данном
случае, «по определению», только вредного действия ионизирующей
радиации, хотя уже хорошо известно, что к этому нельзя свести все
процессы, происходящие в организме под действием облучения.
Подробно вопросы о лучевом поражении человека, животных и
растительных организмов специально не рассматриваются в данном
учебнике. Однако следует подчеркнуть чрезвычайно важное значе-
значение динамических, биологических свойств облучаемых организмов,
6. Эквидозиметрия и концепция риска 53
их репаративную способность, наличие компенсаторных структурно-
функциональных механизмов ответа на любые повреждающие воздей-
воздействия, включая действие ионизирующих излучений.
Кроме того, известно влияние мощности дозы, в зависимости от
которой меняется скорость восстановительных процессов в биологи-
биологических системах, особенности лучевых реакций на способы облучения
при распределении поглощаемой энергии во времени и пространстве,
зависимость эквивалентных и эффективных доз от радиочувствитель-
радиочувствительности объектов. Все это говорит о том, что на строгие стандартные
условия облучения следует стохастический биологический ответ,
многогранность которого, как мы увидим, будет сказываться все в
большей степени по мере усложнения организации живой системы.
Глава II
ПОГЛОЩЕНИЕ ЭНЕРГИИ ИОНИЗИРУЮЩИХ
ИЗЛУЧЕНИЙ
1. Общий принцип Гроттгуса.
Дискретный характер поглощения энергии ионизирующих
излучений
Прохождение через вещество фотонов рентгеновского или 7~
излучения, потока нейтронов, электронов или ускоренных ядер
элементов может привести к поглощению части энергии этим веще-
веществом. При облучении живой материи мы наблюдаем биологические
последствия радиационного воздействия. Тестируемый биологический
эффект — результат поглощения энергии излучения атомами и
молекулами, составляющими клетки и ткани. Иначе говоря, в
радиобиологии выполняется общий принцип Гроттгуса, согласно
которому только та часть энергии излучения может вызвать
изменения в веществе, которая поглощается этим веществом;
энергия отраженного или проходящего сквозь вещество излучения
не оказывает действия. Именно в силу этого принципа возникает
различие, с одной стороны, между экспозиционной и поглощенной
дозами и с другой стороны — между удельными потерями энергии
и ЛПЭ, о чем говорилось в предыдущей главе. Разница между
потерянной и поглощенной энергией излучения бывает достаточно
велика для того, чтобы говорить о нарушении равновесия между
образованием и поглощением вторичных электронов в среде,
облученной 7-квантами.
Принцип Гроттгуса учитывается при построении дозного распре-
распределения излучения (или, как говорят, дозного поля), которое осуще-
осуществляют лучевые терапевты, чтобы на изображении анатомического
среза тела больного определить область мишени (например, злока-
злокачественной опухоли) и совместить ее границы с выбранной, обычно
90%-ной, изодозой. Под изодозой понимают линии, проведенные через
точки с одинаковой поглощенной дозой в гомогенной или гетерогенной
среде (макроскопическом смысле этих понятий).
2. «Энергетический парадокс» в радиобиологии 55
Радиационная биофизика учитывает и более глубокие различия в
распределении энергии в веществе, которые также связаны с прин-
принципом Гроттгуса. При прохождении ионизирующих излучений в ве-
веществе выделение энергии происходит лишь в отдельных, редко рас-
расположенных микрообъемах, так как обмен энергией между излуче-
излучением и атомами поглотителя носит дискретный вероятностный
характер.
Во многих облучаемых областях излучение вообще не передает
энергию веществу. Эти области, следовательно, «не знают» о том, что
облучение имело место, и испытывают лишь вторичное воздействие
измененных структур, поглотивших энергию.
Вероятностный характер поглощения энергии приводит к необхо-
необходимости описания ряда радиационных величин в терминах статисти-
статистики. Статистические флуктуации радиационных величин существенны,
следовательно, действие излучения должно определяться фактиче-
фактическими, а не средними значениями (математическим ожиданием) со-
соответствующих величин. Поэтому стохастические величины рассмат-
рассматриваются в радиобиологии наряду с нестохастическими.
2. «Энергетический парадокс» в радиобиологии
Пользуясь количественными методами дозиметрии, можно уста-
установить зависимость между величиной поглощенной энергии и выра-
выраженностью биологического эффекта облучения, например, определить
минимальную поглощенную дозу, вызывающую гибель различных ор-
организмов.
Установлено, что при внешнем общем однократном и равномер-
равномерном облучении поглощение ионизирующей радиации в дозе 7-10 Гр
достаточно для возникновения острой формы лучевой болезни и по-
последующей гибели млекопитающих, в том числе и человека.
Согласно определению, доза в 1 Гр соответствует поглощению
1 Дж энергии 1 кг ткани. Следовательно, смертельная для млекопита-
млекопитающих доза общего облучения в 10 Гр ионизирующей радиации приво-
приводит к поглощению одним граммом ткани 105 эрг энергии излучения.
Удивительно, что столь незначительная порция энергии вызывает фа-
фатальные последствия для организма. Если такое же количество энер-
энергии сообщить ткани не в виде потока ионизирующих частиц, а кван-
квантами теплового (инфракрасного) излучения, то регистрируемым ре-
результатом воздействия будет незначительное повышение температуры
тела — всего менее, чем на 0,002 °С. Естественно, что такое повышение
температуры тела никак не может повлиять на состояние организма.
Этот «энергетический парадокс» указывает на кажущееся глубокое
несоответствие между количеством энергии, теряемой в тканях
ионизирующим излучением, и теми биологическими последствиями,
к которым приводит облучение.
56 Гл. П. Поглощение энергии ионизирующих излучений
Следовательно, в самом факте поглощения дозы ионизирующей
радиации и ее величине нет никаких сведений о причинах необык-
необыкновенно высокой биологической эффективности ионизирующих излу-
излучений. Для понимания их надо начать с рассмотрения элементарных
физических процессов, в результате которых осуществляется переда-
передача энергии ионизирующих излучений атомам и молекулам вещества,
чтобы затем установить их значение для процессов, происходящих в
биологических средах.
3. Относительная биологическая эффективность (ОБЭ)
разных видов ионизирующих излучений
На различных биологических объектах проводилось сопоставление
эффективности различных типов ионизирующих частиц. В опытах на
млекопитающих критерием эффективности служило летальное дей-
действие излучений и различные отдаленные эффекты, такие как появле-
появление лучевых катаракт и злокачественных опухолей, снижение продол-
продолжительности жизни. При облучении клеточных суспензий оценивали
выживаемость клеток при действии радиации в одинаковых дозах,
сообщенных различными типами ионизирующих частиц, подсчиты-
подсчитывали число индуцированных облучением хромосомных аберраций и
мутаций.
Эти и другие эксперименты позволили количественно оценить эф-
эффективность различных видов ионизирующих излучений и ввести ко-
коэффициент, который для каждой конкретной биологической системы
показывает эффективность данного типа излучения по сравнению с
выбранным стандартным излучением — коэффициент относительной
биологической эффективности (ОБЭ). ОБЭ определяется из соотно-
соотношения, начальная часть которого показывает, как осуществляется пе-
переход от «абсолютной» биологической эффективности (такой термин
редко употребляется) к ее относительной величине:
биологическая поглощенная доза, необходимая для
эффективность получения данного биологического
исследуемого эффекта при действии рентгеновского
излучения излучения 200 кэВ (в греях)
-р — .
оиологическая поглощенная доза исследуемого
эффективность излучения, необходимая для получения
рентгеновского того же биологического эффекта
излучения с (в греях)
энергией и 200 кэВ
Как видно из определения, в данном случае в качестве стандарт-
стандартного выбрано рентгеновское излучение с энергией квантов 200 кэВ,
которое образует примерно 100 пар ионов на 1 мкм пути в воде.
Для такого излучения ОБЭ принимают равной единице. Необходимо
отметить, что иногда в качестве эталона вместо рентгеновского
принимается излучение источника 60Со, что приводит к некоторым
3. Относительная биологическая эффективность излучений
57
неучтенным различиям в ОБЭ.
Для каждой изучаемой системы коэффициент ОБЭ находят путем
сопоставления эффектов исследуемого и стандартного излучений,
примененных в одинаковой дозе. При этом необходимо учитывать, что
значение ОБЭ может изменяться в зависимости от условий облучения,
например, от того, однократно или дробно поглощалась объектом
определенная доза излучения, а также от мощности дозы. Желательно,
чтобы сравниваемые виды излучения имели сходную «картину действия»
на выбранную тест-систему.
В качестве примера рассмотрим результаты одного из эксперимен-
экспериментов по определению ОБЭ нейтронов по критерию возникновения луче-
лучевой катаракты у мышей. Оказалось, что стандартное рентгеновское из-
излучение в дозе 8 Гр приводило к появлению катаракты у 50% мышей.
Такой же эффект достигался в результате нейтронного облучения
@,5 МэВ) в дозе 2 Гр. Коэффициент#1661 ОБЭ для этой системы
равен четырем. Однако если облучение в той же дозе производили от-
отдельными фракциями, то коэффициент ОБЭ значительно возрастал.
Характерная зависимость ОБЭ от ЛПЭ излучения графически
представлена на рис. П.1. Из рисунка видно, как в широком диапазоне
ЛПЭ излучений (от 0,2 до 100 кэВ/мкм) ОБЭ ионизирующих частиц
растет по мере увеличения о
ЛПЭ. Таким образом, экспе-
экспериментально установлена ве-
ведущая роль плотности рас-
распределения ионов вдоль пути
ионизирующей частицы для
эффективности биологическо-
биологического действия радиации.
При значениях ЛПЭ вы-
выше 90-100 кэВ/мкм кривая за-
О)
о
,мм.1
10 100
ЛПЭ, кэВ/мкм
1000
Рис. II. 1. Зависимость ОБЭ излучения от
ЛПЭ по критерию выживаемости клеток
почек человека в культуре: 1, 2, 3 — ре-
результаты облучения в дозах, при которых
доля выживших клеток составляет соот-
соответственно 0,8, 0,1 и 0,01
висимости ОБЭ от ЛПЭ на
рис. II. 1 проходит максимум
и снижается. Вероятно, это
связано с тем, что уже при
значении ЛПЭ 100 кэВ/мкм
в клетке возникает «критиче-
«критическое» число ионизации, доста-
достаточное для ее гибели. Дальнейшее увеличение плотности ионизации
неэффективно.
Таким образом, в радиобиологических экспериментах возможно ис-
использование излучений с различной величиной ЛПЭ, а следовательно
и ОБЭ. Для этого необходимо выбирать ионизирующие частицы с
определенным зарядом и скоростью (т. е. энергией). Знание механизма
взаимодействия ионизирующих частиц с атомами поглотителя позво-
позволяет судить о характере ионизации в облученном биологическом суб-
субстрате, что необходимо при использовании ионизирующих излучений
58
Гл. П. Поглощение энергии ионизирующих излучений
в радиотерапии при определении оптимальных режимов облучения
различных биологических объектов и систем.
4. Механизмы процессов поглощения энергии излучений
4.1. Поглощение рентгеновского и 7-излУчении
Рентгеновское излучение — это высокоэнергетическое коротковол-
коротковолновое (высокочастотное) электромагнитное излучение, которое может
генерироваться при торможении ускоренных электронов в кулонов-
ском поле ядер атомов вещества-поглотителя. В соответствии с зако-
законами электродинамики электрон, испытывающий торможение, теряет
часть своей энергии за счет излучения; при энергии электрона выше
20 МэВ потеря энергии на излучение становится почти пропорцио-
пропорциональной полной энергии электрона:
радиац
Z2(Ek+mc2)N,
(П.1)
где
— кинетическая энергия электрона, Z — заряд ядра материала
поглотителя, N — число атомов в 1 см3
поглотителя.
Из соотношения (П.1) следует, что
энергия квантов рентгеновского излу-
излучения примерно пропорциональна пол-
полной энергии электрона и находится
в квадратичной зависимости от атом-
атомного номера материала поглотителя.
Это учитывается при конструировании
рентгеновских трубок (рис. П.2), в ко-
которых электроны приобретают боль-
большую кинетическую энергию при уско-
ускорении в электрическом поле, созда-
создаваемом за счет приложения высокого
напряжения (сотни тысяч вольт) меж-
между катодом и анодом.
Анод изготовляют из материалов с
большим атомным номером, так как
именно в кулоновском поле атомов ано-
анода и происходит торможение ускорен-
ускоренных электронов. При бомбардировке
анода электронами только 0,2% их ки-
кинетической энергии испускается в ви-
виде квантов рентгеновского излучения,
остальная энергия рассеивается в ви-
виде тепла. Поэтому необходимо надеж-
надежное охлаждение рентгеновских трубок.
0,4
Рис. П.2. Рентгеновская трубка:
а) принципиальная схема вклю-
включения трубки: источник высо-
высокого напряжения (U) включает-
включается между анодом (А) и катодом
(К); б) спектр излучения трубки
с молибденовым антикатодом
4. Механизмы процессов поглощения энергии излучений 59
Для некоторых экспериментальных исследований в качестве источни-
источника рентгеновского излучения используют ускорители — синхротроны,
в которых электроны могут ускоряться до околосветовых скоростей.
Искривление их траекторий в магнитном поле сопровождается так на-
называемым синхротронным, или магнитотормозным излучением. Это
излучение генерируется в узком конусе и направлено по касательной
к траектории электрона в поле ускорителя. Благодаря высокой ин-
интенсивности такие пучки находят многие применения для научных
исследований в ультрафиолетовой и мягкой рентгеновской области
спектра.
7-излучение — это электромагнитное излучение с чрезвычайно
малой длиной волны (меньше 1 А), возникающее при изменении энер-
энергетического состояния атомного ядра, распада элементарных частиц
и аннигиляции пар частиц, характеризуется дискретным спектром. 7-
излучение появляется также при торможении ускоренных электронов
в кулоновском поле ядер атомов — в этом случае это тормозное
излучение со сплошным спектром.
Во многих биологических исследованиях в качестве источника 7-
излучения используют радиоактивный изотоп кобальта 60Со (источ-
(источник 7~излУчения с этим радионуклидом иногда называют «кобаль-
«кобальтовой пушкой»); в этом случае 7"KBaHTbI генерируются в процессе
радиоактивного распада 60Со с превращением в 60Ni. Возбужденное
ядро никеля переходит в стабильное состояние с последовательным
испусканием двух квантов с энергиями 1,17 и 1,33 МэВ.
Рентгеновское и 7-излучение п0 их физической природе относят
к высокочастотным (коротковолновым) электромагнитным излучени-
излучениям. Частота их квантов и, соответственно, энергия в десятки и сотни
тысяч раз выше, чем у квантов ультрафиолетового излучения. Ис-
Используя различные источники, можно получить рентгеновские и 7-
кванты сравнимой энергии, которые будут оставлять в тканях одина-
одинаковое количество энергии и образовывать одно и то же число ионов
на единицу пути.
Следовательно, различие этих двух видов излучения связано с
происхождением: рентгеновские лучи генерируются при торможении
ускоренных электронов в кулоновском поле ядер атомов, а 7~ИЗЛУ~
чение испускается возбужденными ядрами или возникает при анни-
аннигиляции частиц. Хотя, как видим, источники обоих видов излучений
весьма отличны, по физическим параметрам они различаются только
энергиями.
Ослабление интенсивности рентгеновского и 7-излучения в веще-
веществе подчиняется закону
I = I0 e~NSI, (II.2)
где / и /q — соответственно значения интенсивности излучения до и
после их прохождения через слой толщиной I; N — плотность частиц
(число частиц в 1 см3 вещества); S — эффективное сечение, харак-
характеризующее вероятность процесса взаимодействия. Энергия квантов
60
Гл. П. Поглощение энергии ионизирующих излучений
7-квант
фотоэлектрон
рассеянный фотон
первичный
фотон
комптоновский
электрон
позитрон еп
Е+ + Е- =hv
hv > -1,022 МэВ
/ш-0,511 МэВ
аннигиляция
позитрона
hi/-0,511 МэВ
электрон е
Рис. П.З. Схема основных процессов поглощения энергии фотонов рентгеновского
и 7"излУчения: а) фотоэффект; б) эффект Комптона; в) эффект образования
электрон-позитронных пар
рентгеновского и 7~излУчения поглощается веществом в результате
одного из следующих процессов (рис. П.З).
Фотоэлектрический эффект (фотоэффект) состоит в том,
что квант излучения полностью передает энергию атому; этой энергии
достаточно для того, чтобы атом испустил электрон (рис. П.З, а).
Электрон, высвобожденный из атома в результате фотоэффекта, об-
обладает запасом кинетической энергии, равным энергии падающего
кванта hv за вычетом энергии связи электрона с соответствующим
атомом или молекулой:
¦^кин.
электрона
= hv- TCB
(П.З)
Вероятность фотоэффекта зависит от энергии падающего кванта и
атомного номера поглощающей среды. Сечение процесса существенно
зависит от Z заряда ядра атомов среды Z, и при одной и той же
энергии фотонов возрастает как Zn, где п « 4-5. С ростом энергии
4. Механизмы процессов поглощения энергии излучений
61
сечение уменьшается как Ет, где значение т понижается по мере
возрастания энергии от трех (малые энергии) до единицы (высокие
значения энергии). При этом сечение испытывает большие скачки при
величине энергии фотона, равной энергии связи электрона в атоме.
Эффект Комптона можно рассматривать как результат упру-
упругого соударения кванта излучения с электроном (рис. П.З, б). При
этом квант отдает электрону не всю энергию, а лишь некоторую ее
часть, причем сам он продолжает движение в качестве рассеянного
кванта в новом направлении и с меньшей энергией. В отличие от фото-
фотоэлектрона, комптон-электрон (его еще называют электроном отдачи)
приобретает не всю энергию первичного кванта.
Коэффициентом комптоновского поглощения называется доля
энергии, приобретенная электроном отдачи. Он определяется по
формуле Клейна-Нишины:
О" г. —
2A+gJ
a2(l + 2a)
За
2а-2а2)
4а2
где re = e2/me2 = 2,818 • 10 15 м — постоянная, так назы-
называемый «классический радиус электрона»; е — заряд электро-
электрона; т — масса электрона; с — скорость света; а = hv /me2;
h = б, 626 • 10~34 Дж • с = б, 626 • 10~27 эрг • с — постоянная Планка;
v — частота падающего кванта.
Определив величину ас для кванта определенной энергии и умно-
умножив этот коэффициент на число электронов, находящихся в 1 г ткани,
получим величину комптоновского «поглощения» на 1 г ткани (так
называемый «массовый коэффициент комптоновского поглощения»).
Следует, однако, уточнить, что 7"квант не поглощается, а меняет
направление и энергию (в отличие от фотоэффекта) и может далее
участвовать в процессе ионизации.
Как видно из табл. II. 1, электронный коэффициент комптонов-
комптоновского поглощения в ткани возрастает с увеличением энергии кванта
излучения. Следовательно, с увеличением энергии падающих квантов
увеличивается число комптоновских электронов и уменьшается число
фотоэлектронов.
Таблица П.1. Электронные коэффициенты комптоновского поглощения
Энергия
квантов
hv, кэВ
5,108
25,54
45,98
76,62
а = hv /me2
0,01
0,05
0,09
0,15
*с • Ю25
0,0638
0,2731
0,4276
0,5914
Энергия
квантов
hv, кэВ
137,9
199,2
306,5
715,2
а = hv /me2
0,27
0,39
0,6
1,4
*с • Ю25
0,7812
0,8793
0,9562
0,9711
62
Гл. П. Поглощение энергии ионизирующих излучений
Таблица П.2. Комптоновские и фотоэлектроны, возникающие в воде при воз-
воздействии рентгеновского и 7-излучений
Длина
волны
Л, А
2,4265
0,4853
0,2696
0,1618
0,0899
0,0622
0,0404
Энергия
квантов
Е, кэВ
5,108
25,542
45,975
76,625
137,92
199,22
306,50
Вклад в полное число
электронов для
фотоэффекта
0,994
0,676
0,195
0,052
0,010
0,004
0,001
комптон-эффекта
0,006
0,424
0,805
0,948
0,990
0,996
0,999
В табл. П.2 представлены данные об относительном числе фото-
и комптоновских электронов, образующихся в воде при воздействии
рентгеновского и 7~излучений.
В воде и биологических тканях поглощение излучения с энергией
квантов более 300 кэВ в основном происходит за счет эффекта Ком-
птона. В результате нескольких последовательных комптоновских вза-
взаимодействий энергия кванта снижается настолько, что он уже может
полностью поглотиться в результате фотоэффекта.
Образование электрон-позитронных пар. Если энергия пада-
падающего кванта превышает 1,022 МэВ, становится возможным еще один
тип взаимодействия — эффект образования пар. Электрон-позитрон-
ные пары возникают в результате взаимодействия кванта излучения
с кулоновским полем ядра. Квант высокой энергии, приближаясь к
полю ядра атома, исчезает, и одновременно возникает пара элемен-
элементарных частиц позитрон-электрон (рис. П.З, в): hi/ —> е+ + е~.
Вся энергия падающего кванта используется на образование пары,
причем энергия, равная 1,022 МэВ, всегда преобразуется в «массу
покоя» элементарных частиц, а остаток — в их кинетическую энергию:
Екин. е- + Екин. е+ = hi/ - 1,022 МэВ. (П.5)
Суммарную кинетическую энергию пары можно условно разделить
поровну между электроном и позитроном, но в действительности она
зависит от углов разлета этих частиц.
Пролетающий через вещество позитрон испытывает взаимодей-
взаимодействия с электронами среды, при этом происходит их аннигиляция. В
результате образуется 7-квант, способный передать энергию веществу
за счет комптоновского и фотоэффекта, а также ядро отдачи, которое
обязательно получает свою порцию энергии за счет действия закона
сохранения энергии. Вероятность рождения пары электрон-позитрон
увеличивается с ростом энергии кванта и пропорциональна Z2. В
биологических системах этот эффект выражен слабо, так как средний
эффективный атомный номер Z имеет малые значения.
4. Механизмы процессов поглощения энергии излучений
63
Относительная частота трех пе-
перечисленных процессов поглощения
веществом квантов ионизирующе-
ионизирующего излучения показана на рис. П.4.
Как видно из рисунка, кванты с
энергией 10-100 кэВ в биологиче-
биологических тканях поглощаются преиму-
преимущественно за счет фотоэффекта;
в диапазоне энергий 0,3-10 МэВ
основной тип взаимодействия — эф-
эффект Комптона, а при энергиях
квантов более 10 МэВ начинает пре-
преобладать эффект образования пары
80
40
0
V
X
Л1
/
х
0,01
10
100
ОД 1,0
Е, МэВ
Рис. П.4. Относительная частота об-
образования электронов и пар фото-
фотонами в углероде: 1 — фотоэффект;
2 — комптоновский эффект; 3 — об-
образование пар
электрон-позитрон. Аннигиляция пары приводит к образованию двух
7-квантов с энергией 0,511 МэВ (рис. П.З). Проходя через вещество,
они теряют свою энергию в результате комптоновского рассеяния и
фотоэффекта. Поэтому в дальнейшем мы ограничимся рассмотрением
характера взаимодействия с веществом фото- и комптоновских элек-
электронов.
Поглощение квантов электромагнитного излучения высокой энер-
энергии приводит к возникновению в веществе небольшого числа атомов,
утративших электроны. Эта первичная ионизация — следствие фото-
и комптоновского эффектов. Высвободившиеся электроны обладают
огромным запасом кинетической энергии (к ним перенесена большая
часть энергии падающего кванта) и могут многократно взаимодей-
взаимодействовать с атомами и молекулами, отдавая энергию на их ионизацию
и возбуждение. Так продолжается до тех пор, пока энергия свободного
электрона не снизится до того минимального уровня, при котором
электрон уже сможет присоединиться к нейтральному атому с обра-
образованием отрицательного иона.
Каждый первичный электрон от момента своего рождения до за-
захвата нейтральным атомом или молекулой многократно взаимодей-
взаимодействует с атомами, расположенными вдоль направления его движения,
генерируя большое число вторичных электронов. Распределение энер-
энергии вторичных электронов точно может быть рассчитано лишь для
атома водорода. Для более сложных молекул возможны лишь каче-
качественные рассуждения (подробнее см. гл. IV). В среднем около 70%
энергии первичных электронов переносится к вторичным электронам,
обладающим энергией, достаточной для того, чтобы индуцировать
дальнейшую ионизацию. Остальные 30% энергии первичного электро-
электрона расходуются на возбуждение молекул и высвобождение электронов
с «нулевой» кинетической энергией. Незначительная доля энергии
затрачивается на тормозное излучение. Следовательно, перенос ве-
веществу энергии квантов излучения осуществляют главным образом
высокоэнергетические вторичные электроны.
Первичная ионизация при действии рентгеновского или 7"излУ-
чения пренебрежимо мала по сравнению с тем количеством ионизи-
ионизированных и возбужденных атомов, которое возникает в результате
64 Гл. П. Поглощение энергии ионизирующих излучений
взаимодействия вторичных электронов с веществом. Поэтому фотоны
рентгеновского и 7~излучения следует относить к косвенно ионизиру-
ионизирующим частицам, высвобождающим в веществе непосредственно иони-
ионизирующие частицы — высокоэнергетические вторичные электроны.
4.2. Поглощение нейтронного излучения
Нейтронное излучение представляет собой поток элементарных
частиц с массой 1,0087 атомной единицы и нулевым зарядом. Ней-
Нейтронное излучение в зависимости от энергии частиц подразделяется
на группы: быстрые, промежуточные и медленные нейтроны.
Вследствие электронейтральности нейтроны не взаимодействуют
с кулоновскими полями атомов и молекул и могут проходить в ве-
веществе значительные расстояния, не отклоняясь от первоначального
направления. Нейтрон, не имея заряда, тем не менее вызывает иониза-
ионизацию атомов и молекул. Происходит это за счет косвенных эффектов,
связанных со следующими типами взаимодействия нейтронов с ядром
атома.
Упругое рассеяние — результат соударения нейтрона с ядром
атома. Кинетическая энергия нейтрона распределяется между ним и
«ядром отдачи» согласно уравнению:
где тн и Ен - масса и энергия нейтрона, М и Е — масса и энергия
ядра отдачи, в — угол между направлением движения падающего
нейтрона и ядра отдачи. Из уравнения (П.6) следует, что ядру отдачи
передается максимальная энергия, если это ядро имеет минимальную
массу М. Значит, в результате упругого рассеяния наибольшее коли-
количество энергии нейтронного излучения поглощает водород (М = 1).
Поэтому для экранирования нейтронных источников используют не
свинец, а материал, богатый водородом, например парафин.
Биологические ткани богаты водородом, следовательно, в резуль-
результате нейтронного облучения в них появляются ядра водорода, облада-
обладающие значительным запасом кинетической энергии — так называемые
«протоны отдачи». Эти протоны, обладая электрическим зарядом, мо-
могут взаимодействовать с электронными оболочками атомов, вызывая
ионизацию. Упругое рассеяние нейтронов в тканях можно рассмат-
рассматривать как способ генерирования в глубине биологического объекта
протонного излучения.
В биологических тканях нейтроны с энергией от 20 до 0,5 МэВ
передают протонам отдачи соответственно от 78 до 96% своей энергии.
Неупругое рассеяние нейтронов состоит в том, что часть
их энергии идет на сообщение ядру запаса кинетической энергии,
а часть — на возбуждение ядра. Возбужденное ядро переходит
4. Механизмы процессов поглощения энергии излучений 65
в основное состояние с испусканием одного или нескольких гу-
квантов. Неупругое рассеяние становится возможным при энергии
нейтронов больше нескольких кэВ. В результате этого эффекта
помимо непосредственно ионизирующих частиц (ядра элементов) в
веществе возникают 7~кванты5 косвенное ионизирующее действие
которых обсуждалось выше.
Радиационный захват нейтрона ядром. Этот эффект стано-
становится вероятным при низких значениях скоростей нейтронов. Соглас-
Согласно уравнению Ферми:
<г(п,7) ~1/л/^~1/Ч, (П.7)
где Ен и i?H — энергия и скорость нейтрона соответственно, а — эф-
эффективное сечение реакции, т. е. величина, количественно характери-
характеризующая вероятность взаимодействия нейтронов с ядром. В результате
захвата нейтрона образуется короткоживущее высоковозбужденное
ядро (его называют компаунд-ядром, или сложным ядром), которое
переходит в стабильное состояние с испусканием 7-квантов, протонов
или а-частиц. При захвате нейтрона легкими ядрами, например ядром
водорода, испускается 7-квант с энергией 2,2 МэВ:
}H + Jn^D + 7. (П.8)
Если же нейтрон захватывается промежуточным или тяжелым
ядром, то могут испускаться протоны или а-частицы. Так, в случае
захвата нейтрона ядром азота образуется изотоп углерода 14С и ис-
испускается протон с энергией 0,66 МэВ:
14N + ln_>14G + lp- (П9)
Среди элементов, составляющих основную долю биологических
тканей, наибольшее значение сечения реакции радиационного захвата
медленных нейтронов установлено для водорода и азота. В результате
этой ядерной реакции возникает высокоэнергетическое j- и протон-
протонное излучение. Соотношение каждого из перечисленных процессов
поглощения нейтронного излучения зависит от энергии частиц. Если
ткань облучают потоком быстрых или сверхбыстрых нейтронов, то
вначале преобладает упругое соударение с выбиванием ядер отдачи.
После нескольких упругих соударений энергия нейтронов снижается,
и нейтрон переходит в разряд медленных. Теперь преобладающим
становится процесс радиационного захвата с испусканием вторичного
излучения. В конечном счете облучение ткани нейтронами приводит к
появлению протонов отдачи, ускоренных ядер других элементов и 7-
излучения. Все эти продукты взаимодействия нейтронов с атомными
ядрами могут вызывать значительную ионизацию в веществе.
Таким образом, ионизация поглотителя происходит косвенным пу-
путем. Нейтрон сам не в состоянии взаимодействовать с орбитальны-
орбитальными электронами. Взаимодействие осуществляют быстрые заряженные
частицы, высвобождаемые в веществе в результате поглощения кине-
кинетической энергии нейтронов. Это обстоятельство позволяет отнести
нейтроны к разряду косвенно ионизирующих частиц и объединить их
5 Ю. Б. Кудряшов
66
Гл. П. Поглощение энергии ионизирующих излучений
по принципу действия в одну группу с фотонами рентгеновского и
7-излучения.
Согласно принятому определению, косвенно ионизирующие части-
частицы — это незаряженные частицы, которые могут высвобождать
непосредственно ионизирующие частицы или вызывать ядерные пре-
превращения.
4.3. Ионизация в тканях косвенно ионизирующими частицами
Нейтронное, рентгеновское и 7-излучение генерируют в веществе
ионизации, пространственное распределение которых существенно от-
отличается от такового при действии ускоренных заряженных частиц.
Электронейтральные частицы, обладая высокой проникающей способ-
способностью, углубляются в ткани организма на значительные расстояния.
Они формируют большинство ионизации косвенным путем: фотоны
рентгеновского и 7-излучения — за счет комптоновских и фотоэлек-
фотоэлектронов, а нейтроны — за счет ядер отдачи. Эти заряженные частицы
в основном и осуществляют перенос энергии излучения веществу,
вызывая ионизации и возбу-
возбуждения атомов.
Мягкие рентгеновские лучи
(до 100 кэВ) поглощаются в
поверхностных слоях ткани за
счет фотоэффекта. Длина про-
пробега фотоэлектронов не пре-
превышает 2 мм, поэтому биоло-
биологически существенный эффект,
связанный с ионизацией ато-
атомов и молекул, возникает вбли-
вблизи места поглощения падаю-
падающего кванта. Пространственное
распределение ионов определя-
определяется энергией выбитых фото-
фотоэлектронов. Так, фотоны мяг-
мягкого рентгеновского излучения
с энергией 10 кэВ (это соответ-
соответствует длине волны А = 10 нм)
а
' ч -- \ /• ч.
трек фотоэлектрона
4 — / - ! J< /
j. - #|~ '- - ' ^
'' к\^ "г ;.
у х Ч / ^ Ч 1 %
/ Ч / /О " * '
1 ММ
б
о фотоэлектроны
^ электроны
*""" отдачи
0 -1 о ^
о _ о "
- -> 0
J °
10 см
Рис. П.5. Характер ионизации вещества
фотонами мягкого (а) и жесткого (б)
рентгеновского и 7"излУчении: 1 — фо-
фотоэлектроны (выбиты рассеянным кван-
квантом); 2 — треки электронов отдачи
передают фотоэлектрону око-
около 9,5 кэВ энергии.
Из табл. П.4 (с. 78) мы уви-
увидим, что длина пробега такого
электрона в ткани — 2,3 мкм, ЛПЭ = 2,4 кэВ/мкм, а плотность иони-
ионизации — около 32 пар ионов на 1 мкм пути. Число таких треков, т. е. ко-
количество выбитых фотоэлектронов в результате первичной ионизации,
определяется поглощенной дозой. Картина ионизации ткани мягким
рентгеновским излучением при поглощенной дозе 104 Гр показана на
рис. П.5, а.
4. Механизмы процессов поглощения энергии излучений
67
а;
л
ител
ОС]
н
О
^ 100
РОЗ.
Я 60
к
:чи
1 20
и
f ^^^
200 кэВ*^
" рентгеновский
ifiii
*^етатрон
ч^бетатрон
аппарат^4
I i 1
35
15
*¦—,
¦^«^
—^.
1
МэВ
МэВ
1
6 10 14
Глубина слоя воды, см
18
22
Рис. П.6. Поглощение энергии в воде для рент-
рентгеновского и 7"излУчения с разной энергией
квантов
Жесткие рентгеновские
и 7"лучи с энергией фото-
фотонов выше 300 кэВ изменя-
изменяют направление движения
(меняется их энергия) в
основном за счет эффекта
Комптона. Максимум вы-
выделения энергии лежит на
глубине вплоть до несколь-
нескольких сантиметров и связан с
процессом накопления вто-
вторичных электронов, кото-
который начинается на малых глубинах и возрастает до того момента,
когда устанавливается равновесие между образованием вторичных ча-
частиц и их поглощением. Так, 7-лучи 60Со теряют 60% всей энергии при
прохождении первых 5-6 см ткани, а фотоны с энергией 35 МэВ, гене-
генерируемые в бетатронах, отдают максимум своей энергии на глубине 6-
8 см. Эта важная особенность действия жесткого электромагнитного
излучения позволяет воздействовать на глубоко расположенные опу-
опухоли без чрезмерного повреждения кожи и промежуточной ткани.
Существование такого максимума (рис. П.6) объясняется тем, что в
результате комптоновского взаимодействия фотонов высокой энергии
и электронов атома последние воспринимают значительную часть
энергии фотона (чем выше энергия излучения, тем более вероятен
перенос к электрону отдачи максимальной энергии, вплоть до 99,9%
энергии кванта). Электроны таких высоких энергий (несколько тысяч
кэВ) проникают в ткань на глубину в несколько сантиметров, образуя
максимальное число ионизации и возбуждений в конце пробега, когда
скорость их значительно снижается.
Следовательно, электроны, высвобождаемые квантами излучения
на поверхности облучаемого объема, образуют максимальное число
ионов на глубине ткани в несколько сантиметров, т.е. они осуществля-
осуществляют перенос энергии излучения вглубь ткани.
Так, например, 7~лучи с энергией квантов 1 МэВ высвобожда-
высвобождают в результате комптоновского взаимодействия электроны отдачи с
максимальной энергией 817 кэВ и средней энергией 452,5 кэВ. При
энергии 450 кэВ электрон теряет около 0,2 кэВ на 1 мкм пути и
способен пройти путь в 1500 мкм от места своего образования. В
среднем он образует около 10 пар ионов на 1 мкм пути, однако
ионизация распределена неравномерно, резко выраженный максимум
наблюдается в конце трека.
На рис. П.6 показан характер ионизации вещества жестким рентге-
рентгеновским излучением при общей поглощенной дозе 104 Гр. Облучение
нейтронами высоких энергий A0-15 МэВ) приводит к пространствен-
пространственному распределению ионов в поглощающей ткани, которое сходно с
картиной ионизации жестким 7-излучением. Отличие состоит в том,
что энергия нейтрона переносится не к электронам, а к ядрам отдачи,
68 Гл. П. Поглощение энергии ионизирующих излучений
т. е. к тяжелым ускоренным частицам, несущим положительный за-
заряд. Наибольшее количество энергии переносится протонами отдачи,
т. е. ускоренными ядрами водорода.
Так, при облучении тканей такими нейтронами основная часть
поглощенной дозы создается протонами и тяжелыми ядрами отдачи с
высокой плотностью ионизации. В результате облучения тканей в ред-
корасположенных микрообъемах возникают короткие треки с очень
высокой плотностью ионизации. Это служит причиной значительно
более высокого, чем для рентгеновского и 7-излучения, значения ОБЭ
нейтронов высоких энергий.
4.4. Поглощение ускоренных заряженных частиц
Облучение тканей косвенно ионизирующими частицами в конеч-
конечном счете заканчивается появлением заряженных частиц: фотоны
рентгеновского и 7-излучения высвобождают в тканях высокоэнер-
высокоэнергетические электроны; нейтроны вызывают появление в тканях про-
протонов отдачи, а-частиц и ядер других элементов. Все эти заряженные
частицы обладают значительной энергией и способны многократно
вызывать ионизацию и возбуждение атомов и молекул.
Для того чтобы описать характер ионизации поглотителя, необ-
необходимо построить качественную картину и выяснить количественные
закономерности взаимодействия ускоренных заряженных частиц с
атомами.
Пучки таких частиц, движущихся с большими скоростями, часто
используются в радиобиологических экспериментах. Вместо /^-частиц,
т. е. быстрых электронов, испускаемых в процессе радиоактивного
распада, можно создавать потоки электронов, ускоренных в электри-
электрическом поле. Протонное излучение также генерируется специальными
ускорителями; а-частицы, испускаемые радиоактивными веществами,
тоже заменяются ускоренными до различных энергий ионами гелия.
Ускоренные заряженные частицы, которыми облучают ткани, вы-
вызывают возбуждение и ионизацию атомов точно так же, как и те
заряженные частицы, которые высвобождаются нейтронами или фо-
фотонами рентгеновского и 7"излУчения- Различие связано только с
неодинаковой энергией и зарядом высвобождающихся в каждом от-
отдельном случае ионизирующих частиц. Важно знать, как зависит
ионизирующая способность заряженных частиц от величины их энер-
энергии, от массы и величины заряда, который они несут.
При возмущении атомов существует вероятность либо перехода их
в возбужденное состояние, либо их ионизации. Она возрастает при
увеличении длительности возмущения или его интенсивности, поэто-
поэтому медленные частицы вызывают больше переходов, чем быстрые,
а многократно заряженные — больше, чем однократно заряженные;
масса частицы не оказывает влияния на эти эффекты. Ускоренную
частицу можно рассматривать как перемещающийся в пространстве
4. Механизмы процессов поглощения энергии излучений
69
<§>
Положение частицы
г
медленная
частица
быстрая
гица
Время
источник электрического поля. За счет взаимодействия электриче-
электрического поля частицы с полем орбитального электрона последний при-
приобретает энергию. Если заряженная частица пролетает достаточно
близко от орбитального электрона, то а
перенесенной энергии достаточно для
ионизации: электрон отрывается от со-
соответствующего атома или молекулы,
и в результате образуются положи-
положительно заряженный ион и свободный
электрон. Если же частица значитель-
значительно удалена от электронных оболо-
оболочек, то электрон приобретает энергию,
недостаточную для ионизации, и пере-
переходит на более удаленную энергетиче-
энергетическую орбиту.
Такая схема, основанная на принци-
принципе упругого и неупругого соударений,
еще не позволяет определить зависи-
зависимость характера поглощения энергии
ускоренной заряженной частицы от ее
параметров — заряда, массы, скорости.
Качественно на эти вопросы можно
ответить, рассмотрев модель, предло-
предложенную Дертингером и Юнгом еще в
конце 60-х годов XX столетия, которая
учитывает изменение поля частицы во
времени (рис. П.7).
В верхней части рис. П.7, а пока-
показан путь летящей частицы через об-
область с высокой плотностью атомов.
Стрелками обозначено возникновение
ионизации (в данном случае двух), а
пунктирными кружками - возбужден-
возбужденные атомы. Ниже (рис. П.7, б) изображена траектория частицы при
ее прохождении вблизи одного из атомов. На рис. П.7, в вычерчена
зависимость поля, действующего в атоме, от положения частицы, а
на рис. П.7, г — зависимость этого поля от времени, прошедшего
после приближения частицы к атому. Для медленной частицы это
поле существует длительное время, для быстрой оно сначала резко
возрастает, а затем быстро уменьшается. Значит, медленная частица
будет вызывать возмущение в атоме в течение длительного времени и
передаст ему гораздо больше энергии, чем быстрая частица.
Рассмотрение такой модели позволяет сформулировать ряд след-
следствий, к которым приведет наложение на атом дополнительного поля
заряженной частицы:
1) действие поля ускоренной частицы вызывает временное возму-
возмущение каждого атома, вблизи которого эта частица проходит;
Рис. П.7. Модель, поясняющая
характер взаимодействия уско-
ускоренных заряженных частиц с
атомом: а) частица проходит че-
через некоторую совокупность ато-
атомов, производя несколько иони-
ионизации и возбуждений; б) атом
и частица, проходящая мимо
него; в) зависимость величины
поля, создаваемого в атоме бы-
быстрой заряженной частицей, от
положения частицы; г) зависи-
зависимость того же поля от времени
70 Гл. П. Поглощение энергии ионизирующих излучений
2) это возмущение существует тем дольше, чем медленнее движет-
движется частица;
3) частицы, несущие неединичный заряд, вносят большее возмуще-
возмущение, чем однозарядные;
4) величина массы движущейся частицы не влияет на количество
перенесенной энергии, т. е. при равных скоростях электроны и прото-
протоны переносят веществу одинаковое количество энергии, хотя массы их
различаются почти в две тысячи раз.
Такое взаимодействие частицы с веществом называется электро-
электромагнитным взаимодействием (в отличие, например, от ядерного
взаимодействия, которое происходит под действием ядерных, а не
кулоновских, т.е. электрических сил).
Вероятность взаимодействия отдельной частицы с веществом ха-
характеризуется эффективным сечением взаимодействия. Обычно его
пересчитывают на более удобные для практического применения ве-
величины. Количественно дифференциальная потеря энергии заряжен-
заряженной частицы, т. е. потери энергии на единицу длины трека (в едини-
единицах МэВ/см), определяются из уравнения Бете-Блоха:
_ d_E = 4_ne^NZ I W _ ь A _ р2) _
ах mv l lo
где е = 1,602 • 10~19 Кл — заряд электрона; v — скорость частицы
в см/с; z — заряд частицы в единицах элементарного заряда е; N —
число атомов в 1 см3 вещества; Z — среднее число электронов в
атоме, т. е. «эффективный» атомный номер; /о — средний потенциал
ионизации или возбуждения атома, определяемый экспериментально;
/3 = v/c (отношение скорости заряженной частицы к скорости света);
для того, чтобы получить потери энергии в единицах МэВ/см, массу
электрона принимают равной т = 0, 511 МэВ/с2.
Анализируя уравнение A1.10), можно количественно обосновать
те качественные представления, которые были основаны на простой
модели взаимодействия (рис. П.7).
Действительно, член e4z2 соответствует взаимодействию между
полем заряженной частицы и электроном (это становится яснее, если
записать его в виде (e2zJ, т. е. в виде квадрата произведения квадрата
заряда летящей частицы на заряд электрона в атоме). Зависимость от
скорости определяется в основном первым множителем, в который
входит 1/и2, так как во втором множителе скорость частицы входит в
медленно изменяющуюся функцию, содержащую энергию mv2/2 под
знаком логарифма. В формуле фигурирует только масса электрона
как масса возбуждаемой в атоме частицы. Масса летящей частицы
в уравнение (П.8) не входит. Потеря энергии пропорциональна 7VZ,
т. е. зависит от числа атомов в единице объема и от числа элек-
электронов в атоме (для многих биологических тканей и воды среднее
4. Механизмы процессов поглощения энергии излучений 71
число электронов на 1 г примерно одинаково и находится в преде-
пределах 3 • 1023-3, 5 • 1023). Сжатие электрического поля при больших ско-
скоростях частицы (рис. П.7) учитывается с помощью членов, зависящих
от скорости частицы.
Следует учесть одну особенность, вытекающую из уравнения (П.8).
Так как dE/dx зависит от 1/и2, то можно ожидать бесконечно боль-
больших удельных потерь энергии излучения при низких скоростях ча-
частицы. Однако этого не происходит. Кажущаяся противоречивость
устраняется, если принять во внимание уменьшение заряда частицы
по мере ее замедления, так что уже малая энергия частицы подхо-
подходит к порогу ионизации или возбуждения. Так, по мере снижения
скорости а-частицы увеличивается вероятность захвата ею электрона.
При этом она продолжает свой путь как частица, имеющая одиночный
заряд (ион гелия Не+, а не Не2+). При достаточно низких скоростях
одиночно заряженный ион гелия захватывает еще один электрон и
превращается в атом гелия.
Для учета такого рода процессов в формулу Бете—Блоха вводится
уточнение, связывающее изменение заряда частицы со скоростью:
z* = z\\ - ехр (-125/?2-2/3)], A1.11)
где z* — заряд частицы, зависящий от скорости. Если v —> 0, то и
член /3 = v/c —У О, а следовательно, и z* —у 0, т. е. при достаточно
низких скоростях частицы удельные потери энергии dE/dx снижаются
и стремятся к нулю.
Это происходит уже после того, как удельные потери достигли мак-
максимума (например, для протонов — при энергии между 60 и 100 кэВ).
Величина этого максимума в реальных условиях оказывается сни-
сниженной во много раз (и средняя энергия частиц также во много раз
больше) из-за другого эффекта. По мере торможения частиц их энер-
энергетический спектр постепенно размывается из-за флуктуации потерь
энергии в единичных столкновениях с атомами вещества. Тем не менее
определенный максимум наблюдается, и
он известен под названием «пик кривой к к
Брэгга». Для электронов пик Брэгга по- $ >>
чти незаметен, для протонов его величи- § ^
на по отношению к начальной ионизации в \
является 4-10-кратной. н §
На рис. П.8 показано это резкое воз- § §
растание удельных потерь энергии dE/dx о g4
в конце пути заряженных частиц (пик с к -—
Брэгга). Длина пути частиц
Подбирая соответствующий тип излу- „ тт о тт
/ „\ Рис П.8. Изменение линеи-
чения (или нескольких излучении) и ва- ной плотности ионизации при
рьируя Энергию ИОНИЗИруЮЩИХ чаСТИЦ, прохождении ускоренной тя-
можно добиться оптимального распреде- желой заряженной частицы
ления поглощенной дозы, в частности через ве1Ц.еств0
благоприятного соотношения между степенью поражения нормаль-
нормальных тканей и опухолей, залегающих на значительной глубине, что
72
Гл. П. Поглощение энергии ионизирующих излучений
2,0
« 1,5
ей
S 1,0 -
о
к
н
О
0,5
0
/^^^Ч^ нейтроны
-60Со N4
неон (Ne2) ^>s^
(со вторичным
"" ol излучением)^^^^^
протоны тг-мезоны
нормальная ткань 1
(п) 14 МэВ
11
протоны-JV
Чтг-мезоны
Y Ne
60 Со
п
2
Рис. П.9.
6 8 10 12 14 16 18 20
Глубина в ткани, г/см2
Пространственное распределение поглощенной дозы для разных видов
излучения
показано на рис. П.9. Все кривые проведены так, что относительная
доза, равная 1,0, лежит в центре опухоли диаметром 4 см; уплощение
и расширение пика Брэгга достигается установкой по ходу пучков
специальных гребенчатых фильтров.
Оптимизация дозового распределения для проведения лучевой те-
терапии требует одновременного решения нескольких задач: максималь-
максимального поражения опухолевых клеток как в самой опухоли, так и в зонах
регионарного метастазирования; при этом находящиеся по соседству
радиочувствительные органы должны быть защищены.
Существование пика Брэгга позволяет с максимальной эффектив-
эффективностью проводить лучевую терапию злокачественных опухолей. В
зависимости от локализации опухолей выбирают вид излучения и его
энергетическую характеристику такими, чтобы пик Брэгга приходил-
приходился на топографически обозначенный очаг злокачественных клеток.
Поскольку размер очага может оказаться большим по сравнению с ши-
шириной пика Брэгга, составляющей только миллиметры, то приходится
искусственно увеличивать размытие энергетического спектра частиц.
Так создается модифицированная кривая Брэгга с максимумом, в
котором обеспечена постоянная доза в пределах облучаемого очага
новообразования. Доза в любом месте вне очага имеет значительно
меньшую величину, что позволяет добиваться улучшенных условий
дозирования для прилегающих к очагу радиочувствительных тканей.
Эта область применения пучков протонов и более тяжелых ускорен-
ускоренных ионов в целях лучевой терапии получила название адротерапии.
Ее развитие, начатое в 60-х гг. в США, Швеции и СССР, в настоящее
время продолжается, и во многих странах мира созданы установки
уже на индустриальной основе.
5. Пространственное распределение ионов
73
. 100
о
I
и
10
од
0,01
I I
I
1111
2 4 6 8 10 12 14
Поглощенная доза, Гр
5. Пространственное распределение ионов
Итак, поглощенная энергия излучений затрачивается на возбу-
возбуждение и ионизацию атомов и молекул. В основе конечного радио-
радиобиологического эффекта лежат физико-химические превращения с
участием возбужденных и ионизированных молекулярных структур.
И поскольку число возбуждений и ионизации определяется величиной
поглощенной дозы излучения, можно было бы ожидать, что раз-
различные виды ионизирующих частиц приводят к одному и тому же
биологическому эффекту при условии, что объект поглотил излучение
в одинаковых дозах. В действитель-
действительности это не так. ^
На рис. 11.10 приведены резуль-
результаты эксперимента по определе-
определению выживаемости клеток, облу-
облученных ионизирующими частицами
различных типов. Поглощение из-
излучения в одной и той же дозе
приводит к различным эффектам.
Так, сообщение популяции клеток
потоком а-частиц поглощенной до-
дозы 4-6 Гр приводит к гибели 99,9%
клеток, а при такой же дозе рент-
рентгеновского или 7-излучения гибнет
только 20-30% облученных клеток
(рис. 11.10).
Следовательно, поглощенная
доза, по величине которой судят
о суммарном числе образованных
возбуждений и ионизации, не мо-
может использоваться для сопостав-
сопоставления эффективности различных
типов излучения. Точно так же не
совпадает со степенью конечного
биологического эффекта величина
энергии ионизирующих частиц: а-
частицы с энергией 2,5 МэВ эффективнее а-частиц с энергией 27 МэВ,
а /3- и а-частицы примерно равной энергии значительно различаются
по степени поражающего действия.
Приведенные данные еще раз подтверждают, что биологический
эффект зависит не только от поглощенной дозы, но и от ЛПЭ из-
излучения. Поэтому упрощенных критериев, применяемых в системе
нормативов радиационной защиты в виде вводимых весовых множите-
множителей (см. гл. I, раздел 6), совершенно недостаточно при осуществлении
дозиметрии в конкретных биологических исследованиях.
Обратимся еще раз к данным рис. 11.10. Наклон кривых на этом
рисунке отражает эффективность, с которой различные виды из-
излучения вызывают гибель клеток. Чем больше наклон кривой, тем
Рис. 11.10. Выживаемость куль-
культуры Т — клеток почки человека
при действии ионизирующих
частиц различных типов:
а-частицы с энергией 2,5
ЛПЭ = 165 кэВ/мкм; 2
частицы с энергией 27
ЛПЭ = 25 кэВ/мкм;
дейтроны с энергией 3,0
ЛПЭ = 20 кэВ/мкм;
рентгеновские лучи, 20
ЛПЭ = 6 кэВ/мкм;
рентгеновские лучи, 250
ЛПЭ = 2,5 кэВ/мкм; 6 — /3-частицы
с максимальной энергией 2,2 МэВ,
ЛПЭ = 0,3 кэВ/мкм
1 —
МэВ,
— Q-
МэВ,
3 -
МэВ,
4 —
кВ,
5 —
кВ,
74 Гл. П. Поглощение энергии ионизирующих излучений
меньше клеток выживает в популяции, поглотившей определенную
дозу излучения, т. е. тем эффективнее биологическое действие данного
типа ионизирующих частиц. Наклон кривых увеличивается с ростом
ЛПЭ излучения. Наибольшей эффективностью в рассматриваемом
эксперименте обладали а-частицы с ЛПЭ = 165 кэВ/мкм. И мы знаем,
что чем выше значение ЛПЭ, тем больше энергии теряет частица на
единицу пути и тем плотнее распределены создаваемые ею ионы вдоль
трека.
Величина ЛПЭ — важнейшая радиобиологическая характеристика
излучения, показатель его биологической эффективности, или, как
иногда говорят, «качества». Физическая природа частиц или квантов
не сказывается на специфике биологического действия: например, при
равных ЛПЭ наблюдают одинаково эффективное подавление размно-
размножения клеток как в результате рентгеновского облучения, так и при
действии а-частиц.
Для того чтобы представить возможную причину различной эф-
эффективности излучений с высокими и низкими значениями ЛПЭ,
рассмотрим схематическое изображение треков некоторых частиц
(рис. 11.11). Здесь представлены участки треков частиц, сферическая
молекула белка радиусом в 310 нм, распределение актов возбуждения
и ионизации, произведенных частицами вдоль направления своего
движения.
а-Частицы, обладающие энергией 4 МэВ, передают вещест-
веществу 130 кэВ на 1 мкм пути, что соответствует примерно 3800 иониза-
циям на 1 мкм. При такой высокой плотности ионизации в масштабе
белковой молекулы частица может произвести несколько следующих
друг за другом актов ионизации и возбуждения.
Электроны с энергией 0,5 МэВ имеют величину ЛПЭ =
= 0,2 кэВ/мкм. Такие электроны образуют около б пар ионов
на 1 мкм пути, т. е. вероятность возникновения ионизации в пределах
белковой молекулы толщиной около 0,003 мкм весьма мала.
При облучении клеток величина поглощенной дозы показывает
лишь среднее количество энергии, переданной облучаемой системе.
О плотности ионизации в клетке можно судить по величине ЛПЭ.
Если движущаяся частица производит ионизации, значительно
удаленные друг от друга, то вероятность возникновения нескольких
ионов в пределах макромолекулы, субклеточной органеллы или клет-
клетки в целом сравнительно невелика. Напротив, когда акты ионизации
следуют непрерывно вдоль трека частицы, можно ожидать возник-
возникновения многих ионов в пределах одной субклеточной структуры,
например, двух ионизации в комплементарных участках двунитевой
молекулы ДНК.
Конечно, биологические последствия поражения (в результате
ионизации) обеих нитей этой уникальной молекулярной структуры
значительно ощутимее для клетки, чем разрушение какого-либо
участка одной спирали ДНК при сохранении целостности комплемен-
комплементарной цепи. Так как с ростом линейной плотности ионизации
возрастает вероятность именно такого «двунитевого» разрыва,
5. Пространственное распределение ионов
75
100 А
дейтрон
" 3,5 МэВ
!«.<?¦•*<
1 * i •/"Ч • дейтрон
w ч-/# 0,8 МэВ
белковая молекула
средних размеров
электрон
0,5 МэВ
1 - ?) первичная 2 - о вторичная 3 - • возбуждение
ионизация ионизация
Рис. 11.11. Схематическое изображение отрезка траектории различных заря-
заряженных частиц, показывающее распределение актов ионизации и возбуждения
вдоль трека частицы в указанном масштабе: а) трек дейтрона с Е = 4 МэВ,
ЛПЭ = 19,4 кэВ/мкм, ЛПИ = 570 ионов/мкм; б) трек дейтрона с Е = 1 МэВ,
ЛПЭ = 54,0 кэВ/мкм, ЛПИ = 1600 ионов/мкм; в) трек а-частицы с Е = 4 МэВ,
ЛПЭ = 130 кэВ/мкм, ЛПИ = 3800 ионов/мкм; г) трек электрона с Е = 0,5 МэВ,
ЛПЭ = 0,2 кэВ/мкм, ЛПИ = 6 ионов/мкм; 1 — первичная ионизация; 2 —
вторичная ионизация; 3 — возбуждение
ясно, что плотноионизирующие частицы (с высокой ЛПЭ) должны
значительно эффективнее поражать ДНК и связанные с ней
клеточные функции, чем редкоионизирующее излучение.
5.1. Ионизация в тканях при действии тяжелых заряженных
частиц
На примере ускоренных ядер гелия (а-частицы) в табл. П.З пред-
представлены результаты количественных измерений ионизирующей спо-
способности частиц и глубины их проникновения в ткани (по данным
Д. Е. Ли). На основании этих данных можно оценить картину первич-
первичной ионизации вещества.
а-Частицы с энергией 1 МэВ теряют свою энергию на пер-
первых 5,3 мкм ткани, в среднем на каждый микрон пути веществу
переносится 263,9 кэВ энергии (табл. П.З), которая расходуется
на возбуждение и ионизацию атомов. В среднем на каждый
микрон пути образуется около 6,2 тыс. пар ионов, неравномерно
распределенных вдоль трека частицы. Тяжелые заряженные частицы
практически не отклоняются от своего первоначального направления
распространения благодаря значительной разнице их массы и массы
электрона, с которым они взаимодействуют, т. е. их треки можно
76
Гл. П. Поглощение энергии ионизирующих излучений
Таблица П.З. Длина пробега, потеря энергии и число первичных ионов при
прохождении а-частиц в ткани плотностью 1 г/см3
Энергия
а-частиц,
МэВ
1
3
6
9
10
ЛПЭ,
кэВ/мкм
263,9
134,6
82,01
60,41
55,71
Длина
пробега,
мкм
5,3
16,8
47,0
91,6
108,4
Число первичных
ионов на 1 мкм пути в
ткани, пар ионов/мкм
6207,0
2031,0
1109,0
775,4
706,4
считать прямолинейными, и имеет смысл говорить об определенной
«глубине проникновения» их в вещество.
При ионизации атомов вдоль своего пути а-частица оставляет
вдоль своего прямолинейного трека не всю энергию, иначе тяжелые
частицы были бы идеальным «щупом», позволяющим зондировать
клетки, строго избирательно повреждая микроструктуры, располо-
расположенные на определенной глубине. Некоторая доля энергии частицы
выносится за пределы ее трека выбитыми из атомов электронами,
обладающими значительным запасом энергии и большой длиной про-
пробега. Эти электроны образуют треки, ответвляющиеся от трека пер-
первичной частицы, и вызывают на своем пути ионизации и возбуждения,
плотность распределения которых зависит от энергии выбитого элек-
электрона. Так, например, а-частицы с энергией 1 МэВ могут генериро-
генерировать вторичные электроны, длина пробега которых вдвое превосходит
трек самой тяжелой части-
частицы. Вторичные электроны,
энергия которых превосхо-
превосходит 100 эВ, называют 5-элек-
тронами (иногда этот предел
приравнивают к 1 кэВ). На
их долю приходится прибли-
приблизительно 25% всей иониза-
ионизации, вызываемой первичной
частицей. Схема, иллюстри-
иллюстрирующая этот процесс, пред-
о- ионизация • - возбуждение
Рис. 11.12. Передача энергии по траек-
траектории тяжелой заряженной частицы. Для
а-частицы с энергией 6 МэВ расстояние
АБ = 3,1 нм, что соответствует размеру
средней молекулы белка: а — «рой ионов»;
аE) — (^-электроны
ставлена на рис. 11.12.
Большая часть энергии
тяжелой заряженной части-
частицы переносится к вторичным электронам «малыми порциями», т. е.
образуются свободные электроны с энергией менее 100 эВ. Вызванная
ими ионизация происходит в непосредственной близости от места
первичной ионизации, на расстоянии порядка нескольких десятков
нанометров от трека частицы.
Таким образом, в относительно небольшом объеме вдоль трека
частицы возникает некоторое число пар ионов (положительные ионы и
5. Пространственное распределение ионов 77
электроны), порожденных первичной ионизацией и вторичными элек-
электронами с энергией менее 100 эВ. Эти скопления получили название
«рой ионов»; они и формируют трек частицы. Термины «первичная
ионизация», «рой ионов» и «событие потери энергии» можно считать
эквивалентными.
Рои ионов называют также шпорами. Несколько тесно располо-
расположенных шпор A00-500 эВ) образуют «блобы» и короткие треки @,5-
5 кэВ). В состав последних входят также так называемые Оже-элек-
троны, выносящие из ионизированного атома энергию перестройки
внутренних оболочек (но не следует путать это с фотонным Оже-
эффектом). Например, в случае ионизации if-оболочки кислорода
вероятность испускания дополнительного Оже-электрона с энергией
около 540 эВ близка к 100%.
Тяжелые заряженные частицы образуют короткие плотные треки,
имеющие форму основного стержня с высокой удельной плотностью
ионизации (рои ионов плотно прилегают друг к другу, образуя сплош-
сплошной столбик, или «колонну» ионов), от которого во все стороны отхо-
отходят стержни, соответствующие й-лучам со значительно более низкой
плотностью ионизации. Такая картина характерна не только для а-
частиц, но и для ускоренных тяжелых ядер различных элементов.
5.2. Ионизация в тканях при действии ускоренных электронов
Картина, наблюдаемая при облучении тканей потоком /^-частиц,
отличается от рассмотренной выше прежде всего криволинейной тра-
траекторией частиц в веществе. Это связано с равенством масс взаимо-
взаимодействующих частиц: в единичном акте соударения с орбитальным
электроном /^-частица теряет большое коли-
количество энергии и изменяет первоначальное
направление движения (рис. 11.13).
Данные о распределении ионизации по-
получают путем фотографирования треков ча-
частиц в камере Вильсона или в пузырьковой
камере. В этих приборах создается метаста- Рис. 11.13. Истинная и
бильное (неустойчивое) состояние рабочего практическая длина про-
v J J ^ г бега электронов в веще-
вещества, пара или жидкости, так, чтобы при стве Путь от А до В —
прохождении через них даже единичной за- истинная длина пробега;
ряженной частицы вдоль ее трека происходи- ^ ~~ пРактическая длина
/ ч пробега (глубина проник-
проникла конденсация (или испарение) и возникали новения)
хорошо видимые следы частицы. На рис. 11.14
представлен участок трека электрона, каким он виден в камере Виль-
Вильсона. Капли воды конденсируются из насыщенного пара в местах
образования ионов.
Длина пробега /^-частиц определяется их энергией: при энергии
150 кэВ они проникают в ткань на глубину 278 мкм, а очень быстрые
частицы с энергией 50 МэВ — на глубину до 19 см.
78
Гл. П. Поглощение энергии ионизирующих излучений
скопление капель воды
соответствует возникновению
ионов
•. А
рой ионов
Рис. 11.14. Трек быстрого электрона (по фотографии в камере Вильсона): 1 — трек
быстрого электрона (Е = 200 кэВ), 2 — трек медленного электрона (Е = 20 кэВ).
При низкой энергии изгибание трека вызвано рассеянием.
Приведем таблицу (по данным Д. Е. Ли)зависимости длины про-
пробега, потери энергии и числа пар ионов электрона от его энергии на
единицу пути в ткани (табл. П.4).
Таблица П.4. Длина пробега, потеря энергии и число первичных ионов, вызы-
вызываемых электронами в ткани плотностью 1 г/см3
Энергия
электрона,
кэВ
0,1
0,2
0,8
2,0
9,5
22,5
45,0
90,0
150,0
450,0
Длина
пробега,
мкм
0,003
0,006
0,038
0,1595
2,303
10,51
35,76
118,0
278,1
1508,5
Потеря
энергии,
кэВ/мкм
33,23
28,71
14,17
7,680
2,367
1,233
0,7255
0,4462
0,3278
0,2108
Число первичных ионов
на 1 мкм ткани,
пар ионов/мкм
1697
843,1
285,3
127,8
31,90
15,06
8,452
4,986
3,567
2,166
6. Локальные характеристики поглощения энергии
веществом. Проблемы микродозиметрии (М. Ф. Ломанов)
Ввиду вероятностного характера явлений, связанных с энергети-
энергетическим парадоксом, сформировалось особое направление в радиаци-
радиационной физике, которое носит название микродозиметрии. Для того,
чтобы понять, в чем основное отличие новых методов от обычной
дозиметрии, можно привести такую аналогию. Любая газовая среда
характеризуется давлением, но никогда не говорят о давлении от-
отдельной частицы газа так же, как и о температуре молекулы. Вместо
макроскопических характеристик в статистической физике речь идет
только о максвелловском статистическом распределении энергий и
скоростей молекул газа. Аналогичным образом понятие поглощенной
дозы заменяется в микроскопических масштабах соответствующей
статистически распределенной величиной.
6. Локальные характеристики поглощения энергии веществом 79
Энергия, переданная излучением веществу, определяется по фор-
формуле:
где ^Е\ — сумма кинетических энергий всех ионизирующих частиц,
которые вошли в данный объем; ^2 Е<± — сумма кинетических энергий
всех ионизирующих частиц, которые покинули объем; ^2 Q — сумма
всей энергии, затраченной на любые превращения ядер и элементар-
элементарных частиц внутри объема (знак минус может быть поставлен в случае
увеличения суммарной массы покоя этих частиц).
Энергия г ионизирующего излучения, фактически поглощенная в
элементе объема, является стохастической величиной, когда речь идет
о микрообъеме. Пусть т — масса вещества в этом объеме. Частное
от деления г на т называют удельной энергией Z:
Z = г/т. A1.13)
Единица измерения — та же, что и для поглощенной дозы D,
грей. Как стохастическая величина удельная энергия может значи-
значительно отклоняться от нестохастической величины D, хотя в пределе
к большим объемам она переходит в обычную дозу. Формально при
определении величины поглощенной дозы D может применяться со-
соотношение A1.14, то же 1.6):
D = ?' <IL14>
где ds — ожидаемая (нестохастическая) величина переданной энергии,
т. е. средняя энергия, переданная ионизирующим излучением веще-
веществу в элементе объема, dm — масса вещества в этом объеме. Для
того, чтобы не было противоречия с малостью элемента dm, вводя
такое определение, подчеркивают макроскопический характер приме-
применяемых здесь величин.
Можно сказать, что удельная энергия, как и вероятность процесса,
зависит от ряда параметров, в том числе от поглощенной дозы. Из
соотношения A1.14) следует, что поглощенная доза D — это средняя
величина, полученная путем усреднения удельной энергии по доста-
достаточно большим объемам и интервалам времени.
Почему мы должны переходить от дозы не просто к ее локальной
характеристике, а к ее стохастическому аналогу? Напомним об энер-
энергетическом парадоксе: энергия, фактически поглощенная в малом ми-
микрообъеме, может испытывать огромные флуктуации и определяется
вероятностными законами. Изучение флуктуации энергопоглощения
в чувствительных микрообъемах, анализ соответствующих про-
пространственных распределений поглощенной энергии и составляет
предмет микродозиметрии, которая возникла из потребностей радио-
радиобиологии и дала в руки исследователей новый инструмент познания.
Ее основные подходы и методы в основном были завершены в период
1970-1980-х гг.
80 Гл. П. Поглощение энергии ионизирующих излучений
Статистический характер процесса передачи энергии означает, что
результат взаимодействия излучения с веществом может быть пред-
предсказан, если пользоваться вероятностями больших передач энергии ве-
веществу, которые определяются методами микродозиметрии. Размеры
микрообъема настолько малы, что изменением обычной, поглощенной
дозы в его пределах всегда можно пренебречь. Линейные размеры
таких чувствительных областей находятся в области 0.01-10 мкм.
Микродозиметрия *) изучает распределение поглощенной в ве-
веществе энергии в таких микрообъемах. Дозиметрия ионизирующих
излучений также пользуется понятием статистического распределения
дозы, но только в значительно больших, макроскопических объемах,
в которых только возможно непосредственное измерение дозы физи-
физическими приборами.
Кроме удельной энергии, микродозиметрия широко пользуется
аналогом такой макроскопической дозиметрической величины, как
ЛПЭ. Это линейная энергия у — стохастическая величина, равная от-
отношению энергии е, переданной в одном событии поглощения микро-
микрообъему, к средней длине I треков, пересекающих этот микрообъем (для
сферического объема диаметром d это средняя длина хорды I = 2d/3):
у = e/l. (IL15)
В отличие от z, линейная энергия, как и ЛПЭ, не зависит ни от
дозы, ни от потока частиц, поскольку относится к единичным трекам
или к событиям пересечения ими микрообъема. Но ее статистическое
распределение (а не сама величина!) характеризует качество излуче-
излучения более точно, чем величина ЛПЭ, и именно по нему может произ-
производиться расчет биологической эффективности излучения. Единица
измерения — та же, что и для ЛПЭ, — кэВ/мкм.
Микродозиметрические величины у и z характеризуются следу-
следующими особенностями случайных величин: их значения изменяются
скачкообразно в пространстве и времени, они принципиально непред-
непредсказуемы и до их измерения можно указать лишь вероятность обна-
обнаружения заданного значения величины. В приложениях микродози-
микродозиметрии обычно рассматривается сферический микрообъем, в котором
распределение хорд хорошо известно (оно близко к треугольному рас-
распределению), что позволяет строить математические модели. Пред-
Представляют большой интерес и другие типы микрообъема, например
плоская поверхность мембраны, но в этом случае препятствия для
моделирования колоссально возрастают. Из результатов отечествен-
отечественных исследований широко известны расчеты Лаппа (новосибирская
школа), выполненные по методу Монте-Карло, и построенная им база
микродозиметрических данных.
Теория и методы микродозиметрии описаны в книгах [18, 160].
6. Локальные характеристики поглощения энергии веществом 81
6.1. Зависимость ОБЭ от локального распределения энергии
излучения
Рассмотренные положения о действии излучения на биологические
объекты уже достаточны для того, чтобы вместо упрощенного подхода
к ОБЭ перейти к пониманию характера изменения ОБЭ излучения
при различном составе и энергии излучения. Для определенности
будем говорить о нейтронах, хотя особенности процессов в треках
образованных ими вторичных частиц — те же, что и для тяжелых
заряженных частиц (если не говорить о примеси вторичных фотонов,
которая мало меняет существо рассуждений).
«Теория дуального действия» излучения (ТДД) *), разработанная
Келлерером и Росси в 1970-х годах, предполагает, что каждое пер-
первичное элементарное повреждение происходит путем взаимодействия
двух субповреждений, допустим, одиночных разрывов (ОР) отдель-
отдельных цепочек молекулы ДНК. Это возможно в пределах некоторой
ограниченной области, «сайта». Случайно оба субповреждения могут
быть инициированы внутри сайта одной и той же частицей, и тогда
это приведет к двунитевому разрыву ДНК (ДР).
Допустим, это фотонное излучение в дозе D1 или нейтронное в
дозе Dn. Обладающее значительно более низкой плотностью иониза-
ионизации фотонное излучение чаще будет производить такое же двойное
событие не в одном и том же треке, а за счет двух независимых
попаданий треков разных частиц в один и то же сайт, и вероятность
этого пропорциональна уже квадрату дозы Uz. В какой-то степени это
возможно и для нейтронов, поэтому при равенстве вероятностей обо-
обоих биологических эффектов, всегда предполагаемом при определении
ОБЭ, с учетом некоторых постоянных коэффициентов, получим
anDn + f3nD2n = a1D1 + p^D*. A1.16)
В пределе малых доз следует пренебречь квадратом дозы, и тогда
ОБЭ не зависит от дозы и равна отношению D^/Dn = an/a^. Точно
так же можно ожидать, что ОБЭ не зависит от дозы и в пределе
больших доз. Но величина ОБЭ окажется намного больше, что сразу
вытекает из ситуации для промежуточных доз. Тогда, как мы видели,
функции для протонов и нейтронов имеют различный характер. Заме-
Заметим кстати, что по современной терминологии воздействия, связанные
с совместным действием нескольких частиц, иногда называют «7-
смертельным ударом» или «7-ударом» **), по типу облучения фото-
фотонами, а процессы, происходящие в пределах одного и того же трека, по
типу трека быстрого многозарядного иона — «ионным ударом» ***).
Конечно, удар этого типа возможен и под действием фотона. Нейтрон
*) Примененный Келлерером и Росси термин «дуальное действие»
неудачен, так как речь идет о двунитевых разрывах ДНК, а не о дуальной
природе или противоречивости моделей.
**) Неточный перевод «7-kill».
***) Неточный перевод «ion-kill».
6 Ю. Б. Кудряшов
82
Гл. П. Поглощение энергии ионизирующих излучений
чаще производит ионный удар, а фотон — 7-удар, и уравнение A1.16)
сокращается: anDn = f37D^. Тогда сразу определяем ОБЭ нейтронов
как отношение доз равного эффекта:
D1/Dn = const/л
A1.17)
Полученная зависимость ОБЭ нейтронов от квадратного корня из
дозы хорошо подтверждается многими экспериментами и в широких
пределах изменения дозы, как показано на рис. 11.15 (в двойном
логарифмическом масшта-
масштабе зависимость A1.17) изоб-
изображается прямой линией).
Этот результат был
большим успехом теории
микродозиметрии. При ма-
малых дозах в уравнении A)
остаются только линейные
члены, что означает, что
ОБЭ больше не зависит
от дозы. Подобные рас-
Рис. 11.15. Зависимость ОБЭ нейтронов от суждения могли бы также
дозы для инактивации клеток человека в куль-
культуре A), клеток кожи B), хромосомных абер-
аберраций в клетках лейкоцитов человека C), раз-
различных эффектов на семенах кукурузы D),
уменьшения скорости роста бобов E), индук-
индукции опухолей молочной железы у крыс F),
мутаций тычинок у традесканции G) и помут-
помутнения хрусталика у мышей (8)
10
связать между собой зна-
значения ОБЭ при малых
и больших дозах, но
экспериментального под-
подтверждения такой связи
получить не удалось.
Заметим, что все рассу-
рассуждения пока были проведены нами без применения микродозимет-
микродозиметрических функций (у и z) и разработанной для них своеобразной
статистики. Поскольку речь идет о повреждающем эффекте при двух
попаданиях в микрообъем, а вероятность каждого попадания про-
пропорциональна удельной энергии z, то два попадания — это просто
квадрат z.
Путем таких рассуждений Келлерер и Росси пришли в точности
к тому же результату, что ОБЭ нейтронов обратно пропорциональна
квадратному корню от дозы, а при малых дозах становится постоян-
постоянной.
Чисто микродозиметрический подход позволял также определить
размер «сайта» и можно было надеяться, что наконец биологически
ориентированная модель микродозиметрии построена. Однако связать
факт двунитевых разрывов ДНК с полученными в расчетах по гипоте-
гипотезе прямого действия размерами сайтов порядка микрометров, никак
не удавалось: реально им следовало приписывать размеры порядка
десятков нанометров.
Разительное расхождение сайтовой модели с экспериментом было
обнаружено группой Гудхеда, использовавшей низкоэнергетическое
6. Локальные характеристики поглощения энергии веществом 83
рентгеновское излучение характеристических линий алюминия с энер-
энергией 1,5 кэВ и углерода, 0,28 кэВ, в опытах на культуре клеток
китайского хомячка. Вопреки ожиданиям, углеродная линия оказа-
оказалась намного эффективнее алюминиевой, а размер сайта составил 70
и 7 нм соответственно, что близко к диаметру нативной молекулы
ДНК B нм). Этот и многие другие результаты позволяют считать,
что сайт имеет сложную природу.
Другим недостатком теории дуального действия является отсут-
отсутствие учета внутренней структуры трека, о которой мы уже говори-
говорили и которая послужила основой для разработки трековых моделей.
Большим этапом развития микродозиметрии явились исследования
школы Буттса-Каца. Создаваемые в настоящее время пакеты про-
программ учитывают и положения, развивавшиеся на основе частично
упомянутых разработок Росси и Келлерера. Трековые модели основ-
основное внимание уделяют структуре трека заряженной частицы. Выше
подробно обсуждалась эта структура. По этим представлениям, 5-
электроны, отлетающие от ствола трека на заметное расстояние, мож-
можно считать образованными в свободных соударениях (что происходит
при передаче электронам энергии, намного превосходящей потенци-
потенциал ионизации атома). Согласно классической формуле Резерфорда,
дифференциальное эффективное сечение as образования таких элек-
электронов с энергией выше Е$ обратно пропорционально квадрату их
конечной энергии:
dos = CZ*2dEs/p2El A1.18)
где Z* — эффективный заряд частицы, который, кстати, изменяется
при малых скоростях частицы /?, согласно формуле A1.11). Несмотря
на сложный характер зависимости пробег-энергия электронов при
учете их почти диффузионного рассеяния в среде, выполняется за-
закон обратной пропорциональности создаваемой ими дозы квадрату
радиуса трека D ~ 1/г2.
Упомянем о двух результатах последних работ по «трековой тео-
теории». Зависимость ОБЭ от ЛПЭ оказалась не однозначной, как утвер-
утверждал Барендсен, автор кривых рис. II. 1, а эта функция проходит через
максимум при разных ЛПЭ для разных зарядов частиц, даже если
биологический тест один и тот же.
Впоследствии этот вывод был блестяще подтвержден многочис-
многочисленными экспериментами. К такому же выводу можно прийти на
основании формулы для эффективного заряда частицы, но оказалось,
что положение максимума различается даже для пучков ионов разных
изотопов одного и того же элемента, так как их зависимости пробега
от энергии не совпадают.
Мы уже не раз повторяли, что после того, как ОБЭ проходит
через максимум, новые повреждения уже не эффективны, и ОБЭ
стремительно уменьшается. Как уже говорилось, это приводит к пе-
переубиванию клеток, «overkill». Недавно эта гипотеза была проверена
непосредственно в опытах с электрофорезом гелей. В итоге этих опы-
опытов возник неожиданный результат: уменьшение репараций — главная
84 Гл. П. Поглощение энергии ионизирующих излучений
причина снижения ОБЭ, а вовсе не «overkill». Это лишь один пример
того, как выводы моделирования постоянно подвергаются все новым
испытаниям при проверке в эксперименте!
Здесь мы переходим к наиболее спорному моменту трековой тео-
теории. В настоящий момент принято считать, что за высокую концентра-
концентрацию энергии ответственны флуктуации ионизации, то есть рои ионов,
и вероятность эффекта непосредственно зависит от ЛПЭ. Однако есть
и другая точка зрения. Замедляясь, электроны наиболее реактивны
при их энергиях в несколько сотен электронвольт, когда образуются,
как мы определили выше, короткие треки и й-электроны, а также
Оже-электроны (напомним, что их энергия точно определена и близка
к потенциалу ионизации i^-оболочки).
Равная или большая энергия передается атомным ядрам отдачи,
радиационный эффект от которых проявляется, например, в виде
окрашивания кристаллов КС1 (Дюрап, Платцманн). Так или иначе от-
отсюда возникают поправки, возможно немалые, и это особенно очевид-
очевидно для всей области низких ЛПЭ, где обычная теория просто прирав-
приравнивает коэффициенты ОБЭ единице, но их значения могут доходить
до 2 и выше. При больших ЛПЭ эта поправка может уменьшиться, так
как вклад обычных ионизации возрастает из-за перекрытия ионных
«шпор». Эти вопросы, детально разработанные в 60-х и 70-х гг. XX в. в
русских публикациях (ИТЭФ, ФИАН), в последнее время вновь стали
обсуждаться зарубежными авторами.
6.2. Моделирование в микродозиметрии
На основании вышеизложенного можно предположить, что в реше-
решении проблем микродозиметрии преобладают аналитические методы
математического моделирования, и это действительно так. Однако
широко используются также методы физического моделирования и
создаются приборы, эквивалентные биологическому объекту. Их при-
применение во многих случаях позволяет избежать громоздких расчетов,
а также многих недостатков, заложенных в самих гипотезах, прини-
принимаемых при этих расчетах.
Исторически наиболее ранним и до сих пор широко распростра-
распространенным является ионизационно-импульсный метод микродозиметрии,
в котором применяется бесстеночный газоразрядный пропорциональ-
пропорциональный счетчик. Физический процесс в нем тот же, что и в ионизаци-
ионизационной камере, однако ионы, ускоренные электрическим полем, дают
заранее усиленный сигнал. Масса газа в объеме прибора соответствует
моделируемому микрообъему, а эквивалентность газа жидкости обес-
обеспечивается выполнением принципа Брэгга-Грея. Разумеется прибор
имеет стенки, но их влияние исключено специальным дополнитель-
дополнительным электрическим полем. Применяя двухкамерную конструкцию,
удается даже разделить два процесса: ионизацию среды и газовое
усиление.
В однокамерном варианте, так называемом счетчике Россщ
были получены спектры событий — распределения у dy — в
6. Локальные характеристики поглощения энергии веществом 85
чувствительных объемах размером от 0,1 до 10 мкм, а двухкамерный
счетчик Буза позволяет довести этот предел до 50,0 А. Заметим,
что 1 А = 10~8 см = 0,1 нм. Поэтому в последнее время речь все
чаще заходит о «нанодозиметрах».
Приборы, уже послужившие нам для иллюстрации механизма об-
образования треков — камера Вильсона и пузырьковая камера, дают
повод поразмышлять, не являются ли они по существу нанодозимет-
рами? Ведь процессы, на которых основано их действие, постоянно на-
наблюдаются в природе: дождь не выпадет, пока в «абсолютно чистой»
туче не возникнет центр, инициирующий конденсацию паров, которым
может оказаться всего лишь одна частица космического излучения,
прошедшая через микроскопический объем с размером порядка тех
же ангстремов. Как происходит взрыв парового котла, также вполне
известно. Таким образом, энергетический парадокс работает в полную
силу и в неживой природе.
Нанодозиметры действительно создаются. Примером является
«капле-пузыръковый детектор» Эппла, в котором капелька геля
помещается в другую, но тоже гелевую среду. Эта капля приводится
в метастабильное состояние, в котором она готова испариться, но это
происходит лишь при наличии некоторого количества ионов. Авторы
прибора утверждают, что количество центров капельного испарения
соответствуют эквивалентной или биологической дозе (это зависит от
режима работы прибора). Подобных публикаций насчитывается уже
довольно много (на них в библиотеках Интернета заведено ключевое
слово «nanodosimetry»). Но, по-видимому, серьезные разработки в
этой области только еще начинаются.
Рассмотренные нами сведения о процессах поглощения энергии из-
излучения необходимы для выяснения механизмов радиобиологических
процессов. Возникающие на физической стадии ионизированные и воз-
возбужденные молекулы запускают сложную цепь реакций, приводящих
в конечном счете к тестируемому биологическому эффекту. Поэтому
информация о первичных событиях (число ионизации, характер их
распределения и т.д.) служит отправной точкой биофизического ана-
анализа механизмов биологического действия ионизирующих излучений.
Попытки как-то ввести эти механизмы, предпринятые микродозимет-
микродозиметрией, коснулись лишь стадии определения эффективности передачи
энергии чувствительным микрообъемам и никак не затронули суще-
существа реакции тканей или даже клеток на воздействие излучения. В
принципе в клетке может существовать некая микроструктура (ми-
(мишень), поражение которой прямо или косвенно приведет к конечно-
конечному биологическому эффекту. Например, глубокая деградация какого-
либо мембранного участка может резко нарушить ионный гомеостаз
и привести к быстрой гибели клетки, а поражение определенного
участка хромосомы может привести к метаболическим изменениям,
86 Гл. П. Поглощение энергии ионизирующих излучений
которые постепенно приведут к нарушению жизненно важных функ-
функций и также к гибели клетки. Априори можно предполагать, что
прохождение трека частицы через «мишень» приведет к ее поражению
вследствие ионизации большого числа атомов, составляющих такую
мишень, если для конечного эффекта достаточно этой ионизации в
пределах определенной структуры.
Такого рода соображения открывают широкие возможности для
формального анализа первичных процессов, приводящих к тестируе-
тестируемому биологическому эффекту облучения. Проводя соответствующую
математическую обработку кривых, отражающих зависимость биоло-
биологического эффекта от поглощенной дозы излучения, можно попытать-
попытаться оценить минимальное количество актов ионизации, достаточное
для возникновения эффекта, примерный размер мишени, в которой
должны произойти акты ионизации, и т. д. Такой анализ (подробнее
он будет рассмотрен в следующей главе) позволит получить важную
информацию о характере ионизации, которая произошла в объекте на
начальной стадии действия излучения и спустя определенное время
(секунды или часы) приведет к конечному биологическому эффекту.
Глава III
ЗАВИСИМОСТЬ БИОЛОГИЧЕСКОГО ЭФФЕКТА ОТ
ПОГЛОЩЕННОЙ ДОЗЫ ИЗЛУЧЕНИЯ
Исследования, выполненные еще на начальном этапе развития
радиобиологии, позволили в общих чертах установить качественную
картину лучевого поражения клеток и разнообразных многоклеточ-
многоклеточных организмов. Экспериментаторы с большим интересом подвергали
биологические объекты «рентгенизации» или действию эманации ра-
радия. Они отмечали, что в результате облучения угнетается клеточное
деление, возникают аномалии роста и развития, происходит атрофия
кроветворных и других органов, дегенерация семенников и яичников,
гибель различных организмов, включая млекопитающих; наблюдается
бластомогенное действие радиации и другие отдаленные во времени
биологические эффекты облучения. Еще в начале XX века были описа-
описаны различные реакции клеток на облучение — от временной задержки
роста и размножения до полной деградации и лизиса. Выраженность
эффекта зависела от дозы облучения и особенностей объекта — его
физиологического состояния, генетической конституции и др.
1. Принцип попадания и концепция мишеней
1.1. Зависимость «доза-эффект». Количественные
закономерности
Строгие количественные эксперименты впервые были проведены
в конце 20-х годов. Этому способствовало два обстоятельства. Во-
первых, широкое распространение получают ионизационный метод
дозиметрии излучения и использование в качестве единицы экспозици-
экспозиционной дозы рентгена. Благодаря этому облучение экспериментальных
объектов становится строго дозированным, и условия опыта могут
быть многократно воспроизведены. Во-вторых, для количественных
экспериментов радиобиологи стали использовать клоны генетически
однородных клеток, вирусные частицы, препараты макромолекул, т. е.
такие системы, в которых легко определить реакцию единичного объ-
объекта на действие излучения в данной дозе.
88 Гл. III. Зависимость биологического эффекта от поглощенной дозы
1.1.1. Кривые «доза-эффект»
Уже в первых радиобиологических исследованиях отмечалась важ-
важнейшая закономерность — вероятностная природа проявления реак-
реакции клеток на облучение. При оценке зависимости доли погибших
клеток от величины дозы облучения выяснялось, что различные од-
одноклеточные объекты гибнут при самых малых дозах облучения, с
ростом дозы увеличивается число погибших клеток, однако даже при
облучении в очень высоких дозах некоторое число клеток сохраняет
жизнеспособность.
Существенно, что с ростом дозы облучения наблюдалось увели-
увеличение не столько степени проявления эффекта (глубины поражения
отдельной клетки), сколько доли летально пораженных клеток в об-
облученной популяции. Примеры типичных графических кривых, от-
отражающих зависимость доли выживших клеток от величины дозы
облучения (кривые «доза-эффект»), приведены на рис. III. 1.
100
60
40
20
0,1
0,01
0,001
0,0001
J I
12 3 4
Доза, отн. ед.
о
и
i
1
2 6 10 14 16 20
Доза рентгеновских лучей, хЮ2 Гр
100 Г
80
60
1 40
20
I I
0 5 10 15 20 25 30
Доза 7"лучей, хЮ2 Гр
0
12 3 4 5 6 7
Доза рентгеновских лучей, хЮ2 Гр
Рис. III. 1. Зависимость конечных биологических эффектов от дозы облучения:
а) гибель инфузорий Colpidium colpoda через 2 часа после облучения; б) гибель яиц
аскариды после облучения в аэробных условиях; в) инактивация вируса табачной
мозаики 7"лучами; г) инактивация сухой рибонуклеазы
Для построения этих кривых определенное количество объектов
данного вида облучали в широком диапазоне доз; после облучения
в каждой дозе определяли долю объектов, сохранивших исходные
свойства, по отношению к их общему числу до облучения.
1. Принцип попадания и концепция мишеней 89
Изображенные на рис. III. 1 кривые «доза-эффект» построены раз-
разными авторами на основании экспериментов с простейшими организ-
организмами, одиночными клетками, вирусами и ферментами. Разнообразны
объекты, различны диапазоны использованных доз излучения, но во
всех случаях наблюдается интересная закономерность: при облуче-
облучении *) уже в самых малых дозах обнаруживаются инактивированные
организмы, клетки, вирусные частицы или макромолекулы, а при
дозах, в сотни и тысячи раз больших, все еще удается обнаружить
объекты, сохранившие исходные биологические свойства, т. е. не пора-
пораженные излучением (однако, в конечном итоге, все кривые достигают
нулевой точки).
Возможная «биологическая» интерпретация кривых «доза-
эффект», наблюдаемых в экспериментах с клетками, могла бы
основываться на представлении о широкой индивидуальной вари-
вариабельности радиочувствительности. Действительно, фармакологам
хорошо известно, что 5-образные кривые «доза-эффект», получаемые
при действии ядов на животных и клетки, связаны с их различной
индивидуальной устойчивостью к действию токсического агента.
Вплоть до некоторой пороговой дозы все организмы переносят
действие яда; при концентрациях, превышающих пороговые, резко
возрастает доля погибших особей; а при некоторой дозе яда
обнаруживается 100% летальный эффект. Чем меньше выражены
индивидуальные различия, тем круче наклон кривой «доза-эффект».
Однако такое объяснение в случае радиационного воздействия до
сих пор считается малоубедительным. Во-первых, трудно предста-
представить, что внутри генетически однородной популяции клетки в десятки
тысяч раз различаются по устойчивости к облучению. Во-вторых, на
кривых «доза-эффект» отсутствует четкий порог: как угодно малая
доза излучения убивает некоторое число клеток, а при высоких дозах
все еще обнаруживаются выжившие (исключение составляют ситуа-
ситуации, когда в результате предшествующего облучения в малых дозах
клетки становятся более радиорезистентными, реагируют явлением
гормезиса). Тем не менее, полагают, что вряд ли у клеток одного клона
существуют такие различия в строении или обмене веществ, которые
делают их тысячекратно различающимися по радиочувствительно-
радиочувствительности. Впрочем, в этом умозрительном заключении не учтены факторы
состояния клеток в разных стадиях клеточного цикла, различий по
степени вовлеченности в реализацию физиологических функций (по
функциональному состоянию), по состоянию питания из прилежащих
микрообъемов питательной среды, различий по ориентации по отно-
отношению к потоку ионизирующего излучения и т. п.
*) В настоящее время хорошо известно, что при облучении в малых
дозах наблюдается более сложная, немонотонная зависимость, чем это было
показано на начальных участках кривых (до 0,5—1 Гр) «доза—эффект» в
гл. VII.
90 Гл. III. Зависимость биологического эффекта от поглощенной дозы
Еще труднее предполагать, что среди макромолекул рибонуклеазы
(рис. III. 1, г), обладающих одинаковыми физико-химическими свой-
свойствами, одни молекулы утрачивают каталитическую активность при
действии небольших доз, а другие сохраняют активность при действии
тысячекратно превосходящих доз лишь в силу особенностей самого
объекта, подвергающегося облучению. Хотя и при этом так же, как и
в случае клеток, не учитываются различия в длительности предше-
предшествующего облучению существования и функциональной активности
разных молекул фермента (их «возраста»), выделенных к тому же
из разновозрастных клеток, — различия, основанные на постепен-
постепенном «старении» молекул, изменении в них степени первоначальной
«жесткости», исходного состояния прочности химических связей меж-
между атомами, способных оказывать заметное влияние на химическую
устойчивость молекул к действию ионизирующей радиации.
Рассматриваемые кривые «доза-эффект» показывают, какая доля
объектов инактивируется при поглощении системой определенного
количества энергии ионизирующих излучений. Представим, что эта
же система (суспензия клеток, препарат вирусных частиц или макро-
макромолекул) получает энергию иным путем, например за счет нагрева-
нагревания от какого-либо источника тепла. В этом случае кривая «доза-
эффект» примет иной вид. Вплоть до некоторой температуры Т\ не
обнаруживаются инактивированные объекты; после этой пороговой
температуры число пораженных объектов возрастает до максималь-
максимального значения, и если процесс термоинактивации необратим, то при
достижении некоторой температуры Т<± мы не обнаружим ни одного
вируса, макромолекулы и тем более клетки, оставшихся непоражен-
непораженными.
Объяснение наблюдаемого вида кривых зависимости эффекта от
дозы облучения все же следует искать в особенностях воздействия
ионизирующих излучений, в способе сообщения ими энергии
биологическому объекту, т. е. в иной, биофизической трактов-
трактовке экспериментальных кривых «доза-эффект». Она основывается на
излагаемых в данном учебнике основополагающих принципах — пред-
представлении о дискретной природе ионизирующих излучений и веро-
вероятностном характере передачи энергии внутриклеточным молеку-
молекулярным структурам.
1.1.2. Гипотеза «точечного нагрева»
В опытах по термоинактивации, о которых шла речь, энергия от
источника тепла сообщалась всем объектам равномерно и одинаково
за счет теплопроводности воды или воздуха (в жидких или сухих
препаратах соответственно). Ионизирующие частицы, напротив, со-
сообщают системе энергию дискретными порциями, и процесс передачи
энергии носит статистический характер. Поэтому среди совокупности
облучаемых микроструктур одни из них с определенной вероятностью
поглощают энергию излучения, тогда как другие вообще «не знают»,
что облучение имело место.
1. Принцип попадания и концепция мишеней 91
Иными словами все микроструктуры могут поглощать энергию
с некоторой вероятностью, так что в итоге определенная часть их
поглощает больше, другая — меньше, а некоторая доля их может и
вообще не провзаимодействовать. Такие представления, основанные
на фундаментальных физических концепциях о механизме взаимодей-
взаимодействия ионизирующих излучений с веществом, позволяют объяснить
количественные закономерности, наблюдаемые в радиобиологических
экспериментах.
Ф. Дессауэр в начале 20-х гг. подошел к проблеме биологического
действия ионизирующей радиации, исходя из физической природы из-
излучения. Выдвинутая им гипотеза «точечного нагрева» основывалась
на следующих положениях*):
- ионизирующие излучения обладают очень малой объемной плот-
плотностью по сравнению с видимым или ультрафиолетовым светом
энергетически эквивалентной дозы;
- фотоны рентгеновского или 7~излучения, ускоренные электроны
или тяжелые заряженные частицы обладают огромной энерги-
энергией, величина которой значительно превосходит энергию любой
химической связи;
- облучаемый биологический объект, например клетка, состоит, с
одной стороны, из относительно менее значимых и, с другой —
весьма существенных для жизни микрообъемов и структур;
- в облучаемом объекте при поглощении относительно небольшой
общей энергии в отдельных случайных и редкорасположенных
микрообъемах остаются настолько большие порции энергии, что
их можно сравнить с микролокальным нагреванием и они могут
производить почти любые узколокальные изменения в веществе;
- так как распределение «точечного тепла» является чисто ста-
статистическим, то конечный эффект в клетке будет зависеть от
случайных попаданий дискретных порций энергии в жизненно
существенные микрообъемы внутри клетки. С повышением дозы
увеличивается вероятность таких попаданий, и наоборот, при
понижении дозы вероятность снижается. Из этого следует, что
любая самая малая доза может соответственно с малой вероят-
вероятностью и, следовательно, малой частотой вызывать экстремаль-
экстремальный биологический эффект (например, гибель клетки), но даже
при очень высокой дозе могут с малой вероятностью и малой
частотой сохраниться отдельные неповрежденные клетки.
В 1922 г. Блау и Альтенбургер предложили общую формулу
для расчета кривых «доза-эффект», основанную на статистическом
*) Излагается по Тимофееву-Ресовскому Н.В. и др., 1968.
92 Гл. III. Зависимость биологического эффекта от поглощенной дозы
принципе «попадания»:
к=0
где Nq — исходное число клеток до облучения, N — число клеток, про-
прореагировавших данным образом, D — доза облучения, п — требуемое
число попаданий в мишень и v — коэффициент, пропорциональный
объему V «мишени», попадание в которую приводит к оцениваемому
эффекту (точный смысл коэффициента v будет определен при рас-
рассмотрении статистики одноударных процессов).
Блау и Альтенбургер из уравнения (III. 1) рассчитали теоретиче-
теоретические кривые «доза-эффект» для разного «числа попаданий в ми-
мишень». Эти кривые соответствовали реальным дозовым кривым, на-
наблюдаемым при облучении изолированных клеток.
1.2. Принцип попадания и концепция мишеней
В работах, выполненных Дж. Кроутером, Д. Ли, К.Циммером,
Н. В. Тимофеевым-Рессовским и др., были предложены и использо-
использованы для анализа радиобиологических эффектов принцип попадания
и концепция мишени (или, как иногда называют, «теория» мишеней).
В 1924 г. Дж. Кроутер сформулировал «теорию попадания» (прин-
(принцип попадания). Считая попаданием возникновение акта ионизации в
облучаемом объеме, автор предположил, что регистрируемый эффект
связан с некоторым критическим числом ионизации (попаданий) в
пределах мишени, занимающей определенный чувствительный объем
внутри клетки. Параметры мишени оказались сопоставимыми с раз-
размерами центриолей и ядрышек. С тех пор в радиобиологии начался
активный поиск мишени на основании статистических принципов по-
попадания. Он привел к выводу о ведущей роли ядра и внутриядерных
наследственных структур в летальном поражении клетки.
1.2.1. Одиночные и множественные попадания в мишень
В общем виде количественный анализ, основанный на принципе
попадания, состоит в том, что полученные в эксперименте кривые
«доза-эффект» интерпретируются на основании следующих физиче-
физических положений:
- ионизирующие излучения переносят энергию в дискретном виде;
- акты взаимодействия (попадания) не зависят друг от друга и
подчиняются пуассоновскому распределению;
- исследуемый эффект наступает, если число попаданий в
некоторую чувствительную область гетерогенной биологической
структуры, так называемую мишень, составляет по крайней
мере п ^ 1.
1. Принцип попадания и концепция мишеней 93
Рассмотрим простейший случай «одноударного процесса», ко-
когда попаданием считают одиночную передачу некоторого минималь-
минимального количества энергии. Переданная энергия («энергия попадания»)
определяет характер повреждения, зависящий и от специфики облуча-
облучаемой системы, т. е. тестируемый эффект наступает лишь тогда, когда
определенное минимальное количество энергии поглощено чувстви-
чувствительной областью — мишенью.
Представим, что облучаемая система состоит из Nq объектов, каж-
каждый из которых обладает мишенью сечением S и объемом V. Пусть
для инактивации объекта достаточно, чтобы трек плотноионизируго-
щей частицы прошел через сечение мишени S; такое событие будем
именовать попаданием.
Это предположение имеет физический смысл. Так, например, а-
частица с энергией 2,5 МэВ образует около 3000 пар ионов на 1 мкм
пути. Если пренебречь неравномерностью распределения ионов вдоль
трека, то даже при толщине мишени 10~3 мкм с большой вероятностью
в пределах мишени, через которую проходит трек частицы, возникнет
несколько ионизации. Если траектории частиц распределяются по
поперечному сечению объекта случайным образом и не зависят друг
от друга, то вероятность одного, двух, ..., п попаданий в мишень,
находящуюся в пределах объекта, описывается уравнением:
Р{п) = ^ЦД (Ш.2)
где а — среднее число попаданий в мишень. Если Ф — флюенс, то есть
среднее число частиц, пролетающих через единичную площадку, a S —
сечение мишени, то а = 5Ф. Как было определено формулой A.8)
(гл. I), флюенс Ф пропорционален поглощенной дозе излучения.
При сколь угодно малой дозе излучения существует вероятность
прохождения частицы через одну из мишеней. С увеличением потока
частиц (т. е. с ростом дозы излучения) в объекте возрастает число
мишеней, в которые произошло попадание.
Если Nq — общее число объектов в облучаемой системе, а N —
число объектов, сохранивших после облучения исходные свойства (т. е.
«выживших»), то величина N/Nq соответствует вероятности непопа-
непопадания (п = 0). Из уравнения (Ш.2) для случая п = 0 (учитывая,
что 0! = 1) получим
N _ EФ)°е-5Ф _ _5Ф
No 0!
(Ш.З)
При некоторой дозе облучения выполняется условие 5Ф = 1. Это
соответствует случаю, когда в среднем число попаданий равно чис-
числу мишеней. В действительности же часть попаданий испытали уже
однажды пораженные мишени, а некоторые не претерпели ни одного
попадания.
94 Гл. III. Зависимость биологического эффекта от поглощенной дозы
Согласно формальной статистике Пуассона при 5Ф = 1 реально
поражается только 63% мишеней, а 37% оказываются непораженны-
непораженными*). Действительно, подставив в уравнение (III.3) значение 5Ф = 1,
получим
N_
No
тг =е~5Ф =е~1 =0,37.
(Ш.4)
Из соотношения (III.3) определяется и доза облучения, при которой
выживает 37% объектов, т. е. N/Nq = 0,37, если воспользоваться
формулой A.8) для пересчета флю-
енса в дозу:
(Ш.5)
37% непораженных
мишеней
D = 1,602-
Гр,
0,37 i
Доза облучения
Рис. III.2. Зависимость между
числом непораженных мишеней и
поглощенной дозой ионизирующих
излучений: 1 — объект с мишенью
сечением 5; 2 — треки частиц
где L — средняя ЛПЭ в единицах
МэВт^см2.
Отношение N/Nq легко опре-
определить в эксперименте: это доля
«выживших» объектов по отноше-
отношению к их общему числу до об-
облучения. Узнав, при какой дозе
облучения выживает 37% объектов,
т.е. N/No = 0,37 (эту дозу излу-
излучения обозначают символом D37),
мы можем определить сечение ми-
мишени, принимая, что дозе D37 со-
соответствует флюенс Фз75 который
определяется формулой (Ш.5):
5Ф37 = 1, S = 1/Ф37. (Ш.6)
На рис. III.2, а-б представле-
представлена схема, иллюстрирующая зависи-
зависимость числа пораженных мишеней
от дозы облучения. Из рис. III.2, а
видно, что даже при облучении в
малой дозе некоторое число частиц
проходит через мишени и вызыва-
вызывает их инактивацию. С ростом дозы
число пораженных объектов воз-
возрастает резко, почти линейно, а за-
затем все более вероятно повторное
прохождение частиц через уже по-
пораженные мишени. При дозе D37
общее число частиц соответствует
числу мишеней (SD = 1), но 37%
объектов остаются непораженными,
Здесь не учитываются процессы восстановления в облученных клет-
1. Принцип попадания и концепция мишеней 95
тогда как некоторые из 63% мишеней испытали по два и более по-
попаданий (рис. III.2, б). Даже при очень большой дозе облучения все
же какое-то число объектов оказалось не пораженным излучением
(рис. III.2, в). Графически зависимость доли выживших клеток от
величины дозы выражается экспонентой (рис. III.2, г)
N/No = е~БФ = е- D'D^. (III.7)
Аналогичные рассуждения можно использовать для анализа «од-
ноударных процессов» при действии рентгеновского или 7-излучения,
вызывающего редко расположенные акты ионизации по всему объему
облучаемого объекта. В этом случае можно установить еще один важ-
важный параметр мишени — ее объем.
Пусть в системе имеется Nq объектов с мишенью объемом V, и
для инактивации достаточно одиночной ионизации в пределах этой
мишени. Если акты ионизации подчиняются распределению Пуассона,
то вероятность 1, 2, ..., п попаданий в мишень описывается уравнением
того же типа, что и (III.2):
Р{п) = Ц^, (Ш.8)
где а — среднее число попаданий в мишень, пропорциональное дозе, то
есть а = z/D, причем смысл коэффициента будет определен, если вос-
воспользоваться правилом, по которому в показателе экспоненты должна
стоять физически безразмерная величина*). Для случая п = 0 доля
выживших объектов определяется из соотношения
«=(^=е^ (ш.9)
На рис. III.3, а-в показано, как с ростом числа ионизации в об-
облучаемой системе (т. е. с ростом дозы ионизирующего излучения)
увеличивается доля пораженных объектов. Как и в случае плотной
ионизации, при самой малой дозе вероятно возникновение иониза-
ионизации хотя бы в одной из мишеней, и при дозе D37 число ионизации
в среднем соответствует числу мишеней. Зависимость между долей
непораженных объектов N/Nq и поглощенной дозой экспоненциальна
*) К сожалению, это простое математическое правило было проигнори-
проигнорировано во многих трудах по теории мишени, где в показатель степени или
под знак логарифма ставили величины различной физической размерности,
хотя там возможна только нулевая размерность. Однако, пользуясь указан-
указанным простым правилом, можно без труда установить ошибки, допущенные
некоторыми авторами. Происхождение ошибки нетрудно проследить. Осно-
Основоположники теории мишени выражали показатель соотношения (III. 1) в
виде произведения объема мишени V на дозу D, указывая при этом, что
в данном случае доза измеряется количеством попаданий в единичный
объем 1 см3 (см., например, [65]). Но впоследствии, когда определение дозы
точно установилось, существенное замечание Циммера и др. было прочно
забыто.
96 Гл. III. Зависимость биологического эффекта от поглощенной дозы
непораженная
мишень
N/No
0,37F--
Доза облучения
Рис. III.3. Зависимость между
числом непораженных объектов
и дозой 7" или рентгеновского
облучения: 1 — объект с мишенью
объемом У; 2 — акты ионизации
х О
h
14
- О 0,5 1,0 1,5 2,0
Доза 7-лучей, х 103 Гр
Рис. III.4. Инактивация вируса та-
табачной мозаики 7-излучением. Кри-
Кривая «доза-эффект» преобразова-
преобразована из соответствующей кривой на
рис. III.1, в
(рис. III.3, г), а по величине до-
дозы D37 можно определить так на-
называемый коэффициент радиочув-
радиочувствительности г/, пропорциональный
объему мишени V.
Таким образом, точный смысл
коэффициента v — I/D37 — это
обратная величина средней до-
дозы D375 при которой выживаемость
уменьшается в е = 2,72 раза
(т.е. 1/е = 0,37). Теоретические
положения концепции мишени,
основанные на предположении об
«одноударности» процесса попада-
попадания, предсказывают экспоненциаль-
экспоненциальную зависимость «доза-эффект».
В реальных условиях эксперимента
такую зависимость наблюдали при
облучении макромолекул, вирусов,
бактериальных спор, некоторых
одноклеточных организмов (см.,
например, рис. III. 1, а-г). Чтобы
выявить существование экспонен-
экспоненциальной зависимости эффекта
облучения от поглощенной дозы,
поступают следующим образом.
Объекты облучают в широком
диапазоне доз, для каждой дозы
определяют долю выживших N/Nq
и находят значение натурального
логарифма этой величины. Если
на графике, отражающем зависи-
зависимость In N/Nq от поглощенной дозы,
все точки укладываются на прямую,
значит выполняется соотношение
\uN/N0 = -isD,
или N/No = e~vD. (III. 10)
На рис. III.4 представлена за-
зависимость эффекта от дозы, полу-
полученная преобразованием в полуло-
полулогарифмических координатах кривой
из рис. III.1, в. Видно, что доля вирусов, сохранивших исходную ак-
активность, экспоненциально зависит от дозы облучения, так как все
экспериментальные точки укладываются на прямую, т. е. выполняется
уравнение (III. 10).
1. Принцип попадания и концепция мишеней 97
Количественный анализ, основанный на принципе попадания, не
в состоянии вскрыть природу физико-химических процессов, разви-
развивающихся в клетке вслед за возникновением одиночных актов иони-
ионизации (попаданий). Однако он позволил ввести в радиобиологию
представление о вероятностной природе единичной реакции клетки
на облучение. Появилась возможность корректного описания кривых
«доза-эффект», анализа важнейших параметров кривых, планиро-
планирования радиобиологического эксперимента и точного количественного
учета полученных результатов.
Экспоненциальная зависимость «доза—эффект» — важный, но не
единственный критерий одноударности процесса инактивации. Если
действительно одного попадания в мишень достаточно для инактива-
инактивации объекта, то должны выполняться следующие требования:
1 — эффект, вызываемый облучением в данной дозе, не зависит
от интенсивности излучения (мощности дозы) и от того, какими
частями доза сообщалась объекту;
2 — при одинаковом эффекте вызывающая его доза различных
излучений возрастает при переходе от редко- к плотноионизиру-
ющим частицам.
Рассмотрим значение этих ограничительных условий. Если выпол-
выполняется первое требование, значит тестируемый эффект не возника-
возникает вследствие кумулятивного действия нескольких последовательных
ионизации (иначе эффект зависел бы от распределения ионизации во
времени). Каждая ионизация, возникающая в пределах облучаемых
объектов, имеет определенную вероятность оказаться причиной эф-
эффекта, но эта вероятность при одноударном процессе не должна зави-
зависеть ни от времени, прошедшего с момента предыдущей ионизации, ни
от времени, отделяющего ее от последующей ионизации. Следователь-
Следовательно, эффект данной дозы должен определяться только ее величиной
(т.е. числом возникших актов ионизации); интенсивность излучения
и распределение дозы во времени не должны играть никакой роли.
Выполнение второго требования означает, что плотноионизирую-
щие излучения менее эффективны, чем редкоионизирующие. Действи-
Действительно, если одиночной ионизации достаточно для возникновения те-
тестируемого эффекта, то частицы, производящие большое число ионов
на единицу пути, вызовут в пределах мишени множество «ненуж-
«ненужных» ионизации. Редкоионизирующие излучения генерируют сгустки
ионов, значительно удаленные друг от друга, и вероятность возник-
возникновения нескольких ионизации в пределах мишени малого размера
незначительна. Величина поглощенной дозы определяет общее число
ионизации, произведенных данным видом излучения в единице объ-
объема. При одноударном процессе большинство ионизации, вызванных
плотноионизирующим излучением, «бесполезно». Поэтому при равной
дозе, т. е. при равном общем числе ионизации, редкоионизирующие
излучения окажутся более эффективными.
7 Ю. Б. Кудряшов
Гл. III. Зависимость биологического эффекта от поглощенной дозы
Напротив, если тестируемый эф-
эффект наступает вследствие боль-
большого числа ионизации в пределах
мишени (многоударный механизм
инактивации), то частицы с высо-
высокой плотностью ионизации окажут-
окажутся значительно эффективнее, чем
редкоионизиру ющие.
Кривые «доза-эффект» при
многоударном механизме
инактивации отличаются от экспо-
экспоненциальных дозовых кривых, на-
наблюдаемых в случае одноударного
процесса. В полулогарифмическом
масштабе семейство дозовых
кривых для случая п = 2, 3, ...,
к представлено на рис. III.5 (по
Дессауэру, 1954).
Чем больше «ударность» мише-
мишени, тем заметнее «плечо» — началь-
начальный, более горизонтальный участок
кривой. Вслед за плечом следует
переход к прямолинейному участ-
участку, наклон которого совпадает с на-
наклоном соответствующей одноудар-
ной кривой. Вид дозовой кривой
при многоударном механизме инак-
инактивации определяется тем, что при
малых дозах лишь небольшое чис-
число объектов может испытать тре-
требуемое число попаданий /с, а все
остальные — не более к — 1 попада-
попаданий. По достижении к — 1 попаданий
во все или большинство объектов возникает ситуация, при которой
последнее, &-е, попадание приводит к тестируемому эффекту. Начиная
с этой дозы кривая принимает вид, характерный для одноударного
процесса.
Формально такие кривые могут быть получены суммированием
всех объектов, получивших 0, 1, 2, ..., п — 1 попаданий; согласно
распределению Пуассона их точное число выражается соотношени-
соотношением (III. 1), а доля выживших, т. е. претерпевших от 0 до п—1 попаданий,
определяется следующей формулой:
2 4 6
Доза, усл. ед.
10
Рис. III.5. Теоретические кривые
выживаемости для объектов, инак-
тивируемых в результате нескольких
попаданий: а) в полулогарифмичес-
полулогарифмическом масштабе; б) в обычном масшта-
масштабе. «Ударность» процесса инактива-
инактивации обозначена на верхнем рисунке
IL = e~vD V
No *-" k\
к=0
(Ш.11)
1. Принцип попадания и концепция мишеней
99
где N — число выживших, a Nq — общее число особей в облученной
совокупности объектов. Уравнение для одноударного процесса легко
получить из (III. 11), подставив п = 1.
На основании принципа попадания и концепции мишени можно
анализировать кривые «доза-эффект», полученные в эксперименте.
В зависимости от вида объекта и характера излучения получают
различные дозовые кривые — от простых экспоненциальных до сигмо-
идальных с различной шириной плеча. Наиболее надежно поддаются
формальному анализу одноударные радиобиологические реакции, в
которых попаданием служит одиночная ионизация или рой ионов в
пределах мишени. В этом случае, располагая кривыми «доза-эффект»
для излучений с различными значениями ЛПЭ, можно рассчитать
размеры и число мишеней, отражающие размеры и число тех элемен-
элементарных биологических структур, поражение которых вследствие иони-
ионизации приводит к регистрируемому биологическому эффекту. Подоб-
Подобное применение принципа попадания позволило впервые определить
размеры некоторых макромолекул, вирусов, генов, получить сведения
о внутренней структуре бактериальных спор и т. д.
1.2.2. Попадания в мишени и гибель облученных клеток
Лишь в очень ограниченном числе случаев зависимость доли вы-
выживших клеток от величины дозы облучения описывается экспо-
нентой, т. е. простой одно-
ударной кривой. Значительно
чаще в эксперименте по-
получают кривые «доза-эф-
«доза-эффект», которые имеют плечо
(рис. III.6, по С.П.Ярмонен-
ко, 1988).
Для построения кривой,
используемой в качестве
примера, на рис. III.6 взяты
данные по выживаемости
клеток ELD, полученные
в работах С. П. Ярмоненко
(рис. III.7, б).
Ось абсцисс начинается не
от нуля оси ординат, а от
выбранной для удобства точ-
точки, соответствующей 0,01%
выживаемости. Поэтому кри-
кривая упирается в ось аб-
абсцисс. В действительности же
для популяции изолирован-
изолированных клеток не существует
критической дозы, при кото-
которой гибли бы все 100% особей.
е
10
5
2
1,0
0,5
0,37
0,2
0,1
0,05
0,037
0,02
0,01
0,005
0,0037
0,002
0,001
: \ Dq
-
—
z
-
г
-
1
п = 7
Dq = 220 Р
Do = 115 Р
?>з7 = 280 Р
\
\
\
1 1 1
200 400 600 800
Доза облучения, Р
1000
Рис. III.6. Определение основных парамет-
параметров кривой выживания
100 Гл. III. Зависимость биологического эффекта от поглощенной дозы
2 4 6 8 10 12
Доза рентгеновского
облучения, Гр
Рис. III.7. Кривая «доза-эф-
«доза-эффект» для популяции клеток,
подвергнутых воздействию 7-из-
лучения: а) клетки почки чело-
человека в культуре; б) линия клеток
ELD в культуре
Такой тип кривой описывается уравне-
уравнением:
N/No = 1 - A - e-D/Do)n, (III.12)
где п — экстраполяционное число,
определяемое как значение ординаты
в месте ее пересечения экстраполи-
экстраполированным прямолинейным участком
кривой выживаемости, Dq определя-
определяет исходную радиочувствительность и
вычисляется как приращение дозы,
снижающей выживаемость в е раз на
прямолинейном участке кривой «доза-
эффект». Как видно из рис. III.6, Dq —
«квазипороговая доза» — соответству-
соответствует отрезку, отсекаемому от перпендикуляра, проведенного из точки
100-процентной выживаемости на оси ординат, продолжением линей-
линейного участка кривой выживаемости. В этом случае доза D37 связана
с Do и Dq простым уравнением
D37 = D0 + Dq, A11.13)
согласно которому выживает 37% облученных клеток, а 63% гибнет.
Это соответствует распределению Пуассона: так как при дозе Do
часть попаданий приходится в уже погибшие клетки, 37% клеток
не испытывают ни одного попадания. Значение Dq является мерой
радиочувствительности клеток; для экспоненциальных, одноударных
кривых эта доза не отличается по величине от D37, а для сигмоидаль-
ных кривых Do и D37 различны.
Рассматриваемый тип кривых выживания формально можно опи-
описать с позиции теории мишени рядом моделей. Если простые экс-
экспоненциальные кривые выживаемости хорошо описываются моделью
«одно попадание — инактивация одной критической мишени», то для
сигмоидальных кривых рассматриваются две модели: «много попада-
попаданий — инактивация одной критической клеточной мишени» и «одно
попадание — инактивация каждой из многих клеточных критических
мишеней». Первая модель предполагает наличие в клетке одной уни-
уникальной структуры — мишени, для инактивации которой необходимо
осуществление в пределах чувствительного объема п актов абсорб-
абсорбции энергии («попаданий»), а вторая модель предполагает наличие в
клетке т критических мишеней, для инактивации каждой из которых
допускается по одному событию попадания.
Такие формальные модели используются для анализа первичных
эффектов передачи энергии излучения клетке. Построив на основании
экспериментальных данных как можно более точную кривую «доза-
эффект», можно определить величины D37, Do, n и Dg, которые ха-
характеризуют радиочувствительность клетки и ее способность восста-
восстанавливаться от радиационного поражения. С помощью ЭВМ можно
получать теоретические «кривые выживаемости», варьируя основные
1. Принцип попадания и концепция мишеней 101
параметры n, Dq, Dq. При определенных значениях выбранных па-
параметров теоретические кривые выживаемости совпадают с кривы-
кривыми, полученными на основании экспериментов по облучению клеток.
В таком случае можно формально судить о том, какая из моделей
лучше описывает характер лучевого поражения клетки, высказывать
предположения о числе критических мишеней и количестве событий
попадания, необходимых для инактивации.
Развитие этих методов позволило создать весьма сложные модели.
Например, Циркль и Тобайес для объяснения инактивации диплоид-
диплоидных и полиплоидных клеток предложили модель «одно попадание —
п наборов — I мишеней». В экспериментах по облучению клеток раз-
разной плоидности получают семейство сигмоидных кривых. По мнению
авторов модели, эти кривые соответствуют уравнению
N/No = [l - A - е-°/°0)п], A11.14)
где п — плоидность клетки, т. е. число наборов хромосом, а I —
число генов в каждом наборе. Гибель клетки согласно такой модели
происходит в результате одного попадания в г-й ген одной и той же
хромосомы каждого набора; г-м геном может быть любой из I генов.
Другая возможность формального описания сигмоидальных кри-
кривых «доза-эффект» состоит в том, что предполагают наличие в объ-
объекте нескольких чувствительных объемов — мишеней, и что реакция
наступает лишь после того, как все они получили определенное число
попаданий. Согласно теории вероятности уравнение, описывающее
«кривую гибели» для системы из т мишеней, имеет вид
к=0
где 7V+ соответствует числу нежизнеспособных объектов. Эта форму-
формула может быть распространена и на описание мишени с варьирующим
размером щ и неодинаковым числом попаданий, необходимых для
инактивации различных мишеней щ:
^ где Б, = е-^2^. A11.16)
г=1 к=0
Такие сложные выражения теряют свое практическое значение.
На основании этих уравнений можно построить теоретические кри-
кривые «доза—эффект», однако с большой точностью сопоставлять их с
кривыми, получаемыми в реальном эксперименте, не представляется
возможным. Еще более сложно вычислить на основании эксперимен-
экспериментальных дозовых кривых параметры мишени — г/, п и т. Иначе
говоря, математический аппарат теории попадания и мишени не поз-
позволяет определить размеры и форму тех элементарных биологических
структур, которые отвечают за биологические эффекты, описываемые
102 Гл. III. Зависимость биологического эффекта от поглощенной дозы
дозовыми кривыми, более сложными, чем одноударная кривая. Поми-
Помимо чисто технических трудностей существует целый ряд теоретиче-
теоретических ограничений для использования формальных построений теории
попадания в анализе сложных радиобиологических процессов.
При облучении молекул и клеток наряду с прямым их поврежде-
повреждением от ионизирующей частицы, попавшей в мишень, в поражающее
действие излучения вносят вклад активные продукты, возникающие в
окружающем растворителе (радикалы воды и липидов; вещества, се-
кретируемые соседними клетками). При облучении клеток биологиче-
биологический эффект может быть также обусловлен попаданием в различные
мишени, параметры которых зависят от физиологического состояния
объекта. В каждом отдельном случае поражение определенной струк-
структуры может вызываться различными по своей физической природе
событиями попадания. В результате мы будем наблюдать появление
у клеток генетически однородной популяции одного и того же тести-
тестируемого эффекта вследствие различных первичных повреждений.
И наконец, трудно ожидать, что клетка «пассивно» восприни-
воспринимает полученные повреждения. За счет работы репаративных или
компенсаторных систем некоторая часть повреждений может быть
восстановлена. Вследствие этих и ряда других причин наблюдаются
самые разнообразные формы кривых «доза-эффект», их вид может
меняться в зависимости от физиологических особенностей объекта и
условий, в которых проводится их облучение.
Таким образом, для интерпретации кривых «доза—эффект» гибе-
гибели клеток привлекаются сложные математические модели, в основе
которых лежит фактический материал радиационной биофизики и
радиобиологии. Поэтому для прогнозирования и исследования за-
зависимости биологических эффектов от дозы облучения необходимо
совершенствовать методы математического радиобиологического мо-
моделирования и учитывать особенности гибели облученных клеток.
2. Математическое моделирование радиобиологических
эффектов (С. В. Мамихин)
Содержание предыдущих разделов наглядно показывает, что ра-
радиобиологические исследования характеризуются высокой степенью
математизации. Формализация, то есть описание математическими
уравнениями наблюдаемых или предполагаемых механизмов воздей-
воздействия ионизирующих излучений на живые объекты и его послед-
последствий — типичный для радиобиологии способ количественной трактов-
трактовки этих явлений. Именно такой подход и привел к появлению особой
области знаний в радиобиологии, получившей название количествен-
количественной радиобиологии.
Как уже отмечалось, фундаментом количественной радиобиологии
служат принцип попадания и концепция мишени, которые являются
системой представлений, позволяющих описывать в математической
2. Математическое моделирование радиобиологических эффектов 103
форме зависимость частоты поражения мишеней различных геомет-
геометрических конфигураций. Эта теория основана целиком на физиче-
физических представлениях и по отношению к биологическим объектам
носит формальный характер, что позволяет использовать ее лишь
для анализа простых одноударных радиобиологических реакций. Тем
не менее именно на основе этих теоретических положений были по-
построены первые математические модели, которые позволили удовле-
удовлетворительно описать в формализованном виде эффекты воздействия
облучения на биологические объекты. Позднее эти представления бы-
были дополнены «стохастической концепцией» биологического действия
ионизирующих излучений (Хуг, Келлерер, 1969), и были построены
модели, более адекватно отражающие сложный вероятностный ха-
характер процессов, происходящих в живом объекте при облучении.
Дальнейшим развитием математической интерпретации радиобиоло-
радиобиологических эффектов стало создание так называемой «вероятностной»
модели Капульцевича A978), представляющей синтез двух вышеупо-
вышеупомянутых подходов.
Накопление исходной экспериментальной информации, развитие
теоретических представлений и совершенствование математических
моделей в радиационной биофизике представляют собой неразрывный
процесс. Зачастую в процессе создания и исследования математиче-
математических моделей возникает необходимость осуществить дополнительные
экспериментальные исследования в определенном направлении и дать
теоретическое обоснование соответствующим математическим постро-
построениям.
Возможности применения метода математического моделирования
при проведении радиационных исследований со временем расширя-
расширяются. Например, появление вычислительной техники и повышение ее
доступности обусловили развитие такого направления в математиче-
математическом моделировании, как разработка имитационных моделей, которые
применяются в первую очередь для прогнозирования последствий
облучения живых объектов.
2.1. Краткое описание метода математического моделирования и
его применение в биологии
В современной биологии метод математического моделирования
используется очень широко. Основное достоинство математического
моделирования как научного метода познания состоит в возможности
подмены реальных объектов их математическими аналогами, пред-
представляющими собой одно или несколько уравнений, описывающих в
упрощенной форме отдельные процессы, компоненты или целостные
объекты. Это позволяет проводить в численной форме на модели экс-
эксперименты, которые слишком трудоемки или невозможны при работе
с системой-оригиналом или могут нанести значительные повреждения
системе, чувствительной к внешнему воздействию. Математические
104 Гл. III. Зависимость биологического эффекта от поглощенной дозы
модели служат эффективным средством для формализованного опи-
описания механизмов изучаемых процессов, проведения исследований,
прогнозирования и т. д.
Развитие и широкое внедрение математических и вычислительно-
информационных методов в современные биологические исследования
сняли некогда дискуссионный вопрос о применимости математическо-
математического моделирования в биологических науках. Математическое модели-
моделирование стало полноправным методом научного познания.
2.1.1. Типы моделей
По способу реализации можно выделить два основных типа мате-
математических моделей, использующихся в биологии: аналитические (эм-
(эмпирические) и имитационные. Если рассматривать наиболее простую
математическую модель, в которой присутствует только одна перемен-
переменная X, зависящая от одного фактора t, то ее можно представить в сле-
следующем виде: X(t) = F(Xq,?), где F — некая функция, отражающая
зависимость X от t. При рассмотрении моделей, включающих более
одной переменной, F является разрешающим оператором совокупно-
совокупности математических соотношений между переменными и факторами.
В случае, когда для F найдено точное аналитическое выражение,
позволяющее для любого начального условия определить значение
переменной X для любого ?, модель принято считать аналитической
(Федоров, Гильманов, 1980).
2.1.1.1. Аналитические модели
Подобные модели могут успешно использоваться при рассмотре-
рассмотрении отдельных процессов или простых биосистем, подверженных воз-
воздействию небольшого числа факторов. Традиционно аналитические
модели применяются для формализации представлений о механизмах
изучаемых процессов и носят ярко выраженный объяснительный ха-
характер в отношении рассматриваемых явлений. Модели этого типа
обладают многими удобными с математической точки зрения свой-
свойствами, облегчающими их применение для изучения моделируемых
объектов. В частности, они позволяют использовать весьма эффек-
эффективные аналитические методы качественной теории дифференциаль-
дифференциальных уравнений, теории колебаний и теории бифуркаций*). Подроб-
Подробное изложение общих принципов описания кинетического поведения
открытых систем с помощью аналитических моделей и приемов ка-
качественного исследования биологических процессов можно найти в
учебниках Ю. М. Романовского, Н. В. Степановой, Д. С. Чернавского
A984), А. Б. Рубина A999) и Г.Ю.Ризниченко B002), поэтому мы
опускаем этот материал в данной книге.
*) Бифуркация — неодинаковость поведения математического объекта,
зависящего от какого-либо параметра, в любой окрестности определенного
значения этого параметра.
2. Математическое моделирование радиобиологических эффектов 105
При моделировании сложных систем нахождение аналитического
выражения для разрешающего оператора F часто оказывается затруд-
затруднительным или в принципе невозможным. В случае, если соотношения
между переменными и факторами не противоречат друг другу и
их достаточно для нахождения решения, составляют алгоритм чис-
численного решения на компьютере уравнения или системы уравнений,
формирующих модель. Оператор F реализуется в виде программы, с
помощью которой по входным и начальным данным рассчитываются
значения переменных модели. Такие модели называются имитацион-
имитационными.
2.1.1.2. Имитационные модели
Основа имитационного моделирования заключается в упрощенном
графическом описании структуры объекта в виде потоковой диаграм-
диаграммы*), написании системы уравнений, отражающих функционирова-
функционирование объекта с позиции такого упрощения, идентификации уравнений
функций переноса и параметров, входящих в них, и реализации моде-
модели на компьютере, включая отладку программы и проверку работы
модели. Все это предваряется и сопровождается сбором информации
об объекте, необходимой для построения и проверки модели, и анали-
анализом ее поведения. Имитационные модели позволяют наиболее полно
использовать всю имеющуюся информацию об объекте моделирова-
моделирования. Признано также, что имитационное моделирование остается пока
одним из наиболее эффективных методов количественного прогноза
поведения сложных систем (Розенберг, 1984). Традиционным спосо-
способом реализации имитационных моделей является написание программ
на различных алгоритмических языках**), которые затем вводятся в
компьютер для дальнейшего просчета.
Следует отметить, что зачастую исследователи, столкнувшись с
невозможностью окончательной реализации модели в аналитическом
виде, пытаются решить проблему, прибегая к приемам имитационного
моделирования, реализуя модели в виде программы и просчитывая их
на компьютере. Но при этом следует учитывать разницу в изначаль-
изначальном подходе при создании аналитических и имитационных моделей.
Те ограничения и запреты, которые накладываются в аналитическом
моделировании, например на число переменных, на изменение вели-
величин параметров и вида функций и т. д., не могут быть компенсированы
даже при реализации аналитических моделей на компьютере.
*) Потоковая диаграмма — наглядное представление о структуре рас-
рассматриваемой системы. Компоненты изображаются в виде прямоугольни-
прямоугольников, потоки вещества и энергии — в виде сплошных стрелок, а информаци-
информационные связи — в виде пунктирных стрелок.
**) Алгоритмический язык — язык записи алгоритмов для их реализации
на компьютере, публикации или формального анализа.
106 Гл. III. Зависимость биологического эффекта от поглощенной дозы
2.1.2. Подтипы моделей
В свою очередь аналитические и имитационные модели подраз-
подразделяются по ряду свойств на определенные подтипы. Например, по
критерию времени оба типа моделей могут быть статичными и ди-
динамическими. В отличие от статичных моделей, динамические отобра-
отображают динамику поведения объекта во времени. По пространственному
критерию модели могут быть точечными или распределенными. То-
Точечные модели описывают поведение моделируемого объекта в одной
точке пространства, а распределенные модели отображают этот про-
процесс в некоторой пространственной области. Так например, численные
значения переменных динамических точечных моделей имеют только
временную динамику, тогда как значения переменных распределен-
распределенных моделей варьируют и во времени, и в пространстве.
Математические модели могут быть детерминированными или
стохастическими. В детерминированных моделях значения рассчи-
рассчитываемых переменных при одних и тех же начальных условиях и вхо-
входящих параметрах определяются однозначно (с точностью до ошибок
вычисления), то есть при введении одних и тех же исходных данных
каждый раз получается один и тот же результат. Стохастические
модели дают для каждой переменной распределение возможных зна-
значений, характеризуемое такими вероятностными показателями, как
математическое ожидание, среднее квадратичное отклонение и т.д.,
то есть при введении одних и тех же исходных данных каждый раз
результаты модельных расчетов будут разными.
В ряде случаев применяются так называемые феноменологические
(базовые) математические модели, в которых отбрасываются детали
механизмов изучаемых процессов. Обычно это диктуется задачами
исследований только главных (базовых) признаков объектов.
При выборе подтипа модели определяющим критерием обычно
служит круг решаемых задач. Так например, хотя биологические
процессы всегда стохастичны в той или иной степени, при решении
определенных задач, скажем таких, как рассмотрение долгосрочной
динамики объекта в усредненных условиях, исчерпывающим сред-
средством могут служить детерминированные и базовые модели.
Для разработки надежных математических моделей требуются
параметры, характеризующие вещественные, энергетические и инфор-
информационные потоки между компонентами моделируемой системы. Со-
Соответствующая количественная информация в полном объеме имеется
лишь для ограниченного числа биосистем. Для преодоления трудно-
трудностей, возникающих в связи с неполнотой информации, при модели-
моделировании приходится прибегать к экстраполяции или использованию
косвенных сведений, полученных при решении других задач. В этом
2. Математическое моделирование радиобиологических эффектов 107
случае уточнение параметров модели достигается методом последо-
последовательных приближений (итераций*)) результатов моделирования к
имеющимся экспериментальным данным при многократном проигры-
проигрывании модели на компьютере.
В заключение данного подраздела остановимся на некоторых
принципиально важных аспектах моделирования.
Исходные предпосылки в построении моделей. Ключевым
моментом при создании моделей являются исходные предпосылки,
которые закладываются в их основу. Часто недостатком модели-
моделирования является неполное или ошибочное обоснование принятых
предпосылок.
Степень интегрированности и полнота отображения. При
построении модели важно найти «золотую середину» в процессе
отображения структуры изучаемого объекта. Слишком сложная
структура модели делает невозможной ее реализацию, а чрезмерное
упрощение структуры и слишком высокая интегрированность
компонентов, иначе говоря, излишняя минимизация модели, может
свести на нет какую-либо ее ценность. Следует учесть, что один из
основных аргументов прошлого в пользу минимизации моделей —
трудность или невозможность решения слишком сложных систем
дифференциальных уравнений, составляющих модель (например,
уравнений со многими неизвестными, где сами неизвестные могут
в свою очередь являться функциями от каких-либо переменных). В
настоящее время этот аргумент отчасти утратил свою актуальность
в связи с появлением быстродействующих компьютеров нового
поколения.
Достоверность моделей. Очень часто уравнения, включаемые
в состав математических моделей биологических объектов, являются
лишь формальным описанием экспериментальных кривых, отражаю-
отражающих функционирование этих объектов. Описание биологических про-
процессов математическими формулами, включающими параметры, не
имеющие физического или биологического толкования, не позволяет
идентифицировать их величину в ходе лабораторных экспериментов.
Это резко снижает достоверность модели. Поскольку биологические
объекты, даже однотипные, не являются абсолютно идентичными, а
также потому, что динамические исследования требуют много време-
времени, нередко в качестве данных для проверки используется информа-
информация, на основании которой проводилась калибровка (подгонка пара-
параметров) моделей. Для проверки правильности отображения моделью
изучаемых процессов необходимы независимые данные.
*) Итерация — результат повторного применения совокупности мате-
математических операций при решении уравнений методом последовательных
приближений.
108 Гл. III. Зависимость биологического эффекта от поглощенной дозы
Классификация моделей, взаимоотношения моделей раз-
различных типов и подтипов. Следует принимать во внимание,
что приведенная выше классификация моделей является достаточно
условной. Деление на аналитические и имитационные модели осуще-
осуществлено нами по наиболее общему признаку — по способу реализации.
Как будет показано далее, возможны и другие подходы, которые
диктуются задачами, решаемыми с помощью математического моде-
моделирования в той или иной области биологии. Столь же специфичным
может быть и отношение специалистов к роли тех или иных типов или
подтипов моделей. Со временем это отношение может меняться, как
это было, например, в экологии, когда аналитические модели были
оттеснены на второй план моделями имитационными.
Иногда возникают сомнения в правомочности отнесения некоторых
видов математических моделей к моделям как таковым. Так, в биоло-
биологии широко распространены так называемые регрессионные модели,
которые включают в себя уравнения, позволяющие учитывать вли-
влияние целого ряда параметров на процессы, происходящие в системе.
Однако поскольку эвристическая ценность этих моделей низка и их
основная цель — описывать в компактной форме имеющийся эмпи-
эмпирический материал, это дает основания некоторым исследователям
вообще не считать их моделями.
В ряде случаев модели, которые первоначально разрабатывались
как модели одного типа или подтипа, полностью или частично транс-
трансформируются в модели другого типа (подтипа). Например, обычным
случаем является развитие аналитических моделей в имитационные
по мере накопления исходной информации, усложнения модели и
реализации ее на компьютере. Возможно также включение элементов
стохастичности в детерминированную модель, что повышает «правдо-
«правдоподобность ее поведения».
2.2. Специфика моделирования в радиационных исследованиях
Особенности применения метода математического моделирования
в радиобиологических исследованиях в общих чертах совпадают с
особенностями, отмеченными для математического моделирования в
биологии в целом. Специфика моделирования в радиационной био-
биофизике определяется сущностью и характером изучаемых объектов и
явлений. Поскольку исследования в радиационной биофизике осуще-
осуществляются на субклеточном и клеточном уровнях и уровне клеточных
популяций, то большинство созданных к настоящему моменту моделей
посвящено исследованию механизмов и последствий воздействия иони-
ионизирующих излучений на клетки, генетические структуры, клеточные
органоиды и высокомолекулярные химические соединения, входящие
в их состав. Изучаемые явления имеют ярко выраженный вероятност-
вероятностный характер, поскольку при формировании радиобиологического эф-
эффекта осуществляется взаимодействие множества случайных событий
и происходит наложение стохастики нескольких порядков.
2. Математическое моделирование радиобиологических эффектов 109
Насколько широк спектр объектов, процессов и проблем, кото-
которые решаются в радиационной биофизике с помощью метода мате-
математического моделирования, настолько разнообразны используемые
модели. Четкой классификации радиобиологических моделей пока не
существует. Модели достаточно произвольно подразделяются по раз-
различным критериям, например, по уровню биологической организации
объекта моделирования, как предложил Г. Н. Обатуров A987). Им же
было предложено выделить так называемые «физические» и «систем-
«системные» радиобиологические модели. Физические модели по интерпрета-
интерпретации Обатурова представляют собой развитие теории мишеней и непо-
непосредственно связывают первичные физические процессы с конечными
эффектами (к ним автор относит, например, модели Келлерера и
Росси, Капульцевича). Модели системные рассматривают процессы на
двух и более уровнях биологической организации (например, модели
Мансона, Обатурова и др.). В основе таких моделей обычно лежит
информационная количественная связь между различными уровнями
организации живого.
Существуют также конструкционные или технические критерии
систематизации моделей. Например, можно различать модели по
уровню сложности, который варьирует от отдельных математических
уравнений, описывающих единичные процессы, до блочных моделей
биологических систем, каждый блок которых представляет собой си-
систему таких уравнений.
По способу реализации наиболее распространенным типом матема-
математических моделей, использующихся в радиационной биофизике в про-
прошлом и в настоящее время, являются аналитические модели, которые
зачастую представляют собой единичные математические уравнения
разной степени сложности. Их применение основано в первую очередь
на методах качественной теории дифференциальных уравнений, тео-
теории колебаний и теории бифуркаций.
Развитие информационно-вычислительных технологий и широкий
доступ ко все более высокопроизводительной компьютерной технике
создали в настоящее время предпосылки к разработке имитационных
радиобиологических моделей, которые в большей степени отвечают
системному подходу в исследованиях, позволяют отражать временную
и пространственную динамику, учитывать комбинированное воздей-
воздействие различных факторов, изменение условий, в которых находится
или может находиться моделируемый объект, и более адекватно вос-
воспроизводить стохастические процессы.
В заключение отметим, что на наш взгляд при создании радиобио-
радиобиологических математических моделей для исследователя существует
особая опасность необоснованного применения чисто математических
построений без учета физиолого-биохимических состояний облучае-
облучаемых клеток.
110 Гл. III. Зависимость биологического эффекта от поглощенной дозы
2.3. Эволюция математических моделей, описывающих
инактивацию облученных клеток
Рассмотрим три группы первичных радиобиологических моде-
моделей, описывающих инактивацию облученных клеток, выделяемые
Ю.Г.Капульцевичем A978).
I. В основе «классических» моделей лежат два основных предпо-
предположения:
- разные клетки, облученные в одной дозе, поражаются в разной
степени в соответствии с принципом попадания и концепцией
мишеней;
- выживаемость (или инактивация) клетки однозначно определя-
определяется числом повреждений облученной клетки: если число по-
повреждений больше критического, то клетка инактивируется с
вероятностью единица, а если число повреждений меньше кри-
критического, то клетка выживает.
К классическим моделям относятся, например, модель «многих
попаданий» (Блау, Альтенбургер), модель «многих одноударных ми-
мишеней» (Этвуд, Норман), «репарационные модели инактивации кле-
клеток» (Хейнс). Все эти модели связывают гибель клетки с поражением
определенного числа мишеней. Так, модель Блау и Альтенбургера
подразумевает, что для гибели клетки, представляющей собой единую
мишень, необходимо осуществление некоторого критического числа
попаданий. Этвуд и Норман построили модель, основанную на поло-
положении, что клетка представляет собой п мишеней, и для ее инакти-
инактивации необходимо поразить все эти мишени, причем для поражения
достаточно одного попадания. Хейнс ввел в свою модель облучаемых
клеточных популяций учет репарации клеточных повреждений, что
позволило ему удовлетворительно описать экспериментальные кривые
выживания двух штаммов бактерий — чувствительного и резистент-
резистентного.
Модели, основанные на двух приведенных выше предположениях,
позволили дать предварительное формализованное описание воздей-
воздействия ионизирующих излучений на живые объекты. Однако после-
последующий анализ количественных закономерностей различных радио-
радиобиологических эффектов, связанных с нарушением репродукционной
способности клеток, показал, что второе из этих предположений про-
противоречит экспериментальным данным.
П. Концепция «биологической стохастики», предложенная Хугом
и Келлерером A969), основана на следующих положениях, отличаю-
отличающихся от классических:
- разные клетки, облученные в одной дозе, поражаются одинаково;
- выживаемость клетки зависит от степени ее поражения по веро-
вероятностному закону.
2. Математическое моделирование радиобиологических эффектов 111
Данная концепция в большей степени соответствовала представле-
представлениям о стохастичности биологических процессов, но не позволила
объяснить многие закономерности различных проявлений действия
излучений на клетки, причем все возникающие затруднения были
связаны с первым из этих предположений.
III. Для снятия противоречий в вышеописанных подходах и даль-
дальнейшего продвижения вперед в математическом моделировании реак-
реакций клеток на облучение Капульцевичем были сформулированы два
следующих компромиссных положения:
- разные облученные клетки поражаются в различной степени в
соответствии с принципом попадания, но каждое повреждение
проявляется с вероятностью меньшей единицы, например, вслед-
вследствие работы соответствующих компенсаторных систем, так что
выживаемость клетки определяется степенью ее поражения по
вероятностному закону;
- облучение приводит к уменьшению вероятности Р успешного
деления клетки, но эта вероятность неодинакова для разных
клеток облученной популяции вследствие тех или иных причин,
например биологической изменчивости или неравномерного рас-
распределения поглощенной энергии излучений.
Модель, в основу которой легли данные положения, учитываю-
учитывающая как принцип попадания и теорию мишеней, так и некоторые
положения биологической стохастики, была названа Ю. Г. Капульце-
Капульцевичем A978) «вероятностной» моделью радиационного поражения
клетки. Модели первых двух групп являются частными случаями
«вероятностной» модели.
В рамках каждой из упомянутых трех групп было построено
большое количество моделей. Постепенное накопление количествен-
количественной информации обуславливало эволюцию от простейших моделей
к более сложным, учитывающим влияние вновь обнаруженных фак-
факторов. Ярким примером этому служит семейство моделей выжива-
выживания клеток, подвергающихся воздействию ионизирующего излучения,
описывающих кривые типа «доза-эффект». По мере совершенствова-
совершенствования представлений о механизме рассматриваемого процесса, напри-
например обнаружения репарационных процессов в живых объектах или
формирования представлений о дискретной природе ионизирующего
излучения, совершенствовались и математические модели, описыва-
описывающие его. В свою очередь, неполное соответствие расчетных кривых
экспериментальным побуждало исследователей к дальнейшим поис-
поискам недостающей информации о процессе инактивации облученных
клеток.
112 Гл. III. Зависимость биологического эффекта от поглощенной дозы
2.4. Некоторые нетрадиционные подходы к построению
радиобиологических моделей
Помимо традиционно широко используемого в радиационных ис-
исследованиях аналитического моделирования, развитие новых подхо-
подходов в математическом моделировании биологических объектов неиз-
неизменно находило и находит применение в радиобиологии. Рассмотрим
два таких примера.
2.4.1. Имитационное моделирование в радиобиологии
Учитывая сложность процессов, происходящих в живых объек-
объектах под воздействием ионизирующих излучений, можно утверждать,
что имитационное моделирование в радиобиологии имеет многообе-
многообещающие перспективы при решении разнообразных исследователь-
исследовательских и прогностических задач. Так, реализации моделей, отнесенных
Г. М. Обатуровым A987) к «системным», т.е. рассматривающим ра-
радиобиологические эффекты одновременно на различных уровнях био-
биологической организации, оказываются весьма эффективными в виде
имитационных моделей.
Использование метода имитационного моделирования позволяет
разбивать такие многофакторные процессы, как, например, выжи-
выживание клеток, на ряд более простых процессов, параметры которых
имеют конкретный биофизический смысл и могут быть получены в хо-
ходе специально поставленных экспериментов. В таких моделях удобно
менять условия облучения и жизнедеятельности изучаемых объектов,
с легкостью переходить с одного уровня организации живой системы
на другой (например, с молекулярного на субклеточный, а далее на
клеточный) и т. д.
Подобная модель может быть реализована в виде блоков, вло-
вложенных друг в друга (рис. III.8) и, в свою очередь, состоящих из
отдельных компартментов, связанных между собой энергетическими,
вещественными или информационными связями.
источник ионизирующего излучения
клеточная популяция
клетка
субклеточные органоиды
молекулы
Рис. III.8. Примерная схема построения имитационной модели облучаемого объ-
объекта
2. Математическое моделирование радиобиологических эффектов 113
Такая форма реализации модели позволяет учесть специфику воз-
воздействия облучения на различные уровни организации живой мате-
материи, составляющей объект, на различных временных этапах. Именно
имитационное моделирование обладает необходимым аппаратом для
рассмотрения в динамике одновременно двух тесно связанных меж-
между собой сложнейших процессов — передачи энергии ионизирующих
излучений и лучевых повреждений отдельных компонентов и объекта
в целом, происходящих в трехмерном пространстве (при временной
динамике процессов говорят даже о четырехмерном пространстве).
Следует констатировать, что существующие радиобиологические
имитационные модели посвящены, как правило, рассмотрению какого-
либо одного иерархического уровня. По всей видимости, появление
более сложных по структуре моделей, построенных по схемам, анало-
аналогичным приведенной на рис. III.8 — дело ближайшего будущего.
Современный уровень развития вычислительных средств, посто-
постоянно повышающееся быстродействие компьютеров создают предпо-
предпосылки к созданию все более правдоподобных радиобиологических мо-
моделей. При реализации адекватной имитационной модели подобного
типа исследователь получит виртуальный объект для проведения лю-
любого рода экспериментов и разработки прогнозов для всевозможных
режимов облучения различными видами излучений, в том числе ком-
комбинированных и в сочетании с нерадиационными факторами. Однако
необходимым условием создания таких моделей является достаточная
изученность основных процессов, определяющих функционирование
биологических систем, подвергнутых облучению.
2.4.2. Стохастические модели, основанные на теории марковских
случайных процессов
Вероятностный характер воздействия ионизирующего излучения
на живые объекты, связанный со случайным, дискретным поглощени-
поглощением ими энергии, вынуждает исследователей прибегать к использова-
использованию стохастических моделей для оценки последствий радиационного
воздействия. К таким моделям относится, например, описанная ранее
в этой главе известная модель Блау и Альтенбургера, предложенная
для математической интерпретации принципа попадания и объясне-
объяснения кривой выживания клеток. Алгоритмы стохастических моделей
постоянно совершенствуются.
Приведем как пример алгоритм, описанный Р. А. Бесядовским и
др. A978), который учитывает вероятностный характер процессов,
происходящих при облучении объектов, и основан на теории марков-
марковских случайных процессов. При таком подходе обычно рассматривают
состояние системы X, которая под влиянием случайного фактора
через определенные промежутки времени может переходить из од-
одного состояния в другое или оставаться без изменений. Под системой
подразумевается совокупность однородных биологических объектов,
подвергшихся воздействию ионизирующих излучений и находящихся
в последующем в одинаковых условиях. Под состоянием понимается
8 Ю. Б. Кудряшов
114 Гл. III. Зависимость биологического эффекта от поглощенной дозы
1
Al,2
А2д
2
Аг,з
А3,2
3
Аз,4
4
Рис. III.9. Диаграмма состояний биологической системы
величина реакции организма на то или иное воздействие или ее отсут-
отсутствие.
Функционирование такой системы описывается «цепью Марко-
Маркова», то есть вероятность того или иного состояния в заданный момент
времени определяется состоянием системы в предыдущий временной
интервал. Если взять в качестве примера ситуацию, когда биологиче-
биологическая система может находиться в различные периоды формирования
отдаленных последствий в четырех состояниях, тогда принципиаль-
принципиальный граф имеет вид, изображенный на рис. III.9.
Используя теорию марковских случайных процессов, можно для
вероятностей каждого из состояний pi(t), P2(t), ..., pn(t) составить и
решить систему линейных дифференциальных уравнений вида:
(Ш.17)
dt
-(А2д+А2,зЫг),
= А3,4Р4(«).
Решение задачи в данном случае сводится к отысканию значе-
значений Afj, характеризующих скорость перехода из одного состояния в
другое. При этом принимается, что для любого момента времени t
для данной системы выполняется условие pi(t) +P2(t) + ... +pn(t) = 1-
Принимается также, что константы скорости перехода А^ из одного
состояния в другое являются величинами постоянными, не зависящи-
зависящими от времени. Их значения могут быть найдены для каждого объекта
и характера воздействия путем анализа статистически достоверных
экспериментальных данных, позволяющих оценить вероятность состо-
состояния pn(t) в каждый конкретный момент времени. В основу таких
оценок могут быть положены количественные характеристики ряда
функциональных показателей ведущих внутриклеточных систем, их
максимальное отклонение от исходного уровня и динамика изменения
во времени с учетом значимости каждого из них в системе поддер-
поддержания гомеостаза, а также такие интегральные показатели оценки
функционального состояния объекта, как например продолжитель-
продолжительность жизни.
2. Математическое моделирование радиобиологических эффектов 115
2.5. Примеры построения радиобиологических математических
моделей
Метод математического моделирования применяется во многих
областях фундаментальной и прикладной радиационной биофизики и
радиобиологии в целом. При создании моделей используются многие
из рассмотренных выше подходов и приемов моделирования. Рассмот-
Рассмотрим конкретные примеры.
2.5.1. Моделирование нарушений системы гемопоэза при
лучевом поражении
Метод математического моделирования успешно применяется для
изучения влияния ионизирующих излучений на процессы гемопо-
гемопоэза (кроветворения). В качестве примера рассмотрим разработанный
О.А.Смирновой A992) комплекс моделей системы гемопоэза в орга-
организме, подвергшемся облучению. Модели трудно отнести к какому-
либо определенному типу. Они реализовывались на компьютере для
идентификации параметров методом итераций и для разработки про-
прогнозов, что типично для имитационных моделей, но для их иссле-
исследования использовались также аналитические методы качественной
теории дифференциальных уравнений, теории колебаний и теории
бифуркаций.
Система гемопоэза рассматривается как совокупность четырех ли-
линий кроветворения: тромбоцитопоэза, лимфопоэза, эритропоэза и гра-
нулоцитопоэза. Модели отдельных линий кроветворения построены
с учетом главных этапов развития гемопоэтических клеток, а также
отражают индивидуальные особенности отдельных ростков: непосто-
непостоянство числа ядер мегакариоцитов и наличие костномозгового «депо»
гранулоцитов. Одна из основных предпосылок — регуляция гемопо-
гемопоэза тканеспецифическими веществами (кейлонами), представляющи-
представляющими собой продукты жизнедеятельности и гибели клеток.
В модели отдельного ростка рассмотрены три типа клеток (Xi,
Х2 и Хз): костномозговые клетки-предшественники— от стволовой,
находящейся в соответствующем микроокружении, включительно до
стадии морфологически идентифицируемой как делящаяся Х\\ неде-
лящиеся — созревающие клетки костного мозга Х<± и зрелые клетки
крови Хз. В уравнении гранулоцитопоэза был рассмотрен еще один
тип клеток — гранулоциты тканей Х±.
В свою очередь, пулы радиочувствительных клеток по реакции
на облучение разделены на три группы. К первой отнесены непо-
неповрежденные клетки Xi, ко второй — поврежденные, погибающие че-
через 1-2 суток Xni, к третьей — тяжелоповрежденные, погибающие
в течение 4-7 часов после акта взаимодействия с ионизирующим из-
излучением ХТП}. В качестве переменных модели использованы концен-
концентрации перечисленных клеток, а также концентрация специфического
кейлона /.
116 Гл. III. Зависимость биологического эффекта от поглощенной дозы
Динамика каждой отдельной линии кроветворения млекопитаю-
млекопитающих, подвергающихся хроническому облучению с мощностью дозы D',
описана системой дифференциальных уравнений:
dX1/dt = ВХ1 - -yXt - D'X1/D1, (III. 18)
dX2/dt = 7X1 - FX2 - D'X2/D2j (III. 19)
dX3/dt = FX2 - EX3 - D'X3/D3, A11.20)
dX4/dt = EX3 - AX4 - D'X4/D4, A11.21)
dXni/dt = D'Xi/Di/(l + Pi) - /iXni, (i = 1, ..., n), A11.22)
dXTni/dt = piD'Xi/Di/il + Pi) - z/XTni, (i = 1, ..., n), (IIL23)
m
dl/dt = GY,®i(Xi + ФХи1 + TXTni) - HI. A11.24)
В уравнениях A11.18)—A11.20) параметры B,j, F — удельные скоро-
скорости *) деления клеток Xi, перехода клеток из группы Х\ в Х2 и из Х2
в Хз. В уравнении (III.20) коэффициент Е — удельная скорость пере-
перехода клеток из группы Х3 в X*, а в остальных — удельная скорость
гибели клеток Хз. В уравнении (III.21) коэффициент А — удельная
скорость гибели клеток X*. В моделях лимфопоэза и эритропоэза 7,
F, Е — константы. В модели гранулоцитопоэза A, j, E — константы,
а функция F = 6A + МХ|)/A + LXf) описывает существование кост-
костномозгового «депо». В модели тромбоцитопоэза для воспроизведения
зависимости средней плоидности мегакариоцитов от концентрации
тромбоцитов введен коэффициент плоидности / = (h + срХз)-1, на ко-
который в уравнении (III. 19) умножен постоянный коэффициент гу. Кро-
Кроме этого, в уравнении (III.20) постоянный коэффициент F умножен
на константу а, равную среднему числу тромбоцитов, образующихся
в норме из одного мегакариоцита. Влияние ингибитора на скорость
деления клеток Х\ описано в модели уравнением В — аA + 1/К)~1,
где а — максимальная удельная скорость деления, К —константа
ингибирования.
При моделировании действия радиации на клетки использова-
использовалась одномишенная одноударная теория, согласно которой удельная
скорость поражения клеток пропорциональна мощности дозы ради-
радиации D;, а также экспериментальные данные по радиочувствитель-
радиочувствительности клеток кроветворения. Так, в уравнениях (Ш.18)-(Ш.21) вели-
величины D'/Di — удельные скорости убыли неповрежденных радиацией
клеток Xi, в уравнениях A11.23), A11.24) величины (D'/Di)(l/A + рг))
*) Удельная скорость — отношение приращения переменной за единицу
времени (производной по времени) к величине переменной.
2. Математическое моделирование радиобиологических эффектов 117
и (D'/Di)(pi/(l+pi)) — удельные скорости перехода клеток Xi в повре-
поврежденное (Xni) и тяжелоповрежденное (XTui) состояния, а константы \±
и v — удельные скорости гибели клеток Xui и XTni. Параметры pi
выражены через величины Di и Dmi, характеризующие радиочувстви-
радиочувствительность клеток Xf.
В (III.25), (III. 18)—(III. 19) Dmi и Di равны соответственно дозам
острого облучения, после воздействия которых число клеток Х^ не
погибших в интерфазе и оставшихся неповрежденными, в е = 2,71...
раз меньше их исходного количества. Уравнение (III.24) описывает
кинетику специфического кейлона /.
Коэффициенты G@i, GФ@i, GT@i в (III.24) — удельные скорости
выделения кейлона клетками Х^ ХПг, XTui при жизнедеятельности
и гибели, причем Г = Фуj\i. Параметр Н — удельная скорость
естественного распада кейлона. С учетом того, что кейлоны сохра-
сохраняют активность в течение нескольких часов, а процессы дифферен-
цировки, созревания и функционирования гемопоэтических клеток
имеют длительность нескольких суток, уравнение (III.24) считалось
«быстрым» и было заменено стационарным решением. В результате
было получено следующее выражение для удельной скорости деления
клеток Xf.
т
г=1
где /? = G/(HK) — константа.
Зрелые клетки крови некоторых линий, а в ряде случаев и их кост-
костномозговые предшественники являются радиорезистентными. Для та-
таких клеток члены (—Df/Di)Xi в правых частях соответствующих
уравнений опускались, концентрации Xni и XTni в уравнении (III.25)
приравнивались нулю, а уравнения (III.22) и (III.23) не рассматрива-
рассматривались. В частности, в моделях тромбоцитопоэза, лимфопоэза и эрит-
ропоэза т = 3ип = 1,3,2,ав модели гранулоцитопоэза т = 4
и п = 4.
При D' = 0 уравнения (Ш.18)-(Ш.21) описывают динамику от-
отдельных линий кроветворения у необлученных млекопитающих. При
этом модель сводится к уравнениям (Ш.18)-(Ш.2О) или (III. 18)-
(III.21). Эти системы имеют две особые точки*). Первая — нулевая.
Координаты второй положительны, если а > 7- Исследования моде-
моделей показали, что тривиальная особая точка устойчива («узел» **))
*) Особая точка — точка кривой или поверхности (на фазовом портрете
фазовой плоскости), в которой нарушается ее гладкость.
**) Узел — тип особой точки дифференциального уравнения; вид ин-
интегральных кривых около особой точки типа узел на фазовом портрете
напоминает семейство парабол, проходящих через эту точку и касающихся
одной прямой в данной точке.
118 Гл. III. Зависимость биологического эффекта от поглощенной дозы
при а < 7 и неустойчива («седло» *)) при а > 7- Вторая особая точка
с положительными координатами определенной области изменения
параметров устойчива («узел», «фокус»). В этом случае величины Х\
можно отождествить со стационарными концентрациями клеток Х\
соответствующего ростка кроветворения в норме. При отклонени-
отклонениях от этого положения равновесия восстановительный процесс име-
имеет апериодический или колебательный характер. Для моделей тром-
боцитопоэза, лимфопоэза, эритропоэза и модифицированной модели
гранулоцитопоэза, сведенной к трем уравнениям для концентрации
гранулоцитов вне костного мозга и их способных и неспособных к
делению костномозговых предшественников, были определены бифур-
бифуркационные соотношения, которые задают в пространстве параметров
условия потери устойчивости второй особой точки. В найденной об-
области изменения параметров данные системы помимо двух неустой-
неустойчивых особых точек имеют еще одно особое решение — устойчивый
предельный цикл (устойчивые колебания концентраций клеток крови
и их предшественников в костном мозге).
В рамках разработанных моделей имитировалась динамика гемо-
поэза у мелких лабораторных животных (мышей, крыс), подверг-
подвергшихся острому и хроническому облучению. Значения большинства
коэффициентов определялись на основе данных гематологических и
биологических экспериментов. Величины параметров, которые невоз-
невозможно измерить опытным путем, подбирались методом итераций в
ходе численных экспериментов с моделями на компьютере. Пример
результата моделирования представлен на рис. III. 10.
2,0г
1,5
1,0
0,5
0,0^
0 12 3 4 5 6 7
9 10 11 12 13
Рис. III. 10. Динамика концентрации тромбоцитов в крови необлученных крыс, у
которых она была искусственно увеличена до 180% (о) и снижена до 10% (д) от
первоначального уровня. Модельные кривые и соответствующие эксперименталь-
экспериментальные данные. По оси абсцисс — время в сутках, по оси ординат — концентрация
тромбоцитов.
*) Седло — тип особой точки дифференциального уравнения, в окрест-
окрестности которой интегральные кривые напоминают деформированное семей-
семейство гипербол с общими асимптотами, проходящими через данную точку на
фазовом портрете.
2. Математическое моделирование радиобиологических эффектов 119
Сопоставление расчетных и опытных данных показывает удовле-
удовлетворительное, на наш взгляд, качество воспроизведения моделями
основных процессов кроветворения в условиях облучения. Модели
позволили достаточно детально исследовать процессы поражения и
восстановления пулов клеток и дали возможность описать вклад по-
поврежденных радиацией клеток в кейлонную регуляцию кроветворе-
кроветворения. Слабым местом приведенных моделей является их жесткая де-
детерминированность, в них не учитывается стохастичность изучаемых
процессов.
2.5.2. Клеточные модели, применяемые в радиотерапии
Поскольку в ответ на облучение в клетках, органах и тканях живых
объектов развивается цепь весьма сложных, во многих деталях не
исследованных процессов, модели в радиотерапии носят в основном
феноменологический характер. Их главной задачей является опти-
оптимизация радиотерапевтической процедуры, т. е. определение наиболее
эффективного распределения доз в пространстве и времени. Матема-
Математические модели, которые применяются в лучевой терапии, отлича-
отличаются широким разнообразием.
Математические модели лучевых изменений во времени
Рассмотрим в качестве примера один из возможных вариантов
подхода к решению задачи изучения и оптимизации кинетики постлу-
постлучевых изменений. При рассмотрении данной проблемы на клеточном
уровне Балантер и др. A980) выделяют процессы, сопровождающиеся
изменением численности клеток с характерным временем не менее
суток и более краткосрочные процессы изменения состояния клеток,
называемых авторами процессами быстрой кинетики. Соответственно
и модели, отображающие эти две группы процессов, значительно отли-
отличаются. К моделям, рассматривающим процессы первой группы, мож-
можно отнести, например, модель глобальной (многошаговой) оптимиза-
оптимизации временного режима радиотерапии, предложенной В. К. Ивановым
и А. М. Петровским A986), с помощью которой исследуется результи-
результирующая выживаемость раковых и нормальных клеток.
В качестве примера модели, рассматривающей процессы второй
группы, приведем модель, разработанную Д. С. Чернавским и др.
A975). Моделируемые процессы в данном случае — это изменение
энергетического состояния клетки и ее мембранно-плазматического
комплекса, продвижение клетки по циклу и (или) переключение ее из
фазы покоя в пролиферацию (Goi —> S; G02 —> М). Авторы исхо-
исходят из положения, что радиочувствительность клеток сильно зависит
от их состояния и, следовательно, от процессов быстрой кинетики.
Наиболее чувствительны клетки в поздней G\ и ранней S фазах и в
митозе. Другими словами, наибольшая чувствительность существует
в момент перехода (Gi —> S и Goi —> S; G2 —> М и G02 —> М)
из фазы в фазу или от одного состояния к другому. Радиация влияет
на упомянутые процессы, и таким образом возникает типичная кар-
картина ретроингибирования с «обратной связью». Поскольку процессы
120 Гл. III. Зависимость биологического эффекта от поглощенной дозы
3
1
z
7
/о
s
2
- X
5
и
4
6
Рис. 111.11. Блок-схема радиационного воздействия на клетку
быстрой кинетики сложны и их механизмы недостаточно изучены,
используют полуфеноменологический подход. Для этого вводят по-
показатель U, отражающий интенсивность метаболических процессов
клетки, изменяющийся с характерным временем 10 мин и обладающий
следующими свойствами: слабое воздействие излучения повышает по-
показатель С/, а сильное подавляет его.
На рис. III. 11 представлена блок-схема моделируемых процессов,
где z — радиационные повреждения, х — некий активный фактор,
возникающий под действием радиации (например промежуточные
продукты распада, дефекты мембран и т.д.), U — интенсивность ме-
метаболизма, s — доля выживших клеток. Соответствующая этой схеме
система уравнений записана следующим образом:
^ = Q> - _L_
dt V l-«
dx
~dt
cf(U)),
A11.27)
A11.28)
A11.29)
^ = -XUzS.
at
(Ш.ЗО)
Первый член в уравнении (III.27) Q1 — скорость возникновения
радиационных повреждений z (на рис. 111.11, стрелка 1). Величина Q'
пропорциональна исходной радиочувствительности rz и мощности ис-
источника радиации /q. Второй член — скорость репараций (стрелка 3),
обладающая насыщением. Зависимость ее от метаболизма отражена
членом с f(U), который имеет максимум при U = U, и представлена
2. Математическое моделирование радиобиологических эффектов 121
в форме:
A11.31)
В уравнении (III.28) первый член Q — скорость возникновения
активного фактора х (стрелка 2); она пропорциональна /0 и исход-
исходной радиочувствительности rz и обратно пропорциональна скорости
выведения веществ из клетки j. Величины Q и Q' обратны временным
интервалам, за которые переменные х и z соответственно достигают
характерных значений. Предполагается, что эти интервалы одного
порядка, и в качестве первого приближения их можно принять оди-
одинаковыми. Второй член в уравнении (III.28) — отток х (стрелка 4),
обладающий насыщением.
В уравнении (III.29) первый член описывает изменение метабо-
метаболизма U под влиянием радиации (опосредованно, через фактор х).
Зависимость этого влияния от х такова, что при малых х имеется
резкий максимум (стрелка 5), при больших х оно отрицательно (стрел-
(стрелка 6). Функция ср(х) выбрана в виде ц>(х) = (х2/(д3+х3)) , где д
соответствует значению ж, при котором (р(х) максимальна. Второй
член в уравнении (III.29) описывает возвращение уровня метаболизма
к норме в отсутствие радиации. Коэффициенты 7w и еи — скорости
изменения метаболизма — как под действием радиации, то есть в
присутствии фактора ж, так и в норме они приняты одинаковыми.
Уравнение (III.30) описывает убыль клеток, не имеющих леталь-
летальных повреждений (s = п*/п, где п* — число выживших клеток,
п — общее число клеток), в результате реализации потенциально
летальных повреждений. Как указывалось выше, этот процесс зависит
как от количества радиационных повреждений z, так и от уровня
метаболизма U (стрелка 7).
На рис. III. 12 приведены з 6 9 12 15 Гр
рассчитанные дозовые кри-
кривые при традиционном облу-
облучении, а также в модифи-
модифицированных процедурах, т. е.
при предварительном сенси-
сенсибилизирующем и защитном
облучениях. Из рисунка вид-
видно, что модификация облу-
облучения увеличивает (в случае
защитной процедуры) или
уменьшает (в случае сен-
сенсибилизации) плечо дозовой
кривой, не изменяя ее на-
наклона при высших дозах.
Появление «ступеньки» при
малых дозах D в интерва-
интервале 0,5-1,5 рад авторы объяс-
объясняют тем, что относительная
-2
-6
-10
Рис. III. 12. Теоретические дозовые кривые
для культуры клеток HeLa в контроле B),
в случае сенсибилизации A) и защиты C)
предварительным облучением; эффектив-
эффективность высева в контроле принималась рав-
равной 100%. По оси абсцисс — доза облуче-
облучения, Гр; по оси ординат — натуральный
логарифм отношения числа выживших кле-
клеток к общему числу клеток (Чернавский и
др., 1975)
122 Гл. III. Зависимость биологического эффекта от поглощенной дозы
эффективность сравнительно низких доз может быть больше, чем
высоких.
Следует отметить, что рассмотренная модель носит скорее объяс-
объяснительный характер. Как отмечают сами авторы, для практического
применения модели необходимо определить экспериментально боль-
большое число параметров. В данной модели не учтены межклеточные
взаимодействия, т. е. популяционный уровень защиты не рассматри-
рассматривается.
2.5.3. Разноуровневые («системные») модели
В разноуровневых (или системных по Обатурову) моделях рас-
рассматриваются конечные радиобиологические эффекты в связи с пер-
первичными повреждениями низкоуровневых компонентов. Такой подход
дает определенные преимущества при создании моделей. Например,
при моделировании выживаемости облучаемых клеток такими ком-
компонентами принимают дезоксирибонуклеиновые кислоты. В данном
случае это позволяет строить более надежные модели, поскольку для
ДНК закономерности между уровнем облучения и повреждением уже
установлены опытным путем.
Приведем в качестве примера разноуровневых моделей разработку
Мансона с соавторами, описанную Обатуровым A987). Это модель
инактивации клеток бактерии Е. coli при облучении заряженными ча-
частицами в широком диапазоне линейной передачи энергии L. Модель
основана на следующих предпосылках.
- Чувствительной мишенью в клетке является молекула дезокси-
рибонуклеиновой кислоты, состоящая из двух цилиндрических
нитей диаметром d.
- При прохождении частицы через ДНК каждое событие поглоще-
поглощения энергии (первичная ионизация) с вероятностью w индуциру-
индуцирует однонитевой разрыв в одной из ее нитей. Разрыв в противо-
противоположных нитях ДНК, вызванный воздействием одной частицы,
приводит к двунитевому разрыву, который не репарируется и
является летальным. Вероятность образования двунитевого раз-
разрыва двумя отдельными частицами мала, что подтверждается
экспоненциальной формой кривых выживаемости и вытекает из
общих принципов микродозиметрии.
- Однонитевой разрыв частично репарируется; вероятность того,
что репарация такого разрыва не произойдет, равна и. Нерепа-
рируемые однонитевые разрывы являются также летальными.
Авторами была предложена следующая формула для описания
выживаемости клеток бактерий:
S = ехр (-(р<тР2) = exp (-aD), A11.32)
где Р<± = 1 — W\W2] w\ = exp [2sPi^(l — #Pi)], w\ — вероятность того,
что в клетке при пересечении заряженной частицей не образуется ни
2. Математическое моделирование радиобиологических эффектов 123
одного нерепарированного однонитевого разрыва, a w^ — ни одного
двухнитевого разрыва, w^ — ехр (—sg?\), P\ — вероятность обра-
образования однонитевого разрыва ДНК при однократном пересечении
молекулы заряженной частицей, Р\ = 1 — ехр (—16Lpdw); s — среднее
число пересечений хроматиды одной частицей; д — вероятность того,
что трек, пройдя через одну нить ДНК, пересечет другую; р —
относительная плотность ДНК; а = СГР2/0,16L; D — доза.
Выражение (III.32) можно представить в следующем виде:
S = ехр {-ipa[l - ехр (-т)]}, (Ш.ЗЗ)
где т — число летальных повреждений на одну частицу, описывается
уравнением: т = s[gP\ + 2Piix(l — gPi)].
В модели содержится пять параметров (d, w, s, g, и), из которых
только последний зависит от типа штамма Е. coli, остальные должны
иметь значения, одинаковые для любых штаммов. Параметры полу-
получены путем калибровки модели по экспериментальным данным.
Модель позволила получить удовлетворительное описание зави-
зависимости радиочувствительности от ЛПЭ для различных клеточных
штаммов.
* *
*
Развитие количественного направления в радиобиологии привело к
накоплению таких экспериментальных данных, которые не могли быть
истолкованы в рамках чисто биологических феноменов. Отсутствие
порога на кривых «доза-эффект», полученных в опытах по облуче-
облучению макромолекул, вирусов, бактерий, ряда изолированных клеток,
указывало на то, что облучение в любой как угодно малой дозе может
вызвать появление у некоторой части особей наблюдаемой реакции.
В то же время поглощение облучаемой системой излучения в очень
больших дозах не приводило к инактивации всех объектов, некоторые
из них сохраняли исходные биологические свойства. Следовательно,
с ростом дозы повышается не столько степень проявления эффекта у
отдельных особей облучаемой популяции, сколько количество (доля)
объектов, реагирующих данным образом, т. е. возрастает вероятность
проявления данной реакции на облучение.
Для интерпретации стохастического характера биологического
действия ионизирующего излучения были использованы фунда-
фундаментальные физические концепции о вероятностном характере
взаимодействия квантов высоких энергий и ускоренных заряженных
частиц с веществом. При каждом акте взаимодействия к атому
или молекуле переносится такая дискретная порция энергии,
которая может заведомо привести к разрыву любой химической
связи. Поэтому можно было рассматривать каждый акт такого
одиночного переноса энергии как событие попадания, приводящее к
поражению определенной структуры. Акты попадания статистически
распределяются по всей облучаемой системе, так же статистически
124 Гл. III. Зависимость биологического эффекта от поглощенной дозы
будут распределены микрообъемы, поврежденные излучением. Если
часть микрообъемов — это мишени, ответственные за наблюдаемую
реакцию, то на основании соответствующих математических постро-
построений можно оценить их параметры — сечение, объем, молекулярную
массу.
Подобные соображения стимулировали большое число исследова-
исследований, посвященных математическому анализу экспериментальных кри-
кривых «доза-эффект». Методологической основой такого анализа послу-
послужил метод математического моделирования. Это сыграло большую
положительную роль, но были и отрицательные моменты. В частно-
частности, высокая степень математизации исследований в радиобиологии в
целом и радиационной биофизике привела во многих случаях к то-
тому, что исследователи ограничились чисто формальной констатацией
соответствия экспериментальных кривых тем или иным уравнениям
без характеристики лежащих в их основе реакций изучаемых живых
объектов на облучение.
Тем не менее следует отметить, что математическое моделирование
стало мощным и эффективным средством интерпретации и прогнози-
прогнозирования влияния ионизирующих излучений на живые объекты.
В то же время, несмотря на эффективность математического мо-
моделирования, проявленную в научных исследованиях, и общепризнан-
общепризнанные достоинства этого метода, в современной радиационной биофизи-
биофизике он применяется все еще недостаточно активно. Научный прогресс
последних двадцати лет в информационно-технической области, свя-
связанный с повышением доступности ЭВМ и особенно с появлением
персональных компьютеров во многих областях биологии сопрово-
сопровождался скачкообразным повышением интереса к математическому мо-
моделированию и появлению перспективных моделей, в первую очередь
имитационных. Рискуя повториться, отметим, что к сожалению, это
слабо коснулось исследований по изучению воздействия ионизирую-
ионизирующих излучений на живые объекты.
До сих пор основная роль, которая отводится математическому
моделированию в радиационной биофизике — это формализованная
трактовка механизмов воздействия радиационных излучений с по-
помощью аналитических моделей. Остались практически невостребо-
невостребованными имитационные математические модели, которые позволяют
изучать и прогнозировать поведение объекта в сложной временной и
пространственной динамике при постоянно меняющихся условиях (на-
(например, уровня излучения, концентрации веществ, модифицирующих
действие излучения и т.д.).
Такое отставание объясняется сложностью явлений, изучаемых в
радиобиологии, отсутствием достаточно полного объема исходной ко-
количественной информации и ее разрозненностью. Эта проблема может
быть отчасти решена в рамках компьютеризации исследований, под-
подразумевающей, в числе прочего, создание баз данных по результатам
экспериментальных исследований в этой области, их последующий
анализ и построение адекватных математических моделей. Развитие
2. Математическое моделирование радиобиологических эффектов 125
и повышение доступности вычислительных средств также должны со-
создать предпосылки к более активному использованию метода матема-
математического моделирования как в фундаментальной, так и в прикладной
областях радиационной биофизики и радиобиологии.
Приведенный в данной главе биофизический анализ зависимости
эффектов от поглощенной клеткой дозы ионизирующих излучений
позволяет оценить параметры структур — мишеней и получить необ-
необходимые сведения о характере первичных физических событий (по-
(попаданий). Понятно, что такой анализ все же не позволяет раскрыть
последовательности событий, приводящих к поражению мишени в
результате попаданий.
Вопросу последовательного развития событий при лучевом воз-
воздействии на молекулы и клетки посвящены следующие главы данной
книги.
Глава IV
ПРЯМОЕ ДЕЙСТВИЕ ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ
Главная задача радиационно-биофизических исследований, как от-
отмечалось, заключается в раскрытии последовательной цепи событий,
начиная от поглощения энергии излучения до поражения мишени, а
затем и изменений всего облучаемого объекта. Из-за высокой энергии,
дискретно поглощаемой в клетке, и отсутствия избирательного дей-
действия ионизирующее излучение способно вызвать изменение любой
молекулы, любой биологической системы. Для радиационной
биофизики основной трудностью является установление (в сложной
иерархии возникающих или уже возникших многочисленных, посто-
постоянно меняющихся во времени, молекулярных повреждений) в клетке
«запального», ведущего механизма в формировании лучевого пора-
поражения, установление причинно-следственной связи в сложной цепи
событий, формирующих зависимость «доза-эффект».
По-видимому, наиболее логично начать изучение лучевых радиа-
радиационных эффектов с наиболее простого — с непосредственного (пря-
(прямого) облучения интересующих биологов макромолекул и оценки
последовательности возникающих изменений.
Однако при этом мы все же не будем застрахованы от того, что
наблюдаемые изменения могут в точности не проявиться в более
сложных системах, например в облученной клетке, или даже просто
в облученных растворах. Необходимо это предвидеть и все же сделать
первые шаги по тернистой, и вместе с тем увлекательной дороге
исследований радиационной биофизики.
1. О прямой и непрямой радиационной инактивации
макромолекул
В результате облучения макромолекул их биологические функции
могут полностью или частично утрачиваться. В этом случае говорят
об инактивации макромолекул ионизирующей радиацией. Инакти-
Инактивация макромолекулы может произойти в результате прямого либо
опосредованного действия ионизирующего излучения.
Прямое действие состоит в том, что инактивированными ока-
оказываются те молекулы, которые непосредственно поглотили энергию
излучения.
2. О структурных повреждениях и радиационной инактивации 127
Если же молекула была поражена активными реакционноспособ-
ными продуктами, возникшими за счет поглощения энергии излуче-
излучения ее микроокружением (например, полярными или неполярными
растворителями), то говорят о непрямом (опосредованном, кос-
косвенном) действии радиации.
2. О структурных повреждениях и радиационной
инактивации макромолекул
Определенные типы структурных повреждений, например, раз-
разрушение некоторых аминокислотных остатков в белковой молеку-
молекуле или нуклеотидов в молекуле ДНК, влекут за собой изменения
функциональных свойств соответствующих макромолекул. Выясне-
Выяснение причинно-следственных отношений между типами структурных
повреждений и характером инактивации макромолекул составляет
заключительный этап биофизического анализа механизмов лучево-
лучевого поражения биологически активных молекул. Такие исследования
имеют важное значение не только для радиационной биофизики, но
и для молекулярной биологии в целом, так как позволяют выявить
функциональную роль отдельных субмолекулярных структур.
В последние десятилетия успешно развивается особое направление
радиационной биофизики — молекулярная радиобиология, основная
задача которой состоит в исследовании радиационно-физических и
химических процессов, вызывающих повреждение биомолекул, а так-
также в объяснении радиационно-обусловленных нарушений жизненно
важных процессов в терминах молекулярных изменений.
Биофизический анализ механизмов лучевой радиационной инакти-
инактивации макромолекул состоит в описании в терминах физики и химии
всей последовательности процессов, которые начинаются с поглоще-
поглощения молекулой дискретной порции энергии излучения и заканчивают-
заканчиваются очевидными, доступными экспериментальному анализу изменения-
изменениями ее биологических свойств. Такой анализ включает следующие три
логически связанных этапа.
Первый этап — это феноменологический анализ картины лучевого
поражения молекул. Он осуществляется путем построения кривых
«доза-эффект» и изучения на их основе радиочувствительности *)
отдельных биологических функций макромолекул.
В толковании понятия «биологические функции макромолекул»
существует известная неопределенность, связанная с тем, что в насто-
настоящее время мы не в состоянии очертить весь круг функциональных
признаков, определяющих уникальную роль данного типа молекул в
жизнедеятельности клеток и организмов. Еще труднее охарактеризо-
охарактеризовать эти признаки количественно.
Однако для некоторых биомолекул уже сейчас можно указать на
ряд свойств, определяющих их значение в процессах обмена веществ,
*) Термин радиочувствительность для молекул принят условно.
128 Гл. IV. Прямое действие ионизирующих излучений
в хранении и передаче наследственных свойств, в возникновении есте-
естественной изменчивости. Анализируя влияние облучения на фермен-
ферменты, мы прежде всего должны оценить изменения их каталитической
активности, субстратной специфичности, чувствительности к соот-
соответствующим активаторам и ингибиторам, возможность воздействия
на их стерическое регулирование. Если по любому из этих функцио-
функциональных признаков отмечается негативный эффект облучения, то мы
будем называть такое событие лучевой инактивацией фермента. Со-
Соответствующими биохимическими методами можно оценить степень
инактивации количественно.
В экспериментах по облучению нуклеиновых кислот критери-
критерием инактивации ДНК может служить изменение ее инфекционно-
сти, трансформирующей активности (для бактериальных и вирусных
ДНК), способности служить матрицей для синтеза соответствующих
комплементарных полинуклеотидных последовательностей. Влияние
излучения на молекулы тРНК оценивают по их способности связывать
специфические аминокислоты. В подобных опытах удается количе-
количественно оценить инактивирующее действие излучения на этот тип
нуклеиновых кислот.
На втором этапе биофизического анализа механизмов радиацион-
радиационной инактивации макромолекул последовательно оценивают стадии
прямого эффекта ионизирующей радиации (условно они делятся на
первичную физическую, физико-химическую и химическую-деструк-
химическую-деструктивную):
На третьем этапе биофизического анализа устанавливаются
причинно-следственные связи между типами структурного поврежде-
повреждения и характером инактивации макромолекулы. Для решения этих
вопросов перспективно использование модифицирующих агентов,
видоизменяющих типы структурного повреждения и (или) характер
инактивации. Сочетание различных модифицирующих агентов
позволяет дифференциально оценить роль тех или иных типов
повреждений в инактивации макромолекулы.
Детальное описание всех этапов радиационной инактивации макро-
макромолекул составляет одну из важнейших задач современной радиаци-
радиационной биофизики. Эта проблема еще далека от полного разрешения.
Однако уже сегодня можно говорить о важнейших деталях и указать
основные направления, по которым развиваются исследования.
3. Феноменологический анализ радиационного повреждения
макромолекул
Прямое действие ионизирующей радиации на макромолекулы
обычно исследуют на обезвоженных или кристаллических препаратах
ферментов и нуклеиновых кислот. В этом случае большинство
3. Феноменологический анализ радиационного повреждения
129
молекул инактивируется в результате прямого поглощения энергии
излучения*).
3.1. Прямое действие излучения на ферменты
Схема эксперимента по определению числа инактивированных мо-
молекул фермента при действии излучения в данной дозе состоит в том,
что ампулу с гомогенным препаратом (сухим или кристаллическим)
подвергают облучению, а затем сопоставляют активность опытного
и контрольного образцов. Путем соответствующего пересчета можно
перейти от доли инактивированных молекул (или процента инактива-
инактивации) к истинному числу молекул фермента, инактивированных излу-
излучением в данной дозе. Используя соответствующие биохимические ме-
методы, можно оценить изменение различных функциональных свойств
облученного фермента — каталитической активности, субстратной
специфичности, стерического регулирования и т. д.
На рис. IV. 1, а, б представлены результаты одного из эксперимен-
экспериментов Юнга и Дертингера с кристаллической рибонуклеазой. В широком
диапазоне доз излучения оценивается каталитическая активность и
субстратная специфичность облученного фермента.
Так как деградация РНК под действием рибонуклеазы осуще-
осуществляется в два этапа (вначале расщепляется фосфодиэфирная связь
в РНК и образуется циклический диэфир, а на второй стадии фос-
фосфатная связь гидролизуется до нуклеотид-3-фосфата), то, используя
РНК в качестве субстрата, можно исследовать суммарную реакцию, а
с помощью цитидин-2/, 3-циклофосфата — только вторую ее стадию.
И CD
PI
100
Qh50
h
g 25
2 100
g 80
g 60
^ 40
к -
§s.20
J I
I I I
0 12 3 4 5 6
Доза облучения, хЮ5 Гр
12345678
Доза облучения, хЮ5 Гр
Рис. IV. 1. Инактивация РНКазы 7-излучением. Ферментная активность опреде-
определялась для двух различных субстратов: 1 — РНК; 2 — цитидин-2/, З'-циклофос-
фата; а) зависимость «доза-эффект» выражена в линейных координатах; б) эти
же данные представлены в полулогарифмическом виде, экспериментальные точки
укладываются на прямую
*) Следует все же оговориться, что даже при облучении высокоочи-
щенных препаратов в глубоком вакууме наличие одного только прямого
действия маловероятно: активные продукты, возникающие при поражении
одних молекул, могут индуцировать структурные изменения в молекулах
ближайшего окружения.
9 Ю. Б. Кудряшов
130
Гл. IV. Прямое действие ионизирующих излучений
Одинаковую радиационную инактивацию РНКазы наблюдали при ис-
использовании обоих субстратов (рис. IV. 1), т. е. при облучении в равной
мере поражаются обе функциональные единицы фермента.
Зависимость эффекта от дозы облучения экспоненциальна. При
самых малых дозах обнаруживаются молекулы фермента, утратив-
утратившие способность расщеплять субстраты обоих типов; с ростом погло-
поглощенной дозы число таких молекул возрастает вначале резко, почти
линейно, а затем мы видим, как значительному приращению дозы
соответствует лишь небольшое увеличение доли инактивированных
молекул. Для проверки экспоненциального характера зависимости
«доза-эффект» необходимо преобразовать кривую IV. 1, а, построив
ее в полулогарифмических координатах, как это сделано на рис. IV. 1, б
(по оси ординат откладывается не доля молекул, сохранивших ис-
исходную активность, а натуральный логарифм этой величины). Все
экспериментальные точки укладываются на прямую, проходящую под
углом к оси ординат, следовательно, In N/Nq = —kD или N/Nq = e~kD
(см. уравнение (III.9)).
Экспоненциальная зависимость «доза-эффект» обнаружена в экс-
экспериментах по лучевой инактивации различных ферментов (рис. IV.2)
и может рассматриваться
как общая закономерность
прямого действия радиации
на ферменты.
Сравнивая кривые «до-
«доза-эффект», можно сопоста-
сопоставить радиочувствительность
различных ферментов. Из
рис. IV.2 видно, что для по-
получения сравнимой инакти-
инактивации изученных ферментов
требуются существенно раз-
различающиеся дозы. Обычно в
качестве критерия радиочув-
радиочувствительности выбирают такую дозу излучения, которая необходима
для инактивации 63% молекул в облученном препарате фермента.
Так как при этом 37% молекул сохраняют нативные свойства, эта
доза получила название «доза 37%-ой сохранности», или доза D^. По
рис. IV.2 можно установить, что для инвертазы D37 B данных условиях
составляет около 80 кГр, а для рибонуклеазы — 280 кГр, т. е. при оди-
одинаковой дозе молекулы первого фермента поражаются со значительно
большей вероятностью. Это может быть связано с различными раз-
размерами макромолекулы, особенностями ее аминокислотного состава,
характером миграции энергии в полимере или другими причинами,
которые должны быть установлены в ходе биофизического анализа.
Известно, что функциональные свойства фермента определяются
его различными структурными участками. Так как поглощение энер-
энергии излучения может приводить к различным типам структурного
100
80
60
40
20
10
0 12 3 4 5 6
Доза облучения, хЮ5 Гр
Рис. IV.2. Радиочувствительность ряда
ферментов, подвергнутых воздействию 7-из-
лучения в вакууме
3. Феноменологический анализ радиационного повреждения 131
Таблица IV. 1. Радиочувствительность функций, определяющих биологиче-
биологическую активность ферментов
Фермент
химотрипсин
трипсин
глутамат-
дегидрогеназа
рибонуклуаза
аспартаткарбамо
илтрансфераза
Радиочувствительность функций, связанных с
ферментной активностью (по величине дозы D37)
эстераза > протеаза > связывание диизопропил-
фосфата > уменьшение максимальной скорости >
> увеличение константы Михаэлиса—Ментен *)
протеаза > эстераза
уменьшение максимальной скорости и
увеличение константы Михаэлиса-Ментен >
поражение активного центра и способности
связывать кофермент
уменьшение максимальной скорости; константа
Михаэлиса-Ментен без изменения
поражение активного центра > инактивация
участка ингибирования по принципу обратной
связи (аллостерические свойства)
*) Более высокая радиочувствительность (т.е. меньшие дозы D37) обозна-
обозначена символом >. Например, эстераза > протеаза означает, что эстеразная
активность фермента более радиочувствительна, чем протеазная.
повреждения, следует ожидать, что не все функции фермента подав-
подавляются радиацией в равной степени. В табл. IV. 1 сведены результаты
исследований различных авторов, которые подтверждают такую воз-
возможность.
В опытах с рибонуклеазой обнаружено, что облучение приводит
к снижению максимальной скорости реакции, а величина константы
Михаэлиса—Ментен остается без изменения. Это означает, что число
каталитически активных молекул в облученном препарате понижа-
понижается, однако пораженные молекулы сохраняют сродство к субстрату.
Вероятно, возникающие поражения структуры затрагивают активный
центр, но не препятствуют взаимодействию фермента со специфиче-
специфическим субстратом. В случае с трипсином протеазная активность пора-
поражается в большей мере, чем эстеразная, т. е. в результате облучения
возникают повреждения главным образом в тех структурных звеньях,
которые определяют протеазную активность фермента.
Если ионизирующие излучения в состоянии вызывать специфиче-
специфические структурные повреждения в молекуле фермента и приводить к
определенному изменению его функциональных характеристик, то с
помощью радиационного воздействия можно исследовать причинную
связь между структурой и функцией фермента.
Рассмотрение феноменологии лучевого поражения ферментов поз-
позволяет заключить, что в результате прямого действия излучения воз-
возникают различные нарушения функциональных свойств фермента;
наблюдается экспоненциальная зависимость биологического эффекта
от величины поглощенной дозы, т. е. с увеличением поглощенной дозы
132 Гл. IV. Прямое действие ионизирующих излучений
излучения доля макромолекул, сохранивших нативные свойства, убы-
убывает по закону e~kD, где к — константа, D — поглощенная доза. Об-
Облученный фермент может утрачивать одни функциональные свойства
при сохранении других, т. е. наблюдается неодинаковая радиочувстви-
радиочувствительность различных биологических свойств фермента; по одному и
тому же критерию, например каталитической активности, различные
ферменты обладают неодинаковой радиочувствительностью.
3.2. Прямое действие излучения на нуклеиновые кислоты
Существуют определенные трудности количественного измерения
инактивации нуклеиновых кислот. Ниже перечислен ряд модельных
систем, которые позволяют количественно оценить важнейшие из
функциональных характеристик этих макромолекул, и приведены
основные феноменологические данные, полученные при изучении ха-
характера инактивации облученных нуклеиновых кислот.
3.2.1. Инфекционность нуклеиновых кислот
Термином «инфекционность» обозначают способность вирусной
ДНК или РНК индуцировать образование бактериальной клеткой
новых полноценных фагов. Методически эксперимент выглядит так.
Бактерии обрабатывают лизоцимом, в результате чего они теряют
часть клеточной стенки и образуют сферопласты, которые можно
инфицировать нуклеиновой кислотой, выделенной из бактериофага.
Если в инфицированной бактерии возникают новые полноценные фа-
фаги, то бактериальная стенка ее разрывается, и из бактерии высвобо-
высвобождается 100—200 бактериофагов. Количество вирусных частиц, высво-
высвободившихся из лизированных сферопластов, в определенных пределах
пропорционально количеству молекул ДНК или РНК, сохранивших
инфекционные свойства. Так как фаги лизируют новые сферопласты
вблизи места своего высвобождения, то на сплошном газоне бакте-
бактериальных клеток, выращенных на агаре, образуется пятно лизиса —
«бляшка». Количество бляшек можно подсчитать визуально, и их
число служит количественным критерием инфекционности вирусной
нуклеиновой кислоты.
Этим методом определяют инактивацию вирусной ДНК в резуль-
результате облучения. Результаты одного из таких экспериментов приведены
на рис. IV.3. Доля молекул ДНК, сохранивших инфекционность, от-
отложена по оси ординат в логарифмическом масштабе, все эксперимен-
экспериментальные точки укладываются на прямую, т. е. \uN/Nq = —kD, кривая
«доза-эффект» экспоненциальна.
3.2.2. Трансформирующая активность
Трансформирующая активность бактериальной ДНК часто
оценивается по появлению специфических генетических маркеров
у бактерий-реципиентов, «поглотивших» трансформирующую ДНК
донора. Например, извлекают ДНК из бактерии, устойчивой к
стрептомицину, и клетки стрептомицин-чувствительных мутантов
3. Феноменологический анализ радиационного повреждения
133
100
.10
S gO,l
0 4 8 12
Доза облучения, хЮ3 Гр
Рис. IV.3. Инфекционность
ДНК фага <^Х174, препарат ко-
которого подвергнут воздействию
7-излучения 6(^Со в вакууме
0 12 3 4 5
Доза облучения, хЮ5 Гр
Рис. IV.4. Инактивация трансформиру-
трансформирующей активности ДНК Bacillus subtilis
при облучении сухих спор электронами
с энергией 1 МэВ
инкубируют в ее присутствии. Если в результате этого путем
рекомбинации происходит встраивание специфической последова-
последовательности нуклеотидов ДНК донора в геном реципиента, т. е. мутанты
становятся устойчивыми к стрептомицину (генетический маркер), то
на среде, содержащей стрептомицин, мутанты будут формировать
колонии. Число таких колоний пропорционально доле молекул ДНК,
сохранивших трансформирующую активность после облучения.
На рис. IV.4 показаны результаты опытов, в которых изучали
трансформирующую активность ДНК после облучения электронами
с энергией 1 МэВ. Для этого сухие споры Bacillus subtilis подвер-
подвергали облучению, затем выделяли из них ДНК и инкубировали ее с
клетками, не способными синтезировать индол (генетический маркер).
Необлученная ДНК восстанавливала способность мутантных клеток
синтезировать индол. Зависимость «доза-эффект» утраты трансфор-
трансформирующей активности ДНК после облучения является экспоненци-
экспоненциальной.
3.2.3. Затравочная активность ДНК
Затравочная активность ДНК, т. е. ее способность служить мат-
матрицей для синтеза комплементарных нитей ДНК или РНК, также
служит важным критерием для изучения инактивации нуклеиновых
кислот ионизирующим излучением. Облученную ДНК инкубируют в
полной ДНК-полимеразной (или РНК-полимеразной) системе, содер-
содержащей меченные рибо- и дезоксирибонуклеозидтрифосфаты, а затем
измеряют индекс метки в кислотонерастворимой (полимерной) фрак-
фракции.
3.2.4. Способность ДНК к образованию гибридов с мРНК
Способность ДНК к образованию гибридов с мРНК также позволя-
позволяет количественно оценить инактивацию ДНК в результате облучения.
Для проведения такого эксперимента при помощи матричного синтеза
134
Гл. IV. Прямое действие ионизирующих излучений
на ДНК получают РНК, меченную радиоактивным фосфором. Затем
ее смешивают с предварительно облученной порцией той же ДНК и
инкубируют смесь в определенных условиях. В ряде опытов изучали
торможение образования гибридов ДНК-РНК после рентгеновского
облучения ДНК из Е. coli В (препарат мРНК выделяли из того же
объекта). Молекула мРНК воспринимала ДНК как «комплементар-
«комплементарную», даже если она уже содержала несколько индуцированных излу-
излучением повреждений; только после накопления определенного числа
повреждений способность облученной ДНК образовывать гибриды с
мРНК резко понижалась.
3.2.5. Способность транспортных РНК связывать
соответствующие аминокислоты
Способность транспортных РНК связывать соответствующие
аминокислоты можно оценить в специальных модельных системах и,
таким образом, количественно оценить их инактивацию ионизирую-
ионизирующими излучениями. Для этого препарат тРНК облучают и инкубиру-
инкубируют с аминокислотами, мечеными по углероду 14С. Затем тРНК оса-
осаждают и в кислотонерастворимой фракции определяют содержание
меченых аминокислот. Результаты такого эксперимента приведены в
табл. IV.2. Относительную радиочувствительность различных тРНК
оценивали по величине дозы D^. Наиболее радиочувствительной ока-
оказалась лейциновая тРНК.
Таблица IV.2. Сравнительная радиочувствительность различных тРНК (по
способности связывать соответствующие аминокислоты)
Изученный комплекс:
аминокислота/тРНК
лейцин
аланин
изолейцин
?>зт х 104,
Гр
25
43
46
Изученный комплекс:
аминокислота/тРНК
пролин
метионин
валин
?>37 х 104,
Гр
58
62
86
Кривые «доза-эффект» для радиационной инактивации тРНК
представлены на рис. IV.5, из которого видно, что доля молекул,
сохранивших способность связывать аминокислоты, экспоненциально
убывает с ростом поглощенной дозы излучения.
3.2.6. Функциональная активность рибосом
Функциональная активность рибосом, облученных in vitro, оце-
оценивается по количеству белка, синтезированного в единицу времени в
полной системе, содержащей соответствующие мРНК, тРНК и амино-
аминокислоты (рис. IV.6). Рибосомы выделяли из клеток Е. coli, облучали и
инкубировали в системе, содержащей в качестве мРНК полиуридино-
вую кислоту (поли-У), которая инициирует синтез полифенилаланина.
Как видно из рис. IV.6, с ростом дозы облучения экспоненциально
3. Феноменологический анализ радиационного повреждения
135
1 6
^ к
W О
Is
Обрг
плек
Рис.
пара
гией
ЮОр^
^ 50
щ 37
Он 20
i i i I i
3 2 4 6 8 10
Доза облучения, хЮ5 Гр
IV.5. Инактивация сухих пре-
тов тРНК электронами с энер-
1 МэВ. 1, 2, 3, 4, 5, 6 —
О
s
зость
м
к
<!
100
90
80
70
60
50
40
30
-
i i
1 2
Доза облучения
1 I
3 4
, хЮ3 Гр
соответственно комплексы лейцина,
аланина, изолейцина, пролина, мети-
онина и валина со специфическими
для каждого из них тРНК
Рис. IV.6. Инактивация лиофилизи-
рованных рибосом из клеток Е. coli
7-излучением 60Со.
снижается доля рибосом, сохранивших исходную синтетическую ак-
активность.
Таким образом, в модельных системах in vitro можно анализи-
анализировать инактивацию нуклеиновых кислот и надмолекулярных ком-
комплексов, в которые входят эти макромолекулы. Особый интерес пред-
представляют исследования радиационного поражения хроматина. Эти
эксперименты приближают нас к пониманию реальных процессов
инактивации ДНК в клетке.
Прямое действие радиации на молекулы ДНК, иРНК, тРНК и
сложные надмолекулярные ансамбли — рибосомы — приводит к утра-
утрате ими биологических функций, связанных с репликацией, транскрип-
транскрипцией и трансляцией генетического кода. Такого рода эффекты имеют
решающее значение при действии радиации на вирусы, бактерии,
клетки и сложные многоклеточные системы. Поэтому изучению меха-
механизмов инактивации нуклеиновых кислот ионизирующим излучением
уделяется большое внимание.
В настоящем разделе описаны некоторые экспериментальные под-
подходы, позволяющие изучать характер инактивации белков и нукле-
нуклеиновых кислот под действием ионизирующей радиации. Феномены,
наблюдаемые в такого рода экспериментах, отражают заключитель-
заключительный этап лучевого поражения, когда стойкие структурные поврежде-
повреждения уже привели к необратимым изменениям биологических свойств
макромолекулы. Эти данные могут служить отправной точкой био-
биофизического анализа механизма инактивации при прямом действии
излучения. Биофизический анализ должен воссоздать все предшеству-
предшествующие этапы «размена энергии» излучения, которые в конечном счете
и сформировали наблюдаемые функциональные нарушения.
136 Гл. IV. Прямое действие ионизирующих излучений
4. Последовательность стадий прямого действия радиации
Здесь будет рассмотрена последовательность событий, происходя-
происходящих от момента непосредственной передачи энергии излучения макро-
макромолекуле и до появления в ней стойких структурных и функциональ-
функциональных изменений. Как упоминалось выше, условно этот процесс может
быть поделен на три стадии.
На первой, или физической, стадии энергия излучения перено-
переносится веществу, возникают возбужденные и ионизированные молеку-
молекулы, неравномерно распределенные в объеме вещества. Эти события
происходят в первые 10~16-10~13 с.
Для выяснения природы первичных физических процессов необ-
необходимо определить параметры «мишени», ответственной за инактива-
инактивацию молекул. Для решения этой задачи необходим формальный ана-
анализ кривых «доза-эффект», сопоставление эффективности излучений
с различными ЛПЭ и с различной мощностью дозы, теоретические ис-
исследования величин «энергетических пакетов», переносимых молекуле
в единичном акте взаимодействия излучения с веществом. Для этой
цели привлекаются квантовомеханические представления и сложный
математический аппарат.
Следующая, физико-химическая, стадия состоит из различ-
различных типов реакций, приводящих к перераспределению между возбу-
возбужденными молекулами избыточной энергии. Эти реакции протекают
за время порядка 10~13—10~10 с. Облученные молекулы, находящиеся
в различных электронно-возбужденных состояниях, в течение физико-
химической стадии имеют много возможностей для дальнейших пре-
превращений. В результате появляются разнообразные активные продук-
продукты: ионы, радикалы. Поэтому в веществе, состоящем даже из одного
типа молекул, облучение генерирует ионы и радикалы с широким
спектром химических свойств.
Для изучения этой стадии исследуют спектр первичных продуктов,
возникающих в результате физико-химических процессов перераспре-
перераспределения избыточной энергии, поглощенной молекулами. Особая роль
здесь принадлежит методу электронного парамагнитного резонанса
(ЭПР) и другим способам идентификации свободных радикалов.
На третьей, или химической, стадии действия ионизирующих
излучений ионы и радикалы взаимодействуют друг с другом и с окру-
окружающими молекулами, формируя структурные повреждения различ-
различного типа. Реакции химической стадии заканчиваются в первые 10~6-
10~3 с после облучения*). Для выявления разного типа структурных
повреждений молекул используется современный арсенал физических
и химических методов анализа макромолекул.
*) Рассматриваемая классификация и порядок величин для отдельных
стадий предложены Платцманом A958, 1962).
4. Последовательность стадий прямого действия радиации 137
4.1. Первичные физические процессы
В гл. III рассматривался формальный подход к объяснению при-
природы первичных событий, приводящих к конечному радиобиологиче-
радиобиологическому эффекту, основанный на анализе экспериментальных кривых
«доза-эффект». В частности, обсуждались критерии «одноударно-
сти» процесса инактивации и перечислялись условия, выполнение
которых показывает, что радиобиологический эффект вызван оди-
одиночным переносом дискретной порции энергии излучения к мишени,
находящейся в пределах объекта.
Рассмотрим, выполняются ли эти условия в случае инактивации
белков и нуклеиновых кислот.
Первое условие — экспоненциальный характер кривых «доза-
эффект». Как указывалось в данной главе, при облучении сухих или
кристаллических белков и нуклеиновых кислот эффект облучения
экспоненциально зависит от поглощенной дозы радиации.
Второе условие — независимость эффекта от мощности дозы и от
того, какими частями она сообщалась объекту, — также выполняется
на различных изученных системах.
О выполнении третьего условия — снижения эффективности из-
излучения с ростом ЛПЭ — свидетельствуют многочисленные опыты,
результат одного из которых пред-
представлен на рис. IV.7.
Трипсин подвергали воздействию
7-излучения и а-частиц полония (с
энергией 5,25 МэВ) в сравнимых
дозах. Во всем диапазоне использо-
использованных доз 7"излУчение оказалось
примерно вдвое более эффективным: ^ ZUq j^ *^—зо* 40"
доза 1)з7 для 7-излучения составля- А
ton -п ооп -п Доза облучения, хЮ4 Гр
ла 180 кГр, а для а-частиц — 320 кГр. ^ J F
При одинаковой поглощенной дозе 7- Рис' IV'7' Инактивация трипсина
7-излучением DUCo A) и а-частица-
излучение генерирует редко распо- ми полония B) в вакууме
ложенные одиночные ионизации, а
а-частицы — плотные колонны ионов, практически непрерывно сле-
следующие вдоль трека частиц. Если одиночной ионизации достаточно
для инактивации макромолекулы, то а-частицы образуют множество
«ненужных» ионизации в пределах мишени, а большинство редко
расположенных ионизации, вызванных 7-излучением, эффективно и
приводит к поражению большого числа молекул.
Если представление об одноударности процесса инактивации ма-
макромолекулы справедливо, то исходя из величины дозы D375 можно
определить параметры мишени — ее геометрические размеры и моле-
молекулярную массу (см. уравнение (III.9)).
Определение параметров мишени проводится на основании следу-
следующих рассуждений. Как мы видели в гл. III, в случае одноударного
процесса теория мишени позволяет по характеру повреждения судить
об объеме V мишени при облучении 7-квантами (соотношение (III. 10)),
138
Гл. IV. Прямое действие ионизирующих излучений
а а-излучение дает другую информацию — о поперечном сечении S
мишени (соотношение (III.7)). В любом случае как объем, так и поверх-
поверхность коррелирует с массой мишени М, а ее молекулярная масса мо-
может определяться независимо химическими методами. Сравнивая эти
значения, можно подтвердить (или наоборот, опровергнуть) основные
положения, выдвигаемые теорией мишени.
Рассмотрим это подробнее на примере облучения 7-квантами. Для этого
связывают с массой мишени, например, соотношение (III. 10). Для оценок
достаточно принять 1/v = D37, и остальные расчеты относить только к
этой дозе, если экспериментально определить число попаданий при одном и
том же проценте выживающих объектов. Известно, что инактивация, сни-
снижающая число мишеней в е = 2, 73 раза, создается облучением в дозе D37.
Пусть на образование пары ионов расходуется 32-34 эВ, а на рой
из 2-3 пар ионов — около 110 эВ; скоплению ионов можно приписать в
среднем энергию 75 эВ. Такое энерговыделение в среднем соответствует
одному попаданию в мишень. Поскольку 1 Гр = 1 Дж/кг, а 1 эВ —
это 1,602 • 10~19 Дж (определение единиц см. в начале гл. I), доза в 1 Гр
соответствует выделению 6, 24 • 1015 эВ/г. Разделив эту величину на 75 эВ
(определенная выше средняя энергия на одно попадание), получим число
повреждений в мишени при дозе 1 Гр. Определив из эксперимента величи-
величину Ds7, найдем окончательно массу, на которую приходится одно поврежде-
повреждение, т. е. массу мишени. Зная массу мишени в граммах, легко определить и
ее молекулярную массу умножением массы на число Авогадро.
На основании экспериментально установленных величин D37 были
рассчитаны молекулярные массы мишеней, ответственных за инак-
инактивацию большого числа
107. 1 1 [¦ г -т* молекул. Во всех случаях,
начиная от небольшой моле-
молекулы пенициллина, имеющей
молекулярную массу око-
около 103 дальтон, и до транс-
трансформирующей ДНК массой
в 107 дальтон, наблюдается
хорошее соответствие между
молекулярной массой мише-
мишени и истинной молекулярной
массой соответствующей
молекулы.
Представление о корреля-
корреляции этих двух характеристик
дает рис. IV.8, где по оси аб-
абсцисс отложены истинные мо-
молекулярные массы веществ, а
по оси ординат — молекуляр-
молекулярные массы мишеней, ответ-
ответственные за инактивацию со-
соответствующих молекул.
ю6
ю4
103
о
<
"^ пенил
%у
,иллин
«оЯлкат
V
дню/
ал аз а
ю2 ю3 ю4 Ю5 ю6
^физ.-хим
ю7
Рис. IV.8. Корреляция между молекуляр-
молекулярной массой веществ, определенной физико-
химическими методами (Мфиз.-Хим) и моле-
молекулярной массой мишени, ответственной за
инактивацию (Мрадиац)
4. Последовательность стадий прямого действия радиации 139
Если характеристики равны по величине, то пересечение проекций
их значений в системе координат дает точку, лежащую на прямой,
проходящей под углом 45°, как это в действительности и имеет место.
В большинстве случаев размер мишени близок к геометрическим
размерам молекул, т. е. одиночное событие потери энергии в любой
точке молекулы приводит к ее инактивации. Этот вывод имеет важное
значение. Дальнейший биофизический анализ должен исходить из то-
того факта, что в результате одиночного взаимодействия ионизирующей
частицы и молекулы с затратой энергии около 75 эВ молекула белка
или нуклеиновой кислоты утрачивает различные функциональные
свойства.
Между двумя этими событиями — переносом дискретной порции
энергии излучения на макромолекулу и ее инактивацией — происходит
ряд последовательных физико-химических процессов, которые требу-
требуют детального описания.
4.1.1. Первичные продукты радиационного превращения
молекул
Представление о вероятностном характере взаимодействия излу-
излучения с веществом, в результате которого некоторые атомы или мо-
молекулы поглощают дискретные порции энергии, сформировалось в
20-е годы XX в. Оно привело к формулированию принципа попадания
в радиобиологии. Однако до настоящего времени не создана строгая
теория, позволяющая на основании строения молекулы предсказать
вероятность поглощения ею определенного количества энергии иони-
ионизирующего излучения, т. е. оценить относительную частоту поглоще-
поглощения различных «энергетических пакетов».
Исследования в этом направлении интенсивно проводились в по-
последнее время. Наметилось два подхода: теоретический, основанный
на квантовомеханических моделях, и экспериментальный, связанный
с поиском методов прямого измерения потерь энергии в результате
одиночного взаимодействия заряженной частицы с молекулой.
На основании приведенного нами ранее уравнения Бете-Блоха
A1.10) (см. с. 70) можно рассчитать дифференциальную потерю энер-
энергии частицей определенного заряда, движущейся со скоростью v в
веществе данной плотности. Однако величина потери энергии dE/dx
еще ничего не говорит о том, какие «энергетические пакеты» перено-
переносятся к молекуле.
В принципе, передача энергии может происходить за счет двух
типов взаимодействия — лобового и скользящего соударения. Лобо-
Лобовое соударение достаточно точно описывается классической электро-
электродинамикой. При этом типе взаимодействия осуществляется «прямое
попадание» заряженной частицы в орбитальный электрон, который
приобретает необыкновенно большой момент количества движения.
Вероятность этого эффекта низка.
В 8-10 раз чаще происходит скользящее соударение, которое слу-
служит основным типом взаимодействия заряженной частицы с молеку-
молекулами.
140
Гл. IV. Прямое действие ионизирующих излучений
потенциальная
энергия
расстояние
При описании скользящего соударения частица рассматривается
как источник электрического поля, в котором содержатся фотоны всех
возможных частот. Такое поле может взаимодействовать с орбиталь-
орбитальными электронами на значительных расстояниях. В газах это расстоя-
расстояние («прицельный параметр») порядка 100 нм, в плотном веществе —
около 10 нм. Взаимодействие электри-
электрического поля заряженной частицы с
молекулой переводит ее в то или иное
возбужденное состояние, в том числе и
соответствующее ионизации (рис. IV.9).
Силу, с которой электрическое по-
поле действует на молекулы, можно раз-
разложить на две составляющие: парал-
параллельную пути частицы (продольная
компонента) и перпендикулярную (по-
(поперечная компонента). Каждую компо-
компоненту можно изобразить рядом Фурье
как сумму чисто гармонических функ-
функций времени:
расстояние
Япопереч =
C0S
(IV.l)
Рис. IV.9. Кривая потенциаль-
потенциальной энергии молекулы, взаимо-
взаимодействующей с полем заряжен-
заряженной частицы: а) молекула до
наложения поля; б) после взаи-
взаимодействия с полем; 1 — возбу-
возбужденная молекула; 2 — ионизи-
ионизированная молекула
Продольная компонента так мала,
что ею можно пренебречь (частица про-
проходит на значительном расстоянии от
молекулы).
Анализ функции Фурье для ^попереч
показывает, что сила поперечной ком-
компоненты постоянна от низких до почти
максимальных частот; каждый интер-
интервал частоты включает одно и то же
количество энергии фотонов, составля-
составляющих поле частицы. Таким образом,
действие заряженной частицы (ее элек-
электрического поля) на молекулу совпадает с действием света источника,
дающего равное число фотонов для каждого интервала частот от
видимого света до рентгеновского излучения.
В теории, развитой в 50-е годы Платцманом, для характеристи-
характеристики молекулы, взаимодействующей с заряженной частицей, вводит-
вводится величина «силы осциллятора» этой молекулы, которая выражает
вероятность перехода, приводящего к возбуждению или ионизации
молекулы.
Силу осциллятора, пропорциональную коэффициенту макроско-
макроскопического оптического поглощения света соответствующей частоты,
обозначают через fs для перехода из основного состояния в дис-
дискретное возбужденное состояние s, которое появляется в результате
поглощения света частотой vs — Es/h, где Es — энергия молекулы в
возбужденном состоянии относительно энергии в основном состоянии
4. Последовательность стадий прямого действия радиации 141
(энергия возбуждения). Для переходов внутри непрерывного спектра
дискретную силу осциллятора нужно заменить на df jdv или df /dE,
зависящую от энергии Е — hv. Обе формы выражения силы осцилля-
осциллятора нужно понимать как величины, усредненные по всем возможным
ориентациям молекулы.
Если молекула возбуждается светом источника, дающего равное
число фотонов для каждого интервала частот — от видимого света
(белый свет) до рентгеновского излучения, то число молекул, активи-
активированных до состояния s, пропорционально силе осциллятора этого
состояния:
Ns = const- fs. (IV. 2)
Уравнение (IV.2) показывает, что при постоянном распределении
частоты величина Ns пропорциональна силе осциллятора. Если часто-
частота падающего света характеризуется распределением \jhvs — 1/ES, то
число молекул, возбужденных до состояния s прохождением быстрой
заряженной частицы, описывается уравнением
Ns ~ fs/Es. (IV.3)
Аналогичное выражение для непрерывного спектра:
N(E) ~ (df/E)/E. (IV.4)
Уравнение (IV.4) называют «оптическим приближением». Основное
ограничение этого метода — значительная погрешность при малых
значениях fs. Однако применение оптического приближения дает хо-
хорошие результаты для анализа энергетического спектра первичных
активаций, генерируемых излучением, в действующем спектре кото-
которого преобладают быстрые заряженные частицы.
Сила осциллятора fs пропорциональна числу электронов в обо-
оболочке, в которой индуцируется активация, т. е. она максимальна для
внешних оболочек; Es пропорциональна квадрату эффективного за-
заряда ядра и менее значима для внешних оболочек, так как электроны
внутренних оболочек экранируют поле ядра. Поэтому, согласно урав-
уравнениям (IV.3), (IV.4), можно сделать вывод: активация валентных
электронов — преобладающий первичный процесс, происходящий в
результате прохождения заряженной частицы через вещество.
Если бы существовала возможность теоретически рассчитать силу
осциллятора молекулы, то можно было бы предсказать уровни акти-
активации молекул в результате взаимодействия с заряженной частицей.
Такой расчет, основанный на квантовомеханических представлениях,
был проведен лишь для атома водорода. Уже для малых много-
многоатомных молекул эта задача практически невыполнима (не говоря
уже о макромолекулах). Оценить спектр сил осциллятора удается на
основании косвенных данных, полученных при изучении коэффици-
коэффициентов поглощения в области непрерывного абсорбционного спектра,
показателя преломления и оптической дисперсии, сечения неупругого
рассеяния электронов и др.
142
Гл. IV. Прямое действие ионизирующих излучений
Согласно уравнению (IV.4) в области непрерывного спектра веро-
вероятность создания данного возбужденного состояния пропорциональ-
пропорциональна (df/dE)/E. Представив на основании косвенных данных спектр
сил осциллятора многоатомной молекулы, можно для нее построить
спектр возбуждения как функцию R(df/dE)/E; константа Ридберга R
вводится для единства размерности. При таком определении спектр
возбуждения совпадает со спектром первичных активаций, создавае-
создаваемых заряженной частицей при ее первом столкновении.
Анализ спектра возбуждения молекул, состоящих из атомов
с Z < 10 и поэтому имеющих кроме валентных электронов только К-
оболочку, показал, что практически все возбуждения сосредоточены
в области сравнительно больших значений Е. Непрерывный спектр
поглощения молекул, в котором сосредоточена сила осциллятора,
содержит в себе непрерывные спектры, обусловленные процессом
ионизации и процессом диссоциации, а
также спектр, создаваемый процессами,
в которых возможна как ионизация, так
и диссоциация молекулы, конкурирую-
конкурирующие между собой (сверхвозбужденное со-
состояние) .
На рис. IV. 10 показан спектр возбу-
возбуждения метана, построенный на основа-
основании экспериментальной оценки силы ос-
осциллятора молекулы. Видно, что из всех
первичных событий, которые не приво-
приводят к ионизации, 45% составляют сверх-
сверхвозбужденные состояния. Среднее значение энергии, соответствующее
полосе сверхвозбуждения, равно приблизительно 15 эВ, т. е. более чем
в 3 раза превосходит энергию диссоциации СНз-Н, равную 4,4 эВ. В
этом сверхвозбужденном состоянии существует конкуренция между
явлениями ионизации и диссоциации. Часть спектра, обозначенная
как «ионизация», соответствует тем уровням возбуждения, которые
всегда приводят к ионизации.
Анализ спектров возбуждения показывает, что для большинства
органических молекул спектр сил осцилляторов лежит в области при-
примерно 10-30 эВ над основным состоянием. Сила более длинноволновых
осцилляторов невелика (исключение составляют молекулы, имеющие
двойные и тройные связи: они могут возбуждаться и при меньших
энергиях).
В большинстве случаев спектры энергий осцилляторов превышают
потенциал ионизации. Однако не все состояния с энергиями, превос-
превосходящими потенциал ионизации, непременно приводят к ионизации
молекулы. « Сверхвозбужденные состояния» могут рассеивать
энергию при внутримолекулярных изменениях или при диссоциации
молекулы на два радикала.
Только часть спектра, обозначаемая как «ионизация», относится к
тем переходам, которые всегда приводят к потере электрона.
12 18 24 30 36
Энергия, эВ
Рис. IV. 10. Спектр возбужде-
возбуждения метана
4. Последовательность стадий прямого действия радиации
143
gffl
К о
ffl S
И
30
20
10
/
-if
-
• 1
\
\\
\\
» —
el
4 8
ffl
- 2
H
о а
Jp 0 20 40 60 80 100 120 140
Потери энергии, эВ
Рис. IV.11. Распределение потери энергии электронами, проходящими через тон-
тонкие слои органического вещества: 1 — электроны 20 кэВ проходят через слой
полимера «формвар» толщиной 130 А; 2 — электроны с энергией 150 кэВ проходят
через пленку ДНК толщиной 2000 А
Знание спектра возбуждения для биологически активных макро-
макромолекул позволило бы оценить распределение и частоту переносимых
к молекуле дискретных порций энергии. Теоретический расчет сил
осцилляторов многоатомных молекул, как уже говорилось, задача
практически невыполнимая. Отсутствуют и экспериментальные ис-
исследования, которые позволили бы представить спектр возбуждения
макромолекул.
Величину «пакетов энергии», передаваемых макромолекуле в ре-
результате одиночного взаимодействия, можно получить путем прямого
измерения потери энергии электронами, проходящими через тонкие
пленки, для которых вероятность более чем одного взаимодействия
с электроном крайне мала. Для этого электроны с энергией 20 кэВ
пропускали через тонкие пленки полимера (формваровая фольга)
толщиной 13 нм и слои ДНК толщиной 200 нм. Исходя из величины
неупругого рассеяния определяли частоту различных событий поте-
потери энергии электроном (рис. IV. 11). Вероятность более чем одного
события потери энергии при прохождении электроном слоя толщи-
толщиной в 13 нм очень мала. Поэтому данные 1 на рис. IV. 11 можно
рассматривать как меру распределения частоты различных событий
потери энергии. Из рисунка видно, что чрезвычайно редко величина
потери энергии меньше 10 эВ. С наибольшей частотой при каждом
первичном взаимодействии переносится пакет энергии в 22 эВ, в
то время как среднее количество потери энергии на одно событие
взаимодействия 60 эВ.
Спектры потери энергии в формваре и ДНК качественно сходны.
Различие, вероятно, связано с неодинаковой толщиной пленок (тех-
(технически очень трудно получить пленки ДНК тоньше 200 нм). При
такой толщине слоя ДНК можно ожидать более одного события потери
энергии. Следует также учесть, что оба рассматриваемых спектра
144 Гл. IV. Прямое действие ионизирующих излучений
включают и небольшое число лобовых соударений. Если сделать необ-
необходимые поправки на эти эффекты, то мы получим спектр возбужде-
возбуждения ДНК, который позволил бы оценить спектр сил осцилляторов этой
молекулы.
Итак, прямые эксперименты показывают, что на одно событие по-
потери энергии в среднем на макромолекулы переносится 60 эВ энергии
излучения. Эта величина значительно превосходит потенциал иониза-
ионизации молекулы. Перенос такого большого количества энергии с высокой
вероятностью переводит молекулу в ионизированное состояние. Поми-
Помимо ионизированных, возникают возбужденные и сверхвозбужденные
молекулы.
Относительный вклад ионизации и возбуждения в биологический
эффект можно оценить некоторыми специальными методами.
Обратимся еще раз к рис. IV.11. Возбуждение различных осцил-
осцилляторов приводит к появлению возбужденных, сверхвозбужденных и
ионизированных молекул. Теоретический расчет выхода этих первич-
первичных продуктов требует знания действующего спектра, сечения возбу-
возбуждения и ионизации и представляет пока еще не решенную задачу.
Метод «оптического приближения» позволяет оценить соотношение
этих продуктов исходя из распределения спектра сил осциллятора мо-
молекулы. Информацию о распределении силы осциллятора молекулы
можно получить на основании косвенных экспериментов с использо-
использованием различных физических методов.
Образованием первичных продуктов, т. е. возбужденных, сверхвоз-
сверхвозбужденных и ионизированных молекул, неравномерно распределен-
распределенных в пространстве, заканчивается первая, или физическая, стадия
действия излучения.
4.2. Физико-химическая стадия действия излучения
С того момента, как в облученной системе возникли первичные
возбужденные продукты, и до момента установления температурного
равновесия протекает сложная цепь реакций, относящихся к физико-
химической стадии действия излучения. На этом этапе высоковозбу-
высоковозбужденные продукты перераспределяют свою избыточную энергию или
избавляются от нее.
В ряде работ, которые носят пока сугубо оценочный характер,
рассматривается возможная судьба первичных возбужденных продук-
продуктов, генерируемых высокоэнергетическим излучением среди молекул
поглощающей среды.
На рис. IV. 12 представлена временная шкала различных процессов,
в результате которых молекула перераспределяет избыточную энер-
энергию или избавляется от нее.
Рассмотрим различные характеристики процессов в молекуле,
представленные на рис. IV. 12. Нижний предел времени, необходимый
для передачи энергии от частицы к частице, устанавливается принци-
принципом неопределенности Гейзенберга. Передача энергии Е, сравнимой
с энергией связи электрона в молекуле, требует времени, равного по
4. Последовательность стадий прямого действия радиации
145
Шкала времени, 10 х с
-16 -15 -14 -13 -12 -11 -10 -9 -8
-7 -6 -5
Молекулярное
электронное колебательное
20 эВ
диссоциация
электроны
в воде >
возбуждение:
вращательное
¦ \- — релаксация
вода
\
флуоресценция
замедление тепловое захват
равновесие в ловушку
время жизни радикалов I
(реакция первого порядка
сХК = б'-Ю^'М"^-1)
10"
10"
10"
время жизни еГИДр
10"
лед
10"
молярность акцептора радикалов
Рис. IV. 12. Временная шкала процесса превращений энергии, передаваемой заря-
заряженными частицами молекулам среды
порядку величины периоду колебаний электрона — 1016-1015 с. Это-
Этого времени достаточно для любой перестройки электронной системы
сильно возбужденной молекулы. Однако на самом деле некоторые из
сильно возбужденных состояний существуют в сотни раз дольше. Это
означает, что с процессами ионизации могут конкурировать процес-
процессы внутренней перестройки, сопровождающиеся смещением атомов в
молекулах.
Эти изменения в молекуле происходят со скоростью, ограниченной
инерцией атомов и силами, действующими между ними. Для этого
необходимо время, сравнимое с периодом нормальных колебаний для
данной связи. Инфракрасная спектрометрия позволяет получить све-
сведения о частоте таких колебаний. Для целого ряда молекулярных ко-
колебаний (растяжение связей, изгиб линейных молекул и т.д.) периоды
лежат в сравнительно узком диапазоне — от 10~14 до 2 • 10~13 с.
Следовательно, в результате внутренней конверсии долгоживущие
сильновозбужденные состояния могут перейти в слабовозбужденные.
В больших молекулах избыточная энергия электронов легко пере-
переходит в колебательную энергию из-за наличия целого ряда возможных
электронных и колебательных энергетических состояний. В точках
их пересечения переход от более высоких электронных возбужденных
состояний к более низким может происходить без испускания излуче-
излучения, и избыточная энергия будет переходить в колебательную форму.
Такая внутренняя конверсия приводит к переходу молекулы в низшее
возбужденное состояние с сохранением той же мультиплетности за
10 Ю. Б. Кудряшов
146 Гл. IV. Прямое действие ионизирующих излучений
время, примерно равное 10~13-10~12 с. Накопление колебательной
энергии в отдельных связях может привести к диссоциации моле-
молекулы с образованием радикальных продуктов, находящихся в возбу-
возбужденном состоянии.
В конденсированной системе вероятность такого распада молекулы
сильно снижается за счет двух обстоятельств.
1. Высокая частота столкновений молекул вызывает перераспре-
перераспределение колебательной энергии в результате внутренней конверсии.
Таким образом, исключается накопление ее в той молекуле, которая
получила первичное возбуждение.
2. Окружающие молекулы образуют «клетку», которая затрудняет
расхождение фрагментов; вместо этого они, вероятно, испытывают
ряд столкновений и рекомбинируют. Молекулы распадаются на два
фрагмента, один из которых — атом водорода. Большую часть кине-
кинетической энергии уносит атом водорода, и поэтому он легче проникает
через стенки «клетки».
4.2.1. Сверхвозбужденные молекулы
Сверхвозбужденные молекулы — это молекулы, обладающие
избыточной энергией, которая превышает потенциал ионизации
(рис. IV. 10). Существуют экспериментальные данные, подтвер-
подтверждающие представления о том, что сверхвозбужденное состояние
в сложных молекулах сохраняется в течение времени, примерно
в 100 раз превышающего период колебаний, т.е. больше 10~13 с.
Некоторые из сверхвозбужденных состояний возникают в резуль-
результате одновременного перехода двух или нескольких электронов на
более высокие энергетические уровни. Взаимодействие таких уровней
может привести к концентрации энергии в одном из электронов. Если
этот эффект произойдет, то электрон будет выброшен из молекулы,
а сама она станет положительным ионом. С такой «автоионизаци-
«автоионизацией» конкурируют процессы внутренней перестройки молекулы, в том
числе и те, которые приводят к смещению атомов и переходу избы-
избыточной энергии в химическую и тепловую, что ведет к уменьшению
имеющейся энергии до значений, меньших порога ионизации. Таким
образом, в сверхвозбужденных молекулах существует конкуренция
между процессом ионизации и диссоциации.
4.2.2. Ионизированные молекулы
Ионизацию можно рассматривать как одну из форм возбуждения,
при которой электрон или группа электронов приобретает настолько
большой запас энергии, что выбрасывается из молекулы. Образу-
Образуются ионы, находящиеся в состоянии электронного и, как правило,
некоторого колебательного возбуждения. Это происходит потому, что
межатомные расстояния в ионе, находящемся в основном состоянии,
и в нейтральной молекуле различаются между собой, акт же иони-
ионизации происходит значительно быстрее перестройки связи (принцип
Франка-Кондона). В результате ион начинает свое существование с
4. Последовательность стадий прямого действия радиации 147
атомными расстояниями, отличающимися от нормальных и соответ-
соответствующими некоторой колебательной потенциальной энергии. Про-
Процесс внутренней конверсии, рассмотренный выше для возбужденных
молекул, происходит аналогичным образом и в ионе, если ион изоли-
изолирован; концентрация колебательной энергии на определенных связях
может привести к его распаду. В жидкостях и твердых телах быстрое
рассеяние колебательной энергии в состоянии предотвратить распад
и позволить иону перейти в низшее электронное состояние, в котором
он способен существовать некоторое время. Если затем ион встретится
с каким-либо отрицательно заряженным образованием (ион, сольва-
тированный электрон и т.д.), энергия соединения может оказаться
достаточной для распада молекулы на два свободных радикала.
Таким образом, дальнейшие превращения, которые испытывает
ионизированная молекула, вероятнее всего приведут ее к распаду на
два свободных радикала.
4.2.3. Судьба электронов, испущенных молекулой
Электроны, выбитые из молекулы, обычно делят на две группы в
соответствии с тем, больше их кинетическая энергия энергии низшего
уровня электронного возбуждения молекул окружающей среды или
меньше ее. Электроны первой группы взаимодействуют с электронной
системой молекул, с которыми они сталкиваются, и теряют энергию
в неупругих соударениях. В конце концов они переходят во вторую
группу, оставляя на своем пути ряд молекул с электронными воз-
возбуждениями. В дальнейшем эти электроны теряют энергию за счет
возбуждения колебательных и вращательных движений в сталкиваю-
сталкивающихся с ними молекулах.
Если в среде преобладают молекулы, у которых энергия низшего
уровня электронного возбуждения существенно превышает кинети-
кинетическую энергию электрона, но в этой же среде имеется небольшая
доля молекул с низкими энергиями электронного возбуждения, то
электроны, теряющие мало энергии при столкновении с молекулами
первого типа, будут «разыскивать» и возбуждать молекулы второго
типа, передавая значительно большую часть поглощенной энергии,
чем это соответствовало бы их малой концентрации в среде. По дан-
данным Платцмана 15—20% всей энергии, поглощенной при воздействии
высокоэнергетического излучения, передается медленными электро-
электронами, и среднее время, необходимое для достижения ими теплового
равновесия со средой, составляет примерно 10~п с. За время такого
же порядка происходит поляризация среды вокруг замедлившегося
электрона. Возникает чрезвычайно активное в химическом отноше-
отношении образование, названное сольватированным электроном (в водной
среде это так называемый «гидратированный электрон», о котором
подробнее сказано в следующей главе).
Процессы, происходящие на физико-химической стадии, приводят
к различным типам перераспределения возбужденными молекула-
молекулами избыточной энергии и, таким образом, обусловливают появление
10*
148 Гл. IV. Прямое действие ионизирующих излучений
разнообразных активных продуктов (ионов, радикалов и т.д.). Эти
процессы протекают в течение очень короткого интервала времени,
порядка КГ14-КГП с.
4.2.4. Последовательность образования промежуточных
активных частиц
В настоящее время образование промежуточных активных частиц
в облученных органических веществах изучено достаточно подробно.
Известно, что образование возбужденных состояний молекул — син-
глетных и триплетных — может происходить:
при первичном возбуждении молекул излучением:
М-^М*, (IV.5)
при нейтрализации ионов:
а также при передаче возбужденных молекул матрицы другим моле-
молекулам клетки (или «добавкам»), например, ингибиторам — Ing:
М* + HIng —> МН + Ing. (IV.7)
В отдельных молекулярных системах могут образовываться более
сложные возбужденные и высоковозбужденные состояния.
На ионизацию атомов и молекул в клетке расходуется более поло-
половины поглощенной энергии излучений. При этом образуется материн-
материнский положительный ион М+ и электрон:
M-^M++e~. (IV.8)
При высоких концентрациях молекул протекают ион-молекуляр-
ион-молекулярные реакции, например, в воде:
Н2О+ + Н2О —> Н3О+ + ОН. (IV.9)
Электроны, выбитые вследствие ионизации, тратят свою энергию
на ионизацию, возбуждение и термализуются:
М + е"—>М", (IV.10)
Свободные электроны после замедления захватываются матрицей
углеводородов, воды и образуют сольватированные (гидратирован-
ные) электроны, которые взаимодействуют с другими молекулами.
Ионы так же, как и возбужденные молекулы, могут диссоцииро-
диссоциировать с образованием свободных радикалов молекул:
М+-^М'+Н+, (IV.12)
М- —>М' + ОН", (IV.13)
4. Последовательность стадий прямого действия радиации 149
При радиолизе молекул образуются также анион-радикалы М~ и
катион-радикалы М *, т. е. соединения, несущие одновременно и заряд,
и неспаренный электрон. Фрагментация ион-радикалов приводит к
образованию иона и радикала (реакция гомогетеролиза):
В образовании свободных радикалов принимают участие и элек-
электроны, реагируя с нейтральной молекулой MX:
MX + е~ —> М* + Х-. (IV.17)
Свободные радикалы образуются также при ион-молекулярных
реакциях с участием нейтральной молекулы и катиона MiH+:
мх + MiH+ —> мхн+ + м;. (iv.i8)
При облучении вещества, состоящего из «однородных» молекул,
с определенной вероятностью возникают возбужденные, сверхвоз-
сверхвозбужденные и ионизированные молекулы, а каждый из этих первичных
продуктов имеет много возможностей для дальнейших превращений.
В результате образуются ионы и радикалы разнообразной природы
с широким спектром химических свойств, взаимодействующие друг
с другом и с окружающими молекулами. Эти процессы составляют
третью, или химическую, стадию действия ионизирующего излучения.
Реакции ионов и радикалов формируют различные типы структур-
структурного поражения молекул. Если исследуемые молекулярные структуры
входят в состав биологических систем, то их повреждение может по-
повлечь за собой такие нарушения в этих системах, которые могут стать
проявлением биологического эффекта облучения. Если процессы,
происходящие на химической стадии, заканчиваются в первые 10~6—
10~3 с после облучения, то биологическая стадия может длиться от
нескольких секунд до многих лет (например, вызванное облучением
уменьшение средней продолжительности жизни млекопитающих).
4.3. Химическая стадия
4.3.1. Структурные повреждения, возникающие в облученных
макромолекулах
Повреждения, возникающие в структуре облученной макромолеку-
макромолекулы, могут привести к изменению ее биологических свойств. Поэтому
важнейший этап биофизического анализа механизмов инактивации
макромолекул ионизирующим излучением состоит в выявлении всех
типов структурного повреждения молекул, выяснении природы про-
процессов, приводящих к данному типу повреждения, и в установлении
причинно-следственной связи между типом структурного поврежде-
повреждения и характером изменения биологических свойств макромолекулы.
Эти вопросы изучены все еще недостаточно.
150 Гл. IV. Прямое действие ионизирующих излучений
Анализ структурных повреждений, возникающих в облученной
макромолекуле, представляет сложную экспериментальную задачу,
требующую использования высокочувствительных методов исследо-
исследования.
Структурные повреждения, выявляемые в облученных
нуклеиновых кислотах. При облучении сухих препаратов ДНК воз-
возникает ряд структурных повреждений, которые удается количествен-
количественно оценить, как правило, при использовании высоких доз излучения,
порядка 104 Гр. Это значительно превосходит значение дозы D37 для
различных типов инактивации. Не исключено, что в действительности
инактивация нуклеиновых кислот возникает в результате единичных
повреждений, например вследствие разрушения нескольких нуклео-
тидов. Однако ни одним из современных методов анализа не удается
прямо, не прибегая к расчетам и экстраполяции, обнаружить столь
незначительные повреждения среди десятков тысяч нуклеотидов, со-
составляющих полинуклеотидную последовательность ДНК или РНК.
Для выявления структурных повреждений нуклеиновых кислот,
сопровождающихся изменением их размеров, используют различные
методы измерения молекулярной массы облученного препарата (се-
диментационный анализ, изменение светорассеяния, осмоса, характе-
характеристической вязкости и т.д.), так как молекулярная масса ДНК или
РНК изменяется вследствие разрыва полимерной цепи (двунитевого
в случае ДНК) или из-за возникновения сшивок между молекулами.
Если разрыв произошел только в одной из цепей ДНК, то снижение
молекулярной массы выявляется после щелочной денатурации или
нагревания до 90°.
Количественно число однонитевых разрывов определяют с помо-
помощью фермента фосфомоноэстеразы, который отщепляет неорганиче-
неорганический фосфат от всех концевых монофосфоэфирных групп по местам
разрывов, а количество отщепившегося фосфата измеряют фотомет-
фотометрически.
Влияние облучения на состояние системы водородных связей в
молекуле ДНК оценивают по возникновению в ней участков денату-
денатурации, например, сопоставив количество кислоты, необходимое для
денатурации нативной и облученной ДНК при электрометрическом
титровании.
Один из способов определения меры денатурированности ДНК
основан на использовании гиперхромного эффекта, свойственного
процессу денатурации. Так, коэффициент оптического поглощения
нативной ДНК примерно на 30% ниже, чем для одиночной цепи ДНК
или смеси равного по содержанию в ней количества соответствующих
нуклеотидов, возрастание коэффициента оптического поглощения об-
облученной ДНК указывает на ее денатурацию.
Еще один метод выявления денатурированных участков основан на
хроматографическом отделении неповрежденных молекул от молекул,
имеющих денатурированные участки.
4. Последовательность стадий прямого действия радиации 151
g S 2
1 2 3
Доза облучения, хЮ4 Гр
Рис. IV. 13. Зависимость образова-
образования однонитевых (В\) и двунитевых
{В2) разрывов в сухой ДНК тимуса
теленка от дозы рентгеновского об-
облучения в вакууме
10 20 30 40
50
Коэффициент седиментации S
Рис. IV. 14. Профиль седиментации
ДНК тимуса теленка при облучении
сухих ее препаратов в вакууме в до-
дозе 3 • 104 Гр: а) контроль; б) после
облучения
Наконец, разрушение азотистых оснований в облученной нуклеи-
нуклеиновой кислоте можно обнаружить с помощью специфических химиче-
химических реакций или по уменьшению оптического поглощения.
Использование перечисленных и ряда других методов позволило
установить, что в результате облучения сухих препаратов ДНК воз-
возникают следующие типы структурного повреждения макромолекулы:
- одно- и двунитевые разрывы;
- межмолекулярные поперечные сшивки полинуклеотидных це-
цепей;
- разветвленные цепи вследствие суммарного эффекта одно- и
двунитевых разрывов (за счет присоединения обломков молеку-
молекулы, образовавшихся в результате двунитевого разрыва, к местам
однонитевых разрывов в цепях ДНК).
Результаты одного из экспериментов по определению одно- и двуни-
двунитевых разрывов в ДНК приведены на рис. IV. 13.
Одиночные разрывы нитей ДНК и разрывы в комплементарных
участках обеих нитей пропорциональны поглощенной дозе излучения.
Это означает, что двунитевой разрыв вызывается одиночным собы-
событием потери энергии, а не случайным совпадением двух соседних
однонитевых разрывов (в противном случае кривая B<i имела бы иной
вид). Вероятность двунитевого разрыва возрастает с увеличением
ЛПЭ излучения. Так, при облучении ДНК из фага Т7 ускоренными
ионами аргона однонитевые разрывы встречаются только в 2-3 раза
чаще двухнитевых, в то время как для воздействия 7-излучения это
отношение достигает 5 или 6.
152 Гл. IV. Прямое действие ионизирующих излучений
После облучения сухой ДНК возникают не только разрывы поли-
нуклеотидных нитей, но и сшивки между ними (рис. IV. 14). По срав-
сравнению с контрольными образцами максимум коэффициента седимен-
седиментации облученной ДНК сдвигается в область меньших значений, т. е.
молекулярная масса основной части облученного препарата снижает-
снижается вследствие одно- и двунитевых разрывов. Однако наряду с этим
наблюдается небольшой пик в области 30-50 S, который не отмечен
в контрольном образце. Он соответствует фракции, которая возникла
вследствие сшивок между полинуклеотидными тяжами ДНК.
Механизм возникновения структурных повреждений ДНК в
результате поглощения энергия ионизирующего излучения выяснен
недостаточно. Работы в этом направлении интенсивно продолжаются.
Большее число исследований посвящено анализу начальной стадии
химических изменений в облученных нуклеиновых кислотах, для
которой характерно появление свободных радикалов. Методом ЭПР-
спектроскопии изучают выход и структуру радикалов, возникающих
при облучении свободных азотистых оснований, нуклеозидов и
нуклеотидов. Сопоставление этих спектров с наблюдаемыми при
облучении сухой ДНК позволяет в ряде случаев идентифицировать
радикалы, возникающие в облученных нуклеиновых кислотах.
Один из компонентов сигнала ЭПР облученной ДНК — радикал
тимина, образованный, по мнению ряда авторов, продуктом присо-
присоединения атомарного водорода к Сб-атомам тимина. Аналогичный
эффект можно продемонстрировать при действии на порошкообраз-
порошкообразный образец тимина атомарным водородом, полученным при газовом
разряде: образующиеся сигналы ЭПР сходны с наблюдаемыми в об-
облученных тимидиннуклеотидах и препаратах ДНК. При облучении
атомарный водород отщепляется от остатка дезоксирибозы, радикалы
которой образуются посредством утраты атома водорода и раскрытия
кольца.
В биофизических исследованиях последних лет анализируется
роль эффектов миграции энергии в пределах двунитевой ДНК или
между молекулами.
Ряд данных указывает на возможность передачи энергии от одной
цепи к другой посредством системы водородных связей. Так, при
облучении (при 77 К) 1:1-кокристалла, состоящего из 9-метиладенина
и 1-метилтимина, обнаружили неспецифический сигнал ЭПР. После
нагревания образца до комнатной температуры спектр приобретал
характерные очертания радикала тиминового кольца. Обработанная
таким образом эквимолярная смесь указанных соединений давала
сигнал ЭПР, характерный для суммарного спектра аденина и тими-
тимина. Этот опыт свидетельствует о переносе энергии или спина через
водородные мостики в кокристалле от аденина к тимину.
В облученной ДНК также наблюдают ярко выраженный сигнал
тимина и слабый — аденина. О существовании внутримолекулярного
переноса спина в облученной ДНК свидетельствует изменение сиг-
сигнала ЭПР при нагревании облученных образцов от 77 К до комнат-
комнатной температуры. Анализ форм спектра, полученного при комнатной
4. Последовательность стадий прямого действия радиации 153
температуре, показывает, что он не образуется простым наложением
первичного спектра отдельных составных частей ДНК, а на него
оказывают влияние эффекты ее структурной перестройки.
Интересные данные о механизме возникновения структурных по-
повреждений в облученной ДНК получены в экспериментах с использо-
использованием модифицирующих агентов.
Структурные повреждения облученных ферментов. Слож-
Сложность построения реальной картины возникновения структурных по-
повреждений в облученных белках заключается прежде всего в том, что
необходимо выявить те физико-химические процессы, в результате
которых одиночное событие потери энергии в пределах белковой моле-
молекулы, т. е. поглощение структурой около 60 эВ, вызывает ее генерали-
генерализованное повреждение, такое, например, как изменение конформации.
Первичное событие абсорбции энергии носит вероятностный характер,
т. е. любая из аминокислот с равной вероятностью поглощает энер-
энергию излучения. Тем не менее, оказывается, что конечное структурное
поражение локализуется в специфических участках. Для объяснения
этого эффекта, вероятно, необходимо допустить возможность мигра-
миграции энергии и заряда по полипептидной цепи вплоть до локализации
в определенном структурном звене.
Большинство исследований по радиационной химии протеинов вы-
выполнено на белках с известной первичной структурой. Это позволило
выявить тонкие различия облученных и нативных препаратов.
Анализ структурных повреждений, возникающих в облученных
препаратах рибонуклеазы, показал, что при дозах, близких к D37,
наблюдается:
- изменение аминокислотного состава; заметнее всего в образцах
снижалось содержание б аминокислот: метионина, фенилалани-
на, лизина, гистидина, тирозина и цистина;
- нарушение третичной структуры макромолекулы, оцениваемое
но изменению оптического поглощения и оптического вращения,
доступности остатков тирозина, степени переваривания белка
трипсином и т.д.;
- возникновение разрывов полипептидной цепи, приводящее к по-
появлению свободных амидных групп и фрагментов молекулы;
- появление агрегатов, о наличии которых судили по изменению
константы седиментации и скорости элюции при хроматографии
на колонках из сефадекса;
- разрыв сульфгидрильных связей и появление свободных SH-
групп.
При облучении лизоцима обнаружен несколько иной характер
структурных повреждений:
- изменяется конформация макромолекулы;
154 Гл. IV. Прямое действие ионизирующих излучений
- появляется несколько компонентов, обладающих ферментной ак-
активностью;
- не обнаруживаются изменения в аминокислотном составе макро-
макромолекулы.
Исследование структурных повреждений облученного химотрип-
сина показало, что поглощение энергии ионизирующих излучений
вызывает:
- появление новых хроматографических пиков при элюции облу-
облученного препарата; эти фрагменты утратили ферментную актив-
активность;
- возникновение конформационных изменений, выявляемых по из-
изменению оптического вращения и уменьшению прочносвязанных
амидных атомов водорода;
- разрушение аминокислотных остатков серина и триптофана (в
среднем одна молекула серина и одна триптофана на молекулу
фермента при дозе D37);
- снижение способности активного центра фермента связывать
субстрат.
Структурные повреждения, о которых говорилось выше, наблю-
наблюдаются после облучения в дозе, меньшей или равной D375 т.е. в
случаях, когда в среднем каждая молекула испытывает только одно
событие попадания (см. «одноударные» кривые инактивации, гл. III).
В диапазоне больших доз картина существенно усложняется за счет
возникновения повторных актов взаимодействия, вызывающих допол-
дополнительные повреждения.
Для понимания механизма обнаруживаемых изменений в белках
при облучении в радиационной биофизике прибегают к идентифика-
идентификации свободнорадикальных состояний, возникающих в облученных ма-
макромолекулах. Для этого используются ЭПР-спектроскопия и другие
специальные методы анализа*).
Метод ЭПР (электронного парамагнитного резонанса) основан на вза-
взаимодействии исследуемого вещества с магнитным полем и применяется
для изучения парамагнитных частиц, например, свободных радикалов. В
радиационной биофизике метод ЭПР позволяет оценить процессы, протека-
протекающие с участием свободных радикалов, не только в модельных системах и
биомакромолекулах, но и в клеточных фрагментах, в облученных системах
и биологических объектах.
Установлено, что после облучения ферментов в сухом состоянии
при температуре 77 К на спектрах ЭПР обнаруживается синглетный
См. [57, 163].
4. Последовательность стадий прямого действия радиации
155
77 К
60 Гс
сигнал ЭПР. При нагревании образцов до комнатной температуры
спектр ЭПР представляет собой уже спектр вторичных радикалов,
состоящих из дублетного сигнала (воз-
(возможно, а-углеродных радикалов) и слож-
сложного сигнала серосодержащих радикалов
(рис. IV.15).
При дальнейшем анализе требуется
установить роль наблюдаемых вторичных
радикалов в появлении конечных струк-
структурных повреждений и в эффекте инак-
инактивации фермента. Перспективным для
этого может оказаться использование мо-
модифицирующих агентов, т. е. воздействий,
способных изменить характер возникаю-
возникающих радикальных продуктов. Например,
если эти агенты параллельно изменяют
как спектр ЭПР вторичных радикалов,
так и характер структурных изменений
в ферменте, то можно предположить
причинную связь между появлением вто-
вторичных радикалов и потерей ферментной
активности облученными молекулами.
Рис. IV.15. Спектр ЭПР ри-
бонуклеазы, облученной при
температуре 77 К: а-г) изме-
измерение сигнала ЭПР при раз-
различных температурах
Для локализации радикалов, возникающих в полипептидной цепи
после облучения, применяют метод, основанный на использовании ме-
меченного тритием сероводорода. Образованные излучением радикалы
должны взаимодействовать с 3H2S согласно уравнению
М* + 3H2S —> 3НМ + 3HS\ (IV.19)
Помещая облученную рибонуклеазу в атмосферу 3H2S, а затем под-
подвергая ее гидролизу, устанавливают, в каких аминокислотах содержит-
содержится радиоактивная метка 3Н, т.е. определяют локализацию возникших
радикалов. Опыты показали, что тритий включается (в убывающем
количестве) в лизин, метионин, пролин, гистидин; в небольших кон-
концентрациях тритий обнаруживается в фенил ал анине, изолейцине и
валине. В общем, это соответствует количественному распределению
поврежденных аминокислот в облученной РНКазе.
При комнатной температуре в облученных молекулах все еще
содержится много нестабильных продуктов. При растворении фер-
фермента (необходимом для определения его активности) нестабильные
промежуточные продукты превращаются в стабильные пораженные
структуры. Это может быть связано с реакцией белковых радикалов
или лабильных химических связей в молекуле фермента с водой либо
с увеличением подвижности в растворе отдельных полипептидных
цепей. В опытах с рибонуклеазой было показано, что растворение
облученной молекулы приводит к ее денатурации. Появление свобод-
свободных амидных групп и фрагментов после развертывания глобулярных
структур облученных белков указывает на существование замаскиро-
замаскированных разрывов полипептидной цепи.
156
Гл. IV. Прямое действие ионизирующих излучений
а;
е
70
50
40
30
20
i
i i i
о 1
x 2
1 t
0,5 1,0 1,5 2,0 2,5
Доза облучения, хЮ5 Гр
3,0
Рис. IV. 16. Корреляция между потерей
ферментной активности, поражением ак-
активных центров и конформационными из-
изменениями химотрипсина, подвергнутого
воздействию 7"излУчения 137Cs: 1 — оста-
остаточная ферментная активность; 2 — остав-
оставшиеся непораженными активные центры;
3 — изменение конформации, определяемое
по оптическому вращению Л
В случае с лизоцимом
(D37 инактивации — 266 кГр)
при дозе 300 кГр, как
уже отмечалось, изменения
аминокислотного состава не
происходит. Однако вы-
выявлены конформационные
изменения. Вероятно, они и
обусловливают инактивацию
фермента.
В случае с химотрипси-
ном нет единства взглядов
на роль отдельных струк-
структурных нарушений в эффек-
эффекте инактивации. Данные на
рис. IV. 16 свидетельствуют о
параллелизме между инакти-
вирующим действием излу-
излучения, возникновением кон-
формационных изменений в
облученной молекуле и потерей способности к связыванию субстрата
активным центром.
Эти результаты объясняют по-разному.
Первое объяснение состоит в том, что поглощение энергии излу-
излучения приводит к нарушению конформации белковой молекулы; это,
в свою очередь, вызывает изменение конформации активного центра
и его способности связывать субстрат, что и вызывает инактивацию
фермента.
Другая точка зрения основана на том, что один сериновый и (или)
триптофановый остаток в особом участке химотрипсина, например, в
активном центре, более радиочувствителен, чем такие же аминокис-
аминокислоты в других участках белковой молекулы. Поскольку при дозе D37
в среднем на одну молекулу фермента разрушается по одному сери-
новому и триптофановому остатку, то в случае, если эти ключевые
аминокислоты регулируют конформацию активного центра, их раз-
разрушение приведет к поражению активного центра и, тем самым, к
инактивации химотрипсина.
Схема отдельных этапов радиационной инактивации сухих фер-
ферментов приведена на рис. IV. 17. Она нуждается в дальнейших уточ-
уточнениях.
В последние годы особое внимание уделяют анализу скрытых по-
повреждений, возникающих в облученных белках, и изучению механиз-
механизмов миграции энергии в макромолекулах.
4. Последовательность стадий прямого действия радиации 157
радиация
добавление
Н2О
положи-
положительные
отрица-
отрицательные
фрагменты молекул,
образовавшихся при
разрыве связей
вторичные
реакции
вторичные
радикалы
вторичные
реакции
биологическое
поражение
потеря фермен-
ферментативной
активности
III
промежуточные
продукты
IV
V
конечный
эффект
Рис. IV. 17. Свободнорадикальная модель радиационной инактивации сухих фер-
ферментов: I — спектр первичных продуктов; II — процессы, протекающие на физико-
химической стадии; III — образовавшиеся промежуточные продукты; IV, V —
конечный эффект — инактивация фермента
4.3.2. Миграция энергии излучения в биологических структурах
Анализ кривых «доза-эффект» свидетельствует о том, что инак-
инактивация фермента может произойти в результате одиночного события
потери энергии излучения в любой точке макромолекулы (параметры
мишени совпадают с истинными размерами макромолекулы). Пред-
Представление об одноударности процесса инактивации означает, что по-
поглощение энергии в любой точке молекулы однозначно приводит к
изменению ее биологических свойств. Однако при объяснении меха-
механизма инактивации фермента в результате одиночного события по-
попадания следует иметь в виду, что определенный тип инактивации
(например, утрата субстратной специфичности) может быть связан со
структурным повреждением, возникшим не в любом, а, скорее всего, в
определенном участке макромолекулы. Теоретический анализ спектра
сил осцилляторов молекулы и результаты прямых измерений поте-
потери энергии, приходящейся на одно взаимодействие, показывают, что
ускоренные заряженные частицы с большой вероятностью переносят к
макромолекуле значительные порции энергии, в среднем около 60 эВ.
Этого более чем достаточно для разрыва любой химической связи и
удаления электрона из молекулы.
Можно было бы думать, что разрыв химической связи, в какой бы
точке макромолекулы он ни произошел, приведет к ее денатурации и
потере функциональной активности. Это не всегда так.
Для многих ферментов показано, что при дозе D^7, когда в сред-
среднем одиночному попаданию подвергается каждая макромолекула, на-
наблюдается утрата лишь некоторых функциональных свойств, в то
158 Гл. IV. Прямое действие ионизирующих излучений
время как другие остаются без изменения. Так, для рибонуклеазы,
облученной в дозе D375 отмечена потеря каталитической активности
при сохранении способности связывать специфический субстрат. Это
подтверждает точку зрения, согласно которой в результате одиноч-
одиночного акта абсорбции энергии структурное повреждение локализуется
в определенном звене макромолекулы, обусловливая специфический
характер инактивации.
Возможное объяснение селективного действия облучения состоит
в том, что, хотя первоначальное событие поглощения энергии с оди-
одинаковой вероятностью происходит в любом звене макромолекулы (на-
(например, в любой из сотен аминокислот, составляющих фермент), су-
существует возможность миграции поглощенной энергии и «остановки»
процесса в определенном «слабом звене», которое будет претерпевать
дальнейшие химические изменения.
Существует ряд прямых способов доказательства миграции энер-
энергии возбуждения внутри молекулы и между молекулами.
Термолюминесценция возникает как следствие рекомбинации (по
мере повышения температуры) короткоживущих продуктов, «заморо-
«замороженных» при температуре жидкого азота. Повышение температуры
приводит к увеличению подвижности первичных продуктов (корот-
(короткоживущих радикалов, электронов), что способствует реакциям их
друг с другом и образованию вторичных продуктов. В процессе этих
реакций и регистрируется термолюминесценция.
Измерение сигнала ЭПР. Мы уже отмечали, что характерный для
исследуемого радикала сигнал ЭПР возникает в результате взаимо-
взаимодействия магнитного момента неспаренного электрона с магнитными
полями окружающих ядер и электронов, т. е. сигнал ЭПР изменяется
в зависимости от локализации неспаренного электрона.
На рис. IV. 18 приведен характерный спектр ЭПР при комнатной
температуре белка, облученного при низкой температуре. С повыше-
повышением температуры, как было показано на рис. IV. 15, сигнал ЭПР
изменяется от синглета до характерного спектра, в котором можно
выявить сигналы глицинподобного серосодержащего радикала.
Ранее мы упоминали, что при облучении смеси молекул двух типов
суммарный сигнал ЭПР отличается от теоретической суммы спектров
ЭПР этих молекул. Еще одно доказательство получено при изуче-
изучении облученной глицеральдегиддегидрогеназы. В спектре ЭПР этого
фермента после облучения не обнаруживается сигнал радикала серы.
Если же к облученному ферменту добавить цистеамин, то в спектре
ЭПР этой смеси регистрируют появление сигнала, характерного для
радикала серы, т.е. можно предположить, что в результате межмоле-
межмолекулярного переноса энергии от облученного белка к необлученному
цистеамину в последнем произошел отрыв атома водорода от SH-
группы.
Реакция присоединения. Существование этого типа реакций прямо
указывает на возможность переноса энергии от облученных белков
к низкомолекулярным молекулам-примесям. Перенесенная энергия
4. Последовательность стадий прямого действия радиации
159
рентгеновские
лучи
Н радикал водорода
сн2 \
I \
^т глициноподобный
/ * радикал
Рис. IV. 18. Схема образования при комнатной температуре вторичных радикалов
в белках, облученных при низкой температуре: а) полипептидная цепь до облуче-
облучения; б) полипептидная цепь после облучения; стрелки обозначают спины электро-
электронов; в) спектр ЭПР при 295 К трипсина, облученного в вакууме электронами с
энергией 6,5 МэВ
160 Гл. IV. Прямое действие ионизирующих излучений
расходуется на отрыв от молекулы-примеси «Н—М» атома водорода,
который присоединяется к радикалу белка:
К + НМ —> R-H + М*. (IV.20)
Протекание такой реакции доказано в экспериментах с серово-
сероводородом, меченным тритием 3Н, описанных выше (см. (IV. 19)). В
экспериментах с облученной рибонуклеазой, обработанной 3H2S, были
отмечены следующие эффекты:
- исчезновение сигнала ЭПР облученного белка;
- преимущественное включение метки в определенные типы ами-
аминокислот, главным образом, в остаток цистина;
- соответствие между количеством включенного трития и числом
свободных радикалов, возникающих в облученном белке при
данной величине поглощенной дозы радиации.
Такие результаты свидетельствуют о межмолекулярном переносе
энергии от облученной рибонуклеазы к необлученному сероводороду.
Соответствие между общим количеством включенного в аминокисло-
аминокислоты трития и радиационно-химическим выходом радикалов указывает
на возникновение в облученном белке нескольких типов радикалов из
различных аминокислотных остатков.
Механизмы переноса энергии выяснены недостаточно. Экспери-
Эксперименты по изучению термолюминесценции свидетельствуют о переносе
энергии возбуждения с помощью особых структур, таких, как трипто-
фановые кольца и кольца тирозина и фенилаланина, а в нуклеиновых
кислотах — за счет расположенных в одной плоскости пуриновых и
пиримидиновых оснований.
Еще один возможный механизм переноса энергии — это миграция
электронов через зону проводимости с последующим захватом их
положительно заряженными «дырками».
Эксперименты с 3H2S и анализ спектров ЭПР указывают на пе-
перенос энергии за счет миграции малых радикалов, таких, как атом
водорода, NH3 и другие небольшие фрагменты облученных молекул.
Перенос энергии возбуждения и перенос электронов требуют уча-
участия специальных структур и, возможно, высоких энергий активации,
тогда как экспериментально наблюдаемые значения энергии актива-
активации радикалообразования и инактивации различных молекул доволь-
довольно малы. Эти факты позволяют предположить, что именно перенос
радикалов имеет большое значение в процессах миграции энергии при
прямом действии радиации.
5. Модификация лучевого повреждения макромолекул
Чувствительность макромолекул к радиационному воздействию
можно изменить по меньшей мере в два или три раза в зависимости
от условий во время облучения или после него. К числу агентов,
5. Модификация лучевого повреждения макромолекул
161
е
ии
80
60
40
30
20
10
5
-Л37 = 200\
КГр
—
"Ill
ЧЧ^ 1
D37 = 42(N
\ КГр
V
1 1X1 1 1
J_
120 240 360 480 600
Давление, мм рт. ст.
720
0 2 4 6 8
Доза облучения, хЮО Гр
Рис. IV. 19. Инактивация сухой
РНКазы 7-излучением 60Со в вакуу-
вакууме A) ив присутствии кислорода B)
Рис. IV.20. Относительная чувстви-
чувствительность сухого трипсина к действию
7-излучения в зависимости от содер-
содержания кислорода во время облучения
(за единицу принята радиочувствитель-
радиочувствительность трипсина в вакууме)
которые модифицируют радиочувствительность макромолекул, от-
относятся кислород, температурное воздействие, присутствие молекул-
примесей и др. Каждый из этих факторов, естественно, не может
повлиять на физический акт переноса энергии излучения к макро-
макромолекуле, и все-таки эти воздействия способны усилить или ослабить
лучевое повреждение. Поэтому считают, что модифицирующие агенты
влияют не на первичные акты абсорбции энергии, а на более поздние
этапы лучевого поражения. Например, они могут изменить характер
миграции энергии внутри макромолекулы или между молекулами,
избирательно защитить определенные функциональные группы, ре-
парировать лучевые повреждения или изменить характер физико-
химических реакций, в которые вступают облученные молекулы.
5.1. Модифицирующее действие кислорода
В экспериментах с сухими препаратами ферментов было уста-
установлено, что их радиочувствительность значительно возрастает, если
облучение проводится в атмосфере кислорода, а не в вакууме.
На рис. IV. 19 представлены результаты эксперимента по сопостав-
сопоставлению эффективности инактивации сухой РНКазы 7-излучением в ва-
вакууме и в атмосфере кислорода. Значение дозы D37 для инактивации
рибонуклеазы в вакууме примерно вдвое выше, чем в атмосфере О2.
Приведем еще один пример модифицирующего влияния кислорода
на прямое действие облучения (рис. IV.20). На рисунке видно, что да-
даже незначительное содержание кислорода в среде приводит к резкому
возрастанию инактивирующего действия данной дозы облучения. При
увеличении давления О2 примерно до 120 мм рт. ст. эффект инактива-
инактивации возрастает; дальнейшее повышение содержания кислорода в среде
оказывается неэффективным.
11 Ю.Б. Кудряшов
162 Гл. IV. Прямое действие ионизирующих излучений
Механизм кислородной радиосенсибилизации молекул в прямом
действии излучения выяснен все еще недостаточно. Ряд исследовате-
исследователей (например, Дертингер и Юнг, 1973) объясняли способность кисло-
кислорода повышать чувствительность макромолекул к прямому действию
излучения тем, что некоторые молекулы, изначально получившие по-
повреждение, восстанавливаются в отсутствие кислорода в результате
одного из таких процессов:
(ионизированная молекула) МН+ + е~ —У МН, (IV.21)
(свободнорадикальное м- + н- _^ мн fIV22)
состояние молекулы) ' v J
а кислород ингибирует обе реакции либо за счет перехвата электрона,
либо за счет превращения радикала М' в перекисный радикал ЪА0'2
(в последнем случае возникает необратимое повреждение, связанное с
пероксидацией радикала М').
В обоих случаях предполагается, что кислород оказывает потенци-
потенцирующее действие, т. е. он не увеличивает истинное число первичных
повреждений, а тормозит или полностью прекращает протекание вос-
восстановительных процессов.
5.1.1. Кислородное последействие
Л. X. Эйдус и его сотрудники обнаружили пострадиационное дей-
действие кислорода на ферменты, которое было названо кислородным
последействием. Один из экспериментов, в которых был обнару-
обнаружен этот эффект, состоял в следующем. Ампулы с сухим пепсином
облучали в анаэробных условиях в дозах, в 1,5 раза превышающих
дозу D375 затем облученный фермент переносили (без доступа О2)
в герметическую камеру, наполненную аргоном, где и проверяли ак-
активность фермента. Было показано, что при облучении ферментная
активность не теряется и в анаэробных условиях может сохраняться
длительное время. В отсутствие воды кислород также не оказывал
инактивирующего действия, и лишь при увлажнении препарата про-
происходила его инактивация под действием кислорода, степень которой
увеличивалась с ростом поглощенной дозы.
Существование долгоживущих скрытых повреждений*), реализу-
реализуемых при взаимодействии с кислородом, доказано, по крайней мере,
для некоторых ферментов по критерию их инактивации. Отсутствие
поражения некоторых объектов при анаэробном облучении свидетель-
свидетельствует, что кислород не просто один из агентов, модифицирующих
поражение, а необходимый участник определенных видов поражения.
*) Согласно принятому определению, «скрытое (потенциальное) повре-
повреждение — это состояние, при котором исследуемые свойства макромолекулы
после ее облучения не отличаются от исходных (имеется в виду эмпириче-
эмпирическая структура молекулы), но могут стать иными в силу дополнительных
внешних воздействий или в результате процессов, происходящих в объекте»
(Эйдус Л.Х., 1972).
5. Модификация лучевого повреждения макромолекул
163
При этом кислород может оказать поражающее действие, присутствуя
не только во время облучения, но и после его окончания.
По мнению ряда радиобиологов, в облученном образце возникают
два вида поражения: первый требует присутствия кислорода непо-
непосредственно «под лучом», второй способен длительное время сохра-
сохраняться в отсутствие кислорода, т. е. образуются соответственно корот-
коживущие и долгоживущие «скрытые» повреждения.
Анализ физико-химических процессов, приводящих к возникнове-
возникновению скрытых повреждений, требующих для своей реализации кисло-
кислорода, актуален и в настоящее время. В частности, продолжается иссле-
исследование связи этих эффектов с возникающими в результате облучения
свободными радикалами (кислород влияет на спектр ЭПР облученных
биомакромолекул и в ряде случаев даже приводит к исчезновению
сигнала ЭПР облученных белков).
В целом, проблема возникновения и реализации скрытых повре-
повреждений далека от окончательного разрешения и продолжает оставать-
оставаться предметом радиационно-биофизического изучения.
5.2. Влияние температуры во время прямого действия радиации
Радиочувствительность многих макромолекул зависит от темпера-
температуры во время облучения. Пример этого приведен на рис. IV.21, где
показана инактивация сухой
Й lOOle
а 80-
РНКазы 7-излучением при трех
различных температурах.
Механизм температурного
эффекта также окончательно
еще не установлен. Предпола-
Предполагают, что константа скорости
реакции (или реакций), опреде-
определяющей инактивацию макромо-
макромолекулы, зависит от повышения
температуры. По крайней мере
некоторыми из таких реакций
могут быть взаимодействия ма-
макромолекул с атомарным во-
водородом и другими малыми
радикалами, которые высвобо-
высвобождаются при облучении органи-
органических материалов и, вероятно,
В 60-
а;
е
2 3 4 5 6
Доза облучения, хЮ5 Гр
Рис. IV.21. Инактивация РНКазы 7-из-
7-излучением 60Со в вакууме при различ-
различных температурах
атакуют непораженные молекулы.
5.2.1. Температурное последействие
В облученных белковых молекулах возникают скрытые поврежде-
повреждения, переходящие в явные при дополнительном тепловом воздействии.
Например, возникающие внутримолекулярные повреждения приводят
к инактивации фермента после обработки облученного препарата теп-
теплом. Тепловое воздействие эффективно и после аэробного облучения,
т. е. в результате нагрева реализуются иные скрытые повреждения,
чем те, на которые способен воздействовать кислород. Таким образом,
и*
164
Гл. IV. Прямое действие ионизирующих излучений
2,0 р
2,2
H О
О S
1,8
1,4
1,0
i
0 0,1 1 10 100
Концентрация глутатиона,
ммоль
Рис. IV.22. Влияние глутатиона на ра-
радиочувствительность инвертазы (смесь 5%
инвертазы и глутатиона в разных концен-
концентрациях высушивали, а затем подвергали
воздействию рентгеновского излучения)
0,01 0,1 1
мг цистерина/мг РНКазы
Рис. IV.23. Зависимость фактора
уменьшения дозы ФУД радиацион-
радиационной инактивации рибонуклеазы от
концентрации прибавленного ци-
стамина. ФУД = (?>37 в присут-
присутствии цистамина)/A)з7 для чисто-
чистого фермента)
в одной и той же макромолекуле могут возникать по крайней мере два
типа скрытых повреждений: независимые от кислорода и зависимые
от присутствия его. В то же время под влиянием тепла не могут быть
реализованы все типы скрытых повреждений.
Природа скрытых повреждений, требующих для своей реализации
дополнительного теплового воздействия, продолжает исследоваться в
настоящее время.
5.3. Роль молекул-примесей
Облучение белка в смеси с рядом низкомолекулярных веществ
может либо уменьшить его радиочувствительность (эффект защиты),
либо увеличить ее (эффект сенсибилизации). Наиболее выраженным
защитным действием в сухих системах обладают тиолы (аминотиолы)
и инд оли л ал кил амины, известные в радиобиологии как классические
радиопротекторы.
На рис. IV.22 показано, как изменяется относительная радиочув-
радиочувствительность инвертазы (ее оценивали по величине дозы D37) в за-
зависимости от концентрации прибавленного глутатиона.
Для количественной оценки эффективности защитного агента ча-
часто определяют значение фактора уменьшения дозы (ФУД), которая
определяется как отношение величины дозы D37 (или D50) в присут-
присутствии защитного агента к ее значению в отсутствие указанного агента.
На рис. IV.23 показано изменение величины ФУД для рибонуклеазы
в зависимости от концентрации цистамина, прибавленного к ней в
качестве «защитного» агента.
5. Модификация лучевого повреждения макромолекул 165
Не все примесные молекулы защищают белки. Так, прибавление
сахарозы увеличивает степень инактивации рибонуклеазы в 2,6 раза.
Аналогичным действием обладает целый ряд углеводов.
Выяснение механизма защитного и сенсибилизирующего действия
примесных молекул служит предметом радиационно-биофизического
анализа. Прогресс в этой области во многом зависит от понимания
природы начальных поражений, возникающих в облученных макро-
макромолекулах.
Существует ряд гипотез о механизме защиты макромолекул низ-
низкомолекулярными соединениями. Прежде всего, защитное действие
последних может осуществляться за счет конкуренции за высокоак-
высокоактивные свободные радикалы (атомарный водород и другие фрагменты
облученных молекул), которые могут вызывать структурные пораже-
поражения макромолекулы. Другая возможность состоит в том, что защит-
защитный агент способствует восстановлению пораженной макромолекулы
за счет переноса водорода с защитного вещества РН на свободный
радикал пораженной биомакромолекулы R' по типу реакции (IV.6).
Показано, что тиольные радиопротекторы (цистеамин, глютатион
и др.) репарируют возникающие при радиолизе биополимеров (бел-
(белки, ДНК, полисахариды) повреждения: пространственно-затруднен-
пространственно-затрудненные фенолы реагируют с макрорадикалами по типу (IV.6).
Использование термина «репарация повреждений» для физико-
химического уровня исследований требует разъяснений. Строго гово-
говоря, репарация по отношению к макрорадикалам ДНК, например, по
реакции (IV.6), возможна лишь в случае, если неспаренный электрон
(свободная валентность) находится на 2-дезоксирибозном остатке (ра-
(радикал образуется по реакциям (IV.8) и (IV.9)). При этом макроради-
макрорадикал в присутствии радиопротектора прекращает свое существование.
Тем самым снижается количество разрывов в сахарофосфатной цепи
ДНК, поскольку эти разрывы — результат превращений 2-дезоксири-
бозильных радикалов с неспаренным электроном на атомах углерода
в положениях СЗ, С4 и С5.
Если же в макрорадикале ДНК неспаренный электрон локализован
на каком-либо из оснований, то реагируя с молекулой ингибитора
(по реакции (IV.6)), исходная структура макромолекулы не восста-
восстанавливается — из оснований образуются молекулы с насыщенными
связями. В таком модифицированном нуклеотиде в составе ДНК N-
гликозидная связь (между 2-дезоксирибозилом и основанием) подвер-
подвергается гидролитическому расщеплению. В результате в ДНК появ-
появляются апуриновые и апиридиновые сайты. При возрастании рН в
измененных местах нитей ДНК образуются разрывы.
Были предложены гипотезы, связывающие защитное действие низ-
низкомолекулярных веществ с процессами межмолекулярной миграции
энергии, т. е. полагают, что в облученном межмолекулярном комплексе
«макромолекула-примесь» возможна миграция энергии и заряда. В
зависимости от того, какая из компонент этого комплекса является до-
донором или акцептором, возможно ослабление или усиление поврежде-
повреждения биомакромолекулы. Эффективность миграции энергии зависит от
166 Гл. IV. Прямое действие ионизирующих излучений
степени комплексообразования. Показано, что в механической смеси
(комплексообразование отсутствует) защитный агент обладает гораз-
гораздо более слабым действием, чем при наличии комплекса защитного
соединения и макромолекулы (комплекс получают из раствора при
совместном осаждении макромолекулы и защитного соединения). В то
же время известно, что при комплексообразовании миграция заряда
гораздо сильнее, чем в механической смеси этих же веществ. Веро-
Вероятно, за счет миграции энергии и заряда защитный агент «отводит»
избыточную энергию, поглощенную облученной макромолекулой.
Модифицирующее действие низкомолекулярных примесных моле-
молекул используют для выяснения роли миграции энергии в начальных
радиобиологических процессах, тем более что в реальных условиях (в
ядре, цитоплазме или органоидах) биомакромолекулы окружены низ-
низкомолекулярными соединениями, которые могут служить донорами
или акцепторами поглощенной энергии излучения.
Использование модифицирующих агентов стало традиционным
приемом биофизического анализа первичных процессов лучевого по-
поражения макромолекул и значительно более сложных систем, вклю-
включая клетку и многоклеточный организм. Таким образом, пытаются
подойти к выяснению роли свободных радикалов в возникновении
структурных повреждений и последующей инактивации макромоле-
макромолекул. Представляет интерес использование агентов, видоизменяющих
выход первичных радикалов или их характер, с последующим изуче-
изучением структурных повреждений, возникающих в модифицированных
условиях.
Изучение кислородного и температурного последействия выяви-
выявило существование «скрытых» повреждений, требующих для своей
реализации дополнительного, нерадиационного воздействия во время
облучения и после него. Это означает, что в ряде случаев одного
лишь прямого лучевого воздействия недостаточно для инактивации
макромолекулы.
Использование модифицирующих агентов перспективно для выяс-
выяснения причинно-следственной связи между различными типами ра-
радиационного поражения макромолекулы и характером изменения ее
биологических свойств. Логика такого исследования состоит в следу-
следующем.
Пусть модифицирующий агент видоизменяет характер инактива-
инактивации макромолекулы; например, в его присутствии облученный фер-
фермент сохраняет сродство к субстрату, хотя и утрачивает каталити-
каталитическую активность, а без модифицирующего агента облучение инак-
тивирует обе функции макромолекулы. В этом случае интересно со-
сопоставить структурные повреждения, возникающие в присутствии
модифицирующего агента и без него. Если в отсутствие модифици-
модифицирующего агента наблюдаются какие-то дополнительные структурные
повреждения, то можно предположить, что с ними связана потеря
субстратной специфичности облученного фермента.
5. Модификация лучевого повреждения макромолекул 167
Для проверки такого предположения необходимы строгие
количественные исследования, например сопоставление радиационно-
химического выхода данного типа структурного поражения и выхода
инактивированных молекул, концентрационных зависимостей и т.д.
Если это возможно, следует вызвать такие же повреждения иными,
нерадиационными воздействиями и оценить, к каким последствиям
для фермента это приведет.
Материал этой главы посвящен рассмотрению биофизических под-
подходов к анализу механизмов инактивации биомакромолекул ионизиру-
ионизирующим излучением. В общем ряду радиобиологических проблем этот
вопрос имеет первостепенное значение: радиационное поражение лю-
любой биологической системы, от вируса до многоклеточного организма,
начинается с инактивации небольшого числа молекул, составляющих
биологический объект.
Облученные сухие гомогенные препараты ферментов или нукле-
нуклеиновых кислот — «идеальная» система для первоначального био-
биофизического анализа. В живой клетке на первичные радиационные
повреждения макромолекул накладываются эффекты, гораздо более
сложные и пока еще не определенные: расширение поражения за счет
метаболических реакций, восстановление пораженной молекулы за
счет функционирования репарирующих систем, эффекты, связанные
с гетерогенностью облучаемой системы, присутствием воды, липидов
и низкомолекулярных субстратов и т. д. Следовательно, изучение ме-
механизмов инактивации сухих препаратов — только первый необходи-
необходимый этап на пути познания природы радиобиологических процессов,
протекающих при облучении клетки и организма.
В то же время изучение инактивирующего действия ионизирую-
ионизирующей радиации на макромолекулах представляет и самостоятельный
интерес как метод анализа функциональных свойств отдельных суб-
субмолекулярных структур. В этом случае ионизирующее излучение вы-
выступает в качестве уникального «инструмента» биофизического ана-
анализа ферментов, нуклеиновых кислот и различных надмолекулярных
комплексов: ДНП, хроматина, рибосом и т.д.
Используя математический аппарат теории мишени, можно на
основании экспериментальных кривых «доза—эффект» установить
геометрические размеры мишени, ответственной за данный тип
инактивации макромолекулы. Модифицируя условия облучения, в
ряде случаев можно добиться возникновения селективных поражений
макромолекулы и оценить их роль в эффекте инактивации (например,
если в результате облучения фермента разрушается определенный
аминокислотный остаток и при этом нарушается конформация
активного центра и исчезает сродство к субстрату, то можно
предположить, что данный структурный участок регулирует
конформацию активного центра).
168 Гл. IV. Прямое действие ионизирующих излучений
Преимущество использования радиационного воздействия состоит
еще и в том, что с его помощью можно добиться возникновения
узколокальных повреждений в любом участке молекулы;при этом дру-
другие структурные звенья останутся неповрежденными (существенно,
что при этом макромолекулы могут оставаться сухими, находиться
в вакууме или в любой газовой смеси, быть замороженными до лю-
любой температуры или параллельно подвергаться иным воздействиям).
Тем не менее, предстоит еще многое сделать для воссоздания
целостной картины, которая развертывается от момента ионизации
или возбуждения макромолекулы, поглотившей энергию излучения,
до ее химического повреждения и инактивации. Необходим дальней-
дальнейший глубокий теоретический анализ спектра первичных возбуждений
макромолекул, детальное выяснение процессов миграции энергии и
заряда внутри молекулы и между молекулами. В результате экспе-
экспериментальных исследований предстоит установить спектр первичных
продуктов и характер их дальнейших преобразований до возникнове-
возникновения стабильного радиационного повреждения. И, наконец, предстоит
выяснить вклад определенных типов структурного повреждения
в суммарный эффект функциональной инактивации макромолекул.
Глава V
НЕПРЯМОЕ ДЕЙСТВИЕ ИОНИЗИРУЮЩЕГО
ИЗЛУЧЕНИЯ
1. Общая характеристика непрямого действия
ионизирующих излучений на макромолекулы в водных
растворах
В общих чертах механизм лучевого поражения биомакромолекул
представляет следующую цепь процессов. К молекуле переносится
и поглощается ею дискретная порция энергии излучения (вероятнее
всего, она составляет 10-30 эВ над основным состоянием). Поглощен-
Поглощенная энергия растрачивается на ионизацию, сверхвозбуждение и возбу-
возбуждение. Ионизированные и возбужденные молекулы нестабильны —
для образования стабильных структур электронные конфигурации
их должны претерпеть определенную перестройку за счет миграции
энергии внутри молекулы или между молекулами. В конечном ито-
итоге избыточная энергия оказывается в определенном «слабом звене»,
которое испытывает химическое изменение. Возникшее структурное
повреждение может привести к определенному типу инактивации (ха-
(характер инактивации определяется функциональной ролью поражен-
пораженного структурного звена макромолекулы).
Представим, что облучению подвергаются не высушенные или
кристаллические препараты, а водные растворы их в низкой кон-
концентрации, в которых каждую биомакромолекулу окружает множе-
множество молекул воды. Вероятность поглощения энергии ионизирующего
излучения водой или органической молекулой примерно одинакова
(см. уравнение A1.15)). Поэтому в разбавленных водных растворах
большая часть энергии будет поглощаться молекулами воды, которых
значительно больше, чем растворенных биомакромолекул.
Если в результате поглощения энергии ионизирующего излучения
вода становится «химически активной», то растворенные молекулы
будут испытывать дополнительное поражение. В этом случае эф-
эффективность лучевого поражения макромолекул в водных растворах
должна быть значительно выше, чем в сухих препаратах.
На рис. V.1 сопоставлена радиочувствительность рибонуклеазы в
сухих препаратах и в водном растворе. Как следует из данных экспе-
эксперимента, если значение дозы D37 Для инактивации сухого фермента
составляет 420 кГр, то в водном растворе сравнимая инактивация
достигается после облучения в дозе 4 кГр. Такой результат характерен
170 Гл. V. Непрямое действие ионизирующего излучения
для различных макромолекул —
белков, нуклеиновых кислот, и др.;
в разбавленном водном растворе их
радиочувствительность возрастает в
десятки и сотни раз.
Зависимость «доза-эффект» при
облучении водных растворов макро-
макромолекул носит экспоненциальный
^g^характер, аналогично наблюдаемо-
4 му при облучении сухих препаратов.
Это указывает на одноударность
Рис. V.l. Инактивация 7-излуче- процесса инактивации. При одно-
= Р(^УяТ13рЬивВаяГиМвСОвС™: УД^ном механизме объем мише-
ном растворе фермента в концен- ни, ответственной за инактивацию,
трации 5 мг/мл (нижняя кривая) пропорционален 1/?>37 (см. уравне-
уравнение (III.8)). Из сравнения доз D37
для инактивации сухого и растворенного ферментов можно было бы
заключить, что в растворе размер чувствительной мишени, инакти-
вируемой одиночным попаданием кванта энергии, возрастает в сотни
раз по сравнению с размером мишени для инактивации этого же фер-
фермента в высушенном состоянии. Такое предположение маловероятно.
Объем макромолекулы не может увеличиться в сотни раз в результате
растворения ее в воде.
Убедительнее предположение, согласно которому в растворе фор-
формальная мишень охватывает область, превосходящую линейные раз-
размеры макромолекулы, и включает в себя прилегающие к ферменту
молекулы воды. Тогда одиночное попадание не только в пределы
рассматриваемой белковой молекулы, но и в окружающие ее молекулы
воды может привести к ее инактивации.
Для рассматриваемого случая поражения мишеней, растворенных
в воде, вводится понятие «эффективного объема», или такого объ-
объема, из любого места которого энергия попадания, не растраченная
до уровня, более низкого, чем порог действия, тем или иным путем
достигнет «места действия» (например, определенного структурного
звена макромолекулы, ответственного за инактивацию) и приведет к
возникновению «единицы реакции» (т.е. к инактивации фермента).
В водном растворе энергия, поглощенная растворителем, может пе-
передаваться растворенной макромолекуле за счет диффузии активных
продуктов радиолиза воды.
В принципе, более высокую радиочувствительность макромолеку-
макромолекулы в водном растворе можно было бы объяснить снижением энергии
активации. В этом случае на каждые 100 эВ поглощенной энергии
в растворе инактивировалось бы значительно больше молекул, чем
в сухом препарате. Для сравнения энергий активации необходимо
2. Биофизический анализ радиационной инактивации в растворах 171
определять величину радиационно-химического выхода G инактива-
инактивации фермента в растворе и в сухом препарате из соотношения
^ _ число образованных или пораженных молекул ,, j 1 ч
100 эВ поглощенной энергии
В опытах с РНКазой установлено, что G в сухом препарате рав-
равна 1,68, в водном растворе — 0,89. Обе величины относительно мало
отличаются друг от друга. По-видимому, причина повышения радио-
радиочувствительности фермента в водном растворе связана не с изменени-
изменением его физико-химических свойств в результате растворения (энергия
активации изменилась незначительно), а с появлением в облученной
воде дополнительных поражающих факторов — активных продуктов
радиолиза воды. Поэтому правильнее говорить не об истинном повы-
повышении радиочувствительности макромолекулы, а об увеличении эф-
эффективности данной дозы, которое обусловлено увеличением объема
чувствительной мишени. В мишень большего размера более вероятно
одиночное попадание, приводящее к инактивации.
Для изучения механизма радиационной инактивации растворен-
растворенных в воде молекул необходимо осуществить ряд логически связанных
друг с другом этапов биофизического анализа:
- изучить характер радиационно-химического превращения моле-
молекул воды, природу возникающих активных продуктов, их физи-
физико-химические свойства и реакционную способность;
- установить кинетические характеристики процесса инактивации
растворенных молекул;
- определить основные типы реакций, в которые могут вступать
органические молекулы и продукты радиолиза воды;
- исследовать характер структурных повреждений, возникающих
в биомакромолекулах, взаимодействующих с активными про-
продуктами радиолиза воды, и найти причинно-следственную связь
между типами структурного повреждения и характером инакти-
инактивации растворенных макромолекул.
Далее мы кратко рассмотрим ряд методических подходов к ре-
решению перечисленных задач и остановимся на некоторых важных
результатах, полученных в биофизических исследованиях.
2. Биофизический анализ радиационной инактивации
молекул в растворах
2.1. Радиационно-химические превращения молекул воды
На рис. V.2 представлен оптический спектр поглощения воды,
дающий представление о распределении сил осцилляторов молеку-
молекулы Н2О *). В части спектра, соответствующей обычному возбуждению
*) Оптический спектр Н2О и его трактовка заимствованы из работы
Р. Л. Платцмана A972).
172
Гл. V. Непрямое действие ионизирующего излучения
0,30
PQ
75
0,20
-0,10
ионизация
возбуждение
сверхвозбуж
Рис. V.2. Оптический спектр погло-
поглощения воды
с энергией, меньшей потенциала
ионизации / = 12,6 эВ, мож-
можно различить три области. По-
Полоса непрерывного поглощения с
наименьшей энергией обусловлена
только переходом, который приво-
приводит к диссоциации с образованием
основного (электронного) состоя-
состояния Н + ОН и ответственен за из-
известную непрозрачность воды во
всех фазовых состояниях для длин
волн короче 180 нм. В другие по-
полосы возбуждения входят как об-
область непрерывного поглощения,
так и ряд отчетливых полос, в которых соответствующие им наиболее
распространенные первичные продукты диссоциируют на Н и ОН*
или Н2 и О.
Область сверхвозбуждения простирается от /о до энергии
около 30 эВ. Сверхвозбуждение возникает в результате пример-
примерно 63% всех первичных событий, происходящих без ионизации, а кон-
конкуренция между двумя путями — ионизацией и диссоциацией — была
доказана экспериментально. Сверхвозбужденные молекулы Н2О*
могут диссоциировать на два радикала:
Н2О* —>Н' +ОН\ (V.2)
Конкурирующий процесс — «автоионизация» сверхвозбужденной мо-
молекулы воды:
Н2О* -^Н2О+ + е~. (V.3)
Большая часть энергии осцилляторов превосходит потенциал
ионизации. Перенос к молекуле Н2О и передача ей энергии, большей,
чем /о, с высокой вероятностью приводят к ионизации:
Н2О-^Н2О+ + е-. (V.4)
Ионы Н2О+ могут находиться в различных электронных состоя-
состояниях, одни из которых стабильны, а другие приводят к диссоциации.
Концентрация колебательной энергии на определенных связях может
привести к распаду иона:
Н2О+ -^Н+ + ОН\ (V.5)
Свободные радикалы Н' и ОН' пространственно не разобщены,
поэтому они могут с большой вероятностью рекомбинировать с об-
образованием молекулярных продуктов:
Н+ОН—^Н2О, (V.6)
Н+Н" ¦
он- + он"
н2,
> н2о2.
(V.7)
(V.8)
2. Биофизический анализ радиационной инактивации в растворах 173
Чем выше ЛПЭ излучения, тем больше свободных радикалов воз-
возникает на единицу пути частицы и тем соответственно выше веро-
вероятность их рекомбинации с образованием молекулярных продуктов
согласно реакциям (V.6)-(V.8).
До середины 60-х гг. считалось, что при облучении водных раст-
растворов макромолекул косвенное поражение их происходит за счет взаи-
взаимодействия с радикалами Н', ОН' и перекисью водорода. Это соответ-
соответствовало гипотезе, высказанной еще в 1944 г. Вейсом. Роль свободного
электрона, возникающего в реакциях (V.3), (V.4), оставалась невыяс-
невыясненной.
По одной схеме (Вейс, 1944) предполагалось, что электрон пере-
переходит на соседний ион водорода Н+ и превращает его в радикал Н'.
Согласно схеме Ли A946) электрон захватывается молекулой воды
с образованием отрицательно заряженного иона Б^О", который рас-
распадется на ОН~ и Н'. Однако существование ионов Н^О" даже в
качестве промежуточных продуктов доказать не удалось. Дальнейшие
исследования привели к открытию в облученной воде особой стабили-
стабилизированной формы электрона, которая получила название «гидрати-
«гидратированный электрон».
Гидратированный электрон, обозначаемый е^др, возникает в ре-
результате стабилизации свободного электрона в «потенциальной яме»,
образованной поляризованными молекулами воды (рис. V.3, а, б).
Растеряв на возбуждение и ионизацию
среды большую часть энергии, элек- а
трон продолжает взаимодействовать с ^ (~} Q
окружающими его молекулами до тех
пор, пока он в конце концов не ока-
окажется в «потенциальной яме», так как
не сможет преодолеть электростатиче-
электростатическое отталкивание электронного обла-
облака молекулы, через которую он про-
проходит. Свободный электрон окажется в
области относительно низкой потенци-
потенциальной энергии, т. е. в промежуточном
положении, соответствующем элементу
свободного объема в жидкости. Здесь
он стабилизирован близкодействующими
силами отталкивания. Перед стабилиза-
стабилизацией электрона его кинетическая энер-
энергия в областях с низкой потенциальной
энергией уменьшается до 1 эВ и ме-
менее, а скорость падает до 6-Ю7 см/с,
так что для пересечения электроном мо-
молекулярного диаметра или среднего по
размеру межмолекулярного промежутка б) основная ориентация п0_
ему требуется ОКОЛО 10 С. ПОСКОЛЬ- дярных молекул воды вокруг
ку электронная поляризация молекул гидратированного электрона
°
o
о
oggo
W*
Рис. V.3. Гидратированный
электрон: а) схематическое
представление последнего
участка пути «свободного
электрона» в жидкости;
)
174
Гл. V. Непрямое действие ионизирующего излучения
происходит быстрее чем за 10 15 с, стабилизированный электрон ока-
оказывается в электронно-поляризованной «дырке».
Последовательное уменьшение потенциальной энергии стабилизи-
стабилизированного электрона происходит за счет атомной поляризации, рас-
расширения полости и ориентационной поляризации окружающих моле-
молекул. Глубина «потенциальной ямы» для стабилизированного электро-
электрона увеличивается с переходом от одного типа поляризации среды к
другому, однако кинетическая энергия электрона не уменьшается до
нуля, а сохраняет малое, но конечное значение.
Тепловое равновесие свободного электрона со средой достигает-
достигается примерно за 10~п с, время релаксации молекул воды при ком-
комнатной температуре составляет такую же величину. Следователь-
Следовательно, за 10—11—10~10 с вокруг стабилизированного электрона возник-
возникнет область радиальной поляризации, т. е. поляризованные молекулы
воды ориентируются в собственном электрическом поле электрона
(рис. V.3). Область радиальной поляризации, обладающая избыточ-
избыточным положительным зарядом около своего центра, служит ловушкой
для электрона, обусловливающего поляризацию.
Вместе они и формируют уникальное образование — гидратирован-
ный электрон, который в химическом отношении ведет себя, как очень
активный ион, вступая в реакции со многими веществами при первом
соударении. Скорость реакции ограничена временем, необходимым
для того, чтобы перемещающиеся в результате диффузии реагенты
«нашли друг друга». Время жизни е^др в высокоочищенной воде
приближается к 1 мс. Такое большое время жизни позволяет гидрати-
рованному электрону диффундировать на значительные расстояния
от трека первичной ионизирующей частицы и взаимодействовать с
растворенными молекулами.
Основные характеристики е^др приведены в табл. V.I.
Таблица V.I. Характеристика гидратированного электрона
Амакс
?720 нм
?578 нм
П/2 (е^Идр + Н2О)
Ti/2 (нейтральная Н2О)
заряд иона
радиус распределения заряда (расч.)
энергия гидратации
коэффициент диффузии
Е° (ег-идр + Н3О+ —>• 1/2Н2 + Н2О)
рК (ег-идр + Н2О —>• Н + ОН")
ке- +Н2О
720 нм
15800 моль-см
10600 моль-см
780 мкс
230 мкс
-1
0,25-0,3 нм
1,82 эВ
4, 7-Ю см^
2,58 эВ
9,7
16
2. Биофизический анализ радиационной инактивации в растворах 175
Н2О —^ - Н2О'
возбуждение
Н2О а ^ H2O+ + e"
ионизация
н2о- ^н' + он-
\ ^^
Н+ + ОН'
ч+н2о
егидр
Рис. V.4. Схема образования первичных продуктов радиолиза воды
Первичные реакции, происходящие после возбуждения и иониза-
ионизации, которые мы обсуждали ранее, можно суммировать в виде общей
схемы (рис. V.4). Первичные продукты радиолиза воды — радикалы
Н', ОН', е^др — располагаются в пространстве достаточно близко
друг от друга, образуя своеобразные скопления — «рои» небольшого
объема, средний радиус которых около 1,5 нм. Радиохимики называют
эти скопления шпурами. В среднем на шпур приходится около б ра-
радикалов. Именно в шпуре происходит рекомбинация радикалов с об-
образованием молекулярных продуктов — Н2 и Н2О2 — например, по
реакциям (V.6)-(V.8).
Атаковать растворенные молекулы могут лишь те радикалы, кото-
которые не рекомбинируют, а выходят из шпура. Эти радикалы, а также
молекулярные продукты радиолиза мы будем называть продукта-
продуктами радиолиза воды. Образование их отражает следующее суммарное
уравнение:
Н2О
Н' + ОН+ + е" + Н2 + Н2О2 + Н3О+, (V.9)
где НзО+ — принятая форма записи иона Н+, уравновешивающего
отрицательный заряд гидратированного электрона.
В табл. V.2 приведены радиационно-химические выходы продуктов
радиолиза воды.
Таблица V.2. Радиационно-химический выход G первичных продуктов радио-
радиолиза воды
Продукты
радиолиза воды
^гидр
Н"
ОН'
Н2О2
н2
Значение G
2,6
0,6
2,6
0,75
0,45
176 Гл. V. Непрямое действие ионизирующего излучения
Оказалось, что при нейтральном значении рН на каждые 100 эВ
поглощенной энергии излучения в наибольшем количестве образуются
гидратированные электроны и радикалы ОН'.
Для исследования механизмов взаимодействия продуктов радио-
лиза воды и растворенных макромолекул необходимо располагать
надежными методами идентификации продуктов радиолиза и уметь
определять их количество. Количество молекулярных продуктов —
Н2 и Н2О2 — оценивают стандартными методами химического анали-
анализа. Наличие гидратированного электрона можно зарегистрировать по
характерному спектру оптического поглощения (табл. V.1). Спектр
поглощения радикала ОН' регистрируют в области ниже 300 нм. В
сочетании перечисленные методы позволяют исследовать типы реак-
реакций, происходящих при взаимодействии продуктов радиолиза воды с
органическими молекулами.
2.2. Роль продуктов радиолиза воды в инактивации
биоорганических молекул
Рассмотрим характер химического превращения органических ве-
веществ, облученных в водных растворах низкой концентрации, когда
преобладает непрямое действие излучения.
Спектр конечных продуктов определяют традиционными мето-
методами химического анализа. Значительно сложнее установить, какой
из активных продуктов радиолиза воды приводит к данному типу
структурного превращения молекулы. Для ответа на этот вопрос раз-
разработаны специальные методические приемы.
Эффекты, связанные с перекисью водорода, образующейся в облу-
облученной воде, установить несложно. Для этого в необлученный раствор
вводят Н2О2 до такой же концентрации, какая отмечена после облу-
облучения.
Типы реакций, осуществляемые радикалом ОН', также возможно
исследовать в необлученных растворах. Так как в ходе реакции между
перекисью водорода и двухвалентным железом возникают радика-
радикалы ОН', то, подбирая соответствующие количества этих реагентов,
добиваются появления в растворе требуемого количества ОН'.
Некоторые вещества служат перехватчиками свободных радика-
радикалов. С их помощью вызывают селективное поражение растворенных
молекул одним из радикалов воды. Так, N2 О в нейтральной среде
перехватывает е^др, кислород — перехватчик е~идр и Н', этиловый
спирт в нейтральной среде избирательно взаимодействует с радикала-
радикалами ОН'. Облучая растворы в присутствии различных комбинаций кон-
конкурирующих агентов, раздельно изучают реакционную способность
продуктов радиолиза воды.
Ниже перечислены основные типы реакций радикалов воды с ор-
органическими молекулами, обозначаемыми RH, где Н — реакционно-
способный атом водорода, R — остальная часть молекулы (по Окада,
1974).
2. Биофизический анализ радиационной инактивации в растворах 177
1) Отрыв атома водорода:
R-H + ОН* —> R/ + Н2О, (V.10)
R-H + H* —>R/+H2. (V.11)
Радикал е~идр не отрывает атом водорода от органических моле-
молекул. В результате реакций (V.10), (V.11) в растворе появляется ор-
органический радикал R'. С помощью дейтериевого обмена установили,
какой из атомов водорода отрывается от органической молекулы в
реакциях этого типа. Отрыв водорода возможен от третичных угле-
углеродных атомов, атомов серы в сульфгидрильных группах и а-углерод-
ных атомов. Не происходит отрыва атома водорода в функциональных
группах -CONH2, -CONH, -CONH, -NH3, -ОН, -СООН.
2) Реакции диссоциации:
RNH++e-
RNH2 +:
3) Реакции присоединения:
H
ДР
¦R"+NH3.
•С =
R
¦ОН"
R
R—С—С—R
ОН Н
о
(V.12)
(V.13)
(V.14)
(V.15)
(V.16)
В результате протекания этих двух типов реакций также образуется
растворенный органический радикал R'.
Для изучения кинетики перечисленных реакций необходимо знать
константы абсолютных скоростей к. Их значения можно установить
с помощью импульсного радиолиза. Суть метода состоит в том, что
водный раствор облучают в течение очень короткого промежутка
времени, измеряют концентрацию свободных радикалов и подсчиты-
подсчитывают константы скоростей реакции органических молекул, в том числе
белков и нуклеиновых кислот, с радикалами е^др, Н' и ОН'.
Продукты радиолиза воды высокоактивны по отношению к амино-
аминокислотам, белкам, нуклеотидам и ДНК; константы скоростей соответ-
соответствующих реакций лежат в пределах 107-1011 М^. Радикальные
продукты реакций можно зарегистрировать методом ЭПР.
12 Ю. Б. Кудряшов
178 Гл. V. Непрямое действие ионизирующего излучения
Свободные радикалы органических молекул претерпевают внутри-
внутримолекулярные перестройки, вступают в реакции друг с другом и с мо-
молекулами растворенных веществ. В результате формируется стабиль-
стабильное структурное поражение, приводящее к изменению биологических
свойств макромолекул.
2.3. Реакции радикалов органических молекул, ведущие к
образованию стабильных продуктов
Перечислим основные типы реакций, в которые вступают свобод-
свободные радикалы органических молекул в водных растворах.
1) Димеризация и присоединение:
r; + r2 —>Ri—r2, (v.i7)
R/+R" —>R—R. (V.18)
Продукты реакции — димеры молекул и агрегаты более высоких
порядков. Например, при облучении водного раствора цистеина об-
образуется димер — цистин:
НООС—СН—NH2
2Н00С—СН—NH2
I s
CH2 y I . (v.19)
SH I
CH2
НООС—СН—NH2
цистеин цистин
Другой пример — образование аспарагиновой кислоты из двух
радикалов глицина:
NH2—CHCOOH
2NH2—СН2—СООН > 2NH2CHCOOH > I
СН2СООН
(V.20)
2) Реакции диспропорционирования:
R+R* -^RH + P. (V.21)
В результате реакции атом водорода перераспределяется между ра-
радикалами. Один из радикалов может восстановиться до исходной
структуры, а другой — превратиться в новое соединение. Например,
при облучении раствора глицина в присутствии перехватчиков ОН'
и е^др с аминокислотой взаимодействует радикал Н', осуществляя
отрыв атома водорода:
2NH2CH2COOH -3-» 2NH2CHCOOH. (V.22)
2. Биофизический анализ радиационной инактивации в растворах 179
Реакция диспропорционирования, в которую вступают два ради-
радикала глицина, приводит к появлению иминоуксусной кислоты и вос-
восстановлению одного из радикалов до исходной структуры:
2NH2'CHCOOH > NH=CHCOOH + NH2CH2COOH. (V.23)
3) Реакции гидролиза:
R"+H2O—>P. (V.24)
Пример такой реакции — расщепление пептидной связи при облучении
раствора белка:
-RiCONHCHR2 у -RiCONH2 + R2COH. (V.25)
4) Присоединение кислорода.
В присутствии молекулярного кислорода в облученном растворе
образуются окислительные радикалы НО2 и OJ согласно реакциям:
Н"+О2 -^НО2, (V.26)
егидр "г -"-
Н2О2 + ОН'
егидр "+
+ 02-^
—>н2о
-О2 —>0
но2,
+ но2,
q.
(V.27)
(V.28)
(V.29)
Важно учесть, что в присутствии кислорода высокоактивные окисли-
окислительные радикалы образуются за счет радикалов-восстановителей Н'
и е^др. Следовательно, в облученном водном растворе возникают
условия, благоприятные для окисления. Свободные радикалы О^
и Н02 энергетически способны вызвать окисление органических ве-
веществ по любым связям, в том числе и тем, которые обычно устойчивы
в ходе окислительно-восстановительных реакций.
К числу наиболее характерных реакций органических радикалов
с радикалами Н02 относится реакция образования гидроперекисей:
R* + Н02 —> ROOH. (V.30)
В облученных растворах аминокислот, тимина и цитозина обнару-
обнаружено появление гидроперекисей этих соединений. Если аминокислоты
имеют длинные углеродные цепи, то образующиеся гидроперекиси
весьма стабильны, как, например, гидроперекиси лейцина и изолей-
цина. В конечном счете гидроперекиси распадаются с образованием
стабильных продуктов.
5) Реакции переноса водорода.
В облученном водном растворе репарация молекул от поврежде-
повреждений может происходить при участии второго растворенного веще-
вещества Р—Н, которое отдает атом водорода:
R* + Р—Н —> R—Н + Р\ (V.31)
12*
180 Гл. V. Непрямое действие ионизирующего излучения
Особенно эффективны соединения, содержащие свободную SH-rpynny.
Пример таких реакций — взаимодействие метанола с радикалом ОН'
в присутствии SH-соединений:
СН3ОН + ОН* —> Н2О + СН2ОН, (V.32)
СН2ОН + R-SH —> СН3ОН + RS\ (V.33)
2.4. Количественные характеристики непрямого действия
радиации в водных растворах. Эффект Дейла
Прежде чем перейти к результатам экспериментов, в которых
изучали зависимость инактивации макромолекул от концентрации
раствора, попытаемся качественно проанализировать возникающую
ситуацию. При определенной концентрации раствора в нем существу-
существуют молекулы-мишени, поражение которых приводит к определенному
типу инактивации.
Если в растворе преобладает прямое действие излучения на ма-
макромолекулы, то с ростом концентрации (больше мишеней) должно
увеличиваться число пораженных молекул, так как увеличивается
вероятность попадания. Если же инактивация происходит вследствие
взаимодействия макромолекул с активными продуктами радиолиза
воды, то лимитирующим будет не число объектов в растворе (концен-
(концентрация), а количество образующихся радикалов воды, которое зависит
лишь от дозы излучения.
Это означает, что в достаточно широком диапазоне концентра-
концентраций выход инактивированных молекул при облучении в определенной
дозе D не должен зависеть от числа этих молекул (концентрации рас-
раствора). Лишь при очень низких концентрациях, когда число объектов-
мишеней меньше числа продуктов радиолиза, приращение концентра-
концентрации приведет к увеличению абсолютного числа инактивированных
молекул. Но вскоре, по мере роста концентрации, число мишеней
сравняется с числом активных радикалов воды, и дальнейший рост
концентрации не приведет к увеличению числа инактивированных
молекул. Только при очень высоких концентрациях возможно некото-
некоторое увеличение числа поврежденных молекул вследствие их прямого
поражения ионизирующим излучением.
Именно такую зависимость наблюдали в эксперименте (рис. V.5, а).
На рис. V.5, б показано, как изменяется радиационно-химический вы-
выход пораженных молекул ДНК с ростом концентрации раствора.
Видно, что в широком диапазоне концентраций раствора на каж-
каждые 100 эВ поглощенной энергии инактивируется одинаковое чис-
число молекул, т. е. радиационно-химический выход инактивированных
молекул не зависит от концентрации. Этот эффект (его называют
«эффектом разбавления» или «эффектом Дейла») используют для
выявления непрямого действия радиации на молекулы.
Рассмотрим результаты других экспериментов, в которых опре-
определяли радиочувствительность макромолекул в растворах различной
концентрации.
2. Биофизический анализ радиационной инактивации в растворах 181
сб
О
1
1
л
1
17 ->
О
1 1
G
0,9
0,7
0,5
0,3
0,1
й ю-6 ю-4 ю-2 1
Концентрация фермента, г/мл
7
У
1 1
о
1
0,1 0,5 1 5 10 100
Концентрация ДНК, %
Рис. V.5. Количественные закономерности непрямого действия радиации на моле-
молекулы веществ в водных растворах: а) зависимость числа инактивированных моле-
молекул карбоксипептидазы от концентрации раствора; б) зависимость радиационно-
химического выхода G однонитевых разрывов от концентрации ДНК
В одном из таких опытов, представленном на рис. V.6, в разбавлен-
разбавленных растворах облучение оказывается значительно эффективнее. При
одной и той же дозе в растворе низкой концентрации инактивируется
значительно большая доля молекул, чем в высококонцентрированных.
Такой результат не находит объяснения с позиции прямого действия
излучения на молекулы. При прямом действии величина дозы указы-
указывает на число попаданий. При данной дозе каждый из растворов ис-
испытывает одинаковое число попаданий, следовательно, в них должно
было бы инактивироваться одно и то же относительное число молекул.
Иначе можно анализировать результат эксперимента, исходя из
представлений о непрямом действии излучения, которое опосредовано
активными продуктами радиолиза воды.
При низких концентрациях общее число молекул-мишеней невели-
невелико, поэтому необходимое число активных продуктов радиолиза воды
появится уже при облучении в малых дозах. В концентрированных
растворах такая же доля молекул (сравнимый процент от общего
числа) окажется инактивированной только в том случае, если в воде
возникнет достаточное число активных продуктов. В результате мы
отмечаем кажущееся повышение устойчивости к излучению концен-
концентрированных растворов.
Таким образом, важный критерий непрямого действия излучения
в водных растворах — это снижение относительного числа инакти-
инактивированных молекул вещества (% инактивации) по мере роста его
концентрации в растворе (рис. V.7).
3
jioo
30
10
5
k 50 мкг/мл
k 500 мкг/мл
о
а
_! |
" § 0 4 8 12 16 20
Доза облучения, хЮ2 Гр
Рис. V.6. Инактивация растворов
дезоксирибонуклеазы I различной
концентрации
Концентрация раствора
Рис. V.7. Прямое A) и непрямое (кос-
(косвенное) B) действие ионизирующих из-
излучений в одной и той же дозе на фер-
фермент в растворе
182
Гл. V. Непрямое действие ионизирующего излучения
2.5. Модификация радиолиза молекул в водных растворах
Приведенный фактический материал свидетельствует о том, что
в разбавленных водных растворах веществ непрямое действие ради-
радиации, опосредованное продуктами радиолиза воды, играет ведущую
роль в инактивации молекул. Последовательность протекающих про-
процессов выглядит так.
1. В момент прохождения ионизирующей частицы через воду (в
первые 10~18-10~16 с) вдоль ее трека возникают возбужденные, сверх-
сверхвозбужденные и ионизированные молекулы, которые испытывают
цепь превращений, приводящих к образованию радикалов Н', ОН'
И егидр*
2. Часть свободных радикалов рекомбинирует с образованием мо-
молекулярных продуктов Н2О2, H2O и Н2; некоторые радикалы способ-
способны взаимодействовать с растворенными органическими молекулами.
3. Каждый из радикалов воды вступает в специфические реакции с
растворенными макромолекулами, в результате возникают свободные
органические радикалы (при этом биологически активные макромоле-
макромолекулы имеют высокое сродство к радикалам воды).
4. Возникшие радикалы органических молекул взаимодействуют
друг с другом и с окружающими молекулами, образуя стабильные ре-
парированные или поврежденные структуры. Характер инактивации
макромолекул зависит от типа их структурного поражения.
5. Критерием непрямого действия излучения служит «эффект
разбавления» и снижение относительного числа инактивированных
молекул с ростом концентрации раствора.
cf Эффект защиты. Если в
растворе существуют молекулы-
примеси, способные конкурировать
с макромолекулами за активные
продукты радиолиза воды, то это
приводит к снижению радиаци-
радиационного поражения макромолекул.
Справедливость такого утвержде-
утверждения доказана экспериментально
(рис. V.8).
Влияние ЛПЭ излучения.
Поражающее действие излучения
снижается с ростом ЛПЭ излучения,
т. е. рентгеновское и 7~излУчения
оказываются эффективнее а-частиц
100
< 80
60
40
12 3 4 5
Доза облучения, хЮ3 Гр
Рис. V.8. Поражение сывороточно-
сывороточного альбумина человека 7~излУчени~
ем: а) 1%-ый раствор; б) то же в
присутствии 2-10~3 моль/л /3-мер-
каптоэтиламина; в) то же в присут-
присутствии 1-10~3 моль/л тиомочевины
или ускоренных ядер элементов. Это связано с неодинаковой линейной
плотностью ионизации, которая определяет пространственное
распределение активных радикалов воды. В случае плотноиони-
зирующего излучения продукты радиолиза формируются вдоль
редких, но мощных треков ионизации, пространственно не разобщены,
2. Биофизический анализ радиационной инактивации в растворах 183
100
g л50
10
е
N2
0 0,5 1,0 1,5
Доза облучения, х 103 Гр
Рис. V.9. Инактивация трипсина в
водных растворах @,1 мг фермен-
фермента в мл) рентгеновским излучением
в аэробных (Ог) и анаэробных (N2)
условиях
0 0,2 0,4 0,6 0,8
Доза облучения, хЮ3 Гр
Рис. V.10. Инактивация трансформиру-
трансформирующей ДНК из Diplococcus pheumonia в
водном растворе: облучение в атмосфе-
атмосфере азота A) и кислорода B) в присут-
присутствии 1,4'10~3 моль/л глутатиона М; 3 —
облучение в отсутствии защитного агента
значит, увеличивается вероятность их рекомбинации с образованием
молекулярных продуктов Н2, H2O и Н2О2. При действии редкоио-
низирующего излучения радикалы воды диспергированы по всему
облучаемому объему и потому с большей вероятностью достигнут
растворенных молекул и вызовут их поражение.
Кислородный эффект. Наличие кислородного эффекта при пря-
прямом действии излучения доказано во многих работах. Для сухих
препаратов ферментов и нуклеиновых кислот фактор кислородного
эффекта равен 1,5-2,2, т. е. в присутствии кислорода макромолекулы
в 1,5—2,2 раза эффективнее поражаются ионизирующим излучением.
В водных растворах веществ кислородный эффект либо очень
мал, либо вообще отсутствует. Для ряда систем даже было показано
защитное действие кислорода. Так, при облучении раствора трипсина
(рис. V.9) обнаружено увеличение радиочувствительности фермента
при замене атмосферы кислорода на атмосферу инертного газа.
В водных растворах ДНК наблюдают примерно одинаковое пора-
поражение ее молекул как в присутствии кислорода, так и в аноксических
условиях (рис. V.10). В клетках инактивация трансформирующей
ДНК происходит в 3,7 раза эффективнее, если клетки аэрировались
во время облучения.
Прибавляя к раствору ДНК радиозащитные вещества (глутати-
он), удалось воспроизвести ситуацию, аналогичную наблюдаемой при
облучении клетки. При концентрации глутатиона 1,4-10~3 моль/л
трансформирующая ДНК в 3,7 раза эффективнее поражалась облу-
облучением в аэрированных растворах, чем в атмосфере азота (N2). Так
возникло предположение, что наблюдаемый в клетках кислородный
эффект связан с присутствием защитных веществ, главным образом
сульфгидрильных соединений.
Г. Дертингер и X. Юнг A973) предлагают следующую интерпре-
интерпретацию кислородного эффекта для макромолекул. Благодаря пара-
парамагнитным свойствам молекулярный кислород обладает высоким
184 Гл. V. Непрямое действие ионизирующего излучения
сродством к возникающим под действием излучения радикалам. При
взаимодействии кислорода с радикалом R' образуются пероксидные
радикалы:
R'+O2 —>ROO\ (V.34)
Это свойство кислорода не зависит от того, является радикал R' ра-
радикалом макромолекул или одним из активных продуктов радиолиза
воды. Кроме того, электроотрицательный кислород способен улавли-
улавливать электроны согласно уравнению:
ег"„дР + 02 —>¦ OJ (V.35)
Таким образом, в присутствии кислорода вместо радикалов Н',
ОН' и е^др могут возникать радикалы ОН', И0'2 и OJ.
Если определенный специфический тип инактивации макромоле-
макромолекул связан с радикалами Н' и е^др, то кислород будет оказывать
защитный эффект, конкурируя с ними за эти радикалы воды. В
случае, когда данный тип повреждения преимущественно связан с
радикалом ОН', кислород может усиливать радиационное поражение
вследствие перехвата радикалов Н' вследствие некоторого увеличения
выхода радикалов ОН', поскольку в отсутствие кислорода возможна
рекомбинация Н' и ОН' с образованием Н2О, а взаимодействие ради-
радикалов Н' с кислородом, согласно уравнению (V.26), уменьшает число
рекомбинированных радикалов Н' и ОН'. Действительно, в опытах по
облучению РНКазы в присутствии кислорода обнаружено усиление
поражающего действия излучения (фактор кислородного эффекта
равен 1,2).
В присутствии SH-соединений лучевое поражение макромолекул
снижается в результате двух эффектов: защитное соединение конку-
конкурирует за свободные радикалы воды и способно обеспечивать репа-
репарацию от начального повреждения путем переноса водорода с SH-
группы на радикал макромолекулы. На рис. V.10 показано, что в
анаэробных условиях глутатион в 3,7 раза понижает радиочувстви-
радиочувствительность трансформирующей ДНК (кривая 1), вероятно, в результа-
результате обоих эффектов.
В атмосфере кислорода защитный эффект глутатиона снижается,
но все же радиочувствительность ДНК ниже, чем в водном растворе
без радиозащитного соединения, даже если облучение проводили в
аноксических условиях. Вероятно, кислород конкурирует с восстано-
восстановительной способностью глутатиона, переводя радикалы ДНК в труд-
трудно репарируемую пероксидную форму, хотя и в этих условиях эффект
глутатиона как перехватчика радикалов сохраняется (кривая 2 лежит
выше, чем кривая 3).
Таким образом, модифицирующее действие кислорода на макро-
макромолекулы, облученные в водном растворе, определяется многими
факторами: присутствием защитного соединения, его сродством к
кислороду, типом радикала воды, вызывающего данное повреждение
макромолекулы, вкладом прямого и непрямого действия радиации в
3. Радиационно-обусловленные изменения 185
эффект поражения. Во всех случаях кислород, вероятно, не вызыва-
вызывает истинной сенсибилизации или защиты макромолекул, так как он
не влияет на число первичных повреждений. По-видимому, действие
кислорода связано с участием в процессах репарации макромолекул от
начальных повреждений в присутствии защитных веществ. Поэтому
в разбавленных водных растворах, не содержащих радиопротектора,
кислородный эффект может отсутствовать.
3. Радиационно-обусловленные изменения
и радиочувствительность биоорганических молекул
в растворах
Рассмотрим отдельные примеры радиационно-обусловленных из-
изменений биологически важных молекул: белков (ферментов), нуклеи-
нуклеиновых кислот, фосфолипидов, а также их низкомолекулярных состав-
составляющих. При этом попытаемся найти связь между типом структурно-
структурного повреждения и характером инактивации макромолекул и сравнить
их радиочувствительность.
Работы в этом направлении проводятся в настоящее время во
многих лабораториях. Они требуют привлечения сложного арсенала
биохимических и физико-химических методов анализа для выявления
структурных повреждений макромолекул.
3.1. Радиационно-обусловленные изменения молекул
Переходя к экспериментам с облученными водными или липидны-
ми растворами биологически значимых молекул, необходимо по воз-
возможности точнее установить, какой из активных продуктов радиолиза
вызывает данное повреждение молекулы. Для этого используют пере-
перехватчики радикалов определенных типов. В результате при облучении
в растворе останется реакционноспособным только один из радикалов
воды, остальные будут перехвачены. Другой прием состоит в том, что
в растворе специальными методами создают определенную концентра-
концентрацию какого-либо из радикалов воды, или липида, или молекулярных
продуктов радиолиза, прибавляют исследуемое вещество и изучают
характер реакции. Во обоих случаях стремятся к дифференциальной
оценке эффекта каждого из активных продуктов радиолиза раствори-
растворителя.
3.1.1. Изменения белковых молекул (ферментов)
Фермент лизоцим облучали в присутствии различных перехват-
перехватчиков или селективно воздействовали на него радикалами Н' и ОН'.
Было показано, что инактивация фермента происходит в результате
атаки белковой молекулы тремя типами радикалов: Н', ОН' и е^др.
Другой фермент — трипсин — инактивируется главным образом
за счет атаки радикалов ОН', из всех использованных перехватчиков
только этанол — перехватчик ОН' — защищал трипсин от инактивации
в водном растворе.
186
Гл. V. Непрямое действие ионизирующего излучения
В растворе белковая молекула многократно взаимодействует с ра-
радикалами, среди вызываемых ими повреждений необходимо выявить
те, которые приводят к инактивации.
Зависимость «доза-эффект» для инактивации белковых молекул
в водном растворе сохраняет экспоненциальный характер. Как и в
случае прямого действия, причина их инактивации — одиночное со-
событие попадания. В водном растворе белков инактивирующим собы-
событием может быть одна специфическая реакция водного радикала со
структурным звеном макромолекулы. Выявить эту специфическую
реакцию или ее последствия крайне трудно, так как белковая моле-
молекула испытывает множество соударений с радикалами. Рассмотрим
несколько примеров.
После облучения рибонуклеазы в водном растворе A мг/мл)
физико-химический анализ выявил следующие структурные по-
повреждения ее макромолекул: образование агрегатов (наблюдаются
увеличение внутренней вязкости раствора и дополнительные фракции
при гельфильтрации); появление свободных SH-групп; селективное
разрушение аминокислот метионина, цистина, лизина, тирозина,
фенилаланина, гистидина; изменение конформации (увеличивается
перевариваемость молекул трипсином).
Все эти структурные изменения обнаружены при дозе, близкой
к D375 когда каждая молекула подверглась в среднем одному инак-
тивирующему событию попадания. Важной причиной инактивации
фермента является изменение ее
конформации — развертывание
молекулы вследствие разрушения
аминокислот, формирующих гид-
гидрофобные или 8=8-связи, поддер-
поддерживающие вторичную структуру
белка.
После облучения дезоксирибону-
клеазы I обнаружено снижение чис-
числа триптофановых остатков на мо-
молекулу фермента. Известно, что эта
аминокислота входит в состав ак-
активного центра. Если в норме на
молекулу фермента приходится око-
около 5 ее остатков, то после облу-
облучения в дозе D37 обнаруживается
только 3 остатка триптофана. При
этом происходит резкое снижение
каталитической активности фермен-
фермента. Интересно, что специфический
ингибитор дезоксирибонуклеазы I — бромсукцинимид — также вза-
взаимодействует с триптофаном, и отмечается известный параллелизм в
действии излучения и этого ингибитора (рис. V.11).
О 20 40 60 80 100
Максимальная вязкость, %
Рис. V.11. Зависимость между
числом поврежденных триптофа-
новых остатков и максимальной
скоростью реакции облученной
дезоксирибонуклеазы I: 1 — актив-
активность фермента, облученного в
водном растворе; 2 — активность
фермента, обработанного N-бром-
сукцинимидом в разной концен-
концентрации (активность фермента оце-
оценивали по максимальной вязкости
ДНК)
3. Радиационно-обусловленные изменения
187
Таблица V.3. Предполагаемые причины инактивации ферментов, облученных
в водных растворах
Фермент
рибонуклеаза
дезоксирибонуклеаза I
фосфоглюкомутаза
каталаза
лактопероксидаза
фосфоглицеральдегид-
дегидрогеназа
аденозинтрифосфатаза
сукцинатоксидаза
уреаза
глутаматдегидрогеназа
лактатдегидрогеназа
алколгольдегидрогеназа
Предполагаемая причина инактивации
при облучении
разрушение остатка метионина
разрушение одной молекулы триптофана
разрушение одной молекулы гистидина
разрушение гемопорфириновой группы
чатстичное разрушение одной
гемопорфириновой группы
деструкция SH-групп цистина
или окисление SH-rpynn
окисление SH-rpynn
окисление SH-rpynn
окисление SH-rpynn
окисление SH-rpynn
окисление SH-rpynn
окисление SH-rpynn
В табл. V.3 представлены выводы ряда исследователей, изучавших
механизм инактивации ферментов ионизирующим излучением в воде.
3.1.2. Радиационно-химические изменения нуклеиновых кислот
Выяснению механизма поражения клеточной генетической мише-
мишени — ДНК — в облученных водных растворах посвящено большое
число исследований. В физико-химических экспериментах выявлены
основные типы структурных повреждений, возникающих в облучен-
облученной ДНК. Представление об этом дает табл. V.4, где приведены ре-
результаты исследований ОкадаA974) по инактивации ДНК, облучен-
облученной в разбавленном водном растворе.
Появление разрывов полинуклеотидной цепи и поперечных межмо-
межмолекулярных сшивок легко регистрируется методами седиментацион-
ного и хроматографического анализа. Значительно сложнее выявить
разрушение нескольких азотистых оснований из десятков тысяч их в
составе молекулы ДНК. Тем не менее такие повреждения происходят
и могут иметь значительные биологические последствия.
Для оценки радиационных изменений макромолекул важно было
установить, какой из активных продуктов радиолиза воды отвечает
за определенный механизм инактивации. Это позволило в дальней-
дальнейшем изучить кинетику реакции, выявить радикальный продукт или
продукты, исследовать их дальнейшие превращения.
Для этой цели часто используют перехватчики радикалов. На-
Например, облучение инфекционной ДНК фага (^Х-174 в присутствии
188
Гл. V. Непрямое действие ионизирующего излучения
Таблица V.4. Радиационные повреждения ДНК из тимуса теленка, облученной
в водном растворе
Типы радиационного
повреждения ДНК
однонитевые разрывы
двунитевые разрывы
поперечные сшивки
денатурация ДНК (разрыв
водородных связей)
разрушение оснований:
тимин
цитозин
гуанин
аденин
образование перекисей
тимина и цитозина
дезаминирование
(образование NH3)
освобождение оснований:
тимин
цитозин
аденин
гуанин
Среда
суспенди-
рования *)
0,01 NaCl,
моль/л
II
II
II
0,01
фосфат
Na,
моль/л
вода
вода
0,01
фосфат
Na,
моль/л
Концен-
Концентрация
ДНК, %
0,02
0,02
0,02
0,14
0,5
0,025
0,2
0,5
Радиационно-
химический
выход G,
моль/100 эВ
0,24
не определяли
не определяли
38
0,45
0,28
0,17
0,12
0,30
0,4
0,5
0,08
0,07
0,04
*) Облучение растворов проводили в атмосфере воздуха.
перехватчика ОН' (йод) и перехватчиков Н' и е^др (кислород) по-
показало, что утрата инфекционной способности вызывается действием
радикала ОН'. В присутствии йода (понижающего количество ОН)
инактивация уменьшалась, в то время как кислород, хотя и уменьшал
число радикаловН' и е^др, не влиял на выраженность инактивации.
За счет атаки радикалов ОН' в ДНК возникали однонитевые раз-
разрывы, повреждения азотистых оснований и другие эффекты. Удель-
Удельный вклад каждого структурного повреждения в эффект инактивации
оценивают путем сопоставления величин радиационно-химического
выхода инактивации с выходом однонитевых разрывов, повреждения
оснований и других типов структурных изменений.
3. Радиационно-обусловленные изменения 189
Изучение радиационной инактивации инфекционной активности
двунитевой ДНК фага (р29 показало, что она происходит вследствие
двунитевых разрывов полинуклеотидных цепей. Зависимость числа
возникающих двунитевых разрывов от дозы облучения сигмоидальна.
Это означает, что в результате атаки водными радикалами в каждой
из цепей вначале появляются одиночные разрывы, а при определен-
определенном критическом числе становится вероятным двунитевой разрыв как
результат совпадения близкорасположенных однонитевых разрывов.
Эксперименты с трансформирующей ДНК показали, что ее инак-
инактивация также обусловлена атакой полинуклеотидной цепи радика-
радикалом ОН'. Об этом свидетельствует независимость выхода инактиви-
рованных молекул от концентрации кислорода в среде (кислород —
перехватчик радикалов е^др и Н'). Сопоставив величины радиа-
ционно-химических выходов инактивированных молекул с выходом
различных типов повреждений, предположили, что инактивация воз-
возникает вследствие однонитевых разрывов цепи ДНК.
В целом проблема лучевого поражения нуклеиновых кислот в
водных растворах далека от полного разрешения. В настоящее время
интенсивно анализируется возможность миграции энергии в молекуле
и между молекулами, роль различных модифицирующих факторов в
первичных процессах лучевого поражения нуклеиновых кислот, воз-
возможность химической репарации повреждений, вызванных в молекуле
ДНК водными радикалами.
3.1.3. О радиационно-химических изменениях фосфолипидов
Основные радиационно-химические превращения водных раство-
растворов, суспензий и эмульсий фосфолипидов начинаются с разрушения
двойной связи в ненасыщенной жирной кислоте. В присутствии кис-
кислорода за ним следует образование гидроперекиси и распад последней
с образованием различных карбонильных соединений, накопление ко-
которых в избыточных количествах оказывает токсическое действие на
клетку (см. гл. V и VI). По мнению многих радиобиологов, фосфо-
липиды могут быть отнесены к молекулам-мишеням хотя бы по той
причине, что повреждение их даже в небольших количествах приво-
приводит к изменению проницаемости биологических мембран, нарушению
ионного гомеостаза, энергетических и обменных процессов в клетке.
Такие нарушения могут привести клетку к летальному исходу при
облучении ее в относительно невысоких дозах. Однако для выяснения
неординарной роли фосфолипидов в лучевом поражении субклеточ-
субклеточных структур и биологических структур более высокого порядка —
клеток, иных тканевых структур, самих тканей — необходимы данные
о сравнительной радиочувствительности *) различных биологически
важных молекул.
*) Термин «радиочувствительность» — условный, применяемый к от-
отдельным молекулам для оценки их степени реакций на облучение.
190 Гл. V. Непрямое действие ионизирующего излучения
3.2. Радиочувствительность биомолекул
В радиационно-химических экспериментах радиолиз молекул, как
известно, определяется его радиационно-химическим выходом G, ко-
который выражается числом молей изменившегося субстрата или вновь
образованных продуктов на 100 эВ поглощенной энергии (V.1).
Для оценки радиочувствительности радиационно-химический вы-
выход определяют и через производную от концентрации исследуемого
вещества С по дозе излучения D с учетом коэффициента г]:
w\- -> (у-36)
где r\ — численный коэффициент, зависящий от выбранных единиц
измерения. Если концентрация выражена в микромолях на литр, а
доза в десятках грей (килорадах), то г) — 0, 96.
Известно, что радиационно-химические выходы зависят от многих
факторов: вида соединения, его концентрации в облученной среде,
рН среды, газовой атмосферы и др. Поэтому в табл. V.5, составленной
по данным работ А.В.Савича A987), приведено не одно какое-
то значение радиационно-химического выхода для той или иной
группы веществ или для тех или иных видов реакций, а диапазоны
изменения G, в которые эти выходы преимущественно попадают.
Выделены четыре диапазона радиочувствительности: I — высокая,
II — средняя, III — низкая и IV — очень низкая. В соответствующих
графах таблицы перечислены виды превращений, соответствующих
каждому диапазону радиочувствительности.
Основываясь на приведенном нами ранее в данной главе (разде-
(разделы 2 и 3) фактическом материале о радиационно-химических реак-
реакциях, можно выделить несколько общих путей радиационных пре-
превращений молекул белков, нуклеиновых кислот и фосфолипидов в
растворах.
Начальный этап — образование радикалов растворенного веще-
вещества. Здесь можно отметить следующие основные типы реакций:
отрыв атома Н с разрывом связи —С—Н, разрыв двойной меж-
межуглеродной связи, отщепление присоединенной группы (реакция дис-
диссоциации). Далее происходят межрадикальные реакции и реакции
радикалов растворенного вещества с его молекулами и другими при-
присутствующими в растворе молекулами.
Следует выделить также и такие реакции, как гидроксилирование
или гидрирование; образование карбонильных соединений RC=O; ди-
меризацию; диспропорционирование, в результате которого образует-
образуется исходная молекула и новое ненасыщенное соединение; образование
гидроперекисных радикалов, гидроперекисей и далее продуктов их
разложения — карбонильных соединений: альдегидов, кетонов, спир-
спиртов.
Продукты радиолиза, представленные в табл. V.5, образуются пре-
преимущественно в реакциях перечисленных типов.
3. Радиационно-обусловленные изменения
191
Таблица V.5. Радиочувствительность к воздействию 7-излучения молекул бел-
белков, нуклеиновых кислот, фосфолипидов и их компонентов в растворах
Класс
биомолекул
белки
амино-
аминокислоты
ДНК
нуклеотиды
углеводы
фосфолипиды
Радиочувствительность (диапазон изменений
радиационно-химических выходов G,
моль/100 эВ)
I
высокая
E-300)
—
—
—
—
—
распад
ROOH
II
средняя
A-5)
распад,
NH3
распад,
NH3
распад
моно-
мономера
распад,
R-OH,
R-H
распад,
R-H,
R-OH,
RC=O
—
Ill
низкая
@,1-1)
R-H,
R-OH,
R-R,
разрыв
тяжа
R-H,
R-OH,
R-R
PO?",
RC=O,
однотя-
жевый
разрыв,
NH3
RC=O,
NH3,
РОГ,
ROOH
МДА
роГ,
RC=O
IV
очень низкая
@,01-0,1)
—
—
МДА, ШО*),
двухтяжевый
разрыв,
сшивки
МДА, ШО
—
МДА, ШО
*)МДА — малондиальдегид; ШО — шиффовы основания.
Рассмотрим подробнее данные о радиочувствительности биологи-
биологически важных молекул, полученные А.В.Савичем и его сотрудни-
сотрудниками.
3.2.1. Радиочувствительность белков
Радиочувствительность белков во многом определяется характе-
характером радиационно-химических изменений входящих в них аминокис-
аминокислот. Поэтому рассмотрим сначала данные по радиолизу отдельных
аминокислот в водных растворах.
Радиолиз не всех аминокислот изучен достаточно подробно. Для
некоторых из них известны лишь общие выходы распада. Из общих
реакций в них наблюдается дезаминирование, декарбоксилирование,
192 Гл. V. Непрямое действие ионизирующего излучения
димеризация, а в присутствии кислорода может происходить обра-
образование гидроперекисей. Определенный вклад в радиолиз аминокис-
аминокислот вносит также образование карбонильных соединений и гидрок-
силирование. В циклических аминокислотах основные превращения
затрагивают кольцевую структуру. Диапазоны выходов этих реакций
приведены в табл. V.5.
Относительная радиочувствительность при одинаковой концентра-
концентрации A ммоль/л) аминокислот определена при сравнении их выходов
разложения и константы скоростей реакций с продуктами радиолиза
воды при облучении в атмосфере воздуха. По этим критериям амино-
аминокислоты по убыванию радиочувствительности образуют ряд, который
выглядит следующим образом: серосодержащие (серии, метионин);
некоторые циклические (тирозин, триптофан, гистидин); имеющие в
остатке Ra азотсодержащие группы (аргинин, аспарагиновая кислота,
глутаминовая кислота, глицин) и, наконец, те, у которых остаток Ra —
углеводород без присоединенных групп или с ОН (фенилаланин, про-
лин, валин, лейцин, изолейцин, серии, треонин).
Выход разрушения аминокислот увеличивается по мере роста их
концентрации, а не стремится к постоянной величине (как это имеет
место для углеводов и азотистых оснований). При концентрации око-
около 0,1 моль/л выходы разложения глутаминовой кислоты, гистидина,
пролина и аспарагиновой кислоты составляют несколько десятков еди-
единиц; выходы разложения серина, аланина, глицина и фенилаланина
при концентрации, на порядок большей A моль/л), близки к 10. Эти
данные говорят о том, что радиолиз аминокислот если и протекает в
отдельных случаях по цепному механизму, то с развитием коротких
цепей.
Данные по радиочувствительности аминокислот нельзя безогово-
безоговорочно переносить на белки. На поражаемость аминокислотных остат-
остатков в белке влияют их расположение внутри белковой глобулы или
фибриллы и связи между аминокислотными остатками. Показателем
радиочувствительности аминокислоты в составе белка может служить
относительный выход ее разложения:
G (мол./ЮО эВ) ,
Go™ = —щщ—• (v-37)
Например, при облучении коллагена в 2,5-10~6 моль/л водных рас-
растворах в атмосфере воздуха GOTH изменялся в нешироких пределах
от 1 до 3 для всех аминокислот, исключая цистеин (для которого GOTH
составил 0,17) и метионин D,8).
При облучении раствора коллагена в бескислородных условиях
основным превращением является образование сшивок, а разрушение
большинства аминокислот не регистрируется. Так, при дозе 2 кГр об-
обнаруживается уменьшение количества только четырех аминокислот:
фенилаланина, гистидина, метионина и тирозина.
Наличие в растворах кислорода, присоединяющегося к радикалам
мишени, может объяснить малый выход сшивок при облучении в
атмосфере воздуха. Повреждения аминокислотных остатков, а также
3. Радиационно-обусловленные изменения 193
разрывы пептидных связей могут способствовать нарушениям вторич-
вторичной и третичной структуры белков. Разрывы пептидных связей при
действии ионизирующей радиации на белки происходят, как правило,
беспорядочно по всей длине полипептидной цепочки с радиационно-
химическим выходом, близким к 1 разрыву на 100 эВ.
3.2.2. Радиочувствительность нуклеиновых кислот
При радиолизе нуклеиновых кислот и их низкомолекулярных ком-
компонентов (табл. V.5) обнаружены изменения в азотистых основани-
основаниях углеводной части, а также разрыв гликозидной связи углевод-
основание и фосфоэфирной связи углевод-фосфат.
Радиолиз углеводов в водных растворах начинается с отщепле-
отщепления Н от одного из углеродных атомов с образованием углеводного
радикала. После этого отщепление молекулы воды и присоединение к
радикалу Н' или ОН' приводит к образованию карбонильного соеди-
соединения. Эту последовательность превращений мы демонстрируем на
примере 2-дезоксирибозы — углеводной компоненты ДНК:
ОН
' CH2-O
не-
неон
(V.38)
Суммарный выход карбонильных соединений в рассматриваемых
условиях близок к выходу разложения дезоксирибозы. Этот процесс
основной и относится к категории средней радиочувствительности
(табл. V.5).
При облучении растворов дезоксирибозы в атмосфере кислорода
обнаружено низкомолекулярное карбонильное соединение — малон-
диальдегид, возникающий после разрыва связи —С—С— в углевод-
углеводной цепочке. Как видно из табл. V.5, выход этого вещества отно-
относительно невелик. При облучении быстрыми нейтронами со средней
ЛПЭ порядка 35 эВ/нм суммарный, по сравнению с редкоионизирую-
щим излучением, выход карбонильных соединений из дезоксирибозы
уменьшается, а выход МДА увеличивается. Уменьшение суммарно-
суммарного выхода карбонильных соединений можно объяснить уменьшением
выхода радикалов ОН' с ростом ЛПЭ. Увеличение выхода МДА ука-
указывает на то, что этот процесс протекает в треках ионизирующих
13 Ю. Б. Кудряшов
194 Гл. V. Непрямое действие ионизирующего излучения
частиц и требует последовательного участия двух радикалов воды
(предположительно Н' и НО2).
Карбонильные соединения рассмотренного вида образуются и при
радиолизе нуклеотидов и ДНК. Но выходы их меньше по сравнению с
радиолизом дезоксирибозы (см. табл. V.5), поскольку в этих случаях
большая часть радикалов воды расходуется на радиолиз азотистых
оснований.
При радиолизе азотистых оснований в водных растворах основные
их превращения начинаются с размыканий двойной связи в пирими-
динах и в пуринах:
NH2 NH2
^ не* з *а 9 5СН (v-39)
^Ж I ^Ж ^Nx I
OH(H) H OH(H)
радикал радикал
цитозина аденина
После образования радикалов указанного типа в пиримидинах к сво-
свободной валентности присоединяются Н' либо ОН', образуя разные
виды конечных продуктов. Преобразования пуриновых радикалов
приводят к возникновению различных продуктов с раскрытым пи-
римидиновым либо имидазольным циклом, а также ациклических
соединений.
При облучении водных растворов азотистых оснований в присут-
присутствии кислорода образуются их гидроперекиси и происходит дезами-
нирование.
Выходы разрушения оснований соответствуют среднему диапазону
радиочувствительности.
В макромолекуле-мишени ДНК разрушение азотистых оснований,
образование гидроперекисей, карбонильных соединений, МДА и ам-
аммиака происходит примерно с такими же выходами, как и в нуклеоти-
дах. Кроме того, при радиолизе ДНК возникают одно- и двунитевые
разрывы, «плавление» водородных связей между комплементарными
основаниями в двойной спирали, ковалентные сшивки между ее нитя-
нитями. Диапазоны радиочувствительности этих превращений представ-
представлены в табл. V.5.
При разрыве фосфоэфирных связей образуются два вида концов:
З'ОН и 5'РО^, а также 5'ОН и З'РО^. Отрыв фосфатной группы
приводит к образованию концов З'ОН и 5'ОН. Если же разрыв тяжа
произошел с разрушением молекулы дезоксирибозы, тогда возникнет
пробел с одним фосфатным, другим фосфаталкильным концом.
3. Радиационно-обусловленные изменения 195
Выход однонитевых разрывов ДНК падает с ростом ЛПЭ, а выход
двунитевых разрывов возрастает, достигая максимума при ЛПЭ в диа-
диапазоне 100-200 эВ/нм, при дальнейшем увеличении ЛПЭ он снижает-
снижается. Такой характер зависимости выхода двунитевых разрывов ДНК от
ЛПЭ подобен зависимости радиочувствительности клеток по эффекту
репродуктивной гибели от ЛПЭ. Это подкрепляет представление о
том, что двунитевые разрывы ДНК являются критическим событием
для репродуктивной гибели клеток при облучении (см. гл. VI).
Однонитевые разрывы ДНК происходят с низкими выходами; вы-
выходы двунитевых разрывов и сшивок в ДНК еще примерно на порядок
меньше.
Показано, что сшивки типа Шиффовых оснований образуются при
радиолизе водных растворов нуклеотидов и нуклеозидов, содержащих
аминогруппу, а также при радиолизе ДНК. Здесь возможен тот же
механизм образования ШО, что и в фосфолипидах: карбонильные
соединения, продукты радиолиза дезоксирибозы присоединяют ами-
аминогруппы азотистых оснований. Выходы этих соединений такого же
порядка, что и выходы ковалентных сшивок ДНК. Накопление ШО
происходит не только во время, но и в течение часов и даже дней
после облучения. Эту реакцию рассматривают как начало механизма
деструкции макромолекулы за счет образующихся в нуклеиновых
кислотах токсических веществ — продуктов окисления ненасыщенных
фрагментов макромолекулы.
Реакция окисления ненасыщенных связей является важнейшей в
оценке радиочувствительности фосфолипидов, к рассмотрению кото-
которой мы сейчас переходим.
3.2.3. Радиочувствительность фосфолипидов
При облучении фосфолипидов обнаружены очень высокие вы-
выходы гидроперекисей. Радиочувствительность фосфолипидов превы-
превышает радиочувствительность любых других неполимерных молекул
(табл. V.5).
Разрушения фосфолипидов намного превышают также выходы
продуктов радиолиза воды, что свидетельствует о цепном механиз-
механизме реакции (см. гл. V, раздел 4). Это подтверждается и тем, что выход
гидроперекисей падает с увеличением мощности дозы, когда увели-
увеличивается вероятность реакций обрыва цепи. Среди продуктов радио-
радиолиза фосфолипидов обнаружены карбонильные соединения, дающие
цветную реакцию с тиобарбитуровой кислотой (ТБК). Они являются
ненасыщенными альдегидами с числом углеродных атомов от 3 до 10.
Самый низкомолекулярный из них — МДА:
О=СН-СН2-НС=О . (V.40)
Выходы карбонильных соединений невелики (см. табл. V.5). При-
Приблизительно 60% от общего их количества экстрагируется водой из
облученной эмульсии (около 60% составляет МДА, а остальные —
альдегиды с числом углеродных атомов от б до 10). Карбонильные
13*
196 Гл. V. Непрямое действие ионизирующего излучения
соединения способны реагировать с молекулами, содержащими ами-
аминогруппу. Диальдегиды могут сшить две молекулы, содержащие ами-
аминогруппу, образуя Шиффово основание с хромофорной группой вида
К-Т=СР-СР=СР-ТР-К (V.41)
с сопряженными двойными связями, которое поглощает свет в обла-
области 360 нм и люминесцирует в области 430 нм. Такого рода флуоресци-
флуоресцирующие продукты были найдены при радиолизе в водных эмульсиях
фосфолипидов, содержащих аминогруппу — фосфатидилхолин и фос-
фатидилэтаноламин. Некоторые из них оказались водорастворимыми,
а другие липидорастворимыми. Водорастворимые ШО образуются в
реакции карбонильных соединений с отщепившимися от фосфолипида
гидрофильными головками, содержащими аминогруппу. Выходы ШО
очень малы — процессы их образования при радиолизе фосфолипидов
относятся к наименее радиочувствительным (см. табл. V.5).
Еще одно превращение фосфолипидов — отщепление неорганиче-
неорганического фосфата — можно отнести к событиям, попадающим в третий
диапазон радиочувствительности. Выход этого превращения растет
линейно с увеличением дозы облучения и достигает 0,5 при 10 Гр.
Основные продукты радиолиза фосфолипидов — гидроперекиси,
карбонильные соединения, Шиффовы основания — регистрируются,
по данным А.В.Савича, и при облучении суспензий ядер, микросом,
митохондрий и клеток. Радиационно-химические выходы этих соеди-
соединений близки к тем, что зарегистрированы для облученных эмульсий
фосфолипидов.
3.2.4. Сравнительная оценка радиочувствительности
Приведенный фактический материал позволяет дать ориентиро-
ориентировочную сравнительную оценку радиочувствительности биомолекул.
Так, для полимерных макромолекул — белков и нуклеиновых кис-
кислот — можно использовать не радиационный выход G, а иной кри-
критерий радиочувствительности — процент пораженных макромолекул
на единицу дозы РПолимера [!]• Применив этот критерий, авторы при-
пришли к выводу о высокой радиочувствительности ДНК среди других
макромолекул.
Сравнивая данные табл. V.5 по радиационно-химическим выходам
распада фосфолипидов, углеводов, нуклеотидов и аминокислот, легко
заметить, что наибольшую радиочувствительность имеют фосфоли-
пиды: выходы их распада на порядок и более выше, чем у остальных
рассматриваемых соединений.
Из других типов превращений, представленных в таблице, в диа-
диапазон среднего уровня радиочувствительности укладываются реак-
реакции дезаминирования и гидроксилирования. Остальные превращения
происходят, как правило, с низкими или с весьма низкими выходами.
Высокая радиочувствительность фосфолипидов привлекает вни-
внимание к ним не только как молекулам, формирующим биологические
мембраны, но и как к неполярным растворителям, в которых, как и
4. Непрямое действие радиации в липидных растворах 197
в водных растворах, могут осуществляться процессы передачи погло-
поглощенной энергии ионизирующих излучений другим биоорганическим
молекулам.
4. Непрямое действие радиации в липидных растворах
Исследуя возможности непрямого действия радиации посредством
водных радикалов, радиобиологи долгое время не уделяли внимания
другому необходимому для жизнедеятельности клетки неполярному
растворителю — липидной фазе и системам, связанным с ней.
В середине 50-х гг. был достигнут значительный прогресс в пони-
понимании структурной организации и биологической роли субклеточных
мембранных структур. В этот и последующий периоды накапливается
обширный экспериментальный материал о роли липидов мембран в
функционировании липопротеиновых комплексов, интегрированных
ферментов, ДНК-мембранных взаимоотношений в функциональной
активности субклеточных структур. Появились первые работы, посвя-
посвященные физико-химическим процессам в липидной фазе облученных
клеток, липидным радиотоксинам, начались исследования механиз-
механизмов перекисного окисления липидов под действием ионизирующей
радиации. В центре внимания этих работ лежат химические исследо-
исследования высокорадиочувствительного механизма свободнорадикальных
цепных реакций перекисного окисления ненасыщенных липидов.
4.1. Цепные свободнорадикальные реакции перекисного
окисления в облучаемых липидах
Термин «цепные реакции» предложил еще в 1913 г. М. Боденштейн,
обнаруживший необычную для того времени фотохимическую реак-
реакцию превращения десятков тысяч молекул (хлора) при поглощении
только одного фотона света. Спустя несколько лет В.Нернст описал
цепную реакцию с участием активного атома СГ. Так, при поглощении
энергии фотона молекула С12 образует два активных атома СГ:
С12 —>СГ +С1\ (V.42)
каждый из которых вступает в реакции:
СГ + Н2 —> НС1 + Н', (V.43)
Н' + С12 —> НС1 + СГ. (V.44)
Последовательность реакций (V.43) и (V.44) может повторяться мно-
многократно, подобно звеньям одной цепи, но протекает уже без участия
фотона света (темновые стадии). Таким образом, цепная реакция —
это каталитическая циклическая реакция, в которой катализа-
катализатором являются свободные радикалы (или активные возбужденные
частицы).
Отмечают три последовательные стадии цепной реакции:
1 — инициирования (реакции зарождения) цепи,
198 Гл. V. Непрямое действие ионизирующего излучения
2 — развития (продолжения) цепи,
3 — обрыва цепи (реакция гибели).
Рассмотрим подробнее стадии цепной реакции, протекающей в ли-
пидах под действием поглощенной энергии излучений*).
4.1.1. Стадия инициирования цепи
Зарождение цепи осуществляется в результате распада валентно-
ненасыщенной молекулы и образования двух свободных радикалов
с неспаренным электроном. В растворах это обычно происходит в
результате переноса электрона. Стадия инициирования (или зарожде-
зарождения) цепи наиболее энергоемкая в любой цепной реакции. Поскольку
ее энергия активации зависит от энергии разрыва химической связи,
радиационный распад молекул на радикалы осуществляется неодина-
неодинаково для различных молекул и систем.
Лауреат Нобелевской премии академик Н. Н. Семенов A934) при-
придавал большое значение наличию в сложных гетерогенных системах
веществ («примесей»), облегчающих развитие цепных реакций. Та-
Такие вещества легко образуют свободные атомы и радикалы. Напри-
Например, радикалы пероксидов являются наиболее универсальными ини-
инициаторами цепей. Анализируя реакционную способность различных
субстратов и развивающихся цепных реакций, Б.Н.Тарусов A962)
и Н. М. Эммануэль A969) установили, что наиболее вероятной для
развития первичных лучевых процессов в живой системе является
реакция окисления ненасыщенных липидов и образование перекисей.
Образование перекисей липидов может иметь цепной свободнора-
дикальный характер с образованием свободных радикалов, реакцион-
реакционная способность которых позволяет произойти реакции
X"+RH—>XH + R\ (V.45)
где X' — свободный радикал, инициирующий цепь; RH — молекула
жирной кислоты; R' — радикал липида.
В простой модельной системе, состоящей из ненасыщенной жир-
жирной кислоты и молекулярного кислорода, происходит реакция между
радикалом и молекулой О2:
R+O2-^RO2, (V.46)
в результате которой возникают пероксидные радикалы липидов.
Константа скорости этой реакции 107—108 л/моль-с, а энергия акти-
активации практически равна нулю. Следовательно, при концентрациях
кислорода выше 10~6 моль/л все радикалы R' превращаются в ради-
радикалы ROo.
*) Цепные процессы перекисного окисления липидов в облученной клет-
клетке описаны в гл. VI.
4. Непрямое действие радиации в липидных растворах 199
Пероксидный радикал может вступить во взаимодействие с новы-
новыми молекулами ненасыщенных жирных кислот с образованием гидро-
гидроперекиси и нового радикала R^:
RO2+RiH—^ROOH + R;. (V.47)
Эта реакция также имеет низкую энергию активации и высокую кон-
константу скорости, величина которой зависит от типа окисляющегося
соединения, а также от активации молекулы кислорода.
В более сложных системах — в биологических средах — с участием
активных форм кислорода происходит разрыв не двух, а только одной
химической связи ненасыщенной жирной кислоты (фосфолипида) с
образованием окислительного радикала RO' и гидроперекисей (см.
гл. VI).
4.1.2. Стадия развития цепной реакции (продолжение цепи)
Чередование реакций (V.46) и (V.47) приводит к развитию цепной
реакции окисления, схема которой может быть представлена так:
О2 RH O2 RH О2
ROiRROiRROi ... (V.48)
ROOH ROOH
В процесс вовлекаются все новые молекулы липида RH и кислорода, в
результате накапливаются гидроперекиси, а число радикалов R' и RO2
не изменяется (принцип неуничтожимости свободной валентности),
они выступают в качестве катализаторов реакции; нечетное число
валентных электронов не может измениться в процессе реакции ради-
радикала с молекулой. Реакции развития цепи имеют невысокие величины
энергии активации.
Скорость всего процесса лимитируется реакцией взаимодействия
перекисного радикала с новой окисляющейся молекулой — реакцией
продолжения цепи.
4.1.3. Стадия обрыва цепи
С реакцией продолжения цепи конкурируют реакции, приводящие
к обрыву цепей (Ю.А.Владимиров, А. И. Арчаков, 1972):
а) реакции взаимодействия радикалов — рекомбинации, например
R' + R' —> R-R, (V.49)
в результате которых образуются молекулярные продукты;
200 Гл. V. Непрямое действие ионизирующего излучения
б) реакции радикалов с ионами переменной валентности, например
с ионами железа:
RO2 + Fe2+ + Н+ —> ROOH + Fe3+, (V.50)
К + Fe2+ + Н+ —> RH + Fe2+; (V.51)
в) реакции радикалов с ингибиторами-антиоксидантами (InH):
RO2 + InH —> ROOH + In*, (V.52)
в результате которых возникают малоактивные радикалы антиокси-
дантов, не способные вступать в реакции с новыми молекулами (нена-
(ненасыщенных жирных кислот). Они исчезают в результате рекомбинации
с другим радикалом In' или радикалами R' и RO2.
4.1.4. Коррекция цепных реакций
В присутствии металлов переменной валентности описанный про-
процесс (V.50), (V.51) может приобрести разветвленный характер за счет
реакции:
ROOH + Fe2+ —> RO* + ОН" + Fe3+, (V.53)
т. е. появляются новые свободные радикалы, а значит, новые цепи
перекисного окисления. Для того чтобы происходило эффективное
разветвление цепей, необходимо добавлять в систему ионы металла
переменной валентности или же регенерировать окисленное железо.
Такая регенерация может происходить за счет сульфгидрильных со-
соединений:
RSH + Fe3+ —> ^RSSR + Fe2+ + Н+. (V.54)
В результате образуется восстановленное железо, способное иниции-
инициировать образование радикалов RO' при взаимодействии с молекулой
гидроперекиси ROOH.
Рассматривая последовательность реакций цепного перекисного
окисления липидов, можно выделить три возможности значительной
интенсификации процесса:
1 — увеличение содержания свободных радикалов, инициирующих
цепи перекисного окисления;
2 — усиленное разложение гидроперекисей с образованием новых ра-
радикалов, инициирующих новые цепи окисления (процесс приоб-
приобретает разветвленный характер);
3 — разрушение антиоксидантами, ингибирующими развитие процес-
процесса за счет обрыва цепей.
Химическая природа инициаторов или ингибиторов может быть
различной — и молекулярной, и радикальной.
Применяя добавки инициаторов или ингибиторов, можно управ-
управлять цепными реакциями, создавать неразветвленные и разветвлен-
разветвленные цепи, цепи с вырожденным разветвлением. В радиобиологии этот
4. Непрямое действие радиации в липидных растворах
201
принцип нашел большое применение при изыскании радиопротекто-
радиопротекторов и радиосенсибилизаторов, первичный отбор которых проводится
также и на модельных растворах, с протекающими в них цепными про-
процессами окисления липидов (Е. Н. Гончаренко, Ю. Б. Кудряшов, 1985).
Цепные процессы окисления липидов в модельных системах отно-
относятся к реакциям с самоускорением, поскольку их важным свойством
является промежуточное образование гидроперекисей ROOH:
R'+O2—+ Щ>, (V.55)
RO2 + RH —> ROOH + R/,
(V.56)
и цикл продолжения цепи может многократно повторяться по приве-
приведенной схеме.
4.2. Роль свободных радикалов липидов в непрямом эффекте
инактивации биоорганических молекул
Выводы о высокой радиочувствительности ненасыщенных жир-
жирных кислот в составе фосфолипидов и их способности к образова-
образованию активных свободных радикалов в цепных окислительных реак-
реакциях позволили предположить наличие у липидных растворителей
способности осуществлять не-
непрямой эффект радиации.
Для выяснения этого вопро-
вопроса легко идти по проторенной
дороге и использовать богатый
опыт радиобиологов по класси-
классическим исследованиям непрямо-
непрямого эффекта в воде.
Еще в середине 60-х гг. в ла-
лаборатории радиационной биофи-
биофизики МГУ им. М.В.Ломоносова
были начаты работы, показав-
показавшие возможность непрямого ме-
механизма действия ионизирую-
ионизирующей радиации через продукты
радиолиза липидов. Для иссле-
исследований была выбрана молеку-
молекулярная модель раствора кароти-
каротина в липидах.
Было обнаружено радиаци-
150 250 300
Доза, Гр
МО5
Рис. V.12. Радиолиз /3-каротина в за-
зависимости от величины дозы 7~ИЗЛУ~
чения: 1 — кристаллический /3-каро-
тин, +18 °С; 2 — раствор /3-каротина в
олеиновой кислоте, в атмосфере азота,
+ 18 °С; 3 — раствор /3-каротина в оле-
олеиновой кислоте, воздушная атмосфера,
+ 18 °С; 4 — раствор /3-каротина в оле-
олеиновой кислоте, воздушная атмосфера,
-196 °С
онное повреждение каротина в
результате прямого (кристаллический каротин) и опосредованного (в
липидных растворах) действий излучения. Данные представлены на
рис. V.12.
Как видно из рисунка, кристаллический каротин обладает значи-
значительной радиорезистентностью: облучение в дозе 105 Гр вызывает ра-
радиолиз лишь 10% облученных молекул. Растворение каротина в одном
из строительных блоков липидов (в олеиновой кислоте) приводит к
202
Гл. V. Непрямое действие ионизирующего излучения
о
^
о
к
л
1
?н
о
м
н
а;
о
hi
ОТИ]
4
3
2
1
-
-
^ W
ЛХ
1 1 1 L 1 1 1 X
3 V
v 2
* X
1 *
X
1 1 1 1
5
I
10 20
Концентрация раствора, 7/мл
Рис. V.13. Радиолиз /3-каротина в
зависимости от его концентрации
в олеиновой кислоте при облучении
в разных дозах: 1 — 20 Гр, 2 — 50 Гр,
3 - 100 Гр
2 4 6 8 10 12
Количество перекисей,
мкмоль Ог/г-Ю
Рис. V.14. Радиолиз /3-каротина, рас-
растворенного в олеиновой кислоте, в за-
зависимости от содержания перекисей в
растворе
резкому возрастанию его радиочувствительности. D37 составляет от-
относительно незначительную величину — всего лишь 40 Гр. Естествен-
Естественно, такое возрастание радиочувствительности не может объясняться
увеличением линейных размеров каротина в олеиновой кислоте в де-
десятки тысяч раз. Формально можно утверждать, что чувствительный
объем увеличился за счет того, что в растворе достаточно попадания
кванта излучения в некую область, окружающую молекулу каротина,
откуда возможна диффузия поражающего агента к молекуле. Так
возникло предположение о существовании опосредованного действия
ионизирующей радиации в липидах. Однако более строго доказать
это предположение стало возможным при изучении температурных,
дозовых, концентрационных зависимостей радиолиза каротина, добав-
добавления модифицирующих радиолиз веществ.
Из рис. V.12 следует, что радиолиз каротина, растворенного в
олеиновой кислоте, резко уменьшается, если облучение растворов про-
проводить при низкой температуре. Это свидетельствует о температурной
зависимости процессов непрямого действия ионизирующей радиации.
Исследование зависимости радиолиза каротина от его концентрации в
растворах олеиновой кислоты позволило получить типичные кривые,
подтверждающие вывод о непрямом действии радиации. Эти данные
представлены на рис. V.13. Увеличение дозы облучения вызывает по-
повышение количества активных, диффундирующих продуктов, поэто-
поэтому уровень плато кривых возрастает с повышением дозы 7~излучения.
Высокая радиочувствительность веществ, растворенных в олеи-
олеиновой кислоте, в значительной степени определяется уровнем содер-
содержания продуктов ее окисления, в первую очередь гидроперекисей и
перекисей. На рис. V.14 показано, что предварительное окисление
кислородом воздуха олеиновой кислоты приводит к резкому усилению
процессов радиолиза.
Дальнейшие исследования показали, что вещества, модифицирую-
модифицирующие лучевое поражение биологических объектов, аналогично влияют
4. Непрямое действие радиации в липидных растворах 203
на процесс радиолиза растворов каротина в липидах. Так, аминоэ-
тилизотиуроний и ингибитор свободнорадикальных реакций — 4-ме-
тил-2,б-дитретбутилфенол — обладали радиозащитным действием. Из
приведенных ранее данных можно видеть, что снижение содержания
кислорода в растворе также приводит к радиозащитному эффекту.
Вывод об опосредованном действии радиации в липидах подтвер-
подтвердили также данные о продолжительности жизни активных радикалов
ненасыщенных жирных кислот. Так, используя метод «флеш-радио-
лиза», показали, что средняя продолжительность жизни первичных
продуктов радиолиза — медиаторов реакции — не превышает 8 мс
(Кудряшов, Балтбарздыс, 1966). Этот вывод особенно важен тем об-
обстоятельством, что удалось определить участие перекисных радика-
радикалов липидов в непрямом эффекте ионизирующей радиации.
Данные о роли перекисных радикалов липидов в непрямом
механизме действия ионизирующей радиации были подтверждены в
дальнейшем на других липидных растворах, биологических объектах
и системах.
* *
*
Материал гл. V посвящен рассмотрению непрямого действия иони-
ионизирующих излучений в растворах. Опосредованное поражение ор-
органических молекул в разбавленных водных растворах обусловлено
действием высокоактивных диффундирующих свободных радикалов,
возникающих в результате радиолиза молекул воды. Свободные ра-
радикалы Н', ОН', е^др обладают высокой реакционной способностью,
они могут вызывать разрушение химических связей в белках, нукле-
нуклеиновых кислотах, фосфолипидах и других органических молекулах.
Во многих случаях реакция органической молекулы со свободными
радикалами воды приводит к возникновению свободных радикалов
органических молекул, которые вступают в различные реакции друг
с другом и с другими молекулами. В результате формируются ста-
стабильные растворенные продукты — молекулы с измененными струк-
структурными и функциональными характеристиками. Это могут быть
ферменты с нарушенными каталитическими характеристиками, мо-
молекулы ДНК с одно- и двунитевыми разрывами полинуклеотидных
цепей или разрушенными азотистыми основаниями, фосфолипиды,
образующие высокоактивные продукты перекисного окисления и т. д.
Многие из этих повреждений, в принципе, могут служить причиной
гибели клеток и организмов.
Оценивая радиационно-химический выход при облучении раство-
растворов ряда биоорганических веществ, можно отметить весьма высокую
радиочувствительность фосфолипидов, образующих в присутствии
кислорода высокоактивные перекисные радикалы и гидроперекиси
при цепных автокаталитических реакциях. Так же как и водные ра-
радикалы, радикалы липидов, индуцированные облучением, способны
204 Гл. V. Непрямое действие ионизирующего излучения
вызывать инактивацию биоорганических молекул, в том числе и мо-
молекул фосфолипидов биологических мембран. Цепные реакции окис-
окисления ненасыщенных липидов приводят к накоплению в биологиче-
биологических средах избыточного количества свободных радикалов, продуктов
перекисного окисления липидов, способных, как это будет показано в
следующей главе, к токсическому действию на клетку. Таким образом,
не только в воде, но и в липидах осуществляется непрямой механизм
действия ионизирующих излучений.
Ряд модифицирующих агентов, таких, как кислород, низкая темпе-
температура, серосодержащие соединения и другие воздействия, изменяют
характер радиационно-химических реакций в водных и липидных рас-
растворах, конкурируя с органическими молекулами за активные ради-
радикалы или восстанавливая пораженные молекулы. Это открытие сти-
стимулировало, например, использование радиопротекторов для защиты
клеток и организмов от действия излучения.
Так, уже первые работы В.Дейла A942), открывшего непрямое
действие ионизирующих излучений в водных растворах, показали, что
прибавление ряда антиокислителей к облучаемым растворам фермен-
ферментов снижает их радиационную инактивацию. Эти работы, как извест-
известно, послужили дальнейшим открытиям химической защиты бакте-
бактериофагов (Латарже и Эфрати, 1948) и мышей (Бак и Херве, 1952)
радиопротекторами — аминотиолами.
По признанию 3. Бака A968), на проведение исследований защит-
защитного действия антиокислителей повлиял факт образования в облучен-
облученной воде перекисей, обладающих, по его мнению, радиомиметически-
радиомиметическими свойствами. В дальнейшем стали применяться и липидные модели
оценки непрямого радиационного эффекта для первичного отбора,
изучения свойств и биологического действия радиопротекторов.
Феномен непрямого действия излучения продемонстрирован на
разбавленных водных растворах и липидах. Однако это не означает,
что непрямое действие может наблюдаться только в данных биологи-
биологически важных средах. В принципе, любой химический растворитель,
в котором возникают диффундирующие активные продукты, может
служить средой для проявления непрямого действия радиации.
Радиобиологов интересует не только сам факт прямого или непря-
непрямого эффектов радиации как таковых, а реакции живой клетки на
повреждения, вызванные ими. Этому посвящена гл. VI.
Глава VI
РЕАКЦИИ КЛЕТКИ НА ДЕЙСТВИЕ
ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ
Реакции клеток на действие ионизирующих излучений исследу-
исследуются со времени открытия рентгеновских лучей и радиоактивности.
За этот период накоплен обширный экспериментальный материал о
характере морфологических и биохимических изменений в облученной
клетке, изучены закономерности развития лучевого поражения во вре-
времени, проведен количественный анализ гибели клеток в облученной
популяции.
Однако и до настоящего времени выяснение механизмов ответных
реакций клетки на действие ионизирующих излучений — одна из
основных проблем радиобиологии. Ее решение имеет важное теоре-
теоретическое значение, так как позволяет расшифровать природу про-
процессов, приводящих к развитию радиационного поражения, а также
восстановления как самой клетки, так и биологических структур более
высоких, чем клеточный, уровней организации. Практическая значи-
значимость исследований, проводимых на клеточном уровне, несомненна,
т. к. реакции различных клеток на действие ионизирующей радиации
лежат в основе лучевого поражения сложных биологических систем —
органов, тканей, организмов растительного и животного царств, вклю-
включая млекопитающих.
До недавнего времени считалось, что такие лучевые реакции
клеток как их гибель, хромосомные аберрации, соматические мута-
мутации, а также опухолевая трансформация тканей, являются следстви-
следствием необратимых радиационных повреждений первичной структуры
ДНК, возникающих в результате прямого и опосредованного молеку-
молекулярным окружением воздействия ионизирующего излучения. Однако
достижения современной молекулярной биологии и радиационной био-
биофизики, радиобиологии привели к выводу о более сложных механиз-
механизмах, связанных с функциональными реакциями самих радиационных
мишеней: с одной стороны, ДНК, с другой — биологических мембран
(БМ), непосредственно связанных с системой окислительно-восста-
окислительно-восстановительного гомеостаза клетки.
В связи с этим все с большим интересом радиобиологи сосредо-
сосредоточивают внимание на образующиеся в биологической мембране и
ДНК под влиянием ионизирующих излучений оксирадикалы и другие
продукты окисления молекул, а также на вызываемые ими изменения
206 Гл. VI. Реакции клетки на действие ионизирующих излучений
в механизмах регуляции, осуществляемые в клетке при непосредствен-
непосредственном участии ДНК и БМ.
1. От изолированных молекул к клетке
В предыдущих главах была дана оценка характера процессов
поглощения энергии радиации веществом, рассмотрены механизмы
действия ионизирующих излучений на изолированные молекулы и
простые системы. При переходе на новый уровень организации жи-
живого — клеточный — мы уже говорим не только о взаимодействии
излучений с отдельными молекулами, а о более сложной, ответной
реакции клетки, включающей в себя взаимосвязанные нарушения
структуры и функции ее элементов, зависимые от характера и степени
повреждений. Во многих случаях биологический клеточный эффект
может быть связан с радиационным повреждением не только тех
участков в макромолекуле или даже не только тех молекул, которые
непосредственно поглотили энергию излучений, а с теми элементами
клетки, которые вступили в реакцию с активными продуктами, об-
образующимися вследствие облучения.
Иными словами, важно знать не только то, какие изменения пре-
претерпевают макромолекулы в клетке при действии ионизирующих из-
излучений, но и каким образом клетка, как живая система, реагирует
на возникающие в этих макромолекулах нарушения.
Таким образом, на более сложном, клеточном уровне рассматрива-
рассматриваемые изменения макромолекул приобретают уже качественно новый
смысл причастности к системному ответному эффекту. Поэтому
в данной главе мы вынуждены будем обращаться к рассмотренным
ранее фактическим данным, служащим фоном, на котором протекают
более сложные радиационно-индуцируемые процессы в живой клетке.
Напомним, что основная задача радиационной биофизики состо-
состоит в изучении последовательности процессов, протекающих в живой
материи в результате облучения от момента возникновения немного-
немногочисленных начальных повреждений до появления тестируемых био-
биологических эффектов, включая гибель клетки. Как это очевидно из
материалов предшествующих глав учебника, в настоящее время боль-
большое внимание уделяется первичным («инициальным», «запальным»)
физико-химическим реакциям.
До недавнего времени основную информацию о первичных и на-
начальных биофизических процессах в облучаемой клетке получали в
модельных экспериментах с изолированными биоорганическими мо-
молекулами, водными и липидными растворами или отдельными суб-
субклеточными органоидами. Опираясь на рассмотренные ранее данные
о действии ионизирующих излучений на молекулы, можно воссоздать
следующую элементарную качественную картину первых стадий био-
биофизических процессов, возникающих в облученной клетке.
1. От изолированных молекул к клетке 207
Как отмечалось в предыдущих главах, ионизирующие излучения
с определенной вероятностью передают часть своей энергии отдель-
отдельным молекулам, расположенным вдоль треков частиц. Напомним, что
молекулы, поглотившие энергию излучения, переходят в различные
возбужденные состояния, часть которых заканчивается ионизацией.
Вероятность переноса энергии на молекулу не зависит от ее хими-
химической структуры, она определяется суммарной электронной плотно-
плотностью, имеющей примерно равные значения для различных органиче-
органических молекул и воды.
Это означает, что в облученной клетке не существует струк-
структур, испытывающих преимущественное поглощение энергии, — воз-
возбужденными и ионизированными оказываются белки и нуклеиновые
кислоты, липиды и углеводы, молекулы воды и различные низкомо-
низкомолекулярные органические соединения.
Первая, или физическая, стадия действия излучения в облученной
клетке протекает, как и в изолированных молекулах, за время 10~16—
10~14 с. Ее иногда называют неспецифической стадией. Она включает
процессы поглощения, перераспределения и деградации поглощенной
энергии в клетке. Результатом этих событий служит возникновение
ионизированных и возбужденных молекул, неравномерно распреде-
распределенных вдоль треков ионизирующих частиц.
Образуются ионы (М+), возбужденные ионы молекул (М+ ), элек-
электроны, возбужденные, а также (в зависимости от дозы облучения)
сверхвозбужденные состояния молекул (М*, М**), энергия которых
превышает первый потенциал ионизации молекул, наконец, плазмо-
ны — находящиеся в коллективно сверхвозбужденном состоянии ан-
ансамбли молекул [MiMn...Mn]**.
Общий радиационный выход первичных частиц составляет 7-
10 частиц/100 эВ. Молекулярная система находится в энергетически
неравновесном состоянии с гетерогенным распределением активных
частиц.
Процессы, происходящие на этой стадии в клетке, нельзя моди-
модифицировать — число первичных актов ионизации и возбуждения не
зависит от состояния объекта, а определяется лишь свойствами излу-
излучения.
На физико-химической стадии за время 10~13-10~10 с происходят
реакции заряженных и возбужденных частиц, процессы внутримоле-
внутримолекулярной миграции энергии и диффузии радикалов, различные меж-
межмолекулярные перестройки возбужденных и ионизированных клеточ-
клеточных структур.
Ионизированные и возбужденные молекулы в клетке, как и в
растворах, нестабильны. Исчезновение этого состояния происходит за
счет миграции энергии внутри молекул или между ними. Вероятно,
энергия может мигрировать за счет переноса спина, миграции «поло-
«положительно заряженной дырки», миграции малых радикалов, прежде
всего атомарного водорода. Помимо возможного прямого действия
208
Гл. VI. Реакции клетки на действие ионизирующих излучений
на органические молекулы в клетке, ионизирующие излучения вызы-
вызывают их повреждение косвенным путем — диффундирующими е^др,
свободными радикалами, образующимися в водной и липидной фазах
клетки.
Возникающие первичные радикалы, как правило, неустойчивы и
быстро претерпевают вторичные превращения, приводящие к образо-
образованию органических гидропероксидов и оксирадикалов органических
молекул (в том числе ДНК и липидов биологических мембран), вза-
взаимодействующих друг с другом и с другими молекулами. Система
переходит в состояние теплового равновесия.
Для модификации процессов на физико-химическом этапе луче-
лучевого поражения используют химические соединения, способные изме-
изменять характер миграции энергии или вступать в реакции со свобод-
свободными радикалами.
На химической стадии, т. е. к 10~7-10~6 с, в шпорах, блобах,
коротких треках в клетке успевает произойти взаимодействие орга-
органических радикалов друг с другом и с окружающими молекулами,
которое приводит к возникновению стойких изменений — разнообраз-
разнообразных повреждений в структуре молекул, составляющих живую клет-
клетку. Происходит выравнивание концентраций продуктов радиолиза по
объему.
Как уже отмечалось, под действием излучения в «радиочув-
«радиочувствительных», наиболее легко окисляемых молекулах — полинена-
полиненасыщенных липидах мембран — будут интенсифицироваться реак-
реакции свободнорадикального перекисного окисления и накапливаться в
избыточных, токсических для живой системы количествах продукты
окисления липидов. При этом нарушается структура и функции био-
биологических мембран.
В белковых макромолекулах клетки при облучении ее в высоких,
летальных дозах может произойти повреждение первичной струк-
структуры (селективное разрушение отдельных аминокислот), измениться
их вторичная структура; нарушиться конформация и, возможно, в
конечном итоге, произойдет деградация активного центра ферментов.
Упоминалось также, что в ДНК возникают одно- и двунитевые
разрывы полинуклеотидных цепей, разрушаются некоторые азоти-
азотистые основания, возникают межмолекулярные сшивки (ДНК—ДНК,
ДНК—белок). Могут оказаться пораженными молекулы иРНК и
тРНК, а также рибосомы.
Различные повреждения молекул и субклеточных структур приво-
приводят к разнообразным функциональным нарушениям и формированию
ответных реакций облученной клетки, составляющих последнюю, био-
биологическую стадию действия излучения.
Вовлечение липидов мембран в процессы перекисного окисления
приводит к нарушению важнейших для клетки барьерно-матричных,
энергетических и регуляторных функций, к снижению и выравни-
выравниванию важнейших для клетки электро-химио-осмотических градиен-
градиентов, а также к повреждению мембраносвязанных белков с выходом
1. От изолированных молекул к клетке 209
ферментов из мест специфической локализации. При облучении в
высоких дозах ферменты могут утрачивать каталитические свойства,
субстратную специфичность, чувствительность к соответствующим
активаторам и ингибиторам или (и) аллостерические свойства.
Повреждения ядерной мембраны могут иметь глубокие послед-
последствия для генетического аппарата, например, вследствие проникно-
проникновения в ядро гидролитических ферментов — ДНКаз, РНКаз, кислых
фосфатаз и др.
Структурные повреждения нуклеиновых кислот создают препят-
препятствия для протекания процессов репликации, транскрипции и транс-
трансляции генетической информации, нарушают контроль за развитием
клеток и генетическую программу их гибели.
Инактивация отдельных компонентов различного типа биологи-
биологических процессов в облученной клетке возникает при неодинаковых
дозах облучения и имеет различные последствия для клеточного го-
меостаза: одни процессы оказываются исключенными из цепи мета-
метаболических реакций, другие нарабатывают продукты в избыточных,
токсических концентрациях, третьи перестают регулироваться соот-
соответствующими эффекторами.
Впрочем, с позиций радиационной биофизики описанная здесь
картина развития биологической стадии радиационного поражения
клетки носит в большой мере качественный вероятностный харак-
характер. Действительно, повреждение in situ, в самой клетке, каждого
из рассмотренных здесь типов биомолекул не охарактеризовано ко-
количественно, особенно в отношении функциональной инактивации, с
точки зрения масштабов биологических последствий ее при каждом
уровне доз облучения и реального вклада в нарушение процессов
жизнедеятельности клетки. Даже при наиболее упрощенном, чисто
биофизическом подходе (без учета биохимической динамики процес-
процессов самообновления клеточных молекул) к решению проблемы ра-
радиационного поражения клетки до сих пор не просчитано (или не
установлено экспериментально из-за методических трудностей), какая
доля, какой процент повреждений возникает хотя бы в одном классе
главных входящих в состав клетки биомолекул in vivo при каждой дозе
облучения и какие последствия для соответствующих функций клетки
могут иметь эти радиационные повреждения с учетом уникальности
или множественности тех или иных субклеточных структур, в которые
эти биомолекулы входят.
Это при том, что наряду с рассмотренными примерами радиацион-
радиационных нарушений в макромолекулах разных классов, в клетке активиру-
активируются защитные механизмы, предохраняющие или восстанавливающие
макромолекулы и субклеточные структуры от лучевых повреждений.
Имеются в виду антирадикальные, гипоксические и антиокислитель-
антиокислительные механизмы, контролирующие процессы липопероксидации, мно-
многоплановые процессы репарации повреждений ДНК и других макро-
макромолекул.
Вместе с тем, пожалуй, нет таких биохимических процессов, кото-
которые, в зависимости от величины дозы и характера облучения, рано или
14 Ю. Б. Кудряшов
210 Гл. VI. Реакции клетки на действие ионизирующих излучений
поздно не претерпели бы изменений под действием ионизирующих из-
излучений. Временная иерархия, т. е. последовательность появления ста-
стабильных структурно-метаболических радиационных изменений, про-
проявляется в зависимости от этапов развития процессов повреждений и
включения тех или иных защитных ресурсов в клетке.
Разнообразные и взаимосвязанные изменения на биологической
стадии формируются в течение секунд, часов, суток, всего пери-
периода жизни клетки, исчисляемой для некоторых типов клеток ме-
месяцами.
Критическими для жизнедеятельности облученной клетки оказы-
оказываются, в первую очередь, повреждения таких радиобиологических
мишеней как ДНК и биологические мембраны. Повреждения их
могут приводить к преждевременной гибели клетки посредством
механизмов апоптоза или путем некроза, а в случае нелетального
уровня — передаваться по наследству.
Таким образом, в клетке, в отличие от изолированных молекул и
их растворов, развертывается более сложная, многоплановая карти-
картина системного ответа на поражающее действие ионизирующих излу-
излучений.
2. Об усилении первичных молекулярных повреждений
Основной результат, который следует из опытов по изучению инак-
инактивации облученных молекул, состоит в том, что значение инактиви-
рующей дозы Ds7 варьирует от нескольких тысяч до миллиардов Гр.
В то же время для большинства клеток летальная доза радиации
колеблется в пределах от 1 до 100 Гр. Следовательно, в летально
облученной клетке доля непосредственно инактивир о ванных молекул
чрезвычайно низка — около 0,001-0,1%. Если речь идет, например,
о ферментах, то 99,9—99,999% молекул, оставшихся непораженными,
способны выполнять свои функции. Маловероятно, чтобы убыль та-
такого незначительного числа биокатализаторов имела столь серьез-
серьезные последствия для клетки. Можно было бы предполагать, что по-
повреждение столь ничтожной доли уникальных структур, таких, как
ядерная ДНК, все же способно привести к гибели клетки. Однако
этому предположению можно возразить, имея в виду то, что потери
макромолекул клеткой в процессе ее нормальной жизнедеятельности
значительно превышают потери, происходящие за счет непосредствен-
непосредственного облучения в летальных дозах.
Могут ли все же ничтожные потери первично радиационно-инакти-
вированных биологически значимых молекул привести к фатальному
для облученной клетки исходу? Следует ответ: "Да, могут", посколь-
поскольку, как уже многократно отмечалось, изменения биомакромолекул
в биологической стадии развития лучевого поражения развиваются
(умножаются) во времени и могут достигнуть такого уровня, при кото-
котором происходят необратимые и фатальные для клеток повреждения.
3. Прямое и непрямое действие излучений в клетках 211
Таким образом предполагается существование механизма усиления
первичных молекулярных изменений, приводящих к развитию повре-
повреждений и к гибели облученной клетки.
3. Прямое и непрямое действие излучений в клетках
Возникновение стойких молекулярных повреждений на биологиче-
биологической стадии лучевого поражения клетки обнаруживали в облученных
клетках еще в середине 50-х годов (в работах Хатчинсона, Поллар-
да, Раевского и др.). Радиочувствительность некоторых молекул в
изолированных сухих препаратах и высушенных клетках совпадала.
Вероятно, в данном случае эти молекулы инактивируются в клетке за
счет действия радиации независимо от водных радикалов.
В опытах с коферментом А было показано, что в высушенных
клетках он в 2,7 раза более чувствителен к облучению, чем в изолиро-
изолированном состоянии. Такой результат позволяет предположить наличие
в клетке факторов, модифицирующих радиочувствительность моле-
молекул (образование избытка радикалов в клетках, высокая степень агре-
агрегации, адсорбция на поверхности субклеточных структур, образование
комплексов и др.). В большом числе экспериментов сопоставляли ра-
радиочувствительность молекул во влажных и обезвоженных клетках.
Как правило, обезвоживание приводило к повышению радиоустойчи-
радиоустойчивости молекул. Все это указывало на важную роль радикалов воды —
одного из факторов чувствительности клетки к действию радиации.
К распространенным методам модификации свободнорадикальных
лучевых изменений относятся метод температурных воздействий и
уже упоминавшийся метод высушивания клеток*).
Так, замораживание клеток в равной мере предотвращало сниже-
снижение уровня свободных радикалов и развитие лучевого поражения. При
помещении клеток после облучения в атмосферу чистого кислорода
наблюдали быстрое исчезновение радикалов и более глубокое, чем в
обычных условиях, лучевое поражение.
Аналогичное действие оказывает высокая температура. Предпо-
Предполагается, что в обоих случаях быстрое исчезновение свободных ра-
радикалов связано с образованием стабильных аддуктов поврежденных
молекул, приводящих к летальному исходу клетки.
Во многих упомянутых радиобиологических исследованиях про-
производили сопоставление радиочувствительности высушенных или за-
замороженных клеток с радиочувствительностью клеток, облученных
во влажном состоянии. В первых двух случаях преобладает прямое
*) Следует отметить, что жесткие физические воздействия на клетки,
например, замораживание, могут привести клетки к гибели и без облучения.
В связи с этим в таких экстремальных опытах по оценке радиочувствитель-
радиочувствительности эксперименты проводили, по возможности, в щадящих клетки усло-
условиях физических воздействий (например, содержание клеток в глицерине
при замораживании и т.д.).
14*
212 Гл. VI. Реакции клетки на действие ионизирующих излучений
действие радиации, а в последнем — происходит как прямое, так и
опосредованное влияние (через продукты радиолиза воды).
В табл. VI. 1 представлены данные Ш. Окада A974), в которых
приведены сопоставления прямого и опосредованного (непрямого)
действия ионизирующих излучений на клетки. Автор завысил роль
прямого эффекта радиации, поскольку в 70-е годы непрямой эффект
излучений многими учитывался только на основании представлений
об образовании водных радикалов.
По мнению известного генетика Ш. Ауэрбах A978), включение в
рассмотрение непрямых эффектов радиации придает более точное
значение выводу о том, что радиационно-генетические эффекты вы-
вызываются ионизацией в самой хромосоме или (и) в непосредственной
близости от нее.
Вопрос о количественном вкладе непрямого действия радиации в
радиобиологический эффект длительное время оставался неясным и
дискутировался более полувека. В количественные расчеты часто вно-
вносилась путаница при использовании ограниченного, устаревшего поня-
понятия «косвенного (непрямого, опосредованного) действия излучения»,
относящегося только к действию радикалов воды и не учитывающего
роль других радикалов и миграцию поглощенной энергии излучений
в биологических системах.
Так, в зависимости от метода и объекта исследования разные ав-
авторы предлагали цифры от 0 до 100% вклада непрямого эффекта за
счет радиолиза воды.
Произведя тщательный анализ данным литературы, Ю. Н. Корыс-
тов A986) пришел к выводу, что в клетках прокариот и эукариот
непрямое действие радиации за счет воды достигает 80—90% и яв-
является определяющим в инактивации клетки ионизирующим излуче-
излучением. Действительно, сухие или замороженные клетки обычно в 2—
3 раза более устойчивы к облучению, чем нативные. Этот результат
указывает на роль диффундирующих активных продуктов (в жидкой
фазе клетки) в поражении внутриклеточных структур, определяющих
чувствительность клетки к радиационному воздействию.
Были проведены прямые эксперименты по сопоставлению радио-
радиочувствительности макромолекул во влажных и обезвоженных клет-
клетках. Критерием радиочувствительности служила величина дозы, вы-
вызывающей инактивацию 63% макромолекул (D^). Оказалось, что
доза Ds7 для инактивации ряда ферментов значительно ниже во
влажных клетках, чем в высушенных или замороженных. Например,
активность алкагольдегидрогеназы во влажных дрожжевых клетках
снижается до 37% от исходной величины в результате облучения кле-
клеток в дозе 12 кГр; в сухих клетках аналогичная степень инактивации
наблюдалась после облучения в дозе 280 кГр. Для инвертазы во влаж-
влажных клетках доза D37 = 6 Мрад, а в замороженных — 12 Мрад. По-
видимому, более эффективное поражение макромолекул во влажных
клетках связано с действием активных продуктов радиолиза воды.
3. Прямое и непрямое действие излучений в клетках
213
1
!
I
8.Й
U1 о»
И
н
I
2
о
I
РЭ
I—Н
сб
S §
о и
и
к*
и
ю
см
о
ю
о
ю
I
о
и
о
см
о
ю
о
ю
I
о
и
1т
о о
о о
к
и
н
I
рр
1
го
214 Гл. VI. Реакции клетки на действие ионизирующих излучений
Не все изученные ферменты поражаются в клетке радикалами
воды в одинаковой степени. Например, /^-галактозидаза и ацетилхо-
линэстераза в равной степени инактивировались во влажных, обез-
обезвоженных и замороженных клетках. Возможно, некоторые макро-
макромолекулы локализованы в клетках таким образом, что становятся
недоступными для продуктов радиолиза воды.
В связи с этим интересен вопрос о возможном расстоянии диффу-
диффузии радикалов воды от места возникновения до поражаемой структу-
структуры. Если бы это расстояние было достаточно велико и сопоставимо
с размерами клетки, то облучение любого участка клетки с равной
эффективностью вызывало бы биологическое поражение, связанное
только с непрямым действием радикалов воды. Опыты К. Коула, про-
проведенные еще в 1965 г., показали, что радикалы воды, возникающие в
цитоплазме, могут оказаться малоэффективными — пучки электронов
были способны вызывать репродуктивную гибель клетки лишь в том
случае, если они пронизывали ядро. Теоретическая оценка расстояния
диффузии радикалов показывает, что наиболее вероятное значение
этой величины для диффундирующих радикалов — 3 нм.
Следовательно, в непрямое действие радиации вовлекается водная
оболочка, окружающая мишени, толщиной примерно в 10 молекул
воды. Основная часть радикалов, образующаяся в более отдаленных
участках клетки, возможно, рекомбинирует до того, как достигает
мишени.
Как сейчас хорошо известно, радикалы могут образовываться и в
липидах ядерных мембран. Тогда непрямой эффект ионизирующих
излучений на генетический аппарат клетки может осуществиться не
только в водной фазе, но и при поглощении электронов липидами
ядерной мембраны*).
4. Свободные радикалы в облученной клетке и методы их
определения
Свободные радикалы обладают высокой реакционной способно-
способностью, поэтому исследовать переход молекул в облученной клетке в
свободнорадикальное состояние и последующие процессы переноса
энергии можно лишь с помощью высокочувствительных биофизи-
биофизических и биохимических методов. К их числу относятся методы
радиоспектроскопии**) (регистрация существования неспаренных
электронов в образце, определение их концентрации и в ряде
случаев — выяснение химической структуры радикалов).
В группу методов радиоспектроскопии входят уже упоминавшийся
метод ЭПР — электронного парамагнитного резонанса, а также методы
*) К непрямому действию излучений относят также и обсуждаемый в
последнее время «эффект свидетеля» (см. гл. VII).
**) См. [57, 163].
4. Свободные радикалы в облученной клетке 215
ЯМР — ядерного магнитного резонанса и ЯКР — ядерного квадрупольного
резонанса.
Явление ЭПР было открыто в 1944 г. российским физиком Е. К. Завой-
ским. Разработанный на его основе метод применяется для исследований
веществ, содержащих неспаренные электроны: свободные радикалы, ион-
радикалы, молекулы в триплетных состояниях, ионы и комплексы переход-
переходных металлов и фазы, содержащие свободные электроны.
Мы уже отмечали (гл. IV), что характерный для исследуемого радикала
сигнал ЭПР возникает в результате взаимодействия исследуемого вещества
с магнитным полем. Неспаренный электрон обладает магнитным момен-
моментом //, связанным с его механическим моментом (спином) s: fi = js. При
помещении во внешнее магнитное поле магнитный момент неспаренного
электрона ориентируется вдоль или против поля. Энергии электронов в этих
состояниях отличаются, и их разность определяется уравнением:
АЕ = Е2-Е1 = д/ЗН, (VI.1)
где Е — энергия электрона, д — фактор, равный 2 для спинового магнитного
момента, /3 — константа (магнетон Бора), равная 9, 27-1СГ21 эрг/Гс, Н — на-
напряженность магнитного поля. При Н = 3000 Гс (гауссов), АЕ = 4-10~5 эВ,
т. е. меньше средней энергии теплового движения молекул при комнатной
температуре.
Используя закон Больцмана, можно связать заселенность п2 верхнего
уровня (магнитный момент электрона ориентирован против внешнего поля)
и п\ нижнего уровня (магнитный момент ориентирован по полю) следую-
следующим выражением:
n2 = nie-AE/kT = me-»wtT (VI.2)
Переходы электронов между уровнями можно вызвать электромагнитным
излучением такой частоты z/, что энергия кванта этого излучения hv будет
равна разности энергий электронных уровней АЕ:
hv = АЕ. (VI.3)
В результате получим так называемое условие резонанса:
hv = д/ЗН. (VIA)
Таким образом, если к исследуемому образцу, находящемуся в маг-
магнитном поле напряженностью Н, подвести высокочастотное излучение с
частотой г/, то в образце возникнут вынужденные электронные переходы
из нижнего состояния Е\ в верхнее Е2 (с поглощением энергии), и наобо-
наоборот — из Е2 в Е\ (с испусканием энергии). Поскольку заселенность нижнего
состояния больше заселенности верхнего, в образце при выполнении усло-
условий резонанса (VI.4) будет происходить, в общем, 'резонансное поглощение
высокочастотного излучения. При этом частота излучения связана с на-
напряженностью магнитного поля соответственно:
Я = hv/g/3. (VI.5)
Из уравнения (VI.5) следует, что резонансное поглощение может про-
происходить: при изменении Н и постоянстве v, либо при постоянстве Н и
изменении v. По техническим условиям применяется первый способ реги-
регистрации: меняется напряженность внешнего магнитного поля и сохраняется
постоянной частота излучения. Для построения графика регистрации ЭПР
по оси абсцисс откладывают напряженность магнитного поля Н, а по оси
ординат — величину поглощенного образцом высокочастотного излучения
при данной температуре РПогл (рис. IV. 15, IV. 18, в). Одним из параметров
216 Гл. VI. Реакции клетки на действие ионизирующих излучений
сигнала ЭПР является амплитуда сигнала, характеризующая его интенсив-
интенсивность (чаще всего измеряется в относительных единицах, например, в мм).
Значение амплитуды сигнала (при постоянстве ширины) отражает концен-
концентрацию парамагнитных частиц в образце. Ширина сигнала характеризуется
величиной Ai^max, измеряемой в единицах магнитной индукции магнитного
поля — в гауссах (Гс) или миллитеслах (мТл).
При анализе сигнала ЭПР от исследуемого биологического образца оцен-
оценки взаимодействия магнитного момента электрона с внешним полем лабо-
лабораторного магнита оказывается явно недостаточным. В реальной ситуации
необходимо учитывать еще и взаимодействия магнитного момента электро-
электрона с локальными магнитными полями, создаваемыми как неспаренными
электронами соседних парамагнитных частиц (взаимодействия их друг с
другом), так и атомными ядрами с ненулевым магнитным моментом. Вклад
величины напряженности локальных магнитных полей Нлок и поля внеш-
внешнего магнита Но в общую напряженность магнитных полей («эффективное
магнитное поле» Нэфф) представляется в виде простой суммы:
тт | тт (\Т~\ ?.\
эфф — -"О ~г -П-лок- \\ 1.0)
В настоящее время созданы спектрометры, работающие в широком диа-
диапазоне частот A-95 ГГц). Однако наиболее распространены спектромет-
спектрометры, использующие излучение с v ~ 1 ГГц (длина волны такого излуче-
излучения А ~ 3 см).
С помощью метода ЭПР можно изучать не только структуру пара-
парамагнитных частиц, но и взаимодействие их с окружением и динамику в
гетерогенной биологической структуре образца.
Явление ЯМР — ядерного магнитного резонанса — обнаружено также
в 1945 г. одновременно в двух американских лабораториях — Ф. Блоха и
Э. Пурселла. Метод ЯМР используется для изучения переходов в состоя-
состояниях между уровнями энергии, соответствующими различной ориентации
ядерных магнитных моментов по отношению к внешнему магнитному полю.
Использование ЯМР-спектрометров позволяет проводить анализ состава
сложных смесей веществ (экстрактов из тканей организмов, биологических
жидкостей и т.п.), а применение ЯМР-томографов — получать картины
(томограммы) послойных срезов внутреннего строения объекта исследова-
исследования. Ядра со спином / > 1/2 обладают электрическим квадрупольным
моментом eQ, отражающим степень отклонения распределения заряда в
ядре от сферической симметрии.
Использование метода ЯКР — ядерного квадруполъного резонанса поз-
позволяет получать важную информацию о строении изучаемых объектов —
твердых тел и кристаллов при низких температурах.
Методы спектроскопии основаны на способности веществ (молекул,
атомов, свободных радикалов) поглощать и испускать кванты энергии
электромагнитного излучения, величина которых составляет разность
энергий дискретных состояний, между которыми происходит спектральный
переход. Кванты энергии при таких переходах находятся в радиоволновом
диапазоне — от единиц кГц до сотен МГц, что соответствует названию
методов — «спектроскопия в радиодиапазоне» или «радиоспектроско-
«радиоспектроскопия» *). Эти методы нашли широкое применение в исследовании структуры
Подробно с этими методами можно ознакомиться в книге [152].
4. Свободные радикалы в облученной клетке 217
белков, нуклеиновых кислот, биологических мембран, а также могут быть
использованы для исследования всех процессов, протекающих с участием
парамагнитных частиц, в том числе — свободных радикалов.
Первые радиобиологические исследования с использованием ме-
методов радиоспектроскопии провел в конце 50-х годах К. Г. Циммер,
получивший спектры ЭПР в тканях облученных животных. В после-
последующие годы число таких исследований непрерывно возрастало.
Известно, что в клетке обнаруживаются высокоактивные свобод-
свободные радикалы, количество которых может зависеть от величины дозы
облучения. В диапазоне средних («промежуточных») доз число ради-
радикалов возрастает быстро с увеличением дозы облучения, а в области
больших доз — значительно медленнее. Это может быть связано с
интенсивной рекомбинацией радикалов в высоких концентрациях при
больших дозах облучения. Различные биологически активные моле-
молекулы имеют близкие значения по величине радиационно-химических
выходов радикалов. Следовательно, на единицу поглощенной энергии
первично возникает примерно равное количество радикалов ДНК,
белков, липидов и других органических молекул. Все они вносят вклад
в суммарный сигнал ЭПР.
Следует отметить, что из-за высокой реакционной способности
стационарная концентрация короткоживущих радикалов, возникаю-
возникающих при радиационном поражении живых систем, может оказаться
слишком малой для того, чтобы эти радикалы могли быть обнаружены
методом ЭПР. В этой связи для улавливания короткоживущих ради-
радикалов разработан и успешно применяется метод спиновых ловушек.
Спиновая ловушка — это реагент, способный присоединять радикал.
Получившийся продукт — спиновый аддукт — является относительно
стабильным радикалом и поэтому может быть накоплен в концентра-
концентрации, доступной для регистрации сигнала аддукта методом ЭПР. Кро-
Кроме того по спектру ЭПР спинового аддукта можно сделать заключение
о том, какой короткоживущий радикал уловлен спиновой ловушкой.
Так, для захвата высокоактивного радикала ОН' используют такие
ловушки как 5,5-диметил-пирролин-]Ч-оксид и фенилбутилнитрон.
Помимо радиоспектроскопических используют и другие методы.
Так, для выявления свободнорадикальных состояний в клетках при-
применяют методы хемилюминесценции, привитой сополимеризации мо-
мономеров, вводимых в ткани до облучения, а также метод модифици-
рующих воздействии на клетки и модельные системы *).
Один из эффективных методов определения свободнорадикальных ре-
реакций в тканях — метод хемилюминесценции — ХЛ («сверхслабого свече-
свечения»), предложенный Ю.А.Владимировым и Ф.Ф.Литвиным A959). При
взаимодействии радикалов выделяется энергия, которая может излучаться
в виде квантов света. Интенсивность такой ХЛ пропорциональна скорости
реакции, в которой участвуют радикалы. Таким образом, с помощью ХЛ
*) См. [29, 58, 182].
218 Гл. VI. Реакции клетки на действие ионизирующих излучений
регистрируется изменение концентрации радикалов в процессе реакций,
например, перекисного окисления липидной фазы мембран.
Б. Н. Тарусов с сотрудниками A972) обнаружили, что в нормальных
условиях, в интактных биологических системах, ХЛ испускается стабильно,
непрерывно, на стационарном уровне, характерном для данного исследуемо-
исследуемого биологического объекта. Ионизирующее излучение индуцирует вспышку
ХЛ, обусловленную переходом стационарного окислительного процесса в
процесс самоускоряющийся, автокаталитический, сопровождающийся обра-
образованием стойких свободных радикалов. Вспышка ХЛ может быть усилена
влиянием электрического тока (метод электрохемилюминесценции — ЭХ Л).
Метод ЭХ Л отражает сложные, многоплановые процессы, развертыва-
развертывающиеся в биомембранах, находящиеся в тесной взаимосвязи с реакцией
свободнорадикального окисления.
Предполагают, например, что динамика ЭХ Л сыворотки крови корре-
коррелирует со степенью тяжести лучевого поражения.
Попытки количественно связать суммарные свободнорадикальные
изменения в клетке при облучении с величиной поглощенной ею дозы
радиации приводили к поиску упрощенных биофизических методов и
приемов, например, метода привитой сополимеризации.
Метод, предложенный Ю.П.Козловым A965), основан на способности
свободных радикалов катализировать полимеризацию некоторых ненасы-
ненасыщенных химических соединений. Измеряя скорость полимеризации, можно
определять содержание свободных радикалов в системе. Свободные ради-
радикалы макромолекул взаимодействуют с ненасыщенными соединениями в
результате захвата электрона из электронной пары ненасыщенной углерод-
углеродной связи с образованием нового соединения — привитого сополиме-
сополимера. Количество свободных радикалов соответствует количеству «активных
центров» полимеризации, которое пропорционально молекулярной массе
образующегося за определенное время привитого сополимера. Так удалось
получить сополимеры крахмала со стиролом, льняного масла и олеиновой
кислоты с акрил амидом, желатина и целлюлозы с акрилонитрилом и др.
Свободнорадикальные процессы в облученных организмах (реакция по-
полимеризации с использованием винилпирролидона, акриламида) в разных
тканях облученных животных не одинаковы. Так, в одной группе тканей
и клеток (головной мозг, скелетные мышцы, эритроциты) после облучения
животных в дозах 6-15 Гр не обнаружены пострадиационные изменения
содержания свободных радикалов; в другой (печень и почки) происходит
усиление процесса сополимеризации на первые-вторые сутки после облуче-
облучения; в третьей группе (плазма крови, селезенка) наблюдаются фазовые из-
изменения количества свободных радикалов в ткани. В плазме крови в течение
двух суток после облучения происходит непрерывное увеличение концен-
концентрации свободных радикалов, интенсивность накопления которых зависит
от дозы излучения в широком диапазоне. Еще ранее было показано, что
основное количество активных оксипродуктов («радиотоксинов») возника-
возникает в тканевых ненасыщенных липидах, количество токсических продуктов
возрастает в зависимости от величины дозы и времени, прошедшего после
облучения (Ю. Б. Кудряшов, 1956, Е. Н. Гончаренко и сотр., 1968).
4. Свободные радикалы в облученной клетке 219
Фундаментальные исследования, экспериментально подтвердив-
подтвердившие важнейшую роль свободных радикалов и антиоксиданов, регу-
регулирующих их уровень, в развитии лучевого поражения клетки и ор-
организма проводились в радиобиологических школах Н. М. Эмануэля
и Б. Н. Тарусова. Получены многочисленные данные, указывающие
на связь между количеством индуцируемых излучением свободных
радикалов и степенью лучевого поражения клеток. Большинство та-
таких данных получено с использованием методов, позволяющих регу-
регулировать уровень и дальнейшее превращение свободных радикалов в
облученной клетке.
Следует отметить, что для проведения тонких радиобиологических ис-
исследований чувствительность упомянутых методов часто оказывается недо-
недостаточно высокой. Так, в биологических системах скорости образования
свободных радикалов часто оказываются на границе пределов чувствитель-
чувствительности метода определения содержания радикалов; вместе с тем скорости
деградации радикалов достаточно велики, поэтому исследуемая концентра-
концентрация радикалов в каждый момент времени оказывается низкой. Поэтому в
радиационной биофизике успешно применяются такие методы, как «спино-
«спиновые ловушки» в методе ЭПР и «активатор свечения» в методах ХЛ и ЭХЛ.
В радиобиологических исследованиях по изучению свойств свободных
радикалов, возникающих в липидах, белках и нуклеиновых кислотах облу-
облученных клеток, успешно применяется метод обменных реакций свободных
радикалов с ингибиторами радикальных процессов («метод ингибиторов»,
«метод добавок»).
Для этого используются вещества — ингибиторы радикальных процес-
процессов, которые вступают в обменные реакции со свободными радикалами,
заменяют активные радикалы на неактивные и защищают тем самым жи-
животных и исследуемые системы от лучевого поражения. Обменные реакции
синтезированных ингибиторов с радикалами в облученном организме кон-
контролировались методами ЭХЛ, привитой сополимеризации и ЭПР-спектро-
скопии.
С помощью метода ингибиторов Н. М. Эмануэлю, Е. Б. Бурлаковой и
сотр. удалось, например, показать возможность обменных реакций ради-
радикалов ДНК с ингибитором радикальных процессов. Методика эксперимента
позволила количественно определить гидроксильные радикалы, гидратиро-
ванные электроны, радикалы ДНК, а также радикалы, возникающие при
добавлении ингибитора.
Показано, что сразу после облучения раствора ДНК с ингибитором про-
происходит возрастание концентрации радикалов в ДНК, затем их концентра-
концентрация уменьшается и появляется радикал ингибитора. В качестве ингибитора
радикальных реакций применялся пропиловый эфир галловой кислоты.
Используя другие ингибиторы, удалось обнаружить такую закономерность:
чем выше антирадикальная активность, тем лучше препараты защищают
молекулы ДНК от радиолиза.
Аналогичные закономерности обнаружены и при изучении свободнора-
дикальных процессов в облученных липидах. Ингибиторы в модельных опы-
опытах реагировали с радикалами липидов, накапливающимися в результате
облучения, и снижали интенсивность окислительных свободнорадикальных
реакций, индуцированных ионизирующим излучением.
220 Гл. VI. Реакции клетки на действие ионизирующих излучений
Основополагающие выводы о роли свободных радикалов в лучевом
поражении были подтверждены в зарубежных и отечественных иссле-
исследованиях и значительно расширены, особенно в последние 10-20 лет.
Принципиально новые методические усовершенствования (селективной
ион-масс-спектрометрии, рентгеноэлектронной и атомной спектроскопии,
ЭПР, различных видов хроматографии, активированной ХЛ и биолюми-
биолюминесценции), использование радиоактивных индикаторов, применение моди-
модификаторов свободнорадикальных состояний и др. (Л. Дж. Мернетт, 2000)
создали основу для высокочувствительной и специфической идентификации
вызываемых активными кислород-содержащими соединениями — АКСС (в
том числе оксирадикалами и активными соединениями азота) — поврежде-
повреждений биологических мембран и ДНК.
В предыдущей главе оценивалась возможность образования ППОЛ и
их участие в непрямом механизме действия ионизирующих излучений.
Использование новых методов анализа ядерной ДНК показало, что многие
эндогенные оксидазные модификации этой макромолекулы в облученной
клетке и в клетках организма являются результатом действия на ДНК
АКСС. При помощи этих методов исследования расшифрована химическая
структура оксирадикалов и продуктов их взаимодействия с ДНК, а также
с другими биомакромолекулами.
Таким образом, активные кислород-содержащие соединения —
АКСС — принимают непосредственное участие в зарождении и
развитии нарушений системы окислительно-восстановительного
равновесия в облученной клетке.
Остановимся подробнее на этой проблеме, учитывая при этом про-
проявление в ней качественно нового, системного клеточного ответа на
облучение. Изменению регуляции окислительно-восстановительного
гомеостаза при действии ионизирующей радиации посвящен следую-
следующий раздел этой главы.
5. Система окислительно-восстановительного гомеостаза
клетки и ее изменения после облучения
Известно, что система окислительно-восстановительных процессов
составляет основу жизнедеятельности клетки и организма, а кислород
играет ключевую роль в энергетике дыхания нормальных аэробных
клеток, являясь единственным акцептором электронов.
Основное количество молекулярного кислорода в клетке — 90-
98% расходуется в реакциях тканевого дыхания и микросомального
окисления, катализируемых соответственно митохондриальной цито-
хромоксидазой, а также и другими оксидазами, в результате чего в
дыхательных цепях происходит запасение энергии и осуществляется
четырехэлектронное восстановление О2 с образованием двух молекул
воды:
О2 + 4е" + 4Н —> 2Н2О. (VI.7)
5. Система окислительно-восстановительного гомеостаза клетки 221
Значительно реже под действием ферментов — оксигеназ — происходит
включение одного из атомов кислорода в биоорганические молекулы:
О2 + М + 2Н —> МО + Н2О. (VI.8)
Так, важную роль в окислении ненасыщенных липидов играют фермент-
ферментные реакции, катализируемые липоксигеназами и циклооксигеназами —
первыми ферментами на путях образования специфических регуляторов
метаболизма — эйкозаноидов.
Около 2% поглощаемого кислорода восстанавливается самопроиз-
самопроизвольным, неферментативным путем. Эти реакции всегда начинаются
с присоединения к молекуле О2 одного электрона и образования ани-
аниона-радикала (содержащего неспаренный электрон) — супероксида OJ
(см. также (V.29)):
О2 + е~ —> OJ. (VI.9)
Донорами электронов в клетке служат Fe2+, Cu+, семихинон и дру-
другие промежуточные участники процессов тканевого дыхания, а под
воздействием ионизирующей радиации, как известно, электроны ге-
генерируются вследствие ионизации воды и биоорганических молекул.
В основном состоянии молекулярный кислород парамагнитен —
представляет собой триплет — «бирадикал», т. е. имеет два неспа-
ренных электрона (с параллельными спинами) на различных орбита-
лях. По этой причине прямые, неферментативные реакции с кисло-
кислородом могут осуществляться по свободнорадикальным механизмам.
Большинство органических молекул синглетны (электроны с анти-
антипараллельными спинами), поэтому, вследствие различий с триплет-
ным кислородом в направлении спинов, их реакции с молекулярным
кислородом из-за спиновых запретов затруднены и протекают очень
медленно. Кинетические барьеры одноэлектронного восстановления
кислорода в клетке достаточно высоки, поэтому образование супер-
супероксида процесс медленный, однако он очень важен для формирова-
формирования системы окислительно-восстановительного гомеостаза в клетке,
так как OJ участвует в генерации многих окислителей — активных
кислород-содержащих соединений — АКС'С (табл. VI.2).
5.1. Активные кислород-содержащие соединения — образование
и биологическое действие в клетке в норме и после облучения
Как видно из табл. VI.2, к АКСС отнесены активные формы кис-
кислорода (АФК), активные соединения азота (АСА) и продукты пере-
кисного окисления липидов. Выступая в качестве сигнально-пусковых
молекул, OJ, а также Н2О2, ОН' и N0' запускают каскад реакций
поддержания окислительно-восстановительного гомеостаза в клетке.
В отличие от многих других биологически активных соединений,
АКСС неспецифичны, так как вступают в реакции не со специаль-
специально «предназначенными» к ферментативному окислению субстратами
дыхания, а непосредственно с любыми восстановленными веществами
R—Н (липидами, ДНК, белками), образуя гидропероксиды RiOOH.
222 Гл. VI. Реакции клетки на действие ионизирующих излучений
и
О)
I
и
и
о
т—I
Л
О
W
о К
§ g
5 8
о и
IS
5g
It
si
о I
о g
О
к
5
о
Л
о
т—I
I
о
О
к
I
I
и
о
s
I
о
К
о
5. Система окислительно-восстановительного гомеостаза клетки 223
И
Н
I
И
So
о W И о
5 и и s
И
и
I
о
О
I
о
1
s
-4
о °
vo о
II
3
I
I
О
224 Гл. VI. Реакции клетки на действие ионизирующих излучений
Схематично это можно представить в виде
АКСС + R-H —> RiOOH. (VI.10)
Принято процесс образования гидропероксидов называть перокси-
дацией {переписным окислением), а действие АКСС на молекулы в
клетке — «оксидазной модификацией».
Взаимодействуя с липидами (L), АФК и АСА способствуют ал-
коксил- и пероксил-радикалообразованию и активации тем самым
самоускоряющихся цепных реакций перекисного окисления липи-
дов (ПОЛ). Главными субстратами ПОЛ в клетке являются полине-
полиненасыщенные жирные кислоты, а конечными продуктами — эпоксиды,
кетоны, альдегиды.
Под влиянием АКСС-продуктов ПОЛ (ППОЛ) в интактной клетке
образуются аддукты ОРТ с ДНК, обладающие цитотоксическим, ци-
тогенетическим и канцерогенным эффектами. Эти эффекты проявля-
проявляются в зависимости от уровня накапливающихся АФК, находящихся
под многоплановым контролем антиокислительной системы в клетке.
Оказывая оксидазное действие, они способны вызывать клеточную
гибель путем апоптоза и радиационно-индуцируемую нестабильность
генома.
Из табл. VI.2 видно, что большинство АКСС обладают относи-
относительно короткой продолжительностью жизни и находятся в низких,
стационарных концентрациях. Однако это не препятствует активным
продуктам выполнять важные для нормальной клеточной жизнедея-
жизнедеятельности физиологические функции.
Рассмотренные представления, а также вывод о повреждающих
эффектах избытка свободнорадикальных или радикалообразующих
продуктов одноэлектронного восстановления кислорода в биологиче-
биологических системах доминируют в литературе на протяжении последних
двух-трех десятилетий. Это относится прежде всего к АФК, АСА, а
также ППОЛ, образующихся в цепных процессах липопероксидации в
биологических мембранах и накапливающихся, в частности, в жидкой
фазе клетки при распаде гидроперекисей липидов — LOOH.
Значительный вклад в исследования механизмов образования и
биологического действия ППОЛ был сделан специалистами в области
радиационной биофизики и молекулярной биологии, показавшими,
что окислительно-деструктивные процессы, вызываемые повышен-
повышенным уровнем АКСС в конденсированной водной фазе и в биологи-
биологических мембранах, лежат в основе клеточной патологии при многих
заболеваниях (см. раздел «Радиотоксины»).
Центральным звеном в поддержании в клетке окислительно-вос-
окислительно-восстановительного равновесия является образование АФК.
5.1.1. Активные формы кислорода
К активным формам кислорода относятся свободные радикалы —
супероксидный анион-радикал (супероксид), гидроксид- и гидропе-
роксид (пергидроксид)-радикалы и нейтральные молекулы — перок-
сид водорода и синглетный кислород (табл. VI.2, рис. VI. 1, VI.2).
5. Система окислительно-восстановительного гомеостаза клетки 225
15 Ю. Б. Кудряшов
226 Гл. VI. Реакции клетки на действие ионизирующих излучений
АФК обнаруживаются в клеточных органеллах. Главными местами
их образования являются митохондриальная, ядерная, плазматиче-
плазматическая и микросомальная мембраны у животных, хлоропласты и хро-
матофоры у растений.
В клетке существуют ферментный и неферментный пути образо-
образования АФК. Метаболические, ферментные пути образования АФК,
участвующие в нормальной жизнедеятельности клетки, представлены
в схеме Бурлаковой-Михайлова-Мазурика (рис. VI.1).
В ферментной генерации АФК участвуют: дыхательная цепь ми-
митохондрий и система микросомального окисления, системы оксидаз
(ксантин-, флавин-, НАДФ.Н*-оксидазы) и цитохромов, глутатионпе-
роксидаза и супероксиддисмутаза (СОД).
Неферментативное образование основных АФК и их превращения
происходят по схеме, изображенной на рис. VI.2, в следующих реак-
реакциях.
О2
2Н4
т
IT
(Н+)
+ е
—>
HOj
+ е-+Н+-
Рис. VI.2. Схема последовательности образования АФК в клетке в цепи нефер-
неферментного одноэлектронного восстановления кислорода до воды (названия продук-
продуктов см. в табл. VI.1)
Образование «надперекисного» анион-радикала кислорода — супер-
супероксида OJ представлено реакцией (VI.9).
При слабокислых значениях рН супероксид образует протониро-
ванную форму — гидроперюксирадикал-ЛО^:
При недостатке супероксиддисмутазы в присутствии металлов пе-
переменной валентности может произойти спонтанная дисмутация су-
супероксидов и образование синглетного кислорода 1О2:
О~2
О~2
2Н+ + Fe3+ —> Н2О2 + Fe2+
Синглетный кислород, содержащийся в хлоропластах растений и в
зрительных рецепторах животных, занимает особое место среди АФК.
Образование его здесь связано не только с реакцией (VI. 12), а пре-
преимущественно с фотохимическими процессами. Поглощая квант света,
пигмент-фотосенсибилизатор переходит в синглетное, а затем в три-
плетное возбужденные состояния. В обоих возбужденных состояниях
молекулы пигмента взаимодействуют с молекулярным кислородом,
передают ему свою энергию и превращают его в активный окислитель.
5. Система окислительно-восстановительного гомеостаза клетки 227
Супероксид при взаимодействии с органическими биомолекулами
обладает слабой реакционной способностью, так как имеет невысокий
окислительно-восстановительный потенциал. Однако он выполняет
важную роль, продолжая дальнейшую цепь одноэлектронного восста-
восстановления кислорода путем образования молекулы пероксида (переки-
(перекиси) водорода Н2О2.
Пероксид водорода — сильный окислитель и образуется при реак-
реакции супероксида с электроном и двумя протонами:
С>2 + е~ + 2Н+ —> Н2О2. (VI.13)
В другой реакции (рис. VI. 1) пероксид водорода появляется вслед-
вследствие рекомбинации (дисмутации) двух супероксидов, уже под влия-
влиянием фермента супероксиддисмутазы (СОД):
Оз + Оз + 2Н+ —> Н2О2 + О2. (VI. 14)
Цепь одноэлектронного восстановления продолжается образованием
из перекиси водорода еще более сильного окислителя — гидроксид-
радикала ОН':
Н2О2 + е- + Н+ —> ОН". (VI.15)
В клетке ОН' может появиться также за счет других реакций —
реакции Фентона из пероксида водорода при участии ионов Fe2+
(или Си2+):
Н2О2 + Fe2+ —> ОН' + ОН+ + Fe3+, (VI.16)
а также реакции Хабера-Вейса:
Н2О2 + OJ —> ОН' + ОН" + О2. (VI. 17)
Гидроксид-радикал завершает неферментный одноэлектронный про-
процесс восстановления кислорода:
ОН' + е~ + Н+ —> Н2О. (VI.18)
Экспериментально показано, что гидроксид-радикал относится к
наиболее эффективным окислителям АКСС (и, соответственно, АФК)
(табл. VI. 1).
Биологическая роль АФК может осуществляться в жизненно необ-
необходимых реакциях иммунитета и воспаления: АФК способствуют об-
образованию цитокинов и иммунных рецепторов, миграции лейкоцитов
в «аварийные ткани», выполняют бактерицидную функцию в фаго-
фагоцитозе. Так, в макрофагах и нейтрофилах АФК реализуют процесс
повреждения и разрушения макромолекул, вредных микроорганиз-
микроорганизмов, попавших в организм, а также старых, поврежденных и ставших
генетически чужеродными клеток. Поглощая повышенное количество
кислорода, защитные клетки с помощью встроенного в плазматиче-
плазматическую мембрану фермента НАД(Ф)Н-оксидазы (рис. VI. 1) производят
реакцию «кислородного взрыва» («дыхательного всплеска»), быстро
образуя необходимые ударные концентрации супероксида:
О2 + НАД(Ф)Н —> 2OJ + НАДФ+ + Н+. (VI.19)
15*
228 Гл. VI. Реакции клетки на действие ионизирующих излучений
Вслед за этим также резко накапливаются перекись водорода, гид-
роксильный радикал и другие АКСС, «сжигающие макромолекулы на
своем пути».
Известно, что возрастающий уровень 1О2 может быть причиной
обновления «отработанных» субклеточных компонентов фоторецеп-
фоторецепторов, а также фотодинамического действия пигментов в клетках, не
имеющих фоторецепторных систем.
В конце XX в. получены данные о способности АФК выполнять
сигнальную функцию в клеточной регуляции. Показано, что АФК сти-
стимулируют накопление цАМФ и цГМФ, ионов Са2+ в цитозоле, акти-
активацию протеинкиназ, протеинтирозинкиназ и подавление активности
протеинфосфатаз. Помимо стимуляции процессов фосфорилирования
белков, АФК активируют и белок Ras, участвующий в передаче сиг-
сигналов в ядро клетки.
Вопрос о биологической роли АФК находится также в связи с
инициированием ими значимых процессов в клетке — перекисного
окисления липидов.
Так, в 1983 г. К. Фонг и соавт. предположили возможность непрямо-
непрямого участия OJ в пероксидации липидов посредством образования радика-
радикалов ОН', L' и LO':
OJ + АДФ-Ге3+ —> О2 + АДФ-Ге2+,
АДФ-Ге2+ + Н2О2 —> АДФ-Ге3+ + 2ОН\
(VI.20)
ОН' +LH —>L' +H2O,
или ОН' + LOOH —> LO" + Н2О.
Через несколько лет была показана возможность прямого взаимодей-
взаимодействия О2 с гидроперекисями липидов LOOH и образования радикалов LO :
OJ + LOOH —> LO' + ОН' + О2. (VI.21)
Однако вопрос о прямом участии супероксида в процессе перекисного
окисления липидов все еще оставался дискуссионным. Причиной этому —
игнорирование аскорбатзависимого пути пероксидации липидов, не требу-
требующего участия OJ. Аскорбиновая кислота, так же, как и супероксидный
анион-радикал, поддерживает (регенерирует) хелатированные ионы двух-
двухвалентных металлов Fe2+, Cu2+ в стационарных концентрациях и обес-
обеспечивает многократное участие их в актах инициирования и разложения
гидроперекисей ненасыщенных жирных кислот — исходных продуктов пе-
перекисного окисления липидов. Естественно, что аскорбатзависимый процесс
не тормозится СОД, так как супероксид в этом процессе не участвует.
Супероксидзависимый процесс липопероксидации — это самостоятельная
реакция, которая подавляется СОД или неферментным путем, например,
катехоламинами, комплексами меди с аминокислотами, перехватчиками
гидроксильных радикалов (Томас, Сазерленд и др.).
5. Система окислительно-восстановительного гомеостаза клетки 229
В настоящее время окончательно установлено, что АФК способны
инициировать цепные реакции липопероксидации в норме, а их избы-
избыток — усиливать цепные процессы при лучевом поражении и других
физических и химических воздействиях.
Непрямой эффект радиации при радиолизе воды в облученной
клетке был изучен давно. Однако биологическое действие ОН' и
других АКСС в норме и в механизме усиления радиационных повре-
повреждений более полно стало раскрываться только в последние 10-20 лет.
Гидроксид-радикал — чрезвычайно активный окислитель и спосо-
способен разрушать фактически любую находящуюся рядом с ним моле-
молекулу в клетке. При взаимодействии с нуклеиновыми кислотами он
вступает в реакции с азотистыми основаниями, образуя продукты их
повреждения, а также разрушает углеводные мостики между нуклео-
тидами и вызывает разрывы цепей ДНК и РНК. Благодаря этому ОН'
способен вызывать мутации и гибель клеток. Взаимодействуя с другой
мишенью — биологическими мембранами (БМ), гидроксид-радикал
внедряется в липидный слой, инициирует цепные реакции липоперок-
липопероксидации, приводит тем самым к нарушениям структуры и функции
мембран, инициируя процессы гибели клеток. При облучении клетки
в больших дозах, действуя на тиольные белковые молекулы, ОН'
денатурирует их и инактивирует ферменты.
Все же следует оговориться, что время жизни ОН' небольшое
(табл. VI.2) и гидроксид-радикал успевает диффундировать лишь на
один-два молекулярных диаметра, взаимодействуя лишь с молекула-
молекулами близлежащих компонентов клетки. Поэтому вероятность прямого
взаимодействия его с ядерной ДНК малая. Диффундирующей «скры-
«скрытой» формой гидроксид-радикала является пероксид водорода — более
длительно живущая АФК, содержащаяся в клетке в относительно
больших количествах (табл. VI.2). Молекула Н2О2 (вступая в реакцию
с ионом металла) «доставляет» ОН' в мембранные структуры и ядро
клетки.
Важнейшую роль в протекании окислительно-восстановительных
реакций, к продуктам которых относятся АФК-прооксиданты, играет
и недавно открытая система N0, выполняющая функции регулятора
многих ключевых физиологических и биохимических процессов.
5.1.2. Активные соединения азота
В последние два десятилетия проведены фундаментальные иссле-
исследования, открывшие новую страницу в молекулярной биологии: уста-
установлено, что, казалось бы, простое химическое соединение — моноксид
азота N0, образующееся в организме из L-аргинина ферментативным
путем (рис. VI.3), — выполняет функции одного из наиболее универ-
универсальных регуляторов метаболизма.
Суммарное уравнение ферментной реакции образования N0,
включающее пятиэлектронное окисление атома азота (N^~ —> N^~)
аргинина (L-аргинин — Apr — превращается в L-цитруллин — Цит),
230
Гл. VI. Реакции клетки на действие ионизирующих излучений
НАДФ.Н; О2;
NO-синтаза
H,N+
coo-
H3N+
+ "NO;
coo-
L-аргинин
L-цитруллин
Рис. VI.3. Образование NO в ходе NO-синтазной реакции. Один из гуанидиновых
атомов азота L-аргинина окисляется молекулярным кислородом в NO при участии
фермента NO-синтазы. Пунктиром отмечены химические группировки, участвую-
участвующие в модификации при образовании NO и L-цитруллина
сопряженное с окислением НАДФ.Н, имеет вид:
2 Арг+3 НАДФ.Н+4 О2+3 Н+ = 2 Цит+2 N0+3 НАДФ++4 Н2О.
(VI.22)
Ферментная реакция генерации моноксида азота обеспечивается
изоформами эндотелиальной и нейрональной NO-синтаз. В 1998 г.
В.П.Реутов и Е.Г.Сорокина сформулировали концепцию цикла ок-
оксида азота, согласно которой электронодонорные системы, содер-
содержащие НАДН, НАДФ.Н, флавопротеиды и восстановленные гемсо-
держащие белки, находящиеся в дезоксиформе, обладают нитрит-
редуктазной активностью и способны замкнуть цепочку в цикл.
Авторы предложили следующую схему метаболических превраще-
превращений: L-аргинин —у N0 —у NO^/NOg" (рис. VI.4).
Обнаружено, что активные соединения N0 выполняют много-
многообразные физиологические регуляторные функции в организме,
выступая в качестве антагониста адренергической нервной системы,
регулирующего по эфферентным нервам деятельность дыхательной,
мочеполовой, мышечной, секреторной, сосудистой и других систем.
Установлено активирующее действие N0 на растворимую форму
важнейшего внутриклеточного регуляторного белка — гуанилатци-
клазы — фермента, ответственного за синтез одного из вторичных
мессенджеров — цГМФ.
Малые размеры двухатомной газообразной молекулы N0 и отсут-
отсутствие заряда позволяют ей легко проникать через плазматические и
внутриклеточные мембраны. Молекулы моноксида азота легко диф-
диффундируют в биологических средах и являются относительно долго-
живущими.
Так, среднее время жизни N0 в клетке составляет 5,6 с (табл. VI. 1).
№/2 его существования в почечной ткани крыс 6,41 с, в миокарде — 0,1 с,
5. Система окислительно-восстановительного гомеостаза клетки 231
о2
L-аргинин ; L-цитруллин
синтез NO ''^*ь- * <r"*""
в присутствии f NO-S j
кислорода
НАДФ.Н 10 НАДО
7 цикл
2JI ОКСИДА
V АЗОТА
в основном
выводится
из организма
синтез NO
в отсутствие
кислорода
Рис. VI.4. Схема образования NO и цикла оксида азота. NO-синтазная (NO—S) и
нитроредуктазная (NO~—R) компоненты цикла оксида азота в клетках млекопита-
млекопитающих: 1 — образование NO в результате NO-синтазной реакции; 2 — окисление NO
в NO при участии нитроредуктазных
и NO^T; 3 — восстановление NO^"
систем
в физиологическом растворе — от 6 до 30 с. В воде, из которой удален
кислород, N0 сохраняется несколько суток).
Наряду с нормальными регуляторными функциями, N0, образуясь
в фагоцитах в больших концентрациях, проявляет цитотоксическую
активность, обнаруживая эффекторные свойства системы клеточного
иммунитета.
Установлено также, что длительная генерация N0 способна вы-
вызывать патологию различного генеза. Так, наряду с другими АКСС,
оксид азота и его производные являются ключевыми факторами вос-
воспаления, инфекции, канцерогенеза, а также развития радиационных,
стрессорных и адаптивных ответов клеток и организма на соответ-
соответствующие воздействия.
Показано, что цитотоксические и цитогенетические эффекты обу-
обусловлены образованием чрезвычайно активного окислителя — пе-
роксинитрита (табл. VI.2), возникающего в реакции взаимодействия
оксида азота с супероксидным анион-радикалом:
N0
(VI.23)
232 Гл. VI. Реакции клетки на действие ионизирующих излучений
или протонированной формой пероксинитрита:
N=0 + '0-0" + Н+ —> O=N-O-OH. (VI.24)
Как видно, пероксинитрит представляет собой связующее звено
двух высокоактивных низкомолекулярных кислород- и азотсодержа-
азотсодержащих систем: АФК и АСА [активные соединения азота). Перокси-
Пероксинитрит может разлагаться с образованием гидроксид-радикала:
O=N-O-OH —> 0=N-0' + ОН'. (VI.25)
Протонир о ванный пероксинитрит так же, как и пероксид водо-
водорода, выполняет функции диффундирующей «скрытой» формы гид-
гидроксид-радикала.
Установлено, что пероксинитрит и его протонированная форма,
диффундируя в клетке и проникая через мембраны с помощью пе-
переносчиков анионов, имеют уникальный спектр химической реактив-
реактивности: разрывы цепочек и окисление оснований ДНК, нитрование
гуанина и белков, окисление липидов биологических мембран и т.д.
Результатом многих таких реакций могут быть цитогенетические эф-
эффекты и мутагенез.
N0 является источником не только пероксинитрита и гидроксид-
радикала, но и синглетного кислорода, который образуется при реак-
реакции моноксида азота с пероксидом водорода.
Сильные окислители 'NO и 0N0^~, обладая высокой реакционной
способностью, могут влиять на цепные свободнорадикальные реакции.
Их оксидазная активность во многом связана со способностью АСА
модифицировать уровень продуктов перекисного окисления липидов.
5.1.3. Продукты цепных реакций перекисного окисления
липидов
Перекисное окисление липидов исследовано не только в модель-
модельных системах (см. гл. V), но и на всех уровнях организации живого и
имеет свои особенности в норме и патологии клетки.
Известно, что биологические мембраны способны подвергаться ин-
интенсивной окислительной деградации, так как ненасыщенные участки
жирных кислот (линоленовой, арахидоновой и др.) фосфолипидов
чрезвычайно чувствительны к окислению.
Многочисленные данные молекулярной биологии показали, что при раз-
различных патологиях, в том числе и при лучевом поражении, одной из первых
клеточных структур повреждается мембрана митохондрий.
Митохондрия — «главная дышащая органелла клетки» (В. П. Скулачев,
2001), содержащая большое количество ферментов и коферментов (перенос-
(переносчиков электронов в дыхательной цепи) — главных участников клеточной
регуляции системы окислительно-восстановительного гомеостаза.
Известно, что БМ формируют элементы цитоскелета и ультраструкту-
ультраструктуру клетки. Они выполняют разнообразные барьерно-матричные функции,
нарушение любой из которых может привести к нарушениям жизнедеятель-
жизнедеятельности и в конечном итоге — к гибели клетки. Особенно уязвим липидный
слой БМ.
5. Система окислительно-восстановительного гомеостаза клетки 233
Лучевые оксидативные изменения структуры и функций БМ (повре-
(повреждения фосфолипидного барьера) приводят к дальнейшему нарушению
регуляции окислительно-восстановительного равновесия, возрастанию
мембранной проницаемости, дезинтеграции внутриклеточных процессов,
выравниванию градиентов с фатальным для клетки исходом.
Большое содержание полиненасыщенных жирных кислот в фос-
фолипидах определяет высокую способность БМ к неферментным
цепным реакциям окисления и образованию инициаторов и продук-
продуктов окисления, обладающих оксидазной активностью. В результате
цепных реакций липопероксидации образуются свободные радика-
радикалы (LО'-алкоксил-радикалы, ЬО^-пероксил-радикалы), гидроперокси-
ды — LOOH и другие молекулярные ППОЛ.
Из табл. VI.2 видно, что содержание таких продуктов в клетке
относительно высокое, время существования — довольно значительно,
и это создает условия для окисления ими практически любых макро-
макромолекул в клетке (ДНК, белков, ферментов и др.).
Первичная роль в зарождении неферментивных цепных процессов
ПОЛ в клетке, как и in vitro, принадлежит свободным электронам, до-
донорами которых могут служить Fe2+, Cu2+, семихиноны; сигнально-
пусковыми продуктами являются, как известно, OJ, H2O2, ОН' и N0'.
В инициировании цепных реакций могут принимать участие и другие
продукты АКСС, проникающие в липиды БМ.
Биологическая значимость цепного процесса, инициированного в
клетке, заключается в том, что он способствует накоплению токсиче-
токсических продуктов окисления в связи с их многократным циклическим
воспроизведением.
Цепной процесс липопероксидации в клетке протекает в такой
последовательности:
1. Молекулы ненасыщенных жирных кислот липидов LH окисля-
окисляются преимущественно радикалом ОН' (или другими АКСС):
LH + ОН' —> I/ + Н20. (VI.26)
2. Образовавшиеся радикалы липида L' претерпевают в клетке
дальнейшее окисление с помощью молекулярного кислорода или
с большей вероятностью — АКСС (АФК, NO-системами). Появ-
Появляются пероксил-ЬО^- и алкоксил-LО '-радикалы:
L' + 02 -^L02,
(VI.27)
I/+H2O2 —>LO'+H2O.
Реакции (VI.26) и (VI.27) имеют низкие энергии активации и
высокие константы скорости, величины которых зависят от окис-
окисляющегося соединения LH (например, степени ненасыщенности
липида) и типа окислителя — АКСС.
234 Гл. VI. Реакции клетки на действие ионизирующих излучений
3. В «топку сгорания» подбрасываются новые порции восстанов-
восстановленных молекул липидов LH, которые, окисляясь алкоксил-ра-
дикалом, образуют замкнутую цепь образования радикалов L':
LH + 2LO* —> 21/ + LOOH. (VI.28)
То же может происходить и с помощью образующихся пероки-
сил-радикалов LO2:
LH + LO2 —> I/ + LOOH. (VI.29)
В процесс вовлекаются все новые и новые молекулы липидов LH
и активных форм кислорода. В результате накапливаются гид-
ропероксиды LOOH. Число радикалов L', LO' (или LO2) не
изменяется (принцип неуничтожимости свободной валентности,
«бессмертия свободных радикалов»), хотя структурно радикалы
могут отличаться друг от друга.
4. Образующиеся липидные гидропероксиды вступают в реакцию
с радикалами ОН' (которые могут мигрировать в клетке на
большие расстояния с помощью пероксида водорода или перок-
синитрита):
2LOOH + 2ОН* —> I/ + 2Н2О2 + LO2
(VI.30)
или LOOH + ОН* —> LO' + Н2О2
или с радикалом LO":
2LOOH + 2LO* —> 21/ + Н2О2 + 2LO2 (VI.31)
и осуществляют вторичное инициирование цепи реакции и про-
протекание разветвленных свободнорадикальных цепных процессов.
5. При окислительном распаде липидных гидропероксидов обра-
образуются высоко лабильные ППОЛ, представляющие собой жир-
нокислотные фрагменты, содержащие пероксидные, эпоксидные,
альдегидные и кетонные группы. Лишь в последние годы, бла-
благодаря применению высокочувствительных аналитических ме-
методов, удалось идентифицировать некоторые из ППОЛ (см., в
дальнейшем, рис. VI.8-VI.10) и показать исключительно важную
их роль в биологии клетки.
Таким образом, цепной процесс липопероксидации в клетке может
быть представлен в виде схемы, изображенной на рис. VI.5.
Гидропероксид L — LOOH — и образованные им конечные продук-
продукты ППОЛ содержатся в клетке в норме на стационарном уровне, не
превышающем 1 мкмоль/л (табл. VI.2). При действии ионизирующих
излучений этот уровень возрастает, и вследствие усиления цепного
процесса многократного накопления конечных ППОЛ образуется их
избыток (ЛРТ, рис. VI.5), оказывающий токсическое действие на
клетку.
5. Система окислительно-восстановительного гомеостаза клетки 235
Рис. VI.5. Схема цепных свободнорадикальных процессов перекисного окисления
липидов (липопероксидации) в клетке. Объяснения в тексте. Обозначения: LH —
восстановленные молекулы липида, L' — радикал липида, LO' — алкоксил-ради-
кал, LOg — пероксил-радикал, ДН — донор водорода
236
Гл. VI. Реакции клетки на действие ионизирующих излучений
Таблица VI.3. Регуляторные и модифицирующие влияния продуктов перекис-
ного окисления липидов на биологические мембраны
Стационарный уровень ППОЛ
ругуляция
пассивного и
активного
транспорта
ионов и
веществ
через
мембрану
активность
системы
клеточной
регуляции
(цАМФ,
цГМФ)
установление и
сохранение в норме
функционирования
«мембранных
машин» и энергетики
клетки: ферментов,
рецепторов,
каналообразователей
разборка и
обновление
биомембран;
универсаль-
универсальная модифи-
модификация ее
структуры и
свойств
Радиационно-биофизические исследования цепных свободно-
радикальных механизмов вызвали резкий приток работ, посвященных
роли липопероксидации в патогенезе очень многих, самых разнооб-
разнообразных клеточных патологий и заболеваний организма. Однако
не менее важными являются и другие работы, на основе которых
сформировались представления и о биологической роли ППОЛ в
условиях физиологической нормы.
Процессы ПОЛ широко распространены в нормальной жизнедеятельно-
жизнедеятельности клетки. Биологическая роль ППОЛ и их связь с активными формами
кислорода и N0 подтверждается работами, в которых показано, что синтез
тканевых гормонов — простагландинов, лейкотриенов и др. — нуждается в
образовании перекисей ненасыщенных жирных кислот. Простагландины и
лейкотриены способны активно участвовать в процессах воспаления, вли-
влиять на цитотоксичность, дегрануляцию, хемотаксис, агрегацию, адгезию
лейкоцитов, синтез цитокинов и др. медиаторов гуморальных клеточных
взаимодействий. Образующиеся эйкозаноиды выполняют роль специфиче-
специфических эндогенных липидных биорегуляторов. Продукты цепных процессов
окисления липидов принимают активное участие в нормальной жизнедея-
жизнедеятельности клетки — в динамике структурообразования и функций БМ и в
эндогенной модификации ДНК.
В настоящее время хорошо известна важная биологическая роль
взаимного влияния активности ППОЛ и физико-химических свойств
липидного бислоя БМ. Так, ППОЛ оказывают значительное влияние
на функционирование плазматических и внутриклеточных БМ, обла-
обладая способностью включаться в механизмы формирования, разборки
и обновления их структуры, являясь физиологическими регуляторами
важнейших функций и универсальными модификаторами структу-
структуры БМ (Е.Б.Бурлакова, табл. VI.3).
Установлена зависимость интенсивности реакций липопероксида-
липопероксидации от степени ненасыщенности жирных кислот и состояния структур-
структурной организации биологических мембран: молекулярной подвижности
липидов, прочности липид-липидных и белок-липидных взаимодей-
взаимодействий.
5. Система окислительно-восстановительного гомеостаза клетки 237
антиокислительная активность
LOOH,
ППОЛ
окисляемость
скорость
расхода
антиоксидантов
активность ферментов
переписного окисления
Т
активность мембранно-
связанных ферментов
вязкость
(текучесть) мембран
активность и чувствитель-
чувствительность аденилатциклазы
цАМФ
фосфоди-
эстераза
протеинкиназы
липолитические
ферменты
Рис. VI.6. Схема модификации клеточного метаболизма
Интенсивность свободнорадикальных процессов перекисного окис-
окисления липидов, находящихся под контролем АКСС, эндогенных ан-
антиокислителей и активности ферментов, взаимосвязана с составом и
физическим состоянием фосфолипидов биологических мембран (теку-
(текучестью, окисляемостью и др.), с чувствительностью их рецепторов к
сигналам лигандов. Активация ПОЛ ведет к ускорению выхода легко
окисляемых липидов из БМ и обогащению их липидов резистентными
к окислению фракциями. Это в свою очередь замедляет скорость ЛПО
и возвращает этот процесс к норме.
Изменения скорости ПОЛ, состава и свойств липидов, т. е. струк-
структурных характеристик БМ, влияют на активность интегральных бел-
белков — ферментов, каналообразующих белков, рецепторов и др.
На рис. VI.6 приведена схема Е. Б. Бурлаковой, иллюстрирующая
способность окисленных БМ влиять на клеточный метаболизм.
238 Гл. VI. Реакции клетки на действие ионизирующих излучений
5.1.4. Окислительные процессы в облученной клетке
Радиационные изменения окислительно-восстановительного равно-
равновесия в живых системах начинаются уже сразу, с момента передачи
энергии ионизирующих излучений биоорганическим молекулам. Как
уже отмечалось в гл. V, в процессе ионизации происходит образование
электронов, которые представляют особый интерес с биологической
точки зрения, так как вызывают поляризацию и окисление молекул.
Электроны в водной среде стабилизируются до гидратированного со-
состояния, превращаясь в е^др, способные диффундировать на значи-
значительные молекулярные расстояния и эффективно взаимодействовать
с молекулярным кислородом, повышая уровень содержания суперок-
супероксида О2 (и других окислительных радикалов и продуктов) не только в
водных растворах, но и в облученной клетке. Другая часть электронов
окисляет биоорганические молекулы, первоначально превращая их в
катионы и радикалы. Кроме того, как уже отмечалось, количество
сильного радикала-окислителя ОН' возрастает в результате непосред-
непосредственного радиолиза молекул воды. В облученной клетке так же, как и
в водных растворах (гл. V) образуются оксирадикалы и оксипродукты,
способные окислять практически любые органические молекулы.
Известно, что ионизирующие излучения могут индуцировать в
клетке образование пероксинитрита. Уже первые работы (В.Д.Ми-
(В.Д.Микоян и др., 1994) показали, что его содержание в облученной клетке
возрастает за счет усиления активности NO-синтазы. Накапливающи-
Накапливающиеся в облученной клетке оксипродукты ОН', Н2О2 и ONO^~ высоко
эффективны и могут быть отнесены к радиотоксинам *) (АКСС-ра-
диотоксины — АКССрт). Важным свойством АКССрт является их
«пусковая» способность — инициировать и усиливать цепной процесс
перекисного окисления и инициировать образование сильных и отно-
относительно долгоживущих окислителей — ППОЛ. В облученной клетке
избыточно накопленные ППОЛ известны под названием «липидных
радиотоксинов» (ЛРТ). Они образуются, в основном, при окислении
полиненасыщенных жирных кислот фосфолипидов БМ.
Обе группы радиотоксинов АКССрт и ЛРТ объединяются под
общим названием оксирадиотоксины (ОРТ). Они вызывают в клетках
и тканях облученного организма повреждения, приводящие к так
называемому лучевому токсическому эффекту.
В начальный период после облучения в клетке происходит нару-
нарушение баланса между образованием ОРТ и антиокислителями. Эти
изменения неспецифичны для ионизирующих излучений и известны
под названием оксидативного стресса. Вначале при этом защитные
*) Радиотоксины (лат. radiare — излучать, гр. toxicon — яд) — низко-
низкомолекулярные биологически активные вещества различной природы, избы-
избыточно образующиеся в клетках и тканях животных и растений, а также в
одиночных клетках при воздействии ионизирующих излучений и участву-
участвующие в формировании лучевых поражений.
5. Система окислительно-восстановительного гомеостаза клетки 239
антиокислительные ресурсы клетки активируются и сдерживают вы-
выход окислителей из стационарного режима. Затем, по мере развития
лучевого поражения, содержание антиокислителей (антиокислитель-
(антиокислительный буфер) постепенно исчерпывается, и накопление радиотоксинов
приобретает бесконтрольный характер.
Известно, что содержание АКССрт и ЛРТ может увеличивать-
увеличиваться не только в липидах, но и в водной фазе клетки. Поэтому эти
продукты способны взаимодействовать с обоими радиационными кле-
клеточными мишенями — БМ и ДНК. Результат этих взаимодействий —
дальнейшее изменение системы окислительно-восстановительного го-
гомеостаза, перестройка физико-химической регуляции метаболизма в
клетке, нарушение барьерно-матричных свойств БМ, образование ад-
дуктов [ОРТ ДНК]. Участвуя в непрямом действии излучений, ОРТ,
и в частности ЛРТ, вызывают хромосомные аберрации, мутации, во-
вовлекаются в формирование радиационно-индуцируемой нестабильно-
нестабильности генома.
В экстремальной стадии оксидативных повреждений происходят
многоэтапные и значительные цитогенетические повреждения мише-
мишеней, завершающиеся гибелью облученной клетки.
В связи с изложенным предлагается следующая краткая схема
образования и действия оксирадиотоксинов (табл. VI.4).
5.1.5. Радиотоксины
Понятие о радиотоксинах возникло еще в начале прошлого сто-
столетия. Ряд немецких радиобиологов-биохимиков вели поиски эндо-
эндогенных «клеточных ядов», образующихся под действием излучений.
Предполагалось, что эти «яды» могли быть гистамином, холином,
какими-то иными низкомолекулярными продуктами распада белков.
Строились гипотезы о роли этих и других веществ в зарождении и
формировании лучевой болезни.
Однако достаточно глубоко рассматривать возникающие гипотезы
не представлялось возможным ввиду отсутствия в то время знаний
о механизмах действия ионизирующих излучений и данных о хими-
химической идентификации веществ, выделяемых из облученных организ-
организмов. Позднее делались попытки найти сходство в эффектах облучения
и действия бактериальных экзотоксинов или синтезированных препа-
препаратов — иприта, эмбихина, мильерана и их аналогов, имитирующих
действие ионизирующей радиации (радиомиметиков), а также эндо-
эндогенных хиноноподобных веществ и липидов.
Радиобиологи ряда лабораторий мира часто обращались к мысли,
что многие проявления лучевого поражения можно объяснить обра-
образующимися при облучении токсическими веществами. На роль радио-
радиотоксинов в развитии лучевого поражения указывали многочисленные
исследования по введению экстрактов, выделенных из облученных
организмов, интактным биологическим объектам; по дистанционному
действию излучений; эксперименты с парабионтами (один партнер —
240 Гл. VI. Реакции клетки на действие ионизирующих излучений
sis
О к
П q; Ц <j
g щ VO К
I: I
a
18
as.
о н
х О
5 &
Н о
к
я
!т!
ьста!
о
о
|м
о ^
Эо
8^
. <м
О
о
фОВ
д-
S
Я"
о м
&о
яК
к
&
vo о
о я
(
о
ft
о
о
к
I
ТГ
о
к
\
>
I
н
р_
о
ЗОЙСТ1
о
3
а
о
н
о
«
н
о
п
кте!
аЗ
а
аЗ
X
СО
на ри
s
со
и
iee с:
VD
а
о
I—1
о
S
Н
Рч
ЬНЫХ
О)
Ч]
о
а
н
а
н
о
кую
счес
5. Система окислительно-восстановительного гомеостаза клетки 241
облученный, другой — реципиент); по оценке роли токсемии в патоге-
патогенезе лучевой болезни; в опытах по повышению радиочувствительности
клеток при их пострадиационной инкубации в тканевых культурах,
наконец, в исследованиях по влиянию облученной цитоплазмы на
необлученные ядра клеток.
Все больше укреплялось предположение, что токсичность является
результатом появления в облученных клетках избыточных концентра-
концентраций продуктов обычного метаболизма, но в условиях выхода его из
нормального режима, а не появления новых, чуждых для организма
веществ.
Подводя итог этим исследованиям, Б.Н.Тарусов еще в 1954 г.
отмечал, что анализ развития лучевого поражения во времени поз-
позволяет говорить о механизмах усиления незначительных первичных
радиационных повреждений — образования активных «первичных
токсинов» (тогда еще не идентифицированных), действие которых
является пусковым для автокаталитической цепной реакции.
Основываясь на данных радиационной биофизики и химической
кинетики, Б. Н. Тарусов (публикации 1957-1962 гг.) выдвинул и развил
теорию свободнорадикальных цепных процессов лучевого поражения
клетки и организма, сводящуюся в основном к следующим трем по-
положениям.
- Ионизирующая радиация не вызывает несвойственные для ор-
организма какие-то новые процессы, а активирует свободноради-
кальные цепные реакции окисления, находящиеся в интактных
клетках в стационарном режиме и обычно протекающие с малой
скоростью.
- Основным субстратом первичных лучевых цепных процессов
перекисного окисления в клетке являются легко окисляемые
биолипиды (т. е. фосфолипиды, содержащие полиненасыщенные
жирные кислоты).
- Процессы перекисного окисления развиваются по кинетике цеп-
цепных разветвленных реакций в присутствии ингибиторов, поэто-
поэтому в этих реакциях большое значение приобретает и характер
природных ингибиторов окислительных реакций — антиоксидан-
тов, с количеством и качеством которых связана в значительной
мере радиочувствительность организма.
Эта теория выдержала проверку временем и явилась основой для
многих радиационно-биофизических исследований механизмов луче-
лучевого поражения биологических объектов и систем.
Развивая идеи о роли радиотоксинов в облученном организме,
А. М. Кузин отмечал, что особое значение для понимания начальных,
пусковых лучевых реакций имеет эффект воздействия токсических
веществ на структуру и функции БМ и уникальных молекул ДНК.
16 Ю. Б. Кудряшов
242 Гл. VI. Реакции клетки на действие ионизирующих излучений
5.1.6. Оксиаддукты ДНК
Еще два десятилетия назад основное внимание биологов уделя-
уделялось экзогенным влияниям излучений, или ксенобиотиков, на ДНК,
а возможность повреждения уникальной макромолекулы в процессе
нормального метаболизма многими категорически отвергалась. Одна-
Однако все же стали появляться данные о случаях модификации ДНК при
действии избытка ППОЛ, накапливающихся в мембранах облученных
клеток. Затем стало ясно, что и образующиеся в интактной клетке
оксирадикалы способны изменять структуру ДНК. Накапливаясь по-
после облучения, ОРТ в виде идентифицированных продуктов ЛРТ,
а именно альдегидов и эпоксидов, взаимодействуют с основаниями
ДНК, образуя высокотоксичные оксиаддукты.
В настоящее время с помощью высокочувствительных аналити-
аналитических методов исследования лабильных структур (см. в этой главе
раздел «Свободные радикалы в облученной клетке и методы их опре-
определения») показано, что в интактной клетке происходят оксидативные
изменения макромолекул геномной ДНК и эти изменения возрастают
количественно при канцерогенезе и лучевом поражении. Большим до-
достижением этих работ оказались выводы об образовании в хроматине
в процессе клеточного метаболизма ДНК-оксиаддуктов, вызывающих
генотоксические эффекты, мутации и клеточную гибель (табл. VI.4).
Наиболее хорошо изучены аддукты с окисленными основанием
гуанозина — (8-оксо-дезоксигуанозин, 8-оксо-дГ), а также тимина (ти-
мингликоль), цитозина (б-гидрокси-5,б-дигидроцитозин) и урацила E-
гидроксиметилурацил; 5-гидроксиурацил; урацилгликоль) (рис. VI.7).
S
т
S CILOH
У
тимин гликоль
-oxo-dG
О
В.
OH
f
J
R
5-гидроксиметилурацил
OH
OH
"R "R
6гидрокси-5,6-дигидроцитозин 5-гидроксиурацил урацил гликоль
Рис. VI.7. Окисленные основания ДНК
5. Система окислительно-восстановительного гомеостаза клетки 243
Многие из идентифицированных оксиаддуктов приводят к значи-
значительным изменениям структуры хроматина, цитотоксичны, канцеро-
канцерогенны и являются структурной основой мутаций, наблюдаемых в му-
тантных генах организма (рис. VI.8-VI.10). Показано, что гуаниновые,
адениновые и цитозиновые оксиаддукты МДА («MDA») с ДНК (MiG,
Mi A, Mi С) обладают мутагенным, канцерогенным и цитотоксическим
действием на клетки различных органов и тканей млекопитающих.
Эпоксид ЭГН («EHN»), взаимодействуя с основаниями ДНК, об-
образует этено-аддукты. Они обладают слабым мутагенным и сильным
цито-генотоксическим эффектами.
Среди ППОЛ выраженным токсическим действием обладают ак-
акролеин и кротоновый альдегид. С основаниями ДНК в клетках они
образуют пропано-аддукты — гидроксипропанодезоксигуанозины —
ГПДГ, (OH-PdGs), вызывающие мутагенные эффекты.
5.2. Антиокислительные механизмы защиты облученной клетки
Современные фундаментальные исследования по биоэнергетике
оказались весьма плодотворными при радиобиологическом изучении
механизмов системного ответа клетки на облучение, например, в ре-
регуляции окислительно-восстановительного равновесия в клетке. На
разных этапах развития лучевого поражения — начиная от момента
облучения вплоть до терминальной стадии процесса — подключаются
разнообразные средства внутриклеточной антиоксидантной защиты
облученной клетки. Облучение вызывает не только повреждение ра-
радиобиологических мишеней — БМ и ДНК, но и изменение (мобили-
(мобилизацию и последующее подавление) нормального функционирования
системы защиты этих критических для жизнедеятельности клеточных
структур.
Проследим последовательность проявления сложнейших и мно-
многоплановых механизмов защиты облученной клетки от избыточного
образования ОРТ — с момента поступления молекулярного кислорода
в клетку до образования при его участии оксирадиотоксинов — ППОЛ
(ЛРТ). Схематично это представлено на рис. VI.11.
5.2.1. Снижение содержания молекулярного кислорода и АФК
5.2.1.1. Гипоксия
Естественно, что наиболее эффективный путь защиты от накопле-
накопления начальных (соответственно — и последующих) продуктов восста-
восстановления кислорода — это снижение в клетке концентрации молеку-
молекулярного кислорода (рис. VI.11, I).
Интересно, что наиболее эффективным клиническим методом за-
защиты организма от лучевого поражения являются физические и фар-
мако-химические способы создания гипоксии к моменту облучения —
профилактическое снижение содержания кислорода в окружающей
атмосфере, инъекции препаратов, вызывающих клеточную и ткане-
тканевую гипоксию и др.
16*
244 Гл. VI. Реакции клетки на действие ионизирующих излучений
и
>
к
к
Я
о
I
ч:
о
1 I
ч; °
1!
PQ
w ы
5. Система окислительно-восстановительного гомеостаза клетки 245
ОН
ОН
H dR
l,N2-3TeHo-dG
этено-dA
этено-dC
N2,3-3TeHo-dG
Рис. VI.9. Реакция эпоксида ЭГН B,3-эпокси-4гидроксиноненала) с основаниями
ДНК и образование этено-аддуктов
ОН О
он о
НО
Рис. VI.10. Пропано-аддукты (ГПДГ)
Нетрудно видеть, что в таких условиях в облучаемой системе
вследствие уменьшения содержания кислорода наблюдается понижен-
пониженный уровень потенциально опасных продуктов окисления (свободных
радикалов, оксирадиотоксинов), в чем и проявляется известный в
радиобиологии универсальный эффект защиты от облучения.
Однако клетка имеет также и свои разнообразные механизмы за-
защиты от любой (в том числе и радиационной) угрозы образования
избытка молекулярного кислорода и компонентов ОРТ (рис. VI.2). К
таким механизмам относится, прежде всего, активность митохондри-
алъной цитохромоксидазы, способной поглощать О2, включая его в
молекулу воды, и тем самым вносить вклад в защиту клетки путем
создания «эндогенной гипоксии».
246
Гл. VI. Реакции клетки на действие ионизирующих излучений
I. Антирадикальный
механизм
Антирадикальный
А н ти р а ди кал ьм ы й
механизм
III. Антиокислительный
механизм
о
ОН
HDWKCW
нродук
мыс
ты
Рис. VI.11. Схема механизмов защиты клетки от образования и токсического дей-
действия ОРТ. Обозначения: LH — восстановленные молекулы липида, L' — радикал
липида, LO' — алкоксил-радикал, LOg — пероксил-радикал, ДН — донор водорода,
HIn — восстановленный ингибитор, FSHF — восстановленный глутатион, FSSF —
окисленный глутатион, R " — молекула в свободнорадикальном состоянии
5.2.1.2. Ферментный контроль уровня АФК
Известно, что молекулярный кислород способен легко проникать
через биологические мембраны, так как он не имеет заряда и его гид-
гидрофобные свойства выражены сильнее, чем гидрофильные (коэффи-
(коэффициент распределения кислорода в системе липид/вода = 10). Поэтому
нейтральная молекула кислорода легко проникает через мембрану
внутрь клетки, образуя в ней супероксид (уравнение (VI.9)).
Если, несмотря на активность цитохромоксидазы, содержание
молекулярного кислорода продолжает возрастать, а концентрация
супероксида увеличиваться, OJ реокисляется с помощью фермента
цитохрома с или (и) удаляется из клетки с помощью дальнейших
превращений.
В отличие от молекулярного кислорода, супероксид имеет заряд
и, следовательно, гидратируется. Такое «громоздкое» образование с
5. Система окислительно-восстановительного гомеостаза клетки 247
гидрофильным окружением не растворяется в липидах БМ и не мо-
может покинуть клетку, которая становится «ловушкой супероксида»
(В. П. Скулачев).
Удаление избытка супероксида из клетки происходит в результате
дисмутации OJ ферментом митохондриального матрикса суперок-
сиддисмутазой (СОД) с превращением в Н2О2 — незаряженную
молекулу, легко проникающую через мембрану (уравнение (VI. 14)).
В свою очередь, пероксид водорода в митохондиях и пероксисомах
инактивируется активным ферментом каталазой*):
2Н2О2 —> 2Н2О + О2. (VI.32)
Ферментная система пероксидаз, например, глутатионперокси-
даза, локализованная в мембранах, отводит избыток Н2О2 на специ-
специальные субстраты, например, глутатион (GSH):
2GSH + Н2О2 —> G-S-S-G + 2Н2О. (VI.33)
Если активность ферментов контроля за стационарным уровнем
АФК оказывается недостаточной, тогда может включаться еще один
механизм защиты — способность мембраны митохондрий регулиро-
регулировать открытие пор.
5.2.1.3. Регуляция открытия пор митохондриальной мембраны
Уже первые сигналы аномального возрастания содержания кис-
кислорода в клетке ведут к накоплению О2, Н2О2 и ОН' в таких кон-
концентрациях, которые вызывают открытие пор мембран митохондрий,
что приводит к быстрому «изгнанию» из клетки излишков кисло-
кислорода и АКСС. При нормализации уровня молекулярного кислорода
концентрации АКСС достигают исходных величин, а это вызывает
регуляторное закрытие пор.
5.2.1.4- Утечка протонов
Известно, что в стадии, предшествующей некрозу клетки, про-
происходит «неомическая» утечка протонов в мембранах митохондрий.
Она позволяет поддерживать низкую концентрацию кислорода, осу-
осуществляя защиту клетки от токсического действия кислорода и по-
появления избыточных концентраций CoQ (кофермента Q, образуемого
дыхательными ферментами) и, следовательно, супероксид-анион ра-
радикалов и других АФК.
5.2.2. Снижение уровня и активности радиотоксинов
При усилении цепных процессов липопероксидации в облучен-
облученной клетке включаются антирадикальные и антиокислительные
механизмы, сдерживающие образование избытка ППОЛ, т. е. ЛРТ
(рис. VI.7, II, III).
*) Радиобиологический кислородный эффект рассматривался в преды-
предыдущих главах. Одна молекула каталазы способна разложить в клетке за 1 с
более 40 тыс. молекул Н2О2.
248 Гл. VI. Реакции клетки на действие ионизирующих излучений
5.2.2.1. Ферментные реакции
С помощью глутатионпероксидаз происходит ферментативное
восстановление молекул липидных гидропероксидов:
2GSH + LOOH —> G-S-S-G + Н20 + LOH. (VI.34)
Фосфолипидгидропероксид-глутатионпероксидаза также произво-
производит восстановление гидропероксидов, но уже не свободных, а находя-
находящихся в составе негидролизованных фосфолипидов:
2GSH + ROOH —> G-S-S-G + Н20 + ROH. (VI.35)
В отличие от глутатионпероксидаз, глутатионтрансферазы вос-
восстанавливают только органические гидропероксиды, в том числе и
ядерный гидропероксид ДНК, локализованный в хроматине. Глута-
тионредуктаза катализирует регенерацию GSH из G—S—S—G:
G-S-S-G + НАДФН + Н+ —> 2GSH + НАДФ, (VI.36)
предоставляя возможность глутатиону вновь и вновь защищать ДНК
и другие жизненно важные компоненты клетки путем предотвраще-
предотвращения образования ROOH и (или) их непосредственного разрушения.
Важную роль в антирадикальной и антиокислительной защите от
оксидативного токсического действия ОРТ играют в клетке также
оксигеназные системы, в том числе и цитохром Р45О5 физио-
физиологическая роль которых сводится к увеличению водорастворимо-
сти, полярности окисляемой молекулы в биологических мембранах.
Считается, что это, по существу, единственный механизм передачи
высоконеполярных, гидрофобных молекул из липидной фазы клетки
(мембраны) в водную фазу и последующей их инактивации, напри-
например, путем превращения окисленного продукта в GSH-зависимых и
трансферазных реакциях и последующего удаления водорастворимых
окисленных веществ (А. И. Арчаков, 1983).
5.2.2.2. Низкомолекулярные антиокислители
Глутатион участвует не только в процессах антиокислительного
механизма защиты, взаимодействуя с пероксидом водорода и гидро-
пероксидами, но он способен обезвреживать ЛРТ — эпоксиды, аль-
альдегиды и др. продукты цепных процессов липопероксидации. Его
концентрация в клетке A—10 ммоль/л) намного превышает уровень
АФК и продуктов ПОЛ (табл. VI.2). Глутатион включается в анти-
антиокислительные защитные реакции буквально во всех частях клетки,
включая митохондрии, ядро, эндоплазматический ретикулум; его ино-
иногда называют «главным восстановителем в клетке» (В. И. Кулинский).
Защитные системы клеток имеют, наряду с глутатионом, в своем
арсенале большой «набор» низкомолекулярных веществ «антиокис-
«антиокислительного буфера», способных перехватывать или инактивировать
радикалы, восстанавливать АПК, в том числе и продукты ПОЛ на
разных этапах их образования.
Приведем перечень наиболее активных из них в табл. VI.5.
5. Система окислительно-восстановительного гомеостаза клетки 249
Таблица VI.5. Перечень наиболее активных низкомолекулярных компонентов
«антиокислительного буфера»
Эндогенные антиоксиданты
Тиолы:
— восстановленный глутатион, цистеин
Биогенные амины:
- серотонин, гистамин, катехоламины
Пептиды:
- карнозин, ансерин
Витамины:
- аскорбиновая кислота
— токоферол, /3-каротин и другие каротиноиды
Стероиды:
- кортикостероиды
Другие антиоксиданты:
- микроэлементы, ионы металлов переменной
валентности
- таурин, убихинон, ураты, билирубин,
фенолы, фосфолипиды
Растворимость
растворимы в воде
растворимы в воде
растворимы в воде
растворима в воде
растворимы в
липидах
растворимы в
липидах
растворимы в воде
и (или) липидах
Приведенные компоненты «антиокислительного буфера» облада-
обладают способностью снижать уровень и токсическое действие АКСС
(ОРТ) в водной и липидной фазах клетки.
Заметим, что многие из этих биологически активных веществ
применяются в радиобиологии в качестве препаратов — радиопротек-
радиопротекторов, введение которых в клетки и организмы оказывает защитное
профилактическое действие от острого облучения (Е. Н. Гончаренко,
Ю.Б.Кудряшов, 1985).
При защите от острого облучения уже полвека используются наибо-
наиболее эффективные радиопротекторы — аминотиолы и биогенные амины, их
многочисленные синтезированные в лабораториях аналоги, а также низ-
низкомолекулярные пептиды и, конечно, вещества и приемы создания гипок-
гипоксии. При длительном хроническом низкоинтенсивном лучевом воздействии,
когда применять радиопротекторы не представляется возможным (напри-
(например, в связи с их кратковременным действием, а также с вынужденной
токсичностью препаратов, эффективных только в высоких концентраци-
концентрациях), используются пищевые добавки, включающие витамины, микроэле-
микроэлементы, адаптогены, содержащие комплексы антиокислителей (Ю. Б. Куд-
ряшов, 2000).
250 Гл. VI. Реакции клетки на действие ионизирующих излучений
Факт эффективности, результативности применения антиокисли-
антиокислителей в качестве препаратов для противолучевой защиты биологиче-
биологических объектов подтверждает общий вывод о ключевой роли наруше-
нарушения системы окислительно-восстановительного гомеостаза в формиро-
формировании радиационного эффекта.
Необходимо особо отметить, что радиационные нарушения окис-
окислительно-восстановительного гомеостаза в биологических мембранах
и цитозоле тесно связаны с повреждениями структуры и функции
ядерного аппарата клетки, ДНК — центральной субклеточной струк-
структуры в жизнедеятельности всех эукариотических клеток. Вопросу об
изменениях ДНК и ее репарации в облученных клетках посвящен
следующий раздел этой главы.
6. Повреждения и процессы восстановления ДНК в
облученной клетке
Согласно центральному постулату генетики, развитие и свойства
организма определяются генами — дискретными единицами наслед-
наследственности в виде участков ДНК. В совокупности они составляют
геном, который в точности воспроизводится в поколениях клеток и ор-
организмов благодаря механизмам наследственности. Основным из этих
механизмов, обеспечивающим поддержание постоянства (стабильно-
(стабильности) генома, является репликация ДНК, корректируемая репарацией,
благодаря чему лишь изредка возникают случайные изменения в ге-
геноме — мутации, являющиеся одним из проявлений другой характе-
характеристики генома — его непостоянства.
Материальную основу мутаций составляют нарушения исходной
структуры ДНК, вызванные весьма редкими ошибками механизма
репликации или действием генотоксических факторов. В результате
закрепления в потомстве (наследования) определенного типа струк-
структурных изменений (мутаций) образовался ряд наследственных заболе-
заболеваний, таких как атаксия-телеангиэктазия, анемия Фанкони, синдром
Блюма, пигментная ксеродерма и др.
Феномен мутационных изменений был открыт в радиобиологиче-
радиобиологических опытах. Развитие представлений о его биологической значимости
также происходило во многом на основании данных радиобиологии.
Стало аксиомой, что такие последствия действия радиации на орга-
организм, как клеточная гибель, хромосомные аберрации и опухолевая
трансформация, возникают в ходе мутационного процесса или служат
его проявлениями как результат необратимых повреждений первич-
первичной структуры клеточной ДНК во время самого облучения. Таким
образом, одним из следствий возникновения мутационных изменений
в геноме является увеличение вероятности развития патологии.
Не менее значима другая, лишь отчасти связанная с возможностью
развития патологии функция непостоянства, изменчивости генома —
адаптационно-эволюционная. При ее осуществлении также возникают
мутационные явления, сходные по внешним признакам с генетически
6. Повреждения и процессы восстановления ДНК 251
наследуемыми, но они имеют иную частоту и механизмы, сопрово-
сопровождают процессы клеточной дифференцировки, регуляции активности
генов. Они передаются в потомстве клеток эпигенетически, направле-
направлены на адаптацию к изменяющимся условиям среды и обеспечивают
эволюционный процесс.
6.1. Повреждения ДНК
Поглощенная мишенью — макромолекулой ДНК — энергия иони-
ионизирующих излучений обусловливает, как уже говорилось, ионизацию
и возбуждение в молекулах, локализованных в чувствительном объ-
объеме. Ионизации, в отличие от возбуждений, с определенной веро-
вероятностью приводят к разрыву химических связей в молекулах. Ко-
Количество ионизации, индуцируемых в треке частицей, пересекающей
чувствительный объем (с учетом й-электронов), зависит от качества
излучений. Так, при рентгеновском или 7"излУчениях в яДРе диа-
диаметром 8 мкм индуцируется несколько десятков ионизации, что эк-
эквивалентно дозе, приблизительно, в 1 мГр. При пролете а-частицы
D МэВ) в ядре с теми же параметрами происходит 23000 ионизации,
эквивалентных дозе 370 мГр. Однако следует отметить, что плотность
ионизации неоднородна даже в треках частиц с малыми величинами
лпэ.
Известно также, что число разорванных химических связей зави-
зависит не только от ионизации и возбуждения молекул, но и от их локаль-
локальных концентраций в треке пролетающей частицы. Эти концентрации в
свою очередь зависят от способа пространственной упаковки молеку-
молекулы-мишени. При равной концентрации молекул-мишеней в некотором
объеме проход соответствующей частицы может реализовать различ-
различные типы повреждений. Например, если отдельные участки молеку-
молекулы пространственно сближены и находятся в области пролетающей
частицы, увеличивается вероятность одновременных разрывов в этих
участках.
В зависимости от ЛПЭ пролетающей частицы при прочих равных
условиях облучения количество и типы разрывов в анализируемом
участке молекулы-мишени варьируют. Множественные повреждения
макромолекул в локальной области называют комплексными. Таким
образом, спектры повреждений в молекулах-мишенях зависят от спо-
способа пространственной организации их отдельных фрагментов и каче-
качества излучения.
Все типы повреждений ДНК в облученной клетке можно условно
разбить на следующие три группы.
К первой группе принадлежат изменения в каждой из цепей двух-
спиральной молекулы ДНК, не нарушающие ее пространственную
непрерывность как целого. Среди таких повреждений выделяют од-
нонитевые разрывы (ОР), модификации и повреждения осно-
оснований, образование щелочелабильных участков и др. Большинство
повреждений этого типа образуется вследствие атаки соответствую-
соответствующих участков ДНК радикалами, генерируемыми в среде, т. е. в ре-
результате непрямого действия излучений.
252 Гл. VI. Реакции клетки на действие ионизирующих излучений
Вторую группу образуют повреждения, приводящие к нарушению
пространственной и, следовательно, информационной непрерывности
двухспиральной молекулы ДНК как целого. К повреждениям этого
типа относят двунитевые (двойные) разрывы (ДР), являющиеся
следствием образования ОР на противоположных цепях ДНК. При
этом расстояние между ОР на противоположных цепях может варьи-
варьировать от единиц до превышающих десяток нуклеотидных пар.
К третьей группе повреждений ДНК в облученной клетке можно
отнести нарушение ее вторичной структуры и надмолекулярной орга-
организации, вклад которых в общую картину лучевых повреждений пока
еще недостаточно изучен.
6.1.1. Повреждения ДНК при внешнем облучении клетки
При плотной упаковке ДНК (например, в составе конденсирован-
конденсированного хроматина) и при внешнем действии излучений с высокими зна-
значениями ЛПЭ в ограниченном участке ДНК, кроме указанных выше
повреждений, в каждой из цепей ДНК могут возникнуть отдельные
или несколько ДР с множественными локальными повреждениями
макромолекулы. Например, компьютерные наблюдения показывают,
что при проходе а-частицы A40 кэВ/мкм) через структуру декон-
денсированного хроматина появляются фрагменты ДНК размером
в 100 нуклеотидных пар, а для конденсированного хроматина (соле-
(соленоид) — 1200-1400 нуклеотидных пар.
Эти и ряд других данных свидетельствуют об образовании класте-
кластеров комплексных повреждений ДНК в пределах отдельных сложно
упакованных фрагментов хромосом. При этом ДР составляют только
некоторую часть комплексных повреждений в кластере, зависящую
от ЛПЭ излучений. Радиационно-химический выход ДР, особенно для
излучений с высокими ЛПЭ, зависит линейно от величины дозы внеш-
внешнего облучения. Это указывает на возможность возникновения ДР в
результате поглощения энергии трека даже одиночной ионизирующей
частицы на локальном участке ДНК.
В ДНК облученной клетки могут возникать также ковалентные
сшивки ДНК-белок. Их количество возрастает с увеличением степени
конденсации хроматина с выходом, сравнимым с выходом ОР. Сшивки
наблюдаются между определенными основаниями ДНК и аминокис-
аминокислотами белков, например, между цитозином и тирозином, тимином
и тирозином и др. Количество сшивок зависит также от качества
излучения: с возрастанием ЛПЭ радиационно-химический выход их
увеличивается.
6.1.2. Повреждения ДНК при внутреннем облучении
Остановимся кратко на повреждениях ДНК, вызываемых излу-
излучениями инкорпорированных в эту макромолекулу радионуклидов,
наиболее часто применяемых в биологических экспериментах: 3Н,
14С, 32Р. Оценка радиобиологического эффекта этих /^-излучающих
радионуклидов затрудняется тем, что в результате радиоактивного
6. Повреждения и процессы восстановления ДНК 253
Таблица VI.6. Повреждения ДНК в клетках млекопитающих, индуцированные
действием излучений с низкими ЛПЭ
Тип повреждений
однонитевые разрывы (ОР)
повреждение оснований
сшивки ДНК-белок
двунитевые разрывы (ДР)
Количество повреждений
в клетке на 1 Гр
1000
500
150
40
распада названные изотопы превращаются в стабильные элементы —
гелий (Не), азот (N) и серу (S) соответственно. Такое превращение ра-
радионуклидов называется трансмутацией. Таким образом, поврежде-
повреждения, возникающие в исходных органических молекулах, могут быть
обусловлены, с одной стороны, воздействием /^-излучения, с другой —
изменением элементного состава вследствие трансмутации одного из
типов атомов, что приводит к внезапному нарушению распределения
орбитальных электронов в молекуле с последующей перегруппировкой
их и образованием стабильной, но другой молекулярной конфигу-
конфигурации.
Для вычленения вклада радиационной компоненты в суммарное
повреждающее действие радиоактивного распада приведенных
радионуклидов используется методика суицидальных экспериментов,
предложенная Херши с соавт. в 1951 г. Суть ее состоит в том, что,
например, в азотистое основание ДНК или какую-либо аминокислоту
клеток вводится радиоактивный изотоп, меченые клетки затем
подвергаются охлаждению до такого состояния, когда метаболические
процессы в ней прекращаются, и единственным событием остается
распад радиоактивных атомов. После выдерживания клеток в таком
состоянии для достижения измеряемого количества трансмутаций
клетки инкубируют при температуре, физиологической для их
жизнедеятельности, и оценивают радиобиологический эффект (по
выживаемости), произведенный /^-излучением.
Зн
При включении 3Н в пуриновые основания ДНК главными про-
продуктами трансмутационного компонента радиоактивного распада ра-
радионуклида в 8-м положении пуринового остатка являются 8-оксо-7-
дигидроаденин (8-оксоА) и 8-оксо7,8-дигидрогуанин (8-оксоГ) — те же
соединения, которые возникают при повреждении пуриновых осно-
оснований оксирадикалами. В опытах на фаге Л образование 8-оксоА и
8-оксоГ в определенных количествах оказывается для бактериофага
летальным. Эффективность инактивации фага (число летальных по-
повреждений на 1 3Н-распад в фаговом геноме) за счет 3Н-распада в
позиции 8 пуринов та же самая, что измеряется при повреждении в
положениях 5 и б колец пиримидиновых оснований ДНК.
254 Гл. VI. Реакции клетки на действие ионизирующих излучений
Образование 8-оксоГ ответственно за главную часть мутагенного
эффекта, вызываемого 3Н. При этом эффективность мутагенного
действия 3Н-пуринов (частота мутаций на 1 3Н-распад в фаговом
геноме) возрастает от 2,4-кратной при отсутствии в бактериальной
клетке одного из ферментов репарации нарушенного спарива-
спаривания А:Г — ДНК-гликозилазы — до 55-кратной, когда отсутствует
и другой аналогичный фермент — формамидопиримидин-ДНК-
гликозилаза. Последняя устраняет до 40% от общего количества
8-оксоГ, образующегося при /^-распаде 3Н, но не предохраняет от
мутаций, возникающих в ДНК в результате ошибок репаративной
репликации по местам апуриновых-апиримидиновых участков,
образуемых гликозилазами в нитях ДНК.
14С
Энергия возбуждения его составляет «45 эВ. Этого достаточно
для разрыва любой химической связи в молекуле ДНК. Поэтому
при /^-распаде 14С в составе колец азотистых оснований ДНК будет
происходить раскрытие колец, либо (и) будут возникать аналоги
с заменой углерода на азот. Таким образом, радиоактивность 14С
может вызывать трансмутации и ОР. Появление ДР в данном случае
маловероятно.
32р
Распад 32Р в составе ДНК с вероятностью = 0,1 приводит к обра-
образованию ДР и с вероятностью =1 — ОР. Разрыв связей происходит по
чисто химическим причинам, т. к. в результате распада 32Р образуют-
образуются серноэфирные связи, которые не устойчивы в водных растворах и
легко гидролизуются. Образовавшиеся при распаде одной цепи ДНК
радикалы взаимодействуют с окружающими молекулами, в том числе
и со второй цепью макромолекулы, а это в конечном счете приводит
к ДР ДНК. По-видимому, основной вклад в летальный эффект кле-
клеток при распаде 32Р, включенного в ДНК, вносит трансмутационная
составляющая.
В целом радиационно-химические выходы продуктов повреждения
ДНК, образующихся в результате /^-распада инкопорированных ради-
радионуклидов, примерно соответствуют тем, которые наблюдаются при
внешнем воздействии /^-излучения в равных экспозиционных дозах.
Следует отметить, что только крайне незначительная часть ра-
радиационных повреждений, возникающих в ДНК при воздействии из-
излучений, сохраняется надолго в облученных клетках. Подавляюще
большая часть их устраняется в ходе репарации ДНК.
6.2. Репарация ДНК от повреждений
Из происходящих в облученных клетках изменений наиболее зна-
значимыми являются повреждения — мутации и хромосомные аберрации,
поскольку они передаются в ряду клеточных поколений и определяют
типы генетических дефектов. Известно, что многие из них служат
6. Повреждения и процессы восстановления ДНК 255
отражением нестабильности генома, являются причиной наследствен-
наследственных заболеваний, приводят к трансформации клеток (одна из стадий
злокачественного перерождения клеток) или к их гибели.
Естественно, что в процессе эволюции были выработаны системные
реакции, предохраняющие геном от вредных воздействий, репариру-
ющие его от возникших повреждений и поддерживающие его посто-
постоянство.
Первичные изменения ДНК — это начальный, узловой этап много-
многостадийного мутационного процесса. Важнейшая стадия, контролиру-
контролирующая мутагенез, — репарация ДНК.
6.2.1. Ранние исследования
На существование репарации ДНК впервые обратили внимание
при анализе летального действия ультрафиолетового (УФ) излучения
на бактерии. Еще в 1928 г. было показано, что наибольшей эффек-
эффективностью в летальном эффекте обладают кванты этого излучения с
длиной волны 260 нм, которые избирательно поглощаются азотисты-
азотистыми основаниями ДНК. Возникло предположение, что мишенью для
летального действия УФ радиации служит бактериальная ДНК. Обос-
Обосновать это предположение удалось лишь после открытия роли ДНК в
наследственности. Стало очевидным, что для клеток фотохимическое
повреждение генетических структур является губительным.
В I960 г. были выявлены фотохимические повреждения ДНК,
ответственные за летальное действие ультрафиолетового излучения.
Ими оказались димеры тимина, возникающие в результате связывания
двух соседних оснований одной полинуклеотидной цепи. Появление
димеров приводит к локальному нарушению вторичной структуры
ДНК и подавлению активности того гена, в котором произошла диме-
ризация.
Было показано, что вероятность летального действия данной дозы
УФ излучения зависит от условий, в которых выдерживают облучен-
облученные клетки (освещение, состав питательной среды и т.д.). Так как
эти факторы не влияли на первичные фотохимические повреждения,
заключили, что бактерии способны репарировать свою ДНК, освобо-
освобождаясь от некоторых из фотохимических повреждений, а летальны
те повреждения, от которых репарация невозможна.
Значительный прогресс в этой области исследований был достиг-
достигнут благодаря открытию мутантов, дефектных по репарации ДНК.
Было обнаружено, что мутации в любом из трех генов — uvr A, uvr В
и uvr С в клетках Е. coli значительно повышают чувствительность
бактерий к действию УФ излучения. Эти гены расположены в трех
далеко отстоящих друг от друга участках генетической карты. Ве-
Вероятно, нормальный продукт, кодируемый ими, участвует в процессе
репарации.
Природу одного из молекулярных процессов репарации ДНК от-
открыл в 1964 г. Сетлоу с соавторами. Опыты проводились с нормальны-
нормальными и мутантными бактериями, ДНК которых предварительно метили
256 Гл. VI. Реакции клетки на действие ионизирующих излучений
3Н-тимидином. Оба типа клеток получали равную дозу УФ излучения,
после чего изучали количество 3Н-тиминовых димеров в клеточных
экстрактах.
Полученные результаты показали, что в обоих экстрактах содер-
содержится одинаковое количество тиминовых димеров в расчете на клетку.
Однако в чувствительном к УФ излучению штамме все тиминовые
димеры оказались в составе высокомолекулярной фракции, т. е. струк-
структурно целостной ДНК. Напротив, в нормальном штамме тиминовые
димеры обнаруживались в составе коротких фрагментов, состоящих
не более чем из шести нуклеотидов.
Отсюда авторы заключили, что в ДНК как нормальных, так и
мутантных штаммов образовалось одинаковое число начальных фото-
фотохимических повреждений. Однако нормальные клетки Е. coli облада-
обладают ферментативной системой, которая вырезает тиминовые димеры
из облученных полинуклеотидных тяжей, заменяя их нормальными
тимидиловыми нуклеотидами. Пониженная выживаемость мутантных
клеток, по-видимому, связана с отсутствием активного фермента,
необходимого для вырезания (эксцизии) димеров тимина.
В дальнейшем было показано, что в рассматриваемом процессе
участвует эндонуклеаза, вызывающая однонитевые разрывы в ДНК с
УФ повреждениями. Эта эндонуклеаза имеется в нормальных штам-
штаммах Е. coli и в мутантах по гену uvr С, но отсутствует в мутантах
по генам uvr А и uvr В. Из этого можно заключить, что гены uvr A
и uvr В кодируют разные субъединицы эндонуклеазы, репарирующей
ДНК от УФ повреждений.
Вслед за вырезанием тиминовых димеров и окружающих их ну-
нуклеотидов начинается репарационная репликация. Ее существова-
существование было доказано в экспериментах с бактериями, которые после
облучения УФ светом инкубировали в присутствии радиоактивного
бромурацила. Накопление радиоактивной метки свидетельствовало о
включении в облученные клетки бромурацила, который используется
при репликации ДНК вместо тимина.
Однако в облученных бактериях происходила не обычная репли-
репликация, протекающая только в репликационных вилках с образованием
меченых бромурацилом протяженных участков полинуклеотидов, а
репарационная, сопровождающаяся включением бромурацила во мно-
многих рассеянных по разным участкам ДНК точках. Об этом говорило
измерение плотности ДНК при равновесном центрифугировании в
растворе CsCl. Бромурацил плотнее тимина, поэтому при обычной
репликации возникала бы «тяжелая» нить ДНК. Однако ее образо-
образования опыты не показали. Весь бромурацил содержался в «легких»
цепях ДНК.
Следовательно, его включение происходило в короткие полину-
клеотидные участки, окруженные длинными нереплицировавшимися
полинуклеотидными последовательностями, так что плотность ДНК
заметно не изменилась.
6. Повреждения и процессы восстановления ДНК 257
В дальнейшем были изучены ферментные механизмы рассматри-
рассматриваемого типа репарации ДНК. Согласно схеме, предложенной Говард-
Фландерсом, одна или несколько молекул фермента, кодируемого ге-
генами uvr А и uvr В, постоянно «обегает» кольцевой бактериальный
геном, «выискивая» в двойной спирали ДНК структурные нарушения.
Когда такой фермент сталкивается с повреждениями ДНК, обуслов-
обусловленными появлением тиминовых димеров, он вызывает два разрыва
в полинуклеотидной цепи по обе стороны от фотохимического повре-
повреждения. В результате происходит эксцизия тиминового димера вместе
с несколькими соседними нуклеотидами.
Другой вариант состоит в том, что фермент вызывает лишь один
разрыв с 5'-стороны повреждения, что позволяет ДНК-полимеразе I
вырезать поврежденный участок под действием своей 5', З'-экзонукле-
азной активности. Образующаяся брешь заполняется под действием
репарирующей активности той же ДНК-полимеразы I, прибавляющей
нуклеотиды к З'-ОН-концу старой полинуклеотидной цепи, используя
в качестве матрицы неповрежденную комплементарную цепь ДНК, в
которой нет УФ повреждений.
Завершается процесс восстановления двойной спирали образова-
образованием с помощью ДНК-лигазы фосфодиэфирной связи между З'-ОН-
концом последнего нуклеотида, включенного при репарационной ре-
репликации, и 5'-концом старой полинуклеотидной цепи.
Помимо рассмотренного механизма репарации ДНК, названного
«выщепление-замещение», у бактерий обнаружен и принципиально
иной путь репарации ДНК от УФ повреждений. В 1950 г. Дулбекко
наблюдал резкое возрастание способности клеток Е. coli репариро-
вать Т-четные фаги от повреждения, если зараженные этим фагом
бактерии после УФ облучения осветить сильной вспышкой видимого
света. Оказалось, что у Е. coli имеется фотореактивирующий фермент,
детерминируемый геном phr. Этот фермент при воздействии светом с
длиной волны 300-500 нм осуществляет прямое превращение тимино-
тиминовых димеров в нормальные основания без эксцизии.
Еще один механизм репарации ДНК от УФ повреждений был
расшифрован с помощью Rec~-мутантов Е. coli, открытых Кларком
в 1965 г. Эти мутанты обладали способностью к эксцизионной репа-
репарации тиминовых димеров и тем не менее оказались необыкновенно
чувствительными к УФ облучению. Помимо высокой чувствительно-
чувствительности к УФ радиации, Rec~-мутанты неспособны к генетической реком-
рекомбинации ни при конъюгации, ни при трансдукции.
Связь между репарацией поврежденной ДНК и генетической ре-
рекомбинацией была установлена в работах Говард-Фландерса, доказав-
доказавшего, что, кроме механизма «выщепления—замещения», в бактериаль-
бактериальной клетке существуют возможности исправления дефектов в дочер-
дочерней ДНК, образующейся при репликации нерепарированной облучен-
облученной родительской ДНК. Первая после облучения копия ДНК образу-
образуется в форме полинуклеотидной цепи с разрывами. Брешь возникает в
дочерней цепи напротив тиминового димера матричной родительской
цепи в результате препятствия для продвижения ДНК-полимеразы.
17 Ю. Б. Кудряшов
258 Гл. VI. Реакции клетки на действие ионизирующих излучений
Однако всего через 1 час после синтеза таких разорванных цепей в
клетке обнаруживаются непрерывные цепи ДНК нормальной длины.
Бреши заполняются в результате пострепликативной репарации, осу-
осуществляемой за счет генетической рекомбинации между комплемен-
комплементарными сестринскими нитями, несущими разрывы. Из этого следует,
что как отсутствие способности к генетической рекомбинации, так и
высокая чувствительность к УФ излучению у мутантов Rec~ обуслов-
обусловлены дефектом системы, отвечающей за рекомбинационные события.
По-видимому, все возможные пути репарации бактериальной ДНК
от УФ повреждений исчерпываются процессами, контролируемыми
генами uvr, rec и фотореактивацией. В отсутствие видимого света
двойные мутанты по генам uvr и гее погибают в результате возникно-
возникновения в их геноме всего одного тиминового димера.
Расшифровка молекулярных механизмов репарации бактериаль-
бактериальной ДНК от УФ повреждений существенно расширила представления
о функционировании генома и показала, что в клетке существуют ге-
генетически детерминированные системы ферментов, поддерживающие
целостность генетической информации и исправляющие ее в случае
нарушений.
В дальнейшем было доказано, что в общих чертах сходная система
существует в клетках млекопитающих. Благодаря активности репара-
тивной системы, клетки способны поддерживать целостность генома
в случае повреждений, наносимых не только УФ излучением, но и
ионизирующей радиацией, канцерогенами и мутагенами. В последнюю
четверть века были проведены интенсивные исследования механизмов
репарации ДНК от повреждений, вызванных ионизирующей радиа-
радиацией. Эти работы вызвали большой интерес не только среди радио-
радиобиологов, но и среди генетиков, молекулярных биологов, биохимиков.
Накоплен обширный экспериментальный материал, зачастую проти-
противоречивый и нуждающийся в дальнейшем уточнении.
В настоящее время не вызывает сомнения наличие в клетках
млекопитающих эффективных систем дорепликативной репарации,
участвующих в воссоединении однонитевых и двунитевых разрывов.
В зависимости от природы концевых участков в месте разрыва в
процесс вовлекаются различные ферментные системы: ДНК-лигазы,
ДНК-полимеразы, эндо- и экзонуклеазы. Пробелы, возникающие в по-
линуклеотидной цепи вследствие освобождения нуклеозидов из ДНК,
восстанавливаются за счет системы эксцизионной репарации, подоб-
подобной (хотя и менее эффективной) темновой репарации УФ поврежде-
повреждений у бактерий.
В 1975 г. была описана пострепликативная репарация в клетках
китайского хомячка, подвергнутых воздействию ионизирующей ра-
радиации. Как и в случае УФ повреждения клеток, новообразованная
ДНК синтезируется в виде коротких фрагментов между местами
сохраняющихся повреждений, а заделывание брешей происходит в
пострепликативный период либо за счет вырезания дефектных участ-
участков нитей ДНК и ресинтеза de novo, либо путем рекомбинационных
обменов между сестринскими дуплексами. Как отмечают В. Е. Комар
6. Повреждения и процессы восстановления ДНК 259
и К.П.Хансон A980), пострепликативную репарацию следует скорее
рассматривать не как истинное восстановление, а как преодоление
повреждений, обеспечивающее клетке сохранение жизнеспособности,
несмотря на наличие дефектов в ДНК. Сохранение измененной струк-
структуры ДНК в поколениях клеток может лежать в основе отдаленных
последствий облучения — канцерогенеза и мутагенеза.
Механизмам репарации принадлежит важнейшая роль в поддер-
поддержании постоянства первичной структуры ДНК как в ходе нормальной
жизнедеятельности, так и при действии различных повреждающих
агентов, в том числе ионизирующего излучения. От эффективности
репаративных систем во многом зависит восстановление, наблюдаемое
на клеточном уровне, однако точный вклад исправления дефектов
структуры ДНК в общую картину радиационного поражения и в
судьбу облученной клетки пока еще не установлен. Расшифровка
молекулярных механизмов репарации ДНК в клетках млекопитаю-
млекопитающих позволила бы активно вмешиваться в этот процесс, селективно
изменять радиочувствительность клеток и, возможно, многоклеточ-
многоклеточных организмов. При этом не исключено, что различная природ-
природная радиочувствительность клеток и организмов связана не только
с эффективностью репаративных систем, но и с их уязвимостью для
радиационного воздействия.
6.2.2. Репарация ДНК от повреждений в облученной клетке
(Д. М. Спитковский)
Известно, что весь спектр ДНК-репарационных реакций в облу-
облученной клетке можно разделить на два типа.
Первый реализуется, когда повреждения носят локальный харак-
характер реализации в одной из двух цепей ДНК. Тогда антипараллельная
ей цепь ДНК является ей матрицей для восстановления физической и
информационной непрерывности поврежденной цепи, т. е. для репа-
репарации. Типичным примером таких повреждений являются ОР ДНК.
Второй тип относится к репарации ДНК от ДР, когда повреждены
обе цепи ДНК, т. е. отсутствует матрица, необходимая для воссоздания
исходной структуры информации макромолекулы.
Повреждения, которые устраняются по первому типу, возникают
при облучении клетки в любых дозах, особенно когда речь идет об
излучениях с низкими значениями ЛПЭ. Количество повреждений,
разумеется, зависит от величины дозы облучения. Однако в клеточной
ДНК возникает и множество спонтанных изменений. Некоторая часть
из них обусловлена тепловыми шумами. Большая же часть является
следствием атаки ДНК окислительными радикалами, образующимися
в процессе нормальной жизнедеятельности клетки и «ускользнувши-
«ускользнувшими» от систем инактивации.
Было рассчитано, что в результате окислительного метаболизма
в одной клетке млекопитающих продуцируется в течение суток око-
около 109 радикалов. Они принимают участие в среднем в 105 модифика-
модификациях ДНК в клетке за тот же период. Однако только незначительная
17*
260
Гл. VI. Реакции клетки на действие ионизирующих излучений
Таблица VI.7. Количество повреждений ДНК, приходящихся на одну «усред-
«усредненную» клетку млекопитающих
Тип повреждений
однонитевые
разрывы (ОР)
двунитевые
разрывы (ДР)
повреждения
оснований и (или)
депуринизация
общее число
повреждений
Спонтанные повреждения
в
сек
14
—
0,8
2,2
в
мин
84
—
48
132
за
сутки
8-Ю5
—
0,9-105
0,75-105
4,85-105
в
год
4,4-107
—
1,9-105
и 1,1-107
и 7-Ю7
Число
повреждений
ДНК
на
1 сГр
10
0,4
9,5
20
часть из всех повреждений ДНК в клетке сохраняется. Умеренное
воздействие внешних факторов среды незначительно увеличивает эту
цифру. В качестве иллюстрации в табл. VI.7 представлены данные из
последних работ Д. М. Спитковского о числе спонтанных повреждений
ДНК в клетке.
Кроме указанных в таблице, существует значительно меньшее ко-
количество «повреждений» ДНК, которые являются, скорее всего, изме-
изменениями макромолекулы в процессе нормального метаболизма клетки
(разрывы ДНК при дифференцировке клеток, V(D)J-npeo6pa3OBaHH-
ях иммуноглобулиновых генов и др.).
Как следует из табл. VI.7, в клетке ежеминутно возникает доста-
достаточно большое количество спонтанных повреждений ДНК (более ста
тридцати), которые в основном успешно устраняются. Дополнительно
к спонтанным повреждениям макромолекулы также должны быть
устранены и повреждения, вызванные действием генотоксических
агентов (например, от облучения в дозе 1-10 сГр в течение минуты и
за большее время). При этом имеется в виду, что повреждения ДНК,
индуцируемые как прямым, так и косвенным действием излучений,
имеют ту же природу, что и спонтанные повреждения.
Вместе с тем возможны изменения распределения разных типов
повреждений.
В ДНК-репарационных процессах первого типа, в зависимости
от характера повреждения, участвуют различные ферменты: глико-
зилазы, фосфодиэстеразы, ДНК-полимеразы, лигазы и др. Количе-
Количество таких ферментов достаточно велико. Так, в дрожжевых клетках
известно более 50 генов, продукты которых участвуют в процессах
репарации ДНК. Некоторые из них выполняют и другие функции,
6. Повреждения и процессы восстановления ДНК 261
например, участвуют также и в процессах регуляции клеточного деле-
деления. Полагают, что из 60000—70000 генов в клетке человека несколько
сотен может принимать участие в поддержании стабильности генома.
Следует отметить, что некоторые процессы репарации первого
типа реализуются с разными скоростями в разных участках гено-
генома. Например, активно экспрессируемые гены восстанавливаются от
повреждений значительно быстрее, чем остальные участки генома.
Известно также, что только одна цепь в ДНК-дуплексе транскрибиру-
транскрибируется. Повреждения именно в этой цепи устраняются наиболее быстро.
Этим, по-видимому, объясняется накопление мутаций в нетранскри-
бируемой цепи ДНК.
Как следует из изложенного, при действии ионизирующих излуче-
излучений в малых дозах (и при низких значениях ЛПЭ) повреждения ДНК,
индуцируемые в одной из ее цепей, должны в основном устранять-
устраняться благодаря емкости ДНК-репарационной системы, принимающей
участие в восстановлении спонтанных повреждений макромолекулы.
Совершенно иная ситуация складывается в случае двунитевых раз-
разрывов ДНК. Такие разрывы, как уже отмечалось, хотя и с достаточно
малой вероятностью образуются даже при фоновых дозах облучения.
Образование ДР приводит к потере физической непрерывности ДНК
и, как следствие, к отсутствию антипараллельной цепи, которая яв-
является матрицей для репарации ДНК по первому типу.
В настоящее время известны два пути репарации ДНК от дву-
двунитевых разрывов. Механизм первого из них — сшивание негомоло-
негомологичных концов (поп homologous end joining — NHEJ) связан с пер-
первоначальной стабилизацией разорванных концов ДНК Ku-белками и
с последующим образованием комплекса между этой структурой и
ДНК-зависимой протеинкиназой. Существенно, что при реализации
NHEJ-стратегии не происходит движения разорванных концов ДНК
в пространстве ядра клетки. При этом координаты ДР относитель-
относительно фиксированы, а комплексы белков, необходимых для репарации,
вероятнее всего мигрируют к месту ДР.
Следует, однако, отметить, что при репарации ДНК по этому ме-
механизму возникают нарушения в ее первичной структуре (делеции и
др.). Эти нарушения обусловлены тем, что при установлении микрого-
микрогомологии в районе разрыва остаются свободные концы ДНК, которые
затем «отрезаются» при помощи ряда ферментативных реакций.
Второй механизм репарации ДНК от ДР реализуется с помощью
гомологичной рекомбинации.
Последовательности ДНК, от которых информация передается на
поврежденную копию, должны быть идентичны на достаточно боль-
большой длине (более 200 пар нуклеотидов). Такие рекомбинационные
процессы могут реализоваться, например, между материнскими и от-
отцовскими копиями одного и того же гена. Известно, что рекомбинации
могут осуществляться также между соответствующими последова-
последовательностями ДНК в пределах одной хромосомы.
Соотношения между обоими типами репарации ДНК от ДР зави-
зависят от ряда условий, в том числе — от стадии клеточного цикла.
262 Гл. VI. Реакции клетки на действие ионизирующих излучений
Репарация с участием механизма гомологичной рекомбинации
подразумевает сближение гомологичных последовательностей в про-
пространстве ядра клетки. Известно также, что часто соответствующие
локусы гомологичных хромосом пространственно разобщены. Радиа-
Радиация индуцирует процессы, приводящие к перемещению этих локусов
в пространстве ядра клетки, необходимые для их сближения. Есте-
Естественно, что репарация ДНК от ДР как более сложный процесс (по
сравнению с репарацией от ОР) требует более длительного времени и
не всегда возможна. Нерепарируемые ДР ДНК часто оказываются ле-
летальными для клетки. С еще меньшей вероятностью следует ожидать
восстановления комплексных повреждений ДНК, локализованных в
кластерах.
Таким образом, при облучении в малых дозах повреждения ДНК,
репарируемые по первому типу, должны полностью восстанавливать-
восстанавливаться (естественно, возможно с некоторой, хотя и малой вероятностью
ошибки).
Схема структурных изменений ДНК при ее репарации приведена
на рис. VI. 12. В целом представленные на ней механизмы репарации
ДНК условно представляют собой:
- эксцизионную репарацию оснований (в англоязычной литерату-
литературе ее сокращенно обозначают BER — base excision repair), осуще-
осуществляемую в одну стадию без разрыва полинуклеотидной цепи
путем замены поврежденного пиримидинового или пуринового
основания на нормальное, комплементарное неповрежденному, в
другой нити ДНК уже упоминавшимися репарационными фер-
ферментами: соответственно формамидопиримидин-ДНК-гликози-
лазой и ДНК-гликозилазой нарушенного спаривания оснований
А:Г;
- эксцизионную репарацию нуклеотидов (NER — nucleotide exci-
excision repair), осуществляемую в несколько стадий при участии
ферментов эндонуклеаз распознавания повреждения и инци-
зии — разрезания, разрыва нити ДНК — по обе стороны на
несколько нуклеотидов вблизи от повреждения либо с одной
стороны от повреждения с последующей эксцизией (вырезанием)
поврежденного и нескольких интактных нуклеотидов при уча-
участии экзонуклеазы; репаративной репликации, обеспечивающей
«застройку» образовавшейся бреши при помощи ряда ДНК-по-
лимераз (у человека, прежде всего, /?-, а также j- (для митохон-
дриальной ДНК), S- и ?-); наконец, завершающей стадии «сши-
«сшивания» концов восстановленного и предсуществующего участков
нитей ДНК, осуществляемой ДНК-лигазами.
Наконец, в правой части на рис. VI. 12 представлена схема репа-
репарации ДР, осуществляемой путем сшивания негомологичных концов
либо посредством рекомбинационного механизма.
6. Повреждения и процессы восстановления ДНК
263
Повреждения оснований
Двунитевые разрывы (ДР) ДНК
JJJIIJJJvJJJJI if
устранение основания
(гликозилаза)
iniiTT
| разрезание
(эндонуклеаза)
1I31. 'НИШ
I
заполнение
¦!!Т?!.!?.
Uliltlllllinil
соединение
разрезание
(эндонуклеаза)
......Н^1...
IHIEEtiEIIIIIIl
процессинг концов ДНК в районе
ДР ДНК
цц ТПЖ
. взаимодействие с
^ неповрежденным
гомологом
соединение
1 заполнение
* (полимераза)
lillillllHlllfin
I соединение
(лигаза)
ШШШШЖШ
1 заполнение
(полимераза)
Ku-белки
ДНК-зависи-
мая протеин- ЩЩ
«иназа
| соединение
Т (лигаза)
(рекомбинация)
тттгпшгииг
ППШШПШ
эксцизионная репарация
репарация с участием
гомологичной
рекомбинации
Рис. VI. 12. Схематическое изображение некоторых механизмов репарации ДНК:
а) поврежденные основания выщепляются специфическими глюкозилазами: нить
ДНК разрезается, и брешь заполняется при помощи полимераз; б) удаляется ну-
клеотидный фрагмент, включающий поврежденные основания (примерно 30 осно-
оснований в клетках человека. Ресинтез происходит с использованием поврежденной
цепи-матрицы; в) двойные разрывы соединяются конец в конец; г) двойные раз-
разрывы репарируют с использованием гомологической неповрежденной молекулы
При репарации ДНК от ДР происходит сложная перестройка про-
пространственной организации генома, а следовательно, изменение актив-
активности ряда генов, необходимых для реализации этой программы. При
описании кривых выживаемости клеток, независимо от концепции,
лежащей в основе такого описания, необходимо учитывать возмож-
возможность восстановления ДНК от ряда первичных ее повреждений. Как
мы уже отмечали, существуют разные математические способы этого
описания (гл. III).
264 Гл. VI. Реакции клетки на действие ионизирующих излучений
Напомним, что наиболее простое выражение — для одноударных
«одномишенных» кривых:
N/N0 = e-(yD-b^\ (VI.37)
где N/Nq — относительное число выживших объектов, VD — число
попаданий в чувствительный объем У, b(D) — среднее число первич-
первичных повреждений, от которых клетка восстанавливается.
В более сложных зависимостях учитывается возможность того, что
число первичных повреждений пропорционально дозе, а число устра-
устраненных при репарации повреждений с ростом дозы увеличивается, но
стремится к некоторому пределу.
6.3. Некоторые представления о надежности генома
Стабильность генома, в том числе и по отношению к действию
ионизирующих излучений, обусловлена рядом факторов: размерами
чувствительного объема, способностью различных клеток репариро-
вать ДНК от повреждений, активностью систем их детоксикации и
т.д. Было предложено мерой надежности генома считать величину,
обратную частоте возникновения элементарных генетических повре-
повреждений на один геном и на единицу дозы облучения (В.И.Корого-
дин, 1983).
Если исходить из вероятностной концепции описания кривых вы-
выживаемости, можно ввести два параметра: а и а.
Параметр а — это вероятность инактивации облученной клетки
или ее потомков от одного повреждения, которая в общем случае
может зависеть от числа клеточных повреждений в клетке. Другими
словами, параметр а — это реакция клетки на уже возникшее повре-
повреждение.
Другой параметр а — это вероятность возникновения одного повре-
повреждения на единицу дозы облучения, что отражает чувствительность
генома к возможному возникновению повреждения.
Показано, что Do ~ а~г. С другой стороны, а « кС, где к —
константа, а С — количество ДНК в геноме. Таким образом, можно
прийти к следующему равенству:
К = Д)С, (VI.38)
где К — удельная надежность генома, выраженная в эВ и равная
количеству энергии излучения, поглощение которой в ДНК клетки
необходимо и достаточно для инициации одного элементарного повре-
повреждения, т.е. К = 1/к. Из анализа соотношений радиоустойчивости
объектов и надежности генома можно сделать два вывода.
1. Если отложить в плоскости координат Dq как функцию коли-
количества ДНК в геноме С, то все ДНК-содержащие объекты можно
разбить на несколько радиотаксонов, отличающихся по удельной на-
надежности генома. В первый из них входят биологические объекты,
содержащие однонитевую ДНК; во второй — вирусы с двунитевой
ДНК; в третий — бактерии и гаплоидные эукариоты, и, наконец, в
6. Повреждения и процессы восстановления ДНК 265
четвертую — диплоидные клетки эукариот. Поскольку распределение
биологических объектов по радиотаксонам коррелирует с организаци-
организацией в них генома, их можно отнести к кариотаксонам.
2. Учитывая радиационно-химические выходы ОР и ДР для излу-
излучений с низкими значениями ЛПЭ и удельную надежность генома К,
можно определить выходы биологически значимых ОР и ДР (их сум-
сумму) на одно элементарное повреждение для разных радиотаксонов.
Расчеты показывают, что если для первого и второго радиотаксона
необходимо около одного повреждения, для третьего радиотаксона —
около двух, то для четвертого радиотаксона число повреждений при-
приближается к тридцати.
Другими словами, по-видимому, благодаря развитой системе ДНК-
репарационных процессов, надежность генома диплоидных эукариот
чрезвычайно высока.
В связи с этим возникает другая проблема: чрезвычайно малая
генетическая изменчивость клеток диплоидных эукариот может при-
привести их к эволюционному тупику. Для того, чтобы обойти указанную
трудность, были предложены две гипотезы. Одна из них связана с
повышенным уровнем геномной изменчивости за счет ошибок в работе
некоторых репарационных систем клеток. Вторая — с наличием субпо-
субпопуляции клеток онтогенетического или эволюционного резерва, если
эта субпопуляция относится к соматическим или половым клеткам
соответственно.
Суть второй гипотезы состоит в существовании среди гетерогенной
по составу популяции клеток данного типа программируемой субпопу-
субпопуляции, которая отвечает на разнообразные генотоксические стимулы
в малых дозах детерминированной реакцией — аутоиндукцией в ее
клетках аномалий кариотипа и (или) других наследуемых структур-
структурных перестроек генома. Появляющиеся при этом новые генетические
варианты после отбора обусловливают выживание новой популяции
клеток. Некоторые из этих генетических вариантов могут быть родо-
родоначальниками трансформированных клонов.
6.4. Повреждения и процессы восстановления ДНК-мембранного
комплекса в облученной клетке (Н. Ю.Кудряшова)
Несколько особняком в радиобиологической литературе стоит про-
проблема лучевых изменений ДНК-мембранного комплекса (ДНК-МК).
Еще в 1968 г. Т. Альпер впервые высказала гипотезу о существовании
двух основных сайтов лучевого воздействия. Один сайт, названный ею
N-сайтом, слабо реагирует на присутствие кислорода в момент облуче-
облучения и представляет собой ДНК. Другой — О-сайт, относящийся к БМ,
значительно в большей степени поражается ионизирующей радиацией
в присутствии кислорода по сравнению с анаэробными условиями.
Хорошо известно, что хромосома в клетках как эукариотов, так
и прокариотов представляет собой сложный структурный комплекс
ДНК с белками, липидами, РНК и многими низкомолекулярными со-
соединениями клеточных элементов. Известно также, что большую роль
266
Гл. VI. Реакции клетки на действие ионизирующих излучений
в организации и функционировании генетического аппарата играют
мембранные структуры. В клетках прокариотов мембраны участвуют
в образовании суперскрученной ДНК, так называемого нуклеоида
бактерий, прототипа ядра высших организмов. Поэтому реальные
события, происходящие в облученной клетке, значительно сложнее,
чем повреждение и репарация облученной ДНК вне ее комплексных
структур.
6.4.1. Повреждения ДНК-МК
Одним из эффектов, наблюдаемых при облучении клеток млеко-
млекопитающих или бактериальных клеток, является разрушение связей
ДНК с клеточными элементами, в результате чего происходит переход
ДНК во фракцию свободных молекул. В процессе пострадиационной
инкубации клеток в условиях их роста возможно восстановление ком-
комплексов ДНК.
Для объяснения механизма высвобождения ДНК из комплекса
ДНК-МК под воздействием облучения высказывались различные ги-
гипотезы. Так, одни авторы связывали этот процесс с повреждением
молекулы ДНК, входящей в комплекс. Согласно их представлению,
после облучения во фракции свободной ДНК оказываются ее фрагмен-
фрагменты, расположенные между соседними точками прикрепления к мем-
мембране и не связанные с мембранными структурами. Другие наоборот
предположили, что в лучевых нарушениях связи ДНК с мембранами
определяющую роль играют изменения самих мембран.
Доказательства этого предположения были получены, например,
в многолетних работах В. А. Стручкова и Н. Б. Стражевской по изу-
изучению структуры ДНК-МК и ее лучевых повреждений. Авторы вы-
выделили из клеток печени и тимуса млекопитающих надмолекулярную
структуру ДНК-липидной природы, состоящей из одинаковых по раз-
размеру субъединиц (молекулярной массой 3-Ю9 дальтон), соединенными
липидными «линкерами». Воздействие ионизирующего излучения да-
даже в дозе 1 Гр вызывает распад комплекса на субъединицы, причем
радиационный выход этой реакции в сотни тысяч (!) раз превышает
выход ОР и ДР в ДНК. Было показано, что липидные линкеры явля-
являются наиболее радиочувствительным местом в ДНК-МК. В 1993 г.
авторы пришли к выводу, что ДНК-мембранный комплекс может
представлять собой единую радиобиологическую мишень — ДНК-БМ,
лучевое повреждение которой способно привести к инактивации и
гибели клетки (Стручков В.А., Стражевская Н.Б., 1993).
Лучевым нарушениям структурно-функциональных свойств ДНК-
МК посвящен ряд работ, начатых в семидесятых-восьмидесятых го-
годах. В работах В. Е. Комара и др. изучали действие рентгеновского
облучения в дозе 15 Гр на репликацию ДНК в ядрах асцитной гепато-
мы крыс. Для регистрации новосинтезированной ДНК использовали
импульсную метку 3Н тимидина на фоне длительной метки 14С ти-
мидина. Было показано, что облучение, нарушая связь ДНК с мем-
мембраной, блокирует инициацию репликации ДНК в составе комплекса,
6. Повреждения и процессы восстановления ДНК 267
но не влияет на продолжающуюся репликацию, индуцированную до
лучевого воздействия.
В работах Крампа и др. (Cramp et al, 1972) изучено подавление
процессов синтеза ДНК, входящей в состав ДНК-МК в облученных
клетках Е. Coli В/г (дикого типа) и его радиочувствительного му-
мутанта BS-I. Оказалось, что способность ДНК к репликации у обоих
штаммов зависит от присутствия кислорода в момент облучения и от
вида облучения. Показано, что в отличие от электронного облучения,
действие нейтронов на процессы синтеза ДНК в большей степени
обусловлено повреждением N-сайта (нечувствительного к кислороду),
и что эффект облучения нейтронами в условиях гипоксии был более
выражен у Е. Coli В/т по сравнению с Е. Coli BS-I. Эти результа-
результаты позволили заключить, что чувствительность к облучению мутан-
мутанта BS-I связана с N-сайтом, и что поражение мембранного компонента
ДНК-МК у обоих штаммов одинаково.
При облучении изолированных ДНК-МК обнаруживается высокая
устойчивость ДНК синтезирующей активности комплекса к иони-
ионизирующим излучениям. Синтезирующая активность не подавляется
даже при облучении в дозах, существенно снижающих выживаемость
клеток, хотя кислородный эффект наблюдался.
Таким образом, вследствие облучения происходит взаимодействие
повреждений О- и N-сайтов, т. е. обоих компонентов ДНК-МК, приво-
приводящих к гибели клеток.
6.4.2. Процессы восстановления ДНК-МК
Впервые процесс восстановления ДНК-МК от лучевых поврежде-
повреждении описали Баррелл с соавторами (Burrell et al, 1971) в опытах на
одной из наиболее радиорезистентных бактерий — М. radiodurans.
Авторы наблюдали, что вслед за диссоциацией ДНК-МК, возника-
возникающей от сублетальных доз облучения, в процессе инкубации клеток
отмечалось появление промежуточного (по плотности в градиенте са-
сахарозы) ДНК-МК, который в дальнейшем приобретал свойства ДНК-
МК из интактных клеток. Было высказано предположение о том,
что мембранные структуры ДНК-МК участвуют в репарации ДНК,
обеспечивая правильное восстановление фрагментов хромосом.
В последующие годы эффект образования промежуточного ДНК-
МК и восстановления исходного комплекса был подтвержден многими
авторами. Уточнялась роль репарации ДНК и участие мембран в этом
процессе и биологическое значение процессов восстановления ДНК-
МК. Были сделаны выводы о том, что ассоциация ДНК с мембраной в
пострадиационный период способствует защите ДНК от неспецифиче-
неспецифического нуклеазного расщепления и деградации макромолекулы и одно-
одновременно создает благоприятные структурные условия для репарации
ДНК. К таким выводам при- шел С.В.Шестаков в исследованиях
пострадиационных изменений ДНК-МК в клетках Anacystis nidulans
и его радиочувствительного мутанта XR.
Участие мембран в процессе репарации ДНК от лучевых повре-
повреждений было подтверждено рядом авторов на бактериальных клетках
268
Гл. VI. Реакции клетки на действие ионизирующих излучений
и подробно изучено на М. radiodurans. Экспериментально показано,
что действие ряда мембраноповреждающих агентов (гипертермии,
аминазина, новокаина) полностью блокирует способность к репара-
репарации ДНК-МК в клетках М. radio durans дикого типа и его радио-
радиочувствительного мутанта UVS-17, дефектного по ДНК-полимеразе
(Н.Ю.Кудряшова, 1987). Восстановление ДНК-МК у М. radiodurans
зависит от нормального функционирования гена гес-30, ответствен-
ответственного за генетическую рекомбинацию. Высказывалось предположение
о том, что для восстановления генетического аппарата в клетках
М. radiodurans необходимы рекомбинационные события, приводящие
к устранению ДР ДНК.
Представленные данные по восстановлению ДНК-МК от луче-
лучевых повреждений относятся к исследованиям, проведенным на про-
кариотических клетках. Вопрос о постлучевой репарации ДНК-МК в
клетках эукариотов остается еще мало изученным. В клетках млеко-
млекопитающих, как in vivo, так и in vitro показано существование двух
механизмов репарации: один воссоединяет разрывы субъединиц, дру-
другой восстанавливает связь между субъединицами, из которых состоит
высокомолекулярная ДНК (Cole A., 1975; Lange С, 1975). Результаты
были получены на активно делящихся клетках яичников китайского
хомячка и клетках лимфомы мыши.
Сходные результаты были получены в неделящихся клетках го-
головного мозга собаки (Wheller К., Lett J., 1972). Таким образом,
репликативный синтез не требуется для восстановления связи меж-
между субъединицами. Характерной чертой репаративных процессов в
неделящихся клетках млекопитающих является существование кри-
критического диапазона доз рентгеновского или 7"°блучения. При низ-
низких дозах репаративные процессы напоминают таковые в культуре
делящихся клеток. При дозах, превышающих критический диапазон,
происходит лишь восстановление самих субъединиц, в то время как
связывание субъединиц между собой не наблюдается. Считается, что
при высоких дозах радиации процессы восстановления линкеров ли-
либо непосредственно подавляются под действием облучения, либо это
связано с накоплением нерепарируемых повреждений ДНК.
Приведенный в этой главе фактический материал свидетельству-
свидетельствует о том, что лучевые повреждения и восстановления как биологи-
биологической мембраны, так и макромолекулы ДНК, а также ДНК-МК
представляют собой сложную взаимосвязанную и взаимозависимую
единую систему ответа клетки на действие ионизирующих излучений.
От соотношения характера и интенсивности проявлений повреждений
и восстановления радиобиологических мишеней зависит дальнейшая
судьба облученной клетки и ее гибель. Механизмам клеточной гибели
и их восстановлению посвящен завершающий раздел этой главы.
7. Механизмы гибели и процессы восстановления клеток 269
7. Механизмы гибели и процессы восстановления клеток от
радиационного поражения
7.1. Два типа гибели облученных клеток — различия в
зависимости от стадии клеточного цикла
Еще в начале века были описаны различные реакции клеток на
облучение — от временной задержки роста и размножения до пол-
полной деградации и лизиса. Выраженность эффекта зависела от дозы
облучения и особенностей объекта. В 1906 г. Бергонье и Трибондо,
обобщив накопленный к тому времени экспериментальный материал,
сформулировали общее правило о том, что рентгеновские лучи тем
сильнее действуют на клетки, чем интенсивнее они делятся и чем
менее дифференцированы. Это эмпирическое правило указывало, что
ответная реакция клеток на лучевое воздействие зависит от физиоло-
физиологического состояния объекта и его генетической конституции.
С появлением методов культивирования клеток вне организма
удалось детально описать характер гибели быстроделящихся мало-
дифференцированных клеток и неделящихся или медленно делящих-
делящихся высокодифференцированных клеток. Выявление принципиальных
различий в реакции на облучение активно пролиферирующих и неде-
неделящихся клеточных популяций позволило раздельно исследовать ме-
механизмы их лучевого поражения, проявляющиеся феноменом гибели
клеток. В зависимости от пролиферативного статуса клеток, а точнее
от стадии клеточного цикла, в которой происходит реализация про-
процесса клеточной гибели, различают соответственно репродуктивную
и интерфазную гибель.
7.1.1. Репродуктивная и интерфазная гибель облученных клеток
Быстроделящиеся клетки, или клетки, стимулированные
к делению*). С помощью замедленной киносъемки можно просле-
проследить судьбу потомков одной облученной клетки. На рис. VI. 13 пока-
показаны клетка линии L, облученная в дозе 2 Гр, и ее потомство.
Первая видимая реакция клеток на облучение — задержка их
вступления в митоз, т. е. клетка, облученная в интерфазе, не делится
в ожидаемый момент. Опыты с синхронизированными культурами
показали, что выраженность задержки деления зависит от стадии
клеточного цикла: наибольший эффект наблюдается при облучении
клеток в стадиях S и G^- Чем больше доза облучения, тем продолжи-
продолжительнее задержка деления.
Через определенный промежуток времени, зависящий от величины
дозы, клетки вступают в митоз. Их дальнейшая судьба складывается
по-разному. Часть клеток облученной популяции, вступив в митоз, не
в состоянии разделиться. Образуются гигантские клетки. Их размеры
*) Деление клеток в печени стимулируют посредством частичной гепат-
эктомии, клеток в почке — удалением одной из почек, малых лимфоцитов —
прибавлением в среду инкубации фитогемагглютининов.
270 Гл. VI. Реакции клетки на действие ионизирующих излучений
2 Гр
ё
О
О)
5
О
50
100
150
I 200
PQ
Рис. VI. 13. Результаты наблюдения
за потомками клетки линии L, облу-
облученной в дозе 0,2 Гр во время позд-
поздней 5-фазы: 1 — погибшие клетки;
2 — гигантская клетка
могут в сотни раз превосходить
размеры необлученных клеток. По-
видимому, гигантские клетки воз-
возникают не за счет набухания, а
в результате общего увеличения
синтезированных клеточных ком-
компонентов (содержание ДНК, РНК
и белка увеличивается пропорцио-
пропорционально размерам клетки). В конеч-
конечном итоге, гигантские клетки по-
погибают, вероятно, из-за нарушения
механической прочности мембран и
изменения оптимального для пита-
питания соотношения поверхности клет-
клетки и ее объема.
Большая часть облученных клеток проходит митоз и делится.
Однако сразу же после первого деления появляются погибшие клетки.
Еще больше клеток гибнет после второго, третьего и т.д. митозов
(рис. VI.13).
Описанный тип гибели неразрывно связан с процессом митоза.
Его существенная особенность состоит в том, что облученные клетки
в течение определенного промежутка времени сохраняют метаболи-
метаболическую активность, но не в состоянии разделиться с образованием
жизнеспособных дочерних клеток, способных делиться далее. До пер-
первого постлучевого митоза погибшие клетки не появляются — процессы
митоза как бы выявляют летальные повреждения, вызванные облу-
облучением. Особенности гибели быстроделящихся клеток подчеркивают
термины, которые в разное время были приняты для ее обозначения:
«митотическая гибель» («гибель в митозе»), «отсроченная гибель»,
«гибель при делении», «репродуктивная гибель».
Последний термин получил наибольшее распространение, так как
подчеркивает связь этого типа клеточной гибели с процессом репро-
репродукции, воспроизводства клеток, для обнаружения которого харак-
характерно использование методов количественной оценки репродуктивной
способности клеток (способность к образованию колоний in vitro, селе-
селезеночных колоний и другие методы оценки клоногенной активности).
Неделящиеся или медленно делящиеся клетки. Примером
неделящихся клеток служат дифференцированные нервные или мы-
мышечные клетки; к медленно делящимся относятся клетки печени; у ма-
малых лимфоцитов и юных ооцитов способность к делению ограничена.
Гибель после облучения клеток этого типа, являющихся «постмито-
тическими», крайне редко делящимися, почти не зависит от деления:
облученные клетки гибнут в интерфазе. Для обозначения рассмат-
рассматриваемого типа гибели приняты термины: «немитотическая гибель»,
«немедленная гибель», «гибель в отсутствие деления», «гибель в ин-
интерфазе» — «интерфазная гибель». Каждый из терминов по-своему
7. Механизмы гибели и процессы восстановления клеток 271
подчеркивает особенности рассматриваемого типа гибели клеток, но
наиболее распространен последний — «интерфазная гибель».
Отмечены две условных категории вариантов, в которых установ-
установлена радиационная гибель по интерфазному механизму: 1) гибель
неделящихся или ограниченно делящихся клеток типа лимфоцитов
при общем облучении организма или при облучении in vitro в дозах
от нескольких десятков сГр и выше; 2) гибель в аналогичных условиях
таких неделящихся или редко делящихся клеток, как нервные, мышеч-
мышечные и печеночные при облучении в дозах от нескольких десятков до
сотен Гр.
В радиобиологии наибольшее количество исследований посвящено
интерфазной гибели лимфоцитов: тимоцитов, лимфоцитов селезенки,
лимфоузлов, костного мозга, отличающихся высокой радиочувстви-
радиочувствительностью.
Основными доказательствами гибели клеток лимфоидной ткани в
интерфазе считают следующие.
1. Совпадение временной динамики гибели лимфоцитов после об-
облучения in vitro и in vivo: первые гибнущие клетки в обоих случа-
случаях появляются через 2 часа после радиационного воздействия, а
максимальное число их обнаруживается в период 4-8 часов после
облучения. Поскольку при инкубации in vitro эта гибель не мо-
может быть связана с делением (в отсутствие фитогемагглютинина
лимфоциты не делятся), это означает, что клетки погибают в
интерфазе.
2. Другое доказательство строится на цитокинетических расчетах.
Известно, что в вилочковой железе (тимусе) животных име-
имеется две субпопуляции тимоцитов: делящиеся, составляющие
около 15% общего числа клеток, и неделящиеся — ~ 85 %.
Время полуобновления первого контингента 7—8 часов, второ-
второго — 40 часов с временем жизни таких клеток 5 суток. При
полном нарушении клеточной репродукции 50% клеток убывало
бы в органе на 50% за 40 часов, т.е. со скоростью 1,25% в час
и 12,5% за 10 часов. Фактически же после облучения в до-
дозе 2 Гр количество клеток в тимусе уменьшалось за это время
на 50%, т.е. было в 4 раза выше ожидаемого. Это означает, что
нарушение репродукции может быть ответственным не более чем
за 1/4 часть пострадиационного опустошения тимуса, основная
же причина — гибель клеток в интерфазе.
3. Наконец, еще одно доказательство радиационной гибели кле-
клеток лимфоидной ткани по интерфазному механизму состоит в
совпадении цитоморфологических признаков и биохимических
проявлений гибели их в интерфазе.
Гибели клетки в интерфазе предшествует ряд закономерных фи-
физиологических и морфологических ее изменений. Нарушается ядерное
272 Гл. VI. Реакции клетки на действие ионизирующих излучений
фосфорилирование, угнетается клеточное дыхание, изменяется про-
проницаемость ядерной, митохондриальной и цитоплазматической мем-
мембран — клетки теряют способность препятствовать проникновению в
цитоплазму красителей, например эритрозина Б, и становятся окра-
окрашенными ими, происходит деградация дезоксирибонуклеопротеид-
ного комплекса в ядре, активируются протеолитические ферменты.
Среди морфологических изменений наиболее отчетливо выражены
набухание и пикноз ядер, вакуолизация и распад ядрышек.
Гибель клеток, как уже отмечалось, происходит через несколько
часов (малые лимфоциты, юные ооциты) или в первые сутки
(нервные, мышечные, печеночные клетки) после облучения. При
действии радиации в очень высоких дозах интерфазная гибель
наступает сразу же, «под лучом». В принципе, можно добиться
того, чтобы клетки, для которых характерна репродуктивная форма
гибели, также погибали в интерфазе до первого митоза. Для этого их
необходимо облучать в большой дозе.
Так, известны данные о непосредственной гибели делящихся клеток
в культуре при облучении в дозах 5, 10 и более Гр. Наблюдалась
гибель делящихся клеток через несколько часов после облучения в дозе
несколько Гр перед вступлением в митоз или в интерфазе следующих
генераций, что также рассматривается как вариант репродуктивной гибели,
поскольку она возникает в связи с клеточным делением.
7.1.2. Модификация лучевого поражения клеток
Чувствительность клеток к летальному (то есть вызывающему
гибель) действию ионизирующей радиации можно повысить или по-
понизить при помощи физических, химических и других модифициру-
модифицирующих факторов, изменяющих биологические характеристики клеток
(плоидность, уровень метаболитов, интенсивность дыхания и другие
процессы обмена веществ).
Модифицирующие факторы пытаются использовать в лучевой те-
терапии, например, для избирательного повышения радиочувствитель-
радиочувствительности опухолевых клеток и защиты от повреждения нормальных кле-
клеток и организма в целом от радиации.
Применение воздействий, изменяющих радиочувствительность,
способствует выяснению механизмов лучевого поражения клеток.
Если какой-либо из внутриклеточных процессов подвергается моди-
модификации и при этом меняется устойчивость клеток к облучению,
логично предполагать связь этого процесса с механизмом лучевого
поражения.
7.1.2.1. Модификация репродуктивной гибели
Радиочувствительность быстроделящихся клеток к летальному
действию радиации удается модифицировать за счет воздействий,
изменяющих продолжительность отдельных стадий жизненного цик-
цикла, плоидность генома, характер внутриклеточного метаболизма. На
7. Механизмы гибели и процессы восстановления клеток 273
репродуктивную гибель оказывают влияние физические параметры
среды — температура, состав атмосферы, присутствие в облучаемой
системе ряда химических агентов, степень замещения нуклеотидов
ДНК на бромированные аналоги.
Несмотря на многолетние исследования, до сих пор окончательно
не ясно, на какие внутриклеточные системы и процессы направлено
действие многих модифицирующих факторов. И все же для некото-
некоторых из них можно указать предположительные механизмы оказывае-
оказываемого ими влияния (Окада, 1970).
Факторы, способные изменять степень начального радиа-
радиационного поражения клетки. Установлено, что при облучении в
присутствии кислорода увеличивается выход однонитевых разрывов
ДНК и эффективность летального поражения клеток. При исполь-
использовании другого модифицирующего агента — бромдезоксиуридина —
происходит включение его в состав ДНК вместо тимидина. В резуль-
результате при облучении увеличивается число однонитевых разрывов и
снижается радиочувствительность.
Цистеамин и цистеин увеличивают устойчивость клеток к дей-
действию радиации при одновременном снижении выхода одно- и дву-
нитевых разрывов в клеточной ДНК.
Таким образом, модифицируя начальное радиационное поврежде-
повреждение ДНК, можно изменить радиочувствительность быстроделящихся
клеток, понизить неизбежность репродуктивной гибели значительной
части их.
Факторы, модифицирующие процессы восстановления.
При увеличении плоидности клетки повышаются ее устойчивость к
действию излучения и способность восстанавливать генетический
аппарат от повреждений. Напротив, с ростом ЛПЭ излучения
эффективность лучевого поражения клеток увеличивается в 2-
3 раза, и снижается их способность к восстановлению, вероятно, за
счет появления трудноустранимых повреждений.
Ряд химических агентов, влияющих на восстановление клеток от
радиационных повреждений, модифицирует радиочувствительность
(актиномицин Д, циклогексимид, стрептовитацин А и др.).
Известно, что на разных стадиях цикла деления клетки облада-
обладают неодинаковой по критерию гибели радиочувствительностью. Для
большинства клеток наиболее радиочувствительными являются ста-
стадии «поздняя Gi», «поздняя G2» и «М». На стадиях «ранняя G\» и
«поздняя 5» клетки наиболее устойчивы к облучению. Некоторые воз-
воздействия, изменяя продолжительность отдельных стадий клеточного
цикла, делают иным распределение клеток в популяции «по возрасту»
и, таким образом, модифицируют радиочувствительность популяции
клеток.
Так, понижение концентрации сыворотки в культуральной среде
пролонгировало стадию G\ клеток китайского хомячка, при этом ра-
радиочувствительность популяции также становилась ниже, чем при
18 Ю. Б. Кудряшов
274 Гл. VI. Реакции клетки на действие ионизирующих излучений
культивировании клеток в сыворотке нормальной концентрации, где
клеток в стадии G\ значительно меньше.
Агенты, блокирующие синтез ДНК, вызывают накопление клеток
на поздней стадии G\ и (или) ранней S. При этом клетки оказываются
наиболее радиочувствительными.
По данным Синклера A968), защитный агент цистеамин отменяет
«возрастную» зависимость радиочувствительности клеток китайско-
китайского хомячка — на всех стадиях цикла клетки становятся одинаково
чувствительными к облучению. Это означает, что радиационное по-
повреждение состоит из двух компонент — зависящей от возраста и
чувствительной к защите цистеамином и не зависящей от возраста,
на которую цистеамин не оказывает защитного действия. Механизм
различия повреждения в этих компонентах и действия цистеамина на
одну из них неизвестен.
7.1.2.2. Модификация интерфазной гибели
Неделящиеся или медленно делящиеся клетки погибают в интер-
интерфазе до первого деления. Как уже отмечалось, гибели клеток пред-
предшествует изменение внутриклеточного метаболизма и проницаемости
мембран, появление морфологических признаков деградации ядерно-
ядерного материала. Можно было ожидать, что воздействия, изменяющие
характер метаболизма или защищающие ядерный материал от дегра-
деградации, модифицируют интерфазную гибель. В целом это предположе-
предположение подтвердилось.
Физические агенты — температура, газовый состав атмосферы и
рН среды — изменяют радиочувствительность клеток по критерию
интерфазной гибели. Так как снижение температуры и уменьшение
рН способны модифицировать выраженность, частоту проявления ин-
интерфазной гибели после облучения, было высказано предположение,
что эти факторы влияют на химические реакции, зависящие от тем-
температуры и рН и, возможно, имеющие ферментный характер.
Частота интерфазной гибели возрастает при облучении клеток в
атмосфере чистого кислорода. Замена кислорода на азот приводит
к снижению радиочувствительности. Возможно, эти агенты модифи-
модифицируют начальное радиационное поражение клеток, тогда степень
или особенности начального повреждения могут определять развитие
интерфазной гибели.
Химические факторы, модифицирующие интерфазную гибель, де-
делят на три группы.
В первую входят «конденсирующие агенты» — агматин, сперми-
дин, хлористый натрий в высоких концентрациях. Считается, что эти
вещества защищают клетки от интерфазной гибели за счет влияния
на степень диспергированности хроматина.
Действительно, в их присутствии понижается число клеток с пик-
нозом ядер. Однако они не снижают доли погибших клеток, если
интерфазную гибель оценивать по выходу К+, уменьшению скорости
7. Механизмы гибели и процессы восстановления клеток 275
дыхания и окрашиванию красителями. Это означает, что пикноз мо-
может зависеть от диспергированности хроматина, но другие проявле-
проявления интерфазной гибели связаны с иными процессами.
Вторая группа веществ включает различные дыхательные яды
(цианиды, арсенат натрия, динитрофенол, йодацетат), которые умень-
уменьшают число клеток с пикнозом ядер и с пониженным количеством
ДНК на клетку. Выход К+ и окрашиваемость эритрозином Б у кле-
клеток, облученных в присутствии дыхательных ядов и без них, мало
различается. По-видимому, поражение мембран не модифицируется
ни первой, ни второй группой веществ.
Третья группа — различные метаболиты. Подробно изучено мо-
модифицирующее действие никотинамида и неорганического фосфата.
Никотинамид, предшественник НАД, уменьшал вызываемое облуче-
облучением число пикнозов ядер, но не влиял на выход К+ и окрашиваемость
клеток. Эффект неорганического фосфата обнаружить не удалось.
Очевидно, состояние хроматина, интенсивность дыхания и уровень
содержания метаболитов играют роль в развитии интерфазной гибе-
гибели клеток, однако мы не располагаем модифицирующими агентами,
способными в равной мере влиять на все эти параметры.
Информация, полученная с помощью модифицирующих агентов,
имеет большое значение для выяснения механизмов соответствующих
типов клеточной гибели.
7.2. О механизмах радиационной гибели клеток
Рассмотренная в разделе 7.1 классификация радиационной гибели
клеток на основе зависимости ее проявления от стадии клеточного
цикла не может оценить конкретных радиационно-химических изме-
изменений после облучения, т. е. ответить на вопрос — какие молекулы,
какие субклеточные структуры (органеллы) являются критическими
для инициации этой гибели, какие процессы возникают в результате
действия излучений и приводят клетку сначала к утрате жизнеспособ-
жизнеспособности, а затем к разрушению. Знание этих механизмов особенно важно
для понимания последствий клеточной гибели на уровне целостного
организма.
Оказалось, что как репродуктивная, так и интерфазная гибель
клеток могут проявляться в двух формах — апоптоза*) или не-
некроза**).
Если вопрос о некротической гибели издавна связывался
биологами с решением проблем неспецифической реакции клетки на
различные воздействия, то исследование апоптоза непосредственно
*) Апоптоз (гр. apoptos) означает «листьев опадение», т. е. избавление
организма от ставших ненужными (или больных) клеток и тканей; термин
апоптоз применяют как синоним программируемой гибели клеток.
**) Некроз (гр. nekros — мертвый) означает «омертвение», «отмира-
«отмирание» — необратимое прекращение жизнедеятельности клеток и тканей
вследствие их деструкции в живом организме.
18*
276 Гл. VI. Реакции клетки на действие ионизирующих излучений
возникло в радиобиологических лабораториях. Исследования меха-
механизмов апоптоза начались с изучения радиобиологической проблемы
радиационной гибели клеток млекопитающих. Большая часть работ
начального периода изучения этой проблемы была выполнена в нашей
стране, хотя первую статью на эту тему опубликовали в США.
В 1957 г. Л. Коулом и М. Эллис в радиочувствительной лимфоидной тка-
ткани животных было обнаружено значительное повышение после облучения
содержания солерастворимой ДНК, оказавшейся на самом деле фрагмен-
фрагментами хроматина, получившими название полидезоксинуклеотидов (ПДН).
Эти данные вскоре подтвердили Т. Н. Рысина и Р. Е. Либинзон (I960).
В дальнейших исследованиях Н.В.Ермолаевой A961, 1966, 1977, 1978),
И.В.Филипповича и Е. Ф. Романцева A968-84), С. Р. У майского A979-
1985), К.П.Хансона и Б. Д. Животовского A979-1985), Н.И. Рябченко с
сотрудниками A975—1982) и многих других было установлено, что ПДН —
это продукты деградации хроматина погибающей части лимфоидной
ткани — малых (неделящихся) лимфоцитов, представляющие собой
нуклеосомы и их олигомеры с нормальным содержанием гистонов и
интактной структурой ДНК-белкового комплекса. Они образуются не в
результате образования радиационных разрывов ДНК, а под действием
неких ферментов типа эндонуклеаз (но не ДНКазы II), активность которых
может быть понижена введением ингибиторов белкового синтеза, что
указывает на их индуцируемую природу.
Было установлено далее, что деградация генетического материала в
клетках лимфоидной ткани начинается сразу после прекращения постра-
пострадиационной репарации ДНК (которая в этом случае, вероятно, остается
незавершенной, неполной) и является необратимым этапом радиационной
гибели клеток. Вне зависимости от дозы облучения этот процесс начина-
начинается после двухчасового лаг-периода и достигает максимальных значений
через 6-8 часов после облучения. Деградация хроматина происходит в жиз-
жизнеспособных по многим показателям клетках, зависит от синтеза белка и
функционирования биоэнергетических систем. Ингибиторы этих процессов
задерживают деградацию ДНК и проявления гибели клеток.
Распад хроматина происходит по механизму энзиматической межну-
клеосомной фрагментации. В гибнущих клетках деградации подвергается
большая часть генетического материала, в то время как в клетках, еще не
вступивших на путь гибели, она остается интактной. Образующиеся продук-
продукты, как уже отмечалось, представляют собой нуклеосомы и их олигомеры.
Деградация хроматина не определяется активацией протеолитических
ферментов, ДНКазы I и ДНКазы II и не является, таким образом, след-
следствием автолиза хроматина лизосомными гидролазами. Н. В. Ермолаевой и
С. Р. Уманским была установлена природа эндонуклеазы — фермента, осу-
осуществляющего межнуклеосомную фрагментацию ДНК, изучены его свой-
свойства и причины активации в облученных клетках. Выявлена общность эн-
зиматического механизма деградации хроматина при облучении и действии
глюкокортикоидов, алкилирующих соединений и химических индукторов
дифференцировки (Н.И.Сорокина, 1984).
Совокупность полученных результатов впервые позволила К. П. Хансо-
ну рассматривать механизмы, приводящие клетки к гибели, как адаптивный
ответ на внешние воздействия различной природы и еще в 1979 г. сфор-
сформулировать концепцию о существовании внутриклеточной генетической
7. Механизмы гибели и процессы восстановления клеток 277
некроз
апоптоз ?-}
Ш
Рис. VI. 14. Изменение структуры клеток ж:ивотных при некрозе и апоптозе. 1 —
нормальная клетка. 2, 3 — некротические изменения: 2 — набухание клетки, 3 —
некротическая дезинтеграция. 4, 5 — апоптозные изменения: 4 — сморщивание
клетки с образованием пузырчатых выростов, 5 — фрагментация клетки с обра-
образованием апоптозных везикул
программы, включение которой приводит к деградации генома и гибели
клеток. Назначение этой программы в здоровом организме заключается в
реализации клеточной гибели в ходе морфо- и эмбриогенеза, в поддержании
клеточного гомеостаза тканей и в осуществлении функций цитотоксических
лимфоцитов (Т-киллеров).
Описанные здесь результаты изысканий отечественных исследователей
послужили стимулом и дали «научную канву» для развертывания анало-
аналогичных работ за рубежом. Как это будет очевидно из дальнейшего изложе-
изложения, основные факты и гипотезы, описанные и сформулированные нашими
соотечественниками в отношении механизмов радиационной гибели клеток,
получили полное подтверждение и способствовали блестящему развитию в
мировой науке научных представлений о молекулярных механизмах апопто-
за и о его значимости как общебиологического явления.
На рис. VI. 14 представлена картина морфологических изменений
клеток при некрозе и апоптозе (В. Д. Самуилов, 2001). Из приведенно-
приведенного рисунка видна отчетливая разница в изменениях ультраструктуры
клетки при ее некрозе и апоптозе.
Непрограммируемая, патологическая форма гибели клетки
(некроз) характеризуется увеличением ее объема (набуханием),
деградацией и разрывом клеточных мембран. Вследствие этого
происходит разрушение органелл, высвобождение ферментов
лизосом, выравнивание клеточных градиентов и выход внутри-
внутриклеточного содержимого наружу, в межклеточные пространства.
В организме некроз является результатом внешнего повреждения
клетки, приводящего к остановке в ней метаболизма с полной
278 Гл. VI. Реакции клетки на действие ионизирующих излучений
утратой способности поддерживать ионный гомеостаз, и обычно
сопровождается воспалительной реакцией тканей*).
Изменение морфологической структуры клетки при апоптозе
происходит в результате сморщивания цитоплазматической мембра-
мембраны, конденсации ядра, фрагментации нитей ДНК и всего ядерного
хроматина с последующим распадом клеточного ядра на части.
Один из ранних морфологических признаков апоптоза — конден-
конденсация хроматина со смещением (маргинацией) к внутренней поверх-
поверхности ядерной мембраны.
Затем происходит фрагментация клетки на мембранные везикулы,
включающие в себя фрагменты хроматина, образуются «апоптозные
тельца». Клетка внешне «спокойно» (без электрического пробоя и
воспаления тканей) распадается на части.
Конечным результатом распада ДНК в клетке при апоптозе
является ее расчленение в составе хроматина на двунитевые
фрагменты — полинуклеотиды — размером от 50 тысяч пар
нуклеотидов до более коротких, олигонуклеотидов, содержащих
фрагменты, кратные 180-200 парам нуклеотидов (нуклеосомам). При
электрофорезе ДНК хроматина апоптотической клетки представля-
представляется в виде «нуклеосомной лесенки». Малые, сформированные из
мембран и ДНК пузырьки, называемые апоптотическими тельцами,
быстро фагоцитируются макрофагами и близкорасположенными
эпителиальными клетками без воспалительного (иммунного) ответа,
в противоположность воспалительной реакции, наблюдаемой при вы-
выбросе внутриклеточного содержимого некротическими клетками. Еще
одно различие апоптоза и некроза: первый затрагивает отдельные,
расположенные диспергированно клетки, второй охватывает группы
клеток, имеющих взаимные контакты.
При учете гибели клеток по пикнозу ядер появление нежизнеспособных
клеток в тимусе крыс наблюдается уже через 2 часа после облучения с
максимумом через 6 часов после него. При световой и электронной микро-
микроскопии цитофотометрические изменения и нарушения ультраструктуры
ядер клеток селезенки крыс, облученных в дозе 6 Гр, обнаруживались в
единичных клетках уже к 75 мин. после воздействия. Через 2 часа в ядрах
большого числа лимфоцитов селезенки хроматин наблюдался смещенным
к периферии, а через 4-6 часов после облучения выявлялся в цитоплазме
и вскоре исчезал вообще.
Наконец, в отличие от некроза («убийства ради убийства» любой
клетки), апоптоз направлен на поддержание «общего блага» ткани и
*) Например, эритема и некротическое воспаление кожи, наблюдаемые
у облученного человека, на заре радиобиологии служили мерой для измере-
измерения величины дозы ионизирующей радиации («кожная эритемная доза» —
HED, Haut Eritem Dose, нем.) — минимальная доза рентгеновского излуче-
излучения, вызывающая покраснение (эритему) облученного участка кожи).
7. Механизмы гибели и процессы восстановления клеток 279
организма — сохранения нормального клеточного гомеостаза за счет
«самоубийства» клеток, ставших лишними или переставших выпол-
выполнять свои функции.
7.2.1. Механизм некротической гибели клеток (некроза)
Некротическая, беспрограммная форма гибели наиболее харак-
характерна для сильных воздействий, например, для облучения клеток и
организма в высоких, летальных дозах. В основе ее — нарушение окис-
окислительно-восстановительного равновесия, достигающее уровня пато-
патологии. Так, накапливающиеся в облученной клетке ОРТ выступают
в роли образователей пор в мембранах. Оксирадиотоксины способ-
способны окислять тиоловые группы белков, инициировать гидролиз и
окисление ненасыщенных фосфолипидов мембран. В результате это-
этого происходит инактивация в мембранах ион-транспортных фер-
ферментов-насосов, содержащих сульфгидрильные группы, например,
Са2+-АТФазы. Ферментный выход ионов Са2+ из клетки через мем-
мембраны тормозится, и они накапливаются в цитозоле.
Ионы Са2+, как известно, являются активаторами фосфолипа-
зы А2, вызывающей гидролиз фосфолипидов внутренней мембра-
мембраны митохондрий. Образуются фрагменты фосфолипида — свободные
жирные кислоты, которые подвергаются дальнейшему окислению с
образованием новых ЛРТ. Кроме того возникает и лизоформа фос-
фосфолипидов, обладающая также разрушающими, лизирующими свой-
свойствами. Развиваются неспецифические процессы дезинтеграции и
нарушения структуры БМ. ОРТ, образуясь в высоких концентра-
концентрациях, воздействуют на фосфолипиды БМ и образуют в них поры.
Появившиеся поры увеличивают ионную проницаемость благодаря
образованию ионных каналов. В итоге в митохондрии входят ионы
калия, а в клетки — ионы натрия.
Одновременно через мембранные поры происходит усиленное про-
проникновение Н+ в клетку, возрастает градиент протонного потен-
потенциала A/iiJ+. Все эти изменения дают начало дальнейшим серьезным
повреждениям мембран митохондрий.
Описанные изменения структуры и проницаемости БМ вызывают
увеличение осмотического давления внутри клеток и их набухание
(рис. VI. 14, 2). Прогрессирующее увеличение градиента A/iH+ может
достичь такого уровня, при котором митохондрии теряют важнейшую
для энергетики клетки способность — синтезировать АТФ; происхо-
происходит разобщение сопряжения процессов дыхания и фосфорилирования
(В.П.Скулачев, 2000).
Уже одно это может служить причиной последующей гибели
митохондрий и клеток. Рост протонного градиента может достичь
пороговых значений электрохимического потенциала (называемого
280
Гл. VI. Реакции клетки на действие ионизирующих излучений
ИОНИЗИРУЮЩИЕ
ИЗЛУЧЕНИЯ
КЛЕТКА
+
образование
избытка
ОРТ
Образование пор в БМ,
нарушение ионной
проницаемости —
набухание клеток.
Окислительная
дезинтеграция и
электрический
самопробой БМ,
некроз.
Рис. VI. 15. Схема модели некротической гибели облученных клеток
«потенциалом пробоя» *)), когда изменения силы тока от возраста-
возрастания электрохимического потенциала мембраны уже перестают подчи-
подчиняться линейной зависимости (по закону Ома). С этого момента ток
самопроизвольно возрастает во времени и происходит резкий электри-
электрический пробой БМ (так называемой самопробой мембраны).
Происходящее снижение электрической прочности мембраны со-
сопровождается глубокими повреждениями и некротической дезинте-
дезинтеграцией клетки до полного ее разрушения, (рис. VI.14, 3; рис. VI.15).
Описанный механизм оксидативного повреждения и самопробоя
БМ электрическим полем с последующим некрозом клетки в тер-
терминальной стадии оксидативного стресса не является специфичным
только для ионизирующей радиации. В основе патобиологического
эффекта разных физических и химических экстремальных воздей-
воздействий лежит одно и то же последствие: снижение электрической
прочности мембраны, создаваемое разностью электрических потен-
потенциалов. Предполагается, что самопробой БМ электрическим полем —
универсальный механизм нарушения барьерных свойств мембран в
патологии и одна из главных причин смерти клеток в экстремальных
неблагоприятных условиях (Ю.А.Владимиров, 2000).
7.2.2. Механизмы апоптоза
Развитие и функционирование многоклеточных организмов под-
подразумевает равновесие между синтезом и распадом молекул, их
окислением и восстановлением, пролиферацией и гибелью клеток
(Д. М. Спитковский, 2002). Этот баланс может устанавливаться на
различном уровне в зависимости от стадии развития организма, вре-
времени года и т.д. Поэтому апоптоз является частью природного ме-
механизма, обеспечивающего этот баланс, физиологическим процессом.
Однако в том случае, когда этот процесс активируется под действием
*) Потенциал пробоя V* клеточных мембран (строма эритроцитов) по
данным Ю. А. Владимирова B000) составляет 90-100 мВ, липидного бислоя
БМ — 130-170 мВ., внутренней мембраны митохондрий — 200 мВ.
7. Механизмы гибели и процессы восстановления клеток 281
повреждающих факторов, апоптоз становится частью патологическо-
патологического процесса.
Индукция апоптоза характерна не только для действия ионизиру-
ионизирующих излучений, но и для многих других патологических явлений в
организме, включая канцерогенез. Как полагают, при этом происходит
значительное нарушение баланса между скоростью деления и гибели
клеток. В организме или культуре клеток стратегия апоптоза исполь-
используется для элиминации клеток, несущих нерепарируруемые поврежде-
повреждения биологических мембран (например, путем супероксид-зависимого
апоптоза), ДНК и, возможно, других макромолекул клетки.
С активацией процессов апоптоза связывают элиминацию апо-
птоз-чувствительных субпопуляций клеток в феномене повышения
радиорезистентности клеточных популяций к действию ионизирую-
ионизирующих излучений в высоких дозах. Так, у ракообразных, облученных
в широком диапазоне доз, уровень апоптотической гибели клеток в
популяции резко возрастал лишь в интервале от 0 до 0,5 Гр. При этом
частота обнаружения клеток, гибнущих по этому механизму, после
облучения в дозах от 0,5 до 5 Гр претерпевала лишь незначительные
изменения. Такая гиперчувствительность части клеток при действии
излучения в малых дозах рассматривается как защитная реакция
для популяции клеток в целом, поскольку по механизму апоптоза
элиминируются клетки, имеющие генетические повреждения. Хотя
эти повреждения не всегда летальны для клетки, однако при делении
последних мутации и другие геномные аномалии могут передаваться
потомкам, нарушая постоянство генома, и поэтому «нежелательны».
Следует отметить интригующее воззрение о так называемом неза-
незавершенном апоптозе, т. е. о том, что начальные стадии в ряде случаев
обратимы, а образующиеся при этом клетки с дефектами в геноме
могут быть родоначальниками новых клонов, в том числе трансфор-
трансформированных.
Генетически запрограммированный механизм апоптоза, удиви-
удивительным образом сходный по большинству реакций у животных
разных видов, реализуется в 3 стадии: индукции — инициирования
(сигнальная), активации механизмов осуществления (контроля и
исполнения) и деградации (структурных изменений).
Генетически обусловленный характер апоптоза проявляется не
только в определенной последовательности его реакций, но в первую
очередь в обязательности активации в клетке тех генов, которые
контролируют синтез белков, необходимых для реализации апопто-
апоптотической гибели. Впервые это было установлено в опытах на нема-
нематоде Caenorhabditis elegans американцем Хартвеллом с соавт., удо-
удостоенным в 2002 г. Нобелевской премии по физиологии и медицине
за выдающийся вклад в изучение механизмов апоптоза. У данного
червя программа включает активацию генов клеточной смерти (cell
death) ced-3, ced~4 и ced-9, играющих центральную роль в механиз-
механизме явления, что приводит к образованию белков CED-3 и CED-4,
необходимых для реализации эффекта, а также CED-9, защищаю-
защищающего клетки от гибели путем ингибирования CED-4, активирующего
282 Гл. VI. Реакции клетки на действие ионизирующих излучений
исполнительную функцию белка CED-3. У млекопитающих гомоло-
гомологом CED-3 является каспаза-1 — белок из семейства 11 цистеиновых
протеиназ с аспартатной специфичностью. Термин каспаза (caspase)
составлен из букв названия протеаз — Cysteine with Aspartate Speci-
Specificity ProteASEs, ранее называвшегося семейством ICE (interleukin-
1/^-converting enzyme). Кандидатом на гомологию CED-4 у млекопи-
млекопитающих является белок семейства Apaf-1 (apoptotic protease-activating
factor-1) — активирующего фактора-1 апоптотических протеаз. Белок
bcl-2 (и члены образуемого им семейства антиапоптотических белков)
является аналогом белка CED-9 в качестве негативного регулятора
(ингибитора) каспазы-1.
Каспазы находятся в цитоплазме клетки в неактивном состоянии.
После каскада активирующих модификаций под влиянием генных
продуктов они переходят в ядро и атакуют в общей сложности око-
около двух десятков структурных и функциональных белков, включая
белки проведения сигналов и цитоскелетные. При этом в каждом
белке расщепляется та химическая связь, которая находится сразу за
аспартатом в специфичной для каждой каспазы аспартатсодержащей
последовательности аминокислот. Большинство субстратов расщеп-
расщепляется каспазами-3 и -7, ламин избирательно каспазой-б. Чтобы про-
произошла характерная для апоптоза межнуклеосомная фрагментация
ДНК, необходима активация апоптоз-специфической эндонуклеазы.
Она происходит путем расщепления каспазой цитоплазматическо-
го ингибитора этой эндонуклеазы (ингибитора каспазо-активируемой
ДНКазы, фактора фрагментации ДНК).
Только после этого ДНКаза переходит в клеточное ядро и произ-
производит деградацию геномной ДНК.
Активация каспаз осуществляется путем восприятия соответству-
соответствующих сигналов, приходящих из внешней среды или из самой клетки. В
результате, как уже отмечалось, возникает экспрессия определенных
генов с образованием белковых продуктов с сигнальной функцией.
Команды на апоптоз реализуются двумя путями — внешним и вну-
внутренним: через так называемые поверхностные рецепторы смерти в
клеточной мембране (death receptors, DR) или через митохондрии
внутри клетки.
Первый путь начинается с рецепторов смерти, которых в
настоящее время насчитывают пять: DR1 (Fas, или Apol), DR2
(TNFR1 — tumor necrosis factor receptor-1, или р55, или CD120a),
DR3 (АроЗ, или WSL-1, или TRAMP, или LARD), DR4 и DR5 (Apo2,
или TRAIL-R2, или TRICK 2, или KILLER). Среди них главными
считаются Fas и TNFR1.
Рецептор *) клеточных мембран — это встроенная в мембраны белковая
молекула, обычно состоящая из трех частей. Наружная, неклеточная
часть молекулы способна узнавать (подобно узнаванию замком своего
Рецептор — от лат. recipere — получать.
7. Механизмы гибели и процессы восстановления клеток 283
ключа) сигнальные молекулы, которые могут либо свободно плавать
во внеклеточной жидкости, либо быть фиксированными на поверхности
других клеток (например, лейкоцитов). При взаимодействии сигнальных
молекул с наружной частью белка-рецептора происходит изменение
конформации рецептора — структурные изменения расположения одних
атомов относительно других в макромолекуле рецептора, причем как
в наружной его части, так и в средней (погруженной в мембрану) и
внутриклеточной его частях. Внутриклеточная часть рецептора передает
сигналы клеточным ферментам.
Таким образом, взаимодействуя с соответствующим генным про-
продуктом — своим специфическим лигандом, рецептор формирует после-
последующий сигнал, активирующий каспазы. В итоге индуцируется каскад
реакций апоптоза.
Митохондриальный путь активации этого процесса осуществляет-
осуществляется каспазой-3. Для своей реализации он требует, помимо АТФ или
дАТФ, участия трех белков: зрелой гемсодержащей формы цитохро-
ма с, Apaf-1 (аналога CED3) и каспазы-9 (аналога CED4).
В норме цитохром с содержится в митохондриальном межмембран-
межмембранном пространстве. Выход его в цитоплазму происходит вследствие по-
повреждения митохондрий, приводит к активации каспазы-3 и запуску
апоптоза.
Существует и иной вариант митохондриального пути, когда в ре-
результате открытия пор проницаемости и утраты протонного и элек-
электрического градиента на внутренней митохондриальной мембране из
митохондрий выходит белок, получивший название апоптоз-индуци-
рующего фактора (apoptosis-inducing factor, AIF), прямо активирую-
активирующий каспазу-3.
В отличие от некроза, уже незначительные нарушения окислитель-
окислительно-восстановительного равновесия в клетке могут послужить началь-
начальной стадией реализации многоплановой программы апоптоза. При
этом к ее «запуску» в данной клетке могут быть причастны другие
клетки.
На рис. VI. 16 представлена ориентировочная схема реализации
апоптоза, вызванного образованием ОРТ в облученной клетке.
Сигналы о неблагополучии клетки.
Даже небольшой избыток оксирадиотоксинов может способство-
способствовать появлению на поверхности клетки первичного сигнала — посла-
послания во внеклеточную среду информации о неблагополучном состо-
состоянии клетки. Таким сигналом часто служит молекула окисленного
фосфатидилсерина (ФСОКM появляющаяся на внешней поверхности
мембраны.
В структуре БМ в норме существует асимметрия в распределе-
распределении фосфолипидов. За счет транспортной АТФазы фосфатидилсерин
(ФС) удерживается только во внутреннем липидном слое БМ. Обра-
Образующиеся в клетке ОРТ окисляют фосфатидилсерин, превращая его
в ФСОК.
284 Гл. VI. Реакции клетки на действие ионизирующих излучений
ИОНИЗИРУЮЩИЕ
ИЗЛУЧЕНИЯ
I КЛЕТКА|
ОБРАЗОВАНИЕ ИЗБЫТКА ОРТ
сигналы на внешней поверхности БМ неблагополучной клетки
У
ЛЕЙКОЦИТ
СИГНАЛЫ >
МЕТКИ»)
< (ФСок) У
(«ЧЕРНЫЕ ' I > РЕЦЕПТОР БМ
(КОНФОРМАЦИЯ)
It
сигналы на внутренней поверхности БМ и в цитозоле неблагополучной
клетки (е том числе цитохром с и др. свободные белки при митоптозе)
ИЗМЕНЕНИЕ ИОННОГО СОСТАВА ЦИТОПЛАЗМЫ,
АКТИВАЦИЯ ФОСФОРИЛИРУЮЩИХ
И ГИДРОЛИТИЧЕСКИХ ФЕРМЕНТОВ,
БИОХИМИЧЕСКИЕ ИЗМЕНЕНИЯ
В БЕЛКАХ, ЛИПИДАХ, НУКЛЕОТИДАХ
активация белковых регуляторов,
образование белков и РНК
+ + +
АКТИВАЦИЯ ПРОТЕАЗ И НУКЛЕАЗ
+ + + +
РАЗРУШЕНИЕ ЖИЗНЕННО ВАЖНЫХ БЕЛКОВ,
ФРАГМЕНТАЦИЯ ДНК С УЧАСТИЕМ
АКТИВИРОВАННОЙ ДНКазы
УПЛОТНЕНИЕ И ФРАГМЕНТАЦИЯ ХРОМАТИНА,
РАСПАД КЛЕТКИ НА АПОПТОЗНЫЕ ВЕЗИКУЛЫ,
ПОГЛОЩАЕМЫЕ МАКРОФАГАМИ
Рис. VI. 16. Схема модели апоптоза облученной клетки
7. Механизмы гибели и процессы восстановления клеток 285
ФСОК либо инактивирует АТФазу, либо фермент не способен удер-
удерживать (транспортировать) окисленный фосфолипид. Это приводит к
проникновению ФСОК из внутреннего липидного слоя плазматической
БМ во внешний. Так на клеточной поверхности появляется апоптоз-
ный сигнал избытка ОРТ — сигнал о неблагополучии клетки.
Химический сигнал о неблагополучии узнается окружающими
клетками (например, лейкоцитами), которые могут передать
неблагополучной клетке решение о необходимости самоубийства с
помощью своего сигнала, условно обозначим его «черной меткой».
« Черные метки».
Во многих случаях атакующие лейкоциты выделяют на «приго-
«приговоренную к самоубийству» клетку собственные АКСС (например,
супероксид-анионы), увеличивающие на ее поверхности концентра-
концентрацию ФСОК5 т-е- усиливают этот сигнал, который затем посылается
внутрь клетки для реализации программы апоптоза (рис. VI. 16).
В других случаях лейкоциты под влиянием ФСОК выделяют вблизи ме-
меченой клетки белки — перфорин и гранзимы. Перфорин проделывает поры
в плазматической мембране, а гранзимы проникают через них в клетку и
запускают программу апоптозного механизма.
Еще один пример принудительного апоптоза и передачи различных
«черных меток» — это секреция лейкоцитами индукторов апоптоза, на-
например, фактора некроза опухоли — TNF (tumor necrosis factor), а так-
также цитокина, которые связываются с соответствующими рецепторами на
поверхности апоптической клетки. TNF и кинины способны инициировать
сразу несколько различных механизмов апоптоза.
Сигналы, появляющиеся в цитозоле в результате апоптоза ми-
митохондрии.
В последнее время термин «апоптоз» распространен на явление
лизиса митохондрий в клетке. Апоптоз клеточной органеллы — ми-
митохондрии (митоптоз) — начинается с открытия пор во внутренней
мембране митохондрии.
Внутренние мембраны митохондрии содержат фосфолипазу Аг, вызы-
вызывающую в присутствии ионов Са2+ гидролиз фосфолипидов с образованием
свободных жирных кислот и лизофосфолипидов.
В интактной митохондрии фосфолипаза А2 неактивна, поскольку ионы
кальция находятся только на внешней мембране органеллы. При облучении
под влиянием образующихся ОРТ в мембранах появляются поры, через
которые ионы Са2+ проникают внутрь и активируют фосфолипазу А2.
Продукты гидролиза и окисления — лизофосфолипиды и окисленные жир-
жирные кислоты (ЛРТ) — приводят к значительным повреждениям мембраны
митохондрий.
Происходит набухание матрикса, разрыв внешней митохондриаль-
ной мембраны и освобождение в цитозоль межмембранных белков и
286 Гл. VI. Реакции клетки на действие ионизирующих излучений
цитохрома с. Освобождение цитохрома с и других митохондриальных
белков происходит значительно раньше, чем истощение внутриклеточ-
внутриклеточного АТФ. К освобождаемым белкам относятся, помимо цитохрома с,
AIF *), Smac **) и прокаспаза ***) (прокаспаза-9). Все они могут вклю-
включаться в реализацию сигнала от поврежденной митохондрии к клетке.
В интенсивно делящихся клетках обычно вырабатываются различные
белковые вещества, называемые факторами роста, стимулирующие
клеточное деление. Они взаимодействуют с внутриклеточной частью
рецептора, часто — с несколькими рецепторами. Отсутствие сигналов от
факторов роста может говорить о неблагополучии и необходимости также
включения программы реализации апоптоза.
Имеются сведения о том, что апоптотические сигналы, идущие от вну-
внутренней части рецептора, могут миновать генетический аппарат и напря-
напрямую активировать протеазы, гидролизующие белковые структуры клетки.
Важную роль для сигналов такого типа могут играть продукты распада
митохондрий.
Недавно появились новые данные о еще одной возможности иниции-
инициирования генетической программы апоптоза. Открытие в последние годы
способности ОРТ непосредственно вступать в реакцию с ДНК и образовы-
образовывать МДА-, этено-, пропано- и другие оксиаддукты ([ОРТ 'ДНК]), облада-
обладающие генотоксическим (мутагенным) и цитотоксическим (инициирующим
апоптоз) действием, позволяет предположить важную роль аддуктов ОРТ
с ДНК в запуске и реализации наследуемой программы радиационного
апоптоза. Однако это предположение требует экспериментальных подтвер-
подтверждений.
Большое разнообразие и многостадийность проведения сигналов,
вынуждающих неблагополучные клетки гибнуть, становится понят-
понятной в связи с важностью самой проблемы равновесного состояния жи-
живой системы. Все неблагополучие клетки может происходить подчас от
неспособности ее защитных ресурсов справиться с избытком ОРТ. По-
Поэтому информация о степени собственного неблагополучия, принятие
и выполнение решения о самоубийстве — задача очень сложная и от-
ответственная, и она решается в клетке в рамках строгой последователь-
последовательности событий проявления уже упоминавшейся предсуществующей
программы апоптоза [192]. Хотя многие детали ее остаются пока еще
не выясненными, в целом эта последовательность проиллюстрирована
на представленной выше схеме (рис. VI. 16).
Возникновение апоптоза под влиянием сигналов повреждения не
является фатальным. В зависимости от интенсивности того или иного
альтернативного процесса регуляции (действующего по принципу:
«усилить сигнал» данного повреждения или «ослабить его» имею-
имеющимися защитными ресурсами) решается вопрос о продолжении или
*) AIF — apoptosis-inducing factor — активирует нуклеазу ядерной ДНК.
*) Smac — second mitochondrial apoptosis-inducing factor.
*) Фермент, неактивный предшественник каспазы.
7. Механизмы гибели и процессы восстановления клеток 287
приостановке развития апоптоза. Апоптотическим сигналам противо-
противодействуют целые семейства белков с антиапоптотическими функция-
функциями, в частности, образуемое белком bcl-2. Недавно идентифицирован
еще и белок BAR (bifunctional apoptosis regulator), способный подав-
подавлять передачу апоптотических сигналов как по внешнему, так и по
внутреннему путям.
Итак, апоптоз завершается потерей целостности, фрагментацией
клетки. Хроматин — главный ядерный компонент, состоящий из ДНК
и белков, уплотняется, а ядро и клетка распадаются на апоптозные
тельца — везикулы (рис. VI. 14, 5). Однако в некоторых программах
апоптоз возможен и без фрагментации ДНК. Появляющиеся везикулы
уничтожаются макрофагами.
Морфологическая и биохимическая картина апоптоза, имеющая
общие черты сходства для самых разных клеток эукариот, имеет так-
также и важное биологическое значение для жизнедеятельности организ-
организма. Это поддержание клеточного гомеостаза, реализация программы
индивидуального развития, дифференцировка некоторых специализи-
специализированных клеток организма, это механизм защиты организма (наряду
с иммунной системой) от действия ксенобиотиков и возбудителей ин-
инфекционных заболеваний, направленного на изменение наследствен-
наследственных свойств и жизнеспособности клеток.
В завершение данного раздела приведем общую схему механизмов
радиационной гибели клеток, любезно предоставленную нам в 2002 г.
проф. В. К. Мазуриком (рис. VI.17).
В результате воздействия ионизирующей радиации в тканях мно-
многократно возрастает содержание оксирадикалов (по отношению к есте-
естественному фону их метаболической продукции) — супероксидного OJ,
гидроксильного ОН', N0 — субстрата для образования вещества с ра-
радикальными функциями — пероксинитрита. Оксирадикалы вызывают
структурные изменения в ряде биологически важных макромолекул,
имеющие характер необратимых повреждений. Часть этих поврежде-
повреждений реализуется в виде продукции клетками сигнальных молекул
общеклеточного повреждения.
В качестве таких молекул, выделяемых во внеклеточное простран-
пространство, выступают фактор некроза опухоли (TNF) или Fas-(CD95)^n-
ганд, являющиеся прямыми инициаторами апоптоза, либо митогены,
необходимые для прохождения клеткой клеточного цикла, возникно-
возникновение дефицита которых приводит к необратимому блокированию ее
на какой-то из стадий цикла, что инициирует апоптоз.
Внутриклеточными сигналами апоптоза становятся неустранимые
повреждения ДНК (в особенности двунитевые разрывы), высвобожде-
высвобождение церамида из мембран под действием оксирадикалов (в результате
активации сфингомиелиназ или активация его синтеза церамидсинта-
зой), высвобождение цитохрома с из митохондрий в результате изме-
изменения мембранной проницаемости.
Однако после облучения в сверхлетальных дозах эти каскады, так
же как и продукция макроэргов в окислительно-восстановительных
288
Гл. VI. Реакции клетки на действие ионизирующих излучений
Ионизирующая радиация
* * *
Многократное возрастание в тканях содержания оксирадикалов
Ф Ф
Генерация оксирадикалами сигналов необратимого повреждения —
внутриклеточных, таких как:
- неустранимые повреждения ДНК
- высвобождение церамида из мембран под
действием оксирадикалов в результате ак-
активации сфингомиелиназ или активация его
синтеза церамидсинтазой
- высвобождение цитохрома с из митохон-
внеклеточных, таких как:
- высвобождение фактора
некроза опухоли (TNF) и
СБ95-лиганда (Fas-лиганда)
— дефицит митогенов
дрий в результате изменения мембранной
проницаемости
Действие сигнальных молекул на сенсорные структуры
программы апоптоза (программируемой клеточной гибели)
в клетках
После облучения в суб-
сублетальных и летальных
дозах —
рецепция сигналов по-
повреждения и активация
программ апоптоза
После облучения в очень высоких
летальных дозах —
инактивация компонентов сигнальных
каскадов, невозможность реализации про-
программируемой клеточной гибели —
НЕКРОЗ
Активация рецепторов смерти на плазматической мембране:
DR1 (Fas, или Apol), DR2 (TNFR1, или р55, или CD120a), DR3 (АроЗ, WSL-1,
TRAMP, или LARD), DR4 и DR5 (Аро2, TRAIL-R2, TRICK 2, или KILLER)
Ф
Активация каспазного каскада (диссоциация комплекса каспаз-9, -3 и
-4, связывание каспазы-4 с каспазой-3 с активацией последней),
приводящего к деструкции клеточных компонентов до низкомолекулярных
продуктов, включая хроматин ДНК с образованием продуктов его
деградации, формирующих при электрофорезе характерную «лесенку»
Ф
АПОПТОЗ
Рис. VI. 17. Схема, иллюстрирующая современные представления о механизмах
радиационной гибели клеток
реакциях, оказываются инактивированными под действием радиаци-
радиационных радикалов. В результате этого реализация программируемой
клеточной гибели становится невозможной. Возникает процесс некро-
некротических изменений клетки. Утрата ионных градиентов приводит к
набуханию субклеточных структур и клеток до таких размеров, а на-
натяжение ограничивающих их мембран до таких величин, при которых
мембраны становятся неспособными сохранить свою механическую
целостность и разрываются, выбрасывая содержимое в межклеточные
пространства. Радиационная гибель клеток реализуется как некроз.
7. Механизмы гибели и процессы восстановления клеток 289
После облучения в сублетальных и летальных дозах происходит
рецепция сигналов повреждения и активация программ апоптоза:
сначала уже упоминавшихся рецепторов смерти на плазматической
мембране - DR1 (Fas, или Apol), DR2 (TNFR1, или р55, или CD120a),
DR3 (АроЗ, WSL-1, TRAMP, или LARD), DR4 и DR5 (Аро2, TRAIL-
R2, TRICK 2, или KILLER), затем киназных каскадов Erk (extracellular
signal regulated kinase — киназа, регулируемая внеклеточными сигна-
сигналами) и JNK (с-Jun N-terminal kinase — с-Jun-терминальная киназа),
обеспечивающих транскрипционную активацию генома и синтез бел-
белков для реализации программируемой клеточной гибели и активации
необходимых для нее зимогенов. В конечном итоге наступает испол-
исполнительская стадия апоптоза — активация каспазного каскада: проис-
происходит диссоциация комплекса каспаз-9, -3 и -4, связывание каспазы-4
с каспазой-3 с активацией последней и под действием их деструкция
клеточных компонентов до низкомолекулярных продуктов, в первую
очередь, хроматина ДНК с образованием продуктов его деградации,
формирующих при электрофорезе характерную «лесенку».
7.2.3. Общий биологический закон самоликвидации —
биологический смысл апоптоза
Гибель «во имя высшей цели»
Рассмотренные процессы защиты облучаемой клетки от возни-
возникающих повреждений, вызывающих нарушения структуры ДНК и
окислительно-восстановительного равновесия, свидетельствуют о глу-
глубоко эшелонированном и последовательном развитии этих процессов.
Мы видели, что в клетке существует тщательно отрегулированный,
многокомпонентный и разнообразный по способам действия аппарат
предупреждения и защиты от оксидативных повреждений клеточных
структур, вызываемых ОРТ.
Однако этим эндогенный механизм противолучевой защиты не
исчерпывается, если оценивать способность клеток ликвидировать
себя в целях защиты всего организма. В этом случае, например,
апоптоз клеток можно рассматривать не как самоубийство, а скорее
как самопожертвование для организма.
В последнее время установлено, что механизмы апоптоза свой-
свойственны не только клеткам, но они также присущи субклеточным и
надклеточным структурам [321]. В.П.Скулачев сформулировал об-
общий биологический закон самоликвидации: «любая достаточ-
достаточно сложная биологическая система {от органеллы и выше) всегда
готова к самоликвидации. Она кончает с собой, если становит-
становится опасной для самого существования живой системы, занимаю-
занимающей более высокую ступень в иерархии организации жизни». Са-
Самоликвидация митохондрий была названа митоптозом, а органов
и тканей (например, в норме, в эмбриональном развитии) — орга-
ноптозом. Как мы видели, важный сигнальный механизм в нор-
норме, а также цито- и генотоксические эффекты самопожертвования
инициируются образованием АПК и возрастанием активности ОРТ.
19 Ю. Б. Кудряшов
290
Гл. VI. Реакции клетки на действие ионизирующих излучений
Митоптоз, апоптоз и некроз клеток в облученном организме
Если радиационное воздействие на организм еще в нелетальных
дозах способно увеличить содержание АКСС в митохондриях, то в
популяции митохондрий клетки может оказаться уже такое количе-
количество митоптозов, свободных цитохрома с и проапоптических белков,
что уровень их окажется способным активировать механизм следу-
следующего этапа защиты — самоликвидации клетки. Наступает апоптоз
клеток, содержащих поврежденные митохондрии. Эта часть клеток
с повышенным содержанием продуктов распада выбраковывается и
удаляется из ткани облученного организма. Все это может происхо-
происходить раньше, чем наступает некроз митохондрий и клетки.
При облучении организма в более высоких, летальных дозах, когда
защитные механизмы оказываются уже неспособными противостоять
повреждениям, количество некротизированных митохондрий быстро
возрастает, и клетки «без разбора» погибают раньше от некротиче-
некротического убийства, чем произошла бы самоликвидация некоторых из них
путем апоптоза. Таким образом, вслед за снижением эффективности
химической защиты организм может терять и биологический меха-
механизм восстановления, начиная с субклеточного уровня.
Степень поражения организма, лучевые синдромы зависят от из-
изменений во времени соотношения эффектов повреждения и восста-
восстановления элементов систем на разных уровнях организации их струк-
структуры и функций. Хорошо известно, например, что в зависимости от
диапазонов доз острого облучения организма наблюдаются различные
лучевые синдромы, являющиеся следствием массовой гибели популя-
популяций клеток и клеточного опустошения тех или иных «критических»
органов и тканей (см. гл. VII).
Другим важным многоплановым механизмом системного ответа
на облучение являются процессы пострадиационного восстановления
клеток.
7.3. Процессы восстановления облученных клеток
Среди радиобиологов давно утвердилось представление о том, что
организмы способны избавляться по крайней мере от части нанесен-
нанесенных им радиационных повреждений. На это указывали следующие
эксперименты.
Частота гибели организмов, длительность задержки деления, вы-
выраженность различных морфологических и биохимических эффектов
облучения уменьшаются в том случае, когда доза радиации сообща-
сообщается в виде отдельных фракций с достаточным промежутком времени
между ними. Было предположено, что перерыв между отдельными
фракциями облучения используется для ликвидации ряда поврежде-
повреждений.
В начале пятидесятых годов Н. В. Лучник подробно изучил частоту
структурных мутаций в клетках, делящихся через разные интервалы
времени после облучения, и показал, что чем больше этот интервал,
тем меньше выражен биологический эффект. Автор предположил, что
наблюдаемая закономерность объясняется восстановлением клеток от
7. Механизмы гибели и процессы восстановления клеток 291
первичных повреждений. Были получены данные о корреляции между
радиорезистентностью хромосом и наклоном кривых «доза-эффект».
Аналогичное уменьшение лучевого поражения наблюдалось и в том
случае, когда облучение в данной дозе радиации происходило в тече-
течение длительного времени, т. е. при малой мощности дозы.
Этот эффект можно объяснить тем, что решающей оказывается
скорость нанесения повреждений. Если она соизмерима со скоростью
и эффективностью работы восстановительных систем, то организм
окажется в состоянии исправлять возникающие повреждения, не до-
допуская их реализации.
Группа фактов получена при различных воздействиях на уже об-
облученные биологические объекты. Варьируя состав питательной сре-
среды, освещенность, температуру во время инкубации, газовый состав
атмосферы и другие факторы, удается значительно снизить поража-
поражающее действие радиации. Ни один из этих факторов не в состоянии
повлиять на степень начального радиационного повреждения, поэто-
поэтому естественным выглядит предположение о том, что в данном случае
создаются оптимальные условия для протекания восстановительных
процессов.
Так, в 1957 году, проводя эксперименты на дрожжевых клетках,
В. И. Корогодин открыл реальное существование эффекта пострадиа-
пострадиационного восстановления. Он показал, что способность клеток к обра-
образованию макроколоний частично восстанавливается, если облученные
дрожжи высевать на питательную среду не сразу после облучения, а
после выдерживания их в воде.
Принципиальной новизной эффекта восстановления явилась неиз-
неизвестная ранее способность клеток спонтанно избавляться от луче-
лучевых и иных ДНК-зависимых повреждений, вызывающих летальные
и генетические эффекты. Сама идея восстановления противоречила
распространенному тогда представлению о необратимости лучевых
повреждений мишени.
Открыв явление пострадиационного восстановления, В. И. Коро-
Корогодин выдвинул концепцию «потенциальных повреждений» в об-
облученной клетке, концепцию, не противоречащую, а развивающую
трактовку принципов количественной радиобиологии с позиций за-
зависимости «время-эффект». Согласно этой концепции, в результате
поглощения энергии ионизирующих излучений, отдельных попаданий,
могут формироваться потенциальные повреждения структур клеток.
Эти повреждения, развиваясь во времени, «способны приводить к
проявлению единиц реакции, только пройдя фазу реализации». В
интервал времени между потенциальным повреждением и его реали-
реализацией возможно протекание восстановительных процессов, которые
подчиняются статистическим закономерностям.
Вскоре была обнаружена способность клетки репарировать ДНК
от разрывов, возникающих под воздействием ионизирующих излуче-
излучений, и показана связь восстановления ДНК с радиорезистентностью
клетки.
19*
292 Гл. VI. Реакции клетки на действие ионизирующих излучений
Основные характеристики процесса восстановления клеток от ле-
летального радиационного повреждения были изучены в 60-х годах
благодаря использованию метода культивирования одиночных клеток
млекопитающих. Этот метод позволил проводить количественные ра-
радиобиологические эксперименты на клетках млекопитающих с такими
же точными результатами, какие ранее получали только на бактериях,
вирусах и фагах.
Одно из наиболее подробных исследований в этом направлении
было проведено Элкиндом и Саттон на клетках китайского хомячка.
Когда популяцию клеток облучали однократно в дозах 9,92, 5,05
или 4,87 Гр, выживало соответственно 0,186%, 8,2% и 9,5% клеток.
Рассмотрим результат облучения в дозе 5,05 Гр. Летально по-
поврежденными оказались 91,8% клеток, и только 8,2% были либо не
повреждены, либо несли су б летальные повреждения, которые мог-
могли проявиться при последующем облучении. Если эту же популя-
популяцию клеток после облучения в дозе 5,05 Гр повторно облучить
в дозе 4,87 Гр, то возможна одна из трех ситуаций: 1) репара-
репарация летального и сублетального повреждений завершится к моменту
повторного облучения; предполагаемая выживаемость будет равнять-
равняться 9,5%; 2) су б летальные повреждения будут полностью восстанов-
восстановлены, а летальные сохранятся; предполагаемая выживаемость соста-
составит 0,082 х 0,095 = 0,0078 @,78%); 3) ни одно из повреждений не будет
репарировано, и выживаемость двукратно облученной популяции не
будет отличаться от выживаемости в случае однократного облучения
в дозе 9,92 Гр, т.е. составит 0,186%.
В конкретных условиях эксперимента наблюдаемая в действитель-
действительности выживаемость изменялась от 0,186 до 0,78%, находясь при
этом в зависимости от интервала времени между двумя облучениями.
Наибольшая выживаемость наблюдалась в том случае, когда интервал
между облучениями превышал 10 часов.
Это означает, что клетки, имеющие сублетальные повреждения (о
них свидетельствует «плечо» на кривой «доза-эффект»), успевают
к моменту повторного радиационного воздействия полностью завер-
завершить восстановление и, следовательно, не погибают от добавочно-
добавочного сублетального повреждения, нанесенного второй дозой радиации.
Таким образом, полученные данные позволили их авторам заклю-
заключить, что клетки млекопитающих способны ликвидировать сублеталь-
сублетальные, подпороговые повреждения, нанесенные ионизирующим излуче-
излучением.
Для выяснения природы восстановления от сублетальных повре-
повреждений изучали влияние различных модифицирующих факторов на
этот процесс. Увеличение ЛПЭ излучения, облучение в условиях анок-
сии или использование клеток малой плоидности приводило к сниже-
снижению до минимума начального восстановления. По-видимому, в этих
случаях образуется крайне мало сублетальных повреждений (сужает-
(сужается «плечо» на кривой «доза-эффект») и большое число летальных.
7. Механизмы гибели и процессы восстановления клеток 293
Использование различных ингибиторов и активаторов не позволи-
позволило выявить роль синтеза ДНК или белков, окислительного фосфори-
лирования или дыхания в этом процессе.
Анализ температурной зависимости указывает на участие фер-
ферментов в восстановлении от сублетальных повреждений. Способность
актиномицина D в низких концентрациях подавлять восстановление
позволило Элкинду и соавторам высказать гипотезу, согласно кото-
которой связывание антибиотика молекулой ДНК препятствует процессу
восстановления либо за счет перевода репарированной ДНК в функци-
функционально неактивное состояние, либо за счет ингибирования образова-
образования комплекса ДНК—РНК—белок. Ни природа сублетальных повре-
повреждений, ни молекулярный механизм их восстановления до настоящего
времени все еще не выяснены.
Другая разновидность процесса восстановления была обнаружена
в экспериментах с клетками млекопитающих, которые после облуче-
облучения подвергали воздействию различных химических и физических
агентов. Еще одна — восстановление от потенциально летальных по-
повреждений — обнаружено при облучении клеток в неоптимальных
условиях — пониженной температуры, при помещении клеток в де-
дефицитную питательную среду, в условиях торможения синтеза ДНК
и т.д.
Филипс и Толмач в 1966 г. провели наблюдения над облученными
клетками HeLa, к которым через различные сроки после однократного
облучения прибавляли оксимочевину. Оказалось, что этот препарат
увеличивает летальное поражение клеток, если его прибавить сразу
же после облучения. Удлинение интервала времени между радиаци-
радиационным воздействием и прибавлением оксимочевины до б часов полно-
полностью предотвращало гибель облученных клеток, вызванную оксимо-
чевиной.
Следовательно, за этот период потенциально летальные поврежде-
повреждения, чувствительные к оксимочевине, перешли в состояние, нечув-
нечувствительное к этому химическому агенту. Так как используемые кон-
концентрации оксимочевины вообще не влияли на необлученные клетки,
то наблюдаемый эффект можно объяснить тем, что в результате
облучения в клетках индуцировались сублетальные повреждения, для
перехода которых в летальные требуется дополнительное воздействие
оксимочевиной. За счет функционирования репаративных систем эти
повреждения могут быть восстановлены, однако для этого требует-
требуется определенный интервал времени для активного синтеза ДНК и
белков.
Аналогичные результаты на клетках китайского хомячка были
получены с использованием актиномицина D, который увеличивает
гибель облученных клеток, переводя су б летальные повреждения в
летальные (уменьшает «плечо» на кривой выживаемости). Если меж-
между облучением и прибавлением актиномицина D проходит 2-8 часов,
то способность антибиотика увеличивать летальное поражение резко
падает. Это означает, что восстановительные системы клетки перево-
переводят сублетальные повреждения, чувствительные к актиномицину D,
294 Гл. VI. Реакции клетки на действие ионизирующих излучений
в нечувствительное состояние. По ряду признаков последний эффект
имеет много общего с восстановлением, описанным Элкиндом и Сат-
тон, но отличается от репарации потенциально летальных поврежде-
повреждений, реализуемых оксимочевиной.
Одним из наиболее вероятных механизмов, определяющих способ-
способность клетки избавляться от сублетальных повреждений, может быть
процесс репарации радиационных нарушений структуры ДНК. Во-
первых, уникальность текста, записанного в ДНК, и его значение для
клетки совершенно исключают замещение пораженных облучением
молекул вновь синтезированными. Во-вторых, сама структура ДНК
позволяет проводить работы по исправлению генетического «текста»,
так как он присутствует в двух комплементарных копиях.
Согласно принятому определению, восстановление — это процесс
ликвидации явных или (и) скрытых повреждений. При явном по-
повреждении восстановление заключается в возврате исходных свойств
объекта после периода, в течение которого они вследствие облучения
были изменены. При скрытом повреждении (потенциально летальном)
восстановление состоит в утрате способности к реализации повреж-
повреждения.
Наконец, наблюдаются восстановление от повреждений в клетках,
не гибнущих от облучения. Обнаруживается это при так называемом
адаптивном ответе, когда эффект восстановления регистрируется по
возрастанию выживаемости клеток при облучении в дозе, разделенной
интервалом времени на две фракции по сравнению с облучением в
одной суммарной дозе (см. гл. VII, «адаптивный ответ»).
Ведущую роль в изучении процессов пострадиационного восста-
восстановления клеток вновь сыграли успехи молекулярной биологии по ис-
исследованию ферментных систем, репарирующих повреждения ДНК.
Изучены различные репаративные ферменты, одни из которых как
бы усиливают первичные лучевые повреждения ДНК (в том числе —
экзо- и эндонуклеазы), другие — ликвидируют их (полимеразы,
лигазы, фосфатазы). К процессам пострадиационного восстановления
клеток оказались причастными также некоторые гормоны и факторы
роста, влияющие на отдельные хромосомы и их фрагменты. Оценка
соотношений между активностью первой и второй групп ферментов
дала важную информацию о механизмах усиления повреждений
и восстановления главной мишени радиационного воздействия
мишени — ДНК.
Таким образом, по мере развития радиобиологических исследова-
исследований становилось совершенно очевидным, что существует множество
путей репарации лучевых повреждений на всех уровнях организации
живого: молекулярном, клеточном и уровне целостного организма.
Параллельно с вопросами, изученными в упомянутых работах, в
ряде лабораторий исследованы «физические» и молекулярно-биоло-
гические механизмы пострадиационного восстановления и доказано,
что клетки мутантных бактерий, простейших, млекопитающих и рас-
растений восстанавливаются от летальных, сублетальных и мутационных
7. Механизмы гибели и процессы восстановления клеток 295
изменений. В многоклеточном организме восстановление клеток от по-
повреждений в разных органах и тканях также имеет свои особенности.
Так, наибольшей скоростью восстановления клеточного состава
обладают активно пролиферирующие ткани за счет репарации ство-
стволовых клеток, еще сохранивших свою жизнеспособность. Показана ко-
количественная зависимость ОБЭ от ЛПЭ разных видов ионизирующих
излучений, ОБЭ по зависимости между восстановлением хромосом и
понижением летального эффекта излучений, восстановлением генов и
выходом мутаций отдельных генов.
Весьма плодотворным в изучении механизмов радиационного по-
повреждения и пострадиационного восстановления оказались представ-
представления о важной роли кислорода в этих процессах, а также о модифици-
модифицирующем действии ряда радиопротекторов и радиосенсибилизаторов.
Наконец, все более актуальной становится необходимость учиты-
учитывать новые подходы к пониманию биофизических механизмов фор-
формирования радиационных эффектов — принимать в расчет принципы
системного ответа клетки на облучение: наряду с ролью деструк-
деструктивных процессов исследовать вклад в формирование радиационных
эффектов реакции систем репарации, контроля и регуляции, заложен-
заложенных в клетке.
Глава VII
БИОЛОГИЧЕСКИЕ ЭФФЕКТЫ МАЛЫХ ДОЗ
ИОНИЗИРУЮЩИХ ИЗЛУЧЕНИЙ.
ОТДАЛЕННЫЕ ПОСЛЕДСТВИЯ ОБЛУЧЕНИЙ
В предыдущих главах учебника основное внимание уделялось об-
облучению в таких дозах, которые приводили к инактивации молекул,
значительным проявлениям эффектов лучевого поражения и гибели
клеток. Однако не менее важной оказывается проблема биологиче-
биологических эффектов воздействия ионизирующих излучения низкой интен-
интенсивности в малых дозах, которая в последние годы стала особенно
актуальной и заняла доминирующее место в радиационной биофизике,
особенно в связи с интересом к радиоэкологическим проблемам.
Казалось бы простая, линейная экстраполяция от больших доз
к малым, вплоть до величины естественного радиационного фона
(рис. VII.2, пунктирная линия) могла бы легко решить вопрос о по-
последствиях слабых воздействий, механизм которых мог бы свестись к
одному лишь количественному понижению выраженности радиобио-
радиобиологических эффектов. Действительно, среди многих радиобиологов
существовала долгое время известная парадигма: «большие дозы об-
облучения вызывают большие повреждения, малые дозы — меньшие».
То, что это не так, следует из результатов ознакомления с эффектами
облучения организмов в малых, нелетальных дозах: открывается кар-
картина качественно иных радиобиологических явлений, не свойствен-
свойственных лучевым поражениям, инициируемым облучением в больших
дозах.
Для характеристики эффектов облучения биологических объектов
в малых дозах приведем данные, позволяющие сравнить эти эффекты
с характером поражающего действия больших доз при внешнем общем
однократном воздействии ионизирующих излучений.
1. Лучевые реакции многоклеточных организмов
1.1. От больших (летальных) доз облучения к малым
(нелетальным) дозам
Известно, что у многоклеточных организмов при остром облучении
в больших дозах гибель вызывается клеточным опустошением
«критических» органов и тканей. Опустошение происходит в
1. Лучевые реакции многоклеточных организмов
297
результате повреждения и гибели клеток тех «критических» органов и
тканей, которые первыми выходят из строя в исследуемом диапазоне
доз облучения, приводящих к лучевым синдромам. При внешнем
однократном общем облучении в очень больших дозах гибель
организмов происходит под лучом, при меньших дозах — через
различные интервалы времени.
В современной радиобиологической литературе достаточно подробно
изучено лучевое поражение критических органов у млекопитающих, облу-
облученных в больших дозах. Поэтому остановимся лишь на отдельных интере-
интересующих нас вопросах.
В зависимости от степени тяжести лучевой патологии причиной гибели
организма может стать «отказ» различных органов. Описаны следующие
основные лучевые синдромы, базирующиеся на органной патологии: кост-
костномозговой (кроветворный), кишечный и церебральный (ЦНС).
При этих лучевых синдромах обнаружена прямая зависимость морфоло-
морфологических и функциональных изменений критических систем от величины
поглощенных доз ионизирующей радиации, свидетельствующая о законо-
закономерной связи клеточного опустошения с клеточной кинетикой или радиа-
радиационной гибелью соответствующих критических органов и тканей много-
многоклеточных организмов.
На рис. VII. 1 представлены данные интегрального радиационного пока-
показателя — изменения средней продолжительности жизни облученных жи-
животных, полученные разными авторами в опытах на некоторых видах
млекопитающих.
Органы кроветворения относятся к наиболее радиочувствительным
критическим органам: поражение костного мозга, тимуса, лимфатических
узлов, селезенки представляет собой ведущее звено в развитии костно-
костномозгового (кроветворного) синдрома, вызванного внешним общим
50 д
20 д
10 д
5 Д
2 Д
1 Д
12 ч
6 ч
! \ 1
\
| h&
1
«..
1 1
- -о,
1
I I
i_ ) Т\
+1 1
t
\
1_. у-
\
¦""
N
•\ •
V
1,25 2,5
10
20 40 80
Дозы в Гр
160 320 640 1280
Рис. VII. 1. Зависимость средней продолжительности жизни животных от внеш-
внешнего общего однократного рентгеновского облучения в больших дозах (лучевые
синдромы). Сплошная линия — мыши, точечная (о) — крысы, пунктирная (+) —
морские свинки, штрих-пунктирная (•) — обезьяны
298 Гл. VII. Биологические эффекты малых доз излучений
однократным равномерным воздействием рентгеновского или 7-излучений
в дозах, близких к среднелеталъным B,5—3 Гр для человека, собаки и
свиньи, 4,5 Гр для морских свинок, 6-6,5 Гр для мышей и хомячков, 7,5 Гр
для кроликов). Наиболее важным результатом поражения этих органов,
приводящим к изменениям морфологического состава периферической кро-
крови, является клеточное опустошение перечисленных органов. Пострадиа-
Пострадиационные изменения числа клеток разного типа в периферической крови
у млекопитающих и человека являются зависимыми от дозы облучения,
многофазными во времени после радиационного воздействия и сходными
по форме характеризующих их кривых.
Выделяют 3 фазы изменений в клеточном составе крови: 1) ранняя
дегенеративная; 2) максимальное понижение числа клеток; 3) регенерация.
При более детальном анализе выявляется большее число фаз: 1) лаг-фаза,
характеризующаяся сохранением (или первоначальным повышением, как в
случае нейтрофилов) количества клеток по сравнению с исходным уровнем;
2) 1-го опустошения; 3) абортивного подъема; 4) повторного опустошения;
5) восстановления, или регенерации.
Выраженность и время проявления описанных фаз после облучения
зависят от поглощенной дозы ионизирующего излучения. После облучения
в низких и среднелетальных дозах глубина опустошения менее значительна,
а восстановление устойчиво. При смертельных дозах падение числа клеток
резкое, раннее, глубокое, восстановление хотя и может начаться, но не
завершается, так как наступает гибель.
В основе этих изменений лежат радиобиологические механизмы апопто-
за в процессе интерфазной (с максимумом через 6-8 часов после облучения)
и репродуктивной гибели клеток, а также связанное с задержкой прохожде-
прохождения клетками по циклу нарушение кинетики клеточных популяций в орга-
органах кроветворения (костном мозге, тимусе, селезенке), поддерживающих
клеточный гомеостаз в периферической крови.
В настоящее время общепринято предложенное В. Бондом, Т. Флидне-
ром и Д. Аршамбо распределение всех клеток системы крови и кроветворе-
кроветворения в зависимости от степени зрелости относить к следующим четырем
пулам: а) в костном мозгу это 1) стволовые клетки; 2) делящиеся-созреваю-
делящиеся-созревающие; 3) уже неделящиеся, но еще созревающие клетки; б) в периферической
крови — зрелые клетки.
Время пребывания клеток в каждом пуле до перехода в другой для
всех ростков кроветворения (направлений дифференцировки) определяется
цитокинетическими параметрами этих клеток и у животных разных видов
различно.
Наиболее радиочувствительными клетками являются стволовые: Do для
плюрипотентных стволовых клеток костного мозга мышей составляет око-
около 1 Гр, для предшественников гранулоцитарно-макрофагального ростка —
около 1,6 Гр. После облучения мышей в дозе 1,5 Гр выживает 10-20%, в
летальных дозах — 0,1-1% стволовых кроветворных клеток костного мозга.
По мере созревания радиочувствительность клеток понижается. Так,
клетки предшественники В-лимфоцитов мышей имеют Do, равную 0,89 Гр,
дифференцирующиеся клетки — 1,25 Гр, зрелые В-лимфоциты — 2,23 Гр.
Т-клетки в стадии дифференцировки имеют Do, равную 4,41 Гр, зрелые —
10,95 Гр.
Таким образом, после облучения больше всего гибнет стволовых клеток,
меньше — клеток следующих пулов, и вообще не погибают до отведенного
им природой обычного срока зрелые клетки периферической крови. Убыль
1. Лучевые реакции многоклеточных организмов 299
их в кровяном русле после облучения оказывается проявлением естествен-
естественного отмирания, она целиком зависит от равновесия между естественной
продолжительностью жизни клеток разного типа и темпом их восполнения
из кроветворных органов. Когда в результате облучения в органах кроветво-
кроветворения возникают Gi-, S-, G2- и М-блоки клеточного цикла и гибель клеток-
предшественников элементов крови, естественный «поток» клеточных эле-
элементов из центров кроветворения в кровяное русло «усыхает», равновесие
нарушается, смещается в сторону естественной клеточной убыли, и насту-
наступает клеточное опустошение.
В фазе восстановления длительность стадий клеточного цикла и пре-
пребывания клеток-предшественников в каждом пуле сокращается, благодаря
повышенному темпу деления новообразование клеток возрастает, восполне-
восполнение начинает превышать естественную клеточную убыль и происходит рез-
резкое увеличение содержания, восстановление числа клеток в крови, быстро
приближающееся к исходным (до облучения) значениям.
В целом большой вклад в изучение закономерностей клеточного опусто-
опустошения органов кроветворения и иммунитета при лучевом поражении внесли
исследования П. Д. Горизонтова и его учеников (Г. П. Груздев, О. И. Бело-
усова, М. И. Федотова) в 60—70-е годы прошлого столетия. Ими было уста-
установлено, что процесс клеточного опустошения указанных органов начина-
начинается уже в ближайшие часы после облучения. Он обусловлен при дозах
около 1 Гр миграцией, а при больших дозах — апоптозом клеток, линейно
зависит от дозы облучения и в костном мозге, тимусе, селезенке может
приводить к 50-90%-му понижению числа клеток.
Установлен значительный вклад в клеточное опустошение глюкокорти-
коид-зависимого апоптоза.
Гибель клеток лимфоидной ткани приводит к тому, что это освобождает
кроветворные стволовые клетки от существующего в норме ингибирующего
действия на их репродукцию со стороны отдельных фракций лимфоцитов.
Устранение ингибирующего влияния со стороны лимфоцитов становится
сигналом и условием постепенного восстановления численности клеток (ре-
популяции, регенерации) сначала в кроветворной и лимфоидной системе, а
затем в системе крови (А. М. Поверенный).
Исследование закономерностей и механизмов клеточного опустошения
кроветворных и лимфоидных органов, их связи, в частности, с феноменом
апоптоза, при параллельном изучении биохимическими методами позволило
установить дозовые и временные закономерности метаболических превра-
превращений (катаболизма) продуктов деградации хроматина (ДНК) при лучевом
поражении. Оказалось, что эти превращения являются радиобиологической
основой радиационного феномена дезоксинуклеозидурии — повышенной
экскреции дезоксинуклеозидов с мочой из облученного организма. Зако-
Закономерности проявления этого феномена в пострадиационный период (за-
(зависимости «доза-эффект» и «время-эффект») являются адекватным от-
отражением выраженности апоптоза среди облученных контингентов клеток
и закономерностей клеточного опустошения радиочувствительных органов
на уровне организма (В. К. Мазурик). При определенных условиях этот
феномен и присущие ему закономерности проявления рассматривались как
реальная биохимическая основа для разработки методов ранней диагно-
диагностики и дозиметрии острых лучевых поражений человека (Т. А. Федорова,
О. Я. Терещенко, В. К. Мазурик).
300 Гл. VII. Биологические эффекты малых доз излучений
Большой интерес в оценке костномозговой формы гибели живот-
животных представляют работы Е. И. Щербовой A984) по сопоставлению двух
критических тканей — кроветворной и сосудистой — у различных по
радиочувствительности видов млекопитающих. Обнаружено, что видовые
различия степени тяжести лучевого поражения зависят как от глубины
поражения гемопоэза — исходной численности пула стволовых клеток
кроветворения, выраженности гибели костномозговых клеток делящегося-
созревающего пула, высоты и продолжительности абортивного подъема
нейтрофилов периферической крови и т.д., так и от времени наступления
процесса восстановления. Характерно, что у радиочувствительных видов
млекопитающих геморрагия, развивающаяся вследствие гибели клеток-
предшественников тромбоцитов, зависит не только от тромбоцитопении, но
в значительно большей степени (по сравнению с радиорезистентными
видами) от непосредственного поражения эндотелиальных клеток
кровеносных сосудов (Воробьев, Степанов, 1985).
При кишечном синдроме, развивающемся после облучения в дозах
от 8-10 до 10-15 Гр, подавление обновления клеток в криптах и ворсинках
кишечника наблюдается в более ранний период, чем полное подавление
обновления клеток в кроветворных органах. Через трое суток после облуче-
облучения происходит почти полное исчезновение эпителиоцитов и бокаловидных
клеток (Расина и др., 1977).
Высокая радиочувствительность стволовых клеток кишечного эпите-
эпителия и связанные с нею уровень содержания и морфофункциональное состо-
состояние эпителиоцитов являются определяющими в формировании кишечного
синдрома. Отмечается возрастание уровня содержания в ткани перекисных
соединений, активности ферментов протеолиза и автолиза, оказывающее
общетоксическое действие на организм (Нестеренко, Паршков, 1982).
После общего облучения мышей в дозах, вызывающих кишечный луче-
лучевой синдром, создаются условия, при которых эпителиального покрытия ки-
кишечника и желудка уже недостаточно для поддержания жизни организма, в
результате этого все животные погибают на 3-5-ые сутки. Так называемая
«кишечная гибель» животных наступает при резком снижении в слизистой
оболочке кишечника содержания крипт, ворсинок (более чем вдвое), а также
в особенности стволовых клеток. В результате оголения эпителиального
покрытия фатальными оказываются быстро развивающаяся инфекция ки-
кишечной микрофлоры, поражение сосудов и др. (Федоровский, 1976; Яр-
моненко, 1984). В конечном счете тяжесть лучевого поражения эпителия
тонкого кишечника, смертность от кишечной формы лучевой болезни (как и
в случае кроветворного синдрома в результате поражения гемопоэтической
системы) во многом определяется уровнем выживаемости соответствующих
стволовых клеток (Коноплянникова, Коноплянников, 1984).
Центральная нервная система — морфологически наиболее радиоре-
радиорезистентная критическая система. Зрелая нервная ткань состоит из непроли-
ферирующих высокодифференцированных клеток, не способных замещать-
замещаться в организме.
Церебральный синдром наиболее четко начинает проявляться у мле-
млекопитающих при возрастании дозы общего облучения от 10—15 Гр до 200
и более Гр. После некоторого латентного периода у животных возникают
двигательные нарушения, появляются судороги, и они погибают в коме.
После облучения в сверхвысоких дозах (более 100-150 Гр) сразу после
облучения у животных возникают двигательное возбуждение, нарушения
1. Лучевые реакции многоклеточных организмов 301
координации движений, клонические судороги. Затем наступает общая за-
заторможенность (вялость, пониженная реакция на болевые раздражители),
длящаяся около одних суток. За несколько часов до гибели развивается
повторное возбуждение, но в более резкой форме, более глубокие нарушения
координации движения и судороги типа тонических.
Время наступления симпотомов обратно пропорционально дозе облуче-
облучения, а величины доз, вызывающих церебральный синдром, у разных видов
животных имеют значительные различия. Подобно кроветворному и кишеч-
кишечному синдромам, формирующимся вследствие функциональной и морфо-
морфологической инактивации клеточных элементов соответствующих органов,
церебральный синдром формируется на основе радиационного поражения
клеточных элементов центральной нервной системы и неспособности нейро-
нейронов обеспечивать синаптическую нейропередачу из-за нарушения функций
нейронов головного мозга, обусловленной дезинтеграцией синаптических
и других клеточных мембран (Лаврова и др., 1983). При сопоставлении
эффектов локального облучения головы и общего облучения обнаружено,
что гибель крыс от церебрального синдрома является в основном систем-
системным ответом всего организма, а не только следствием непосредственного
действия излучения на ткань головного мозга. У более крупных животных
таких видов, как собаки и обезьяны, церебральный синдром может быть
вызван облучением только области головы при экранировании остальной
части тела. На облучение организма в массированных дозах мозг реаги-
реагирует как единый многотканевой орган: прямые поражения нейронных
структур и расстройства циркуляции, связанные с поражением стенок
кровеносных сосудов, обычно сопутствуют друг другу (Воробьев, Сте-
Степанов, 1985).
При гистологическом исследовании головного мозга животных с прояв-
проявлениями церебрального синдрома в ткани этого органа наблюдаются мно-
многочисленные пикнотические нервные клетки, периваскулярные инфильтра-
инфильтрации, явления воспаления мозговых оболочек и отек. Гибель нейронов обна-
обнаруживается обычно после облучения в сверхвысоких дозах (свыше 100 Гр),
относится к интерфазному типу и обусловлена как радиационным повре-
повреждением этих клеток, так и компрессией их вследствие повышения внутри-
внутричерепного давления.
Тщательные исследования позволили установить у крыс и мышей так
называемую переходную (от кишечного к церебральному синдрому) форму
острой лучевой болезни (характерную и для других видов млекопитающих)
в диапазоне доз общего облучения от 15 до 20 Гр 7-квантов. Эта переходная
форма подобна токсемической, которую объясняют интоксикацией орга-
организма продуктами распада облученных тканей в клинике острой лучевой
болезни человека (Гуськова, Байсоголов, 1971).
При этой форме поражения, помимо явлений поражения кишечника,
наблюдаются застойное полнокровие печени, селезенки, головного мозга, а
также множественные кровоизлияния в легкие и почки.
К числу причин нарушения функции нервной системы и гибели облу-
облученных животных от шокоподобного состояния относят нарушение гемоди-
гемодинамики центрального происхождения, а также отек мозга.
Таким образом, характер лучевых синдромов, возникающих у живот-
животных, определяется дозовыми характеристиками облучения и динамикой
процессов поражения и восстановления. Развитие костномозгового и ки-
кишечного синдромов определяется кинетикой клеточного опустошения кри-
критических органов: соответственно кроветворной системы и кишечника.
302 Гл. VII. Биологические эффекты малых доз излучений
Церебральный синдром является следствием функциональной инактивации
и гибели нервных клеток. При этом неделящиеся или медленно делящиеся
дифференцированные радиорезистентные клетки других критических ор-
органов взрослого организма погибают в интерфазе путем апоптоза, а по мере
увеличения доз облучения в диапазоне сверхвысоких — во все большем
количестве по некротическому механизму гибели (Окада, 1974; Хансон,
Комар, 1985).
В последнее время подчеркивается взаимосвязь между мерой диффе-
дифференцированно сти клеток и их чувствительностью к действию излучений
(Филиппович и др., 1985; Эйдус, 2001). Так, апоптоз и некротическая гибель
клеток в облученном организме рассматриваются в связи с развитием про-
процессов клеточной дифференцировки. В первом случае излучение оказывает
влияние на скорость клеточного деления, во втором — на процесс самой
дифференцировки. Известны примеры изменения после облучения скорости
и направления клеточной дифференцировки (в стволовых кроветворных
клетках), упорядоченности расположения клеток (нейронам головного моз-
мозга) и др.
Пострадиационное клеточное опустошение различных критических ор-
органов, обусловленное нарушением кинетики клеточных популяций, гибе-
гибелью и элиминацией погибших клеток, происходит не только в результате
непосредственного поглощения энергии излучений критическим органом
или тканью, но зависит от функционального состояния этих образований в
момент поражения, от эндогенного фона резистентности, нервно-гумораль-
нервно-гуморальных, клеточно-регуляторных и других процессов, связывающих критиче-
критические и «менее критические» структуры между собой (Акоев и др., 1972;
Кудряшов, 1966, 1987, 2001; Гончаренко, Кудряшов, 1980, 1998; Бурлакова,
Мазурик, Михайлов, 2001). Важную роль в поражении критических струк-
структур играют «дистанционные эффекты», «лучевой токсический эффект»,
нарушения окислительно-восстановительного гомеостаза. Однако эти ме-
механизмы еще недостаточно изучены для оценки их количественного вклада
в тот или иной конкретный лучевой синдром. Это связано не столько с
недостаточностью знаний о лучевых нарушениях регуляторных механизмов
или о развитии токсических процессов в организме, сколько с тем, что
прямой перенос известных молекулярных нарушений на события, происхо-
происходящие в более сложных системах — в организме, пока еще методологически
затруднен. Кроме того, все еще нет достаточной ясности в вопросе о
количественном соотношении прямого или опосредованного (косвенного)
действия излучений на исследуемые структуры.
Для млекопитающих и человека смертельными дозами считаются
такие, при которых после острого или пролонгированного облучения
часть популяции организмов погибает в течение 30 (животные) или
45 суток (человек).
При переходе к облучению в малых дозах последовательное сни-
снижение дозы уже не приводит к преждевременной гибели организмов,
однако повреждение (или изменение) тех или иных органов и тканей
или проявления лучевой патологии могут быть обнаружены по раз-
различным биологическим и медицинским показателям.
1. Лучевые реакции многоклеточных организмов 303
РР
I
Рис. VII.2. Биологические эффекты облучения организмов в сублетальных дозах.
ЕРФ — «ультрамалые дозы» естественного (природного) радиационного фона;
I — эффекты облучения в «сверхмалых» дозах, феномен гиперрадиочувстви-
гиперрадиочувствительности; II — эффекты облучения в малых дозах, вызывающих стимуляцию
биологических процессов — гормезис; III — развитие структурно-функциональных
повреждений при облучении в «средних сублетальных» дозах; IV — условная
граница между «большими» и «средними» дозами для млекопитающих состав-
составляет ~ 1-2,5 Гр. Пунктиром обозначена линейная экстраполяция из области
больших доз
Оценивая биологические последствия (эффекты) облучения орга-
организмов, удобно делить их на летальные, возникающие в результате
действия излучений в больших дозах, и нелетальные (сублетальные),
инициируемые воздействием ионизирующих излучений в малых и
средних дозах. В отличие от эффектов острого облучения в леталь-
летальных дозах, биологический ответ на облучение в нелетальных дозах,
оцениваемый по субклиническим показателям, имеет немонотонный
характер, при графическом описании — S-образный вид. В опреде-
определенном диапазоне доз наблюдаются эффекты стимуляции, а не по-
повреждения или угнетения таких процессов как, например, клеточное
деление, рост и развитие организмов. На рис. VII.2 представлена схе-
схема последовательной смены эффектов, вызываемых внешним общим
однократным облучением организмов в сублетальных дозах.
Следует отметить, что экспериментальные факты о фазовой, немо-
немонотонной зависимости биологических эффектов от дозы облучения в
диапазоне малых доз противоречат линейной концепции, официально
принятой еще в 1978 г. Международной комиссией МКРЗ и НКДАР
304 Гл. VII. Биологические эффекты малых доз излучений
ООН*). На рис. VII.2 пунктиром обозначена экстраполяция из обла-
области больших доз, осуществленная исходя из упомянутой гипотетиче-
гипотетической линейной концепции. Видно явное расхождение теоретической
зависимости «малые дозы—гипотетический линейный ответ» с ре-
реальными фактами синусоидальной зависимости ответа биологических
объектов и систем на облучение в малых дозах.
Понятно, что отмеченные в схеме и таблице эффекты облучения в
малых дозах не могут служить для точного количественного опреде-
определения величины «дозы», а являются только иллюстрацией ответной
реакции биологических объектов на облучение.
Численные физические величины диапазона малых доз для разных
организмов при таком определении могут сильно различаться. Для
млекопитающих, например, условная граница между летальными и
сублетальными дозами лежит в области 1—2,5 Гр при внешнем об-
общем однократном облучении (ср. рис. VII. 1 и VII.2). Для других
таксономических групп организмов, в зависимости от различий их
радиочувствительности, эта граница может значительно отличаться
(даже на несколько порядков) от упомянутой. Однако нелинейная
зависимость радиобиологических изменений от величины дозы облу-
облучения и времени после облучения — характерный признак динамики
эффектов облучения в малых дозах. К такому выводу пришли многие
радиобиологи, особенно в последнее десятилетие, используя физиоло-
физиологические, биохимические и цитогенетические методы.
Обобщение большого экспериментального материала показало, что
многочисленные и самые разнообразные биологические параметры
клеток и тканей животных, хронически облученных в малых до-
дозах, обнаруживают нелинейный, немонотонный характер зависимо-
зависимостей «время—эффект» и «доза—эффект» и что фазовые изменения
метаболизма как функции времени и дозы — это общебиологическое
явление, отражающее включение различных путей поддержания го-
меостаза. Так, по мнению И. К. Коломийцевой A999-2003) немоно-
немонотонность кривых «доза-эффект» является результатом нелинейной
зависимости «время-эффект». В фиксированной временной точке за-
зависимость «доза—эффект» может принимать немонотонный характер.
При этом наблюдаются обратные отношения проявлений эффекта от
дозы. При изменении дозы радиации меняются как амплитуда, так и
период колебаний.
Как видно из схемы, для наиболее высоких значений сублетальных
доз (рис. VII.2, III) еще существует прямая зависимость ответа (разме-
(размера повреждения) от величины дозы облучения. Можно выделить этот
участок кривой в область «средних сублетальных» доз (или иначе —
«промежуточных» — между большими и малыми дозами облучения)
*) Публикации МКРЗ (Международной комиссии по радиационной
защите, основанной в 1928 г. в Стокгольме) № 26, 1978 и НКДАР (Науч-
(Научного комитета по действию атомной радиации Организации Объединенных
Наций, учрежденного 3 декабря 1955 г.).
1. Лучевые реакции многоклеточных организмов 305
(рис. VII.2, III). Остальная, немонотонная часть кривой, относится к
малым дозам. Она имеет два противоположно направленных максиму-
максимума: собственно малые дозы (рис. VII.2, II), вызывающие «гормезис» —
стимуляцию жизненных процессов (табл. VII.1), и «сверхмалые» до-
дозы — всплеск повреждений, соответствующий эффекту гиперрадио-
гиперрадиочувствительности (рис. VII.2, I).
Естественный радиационный фон (ЕРФ) изображен на схеме в ка-
качестве начальной точки отсчета радиобиологических изменений. Его
биологическая роль источника излучения с ультрамалыми мощностя-
мощностями доз ранее вообще не принималась во внимание, так как оказалась
сложной корректная постановка биологического эксперимента со зна-
значительным снижением уровня фона природной радиации.
1.2. Характеристика биологических эффектов облучения в
малых дозах
1.2.1. Значение ультрамалых мощностей доз естественного
радиационного фона
Вопрос о том, какое значение для жизни на нашей планете име-
имеет постоянное действие излучений с ультрамалыми мощностями доз
A0-15 мкР/час) или облучения (~ 1 мЗв/год) за счет естественного
(природного) радиационного фона, долгое время оставался не изучен-
изученным. На основе экстраполяции от больших, летальных доз к фоновым
строились лишь предположения (рис. VII. 1, пунктирная линия), что
ЕРФ представляет собой низший уровень наносимого ионизирующими
излучениями организму вреда, такого как спонтанная заболеваемость
раком, наследственные и другие болезни, встречающиеся обычно без
дополнительного облучения.
Первые эксперименты по выяснению биологического значения
ЕРФ были поставлены только в 1965 г. Изучая скорость размножения
парамеций при экранировании их от ЕРФ свинцом*), X. Планель
обнаружил, что снижение фона природной радиации приводит не к
улучшению, а наоборот к ухудшению развития клеточных культур и
замедлению скорости деления клеток. На следующий год X. Планель
доложил о своих экспериментах на III Международном конгрессе по
радиационным исследованиям в Кортина д'Ампеццо и опубликовал
данные, выводы из которых с трудом воспринимались научной обще-
общественностью.
Затем, в 60-70 годах появились новые работы X. Планеля, а также
А. М. Кузина, А. А. Козлова, Т. Д. Люкки и др., показавших, что сни-
снижение внешнего ЕРФ (космического и Земного) замедляет скорость
деления одиночных клеток (простейших, водорослей, культуры кле-
клеток), эмбриональное развитие насекомых, рост и развитие растений
*) Экранирование производилось в свинцовых камерах со стенками
толщиной 10 см, снижающими ЕРФ в 20 раз.
20 Ю. Б. Кудряшов
306 Гл. VII. Биологические эффекты малых доз излучений
и животных. В дальнейшем стали применяться подземные термоста-
тируемые железобетонные камеры — бункеры. Радиобиологические
исследования в таких бункерах подтвердили выводы о положительной
роли ЕРФ в жизнедеятельности организмов.
Внесение в камеры солей урана, излучение которого восстанавли-
восстанавливало ЕРФ, при сохранении всех других условий полностью снимало
эффект угнетения развития организмов.
Однако при одном только экранировании организмов от действия
внешнего ЕРФ наблюдалось все же незначительное снижение жизне-
жизнеспособности организмов (в 1,2-1,5 раз), поскольку при такой поста-
постановке экспериментов оставалось еще внутреннее облучение, главным
образом, за счет эндогенного радионуклида*) 40К. Только в 80-90 го-
годах начали проводить эксперименты на высших растениях и живот-
животных с использованием их экранирования в сочетании с удалением
радона из воздуха и заменой в организме при поступлении с пищей
радиоактивного калия на стабильный. При такой защите организмов
от внешнего и внутреннего ЕРФ мощность природного облучения
резко падала и происходило значительное, более чем вдвое, угнетение
жизненных процессов.
С 1977 по 2002 г. опубликовано 5 монографий А. М. Кузина, в кото-
которых обобщен большой фактический материал собственных исследова-
исследований автора и мировой литературы, дан его последовательный анализ
и сформулирована идея о роли ЕРФ для жизнедеятельности живых
организмов. Автор пришел к выводу, что ЕРФ не только не вреден
для биоты, а необходим для ее существования на нашей планете.
Открытие жизненно важной необходимости непрерывного облуче-
облучения организмов от источников природной ионизирующей радиации в
ультрамалых дозах поставило перед радиобиологами задачу выясне-
выяснения биофизического механизма этой зависимости.
Незадолго до своей кончины A.M. Кузин выдвинул концепцию
о роли ЕРФ в формировании «вторичного биогенного излучения»,
представляющего собой когерентное, очень слабое по интенсивно-
интенсивности ультрафиолетовое излучение, характерной особенностью кото-
которого является стимуляция митозов, клеточного деления, образо-
образования «внутреннего радиационного поля». При обосновании этой
концепции он опирался на периодически утверждавшиеся в биофизи-
биофизической литературе теории: биологического поля и митогенетических
лучей А. Г. Гурвича A932, 1934); внутри- и внеклеточных эффектов
сверхслабого когерентного электромагнитного излучения В. П. Казна-
чеева и Л. П. Михайловой A981); клеточного биофотонного излучения
Ф.Попа A989).
*) Известно, что эндогенный уровень радиоактивности калия в десятки
раз превышает внутреннюю радиоактивность клеток и тканей организма,
инициируемую другими эндогенными природными радионуклидами.
1. Лучевые реакции многоклеточных организмов 307
Особый интерес представляют исследования в этом направле-
направлении Б.Н.Тарусова и его школы, посвященные «сверхслабому свече-
свечению», испускаемому любыми живыми клетками (Ю. А. Владимиров,
Ф.Ф. Литвин, 1959; В. А. Веселовский, 1965; Б.Н.Тарусов, И.И.Ива-
И.И.Иванов, Ю. М. Петрусевич, 1967 и др.). Ими обнаружено, что измерение
сверхслабого свечения — биоэлектрохемилюминесценции — открывает
широкие возможности оценки физиологического и физико-химическо-
физико-химического статуса клетки в норме и на различных стадиях стрессовых состо-
состояний организма и является важнейшим способом получения инфор-
информации об изменениях окислительно-восстановительного равновесия
в биологических системах.
Концепции биологической значимости поглощения энергии ЕРФ
и вторичного спонтанного испускания излучений живыми системами
являются важным шагом в расширении радиационно-биофизических
представлений и нуждаются в дальнейшем развитии на основе экспе-
экспериментальных исследований.
1.2.2. Эффект воздействия излучений в сверхмалых дозах.
Гиперрадиочувствительность
В конце прошлого столетия появились сообщения о том, что од-
однократное облучение клеток млекопитающих в сверхмалых дозах —
от исходной «нулевой» отметки ЕРФ до ~ 5-20 сГр, вызывает у них
так называемый эффект гиперрадиочувствительности (рис. VII.2,1),
оцениваемой по биохимическим (нарушение окислительно-восстано-
окислительно-восстановительного гомеостаза) и цитогенетическим показателям (аберрации
хромосом, выход клеток с микроядрами, злокачественная трансфор-
трансформация и др. прецизионные показатели), имеющим при больших дозах
облучения связь с выживаемостью клеток.
В настоящее время этот феномен показан более чем на трех десят-
десятках линий клеток млекопитающих, а также в опытах на многоклеточ-
многоклеточных организмах.
В качестве одного из примеров гиперрадиочувствительности, про-
проявляющейся в тканях облученных организмов, можно привести дан-
данные из работ Е. Б. Бурлаковой. Автором этих исследований обнару-
обнаружено, что уже при незначительном (на 1-3 порядка) превышении
ЕРФ при общем однократном облучении в диапазоне сверхмалых
доз наблюдается характерный «колоколобразный» по форме кривой
всплеск оксидативных изменений в липидах.
Обнаруженное изменение получило название эффекта сверхмалых
доз или «эффекта колокола». Показано, что в основе его лежат
нарушения конкурентных отношений между про- и антиоксиданта-
ми в окислительно-восстановительном гомеостазе, возникающие при
облучении в сверхмалых дозах в клетках и тканях животных и расте-
растений, одиночных клетках и биологических мембранах. Эти изменения
наблюдаются как при кратковременном, так и пролонгированном об-
облучении в сверхмалых дозах.
20*
308 Гл. VII. Биологические эффекты малых доз излучений
Так, у мышей после общего хронического внешнего воздействия гу-
излучения (мощность дозы 0,6 мГр/сут) установлены статистически
достоверные изменения уровня содержания в надпочечниках адрена-
адреналина и кортикостероидов: возрастание на 1/3 при дозе 0,6 мГр, возвра-
возвращение к норме после облучения в дозе 1,2 мГр и начало падения ниже
нормы уже при воздействии в дозах 2,4—5,4 мГр (Е. Н. Гончаренко и
соавт., 2000).
В последние годы появились работы, позволяющие более полно
характеризовать природу «эффекта колокола» в организмах, облучен-
облученных в сверхмалых дозах: наблюдаемые изменения уровней содержа-
содержания АФК, ППОЛ и АО у животных, облученных в сверхмалых дозах,
характерны для неспецифических реакций живых систем на слабые
воздействия.
Таким образом, изменения внутриклеточных структур, а также
содержания биологически активных веществ, участвующих в механиз-
механизмах реализации первичных реакций оксидативного стресса, наблюда-
наблюдаются после облучения в очень незначительных по величине дозах и
отражают асинхронность конкурентных процессов повреждения и
репарации, окисления и восстановления.
1.2.3. Радиационный гормезис
Еще в конце XIX века было известно, что ряд химических соединений
оказывает стимулирующий эффект на рост и развитие микроорганизмов,
грибов, водорослей, растений. Впоследствии это явление было обнаружено
на самых разнообразных биологических объектах. Термин «гормезис» впер-
впервые появился в научных публикациях в 1942 г. при описании стимуляции
клеточного деления и роста грибка под влиянием антибиотика в малых
концентрациях, тогда как в больших концентрациях антибиотик оказывал
угнетающее действие. Таким образом, гормезис — это неспецифический
эффект воздействий на живые организмы в малых дозах (концентраци-
(концентрациях), вызывающих изменения, диаметрально противоположные поврежда-
повреждающим эффектам при воздействии в больших дозах.
Анализ характеристических показателей гормезиса для разнообразных
химических веществ показал, что вызываемый последними эффект имеет
пределы выраженности: высота стимуляции в максимуме обычно не превос-
превосходит 130-160% от контроля, а верхний предел дозы или концентрации, при
которой еще наблюдается гормезис, обычно не превышает более, чем в 10—
20 раз минимальные значения дозы (концентрации), при которых эффект
стимуляции возникает (Кейлабрезе и Болдуин, 1999).
Вскоре после открытия ионизирующего излучения Рентгеном ста-
стали появляться отдельные сообщения, в которых наряду с поража-
поражающим действием больших доз радиации иногда обнаруживались и
стимулирующие эффекты при облучении биологических объектов в
малых дозах. Однако эти сообщения были немногочисленны, и основ-
основное внимание радиобиологических работ было приковано к поража-
поражающему действию ионизирующих излучений. Беспороговая линейная
концепция, предполагающая опасность любого, даже самого малого
превышения естественного радиационного фона, была положена в
1. Лучевые реакции многоклеточных организмов
309
основу рекомендаций МКРЗ. Мы уже отмечали, что эта парадиг-
парадигма не выдержала проверки временем. В 1980 г. вышла монография
Т. Д. Л юкки, в которой автор обобщил данные литературы и привел
собственные эксперименты о биологическом эффекте ионизирующих
излучений в малых дозах, которые в отличие от воздействия в боль-
больших, повреждающих дозах оказывают диаметрально противополож-
противоположное, «благоприятное», стимулирующее действие на рост, развитие и
жизнедеятельность клеток и многоклеточных организмов. Такие от-
ответные реакции на облучение в малых дозах были объединены авто-
автором под названием «радиационный гормезис».
Стало очевидным, что гормезисные эффекты, производимые ради-
радиацией в малых дозах, характеризуются теми же свойствами и теми же
характеристическими параметрами описывающих их графиков, что
и при химическом гормезисе. Это является еще одним доказатель-
доказательством проявления неспецифической защитной реакции организмов и
клеток на лучевые воздействия. Реальность радиационного гормезиса
нашла подтверждение в многочисленных исследованиях, результаты
которых показали, что облучение в малых дозах вызывает неспеци-
неспецифический ответ, а одно из проявлений его — гормезис — аналогичен
стадии адаптации стрессовой реакции.
В качестве иллюстрации проявлений гормезиса приведем
табл. VII.1, составленную А.М.Кузиным A989), с нашими дополне-
Таблица VII. 1. Примеры сравнения биологических эффектов действия иони-
ионизирующих излучений в больших и малых дозах
Объект
исследования
парамеции,
фито- и
зоопланктон,
дрожжи, клетки
в культуре
семена,
растения
эмбрионы
насекомых и
птиц
насекомые,
птицы, рыбы,
млекопитающие
животные,
человек
Критерий
действия
радиации
скорости
деления
клеток, роста
популяции,
синтеза ДНК
всхожесть
семян, рост,
развитие
растений
рост и
развитие
плодовитость
иммунитет
Результат действия
радиации в дозах
больших
понижение,
вплоть до
полного
прекращения
процесса
задержка,
прекращение
задержка,
прекращение
падение
угнетение
малых,
вызывающих
гормезис
возрастание
стимуляция
стимуляция
возрастание
активация
310
Гл. VII. Биологические эффекты малых доз излучений
ниями. Как видно из таблицы, эффект гормезиса обнаруживается на
разных уровнях организации живых систем и проявляется событиями,
противоположными наблюдаемым при больших дозах.
В связи с резким различием видовой радиочувствительности аб-
абсолютные величины диапазона малых доз для разных биологиче-
биологических объектов, как уже отмечалось, сильно отличаются. По расчетам
A.M. Кузина, область малых доз, вызывающих гормезис, лежит, как
правило, ниже полулетальных доз LD$q на один-два порядка при
внешнем общем однократном облучении. Например, для человека и
ряда млекопитающих LD^q составляют 4—5 Гр. Поэтому дозы для них
от 0,4-0,5 Гр и ниже могут быть отнесены к малым. Полулетальная
доза для многих семян растений существенно выше и находится в диа-
диапазоне 200—500 Гр. Следовательно область малых доз для них имеет
верхнюю границу, характеризуемую уже более высокими величинами,
т. е. 2-5 Гр.
1.3. Некоторые особенности действия радиации в нелетальных
дозах
В отличие от действия ионизирующих излучений в больших
дозах, облучение в малых, нелетальных дозах в определенных
диапазонах обладает способностью вызывать «индуцированную ре-
резистентность» — повышение устойчивости биологических объектов
к экстремальным радиационным воздействиям, в результате чего
обнаруживается обратная зависимость биологических изменений от
мощности доз облучения (табл. VII.2).
Таблица VII.2. Особенности действия ионизирующей радиации в нелетальных
(малых и средних) дозах в сравнении с действием в больших, летальных дозах на
одиночные клетки, растения и животных
Критерий
действия
радиации
устойчивость к
повторному
облучению в
большой дозе (D2)
эффективность
мощности дозы
облучения
Результат действия радиации
больших дозах
понижается
прямая
зависимость
радиобиологиче-
радиобиологического ответа от
мощности дозы
облучения
в малых и средних дозах
возрастает
(радиоадаптивный ответ)
более эффективно
пролонгированное или
хроническое облучение с
малой мощностью дозы
по сравнению с большой
мощностью (непрямая
зависимость
радиобиологического
ответа от мощности доз)
1. Лучевые реакции многоклеточных организмов 311
1.3.1. Радиационно-индуцированный адаптивный ответ
Радиационно-индуцированный адаптивный ответ («радиоадаптив-
(«радиоадаптивный ответ») — это реакция биологических объектов, которая заклю-
заключается в том, что после действия излучения в малых, адаптирующих
дозах D\ при повторном облучении через определенный интервал вре-
времени в больших, проявляющих дозах D^ радиобиологический эффект
от дозы D2 понижается, иными словами, облучение в малой дозе в
определенном интервале доз способно вызывать состояние повышен-
повышенной радиоустойчивости (табл. VII.2).
Особенностью радиоадаптивного ответа обычно являются много-
многократные различия в величинах адаптирующей D\ и проявляющей D^
доз облучения, а также фиксированные интервалы времени между
двумя экспозициями (например, для мышей и крыс — две недели, а
для клеток млекопитающих — 4-6 часов).
Эти параметры подвержены колебаниям в зависимости от объекта ис-
исследований, условий облучения и выбранного радиобиологического теста.
Обязательное соблюдение интервала времени между облучениями в
дозах D\ и D2 указывает на то, что программа переключения клеток
на адаптивный ответ требует сравнительно продолжительной перестройки
радиорезистентности, которая может сохраняться в течение многих клеточ-
клеточных циклов. Так, если экспозиция адаптивного ответа на клеточном уровне
обычно требует 4—6 часов, то сохраняться ответ может несколько часов,
суток, месяцев.
Последний феномен позволяет говорить о двух возможных способах
реализации адаптирующих воздействий:
- включение новой генетической программы,
- индуцированные радиацией синтез белков и мобилизация антиокис-
антиокислителей, т. е. эндогенных защитных ресурсов клетки, в количествах,
способных поддерживать состояние готовности к адаптивному ответу
в течение нескольких клеточных поколений.
Так, было обнаружено, что через 4-6 часов после воздействия 7-излуче-
7-излучения в адаптирующих дозах в лимфоцитах человека появляются вновь син-
синтезированные белки, которые могут быть кандидатами на роль адаптивных
белков. Известно также, что уже вскоре после действия ионизирующих из-
излучений в адаптирующих дозах в клетке происходит накопление антиокис-
антиокислителей-ад аптогенов, выполняющих функцию противолучевых средств.
Радиоадаптивный ответ обнаружен при облучении растительных
и животных организмов, а также в опытах на лимфоцитах человека,
мыши и кролика, фибробластах китайского хомячка, клетках кост-
костного мозга и сперматоцитах мышей. При адаптивном ответе можно
достичь 50—60% снижения количества генных, хромосомных мутаций
или других нарушений генома, а также иных проявлений повреждения
биологических объектов. Наиболее общим, интегральным критерием
адаптивного ответа в опытах на животных является изменение их
выживаемости после повторного, проявляющего воздействия рентге-
рентгеновского или 7-из лучения.
312
Гл. VII. Биологические эффекты малых доз излучений
0 30-
1 25-
и
м 15-
0,15 0,5 1,0 2,0
Адаптирующие дозы D\, Гр
Рис. VII.3. Влияние предварительного облучения в адаптирующей дозе D\ на вы-
выживаемость мышей после повторного (через 14 суток) облучения в проявляющей
дозе 6 Гр
На рис. VII.3 представлен один из примеров радиоадаптивного
ответа лабораторных животных на действие облучения в однократных
малых и средних дозах D\ (по М.Д.Померанцевой и Л.Х.Рамайя,
1962). Из рисунка видно, что облучение мышей в нелетальных для них
дозах от 0,5 до 2,5 Гр способно увеличивать выживаемость животных
до 25- 30% после воздействия в повторной дозе D2 = б Гр (эта доза —
абсолютно летальная при однократном облучении, т. е. выживаемость
при ней равна 0). Двухнедельный интервал между двумя облучениями
(р\ и D2) оказывается оптимальным для выявления данного радио-
радиоадаптивного ответа.
В опытах на клетках критериями для выявления радиоадаптивной
реакции обычно служат разрывы ДНК, аберрации хромосом, мута-
мутации, выход микроядер, нарушения окислительно-восстановительного
гомеостаза и проницаемости биологических мембран, а также выжива-
выживаемость клеток. Радиоадаптивный ответ наблюдается при воздействии
на клетки рентгеновского и 7-излучения , а также /^-частиц различных
энергий от инкорпорированных изотопов 3Н, 14С и 32Р.
Способность ионизирующих излучений к формированию адаптив-
адаптивного ответа зависит не только от величины дозы облучения,но и от ее
мощности. При сравнительно больших дозах необходима невысокая
ее мощность, и наоборот. Так, для многих типов клеток установлена
связь между адаптирующей дозой D\ и ее мощностью ——^ при ин-
dt
дукции клеточной реакции адаптивного ответа:
D\——^ = const. (VII.1)
dt
Следует отметить, что способность к реакции адаптивного ответа обна-
обнаружена не у всех клеток. Доля случаев, когда не удается обнаружить этот
ответ, возрастает для популяций, находящихся в условиях с повышенным
радиационным фоном, а также при патологиях, в том числе наследственных
1. Лучевые реакции многоклеточных организмов
313
(И. И. Пелевина и др., 2000). Имеются также сведения о пониженной частоте
адаптивного ответа у детей. Вместе с тем, не совсем ясно, является ли от-
отсутствие реакции адаптивного ответа в этих случаях абсолютным, или этот
феномен обусловлен тем, что в данных клетках адаптирующее воздействие
по тем или иным причинам уже было реализовано.
В последнее время показано (А. Н. Котеров, И.В.Филиппович,
2002), что повышение радиорезистентности происходит не только по-
после однократных Di, но и после хронических, а также дробных лу-
лучевых воздействий, которые по суммарной величине адаптирующей
дозы могут приближаться к соответствующим параметрам однократ-
однократного облучения D2. При этом интервалы времени между D\ и D^ мо-
могут значительно варьировать в зависимости от условий эксперимента.
Обнаружено также, что не только ионизирующие излучения в ма-
малых дозах, но и другие физические или химические воздействия низ-
низкой интенсивности способны отсроченно вызывать повышение устой-
устойчивости биологических объектов к последующему, более сильному,
экстремальному действию, т. е. можно говорить о существовании более
общего феномена адаптивного ответа.
Все это еще раз подтверждает вывод о неспецифическом, стрессо-
стрессовом характере эффектов действия малых доз ионизирующих излуче-
излучений.
1.3.2. Зависимость наблюдаемых изменений от мощности дозы
излучения. Эффект Петко
Известно, что характер и интенсивность радиобиологических отве-
ответов организмов на действие ионизирующих излучений зависят не толь-
только от величины, но и от мощности дозы облучения. Для больших
доз излучения характерна прямая зависимость лучевого поражения
от мощности дозы. Так, например, из приведенной табл. VII.3 видно,
что увеличение мощности («скорости получения») дозы излучения
на два-три порядка вызывает возрастание поражающего эффекта бо-
более, чем в три раза. Поэтому для осуществления одного и того же
биологического ответа E0%-го выживания) при остром облучении
Таблица VII.3. Влияние мощности дозы 7~излучения при однократном внеш-
внешнем общем воздействии на величину дозы 50%-ой выживаемости ЛД5о/зо белых
лабораторных крыс
Мощность
дозы, Гр/мин
0,001
0,002
0,003
0,02
0,15
0,6
ЛДзо/зо, Гр
16, 4 ±1,4
13,1 ±1,3
10,0 ±1,2
6, 4 ±0,6
5, 4 ±0,5
5,3 ±0,5
Мощность
дозы, Гр/мин
0,7
0,8
0,9
1,5
3,0
3,5
ЛДзо/зо, Гр
5, 2 ±0,6
5,1 ±0,6
5, 2 ±0,5
4, 8 ±0,4
3,9 ±0,6
3,5 ±0,7
314 Гл. VII. Биологические эффекты малых доз излучений
требуется соответствующее снижение дозы радиации. Обнаружено,
что при высокой мощности дозы острого облучения репарирующая
активность биологических систем не успевает проявляться в полной
мере.
Иная картина зависимости радиобиологических эффектов от мощ-
мощности дозы наблюдается при облучении в не летальных, малых
дозах, когда растянутая во времени доза хронического облучения
может оказывать более сильный эффект по сравнению с той же до-
дозой, полученной при кратковременной лучевой экспозиции большей
мощности.
Впервые такой эффект на уровне клеточной мембраны обнаружил
в 1972 г. канадский ученый А. Петко, который показал, что дли-
длительное облучение клеток вызывает значительно большее изменение
проницаемости БМ, чем кратковременное в той же дозе. Так, при
кратковременном действии рентгеновского излучения большой мощ-
мощности B6 рад/мин) на клетку проницаемость БМ изменялась при
высокой дозе облучения — 3,5 крад. Но при длительном облучении
клетки B2Na в физиологическом растворе) в дозе малой мощности
A0~3 рад/мин) для изменения проницаемости мембраны для Na было
достаточно поглощенной дозы 0,7 рад. Таким образом, для проявле-
проявления радиобиологического эффекта при длительном действии мало-
маломощного излучения оказалась достаточной доза, в 5 тысяч раз мень-
меньшая, чем при облучении с высокой мощностью дозы. Этот феномен
обратной зависимости от мощности дозы при облучении клеток в
незначительной по величине дозе и их гиперрадиочувствительности
по некоторым критериям при облучении в сверхмалых дозах получил
впоследствии название «эффект Петко» (Р. Грейб, 1996).
Для математического описания этого явления А. Петко A984) ис-
использовал два уравнения, связывающие эффекты дозы и мощности
дозы при облучении в широком диапазоне доз и мощностей дозы,
включая низкие их уровни. Одно уравнение (VII.2) предложено самим
Петко, другое (VII.3) взято им из работы М. Лайона и соавт. A972):
R = вшГп (VII.2)
и
R = D[a + b\nI + ft(lnIJ], (VII.3)
где R — величина эффекта, ответа (response): в первом уравнении —
это количество связанных липидных гидропероксидов, образующихся
в мембранах при облучении, во втором — число радиационно-инду-
цируемых мутаций на локус, возникающих в сперматогониях мышей;
D — доза облучения: в первом уравнении в диапазоне от близкой к 0
до 3000 сГр, во втором — от 37,5 до 861 сГр; / — мощность дозы облуче-
облучения: в уравнении (VII.2) — от 1 до 0,16 сГр/мин, в уравнении (VII.3) —
от 0,00034 до 895 рад/мин; т, п, а, Ъ и h — константы, имеющие
величину: т = 1,44 ± 0, 30, п = 1,18 ± 0,15, а = (8, 66 ± 1,44) • 10~8,
Ъ = A, 70 ± 0,20) • Ю-8 и h = B,46 ± 0,65) • 10~9.
1. Лучевые реакции многоклеточных организмов
315
0,04 0,08 0,12 0,16 0,20
Мощность дозы, Гр/мин
0,04 0,08 0,12 0,16 0,20
Мощность дозы, Гр/мин
Рис. VII.4. Зависимость адаптивного ответа клеток китайского хомячка от ве-
величины мощности адаптирующей дозы D\ (по Дж. Виенкке и др., 1986). а —
D\ = 0,01 Гр — обратный эффект мощности; б — D\ =0,5 Гр — прямой эффект
мощности. Заштрихованные полосы — диапазон средних значений эффекта только
однократного облучения в дозе D2 с ошибкой средней
Зависимость радиобиологических эффектов от мощности дозы
удобно оценивать по показателям проявления адаптивного ответа. Об-
Обнаружено, что зависимость радиобиологического ответа от мощности
адаптирующей дозы D\ может иметь противоположную направлен-
направленность при облучении в малых и больших дозах D\. Это особенно
отчетливо видно в опытах на одиночных клетках. В этом случае
при малых значениях дозы D\ обнаруживается обратная зависимость
выраженности радиационных изменений от мощности дозы.
Как видно из рис. VII.4, при малой величине адаптирующей дозы
(Di = 0,01 Гр) наблюдается «обратный эффект мощности»: с увели-
увеличением мощности дозы от 0,01 до 0,2 Гр/мин повреждающее действие
повторной, проявляющей дозы D^ снижается. В том случае, когда
адаптирующая доза более высока [D\ — 0, 5 Гр), в противоположность
первому случаю, эффект повреждения по мере возрастания мощности
дозы облучения увеличивается, проявляется обычная для облучения
в больших дозах прямая зависимость радиобиологических изменений
от мощности дозы.
Прямая или обратная зависимости радиобиологического эффекта
от мощности дозы облучения в малых дозах обнаружены при исполь-
использовании в качестве показателей реакции и других физиологических,
биохимических, цитогенетических характеристик клеток и целостных
организмов.
Таким образом, биологические ответы на изменение мощности до-
дозы радиации могут служить еще одной иллюстрацией принципиаль-
принципиальных различий в механизмах биологического действия ионизирующих
излучений в больших и малых дозах.
316 Гл. VII. Биологические эффекты малых доз излучений
1.4. Общая неспецифическая реакция организмов на облучение
В ходе рассмотрения приведенных выше радиобиологических эф-
эффектов неоднократно возникал общий вывод о неспецифическом,
стрессовом характере действия ионизирующих излучений во всем
интервале малых доз.
1.4.1. Стресс
Понятие «стресс» (англ. stress — напряжение) широко вошло в повсе-
повседневную жизнь. Как известно, его ввел еще в 1936 г. канадский ученый Ганс
Селье для обозначения способности любого организма стандартно реагиро-
реагировать на действие факторов внешней среды в виде так называемой общей
неспецифической реакции. Различные внешние воздействия — холод, тепло,
боль, физические, химические или эмоциональные нагрузки — вызывают
не только свойственные им специфические проявления ответных реакций
организма, но и активацию общего для всех раздражителей, заложенного
в любом организме механизма ответа на воздействие стрессора — состоя-
состояния напряжения. Такие термины как холодовой, тепловой, эмоциональный
стрессы и т. п. указывают только на конкретную природу того или иного
воздействия и на непосредственный специальный ответ на них отдельных
тканевых систем: спазм или расширение сосудов кровеносной системы со-
соответственно на холод или тепло, изменение эмоционального состояния со
стороны центральной нервной системы.
Стресс-реакция характерна не только для экстремальных воздействий.
Она — необходимое звено в защитно-приспособительной реакции организма
и клетки в процессе их нормальной жизнедеятельности, при которой для
поддержания стабильного, «равновесного» состояния (т. е. гомеостаза или
стационарного состояния) в ответ на меняющиеся условия среды обитания
необходима мобилизация защитных резервов.
Степень и выраженность проявления реакций стресса зависят от силы и
продолжительности действия стрессора (раздражителя). Г. Селье показал,
что при действии стрессоров различного происхождения в организме про-
происходят однотипные изменения, активирующие ось гипоталамус—гипофиз-
кора надпочечников с вовлечением также тимуса и желудочно-кишечного
тракта. Позднее было установлено, что в результате стресса в организме
из синапсов нейронов секретируются 5 нейромедиаторов АО: катехоламины
(адреналин, норадреналин, дофамин), а также серотонин и ацетилхолин.
Изменение устойчивости организма к стрессорным воздействиям про-
происходит по универсальной схеме. Начинается стресс стадией тревоги:
вследствие активации нейро-гормональных механизмов в ответ на дей-
действие раздражителя мобилизуются защитные силы организма; повышается
функциональная активность клеток, органов и тканей, реализующих ответ
за счет усиления продукции энергетических ресурсов и активации систем
защиты; изменяется нормальный ритм клеточного деления и т. п. На стадии
тревоги резистентность (т. е. устойчивость к действующим факторам —
стрессорам) незначительно возрастает.
При продолжающемся воздействии стрессора в организме развивается
вторая стадия — адаптации (резистентности). Процессы, характерные
для первой стадии, сменяются реакциями, приводящими к прогрессивно-
прогрессивному повышению резистентности. Для этой стадии характерно устойчивое,
сбалансированное производство и расходование адаптационных резервов в
1. Лучевые реакции многоклеточных организмов 317
условиях изменившейся окружающей среды. Организм приобретает устой-
устойчивость не только к воздействующему, но и к другим раздражителям.
Однако защитные резервы имеют предел, и при продолжающемся воз-
воздействии усиленное восполнение их становится недостаточным, а поддер-
поддержание работоспособности биологических систем происходит все в большей
степени за счет возникновения разрушения собственных жизненно важных
структур и постепенного понижения общей устойчивости. В итоге наступает
третья стадия стресса — состояние истощения. Начинается прогрес-
прогрессирующее падение массы тела, некоторые типичные изменения в крови,
снижение функции нейрогормональной системы, другие патологические
проявления, а в результате — падение общей устойчивости организма ниже
исходного уровня.
Периодическое воздействие на организм привычных для него факторов
среды обитания умеренной силы и длительности активирует и тренирует
соответствующие функциональные системы, повышая их защитные воз-
возможности. Такая адаптация по мере снижения потребности в ней может
постепенно исчезать.
Стресс-реакция, вызывающая благоприятное влияние на реактивные
приспособительные способности организма, получила название эустресс.
Раздражители необычной природы, силы и продолжительности, затруд-
затрудняющие адаптацию, характеризуются как экстремальные. Их действие вы-
вызывает так называемый дистресс — мобилизацию и истощение защитных
ресурсов организма, нарастание повреждения биологических структур и
различные формы патологии. Крайнее напряжение регуляторно-приспо-
собительных механизмов может не обеспечить сохранение и поддержание
стабильного, устойчивого состояния — гомеостаза, и тогда может наступить
смертельный исход.
Таким образом, в одних случаях стрессорное воздействие оказывает
тренирующий, полезный эффект, в других — истощает защитные резервы
организма и приводит к развитию патологии.
Исследования Г. Селье послужили толчком к всестороннему изучению
стресса как явления. Возник вопрос — является ли сам принцип форми-
формирования стресс-реакции универсальным, общебиологическим механизмом
ответа для разных уровней организации живых систем на любое внешнее
воздействие, или он относится только к организмам человека и животных?
Оказалось, что для растительных организмов такая ответная реакция
также существует. Она получила название «фитостресс» и тоже протека-
протекает в три стадии последовательных структурно-метаболических изменений.
Первые две стадии обратимы (стадия «первичной реакции» и стадия «ре-
«реституции», т. е. восстановления) и могут привести растение в состояние по-
повышенной устойчивости к раздражителям; третья стадия охарактеризована
как стадия «необратимых изменений и гибели».
Одиночные клетки также оказываются способными к триадному стан-
стандартному ответу на физические и химические воздействия. Так, «пред-
паранекротическое состояние» (обратимое состояние, предшествующее по-
повреждению) сменяется «паранекротическими изменениями» (процессами
восстановления клеток) и завершается стадией «необратимой альтера-
альтерации» (необратимого повреждения). Эта концепция паранекроза, выдвину-
выдвинутая Д. Н. Насоновым и В. Н. Александровым A934, 1940), получила впослед-
впоследствии новое название «неспецифического адаптационного синдрома клетки»
в связи с признанием универсального, общебиологического характера неспе-
неспецифической стресс-реакции.
318 Гл. VII. Биологические эффекты малых доз излучений
В дальнейшем резко возрос интерес к механизмам инициирования и
развития неспецифической реакции. Было показано, что в основе их ле-
лежат изменения окислительно-восстановительного гомеостаза, активизация
продукции АФК и окислительных процессов в ненасыщенных липидах био-
биологических мембран (так называемый оксидативный стресс).
1.4.2. Синдром липопероксидации
С начала шестидесятых годов прошлого столетия, т. е. в первый
период исследований оксидативного стресса, главное внимание было
обращено на традиционные липидные оксирадикалы и токсические
продукты, образующиеся при лучевом поражении биологических объ-
объектов и систем. В дальнейшем радиобиологическими работами заинте-
заинтересовались в медицине, и проблеме биохимического «синдрома липо-
пероксидации» и «свободнорадикальной патологии» стало уделяться
самое пристальное внимание. Количество работ в этом направлении
прогрессивно возрастает вплоть до последнего времени. Уже неполный
перечень состояний организма и заболеваний, при которых проявля-
проявляется синдром липопероксидации (ЛПО), говорит об исключительно
широком круге ситуаций, для которых он характерен (табл. VII.4).
Удивительно, до чего разнообразны и далеки друг от друга по
характеру этиологии и патогенеза заболевания, при которых прояв-
проявляется синдром ЛПО! Приведенные данные свидетельствуют о неспе-
неспецифическом характере этого синдрома.
В настоящее время инициирование очень многих заболеваний ста-
стали оценивать с позиции свободнорадикальной патологии и накопления
в организме не только липидных перекисных продуктов, но и промо-
промоторов цепных реакций — АФК и др. оксипродуктов.
Однако трудно согласиться с оценкой роли этих продуктов как
факторов этиологии (причинных факторов) столь разных патологий.
Развитие синдрома ЛПО совсем не значит, что образование радика-
радикалов — окситоксинов — является причиной каждого из перечисленных
заболеваний. Совершенно очевидно, что образование ППОЛ является
событием, сопутствующим развитию многих заболеваний, патогенети-
патогенетическим звеном в системе его механизмов.
Следует отметить также, что если процесс собственно липопе-
липопероксидации протекает по «единому сценарию», то регуляция его
чрезвычайно разнообразна и осуществляется многоэшелонированной
системой контроля, к которой относятся в клетке и действие
антиокислительного буфера (низкомолекулярные и ферментные
антиокислители), и механизм регуляции открытия пор БМ.
Напомним, что при действии ионизирующих излучений токсиче-
токсическое действие ОРТ является важнейшим инициирующим механиз-
механизмом повреждения клеточных структур, осуществляющим непря-
непрямой эффект радиации, механизм запуска и усиления первичных
изменений. Липопероксидация является элементарной неспецифи-
неспецифической реакцией, особенно ярко проявляющей свою активность в этих
условиях.
1. Лучевые реакции многоклеточных организмов 319
Таблица VII.4. Перечень физиологических состояний организма и заболева-
заболеваний, при которых проявляется биохимический синдром липопероксидации
- Лучевое поражение (лучевой токсический эффект).
- Фотодинамическое действие ультрафиолетовых излучений.
- Действие электрических и магнитных полей.
- Механические травмы.
- Гипер- и гиподинамия.
- Гипер- и гипоксия.
- Атеросклероз и сердечно-сосудистая патология.
- Гипер- и гипотермия.
- Ожоги, воспаления, обморожения.
- Гипер- и гипоосмотические нарушения обмена веществ.
- Гипервитаминоз А и Д и гиповитаминоз (авитаминоз) Е.
- Аутоиммунные и хронические воспалительные заболевания:
артрит, колит, цистит, гастрит и язва.
- Острые и хронические заболевания печени, легких и
др. органов.
- Токсикозы. Сахарный диабет.
- Дегенеративные заболевания нервной системы:
болезнь Альцгеймера, паркинсонизм.
- Злокачественный рост:
химический, гормональный и вирусный канцерогенез.
- Синдром приобретенного иммунодефицита — СПИД.
- Старческая катаракта.
- Старение.
1.5. Отдаленные последствия облучения организмов
Важной особенностью биологического действия ионизирующих из-
излучений в нелетальных дозах является то, что через значительный
промежуток времени после этого события на фоне, казалось бы, пол-
полного восстановления организма от первоначальных нарушений появ-
появляется ряд характерных изменений — отдаленные последствия
облучения.
Естественно, что время от облучения до проявления этого радио-
билогического эффекта для разных организмов может сильно отли-
отличаться. Для человека оно может составлять 10-20 лет и более, для
лабораторных мышей и крыс — несколько месяцев и т. п. Наконец,
теоретически отдаленные последствия могут появляться не только в
пределах жизни облученного организма, но и у его потомства, как
непосредственного, так и через несколько поколений.
Отдаленные последствия облучения не являются какими-то но-
новыми, свойственными только для действия ионизирующих излуче-
излучений заболевания. Скорее это провокация развития таких известных
320 Гл. VII. Биологические эффекты малых доз излучений
болезней, как лейкозы (лейкемии), раковые опухоли всех видов, по-
пониженная плодовитость, физические и умственные пороки развития,
ослабление сопротивляемости к инфекциям, катаракта хрусталика
глаза, сокращение продолжительности жизни, возможно, большая
подверженность развитию заболеваний сердечно-сосудистой системы
и органов кровообращения и др. на фоне хромосомных изменений в
клетках крови и других тканей.
Отдаленные последствия облучения иногда связывают с изменениями
в организме, происходящими при естественном старении, повышающими
вероятность появления раковых опухолей, развития катаракт, наступления
поседения, ослабления эластических свойств кожи, сосудистых склеротиче-
склеротических изменений и др. Эти явления наступают в облученном организме в
более раннем возрасте, чем в норме, а поскольку уменьшается и средняя
продолжительность жизни, то многие радиобиологи приходят к выводу о
том, что действие излучений, в том числе, возможно, и в малых дозах,
способно вызывать радиационное старение организма — ускоренное под
влиянием облучения наступление старости.
В литературе широко дискутируется вопрос о влиянии облучения
в малых дозах на возникновение отдаленных последствий действия
излучений, возникающих в природных условиях в результате за-
загрязнения окружающей среды радионуклидами. Наибольшее
число работ, посвященных таким отдаленным последствиям, касается
появления раковых заболеваний.
Однако общепризнанного мнения о причинной связи тех или иных
заболеваний людей с действием на них ионизирующих излучений все
еще не выработано. Трудность представляет установление такой связи
на основе статистически достоверных данных, само получение кото-
которых требует большого экспериментального, клинического и эпидемио-
эпидемиологического материала на большом количестве исследуемых объектов
с учетом исходного физиологического их состояния, и достоверно-
достоверного вычленения радиационной компоненты из множества эффектов,
обусловленных воздействием других патогенных факторов среды на
организм. Проявление же радиационного эффекта в свою очередь
зависит от вида излучения и характера облучения (величины дозы
и мощности дозы излучения, внешнего или от инкорпорированных
радионуклидов, однократного или многократного, острого или хрони-
хронического, локального или общего и т.д.).
Так, после аварии на Чернобыльской АЭС среди многих радиобио-
радиобиологов укоренилось мнение, что классическая радиобиология на основе
данных по облучению в больших дозах может и должна описать и
количественно оценить эффекты действия на здоровье людей низ-
низкоинтенсивного облучения, обусловленного загрязнением природной
среды радионуклидами. Предлагались различные модели экстрапо-
экстраполяции данных от высоких доз облучения. Несмотря на их разнообра-
разнообразие, они основывались на априорном логическом постулате: большие
дозы вызывают большие повреждения, малые дозы — такие же, но
меньшие.
2. О количественной оценке биологического действия излучений 321
Под давлением современных данных ряд радиобиологов хотя и
вынужден признать вывод о немонотонной зависимости биологиче-
биологических эффектов (например, цитогенетических изменений и частоты
злокачественных заболеваний) от доз низкоинтенсивного облучения,
все же считает, что если и существует такая зависимость, то возникшие
изменения настолько малы, что не имеют реальной значимости для
популяции.
Однако такой подход подвергся критике, по крайней мере, по сле-
следующим позициям (Е. Б. Бурлакова и др., 1994).
1. К вопросу о влиянии Чернобыльской аварии на здоровье челове-
человека нельзя подходить только с позиции действия одних ионизиру-
ионизирующих излучений на население, необходимы знания о сочетанном
действии радиации и разнообразных химических загрязнений
среды. Эффекты синергизма и антагонизма этих факторов при-
приводят к изменению соотношения их значимости для здоровья
человека. Для одних и тех же условий облучения эффекты бу-
будут разными в экологически чистых и химически загрязненных
районах. Могут возникнуть даже качественно новые эффекты
факторов окружающей среды. При этом роль радиационного
фактора может быть провоцирующей.
2. Анализ клинических данных немонотонной зависимости
«доза-эффект» привел ряд радиобиологов к заключению, что
эффект от облучения в малых дозах может быть «недооценен»
из расчета эффектов при больших дозах и последующих
экстраполяции к малым.
Не обсуждая медицинские проблемы возникновения отдаленных
изменений в организме, приведем лишь один из многих примеров
результатов наблюдения частоты заболеваемости у ликвидаторов
последствий аварии на Чернобыльской АЭС (по В.К.Иванову и
А. Ф. Цыбу, 1996) в табл. VII.5. Понятно, что «привязать» обнаружен-
обнаруженную частоту проявления патологий к точной величине вызывающих
их доз и мощности доз облучения в условиях проводимых обсле-
обследований оказалось невозможным. Поэтому представленные данные
могут служить лишь ориентиром к оценке того или иного возможного
факта отдаленного последствия сочетанного действия ионизирующих
излучений и других повреждающих факторов (химических аэрозолей,
эмоционально-психологического стресса, физических перегрузок).
2. О количественной оценке биологического действия
излучений в малых дозах
В настоящее время нет единого определения понятия «малости»
доз. Широко используются биологические оценки количественных
границ диапазона доз, называемых малыми, хотя и здесь нет единства
мнений.
21 Ю. Б. Кудряшов
322
Гл. VII. Биологические эффекты малых доз излучений
Таблица VII.5. Показатели заболеваемости по основным классам болезней у
ликвидаторов и населения России в целом, случаев на 105 человек
Основные классы болезней
новообразования
злокачественные
новообразования
болезни крови и
кроветворных органов
болезни органов пищеварения
болезни органов
кровообращения
психические расстройства
болезни эндокринной системы
все классы болезней
Ликвидаторы
747
233
339
9739
6306
5743
6036
75606
Население
России
788
140
94
2635
1472
599
327
50783
По данным НКДАР ООН (UNSCEAR) 1999 г. [72] к малым дозам
облучения клетки можно отнести дозы до 0,2 Гр B00 мЗв), хотя в
принципе даже при дозе в 0,1 сГр можно ожидать прохождения одного
трека через ядро диаметром 8 мкм, возникновения изменений в клетке
и соответствующих радиобиологических эффектов. Для млекопитаю-
млекопитающих малыми наиболее часто считают дозы ниже 1,0 Гр; иногда гра-
границу между большими и малыми дозами понижают до 0,25-0,20 Гр,
приближая ее к величинам, рассматриваемым в качестве малых для
клеток (Дж. Гофман, 1994). В соответствии с другим подходом это все
те дозы, которые в 100 раз меньше ЛД5о/зо и в Ю0 раз больше уров-
уровня ЕРФ (Р. Грейб, 1996). Ранее мы приводили данные А.М.Кузина
A989) о большом разбросе значений диапазона малых доз, в котором
проявляется, например, гормезис у разных биологических объектов.
Таким образом, термин «малые дозы» — условное по-
понятие. Величина малых доз различна для разных уровней
организации живых систем, и определяется она характер-
характерными проявлениями биологических эффектов, вызываемых
слабым однократным и (или) хроническим радиационным
воздействием.
Так, при определении малых доз для многоклеточных организмов
имеют в виду нелетальные дозы облучения. Для клеток и других
биологических объектов малые дозы характеризуются не свойстен-
ными большим дозам эффектами, например, гормезисом. Часто
говорят о том, что малые дозы вызывают эффекты, «противопо-
«противоположные» большим дозам облучения.
Однако термин «доза» — это прежде всего физическое понятие, и
поэтому хотелось бы дать строгое определение диапазона малых доз,
исходящее из оценки поглощенной энергии излучения. Поскольку в
2. О количественной оценке биологического действия излучений 323
физической дозиметрии нет деления доз на большие и малые, радио-
радиобиологи вынуждены производить такое деление в связи с различиями
в биологических эффектах.
Существует более строгий — биофизический — подход в класси-
классификации дозы на клеточных моделях — по характеру прохождения
ионизированной частицы через гетерогенную структуру клетки, на
основании чего возможно количественное определение диапазона ма-
малых доз. Однако и при таком способе его оценки нельзя не учитывать
«биологический фактор», так как наряду с прямым осуществляется и
непрямое действие радиации, а в популяции клеток или в тканях, по-
помимо ионизации на облученную или необлученную клетку, действуют
секретируемые (в их составе, возможно, и токсические) вещества об-
облучаемых «клеток-соседей», называемых в литературе «свидетелями»
облучения.
2.1. О биологических критериях (показателях), используемых
для оценки эффектов малых доз
Проблема изучения индивидуальных биологических реакций орга-
организма при низкодозовых радиационных воздействиях, поиск наиболее
характерных для этих воздействий биологических изменений занима-
занимает одно из ключевых мест в современной радиобиологии. Характером
и точностью дозиметрической информации определяется решение о
необходимости, сроках и объеме оказания медицинской помощи по-
пострадавшим, оценка вероятности и характера отдаленных последствий
действия облучения, установление социальных прав на возмещение
ущерба здоровью людей. Все это стимулировало поиск критериев
установления поглощенной дозы на основе величины вызываемых
ею радиобиологических эффектов. На такую возможность указывали
факты количественной зависимости их от величины дозы облучений
по некоторым показателям и длительное сохранение пострадиацион-
пострадиационных изменений. Так, еще в середине прошлого столетия возникло
особое направление в радиобиологии - биодозиметрия. Были сфор-
сформулированы требования к биоиндикаторам, их классификация, дана
попытка определить те из них, которые уже сейчас можно рассмат-
рассматривать в качестве реальных биодозиметров. Наибольшее развитие это
направление получило, как известно, после аварии на Чернобыльской
АЭС в связи с необходимостью ретроспективной дозиметрии малых
доз излучений.
Существует пять групп ретроспективного выявления последствий
дозовых нагрузок на организм при внешнем и внутреннем облу-
облучении: цитогенетические, гематологические, иммунобактериологиче-
ские, биохимические и биофизические. При оценке эффектов биоло-
биологического действия радиации в малых дозах возможна регистрация
цитогенетических и гематологических повреждений: частоты хромо-
хромосомных перестроек (например, при помощи анафазного и метафазного
анализа аберраций хромосом), числа лимфоцитов с микроядрами, а
21*
324 Гл. VII. Биологические эффекты малых доз излучений
также частоты клеток-носителей соматических мутаций в перифери-
периферической крови.
Метод хромосомных аберраций принят в качестве официального
метода биологической дозиметрии*). Основой радиационной биодо-
биодозиметрии по аберрациям хромосом является количественная зависи-
зависимость образования аберраций в лимфоцитах периферической крови
и костного мозга от дозы излучений. Поскольку лимфоциты пери-
периферической крови обладают высокой радиочувствительностью, то
содержание их в крови у человека, облученного в высоких дозах,
вскоре резко снижается, и их количество может оказаться слишком
малым для культивирования. В то же время в отделах костного мозга,
особенно при неравномерном облучении, уровень лимфоцитов может
оставаться достаточным для подсчета аберраций хромосом, и таким
образом трудности в выборе клеток могут быть преодолены. In vitro
использование прецизионных методов позволяет оценивать выживае-
выживаемость клеток млекопитающих в диапазоне невысоких доз облучения —
от уровня природного фона до 1-2 Гр.
Количественная ретроспективная дозовая оценка по хромосомным
аберрациям у хронически облученных людей и в отдаленные сроки
после воздействия излучений встречает известные трудности. Так, да-
даже при раннем цитогенетическом анализе, исключающем элиминацию
аберраций хромосом вследствие гибели клеток, на дозовой кривой
в диапазоне малых доз от 0,1-0,2 Гр и выше (до 0,5 Гр) разброс
индивидуальных значений настолько велик, что установление дозы
облучения становится крайне сложной проблемой. Явление гормезиса
существенно модифицирует зависимость «доза-эффект». Вместе с тем
имеются данные о длительном сохранении хромосомных аберраций в
лимфоцитах периферической крови у профессионалов, работающих
с источниками ионизирующих излучений. Однако ретроспективную
оценку индивидуальных доз провести не удается.
Также встречают затруднения попытки осуществить дозиметриче-
дозиметрическую оценку по численности клеточного состава периферической кро-
крови. Вместе с тем в литературе известны данные о том, что на основе
динамики количества нейтрофилов и тромбоцитов и использования
соответствующей компьютерной обработки данных дозы облучения
человека могут быть установлены ретроспективно.
Перспективной является оценка выхода микроядер в облученных
популяциях клеток и их потомков, например, при исследовании адап-
адаптивного ответа клеток. Появление микроядер — это следствие повре-
повреждений генетического аппарата клеток. Микроядра возникают в про-
процессе разделения хромосомного материала лимфоцитов между двумя
дочерними клетками из-за препятствия, создаваемого аберрациями
переходу разорванных или слипшихся хромосом в одно или два до-
дочерних ядра, и оказываются в отдельных микроядерных структурах,
наблюдаемых в клетках, не сумевших разделиться из-за повреждения
Принято МАГАТЭ в 1986 г.
2. О количественной оценке биологического действия излучений 325
веретена или центромеры. Процесс этот может быть усилен прибав-
прибавлением цитохалазина В в культуральную среду для лимфоцитов, ко-
который препятствует разделению цитоплазмы клетки и образованию
дочерних клеток. Образующиеся при этом двуядерные клетки учесть
намного проще, чем подсчитать аберрации хромосом.
Микроядерный тест обладает высокой разрешающей способно-
способностью, удобен и более быстр по сравнению с хромосомным анализом,
что делает его незаменимым для оценки мутагенного действия разных
агентов. Он позволяет наблюдать повреждения хромосом в асинхрон-
асинхронной популяции клеток в следующем после воздействия повреждаю-
повреждающего агента клеточном цикле (И.И.Пелевина и др., 2001). Анализ
цитогенетических эффектов облучения в малых дозах изложен в ряде
других современных работ (например, Н.Л.Шмаковой и др., 2002).
По перечисленным критериям показана сложная нелинейная зави-
зависимость «доза-эффект» после воздействия радиации в диапазоне ма-
малых доз. Общий вид ее представлен схематически на рис. VII.2.
Исследование радиационных изменений на разных уровнях органи-
организации живых систем (от молекулярного до организменного) привело
к накоплению большого фактического материала по количественной
оценке биологического действия излучений в малых дозах. Однако
попытки простого переноса используемых приемов и данных с одного
уровня на другой (например, от животных на человека) без учета ино-
иного качества системы более высокого уровня, встречая значительные
трудности, в принципе не могут быть успешными.
В радиобиологии встречаются отдельные работы, в которых тер-
термин «биодозиметрия» иногда употребляют применительно к количе-
количественной оценке уровня содержания радионуклидов в клетках, орга-
органах и тканях облучаемого организма. При этом забывают, что термин
«биодозиметрия» подразумевает не физическую дозиметрию в био-
биологическом объекте, а оценку дозы излучения, поглощенной биоло-
биологическим объектом, по вызванному этим событием биологическому
эффекту. Именно такой смысл имеет, например, биофизический метод
индивидуальной биологической оценки доз облучения по ЭПР-сигналу
эмали зубов облученных млекопитающих, отражающему накопление
радиационных радикалов в химической структуре гидроксиапатита,
входящего в состав биологической ткани — зубной эмали.
Еще в 1968 г. при ЭПР-спектроскопии образцов бедренной кости
и резцов млекопитающих, облученных в дозах от 1 до 250 Гр была
обнаружена строгая линейная зависимость величины ЭПР-сигнала
от дозы облучения. Последующие исследования позволили выяснить
механизмы ЭПР-эффекта, установить длительность его проявления
и разработать методы практического применения в лучевой биодози-
биодозиметрии.
Было установлено, что радиационно-индуцируемые резонансные центры
в эмали зубов дают многократно более интенсивные сигналы, чем в любых
326 Гл. VII. Биологические эффекты малых доз излучений
других тканях. В основе этих сигналов лежит образование в дефектах кри-
кристаллической решетки зубной эмали (включающей кристаллы гидроксиа-
патита) свободных радикалов СО^3 в результате захвата комплексом СО22
свободных электронов, появляющихся в облученной эмали. Таким образом,
зубы представляют собой своеобразные «накопительные биодозиметры»,
накапливающие дозы облучения организма за всю его жизнь, т. к. в связи с
высокой минерализованностью эмали (96%) и замедленного обмена веществ
в ней при 25° С ЭПР-центры могут сохраняться 109 лет!
Известны и другие попытки изыскания методов, с помощью ко-
которых можно было бы на основании биологических и медицинских
показателей ретроспективно оценивать величину дозы облучения ор-
организма и предсказать степень риска возникновения патологии от
лучевого воздействия.
Однако задача оценки величины малых доз радиации с помо-
помощью «биологических маркеров» затруднена в связи с нелинейным
характером ответа организма на низкоинтенсивные воздействия и
разбросом данных, связанным с большими колебаниями видовой и ин-
индивидуальной чувствительности организмов к облучению. На этом
же основании также понятно, что сейчас, без достаточного понимания
сущности радиационного эффекта в диапазоне малых доз, еще рано
делать окончательные выводы о возможных отдаленных последствиях
облучения ликвидаторов радиационных аварий и населения.
Тем не менее такой прогноз необходим в первую очередь для
решения важных медицинских и социальных проблем.
Рассмотрим один из примеров прогноза возможной индукции онколо-
онкологических заболеваний среди ликвидаторов последствий аварии на ЧАЭС и
жителей загрязненных радионуклидами территорий (А. Цыб, В. Иванов,
2002). НКДАР ООН на 49-ой сессии (Вена, май 2000 г.) пришел к за-
заключению, что средняя доза внешнего облучения ликвидаторов аварии
на Чернобыльской АЭС составляет 0,1 Гр. Сформированный к 2000 г.
Российский Национальный радиационно-эпидемиологический регистр со-
содержит индивидуальную медико-дозиметрическую информацию о 180 тыс.
ликвидаторах этой аварии. Если для прогноза отдаленных канцерогенных
рисков воспользоваться линейной беспороговой моделью «доза-эффект»
(рис. VII.2, пунктирная линия), т.е. предположить, что сколь угодно малая
доза облучения может вызвать с крайне малой вероятностью онкологи-
онкологическое заболевание, то можно было бы предсказать, что среди 180 тыс.
ликвидаторов за всю предстоящую жизнь будет выявлено около 1 тыс.
онкологических заболеваний, обусловленных полученной дозой облучения.
Авторы прогноза заболеваемости сравнили данные упомянутого регистра с
результатами японско-американских радиационно-эпидемиологических ис-
исследований A950-1990 гг.) на когорте в 86,5 тыс. чел. (Хиросима-Нагасаки)
и пришли к выводу о том, что к группе действительно радиационного
риска следует относить только ликвидаторов, получивших дозы внешнего
облучения более 0,2 Гр (т. е. по сути только ликвидаторов 1986 года). Вместе
с тем реальные накопленные к настоящему времени данные Национального
2. О количественной оценке биологического действия излучений 327
регистра свидетельствуют о повышении частоты онкологических заболева-
заболеваний среди ликвидаторов, получивших меньшие дозы внешнего облучения —
более 0,1 Гр, а не более 0,2 Гр. Тем не менее упомянутые авторы счи-
считают, что имеющиеся в настоящее время эпидемиологические данные
не позволяют сделать заключение о доказанной реальности радиационного
канцерогенеза, вызванного облучением в малых дозах. Понятно, что работы
по количественной оценке биологических эффектов действия излучений
в малых дозах должны продолжаться и совершенствоваться с целью по-
получения объективных данных и выработки на этой основе оптимальных
нормативов радиационной безопасности.
В последнее время М. Ф. Киселев A999-2002) предложил комплекс
методов экспресс-диагностики индивидуальных доклинических изме-
изменений в основных саногенетических *) системах организма (в систе-
системах обмена веществ и гуморального иммунитета, сердечно-сосудистой,
дыхательной, психомоторной) при низкодозовых радиационных воз-
воздействиях в сочетании с действием других антропогенных факторов
внешней среды.
Автор отошел от традиционной схемы изучения пострадиационных
реакций организма при облучении в малых дозах, когда вначале опре-
определяется вероятный уровень действующих доз, а затем определяется
вызванный ими эффект (заболеваемости, сокращения продолжитель-
продолжительности жизни, изменения смертности). В основу оценки биологических
реакций организма, возникающих при низкодозных радиационных
воздействиях в сочетании с другими антропогенными факторами,
положен учет интегральных эффектов воздействий стрессов: радиа-
радиационного, химического, психо-эмоционального, а также влияния кли-
мато-географических условий и экологической ситуации.
Автор пришел к выводу, что при оценке биологического дей-
действия радиации в малых дозах необходимо проводить комплексное
тестирование, а не ограничиваться только изучением отдельных, хо-
хотя и принципиально важных функциональных систем. Для такого
комплексного тестирования предложен биофизический метод лазер-
лазерной «корреляционной спектроскопии» (ЛКС). Этот метод (Киселева-
Носкиных) позволяет оценивать «функциональные напряжения» в
системе обмена веществ и гуморального иммунитета, возникающие
при низко дозовых лучевых воздействиях.
Экспериментально установлено, что по характеру изменения ме-
метаболических сдвигов, регистрируемых методом ЛКС, представляет-
представляется возможным прогнозировать исход лучевого воздействия (в том
числе и процессов канцерогенеза) в сроки, заметно предшествующие
проявлению достоверных морфологических признаков. Характер и
степень выраженности сдвигов в ЛК-спектрах позволяют в динамике
*) Здесь под термином «саногенетические системы» подразумеваются
«системы жизнеобеспечения», поддержания здоровья (лат. «sano» — выле-
вылечивать, оздоровлять).
328 Гл. VII. Биологические эффекты малых доз излучений
проводить скрининговые *) оценки «патологической отягощенности»
организма, облученного в малых дозах.
Так, методом Л КС установлено, что хроническое облучение людей,
проживающих в пойме реки Теча (в диапазоне доз до 75 сЗв, а также и
в более высоких дозах), вызывает функциональные изменения в системе
иммунитета, проявляющиеся изменением субфракционного состава плазмы
крови в направлении нарастания частоты встречаемости анаболически на-
направленных сдвигов (увеличение в плазме крови кластера частиц с гидро-
гидродинамическим радиусом в основном 70-150 нм). М.Ф.Киселев обнаружил
также, что при радиационно-индуцированном канцерогенезе в субфракции
плазмы крови происходит увеличение числа частиц с радиусом до 10 нм.
Прогноз развития процессов канцерогенеза по указанным сдвигам ЛК-
спектров осуществляется на 1-2 месяца раньше, чем принятыми методами
детекции опухолевых процессов.
Проанализировав большой фактический материал современной ли-
литературы по отдаленным последствиям облучения, Е. Б. Бурлакова
B001, 2002) пришла к выводу о необходимости рассматривать за-
заболеваемость облученных людей с учетом индивидуального их рас-
распределения по «уровням здоровья», «группам инвалидности» и др. в
зависимости от узкого диапазона доз облучения. При таком квали-
метрическом**) анализе данных оказалось, что в каждом из выбран-
выбранных узких диапазонов доз хронического облучения имеется своя для
определенного контингента людей зависимость «доза-эффект». Так,
при облучении в малых дозах (менее 0,1 Гр) имеется область сни-
снижения эффекта вероятности возникновения лейкозных заболеваний с
увеличением дозы облучения; в другой области доз происходит смена
знака эффекта на противоположный и т. д.
Квалиметрический подход к оценке последствий облучения поз-
позволил прийти к важному выводу о статистической достоверности
и характерной зависимости радиобиологических эффектов от дозы
облучения для каждой группы обследованных людей. Показав, что
устойчивость организма к воздействиям экзо- и эндогенной приро-
природы определяется, в основном, состоянием систем антиоксидантной и
иммунологической защиты, Е. Б. Бурлакова B002) предположила, что
*) Скрининг (англ. screening — просеивание, сортировка, от to screen —
просеивать, сортировать) — выявление и контроль потенциально вредных
эффектов, которые могут быть вызваны при антропогенном загрязнении
среды, в том числе радионуклидами.
**) Квалиметрия (лат. quails — какой по качеству, гр. metron — мера) —
научное направление, разрабатывающее методы количественной оценки
(классификации) процессов или явлений с помощью оценочной шкалы при-
признаков, т. е. разбиения немонотонно изменяющихся явлений на несколько
групп. Квалиметрия используется, когда интенсивность явления трудно
точно измерить, а также при сопоставлении влияния на объект нескольких
разнородных факторов.
2. О количественной оценке биологического действия излучений 329
дефицит потенциала этих систем является важным показателем при
оценке возможных последствий и в прогнозе возникновения заболева-
заболеваний у лиц, облученных в малой дозе.
Конечно, как уже отмечалось, едва ли возможно найти простые
соотношения, поставить знак равенства между физической и биологи-
биологической оценками ожидаемого эффекта дозы облучения. В полной мере
это никак не удается в связи с большими колебаниями биологической
ответной реакции на одну и ту же дозу воздействия. Биологический
ответ организма на облучение зависит от большого множества причин,
например таких как рацион питания, психо-физиологическое состоя-
состояние организма, время года и суток в момент облучения, от адаптивного
ответа, который может быть вызван предшествующими воздействия-
воздействиями любых физических, химических и даже биологических факторов,
например таких как вирусная инфекция, стресс и др.
Сами понятия «радиорезистентность» или «радиочувствитель-
«радиочувствительность» — это меняющиеся от многих причин количественные призна-
признаки, такие же как вес, рост, плодовитость и т.д. Известно, что такие
количественные признаки детерминированы полигенно и на их про-
проявление оказывает влияние физиологическое состояние облучаемого
биологического объекта. Кроме того, известно, что особи в популяции
распределены по признаку радиочувствительности биномиально, при
этом в 5% крайних отклонений от средней величины 2,5% особей явля-
являются «суперрезистентными» и еще 2,5% — «суперчувствительными»
(И.Б.Моссе, 2002).
При количественной оценке биологического действия ионизирую-
ионизирующих излучений необходимо четко разграничивать цели исследований:
изучение существа возникающего эффекта или установление дозы
облучения. При решении задачи оценки характера и меры изменений,
возникающих в облученных биологических объектах, первостепенную
роль играют биологические методы.
Однако совершенно очевидно, что биологическая оценка ответа на
радиационное воздействие не может и не должна подменять собой
физические или биофизические способы определения поглощенных
доз излучения, характера и количественной меры поглощения энергии
облучаемой клеткой. Приведем один из известных в биофизической
литературе подходов в оценке диапазонов доз облучения, помятуя, что
для модельных систем количественная оценка диапазона доз может
отличаться от значений, получаемых с помощью радиобиологических
показателей организменного уровня.
2.2. Биофизический подход в оценке диапазона малых доз по
характеру поглощения энергии излучений (Д. М. Спитковский)
В связи с актуальностью исследований биологического действия
низкоинтенсивных излучений на клетку с неизбежностью возникают
вопросы о понятии малых и больших доз: что считать малой дозой
облучения, где граница между «малой» и большой дозой и в чем
330
Гл. VII. Биологические эффекты малых доз излучений
D
особенности радиобиологического эффекта при действии на клетку из-
излучений в разных диапазонах доз? Последний вопрос в радиационной
биофизике естественно должен решаться комплексно, т. е. с учетом не
только физической величины дозы, ее мощности и условий облучения,
но и в сопоставлении с оценкой биологического ответа различных по
радиочувствительности клеток.
2.2.1. Анализ прохождения частицы через гетерогенную
структуру клетки
Известно, что в силу гетерогенности структурной организации
и состава клетки различная пространственная локализация иони-
ионизирующих событий в ее объеме должна приводить к различным
биологическим последствиям. Например, прохождение трека через
цитоплазму, если при этом радиационно-
радиационному воздействию подвергается достаточное
количество ее элементов, может привести
к функциональным изменениям, которые
в зависимости от степени их выражен-
выраженности и необратимости способны индуци-
индуцировать механизмы, приводящие к гибели
клетки.
При действии ионизирующих излуче-
излучений областью инициации последующих
реакций клетки может явиться не только
ее ядро, но и мембрана. Рассмотрим во-
вопрос о потенциальных различиях в чис-
числе «воспринимающих» энергию радиации
объемов биологической мембраны при
пересечении ее треком частицы с низкими
значениями ЛПЭ. Для этой цели предста-
представим клеточную поверхность в виде сферы
(рис. VII.5).
Как видно из схемы, можно ожидать
два крайних типа пересечения мембраны,
отличающихся по своим последствиям.
Первый из них: трек проходит перпенди-
перпендикулярно к поверхности клетки (рис. VII.5,
трек А). При этом инициируемые события
Рис. VII.5. Сечение сфериче-
сферического объема клетки (схема,
выделена только мембрана).
Затемненное кольцо — плаз-
плазматическая мембрана; А, В —
треки ионизирующих частиц
(обозначены стрелками); С
и D — области мембраны (за-
(затемнены), в которых возмож-
возможна ионизация и локализация
продуктов радиолиза воды и
липидов в случае прохожде-
прохождения соответственно треков А
и В
(с учетом диффундирующих продуктов радиолиза) будут «воздей-
«воздействовать» на области в относительно небольших участках мембраны,
на ее «полюсах».
Совершенно иная ситуация будет иметь место во втором случае,
т. е. если трек проходит как бы по касательной в районе экватора
мембраны (рис. VII.5, трек В). В этом случае воздействию будет
подвергнута существенно большая часть мембраны.
Указанные различия в рассмотренных двух крайних вариантах
пересечения мембраны клетки треком частицы могут быть причиной
2. О количественной оценке биологического действия излучений 331
разных ответных реакций клетки. Естественно, такая ситуация может
быть реализована только при облучении в малых дозах, когда
клетки пересекаются единичными треками ионизирующих частиц.
При облучении анизотропно облучаемых систем в больших дозах
указанные различия нивелируются, и последствия могут оказаться
иными.
Локализация трека в пределах генетического субстрата клетки
также может быть причиной различных последующих событий при
облучении в малых дозах.
Известно, что геном эукариот имеет сложную структурную орга-
организацию. Его ионизация в транскрибируемой области может иниции-
инициировать мутации, т. е. появление мутантных белков или пептидов. Те же
события в достаточно протяженных участках генома, представленных
повторяющимися последовательностями ДНК (а такие последователь-
последовательности в геноме человека представлены достаточно часто) могут иници-
инициировать как генетические последствия, связанные с разнообразными
структурными нарушениями в кариотипе, так и функциональные.
Функциональные нарушения могут быть связаны с изменениями
структуры хроматина, в организации которой принимают участие
также повторяющиеся последовательности ДНК, поскольку спосо-
способы организации хроматина существенны для реализации процессов
транскрипции.
Таким образом, результатом действия ионизирующих излучений
могут быть как функциональные, так и генетически значимые собы-
события в клетке. В зависимости от степени выраженности или значимости
для функционирования клетки, события, происходящие как в БМ, так
и в ДНК, могут оказаться несовместимыми с ее жизнедеятельностью.
Однако такое схематическое рассмотрение является все же упро-
упрощенным, поскольку клетка представляет собой единую динамическую
систему, элементы которой функционально взаимосвязаны. Так, ра-
диационно-индуцированное подавление ДНК-репарационных систем
клетки может оказаться причиной последующего генетического небла-
неблагополучия, связанного, например, с риском возникновения процессов
злокачественной трансформации клеток и наследственных заболева-
заболеваний. Поэтому приведенная выше упрощенная оценка радиационных
событий не снимает многих других вопросов. По крайней мере два из
них являются весьма принципиальными.
Во-первых, является ли «генетической мишенью» излучений соб-
собственно молекула ДНК или же некий «событийный комплекс» моле-
молекул, ионизации в пределах которого вызывают образование поврежде-
повреждений ДНК.
И во-вторых, обязательно ли прохождение треков ионизирующих
частиц только через клетку (или ее ядро) для инициации генетических
нарушений в этих клетках или же источник этих нарушений может
быть индуцирован радиацией в межклеточной среде, представляя
из себя, возможно, продукты, секретируемые другими облученными
клетками.
332 Гл. VII. Биологические эффекты малых доз излучений
Для ответа на первый вопрос следует уточнить определение
понятия «попадание». Как известно, оно сформулировано так: со-
событием попадания является поглощение дискретной порции энергии,
оставляемой быстрой частицей в форме ионизации и возбуждений
атомов в пределах некоего эффективного объема. Из любой точки
такого объема эта энергия, не диссипировав ниже порога работы, с по-
помощью какого-либо физического механизма миграции достигает места
действия (Н.В.Тимофеев-Ресовский, В.И.Иванов, В. И. Корогодин,
1968).
Как уже отмечалось ранее, основными факторами радиационно-
индуцированных повреждений молекул, в том числе и ДНК, являются
непосредственное поглощение энергии в молекуле (прямое действие) и
воздействие продуктов радиолиза растворителя (непрямое, косвенное
действие). Среди последних наиболее активным по отношению к ДНК
является радикал ОН'. Его средний диффузионный пробег в клетках
равен приблизительно 30 А*).
Таким образом, можно аппроксимировать мишень в виде цилин-
цилиндра диаметром 20 А (диаметр В-формы ДНК), содержащего раз-
различным образом упакованную ДНК, окруженного цилиндрическим
слоем воды толщиной в 30 А. По разным данным, содержание ДНК
в диплоидной клетке человека (и некоторых других организмов) со-
составляет F, 3-8, 3)-10~12 г. Тогда объем цилиндра ДНК, окруженного
упомянутым слоем воды, составит 1,2-10~10 см3. Существенно, что в
таком объеме собственно ДНК занимает только малую часть, и по-
поэтому можно пренебречь различиями в плотности воды и ДНК. Если
мишень представляет собой сферу, то объему мишени 1,2-10~10 см3
соответствует радиус сферы приблизительно в 3 мкм. Этот радиус
близок к таковому для ядер лимфоцитов периферической крови че-
человека. Многие радиобиологи для расчетов размеров мишени клеток
человека используют в качестве последней сферический объем с ра-
радиусом 4 мкм. Эту величину мы будем приводить и в дальнейшем.
Опираясь на выводы из многочисленных экспериментальных дан-
данных, можно заключить, что мишенью в клетках эукариот, в которой
оцениваются генетически значимые повреждения генома, является
ядро клетки диаметром в несколько микрометров.
Вместе с тем известно, что при воздействии радиации в малых
дозах часть клеток в облучаемой популяции {через которые прошли
треки соответствующих частиц) может передавать путем кон-
контактов сигналы или секретировать фактор или факторы, влияющие
на функционирование и выживаемость «соседеш или другой части
*) Расчеты проводились в отношении только радикала ОН'. Однако,
имеются «средства доставки» этого радикала активными молекулами, на-
например, Н2О2 или пероксинитритом, диффундирующими на большие кле-
клеточные расстояния и проникающими в ядро клетки (гл. VI, табл. VI.2, см.
также уравнения (VI.9) и (VI. 19)).
2. О количественной оценке биологического действия излучений 333
клеток этой же популяции, через которые соответствующие ча-
частицы не проходили. Феномен приобретения клетками свойств облу-
облученных наблюдали и после внесения необлученных клеток в среду,
в которой предварительно культивировали облученные клетки («эф-
(«эффект свидетеля», см. с. 346 в этой главе).
Учитывая феномен «свидетеля», следует заметить, что определе-
определение понятия малых доз относительно и нуждается в поправках и на
«эффект свидетеля», и на другие, внутриклеточные непрямые эффек-
эффекты ионизирующей радиации, обнаруженные при облучении клеток в
малых дозах.
2.2.2. Диапазоны доз, отличающихся по событиям поглощения
энергии (малые, низкие и средние дозы)
Как уже отмечалось, понятие «малая доза» для клеточной моде-
модели можно связать с представлением о минимальном количестве дей-
действующего начала, например, таким, как прохождение ионизирующей
частицы через критическую область, при котором в этой области воз-
возможно минимальное поглощение энергии. При этом предполагается,
что возбуждения и ионизации молекул происходят в основном вдоль
траекторий первичных заряженных частиц как отдельные статисти-
статистически независимые события. Предложено*) малой считать ту дозу,
при которой в «критической мишенш будет инициировано не более,
чем одно «радиационное событие».
Пусть ~z — среднее значение удельной энергии в микрообъемах,
распределенных в облучаемой среде. Вопрос, почему вместо дозы
вводится это новое понятие, уже рассматривался в гл. II в связи с
так называемым энергетическим парадоксом. Как правило, биологи-
биологический эффект не пропорционален дозе. Как мы видели, величина
ОБЭ излучения, выражающая различие между дозой и производи-
производимым ею эффектом, может возрастать во много раз при переходе от
больших доз к малым, но не наоборот, как может показаться. Ми-
Микродозиметрия, а конкретно теория дуального действия, позволила
разобраться в этой парадоксальной ситуации, рассматривая спектры
одиночных и кратных событий пересечения треками чувствительных
микрообъемов. При малых дозах можно ограничиться только оди-
одиночными событиями, так как остальные относительно редки. Но в
этом случае каждое попадание является эффективным, избыточных
попаданий нет, и именно поэтому ОБЭ при малых дозах возрастает.
При уменьшении массы или микрообъема (при неизменной плот-
плотности среды) среднее значение удельной энергии ~z приближается к
теоретическому значению поглощенной дозы D. Поскольку микрообъ-
микрообъемы критических областей в клетке достаточно малы, можно считать,
что D =~z.
*) Научный комитет Организации Объединенных Наций по действию
атомной радиации — НКДАР ООН, 1994, 1999.
334 Гл. VII. Биологические эффекты малых доз излучений
Обозначим среднюю дозу, поглощенную в результате одного со-
события поглощения энергии, символом Doc. Величина Doc зависит
как от качества излучения, подобно ЛПЭ, так и от длины пробега и
траектории частицы в исследуемом микрообъеме. Doc может быть по-
получена путем усреднения удельной энергии z\ (см. гл. II), выделенной
в одиночном событии, которая является стохастической величиной,
флуктуация которой определяется геометрическими и физическими
факторами облучаемого объекта. Таким образом, мы приходим к
следующему выражению для Doc:
Doc = kL = Z!. (VII.4)
Если Doc выражена в сГр, чувствительный объем V — в мкм3, а
ЛПЭ L — в кэВ/мкм, то к = 16L/V*).
Пусть I мкм — средняя длина пробега частицы в объеме с пло-
площадью поверхности S мкм2. Тогда для выпуклого объема I = 4V/S
и к = 64/5, а для сферы I = 2/3d, где d — диаметр сферы в мкм,
Doc = 161LV-1 = 20,4Ld~2 сГр. (VII.5)
При воздействии 7-излучения 60Со (ЛПЭ = 0,3 кэВ/мкм) на клеточ-
клеточное ядро диаметром 8 мкм получим Doc = 0,1 сГр = 1 мГр.
Полагая, что число событий поглощения при данной дозе D рас-
распределяется по закону Пуассона, определим вероятность появления п
событий Рп:
Рп = (D/Doc)n exp(-D/Doc)/n\, (VII.6)
где D/Doc — ожидаемое число событий.
В случае, когда каждый чувствительный объем пересекает в сред-
среднем один трек, точная оценка событий соответствует следующей си-
ситуации: около 37% объектов не пересекается треком (отсутствуют
попадания), 37% пересекает один трек, 26% — два трека и более.
При таком подходе следует, что уменьшение дозы от 1 мГр до
фоновых значений будет соответствовать только уменьшению числа
ядер клеток, через которые проходят треки ионизирующих частиц.
Характерно, что в этом случае существенно изменяется соотношение
между числом ядер клеток, которые пересекают соответственно один,
два и более треков. Например, при уменьшении D в пять раз по
сравнению с Doc, т. е. до 0,2 мГр, ядра около 82% клеток вообще
не будут пересекаться треками и только менее 2% будут пересечены
двумя и более треками.
Интересно, что за 5 часов (условное время устранения сложно
репарируемых повреждений ДНК) при фоновой дозе 1 мГр/год клет-
клетки будут подвергнуты облучению в дозе 0,57 мкГр. В этом случае
попаданиям не будут подвержены более чем 99,9% облученных клеток,
один трек пересечет около 5, 7-10~2% их, а два и более треков — всего
лишь 1,7-10~5% ядер клеток.
*) Точное значение переводного коэффициента выводилось в гл. II; оно
связано с зарядом электрона 1, 6022-Ю9 Кл.
2. О количественной оценке биологического действия излучений 335
Таким образом ясно, что происходит во всем диапазоне малых
доз, вплоть до фоновых величин, когда изменяется количество ядер
клеток, которые будут пересечены одним, двумя и более треками иони-
ионизирующих частиц. Соотношение между числом ядер клеток приведено
в табл. VII.6. Как следует из таблицы, верхнему пределу диапазона
доз соответствует доза в 0,2 мГр (= 0, 2DOC) при 7-облучении. Для а-
частиц, для которых Doc = 350 мГр, верхний предел малых доз будет
соответствовать 350-0, 2 = 70 мГр и т.д.
Однако принятое выше определение верхней границы интервала
малых доз не совсем удачно. Действительно, при D/Doc <С 1 мы как
будто бы приближаемся к ситуации, соответствующей определению
малой дозы. При анализе биологических последствий облучений в
таких «малых дозах» этот подход правомочен только в ситуации,
когда абсолютное количество клеток в облучаемой системе относи-
относительно невелико. Проанализируем сказанное на примере гемопоэти-
ческих клеток человека. Их количество примерно 1,5-109. В этом
случае при воздействии фоновой дозы в течение 5 часов 8, 9-Ю5 клеток
будут пересечены одним и около 240 ядер клеток — двумя трека-
треками. Известно, что организм взрослого человека (« 70 кг) содержит
примерно 7-Ю13 клеток, соответствующих чувствительным объемам с
массой каждого 1 нг. Продолжая предыдущий анализ, легко показать,
что в этом случае за 5 часов воздействия фоновой дозой 1 треком будет
пересечено 4-Ю10, а двумя треками — 1-Ю7 ядер клеток человека.
Естественно, что и в этом случае возможными радиационными по-
последствиями в 1-Ю7 ядер клеток пренебречь нельзя, хотя выполняется
условие D/Doc <С 1.
Определим, насколько D/Doc должно быть меньше 1, чтобы в
облучаемой популяции не содержались клетки, пересекаемые двумя и
более треками ионизирующих частиц. Для реализации такой ситуации
должно выполняться условие:
S = FN<1, (VII.7)
1 2
где F = - (D/Doc) exp (—D/Doc) — доля клеток, каждая из кото-
рых пересекается двумя треками ионизирующих частиц при дозе D;
N — абсолютное число клеток облученной популяции. Учитывая, что
exp (-D/Doc) « 1 при D/Doc < 1, можно записать (D*/Docf N/2 < 1
или окончательно
где D* — доза, при которой в облучаемой популяции S клеток коли-
количество клеток, пересекаемых двумя треками, менее 1. На рис. VII.6
область А находится в диапазоне доз, где в зависимости от числа кле-
клеток облучаемой популяции реализуется такая ситуация. Значения D*
прямо пропорциональны величине Doc.
336
Гл. VII. Биологические эффекты малых доз излучений
о
vo
о g
ф ^
*1
^ Он
о §
1
популя:
О
лучен]
, об.
н
и
леток
«
о
оличес
ф
щ °
5 1
о
Н
н
jSj
рекам
и
о
ее
ф
и"
§
С
о
0
с
A4
еди вс(
ядер,
к
I
Ф
н
i
есе
щи
» 2
в
i
к
учивш
g
и
ф
ф
VO
4 трек;
трекг
со
аЗ
ф
Н
СМ
ф
н
т—1
по-
(нет
гадани:
о
И
реков
н
паданий)
99,97
т—1
1
о
т—1
ю
со
1
О
т—1
О)
1
О
т—1
гН
со"
ю
1
О
zb
1—1
1
о
1—1
99,!
1
7-10
1^-
Ю
ST с
т—1
о
ГО
т—1
о
СО
1
О
т—1
00
0,0004
0,015
ю
о"
Oi
ю
т—1
т—1
о"
90,3
i
о
1—i
0,005
т—1
т—1
16,
т—Г
00
csi
°1
о"
т—1
0,03
csi
о~
со^
т—1
СО
30,
t^
о~
ю
58,2
ю
т—1
т—1
to
об4
т—1
00
36,
00
to
со
т—1
т—1
11
II
т—1
со^
т—1
со
со^
о
00
т—1
т—1
|>^
см
т—1
27,
со
1—1
см
см
со^
to
ю
т—1
т—1
00~
со^
сГ
ю
ю
0,05
т—1
т—1
0,8
см
cf
ю
о
ю
Г")
0,01
см
сГ
о
2. О количественной оценке биологического действия излучений 337
О
\g(N/2)
6 8 10
ьр
см
-2
-4
-6
-10
А
Рис. VII.6. Доза D*, ограничива-
ограничивающая верхний предел диапазона
малых доз, как функция числа
облучаемых клеток N. А — об-
область малых доз
Тогда для случая гемопоэтических клеток (N = 1,5-109)
неравенство (VII.7) начинает выполняться (Doc = 1 мГр) при дозе
3,6-10~5 мГр. Эту дозу клетки получают при фоновом облучении
примерно за 20 минут. В этом слу-
случае в 99,996% клеток вообще не
реализуются попадания, один трек
пройдет лишь через 3,б-10~3% кле-
клеток E,4-Ю4 гемопоэтических кле-
клеток), а число клеток с двумя по-
попаданиями — меньше единицы. С
рассматриваемых позиций верхний
предел диапазона малых доз при
облучении 7-Ю13 клеток человека
будет иной. В этом случае пара-
параметр S = FN = F-7-1013 < 1, т.е.
F < 0,14-Ю-13 и D* = 1,7-КГ7 мГр
(при Doc = 1 мГр). Такую дозу клет-
клетки получают при воздействии фоно-
фонового облучения A мГр/год) примерно
за 5,2 секунды. Из сказанного следует,
что чем больше количество клеток в их облучаемой популяции, тем
меньше доза D*, которая ограничивает сверху диапазон малых доз.
Зная значения Doc и абсолютную численность облучаемой кле-
клеточной популяции, легко найти верхний предел малых доз, т. е. ту
дозу, при которой в пораженной радиацией части клеток абсолютное
количество последних, через которые проходят 2 трека ионизирующих
частиц, будет меньше единицы. Следует отметить, что верхний пре-
предел диапазона малых доз подвижен и зависит от числа облучаемых
чувствительных объемов. Именно в диапазоне доз, ограниченном свер-
сверху D*, нет зависимости эффектов в пораженных клетках ни от дозы,
ни от ее мощности.
Таким образом, становится ясным, что при облучении достаточно
большого количества чувствительных объемов диапазон малых доз
находится в интервале фоновых облучений, причем за короткое время.
Только доза, накапливаемая при фоновом облучении в течение года
и даже суток, выходит за пределы этого диапазона. Вместе с тем
следует полагать, что к воздействию фоновых доз в течение длитель-
длительного периода клетки адаптированы. Следовательно, нам необходимо
определить диапазон, в интервале которого в клетках в среднем про-
происходят качественно те же события, что и при фоновых облучениях.
Как видно из табл. VII.6, и мы это обсуждали ранее, начиная от
фонового облучения в течение 5 часов и до значения Doc, хотя и
в разных пропорциях, через клетки проходят 1, 2, 3 и т.д. треков
ионизирующих частиц. При этом количество однотрековых событий
достигает максимума, а затем спадает, однако при этом увеличивается
количество многотрековых событий.
22 Ю. Б. Кудряшов
338 Гл. VII. Биологические эффекты малых доз излучений
Следовательно, во всем диапазоне, ограниченном сверху Doc, ка-
качественно события в пораженных клетках в среднем те же, что и при
длительном воздействии фоновых доз. Мы еще раз акцентируем это
утверждение, поскольку оно представляется довольно важным. Вме-
Вместе с тем поглощенная доза, равная Doc, соответствует ситуации, когда
в среднем через каждую клетку в облучаемой популяции проходит
один трек ионизирующей частицы. Таким образом, Doc ограничивает
сверху диапазон доз, в котором качественно в пораженных клетках
происходят события те же, что и при фоновых воздействиях.
Тем самым можно выделить еще один критерий определения
малых доз, которому соответствует дозовый диапазон, отличаю-
отличающийся по ответным реакциям клеток {адаптивным) на воздействие
радиации.
Ничего удивительного нет в том, что изменив критерий, по кото-
которому определяется диапазон малых доз, мы пришли к определению
более расширенного диапазона доз (меньший диапазон отвечал чисто
формальному определению, которое было основано на представлении
о якобы линейности всех эффектов, и как мы видели, оно уже уста-
устарело) .
Прикинем, насколько это важно. Ведь при расчете величины Doc
существует немалая неопределенность. В основном она связана с опре-
определением величины чувствительного объема (ранее эта величина уже
рассчитывалась). Учет пробега свободных радикалов и моделирова-
моделирование в связи с этим чувствительного объема позволили заключить,
что если он представлен сферой, то радиус последней приближается
к 3 мкм. Однако возможен и другой подход. Удельный парциальный
объем ДНК человека равен приблизительно 0,63 см3/г. Масса ДНК в
клетках человека примерно 7, 2-10~12 г. Тогда объем молекулы ДНК
равен 4,5-10~12 см3. Если этот объем представить в виде сферы, то
ее диаметр будет равен примерно 2 мкм. Тогда Doc для 7-излучения
60Со согласно уравнению (VII.5) равна примерно 2,1 сГр, а для 160 кВ
рентгеновского излучения (ЛПЭ = 2 кэВ/мкм) — 10,2 сГр. Значит,
при разных определениях чувствительного объема рассчитанные ве-
величины Doc различаются почти на порядок.
Таким образом, верхний предел диапазона доз, в котором каждая
из клеток облучаемой популяции получает в среднем одно попада-
попадание, может достигать нескольких сГр (для фотонов). Уменьшение
дозы от этого предела будет приводить не только к уменьшению
количества клеток, получивших попадания, но и к изменению рас-
распределения одного, двух, трех и т.д. попаданий по клеткам. В этом
дозовом диапазоне должна наблюдаться зависимость этих параметров
и от мощности дозы. Во всем этом диапазоне, поскольку качественно
пораженные клетки не отличаются от таковых при фоновых дозах,
все клетки должны быть адаптированы к действию ионизирующих
излучений.
3. Механизмы действия ионизирующих излучений в малых дозах 339
Важно отметить, что величина Doc не зависит не только от дозы,
но и от ее мощности. В зависимости от мощности дозы D/t различает-
различается время tx между двумя последовательными событиями пересечения
чувствительного объема 0,2 треками в среднем, чем определяется гра-
граница диапазона малых доз. Несколько расширим эту границу, пусть
в среднем это не 0,2, а 1 трек; это не так существенно, поскольку эта
величина условна, а расчеты упростятся. Например, мощность дозы
7-излучения в 1 мГр/сутки означает, что за сутки ядра клеток были
пересечены в среднем одним треком. Однако если мощность дозы
равна 3 мГр/сутки, то пересечение чувствительного объема в среднем
одним треком произойдет за 8 часов A/3 суток), после чего такие
события будут повторяться в среднем через 16, 24 часов и т.д. За эти
интервалы времени накапливается доза в 3 мГр. Можно рассчитать,
что при облучении в дозе 1 Гр/сутки будут происходить через каж-
каждые 1,4 мин. пересечения ядра клетки в среднем одним треком. Таким
образом, мощность дозы и Doc можно связать соотношением:
Т Тх
Таким образом, в диапазоне малых доз поглощенная доза про-
пропорциональна доле пораженных мишеней, а средняя энергия, погло-
поглощенная в объеме мишени, является дозовонезависимой величиной.
Учитывая, что в реальности распределение попаданий реализуется
по закону Пуассона, при облучении биологического объекта диапа-
диапазон малых доз ограничен значением попаданий, которые характерны
для фоновых весьма кратковременных облучений. При увеличении
поглощенных доз от этих значений до величин, при которых в сред-
среднем в каждой мишени реализуется одно событие попаданий (верхняя
граница низких доз), будет увеличиваться количество мишеней, в
которых реализованы попадания. При этом изменяются соотношения
одного, двух и т. д. попаданий в поражаемых мишенях. Поскольку эти
события характерны и для фоновых облучений в течение длитель-
длительных воздействий радиации, следует ожидать, что во всем диапазоне
рассматриваемых доз должны сохраняться эволюционно выработан-
выработанные механизмы ответных (адаптивных) реакций клеток на облучение.
3. Механизмы действия ионизирующих излучений в малых
дозах на клетки
Описание биологических эффектов облучения в малых дозах и
при низких интенсивностях позволяет прийти к выводу, что область
знаний о них представляет собой самостоятельный, быстро развива-
развивающийся раздел в современной радиобиологии. Несмотря на то, что
проблеме облучения в малых дозах посвящено уже большое количе-
количество публикаций и фундаментальных исследований, все же вопрос о
механизмах формирования и проявления вызываемых ими эффектов
часто остается еще на уровне гипотез и предположений.
22*
340 Гл. VII. Биологические эффекты малых доз излучений
Наиболее важным достижением в данной проблеме является пони-
понимание того, что эффект воздействия излучений в малых дозах нельзя
оценивать путем простой экстраполяции экспериментальных данных,
полученных при использовании больших повреждающих доз облуче-
облучения. Синусоидальная зависимость эффектов при изменениях дозы об-
облучения: гиперрадиочувствительность при облучении в сверхмалых
дозах и индуцированная радиорезистентность (адаптивный ответ)
при возрастании дозы; проявление стимуляции биологически важных
процессов роста, развития, клеточного деления и других физиологиче-
физиологических функций в период гормезиса, обратный эффект мощности доз —
уже одни только эти, наиболее изученные проявления биологического
действия ионизирующих излучений в малых дозах свидетельствуют
об их принципиальном отличии от эффектов, наблюдаемых после
облучения в более высоких дозах. Попытки объяснить пусковые
механизмы эффектов облучения в малых дозах с привычных, тра-
традиционных позиций одного только первичного повреждения ДНК на-
наталкивались на все новые и новые факты принципиального различия.
В развиваемой концепции «мембранного механизма биологического
действия малых доз» Л. X. Эйдус B001) пришел к выводу, что пер-
первичной мишенью действия радиации в малых дозах является не
ДНК, а клеточные мембраны, и в этом состоит принципиальное
отличие эффектов, вызываемых облучением в малых дозах по срав-
сравнению с большими.
Крупнейшим событием в раскрытии мембранных механизмов фор-
формирования биологического эффекта малых доз радиации стало появ-
появление новых данных о способности облученной клетки секретировать
в микросреду токсические и сигнальные факторы и передавать через
них, а также путем непосредственных межклеточных контактов необ-
лученным клеткам-соседям сигналы радиационного повреждения, вы-
вызывая у последних квазилучевые изменения.
Одно из проявлений этого эффекта, как мы отмечали ранее, было
давно известно под названием лучевого токсического эффекта, вызы-
вызываемого радиотоксинами («эндогенными радиомиметиками»). Однако
в последние годы роль радиотоксинов в вызываемом эффекте, полу-
получившем название «bystander effect», была существенным образом
уточнена, а сама проблема значительно развита в связи с исследова-
исследованиями ряда особенностей биологического действия радиации в малых
дозах.
Плодотворным оказалось направление исследований отечествен-
отечественных лабораторий в изучении процессов перекисного окисления ли-
пидов БМ, что позволило оценить вклад изменений окислитель-
окислительно-восстановительного гомеостаза и оксидативного стресса
в развитие пусковых реакций эффектов, вызываемых облучением в
малых дозах (Е. Б. Бурлакова, 2001, 2002; Ю. Б. Кудряшов, 2001 и др.).
В связи с этим вызывает особый интерес гипотеза о механизме
индукции адаптивного ответа, высказанная в недавней публикации
И. А. Боднарчука B002). Автор пришел к выводу о том, что ключом
в понимании радиоадаптивного ответа клетки на действие радиации
3. Механизмы действия ионизирующих излучений в малых дозах 341
в малых дозах является первичное усиление процессов перекисного
окисления липидов в плазматической мембране с последующей ак-
активацией находящихся на БМ рецепторов факторов роста клеток. В
результате этого происходит запуск каскадов реакций эксцизионной
репарации ДНК и апоптоза. Происходящая под влиянием адаптиру-
адаптирующих доз радиации программированная выбраковка наиболее радио-
радиочувствительной клеточной субпопуляции способствует проявлению в
оставшейся устойчивой части популяции клеток способности к адап-
тивому ответу.
В предлагаемой И. А. Боднарчуком схеме выстроена последова-
последовательность включения цепи присущих клетке метаболических
каскадов, начинающаяся с инициируемых радиацией первичных ре-
реакций пероксидации липидов в БМ, играющих роль пусковых в ак-
активации клеточных рецепторов, запускающих упомянутые каскады
через экспрессию генов, отвечающих за конечные эффекты облучения
в малых дозах.
3.1. Мембраны в механизме действия радиации в малых дозах
Наряду с традиционной генетической мишенью — ДНК — в радио-
радиобиологических исследованиях прочное место заняли и другие крити-
критические структуры — БМ. Внимание радиобиологов к ним еще более
возросло с тех пор как стали выясняться механизмы эффектов малых
доз радиации.
Мы уже отмечали, что ионизирующие излучения «не выбирают»
субстрат, их энергия поглощается всеми молекулами и структурами
клетки, а дальнейшее развитие событий связано с первичным повре-
повреждением критических структур — радиобиологических мишеней, ини-
инициирующих в конечном счете нарушение клеточных функций вплоть
до гибели клеток, клеточного опустошения, нарушения функций кри-
критических органов и тканей при облучении организма в конкретных
диапазонах доз.
В отличие от воздействия в больших дозах, радиация в малых
дозах не приводит к клеточному опустошению тканей. При облучении
в малых дозах может происходить гибель только некоторой части
популяции клеток. В подавляющем большинстве клеток развиваются
упомянутые эффекты, инициаторами которых являются изменения
структуры и функций БМ.
3.1.1. Биологические мембраны — особый принцип организации
структур в живых системах
Оценивая роль БМ в появлении и развитии лучевых эффектов,
следует кратко упомянуть о наиболее важных особенностях их роли в
интактной клетке.
Напомним, что БМ — это универсальный компонент биологических
систем. В их строении заложен особый принцип организации такой си-
системы: мозаичность самообновления, динамичность структуры цито-
скелета и выполнение барьерно-матричных функций. Разнообразные
342 Гл. VII. Биологические эффекты малых доз излучений
изменения в окружающей среде, возрастные изменения метаболизма,
инфекционные, онкологические и многие другие заболевания, иони-
ионизирующие и неионизирующие радиационные воздействия приводят к
структурным перестройкам БМ, которые, в свою очередь, вызывают
изменения нормального функционирования клеток.
Первичными неспецифическими изменениями в мембранах явля-
являются нарушения тонко отрегулированного уровня окислительно-вос-
окислительно-восстановительных процессов (редокс-гомеостаза) и нарушение физико-
химических свойств липидов.
БМ обладают свойством текучести*). Изменяясь под действием
ионизирующих излучений и других различных физических, а также
химических факторов, это свойство обеспечивает адаптивные пере-
перестройки в мембране и изменение активности мембраносвязанных
белков, воспринимающих и передающих внешние сигналы.
К числу таких молекул относятся рецепторные протеинкиназы и
другие сенсоры, ионные каналы, белки-переносчики различных моле-
молекул. Изменение функционального состояния сенсорных белков влияет
на экспрессию генов, отвечающих за адаптацию клеток к стрессовым
условиям.
К числу важнейших барьерно-матричных свойств БМ относятся:
- регуляция окислительно-восстановительного гомеостаза;
- рецепторно-сигнальная, транспортная, биоэнергетическая функ-
функции;
— создание многочисленных ионных, молекулярных и др. градиен-
градиентов в клетке, регуляция метаболических процессов;
— межклеточные взаимодействия.
Можно предположить, что при высокой радиочувствительности из-
изменение любого из перечисленных свойств БМ окажется решающим
в проявлениях эффектов ионизирующих излучений в малых дозах.
Данные о высокой радиочувствительности БМ и их ранней ре-
реакции на облучение начали появляться уже вскоре после получения
первых электронно-микроскопических снимков клетки.
3.1.2. Радиочувствительность мембран.
Гиперрадиочувствительность
В 1955 г. в первом издании монографии 3. Бака, П. Александера
«Fundamentals of radiobiology» ее авторы предположили, что пер-
первичный пусковой механизм, ведущий к лучевому поражению клет-
клетки, сводится к нарушению структурно-функциональных свойств БМ,
*) Термин «текучесть» (противоположный «вязкости») используется
для описания степени неупорядоченности и физической подвижности вну-
внутри липидного бислоя мембран.
3. Механизмы действия ионизирующих излучений в малых дозах 343
главным из которых является возрастание проницаемости и последу-
последующее окислительное повреждение структуры мембран, приводящее к
ферментативному распаду клетки. На основании этих представлений
авторы выдвинули гипотезу «высвобождения ферментов». При-
Приведем краткое изложение этой гипотезы, опубликованной в русском
издании монографии в 1963 г. [3].
Ионизирующие излучения вызывают повреждение липидной
структуры БМ (например, лизосом) и нарушение их барьерных
функций, обеспечивающих компартментализацию в клетке. Это
приводит к нарушению пространственной изоляции ферментов
от их субстратов, высвобождению ферментов и к последующему
разрушению макромолекул и внутриклеточных структур клетки.
Первичное лучевое повреждение структуры БМ представлялось
авторами гипотезы как локальный распад фосфолипидов
вследствие развития цепных процессов окисления. К сожале-
сожалению, не делая ссылок на работы Б.Н.Тарусова A954, 1957, I960),
авторы гипотезы отмечают: «известно, что ионизирующее излучение
инициирует окисление липидов, идущее по типу цепной реакции,
в результате которой каждый акт ионизации вызывает окисление
многих молекул липидов. Изолированный акт ионизации может не
повредить внутриклеточную мембрану, если его эффект не будет
усилен в результате цепного процесса, происходящего с участием
кислорода» [3, с. 267].
Многие радиобиологи обращали внимание также и на то, что
транспортные функции БМ относятся не только к уязвимым, но и
к таким, нарушения которых возникают быстро. Показано, что из-
изменения клеточной проницаемости для К+, Са2+, Na+, протонов,
фосфатных и других ионов могут наступать уже в первые секунды
и минуты после облучения и даже в процессе непосредственного дей-
действия ионизирующих излучений. По мнению многих радиобиологов,
это время слишком мало для того, чтобы успели развиться какие-
то биохимические процессы повреждения. Это позволило отнести из-
изменение проницаемости БМ к пусковым физико-химическим
эффектам облучения.
Далее было показано, что нарушение ионной проницаемости БМ
зависит от возрастания в них окисленности и текучести липидов,
приводящих к изменениям величины биоэлектрических мембранных
потенциалов, состояния клеточной пролиферации. Была высказана
идея о неспецифическом механизме действия излучений на
мембраны и что нарушения проницаемости БМ обладают высокой
чувствительностью к действию самых различных физических и хи-
химических агентов.
Выводы о высокой функциональной чувствительности БМ под-
подтверждались в ранних радиобиологических исследованиях различных
лабораторий мира. Однако с 70-80-х годов прошлого столетия начали
появляться другие, достаточно многочисленные работы, свидетель-
свидетельствующие об устойчивости БМ к повреждениям от облучения в высо-
высоких дозах in vivo и in vitro (Ятвин и др., 1976, 1982). Естественно, что
344 Гл. VII. Биологические эффекты малых доз излучений
для сопоставления этих двух кажущихся противоположными выводов
о радиочувствительности БМ требовалось проведение в одинаковых
условиях экспериментов, использования сравнимых объектов и ме-
методов исследований, поскольку при невыполнении этих правил было
трудно подчас объяснять причины несовпадения получаемых резуль-
результатов. Кроме того, как мы уже отмечали, с получением новых данных
молекулярной радиобиологии стали понятными ошибочные представ-
представления о линейной зависимости радиобиологических эффектов от до-
дозы и мощности дозы облучения. Такие представления, как известно,
значительно затрудняли объективность оценки чувствительности и
других биологических объектов и систем к излучениям.
Для характеристики реакции БМ на облучение большой инте-
интерес представляют исследования радиочувствительности упрощенных
мембранных структур — липидных моделей БМ.
Так, открытый в 1972 г. «эффект Петко» [обратный эффект
мощности дозы и гиперрадиочувствительность) на облученных
клетках был продемонстрирован также и на уровне искусственных
клеточных мембран А. Петко и В. Челак A976, 1980). Авторы показа-
показали, что помещение липосом в физиологический раствор, содержащий
радиоактивные 22Na или 3Н (мощность дозы 10~3-10~5 рад/час),
вызывает при ничтожных дозах облучения (единицы и даже
сотые доли мрад) образование гидроперекисей фосфатидилхолина
(лецитина) и активирование свободнорадикальных цепных процессов
перекисного окисления липидов мембран. Было обнаружено
понижение «квантового выхода» гидроперекисей от возрастания
мощности дозы при постоянной абсолютной величине поглощенной
дозы. Упомянутые изменения нормализуются при действии СОД
(одного из ферментов антирадикальной защиты) и различных
низкомолекулярных антиоксидантов — радиопротекторов.
Обсуждая механизм обратного эффекта мощности дозы, авторы
отмечают, что «чем меньше свободных радикалов создает ионизиру-
ионизирующее излучение в данном объеме в единицу времени (а доза меньшей
мощности формирует меньшие их концентрации), тем чаще они могут
достигать молекул внешней микросреды, не подвергшись до этого
рекомбинации». Напротив, при повышении доз (и мощности доз) в
диапазоне низкодозового облучения, т. е. при кратковременном облу-
облучении, в единицу времени образуются большие концентрации свобод-
свободных радикалов, успевающие прореагировать между собой и нейтрали-
нейтрализовать друг друга, прежде чем они окажутся способными повредить
мембрану. Поэтому и радиобиологический эффект при возрастании
мощности дозы снижается (Р. Грейб, 1996).
В диапазоне больших доз кратковременного облучения свобод-
свободных радикалов образуется достаточно много и для рекомбинации,
и для реакции с молекулами микросреды. При этом с увеличением
мощности дозы доля реагирующих радикалов с молекулами внешней
микросреды растет, радиобиологический эффект возрастает в прямой
зависимости от мощности дозы. Впоследствии данные о гиперрадио-
гиперрадиочувствительности искусственных БМ и клеток при облучении их в
3. Механизмы действия ионизирующих излучений в малых дозах 345
сверхмалых и малых дозах были многократно подтверждены рабо-
работами многих японских, американских, западноевропейских и отече-
отечественных лабораторий. Упрощенный химический состав структуры
липосом, везикул и других искусственных БМ позволил изучать весь-
весьма чувствительные к радиации процессы пероксидации в липидных
слоях мембран, лишенных антиокислителей, белков и других систем
биогенной защиты, какими обладают природные БМ, клетки и ткани
живых организмов.
Можно предположить, что обнаруженная гиперрадиочувствитель-
гиперрадиочувствительность (рис. VII.2, I) клеток и моделей БМ при сверхмалых дозах
облучения имеет сходство в ответной реакции на облучение по по-
показателям ПОЛ. По-видимому, при облучении в сверхмалых дозах
защитная система клеток, оказавшаяся более устойчивой к радиации,
еще не реагирует на облучение, не мобилизуется в клетке, позволяя
свободно развиваться оксидативным реакциям в липидах так же, как
это происходит в «чистых» липидных структурах искусственных БМ.
По мере дальнейшего возрастания дозы облучения клеток все более
активируется защитная система ингибирования процессов липоперок-
сидации.
Известно, что образование оксирадикалов, активация лучевых про-
процессов липопероксидации в плазматических мембранах и проницае-
проницаемости БМ может быть рассмотрена в качестве пускового, ведущего
механизма в проявлении цитогенетических изменений при действии
облучений в малых дозах (Е. Б. Бурлакова, 2001; Л.Х. Эйдус, 2001;
И. А. Боднарчук, 2002 и др.).
На основании полученного фактического материала можно пред-
предположить такую последовательность в развитии эффекта облучения
в сверхмалых дозах:
— радиационное образование оксирадикалов и накопление ППОЛ
в плазматических мембранах инициируют каскад стереотипных
биохимических реакций в субпопуляции наиболее радиочувстви-
радиочувствительных клеток на повреждающие воздействия, в том числе тех
механизмов, которые приводят к их апоптозу; в связи с этими
событиями наблюдаются прогрессирующие изменения липопе-
липопероксидации, вызываемые облучением клеток в сверхмалых до-
дозах (левая, восходящая ветвь кривой на рис. VII.2, I);
- при дальнейшем возрастании величины сверхмалых доз облуче-
облучения и достижении определенного дозового порога, происходит,
как отмечалось, снижение уровня ППОЛ (вследствие мобили-
мобилизации антиокислительного механизма защиты); наблюдается ак-
активация упомянутого каскадного механизма реакций на повре-
повреждение, задержка клеточного цикла и усиление работы системы
репарации ДНК в выжившей субпопуляции клеток; поэтому по-
после прохождения пика дозовой кривой возникшие изменения ли-
липопероксидации постепенно утрачиваются (правая, нисходящая
ветвь кривой на рис. VII.2, I).
346 Гл. VII. Биологические эффекты малых доз излучений
Следует отметить, что снижение уровня содержания ППОЛ в об-
облученной клетке, приводящее к исчезновению эффекта сверхмалых
доз, может зависеть не только от мобилизации антиокислителей, но
и от «утечки» (с помощью открытия пор мембран) из клетки части
токсических липидов.
3.1.3. «Эффект свидетеля» («bystander effect»)
В последние годы ушедшего столетия начали появляться сообще-
сообщения о способности клеток, подвергнутых воздействию ионизирующих
излучений в малых дозах, секретировать в окружающую среду токси-
токсические вещества и передавать ими необлученным клеткам различные
повреждения, в частности, признаки нестабильности генома*). Этот
эффект воздействия облученных клеток на необлученные получил в
зарубежной литературе название «bystander effect» (C.B.Seymour,
C.Mothersill, 1997; B.E.Lehnert, E. H. Goodvin, 1997). Он реализуется
путем межклеточных контактов и секреции в межклеточные про-
пространства активных веществ.
По-видимому, механизм секреции облученной клеткой активных
веществ является одним из способов ее защиты от избытка эндоген-
эндогенных АФК и токсических липидных оксипродуктов, избавления
от них при помощи регуляторного открытия пор БМ. Поры
во внутренней митохондриальной мембране проницаемы в норме для
веществ с молекулярной массой не более 1,5 кДа. Способность их от-
открываться в ответ на накопление АФК предохраняет клетку от накоп-
накопления ППОЛ и других токсических продуктов. Благодаря большому
диаметру открывшихся пор происходит «немедленное выравнивание
всех градиентов низкомолекулярных веществ», включая протоны и
субстраты окисления (В. П. Скулачев, 1996).
Как показали исследования последних лет, в состав секретируемых
веществ могут входить не только АФК, но и другие биологически
активные соединения (цитокины или иные факторы, способные по-
повышать в необлученных клетках уровень АФК), белок р53 и др.
Выделившиеся в межклеточную среду экзорадиотоксины (или
активные продукты, способные индуцировать эндотоксические ве-
вещества после проникновения в другую клетку), проникают в необлу-
необлученные клетки-соседи и, накапливаясь в достаточных концентрациях,
вызывают квазилучевые ответные реакции, т. е. цитогенетические и
морфологические изменения, сходные с наблюдаемыми в самих облу-
облученных клетках на разных постлучевых стадиях.
Эта способность передавать активные продукты и цито- и гено-
токсические вещества свойственна как непосредственно облученным
*) Подробнее проблема нестабильности генома будет рассмотрена в
конце этой главы.
3. Механизмы действия ионизирующих излучений в малых дозах 347
клеткам, так и части их потомков в последующих поколениях. Важ-
Важно отметить, что повышение содержания секретируемых веществ на-
наблюдалась при облучении клеток даже в сверхмалых дозах а- и j-
излучения.
Удобным объектом для исследования подобных эффектов излуче-
излучений в сверхмалых и малых дозах могут служить высоко радиочувстви-
радиочувствительные лимфоидные клетки — лимфоциты, дифференцирующиеся
ооциты, сперматогонии В, кортикальные тимоциты и др. Еще в се-
середине прошлого столетия было обнаружено, что LD50 лимфоидных
клеток может составлять всего лишь несколько десятков рад, и их
гибель обнаруживает прямую зависимость от времени инкубации. Ис-
Исследование в то время гибели *) этих клеток показывало зависимость
поражения клеток от их химического микроокружения: модифици-
модифицирующее действие оказывали различные биологически активные веще-
вещества, в том числе ППОЛ, антиоксиданты и уровень кислорода в среде.
Для лимфоидных, так же как и других клеток, обнаруживался
характерный для облучения в сверхмалых и малых дозах обратный
эффект мощности.
В экспериментах на тимоцитах Л. X. Эйдус еще в 1989 г. обна-
обнаружил, что не только химический состав микроокружения среды
оказывает на клетку модифицирующий эффект, но и концентрация
облученных клеток в среде: «чем больше концентрация клеток в облу-
облученной среде (до известного предела), тем сильнее лучевое поражение
клеток».
Анализ феномена «межклеточного взаимодействия облу-
облученных клеток» позволил прийти к выводу о способности облучен-
облученных клеток выделять медиаторы в окружающую среду, изменяя тем
самым химическое микроокружение клетки, влияющее на ход раз-
развития лучевого поражения. Используя метод ингибиторного анализа,
удалось показать, что медиаторная роль в феномене межклеточного
взаимодействия принадлежит окисленной полиненасышенной жирной
кислоте — арахидоновой, образующейся под действием фосфолипа-
зы А2 из фосфолипидов БМ и подвергающейся в последующем окис-
окислению липоксигеназой.
К выводу о «дистанционном действии облученных клеток»
пришли также и другие авторы при оценке важной роли процессов
липопероксидации в этом эффекте (Poli et al, 1985; Gutteridge et al,
1990).
Как видно, «эффект свидетеля» и примеры «межклеточного или
дистанционного взаимодействия» говорят об одном и том же фено-
феномене, только в первом утверждении речь идет о влиянии выделяемых
облученной клеткой токсических медиаторов на облученную клетку,
а во втором — и на необлученную. Итак, при воздействии радиации
в малых дозах часть клеток в облучаемой популяции, через которые
*) Следует обратить внимание на то, что гибнут сами облученные
клетки, а не их потомки.
348 Гл. VII. Биологические эффекты малых доз излучений
прошли треки соответствующих частиц, может секретировать фактор
или факторы (радиотоксины), влияющие на функционирование и вы-
выживаемость другой части клеток этой же популяции, через которые
соответствующие частицы не проходили. Более того, аналогичный
феномен наблюдали и после внесения необлученных клеток в среду, в
которой предварительно культивировали облученные клетки. Обнару-
Обнаруживается этот эффект вскоре после воздействия радиации на стадии
накопления радиотоксинов. Одним из главных биофизических меха-
механизмов передачи радиотоксинов от облученных клеток необлученным
является механизм открытия пор митохондриальных мембран.
Известно, что уже первые сигналы аномального возрастания содер-
содержания молекулярного О2, H2O2, ОН' в клетке ведут к накоплению
в клетках таких концентраций и уровня содержания ППОЛ, которые
вызывают открытие пор мембран, что приводит к быстрому удалению
из клетки излишков кислорода и радиотоксинов. При нормализа-
нормализации уровня содержания молекулярного кислорода концентрации АФК
достигают исходных величин, а это вызывает регуляторное закры-
закрытие пор.
На многоклеточных организмах одно из проявлений «эффекта сви-
свидетеля», связанное с образованием и медиаторным действием липидных и
хиноидных радиотоксинов, — лучевой токсический эффект последних —
давно хорошо изучено. В опытах с локальным облучением животных и рас-
растений, а также в экспериментах на парабионтах способность радиотоксинов
к миграции в пределах организма или у парабиотически сращенных живот-
животных через кровь — от облученного донора к необлученному реципиенту —
продемонстрирована также давно (Ю. Б. Кудряшов, 1956, 1966; А. М. Кузин,
1966).
ППОЛ, образующиеся при облучении организмов, а также при облу-
облучении и при окислении высших ненасыщенных жирных кислот, вошли в
литературу под названием «естественных (т. е. природных) радиомимети-
ков» за их способность имитировать действие излучений при введении
в необлученный организм, вызывая в нем квазилучевое поражение по
многим гистологическим, физиологическим и биохимическим проявлениям
(Ю. Б. Кудряшов и др., 1964).
Таким образом, уже в шестидесятых годах было известно о существо-
существовании некоторых из молекулярных продуктов, участвующих в реализации
«эффекта свидетеля» (радиотоксинов — ППОЛ), и об их медиаторном
радиомиметическом действии.
3.1.4. Мембранный механизм индукции радиоадаптивного ответа
Несмотря на то, что проблеме радиоадаптивного ответа клеток
млекопитающих посвящено большое количество публикаций, понима-
понимание его механизма все еще остается на уровне отдельных гипотез.
До недавнего времени существовало в основном два объяснения
причин повышения радиорезистентности клеток, облученных в малой,
адаптирующей дозе D\:
3. Механизмы действия ионизирующих излучений в малых дозах 349
— происходит гибель наиболее радиочувствительной части кле-
клеточной популяции, и в результате оставшаяся часть демонстри-
демонстрирует большую устойчивость к повторному облучению (гипотеза
клеточной селекции в популяции);
- в диапазоне адаптирующих доз облучения включаются репа-
репарационные процессы, делающие всю популяцию менее чувстви-
чувствительной к последующему облучению (гипотеза поклеточной ин-
индукции репарации ДНК).
Обе гипотезы имеют право на существование, поскольку опирают-
опираются на достоверные факты, однако оставалось неясным, являются ли
гипотезы альтернативными или могут дополнить одна другую.
Известно, что радиоадаптивный ответ клеток зависит от многих
факторов, к числу которых можно отнести гетерогенность клеток
в популяции относительно стадий клеточного цикла, пролиферации
или дифференцировки, а также от их физиологического состояния:
возраста и эндогенного фона радиорезистентности клеток, состояния
липидов БМ (например, интенсивности пероксидации и текучести
липидов).
Предполагалось в самом общем виде, без детального рассмотрения
конкретных молекулярных и биохимических процессов, что пусковая
реакция, инициирующая радиоадаптивный ответ, представляет со-
собой общий неспецифический защитный механизм ответа на внешние
воздействия. Этот механизм обусловлен нарушением окислительно-
восстановительного равновесия в клетке и сопровождается синте-
синтезом защитных белков, мобилизацией антирадикальных и антиокисли-
антиокислительных систем, активацией процессов репарации повреждений ДНК
и т.д.
В 2002 г. И. А. Боднарчук, суммировав данные литературы, вы-
выдвинул гипотезу о механизме индукции адаптивного ответа
клеток при облучении в малых дозах. Автор проследил весь путь
индукции радиорезистентности от возникновения повреждений БМ
до активации репарации ДНК и клеточной селекции. Кратко детали
этой гипотезы состоят в следующем.
Известно, что для реализации адаптивного ответа необходим кис-
кислород, т. к. облучение клеток млекопитающих в дозе D\ в условиях ги-
гипоксии эффекта защиты от повторной дозы D^ не проявляет. Показано
также, что ППОЛ и Н2О2 вызывают изменение микровязкости БМ,
снижая их текучесть, а в малых концентрациях стимулируют деление
клеток и оказывают защитный эффект на клетки при повторном
облучении их в дозе D^. Автор рассматриваемой гипотезы привел
данные о ведущей роли БМ в инициации адаптивного ответа и
схему «каскада событий, запускаемого при облучении клеток млекопи-
млекопитающих в малой дозе, приводящего к индукции реакции адаптивного
ответа», фрагменты которой представлены в табл. VII.7, рис. VII.7
и VII.8.
350 Гл. VII. Биологические эффекты малых доз излучений
Таблица VII.7. Пусковой механизм ответа клеток млекопитающих на облуче-
облучение их в малой, адаптирующей дозе D\ (начало схемы)
Облучение в
активация перекисного окисления
малой дозе D\
ф
липидов плазматической мембраны
Ф
увеличение микровязкости липидного матрикса
димеризация субъединиц
активация
прикрепление лигандов ]
Ф
рецепторов фактора роста
рецепторов
ф
к рецепторам и активация
регуляторных белков
Ф
Ф Ф
Из табл. VII.7, где изображена начальная часть предложенной
схемы, следует, что при облучении клетки в малой, адаптирующей
дозе D\ происходит первичное оксидативное повреждение плазма-
плазматической мембраны за счет активных форм кислорода, инициации
образования и накопления ППОЛ.
В результате накопления повреждений и отсутствия репарации БМ
возрастает микровязкость липидов мембраны и происходит модифи-
модификация рецепторов на поверхности клеток. Модификация заключает-
заключается в димеризации гомологичных субъединиц рецептора — такой же,
какая обычно сопровождает активацию рецепторов соответствующим
лигандом, различными физическими и химическими воздействиями.
По мнению И. А. Боднарчука, ключом к пониманию природы адап-
адаптивного ответа может послужить аналогия происходящих процессов с
наблюдаемыми при стимуляции пролиферативной активности клеток
под действием фактора роста. Поэтому к пусковым механизмам адап-
адаптивного ответа относится активация рецепторов факторов роста, вы-
вызывающих включение последующих процессов, в которых участвуют
компоненты передачи митогенного сигнала.
Передача митогенного сигнала начинается с прикрепления ми-
тогенов к активированным рецепторам и проявляется последующей
каскадной активацией различных белков.
Сразу после активации рецептора в клетке возрастает активность
фосфолипазы С (ФЛ С), фосфатидилинозитол-3-киназы (ФИ-З-К),
Ras. Продукты реакций, катализируемых этими ферментами, возни-
возникающие уже через несколько секунд после активации рецептора, —
фосфатидилинозитолтрифосфат и диацилглицерин активируют про-
теинкиназу С (ПК С). Белок Ras, связываясь с рецептором, вызывает
активацию последовательности протеинкиназ, включая митоген-акти-
митоген-активируемую протеинкиназу (МАПК) и c-Jun-N-концевую киназу (JNK).
3. Механизмы действия ионизирующих излучений в малых дозах 351
Цитоплазматические протеинкиназы ПК С, МАПК и JNK
служат основными посредниками, участвующими в передаче сигнала
от активированных рецепторов к активаторам транскрипции.
Активаторы транскрипции с-Jun/AP-l и белок р53 отно-
относят к ключевым факторам реализации радиоадаптивного ответа, так
как они непосредственно или посредством активации генов-мишеней
принимают участие в инициации процессов апоптоза и эксцизионной
репарации ДНК.
Активация генов-мишеней транскрипционного фактора
с-Jun/AP-l приводит к образованию комплекса c-Jun/AP-1
с белком c-Fos, который предварительно модифицируется ПК С
(рис. VII.7).
Мишенями транскрипционного фактора с-Jim/АР-1 являются ге-
гены, участвующие в клеточной пролиферации, дифференцировке, зло-
злокачественной трансформации и апоптозе.
Сайт связывания транскрипционного фактора с-Jim/АР-1 присут-
присутствует в гене, кодирующем МТ. МТ (металлотионин) — фермент,
участвующий в перехвате свободных радикалов. Предполагается, что
индукция синтеза МТ — один из механизмов обеспечения радиоадап-
радиоадаптивного ответа.
Транскрипционный фактор с-Jim/АР-1 способен не только акти-
активировать транскрипцию генов индукции радиоадаптивного ответа, но
и сам непосредственно участвует в повышении радиорезистентности
клеток, обеспечивая инициацию эксцизионной репарации, благодаря
узнаванию поврежденной ДНК и (или) ингибирующему действию
на транскрипцию в репарируемых участках ДНК. Таким образом
транскрипционный фактор с-Jim/АР-1 может выполнять роль как
активатора, так и ингибитора транскрипции. Стимуляция экспрессии
генов c-JUN обусловливает усиление и длительное сохранение в клет-
клетках радиорезистентного фенотипа.
Период полураспада транскрипционного фактора с-Jim/АР-1 в
клетках млекопитающих составляет около б часов. Это определя-
определяет сохранение радиорезистентного состояния клеток на протяжении
нескольких часов или клеточных циклов. В то же время измене-
изменения, сопровождающие адаптивное состояние, способны сохраняться
длительное время, например в течение многих месяцев (А. С. Саенко,
1997).
Активация гена c-FOS, регулируемого собственным продуктом —
белком c-FOS — по принципу отрицательной обратной связи, прекра-
прекращается вскоре после возрастания уровня содержания этого белка в об-
облученной клетке; ингибирование транскрипции гена c-FOS приводит
к последующему понижению и выключению адаптивного ответа.
Предполагают, что сайт связывания транскрипционного факто-
фактора с-Jim/АР-1 имеется в гене, кодирующем ДНК-полимеразу /3-
(DNA Pol /3). Этот фермент синтезирует короткие фрагменты ДНК во
время функционирования доминирующего механизма эксцизионной
репарации оснований в клетках млекопитающих.
352
Гл. VII. Биологические эффекты малых доз излучений
Ц
о
о.
гг1
Q
\
'о
<!
ел
О
fin
6
(Л
<!
'"г
о
ей
а;
и
О
а>
S
м
о
1
VO
о
7
О
6
1
т—1
fin
<
1-5
6
\
\
со
О
\
7
«2
О
3. Механизмы действия ионизирующих излучений в малых дозах 353
Сайт связывания транскрипционного фактора с-Jim/АР-1 содер-
содержится также и в других генах, продукты которых участвуют в экс-
цизионной репарации оснований, поскольку экспрессия этих генов
активируется ПК С (рис. VII.7 и VII.8).
Активированная протеинкиназа С транслоцируется из цито-
цитоплазмы в клеточное ядро и, связываясь с ядерным матриксом, осу-
осуществляет посттрансляционную модификацию ДНК-полимеразы а
(DNA Pol а), топизомеразы I (ТОР I), гистона (Н 1), ДНК и белков,
регулирующих транскрипцию, в частности белков р53 и c-Fos, а так-
также апуриновой (апиримидиновой) эндонуклеазы (АРЕ-1) (рис. VII.8).
Как видно из рис. VII.8, белок р53 («страж генома») под действи-
действием протеинкиназы ПК С переходит в клетке в стабильное состояние,
количество его возрастает и активирует транскрипцию р53-зависимых
генов CDKNIA и GADD45. Продукты этих генов активируют репара-
репарационную систему, вызывают остановку клеточного цикла, создавая
условия для репарации повреждений ДНК или инициируют апоптоз,
что обеспечивает удаление из популяции неспособных к восстанов-
восстановлению поврежденных радиочувствительных клеток. Кроме того, бе-
белок р53 может принимать непосредственное участие в эксцизионной
репарации нуклеотидов, возможно, способствуя узнаванию поврежде-
повреждений ДНК.
Топоизомераза I (ТОР I) в результате посттрансляционной моди-
модификации под влиянием ПК С переходит в активное состояние и обес-
обеспечивает деконденсацию хроматина. Это облегчает работу ферментов
репарации ДНК и тем самым увеличивает радиорезистентность кле-
клеток, облученных в адаптирующей дозе D\.
Фосфорилирование ПК С гистона Н I ослабляет компактизацию
хроматина и также способствует репарации ДНК и повышению устой-
устойчивости клеток к облучению. Активация ДНК полимеразы а под
влиянием ПК С содействует протеканию эксцизионной репарации
оснований ДНК, осуществляемой при участии ДНК полимеразы /3 и
полиАДФ-рибозополимеразы (ПАРП).
Апуриновая (апиримидиновая) эндонуклеаза 1 (АРЕ-1) — еще
один субстрат фосфорилирования протеинкиназой ПК С — являет-
является ключевым, лимитирующим ферментом эксцизионной репарации
оснований ДНК. Активация ее существенным образом усиливает ре-
репарацию ДНК, обеспечивая повышение радиорезистентности клеток
в радиоадаптивном ответе. Наряду с этим АРЕ-1 регулирует ДНК-
связывающую транскрипционную активность не только c-Jim/AP-1,
но и белка р53.
Описанная И. А. Боднарчуком схема каскадного механизма иници-
инициации радиоадаптивного ответа впервые дает приемлемое согласование
высказанных до него гипотез формирования, селекции и элиминации
радиочувствительной субпопуляции клеток и активации механизмов
репарации ДНК в клетках, выживающих после облучения в адапти-
адаптирующей дозе D\.
23 Ю. Б. Кудряшов
354
Гл. VII. Биологические эффекты малых доз излучений
Н
РР
с
о
3. Механизмы действия ионизирующих излучений в малых дозах 355
Селекционная гипотеза механизма радиоадаптивного ответа бы-
была сформулирована Д. М. Спитковским еще в 1992 г. Гибель от об-
облучения в малых дозах радиочувствительной субпопуляции клеток
скорее всего происходит вследствие активации механизмов апопто-
за, способных включаться уже при низких уровнях нерепарируемых
повреждений. Действительно, как это было показано в лаборатории
Л. А. Носкина A999), количество апоптотически гибнущих клеток воз-
возрастает после облучения культуры в адаптирующих дозах. Из схемы
видно, что лучевая активация рецепторов фактора роста способна
содействовать инициации апоптоза, осуществляемого под контролем
и при участии белка р53, выполняющего функцию «стража генома» и
обеспечивающего поддержание постоянства генома.
О зависимости адаптивного ответа от репарации ДР ДНК *)
Реакция адаптивного ответа уже в первой стадии воздействия адапти-
адаптирующих доз D\ переводит клетку в состояние готовности к последующей
репарации ДНК от ДР, которые индуцируются через 4-6 часов после воз-
воздействия повреждающей дозы. Однако для репарации ДНК от ДР необ-
необходимо включение новой программы и осуществление процесса сближения
гомологичных последовательностей ДНК в пространстве ядра клетки.
Было обнаружено, что при воздействии на лимфоциты человека рент-
рентгеновских лучей в адаптирующих дозах C-10 сГр, 160 кВ) в этих клетках
действительно происходит перемещение центромерных локусов хромосом
в направлении от периферии к центру ядра. Вместе с тем известно, что
в лимфоидных клетках с этими локусами связаны белковые Jkaros-ком-
плексы, являющиеся неспецифическими репрессорами многих генов. Таким
образом, индуцируемое облучением в адаптирующих дозах перемещение
локусов хромосом может являться фундаментальным механизмом как для
изменения спектра экспрессируемых белков (в результате переключения ак-
активности генов, необходимого для реализации программы репарации ДНК
от ДР), так и для пространственного сближения соответствующих гомоло-
гомологичных последовательностей ДНК в ядре клетки, что необходимо для репа-
репарации ДР с участием механизмов гомологичной рекомбинации. В клетках с
нарушенной репарацией ДР ДНК (например, при раке молочной железы —
мутации в генах BRCA 1 и BRCA 2) упомянутого движения локусов не
происходит.
Важно отметить, что перемещение центромерных локусов при адап-
адаптирующих дозах наблюдается в лимфоцитах человека, находящихся в Go
стадии клеточного цикла. Вместе с тем аналогичное движение имеет место
в отсутствии внешнего воздействия в лимфоцитах, находящихся в S-, G2-
стадиях клеточного цикла. Однако в последнем случае клетки теряют свою
функцию, характерную для покоящихся дифференцированных клеток.
В связи с этим было высказано предположение (Д. М. Спитковский),
что и при хронических воздействиях, если они осуществляются длительно,
дифференцированные клетки могут частично терять свою функцию. В тех
случаях, когда репарация ДНК не может быть полностью реализована,
появляются клетки с соответствующими нарушениями в геноме или же
*) Д.М. Спитковский, 2002.
23*
356 Гл. VII. Биологические эффекты малых доз излучений
клетки гибнут. В последнем случае реализуется специфическая программа
гибели клеток — апоптоз.
Итак, в инициации различных механизмов радиоадаптивного отве-
ответа клеток при облучении в малых дозах низкой интенсивности важную
роль играют мембранные механизмы, в то время как в реализации
этого ответа центральное место занимают каскады регуляторных ре-
реакций, активирующих транскрипционные факторы c-Jim/AP-1 и р53,
благодаря которым при помощи механизмов апоптоза обеспечивается
элиминация неспособной к восстановлению от повреждений высокора-
высокорадиочувствительной субпопуляции клеток и активация механизмов ре-
репарации ДНК в оставшейся части клеток, делающая их относительно
резистентными к воздействию излучения в «разрешающей» дозе.
3.2. Неспецифическая реакция биомембран и клеток на действие
ионизирующих излучений
Рассматривая различные аспекты воздействия ионизирующих из-
излучений в малых дозах, нельзя оставить без ответа вопрос о том, в
какой мере радиобиологические эффекты, наблюдаемые в биомембра-
биомембранах после облучения в этом диапазоне доз, являются специфичными.
Другими словами, могут ли аналогичные эффекты быть вызваны
действием иных, нерадиационных повреждающих факторов? Если да,
то как они проявляются в самой мембране и в целой клетке?
3.2.1. Неспецифическая реакция биологических мембран
Известно, что подобно ионизирующим излучениям, разнообразные
химические и физические воздействия, вызывая стрессовые измене-
изменения в организме, индуцируют стандартные изменения в структуре
мембран, проявляющиеся развитием общей неспецифической оксида-
тивной реакции в клетках. Многочисленные данные радиационной
биофизики позволяют говорить о том, что эффекты ионизирующих
излучений принципиально не отличаются от действия других стрес-
стрессоров, а клетки и клеточные мембраны отвечают на облучение обыч-
обычными, неспецифическими изменениями.
БМ в норме находится в жидкокристаллическом состоянии и име-
имеет определенную вязкость, величина которой находится в обратной
зависимости от текучести липидов («норма» на рис. VII. 10 и VII. 11).
Вязкость («микровязкость») — это основная характеристика
степени неупорядоченности и подвижности липидного бислоя мем-
мембран. Она играет важную роль в восприятии мембраной сигналов
различных воздействий, в том числе и ионизирующих излучений.
Изменение вязкости мембраны связано с изменениями расположения
и окисленности ненасыщенных жирных кислот в бислое. Вследствие
структурных изменений БМ происходят адаптивные перестройки и
изменения функционального состояния мембраносвлзанных белков,
воспринимающих и передающих внешние сигналы. К таким белкам
относятся протеинкиназы и другие сенсоры, а также ионные каналы и
3. Механизмы действия ионизирующих излучений в малых дозах 357
2,0-
1.5-
переносчики различных ионов и молекул. Изменения активности сен-
сенсорных белков влияют на экспрессию генов, обеспечивающую преодо-
преодоление клеткой возникших изменений, направленную на нормализацию
ее состояния.
При действии ионизирующих излучений, также как и любого дру-
другого стрессора, происходят характерные изменения вязкости липи-
дов БМ. В качестве иллюстрации таких изменений вязкости БМ от
воздействия облучения в малых дозах приведем данные Е.Б.Бурла-
ковой 1994 г. (рис. VII.9). Эти изменения после облучения в среднем
диапазоне малых доз наступают практически сразу после облучения и
обнаруживают немонотонную, колоколобразную зависимость от дозы.
Возрастание вязкости по мере увеличения дозы облучения прохо-
проходит через максимум, сменяясь затем при росте дозы спадом кривой
(рис. VII.9) вплоть до значений, меньших нормальной величины.
Интересно, что при
других, нерадиационных
стрессовых воздействиях
на клетку также наблю-
наблюдаются зависимые от их
интенсивности (дозы УФ-
излучения, температуры,
концентрации вещества во
внешней среде) как повы-
повышение, так и понижение
вязкости липидов БМ.
Например, при холодовом
или гиперосмотическом
стрессе (повышение кон-
концентрации растворенных
веществ во внешней
среде клетки) происходит
увеличение вязкости БМ,
а при гипертермии или
гипоосмотическом давлении — ее понижение. При этом наблюдается
прямая зависимость текучести мембраны от степени ненасыщенности
фосфолипидов в ней, а увеличение числа двойных связей в жирных
кислотах способствует интенсификации их окисления.
Проиллюстрируем изменения структуры и свойств БМ на приме-
примерах гипо- и гипертермического стресса (рис. VII. 10, VII.11; Л. А. Лось,
2001).
3.2.1.1. Адаптивные изменения БМ при холодовом
(гипотермическом) стрессе
При понижении температуры происходит сближение «хвостов»
(молекул жирных кислот) и заряженных головок фосфолипидов в
горизонтальной плоскости липидного слоя мембраны. Это вызывает
PQ
0,5-
0
0,06 0,12 0,18 0,24
Дозы облучения, Гр
0,30
Рис. VII.9. Относительное изменение вязко-
вязкости липидов ядерной мембраны после облу-
облучения клеток в малых дозах. На ординате
изображена вязкость в относительных к норме
(= 1,0) величинах
358
Гл. VII. Биологические эффекты малых доз излучений
щ
";:%r
Рис. VII. 10. Схематическое изображение молекулярной геометрии фосфолипидов
мембран в норме (N), при гипотермии (I) и гипертермии (II). При понижении
температуры молекулы жирных кислот сближаются, их подвижность и радиус
свободного вращения уменьшаются (I). В результате повышения температуры
происходит противоположное — молекулы раздвигаются, их подвижность и радиус
вращения возрастают (II)
норма
ш
жидкокристаллическая
фаза
зона фазового
перехода
I
16
холодовой
стресс
фаза геля
II
гипертермический стресс
дезинтеграция и нарушение
структуры мембраны
Рис. VII.11. Изменения структуры и свойств мембраны при стрессорных воздей-
воздействиях на клетку.
Норма: В норме мембрана находится в жидкокристаллической фазе.
I a-I b: При снижении температуры окружающей среды в мембране возникают
зоны разделения фаз (I а), и затем мембрана может перейти в фазу геля (I б). При
этом происходит сближение полярных головок фосфолипидов, уменьшение объема
клеток и сжатие мембран.
II: При повышении температуры может произойти частичная или полная дез-
дезинтеграция мембраны с хаотичным слиянием липидов и образованием внутримем-
бранных инвертированных фаз. Ненасыщенные жирные кислоты фосфолипидов
в разрыхленной мембране легко подвергаются окислительным реакциям, образуя
токсические продукты.
При более глубоких стрессовых повреждениях возможен пробой липидного
слоя с выщеплением окисленных фрагментов жирных кислот и образованием пор
в мембране. Это наблюдается, например, при некротической форме гибели клеток
после воздействия ионизирующих излучений в высоких дозах
3. Механизмы действия ионизирующих излучений в малых дозах 359
увеличение вязкости липидов и сжатие БМ. По мере усиления гипо-
гипотермии текучесть липидов понижается настолько, что мембрана при-
приобретает гелеобразное состояние (рис. VII.11, 16). В этом состоянии
резко снижается подвижность и конформационная мобильность мем-
браносвязанных белков, и в завершение подавляются биологические
функции БМ и клетки.
Однако в клетке имеются механизмы, защищающие ее от такого
состояния. Начало увеличения вязкости липидов (снижения текуче-
текучести) мембраны в клетке служит сигналом неблагополучия, «тревоги».
Вследствие этого мобилизуются процессы десатурации — образова-
образования двойных связей в хвостах жирных кислот фосфолипидов. Это
приводит к увеличению уровня содержания ненасыщенных жирных
кислот в мембране и восстановлению текучести.
Предполагается следующий механизм регуляции биофизического
состояния мембран с помощью десатурации жирных кислот: 1) сигнал
повышения вязкости фосфолипидов БМ передается через мембрано-
связанные сенсорные переносчики *) к промоторам генов десатураз в
клетке; 2) возрастает синтез полиненасыщенных жирных кислот, нор-
нормализуется текучесть мембран и физиологическое состояние клетки
(Д. А. Лось, 2001). Следует отметить, что индукция генов десатурации
зависит не от абсолютной температуры, а от разницы температур
преадаптации и индукции.
В случае образования избытка ненасыщенных связей при деса-
десатурации появляется опасность накопления ППОЛ, а это приводит к
мобилизации другой системы защиты клетки и мембран от поврежде-
повреждений — активации антиоксидантной системы, регулирующей окисли-
окислительно-восстановительный гомеостаз.
3.2.1.2. Адаптивные изменения БМ при гипертермическом
стрессе
При повышении температуры вязкость БМ понижается, теку-
текучесть и подвижность липидов возрастает, происходит разрыхление
мембраны. При этом усиливаются процессы липопероксидации и
накопления токсических ППОЛ, приводящих к молекулярной дез-
дезинтеграции фосфолипидов. При высокой интенсивности воздействий
происходит нарушение структурно-функциональных свойств БМ и
клетки (рис. VII.11, II).
Так же, как и при холодовом стрессе, в ответ на сигнал неблагопо-
неблагополучия включаются стандартные системы, регулирующие десатурацию
и окисление ненасыщенных жирных кислот. Повышение температуры,
увеличивая текучесть мембраны, понижает активность десатураз и
мобилизует антиоксидантные системы. Характерной для регуляции
*) Сенсорный белок-переносчик локализован в цитоплазматической
мембране. Под действием изменений вязкости БМ он может менять конфор-
мацию и/или проходить через циклы фосфорилирования-дефосфорилиро-
вания. Предполагается, что сенсорный белок обладает свойствами гистидин-
киназы. (Б. А. Лось, 2001).
360 Гл. VII. Биологические эффекты малых доз излучений
реакции на гипертермию является активация экспрессии генов тепло-
теплового шока, в частности Hsp 90 (heat shock protein 90), кодирующего
один из белков теплового шока. Этот белок способен связываться с
фосфолипидами и предохранять тем самым БМ от окислительной
дезинтеграции.
Концепция влияния текучести липидов мембраны на регуляцию
экспрессии генов подтверждена многими исследованиями.
В зависимости от природы и интенсивности фактора, воздействую-
воздействующего на мембрану, клетка мобилизует те или иные механизмы сохране-
сохранения гомеостаза. При осмотических стрессах клетка активирует синтез
биологически активных веществ, регулирующих ее объем (глицерина,
пролина, глицин-бетаина), или пытается избавиться от избытка воды
в цитоплазме.
Помимо описанных механизмов регуляции, через мембраны мо-
могут активироваться иные способы восприятия и передачи сигналов
в клетке. Это может происходить при участии ассоциированных с
рецептором ферментов — фосфолипазы С, протеинкиназы С, механиз-
механизмов регуляции проницаемости, мобилизации ионов Са2+, изменения
уровней содержания циклических нуклеотидов и др.
Рассмотренные изменения текучести мембран связаны не только с
уровнем ненасыщенности жирных кислот, но и зависят от степени их
окисленности. Они являются частью общей неспецифической реакции
регуляции гомеостаза, происходящей в клетке в ответ на физические
и химические воздействия.
Здесь вспоминаются слова основателя теории стресса Ганса Селье
о том, что стресс — это состояние живой системы, характеризующееся
выработкой адаптационных реакций в ответ на неблагоприятные фак-
факторы среды.
3.2.2. Стадии неспецифической оксидативной реакции клетки
Любой стрессор вызывает в клетке ответную стресс-реакцию —
«оксидативный стресс», проявления которого зависят от интенсивно-
интенсивности и длительности воздействия.
Эта реакция состоит из двух основных взаимосвязанных процес-
процессов: оксидативного, развивающегося в результате накопления ОРТ,
приводящего к патологическому эффекту, и сдерживания этого про-
процесса с помощью мобилизации запасов защитных ресурсов клетки —
системы ферментных и низкомолекулярных антиоксидантов, т. е. ем-
емкости антиокислительного буфера*) (АОБ) (рис. VII.12).
При действии ионизирующего излучения в малых дозах на клетки
и организмы проявляются первые две стадии неспецифической стресс-
*) Емкость антиокислительного буфера характеризует суммарную ак-
активность защитных ресурсов клетки (гипоксического, антирадикального,
антиокислительного и др.) от токсического действия ОРТ. Подробнее о со-
составе компонентов антиокислительного буфера см. в последующих разделах
учебника.
3. Механизмы действия ионизирующих излучений в малых дозах 361
я I
а
к
к
О)
0 ОКИСЛ
сног
1
О)
к
н
к
и
к
о
и
н
м
а 1
k, i
Па ^
Х^^Х^ 16
1а / \ /
/ \ /
/^^v / \ /
/Л /л
' / \ ^^ \
1 \ \ норма
стадия стадия \
тревоги адаптации \
\Пб
\
стадия
истощения
Время после воздействия
к,
VO
о
о
м
л
i
исли
^ОК
н
о
о
н
г
Рис. VII. 12. Схема соотношения интенсивности перекисного окисления липи-
дов (I) и емкости антиокислительного буфера (II) на разных стадиях оксидатив-
ного стресса клетки и организма
В ответ на стресс-воздействие возникает первая реакция — всплеск ПОЛ и
образование ППОЛ (I а). Это «стадия тревоги», которая служит сигналом для
мобилизации антиокислительных ресурсов клетки — возрастания емкости анти-
антиокислительного буфера, сдерживающего процессы перекисного окисления липи-
дов (II а) в «стадии адаптации».
Процесс возрастания устойчивости организма на стадии адаптации связывают
с активизацией антиокислителей, открытием пор БМ для секреции во внешнюю
среду токсических веществ и с восстановлением «критических» органов клеток от
возникших повреждений.
Защитные ресурсы клетки небезграничны, и наступает момент, когда емкость
антиокислительного буфера уменьшается и достигает в «стадии истощения» уров-
уровня ниже стационарного состояния нормы (II б), предоставляя возможность резко
развиваться процессам липопероксидации (I б)
реакции. Стадии тревоги оксидативного стресса соответствует эф-
эффект гиперрадиочувствительности, а адаптации — радиоадаптивный
ответ (РАО) и эффект гормезиса.
Облучение в высоких дозах приводит к состоянию, характерно-
характерному для стадии истощения. В этой стадии происходит значительное
расходование антиокислительного буфера. Параллельно этому «вы-
«вырывается» из-под контроля и развертывается по цепному механизму
процесс липопероксидации. Наблюдается резкое возрастание ОРТ, в
том числе прогрессирующее накопление ЛРТ. В этой стадии в наи-
наибольшей степени развивается дисбаланс регуляторных (защитных) и
оксидативных механизмов. При этом в клетках и тканях происходит
изменение соотношения между уровнями емкости антиокислительного
буфера (АОБ) и содержания оксирадиотоксинов (ОРТ) в направлении
понижения этого соотношения, когда АОБ/ОРТ становится меньше 1
362 Гл. VII. Биологические эффекты малых доз излучений
(естественно, что в норме, в состоянии гомеостаза, этот коэффициент
равен единице и он может превышать ее при мобилизации и увеличе-
увеличении содержания защитных ресурсов в клетке). В радиобиологии это
соотношение получило название эндогенного фона радиорезистентно-
радиорезистентности (ЭФР) (Е. Н. Гончаренко, Ю. Б. Кудряшов, 1980).
Специфика нарушений окислительно-восстановительного гомео-
гомеостаза при различных заболеваниях заключается в характере и вели-
величине изменений АОБ и ОРТ. Длительная или интенсивная активация
перекисного окисления липидов при снижении емкости антиокисли-
антиокислительного буфера вызывает значительные биохимические изменения
облученных клеток и внутриклеточных структур. Характер этих из-
изменений требует дальнейшего изучения в свете концепции включения
биохимических модулей ответа в реакции клеток на повреждения.
При крайней интенсивности острого лучевого поражения возни-
возникают деструктивные процессы, приводящие к такой форме клеточной
гибели, как непрограммированное «убийство» — некроз. Менее интен-
интенсивные воздействия вызывают, как известно, стимуляцию программи-
программированной гибели клеток, «самоубийства» — апоптоз.
4. Радиационно-индуцированная нестабильность генома
(В. К. Мазурик, В. Ф. Михайлов)
До сих пор в данной книге уделялось главное внимание рассмот-
рассмотрению радиационного поражения и восстановления на разных
уровнях биологической организации — от молекулярного и клеточного
до уровня организма — эффектов, проявляющихся с одной стороны
инактивацией молекул, разными формами клеточной гибели, гибелью
организма и с другой — процессами структурного восстановления
объектов названных уровней и выживаемостью. Меньше рассмат-
рассматривались функциональные характеристики клеток и организмов,
выживших после облучения. Между тем это весьма важный аспект
последствий действия ионизирующей радиации как на клеточном, так
и на организменном уровне, поскольку имеет отношение к механизмам
радиационного канцерогенеза и преждевременного старения, основу
которых составляют клеточные изменения. В опытах in vitro уже
давно было обнаружено особое состояние потомства облученных кле-
клеток, делающее их существенно отличными от нормальных, необлу-
ченных (A.R.Kennedy, J. В. Little, 1980; C.B.Seymour, С. Mothersill,
1986; И. И. Пелевина с сотр., 1992, 1995; W. F. Morgan et al, 1996). Оно
проявлялось рядом феноменов: спонтанным возникновением так назы-
называемой отсроченной репродуктивной гибели в потомстве облученных
клеток в отсутствие воздействия излучения, снижением жизнеспособ-
жизнеспособности потомков клеток, облученных в дозе 50 сГр, при дополнитель-
дополнительном воздействии химических соединений, влияющих на клеточный
метаболизм, появлением гигантских клеток как при остром, так и
4. Радиационно-индуцированная нестабильность генома 363
при хроническом воздействии излучений. Восстановление от потен-
потенциально летальных повреждений сопровождалось почти в 20 поко-
поколениях потомства облученных клеток усилением элиминации клеток
с микроядрами. Более чем в 30 поколениях потомства облученных
клеток наблюдали спонтанную индукцию сестринских хроматидных
обменов, увеличение числа клеток с такими обменами и с микро-
микроядрами, повышение радиочувствительности и отсутствие адаптивного
ответа (И.И.Пелевина с сотр.). Сходные описанным здесь функци-
функциональным изменениям в клеточном потомстве облученных клеток
наблюдали еще раньше и продолжают исследовать в настоящее время
И. Б. Бычковская, Г. К. Очинская и др. A973-2002).
В последнее десятилетие это состояние получило название радиа-
ционно-индуцированной нестабильности генома и стало одной из са-
самых активно разрабатываемых проблем современной радиобиологии.
Термином «радиационно-индуцируемая нестабильность ге-
генома» обозначают радиобиологический феномен, проявляющийся в
том, что часть клеток, выживших после облучения, может давать
функционально измененное потомство, в котором с высокой частотой
на протяжении многих поколений возникают de novo аберрации хро-
хромосом и генные мутации, в ряде случаев приводящие к повышенной
клеточной смертности путем апоптоза. Эти отсроченные проявления
радиационного эффекта не имеют клонального характера, обнаружи-
обнаруживаются с высокой частотой, сильно зависят от вида воздействующего
излучения, типа облучаемых клеток.
Таким образом, в отличие от перманентной геномной неста-
нестабильности, свойственной таким наследственным болезням, как
анемия Фанкони, синдром Блюма, атаксия-телеангиэктазия и др.,
радиационно-индуцированная нестабильность генома не определяется
возникновением стойких нарушений в первичной структуре ДНК,
копированием в клеточном потомстве радиационных поврежде-
повреждений ДНК родительских клеток, не имеет клонального характера и
может возникать в клетках, не подвергавшихся облучению, но полу-
получивших сигналы повреждения от облученных «соседей» («эффект
свидетеля»). Очевидно, она обусловлена длительно сохраняющимся
приобретенным изменением функционирования клетки как целого,
передаваемым потомству посредством эпигенетических механизмов.
4.1. Варианты проявления нестабильности генома
В табл. VII.8 представлены характеристики клеток по существен-
существенным показателям (мутации, состояние систем контроля и обеспечения
постоянства генома) в норме и при геномной нестабильности различ-
различной природы.
4.1.1. Соматические клетки и спонтанные мутации
В норме ДНК клеток организма человека и животных подвергается
постоянному воздействию АКСС, образующихся в ходе окислительно-
восстановительного метаболизма @'2, Н2О2, ОН', N0', пероксинитрит
364
Гл. VII. Биологические эффекты малых доз излучений
О
1
И
о
к
о
00
сб
ЕГ
К
VO
сб
s
i l
i l
Я" >»
3 ?
о
т—I
Л
Р 1
И
О
о
1—I
Л
I
о
1'S
Р 1
о о
о
I
о
V/
н
I
3
4. Радиационно-индуцированная нестабильность генома
365
о
Ч оЗ
н
Он
о
ч:
аЗ
К
Н
о
о
О
о
366 Гл. VII. Биологические эффекты малых доз излучений
и др.). В результате возникает значительное количество повреждений,
большинство из которых эффективно устраняется механизмами репа-
репарации ДНК. Тем не менее часть таких повреждений сохраняется в
геноме и служит структурной основой спонтанных мутаций, прояв-
проявляющихся в норме с частотой ^ 10~6. Если клетки с такими мута-
мутациями преодолевают барьеры сверочных точек клеточного цикла и не
устраняются путем апоптоза, то эти мутации наследуются потомством
клеток при помощи клонального механизма. Фенотипически такие
мутации практически никак себя не проявляют, и клетки тканей, в
которых они обнаруживаются, характеризуются нормальным темпом
старения и гибели.
4.1.2. В-лимфоциты — представители клеток с функциональной
нестабильностью генома
Непостоянство генома не является патологией, скорее оно имеет
эволюционно-приспособительную функцию. В клетках различных ор-
организмов она осуществляется путем амплификации генов с последу-
последующим адаптивным изменением части их в ответ на изменение среды.
Наиболее демонстративным примером описанного явления служит
ответ В-лимфоцитов на воздействие антигена, завершающийся выра-
выработкой специфических антител.
Гены, кодирующие различные части цепей иммуноглобулинов, в
недифференцированных В-клетках разобщены и при дифференциров-
ке, вызванной антигенным стимулом, соединяются между собой. До
начала этого процесса существуют много сотен генов вариабельных
(variable, V) частей легких и тяжелых цепей иммуноглобулинов. От-
Отдельно от них на расстоянии тысяч пар нуклеотидов перед началом
генов константных (constant, С) частей иммуноглобулинов расположе-
расположено несколько коротких сшивающих (joining, J) последовательностей.
Еще левее их находятся также очень короткие участки разнообразия
(diversity, D).
Для синтеза антител в результате внутрихромосомных рекомби-
рекомбинаций возникает колоссальное количество вариантов соединения V-,
D-, J- и С-генов. При соединении V- и J-генов рекомбинация происхо-
происходит не в точно фиксированных местах, а с отклонением на несколь-
несколько нуклеотидов. Поэтому в некоторых участках уже собранных ге-
генов усиливается соматический мутагенез. В результате многообразие
вариаций существенно увеличивается, обеспечивая соответствующее
многообразие клонов лимфоцитов как материала для отбора тех из
них, которые синтезируют антитела, специфические к антигену.
Состояние систем контроля стадий клеточного цикла и окислитель-
окислительно-восстановительного гомеостаза, частота апоптоза и радиочувстви-
радиочувствительность на фоне активированной системы V(D)J-peкoмбинaции*)
не отличаются от нормальных для данного типа клеток значений.
*) V(D) J-рекомбинация — перестройка генома В-лимфоцитов в ответ на
антигенный стимул, завершающаяся выработкой этими клетками специфи-
специфических антител.
4. Радиационно-индуцированная нестабильность генома 367
4.1.3. Перманентная (генетически наследуемая) нестабильность
генома
Синдромы наследуемой хромосомной нестабильности лежат в осно-
основе группы аутосомных рецессивных заболеваний человека, в которую
входят атаксия-телангиэктазия, анемия Фанкони, синдромы Блюма,
Вернера и Ниджмегена и атаксия-панцитопения. Для них характерны
повышенная частота спонтанных мутаций (> 10~5), обусловленная
передачей молекулярных дефектов в установленных локусах ДНК,
специфичных для каждого из синдромов.
В системе контроля за стабильностью генома при таких заболева-
заболеваниях обнаружены существенные дефекты.
При атаксии-телангиэктазии это мутация в гене ЛГМ*), ответ-
ответственном за распознавание разрывов ДНК и включение системы све-
рочных точек клеточного цикла, активации репарации ДНК и апо-
птоза путем стабилизации белка р53, контролирующего эти процессы.
Для анемии Фанкони характерны мутации в генах FACC**), кон-
контролирующих белки, образующие при этом заболевании 5 групп ком-
комплементации. Предполагается, что в результате страдают процессы
узнавания дефекта — поперечных сшивок ДНК, развития и заверше-
завершения репарации. Кроме того, клетки высокочувствительны к действию
активных форм кислорода, что свидетельствует об инактивации в них
генов, участвующих в антиоксидантной защите.
При синдроме Блюма это мутации в гене ШуМ***), локализо-
локализованном в участке 15q26.1 хромосомы 15. Белок, кодируемый этим
геном, принадлежит к семейству геликаз, необходимых для раскру-
раскручивания нитей ДНК в репликативных вилках при репликации и для
обеспечения доступа репарационного комплекса к месту поврежде-
повреждения ДНК. Поэтому при синдроме Блюма мутация BLM приводит к
возникновению высоко рекомбиногенных разрывов ДНК, нарушению
разделения гомологичных нитей ДНК во время клеточного деления
с увеличением количества анеуплоидий и разрывов хромосом. Неспо-
Неспособность репарационного комплекса взаимодействовать с участками
повреждения ДНК сопровождается увеличением протяженности обла-
областей нерепарированной ДНК, что объясняет возрастание генетической
нестабильности, чувствительности к мутагенам и частоты возникно-
возникновения аберраций хромосом при этой патологии.
Для всех рассмотренных заболеваний, характеризующихся гене-
генетически передающейся нестабильностью генома, типична высокая
чувствительность к генотоксическим агентам и склонность к онко-
трансформации.
*) Ataxia-teleangiectasia mutated — ген, мутация в котором лежит в
основе заболевания атаксия-телеангиэктазия.
**) Гены Fanconi anemia complementation control — гены контроля ком-
комплементации при анемии Фанкони.
***) Bloom mutated — ген, мутация в котором лежит в основе заболевания
синдром Блюма.
368 Гл. VII. Биологические эффекты малых доз излучений
4.2. Характеристика некоторых проявлений радиационно-
индуцируемой нестабильности генома
Существенные отличия от рассмотренных вариантов геномной
нестабильности обнаруживаются при радиационно-индуцируемой
нестабильности генома.
Мутации при радиационно-индуцируемой нестабильности
генома. Как и генетически наследуемая геномная нестабильность,
радиационно-индуцируемая нестабильность генома характеризуется
высокой частотой мутаций, достигающей значений > 10~5.
Установлено, что после радиационного воздействия в десятках по-
поколений клеток число их значительно превосходит спонтанный уро-
уровень. Так, частота мутаций в локусе гуанин-гипоксантинфосфори-
бозил-трансферазы (hprt*)) у потомства облученных клеток после
95—100 делений была на 2 порядка выше спонтанного уровня, до-
достигая 10~3. Если при непосредственном радиационном воздействии
более 70% мутаций относится к делециям, то при радиационно-ин-
радиационно-индуцируемой нестабильности генома они имеют характер точковых,
затрагивая многие гены: hprt, резистентности к уабаину, тимидинки-
назы (tk**)), опухолевого супрессора р53 и, возможно, др. При этом
в мутационный процесс вовлекаются не только кодирующие участки
генов, но и интронные, не экспрессируемые, а также минисателлитные
области всего генома.
При радиационно-индуцируемой нестабильности генома в популя-
популяциях клеток длительно наблюдается повышенный уровень аберраций
хромосом. При этом обнаруживаются множественные перестройки их
структуры, и это коррелирует с пониженной клоногенной активно-
активностью клеток (повышением частоты проявлений их отсроченной ре-
репродуктивной гибели).
В силу разных причин общее число клеток с аберрациями хро-
хромосом с каждым митозом убывает. При этом клоны с хромосомной
нестабильностью в следующей клеточной популяции могут восстанав-
восстанавливать стабильность, сохранять тот же уровень нестабильности либо
становиться еще более нестабильными. В клетках, претерпевших опу-
опухолевую трансформацию, нестабильность хромосом становится устой-
устойчивым признаком.
Получены прямые доказательства существования феномена ра-
диационно-индуцированной нестабильности генома in vivo.
Так, если мышиные клетки СЗН/10Т1/2 подвергали воздействию
рентгеновского излучения in vitro, а затем выращивали потомство их
in vivo (в организме сингенных мышей СЗН) в течение около б мес,
то оказалось, что частота геномных перестроек в условиях in vivo
существенно выше, чем при смене того же числа поколений при
*) hprt-мутация — мутация в гене гуанин-гипоксантинфосфорибозил-
трансферазы (hypoxantine-phosphoribosyltransferase).
**) tk-мутация — tymidinekmase-мутация в гене тимидинкиназы.
4. Радиационно-индуцированная нестабильность генома 369
культивировании in vitro. Причем перестройки хромосом затрагивают
50-100% клеточных субклонов.
При пересадке клеток костного мозга мышей-самцов СВА/Н, под-
подвергнутых воздействию нейтронов с энергией 2,2 МэВ в дозе 0,5 Гр
B52Cf, мощность дозы 0,04 Гр/мин), самкам-реципиентам, которые
были облучены на рентгеновской установке в дозе 10 Гр, обнаруже-
обнаружены четкие проявления радиациационно-индуцируемой нестабильности
генома на протяжении всего срока исследования A3 мес). Пересадка
сингенных облученных D0XY) и необлученных D0XYT6T6) клеток
костного мозга, отличавшихся от первых стабильной Тб-реципрок-
ной транслокацией между хромосомами 14 и 15, показала наличие в
потомстве 40XYT6T6 необлученных клеток хроматидных и хромосом-
хромосомных разрывов, типичных для индуцированной нестабильности генома,
количество которых, правда, было несколько ниже, чем в условиях
культивирования in vitro.
Схематически характер проявления мутационного процесса при
радиационно-индуцированной нестабильности генома представлен в
табл. VII.9.
При действии ионизирующей радиации в малых дозах в нормаль-
нормальных клетках с эффективно функционирующими механизмами кон-
контроля клеточного цикла и репарации ДНК происходит устранение
спонтанно возникающих и радиационных повреждений ДНК (путем
репарации или апоптоза), восстановление возмущенного окислитель-
окислительно-восстановительного гомеостаза. В результате после деления облу-
облученной клетки возникает клон ее потомства с нормальным фенотипом.
Отдельные клетки с повреждением ДНК крайне редко преодолевают
барьеры сверочных точек клеточного цикла и апоптоза и дают жиз-
жизнеспособное мутантное потомство, формирующее путем генетического
механизма наследования повреждений мутантный клон. Практически
такие клетки в большинстве случаев функционально не отличимы
от нормальных, и мутации в них выявляются только специальными
методами.
4.2.1. Эпигенетическое наследование при радиационно-
индуцированной нестабильности генома
Экспериментальные данные, полученные в опытах in vitro и in vivo,
свидетельствуют о том, что после облучения выживает еще одна часть
клеток — те, в которых адаптационные механизмы были активирова-
активированы, но не пришли в норму к моменту деления. В таких клетках нет
повреждений ДНК, препятствующих преодолению барьера сверочных
точек клеточного цикла, однако генерация активных форм кислорода
в них усилена, а их ДНК чувствительна к действию оксирадикалов,
липидных радиотоксинов и других генотоксических агентов.
В таких клетках и обнаруживается радиационно-индуцированная
нестабильность генома со всеми ее фенотипическими проявлениями.
При этом она возникает как в потомстве клеток, непосредственно
подвергавшихся облучению (табл. VII.9, А), так и в потомстве клеток,
24 Ю. Б. Кудряшов
370
Гл. VII. Биологические эффекты малых доз излучений
И"
к
К
6
к
X
о
к
И"
о л
S §
tj vo
сб
И"
к
VO
сб
4. Радиационно-индуцированная нестабильность генома 371
через которые при низких дозах излучения не прошли треки иониза-
ионизации, либо они не затронули клеточное ядро, оказав воздействие только
на цитоплазму (клетки-«свидетели») (табл. VII.9, Б).
Если генетическое наследование подразумевает передачу от роди-
родителей потомству записанной в ДНК информации, необходимой для
воспроизведения определенных биологических структур, то под эпи-
эпигенетическим наследованием подразумевают передачу информации о
функциональном состоянии генетических программ для названных
структур, т. е. о наследуемых изменениях активности какого-либо гена
или совокупности генов после воздействия на родительские клетки
внутренних или внешних модифицирующих факторов. Именно это мо-
может иметь существенное значение в механизмах радиационно-индуци-
рованной нестабильности генома: изменение свойственной необлучен-
ной клетке модели генной экспрессии, передача измененной модели, в
которой хроматин дочерних клеток более чувствителен к повреждаю-
повреждающему действию оксирадикалов и оксирадиотоксинов, воспроизведение
этой модели в фенотипе последующих поколений.
4.2.2. Возможная роль «эффекта свидетеля»
Объяснение механизма возникновения радиационно-индуцирован-
ной нестабильности генома в последнее время пытаются найти путем
выяснения причин так называемого «эффекта свидетеля».
Как уже отмечалось, этот феномен обнаружен в опытах, когда
в культуральную среду от облученных клеток высеивали интактные
клетки, которые не подвергались действию ионизирующей радиации.
Вскоре такие клетки, а затем и часть их потомства начинали про-
проявлять все или многие из признаков, характерных для радиационно-
индуцированной нестабильности генома, как если бы были потомками
облученной клетки.
«Эффект свидетеля», проявляющийся индукцией генетических
изменений в необлученных ядрах клеток, может быть следствием двух
различных механизмов.
Первый механизм предполагает приобретение клетками свойств
нестабильности генома путем контактов с клетками-носителями неста-
нестабильности. Этот механизм реализуется через р53-опосредуемый путь
проведения сигнала повреждения.
Известно, что содержание белка р53 в клетке, играющего роль
стража генома, ответственного за поддержание его постоянства путем
активации механизмов сверочных точек клеточного цикла, репара-
репарации ДНК и апоптоза, при повреждении ДНК повышается. Такое
повышение служит индикатором поврежденности ДНК и после облу-
облучения обнаруживается в большей доле клеток легочного эпителия, чем
можно было ожидать на основании данных о числе клеток, которые
были повреждены а-частицами непосредственно. Важно отметить,
что повышение содержания белка р53 наблюдалось даже после облу-
облучения а-частицами в таких низких дозах, как 0,6 сГр, а при действии
редкоионизирующего рентгеновского излучения — в дозе 10 сГр.
24*
372 Гл. VII. Биологические эффекты малых доз излучений
Отмечается участие в реализации «эффекта свидетеля» экспрес-
экспрессии генов, связанных с клеточным циклом, — р53*), p21/Wafl **),
p34cdc2 ***), циклина В1 ****) и rad51. Так, при исследовании ре-
реакции культуры первичных диплоидных фибробластов человека на
низкоэнергетическое а-излучение в малых дозах было отмечено, что,
хотя треки частиц проходили только через 5% ядер, наблюдалось
3-4-кратное увеличение уровней содержания белков р53 и p21/Wafl.
Повышенная экспрессия этих белков в культуре клеток отменялась
прединкубацией с линданом — ингибитором межклеточных контакт-
контактных взаимодействий, что указывает на важную роль передачи сигна-
сигналов от непосредственно поврежденных радиацией клеток через меж-
межклеточные контакты.
При облучении культуры клеток низкоэнергетическими а-частица-
ми, когда они пересекали только ~ 2% ядер, наблюдали повышенную
экспрессию генов в ограниченных участках культуры. При этом в
некоторых группах клеток, не подвергавшихся облучению, наблюдали
повышенный уровень содержания соответствующих белков, в то время
как в других клетках тех же самых культур их содержание оставалось
на исходном уровне. «Эффект свидетеля» существенно подавлялся
линданом, а также при понижении плотности клеточной популяции.
Согласно другому механизму, облученные клетки секретируют ци-
токины или другие факторы, которые в необлученных клетках по-
повышают внутриклеточный уровень содержания АФК. Действитель-
Действительно, если клетки, облученные потоком низкоэнергетических а-частиц,
после отмывания от среды, в которой их облучали, высеивали на
жидкую среду, то при использовании этой среды в последующем для
инкубации необлученных тест-клеток наблюдали повышение в них ча-
частоты сестринских хроматидных обменов. Поскольку использованная
среда непосредственному облучению не подвергалась, то наблюдав-
наблюдавшийся эффект мог быть только результатом накопления в ней неких
факторов, выделявшихся облученными клетками. Эффект свидетеля
не развивался, если среду подвергали тепловой обработке или облу-
облученные клетки до их удаления из среды обрабатывали ингибиторами
белкового синтеза. Это доказывает, что данные секретируемые факто-
факторы имеют белковую природу. Они способны индуцировать повышение
*) Ген опухолевого супрессора — белка р53, выполняющего функции
стража генома; новое название — ТР53 (transcription protein 53).
**) p21/Wafl, WAF1, CIP1 - wild-type p53-activated fragment 1, Cdk
(cyclin-dependent kinase)-interacting protein 1 — белок с мол. массой 21 кДа;
фрагмент 1, активируемый белком р53 дикого типа; новое название —
CDKN1A.
***) Димерный белок с мол. массой 34 кДа, участвующий в контроле
цикла клеточного деления (cell division cycle); новое название — CDC2.
****) Один из циклинов семейства белков-инициаторов продвижения кле-
клеток по циклу; новое название — CCNB1).
4. Радиационно-индуцированная нестабильность генома 373
внутриклеточного содержания АФК, включая супероксидный анион-
радикал О 2 и пероксид водорода, оксирадиотоксинов — критических
интермедиатов в распространении повреждения.
Для реализации «эффекта свидетеля» по этому механизму чрезвы-
чрезвычайно важно состояние внутриклеточных систем, контролирующих
окислительный гомеостаз. Так, способность культуральной среды
после выращивания на ней кератиноцитов человека или мутантных
клеток китайского хомячка СНО-К1, подвергнутых воздействию 7-из-
лучения, вызывать «эффект свидетеля» в необлученных клетках зави-
зависела от наличия или отсутствия в таких клетках ферментов лактатде-
гидрогеназы или глюкозо-б-фосфатдегидрогеназы, играющих важную
роль в окислительно-восстановительных превращениях углеводов.
Среда выращивания облученных клеток с мутантным фенотипом по
названным ферментам, т. е. (LDH-/-) *)- или (G6PD-/-) **)-клеток,
обладала пониженной способностью или вообще оказывалась
неспособной вызывать «эффект свидетеля» в нормальных клетках,
культивируемых в ней, что проявлялось отсутствием апоптоза. Транс-
фекция клеток геном G6PD приводила к восстановлению «эффекта
свидетеля». Обработка клеток антиоксидантными веществами — L-
лактатом и L-депренилом — также предотвращала действие фактора
«свидетеля», проявлявшегося клеточной гибелью, что указывает
на участие энергетического/окислительно-восстановительного ме-
метаболизма в экспрессии клетками радиационно-индуцированного
«эффекта свидетеля».
«Эффект свидетеля» зависит от дозы облучения нелинейно. Он
максимален при облучении в малых дозах.
Таким образом, очевидно, что в инициировании радиационно-ин-
дуцированной нестабильности генома могут играть роль оба механиз-
механизма «эффекта свидетеля»: как сигналы о повреждении, передаваемые
через клеточные контакты от потомков облученных клеток к интакт-
ным, так и сигналы через культуральную среду. Пока не установле-
установлена длительность существования «эффекта свидетеля» в поколениях
клеток; однако есть доказательство, что этот эффект наблюдается
до тех пор, пока облученные клетки не вернутся к исходным уров-
уровням реакции на повреждение ДНК. Таким образом, первоначальный
профиль повреждения усиливается «эффектом свидетеля», и клетки,
которые затронуты этим механизмом, в течение ряда поколений могут
оставаться в области повышенного риска генетического изменения.
*) Нокаутная мутация (в двух аллелях гена) лактатдегидрогеназы
(LDH).
**) Нокаутная мутация (в двух аллелях гена) глюкозо-б-фосфатдегидро-
глюкозо-б-фосфатдегидрогеназы (G6PD).
374 Гл. VII. Биологические эффекты малых доз излучений
4.2.3. Механизмы реализации нестабильности генома
Механизмы проявления радиационно-индуцированной нестабиль-
нестабильности генома окончательно не изучены. Предполагают, что в качестве
необходимых условий нестабильности выступают повреждение ДНК
и усиленная продукция АФК.
Известно, что стабильность генома обеспечивается на клеточном
уровне тремя взаимосвязанными системами.
Первая из них — система контроля клеточного цикла в све-
рочных точках (checkpoints). Она создает условия для удаления
клеток с измененной структурой ДНК. Вызывая остановку продви-
продвижения клеток по циклу, эта контрольная система обеспечивает время,
необходимое для репарации, а при ее неэффективности индуцирует
процессы апоптоза. Центральным компонентом этой системы явля-
является опухолевый супрессор — белок р53. В целом система контроля
клеточного цикла в сверочных точках при действии ионизирующей
радиации эффективна. Однако ген р53 относится к числу высоко
мутабельных. Мутантный белок р53 может утрачивать способность
к полноценному взаимодействию с хромосомой и, как следствие, те-
терять эффективный контроль над другими генами, в частности, над
генами р21, bcl-2*), bax**), непосредственно участвующими в реали-
реализации надзора за прохождением клеток по циклу и за элиминацией
дефектной части клеточного контингента посредством апоптоза. В
итоге в 5-20 раз возрастает частота спонтанной гомологичной реком-
рекомбинации между хромосомными прямыми последовательностями, что
свидетельствует о возрастании геномной нестабильности.
Показано, что при действии ионизирующей радиации в дозах 0,5
и 5 Гр в культуре нормальных эпителиоцитов человека через 5-10 ци-
циклов клеточного деления возникает спонтанное развитие множествен-
множественных «фокусов» морфологически нормальных делящихся клеток с по-
повышенной экспрессией гена р53, который, однако, был мутантным.
Клетки с такими мутациями оказывались не способными эффективно
устранять метаболические повреждения ДНК, что приводило к накоп-
накоплению последних и служило одной из причин поддержания геномной
нестабильности в поколениях.
Вторая система — механизмы репарации ДНК, направ-
направленные на устранение повреждений, возникающих в ее молекулах
в процессе клеточного метаболизма, тепловых флуктуации атомов
полимера и действия генотоксических агентов, включая ионизирую-
ионизирующую радиацию. К числу таких механизмов относятся эксцизионная
репарация оснований, эксцизионная репарация нуклеотидов, репара-
репарация нарушений спаривания оснований и рекомбинационная репарация
*) B-cell lymphoma protein — антиапоптотический онкогенный белок с
дополнительной функцией активации пролиферации, обнаруженный впер-
впервые в фолликулярной В-клеточной (В-лимфоцитарной) лимфоме.
**) bcl-2-связывающий Х-белок (bcl-2-associated X-protein) — проапопто-
тический белок — антагонист bcl-2.
4. Радиационно-индуцированная нестабильность генома 375
разрывов ДНК, осуществляемая путем гомологичного механизма и
негомологичного соединения концов ДНК. Эффективность репарации
определяется характером повреждений, реальными условиями для
ее осуществления, активностью ферментов репарационной системы,
состоянием укладки ДНК хроматиновых нитей, функциональной пол-
полноценностью белка р53, участвующего в контроле репарации, в част-
частности, путем активации гена GADD45 *) и др. Изменение каждого из
перечисленных факторов существенным образом сказывается на под-
поддержании стабильности генома и может приводить к возникновению
его нестабильности.
Например, дефекты компонентов системы негомологичного соеди-
соединения концов ДНК приводят к преждевременному старению, повы-
повышению чувствительности клеточной ДНК к воздействию ДНК-по-
вреждающих агентов, индуцирующих двойные разрывы, в конечном
счете, к геномной нестабильности. У мышей, нокаутных по гену
GADD45 (GADD45a-/-) **), отмечены повышенная частота возник-
возникновения радиационного рака и геномной нестабильности. Последняя
проявлялась анеуплоидией, аберрацией хромосом, амплификацией ге-
генов и центросомы и сопровождалась аномалиями в процессах митоза,
цитокинеза и контроля роста.
Приведенные факты делают понятным, почему участие систем ре-
репарации ДНК в развитии радиационно-индуцируемой нестабильности
генома является предметом интенсивного изучения.
Третья система, оказывающая существенное влияние на поддер-
поддержание стабильности генома — система окислительно-восстанови-
окислительно-восстановительного гомеостаза***).
Как уже отмечалось, АФК (супероксидный анион-радикал OJ,
синглетный кислород О\, пероксид водорода Н2О2, гидроксильный
радикал ОН') и антиоксиданты образуют единую прооксидантно-ан-
тиоксидантную систему. С этой системой до недавнего времени свя-
связывали только защитные функции: некоторых типов клеток — против
чужеродных антигенов (прооксидантная активность), а при действии
ионизирующей радиации, эффекты которой в значительной мере обу-
обусловлены образованием кислородных радикалов, — с инактивацией
последних (антиоксидантная активность). Существенное влияние на
антиоксидантную активность клеток оказывает онкобелок bcl-2, лока-
локализованный в тех же микроструктурах клетки, где происходит генера-
генерация OJ. Активация гена bcl-2 предотвращает окислительное повреж-
повреждение клеточных компонентов, препятствует развитию апоптоза.
*) Ген белка GADD45 — growth arrest and DNA damage — белка с
мол. массой 45 кДа, индуцируемого повреждением ДНК и вызывающего
остановку (блок, арест) клеточного цикла.
**) Нокаутная мутация (в двух аллелях гена) GADD45.
***) Более подробное изложение вопроса о состоянии системы окислитель-
окислительно-восстановительного гомеостаза и его изменении в облученной клетке см.
в предыдущей главе.
376 Гл. VII. Биологические эффекты малых доз излучений
Помимо непосредственно защитных функций, для некоторых
из АФК в настоящее время установлена функция молекул,
участвующих в передаче сигналов в клетках, направленных на
формирование адекватного ответа при действии факторов внешней
среды.
Экспрессия в потомстве облученных клеток системы об-
образования повышенных количеств АФК предполагается в
качестве главного источника радиационно-индуцированной
нестабильности генома: АФК *) перманентно повреждают
клеточные компоненты, прежде всего ДНК, увеличивая ча-
частоту клеточной гибели, мутаций и аберраций хромосом.
Это предположение подтверждается, хотя и не прямо, экспе-
экспериментальными данными о способности антиоксидантов изменять
характер проявлений нестабильности генома. Так, выращивание
потомства кератиноцитов человека линии НаСаТ в присутствии
низкомолекулярных антиоксидантов, понижающих содержание АФК,
уменьшало выраженность радиационно-индуцированной нестабиль-
нестабильности генома после воздействия 7~излучения в дозе 5 Гр, приводя к
понижению соответствующего этой дозе количества апоптотических
клеток, восстановлению клоногенной активности.
Другой пример — снижение содержания антиапоптотического бел-
белка bcl-2, способного увеличивать в клетках содержание глутатиона,
было характерно для потомства облученных клеток с проявлениями
радиационно-индуцированной нестабильности генома. Выращивание
клеток в среде с антиоксидантами восстанавливало процент bcl-2 по-
позитивных клеток до нормального уровня.
С другой стороны, показано, что при увеличении в клетках со-
содержания АФК стабильность генома резко падает. Так, в опытах на
культурах клеток костного мозга, различающихся двукратно по спо-
способности к эндогенной продукции супероксидного анион-радикала 0J,
инициирование «респираторного взрыва» приводило к возникновению
значительного числа хроматидных разрывов в клетках линии, харак-
характеризующейся более высоким образованием 0J.
Наконец, при исследовании радиационно-индуцированной неста-
нестабильности генома и радиочувствительности в клетках с различным ге-
генотипом в опытах на мышах обнаружена доминантность наследования
как предрасположенности к повышенному образованию аберраций
хромосом, так и сопровождающей ее способности тканей к генерации
повышенных количеств супероксидного анион-радикала OJ.
*) Следует напомнить, что АФК являются первичным звеном в образо-
образовании и накоплении ППОЛ-оксирадиотоксинов, обладающих цитотоксиче-
ским и генотоксическим действием.
4. Радиационно-индуцированная нестабильность генома 377
4.3. Биологическое значение радиационно-индуцированной
нестабильности генома
Как уже отмечалось, судьба клеток, выживающих после облуче-
облучения, и особенно их потомства не одинакова.
Активация механизмов репарации ДНК в клетках с высоким уров-
уровнем эффективности антиоксидантных механизмов приводит к устра-
устранению структурных повреждений в геноме и нормализации метаболи-
метаболических процессов.
Часть клеток, сохранивших повреждения, нарушающих постоян-
постоянство генома или жизнеспособность, элиминируется механизмами апо-
птоза. Однако остаются клетки, которые, несмотря на имеющиеся
повреждения, преодолели барьеры репарации ДНК и апоптоза и стали
мутантными.
Наконец, после облучения выживает еще одна часть клеток —
те, в которых адаптационные механизмы были активированы, но не
пришли в норму к моменту деления. В таких клетках нет поврежде-
повреждений ДНК, препятствующих преодолению барьера сверочных точек
клеточного цикла, однако генерация АФК в них усилена, а их ДНК
чувствительна к действию метаболических оксирадикалов и гено-
токсических агентов. Они-то и становятся носителями радиационно-
индуцированной нестабильности генома со всеми ее проявлениями.
Фенотипически радиационно-индуцированная нестабильность ге-
генома — это особое состояние части потомства облученных клеток,
при котором они существенно отличаются от нормальных клеток, не
подвергавшихся никаким повреждающим воздействиям. Это состоя-
состояние характеризуется в настоящее время цитогенетическими, молеку-
лярно-биологическими, цитологическими и биохимическими проявле-
проявлениями, не свойственными нормальным клеткам.
На цитогенетическом уровне — это передача части потомства
склонности к спонтанному образованию аберраций хромосом de novo.
Это относится и к образованию точковых мутаций, особенно затраги-
затрагивающих регуляторные гены, что делает неэффективным их функци-
функционирование, в частности по контролю за поддержанием постоянства
генома, темпа клеточного обновления и элиминации чужеродных кле-
клеток, и облегчает опухолевую трансформацию.
На молекулярно-биологическом уровне — это существование и эпи-
эпигенетическая передача части потомства облученных клеток конфор-
мационных изменений в структуре хроматина, свойственного мате-
материнской клетке состояния его активности, включая экспрессию и
продукцию белков, участвующих в осуществлении функции свероч-
сверочных точек в клеточном цикле, прежде всего белка р53. Оно под-
поддерживает измененный биохимический фенотип клетки, способству-
способствует мутагенезу. Изменение в локализации мини- и микросателлитных
последовательностей ДНК, амплификация генов также облегчают фе-
нотипические проявления мутагенеза.
378 Гл. VII. Биологические эффекты малых доз излучений
На клеточном уровне это проявляется снижением жизнеспособ-
жизнеспособности в обычных для нормальных клеток условиях, понижением, по
крайней мере in vitro, их клоногенной способности.
Биохимические особенности такого состояния и механиз-
механизмы, приводящие к проявлению отсроченных летальных мута-
мутаций/репродуктивной гибели, пока еще недостаточно изучены.
Радиобиологическая характеристика радиационно-индуцирован-
ной нестабильности генома показывает, что этот феномен возникает
после облучения в широком диапазоне доз, включая малые (< 20 сГр),
особенно при воздействии плотноионизирующих излучений. Он
зависит от дозы излучения, вероятно, в ограниченном диапазоне и
может наблюдаться в некоторых случаях в потомстве облученных
клеток длительное время, на протяжении многих десятков клеточных
циклов.
Феноменология радиационно-индуцированной нестабильности ге-
генома находит объяснение с позиций концепции непостоянства генома,
развивавшейся Р. Б.Хесиным. Многообразные механизмы перестрой-
перестройки хроматина могут рассматриваться как направленные на обеспече-
обеспечение адаптивно-эволюционного процесса приспособления вида к изме-
изменяющимся условиям внешней среды, как переход потомства облучен-
облученных клеток в состояние готовности к адаптационным изменениям.
Такое состояние может иметь два исхода: приспособление к возник-
возникшим условиям с постепенной нормализацией клеточных функций и
фенотипа путем репарации и элиминации дефектных клеток, переход
в нормальное стабильное состояние, либо переход клеток в транс-
трансформированное состояние с сохраняющейся нестабильностью генома
и приобретением свойств опухолевого роста.
Заключение 379
Заключение
Радиационная биофизика, как мы видели, — сложная, многопла-
многоплановая наука. Ее задача заключается в том, чтобы выяснить каждую
стадию в развитии лучевых изменений, начиная от поглощения энер-
энергии излучения отдельными молекулами до конечного радиобиологи-
радиобиологического эффекта — лучевого поражения и гибели клетки и организма.
Радиационная биофизика также и комплексная наука — в ней
работают специалисты самых разных научных дисциплин.
Это и физики, изучающие атомное ядро, свойства излучений, спо-
способы их регистрации, физические аспекты взаимодействия излучений
с веществом, включая биоматерию.
Это и биологи самого широкого профиля, в задачи которых вхо-
входит оценка существа и механизмов ответной реакции биологических
объектов на разных уровнях их организации на воздействия ионизи-
ионизирующих излучений.
Это и врачи, интересы и обязанности которых сосредоточиваются
на изучении механизмов развития, распознавания лучевой болезни и
лучевых поражений, их лечении и профилактике.
На разных этапах своего развития радиационная биофизика нахо-
находила возможности для объяснения с единых позиций, казалось бы,
непримиримых концепций и подходов ученых в оценке механизмов
ответных реакций биологических систем и объектов на лучевые воз-
воздействия.
Методологической основой для биофизического анализа механиз-
механизмов инициируемых излучениями процессов является изучение био-
биологических явлений в динамике на принципе «от простого — к слож-
сложному».
Так, биофизические исследования процессов, протекающих на
разных уровнях организации живого, позволили оценить наиболее
простые и фундаментальные механизмы реакций элементов биологи-
биологических систем на внешние физические воздействия. Как отмечал
профессор-эколог Массачусетского технологического института
Роберт Вайнберг, «прелесть и загадочность красоты Природы нигде
не проявляется так ярко, как в молекулярной организации живой
системы». Однако к этим словам следует добавить, что по мере
усложнения организации исследуемой живой системы загадочность ее
все более возрастает, поскольку появляются новые, качественно иные,
не свойственные другим уровням и потому не сопоставимые свойства.
В настоящем учебнике для описания динамической картины лу-
лучевого поражения использован в основном наиболее «устоявшийся»
и вместе с тем не потерявший новизну фактический материал по
эффектам внешнего однократного воздействия ионизирующих излу-
излучений на молекулярные системы, клетку и организм. Наряду с ним
приводятся материалы новейших исследований радиационной биофи-
биофизики, которые можно отнести к дискуссионным, но необходимым для
современной оценки бурно развивающейся науки.
380 Заключение
Описание экспозиционных и поглощенных доз излучений, характе-
характера поглощения и передачи их энергии биомолекулам позволило изло-
изложить последовательную схему событий, развивающихся во времени и
пространстве, начиная с момента эмиссии ионизирующих излучений и
поглощения их энергии, радиолиза и инактивации молекул, усиления
первичных повреждений, вплоть до поражения и гибели клетки и
организма.
Однако, как стало очевидно, одного только формального описания
общей логической схемы последовательности радиационных событий
оказывается явно недостаточно для анализа ответной реакции слож-
сложной системы на облучение.
Уже на раннем этапе развития радиобиологии выяснилось, что
ионизирующие излучения, в отличии от неионизирующих, обладают
необычайно высокой биологической эффективностью, способностью
не только повреждать молекулы, но и приводить к гибели клеток
и организма. С привычных позиций тепловой энергетики вызывала
недоумение ничтожность величины дозы ионизирующей радиации,
способной оказывать биологический эффект.
Так, напомним, что минимальная доза общего однократного облучения,
вызывающая гибель человека («минимальная абсолютно летальная доза»),
составляет 7 Гр. Эта доза в пересчете на массу тела человека в 70 кг состав-
составляет 490 Дж или 117,6 калорий тепловой энергии. Такая ничтожно малая,
но фатальная для жизни, тепловая энергия, равномерно распределившись
в теле человека, «согреет» его всего лишь менее чем на две тысячные доли
градуса. Аналогичные расчеты можно привести и для облучаемой клетки.
Уже этот хорошо известный в радиобиологии «энергетический
парадокс» позволяет видеть, что рамки необратимой, неравновесной,
нелинейной термодинамики («тепловой») оказываются тесными для
объяснения столь значимого эффекта биологического действия иони-
ионизирующих излучений*). Необходимы новые представления энергоди-
энергодинамики открытых систем, учитывающие особенности природы иони-
ионизирующих излучений и характер ответа живой системы на облучение.
Вековой опыт радиобиологических исследований и недавние фун-
фундаментальные научные открытия молекулярной биологии легли в
основу современной радиационной биофизики, развитие которой поз-
позволяет объединить в систему основные принципы радиобиологии, ка-
касающиеся особенностей природы излучений и характера ответа живой
системы на облучение. Напомним исходные положения этих основопо-
основополагающих принципов.
Речь пойдет прежде всего о принципе попаданий и принципе гете-
гетерогенности, постулированных на основе исследования количественной
*) Так, в известном каноническом уравнении Гиббса следовало бы
внести слагаемым, по крайней мере, еще и энергию нетепловых (ионизи-
(ионизирующих) излучений.
Заключение 381
зависимости биологических эффектов от дозы облучения, успешно
развивавшихся в работах Д. Е. Ли, Н.В.Тимофеева-Ресовского и др.
и ставших большим вкладом в теоретическую радиобиологию.
Первый принцип, как известно, исходит из физических свойств
ионизирующих излучений — их дискретности, квантованности взаи-
взаимодействия излучений с веществом, вероятностного процесса распре-
распределения энергии в пространстве.
1. Принцип попаданий (дискретности ионизирующих
излучений)
- Ионизирующие излучения обладают очень малой объемной
плотностью по сравнению, например, с тепловым излучением,
т. е. переносят энергию в дискретном виде, попадая в некий объ-
объект «концентрированными порциями».
- Фотоны рентгеновского или 7-излучения, ускоренные электроны
или тяжелые заряженные частицы обладают огромной энергией,
величина которой значительно превосходит энергию любой хи-
химической связи.
- За время первой, или физической, стадии действия ионизирую-
ионизирующего излучения на биологические системы A0~16-10~13 с) про-
происходят процессы поглощения, перераспределения и диссипиро-
вания энергии.
- Энергия поглощенных живой системой фотонов или заряжен-
заряженных частиц полностью (прямо или косвенно) растрачивается на
возбуждение и ионизацию атомов и молекул.
- Вероятность переноса энергии к молекуле не зависит от хими-
химической структуры последней, она определяется суммарной элек-
электронной плотностью, имеющей примерно равные значения для
различных элементов клетки.
В основе другого принципа — принципа мишени — заложено пони-
понимание особенности живой системы — того, что структура ее элементов,
а также и функции гетерогенны, неравноценны и проявляют различия
в ответах на одно и то же попадание. Образно говоря, если радиация
«одинаково безразлична» к облучаемым субстратам («не выбирает»
их), то повреждения отдельных элементов биологических систем име-
имеют неодинаковую значимость для судьбы клетки.
2. Принцип мишени (структурной и функциональной
гетерогенности клетки)
- Высокая энергия, дискретно поглощаемая в клетке, и отсутствие
избирательного действия позволяют ионизирующим излучени-
излучениям вызвать изменения любой молекулы, любой биологической
системы. В биологических объектах не существует структур,
382 Заключение
испытывающих преимущественное поглощение энергии радиа-
радиации; возбужденными и ионизированными оказываются белки и
нуклеиновые кислоты, липиды и углеводы, молекулы воды и
различные низкомолекулярные органические соединения.
- Однако неоднородные элементы клетки, поглотившие одну и
ту же энергию излучения, по истечении времени (различного
для каждого элемента живой системы) претерпевают изменения,
приводящие к различным по степени и биологической значимо-
значимости повреждениям.
- Характерные зависимости «доза-эффект» являются отражени-
отражением квантованного характера взаимодействия излучения с веще-
веществом и наличия в клетках высокочувствительных критических
объемов — мишеней.
- Наблюдается дальнейшая последовательность физико-химиче-
физико-химического, химического и биологического этапов лучевых изменений
молекул и разнообразие их ответов на одно и то же попадание.
Исходя из упомянутых принципов попадания (дискретности) и
мишеней (гетерогенности), заложивших фундамент радиобиологии,
была сформулирована теория мишени, согласно которой в зависи-
зависимости от интерпретации понятия радиочувствительности и биологиче-
биологической значимости радиобиологических эффектов в качестве клеточных
мишеней рассматриваются высокочувствительные объемы — критиче-
критические структуры, такие как ДНК и биологическая мембрана, лучевые
повреждения которых могут быть ответственными за летальные ис-
исходы.
Если не было сомнений в том, что ДНК является критической
радиобиологической мишенью, повреждение которой приводит к «ге-
«генетической» гибели клеток, то в отношении признания в качестве
мишени БМ ранее возникали серьезные возражения.
Фундаментальные открытия радиационной биофизики 30-50-х
годов ознаменовали новый этап в теоретической радиобиологии,
посвященной первичным механизмам взаимодействия ионизирующих
излучений с биологическими системами. Открытие кислородного
эффекта, непрямого действия излучений, возможности химической
модификации лучевого поражения — все это позволило начать
исследования биофизической природы «событий попадания»,
характера поражения элементов гетерогенной живой системы и
оценки значимости повреждений критических структур облученной
клетки.
Важным достижением этого периода является установление ро-
роли активированной воды (активированной вследствие ее радиолиза),
роли окислительных радикалов в развитии радиобиологических эф-
эффектов. Появились многочисленные исследования, показавшие, что
ионизация и возбуждение вызывают не только повреждение органи-
органических молекул, но и сами эти повреждения способны передавать
Заключение 383
энергию излучения, т. е. проявляют новую повреждающую активность
в отношении различных клеточных элементов. Так начала зарождать-
зарождаться идея усиления лучевых повреждений в последовательности
радиобиологических эффектов от времени, проходящего после облу-
облучения.
Однако упомянутые открытия радиационной биофизики были
ошибочно восприняты рядом радиобиологов так, «что понятие мише-
мишени расплывается и теряет реальный смысл», и не дали в то время
возможности рассматривать «негенетические структуры» в качестве
реальной радиобиологической мишени.
Еще в 1970 году Дертингер и Юнг отмечали, что БМ так же, как
и ДНК может оказаться структурой, претерпевающей резкие измене-
изменения при одном или нескольких событиях поглощения энергии. Однако
поскольку после облучения удавалось наблюдать деградацию ДНК,
а не мембран или других клеточных компонентов, то, по мнению
авторов, это позволяло утверждать, что «на данном этапе нельзя при-
привести экспериментальных доказательств в пользу того, что в клетке
существуют другие мишени, которые можно было бы сравнить по
значимости с ДНК».
В связи с имевшейся неопределенностью в оценке фатальности для
клетки повреждений БМ долгое время ей отводили скромную роль
лишь «кандидата на мишень».
Новые экспериментальные доказательства в отношении радиобио-
радиобиологической значимости БМ, ее лучевой деградации и деградации ДНК
стали появляться в результате впечатляющих достижений молекуляр-
молекулярной биологии о роли оксирадикалов в повреждениях ДНК и БМ. Эти
данные экспериментально подтвердили, а также существенно разви-
развили и дополнили представления Б.Н.Тарусова о цепном механизме
лучевого поражения и о радиобиологической роли оксирадикалов и
токсических продуктов перекисного окисления липидов.
Среди главных новых данных, подтверждающих идею усиления
радиационных эффектов, было открытие цитогенетического дей-
действия ЛРТ и генотоксических оксидативных повреждений ДНК
вследствие непрямого действия ионизирующей радиации.
В 1966 г. в совместном исследовании лабораторий Ю. Б. Кудряшова
и Н. В. Лучника впервые обнаружено, что радиационно-индуцирован-
ные продукты окисления липидов вызывают цитогенетический эф-
эффект. Через три года была показана их способность повреждать струк-
структуру нуклеиновых кислот.
В лаборатории Е. Б. Бурлаковой с середины семидесятых годов
проводились радиобиологические исследования роли липидов и про-
продуктов их перекисного окисления в биосинтезе и функциональной ак-
активности ДНК. Однако только на современном уровне молекулярной
биологии удалось провести фундаментальное изучение структуры и
свойств высоколабильных оксирадикалов и оксипродуктов и их вли-
влияния на макромолекулу ДНК и БМ (Л. Дж. Мернетт, 2000). Стало
384 Заключение
известно, что накопление ОН' и Н2О2 является не только резуль-
результатом радиолиза воды, но и усиления радиационно-индуцированного
четырехэлектронного неферментативного восстановления кислорода в
клетке.
Непрямой эффект радиации через радикалы воды был изучен
давно, однако цито- и генотоксическое действие ОН', Н2О2 и других
активных окислителей в механизме усиления лучевых повреждений
более полно стало раскрываться только в последнее время. Гидрок-
сид-радикал — чрезвычайно активный окислитель с весьма малым
пробегом — способен разрушать фактически любую находящуюся
вблизи него молекулу в клетке. При этом он взаимодействует не толь-
только с мембранными структурами. На большие клеточные расстояния
его доставляет пероксид водорода, являющийся диффундирующей,
«скрытой» формой гидроксид-радикала.
Перемещаясь на большие клеточные расстояния и диссоциируя,
молекула Н2О2 способна оказать токсическое действие гидроксид-
радикалом не только на ядерный хроматин, но и на любые другие
элементы клетки. Действие радикалов на клеточные мишени может
быть облегчено в ДНК-липидном комплексе, подробно изученном в
60-70 годах. Вполне вероятно, что ДНК-мембранный комплекс (мол.
масса 3-Ю9 Да) может представлять собой единую радиобиологи-
радиобиологическую мишень — ДНК-МК, лучевое повреждение которой может
привести к инактивации и гибели клеток как эукариотов, так и про-
прокариотов.
Радиационное окисление ДНК было известно давно и являет-
является важнейшим и твердо установленным фактом, как и механизмы
окислительной деградации БМ и лучевого токсического эффекта
продуктов ПОЛ, исследование которых проводилось, начиная с пя-
тидесятых-шестидесятых годов прошлого столетия. Однако эти ис-
исследования происходили изолированно друг от друга, а возможная
связь процессов в липидах и ДНК практически не рассматривалась.
Известно, что БМ наиболее подвержены окислительной деграда-
деградации, и большое содержание полиненасыщенных жирных кислот в фос-
фолипидах определяет высокую способность БМ к цепным реакциям
окисления и образованию новых инициаторов окисления, обладающих
оксидазной активностью.
Показано, что оксирадикалы и образованные ими оксирадиотокси-
ны содержатся в клетке в норме на стационарном уровне, не превы-
превышающем 1 мкмоль/л. При действии ионизирующих излучений этот
уровень возрастает и вследствие многократного накопления ППОЛ
образуется их избыток, который нарушает окислительно-восстано-
окислительно-восстановительное равновесие и оказывает токсическое действие на клетку,
например вызывая денатурацию мембрано-связанных макромолекул
и инактивацию встроенных в мембрану ферментов.
Реакция цепного окисления липидов, инициируемая ионизирую-
ионизирующими излучениями, играет исключительно важную роль в клеточной
патологии и гибели клетки. Важность такой реакции заключается в
Заключение 385
том, что это процесс, способствующий наиболее массивному накоп-
накоплению избытка токсических продуктов окисления (ППОЛ) в связи с
многократным их воспроизведением. Таким образом, имеются убеди-
убедительные данные о непрямом эффекте излучений не только за счет
продуктов радиолиза воды, но и в результате образования свободно-
радикальных продуктов окисления липидов.
В последние годы ведутся интенсивные работы по исследованию
механизмов непрямого повреждения ДНК эндогенными оксирадика-
лами. Принципиально новые методические усовершенствования (газо-
(газовая, тонкослойная хроматография, селективная ион-масс спектромет-
спектрометрия, ЭПР, хемилюминесценция, использование радиоактивных меток,
радикальных ингибиторов и др.) создали в конце прошлого столетия
основу для высокочувствительной и специфической идентификации
токсических оксипродуктов и оксидативных повреждений ДНК, а
также для оценки биологических последствий их образования.
Обнаружено, что в нуклеиновых кислотах оксирадиотоксины всту-
вступают в реакции с основаниями, образуя оксиаддукты, составляющие
основу повреждений генома. Они также разрушают углеводные мости-
мостики между нуклеотидами и вызывают разрывы связей в ДНК и РНК.
В итоге оксидативные повреждения ДНК в клетке оказываются цито-
генотоксичными — вызывают задержку клеточного деления, а при
репликации нанесенные ими повреждения вызывают появление на
всех стадиях клеточного цикла мутаций в виде аберраций хромосом.
Показано, что оксидативные повреждения в клетке являются важ-
важным звеном в патогенезе не только лучевых, но и многих других
заболеваний, что свидетельствует о неспецифическом характере это-
этого важнейшего общебиологического процесса. Использование новых
методов анализа ядерной ДНК показало также, что непрямой меха-
механизм повреждения этой макромолекулы в клетках организма являет-
является результатом действия на нее АФК, ППОЛ и системы моноксида
азота N0.
В последнее время особенно большой интерес у исследователей
вызвало простое химическое соединение — моноксид азота (структур-
(структурная формула 'N=0), обладающее высокой реакционной активностью
(в том числе способного активировать и ингибировать цепные сво-
боднорадикальные реакции). Диффундирующий молекулярный мес-
седжер — моноксид азота — и продукт его окисления — протони-
рованный пероксинитрит O=N-O-OH — накапливаются в клетках
и тканях облученных организмов и вызывают весьма сильное цито-
и генотоксическое действие. Пероксинитрит так же, как и перекись
водорода, выполняет функции диффундирующей «скрытой» формы
гидроксида-радикала.
Благодаря использованию современных методов молекулярной
биологии, появляются все новые и новые данные о регуляторной
роли N0 и пероксинитрита в оксидазных процессах и механизмах
влияния на экспрессию генов и биосинтез белков. Установлено,
например, что длительная генерация их инициирует апоптоз.
25 Ю. Б. Кудряшов
386 Заключение
Наряду с оксирадикалами моноксид азота и его производные
являются ключевыми факторами воспаления, механизмов инфекции,
канцерогенеза, а также развития стрессорного и адаптивного ответов
организма.
Установлено, что пероксинитрит и его протонированная форма,
диффундируя в клетке и проникая через мембраны с помощью пе-
переносчиков-анионов, имеют уникальный спектр химической реактив-
реактивности: вызывают разрывы цепочек и окисление оснований ДНК, нит-
нитрование гуанина и белков, окисление липидов биологических мембран
и т. д. Результатом многих таких реакций могут быть цитотогенетиче-
ские эффекты и мутагенез.
Все полученные к настоящему времени данные свидетельствуют о
том, что ДНК, а также и БМ представляют собой мишени не только
для непосредственного попадания в них квантов энергии ионизиру-
ионизирующих излучений, но и непрямого оксидантного действия радиации,
т. к. мишени повреждаются вследствие действия в облученной клетке
мультитоксичных и мутагенных прооксидантов-оксирадиотоксинов:
ОН', Н2О2, ONO^~, NO и ППОЛ-липидных радиотоксинов.
Оценивая характерный для ионизирующих излучений эффект по-
последействия с прогрессирующей деградацией критических структур
клетки, следует остановиться еще на одном принципе радиобиоло-
радиобиологии — «принципе усиления первичных повреждений».
3. Принцип усиления первичных радиационных
повреждений в критических структурах-мишенях
— Радиационно-индуцированные первичные повреждения ДНК
(одно- и двунитевые разрывы, повреждение и/или освобождение
оснований) и БМ (начальные стадии окисления полиненасыщен-
полиненасыщенных липидов) потенциально опасны для судьбы клеток.
Реальная опасность этих нарушений связана с накоплением
лучевых повреждений критических структур. Показаны коли-
количественная зависимость ОБЭ по отношению к хромосомам (ле-
(летальный эффект) и генам (мутации отдельных генов), а также
зависимость ОБЭ от ЛПЭ разных видов ионизирующих излу-
излучений.
- Если непосредственные первичные радиационные повреждения
локализованы в структурной части гена и проявятся как му-
мутации, то в результате экспрессии гена синтезируются сотни и
тысячи молекул мутантных белков, нарушающих функциони-
функционирование клетки или вызывающих изменения, несовместимые с
ее жизнью. Последующий этап усиления первичных поврежде-
повреждений ДНК в отсутствие контроля со стороны механизмов над-
надзора на молекулярном (мутантный белок р53) или клеточном
(иммунные механизмы элиминации чужеродных клеток) уровне
может сопровождаться их передачей (наследованием) потомкам
материнских клеток, т. е. приводить к увеличению численности
клеточного потомства, несущего повреждения.
Заключение 387
— Процесс ионизации, образование избыточных концентраций
АФК, N0, пероксинитрита и первичных ППОЛ, образование
токсических окислительных аддуктов ДНК и БМ на физико-
химическом и химическом этапах передачи энергии излучений,
а также фактическая универсальность проявления кислородного
эффекта — все это говорит об исключительно важной роли
кислорода в трансформации энергии излучения в лучевое
поражение клетки.
— Развитие оксидативного процесса, цепных реакций окисления
в БМ представляет собой механизм усиления первичных повре-
повреждений, завершающегося необратимой окислительной деграда-
деградацией мембранных структур клетки.
— Необратимая деградация структур как ДНК, так и БМ может
привести к фатальным для клетки последствиям.
Следует еще раз подчеркнуть, что важнейшая биологическая роль
клеточных мембран в энергетике, их барьерно-матричные, регулятор-
ные функции в клетке, высокая способность к радиационно-индуци-
рованному окислению и образованию избытка мультитоксических и
мутагенных оксирадикалов и ППОЛ — все это в настоящее время поз-
позволяет говорить о БМ как о критической структуре — радиобиологиче-
радиобиологической мишени (наряду с критической структурой ДНК), повреждение
которой может оказаться губительной для клетки.
В интактной клетке оксидативные процессы находятся в состоянии
гомеостаза — под строгим и чрезвычайно разнообразным контролем
ферментативных и неферментативных систем, скорость этих процес-
процессов невелика, а содержание природных прооксидантов находится на
низком стационарном уровне.
Важная роль оксидативных процессов для нормальной жизнедея-
жизнедеятельности клетки экспериментально установлена и в настоящее время
продолжает исследоваться. Получены убедительные данные, что ок-
сидативная деградация, возникающая вследствие накопления избытка
продуктов окисления, способная вызывать ряд патологических состоя-
состояний организма (они получили разные названия: «лучевой токсический
эффект», «лучевой стресс», «синдром липопероксидации», «оксида-
тивный стресс» и др.), есть результат системной, общей неспеци-
неспецифической реакции клеток и организма на внешние воздействия. При
этом происходит изменение эндогенного фона радиорезистентности,
т. е. соотношения в клетках или тканях между количествами проокси-
прооксидантов — ПО и антиоксидантов — АО, т. е. ПО/АО, которое становится
заметно > 1.
Специфика нарушений окислительно-восстановительного равнове-
равновесия при различных заболеваниях заключается в характере и степени
изменений конкретных компонентов АО и ПО. Для лучевого пора-
поражения, как уже отмечалось, характерно лучевое последействие раз-
развивающихся во времени механизмов усиления процессов деградации
25*
388 Заключение
критических структур. В настоящее время ферментная и нефермент-
неферментная внутриклеточная защита и восстановление от избыточного накоп-
накопления ППОЛ носит сложный и многоэтапный характер и подробно
изучена.
Обращая внимание на процессы липопероксидации в БМ, следует
отметить, что хотя этот процесс развивается в липидной фазе клетки,
многие стадии этой сложной системы реакций окисления протекают
также и в водной среде. Поэтому часть эндогенных защитных систем
в клетке локализована в липидах БМ, часть — в водной клеточной
фазе.
Другим важным многоплановым механизмом системного ответа на
облучение являются процессы репарации ДНК и пострадиационного
восстановления клетки и ее генетического аппарата, связь восста-
восстановления ДНК с радиорезистентностью клетки. Стало совершенно
очевидным, что существует чрезвычайно великое множество путей
восстановления от лучевых повреждений на всех уровнях организации
живого: молекулярном, клеточном и уровне целостного организма.
Множество путей предохранения и защиты критических структур-ми-
структур-мишеней обеспечивает клетке и организму высокую степень надежности
их защиты от развития патологического процесса.
В ряде лабораторий исследованы «физические» и молекулярно-
биологические механизмы пострадиационного восстановления и дока-
доказано, что клетки мутантных бактерий, простейших, млекопитающих и
растений восстанавливаются от летальных, сублетальных и мутацион-
мутационных изменений. В многоклеточном организме клеточное восстановле-
восстановление в разных органах и тканях имеет свои особенности. Так, наиболь-
наибольшей скоростью восстановления обладают активно пролиферирующие
ткани за счет репопуляции от стволовых клеток, еще сохранивших
свою жизнеспособность.
Плодотворными в изучении механизмов радиационного поврежде-
повреждения и пострадиационного восстановления оказались выводы о ключе-
ключевой роли кислорода в этих процессах, а также о модифицирующем
действии ряда радиопротекторов и радиосенсибилизаторов.
Все убедительнее становилась необходимость учитывать новые
подходы в оценке биофизических механизмов радиационных эффек-
эффектов — принципы системного ответа клетки на облучение: наряду
с усиливающим первоначальное повреждение эффектом деструктив-
деструктивных процессов принять в расчет работу контролирующих и репараци-
репарационных систем, «заложенных» в клетке.
Ведущую роль в исследовании процессов пострадиационного вос-
восстановления сыграли успехи молекулярной биологии по изучению
ферментных систем, обеспечивающих репарацию ДНК от поврежде-
повреждений. Изучены различные репаративные ферменты, одни из которых
как бы усиливают первичные лучевые повреждения ДНК (экзо- и
эндонуклеазы), другие — отчетливо направлены на их ликвидацию
(полимеразы, лигазы, фосфатазы) и др. В реакциях восстановления
участвуют некоторые гормоны и факторы роста, влияющие на отдель-
отдельные хромосомы и их фрагменты.
Заключение 389
Слаженность и многоплановость процессов репарации ДНК, про-
процессов, протекающих с разной скоростью и наблюдаемых в клетках
(облученных даже в очень высоких, абсолютно летальных дозах),
работа систем, контролирующих пострадиационную деградацию по-
линуклеотидных цепей, открыли возможность детально исследовать
механизмы репродуктивной и интерфазной гибели клеток, апоптоза,
некротической гибели клеток, формирования радиационно-индуциру-
емой нестабильности генома, т. е. главных явлений системного ответа
клетки на действие ионизирующих излучений.
Появление идей о необходимости учета фактора времени приве-
привели к существенной трансформации представлений о характере дей-
действия ионизирующей радиации на клетку. Если на заре развития
радиобиологии предпочтение отдавалось статичным моделям, кото-
которые рассматривали гибель клетки как результат простого поврежде-
повреждения субклеточной мишени, то для современного периода характерен
динамический и системный подход, который в целом соответствует
представлениям динамической биохимии и биофизики. На основе ко-
количественной оценки эффектов восстановления клеток были предло-
предложены «стохастические модели», внесшие существенные коррективы в
концепцию принципов попаданий и гетерогенности, а также в теорию
мишени. Они базируются на представлениях о том, что случайные
и диффузно расположенные акты ионизации и возбуждения только
в редких и маловероятных случаях однозначно приводят клетку к
гибели. На эту «стохастику первого порядка» должна накладываться
«стохастика более высоких порядков», которая определяется динами-
динамической нестабильностью жизненных процессов, способных усиливать
или элиминировать начальное радиационное повреждение.
Разработанный математический аппарат позволил формально оце-
оценить вероятность перехода повреждений с одного уровня на следую-
следующий, перехода, связанного с принципами усиления и восстановления
радиационных повреждений. Предложенные математические модели
позволили, например, Хугу и Келлереру A969) получить семейство
дозовых кривых, удовлетворительно согласующихся с получаемыми
в реальных экспериментах на клетках. Это послужило важным кри-
критерием приложимости динамических моделей для объяснения фено-
феноменов радиационной биофизики. Стохастическая теория, например,
ввела понятие «дисперсного начального повреждения» не только ге-
генетического аппарата, но и элементов других клеточных структур, в
том числе и БМ. Репаративные механизмы, определяющие конечный
радиобиологический процесс, формируются за счет неспецифической
«компенсационной способности объекта».
Таким образом, математическое моделирование стало эффектив-
эффективным средством оценки влияния ионизирующих излучений на живые
объекты. Однако методы моделирования применяются все еще недо-
недостаточно активно.
Так, до сих пор основная роль моделирования в радиационной
биофизике — это формализованная трактовка механизмов воздей-
воздействия ионизирующих излучений с помощью аналитических моделей.
390 Заключение
Остаются практически невостребованными имитационные математи-
математические модели, которые позволяют изучать и прогнозировать пове-
поведение объекта в сложной временной и пространственной динамике
при постоянно меняющихся условиях (например, уровня излучения,
концентрации веществ, модифицирующих действие излучения и т. д.).
Тем не менее важным достижением стохастических представлений
в радиобиологии явилось объяснение роли системного ответа клетки
на повреждение клеточных структур.
К оригинальному в этом плане выводу пришел недавно Л. X. Эй-
дус [355, с. 676]: «... репарация ДНК позволяет понять назначение
неспецифической реакции клеток на внешние влияния. По-видимому,
главная цель этой приспособительной реакции, выработанной в ходе
эволюции, — поддержание целостности основного достояния клетки —
ее генома, а способ достижения этой цели природа изобрела наи-
наипростейший: воздействие на плазматическую мембрану — наиболее
уязвимую структуру клетки, миновать которую не может ни один
химический или физический повреждающий агент.»
В дополнение ко всему сказанному можно привести следующую
краткую трактовку принципа «системного ответа клетки».
4. Принцип системного ответа клетки на повреждение
радиационных мишеней (регуляция клеточного
гомеостаза)
- Облучение клетки (как и вообще любых «сложных» биологиче-
биологических систем) активирует функции механизмов авторегуляции
гомеостаза. Значение их заключается в мобилизации компен-
компенсаторных механизмов, предназначенных для предотвращения
повреждений или активации восстановления поврежденных
структур и нарушенного динамического равновесия облученной
системы.
Особенно важны такие компенсаторные процессы для сохране-
сохранения структуры и функций критических структур — мишеней.
- Контроль за избыточным, токсическим накоплением ОН', Н2О2
и др. активных форм кислорода, NO, ONO^~ и продуктов ПОЛ
в БМ выполняет сложная многоэтапная система защитных
ресурсов клетки (водо- и жирорастворимые биологически
активные соединения), включающая ферментативные и нефер-
неферментативные «антирадикальные», «гипоксические» и «анти-
оксидантные» механизмы, активность которых зависит от
величины дозы и времени, прошедшего после облучения. Сдвиги
окислительно-восстановительного гомеостаза, т. е. соотношения
содержания в клетке анти- и прооксидантов, характеризуют
уровень эндогенного фона радиорезистентности.
Заключение 391
— Для восстановления ДНК от повреждений в клетке функциони-
функционируют многочисленные (зависящие от типа повреждения) ДНК-
репарационные системы. Активность некоторых из них индуци-
индуцируется самими повреждениями ДНК и, следовательно, зависит
от величины поглощенной дозы. Процесс восстановления по-
повреждений структуры ДНК с участием ферментов репарации
предваряется сложными преобразованиями хроматина или пе-
перемещениями локусов хромосом в ядре клетки.
Чернобыльские события и наступивший на нашей планете радио-
радиоэкологический кризис поставили перед радиобиологами и биофизика-
биофизиками новую задачу — исследование биологического действия ионизиру-
ионизирующих излучений в малых дозах и с малой мощностью, соответственно
условиям реально загрязненной среды.
Исследования нелетального действия радиации на организм, клет-
клетку и молекулярные системы открыли новый мир радиобиологических
эффектов. Это и гиперрадиочувствительность при сверхмалых мощ-
мощностях и дозах облучения, это и стимулирующее действие и адаптив-
адаптивный ответ при облучении в более высоком диапазоне малых доз, это и
«эффект свидетеля» — передача необлученной клетке сигналов повре-
повреждения токсическими и регуляторными «выделениями» от соседней
облученной, это и «непривычное» возрастание устойчивости клетки к
действию излучения с ростом мощности дозы при одной и той же дозе
радиации («обратный эффект мощности доз»)...
В природных условиях характер и выраженность эффектов облу-
облучения в малых дозах искажается на фоне химического загрязнения
среды обитания; в экологически чистых условиях ультрамалые до-
дозы ЕРФ оказываются необходимыми для нормальной жизнедеятель-
жизнедеятельности организмов.
Как видно, принцип системного ответа клетки и организма про-
проявляется во всем многообразии при разных диапазонах доз ионизиру-
ионизирующих излучений.
Появилась принципиально новая трактовка динамики радиобиоло-
радиобиологических эффектов радиационного воздействия в малых дозах, име-
имеющей синусоидальный, т. е. нелинейный, немонотонный характер при
возрастании дозы облучения.
Приведем основные выводы по данной проблеме.
Системный ответ клетки на действие излучений в малых
дозах.
— Биологический эффект излучений малых величин и мощностей
проявляется в узких интервалах доз и мощностей доз и отли-
отличается от действия больших доз не только количественно, но и
качественно.
— Системы индуцибельной репарации, восстановления, нормали-
нормализации функций, измененных после облучения клетки в малых
дозах и при малых мощностях дозы, в определенном диапазоне
392 Заключение
интенсивностей воздействия работают с низкой эффективностью
или могут вообще «не включаться». Чем ниже интенсивность об-
облучения, тем позже могут включаться системы индуцибельного
восстановления.
— Дозы облучения малой величины и мощности в этих услови-
условиях могут оказаться более значимыми в сочетании с действием
разнообразных факторов окружающей среды, и это может быть
следствием синергетических эффектов при радиоэкологических
загрязнениях.
— Одним из важных механизмов системного ответа является общая
неспецифическая реакция на облучение. Инициирующая роль в
этой реакции принадлежит окислительным процессам в плазма-
плазматических БМ.
- Анализ совокупности непосредственных эффектов облучения в
малых дозах позволил прийти к выводу о том, что в их прояв-
проявлениях БМ выполняет роль чувствительной радиобиологической
мишени.
- Облучение биологических объектов в указанном режиме
способно вызывать формирование радиационно-индуцируемой
нестабильности генома. Это состояние может передаваться в
потомстве облученных клеток посредством эпигенетических
механизмов и будет существовать до тех пор, пока клетки
не вернутся к исходным уровням системного ответа на
повреждение ДНК.
Как видно, эти выводы являются важным дополнением к проблеме
системного ответа живых объектов на действие ионизирующих излу-
излучений.
Таким образом, рассмотрение основных принципов радиобиологии
с современных позиций радиационной биофизики и молекулярной
биологии показывает, что достигнутый уровень научного знания в
этой области может служить основой для построения общей теории
механизмов действия ионизирующих излучений на живую клетку.
Такая теория окончательно еще не построена, так как ряд проблем,
касающихся, например, особенностей, характера и роли изменений
критических структур и систем в эффектах действия излучений в
больших и малых дозах нуждаются в дальнейшем изучении.
Однако ясно, что общая теория должна учитывать как физические
особенности действия ионизирующих излучений на радиобиологиче-
радиобиологические мишени, так и принимать в расчет особенности биологического
ответа на облучение. Это, с одной стороны, инициирующее звено («за-
(«запальный» и каскадный механизмы усиления эффекта на определен-
определенных уровнях организации живого), с другой — особенности системного
ответа, механизмы компенсации в биосистемах более сложного уровня.
Последние развертываются при формировании последовательности
Заключение 393
биофизических, биохимических и физиологических процессов в клет-
клетке и их проявлений на уровне клетки и организма облученных как в
больших, так и малых дозах, в виде функциональных изменений или
патологического процесса.
Другими словами, анализ динамики лучевых эффектов должен
обязательно основываться на принципах учета усиления немногочис-
немногочисленных начальных молекулярных изменений до видимых, регистриру-
регистрируемых биологических эффектов на фоне способности клетки и организ-
организма к системному ответу — мобилизации свойственных им защитных
и восстановительных ресурсов и механизмов до уровня полной ком-
компенсации возникшего отклонения от нормы. При этом следует иметь
в виду, что компенсаторные возможности каждого уровня имеют свой
предел, за которым возникает патология.
Логика современного исследования требует планомерного поэтап-
поэтапного анализа механизмов действия излучений и создания динамиче-
динамических радиобиологических моделей с применением новейших достиже-
достижений электроники и математического аппарата. Для этого необходимо
использовать всю совокупность данных, полученных на биологиче-
биологических системах различной сложности структурной организации, с уче-
учетом динамики их «поведения» в зависимости от величины и мощности
дозы, а также характера облучения.
394 Список литературы
РЕКОМЕНДОВАННАЯ ЛИТЕРАТУРА
Основная литература
Монографии, учебники, учебные пособия
1. Амирагова М.И., Дуэюенкова Н.А., Савич А.В., Шальное М.И. и др.
Первичные радиобиологические процессы. 2-е изд. /Под ред. Н. В. Ти-
Тимофеева-Ресовского. М.: Атомиздат, 1973. 336 с.
2. Бак 3. Химическая защита от ионизирующей радиации. М.: Атомиздат,
1968. 264 с.
3. Бак 3., Александер П. Основы радиобиологии. М.: И. Л., 1963. 500 с.
4. Барабой В.А., Брехман И.И., Голотин В.Г., Кудряшов Ю.Б. Перекис-
ное окисление и стресс. СПб.: Наука, 1992. 149 с.
5. Бонд В., Флиднер Т., Аршамбо Д. Радиационная гибель млекопита-
млекопитающих. Нарушение кинетики клеточных популяций. /Пер. с англ. М.:
Атомиздат, 1971. 320 с.
6. Гончаренко Е.Н., Кудряшов Ю.Б. Гипотеза эндогенного фона радио-
радиорезистентности. М.: Изд-во МГУ, 1980. 176 с.
7. Гончаренко Е.Н., Кудряшов Ю.Б. Химическая защита от лучевого
поражения. Учебное пособие. М.: Изд-во Моск. ун-та, 1985. 249 с.
8. Граевский Э.Я. Сульфгидрильные группы и радиочувствительность.
М.: Атомиздат, 1969. 243 с.
9. Гродзинский Д.М. Радиобиология растений. Киев: Наукова думка,
1989. 402 с.
10. Груздев Г.П. Проблема поражения кроветворной ткани при острой
лучевой патологии. М.: Медицина, 1968. 124 с.
11. Гудков И.И. Клеточные механизмы пострадиационного восстановле-
восстановления растений. Киев.: Наукова думка, 1985. 224 с.
12. Гуськова А.К., Байсоголов Г.Д. Лучевая болезнь человека. М.: Меди-
Медицина, 1970. 333 с.
13. Даренская Н.Г., Кознова Я.Б., Акаев И.Г., Невская Г.Ф. Относитель-
Относительная биологическая эффективность излучений. Фактор времени облу-
облучения. М.: Атомиздат, 1968. 302 с.
14. Дейл В. Действие ионизирующих излучений на ферменты in vitro
//Ионизирующие излучения и клеточный метаболизм. М.: Изд-во ИЛ,
1958. С. 43-57.
15. Дертингер Г1., Юнг X. Молекулярная радиобиология. М.: Атомиздат,
1973. 248 с.
16. Жестяников В.Д. Восстановление и радиорезистентность клетки. Л.:
Наука, 1968. 351 с.
17. Иванов В. И. Курс дозиметрии. М.: Энергоатомиздат, 1988.
18. Иванов В.И., Лысцов В.Н., Губин А.Т. Основы микродозиметрии. М.:
Атомиздат, 1979. 192 с.
19. Итоги науки и техники. Общая генетика. Т. 4. Биологические си-
системы репарации ДНК у эукариотов. /Под ред. В. К. Мазурика и
Г. Г. Порошенко. М.: ВИНИТИ, 1978. 246 с.
Список литературы 395
20. Капулъцевич Ю.Г. Количественные закономерности лучевого пораже-
поражения клеток. М.: Атомиздат, 1978, 232 с.
21. Кеирим-Маркус И.Б. Эквидозиметрия. М.: 1980. 222 с.
22. Киселев М.Ф. Медико-биологические исследования низкодозовых ра-
радиационных воздействий в сочетании с другими антропогенными фак-
факторами. /Дисс. докт. биол. наук. М.: МГУ, 2002. 248 с.
23. Киселев М.Ф., Довгуша В.В., Носкин Л. А. Лайда СБ. Детекция ан-
антропогенных факторов окружающей среды на основе анализа сдви-
сдвигов в системе гомеостаза, устанавливаемых с помощью лазерной
корреляционной спектроскопии плазмы крови. (Биологическая до-
дозиметрия радиационных нагрузок). //Методические рекомендации
№ 32-00358/57-Р4. М.: Минздрав России (Федеральное управление
«Медбиоэкстрем»). 2000. 27 с.
24. Коггл Дэю. Биологические эффекты радиации. /Пер с англ. М.: Энер-
гоатомиздат, 1986. 184 с.
25. Коломийцева И.К. Радиационная биохимия мембранных липидов. М.:
Наука, 1989. 181 с.
26. Комар В.Е., Хансон К. П. Информационные молекулы при лучевом
поражении клеток. М.: Атомиздат. 1980, 175 с.
27. Корогодин В.И. Проблемы пострадиационного восстановления. М.:
Атомиздат. 1966, 392 с.
28. Красавин Е.А. Проблема ОБЭ и репарация ДНК. М.: Энергоатомиз-
дат. 193 с.
29. Кудряшов Ю.Б. Практикум по общей биофизике. Вып. 7. Радиобиоло-
Радиобиология. М.: Высшая школа, 1962. 275 с.
30. Кудряшов Ю.Б., Беренфельд Б. С. Радиационная биофизика. Курс лек-
лекций по биологическому действию ионизирующих излучений. М.: Изд-
во Моск. ун-та, 1979. 241 с.
31. Кудряшов Ю.Б., Беренфельд Б. С. Основы радиационной биофизики.
Учебник. М.: Изд-во Моск. ун-та, 1982. 302 с.
32. Кузин A.M. Стимулирующее действие ионизирующего излучения на
биологические процессы: к проблеме биологического действия малых
доз. М.: Атомиздат, 1977. 284 с.
33. Кузин A.M. Структурно-метаболическая теория в радиобиологии. М.:
Наука, 1986. 284 с.
34. Кузин A.M. Идеи радиационного гормезиса в атомном веке. М.: Наука.
1995. 158 с.
35. Кузин A.M. Роль природного радиоактивного фона и вторичного био-
биогенного излучения в явлении жизни. М.: Наука, 2002. 80 с.
36. Ли Д.Э. Действие радиации на живые клетки./Пер. с англ. М.: Госа-
томиздат, 1963. 288 с.
37. Моссе И.Б. Радиация и наследственность: генетические аспекты про-
противорадиационной защиты. Минск: Университетское, 1990. 208 с.
38. Нормы радиационной безопасности — НРБ-99. //Государственные са-
санитарно-эпидемиологические правила и нормативы. СПб.: Минздрав
России, 1999. 115 с.
39. Обатуров Г.М. Биофизические модели радиобиологических процессов.
М.: Энергоатомиздат, 1987. 152 с.
40. Окада Ш. Радиационная биохимия клетки. /Пер с англ. М.: Мир, 1974.
408 с.
41. О санов Д. П., Лихарев И. А. Дозиметрия излучения инкорпорирован-
инкорпорированных радиоактивных веществ. М.: 1977. 198 с.
396 Список литературы
42. Основные санитарные правила обеспечения радиационной безопасно-
безопасности (ОСПОРБ-99), М.: Минздрав России, 2000.
43. Особенности механизмов действия плотноионизирующих излучений.
/Под ред. А. В. Савича и В. К. Мазурика. М.: Медицина, 1985. 232 с.
44. Панин М.П., Скотникова О.Г. Действие ионизирующей радиации на
человека и окружающую среду. М.: МИФИ. 143 с.
45. Пелевина И.П., Саенко А.С, Готлиб В.Я., Сынзыныс Б.И. Выжи-
Выживаемость облученных клеток млекопитающих и репарация ДНК. М.:
Энергоатомиздат, 1985. 120 с.
46. Петин В.Г., Комаров В.П. Количественное описание модификации
радиочувствительности. М.: Энергоатомиздат, 1989. 192 с.
47. Петров Р.В. Иммунология острого лучевого поражения. М.: Госатом-
издат, 1962. 268 с.
48. Поливода Б.П., Конев В.В., Попов Г.А. Биофизические аспекты ради-
радиационного поражения биомембран. М.: Энергоатомиздат, 1990. 160 с.
49. Радиотоксины, их природа и роль в биологическом действии радиации
высокой энергии. //Сб. тр. М.: Атомиздат, 1966. 296 с.
50. Ретроспективная дозиметрия участников ликвидации последствий ава-
аварии на Чернобыльской АЭС. /Под ред. В. П. Крючкова и А. В. Носов-
Носовского. Киев: Седа-Стиль, 1996. 256 с.
51. Реутов В.П., Сорокина Е.Г., Охотин В.Е., Косицин П.С. Циклические
превращения оксида азота в организме млекопитающих. М.: Наука,
1997. 160 с.
52. Ризниченко Г.Ю. Лекции по математическим моделям в биологии. М.,
Ижевск: Dynamics. 2002. 232 с.
53. Рубин А.Б. Биофизика. (Теоретическая биофизика). М.: Книжный дом
«Университет», 1999. Том I. 443 с.
54. Рубин А.Б. Биофизика. (Биофизика клеточных процессов) . М.: Книж-
Книжный дом «Университет», 2000. Т. П. 468 с.
55. Рябченко Н.И. ДНК и радиация. М.: Атомиздат, 1979. 154 с.
56. Савицский А.К. Взаимодействие электронов с тканеэквивалентными
средами, М.: Энергоатомиздат, 1984. 111 с.
57. Сборник задач малого практикума по биофизике. М.: Изд-во Моск.
ун-та, 1999. 98 с.
58. Современные методы биофизических исследований. Практикум по
биофизике. /Под ред. А. Б. Рубина М.: Высшая школа, 1988. 358 с.
59. Тарусов Б.П. //Роль перекисей и кислорода в начальных стадиях ра-
радиобиологического эффекта. М.: Госатомиздат, 1960. С. 60-65.
60. Тарусов Б.П. Первичные процессы лучевого поражения. М.: Госатом-
Госатомиздат, 1962. 96 с.
61. Тимофеев-Ресовский Н.В., Иванов В.П., Корогодин В.И. Применение
принципа попадания в радиобиологии. М.: Атомиздат, 1968. 228 с.
62. Тимофеев-Ресовский Н.В., Савич А.В., Шальное М.И. Введение в мо-
молекулярную радиобиологию. М.: Медицина, 1980. 320 с.
63. Федорова. Т.А., Терещенко О.Я., Мазурик В.К. Нуклеиновые кис-
кислоты и белки в организме при лучевом поражении. /Под ред.
Т.А.Федоровой. М.: Медицина, 1972. 407 с.
64. Хуг О., Келлер А. Стохастическая радиобиология. /Пер. с нем. М.:
Атомиздат, 1969. 183 с.
65. Циммер К.Г. Проблемы количественной радиобиологии. /Пер. с нем.
М.: Госатомиздат, 1962. 101 с.
Список литературы 397
66. Штреффер К. Радиационная биохимия. /Пер. с нем. М.: Атомиздат,
1972. 200 с.
67. Эйдус Л.Х. Физико-химические основы радиобиологических процессов
и защиты от излучений. М.: Атомиздат, 1979. 216 с.
68. Эйдус Л.Х. Мембранный механизм биологического действия малых
доз. Новый взгляд на проблему. М.: ООО «Типография ФНПР», 2001.
81 с.
69. Эйдус Л.Х., Корыстов Ю.Н. Кислород в радиобиологии. М.: Энерго-
атомиздат, 1984. 176 с.
70. Эмануэль Н.М., Заиков Г.Е., Крицман В. А. Цепные реакции (истори-
(исторический аспект). М.: Наука, 1989. 336 с.
71. Ярмоненко СП. Радиобиология человека и животных. Учебник. Изд.
2-е. М.: Высшая школа, 1988. 424 с.
72. Biological Effects of Low Radiation Doses — Models, Mechanisms and
Uncertainties. Report to the General Assambley, 48 Session of UNSCEAR.
Vienna, April 12-16, 1999.
73. Gerber G.B., Altman K.I. Radiation Biochemistry. Vol. II. Tissue and
body fluids. New York, London: Acad. Press, 1970. 396 p.
Статьи, тезисы докладов
74. Бонд В.П. Основы радиобиологии, необходимые для понимания вли-
влияния ионизирующих излучений на кроветворение. //Руководство по
радиационной гематологии. (Совм. изд. МАГАТЭ и ВОЗ). /Пер. с англ.
М.: Медицина, 1974. С. 68-70.
75. Бурлакова Е.Б. Действие сверхмалых доз. //Вестник РАН. 1994. Т. 64.
С. 425-431.
76. Бурлакова Е.Б. Биоантиоксиданты: новые горизонты. //Биоантиокси-
дант. VI Междунар. конф.. Тез. докл. М.: РАН, 2002. С. 69-70.
77. Burlakova E.B.//Low doses of radiation: are they dangerous? Hungtington,
New York: Nova Science Publs., Inc., 2000. Ch. 11. P. 141-154.
78. Бурлакова Е.Б., Михайлов В.Ф., Мазурик В.К. Система окислительно-
восстановительного гомеостаза при радиационно-индуцируемой неста-
нестабильности генома. //Радиационная биология. Радиоэкология. 2001.
Т. 41, № 5. С. 489-499.
79. Ванин А.Ф. Оксид азота в биологии: история, состояние и перспективы
исследований. //Биохимия. 1998. Т. 63. Вып. 7. С. 867-869.
80. Вилков Л.В. Физические методы исследования в химии. //ISSEP. Эн-
Энциклопедия. Современное естествознание. Т. 1. Физическая химия. М.:
Наука-Флинта, 1999. С. 225-230.
81. Владимиров Ю.А. Биологические мембраны и незапрограммированная
гибель клетки. //Соросовский образовательный журнал. 2000. Т. 6, № 9
E8). С. 2-9.
82. Газиев А. И. Ферменты в пострадиационном метаболизме ДНК.
//Современные проблемы радиобиологии. /Под общей ред. А. М. Ку-
Кузина. Т. 4. Радиационная биохимия. /Под ред. Е. Ф. Романцева. М.:
Атомиздат, 1975. С. 41-82.
83. Гераськин С.А. Концепция биологического действия малых доз иони-
ионизирующего излучения на клетки. //Радиационная биология. Радиоэко-
Радиоэкология. 1995. Т. 35, № 5. С. 571-508.
84. Грейб Р. Действие малых доз ионизирующего излучения. Эффект
Петко. //Ядерная энциклопедия. М.: Благотв. фонд Ярошинской, 1996.
398 Список литературы
С. 387-394.
85. Зеленцов Б. П. Математические модели на основе процесса размноже-
размножения и гибели объектов. //Соросовский образовательный журнал. 2001.
Т. 7, № 6 F7). С. 92-97.
86. Коломийцева И. К. Немонотонность зависимости доза-эффект в обла-
области малых доз ионизирующей радиации. //Радиоэкология. 2003. Т. 43,
№ 2. С. 179-181.
87. Кудряшов Ю.Б. Роль липидных радиотоксинов в лучевом токсическом
эффекте. //Радиотоксины, их природа и роль в биологическом дей-
действии радиации высокой энергии. М.: Атомиздат, 1966. С. 119-125.
88. Кудряшов Ю.Б. Основные принципы в радиобиологии. //Радиацион-
//Радиационная биология. Радиоэкология. 2001. Т. 41, № 5. С. 531-548.
89. Кудряшов Ю.Б., Гончаренко Е.Н. Лучевой стресс. //Москва — Черно-
Чернобылю. Книга II, М.: Воениздат, 1998. С. 197-204.
90. Кудряшов Ю.Б., Пархоменко И.М. Молекулярно-клеточные механиз-
механизмы биологического действия малых доз рентгеновского излучения на
изолированные клетки млекопитающих. //Радиобиология. 1987. Т. 27,
вып. 3. С. 297-302.
91. Кузин A.M. Радиотоксины. Их возможная природа и роль в развитии
радиационного поражения. //Радиотоксины, их природа ироль в био-
биологическом действии радиации высокой энергии. М.: Атомиздат, 1966.
С. 5-17.
92. Лучник Н.В., Куликова В.Г. Влияние предварительного облучения мы-
мышей на их последующую радиорезистентность. //Доклады АН СССР.
1956. Т. 110. С. 109-113.
93. Luchnic N.V., Sevankaev A.V. Radiation-induced chromosomal aberra-
aberrations in human lymphocytes. 1. Dependence on the dose of gamma-rays
and anomaly of low doses. //Mutat. Res. 1976. V. 36. P. 363-378.
94. Мазурик В.К., Михайлов В.Ф.О некоторых молекулярных механизмах
основных радиобиологических последствий действия ионизирующих
излучений на организм млекопитающих. //Радиационная биология.
Радиоэкология. 1999. Т. 39, № 1. С. 91-98.
95. Мазурик В.К., Михайлов В.Ф. Радиационно-индуцируемая нестабиль-
нестабильность генома: феномен, молекулярные механизмы, патогенетическое
значение. //Радиационная биология. Радиоэкология. 2001. Т. 41, № 3.
С. 272-289.
96. Мазурик В.К., Мороз Б.Б. Проблемы радиобиологии и белок р53.
//Радиационная биология. Радиоэкология. 2001. Т. 41, № 5. С. 548-572.
97. Мильничук В.К. Радиационная химия. //Соросовский образователь-
образовательный журнал. 2000. Т. 6, № 4 E3). С. 24-29.
98. Михайлов В.Ф., Мазурик В.К., Бурлакова Е.Б. Сигнальная функция
активных форм кислорода в регуляторных сетях ответа клеток на
повреждающие воздействия: участие в реализации радиочувствитель-
радиочувствительности и нестабильности генома. //Радиационная биология. Радиоэко-
Радиоэкология. 2003. Т. 43, № 1. С. 5-18.
99. Неймарк Ю.И. Простые математические модели и их роль в постиже-
постижении мира. //Энциклопедия. Современное естествознание. Т.З. Матема-
Математика. Механика. М.: МАГИСТР-ПРЕСС, 2000. С. 141-144.
100. Pelevina /./., Afanas'ev G.G. et al. //Low doses of radiation: are they
dangerous? /Ed. E. B. Burlakova. Hungtington, New York: Nova Science
Publishers, Inc., 2000. Ch. 11. P. 141-153.
Список литературы 399
101. Рождественский Л.М. Pro и contra пороговости/беспороговости мута-
мутагенного (канцерогенного) действия ионизирующего излучения низкого
уровня. //Радиационная биология. Радиоэкология. 2001. Т. 41, № 5.
С. 580-588.
102. Рубин А.Б. Кинетика биологических процессов. //Соросовский обра-
образовательный журнал. 1998. № 10 C5). С. 84-91.
103. Ряшко Л. Б. Модели динамики популяции: от порядка к хаосу.
//Соросовский образовательный журнал. 2001. Т. 7, № 10 G1). С. 122—
127.
104. Савич А.В. Радиационно-химические превращения и радиочувстви-
радиочувствительность биологических макромолекул. //Лучевое поражение. /Под
ред. Ю.Б.Кудряшова. М.: Изд-во Моск. ун-та, 1987. С 73-83.
105. Самуилов В.Д. Биохимия программированной клеточной смерти (апо-
птоза) у животных. //Соросовский образовательный журнал. 2001.
Т. 7, № 10 G1). С. 18-25.
106. Саенко А.С, Семенец Т.Н., Семина О.В. Повышение радиорези-
радиорезистентности (адаптивный ответ) in vivo колониеобразующих единиц
(КОЕс) после воздействия на мышей 7"лУчеи 60Со в малых дозах.
//Радиобиология. 1991. Т. 31. С. 716-717.
107. Скулачев В. П. О биохимических механизмах эволюции и роли кисло-
кислорода. //Биохимия. 1998. Т. 63, вып. 11. С. 1570-1579.
108. Скулачев В. П. Альтернативные функции клеточного дыхания
//Соросовский образовательный журнал. 1998. Т. 7, № 8 C3). С. 2-7.
109. Скулачев В. П. Активные формы кислорода и явления запрограм-
запрограммированной смерти: от органеллы до организма. //Биоантиоксидант.
VI Международная конференция. Тез. докл. М.: Изд-во Ун-та Дружбы
народов. 2002. С. 523-524.
110. Спирин А.С. Принципы структуры рибосом. //Соросовский образова-
образовательный журнал. 1998. № 11 C6). С. 65-70.
111. Спитковский Д.М. Концепция действия малых доз ионизирующих
излучений на клетки и ее возможные последствия к трактовке медико-
биологических последствий. //Радиационная биология. Радиоэкология.
1992. Т. 32, вып. 3. С. 382-400.
112. Спитковский Д.М. Новые биофизические и биохимические ас-
аспекты механизмов действия малых доз ионизирующей радиации.
//Радиационная биология. Радиоэкология. 1999. Т. 39, № 1. С. 145-155.
113. Spitkovsky D.M. //Low doses of radiation: are they dangerous? /Ed.
E. B. Burlakova. Hungtington, New York: Nova Science Publishers, Inc.,
2000. Ch. 14. P. 212-230.
114. Спитковский Д.М., Кузьмина И.В. Теоретические и эксперименталь-
экспериментальные подходы к проблеме индуцируемых адаптирующими дозами иони-
ионизирующей радиации изменений функциональных возможностей кле-
клеток. //Радиационная биология. Радиоэкология. 2001. Т. 41, № 5. С. 599-
605.
115. Тарусов Б.Н. Особенности действия радиоактивных веществ на орга-
организм. //Биологическое действие излучений и клиника лучевой болезни.
М.: 1954. С. 63-75.
116. Тарусов Б.Н. Первичные процессы при действии ионизирующих из-
излучений. //Первичные процессы лучевого поражения. /Под ред.
Б.Н.Тарусова. М.: Медгиз, 1957. С. 3-28.
117. Хансон К.П. Молекулярный механизм гибели лимфоидных клеток.
//Радиобиология. 1979. Т. 19, вып. 15. С. 814-820.
400 Список литературы
118. Хансон К. П. Апоптоз: современное состояние проблемы. //Известия
РАН, сер. биол. 1998. № 2. С. 134-141.
119. Цыб А., Иванов В. Канцерогенные риски малых доз облучения.
//Ядерное общество. 2002. № 3. С. 13-15.
120. Черпав скип Д. С, Паламарчук Е.К., Календо Г.С., Календо Ю.И. Ма-
Математическая модель одного из способов модификации радиочувстви-
радиочувствительности клеток. //Радиобиология. 1975. Т. 15, вып. 5. С. 662-670.
121. Шарпатый В. А. Радиационная модификация сахарного фрагмента
ДНК: образование разрывов, изменение конформации полимера, пе-
передача повреждения на основание. //Радиационная биология. Радио-
Радиоэкология. 1992. Т. 32, вып. 2. С. 183-193.
122. Шевченко В.А. Эволюция представлений о генетической опасности
ионизирующих излучений для человека. //Радиационная биология.
Радиоэкология. 2001. Т. 41, № 5. С. 615-626.
123. Шестаков СВ., Карбышева Е.А., Еланская И.В. //Генетика. 1982.
Т. 18, № 8. С. 1271-1281.
124. Шмакова Н.Л., Фадеева Т.А., Насонова Е.А., Красавин Е.А., Рзянина
А.В. Цитогенетические эффекты малых доз облучения в клетках мле-
млекопитающих: анализ феномена гиперрадиочувствительности и инду-
цировнной резистентности. //Радиационная биология. Радиоэкология.
2002. Т. 42, № 3. С. 245-250.
125. Эмануэль Н.М. Роль свободных радикалов в радиобиологических про-
процессах и некоторые новые возможности в разработке средств про-
против лучевого поражения. //Первичные механизмы биологического дей-
действия ионизирующих излучений. М.: Изд-во АН СССР, 1963. С. 73-84.
126. Alper Т. Low oxygen enhancement ratios for radiosensitive bacterial
strains and two types of primer lesion. //Nature. 1968. V. 217, № 5131.
P. 862-863.
127. Alper T. Cell death and its modification: the role of primary lesion in
membranes and DNA. //Biophysical aspects of radiation qualities. Vienna:
JAEA, 1971. P. 171-194.
128. Burrell A.D., Feldschreiber P., Dean C.J. DNA-membrane association and
the repair of double-strand breaks in X-irradiated micrococcus radiodurans.
//Biochimica et Biophysica Acta. 1971. V. 247, № 1. P. 38-53.
129. Calabrese E.J. Hormesis: changing view of the dose-response, a personal
account of the history and current status. //Mutat. Res. 2002. V. 511.
P. 181-189.
130. Calabrese E.J., Baldwin L.A. Radiation hormesis: its historical foundation
as a biological hypothesis. //BELLE Newsletter. 1999. V. a8. P. 2-37.
131. Ikushima T. Chromosomal responses to ionizing radiation reminiscent of
an adaptive response in culture Chinese humster cells. //Mutat. Res. 1987.
V. 180. P. 215-221.
132. Marnett L.J. Oxyradicals and DNA damage. //Carcinogenesis. 2000. V. 21,
№ 3. P. 361-370.
133. Oberbaum M., Kambar J. Hormesis: Dose-Dependent Reverse Effect of
Low and Very Low Doses. //Ultra High Dilution. Physiology and Physics.
/Ed. P. S. Endler, J. Shulte. Boston, Dordrecht, London: Kluwer Academic,
1994. 321 p.
134. Selye H. Syndrome produced by diverse nocuous agents. //Nature. 1936.
V. 138, № 3479.
Список литературы 401
Дополнительная литература
Монографии, учебники, пособия, справочники
135. Акаев И.Г. Проблемы постлучевого восстановления. М.: Атомиздат,
1970. 281 с.
136. Алексахин P.M., Васильев А.В., Дикарев В.Г. и др. Сельскохозяйствен-
Сельскохозяйственная радиоэкология. /Под ред. Р. М. Алексахина и Н. А. Корнеева. М.:
Экология. 1992. 400 с.
137. Аспекты клинической дозиметрии. /Под ред. Р. В. Ставицкого. М.:
Изд-во МНПИ, 2000. 388 с.
138. Артюхов В.Г., Наквасина М.А. Биологические мембраны. Структур-
Структурная организация, функции, модификация физико-химическими аген-
агентами. Учебное пособие. Воронеж: Воронежский ун-т, 2000. 296 с.
139. Артюхов В.Г., Наквасина М.А., Резван СР., Башарино О.В., Ваша-
нов Г.А. Практикум по биофизике. Воронеж: Воронежский ун-т, 2001.
224 с.
140. Арчаков А.И. Микросомальное окисление. М.: Наука, 1975. 328 с.
141. Ауэрбах Ш. Проблемы мутагенеза. /Пер. с англ. М: Мир, 1978. 463 с.
142. Ахманов С.А., Никитин СБ. Физическая оптика. М.: Изд-во Моск.
ун-та. 1998. 656 с.
143. Балантер Б.И., Ханин М.А., Чернавский Д.С. Введение в математи-
математическое моделирование патологических процессов. М.: Медицина, 1980.
264 с.
144. Бесядовский Р.А., Иванов К.В., Козюра А.К. Справочное руководство
для радиобиологов. М.: Атомиздат, 1978. 125 с.
145. Биоантиокислители. Труды МОИП. Секция биофизики и радиобиоло-
радиобиологии. Т. LII. /Под ред. И.И.Иванова М.: Наука, 1975. 268 с.
146. Болдырев А.А., Карнозин. М.: Изд-во Моск. ун-та, 1998. 320 с.
147. Браун А.Д., Моженок Т.П. Неспецифический адаптационный синдром
клеточной системы. М.: Наука, 1987. 231 с.
148. Бударков В.А, Зенкин А.С, Киршин В.А. Краткий радиоэкологиче-
радиоэкологический словарь. Саранск: 1998. 256 с.
149. Бурлакова Е.Б., Алесенко А.В., Молочкина Е.М., Пальмина Н.Л., Хра-
пова Н.Г. Биоантиоксиданты в лучевом поражении и злокачественном
росте. М.: Наука, 1975. 214 с.
150. Василенко О.И. Радиоэкология. М.: УНЦ ДО, 2003. 350 с; Курс лек-
лекций. М.: Изд-во Моск. ун-та, 1979. 241 с.
151. Веселова Т.В., Веселовский В.А., Чернавский Д. С. Стресс у растений.
М.: Изд-во Моск. ун-та, 1993. 145 с.
152. Вилков Л.В., Пентин Ю.А. Физические методы исследования в химии.
М.: Высшая школа, 1989.
153. Владимиров Ю.А., Арчаков А.И. Перекисное окисление липидов в
биологических мембранах. М.: Наука, 1972. 252 с.
154. Владимиров В.Г., Красильников И.И., Арапов О.В. Радиопротекторы:
структура и функции. Киев: Наукова думка, 1989. 220 с.
155. Геннис Р. Биомембраны. Молекулярная структура и функции. /Пер.
с англ. М.: Мир. 1997. 624 с.
156. Гурвич А.Г. Митогенетическое излучение. М.: Гослитиздат, 1932. 270 с.
157. Гурвич А.Г. Теория биологического поля. М.: Сов. наука, 1944. 155 с.
158. Дубур Г.Я., Белена А.Х. Биомембраны: структура, функции, медицин-
медицинские аспекты. Рига: 1981. 257 с.
26 Ю. Б. Кудряшов
402 Список литературы
159. Жербин Е.А., Комар В.Е., Хансон К.П., Чухловин А.А. Радиация.
Молекулы и клетки. М.: Знание, 1984. 160 с.
160. Иванов В.И., Лысцов В.Н., Губин А.Т. Справочное руководство по
микродозиметрии. М.: Энергоатомиздат, 1986. 184 с.
161. Иванов В.И., Машкович В.П., Центер Э.М. Международная система
единиц (СИ) в атомной науке и технике. М.: Атомиздат, 1981. 55 с.
162. Иванов В.К., Петровский A.M. Пошаговые и многошаговые процессы
управления в задачах оптимизации лучевой терапии опухолей. Мате-
Математические модели в иммунологии и медицине. М.: Мир, 1986. 310 с.
163. Ингрем Д. Электронный парамагнитный резонанс в биологии. /Пер. с
англ. М.: Мир, 1972. 296 с.
164. Каган В.Е., Орлов О.Н., Прилепко Л.И. Проблемы анализа эндоген-
эндогенных продуктов ПОЛ. //Итоги науки и техники. Биофизика. Т. 18. М.:
ВИНИТИ, 1986. 135 с.
165. Казначеев В.П., Михайлова Л.П. Сверхслабые свечения в межклеточ-
межклеточных взаимодействиях. Новосибирск: Наука, 1981. 144 с.
166. Клеппер Л. Я. Формирование дозовых полей радиоактивными источ-
источниками излучения. М.: Энергоатомиздат, 1993. 272 с.
167. Корогодин В.И. Каскадный мутагенез. //Сообщение ОИЯИ. Дубна:
1992. Препринт 19-22-81. 15 с.
168. Кудряшов Ю.Б. Радиобиология. //Бурлакова Е.В., Владимиров Ю.А.,
Колье О. Р. и др. Малый практикум по биофизике. М.: Высшая школа,
1964. С. 279-342.
169. Кузин A.M., Копылов В.А. Радиотоксины. М.: Наука, 1983. 76 с.
170. Меерсон Ф.З. Адаптация, стресс и профилактика. М.: Наука,1981.
278 с.
171. Милинчук В.К., Клиншпонт Э.Р., Тупиков В.И. Основы радиацион-
радиационной стойкости органических материалов. М.: Энергоатомиздат, 1994.
256 с.
172. Мороз Б.В., Кендыш И.И. Радиобиологический эффект и эндокринные
факторы. М.: Атомиздат, 1975. 232 с.
173. Насонов Д.И., Александров В.Я. Реакция живого вещества на внешние
воздействия. М.-Л.: Изд-во АН СССР, 1940. 321 с.
174. Романовский Ю.М., Степанова Н.В., Чернавский Д. С. Математиче-
Математическая биофизика. М.: Наука, 1984. 304 с.
175. Розенберг Г. С. Модели в фитоценологии. М.: Наука, 1984. 264 с.
176. Селье Г. Очерки об адаптационном синдроме. М.: Медгиз, 1960. 123 с.
177. Семенов И.И. Цепные реакции. Химическая кинетика. М.: Госхимте-
хиздат, 1966.
178. Скулачев В.П. Энергетика биологических мембран. М.: Наука, 1989.
564 с.
179. Смирнова О.А. Математическое моделирование динамики основных
систем организма облученных млекопитающих. //Автореф. дисс. д-ра
физ.-мат.наук. М.: 1992. 48 с.
180. Соболев А.С. Биохимия циклических ну к леотидов. М.: Энергоатомиз-
Энергоатомиздат, 1987. 111 с.
181. Суворов Н.Н. Шаткое B.C. Химия и фармакология средств профи-
профилактики радиационных поражений. М.: Атомиздат, 1975. 223 с.
182. Тарусов Б.Н. Сверхслабое свечение живых организмов. М.: Знание,
1972. 275 с.
183. Тарусов Б.Н., Иванов И.И., Петрусевич Ю.М. Сверхслабое свечение
биологических систем. М.: Изд-во Моск. ун-та, 1967. 71 с.
Список литературы 403
184. Томилин П. В. Генетическая стабильность клетки. Л.: Наука, 1983.
387 с.
185. Хансон К.П., Комар В.Е. Молекулярные механизмы радиационной
гибели клеток. М.: Энергоатомиздат, 1985. 380 с.
186. Шевченко В.А., Абрамов В.И., Печкуренков В.Л. Генетические иссле-
исследования на Восточноуральском радиоактивном следе. //Экологические
последствия радиоактивного загрязнения на Южном Урале. М.: Нау-
Наука, 1993. С. 258-302.
187. Шевченко В. А., Померанцева М.Д. Генетические последствия действия
ионизирующих излучений. М.: Наука, 1985. 279 с.
188. Шеннон С. Питание в атомном веке. Как уберечь себя от малых доз
радиации. Минск: 1991. 304 с.
189. Эмануэль Н.М., Кнорре Д. Г. Курс химической кинетики. М.: Высшая
школа, 1984. 463 с.
190. Luckey T.D. Hormesis with ionizing radiation. Boca Raton: CRC Press,
1980. 198 p.
191. Pospisil M., Vacha Y. Individual radiosensitivity mechanisms and their
manifestations. Praha: Academia. 210 p.
Статьи, тезисы докладов
192. Агол В.И. Генетически запрограммированная смерть клетки. //Эн-
//Энциклопедия. Современное естествознание. Т. 2. Общая биология. М.:
Наука-Флинта, 1999. С. 185-188.
193. Алесенко А.В. Роль липидов и продуктов перекисного окисления в
биосинтезе и функциональной активности ДНК. //Биохимия липидов
и их роль в обмене веществ. М.: Наука, 1981. С. 3-16.
194. Алесенко А.В. Роль липидов в передаче информационных сигналов
клеточной пролиферации и экспрессии онкогенов. //Биоантиоксидан-
ты: теоретические и прикладные аспекты. /Под ред. У. К. Ибрагимова
и Е. Б. Бурлаковой. Ташкент: ФАН, 1995. С. 83-112.
195. Альфредович А.А., Готлиб В.Я., Конрадов А.А., Конопля Е.Ф., Пеле-
Пелевина И. И. Действие малых доз гамма-излучения на клетки млекопи-
млекопитающих. //Изв. Акад. наук СССР, сер. биол. 1992. № 1. С. 127-130.
196. Andreev S,G, Khvosdunov J. К., Spitkovsky D.M, et al. //Microdosi-
metry. An Interdisciplinary Approach. /Eds. D. T. Goodhead, P. O'Neill,
H. G.Vinzel. Cambridge: Roy. Soc. Chemistry, 1997. P. 133-136.
197. Анищенко B.C. Динамические системы. //Соросовский образователь-
образовательный журнал. 1997. № 11 B4). С. 77-84.
198. Антонов В.Ф. Биофизика мембран. //Соросовский образовательный
журнал. 1996. № 6 G). С. 4-12.
199. Антонов В.Ф. Липидные поры: стабильность и проницаемость мем-
мембран. //Соросовский образовательный журнал. 1998. № 10 C5). С. 10-
17.
200. Арчаков А.П., Карузина И.И. Микросомальное окисление. //Энцик-
//Энциклопедия. Современное естествознание. Т. 8. Молекулярные основы
биологических процессов. М.: МАГИСТР-ПРЕСС, 2000. С. 261-268.
201. Безлепкин В.Г., Газиев А.И. Индуцированная нестабильность генома
половых клеток по мини- и микросателлитным последовательностям.
//Радиационная биология. Радиоэкология. 2001. Т. 41, № 5. С. 475-488.
202. Бердоносов С. С. Радиоактивные индикаторы в химических исследова-
исследованиях. //Соросовский образовательный журнал. 1999. № 4 D1). С. 51-57.
26*
404 Список литературы
203. Бердоносов С.С, Сапожников Ю.А. Ионизирующее излучение и окру-
окружающая среда. //Соросовский образовательный журнал. 2001. Т. 7,
№ 2 F3). С. 40-46.
204. Бирштейн Т.М., Хохлов А. Р. Конформация молекул. //Энциклопе-
//Энциклопедия. Современное естествознание. Т. 6. Общая химия. М.: МАГИСТР-
ПРЕСС, 2000. С. 117-120.
205. Благой Ю.П. Взаимодействие ДНК с биологически активными веще-
веществами (ионами металлов, красителями, лекарствами). //Соросовский
образовательный журнал. 1998. № 10 C5). С. 18-24.
206. Блюменфельд Л.А., Тихонов А.Н. Электронный парамагнитный резо-
резонанс. //Соросовский образовательный журнал. 1997. № 9 B2). С. 91-99.
207. Богданов А.А. Теломеры и теломераза. //Соросовский образователь-
образовательный журнал. 1998. № 12 C7). С. 12-18.
208. Богданов А.А. Биосинтез белка на рибосоме — заключительный этап
трансляции. //Энциклопедия. Современное естествознание. Т. 8. Мо-
Молекулярные основы биологических процессов. М.: МАГИСТР-ПРЕСС,
2000. С. 94-103.
209. Болдырев А.А. Окислительный стресс и мозг. //Соросовский образова-
образовательный журнал. 2001. Т. 7, № 4 F5). С. 21-28.
210. Боднарчук Н.А. Гипотеза о механизме индукции адаптивного ответа
при облучении клеток млекопитающих в малых дозах. //Радиационная
биология. Радиоэкология. 2002. Т. 42, № 1. С. 36-43.
211. Брюне Б., Сандау К., фон Кнетон А. Апоптическая гибель клеток и
оксид азота: механизмы активации и антагонистические сигнальные
пути. //Биохимия. 1998. Т. 63, вып. 7. С. 966-974.
212. Бумагин Н.А. Радикалы и их реакции. //Энциклопедия. Современное
естествознание. Т. 6. Общая химия. М.: МАГИСТР-ПРЕСС, 2000.
С. 24-29.
213. Бурлакова Е.Б. Особенности действия сверхмалых доз биологически
активных веществ и физических факторов низкой интенсивности.
//Росс. хим. журнал. 1999. Т. 43, № 5. С. 3-11.
214. Burlakova Е.В., Goloschapov et al. New aspects of regularities in the action
of low doses of low-level irradiation //Low doses of radiation: are they
dangerous? /Ed. E. B. Burlakova. Hungtington, New York: Nova Science
Publishers, Inc., 2000. Ch. I. P. 1-14.
215. Бурлакова Е.Б., Дзантиев Б.Г., Сергеев Г.Б., Эммануэль Н.М. Ра-
диолитическое расщепление жиров. //Известия вузов. Химия и хим.
технология. 1959. № 2. С. 533-540.
216. Бурлакова Е.Б., Храпова Н.Г. Перекисное окисление липидов и приро-
природа антиоксидантов. //Успехи химии. 1985. Т. 54, вып. 9. С. 1540-1558.
217. Бурлакова Е.Б., Эмануэль Н.М. //Физико-химические основы авторе-
авторегуляции в клетках. М.: 1965. С. 44.
218. Вартанян Л.С, Гуревич С.Н., Козаченко А.И., Наглер Л.Г., Лозов-
Лозовская Е.Л., Бурлакова Е.Б. Изменения скорости образования суперок-
супероксидных радикалов и активности супероксиддисмутазы и глютатион-
пероксидазы в субклеточных органеллах печени мышей при низкоин-
низкоинтенсивном облучении в малых дозах. //Биохимия. 2000. Т. 65, вып. 4.
С. 522-527.
219. Варфоломеев С.Д. Простагландины — новый тип биологических регу-
регуляторов. //Соросовский образовательный журнал. 1996. № 1 B). С. 17-
23
220. Васильев Ю.М. I. Сигнальные молекулы, вызывающие размножение
Список литературы 405
и гибель клеток. //Соросовский образовательный журнал. 1997. № 4
A7). С. 17-22.
221. Васильев Ю.М. П. Клетки строят ткань. //Соросовский образователь-
образовательный журнал. 1997. № 5 A8). С. 20-25.
222. Васъковский В.Е. Липиды. //Соросовский образовательный журнал.
1997. № 2 A5). С. 32-37.
223. Веселовский В.А. Сверхслабая биолюминесценция проростков злако-
злаковых. //Тр. МОИП. Т. 21. Биолюминесценция. М.: Наука, 1965.
224. Виноградов А. Д. Синтез АТФ в митохрондриях. //Энциклопедия. Со-
Современное естествознание. Т. 8. Молекулярные основы биологических
процессов. М.: МАГИСТР-ПРЕСС, 2000. С. 236-245.
225. Виноградов А.Д. Преобразование энергии в митохрондриях. //Энцик-
//Энциклопедия. Современное естествознание. Т. 8. Молекулярные основы
биологических процессов. М.: МАГИСТР- ПРЕСС, 2000. С. 246-255.
226. Владимиров Ю.А. Свечение, сопровождающее биохимические реак-
реакции. //Соросовский образовательный журнал. 1999. Т. 5, № 6 D3).
С. 25-32.
227. Владимиров Ю.А. Свободные радикалы в биологических систе-
системах. //Энциклопедия. Современное естествознание. Т. 8. Молекуляр-
Молекулярные основы биологических процессов. М.: МАГИСТР-ПРЕСС, 2000.
С. 271-279.
228. Владимиров Ю.А. Активированная хемилюминесценция и биолюми-
биолюминесценция как инструмент в медико-биологических исследованиях.
//Соросовский образовательный журнал. 2001. Т. 7, № 1 F2). С. 16-23.
229. Владимиров Ю.А, Литвин Ф.Ф. Исследование сверхслабых свечений
в биологических системах. //Биофизика. 1959. Т. 4, № 5. С. 601-605.
230. Власов П.А., Квачева Ю.Е. и др. APUD- и RAA-системы регуляции
при остром лучевом поражении. //Радиационная биология. Радиоэко-
Радиоэкология. 2001. Т. 41, № 1. С. 16-19.
231. Вовна В.И. Фотоэлектронная спектроскопия молекул. //Соросовский
образовательный журнал. 1999. № 1 C8). С. 86-91.
232. Voevodskaya, N. V, Vanin A,F. Gamma irradiation potenciation L-arginin
dependent NO formation in mice. //Biochem. biophys. res. commun. 1992.
V. 186, № 3. P. 1423-1428.
233. Воронов В.К. Ядерный магнитный резонанс. //Соросовский образова-
образовательный журнал. 1996. № 10 A1). С. 70-75.
234. Гераськин С.А., Срапульцев Б.И. Стохастическая модель индуцирован-
индуцированной нестабильности генома. //Радиационная биология. Радиоэкология.
1995. Т. 35, вып. 4. С. 451-462.
235. Гильяно Н.Я., Бондарев Г.Н., Бикинеева Е.Г., Красоцкая Г.И., Нос-
кин Л.А. Исследование радиопротекторного эффекта ингибитора NO-
синтазы L-NAME в культуре клеток китайского хомячка. //Радиаци-
//Радиационная биология. Радиоэкология. 2001. Т. 41, № 6. С. 653-658.
236. Гольдштейн Н.И. Аэроионы: возможная роль активных форм кисло-
кислорода в механизмах биологического действия. //Кислородные радикалы
в химии, биологии и медицине. Рига: 1988. С. 80—108.
237. Гольдштейн Н.И. Биофизические аспекты физиологического действия
экзогенного О2 на животных. //Автореф. дисс. докт. биол. наук. М.:
2000. 57 с.
238. Гончаренко Е.Н., Антонова СВ., Ахалая М.Я., Кудряшов Ю.Б. Вли-
Влияние малых доз ионизирующей радиации на уровень катехоламинов и
кортикостероидов в надпочечниках мышей. //Радиационная биология.
406 Список литературы
Радиоэкология. 2000. Т. 40, № 2. С. 160-161.
239. Гончаренко Е.Н., Балтбарздыс З.Я. Граевская Е.Э., Ковалева Т.А.,
Кудряшов Ю.Б. О химической природе липидного радиотоксина. //Ра-
//Радиобиология. 1968. Т. 8, вып. 4. 497-506.
240. Делоне Н.Б. Нелинейная оптика. //Энциклопедия. Современное есте-
естествознание. Т. 7. Физика волновых процессов. М.: МАГИСТР-ПРЕСС,
2000. С. 181-187.
241. Дмитриев Л.Ф. Малоновый диальдегид может контролировать кле-
клеточное деление на стадии репликации ДНК (гипотеза). //Ж. эвол.
биохимии и физиологии. 1992. Т. 28, № 6. С. 720-730.
242. Евгеньева И.И. Планарная хроматография и анализ органических ве-
веществ. //Соросовский образовательный журнал. 1999. № 11 D8). С. 50-
55.
243. Евстигнеева Р.П. Химия биологически актитвных гетероциклов.
//Энциклопедия. Современное естествознание. Т. 6. Общая химия. М.:
МАГИСТР-ПРЕСС, 2000. С. 50-55.
244. Еловников С. С. Оже-электронная спектроскопия. //Соросовский обра-
образовательный журнал. 2001. Т. 7, № 2 F3). С. 82-88.
245. Ермолаева Н.В. Ферментативный распад дезоксирибонуклеопроте-
идов. //Биохимия. 1961. Т. 26, вып. 5. С. 897-908.
246. Ермолаева Н.В., Водолазская Н.А. Физико-химические свойства хро-
хроматина и его фрагментов, образующихся в тимусе крыс в процессе
постлучевого автолиза и под действием кислой ДНК-азы и протеазы
на препараты ДНК. //Радиобиология. 1978. Т. 18, вып. 4. С. 492-497.
247. Жестяников В.Д. Ингибирование пострадиационного восстановления
как один из путей усиление действия ионизирующих излучений. //Мед.
радиология. 1975. Т. 20, № 1, С. 32-38.
248. Животовский Б.Д., Звонарева Н.Б., Воскобойников Г.В., Хансон К. П.
Молекулярные механизмы интерфазной гибели лимфоидных клеток.
Сообщ. 2. Сравнительная характеристика продуктов пострадиацион-
пострадиационной деградации и нуклеазного переваривания хроматина тимуса крыс.
//Радиобиология. 1980. Т. 20, вып. 4. С. 502-507.
249. Животовский Б.Д., Звонарева Н.Б., Степанов Р.П., Хансон К.П. Мо-
Молекулярные механизмы интерфазной гибели лимфоидных клеток. Со-
Сообщ. 3. Исследование плавучей плотности и электронно-микроскопи-
электронно-микроскопическая характеристика продуктов пострадиационной деградации хро-
хроматина тимуса крыс. //Радиобиология. 1980. Т. 20, вып. 5. С. 643-647.
250. Zasukhina G.D. //Low doses of radiation: are they dangerous? /Ed.
E. B. Burlakova. Hungtington, New York: Nova Science Publishers, Inc.,
2000. Ch. 6. P. 77-86.
251. Зеленин К.Н. Газовая хроматография в медицине. //Соросовский об-
образовательный журнал. 1996. № 10 A1). С. 20-25.
252. Зеленин К.Н. Оксид азота (II): новые возможности давно известной
молекулы. //Соросовский образовательный журнал. 1997. № 10 B3).
С. 105-110.
253. Иванов В.К., Цыб А.Ф. Последствия Чернобыльской катострофы.
//Здоровье человека. /Под ред. Е. Б. Бурлаковой. М.: Центр экологи-
экологической политики Е. Б. Бурлаковой — Центр экологической политики
России, 1996. С. 10-23.
254. Календо Г. С. Различные уровни радиозащиты в популяции опухолевых
клеток. //Радиационная биология. Радиоэкология. 2001. Т. 41, № 5.
С. 519-427.
Список литературы 407
255. Карцева А. А. ^Жидкостная хроматография в медицине. //Соросовский
образовательный журнал. 2000. Т. 6, № 11 F0). С. 35-40.
256. Киселев М.Ф. Российско-американская программа изучения влияния
радиации на здоровье населения на Южном Урале. //Мед. радиол, и
рад. безопасность. 2001. № 6. С. 5-8.
257. Кнорре Д. Г. Что изучает молекулярная биология? //Энциклопедия.
Современное естествознание. Т. 8. Молекулярные основы биологиче-
биологических процессов. М.: МАГИСТР-ПРЕСС, 2000. С. 7-12.
258. Kolomiytseva I.K., Slozhenikina L.V. et at. Nonmontonous changes in
metabolic parameters of tissues and cells under action of ionizing radiation
in animals. //J. Biol. Physics. 1999. V. 25. P. 325-338.
259. Корогодин В.И. Радиотаксоны и надежность генома. //Радиобиология.
1982. Т. 22, вып. 2. С. 147-154.
260. Корогодин В.И. Кариотаксоны, надежность генома и прогрессивная
биологическая эволюция. //Природа. 1985. № 2. С. 3-14.
261. Корочкин Л. И. Генетический контроль развития клеток. //Энцикло-
//Энциклопедия. Современное естествознание. Т. 2. Общая биология М.: Наука-
Флинта, 1999. С. 93-98.
262. Корыстное Ю.Н. Прямое и косвенное действие ионизирующего излуче-
излучение в клетке. //Радиобиология. 1986. Т. 26, вып. 1. С. 137.
263. Кошеров А.Н., Филиппович И.Н. Радиоадаптивный ответ in vitro
нестимулированных лимфоцитов крыс по металлотионеиновому тесту.
//Радиационная биология. Радиоэкология. 2002. Т. 42, № 2. С. 130-135.
264. Красавин Е.А. Радиобиологические исследования в ОИЯИ. //Радиаци-
//Радиационная биология. Радиоэкология. 2001. Т. 41, № 5. С. 528-530.
265. Кудряшов Ю.Б. О природе и характере накопления гемолитического
фактора, появляющегося в печени крыс, облученных рентгеновскими
лучами. //Доклады АН СССР. 1956. Т. 109, № 3. С. 515-521.
266. Кудряшов Ю.Б. Лучевое поражение критических систем. //Лучевое
поражение. /Под ред. Ю. Б. Кудряшова. М.: Изд-во Моск. ун-та, 1987.
С. 5-72.
267. Кудряшов Ю.Б. Химическая защита от лучевого поражения. //Соро-
//Соросовский образовательный журнал. 2000. Т. 6, № 6 E5). С. 21-26.
268. Кудряшов Ю.Б., Балтбарздыс З.Я., Ле Дак Льеу. О возможности
непрямого эффекта ионизирующей радиации в липидных растворах.
//Доклады АН СССР. 1964. Т. 156. № 1. С. 191-193.
269. Кудряшов Ю.Б., Гасанов Г.И., Гончаренко Е.Н., Дороэюинский В.Б.,
Дряновский П.Г., Какушкина М.Л., Коноплянников А.Г., Лабзи-
на Н.Г., Сюэ Юй-хуа. Естественный радиомиметик и его действие
на различные биологические объекты и системы. //Журнал общей
биологии. 1964. Т. XXV, № 1. С. 3-21.
270. Кудряшов Ю.Б, Гончаренко Е.Н. Лучевая болезнь. //Ядерная энци-
энциклопедия. М.: Благотв. фонд Ярошинской, 1996. С. 322-326.
271. Кудряшов Ю.Б, Гончаренко Е.Н. Современные проблемы противо-
противолучевой химической защиты организмов. //Радиационная биология.
Радиоэкология. 1999. Т. 39, № 2-3. С. 197-211.
272. Кудряшов Ю.Б., Гончаренко Е.Н., Антонова СВ., Ахалая М.Я., Бай-
эюуманов А.А. Исследование действия сублетальных доз ионизирую-
ионизирующих излучений на эндогенный фон радиорезистентности. //Радиаци-
//Радиационная биология. Радиоэкология. 1997. Т. 37, вып. 3. С. 372-376.
273. Кудряшова Н.Ю. Влияние ионизирующей радиации на ДНК-мембран-
ДНК-мембранные комплексы. //Лучевое поражение. М.: Изд-во Моск. ун-та, 1987.
408 Список литературы
С. 93-97.
274. Кузин A.M. Молекулярная радиобиология клеточного ядра. М.: Атом-
издат, 1973. 208 с.
275. Кузнецов В. В. Проточный инжекционный анализ. //Соросовский об-
образовательный журнал. 1999. № 11 D8). С. 56-60.
276. Кузьмин Р.Н. Рентгеновская оптика. //Энциклопедия. Современное
естествознание. Т. 7. Физика волновых процессов. М.: МАГИСТР-
ПРЕСС, 2000. С. 23-30.
277. Кулинский В.И, Колесниченко Л.С. //Успехи совр. биологии. 1993.
Т. 113, вып. 1. С. 107-122.
278. Кулинский В. И. Активные формы кислорода и оксидативная модифи-
модификация. //Соросовский образовательный журнал. 1999. Т. 5, № 1 C8).
С. 2-7.
279. Лабзина Н.Г., Кудряшов Ю.Б., Лучник Н.В. Цитогенетическое дей-
действие липидных радиотоксинов. //Радиотоксины, их природа и роль
в биологическом действии радиации высокой энергии. М.: Атомиздат,
1966. С. 176-181.
280. Легеза В.И., Владимиров В.Г. Новая классификация профилактиче-
профилактических противолучевых средств. //Радиационная биология. Радиоэколо-
Радиоэкология. 1998. Т. 38, вып. 3. С. 416-425.
281. Лось Л.А. Восприятие сигналов биологическими мембранами: сенсор-
сенсорные белки и экспрессия генов. //Соросовский образовательный жур-
журнал. 2001. Т. 7, № 9 G0) С. 14-22.
282. Лучник Н.В., Морозов К.Н. и др. Влияние стадии клеточного цикла
и времени фиксации на частоту хромосомных аберраций, вызванных
облучением. //Доклады АН СССР. 1973. Т. 212, № 5. С. 1220-1223.
283. Мазалов М.Л. Рентгеновские спектры и электронная структура мо-
молекул. //Энциклопедия. Современное естествознание. Т. 7. Физика
волновых процессов. М.: МАГИСТР-ПРЕСС, 2000. С. 73-78.
284. Мазалов М.Н. Рентгеноэлектронная спектроскопия и ее применение в
химии. //Соросовский образовательный журнал. 2000. Т. 6, № 4 E3).
С. 37-44.
285. Мазо Г.Н. Методы атомного спектрального анализа. //Соросовский
образовательный журнал. 2000. Т. 6, № 7 E6) С. 31-34.
286. Мазурик В.К., Михайлов В.Ф., Ушенкова Л.Н. Динамический компо-
компонент поддержания стабильности генома в клетках костного мозга у
мышей после хронического облучения низкой интенсивности длитель-
длительностью один год. //Радиационная биология. Радиоэкология. 2002. Т. 42,
№ 6. С. 669-674.
287. Малышев И.Ю., Манухина Е.Б. Стресс, адаптация и оксид азота.
//Биохимия. 1998. Т. 63, вып. 7. С. 992-1006.
288. Меньщикова Н.Б., Зенков Н.К., Реутов В.П. Оксид азота и NO-
синтазы в организме млекопитающих при различных функциональных
состояниях. //Биохимия. 2000. Т. 63, вып. 4. С. 485-503.
289. Мерзляк М. Н. Активированный кислород и окислительные процессы
в мембранах растительной клетки. //Итоги науки 1989. Т. 113, вып. 1.
С. 107-122.
290. Мерзляк М.Н. Активированный кислород и жизнедеятельность рас-
растений. //Соросовский образовательный журнал. 1997. Т. 5, № 9 D6).
С. 20-26.
291. Микоян В.Д., Воеводская Н.В., Кубрина Л.Н., Маленкова И.В., Ва-
Ванин А.Ф. Экзогенное железо и 7-облучение индуцируют синтез NO-
Список литературы 409
синтетазы в печени мышей. //Биохимия. 1994. Т. 59, вып. 5. С. 732—
738.
292. Москалев А.А., Зайнуллин В. Г. Изучение роли апоптотической гибели
клетки в радиоиндуцированном старении. //Радиационная биология.
Радиоэкология. 2001. Т. 41, № 6. С. 650-652.
293. Моссэ И.Б. Современные проблемы биодозиметрии. //Радиационная
биология. Радиоэкология. 2002. Т. 42, № 6. С. 654-660.
294. Недоспасов А.А. Биогенный NO в конкурентных отношениях. //Био-
//Биохимия. 1998. Т. 63, вып. 7. С. 881-1006.
295. Осадько И.С. Молекулярная спектроскопия. //Энциклопедия. Со-
Современное естествознание. Т. 7. Физика волновых процессов. М.:
МАГИСТР-ПРЕСС, 2000. С. 93-98.
296. Осипов А.И. Термодинамика вчера, сегодня, завтра. Часть I. Равно-
Равновесная термодинамика. //Соросовский образовательный журнал. 1999.
№ 4 D1). С. 79-85.
297. Осипов А.И. Термодинамика вчера, сегодня, завтра. Часть П. Неравно-
Неравновесная термодинамика. //Соросовский образовательный журнал. 1999.
№ 5 D2). С. 91-97.
298. Пархоменко И.М., Перишвили Г.В., Туровецкий В.В., Кудряшов Ю.Б.,
Рубин А.В., Бровко Л.Ю. Влияние малых доз ионизирующей радиации
на внутриклеточный рН, содержание АТФ и синтетическую актив-
активность активность культивируемых фибробластов китайского хомячка.
//Радиобиология. 1993. Т. 33, вып. 1. С. 104-109.
299. Пелевина И.П., Алексенко А.В. и др. Уровень спонтанных и индуциро-
индуцированных облучением цитогенетических повреждений в лимфоцитах кро-
крови детей в зависимости от возраста и условий жизни. //Радиационная
биология. Радиоэкология. 2001. Т. 41, № 5. С. 489-499.
300. Пескин А.П. О регуляторной роли активных форм кислорода.
//Биохимия. 1998. Т. 63, вып. 9. С. 1307-1308.
301. Платцман Р. Л. Энергетический спектр возбуждения при действии
ионизирующей радиации. //Современные проблемы радиационных ис-
исследований (материалы III Международного конгресса по радиацион-
радиационным исследованиям. Италия, 1966 г.). М.: 1972.
302. Померанцева М.Д., Рамайя Л.Х. Предварительное облучение как фак-
фактор, изменяющий эффективность лучевого воздействия на организм.
//М.: Изд-во АН СССР, 1962. С. 91-106.
303. Поливода Б.П., Конев В.В. Корреляция мембранных и генетических
эффектов перекисного окисления липидов. //Радиобиология. 1986.
Т. 26, вып. 6. С. 803-805.
304. Пурмаль А.П. Цепные реакции. //Энциклопедия. Современное есте-
естествознание. Т. 1. Физическая химия. М.: Наука-Флинта, 1999. С. 116-
122.
305. Пшенникова М.Г. Стресс и адаптация. //Энциклопедия. Современное
естествознание. Т. 2. Общая биология. М.: Наука-Флинта, 1999. С. 244-
251.
306. Радиация и риск. Бюлл. Национ. радиац.-эпидемиол. регистра, а) 1995.
вып. 5, 6; б) 1998.
307. Раева Н.Ф. Роль малондиальдегида и сходных с ним соединений в
образовании сшивок при 7"°блучении ДНК. //Радиобиология. 1980.
Т. 20, вып. 5. С. 664-670.
308. Реутов В.П., Сорокина Е.Г. NO-синтазная и нитроредуктазная
компоненты цикла оксида азота. //Биохимия. 1998. Т. 63, вып. 7.
410 Список литературы
С. 1029-1038.
309. Рождественский Л.М. Концепция биологического действия ионизи-
ионизирующей радиации низкого уровня (анализ проблемы в аспектах по-
роговости эффектов и радиочувствительности—радиоактивности био-
биоструктур различного уровня организации). //Радиационная биология.
Радиоэкология. 1999. Т. 39, вып. 1. С. 127-149.
310. Рощина Т.М. Хроматография в физической химии. //Соросовский об-
образовательный журнал. 2000. Т. 6, № 8 E7) С. 39-46.
311. Рысина Т.Н., Либинзон Р.Е. Связанные и солерастворимые дезоксипо-
линуклеотиды в тканях кролика поссле облучения. //Биохимия. 1960.
Т. 25, вып. 5. С. 825-830.
312. Саенко А.С, Замулаева И.А. Результаты и перспективы использо-
использования методов определения частоты мутантных клеток по локусам
гликофорина А и Т-клеточного рецептора для оценки генотоксиче-
ского действия ионизирующих излучений в отдаленные сроки после
воздействия. //Радиационная биология. Радиоэкология. 2000. Т. 40,
№ 5. С. 549-553.
313. Самуилов В. Д. Программированная клеточная смерть у растений.
//Соросовский образовательный журнал. 2001. № 10 G1). Т. 7. С. 12-
17.
314. Свободнорадикальные процессы в биологических системах. //Труды
МОИП. Секция биофизики и радиобиологии /Под ред. А. И. Журав-
Журавлева. М.: Наука, 1966. Т. XVI. 295 с.
315. Севанькаев А.В. Некоторые итоги цитогенетических исследований в
связи с оценкой последствий Чернобыльской аварии. //Радиационная
биология. Радиоэкология. 2000. Т. 40, № 5. С. 590-597.
316. Сидоров Л.Н. Масс-спектрометрия и определение массы больших мо-
молекул. //Соросовский образовательный журнал. 2000. Т. 6, № 11 F0).
С. 41-45.
317. Скулачев В.П. Кислород в живой клетке: добро и зло. //Соросовский
образовательный журнал. 1996. Т. 2, № 3 D). С. 4-10.
318. Скулачев В.П. О биохимических механизмах эволюции и роли кисло-
кислорода. //Биохимия. 1998. Т. 63, вып. 11. С. 1570-1579.
319. Скулачев В.П. Эволюция, митохондрии и кислород. //Соросовский
образовательный журнал. 1998. № 9 C3). С. 1-7.
320. Скулачев В.П. Законы биоэнергетики. //Энциклопедия. Современное
естествознание. Т. 8. Молекулярные основы биологических процессов.
М.: МАГИСТР-ПРЕСС, 2000. С. 223-227.
321. Скулачев В. П. Явления запрогрммированной смерти. Митохондрии,
клетки и органы: роль активных форм кислорода. //Соросовский об-
образовательный журнал. 2001. Т. 7, № 6 F7). С. 4-10.
322. Славатпинский С.А. Фундаментальные частицы. //Соросовский обра-
образовательный журнал. 2001. Т. 7, № 2 F3). С. 62-68.
323. Сойфер В.Н. Репарация генетических повреждений. //Энциклопедия.
Современное естествознание. Т. 8. Молекулярные основы биологиче-
биологических процессов. М.: МАГИСТР-ПРЕСС, 2000. С. 32-42.
324. Солдатов А.В. От спектроскопии HEXAFS к спектроскопии XANES:
новые возможности исследования материи. //Соросовский образова-
образовательный журнал. 1998. № 12 C7). С. 101-104.
325. Спитковский Д.М., Ермаков А.В., Горин Ф.И. Особенности внепла-
внепланового синтеза ДНК и изменений структурных параметров ядер лим-
лимфоцитов человека после действия рентгеновского излучения в малых
Список литературы 411
дозах и в сочетании с УФ-облучением. //Радиационная биология. Ра-
Радиоэкология. 1994. Т. 34, № 1 С. 23-31.
326. Сторожок Н.М. Биоантиоксиданты и фосфолипиды. Механизм соче-
танного действия. //Биоантиоксидант. VI Международная конферен-
конференция. Тез. докл. М.: Изд-во ун-та Дружбы народов, 2002. С. 555-556.
327. Стручков В.А., Стражевская Н.Б. ДНК-связанные липиды: состав и
возможные функции. //Биохимия. 1993. Т. 58. С. 1154-1176.
328. Тарханов И.Р. //Известия СПб биол. лаборатории АН 1896. Т. 1. № 3.
С. 47.
329. Тимофеев-Ресовский Н.В. //Первичные механизмы биологического
действия ионизирующих излучений. М.: Изд-во АН СССР, 1963. С. 162.
330. Тимофеев-Ресовский Н.В. Биофизическая интерпретация явления ра-
радиостимуляции растений. //Биофизика. 1956. Т. 1, вып. 7. С. 616-627.
331. Тихонов А.Н. Молекулярные преобразователи энергии в живой клетке.
//Соросовский образовательный журнал. 1997. № 7 B0). С. 10-17.
332. Тихонов А.Н. Электронный парамагнитный резонанс в биологии.
//Соросовский образовательный журнал. 1997. № 11 B4). С. 8-15.
333. Тихонов А.Н. Спиновые метки. //Соросовский образовательный жур-
журнал. 1998. № 1 B6). С. 8-15.
334. Ткачук Б.А. Молекулярные механизмы нейроэндокринной регуляции.
//Соросовский образовательный журнал. 1998. № 6 C1). С. 16-20.
335. Ткачук В.А. Мембранные рецепторы и внутриклеточный кальций.
//Соросовский образовательный журнал. 2001. Т. 7, № 1 F2). С. 10-15.
336. Тонкое М.В. Фурье-спектросопия — максимум информации за мини-
минимум времени. //Соросовский образовательный журнал. 2001. Т 7, № 1
F2). С. 83-88.
337. Тюрин В.А. и др. Репарация липидного бислоя мембран при окисли-
окислительном стрессе: реацелирование фосфатидилэтаноламина в мембра-
мембранах синаптосом фоторецепторов и эритроцитов. //Ж. эволюц. биохи-
биохимии и физиологии. 1996. Т. 32, № 3. С. 248-255.
338. Угай Я.А. Валентность, химическая связь и степень окисления —
важнейшие понятия химии. //Соросовский образовательный журнал.
1997. № 2 A5). С. 53-57.
339. Уманский СР. Генетическая программа клеточной гибели: гипотеза и
некоторые приложения. //Успехи совр. биол. 1982. Т. 93, вып. 1. С. 139-
148.
340. Уманский СР. Критерии клеточной гибели. Радиобиология. //Инф.
Бюлл. Научного совета по радиобиологии АН СССР. 1985. № 31. С. 78-
79.
341. Филиппович И.В., Романцев Е.Ф. Влияние ионизирующей радиации,
сульфгидрильных соединений и гипоксии на фософрилирование ти-
мидина в зобной железе и селезеке крыс. //Радиобиология. 1968. Т. 8,
вып. 6. С. 800-805.
342. Филиппович И.В., Солдатенков В.А., Сорокина Н.И., Романцев Е.Ф.
Исследование молекулярных механизмов радиационной гибели лим-
фоидных клеток. Сообщ. 3. Репарация суперспиральной ДНК суб-
субпопуляций тимоцитов, различающихся по радиочувствительности.
//Радиобиология. 1982. Т. 22, вып. 2. С. 165-170.
343. Хансон К. П. Молекулярные механизмы интерфазной гибели лимфо-
идных клеток. //Радиобиология. 1979. Т. 19, вып. 6. С. 814-820.
344. Черепанов В.И. Резонансные методы исследования вещества.
//Энциклопедия. Современное естествознание. Т. 7. Физика волновых
412 Список литературы
процессов. М.: МАГИСТР-ПРЕСС, 2000. С. 115-120.
345. Чернавский Д.С., Паламарчук Е.К., Календо Г.С., Календо Ю.И. Ма-
Математическая модель одного из способов модификации радиочувстви-
радиочувствительности клеток. //Радиобиология. 1975. Т. 15, вып. 5. С. 662-670.
346. Чизмадэюев Ю.А. Мембранная биология: от липидных бислоев до
молекулярных машин. //Соросовский образовательный журнал. 2000.
Т. 6, № 8 E7). С. 12-17.
347. Чизмадэюев Ю.А. Как сливаются биологические мембраны.
//Соросовский образовательный журнал. 2001. Т. 7, № 5 F6).
С. 4-9.
348. Чизмадснсев Ю.А. Мембранная биология: от липидных бислоев до
молекулярных машин. //Соросовский образовательный журнал. 2000.
Т. 6, № 8 E7) С. 12-17.
349. Шарпатый В. А. Проблемы радиационной химии белковых молекул.
//Химия высоких энергий. 1995. Т. 29, № 2. С. 85-100.
350. Шишкина Л.Н., Кушнирева Е.В. и др. Роль антиоксидантного статуса
в формировании последствий биологического действия излучения в
малой дозе. //Радиационная биология. Радиоэкология. 2000. Т. 40, № 2.
С. 162-167.
351. Шмакова Н.Л., Абу Зеид О., Фадеева Т.А., Красавин Е.А., Куца-
ло П. В. Дозовая зависимость цитогенетических повреждений и адап-
адаптивный ответ клеток млекопитающих при действии ионизирующих
излучений в малых дозах. //Радиационная биология. Радиоэкология.
2000. Т. 40, № 4. С. 405-409.
352. Эберт М. Образование перекиси водорода при различных условиях
облучения. //Вопросы радиобиологии. М.: И. Л., 1956. С. 56-68.
353. Эйдус Л.Х. Роль межклеточного взаимодействия в инициации радиа-
радиационной гибели тимоцитов и проблема апоптоза. //Известия РАН, сер.
биол. 1998. № 2. С. 204-212.
354. Эйдус Л.Х. О механизме индукции репарации повреждений ДНК при
действии ионизирующего излучения на клетки. //Радиационная био-
биология. Радиоэкология. 2000. Т. 40, № 6. С. 674-677.
355. Эйдус Л.Х. Интерфазная гибель облученных тимоцитов — результат
эффекта свидетеля? //Радиационная биология. Радиоэкология. 2002.
Т. 42, № 3. С. 284-286.
356. Эйдус Л.Х., Эйдус В. Л. Проблемы механизма радиационного и химиче-
химического гормезиса. //Радиационная биология. Радиоэкология. 2001. Т. 41,
№ 5. С. 627-630.
357. Eidus L.Kh., Korystov Yu.N., Dobrovinskaya O.R., Shaposhnikova V.V.
The mechanism of radiation-induced interphase death of lymphoid cells: a
new hypothesis. //Radiat. Res. 1990. V. 123. P. 17-21.
358. Cramp W.A., Watkins D.K., Collins J. Synthesis of DNA by membrane-
DNA complexes from E.coli B/r and BS-I after exposure to fast electrons
and neutrons. //Int. J. Rad. Biol. 1972. V. 22, № 4. P. 379-387.
359. Desai J., Sawant P., Tappel A., Miller G.G. Lipid peroxidation as a cause
of damage in irradiated biological membranes. //Biochem. Biophys. Acta.
1964. Vol. 2, № 86. P. 277-289.
360. Frankel E.N. Lipid oxidation. //Progr. Lipid Res. 1980. V. 19, № 1-2. P. 1-
22.
361. Frankel E.N. Secondary product of lipid peroxidation. //Chem. Phys. of
Lipids. 1987. V. 44, № 2-4. P. 73-83.
Список литературы 413
362. Gille J.J., Joenji Н. Biological signification of oxygen toxicity: an introduc-
introduction. //Membrane Lipid oxidation V. 3. /Ed. С Vigo-Perfley. Boca Raton,
Ann Arbor, Boston: 1991. P. 1-32.
363. Gutteridge J.M.C., Hallivell A. The measurement and mechanism of lipid
peroxidation in biological systems. //TIBS. 1990. Vol. 15. P. 129-135.
364. Kagan V.E., Fabisiak J.P., Shvedova A. A. et al. Oxidative signaling
pathway for externalization of plasma membrane phosphatidilserine during
apoptosis. //FEBS Letters. 2000. V. 477. P. 1-7.
365. Kellerer A.M., Rossi E.N. //Proc. Second Symposium in microdosimetry
/Ed. H. G. Ebert Brussels: Commission of the Eur. Communities, 1970.
366. Lange C.S. Size and structure of a mammalian DNA determined by
viscoelastometry. //Biophysical J. 1975. V. 15, № 2, Pt. 2. P. 205.
367. Lehnert B.E., Goodvin E.H. Extracellular factor(s) following exposure to
alpha particle can cause sister chromatid exchanges in normal human cells.
//Cancer Res. 1997. V. 57. P. 2164-2171.
368. Leonarduzzi G., Arcan M.C. et al. Lipid oxidation products in cell signal-
signaling. //Free Radical Biology and Medicine. 2000. V. 28, № 9. P. 1370-1378.
369. Luckey T.D. Ionizing radiation promotes protozoan reproduction.
//Radiat. Res. 1986. V. 108. P. 215-221.
370. Marathe W.K., Harrison K.A. et al. Bioactive phospholipid oxidation
products. //Free Radical Biol. Med. 2000. V. 28, № 28. P. 1762-1770.
371. Mother sill C, O'Malley K., Seymour C.B. Relevance of radiation-induced
bystander effects for environmental risk assessment. //Радиационная био-
биология. Радиоэкология. 2002. Т. 42, № 6. С. 585-587.
372. Myers D.M., Be Wolfe D.E., Araki К. Effects of X-irradiation and of
metabolic inhibitors on rat thymocytes in vitro. //Can. J. Biochem. Phys-
iol. 1962. V. 40. P. 1532-1552.
373. Petkau A. Radiation affection of model phospholipid membranes. //Acta
Physiol. Scand. 1980. V. 492. P. 81-90.
374. Petkau A, Chelak W.S. Radioprotective effect of SOD on model phospho-
phospholipid membranes. //Biochem.. Biophys. Acta. 1976. V. 433, № 3. P. 111-
127.
375. Poli G., Bianzani M.V., Cheesman K.H. et al. Separation and charac-
characterization of the aldehidic products of lipid peroxidation stimulated by
carbon tetrachloride or ADP — iron in isolated rat hepatocytes fnd rat
liver microsomal suspensions. //Biochem. J. 1985. V. 227. P. 629-638.
376. Porter, N.A. Mechanisms for the autoxidation of polyunsaturated lipids.
//Ace. Chem. Res. 1986. V. 19. P. 262-268.
377. Reinhart E. Hormesis und die Bewertung kleinster Dosen von Wirkstoffen.
//Biol. Med. 1998. V. 27, № 2. P. 51-54.
378. Seymour C.B., Mothersill C. Delayed expression of lethal mutations and
genomic instability in the progeny of human epithelial cells that survived
in a bystander-killing environment. //Radiat. Oncol. Investig. 1997. V. 5,
№ 3. P. 106-110.
379. Wheeller K.T., Lett J.T. Formation and rejoining of DNA strand breaks
in irradiated neutrons in vivo. //Radiat. Res. 1972. V. 52, № 1. P. 59-67.
380. Wiencke J.K., Afzal V., Olivieri G., Wolffe S. Evidence that the H-tymi-
dine-induced adaptive response of human lymphocytes to subsequent doses
of X-Rays involves the induction of the chromosomal repair mechanism.
//Mutagenesis. 1986. P. 375-380.
414 Материалы международных конгрессов, съездов, конференций
Материалы между народных конгрессов, съездов,
конференций по радиобиологии *)
Материалы Международной конференции по мирному использованию
атомной энергии. Женева, 8-20 августа 1955. М.: Гос. изд-во Междун. лит-
литры, 1958. Т. 11. 487 с.
Симпозиум МОИП. Секция биофизики и радиобиологии. Первичные ме-
механизмы биологического действия ионизирующих излучений. Секция био-
биофизики. М., 30 мая — 1 июня 1960. М.: Изд-во № 1 Госплана СССР. 52 с.
Second International Congress of Radiation Research. Congress Proceedings
Radiation Research. London-Harrogate, August 1962. President Gray L. H.
Harrogate. England (UK). 254 p.
Международный симпозиум по первичным и начальным процессам, про-
происходящим в живых клетках при действии на них ионизирующей радиации.
18-22 октября 1963 М.: АН СССР, ЮНЕСКО, МАГАТЭ.
Первичные механизмы биологического действия ионизирующих излуче-
излучений. //Сборник трудов МОИП. Т. VII. М.: АН СССР, 1963. 230 с.
Первое всесоюзное совещание по вопросам природы и роли радиоток-
радиотоксинов в биологическом действии ионизирующей радиации. М., 10 июня —
12 июня 1965. //Радиотоксины, их природа и роль в биологическом действии
радиации высокой энергии. М.: Атомиздат, 1966. 296 с.
Third International Congress of Radiation Research. Congress Proceedings
Radiation Research. Cortina d'Ampezzo, June 26 — July 2 1966. President
Hollaender A. Italy. 263 p.
II Международный Симпозиум по первичным и начальным механизмам
биологического действия ионизирующего излучения на клетку. Материалы
Симпозиума. Ереван, 28 октября — 4 ноября 1968. Ереван: Изд-во АН
Арм. ССР, 1989. 92 с.
IV International Congress of Radiation Research. Congress Proceedings
Radiation Research. Evian, June 29 — July 4 1970. President Latarjet R. France.
264 p.
V International Congress of Radiation Research. 1975.
Всесоюзная конференция, посвященная 130-летию со дня рождения
И. Р. Тархан-Моурави (Тарханова) и 80-летию издания его основополага-
основополагающих работ по радиобиологии. Материалы конференции. Тбилиси, 10-
15 ноября 1976. Тбилиси: Мецниереба, 107 с.
IV International Congress. International Radiation Protection Association.
Proceedings. Paris, April 24-30 1977. France. General Secretary Bresson G. V. I.
232 p.; V. II. 690 p.; V. IV. 1439 p.
The Sixth International Congress of Radiation Research. Congress Proceed-
Proceedings Radiation Research. Tokyo, May 13-19 1979. Japan. President Okada S.
1025 p.
*) Приведены выборочно форумы, наиболее значимые для радиацион-
радиационной биологии.
Материалы международных конгрессов, съездов, конференций 415
Seventh International Congress of Radiation Research. Congress Proceed-
Proceedings. Radiation research under the auspices of the international association
for radiation research. Program. Amsterdam, July 3-8 1983. The Netherlands.
President Hollaender A. 144 p.
The Eight International Congress of Radiation Research. Congress Proceed-
Proceedings. Radiation Research. Edinburgh, July 19-24 1987. President Adams G.E.
UK. Tailor к Francis. V. I. 441 p.; V. II. 985 p.
Radiation Biological Effects. Modifiers and Nreatment. Proceedings of the
international conference on biological effects of large dose ionizing and non
ionizing radiation. Hangzhou, March 29 — April 1 1988. Chinese Med. Assoc.
President Wu C.T. Beijing, China. 372 p.
Первый Всесоюзный радиобиологический съезд. 21-27 августа 1989. М.:
АН СССР. Т. I. 254 с; Т. П. 562 с; Т. III. 809 с; Т. IV. 1017 с; Т. V. 1031 с.
The Ninth International Congress of Radiation Research. Congress Proceed-
Proceedings. Radiation Research. Toronto, July 7-12 1991. President Whitmore G.F.
Canada. Academic press, Inc. V. II. 1057 p.
International Conference on Low dose Irradiation and Biological Defense
Mechanisms. Proceedings. Radiation Research. Kyoto, July 12-16 1992. Presi-
President Sugahara Ts. Japan. Excerpta Medica. 510 p.
Второй съезд по радиобиологии. Киев, 20-25 сентября 1993. Пущино:
Изд-во ОНТИ ПНЦ. Т. I. с. 443; Т. П. 777 с; Т. III. 1179 с.
United Nations General Assambley. Adaptive responses to radiation in cells
and organisms. 43 session of UNSCEAR. Vienna, Austria, 7-11 March 1994.
105 p.
Tenth International Congress of Radiation Research. Congress Proceedings.
Radiation Research 1895-1995. Wurzburg, August 27 — September 1 1995.
ISBN. President Hagen. Canada. V. II. 1057 p.
Третий съезд по радиационным исследованиям. Радиобиология. Радио-
Радиоэкология. Радиационная безопасность. М., 14-17 октября 1997. Пущино:
Изд-во ОНТИ ПНЦ. Т. I. 454 с; Т. П. 495 с; Т. III. 269 с.
United Nations General Assambley. Biological effects at low radiation
doses — models, mechanisms and uncertainties. 49 session of UNSCEAR. Vi-
Vienna, Austria, 12-16 April 1999. 130 p.
Международный симпозиум. Хроническое радиационное воздействие.
Возможности биологической индикации. 14-16 марта 2000. //Сборник УНЦ
РФ. Радиционная медицина. 308 с.
Modern problems of Radiobiology, radioecology and evolution dedicated
to centenary of N. W. Timofeeff-Resovsky. Russia, Dubna, Joint Institute for
Nuclear Research, September 6-9 2000. Abstracts. 231 p.
Современные проблемы радиобиологии, радиоэкологии и эволюции.
Труды Международной конференции F-9 сентября 2000), посвященной 100-
летию со дня рождения Н. В. Тимофеева-Ресовского. ОИЯИ. /Под общей
ред. В.И.Корогодина. 2001. 494 с.
European Radiation Research. 31 Annual Meeting of the European Society
for Radiation Biology (ESRB) and 5 Jahrestagung der Gesselschaft fur Biolo-
gische Strahlenforschung (GBS). 01-05 09 2001. Dresden, Germany.
International Congress on Radioecology-ecotoxicology of Continental and
Estuarine Environments. 3-7 September, 2001. Nuclear protection and Safety
Institute. France.. Aix-en-Provence. Congress Centre.
416 Материалы международных конгрессов, съездов, конференций
Четвертый съезд по радиационным исследованиям. Радиобиология.
Радиоэкология. Радиационная безопасность. 20-24 ноября 2001. М.: Изд-во
Рос. Ун-та Дружбы народов.
Международная конференция «Генетические последствия чрезвычай-
чрезвычайных радиационных ситуаций». 10-13 июня 2002. М.: Изд-во Рос. Ун-та
Дружбы народов.
Ill International Symposium "Mechanisms of Action of Ultra-Low Doses".
Moscow, December 3-5, 2002.
Список сокращений, символов и некоторых условных терминов 417
Список сокращений, символов и некоторых
условных терминов
— градиент протонного потенциала.
BER — (base excision repair) эксцизионная репарация оснований.
D37 — облучение в данной дозе приводит к выживаемости 37% биологи-
биологических объектов или молекул.
Doc — доза «одного события».
DR — (death receptors) «рецепторы смерти» на поверхности клеточной
мембраны.
е™ДР — гидратированный электрон.
G — радиационно-химический выход.
HED — (Haut Eritem Doses, нем.) кожная эритемная доза.
НО2 — гидроперокси-радикал (пергидроксид)
Н2О2 — пероксид (перекись) водорода.
LO' — ал кокси л-радикал.
LO2 — пероксил-радикал.
LOOH — гидропероксил.
NER — (nucleotide excision repair) эксцизионная репарация нуклеотидов.
NO — моноксид азота.
NOS — моноксида азота синтетаза (то же: NO-синтаза).
О2 — анион-радикал кислорода; супероксид.
ХО2 — синглетный кислород.
^2 Ог — кислород в основном, триплетном состоянии.
ONOO" — пероксинитрит.
ОН' — гидроксид-радикал.
ROOH — гидропероксид (гидроперекись).
TNF — (tumor necrosis factor) фактор некроза опухоли.
~z — средняя доза, поглощенная в результате одного события поглощения
энергии.
A AT — аминоалкилтиолы.
АКСС — активные кислородосодержащие соединения, к которым относят-
относятся активные формы кислорода, активные соединения азота и продук-
продукты перекисного окисления липидов.
АКССрт — АКСС-радиотоксины.
27 Ю. Б. Кудряшов
418 Список сокращений, символов и некоторых условных терминов
АО — антиокислители.
АО А — антиокислительная активность.
АО Б — антиокислительный буфер.
АСА — активные соединения азота.
AT — аминотиолы.
АТФ — аденозинтрифосфорная кислота.
АТФаза — аденозинтрифосфатаза.
АФК — активные формы кислорода.
АЭТ — аминоэтилизотиуроний.
БМ — биологическая мембрана.
ВОЗ (WHO) — всемирная организация здравоохранения (образована в
1946 г. в Нью-Йорке).
ГПДГ — гидроксипропанодезоксигуанозины.
Да — дальтон (кДа — килодальтон).
ДР — двунитевые (двойные, двутяжевые) разрывы молекулы ДНК.
ДНК — дезоксирибонуклеиновая кислота.
ДНКаза — дезоксирибонуклеаза.
ДНК—МК — ДНК-мембранный комплекс.
ЕОРБ (ESRB) — европейское общество радиобиологии (основано в 1959 г.
в Брюсселе).
ИАА — инд оли л ал кил амины.
КЭ — кислородный эффект.
JlJXpc/y (LDx/y) — летальная доза для х% объектов в течение у суток.
ЛД50 (C.D50) — «полулетальная» доза (смертельная доза для 50% облу-
облученных объектов).
ЛДюо (CDioo) — «минимально летальная» доза (минимально доза, смер-
смертельная для всех облученных объектов).
Л КС — лазерная «корреляционная спектроскопия».
ЛПИ — линейная плотность ионизации.
ЛПО — липопероксидация (синдром ЛПО — синдром липопероксидации).
ЛПЭ (LET) — линейная передача (потеря) энергии.
ЛРТ — липидные радиотоксины.
МАГАТЭ (IAEA) — международное агентство по атомной энергии (ав-
(автономная межправительская организации, учрежденная в 1957 г. в
Вене в соответствии с решением Генеральной Ассамблеи ООН).
МАРЗ (IRPA) — международная ассоциация радиационной защиты
(основана в 1966 г. в Гиме).
МАРИ (IARP) — международная ассоциация радиационных исследова-
исследований (основана в 1962 г. в Харрогейте).
МДА — малоновый диальдегид.
Список сокращений, символов и некоторых условных терминов 419
МКРЕИ (ICFMJ) — международная комиссия по радиационным едини-
единицам и измерениям (основана в 1925 г. в Лондоне).
МКРЗ (ICRP) — международная комиссия по радиационной защите
(основана в 1928 г. в Стокгольме).
МСР (IUR) — международный союз радиоэкологов (основан в 1978 г. в
Бельгии).
НКДАР ООН (UNSCEAR) — научный комитет Организации Объеди-
Объединенных Наций по изучению действия атомной радиации (учрежден
на 10-й сессии Генеральной Ассамблеи ООН в 1955 г. в Вене).
НРБ — нормы радиационной безопасности.
ОБЭ — относительная биологическая эффективность излучений.
О HP О — общая неспецифическая реакция организма (= объекта биологи-
биологического).
ОР — однонитевые разрывы молекулы ДНК.
ОРТ — оксирадиотоксины (к ним относятся АКССрт и ЛРТ).
[ОРТ"" ДНК] — аддукты (оксиаддукты) ОРТ с ДНК.
ОСПОРБ — Основные санитарные правила обеспечения радиационной
безопасности.
ПД — предел дозы.
ПДД — предельно допустимые дозы облучения.
ПДН — полидезоксинуклеотиды.
ПО — прооксиданты.
ПОЛ — перекисное окисление липидов.
ППОЛ — продукты перекисного окисления липидов.
РНК — рибонуклеиновая кислота.
СИ (SI) — Международная система единиц измерения.
СОД (SOD) — супероксиддисмутаза.
СПЖ — средняя продолжительность жизни.
УФ — ультрафиолет.
Ф — флюенс, то есть среднее число частиц, пролетающих через единичную
площадку.
ФИД (ФУД) — фактор изменения (уменьшения) дозы.
ФС — фосфатидилсерин.
ФС — фосфатидилсерин.
ФСок — фосфатидилсерин окисленный.
ХЛ — хемилюминесценция.
ЦНС — центральная нервная система.
ЧАЭС — чернобыльская атомная электростанция.
П1О — Шифовые основания.
эВ — электронвольт.
27*
420 Список сокращений, символов и некоторых условных терминов
ЭГН — 2,3-эпокси-4гидроксиноненал.
ЭПР — электронный парамагнитный резонанс.
ЭФР — эндогенный фон радиорезистентности.
ЭХ Л — электрохемилюминесценция.
5IKP — ядерный квадрупольный резонанс.
ЯМР — ядерный магнитный резонанс.
Предметный указатель 421
Предметный указатель *)
/3- каротин
— радиолиз 201, 202, 203
Е. coli 134, 255, 256, 257
— гены репарации ДНК 258
гее 257, 258
uvr A 257
uvr В 257
Е. coli В/г и BS-I 122, 123, 135, 267
Адаптивный ответ (индуцированная радиорезистентность) 33,
276, 294, 311, 312, 313, 324, 340, 341, 348, 349, 350, 351, 352, 354,
355, 356, 361, 363
— адаптирующие дозы 311, 312, 315, 341, 348, 349, 350, 353, 355
выраженность при дроблении и длительности облучения 313
— влияние мощности дозы 312, 313, 315
— гипотеза о механизме 349
— интервал между облучениями 312, 313
как условие проявления неспецифического механизма защиты
313, 349
— мембранный механизм индукции 348
— механизмы развития 340, 350, 353
клеточной селекции 349, 353, 355
мембранной индукции репарации ДНК 349, 353
— проявляющие дозы 311, 312, 315, 356
— схема последовательности реакций формирования 349, 350, 355
Адреналин 308
Активность радионуклида 38, 39, 40, 41
Активные кислородсодержащие соединения (АКСС) 28, 220,
221, 222, 224, 227, 228, 231, 233, 237, 238, 239, 247, 249, 285, 290, 363
Активные соединения азота (АСА) 221, 224, 229, 232
Активные формы кислорода (АФК) 27, 199, 221, 224, 226, 227, 228,
229, 232, 233, 243, 246, 247, 248, 308, 318, 346, 348, 350, 372, 373,
374, 375, 376, 385, 387, 390
— биологическая роль 227, 228
— виды 224
— места образования 226
— метаболическая генерация 225, 226
Алкогольдегидрогеназа
— радиационная инактивация
причина 187, 212
Аминотиолы 164, 204
Антиокислители (антиоксиданты) 200, 238, 249, 250, 344, 345, 346,
347, 373, 375, 376, 387
— эндогенные 249, 360
*) Каждое тире Указателя соответствует термину (слову или сочетанию
слов, определяющему понятие) предыдущего уровня.
422 Предметный указатель
Антиокислительная (антиоксидантная) защита 224, 243, 328, 345,
349, 359, 361, 390
Антиокислительный буфер 209, 239, 248, 249, 360, 361, 362, 390
— низкомолекулярные компоненты 248, 249
Апоптоз 224, 275, 278, 280, 281, 282, 283, 285, 287, 289, 290, 299, 302,
341, 345, 351, 353, 355, 356, 362, 363, 366, 367, 369, 377, 389
— биологический смысл 278, 287, 289
— два пути реализации 282
митохондриальный 283
— каспазы 282, 283, 286, 289
— механизмы 30, 277, 278, 280, 281, 285, 298, 356
— морфологические признаки 277, 278, 287
— нематода Caenorhabditis elegans 281
— программа апоптоза 283, 285, 287, 289
— сигналы неблагополучия клетки («черные метки») 283, 285, 287
— стадии 281, 289
— схема реализации 283, 284
Арахидоновая кислота 347
АТФаза (аденозинтрифосфатаза)
— радиационная инактивация 20, 187, 279, 285
Атомная радиация 24
Атомные бомбардировки Хиросимы и Нагасаки 24
Беккерель (единица активности радионуклида) 39
Белок р53 346, 351, 353, 354, 355, 356, 367, 371, 374, 375, 377
Биогенные амины 249
Биодозиметрия 323, 324, 325, 326, 327
Биологический закон самоликвидации 30, 289, 290
Биомембраны (БМ) 27, 28, 30, 33, 205, 206, 220, 226, 229, 232, 233,
236, 237, 238, 240, 246, 247, 265, 279, 330, 331, 341, 345, 346, 348,
349, 356, 358, 382, 383, 384, 386, 387, 392
— барьерно-матричные свойства 239, 240, 341, 342
ведущая роль в инициации адаптивного ответа 341
— вязкость (микровязкость) 349, 350, 356, 357, 359
— изменение структуры и функций при холодовом и гипертермиче-
гипертермическом стрессе 357, 359
— как радиобиологическая мишень 10, 33, 210, 341, 382, 383, 387, 392
— неспецифический характер изменений при облучении 279, 308, 343,
356
— особый принцип организации 341
— проницаемость для 22Na после облучения в разных дозах 279, 314,
343
— проницаемость для К+, Са2+, Na+, протонов, фосфатных и др.
ионов 279, 343
— «самопробой» при некрозе 280
— радиочувствительность (гиперррадиочувствительность) 342, 343,
344, 345
— рецепторы, включая рецепторы смерти 282, 283, 289, 341
— текучесть 342, 356, 357, 359, 360
— цепные реакции пероксидации 233, 343, 388
Биохемилюминесценция 220
Предметный указатель 423
Блау и Альтенбургера формула расчета числа попаданий в
мишень 91, 92, 110, 113
Больцмана закон 215
Бора константа магнетона 215
Брэгга пик 71, 72
Брэгга—Грэя принцип 43, 84
Бэр 46, 47
Взвешивающий коэффициент для отдельных видов ионизиру-
ионизирующих излучений см. Доза облучения (поглощенная доза)
Вирус табачной мозаики
— инактивация 7-излучением 88, 96
Вода 207, 226
— оптический спектр поглощения при облучении 172
— первичные продукты радиолиза 175, 176, 181, 212, 330, 384
роль в инактивации биомолекул 177
радиационно-химический выход (G) 175, 195
— радиационно-химические превращения 212, 238, 382
возбуждение 381, 382
ионизация 381, 382
образование радикалов 172, 175, 197
сверхвозбуждение 172
— расстояние диффузии радикалов 214
— схема реакций радиолиза 175
Возбуждение молекул 67, 68, 73, 74, 75, 76, 140, 141, 142, 144, 146,
147, 148, 160, 173, 175
— сверхвозбужденное состояние 142, 144, 145, 146, 148, 149, 172
— спектр 142, 143, 144, 171
Выживаемость 99
— ЛДso/зо Для белых крыс 313
— уравнение кривой 100
Гейзенберга принцип неопределенности 144
Гемопоэз
— модель нарушений при лучевом поражении 115, 118, 119
Геном 250, 261, 264, 265, 272, 281, 289, 331, 332, 355, 363, 366, 367, 374,
375, 376, 377, 378
— надежность 250, 264, 265
— перестройка пространственной организации при репарации 263
Гены {см. таксисе Е. со1ц гены репарации ДНК; Репарация ДНК, гены)
250, 255, 260, 261, 263, 311, 341, 351, 352, 353, 359, 360, 366, 368,
377, 386
-ATM 367
— bax 374
— bcl-2 374, 375, 376
— BLM 367
— c-FOS 351
— c-JUN 351
— DNA Pol /3 351
— FACC 367
— G6PD 373
— GADDAb 353, 375
424 Предметный указатель
— p21/Waf (CDKN1A) 353, 372, 374
— p34cdc2 (CDC2) 372
— P53 (TP53) 372, 374
— phr 257
— rad51 (CCNBl) 372
— uvr A 255, 256
— uvr В 255, 256
— uvr С 255, 256
— иммуноглобулиновые — С, V, D, J 366
— клеточной смерти (cell death) 281
ced-3 281
ced-4 281
ced-9 281
Гидроксид-радикал 222, 224, 227, 229, 232, 248, 332, 384, 385
Гидроксильный радикал (ОН) 176, 184, 185, 188, 193, 217, 221, 227,
228, 229, 234, 238, 287, 332, 375, 384
Гидропероксиды 233, 234
Гидропероксирадикал 199, 200, 222, 224, 226
Гиперрадиочувствительность 305, 307, 344, 361
— и ЕРФ 303, 305, 307
— и сверхмалые дозы 303, 305, 306, 307, 314, 340, 345, 346, 347, 391
Глутаматдегидрогеназа
— радиационная инактивация
причина 187
Глутатион 164, 165, 183, 184, 246, 247, 248, 249, 376
Глутатионпероксидаза 226, 247, 248
Глутатионредуктаза 248
Глутатионтрансфераза 248
Головной мозг (см. таксисе Облучение организма, церебральный син-
синдром) 48
Гомеостаз 221, 317, 360
— окислительно-восстановительный
система 205, 220, 221, 224, 233, 238, 239, 243, 250, 302, 307, 312,
340, 342, 349, 359, 362, 366, 369, 373, 375, 387, 390
Гонады 48
Гормезис (радиационный) 33, 89, 303, 308, 309, 310, 324, 340, 361
— диапазон доз 305, 308, 310
Государственная премия 28, 29, 30
Гранулоцит 115, 118
— гранулоцитопоэз 115, 116, 117, 118, 307
Гроттгуса принцип 54, 55
Грэй (единица поглощенной дозы) 42, 138
Дезоксинуклеозидурия 299
— зависимости «доза-ффект» и «время-эффект» 299
— закономерности после облучения 299
— связь с апоптозом 299
— связь с клеточным опустошением 299
Дессауэра теория нагрева 21, 22
Джоуль (см. таксисе Энергия излучения, единица Джоуль) 35, 42
Димер тиминовый 255, 256, 257, 258
Предметный указатель 425
ДНК 22, 74, 123, 127, 128, 132, 150, 151, 152, 153, 183, 188, 191, 194, 205,
206, 219, 220, 229, 254, 255, 331, 383, 385
— восстановление от повреждений 28, 31, 250, 263, 291, 391
— денатурация 150, 188
— как критическая структура (мишень) 23, 29, 210, 251, 331, 341, 382
— комплексные повреждения 252
— модификация оснований 188, 251
— повреждения 152, 187, 205, 250, 251, 252, 331, 363, 374, 386
аддукты 239, 240, 387
двунитевые разрывы 74, 81, 122, 150, 151, 152, 188, 189, 194,
195, 252, 261, 287, 355
число на клетку спонтанных и на 1 Гр 253, 260
количество в клетке млекопитющих 260
МДА 193, 194, 195, 243, 244
однонитевые разрывы 81, 122, 123, 150, 151, 152, 188, 189, 194,
195, 251, 252, 259
число на клетку спонтанных и на 1 Гр 253, 260
оснований
число на клетку спонтанных и на 1 Гр 253, 260
при внутреннем облучении 253
сшивки ДНК-ДНК и ДНК-белок 151, 152, 188, 195, 252, 253
фотохимические (УФ) 255, 256, 257, 258, 306
— репарация от повреждений 250, 254, 255, 259, 260, 261, 262, 263, 267,
291, 294, 331, 349, 351, 353, 355, 356, 374, 388, 389, 391
путем некомплементарного (негомологичного) сшивания кон-
концов ДНК 29, 261, 262
рекомбинационная 29, 261, 262, 263, 355, 375
схема механизмов 262, 263
эксцизионная нуклеотидов 262, 353, 374
эксцизионная оснований 262, 353, 374
ДНК Diplococcus pneumonia 133
— инактивация 183, 189
— трансформирующая активность 133
ДНК тимуса теленка
— радиационные повреждения 151, 188
ДНК-лигаза 257, 258, 260, 262, 294
ДНК-мембранный комплекс 265, 266, 267, 268
— восстановление 265, 267, 268
— единая радиобиологическая мишень 266
— радиационное повреждение 265, 266, 267
ДНК-полимераза I
— экзонуклеазная активность 257, 258, 260, 262, 263, 294
ДНКаза (дезоксирибонуклеаза) I 186, 209, 282
— радиационная инактивация 181, 186, 187
Доза излучения (экспозиционная доза) 37, 40, 322
— единица измерения 40
— мощность дозы 40
Доза облучения (поглощенная доза) 17, 38, 41, 42, 68, 71, 72, 73,
74, 87, 131, 132
— Do 100, 101
— ?>37 94, 95, 96, 100, 137, 138, 150, 153, 154, 157, 158, 161, 162, 164,
186, 202, 210, 212
426 Предметный указатель
— Dq, квазипороговая 100, 101
— единицы и их соотношение 42
— зависимость «доза-эффект» 94
— интегральная 42
— кожная эритемная 18, 278
— летальная для клетки 210, 255
— малая 32
— мощность 42, 49, 339
— эквивалентная 45, 47, 51, 91
взвешивающий коэффициент для отдельных видов излучений
45, 46, 48
единица Зиверт 46, 47
мощность 47
Дозиметр Фрике 44
Дозиметрия 18, 43, 73, 80
— методы 43
ионизационной камеры 43
калориметрический 43
сцинтилляционный 44
химические 44
«Дыхательный всплеск» 227
Единицы измерения
— система СИ 37, 39, 40
Естественный радиационный фон (ЕРФ) 296, 305, 306, 307, 308,
322, 337
— ультрамалые мощности доз 305, 306
Желудок 48
Живая система 22, 31, 206, 289, 341, 360, 379, 381
— гетерогенность 22, 381, 382
— неспецифическая реакция 31, 317, 318
— поглощение излучения 22
Зависимость «доза-эффект» 87, 96, 126, 129, 130, 170, 186, 324, 328,
382
— кривые 88, 89, 90, 91, 92, 96, 97, 99, 100, 101, 102, 111, 123, 124, 127,
132, 134, 136, 137, 157
— критерии одноударности 97, 264
— сигмоидальная 100, 101, 189
— экспоненциальная зависимость 96, 97, 100, 130, 131, 134, 137, 170,
186
Излучение ионизирующее 13, 14, 15, 72, 91, 205, 238, 241, 318, 381
— 7-кванты 14, 17, 35, 58, 59, 60, 61, 62, 63, 65, 66, 67, 68, 73, 91, 96,
130, 133, 137
— качество 45
— корпускулярное 15, 35
а-частицы (ядра гелия) 15, 17, 35, 36, 46, 62, 65, 68, 73, 74, 75,
76, 93, 137
/3-частицы (электроны и позитроны) 15, 17, 68, 73, 77
тг-мезоны 15
Предметный указатель 427
нейтроны 15, 35, 46, 65, 67, 68
протоны 15, 35, 46, 65
— механизмы биологического действия 84, 321
непрямое действие 25, 127
прямое действие 126, 132
стадии 128, 136
физико-химическая 128, 136, 144, 147, 157, 165, 207, 382
физическая 128, 136, 137, 144, 207
химическая 128, 136, 149, 208, 382
«теория дуального действия» 81, 83
— плотноионизирующее 75, 97
— редкоионизирующее 75, 97
рентгеновское (Х-лучи) 14, 17, 35, 56, 58, 59, 60, 62, 63, 66, 67,
68, 73, 83, 91, 96
фотонное (электромагнитное) 35, 46, 91
Излучение электромагнитное 15
— виды 35
— оптическое 14
видимое 14
инфракрасное 14, 129
ультрафиолетовое 14, 59
— радиочастотное 14
высокочастотное 14
деци- и миллиметровое 14
низкочастотное 14
спектр 14
среднечастотное 14
Инвертаза 130, 164
— радиационная инактивация 130
Ингибиторы
— метод 219, 241, 385
Индолилалкиламины 164
Ионизация 63, 65, 66, 67, 68, 74, 75, 76, 77, 84, 92, 95, 96, 97, 122, 137,
140, 142, 144, 146, 148, 169, 172, 173, 175, 331
— молекул 68, 73, 146, 148, 149
— потенциал 15, 142, 144, 146, 172
— тяжелые заряженные частицы 75, 76, 77, 91
Ионы 56, 66, 67, 75, 76, 77, 78, 93, 137, 138, 146, 147, 148, 149, 151, 172,
173
— блобы 77, 208
— пространственное распределение 73
— шпоры (рои ионов, шпуры) 76, 77, 175, 208
Камера Вильсона 77, 78, 85
Карбонильные соединения 122
— реагирующие с тиобирбитуровой кислотой 195
Каталаза
— радиационная инактивация
причина 187, 247
Кейлон 115, 117
Кислород 161, 162, 163, 176, 183, 184, 185, 192, 198, 199, 203, 220, 221,
222, 224, 226, 227, 230, 243, 246, 349, 384, 387
428 Предметный указатель
— оксирадикалы 183, 238, 383, 387
— синглетный 222, 224, 226, 228, 375
Кислородное последействие 162, 386
Кислородный эффект 183, 184, 185, 382, 387
Клейна—Нишины формула 61
Клетка 27, 29, 31, 76, 89, 100, 205, 206, 207, 250, 290, 324, 330, 363
— антиокислительная защита 27
— восстановление от повреждений 28, 269, 290, 291, 292, 293, 294, 295,
298, 363, 388, 389
— восстановление от сублетальных повреждений 29, 292, 293
— интерфазная (немитотическая) гибель 29, 269, 270, 271, 274, 275,
389
биохимические и морофологические изменения 271
— клеточный цикл 299
блоки Gi-, S-, G2- и М 273, 299
фазы S и G2 274
— лучевое поражение 270, 379
выживаемость 94, 95, 99
модификация 26, 27, 120, 219, 272, 274
факторы 272, 273, 274, 275
— механизмы гибели 275
— неспецифическая оксидативная реакция 269, 356, 360
стадии 361
— неспецифическая реакция на повреждение 31, 387, 392
— окислительно-восстановительный гомеостаз 29, 30
— окислительные процессы в облученной клетке 30
— оксидативный стресс 280, 318, 340, 360, 361, 387
— принцип системного ответа на облучение 31, 295, 388, 390, 391, 392
— принцип структурной и функциональной гетерогенности 389
— радиационное поражение 238
— радиочувствительность 117, 119, 273, 330, 363, 366, 376
— репродуктивная (митотическая) гибель 195, 269, 270, 272, 273, 275,
298, 362, 368, 389
— ядро 324, 330, 331, 332, 334, 335, 336, 339, 353, 355, 371, 372
Клеточная популяция (популяция клеток) 290, 298, 302, 323, 332,
335, 337, 341, 345, 347, 349, 368
Кожа 18, 48
— лучевое поражение 82
— радиогенный дерматит 18
— рак 18
Коллаген
— радиационные превращения 192
Комптона эффект 60, 61, 62, 63, 67
Комптоновские электроны
— энергия 60, 62
Комптоновское поглощение
— коэффициенты 61, 67
Константа Михаэлиса—Ментен 131
Кортикостероиды 308
Косвенно ионизирующие частицы 65, 66
Кости 48
Костный мозг 48, 118
Предметный указатель 429
Кровь
— клеточный состав после облучения 298
Кулон 40
Кюри (единица активности радионуклида) 39, 41
Лактатдегидрогеназа
— радиационная инактивация
причина 187
Лактопероксидаза
— радиационная инактивация
причина 187
Легкие 48
Лизоцим
— инактивирующие радикалы 185
Лимфоцит 276, 347
— В-лимфоцит 298, 366
— гибель 271
— ингибирование стволовых клеток 299
— лимфопоэз 115, 116, 117, 118
Линейная передача энергии (ЛПЭ) 36, 37, 57, 71, 74, 75, 80, 83, 84,
94, 95, 97, 123, 136, 137, 139, 151, 173, 193, 195, 252, 330, 334, 386
— временная шкала превращений 144, 145
— соударение лобовое 139
— соударение скользящее 139, 140
Линейная плотность ионизации (ЛПИ) 37, 74, 75
Липидные радиотоксины (ЛРТ) 10, 228, 239, 247, 248, 279, 285, 361,
369, 386
Липиды 27, 197, 198, 199, 202, 203, 207, 224, 232, 234, 238, 239, 240, 242,
247, 248, 361
— перекисное свобонорадикальное окисление (пероксидация) 27, 28,
197, 198, 201, 224, 228, 229, 232, 233, 234, 235, 236, 318, 341, 345,
350, 359, 361, 384
коррекция цепных реакций 200
продукты (ППОЛ) 221, 223, 224, 232, 233, 234, 236, 238, 242,
243, 248, 308, 318, 330, 345, 346, 347, 348, 349, 350, 359, 361, 376,
383, 384, 385, 386, 387, 388
синдром 318, 319
стадия инициирования (зарождения цепи) 197, 198, 234
стадия обрыва цепи 198, 199
стадия развития цепной реакции 198, 199
— радикалы 235
Лучевое поражение 18, 19, 20, 29, 189, 229, 241, 300, 379
— биологическая стадия 208, 209, 210, 211, 382
— гемопоэз 300
— структурно-метаболическая теория 29
— теория свободнорадикальных цепных процессов 27, 241
— эмбриогенеза 19
Макромолекулы 127, 169, 170, 210
— радиационная инактивация 127, 128, 180, 210
непрямая 184
прямая 180, 184
430 Предметный указатель
— радиочувствительность функций 127, 160, 170, 180
этапы биофизического анализа 127, 128, 130, 135, 166, 167, 171
Малые дозы (см. также Облучение, малые дозы) 82, 89, 94, 95, 181,
261, 262, 281, 304, 312, 321, 322, 323, 325, 326, 327, 328, 329, 331,
332, 333, 335, 339, 340, 341, 342, 345, 347, 356, 357, 360, 369, 373, 391
— диапазон (интервал) 314, 321, 322, 323, 326, 329, 333, 335, 337, 338,
339, 357
— зависимость «доза-эффект»
неправомерность экстраполяции от больших доз к малым 296,
303, 320, 340
сложный (немонотонный) характер 303, 304, 321, 325, 326, 340,
391
— зависимость эффекта от мощности дозы 310, 314, 340, 344, 347, 391
— механизмы биологического действия 339
— первичная мишень не ДНК, а мембраны 340
Маркова цепь 24, 114
Марковские случайные процессы 113, 114
Математические модели 103, 104, 106, 107, 108, 109, 110, 119, 124
— подтипы 106
детерминированные и стохастические 106, 108
статичные и динамичные 106
точечные и распределенные 106
феноменологические (базовые) 106
— системные (разноуровневые) 109, 112, 122
Мансона 109, 122
— типы 104, 115
аналитические 104, 105, 106, 108, 109, 112, 124, 389
имитационные модели 104, 105, 106, 108, 109, 112, 124, 390
стохастические 110, 113, 389
Математическое моделирование 102, 103, 104, 107, 108, 109, 111, 112,
115, 124, 125, 389
— методы 108, 115, 389
Матка 48
Металлотионеины
— роль в адаптивном ответе 351
Метионин 192
Микродозиметрия 78, 79, 80, 82, 83, 84, 333
— и бесстеночный газоразрядный пропорциональный счетчик 84
— и моделирование 84
— ионизационно-импульсный метод 84
— сайтовая модель 82
— трековая модель 83
Митохондрия
— митоптоз 30, 232, 285, 289, 290
Мишень 92, 93, 94, 95, 96, 99, 100, 101, 103, 137, 138, 214, 332, 333, 339,
341, 383, 390
— ДНК 205, 239
— концепция 87, 92, 99, 102, 103
— мембраны 33, 239
— параметры мишени 92, 136, 137, 138, 332
— принцип 380, 381, 382, 389
— расчет молекулярной массы 138
Предметный указатель 431
— теория 111, 382, 389
— формула расчета числа попаданий 93, 94
— эффективный объем 96, 101
МКРЗ (Международная комиссия по радиационной защите)
303, 304, 309
Молекула 146, 201, 206
— возбужденное состояние 140, 144, 146, 147, 148, 149, 169
синглетное 148, 221
триплетное 148, 221
— диссоциация 142, 146
— радиолиз 149
Молекулярная радиобиология 127, 392
Молочная (грудная) железа 48
Мочевой пузырь 48
Мутагенез (мутагенные изменения) 250, 255, 294, 369
Мутации 239, 250, 254, 261, 281, 311, 312, 331, 363, 366, 367, 368, 369,
375, 376, 377, 378, 385, 386
— соматические 324
— спонтанные 363, 366, 367
Мышечная ткань 48
Надпочечники 48
НАД(Ф)Н-оксидаза 226, 227
Нанодозиметры 85
Научный комитет по действию атомной радиации ООН
(НКДАР) 24, 303, 304, 322, 326, 333
Нейтроны 57, 64, 81
— неупругое рассеяние 64
— ОБЭ 82
— поглощение веществом 64, 65
— радиационный захват ядром 65
— упругое рассеяние 64
Некроз (некротическая гибель клеток) 275, 277, 278, 279, 280, 283,
285, 287, 290, 302, 358, 362, 389
Непрямое действие радиации 169, 176, 180, 181, 182, 197, 201, 202,
203, 204, 212, 213, 214, 229, 323, 332, 333, 382, 384, 385
— в клетках 211, 213, 251
— зависимости «доза-эффект» 181
— критерий 181
— последовательность процесса 182
— соотношение прямого и непрямого эффекта 213, 302
— эффект Дейла 180
Нормы радиационной безопасности (НРБ-99) 39, 49, 50, 51, 52
Нуклеиновые кислоты
— радиационная инактивация 128, 132, 135, 137, 189, 191, 207
акцепторная активность тРНК 134, 135
гибридизация с мРНК 133, 134
затравочная активность ДНК 133
инфекционность ДНК и РНК 128, 132, 133, 187, 189
трансформирующая активность бактериальной ДНК 128, 132,
133, 138, 183
432 Предметный указатель
ОБЭ (относительная биологическая эффективность) излуче-
излучения 56, 57, 81, 82, 83, 84, 333, 386
— коэффициент 56, 57, 84
Облучение 23
— клетка 23, 32
системный ответ 389
— малые дозы 33, 296, 305
сравнение эффектов больших и малых доз 309, 310, 315
— организма 296
внешнее 49
внутреннее (инкорпорированное) 49
длительное (хроническое) 49, 51
кратковременное (острое) 49, 50
критические органы 290, 296, 297, 301
клеточное опустошение 290, 296, 297, 298, 299, 301, 302, 341
местное (локальное) 49
многкратное (фракционированное) 49
нелетальные (сублетальные) дозы 303, 304, 310
общее 49
однократное 49
отдаленные последствия 296, 319, 321, 362
протяженное 50
радиационные синдромы 290, 297, 301, 302
кишечный 297, 300, 301
костномозговой (кроветворный) 297, 300, 301
средняя продолжительность жизни при них 297
церебральный (ЦНС) 297, 300, 301
смертельные (летальные) дозы 296
стволовые клетки 295, 298, 300, 302, 388
Ожидаемая индивидуальная доза 47, 48
Оксиаддукты ДНК 28, 242, 243
— МДА 191, 286
— пропаноаддукты 243, 245, 286
— этеноаддукты 243, 245, 286
Оксид азота 221, 223, 229, 230, 231, 232, 233, 238, 287, 385, 386, 387
— продукты превращения 223
— цикл 231
Оксимочевина 293, 294
Оксирадиотоксины (ОРТ) 238, 239, 240, 242, 243, 245, 246, 279, 283,
285, 286, 289, 318, 360, 361, 362, 371, 373, 376, 385, 386
— аддукты с ДНК 242
Оптическое приближение 141, 144
Острая лучевая болезнь 20, 300
Осциллятор молекулы
— сила 140, 141, 142, 143, 144, 171, 172
Перекисное свобонорадикальное окисление 27, 208, 209, 210, 224,
228
— продукты
алкоксил-радикал 224, 233, 234, 246
пероксил-радикал 223, 224, 233, 246
Пероксиды 184, 199
Предметный указатель 433
— водорода 175, 176, 221, 222, 224, 227, 228, 229, 232, 238, 247, 332, 349,
373, 375, 384
— гидропероксиды 221, 224, 228
— липипероксиды 228
Пероксинитрит 231, 232, 238, 287, 332, 385, 386, 387
Печень 48
Пищевод 48
Планка постоянная 61
Поглощенная доза (излучения) (см. таксисе Доза облучения) 41,
333, 334, 339
Поджелудочная железа 48
Попадание 93, 95, 99, 101, 138, 332, 338, 339
— множественные (многоударные) 92, 100, 101
— одиночное 92, 100, 101
— одноударная модель 93, 95, 96, 99, 110, 116, 137
— принцип 22, 87, 92, 99, 102, 111, 139, 382
Почка 73
— зависимость «доза-эффект» при облучении 100
Предел дозы 51, 52
Привитой сополимеризации метод 217, 218
Принцип Франка—Кон дона 146
Протеинкиназа С (ПК С) 228, 350, 351, 353, 356, 360
Протон 247
— отдачи 68
Прямое действие радиации 126, 163, 166, 180, 181, 201, 211, 212, 213,
323, 332
— модификация (защита) низкомолекулярными веществами 165, 166
— на нуклеиновые кислоты 135
— способы оценки соотношения прямого и непрямого эффектов с
применением температурных воздействий, высушивания, замора-
замораживания 211
Рад (единица дозы) 42
Радиационная биофизика 9, 12, 13, 15, 16, 21, 23, 24, 25, 27, 28, 29,
33, 103, 108, 109, 115, 124, 125, 126, 127, 128, 154, 206, 209, 224, 296,
330, 379, 380, 382, 383, 389, 392
— математические модели 23
— радиационной биофизики лаборатория 9, 201
Радиационная гибель клеток 269, 276, 288
— механизмы 276, 277, 287, 288
— некроз 288
Радиационно-индуцируемая нестабильность генома 224, 239, 362,
363, 368, 369, 371, 373, 374, 375, 376, 377, 378, 389, 392
— биологическое значение 377
— варианты проявления 363
— контроль клеточного цикла 366, 367, 369, 374
— механизмы 371
межклеточных контактов 371, 373
обмена гуморальными сигналами 372, 373
— определение понятия 363
— отличия от перманентной нестабильности 363
— схема вариантов проявления 370
28 Ю. Б. Кудряшов
434 Предметный указатель
— характеристика 364, 365, 368
— эпигенетическое наследование 363, 369, 377
Радиационно-химический выход (G) 171, 180, 190, 191, 196, 203, 252
Радиационное старение 19, 320, 362
Радиационный (лучевой) канцерогенез (онкотрансформация)
19, 362, 368
Радиационный мутагенез 21, 386
Радиационный риск 44, 48, 326
Радиационный эффект 379
— механизм усиления 241, 343, 386
Радиация
— гипотеза точечного нагрева 90, 91
— принцип и механизмы усиления начального радиационного повре-
повреждения 27, 211, 294, 383, 386, 387, 389
— теория физико-химического механизма 27
Радикалы метаболические 259, 377
— число повреждений ДНК за счет их ежесуточной продукции 259,
260, 261
Радикалы радиационные 149, 152, 173, 175
— аденина в ДНК 194
— органических молекул
реакции 159, 176, 177, 190, 238
с образованием стабильных продуктов 178
гидролиз 179
димеризация и присоединение 177, 178
диспропорционирование 178
перенос водорода 179
присоединение кислорода 179
— перехватчики 185, 187, 188, 189
— тимина в ДНК 152
— цитозина в ДНК 194
Радиоактивное загрязнение 39
— плотность 39
Радиоактивность 17
— естественная (природная) 17
— искусственная 17
Радиобиологический эффект 29, 73, 137, 212, 311, 344, 382
— «вероятностная» модель Капульцевича 103, 109, 110, 111
— детерминированный 50
— зависимость от дозы облучения 20, 87, 88
— сравнение при больших, малых и средних дозах 303
— стохастический 50, 103, 123, 389
Радиобиология 13, 16, 24, 27, 32, 33, 102, 123, 124, 125
— основные принципы 34, 380, 392
— периоды развития
второй 20
первый (начальный) 18
третий 24, 32
— принцип попадания 380, 381
— «энергетический парадокс» 55, 78, 380
Радиолиз биоорганических молекул 185, 190
— влияние ЛПЭ 182
Предметный указатель 435
— импульсный 177
— модификация в водных растворах 182
— фосфолипидов 189, 195, 201
с образованием гидроперекисей 195, 196
с образованием карбонильных соединений 196
с образованием Шиффовых оснований 191, 195, 196
— эффект защиты 182
Радионуклиды 32, 320, 325
— 222Ra (радон) 39
— 60Со 56, 57, 59, 67, 133
— гелий 36
— радий 18, 19
— трансмутация 253
14С (радиоуглерод) 252, 254
32Р (радиофосфор) 252, 254
3Н (тритий) 252, 253, 254
Радиопротекторы 25, 164, 204, 344
Радиорезистентность 310, 329, 348, 351, 353
Радиоспектроскопия
— методы 214
Радиотаксон 265
Радиотерапия
— клеточные модели 119
— модель глобальной (многошаговой) оптимизации временного режи-
режима 119
Радиотоксины 34, 218, 224, 238, 239, 240, 241, 242, 247, 248, 346, 348
Радиочувствительность 96, 123, 134, 164, 189, 190, 191, 196, 202, 241,
329, 382
— аминокислот 191, 192, 196, 212
относительный выход разложения (GOTU) 192
белков 191
ДНК 196
— биомолекул 161, 163, 164, 185, 189, 190
— закон Бергонье-Трибондо 19
— клеток 89
— сравнительная 25
нуклеиновых кислот 184, 185, 193
нуклеотидов 191, 196
углеводов 191, 193, 196, 207
ферментов 185
фосфолипидов 185, 195
Радиоэкология 32, 33, 296, 391
Реакция Хабер—Вайса 227
Рентген (единица экспозиционной дозы) 21, 40, 341
Рентгеновская трубка 58
Репарационная репликация 256, 262
Репарация ДНК 257, 341, 366, 367, 369, 377
— два типа («выщепление—замещение» и фотореактивация) 257
— пострепликативная 258
— схема Говард-Фландерса 257
Рецепторы клеточных мембран 350, 351
28*
436 Предметный указатель
Рибонуклеаза (РНКаза) 129, 130, 155, 158, 160, 161, 164, 171, 184,
187, 209
— радиационная инактивация 88, 90, 163, 170, 186
?>37 130, 169, 170, 171
зависимость «доза-эффект» 161
причина 186, 187
— радиочувствительность 169
Рибосомы
— радиационная инактивация функциональной активности 134, 135
Ридберга константа 142
Свободнорадикальное перекисное окисление 211, 218, 219
Свободные радикалы 25, 26, 147, 148, 149, 152, 160, 162, 163, 166, 172,
176, 178, 182, 197, 198, 200, 203, 214, 218, 219, 224, 233, 242, 338,
344, 351
— анион-радикалы 149
— в облученной клетке 214, 220
методы определения 214, 216, 217
— катион-радикалы 149
— липидов 198, 201
— модель инактивации ферментов 156, 157
Селезенка 48
Серотонин 249
Система СИ см. Единицы измерения
Спиновая ловушка
— метод 217, 219
Стресс 316, 317, 327, 358, 360
— дистресс 317
— оксидативный 238
— понятие 316
— стадии 309, 316, 317
— фитостресс 317
— эустресс 317
Структурные повреждения радиационные 149, 150, 153, 154, 162,
163
— в нуклеиновых кислотах 150
— в ферментах 153
в лизоциме 153, 156
?>37 156
в рибонуклеазе 153
в химотрипсине 154, 156
— модификация 160, 163
кислородом 161, 183
молекулами примесей 164, 165, 166
температурой 163
Сукцинатоксидаза
— радиационная инактивация
причина 187
Супероксиддисмутаза 226, 227, 228, 247
Супероксидный анион-радикал (супероксид) 221, 222, 224, 226,
227, 228, 231, 238, 246, 247, 281, 285, 287, 344, 373, 375, 376
Счетчики
Предметный указатель 437
— Буза 85
— «капле-пузырьковый детектор» Эппла 85
— Росси 84
Теория мишени 22, 23, 137, 138
Тимус (вилочковая железа) 48
Тонкая кишка 48
Трек ионизации 36, 75, 85, 208, 330, 331, 334, 335, 336, 337, 339, 348,
371
— а-частицы 75
— дейтрона 75
— электрона 75, 76, 77, 78
Трипсин 131, 137, 161, 183
— радиационная инактивация 137, 183, 185, 186
зависимость «доза-эффект» 183
радикалы 159
Тромбоциты 116, 324
— динамика концентрации после облучения у крыс 118
— тромбоцитопоэз после облучения 115, 116, 117, 118, 300
Уравнение Бете—Блоха 70, 71, 139
Уреаза 187
Ускоренные заряженные частицы 68, 71
— модель Дертингера и Юнга 69
УФ-излучение 91, 255, 256, 257, 258
Ферменты 128, 129, 130, 131, 191, 209, 212, 343
— радиационная инактивация 129
— радиочувствительность 130, 131, 132
глутаматдегидрогеназа 131
протеаза 131
рибонуклеаза 131
химотрипсин 131
Ферми уравнение 65
Флюэнс 41, 93, 94
Фосфатидилсерин 283
— окисленный 283, 285
Фосфоглюкомутаза
— радиационная инактивация
причина 187
Фосфолипиды 191, 196, 199, 201, 232, 233, 238, 241, 279, 283, 285, 343,
357, 358, 359, 360
— молекулярная геометрия при стрессах 358
Фотонное излучение см. Излучения ионизирующие
Фотоэлектроны 61, 62, 66, 187
Фотоэффект (фотоэлектрический эффект) 60, 62, 63, 66
ФУД (фактор уменьшения дозы) 164
Хемилюминесценции метод 217, 218, 219, 220, 385
Херши
— методика суицидальных экспериментов 253
Химическая защита от излучений 25, 34, 290, 382
438 Предметный указатель
— гипотеза «биохимического шока» 26
— гипотеза «комплексного биохимического механизма действия ра-
радиозащитных средств» 26
— гипотеза «эндогенного фона радиорезистентности» 26, 349, 362
— радиозащитные препараты 25, 32
— «сульфгидрильная гипотеза» 26
Хромосомные аберрации (аберрации хромосом) 82, 239, 254, 307,
312, 323, 324, 325, 363, 367, 368, 376, 377, 385
Цепные свободнорадикальные реакции 197, 198
— и лучевое поражение клетки 241, 383
Цистамин 164
Цистеамин 165
Цитохром с 226, 246, 283, 286, 290
Цитохромоксидаза 245, 246
Чернобыльская авария 32, 320, 321, 323, 326, 391
Щитовидная железа 48
Эквидозиметрия 44, 45
Экзонуклеазная активность (экзонуклеаза) 258, 262, 294
Экспозиционная доза (доза излучения) см. Доза излучения (экс-
(экспозиционная доза)
Экстраполяционное число п 100, 101
Электрон 15, 35, 46, 58, 67, 68, 74, 76, 77, 146, 147, 148, 149, 160, 173,
220, 221, 227
— активация 141
— вторичный (^-электрон) 63, 76
— Оже 77
— отдачи 66
— потеря энергии 78, 143
— пробег в веществе 77, 78
— свободный 148, 173, 174, 233, 240
— сольватированные (гидратированные) 148, 173, 174, 175, 176, 177,
184, 185, 188, 189, 203, 238
характеристики 147
— судьба после испускания молекулой 147
— ускоренный 58, 77
— энергия 58, 67, 78
Электрон-вольт 35
Электронно-позитронные пары 62, 63
— кинетическая энергия пары 62
Электрохемилюминесценции метод 218, 219, 307
Эндогенный фонд радиорезистентности (ЭФР) 30, 387, 390
Эндонуклеаза 256, 258, 262, 282, 294
Энергия излучения 54, 55, 58, 67, 76, 81, 90, 144, 381
— линейная потеря (ЛПЭ) (см. таксисе Линейная передача энергии)
37, 76, 79, 157, 158
— миграция в биоструктурах
изменение сигнала ЭПР 158
реакция присоединения 158
Предметный указатель 439
термолюминесценция 158, 160
— пакет 143
— перенос на молекулу 158, 160, 161, 381
— поглощение веществом 54, 55, 58, 59, 60, 67, 73, 78, 79, 80, 81, 207,
329, 333, 334, 339, 381, 382
— удельная потеря 37, 71, 79, 80, 143
ЭПР-спектроскопия 152, 154, 155, 158, 159, 160, 163, 214, 215, 216, 217,
219, 220, 325, 326
— метод 136, 154, 217, 385
— спектры ЭПР облученных животных 152, 155, 158, 217
Эритропоэз 115, 116, 117, 118
Эффект Петко 313, 314, 344
Эффект свидетеля (bystander effect) 34, 333, 340, 346, 347, 348, 363,
371, 372, 373, 391
Эффективная доза 47, 48, 51
Ядерная реакция 17, 65
Ядро отдачи 64, 65, 67
5IKP (ядерный квадрупольный резонанс) 215, 216
ЯМР (ядерный магнитный резонанс)
— ЯМР-спектроскопия 215, 216
440
Указатель имен
Указатель имен
Акоев И.Г. 302
Александер П. 26, 31, 342
Александров В.Н. 317
Альтенбургер К. 91, 92, 110, 113
Арчаков А.И. 28, 199, 248
Аршамбо Д. 298
Ауэрбах Ш. 212
Байсоголов Г.Д. 301
Бак 3. 25, 26, 31, 204, 342
Беккерель А. 17
Бергонье И. 19, 269
Беренфельд Б.С. 9
Бесядовский Р.А. 113
Блау М. 91, 92, 110, 113
Блох Ф. 216
Блюменфельд Л.А. 44
Боденштейн М. 197
Боднарчук И.А. 340, 341, 345, 349,
350, 353
Бонд В. 298
Бурлакова Е.Б. 12, 27, 28, 219, 226,
236, 237, 302, 307, 321, 328, 340,
345, 357
Бычковская И.Б. 363
Вайнберг Р. 379
Василенко О.И. 12
Вейс Дж. 173
Веселовский В.А. 307
Виенкке Дж. 315
Владимиров Ю.А. 28, 199, 217, 280,
307
Говард-Фландерс П. 257
Гольдберг СВ. 18
Гончаренко Е.Н 12, 26, 201, 218, 249,
302, 308, 362
Горизонтов П.Д. 30, 299
Гофман Дж. 322
Граевский Э.Я. 26
Грей Л. 25, 42
Грейб Р. 314, 322, 344
Груздев Г.П. 299
Гурвич А.Г. 306
Гуськова А.К. 301
Деев Л.И. 12
Дейл В. 25, 180, 204
Дертингер Г. 69, 162, 183
Дессауэр Ф. 21
Дубинин Н.П. 24
Ермолаева Н.В. 276
Жолио-Кюри Ирен 17
Жолио-Кюри Фредерик 17
Жербин Е.А. 30
Жеребченко П.Г. 25
Животовский Б.Д. 30, 276
Зиверт P.M. 46
Иванов В.И. 40, 332
Иванов В.К. 119, 321, 326
Иванов И.И. 28, 307
Каган В.Е. 28
Казначеев В.П. 306
Капульцевич Ю.Г. 103, 109, 111
Касьяненко А.А. 12
Кеирим-Маркус И.Б. 45
Кейтер Д. 25
Келлерер 103, 109, 110, 389
Киселев М.Ф. 327, 328
Кларк Л. 257
Козлов Ю.П. 28, 218
Козлов А.А. 305
Коломийцева И.К. 304
Колье О.Р. 12
Комар В.Е. 258, 302
Коноплянников А.Г. 300
Коноплянникова О.А. 300
Корогодин В.И. 22, 291, 332
Корыстов Ю. Н. 212
Котеров А.Н. 313
Коул К. 214
Коул Л. 276
Кроутер Дж. 22, 92
Кудряшов Ю.Б 26, 28, 201, 203, 218,
249, 302, 340, 348, 362, 383
Кудряшова Н.Ю. 265, 268
Кузин A.M. 24, 30, 241, 305, 306, 309,
310, 322, 348
Кулинский В.И. 248
Кюри Мария 17, 35
Указатель имен
441
Кюри Пьер 17
Лангендорф X. 25
Ли Д.Е. 22, 75, 78, 92, 173, 381
Либинзон Р.Е. 276
Литвин Ф.Ф. 217, 307
Ломанов М.Ф. 11, 44, 78
Лондон Е.С. 17, 18, 19
Лось Л.А. 357, 359
Лучник Н.В. 290, 383
Люкки Т.Д. 305, 309
Мазурик В.К. 11, 30, 226, 287, 299,
302, 362
Мамихин СВ. 11, 102
Мернетт Л. Дж. 220, 383
Мёллер Г. 21
Микоян В.Д. 238
Михайлов В.Ф. 11, 302, 362
Михайлова Л.П. 306
Моссэ И.Б. 329
Надсон Г.А. 21
Насонов Д.Н. 317
Нейфах Е.А. 28
Неменов М.И. 19
Нернст В. 197
Носкин Л.А. 355
Обатуров Г.Н. 109, 112, 122,
Окада Ш. 176, 187, 212, 273, 302
Острецов И.Н. 12
Очинская Г.К. 363
Пальмина Н.П. 28
Парибок В.П. 31
Патт X. 25
Пелевина И.И. 12, 313, 325, 362
Перов СЮ. 12
Петко А. 313, 314, 344
Петровский A.M. 119
Петрусевич Ю.М. 307
Платцман Р.Л. 84, 136, 140, 147, 171
Планель X. 305
Платонов А.Г. 12
Поверенный A.M. 30, 299
Померанцева М.Д. 312
Попа Ф. 306
Пурселл Э. 216
Ризниченко Г.Ю. 12, 104
Ромайя Л.Х. 312
Романовский Ю.М. 104
Романцев Е.Ф. 30, 276
Рощупкин Д.И. 28
Рубин А.Б. 12, 104
Рысина Т.Н. 276
Рябченко Н.И. 30, 276
Савич А.В. 190, 191, 196
Саган Л. 24
Саенко А.С. 351
Самуилов В.Д. 277
Саттон Е. 292, 294
Селье Г. 316, 317, 360
Семенов Н.Н. 27, 198
Сетлоу Р.Б. 255
Синклер У.К. 274
Скулачев В.П. 30, 232, 247, 279, 289
Смирнова О.А. 115
Сорокина Е.Г. 230
Сорокина Н.И. 276
Спитковский Д.М. 11, 259, 260, 280,
329, 355, 355
Степанова Н.В. 104
Суворов Н.Н. 25
Тарусов Б.Н. 10, 27, 28, 198, 218,
219, 241, 307, 343
Тарханов (Тарханишвили) И.Р. 17
Терещенко О.Я. 299
Тимофеев К.Н. 12
Тимофеев-Ресовский Н.В. 22, 91, 92,
332, 381
Тихонов А.Н. 44
Тобайес К.А. 101
Толмач Л.Дж. 293
Трибондо Л. 19, 269
Уманский СР. 30, 276
Федорова Т.А. 299
Федоровский Л.Л. 300
Федотова М.И. 299
Филиппов Г.С. 21
Филиппович И.В. 30, 276, 302, 313
Филипс Г.О. 293
Флиднер Т.: 298
Фонг К.: 228
Рентген В.К. 17, 17, 35
Реутов В.П. 230
Хартвелл Л. 281
Хансон К.П. 30, 258, 276, 302
442 Указатель имен
Хейнеке Г. 18 Щербова Е.И. 300
Хесин Р.Б. 378
Хуг О. 103, ПО, 389 Эйдус Л.Х. 31, 162, 302, 340, 345,
347, 390
Циммер К.Г. 22, 92, 95, 217 Элкинд М.М. 292
Циркль Р. 101 Эмануэль Н.М. 27, 198, 219
ЦыбА.Ф. 326 ЭрвА. 25
Челак В. 344 Y ,n 1QQ
Чернавский Д.С. 12, 104, 119, 121 Шнг Х' ЬУ' 1Ь6
Шарпатый В.А. 12 Ярмоненко СП. 9, 25, 99, 300
Шило А. 12 Ятвин М. 343
Учебное издание
КУДРЯШОВ Юрий Борисович
РАДИАЦИОННАЯ БИОФИЗИКА
(ИОНИЗИРУЮЩИЕ ИЗЛУЧЕНИЯ)
Редакторы Е.Н. Гончаренко, Р. А. Бунатян
Оригинал-макет: A.M. Широков
Оформление переплета: А.А. Логунов
ЛР №071930 от 06.07.99. Подписано в печать 17.11.03.
Формат 60x90/16. Бумага офсетная. Печать офсетная.
Усл. печ. л. 28. Уч.-изд. л. 30,8. Заказ №
Издательская фирма «Физико-математическая литература»
МАИК «Наука/Интерпериодика»
117997, Москва, ул. Профсоюзная, 90
E-mail: fizmat@maik.ru, fmlsale@maik.ru
http://www.fml.ru
Отпечатано с готовых диапозитивов в ПФ «Полиграфист»
160001, г. Вологда, ул. Челюскинцев, 3
Тел.: (8172) 72-55-31, 72-61-75, факс: (8172) 72-60-72
E-mail: form.pfp@votel.ru http://www.vologda/~pfpv
ISBN 5-9221-0388-1
9 785922 103886