Текст
Т.М.Варламова, А.И.Кракова
ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ: БАЗОВЫЙ КУРС
В данном пособии изложены основные вопросы общей и неорганической
химии, многие из которых вызывают трудности у учащихся и абитуриентов.
Подробно рассмотрены типовые задачи по всем разделам школьного курса химии
и предложены задания для самостоятельного решения.
Пособие предназначено слушателям подготовительных отделений при высших
учебных заведениях, а также лицам, готовящимся для поступления в вузы
самостоятельно, учащимся старших классов средних школ, лицеев, гимназий и
колледжей.
Предисловие
В настоящем пособии изложен материал общей и неор-
ганической химии. Авторы сосредоточили внимание на
систематическом и подробном рассмотрении вопросов
общей химии, вызывающих наибольшие трудности у уча-
щихся. В каждом разделе разбираются необходимые тео-
ретические положения, которые далее закрепляются при
разборе решений всех типовых задач. В разделе, посвящен-
ном неорганической химии, материал изложен, в основ-
ном, в форме вопросов, задач и упражнений. Они подобра-
ны таким образом, что для ответа необходимо вспомнить
фактический материал, хорошо изложенный в большин-
стве руководств и учебников, а также теоретические поло-
жения, приведенные в разделе общей химии данного посо-
бия. Проверка усвоения материала осуществляется путем
анализа теоретических вопросов, задач повышенной труд-
ности, а также задач, предлагавшихся на вступительных
экзаменах в вузы. Для их решения требуется не только
прочное усвоение всех пройденных разделов, но и примене-
ние приобретенных знаний.
Мы выражаем надежду, что приведенные типовые за-
дачи с решениями, а также большое число заданий для
самостоятельной работы (свыше 1000) будут способство-
вать активному усвоению курса общей и неорганической
химии, развитию химического мышления учащихся.
Программа для поступающих в вузы
1. Общая химия
1.1. Предмет и задачи химии. Место химии среди ес-
тественных наук, взаимосвязь наук с химией. Химия и
экология.
1.2. Основные понятия и законы химии. Химическая
символика. Атомно-молекулярное учение. Понятие ато-
ма, молекулы, элемента, вещества. Аллотропия. Моль —
мера количества вещества. Молярная масса. Валентность.
Стехиометрические законы: закон сохранения массы, за-
кон постоянства состава, закон эквивалентов. Молярная
з
масса эквивалента. Расчет молярных масс эквивалентов
кислот, гидроксидов, солей. Газовые законы: закон Бой-
ля-Мариотта, закон Гей-Люссака, закон Шарля. Объеди-
ненный газовый закон. Закон Авогадро и молярный объем
газа. Уравнение состояния идеального газа. Уравнение
Клапейрона-Менделеева.
1.3. Классификация химических реакций. Явления
физические и химические. Смеси и химические соедине-
ния. Реакции соединения, разложения, замещения обме-
на. Экзо- и эндотермические реакции. Тепловой эффект
химической реакции. Термохимические уравнения. Окис-
лительно-восстановительные реакции.
1.4. Химическая кинетика. Скорость химических ре-
акций. Факторы, влияющие на скорость химической ре-
акции. Закон действующих масс. Физический смысл
константы скорости. Правило Вант-Гоффа. Понятие об
энергии активации, ее влияние на скорость химической
реакции. Уравнение Аррениуса. Явление катализа. Го-
могенный и гетерогенный катализ. Катализаторы, инги-
биторы, промоторы, каталитические яды. Химическое
равновесие. Реакции обратимые и необратимые. Состоя-
ние химического равновесия. Принцип Ле Шателье.
1.5. Строение атома и периодический закон Д. И. Мен-
делеева. Основные этапы развития представлений о стро-
ении атома. Модель строения атома Резерфорда. Посту-
латы Бора. Корпускулярно-волновая природа электрона.
Квантово-механическая модель атома. Квантовые числа.
Атомные орбитали. Заполнение уровней, подуровней и
орбиталей электронами: принцип минимальной энергии,
принцип Паули, правило Хунда. Правила Клечковского.
Электронные формулы элементов I-IV периодов. Строе-
ние атомных ядер. Изотопы. Изобары. Ядерные реакции.
Современная формулировка периодического закона. Пе-
риодическая система элементов в свете строения атома.
Периоды, группы, подгруппы, s-, р-, d- и f-элементы. Пери-
одичность свойств химических элементов.
1.6. Химическая связь и строение молекул. Условие
образования химической связи. Типы химической свя-
зи: ковалентная, ионная, металлическая и водородная.
Основные характеристики связи. Ковалентная связь (по-
4
лярная и неполярная). Механизмы ее образования и при-
меры соединений. Свойства ковалентной связи, а- и л-
связи. Ионная связь, ее образование. Ненаправленность и
ненасыщаемость ионной связи. Основные представления
о природе металлической связи. Свойства металлов, обус-
ловленные металлической связью. Природа и энергия
водородной связи, примеры. Понятие о силах Ван-дер-
Ваальса.
1.7. Окислительно-восстановительные процессы. Степень
окисления. Окисление и восстановление. Окислители. Вос-
становители. Составление уравнений окислительно-восста-
новительных реакций. Метод электронного баланса. Влия-
ние среды на характер протекания окислительно-восстано-
вительных реакций. Типы окислительно-восстановительных
реакций.
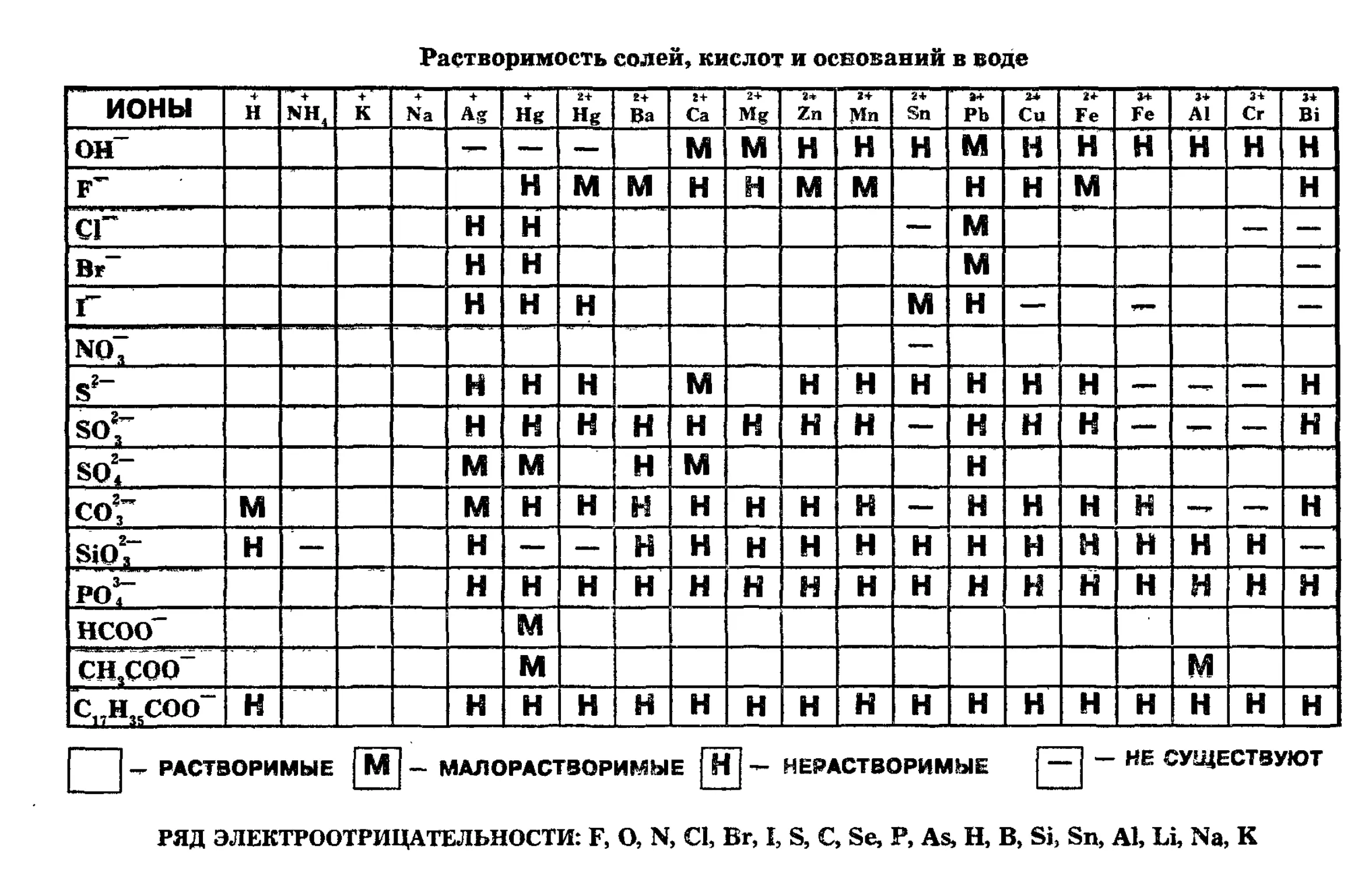
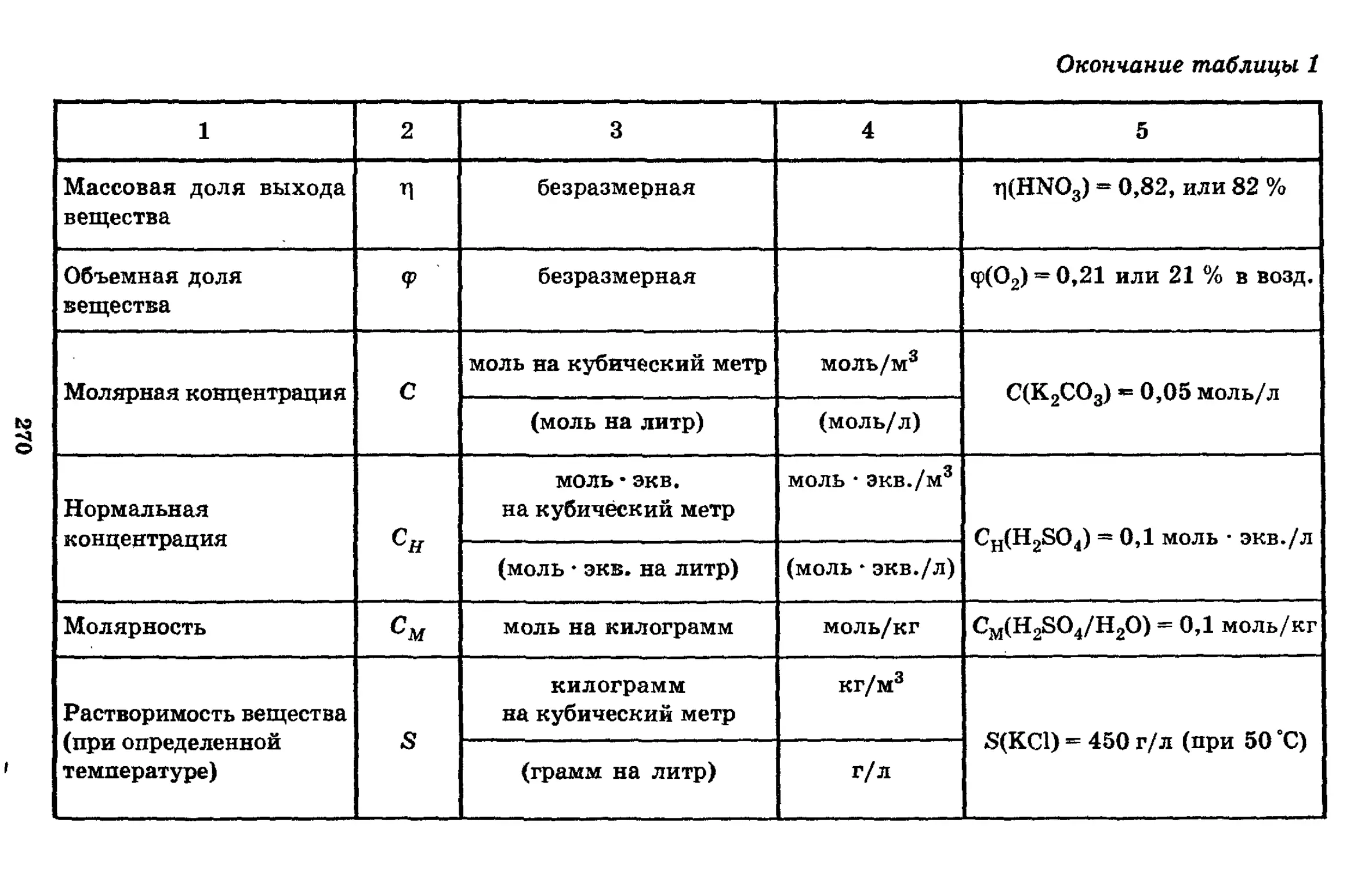
1.8. Растворы. Классификация растворов. Раствори-
тель и растворенное вещество. Общие свойства истинных
растворов. Насыщенный, пересыщенный и ненасыщенный
раствор. Способы выражения состава раствора (массовая
доля вещества в растворе, молярная концентрация, нор-
мальная концентрация). Физическая теория растворов
Я. Вант-Гоффа и С. Аррениуса. Химическая теория ра-
створов Д. И. Менделеева. Сольваты, гидраты, кристалло-
гидраты, кристаллизационная вода. Растворение веществ
как физико-химический процесс. Тепловой эффект про-
цесса растворения. Растворимость веществ. Факторы,
влияющие на растворимость веществ. Электролиты и
неэлектролиты. Теория электролитической диссоциации
С. Аррениуса. Степень электролитической диссоциации.
Зависимость степени диссоциации от природы электро-
лита, природы растворителя, концентрации и температу-
ры раствора. Кажущаяся степень диссоциации сильных
электролитов. Константа электролитической диссоциа-
ции. Диссоциация воды. Ионное произведение воды. Во-
дородный показатель. Ионно-молекулярные уравнения
реакций. Гидролиз солей. Факторы, влияющие на про-
цесс гидролиза. Степень и константа гидролиза.
1.9. Классы неорганических соединений. Оксиды, их
классификация. Получение и химические свойства ос-
новных, кислотных и амфотерных оксидов. Основания, их
5
классификация. Получение и химические свойства ос-
нований. Амфотерные гидроксиды, примеры, важнейшие
химические свойства. Кислоты, их классификация. По-
лучение и химические свойства кислот. Соли, их класси-
фикация. Получение и химические свойства солей. Гене-
тическая взаимосвязь веществ различных классов.
2. Неорганическая химия
2.1. Общая характеристика неметаллов. Положение
неметаллов в периодической системе. Сродство к элект-
рону — количественная характеристика окислительной
способности неметаллов. Агрегатное состояние неметал-
лов. Соединения неметаллов с водородом и кислородом.
Взаимодействие неметаллов с простыми и сложными ве-
ществами.
2.1.1. Водород, его физические и химические свойства.
Лабораторные и промышленные способы получения во-
дорода, его применение. Вода, строение молекулы. Физи-
ческие и химические свойства воды. Тяжелая вода.
2.1.2. Галогены, их общая характеристика. Хлор, его
физические и химические свойства. Получение хлора.
Окислительные свойства галогенов. Галогеноводороды,
строение, получение, физические и химические свойства.
Восстановительные свойства галогеноводородов. Хлоро-
водород, хлороводородная (соляная) кислота. Кислородо-
содержащие соединения хлора: кислоты, соли. Бертоле-
това соль. Хлорная известь.
2.1.3. Общая характеристика элементов главной под-
группы VI группы периодической системы. Кислород,
строение атома, аллоторопия. Промышленные и лаборатор-
ные способы получения. Физические и химические свой-
ства. Роль кислорода в природе и применение в технике.
Озон, строение молекулы. Получение и химические свой-
ства озона. Сравнительная характеристика окислитель-
ных свойств кислорода и озона. Роль атмосферного озон-
ного слоя для развития жизни на Земле. Сера, строение
атома, возможные степени окисления. Физические свой-
ства серы, аллотропные модификации. Химические свой-
ства серы. Сероводород, получение. Физические и химиче-
ские свойства. Восстановительные свойства сероводорода.
6
Сероводородная кислота, образование кислых и средних
солей. Гидролиз сульфидов. Растворимость сульфидов.
Оксид серы (IV), строение молекулы, получение. Физичес-
кие и химические свойства. Получение сернистой кисло-
ты. Соли кислые и средние. Окислительно-восстанови-
тельные свойства соединений серы со степенью окисле-
ния +4. Оксид серы (IV), строение молекулы, получение.
Физические и химические свойства. Получение серной
кислоты. Химические свойства разбавленной и концент-
рированной серной кислоты (взаимодействие с металла-
ми, неметаллами, органическими веществами).
2.1.4. Общая характеристика элементов главной под-
группы V группы периодической системы. Азот. Строе-
ние атома, строение молекулы, степени окисления. Кру-
говорот азота в природе. Получение, физические и хими-
ческие свойства азота. Аммиак, строение молекулы,
получение, физические и химические свойства. Восста-
новительные свойства аммиака. Аммиачная вода. Соли
аммония, их получение. Термическое разложение солей
аммония. Оксиды азота, их получение и основные хими-
ческие свойства. Азотистая кислота. Окислительно-вос-
становительные свойства соединений азота со степенью
окисления +3. Азотная кислота, ее получение и химичес-
кие свойства. Окислительные свойства азотной кислоты
в реакциях взаимодействия с металлами и неметаллами.
Царская водка. Соли азотной кислоты, их термическое
разложение. Азотные удобрения. Фосфор, строение атома,
степени окисления. Аллотропия. Физические и химичес-
кие свойства. Фосфин. Фосфиды, их гидролиз. Оксиды
фосфора (III) и (V), их получение, свойства. Ортофосфор-
ная кислота, ее получение. Одно-, двух- и трехзамещен-
ные фосфаты. Их растворимость и гидролиз. Метафос-
форная кислота, ее общая характеристика. Фосфорные
удобрения.
2.1.5. Общая характеристика элементов главной под-
группы IV группы периодической системы. Углерод, стро-
ение атома, степени окисления, аллотропия. Круговорот в
природе. Химические свойства: взаимодействие с про-
стыми веществами, оксидами некоторых металлов, кон-
центрированными серной и азотной кислотами. Оксиды
7
углерода (II) и (IV), их строение, получение, важнейшие
химические свойства. Действие оксида углерода (II) на
организм. Угольная кислота. Образование кислых и сред-
них солей. Термическое разложение карбонатов и гидро-
карбонатов. Гидролиз карбонатов. Карбиды кальция и
алюминия, их взаимодействие с водой и кислотами. Крем-
ний, строение атома, распространенность в природе. По-
лучение кремния, физические и химические свойства.
Силан, его получение, свойства. Оксид кремния (IV), фи-
зические и химические свойства. Кремниевая кислота,
получение, химические свойства. Получение и примене-
ние силикатов. Стекло. Силикаты в природе.
2.2. Общая характеристика металлов. Положение ме-
таллов в периодической системе. Физические свойства
металлов. Химические свойства металлов. Металлы и
сплавы в технике. Основные способы получения метал-
лов. Электрохимический ряд напряжений металлов. Кор-
розия металлов. Методы защиты от коррозии. Электро-
лиз расплавов и водных растворов солей. Процессы, про-
текающие у катода и анода.
2.2.1. Щелочные металлы. Общая характеристика на
основе положения в периодической системе элементов.
Получение, физические и химические свойства. Оксиды
и пероксиды щелочных металлов. Гидроксиды щелочных
металлов, получение, химические свойства (гидроксиды
натрия и калия). Важнейшие соли натрия и калия, их
применение. Калийные удобрения.
2.2.2. Щелочноземельные металлы. Общая характе-
ристика подгруппы щелочноземельных металлов. Каль-
ций, получение, свойства. Соли кальция. Жесткость воды
(временная и постоянная), способы ее устранения.
2.2.3. Алюминий, электронная формула, степень окис-
ления. Получение, физические и химические свойства.
Соединения алюминия в природе, его роль в технике.
Амфотерность оксида и гидроксида алюминия. Комплек-
сные соединения алюминия.
2.2.4. Переходные элементы, их важнейшие предста-
вители. Общая характеристика (строение атома, физи-
ческие и общие химические свойства). Железо, электрон-
ная формула, степени окисления. Железо в природе. Фи-
8
зические и химические свойства. Оксиды железа (II) и
(III). Гидроксиды железа (II) и (III). Их свойства. Комп-
лексные соединения железа. Химические реакции, лежа-
щие в основе получения чугуна и стали. Роль железа и
его сплавов в технике. Хром, электронная формула, степе-
ни окисления. Получение, физические и химические свой-
ства хрома. Оксиды хрома (II) и (III). Гидроксиды хрома
(II) и (III). Их свойства. Оксид хрома (VI). Хромовая и
дихромовая кислоты. Дихромат калия как окислитель.
Марганец, электронная формула, степени окисления. По-
лучение, физические и химические свойства марганца.
Кислотно-основные и окислительно-восстановительные
свойства соединений марганца. Оксиды марганца (II) и
(IV). Гидроксид и соли марганца (II). Соединения мар-
ганца (VI) и (VII). Перманганат калия как окислитель.
1
Предмет и задачи химии
Химия — одна из естественных наук, изучающих при-
роду. Бесконечное многообразие тел и явлений природы
проникнуто единством, которое заключается в матери-
альности мира. Окружающий нас мир существует объек-
тивно, независимо от человеческого сознания; он пред-
ставляет собой различные виды движущейся материи,
различные формы ее проявления.
Материя бесконечно многообразна. Это объясняется
тем, что она состоит из различного типа дискретных ча-
стиц, находящихся во взаимодействии. Те виды материи,
дискретные частицы которых имеют конечную массу
покоя, называются веществом. Веществом, в частности,
являются такие элементарные частицы, как протон, ней-
трон, электрон и др. Сочетанием этих и других элемен-
тарных частиц образуются более сложные образования —
ядра атомов, атомы, молекулы, ионы, кристаллы, живые
организмы и т. п.
Те виды материи, дискретные частицы которых не
имеют массы покоя, называются полями. Таковы элект-
ромагнитное и ядерное поля.
Поле и вещество находятся в непрерывной связи друг
с другом, поскольку любые частицы вещества связаны
между собой тем или иным полем.
Материя неразрывно связана с движением. Движе-
ние — это изменение вообще, всякое взаимодействие ма-
териальных объектов, это свойство и способ существова-
ния материи. Оно происходит в пространстве и времени,
которые являются всеобщими формами существования
материи. В своей практической деятельности человек
имеет дело с конкретными проявлениями движущейся
10
материи, т. е. конкретными ее видами — с веществами,
например с кислородом, мелом, сахаром, водой и т. д.
Химия — наука, изучающая состав, строение и свой-
ства веществ, процессы их превращений и те явления,
которыми сопровождаются эти превращения.
Задачи химии:
|7] Получение веществ с заданными свойствами.
ГЦ Интенсификация промышленных процессов.
(3) Использование энергии химических превращений.
[7] Охрана окружающей среды.
Значение химии
для народного хозяйства
Химия играет исключительно важную роль в произ-
водственной деятельности человека. Природа дает нам
лишь исходное сырье — дерево, руду, нефть и др. Подвер-
гая природные материалы химической обработке, полу-
чают разнообразные вещества, необходимые для изготов-
ления промышленных изделий, для сельского хозяйства,
для строительства жилищ и производства товаров народ-
ного потребления.
Химическая промышленность выпускает синтетиче-
ский каучук, пластмассы, искусственное волокно, искус-
ственное топливо, красители, лекарственные препараты,
моющиеся средства и др.
С использованием химических методов получают ме-
таллы, а также осуществляют их защиту от коррозии.
Химические вещества помогают ускорить многие техноло-
гические процессы в пищевой и легкой промышленности.
Нефтеперерабатывающая и нефтехимическая промыш-
ленность выпускает конечные продукты переработки не-
фти и газа, резино-технические изделия.
Химия играет важную роль в решении энергетиче-
ской проблемы (химические источники тока), в создании
необходимых материалов для электротехнической про-
мышленности и атомной энергетики (материалы и горю-
чее для атомных реакторов).
В сельском хозяйстве широко применяются минеральные
11
удобрения, химические средства защиты растений и ре-
гуляторы их роста, химические добавки в корма живот-
ных и консерванты кормов.
Современная медицина немыслима без сотрудничества
химиков и медиков. Выяснение сложнейших процессов,
происходящих в живых организмах, связи между струк-
турой химического соединения и его влиянием на орга-
низм, природы заболеваний, связанных с недостатком ви-
таминов или микроэлементов — вот те насущные задачи, в
решении которых значительную роль играет химия.
Говоря о значении химии, можно привести слова ака-
демика Ю. А. Овчинникова: «Могущество химии распро-
страняется сегодня на познание самых удивительных яв-
лений природы — от процессов в живой клетке до пре-
вращения веществ в глубинах Земли и Океана и на других
Планетах».
Химия и охрана окружающей среды
В конце XX века человечество столкнулось с серьезной
проблемой вредного воздействия на окружающую среду
промышленности, транспорта, энергетики. Происходит за-
грязнение среды обитания человека вредными отходами
производства, выделяется избыточная энергия, истощают-
ся природные ресурсы. Отрицательными следствиями этих
процессов являются загрязнение воды и атмосферы, изме-
нение климата, вымирание многих видов животных и ра-
стений, ухудшение здоровья людей.
Наука, которая изучает взаимоотношение человечества
с окружающей средой, получила название экологии. Эко-
логия имеет тесную связь с химией. С одной стороны,
химическое воздействие на окружающую среду наносит
ей большой вред, но с другой стороны, предупредить дег-
радацию природы можно путем использования химиче-
ских методов.
Химия и химическая промышленность являются од-
ними из наиболее существенных источников загрязне-
ния окружающей среды. Из других производств небла-
гоприятными в экологическом отношении являются
12
черная и цветная металлургия, автомобильный транспорт
и энергетика (тепловые станции).
Основные источники загрязнения среды обитания че-
ловека могут быть газообразными, жидкими и твердыми.
Газообразные отходы содержат оксиды углерода (II и IV),
оксид серы (IV), оксиды азота и другие вредные вещества.
Другой источник загрязнения окружающей среды —
промышленные и бытовые сточные воды. Сточные воды
могут содержать многие неорганические соединения, в том
числе ионы таких металлов, как ртуть, цинк, кадмий, медь,
никель, хром и др. Не менее опасно присутствие в сточ-
ных водах различных органических соединений. Хими-
ческие вещества, содержащиеся в воде, попадают в реки,
озера и моря, проникают в грунтовые воды. В результате
вредные вещества появляются в питьевой воде, пище и
могут вызвать глубокие генетические изменения в орга-
низме человека и животных.
Наконец, третий источник загрязнения — твердые отхо-
ды. К ним относятся различные отходы горнодобывающей
промышленности, строительный и бытовой мусор и т. д.
Важнейшие направления работ, которые проводятся
для снижения отрицательного воздействия производствен-
ной деятельности следующие:
ГТ) Разработка и создание малоотходных и полностью
безотходных технологий.
IjQ Разработка технологий, которые наиболее эконом-
но расходуют сырье, топливо, энергетические ресурсы.
Гз) Создание производных процессов, которые не исполь-
зуют вредные химические вещества и не дают их в каче-
стве побочных продуктов.
Г4| Разработка систем очистки выбрасываемых газов
и сточных вод.
Г§] Разработка технологий переработки твердых отходов.
Охрана окружающей среды — проблема, охватываю-
щая всю нашу планету. В связи с этим в настоящее вре-
мя в области экологии развивается международное со-
трудничество, многие проблемы решаются путем совмест-
ных действий различных государств.
2
Простейшие химические расчеты.
Основные понятия и законы химии
Химическая символика
Химический знак (символ химического элемента) при-
меняется как сокращение для названия элемента. В каче-
стве знака обычно берут одну или две буквы от латинско-
го названия элементов. Си — медь (cuprum), Аи — золото
(Аигит) и т. п. Система химических знаков была предло-
жена в 1811 г. шведским ученым Я. Берцелиусом.
Химический знак обозначает:
ГТ) название элемента;
[21 один атом элемента;
Гз]1 моль его атомов;
И1 атомный номер;
Г§] относительную атомную массу элемента.
Химические расчеты
Химическая формула — выражение состава вещества
при помощи химических знаков.
Из химической формулы можно узнать:
|71 название вещества;
[2] одну его молекулу;
Гз) один моль вещества;
И1 качественный состав вещества;
ГЦ сколько моль атомов каждого элемента содержит
один моль вещества.
Характеризуя соотношение между массовыми коли-
чествами элементов, входящих в состав вещества, форму-
14
ла дает возможность расчета массы каждого элемента в
соединении и его массовую долю.
Пример 1
Рассчитайте массовую долю водорода в аммиаке.
I Дано:
l__J M(N) = 14 г/моль
М(Н) = 1 г/моль
Найти:
ш(Н)
Решение:
1) Определяем молярную массу NH3:
M(NH3) =14+ 1- 3 = 17 г/моль.
2) Определяем массу аммиака в количестве веще-
ства 1 моль:
m(NH3) = 1 моль • 17 г/моль = 17 г.
3) Из формулы аммиака следует, что количество
вещества атомарного водорода в 3 раза больше ко-
личества вещества NH3:
v(H) = 3v(NH3), v(H) = 31 = 3 моль.
4) Рассчитываем массу водорода:
т = v • М; /та(Н) = 3 • 1 = 3 г.
5) Находим массовую долю водорода в аммиаке:
о>(Н) = -уу = 0,176 или 17,6%.
Ответ: о>(Н) - 17,6 % .
Пример 2
Рассчитайте массу фосфора, которую можно полу-
чить из 620 кг ортофосфата кальция.
Дано:
т(Са3(РО4)2) = 620 кг
Найти:
т(Р)
15
Решение:
1) Определяем молярную массу Са3 (РО4)2:
М(Са3 (РО4)2) = 40-3 + 312 + 16-8 = 310 г/моль.
2) Рассчитываем количество вещества ортофосфа-
та кальция:
v(Ca3(PO4)2) = - 2 • 103 моль.
3) Из формулы ортофосфата кальция следует, что
количество вещества атомарного фосфора в 2 раза
больше количества вещества Са3(РО4)2:
v(P) = 2v(Ca3(PO4)2),
v(P) = 2 • 2 • 103 = 4 • 103 моль.
4) Находим массу фосфора:
ш(Р) = 4 • 103 • 31 = 124 кг.
Ответ: т(Р) = 124 кг.
Различают простейшие и истинные (молекулярные)
формулы. Простейшая формула выражает наименьшее
отношение между числами атомов элементов, входящих в
молекулу. Истинная формула показывает действитель-
ное число атомов в молекуле, отвечающее наименьшему
соотношению. Для установления истинной формулы нуж-
но знать не только массовый состав вещества, но и его
молекулярную массу.
Пример 3
Выведите формулу соединения, содержащего 25 %
водорода и 75 % углерода.
а Дано:
ц>(Н) = 25 %
ц>(С) = 75 %
Найти:
Решение:
1) Выбираем массу неизвестного соединения за 100 г.
Тогда массы элементов Н и С равны:
16
m(H) = 100 • 0,25 = 25 г,
m(C) = 100 • 0,75 = 75 г.
2) Определяем количества веществ атомарных эле-
ментов Н и С:
25 75
v(H) = —j— = 25 моль, v(C) = = 6,25 моль.
3) Составляем количественное отношение веществ:
v(H): v(C) = 25 : 6,25.
4) Делим правую часть пропорции на меньшее чис-
ло (6,25) и получаем соотношение атомов в форму-
ле неизвестного соединения:
х(С): у(Н) = 1:4.
Простейшая формула соединения — СН4.
Ответ: СН4.
Пример 4
При полном сгорании 2,66 г некоторого вещества
образовалось 1,54 г оксида углерода (IV) и 4,48 г
оксида серы (IV). Плотность пара этого вещества по
воздуху равна 2,62. Выведите истинную формулу
этого вещества.
Дано:
т(С02) = 1,54 г
m(S02) = 4,48 г
Найти:
истинную формулу вещества
Решение:
1) Рассчитываем количества веществ оксида угле-
рода (IV) и оксида серы (IV):
1,54
v(CO„) = ——— = 0,035 моль,
44
4,48
v(SO2) = ——— - 0,07 моль.
64
2) Определяем количества веществ атомарных уг-
лерода и серы:
17
v(C) = v(CO2) = 0,035 моль,
v(S) = v(SO2) = 0,07 моль.
3) Находим массы углерода и серы:
т(С) = 0,035-12 = 0,42 г,
m(S) = 0,07-32 = 2,24 г.
Суммарная масса этих элементов составляет 2,66 г
и равна массе сжигаемого вещества. Следовательно,
оно состоит только из углерода и серы.
4) Находим простейшую формулу вещества:
v(C): v(S) = 0,035 : 0,07 = 1:2.
Простейшая формула— CS2.
5) Определяем молярную массу CS2:
M(CS2) = 12 + 32 • 2 = 76 г/моль.
6) Рассчитываем истинную формулу вещества:
М, „ = 29 • = 29 • 2,62 = 76 г/моль.
Таким образом, истинная формула вещества совпа-
дает с простейшей.
Ответ: Мист_ = 76 г/моль.
Пример 5
Выведите истинную формулу органического соедине-
ния, содержащего 40,03 % С, 6,67 % Н и 53,30 % О.
Молярная масса данного соединения равна 180 г/моль.
Дано:
о>(С) = 40,03 %
ш(Н) = 6,67%
ш(О) = 53,30%
mCC^H^Oz) = 180 г/моль
Найти:
СЛ,Ог
Решение:
1) Обозначим число атомов углерода через х, число
атомов водорода — у, число атомов кислорода — г.
2) Делим процентное содержание элементов соот-
ветственно на величины их относительных атомных
масс и находим соотношения между атомами в мо-
лекуле данного соединения:
18
40,03 6,67 53,30
х : у : z = 3,33 : 6,67 : 3,33.
3) Приводим найденные величины к целочислен-
ным значениям:
х : у : г = 1: 2 : 1.
Простейшая формула органического соединения бу-
дет СН2О. Молярная масса составляет:
(12 + 2 + 16) • 30 г/моль.
Молярная масса простейшей формулы в 6 раз
180:30 = 6
меньше молярной массы истинной формулы этого
соединения. Поэтому для вывода истинной формулы
органического соединения надо число атомов умно-
жить на 6. Тогда получим С6Н12О6.
Ответ: С6Н12О6.
Пример 6
Установите формулу кристаллогидрата хлорида каль-
ция, если при прокаливании 6,57 г его выделилось
3,24 г сконденсировавшейся воды.
Г>Г~| Дано:
1°-^! т(СаС12 • хН2О) = 6,57 г
т(Н20) = 3,24 г
Найти:
формулу кристаллогидрата
Решение:
1) Рассчитаем массу безводной соли СаС12, содер-
жащейся в кристаллогидрате:
т(СаС12) - 6,57 - 3,2 = 3,33 г.
2) Определяем количества веществ СаС12 и Н2О:
v(CaCl2) = " щ '= 0,03 моль,
3,24
v(H2O) = —~— = 0,18 моль.
3) Находим формулу кристаллогидрата:
19
v(CaCl2): v(H2O) = 0,03 : 0,18 = 1:6.
Формула кристаллогидрата — СаС12 • 6H2O.
Ответ: СаС12 • 6Н2О.
Химическое уравнение — это изображение химической
реакции при помощи химических знаков и формул. Урав-
нение характеризует как качественную сторону реакции
(какие вещества вступили в химическую реакцию и какие
получились в ходе ее), так и количественную (каковы коли-
чественные соотношения между массами или объемами для
газов исходных веществ и продуктов реакции). Отражение
уравнениями количественной стороны химических процес-
сов позволяет производить на их основе различные расче-
ты: нахождение массы или объема исходных веществ для
получения заданного количества продуктов реакции, мас-
сы или объема новых веществ, которые можно получить из
данного количества исходных веществ, и т. п.
Пример 7
Какую массу алюминия необходимо взять для вос-
становления железа из 464 г железной окалины?
а Дано:
zn(Fe3O4) = 464 г
Найти:
т(А1)
Решение:
1) Записываем уравнение реакции и указываем ко-
личественные отношения необходимых веществ:
8А1 + 3Fe3O4 = 9Fe + 4А12О3.
8 моль 3 моль
2) Определяем молярную массу Fe3O4:
M(Fe3O4) = 56 • 3 + 16 • 4 = 232 г/моль.
3) Рассчитываем количество вещества железной ока-
лины (Fe3O4):
464
v(Fe3O4) =-^-= 2 моль.
20
4) Составляем пропорцию согласно уравнению ре-
акции (закону сохранения массы веществ) и опре-
деляем количество вещества А1:
8 моль А1 — 3 моль Fe„O.
3 4
v моль А1 — 2 моль Fe3O4
v(Al) = 5,33 моль.
5) Находим массу А1:
ти(А1) = 5,33 • 27 = 144 г.
Ответ: ?п(А1) = 144 г.
Пример 8
Рассчитайте объем углекислого газа (н. у.), кото-
рый необходимо пропустить через известковую воду
для осаждения карбоната кальция массой 50г.
Дано:
т(СаСо3) = 50 г
Найти:
7(С02)
Решение:
1) Записываем уравнение реакции:
Са(ОН)2 + СО2 = СаСО3 + Н2О.
2) Определяем молярную массу СаСО3:
М(СаСО3) = 40 + 12 + 16 • 3 = 100 г/моль.
3) Рассчитываем количество вещества СаСО3:
50
v(CaCO,) = — = 0,5 моль.
3 100
4) Находим количество вещества СО2 согласно урав-
нению реакции по пропорции:
1 моль СаСОо — 1 моль СО„
«5 А
0,5 моль СаСО3 — v моль СО2
v(CO2) = 0,5 моль.
5) Рассчитываем объем СО2:
V = v-7m; V(CO2) = 0,5 • 22,4 = 11,2 л.
Ответ: 7(С02) = 11,2 л.
21
С помощью уравнения химической реакции можно рас-
считать, какое вещество и в каком количестве взято в
избытке (или недостатке) при взаимодействии заданных
количеств реагирующих веществ.
Пример 9
К раствору, содержащему 37,6 г азотнокислой меди,
прибавили железных опилок массой 5,6 г. Рассчи-
тайте, останется ли в растворе нитрат меди после
окончания химической реакции.
| Дано:
m(Cu(NO3)3) = 37,6 г
т(Ее) = 5,6 г
Найти:
останется ли в растворе нитрат меди
Решение:
1) Записываем уравнение реакции:
Cu(NO3)2 + Fe = Fe(NO3)2 + Си.
2) Находим молярную массу Cu(NO3)2:
M(Cu(NO3)2) = 64 + 14 • 2 + 16 • 6 = 188 г/моль.
3) Определяем количества веществ Cu(NO3)2 и Fe:
37,6
v(Cu(NO3)2) = ——- = 0,2 моль,
loo
5,6
v(Fe) = = 0,1 моль.
56
4) Рассчитываем количество вещества Си (NO3)2 со-
гласно уравнению реакции по пропорции:
1 моль Cu(NO3)2 — 1 моль Fe
умоль Cu(NO3)2— 0,1 моль Fe
v(Cu(NO3)2) = 0,1 моль.
Сравнивая исходное количество Cu(NO3)2 и требуе-
мое для реакции, делаем заключение, что количе-
ство Cu(NO3)2 взято в избытке. Расчет количества
реагирующих веществ и продуктов реакции необ-
ходимо проводить по количеству вещества, взятого
в недостатке. В нашем случае — по Fe.
22
5) Рассчитываем количество вещества и массу Cu(NO3)2
в растворе после реакции:
v(Cu(NO3)2) = 0,2 - 0,1 = 0,1 моль,
m(Cu(NO3)2) = 0,1 • 188 = 18,8 г.
Ответ: 7n(Cu(NO3)2) = 18,8 г.
По химическому уравнению можно производить рас-
четы и в том случае, когда исходное вещество содержит
некоторое заданное количество примесей.
’ Пример 10
Вычислите, какое количество нитрита натрия об-
разуется при прокаливании 1 кг чилийской селит-
ры, содержащей 85 % NaNO3.
Дано:
тп(селитры) = 1 кг
w(NaNO3) = 85 %
Найти:
?n(NaNO2)
Решение:
1) Записываем уравнение реакции:
t°
2NaNO„ = 2NaNO„ + О Л.
о £ £ 1
2) Определяем массу NaNO3:
,хт ктл Ч т(селитры) • w(NaNO3)
v 3 100 %
1 • 103 • 85%
7n(NaNO„) =----——--------- 850 г.
3 100 %
3) Определяем количество вещества NaNO3:
850
v(NaNO„) = ——— = 10 моль.
3 85
4) Рассчитываем количество вещества NaNO2 со-
гласно уравнению реакции по пропорции:
2 моль NaNO, — 2 моль NaNO,
10 моль NaNO, — v моль NaNO,,
23
v(NaNO2) ==10 моль.
5) Находим массу NaNO2:
m(NaNO2) = 10 • 69 = 690 г.
Ответ: m(NaNO2) = 690 г.
На основе уравнения химической реакции (или хими-
ческой формулы) производится решение задач на выход
продукта.
Пример 11
Песок массой 2 кг сплавили с избытком гидрокси-
да калия, получив в результате реакции силикат
калия массой 3,82 кг. Определите выход продукта
реакции, если массовая доля оксида кремния (IV) в
песке равна 90 %.
т(песка) = 2 кг
w(SiO2) = 90 %
m(K2SiO3) = 3,82 кг
Найти:
n(K2SiO3)
Решение:
1) Записываем уравнение реакции:
SiO2 + 2КОН = K2SiO3 + Н2О.
2) Определяем массу
m(SiO2) =
m(SiO2) =
SiO2:
тп(песка) • 90 %
100 % ’
2-90 % , о
Л5^Г-1’8кг-
3) Определяем количество вещества SiO2:
1,8 • 103
v(SiO2) --—— = 30 моль.
4) Рассчитываем количество вещества K2SiO3 со-
гласно уравнению реакции по пропорции:
24
1 моль SiO2 — 1 моль K2SiO3
30 моль SiO2 — v моль K2SiO3
v(K2SiO3) = 30 моль.
5) Находим массу K2SiO3, которая должна образо-
ваться в соответствии с теоретическим расчетом:
m(K2SiO3) = 30 • 154 = 4620 г или 4,62 кг.
6) Рассчитываем выход продукта реакции:
3,82 • 100 %
”----5^----------82’7%'
Ответ: r|(K2SiO3) = 82,7 %.
Задачи для самостоятельного решения
1. Вычислите массовую долю каждого из элементов в
следующих соединениях хрома:
a) Fe(CrO2)2; б) Cr2(SO4)3; в) (NH4)2CrO4.
2. Вычислите массу меди, содержащейся в 444 г основ-
ного карбоната меди.
Ответ: 256 г.
3. Вычислите массу железа, которую можно получить
из 320 г красного железняка.
Ответ: 224 г.
4. В каком количестве моль нитрата свинца содер-
жится в:
а) 414 г свинца; б) 560 г азота; в) 768 г кислорода.
Ответ: а) 2 моль; б) 20 моль; в) 8 моль.
5. Вычислите массу фосфора, которую можно полу-
чить из 1 т фосфорита, содержащего 31 % ортофосфата
кальция.
Ответ: 62 кг.
6. Неочищенная глауберова соль содержит 94 % кри-
сталлогидрата. Вычислите массу безводного сульфата нат-
рия, которую можно получить из 6,85 т этого сырья.
Ответ: 2,84 т.
7. Выведите простейшую формулу соединения, содержа-
щего 44,89 % калия, 18,37 % серы и 36,74% кислорода.
Ответ: K2SO4.
25
8. Минерал медный блеск содержит 79,87 % меди и
20,13 % серы. Найдите формулу минерала.
Ответ: Cu2S.
9. Кальций или магний, сгорая в атмосфере азота, об-
разуют соединения, содержащие соответственно 18,92 %
и 27,75 % азота. Найдите формулы этих соединений.
Ответ: Ca3N2; Mg3N2.
10. Углеводород содержит 85,72 % углерода и 14,28 %
водорода. Найдите его формулу и определите, к какому
гомологическому ряду он относится.
Ответ: С2Н4.
11. Молярная масса соединения равна 98 г/моль. Опре-
делите формулу этого соединения, содержащего 3,03 % Н,
31,62 % Р и 65,35 % О.
Ответ: Н3РО4.
12. При сжигании органического вещества, состояще-
го из углерода, водорода и серы, получено 2,64 г оксида
углерода (IV), 1,62 г воды и 1,92 г оксида серы (IV). Най-
дите формулу этого вещества.
Ответ: C2H6S.
13. Установите истинную формулу органического ве-
щества, если при сжигании 2,4 г его было получено 5,28 г
оксида углерода (IV) и 2,86 г воды. Плотность паров этого
вещества по водороду равна 30.
Ответ: С3Н8О.
14. Установите формулу одного из кристаллогидратов
сернокислого натрия, если при его обезвоживании потеря
массы составляет 20,22 % от массы кристаллогидрата.
Ответ: Na2SO4 • 2Н2О.
15. 0,327 г цинка растворили в серной кислоте и из полу-
ченного раствора выкристаллизовали 1,438 г кристаллогид-
рата соли цинка. Установите формулу кристаллогидрата.
Ответ: ZnSO4 • 7Н2О.
16. При восстановлении оксида вольфрама (VI) водо-
родом образовалось 27 г воды. Какая масса вольфрама
может быть при этом получена?
Ответ: 92 г.
17. Железную пластинку погрузили в раствор сульфа-
та меди. Через некоторое время масса пластинки увели-
чилась на 1г. Какая масса меди осадилась на пластинке?
26
Ответ: 8 г.
18. Определите, какое вещество и в каком количестве
останется в избытке в результате реакции между 4 г ок-
сида магния и 10 г серной кислоты.
Ответ: 0,20 г H2SO4.
19. Какой объем углекислого газа потребуется для
превращения 50 г карбоната кальция в гидрокарбонат?
Ответ: 11,2л СО2.
20. Какого состава и в каком количестве образуется
соль, полученная при взаимодействии раствора, содержа-
щего 9 г едкого натра с углекислым газом, образовавшим-
ся при сжигании 2,24 л метана?
Ответ: 11,9 г Na2CO3.
21. При разложении 44,4 г малахита получено 4,44 л
оксида углерода (IV) (н. у.). Определите массовую долю
(%) примесей в малахите.
Ответ: 0,9 %.
22. При обработке смеси магния и оксида магния мас-
сой 5 г хлороводородной кислотой выделилось 4 л (н. у.)
водорода. Рассчитайте массовую долю магния в смеси.
Ответ: 85,7%.
23. Какой объем аммиака (н. у.) будет получен при
нагревании смеси 5,35г хлорида аммония с Юг гидро-
ксида кальция?
Ответ: 2,24 л.
24. Какая масса кремния, содержащая 8 % примесей,
вступила в реакцию с раствором едкого натра, если при
этом выделилось 5,6 л водорода (н. у.)?
Ответ: 3,8 г.
25. Из природного фосфорита массой 310 кг получили
фосфорную кислоту массой 195 кг. Вычислите массовую
долю Са3(РО4)2 в природном фосфорите.
Ответ: 99,5%.
Атомно-молекулярное учение в химии
Наибольшее развитие атомистика (учение об атомах)
получила в работах М. В. Ломоносова, создавшего строй-
ное атомно-молекулярное учение. Его основные положения,
27
изложенные в работе «Элементы математической химии»
(1741 г.), сводятся к следующему:
[Т] Все вещества состоят из «корпускл» (молекул).
12 Молекулы состоят из «элементов» (атомов).
(2 Частицы — молекулы и атомы находятся в непре-
рывном движении. Тепловое состояние тел есть резуль-
тат движения их частиц.
Г4~| Молекулы простых веществ состоят из одинаковых
атомов, молекул сложных веществ — из различных ато-
мов.
Оперируя введенными понятиями атома и молекулы,
Ломоносов объяснил многие физические и химические
явления. Он считал, что от вида и числа атомов, а также
от порядка соединения их между собой зависят свойства
получаемых веществ. На основе атомистики Ломоносов
развил кинетическую теорию материи, рассматривая все
частицы находящимися в непрерывном движении. Идеи
Ломоносова послужили в первой половине XIX века от-
правным пунктом кинетической теории газов. Все эти
представления далеко опередили науку того времени.
Лишь спустя 67 лет после Ломоносова английский уче-
ный Д. Дальтон далее развил атомистические взгляды.
Достижением атомистики Дальтона явилось его учение
о массе атомов. Считая, что абсолютные массы атомов
чрезвычайно малы, Дальтон предложил определять отно-
сительные атомные массы. При этом массу атома водо-
рода, как самого легкого из всех атомов, он принял за
единицу. Таким образом, впервые Дальтон определил
атомную массу элемента, как отношение массы атома
данного элемента к массе атома водорода. Он составил
первую таблицу атомных масс 14 известных элементов и
ввел знаки для обозначения атомов этих элементов. Од-
нако Дальтон отрицал существование молекул у простых
веществ, и в этом смысле его учение было шагом назад по
сравнению с атомно-молекулярными представлениями
Ломоносова.
Атомно-молекулярное учение в химии окончательно
утвердилось лишь в середине XIX века. На международ-
ном съезде химиков в г. Карлсруэ в 1860 году были при-
няты определения понятий молекулы и атома.
28
Молекула — это наименьшая частица данного веще-
ства, обладающая его химическими свойствами. Хими-
ческие свойства молекулы определяются ее составом и
химическим строением.
Атом — это наименьшая частица химического элемента,
входящая в состав молекул простых и сложных веществ.
Химические свойства элемента определяются строением
его атома. Отсюда следует определение атома, соответ-
ствующее современным представлениям.
Атом — это электронейтральная частица, состоящая
из положительно заряженного атомного ядра и отрица-
тельно заряженных электронов.
Согласно современным представлениям, из молекул
состоят вещества в газообразном и парообразном состо-
яниях. В жидком состоянии из молекул состоят только
те вещества, которые находятся не в ассоциированном
состоянии; в твердом же состоянии из молекул состоят
лишь те вещества, которые имеют молекулярную струк-
туру. К ним относятся органические соединения и не-
большое количество неорганических веществ (например:
кристаллический йод, твердый оксид углерода (IV), вода...).
Абсолютное же большинство твердых неорганических
веществ не имеют молекулярной структуры, существуя в
виде кристаллических форм, образованных не молекула-
ми, а другими частицами (атомами, ионами). К ним отно-
сятся: металлы, оксиды, сульфиды, карбиды и многие дру-
гие соединения.
Основные понятия химии
Химический элемент — это определенный вид атомов
с одинаковым положительным зарядом ядра. В настоя-
щее время известно 109 элементов. Большинство из них
встречаются в природе, однако некоторые получены толь-
ко искусственным путем.
В результате соединения атомов одного и того же
элемента образуется простое вещество, которое явля-
ется формой существования элемента в свободном состоя-
нии. Соединение атомов различных элементов приводит к
29
образованию сложных веществ, т. е. химических соеди-
нений.
Многие химические элементы образуют не одно, а не-
сколько простых веществ. Эта способность химического
элемента существовать в виде нескольких простых веществ
называется аллотропией. Простые вещества, образованные
одним и тем же элементом, называются аллотропными
видоизменениями (модификациями) данного элемента.
Явление аллотропии — наглядное подтверждение разли-
чия между простым веществом и химическим элемен-
том. Существование аллотропных видоизменений связано
с различным строением кристаллических структур про-
стых веществ или с различием числа атомов, входящих в
состав молекул отдельных аллотропных форм. Например,
углерод имеет аллотропные формы: алмаз, графит, кар-
бин; кислород — молекулярный кислород О2 и озон О3.
В 1961 г. была принята единая шкала относительных
атомных масс, основой которой является атомная едини-
ца массы (сокращенное а. е. м.), представляющая собой
1/12 часть массы изотопа углерода 12С. Поскольку пос-
ледняя очень мала (1,993 • 10~28 г), то для удобства ис-
пользуют относительные атомные массы, вычисляемые как
отношение массы данного атома к а. е. м. Относительная
атомная масса является безразмерной величиной, но она
тождественна числу а. е. м.; в соответствии с этим отно-
сительной атомной массой (или простой атомной мас-
сой) элемента очень часто называют массу его атома, вы-
раженную в атомных единицах массы.
Масса молекулы любого вещества равна сумме масс ато-
мов, образующих эту молекулу. Поэтому молекулярная масса
равна сумме соответствующих атомных масс. Например,
молекулярная масса серной кислоты, молекула которой
содержит два атома водорода, один атом серы и четыре
атома кислорода, равна: 2 1,008 + 32,06 + 15,99 • 4 = 98,076.
Следовательно, относительной молекулярной массой (или
просто молекулярной массой) простого или сложного веще-
ства называют массу его молекулы, выраженную в атомных
единицах массы. Отмечалось, что одной из важнейших опе-
раций в химии является расчет по химическим формулам
30
и уравнениям. При этом весьма существенным представ-
ляется вопрос: в каких единицах выражать количество ве-
щества? Оно может выражаться через массу веществ — в
граммах, килограммах и т. д. Наряду с единицами массы
пользуются также единицей количества вещества, называ-
емой моль (обозначение «моль»).
Моль — это количество вещества определенной хими-
ческой формулы, содержащее то же число структурных
единиц (атомов, молекул, ионов, электронов или других
частиц), сколько содержится атомов в 12 г изотопа углеро-
да с массовым числом двенадцать 12С. Применяя понятие
«моль», необходимо в каждом конкретном случае точно
указывать, какие именно структурные единицы имеются
в виду. Например, следует различать моль атомов Н, моль
молекул Н2, моль ионов Н+.
В настоящее время число структурных единиц, содер-
жащихся в одном моль вещества (число Авогадро), опре-
делено с большой точностью. При практических расче-
тах его принимают равным 6,02 • 1023. В соответствии с
этим:
1 моль атомов содержит 6,02 1023 атомов;
1 моль молекул содержит 6,02 • 1023 молекул;
1 моль ионов содержит 6,02 • 1023 ионов;
1 моль электронов содержит 6,02 • 1023 электронов.
Масса 1 моль данного вещества называется его моляр-
ной массой.
Молярная масса обычно выражается г/моль. Посколь-
ку в одном моль любого вещества содержится одинаковое
число структурных единиц, то молярная масса, выражен-
ная в граммах, имеет то же численное значение, что и его
относительная молекулярная (атомная) масса, выражен-
ная в а. е. м. Так, молярная масса атомного водорода равна
1,008 г/моль, молекулярного водорода— 2,016 г/моль,
молекулярного кислорода— 31,98 г/моль.
Следует отметить, что во многих веществах, например
в хлориде натрия, карбонате кальция и ряде других, нет
изолированных молекул. В применении к таким соеди-
нениям термин «моль» имеет однозначный смысл в том
случае, когда его связывают с конкретной химической
формулой.
31
Валентность. Понятие валентности элементов было
введено в 50-х годах прошлого столетия. Особое значение
его определяется тем, что оно легло в основу теории стро-
ения химических соединений. При первоначальном изу-
чении химии валентность определялась как свойство ато-
мов одного элемента присоединять определенное число
атомов других элементов. В свете современной теории
строения атомов валентность элемента связывается с его
способностью образовывать химические связи. Количе-
ственно валентность определяется числом химических
связей, образованных атомом. Именно поэтому валентность
не имеет знака, так как количество связей нельзя выра-
зить отрицательным числом.
Атомы элементов способны отдавать, присоединять
электроны или образовывать общие электронные пары.
Электроны, участвующие в образовании химических свя-
зей между атомами, называются валентными. Общее чис-
ло валентных электронов в атоме, как правило, равно но-
меру группы периодической системы элементов Д. И. Мен-
делеева.
В химии обычно пользуются структурными форму-
лами, памятуя, что атомы имеют пространственное распо-
ложение. Эти формулы применяют только для соедине-
ний с ковалентной связью, имеющих молекулярные кри-
сталлические решетки. Структурные формулы, в которых
каждая связующая электронная пара изображается чер-
точкой (штрихом), показывают порядок соединения ато-
мов в молекуле, их взаимосвязь друг с другом. Примеры
структурных формул молекул:
водорода Н2
воды Н2О
аммиака NH3
метана СН4
Н - Н,
н - О - н
Н - N - Н,
Н
Н
Н - С - Н.
I
Н
32
Пример 1
Изобразите структурную формулу ортофосфорной
кислоты.
Решение:
При изображении молекул кислородосодержащих
кислот необходимо помнить, что атомы водорода, спо-
собные замещаться на металл, всегда соединяются с
кислородообразующим элементом (для которого
определяют валентность, в нашем случае — Р) че-
рез атом кислорода:
Н-О\
Н - О - Р = О.
Н-о/
Пример 2
Изобразите структурную формулу гидроксида каль-
ция.
Решение:
В молекулах гидроксидов гидроксид-ионы присое-
диняются к атому металла через атом кислорода:
Пример 3
Изобразите структурную формулу сульфата хрома (III).
Решение:
Формула соли Cr2(SO4)3. Изображают структурную
формулу кислоты, образующей соль, и пунктиром
выделяют сульфат-ион:
Н"°\
Н - 0х ^0
В формуле соли сульфат-ион взят трижды, поэтому
записывают три кислотных остатка один под дру-
гим:
33
К свободным связям присоединяют два атома хро-
ма и получают структурную формулу соли:
Вопросы и задачи
для самостоятельного решения
1. Какими свойствами обладает молекула? Почему?
2. Все ли вещества состоят из молекул?
3. Приведите примеры простых веществ. Отметьте,
существуют ли какие-либо из этих веществ в других
аллотропных видоизменениях.
4. Приведите примеры простых веществ, молекулы
которых состоят более чем из двух атомов.
5. Приведите примеры известных вам веществ, моле-
кулы которых состоят из двух, трех и четырех химиче-
ских элементов.
6. При нагревании нитрата калия образуется твердое.
34
вещество, хорошо растворимое в воде, и выделяется кис-
лород. Каким веществом, простым или сложным, являет-
ся нитрат калия?
7. Одинаковы ли понятия «атомная масса» и «масса
атома»?
8. Почему атомные массы большинства элементов пе-
риодической системы являются дробными величинами?
9. Сколько атомов содержится в 100 г кальция?
Ответ: 1,505 • 1024.
10. В каком количестве хлороформа содержится столь-
ко же молекул, сколько их содержится в 72 г Н2О?
Ответ: 477,44 г.
11. Сравните число молекул, содержащих в 1 кг Н3РО4,
с числом молекул, содержащихся в 1 кг СН3СООН. В ка-
ком случае и во сколько раз число молекул больше?
12. Вычислите массу двадцати атомов аргона.
Ответ: 1,33 • 10~21 г.
13. Вычислите массу одной молекулы хлора.
Ответ: 1,18 • 10-22 г.
14. Сколько атомных единиц массы содержат: а) два
атома кислорода; б) восемь атомов фосфора; в) четыре
атома брома?
15. Сколько моль и молекул содержится в 56 г азота?
Ответ: 2; 12,04 • 1023.
16. Узнайте, в каких отношениях масс находятся же-
лезо и сера в соединении FeS2?
Ответ: 7: 8.
17. Вычислите, сколько атомов азота содержится в 12,6 г
азотной кислоты. Сколько моль атомов азота это состав-
ляет?
Ответ: 1,2 • 1023; 0,2.
18. В каком количестве хлорида кальция содержится
столько же хлора, сколько его содержится в 2 моль берто-
летовой соли КС1О3?
Ответ: 111г.
19. Выведите формулу оксида марганца, если известно,
что в этом соединении масса марганца относится к массе
кислорода в отношении 1:1.
Ответ: Мп2О7.
29. Высший оксид металла является ангидридом од-
33
неосновной кислоты, натриевая соль которой содержит
23,4 % кислорода. Определите атомную массу металла.
Ответ: 186,2.
21. Определите валентность элементов в молекулах сле-
дующих веществ: a) KNO3; б) NaNO2; в) NH3; г) N2O4.
Изобразите структурные формулы этих веществ.
22. Определите валентность хлора в следующих соеди-
нениях: a) NaOCl; б) Са(С1О3)2; в) Mg(C104)2. Изобразите
структурные формулы этих веществ.
23. Определите валентность хрома в следующих соеди-
нениях: a) Fe(CrO2)2; б) СгВг3; в) К2СгО4; г) СгО; д) К2Сг2О7.
Изобразите структурные формулы этих веществ.
24. Изобразите структурные формулы следующих со-
лей: a)Na2CO3; б) NaHCO3; в) Cu2(OH)2SO4.
25. Изобразите структурные формулы следующих ве-
ществ: a)Mg(OH)2; б) H2SO3; в) HNO3; г)Р2О5.
Законы химии
Общие законы
QJ Закон сохранения массы: масса веществ, вступаю-
щих в реакцию, равна массе веществ, образующихся в
результате реакции (1848 г., М. В. Ломоносов).
При химических реакциях атомы не исчезают и не
возникают вновь; общее число атомов остается постоян-
ным до и после реакции. И, поскольку атомы имеют по-
стоянную массу, не меняется и масса веществ до и после
реакции. Закон сохранения массы веществ М. В. Ломо-
носов связывал с законом сохранения энергии (количе-
ства движения) и рассматривал эти законы в единстве
как всеобщий закон природы. Закон сохранения массы
веществ дает материальную основу для составления урав-
нений химических реакций. Опираясь на него, произво-
дят расчеты по химическим уравнениям.
а Пример 1
При разложении 24,5 г бертолетовой соли выдели-
лось 9,6 г кислорода. Какова масса образовавшего-
ся при этом хлорида калия?
36
Дано:
тп(КС1О3) = 24,5 г
тп(О2) = 9,6г
Найти:
7П(КС1)
Решение:
тп(КС1О3) = тп(О2) + тп(КС1),
тп(КС1) = тп(КС1О3) - ТП(О2),
тп(КС1) = 24,5 - 9,6 = 14,9 г.
Ответ: т(КС1) = 14,9 г.
Пример 2
В реторту поместили 1 г металлических опилок, гер-
метично закрыли ее и в течение некоторого времени
нагревали на пламени горелки. После охлаждения
реторты конец каучуковой трубки опустили в воду и
открыли зажим. Объем воды, проникший в реторту,
оказался равным 75 мл. Принимая массу 1 л кисло-
рода, равной 1,43 г, определите суммарную массу не
окислившегося металла и образовавшегося оксида.
Дано:
тп(Ме) = 1г
У(Н2О) = 75 мл
тп(1л О2) = 1,43 г
Найти:
тп(металла и оксида)
Решение:
1) Находим массу кислорода, учитывая, что объем
прореагировавшегося кислорода равен объему за-
сосавшейся в реторту воды, т. е. 75 мл:
1 л О2 — 1,43 г
0,075 л О2 — т г
0,075-1,43
тп(О2) = —: --------= 0,107 г.
2) Очевидно, что суммарная масса металла и кисло-
рода, вступившего в реакцию, равна массе неокис-
лившегося металла и образовавшегося оксида:
37
^(металла и оксида) •= 1 + 0,107 = 1,107 г.
Ответ: т = 1,107 г.
[21 Закон постоянства состава: всякое чистое веще-
ство независимо от способа его получения имеет по-
стоянный качественный и количественный состав (1808 г.,
Ж. Пруст).
Например, состав оксида углерода (IV) СО2. Он состоит
из углерода и кислорода (качественный состав). Содер-
жание углерода в СО2— 27,27 %, кислорода— 72,73 %
(количественный состав). Получить углекислый газ мож-
но многими способами: синтезом из углерода и кислоро-
да, из оксида углерода (II) и кислорода, действием кислот
на карбонаты и др.
С + О2 = СО2,
2СО + О2 = 2СО2,
СаСО3 + 2НС1 = СаС12 + СО2 + Н2О.
Развитие химии показало, что наряду с соединениями
постоянного состава существуют соединения переменного
состава. Первые, по предложению Н. С. Курнакова, назва-
ны дальтонидами в память английского химика и физика
Дальтона. Вторые — бертоллидами в память французско-
го химика Бертолле, предвидевшего такие соединения.
Состав дальтонидов выражается простыми формулами с
целочисленными стехиометрическими индексами, напри-
мер Н2О, СО2, НС1. Состав бертоллидов не отвечает стехио-
метрическим отношениям. Например, состав оксида ура-
на (VI) выражают формулой UO3, хотя на самом деле он
имеет состав от UO2 5 до UO3. Оксид ванадия (II) в зависи-
мости от условий получения имеет состав от VO0 9 до NO1 3.
Бертоллиды встречаются среди оксидов, гидридов, сульфи-
дов, нитридов, карбидов, силицидов и других неорганиче-
ских соединений, имеющих кристаллическую структуру.
Таким образом, закон постоянства состава применим
только к соединениям с молекулярной структурой. Со-
став соединений с немолекулярной структурой (с атом-
ной, ионной и металлической решеткой) не является по-
стоянным и зависит от условий получения.
38
Гз| Эквивалентом называют реальную или условную
частицу, отвечающую в данной окислительно-восстано-
вительной реакции одному электрону, а в данной обмен-
ной реакции - одному протону (одному гидроксил-иону,
одному единичному заряду). Таким образом эквивален-
том является либо молекула (реальная частица), либо
часть молекулы (условная частица).
Фактор эквивалентности показывает, какую часть от
молекулы составляет эквивалент.
Например, в процессах:
+5 +4
Си + HNO3(koh4 > - Cu(NO3)2 + NO2 + Н2О,
+5 +2
Си + HNO3. ,. - Cu(NO3)2 + NO + H2O,
о tpujv.} о с 4
H3PO4 + кон — К2НРО4 + н2о,
НчР04 + КОН -» К„Р04 + н„о.
0 4 0 4 4
Эквивалентом азотной кислоты в первой реакции яв-
ляется сама молекула (фактор эквивалентности едини-
ца), во второй реакции - одна третья часть молекулы
HNO3 (фактор эквивалентности кислоты равен одной
трети). Аналогично в последующей реакции эквива-
лентом Н3РО4 является половина молекулы (фактор эк-
вивалентности равен одной второй). Наконец, в послед-
ней реакции эквивалентом Н3РО4 является одна третья
часть молекулы (фактор эквивалентности равен одной
трети).
Аналогично понятию «молярная масса» вводится
понятие «молярная масса эквивалента». Эта величина
связана с молярной массой через фактор эквивалентно-
сти:
М =f -М.
экв. • экв.
Закон эквивалентов: число молей эквивалентов участ-
ников химической реакции есть постоянная величина.
Для реакции общего вида
тпА + пВ = рС + <?D
закон эквивалентов запишется:
п „ А = п,„п В = С = п. D = const.
ЭКВ» ЭКВ» 0ISD»
39
Число молей эквивалентов данного вещества может
быть найдено следующим образом:
д т(А)
"экв- МЭК8 А *
Для газов полезно ввести понятие «объем одного моля
эквивалентов». При нормальных условиях эта величина
составляет:
моль • экв. = А>кв. ' 22,4 (л).
Пример 3
При сжигании навески металла массой 4,14 г было
получено 4,46 г его оксида. Определить молярную
массу эквивалента металла.
Дано:
тп(Ме) — 4,14 г
тп(оксида) = 4,46 г
Найти:
Мэкв.Ме
Решение:
1)
Me + О? -> МежО72,
* * у 9
f о = —,
'экв. 2 4 ’
Чкв °2 = Лкв ’ Мо = ““ • 32 = 8 г/моль • экв.
jkdi л <?kd« ^2 *
2) Согласно закону эквивалентов:
т(Ме) тп(О2)
"экв Ме ” "экв °2 =* Т7-----5-----
экв. экв. 2 Мэкв Ме 8
находим массу кислорода, пошедшего на окисление
металла:
т(О) = 4,46 - 4,14 = 0,32 г.
3) Вычисляем молярную массу эквивалента метал-
ла:
4,14 0,32 4,14-8
----------- -’---=>М Ме = ----------=103,5.
МэквМе 8 экв- 0,32
Ответ: Мэкв Me = 103,5 г/моль • экв.
40
Пример 4
Определить молярную массу эквивалента металла,
зная, что его сульфид содержит 52 мае. % металла,
а молярная масса эквивалента серы равна 16 г.
Дано:
со(Ме) = 52 %
M3KBS = 16r
Найти:
Мэкв Me
Решение:
1) Находим массовую долю (%) серы в сульфиде:
w(S) = 100 - 52 = 48 %.
2) Согласно закону эквивалентов:
гаэкз.Ме = "экв.8’
тп(Ме) m(S) ,, „ M3KBS-/n(Me)
- — ......... => Л7 Me = ,
Мзкв Me мзкв S экв- m(S)
3) Находим молярную массу эквивалента металла:
52 16
М Me -------— 17,3.
экв. 48
Ответ: Мзкв Ме = 17,3 г/моль-экв.
Пример 5
Определить молярную массу эквивалента металла,
2 г которого вытесняют из раствора медной соли
1,132 г меди. Молярная масса эквивалента меди
равна 31,8 г.
Дано:
тп(Ме) = 2 г
тп(Ме) = 1,132 г
МзквСи = 31,8 г
Найти:
Мзкв Me
Решение:
1) Согласно закону эквивалентов:
п Me = п „ Си.
ЭКВ. экв.
41
m(Me) m(Cu) „ Мэкв Cu • m(Me)
—............. => Az Me — " ... •
Мэкв Me Мэкв Си экв. m(Cu)
2) Находим искомую величину:
2-31,8
M Me =--------:— = 56,2 г.
экв- 1,132
Ответ: Мэкв Me = 56,2 г/моль • экв.
Пример 6
При взаимодействии 15 г металла с избытком кис-
лоты выделилось 8,4 л (н.у.) водорода. Определить
молярную массу эквивалента металла.
Дано:
тп(Ме) = 15 г
И(Н2) = 8,4 л
Найти:
Мэкв Me
Решение:
1) Me + Н+-» Меп++ Н2,
f Н = -L
'экв. .2 2 ’
^МоЛьэКВ.Н2 = у-22,4 = 11,2л.
2) Согласно закону эквивалентов:
п „„ Me = п Н„
экв. экв. 2’
т(Ме)У(Н2)
^экв.Ме ^1моль-экв.Н2
3) Находим требуемую величину:
М Me = —‘ Vi моль:.экв.н2
экв- V(H2)
15•11,2
М Me ---------------- 20 г.
эКВ. 8>4
Ответ: Мэкв Me = 20 г/моль • экв.
42
Газовые законы
[4] Закон объемных отношений: при неизменной тем-
пературе и давлении объемы вступающих в реакцию га-
зов относятся друг к другу, а также к объемам образую-
щихся газообразных продуктов как небольшие целые
числа (1808 г., Гей-Люссак),
Так, при взаимодействии двух объемов водорода и од-
ного объема кислорода образуется два объема водяного
пара:
2Н2 + О2 = 2Н2О.
Состояние газа можно охарактеризовать массой т,
объемом V, давлением Р и температурой Т (Т = 273 + t °C).
Связь между этими величинами описывается следующи-
ми законами.
fsj Закон Бойля — Мариотта (1660-1667 гг.): для дан-
ной массы газа при постоянной температуре (изотерми-
ческий процесс, Т = const) объем обратно пропорциона-
лен давлению:
vi Р2
— = — = const.
и2 *1
а Пример 7
При изотермическом сжатии газа, занимающего
объем 10 л, до 2 л давление газа возросло на 4 атм.
Определите первоначальное давление газа.
I Дано:
Vt = 10 л
V2 = 2 л
АР = 4 атм
Найти:
Pi
Решение:
1) После изотермического сжатия давление газа воз-
росло на 4 атм, следовательно:
Р2 = (Pj + 4) атм.
43
2) По закону Бойля — Мариотта:
Л = -у2-Р2
v2 рг 1 v. ’
2 • (Р, + 4)
Л = 'Хо-—> 10Рх = 2Р1 + 8.
Pj = 1 атм.
Ответ: Рх = 1 атм.
[б] Закон Гей-Люссака (1802 г.): для данной массы газа
при постоянном давлении (изобарный процесс, Р = const)
объем прямо пропорционален абсолютной температуре:
У, V2 V
—— = —— , —- = const.
Л Т2 Т
Пример 8
Во сколько раз возрастает объем газа при нагрева-
нии его от температуры 17 °C до температуры 90 °C
при постоянном давлении.
Дано:
Тг = 273 + 17
Т2 = 273 + 90
Найти:
во сколько раз увеличится V
Решение:
1) Пусть при температуре объем газа Ур а при
т2- v2.
2) Выразим объем газа V2 = пУР
3) По закону Гей-Люссака:
- . У1'Т2
2 Т1 >
Т2
> п = ~^Г~ >
Ti Т2
У. • т2
пУ. —
1 Л
273 + 90
п --------------------- 1,25 раз.
273 + 17 290 Р
Ответ: в 1,25 раз.
44
363
Г7] Закон Шарля (1787 г.): для данной массы газа при
постоянном объеме (изохорный процесс, V — const) дав-
ление прямо пропорционально абсолютной температуре:
Pi Р2 Р
----=----,----= const.
Тг Т2 Т
а Пример 9
При 12 °C давление в баллоне с аргоном равно 60 атм.
Каким будет давление в баллоне, если его помес-
тить в лабораторию с температурой 24 °C?
а Дано:
7\ = 273 + 12
Т2 = 273 + 24
Pi = 60 атм
Найти:
Рг
Решение:
1) По закону Шарля:
_£1_ = А.=>р pi-r2
Л т2 2 т\
„ 60-297 „ „
Р2 = —777---= 62,5 атм.
2 285
Ответ: Р2 = 62,5 атм.
Нормальные условия. Сравнивать объемы газов мож-
но лишь при одинаковых (равных) условиях. Такими
принято считать 0°С (273 К) и 760 мм рт. ст. (1 атм). Эту
температуру и давление называют нормальными услови-
ями (н. у.).
|1[] Объединенный газовый закон
Взаимосвязь между тремя параметрами Р, V, Т, харак-
теризующими состояние газа данной массы, выражается
объединенным газовым законом:
РУ _ Р0У0
т т0 ’
45
где Ро, Vo, То — давление, объем газа и температура при
нормальных условиях.
„ povo п
При н. у. для одного моля газа величина -------R
ро
является одинаковой для всех газов. Она называется уни-
версальной газовой постоянной и в зависимости от еди-
ниц измерения величин Ро, Vo, То имеет следующие значе-
ния:
мм рт. ст • мл
62360-----------—
моль • К
0,082
л • атм
моль • К’
8,314
Дж
моль•К
1,98
кал
моль • К’
Пример 10
В баллоне вместимостью 60 л при 20 °C и 40 атм
находится гелий. Определите объем израсходован-
ного гелия при н. у., если после 8 часов работы дав-
ление в баллоне понизилось до 32 атм, а температу-
ра возросла до 22 °C.
I v | Дано:
РМ V =60 л
Рг = 40 атм
Р2 = 32 атм
Tt = 273 + 20
Т2 = 273 + 22
Найти:
^х
Решение:
1) По объединенному газовому закону:
= „ рут0
т т0 0 рот '
2) Для исходного состояния гелия в баллоне приве-
денный объем составил:
0 Л)Л '
46
3) Для конечного состояния гелия в баллоне приве-
денный объем равен:
укон . ^>2^2Т'о
° Рйт2 •
4) Выразим объем израсходованного гелия при н. ул
V — Т7ИСХ _ Т/КОН
КХ г О *0
Р^Тр р2у2т0 Тр /Р^ Р2У2\
х Р0Т\ Р0Т2 Ро I т, т2 )’
5) Т. к. вместимость баллона постоянна, то Уг = V2 = V
и тогда:
v ToV I pi
х р0 (л
273 60 / 40
V ---------- ----
х 1 1293
Ответ: Vx - 459 л.
*2|
Т2]’
32 \
2-^Н459л-
Пример 11
Какую массу будет иметь азот объемом 30 л при
нормальных условиях?
I v | Дано:
РЧ У(Ы2) = 30л
Найти:
m(N2)
Решение:
1) Рассчитываем количество вещества молекуляр-
ного азота:
V 30
v = —, v(N2) = = 1,34 моль.
2) Определяем массу азота:
zn(N2) = v • М, m(N2) = 1,34 • 28 = 37,52 г.
Ответ: zn(N2) = 37,52 г.
[э] Закон Авогадро (1811г.): в равных объемах раз-
личных газов при одинаковых условиях (температура и
давление) содержится одинаковое число молекул.
47
Следствия закона Авогадро
1. При одинаковых условиях 1 моль любого газа зани-
мает одинаковый объем.
2. При нормальных условиях 1 моль различных газов
занимает объем, равный 22,4 л. Этот объем называется
молярным объемом газа (Vm = 22,4 л).
Молярный объем газа — это отношение объема веще-
ства к количеству этого вещества:
3. Отношение масс равных объемов различных газов
равно отношению их молярных масс:
т1 _
т2 М2
где т1 и т2 — массы, а М\ и М2 — молярные массы пер-
вого и второго газов.
Отношение т1/т2 называется относительной плотнос-
тью первого газа по второму и обозначается D.
Тогда D = —а М, = D • М9.
М2
Относительную плотность обычно вычисляют по отно-
шению к водороду или воздуху:
Л Мг Мг
М 2 ’
D - Мг
ВОЗД. ДЖ 29 ’
1V1 ВОЗД. э
где МТ — молярная масса газа.
Пример 12
Какой объем займет при нормальных условиях ок-
сид углерода (IV) массой 22 г?
Дано:
т(СО2) = 22 г
Найти:
V(CO2)
48
Решение:
1) Определяем количество вещества оксида углеро-
да (IV):
т 22
v = —v(CO„) = —— =0,5 моль.
М 2 44
2) Находим объем СО2:
V = v • Vm, V(CO2) = 0,5 • 22,4 = 11,2 л.
Ответ: У(СО2) = 11,2 л.
Пример 13
Определите плотности иодоводорода по водороду и
по воздуху.
I | Дано:
I I М(Н1) = 127,9 г/моль
М(Н2) = 2 г/моль
М(возд.) = 29 г/моль
Найти:
Ян2(Н1), DB03JHI)
Решение:
1) Определяем относительную плотность иодоводо-
рода по водороду:
Он2(Н1) =
М(Ш)
М(Н2) ’
127,9
^h2(HI)-----~64-
2) Находим плотность иодоводорода по воздуху:
М(Ш)
Л (НТ) = v —
воздД > М(ВОЗД.)’
127,9
Чозд.(Н1) = ^- = 4,41.
Ответ: ННг(Н1) = 64; £>В03Д.(Н1) = 4,4.
|jo) Уравнения Бойля-Мариотта, Гей-Люссака, Шар-
ля и закон Авогадро можно представить единым уравнени-
49
ем Клапейрона—Менделеева — основным уравнением
атомно-молекулярной теории газов:
Р7=п7?Т,
где Р — давление данного количества газа,
V — объем, занимаемый газом,
Т — абсолютная температура,
R— универсальная газовая постоянная,
п — число моль газа.
Пример 14
При О °C в замкнутом сосуде объемом 1 л находит-
ся смесь, содержащая 0,5 г водорода и 0,5 г кислоро-
да. Каким будет давление в сосуде после взрыва
смеси и охлаждения сосуда до 20 °C. Объемом обра-
зовавшейся воды после взрыва пренебречь.
Дано:
Г = 273+ 20
V= 1 л
тп(Н2) = 0,5 г
тп(О2) = 0,5 г
R =0,082
л • атм
моль • К
Найти:
Р
Решение:
1) Записываем уравнение реакции:
2Н2 + О2 = 2Н2О.
2) Определяем количества веществ водорода и кис-
лорода:
v(H2) =
0,5
2
= 0,25 моль— избыток,
v(O2) = аз = 0,0156 моль.
3) Находим массу водорода, которая реагирует с 0,5 г
кислорода:
т(Н,,) = 2 • 0,0156 • 2,016 = 0,06 г.
50
4) Рассчитываем массу водорода в замкнутом со-
суде после взрыва:
т(Н2) = 0,5 - 0,06 = 0,44 г.
5) Определяем давление в сосуде после взрыва:
~, т ____ „ т ВТ
w-M™’ р-м~’
0,44 • 0,082 • 293
Р ------------------- 5,2 атм.
2,016 • 1
Ответ: Р = 5,2 атм.
Определение молекулярных масс
газов и паров
|Т) Определение молекулярной массы по относитель-
ной плотности другого газа:
м2
Fg] Определение молекулярной массы газа по молярно-
му объему:
М = р • Vm.
Гз] Определение молекулярной массы газа по уравне-
нию Клапейрона-Менделеева:
РУ = — RT.
М
а Пример 15
Вычислите относительную молекулярную массу ок-
сида серы (IV) по значению его относительной плот-
ности по водороду, равной 32.
Дано:
*4 = 32
М(Н2) = 2 г/моль
Найти:
M(SO2)
54
Решение:
- M(S0’’ - D"'.'л,(нг)'
M(SO2) = 2 • 32 = 64 г/моль,
что соответствует относительной молекулярной мас-
се, равной 64.
Ответ: M(SO2) = 64 г/моль.
Пример 16
Определите относительную молекулярную массу
газа, если при нормальных условиях 0,824 г его за-
нимают объем 0,260 л.
Дано:
т(газа) = 0,824 г
Уо(газа) = 0,260 л
Найти:
М(газа)
Решение:
При н. у. 1 моль любого газа занимает объем 22,4 л.
Вычислив массу 22,4 л данного газа, получают его
молярную массу:
0,824 г газа занимают объем 0,260 л
хг 22,4л
22,4-0,824 л
х = —---------= 71,0 г.
0,260
Следовательно, молярная масса газа равна 71,0 г/моль,
а его относительная молекулярная масса — 71.
Ответ: М(газа) = 71,0 г.
Пример 17
Рассчитайте относительную молекулярную массу
вещества, 500 мл паров которого при 87 °C и давле-
нии 720 мм рт. ст. имеют массу 0,93 г.
Дано:
т = 0,93 г
52
Т = 273 + 87
V = 500 мл
R = 62 360 ммр-‘ -л
моль•К
Р = 720 мм рт. ст.
Найти:
М(вещества)
Решение:
По уравнению Клапейрона-Менделеева:
т mRT
PV = — RT^M = ~——,
М PV
0,93 • 62360 • 360
М -----———— -------- 58 г/моль.
720 • 500 z
Относительная молекулярная масса вещества рав-
на 58.
Ответ: М(вещества) = 58 г/моль.
Вопросы и задачи
для самостоятельного решения
1. Каково практическое значение закона сохранена
массы вещества?
2. Сформулируйте закон объемных отношений. Ука-
жите, какова его роль в развитии атомно-молекулярных
представлений?
3. Каково значение закона Авогадро? Как можно вос-
пользоваться этим законом для определения величин
молярных масс веществ?
4. Какие газовые законы вам известны? Какие функ-
циональные связи они вскрывают?
5. Укажите основные факторы, приводящие к откло-
нению свойств идеальных газов от предсказываемых урав-
нением состояния идеальных газов.
6. При разложении 12,25 г хлората калия образова-
лось 4,8 г кислорода. Какова масса образовавшегося при
этом хлорида калия. Подтвердите расчетами выполне-
ние закона сохранения массы веществ.
Ответ: 7,45 г.
53
7. Какие количества кислорода и магния необходимо
взять для получения 8 г оксида магния?
Ответ: 4,8 г Mg и 3,2 г О2.
8. Сколько г сульфида цинка должно получиться, если
для реакции взято 8 г серы и 32,7 г цинка?
Ответ: 24,25 г.
9. Определите молярную массу эквивалента металла,
если его соединение с иодом содержит 94,8 % иода. Мо-
лярная масса эквивалента иода равна 127.
Ответ: 6,97.
10. 1 г металла соединяется с 1,78 г серы или с 8,89 г
брома. Найдите молярные массы эквивалентов брома и
металла, зная, что молярная масса эквивалента серы рав-
на 16.
Ответ: Мэкв Вг = 79,9; Мэкв Me = 9.
11. Мышьяк образует два оксида, из которых один
содержит 34,8 %, а другой — 24,3 % кислорода. Опреде-
лите молярную массу эквивалента мышьяка в том и дру-
гом оксиде. Как относятся эти величины друг к другу?
Ответ: 15,0; 24,9; 3:5.
12. Олово образует два оксида, содержащих: первый
78,8 % олова, а второй — 88,12 % олова. Вычислите мо-
лярные массы эквивалентов олова, исходя из состава этих
оксидов, и найдите соотношения между полученными ве-
личинами.
Ответ: 29,7; 59,4; 1 : 2.
13. Оксид металла содержит 28,57 % кислорода, а со-
единение того же металла с фтором — 48,72 % фтора.
Рассчитайте из этих данных молярную массу эквивален-
та фтора.
Ответ: 18,9.
14. 1,6 г кальция и 2,615 г цинка вытесняют из кисло-
ты одинаковые количества водорода. Найдите молярную
массу эквивалента цинка, зная, что молярная масса экви-
валента кальция равна 20.
Ответ: 32,7.
15. Одно и то же количество металла соединяется с
0,2 г кислорода и с 3,173 г одного из галогенов. Определи-
те молярную массу эквивалента галогена.
Ответ: 126,9.
54
16. При нейтрализации некоторой кислоты едким нат-
ром на 1,125 г кислоты расходуется 1 г едкого натра, мо-
лярная масса эквивалента которого равна 40. Вычислите
молярную массу эквивалента кислоты.
Ответ: 45.
17. Определите молярную массу эквивалента хлорно-
го железа, зная, что 1,3 г его взаимодействует без остатка
с 1г едкого натра, молярная масса эквивалента которого
равна 40.
Ответ: 52.
18. Отразите уравнением процесс полного сгорания
метана и рассчитайте отношения между объемами уча-
ствующих в реакции газов, учитывая, что они измерены
при одинаковых условиях.
Ответ: СН4 : О2 = 1 : 2.
19. Один грамм воздуха при нормальных условиях за-
нимает объем 773 мл. Какой объем займет то же количе-
ство воздуха при 0 °C и давлении, равном 700 мм рт. ст.?
Ответ: 839 мл.
20. В сосуде емкостью 1 л находится 0,05 моль газа
при 0 °C. Определите давление газа в сосуде.
Ответ: 1,12 атм.
21. Найдите молекулярную массу вещества, зная, что
380 мл его паров при 97 °C и давлении 740 мм рт. ст.
имеют массу 1,9 г.
Ответ: 156.
22. Определите молекулярную массу вещества, зная,
что масса 200 мл его паров при нормальных условиях
равна 0,232 г.
Ответ: 26.
23. Масса 1 л озона при нормальных условиях равна
2,146 г. Подтвердите расчетом, что значение его молекуляр-
ной массы равно 48, и найдите плотность озона по воздуху.
Ответ: 1,66.
24. Плотность этилена по кислороду 0,875. Рассчи-
тайте молекулярную массу этилена.
Ответ: 28.
25. Определите давление кислорода, если 0,1 кг его
находится в сосуде объемом 0,02 м3 при 20 °C.
Ответ: 380 640 Па.
55
26. Какой объем займет 1 кг воздуха при температуре
17 °C и давлении 1 атм?
Ответ: 820 л.
27. Найдите массу 1 л бромистого водорода при нормаль-
ных условиях. Какова плотность этого газа по воздуху?
Ответ: 3,62 г; 2,79.
28. На сжигание 1 г металла требуется 462 мл (н. у.)
кислорода. Рассчитайте молярную массу эквивалента
этого металла.
Ответ: 12,12.
29. 0,2 г металла вытеснили 197 мл водорода, который
был собран и измерен при 20 °C и 780 мм рт. ст. Найдите
молярную массу эквивалента этого металла.
Ответ: 11,90.
30. При нагревании 4,3 г оксида металла было получе-
но 580 мл кислорода, объем которого измерен при 10 °C и
850 мм рт. ст. Найдите молярную массу эквивалента ме-
талла, если известно, что 1 л кислорода при н. у. имеет
массу 1,43 г.
Ответ: 30,44.
31. Найдите плотность по воздуху газовой смеси, состоя-
щей из 60 % оксида серы (IV) и 40 % оксида углерода (IV).
Ответ: 1,93.
32. Для полного восстановления 42 г оксида металла по-
требовалось 9,56 л водорода, взятого при 7 °C и 730 мм рт. ст.
Рассчитайте молярную массу эквивалента металла.
Ответ: 32.
33. Найдите объемный состав смеси кислорода с озо-
ном, плотность которой по воздуху равна 1,21.
Ответ: О2 : О3 = 4 : 1.
34. Какой объем при н. у. займут 28,2 • 1021 молекул
газа?
Ответ: 1,05 л.
35. Какой объем водорода полностью сгорит в 1 л воз-
духа?
Ответ: 0,42 л.
36. При некоторой температуре плотность паров серы
по воздуху равна 8,83. Из какого количества атомов со-
стоит молекула серы при этой температуре?
Ответ: из восьми.
56
37. Рассчитайте объем оксида углерода (IV), образо-
вавшегося при взрыве 17 л метана с 36 л кислорода.
Ответ: 17 л.
38. Газовая смесь объемом 10,6л (и. у.), применяемая
для получения аммиака, имеет массу 6,57 г. Каков состав
газовой смеси?
Ответ: 4,85л N2; 5,75л Н2.
39. Смесь азота с водородом объемом 1 л при темпера-
туре 0 °C и давлении 2 атм имеет массу 1 г. Определите
объемный состав смеси.
Ответ: 35,36 % N2.
Явления физические и химические.
Смеси и химические соединения
Явления, при которых одни вещества превращаются в
другие, отличающиеся от исходных составом и свойства-
ми, называются химическими.
Примеры: окисление веществ на воздухе, горение, ржав-
ление железа и др.
Химические явления — химические превращения,
химические реакции, химические взаимодействия.
Явления, при которых изменяется форма или физи-
ческое состояние веществ, называются физическими.
Примеры: кипение, плавление, испарение, замерзание,
выделение теплоты, света и др.
Химические явления всегда сопровождаются физиче-
скими.
Примеры: при сгорании магния выделяются теплота
и свет; в гальваническом элементе в результате хими-
ческих реакций возникает электрический ток.
Химическое соединение — химически индивидуаль-
ное вещество, состоящее из атомов одного или различных
элементов.
Примеры: кислород, бертолетова соль, цинк, сера и др.
Смесь — несколько химических соединений, смешан-
ных друг с другом.
Примеры: воздух, сплавы металлов, морская вода и
ДР.
57
Механическая смесь и химическое соединение имеют
следующие основные различия.
При приготовлении механической смеси составные
части могут быть взяты в любых количественных соот-
ношениях. При получении химических соединений ис-
ходные вещества берутся в строго определенных количе-
ствах.
При механическом смешении веществ не наблюдает-
ся, как правило, выделения или поглощения энергии.
Химические реакции сопровождаются тепловыми эффек-
тами.
Индивидуальные свойства веществ, составляющих ме-
ханическую смесь, сохраняются, так как составные части
в смеси находятся химически неизмененными. При хи-
мических реакциях свойства исходных веществ не со-
храняются, поскольку в результате их взаимодействия
образуются новые вещества с новыми свойствами.
Смесь, в отличие от химического соединения, можно
разделить на составные части, используя различия в их
физических свойствах.
Пример 1
При растворении в хлороводородной кислоте смеси
железа с сульфидом железа массой 6,4 г выдели-
лось 1,79 л (н. у.) смеси газов. Определите массо-
вую долю (%) железа в смеси.
1^1 Дано:
ш(смеси) = 6,4 г
К(газов)= 1,79 л
Найти:
ia(Fe) в смеси
Решение:
1) Записываем уравнения реакций:
Fe + 2HCl = FeCl2 + H2t,
FeS + 2НС1 = FeCl2 + H2Sf.
2) Выразим массу Fe в смеси через х г, а объем
выделившегося Н2 — у л. Тогда масса FeS будет
равна (6,4 - х) г, а объем H2S — (1,79 - у) л.
58
3) По первому уравнению реакции находим:
1 моль Fe — 1 моль Н2
х у
— м°льГе- — мольИа
22,4 • х
У= 56 '
4) По второму уравнению реакции находим:
1 моль FeS — 1 моль H2S
6,4- х 1,79 -у
——— моль FeS — ———-— моль H2S
88
22,4-х
(6,4 - х) • 22,4 = 88 • (1,79-).
5Ь
5) Рассчитываем массовую долю (%) Fe в смеси:
w(Fe) = . юо % = 17,34 %.
6,4
Ответ: w(Fe) = 17,34 % .
Пример 2
При нормальных условиях 20 л газовой смеси, со-
стоящей из азота и кислорода, имеют массу 28 г.
Определите объемы газов в смеси.
Дано:
яг(смеси) = 28 г
К(смеси) = 20 л
Найти:
K(N2) и V(O2).
Решение:
1) Обозначим V(N2) в смеси через х л, тогда V(O2)
будет (20 - х) л.
2) Находим количества веществ N2 и О2, а затем их
массы:
х 20-х
V(N2) = *22^4 М°ЛЬ; V(°2) = ~22?4~ М°ЛЬ;
m(N2) =
28-х
22,4
г;
тп(О2)
32 (20 - х)
22,4
г.
59
3) По условию масса смеси газов равна 28 г, т. е.:
28-х 32 (20-х)
- Ч-----——-------- 28, х = 3,2 л.
22,4 22,4
Таким образом, в смеси содержится 3,2 л N2 и 16,8 л
О2.
Ответ: К(Ы2) = 3,2л; И(О2) = 16,8л.
а Пример 3
Определите массовую долю каждого из газов в сме-
си, состоящей из водорода и метана, если ее плот-
ность по водороду равна 5.
Дано:
Ян2 = 5
Найти:
н>(Н2) и н>(СН4)
Решение:
1) Обозначим ir(H2) через х %
2) Находим молекулярную
М = М(Н2)-ВНг,
3) Выразим массовые доли
массе смеси:
2 • х
^(Н2) = ^о"’ “’(СН4,-
2-х 16-(100-х) _
100 + 100 ’
Следовательно, газовая смесь содержит 42,85 % Н2 и
57,15% СН4.
Ответ: н>(Н2) - 42,85 %; w(CH4) = 57,15 %.
, a ir(CH4) — (100 - х) %.
массу смеси:
А4 = 2 • 5 = 10.
газов в молекулярной
16 (100- х)
100
х = 42,85.
Вопросы и задачи
для самостоятельного решения
1. Приведите примеры пяти физических явлений.
Укажите признаки, по которым вы отнесете явления к
физическим.
60
2. Приведите примеры пяти химических явлений.
Укажите признаки, по которым вы отнесете явления к
химическим.
3. К каким явлениям (физическим или химическим)
следует отнести образование дыма:
а) при горении угля;
б) концентрированной соляной кислоты на воздухе;
в) при соприкосновении паров соляной кислоты и на-
шатырного спирта?
4. К каким явлениям (физическим или химическим)
относятся превращения одних аллотропных модификаций
элементов в другие: кислорода в озон, белого фосфора в
красный, ромбической серы в моноклиническую и т. д.?
5. Всегда ли физические и химические явления про-
являются отдельно? Приведите примеры явлений, проис-
ходящих одновременно.
6. К каким явлениям (физическим или химическим)
относятся:
а) приготовление порошка из куска мела;
б) возгорание спички;
в) выделение газа при обработке питьевой соды кисло-
той;
г) возгонки твердого иода.
7. Что такое смесь и химическое соединение?
8. Какие отличительные признаки смесей и химиче-
ских соединений вы знаете?
9. Выпишите отдельно названия химических соедине-
ний и смесей из ниже перечисленного: соль, почва, азот,
воздух, речная вода, молоко, цинк, гранит, мрамор, аргон.
10. К чистым веществам (в отличие от смесей) отно-
сятся:
а) медный купорос;
б) морская вода;
в) воздух;
г) бертолетова соль.
11. К смесям (в отличие от чистых веществ) относятся:
а) соляная кислота;
б) гашеная известь;
в) хлорная вода;
г) питьевая вода.
61
12. Назовите по одному примеру смесей веществ, кото-
рые можно разделить:
а) отстаиванием;
б) фильтрованием;
в) выпариванием;
г) используя магнитные свойства.
13. Приведите схему разделения: тонкой смеси цин-
кового порошка и серы; мела и поваренной соли; желез-
ных и медных опилок; растительного масла с водой; реч-
ного песка, сахара и древесного угля.
14. Через раствор, содержащий 5 г едкого натра, пропу-
щено 6,6 л сероводорода (н. у.). Какая соль и в каком
количестве образовалась при этом?
Ответ: 7 г NaHS.
15. Какой объем хлора необходимо взять для получе-
ния 53,4 г хлорида алюминия?
Ответ: 13,45 л.
16. Какая масса брома прореагировала с иодидом ка-
лия, если при этом образовалось 12,7 г иода?
Ответ: 8 г.
17. Рассчитайте массу фторида кальция, расходуемую
для получения 26,88 л фтористого водорода (н. у.).
Ответ: 46,8 г.
18. Вычислите, из какого количества оксида ртути (II)
получится при разложении 224 л (н. у.) кислорода?
Ответ: 4320 г.
19. Рассчитайте объем кислорода (н. у.), полученный при
термическом разложении нитрата натрия массой 34 кг.
Ответ: 4,48 м3.
20. Рассчитайте массы соды и хлорида кальция, необ-
ходимые для получения 0,5 кг карбоната кальция?
Ответ: 530 г Na2CO3; 555 г СаС12.
21. Какое вещество и в каком количестве останется в
избытке после смешения растворов, содержащих 34 г нит-
рата серебра и 31,8г хлорида кальция?
Ответ: 20,7 г СаС12.
22. Рассчитайте, какой объем оксида углерода (IV)
(н. у.) получится при разложении 0,25 кг мрамора, содер-
жащего 96 % карбоната кальция.
Ответ: 53,8 л.
62
23. При разложении 22,3 г малахита выделилось 2,24 л
углекислого газа (н. у.) Определите чистоту малахита.
Ответ: 99,1%.
24. При сжигании 6 г антрацита выделилось 10,6 л
оксида углерода (IV) (н. у.). Определите массовую долю
углерода в антраците.
Ответ: 94,6 %.
25. Цинковая пластинка массой 3,5 г погружена в ра-
створ нитрата серебра, содержащий 17 г соли. Определите
массу пластинки после прохождения реакции.
Ответ: 11,05 г.
26. Продукт прокаливания 1,3 г природного карбона-
та кальция растворили в избытке соляной кислоты. Оп-
ределите массовую долю карбоната кальция в природ-
ном минерале, если образовавшийся кристаллогидрат
хлорида кальция имел массу 1,29 г.
Ответ: 76,9%.
27. 2,8 г смеси углерода и серы было сожжено в кисло-
роде, полученном при термическом разложении 47,4 г
перманганата калия. Определите массовую долю серы в
исходной смеси.
Ответ: 57,1%.
28. При обработке 5,1 г сплава алюминия и магния с
соляной кислотой выделилось 5,6 л водорода. Определи-
те массовую долю (%) Mg в сплаве.
Ответ: 47,05%.
29. При нормальных условиях газовая смесь объемом
12 л, состоящая из аммиака и оксида углерода (IV), имеет
массу 18 г. Сколько литров каждого из этих газов содер-
жится в смеси?
Ответ: 4,62 л NH3 и 7,38 л СО2.
30. Определите объемные доли (%) газовой смеси, со-
стоящей из оксидов углерода (II, IV), если ее плотность по
водороду составляет 19,6.
Ответ 30 % СО; 70 % СО2.
31. Определите массовую долю (% ) доломита СаСО3 • MgCO3
в руде, если при разложении 10 г ее выделяется 0,96 л оксида
углерода (IV) (н. у.).
Ответ: 39,4 %.
32. Какую массу доломита, содержащего 8 % приме-
63
сей, необходимо взять для получения 56 м3 оксида угле-
рода (IV) (н. у.)?
Ответ: 250 кг.
33. При прокаливании 1,6 г смеси ZnO и ZnCO3 полу-
чено 1,248 г оксида цинка. Каков состав исходной смеси?
Ответ: 37,5 % ZnO.
34. Какова массовая доля (%) хлора содержится в
смеси, состоящей из 2 г хлорида натрия и 2 г хлорида
аммония?
Ответ: 63,5%.
35. Имеется смесь кальция и оксида кальция массой
10 г. Какова масса каждого из веществ в смеси, если при
реакции 2 г ее с водой выделилось 224 мл водорода?
Ответ: 2г Са, 8г СаО.
36. При обработке избытком раствора гидроксида
калия 5,85 г смеси алюминия с его оксидом выделилось
1,26 л газа (н. у.). Определите массовую долю алюминия
в смеси.
Ответ: 17,3%.
37. Для превращения 1 г смеси карбоната калия и гид-
роксида калия в хлорид калия было израсходовано 0,626 г
хлороводорода. Сколько граммов гидроксида калия было
в смеси?
Ответ: 0,8 г.
38. При растворении 6,9 г сплава цинка с алюминием
в серной кислоте выделилось 2,688 л водорода. Опреде-
лите содержание цинка в сплаве.
Ответ: 94,8 %.
39. Объем смеси оксида углерода (II) и кислорода со-
ставляет 100 мл. После сжигания оксида углерода за счет
находящегося в смеси кислорода объем уменьшился на
30 мл. Найдите объемный состав исходной смеси.
Ответ: 60 % СО; 40 % О2.
40. К раствору 2,404 г смеси солей CuSO4 • 5Н2О и
FeSO4 • 7Н2О добавили избыток раствора хлорида бария.
Масса полученного осадка составила 2,172 г. Определите
состав исходной смеси.
Ответ: 67,4 % CuSO4 • 5Н2О и 32,6 % FeSO4 • 7Н2О.
41. Какой объем воздуха необходим для полного сгора-
ния 1 м3 газовой смеси, имеющей объемный состав 20 % Н2,
64
30 % СН4 и 50 % СО? Объемная доля кислорода в воздухе
составляет 20,95 %.
Ответ: 4,53 м3.
42. Определите массовую долю (%) хлорида натрия в
смеси хлоридов натрия и калия, если 0,325 г этой смеси
при взаимодействии с нитратом серебра образовали
0,7175 г осадка.
Ответ: 53,5%.
Классификация химических реакций.
Тепловой эффект химической реакции
Химические реакции классифицируют по различным
признакам.
|Т] По признаку изменения числа исходных и конеч-
ных веществ реакции подразделяют на следующие типы.
1) Реакции соединения — реакции, в результате ко-
торых из двух или нескольких веществ образуется одно
новое вещество:
2Cu + О2 = 2СиО,
NH, + НС1 = NH.C1.
3 4
2) Реакции разложения — реакции, в результате ко-
торых из одного вещества образуется несколько новых
веществ:
Cu„(OH)„CO, = 2СиО + СО„ + Н„О,
(NH .)„Сг„О7 = Сг„О, + N, + 4Н,О.
3) Реакции замещения — реакции, в результате кото-
рых атомы простого вещества замещают атомы в молеку-
лах сложных веществ:
Fe + CuSO4 = FeSO4 + Си,
2KBr + Cl2 = Br2 + 2КС1.
4) Реакции обмена — реакции, в результате которых
два вещества обмениваются своими составными частями,
образуя два новых вещества. В реакцию обмена могут
вступать:
65
а) кислота + основание (реакция нейтрализации)
НС1 + КОН = КС1 + Н2О,
б) кислота + соль
H2SO4 + Ba(NO3)2 = BaSO4l + 2HNO3,
в) основание + соль
2NaOH + CuCl2 = Cu(OH)2J + 2NaCl,
г) соль + соль
КС1 + AgNO3 = AgCl| + KNO3.
Fg] По признаку обратимости реакции делят на обра-
тимые и необратимые.
Реакции, протекающие в двух взаимно противополож-
ных направлениях, называются обратимыми.
ЗН2 + N2 = 2NH3; AH < 0.
Реакции, протекающие в одном направлении и завер-
шающиеся полным превращением исходных веществ в
конечные, называются необратимыми.
2КС1О3 = 2КС1 + ЗО2.
Признаки необратимых реакций:
1) Образующиеся продукты уходят из сферы реакции
(осадок, газ):
ВаС12 + H2SO4 = BaSO4| + 2НС1,
Na2CO3 + 2НС1 = 2NaCl + CO2f + H2O.
2) Образуется малодиссоциирующее соединение, напри-
мер вода:
НС1 + NaOH » NaCl + Н2О.
3) Реакции, сопровождающиеся большим выделени-
ем энергии:
Mg + ~ О2 = MgO, АН = - 602,5 кДж.
Гз] По признаку выделения или поглощения теплоты.
Экзотермическими называются реакции, протекающие
с выделением теплоты:
Н2 + С12 - 2НС1, АН = -184,6 кДж.
Эндотермическими называются реакции, протекаю-
щие с поглощением теплоты.
66
N2 + 02 = 2N0, AH = 180,8 кДж.
Количество выделенной или поглощенной теплоты при
химической реакции называют тепловым эффектом
процесса. Раздел химии, изучающий тепловые эффекты
различных процессов, называется термохимией.
Химические уравнения, в которых приводятся тепло-
вые эффекты реакций, называются термохимическими.
Тепловой эффект реакции необходимо характеризовать
не только абсолютной величиной, но и знаком. Историче-
ски сложилось две системы отчета: термохимическая, в
которой тепловой эффект обозначается буковой Q и счи-
тается положительным в случае экзотермических реак-
ций, и термодинамическая, в которой изменение энергии
обозначается символом АН (изменение энтальпии). В эк-
зотермических процессах АН — величина отрицательная,
а в эндотермических АН — положительная. Иначе говоря:
Q - -АН.
Тепловой эффект в термохимических уравнениях да-
ется в расчете на моль вещества, и поэтому в них допусти-
мы дробные коэффициенты. Тепловой эффект реакции
зависит от ряда факторов:
1) От количества реагирующих веществ и продуктов
реакции; вследствие этого условились относить его к од-
ному моль вещества — обычно продукту реакции.
2) От температуры и давления; поэтому тепловой эф-
фект реакции или изменение энтальпии относят к стан-
дартным условиям (Р = 101 325 Па, Т = 298К). Отнесен-
ные к стандартным условиям изменения соответствую-
щих величин называются стандартными изменениями и
обозначаются АН0 — стандартное изменение энтальпии.
Стандартная энтальпия реакции образования 1 моль дан-
ного вещества из простых веществ носит название стан-
дартной энтальпии образования данного вещества. Эн-
тальпии образования простых веществ в их наиболее ус-
тойчивых состояниях принимаются равными нулю.
3) От агрегатного состояния реагирующих веществ и
продуктов реакции; поэтому в термохимических уравне-
ниях обязательно указывают агрегатное состояние ве-
ществ — кристаллическое (к), жидкое (ж), газообразное (г).
67
(1) С(к) + o2(r) = co2(r), AH = -397,3 кДж,
(2) у N2 (г) + у °2 (г) = №(„), AH = 90,4 кДж.
Уравнение (1) показывает, что при взаимодействии 12 г
кристаллического углерода (графита) с 32 г газообразно-
го кислорода образуется 44 г оксида углерода (IV) и выде-
ляется, в пересчете на стандартные условия, 397,3 кДж
теплоты. Уравнение (2) означает, что превращение 0,5 моль
азота и 0,5 моль кислорода в 1 моль оксида азота (II)
сопровождается поглощением 90,4 кДж теплоты.
[4] По признаку изменения степени окисления атомов,
входящих в состав реагирующих веществ, различают ре-
акции, протекающие без изменения степеней окисления
атомов и окислительно-восстановительные реакции (с
изменением степеней окисления атомов).
а Пример 1
Вычислите количество теплоты, выделившееся при
сжигании 112м3(н. у.) метана, используя термохи-
мическое уравнение реакции горения метана:
СН4 + 2О2 = СО2 + 2Н2О; АН =-890 кДж.
Дано:
У(СН4) = 112 м3
Q — 890 кДж
Найти:
Q1
Решение:
1) Рассчитываем
количество
СН4:
v(CH.) = --—5- = 5 • 103 моль.
v 22,4 • 10-3
2) Из уравнения следует, что при сжигании 1 моль
СН4 выделяется 890 кДж теплоты. Пусть Q1 — ко-
личество теплоты, выделяющееся при сжигании
5 • 103 моль СН4. Тогда:
68
1 5 • 103
n— = ——i—; Q = 4,45 10® кДж.
890 Q1
Ответ: Q1 = 4,45 • 10е кДж.
Пример 2
Вычислите тепловой эффект реакции горения аце-
тилена и составьте термохимическое уравнение этой
реакции, если известно, что при сжигании 1,12 л
(н. у.) ацетилена выделяется 67,5 кДж теплоты.
Дано:
V(C2H2) = 1,12 л
Q1 = 67,5 кДж
Найти:
Q
Решение.
1) Составим уравнение в общем виде:
2С2Н2 + 5О2 = 4СО2 + 2Н2О; ДН = -Q кДж.
Рассчитаем количество С2Н2:
V 1,12
v = —; v(C2H2) = -22 4 = 0,05 моль.
2) Из уравнения следует, что при сжигании 2 моль
С2Н2 выделяется Q кДж. Тогда:
2 0,05
Q ~ 67,5 !
Q = 2700 кДж (тепловой эффект реакции)
Термохимическое уравнение имеет вид:
2С„Н„ + 5О„ = 4СО„ + 2Н„О; ДН = -2700 кДж.
Ответ: ДН = -2700 кДж.
Пример 3
Вычислите, какое количество теплоты выделится
при сгорании 1,2 г угля, используя термохимиче-
ское уравнение реакции горения угля:
с(уголь) + О2 = с°2; ДН =-393,5 кДж.
69
1^1 Дано:
I I тп(угля) = 1,2 г
Q = 393,5 кДж
Найти:
Q1
Решение:
1) Рассчитываем количество угля:
т 1»2
v = —; v = —— = 0,1 моль.
М 12
2) Из уравнения следует, что при сжигании 1 моль
угля выделяется 393,5 кДж теплоты. Тогда:
1 0,1
—— = Q = 39,35 кДж-
393,5 Q1
Ответ: Q1 = 39,35 кДж.
Вопросы и задачи
для самостоятельного решения
1. Какие реакции называются экзо-, эндотермически-
ми? Привести примеры.
2. Что называется тепловым эффектом реакции? В
каких единицах выражаются тепловые эффекты?
3. От каких факторов зависит тепловой эффект реакции?
4. Что называется стандартной энтальпией образова-
ния АН0?
5. Вычислите, сколько выделится теплоты при сгора-
нии серы массой 12 г, если известно, что энтальпия обра-
зования оксида серы (IV) из кислорода и серы равна —
296,9 кДж/моль.
Ответ: 111,3 кДж.
6. При сжигании 30,4 г магния выделилось 7,65 • 102 кДж
теплоты. Вычислите энтальпию образования оксида маг-
ния.
Ответ:-601,1 кДж/моль.
7. Вычислите, какое количество теплоты выделит-
ся при сгорании теллура массой 1 г, если для ТеО2 (К)
АН°обр. = -321,7 кДж/моль.
Ответ: 2,0 кДж.
70
8. Сколько теплоты выделится при сжигании 100 л
водорода, взятого при нормальных условиях, если энталь-
пия образования воды равна — 285,84 кДж/моль.
Ответ: 1276 кДж.
9. При соединении 2 л (н. у.) хлора с водородом выде-
ляется 16,4 кДж теплоты. Рассчитайте энтальпию обра-
зования хлороводорода.
Ответ: -92,3 кДж/моль.
10. Какое количество теплоты поглотится при получе-
нии кислорода объемом 6,72 л (н. у.) по реакции:
f
2KNO3 = 2KNO2 + О2, АН = 254,8 кДж
Ответ: 73,74 кДж.
11. При соединении 2,1 г железа с серой выделилось
3,77 кДж энергии. Вычислите энтальпию образования
сульфида железа.
Ответ: -100,3 кДж/моль.
12. Определите количество теплоты, выделившейся
при взрыве 8,4 л гремучего газа, взятого при нормаль-
ных условиях, если энтальпия образования воды равна
-285,84 кДж/моль.
Ответ: 71,5 кДж.
13. При взаимодействии 9 г алюминия с кислородом
выделяется 274,45 кДж теплоты. Рассчитайте энтальпию
образования оксида алюминия.
Ответ: -1648 кДж/моль.
14. Допишите уравнения реакций и укажите, к како-
му типу химических реакций вы их отнесете:
а) Н2 + С12 —*
КМпО4
б) Са3(РО4)2 + H2SO4 —
t°
Zn + S -»
в) Cu(OH)2 + Н3РО4 -»
Hg(NO3)2 + Zn ->
г) NaNO3
Zn + H2SO4 (разб)
3
Химическая кинетика
Скорость химических реакций
Раздел химии, изучающий скорость и механизм хи-
мических реакций, называется химической кинетикой.
Скорость химической реакции — это количество эле-
ментарных актов взаимодействия в единицу времени в
единице реакционного пространства. Это определение
справедливо как для гомогенных, так и для гетерогенных
процессов. В первом случае реакционным пространством
является объем реакционного сосуда, а во втором — по-
верхность, на которой протекает реакция. Так как при
взаимодействии изменяются концентрации реагентов или
продуктов реакции в единицу времени. При этом нет
необходимости следить за изменением концентрации всех
веществ, участвующих в реакции, поскольку стехиомет-
рическое уравнение ее устанавливает соотношение меж-
ду концентрациями реагентов. Концентрацию реагиру-
ющих веществ чаще всего выражают количеством молей
в 1 литре (моль/л).
Скорость химической реакции зависит от природы
реагирующих веществ, концентрации, температуры, вели-
чины поверхности соприкосновения веществ, присутствия
катализаторов и других.
Увеличение концентрации реагирующих веществ
приводит к увеличению скорости химической реакции
вследствие того, что любая химическая реакция протека-
ет через столкновение между реагирующими частицами
(атомами, молекулами, ионами), а их тем больше, чем
больше частиц в единице реакционного пространства (чем
больше концентрация). Химическая реакция может про-
72
текать через один или несколько элементарных актов
(элементарных стадий взаимодействия). Совокупность
элементарных актов отражает механизм реакции. Для
реакций, отвечающих какому-либо, элементарному акту,
можно записать выражение зависимости скорости реак-
ции от концентрации на основании уравнения реакции.
В том случае, когда в элементарном акте участвует лишь
одна молекула (например, реакция разложения), зависи-
мость имеет вид:
v = к[А],
и говорят о мономолекулярной реакции; когда в элемен-
тарном акте происходит соударение двух разных моле-
кул, зависимость имеет следующий вид:
v = k[A][B],
и говорят о бимолекулярной реакции; когда в элемен-
тарном акте происходит соударение трех молекул, для
зависимости скорости от концентрации справедливо:
v = k[A][B][C],
и говорят о тримолекулярной реакции. Во всех разоб-
ранных зависимостях:
v— скорость реакции;
[А], [В], [С] — концентрации реагирующих веществ;
к — коэффициент пропорциональности; называемый кон-
стантой скорости реакции.
v = к, когда концентрации реагирующих веществ или их
произведение равны единице. Константа скорости зави-
сит от природы реагирующих веществ и от температуры.
Зависимость скорости простых реакций (т. е. реак-
ций, протекающих через один элементарный акт) от кон-
центрации описывается законом действующих масс, ус-
тановленным К. Гульдбергом и П. Вааге в 1867 г.: ско-
рость химической реакции прямо пропорциональна
произведению концентрации реагирующих веществ, воз-
веденных в степень их стехиометрических коэффициен-
тов.
Например, для реакции
2N0 + 02 = 2NO2; v = k[NO]2[O2].
Если уравнение химической реакции не отвечает эле-
ментарному акту взаимодействия, а является просто сум-
марным уравнением, отражающим только связь между
73
массой вступивших и образовавшихся веществ, то при
написании выражения для зависимости скорости реак-
ции от концентрации нужно учитывать, что степени у
концентраций не будут равны коэффициентам, стоящим
перед формулами соответствующих веществ в уравне-
нии реакции. Для реакции, протекание которой связано с
некоторыми элементарными актами, общая скорость оп-
ределяется (лимитируется) скоростью самой медленной
стадии.
Разобранная зависимость скорости реакции от кон-
центрации реагирующих веществ справедлива для газов
и реакций, протекающих в растворе. Она не распростра-
няется на реакции с участием твердых веществ, так как
в этих случаях взаимодействие молекул происходит не
во всем объеме реагирующих веществ, а лишь на поверх-
ности раздела двух фаз. Поэтому скорость гетерогенной
реакции зависит не только от рассмотренных нами ранее
факторов, но и от величины поверхности соприкоснове-
ния между реагирующими фазами. Всякое увеличение
поверхности приводит к увеличению скорости реакции.
ГЛ Влияние температуры на скорость химической ре-
акции согласуется с правилом Вант-Гоффа: при повыше-
нии температуры на каждые 10 °C скорость реакции уве-
личивается в 2-4 раза. Математически это правило пере-
дается следующим уравнением:
"2 ~ *1
vt2 = vti-y 10 ,
где vti и vt — скорости реакций, соответственно при тем-
пературах t2 и tp у — температурный коэффициент реак-
ции (или коэффициент Вант-Гоффа), т. е. число, показы-
вающее, во сколько раз увеличивается скорость реакции
при повышении температуры на каждые 10 °C. Причины
значительной (экспоненциальной) зависимости скорости
химической реакции от температуры состоят в следую-
щем. Образование новых веществ протекает не при вся-
ком столкновении реагирующих молекул: реагируют
только те молекулы (они называются активными), кото-
рые обладают достаточной энергией, чтобы разорвать или
ослабить связи в исходных частицах и тем самым со-
здать возможность образования новых молекул. Поэтому
74
каждая реакция характеризуется определенным энерге-
тическим барьером (см. рисунок ниже). Для его преодо-
ления необходима энергия активации — некоторая из-
быточная (по сравнению со средней энергией молекул при
данной температуре) энергия, которой должны обладать
молекулы для того, чтобы их столкновение приводило к
образованию новых веществ. При небольших температу-
рах только сравнительно незначительная доля частиц
имеет энергию выше энергии активации и способа всту-
пить в реакцию. С ростом температуры число активных
молекул быстро увеличивается, что и приводит в резко-
му возрастанию скорости реакции. Энергия активации
Еа зависит от природы реагирующих веществ и служит
характеристикой каждой реакции.
А В
I + I
А В
Исходное
состояние
системы
А2 + В2 = 2АВ
А ... В А - В
А ... В
Переходное
состояние
А - В
Конечное
состояние
системы
Как видно из рисунка, разность энергий конечного
состояния системы и начального равна тепловому эффек-
ту реакции АН.
Зависимость константы скорости реакции (к) от энер-
75
гии активации (Еа) и температуры выражается уравне-
нием Аррениуса:
к = А • е ,
где А — коэффициент пропорциональности; е — основа-
ние натуральных логарифмов; R — универсальная газо-
вая постоянная и Т — абсолютная температура.
Это уравнение показывает, что при постоянной темпе-
ратуре константа скорости определяется энергией акти-
вации. Чем выше численное значение энергии актива-
ции, тем меньше в реакционной смеси активных моле-
кул, тем меньше число эффективных соударений и тем,
следовательно, ниже константа скорости и сама скорость
химической реакции.
|з] Влияние катализатора. Катализаторами называют-
ся вещества, участвующие в химическом процессе, изме-
няющие его скорость, но не входящие в состав продуктов
реакции, т. е. к концу реакции остающиеся химически
неизменными. Явление изменения скорости реакции под
действием катализаторов называется катализом.
Различают гомогенный и гетерогенный катализ. Когда
взаимодействующие вещества и катализатор находятся
в одинаковом агрегатном состоянии, говорят о гомоген-
ном катализе. При гетерогенном катализе реагирую-
щие вещества и катализатор находятся в различных аг-
регатных состояниях; обычно катализатор в твердом, а
реагирующие вещества — в жидком или газообразном.
Если катализатор снижает скорость химической реак-
ции, то его называют ингибитором. Некоторые вещества не
обладают каталитическим действием, но их добавки резко
увеличивают каталитическую способность катализаторов.
Их называют промоторами. Другие вещества уменьшают
или полностью уничтожают активность катализаторов, их
называют каталитическими ядами, а процесс снижения
активности катализаторов — отравлением.
При гомогенном катализе основной гипотезой, объяс-
няющей механизм действия катализатора, является тео-
рия промежуточных продуктов между катализатором и
реагирующим веществом с меньшим значением энер-
гии активации. Гетерогенный катализ чаще всего объяс-
76
няется адсорбционной теорией, согласно которой на по-
верхности катализатора происходит адсорбция реагиру-
ющих веществ и их концентрация увеличивается. При
этом следует иметь в виду, что для катализатора харак-
терна избирательность действия.
а Пример 2
Во сколько раз возрастет скорость реакции взаи-
модействия оксида углерода (II) с кислородом, если
концентрации исходных веществ увеличить в три
раза?
а Дано:
[СО] и [02] возрастет в три раза
Найти:
и1
V
Решение:
1) Записываем уравнение реакции:
2СО + 02 = 2СО2.
Согласно закону действующих масс
v = к[СО]2[О2].
2) Обозначим [СО] = а; [02] = Ь, тогда:
v = к • а2 • Ъ.
3) При повышении концентрации исходных веществ
в 3 раза получим:
[СО] = За, а[02] = 3&.
4) Рассчитываем скорость реакции и1:
г? = к9а23& = к27а2&, a
и1 к27а2& „
v ка2Ь 27'
Ответ: в 27 раз.
а Пример 3
Во сколько раз возрастет скорость химической ре-
акции при повышении температуры на 40 °C, если
77
температурный коэффициент скорости реакции ра-
вен 3?
Дано:
М = 40 °C
у = 3
Найти:
vt2
Решение:
1) Согласно правилу Вант-Гоффа:
t2 ~
vt = vt • у 10 ,
12 Ч ’
40
^ = vti-310 = v(i-81.
Ответ: в 81 раз.
Пример 4
Реакция между веществами А и В протекает по
схеме 2А + В = С. Концентрация вещества А равна
10 моль/л, а вещества В — 6 моль/л. Константа ско-
рости реакции равна 0,8 л2 • моль-2 сек-1. Вычис-
лить скорость химической реакции в начальный
момент, а также в момент, когда в реакционной сме-
си останется 60 % вещества В.
Дано:
к = 0,8 л2 • моль-2 • сек-1
[А] = 10 моль/л
[В] = 6 моль/л
Найти:
инач;
Решение:
1) Находим скорость реакции в начальный мо-
мент:
v = к[А]2 • [В],
инач = 0,8 ’ Ю2 ’ 8 = 480 моль • л • сек-1.
2) По истечении некоторого времени в реакцион-
ной смеси останется 60 % вещества В. Тогда:
78
[В] = 6 • 0,60 = 3,6 моль/л.
Следовательно, [В] уменьшилась на:
6 - 3,6 = 2,4 моль/л.
3) Из уравнения реакции следует, что вещества А и
В взаимодействуют между собой в отношении 2:1,
поэтому [А] уменьшилась на 4,8 моль/л и стала рав-
ной:
[А] = 10 - 4,8 = 5,2 моль/л.
4) Рассчитываем и1:
г? = 0,8 • 5,22 • 3,6 = 77,9 моль • л'1 • сек-1.
Ответ: инач = 480 моль • л • сек*1,
г/ = 77,9 моль • л*1 • сек*1.
Пример 5
Реакция при температуре 30 °C протекает за 2 ми-
нуты. За сколько времени закончится эта реакция
при температуре 60 °C, если в данном температур-
ном интервале температурный коэффициент ско-
рости реакции равен 2?
Дано:
tx = 30 °C
t2 = 60 °C
у = 2
т = 2 мин = 120 сек
Найти:
т,
С2
Решение:
1) В соответствии с правилом Вант-Гоффа:
V, h
—— = V io ,
—23 = 8.
2) Скорость реакции обратно пропорциональна вре-
мени реакции, следовательно:
79
т= 120 ”= 15сек.
8
Ответ: т= 15 сек.
Вопросы и задачи
для самостоятельного решения
1. Дайте определение скорости реакции. Приведите
примеры реакций, идущих с различными скоростями.
2. Выражение для истинной скорости химической реак-
ции, протекающей при постоянном объеме системы, за-
писывается следующим образом:
dC
v = ± —— .
dz
Укажите, в каких случаях необходим положительный, а
в каких — отрицательный знаки в правой части выра-
жения.
3. От каких факторов зависит скорость химической
реакции?
4. Что называется энергией активации? Влияние ка-
кого фактора на скорость химической реакции она ха-
рактеризует?
5. Чем объясняется сильное увеличение скорости ре-
акции при росте температуры?
6. Дайте определение основному закону химической
кинетики — закону действующих масс. Кем и когда он
был сформулирован?
7. Что называется константой скорости химической
реакции и от каких факторов она зависит?
8. Что такое катализатор и как он влияет на скорость
химической реакции?
9. Приведите примеры процессов, в которых использу-
ются ингибиторы.
10. Что такое промоторы и где они применяются?
11. Какие вещества называют «каталитическими яда-
ми»? Приведите примеры таких веществ.
12. Что такое гомогенный и гетерогенный катализ?
80
Приведите примеры процессов с применением их ката-
литических процессов.
13. Как изменится скорость реакции 2С0 + 02 = 2СО2,
если уменьшить объем газовой смеси в 2 раза?
14. Во сколько раз возрастет скорость химической
реакции при повышении температуры с 10 °C до 40 °C,
если известно, что с повышением температуры на 10 °C
скорость реакции возрастет в 2 раза?
Ответ: возрастет в 8 раз.
15. Скорость реакции А + В = С при повышении тем-
пературы на каждые 10 °C увеличивается в три раза. Во
сколько раз увеличится скорость реакции при повыше-
нии температуры на 50 °C?
Ответ: в 243 раза.
16. Во сколько раз возрастет скорость реакции взаи-
модействия водорода и брома, если концентрации исход-
ных веществ увеличить в 4 раза?
Ответ: в 16 раз.
17. Во сколько раз возрастет скорость реакции при
повышении температуры на 40 °C (у — 2)?
Ответ: в 16 раз.
18. Как изменится скорость реакции
2NO + О2 2NO2,
если давление в системе увеличить в два раза?
Ответ: в 8 раз.
19. Во сколько раз следует увеличить концентрацию
водорода в системе
N2 + 3H2^ 2NH3,
чтобы скорость реакции возросла в 125 раз?
Ответ: в 5 раз.
20. Реакция между оксидом азота (II) и хлором про-
текает по уравнению
2NO + C12?± 2NOC1;
как изменится скорость реакции при увеличении:
а) концентрации оксида азота в два раза;
б) концентрации хлора в два раза;
в) концентрации обоих веществ в два раза?
Ответ: а) в 4 раза; б) в 2 раза; в) в 8 раз.
21. При 150 °C некоторая реакция заканчивается за
81
16 минут. Принимая температурный коэффициент рав-
ным 2,5, рассчитайте, через какой период времени закон-
чится эта же реакция при 80 °C.
Ответ: через 162,5 час.
22. На сколько градусов надо увеличить температуру,
чтобы скорость реакции возросла в 32 раза. Температур-
ный коэффициент скорости реакции равен 2.
Ответ: на 50°.
23. При 30 °C реакция протекает за 3 минуты. За сколь-
ко времени будет протекать эта же реакция при 50 °C,
если температурный коэффициент скорости реакции
равен 3.
Ответ: 20 сек.
24. При температуре 40 °C реакция протекает за 36 мин,
а при 60 °C — за 4 мин. Рассчитайте температурный ко-
эффициент скорости реакции.
Ответ: 3.
25. Скорость реакции при 10 °C равна 2 моль/л. Вы-
числите скорость этой реакции при 50 °C, если темпера-
турный коэффициент скорости реакции равен 2.
Ответ: 32 моль/л • сек.
Обратимость химических реакций.
Химическое равновесие
Реакции, протекающие одновременно в двух взаимно
противоположных направлениях, называют обратимыми.
Реакцию, протекающую слева направо, называют прямой,
а справо налево — обратной.
Например:
2SO2 + О2 2SO3.
Состояние, при котором скорость прямой реакции
равна скорости обратной реакции, называется химиче-
ским равновесием. Оно является динамическим и ха-
рактеризуется константой химического равновесия (Кравн),
которая в общем виде для обратимой реакции
mA + пВ рС + qD
выражается следующим образом:
82
Т£
равн
[С]р[РГ
[А]га[В]п ’
где [А], [В], [С], [D] — равновесные концентрации веществ;
ш, n, р, q — стехиометрические коэффициенты в уравне-
нии реакции.
Смещение химического равновесия с изменением ус-
ловий подчиняется принципу Ле Шателье: если на сис-
тему, находящуюся в состоянии равновесия, производит-
ся какое-либо внешнее воздействие (изменяется концен-
трация, температура, давление), то оно благоприятствует
протеканию той из двух противоположных реакций, ко-
торая ослабляет внешнее воздействие. Нарастание про-
тиводействия продолжается до того момента, пока систе-
ма не достигает нового равновесия, соответствующего но-
вым условиям.
Влияние температуры. При повышении темпера-
туры равновесие смещается в сторону эндотермической
реакции, и, наоборот, при понижении температуры равно-
весие смещается в сторону экзотермической реакции.
ГЦ Влияние давления. В газовых средах повышение
давления смещает равновесие в сторону реакции, приво-
дящей к уменьшению ее объема.
Гз] Влияние концентрации. Увеличение концентрации
исходных веществ приводит к смещению равновесия в
сторону образования продуктов реакции, а увеличение
концентрации продуктов реакции приводит к смещению
равновесия в сторону образования исходных веществ.
Подчеркнем, что введение катализатора в систему не
приводит к сдвигу равновесия, так как при этом в рав-
ной степени изменяются скорости прямой и обратной
реакций.
Пример 1
Как влияет повышение температуры на равновесие
системы
H2(r) + Cl2(r) jpt 2НС1(г); АН < 0.
Решение:
Согласно принципу Ле Шателье, равновесие системы
83
при повышении температуры должно сместиться в
сторону эндотермической реакции. В нашем слу-
чае — в сторону обратной реакции.
Пример 2
Реакция образования оксида азота (IV) выражает-
ся уравнением
2NO + О2 & 2NO2.
Как изменится скорость прямой и обратной реак-
ций, если увеличить давление в 3 раза, а температу-
ру оставить постоянной? Вызовет ли это изменение
скорости смещение равновесия?
Решение:
Пусть до увеличения давления равновесные концен-
трации оксида азота (II), кислорода и оксида азота
(IV) были: [NO] = а, [О2] = b, [N02] = с, тогда скорость
прямой реакции
Vj = kjCt2!»,
скорость обратной реакции
v2 - к2с2.
При увеличении давления в 3 раза во столько же
раз увеличится концентрация всех реагентов:
[NO] = За, [О2] - Sb, [NO2] = Sc.
Скорость прямой реакции станет:
Vj = k1(3a)2 Sb = \27a2b.
Скорость обратной реакции станет:
v2 = к2(3с)2 - к29с2.
Значит, скорость прямой реакции возросла в 27 раз,
а обратной — в 9 раз. Равновесие сместится в сто-
рону прямой реакции, что согласуется с принци-
пом Ле Шателье.
Пример 3
Как влияют на равновесие в системе
ЗН„ + N 2NH„; ДН < О
Z Z о
84
а) понижение давления;
б) повышение температуры;
в) увеличение концентрации исходных веществ?
Решение:
Согласно принципу Ле Шателье, понижение давле-
ния приведет к смещению равновесия в сторону
реакции, приводящей к увеличению ее объема, т. е.
в сторону обратной реакции. Повышение темпера-
туры приведет к смещению равновесия в сторону
эндотермической реакции, т. е. в сторону обратной
реакции. И наконец, увеличение концентрации ис-
ходных веществ приведет к смещению равновесия в
сторону образования продуктов реакции, т. е. в сто-
рону прямой реакции.
Вопросы и задачи
для самостоятельного решения
1. Какие реакции являются необратимыми? Приведи-
те примеры.
2. Какие реакции называются обратимыми? Почему
они не доходят до конца? Приведите примеры.
3. Что называется химическим равновесием? Являет-
ся оно статическим или динамическим?
4. Что называется константой химического равнове-
сия и какой физический смысл она имеет?
5. Какие факторы влияют на состояние химического
равновесия?
6. В чем сущность принципа Ле Шателье?
7. Как влияют катализаторы на состояние химиче-
ского равновесия?
8. Как влияют;
а) понижение давления;
б) повышение температуры;
в) увеличение концентрации
на равновесие системы
2NO2 + О 2NO2; ДН > О?
85
9. Как отразится повышение давления на равновесии
в следующих системах:
2Н2 + О2^2Н2О(пар),
СО2 + Ств. 2СО,
СаСО3(тв) СаО + СО2.
10. Изменениями концентрации каких реагирующих
веществ можно сдвинуть вправо равновесие реакции
СО2 + Н2 & СО + Н2О?
11. Покажите на примере реакции синтеза аммиака,
какими факторами можно сместить равновесие процесса
в сторону образования аммиака?
12. Как изменится скорость прямой и обратной реак-
ций
2SO2 + О2 & 2SO3; ДН < 0,
если объем газовой смеси уменьшится в три раза? В ка-
ком направлении сместится химическое равновесие при
повышении температуры?
13. В каком направлении произойдет смещение рав-
новесия системы
Н2 + S H2S, если
а) увеличить концентрацию водорода,
б) понизить концентрацию сероводорода?
14. В какую сторону сместится равновесие в системах
при повышении температуры:
2Н2 + О2 2Н2О; ДН < 0,
СаСО3 СаО + СО2; ДН > 0.
15. В замкнутой системе в присутствии катализатора
реакция взаимодействия хлористого водорода с кислоро-
дом обратима:
4НС1 + О2 & 2С12 + 2Н2О; ДН < 0.
Какое влияние на равновесную концентрацию хлора бу-
дут оказывать:
а) увеличение давления;
б) увеличение концентрации кислорода;
в) повышение температуры?
16. Вычислите константу равновесия для обратимой
реакции, протекающей по уравнению
86
2NO2 <p* 2N0 + 02,
зная, что при состоянии равновесия
[NO2] = 0,06 моль/л,
[NO] = 0,24 моль/л,
[О2] = 0,12 моль/л.
Ответ: 1,92.
17. Вычислите константу равновесия для процесса:
СО(Г) + С12(Г)?±СОС12,
если при некоторой температуре из взятых в исходном
состоянии пяти моль СО и четырех моль С12 образовалось
1,5 моль СОС12.
Ответ: 0,171.
18. При некоторой температуре константа равновесия
процесса
Н2 (г) + НСОН(г) <р± СН3ОН(г) равна 1.
Начальные концентрации Н2(г) и НСОН(Г) составляли
4 моль/л и 3 моль/л соответственно. Какова равновесная
концентрация СН3ОН(г)?
Ответ: 2 моль/л.
19. Реакция протекает по уравнению
2А В.
Исходная концентрация вещества А равна 0,2 моль/л.
Константа равновесия реакции равна 0,5. Вычислите рав-
новесные концентрации реагирующих веществ.
Ответ: 0,015 моль/л; 0,170 моль/л.
20. В каком направлении произойдет смещение рав-
новесия реакции:
3Fe + 4Н2О FegO4 + 4Н2
1) при увеличении концентрации водорода;
2) при увеличении концентрации паров воды?
21. При некоторой температуре равновесная концент-
рация серного ангидрида, образующегося в результате
реакции
2SO2 + О2 2SO3,
составила 0,02 моль /л. Исходные концентрации сернис-
того газа и кислорода составляли, соответственно, 0,06 и
0,07 моль/л. Рассчитайте константу равновесия реакции.
Ответ: 4,17.
87
22. Как повлияет повышение давления при неизмен-
ной температуре на равновесие в следующих системах:
N2 + О2 & 2NO; ДН > О,
2СО + О2 2СО2; ДН < О,
2НВг Н2 + Вг2; ДН > 0.
В какую сторону сместится равновесие в рассмотренных
процессах при повышении температуры?
23. Какие факторы (давление, температура, катализа-
тор) способствуют смещению равновесия в реакции
СО2 (Р) + с(тв) 2СО; ДН>0
в сторону образования СО? Ответ мотивируйте.
24. Как повлияет увеличение давления на химическое
равновесие в обратимой системе:
^е2®3 (к) + 2В2 (г) 2Fe(K) + ЗН2О(г).
25. Как повлияют увеличение температуры и умень-
шение давления на химическое равновесие в обратимой
системе:
2А(г) + в(г) * а2в(Г); ан>0.
4
Строение атома и периодический закон
Д. И. Менделеева
Основные этапы развития
теории строения атома
В конце XIX — начале XX века появился ряд экспери-
ментальных доказательств, неопровержимо свидетельству-
ющих о сложности строения атома. К наиболее важным
из них относятся: 1) открытие катодных лучей; 2) явле-
ние электролиза; 3) явление радиоактивности; 4) явле-
ние испускания электронов нагретыми телами (в частно-
сти, фотоэффект Столетова). Эти доказательства явились
предпосылкой для развития представлений о строении
атома. Наиболее обоснованной, на ранних этапах изуче-
ния, оказалась предложенная Э. Резерфордом (1911 г.)
планетарная модель строения атома. Планетарная (или
ядерная) модель рассматривала атом состоящим из двух
составных частей — положительно заряженного ядра,
очень малого по размерам (10-15м), но сосредотачиваю-
щего в себе практически всю массу атома, и электронов,
вращающихся вокруг ядра и образующих электронную
оболочку атома. Заряды электронов компенсируются
положительным зарядом ядра, и атом в целом является
эл ектронейтрал ьным.
Предложенная Резерфордом модель строения атома
была крупным шагом в познании строения атома. Но
она не смогла объяснить причины устойчивости атомов, а
также линейчатый характер спектров газов и паров.
Следующим этапом в развитии представлений о строе-
нии атома явилась теория, объединившая ядерную модель
атома с квантовой теорией света. Она была разработана
89
датским ученым Н. Бором (1913 г.). Бор предположил,
что движение электронов в атоме осуществляется только
по строго определенным (стационарным) орбитам. Ут-
верждалось, что пока электроны находятся на таких ор-
битах, они не излучают энергии. Выделение энергии ато-
ма происходит только при переходе электрона с более
отдаленных орбит на орбиты, расположенные ближе к
ядру. Важным положением теории было то, что энергия
излучения изменялась не непрерывно, а дискретно — кван-
тами. Теория Бора объяснила причину устойчивости
атомов, физическую природу линейчатого характера атом-
ных спектров, дала ключ к объяснению периодичности
свойств элементов. Однако эта теория, страдая внутрен-
ней противоречивостью, не могла объяснить свойства и
строение многоэлектронных атомов. Кроме того, модель
атома Бора не учитывала волновых свойств электронов,
экспериментально установленных в 1927 году. Именно
двойственность свойств электрона (корпускулярных и
волновых) легла в основу современной теории строения
атома, опирающуюся на квантовую механику.
Согласно представлениям этой теории, электроны, не-
прерывно двигаясь в поле ядра, образуют так называемое
электронное облако. Пространство вокруг ядра, в кото-
ром наиболее вероятно нахождение электрона, было на-
звано орбиталью. Орбиталь характеризует форму элект-
ронного облака.
По современным представлениям квантовой механи-
ки состояние электрона в атоме описывается четырьмя
квантовыми числами.
Главное квантовое число — п характеризует значе-
ние энергии электрона и определяет размеры электрон-
ного облака. Оно принимает положительные целочислен-
ные значения от 1 до бесконечности. С увеличением п
размеры электронного облака и энергия электронов воз-
растают. Электроны, характеризующие одним и тем же
значением главного квантового числа, имеют электрон-
ные облака примерно одинаковых размеров. Поэтому
говорят о существовании в атоме электронных уровней,
слоев. Их обозначают большими буквами латинского
алфавита К, L, М, N..., причем К-уровень является пер-
90
вым от ядра атома, ему соответствует п = 1, L-уровень
является вторым (п — 2), М-уровень — третьим (п = 3) и
т. д. Число всех энергетических уровней в атоме равно
номеру периода, в котором находится элемент. Наиболь-
шее число электронов на энергетическом уровне опреде-
ляется формулой N = 2п2, где N — максимальное число
электронов на энергетическом уровне; п — номер уров-
ня, или главное квантовое число. Электроны внутри ка-
кого-то одного электронного уровня могут отличаться друг
от друга энергией и поэтому имеют орбитали различных
форм. Количество орбиталей для каждого значения п
равно квадрату главного квантового числа.
Второе квантовое число I, называемое орбитальным
(побочным) квантовым числом, характеризует энергию
электрона на подуровнях внутри электронного уровня и
форму электронного облака. При заданном квантовом
числе I может принимать любые целочисленные значе-
нх’я от 0 до (п - 1) и обозначается строчными буквами
латинского алфавита: I = 0 (s-подуровень); 1=1 (р-поду-
ровень); 1 = 2 (d-подуровень); I = 3 (f-подуровень) и т. д.
Число возможных подуровней в каждом энергетическом
уровне совпадает с порядковым номером электронного
слоя, но фактически ни один энергетический уровень не
содержит больше четырех подуровней.
Третье квантовое число носит название магнит-
ного. Оно определяет ориентацию орбиталей в простран-
стве и при заданном орбитальном квантовом числе при-
нимает любые целочисленные значения от -I до +1, вклю-
чая нулевое значение, т. е. всего имеет (21 + 1) значений.
Магнитное квантовое число есть вектор, поэтому ему со-
ответствует не только определенное числовое значение,
но и направление, выраженное в знаках (+) и (-). Орбита-
ли с различными магнитными квантовыми числами, но с
одинаковыми главным и побочным квантовыми числа-
ми характеризуются одной и той же энергией.
Четвертому квантовому числу та — спиновому не
придают какого-либо образа и считают его чисто кванто-
во-механической величиной, принимающей два значения:
± 1/2.
Важным положением современной теории строения
91
атома является принцип Паули, применяющийся при
заполнении орбиталей. Он формулируется следующим
образом: в атоме не может быть двух электронов с
одинаковыми значениями всех четырех квантовых чи-
сел. Из этого следует, что на каждой орбитали может
находиться не более двух электронов, спины которых
имеют противоположные знаки.
Именно принцип Паули позволил рассчитать макси-
мальное число электронов на каждом энергетическом
уровне и подуровне в атоме. В таблице 1 показана связь
главного квантового числа с числом подуровней, типом и
количеством орбиталей и максимальным числом элек-
тронов на подуровнях и уровнях для элементов первых
четырех периодов.
Таблица 1
Главное квантовое число, типы и число орбиталей,
а также максимальное число электронов
на подуровнях и энергетических уровнях
Энергети- ческий подуровень Число под- уровней Орби- тали Число орбиталей Максимальное число электронов
в под- уровне В уровне в под- уровне В уровне
К(га= 1) 1 1s 1 1 2 2
L (га = 2) 2 2s 1 4 2 8
2р 3 6
М (га = 3) 3 3s 1 9 2 18
Зр 3 6
3d 5 10
N(ra = 4) 4 4s 1 16 2 32
4р 3 6
4d 5 10
4f 7 14
92
Вопросы для самостоятельного решения
1. В чем сущность опытов по изучению электриче-
ских разрядов в газах?
2. Какая информация о строении атома была получе-
на при изучении явления электролиза?
3. Дайте определение явления радиоактивности. Кем
было открыто это явление? Какие ученые внесли боль-
шой вклад в изучение радиоактивности?
4. Чем отличается естественная радиоактивность от
искусственной?
5. Что собой характеризует период полураспада? Кем
было введено в науку это понятие?
6. В чем сущность теории строения атома, предложен-
ной Дж. Томсоном? Каковы недостатки и достоинства этой
теории?
7. В чем сущность теории строения атома, предложен-
ной Э. Резерфордом?
8. Что явилось экспериментальной основой планетар-
ной (ядерной) модели строения атома?
9. Каковы недостатки и достоинства планетарной тео-
рии строения атома?
10. Сформулируйте основные постулаты теории стро-
ения атома по Н. Бору.
11. Раскройте смысл и поясните значение атомной
теории Бора.
12. Отметьте недостатки теории строения атома по Бору.
13. Какие эксперименты свидетельствуют о волновой
природе электрона?
14. Изложите основные положения современной тео-
рии строения атома.
15. Укажите физический смысл квантовых чисел. В
каких пределах меняются численные значения этих ве-
личин?
16. Какова форма s-, р- и d-орбиталей?
17. Какова пространственная направленность р-орби-
талей?
18. Как определяется максимальное число электронов
на энергетическом уровне? Какой принцип лежит в осно-
ве расчета числа электронов в уровне?
93
19. Какое максимальное число электронов может со-
держать атом на энергетическом уровне с главным кван-
товым числом п - 4?
20. Какой зависимостью выражается связь между
количеством орбиталей на уровне и главным кванто-
вым числом?
Электронная конфигурация атомов
Расположение электронов по энергетическим уровням
и орбиталям называется электронной конфигурацией.
Конфигурация может быть изображена в виде так назы-
ваемых электронных формул, в которых цифрой впереди
указан номер энергетического уровня, затем буквой обо-
значен подуровень, а вверху справа от буквы — число элек-
тронов на данном подуровне. Сумма последних чисел со-
ответствует величине положительного заряда ядра атома.
Например, электронные формулы серы и кальция бу-
дут иметь следующий вид:
S (+ 16) — ls22s22p63s23p4,
Са (+ 20) — ls22s22p63s23p64s2.
Заполнение электронных уровней осуществляется в со-
ответствии с принципом наименьшей энергии: наиболее
устойчивому состоянию электрона в атоме отвечает состо-
яние с минимальным значением энергии. Поэтому вначале
заполняются слои с наименьшими значениями энергии.
Советский ученый В. Клечковский установил, что энергия
электрона возрастает по мере увеличения суммы главного
и орбитального квантовых чисел (n +1), поэтому заполне-
ние электронных слоев происходит в порядке увеличения
суммы главного и орбитального квантовых чисел. Если для
двух подуровней суммы (п +I) равны, то сначала идет за-
полнение подуровней с наименьшим п и наибольшим I, а
затем подуровней с большим п и меньшим I.
Пусть, к примеру, сумма (n + I) = 5. Этой сумме соот-
ветствуют следующие комбинации пи I: п = 3; I = 2; п = 4;
1=1; п = 5; 1 = 0. Исходя из этого, вначале должно идти
заполнение d-подуровня третьего энергетического уров-
94
ня, далее должен заполняться 4р-подуровень и лишь пос-
ле этого s-подуровень пятого энергетического уровня.
Все вышеразобранное определяет следующий порядок
заполнения электронов в атомах:
Is2 -* 2s2 -» 2р6 -* 3s2 Зр6 -» 4s2 -» 3d10 -» 4р6 -»
-* 5s2 -* 4d10 -* 5р6 — 6s2 -» 4f14 -* 5d10 6s2 -*
-» 6p6 -» 7s2 -* 5f14 6d10 -» 7p6.
Пример 1
Изобразите электронную формулу атома натрия.
Решение:
Исходя из положения в периодической системе, ус-
танавливают, что натрий является элементом тре-
тьего периода. Это свидетельствует о том, что элек-
троны в атоме натрия располагаются на трех энер-
гетических уровнях. По порядковому номеру
элемента определяют суммарное количество элект-
ронов на этих трех уровнях — одиннадцать. На пер-
вом энергетическом уровне (n = 1, I — 0; s-подуро-
вень) максимальное число электронов равно N = 2п2,
N = 2. Распределение электронов на s-подуровне I
энергетического уровня отображают записью — 1s2.
На II энергетическом уровне п = 2, 1 = 0 (s-подуро-
вень) и 1 = 1 (р-подуровень) максимальное число
электронов равно восьми. Так как на S-подуровне
располагается максимальное 2ё, на р-подуровне бу-
дет 6ё. Распределение электронов на II энергетиче-
ском уровне отображают записью — 2s22p6. На тре-
тьем энергетическом уровне возможны S-, р- и d-
подуровни. У атома натрия на III энергетическом
уровне располагается только один электрон, кото-
рый, согласно принципу наименьшей энергии, зай-
мет Зе-подуровень. Объединяя записи распределе-
ния электронов на каждом слое в одну, получают
электронную формулу атома натрия: ls22s22p63sx.
Положительный заряд атома натрия (+11) компен-
сируется суммарным количеством электронов (11).
95
Кроме того, структура электронных оболочек изоб-
ражается с помощью энергетических или кванто-
вых ячеек (орбиталей) — это так называемые гра-
фические электронные формулы. Каждая такая
ячейка обозначается прямоугольником | |, элект-
рон t, направление стрелки характеризует спин
электрона. По принципу Паули в ячейке (орбита-
ли) размещается один (неспаренный) или два (спа-
ренных) электрона. Электронную структуру атома
натрия можно представить схемой:
tl U tl 3s
tl
2р
„Na
п 2s
Is
При заполнении квантовых ячеек необходимо знать
правило Гуида: устойчивому состоянию атома соответ-
ствует такое распределение электронов в пределах энер-
гетического подуровня (р, d, f), при котором абсолютное
значение суммарного спина атома максимально. Так, если
два электрона займут одну орбиталь |ц| | |, то их сум-
марный спин будет равен нулю. Заполнение электронами
двух орбиталей | т 111 I даст суммарный спин, равный еди-
нице.
Исходя из принципа Гунда, распределение электронов
по квантовым ячейкам, например, для атомов 6С и 7N бу-
дет следующим:
t t
u
2р
u 2s
Is
96
Вопросы и задачи
для самостоятельного решения
1. Перечислите все основные теоретические положе-
ния, необходимые для заполнения злектронов в атомах.
2. Покажите справедливость принципа наименьшей
энергии на примере заполнения электронов в атомах каль-
ция и скандия, стронция, иттрия и индия.
3. Какая из графических электронных формул атома
фосфора (невозбужденное состояние) является правиль-
ной? Ответ мотивируйте с привлечением правила Гунда.
97
4. Напишите все квантовые числа для электронов ато-
мов:
а) натрия, кремния;
б) фосфора, хлора;
в) серы, аргона.
5. Составьте электронные формулы атомов s-элемента
первого и третьего периодов.
6. Составьте электронную формулу атома р-элемента
пятого периода, внешний энергетический уровень кото-
рого имеет вид 6s26p5. Каковы его химические свойства?
7. Изобразите распределение электронов по орбита-
лям в атомах кремния, фтора, криптона.
8. Составьте электронную формулу элемента, в атоме
которого энергетическое состояние двух электронов внеш-
него уровня описывается следующими квантовыми чис-
лами: п = 5; Z = 0; тп, = 0; та = + 1/2; тп8 =-1/2.
9. Внешние и предпоследние энергетические уровни
атомов имеют следующий вид:
a) 3d24s2;
б) 4d105s1;
в) 5s25p6.
Составьте электронные формулы атомов элементов. Ука-
жите р- и d-элементы.
10. Составьте электронные формулы атомов d-элемен-
тов, у которых на d-подуровне 5 электронов.
11. Изобразите распределение электронов по кванто-
вым ячейкам в атомах калия, хлора, неона.
12. Наружный электронный слой элемента выражает-
ся формулой 3s23p4. Определите порядковый номер и
название элемента.
13. Напишите электронные конфигурации следующих
ионов:
a) Na+; Са2+ б) S4+; S6+
14. Содержат ли атомы О, Mg, Ti электроны М-уровня?
15. Какие частицы атомов являются изоэлектронны-
ми, т. е. содержат одинаковое число электронов: Mg2+,
Na+, Si4+; Р3~?
16. Сколько электронных уровней у атомов в состоя-
нии S2’, S4+, S6+?
98
17. Сколько свободных d-орбиталей в атомах Sc, Ti, V?
Напишите электронные формулы атомов этих элементов.
18. Укажите порядковый номер элемента, у которого:
а) заканчивается заполнение электронами 4d-noflypoB-
ня;
б) начинается заполнение электронами 4р-подуровня.
19. Укажите особенности электронных конфигураций
атомов меди и хрома. Какое число 4з-электронов содер-
жат атомы этих элементов в устойчивом состоянии?
20. Сколько вакантных Зр-орбиталей имеет в стацио-
нарном и возбужденном состоянии атом кремния?
Строение атомных ядер.
Ядерные реакции
По современным представлениям положительно заря-
женное ядро состоит из протонов и нейтронов (Д. И. Ива-
ненко, Е. Н. Гапон, 1932 г.). Масса протона (р) равна
1,0073 а. е. м., а величина заряда + 1. Нейтрон (п) пред-
ставляет собой электронейтральную частицу с массой
1,0087 а. е. м. Обе эти частицы рассматриваются как
два различных состояния ядерной частицы нуклона. Ко-
личество протонов в ядре равно порядковому номеру эле-
мента Z, а количество нейтронов (N) равно разности меж-
ду массовым числом А и порядковым номером элемен-
та N = A-Z. Массовое число ядра — целое число, равное
сумме протонов и нейтронов в ядре данного атома. Нук-
лоны связаны между собой особыми ядерными силами.
Не всякая комбинация нуклонов в ядре устойчива. За-
мечено, что количество протонов в ядре всегда равно или
меньше количества нейтронов. Процессы, приводящие к
уменьшению числа нейтронов (и росту числа протонов),
приводят к упрочению ядер атомов. По современным
представлениям ядро имеет оболочечное строение — про-
тоны и нейтроны в ядре независимо друг от друга рас-
пределяются по ядерным оболочкам и подоболочкам.
Еще в 1910 г. был установлен факт существования ато-
мов одного и того же элемента с разными атомными мас-
сами (Ф. Содди). Эти разновидности атомов, имеющие
99
одинаковый заряд ядра, но разные массовые числа, были
названы изотопами. Изотопы характеризуются содер-
жанием одного и того же количества протонов (р) в яд-
рах атомов, но различного количества нейтронов (п).
Каждый изотоп характеризуется двумя величинами —
массовым числом (проставляется вверху слева от сим-
вола соответствующего элемента) и порядковым номе-
ром элемента (проставляется внизу слева). Например,
изотоп калия с массовым числом 39 записывается так:
39tz
19К.
Рассматривая изотопы различных элементов, нетруд-
но заметить существование таких, у которых разные за-
ряды, но одинаковые массовые числа. Атомы различных
элементов, имеющие одинаковые массовые числа, но раз-
личные величины зарядов ядер, называются изобарами.
Например, изотопы ^Ве, j°B, 13С.
У изобар одинаковое общее число нуклонов в ядре, но
различное число протонов (р) и нейтронов (п).
В связи с открытием изотопов возник вопрос об уточ-
нении понятия химического элемента. Химическим эле-
ментом называют совокупность атомов с одинаковым
положительным зарядом ядра. Поскольку элемент пред-
ставляет из себя совокупность изотопов, естественно, что
его атомная масса должна быть средней величиной мас-
совых чисел всех его изотопов, с учетом их распростра-
ненности в природе.
_ AjCi + А2С2 + А3С3 + ...
4 100
где Ач — атомная масса элемента, Ар А2; А3... — массо-
вые числа изотопов, а Сд; С2; С3... — их молярные доли в
природе.
Наряду со стабильными изотопами химических эле-
ментов, существующими в природе, получено большое
количество искусственных радиоактивных изотопов.
Последние получают с помощью ядерных реакций —
превращений атомных ядер в результате их взаимодей-
ствия с элементарными частицами или друг с другом. При
изображении уравнений ядерных реакций соблюдаются
законы сохранения массы и заряда. Это означает, что
100
сумма масс и зарядов в правой части уравнения должна
быть равна сумме масс и зарядов в левой части уравне-
ния.
Например:
2*А1 + |Н = ^Mg + gHe
Пример 1
Ядро атома содержит 30 нейтронов, электронные обо-
лочки — 25 электронов. Укажите, в состав изотопа
какого элемента входит ядро данного атома.
Решение:
Количество электронов равно количеству протонов
в ядре атома, равно порядковому номеру элемента,
т. е. Z = 25. Массовое число
А = Z + N = 25 + 30 = 55.
Исходя из этого констатируют, что это изотоп мар-
ганца с массовым числом 55 — ^Мп.
Пример 2
Рассчитайте количество протонов и нейтронов, со-
держащихся в ядре изотопа с массовым числом
238 и зарядом ядра 92.
Решение:
Заряд ядра (Z) численно равен числу протонов. А
количество нейтронов рассчитывают из выражения
N = А - Z = 238 - 92 = 146.
а Пример 3
Медь СОСТОИТ ИЗ двух ИЗОТОПОВ ggCu И 29^U'
Атомная масса меди равна 63,54. Определите мо-
лярные доли каждого из изотопов в природе.
Решение:
Обозначим молярную долю изотопа 29С11 через х %,
101
а изотопа 2|Cu — (100 - х) %. Выражение, связыва-
ющее значение атомной массы элемента с массовы-
ми числами изотопов и их молярными долями, име-
ет следующий вид:
65x4-63 (100-х) ппа.
63,54 -----------------, отсюда х = 27 %.
100
Ответ: «|Си — 27%; f|Cu — 73 %.
Пример 4
Природный литий состоит из двух стабильных изо-
топов 6Li (7,3 %) и 71д (92,7%). Рассчитайте из
этих данных атомную массу лития.
Решение:
л _ -A-iCi 4- А2С2
4 100
6-7,3 4- 7-92,7
100
= 6,927.
Ответ: Ач = 6,927.
Пример 5
Составьте уравнение ядерной реакции:
2|®Ри 4-2Не = 9п 4-...
Решение:
Сумма массовых чисел в левой части уравнения
239 4- 4 — 243. Вследствие равенства сумм массовых
чисел в правой части уравнения сумма массовых
чисел также должна быть 243, значит, массовое чис-
ло нового элемента 242. Сумма зарядов частиц в
левой части уравнения 94 4- 2 = 96. Частицы пра-
вой части уравнения должны иметь суммарный заряд
96. Нейтрон заряда не имеет, значит, новый элемент
имеет заряд 96. Этим элементом будет изотоп кю-
рия.
Уравнение ядерной реакции в полном виде:
2|®Ри 4-2Не = 9п 4-2g2Cm
102
Пример 6
Определите, изотоп какого элемента получится, если
ядро урана потеряет четыре а-частицы, две Р-части-
цы.
Решение:
Известно, что при испускании а-частицы массовое
число уменьшается на четыре единицы, а заряд
ядра — на две. В периодической системе элемент
смещается на две клетки влево (правило сдвига).
При испускании р-частицы массовое число ядра
атома не изменяется, а заряд ядра увеличивается на
единицу. В периодической системе элемент смеща-
ется на одну клетку вправо. В результате излуче-
ния 4-х а-частиц заряд ядра уменьшается на 8, а
массовое число на 16 единиц, т. е. образуется изо-
топ элемента, заряд ядра которого равен 92 - 8 = 84,
а массовое число 238- 16 = 222. При излучении
ядром 2-х Р-частиц массовое число практически не
изменится, а положительный заряд ядра возрастет
на две единицы. Следовательно, образовавшийся при
распаде изотоп имеет заряд 86, а массовое число
изотопа равно 222. Это изотоп радона: 2g|Rn.
Пример 7
Какой элемент образуется при испускании позит-
рона изотопом фосфора 3°Р? Напишите эту ядер-
ную реакцию.
Решение:
Поскольку позитрон е+ имеет единичный положи-
тельный заряд, в процессе распада образуется эле-
мент с зарядом на единицу меньше, чем у исходно-
го изотопа (15 - 1 = 14). Это будет изотоп кремния.
Масса его останется без изменения.
Ядерная реакция изобразится следующим уравне-
нием:
3°Р = 3°Si + е+.
103
Вопросы и задачи
для самостоятельного решения
1. Кем и когда была предложена теория строения ядер
атомов?
2. Какие элементарные частицы входят в состав ядер
атомов? Дайте их характеристику.
3. Как определяют количество нейтронов и протонов в
ядрах атомов, исходя из положения элементов в периоди-
ческой системе?
4. Какое практическое применение находят нейтро-
ны?
5. Что представляет собой цепная реакция? Когда и
кем она была открыта?
6. Что такое «меченые атомы»? Укажите область их
практического применения.
7. Что такое ядерные реакции? Укажите область их
практического применения.
8. Приведите формулировку правила сдвига.
9. Укажите количество протонов и нейтронов в ядрах
следующих изотопов:
a) n53Sn; 1200Sn; 1210Sn; 123Sn;
6) 233T1; 2gjTl;
в) 18°Та; 1313Та.
10. Каков состав ядер атомов элементов, имеющих по-
рядковые номера 33, 78, 92? Составьте электронные фор-
мулы атомов этих элементов.
11. Атомная масса бора 10,811 а. е. м. В природе он
встречается в виде изотопов с массовыми числами 10 и
11. Рассчитайте молярные доли каждого изотопа бора в
природе.
Ответ: 105В — 18,9%; П5В — 81,1%.
12. Почему у большинства элементов в периодической
системе дробные значения атомных масс?
13. Азот состоит из изотопов с массовыми числами 14
и 15, а водород из изотопов с массовыми числами 1 и 2.
Сколько различных видов молекул содержит обычный
аммиак?
104
14. Природный рубидий состоит из изотопов с массо-
выми числами 85 и 87 и содержит 72,8 % первого и 27,2 %
второго изотопа. Рассчитайте атомную массу элемента.
Ответ: 85,54.
15. Природный калий представляет собой смесь трех
изотопов с массовыми числами 39 (93,10 %), 40 (0,01 %)
и 41. Найдите атомную массу калия.
Ответ: 39,14.
16. По каким признакам могут отличаться друг от
друга атомы одного и того же элемента? Как называются
такие атомы? Приведите примеры.
17. Природная медь состоит из изотопов с массовыми
числами 63 и 65. Отношение числа атомов этих изотопов
8:3. Рассчитайте атомную массу элемента.
Ответ: 63,54.
18. Закончите уравнения следующих ядерных реак-
ций:
6*Ni -ИН -» 6?qCu + ...
АО 1 А У
|3Сг + 2Не-* |4Мп + ...
105В + 4Не
19. К какой группе периодической системы принадле-
жит элемент, получившийся путем последовательного
распада из тория, если при этом образовалось две а- и
одна р-частицы? Какова его атомная масса? С каким из
стоящих в таблице элементов он сходен по химическим
свойствам?
20. Какой объем при н. у. займет гелий, образовав-
шийся вследствие превращения в свинец 2||РЬ одного моль
тория (массовое число 232)?
Ответ: 134,4 л.
21. Изотоп какого элемента получится в результате
последовательного распада атома тория Th, при котором
образуется 5 а- и 5 р-частиц?
Ответ: астат.
22. При последовательных радиоактивных превраще-
ниях ядра выделилась одна а- и две р-частицы. Изменит-
ся ли в результате этих превращений масса и заряд ядра?
Ответ: Изменится масса ядра.
105
23. Природный бром содержит два изотопа. Моляр-
ная доля изотопа 79Вг равна 55%. Какой еще изотоп
входит в состав элемента брома, если его относительная
атомная масса равна 79,9?
Ответ: 81Вг.
24. Внешние и предпоследние энергетические уровни
атомов имеют вид:
a) 4d105s1;
б) 5s25p6;
в) 3d24s2.
Сколько протонов и нейтронов содержится в ядрах
атомов этих элементов?
25. Написать уравнение ядерной реакции получения
ядра атома 2 ^Ne при бомбардировке ядер 1gF протонами.
Периодический закон
и периодическая система Д. И. Менделеева
в свете учения о строении атома
Новейшие представления о строении атома расширили
и уточнили сведения о периодическом законе, объяснили
многие вопросы, ответы на которые не мог дать периоди-
ческий закон в первоначальной формулировке Д. И. Мен-
делеева. Представление о величине заряда ядра как об оп-
ределяющем свойстве атома легло в основу современной
формулировки периодического закона Д. И. Менделеева:
свойства химических элементов, а также формы и свой-
ства соединений этих элементов находятся в периодичес-
кой зависимости от величины заряда ядер их атомов. Со-
временная формулировка закона позволила объяснить ка-
жущееся нарушение принципа расположения элементов в
периодической системе в порядке возрастания атомных
масс для четырех пар элементов Аг — К, Со — Ni, Те — I,
Th — Ра. Она позволила объяснить причину периодичес-
кого повторения свойств элементов, которая заключается
в периодическом повторении строения электронных кон-
фигураций атомов. По сходности строения электронных
106
уровней атомов все элементы периодической системы
разделили на четыре семейства: s-, р-, d- и f-элементы. В
свете учения о строении атомов становится понятным
расположение всех элементов в семи периодах, приведенное
Д. И. Менделеевым. Номер периода соответствует числу
энергетических слоев, а последовательность размещения
электронов по энергетическим слоям позволяет объяснить
ослабление металлических и усиление неметаллических
свойств элементов слева направо в пределах одного перио-
да. Легко объяснимым стал и тот факт, почему изменение
химических свойств элементов больших периодов от ти-
пично металлических до неметаллических происходит зна-
чительно медленнее, чем в малых. Это связано с тем, что в
четных рядах больших периодов по мере увеличения по-
ложительного заряда ядра количество электронов во внеш-
нем слое остается постоянным (один или два электрона).
Именно этим и обуславливаются металлические свойства
переходных металлов (так называют элементы, у которых
происходит заполнение d- или f-орбиталей).
В нечетных рядах больших периодов, где заполнение
предпоследнего электронного уровня уже закончено, про-
исходит достройка внешнего слоя до восьми электронов;
по мере увеличения заряда ядра и числа электронов в
наружном слое металлические свойства переходят в не-
металлические, как и в малых периодах.
Легко объяснимо деление групп на подгруппы, также
основанное на различии в заполнении электронами энерге-
тических уровней. У элементов главных подгрупп заполня-
ются или s-, или р-подуровни внешних уровней. У элемен-
тов побочных подгрупп заполняются более глубоко распо-
ложенные d- или f-подуровни. Таким образом, в каждой
подгруппе объединены элементы, атомы которых имеют
сходное строение внешнего электронного уровня.,При этом
атомы элементов главных подгрупп содержат на внешних
уровнях число электронов, равное номеру группы. Побоч-
ные же подгруппы включают элементы, атомы которых
содержат на внешнем уровне по одному или по два элект-
рона. Эти различия в строении обуславливают и различие
в свойствах элементов, находящихся в разных подгруппах
одной группы. Но у элементов отдельных подгрупп перио-
107
дической системы есть и общее свойство, которое заключа-
ется в том, что все они для образования химических связей
могут максимально использовать количество электронов,
равное номеру группы. При этом у элементов побочных
подгрупп валентными являются электроны не только внеш-
них, но и предпоследних уровней.
Теория строения атома объясняет причину изменения
свойств элементов в группах. Рост радиусов атомов эле-
ментов по мере увеличения положительного заряда ядер
приводит к тому, что электроны удерживаются слабее.
Поэтому в группах сверху вниз усиливаются металли-
ческие свойства элементов.
Подводя итог рассмотрению данного вопроса, приведем
таблицу 2, иллюстрирующую связь свойств элементов со стро-
ением их атомов и положением в периодической системе.
Таблица 2
Периодичность изменения химических и физических
свойств элементов главных подгрупп
Свойства Изменение
В главных подгруппах В периодах
Металлические возрастают | возрастают *-
Неметаллические возрастают f возрастают -*
Высшая валентность по кислороду постоянна возрастает I -* VII
Высшая валентность по водороду постоянна возрастает I _ IV <- VII
Электроотрицательность в осн. возрастает f возрастает -*
Плотность простых веществ возрастает -* возрастает I *- IV -* VII
Температура плавления и кипения металлов возрастает f
Температура плавления и кипения неметаллов возрастает 1
108
Вопросы и задачи
для самостоятельного решения
1. «Периодическому закону будущее не грозит разру-
шением, а только надстройки и развитие быть обещают-
ся». Кому принадлежит данное высказывание?
2. Кем и когда открыт периодический закон? Какова
его формулировка?
3. В какой группе периодической системы находится
элемент, названный в честь России, и кем он был от-
крыт?
4. Что называется группой периодической системы?
Что характеризует номер группы? Покажите изменение
свойств элементов на примере подгруппы галогенов.
5. Что называется периодом? Охарактеризуйте изме-
нение свойств на примере элементов третьего периода.
6. Поче?лу группа делится на главную и побочную под-
группы? Объясните на примере первой группы.
7. Сколько элементов во II, V, VI периодах? Как изменя-
ются свойства элементов при переходе от одного периода
к началу следующего? Составьте электронные формулы
атомов первого и последнего элементов V периода.
8. В какрй части периодической системы находятся
типичные металлы и типичные неметаллы?
9. В первом периоде периодической системы находят-
ся только два элемента — водород и гелий. Остальные
клетки свободны. Можно ли ожидать открытия новых
элементов, которые будут размещены в первом периоде?
Сколько электронов максимально может быть на первом
энергетическом уровне?
10. В периодической системе элементов принято водо-
род записывать дважды — в первой и седьмой группах.
Какие свойства водорода служат основанием для того,
чтобы считать его аналогом щелочных металлов и гало-
генов?
11. Почему в периодах слева направо усиливаются
неметаллические свойства? Составьте электронную схе-
му и электронные формулы атомов:
а) элемента, обладающего самыми сильными окисли-
тельными свойствами;
109
б) элемента, обладающего самыми сильными восстано-
вительными свойствами.
12. Объясните, исходя из строения атомов, как изменя-
ются окислительные и восстановительные свойства эле-
ментов в группах периодической системы с увеличением
порядкового номера.
13. Составьте электронную формулу атома палладия.
Какая особенность в строении электронной оболочки у
атома этого элемента?
14. Охарактеризуйте элементы V группы, исходя из
строения атомов и положения их в периодической систе-
ме.
15. Составьте формулы кислородных и водородных
соединений элементов IV группы. Укажите их степени
окисления.
16. Атомная масса аргона (39,9) больше, чем калия
(39,1), а атомная масса кобальта (58,9) больше, чем нике-
ля (58,7), однако Д. И. Менделеев поставил в периодиче-
ской системе аргон перед калием, а кобальт перед нике-
лем. Докажите, что они правильно размещены в системе.
17. В чем особенность электронного строения атомов
лантаноидов и актиноидов? Какая связь существует меж-
ду строением атомов и свойствами лантаноидов?
18. В каких группах и подгруппах периодической си-
стемы расположены металлы? Составьте электронную
схему атома металла IV периода, который может иметь
максимальную степень окисления +7.
19. Почему у элемента седьмой группы — марганца
преобладают металлические свойства, тогда как стоящие
в той же группе галогены являются типичными неметал-
лами?
20. Какой из элементов четвертой группы, титан или
германий, проявляет более выраженные металлические
свойства?
21. С каким из двух элементов молибден более сходен
по строению атома — с селеном или хромом?
22. Максимальная валентность элемента по кислоро-
ду семь, на внешней электронной оболочке два электрона.
Образует ли этот элемент летучее соединение с водоро-
дом?
110
23. Элемент, высший солеобразующий оксид которого
имеет формулу Э02, образует с водородом соединение, где
содержание водорода 25 %. Что это за элемент?
Ответ: углерод.
24. Оксид элемента пятой группы содержит 56,33 %
кислорода. Назовите этот элемент.
Ответ: фосфор.
25. При отщеплении воды от 80 г одноосновной кисло-
ты, образованной элементом пятой группы, получилось
71 г оксида. Каким элементом образована кислота? Ка-
кова формула кислоты?
Ответ: НРО3.
5
Химическая связь
и строение молекул
Основные понятия химической связи
Под химической связью понимают взаимодействие
атомов, приводящее к образованию молекул простых и
сложных веществ, а также кристаллов. Химическая связь
возникает благодаря взаимодействию электрических по-
лей, создаваемых электронами и ядрами атомов, участву-
ющих в образовании молекулы или кристалла. Процесс
этого взаимодействия может протекать различным об-
разом. Поэтому в настоящее время различают три основ-
ных типа химических связей: ковалентную, ионную и
металлическую.
Прежде чем рассматривать каждый тип связи, отме-
тим, что обязательным условием образования молекул
или кристаллов является уменьшение потенциальной
энергии системы взаимодействующих атомов, так как в
обычных условиях молекулярное или кристаллическое
состояние устойчивее, чем атомное. Важными характе-
ристиками химической связи, определяемыми современ-
ными инструментальными методами, являются прочность
и длина.
Мерой прочности химической связи является энергия
связи. Ее величина определяется работой, необходимой
для разрушения связи, или выигрышем в энергии при
образовании вещества из отдельных атомов.
Вторая фундаментальная характеристика связи — ее
длина. Под длиной связи понимают расстояние между
центрами ядер атома в молекуле или кристалле.
112
Ковалентная связь
Работы американского ученого Дж. Льюиса (1916 г.),
высказавшего предположение, что химическая связь воз-
никает посредством образования электронных пар, одно-
временно принадлежащим двум атомам, явились осно-
вой для разработки теории ковалентной связи. Согласно
современным представлениям, образование общих элект-
ронных пар происходит посредством неспаренных элект-
ронов взаимодействующих атомов, причем они должны
иметь антипараллельные спины. Атомы же с неспарен-
ными электронами, имеющими параллельные спины, от-
талкиваются, и химическая связь между ними не возни-
кает.
Химическая связь, осуществляемая общими электрон-
ными парами, называется атомной или ковалентной. Со-
ответственно, соединения с этой связью называются атом-
ными. Ковалентная связь двухэлектронная и двухцентро-
вая (удерживает два ядра). Различают две ее разновидности:
неполярную и полярную.
В случае ковалентной неполярной связи электронное
облако, образованное общей электронной парой, распреде-
ляется в пространстве симметрично относительно ядер
обоих атомов (например, в молекуле водорода).
В случае ковалентной полярной связи электронное
облако смещено к атому с большей электроотрицатель-
ностью (например, в молекуле хлороводорода). Под пос-
ледней понимают условную величину, характеризующую
относительную способность атома в молекуле притяги-
вать к себе электроны.
Способ образования ковалентной связи, когда каждый
из взаимодействующих атомов представляет электроны
для образования общих электронных пар, носит название
обменного механизма. Нередко число образуемых эле-
ментом связей превосходит число неспаренных электро-
нов в его атомах. Это связано с тем, что кроме рассмотрен-
ного механизма образования ковалентной связи существу-
ет и иной, заключающийся в том, что один из атомов
представляет для этого процесса уже готовую (неподелен-
ную) электронную пару, а другой — свободную орбиталь
113
(например, при образовании катиона аммония). Первый
атом (азот) носит название донора, а второй (водород) —
акцептора. Механизм образования ковалентной связи за
счет неподеленной электронной пары донора и свободной
орбитали акцептора носит название донорно-акцептор-
ного.
Атомы обладают различными возможностями для об-
разования ковалентных связей. Связи могут образовы-
ваться и за счет неспаренных электронов, появляющихся
в результате возбуждения атома, и, наконец, по донорно-
акцепторному механизму. Однако общее число ковалент-
ных связей, которое способен образовывать каждый кон-
кретный атом, ограничено. Оно определяется общим чис-
лом тех валентных орбиталей, использование которых
для образования ковалентных связей оказывается энер-
гетически выгодным. Эта способность атома участвовать
в образовании ограниченного числа ковалентных связей
получила название насыщаемости ковалентной связи.
Очень существенно влияние способа перекрывания
электронных облаков. Химическая связь, образованная
перекрыванием электронных облаков вдоль оси, соеди-
няющей центры взаимодействующих атомов, называется
а-связью.
Связь, образованная в результате перекрывания элек-
тронных облаков, расположенных перпендикулярно оси,
соединяющей центры атомов, называется зг-связью.
Распределение электронной плотности в молекуле
зависит не только от характера отдельных связей в ней
(б- или л-связей), но и от того, как расположены в про-
странстве связывающие электронные пары. Определенное
взаимное расположение связывающих электронных обла-
ков, называемое направленностью химической связи, при-
водит к определенному расположению в пространстве ядер
химически связанных атомов. Пространственная направ-
ленность ковалентной связи характеризуется углами между
образуемыми связями, которые носят название валентных
углов. Для объяснения пространственного строения моле-
кул используется представление о гибридизации валент-
ных орбиталей в данном атоме в процессе образования им
химических связей.
114
Под гибридизацией понимают процесс перестройки
неравноценных по форме и энергии электронных обла-
ков, приводящий к образованию гибридных облаков, оди-
наковых по форме и энергии. При этом число гибридных
орбиталей равно числу исходных.
В зависимости от числа участвующих в гибридиза-
ции р-орбиталей гибридные орбитали имеют различную
пространственную ориентацию. Так, у атома, имеющего
один s-электрон и один р-электрон, будут возникать две
гибридные орбитали, расположенные друг относительно
друга под углом 180°. Гибридизация одной s-орбитали и
двух р-орбиталей (8р2-гибридизация) приводит к образо-
ванию трех гибридных орбиталей, расположенных в плос-
кости под углом 120°. Гибридизация одной s- и трех
р-орбиталей (8р3-гибридизация) приводит к образованию
четырех гибридных орбиталей. Они симметрично распо-
ложены в пространстве и ориентированы к вершинам
тетраэдра под углом 109° 23'.
В высшей школе рассматривают и более сложные виды
гибридизации с участием d- и f-орбиталей.
Ионная связь
Первые представления об ионной связи были введены
В. Косселем (1916 г.), который полагал, что реакционная
способность элементов сводится к стремлению их атомов
приобрести электронную конфигурацию благородных
газов. Образование таких конфигураций является след-
ствием полного перехода электронов от атомов одних
элементов к другим. Образующиеся при этом разноименно
заряженные ионы удерживаются силами электростати-
ческого притяжения.
Химическая связь, осуществляемая посредством элект-
ростатического притяжения ионов, получила название
ионной связи, а соединения, образованные таким путем, —
ионных соединений. Эти соединения характеризуются вы-
сокими температурами плавления и кипения; при раство-
рении в воде или плавлении проявляют свойства сильных
электролитов.
115
Однако в процессе развития теории химической свя-
зи было выяснено, что даже в типично ионных соедине-
ниях, например в галидах щелочных металлов, не проис-
ходит полного перехода электронов от одних атомов к
другим.
Таким образом, идеально ионных соединений не суще-
ствует, современная теория химической связи объясняет
образование ионной связи из ковалентной путем предель-
но возможного смещения общей электронной пары. В
отличие от ковалентной связи ионная связь не обладает
направленностью и насыщенностью.
Металлическая связь
По строению электронной оболочки атомов к метал-
лам относят все s-элементы, кроме водорода и гелия,
все d- и f-элементы и ряд р-элементов — алюминий,
олово, свинец и др. Металлы в конденсированном (жид-
ком или твердом) состоянии обладают способностью к
отражению света, высокой тепло- и электропроводнос-
тью, пластичностью и текучестью. Они имеют сравни-
тельно высокие температуры плавления и кипения. Эти
специфические свойства металлов объясняются нали-
чием у них особого типа химической связи, получив-
шей название металлической, связи. Атомы металлов
содержат на внешнем энергетическом уровне неболь-
шое количество электронов, которые достаточно слабо
связаны со своим ядром. В то же время атомы метал-
лов имеют много свободных валентных орбиталей. Эти
орбитали отдельных атомов перекрываются друг с дру-
гом, обеспечивая электронам способность свободно пе-
ремещаться между ядрами во всем объеме металла.
Следовательно, в кристаллической решетке металлов
электроны обобществлены. Они непрерывно перемеща-
ются между положительно заряженными ионами, ко-
торые расположены в узлах кристаллической решет-
ки. При этом сравнительно небольшое число обобще-
ствленных электронов («электронного газа») связывает
большое число ионов.
116
Химическая связь, образующаяся в результате элект-
ростатического притяжения между ионами металлов и
обобществленными электронами, называется металличе-
ской связью.
Металлическая связь имеет определенное сходство с
ковалентной, поскольку основана на обобществлении ва-
лентных электронов. Однако в образовании ковалентной
связи участвуют валентные электроны только двух взаи-
модействующих атомов, в то время как при образовании
металлической связи в обобществлении электронов при-
нимают участие все атомы. Именно поэтому металличе-
ская связь не обладает пространственной направленнос-
тью и насыщаемостью, что во многом определяет выше
отмеченные специфические свойства металлов. Энергия
металлической связи в 3-4 раза меньше значений энер-
гии ковалентной связи.
Понятие о водородной
и межмолекулярной связях
Водородная связь широко распространена в природе
и играет большую роль во многих химических и биоло-
гических процессах. Водородную связь могут образовы-
вать только те вещества, в молекулах которых атом во-
дорода связан с сильно электроотрицательными атома-
ми: F, О, Cl, N, S и др. Возникновение водородной связи
можно в первом приближении объяснить действием
электростатических сил. Например, в молекуле воды
электроны, образующие связи Н - О, смещены к более
электроотрицательному атому кислорода. Ядро атома
водорода (протон), в свою очередь, почти полностью ли-
шается электронного облака и между ним и отрица-
тельно заряженным атомом кислорода соседней моле-
кулы воды возникает электростатическое притяжение.
Оно и приводит к образованию водородной связи. Про-
цесс образования водородной связи при взаимодействии
двух молекул воды можно представить схемой, на кото-
рой водородная связь изображена пунктиром:
117
/0^
н н. . .
н н
Итак, образование водородной связи обусловлено спе-
цификой строения атома водорода, состоящего из прото-
на и электрона. Чем больше электрон атома водорода
оттянут в сторону другого атома, связанного с ним кова-
лентно, тем сильнее протон притягивает электроны ато-
ма соседней молекулы, образуя с ним дополнительную
связь.
Энергия водородной связи (8-40 кДж/моль), т. е. на
порядок меньше энергии ковалентной связи. Тем не менее
этой энергии вполне достаточно для ассоциации молекул.
Водородная связь может быть не только межмолеку-
лярной, но и внутримолекулярной. Особенно большую роль
внутримолекулярная водородная связь играет в образо-
вании ряда высокомолекулярных веществ, в частности
белков, нуклеиновых кислот и др.
Переход вещества из газообразного в конденсированное
состояние объясняется наличием сил межмолекулярного
взаимодействия. Эти силы иначе называются силами Ван-
дер-Ваальса. Они зависят, прежде всего, от расстояния
между центрами взаимодействующих молекул. На боль-
ших расстояниях эти силы ничтожно малы, что и наблю-
дается в газообразных веществах, молекулы которых на-
ходятся в непрерывном хаотическом движении. В жид-
кости расстояние между молекулами меньше, чем в газе, и,
соответственно, межмолекулярные силы проявляются уже
в большей степени. И, наконец, в твердых телах, где части-
цы совершают лишь колебательные движения около опре-
деленных центров равновесия, силы Ван-дер-Ваальса име-
ют наибольшее значение. Межмолекулярные силы носят
электростатический характер и не обладают свойством
насыщаемости. Они гораздо слабее внутримолекулярных
химических связей. Именно следствием небольших зна-
чений энергии межмолекулярной связи является то, что
молекулярные кристаллы плавятся при низких темпера-
турах и имеют высокую летучесть.
118
Вопросы и упражнения
для самостоятельного решения
1. Какова природа химической связи?
2. Какие основные типы химической связи вам изве-
стны? Приведите примеры.
3. Могут ли образовываться сигма- или пи-связи в
результате перекрывания двух s-электронов, s- и р-элек-
тронов, двух р-электронов?
4. Какой тип связи является наиболее общим и поче-
му?
5. Каковы характеристики химической связи?
6. Отличие понятия «валентность» и «степень окисле-
ния».
7. Можно ли считать, что двойная связь в два раза
прочнее одинарной?
8. Дайте определение ковалентной связи. Приведите
примеры веществ, образованных связями:
а) ковалентной неполярной;
б) ковалентной полярной.
Определите валентность элементов в соединениях.
9. Приведите примеры соединений, образованных по
обменному и донорно-акцепторному механизмам кова-
лентной связи.
10. Приведите примеры соединений, в которых осуще-
ствляется:
а) sp-гибридизация;
б) 8р2-гибридизация;
в) 8р3-гибридизация.
Изобразите пространственное строение рассматриваемых
соединений.
11. Сколько о- и л-связей в молекулах С2Н2; С2Н4.
12. Какую ковалентность может проявлять хлор в сво-
их соединениях? Покажите строение атома хлора в нор-
мальном и возбужденном состояниях.
13. Почему углерод в большинстве своих соединений
четырехвалентен?
14. Почему максимальная ковалентность фосфора мо-
жет быть равна 5, а у азота такое валентное состояние
отсутствует?
119
15. Какое из веществ — водород или этан — должно
иметь более высокую температуру кипения? Почему?
16. Составьте схемы строения молекул СН4, РН3, Вг2,
СО2. Укажите валентность элементов, назовите эти соеди-
нения.
17. Дайте определение ионной связи. Приведите при-
меры соединений, образованных по типу ионной связи.
Укажите, какими наиболее общими свойствами должны
обладать эти соединения.
18. Ионная или ковалентная связь в хлориде цезия?
Ответ мотивируйте.
19. Почему ионную связь называют электростатиче-
ской?
20. В каких фторидах связь: элемент - фтор будет
носить ионный характер: NaF, A1F3, CF4, BaF2, NF3, F2O?
21. Какие типы химических связей в молекулах: С12,
NaCl, НС1. Составьте электронные схемы строения моле-
кул. Укажите валентность элементов в этих соединени-
ях. В каком веществе значение дипольного момента рав-
но нулю?
22. Составьте схемы строения молекул:
а) сульфида меди (II);
б) иодида алюминия;
в) хлорида кальция.
Укажите валентность и составьте электронные формулы
молекул.
23. Какие типы химических связей в молекулах фто-
рида мышьяка, селенида кальция, бромида калия? Составь-
те электронные формулы молекул.
24. Какие физические свойства характерны для ве-
ществ со следующими типами кристаллической решет-
ки:
а) ионная;
б) атомная;
в) молекулярная;
г) металлическая? •
25. Приведите примеры веществ, образованных метал-
лической связью. Почему металлы обладают высокой
тепло- и электропроводностью?
26. Каков механизм образования водородной связи?
120
27. Приведите примеры соединений, образованных с
помощью водородных связей. Оказывают ли водородные
связи влияние на физические свойства веществ?
28. Чем объясняется необходимость учета сил межмо-
лекулярного взаимодействия, хотя они и незначительны?
29. Какие типы химических связей в молекулах H2S,
(HF)X, NH4F? Определите валентность элементов и составьте
электронные формулы.
30. Составьте формулы гидрооксидов рубидия, цезия,
калия, лития, натрия. Расположите их в порядке возрас-
тания основных свойств гидрооксидов. Объясните полу-
ченный результат.
31. Исходя из степени окисления хлора, серы, иода и
азота в соединениях НС1О4, H2S, H2SO4, KI, NH3, объясните,
какое из них может проявлять: а) окислительные свой-
ства; б) восстановительные свойства. Почему?
32. Каков тип связи в молекулах: ВаС12, КС1, СО2, CaS,
СС14, Н2О?
33. Как изменяется сила галогеноводородных кислот
от фтора к иоду?
34. Объясните относительную химическую инертность
благородных газов Не, Ne,Ar, Хе?
35. Чем объяснить химическую инертность азота?
Изобразите строение молекулы азота. Назовите вид гиб-
ридизации.
6
Растворы
Общая характеристика растворов
Из всего многообразия растворов, которые классифи-
цируют или по размерам частиц (взвеси, коллоидные
растворы, истинные растворы), или по агрегатному состо-
янию растворителя и растворенного вещества (газ — газ,
газ — жидкость, газ — твердое, жидкость — жидкость,
жидкость — газ, жидкость — твердое, твердое — газ, твер-
дое — жидкость, твердое — твердое), остановимся на рас-
смотрении жидких истинных растворов и характеристи-
ке их основных свойств.
Истинными растворами называются гомогенные (од-
нородные) системы переменного состава, состоящие из двух
или более компонентов (составных частей) и продуктов
их взаимодействия.
Всякий раствор состоит из растворенных веществ и
растворителя — среды, в которой равномерно распреде-
ляются растворенные вещества. Растворителем счита-
ется тот компонент, агрегатное состояние которого совпа-
дает с агрегатным состоянием раствора. Это определение
справедливо тогда, когда растворяемое вещество и раство-
ритель находятся в разном агрегатном состоянии (на-
пример, растворение твердых или газообразных веществ
в жидкостях с образованием жидких растворов). Если
же оба компонента до растворения имели одно и то же
агрегатное состояние, например вода и спирт, то раство-
рителем считается компонент, находящийся в растворе в
большем количестве.
Состав растворов, в отличие от состава определенных
химических соединений, может меняться непрерывно в
122
довольно широких пределах. В этом отношении раство-
ры сходны с механическими смесями. По ряду других
признаков, таких как однородность, наличие теплового
эффекта, появление окраски при их образовании, раство-
ры сходны с химическими соединениями.
Образование растворов обусловлено протеканием са-
мопроизвольного процесса растворения растворимых ве-
ществ. Он, в свою очередь, является следствием взаимо-
действия частиц растворяемого вещества и растворите-
ля.
Так, процесс растворения кристалла в жидкости зак-
лючается в отрыве частиц растворяемого вещества под
действием силового поля растворителя, с последующим
распределением их за счет диффузии во всем объеме. В
начальный момент времени процесс растворения идет с
бо'льшой скоростью. Но по мере увеличения количества
растворяемого вещества в растворе возрастает скорость
обратного процесса, кристаллизации — выделение веще-
ства из раствора и осаждение его на исходном кристал-
ле. В какой-то момент времени скорости растворения и
осаждения станут одинаковыми, т. е. наступит момент
динамического равновесия:
АВ & АВ.
твердая раствор
фаза
В равновесном состоянии дальнейшее увеличение кон-
центрации раствора при данных условиях оказывается
невозможным. Раствор, который находится в динамиче-
ском равновесии с избытком растворенного вещества, на-
зывается насыщенным. Концентрация насыщенного ра-
створа меняется при изменении внешних параметров, в
частности температуры. Если насыщенный раствор, при-
готовленный при повышенной температуре, охлаждать, то
вследствие уменьшения растворимости часть растворен-
ного вещества будет кристаллизоваться и выпадать в оса-
док. Однако, если вести процесс охлаждения медленно и
осторожно, удается предотвратить выделение вещества из
раствора. Получаемый таким путем раствор будет содер-
жать больше вещества, чем насыщенный при данной тем-
пературе; он называется пересыщенным. Пересыщенный
123
раствор, в отличие от насыщенного, является нестабиль-
ной системой. Достаточно перемешать такой раствор или
бросить самый маленький кристалл растворенного веще-
ства, чтобы прошел процесс кристаллизации. Этот про-
цесс будет продолжаться до тех пор, пока раствор не при-
дет в состояние насыщенного. Раствор, содержащий мень-
ше растворенного вещества по сравнению с насыщенным,
носит название ненасыщенного раствора.
Концентрация растворенного вещества
Важной характеристикой любого раствора является
количественный состав, который выражается концентра-
цией растворенного вещества. Концентрацией раство-
ренного вещества называют определенное мольное, мас-
совое или объемное количество растворенного вещества,
содержащееся в определенном мольном, массовом или
объемном количестве растворителя или раствора.
Для приблизительного выражения концентрации при-
меняют термины концентрированный и разбавленный.
Концентрированным называют раствор, содержащий ра-
створенное вещество в количестве, соизмеримом с коли-
чеством растворителя. Раствор, содержащий количество
растворенного вещества, несоизмеримое с количеством
растворителя (гораздо меньше), называют разбавленным.
Граница между концентрированным и разбавленным ра-
створами условна.
Часто ошибочно считают, что насыщенный раствор
должен быть обязательно концентрированным, а ненасы-
щенный разбавленным. Изменение растворимости различ-
ных веществ в широких пределах помогает понять, что
ненасыщенный раствор может быть концентрированным
(если вещество хорошо растворимо, например раствор
сахара), а насыщенный — разбавленным (если вещество
мало растворимо, например раствор мела).
Существует много точных способов выражения кон-
центрации растворенных веществ. Ниже рассмотрим
необходимые по программе способы выражения концент-
рации:
124
Способ выражения
концентрации
Определение
Массовая доля раство-
ренного вещества, w (%)
Число единиц массы ра-
створенного вещества, содер-
жащихся в 100 единицах
массы раствора
“’(в-ва)
ОТ(°-ва). . 100 о/о
т(Р-ра)
Молярная концентрация
или молярность, См
Число моль растворенно-
го вещества, содержащихся
в 1 литре раствора
< _ У(в-ва)
М у
Нормальная или эквива-
лентная концентрация (ее
еще называют молярной кон-
центрацией эквивалента), Сн
Число молярных масс эк-
вивалента растворенного ве-
щества, содержащихся в
1 литре раствора
V
Связь массового и объемного количества раствора осу-
ществляют с помощью следующей формулы:
т = р • V,
где т, р, V — соответственно, масса, плотность и объем
раствора.
Пример 1
Рассчитайте массовую долю (%) сульфата магния в
растворе, содержащем 5,5 г MgSO4 в 0,5 л раствора.
Плотность раствора р= 1,1 г/мл.
|j^ | Дано:
1°~^1 m(MgSO4) = 5,5г
V(H2O) = 0,5 л- 500 мл
р(р-ра) = 1,1 г/мл
Найти:
u>(MgSO4)
125
Решение:
100 • т,
w----------,
т2
где тг — масса растворенного вещества,
т2 — масса раствора;
так как т = р V,
то, следовательно,
100 • т, 5,5 г • 100 %
w =-------------- - —-3----—--------10%.
т2 1,1 г/мл • 500 мл
Ответ: w = 10 %.
Пример 2
Сколько граммов хлорида калия и воды необходи-
мо взять для приготовления 0,4 кг раствора с массо-
вой долей хлорида калия в нем 15 % ?
Дано:
т(р-ра) = 0,4 кг = 400 г
и<КС1) = 15 %
Найти:
т(КС1);
/п(Н2О).
Решение:
1) Найдем массу соли в 400 г раствора:
400-15
тп(КС1)= 100 = 60 г.
2) Общая масса раствора 400 г, а соли в нем 60 г.
Очевидно, что остальная масса раствора приходит-
ся на воду:
400 г - 60 г = 340 г Н2О.
Ответ: 60 г КС1 и 340 г Н2О.
Пример 3
Какой объем воды необходимо прибавить к 300 мл
раствора хлороводорода с массовой долей НС1 20 %
(р=1,1г/мл), чтобы получить раствор с массовой
долей НС1 5 % ?
126
Дано:
У(р-ра) = 300 мл
w^HCl) = 20 % = 0,2
u>2(HCl) = 5 % = 0,05
Pi (Р-Ра) = 1,1 г/мл
Найти:
V(H2O)
Решение:
1) Найдем массу 300 мл раствора, имеющего массо-
вую долю НС1, равную 20 %:
тп = рфР'=1,1г/мл- 300 мл — = 333 г.
2) Рассчитаем, какова масса НС1 в 333 г этого ра-
створа:
т(НС1) = 333 г • 0,2 = 66,6 г.
3) Очевидно, что 66,6 г НС1 будет содержаться и в
растворе с массовой долей НС1, равной 5 %. Исходя
из этого, найдем массу раствора с w = 5 %:
66,6 г
т(р-ра) = = 1332 г.
0,05
4) Находим массу воды, которую необходимо при-
бавить к исходному раствору:
1332 г - 333 г = 999 г или 999 мл
(так как р воды = 1 г/мл).
Ответ: 999 мл.
Примечание: Эту задачу можно решить с помощью
«правила креста».
Пример 4
К 250 г раствора серной кислоты с массовой долей
H2SO4 10 % добавили 500 г раствора этой же кис-
лоты неизвестной концентрации. Получился ра-
створ с массовой долей H2SO4 25 %. Определите
массовую долю (в %) добавляемого раствора сер-
ной кислоты.
Дано:
т4(р-ра) = 250 г
^(H^OJ = 10 %
127
тп2(р-ра) = 500 г
w3(H2SO4) = 25 %
Найти:
u>2(H2SO4)
Решение:
1) Найдем массу серной кислоты, содержащейся в
250 г раствора с w = 10 %:
тпДН^) = 250 г • 0,1 = 25 г.
2) Найдем массу получаемого раствора с w = 25 %:
250 г+ 500 г =750 г.
3) Найдем массу серной кислоты, содержащейся в
750 г раствора с w = 25 %:
zn2(H2SO4) = 750 г • 0,25 = 187,5 г.
4) Определим массу серной кислоты, содержащейся
в 500 г раствора неизвестной концентрации:
187,5 г - 25 г = 162,5 г.
5) Определим концентрацию добавленного раст-
вора:
100% -пг. 100% -162,5
w =----------L =----- —!_ = 32,5 о/о.
т2 500
Ответ: 32,5%.
Пример 5
Определите массовую долю (%) растворенного ве-
щества в растворе, полученном растворением 6,72 л
оксида серы (IV) (н. у.) в 980,8 г воды.
Дано:
V(SO2) = 6,72 л
тп(Н2О) = 980,8 г
Найти:
ip(SO2)
Решение:
1) Рассчитаем массу 6,72 л SO2 при н. у.:
m(S02) = '64 г/моль. » 19,2 г.
2 22,4л/моль
2) Найдем массу полученного раствора:
19,2 г+ 980,8 г = 1000 г.
128
3) Определим массовую долю (%) раствора SO2:
100% т, 100% -19,2
w----------1-----———2-----1,92 % .
т2 1000
Ответ: 1,92%.
Пример 6
Какие массы кристаллогидрата сульфата натрия
Na2SO4 • 10Н2О и воды надо взять, чтобы получить
раствор массой 71 г с массовой долей безводного
Na2SO4 20 %?
Дано:
тп(р-ра) = 71 г
u>(Na2SO4) = 20 %
Найти:
m(Na2SO4 • ЮН20)
Решение:
1) Вычислим массу безводной соли Na2SO4,
димую для приготовления 71 г раствора:
необхо-
w(Na2SO4) =
zn(Na2SO4)
m(p-pa)
• 100 %,
ат m(P-pa)-w % 71 г-20 %
m(Na„SO.) ---------------- — 14,2 г.
' 2 V 10() о/ 100 О/
2) Вычислим массу кристаллогидрата Na2SO4 • 10Н2О,
необходимую для приготовления раствора:
M(Na2SO4 • 10Н20) = 322 г/моль;
M(Na2SO4) =142 г/моль;
322 г (Na2SO4 • ЮН20) содержит 142 г Na2SO4;
m(Na2SO4 • ЮН20) содержит 14,2 г Na2SO4;
322 г - 14,2 г
m(Na,,SO, • ЮН„0)-------, ---=32,2 г.
24 2 142 г
3) Вычислим массу воды:
тп(р-ра) = тп(Н2О) + m(Na2SO4 • ЮН20);
тп(Н2О) = тп(р-ра) - zn(Na2SO4 • 10Н20) =
= 71 г-32,2 г = 38,8 г.
Ответ: 32,2 г (Na2SO4 • ЮН20); 38,8 г Н2О.
129
Пример 7
В 2 л раствора фосфорной кислоты содержится 29,4 г
Н3РО4. Рассчитайте молярную концентрацию ра-
створа.
Дано:
К(р-ра) = 2 л
/п(Н3РО4) = 29,4 г
Найти:
См
Решение:
1) Найдем, какому количеству моль Н3РО4 соответ-
ствует 29,4 г Н3РО4:
т
29 4 г
v(H„POJ = —-—’—2— = 0,3 моль
v 3 47 98 г/моль
2) Найдем молярную концентрацию раствора по
формуле:
у(в-ва) _ 0,3 моль
См У(р-ра) м 2 л
= 0,15 моль/л.
Количество моль в 1 л будет молярной концентра-
цией раствора.
Ответ: См = 0,15 моль/л.
Пример 8
Сколько граммов едкого кали содержится в 400 мл
0,2 молярного раствора КОН?
Дано:
V(p-pa) = 400 мл
СМ(КОН) = 0,2 моль/л
Найти:
т(КОН)
Решение:
1) Рассчитаем количество моль КОН, содержащих-
ся в 400 мл 0,2 моль/л раствора:
130
v = CM-V;
v = 0,2 моль/л • 0,4 л == 0,08 моль.
2) Найдем, какому количеству граммов соответствует
0,08 моль КОН:
тп(КОН) = v(KOH) • М(КОН) =
= 0,08 моль • 56 г/моль = 4,48 г.
Ответ: 4,48г КОН.
Пример 9
Определите нормальную концентрацию раствора,
если в растворе объемом 200 мл содержится 28,28 г
фосфата калия, /экв К3РО4 = 1/3.
Дано:
У(р-ра) = 200 мл
тп(К3РО4) = 28,28 г
Найти:
Сц
Решение:
1) Рассчитаем, какому числу молярных масс экви-
валента К3РО4 соответствует 28,28 г соли. Моляр-
ная масса эквивалента К3РО4:
м ттгп М<кзр°4) 212,3 г/моль
i’a3KB.JV3rU4 3 3
— 70,7 г/моль.
28,28 г
п „ = —------------- 0,4 моль • экв.
экв. 70,7 г/моль
2) Найдем число молярных масс эквивалента, со-
держащихся в 1 л раствора или, иначе говоря, нор-
мальную концентрацию раствора:
0,4 моль
С„ = ———--------- 2 моль • экв./л.
н 0,2 л
Ответ: Сн = 2 моль • экв./л.
131
Пример 10
Сколько миллилитров раствора серной кислоты с
массовой долей H2SO4 96 % (р = 1,84 г/мл) необхо-
димо взять для приготовления 2 л 0,5 Н раствора?
f3KB.H2SO4=l/2.
Дано:
u>(H2SO4) = 96 %
V(p-pa) = 2 л
Сн = 0,5Н
р = 1,84 г/мл
Найти:
V(H2SO4)
Решение:
1) Найдем массу серной кислоты, содержащейся в
2 л 0,5 Н раствора. Для этого предварительно оп-
ределим молярную массу эквивалента серной кис-
лоты:
,, , ,, 98г/моль ,
= f • М -------------= 49 г/моль • экв.
экв. ' экв. п •
Поскольку необходимо приготовить 0,5 Н раствор,
то отсюда следует, что в 1 литре будет 49 • 0,5 = 24,5 г
H2SO4. Но эта масса серной кислоты в 1 литре ра-
створа, а в двух литрах будет в два раза больше —
24,5-2 = 49 г.
2) Вычислим массу раствора с массовой долей H2SO4
96 %, в котором содержится 49 г H2SO4:
т(в-ва) ________________________
w = —7---т- • 100 %,
т(р-ра)
, ч 49 г-100 % _
zn(p-pa) =--——--------51,04 г.
96 %
3) Найдем объем раствора серной кислоты (р =
= 1,84 г/мл), необходимый для приготовления ново-
го раствора:
тг т гг 51,04 г п_ _
V =----; V=- ----=27,7 мл.
р 1,84 г/мл
Ответ: V(H2SO4) = 27,7 мл.
132
а Пример 11
Плотность раствора с массовой долей серной кис-
лоты 34 % равна 1,25 г/мл. Рассчитайте моляр-
ную и нормальную концентрацию этого раствора.
f9BBH2SO4 = l/2.
I а, 1 Дано:
1^21 u>(H2SO4) = 34 %
p(H2SO4) = 1,25 г/мл
Найти:
Решение:
1) Найдем массу 1 л раствора с w = 34 % H2SO4:
т = 1,25 г/мл • 1000 мл = 1250 г.
2) Найдем массу серной кислоты, содержащейся в
1250 г раствора. Из формулы:
m(H2SO4) • 100 %
zn(p-pa)
____ w(p-pa) • w %
-----------100 % '
1250 г-34 %
m(IW>---------ioo%------425 r-
3) Найдем количество вещества (моль), соответству-
ющее данной массе:
425 г
v = ----------- 4 зз Моль.
98 г/моль
Так как это количество моль H2SO4 содержится в
1 л раствора, то молярная концентрация раствора
См будет равна 4,33 моль/л.
4) Найдем молярную массу эквивалента H2SO4:
, ,, 98г/моль
Af = Лкв М ”------й-----= 49 г/моль • экв.
5) Определяем число молярных масс эквивалента
H2SO4, которое соответствует 425 г массы серной кис-
лоты:
425 г
п = ------------ 8,67 моль • экв.
экв. 49 г/моль • ЭКВ.
133
Следовательно, Сн = 8,67 моль • экв./л.
Ответ: См = 4,33 моль/л; Сн = 8,67 моль • экв./л.
Пример 12
Какова нормальная концентрация раствора едкого
натра, если на нейтрализацию 40 мл его израсходо-
ванного 25 мл 0,5 Н раствора серной кислоты?
Дано:
V(NaOH) = 40 мл
У(Н28О4) = 25 мл
CH(H2SO4) = 0,5 Н
Найти:
CH(NaOH)
Решение:
При решении таких задач следует знать, что объе-
мы растворов реагирующих веществ относятся об-
ратно пропорционально нормальным концентраци-
ям этих растворов.
В нашем конкретном случае:
К(щелочи) • Сн(щелочи) = У(кислоты) • Сн(кислоты)
У(кислоты) • Сн(кислоты)
Сн(щелочи) =-----------------------------
У(щелочи)
25*05
---—-— = 0,31 моль • экв./л.
40
Следовательно, Сн = 0,31 моль • экв./л.
Ответ: CH(NaOH) -= 0,31 моль/л.
Пример 13
В каком массовом отношении нужно взять раство-
ры с массовой долей сахара 10 % и 15%, чтобы
получить раствор с массовой долей сахара 12 %.
Дано:
и>1“= 15 %
w2 = 10 %
u>3=15% -
134
Найти:
массовые отношения заданных растворов
Решение:
Эту задачу можно решить, используя правило сме-
шения (правило «креста»).
1. Записываем массовые доли исходных растворов,
а между ними, в центре массовую долю раствора,
который необходимо приготовить:
15% 10%
^*12 %^
Затем из большей массовой доли по диагонали выс-
читываем меньшую и записываем результат:
15% 10%
^12 %^
2^ ^3
Числа 2 и 3 показывают, в каком массовом отно-
шении надо взять растворы с и\ = 15 % и w2 = 10 %.
Ответ: 2 массовые части р-ра с — 15 % и 3 массо-
вые части р-ра w2 = 10 %.
Вопросы и задачи
для самостоятельного решения
1. Что такое растворы? Какую роль играют растворы в
природе, науке и технике?
2. Что называется растворителем и растворенным ве-
ществом?
3. Постоянен ли состав растворов? Чем отличаются ра-
створы от механических смесей и химических соединений?
4. Объясните процесс растворения веществ с точки
зрения молекулярно-кинетических представлений.
5. Что называется насыщенным, ненасыщенным и пе-
ренасыщенным растворами? Каковы условия получения
этих растворов?
6. Может ли быть насыщенный раствор разбавленным,
концентрированный раствор ненасыщенным?
136
7. Что называется концентрацией растворенного веще-
ства? Какие способы выражения концентрации вы знаете?
8. Какова зависимость между объемами и молярными
концентрациями эквивалентов реагирующих растворов?
9. Сколько граммов нитрата марганца (II) следует ра-
створить в 200 г воды для получения раствора с массовой
долей соли, равной 8 % ?
Ответ: 17,4 г.
10. Сколько граммов хлорида лития и воды необходи-
мо взять для приготовления 250 г раствора с массовой
долей соли, равной 12 % ?
Ответ: 30 г LiCl и 220 г Н2О.
11. В литре воды растворили 15 г нитрата серебра. Ка-
кова массовая доля (%) соли в растворе?
Ответ: 1,47%.
12. Определите массовую долю (%) сульфата меди в
растворе, полученном при растворении 5 г медного купо-
роса в 75 г воды.
Ответ: 4 %.
13. Сколько граммов раствора с массовой долей MgSO4
6 % можно приготовить из 24,6 г MgSO4 • 7Н2О?
Ответ: 200 г.
14. Какую массу металлического натрия надо раство-
рить в воде, чтобы получить 200 г раствора с массовой
долей гидроксида натрия 0,08?
Ответ: 9,2 г.
15. В каком объеме воды необходимо растворить
134,4 л хлороводорода (н. у.), чтобы получить раствор с
массовой долей НС1 6 % ?
Ответ: 3,43 л.
16. Какой объем воды необходимо прибавить к 100 мл
раствора нитрата свинца с массовой долей Pb(NO3)2 10 %
(р= 1,091 г/мл), чтобы получить раствор с массовой до-
лей соли 4 % ?
Ответ: 163,6 мл.
17. До какого объема нужно разбавить 500 мл раствора
хлорида натрия с массовой долей NaCl 20 % (р = 1,152 г/мл),
чтобы получить раствор с массовой долей соли 4,5 %
(р= 1,029 г/мл)?
Ответ: 2,49 л.
136
18. При выпаривании 1 кг раствора едкого натра с
массовой долей NaOH 16 % удалено 200 г воды. Какова
массовая доля едкого натра в растворе после выпарива-
ния?
Ответ: 20 %.
19. Сколько граммов оксида фосфора (V) необходимо
растворить в 400 г раствора фосфорной кислоты с массо-
вой долей Н3РО4 5 % для получения раствора с массовой
долей кислоты, равной 10 % ?
Ответ: 15,6 г.
20. При смешивании 100 г раствора серной кислоты с
массовой долей H2SO4 20 % и 50 мл раствора этой же
кислоты с массовой долей 96 % (р= 1,84 г/мл) получен
раствор неизвестной концентрации. Определите массо-
вую долю (%) полученного раствора.
Ответ: 57,37%.
21. Сколько следует прилить раствора азотной кисло-
ты с массовой долей HNO3 10 % (р= 1,05 г/мл) к 400 мл
раствора с массовой долей HNO3 96 % (р= 1,5 г/мл), что-
бы получить раствор этой же кислоты с массовой долей
HNO3 15 %?
Ответ: 9,26 л.
22. Три литра раствора серной кислоты с массовой
долей H2SO4 40 % (р= 1,30 г/мл) упарили до 2 кг. Опре-
делите массовую долю (%) полученного раствора.
Ответ: 78 %.
23. Какое количество медного купороса нужно доба-
вить к 150 мл воды, чтобы получить раствор с массовой
долей безводной соли 5 % ?
Ответ: 12,32 г CuSO4 • 5Н2О.
24. Сколько литров оксида серы (IV) необходимо ра-
створить в 10 мл воды при н. у., чтобы получить раствор
сернистой кислоты с массовой долей H2SO31,2%?
Ответ: 0,032 л.
25. Какова будет концентрация кислоты в растворе,
полученном сливанием 40 мл раствора азотной кислоты
с массовой долей HNO3 96 % (р= 1,50 г/мл) и 30 мл ра-
створа азотной кислоты с массовой долей HNO3 48 %
(р = 1,30 г/мл)?
Ответ: 77,1%.
137
26. Газообразный аммиак объемом 2,24 л поглощен
14,68 мл раствора с массовой долей ортофосфорной кис-
лоты 50 % (р= 1,335 г/мл). Какая соль образовалась при
этом и какова ее масса?
Ответ: 11,5 NH4H2PO4.
27. Найти массу сульфата калия, необходимого для
приготовления 800 мл 0,15 молярного раствора.
Ответ: 20,88 г.
28. Чему равна молярная концентрация раствора, ко-
торый содержит в 2 литрах 12,97 г NiCl2?
Ответ: 0,05 М.
29. Какой объем раствора с массовой долей H2SO4 60 %
(р = 1,50 г/мл) необходимо взять для приготовления 0,25 л
0,1 молярного раствора серной кислоты?
Ответ: 2,72 мл.
30. Определите молярную концентрацию раствора бромово-
дородной кислоты с массовой долей 20 % (р— 1,10 г/мл).
Ответ: Сн = 2,71.
31. До какого объема следует разбавить водой 1 л
1,5 молярного раствора перхлората лития для получения
0,1 молярного раствора?
Ответ: 15 л.
32. До какого объема следует упарить 3 л 0,05 моляр-
ного раствора хлорида магния для получения 0,15 мо-
лярного раствора?
Ответ: 1 л.
33. Смешали 1 л 0,2 молярного раствора с 2 л 0,8 мо-
лярного раствора. Найдите молярную концентрацию вновь
полученного раствора.
Ответ: См = 0,6.
34. Какова нормальная концентрация раствора гидро-
ксида лития, если в растворе объемом 150 мл содержит-
ся гидроксид лития массой 7,2 г?
Ответ: Сн = 2.
35. Какие объемы водорода и хлора (при н. у.) необхо-
димы для получения 0,5 л 2 М раствора соляной кисло-
ты? Какую массу алюминия можно растворить в этой
кислоте?
Ответ: 9 г А1,
36. Какой объем 1 Н раствора можно приготовить из
138
240 мл раствора фосфорной кислоты с массовой долей
Н3РО4 30 % (р= 1,19 г/мл)? /ЭКВН3РО4=1/3.
Ответ: 2,62 л.
37, Рассчитайте массовую долю (%) 5 Н раствора фос-
форной кислоты (р= 1,29 г/мл). /ЭКВ Н3РО4 = 1/3.
Ответ: 12,63%.
38. Сколько (по массе) воды надо добавить к 200 г ра-
створа с массовой долей соли 15 %, чтобы получить ра-
створ с массовой долей соли 3 %.
Ответ: 800 г.
39. Для нейтрализации 30 мл 0,1 Н раствора кислоты
потребовалось 12 мл раствора едкого натра. Рассчитайте
массу едкого натра в 1 л этого раствора.
Ответ: 10 г.
40. Какой объем 0,5 Н раствора серной кислоты мож-
но нейтрализовать прибавлением 300 мл 0,1 Н раствора
гидроксида кальция?
Ответ: 60 мл.
Химическая теория растворов
Д. И. Менделеева.
Тепловой эффект процесса растворения
В конце XIX века растворы считались физическими
образованиями, в которых отсутствуют какие-либо взаи-
модействия между растворителем и растворенным веще-
ством. Образование раствора объяснялось диспергирова-
нием частиц растворенного вещества в индифферентной
среде растворителя. Основоположниками этих взглядов
были такие известные ученые, как Я. Вант-Гофф, С. Арре-
ниус и В. Оствальд. В 1887 году великий русский химик
Д. И. Менделеев, опираясь на многочисленные эксперимен-
тальные данные, создал химическую (гидратную) теорию
растворов. Основой этой теории была идея о химическом
характере растворения. В растворе образуются соедине-
ния между растворенным веществом и растворителем,
изменяющие свой состав с изменением температуры и
концентрации. Эти соединения были названы Д. И. Мен-
делеевым гидратами, или — сольватами. Образующиеся
139
гидраты имеют различную прочность. Большинство из них
неустойчиво и существует только в растворах. Однако
некоторая часть гидратов является настолько прочными
соединениями, что при выделении растворенного вещества
из раствора вода входит в состав растущего кристалла в
химически связанном виде. Такие кристаллы были на-
званы кристаллогидратами, а входящая в их состав вода —
кристаллизационной. Примерами кристаллогидратов
являются CuSO4 • 5Н2О; Na2SO4 • ЮН2О и др. Прочность
образующихся соединений определяется силами, действу-
ющими между растворителем и растворенным веществом.
В настоящее время известна природа этих сил. Сольваты
(гидраты) образуются за счет ион-дипольного, диполь-ди-
польного, донорно-акцепторного взаимодействия, за счет
водородных связей, а также дисперсионного взаимодей-
ствия.
Менделеев не отрицал роль физического фактора при
образовании растворов. Он писал: «Две указанные сто-
роны растворения (физическая и химическая) и гипоте-
зы, до сих пор приложенные к рассмотрению растворов,
хотя имеют отчасти различные исходные точки, со вре-
менем приведут к общей теории растворов, потому что
одни общие законы управляют как физическими, так и
химическими явлениями». Взгляды Д. И. Менделеева пол-
ностью подтвердились. В настоящее время процесс ра-
створения рассматривают как физико-химический про-
цесс, а растворы — как физико-химические системы.
Химическая теория растворов Д. И. Менделеева позво-
ляла объяснить наличие тепловых эффектов, возникаю-
щих при процессах растворения веществ. Тепловой эф-
фект процесса растворения (ДНраств ) можно представить
в виде суммы теплоты, необходимой для разрушения кри-
сталлической решетки вещества (ДНреш) и теплоты, вы-
деляющейся в процессе сольватации (ДНсольват ), т. е.
ДН = ДН + ДН
раств, реш. сольв.’
ДНреш является значительной эндотермической величи-
ной, а ДНСОЛЬВ близкая к ней по значению экзотермиче-
ская величина. Исходя из этого, конечный знак теплово-
го эффекта процесса растворения будет определяться ве-
личиной вклада каждого из этих параметров. При
140
|лнреш|>|днсольв1
процесс растворения эндотермичен. Это можно наблюдать,
например, при растворении в воде нитратов калия и ам-
мония, хлорида калия и др. При
I АНреш| < | АНсольв |
процесс растворения экзотермичен. Примером этого яв-
ляется растворение в воде хлоридов кальция и магния,
гидроксидов натрия и калия и др. Итак, знак теплового
эффекта определяется природой растворенного вещества
и растворителя, глубиной их взаимодействия между со-
бой. Наличием химического взаимодействия между ком-
понентами объясняются и объемные эффекты при раство-
рении. Так, при растворении 1 л этилового спирта в 1 л
воды объем образующегося раствора оказывается рав-
ным не 2 л, а 1,93 л. В этом случае уменьшение объема
обусловлено, в основном, образованием водородных свя-
зей между гидроксильными группами воды и спирта.
Растворимость веществ
Понятие растворимости можно рассматривать с двух
сторон — качественной и количественной. Качественно
под растворимостью понимают способность вещества ра-
створяться в том или ином растворителе. Количествен-
но растворимость характеризуют концентрацией раство-
ренного вещества в его насыщенном растворе при данной
температуре. Численно растворимость может быть выра-
жена теми же способами, что и концентрация: в массо-
вых долях (%), в моль и т. п., но чаще всего ее выражают
количеством граммов растворенного вещества в 100 г
растворителя — параметром, который носит название
коэффициента растворимости. Для раствора, коэффици-
ент растворимости которого равен К, массовая доля (%)
растворенного вещества равна:
и> = тт К • 100 %.
К+ 100
Растворимость веществ, которая в различных раство-
рителях меняется в широких пределах, определяется ря-
141
дом факторов. Первый из них — увеличение хаотичнос-
ти, неупорядоченности при образовании растворов, спо-
собствует переходу растворенного вещества в раствор.
Второй фактор — энергетические затраты на отрыв час-
тиц от кристаллической решетки растворяемого веще-
ства и возрастание энергии при растворении. Энергети-
ческий фактор препятствует переходу растворенного ве-
щества в раствор. Значение равновесной концентрации
растворенного вещества в растворе будет определяться
совместным действием этих двух факторов. В свою оче-
редь, влияние названных факторов зависит от природы
растворителя, природы растворяемых веществ, их агре-
гатного состояния и внешних условий (температуры, дав-
ления и др.).
Анализ зависимости растворимости любого вещества в
растворителях различной природы наглядно иллюстри-
рует влияние на растворимость природы растворителя.
Влияние природы растворяемых веществ можно пока-
зать на следующих примерах. Так, почти все соли щелоч-
ных металлов и аммония хорошо растворимы в воде, на-
пример нитраты, хлориды (кроме хлоридов серебра, ртути,
свинца) и сульфаты (кроме сульфатов щелочноземельных
металлов и свинца). Для переходных металлов характер-
на небольшая растворимость сульфидов, фосфатов, карбо-
натов и некоторых других солей, а также их гидроксидов.
Более подробно влияние этого фактора иллюстрирует таб-
лица растворимости веществ (см. Приложение).
Анализируя растворимость веществ различного агре-
гатного состояния, следует отметить, что при растворении
твердых и жидких веществ объем раствора обычно изме-
няется незначительно. Поэтому растворимость твердых и
жидких веществ, как правило, не зависит от давления. При
растворении газообразных веществ объем системы суще-
ственно уменьшается, и это предопределяет зависимость
их растворимости от давления, причем повышение давле-
ния в соответствии с принципом Ле Шателье приводит к
увеличению растворимости газа.
Растворимость веществ во всех агрегатных состояни-
ях зависит от температуры. Как, правило, растворимость
твердых веществ с увеличением температуры возрастает
142
(AgNO3, KI, NH4C1). Однако имеются вещества, раствори-
мость которых при увеличении температуры возрастает
очень незначительно (NaCl) или даже уменьшается
(Са(ОН)2, Li2SO4, Са(СН3СОО)2. По принципу Ле Шателье
между веществом в кристаллическом состоянии и его
насыщенным раствором имеет место равновесие:
кристалл + растворитель насыщенный раствор ± ДН
В тех случаях, когда процесс растворения эндотермичен,
т. е. количество энергии, идущей на разрушение кристал-
лической решетки веществ не полностью компенсируется
энергией, выделяющейся при образовании гидратов (сольва-
тов), повышение температуры ведет к увеличению раство-
римости. Ясно, что экзотермичность процесса растворения
приведет к понижению растворимости при повышении тем-
пературы. Зависимость между растворимостью и темпера-
турой изображают как в виде табличных данных, так и в
графической форме — в виде кривых растворимости.
Рассматривая растворимость жидкостей, отметим, что
некоторые из них смешиваются с растворителем в лю-
бых соотношениях, например спирт и вода, другие — ог-
раниченно растворимы — бензол и вода.
В случае ограниченной растворимости жидкости вза-
имно растворимы друг в друге до насыщения при данной
температуре. Так, если смешать гексан с водой, то образу-
ется два слоя: верхний представляет собой насыщенный
раствор воды в гексане, а нижний — насыщенный раствор
гексана в воде. В большинстве подобных случаев с повы-
шением температуры взаимная растворимость жидко-
стей увеличивается до тех пор, пока не будет достигнута
температура, при которой обе жидкости смешиваются в
любых пропорциях.
Растворение газов почти всегда сопровождается выде-
лением теплоты. Согласно принципу Ле Шателье, повы-
шение температуры понижает растворимость газов, по-
этому при кипячении газы полностью удаляются из ра-
створов.
Решение задач по теме «Растворимость» водится или
к определению растворимости веществ в изотермических
условиях (по известным данным о содержании раство-
143
ренного вещества), или к определению количества веще-
ства, выпадающего в осадок, либо растворяющегося в си-
стеме «вещество-растворитель» при изменении темпера-
туры раствора.
а Пример 1
Определить растворимость и массовую долю (%) на-
сыщенного раствора хлорида калия, если 20 мл его
имеют массу 20,94 г и содержат 3,25 г соли.
а Дано:
V(p-pa) = 20 мл
тп(р-ра) = 20,94 г
?п(КС1) = 3,25 и
Найти:
К(КС1)
Решение:
1) Зная массу раствора (20,94 г) и массу растворен-
ного вещества (3,25 г), найдем массу растворителя:
20,94 г - 3,25 г = 17,69 г.
2) Определим коэффициент растворимости соли:
в 17,69 г Н9О — 3,25 г соли
в 100 г Н2О — х г соли х " 18,37 г>
3) Определим массовую долю (%) хлорида калия в
насыщенном растворе по формуле:
“’=таг100% =
18,37
= ’ • 100 % = 15,52 %.
110,0 (
Ответ: п?(КС1) = 15,52 %;
К(КС1)= 18,37 г.
Пример 2
Какое количество сульфата калия необходимо до-
бавить к 400 г насыщенного при 20 °C раствора, что-
бы при нагревании до 100 °C раствор остался насы-
144
щенным? Массовая доля (%) насыщенного при 20 °C
раствора сульфата калия равна 10 %, а при 100 °C —
19,4 %.
Дано:
tr = 20 °C
t2 = 100 °C
тп(р-ра) = 400 г
и\ = 10 %
w2 = 19,4 %
Найти:
m(K2SO4)
Решение:
1) Определим количественный состав 400 г раство-
ра, насыщенного при 20 °C по формуле:
тп(в-ва)
ы = —------- • 100 %,
тп(р-ра)
откуда
w % • т(р-ра)
тп(в-ва) --------------,
100 %
следовательно,
10 % • 400 г
т<сол“)------ioo%—40 г-
Отсюда видно, что 40 г соли содержатся в 400 г р-ра
или в 360 г растворителя. Поскольку при измене-
нии температуры масса растворителя не меняется,
остается узнать, какое количество соли будет содер-
жаться в 360 г воды при насыщении раствора до
100 °C.
2) Исходя из знания массовой доли (%) насыщенно-
го раствора K2SO4 при 100 °C (19,4), видим, что 19,4 г
K2SO4 содержится в 100 г раствора или в 80,6 г ра-
створителя. Найдем количество соли в 360 г воды:
в 80,6 г Н,0 — 19,4 г К,SO,
„ * 4х = 96,65г.
в 360 г Н2О — х г K2SO4
3) Рассчитаем количество соли, которое необходи-
мо добавить к раствору при 20 °C, чтобы он остался
насыщенным при 100 °C:
145
96,65 г - 40,00 г = 46,65 г.
Ответ: тп(К2ЗО4) = 46,65 г.
Вопросы и задачи
для самостоятельного решения
1. Какой взгляд на природу растворов предложил
Д. И. Менделеев, в каких фактах он видел подтвержде-
ние своей теории?
2. Каковы современные взгляды на процесс растворения?
3. Какие факторы влияют на растворимость веществ?
4. Какую роль в процессе растворения играет раство-
ритель и чем объясняется избирательность его действия
на растворимые вещества?
5. Как можно объяснить различные значения тепло-
вых эффектов процесса растворения твердых веществ?
6. Что следует понимать под терминами «раствори-
мость», «коэффициент растворимости»?
7. В какой зависимости находятся коэффициенты ра-
створимости твердых веществ от температуры, как эту
зависимость обычно выражают?
8. Растворимость дихромата калия при 20 °C состав-
ляет 11,0 г. Определите массовую долю (%) насыщенного
раствора соли.
Ответ: 9,91 %.
9. Массовая доля (%) насыщенного при 20 °C раствора
нитрата бария равна 8,25%. Найдите коэффициент ра-
створимости соли.
Ответ: 9 г.
10. При охлаждении 500 г раствора с массовой долей
соли 12 % часть растворенного вещества выпала в осадок
и концентрация раствора стала равной 8 %. Чему равна
масса выпавшей в осадок соли?
Ответ: 21,8 г.
11. При охлаждении насыщенного при 80 °C раствора
до 20 °C выкристаллизовалось 150 г соли. Какова была
масса исходного раствора, если растворимость соли при
80 и 20 °C соответственно составляет 35 и 6,5 г?
Ответ: 710,5 г.
146
12. Определить концентрацию раствора и количество
воды, в которой можно растворить при 40 °C 200 г соли,
содержащей 80 % сульфата калия, если растворимость
сульфата калия при этой температуре равна 64 г.
Ответ: 39 %; 250 г.
13. Определить количество воды, в которой можно ра-
створить при 80 °C 950 г соли, содержащей 84,58 % крис-
таллогидрата хлорида магния, если растворимость безвод-
ного хлорида магния при этой температуре равна 66 г.
Ответ: 569,7 г.
14. Растворимость сульфата меди при 20 °C равна 20,2 г,
а при 100 °C— 77 г. Определите массу сульфата меди,
выпадающего в осадок при охлаждении 165 г раствора от
100 до 20 °C.
Ответ: 54,2 г.
15. Растворимость хлората калия при 70 °C равна 30,2 г,
а при 30 °C — 10,1 г. Определите массу соли, выпадающей
в осадок при охлаждении до 30 °C 350 г насыщенного при
70 °C раствора.
Ответ: 54 г.
Электролитическая диссоциация.
Ионное произведение воды
В зависимости от механизма прохождения тока через
проводники различают проводники первого и второго
рода. К проводникам 1-го рода, обладающим электрон-
ной проводимостью, относят металлы, оксиды, сульфиды,
уголь. Проводники 2-го рода — это вещества, распадаю-
щиеся при определенных условиях на ионы: они облада-
ют ионной проводимостью.
Вещества, растворы или расплавы которых проводят
электрический ток, называются электролитами. Веще-
ства, растворы или расплавы которых не проводят элект-
рического тока, называются неэлектролитами; К элект-
ролитам относят кислоты, основания и почти все соли, к
неэлектролитам — большинство органических соедине-
ний. В растворе или расплаве электролиты распадаются
на ионы. Распад электролитов на ионы при растворении
147
их в воде называется электролитической диссоциацией.
Диссоциация в растворах протекает под действием по-
лярных молекул растворителя. В расплавах диссоциа-
ция протекает вследствие нагревания вещества.
Теория электролитической диссоциации была разра-
ботана знаменитым шведским химиком С. Аррениусом
(1887 г.). Основные положения современной теории элек-
тролитической диссоциации:
(2 При растворении в воде электролиты распадаются
(диссоциируют) на положительные и отрицательные ча-
стицы (ионы), которые находятся в растворе в хаотиче-
ском движении.
[2] Под действием постоянного электрического тока
хаотическое движение ионов сменяется направленным:
положительно заряженные ионы (катионы) движутся к
катоду, а отрицательно заряженные (анионы) — к аноду.
Гз] Электролитическая диссоциация — обратимый про-
цесс. Наряду с самопроизвольным распадом электроли-
та на ионы (диссоциацией) протекает процесс соединения
ионов в молекулы — ассоциация. Поэтому при написа-
нии уравнений реакции диссоциации ставится знак об-
ратимости (?*):
СН3СООН СН3СОО’ + Н+.
Аррениус был сторонником «физической» теории ра-
створов и не учитывал взаимодействия растворенного ве-
щества с растворителем, поэтому теория Аррениуса не мог-
ла объяснить причину диссоциации электролитов. Совре-
менные представления о причинах и механизме сложились
на основе химической теории растворов Д. И. Менделеева и
развиты в работах И. А. Каблукова и В. А. Кистяковского.
Электролитическая диссоциация в растворе происхо-
дит за счет сложного физико-химического взаимодействия
молекул растворителя с растворяемым веществом (элек-
тролитом); при этом решающее значение имеет харак-
тер химической связи и строение молекул растворителя
и растворенного вещества.
Одной из качественных характеристик, введенных для
характеристики электролитической диссоциации, явля-
ется степень диссоциации (а), которая определяется как
отношение диссоциированных молекул к общему числу
148
растворенных молекул. Ее обычно выражают в долях
единицы или в процентах. Степень диссоциации зависит
от природы и концентрации электролита, природы ра-
створителя и температуры. Подчеркнем, что теория элек-
тролитической диссоциации применима только к раство-
рам слабых электролитов, в которых вследствие малой
концентрации ионов силы электростатического взаимо-
действия между ними незначительны. По этой причине
большинство физических свойств слабых электролитов
зависит только от числа частиц в растворе. Сильные же
электролиты в растворах полностью диссоциируют на
ионы, создавая их значительную концентрацию. Причем
распределение ионов в растворах уже не является таким
свободным и независимым друг от друга, как в растворах
слабых электролитов. Каждый ион оказывается окружен-
ным как бы атмосферой из противоположно заряжен-
ных ионов, которая тормозит движение данного иона к
электроду при наложении потенциала. Вследствие этого
электропроводность растворов сильных электролитов при
некоторой конкретной концентрации соответствует как
бы меньшему числу ионов, чем их имелось бы в растворе
при полной диссоциации. Однако такое кажущееся умень-
шение числа ионов объясняется не соединением их в
молекулы (их в растворе нет), а уменьшением скорости
движения ионов из-за взаимного электростатического
влияния друг на друга. Соответственно и степень диссо-
циации, которая для сильных электролитов всегда долж-
на быть равна единице, оказывается меньше единицы и ее
называют кажущейся степенью диссоциации —
Процесс диссоциации слабых электролитов на ионы
является обратимым. В общем виде его можно предста-
вить следующим образом:
КА К+ + А".
Пользуясь законом действующих масс, введем еще одну
характеристику электролитической диссоциации, кото-
рая, в отличие от степени диссоциации, не зависит от
концентрации электролита:
к [к+НА~ 1
D [КА] ’
149
где KD — константа диссоциации — величина, зависящая
от природы электролита и температуры. Для сильных
электролитов значение KD -»оо и это понятие не использу-
ется для характеристики процесса диссоциации. Диссо-
циация многих электролитов происходит последователь-
но, по ступеням. Так, диссоциация сероводородной кисло-
ты по первой ступени отобразится следующей записью:
H2S h+ + hs-.
Значение константы диссоциации KD равно:
v H2s [H+][HS-] 1
D‘ [H2S] °
Для второй ступени диссоциации
HS- H+ + S2-
значение константы диссоциации KD равно:
H2S_ [H+][S2] 2
D» [HS- ] ‘
Для полной диссоциации
H,S 2Н++ S2-
2 vH2S
значение константы диссоциации KD равно произведе-
нию констант диссоциации по первой и второй ступени:
H2S H2S wH2S
KD KD2 .
При прочих равных условиях KD > KD2 >... KD ..., тог-
да как отрыв протона от нейтральной молекулы всегда
протекает легче, чем от отрицательно заряженных ионов.
Важным процессом диссоциации является диссоциа-
ция воды:
Н2О Н+ + ОН-.
Константа для этого процесса при 25 °C равна:
н2о [Н+][ОН~]
D [Н2О] ‘
Поскольку концентрация недиссоциированных моле-
кул воды может быть принята равной общему числу моль
воды в 1 л, т. е. [Н2О] = 1000/18 = 55,56 моль, то [Н+] [ОН-] =
= 10-14. Отсюда и произведение концентрации ионов
Н+ и ОН- при данной температуре постоянно. Это про-
изведение называют ионным произведением воды (КНг0)
[Н+][0Н-] = 10-14 = Кн2о.
150
Поскольку в воде концентрация гидратированных ионов
водорода и гидроксид ионов равны, то [Н+] = [ОН-] =
= 10-7 моль/л. Раствор с равными концентрациями ионов
называют нейтральным; раствор, в котором [Н+] > [ОН-] —
кислым; раствор, в котором [Н+] < [ОН-] — щелочным (ос-
новным). На практике использование концентрации
ионов водорода для характеристики кислотности среды
неудобно. Обычно для этой цели применяют величину
отрицательного десятичного логарифма концентрации
водородных ионов, которую называют водородным пока-
зателем pH ( «пэ аш»):
pH = -lg[H+].
Тогда для нейтральной среды pH = -IglO-7 = 7, для
кислых растворов pH < 7, для щелочных pH > 7.
а Пример 1
Определите концентрации ионов водорода и гидро-
ксид ионов в 5 10-4 М растворе соляной кислоты.
Дано:
СМ(НС1) = 5 • 10-4 М
Найти:
[Н+]; [ОН-]
Решение:
Так как НС1 — сильный электролит, то [Н+] будет
равной молярной концентрации кислоты, т. е.
Сн+ = 5 • 10~4 моль/л,
10-14 10-14
[ОН ] = = 2 • К)-11 моль/л.
Ответ: [Н+] = 5 • 10-4 моль/л;
[ОН-] = 2 • 10-11 моль/л.
а Пример 2
Определите pH 0,01 М раствора КОН.
I Дано:
см(кон) = о,о1м
151
Найти:
рН(р-ра)
Решение:
КОН — сильный электролит, и поэтому [ОН-] будет
равна концентрации щелочи, т. е.
[ОН-] = 10-2 моль/л.
10-14 10-1
[НИ =-------=-----г- = 10 12 моль/л,
1 J [ОН-] 10-2
pH = -lg[H+] = -IglO-12 = 12.
Ответ: pH =12.
Ионно-молекулярные
уравнения реакции
Теория электролитической диссоциации признает, что
все реакции в водных растворах электролитов являются
реакциями между ионами. Поэтому уравнения реакции
для этих процессов, записанные в молекулярной форме,
не отражают истинного состояния веществ в растворах.
Кроме записи уравнений реакций, в молекулярном виде
существует ионная (ионно-молекулярная) форма представ-
ления уравнений реакций между электролитами в вод-
ных растворах. В ионно-молекулярных уравнениях ре-
акций вещества малорастворимые, малодиссоциирован-
ные и газообразные записываются в виде молекул, а
сильные электролиты — в виде ионов, на которые они
диссоциируют. Например, при взаимодействии раство-
ров хлорида меди (II) и гидроксида натрия образуется
осадок гидроксида меди (II):
CuCl2 + 2NaOH = Cu(OH)2] + 2NaCl.
В ионно-молекулярном виде уравнение этой реакции
записывается следующим образом:
Си2+ + 2С1- + 2Na+ + 2ОН- = Cu(OH)2| + 2Na+ + 2С1-.
Концентрации ионов натрия и хлора в процессе реак-
ции остаются неизменными, поэтому из уравнения реак-
ции их можно исключить.
Cu2+ + 2ОН- = Си(ОН)2|.
152
Поскольку реакции между ионами в растворе представ-
ляют собой пример химического равновесия, к ним при-
меним принцип смещения равновесия Ле Шателье. В со-
ответствии с этим принципом равновесие может сместить-
ся, если какое-либо вещество будет удаляться из сферы
реакции по мере ее протекания. Удаление вещества может
быть осуществлено в трех случаях: 1) образование мало-
растворимого осадка; 2) выделение газообразного веще-
ства; 3) образование малодиссоциированного соединения.
При взаимодействии раствора (NH4)2S с соляной кис-
лотой образуется газообразный сероводород и равновесие
реакции смещается вправо:
(NH4)2S + 2НС1 - 2NH4C1 + H2St,
2NH4+ + S2- + 2H+ + 2СГ = 2NH/ + 2СГ + H2Sf
или
2H+ + S2- = H2St.
Примером реакции, равновесие которой смещено в
сторону образования малодиссоциированного соединения,
может служить взаимодействие между растворами азот-
ной кислоты и гидроксида натрия:
HNO3 + NaOH = NaNO3 + Н2О,
Н+ + NO' + Na+ + ОН' = Na+ + NO ~ + Н20
о о Л
или
Н+ + он- - Н2О.
Реакция с образованием малорастворимого соедине-
ния была рассмотрена выше.
Нередко приходится встречаться с такими процесса-
ми, в которых осуществляется не один из трех рассмот-
ренных типов обменных реакций, а та или иная их ком-
бинация. Так, при взаимодействии раствора сульфита
калия с серной кислотой одновременно происходит и об-
разование малодиссоциированного вещества — воды, и
выделения газообразного продукта:
K2SO3 + H2SO4 = K2SO4 + SO2t + H20,
2K+ + SO,2" + 2Н+ + SO 2- = 2K+ + SO Л + SO,t + Н„О
или
2Н+ + SO32- = SO2t + Н2О.
А при взаимодействии раствора гидроксида бария с
153
серной кислотой одновременно образуются и осадок, и
слабый электролит:
Ва(ОН)2 + H2SO4 = BaSO4| + 2Н2О,
Ва2+ + 2ОН- + 2Н+ + SO42- - BaSO4l + 2Н2О.
Некоторые реакции протекают с образованием двух
труднорастворимых веществ:
CuSO4 + BaS = BaSO4| + CuSj,
Cu2+ + SO42' + Ba2+ + S2- = BaSO41 + CuS I.
В ряде обменных процессов малодиссоциированные или
труднорастворимые соединения находятся как среди ис-
ходных, так и конечных продуктов реакции:
NH4OH + Н+ + СГ ч* NH/ + СГ + Н2О.
Вследствие образования труднорастворимых соедине-
ний в отдельных случаях возможно вытеснение сильной
кислоты из соединений слабой, например:
Си2+ + 2СГ + H2S = CuS| + 2Н+ + 2СГ,
Cu2+ + H2S = CuS| + 2Н+.
Таким образом, рассмотренные выше примеры подтвер-
ждают общую закономерность: все реакции обмена в
растворах электролитов протекают в сторону уменьше-
ния числа свободных ионов.
Гидролиз солей
Растворение веществ в воде часто сопровождается хи-
мическим взаимодействием обменного характера. По-
добные процессы объединяют под названием гидролиза.
Гидролизу подвергаются самые различные виды веществ:
соли, углеводы, белки, сложные эфиры, жиры и т. д.
Одним из важнейших случаев гидролиза является
гидролиз солей. Под ним понимают обменное взаимо-
действие ионов растворенной соли с водой с образовани-
ем слабого электролита. В результате гидролиза образу-
ются — либо слабое основание, либо слабая кислота, либо
то и другое, вследствие чего имеет место смещение равно-
весия диссоциации воды:
Н2О Н+ + ОН'.
154
Рассмотрим следующие случаи гидролиза солей.
{Т| При растворении соли, образованной катионом силь-
ного основания и анионом сильной кислоты (например,
KNO3, CsCl, Rb2SO4 и др.), равновесие диссоциации воды
существенно не смещается, так как ионы такой соли с
водой не образуют малодиссоциированных продуктов.
Поэтому, например, в системе:
CsCl + НОН «=* CsOH + НС1
или
Сз+ + С1~ + НОН Сз+ + ОН’ + Н+ + СГ,
НОН &Н+ + ОН~
единственным малодиссоциированным соединением яв-
ляется вода. В результате равновесие реакции нацело
сдвинуто влево, т. е. гидролиз CsCl практически не про-
исходит, и раствор не содержит заметного избытка ни
ионов водорода, ни гидроксид-ионов, т. е. имеет нейтраль-
ную реакцию.
[П Соли, образованные катионами сильных оснований
и анионами слабых кислот (СН3СООК, Na2CO3, K2S и др.),
подвергаются гидролизу. Уравнение гидролиза таких
солей на примере ацетата калия можно представить сле-
дующим образом:
сн3сок + нон сн3соон + кон,
СН-СОО- + К+ + НОН СН-СООН + К+ + ОН-
о о
или
СН3СОО- + НОН CHgCOOH + ОН. (1)
Уравнение показывает, что в данном случае гидроли-
зу подвергается анион соли; реакция сопровождается
образованием малодиссоциированной кислоты. При этом
связываются ионы водорода воды и в растворе накапли-
ваются гидроксид-ионы, которые и придают ему щелоч-
ную реакцию.
Гз1 Соли, образованные катионами слабых оснований и
анионами сильных кислот, также гидролизуются (NH4C1,
NH4NO3, CuC12 и др.).
Например:
NH4C1 + НОН NH4OH + НС1
NH * + СГ + НОН NH .ОН + Н+ + СГ
4 4
155
или
NH/ + НОН NH4OH + Н+ (2)
Гидролизу, в этом случае, подвергается катион соли;
результатом реакции является образование малодиссо-
циированного гидроксида. При этом связываются гид-
роксид-ионы воды и в растворе накапливаются ионы во-
дорода, которые и придают раствору кислую реакцию.
Следует подчеркнуть, что в процессах, отражаемых
уравнениями (1) и (2), вода является более слабым элек-
тролитом, чем уксусная кислота и гидроксид аммония.
Поэтому равновесие реакций (1) и (2) сильно смещено
влево, в результате чего гидролиз таких солей идет лишь
в определенной степени.
R] Соли, образованные катионами слабых оснований и
анионами слабых кислот (CH3COONH4> A12S3, А1(СН3СОО)3
и др.), наиболее легко подвергаются гидролизу, так как
их ионы связывают одновременно в слабые электролиты
и Н+ и ОН-, образующиеся при диссоциации. Образова-
ние в результате гидролиза слабой кислоты и слабого
гидроксида обеспечивает сдвиг равновесия этого процес-
са вправо. Реакция среды в растворах подобных солей
зависит от относительной силы кислоты и основания.
При равной их силе она может быть и нейтральной, что
имеет место, например, при гидролизе CH3COONH4:
ch3coonh4 + НОН сн3соон + nh4oh,
сн3соо- + NH4+ + НОН <₽± сн3соон + nh4oh.
Практически приходится чаще всего иметь дело с гид-
ролизом солей, содержащих в своем составе многоза-
рядный ион слабого компонента (основания или кисло-
ты) и однозарядные ионы сильного. При гидролизе по-
добных соединений — например К2СО3 или Cu(NO3)2,
образуются, как правило, соответственно кислые и ос-
новные соли:
К2СО3 + НОН ч* КНСО3 + КОН,
СО,2- + НОН & НСО - + он
о о
или
Cu(NO3)2 + НОН ч* Cu(OH)NO3 + HNO3,
Cu2+ + НОН ч* CuOH+ + Н+.
156
Дальше, до образования свободной слабой кислоты или
основания, гидролиз обычно не идет из-за накопления в
растворе, соответственно, ионов ОН” или Н+. Исключения
имеют место, когда основные или кислотные свойства
многовалентных ионов выражены крайне слабо или ког-
да процесс гидролиза усиливают специально (например,
нагреванием). В подобных случаях гидролиз идет ступен-
чато и часто практически до конца:
FeCl3 + НОН ч* FeOHCl2 + НС1, (I ступень)
FeOHCl2 + НОН Fe(OH)2Cl + НС1, (II ступень)
t°
Fe(OH)2Cl + НОН Fe(OH)3 | + НС1. (Ill ступень)
Кислые соли слабых кислот также подвергаются гид-
ролизу. Однако здесь наряду с гидролизом происходит и
диссоциация аниона кислой соли. Так, в растворе гидро-
карбоната калия одновременно протекают гидролиз иона
НСО3~, приводящий к накоплению гидроксид-ионов:
НСО3- + НОН ч* н2со3 + ОН-
и его диссоциация, в результате которой образуются ионы
Н+:
нсо3- со32- + Н+.
Таким образом, реакция раствора кислой соли может
быть как щелочной (если гидролиз аниона преобладает
над его диссоциацией — именно это и происходит в ра-
створе гидрокарбоната), так и кислой (в обратном слу-
чае).
Количественно процесс гидролиза характеризуется с
помощью степени гидролиза h и константы КГ. Степе-
нью гидролиза соли называется отношение числа гидро-
лизованных молекул соли к общему числу растворенных
молекул соли. Ее обычно выражают в процентах:
число гидролизованных молекул
п = — --------------------------------- 100 %.
общее число растворенных молекул
В большинстве случаев степень гидролиза солей не-
значительна. Так, в 1 % -ном растворе ацетата натрия h
составляет 0,01 % при 25 °C. Степень гидролиза зависит
от природы растворенной соли, ее концентрации и темпе-
ратуры раствора.
157
(чаще всего в виде основных солей) малораство-
Добавляя к системе избыток одного из образую-
при реакции веществ (обычно кислоты или ще-
можно, в соответствии с законом действующих
Выражение для константы гидролиза соли (Кг) полу-
чают исходя из процесса гидролиза, константы равнове-
сия и постоянства концентрации молекул воды:
МАп + НОН МОН + НАп
[МОНЦНАп]
К“ [МАп][НОН] ’
кгн QI- tMOH][HAn] _
К[Н*°]“ [МАп] "Кг-
Влияние химической природы составляющих дан-
ную соль ионов на степень и константу гидролиза было
уже подробно рассмотрено выше. Ввиду обратимости
гидролиза равновесие этого процесса зависит от всех
тех факторов, которые влияют на равновесие реакций
ионного обмена. Например, оно смещается в сторону
разложения исходной соли, если получающиеся про-
дукты
римы.
щихся
лочи),
масс, сместить равновесие в сторону обратной реакции.
Напротив, добавление избытка воды, т. е. разбавление
раствора, в соответствии с законом действующих масс,
ведет к тому, что гидролиз протекает полнее. Влияние
температуры на степень гидролиза вытекает из прин-
ципа Ле Шателье. Процесс гидролиза является эндо-
термическим (поскольку реакция нейтрализации, яв-
ляющаяся обратной процессу гидролиза, экзотермич-
на). С повышением температуры равновесие смещается
в сторону эндотермической реакции, т. е. процесс гид-
ролиза усиливается.
Из изложенного выше вытекают общие правила, каса-
ющиеся смещения гидролитического равновесия. Если
желательно сместить его в сторону возможно более пол-
ного разложения соли, то нужно работать с разбавленны-
ми растворами и при высокой температуре. Напротив,
чтобы гидролиз протекал как можно меньше, следует
работать с концентрированными растворами и «на холо-
ду»*
158
Вопросы и задачи
для самостоятельного решения
1. Какие ученые разработали теорию электролитиче-
ской диссоциации?
2. Приведите примеры электролитов, относящихся к
различным классам неорганических соединений.
3. Как влияет природа химической связи на диссоци-
ацию веществ в растворах?
4. Изобразите схему диссоциации в воде электроли-
тов, имеющих ионную кристаллическую решетку.
5. Изобразите схему диссоциации в воде полярных
молекул электролитов.
6. Какова роль диэлектрической проницаемости ра-
створителя в процессе электролитической диссоциации?
7. Как и почему изменяется степень диссоциации сла-
бых электролитов при изменении концентрации раство-
ра? Приведи примеры веществ, являющихся слабыми элек-
тролитами.
8. Каково влияние температуры на процесс электро-
литической диссоциации?
9. При каких условиях возможно сравнение значений
степеней диссоциации слабых электролитов?
10. Каково принципиальное отличие сильных элект-
ролитов от слабых?
11. Почему разделение электролитов на сильные и
слабые в значительной степени условно?
12. Каковы особенности поведения растворов сильных
электролитов?
13. Изобразите схемы процессов диссоциации следую-
щих веществ: а) Н3РО4; б) Си(ОН)2; в) MgSO4; г) NaHSO3;
д) MgOHCl.
14. К какому классу неорганических соединений от-
носят воду? Почему?
15. Рассчитайте концентрации ионов в растворах сле-
дующих электролитов:
а) К+ в растворе карбоната калия с массовой долей
К2СО3 10 % (р = 1,09 г/мл);
б) SO42' — в 0,5 М растворе K2SO4 • A12(SO4)3.
Ответ: 1,58; 2.
159
16. Концентрация сульфат-ионов в растворе сульфата
железа (III) составляет 0,16 моль/л. Сколько граммов этой
соли содержится в 1 л раствора? Диссоциация соли пол-
ная.
Ответ: 20 г.
17. Определите степень диссоциации муравьиной кис-
лоты в растворе с концентрацией 0,01 моль/л, если в 1 мл
раствора содержится 6,82 • 1018 растворенных частиц (не-
диссоциированных молекул и ионов).
Ответ: 13,3%.
18. В 1л 0,01 М раствора уксусной кислоты содер-
жится 6,26 • 1021 ее молекул и ионов. Определите степень
диссоциации уксусной кислоты.
Ответ: 4 %.
19. Рассчитайте массовую долю (%) раствора муравь-
иной кислоты (р= 1,0 г/мл), если концентрация ионов
водорода в нем составляет 8,4 • 10-3 моль/л.
Ответ: 1,55%.
20. Рассчитайте pH раствора, если концентрация ионов
водорода равна 4,2 • 10-5 моль/л.
Ответ: 4,37.
21. Определите pH раствора, если концентрация ОН"
равна 10-4 моль/л.
Ответ: pH = 10.
22. Определите концентрации ионов Н+ и ОН'в ра-
створах, pH которых равна 5,8; 11,4.
Ответ: 1,58 • 10-6 моль/л;
6,33 • 10-9 моль/л;
3,98 • 10"12 моль/л;
0,25 • 10'2 моль/л.
23. Напишите в молекулярной и ионно-молекулярной
формах уравнения реакции взаимодействия следующих
веществ:
д) Ca(NO3)2 + К2СО3 —»
е) HNO3 + Ва(ОН)2 —
ж) Fe(NO3)2 + Na3PO4 -
з) H2SO4 + RbOH -»
a) K2S + NiSO4-»
6) K2SO3 + HC1 -»
в) AgNO3 + KI -»
r) Fe(SO4)3 + KOH
24. Напишите в сокращенной ионной форме уравне-
ния реакций, представленных следующими схемами:
160
a) KOH + FeCl2-» в) HCOOK + H2SO4-»
б) CaCO3 + HC1 -» r) KCN + HC1 -*
25. Что называется гидролизом солей? Почему раство-
ры солей могут иметь кислую, щелочную или нейтраль-
ную реакцию среды?
26. Какие соли подвергаются гидролизу частично?
Приведите примеры.
27. Какие соли и почему подвергаются гидролизу пол-
ностью? Приведите примеры.
28. Какие соли не подвергаются гидролизу? Почему
это происходит? Приведите примеры таких солей и дока-
жите справедливость своих суждений, написав соответ-
ствующие уравнения реакций.
29. В каких случаях при гидролизе солей образуются:
а) кислые соли;
б) основные соли?
Приведите примеры на каждый случай, написав уравне-
ния реакций.
30. Какие вещества помимо солей подвергаются про-
цессу гидролиза?
31. Какое значение имеет гидролиз:
а) в живых организмах;
б) в важнейших химических производствах;
в) в природе?
32. Что такое степень гидролиза и какие факторы
влияют на ее величину? Привести примеры.
33. Что характеризует константа гидролиза? От каких
факторов она зависит?
34. Составьте молекулярные и ионно-молекулярные урав-
нения реакции гидролиза следующих солей: Са(СН3СОО)2,
КС1, К2СО3, Ni(NO3)2. Укажите окраску индикаторов в их
растворах.
35. Укажите, какие из солей подвергаются гидролизу:
FeCl3, K2S, SnCl2, AgNO3. Составьте молекулярные и ион-
но-молекулярные уравнения процесса гидролиза.
36. Изменится ли окраска фенолфталеина при добав-
лении к раствору сульфида натрия?
37. Почему раствор хлорида алюминия при добавле-
нии лакмуса окрашивается в красный цвет?
161
38. Напишите уравнение реакции гидролиза карбона-
та рубидия и объясните, как влияет на гидролиз разбав-
ление и нагревание раствора.
39. В одну пробирку поместили раствор карбоната
цезия, в другую — раствор хлорида никеля (II). Почему
при добавлении фенолфталеина малиновую окраску при-
обретает только один раствор? Какой? Составьте уравне-
ния гидролиза этих солей.
40. Закончите уравнения следующих реакций с уче-
том возможности необратимого гидролиза образуемых
солей:
a) A12(SO4)8 + Na2S + НОН =
б) FeCl3 + (NH4)2CO3 + НОН =
41. Составьте уравнения реакций необратимого гид-
ролиза солей А1(СН3СОО)3и Сг2(СО3)3.
42. Почему при добавлении воды к концентрирован-
ному водному раствору хлорида олова (II) выпадает оса-
док основной соли, а при добавлении раствора соляной
кислоты выпадение осадка не происходит?
7
Окислительно-восстановительные
реакции
Степень окисления
Степень окисления атома в молекуле — это формаль-
ный (условный) заряд атома данного элемента, вычислен-
ный исходя из предположения, что все связи в молекуле,
кроме связей между атомами одного и того же элемента,
являются ионными. Степень окисления может быть по-
ложительной, отрицательной, дробной величиной или
равной нулю. Последнее значение она принимает в про-
стых веществах. В соединениях ряд элементов проявляет
всегда одинаковую степень окисления — щелочные ме-
таллы (+1), щелочноземельные элементы (+2), фтор (-1).
Для водорода в большинстве соединений характерна сте-
пень окисления (+1), а в гидридах металлов она равна
(-1). Большинство элементов характеризуется перемен-
ной степенью окисления. Расчет значений степени окис-
ления проводят исходя из электронейтральности моле-
кул, зная формулу соединения и степени окисления ато-
мов других элементов. Электронейтральность молекул
предполагает равенство нулю суммы степеней окисления
атомов элементов с учетом состава молекул. Принимая
это во внимание, определим степень окисления хлора в
хлорате калия КСЮ3. В соответствии с вышеизложен-
ным степени окисления атомов двух элементов в хлора-
те: К — (+1) и О — (~2). Три атома кислорода в соли
дают в сумме заряд (-6). Атом калия компенсирует один
отрицательный заряд. Ясно, что остальные пять отрица-
тельных зарядов должен компенсировать хлор. Это озна-
чает, что степень окисления хлора в хлорате равна (+5).
163
Расчет можно произвести и чисто алгебраически. Обо-
значим степень окисления хлора через X. Сумма всех
степеней окисления в КСЮ3в силу электронейтральнос-
ти должна быть равна нулю. Выразим это уравнением:
(+1) + X + 3(-2) = О
атом атом три атома
калия хлора кислорода
Отсюда 1 + X - 6 = О, X = +5.
Нужно четко осознавать, что степень окисления —
условное, формальное понятие, чаще всего не характери-
зующее валентное состояние атомов в молекулах веществ.
Тем не менее применение этого понятия оказывается весь-
ма полезным при составлении уравнений окислительно-
восстановительных реакций.
Окислительно-восстановительные реакции
и их классификация
Окислительно-восстановительными называются такие
реакции, которые сопровождаются изменением степени
окисления атомов элементов, входящих в состав реагиру-
ющих веществ.
Окислительно-восстановительные процессы — это еди-
ные процессы окисления и восстановления. Сущность
окисления состоит в потере электронов окисляющимся
веществом, что приводит к повышению степени окисле-
ния атомов, входящих в состав этого вещества. Сущность
восстановления состоит в присоединении электронов
восстанавливающимся веществом, что приводит к по-
нижению степени окисления атомов, входящих в состав
этого вещества.
Так, в реакции Fe + S = FeS процесс Fe° - 2е = Fe+2 яв-
ляется окислением, а процесс S° + 2е - S-2 является вос-
становлением.
Атомы, молекулы или ионы, которые отдают электро-
ны, называются восстановителями. К ним относятся ве-
щества, содержащие в своем составе атомы, находящиеся
в низшей степени окисления. Типичные восстановители:
металлы, углерод, оксид углерода (II), сероводород, амми-
164
ак, сернистый газ, хлорид олова (II), иодид калия и другие
вещества.
Атомы, молекулы или ионы, которые присоединяют
электроны, называются окислителями. К ним относятся
вещества, содержащие в своем составе атомы, находящи-
еся в высшей степени окисления. Типичные окислители:
озон, кислород, галогены, азотная кислота, соли хромовой
кислоты, перманганат калия, концентрированная серная
кислота, оксид свинца (IV), а также другие вещества.
Вещества, которые содержат в своем составе атомы,
находящиеся в промежуточных степенях окисления, мо-
гут проявлять как окислительные, так и восстановитель-
ные свойства: пероксид водорода, оксид марганца (IV),
сульфиты, нитриты и другие подобные вещества.
Все окислительно-восстановительные реакции можно
разделить на следующие типы: межмолекулярные, внут-
римолекулярные, диспропорционирования (самоокисле-
ния — самовосстановления) и реакция усреднения.
И] В реакциях межмолекулярного окисления — вос-
становления происходит изменение степени окисления
элементов, входящих в состав различных реагирующих
веществ:
О +5 +2 +4
Си + 4HNO3(koh_.) = Cu(NO3)2 + 2NO2 + 2Н2О,
+6 -1 +з о
K2Cr2O7 + 14НС1 = 2КС1 + 2СгС13 + ЗС12 + 7Н2О.
Пр К реакциям внутримолекулярного окисления-вос-
становления относятся процессы, при которых происхо-
дит изменение степени окисления разных элементов в
одном и том же веществе:
+5—2 +3 О
2KNO3 = 2KNO2 + O2f,
~3 +6 jo +3 о
(NH4)2Cr2O7 = Cr2O3 + N2 + 4H2O.
Гз] В реакциях диспропорционирования происходит
изменение степени окисления одного и того же элемента
в сторону повышения и понижения ее алгебраической
величины, т. е. атомы одного и того же элемента, находя-
щегося в молекуле в промежуточной степени окисления,
являются и окислителем и восстановителем:
165
+6 +7 +4
3K2MnO4 + 2H2O = 2KMnO4 + MnO2 + 4K0H,
О e -1 +5
3C12 + 6K0H = 5KC1 + KC103 + 3H2O.
Q В реакциях усреднения происходит изменение сте-
пени окисления одного и того же элемента с образовани-
ем одной и той же молекулы:
-2 +4
2H,S + HJSO, = 3S0 + ЗН,О.
А Л м &
Составление уравнений
окислительно-восстановительных реакций
Для составления уравнений окислительно-восстанови-
тельных процессов обычно применяют два метода: 1) ме-
тод электронного баланса и 2) ионно-электронный ме-
тод (или метод полуреакций). По существу оба метода
базируются на одном и том же принципе: в окислитель-
но-восстановительных процессах общее число электронов,
присоединяемых окислителем, равно общему числу элек-
тронов, отдаваемых восстановителем. Так как метод по-
луреакций применим лишь для уравнения окислитель-
но-восстановительных процессов в растворах, мы пока-
жем процесс уравнения одним, более универсальным,
методом электронного баланса.
При составлении уравнений окислительно-восстано-
вительных реакций следует руководствоваться следую-
щей логической последовательностью операций:
ГТ] Написать схему уравнения, то есть указать исход-
ные вещества и продукты реакций. Так, процесс окисле-
ния иода азотной кислотой отразится следующей схе-
мой:
i2 + hno3(k0H4)-hio3 + no + h2o.
[2) Найти элементы, изменяющие степень окисления, и
цифрами над символами соответствующих элементов
указать конкретные значения степеней окисления:
О +5 +5 +2
i2 + hno3(K0H4.)- Ч^ Ч*
166
[з] Изобразить электронными уравнениями процессы
окисления и восстановления, при этом обязательно про-
изводить учет количества атомов элементов, участвую-
щих в этих процессах:
О +5
3 12 - 10ё (2 • 5ё) = 21 процесс окисления
+5 +2
10 Ы + Зё = Ы процесс восстановления
Q Определить основные коэффициенты при окисли-
теле и восстановителе. Поскольку количества отдан-
ных и принятых электронов должны быть равными,
вводят дополнительные множители, устанавливающие
электронный баланс. Эти множители подбираются по
правилу нахождения наименьшего общего кратного (в
нашем случае 30) и представляют собой стехиометри-
ческие коэффициенты при окислителе (10) и восстано-
вителе (3):
3I2 + 10HNOS — HIOS + NO + Н2О.
Гб] Согласно закону сохранения массы веществ, расстав-
ляют коэффициенты в правой части уравнения перед
окисленной и восстановленной формами:
312 + 10 HNO3 -* 6ШО3 + 10NO + Н2О.
Гб) Проверяют число атомов водорода в левой и правой
частях уравнения и определяют число участвующих в
реакции молекул воды:
3I2 + 10HNO3 — 6ШО3 + 10NO + 2Н2О.
Q Правильность всех коэффициентов и самого урав-
нения окончательно проверяют по числу атомов кисло-
рода. Если баланс по кислороду сходится, то уравнение
реакции составлено правильно. Конечно, нет необходимо-
сти переписывать схему реакции несколько раз. Все рас-
суждения применяют к одному написанному уравнению,
которое в окончательном виде выглядит следующим
образом:
3I2 + 10HNO3 - 6ШО3 + 10NO + 2Н2О.
3
10
0 +5
12 - 10ё - 21
+5 +2
N + 3e = N
восстановитель (процесс окисления)
окислитель (процесс восстановления)
167
Часто встречаются процессы, в которых восстанови-
тель одновременно выполняет функции солеобразовате-
ля. Так, взаимодействие соляной кислоты с дихроматом
калия протекает по следующей схеме:
НС1 + К„Сг„О7 — КС1 + СгС1, + Cl, + Н,О.
4 Л I Q 6 й
-1 о
3 2С1 - 2ё — С12 восстановитель (процесс окисления)
+6 +3
1 2Сг + 2 • Зё = 2Сг окислитель (процесс восстановления)
Из схемы процессов окисления и восстановления вид-
но, что моль К2Сг2О7 расходуется на окисление шести моль
НС1:
6НС1 + K,Cr„O7 -» 3CL + КС1 + СгС1, + Н,О.
Л A I А в Л
I------------------1
Однако соляная кислота расходуется также и на обра-
зование солей: хлорида хрома и хлорида калия. Расчет
показывает, что на образование солей идет 8 моль HCI
(2 моль на образование КС1 и 6 моль на образование СгС13).
Следовательно, в данной реакции соляная кислота вы-
полняет двоякую роль — является окислителем и соле-
образователем:
14(6 + 8)НС1 + K2Cr2O7 -» ЗС12 + 2КС1 + 2СгС13 + 7Н2О.
Встречаются случаи, когда в молекулу восстановите-
ля входят два элемента, изменяющие степень окисления.
Так, процесс окисления пирита отражается следующей
схемой:
+2-1 to +3 -2 +4
FeS2 + О2 -» Fe2O3 + SO2.
Анализ изменения степеней окисления показывает, что
в молекуле пирита и железо, и сера повышают свою сте-
пень окисления, то есть являются восстановителями. Со-
ставляют схемы процессов окисления и восстановления:
+2 +3 1
Fe - 1ё = Fe
4 > восстановители (процесс окисления)
-1 +4
2S + 2 • 5ё = 2S /
О -2
11 О2 + 4ё = 20 окислитель (процесс восстановления)
1RR
Из схем следует, что коэффициент перед молекулой
FeS2 равен 4, а перед молекулой кислорода коэффициент
равен 11. Уравнивают число атомов железа, серы и кис-
лорода в правой части уравнения — ставят коэффициен-
ты 2 у Fe2O3 и 8 у SO2. Окончательно рассматриваемый
процесс будет представлен следующим уравнением:
4FeS2 + 11О2 = 2Fe2O3 + 8SO2.
Реакции внутримолекулярного окисления-восстанов-
ления и диспропорционирования уравниваются по вы-
шеизображенным схемам, однако удобнее при подборе
коэффициентов мысленно рассматривать процесс как бы
идущим справа налево.
Например:
+5 t° + 7 -1
4КС1О, = ЗКСЮ. + КС1
о 4
t t—
+7 +5 |
Cl + 2ё = Cl 3
-1 +5 4
Cl - 6ё = Cl 1J J
+5 “2 |<j +3 0
2NaNO3 = 2NaNO2 + O2
t t-—
+3 +5 I
N - 2ё = N 2
0 -2
O2 + 4ё = 20 1 J
Многие окислительно-восстановительные реакции
протекают по-разному, в зависимости от характера среды
(среда может быть кислой, щелочной или нейтральной).
Так, в частности, глубина восстановления перманганата
калия в зависимости от pH среды раствора иллюстриру-
ется следующими окислительно-восстановительными
процессами:
2KMnO. + 5K„S0, + 3H.S0, = 2MnS0, + 6K„S0. + ЗН,О,
4 АО А ‘к 4 А 4 А
2КМпО. + 3K-S0, + Н„0 = 2MnO„ + 3K„S0. + 2К0Н,
4 а О a aZ4
2КМпО, + К,SO, + 2К0Н = 2K,MnO, + K„SO. + Н,0.
4 А О в 4 Л 4 Л
169
Из рассмотренных реакций видно, что изменение pH
среды раствора приводит, во-первых, к изменению соста-
ва продуктов восстановления: Мп+2 (в кислой среде),
МпО2 (в нейтральной) и МпО4“(в щелочной), а во-вторых,
к последовательному уменьшению количества моль вос-
становителя окисляющихся одним и тем же количеством
моль окислителя: 5 (в кислой среде), 3 (в нейтральной) и
1 (в щелочной).
Вопросы и задачи
для самостоятельного решения
1. Что называется степенью окисления? Какую роль
играет данное понятие при рассмотрении окислительно-
восстановительных процессов?
2. Определите степень окисления серы в следующих
соединениях:
S, SO2, FeS2, K2SO3, CS2, K2S2O7, P2S3, CaSO4.
3. Определите степень окисления хрома в следующих
соединениях:
СгО3; CrSO4; Fe(CrO2)2; Сг2О3; К3[Сг(ОН)б]; Na2CrO4;
(NH4)2Cr2O7.
4. Определите степень окисления железа в следующих
соединениях:
FeO, NH4Fe(SO4)2, FeCl3, K3[Fe(CN)6], Fe(CrO2)2, K2FeO4.
5. Укажите, какие из приведенных процессов представ-
ляют собой окисление и какие — восстановление:
0 -1 0 +2 0 +i
С1- Cl Ni — Ni Na — Na
+2 +4 +6 -2 +7 +4
Sn — Sn S — S Mn — Mn
0 +5 +6 +3 0 +3
Cl — Cl Fe- > Fe Al- Al
6. Составьте электронные уравнения для следующих
превращений:
+в +2 +2 +7 0 -2
Mn- > Mn Mn — Mn O2— 20
170
+3 +6
Fe -» Fe
+5 -3
N- N
-2 +4
s-> s
+2 0
Cu^ Cu
-1 0
21 -* I2
+6 +3
2Cr -> 2Cr
7. С учетом степеней окисления укажите, какие веще-
ства из нижеприведенных проявляют свойства:
а) окислительные;
б) восстановительные;
в) окислительно-восстановительные:
H2S, SO2, Н2О2, Na, MnO2, F2, Fe2O3, SO3, C, KMnO4, KNO2,
PbO2, O2, KBr, HNO3.
8. Укажите, какие из указанных ниже ионов могут
быть окислителями:
Ag+, Cu2+, SOf, Ct3*, Br“, C1O3-, S2“, MnO2~, NO2.
9. Дайте определение окислительно-восстановительным
реакциям. Какие типы окислительно-восстановительных
процессов вы знаете?
10. Укажите, какие из приведенных ниже реакций
относятся к окислительно-восстановительным:
a) Fe + 2HCI = FeCl2 + H2f,
б) K2Cr2O7 + 2К0Н = 2K2CrO4 + Н2О,
в) Cr(OH)3 + 3NaOH = Na3[Cr(OH)6],
г) 2NH4C1 + Са(ОН)2 = СаС12 + 2NH3 + 2Н2О,
t°
д) 2КМпО4 ~ К2МпО4 + МпО2 + О2,
е) 4NH3 + 5О2 к£ 4NO + 6Н2О,
ж) K4[Fe(CN)6] + FeCl3 - KFe[Fe(CN)6] + ЗКС1.
11. Укажите, какие из приведенных ниже реакций
являются окислительно-восстановительными. Укажите,
какой элемент является окислителем, а какой — восста-
новителем:
a) Ni + Hg(NO3)2 = Ni(NO3)2 + Hg,
f
6) 3Fe + 4H2O = Fe3O4 + 4H2t,
в) 2K0H + CO2 = K2CO3 4- H2O,
171
г) ЗС + Fe2O3 = 2Fe + ЗСО,
д) 3H2S + 2HNO3 = 3S + 2NO + 4H2O,
e) 4HNO3 = 4NO2 + O2 + 2H2O,
ж) A12O3 + 3H,SO4 = A1,(SO4)3 + 3H2O.
12. Какие из приведенных реакций относятся к реак-
циям межмолекулярного окисления-восстановления, к
реакциям внутримолекулярного окисления-восстановле-
ния и к реакциям диспропорционирования или к реак-
циям усреднения:
a) PbS + 403 = PbS04 + 402t,
б) 4НС1 + МпО2 = МпС12 + С12 + 2Н2О,
в) 3S + 6К0Н = K2SO3 + 2K2S + ЗН2О,
г) NH4NO3 = N2O + 2Н2О,
д) 4Zn + 10HNO3(pa36.) = 4Zn (NO3)2 + NH4NO3 + 3H2O,
e) 2Cu(NO3)2 = 2CuO + 4NO2 + O2,
t°
ж) 3C12 + 6NaOH = NaC103 + 5NaCl + 3H2O.
13. Рассчитайте, какое количество моль соляной кис-
лоты выступает в роли восстановителя в следующих про-
цессах:
a) MnO2 + НС1 -» МпС12 + С12 + Н2О,
б) KMnO4 + НС1 - КС1 + МпС12 + С12 + Н2О,
в) КС1О3 + НС1 -» КС1 + С12 + Н2О,
г) K2FeO4 + НС1 -* КС1 + FeCl3 + Cl2 + Н20,
д) Со(ОН)3 + НС1 — СоС12 + С12 + Н20.
14. Рассчитайте, какое количество моль азотной кис-
лоты выступает в роли солеобразователя в следующих
процессах:
a) CuS + HNO3 (копц ) -» Cu(NO3)2 + H2SO4 + N02 + H2O,
6) Fe + HNO3 (раз6 ) - Fe(NO3)3 + NO + H2O,
в) Sn + HNO3 (разб.) - Sn(NO3)2 + NH4NO3 + H2O,
r) PbS + HNO3 (конц ) -» PbSO4 + NO2 + H2O,
172
д) Pb3O4 + HNO3 Pb(NO3)2 + PbO2 + H20.
15. Подберите для осуществления процессов необходимый
окислитель или восстановитель. Напишите уравнения ре-
акций и расставьте коэффициенты:
1) S02 -> S03,
2) FeS2 -* Fe2O3,
3) Fe(OH)2 -» Fe(OH)3,
4) HC1 Cl2,
5) S -» H2SO4,
6) H2S -» H2SO4,
7) HNO3 -> N2,
8) Ag -» Ag+,
9) HNO2 -* NO,
10) P POf~.
16. Закончите уравнения следующих окислительно-
восстановительных реакций:
1) H2S + Br2 S + 2HBr,
2) H2S + Ag + O2 -» Ag2S + H2O,
3) H2S + HIO3 -» S + I2 + H2O,
4) H2S + H2SO3 -» S + H2O,
5) H,S + K2Cr,O7 + H2S04 -* K2S04 + Cr,(S04)4 + S + H2O,
6) H2SO3 + Cl2 + H2O H2SO4 + HC1,
7) H2SO3 + HC1O3 -> H2SO4 + HC1,
t°
8) SO2 + O2 — SO3,
кат.
t°
9) ZnS + O2 -* SO2 + ZnO,
10) SO2 + KMnO4 + H,0 -* K2S04 + MnS04 + H2S04.
17. Закончите уравнения следующих окислительно-
восстановительных реакций:
1) H2SO4 + Zn -» ZnSO4 + Н2,
2) H2SO4(KOB4j + Си —» CuSO4 + SO2 + H2O,
3) Н28О4(ковц>) + Zn -» ZnSO4 + S + H2O,
173
4) Н28О4(котц>) + Al £ A12(SO4)3 + H2S + H20,
5) H2SO4(kohM + KBr - Br2 + K2SO4 + S + H20,
6) Н2804(коиц>) + KI -» I2 + K2SO4 + H2S + H20,
7) Н/О4 (конц>) + C -» C02 + S02 + H20,
8) Н2ЙО4 (конц+ S -* S02 + H20.
18. Закончите уравнения следующих окислительно-
восстановительных реакций:
1) HNO3 (разб-) + Р + Н2О - Н3РО4 + NO,
2) HNO3 (разб ) + 8-* H2SO4 + NO,
3) HNO3 (рвзб-) + CuS - Cu(NO3)2 + S + NO + H2O,
4) HNO3 (pa36i) + Fe -» Fe(NO3)3 + NO + H2O,
5) HNO3 (разб>) + Zn Zn(NO3)2 + NH4NO3 + H2O,
6) HNO3 (pa36i) + As2O3 + H2O -» H3AsO4 + NO2,
7) HNO3 (pa36i) + (C6H10O5)n - CO2 + NO + H2O,
8) HNO3 + HC1 + Au -» AuCl3 + NO + H2O,
9) Pb(NO3)2 PbO + NO2 + O2,
10) AgNO3 Ag + NO2 + O2,
t°
11) KNO3 KNO2 + O2.
19. Закончите уравнения следующих окислительно-
восстановительных реакций:
1) CrS04 + KMnO4 + H2SO4->
— Cr2(SO4)3 + K2SO4 + MnSO4 + H2O,
2) Cr(OH)2 + O2 + H2O — Cr(OH)3,
3) CrCl3 + H2 -» CrCl2 + HC1,
4) Na3[Cr(OH)6] + NaOH + Br2 -* Na2CrO4 + NaBr + H2O,
5) K2Cr2O7 + SO2 + H2SO4 -» K2SO4 + Cr2(SO4)3 + H2O,
6) K2Cr2O7 + H2O2 + H2SO4^P CrO5 + K2SO4 + H2O,
7) MnSO4 + NaOH + Br2 MnO2 + NaBr + Na2SO4 + H2O,
8) Mn(NO3)2 + PbO2 + HNO3 HMnO4 + Pb(NO3)2 + H2O,
9) MnO2 + HC1 — MnCl2 + Cl2 + H2O,
174
10) MnO2 + K2CO3 + KC1O3 -X К2МпО4 + КС1 + со2,
11) К2МпО4 + СО2-» КМпО4 + МпО2 + К2СО3,
12) К2МпО4 + Н2С2О4 -* МпС204 + К2С2О4 + СО2 + Н2О,
13) KMnO4 + KI + H2O - MnO2 + I2 + KOH,
14) KMnO4 + FeSO4 + H2SO4-*
K2SO4 + MnSO4 + Fe2(SO4)3 + H2O,
15) KMnO4 + K,SO, + KOH -* K,MnO4 + K,SO4 + H2O.
20. Закончите уравнения следующих окислительно-
восстановительных реакций:
1) CgH6 + О2 —» СО2 + Н2О,
2) С2Н5ОН + K2Cr2O7 + H2SO4
— СНоСООН + Cr,(S04), + K,S04 + Н2О,
3) С2Н4 + КМпО4 + Н2О
СН2(ОН) - СН2(ОН) + МпО2 + кон,
4) сн3 - nh2 + О2 — СО2 + N2 + Н2О,
5) С6Н5 - NO2 + Н2 СЙН5 - NH, + Н2О.
21. Рассчитайте объем кислорода, получившегося при
разложении 31,6 г перманганата калия.
Ответ: 2,24 л.
22. Какова масса оксида железа Fe3O4, восстановлен-
ного до железа водородом объемом 5,6 м3 (н. у.)?
Ответ: 14,5 кг.
23. К раствору, содержащему нитрат меди (II) массой
18,8 г, прибавили железные опилки массой 30 г. Какова
масса меди, получившейся в результате реакции?
Ответ: 6,4 г.
24. Какой объем оксида серы (IV) (н. у.) можно полу-
чить при обжиге железного колчедана массой 2 т с массо-
вой долей серы 48 %, если в огарке остается массовая
доля серы 1,6 % ?
Ответ: 649,6 м3.
25. На обжиг цинковой обманки массой 300 г с массо-
вой долей 48,5 % был израсходован объем воздуха 300 л
(н. у.). Вычислите объемную долю (%) компонентов об-
разовавшейся при этом газовой смеси.
175
Ответ: N2 — 82,7 %
SO2— 11,8%
O2 — 4,4 %
инертные газы — 1,1 %.
26. Какой объем кислорода (н. у.) будет израсходован
на сжигание 200 л газовой смеси, содержащей 50 % (объем-
ных) водорода и 50 % оксида углерода (II)?
Ответ: 100 л.
27. Одинаковое ли количество азотной кислоты по-
требуется для растворения моль серебра, если в одном
случае она будет восстановлена до оксида азота (IV), а в
другом — до оксида азота (II)? Какой объем оксидов вы-
делится в первом и во втором случаях?
Ответ: нет; 22,4 л NO2 и 7,46 л NO.
28. В каком объеме воздуха содержится количество
азота, достаточное для получения 1 м3 аммиака, если в
реакцию с водородом вступает 80 % азота?
Ответ: 0,8 м3.
29. К 20 г смеси солей, содержащих в качестве окисли-
теля перманганат калия, прибавили раствор концентри-
рованной соляной кислоты. Определите массовую долю
(%) перманганата калия в смеси, если при этом выдели-
лось 6 л (н. у.) хлора (растворимость хлора в растворе
НС1 не учитывалась).
Ответ: 84,5%.
30. Сернокислый раствор содержит 2,94 г дихромата
калия, при пропускании через него сернистого газа он
обесцветился. Определите объем SO2 (н. у.) пропущенно-
го через раствор окислителя.
Ответ: 0,672 л.
31. Определите количество растворенного нитрата
железа (II), если на окисление его в азотнокислом раство-
ре израсходовали 3,16 г перманганата калия.
Ответ: 18 г.
32. Какой объем аммиака (н. у.) выделится при окис-
лении 0,325 кг цинка нитритом калия в щелочной среде?
Ответ: 37,4 л.
33. Хватит ли кислорода, полученного при разложе-
нии хлората калия, для окисления 6,4 г серы до оксида
серы (IV), если хлорат был получен при взаимодействии
176
6,72 л хлора (н. у.) с горячим раствором, содержащим
3,36 г гидроксида калия?
Ответ: нет.
34. Сколько г оксида хрома (III) получится при пол-
ном разложении 25,2 г дихромата аммония, если реак-
ция протекает с выходом 98 % ? ,
Ответ: 14,9 г.
35. Объемы водорода, выделившегося при действии
разбавленной серной кислоты на магний и раствора ще-
лочи на алюминий, численно равны. В каком массовом
отношении взяты металлы?
Ответ: 4 : 3.
36. После термического разложения 39,4 г смеси хло-
рида и хлората калия, в присутствии МпО2, получили
29,8 г остатка. Определите, какой объем хлора (н. у.)
пришлось пропустить через горячий раствор щелочи для
получения хлората, содержащегося в исходной смеси.
Ответ: 13,4 л.
37. Определите массовую долю (%) алюминия в спла-
ве, обработка 25 г которого горячей серной кислотой при-
водит к выделению сероводорода, осаждающего из раствора
28,8 г сульфида меди (II) (считать, что остальные компо-
ненты сплава не взаимодействуют с H2SO4).
Ответ: 43,2%.
38. Сколько г азотной кислоты было израсходовано на
окисление серы до серной кислоты, если при осаждении
последней хлоридом бария выделилось 46,6 г осадка.
Ответ: 75,6 г.
39. Рассчитайте, какое количество меди необходимо
взять для получения сернистого ангидрида, если при окис-
лении его водным раствором перманганата калия обра-
зуется 1 моль серной кислоты.
Ответ: 160 г.
40. Сколько г нитрата калия необходимо взять на окис-
ление оксида хрома (III) в хромат, если при обработке
последнего серной кислотой было получено такое коли-
чество дихромата, которое достаточно для окисления
6 моль хлороводорода (н. у.).
Ответ: 130 г.
8
Электролиз
Электролизом называется окислительно-восстанови-
тельный процесс, протекающий на электродах при про-
хождении постоянного электрического тока через раствор
или расплав электролита. Химические реакции проте-
кают на электродах за счет электрической энергии. При
электролизе катод является восстановителем, так как он
отдает электроны, а анод — окислителем, так как он при-
нимает электроны от анионов.
Например, если в раствор хлорида меди опустить элек-
троды и пропустить постоянный электрический ток, то
ионы меди будут двигаться к катоду, а ионы хлора — к
аноду. На катоде происходит процесс восстановления:
Си2+ + 2ё = Си,
а на аноде — окисления:
2СГ - 2ё - С12.
В итоге на катоде будет выделяться медь, а на аноде —
хлор.
Восстановительное и окислительное действие элект-
рического тока во много раз сильнее химических восста-
новителей и окислителей. Ни один химический окисли-
тель не может отнять у иона фтора его электрон. Окис-
лить ион фтора удалось лишь при электролизе расплава
смеси безводного жидкого фтороводорода с фторидом
калия. На угольном аноде выделяется фтор:
2F- - 2ё = F2,
а на никелевом катоде — водород:
2Н+ + 2ё = Н2.
Различают электролиз расплавов и растворов элект-
ролитов. Процессы в расплавленных электролитах — наи-
178
более простой случай электролиза. Так, в расплаве хлори-
да натрия содержатся ионы Na+ и СГ. При пропускании
через него электрического тока ионы Na+ у катода присо-
единяют электроны и восстанавливаются до атомов на-
трия, ионы хлора СГу анода отдают электроны и окисля-
ются до атомов хлора, которые затем образуют молекулы.
0 Пример 1
Схема электролиза расплава NaCl
NaCl Na+ + Cl~.
расплав
К(-): Na + 1ё -• Na° 2 процесс восстановления
А(+): 2С1 - 2ё = С12 1 процесс окисления
электролиз
2NaCl -* 2Na + Cl„f.
а '
а Пример 2
Схема электролиза расплава СаВг2
СаВг. Са2+ + 2Вг".
4 расплав
К(-): Са + 2ё -* Са° 1 процесс восстановления
А(+): 2Вг - 2ё = Br2 1 процесс окисления
электролиз
СаВг2 -• Са + Вг2.
а Пример 3
Схема электролиза расплава КОН
КОН К+ + ОН",
расплав
К(-): К + ё -» К 4 процесс восстанов-
ления
А(+): 40Н" - 4ё -» 02 + 2Н2О 1 процесс окисления
, электролиз
4К+ + 40Н -* 4К + О2 + 2Н20 — ионное урав-
нение
электролиз
4К0Н 4К + О2 + 2Н2О — молекулярное урав-
нение
179
Если электролизу подвергается расплав, который со-
держит несколько различных катионов, то в этом слу-
чае последовательность восстановления определяется
электродным потенциалом металла в данных услови-
ях. В первую очередь восстанавливаются катионы ме-
таллов, обладающие большим значением электродного
потенциала.
Более сложные процессы протекают при электролизе
водных растворов электролитов, поскольку в этих про-
цессах принимает участие вода. Рассмотрим электролиз
концентрированного раствора хлорида натрия. В этом
случае в растворе, кроме гидратированных ионов натрия
и хлора, присутствуют молекулы воды и продукты ее
диссоциации, которые участвуют в электродных реакци-
ях. При прохождении тока через раствор к катоду будут
двигаться катионы натрия и водород, а к аноду — хлорид
и гидроксид-ионы. По этой причине реакции, протекаю-
щие на электродах, будут существенно отличаться от ре-
акций, идущих в расплаве соли.
На катоде, вместо ионов натрия, будут восстанавли-
ваться молекулы воды и ионы водорода, поскольку они
обладают большей окислительной способностью с иона-
ми натрия. На аноде происходит окисление хлорид-ионов
(обладающих большей восстановительной способностью
по сравнению с гидроксид-ионами).
4
Пример
Схема электролиза раствора NaCl
NaCl & Na+ + СГ,
расплав
НОН н+ + он~.
К(-): 2Н20 + 2ё -» Н2 + 2ОН 1 процесс восстановле-
ния
1 процесс окисления
А(+): 2СГ- 2ё — С12
электролиз
2Н2О + 2СГ — H2f + Cl2t + 2ОН“,
электролиз
2NaCl + 2Н2О — H2f + Cl2f + 2NaOH — моле-
кулярное уравнение
180
Последовательность, в которой происходит разряд
ионов на катоде из растворов солей, определяется ря-
дом стандартных электродных потенциалов, в котором
металлы располагаются в ряд по нарастанию алгебраи-
ческой величины их нормальных электродных потен-
циалов.
Поясним, как образуется ряд стандартных электродных
потенциалов. Погружение металла в раствор одноимен-
ной соли приводит к процессам перехода ионов металла
с поверхности металла в раствор — растворение металла,
или из раствора в металл — осаждение металла. Вслед-
ствие этих процессов поверхность металла (электрода)
приобретает положительный или отрицательный заряд,
причем его величина и знак будут определяться приро-
дой металла, концентрацией соли в растворе и темпера-
турой. Гидратированные катионы и анионы, находящие-
ся в растворе, притягиваются заряженными поверхностя-
ми металлов, в результате чего на поверхности раздела
металл-раствор образуется два слоя с противоположны-
ми зарядами — так называемый двойной электрический
слой. Разность потенциалов этого слоя носит название
электродного потенциала.
Непосредственно измерить величину потенциала отдель-
ного электрода не представляется возможным. Поэтому
электродные потенциалы измеряют путем сопоставления
с потенциалом принятого для сравнения электрода. В ка-
честве последнего обычно применяют стандартный водо-
родный электрод, величину потенциала которого условно
принимают за ноль. Зтот электрод состоит из платиновой
пластинки, покрытой платиновой чернью (электролити-
чески осажденной платиной), которая погружена в 1 М
раствор серной кислоты и омывается струей газообразно-
го водорода под давлением 1 атм.
Если теперь пластинку любого металла, погруженную
в раствор его соли, содержащий 1 моль ионов металла в
1000 г воды, соединить с водородным электродом с помо-
щью так называемого «электролитического ключа», то
получится гальванический элемент, электродвижущую
силу которого (ЭДС) легко измерить. Эта ЭДС, измерен-
ная при 25 °C, называется стандартным электродным
181
Ряд стандартных электродных потенциалов металлов
182
потенциалом данного металла. Располагая металлы в
порядке возрастания алгебраической величины их стан-
дартных электродных потенциалов, получают ряд стан-
дартных электродных потенциалов металлов.
Чем левее металл в ряду стандартных потенциалов,
тем труднее его ион разряжается при электролизе. При
этом возможны три случая:
И] Катионы металлов, имеющих стандартный потен-
циал больший, чем у водорода (от Си2+ до Аи3+), прн элек-
тролизе практически полностью восстанавливаются на
катоде.
Гг] Катионы металлов, имеющих малую величину стан-
дартного электродного потенциала (от Li+ до А13+ вклю-
чительно), не восстанавливаются на катоде, а вместо них
восстанавливаются молекулы воды.
Гз] Катионы металлов, имеющих стандартный элект-
родный потенциал меньший, чем у водорода, но боль-
ший, чем у алюминия (от А13+ до Н2), при электролизе
на катоде восстанавливаются одновременно с молекула-
ми воды.
Если же водный раствор содержит катионы различ-
ных металлов, то при электролизе выделение их на като-
де протекает в порядке уменьшения алгебраической ве-
личины стандартного электродного потенциала соответ-
ствующего металла. Так, из смеси катионов Ag+, Cu2+, Zn2+
сначала будут восстанавливаться катионы серебра, затем
катионы меди и последними — катионы цинка.
Характер реакций, протекающих на аноде, зависит
как от присутствия молекул воды, так и от вещества, из
которого сделан анод. Аноды бывают нерастворимые и
растворимые. Первые изготавливаются из угля, гра-
фита, платины (в процессе электролиза они не перехо-
дят в раствор в виде ионов); вторые — из меди, серебра,
цинка, кадмия, никеля и др. металлов (в процессе элек-
тролиза переходят в раствор в виде ионов, т. е. разру-
шаются).
На нерастворимом аноде в процессе электролиза про-
исходит окисление анионов или молекул воды. При этом
анионы бескислородных кислот и их солей (СГ, Вг“, Г,
S2-) окисляются у анода.
183
При электролизе водных растворов щелочей кислоро-
досодержащих кислот и их солей (SO42-, NO3“, СО32-, РО43“),
а также фторидов на аноде происходит электрохимиче-
ское окисление воды с выделением кислорода.
Рассмотрим возможные случаи электролиза раствора
солей на угольных электродах (электроды не участвуют
в окислительно-восстановительных реакциях).
Электролиз раствора соли, образованной активным
металлом, стоящим в ряду напряжений до алюминия и
кислотным остатком кислородосодержащей кислоты
сводится к электролизу воды.
Пример 5
Схема электролиза водного раствора MgSO4
MgSO4 Mg2+ + SO.2-,
4 раствор 4
НОН Н+ + ОН-, а<2%.
К(-): 2Н2О + 2ё Н2 + 2ОН-
2 процесс восстанов-
ления
1 процесс окисления
А(+): 2Н2О - 4ё 4Н+ + О2
электролиз
6Н2О — 2Н2 Г + о2 Г + 4Н+ + 4OH-.
Учитывая, что 4Н+ + 4ОН- = 4Н2О,
2Н2О
электролиз
2H2f+O2f.
Электролиз раствора соли, образованной малоактив-
ным металлом, стоящим в ряду напряжений после
водорода, и кислотным остатком кислородосодер-
жащей кислоты. В данном случае при электролизе
получается металл, кислород, а в катодно-анодном
пространстве образуется соответствующая кислота.
Пример 6
' Схема электролиза водного раствора CuSO4
CuSO. <=* Cu2+ + SO2-,
раствор 4
НОН н+ + он-.
184
K(-): Cu2+ + 2ё -* Cu° 2 процесс восстанов-
ления
А(+): 2Н2О - 4ё -» 4Н+ + О2 1 процесс окисления
„, электролиз
2Cu2+ + 2Н2О — 2Cu + O2f+4H+,
электролиз
2CuSO. + 2Н„О — 2Си + О Л + 2H„SO..
•Л А ' С Ч
Электролиз раствора соли, образованной активным
металлом (до А1) и кислотным остатком галогено-
водородной кислоты. При электролизе получается
водород, галоген, в катодно-анодном пространстве —
щелочь.
Пример 7
Схема электролиза водного раствора СаС12
СаС1, Са2+ + 2СГ,
раствор
НОН н+ + он~.
К(-): 2Н2О + 2ё -» Н2 + 2ОН~ 1 процесс восстанов-
ления
1 процесс окисления
А(+): 2СГ- 2ё С12
электролиз
2Н2О + 2СГ -* Н2 Г + Cl2 f + 2ОН-,
электролиз
СаС1„ + 2Н,0 -» Н„ t + С1Л + Са(ОН)2.
Электролиз раствора соли, образованный малоак-
тивным металлом и кислотным остатком галоге-
новодородной кислоты. При электролизе получает-
ся металл и галоген.
Пример 8
Схема электролиза водного раствора СиС12
CuCl, Си2+ + 2СГ,
раствор
нон н+ + он~.
К(-): Си2+ + 2ё -* Cu° 1 процесс восстановления
А(+): 2С1 - 2ё -* С12 1 процесс окисления
185
электролиз
Си2+ + 2СГ Cu + Cl2f,
электролиз
CuCL Сп + С1Л.
«а А
Если соль образована металлом, стоящим в ряду
напряжения от алюминия до водорода и в процессе
восстановления принимает участие вода, то процесс
электролиза идет в зависимости от концентрации
раствора соли. Чем менее концентрированный ра-
створ, тем менее интенсивно восстанавливается ме-
талл.
Пример 9
Схема электролиза водного раствора Ni(NO3)2
Ni(NO3)2 Ni2+ + 2NO-
- ° раствор
НОН Н+ + 0Н-.
К(-): Ni2+ + 2ё Ni
2Н2О + 2ё -» Н2 + 2ОН"
А(+): 2Н2О - 4ё 4Н+ + О2
„. электролиз
Ni2+ + 4Н2О -* Ni + Н2 f + О2 f + 2Н2О + 2Н+,
электролиз
Ni(N0,)„ + 2Н„О Ni + Н Л + О Л + 2HN0,.
х 0' А А А ’ А ' о
1 процесс
1 процесс
восстанов-
ления
окисления
Пример 10
Схема электролиза водного раствора NaOH
NaOH Na+ + ОН,
раствор
НОН Н+ + 0Н”.
К(-): 2Н2О + 2ё -* Н2- + 2ОН 2 процесс восстанов-
ления
1 процесс окисления
А(+): 2Н2О - 4ё -» 4Н + О2
электролиз
4Н,О + 4ОН~ -» 2Н, Г + О Л + 2Н„О + 4ОН",
электролиз
2Н2О — 2H2f+O2t.
186
а Пример 11
Схема электролиза водного раствора H2SO4
H,S04 г* 2Н+ + SO.2 ’,
раствор
НОН Н+ + ОН'.
К(-): 2Н+ + 2ё -» Н2 2 процесс восстанов-
ления
А(+): 4ОН~— 4ё -* О2 + 2Н2О 1 процесс окисления
электролиз
4Н+ + 2Н2О — 2Н2| + О2 + 4Н+,
2Н2О
электролиз
2H2t+O2f.
Растворимый анод при электролизе сам подверга-
ется окислению (растворению), т. е. посылает элек-
троны во внешнюю цепь. Так, при электролизе ра-
створа сульфата никеля с никелевым анодом про-
цесс сводится к выделению никеля на катоде и
постепенному растворению анода. Количество суль-
фата никеля в растворе остается неизменным.
Пример 12
Схема электролиза водного раствора NiSO4 с раство-
римым анодом
NiSO4 Ni2+ + SO2’,
4 раствор 4
НОН Н'+ОН.
К(-): Ni2+ + 2ё Ni°
А(+): Ni “ 2ё Ni2+
Количественно процесс электролиза описывается за-
конами Фарадея:
ГТ] Количество вещества, восстановленного на катоде
или окисленного на аноде, пропорционально количеству
прошедшего через раствор или расплав электричества:
т = k • ЛГзкв • Q,
где т — масса окисленного или восстановленного ве-
щества;
187
Мэкв. — его молярная масса эквивалента;
Q — количество электричества, прошедшего через
электролит;
к — коэффициент пропорциональности.
Гг] Количество окисляющихся или восстанавливаю-
щихся на электродах веществ при пропускании одного и
того же количества электричества пропорциональны их
молярным массам эквивалентов.
т, т9
= const.
•^экв.1 -^экв.2
Оба закона Фарадея можно выразить общей форму-
лой:
М)КВ Q
т —--------
F
где F — число Фарадея.
Учитывая, что количество электричества Q равно про-
изведению силы тока J в амперах на время т в секундах,
формулу можно написать так:
М -J-T
т —------------------------:----.
96 500
Если J • т = 1 Кл, то
Величина Е называется электрохимическим эквива-
лентом вещества и характеризует собой массу вещества,
которое восстанавливается на катоде или окисляется на
аноде при прохождении через электролит одного кулона
электричества. Молярная масса эквивалента связана с
электрохимическим эквивалентом отношением:
Мэкв = EF.
Пример 13
Вычислите объем кислорода, выделившегося на
угольном аноде при пропускании через разбавлен-
ный раствор серной кислоты тока силой 5 А в тече-
ние часа.
188
Дано:
7=5А
т = 1 час = 3600 сек
МЭКВ.(О2) = 8 г/моль
Найти:
Г(О2)
Решение:
1) Уравнение электролиза:
электролиз
2Н2О -» 2Н2 + О2.
2) Находим количество электричества:
Q-1-т,
Q = 5 • 3600 = 18 000 Кл.
3) Определим массу кислорода, выделившегося на
аноде:
4) Найдем,
кислорода,
вещества:
МЭКВ Q
т = —-------, где
F
8 18 000 ,
т = —Xz. к/ч/ч— = 1,492 г.
96 500
какой объем при н. у. займет 1,492 г
Для этого сначала найдем количество
1,492
Т(°2) = — “ 0,047 моль.
Откуда У(О2) - 0,047 • 22,4 = 1,044 л.
Ответ: У(О2) = 1,044 л.
Пример 14
Рассчитайте время, необходимое для полного выде-
ления хлора, содержащегося в 2 л 0,5 Н раствора
хлорида калия при электролизе этого раствора то-
ком силой 5 А.
Дано:
У(С12) = 2 л
Сн(КС1) = 0,5
7=5А
189
Найти:
Решение:
Определяем, что в 2 л 0,5 Н раствора хлорида калия
содержится: 2 • 0,5 = 1 моль • экв. соли, для разло-
жения которой требуется 96 500 Кл.
Исходя из этого:
О 96 500
т = —, т = ———---= 321,8 мин = 5,3 ч.
I 5’1
Ответ: т-5,3 час.
Пример 15
Между какими из следующих попарно взятых ве-
ществ, формулы которых даны ниже (электролит
берется в виде водного раствора), будет протекать
реакция замещения:
a) Al + Cu(NO3)2;
б) Zn + MgSO4.
Напишите уравнения реакции в ионной форме.
Решение:
В рассматриваемых реакциях замещения свободный
металл будет вытеснять металл из соли в раствор в
том случае, если он обладает большей восстанови-
тельной способностью по сравнению с металлом,
образующим соль. Сравнивая пары металлов— А1
и Си; Zn и Mg, мы видим из их положения в элек-
трохимическом ряду напряжений, что реакция за-
мещения возможна только в первом случае и она
отразится следующим уравнением:
2А1° + ЗСи2+ - ЗСи0 + 2А18+.
Применение электролиза расплавов и растворов огром-
но. Такие ценные металлы, как алюминий, натрий, цинк,
олово, свинец, кадмий, серебро, золото, получают исключи-
тельно путем электролиза. В производстве никеля, маг-
ния, меди, белой жести электрохимическая продукция
190
составляет 80-90 %. Хлор и его кислородные соединения
в промышленности получают также электрохимически.
Все шире развиваются электрохимические методы полу-
чения органических соединений. Электролиз начинают
применять для обессоливания воды, для укрепления грун-
тов за счет удаления воды (электроосмос). Его развитие
тесно связано с проблемой получения чистых и особо чис-
тых материалов. Ни одна отрасль машиностроения не
может обойтись без электрохимических методов обработ-
ки поверхности металлических изделий. Электрохимичес-
ким методом наносят металлические покрытия, которые
предохраняют металл от ржавчины.
Электролиз используют для получения точных копий
с различных предметов — гальванопластика. Предмет, с
которого хотят получить копию, покрывают воском и
получают матрицу. Поверхность восковой матрицы по-
крывают тонким слоем графита, делая ее проводящей
электрический ток. Графитовый катод опускают в ванну
с раствором сульфата меди, анодом служит медь. При
электролизе медный анод растворяется, а на катоде осаж-
дается медь. С помощью гальванопластики изготавлива-
ются клише для печати матрицы грампластинок, метал-
лизируют различные предметы.
Электролиз используют для очистки металлов от при-
месей. Рафинирование (очистка) меди основано на анод-
ном растворении металла. В больших ваннах подвеши-
вают ряд пластин из черновой меди, а между ними —
тонкие пластинки чистой меди, заливают электролит и
пропускают ток. Анод — черновая медь — растворяется,
а на пластинках из чистой меди, которые служат като-
дом, нарастает слой очищенной меди. Электролитическая
медь содержит 99,97 % чистой меди.
Вопросы и задачи
для самостоятельного решения
1. Укажите отличие проводников первого рода от про-
водников второго рода.
2. Укажите, от каких факторов зависит последователь-
191
ность расположения металлов по величинам их электрод-
ных потенциалов.
3. Объясните, почему электродные потенциалы метал-
лов имеют положительный или отрицательный знак.
4» Объясните, почему последовательность изменения
активности металлов в ряду стандартных электродных
потенциалов не совпадает с последовательностью измене-
ния активности металлов в группах и периодах периоди-
ческой системы.
5. Цинковые пластинки опущены в растворы нитра-
тов калия, кальция, никеля и свинца. В каких случаях
будут протекать химические реакции? Напишите соот-
ветствующие уравнения процессов в молекулярной и
ионно-молекулярной формах.
6. Какая масса технического цинка, содержащего 2 %
примесей, требуется для вытеснения из раствора нитрата
меди (II) 6,35 г меди?
Ответ: 6,67 г.
7. Какие процессы, протекающие на электродах, объе-
диняются общим названием «электролиз»?
8. Чем вызвана необходимость пространственного раз-
деления процессов, протекающих на электродах?
9. Объясните, чем определяется последовательность
восстановления катионов на катоде при электролизе ра-
створов электролитов?
10. Какие факторы предопределяют выбор материала
для электродов при проведении процесса электролиза?
11. Какими показателями оценивается эффективность
процессов электролиза?
12. При получении каких веществ в народном хозяй-
стве используется электролиз?
13. Составьте схемы электролиза водного раствора нит-
рата цинка, если: а) анод угольный; б) анод цинковый.
14. Какие химические процессы происходят у катода
и у анода при электролизе раствора иодида натрия.
15. Чем отличается электролиз расплава едкого натра
пт электролиза его раствора? Какие вещества и в каком
количестве выделяются при электролизе раствора едко-
го натра, если через раствор пропускают ток силой 10 А
в течение 10 ч 44 мин?
192
Ответ: 44,8 л Н2 и 22,4 л О2 (н. у.).
16. Какое количество продуктов будет получено при
электролизе расплава едкого натра током силой 0,6 А в
течение Зч?
Ответ: 1,54 г Na; 0,38 л О2 (н. у.).
17. Будет ли меняться в ходе электролиза водного ра-
створа гидроксида калия: масса гидроксида калия в ра-
створе; концентрация раствора? Почему?
18. Какое количество электричества необходимо про-
пустить через раствор поваренной соли для получения 1 г
едкого натра?
Ответ: 2412,5 Кл.
19. С каким полюсом батареи — положительным или
отрицательным — должна быть соединена металличес-
кая деталь при ее хромировании?
20. Определите объем водорода, выделившегося на
катоде (н. у.) при электролизе водного раствора серной
кислоты, если известно, что при этом вступило в реак-
цию 1,505• 1024 электронов.
Ответ: 28 л.
21. При прохождении через раствор соли трехвалент-
ного металла тока силой 3 А в течение 15 мин на катоде
выделилось 1,071 г металла. Определите атомную массу
металла.
Ответ: 114,9.
22. При электролизе раствора нитрата хрома (III) то-
ком силой 1 А масса хромового катода возросла на 10 г.
Какое количество электричества было пропущено через
раствор и в течение какого времени?
Ответ: 55700 Кл; 15 ч 28 мин.
23. Через раствор нитрата никеля (II) в течение 2 ч 27 мин
пропускали ток силой 3,5 А. Определите, на сколько грам-
мов за это время уменьшилась масса никелевого анода.
Ответ: 9,4 г.
24. При электролизе током силой 2 А в течение 40 мин
на катоде выделилось 4,542 г некоторого металла. Опре-
делите молярную массу эквивалента этого металла.
Ответ: 91,3 г.
9
Классификация
неорганических веществ
Под классификацией понимают объединение разно-
образных и многочисленных объединений определенные
группы или классы, обладающие сходными свойствами.
Индивидуальные химические вещества принято делить
на две группы: немногочисленную группу простых ве-
ществ и очень многочисленную группу сложных веществ.
Сложные вещества делят на четыре важнейших класса:
оксиды, основания (гидроксиды), кислоты, соли.
Оксиды
Оксидами называются сложные вещества, состоящие
из двух элементов, один из которых кислород (К - О - К;
Са==О;О = 8 = Ои др.). Все оксиды делятся на несоле- и
194
солеобразующие. Немногочисленные несолеобразующие
оксиды не взаимодействуют ни с кислотами, ни с основа-
ниями. К ним относятся оксид азота (I) N2O, оксид
азота (II) NO и др. Солеобразующие оксиды делятся на
основные, кислотные и амфотерные.
Основными называются оксиды, которые образуют
соли при взаимодействии с кислотами или кислотными
оксидами. Так, например:
CuO + H2SO4 == CuSO4 + н2о,
MgO + СО2 = MgCO3.
Основными могут быть только оксиды металлов. Од-
нако не все оксиды металлов являются основными —
многие из них относятся к амфотерным или кислотным
(так, Сг2О3 — амфотерный, а СгО3 — кислотный оксид).
Часть основных оксидов растворяется в воде, образуя со-
ответствующие основания:
Na2O + Н2О = 2NaOH.
Кислотными называются оксиды, которые образуют
соли при взаимодействии с основаниями или основными
оксидами. Так, например:
SO2 + 2К0Н - K„SO„ + Н„О,
Л а о Л
Р4О10 + бСаО = 2Са3(РО4)2.
Кислотными являются оксиды типичных неметаллов,
а также оксиды ряда металлов в высших степенях окис-
ления (В2О3; N2O5; Мп2О7). Многие кислотные оксиды
(их также называют ангидридами) соединяются с водой,
образуя кислоты:
N2O3 + Н2О = 2HNO2.
Амфотерными называются оксиды, которые образу-
ют соли при взаимодействии как с кислотами, так и с
основаниями. К амфотерным оксидам относятся: ZnO;
А12О3; Cr2O3; MnO2; Fe2O3 и др. Например, амфотерный
характер оксида цинка проявляется при взаимодействии
его как с соляной кислотой, так и с гидроксидом калия:
ZnO + 2НС1 = ZnCl2 + Н2О,
ZnO + 2 КОН = K2ZnO2 + Н2О,
ZnO + 2КОН + Н2О = K2[Zn(OH)4].
195
Амфотерная природа оксидов, нерастворимых в раство-
рах кислот, и гидроксидов доказывается с помощью более
сложных реакций. Так, прокаленные оксиды алюминия
и хрома (III) практически нерастворимы в растворах
кислот и в щелочах. В реакции сплавления их с дисуль-
фатом калия проявляются основные свойства оксидов:
ALO- + 3K2S2O7 = 3K2SO4 + A12(SO4)3.
it о it At I it 4 it *XO
При сплавлении с гидроксидами выявляются кислот-
ные свойства оксидов:
А12О3 + 2К0Н = 2КА1О2 + Н2О.
Таким образом, амфотерным оксидам присущи свой-
ства как основных, так и кислотных оксидов. Отметим,
что у различных амфотерных оксидов двойственность
свойств может быть выражена в различной степени. На-
пример, оксид цинка одинаково легко растворяется и в
кислотах, и в щелочах, т. е. у этого оксида основная и
кислотная функции выражены примерно в одинаковой
мере. Оксид железа (III) — Fe2O3 — обладает преимуще-
ственно основными свойствами; кислотные свойства про-
являет, только взаимодействуя со щелочами при высо-
ких температурах:
Fe,O„ + 2NaOH = 2NaFeO„ + Н„О.
Zu it it
Способы получения оксидов
ГТ] Получение из простых веществ:
2Са + О2 = 2СаО.
Ij] Разложение сложных веществ:
а) разложение оксидов
4CrO3 = 2Сг2О3 + ЗО2 f;
б) разложение гидроксидов
Са(ОН)2 = СаО + Н2О;
в) разложение кислот
Н2СО3 = Н2О + СО2 f;
г) разложение солей
СаСО, = СаО +СОЛ.
о л '
196
(з) Взаимодействие кислот — окислителей с металла-
ми и неметаллами:
Си + 4HNO3(koha.) = Cu(NO3)2 + 2NO2t + 2Н2О,
С + 2Н28О4(конц-) = CO2t + 2SO2t + 2H2O.
R] Вытеснение летучего оксида менее летучим при
высокой температуре:
Na„COo + SiO„ = Na„SiOo + СО, f.
Z Л Z Z о z
сплавление
Вопросы и задачи
для самостоятельного решения
1. Укажите, какие неорганические вещества называ-
ют оксидами. Что лежит в основе разделения оксидов на
соле- и несолеобразующие; по каким химическим свой-
ствам солеобразующие оксиды делятся на основные, кис-
лотные и амфотерные.
2. Определите, к какому типу относятся следующие
оксиды:
СаО, SiO, BaO, SiO2, SO3, Р4О10, FeO, СО, ZnO, Cr2O3, NO.
3. Укажите, какие основания соответствуют следую-
щим оксидам:
Na2O, СаО, А12О3, CuO, FeO, Fe2O3.
4. Укажите, ангидридами каких кислот являются сле-
дующие оксиды:
СО2, SO2, SO3, N2O3, N2O5, CrO3, P4Ojq.
5. Укажите, какие из перечисленных ниже оксидов
растворимы в воде:
СаО, CuO, Cr9O,, SiO9, FeO, К9О, СО, NO9, СгОч, ZnO, А19ОЧ.
6. Укажите, с какими из перечисленных ниже веществ
будет реагировать оксид углерода (IV):
SO2, КОН, Н2О, Са(ОН)2, СаО.
7. Напишите уравнения реакций, отражающие свой-
ства следующих основных оксидов:
FeO, Cs2O, HgO, Bi2O3.
197
8. Напишите уравнения реакций, доказывающие кис-
лотный характер следующих оксидов:
SO3, Mn2O7, Р4О10, CrO3, SiO2.
9. Покажите, каким образом можно доказать амфо-
терный характер следующих оксидов: ZnO, А12О3, Сг2О3.
10. На примере реакций получения оксида серы (IV)
укажите основные способы получения оксидов.
11. Закончите уравнения следующих химических ре-
акций, отражающие способы получения оксидов:
l)Li + O2 —
2) Si2H6 + О2 —*
3) PbS + О2
4) Са3Р2 + О2 —*
5) А1(ОН)3 X
6) Pb(NO3)2 -
7) HgCl2 + Ва(ОН)2 —
8) MgCO3 + HNO3 —
9) Са3(РО4)2 + SiO2 -
10) СО2 + С
И) Cu + HNO3(30%)
12)С + Н28О4(конц>)£
12. Определите формулу оксида, образованного элемен-
том со степенью окисления +2, если известно, что для
растворения 4,05 г его потребовалось 3,73 г соляной кис-
лоты.
Ответ: СиО.
13. При взаимодействии оксида углерода (IV) с едким
натром образовалось 21г гидрокарбоната натрия. Опре-
делите объем оксида углерода (IV) и массу гидроксида
натрия, затраченные на получение соли.
Ответ: 5,6 л СО2; 10 г NaOH.
14. При электролизе 40 моль воды выделилось 620 г
кислорода. Определите выход кислорода.
Ответ: 96,9%.
198
15. Определите массу кислой и средней солей, которые
могут быть получены при взаимодействии 5,6 л SO2 с
гидроксидом калия. Чему равна масса щелочи в каж-
дом отдельном случае?
Ответ: 30 г KHSO3; 39,5 г K2SO3; 14 г КОН; 28 г КОН.
16. Определите простейшую формулу соединения, со-
держащего 68,4 % хрома и 31,6 % кислорода.
Ответ: Сг2О3.
17. Определите степень окисления марганца в оксиде,
если известно, что на 1 г марганца приходится 1,02 г кис-
лорода.
Ответ: +7.
18. В оксиде одновалентного элемента массовая доля
кислорода 53,3 %. Назовите элемент.
Ответ: литий.
19. Определите массу воды, необходимой для растворе-
ния 188 г оксида калия, если получили раствор с массо-
вой долей КОН 5,6 % .
Ответ: 3812 г.
20. При восстановлении углеродом 32 г оксида железа
(III) образовалось 20,81 г железа. Определите выход железа.
Ответ: 90 %.
Основания
Основаниями называются электролиты, при диссоци-
ации которых в качестве анионов образуются только гид-
роксид-ионы. Например, NaOH; Mg (ОН)2; А1(ОН)3. Чис-
ло гидроксогрупп в молекуле основания, определяющее
его кислотность, равно валентности металла. Например,
КОН — однокислотное основание, Fe(OH)2 — двухкислот-
ное основание. Большинство оснований не растворимо в
воде. Растворимы гидроксиды щелочных, щелочноземель-
ных металлов и гидроксид аммония. Растворимые в воде
основания, проявляющие кроме того свойства сильных
электролитов, называют щелочами.
Как электролиты основания в водных растворах дис-
социируют на катионы металлов и анионы гидроксида.
Многокислотные основания диссоциируют ступенчато:
199
Sr(OH)2?± SrOH+4-ОН-,
SrOH+ Sr2+4-OH-.
Основания, как и основные оксиды, взаимодействуют с
кислотами, кислотными и амфотерными оксидами:
Ni(OH)2 4- 2HNO3 = Ni(NO3)2 4- 2Н2О,
Ва(ОН)2 + СО2 = ВаСО3| 4- Н2О,
t°
2RbOH 4- ZnO = Rb2ZnO2 + H2O.
Растворимые в воде основания, кроме того, могут взаи-
модействовать с солями с образованием новой соли и
нового основания при условии, что новое основание нера-
створимо:
2КОН + Fe(NO3)2 = Fe(OH)2 I + 2KNO3.
С точки зрения теории электролитической диссоциа-
ции свойства растворов оснований (мыльность на ощупь,
изменение цвета индикаторов, взаимодействие с кислота-
ми, кислотными оксидами, солями) обусловлены гидро-
ксид-ионами ОН-.
Особую группу гидроксидов составляют амфотерные
гидроксиды. Они при диссоциации образуют одновремен-
но и катионы водорода Н+ и гидроксид-ионы ОН-. Такими
являются Zn(OH)2, А1(ОН)3, Ве(ОН)2, Сг(ОН)3, РЬ(ОН)2 и др.
Амфотерные гидроксиды взаимодействуют как с ра-
створами кислот, так и с растворами щелочей. При взаи-
модействии с кислотами амфотерные гидроксиды прояв-
ляют свойства оснований, а при взаимодействии с основа-
ниями — свойства кислот:
Zn(OH)2 + H2SO4 = ZnSO4 + 2Н2О,
Cr(OH)3 + 3NaOH = Na3[Cr(OH)6],
(гексагидроксохромат (Ш) натрия)
А1(ОН)3 + NaOH = Na[Al(OH)4].
(тетрагидроксоалюминат (III) натрия)
Способы получения оснований
ГТ] Взаимодействие активного металла с водой:
2Na 4- 2Н2О = 2NaOH + Н21.
Пг) Взаимодействие основных оксидов с водой:
СаО + Н2О = Са(ОН)2.
200
(з)Взаимодействие солей со щелочами:
Na2CO3 + Ва(ОН)2 = 2NaOH + ВаСО31,
CuSO4 + 2К0Н = Cu(OH)2J + K2SO4.
R] Электролиз водных растворов солей:
электролиз
2NaCl + 2Н2О -» 2NaOH + H2f + Cl2f.
Вопросы и задачи
для самостоятельного решения
1. Приведите определение основания с точки зрения
теории электролитической диссоциации. Напишите урав-
нения процессов диссоциации гидроксидов металлов I, II
и III групп периодической системы.
2. Приведите уравнения реакций, отражающие основ-
ные химические свойства оснований.
3. Укажите гидроксиды металлов, называемые щело-
чами.
4. Объясните причину изменения степени диссоциа-
ции оснований в следующем ряду:
NaOH, Ва(ОН)2, А1(0Н)3.
5. Объясните с позиции теории электролитической дис-
социации, какое основание сильнее: Са(ОН)2 или Ва(ОН)2.
6. На примере получения гидроксида натрия отразите
основные способы получения оснований.
7. Напишите уравнения реакций между: а) гидрокси-
дом алюминия и гидроксидом натрия; б) гидроксидом
алюминия и серной кислотой.
8. Кусочек натрия брошен в воду, содержащую несколь-
ко капель фенолфталеина. При этом металл интенсивно
двигался по поверхности воды вплоть до полного раство-
рения, а раствор из бесцветного превратился в малино-
вый. Опишите происходящие явления.
9. При взаимодействии металлического натрия с во-
дой выделилось 0,25 моль водорода. Рассчитайте массу
образовавшегося гидроксида натрия.
Ответ: 20 г NaOH.
201
10. Осуществите следующие превращения, укажите
условия протекания реакций:
1) Са -* СаО -* Са(ОН)2 -» СаСО8 -* Са(НСО3)2
ZnO -* Zn
2) Zn -* ZnO -» ZnCl2 -* Zn(OH)2
Na2[Zn(OH)4]
3) Cu -* CuSO4 -* Cu(OH)2 CuO -* Cu
11. Определите стехиометрические коэффициенты в
уравнении, отражающем процесс окисления гидроксида
железа (III); укажите окислитель и восстановитель в этом
уравнении:
Fe(OH)2 + О2 + Н2О — Fe(OH)3
12. Определите массу едкого кали, содержащего столько
количества вещества, сколько его заключается в 4 г едко-
го натра.
13. Рассчитайте, какое количество электричества по-
требуется для получения 1 т КОН при электролизе ра-
створа хлорида калия. Какие объемы водорода и хлора
выделяются при этом на электродах?
Ответ: 478000 А-ч; 200 м3.
14. При обработке раствором гидроксида натрия 3,9 г
смеси алюминия с его оксидом выделилось 840 мл газа
(н. у.). Определите массовую долю (%) алюминия в сме-
си.
Ответ: 17,3%.
15. К 300 г раствора едкого кали с массовой долей КОН
15 % прибавили 300 г воды. Определите массовую долю
(%) едкого кали в полученном растворе.
Ответ: 7,5%.
16. В щелочных аккумуляторах в качестве электро-
лита применяют раствор гидроксида натрия с массовой
долей NaOH 20 % (р = 1,21 г/мл). Сколько моль ионов
натрия содержится в 1 л такого раствора?
Ответ: 6,1 моль.
17. К 0,8 л раствора гидроксида натрия с массовой
долей NaOH 30 % (р = 1,328 г/мл) прибавлено 0,4 л ра-
створа того же основания с массовой долей NaOH 14 %
(р = 1,153 г/мл). Определите плотность и массовую долю
202
щелочи в полученном растворе, считая объем оконча-
тельного раствора равным 1,2 л.
Ответ: 25,15%; 1,275 г/мл.
18. Сколько едкого натра необходимо добавить к 1 л
раствора гидроксида натрия с массовой долей NaOH 25 %
(р = 1,220 г/мл) для получения раствора с массовой долей
NaOH 35 %.
Ответ: 188 г.
19. Какой объем раствора гидроксида калия с массо-
вой долей КОН, равной 20 % (р = 1,175 г/мл), необходимо
взять для перевода 5,85 г хлорида хрома (III) в соедине-
ние, содержащее хром в составе комплексного аниона?
Ответ: 90 мл.
20. 100 г раствора гидроксида натрия с массовой долей
NaOH 15 % обработали избытком оксида углерода (IV).
Какое вещество и в каком количестве выделится из ра-
створа, если его растворимость при температуре опыта
составляет 10 г в 100 г воды?
Ответ: 23 г NaHCO3.
Кислоты
Кислотами называются электролиты, при диссоциа-
ции которых в качестве катионов образуются только
катионы водорода.
В зависимости от числа атомов водорода в молекуле
кислоты, способных замещаться на металл, кислоты де-
лятся на одно- и многоосновные. Например, иодоводород-
ная HI и уксусная СН3СООН кислоты — одноосновные,
угольная Н2СО3 — двухосновная, фосфорная Н3РО4 —
трехосновная.
По составу кислоты делятся на кислородосодержащие
и бескислородные. Например, азотистая кислота HNO2,
серная H2SO4 и все остальные кислоты, в состав молекул
которых входит кислород, относятся к кислородосодер-
жащим. Кислоты типа HBr, H2S являются бескислород-
ными.
Кислоты представляют собой жидкости (H2SO4, HNO3 и
др.) или твердые вещества (Н3РО4, H^SiO3 и др.). Большинство
203
кислот хорошо растворимы в воде. Их растворы имеют
кислый вкус, разъедают растительные и животные ткани,
изменяют синий цвет лакмуса на красный.
Как электролиты кислоты в водных растворах диссоци-
ируют на катионы водорода и анионы кислотцого остатка.
Многоосновные кислоты диссоциируют ступенчато:
Н3РО4 н+ + н2РО4-,
Н2РО4-?± н+ + нро42~,
НРОЛ?± Н+РО3.
4 4
Кислоты, как и кислотные оксиды, взаимодействуют с
основаниями, основными и амфотерными оксидами:
H2SO4 + 2КОН = K2SO4 + 2Н2О,
H2SO4 + СаО = CaSO4l + Н2О,
3H2SO4 + А12О3 = A12(SO4)3 + ЗН2О.
Кроме того, кислоты могут взаимодействовать с соля-
ми и металлами:
Na2SiO3 + 2НС1 = H2SiO3l + 2NaCl,
Zn + 2HC1 = ZnCl2 + H2f.
В последнем случае ионы водорода окисляют только
те атомы металлов, которые стоят в ряду стандартных
электродных потенциалов левее водорода.
С точки зрения теории электролитической диссоциа-
ции, все общие характерные свойства кислот (кислый вкус,
изменение цвета индикатора, взаимодействие с основани-
ями, основными оксидами, солями) обусловлены ионами
водорода Н+.
Способы получения кислот
(Г) Взаимодействие кислотных оксидов с водой:
Р2О5 + ЗН2О = 2Н3РО4.
Ij] Взаимодействие сильных кислот — окислителей с
неметаллами:
ЗР + 5HNO3 (конц>) + 2Н2О = ЗН3РО4 + 5NO.
Гз] Взаимодействие солей слабых кислот с более силь-
ными кислотами или менее летучими, чем получаемая:
СаСО„ + 2НС1 = СаС1„ + СОЛ + Н„О,
NaCl(T) + Н28О4(койц-) = NaHSO4 + HClf.
204
[4j Получение из простых веществ:
Н9 + С19 = 2НС1,
2 2 (водный раствор)
Вопросы и задачи
для самостоятельного решения
1. Приведите определение кислот с точки зрения тео-
рии электролитической диссоциации. Напишите урав-
нения процессов диссоциации одно-, двух- и трехоснов-
ных кислот.
2. Приведите уравнения реакций, отражающие основ-
ные химические свойства кислот.
3. Приведите примеры нерастворимых в воде кислот.
4. Объясните с позиции теории электролитической
диссоциации, какая кислота сильнее: НС1 или Ш.
5. На примерах получения соляной и серной кислот
отразите основные способы получения кислот.
& Напишите формулы следующих кислот: соляной,
азотной, азотистой, сернистой, фтороводородной, угольной,
фосфорной. Укажите, какие из этих кислот являются:
а) кислородосодержащими;
б) бескислородными;
в) одноосновными;
г) многоосновными.
Подчеркните в формуле каждой кислоты кислотные ос-
татки и укажите римской цифрой наверху их валентность.
7. Укажите формулы кислородосодержащих и бескис-
лородных кислот, содержащих в своем составе атомы:
а) серы;
б) хлора.
8. Укажите, какие ангидриды соответствуют следую-
щим кислотам:
Н3ВО3, Н3РО4, НС1О4, H2SeO4, HNO3.
9. Укажите, с какими из перечисленных веществ будет
взаимодействовать разбавленная серная кислота:
СО2, СаСО3, Zn, Ag, ВаС12, CuO, SO2, КОН.
10. Напишите уравнения следующих химических ре-
акций:
205
1) H2SO4 + Fe2O3 -
2) HNO3 + ZnO -*
3) HC1 + Al —
4) H2SO4 + Ca3(PO4)2 -
5) H3PO4 + Ca(OH)2 -»
6) H3PO4 + NH3-*
11. Стакан с раствором серной кислоты имеет массу
273 г. Определите массу стакана с раствором после реак-
ции, если в раствор опустили 27 г алюминия.
Ответ: 297 г.
12. Рассчитайте, какое количество моль нитрата се-
ребра и соляной кислоты требуется для получения 287 г
хлорида серебра.
Ответ: 2 моль AgNO3; 2 моль НС1.
13. К раствору, содержащему 0,5 моль гидроксида ба-
рия, прилили раствор, содержащий 1,2 моль азотной кис-
лоты. Какую реакцию будет иметь полученный раствор
и каким индикатором ее можно определить?
Ответ: среда кислая.
14. Рассчитайте, сколько миллилитров серной кисло-
ты (р = 1,840 г/мл) с массовой долей 98 % потребуется
для приготовления 5 кг 22 % -ного раствора, применяемо-
го для заправки аккумулятора.
Ответ: 610 мл.
15. К 0,5 л раствора серной кислоты с массовой долей
H2SO4 98 % (р = 1,840 Г/мл) прибавили 2 л воды. Рассчи-
тайте массовую долю (%) серной кислоты в растворе.
Ответ. 30,87 %.
16. Рассчитайте массы серного ангидрида и раствора
серной кислоты с массовой долей H2SO4 49 %, необходи-
мые для приготовления 900 г раствора серной кислоты с
массовой долей 83,3%.
Ответ: 420 г SO3; 480 г раствора H2SO4.
17. Концентрированная серная кислота и оксид фос-
фора (V) применяют как осушители, что происходит при
этом с ними?
18. На чашках весов уравновешены два стаканчика с
соляной кислотой. Одновременно в стаканчики опусти-
206
ли по одному кусочку металла: в один — магний, в дру-
гой — цинк. В каком положении будут чашки весов, если
массы металлов равны?
19. Напишите три уравнения реакций получения сер-
ной кислоты.
20. Напишите структурные формулы следующих кис-
лот:
H2SO4, Н..ВО.,, Н,СОЧ, HNO,, Н,Р04.
Л 4’ О О7 Л О’ О7 О 4
Соли
Солями называются электролиты, при диссоциации
которых образуются катионы металлов (а также катион
аммония NH4) и анионы кислотных остатков.
Соли можно рассматривать как продукты полного или
частичного замещения атомов водорода в молекуле кис-
лоты атомами металла или как продукты полного или
частичного замещения гидроксогрупп в молекуле основ-
ного гидроксида кислотными остатками. При полном
замещении атомов водорода в молекуле кислоты образу-
ются средние (нормальные) соли, при неполном — кислые
соли. Кислые соли образуются многоосновными кислота-
ми при условии их неполной нейтрализации основанием,
например:
H2SO4 + КОН - KHSO4 + Н2О.
При частичном замещении гидроксогрупп в молеку-
ле многокислотного гидроксида кислотными остатками
образуются основные соли:
Cu(OH)2 + НС1 = CuOHCl + Н2О.
Иногда процесс образования основной соли сопровож-
дается ее частичным разложением, проявляющимся в
отщеплении воды, например:
Bi(OH)2NO3 = BiONO3 + Н2О.
Образующиеся при этом вещества (оксосоли) не со-
держат гидроксогрупп, но сохраняют свойства основных
солей, в частности способность взаимодействовать с кис-
лотами с образованием средних солей:
BiONO„ + 2HN0„ = Bi(NO„)„ + Н„О.
о о ' а'а £>
207
В том случае, когда атомы водорода в многоосновной
кислоте замещены атомами не одного, а двух различных
металлов, образуются двойные соли: KA1(SO4)2; NaKCO3 и
ДР-
Существует большая группа комплексных солей, сос-
тав которых не вытекает из обычных представлений о ва-
лентности. Например, гексацианоферрат (II) калия —
K4[Fe(CN)6]; сульфат тетрааминмеди (II) — [Cu(NH3)4] SO4.
Строение и свойства этих соединений изучаются в курсе
химии высшей школы.
Названия солей, согласно международной номенкла-
туре (табл. Приложения), составляются из двух слов: на-
звания анионов в именительном падеже и катиона в ро-
дительном. При этом название аниона производят от
корня латинского наименования кислотообразующего
элемента. Число анионов и катионов, как правило, не
указывается. Но если один и тот же металл проявляет
различную степень окисления, то ее указывают в скоб-
ках римской цифрой. Например, Fe(NO3)2 — нитрат же-
леза (II); Fe(NO3)3 — нитрат железа (III).
В случае бескислородных кислот анион получает окон-
чание «ид». Например, соли KBr, CuS соответственно на-
зываются бромид калия, сульфид меди (II).
Давая названия анионам кислородосодержащих кис-
лот, учитывают степень окисления кислородообразующего
элемента. Высшей степени окисления отвечает оконча-
ние «ат» в латинском названии элемента (Ca(NO3)2 —
нитрат кальция). Более низкой степени окисления эле-
мента соответствует окончание «ит» (Ca(NO2)2 — нитрит
кальция).
Названия кислых солей образуются добавлением к
аниону приставки гидро-, а если необходимо, то с соответ-
ствующими числительными: СаНРО4 — гидрофосфат
кальция; Са(Н2РО4)2 — дигидрофосфат кальция.
Названия основных солей образуют, добавляя к наи-
менованию аниона соответствующей средней соли при-
ставки «гидроксо»: Cr(OH)SO4— гидроксосульфат хро-
ма (III); A1(OH)2NO3 — дигидроксонитрат алюминия.
Соли, за небольшим исключением, являются тверды-
ми кристаллическими веществами. По растворимости в
208
воде их условно делят на растворимые, малораствори-
мые и практически нерастворимые (табл. Приложения).
Как электролиты средние соли в водных растворах
диссоциируют на катионы металлов и анионы кислот-
ных остатков:
MgSO4?± Mg2+ + SO2-.
Кислые и основные соли диссоциируют ступенчато.
У кислых солей вначале происходит диссоциация на ка-
тион металла и анион кислотного остатка, а затем, уже в
значительно меньшей степени, диссоциирует анион с об-
разованием в растворе катионов водорода. Например:
NaHSO, г* Na+ + HSO7,
HSO.’Ft H+ + SO2~.
4 4
У основных солей вначале отщепляются кислотные
остатки, а затем (тоже в значительно меньшей степени) —
гидроксид-ионы. Например:
CaOHCl & СаОН++ СГ,
СаОН+ Са2+ + ОН".
В отличие от кислот и оснований, химические свой-
ства солей во многом зависят от их химической приро-
ды.
Так, соли, образованные летучими или слабыми кисло-
тами типа НС1, H2S, Н3РО4, взаимодействуют с нелетучи-
ми сильными кислотами, например H2SO4, с выделением
летучей или слабой кислоты и образованием новой соли:
CaS + H2SO4 = CaSO4l + H2Sf,
Ca3(PO4)2 + 3H2SO4 = 3CaSO4| + 2H3PO4.
В водных растворах соли могут взаимодействовать с
основаниями, образуя новую соль и новое основание при
условии, если один из продуктов реакции будет нераство-
рим:
Na2SO4 + Ва(ОН)2 = BaSOJ + 2NaOH.
CuCl2 + 2NaOH = Cu(OH)2 J + 2NaCl.
При таких же условиях может происходить взаимо-
действие в водных растворах солей друг с другом с обра-
зованием новых солей:
КС1 + AgC104 = AgCl| + КС1О4.
209
Соли взаимодействуют в водных растворах с металла-
ми, которые стоят в ряду стандартных электродных по-
тенциалов до металла, входящего в состав соли:
Zn + CuSO4 = Си | + ZnSO4.
Важным свойством солей является их обменное взаи-
модействие с водой, приводящее к образованию слабых
электролитов (гидролиз солей).
Генетическую связь между классами неорганических
соединений можно выразить схемой:
металл —* основной оксид -* основание
I
соль
t
неметалл -» кислотный оксид -» кислота
Способы получения солей
ГП Взаимодействие металлов с неметаллами:
2Na + С12 = 2NaCl.
[2] Взаимодействие металлов с кислотами:
Mg + H2SO4 = MgSO4 + H2t.
Гз) Взаимодействие кислот с основными оксидами:
H2so4 + СаО - CaSO4 + Н2О.
Щ Реакция нейтрализации:
3NaOH + Н3РО4 = Na3PO4 + ЗН2О.
Гб] Взаимодействие кислот с солями:
H2SO4 + ВаС12 = BaSO4i + 2НС1.
Гб] Взаимодействие двух солей:
K2SO4 + ВаС12 = Ba SOJ + 2КС1.
ГТ) Взаимодействие основных и кислотных оксидов:
MgO + SiO2 = MgSiO3.
Гб] Взаимодействие гидроксидов с кислотными оксидами:
Са(ОН)2 + СО2 = СаСО3| + Н2О.
Гэ] Взаимодействие металлов с солями (в растворе):
Fe + CuSO4 = FeSO4 + Си].
Ijo] Взаимодействие соли со щелочью:
CuCl2 + 2NaOH = Cu(OH)2| + 2NaCl.
210
Вопросы и задачи
для самостоятельного решения
1. Укажите, какие вещества называют солями. По
каким признакам соли делятся на средние, кислые, ос-
новные, двойные?
2. На примере получения дигидрофосфата кальция
укажите условия, необходимые для получения кислых
солей.
3. На примере получения дигидро КСО карбоната меди
(II) укажите условия, необходимые для получения основ-
ных солей.
4. Приведите уравнения реакций получения сульфата
бария всеми известными вам способами.
5. Выпишите из приведенных ниже формул солей фор-
мулы средних, кислых, основных и двойных солей:
NaHCO3; MgS; CaOHNO3; FeSO4; KNaS; KNaCO3;
Ca(HCO3)2; CuSO4; ZnOHCl; Cal2; Ca(H2PO4)2; NH4C1;
CrPO4; CaSO3; MgHPO4; KCr(SO4)2.
6. Приведите названия следующих солей:
CaSO4; КНСО3; CrCl3; CuCl; CuCl2; Fe2(SO4)3;
Fe2(OH)2CO3; Na3PO4; KNaSO3; FeCl2; FeCl3; Cr(OH)2Cl;
Mg(H2PO4)2.
7. Укажите, какие соли могут быть получены при вза-
имодействии гидроксида меди (II) с серной кислотой.
8. Приведите определение солей с точки зрения тео-
рии электролитической диссоциации. Напишите урав-
нения процессов диссоциации следующих солей:
К8РО4; KHSO4; MgOHNO3; KCr(SO4)2.
9. Приведите уравнения реакций, отражающих основ-
ные химические свойства солей.
10. Изобразите структурные формулы следующих со-
единений:
Cr2(SO4)3; Mg(HSO3)2: А1(ОН)2С1; Mg(NO3)2; Fe(HCO3)2;
Cu2(OH)2CO3.
11. Напишите названия и формулы солей, которые
широко применяются: а) в строительном деле, б) в хими-
ческой промышленности, в) в сельском хозяйстве.
211
12. Напишите названия и формулы солей, которыми
вы пользуетесь в быту.
13. При помощи каких реакций можно осуществить
следующие превращения:
1) Zn -» ZnS - ZnO -» Zn(NO3)2 -» Zn(OH)2 -
-* Na2[Zn(OH)4]
2) S -» H2S -» SO2 - SO3 -> H2SO4 -> KHSO4 - K2SO4
3) Mg — Mg(NO3)2 -* Mg(OH)2 -» MgOHCl -» MgCl2
4) Cr - Cr2(SO4)3 - Cr(OH)3 - Na3[Cr(OH)6]
—* Cr(NO3)3 -* Cr2O3.
14. Составьте уравнения реакций гидролиза следую-
щих солей:
Zn(NO3)2; KBr; NaHSO3; Na3PO4; CuSO4.
Как изменится водородный показатель среды при раство-
рении этих солей.
15. Определите степень окисления железа в хлориде,
если известно, что 1 г хлорида железа при взаимодействии
с избытком азотнокислого серебра дал 2,65 г хлорида
серебра.
Ответ: +3.
16. К раствору, содержащему 20,0 г СгС13, прилили ра-
створ, содержащий 16,8 г КОН. Определите массу образо-
вавшегося осадка.
Ответ: 10,3 г.
17. Какой минимальный объем оксида углерода (IV)
необходимо пропустить при нормальных условиях через
раствор массой 80 г с массовой долей гидроксида бария
5 % для получения гидрокарбоната бария?
Ответ: 1,05 л.
18. К раствору массой 200 г с массовой долей серной
кислоты 8 % прилили раствор массой 50 г с массовой долей
гидроксида натрия 12%. Какова масса гидросульфата
натрия, который выделили из полученного раствора?
Ответ: 18 г.
19. К раствору, в котором находится нитрат алюми-
ния массой 42,6 г, прилили раствор, содержащий карбо-
нат натрия массой 37,2 г. Осадок прокалили. Определите
массу осадка после прокаливания.
212
Ответ: 10,2 г.
20. При прокаливании 8,58 г кристаллической соды
до постоянной массы было получено 5,4 г воды. Опреде-
лите формулу кристаллогидрата карбоната натрия.
Ответ: Na2CO3 • ЮН20.
21. В раствор, содержащий соль двухвалентной ртути,
опустили медную пластинку массой 10 г. Через некото-
рое время ее масса возросла до 12,74 г. Определите массу
выделившейся из раствора ртути.
Ответ: 3,96 г Hg.
22. Определите массу цинка, расходуемого на процесс
взаимодействия с концентрированной серной кислотой,
если известно, что сероводород, являющийся одним из
продуктов этой реакции, осаждает из раствора 46,52 г
сульфида ртути.
Ответ: 51,9 г Zn.
10
Неметаллы
Неметаллы в основном располагаются в конце малых
и больших периодов периодической системы Д. И. Мен-
делеева; число внешних электронов у атомов неметал-
лов от четырех до семи. Типичные неметаллы располо-
жены в главных подгруппах VI и VII групп. Для завер-
шения внешних электронных уровней атомы принимают
электроны, т. е. они окислители. Самый активный окис-
литель фтор, далее активность уменьшается по ряду О,
Cl, N, S, С, Р, Н, Si.
Характеризуя физические свойства неметаллов, мож-
но сказать, что при нормальных условиях они существу-
ют во всех агрегатных состояниях, но большая часть их
являются твердыми веществами.
При реакции с металлами типичные неметаллы об-
разуют соединения в основном с ионной связью. Иног-
да неметаллы реагируют друг с другом, образуя соеди-
нения с ковалентной связью как полярные, так и непо-
лярные.
Отдельно следует сказать о химии благородных газов.
Атомы этих элементов содержат на внешнем уровне по
8 электронов (у гелия 2). Ранее считалось, что такие ато-
мы не способны ни отдавать, ни присоединять электроны,
ни образовывать общие электронные пары. Однако в
1962 г. было получено первое соединение благородного
газа, после чего химия благородных газов начала разви-
ваться быстрыми темпами.
214
Вопросы и задачи
для самостоятельного решения
1. Приведите примеры типичных неметаллов. Охаракте-
ризуйте их положение в периодической системе Д. И. Мен-
делеева.
2. Какой тип связи в соединениях:
NaF; F2; CF4; OF2; MgF2; CH2F2?
Определите степени окисления элементов в каждом
соединении.
3. Закончите и уравняйте реакции:
t°
1) Na + N2 -»
2) Са +12 -*
3) Р + О2-»
> 3000 °C
4) N2 + О2 ->
5) В + О2 —
t°
6) С + 02 -*
4. Перечислите основные химические свойства неме-
таллов; укажите, к каким типам химических реакций
относятся эти процессы, приведите примеры.
5. Составьте электронные формулы молекул: Н2; N2;
О2; Вг2. Определите степень окисления и валентность
элементов в этих соединениях.
6. Приведите примеры химических соединений благо-
родных газов и укажите их свойства.
7. Закончите уравнения реакций и укажите в них
окислитель и восстановитель:
1) Н2 + С12-
2) S + О2 -*
3) Р + С12->
4) N2 + О2 -*
& Масса 0,5 л азота (н. у.) равна 0,625 г. Исходя из
этих данных докажите, что молекула азота двухатомна.
9. При нагревании нитрита аммония NH4NO2 образу-
ются азот и вода. Рассчитайте выход азота в процентах,
215
если известно, что из 6,4 г нитрита аммония было получе-
но 2 л азота (н. у.).
Ответ: 89,3 %.
10. При горении фосфора в кислороде выделяется
774 кДж теплоты на 1 моль фосфора. Составьте термохи-
мическое уравнение реакции горения фосфора и рассчи-
тайте объем кислорода (н. у.), вступившего в реакцию с
фосфором, если при этом выделилось 30,96 кДж тепло-
ты.
Ответ: 1,12 л.
11. При сжигании 10 г карборунда образовалось 5,6 л
оксида углерода (IV) и 15 г оксида кремния (IV). Рассчи-
тайте молекулярную формулу карборунда.
Ответ: SiC.
12. Скипидар сгорает в атмосфере хлора по следую-
щей схеме:
С10Н16 + С12 -» С + НС1
Расставьте коэффициенты в уравнении реакции и
рассчитайте, в каком объеме хлора (н. у.) сгорел скипи-
дар, если в результате реакции было получено 73 г хлори-
стого водорода.
Ответ: 22,4 л.
Водород. Вода
Вопросы и задачи
для самостоятельного решения
1. Какова распространенность водорода в природе?
Почему его называют «солнечным газом»?
2. В виде каких соединений водород встречается в
природе?
3. Каково строение атома водорода? Используя знание
строения атома, объясните положение водорода в перио-
дической системе.
4. Какие степени окисления возможны для атома во-
дорода в соединениях?
5. Назовите известные вам изотопы водорода. Пока-
жите строение ядер их атомов.
216
6. Каково строение молекулы водорода?
7. Укажите основные физические свойства водорода и
области его применения, основанные на этих свойствах.
8. Приведите уравнения реакций, на основе которых
получают водород в лаборатории.
9. Приведите уравнения реакций промышленных ме-
тодов получения водорода.
10. Какие меры предосторожности необходимо соблю-
дать при получении водорода и при работе с ним? Почему?
Как проверить водород на чистоту?
11. Каковы химические свойства водорода? Разграничьте
окислительные и восстановительные свойства водорода.
Отличаются ли свойства атомарного водорода от молеку-
лярного? С помощью каких реакций это можно выявить?
12. Укажите основные области применения водорода
и, в частности, отметьте, почему водород называют «топ-
ливом будущего»?
13. Какова масса молекулы водорода?
Ответ: 3,3 • 10-23 г.
14. Какой объем водорода (н. у.) можно получить при
электролизе 100 мл воды?
Ответ: 125л.
15. Определите массы алюминия и раствора гидрокси-
да натрия с массовой долей NaOH 10 % (р = 1,100 г/мл),
которые могут вступить в реакцию, чтобы образовалось
2 моль водорода?
Ответ: 36 г А1; 483,6 мл раствора.
16. Определите массу кальция, способного вытеснить
из воды 2 г водорода.
Ответ: 40 г.
17. Сколько литров водорода (н. у.) выделится при
растворении в кислоте 2 г сплава, содержащего 85 % алю-
миния и 15 % магния?
Ответ: 2,4 л.
18. Какой объем водорода (при н. у.) выделится при
взаимодействии с водой 2,1 г гидрида кальция?
Ответ: 2,24 л.
19. Какой объем водорода, приведенный к н. у., надо
затратить на восстановление до металла 60 г оксида МоО3?
Ответ: 28 л.
217
20. При растворении 9 г сплава алюминия с магнием в
растворе щелочи выделилось 9,6 л водорода (н. у.). Опре-
делите массовую долю алюминия в сплаве.
Ответ: 85,6 % А1.
21. При растворении 9 г сплава алюминия с магнием в
кислоте выделилось 10,08 л водорода (н. у.). Определите
массовую долю алюминия в сплаве.
Ответ: 60 % А1.
22. При растворении 0,77 г сплава натрия и калия в
воде выделилось 0,336 л водорода (н. у.). Определите мас-
совую долю калия в сплаве.
Ответ: 74,67 % К.
23. Вычислите массовую долю в процентах NaOH в
растворе едкого натра, полученного при взаимодействии
2,3 г металлического натрия с 28,2 мл воды. Какой объем
при нормальных условиях займет выделившийся газ?
Ответ: 13,16%; 1,12 л.
24. Какой объем метана разложится при температуре
900 °C, если образуется 2 м3 водорода?
Ответ: 1 м3.
25. При нагревании метана до 1100 °C было получено
40 г водорода. Сколько сажи образовалось при этом?
Ответ: 120 г.
26. Взорвали литр смеси водорода и хлора, содержа-
щей объемную долю водорода 45 %. Найдите объемный
состав полученной смеси.
Ответ: 0,9 л НС1; 0,1л С12.
27. При получении этанола из ацетилена уксусный
альдегид подвергают действию водорода:
а) напишите уравнения соответствующих химических
реакций;
б) рассчитайте массу водорода, необходимого для вос-
становления 10 г уксусного альдегида.
Ответ: 0,45 г.
28. Какой объем водорода (н. у.) требуется для восста-
новления 3 моль глюкозы в соответствующий спирт?
Ответ: 67,2 л.
29. Какова распространенность воды на земном шаре?
Где находится основное количество воды? Какую долю от
общего количества воды составляют запасы пресной воды?
218
30. Какова роль воды для процесса жизнедеятельнос-
ти животных и растительных организмов?
31. Чем объясняется тот факт, что вода является един-
ственным соединением на планете, которое в земных ус-
ловиях температуры и давления может находиться одно-
временно в трех агрегатных состояниях?
32. Чем объясняется аномально высокое значение тем-
пературы кипения и плавления воды?
33. Какова теплоемкость воды по сравнению с други-
ми жидкими и твердыми веществами? Каким образом
вода через данное свойство оказывает влияние на климат
Земли?
34. Каким образом изменяется плотность воды при
переходе от жидкого к твердому состоянию? Какое это
имеет значение для поддержания жизни в водоемах при
температуре ниже О °C?
35. Покажите строение молекулы воды; объясните
возможность ассоциации молекул воды.
36. Перечислите основные химические свойства воды;
укажите классы неорганических соединений, с которыми
реагирует вода.
37. Приведите примеры химических реакций, в кото-
рых вода выступает в роли катализатора.
38. Что такое кристаллогидраты? Приведите приме-
ры.
39. Чем обусловлена жесткость природной воды? На-
личием каких солей обусловлена временная и каких —
постоянная жесткость воды? Почему жесткая вода мало-
пригодна для технических целей.
40. В каких единицах выражают жесткость воды?
41. Какие методы лежат в основе смягчения жесткос-
ти воды? Дайте краткую характеристику способу устра-
нения временной жесткости воды.
42. Каким образом устраняется постоянная жесткость
воды?
43. Что такое «тяжелая вода»? Укажите способы ее
получения и области применения.
44. Сколько литров паров воды (н. у.) образуется при
взрыве смеси, содержащей 2 г водорода и 14 г кислорода?
Ответ: 9,8 л.
219
45. Электролизу подвергли 3,5 моль воды. Вычислить,
сколько получено: а) моль кислорода; б) граммов кисло-
рода; в) молекул кислорода; г) какой объем занял бы
полученный кислород (н. у.)?
Ответ: 1,75 моль О2; 56 г О2; 10,5 • 1023 молекул; 39,2 л.
46. Какой объем воды необходимо прибавить к 200 мл
раствора серной кислоты (р = 1,800 г/мл) с массовой до-
лей H2SO4 87 % для получения раствора с массовой долей
H2SO4 10 %?
Ответ: 2,77 л.
47. Сколько литров этилена (н. у.) можно получить
при дегидратации 230 г этилового спирта, если, выход со-
ставляет 80 % от теоретического?
Ответ: 896 л.
48. Известно, что при межмолекулярной дегидратации
спирта СпН2п + ХОН образуется 7,4 г простого эфира
(СпН2п+1)2О и при внутримолекулярной дегидратации того
же вещества получается 4,48 л этиленового углеводоро-
да. Какова формула исходного спирта?
Ответ: С2Н5ОН.
49. Найдите массу воды, в которой нужно растворить
100 г медного купороса CuSO4 • 5Н2О, чтобы получить ра-
створ сульфата меди с массовой долей CuSO4 10 %?
Ответ: 540 г.
50. При прокаливании 64,4 г кристаллогидрата соли А
теряется 36 г воды. Установите формулу соли, если изве-
стно, что соль окрашивает пламя в желтый цвет, а при
взаимодействии исходной навески соли с хлоридом ба-
рия образуется 46,6 г белого осадка.
Ответ: Na2SO4 • ЮН20.
51. При прокаливании 25,9 г безводной соли двухва-
лентного металла выделились вода и оксид углерода (IV),
объем которого после пропускания над раскаленным
углем увеличился на 2,24 л. Найдите состав соли.
Ответ: Ва(НСО3)2.
52. При взаимодействии щелочноземельного метал-
ла массой 3,425 г с водой выделился водород объемом
560 мл (н. у.). Определите, какой металл взят для реак-
ции.
Ответ: барий.
220
53. При действии воды на гидрид металла массой 0,84 г
выделился водород, объем которого (при н. у.) составил
896 мл. Определите, гидрид какого металла был взят, если
известно, что степень окисления металла в гидриде + 2.
Ответ: кальций.
Галогены
Вопросы и задачи
для самостоятельного решения
1. Какова распространенность галогенов в природе?
2. В виде каких соединений галогены встречаются в
природе?
3. Какое положение занимают галогены в периодиче-
ской системе, каково строение их атомов?
4. Какие степени окисления наиболее характерны для
каждого из галогенов? Объясните, почему фтор проявляет
степень окисления только -1. Какое соединение с кисло-
родом образует фтор?
5. Назовите известные вам изотопы хлора. Покажите
строение ядер их атомов.
6. Каково строение молекул галогенов?
7. Укажите основные физические свойства галогенов.
С чем связано изменение основных физических свойств
галогенов в ряду фтор — иод?
8. Укажите области применения хлора. Приведите
примеры использования хлора в неорганическом и орга-
ническом синтезе.
9. Почему бромную воду используют в лабораториях
как качественный реактив на непредельные соединения?
10. В каких растворителях можно растворить иод?
11. Почему нет водных растворов фтора?
12. Приведите уравнения реакций получения галоге-
нов в лабораториях.
13. Приведите уравнения реакций промышленных ме-
тодов получения галогенов.
14. Расположите галогены в ряд в порядке уменьше-
ния их окислительной способности. Отразите уравнени-
221
ями химических реакций изменение окислительной спо-
собности в ряду галогенов.
15. Приведите уравнения реакций, отражающие полу-
чение галогеноводородов.
16. Как изменяется сила галогеноводородных кислот с
изменением порядкового номера галогенов?
17. Как изменяются восстановительные свойства га-
логеноводородов по ряду HF, НС1, HBr, HI?
18. Йодистый водород при нагревании приобретает
фиолетовую окраску; по мере повышения температуры
интенсивность окраски увеличивается. Чем это объяс-
няется?
19. Какая химическая реакция протекает при травле-
нии стекла плавиковой кислотой? Напишите уравнения
реакций, учитывая, что в состав стекла входит оксид крем-
ния (IV).
20. Каким образом можно обнаружить ион хлора в
растворе?
21. Напишите формулы хлорноватистой кислоты, бе-
лильной извести, бертолетовой соли, перхлората калия,
хлорного ангидрида.
22. Как изменяются окислительные и кислотные свой-
ства в ряду следующих кислородосодержащих кислот
хлора:
НС1О — НС1О2 — НС1О3 — НС1О4?
Дайте объяснение подобному изменению свойств.
23. Приведите уравнения реакций взаимодействия
бензола с хлором: а) реакция замещения; б) реакция при-
соединения. Укажите условия протекания этих реакций.
24. Укажите степень окисления хлора в следующих
соединениях:
Cl2; НС1; СС14; НСЮ; НС1О2; НСЮ3; НС1О4;
СН3 - СН2 - С1.
25. Закончите уравнения реакций:
1) СсН5ОН + С12-
2) С2Н2 + С12~»
3) KJ + С12 ->
4) С2Н4 + С12
222
26. В раствор гидроксида натрия пропустили неизве-
стный газ желто-зеленого цвета с резким запахом. При
этом образовался раствор смеси двух солей, применяе-
мых для отбеливания ткани и бумаги. 5,85 г одной из
полученных солей при взаимодействии с раствором нит-
рата серебра дает 14,4 г белого творожистого осадка.
Назовите формулы образовавшихся солей, рассчитайте
количество раствора азотнокислого серебра с массовой
долей AgNO3 10 %, затраченного на взаимодействие.
Ответ: NaCl; NaClO; 170 г раствора AgNO3.
27. Фотографирование основано на разложении соли
металла А под действием света. Черное изображение на
проявленной фотографической пленке образовано мельчай-
шими частицами выделившегося металла. Если металл А,
входящий в состав соли, растворить в концентрированной
азотной кислоте, то выделится бурый газ и образуется нит-
рат одновалентного металла. Анионом исходной соли яв-
ляется анион кислоты, которая образуется при взаимодей-
ствии бромной воды и сернистого газа. Назовите эту соль.
Ответ: AgBr.
28. В трех пробирках находятся растворы нитрата
серебра, бертолетовой соли и дихромата калия. При дей-
ствии одного и того же реактива на содержимое всех
пробирок в первой выпадет осадок, а во второй и третьей
выделяется хлор. Определите это вещество, приведите
уравнения соответствующих реакций.
Ответ: НС1.
29. В 200 г раствора, содержащего одинаковые массы
хлорида и фторида одного и того же металла, прилили
избыток раствора нитрата серебра. Выделившийся осадок
отфильтровали, промыли и высушили. Его масса оказа-
лась равной 28,7 г. Исходные соли окрашивают пламя в
желтый цвет. Определите массовые доли солей %.
Ответ: 5,8 %.
30. Определите массовую долю в % соляной кислоты,
полученной сливанием 100 мл раствора хлороводородной
кислоты с массовой долей НС1, равной 36 % (плотность
1,180 г/мл) и 50 мл раствора соляной кислоты с массовой
долей НС1 20 % (плотность 1,100 г/мл).
Ответ: 30,9 % НС1.
223
31. Сколько литров хлористого водорода (н. у.) можно
получить из 23,4 г хлорида натрия?
Ответ: 8,96 л.
32. Хлористый водород, полученный при действии из-
бытка серной кислоты на 58,5 г поваренной соли, раство-
рили в 146г воды. Какова массовая доля (%) соляной
кислоты в полученном растворе?
Ответ: 20 %.
33. Соляную кислоту, полученную при растворении
2 моль хлороводорода в воде, нагрели с избытком оксида
марганца (IV). Рассчитайте, хватит ли образовавшегося
хлора для перевода 28 г железа в хлорид железа (III).
Ответ: не хватит.
34. 100 мл газовой смеси для синтеза хлороводорода
было пропущено через раствор иодида калия. Определи-
те состав исходной смеси (в объемн. %), если известно, что
объем непоглощенного остатка составил 53 мл.
Ответ: 47 % С12 и 53 % Н2.
35. Через склянку с раствором иодида калия было
пропущено 2 л воздуха (н. у.), содержащего хлор. При этом
выделилось 91,6 мг иода. Определите массу хлора, содер-
жащегося в 1 л воздуха.
Ответ: 12,8 мг.
36. Непредельный углеводород прореагировал с НВг с
образованием 24,6 г вещества А, при взаимодействии ко-
торого с металлическим натрием образовалось только
одно вещество Б, состоящее из 83,72 % углерода и 16,28 %
водорода; его' плотность паров по водороду равна 43. Оп-
ределить вещества А и Б, а также рассчитать, сколько
литров углеводорода пошло на реакцию.
Ответ: А — пропилен; Б — изомер гексана.
37. Сколько литров хлора нужно взять для полного
хлорирования 11,2 л метана?
Ответ: 44,8 л.
38. 39 г бензола прохлорировали, побочный продукт
реакции пропустили через 100 г воды. Найдите массовую
долю соляной кислоты в растворе.
Ответ: 15,47%.
39. Сколько литров хлора (н. у.) пойдет на полное хло-
рирование 27 г бутадиена?
224
Ответ: 22,4 л С12.
40. Напишите уравнения реакций, с помощью кото-
рых можно осуществить превращения:
1) КСЮ3 — КС1 -* С12 — NaClO,
2) MnO, -* С12 -* С2Н2С12 -* С2Н2С14,
' А А А А А А А
3) KMnO4 -* С12 -> НС1 -* AgCl,
4) С12 -* НС1 — С12 — NaCl -* NaOH.
Кислород. Озон
Вопросы и задачи
для самостоятельного решения
1. Какова распространенность кислорода в природе?
2. В виде каких соединений кислород встречается в
природе?
3. Укажите состав воздуха и содержание в нем кисло-
рода (в массовых и объемных процентах).
4. Какое положение занимает кислород в периодической
системе элементов? Каково строение атома кислорода?
5. Каковы степени окисления кислорода, проявляемые
им в соединениях?
6. Назовите известные вам изотопы кислорода. Пока-
жите строение ядер их атомов.
7. Каково строение молекулы кислорода?
8. Укажите основные физические свойства кислорода
и области его применения, основанные на этих свойствах.
9. Какое явление называют аллотропией? Какие ал-
лотропные видоизменения кислорода известны и каковы
их свойства?
10. Покажите, как получают кислород в промышлен-
ности и в лаборатории. Напишите уравнения соответ-
ствующих реакций.
11. Каковы химические свойства кислорода? Напиши-
те уравнения взаимодействия кислорода с железом, ме-
дью, серой, водородом, фосфором.
12. Назовите продукты взаимодействия кислорода с
различными простыми веществами.
225
13. Укажите способы получения озона в лаборатории
и каким образом он образуется в атмосфере Земли. Ка-
кова роль «озонного пояса» для процессов жизнедеятель-
ности на Земле?
14. Сравните окислительные свойства кислорода ь
озона.
15. Найдите массу молекулы кислорода?
Ответ: 5,3 • 10~23 г.
16. Сколько литров кислорода при н. у. можно полу-
чить из 40 л воздуха?
Ответ: 8 л.
17. Сколько литров кислорода при н. у. можно полу-
чить при разложении 10 моль бертолетовой соли?
Ответ: 336 л.
18. Какой объем водорода и кислорода необходимо
взять для получения 6 л гремучей смеси? Определите от-
носительную плотность гремучей смеси по воздуху.
Ответ: 4л Н2и 2л О2; 0,41.
19. Какова масса 1 л озона, измеренного при н. у.
Ответ: 2,14 г.
20. Какова масса 10 л смеси (н. у.), содержащей по объе-
му 20 % озона, 70 % кислорода и 10 % азота?
Ответ: 15,5 г.
21. Кислород, полученный при разложении 100 г оксида
ртути (II), был использован для сжигания кокса, содержа-
щего 75 % углерода. Определите массу сожженного кокса.
Ответ: 3,69 г.
22. В лаборатории имеются следующие соединения: пе-
роксид бария, хлорат калия, перманганат калия. Какое из
этих веществ при термическом разложении в пересчете на
одну и ту же массу даст наибольшую массу кислорода?
Ответ: хлорат калия.
23. При нагревании 63,2 г перманганата калия полу-
чили 3,36 л кислорода. Определите степень разложения
перманганата калия и состав твердого остатка.
Ответ: 75%; 29,55 г манганата калия; 13,05 г оксида
марганца (IV); 15,8 г перманганата калия.
24. Для сжигания 136 г смеси водорода и оксида угле-
рода (II) было израсходовано 179,2 л кислорода (н. у.).
Определите состав смеси (в объемных %).
226
Ответ: 75 % водорода и 25 % оксида углерода (II).
25. После озонирования некоторого объема кислорода
его объем уменьшился на 5 мл (н. у.). Какой объем озо-
на образовался? Какой объем кислорода был на это за-
тратен?
Ответ: 10 мл О3, 15 мл О2.
26. Стеклянный шар был наполнен кислородом и взве-
шен, а затем при тех же термодинамических условиях
заново заполнен озонированным кислородом и снова взве-
шен. Привес оказался равным 0,21 г. Какова масса озона,
содержащегося в озонированном кислороде?
Ответ: 0,63 г.
27. Плотность смеси озона и кислорода по водороду
равна 18. Найдите объемный состав смеси.
Ответ: 25 % О3.
28. Электролиз раствора гидроксида натрия шел 10 ча-
сов при силе тока 10 А. Найдите объем газа, выделивше-
гося на аноде.
Ответ: 20,89 л.
Сера
Вопросы и задачи
для самостоятельного решения
1. Какова распространенность серы в природе?
2. В форме каких соединений встречается сера в при-
роде?
3. Каковы физические свойства серы?
4. Какие аллотропные модификации серы известны и
как осуществляются переходы одной модификации в
другую?
5. Какое положение занимает сера в периодической
системе Д. И. Менделеева? Каково строение атома серы?
6. Каковы степени окисления серы, проявляемые ею в
соединениях?
7. Из смеси каких устойчивых изотопов состоит при-
родная сера?
8. Каково строение молекулы ромбической серы?
227
9. Как получают чистую серу в промышленности?
10. Почему серу очищают от мышьяка, который явля-
ется сопутствующим элементом в месторождениях серы?
11. Каковы химические свойства серы? Приведите
примеры уравнений реакций, показывающих окислитель-
но-восстановительные свойства серы.
12. Укажите области применения серы в народном
хозяйстве.
13. Укажите нахождение сероводорода в природе, пе-
речислите его основные физические свойства.
14. Укажите, как получают сероводород в промыш-
ленности и в лаборатории.
15. Отметьте основные химические свойства сероводо-
рода.
16. Докажите, что сероводород является сильным вос-
становителем.
17. Почему раствор сероводорода при стоянии на воз-
духе мутнеет? Напишите уравнение, отражающее проте-
кание этого процесса.
18. Какие сульфиды нерастворимы в воде, кислотах?
Какова окраска сульфидов?
19. Какова реакция среды в растворах Na2S и NaHS?
20. Почему сульфид алюминия нельзя получить об-
менной реакцией в водном растворе?
21. Сколько литров сероводорода (н. у.) нужно пропу-
стить в 600 мл воды для получения раствора кислоты с
массовой долей H2S 1,5 %?
Ответ: 6,02 л.
22. Какие процессы происходят при пропускании се-
роводорода через раствор едкого кали?
23. Какие способы получения сернистого газа вам
известны?
24. Для сернистого газа характерны три типа реак-
ций: с увеличением степени окисления, с уменьшением
и без изменения степени окисления. Приведите уравне-
ния соответствующих реакций.
25. Укажите области применения сернистого ангид-
рида в народном хозяйстве.
26. Как получают серную кислоту в промышленности?
Напишите уравнения соответствующих процессов.
228
21. Опишите основные физические и химические свой-
ства серной кислоты.
28. Почему при приготовлении растворов серной кис-
лоты именно ее нужно приливать в воду, а не воду в сер-
ную кислоту?
29. Напишите уравнения, отражающие процесс сту-
пенчатой диссоциации серной кислоты.
30. Что такое «олеум»? Какой теоретической концент-
рации серной кислоты соответствует 20 % раствор олеума?
Ответ: 104 %.
31. Через раствор, содержащий 10 г едкого натра, было
пропущено 20 г сероводорода. Какая соль и в каком ко-
личестве образовалась при этом?
Ответ: 14 г NaHS.
32. Какой максимальный объем сернистого газа (н. у.)
может быть поглощен 800 мл раствора едкого натра с
массовой долей 10 % (р - 1,115 г/мл)?
Ответ: 49,95 л.
33. 1 л раствора серной кислоты с массовой долей
H2SO440% (р = 1,300 г/мл) упарили до 1000 г. Какой
объем газа (н. у.) выделится при растворении в этой
кислоте меди? Определите массовую долю серной кисло-
ты в растворе после упаривания.
Ответ: 58,5 л; 52%.
34. Пирит содержал 60 % FeS2. Из 100 т этого пирита
было получено 88,2 т серной кислоты. Определите выход
серной кислоты.
Ответ: 90 %.
35. Определите коэффициенты в уравнениях следую-
щих окислительно-восстановительных реакций, иллюст-
рирующих восстановительные свойства сероводорода и
сульфидов:
1) K2S + Вг2 -* S + КВг,
2) H2S + H2SO4 — S + Н2О,
3) K2S + K2Cr2O7 + H2SO4 — S + Cr2(SO4)3 + K2SO4 + H2O.
36. Определите массу серной кислоты, расходуемой на
растворение 50 г ртути. Можно ли для растворения рту-
ти взять разбавленную серную кислоту?
Ответ: 48,92 г; нет.
229
37. Осуществите превращения веществ, укажите уело
вия прохождения реакций:
1) H2S -» SO2 -* NaHSO3 -> NagSOg,
2) H2S -> S — FeS — FeCl2,
3) FeS2 -* SO2 -> SO3 — H2SO4 -* CuSO4 — Cu,
4) S — H2S — Na2S -* PbS,
5) S — SO2 -* SO3 -» H2SO4 -* BaSO4,
I
NaHSO4
6) S -* H2S -* SO2 H,SO- — KHSO3.
I
K2SO3
Азот
Вопросы и задачи
для самостоятельного решения
1. Дайте общую характеристику подгруппы азота.
2. Какова распространенность азота в природе?
3. В виде каких соединений азот встречается в приро-
де?
4. Какое положение занимает азот в периодической
системе Д. И. Менделеева? Каково строение атома азота?
5. Какие степени окисления характерны для атома
азота в соединениях? Приведите примеры соответствую-
щих соединений. Какими окислительно-восстановитель-
ными свойствами обладают эти соединения?
6. Какие устойчивые изотопы азота вам известны?
Покажите строение ядер их атомов.
7. Как получают азот в промышленности и в лабора-
тории?
8. Каковы физические свойства азота?
9. Каково строение молекулы азота? Чем объясняется
малая реакционная способность азота при обычной тем-
пературе?
10. Напишите уравнения реакций, отражающие про-
230
цессы химического взаимодействия азота в «жестких»
условиях.
11. Объясните особенности строения молекулы аммиака.
12. Как получают аммиак в лабораторных условиях и
в промышленности?
13. Каковы физические и химические свойства ам-
миака?
14. Каково строение иона аммония? Как получают соли
аммония и каковы их свойства?
15. Какие оксиды азота вам известны; какими свой-
ствами они обладают?
16. Какие химические процессы лежат в основе про-
мышленного способа получения азотной кислоты?
17. В какой таре можно хранить и перевозить концен-
трированную и разбавленную азотную кислоту?
18. Каковы химические свойства разбавленной азот-
ной кислоты? Напишите уравнения химических реакций,
иллюстрирующие эти свойства.
19. На свету азотная кислота частично разлагается.
Отразите этот процесс уравнением реакции.
20. Напишите уравнения реакций взаимодействия
концентрированной азотной кислоты с неметаллами: се-
рой, углеродом, фосфором, бором.
21. Какие металлы устойчивы по отношению к кон-
центрированному раствору азотной кислоты и почему?
22. Что называется «царской водкой»? Какое действие
оказывает она на благородные металлы? Напишите урав-
нения соответствующих процессов.
23. Каким образом происходит термическое разло-
жение нитратов в зависимости от природы металла, обра-
зующего соль?
24. Укажите области применения азота и азотосодер-
жащих веществ.
25. Даны четыре газа: водород, азот, кислород и фтор.
Приведите не менее пятнадцати уравнений реакций вза-
имодействия этих газов друг с другом, а также с продук-
тами их взаимодействия.
26. Какова масса азотной кислоты, полученной из 2 т
аммиака, если выход продукта составляет 70 %?
Ответ: 5,18т.
231
Z7. Сколько воды и кристаллогидрата нитрата меди
Cu(NO3)2 • ЗН2О необходимо для приготовления 400 г ра-
створа нитрата меди с массовой долей Cu(NO3)2 23,5 % ?
Ответ: 279 г Н2О; 121 г Cu(NO3)2 • ЗН2О.
28. Смесь газов, выделившихся при разложении 33,1 г
нитрата свинца, растворена в 10 мл воды. Какая кислота
при этом образуется и какова ее массовая доля в растворе?
Ответ: 60,6 % HNO3.
29. Одинаковая ли масса азотной кислоты потребует-
ся для растворения 32 г меди, если в одном случае взять
концентрированную кислоту, а в другом — разбавленную?
Какой объем газообразного вещества выделится в одном
и в другом случае?
Ответ: 22,4 л NO2; 7,46 л NO.
30. При нагревании 27,1 г смеси нитратов натрия и
калия выделилось 3,36 л (н. у.) газа. Рассчитайте массы
нитратов в исходной смеси солей.
Ответ: 17 г NaNO3 и 10,1 г KNO3.
31. При взаимодействии 60 г металла II группы пери-
одической системы с азотом, образуется нитрид, при гид-
ролизе которого получается гидроксид соответствующе-
го металла и аммиак. При каталитическом окислении
аммиака выделяется 21,96 л оксида азота (II) с выходом
98 %. Определите, какой исходный металл был взят.
Ответ: кальций.
32. При нагревании 25,6 г соли образуется 14,4 г воды
и 8,96 л (н. у.) химически малоактивного газа, плотность
которого по водороду равна 14. Определите формулу взя-
той соли.
Ответ: NH4NO3.
33. Напишите уравнения реакций, с помощью кото-
рых можно осуществить следующие превращения:
1) N2 -» NH3 -» NO -* NO2 -» HNO3 -» NaNO3 NaNO2,
2) HNO2 -» HNO3 — NH4NO3 -* N2O -* N2.
34. Один литр (н. у.) смеси оксидов азота (II) и (IV)
имеет массу 1,875 г. Найдите массовые доли солей в ра-
створе, если 10 литров этой смеси пропустили через ра-
створ едкого натра массой 100 г. Щелочь израсходована
полностью.
232
Ответ: u>NaNOa = 24 %; u>NaNo2 = 19,5 %.
35. Найдите массовую долю (%) азотной кислоты, если
при растворении меди в 100 г раствора кислоты выдели-
лось 11,2л бурого газа.
Ответ: 63 % HNO3.
36. Какой объем азота и водорода (н. у.) потребуется
для получения 17 г аммиака, если его практический вы-
ход составляет 50 %. Какой объем раствора соляной
кислоты с и>НС1 = 20 % (р = 1,1 г/мл) необходимо взять для
нейтрализации полученного аммиака?
Ответ: 22,4 л N2; 67,2 л Н2; 160 мл.
37. Оксид металла, содержащий 70 % металла, полно-
стью восстановили водородом. При растворении 11,2г
полученного металла в азотной кислоте образовался нит-
рат трехвалентного металла и выделилось 13,44 л оксида
азота (IV). Определите массу исходного оксида.
Ответ: 16 г Fe2O3.
38. Осуществите превращения веществ, укажите усло-
вия прохождения реакций:
1) N2 -* NH3 -* NO -» NO2 -* HNO3 Cu(NO3)2 -» NO2,
2) (NH4)2CO3 -» NH3 -* NH4C1 -* NH3 -» NO,
3) NH4C1 -* NH4NO3 NH3 -» NO -» NO2 — HNO3,
4) Pb(NO3)2 -* NO2 -» HNO3 -* NH4NO3 -» NH3.
Фосфор
Вопросы и задачи
для самостоятельного решения
1. Назовите природные соединения фосфора.
2. Укажите положение фосфора в периодической сис-
теме элементов Д. И. Менделеева. Опишите строение ато-
ма фосфора.
3. Покажите степени окисления фосфора в соединени-
ях. Приведите примеры соответствующих соединений.
4. Назовите аллотропные модификации фосфора; срав-
ните их физические и химические свойства.
233
5. Расскажите об условиях получения каждой из ал-
лотропных модификаций фосфора.
6. Напишите уравнения реакций взаимодействия фос-
фора с кислородом, серой, галогенами и кальцием.
7. Покажйте области применения фосфора.
& Почему советский академик А. Е. Ферсман назвал
фосфор «элементом жизни и мысли»?
9. Напишите уравнения реакций взаимодействия фос-
фида кальция с водой. Отметьте свойства выделяющего-
ся газа.
10. Покажите, какие оксиды образует фосфор, отметь-
те их свойства.
11. Укажите способы получения ортофосфорной кис-
лоты.
12. Покажите, каким образом получают простой и
двойной суперфосфат; в чем заключается их отличие друг
от друга.
13. Напишите уравнение реакции получения преци-
питата.
14. Назовите удобрения, одновременно содержащие азот
и фосфор.
15. Напишите уравнения реакций получения средней
и кислых кальциевых солей ортофосфорной кислоты.
Изобразите структурные формулы этих веществ.
16. Укажите растворимость в воде фосфатов различ-
ных металлов.
17. Определите массу фосфорного ангидрида, которую
необходимо растворить в 120 г раствора ортофосфорной
кислоты с массовой долей Н3РО4 35 %, для получения
раствора с массовой долей кислоты 40 %.
Ответ; 10 г.
18. Сколько кг раствора фосфорной кислоты с массо-
вой долей 20 % можно получить из 500 кг фосфорита,
содержащего 70 % трехзамещенного фосфата кальция?
Ответ: 1105 кг.
18. Вещество, полученное при сжигании 6,2 г фосфора
в 7,5 л (н. у.) кислорода, растворили в 50 мл воды. Како-
ва массовая доля (%) Н3РО4в полученном растворе?
Ответ: 30,5 % Н3РО4.
2р. В 25 мл раствора едкого натра с массовой долей
234
NaOH 25 % (p = 1,280 г/мл) растворен фосфорный ангид-
рид, полученный при окислении 6,2 г фосфора. Определи-
те состав образующейся соли и ее массовую долю (%) в
растворе.
Ответ: NaH2PO4; 50 %.
21. Определите массовую долю (%) раствора ортофос-
форной кислоты, полученного при растворении 35,5 г
фосфорного ангидрида в 100 мл раствора ортофосфорной
кислоты с массовой долей Н3РО485% (р = 1,700 г/мл).
Ответ: 94,16%.
22. Составьте молекулярные и ионно-молекулярные
уравнения гидролиза ортофосфата натрия. Объясните,
почему эта соль используется для смягчения воды. Мо-
жет ли она заменить в данном процессе соду?
23. При гидролизе 36,4 г фосфида кальция образуется
гидроксид кальция и фосфористый водород, который за-
тем сжигают. Образовавшийся оксид фосфора (V) раство-
ряют в 50 г раствора едкого натра с массовой долей NaOH
25 % (р= 1,280 г/мл). Определите состав образующейся
соли и ее массовую долю в растворе.
Ответ: 51,9% NaH2PO4.
24. При окислении фосфора раствором азотной кисло-
ты с массовой долей HNO3 60 % (р = 1,370 г/мл) получена
ортофосфорная кислота, на нейтрализацию которой по-
требовалось 25 мл раствора гидроксида натрия с массовой
долей NaOH 25 % (р = 1,280 г/мл). При этом образовался
дигидрофосфат натрия. Рассчитайте объем раствора азот-
ной кислоты, израсходованный на окисление фосфора.
Ответ: 25,5 мл.
25. Напишите уравнения реакций, с помощью кото-
рых можно осуществить превращения:
1) Р4 - Са3Р2 - РН3 - Р4Н10 НРО3 - Н3РО4,
2) Р4- РС13-* Н3РО4-> К3РО4-» Са3(РО4)2,
3) Р4- Р4О1()~» Н3РО4-» КН2РО4.
I I
К3РО4 -* Са3(РО4)2
26. Найдите массу бертолетовой соли, которая вступи-
ла в реакцию с фосфором, если выделилось 71 г Р2О5
Ответ: 102 г.
235
Z7. Сколько граммов фосфора растворили в концент-
рированной азотной кислоте, если выделилось 11,2 л (н. у.)
оксида азота (II).
Ответ: 9,3 г.
28. 31 г простого вещества при взаимодействии с маг-
нием образует 67 г соединения Mg3X2, при обработке ко-
торого избытком соляной кислоты выделился газ. При
его сжигании получили твердое вещество, которое раство-
рили в 200 г воды. Найдите исходное вещество и его мас-
совую долю в растворе.
Ответ: 35,6 % Н3РО4.
Углерод
Вопросы и задачи
для самостоятельного решения
1. Каково содержание углерода в земной коре?
2. В виде каких соединений встречается углерод в
природе?
& Какое положение занимает углерод в периодической
системе Д. И. Менделеева? Напишите электронную конфигу-
рацию атома углерода. Укажите, какие степени окисления
проявляет углерод в соединениях. Приведите примеры.
4. Назовите известные вам аллотропные модифика-
ции углерода. Отметьте, какими свойствами они облада-
ют. Чем объясняется резкое различие в физических свой-
ствах этих веществ? Каковы области применения извест-
ных модификаций углерода?
5. Что такое адсорбция? Как получают активирован-
ный уголь и где он применяется?
6. Покажите, как совершается круговорот углерода в
природе?
7. Как получают кокс и древесный уголь? Что такое
антрацит?
8. Какие газы называют генераторным и водяным?
Каковы области их применения?
9. Какие соединения образует углерод с водородом?
Приведите примеры.
236
10. Чем объясняется многообразие углеродосодержа-
щих соединений?
11. Укажите названия соединений углерода с метал-
лами.
12. Напишите уравнение реакции получения карбида
кальция. Где применяют карбид кальция?
13. Приведите примеры реакций, в которых углерод
проявляет восстановительные свойства.
14. Какие оксиды образует углерод? Каково их строе-
ние, свойства?
15. Что такое «сухой лед» и какова его особенность?
16. Напишите структурную формулу угольной кисло-
ты. Какими свойствами обладает угольная кислота и как
она диссоциирует в водном растворе?
17. Укажите качественную реакцию на карбонат-ион.
18. Напишите уравнения реакций получения карбо-
ната и гидрокарбоната кальция. Какая из этих солей
растворима в воде?
19. Приведите технические названия карбонатов на-
трия и калия, гидрокарбоната натрия. Каким образом
получают эти вещества и каковы области их примене-
ния?
20. В виде каких природных соединений встречается
карбонат кальция? Каковы области йх применения?
21. Чем объяснить щелочную реакцию водных раство-
ров карбонатов кальция и натрия? Напишите уравнения
реакций.
22. Определите степень окисления углерода в соедине-
ниях:
СН4; СН3С1; СН2С12; СНС13; СС14.
23. Объясните, почему оксид углерода (II) может быть
восстановителем, а оксид углерода (IV) этим свойством
не обладает. Составьте уравнение реакции восстановле-
ния оксида цинка оксидом углерода (II).
24. Как экспериментально доказать, что образец веще-
ства является: а) гидрокарбонатом натрия (питьевой
содой); б) сульфатом натрия; в) известняком (карбона-
том кальция)? Составьте молекулярные и ионно-молеку-
лярные уравнения соответствующих реакций.
25. Какая масса раствора гидрокарбоната натрия с
237
массовой долей NaHCO3 8 % требуется для получения
224 л (н. у.) оксида углерода (IV).
Ответ: 21 кг.
26. При взаимодействии оксида углерода (II) с хлором
образуется фосген СОС12. Как изменяется степень окис-
ления углерода и хлора в этой реакции? Укажите эле-
мент-окислитель и элемент-восстановитель. Какая масса
фосгена получится при взаимодействии 70 г оксида угле-
рода (II) и 177,5 г хлора?
Ответ: 247,7 г.
27. Из 250 г мрамора в лаборатории получено 53,4 л
(н. у.) оксида углерода (IV). Определите массовую долю
(%) карбоната кальция в мраморе.
Ответ: 95,4 %.
28. При нагревании 200 г смеси карбоната и гидрокар-
боната натрия получился остаток массой 138 г. Вычис-
лите массовую долю (%) гидрокарбоната натрия в исход-
ной смеси.
Ответ: 84 %.
29. Какого состава образуется соль и какова ее кон-
центрация в растворе, полученном при растворении в
76,4 мл 32 %-ного раствора едкого кали (р = 1,310 г/мл)
оксида углерода (IV), образовавшегося при сжигании 6,4 л
(н. у.) метана?
Ответ: 36,50 % К2СО3.
30. Какой объем раствора соляной кислоты с массо-
вой долей НС1 20 % (р = 1,100 г/мл) потребуется для ра-
створения 300 г известняка (содержание карбоната каль-
ция в известняке составляет 90 %)? Каков объем выде-
лившегося (н. у.) газа?
Ответ: 895,9 мл НС1; 60,5 л СО2.
31. При прокаливании 11,44 г кристаллического кар-
боната натрия образуется 4,26 г безводной соли. Найдите
формулу кристаллогидрата.
Ответ: Na2CO3 • ЮН20.
32. В 100 г воды растворили 26,5 г соды, а затем пропу-
стили избыток оксида углерода (IV). Определите массу
осадка, если растворимость бикарбоната натрия при ус-
ловиях опыта равна 8 г.
Ответ: 34,8 г.
238
33. Определите массу гашеной извести, которую следует
прибавить к 16 г раствора кислого углекислого кальция с
массовой долей Са(НСО3)2 5 % для образования средней соли.
Ответ: 3,7 г.
34. При обработке 20 г смеси магния и карбоната маг-
ния соляной кислотой выделилось 11,2 л (н. у.) газа. После
сжигания этого газа и конденсации паров воды его объем
стал равен 4,48 л (н. у.). Найдите состав исходной смеси.
Ответ: 16,8 г MgCO3; 3,2 г Mg.
35. Определите массу соли, образующейся в растворе
при пропускании 1,12 л (н. у.) оксида углерода (IV) через
50г раствора едкого кали с массовой долей КОН 12 %.
Ответ: 6,9 г К2СО3.
36. Определите объемный состав смеси оксидов угле-
рода (II) и (IV) объемом 28 л (н. у.), имеющей плотность
по водороду 17,2.
Ответ: 16,8 л СО; 11,2 л СО2.
37. При сжигании 0,896 л (н. у.) смеси оксида углерода
(II) и оксида углерода (IV) в избытке кислорода было израс-
ходовано 0,112 л (н. у.) кислорода. Полученная газовая смесь
пропущена через раствор, содержащий 2,96 г гашеной изве-
сти. Определите объемный состав газовой смеси.
Ответ: срсо = 25 % ;срС0 75 %.
38. Осуществите следующие превращения, укажите
условия прохождения реакций:
1) С -* СО -» СО2 -* NaHCO3 — Na2CO3 -» СаСО3,
2) С4Н10 -» СО2 -» Са(НСО3)2 -* СаСО3 СаО,
3) С6Н6 -* со2 -* со -* нс^> СН3ОН,
хн
4) С -» СН4 -* СН3С1 — СН2С12 -* СНС13 -» СС14,
, о
5) СаСО3 — СаО -* СаС2 -» С2Н2 -» СН3 С
хн
6) С — СО2 -» Н2СО3 -* Na2CO3.
\ /
NaHCOo
О
239
Кремний
Вопросы и задачи
для самостоятельного решения
1. Какова распространенность кремния в природе? В
виде каких соединений он встречается?
2. Укажите положение кремния в периодической сис-
теме Д. И. Менделеева. Покажите строение атома крем-
ния.
3. Какие степени окисления проявляет кремний в сво-
их соединениях? Приведите примеры этих соединений.
4. Укажите способы получения кремния в виде про-
стого вещества. Напишите уравнения реакций, лежащих
в основе этих процессов.
5. Укажите основные физические и химические свой-
ства кремния.
6. Что такое «силаны»? Напишите уравнение реакции
получения простейшего силана. Покажите, какой про-
дукт образуется при горении силана на воздухе.
7. Укажите, различаются ли по химическому составу
кварц, горный хрусталь, желтый и белый песок.
8. Отметьте, к какому типу оксидов относится оксид
кремния (IV). В чем его химическая особенность?
9. Покажите, каким путем можно получить кремне-
вую кислоту, исходя из оксида кремния (IV).
10. Объясните, почему водные растворы силикатов
натрия и калия имеют щелочную реакцию.
11. Укажите состав обычного стекла и способ его по-
лучения.
12. Отметьте, что такое «жидкое стекло» и области его
применения.
13. Напишите уравнение реакции, лежащей в основе
процесса «травления» стекла.
14. Укажите состав полевого шпата. Покажите сущ-
ность химического процесса, происходящего при его вы-
ветривании.
15. Что такое цемент? Опишите процесс «схватывания
цемента».
16. Смесь 0,75 т белого песка и 0,45 т кокса нагрели в
240
электрической печи до 3800 °C. Рассчитайте состав и мас-
су полученного карборунда. Укажите области его приме-
нения.
Ответ: 500 кг; 70 % Si; 30 % С.
17. Какой объем раствора плавиковой кислоты с мас-
совой долей HF 20 % (р = 1,070 г/мл) потребуется для
растворения 1 кг стекла следующего состава:
СаО • Na2O • 6SiO2?
Ответ: 5,5 л.
18. 29,8 г смеси, состоящей из кремния, цинка и желе-
за, обработали гидроксидом натрия. При этом выдели-
лось 13,44 л газа (н. у.). При действии на такое же коли-
чество смеси избытка соляной кислоты выделилось 8,96 л
газа. Каков количественный состав смеси?
Ответ: 5,6 г кремния, 13,0 г цинка, 11,2 г железа.
19. Смесь углерода и кремния массой 40 г растворили
в избытке концентрированного раствора гидроксида на-
трия; при этом выделилось 26,88 л (н. у.) газа. Найти
массовую долю углерода в смеси.
Ответ: 58 %.
20. Осуществите превращения, укажите условия про-
хождения следующих реакций:
1) Si -» SiO2 -* Na2SiO3 NaHSiO3,
2) Si -* Mg2Si — SiH4 — SiO2 — CaSiO3,
3) SiO2 Si -» SiCl4 — Si -* H2.
11
Металлы
Общая характеристика металлов
Если в периодической системе Д. И. Менделеева про-
вести диагональ от бериллия к астату, то справа вверх от
диагонали будут находиться элементы-неметаллы (исклю-
чая элементы побочных подгрупп), а слева внизу — эле-
менты-металлы (к ним относятся элементы побочных
подгрупп). Элементы, расположенные вблизи диагонали
(например, Be, Al, Ti, Ge, Nb, Sb и др.), обладают двойствен-
ным характером.
По признаку деления элементов на семейства к метал-
лам можно отнести s-элементы I и II групп, d- и f-элемен-
ты, а также p-элементы главной подгруппы III группы,
кроме бора.
Таким образом, из 109 элементов 87 являются метал-
лами. В соответствии с положением в периодической
системе атомы металлов имеют небольшое число валент-
ных электронов. Эти электроны достаточно слабо связа-
ны со своими ядрами и могут легко отрываться от них.
В результате в узлах кристаллической решетки появля-
ются положительно заряженные ионы, а между ними сво-
бодно перемещаются электроны (так называемый «элек-
тронный газ»). Связь между положительными ионами,
осуществляемая за счет притяжения электронов, свобод-
но перемещающихся по кристаллу, называется металли-
ческой. Металлической связью объясняются физические
свойства металлов. По агрегатному состоянию все метал-
лы, за исключением ртути, при обычных условиях явля-
ются твердыми веществами. Они обладают характерным
блеском, хорошей ковкостью и пластичностью, электро-
242
и теплопроводностью. Металлы делятся на легкие (плот-
ность до 5 г/см3) и тяжелые (плотность больше 5 г/см3),
металлы отличаются друг от друга по твердости: самые
мягкие — щелочные, их можно резать ножом; а самый
твердый — хром, им можно резать стекло. Металлы де-
лятся на легкоплавкие (условно до 1000 °C) и тугоплав-
кие. Например, наиболее тугоплавкий металл — вольфрам,
плавится при 3390 °C. В металлургии металлы делят на
черные (железо, марганец, хром) и цветные (все остальные
металлы).
При характеристике химических свойств металлов
отмечают, что их атомы способны только к отдаче элек-
тронов с образованием положительно заряженных ионов.
Поэтому они всегда выступают в роли восстановителей.
Способность отдавать электроны проявляется у метал-
лов в разной степени. Чем легче металл отдает электро-
ны, тем он активнее и тем более энергично взаимодей-
ствует с неметаллами и ионами других металлов. По
признаку активности все металлы располагают в ряд,
который называется рядом стандартных электродных
потенциалов.
На основе ряда стандартных электродных потенциа-
лов пишут уравнения реакций вытеснения металлов из
солей; более активный металл вытесняет менее актив-
ный. Все металлы, стоящие в ряду до водорода, вытесняют
его из растворов разбавленных кислот, кроме HNO3, и при
этом растворяются в них. Ряд стандартных электродных
потенциалов применим только к водным растворам и
характеризует химическую активность металлов только
в окислительно-восстановительных реакциях, протекаю-
щих в водной среде.
Химические свойства металлов
Атомы металлов сравнительно легко отдают валент-
ные электроны и переходят в положительно заряженные
ионы. Поэтому металлы являются восстановителями.
Металлы взаимодействуют с простыми веществами:
Са + С12 = СаС12,
243
Са + S = CaS,
ЗСа + N„ = Ca,N,,
it <1 it
t°
2Ca + Si = Ca2Si,
t°
Ca + H2 - CaH2,
2Ca + 02 = 2CaO.
Активные металлы реагируют с водой:
2Na + 2Н2О = 2NaOH + H2f.
Металлы, стоящие в ряду стандартных электродных
потенциалов до водорода, взаимодействуют с разбавлен-
ными растворами кислот (кроме HNO3) с выделением
водорода:
Zn + 2НС1 = ZnCl2 + H2f.
Металлы реагируют с водными растворами солей ме-
нее активных металлов:
Ni + CuSO4 = NiSO4 + CuJ.
Металлы реагируют с кислотами-окислителями:
Си + 2Н2вО4(конц, = CuSO4 + SO2f + 2Н2О,
Zn + 2Н28О4(конц0 =1 ZnSO4 + SO2f + 2H2O,
t,> t.
3Zn + 4H2SO4(kohii j = 3ZnSO4 + SI + 4H2O,
4Zn + 5Н2в04(конц)%= 24ZnSO4 + H2Sf + 4H2O,
4HNO3 (конц.) + Си = Cu(NO3)2 + 2NO2f + 2H2O,
8HNO3 (разе.) + 3Cu = 3Cu(NO3)2 + 2NOf + 4H2O,
10HN03(paa6, + 4Mg = 4Mg(NO3)2 + N2Of + 5H2O,
10HNCL.. _o , v. + 4Zn = 4Zn(NO3)2 + NH4NO3 + 3H2O.
Способы получения металлов
Современная металлургия получает более 75 металлов
и многочисленные сплавы на их основе. В зависимости от
способов получения металлов различают пиро-, гидро- и
электрометаллургию.
ГТ] Пирометаллургия охватывает способы получения
металлов из руд с помощью реакций восстановления,
244
проводимых при высоких температурах. В качестве вос-
становителей применяют уголь, активные металлы, оксид
углерода (II), водород, метан.
t°
Cu2O + С - 2Cu + СО,
Cu2O + СО = 2Cu + СО2,
е
Cr2O3 + 2А1 = 2Сг + А12О3, (алюмотермия)
е
TiCl2 + 2Mg = Ti + 2MgCl2, (магнийтермия)
t’
WO3 + 3H2 = W + 3H2O. (водородотермия)
|j] Гидрометаллургия — это получение металлов из ра-
створов их солей. Например, при обработке разбавленной
серной кислотой медной руды, содержащей оксид меди
(П), медь переходит в раствор в виде сульфата:
CuO + H2SO4 = CuSO4 + Н2О.
Затем медь извлекают из раствора либо электроли-
зом, либо вытеснением с помощью порошка железа:
CuSO. + Fe = FeSO. + Си.
__ 4 4
(з) Электрометаллургия — это способы получения ме-
таллов из их расплавленных оксидов или солей с помо-
щью электролиза:
2NaCl
электролиз
2Na + С12.
Вопросы и задачи
для самостоятельного решения
1. Укажите положение металлов в периодической си-
стеме Д. И. Менделеева.
2. Покажите физические и химические свойства ме-
таллов.
3. Объясните причину общности свойств металлов.
4. Покажите изменение химической активности ме-
таллов главных подгрупп I и II групп периодической
системы.
5. Каким образом изменяются металлические свой-
ства у элементов II и III периодов?
245
& Назовите самый тугоплавкий и самый легкоплав-
кий металлы.
7. Укажите, какие металлы встречаются в природе в
самородном состоянии и какие — только в виде соедине-
ний. Чем это можно объяснить?
8. Какова природа сплавов? Как состав сплава влияет
на его свойства. Покажите на конкретных примерах.
(к Укажите важнейшие способы получения металлов
из руд.
10. Назовите разновидности пирометаллургии. Какие
восстановители используют в каждом конкретном спо-
собе? Почему?
11. Назовите металлы, которые получают с помощью
гидрометаллургии. В чем сущность и каковы преимуще-
ства данного метода перед другими?
12. Приведите примеры получения металлов с помо-
щью электрометаллургии. В каком случае используют
этот способ?
13. Каковы современные способы получения металлов
высокой степени чистоты?
14. Что такое «электродный потенциал»? Какой из
металлов имеет наибольший и какой — наименьший элек-
тродные потенциалы в водном растворе?
15. Охарактеризуйте ряд стандартных электродных по-
тенциалов?
16. Можно ли вытеснить металлическое железо из
водного раствора его сульфата с помощью металлическо-
го цинка, никеля, натрия? Почему?
17. Каков принцип работы гальванических элементов?
Какие металлы могут в них использоваться?
18. Какие процессы относятся к коррозионным? Ка-
кие виды коррозии вам известны?
19. Что называется электрохимической коррозией?
Какие способы защиты от нее вам известны?
20. Как влияет на коррозию железа его контакт с дру-
гими металлами? Какой металл будет разрушаться пер-
вым на поврежденной поверхности луженого, оцинкован-
ного и никелированного железа?
21. Какой процесс называют электролизом? Напишите
реакции, отражающие процессы, происходящие на като-
246
де и аноде при электролизе расплава хлорида натрия,
водных растворов хлорида натрия, сульфата меди, суль-
фата натрия, серной кислоты.
22. Какую роль играет материал электродов при про-
текании процессов электролиза? Приведите примеры про-
цессов электролиза, протекающих с растворимыми и не-
растворимыми электродами.
23. Сплав, идущий на приготовление медных монет, со-
держит 95 % меди. Определите второй металл, входящий
в сплав, если при обработке однокопеечной монеты избыт-
ком соляной кислоты выделилось 62,2 мл водорода (н. у.).
Ответ: алюминий.
24. Навеска карбида металла массой 6 г сожжена в
кислороде. При этом образовалось 2,24 л оксида углеро-
да (IV) (н. у.). Определите, какой металл входил в состав
карбида.
Ответ: магний.
25. Покажите, какие продукты выделятся при электро-
лизе водного раствора сульфата никеля, если процесс про-
текает: а) с угольными; б) с никелевыми электродами?
26. При электролизе водного раствора медного купо-
роса на аноде выделилось 2,8 л газа (н. у.). Какой это газ?
Что и в каком количестве выделилось на катоде?
Ответ: 16 г меди.
27. Составьте схему электролиза водного раствора
нитрата калия, протекающего на электродах. Чему равно
количество пропущенного электричества, если на аноде
выделилось 280 мл газа (н. у.)? Что и в каком количестве
выделилось на катоде?
Ответ: 4825 кл; 0,56 л Н2.
Щелочные металлы
Вопросы и задачи
для самостоятельного решения
1. Укажите положение щелочных металлов в перио-
дической системе Д. И. Менделеева. С чем связано назва-
ние этих металлов?
247
2. Укажите, как изменяются радиусы атомов щелоч-
ных металлов при переходе от лития к францию.
3. Какую степень окисления проявляют атомы щелоч-
ных металлов в соединениях?
4. Как изменяется способность к отдаче электронов
при переходе от лития к францию? Чем это объясняется?
5. В виде каких соединений встречаются в природе ще-
лочные металлы? Какими способами выделяют их из руд?
6. Укажите области применения щелочных металлов.
7. Дайте характеристику физических и химических
свойств натрия и калия.
8. Как хранят щелочные металлы?
9. Как изменяется характер взаимодействия щелоч-
ных металлов с водой и кислородом в зависимости от
размера атома? Напишите формулы оксида и пероксида
натрия.
10. Укажите, на чем основано применение пероксида
натрия на подводных лодках.
11. Напишите уравнения реакций промышленного
способа получения гидроксидов натрия и калия.
12. Какими физическими и химическими свойствами
обладают гидроксиды щелочных металлов? Каково прак-
тическое значение этих гидроксидов?
13. Покажите, как и почему изменяется степень диссо-
циации гидроксидов щелочных металлов в зависимости
от радиуса иона металла.
14. Напишите уравнения реакций получения гидри-
дов щелочных металлов. Укажите их свойства и области
применения.
15. Назовите наиболее известные вам соли щелочных
металлов. Какова их растворимость в воде? Каковы обла-
сти их применения?
16. Какова реакция среды водного раствора карбоната
цезия? Ответ иллюстрируйте уравнением химической
реакции.
17. Какую окраску приобретает пламя горелки при
внесении в него солей натрия, калия?
18. Два кусочка натрия и калия одинаковых по массе
бросили в воду. Укажите, в каком случае выделится боль-
ший объем водорода.
248
19. Покажите, какие из солей будут подвергаться гид-
ролизу: хлорид калия, сульфид калия, сульфат калия
Напишите уравнения соответствующих реакций.
20. Напишите уравнения реакций, с помощью кото-
рых можно осуществить следующие превращения:
1) NaCl -» Na - NaOH -* NaHCO3 — Na2CO3 — NaCl,
2) NaCl — Na2CO3 — NaHCO3 — NaCl — NaOH,
3) K2CO3 — K2SO4 — KC1 — Cl2 — CaCl2,
4) Na -* NaOH — Na2SO4 — NaCl -* NaNO3,
5) Na2SO4 — Na2CO3 — NaCl — Na — NaOH —
- Na[Al(OH)4],
6) Li -> Li2O — LiOH — H2.
21. Какой объем углекислого газа (н. у.) и раствора
едкого кали с массовой долей КОН 44 % (р = 1,460 г/мл)
необходимо взять для получения 13,8 г поташа?
Ответ: 2,24 л СО2; 10,7 мл раствора КОН.
22. При электролизе 300 г раствора хлорида натрия на
электродах выделилось 22,4 л газов (н. у.). Определите
массовую долю соли в исходном растворе.
Ответ: 19,5%.
23. При реакции с водой 15,6г металла, образующего
одновалентный катион, выделяется 4,48 л газа (н. у.).
Определите, какой металл был взят для реакции.
Ответ: калий.
24. Напишите уравнения реакций, отражающие процесс
получения кальцинированной соды (карбоната натрия)
аммиачным способом, и рассчитайте массу полученной соды,
если для реакции было взято 234 кг хлорида натрия.
Ответ: 212 кг.
25. При обработке смеси гидроксида и гидрокарбона-
та калия избытком раствора соляной кислоты образова-
лось 22,45 г хлорида калия и выделилось 4,48 л (н, у.)
газа. Рассчитайте массовые доли веществ в исходной
смеси.
Ответ: 21,9 % КОН; 78,1 % КНСО3.
26. Соль А окрашивает пламя в желтый цвет и с ра-
створом нитрата серебра образует белый творожистый
осадок. При нагревании соли А с концентрированной сер-
249
ной кислотой выделяется газ, который растворим в воде.
Получающаяся при этом кислота взаимодействует с 26,1 г
оксида, содержащего 63,21 % четырехвалентного элемен-
та, с образованием газа X, способного обесцветить влаж-
ную бумагу, окрашенную фиолетовыми чернилами. На-
зовите вещества А и X. Определите количество израсхо-
дованной соли А и объем выделившегося газа X (н. у.).
Ответ: 70,2 г NaCl и 6,72 л С12.
27. Определите массу кристаллической соды
Na2CO3 • ЮН20, требуемой для приготовления 500 г ра-
створа карбоната натрия с массовой долей Na2CO3 10 %.
Ответ: 134,9 г.
28. Имеется смесь КС1О3 и KNO3. При прокаливании
34,61 г этой смеси выделилось 8,96 л (н. у.) газа. Опреде-
лите массовый состав смеси.
Ответ: 70,8 % КС1О3; 29,2 % KNO3.
29. Природный минерал каинит содержит 24,64 % хло-
рида калия, 39,64 % сульфата магния, 35,72 % кристал-
лизационной воды. Найдите формулу этого минерала.
Ответ: КС1 • MgSO4 • 6Н2О.
30. Вещество, полученное при взаимодействии щелоч-
ного металла массой 2,66 г с избытком хлора, растворили
в воде и к полученному раствору добавили избыток нит-
рата серебра. Выпавший осадок имел массу 2,87 г. Опре-
делите порядковый номер взятого металла.
Ответ: 55.
Щелочноземельные металлы. Кальций
Вопросы и задачи
для самостоятельного решения
1. Какие элементы относят к щелочноземельным эле-
ментам? Почему их так называют?
2. Укажите положение щелочноземельных элементов
в периодической системе Д. И. Менделеева.
3. Напишите электронную конфигурацию атома каль-
ция. Покажите, какую степень окисления проявляет каль-
ций в соединениях.
250
4. В виде каких соединений встречается кальций в
природе?
б. Каким образом получают металлический кальций,
каковы его физические и химические свойства?
в. Напишите уравнения реакций взаимодействия каль-
ция с водородом, хлором, кислородом, серой, углем, водой.
7. Каким образом получают оксид кальция, каковы
его свойства?
8. Какие технические названия вам известны для:
оксида кальция, гидроксида кальция, водного раствора
гидроксида кальция?
9. Укажите растворимость в воде различных солей
кальция.
10. Каким образом получают негашеную известь? В
чем заключается процесс ее гашения?
11. Какое соединение называют натронной известью?
Укажите области ее применения в лаборатории.
12. Укажите, какие процессы происходят при пропус-
кании оксида углерода (IV) через известковую воду.
13. Как и почему изменяется степень диссоциации
гидроксидов элементов главной подгруппы второй груп-
пы периодической системы?
14. Какое соединение называют белильной известью?
Укажите области ее применения.
15. Напишите уравнение реакции взаимодействия
гидрида кальция с водой.
16. Напишите структурные изображения гидро-, ди-
гидро- и ортофосфатов кальция.
17. При прокаливании 20 г гипса выделяется 4,18 г
кристаллизационной воды. Установить формулу гипса.
Ответ: CaSO4 • 2Н2О.
18. Определите массу гидроксида кальция, получае-
мую из 24 кг природного известняка, содержащего 90 %
карбоната кальция. Какой объем оксида углерода (IV)
(н. у.) выделяется при этом?
Ответ: 15,9 кг Са(ОН)2; 4,84м3СО2.
19. При растворении в кислоте 5 г смеси оксида и кар-
боната кальция выделилось 140 мл газа (н. у.). Опреде-
лите содержание оксида кальция в исходной смеси.
Ответ: 87,55%.
251
20. Определите количественный состав смеси, состоя-
щей из кальция и оксида кальция, если известно, что при
нагревании этой смеси с углем выделилось 4,48 л газа
(н. у.) и образовалось 19,2 г продукта реакции.
Ответ: 4 г Са, 11,2 г СаО.
21. Осуществите превращения, укажите условия про-
хождения следующих реакций:
1) Са -* СаО -* Ca(NO3)2 -* CaSO4,
2) Са -* СаО — Ca(NO3)2 — Са(ОН)2 — CaSiO3,
I
СаО
3) Са3(РО4)2 — Са(Н2РО4)2 — CaSO4 СаС12 -» СаСО3,
4) СаСО3 СаО — СаС2 — С2Н2 — СН3 С — СО2,
\ / ХН
СаС12
5) Mg -* MgCl2 - Mg(OH)2 - MgO - Mg(NO3)2,
6) Ba — BaO — Ba(OH)2.
\ /
BaCl2 -* BaSO4
Алюминий
Вопросы и задачи
для самостоятельного решения
1. Укажите положение алюминия в периодической
системе элементов Д. И. Менделеева. Напишите элект-
ронную формулу атома алюминия.
2. Укажите степень окисления, проявляемую алюми-
нием в соединениях. Назовите важнейшие соединения
алюминия.
3. Назовите природные соединения, в виде которых
алюминий встречается в природе.
4. Расскажите о промышленном способе получения
алюминия. Покажите его физические и химические свой-
ства, области применения в народном хозяйстве.
252
5. Покажите, при каких условиях алюминий реагиру-
ет с галогенами, серой, азотом, углем. Напишите уравне-
ния соответствующих реакций.
6. Покажите, как ведет себя алюминий по отношению
к серной, соляной и азотной кислотам различной кон-
центрации.
7. Покажите, почему алюминий без дополнительной
очистки не вытесняет водород из воды и в то же время
легко вытесняет из водного раствора щелочи. Напишите
уравнения соответствующих реакций.
8. Какие химические процессы лежат в основе метода
алюмотермии? Для получения каких металлов использу-
ется данный метод?
9. Покажите свойства оксида и гидроксида алюми-
ния. Докажите амфотерность их свойств, написав урав-
нения соответствующих реакций в молекулярной и ион-
но-молекулярной форме.
10. Напишите уравнения реакций, с помощью кото-
рых можно осуществить следующие превращения:
1) А1 -> А1С13 А1(ОН)3 Na[Al(OH)4] -* А1(ОН)3 ->
-> А12О3 — А1
2) А1 — А1(ОН)3 -> А12О3 -» Al -* A12S3 -> H2S
11. Определите массовый состав смеси алюминия и
меди, если известно, что при обработке 10 г этой смеси
избытком соляной кислоты выделяется 5,6 л водорода
(н. у.).
Ответ: 45 % А1.
12. На выплавку 4 кг алюминия расходуется 8 кг ок-
сида алюминия. Определите выход металла.
Ответ: 94 %.
13. Определите состав смеси алюминия и магния, если
известно, что при обработке ее раствором гидроксида
натрия выделяется 22,4 л водорода (н. у.), а при обработ-
ке такого же количества смеси соляной кислотой выде-
ляется 67,2 л водорода (н. у.).
Ответ: 27,7%.
14. Определите состав смеси, состоящей из порошков
алюминия, магния и песка, если известно, что при обработ-
ке 5г ее раствором гидроксида натрия выделилось 2,24 л
253
водорода (н. у.), а при обработке такого же количества смеси
соляной кислотой выделилось 4,48 л водорода (н. у.).
Ответ: 36 % А1; 48 % Mg; 16 % SiO2.
15. При обработке 64,2 г смеси алюминия с его окси-
дом раствором гидроксида натрия выделилось 26,88 л
(н. у.) газа. Определите состав смеси.
Ответ: 33,6 % А1; 66,4 % А12О3.
16. Определите состав смеси алюминия и меди, если
известно, что при обработке 20 г ее концентрированной
азотной кислотой выделилось 4,48 л газа (н. у.).
Ответ: 32 % Си.
17. Определите массовый состав смеси, образующейся
при взаимодействии 13,5 г порошкообразного алюминия
с 32 г оксида железа (III).
Ответ: 44,8 % Д12О3; 49,2 % Fe; 6 % Al.
18. При растворении 4,5 г сплава алюминия с магни-
ем в кислоте выделилось 5,04 л водорода, измеренного
при н. у. Определите процентный состав сплава.
Ответ: 60 % А1; 40 % Mg.
19. Составьте молекулярное и ионно-молекулярное
уравнение гидролиза сульфида алюминия.
20. При растворении в серной кислоте 4,14 г смеси
алюминия с его оксидом образовалось 17,1г безводного
сульфата алюминия. Определите состав взятой смеси.
Ответ: 1,08 г А1; 3,06 г А12О3.
21. В результате электролиза оксида алюминия на
угольном аноде образуется оксид углерода (IV), при про-
пускании которого через раствор гидроксида кальция
образуется 48,6 г гидрокарбоната кальция. Рассчитайте
массу железной окалины, которую можно восстановить с
помощью образовавшегося алюминия. Каков объем по-
лучившегося оксида углерода (IV)?
Ответ: 69,6 г Fe2O3; 13,44 л СО2.
22. При обработке 100 г смеси серебра, алюминия и
оксида магния избытком раствора концентрированной
азотной кислоты образовалось 8,96 л газа (н. у.). При
взаимодействии такой же навески исходной смеси с из-
бытком гидроксида натрия выделилось 13,44 л газа
(н. у.). Рассчитайте массовый состав исходной смеси.
Ответ: 43,2 % серебра; 10,8 % алюминия; 46 % магния.
254
23. Имеется легкий металл серебристо-белого цвета,
сплавы которого с другими металлами обладают большой
легкостью и прочностью. На воздухе металл устойчив, но
хорошо растворяется в растворах соляной кислоты и гид-
роксида натрия; при этом выделяются одинаковые объе-
мы газов. Порошкообразный металл при нагревании вза-
имодействует с серой. Продукт этой реакции при обработ-
ке его водой образует гидроксид, обладающий амфотерными
свойствами. Определите, что это за металл и сколько его
нужно взять, чтобы получить 10,2 г оксида металла.
Ответ: 5,4 г алюминия.
24. Имеется смесь порошков алюминия и оксида неиз-
вестного металла (степень окисления +2). Образец мас-
сой 7,16 г поместили в раствор щелочи и получили газ,
при сгорании которого образовалось 2,16 г воды. При
растворении твердого остатка израсходовали 53,6 мл ра-
створа серной кислоты (u>H s0 =20%, р = 1,140 г/мл).
Какой был взят оксид?
Ответ: оксид магния.
25. При обработке смеси серебра и алюминия избыт-
ком раствора концентрированной азотной кислоты обра-
зовалось 6,72 л (н. у.) газа. При обработке такой же массы
смеси избытком раствора гидроксида натрия выделилось
6,72 л (н. у.) газа. Найдите состав исходной смеси.
Ответ: 86 % Ag; 14 % Al.
Железо
Вопросы и задачи
для самостоятельного решения
1. Укажите положение железа в периодической систе-
ме элементов Д. И. Менделеева. Напишите электронную
формулу атома железа.
2. Какие степени окисления характерны для атома
железа в соединениях? Приведите примеры соединений с
различными степенями окисления.
3. Какова распространенность железа в природе? В виде
каких соединений железо встречается в природе?
255
4. Каковы физические и химические свойства железа?
5. Составьте молекулярные и ионно-молекулярные
уравнения реакции взаимодействия железа:
а) с разбавленной и концентрированной (при нагрева^
нии) азотной кислотой;
б) с разбавленной и концентрированной (при нагрева-
нии) серной кислотой;
в) с соляной кислотой;
г) с раствором нитрата меди (И).
6. Опишите принципы работы доменной печи. Какие
химические процессы лежат в основе получения чугуна?
7. Какие виды чугуна вам известны? Укажите облас-
ти их применения.
8. Назовите известные способы переработки чугуна в
сталь. Чем они отличаются друг от друга?
9. Каким образом отражается на свойствах стали
наличие примесей фосфора, мышьяка, серы? Каким обра-
зом избавляются от этих примесей?
10. Укажите состав и области применения «томасова
шлака».
11. Назовите известные виды стали и области их при-
менения.
12. Напишите уравнения реакций, иллюстрирующие
химические свойства оксида и гидроксида железа (II).
13. Определите степень окисления железа в желтой и
красной кровяной соли.
14. Приведите уравнение качественной реакции на
соединения железа (II).
15. Приведите примеры уравнений реакций, иллюст-
рирующих восстановительные свойства железа (П).
16. Каковы физические и химические свойства окси-
да и гидроксида железа (III)? Ответ проиллюстрируйте
уравнениями соответствующих реакций.
17. Сравните свойства гидроксидов железа в степенях
окисления +2 и +3. Какой из гидроксидов и почему обла-
дает более сильно выраженными основными свойствами?
18. Состав магнетита может быть представлен форму-
лой Fe(FeO2)2. Солью какой кислоты является магнетит?
Напишите структурные формулы магнетита и укажите
степени окисления железа в данном соединении.
256
19. Приведите примеры уравнений реакций, иллюст-
рирующих способы получения соединений железа (III).
20. Приведите примеры уравнений реакций, иллюст-
рирующих окислительные и восстановительные свойства
соединений железа (III).
21. Напишите качественные уравнения реакций на
соединения железа (III).
22. Напишите уравнения реакций, отражающие про-
цесс получения соединений железа (VI). Укажите, каки-
ми свойствами обладают ферраты.
23. Определите массу пирита, содержащего 85 % FeS2,
необходимого для получения 1,6 кг оксида серы (IV).
Ответ: 1,76 кг.
24. Какой объем раствора азотной кислоты с массо-
вой долей HNO3 46 % (р = 1,290 г/мл) расходуется на
растворение железа, если при этом выделяется 700 мл
(н. у.) оксида азота (II)?
Ответ: 13,3 мл.
25. Определите массу железа и меди в их смеси, зная,
что при взаимодействии 11,65 г ее с раствором соляной
кислоты выделяется 4,48 л водорода (н. у.).
Ответ: 11,2 г Fe; 0,45 г Си.
26. В чистом виде минерал магнетит содержит 72,4 %
железа и 27,6 % кислорода. Выведите формулу магне-
тита.
Ответ: Fe3O4.
27. В раствор сульфата меди опущена железная плас-
тинка. Через некоторый период времени ее масса увели-
чилась на 3 г. Определите массу железа, перешедшего в
раствор.
Ответ: 21 г.
28. Определите массу карбида железа, образующегося
при восстановлении 160 г оксида железа (III) оксидом
углерода (II). Известно, что восстановление оксида желе-
за (III) протекает на 90 %, а образование карбида на 1 %
от теоретического.
Ответ: 1,08 г Fe3C.
29. 28,8 г смеси железа с железной окалиной восстано-
вили водородом. Продукты реакции обработали без дос-
тупа воздуха соляной кислотой; при этом выделилось
257
8,96 л газа (н. у.). Определите количественный состав
исходной смеси.
Ответ: 5,6 г Fe.
30. Имеется 20 г смеси сульфатов железа (II) и (III). На
взаимодействие с этой смесью в кислой среде было израс-
ходовано 3,16 г перманганата калия. Определите количе-
ственный состав смеси.
Ответ: 15,2г сульфата железа (II).
31. При взаимодействии водного раствора щелочи с
водным раствором хлорида железа (II) образовалось 36 г
осадка, масса которого при стоянии на воздухе увеличи-
лась. Объясните это явление и рассчитайте, на сколько
граммов масса увеличилась.
Ответ: 3,2 г.
32. 9,2 г смеси железа и магния полностью прореаги-
ровали с газом, выделившимся при электролизе 80,7 г
раствора хлорида меди (II) с массовой долей СиС12 80,7 %.
Определите количественный состав исходной смеси.
Ответ: 5,6 г железа; 3,6 г Mg.
33. Напишите уравнения реакций, с помощью кото-
рых можно осуществить следующие превращения:
1) Fe -> FeSO4 -* Fe2(SO4)3 -» Fe(OH)3 -* Fe(NO3)3,
2) Fe3O4 -> Fe -> FeCl2 -> FeCl3,
3) FeSO4 — Fe(OH)2 -» Fe(OH)3 — Fe2O3 -» Fe.
34. Уравняйте окислительно-восстановительные реак-
ции, укажите окислитель и восстановитель:
1) FeCl3 + KI -» FeCl2 +12 + KC1,
2) Fe(OH)2 + O2 + H2O -* Fe(OH)3,
3) FeSO4 + KMnO4 + H2SO4 -*
-» Fe2(SO4)3 + K2SO4 + MnSO4 + H2O.
Хром
Вопросы и задачи
для самостоятельного решения
1. Напишите электронную формулу атома хрома.
2. Укажите различие в строении атомов элементов
268
Главной и побочной подгрупп шестой группы периоди-
ческой системы на примере атомов серы и хрома.
3. Какие степени окисления характерны для атома
хрома в соединениях? Приведите примеры соединений с
различными степенями окисления хрома.
4. Укажите распространенность хрома и назовите его
природные соединения.
5. Опишите промышленный способ получения хрома.
Покажите его физические, химические свойства и облас-
ти применения в народном хозяйстве.
6. Укажите причину пассивации хрома в концентри-
рованных растворах азотной и серной кислот.
7. Покажите, при каких условиях хром реагирует с
галогенами, серой, азотом, кремнием, углем. Напишите
уравнения соответствующих реакций.
8. Покажите, каким образом можно перевести хром в
растворимое состояние.
9. Каковы физические и химические свойства оксида
и гидроксида хрома (II)? Что можно сказать об устойчи-
вости этих и других соединений хрома (II) на воздухе?
10. Каковы физические свойства оксида хрома (III)?
Каким образом его получают в лаборатории и в про-
мышленности?
11. Докажите амфотерность свойств оксида хрома (III)
с помощью уравнений соответствующих реакций в моле-
кулярной и ионно-молекулярной формах.
12. Закончите уравнения следующих окислительно-
восстановительных реакций и укажите, в каких случаях
соединения хрома (III) проявляют окислительные, а в
каких — восстановительные свойства:
1) NaCrO, + NaOH + NaClO, -* Na,CrO. + NaCl + H,O,
2) NaCrO2 + Zn + H2SO4 -*
— CrSO4 + Na2SO4 + ZnSO4 + H2O,
3) NaCrO2 + Na2CO3 + NaNO3 Na2CrO4 + CO2 + NaNO2.
13. Каковы физические свойства и способы получения
оксида хрома (VI)?
14. Покажите химические свойства хромового ангид-
рида с помощью уравнений реакций взаимодействия его
с водой, серой, фосфором, углем.
259
15. Как изменяется устойчивость, кислотно-основные
и окислительно-восстановительные свойства в следующих
схемах:
1) СгО - Сг2О3 - СгО3,
2) Сг(ОН)2 - Сг(ОН)3 - Н2СгО4.
16. Укажите состав «хромовой смеси» и объясните ее
назначение.
17. Составьте уравнения реакций, отражающие вза-
имные переходы хромат- и дихромат-ионов. Укажите
условия, необходимые для осуществления этих переходов
и окраску растворов, создаваемую присутствием хромат-
и дихромат-ионов.
18. Закончите уравнения следующих окислительно-
восстановительных реакций:
1) K2Cr2O7 + FeSO4 + H2SO4 —
-> Cr2(SO4)3 + Fe2(SO4)3 + K2SO4 + H2O,
2) K2Cr2O7 + HC1 -* KC1 + CrCl3 + Cl21 + H2O,
3) K2Cr2O7 + H2S + H2SO4 -»
- K2SO4 + S| + Cr2(SO4)3 + H2O,
4) K2Cr2O7 + CH3OH + H2SO4 -»
-* HCOOH + Cr2(SO4)3 + K2SO4 + H2O.
19. Напишите уравнения реакций, отражающие сле-
дующие превращения:
1) Cr — CrSO4 — Сг(ОН)2 — Сг(ОН)3 — Na3[Cr(OH)6],
2) Na2CrO4 -* Na2Cr2O7 -» Cr2(SO4)3 -» CrSO4 -» Cr,
3) Cr - Cr2O3 -> Cr2(SO4)3 - (NH4)2CrO4 -*
—» (NH4)2Cr2O7 —* Cr2O3 —* Cr.
20. Каково воздействие соединений хрома (VI) на орга-
низм человека?
21. Из 500 кг хромистого железняка выплавлено 120 кг
феррохрома, сплава, состоящего из 65 % хрома и 35 %
железа. Определите процентное содержание примесей в
РУДе.
Ответ: 66,4 %.
22. Имеется темно-красное кристаллическое веще-
ство А, которое ядовито. При нагревании оно разлагается,
выделяя кислород, и превращается в вещество В зеленого
260
цвета. Вещество А растворяется в воде с образованием
кислот Cj и С2, при нейтрализации которых гидрокси-
дом натрия получится соль Д желтого цвета. В резуль-
тате подкисления насыщенного раствора соли Д кон-
центрированной серной кислотой и охлаждения выде-
ляются темно-красные кристаллы А. Определите, что за
вещество А и какова масса вещества В получится из 80 г
вещества А.
Ответ: СгО3; 60,8 г Сг2О3.
23. Для производства искусственных рубинов сплав-
ляют оксид, содержащий 53 % металла А (III), с неболь-
шим количеством оксида металла В (III), который полу-
чают термическим разложением дихромата аммония.
Назовите металлы А и В.
Ответ: алюминий и хром.
24. При электролизе раствора нитрата хрома (III) на
катоде выделилось 26 г хрома. Какое вещество и в каком
количестве выделилось на аноде? Выделившийся хром со-
жгли в хлоре. К водному раствору образовавшейся соли
постепенно прилили раствор гидроксида натрия. При этом
выпавший вначале осадок полностью растворился. Рассчи-
тайте объем раствора гидроксида натрия (р = 1,400 г/мл) с
массовой долей NaOH 40 %, необходимый для растворе-
ния выпавшего вначале, осадка.
Ответ: 8,4 л О2; 35,7 мл NaOH.
25. К водному раствору, содержащему хлорид хрома
(III) массой 6,34 г, прилили раствор, содержащий суль-
фид калия массой 7,7 г. Какое вещество выпадает в оса-
док? Какова масса полученного осадка?
Ответ: Сг(ОН)3; 4,12 г.
Марганец
Вопросы и задачи
для самостоятельного решения
1. Укажите положение марганца в периодической си-
стеме элементов Д. И. Менделеева. Напишите электрон-
ную формулу атома марганца.
261
2. Какие степени окисления характерны для атома
марганца в соединениях? Приведите примеры.
3. Охарактеризуйте изменение кислотно-основных и
окислительно-восстановительных свойств соединений
марганца.
4. Опишите промышленный способ получения мар-
ганца. Покажите его физические и химические свой-
ства.
5. Напишите уравнения реакций взаимодействия мар-
ганца с неметаллами и кислотами.
6. Охарактеризуйте соединения марганца (II): оксид,
гидрооксид, соли. Напишите уравнения соответствующих
реакций.
7. Каковы химические свойства оксида марганца (IV)?
Напишите уравнения реакций, характеризующие его
окислительные свойства.
8. Приведите примеры соединений марганца (VI). На-
пишите уравнение взаимодействия манганата калия с
водой.
9. Охарактеризуйте окислительные свойства перман-
ганата калия. Приведите примеры окислительно-восста-
новительных реакций, в которых глубина восстановле-
ния перманганата калия находится в зависимости от pH
среды раствора.
10. Напишите полные уравнения реакций, отражаю-
щие следующие превращения:
КМпО4 Хх -» МпС12 Х2 МпО2
Определите неизвестные вещества.
11. Напишите уравнения реакций, соответствующие
следующей схеме:
HCl (NH.),S HNOa X.
МпО2-*Х1 -4 Х2 -»3 Х3 МпО2.
Определите неизвестные вещества.
12. Напишите уравнения реакций, соответствующие
последовательности превращений:
Mn -> Xj -> Mn(NO3)2 -» Х2 -» К2МпО4 -* Х3 -» Мп.
Определите неизвестные вещества.
13. Напишите уравнения реакций, отражающие сле-
дующие превращения:
262
14. Закончите уравнения окислительно-восстановитель-
ных реакций и укажите, в каких случаях соединения
марганца проявляют окислительные, а в каких — восста-
новительные свойства:
1) КМп04(кош0 + НС1 - С12 + ...
2) K2MnO4 + H2SO4-» S02 + ...
3) MnSO4 + PbO2 + HNO3 ->
-* HMnO4 + PbSO4 + Pb(NO3)2 + ...
4) MnO2 + H2O2 + H2SO4 -* O2 + MnSO4 + ...
t°
5) MnO2 + KC1O3 + KOH -» K2MnO4 + ...
6) KMnO4 + H2C2O4 + H2SO4 -» CO2 + MnSO4 + ...
e
7) MnS04 + KC1O3 + KOH -» K,MnO4 + KC1 + ...
' ‘k fi Л ‘k
8) KMnO4 + K2SO3 + H2O -» MnO2| + ...
9) KMnO4 + FeSO4 + H2SO4 — MnSO4 + Fe2(SO4)3 + ...
10) KMnO4 + K2SO3 + KOH -» K2MnO4 + ...
15. При прокаливании эквимолярной смеси нитрата,
оксида и фторида двухвалентного металла масса смеси
уменьшилась на 14,0 г. Определите формулы веществ и
массу исходной смеси, если массовая доля металла в ней
равна 77,2 %.
Ответ: Mn(NO3)2, MnO, MF2; масса смеси 343 г.
16. Через 273 г раствора пермангамата калия с массо-
263
вой долей КМпО410% пропустили 13,44 л (и. у.) смеси
оксида серы (IV) и азота, имеющей плотность по водороду
18,5. Вычислите массовые доли веществ в образовавшем-
ся растворе.
Ответ: 6,32 % КМпО4; 3,21 % MnSO4; 1,85 % K2SO4;
2,08% H2SO4.
17. Рассчитайте объем кислорода (н. у.), получивше-
гося при разложении 31,6 г перманганата калия.
Ответ: 2,24 л О2.
18. К смеси солей, содержащих в качестве окислителя
перманганат калия, массой 20 г, прибавили раствор кон-
центрированной соляной кислоты. Определите массовую
долю (%) перманганата калия в смеси, если при этом
выделился хлор объемом 6 л.
Ответ: 84,5 % КМпО4.
19. Какой объем концентрированной соляной кисло-
ты с массовой долей НС1 39 % и плотностью 1,2 г/мл те-
оретически необходим для взаимодействия с 0,1 моль
перманганата калия?
Ответ: 62,3 мл НС1; 5,6 л С12.
20. Подберите коэффициенты в окислительно-восста-
новительных реакциях методом электронного баланса:
1) Мп + H2SO4(KoaiK) -* MnSO4 + SO2 + ...
2) Мп + HNO3(pa36 ) - Mn(NO3)2 + NO + ...
3) Mn + HNO3(2%)-> Mn(NO3)2 + NH4NO3 + ...
4) Mn(NO3)2 —» MnO2 + NO2 + ...
5) MnCl2 + Br2 + NaOH MnO2 + NaBr + NaCl + ...
6) MnSO4 + HMnO4 + H2O — MnO2 + H2SO4
7) KMnO4 + MnSO4 + KOH -* MnO2 + K2SO4 + ...
8) K,MnO4 + C,H5OH - CH3COH + MnO, + KOH
9) MnO2 + KN03 + K2CO3-» K2MnO4 + KNO2 + CO2
10) MnSO4 + (NH4)2S2O8 + H2O — HMnO4 + H2SO4 +
+ (NH4)2SO4
21. Рассчитайте массовую долю (%) перманганата ка-
лия в техническом препарате, если при действии на 25 г
этого препарата раствором хлороводородной кислоты
264
образовались хлорид марганца (II) и такое количество
хлора, которое способно вытеснить весь йод из раствора,
содержащего иодид калия массой 83 г.
Ответ: 63,2 % КМпО4.
22. Смесь трех газов смешали в замкнутом сосуде и
взорвали. Какая кислота образовалась при этом и какова
ее массовая доля в растворе, если первый газ получен дей-
ствием хлороводородной кислоты на цинк массой 21,45 г,
второй — разложением 25,5 г нитрата натрия, а третий —
действием избытка соляной кислоты на 2,61 г оксида мар-
ганца (IV)?
Ответ: 28,85 % НС1.
23. Тонкая металлическая проволока массой 32 г, пред-
варительно нагретая, раскаляется и сгорает при опуска-
нии в колбу с неизвестным газом. Если через раствор
соли 2-валентного металла, образовавшейся в результате
сгорания, пропустить ток сероводорода, то выпадает 48 г
черного осадка. Из какого металла сделана проволока?
Рассчитайте массу оксида марганца (IV) и объем раство-
ра соляной кислоты с массовой долей 36,5 %, взятые для
получения неизвестного газа в количестве, необходимом
для полного сгорания исходной проволоки.
Ответ: Си; 43,5 г МпО2; 168 мл НС1.
24. Хлороводород, полученный сульфатным способом
из технической поваренной соли массой 400 г, использо-
вали для получения хлороводородной кислоты. При вза-
имодействии последней с оксидом марганца (IV) выде-
лился хлор, который полностью прореагировал с желе-
зом массой 44,8 г. Рассчитайте массовую долю хлорида
натрия в техническом препарате.
Ответ: 70,2 % NaCl.
25. Смесь оксида кальция и оксида марганца (IV) выде-
ляет из хлороводородной кислоты хлор объемом 4,48 л.
На восстановление этих оксидов до металлов из второй
навески той же массы расходуется водород объемом
10,08 л. Объемы газов измерены при н. у. Найдите массу
взятых навесок и массовые доли (%) оксидов смеси.
Ответ: масса навески 20,2 г; 13,86 % СаО; 86,14 %
МпО2.
Периодическая система химических элементов Д. И. Менделеева
266
ГРУППЫ ЭЛЕМЕНТОВ
I п ш IV V VI VII VIII
I 1 1 Н Водород (Н) 2 Не Гелий 40026
II 2 3 1JD Rp 5 В Бор 10311 6 С Углерод 1201115 7 N Азот 140067 8 О Кислород 159994 U F 183984 10 Ne Неон 20Д83
Литий 6339 Бериллий 90122
III 3 И Na Натрий 223898 72 Mg МаЛшй 24312 щ А1 Алюминий 263815 н Si Кремний 28086 15 Р Фосфор 309738 16 s Сера 32364 17 Cl Хлор 35.453 18 Аг Аргон 39348
IV 4 19 К Калий задог 20 Са Кальций 4ОД8 SC 21 Скандий 44356 Ti ЕЙ Титан 4730 v В Ванадий 50342 Сг и Хром 51996 Mn m Марганец 54338 Fe ЕИСо 27 Железо [Кобальт 55047 I 583332 Ni 28 Никель 58.71
5 CU 29 ** «546 Zn ES Цинк 6537 Ш Ga Галлий 6W2 3 Ge Германий 7259 33 As Мышьяк 743216 31 Se Селен 7836 35 Вг Бром 79304 36 Кг Криптон 8330
V 6 зт Rb Рубидий 85,47 38 Sr Стронций &L. Y 39 Иттрий 88305 Zr Ш Цирконий 9132 Nb Ш Ниобий 92906 Мо Щ Молибден 9534 Тс Ш Технеций [991 Ru ElRh Eai’d Щ Рутений [Родий [Палладий 10107 1 102305 1 10604
7 Ag « Серёоро 107,868 Cd « Кадмий 11240 Ш In Индий 11432 В Sn Олово 11869 В Sb Сурьма 12175 52 Те Теллур 127,60 53 J й<“* 12вдам 54 Хе Ксенон 131Д0
VI 8 « CS Цезий 132305 56 Ва Барий 13734 La* 57 Лантан 18831 Hf Ш Гафний 178,49 Та Щ Тантал 180348 W Щ Вольфрам 18335 Re Ш Рений 1862 Os fiSir rapt Осмий [Иридий [Платина 1902 1 1922 1 19509
9 Au В Золото 196367 Hg 80 Hyn’ Moss 81 Т1 Таллий . 20437 В РЬ Свинец 20719 В Bi Висмут 208580 21 Ро Полоний 1210] 85 At Астат 210 86 Rn Радон (222)
VII 10 87 Fr Франций [2251 88 Ra Радий ДИ6] АС** 89 Актиний (227] Db I'M Дуби ий 1261) Л 105 Жашотмй (262) Rf юб Резерфордий [263| Bh Ю7 Борий [262[ Нп 108 Mt 109 Ганий Мейтнерий [2651 [266)
•ЫСШИЕ ОКСИДЫ К2О RO «А ro2 R2°5 RO3 r2o7 ro4
В^СМ’ОДНЫЕ соединения Rh4 * КНз -h2r -* HR —♦
•ЛАМТЛНОИДЬ Се 58 "-“.«Л! Рг 69 ПразеодиН 14W Nd во Неодйи ,144.24 Pm 61 Прьйетей U45| Sm 62 Самарий 1S0.3; £u 63 !в роняй 151,9( Gd м Гадолиний 157,2' ГЬ 65 Тербий 158,924 Dy 66 Диспрозий 142.5 Но 67 Гольмий 0 194.930 Ег 68 Эрбий 167,21 Гт е» Тулий 168.93' Yb 70 Иттербий 173.04 Lu 71 Лютеций 174.97
"ЛКТИИОКДЫ Th » ТорИЙ шш Ра я Лротавтиний 1231] и 92 Ура В .jm.u Nd Ю НеЙТрвий - гаи Ри м ЙЛГГ<*^42| Am 95 1мермпи^43| Cm 96 К“₽** 1247] Вк 97 Берклий JL-azi Cf 9в Калмфорв» И! Es ® Эйнпггевяй J - КМ) Fm 100 Md И» No 102 Lr 103 Лоуровсий —_1Ш1
Растворимость солей, кислот и оснований в воде
ИОНЫ + H NH^ к Na Ag Hg 2+ Hg 2+ Ba 8+ Ca 2+ Mg 3* Zn 2+ Mn 2+ Sn 3+ Pb 24 Cu 24- Fe 3* Fe 3+ Al 3-k Cr 34 Bi
он- — — — M M H H H M H H H H H H
F” H M M H H M M H H M H
сг H H — M — —
Вт H H M —
Г H H H M H — —
NO? —
s?_ H H H M H H H H H H — — H
sof H H H H H H H H — H H H — — — H
sol M M H M H
col” M M H H H H H H H — H H H H H
sio;“ H — H — — H H H H H H H H H H H H —
poT“ H H H H H H H H H H H H H H H H
HCOO” M
сн^сосг M M
CnH35COO~ H H H H H H H H H H H H H H H H H
- РАСТВОРИМЫЕ M - МАЛОРАСТВОРИМЫЕ H НЕРАСТВОРИМЫЕ — — HE СУЩЕСТВУЮТ
РЯД ЭЛЕКТРООТРИЦАТЕЛЬНОСТИ: F, О, N, Cl, Br, I, S, С, Se, Р, As, Н, В, Si, Sn, Al, Li, Na, К
Таблица 1
Обозначение физических величин и их единиц
268
Величина Единица
Наименование Обозначение Наименование Обозначение Примеры записи
1 2 3 4 5
Масса вещества т килограмм кг т(Н2О) = 2,5 кг
Масса покоя частицы, атома, атомного ядра та килограмм атомная единица массы кг а. е. м. да2(О) = 26,56 • 1О'27 кг
Количество вещества V, п моль моль v(H3PO4) = 0,5 моль
Молярная масса м килограмм на моль кг/моль М(СаО) = 5610'3
Относительная атомная масса А безразмерная — АДС) = 12
Относительная молекулярная масса мг безразмерная — МДСаСОз) =100
Объем V кубический метр м3 У(СО2) = 2,3 м3
литр л Г(р-ра КОН) = 35 л
Таблица 1
Обозначение физических величин и их единиц
268 269
Величина Единица
Наименование Обозначение Наименование Обозначение Примеры записи
1 2 3 4 5
Масса вещества т килограмм кг т(Н2О) = 2,5 кг
Масса покоя частицы, атома, атомного ядра та килограмм атомная единица массы кг а. е. м. тп2(О) = 26,56 • 1О'27 кг
Количество вещества V, п моль моль v(H3PO4) = 0,5 моль
Молярная масса м килограмм на моль кг/моль М(СаО) = 56 10'3
Относительная атомная масса Аг безразмерная — АДС) = 12
Относительная молекулярная масса мг безразмерная — Мг(СаСО3) = 100
Объем V кубический метр м3 У(СО2) = 2,3 м3
литр л Г(р-ра КОН) = 35 л
1 2 3 4 5
Молярный объем vm кубический метр на моль м3/моль Ут(СО2) = 22,4 • 10“3 м3/моль
литр на моль (л/моль) Кт(О2) = 22,4 л/моль
Плотность Р килограмм на кубический метр кг/м3 p(H2SO4) = 1840 кг/м3
(грамм на кубический сантиметр) г/см3 (p(H2SO4) = 1840 г/см3)
Относительная плотность D безразмерная
а) по водороду D„ Лн(СН4) = 8
б) по воздуху ^ВОЗД Лвозд(С02) = 1,5
Число молекул N МОЛЬ в минус первой степени моль'1 jV(H2O) = з • ю23
Массовая доля (элемента в веществе, вещества в смеси) (0 безразмерная о>(С) = 0,27 или 27 % в СО2
ш(К2СО3) = 0,15 или 15 % в р-ре
Окончание таблицы 1
1 2 3 4 5
Массовая доля выхода вещества П безразмерная r|(HNO3) = 0,82, или 82 %
Объемная доля вещества <Р безразмерная <р(О2) = 0,21 или 21 % в возд.
Молярная концентрация С моль на кубический метр моль/м3 С(К2СО3) •= 0,05 моль/л
(моль на литр) (моль/л)
Нормальная концентрация сн моль•экв. на кубический метр моль • экв./м3 CH(H2SO4) = 0,1 моль • экв./л
(моль • экв. на литр) (моль • экв./л)
Молярность См моль на килограмм моль/кг CM(H2SO4/H2O) = 0,1 моль/кг
Растворимость вещества (при определенной температуре) S килограмм на кубический метр кг/м3 S(KC1) = 450 г/л (при 50 °C)
(грамм на литр) г/л
Окончание таблицы 1
270 271
1 2 3 4 5
Массовая доля выхода вещества П безразмерная T](HNO3) = 0,82, или 82 %
Объемная доля вещества <Р безразмерная <р(О2) = 0,21 или 21 % в возд.
Молярная концентрация С моль на кубический метр моль/м3 С(К2СО3) = 0,05 моль/л
(моль на литр) (моль/л)
Нормальная концентрация сн моль - экв. на кубический метр моль • экв./м3 CH(H2SO4) = 0,1 моль • экв./л
(моль • экв. на литр) (моль • экв./л)
Молярность См моль на килограмм моль/кг CM(H2SO4/H2O) = 0,1 моль/кг
Растворимость вещества (при определенной температуре) S килограмм на кубический метр кг/м3 S(KC1) = 450 г/л (при 50 °C)
(грамм на литр) г/л
1 2 3 4 5
Температура Т кельвин К Г =273,15 К
t градус Цельсия* °C 1=15 °C
Давление Р паскаль Па Р(О2)»132 кПа
атмосфера (1,01325 • 105Па) атм
Скорость химической реакции V моль на кубический метр/секунду моль/(м3 • с) V = 0,01 моль/(м3 • с)
Количество теплоты Q джоуль Дж/моль Q = 318 Дж или 0,318 кДж
Энтальпия молярная Нт джоуль на моль Дж/(моль-К) AHoep.298(SO2(r)) = = -296,9 кДж/моль
*T-t + 273.1а
Таблица 2
Взаимная связь между физическими величинами
Величина Уравнения связи
1 2
Масса (т) т = т0 No, т = V • г, т = v • М, V N т = М ——, т = М • —т = с • М • V Vm NA
Количество вещества (v) т V No Q М Vm’ NA’ Qm
Объем (V) V^—, V~vVm, v=vm-—, v=vm- — p m mM na
Число единиц (No) m mN M)= — - No = V • Na, N0-Na • —- N0-Na • — "Л) IVl V m
Масса частицы («о) m M 1 m° = ~N^’ m° = N\’ = mo(c)
Молярный объем (Ут) V M MN. V , V = , V = V , V = V m v m p m m m No
Молярная масса (М) M = “7“’ M = ’ P’ M = m0 • Na, V N. M~mQ- M = m0-
Относитель- ная молеку- лярная масса (Afr) Mr = VI Mr= 2 ' Dh < T V12 т0(С) r H* M = 29 • Г В03Д.
272
Окончание таблицы 2
1 2
Относитель- ная плотность (О) Р(Н2) = -^, р2 Mr(2) v 2' МГ(Н2) м °возд. ~ 29 •
Число Авогадро «Д-Л Wa.«_, Wa.«0."_, v т0 т
Массовая доля вещества в растворе (w) ти(в-ва) w = ; тп(р-ра) тп(р-ра) = ти(в-ва) + иг(Н2О) m(p-pa) = V- р иг(в-ва) т(в-ва) W = 9 w = ?п(в-ва) + тп(Н2О) Vp
Массовая доля элемента в веществе (w) т(элемента) и> ; т(элемента) = п Аг; тц(в-ва) п • A. w М. w — п — МГ Аг
Молярная концентра- ция (с) v т т w : v = 1 : => с . F(p-pa) М M-V т Ир-ра) —; т = с • М • V с • М
Молярная концентра- ция эквивалента (Сэ) Сэ= F(p-pa)’ (X) Сэ = —v = —-, С = ~- Z ; э z-V 9 М M-V где п — количество вещества, г — эквивалентность
273
Таблица 3
Название солей наиболее часто встречающихся кислот
(по международной номенклатуре)
Название кислоты Формула Название соли
Азотистая hno2 нитрит
Азотная HNO3 нитрат
Вромоводородная НВг бромид
Иодоводородная HJ иодид
Кремневая H2SiO3 силикат
Марганцовая НМпО4 перманганат
Серная H2SO4 сульфат
Сернистая Н28О3 сульфит
Сероводородная h2s сульфид
Тиосерная H2S2O3 тиосульфат
Угольная Н2СО3 карбонат
Уксусная СН3СООН ацетат
Фосфорная Н3РО4 фосфат
Фтороводородная HF фторид
Хлороводородная НС1 хлорид
Хлорноватистая нею гипохлорит
Хлористая НС1О2 хлорит
Хлорноватая нсю3 хлорат
Хлорная НС1О4 перхлорат
Хромовая Н2СгО4 хромат
Двухромовая Н2Сг2О7 дихромат
Циановодородная HCN цианид
274
Таблица 4
Технические названия некоторых веществ
Название Химический состав или формула
1 2
Аммиачная вода, нашатырный спирт 25%-ный водный раствор аммиака
Бертолетова соль КС1О3
Бура Na2B4O7
Боксит Д12О3 • пН2О
Известь белильная (или хлорная) СаОС12
Известь гашеная Са(ОН)2
Известь негашеная СаО
Царская водка Смесь трех объемов концентрированной НС1 с одним объемом концентрированной HNO3
Горькая соль MgSO4 • 7Н2О
Квасцы хромовокалиевые K2SO4 • Сг2(ЗО4)з • 24Н2О
Гипс CaSO4 • 2Н2О
Глауберова соль Na2SO4 • 10Н2О
Жавелевая вода Раствор КС1 и КОС1 в воде
Каломель Hg2Cl2
Карборунд SiC
Купорос медный CuSO4•5Н2О
Купорос железный FeSO4 • 7Н2О
Криолит 3NaF • A1F3
Кровяная соль желтая K4[Fe(CN)e]
275
Окончание таблицы 4
1 2
Кровяная соль красная K3[Fe(CN)6]
Ляпис AgNO3
Нашатырь NH4C1
Пергидроль 30 % -ный раствор Н2О2
Плавиковая кислота 40 % -ный водный раствор HF
Поташ к2со3
Преципитат СаНРО4 • 2Н2О
Сода питьевая NaHCO3
Сода кальцинированная Na2CO3 • ЮН20
Сода кристаллическая NaOH
Сода каустическая HgCl2
Хромпик калийный K2Cr2O7
Хромистый железняк Fe(CrO2)2
Асбест 3MgO • 2SiO2 • 2H2O
Каолин A12O3 • 2SiO2 • 2H2O
Малахит Cu2(OH)2CO3
Кварц SiO2
Хромовая смесь Раствор К2Сг2О7 в концентри- рованной H2SO4
Сухой лед СО2 в твердом состоянии
Олеум Раствор SO3 в концентрированной H2SO4
Апатиты Ca5[(PO4)3]F
Цементит Fe3C
276
Таблица 5
Распространенность химических элементов в природе
Список литературы
1. Кузьменко Н. Е., Еремин В. В., Попков В. А Начала
химии. Современный курс для поступающих в вузы. — М.:
Федеративная Книготорговая Компания, 1998. — Т. 1, 2.
2. Хомченко Г. П. Химия для поступающих в вузы. —
М.: Высшая школа, 1998.
3. Хомченко Г. П., Хомченко И. Г. Задачи по химии
для поступающих в вузы. — М.: Высшая школа, 1997.
4. Бровко М. И., Волович П.М. Готовимся к экзамену
по химии. — М.: Рольф, 1997.
5. Демахин А Г., Кракова А И., Куриленко. Пособие
по химии для слушателей подготовительного отделения. —
Саратов: Изд-во Саратовского университета, 1988. —
Ч. 1,2.
Содержание
Предисловие......................................... 3
Программа для поступающих в вузы....................3
1. Общая химия..................................3
2. Неорганическая химия ........................6
1. Предмет и задачи химии ......................... 10
Значение химии для народного хозяйства........... 11
Химия и охрана окружающей среды.................. 12
2. Простейшие химические расчеты.
Основные понятия и законы химии.....................14
Химическая символика..............................14
Химические расчеты............................... 14
Задачи для самостоятельного решения............25
Атомно-молекулярное учение в химии................27
Основные понятия химии........................... 29
Вопросы и задачи для самостоятельного решения .34
Законы химии
Общие законы...................................36
Газовые законы ................................43
Определение молекулярных масс газов и паров...... 51
Вопросы и задачи для самостоятельного решения .53
Явления физические и химические. Смеси и химические
соединения........................................57
Вопросы и задачи для самостоятельного решения..60
Классификация химических реакций. Тепловой эффект
химической реакции.............................. 65
Вопросы и задачи для самостоятельного решения..70
3. Химическая реакция............................ 72
Скорость химических реакций ......................72
Вопросы и задачи для самостоятельного решения ..... 80
Обратимость химических реакций. Химическое равновесие 82
Вопросы и задачи для самостоятельного решения .85
4. Строение атома и периодический закон Д. И. Менделеева 89
Основные этапы развития теории строения атома..... 89
Вопросы для самостоятельного решения................... 93
Электронная конфигурация атомов....................94
Вопросы и задачи для самостоятельного решения ..... 97
Строение атомных ядер. Ядерные реакции............99
Вопросы и задачи для самостоятельного решения ... 104
279
Периодический закон и периодическая система
Д. И. Менделеева в свете учения о строении атома. 106
Вопросы и задачи для самостоятельного решения ... 109
5. Химическая связь и строение молекул............. 112
Основные понятия химической связи ............... 112
Ковалентная связь................................ 113
Ионная связь .................................... 115
Металлическая связь............................ 116
Понятие о водородной и межмолекулярной связях.... 117
Вопросы и упражнения для самостоятельного решения .119
6. Растворы........................................ 122
Общая характеристика растворов................... 122
Концентрация растворенного вещества.............. 124
Вопросы и задачи для самостоятельного решения ... 135
Химическая теория растворов Д. И. Менделеева. Тепловой
эффект процесса растворения ..................... 139
Растворимость веществ............................ 141
Вопросы и задачи для самостоятельного решения ... 146
Электролитическая диссоциация. Ионное произведение
воды........................................... 147
Ионно-молекулярные уравнения реакции............. 152
Гидролиз солей................................... 154
Вопросы и задачи для самостоятельного решения ... 159
7. Окислительно-восстановительные реакции.......... 163
Степень окисления................................ 163
Окислительно-восстановительные реакции
и их классификация .............................. 164
Составление уравнений окислительно-восстановительных
реакций......................................... 166
Вопросы и задачи для самостоятельного решения ... 170
8. Электролиз.................................. 178
Вопросы и задачи для самостоятельного решения ... 191
9. Классификация неорганических веществ............ 194
Оксиды....................................... 194
280
Способы получения оксидов................... 196
Вопросы и задачи для самостоятельного решения ... 197
Основания ..................................... 199
Способы получения оснований................. 200
Вопросы и задачи для самостоятельного решения ... 201
Кислоты........................................ 203
Способы получения кислот.................... 204
Вопросы и задачи для самостоятельного решения ... 205
Соли........................................... 207
Способы получения солей .................... 210
Вопросы и задачи для самостоятельного решения ... 211
10. Неметаллы ................................... 214
Вопросы и задачи для самостоятельного решения ... 215
Водород. Вода.................................. 216
Вопросы и задачи для самостоятельного решения ... 216
Галогены....................................... 221
Вопросы и задачи для самостоятельного решения ... 221
Кислород. Озон .............................. 225
Вопросы и задачи для самостоятельного решения ... 225
Сера......................................... 227
Вопросы и задачи для самостоятельного решения ... 227
Азот........................................... 230
Вопросы и задачи для самостоятельного решения ... 230
Фосфор...................................... 233
Вопросы и задачи для самостоятельного решения ... 233
Углерод...................................... 236
Вопросы и задачи для самостоятельного решения ... 236
Кремний...................................... 240
Вопросы и задачи для самостоятельного решения ... 240
11. Металлы...................................... 242
Общая характеристика металлов.................. 242
Химические свойства металлов................... 243
Способы получения металлов.................. 244
Вопросы и задачи для самостоятельного решения ... 245
Щелочные металлы............................... 247
Вопросы и задачи для самостоятельного решения ... 247
Щелочноземельные металлы. Кальций.............. 250
Вопросы и задачи для самостоятельного решения ... 250
Алюминий....................................... 252
Вопросы и задачи для самостоятельного решения ... 252
281
Железо......................................... 255
Вопросы и задачи для самостоятельного решения ... 255
Хром ........................................ 258
Вопросы и задачи для самостоятельного решения ... 258
Марганец........................................ 261
Вопросы и задачи для самостоятельного решения ... 261
Периодическая система химических элементов
Д. И. Менделеева............................ 266
Растворимость солей,кислот и оснований в воде..... 267
Обозначение физических величин и их единиц ....... 268
Взаимная связь между физическими величинами....... 272
Название солей наиболее часто встречающихся кислот
(по международной номенклатуре)................. 274
Технические названия некоторых веществ........... 275
Распространенность химических элементов в природе.. 277
Список литературы .............................. 278
Учебное пособие
Тамара Михайловна Варламова
Анна Исидоровна Кракова
ОБЩАЯ И НЕОРГАНИЧЕСКАЯ ХИМИЯ:
БАЗОВЫЙ КУРС