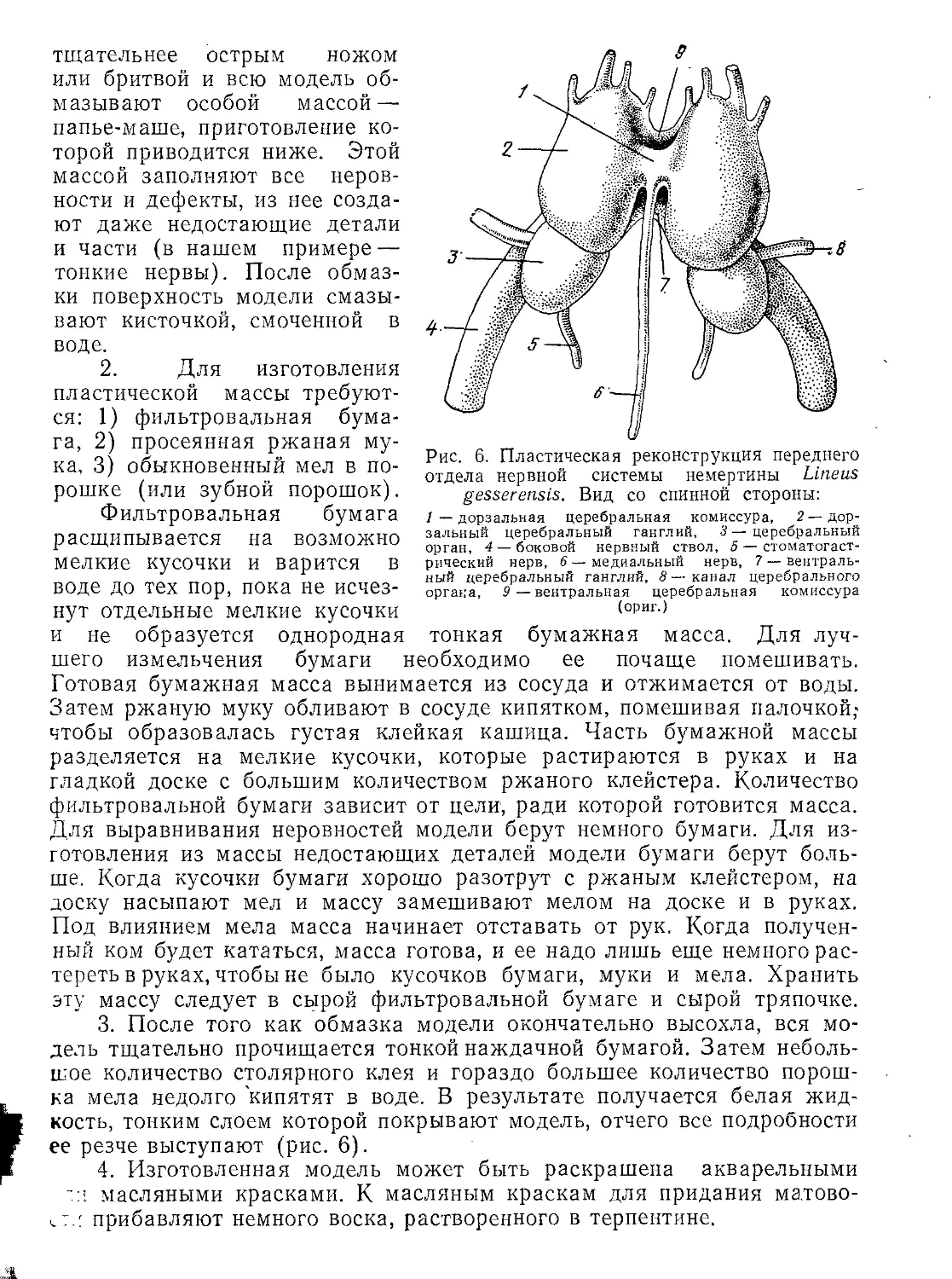
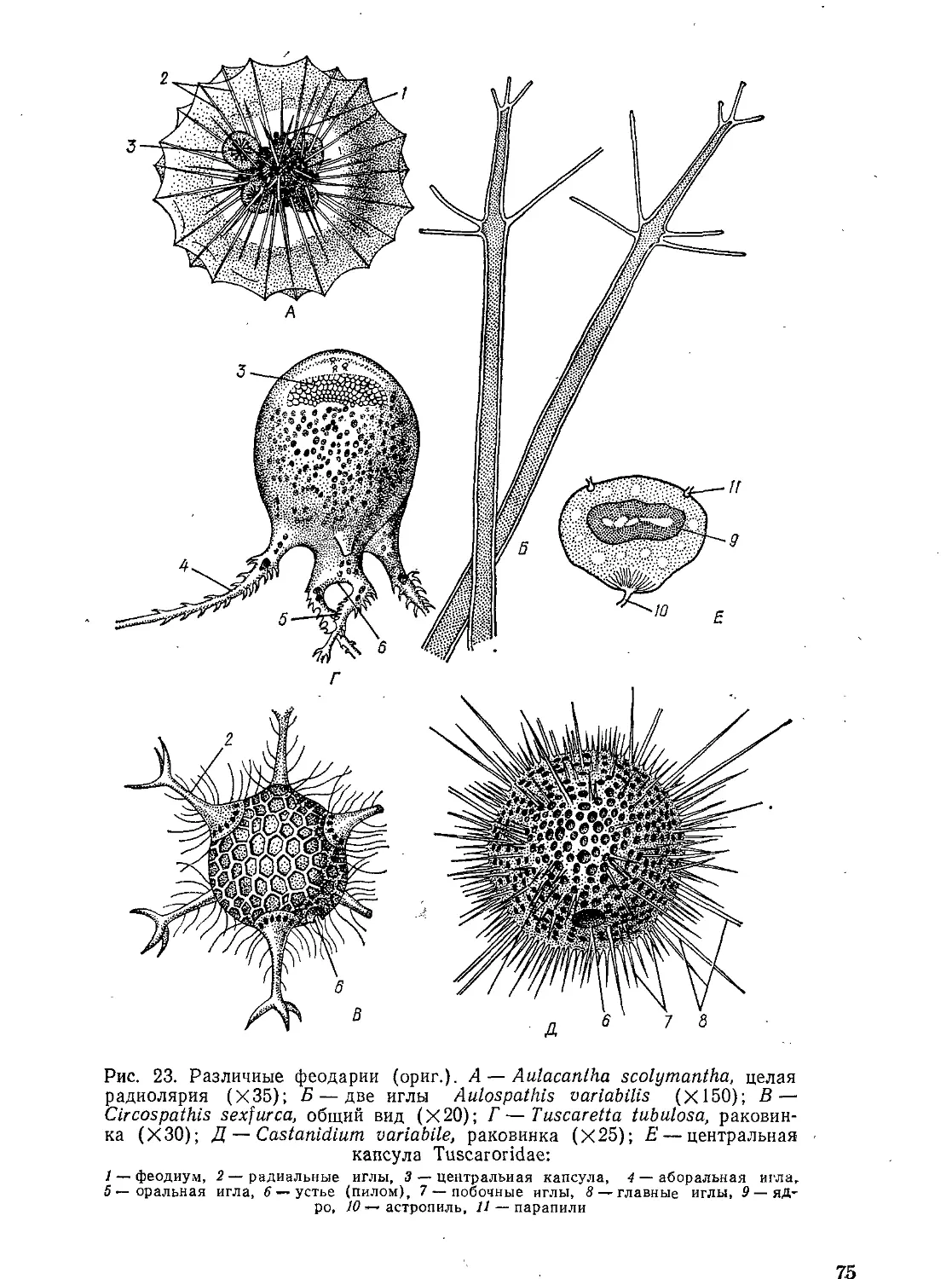
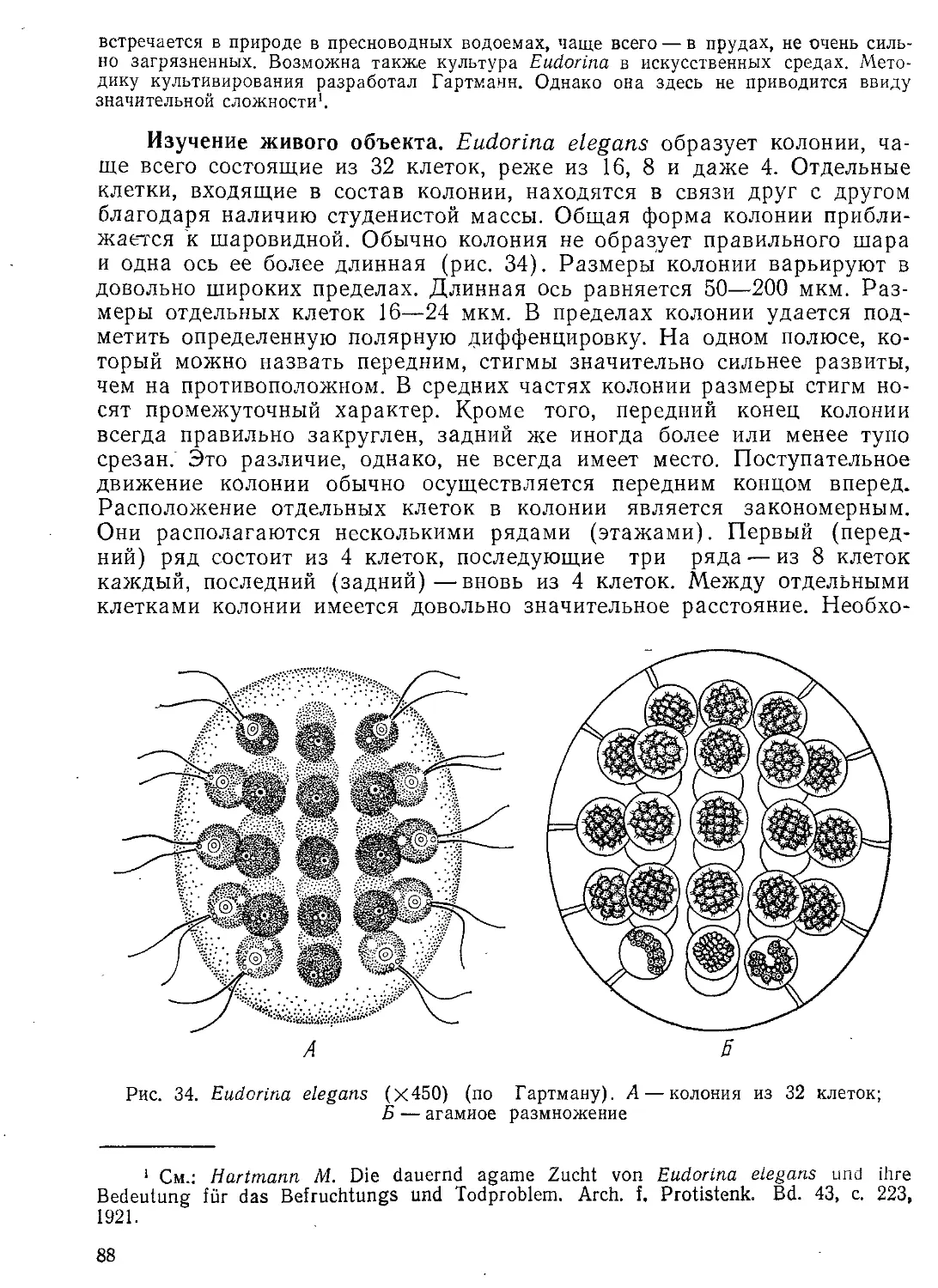
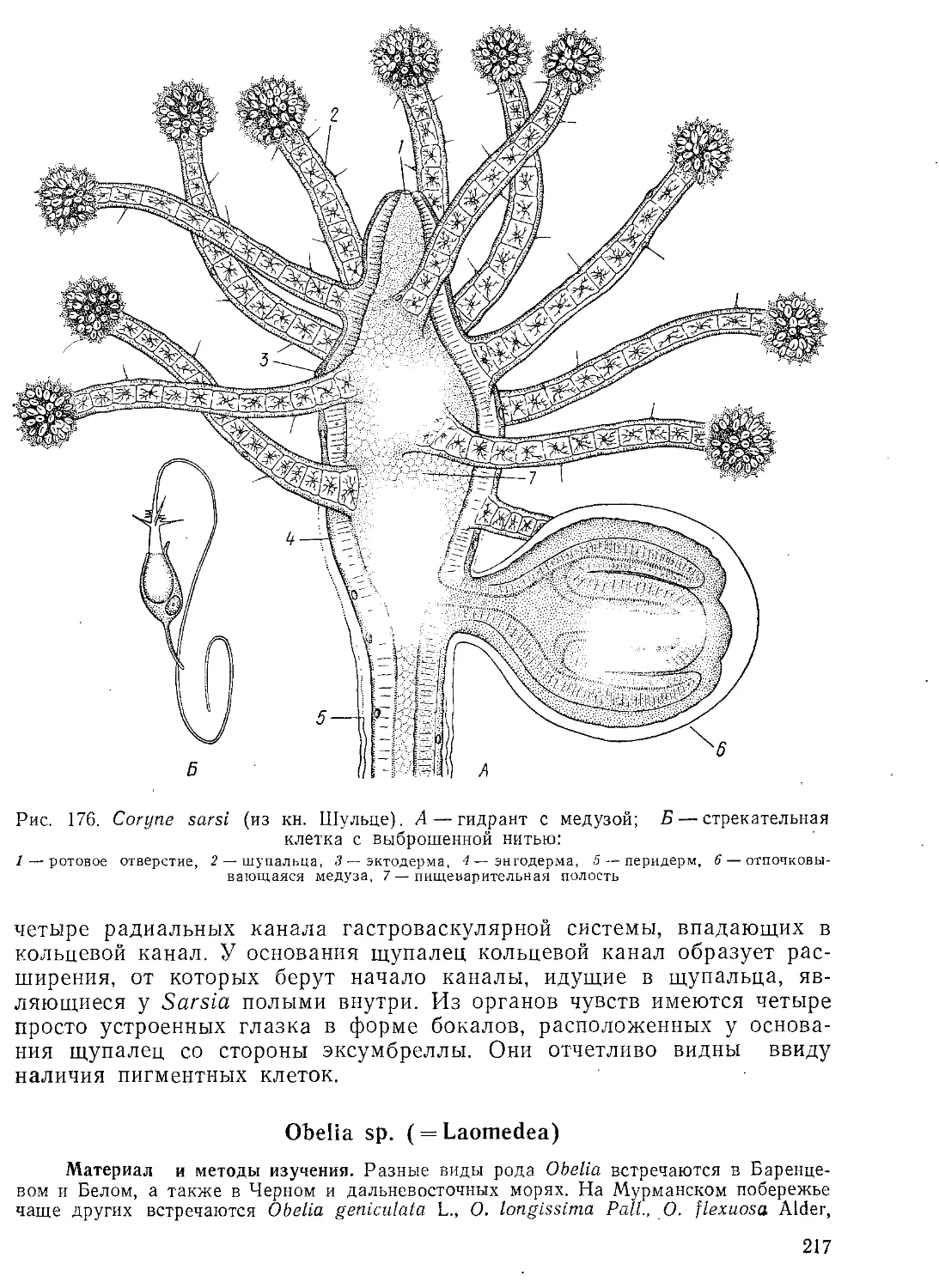
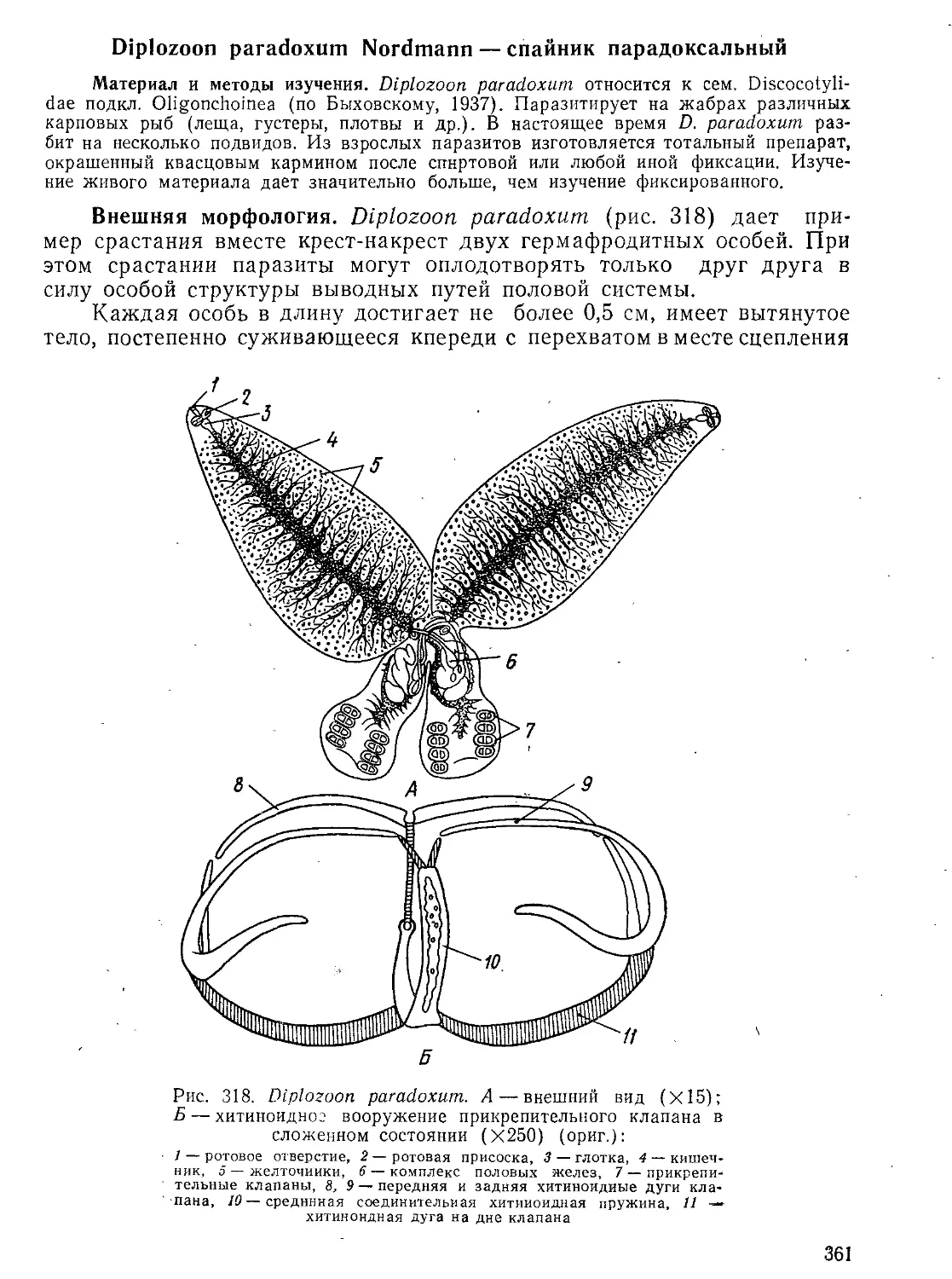
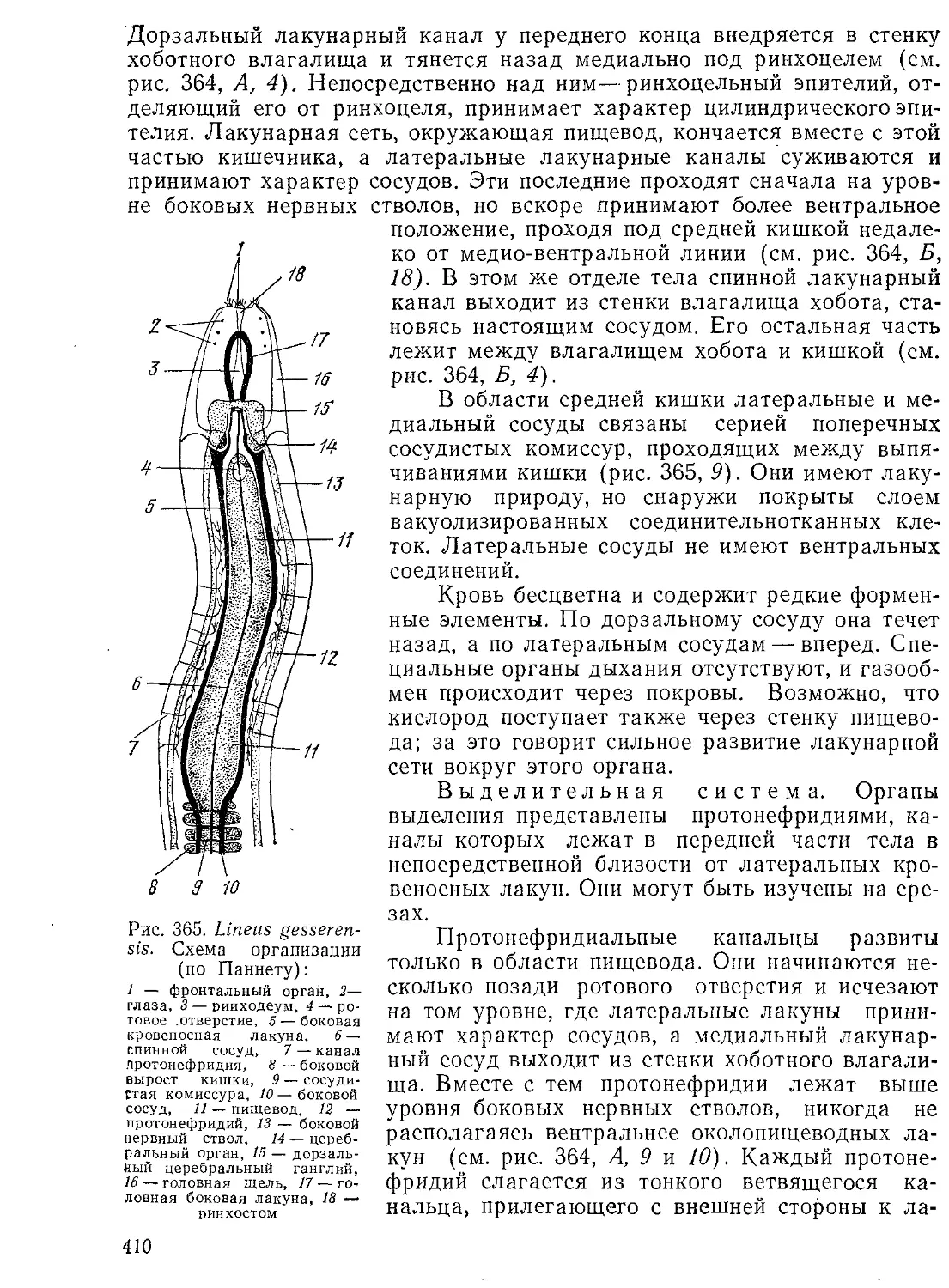
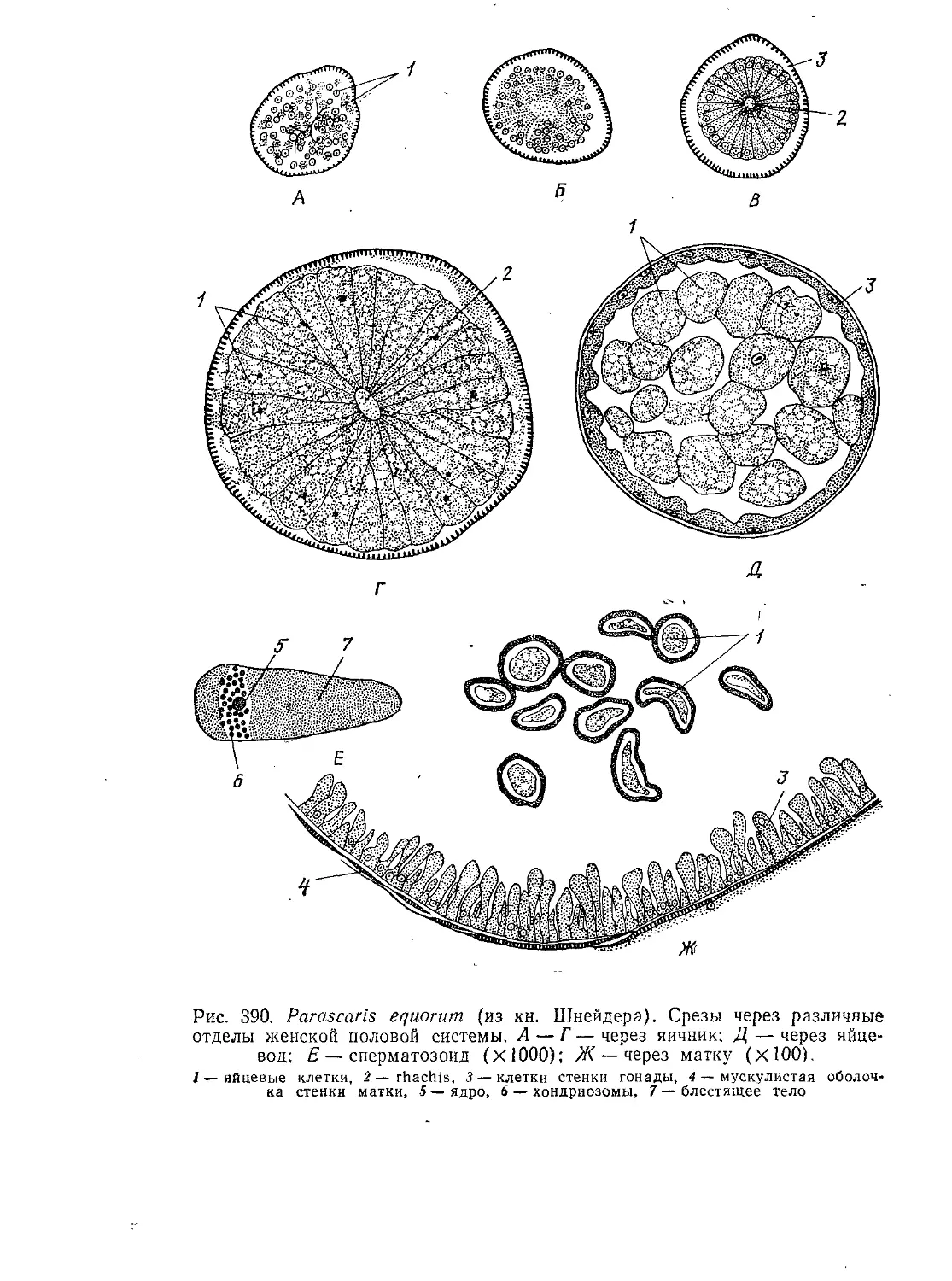
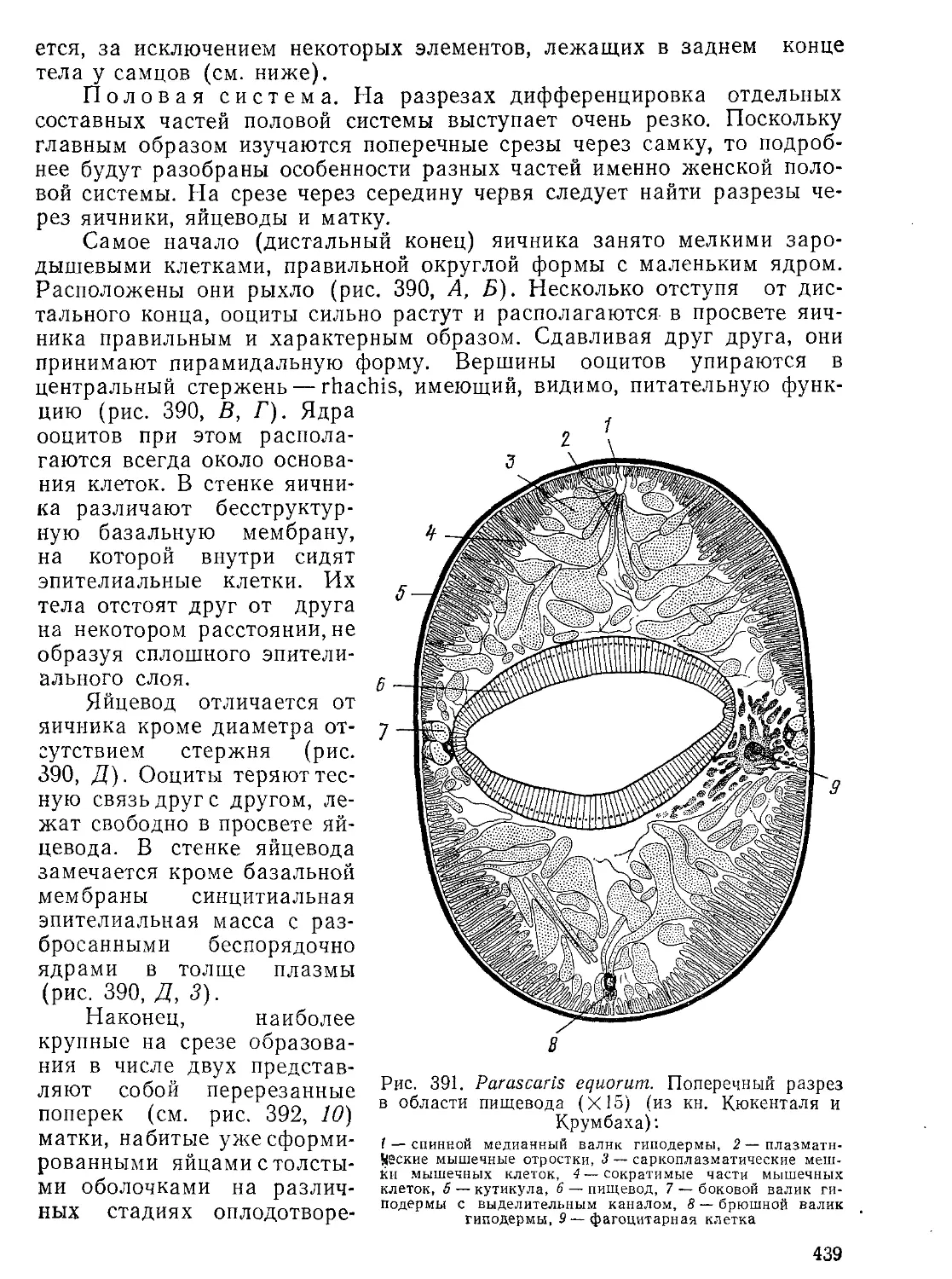
Автор: Стрелков А.А. Полянский Ю.И. Иванов А.В.
Теги: систематика животных специальные зоологические науки биология зоология
Год: 1981
Текст
А.В. Иванов, Ю. И. Полянский, А.А.Стрелков
Большой практикум по зоологии беспозвоночных
ПРОСТЕЙШИЕ, ГУБКИ, КИШЕЧНОПОЛОСТНЫЕ, ГРЕБНЕВИКИ, ПЛОСКИЕ ЧЕРВИ, НЕМЕРТИНЫ, КРУГЛЫЕ ЧЕРВИ
Издание третье, переработанное и дополненное
Допущено Министерством высшего и среднего специального образования СССР в качестве учебного пособия для студентов биологических специальностей университетов
МОСКВА < ВЫСШАЯ ШКОЛА? I98J
ББК 28.691 И21
Рецензенты:
Кафедра зоологии беспозвоночных Киевского университета (акад. АН УССР А. П. Маркевич и проф. Б. Н. Мазурмович); проф. В. И. Здун (зав. кафедрой зоологии Львовского университета)
Иванов А. В., Полянский Ю. И., Стрелков А. А.
И21 Большой практикум по зоологии беспозвоночных. Простейшие, губки, кишечнополостные, гребневики, плоские черви, немертины, круглые черви: Учеб, пособие для биолог, спец, ун-тов. — 3-е изд., перераб. и доп. — М.: Высш, школа, 1981.— 504 с., ил.
В пер.: 1 р. 80 к.
Книга — первый том трехтомного руководства к специализированному студенческому лабораторному практикуму по зоологии беспозвоночных животных.
Руководство знакомит с отдельными объектами, изучаемыми на большом практикуме. Все описание составлено по одному плану: название объекта и его положение в системе, методы изучения, наблюдения на живом объекте, внешняя морфология, вскрытие, изучение тотальных препаратов и срезов. Объекты подобраны таким образом, чтобы они были по возможности доступны.
21008—360
И ----—------ 62—81 2005000000 ББК 28.691
001(01)—81 592
© Издательство «Высшая школа», 1981
ПРЕДИСЛОВИЕ К ТРЕТЬЕМУ ИЗДАНИЮ
Третье издание «Большого практикума по зоологии беспозвоночных» представлено в трех частях, хотя объем книги остается прежним В первой книге наряду с вводной частью приведено описание простейших, губок, кишечнополостных, гребневиков, плоских червей, немертин, круглых червей; во вторую книгу войдут кольчатые черви и членистоногие; в третью — щупальцевые, моллюски, иглокожие.
Книга рассчитана не столько на обычные практические занятия по курсу зоологии беспозвоночных, сколько на расширенный специальный «большой» практикум, который в основном строится на самостоятельной работе студентов в природе и в лаборатории. «Большой практикум» должен способствовать подготовке молодых специалистов-зоологов к исследовательской работе, а также будет служить студентам подготовительной ступенью к дипломной работе. Поэтому особенно важно при проработке практикума наряду с данной книгой пользоваться специальной литературой, списки которой приведены в конце ее. Предполагается, что студент, проходящий большой практикум, владеет не только русским, но и иностранным языком. Важная сторона работы — овладение основными методиками зоологического исследования. Однако несмотря на наличие большого количества специальных руководств по микроскопической технике, мы сочли необходимым в настоящей книге привести основные методики, которыми приходится пользоваться зоологу в практической исследовательской работе. Одни методы излагаются в вводной части, другие, более специальные, при рассмотрении отдельных групп. В число методов включены также методики реконструкций по срезам и инъекций, нередко незаслуженно забываемые, а по существу очень важные для зоолога.
Материал данной книги ограничивается светооптическими методами изучения и совсем не затрагивает электронную микроскопию. Практикум по ультраструктуре беспозвоночных требует специального изложения и овладения методиками, что должно найти место в специальном руководстве. Вкрапливать же отдельные данные по ультраструктуре в зоологический практикум представляется нам нецелесообразным.
По сравнению со вторым изданием, вышедшим в 1958 г., книга подверглась переработке в соответствии с развитием науки. Несколько изменена микроскопическая техника: устранен ряд устаревших методов, введены более современные, в том числе некоторые простейшие цитохимические методики. Излагаются современные методики импрегна
ции простейших серебром и др. Значительно переработана система жи вотного мира в соответствии с современными представлениями. Осс бенно значительной переработке подверглась глава, посвященная прос тейшим, некоторые разделы которой написаны заново.
Авторы учли с благодарностью критические замечания, сделанны многими зоологами по второму изданию практикума.
В первой книге работа между авторами распределилась следую щим образом: А. В. Ивановым написаны главы: Техника вскрытиг инъекций и реконструкций, Рисование, Немертины и Приапулиды Ю. И. Полянским: Введение (о постановке практикума по зоологи; беспозвоночных, микроскопическая техника), Жгутиконосцы, Инфузо рии (частично), Споровики, Миксоспоридии, Микроспоридии, Кишечнс полостные, гребневики, коловратки; А. А. Стрелковым: Саркодовые Инфузории (частично), Губки, Плоские черви, Нематоды, Скребни, Во лосатики. В связи с безвременной кончиной А. А. Стрелкова редакти рование и доработка написанных им глав осуществлены А. В. Ивано вым и Ю. И. Полянским.
Настоящее руководство создано на кафедре зоологии беспозвоноч ных Ленинградского государственного университета им. А. А. Жданов; по совету профессора Валентина Александровича Догеля (1882—1955) учениками которого являются авторы книги.
Проф. А. В. Иванов проф. Ю. И. Полянские
ВВЕДЕНИЕ
О постановке практикума по зоологии беспозвоночных
Прохождение курса зоологии невозможно без соответствующего практикума. Параллельно с теоретическим изучением той или иной группы животных по учебнику совершенно необходимы практические занятия, на которых происходит конкретное знакомство с объектами изучения. Поэтому в любом вузовском курсе на долю практических занятий отводится примерно столько же времени, сколько и на лекции. На практических занятиях студенты не только знакомятся с отдельными объектами, но также приобретают навыки вскрытия животных, изготовления простейших препаратов, микроскопического исследования и т. п.
В нашей учебной литературе наряду с теоретическими курсами (проф. В. А. Догеля, коллектива авторов под ред. проф. Б. С. Матвеева, проф. В. Ф. Натали, проф. С. В. Аверинцева) имеются вполне удовлетворительные руководства для практических занятий по зоологии (проф. С. В. Аверинцева, акад. Е. Н. Павловского, А. Л. Зеликмана и др.), которые дают конкретный фактический материал, методические и технические указания к их организации.
В настоящей книге преподаватель вуза и студент также найдут материал для постановки групповых практических занятий по курсу зоологии беспозвоночных.
Однако авторы настоящего руководства ставили перед собой еще и другую задачу. В большинстве университетов, где имеются биологические факультеты, и в некоторых педагогических институтах наряду с групповыми практическими занятиями, идущими параллельно с лекционным курсом, существует расширенный «большой практикум» по зоологии беспозвоночных. Он строится на базе уже проработанного общего курса, имеет целью дальнейшее углубление знаний и навыков и служит как бы переходной ступенью к исследовательской работе в области зоологии.
Аспиранты-зоологи во многих вузах в течение первого года аспирантуры также проходят большой практикум, являющийся для них подготовкой к кандидатскому экзамену. В деле подготовки научной смены в области зоологии прохождение расширенного практикума чрезвычайно важно и необходимо. Между тем соответствующих руководств в нашей учебной литературе совсем нет, отсутствуют они и за границей.
Настоящая книга и имеет целью служить практическим руководством при прохождении расширенного практикума.
Большой практикум по зоологии беспозвоночных в той форме, в которой он проводится в Ленинградском государственном университете и в некоторых других вузах, представляет собой индивидуальные занятия студентов. Помощь преподавателя носит характер периодических консультаций и проверки выполненных работ. Каждый занимающийся имеет индивидуальное рабочее место и индивидуальный план прохождения практикума. Самый разбор и изучение объектов совершается не на основе объяснений преподавателя, а в результате самостоятельного изучения литературы.
Прохождение большого практикума прежде всего чрезвычайно расширяет круг знаний занимающегося зоологией. Предлагаемая книга должна помочь разобраться в строении отдельных зоологических объектов и указать методы изучения их. Но она ни в коем случае не должна быть единственным руководством при прохождении практикума. Параллельно с практической работой необходимо изучение литературы. Списки основных работ по каждой группе животных приведены в конце книги. Без знакомства хотя бы с основными работами прохождение большого практикума не достигает цели. Одна из задач руководителя— стимулировать занимающегося к самостоятельному чтению, просматривать его конспекты, разъяснять непонятные места и т. п.
Весьма желательно при изучении литературы пользоваться не только русскими, но и иностранными источниками. При прохождении большого практикума, сопровождающегося систематическим чтением литературы, относительно легко приобрести навыки чтения специальных текстов, что явится совершенно необходимым особенно для тех, кто предполагает заниматься исследовательской работой в области зоологии. Практика показывает, что сначала чтение иностранных источников идет медленно, но при настойчивости со стороны занимающегося относительно быстро удается достигнуть хороших результатов.
Прохождение большого практикума способствует овладению навыками исследовательской работы.
Большинство препаратов при правильной постановке дела изготовляется самим занимающимся. Этим достигается основательное знание микроскопической техники и умение применять ее в различные конкретных случаях. Наряду с навыками морфологического исследования при прохождении практикума приобретаются и некоторые навыкг экспериментальной работы, так как при изучении ряда групп животных необходима постановка экспериментов (например, при изученш жизненных циклов некоторых Sporozoa, червей и др.). По ходу проработки большого практикума приобретается также умение производит! зарисовку анатомических и микроскопических препаратов, что очеш важно и для исследовательской работы. Следует подчеркнуть, что руководителю необходимо добиться того, чтобы занимающиеся зарисовыва ли изучаемые объекты. Ссылки на неумение рисовать, которые чаете приходится слышать от приступающего к практикуму, совершенно не основательны. Речь идет не о художественном, а по существу о техни ческом рисунке, для которого не требуется никаких особых художест
венных способностей. Научиться рисовать так, как это нужно зоологу для работы, может всякий. Ниже даются некоторые практические указания по технике рисования зоологических объектов.
Кроме зарисовки каждый работающий над зоологическим практикумом должен научиться фотографировать микроскопические объекты. Однако фотосъемка отнюдь не заменяет собой рисования, а должна сочетаться с ним, ибо в процессе зарисовки изучается объект. На технике фотосъемки в этой книге мы не останавливаемся, так как она излагается в ряде специальных руководств.
Прохождение большого практикума по зоологии приводит также к расширению общебиологических горизонтов занимающегося. Дело в том, что детальное изучение 'той или иной группы животных обычно бывает связано с тем или иным кругом общих вопросов. Так, например, изучение Hydrozoa заставляет углубиться в вопросы чередования поколений, в частности метагенеза, факторов, его определяющих. Знакомство с коловратками выдвигает проблему чередования поколений при партеногенезе, проблему постоянства клеточного состава. Изучение плоских червей — ряд проблем общепаразитологического характера и т. п. При прохождении практикума не следует, разумеется, обходить все эти проблемы и ограничиваться только морфологическими и систематическими данными. Это опять-таки приводит к необходимости углубленного изучения специальной литературы.
Прохождение полностью большого практикума, охватывающего все группы беспозвоночных, требует значительного промежутка времени. При систематической работе он занимает от двух до двух с половиной лет (учитывая другие формы академических занятий студентов). Очень часто в распоряжении занимающегося имеется меньший срок. Как следует тогда строить прохождение практикума? Нужно ли пропорционально уменьшить глубину проработки всех типов и классов или же идти по линии уменьшения числа изучаемых групп, не снижая уровня?
Нам кажется более правильным второй путь. Дело в том, что поскольку практикум преследует цель не только расширения формальных знаний, но в такой же степени и развития ряда навыков (чтение специальной литературы, техника лабораторного исследования и др.),вторая цель не может быть достигнута при ускоренном прохождении практикума.
Наконец, отметим еще одну особенность большого практикума. Для изучения ряда групп животных необходим во многих случаях живой материал. Это в свою очередь придает .известный сезонный характер изучению различных групп. Учитывать этот, момент очень важно при составлении индивидуального плана каждого занимающегося.
Так как расширенный практикум строится на базе уже проработанного вузовского курса, то в отдельных случаях вполне допустимо отступление от систематического порядка с учетом реальных возможностей добывания материала. Указываемые в практикуме морские объекты рассчитаны в основном на фауну Баренцева и Белого морей, на которых имеются академические и университетские биологические станции.
Прохождение практикума связано с освоением технических приемов изучения зоологических объектов. Поэтому прежде чем перейти к систематическому обзору беспозвоночных, остановимся на основных приемах и технике работы по зоологии.
Микроскопическая техника
Изучение живых объектов
При изучении с помощью микроскопа различных зоологических объектов следует рекомендовать всюду, где это возможно, прибегать к исследованию живого материала. В ряде случаев изучение in vivo является основным методом. Это относится в первую очередь ко многим простейшим, коловраткам, низшим ракообразным и т. п. Мелкие животные рассматриваются целиком. У более крупных возможно изучение отдельных изолированных органов,
При исследовании живых объектов особенно важно подобрать не только увеличение, но и соответствующее освещение. Живые ткани многих животных прозрачны и отдельные компоненты их относительно мало отличаются друг от друга по коэффициенту светопреломления. Поэтому в ярком проходящем свете ряд деталей строения не может быть рассмотрен. Обычно приходится несколько затемнять поле зрения. Последнее достигается двумя путями: уменьшением диаметра диафрагмы и опусканием осветителя. При этом резкость изображения возрастает. Иногда приходится прибегать к изучению живого объекта не при проходящем, а при падающем свете. Очень большую помощь при изучении мелких объектов оказывает фазо-контрастная установка, выпущенная в последнее время советской оптической промышленностью.
Для микроскопического исследования объекты помещаются по возможности в ту же среду, в которой они живут. Чаще всего это пресная или морская вода. Для паразитов — содержимое того органа (например, кишечника), где они паразитируют. Для изолированных органов, а также для паразитов применяется физиологический раствор NaCl (для беспозвоночных следует брать NaCl 0,6%-ный) и раствор Рингера. Последний имеет следующий состав: дистиллированной воды 100 см3, NaCl 0,85 г, КО 0,025 г, СаСК 0,03 г. Хлористый кальций растворяется последним, так как в противном случае выпадает осадок. Жидкость Рингера представляет собой эквилибрированный раствор, и в нем изолированные органы, а также паразиты выживают гораздо дольше, чем в растворе NaCl.
Серьезным препятствием при изучении многих объектов in vivo является их подвижность (инфузории, коловратки и др.). Для преодоления этого можно прибегнуть к различным методам. Наиболее обычным является осторожное придавливание объекта между покровным и предметным стеклом, что достигается путем отсасывания жидкости фильтровальной бумагой. К удовлетворительным результатам приводит также (особенно для инфузорий) следующий прием: на предметном стекле в капле жидкости с изучаемым объектом препаровальными иглами расщипывается на отдельные волоконца маленький кусочек гигроскопи
ческой ваты, после чего препарат покрывается покровным стеклом. Благодаря тигмотаксису мелкие животные как бы «прилипают» к волокнам ваты, оставаясь некоторое время неподвижными или мало подвижными.
Для замедления движения инфузорий и других мелких двигающихся при помощи ресничек животных можно также рекомендовать перенести их в каплю раствора вишневого клея или чистого гуммиарабика. Раствор не должен быть очень густым. В вязкой среде движения животного замедляются. Неудобство данного метода заключается. в том, что при этом нередко происходит значительная деформация тела.
Наконец, в некоторых случаях, главным образом для водных животных, прибегают к анестезии, которая достигается разными способами. Она служит не только для изучения объекта in vivo, но часто предшествует его фиксированию.
Анестезия для простейших применима в относительно редких случаях ввиду их большой чувствительности к различным реактивам. Чаще она используется при изучении таких объектов, как коловратки, мшанки и др. Укажем следующие методы анестезии. Анестезия высокой температурой применяется к некоторым простейшим (Stentor, сувойки и др.). Объект осторожно нагревается до температуры 30—35°С. При этом движение прекращается, но разрушения еще не происходит. Малейший перегрев вызывает гибель организма и распад клетки.
Среди различных анестезирующих веществ можно рекомендовать применение хлоралгидрата, сернокислого магния MgSO?,, слабых растворов спирта (10—15%). Если анестезируются относительно крупные объекты (например, мшанки), то поступают следующим образом. Объект помещают в небольшой сосуд, например кристаллизатор или солонку. Понемногу прибавляют анестезирующее вещество в виде капель крепкого раствора или же кристаллов, которые, медленно растворяясь, вызывают постепенное возрастание концентрации наркотика в среде, окружающей объект. Можно с успехом использовать еще следующий прием. Сосуд с раствором наркотика (например, кристаллизатор) помещается рядом с сосудом, где находятся животные, которых предполагают наркотизировать, но несколько выше последнего. Затем оба сосуда соединяются смоченной в воде полоской фильтровальной бумаги. В результате происходит очень медленное и постепенное проникновение наркотика в среду, окружающую животных. Как только прекратится движение животного, вызываемое внешними раздражениями (прикосновение иглой и т. п.), анестезию прекращают и приступают к изучению или фиксированию. Для мелких объектов можно рекомендовать производить анестезию непосредственно на предметном стекле при контроле под микроскопом. Анестезирующие вещества всасывают под покровное стекло при помощи фильтровальной бумаги.
Указать точно необходимые концентрации наркотиков не представляется возможным, так как разные объекты требуют различной концентрации. Приходится всякий раз устанавливать необходимую для данного вида концентрацию путем непосредственного опыта.
При изучении мелких, нежных объектов для того чтобы их не раздавить покровным стеклом, делают небольшие восковые ножки. Для
этого углами покровного стекла осторожно царапают размягченный предварительно воск, благодаря чему на четырех углах стекла образуются восковые ножки. Лучше брать не чистый воск, а смесь его с венецианским терпентином (2,5 г воска, 1 г терпентина). Смесь приготовляется при нагревании. Толщина ножек определяется размером объекта. Вместо восковых ножек можно подложить под покровное стекло маленькие кусочки стеклянных капилляров или просто человеческий волос.
Фиксация
Кроме живого материала в большинстве случаев при изучении зоологических объектов используются фиксированные и окрашенные тем или иным способом препараты. Первым этапом при изготовлении микроскопического препарата служит фиксирование материала. Оно преследует цель быстро убить животное, не вызвав значительных нарушений анатомических и гистологических структур. Нужно, однако, иметь в виду, что не существует фиксирующих жидкостей, которые полностью сохраняли бы структуры, имеющиеся у живого объекта. В состав фиксирующих жидкостей (сокращенно их называют «фиксаторами») входят сильнодействующие на живую протоплазму вещества, достаточно быстро проникающие в ткани объекта. Обычными компонентами фиксаторов являются растворы сулемы, пикриновой и хромовой кислоты, осмиевой кислоты, а также формалин, спирт, уксусная кислота и некоторые соли. Продолжительность самого процесса фиксирования варьирует в зависимости от объекта и состава жидкости в широких пределах.
Сроки фиксации будут указаны ниже при рассмотрении отдельных фиксаторов.
В состав фиксирующих жидкостей входят некоторые ядовитые вещества. Поэтому необходимое условие работы с ними — строгое соблюдение всех установленных правил техники безопасности.
При фиксировании материала следует руководствоваться следующими общими правилами. Объем фиксирующей жидкости должен в несколько десятков раз превосходить объем фиксируемого объекта. Размеры объекта не должны быть слишком велики, чтобы фиксатор мог достаточно быстро проникнуть в ткани, а не вызывать медленное отмирание их. Как правило, не следует допускать величину объекта больше 0,5 см в поперечнике. Если животное крупнее, его режут на части или же вырезают и фиксируют отдельные органы. Фиксатор никогда не приливается постепенно. Объект переносится в фиксатор или же последний выливается на объект. Если имеется оболочка или кутикула, не пропускающая или медленно пропускающая фиксирующие жидкости, то объект прокалывается иглой или же надрезается ножницами.
Существует множество разнообразнейших фиксирующих жидкостей, большинство которых представляет собой различные смеси. Мы рассмотрим лишь немногие из них, наиболее часто применяемые в зоологической практике и дающие достаточно удовлетворительные результаты.
После фиксации в большинстве случаев необходимо произвести
отмывку объекта для того, чтобы удалить из тканей остатки фиксатора. Для разных фиксирующих жидкостей применяются различные методы н сроки отмывки, поэтому соответствующие указания будут даны при описании отдельных фиксаторов.
Формалин. Одна из наиболее часто используемых консервирующих жидкостей. Обычно применяется 4%-ный раствор, который получается путем разбавления покупного 40%-ного формальдегида в 10 раз. Иногда для фиксирования применяется 10%-ный формалин. Непосредственно в формалине можно и хранить объект. Формалиновый материал может применяться для вскрытия (крупные объекты), а также для изготовления тотальных препаратов. Предварительно объекты длительно (сутки) отмываются в воде. Нужно иметь в виду, что после формалина ткани плохо прокрашиваются красками. Для гистологических целей фиксация формалином мало пригодна. Изготовление срезов из формалинового материала следует применять лишь в крайних случаях при отсутствии другого материала.
Метиловый спирт. Как фиксирующая жидкость применяется редко, почти исключительно для фиксации сухих мазков крови (см. с. 78, 166).
Этиловый спирт. В качестве фиксатора используется или абсолютный, или же 96°, чаще 70°. Абсолютный спирт удовлетворительно фиксирует небольшие объекты. Продолжительность действия его от 2 ч до суток. Рекомендуется за это время сменить спирт 2—3 раза. После этого объект либо переводится для хранения в 70° спирт, либо непосредственно заливается в парафин или целлоидин. После фиксации абсолютным спиртом получаются удовлетворительные гистологические картины. Недостатком его служит обычно сильное сморщивание объекта, происходящее в силу быстрого обезвоживания. 96 и 70° спирты фиксируют гораздо хуже, чем абсолютный, и для изучения гистологии мало пригодны. Часто применяются для консервирования небольших объектов (сосальщики, Oligochaeta) и последующего изготовления .тотальных препаратов.
Спирт с формалином. Применяется широко при гистологическом изучении позвоночных животных. Может быть использован и при работах с беспозвоночными. Изготовляется следующим образом: 70° спирт — 100 см3, формалин 40%-ный — 2—3 см3. Продолжительность фиксации 12—24 ч, после чего объекты переводятся в 70° спирт, где и хранятся впредь до дальнейшей обработки. Дает удовлетворительные результаты. Этот фиксатор удобен главным образом в силу своей доступности, так как спирт и формалин имеются в каждой лаборатории.
Фиксирующие жидкости, содержащие сулему. Наиболее распространенные в лабораторной практике фиксирующие жидкости содержат в качестве основного компонента сулему. Все они характеризуются быстрым действием и относительно короткими сроками фиксации. Сулема чаще всего применяется в форме насыщенного раствора, изготовляемого следующим образом. Берется кристаллическая сулема из расчета 8—• 9 г на 100 см3 дистиллированной воды. Нагревается до кипячения и охлаждается (лучше в темноте); при этом избыток сулемы выпадает в. осадок, а насыщенный раствор (около 7%) декантируется.
После фиксации сулемовыми смесями требуется длительная про- ' мывка в дистиллированной воде (не менее суток при многократной смене) для полного удаления следов фиксатора. Вместо длительной промывки часто применяется иодирование. Оно основано на том, что иод образует с сулемой комплексное, легко растворимое соединение. При иодировании объекты после фиксации сначала переносятся на короткий срок в 70° спирт, после чего переводятся в слабый раствор иода в 70° спирте. Последний должен иметь оттенок чая средней крепости (точно концентрация не существенна). Срок пребывания объекта в растворе иода 1—6 ч в зависимости от величины объекта. Рекомендуется раствор иода сменить хотя бы один раз. После иодирования объекты отмываются в 70° спирте, где и хранятся. При фиксировании морских животных лучше раствор сулемы готовить на морской воде.
Раствор иода для иодирования применяется только 1 раз. Повторное применение той же порции раствора не рекомендуется.
Сулема с уксусной кислотой представляет собой один из самых распространенных фиксаторов. Готовится следующим образом: сулема (насыщ. раствор) — 100 см3, ледяная уксусная кислота — 3—5 см3. Срок фиксации возрастает в зависимости от величины объекта от 5 до 30 мин. После фиксации длительная отмывка в дистиллированной воде или иодирование.
Жидкость Шаудина особенно часто применяется для фиксации различных Protozoa и других мелких животных при изготовлении тотальных препаратов и срезов, а также мазков (см. ниже). Готовится следующим образом: сулема (насыщ. раствор)—2 части, спирт (96° или абсолютный) — 1 часть. Обычно применяется в подогретом (50—60°С) состоянии. Срок фиксации—5—10 мин. Последующая короткая промывка в 70° спирте и иодирование. После фиксации по Шаудину особенно хорошо красятся ядра. Цитоплазматические структуры сохраняются не очень хорошо. Нередко наблюдается довольно грубая вакуолизация, являющаяся артефактом.
Жидкость Ценкера относится к числу лучших гистологических фиксаторов. После нее хорошо удаются разнообразные гистологические окраски.
Состав ее следующий: сулема (кристаллическая) —50 г, двухромовокислый калий К2СГ2О7 — 25 г, сернокислый натрий Na2SO4—10 г, вода дистиллированная— 1000 см3. Непосредственно перед использованием прибавляется ледяная уксусная кислота из расчета 5 см3 на 100 см3 основного раствора. Смесь, в которую прибавлена уксусная кислота, длительно хранить нельзя.
Модификацией Ценкеровской жидкости является Ценкер-формол (Ценкер-Хелли). При изготовлении ее вместо уксусной кислоты к основному раствору перед использованием добавляется в таком же количестве крепкий (40%-ный) формалин.
Продолжительность фиксации от 10 мин до 6 ч. Чаще всего фиксируют 20—30 мин. После пребывания в жидкости Ценкера необходима длительная (не менее суток) промывка в многократно сменяемой или проточной воде. При этом происходит отмывка сулемы и двухромовокислого калия. Объекты следует отмывать до тех пор, пока они потеря-12
ют желтоватый оттенок. После промывки водой следует 70° спирт и иодирование. Если промывка совершалась достаточно долго, а размеры объекта невелики, то иодирование не обязательно.
Фиксирующие жидкости, содержащие осмиевую кислоту. Наряду с сулемовыми фиксаторами в лабораторной практике широко распространены разнообразные смеси, содержащие осмиевую кислоту. Эти смеси относятся к числу лучших гистологических фиксаторов. Они весьма хорошо сохраняют цитоплазматические структуры.
Общим недостатком осмиевых смесей является то, что после них не удается окраска некоторыми гистологическими красками (кармины, смесь Маллори) и сами ткани приобретают сероватый оттенок. Жировые включения окрашиваются осмиевой кислотой в черный цвет, так как OsO4 восстанавливается жиром. Поэтому для последующего изготовления тотальных (за исключением мелких объектов) препаратов осмиевые смеси обычно не применяются. Кроме того, осмиевая кислота относится к числу дорогостоящих реактивов. OsO4 легко разлагается на свету, поэтому хранить фиксирующие жидкости следует в темноте в склянках из темного стекла.
Осмиевая кислота продается в запаянных стеклянных трубочках по 1 или 0,5 г. Растворять ее следует весьма осторожно, так как она легко разлагается особенно в присутствии хотя бы следов жира или спирта. Запаянная трубочка с осмиевой кислотой промывается водой, насухо вытирается совершенно чистой тряпкой (не прикасаться пальцами!), надпиливается напильником, разламывается пополам и вместе с осмиевой кислотой бросается в заранее отмеренное количество воды в склянку с притертой пробкой из темного стекла. При надламывании трубочки с осмиевой кислотой нельзя прикасаться к ней пальцами. Следует держать ее кусочками фильтровальной бумаги или чистой тряпкой. Осмиевая кислота растворяется медленно, поэтому раствор ее можно применять лишь через сутки после начала растворения. Обычно приготовляется 2%-ный раствор OsO4, который и используется для изготовления фиксирующих жидкостей.
Осмиевая кислота относительно медленно проникает в ткани. Сроки фиксации всегда применяются длительные. После фиксации необходима последующая длительная отмывка (не менее суток) в часто сменяемой или проточной воде.
/К ид кость Флемминга. Существуют две модификации, так называемые «крепкая» и «слабая» смеси. Последняя применяется реже для фиксации мелких и особо нежных объектов. Состав обеих модификаций следующий:
«Крепкая» смесь
Хромовая кислота 1 %-ная1 ... 15 см:
Осмиевая кислота 2%-ная ... 4 »
Ледяная уксусная кислота ... 1 »
«Слабая» смесь
Хромовая кислота 1 %-ная ... 25 см!
Осмиевая кислота 2%-ная ... 5 »
Уксусная кислота 1 %-ная ... 10 »
Вода дистиллированная..........60 »
1 Хромовая кислота хранится в форме хромового ангидрида. Последний чрезвычайно гигроскопичен, поэтому необходимо держать его в баночке с притертой пробкой, залив парафином.
Небольшие кусочки тканей или мелкие объекты фиксируют не менее 24 ч.
Столь же длительна и промывка в воде, которую необходимо часто менять. Первые порции воды брать дистиллированной, далее можно использовать воду из-под крана. /
Жидкость Флемминга — наиболее рапространенный осмиевый фиксатор. После нее хорошо красятся ядра и сохраняются цитоплазматические структуры.
Жидкость Бенда отличается от «крепкой» жидкости Флемминга почти полным отсутствием уксусной кислоты. На указанное выше количество хромовой и осмиевой кислот берется 2—3 капли ледяной уксусной. Последующая обработка — та же. Жидкость Бенда лучше жидкости Флемминга сохраняет цитоплазматические структуры, но ядра красятся после нее слабее.
Жидкость Шампи состоит из следующих компонентов:
Двухромовокислый калий (K2Ci2O7) 3%-ный.....................40 см3
Хромовая кислота 1%-ная.....................................40 »
Осмив!ая кислота 2%-ная.....................................20 »
Сроки фиксации и последующая обработка те же, что и после жидкости Флемминга. При фиксации по Шампи прекрасно сохраняются цитоплазматические структуры. Ядерные структуры, однако, после него окрашиваются плохо.
Пары осмиевой кислоты применяются для фиксации мелких животных, главным образом простейших, с последующим изучением их непосредственно в капле воды без изготовления постоянного препарата. Преимущества этого метода заключаются в том, что очень хорошо сохраняются внешняя форма тела и различные ресничные образования. Живой объект в небольшой капле боды на предметном стекле быстро опрокидывается над открытой баночкой с осмиевой кислотой и выдерживается в таком положении несколько минут. После этого объект прикрывают покровным стеклом и рассматривают под микроскопом.
Фиксирующие жидкости, содержащие пикриновую кислоту. Третьей группой фиксирующих жидкостей являются смеси, содержащие пикриновую кислоту. Подобно осмиевым смесям, они дают неплохие результаты в отношении анатомии и гистологии. Тонкие цитоплазматические структуры (митохондрии и т. п.) при этом не сохраняются. После фиксации пикриновыми смесями требуется длительная промывка в 70° спирте с неоднократной сменой последнего. Менять спирт следует до тех пор, пока он не перестанет окрашиваться в желтый цвет, а объект потеряет желтоватый оттенок.
Жидкость Буэна (Bouin)—одна из наиболее распространенных пикриновых смесей и дает хорошие результаты. Состав ее следующий: насыщенный водный раствор пикриновой кислоты 150 см3, формалин 40%-ный .50 см3, ледяная уксусная кислота 10 см3. Продолжительность’ фиксации 1—2 чг Крупные объекты можно держать в фиксаторе до одних суток. Промывка в 70° спирте. Годится как для изготовления тотальных препаратов, так и для срезов.
Жидкость Карнуа. Кроме упомянутых выше фиксирующих жидкое- тей следует упомянуть жидкость Карнуа, не относящуюся ни к одной из указанных трех групп. Состав ее следующий: абсолютный спирт 60 см3, хлороформ 30 см3, ледяная уксусная кислота 10 см3. Фиксатор этот проникает в ткани очень быстро. Дает хорошие гистологические картины. Применяется чаще всего при изучении членистоногих. Продолжительность фиксации от 15 мин до 2 ч. После жидкости Карнуа объект переносится непосредственно в абсолютный спирт, после чего следует заливка в парафин или целлоидин. Для изготовления тотальных препаратов не применяется.
Изготовление тотальных микроскопических препаратов
Изготовление тотального микроскопического препарата цельного животного или отдельного органа его совершается различно, в зависимости от того, в какую среду заключается объект. Такой средой обычно являются канадский бальзам, глицерин или глицерин-желатин.
При заключении в канадский бальзам объект в большинстве случаев предварительно окрашивается. Если краска водная (а таковых огромное большинство), то объект из 70° спирта, где он хранится после фиксации, переводится в дистиллированную воду для удаления спирта, а оттуда уже непосредственно в краску. Все эти манипуляции осуществляются в солонках, часовых стеклах или маленьких «бюксах». После окраски избыток ее отмывается дистиллированной водой. Окраска не обязательна. Нередко тотальный препарат делается из неокрашенного объекта. Из 70° спирта объект переводится сначала в 96°, а затем в абсолютный спирт.
Абсолютный спирт из 96° спирта можно изготовить различными способами. Наилучшие результаты дает перегонка с негашеной известью. Для этого бутыль объемом 0,5—2 л почти доверху заполняется кусочками негашеной извести и заливается спиртом. Бутыль должна быть плотно закрыта. Через 10—15 дней приступают к перегонке. Бутыль помещают в водяную баню и соединяют обычными, применяемыми в химических лабораториях методами при посредстве дефлегматора с холодильником. Отогнанный абсолютный спирт следует хранить в хорошо закрытой бутыли с притертой пробкой. Более простой метод получения абсолютного спирта — обезвоживание 96° спирта действием безводного медного купороса CuSO4.
Для этого обычный кристаллический медный купорос CuSO4-8H2O прокаливается на примусе или электрической плитке. Он превращается при этом в белый порошок. Не следует прокаливать слишком сильно, чтобы не произошло восстановление CuSO4 до закиси меди. Безводный CuSO4 всыпается в бутыль с притертой пробкой приблизительно на */4 ее объема и заливается спиртом. Через 1—2 дня абсолютный спирт готов к употреблению. Его либо сливают с медного купороса, либо оставляют в той же бутыли.
В сосуд, где хранится абсолютный спирт, рекомендуется класть несколько кусочков прогретой в термостате желатины, которая поглощает следы воды.
Проведением через спирты возрастающей крепости достигается постепенное обезвоживание и уплотнение. Сроки пребывания в спиртах зависят в значительной мере от величины объекта и плотности тканей. Для небольших животных и органов (например, гидра, медуза, мелкие сосальщики) достаточно пребывание в каждом из спиртов 1,5—2 ч. Более крупные объекты выдерживаются по 6—12 ч.
Необходимо менять спирты для того, чтобы достигнуть полного обезвоживания. Это особенно относится к абсолютному спирту, который для крупных объектов сменяется не менее двух раз. Сосуды, в которых происходит обезвоживание, должны быть хорошо изолированы от воздуха, так как спирты, особенно абсолютный, поглощают влагу.
Для особо нежных объектов следует применять более последовательную шкалу спиртов возрастающей крепости, чтобы избежать образования складок и сморщивания. Можно рекомендовать следующую последовательность: дистиллированная вода—50° спирт — 60°—70°— 80°—90°— абсолютный. В редких случаях приходится прибегать к еще более последовательной смене спиртов.
Прилагаемая табличка облегчает приготовление спирта любой крепости исходя из 95° спирта.
Таблица разбавления спиртов (по Гей-Люссаку)
Крепость разбавленного спирта в градусах Крепость разбавляемого спирта в градусах
95 90 85 80 75 70 65 60 55 50 45 40 35
Количество воды, см3
90 85 80 75 70 65 60 55 50 45 40 35 30 6,41 13,33 20,95 29,52 39,18 50,22 63,00 77,99 95,89 117,57 144,46 178,71 224,08 6,56 13,79 21,89 31,05 41,53 53,65 67,87 84,71 105,34 130,80 163,28 206,22 6,83 14,48 23,14 33,03 44,48 57,90 73,90 93,30 117,34 148,01 188,57 7,20 15,35 7,64 24,66 16,37 8,15 35,44 26,47 17,58 8,76 48,07 38,32 28,63 19,02 9,47 63,04 52,43 41,73 31,25 20,47 10,35 81,38 69,54 57,78 46,09 34,46 22,90 11,41 104,01 90,76 77,58 64,48 51,43 38,46 25,55 11,7 132,88 117,82 102,84 87,93 73,08 58,31 43,59 27,6 171,1 153,61 136,04 118,94 101,71 84,54 67,45 50,6 14,4 33,4 17,8
Примечание. В данной таблице указано, какое количество воды нужно прибавить к 100 см1 разбавляемого спирта, чтобы получить разбавленный спирт желаемой крепости. Искомая цифра расположена на пересечении соответствующего горизонтального и вертикального рядов. Например; 1) чтобы получить 70° спирт из 95°, следует к 100 см3 последнего прибавить 39,18 см3 воды; 2) чтобы получить 50° спирт из 70°, следует к 100 см3 последнего добавить 41,73 см2 воды и т. п.
За обезвоживанием следует просветление объекта. В лабораторной практике применяют различные просветляющие средства. Для тотальных препаратов одним из лучших является гвоздичное масло, куда объекты переносятся из абсолютного спирта. В гвоздичном масле их выдерживают до полного просветления, что занимает для крупных
объектов около часа. Кроме гвоздичного масла хорошие результаты дает кедровое или бергамотное масло. Одну и ту же порцию масла можно использовать несколько раз. Годится также терпинеол, или касторовое масло.
Вместо масел для просветления можно воспользоваться ксилолом или толуолом. Объекты при этом лучше перенести сначала в смесь равных частей ксилола (или толуола) с абсолютным спиртом и лишь после этого в чистый ксилол (толуол). В случае если объект очень нежен, при переносе его из абсолютного спирта в масло образуются многочисленные складки (например, у медуз). В таких случаях рекомендуется переход этот осуществлять постепенно. Сначала перенести объект в смесь равных частей масла с абсолютным спиртом, затем в смесь двух частей масла с одной частью спирта и, наконец, в чистое масло. Можно прибегнуть также к следующему приему. В энтомологическую пробирку налить на дно кедрового масла. Сверху прилить абсолютного спирта, куда и перенести объект. При этом объект будет очень медленно опускаться в кедровое масло, которое, в свою очередь, начнет смешиваться со спиртом. После того как объект опустился на дно, его переносят в чистое кедровое масло. Объект перекладывают осторожно шпателем или иглой.
Из просветляющей жидкости объект переносят на предметное стекло в каплю канадского бальзама и покрывают покровным стеклом. Размеры капли бальзама следует рассчитать таким образом, чтобы его хватило на препарат, но чтобы он не выступал по краям покровного стекла. Если объект обладает значительной толщиной, то делают восковые ножки или подкладывают капилляры (с. 10).
При заключении объекта в глицерин имеет место меньшее количество манипуляций. Из воды или 70° спирта объект переносится в смесь равных частей глицерина со спиртом (или водой), затем следуют смесь двух частей глицерина с одной частью воды или спирта и чистый глицерин. На предметном стекле объект помещается в каплю глицерина. Чтобы последний не испарялся, края покровного стекла обводятся асфальтовым лаком. В таком виде препарат может храниться годами. Для того чтобы лак пристал к стеклу, глицерин не должен выступать из-под покровного стекла и смачивать предметное стекло.
Вместо глицерина можно заключить объект в глицерин-желатин. Последний приготовляется следующим образом. Чистый желатин (7 г) размачивают в течение 2—3 ч в 42 см3 дистиллированной воды, добавляют 50 г глицерина и 0,5 г кристаллической карболовой кислоты. Все вместе нагревается при помешивании на водяной бане, фильтруется и охлаждается. При этом глицерин-желатин застывает.
Небольшой кусочек глицерин-желатина иглой или скальпелем переносят на предметное стекло. Последнее слегка нагревают на спиртовке, глицерин-желатин расплавляется. В него из глицерина переносится объект и покрывается покровным стеклом.
Препараты в глицерин-желатине хранятся очень долго даже без окантовки асфальтовым лаком.
При изготовлении тотальных п-р^поуацзв из очень мелких объектов их легко утерять. Существует несколько сриемов, облегчающих изго
товление препаратов из мелких объектов. Можно фиксировать объект непосредственно на предметном стекле, подпустив с краю под покровное стекло немного фиксирующей жидкости. При этом желательно, чтобы покровное стекло имело восковые ножки, а не плавало на поверхности жидкости. Фиксатор, а также и все последующие жидкости вплоть до канадского бальзама протягивают под покровным стеклом при помощи фильтровальной бумаги. С одной стороны покровного стекла жидкости при этом осторожно выпускают из пипетки, с противоположной — вытягивают полоской фильтровальной бумаги. Не следует пускать слишком много жидкости, так как покровное стекло может всплыть.
Указанный метод позволяет все время контролировать наличие объекта при помощи лупы или микроскопа. В качестве фиксатора лучше всего применять жидкость Шаудина, так как она приклеивает объекты к предметному или покровному стеклу и при протягивании жидкости они не уплывают.
Очень удобен для изготовления тотальных препаратов мелких объектов (инфузорий, личинок червей и т. п., не превышающих размеров 1 мм) метод приклеивания их к покровному или предметному стеклу целлоидином. Жидкость с живыми объектами наносят тонкой пипеткой на чисто вымытое обезжиренное стекло, распределяют равномерно по его поверхности. Избыток воды отсасывают. На стекло наливают несколько капель фиксатора (удобна жидкость Буэна). Через 10—20 мин фиксатор сливают или отсасывают. Стекло ополаскивают 96° спиртом. Объекты, слегка приклеившиеся фиксатором, остаются при этом на стекле. После этого на угол стекла с объектами наносят каплю (из пипетки) жидкого раствора целлоидина на смеси равных частей абсолютного спирта и серного эфира (0,25—0,5%). Покачиванием стекла добиваются равномерного растекания целлоидина. Стекло с объектами, покрытыми целлоидиновой пленкой, переносят на 10—15 мин (можно и больше) в 70° спирт для уплотнения пленки. После этого приклеенные к стеклу объекты можно подвергать всем этапам обработки, необходимым для получения окрашенного тотального препарата.
Этот метод можно применять и в несколько иной модификации, особенно удобной при работе с культурами простейших. Объект фиксируется жидкостью Буэна в небольшом сосуде (солонке), где он оседает на дно. Затем тонкой пипеткой берут 1—2 капли фиксатора с объектом и равномерно распределяют по поверхности покровного или предметного стекла. Дальнейшая обработка идет так, как сказано выше.
Часто применяется метод центрифугирования. Объекты фиксируются в центрифужной пробирке. В ней же осуществляется и вся дальнейшая смена жидкостей вплоть до просветления. При этом перед каждой сменой жидкости производится центрифугирование. Из просветляющей жидкости со дна центрифужной пробирки объекты при помощи пипетки переносятся на предметное стекло в каплю бальзама. Метод центрифугирования применяется очень часто, например при изготовлении препаратов простейших. Некоторые другие более специальные методы изготовления тотальных' препаратов из мелких объектов будут рассмотрены в специальной части данного руководства.
Декальцинация
У многих беспозвоночных животных имеется внутренний или наружный скелет, состоящий из углекислой извести СаСО3. Такие объекты после фиксации перед изготовлением тотальных препаратов или срезов следует декальцинировать, т. е. растворить углекислую известь действием кислоты. Для декальцинации используется соляная или азотная кислота, которая добавляется к 70° спирту (слабый раствор 0,5—1%). Для крупных объектов концентрация HNO3 может быть доведена до 5%. Процесс декальцинации в зависимости от объекта длится от нескольких часов до суток и больше. Более крепких кислот брать не следует, так как они неблагоприятно отражаются на структуре тканей. После декальцинации объект отмывается в нескольких порциях чистого 70° спирта, после чего подвергается дальнейшей обработке (тотальный препарат, заливка в парафин). Иногда бывает полезно на несколько часов поместить декальцинированный объект в 5%-ный водный раствор Na2SO4. Это препятствует его набуханию, которое иногда имеет место после декальцинации, особенно если по ходу обработки объект приходится помещать в воду.
Объекты, обладающие известковым скелетом, не следует фиксировать смесями, содержащими значительное количество кислот (сулема с уксусной), так как при этом происходит быстрое растворение СаСО3 и выделение СО2. Пузырьки газа застревают в тканях, а это мешает изготовлению препаратов.
Изготовление 'мазков
Различают «сухие» и «влажные» мазки. Первые имеют ограниченное применение и используются почти исключительно при изучении крови и кровепаразитов. Способы их изготовления указаны в специальной части при рассмотрении малярийного плазмодия (с. 66). «Влажные» мазки применяются часто главным образом при изучении паразитических простейших, а также и в других случаях. Мазки изготовляются следующим образом. Пинцетом берут тот орган, из которого предполагается сделать мазок, и «намазывают» на покровное стекло. Мазок должен быть совершенно равномерным и одинаковой толщины на всем покровном стекле. Если этого достигнуть сразу не удалось, то при помощи препаровальной иглы можно частично исправить мазок.
Не давая подсохнуть мазку, покровное стекло опускают мазком вниз на теплую жидкость Шаудина, предварительно налитую в часовое стекло или солонку. Происходит быстрая коагуляция тканевых элементов, и мазок плотно пристает к стеклу. Дальнейшая обработка мазка та же, что и тотальных препаратов. После фиксатора следуют промывка в 70° спирте, иодирование, вторичная промывка в спирте, перенос в воду, окраска, отмывка в воде; спирты возрастающей крепости, ксилол, бальзам.
Заливка и приготовление срезов
При изучении различных зоологических объектов очень часто приходится прибегать к изготовлению разрезов. Для получения тонких срезов толщиной в несколько микрон объект подвергается довольно сложной обработке, в результате которой он заключается в плотную или эластичную среду (заливка), после чего при помощи микротома разлагается на срезы.
Существует два основных метода заливки — в парафин и целлоидин— с различными модификациями. При зоологических работах чаще применяется заливка в парафин.
Заливка в парафин. Необходимым прибором для заливки в парафин служит термостат, отрегулированный на 56—60°С. В крайнем случае его может заменить водяная баня.
Первой манипуляцией при подготовке материала к заливке в парафин является его обезвоживание, которое производится так же, как и при изготовлении тотальных препаратов. Из абсолютного спирта объект не может быть непосредственно переведен в парафин, так как эти вещества друг с другом не смешиваются. Поэтому после абсолютного спирта следует перенести объект в жидкость, которая смешивается как с абсолютным спиртом, так и с парафином. Чаще всего для этой цели служат ксилол или толуол. Из абсолютного спирта объект сначала переводят в смесь равных частей абсолютного спирта с ксилолом (толуолом), а отсюда уже в чистый ксилол. Вместо ксилола (толуола) с успехом можно применять также кедровое масло или хлороформ.
Кедровое масло имеет перед ксилолом то преимущество, что в нем объект не столь сильно затвердевает, как это имеет место в ксилоле, что представляет значительное преимущество при последующей резке на микротоме. Недостаток кедрового масла заключается в том, что оно труднее, чем ксилол, замещается парафином и при заливке парафин необходимо менять. Хлороформ, напротив, в силу своей летучести легко замещается парафином, представляя в этом отношении преимущества не только перед кедровым маслом, но и перед ксилолом.
Из ксилола объект переводится в смесь ксилола (или толуола, или хлороформа — в зависимости от того, через какую жидкость совершается заливка) с парафином (при заливке через кедровое масло эта манипуляция отпадает, и объект непосредственно переводится в парафин, который сменяется 2—3 раза). Для этого чистый парафин в виде мелких стружек насыпают в сосуд с ксилолом, где помещается заливаемый объект из расчета (приблизительно) равного объема жидкости и парафина, и ставят в термостат с температурой 35—40°С. Происходит медленное растворение парафина. Можно и непосредственно перенести объект из ксилола в заранее приготовленную и подогретую смесь равных частей ксилола и парафина. Сроки пребывания объекта в ксилоле и смеси последнего с парафином варьируют в зависимости от величины объекта. Обычно в ксилоле выдерживают 1—2 ч, в смеси 0,5—1 ч. Во время указанных манипуляций в термостате заранее расплавляют парафин и разливают его в часовые стекла или другие мелкие сосуды (например, маленькие кристаллизаторы) по числу отдельно заливае
мых объектов. Существенно важным является вопрос о точке плавления парафина. Для изготовления не очень тонких срезов (5 мкм и толще) берут парафин с точкой плавления 54—65°С. Парафин должен быть совершенно чистым от всяких механических примесей, поэтому рекомендуется его предварительно профильтровать через бумажный фильтр (разумеется, в термостате). Из смеси ксилола (толуола, хлороформа) с парафином объект переносится шпателем или иглами в термостат в чистый расплавленный парафин.
Наиболее удобные сосуды для парафина — часовые стекла. Вовремя пребывания объекта в парафине последний 1—2 раза сменяется. Это осуществляется или путем переноса объекта в другое стекло, или путем декантации и приливания чистого парафина. Первый способ удобнее для крупных, второй — для более мелких объектов. Все эти манипуляции нужно производить быстро, так как при открывании термостата парафин застывает. Продолжительность пребывания объекта в парафине опять-таки варьирует в зависимости от его величины в пределах от 30 мин до 1,5 ч. Более продолжительные сроки приводят к излишнему затвердеванию объекта.
Перед окончанием заливки объект переводят еще раз в чистый парафин в часовое стекло. Последнее предварительно слегка смазывается глицерином, что способствует в дальнейшем легкому отставанию парафина от стекла.
Если объекты очень мелки и перенос их представляет затруднение, то можно обойтись декантацией парафина и произвести охлаждение в том же стекле без глицерина.
Последней манипуляцией при заливке в парафин является быстрое охлаждение последнего. Предварительно наливается вода комнатной температуры в какой-либо открытый сосуд, например простоквашницу. Часовое стекло с объектом вынимают из термостата и своей нижней выпуклой поверхностью приводят в соприкосновение с водой. Начинается быстрое охлаждение и застывание парафина. Как только поверхность парафина подернется довольно толстой пленкой, стекло опускают целиком в воду. Чтобы ускорить процесс образования пленки, рекомендуется осторожно дуть на поверхность расплавленного парафина. Быстрое затвердевание парафина необходимо для того, чтобы избежать кристаллизации, которая портит объект и делает невозможной последующую резку на микротоме. После того как закончилось застывание парафина, при помощи скальпеля обрезают края (не затрагивая объекта) и застывший парафин вместе с объектом снимают с часового стекла. Последнее легко удается в том случае, если часовое стекло было предварительно смазано глицерином. При отсутствии глицерина отделить парафин от стекла сразу не удается. Тогда стекло с застывшим парафином, обрезанным по краям, вновь опускают на несколько часов в воду, после чего парафин с объектом легко отделяется от часового стекла.
При отсутствии часовых стекол заливку можно вести в маленьких, сделанных из плотной белой бумаги коробочках, размеры которых определяются размерами заливаемого объекта. Такие коробочки заполняются жидким парафином, ставят в термостат и в них переносят за
ливаемый объект. После охлаждения бумага легко отделяется от парафина, заключающего объект.
Иногда при охлаждении парафина в воде происходит растрескивание последнего, что делает невозможным последующую резку. Указанное обстоятельство зависит чаще всего от двух причин: 1) от слишком быстрого охлаждения и 2) от качества самого парафина. Чтобы избежать первой причины, не следует брать слишком холодную воду зимой из водопровода. Лучше всего пригодна вода, имеющая температуру 14—16°С. Со второй причиной бороться труднее. В большинстве случаев помогает прибавление к парафину небольшого количества пчелиного воска (не более 7ю по объему), который делает его более мягким и эластичным. Нужно иметь в виду, что избыток воска делает парафин слишком мягким. Это препятствует последующей резке на микротоме.
Заливка в целлоидин. Продажный целлоидин, имеющий вид прозрачных режущихся ножом пластинок, разрезают на мелкие кусочки и высушивают на воздухе (оберегать от пыли!). Приготовляется четыре разной крепости раствора целлоидина в смеси равных объемов абсолютного спирта и серного эфира, а именно: 1, 2, 4 и 8%-ный раствор. Целлоидин растворяется очень медленно, и весь процесс приготовления указанных растворов занимает 2—3 дня. Хранить их следует в небольших склянках с хорошо притертыми пробками, обмазанными вазелином, так как эфир легко испаряется.
Объект, подлежащий заливке, основательно обезвоживают абсолютным спиртом, после чего переносят в смесь равных объемов абсолютного спирта и эфира. Отсюда он поступает последовательно в растворы целлоидина возрастающей крепости. В каждой из них объект выдерживается не менее 2 суток. Крупные объекты приходится держать в каждом растворе по 5—7 дней.
Из банки с 8°/0-ным раствором целлоидина объект переносят в маленькую чашку Петри или на часовое стекло и заливают 8—10%-ным раствором целлоидина. Сосуд оставляют открытым и ставят в эксикатор, где происходит благодаря испарению эфира и спирта постепенное застывание целлоидина. Прямо на воздухе сосуд оставлять не следует,. так как атмосферная влага может вызвать помутнение целлоидина и потерю им эластичности.
При отсутствии эксикатора можно воспользоваться простым стеклянным колпаком. Для ускорения затвердевания целлоидина под колпак иногда ставят открытую баночку с хлороформом, в парах которого процесс уплотнения целлоидина протекает более быстро и занимает 1—2 суток. К концу его целлоидин приобретает консистенцию густого желе и легко режется ножом. При помощи скальпеля вырезают объект с окружающим его слоем целлоидина в форме прямоугольной призмы. Не следует обрезать целлоидин вплотную к объекту. Вокруг объекта нужно оставить небольшой слой его в 2—3 мм.
Вырезанный указанным способом блок промывают в 70° спирте, после чего сразу же приклеивают к пробке или небольшой деревянной призме. Для этого берут густой раствор целлоидина, наносят его на-пробку или деревяшку и прикладывают целлоидиновый блок. Оставля-22
ют на короткий срок затвердеть на воздухе или под колпаком, после чего опускают в банку с 70—80° спиртом. В нем происходит окончательное уплотнение целлоидина, и объект плотно пристает к пробке. В спирте целлоидиновые блоки могут храниться долгое время,прежде чем подвергнутся резке на микротоме. Приклеивание к пробке или деревяшке необходимо потому, что они зажимаются в объектодержателе микротома во время резки. При заливке в целлоидин важно наблюдать, чтобы получилась необходимая консистенция целлоидина, что устанавливается путем практики. Если уплотнение недостаточно, то не удается получить тонких срезов (тоньше 15—20 мкм). Если, напротив, целлоидин слишком тверд, то он плохо режется бритвой.
Целлоидин-парафиновая заливка по Петерфи. Наряду с чистой парафиновой и целлоидиновой заливками в микроскопической технике нередко применяется комбинированная целлоидин-парафиновая заливка. Среди различных методов ее наиболее удобным для зоологических объектов является метод Петерфи. При комбинированной заливке объект сначала пропитывается целлоидином, после чего уже происходит заливка в парафин.
Преимущество этих методов заключается прежде всего в том, что пропитанные целлоидином объекты при последующей заливке в 'парафин лучше режутся на микротоме. Это имеет особенное значение для объектов, обладающих значительной твердостью, как, например, большинство членистоногих с их хитиновым покровом. Кроме того, во время резки не происходит смещение органов, которое иногда наблюдается при простой парафиновой заливке. Наконец, некоторые специальные видоизменения двойной заливки позволяют точно ориентировать мелкие объекты, что при парафиновой заливке нередко представляет затруднения.
При заливке по Петерфи сначала производится обычно обезвоживание объекта, который доводится до абсолютного спирта. После этого объект переносят в 1%-ный раствор целлоидина в гвоздичном масле. Последний приготовляется следующим образом: 2%-ный раствор сухого целлоидина в смеси равных количеств абсолютного спирта и серного эфира разбавляется гвоздичным маслом в отношении I : 1 (по объему) . Хранится в плотно закрывающейся посуде. Можно прямо растворять целлоидин в гвоздичном масле. Нужно иметь в виду, что при этом растворение целлоидина происходит чрезвычайно медленно.
Иногда следует использовать более крепкий (3—4%-ный) раствор целлоидина, особенно в тех случаях, когда заливаются объекты, обладающие большой плотностью тканей (например, членистоногие). Гвоздичное масло может быть заменено метилбензоатом, представляющим собой преломляющую свет жидкость с характерным запахом. Некоторые авторы (например, Ромейс) предпочитают метилбензоат гвоздичному маслу.
Необходимо иметь в виду, что метилбензоат ядовит и вдыхание паров его строго противопоказано. Поэтому все манипуляции с метилбензоатом надо вести в вытяжном шкафу.
В растворе целлоидина объект выдерживается не менее суток. Если производится заливка объекта, обладающего плотными покровами (чле
нистоногие) и при обычной парафиновой методике плохо режущегося на микротоме, то следует в растворе целлоидина выдерживать более длительные сроки — неделю и больше. В растворе целлоидина в гвоздичном масле объекты могут пребывать неограниченно долгий срок.
После раствора целлоидина следует хлороформ, в котором выдерживают объект (в зависимости от размеров) 1—2 ч. При этом целлоидин желатинизируется. В том случае, если раствор целлоидина был приготовлен на метилбензоате, вместо хлороформа можно взять бензол. За хлороформом (бензолом) следуют, как при обычной парафиновой заливке, хлороформ с парафином (бензол с парафином) и чистый парафин. Продолжительность пребывания в последнем та же, что и при обычной заливке.
Некоторым видоизменением рассмотренного метода является заливка в целлоидиновых каплях, используемая для очень мелких объектов. При этом объекты (например, инфузории), находящиеся в растворе целлоидина в гвоздичном масле, помещаются в центрифужную пробирку и центрифугируются. Со дна пробирки объекты вместе с раствором целлоидина набираются в пипетку с довольно широким отверстием (прибл. 2—3 мм). Из пипетки капают в хлороформ. Капли раствора целлоидина, как только они попадают в хлороформ, сразу же желатинизируются, образуя небольшие прозрачные шарики, внутри которых заключены заливаемые объекты. При дальнейшей обработке эти шарики при посредстве шпателя переносятся в хлороформ-парафин и парафин. В дальнейшем на микротоме режется целый шарик. Удобство этого метода заключается в том, что вместо того чтобы иметь дело с очень мелкими объектами, перенося их из жидкости в жидкость, приходится оперировать с довольно крупной каплей целлоидина. Главный недостаток в том, что ориентировка объектов получается случайной.
Кроме заливки мелких объектов в целлоидиновой капле существует метод заливки их на целлоидиновых пластинках, который позволяет производить очень точную ориентировку даже очень мелких объектов (отдельных инфузорий и т. п.). Прежде чем приступить к заливке упомянутым методом, заготовляют целлоидиновые пластинки. Для этого 4—5%-ный раствор целлоидина в смеси абсолютного спирта и эфира выливают в чашку Петри слоем толщиной 5—7 мм. Целлоидину дают застыть под стеклянным колпаком в парах хлороформа (ставится открытая баночка или кладется ватка, смоченная хлороформом). Через 2—3 суток застывший целлоидин нарезают скальпелем небольшими кусочками призматической формы и хранят в банке с терпинеолом. Важно, чтобы целлоидин имел необходимую консистенцию. Он не должен быть слишком мягким, желеобразным. Вместе с тем излишняя плотность его будет препятствовать дальнейшей резке на микротоме. Он должен сохранять эластичность и свободно резаться скальпелем. В терпинеоле целлоидиновые пластинки могут храниться неограниченно долгое время.
При заливке по Петерфи на пластинках берут небольшую целлоидиновую пластиночку и стороны ее подравнивают скальпелем. Необходимо, чтобы она имела форму прямоугольной призмы, причем отдельные плоскости должны быть строго перпендикулярны друг другу. Размеры 24
пластинки зависят от величины и количества объектов. Как удобный размер можно указать: длина 3 мм, ширина 2 мм, высота 1,5 мм.
Подготовленную указанным способом целлоидиновую пластиночку обсушивают от терпинеола фильтровальной бумагой, переносят на предметное стекло, где кладут широкой поверхностью кверху. Дальнейшие манипуляции лучше производить на предметном столике штативной лупы или бинокуляра (в зависимости от размеров заливаемого объекта). При помощи тонкой пипетки объект из раствора целлоидина в гвоздичном масле переносят на целлоидиновую пластинку. При помощи тонких игл он ориентируется (под лупой и бинокуляром) определенным образом относительно краев (ребер) целлоидиновой пластинки. Например, если заливается инфузория туфелька, то ее можно ориентировать длинной осью тела перпендикулярно к короткому ребру верхнего основания целлоидиновой пластинки. На одну и ту же пластинку можно расположить несколько объектов. На поверхность пластинки не следует вместе с объектом из пипетки вносить большое количество раствора целлоидина в гвоздичном масле. В таком случае объекты будут плавать и ориентировать их не удастся. Нужно, чтобы они лежали на поверхности пластинки, будучи лишь смочены раствором целлоидина. Не рекомендуется также на одной и той же пластинке располагать слишком много объектов, так как это затрудняет ориентировку. Объекты из раствора целлоидина можно брать не пипеткой, а небольшим крючочком, сделанным, например, из зубочистки. При этом захватывается меньшее количество раствора целлоидина. После того как ориентировка объекта закончилась, целлоидиновую пластинку переносят на 15— 20 мин в пары хлороформа, где происходит желатинизация целлоидина, и благодаря этому объект оказывается плотно приклеенным к целлоидиновой пластинке. Для этого удобнее всего поступать следующим образом: предметное стекло с лежащей на нем целлоидиновой пластинкой . переносят в чашку Петри, кладут на дно ее ватку, смоченную хлороформом, и прикрывают крышкой. После паров хлороформа пластинку переносят пинцетом в хлороформ на 1—1,5 ч, вплоть до полного просветления как объекта, так и самой пластинки. Далее заливка идет обычным способом. В самый момент охлаждения часового стекла в конце заливки следует обратить внимание на то, чтобы та сторона целлоидиновой пластинки, на которой помещается объект, оказалась направленной к стеклу, а не в толщу парафина. Это важно для того, чтобы иметь возможность в дальнейшем при резке видеть объект.
Указанный способ заливки мелких объектов имеет то большое преимущество, что позволяет достигнуть точной ориентировки. Приклеив объект к целлоидиновой пластинке, в дальнейшем приходится иметь дело уже не с мелким объектом, перенос которого из жидкости в жидкость представляет значительные затруднения, а со всей пластинкой в целом. Зная, например, что длинная ось заливаемой инфузории ориентирована параллельно длинной оси пластинки, можно наверняка сказать, что, порезав на микротоме пластинку поперек, мы вместе с тем получили поперечные срезы инфузории.
Если подлежащие заливке объекты очень мелки и их трудно отыскать после просветления в целлоидине с гвоздичным маслом даже под
лупой или бинокуляром, то следует их предварительно подкрасить. Для подкраски лучше всего взять какую-нибудь цитоплазматическую краску (например, эозин) или же гематоксилин Бёмера (с. 30).
Резка после парафиновой или парафино-целлоидиновой заливки-Прежде чем приступить к резке на микротоме, вырезают объект при помощи острого скальпеля в форме правильного «блока» из общей массы парафина. Срезать избыточный парафин не следует вплотную к объекту. Необходимо оставить слой его не менее 1 мм. При заливке по Петерфи на пластинках парафин также не следует срезать вплотную к целлоидину. Сам парафиновый блок с объектом должен иметь форму четырехгранной призмы со строго параллельными поверхностями и противоположными ребрами.
Если толщина объекта неравномерна на всем протяжении блока, то можно придать ему форму усеченной четырехгранной пирамиды, строго соблюдая при этом параллельность противоположных верхних ребер. Парафиновый блок прикрепляется на пробку или четырехгранную деревянную призму, поверхность которой залита небольшим . количеством парафина. Само прикрепление совершается путем нагревания основания блока разогретой на пламени спиртовки иглой или скальпелем. После этого деревяшка или пробка, на которую прикреплен парафиновый блок, закрепляется в объектодержателе микротома и при помощи винтов ставится на уровень микротомного ножа. Микротомный нож (бритва), который применяется для резки парафиновых блоков, несколько отличается от бритвы, применяемой для целлоидиновых блоков. На первых обычно имеется отметка в виде буквы Ь, на вторых — буквы а. Различие между ними сводится к разной величине утла, под которым совершается точка лезвия. Сам микротом к моменту резки следует начисто вычистить и смазать костяным маслом.
Парафиновый блок должен быть обращен к микротомному ножу своей длинной гранью и той стороной, ближе к которой расположен объект. Край его ориентируется строго параллельно краю бритвы. Необходимое положение парафинового блока достигается при помощи нескольких винтов, благодаря наличию которых объектодержатель может двигаться в вертикальном направлении, а также менять свой угол в отношении вертикальной оси. После того как необходимое положение парафинового блока в объектодержателе достигнуто, производится установка желательной толщины среза. Сама резка достигается равномерными не очень быстрыми движениями бритвы, причем каждому движению предшествует поднятие объектодержателя на толщину среза при помощи подающего механизма. Движение бритвы производится правой рукой работающего, которой он прикасается к специальной ручке салазок микротомной бритвы. Не следует нажимать на салазки, так как это повлечет неравномерную толщину срезов. Салазки бритвы должны двигаться по рельсам совершенно свободно. Если резка идет хорошо, то отдельные срезы склеиваются между собой, образуя ленту. Кусочки ленты при помощи влажной кисточки переносят на предметное стекло. Длина кусочка ленты должна быть на 2—3 мм уже ширины покровного стекла, которым в дальнейшем предполагается прикрыть препарат. Предметное стекло, на которое переносят парафиновые срезы, предва
рительно обезжиривается (кипячение в растворе соды и промывка в воде), слегка смазывается смесью глицерина с белком1 и смачивается дистиллированной водой.
Парафиновые срезы кладутся на воду, которой не дают испариться, добавляя ее кисточкой или пипеткой. Для дальнейшей обработки весьма желательно возможно аккуратнее располагать срезы на предметном стекле, что особенно необходимо при получении серии срезов. Чтобы площадь, занятая срезами, соответствовала точно размерам покровного стекла, можно рекомендовать пользоваться шаблончиками, которые подкладываются под предметное стекло. На шаблончик наносятся контуры как предметного, так и покровного стекла. Срезы раскладываются только в области последнего.
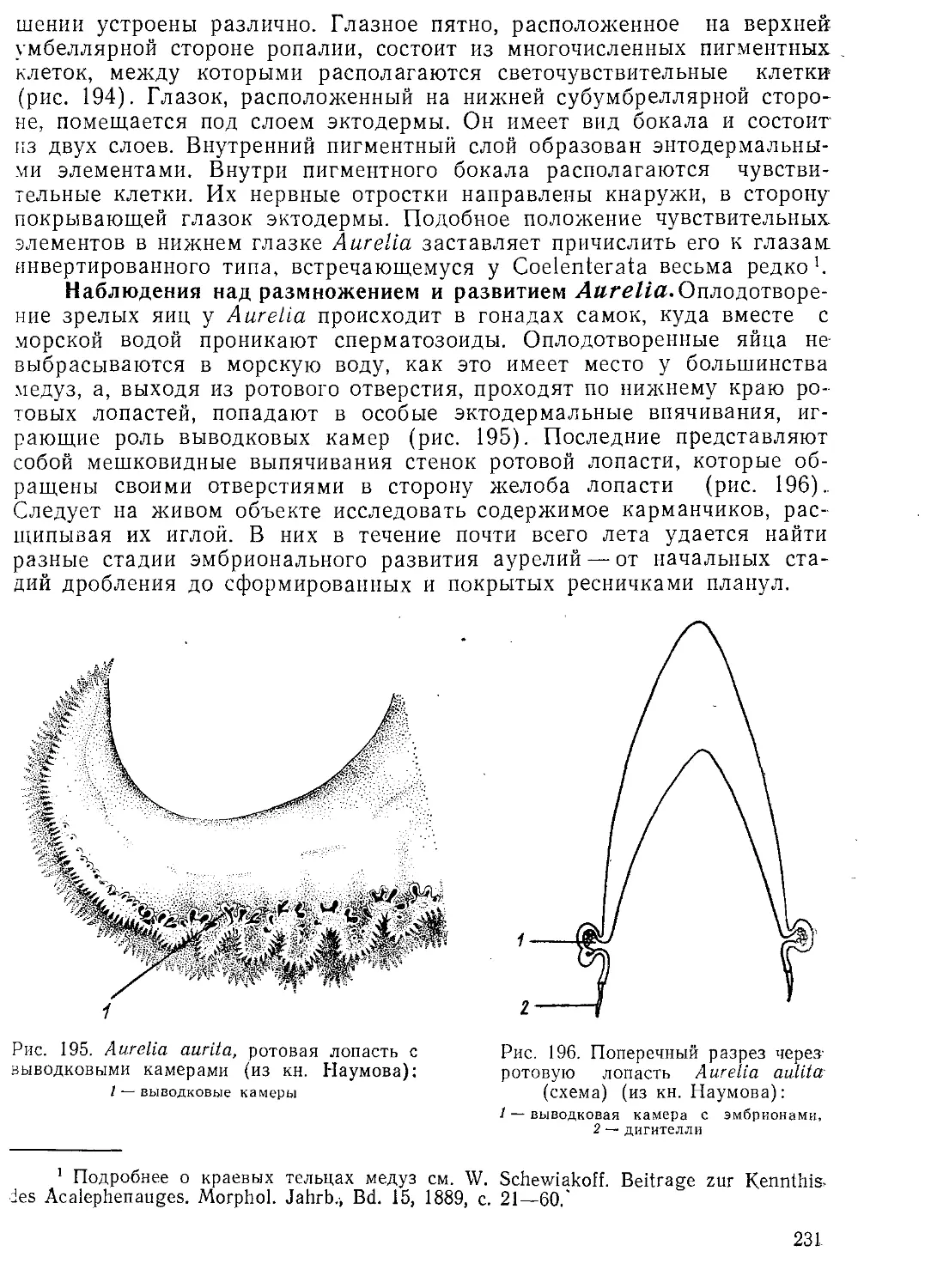
Следующей манипуляцией является расправление срезов. Предметное стекло, смоченное водой, с парафиновыми срезами осторожно нагревают, для чего несколько раз проводят над пламенем спиртовой горелки. Ни в коем случае нагревание не следует доводить до расплавления парафина. Подогретые срезы расправляются, теряют имеющиеся складки и становятся совершенно гладкими. После этого предметное стекло со срезами подсушивают в термостате при температуре 35—40°С. При этом срезы плотно пристают к предметному стеклу. Высушенные срезы, при условии изоляции их от пыли, могут без дальнейшей обработки храниться очень долго.
Резка на микротоме требует известных навыков и практики. У начинающего дело далеко не всегда идет гладко. Отметим некоторые наиболее часто встречающиеся трудности.
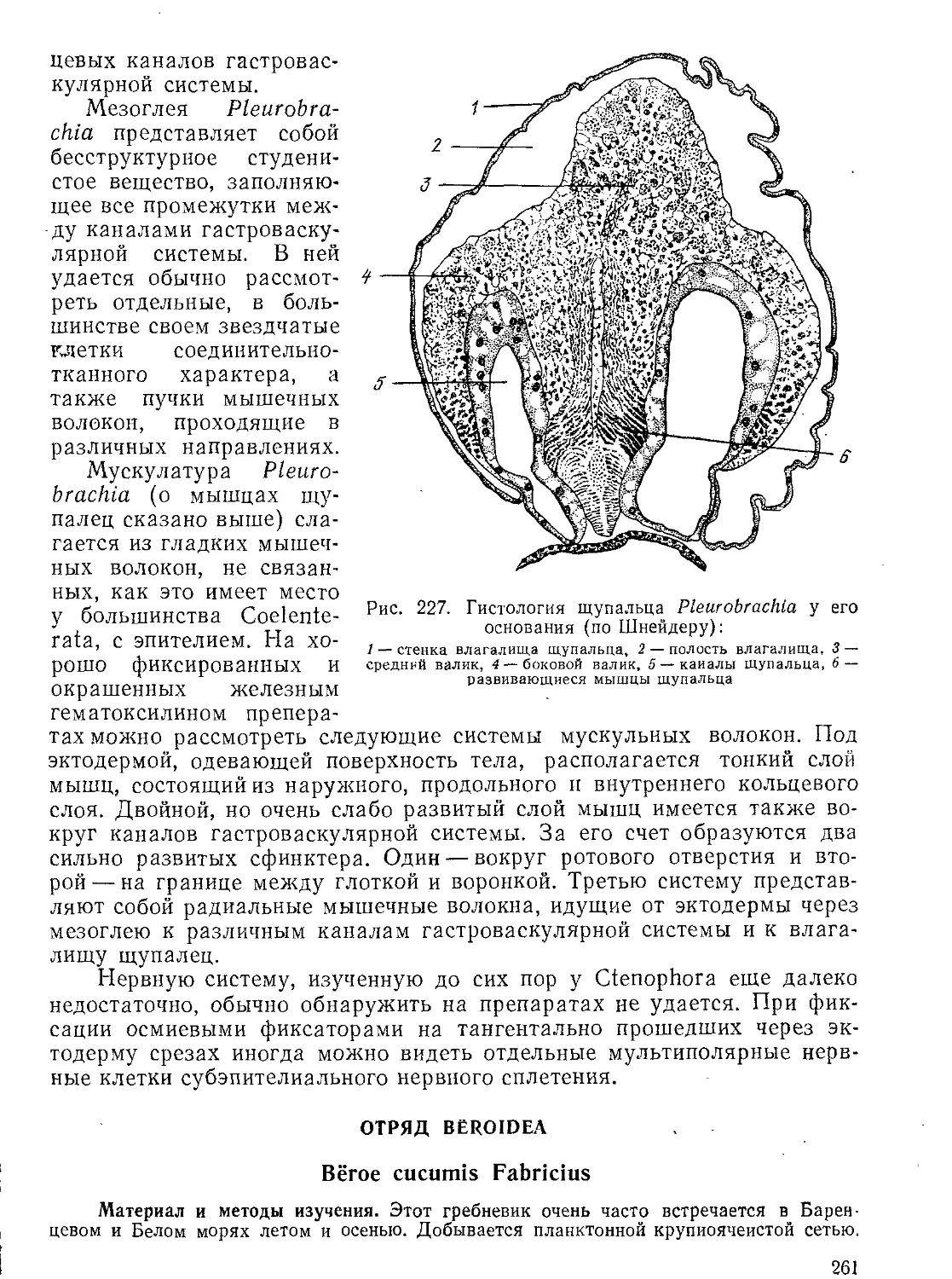
1. Отдельные срезы на самой бритве закручиваются и не образуют ленты. Это зависит обычно от двух причин: или парафин слишком тверд, или же окружающая температура слишком низка. Указанного недостатка иногда удается избежать, слегка подогрев бритву или поставив около микротома какой-либо нагревательный прибор.
2. Срезы сильно мнутся и их на предметном стекле не удается расправить. Обычно это наблюдается с очень тонкими срезами (тоньше 5 мкм). Возможные причины: парафин слишком мягок, температура слишком высока. Возможные пути исправления: медленнее вести бритву, охладить блок (холодной водой или смочив основание его серным эфиром), перезалить в парафин с более высокой точкой плавления.
3. На срезах образуются полосы и царапины, идущие в направлении движения бритвы. Причина этого явления заключается в том, что на бритве имеются неровности. Следует переменить место, которым режется блок, передвинув бритву в держателе.
4. Объект не режется, а крошится и выпадает из срезов. Это указывает на то, что он не пропитался парафином, что в свою очередь может зависеть от ряда причин. Чаще всего это бывает обусловлено тем, что перед заливкой объект недостаточно обезвожен. Путь исправления:
1 Готовится следующим образом: взбивают яичный белок, после чего ему дают «спасть», и фильтруют через фильтровальную бумагу. Разбавляют пополам глицерином. Чтобы избежать гниения, добавляют кристалл тимола.
растворить парафин в ксилоле, перенести- объект вновь в абсолютный спирт и залить заново.
Указанными выше моментами не исчерпываются все те затруднения, с которыми можно встретиться при резке на микротоме. Необходимые практические навыки приобретаются, однако, довольно быстро, и при наличии хороших реактивов и исправного микротома овладеть искусством хорошо резать не представляет особой трудности.
После высушивания парафиновые срезы оказываются плотно приклеенными к предметному стеклу, что облегчает все дальнейшие манипуляции с ними, которые удобнее всего производить в цилиндрических стаканчиках с хорошо подогнанной пробкой.
Парафин растворяется ксилолом или толуолом. В стаканчик, наполненный одной из указанных жидкостей, предметные стекла со срезами опускаются на 3—5 мин. После этого они переносятся в абсолютный спирт. Последний с успехом может быть заменен карбол-ксилолом или карбол-толуолом, который приготовляется следующим образом. Кристаллическая карболовая кислота (фенол) расплавляется в термостате и приливается в стаканчик с ксилолом или толуолом в количестве — 1/з объема последних. Можно, не расплавляя фенола, всыпать его на дно стаканчика и залить ксилолом. Растворение карболовой кислоты происходит быстро. Из абсолютного спирта или карбол-ксилола срезы поступают в 96, 70° спирт и, наконец, дистиллированную воду. При переносе предметного стекла со срезами из одной жидкости в другую рекомендуется при помощи фильтровальной бумаги или тряпочки обтирать тыльную сторону стекла (где нем срезов), чтобы избежать быстрой порчи жидкостей. После воды приступают к окраске срезов (о методах окраски см. следующую главу). Окрашенные срезы обрабатывают в порядке, обратном рассмотренному выше. Из воды они поступают в 70° спирт, далее следует 96° спирт, карбол-ксилол (или абсолютный спирт) и ксилол. После ксилола на срезы наносят каплю канадского бальзама (или дамар-лака, растворенного в ксилоле, или пихтового бальзама) и препарат покрывают покровным стеклом. Тыльная сторона обтирается тряпочкой. После того как произойдет подсыхание бальзама, препарат готов для изучения.
В том случае, если объект был окрашен до заливки (например, борным кармином, с. 30), указанные манипуляции значительно сокращаются. Парафин на срезах растворяется ксилолом, после чего непосредственно наносят бальзам и накладывают покровое стекло.
Главная неудача, которая иногда постигает занимающегося при обработке срезов, сводится к тому, что последние отклеиваются от стекла, после чего оказываются безвозвратно потерянными. Чаще всего это происходит при переводе стекла из 70° спирта в воду, а иногда и раньше. Причиной этого явления обычно служит недостаточное предварительное подсушивание срезов или же подсушивание их при низкой температуре, а не при 30—40°С. Вторая причина, обусловливающая отклеивание срезов, — грязное предметное стекло, несущее следы жира.
Особенно тщательно следует расправлять и подсушивать срезы при двойной целлоидин-парафиновой заливке, так как целлоидин относительно плохо пристает к предметному стеклу.
Резка после целлоидиновой заливки. Укажем лишь на основные различия резки целлоидиновых блоков от резки парафиновых блоков. Бритва ставится не параллельно краю блока, как это имеет место при парафиновых срезах, а под углом в 45°. Сама резка производится под 70° спиртом. Для этого как на поверхность блока, так и на бритву при помощи кисточки постоянно наносится спирт. Ленты не образуются, и каждый срез отдельно при помощи кисточки переносится в 70° спирт, налитый в кристаллизатор или небольшую чашку Петри. Таким образом, для получения серии срезов целлоидиновая заливка менее пригодна, чём парафиновая. На поверхности бритвы во время резки получающиеся срезы обычно оказываются в большей или меньшей степени смятыми. Они расправляются при переносе в 70° спирт. Существуют методы получения серий срезов и при целлоидиновой заливке, но они довольно сложны и здесь не рассматриваются.
Обработка целлоидиновых срезов идет по существу так же, как тотальных препаратов. Если предполагается далее окрашивать срезы, то из 70° спирта кисточкой или шпателем их переносят в 50° спирт и затем в воду. После окраски следуют спирты возрастающей крепости, карбол-ксилол и ксилол (толуол).
Из ксилола опять-таки шпателем срез переносится на предметное стекло в каплю бальзама и накрывается покровным стеклом. Если на срезе образовались складки, то они расправляются на предметном стекле осторожными движениями. Полезно также на покровное стекло положить небольшой груз (например, гирьку в 10—15 г) и оставить подсохнуть бальзам на сутки. Таким образом, в отличие от парафиновых срезов при целлоидиновой заливке та среда, в которую производилась заливка, не удаляется, а остается в препарате. Благодаря тому, что целлоидин прозрачен и слабо окрашивается большинством красок, это не препятствует изучению препарата.
В тех случаях, когда объект окрашен еще до заливки, соответственно число отдельных манипуляций со срезами сокращается. Из 70° спирта они переносятся в 96°, а затем в карбол-ксилол и ксилол, после чего* помещаются в бальзам на предметном стекле.
Целлоидиновые блоки не удается порезать столь же тонко, как парафиновые. Обычная толщина целлоидиновых срезов 15—30 мкм. Срезы тоньше 10 мкм не удаются — целлоидин рвется и сморщивается. Этот метод применяется для относительно крупных объектов с плотными покровами и там, где нет необходимости в получении серии срезов.
Окраска препаратов
Обычные гистологические красители распадаются на две группы: основные и кислые. Первые преимущественно окрашивают ядерные структуры, вторые — цитоплазму. Не останавливаясь на химической характеристике разных групп красителей, укажем лишь, что самый процесс гистологической окраски представляет собой явление весьма сложное и разнородное. Здесь играет роль плотность структур и дисперсность краски, т. е. явления физического порядка. Существенное значение имеет электроадсорбция, в некоторых случаях несомненно происходит химическое связывание красителя.
Среди огромного количества красителей рассмотрим относительно немногие, которые рекомендуются нами в специальной части Практикума. Сначала изложим способы изготовления и применения основных, затем — кислых красителей и в конце остановимся на более сложных комбинированных и некоторых специальных методах окрашивания препаратов и цитохимии.
Квасцовый кармин. Приготовление. Калийные квасцы, 3—5 г, растворяют в 100 см3 дистиллированной воды. Можно вместо калийных взять аммиачные квасцы. Прибавляют 2 г мелкоистертого кармина (среди различных сортов кармина лучше брать кармин-накарат). Кипятят в течение часа. Остужают и фильтруют. Добавляют 1 см3 формалина или кристалл тимола, чтобы избежать развитие плесени.
Способ применения. Квасцовый кармин применяется главным образом для окраски тотальных препаратов. Объекты переносятся в него из воды и водой же после окончания окраски обмываются. Продолжительность пребывания объекта в краске невелика (обычно 5—• 15 мин), точно устанавливается всякий раз опытным путем. Квасцовый кармин — один из лучших красителей для тотальных препаратов. Он окрашивает элективно ядра и слабо цитоплазму. Благодаря этому им трудно перекрасить объект. Имеет весьма широкое применение.
Борный кармин. Приготовление. Кармин, 2—3 г, смешивают с 4 г буры и вместе возможно мельче растирают в ступке. Растворяют в 100 см3 воды при нагревании. После охлаждения добавляют 100 см3 70%-ного спирта. Оставляют стоять несколько недель, после чего фильтруют.
Способ применения. Окраска борным кармином представляет собой один из классических старинных методов. Используется прежде всего для окраски объектов, предназначенных для заливки. Продолжительность окраски 1—3 дня. После этого следует оттянуть избыток краски при помощи очень слабо подкисленного соляной кислотой (0,25—0,5%) 70° спирта (дифференцировка), что длится тоже от 1 до 3 дней. Дифференцировать следует до тех пор, пока из объекта перестает извлекаться краска, образующая вокруг него как бы облачко. После этого объект отмывается в чистом 70° спирте и заливается в парафин или целлоидин. Срезы не требуют дополнительной подкраски. Элективно окрашиваются ядра. Борный кармин часто применяется также для окраски тотальных препаратов. При этом лучше перекрасить объект и избыток краски оттянуть подкисленным спиртом.
Борный кармин иногда применяется также в сочетании с некоторыми другими цитоплазматическими красками.
Гематоксилин Бёмера. Приготовление. Гематоксилин 1 г, растворяют в 10 см3 96° спирта. Отдельно готовят 200 см3 10%-ных калиевых квасцов. Раствор гематоксилина к раствору квасцов добавляют постепенно в течение нескольких дней. Сначала — по каплям, затем по >/2—1 см3 за раз. Перед окрашиванием краска должна «созреть», что занимает около двух недель.
Способ применения. Гематоксилин Бёмера применяется для окраски как тотальных препаратов, так и срезов. Обычно перед исполь-чп
зованием разбавляют в 2 раза водой. Окраска непродолжительна (несколько минут). В случае если объект перекрашен, возможно оттянуть избыток краски подкисленным спиртом. В этих случаях получаются более отчетливые картины, чем при прогрессивной окраске. С?резы после окраски длительно отмывают в сырой воде, где они приобретают сиреневый оттенок.
При окраске срезов гематоксилин Бремера часто комбинируется с какой-нибудь протоплазматической окраской, например эозином.
Кислый гематоксилин Эрлиха. Приготовление. Гематоксилина 2 г растворяют в 100 см3 96° спирта. Прибавляют 100 см3 дистиллированной воды, 100 см3 чистого глицерина, 3 г калиевых квасцов и 10 см3 ледяной уксусной кислоты. Получающийся светло-красный раствор должен «созревать» не менее 14 дней в открытой бутыли. Цвет его при этом меняется на вишнево-красный.
Способ применения. Дает хорошие результаты при окраске срезов; Иногда применяется и для тотальных препаратов. Продолжительность пребывания срезов в краске 2—6 мин. После окраски длительная промывка в водопроводной воде. В результате элективная синяя окраска ядер. Возможно комбинирование с кислыми цитоплазматическими красками.
Железный гематоксилин Гейденгайна. Один из наиболее широко распространенных красителей, дающих прекрасные результаты при окраске как срезов, так и небольших объектов in toto. В отличие от предыдущих методов железный гематоксилин относится к числу красок, для которых требуется предварительная протрава и последующая (после окраски) дифференцировка.
Приготовление. 0,5 г гематоксилина растворить в 10 см3 96° спирта. Разбавить 90 см3 дистиллированной воды. Раствор должен «созревать» в открытом сосуде 3—4 недели. Перед использованием разбавляется в два раза водой. В качестве протравы служит 3%-ный раствор железно-аммиачных квасцов. Дифференцировка ведется 1,5%-ным раствором железо-аммиачных квасцов или раствором пикриновой кислоты (насыщенный водный раствор, вдвое разбавленный дистиллированной водой).
Способ применения. Срезы, или мазки, или мелкие объекты целиком из воды поступают на 6—24 ч в 3%-ные железо-аммиачные квасцы, которые служат протравой к предстоящей окраске. После квасцов быстро споласкивают водой и переносят в раствор гематоксилина на 12—24 ч. В гематоксилине объекты становятся совершенно черными и для получения препарата требуется их дифференцировать. Перед дифференцировкой объекты из гематоксилина переносят на 0,5—1 ч в дистиллированную или водопроводную воду. Дифференцировка (оттягивание избытка красителя) совершается в 1,5% -ных квасцах при постоянном контроле под микроскопом (обычно при малом увеличении). Срезы дифференцируются относительно недолго (2—5 мин в зависимости от толщины среза и характера тканей), дифференцировка мазков и тотальных препаратов занимает гораздо больше времени, иногда до 1 ч. Если малое увеличение микроскопа недостаточно для того, чтобы
понять, достигла ли дифференцировка должной степени, то срезы переносят в дистиллированную воду и рассматривают при большом увеличении. Это необходимо потому, что объектив большого увеличения имеет малое фокусное расстояние. Опускать же его в квасцы нельзя — от этого портятся линзы. Опустить объектив в дистиллированную воду можно без вреда, необходимо только протереть его потом сухой мягкой тряпкой,- Дифференцировку удобнее всего вести в чашках Петри. По окончании дифференцировки объекты основательно отмывают в проточной или часто сменяемой воде (1—2 ч) и после этого обычным способом заключают в бальзам.
Железный гематоксилин — в некотором отношении универсальный краситель. Он прекрасно выявляет не только ядра, но и разнообразные цитоплазматические структуры, которые окрашиваются в темно-синий цвет. Железный гематоксилин, особенно при окраске срезов, часто комбинируют с различными цитоплазматическими кислыми красителями, например эозином.
Хорошие результаты дает модификация окраски железным гематоксилином, предложенная Кливлендом. Основной раствор готовится по приведенной выше прописи. «Созревания» раствора не требуется. Он используется сразу по изготовлении. Препараты переводятся в раствор гематоксилина на 30—60 мин из 4%-кого раствора железоаммиачных квасцов без промывания. Дифференцировка в 4%-ных железоаммиачных квасцах или в растворе пикриновой кислоты (по приведенной выше прописи). После дифференцировки промывка в проточной воде, спирты, доведение до бальзама по обычной схеме.
Эозин. Растворы эозина употребляются главным образом для подкраски окрашенных гематоксилином препаратов. Придает протоплазме розоватый оттенок.
Приготовление. Существуют две разновидности эозина, один из них растворим в воде, другой — в спирте. Употребляются в виде слабых (0,1%-ных) растворов.
Способ применения. В водный эозин препараты переносятся из воды на непродолжительный срок (обычно не более 5 мин). После отмывки в воде проводятся через спирты обычным способом. Воднорастворимый эозин в спиртах оттягивается слабо, поэтому перекрашивать им препарат не следует. Окраска спиртовым эозином производится при проведении препарата через набор спиртов между 70 и 96° спиртом. Он легко оттягивается спиртом. Поэтому в тех случаях, когда препарат перекрашен, выдерживая его в спирту, легко оттянуть избыток эозина.
Оранж G. Подобно эозину, служит для подкраски протоплазмы после различных «ядерных» красок.
Приготовление. Применяется обычно в виде 0,5%-ного водного раствора.
Способ применения. Тот же, что и для воднорастворимого эозина; спиртом оттягивается слабо.
Лихтгрюн. Так же, как эозин и оранж G, представляет собой кислый протоплазматический краситель, употребляемый в комбинации с различными основными красителями.
Приготовление. Употребляется 0,1%-ный раствор на 96й спирте.
Способ применения. Тот же, что и растворимого в спирте эозина. Слабо оттягивается спиртами, поэтому перекраска препарата нежелательна.
Кроме эозина, оранжа и лихтгрюна — наиболее распространенных кислых протоплазматических красителей — с успехом можно применять для аналогичных целей 0,1%-ный водный раствор кислого фуксина (красная окраска), 0,5%-ный водный бордо (красная), слабый раствор пикриновой кислоты (желтая).
Метиловый зеленый. Имеются некоторые красители, которые используются без предварительной фиксации объекта, являясь одновременно и фиксаторами и красителями; они служат обычно для быстрой ориентировочной окраски, для выявления ядер. Из них часто применяются, особенно при изучении простейших, метиловый зеленый и уксуснокислый кармин.
Приготовление. Метиловый зеленый растворяется в 1%-ной уксусной кислоте. Приготовляется крепкий (2—3%-ный) раствор. Точная концентрация краски не существенна.
Способ применения. Краситель действует непосредственно на живой объект. При окраске мелких животных подпускают каплю метилового зеленого под покровное стекло. При этом наиболее отчетливые картины получаются в зоне соприкосновения красителя с той средой, в которой плавают животные. Уксусная кислота фиксирует объект, ядра же одновременно окрашиваются в зеленый цвет.
Уксуснокислый кармин. Приготовление. Сухой, растертый в порошок кармин растворяют при кипячении в 40%-ной уксусной кислоте. Употребляют насыщенный раствор. По охлаждении фильтруют.
Способ применения. Тот же, что и метилового зеленого. Изучение ведется непосредственно в самом растворе красителя. Ядра (хроматин) окрашиваются в красный цвет.
Окраска кармином по Блажииу. Особый характер носит применяемая для Cestoidea и Trematoda окраска по Блажину, при которой объект окрашивается без предварительной фиксации.
Приготовление. Готовятся два раствора: 1) 0,3 г кармина растворяют в 100 см3 30%-ной молочной кислоты; 2) к 100 см3 воды добавляют три капли полуторахлорного железа (liquor ferri sesquichlo-rati) и две капли 1%-ной карболовой кислоты.
Способ применения. Цестоды или трематоды мацерируют в воде 3—4 суток (меняют воду). При высокой температуре (например, летом) срок мацерации сокращается до 1 суток. Переносят на 4—6 ч в краситель (контроль под микроскопом или под лупой). После окраски основательно обмывают водой и помещают на 16—24 ч в раствор полуторахлорного железа. Оттенок окраски при этом становится коричнево-черным. После вторичной промывки в воде можно поступать двояким образом: либо обычным путем заключить объект в бальзам, либо предварительно высушить его на предметном стекле (при 35—40°С) и после этого залить бальзамом. Первый способ удобнее применять для относительно мелких объектов, второй — для крупных члеников Cestoi-
dea. При заключении в бальзам Trematoda рекомендуется основательно сплющивать.
Метод Блажина дает исключительно четкие картины анатомического строения на тотальных препаратах.
Комбинация гематоксилина с кислыми красителями. В микроскопической технике очень часто применяются разнообразные комбинированные способы окраски, включающие как основные, так и кислые красители, а также импрегнацию тканей металлами. Мы упомянем некоторые наиболее распространенные методы, применяемые в зоологической практике.
В большинстве случаев, особенно при окраске срезов, различные гематоксилины сочетаются с подкраской кислыми красителями. Это позволяет на препаратах получить большие контрасты в окраске ядерных и цитоплазматических структур. О способах применения цитоплазматических красителей уже говорилось выше.
Окраска по Ван Гизону (пикрофуксин). Используется для подкраски окрашенных гематоксилином срезов.
Приготовление. К 100 см3 насыщенного водного раствора пикриновой кислоты прилить 10 см3 раствора (водного) кислого фуксина.
Способ применения. Препараты предварительно несколькс перекрашивают .гематоксилином. Споласкивают сначала водой, затек подкисленным спиртом (не более 1 мин), после чего переносят на 2— 3 мин в раствор пикрофуксина. Затем следует вновь вода, подкисленныг спирт и, наконец, обезвоживание и ксилол.
Предварительная перекраска гематоксилином необходима потому что пикрофуксин несколько оттягивает краску. На удавшихся препара тах мышцы и соединительная ткань окрашиваются в желтые и красные тона, ядра — в коричневатые.
Окраска по Маллори. Приготовление. Готовят три раствора последовательно используемых для окраски:
1) 0,5%-ный водный раствор кислого фуксина;
2) 1%-ная фосфорно-молибденовая кислота;
3) смесь: анилиновый синий 0,5 г, оранж G 2 г, щавелевая кислот; 2 г, дистиллированная вода 100 см3.
Способ применения. Используется для окраски срезов. Луч ше, чтобы толщина последних не превышала 10 мкм. Из воды препара' переносят на 2—3 мин в раствор фуксина, после чего споласкивают во дой и 2—3 мин выдерживают в фосфорно-молибденовой кислоте За ней следуют вода и смесь анилинового синего, G оранжа и щавеле вой кислоты (1—2 мин). Быстрое споласкивание в воде (не обязатель но), откуда препарат прямо поступает в 96° спирт, а затем в карбол ксилол и ксилол. Спирты сильно оттягивают красители (особенно ани линовый синий), поэтому обезвоживание следует проводить очен быстро.
Окраска по Маллори дает очень эффектные гистологические карти ны, отдельные гистологические элементы отчетливо дифференцировань: ядра красные, мышцы фиолетовые, соединительные прослойки голубы;
Окраска по Маллори возможна при известных навыках. Указанны выше сроки приблизительны, нередко их приходится менять. Одна и
наиболее часто встречающихся ошибок — перекраска в смеси с анилиновым синим. Последнее приводит к тому, что препарат получается очень темный и красная окраска ядер исчезает.
Метод Маллори широко применяется при изучении различных групп животных. Он не годится после фиксаторов, содержащих осмиевую кислоту. Не применяется также после фиксации формалином.
Окраска эозин-азуром. Применяется для окраски срезов.
Приготовление. Исходным материалом для приготовления красителя служат следующие два основных раствора: 1) 0,1%-ный воднорастворимый эозин; 2) 0,1%-ный водный раствор азур II. Непосредственно перед использованием 10 см3 эозина разбавляют 100 см3 дистиллированной воды и, постоянно взбалтывая, приливают 10 см3 раствора азура II. В таком виде смесь долго храниться не может — выпадает осадок, поэтому всякий раз приготовляют свежую.
Способ применения. Срезы из дистиллированной воды поступают на 6—24 ч в смесь эозин-азура. Следует следить, чтобы во время окрашивания не выпал осадок. В случае появления его — сменить краситель. Дифференцировка (несколько минут) в 96° спирте. Быстро обезводить в абсолютном спирте, провести через 2—3 порции чистого ксилола и заключить в бальзам.
Не применяется после осмиевых фиксаторов.
В хорошо окрашенных препаратах хроматин окрашивается в синий цвет, ядрышки — в розовый, цитоплазматические структуры — в метиленовый от розового до голубого.
Окраска по Романовскому—Гимза. Приготовление. Применяется почти исключительно для окраски мазков крови. Содержит метиленовый синий и эозин. Смесь (основной раствор) покупают в готовом виде и лишь разводят дистиллированной водой перед использованием (с. 166). Иногда приходится иметь дело со смесью в порошке. Обычно в сухом виде он продается в капсюлях, рассчитанных на изготовление 100, 50 и 25 см3 основного раствора. Порошок растворяется при нагревании до 60°С в смеси равных объемов метилового спирта и глицерина. Реактивы должны быть химически чистыми, посуда желательно йенская. От качества реактивов и чистоты посуды в значительной мере зависит успех последующей окраски, так как метод исключительно «чувствительный» к изменениям химического состава растворителей.
Способ применения. При окраске кровяных мазков (последние фиксируются в течение 3 мин в метиловом спирте или в смеси абсолютного спирта с эфиром 20 мин) разведенный краситель наливают на высушенный на воздухе препарат. Разведение следующее: 1 капля красителя на 1 см3 дистиллированной воды (0,2 см3 краски на 10 см3 воды). Срок окрашивания — 30 мин, после чего препарат споласкивают водой и высушивают на воздухе (без подогревания!). Кровяные мазки обычно рассматривают без заключения в бальзам.
Для окраски срезов используется более сильно разведенный краситель (0,5 см3 красителя на 50 см3 воды), причем срок окраски удлиняется до 12 ч. После промывки в воде обезвоживание производится в смеси ацетона с ксилолом в следующей последовательности. Сначала препарат из воды помещают в смесь из 95 см3 ацетона и 5 см3 ксилола.
Далее в смесь из 70 см3 ацетона и 30 см3 ксилола, потом — ацетона 30 см3 + ксилола 70 см3. Наконец, препарат переносят в чистый ксилол и заключают в кедровое масло, дамарксилол или в нейтральный канадский бальзам.
Борный кармин с осмиевой кислотой. Применяется главным образом для паренхиматозных животных. Особенно хорошие результаты дает на пиявках.
.Способ применения. Фиксированный любым фиксатором, не содержащим осмиевую кислоту, материал окрашивают in toto борным кармином (с. 30) в течение 0,5—1 ч, дифференцируют подкисленным спиртом и промывают в воде. После этого переносят на сутки в */4— ‘/г^о-ный раствор осмиевой кислоты (обязательно в темноте!). После осмиевой кислоты быстро обмывают водой и переводят на 12—14 ч в древесный уксус (в темноте). За ним следует основательная, в течение суток, промывка в воде и заливка в парафин обычным способом. Срезы ничем дополнительно не подкрашивают.
В результате получается очень четкая гистологическая дифференцировка. Ядра красные, соединительнотканные элементы буроватые и коричневые.
Некоторые цитохимические методы
Ниже излагаются некоторые цитохимические методы, широко применяемые при зоологических работах. От обычных гистологических методик они отличаются тем, что .позволяют судить не только о морфологии, но и о химической природе изучаемых структур. Цитохимические методы применяются как при изучении ядра, так и цитоплазмы и ее включений.
Нуклеальная реакция Фёльгена. Реакция Фёльгена существенно отличается от огромного большинства других методов гистологической окраски тем, что она основана на чисто химическом принципе и представляет собой микрохимическую цветную реакцию на нуклеопротеиды дезоксирибонуклеиновой кислоты. Так как нуклеопротеиды в клетке сосредоточены почти исключительно в ядре, то реакция Фёльгена дает отчетливую окраску ядер в красно-фиолетовый цвет, причем в ядре окрашивается только хроматин. Цитоплазматические компоненты клеток г тканей остаются при этом совершенно бесцветными. По элективности г отчетливости окраски ни один гистологический метод не может срав ниться с методом Фёльгена. Самый принцип реакции сводится к еле дующему. При гидролизе в горячей соляной кислоте дезоксирибонуклеи новая кислота отщепляет входящие в состав ее молекулы пуриновые 1 пиридиновые основания. При этом освобождаются альдегидные группы При последующей обработке фуксиносернистой кислотой они образую' с последней соединение, обладающее красно-фиолетовой окраской. Та ким образом окраска ядер обязана не фуксину, а сложному соединении фуксиносернистой кислоты с альдегидом. Это ясно видно и по характе ру окраски — оттенок получается не красный, а фиолетовый.
Для реакции Фёльгена материал лучше всего фиксировать сулемо с уксусной кислотой без иодирования, с длительной промывкой в воде 36
Вполне пригодны также жидкости Шаудина и Ценкера (с уксусной кислотой). Поскольку реакция Фёльгена связана с альдегидными группами, недопустимо присутствие формалина, являющегося альдегидом и дающего цветную реакцию с фуксиносернистой кислотой. Для окраски годятся срезы, мазки, а также мелкие объекты in toto, приклеенные к предметному или покровному стеклу.
Приготовление реактивов. Для окраски по Фёльгену необходимы: нормальный раствор соляной кислоты, фуксиносернистая кислота, вода, содержащая SO2.
1. Получение нормального раствора НС1: 82,5 см3 концентрированной НС1 плотности 1,19 доливаются дистиллированной водой до объема 1000 см3.
2. Получение фуксиносернистой кислоты: 1 г мелкорастертого основного фуксина заливают 200 см3 кипящей дистиллированной воды (в колбе) и растворяют в течение 5 мин при постоянном помешивании. После охлаждения до 50°С (фильтруется в сосуд с плотно притертой пробкой, удобен цилиндрик с притертой пробкой). Добавляют 20 см3 нормального раствора соляной кислоты, после чего охлаждается далее до 25°С. При этой температуре в раствор всыпают 1 г химически чистого бисульфита натрия NaHSO3. Сосуд плотно закрывают притертой пробкой и оставляют стоять на сутки в темноте. Через 24 ч заканчивают образование фуксиносернистой кислоты, раствор полностью теряет красную окраску и становится либо совершенно бесцветным, либо получает желтоватый оттенок. Если красный цвет фуксина хоть в какой-либо степени сохранился, то реактив не годен для применения.
Настоятельно рекомендуем при изготовлении реактива совершенно точно выполнять все указанные выше манипуляции. Фуксиносернистая кислота обладает резким запахом SO2. При доступе воздуха, а также на ярком свету легко распадается, отщепляя фуксин. Поэтому хранение ее, так же как и все манипуляции по окраске препаратов, возможно лишь в герметически закрывающемся сосуде и в темноте. При соблюдении указанных условий сохраняется в течение 1,5—2 месяцев.
3. Вода, содержащая SO2, используется для промывки объектов после пребывания их в фуксиносернистой кислоте и готовится всякий раз заново. К 200 см3 воды прибавляют 10 см3 10%-кого раствора бисульфита натрия и 10 см3 нормальной соляной кислоты. При этом появляется резкий запах SO2, освобождающегося в результате реакции: NaHSO3 + HCl = NaCl + H2SO3.
Способ применения. Так же как и при изготовлении реактивов, в самом ходе окрашивания требуется большая аккуратность и точное соблюдение всех условий реакции.
Перед окраской срезы1 выдерживают в течение суток в чистом 70° спирте, чтобы извлечь из протоплазмы все альдегиды, которые в небольшом количестве могли бы в ней оказаться. Из спирта объекты переносят в дистиллированную воду. Далее с ними производят следующие манипуляции.
1 Срезы, или мазки, или мелкие объекты, приклеенные к предметному стеклу. Для краткости речь будет идти только о срезах.
1. Гидролиз в нормальном растворе НС1 при температуре 60°С в течение 3—.5 мин (можно в водяной бане, куда помещают стаканчик с НС1). Термометр непосредственно опускают в соляную кислоту. Удобно повесить его в штативе.
Вместо металлической водяной бани можно рекомендовать следующую установку из двух химических стаканов: один большой (объем не менее 500 см3), другой — значительно меньше (100—150 см3); меньший стакан укрепляют внутри большого при помощи проволочного держателя таким образом, чтобы стенки обоих стаканов не соприкасались. В большой (наружный) стакан наливают воду, в маленький (внутренний) — соляную кислоту. Оба стакана укрепляют в штативе и во внутренний из них опускают термометр. Нагревание производят при помощи спиртовой горелки.
2. Гидролиз прерывают опусканием объекта в холодный нормальный раствор соляной кислоты.
3. Из соляной кислоты препараты поступают в фуксиносернистую кислоту на 1—3 ч в плотно закрытом сосуде при комнатной температуре.
4. После фуксиносернистой кислоты — промывка в 2—3 порциях воды, содержащей SO2.
5. Промывка в дистиллированной воде.
6. Спирты возрастающей крепости, ксилол, бальзам.
Применение воды, содержащей SO2, необходимо, так как при перенесении объекта из фуксиносернистой кислоты в простую воду сейчас же происходит разрушение кислоты и выделение фуксина, который окрашивает дополнительно объект. В воде с SO2 этого не происходит. Лишь после основательной отмывки фуксиносернистой кислоты возможно опустить препарат в чистую воду.
При окраске по Фёльгену окрашенными оказываются только ядра Протоплазма совершенно бесцветна. Для ее выявления препарат в дополнение к Фёльгену можно подкрасить каким-нибудь цитоплазматическим красителем, желательно не красным, например лихтгрюном.
Ни один другой метод окрашивания не даст таких исключительнс отчетливых картин строения ядер, как метод Фёльгена. Он может быт! использован при окраске различных объектов, но особенно удобен ДЛ5 некоторых Protozoa.
В последние годы широкое распространение получила модификацщ нуклеальной реакции Фёльгена, предложенная Лилли. Ее следует при менять на объектах, у которых ядра относительно бедны хроматином ибо. она дает более яркое окрашивание, чем «классический» метод. Со гласно прописи Лилли фуксиносернистую кислоту готовят следующие образом. 1 г основного фуксина и 1,9 г химически чистого бисульфит; натрия растворяют в 100 мл 0,15 нормального раствора НС1. Раство] встряхивают при комнатной температуре в течение 2 ч (с помощью ме ханической мешалки или вручную). Растворение ведется в сосуде с при тертой пробкой. За это время раствор обесцвечивается (становитс: желтоватым и прозрачным). Затем добавляют 500 мг активированноп угля в порошке и раствор встряхивают еще 2—3 мин, после чего еп фильтруют и помещают в сосуде с притертой пробкой в холодильни (0—4°С), где он и хранится.
Обработка препарата ведется сначала, как при «классическом» методе. После гидролиза в нормальном растворе HCI препарат переносят на сутки в холодный раствор фуксиносернистой кислоты, изготовленной по указанной выше методике (в холодильнике). Дальнейшая обработка — как при «классическом» методе.
Метиловый зеленый — пиронин для выявления нуклеиновых кислот. Существует несколько прописей этого метода, впервые введенного Пап-пенгеймом. Фиксация объекта осуществляется 10—20%-ным нейтральным формалином или смесями Карнуа или Ценкер формолом. Окрашиваются срезы, мазки или тотальные препараты очень мелких объектов (мелкие инфузории и т. п.). Фиксация осмиевыми смесями непригодна.
Приготовление раствора. Первый вариант. Метиловый зеленый кристаллический 0,15 г, пиронин 0,25 г, 96° этиловый спирт 2,5 мл, глицерин 20,0 мл, 0,5%-ный водный раствор карболовой кислоты 100 мл.
Второй вариант. Готовится два раствора. Раствор А: 5%-ный водный раствор пиронина 17,5 мл, 2%-ный раствор метилового зеленого 10,0 мл, дистиллированной воды 250 мл. Раствор Б: 51,5 мл 0,2 М, 48,5 мл 0,1 М лимонной кислоты (pH этой смеси должно быть равно 5,0). Перед использованием смеси А и Б смешиваются в равных объемах. В таком виде смесь хранится около недели, после чего ее готовят заново, используя основные растворы А и Б. В раствор красителей препараты переводятся из воды. Продолжительность окраски варьирует в широком диапазоне от 20 мин до суток. Она зависит от фиксации, количества хроматина в ядрах изучаемого объекта и т. п. После красителя быстрое (мгновенное) споласкивание в дистиллированной воде. Удаление воды фильтровальной бумагой с левой стороны предметного стекла. Быстрое обезвоживание в 2—3 порциях (стаканчиках) абсолютного спирта. При этом происходит дифференцировка, оттягивание излишней краски. Длительное пребывание в абсолютном спирте обесцвечивает препарат. Из абсолютного спирта в ксилол с ацетоном (1 : 1), чистый ксилол и бальзам (обязательно нейтральный, иначе препарат быстро обесцветится).
На хороших препаратах ядерный хроматин (ДНП) окрашивается в зеленый цвет, ядрышки (содержащие РНК) — в красный цвет, также как и РНК цитоплазмы. Кроме РНК слабо окрашивается пиронином и основное вещество цитоплазмы.
Нужно иметь в виду, что метиловый зеленый нередко содержит примесь метилового фиолетового. Для очищения красителя от этой примеси (которая портит весь результат окраски) краситель надо обработать хлороформом, который не растворяет метиловый зеленый и растворяет метиловый фиолетовый. После обработки хлороформом краситель высушивают.
Методы выявления полисахаридов (гликогена и амилопектина)
Среди довольно многочисленных методов цитохимического выявления полисахаридов остановимся лишь на двух наиболее распространенных в практике зоологических исследований. При любой методике вы
явления полисахаридов в клетке и тканях необходимо иметь контрольные препараты, на которых полисахариды растворяются действием специфических ферментов — птиалина (присутствует в слюне) или диастаза (присутствует в прорастающих семенах растений). Сопоставление препаратов, обработанных и не обработанных ферментами, позволяет сделать вывод о том, в какой мере окраска связана с наличием полисахаридов.
Жидкость Люголя. Применяется для окрашивания полисахаридов главным образом у простейших (инфузорий), а также мелких объектов в цикле развития плоских червей (мирацидиев, церкарий, личинок цес-тод и т. п.).
Приготовление. Жидкость Люголя представляет собой раствор иода в иодистом калии. Основной раствор приготовляется следующим образом: дистиллированной воды 300 мл, йодистого калия химически чистого 1 г, иода кристаллического 1 г.
Способ применения. Разбавляется в большей или меньшей мере дистиллированной водой в зависимости от размера объекта и богатства его гликогеном или амилопектином. Последние окрашиваются жидкостью Люголя в красно-коричневый цвет.
Жидкостью Люголя действуют как на живые, так и на фиксированные объекты. При фиксации лучше применять фиксаторы, не содержащие воду (например, абсолютный спирт), так как в воде гликоген постепенно растворяется (в холодной воде медленно, в теплой довольно быстро).
Метод ШИК (реактив Шиффа и иодная кислота). Эта методика применяется для окрашивания срезов и дает очень четкие и наглядные результаты. Фиксируется материал жидкостью Карнуа (см. выше). Годится также жидкость Ценкера с формалином. Для окрашивания используют фуксиносернистую кислоту (реактив Шиффа), изготовляемую так же, как и для реакции Фёльгена (в ее «классическом» варианте). Реакция проводится следующим образом.
1. Срезы на предметном стекле, отмытые предварительно в воде, подвергаются окислению. Оно проводится в 0,5% растворе иодной кислоты (Н1О4-2Н2О) в течение 2—5 мин (время подбирается экспериментально для изучаемого объекта).
2. После отмывки в дистиллированной воде проводится обработка срезов реактивом Шиффа (фуксиносернистой кислотой) при комнатной температуре в течение 10—15 мин.
3. Отмывка в нескольких порциях дистиллированной воды и под. краска ядер каким-либо ядерным красителем (например, гематоксилином Бёмера или слабым раствором метиловой зелени).
4. Обезвоживание в спиртах нарастающей крепости, просветление в ксилоле, заключение в канадский бальзам.
Полисахариды элективно окрашиваются в красно-фиолетовый цвет (такой же, как хроматин при реакции Фёльгена). Белки, содержащие углеводы (гликопротеиды), окрашиваются так же, но менее интенсивно.
Методы выявления жировых включений
Приведем два метода, из которых один применяется преимущественно для тотальных препаратов, второй — для срезов.
Окраска жировых включений Суданом III. Эта методика дает результаты при обработке мелких объектов (на тотальных препаратах), как-то: инфузорий, личинок паразитических червей, ресничных червей, мелких ракообразных и т. п. Материал для окрашивания фиксируется формалином или какой-либо фиксирующей смесью, не содержащей спирта. Последний очень быстро растворяет жировые включения. Перед окраской объект рекомендуется на короткий срок поместить в 50 %-ный спирт, ибо при соприкосновении раствора Судана III с водой могут выпасть кристаллы красителя. Готовят насыщенный раствор Судана III на 70° спирте. Для этого 0,3 г красителя заливается 100 мл горячего 70° этилового спирта. В хорошо закрытом сосуде раствор ставят на сутки в термостат при температуре между 50—60°С и после этого фильтруют. Сохраняют в сосуде с хорошо притертой пробкой.
Фиксированные формалином объекты промывают в 50° (не крепче!) спирте и переносят в раствор Судана III на 20—30 мин. За этим следу; ет промывка в 50° спирте и заключение в глицерин, в котором и ведется изучение объекта. Жировые включения (капли) оказываются окрашенными в яркий оранжево-красный цвет, все остальные части клеток не окрашиваются.
Обработка жировых включений осмиевой кислотой. Эти методы в цитохимическом плане менее специфичны для жировых включений, чем окраска Суданом III, ибо осмиевая кислота (вернее, четырехокись осмия — OsO4) кроме липидов может вычеркивать и ряд других включений иной химической природы. Полученные этими методами результаты следует сопоставлять с результатами других методик (окраска Суданом III, растворение в органических растворителях и др.). Осмиевые методы обнаружения жировых включений используются главным образом при изучении срезов.
Материал фиксируют в течение суток или 2%-ным раствором OsO4, или одним из названных выше фиксаторов, содержащих осмиевую кислоту (с. 13). Тщательно отмывают в нескольких порциях дистиллированной воды (в течение суток и более). Затем следует по обычной методике заливка в парафин. Однако при проведении материала через 70° спирт вставляют одно дополнительное звено — 70° спирт, в который добавляют небольшое количество сернистого натрия (NaS) (примерно один кристалл на солонку). В этом растворе объект пребывает около часа. При этом образовавшиеся в результате реагирования OsO4 с жирами низшие окислы осмия (OsO2), которые имеют темную окраску, превращаются в сернистый осмий (OsS). Это необходимо потому, что низшие окислы осмия растворимы в ксилоле и цри заливке растворятся. Сернистый осмий нерастворим ни в спирте, ни в ксилоле. После основательной отмывки в чистом 70° спирте объект заливают обычным способом и режут на микротоме. Возможна дополнительная подкраска ядра и цитоплазмы. В результате жировые включения видны в форме черных, капель.
Прижизненные красители. При изучении живых объектов, особенно обладающих небольшими размерами, нередко применяется окрашивание витальными красителями, т. е. такими, которые в известных концентрациях окрашивают объект, не убивая его. Различают основные и кислые витальные красители, причем при зоологических работах чаще применяются первые.
Необходимо отметить, что при обычных условиях витальные красители не окрашивают ядра живой клетки или в очень малой степени окрашивают основное вещество протоплазмы. Краски адсорбируются главным образом различными клеточными включениями. При длительном воздействии на клетки краски откладываются в протоплазме в виде гранул.
Мы не можем здесь рассматривать теорию витального окрашивания и ограничимся указанием некоторых наиболее распространенных основных красителей.
Нейтральный красный особенно часто применяется для витального окрашивания простейших, при изучении у них процессов внутриклеточного пищеварения и т. д. Применяется в очень слабых концентрациях от 0,1 до 0,001 %-ного. В более крепких концентрациях убивает клетку. Нейтральный красный является индикатором. В кислой среде он имеет ярко-красный оттенок, в щелочной — желтоватый.
Конго красный дает коллоидные растворы с малой степенью дисперсности, поэтому лишь с трудом проникает в протоплазму. Является индикатором, в кислой среде синий, в щелочной — красный. Применяется главным образом при изучении внутриклеточного пищеварения.
Метиленовый синий — один из обычных витальных красителей. Применяется, как и нейтральный красный, в очень слабых концентрациях. Иногда служит для окрашивания некоторых систем органов — нервной системы, выделительной системы (например, у Dinophilus).
Янус зеленый занимает среди прижизненных красителей особое положение. Он окрашивает избирательно митохондрии. Используются очень слабые водные растворы (0,01—0,05%-ные). Окраску объекта лучше вести, не покрывая покровным стеклом. Это связано с тем, что для окраски митохондрий необходимо наличие свободного кислорода. Продолжительность окраски 20—30 мин.
Вскрытие
Все вскрытия производятся в препаровальной ванночке под водой, если только не оговаривается особо.
Дно препаровальной ванночки должно состоять из восковой массы. Для приготовления восковой массы используется обыкновенный пчелиный воск, смешанный с топленым салом в пропорции 4:1. Смесь растапливается на огне, и к ней прибавляется немного голландской сажи. После основательного промешивания горячую массу выливают в нагретую ванночку. Можно массу приготовить также из смеси равных количеств воска и вара. В ванночке по углам припаиваются угольники, чтобы восковая масса не отставала от дна после остывания. При вскрытиях следует соблюдать следующие правила.
1. Орган или животное, подлежащее вскрытию, прочно прикрепляют ко дну ванночки булавками, которые следует втыкать в самые плотные части препарата, наиболее удаленные от препарируемого места.
2. Никогда не следует производить вскрытия под грязной водой. Если вода становится мутной, что может зависеть от разных причин, то объект следует промыть под слабой струей воды и сменить воду в ванночке.
3. Не следует ничего отрезать и удалять без надобности. Удаляются после внимательного рассмотрения только те части и органы, которые мешают дальнейшему вскрытию или исследованию.
4. После употребления инструменты следует тщательно обтереть и обсушить, а сочленение ножниц смазать маслом. В особенности необходим тщательный уход за инструментами, употребляющимися при вскрытии в морской воде, от которой они быстро ржавеют и портятся.
Инъекция
В некоторых случаях, преимущественно при вскрытиях, приходится прибегать к методу инъекции, т. е. наполнению краской сосудов или других полостей с целью изучения их топографии, отношения к окружающим органам и т. д.
Иногда, например при инъекции пищеварительной и выделительной систем у Fasciola или выделительных каналов у Cestoidea, употребляются простые пипетки с резиновой грушей. Конец такой пипетки легко оттянуть до нужной толщины на пламени спиртовой горелки.
Все прочие инъекции, рекомендуемые в специальной части руководства, могут быть произведены шприцем «Рекорд» средней емкости (15— 20 см3). Кроме того, необходимо иметь иглы для шприца различных номеров, канюли с небольшим вздутием на конце, за которое могла бы зацепиться нитка при перевязке, и тонкие обыкновенные нитки или лучше хирургический шелк. Необходима также резиновая трубочка длиной в несколько сантиметров такого диаметра, чтобы ею можно было соединить носик шприца с канюлей.
Канюлю можно изготовить самому из тонкой иглы для шприца. Конец иглы в том месте, где начинается заострение, смачивают травленой соляной кислотой (дымящейся соляной кислотой, в которой до насыщения растворен металлический цинк). Далее на это место кладут небольшой кусочек припоя (сплава 1 части свинца с 2 частями олова) и нагревают его на пламени спиртовой или газовой горелки. В результате сплав оплавляет кругом конец иглы, образуя головку. Заостренный конец иглы стачивается напильником. Головка канюли должна быть по возможности маленькой и яйцевидной.
В качестве инъекционной краски может служить берлинская лазурь или окрашенная желатиновая масса. Берлинская лазурь разводится водой (чайная ложка краски на 100—200 см3 воды). Перед употреблением эту жидкость хорошенько размешивают. Для получения желатиновой массы обыкновенная столовая желатина распускается в небольшом количестве горячей воды и подкрашивается кармином или другим красителем. Эта масса при инъекции должна быть достаточно нагрета.
Инъецируемое животное помещается в- теплую воду, в которой должно пролежать 30 мин до инъекции. После инъекции препарат переносят в холодную воду, и наполняющая сосуды желатина застывает.
Самый процесс инъекции производится под водой или вне ее в зависимости от обстоятельств. Нередко достаточно ввести в полость сосуда иглу шприца, проткнув ею стенку сосуда в косом направлении. При впрыскивании получаются вполне удовлетворительные результаты, хотя часть красителя и попадает в воду. Иногда же такой способ недостаточен и приходится, сделав небольшой надрез на сосуде, вводить в него канюлю, которая затем перевязывается вместе со стенками сосуда ниткой. В этом случае для удобства манипуляций необходимо, чтобы канюля была соединена с носиком шприца резиновой трубочкой.
Конец инъекции определяется по наполнению сосудов, что часто можно наблюдать непосредственно. В тех же случаях, когда не все сосуды отпрепарированы, окончание инъекции узнается по некоторому растяжению соответствующих органов и частей препарата, что устанавливается путем опыта. Если употреблялась берлинская лазурь, то после того как инъекция закончена, препарат помещают на некоторое время в 70° спирт, от действия которого частицы берлинской лазури оседают на стенках сосудов. Такое же действие оказывает морская вода, поэтому если инъекция производится на морском животном, то необходимо предварительно промыть препарат пресной водой и инъецировать в пресной воде, а затем сменить пресную воду на морскую.
Часто для того чтобы наполнить краской всю кровеносную систему, приходится инъецировать несколько раз в различные сосуды. Иногда удобнее инъекции отдельных частей кровеносной системы производить на разных экземплярах животного. При инъекциях необходимо соблюдать следующие условия.
1. Инъекцию всегда следует производить на свежеубитом животном.
2. В наполненном инъекционной жидкостью шприце не должно быть воздуха. Перед инъекцией шприц следует повернуть иглой или канюлей кверху и изгнать из него воздух перемещением поршня.
3. Никогда не следует сначала вводить в сосуд иглу или канюлю, а затем уже надевать иглу или канюлю на носик шприца. Это неудобно и приводит к тому, что в полость сосудов вместе с краской попадают пузырьки воздуха.
4. Если сосуд вскрывают для введения в него канюли, то нужно выпустить как можно больше крови. Прежде чем ввести канюлю, препарат следует тщательно промыть.
5. Перед инъекцией следует пропустить вокруг сосуда нитку, завязав ее неплотным узлом. По удалении иглы или канюли наполненный красителем сосуд немедленно перевязывается, для чего достаточно плотно затянуть узел.
6. Инъекцию следует производить при равномерном давлении. Если встретится сопротивление, то следует, прервав операцию, выяснить причину задержки и по возможности устранить ее. Чаще всего причиной служит сопротивление сети мелких сосудов или лакун. Для устра
I
нения его можно проколоть один-два крупных сосуда на удаленном по возможности расстоянии от того места, где производится инъекция. Так, при инъецировании в артерию прокалывают вену, и наоборот.
Рисование при прохождении зоологического практикума
Особое внимание при прохождении зоологического практикума следует уделять рисованию изучаемых объектов. Необходимо твердо помнить, что только рисуя объект, можно правильно понять и основательно его изучить. В процессе рисования фиксируется внимание на тех деталях, которые ускользают при простом просмотре препарата. Можно сказать, что тот, кто не делает рисунков, теряет половину, если не больше, того, что может дать практикум. Рисование объекта должно быть одним из основных методов его изучения.
При неумении рисовать занимающийся нередко склонен обходиться без рисования или рисовать с большой неохотой. Однако надо иметь в виду, что морфологический рисунок представляет собой рисунок технический, которому может научиться всякий. Поэтому неумение рисовать не должно смущать начинающего. Как показывает практика, способность правильно изобразить объект достигается постепенно в процессе работы.
В начале прохождения практикума все рисунки следует делать без помощи рисовального аппарата, срисовывая препарат на глаз, ибо только таким образом можно научиться рисованию. Выполнение этого условия обязательно для каждого начинающего. Лишь после того как техника рисунка с натуры усвоена, можно пользоваться рисовальным аппаратом.
Рисовать следует на плотной и гладкой бумаге, выдерживающей стирание резинкой. Рисунки, как правило, рекомендуется делать карандашом. Однако желательно, чтобы постепенно, по мере прохождения практикума, занимающийся научился рисовать пером и кистью так называемые чистые рисунки, годные для воспроизведения в печати.
При разборе организации отдельного животного, в особенности на живых объектах или при вскрытиях и препаровках и даже на микроскопических препаратах, очень полезно делать предварительные черновые наброски и схемы. В некоторых случаях обойтись без них совершенно невозможно.
Часто организация животного разбирается на серии срезов. В этих случаях рисунки делаются двух родов в зависимости от поставленной цели. Если изучается анатомия животного, то зарисовывается несколько отдельных наиболее важных и интересных срезов, причем внимание обращается только на анатомические соотношения органов, а гистологические детали опускаются.
На рисунках этого типа изображаются лишь контуры органов, попавших на срез. Отдельные органы или их системы закрашиваются условными цветами акварельными красками или карандашами. Каждый срез рисуется на отдельном листке бумаги, а затем листки склеиваются гармоникой, при разворачивании которой можно обозреть всю се
рию целиком. Помимо этого, желательно изготовление схемы общего плана строения или отдельных систем органов изучаемого животного. Если такая схема не воспроизводится с помощью одного из методов реконструкции по срезам, то ее следует построить на глаз.
Анатомические рисунки необходимо дополнять гистологическими, которые должны возможно точнее передавать структуру и взаимоотношения тканевых элементов.
В рисунках, изображающих внешнюю морфологию животного или картину вскрытия, главное внимание нужно обращать на точность и четкость контуров. Накладка теней имеет второстепенное значение, и в тех случаях, когда она сопряжена с затратой большого количества времени и труда, можно ограничиться лишь теми тенями, которые необходимы для ясности рисунка.
Вообще любой рисунок, даже очень детальный, всегда имеет известную долю схематизации, чем отличается от фотографии. Кроме того, на рисунках нередко подчеркиваются и оттеняются те детали, которые имеют особое значение. Степень схематизации может быть различной в зависимости от назначения рисунка. Поэтому сплошь и рядом законченным рисунком можно считать рисунок контурный, тогда как в других случаях требуется тушовка, накладка теней и т. д. Искусство схематизировать рисунки в нужной мере приобретается опытом. Следует, однако, предостеречь против чрезмерной схематизации рисунка. Нужно помнить, что всякий рисунок должен быть прежде всего рисунком с натуры.
При прохождении большого практикума занимающийся должен обладать техникой микрофотографирования. Надо научиться снимать живые объекты, а также гистологические препараты. Нередко целесообразно сочетать фотографию и рисунок. С фотографии снимается через кальку контур снятого объекта, который используется затем для изготовления рисунка. Такое сочетание фотографии и рисунка одного и того же объекта дает хорошие результаты при изучении объекта.
Методы реконструкций по срезам
Многие морфологические объекты, например органы и их системы у некоторых животных, слишком малы и вместе с тем слишком сложны для того, чтобы можно было получить правильное представление об их форме путем простого вскрытия, препаровки, рассматривания в лупу или при слабом увеличении микроскопа. С другой стороны, они настолько велики, что изучение их на отдельном срезе невозможно. В таких случаях прибегают к методу реконструкции, т. е. к построению целостных картин данного объекта по следующим друг за другом срезам серии.
Реконструкции по срезам могут быть плоскостными, т. е. чисто графическими, или же телесными — пластическими.
В первом случае изображение реконструируемого объекта получается на бумаге в двух измерениях, и форма отдельных частей может быть показана лишь накладкой теней в соответствующих местах. Плас
тические реконструкции представляют собой телесные модели в трех измерениях. В обоих случаях реконструкция всегда связана с определенным увеличением действительных размеров объекта. Графические реконструкции технически более просты и нередко применяются как вспомогательный метод.
Все способы реконструкций кропотливы и отнимают много времени. Поэтому к ним следует прибегать лишь в тех случаях, когда другие методы (вскрытие, препаровка, инъекция и т. д.) оказываются недостаточными или невозможными. Объект, предназначенный для реконструкции, должен быть возможно точно ориентирован во время заливки. Мелкие объекты ориентируют на целлоидиновых пластинках (с. 24). Следует поставить себе за правило при изготовлении срезов поперечную серию начинать резать с переднего конца животного, фронтальную со спинной, а сагиттальную с правой стороны тела. Соблюдение этого условия позволяет избежать ошибки при определении правой и левой сторон на срезах. Для приготовления любой реконструкции необходимо иметь серию срезов без пропусков. Срезы должны быть одинаковой толщины, и толщина должна быть точно известной. В зависимости от величины и характера объекта, а также способности его резаться на микротоме применяются срезы толщиной в 5; 7,5; 10; 15 и 20 мкм. Все срезы должны быть совершенно равными, без складок и смещений отдельных частей.
При реконструкциях приходится накладывать изображение (или проекции главных точек) среза на предыдущий и совмещать его с последующим. Поэтому для правильной ориентировки срезов по отношению друг к другу иногда возникает необходимость в специальных ориентировочных линиях, получаемых рядом с каждым срезом. Однако в большинстве случаев (в частности, при реконструкциях, изготовление коих рекомендуется в настоящем руководстве) ориентировочные линии излишни. Они могут быть заменены некоторыми наиболее постоянными, т. е. наименее изменяющимися от среза к срезу элементами самих срезов, как-то: нервами, кровеносными сосудами, наружными контурами тела и т. п.
Для построения реконструкции приходится рисовать все срезы, на которых имеются реконструируемые части. Рисование производится обязательно с помощью рисовального аппарата на отдельных листках бумаги. Все рисунки нумеруются в порядке номеров срезов. Увеличение всех изображений срезов должно быть одинаково. При рисовании достаточно изображать лишь внешний контур среза и очертания реконструируемых органов, а также тех элементов, которые могут служить для целей ориентировки при совмещении соседних срезов. Если изображения срезов получаются настолько сложными, что возникает опасение перепутать в дальнейшем отдельные органы и их части, то последние закрашиваются в различные цвета карандашами или акварельными красками.
Графическая изоляция по Кащенко. С помощью этого метода можно получить картину объекта в плоскости, параллельной 'плоскостям срезов. Чаще всего приходится по фронтальной серии делать фронтальные же реконструкции или по сагиттальным — сагиттальные.
Принцип метода заключается в том, что все срезы перерисовывают на один лист кальки в порядке их номеров, причем каждый последующий срез по возможности наиболее полно накладывается на предыдущий. Рисование начинают со стороны, обращенной к рисующему. Так, если воспроизводимый объект должен быть изображен со спинной стороны, то сначала рисуют самый дорзальный срез, а последним — самый вентральный. Контуры, которые покрывают уже нарисованными, не изображают.
В результате получаются системы контурных линий, лежащих вблизи и вокруг друг друга и дающих форму реконструируемого объекта. Самый внешний контур системы линий отвечает общему наружному контуру данного органа. Расположение и частота внутренних линий указывают на форму органа и позволяют правильно наложить тени на окончательном рисунке. Рассмотрим соответствующий пример.
Требуется построить реконструкцию переднего отдела нервной системы немертины Lineus gesserensis по серии фронтальных срезов. Изображение должно быть дано со спинной стороны.
1. Все срезы, на которых имеются разрезы через нервную систему, рисуют с помощью рисовального аппарата на отдельных листках бумаги. Увеличение всех рисунков должно быть одинаковым. Кроме наружных очертаний среза и нервной системы следует изображать также и контуры близлежащих органов, которые понадобятся для ориентировки соседних срезов при накладывании их друг на друга. В нашем примере такими органами могут служить кровеносные сосуды и система хобота (ринходеум, полость влагалища хобота). Рисунки нумеруются соответственно порядковым номерам срезов.
2. Рисунок первый, т. е. изображающий самый дорзальный срез с кальку или тонкое матовое стекло. Далее калька накладывается на рисунок второй и оба рисунка по возможности полнее совмещают. При этом нужно стремиться к наиболее полному наложению отвечающих друг другу сечений всех перерезанных органов. Чем больше элементов изображено на рисунках срезов, тем легче и точнее это можно сделать. После того как все линии второго рисунка перенесены на кальку, последнюю накладывают на рисунок третий, по отношению к которому ориентируют по контурам второго рисунка. Таким же образом наносится изображение четвертого среза и т. д. (рис. 1). Наиболее ответственным моментом, который может вызвать затруднения,
нервной системой, переводят на
Рис. 1. Реконструкция переднего отдела нервной системы немертины Lineus gesserensis. Графическая изоляция по Кащенко. Цифрами отмечены номера срезов. Объяснения в тексте (ориг.)
служит ориентировка рисунков срезов по отношению друг к другу. Однако при некотором навыке легко избежать грубых ошибок, и реконструкция получается если и не абсолютно точной, то во всяком случае достаточно близкой к действительной форме объекта.
3. При перенесении рисунков на кальку контуры, которые покрываются уже изображенными, не рисуются.
4. Каждый раз после перевода на кальку нового рисунка все контуры предыдущего среза, не относящиеся к реконструируемой нервной системе и ненужные более для накладки следующего среза, стирают резинкой. Если этого не делать, то довольно скоро на кальке отказывается слишком большое количество излишних и мешающих линий, которые к тому же перекрещиваются с нужными контурами в силу налегания отдельных органов друг на друга. Таким образом, в конечном результате на кальке останутся только те системы линий, которые характеризуют форму нервной системы (рис. 1), т. е. реконструируемый объект окажется графически изолированным от остальных органов. Часто, однако, бывает важно получить и внешний контур животного. В таком случае наружную линию, отвечающую этому контуру, следует сохранить.
5. Когда перерисовывание на кальку закончено, обводится общий абрис нервной системы и ее отдельных частей (рис. 1). Уже на этой стадии работы форма реконструируемого объекта, собственно говоря, восстановлена.
6. Общий контур нервной системы и ее частей переносится с кальки на бумагу. На окончательном рисунке накладываются тени в соответствии с конфигурацией и взаимным расположением контурных линий на кальке. Если принять, что источник света находится сверху, то более глубокие тени накладываются в тех местах, где линии расположены гуще. Если допустить, что объект освещен слева и сверху, как обычно изображается на рисунках, то при накладке теней надо внести соответствующие поправки.
В тех случаях, когда по одной серии срезов необходимо сделать реконструкцию нескольких систем органов, можно для каждой системы приготовить отдельную реконструкцию, а затем соединить их на одном рисунке или реконструировать все системы одновременно. В последнем случае вместо кальки удобнее употреблять матовое стекло, а контурные линии разных систем рисовать карандашами разного цвета. Так же следует поступать, если объект хотят изобразить прозрачным и внутри него воспроизвести внутренние образования, например полости, сосуды и другие детали.
Само собой понятно, что при построении подобных реконструкций многие системы линий должны пересекаться.
При перенесении главных контурных линий на бумагу удобно пользоваться ретушерским столиком, употребляемым фотографами. На матовое стекло с реконструкцией кладется бумага, а под стекло помещается электрическая лампа. Просвечивающие сквозь бумагу контуры легко могут быть обведены карандашом.
Иногда, впрочем, при обилии и сложности линий разного значения на реконструкции такой способ недостаточен, так как невозможно от
личить линии общего контура органа от других, второстепенных, даже если эти последние сделаны иным цветом, нежели первые. В этом случае можно прибегнуть к приему, введенному в практику А. В. Фурсенко. Предположим, срезы рисовали красным карандашом, а главные контуры были обведены черным. Если на ретушерском столике под матовое стекло подложить тонкую красную бумагу, то сквозь наложенную сверху рисовальную бумагу будут просвечивать только черные контуры, тогда как все красные линии станут незаметными. Так следует поступать всегда, когда необходимо изолировать сложные системы линий, нарисованные двумя различными цветами.
Проекционная реконструкция по Гису. Этот способ реконструкции позволяет получать картины объекта, плоскость которых перпендикулярна плоскости срезов. Так, по поперечной серии срезов можно получить изображение органа или системы органов в фронтальной или сагиттальной плоскости.
Принцип метода сводится к следующему. На бумагу наносят ряд параллельных линий, расстояние между которыми должно соответствовать толщине срезов при выбранном увеличении. На каждую поперечную линию наносятся проекции на выбранную плоскость главнейших точек с соответствующего среза. Затем отвечающие друг другу точки соединяются. В результате получается контур органа в выбранной плоскости. Рассмотрим следующий пример.
Требуется по серии поперечных срезов через дигенетического сосальщика построить фронтальную реконструкцию пищеварительной системы с брюшной стороны, увеличенную против действительных размеров в 200 раз. Вся серия содержит
Рис. 2. Проекционная реконструкция. Подготовка рисунков срезов к перенесению с них проекций главных точек (а', б', в' и т. п.) на основу. Изображены рисунки срезов № 17 и 18. Объяснения в тексте (ориг.)
50 срезов. Толщина каждого среза равна 12 мкм.
1. На отдельных листках бумаги с помощью рисовального аппарата приготавливаются рисунки всех срезов. Увеличение рисунков должно быть равно 200. На каждом рисунке изображаются внешний контур среза и очертания присосок и пищеварительных органов. Все рисунки нумеруются в порядке номеров срезов (рис. 2).
2. Увеличение изображений, полученных при помощи рисовального аппарата, определяется следующим способом. На предметный столик микроскопа кладут объект-микро-метр и рисуют всю его шкалу или несколько делений ее с помощью рисовального аппарата. При этом должны быть соблюдены все условия, при которых изготовлялись рисунки срезов (те же объектив,
окуляр и длина тубуса, тот же рисовальный аппарат, та же высота рисовальной бумаги над уровнем стола). Нарисованное изображение шкалы или ее части измеряют. Полученную длину делят на истинную длину шкалы объект-микрометра или ее части. Частное от деления и будет искомое увеличение. Обычно шкала объект-микрометра представляет собой 1 мм, разделенный на 100 частей.
Если необходимо подобрать определенное увеличение, при котором нужно приготовить рисунки, то, комбинируя различные объективы и окуляры, подбирают сначала увеличение, по возможности близкое к требуемому. Окончательная подгонка увеличения достигается выдвижением тубуса микроскопа. Иногда приходится изменить высоту над уровнем стола бумаги, предназначенной для рисунка. При этом все увеличения определяют и проверяют при помощи объект-микрометра.
3. На отдельном листе плотной бумаги приготавливают основу, на которую затем будут нанесены проекции срезов. Именно на бумагу наносят 50 (по числу срезов) параллельных линий, расстояние между которыми должно быть равно толщине одного среза, взятой при увеличении в 200 раз, т. е. 12 мкмХ200 = 2,4 мм.
Таким образом, вся реконструкция займет пространство длиной в 2,4 ммХ50, т. е. 120 мм. Следовательно, задача сводится к тому, чтобы между двумя параллельными линиями, отстоящими друг от друга на 120 мм, провести 49 параллельных линий с равными промежутками между ними. Однако технически гораздо легче разделить расстояние между двумя параллельными линиями на равные участки в том случае, если число их равняется одному из членов геометрической прогрессии с коэффициентом 2 (2, 4, 8, 16, 32 и т. д.). Ближайшим к 50 и большим, чем число, членов является 64.
Итак, чтобы разделить бумагу на 64 равных по ширине полосок, отвечающих 64 срезам, надо сначала провести две параллельные линии с расстоянием между ними в 153,6 мм (2,4 ммХб4) (рис. 3, линии 0—0 и 64—64). Затем промежуток между этими линиями делят пополам; соответствующая линия будет отвечать 32-му срезу (рис. 4, линия 32— 32). Таким же образом проводят линии 16-го и 48-го срезов и т. д., пока не будут нанесены линии всех первых 50 срезов. Все параллельные линии нумеруются, начиная сверху, соответственно порядковым номерам срезов (рис. 3 и 4).
4. На каждый рисунок среза наносят линии пересечения главной фронтальной плоскости объекта с плоскостью рисунка (см. рис. 2, АБ) и затем рядом с рисунком со спинной его стороны прочерчивают вторую линию, параллельную первой (см. рис. 2, ВГ). На эту вторую линию проектируются главные точки среза, как показано на рис. 2 (точка а' есть проекция точки а, б' — бит. д.). Далее край листка, на котором сделан рисунок, отрезают ножницами по линии ВГ. Таким образом подготавливают все рисунки срезов.
5. Следующим этапом работы является перенесение проекции точек с рисунков срезов на разграфленную основу. Рисунок прикладывают обрезанным краем к поперечной линии основы, имеющей одинаковый с ним номер, и на эту линию переносят проекции точек среза (рис. 3). Сперва на основу переносят точки 1-го среза, затем 2-го, 3-го и т. д.
Каждый последующий рисунок среза прикладывают к своей поперечной линии на основе таким образом, чтобы наибольшее количество точек
этого среза возможно точнее совпало с точками предыдущего. При этом надо внимательно следить, чтобы правая сторона объекта на ри-
сунке совпадала с правой стороной будущей реконструкции, а левая — с левой ее стороной. Так как в данном случае реконструкция должна быть изображением с брюшной стороны, то правая сторона тела на ре-
конструируемом изображении должна
Я'.---------------------------------------
Рис. 3. Проекционная реконструкция пищеварительной системы дигенетического сосальщика, изображаемая с брюшной стороны. Момент нанесения на основу проекций точек с изображения среза № 17. Объяснения в тексте (ориг.)
быть на левой стороне, и наоборот (рис. 3). Следовательно, каждый рисунок прикладывают к соответствующей поперечной линии снизу, это удобно в том отношении, что он не закрывает собой уже ранее нанесенные на основу точки (рис. 3). Если бы эту реконструкцию требовалось построить со спинной стороны, то линии на рисунках срезов, на которые наносят проекции точек, следовало бы провести на брюшной стороне от изображения среза. При ее положении на спинной стороне рисунка накладывать рисунки на основу пришлось бы, переворачивая их вверх ногами. В последнем случае пришлось бы начать перенесение точек на основу с заднего конца животного, т. е. с 50-го среза, затем перейти к 49-му, 48-му и т. д.
6. Соответствующие друг другу точки, нанесенные на основу, соединяют. В результате получают общие контуры тела сосальщика, очертания присосок и всего кишечника (рис. 3, верхняя часть). Для
получения окончательного рисунка неровности контуров сглаживаются (рис. 4). Отдельные органы реконструкции могут быть раскрашены условными цветами.
Если этим методом необходимо реконструировать несколько различных систем органов, например пищеваритель
ную, нервную, половую и т. п., то для каждой системы делается отдельная реконструкция. Несколько реконструкций затем могут быть объединены в одной схеме. Так же поступают, когда реконструируемая
система очень сложна, т. е. производят реконструкцию по частям.
Иногда при реконструкции какого-нибудь сложного по форме объ екта, например сильно извитой матки сосальщика с ее многочисленны ми петлями, приходится переносить на основу такое большое количество точек, что в них подчас нелегко разобраться. В этих случаях выбирают такой срез, на котором имеется начало органа, и на- п О
носят на основу только точки 2 этой части, несмотря на наличие на этом же срезе еще раз-резов того же органа. На ри- Ё сунке отмечают нанесенную s часть условным знаком, на- /й пример крестиком. На следую-щем срезе находят соответст- /4 венное продолжение органа, переносят на основу его точки и отмечают его на рисунке го условным знаком и т. д. Когда гг орган загибается к переднему го-концу, его продолжение пере- 26 носят с предыдущего среза или с ряда предыдущих срезов и т. д. Часто в подобных случаях приходится возвращаться к уже неоднократно использо-ванным рисункам срезов. Та- 36 ким способом можно пригото- 38 вить реконструкцию весьма 40 сложных по форме объ- 42 ектов. 44
На окончательном рисунке 46 те части, которые скрыты ле- 48 жащими поверх них, не изобра- so жаются или отмечаются пунк-тиром. На готовой реконструкции может быть показана форма отдельных частей путем наложения в соответственных
52
местах теней и полутеней.
Пластическая реконструкция. В основе любой пластической реконструкции по срезам лежит метод Борна, принцип которого заключается в следующем.
54---------------------------------------
Рис. 4. Один из моментов окончательного оформления проекционной реконструкции пищеварительной системы дигенетического сосальщика. Объяснение в тексте (ориг.)
С каждого среза при определенном увеличении рисуют части того органа, который нужно реконструировать. Затем эти части вырезают из пластинки, причем толщина последней должна отвечать толщине среза при данном увеличении. Соответственные части наклеивают друг на друга в порядке срезов. В результате получается объемная модель ре-констриуруемого объекта, которая далее может быть обработана для того, чтобы придать ей более аккуратный и изящный вид.
В качестве основного материала используют или восковые пластинки, или картон. Первый способ во многих отношениях удобен, но так как для изготовления пластинок из воска требуются специальные приспособления и оборудование, отсутствующие во многих зоологических лабораториях, рекомендуем более доступный способ построения модели из картона. Приведем пример.
Требуется реконструировать по серии поперечных срезов передний отдел центральной нервной системы немертины Lineus gesserensis при увеличении от 50 до 80. Толщина срезов 10 мкм.
Подготовительные работы. Прежде всего срезы должны быть нарисованы с помощью рисовального аппарата. При этом увеличение рисунков должно быть строго определенным в зависимости от толщины картона, предназначенного для реконструкции. Если имеется картон любой толщины, то увеличение модели может быть точно задано заранее. Если например, при этом условии требуется изготовить модель, увеличенную против- действительных размеров объекта в 50 раз, то толщина картона должна быть 10 мкмХ50 = 500 мкм = 0,5 мм. Однако не всегда под рукой может быть картон нужной толщины. Поэтому на практике приходится, выяснив предварительно толщину имеющегося картона, вычислять соответствующее ей увеличение, в котором должны быть сделаны рисунки срезов.
1. Для выяснения толщины картона 10—20 кусочков его наклеивают друг на друга тем клеем, которым в дальнейшем будут склеивать модели срезов, и измеряют толщину полученного тела. Последняя, разделенная на общее число склеенных кусочков, даст толщину картона с учетом слоя клея. Предположим, что измеренная таким способом толщина картона оказалась 0,655 мм = 655 мкм.
2. Требуемое увеличение вычисляют по уравнению: 10 мкм X х= = 655 мкм; х=65,5, где 10 мкм — толщина срезов, а 655 мкм — толщина картона.
3. В дальнейшем следует подобрать такую комбинацию объектива, окуляра и длины тубуса микроскопа, чтобы увеличение рисунков, сделанных с рисовальным аппаратом, равнялось 65,5. Для этого на листке бумаги прочерчивают две параллельные линии с расстоянием между ними в 65,5 мм. Затем на предметный столик микроскопа кладут объект-микрометр (1 мм, разделенный на 100 частей) и видимое в микроскоп изображение его шкалы сравнивают с помощью рисовального аппарата с промежутком между начерченными на бумаге линиями. Меняя объективы, окуляры и длину тубуса (в некоторых случаях приходится изменять и высоту рисовальной бумаги над уровнем стола), легко добиться точного совмещения шкалы объект-микрометра с отмеренным расстоянием на бумаге. Когда требуемое увеличение достигнуто, все условия
установки записываются (номера объектива и окуляра, длина тубуса и т. д.). Все срезы, на которых имеются те или иные части переднего отдела нервной системы, рисуют с рисовальным аппаратом при увеличении 65,5. На рисунках следует изображать не только контуры реконструируемой системы, но также контуры самого среза полости ринхоце-ля (влагалища хобота) и других образований, которые в дальнейшем служат лишь для ориентировки одного среза по отношению к соседним. Рисунки делают на отдельных листках и нумеруют согласно номерам срезов.
4. Далее все рисунки переводят тушью на листки прозрачной кальки, причем контуры нервной системы рисуют особым цветом (например, красной тушью). Затем следует, накладывая прозрачные рисунки на кальке друг на друга в порядке номеров штук по 10 и ориентируя их по отношению друг к другу, сделать на них особые ориентировочные знаки. Для этого достаточно проколоть все сложенные листки в трех местах препаровальной иглой. Места прокола отмечают тушью.
5. С рисунков на обычной непрозрачной бумаге части нервной системы переводят на картон и вырезают ножницами или острым скальпелем. На каждом вырезанном кусочке сверху пишут номер среза и отмечают, к какому органу или части системы он относится. Можно для этого использовать цветные карандаши или акварельные краски, отмечая условными цветами соответственные части и органы. Чтобы мелкие части модели не растерялись и не перепутались, можно наклеивать их сразу же (непрочно!) при вырезывании на соответствующие предыдущие части.
Склеивание модели. 1. В качестве основы берут кусок картона или фанеры. На него наклеивают полоску, вырезанную из того же картона, из которого вырезали срезы. На эту полоску № 1 наклеивают одним краем прозрачный (на кальке),рисунок № 1. Части нервной системы, вырезанные из картона и относящиеся к срезу № 1, наклеиваются на основу в соответственных местах, причем накладыванием на них сверху кальки № 1 (уже приклеенной к полоске картона) устанавливают их правильное и точное положение.
Далее на полоску № 1 наклеивают такую же полоску № 2, а на нее наклеивают кальку № 2. При этом ориентировочные точки проколов на обеих кальках должны совпасть. Кальку № 2 отгибают кверху, а кальку № 1 срезают совсем. Затем вырезанные картонки, относящиеся к срезу № 2, наклеивают на соответственные части среза № 1, уже приклеенные к основанию. Ориентировку картонок среза № 2 опять контролируют пригибанием на них сверху приклеенной к полоске кальки № 2. Далее поступают таким же образом с калькой № 3 и частями среза № 3 и т. д. (рис. 5).
2. Если на данном срезе появляется новый орган или часть, соответствующей части для которой на предыдущих срезах не было, то для укрепления в соответственном месте этой картонной модели к основе приклеивается нужной высоты картонный мостик. Последний составляют из прямоугольных (или другой правильной формы) кусочков картона. На этом мостике укрепляют вновь появившуюся часть (рис. 5, 4).
3. Отдельные части модели можно соединить мостиками из карто
на или проволоки. В последнем случае просверливают буравчиком две соответствующие дырочки в обеих соединяемых частях модели и в них вставляют кусочек проволоки подходящей длины. Концы проволоки смазывают клеем. Если нужно, чтобы модель была разборной, то клеем смазывают только один конец проволоки.
4. Если срезов очень много, то для удобства их можно разбить на несколько групп, а потом готовые уже модели этих групп соединить вместе.
5. Срезанные кальки следует сохранять для возможной проверки.
6. Наклейка картонных частей срезов и вообще склеивание картона производится хорошим клеем. Рекомендуется довольно жидкий столярный клей. Лучше всего развести этот клей в выпаривательной чашке и держать его во время работы в водяной бане. Для смазывания картона пользуются щетинной кисточкой.
Обработка модели. 1. Когда склеивание модели закончено, острые углы картонных пластинок и неровности подрезают возможно
Рис. 5. Пластическая реконструкция. Склеивание модели переднего отдела нервной системы немертины Lineus gesserensis;
/ — калька с просвечивающим рисунком среза № 72, наклеенная на слой картонных полосок и отогнутая кверху, 2 — картонная полоска № 72, 3 — фанерная основа, 4—опорный мостик, или колонка, склеенная из квадратных кусочков картона, 5 — склеенная часть модели, 6 — остатки обрезанных калек, 7 — просвечивающие сквозь кальку ориентировочные знаки (орнг.)
тщательнее острым ножом или бритвой и всю модель обмазывают особой массой — папье-маше, приготовление которой приводится ниже. Этой массой заполняют все неровности и дефекты, из нее создают даже недостающие детали и части (в нашем примере — тонкие нервы). После обмазки поверхность модели смазывают кисточкой, смоченной в воде.
2. Для изготовления пластической массы требуются: 1) фильтровальная бумага, 2) просеянная ржаная мука, 3) обыкновенный мел в порошке (или зубной порошок).
Фильтровальная бумага расщипывается на возможно мелкие кусочки и варится в воде до тех пор, пока не исчезнут отдельные мелкие кусочки и не образуется однородная
Рис. 6. Пластическая реконструкция переднего отдела нервной системы немертины Lineus gesserensis. Вид со спинной стороны: /—дорзальная церебральная комиссура, 2 — дорзальный церебральный ганглий, 3 — церебральный орган, 4— боковой нервный ствол, 5—стоматогаст-рический нерв, 6—медиальный нерв, 7—вентральный церебральный ганглий, 8 —- канал церебрального органа, 9—вентральная церебральная комиссура (ориг.)
тонкая бумажная масса. Для луч-
шего измельчения бумаги необходимо ее почаще помешивать. Готовая бумажная масса вынимается из сосуда и отжимается от воды. Затем ржаную муку обливают в сосуде кипятком, помешивая палочкой; чтобы образовалась густая клейкая кашица. Часть бумажной массы
разделяется на мелкие кусочки, которые растираются в руках и на гладкой доске с большим количеством ржаного клейстера. Количество фильтровальной бумаги зависит от цели, ради которой готовится масса. Для выравнивания неровностей модели берут немного бумаги. Для изготовления из массы недостающих деталей модели бумаги берут больше. Когда кусочки бумаги хорошо разотрут с ржаным клейстером, на доску насыпают мел и массу замешивают мелом на доске и в руках. Под влиянием мела масса начинает отставать от рук. Когда полученный ком будет кататься, масса готова, и ее надо лишь еще немного рас-тереть в руках, чтобы не было кусочков бумаги, муки и мела. Хранить эту массу следует в сырой фильтровальной бумаге и сырой тряпочке.
3. После того как обмазка модели окончательно высохла, вся модель тщательно прочищается тонкой наждачной бумагой. Затем небольшое количество столярного клея и гораздо большее количество порошка мела недолго 'кипятят в воде. В результате получается белая жидкость, тонким слоем которой покрывают модель, отчего все подробности ее резче выступают (рис. 6).
4. Изготовленная модель может быть раскрашена акварельными масляными красками. К масляным краскам для придания матовому.: прибавляют немного воска, растворенного в терпентине.
Подцарство Protozoa
Тип Plasmodroma
КЛАСС SARCODINA - САРКОДОВЫЕ
Прохождение практикума по простейшим рекомендуется начинать с Sarcodina из соображений педагогического характера, ибо войти в курс работы с простейшими легче на объектах малоподвижных или на готовых препаратах. Относительная простота организации делает сар-кодовых удобным объектом для начала практикума.
Определение пресноводных саркодовых (амеб, раковинных амеб) следует вести по «Определителю пресноводных беспозвоночных...» под ред. Л. А. Кутиковой и Я. И. Старобогатова (1977) или по монографии Пажа (Page, 1976) — см. список литературы в конце книги.
Морские Foraminifera. Объекты выбирают из морского песка и так же ведут их определение по Кашмену (1933).
Из Heliozoa предлагаем разобрать один объект часто встречающегося в пресных водах солнечника Actinosphaerium eichhorni.
Труднее обстоит дело с Radiolaria. Эта весьма богатая формами группа представляет большой интерес, но в практикуме эти группы могут быть затронуты только вскользь, так как получение материала по лучевикам весьма затруднено. Поэтому ограничимся описанием немногих форм, рассчитывая на наличие материала в более крупных лабораториях.
ПОДКЛАСС RHIZOPODA — КОРНЕНОЖКИ
ОТРЯД AMOEBINA
Amoeba proteus Roessel
Материалы и методы изучения. Amoeba proteus принадлежит к сем. Amoebidae и живет в иле водоемов со стоячей, часто загрязненной водой (с гниющими на дне растительными остатками, листьями т. д.). Пробы из таких водоемов можно брать планктонным сачком, проводя им вблизи поверхности ила. Ил слегка взмучивают движениями сачка и собирают в последний. Можно также опустить в воду отверстием вниз батарейный стакан или четырехугольную аквариумную банку, быстро поворачивая ее отверстием кверху около водоема. Выходящий воздух взмучивает достаточное количество ила, который и зачерпывают сосудом. После спокойного стояния таким способом наполненных банок наверняка можно рассчитывать на нахождение крупных амеб в каплях воды, взятых пипеткой из придонного слоя. Амебы настолько велики, что их можно разыскивать даже под лупой.
Не представляет труда культивировать крупных амеб в лаборатории. Профильтрованную прудовую воду (лучше из водоема, где водятся амебы) разливают тонким слоем в чашки Петри, которые прикрывают крышечкой, В каждую чашку закладывают 5—6 зерен риса. Через несколько дней вокруг зерен образуется облачко — разводятся бактерии, которые служат пищей амебам. В подготовленные указанным способом чашки вносят живые амебы, которые хорошо живут и размножаются. Если в лаборатории есть культура инфузорий тетрахимен (с. 121), то раз в 3—4 дня в чашки Петри следует добавлять понемногу живых тетрахимен, которые охотно поедаются амебами. Пересев культур следует проводить через каждые 1,5—2 месяца.
Изучают главным образом живой материал. Для рассмотрения ядра изготовляют тотальные препараты. Фиксация по Буэну или Шаудину с последующей приклейкой к стеклу целлоидином (с. 18). Окраска квасцовым кармином, железным гематоксилином или же двойная окраска метиловым зеленым (с. 33) для выявления в ядре хроматина и ядрышек.
Изучение живого объекта. Amoeba proteus — одна из самых крупных амеб, достигает размера в активном состоянии 200— 500 мкм (даже больше). Данный вид характеризуется наличием многочисленных (до десятка и более) длинных, лопастных псевдоподий, нередко составляющих главную часть тела (рис. 7). Псевдоподии беспрерывно меняют свою форму, исчезают, возникают вновь, благодаря чему постоянство тела у амебы не сохраняется.
Цитоплазма A. proteus совершенно ясно подразделяется на экто- и эндоплазму. Эктоплазма представляет собой тонкий гиалиновый гомогенный слой, одевающий тело амебы со всех сторон. Консистенция его вязкая. Приходя в соприкосновение с водой наружной среды, поверхность ее уплотняется (желатинизируется), образуя тончайшую мембрану поверхностной пленки (plasmalemma).
Эндоплазма резко выделяется зернистой структурой, массой пищевых включений и мелких вакуолей с экскреторными кристаллами внутри и другими включениями (рис. 8). Окраска тела амебы зависит в значительной степени от включений эндоплазмы, нередко становится темно-серой благодаря наличию большого количества кристаллов, сильно преломляющих свет и выглядящих благодаря этому почти черными включениями в вакуолях.
Присматриваясь внимательно к эндоплазме, особенно при больших увеличениях, удается заметить различие в консистенции внутренней и периферической ее областей. В центральной части, несколь
Рис. 7. Amoeba proteus. А— в ползущем состоянии, Б— захватывающая пищу (Х200 из кн. Дофлейна):
/ — эктоплазма, 2 — эндоплазма. 3 — пищевые частички, 4 — ядро, 5 — псевдоподии, 6 — сократительная вакуоль
ко более светлой, замечают интенсивные токи цитоплазмы, что указывает на жидкое состояние этой зоны и что позволяет назвать внутреннюю часть плазмазоль (plasmasol, рис. 8). В периферической же области никаких токов не заметно и она представляет собой желатинизированную цитоплазму, называемую плазмажель (plasmagel). Подобное желатинизированное состояине обратимо — жель легко пере-
Рис. 8. Amoeba proteus. Разделение цитоплазмы на слои (Х250) (из кн. Маста):
1— эктоплазма, 2 — плазмажель, 3— плазмазоль, 4— пищевые вакуоли, 5 — вакудли с экскреторными кристаллами, 6 — сократительная вакуоль, 7 — ядро
ходит в золь, что можно наблюдать при формировании псевдоподий. Мы видим тогда, что токи протоплазмы устремляются к какому-нибудь пункту поверхности тела амебы.
Плазмажель в этом месте разжижается, что хорошо видно, так как токи эндоплазмы как бы прорываются в эктоплазму и вызывают ее выпячивание в виде псевдоподии. В это выпячивание перетекает значительный участок эндоплазмы, и когда псевдоподия сформируется, можно видеть, как снова желатинизируется периферическая область плазмы на конце псевдоподии, бывшая до сих пор жидкой.
Псевдоподии выпускаются и .для передвижения тела и для захвата пищи. В первом случае движение обусловливается тем, что в образующуюся псевдоподию начинает перетекать цитоплазма. При этом у A. proteus замечается так называемое шагающее движение. Амеба соприкасается с субстратом не всей нижней поверхностью, а только некоторыми точками. Псевдоподия вытягивается свободно вперед в воду и, загибаясь потом вниз, прилипает к субстрату. Одновременно задние псевдоподии отстают от субстрата,
втягиваются в тело и таким образом амеба шагает вперед, снова и снова выпуская вперед псевдоподии (рис. 9).
Наблюдать подобный способ движения можно только рассматривая амебу сбоку. Для этого приходится применять следующее несложное приспособление (рис. 10). На предметном стекле канадским бальзамом наклеивают три полоски стекла (того же предметного) в виде буквы П. Между ними помещают каплю воды с амебами, покрывают
покровным стеклом так, что оно ложится своими краями на эти полоски, и предметное стекло ставят вертикально на ребро так, чтобы амебы могли осесть на перекладину буквы П. Вставляя всю эту систему в вертикальном положении в микроскоп, тубус которого нагибают гори-
зонтально, можно прекрасно проследить детали этого шагающего дви-
жения. Для того чтобы амеба перемещалась в на частью своей поверхности прикрепиться к открепилась от субстрата, то передвижение псевдоподии и могут образовываться.
Захватывание пищи производится следующим образом. Псевдоподия прикасается к пищевой частичке, начинает обтекать ее до тех пор, пока она не будет окружена плазмой со всех сторон. Тогда концы псевдоподии сливаются уже за пищевой частичкой, и она таким образом оказывается внутри тела амебы. При дефекации вакуоль с непереваренными остатками подходит к поверхности и прорывается наружу, благодаря чему содержимое ее выбрасывается в окру
пространстве, она долж-субстрату. Если амеба ее- прекращается, хотя
жающую среду.
Единственная сократительная вакуоль лежит у поверхности в толще плаз-мажеля. При обычной комнатной темпе
ратуре опорожнение ее совершается через 5—8 мин.
Окрашенные препараты. Ядро на живой амебе увидеть почти не удается — оно в редких случаях выглядит светлым пятном, чаще же маскируется темными включениями плазмы. Изучение окрашенного препарата показывает, что ядро имеет дисковидную форму. Центральная часть его занята относительно крупным центральным телом (рис. 11). В периферической зоне разбросаны зернышки, окрашивающиеся гематоксилином, а между ними — вакуоли. Реакция по Фёльгену на тимонуклеиновую кислоту показывает, что хроматин сконцентрирован в центральном теле в виде сеточки. Периферическая же зона совершенно лишена хроматиновых элементов. При
Рис. 9. Amoeba proteus «Шагающая» амеба, вид сбоку (Х100) (по Деллингеру из кн.
Дофлейна)
Рис. 10. Схема устройства приспособления для рассматривания Amoeba proteus сбоку:
1 — предметное стекло. 2 —- покровное стекло, 3 — полосочки стекла, приклеенные канадским бальзамом к предметному стеклу, 4 — комочки воска (ориг.)
Рис. 11. Amoeba proteus. Ядро. A—вид с широкой стороны; Б — вид с узкой стороны— окрашено гематоксилином (Х1000) (из кн. Дофлейна); В — вид с широкой стороны; Г —с узкой стороны — реакция Фельгена (Х750) (из кн. Богдановича): /—периферическая зона, 2 — центральное тело
Рис. 12. Difflugia piriformis. Общий вид in vivo (Х150) (из кн. Маста):
1 — песчинки на поверхности раковинки, 2 — граница цитоплазмы внутри раковинки, 3 — выступающая из раковинки цитоплазма. 4 — псевдоподии, 5 — плазмажель, 6 — плазмазоль
двойной окраске метиловым зеленым — пиро-нином выявляется, что в периферической части ядра расположены многочисленные нуклео-лы (окрашиваются в розовый цвет).
ОТРЯД TESTACEA
Difflugia piriformis Perty
Материал и методы изучения. Difflugia piriformis (из сем. Difflugiidae) живет приблизительно в тех же условиях, что и Amoeba proteus и может быть поэтому обнаружена в тех же пробах, откуда мы берем эту амебу. Изучение ведется in vivo — живые экземпляры, однако, попадаются далеко не часто, обычно в пробе обнаруживаются пустые раковинки. Для рассмотрения ядра приходится изготовлять из живых корненожек тотальные препараты после фиксации Шаудином, окрашенные квасцовым кармином.
Изучение морфологии. Раковинка D. piriformis имеет грушевидную форму, обычно с легким заострением на вершине и округлую в сечении (рис. 12). Суженная часть раковинки— ее основание — открывается наружу устьем, расположенным терминально. Длина раковинки сильно варьирует — от 60 до 500 мкм и более. Раковинка построена из посторонних частичек. Чаще всего это мелкие песчинки неправильной формы, вплотную прилегающие друг к другу. Нередко в состав раковинки входят панцыри диатомей и т. п.
Цитоплазма обычно заполняет раковинку целиком. Длинные пальцевидные псевдоподии в небольшом числе выпускаются через
устье. На каждой из них при большом увеличении можно видеть токи цитоплазмы, направленные к концу, если псевдоподия вытягивается, или к основанию, если она втягивается. Поверхностный слой цитоплазмы в них желатинизирован в виде тонкой пленочки на поверхности.
Имеется несколько сократительных вакуолей, но их увидеть почти никогда не удается, так как они лежат внутри раковинки и сильно преломляющие свет песчинки мешают рассмотреть содержимое цитоплазмы.
Ядро пузырьковидного характера с небольшим кариозомом внутри, оно на окрашенных препаратах также плохо видно.
Euglypha alveolata Duj
Материал и методы изучения. Euglypha alveolata принадлежит к сем. Euglyphi-dae, в большом количестве может быть обнаружена в выжимках из торфяного мха, которые производятся обычно рукой из верхних частей (стеблей) мха, насыщенных водой. Отжатые вершины полезно прополоскать в отжатой жидкости и снова выжать.
Рис. 13. Euglypha alveolata. А — структура раковины; Б — инцистированная корненожка (X 500) (из кн. Дофлейна)
Рис, 14. Euglypha alveolata. Общая организация in vivo (Х750) (из кн. Гартмана): I—стенка раковины, 2—гиалиновая цитоплазма, 3 — ядро, 4 — кариосома, 5 — формирующиеся пластинки раковины, 6 — зернистая цитоплазма, 7— сократительная вакуоль, 8—альвеолярная цитоплазма, 9—филлоподии
На дне сосуда отстаивается осадок, из которого берут пипеткой капельки и в них наряду с другими Testacea будут и искомые Euglypha. Изучение ведется, главным образом, in vivo с применением иммерсионной системы. И здесь так же, как и в случае с Difflugia, чаще попадаются пустые раковинки.
Тотальные препараты также следует изготовить для рассмотрения ядра и некоторых деталей строения.
Рис. 15. Euglypha alveolata на окрашенном гематоксилином препарате (Х750) из книги Дофлейиа:
1 — гиалиновая цитоплазма, 2 — ядро, 3 — зернистая цитоплазма, 4 — альвеолярная цитоплазма
Изучение морфологии. Раковинка яйцевидной формы с закругленной вершиной и почти округлым поперечным сечением. Устье—на суженном конце окружено обычно восемью зубцами. Длина раковинки 30—150 мкм. Раковинка бесцветна. В состав раковинки входят тонкие кремневые пластиночки правильной овальной формы (рис. 13), налегающие своими краями друг на друга. Нередко от раковинки в стороны отходят тонкие щетинки или волоски.
Цитоплазма выполняет раковинку целиком и подразделяется на три слоя. От устья приблизительно до середины в ней видны крупные вакуоли с водянистым содержимым, это — вакуолистый, альвеолярный слой. Далее следует сравнительно узкая зона с большим количеством гранул и пищевых частичек (рис. 14) — зернистый слой. В этом слое происходит переваривание пищи. Наконец, вершина раковинки занята прозрачной цитоплазмой, в которой помещается ядро. И в зернистом, и в гиалиновом слое можно заметить формирующиеся пластиночки раковины (рис. 14). Псевдоподии отходят во все стороны от выступающего из устья участка плазмы. По типу строения это филлопо-дии — прямые, заостренные на концах, изредка ветвящиеся, прозрачные, исключительно эктоплазматические. Единственная сократительная вакуоль помещается в зернистой плазме.
Ядро хорошо видно и на живом объекте в виде прозрачного пузырька с более темным кариозомом внутри. На окрашенных препаратах видны мелкие зернышки хроматина, разбросанные в ядерном соке. На этих же препаратах красится и гиалиновый слой сильней по сравнению с другими участками цитоплазмы (рис. 15).
В материале нередко попадаются инци-стированные Euglypha. Циста образуется внутри раковинки, причем вокруг нее за счет запасных пластиночек формируется кремнистая обкладка. Сама же циста (шаровидной формы) лежит свободно в этой обкладке (см. рис. 13, Б).
Arcella vulgaris Ehrbg.
Материал и методы изучения. Arcella vulgaris (из сем. Arcellidae) попадается часто вместе с Difflugia в тех же пробах. Изучается в живом состоянии и на окрашенных препаратах.
Изучение живого объекта. Раковинка дисковидная (или в виде часового стекла). Устье открывается наружу в центре вогнутой стороны. Другая сторона выпуклая (рис. 16, А). Диаметр колеблется от 50 до 150 мкм. Материал раковинки — псевдохитин, обычно окрашенный (окислами железа) в коричневый цвет, вследствие чего внутреннее содержимое in vivo почти не удается рассмотреть. Поверхность раковинки имеет определенную скульптуру— она разбита на мелкие гексагональные поля (рис. 16, В). Подобная.структура яснее выступает на мертвых пустых раковинках, особенно при рассматривании под иммерсией.
Протоплазма не заполняет всего объема раковинки и связана с ее стенками посредством особых выростов (эпиподий). Наружу через устье высовываются немногочисленные лопастные закругленные на концах псевдоподии. Несколько сократительных вакуолей располагается по периферии диска, но увидеть их затруднительно.
Окрашенные препараты. На окрашенных препаратах видны два ядра с крупным кариозомом каждое, лежа-
Рис. 16. Arcella vulgaris. А — живой экземпляр, вид сбоку (Х500) (из кн. Бючли); Б — окрашенный гематоксилином, вид сверху (Х700) (из кн. Дофлейна); В — структура раковинки {X1500) (из кн. Бючли):
1 — стенка раковинки, 2 — цитоплазма, 3— сократительная вакуоль, 4— псевдоподии, 5 — эпиподии, 6 — ядро, 7 — хромидиальное кольпо
щие друг против друга по сторонам
от устья (рис. 16, Б). Кроме ядер основными красками сильно окрашивается кольцевидно расположенная зона цитоплазмы (рис. 16, Б, 7), содержащая значительные количества рибосомальной РНК, а также гликопротеидов. В период господства хромидиальной теории строения ядра у простейших эта зона получила название «хромидаль-
ного кольца».
ОТРЯД FORAMINIFERA
Морфология раковинки различных Foraminifera
Материал и методы изучения. Ниже предлагается изложение в сравнительно-анатомическом аспекте структуры раковинок различных Foraminifera. В качестве материала служат корненожки из морского песка, собранного с различных глубин наших северных морей (особенно с Мурманского побережья) и Черного моря (в районе Севастопольской и Карадагской биологических станций). Песок собирают в 70° спирт,
часть же с живыми корненожками должна быть зафиксирована сулемовым фиксатором для изготовления окрашенных препаратов.
Раковинки выбирают из песка препаровальными иглами под лупой и рассматривают на постоянных тотальных препаратах. Из 70° спивта их переводят в часовом стекле через 96° спирт в карбол-ксилол, из которого их можно заключать прямо в бальзам. Можно делать препараты из высушенных раковинок—бальзам подбавляют к материалу, лежащему на нагретом предметном стекле. Для изучения наружной структуры раковинок их можно рассматривать высушенными, освещая сверху сильным источником света. Нет надобности заключать их в постоянный препарат, их рассматривают в падающем свете на черном фоне.
Изучение ядерного аппарата возможно только иа декальцинированных объектах. Для этого корненожек, фиксированных сулемой, следует перенести в 70° спирт, к которому прибавлено 1—2% раствора соляной кислоты. Через несколько часов раковинка растворяется, и объект основательно промывают спиртом и окрашивают квасцовым кармином.
Однокамерные раковинки. 1. Мешковидные. Наиболее просто устроены мешковидные раковинки. Более примитивные из них те, которые имеют аггломерированные стенки: на псевдохитиновой основе прикреплены многочисленные посторонние частички — песчинки и т. д. У представителей рода Saccammina (сем. Saccamminidae, рис. 17, /), шарообразная раковинка открывается наружу устьем на вершине слабо выраженной шейки. Эти корненожки подбирают определенный материал для построения раковинки. У более совершенных представителей (например, из рода Lagena сем. Lagenidae, рис. 17, 2) раковинка пропитывается известью. И в этом случае устье открывается на вершине шейки, часто выраженной довольно сильно.
2. Трубчатые. Вытягивание в длину обычно наблюдается у примитивных корненожек с аггломерированной стенкой раковинки, примером чего может служить Hyperammina (сем. Hyperamminidae, рис. 17, 3 и 4) и Rhabdammina (сем. Astrorhizidae, рис. 17, 5 и 6). У первой один конец слепо замкнут, у второй оба конца трубки открыты и служат двумя устьями.
3. 3 в е з д ч а т ы е. От центральной камеры отходят несколько трубчатых отростков — Astrorhiza (сем. Astrorhizidae, рис. 17, 7). На конце каждого из них — устье.
4. Спиральные1. Сильно вытянутые в длину трубчатые раковинки имеют тенденцию закручиваться в спираль, что наблюдается в различных группах Foraminifera. Среди них имеются такие, которые склеивают стенку из песчинок (Ammodiscus, сем. Ammodiscidae, рис. 17, 8 и 9), другие же обладают известковой раковинкой (Cornuspira, сем. Ophtaimididae, рис. 17, 10).
Многокамерные раковины. 1. Прямые. Среди них можно видеть формы с аггломерированным скелетом. У Reophax (сем. Reophacidae, рис. 17, 11) раковинка прямая или слегка изогнутая, подразделенная пережимами на сравнительно небольшое количество камер, то объемлющих друг друга, то разъединенных и сообщающихся трубчатыми шейками.
1 Спиральные раковины этого типа на самом деле двухкамерные, так как в них имеется округлая начальная (эмбриональная) камера, к которой пристраивается трубка окончательной, закручивающейся в спираль.
Рис. 17. Раковинки различных Foraminifera (рис. 1—11, 13—22 из кн. Кэш-мена, 12 — из кн. Дофлейна, 23 — из ки. Ланга):
1 — Saccammina sphaerica (ХЮ), 2 — Lagena plumigera (Х50(, 3 — Hyperammina elongata, общий вид, 4— то же, в разрезе (Х50), 5 •— Rhabdammina linearis, общий вид, 6 — то же, в разрезе (Х7), 7 — Astrorhiza llmicola с частично вскрытой стенкой (Х5), 8 —- Ammbdiscus incertus, вид сбоку, 9 — то же, вид со стороны устья (Х135), 10 — Cornuspira involvens (Х20); 11— Rheophax nodulosus (X7), 12—Nodosaria hispida (X10), 13 — Haplophragmoides canariensis, вид сбоку, 14 — то же, вид со стороны устья (Х65), 15 — Nonion umbilicatulus, вид сбоку, 16 — то же, вид со стороны устья (Х50), 17 — Discorb is vesicularis, вид с вершины, 18 — то же, вид с основания (Х20), 19 — Quinqueloculina setninulum, вид сбоку, 20 —* то же, вид со стороны устья (Х40), 21 — Spiroloculina depressa (Х50), 22— Textularia sagittula (X20), 23 — Globigerina sp. (X50).
Известковые стенки мы видим у Nodosaria (сем. Lagenidae, рис. 17, 12) с прямой многокамерной раковинкой. Нередко вдоль нее проходят ребра, служащие средством для укрепления раковинки.
2. Спирально закрученные. Прежде всего должны быть упомянуты довольно редкие в этом типе раковинки с аггломерирован-ной стенкой — Haplophragmoides (сем. Lituolidae, рис. 17, 13 и 14). Здесь небольшое число камер свернуто в плоскую спираль. Последняя камера имеет полулунное устье. Остальные типы раковинок известковые.
Раковинка, закрученная в плоскую спираль. Примером служит Nonion, Elphidium ( = Polystomella) из сем. Nonionidae. Внутренние обороты частично прикрывают последующие, но они все же видны снаружи (Nonion, рис. 17, 15 и 16) —эволютная раковинка, или последующие обороты целиком обнимают предыдущие — они оказываются внутренними (снаружи не видными), и такая раковинка приобретает инво-лютный характер (Elphidium, рис. 18, А). Устье в таких случаях щелевидно или их несколько. Следует обратить внимание на пористость стенок.
Раковинка, закрученная в коническую спираль (трохоидная). Наиболее обычная форма среди Foraminifera. Более распространены раковинки с низкой спиралью. В качестве примера можно привести Rotalia или Discorbis (из сем. Rotalidae, рис. 17, 17 и 18). На такой раковинке различают вершину (на ней видны все обороты) и основание. Если смотреть со стороны основания, то видны только несколько последних камер и даже иногда только одна последняя, т. е. со стороны вершины
Рис. 18. Раковинки Elphidium и Archiacina. А — раковинка Elphidium (Polystomella) strigiata (Х50) (из Шульце); Б — раковинка Archiacina verworni (ХЗО) (изЛаига):
У— устье раковинки, 2 — перегородки между камерами, 3—поры, 4 — эмбриональные завитки раковинки
раковинка имеет эволютные обороты, со стороны же основания — инво-лютные. Устье у таких раковинок обычно бывает щелевидно и располагается сбоку. Стенки раковинок у обеих форм прободен-ные.
3. Раковинка Miliolidae. Ее камеры вытянуты в одном направлении параллельно оси раковинки и расположены в нескольких взаимно пересекающихся плоскостях. Наибольшее количество плоскостей— пять — у Quinqueloculina (рис. 17, 19 и 20). Они расположены друг к другу под углом 72°. Снаружи при этом видны всего три оборота, прикрывающие все внутренние. Устье помещается на одном из полюсов раковинки и снабжено зубцом. У Triloculina камеры располагаются в трех плоскостях. У Spiroloculina (рис. 17, 21) камеры распола-ются в одной плоскости, друг против друга.
4. Двухрядные раковинки. Своеобразное видоизменение спирального расположения камер можно продемонстрировать на примере Textularia (сем. Textulariidae, рис. 17, 22). В начале развития камеры располагаются спирально, но позже они образуют два ряда чередующихся друг с другом камер наподобие заплетенной косы. Стенки прободены и аггломерированы песчинками.
5. Ацервальные раковинки. Свойственны представителям рода Globigerina (сем. Globigerinidae, рис. 17, 23) и характеризуются беспорядочным на первый взгляд расположением шарообразных камер. Но, присматриваясь к расположению более старых мелких камер, видно их спиральное расположение. Стенки раковинки прободены порами, и у хорошо сохранившихся экземпляров можно видеть тонкие длинные шипы, играющие существенную роль при парении данной формы, так как она ведет планктонный образ жизни.
6. Циклические раковинки. Данный тип есть производное спирального. При этом внутренние камеры располагаются по спирали, наружные же—концентрическими кольцами (Archtacina, сем. Репегор-lidae, рис. 18, Б, Orbitolit.es и др.).
Изучение ядерного аппарата Foraminifera. Для изучения ядерного аппарата декальцинируются фиксированные в живом состоянии Elphi-dium и другие более крупные корненожки.
Фораминиферы обладают, как известно, сложным гетерофазным жизненным циклом (диплоидные агамонты и гаплоидные гамонты). На препаратах могут попасться разные стадии цикла. Агамонты многоядерны. В них обнаруживаются покоящиеся ядра, а также стадии мейоза, ведущие к образованию агамет. Вырастающие из агамет гаплоидные гамонты на большей части своей жизни обладают одним крупным пузырьковидным ядром. На препаратах попадаются иногда и стадии гаметогенеза, в результате которого вся цитоплазма гамонта оказывается заполненной огромным числом ядер гамет или уже сформированными гаметами. Чтобы разобраться в стадиях жизненного цикла форамини-фер, см. Догель В. А., Полянский Ю. И. и Хейсин Е. М. «Общая протозоология», 1962; Фурсенко А. В. «Введение в изучение фораминифер», 1978.
ПОДКЛАСС HELIOZOA—СОЛНЕЧНИКИ
Actinosphaerium eichhorni Enrbg
Материал и методы изучения. Actinosphaerium eichhorni (из сем. Aphrothoraca) живет в мелких стоячих водоемах с водой, богатой органическими веществами. Часто развивается в большом количестве в байках с пробами, взятыми подобно тому, как это было описано в отношении Amoeba proteus. Солнечников легко обнаружить с по-
мощью лупы иа стейках сосуда, откуда берут пипеткой для изучения главным образом в живом состоянии. При этом покровное стекло должно быть обязательно снабжено восковыми иожками. Тотальные препараты изготовляют только для изучения ядра. Особенно хорошие результаты получаются при обработке по Фёльгеиу после фиксации сулемой с уксусной кислотой, ио можно ограничиться и окраской гематоксилином или кармином.
Изучение морфологии. От шарообразного тела диаметром 200—300 мкм (достигающего и больше 1 мм) отходят многочисленные тонкие прямые псевдоподии, направленные по радиусам (рис. 19).
Цитоплазма Actinosphaerium имеет грубо-вакуо-листую (альвеолярную) структуру и разбивается на два слоя. Наружный (кор-диаметра тела, состоит из
Рис. 19. Actinosphaerium eichhorni. Живой солнечник (Х500) из кн. Дофлейна:
/ — сердцевинный слой цитоплазмы, 2 —пища, 3 — ядра, 4— аксоподии, 5 —корковый слой цитоплазмы, 6 — сократительная вакуоль
ковый) слой, достигающий ’/ю—Че всего
очень крупных вакуолей с прозрачным содержимым, отграниченных друг от друга мелкозернистой цитоплазмой. В «молодом» возрасте (у мелких экземпляров) вакуоли располагаются правильным слоем и сдавливают друг друга в радиальном направлении. У «взрослых» же (крупных) солнечников правильность расположения нарушается, и вакуоли располагаются неправильно, в несколько рядов (рис. 20, А).
Вакуоли внутреннего слоя (сердцевинного) значительно мельче, между ними прослойки зернистой цитоплазмы более толстые. Этот слой, кроме того, обычно бывает набит пищевыми включениями (от чего зависит его окраска), и в нем же помещается ядерный аппарат Actinosphaerium. Граница между обоими слоями выражена очень резко (рис. 19).
Даружный слой выпускает псевдоподии, постепенно сужающиеся к дистальному концу. Мелкозернистая, текучая плазма псевдоподий образует иногда легкие вздутия (узелки).
4
Рис. 20. Actinosphaerium eichhorni. А—край тела in vivo (XH00) (из кн. Бючли); Б — ядро, обработанное по Фёльгену (Х2500) (из кн. Богдановича) :
/ — пища, 2— ядро, 3— сердцевинный слой цитоплазмы, 4—корковая цитоплазма, 5— аксоподии, 6 — осевая нить аксоподии, 7— карцозома
Внутри каждой псевдоподии при больших увеличениях (под им-мерзией) следует рассмотреть плотную скелетную осевую нить. Каждая нить входит в пределы тела, пронизывает наружный слой и заканчивается в периферической области сердцевинного слоя (рис. 20, Л). Псевдоподии такой структуры носят название аксопо-дий. Они могут медленно изгибаться, могут вытягиваться и, наоборот, могут втягиваться внутрь плазмы. В последнем случае осевая нить разжижается и исчезает. Фибриллярная структура осевой нити может быть уловлена только путем применения специальных методов исследования (затемненное поле зрения, окраска срезов особыми методами и т. д.).
Аксоподии служат солнечникам главным образом для захвата пищи, но при медленном их изгибании животные могут передвигаться по субстрату катящимся способом. Кроме того, Actinosphaerium может парить в воде и даже плавать в ней. Пища захватывается аксоподиями. Инфузории, коловратки, мелкие черви и т. п. при прикосновении к псевдоподии перестают двигаться, видимо, их парализует какое-то ядовитое вещество, выделяемое солнечником. Далее вокруг добычи склоняются соседние поверхности коркового слоя плазмы. От последнего нередко выступает широкая лопастная псевдоподия, которая и поглощает пищу, иногда же на поверхности просто образуется ямка, в которую пища и втягивается. Далее она окружается светлым полем и передается в сердцевинный слой в виде пищеварительной вакуоли (см. рис. 19). Непереваренные остатки выталкиваются вон из тела.
Сократительные вакуоли у Actinosphaerium располагаются в наружном слое (см. рис. 19). Обычно их две, хотя часто бывает и больше, и количество их может доходить даже до 14. Перед сокращением каждая вакуоль сильно увеличивается в размерах, значительно выдается над поверхностью тела и лопается. Сокращение вакуолей происходит не одновременно, и интервалы между ними при комнатной температуре бывают несколько меньше минуты.
аксоподии, и она подводится к
Ядра располагаются в сердцевинном слое в большом количестве (см. рис. 19). У крупных экземпляров их бывает больше 200. Каждое из них небольших размеров, in vivo они видны плохо — обычно мешают многочисленные включения внутреннего слоя, поэтому лучше ядра рассматривать на окрашенном препарате. Тогда выступает их кари-озомная природа. Реакция Фёльгена показывает, что хроматиновые частицы распределены как в кариозоме, так и в окружающей его периферической части ядра (рис. 20, Б). Нередко удается наблюдать стадии деления. Тело солнечника при этом перешнуровывается пополам.
ПОДКЛАСС RADIOLARIA — ЛУЧЕВИКИ
Данная группа саркодовых живет главным образом в теплых и тропических морях. В пределах Советского Союза радиолярии попадаются изредка в Кольском заливе, известны из морей Дальнего Востока, поэтому получение материала затруднено. Приходится основной объект брать из Средиземноморского материала или Японского моря.
Acanthometra sp.
Материал и методы изучения. Различные виды Acanthometra (из сем. Acanthomet-ridae) ведут планктонный образ жизни. При обычных методах сбора планктона, с фиксацией формалином, сохраняются плохо. Их следует отбирать из планктонной пробы пипеткой и фиксировать отдельно. В качестве фиксирующих жидкостей годятся пикриновые смеси, Ценкер, осмиевые смеси. Материал хранится в 70° спирте. Окраска квасцовым кармином или гематоксилинами.
Рис. 21. Acanthometra elastica in vivo (X1000) (из кн. Бючли):
1 — экваториальные иглы, 2 — тропические иглы, 3 — полярные иглы. 4 — псевдоподии, 5 — экстра-капсулярная цитоплазма, 6— интракапсулярная цитоплазма с разбросанными в ней ядрами, 7— миофриски
Изучение морфологии. Шарообразное тело едва достигает в диаметре 40—50 мкм. От него во все стороны расходятся псевдоподии и торчат наружу скелетные иглы. Протоплазма имеет альвеолярную структуру и резко разделяется центральной хитино-идной капсулой на два слоя: внутреннюю интракапсулярную и наружную экстракапсулярную плазму (calymma) (рис. 21).
Интракапсулярная плазма более мелкоячеиста, содержит в себе ядерный аппарат, жировые капельки и многочисленные зооксантеллы (симбиотические водоросли), окрашенные в желтый цвет, что и придает окраску всей внутренней плазме.
Экстракапсулярная цитоплазма грубо вакуолиста, прозрачна. Промежутки между вакуолями заполнены зернистой
цитоплазмой. От нее отходят во все стороны аксоподии, тонкие, длинные с зернистой цитоплазмой и с осевой нитью внутри. Нередко образуются на них узелки. Псевдоподии служат главным образом для захвата пищи. Переваривание ее идет экстраплазматически, т. е. по псевдоподиям притекает цитоплазма к захваченной пищевой частичке (например, диатомовой водоросли), здесь происходит переваривание, и растворенные вещества перетекают обратно в тело. На препаратах псевдоподии обычно не сохраняются.
Псевдохитиновая центральная капсула тонкая, эластичная, пронизана многочисленными порами, с помощью которых оба слоя цитоплазмы сообщаются друг с другом. Сквозь капсулу к центру тела проходят скелетные иглы. Они соединяются вместе своими пирамидально заостренными проксимальными концами и прочно скрепляются. Материал, из которого построены иглы Acanthometra, — сернокислый стронций.
Всего имеется 20 скелетных игл одинакового размера. Длина отрезка иглы, выступающего за пределы наружного слоя, равна приблизительно диаметру тела. Иглы располагаются по так называемому Мюллеровскому закону, образуя пять параллельных кругов по четыре иглы каждый. Тело ориентируется таким образом, что четыре иглы располагаются по экватору друг к другу под углом 90°. Два круга (пояса) тропических игл ориентируются в промежутках между экваториальными иглами под углом 30° к экваториальной плоскости по обеим сторонам от нее. Наконец, иглы двух полярных кругов располагаются точно над и под экваториала альной плоскости. При такой ориентировке полюса оказываются совсем без игл.
Экстракапсулярная цитоплазма в области каждой иглы выдается конусом, одевая ее на некотором протяжении. Прикреплены эти выросты с помощью пучка (конуса) сократимых элементов, так называемых миофрисков (рис. 22). Сокращением миофрисков растягивается вся внекапсу-лярная цитоплазма, чем изменяется — увеличивается общая поверхность тела. Удлинение миофрисков, наоборот, приводит к сокращению этой цитоплазмы. Подобное изменение поверхности тела позволяет радиолярии передвигаться пассивно в вертикальном
иглами, но под углом 4о к эватори-
❖ S
Рис. 22. Acanthometra pellucida (Х2000) (из кн. Ланга):
/ — скелетная игла, 2 — миофриски, <? —псевдоподии. 4— экстракапсулярная цитоплазма, 5 — интракапсулярная цитоплазма
направлении в толще воды, увеличивая и уменьшая свою способность «парения» в водной толще. Миофриски имеют поперечнополосатую структуру, чем эти сократимые элементы резко отличаются от гладких мионем других простейших.
Многочисленные ядра разбросаны исключительно во внутренней зоне плазмы, ближе к ее периферии.
Различные феодарии
Материал и методы изучения. Представители отряда Phaeodaria являются планктонными глубоководными простейшими. Они обильно представлены в дальневосточных морях, и каждая проба, взятая планктонными сетками даже с крупной ячеей с глубины 1000, 500 м, содержит их в массе благодаря значительным размерам этих представителей. Планктонные пробы обычно фиксируются формалином. Из такой пробы под лупой или бинокуляром выбирают радиолярии, и из них готовят тотальные препараты либо в неокрашенном состоянии, либо их слегка подкрашивают квасцовым кармином.
Aulacantha scolymantha Haeckel (сем. Aulacanthidae)
Эта крупная радиолярия имеет шарообразную форму (рис. 23, А) и достигает в диаметре 3—3,5 мм. В центре цитоплазматического тела Aulacantha сосредоточено особое, свойственное только данному отряду образование — феодиум, представляющее собой скопление пигментных зерен, частиц перевариваемой пищи (чаще это створки диатомовых водорослей) и гранул запасных питательных веществ вместе с каплями жира. Феодиум принимает важное участие в обмене веществ радиолярии.
Единственная у неделящихся особей центральная капсула находится в непосредственной близости с феодиумом, она небольших размеров и имеет три отверстия, сообщающих интракапсулярную цитоплазму с экстракапсулярной. Одно из этих отверстий более крупное (астро-пиль), два других — же маленькие (парапили), расположены на противоположном полюсе от первого. Интракапсулярная цитоплазма имеет грубо вакуолистую структуру, и в ней заключено крупное ядро. У делящихся Aulacantha может быть две и даже четыре центральные капсулы.
Радиальные скелетные кремнистые иглы прямые, полые внутри, гладкие (или с небольшими бугорками), в числе 30—40, пронизывают толщу внекапсулярной цитоплазмы и своими проксимальными концами сходятся в толще феодиума'. Их дистальные концы слегка выдаются над поверхностью тела радиолярии, приподнимая плазму в этих местах. Кроме радиальных игл Aulacantha у самой поверхности плазмы имеет сплошной слой мелких тоже прямых тангентальных иголочек.
1 У представителей других родов сем. Aulacanthidae иглы могут быть с отростками, как, например, у видов рода Aulospathis (рис. 23, Б).
2
7
Рис. 23. Различные феодарии (ориг.). А— Aulacantha scolymantha, целая радиолярия (Х35); Б — две иглы Aulospathis variabilis (Х150); В — Circospathis sexfurca, общий вид (Х20); Г—Tuscaretta tubulosa, раковинка (ХЗО); Д — Castanidium variabile, раковинка (Х25); Е — центральная капсула Tuscaroridae:
1— феодиум, 2—радиальные иглы, 3 — центральная капсула, 4 — аборальная игла, 5—оральная игла, 6 — устье (пилом), 7 — побочные иглы, 8^ главные иглы, 9 — ядро, 10 — астропиль, 11 — парапили
Circospathis sexfurca Haeckel (сем. Circoporidae)
Тело этой своеобразной феодарии заключено в сплошную шарообразную темно-коричневую кремневую раковинку, имеющую на поверхности ячеистую структуру в виде довольно правильных многоугольников (рис. 23, В). С наружной средой полость раковинки сообщается через устье (пилом), окруженное четырьмя крупными зубцами (рис. 23, В, 6). Диаметр шара 0,5—0,75 мм.
От раковинки отходят шесть радиальных игл длиной немного меньше ее диаметра. Расширенное основание каждой иглы пронизано десятком пор. На дистальных концах иглы раздвоены или имеют по три концевых веточки. Как поверхность раковинки, так и радиальная игла покрыты редко сидящими, загнутыми щетинками.
Tuscaretta tubulosa Murray (сем. Tuscaroridae)
Раковинка овальной формы (рис. 23, Г), темно-коричневая, в длину достигает 1,5 мм, пронизана очень тонкими порами. На одном из полюсов раковинки имеется довольно широкое устье (пилом), сжатое с боков, с двумя отходящими от его краев оральными иглами (рис. 23, Г, 5). Они длинные, обычно бывают обломаны и на слегка вздутых основаниях имеют несколько пор. Вблизи устья от стенки раковинки отходят 3—4 аборальные иглы (рис. 23, Г, 4), тоже длинные, загнутые и с порами у основания. Иглы на всем протяжении покрыты загнутыми дистально шипиками. У живых особей экстракапсулярная цитоплазма тонким слоем покрывает как раковинку, так и иглы. Внутри раковинки лежит центральная капсула овальной формы и ярко окрашенный феодиум.
Castanidium variabile Borgert (сем. Castanellidae)
Обладают правильно шаровидной бесцветной кремнистой раковинкой, пронизанной массой довольно крупных пор одинаковой величины. Диаметр раковинки около 0,75 мм. Наряду с порами имеется и широкое устье (пилом), снабженное 2—3 иглами, прикрепленными к его краям. От поверхности раковинки отходят многочисленные радиальные иглы двух категорий — главные и побочные. Главные иглы длинные, почти равные радиусу раковинки, перемежаются с побочными, которые короче главных в несколько раз. Чаще иглы бывают с обломанными кончиками.
КЛАСС MASTIGOPHORA — ЖГУТИКОНОСЦЫ
Здесь рассматриваются представители семи отрядов этого класса (Kinetoplastida, Euglenoidina, Phytomonadina, Dinoflagellata, Polymasti-gina, Hypermastigina и Opalinina). В пределах каждого отряда выбраны наиболее характерные формы. Как и среди других Protozoa, при изучении Mastigophora наиболее существенную роль в большинстве 76
случаев играет изучение живого материала. В ряде случаев его приходится дополнять фиксированными и окрашенными различными способами препаратами.
ОТРЯД KINETOPLASTIDA
Bodo Sp.
Материал и методы изучения. Различные виды Bodo довольно часто можно обнаружить в очень сильно загрязненных водах. Обычно удается наблюдать развитие в значительном количестве Bodo в «навозных культурах». Последние получаются следующим образом. Небольшое количество слегка перепревшего конского навоза заливают на 2/3 водой. Через несколько дней наблюдается массовое развитие различных простейших и в том числе Bodo.
В пределах этого рода различают несколько видов, чрезвычайно схожих друг с другом по своим морфологическим признакам. Изучение строения Bodo следует вести на живом материале. Если культура богата, то можно сделать препарат, зафиксирован его жидкостью Шаудина по методу мазков и окрасив железным гематоксилином.
Изучение живого объекта. Чаще других попадаются Bodo caudatus Duj и В. edax Klebs — два очень близких вида. Первый из них несколько крупнее второго. Форма тела довольно сильно варьирует. Тело несколько суживается к заднему концу (рис. 24, Л). Длина В. caudatus 10—25 мкм. На переднем конце берут начало два длинных жгутика.
Рис. 24. Bodo edax (Х1000). А—неделящаяся особь; Б—К — последовательные стадии деления (по Кюну):
Один из них при движении направлен вперед, другой — назад. Первый активно движется, вызывая поступательное движение жгутиконосца, второй более или менее пассивно волочится в воде. На переднем же конце у места отхождения жгутиков происходит заглатывание пищи. Морфологически оформленного ротового отверстия у Bodo нет, но имеется особый участок протоплазмы, лишенный пелликулы («Mundstel-1е»). Одна простая сократительная вакуоль расположена на переднем конце, недалеко от места прикрепления жгутиков. В протоплазме часто имеются мелкие частицы заглоченной пищи (обычно бактерии).
Окрашенные препараты. На окрашенных железным гематоксилином препарате следует рассмотреть ядро с кариозомом, расположенное в передней половине тела. Впереди ядра лежит кинетопласт (параба-зальное тело). На удачно окрашенных железным гематоксилином препаратах с иммерсией удается рассмотреть у основания жгутиков кине-тосомы (базальные тельца) в виде темноокрашенных зерен.
На препаратах желательно отыскать разные стадии деления Bodo (рис. 24, Б — К). Деление продольное, что ясно видно на первых стадиях. На поздних стадиях оно кажется поперечным, так как происходит изменение оси деления. Ядро делится митотически. Однако по ходу митоза ядерная оболочка не исчезает, а перетягивается, в силу чего фигуры деления напоминают амитоз. Это сходство усиливается еще тем, что в силу очень мелких размеров ядра хромосомы при светооптическом исследовании почти не видны.
Кинетопласт делится одновременно с ядром путем простой перетяжки.
Trypanosoma lewisi (Kent)
Материал и методы изучения. Среди многочисленных видов Trypanosoma, паразитирующих в крови позвоночных животных, наиболее доступны для изучения Т. lewisi, часто встречающаяся в крови крысы пасюка (Rattus norvegicus). Следует взять каплю от живой крысы и исследовать ее, прикрыв покровным стеклом, под микроскопом !. В том случае, если трипанозомы будут обнаружены, сделать мазок и окрасить его сухим способом по Романовскому (методику изготовления мазков крови см. с. 36—38). Второй мазок желательно окрасить по Фёльгеиу (с. 35) с подкраской лихтгрюном.
Изучение живого объекта. В плазме крови2 при большом увеличении микроскопа хорошо видно движение трипанозом. При этом наблюдается характерное смещение отдельных эритроцитов. Под иммерсией удается разглядеть ундулирующую мембрану, идущую вдоль края тела с одной стороны почти до заднего конца и продолжающуюся на переднем конце в жгутик. Ундулирующая мембрана производит колебательные движения, которые распространяются волнами от переднего конца к заднему. Сама ундулирующая мембрана образуется в результате того, что жгутик, тянущийся вдоль тела, соединяется с краем последнего тонкой цитоплазматической перепонкой.
1 Получить каплю крови проще всего, надрезав у крысы хвост.
5 Можно также взять кровь, убив крысу. При этом нужно брать кровь от только что убитого животного. Следует иметь в виду, что молодые крысы бывают заражены трипанозомами чаще, чем старые.
Окрашенные препараты. На окрашенных, по Романовскому, сухих мазках под иммерсией удается хорошо рассмотреть морфологию Т. lewi-si. Размеры ее варьируют в довольно широких пределах. Длина ее 7— 35 мкм, ширина 1,5—3 мкм. Чаще встречаются особи длиной 20— 25 мкм. Форма тела ланцетовидная, заостряющаяся к переднему и заднему концу (рис. 25). Обычно тело изогнуто в одну сторону, причем выпуклой является та сторона, которая несет ундулирующую мембрану. Цитоплазма, по Гимза, окрашивается в синий или фиолетовый цвет и часто обнаруживает мелкую зернистость. Ядро, занимающее почти весь поперечник клетки, располагается на границе передней трети тела. Оно имеет овальную форму и несколько вытянуто по продольной оси жгутиконосца, по Романовскому, окрашивается в красный цвет. Жгутик довольно короткий. Его продолжением служит краевая нить унду-лирующей мембраны. На удачно окрашенных препаратах краевая нить отчетливо видна, она окрашена в красный цвет. Кинетопласт располагается около заднего конца трипанозомы. Он значительно меньше ядра, но так же, как последнее, ярко окрашивается в красный цвет. К нему подходит краевая нить ундулирующей мембраны.
На обработанных, по Фельгену, препаратах положительную реакцию дает не только ядро, но и кинетопласт. Это доказывает наличие в нем ДНК. По современным представлениям, кинетопласт представляет собой органоид митохондриальной природы, несущий вместе с тем значительное количество ДНК.
Если крыса, из которой взята кровь для исследования, недавно заразилась трипанозомами, то на препаратах удается обнаружить раз-
Рис. 25. Trypanosoma lewisi (Х2000) (по Веиьону). А — Г — неде-лящиеся особи; Д — деление надвое; Е, Ж — множественное деление:
. 1 — жгутик, 2 — уидулирующая мембрана, 3 — кинетопласт, 4 — ядро
ные стадии деления (рис. 25). У Т. lewisi имеет место либо деление надвое, либо множественное деление. При множественном делении образуются характерные формы в виде розеток (рис. 25, Ж)- Кинетопласт при этом смещается и располагается вблизи ядра. Период энергичного размножения у Т. lewisi непродолжителен. Дней через 13—14 после заражения делящихся особей в крови обнаружить почти не удается.
Заражение крыс трипанозомами осуществляется через блох (Сега-tophyllus fasciatus, Xenopsylla cheapis) %
ОТРЯД EUGLENOIDINA
Euglena viridis Ehrbg.
Материал и методы изучения. Многочисленные виды рода Euglena встречаются в пресноводных водоемах очень часто. Многие из них преимущественно населяют водоемы, богатые органическими веществами и мезосапробного и полисапробного типа. Некоторые виды Euglena (иапример, Е. gracilis, Е. viridis, Е. deses) удается довольно легко культивировать в искусственных средах1 2.
Среди многочисленных сред, которые приводятся в литературе, укажем среду Кнопа (вода дистиллированная 1000 г, MgSO4 — 0,25, Са(МОз)г—1,0, КН2РО4 — 0,25, КС1 — 0,12 г, FeCl3 — следы) и среду Бенеке (вода дистиллированная 1500 г, NH4NO3 — 0,3, СаС12 —0,15, К2НРО4 —0,15, MgSO4 — 0,15, FeCl — следы).
На чисто минеральных средах евглены размножаются довольно медленно. Гораздо лучше развиваются культуры, если к минеральным средам прибавить органические вещества. В частности, евглены хорошо развиваются на мясном бульоне (0,25% либи-ховского экстракта). Последний (если нет готового экстракта Либиха) приготовляется путем кипячения мелко нарезанных кусочков мяса (без жира) в воде. Полученная таким путем жидкость фильтруется через вату. Несколько капель бульона следует добавить к минеральной среде. Стерильности среды для культивирования евглен не требуется. Развивающиеся в небольшом количестве бактерии не препятствуют размножению евглен. Но бульон для сохранения (чтобы не готовить всякий раз новый) желательно простерилизовать обычным способом в автоклаве.
В качестве посуды для культуры евглен годятся обычные химические пробирки или небольшие эрленмейровские колбы.
Вместо искусственно приготовленной минеральной среды можно сделать почвенную вытяжку, на которой (особенно при прибавлении бульона) евглены иногда развиваются очень хорошо.
В качестве^ представителя евглен мы рассмотрим организацию Euglena viridis, особенно часто встречающуюся в природе.
Изучение живого объекта. Для рассмотрения Е. viridis необходимо использовать большие увеличения микроскопа.
Е. viridis (рис. 26) обладает веретеновидным телом, задний конец ее заострен. Длина тела около 50—60 мкм, ширина 14—18 мкм. Форма тела не остается постоянной, евглена обнаруживает ясно выраженную способность к метаболизму. Она сокращается вдоль своей продольной оси, причем в момент сокращения тело ее становится короче и шире.
1 Размножение трипанозом происходит в кишечнике у блох. Затем они концентрируются в прямой кишке и выходят наружу с калом. Крыса, слизывая и проглатывая экскременты блох, заражается трипанозомами. Последние проникают в кровь, по-видимому, через слизистую оболочку ротовой полости. Изучение стадий развития трипанозом в блохах представляет значительные трудности, поэтому здесь и не приводится.
2 О культивировании евглен и других зеленых жгутиконосцев см. в кн.: Определитель пресноводных водорослей СССР. Вып. 1. Общая часть. М., 1951.
Снаружи евглена покрыта тонким эластическим слоем цитоплазмы (пелликулой), играющей роль оболочки. Пелликула обладает очень нежной спиральной исчерченностью, которую, однако, далеко не всегда удается рассмотреть. В цитоплазме Е. viridis имеются многочисленные овальные или удлиненные зеленые хроматофоры, расположенные в виде звезды. Кроме хроматофоров в цитоплазме всегда присутствуют в различном количестве мелкие овальные бесцветные зерна углевода парамила, представляющего продукт ассимиляции. Если парамила очень много, то он маскирует хроматофоры, которые при этом трудно бывает рассмотреть. В таких случаях полезно культуру евглен поместить на 2—3 дня в полную темноту. Число зерен парамила после этого уменьшается и хроматофоры выступают отчетливо. Ядро на живых евгленах без окраски обычно не видно. Оно располагается в задней трети тела и в этом месте имеется светлое пятно, так как хроматофоры оттесняются ядром.
При окраске уксуснокислым кармином оно выступает отчетливо. Ядро Е. viridis обладает крупным центрально расположенным ядрышком, хроматин располагается в периферической его части. В цитоплазме кроме хроматофоров и парамила иногда в различном количестве присутствуют зерна красно-коричневого пигмента гематохрома.
В передней части тела располагается довольно сложно устроенная сократительная вакуоль. Она состоит из следующих компонентов. Имеется округлая сократительная вакуоль, вокруг которой располагается несколько мелких собирательных вакуолей (рис. 26, 3). При систоле содержимое
Рис. 26. Euglena viridis (Х1500) (по До-флейну):
1 — жгутик, 2 — резервуар сократительной вакуоли, 3— сократительная вакуоль, 4— хроматофоры, 5 — ядро, 6 — парамиловые зерна, 7 — стигма (глазок)
сократительной вакуоли изливается в довольно обширный резервуар. Последний не обладает сократимостью. Он сообщается с наружной средой при помощи узкого канала (воронки), открывающегося наружу на
переднем конце евглены.
У евглены имеется один жгут, хорошо видимый на живых экземплярах, особенно при некотором затемнении поля зрения микроскопа. Жгут входит в канал воронки '. В цитоплазме в непосредственном со-
седстве с резервуаром располагается ярко окрашенная в красно-коричневый цвет стигма (иначе называемая иногда глазным пятном) (рис. 26, 7).
1 Строение базальной части жгута Euglena довольно сложно. В резервуаре жгут раздваивается. Одна из ветвей его образует на уровне стигмы утолщение. У дна резервуара обе базальные части входят в цитоплазму, где и берут начало от двух базальных телец. Однако для того чтобы обнаружить указанные детали в строении жгута, необходимы специальные методы обработки.
Другие виды евглен
5
Г
Рис. 27. Разные виды евглен (из кн. Пашера). А — Euglena gracilis (Х500); Б — Е. acus (Х200); В—Е. deses (Х500); Г — Е. oxyuris (Х250)
Наряду с Euglena viridis встречается и ряд других видов этого рода. Здесь дается краткое описание и рисунки наиболее обычных из них 1.
Euglena gracilis (рис. 27, А). Небольшие евглены (длина 37—45 мкм, ширина 6—22 мкм), оживленно мета-болирующие. Хроматофоров несколько, обычно 5—10, продолговатой формы, иногда с неправильно изрезанными краями. Каждый хроматофор несет один пиреноид, занимающий его центральную часть. Длина жгута равна длине тела.
Eyglena acus (рис. 27, Б). Сильно вытянутые веретенообразные евглены с заостренным задним концом. Почти не метаболируют. Длина около 250—300 мкм, ширина 20—30 мкм. Многочисленные овальные хромато-форы. Парамиловые зерна крупные, палочковидные. Жгутик короткий.
Euglena deses (рис. 27, В). Цилиндрическое тело, усиленно метабо-лирует. Длина 85—155 мкм, ширина 15—22 мкм. Многочисленные мелкие хроматофоры, расположенные преимущественно периферически, непосредственно под пелликулой. Жгутик короткий.
Euglena oxyuris (рис. 27, Г). Очень крупные формы (длина 350— 500 мкм, ширина 30—45 мкм) с плотной пелликулой, обладающей выраженной спиральной исчерченностью.
Многочисленные мелкие хроматофоры. Характерно наличие двух крупных парамиловых зерен в форме колец, из которых одно расположено в передней, а другое — в задней трети тела.
Phacus sp., Trachelomonas sp. и Peranema sp.
Кроме рода Euglena в пресных водах чрезвычайно обычны представители двух других родов, относящихся к отряду Euglenoidina, а именно Phacus, Trachelomonas и Peranema. Так как они обычно попадаются наряду с евгленами, здесь дается краткое описание наиболее обычных видов, относящихся к обоим указанным родам.
Phacus longicauda. Представители рода Phacus отличаются от большинства евглен тем, что имеют весьма прочную пелликулу и форма их
1 Для более точного определения евглен см., например, в кн.: Попова Т. Г. Эвгле-новые водоросли. М., 1955.
тела постоянна. Ph. longicauda обладает сильно сплющенным телом, несущим на заднем конце длинный вырост в виде иглы (рис. 28, А). Длина 85—115 мкм, ширина 45—70 мкм. Пелликула продольно исчерчена. Многочисленные хроматофоры прилегают изнутри к пелликуле. В середине тела располагается одно крупное парамиловое зерно (не путать с ядром). Строение сократительной вакуоли и стигмы такое же, как и у Euglena. Имеется один довольно длинный жгутик на переднем конце тела. Ядро на живых экземплярах рассмотреть не удается.
Оно располагается в задней половине тела и имеет у этих жгутиконосцев такую же структуру, как и у Euglena. Выступает отчетливо при окраске ядерными красками.
Trachelomonas hispida. Представители рода Trashelomonas обладают весьма прочной оболочкой. При этом цитоплазматическая часть может несколько отделяться от оболочки, которая приобретает характер домика или раковинки. У Tr. hispida (рис. 28, Б), как и у многих других представителей этого рода, домик снаружи имеет характерную скульптуру, он несет многочисленные шипики, довольно густо расположенные. Имеется несколько хроматофоров с пиреноидами. Хорошо выражена стигма. Сократительная вакуоль устроена по тому же типу, каку Euglena. Один жгутик расположен на переднем конце тела. Он выходит наружу через особое отверстие в стенке домика. У Trachelomonas домик часто бывает окрашен в желтоватый и даже в коричневый цвет. Это обусловлено тем, что он инкрустируется солями железа.
Ядро, имеющее структуру, сходную с таковой у Euglena и Pha-cus, расположено в задней части клетки. Без окраски его не видно.
Рис. 28. Представители отряда евглеиовых. А — Phacus longicauda (Х600); Б — Trachelomonas (Х600); В—Peranema trichophorum (Х1500) (А и Б поДофлей-ну, В—по Грассе):
1 — сократительная вакуоль, 2 —стигма, 3 — пиреноид, 4 — ядро, 5 — передний жгут, 6— па-лочковый аппарат» 7 — задний жгут, 8 т-парамиловые зерна
Род Регапета относится к числу бесцветных представителей Eug-lenoidea. Чаще других в «навозных культурах» и в других богатых органическими веществами настоях развивается в массовом количестве Регапета trichophorum (рис. 28, В). Это довольно крупный жгутиконосец (до 70 мкм длины) почти цилиндрической формы, несколько суживающийся к переднему концу. Обладает прочной эластичной пелликулой, способен к резко выраженным метаболическим изменениям формы тела. Имеет два жгута. Из них передний обладает длиной, равной или превосходящей длину тела, и значительной толщиной, что обусловливает очень хорошую его видимость под микроскопом. При плавании активные движения совершает лишь дистальная часть жгута, остальная же часть направлена прямо вперед и мало подвижна. Второй жгут гораздо тоньше, направлен назад и прирастает к пелликуле. Разглядеть его удается редко. Р. trichophorum может заглатывать оформленные частички пищи. Имеется палочковидный аппарат, окружающий ротовую щель. Он состоит из трех эластических палочек (рис. 28, В, 6). Кроме того, Регапета питается, по-видимому, и сапрофитически.
В эндоплазме имеются резервные вещества в виде довольно крупных парамиловых зерен.
Ядро с центрально расположенным кариозомом помещается в задней половине тела.
Рекомендуется сделать препарат (мазок), окрасив его железным гематоксилином.
ОТРЯД PHYTOMONADINA
Chlamydomonas sp.
Материал и методы изучения. Многочисленные виды Chlamydomonas развиваются иногда в больших количествах в пресноводных водоемах, вызывая «цветение». Чаще всего массовое размножение Chlamydomonas имеют место в небольших лужицах, в канавах, в воде, более или менее богатой органическими веществами. Культивировать Chlamydomonas возможно и в искусственных средах, например в растворах Кнопа и Бенеке.
Род Chlamydomonas, к которому относится более 150 видов, отличается исключительным многообразием. Поэтому мы не приурочиваем нашего описания к какому-либо одному виду, а укажем общие признаки рода Chlamydomonas.
Изучение живого объекта. Форма тела большинства видов хламидомонад более или менее правильно яйцевидная (рис. 29), иногда округлая. Длина 10—30 мкм. Имеется довольно прочная целлюлозная оболочка. На переднем конце располагается два жгутика одинаковой длины. У многих видов Chlamydomonas на переднем же конце помещается небольшое утолщение оболочки — так называемая папилла. Ярко-зеленая окраска жгутиконосца обязана наличию большого хроматофора чашевидной формы *. В задней части хроматофора обычно имеется один пиреноид. Ближе к переднему концу располагается стигма (она имеется не у всех видов). Две небольшие сократительные вакуоли уда-
1 У некоторых видов Chlamydomonas может быть несколько хроматофоров.
1
Рис. 29. Chlamydomonas angulosa (X1900). A — иеделящаяся особь; Б— Г — последовательные стадии деления (по Дилль):
/’—жгут, 2 — сократительная вакуоль, 3 — стигма, 4 — хроматофор, 5 — пиреноид, б— ядро
ется иногда рассмотреть у основания жгутиков. В цитоплазме присут-
ствуют зерна крахмала.
Ядро занимает в клетке более или менее центральное положение. Иногда оно располагается ближе к переднему концу. Без окраски об-
наружить ядро не удается.
Наряду с изучением строения хламидомонад не представляет особых затруднений познакомиться с их агамным размножением. Нужно, однако, иметь в виду, что размножение у большинства видов происходит в ночное время. Некоторые виды размножаются путем продольного деления в свободноподвижном состоянии. В большинстве случаев, однако, жгутики теряются, хламидомонада опускается на дно, и внутри оболочки происходит деление протопласта сначала на две, а затем на четыре части (рис. 29, Б—Г). Через разрыв оболочки материн-
Рис. 30. Chlamydomonas braunii (Х1500). Деление в пальмеллевидной стадии (по Горо-жанкину)
ской клетки образовавшиеся таким путем зооспоры выходят наружу, образуя жгутики, и начинают активно плавать. Вскоре они достигают величины исходной материнской клетки.
У многих видов Chlamydomonas, особенно в условиях культуры, наблюдается образование так называемых пальмеллевидных стадий (рис. 30). При этом хламидомонады теряют жгуты, оболочка их ослизняется. В результате многократных делений образуются многоклеточные комплексы. Отдельные клетки могут вновь образовать жгуты и перейти в свободноподвижное состояние.
У хламидомонад иногда удается наблюдать и половой процесс, который представляет собой копуляцию гамет. У некоторых видов имеет место изогамия, у других — анизогамия.
Polytoma uvella Ehrbg.
Материал и методы
Рис. 31. Polytoma sp. (схема организаций) (по Энтцу):
1 — жгут, 2 — сократительная вакуоль, 3 — ядро. 4—зерна крахмала, 5 — корневая нить, связывающая ядро с базальными зернами жгутов,
6 — стигма
изучения. Polytoma uvella попадается весьма часто в сильно загрязненных водоемах с большим содержанием растворенных органических веществ. Почти всегда она разводится в лаборатории в аквариумах, в которые внесено небольшое количество конского навоза. Часто можно найти ее также в сенных настоях. Изучение Polytoma uvella следует вести на живом материале.
\ / Изучение живого объ-
’ / екта. Р. uvella имеет тело
/ яйцевидной формы, не-\ / сколько расширенное к зад-
. \/ нему концу (рис. 31). Дли-
/Д\ /лХ на 15—30 мкм, ширина 10—
20 мкм. На переднем кон-рА®,0) че — два-одинаковой длины
Жйу) жгутика. В цитоплазме
xS&z хД-У обычно имеется довольно
значительное количество
Zx //ем\ мелких крахмальных зерен,
природа которых может ® ) ] быть легко установлена пу-
/ тем подкраски иодом (синее
\. ''Д/ окрашивание).
Кроме крахмала иногда имеется небольшое коли-
Рис. 32. Polytoma pseuduvela (Х750). Стадии деления (по Пашеру)
чество мелких, сильно светопреломляющих гранул, которые представляют собой жировые капли. В переднем конце располагаются две небольшие сократительные вакуоли.
Ядро с крупным кариозомом (ясно видно только после окраски) занимает или центральное положение, или, чаще, смещается ближе к
переднему концу.
Близ переднего конца располагается стигма.
Агамное размножение, которое легко наблюдать, совершается путем деления. Последнее протекает следующим образом. Протопласт внутри оболочки делится сначала надвое, причем продукты деления обычно располагаются друг за другом по продольной оси. После этого каждая из клеток делится еще раз (рис. 32). Получается четыре дочерние клетки, которые выходят наружу через разрыв оболочки.
Половой процесс у Polytoma uvella (рис. 33) представляет собой изогамную копуляцию гамет. Наблюдать его можно очень часто, поэтому на данном примере удобно познакомиться с половым процессом у Mastigophora. Вызвать копуляцию у Polytoma обычно удается следующим приемом. Нужно взять небольшое количество жидкости из культуры, где имеется много Polytoma, и разбавить ее в 2—3 раза чистой (например, водопроводной) водой. Вскоре после этого начинается массовая копуляция. Следует под микроскопом наблюдать за образованием парочек и проследить весь процесс копуляции. Гаметы относительно мало отличаются от некопулирующих особей. Размеры их те же. Они несколько больше вытянуты в длину и имеют большее количество зерен крахмала. Копуляция начинается с того, что две гаметы соединяются
Рис. 33. Polytoma uvella (Х700) (по Догелю). А— некопулирующая особь; Б—Ж — последовательные стадии копуляции; 3 — зигота в состояния инцистирования
одним из жгутиков и плавают некоторое время вместе, причем их продольные оси более или менее совпадают (рис. 33, В). Эта стадия длится 5—10 мин, после чего происходит соединение двумя жгутиками и обе гаметы оказываются расположенными друг против друга. Эта стадия кратковременна (1—7 мин). Далее начинается процесс слияния плазмы обеих гамет (рис. 33, Г—Ж), при этом подвижность гамет не теряется. Жгутики смещаются со своего первоначального терминального положения и оказываются расположенными сбоку.
На последних стадиях слияния гаметы обнаруживают повышенную подвижность и очень активно плавают. Процесс слияния протоплазмы гамет довольно длительный и занимает около 2 ч. В конце копуляции жгутики сбрасываются и зигота округляется. В это время совершается слияние ядер.
Зигота окружается довольно толстой оболочкой и переходит в состояние покоя (рис. 33, Ж, 3).
Eudorina elegans Ehrbg.
Материал и методы изучения. Наиболее широко распространенный представитель этого рода — Eudorina elegans Ehrbg., довольно часто
встречается в природе в пресноводных водоемах, чаще всего — в прудах, не очень сильно загрязненных. Возможна также культура Eudorina в искусственных средах. Методику культивирования разработал Гартманн. Однако она здесь не приводится ввиду значительной сложности1.
Изучение живого объекта. Eudorina elegans образует колонии, чаще всего состоящие из 32 клеток, реже из 16, 8 и даже 4. Отдельные клетки, входящие в состав колонии, находятся в связи друг с другом благодаря наличию студенистой массы. Общая форма колонии приближается к шаровидной. Обычно колония не образует правильного шара и одна ось ее более длинная (рис. 34). Размеры колонии варьируют в довольно широких пределах. Длинная ось равняется 50—200 мкм. Размеры отдельных клеток 16—24 мкм. В пределах колонии удается подметить определенную полярную диффенцировку. На одном полюсе, который можно назвать передним, стигмы значительно сильнее развиты, чем на противоположном. В средних частях колонии размеры стигм носят промежуточный характер. Кроме того, передний конец колонии всегда правильно закруглен, задний же иногда более или менее тупо срезан. Это различие, однако, не всегда имеет место. Поступательное движение колонии обычно осуществляется передним концом вперед. Расположение отдельных клеток в колонии является закономерным. Они располагаются несколькими рядами (этажами). Первый (передний) ряд состоит из 4 клеток, последующие три ряда — из 8 клеток каждый, последний (задний)—вновь из 4 клеток. Между отдельными клетками колонии имеется довольно значительное расстояние. Необхо
Рис. 34. Eudorina elegans (Х450) (по Гартману). А — колония из 32 клеток; Б — агамиое размножение
1 См.; Hartmann М. Die dauernd agame Zucht von Eudorina elegans und ihre Bedeutung fiir das Befruchtungs und Todproblem. Arch. f. Protistenk. Bd. 43, c. 223, 1921.
димо, однако, отметить, что правильность расположения клеток нередко нарушается и от описанного выше порядка их возможны разнообразные уклонения. Наружный слой студенистой прозрачной массы, связывающей клетки колонии воедино, является довольно плотным. Внутренние части ее, напротив, полужидкой консистенции. Вся масса в це-ЛОМ представляет собой, по-видимому, результат ослизнения оболочек отдельных клеток.
Отдельные клетки колонии имеют более или менее правильную шаровидную форму. Каждая клетка несет два довольно длинных жгута, проходящих своей базальной частью сквозь студенистую массу и выдающихся наружу. Каждая клетка имеет один чашевидный хрома-тофор. В задней части его располагается пиреноид. Чаще всего имеется только один пиреноид. Но в некоторых случаях число их может возрастать до пяти. На переднем конце каждой клетки имеются две сократительные вакуоли. Близ переднего конца лежит также стигма. Ядро, обладающее довольно крупным кариозомом, располагается не в центре тела клетки, а ближе к переднему концу.
Eudorina размножается как агамным, так и половым путем. Стадии ее агамного размножения удается нередко наблюдать. Оно происходит следующим образом. Каждая клетка колонии путем последовательных делений делится на 2, 4, 8, 16 и 32 клетки меньших размеров.
Продукты деления каждой клетки дают таким образом начало новой колонии. В пределах одной материнской колонии образуются 32 дочерние (рис. 34, Б).
Образовавшиеся дочерние колонии сначала остаются вместе, будучи связаны слизистой массой материнской колонии. Последняя в дальнейшем разрушается, и дочерние колонии становятся свободными. Размеры их клеток увеличиваются, образуется студенистая масса. На этом процесс агамного размножения заканчивается.
Половой процесс у Eudorina удается наблюдать гораздо реже, чем агамное размножение. Тем не менее иногда возможно его обнаружить. У Eudorina elegans наблюдается ясно выраженная анизогамия. Колонии раздельнополы. Все клетки женской колонии превращаются, не делясь, в макрогаметы. При этом происходит, по-видимому, обогащение их резервными питательными веществами (крахмал). Мужские колонии образуют гаметы иным путем. Каждая клетка колонии путем последовательных делений дает начало 64 микрогаметам. Последние оказываются более мелкими, чем клетки, образующиеся при агамном размножении. Они не образуют шара, а остаются в связи друг с другом в форме клеточной пластинки. Каждая микрогамета сохраняет хрома-тофор и стигму. В дальнейшем микрогаметы отделяются друг от друга (рис. 35). Они активно плавают, отыскивают макрогаметы и сливаются с ними.
Зигота образует довольно толстую оболочку, окрашенную обычно в желтоватый цвет. После некоторого периода покоя зигота может дать начало новой колонии.
В пресных водах наряду с Eudorina часто встречаются представители близкого рода Pandorina.
Pandorina morum образует колонии из 16 клеток (рис. 36). Отдель-
2
Рис. 35. Eudorina elegans (X400) (из кн. До-флейна):
1 — микрогаметы, 2 — макрогамета, копулирующая с микрогаметой
Рис. 36. Pandorina тогит (Х400). Общий вид колонии (по Смит)
ные клетки располагаются в непосредственной близости, прилегают друг к другу почти вплотную.
Структура отдельных клеток напоминает таковую у Eudorina. Агамное размножение совершается тем же путем.
Volvox aureus Ehrbg.
Материал и методы изучения. Два широко распространенных вида этого рода Volvox globator и V. aureus часто встречаются в планктоне пресноводных водоемов прудового и озерного типа.
Для изучения следует взять живой материал. При отсутствии такового можно использовать материал, фиксированный формалином. На нем, однако, многих деталей организации разглядеть не удается. Препараты, окрашенные н заключенные в канадский бальзам, мало пригодны.
Здесь описано строение V. aureus, который встречается чаще, чем V. globator, и изложены кратко те черты, которые характеризуют последний.
Изучение живого материала. Общий вид колонии следует рассматривать при малом увеличении микроскопа. Для изучения структуры отдельных клеток раздавить колонию и вести изучение с иммерзионной системой или же с большим увеличением.
Volvox aureus Ehrbg. образует большие шаровидные колонии диаметром 500—850 мкм (рис. 37). В состав колонии входит блоьшое количество (500—1000) отдельных клеток.
Студенистое вещество, образующее основную массу колонии, представляет собой результат ослизнения оболочек отдельных клеток. Самый наружный слой ее образует довольно плотную мембрану, придающую известную прочность всей колонии. Центральные части студенистого вещества обладают гораздо менее плотной консистенцией, они
Рис. 38. Volvox aureus. Разрез через участок колонии, схематизировано (по Жанэ): 1—вегетативная особь, 2—«вегетативная клетка размножения», 3 — хроматофор с пиреноидами, 4— ядро, 5 — цитоплазматический мостик
Рис. 37. Volvox aureus (XlOO). Общий вид колонии. Внутри материнской колонии — шесть дочерних (по Пашеру)
являются полужидкими. Несмотря на то, что колония шаровидная, она обладает полярной дифференцировкой. На одном полюсе, подобно тому, как это имело место у Eudorina, стигмы развиты сильнее и занимают в клетках терминальное положение. В этом направлении совершается движение колонии, почему этот полюс и может быть назван передним. На переднем конце колонии никогда не образуется репродуктивных клеток (гамет и «партеногонидий» — см. ниже). Последние формируются на противоположном, заднем, полушарии.
Отдельные клетки, входящие в состав колонии, не все одинаковы. Огромное большинство их не способно к дальнейшему размножению и представляет собой вегетативные клетки. На их структуре мы прежде всего и остановимся.
Сам протопласт имеет 5—8 мкм в длину и обладает грушевидной формой (рис. 38). Хроматофор один, неправильно чашевидной формы. На нем располагается обычно один (иногда больше) пиреноид. Имеется две сократительные вакуоли. Стигма различно развита на разных участках колонии (см. выше). Два одинаковых жгутика превосходят длину протопласта в 2—3 раза. Ядро маленькое, сдвинуто к переднему концу. Рассмотреть его обычно не удается. При рассмотрении колонии сверху при очень сильном увеличении можно обнаружить вокруг каждого протопласта более или менее правильные шестиугольники, в центре которых располагаются сами протопласты. Эти шестиугольники суть границы ослизненных оболочек отдельных клеток. Протопласты связаны друг с другом очень тонкими протоплазматическими мостиками (рис. 39), обнаружить которые можно, применяя очень сильное увеличение.
Рис. 39. Volvox aureus — участок колонии, вид сверху (по Жанэ):
1 — вегетативная особь, 2— граница между ослизненными оболочками клеток, 3 — цитоплазматический мостик, 4—«вегетативная клетка размножения», 5 хроматофор с пиреноидом, 6 — ядро
Среди генеративных клеток следует различать, с одной стороны, клетки, служащие для агамного размножения, так называемые «вегетативные клетки размножения»1, ас другой — гаметы.
Вегетативные клетки размножения образуются в числе 4—10 в задней (нижней) половине колонии. Они отличаются большими размерами (20—30 мкм), имеют несколько пиреноидов (см. рис. 38) и соединяются с каждой из ок
ружающих их вегетативных клеток несколькими цитоплазматическими мостиками (рис. 39). Каждая такая клетка дает начало дочерней колонии. Если рассматривать молодые колонии, то можно ви
деть сами вегетативные клетки размножения. На более старых колониях имеются различные стадии их развития, которое протекает как типичная палинтомия1 2 (рис. 40).
Клетка многократно делится. Параллельно с делением происходит процесс впячивания внутрь материнской колонии, что, в свою очередь, ведет к образованию шара, открывающегося наружу лишь небольшим отверстием. При этом передние концы клеток, несущие стигму, обращены первоначально во внутреннюю полость шара. После этого происходит своеобразный процесс выворачивания (экскурвации) шара (рис. 40, Д — Ж), начинающийся с краев отверстия его, расположенного на той стороне, где он граничит с периферическим слоем материнской колонии. Это выворачивание приводит к тому, что внутренняя поверхность шара становится наружной. Благодаря этому передний полюс клеток, несущий стигму и позже развивающий жгутики, вновь занимает нормальное периферическое положение. Развитие дочерней колонии начинается на поверхности материнской. Образующаяся в результате дочерняя колония смещается во внутрь материнской и помещается внутри шара. У V. aureus на дочерних колониях, еще находящихся внутри материнской, нередко начинается развитие следующего поколения и образуются дочерние колонии второго порядка. Выход дочерних колоний из материнской сопровождается разрывом стенок последней и ее гибелью.
1 Многие авторы называют их партеногонидиями, рассматривая их развитие как партеногенез. Против подобного толкования и терминологии решительно возражает Пашер, называя эти клетки «vegetative Vermehrungszellen».
2 Под палинтомией понимают бесполое размножение, происходящее путем ряда равномерных последовательных делений без промежуточных стадий питания и роста.
Рис. 40. Volvox aureus — развитие колонии при агамном размножении (схема по Циммерману). А — стадия двух клеток; Б — переход к четырехклеточной стадии; В, Г — первая пузыревидная стадия; Д, Е, Ж — выворачивание (экскурвация) первой пузыревидной стадии; 3 — молодая колония после окончания выворачивания (по Циммерману)
Из клеток, подобных по строению «вегетативным клеткам размножения» (из оогоний), образуются гаметы. V. aureus является раздельнополым, поэтому различают мужские и женские колонии *. У V. globator колонии обоеполые. Женские половые клетки — макрогаметы отличаются значительными размерами (60—75 мкм) (рис. 41), они окрашены в буровато-зеленый цвет.
Микрогаметы образуются путем многократного деления клетки. Каждая микрогамета представляет собой небольшую, сильно вытянутую в длину клетку с двумя жгутиками и хроматофором. Все микрогаметы, образовавшиеся из одной материнской клетки (числом около
1 Иногда у V. aureus наблюдается развитие макро- и микрогамет на одной колонии.
Рис. 41. Volvox globator (X250)—участок колонии с половыми клетками (по Клейну): 1 — макрогамета, 2 — микрогаметы
Рис. 43. Volvox globator — вид на участок колонии сверху (по Жанэ): видны широкие протоплазматические мосТики (1) и границы между клетками (2)
Рис. 42. Volvox globator — схематический разрез через небольшой участок колонии (по Жанэ)
ста), некоторое время остаются друг с другом в связи, образуя характерную группу в виде пластинки (рис. 41). После оплодотворения зигота одевается прочной двойной оболочкой. Она освобождается после гибели материнской колонии и может дать начало новой колонии путем многократного деления.
Vodvox globator Ehrbg. в отличие от V. aureus может достигать большей величины (диаметр колонии до 2 мм). Число слагающих колонию клеток у него бывает больше, чем у V. aureus (до 20 тыс., чаще около 10 тыс.). Форма вегетативных клеток иная (рис. 42, 43). Они сильно уплощены в передне-заднем направлении. Цитоплазматические мостики, соединяющие отдельные клетки, гораздо шире, чем у V. aureus. Благодаря этому весь протопласт при рассматривании сверху имеет звездчатую форму. Колонии V. globator в большинстве случаев обоеполы. Поэтому в одной колонии удается рассмотреть как микро-, так и макрогаметы
1 Кроме двух рассмотренных видов Volvox иногда встречается третий вид — К tertius. Он походит на V. aureus, но отличается во взрослом состоянии отсутствием цитоплазматических мостиков.
ОТРЯД DINOFLAGELLATA (PERIDINEAE)
Peridinium sp.
Материал и методы изучения. Различных представителей рода Peridinium очень часто удается обнаружить в пресноводном планктоне. Иногда, развиваясь в больших количествах, они вызывают «цветение» воды в мелких пресноводных водоемах. Некоторые виды этого рода входят в состав морского фитопланктона. Число видов рода Peridinium очень велико. Одни из наиболее обычных для мелких пресноводных водоемов — Р. tabulatum, Р. cinctum и многие другие. Ниже приводится описание Р. tabu-latum.
с. п.
Рис. 44. Peridinium tabulatum — расположение пластинок панциря. А — с брюшной стороны; Б — со спинной стороны; В—сверху; Г—снизу (Х550) (из кн. Пашера):
а. п. — апикальные пластинки, 6. э.—боковые экваториальные пластинки, н. п. — нижние полярные пластинки, п. — передние экваториальные пластинки, п. э. — постэкваториальные пластинки, р. п.—ромбическая пластинка, с. п.— спинные пластинки, з.э. — задняя экваториальная пластинка
Изучение живого объекта. Для изучения строения Peridinium следует воспользоваться большим увеличением микроскопа или иммерсионной системой.
Форма тела у Peridinium tabulatum (рис. 44) более или менее правильно яйцевидная. Длина около 50. Движение осуществляется при помощи двух жгутов, расположение которых чрезвычайно характерно • для большинства Dinoflagellata, в том числе и для Peridinium. Оба жгута берут начало рядом друг с другом приблизительно по середине тела на стороне, которая называется брюшной. Один жгут идет назад и свободно выдается в окружающую среду. Начало его проходит в небольшом желобке, идущем перпендикулярно к экватору и несколько расширяющемся на заднем конце (рис. 44, Д). Другой жгут (так называемый поперечный) опоясывает все тело в экваториальной плоскости и располагается в довольно глубоком желобке (поясок — cingulum), опоясывающем все тело. Этот желобок образован особой пластинкой клет-чатковой оболочки. Поперечный жгут производит волнообразные движения, что создает иногда ложное впечатление, будто бы в поперечной борозде располагается ряд ресниц. Peridinium обладает прочной оболочкой из клетчатки, которая слагается из отдельных пластинок. Форма, структура и расположение этих пластинок характерны для отдельных видов. Рассмотреть пластинки удается на живом объекте. Более отчетливо они выступают, если подсушить препарат и
рассматривать его без воды в сухом виде, а также на отмерших экземплярах, утерявших цитоплазматическое содержимое.
Оболочка Peridinium состоит из двух половинок. Одна из них располагается над пояском (эпитека, или эпивальва), другая — под ним (гипотека, или гиповальва). В свою очередь, обе половинки панциря слагаются из 21 пластинки (щитка). В состав эпитеки входит 14 пластинок, в состав гипотеки — 7 пластинок. Сначала рассмотрим пластинки эпитеки.
На брюшной стороне, непосредственно над местом отхождения жгутиков, располагается ромбическая пластинка (рис. 44). Над пояском расположены семь преэкваториальных пластинок, среди которых различаем (на брюшной стороне) две передних экваториальных, четыре боковые экваториальные и одну (на спинной стороне) заднюю экваториальную. Кпереди от ромбической пластинки и ряда преэкваториальных имеется четыре апикальные (верхушечные) пластинки.
На спинной стороне над задней экваториальной расположены две спинные пластинки. Спинные, апикальные и ромбическая пластинки окружают небольшое отверстие в оболочке, располагающееся на самом переднем конце Peridinium.
Нижняя половинка панциря (гипотека) состоит из меньшего числа пластинок, чем эпитека. В ее состав входят пять постэкваториальных пластинок и две нижние полярные, или антапикальные (рис. 44), расположенные на нижнем полюсе жгутиконосца. Отдельные пластинки, слагающие оболочку Peridinium, соединяются друг с другом довольно - широкими (так называемыми интеркалярными) полосками. Каждая пластинка снаружи несет множество мельчайших шипиков и пронизана очень мелкими порами (последнее обычно разглядеть нс удается).
Цитоплазма Peridinium окрашена в буроватый цвет, который обусловлен наличием большого количества мелких дисковидных хроматофоров. В них кроме хлорофилла присутствуют бурые пигменты. Чтобы лучше разглядеть хроматофоры, рекомендуется раздавить Peridinium, выдавив из клетчатковой оболочки цитоплазматическое содержимое. Продуктом ассимиляции является крахмал. Небольшие зерна его удается обнаружить отчетливо при окраске иодом (крахмальные зерна приобретают синий цвет).
Peridinium (как и все Dinoflagellata) обладает крупным, массивным, богатым хроматином ядром, занимающим в теле центральное положение. На живых экземплярах разглядеть ядра не удается. Его легко обнаружить, если окрасить препарат каплей уксуснокислого кармина (с. 33). При этом становятся видимыми нуклеола и хроматин, имеющий своеобразную нитчатую структуру.
В цитоплазме Peridinium имеется довольно крупная несократимая вакуоль, рассмотреть которую благодаря наличию большого количества хроматофоров возможно далеко не всегда.
Иногда удается наблюдать стадии агамного размножения Peridinium, которое совершается в неподвижном состоянии. У Р. tabulatum протопласт делится внутри оболочки. Обе образовавшиеся таким путем клетки выходят наружу через разрыв оболочки в области пояска и 96
каждая из них образует новую оболочку. У других видов Peridinium протопласт может сначала покинуть оболочку и после этого приступить к делению, которое протекает в особой цисте и приводит к образованию многих зооспор.
Ceratium hirudinella О. F. Mull
Материал. Разные виды рода Ceratium входят в состав как пресноводного, так и морского фитопланктона. В качестве примера рассмотрим одного из обычнейших пресноводных представителей Ceratium hirudinella.
Изучение живого объекта. Ceralium обладает чрезвычайно характерной асимметричной формой тела (рис. 45). На переднем конце его имеется длинный апикальный шип. На заднем конце — два или три ан-тапикальных шипа. Длина шипов, особенно антапикальных, варьирует
Рис. 45. Ceratium hirudinella (Х400), хорошо видна скульптура панциря (по Энтцу)
Рис. 46. Ceratium hirudinella — расположение пластинок скелета. А — с брюшной стороны; Б — со спинной стороны (по Энтцу):
Ар1—АрЗ — апикальные пластинки, Prl—Pr6—пре* экваториальные пластинки (из них Ргб называется первой брюшной), Ро1—Ро5 — постэкваториальные пластинки; У, Z — вторая н третья брюшные пластинки, F— жгутиковая пластинка, О — ротовая пластинка, G — поясок, LF— продольная бороздка жгутика, Ап— антапикальные пластинки
в широких пределах. Один из них (левый) довольно часто вовсе отсутствует (на рис. 46, А он слабо выражен). Варьирует также угол, который антапикальные шипы образуют друг относительно друга. Чрезвычайно изменчивы и размеры Ceratium. Длина варьирует приблизительно от 100 до 400 мкм. Столь широкий размах изменчивости различных морфологических признаков послужил основанием для разделения вида С. hirudinella на ряд варьететов и форм. Необходимо, однако, отметить, что природа широкой изменчивости Ceratium1 недостаточно выяснена.
Движение Ceratium осуществляется так же, как и у Peridinium, при помощи двух жгутов, расположенных подобно тому, как это описано выше для Peridinium.
Поясок (cingulum) опоясывает почти все тело жгутиконосца. Лишь на брюшной стороне в нем образуется перерыв, где располагаются осо-
Рис. 47. Ceratium. hirudinella — деление в свободноподвижном состоянии (по Лаутерброну, из кн. Дофлейна):
У только что разделившейся особи (справа) недостающие пластинки скелета еще не восстановились
1 Энтц (1927) показал, что широкий размах изменчивости С. hirudinella носит отчасти сезонный характер. Весной он находил преимущественно трехшипные, летом и осенью — четырехшипные формы.
бые брюшные пластинки. Панцирь Ceratium слагается из отдельных целлюлозных пластинок, расположение которых ясно видно на схеме (рис. 46). Пластинки, слагающие панцирь, обычно скульптурированы, они имеют ясно выраженную сетчатую структуру. Интеркалярные полоски развиты у Ceratium слабо, и отдельные пластинки непосредственно прилегают друг к другу. Строение панциря Ceratium лучше изучать на отмерших экземплярах.
Буроватая окраска цитоплазмы Ceratium обязана наличию большого количества мелких дисковидных хроматофоров. Имеется одна, по-видимому, несокращающаяся вакуоль. Крупное массивное ядро занимает в теле Ceratium центральное положение.
Агамное размножение (деление) происходит у Ceratium в свободноподвижном состоянии (рис. 47). В отличие от других Mastigophora, где плоскость деления совпадает с продольной осью тела, у Ceratium она проходит косо. После деления обе дочерние особи восстанавливают недостающие пластинки.
При изучении морского планктона обычно также встречаются различные виды рода Ceratium. В качестве интересной особенности некоторых морских видов следует отметить образование цепочек (рис. 48), которые представляют собой результат незавершенного деления.
Gymnodinium sp.
Кроме описанных выше Peridinium и Ceratium мы кратко рассмотрим еще один род Dinoflagellata — Gymnodinium. В пресных водах часто встречаются Gymnodinium fuscum (рис. 49). В отличие от Peridi-
Рис. 48. Ceratium voltur — «цепочка», образовавшаяся в результате деления (Х80) (по Кофоиду, из кн, Дофлейна)
Рис. 49. Gymnodinium fuscum (Х450) (из кн. Штейна): А — с брюшной стороны; Б — со спинной стороны
nium и Ceratium он не имеет клетчаткового панциря из отдельных пластинок. Gumnodinium является представителем «голых» Dinoflagellata. У него имеется два жгута, из которых один лежит в пояске, другой же на заднем конце свободно выдается наружу. В цитоплазме— множество мелких буроватых хроматофоров. Некоторые виды Gymnodinium обладают стигмой.
ОТРЯД POLYMASTIGINA Trichomonas muris Grassi
Материал и методы изучения. Род Trichomonas включает довольно значительное количество видов, паразитирующих главным образом в кишечнике различных позвоночных. Наиболее удобный и доступный объект—Trichomonas muris Grassi, очень часто встречающийся в толстой и слепой кишке мышей и крыс. Для изучения — Trychomonas следует взять содержимое толстой или слепой кишки у свежеубитой мыши. Нужно рассмотреть при иммерсии живой материал и сделать мазки на покровных стеклах, фиксировав их жидкостью Шаудина. Окрасить мазки железным гематоксилином. г
Изучение живого объекта. Т. muris довольно активно двигаются в поле зрения микроскопа. На живом объекте удается рассмотреть общую форму тела, которая почти округлая, и ундулирующую мембрану, располагающуюся с одной стороны тела. Жгутики у Т. muris очень короткие и тонкие и in vivo плохо заметны. Иногда удается увидеть аксостиль в виде эластичного стержня, проходящий по продольной оси в середине тела.
Окрашенные препараты. Trichomonas muris достигает в длину около 20 мкм. На переднем конце располагаются три коротких жгута (рис. 50), которые берут начало от группы базальных зерен. С одной стороны вдоль всего тела проходит ундулирующая мембрана, которая у этого вида очень хорошо развита. По наружному краю ее идет краевая нить, резко окрашивающаяся железным гематоксилином. На переднем конце она так же, как и свободные жгутики, берет начало от я конце краевая нить часто свободно выдается в виде короткого жгута. В теле жгутиконосца вдоль основания унд'улирующей мембраны проходит опорная фибрилла, базальная нить. Последняя на препаратах выступает менее отчетливо, чем краевая нить. Аксостиль расположен по средней линии тела, задний конец его иногда свободно выдается наружу. Довольно крупное ядро с кариозомом располагается в передней трети тела. С группой базальных телеп оно связано тонкой нитью — ризопластом В цитоплазме Trichomonas обычно имеются разнообразные включения в форме зерен, палочковидных образований и т. п Эти включения представляют собой пищу заглоченную жгутиконосцем.
базальных телец. На
Рис. 50. Trichomonas muris (Х1200) (из кн. Гартмана):
1 — жгутики, 2— базальные тельца, 3 — ядро, 4 — аксостиль, 5 — опорная фибрилла ундулирующей мембраны
Рис. 51. Trichomonas muris (X1200)— последовательные стадии деления (по Венриху из Веньона). А — базальные тельца разделились, обе половины их соединены параде-смозой; Б — дальнейшая стадия расхождения базальных телец, в ядре видны хромосомы; В — анафаза деления ядра; Г — деление ядра закончилось; Д — образование дочерних аксостилей и ундулирующих мембран; Е — окончание формирования аксо-стилей
Заглатывание пищи совершается через ротовое отверстие (цитостом), расположенное на переднем конце тела вблизи основания жгутиков на стороне, противоположной той, по которой проходит ундулиру-ющая мембрана. На препаратах его далеко не всегда удается обнаружить.
Деление Т. muris совершается в свободноподвижном состоянии. На препаратах часто удается обнаружить различные стадии деления (рис. 51, А—Е).
Lamblia ( = Giardia) muris Grassi
Материал и методы изучения. Один из видов рода Lamblia — L. muris Grassi часто встречается в тонких кишках мышей и крыс, поднимаясь до двенадцатиперстной кишки включительно. Кроме того, L. cunicull часто встречается в кишечнике кроликов, a L. сатае — в морских свииках. Материал от свежеубитых животных следует рассмот-
Рис. 52. Lamblia. А — Lamblla muris, вегетативная особь с брюшной стороны (Х2500); Б — вегетативная особь Lamblia, прикрепившаяся к эпителиальной клетке; В — Lamblia intestinalis, циста (Х2700) (А —по Бензен, из кн. Дофлейна; Б — по Шевякову; В — из кн. Дофлейна)
реть in vivo и в случаях нахождения Lamblia сделать мазки на покровных стеклах, фиксировав их жидкостью Шаудина и окрасив железистым гематоксилином. Ввиду незначительных размеров объекта изучение его возможно лишь при использовании иммерсионных систем.
Изучение живого объекта. На живых L. muris удается разглядеть общую форму жгутиконосца, имеющего грушевидное тело при рассматривании с брюшной или спинной стороны (рис. 52, А) и довольно сильно сплющенного в дорзовентральном направлении, что видно при рассмотрении его сбоку (рис. 52,Б). Спинная сторона — выпуклая, брюшная— плоская. В передней части брюшной поверхности Lamblia имеется углубление — присоска, при помощи которой происходит прикрепле ние к эпителиальным клеткам стенки кишечника.
Следует отметить характер движения Lamblia, при котором все те ло, особенно задний его конец, производит волнообразные сокращения Жгутиковый аппарат in vivo виден плохо, его лучше изучать на окра шенных препаратах.
Окрашенные препараты. Длина L. muris равняется 7—12 мкм, ши рина 5—10 мкм. Очень отчетливо выражена двусторонняя симметри: тела. Большинство органоидов присутствует в числе, кратном дву! (рис. 52).
По середине тела, начинаясь спереди на уровне ядер, от двух ба зальных телец и до самого заднего конца, проходит двойно аксостил! состоящий из двух эластических нитей. На заднем конце обе нити пре должаются в виде жгутов, которые можно назвать хвостовыми жгутг ками. Общее число жгутов у Lamblia равняется восьми. На брюшно стороне приблизительно от средней части аксостилей берут начало дв пары брюшных жгутов.
По сторонам от двух базальных зерен, лежащих у основания аксс стилей, расположена еще одна пара базальных телец. От них кперед отходят две опорные нити (фибриллы). Та фибрилла, которая бере начало от левого базального зерна, идет вперед, затем заворачивает и;
право и продолжается назад, подходя к самому краю тела. Фибрилла, отходящая от правого базального зерна, располагается точно так же, но заворачивает налево. Благодаря этому обе фибриллы перекрещиваются. Подойдя к краю тела, обе нити продолжаются в виде боковых жгутов. От тех же боковых базальных телец отходят еще две фибриллы, лежащие по сторонам от аксостилей. Подходя к краю в задней половине тела, они продолжаются в форме задних боковых жгутиков.
Кроме описанных выше опорных фибрилл, являющихся по существу проксимальными частями жгутов, в теле Lamblia имеются еще следующие опорные образования, не связанные непосредственно с локомоторным аппаратом. От края тела, там, где отходят передние боковые жгуты, по заднему краю присоски, расположена опорная нить. Кроме того, опорная фибрилла проходит также по краю присоски, ограничивая ее спереди и с боков.
Два ядра овальной формы лежат справа и слева от передней части аксостилей. Обычно ядро имеет один или несколько кариозомов. Ядра связаны с боковыми базальными тельцами при помощи ризопластов. L. muris обладает довольно крупным парабазальным телом, расположенным в задней трети тела жгутиконосца. Питание Lamblia совершается осмотическим путем. Ротовое отверстие отсутствует.
Деление в свободноподвижном состоянии у Lamblia наблюдается очень редко. Размножение их имеет место главным образом в инцисти-рованном состоянии. Цисты L. muris можно обнаружить в тонких кишках, а также в заднем отделе кишечника и в кале. Цисты овальной формы с довольно плотной оболочкой (рис. 52, В). В цисте находим два или, чаще, четыре ядра, образовавшихся в результате деления. В цистах сохраняются аксостили, что позволяет очень легко отличить их от цист других кишечных простейших. Кроме того, обычно имеются две пары своеобразных полулунной формы образований, которые, вероятно, представляют собой отделившиеся краевые фибриллы присоски.
ОТРЯД HYPERMASTIGINA
Lophomonas blattarum Stein
Материал и методы изучения. Lophomonas blattarum нередко встречается в заднем отделе кишечника черного таракана (Blatta orientalis). Согласно Д. Н. Засухину (1929), Lophomonas размножается в огромном количестве при кормлении тараканов сырым картофелем. Изучение ведется на живом материале в содержимом кишечника, а также на мазках, фиксированных жидкостью Шаудина и окрашенных железным гематоксилином. Кроме L. blattarum в кишечнике таракана может встречаться и другой вид — L. striata.
Изучение живого объекта. Живые Lophomonas blattarum в содержимом кишечника довольно подвижны благодаря движению многочисленных жгутиков, расположенных на переднем конце. На живом материале можно рассмотреть общую форму тела, жгутика, а также констатировать, что L. blattarum способны несколько изменять форму тела благодаря сократимости протоплазмы и эластичности пелликулы.
Длина L. blattarum варьирует в пределах 15—30 мкм.
Рис. 53. Lophomonas blatlarum (X1500). A — вегетативная особь; Б, В — стадии деления; Г — циста (А — из Грассе; Б — Г — из Дофлейиа):
1 — венчик жгутиков, 2 — ядро, 3 — радиально исчерченная зона цитоплазмы, 4 — аксостиль, 5 — пищевые включения
Окрашенные препараты. Жгутиковый аппарат расположен на переднем конце животного. Он слагается из многочисленных жгутиков числом около 50. Длина их неодинакова. По периферии пучка расположены самые короткие жгутики, в центре — самые длинные. Каждый жгут берет начало от базального зерна. В глубь цитоплазмы от базальных зерен идут фибриллы. По мере углубления в протоплазму они постепенно сближаются и в конце концов соединяются в аксостиль, который тянется до самого заднего конца тела и нередко даже несколько выдается наружу (рис. 53, А—В). Фибриллы между аксостилем и базальными зернами в совокупности отграничивают пространство, напоминающее по форме чашу, внутри которой неделящихся особей располагается ядро. Вокруг чаши с ядром расположена особая радиально исчерченная зона цитоплазмы, слагающаяся из тесно расположенных палочковидных отдельностей (рис. 53, А, 3). Некоторые исследователи считают это образование гомологичным парабазальному телу.
В цитоплазме L. blattarum всегда присутствуют многочисленные пищевые включения: зерна крахмала, споры грибков, бактерии и т. п. Специально дифференцированное ротовое отверстие отсутствует, и захват пищевых частиц осуществляется цитоплазмой преимущественно в задней половине тела. Нередко на препаратах удается обнаружить различные стадии деления Lophomonas, которое осуществляется в свободноподвижном состоянии. При этом ядро выходит из чаши (рис. 53, Б,
В), которая у дочерних особей образуется заново. Деление ядра осуществляется путем своеобразного митоза.
Наряду с активно подвижными особями в кишечнике таракана часто наблюдаются одноядерные цисты Lophomonas. Массовое инцисти-рование, как показал Засухин, удается вызвать путем изменения характера пищи хозяина. Оно наблюдается при переводе тараканов с кормления сырым картофелем на мясную диету. Последняя, очевидно, неблагоприятна для паразита.
ОТРЯД OPALININA
Опалин до недавнего времени относили к инфузориям в качестве самостоятельного подкласса Protociliata. Работы последних лет по изучению морфологии, строения ядра и жизненному циклу заставляют пересмотреть вопрос о их положении в системе. Отсутствие у Opalinina ядерного диморфизма, наличие полового процесса по типу копуляции заставляют исключить опалин из инфузорий и рассматривать их как своеобразную глубоко специализированную группу жгутиковых, у которых локомоторный и ядерный аппарат претерпели высокую степень полимеризации.
Opalina ranarum Stein
Материал и методы изучения. Opalina ranarum (из сем. Opalinidae) — обычный паразит лягушки (Rana temporaria). В задней кишке каждого животного их можно находить в большом количестве. Рассматривать объект in vivo и на окрашенных гематоксилином тотальных препаратах, изготовленных в виде мазка после фиксации жидкостью Шаудина. Ядра при этом часто красятся плохо, поэтому более четкую картину можно получить применением метода Фёльгена.
Изучение морфологии. Плоское листовидное асимметричное тело косо срезано спереди и закруглено сзади (рис. 54). Одна сторона тела (длинная) выпуклая, другая имеет небольшую впадину. Длина достигает 500—800 мкм. Поверхность тела покрыта многочисленными, длин-
Рис. 54. Opalina ranarum. А — взрослая особь; Б — деление, В — циста, Г — микрогамета; Д — макрогамета; £— копуляция (А, Б—из кн. Целлера; В—Е—из кн. Грассе): 2 == эктоплазма, 2 — эндоплазма, 3 ядра
ными, густо посаженными ресничками. Их ряды проходят вдоль тела, слегка изгибаясь S-образно. Цитоплазма подразделяется на хорошо различимые два слоя: тонкую гомогенную, прозрачную эктоплазму и набитую различными включениями эндоплазму. В эндоплазме разбросаны небольшие дисковидные ядра в количестве нескольких десятков. При больших увеличениях на окрашенных препаратах хорошо видно в центре каждого ядра небольшое ядрышко, окруженное сеточкой хроматина. In vivo ядра также хорошо видны в виде прозрачных пятен на зернистом фоне плазмы. Кроме ядер в эндоплазме есть и другие включения. Из них следует отметить овальные тельца, более мелкие по сравнению с ядрами и окрашивающиеся равномерно. Отношение к краскам заставляет признать их за хондриозомальные производные.
Сократительных вакуолей у Opalina до сих пор не обнаружено. Иногда встречаются и делящиеся особи. Борозда деления при этом проходит косо (рис. 54, Б).
В лягушках, пойманных ранней весной в момент откладки икры, встречаются мелкие формы опалин с малым количеством ядер —пред-цистные, которые инцистируются и попадают на дно водоема. Цисты далее заглатываются развившимися головастиками, в них из цист вылупляются опять-таки мелкие опалины, дающие при делении удлиненные одноядерные гаметы неодинакового размера, копулирующие анизо-гамно. Зиготы инцистируются, цисты снова заглатываются уже крупными головастиками, и при окончании ими метаморфоза в них развиваются окончательного размера многоядерные формы. Вскрывая головастиков разных возрастов, удается рассмотреть различные стадии полового процесса опалин.
Кроме видов рода Opalina в средней и южной полосе СССР в лягушках и жабах нередко встречаются представители другого рода Ора-linina — Cepedea, например С. dimidiata. Род Cepedea отличается от Opalina более сильно вытянутым в длину телом, соотношение длины к ширине у них равняется 3—5:1. В остальном строение Cepedea не отличается от Opalina.
Тип Ciliophora
КЛАСС INFUSORIA — ИНФУЗОРИИ
Инфузории — группа разнообразных простейших, представляющих интерес с точки зрения сложной морфологии. Это обстоятельство позволяет продемонстрировать на примере данного класса ту высоту организации, которой достигает в процессе эволюции простейший организм. Добывание инфузорий не представляет особых трудностей; изучение ведется главным образом на живом материале, что особенно повышает интерес к этой группе простейших.
В пределах каждого отряда следует разобрать более подробно одного из обычных представителей.
t Число описанных видов инфузорий превышает 7 тыс., которое слагается в большое число отрядов и семейств. Систематика инфузорий за последние годы подверглась коренной переработке, что обсуловлено расширением наших знаний о структуре инфузорий и в особенности их локомоторных органелл (ресничек и их производных — мембран, мембранелл и т. п.). Выяснилось, что эктоплазма инфузорий, которая получила название кортекса, обладает сложной структурой. Она слагается из мембран, локомоторных органоидов и сложной системы фиб-риллей. Частично на светооптическом уровне структуры кортекса выявляются методами серебрения, которые описываются ниже. Однако полное представление может быть получено лишь путем применения электронно-микроскопических методов исследования.
Современная систематика инфузорий базируется главным образом на строении и положении ротового аппарата и связанных с ним ресничных образований, а также распределении локомоторных органелл в кортексе. Важное значение имеет также строение ядра.
Методы изучения инфузорий. Прежде чем ознакомиться с отдельными представителями инфузорий, остановимся на некоторых методах изучения, общих для большинства представителей этого класса.
Очень важно научиться рассматривать инфузорий на живом материале, применяя при этом кроме обычных светооптических систем фазоконтрастное устройство, что резко улучшает видимость ресничных образований. Сильно препятствует изучению живых инфузорий их подвижность. Чтобы частично устранить это затруднение, можно прибегнуть к следующим приемам. Использовать тигмотаксис инфузорий. Поместить под покровное стекло очень тонкий слой гигроскопической ваты— инфузории застревают между ее волосками. Можно достигнуть за
медления движения повышением вязкости среды, прибавляя раствор агар-агара, вишневый клей, коррагеновый клей и другие нейтральные вещества, вызывающие остуднение капельки жидкости с простейшими.
Структура многих инфузорий хорошо сохраняется при фиксации их в парах OsCU. Для этого поступают следующим образом. Небольшую каплю с инфузориями на предметном стекле переворачивают жидкостью вниз над открытым сосудом с 2%-ным раствором осмиевой кислоты. Пары ее быстро убивают инфузорий, хорошо сохраняя их форму и реснички. Препарат покрывают покровным стеклом; изучение ведется без окраски в капле воды. Можно использовать также кратковременную фиксацию в осмиевых смесях (5—15 мин) (с. 13) с последующим рассмотрением объекта без окраски в капле воды. При этом хорошо видны кинетиды.
Хорошие результаты при изучении инфузорий дают витальные красители (с. 42). Нейтральный красный хорошо прокрашивает пищеварительные вакуоли. Для изучения ядерного аппарата используются тотальные препараты инфузорий, фиксированные сулемовыми или пикриновыми смесями и приклеенные к стеклу целлоидином (с. 14, 18). Особенно следует рекомендовать окраску по Фёльгену (с. 36—37).
Особенно важно при изучении инфузорий хорошо разобраться в строении ротового аппарата и ресничных образований. Для этого применяют различные методики импрегнации солями серебра. Методы эти довольно сложны, но при правильном применении дают очень четкие результаты. Ниже приводится методика Шаттона и Львова в модификации Корлиса, многократно проверенная и дающая прекрасные результаты.
1. Фиксация инфузорий в солонке свежеприготовленной смесью Шампи (с. 14) 1—5 мин.
2. Постепенная замена смеси Шампи раствором Да-Фано (пипеткой оттягивается смесь Шампи и другой пипеткой добавляется раствор Да-Фано) (состав смеси Да-Фано: CoNOs—1 г, NaCl—1 г, формалин 40%-ный—10 см3, дистиллированная вода — 90 см3). Выдерживают объекты в растворе Да-Фано не менее 2 ч. При необходимости в растворе можно хранить объекты неделями.
3. Отмывают инфузорий от раствора Да-Фано в 2—3 сменах дистиллированной воды.
4. Дальнейшую работу продолжают на нагревательном столике 37—45°С (можно заменить чашкой Петри, в которую налита горячая вода). Каплю с инфузориями помещают на подогретое (очень чистое) предметное стекло и добавляют каплю предварительно подогретой соленой желатины (состав ее: желатина — 10 г, хлористый натрий химически чистый 0,05 г, дистиллированная вода—100 см3). Каплю с простейшими и каплю желатины перемешивают теплой стеклянной палочкой. Размазывают по стеклу (по размеру покровного стекла). Избыток оттягивают подогретой пипеткой.
Дальнейшие процедуры (5, 6, 7, 8, 9) проводят в холодильнике при 5—10°С. В качестве холодильника можно использовать чашку Петри, на дно которой положены кусочки льда и фильтровальная бумага.
5. Предметное стекло с объектом в желатине переносят на несколь
ко минут в холодильную камеру для застывания желатины (избегать подсушивания! Пользоваться прикрытой чашкой Петри).
6. Предметное стекло с объектом помещают в 3%-ный раствор азотно-кислого серебра (заранее охладить). Раствором можно пользоваться 2—3 раза. Продолжительность выдерживания в растворе варьируют в зависимости от размеров объекта в пределах 10—30 мин.
7. Быстро и тщательно промывают объект в 2—3 сменах холодной дистиллированной воды.
8. Препарат погружают на глубину 3—4 см в чашку с холодной водой, которую ставят в большую чашку со льдом. Выставляют под источник УФ света. Проявлять следует в белой фарфоровой чашке либо под стеклянную прозрачную чашку положить лист белой бумаги. Время восстановления серебра в препаратах зависит от мощности источника УФ излучения. Удобно пользоваться ртутно-кварцевыми лампами ПРК, широко применяемыми в медицинской практике. Время освещения под такой лампой 30—40 мин. Расстояние от препарата до источника света 20—30 см.
9. После прекращения экспозиции быстрая отмывка в 70° холодном спирте.
Дальнейшие манипуляции проводятся при комнатной температуре.
10. Обезвоживание в 96° и абсолютном спирте, просветление в ксилоле или толуоле, заключение в бальзам.
При удавшейся окраске в черный цвет импрегнируется каждая ки-нетосома, что дает ясную картину распределения ресничного аппарата.
Гораздо проще методика, предложенная Клейном и дающая удовлетворительные результаты. Каплю культуры с объектами размазывают по стеклу и высушивают на воздухе (без нагрева). Сухой мазок (лучше через несколько дней после высушивания) на 6—8 мин помещают в 2%-ный раствор азотнокислого серебра. Промывают дистиллированной водой и в белой фарфоровой чашке выставляют на свет (не прямой солнечный, но достаточно яркий). Срок освещения 4—10 ч в зависимости от яркости света. При освещении УФ ртутной лампой срок сокращается до 20—30 мин. Отмывают в воде, высушивают и заключают в бальзам. Импрегнируются кинетосомы, частью реснички, фибриллярные структуры.
Для изучения строения крупных инфузорий (парамеции, стентора и др.) рекомендуется прибегнуть к заливке в целоидин-парафин по Пе-терфи с ориентировкой объекта на целлоидиновых пластинках, как это описано на с. 23.
ПОДКЛАСС CILIATA — РЕСНИЧНЫЕ ИНФУЗОРИИ
Надотряд Kinetojragminophora
Этот обширный и наиболее примитивный таксон характеризуется отсутствием специальных ресничных образований (мембран и мембра-нелл), связанных с ротовым аппаратом. Он включает несколько отрядов, из которых здесь рассматриваются представители двух отрядов.
ОТРЯД GYM NOSTOMATA
Среди многочисленных родов и видов гимностомид рекомендуется ознакомиться с организацией и биологией представителей трех родов: Prorodon, Dileptus и Didinium, широко распространенных в пресных водах.
Материал и методы изучения. Представители всех трех названных выше родов обычны в планктоне мелких водоемов, где они концентрируются преимущественно в придонных слоях. Dileptus и Didinium легко поддерживать в культурах. Виды этих двух родов — активные хищники. Они хорошо разводятся на сенных или навозных культурах при наличии достаточного количества пищи. В качестве последней могут служить живые инфузории туфельки, которых разводят в отдельной культуре (с. 123).
Небольшое количество их следует добавлять к среде, в которой живут хищные инфузории. Дилептусы очень хорошо живут в чашках Петри, в которых заложены зерна риса (с. 8). Получается многочленная культура: на рисе разводят бактерии, которые служат пищей инфузориям (парамеции, гипотрихи и др.). Последними в свою очередь питаются хищники. При отсутствии пищи дилептусы и дидиниумы легко инци-стируются. Столь же легко они выходят из цист при пересеве на свежую среду.
Изучение ведется преимущественно на живом материале. Кроме того, изготовляют окрашенные различными ядерными красками тотальные препараты после фиксации сулемовыми или пикриновыми смесями (с. 14).
Prorodon sp. Одним из наиболее обычных видов этого обширного рода является Р. teres (рис. 55, А) (длина 130—200 мкм). Форма тела у большинства видов этого рода яйцевидная. Ротовое отверстие расположено терминально на переднем конце. Такое положение ротового аппарата рассматривается для ресничных инфузорий как наиболее примитивное. На противоположном (заднем) конце тела помещается сократительная вакуоль. От ротового отверстия в глубь эндоплазмы идет глотка (у разных видов Prorodon разной длины). В стенке ее расположен так называемый палочковый аппарат, слагающийся из нескольких десятков упругих тонких палочек (трихитов). Этот аппарат играет опорную роль, а также направляет заглатываемую пищу в глубину эндоплазмы. Ресничный аппарат (цилиатура) состоит из многочисленных (свыше 100) рядов ресничек, идущих в строго меридиональном направлении (каждый ресничный ряд носит название кинеты). У большинства видов рода Prorodon имеется один бобовидный или яйцевидный макронуклеус и один (иногда несколько) микронуклеус. Пища прородонов разнообразна. Это бактерии или мелкие простейшие или водоросли.
Dileptus sp. В пресных водах встречается свыше десяти видов этого рода. Наиболее обычным и легко размножающимся в культуре является Dileptus anser — крупная инфузория, достигающая в длину 500 мкм и более. Размеры дилептусов широко варьируют в пределах вида в зависимости от условий питания. При голодании инфузории резко уменьшаются в размерах.
Тело Dileptus распадается на два ясно выраженных отдела. Передняя часть образует относительно узкий очень подвижный хобот (рис. 55, Б), составляющий у разных видов от */з до '/г длины тела. Более широкое туловище на заднем конце вытянуто в виде небольшого заостренного хвостового придатка. На границе между хоботом и туловищем помещается рот. Эта сторона называется брюшной.
1
Рис. 55. Инфузории отряда Gymnostomata:
А — Prorodan teres (по Бючли): / — ротовое отверстие, 2 — палочковый аппарат, 3 — пищеварительные вакуоли, 4 — сократительная вакуоль;
Б — Dileptus'anser (по Дражеско). / — общий вид инфузории; //— детали строения рта и цилиатуры (с препарата, импрегнированного серебром); 1 — хоботок, 2 — ротовое отверстие, 3 — ядра, 4—сократительные вакуоли, 5 — желобок, лишенный ресничек и несущий трихоцисты;
В — Didinium nasutum (по Дражеско). / — начало захвата добычи; II— дидиний, наполовину заглотивший парамецию: /— ротовое отверстие, 2— передний венчик ресниц, 3 — задний венчик ресниц, 4 => сократительная вакуоль, 5 — цитоплазматический вырост, служащий для захвата добычи
Все тело покрыто густо расположенными рядами ресничек. У Dilep-tus anser число кинетид в туловищном отделе равно 40—50, только часть их переходит на хобот, часть же кинетид заканчивается у ротового отверстия (рис. 55, Б). На брюшной стороне хобота имеется желобок, лишенный ресничек и идущий ко рту.
Вокруг ротового отверстия располагается валик пелликулы, укрепленный системой фибрилл. От рта в глубь цитоплазмы также идут многочисленные опорные фибриллы, являющиеся опорным аппаратом при прохождении пищи. Эти фибриллы сходны с палочковым аппаратом Prorodon. Их можно хорошо разглядеть, если сделать срезы и окрасить их железным гематоксилином. У не питающихся дилептусов ротовое отверстие закрыто. При поглощении пищи ротовое отверстие может сильно растягиваться, увеличивая свой диаметр во много раз. Вдоль желобка на брюшной стороне хобота в эктоплазме расположены многочисленные палочковидные трихоцисты; их хорошо видно при большом увеличении на живом объекте, и на срезах, окрашенных железным гематоксилином. Сократительные вакуоли в количестве десятка и более расположены по спинной стороне туловища и заходят на хобот.
Строение ядерного аппарата в пределах рода Dileptus сильно варьирует. У одних видов (Z). cygnus, D. grandis и др.) макронуклеус четковидный, состоящий из большого количества отдельных узелков, микронуклеусы многочисленные и расположены вблизи четок макронуклеуса. У некоторых других видов, в том числе у D. anser (рис. 55, 5), макронуклеус распадается на отдельные фрагменты, число которых может быть свыше 200. Многочисленные микронуклеусы разбросаны по всей цитоплазме вперемешку с фрагментами макронуклеусов. Такое состояние ядра несомненно является вторичным, ибо после конъюгации из каждого зачатка развивается один макронуклеус, который лишь потом распадается на фрагменты.
На живом материале представляет интерес наблюдение за захватом добычи и питанием дилептусов. Спектр пищевых объектов у этих хищников чрезвычайно разнообразен — это инфузории, жгутиконосцы и даже мелкие многоклеточные (коловратки, турбеллярии). Никогда не заглатываются амебы и очень редко зеленые клетки (хламидомонады, эвглены). Хобот дилептуса находится в непрерывном движении. Плавая, дилептусы «размахивают» своим хоботом. Если брюшная сторона хобота прикоснется к пищевому объекту, то происходит выстреливание трихоцист, которые чрезвычайно ядовиты. Происходит немедленное разрушение пелликулы и цитолиз цитоплазмы. Подобные частично разрушенные пищевые объекты, по-видимому, действием ресничного аппарата направляются к ротовому отверстию, которое растягивается в соответствии с размерами добычи, и последняя заглатывается вместе со значительным количеством жидкости. Образуется пищеварительная вакуоль. Если добычи много, то не каждая пораженная трихоцистами пища проглатывается. Дражеско, например, наблюдал, что один дилеп-тус убивает до 70 инфузорий Colpidium, не имея возможности их заглотить. После такого массового поражения добычи дилептусы на некоторое время (2—3 ч) теряют способность убивать, что связано, очевидно, с израсходованием трихоцист.
Didinium nasuium О. F. M., так же как и дилептусы,— хищник, причем излюбленной пищей его являются инфузории рода Paramecium. При отсутствии последних он может питаться и другими инфузориями, но при наличии в среде разных видов активно выбирает парамеций. Инфузория имеет бочонковидную форму, на переднем конце выдается вперед хоботок (рис. 55, В). Длина дидиниев варьирует в пределах 150— 180 мкм. D. nasutum легко разводятся в культурах (настой сена или салата, навозные культуры) при наличии обильной пищи. При отсутствии пищи быстро инцистируются. Чтобы поддерживать культуру, ее надо регулярно пересевать (примерно раз в неделю).
Ресничный аппарат на большей части тела редуцирован и сведен к двум пояскам, расположенным один в нижней, другой в верхней части тела. Несмотря на частичную редукцию цилиатуры, инфузории очень подвижны, что необходимо для охоты за добычей.
Хоботок, на конце которого помещается ротовое отверстие, обладает двоякого рода структурами. Во-первых, это веретеновидные трихоцисты (токсицисты), используемые при ловле добычи, во-вторых — опорные фибриллы, окружающие глотку (гомолог палочкового аппарата). Эти структуры можно рассмотреть на живом объекте с иммерсионной системой, сильно придавив инфузорию, или на срезах (лучше после фиксации осмиевыми смесями, с. 13) при окраске железным гематоксилином.
Одна сократительная вакуоль расположена на заднем конце тела. Ядерный аппарат слагается из почковидного макронуклеуса и располагающегося вблизи него маленького микронуклеуса. Для рассмотрения ядра дидиниев лучше всего прибегнуть к изучению тотальных препаратов, окрашенных по Фельгену.
Интересен процесс охоты и поглощения пищи, ибо обычная пища дидиниев — инфузории туфельки, значительно крупнее самого хищника. Весь этот процесс был подробно изучен и описан еще свыше 100 лет тому назад Бальбиани (1873) в специальной статье, посвященной биологии D. nasutum. Если, быстро плавая, дидиний прикоснется хоботком к парамеции, то последняя оказывается прочно закрепленной к хищнику. При этом из тела дидиния через ротовое отверстие выбрасывается наружу особый органоид, имеющий форму языка. Он удерживает добычу и втягивает ее внутрь тела через хоботок (рис. 55, В). Вместе с этим выстреливаются трихоцисты (токсицисты), которые убивают добычу. В результате заглатывания туфельки в теле хищника образуется огромная пищеварительная вакуоль. Туфелька, на которую нападает дидиний, не остается пассивной. Она активно защищается, выстреливая свои трихоцисты, которые неблагоприятно действуют на хищника. Иногда туфельке удается оторваться от хищника, и она уплывает. Такие особи обычно погибают, вероятно, вследствие ядовитого действия токсикоцист. Впрочем, описывались и случаи «выздоровления» поврежденной дидинием парамеции.
Все описанные выше процессы вполне возможно наблюдать на живом материале. Детали заглатывания пищи изредка удается наблюдать на срезах, удачно зафиксированных в момент питания дидиниев.
Epidinium ecaudatum Fiorentini
Материал и методы изучения. Epidinium ecaudatum относится к подсем. Ophryo-scoleciinae сем. Ophryoscolecidae. Это обычная форма среди инфузорного населения рубца крупного рогатого скота. У данного вида в настоящее время известны так называемые формы, отличающиеся друг от друга только отсутствием или наличием хвостовых отростков при полном тождестве всей остальной наружной и внутренней морфологии. Для наших целей совершенно безразлично, с какой формой придется иметь дело.
Материал добывают с бойни. У только что убитого быка из рубца извлекают теплое еще содержимое, из которого отжимают (хотя бы просто рукой) жидкую фракцию в термос, в котором и привозят в теплом состоянии в лабораторию (проба в термосе обычно не остывает в течение 2—3 ч).
Желательно в один термос забрать пробы из нескольких рубцов, так как Epidinium хотя и обычная форма, но все же попадается не в каждом животном.
Инфузории изучают прежде всего in vivo на нагревательном столике (его может заменить, например, чашка Петри с теплой водой, на которую кладут предметное стекло, пластинку толстого стекла, периодически подогреваемую, и т. д.). Далее материал должен быть зафиксирован для изготовления тотальных препаратов и разрезов. При фиксации желательно иметь инфузорий с расправленным ресничным аппаратом, для чего приходится применять теплый фиксатор и нагретую посуду для фиксации. Лучше всего на спиртовке подогреть чашку Петри с небольшим количеством содержимого рубца. В чашку вливают теплый фиксатор (лучшие результаты дает жидкость Ценкера с формалином для срезов и жидкость Шаудина для тотальных препаратов), все это энергично перемешивают и сливают в центрифуражную пробирку, где и оставляют на 20—30 мин. Дальнейшие манипуляции (промывка, проведение через спирты, иодирование) ведут при помощи центрифуги. Тотальные препараты и срезы лучше всего окрашивать железным гематоксилином. Заливка производится комбинированная в целлои-дин-парафин по Петерфи с применением целлоидиновых пластиночек для ориентировки объекта (см. с. 23). Подобный способ заливки приходится применять из-за наличия у Epidinium довольно плотной кутикулы и твердых скелетных элементов. Последние рвут срезы, если режут материал, залитый обычным способом в парафин. Полезно перед заливкой подкрасить инфузорий тем же железным гематоксилином, что чрезвычайно облегчает выбирание именно Epidinium из массы других инфузорий при раскладке их на целлоидиновую пластиночку. Рекомендуется изготовить серию поперечных и продольных разрезов. Толщина срезов 4—5 мкм.
Изучение тотальных препаратов. Внешняя морфология. Вытянутое тело Epidinium имеет в длину от 90 до 180 мкм. Оно округло в поперечном сечении, постепенно суживается кзади. На переднем конце сконцентрирован ресничный аппарат, задний же конец либо гладкий, закругленный (у forma ecaudatum), либо с 1—5 каудальными шипами. Прежде чем разбираться в расположении шипов, следует условиться относительно ориентировки тела Epidinium в пространстве. Мы условно принимаем за брюшную сторону ту, на которую смещено ротовое отверстие и вблизи которой располагается анальная трубка (рис. 56). Тогда ядерный аппарат и сократительные вакуоли будут лежать вблизи
1 Отряд Entodiniomorpha длительное время сближали с отрядом Oligotricha и включали в надотряд (или подкласс) Spirotricha (в современной системе — Polyhyme-nophora). Однако исследования последних лет (Нуаро-Тимотэ, Вольска, Янковского) показали, что у них отсутствует основной признак Polyhymenophora — закрученная спирально адоральная зона мембранелл. Околоротовая цилиатура Entodiniomorpha слагается из расположенных пучками ресничек, а не ряда мембранелл. Таким образом, Entodiniomorpha должны быть выключены из Polyhymenophora и включены в Kinetofragminophora. - - - .
Рис. 56. Epidinium ecaudatum forma ecaudatum (из кн. Шарпа). A — общий вид инфузории с правой стороны и Б — с левой (Х650):
/ — адоральная зона, 2 — теменной вырост, 3 —скелетная пластинка, просвечивающая сквозь пелликулу — primitiva, 4 — cirri дорзальной ресничной зоны, 5 — передняя сократительная вакуоль, 6— макронуклеус, 7 — мнкро-нуклеус, 8 — задняя сократительная вакуоль, 9—анальное отверстие, 10— анальная трубка, // — скелетная пластинка — sternum, 12— cirri периферического ряда адоральной ресничной зоны, 13 — внутренний ряд адоральных ресничных образований, 14— периферическая двойная губа, 15 — скелетная пластинка parasternum, 16 — губа у основания cirri дорзальной зоны, 17 — околоротовой валик
спинной стороны и дополнительная ресничная зона займет дорзальное положение. При этом замечается легкий изгиб тела на вентральную сторону (рис. 56).
Наибольшее возможное количество шипов на заднем конце Epidinium. равняется пяти (forma cattaneoi, fasciculus, рис. 57, I—V). Самый крупный из них I занимает вентральное положение. Напротив него значительно меньших размеров IV шип. II и III, еще меньших размеров, обычно располагаются на правой стороне. Пятый же (7), по размерам не уступающий четвертому, лежит слева. У четырехшипного Epidinium (forma quadricaudatum) обычно отсутствует III шип. У трехшипного (forma tricaudatum) сохраняются I, IV и V. У двухшипного (forma bi-caudatum) чаще всего остаются I и IV шипы. У наиболее же обычного
Рис. 57. Epidinium ecauda-turn forma cattaneoi. Задний конец тела с правой стороны (Х650) (из кн. Шарпа): 1— анальная трубка, 2 — эктопласт, 3 — эндоплазматический мешок, 4 — задняя сократительная вакуоль, 5—макронуклеус; I — вентральный шип, II и III— шипы правой стороны, IV — дорзальный шип, V — шип левой стороны
брюшную и правую
однотипного Epidinium (forma caudatum и forma hamatum) виден только I шип.
Каждый шип выходит из тела инфузории широким основанием, заострен на вершине и загнут острием медианно (рис. 57). Анальная трубка открывается наружу у основания I (вентрального) шипа.
Ресничный аппарат представлен адоральной (околоротовой) зоной и дорзальной. Его разбор удается лучше всего на живом материале или на фиксированном, но неокрашенном. Ресничные образования в данном случае — это типичные пальцевидные цирры, округлые (или овальные) в сечении и склеенные из многих ресничек. При плохой фиксации концы цирр размочаливаются, распадаются на отдельные составляющие их реснички.
Адоральный ресничный аппарат у Epidinium разбивается на две части: периферическую и внутреннюю, отделенные друг от друга высоким цитоплазматическим валиком, который идет по спирали вокруг ротового отверстия (см. рис. 56). Периферический ряд цирр начинается на левой стороне тела, огибает гороны по часовой стрелке и, пройдя по
спинной стороне, заканчивается слева на краю ротового отверстия. Образуется полный оборот спирали, причем внутренний конец спирали приподнимается над уровнем наружного (рис. 56, Б). Внутренний ряд составлен из тонких, нежных ресничных образований. Они сидят по краю ротового углубления и образуют оборот спирали, направленный против часовой стрелки. Начало этого оборота совпадает с концом периферического ряда цирр. Основания периферических цирр снаружи прикрываются двойной цитоплазматической губой (см. рис. 56).
Дорзальная добавочная ресничная зона имеет в своем составе мощные цирры, концами направленные вперед. Их основания покоятся в глубине борозды, проходящей поперек тела назад от адоральной зоны. Борозда заканчивается асимметрично: на правой стороне тела она несколько не доходит до медианной линии, на левой же несколько переходит за нее. Основания цирр здесь отграничены снаружи двойной складкой (губой, см. рис. 56). Между обеими зонами обособляется выпуклый участок поверхности тела, теменной вырост.
Различные внешние раздражения вызывают у Epidinium втягивание ресничного аппарата. При остывании, при медленной фиксации адоральная и дорзальная зоны втягиваются внутрь тела и снаружи прикрываются вытягивающимися губами. На нагревательном столике прекрасно удается наблюдать втягивание обеих зон при остывании и, наоборот, выпячивание их при повышении температуры.
Поверхность тела покрыта прочной пелликулой с многочисленными мелкими продольными бороздками.
Протопласт. На окрашенных тотальных препаратах видно подразделение протопласта Epidinium на два слоя: внутренний, объемистый, в который поступает пища через ротовое отверстие и глотку и который следует именовать эндоплазматическим мешком, и наружный, одевающий эндоплазматический мешок — эктопласт Эти подразделения будут лучше видны на разрезах (см. дальше).
Эндоплазматический мешок связан с наружной средой через глотку и анальную трубку.
Скелет. Для изучения скелета необходимо неокрашенных инфузорий обработать в воде хлор-цинк-иодом или раствором Люголя. Тогда ясно выступят коричневые пластинки скелета. Они расположены главным образом на правой и вентральной стороне тела, непосредственно под пелликулой. Прежде всего бросается в глаза их ячеистая структура. Каждая пластинка разбивается на ряд полигональных призмочек (см. рис. 60, В), поставленных перпендикулярно к кутикуле и имеющих в составе клетчаткоподобное вещество — офриосколецин. Призмочки склеены промежуточной белковой субстанцией.
У Epidinium ecaudatum вдоль тела тянутся три скелетные пластинки, разъединенные по середине тела узкими промежутками и тесно прилегающие друг к другу спереди и сзади. На правой стороне тела мы различаем правую дорзальную пластинку (рис. 56), соответствующую таковой у представителей рода Diplodinium, которую Догель (1927) назвал primitiva. Ее передний край упирается в теменной вырост, дорзальным же краем она идет вдоль макронуклеуса. Это самая узкая пластинка из всех трех. На правой же стороне тела, загибаясь и на брюшную, лежит вентральная пластинка, так называемая sternum. Это наиболее широкая пластинка. Наконец, с брюшной стороны наискось налево вперед располагается левая пластинка, несколько более широкая, чем первая, называемая parasternum. Sternum и parasternum заканчиваются спереди около адоральной ресничной зоны. Все три пластинки тянутся приблизительно на расстоянии 5/б всей длины тела, утончаясь кзади и сходя совершенно на нет только позади макронуклеуса.
Сократительные вакуоли. У Epidinium видны всегда две сократительные вакуоли, расположенные вблизи концов макронуклеуса дорзально от него, на правой стороне тела. Передняя вакуоль часто несколько крупнее задней. Обе вакуоли имеют линзообразный вид. Каждая из них открывается наружу постоянно существующей порой в кутикуле (см. рис. 56). Сокращение вакуолей in vivo наблюдать трудно, так как интервал между сокращениями достигает 1 ч.
Ядерный аппарат. Макронуклеус колбасовидной формы, спереди закруглен, назад постепенно сужается и заканчивается заострением (см. рис. 56). На окрашенных препаратах хорошо видна зер-
1 Подобная терминология имеет целью подчеркнуть принципиальное отличие, например, внутренней зоны Entodiniomorplia от эндоплазмы других инфузорий. Наружный слой при этом резко отграничивается от нее пограничной мембраной (см. дальше), И у данных инфузорий обособляется особый пищеварительный слой.
нистая структура хроматина. Гранулы последнего вплотную лежат друг около друга, образуя ядро массивного типа.
Приблизительно посередине на макронуклеусе имеется с правой стороны вдавление, в котором лежит небольшой сферический микронуклеус.
Изучение срезов. Прежде всего надо разобраться в серии поперечных срезов. Для этого следует рассмотреть каждый срез под иммерсией, начиная от переднего конца тела до заднего. При этом необходимо обратить внимание на постепенные изменения того или иного органоида в пределах серии.
Очень полезно изготовить рисунки 6—8 срезов в разных областях и расположить их в определенном порядке — тогда на них ясно выступают все особенности расположения отдельных органоидов.
Из передних срезов остановимся на описании среза в области дорзальной дополнительной ресничной зоны (рис. 58,А). Прежде всего-следует обратить внимание на цирры, отметить их сложную природу: отдельные реснички, входящие в их состав, лучше всего видны именно на срезах. Относительно толстая пелликула сильно красится гематоксилином, и на ней видна ребристость. Под пелликулой виден эктопласт, заполняющий значительную часть среза и утолщенный вентрально. Следует отметить его характерную мелкоячеистую структуру. С вентральной стороны на срезе перерезаются все три пластинки скелета. Они вплотную прилегают к пелликуле, и можно заметить перерезанные фибриллы, проходящие вдоль пластинок с наружной стороны. Primitive здесь из всех пластинок наиболее толстая. На parasternum утолщен дорзальный край, sternum же имеет более или менее равномерную толщину. Хорошо видна на срезах призматическая структура пластинок— сама скелетная субстанция остается бесцветной, а гематоксилином окрашивается только склеивающая призмы прослойка (рис. 58,А).
В эктопласте здесь видна также перерезанная поперек глотка. Наконец, около глотки можно рассмотреть пучок сократимых фибрилл — ретрактор околоротовой ресничной системы.
Эндоплазматический мешок наполнен мелкозернистой на срезах цитоплазмой с многочисленными гликогеновыми зернами (не окрашивающимися гематоксилином) и пищевыми частичками. Стенка эндоплазматического мешка — очень тонкая пограничная мембрана с проходящими в ней плохо заметными продольными фибриллами.
Далее следует обратить внимание на срез в области передней сократительной вакуоли. Эктопласт здесь уже сильно утончается, вдоль дорзальной и правой стороны среза он проходит в виде еле заметного слоя. Утолщение его остается в области скелетных пластинок, сократительной вакуоли и ядра.
Primitiva на срезе уже двух остальных пластинок и отстает от пелликулы, погружаясь почти целиком в эктопласт. Sternum сохраняет прежнее положение вплотную к пелликуле. Parasternum также отступает от пелликулы. Глотка в этой области имеет еще замкнутый контур, но она уже с широким просветом и вентральной стенкой прилегает вплотную к скелету. В ее стенках следует отметить продольные лентовидные фибриллы.
1
Рис. 58. Epidinium ecaudatum (ориг.). Серия поперечных разрезов (Х1600). А — разрез в области спинной ресничной зоны; Б — в области передней сократительной вакуоли; В—через микронуклеус; Г — на уровне заднего конца макронуклеуса; Д — в области анальной трубки:
J— cirri спинной ресничной зоны, 2—эндопласт, 3— эктопласт, 4 — primitiva, 5 —* sternum, 6—глотка, 7 — ретрактор адоральной зоны, 8 — parasternum, 9— передняя сократительная вакуоль, 10 — пелликула, // — макронуклеус, 12—микронуклеус, /3— анальная трубка
На этом же срезе виден перерезанный поперек макронуклеус, лежащий в специальном углублении эндоплазматического мешка, но окруженный тонким слоем эктопласта. Хорошо видны его оболочка и зернистая структура.
Сократительная вакуоль лежит дорзально по отношению к ядру, также в эктопласте. Пелликула в этом месте обычно несколько продавливается внутрь в результате фиксации. На удачных срезах можно видеть и выводную пору. Большая часть среза занята эндопластом.
Следующий срез в области микронуклеуса приблизительно посередине тела (рис. 58, В). Эктопласт выглядит так же, как и на предыдущем срезе. Primiti-va становится очень узкой, снова прилегает к пелликуле и ясно прижимается к sternum, сохраняющей тот же вид, что и на предыдущем срезе. Parasternum сильно утолщается по левому краю: вдоль него образуется гребень.
Глотка в этой области уже широко сообщается дорзально с эндоплазматическим мешком. В ее стенках, прилегающих к скелету, также видны продольные фибриллы. Макронуклеус имеет вдавление, в котором помещается микронуклеус.
Следующие срезы в общем мало отличаются от только что разобранного. На них только видно, как у parasternum сильно загибается левый край (рис. 58, Г).
Наконец, брать срез в Ее просвет
стороне среза, стенка кольцевых фибрилл. Эктопласт кнаружи от нее утолщен (рис. 58, Д).
Из продольных срезов рекомендуем разобрать сагиттальные, легче всего получающиеся. На таких срезах (рис. 59) прежде всего следует обратить внимание на форму эндоплазматического мешка. Он кончается, не доходя до переднего конца тела, и стенка его с вентральной стороны вдается внутрь, соприкасаясь в этом месте с глоткой. На таких срезах хорошо удается рассмотреть глоточный аппарат с продольными фибриллами. В начале глотки можно видеть
15
1Z
11
последним следует чразообласти анальной трубки, приближен к вентральной составлена из
Рис. 59. Epidinium ecaudatum. Сагиттальный разрез (Х750) (по Шарпу, с изменен.):
1 — cirri адоральной зоны, 2 — плазматические губы у основания cirri, 3 — теменной вырост, 4 — корневые нити cirri, 5 — эктопласт, б* — cirri дорзальной зоны. 7 — передняя сократительная вакуоль, 8 — макронуклеус, 9 — микронуклеус, 10 — задняя сократительная вакуоль, 11 — анальное отверстие, 12 — анальная трубка, 13 — эндоплазматический мешок, 14 — скелетная пластинка, 15 — глоточные фибриллы, 16 — окологлоточное Фибриллярное кольцо, 17 — ротовое отверстие
фибриллярное кольцо, видимо, играющее роль сфинктера.
Так же хорошо удается разобрать способ прикрепления cirri к телу, удается найти их корневые фибриллы, хорошо видно расположение губ у их основания, видны опорные нити шипов (рис. 60) и т. д.
Наконец, на таких разрезах следует найти сократительные вакуоли и анальную трубку.
Остальные же органоиды легко разобрать, пользуясь прилагаемыми рисунками.
Надотряд Oligohymenophora
Представители этой обширной и весьма разнообразной группы ресничных инфузорий характеризуются наличием специальной око-лоротовой цилиатуры, слагающейся из мембраны и небольшого числа мембранелл (чаще всего трех). Из многих отрядов этого надотряда здесь будут рассмотрены представители двух отрядов — Hymenostomata и Peri-tricha.
ОТРЯД HYMENOSTOMATA '
Tetrahymena pyriformis (Ehrenberg)
Материал и методы изучения. Tetrahymena pyriformis, так же как и некоторые другие виды этого рода, широко распространена в природе в разнообразных мелких пресных водоемах. За последнее десятилетие тетрахимены стали объектом для экспериментальных и молекулярно биологических исследований во многих биологических лабораториях мира, так что обычно не
Рис. 60. Epidinium ecaudatum. А — продольный разрез через шип заднего конца тела; Б — поперечный разрез через шип (из кн. Гартманна); В—танген-тальный разрез через скелетную пластинку, окрашенную хлор-цннк-иодом (Х1200) (орнг.):
I — анальная трубка, 2 — суб-пелликулярная сеть фибрилл, 3— опорные фибриллы шипа
цредставляет труда получить для изучения гото-
вую чистую культуру. Тетрахимены легко разводятся в культурах на сене или салате. Для получения сенной культуры поступают следующим образом. Хорошее (не кислое) сено мелко нарезают ножницами. Сена 2 г на 100 см3 сырой воды кипятят 10—15 мнн в колбе, заткнутой ватной пробкой. После этого колбы ставят в теплое место на 2— 3 дня. За это время на поверхности жидкости в колбе появляется пленка, состоящая из сенной палочки (споры ее выносят кипячение), которая и служит пищей для инфузорий. В такую культуру вносят инфузории (тетрахимены или туфельки), которые размножаются и сохраняются длительное время. Пересев достаточно делать раз в 1—1,5 месяца. Вместо сена еще лучше использовать порошок салата. Для получения его обычные листья салата высушивают до воздушно-сухого состояния и размельчают. В сенную или салатную культуру кроме сенной палочки желательно внести еще какую-либо бактерию, которая может служить пищей инфузориям. В качестве таковой хорошо использовать Aerobacter.
Разработаны методы аксеиичного (безбактериального) культивирования тетрахи-мен, но они довольно сложны и мы не будем их рассматривать.
Тетрахимен изучают на живом материале. Изготовляют различным образом окрашенные тотальные препараты (в том числе метод Фёльгена с подкраской лихтгрюном).
На тетрахимене из-за ее небольших размеров и относительно просто устроенного ресничного аппарата, особенно удобно применять методы серебрения (с. 108), которые дают исключительно четкие картины строения цилиатуры. На тетрахимене возможно также изучить все стадии морфогенеза цилиатуры в процессе бесполого размножения (при делении).
Изучение морфологии. Тетрахимены (рис. 61) обладают грушевидной формой тела (что отражено и в их видовом названии). Средние размеры тела 50—30 мкм. Инфузории прозрачны. При применении фа-
зово-контрастной системы особенно хорошо видна цилиатура, ротовое
отверстие с мембраной и мембранеллами, сократительная и пищева-
Рис. 61. Tetrahymena pyriformis. Рисунок с препарата, импрегнирован-ного серебром (ориг.):
1 — тетрахимениум, слагающийся из трех мембранелл и одной мембраны, 2 — ряды ресничек (кинеты); кинетосомы >- черные зерна
рительные вакуоли. Соматическая цилиатура слагается из продольных рядов ресничек (кинет), идущих в меридиональном направлении (рис. 61). Число последних варьирует от 16 до 26. Чаще других встречается 18— 22 кинет. В передней трети тела помещается ротовое отверстие, в области которого расположена околорото-вая цилиатура, слагающаяся из следующих частей. Справа по краю рта проходит ундулирующая мембрана (рис. 61), слева лежат три мембра-неллы (Mi, М2 и М3). Весь этот околородовой ресничный аппарат получил название «тетрахимениум» (по родовому названию инфузории) и может рассматриваться как исходная и типичная форма околородовой цилиатуры для всего надотряда Oligohyme-nophora. Все другие формы ротовых ресничных образований в пределах этого надотряда удается вывести как от исходного морфологического- типа из тетрахимениума.
На заднем конце тела располагается анальная пора, через которую осуществляется дефекация. На заднем же конце тела помещается и единственная сократительная вакуоль.
В эндоплазме тетрахимен обычно имеются многочисленные пищеварительные вакуоли, наполненные бакте
риями.
Ядерный аппарат тетрахимен слагается из одного сферического макронуклеуса и прилежащего к нему микронуклеуса. При окраске по Фёльгену макронуклеус красится элективно,
1 z з if 5 e
Рис. 62. Tetrahymena pyriformis (по Вильямсу);
I— 6—‘последовательные стадии стоматогенеза в задней особи при делении; импрегнация серебром обнаруживая большое количество ДНК. Желательно отыскать делящиеся формы тетрахимен и рассмотреть стадии митоза микронуклеуса, который обладает у тетрахимен относительно небольшим количеством хромосом (диплоидное число 10).
Имея культуру тетрахимен в начальном периоде ее развития, когда в культуре много делящихся особей, на импрегнированных серебром препаратах удается рассмотреть последовательные стадии развития ротового аппарата (стоматогенез) при делении инфузорий. Этот процесс носит строго закономерный характер (рис. 62). Процесс начинается с того, что слева от кинеты I (так называют ресничный ряд, идущий от средней части мембраны к заднему концу инфузории) возникает состоящая из нескольких десятков группа кинетосом '. Сначала в их расположении не наблюдается какой-либо системы. Затем кинетосомы группируются в базальные образования тетрахимениума, т. е. ундулирующей мембраны и трех мембранелл. Каждая из кинетосом дает начало ресничке. Последние, соединяясь друг с другом, формируют названные выше компоненты тетрахимениума. По мере образования нового около-ротового ресничного аппарата непрерывность кинетиды I и двух соседних с ней кинетид нарушается (рис. 62, 6). Таким образом «старый» ротовой аппарат при делении отходит к передней дочерней особи, тогда как задняя особь развивает новый тетрахимениум.
В то время как протекает стоматогенез, на хорошо импрегнированных серебром препаратах удается иногда обнаружить процесс возникновения новых ресничек соматической цилиатуры. Перед кинетосомами существующих ресничек возникают новые кинетосомы, сначала лишенные ресничек.
Paramecium caudatum Ehrbg. — туфелька
Материал и методы изучения. Paramecium caudatum — инфузория туфелька относится к числу обычных обитателей мелких пресноводных водоемов с высоким содержанием органических веществ. Живет в придонных слоях. Легко разводится в культурах. Методы культивирования те же, что и для тетрахимен (с. 121). Для длитель-
1 Способ возникновения кинетосом может быть изучен только на электронномикроскопическом уровне, что не входит здесь в нашу задачу,
ного содержания культуры туфелек можно рекомендовать также метод, предложенный Цингером. Чистые химические пробирки заполняют предварительно прокипяченной водой. Добавляют 2 3 капли снятого молока. Через 3—4 дня в культуру вносят парамеции, которые быстро размножаются, питаясь молочнокислыми бактериями. Каждые 2—3 недели производится пересев культуры в ту же свежую среду.
Род Paramecium включает свыше 10 видов. Для изучения морфологии наиболее удобна Р. caudatum в силу своих относительно крупных размеров и широкого распространения в природе (длина 180—280 мкм). Очень сходна с ней Р. multimicronucleatum (длина 180 310 мкм), а также более мелкая Р, aurelia (длина 80—310 мкм).
Изучение ведется на живом материале, используя методы частичной остановки движения (с. 8 10). Работа ресничек хорошо видна при использовании фазо-контрастного устройства. Для изучения ядра применяют окраску по Фёльгену со слабой под-
7
1
2
MJ
2
6
Рис. 63. Paramaecium caudatum. Общая организация in vivo (Х750) (из кн. Полянского и Стрелкова):
/ — реснички, 2 — пищеварительные вакуоли, 3 — микронуклеус, 4 — ротовое отверстие, 5 — глотка, б — содержимое анальной вакуоли, 7 — резервуар сократительной вакуоли, 8 — макронуклеус, 9 — трихоцисты
гематоксилином после фиксации осмиевыми или ценкер-формолом. Заливку проводят по на целлоидиновых пластинках
краской лнхтгрюном (методы приклеивания инфузо-• рий к стеклу, с 8—10). У туфелек особенно тщательно и подробно изучена цилиатура, как соматическая, так и околоротовая. Для того чтобы разобраться в строении локомоторных органоидов парамеций, необходимо применить методы серебрения, желательно по Шаттону-Корлнсу (с. 108).
Для изучения питания и пищеварения применяют витальное окрашивание нейтральным красным и конго красным.
Рекомендуется также для изучения цитоплазматических структур изготовить срезы, окрасив их железным смесями методу Петерфи (с. 23).
Парамеции представляют собой объект, удобный для изучения полового процесса — конъюгации. Иногда конъюгация возникает в культурах спонтанно. Как известно, конъюгируют между собой особи, принадлежащие к противоположным (комплементарным) типам спаривания. В некоторых лабораториях имеются генетические линии парамеций, относящихся к комплементарным типам спаривания. В таком случае конъюгация получается при смешивании культур, находящихся в хорошем физиологическом состоянии, активно делящиеся. Если таких культур нет, то рекомендуется развести несколько культур, происходящих каждая от одной отсаженной особи (такие культуры представляют собой клоны), взятой нз разных источников. При смешении таких клональных культур между собой имеется значительная доля вероятности, что они окажутся относящимися к разным типам спаривания и вступят в конъюгацию. Для изучения ядерных процессов при конъюгации рекомендуется сделать тотальные препараты на стекле и окрасить их по методу Фёльгена (с докраско^ лихтгрюном). Если удалось получить массовую конъюгацию путем сливания культур, относящихся к разным типам спаривания, то рекомен-
дуется проводить фиксацию через разные сроки начала конъюгации на дистанции 2—3 ч в течение суток, чтобы получить разные стадии полового процесса н последующей реконструкции ядерного аппарата.
Изучение морфологии. Тело туфельки вытянуто в длину и напоминает по форме своей дамскую туфельку-лодочку, Наиболь-
z
Рис. 64. Схема строения кортекса Paramecium (по Греллю): / — гребни пелликулы, образующие шестиугольники, 2 — реснички, 3— кинетосома, 4 — кинетодесмы, 5 — трихоциста
шая ширина в задней трети тела (рис. 63). Задний конец у Р. caudatum несколько заострен и несет более длинные реснички, чем остальное тело (отсюда происходит и видовое название — caudatum, т. е. снабженный хвостом). На одной стороне дела, которая: условно называется брюшной, внутрь тела вдается глубокий желоб. Это перистом, в глубине и задней части которого, именуемой вестибулум, открывается отверстие, ведущее в глотку (этот отдел пищеварительного аппарата по Корлису называется предротовой полостью). Вся пелликула инфузории густо покрыта ресничками (соматическая цилиатура). Число ресничек у Р. caudatum равняется примерно 15 тыс., у Р. aurelia — 5 тыс. Поверхность пелликулы парамеций скульптурирована. Схематически это показано на рис. 64. Вся поверхность инфузории покрыта ромбическими полями, отделенными друг от друга валиками. В центре каждого шестиугольника расположена ресничка, берущая начало от кинетосомы, погруженной в толщу эктоплазмы (кортекса). С кинетосомой связаны фибриллярные структуры. Чередуясь с ресничками, на границе между шестиугольниками пелликулы располагаются трихоцисты (рис. 64, 5), число которых таким образом примерно соответствует числу ресниц. Детально эти структуры можно изучить лишь с помощью сканирующего электронного микроскопа, но общую картину структурированности пелликулы можно рассмотреть и со световым микроскопом. Для этого инфузории высушивают на воздухе в крепком растворе конго красного (еще лучше опалового синего), после чего заключают в бальзам и изучают с иммерсионной системой. На удавшихся препаратах структура пелликулы видна очень отчетливо, ибо ромбические поля выполняются краской, а валики между ними остаются светлыми.
Для изучения расположения соматической цилиатуры следует прибегнуть к препаратам, импрегнированным серебром (рис. 65). На удачных препаратах вычеркивается каждая кинетосома, что создает чрезвычайно отчетливую картину распределения цилиатуры по телу инфузории. На спинной стороне (рис. 65,Л) реснички расположены продольными рядами. Всегда отчетливо вычеркиваются отверстия сократительных вакуолей. На брюшной стороне расположение соматической цилиатуры довольно сложно и строго закономерно (рис. 65,5). Различают следующие пять зон. Переднее правое поле состоит из кинетид, проходящих почти параллельно преоральному шву (светлое, лишенное кинетид поле, идущее от перистома к переднему концу). Переднее левое поле слагается кинетидами, идущими перпендикулярно ко шву (на рисунке 65,5 правое поле расположено слева, а левое справа, так как инфузория обращена брюшной стороной к зрителю). Цирку-моральное (вестибулярное) поле окружает ротовое углубление (вести-булум или перистом). Посторальное правое поле слагается из кинет, идущих параллельно щели порошицы и, наконец, левое посторальное поле состоит из кинет, расположенных под острым углом к порошице. Следует подчеркнуть, что вся эта сложная система кинетид, включающая многие тысячи отдельностей — ресничек с кинетозомами — работает согласованно, как единая локомоторная система инфузории, вызывающая ее поступательное и вращательное движение. При определенных воздействиях (например, механическом воздействии на передний ко-
Рис. 65. Расположение кинетосом в кортексе Paramecium aurelia (импрегнация серебром). А — со спинной стороны; Б — с брюшной стороны (по Соннеборну):
/ — поры сократительных вакуолей, 2— правое преоральное иоле, 3 — преораль-ный шов, 4— левое преоральное поле, 5 — перистом и ротовое отверстие, 6— левое посторальное поле, 7 — щель порошицы, 8 — правое посторальное поле, 9 — вестибулярное поле, п — передний конец, з — задний конец
Рис. 66. Схема строения ротового аппарата Paramecium (по Корлису):
1 — ротовое отверстие, 2 — vestibulum, 3 —ротовая полость, в которой расположены базальные части мембраны и мембранелл, 4 —цитостом, 5 — цитофаринкс (глотка)
нец) вся работа системы может перестраиваться и происходит реверсия направления движения — инфузория на некоторый отрезок времени двигается задним концом вперед. После устранения действия раздражителя нормальное движение восстанавливается.
Пищеварительная система и питание. Номенклатура частей рото
Рис. 67. Строение ротового аппарата Paramecium aurelia (схематизировано) (по Дидиэ):
1—3 — пеникулюсы, 4 — околоротовая мембрана (parorale), 5 —ресннчки вестибулярного поля
вого и пищеварительного аппарата инфузорий необычайно запутана. Ниже мы примем систему, предложенную Корлисом (1959), и дополним ее данными Дидиэ (1971) (рис. 66). На дне перистомального углубления (вестибулума) распола-
гается отверстие, ведущее в предротовую полость (у других авторов это отверстие называется ротовым, а предротовая полость глоткой). В конце этой полости расположено ротовое отверстие, ведущее в эндоплазму. В области этого отверстия формируются пищеварительные вакуоли. В предротовой полости (глотке) расположены в числе трех особые ресничные образования, напоминающие удлиненные мембранеллы, каждое из которых слагается из четырех очень тесно расположенных рядов ресниц, частично склеенных между собой. Они носят название пеникулюсы (peniculus) (рис. 67) Ч
Кроме пеникулюсов в предротовой полости на стороне, противоположной пеникулюсам, располагается еще одна оробая кинета, состоящая из тесно расположенных ресничек и получившая название «парорале» (parorale). Пеникулюсы и парора-ле являются мощным аппаратом, направляющим ток воды со взвешенными в ней пищевыми частицами к ротовому отверстию, в области которого формируются пищеварительные вакуоли.
Сравнивая организацию околоротовой цилиатуры тетрахимены и парамеции, имеются основания провести ряд гомологий. Пеникулюсы рассматриваются как гомологи мембран тетрахимениума (Ml, М2 и М3), а парорале — как гомолог унду-лирующей мембраны. Это дает основание для включения парамеций и других Hymenostomata в
Рис. 68. Paramecium caudatum. Путь пищеварительной вакуоли в цитоплазме (из кн. Кальмуса)
1 Некоторые авторы насчитывают два пеникулюса, а третий с более широко расставленными рядами ресниц называют квад-рулюсом (quadrulus).
надотряд Oligohymenophora. Образующиеся пищеварительные вакуоли (размеры их широко варьируют в зависимости от характера пищи, температуры окружающей среды и других факторов) отрываются от ротового отверстия и как бы соскальзывают по одному из краев пред-ротовой полости в эндоплазму и направляются к заднему концу тела. Описаны специальные опорные фибриллы, идущие от ротового отверстия назад и направляющие начальное движение пищеварительных вакуолей.
Далее пищеварительные вакуоли в эндоплазме проделывают сложный и закономерный путь, изображенный на приведенной схеме (рис. 68). От заднего конца тела пищеварительные вакуоли токами эндоплазмы увлекаются вперед и движутся до переднего конца, после чего поворачивают и направляются снова назад. Иногда во время такого циклоза вакуоль проделывает не один, а два круга, из которых первый осуществляется на уровне расположения макронуклеуса. Непереваренные остатки пищи выбрасываются из тела туфельки через особую щель в пелликуле — порошицу (см. рис. 65). Продолжительность пребывания пищеварительной вакуоли в теле инфузории зависит от множества факторов и прежде всего от качества пищи. Как показал еще С. И. Метальников, вакуоли, заполненные питательной пищей (бактерии, куриный желток и т.п.), пребывают в теле инфузории гораздо дольше (при комнатной температуре около 1 ч), чем вакуоли с непитательными веществами (мелко истолченный уголь, стекло и т.п.). Процесс заглатывания пищи у туфельки совершается непрерывно в течение всей жизни, и поэтому ее можно заставить заглатывать любые вещества, лишь бы они по размеру могли пройти через ротовое отверстие, которое постоянно открыто. В этом существенное отличие от механизма питания хищных инфузорий, которые были рассмотрены выше на дидиниях и дилептусах.
Для того чтобы наблюдать поглощение пищи и циклоз пищеварительных вакуолей, следует покормить парамеции окрашенной пищей. Лучше использовать мелко растертую тушь или кармин. Для того чтобы ознакомиться с некоторыми физиологическими сторонами процесса, рекомендуется добавить к культуре раствор конго красного (2— 3 крупинки красителя на солонку). Конго красный — индикатор. В щелочной среде он красный, в кислой — синий. Сначала в процессе образования вакуоли и сразу после ее отделения от цитофаринкса и перехода в эндоплазму содержимое остается красным (слабо щелочная реакция). Вскоре цвет меняется — вакуоли становятся синими (кислая фаза пищеварения). Эта фаза сопровождается уменьшением объема вакуолей, что обычно происходит при движении ее к переднему концу тела. Далее содержимое вакуолей опять краснеет (становится щелочным) до конца циклоза. По ходу пищеварения из эндоплазмы в вакуоли поступают лизосомы, несущие ферменты. Однако изучение этой стороны процесса требует применения электронной микроскопии и некоторых специальных методов цитохимии. Перед дефекацией несколько пищеварительных вакуолей обычно сливаются в одну более крупную, которая и опорожняется наружу через порошицу.
Сократительные вакуоли у парамеций расположены в передней и задней трети тела, в цитоплазме, ближе к спинной стороне под кортек-сом. Каждая вакуоль состоит из центрального резервуара и 7-—10 приводящих каналов (систолетт). Вакуоли работают попеременно. Отверстия вакуолей преформированы к пелликуле (см. рис. 65). В пределах каждой сократительной вакуоли сначала наполняются жидкостью систолетты. Содержимое их переливается в центральный резервуар, из которого уже через пору изливается наружу. Интервалы между сокращениями сильно зависят от температуры, физиологического состояния инфузории и осмотического давления окружающей инфузорию жидкой среды. При 16°С частота пульсации составляет примерно 20—25 с.
В эндоплазме парамеций кроме органоидов, выявляемых преимущественно методами электронной микроскопии (митохондрии, эндоплазматический ретикулум, аппарат Гольджи), имеются различные включения, которые можно обнаружить и на светооптическом уровне. Это различные резервные и экскреторные включения. Применяя описанные выше методы (с. 39), в эндоплазме туфелек легко обнаружить наличие гликогена и нейтральных жиров. Количество их варьирует в самых широких пределах в зависимости от условий среды и физиологического состояния инфузорий. Наиболее обильное накопление этих веществ наблюдается при низких температурах, когда расходование их в процессе обмена веществ понижено. Нередко (особенно в старых культурах) в эндоплазме можно наблюдать мелкие кристаллы разной формы. В основном это экскреты разного химического состава. Еще Шевяковым было показано, что среди этих кристаллов преобладает фосфорнокислая известь.
Ядерный аппарат Paramecium caudatum слагается из большого почковидного макронуклеуса, исключительно богатого ДНК (изучение ведется на тотальных препаратах, окрашенных по Фельгену), и одного довольно крупного микронуклеуса, один полюс которого остается неокрашенным (в нем сосредоточены элементы, связанные с формированием ахроматинового веретена). У Р. multimicronucleatum тоже один макронуклеус, но несколько микронуклеусов (3—4) гораздо меньших размеров, чем у Р. caudatum. У Р. aurelia один макронуклеус и два очень мелких микронуклеуса.
Если изготовлены срезы парамеций (по методу Петерфи, с. 23), то часть их следует покрасить методом двойной окраски по Унна-Пап-пенхейм. При этом выявится, что часть гранул макронуклеуса окрашивается в зелено-фиолетовый цвет. Это тот материал, который дает интенсивную окраску по Фельгену и представляет собой хроматин ядра. Наряду с этим выявятся многочисленные мелкие окрашенные в красный цвет гранулы. Это — нуклеолы, богатые РНК- Размеры и количество нуклеол в высокой степени зависят от физиологического состояния инфузории. В микронуклеусах нуклеолы отсутствуют.
В молодых активно размножающихся культурах нередко удается обнаружить стадии деления ядер. Макронуклеус при этом вытягивается и перешнуровывается, а микронуклеус делится митозом, но без разрушения ядерной оболочки. Подробности о делении микронуклеусов см. в Монографии И. Б. Райкова (1978) о ядре простейших.
Выше указано, что, имея разнообразные культуры парамеций, не трудно получить конъюгацию и изучить ход ядерных процессов. Здесь не дается их описания, ибо проходящий практикум сможет разобраться
в них, используя руководства по протозоологии В. А. Догеля, Ю. И. Полянского и Е. М. Хейсина (1962) и К. Грелля (К. Grell, 1973), приведенные ниже в списке литературы к этой главе.
ОТРЯД PERITRICHA — ' КРУГОРЕСНИЧНЫЕ
Vorticella sp. — сувойка
Материалы и методы изучения. Vorticella sp. принадлежит к одиночным Peritri-cha (сем. Vorticellidae) и встречается сидящей на водяных растениях, палочках и других предметах иногда в таком количестве, что образует видимый даже на глаз налет. На корешках ряски часто можно найти V. lemnae. Получение материала зимой из природы невозможно, но в любое время можно получить V. microstoma в навозных настоях. Для этого сырой водой заливают в банках навоз (лучше всего конский). Через 1—2 недели почти наверняка разовьется эта форма. Наблюдения ведут исключительно in vivo.
Изучение морфологии. Колоколообразное тело сувойки сидит на длинном сократимом стебельке. У наиболее крупных сувоек длина тела достигает 170 мкм (К campanula), обычно же они мельче, в среднем не больше 50 мкм. Длина стебелька очень варьирует в пределах одного и того же вида.
Как тело, так и стебелек в обычном состоянии сувойки лишены
Рис. 69. Vorticella. Общая организация (из кн. Ноланда):
1 — внутренняя ундулирующая мембрана, 2— средняя мембрана, 3 — наружная мембрана, 4 — микронуклеус, 5 — образующаяся пищеварительная вакуоль, 6 — макронуклеус, 7 —киноплазма мионемы, 8 — текоплазма мионемы, 9 — наружная стенка стебелька, 10—колечко стебелька, 11— ресничная бороздка на заднем конце тела, 12 — сократительная вакуоль, 13— вход в vestlbulum> 14—перистомальный край
ресничек. Пелликула, покрывающая тело, часто бывает скульптуриро-вана. Чаще замечаются кольцевые бороздки, реже — различной формы и расположения бугорки, сосочки, бородавочки (рис. 69). Ресничный аппарат сконцентрирован только в околоротовой области, где формируется перистомальный диск.
Тело у большинства сувоек
расширяется кпереди, так что этот диск оказывается наиболее широкой частью, хотя у К microstoma можно увидеть резкое сужение тела именно в области перистома, и последний оказывается незначительных размеров (см. рис. 72). Края тела в области перистомаль-ного диска отогнуты наружу в виде леристомальной губы или края (рис. 69). Поверхность диска выпуклая.
Ресничный аппарат адоральной зоны расположен по периферии диска в специальной борозде, отделяющей от диска перистомальную губу. Данная борозда образует несколько больше одного полного оборота спирали,. Наружный конец спирали подходит к отверстию преддверия (vestibulum, рис. 69, 70), далее бороздка огибает диск по часовой стрелке, и внутренний ее конец заканчивается на диске и расположен выше наружного. Реснички адоральной зоны склеиваются в три ундулирующие мембраны, проходящие рядом друг с другом. При этом склеивание происходит неполное, концы ресничек остаются свободными, благодаря чему свободный край каждой мембраны оказывается бахромчатым, и мы имеем здесь особую категорию так называемых полумембран (semi-membranae). Реснички обеих внутренних мембран обычно стоят вертикально (перпендикулярно по отношению к поверхности диска, см. рис. 69). Третья же, наружная, мембрана расположена, наоборот, горизонтально. Все три мембраны спускаются в преддверие, и
Рис. 70. Vorticella. Вид перисто-мального поля сверху (из кн. Ноланда и Финлей):
1 — базальная линия прикрепления внутренней мембраны, 2 —то же, средней, 3—то же, наружной, 4—макронуклеус, 5— конец обеих внутренних мембран, 6 — сократительная вакуоль, 7 — вестибулярная ундулирующая мембрана, 8—преддверие (vestibulum), 9— перистомальный край, 10— перисто*
мальное поле
Рис. 71. Vorticella nebulifera. Движение мембран. Вид сбоку (Х600) (из кн. Ноланда и Финлей)
Рис. 72. Vorticella microstoma (из кн. Ноланда и Финлей). А— инфузория в спокойном состоянии (X 600); Б — сократившийся стебелек и втянутый перистом (Х600); В—
Е — последовательные стадии образования бродяжки (Х400)
здесь за счет наружной формируется широкая, уже настоящая, вестибулярная ундулирующая мембрана. Обе вертикальные мембраны находятся в постоянном волнообразном движении (рис. 71), наружная же в более «спокойном» состоянии. Создается ток воды между наружной мембраной и остальными, направленный против часовой стрелки. При этом захватываются пищевые частички, которые и продвигаются в преддверие.
Три описанные выше мембраны (полумембраны) следует рассматривать как гомологов мембранелл тетрахимениума (Мь Мг и М3) (см. с. 122, рис. 61), тогда как четвертая ундулирующая мембрана есть, очевидно, гомолог ундулирующей мембраны тетрахимены.
Между обеими внутренними мембранами и внутренней стенкой преддверия создается обратный ток воды, выбрасывающий наружу выделенное в преддверие содержимое сократительной вакуоли и непереваренные остатки из пищеварительных вакуолей (см. ниже).
В известный момент жизненного цикла у сувоек появляются дополнительные реснички на заднем конце тела. Они закладываются в специальной ресничной бороздке (см. рис. 69) и функционируют после отрывания тела от стебелька, когда сувойка превращается в бродяжку (рис. 72). У нее задние реснички представляют основной двигательный элемент, так как адоральная зона втягивается внутрь и движение совершается вперед задним концом.
Тело бродяжки обычно принимает цилиндрическую форму. Нередко удается наблюдать весь процесс формирования таких свободно подвижных стадий (рис. 72).
Весь адоральный аппарат у сувойки может втягиваться внутрь тела под влиянием различных внешних раздражений. Постукивание по стеклу позволяет наблюдать под микроскопом, как весь перистом очень быстро втягивается и как он медленно выпячивается обратно после «успокоения» сувойки. Обнаружить все составные части ресничного аппарата можно только у активных сувоек при рассматривании их с иммерсионным объективом. Наиболее четкая картина получается на оптическом разрезе краев перистома.
Пищеварительная система начинается с преддверия (vestibulum). Широким отверстием он сообщается с наружной средой и представляет собой длинную воронку, загибающуюся внутрь тела инфузории. На конце преддверия формируется пищеварительная вакуоль, которая по узкой глотке, почти незаметной in vivo, передается в плазму, где она и совершает циклоз.
Кормление сувоек удается хорошо наблюдать, прибавляя к капельке жидкости с сувойками растертую в воде тушь или кармин. Непереваренные остатки из пищевых вакуолей выбрасываются не прямо наружу, а в определенном месте в преддверие.
Единственная шарообразная сократительная вакуоль находится около преддверия и связывается с ним посредством специального, небольшого соединительного резервуара (см. рис. 70). Промежуток между двумя сокращениями у V. microstoma, например, оставляет около 15 с, у ряда других Vorticella отмечаются и меньшие интервалы (5—6 с).
Макронуклеус у сувоек сильно вытянут в длину — колбасовидной формы. Часто он изогнут вдоль края перистома и одним концом спускается в плазму к заднему концу тела. In vivo можно заметить его зернистую структуру, если объект посильнее придавить покровным стеклом. Маленький, овальный микронуклеус прижимается к нему в передней части тела.
Стебелек у сувоек имеет чрезвычайно характерную структуру. Он состоит из наружной стенки, внутренней жидкости и проходящей внутри по весьма пологой спирали мионемы. Г всего видна сократимая часть — киноплаз) рис. 69), одетая прозрачной, обычно плохо личие у некоторых видов специальных текоплазматических гранул позволяет ее рассмотреть лучше.
При сокращении мионемы весь стебелек скручивается в спираль (рис. 72, 5), благодаря чему и получается его укорочение. При расслаблении мионемы, благодаря эластическому действию наружной стенки, стебелек расправляется и вытягивается. Мионема входит в тело сувойки и связывается с пучком фибрилл у его основания. Наружная стенка стебелька отделяется от пелликулы тела кольцеобразной скопулой — зоной железистой цитоплазмы, секретирующей стебелек при делении и при креплении бродяжки к субстрату.
В некоторых случаях на стебельке замечается колечко, отделяющее более толстую дистальную часть (см. рис. 69). Оно образуется в том месте, где от старого стебелька отделяется стебелек до-
> составе последней лучше ia, или спазмонема (см. заметной текоплазмой. На-
Рис. 73. Vorticella microstoma. Циста (X1800) (из кн. Брандта) :
1 — наружная оболочка, 2 — внутренняя оболочка, 3 — сократительная вакуоль, 4 — стебелек, 5 — макронуклеус
черней особи при делении. При сокращении стебелька с колечком в спираль свертывается только проксимальная, более тонкая часть. Стебелек прикрепляется к субстрату базальной пластинкой на дистальном конце стебелька.
В культурах V. microstoma часто попадаются цисты с толстой бугорчатой наружной оболочкой, остающиеся прикрепленными к субстрату с помощью стебелька (рис. 73).
Zoothamnium arbuscula Ehrbg.
Эта чрезвычайно своеобразная колониальная Peritricha заслуживает специального внимания как форма с диморфной колонией и как представитель, позволяющий чрезвычайно легко проследить процесс развития колонии путем деления прикрепившейся бродяжки.
Материал и методы изучения. Колонии Zoothamnium arbiscula (из сем. Vorticel-lidae) прикрепляются главным образом к водяным растениям (особенно к Elodea) в водоемах (прудах) со стоячей, но прозрачной водой. Zoothamnium не встречается глубже 1 м. Колонии легче отыскивают, просматривая веточки элодеи в банке с водой, они видны тогда и простым глазом. Изучение ведется только in vivo, причем общую форму колонии легче всего разобрать в чашечке или в часовом стекле, не отрывая от листочка. Для наблюдения за развитием новой колонии из бродяжки следует несколько крупных колоний отсадить в отдельную посуду обязательно с веточками элодеи. Лучше всего подобную отсадку произвести вечером, к утру будет гарантировано прикрепление нескольких бродяжек. Тогда в течение целого дня можно наблюдать за ростом стебелька и делением бродяжки, ведущим к формированию колоний.
Изучение морфологии. Колония Zoothamnium имеет вид зонтика. Стебелек ее достигает в длину 2—3 мм. Приблизительно такого же диа-
Рис. 74. Zoothamnium arbuscula. Общий характер ветвления колонии (из кн. Фурсенко): /’—место отхождения стебелька колонии, 2 — макро-зоиды
метра достигают крупные колонии в расправленном состоянии. При всякого рода внешних, особенно механических, раздражений вся колония сокращается и собирается в комок.
Прежде всего следует обратить внимание на ветвление колонии. От стебелька отходят постоянно девять главных ветвей (рис. 74). Постоянство этого количества связано с особенностями развития колонии, о чем речь будет ниже. В обе стороны от стебелька отходят две основные ветви, отдающие от себя одна — пять главных боковых ветвей, другая — четыре. От каждой главной
ветви отходят не больше 20 боковых вето-чек, на которых сидят на коротких ножках 10—40 или даже 50 особей, так называемых микрозондов (рис. 75). Общее количество особей во взрослой колонии достигает 2000—3000. Каждая из главных ветвей может быть обозначена по Фурсенко (1924 и 1929) особыми буквами (см. рис. 74), значение которых становится понятным только после разбора особенностей развития колонии1.
На каждой крупной колонии, кроме микрозондов, обязательно имеются так называемые макрозоиды. Если микрозонды имеют колоколообразную форму и достигают в длину 45—60 мкм, то последние обладают шарообразным телом диаметром 200—250 мкм (рис. 75, 76). У микрозондов адоральная зона развита нормально и выглядит типично для Peritricha, в то время как у макрозоидов она редуцирована и не функционирует. Доказательство последнего можно привести весьма убедительно, поместив всю колонию во взвесь туши или кармина. Микрозонды наполняются окрашенными гранулами, в то время как в макрозоидах их не будет.
Макрозоиды дифференцируются на главных ветвях за .счет изменения обыкновенных микрозондов. Последние усиленно растут, но своеобразно, неравномерно. Общая масса цитоплазмы увеличивается в несколько сот раз, параллельно растет и ядро, и сократительная вакуоль, но перис-
Рис. 75. Zoothamnium arbus-cula. Отдельная веточка колонии in vivo (Х75) (из кн. Фурсенко):
1 — боковые ответвления с микрозондами, 2— макрозоиды, 3— стебелек колонии
том, преддверие и глотка в размерах не
увеличиваются. Адоральная зона втягивается, и преддверие функционирует только как проток сократительной вакуоли. При этом у основания макрозоида дифференцируется особая область зернистой цитоплазмы— скопула, секретирующая стебелек при развитии новой колонии. Вполне выросшие макрозоиды отрываются от колонии и в обычных условиях становятся родоначальниками новых колоний. На месте их прикрепления к главной ветви остаются круглые следы (рис. 77).
Рекомендуется детально рассмотреть структуру ствола колонии. Каждая из главных ветвей представляет собой трубку из плотного хитиноподобного материала, выполняющую поддерживающую роль. Внутри трубка выполнена прозрачной жидкостью, и в ней проходит слегка по спирали мионема. На последней совершенно ясно удается различить
Обозначения отдельных ветвей даны по Фурсенко (1929).
зернистую периферическую текоплазму, покрытую пелликулой, и внутреннюю гомогенную киноплазму, разделенные между собой слоем продольных эластичных волокон. Последние in vivo видны плохо. Боковые веточки также содержат мионему, ответвляющуюся от таковой главной ветви.
Проксимальный конец ножки колонии также имеет мионему подобной структуры. Приблизительно посередине стебелька мионема превращается в лишенное сократимости сухожилие, которое своим нижним концом переходит в стенки трубки стебелька (рис. 78, А). Дистальный конец стебелька представлен только трубкой. Постукиванием по стеклу при рассматривании стебелька можно вызвать его сокращение. Та часть его, где проходит мионема, свивается в спираль, дистальный же конец, наоборот, не испытывает никаких изменений (рис. 78, Б). Стебелек при этом перегибается в области заднего конца сухожилия — это
Рис. 76. Zoothamnium arbuscula. Часть веточки колонии с макрозоидом (Х20) (из кн. Фурсенко):
J — микрозонды, 2 — растущий макрозоид, 3 — скопула, 4 — вполне выросший макрозоид, 5 — макронуклеус, 6 — перистом, 7 — сокра* тительная вакуоль
место с полным правом можно назвать шарниром, Нижний конец Стебелька расширен в виде базальной пластинки, которой колония прикрепляется к субстрату.
Развитие колонии. У макрозоида перед отрыванием от места прикрепления недалеко от базальной части вырастает аборальное кольцо ресничек. Оторвавшийся макрозоид — бродяжка — получает характерную коническую форму (рис. 79). Вершина конуса при этом занята пе-ристомальным аппаратом, основание же опоясано ресничками и около него в плазме видно .
скопление секреторных гранул, образующих ско- jgf
пулу. Бродяжка плавает основанием вперед, 1—Ш
вращаясь вокруг продольной оси тела и сильно /и
раскачиваясь в стороны. Своим базальным кон- Ц
цом она натыкается время от времени на встреч- m
ные предметы и пытается прикрепиться. На та- 2—ы кие попытки обычно уходит 2—3 ч (иногда этот ]__3
свободный период достигает и суток). 4
Макрозоид легко прикрепляется далеко не к 1
каждому субстрату. Быстрей всего это происхо- |
дит на элодее. Если же из чашечки ее вынуть, то
к стеклу бродяжки начнут прикрепляться только через сутки. При прикреплении бродяжка прикладывается скопулой к субстрату и приклеива- |
Рис. 77. Zoothamnium arbuscula. Следы на местах прикрепления макрозои-дов к ветви колонии (Х175) (из кн. Фурсенко):
1 — мионема стебелька. 2 •— следы от макрозоидов
Рис. 78. Zoothamnium. arbuscula (нз кн. Фурсенко) . А — структура нож-ки колонии (Х75); Б — сократившаяся ножка колонии:
1 — наружная трубка, 2 — киноплазма мионемы, 3 — текоплазма мионемы, 4 — су-хожилие, 5 — шарнир, 6 — несократимая часть стебелька, 7 — базальная пластинка
Рис. 79. Zoothamnium arbuscula. Оторвавшийся макрозоид-бродяжка (Х175) (из кн. Фурсенко) :
/ = скопула, 2 — венчик аборальных ресничек, 3 — макронуклеус, 4— сократительная вакуоль, 5 —перистом
Рис. 80. Zoothamnium arbuscula (из кн. Фурсенко). Рост стебелька колонии после прикрепления бродяжки (Х85). А, Б и В—рост несократимой части стебелька; Г — врастание скопулы в стебелек и образование сухожилия
Рис. 81. Zoothamnium arbuscula (из кн. Фурсенко). Развитие колонии после достижения стебельком окончательной длины (Х150). А — стадия двух клеток; Б — стадия четырех; В — стадия восьми и Г — стадия шестнадцати; буквами обозначены последовательно образующиеся зооиды (объяснение в тексте)
ется к нему вращательным движением, образуя в этот момент базальную пластинку ножки колонии. Сразу же начинается рост стебелька, аборальный венчик ресничек перестает работать и редуцируется.
В первый час успевает выделиться вся несократимая часть стебелька (600—700 мкм длиной, рис. 80). Далее скопула врастает внутрь стебелька — сначала формируется сухожилие, а затем и мионема. Окончательной длины стебелек достигает часов через пять с момента прикрепления бродяжки, когда начинается первое деление, длящееся около 40—50 мин. Этот процесс сопровождается прежде всего увеличением поперечного диаметра макрозоида, потом появляется на переднем конце борозда, разделяющая его тело на две неравные части. Возникают две особи —одна покрупней, другая помельче (рис. 81, Д). Обе отделившиеся особи имеют вытянутую форму тела с еще маленьким перистомом. Далее почти сразу же они приступают к следующему делению, которое длится также 40—50 мин. Плоскость деления на этот раз перпендикулярна предыдущей. Образуются четыре особи, из которых три более или менее одинаковой величины, а четвертая мельче их всех (рис. 81, Б). Затем образуются восемь особей (рис. 81, В) синхронно. На стадии шестнадцати клеток (рис. 81, Г) синхронность нарушается за счет запаздывания в делении мелких особей. На стадии восьми и шестнадцати клеток часть особей принимают типичный для
Рис. 82. Zooihamnium arbuscula (из кн. Фурсенко). Схема ветвления эксконьюгаци-онной колонии:
1 — место отхождения стебелька колонии, 2 — за-мещающне веточки
1
3
Рис. 83. Zooihamnium arbuscula. Циста (Х130) (из кн. Фурсенко):
1 — сократительная вакуоль, 2 — макронуклеус, 3 — стебелек
микрозондов облик. Здесь выделяются родоначальники главных ветвей колоний.
На колониях, взятых во вторую половину лета, иногда замечаются уклонения от вышеописанной правильности ветвления. Именно вместо девяти веточек развивается десять. Это не что иное, как колонии, на которых происходит конъюгация. Макроконъюганты формируются всегда в количестве двух на концах обеих главных ветвей Л(Е) и В (С). Эти ветви прекращают рост, и тогда начинают расти дополнительные или замещающие веточки — две с одной стороны, одна с другой (рис. 82), что и приводит к образованию 10-веточной колонии. Микро-конъюганты формируются на крупных колониях за счет микрозондов. Они развивают венчик ресниц и уплывают.
В редких сравнительно случаях (при неблагоприятных условиях, особенно температурных) макрозоиды после периода выделения несократимой части стебелька инцистируются, не приступая к делению. Структуру такой цисты (с двойной оболочкой) рекомендуется разобрать, пользуясь прилагаемым рис. 83.
Надотряд Polyhymenophora
Основным признаком, характеризующим этот обширный высший надотряд ресничных инфузорий, служит наличие адоральной зоны мембранелл, слагающийся из большого количества отдельных компонентов. Полагают, что адоральная зона появилась на основе полимеризации компонентов тетрахимениума (с. 122). В пределах Polyhymenophora рассмотрим представителей двух отрядов: Heterotricha и Hypotricha.
ОТРЯД HETEROTRICHA - РАЗНОРЕСНИЧНЫЕ
Stentor coeruleus Ehrbg. — трубач
Материал и методы изучения. Stentor coeruleus из сем. Stenioridae — обычная форма многих стоячих водоемов с прозрачной чистой водой. Инфузории сидят группами на различных мелких предметах на дне. Изучение ведут главным образом in vivo. Ядерный же аппарат рассматривают на тотальных препаратах. Чтобы избежать при фиксации сильного сокращения тела, следует стекло (часовое или предметное) слегка подогреть, чем и вызывается наркотическое состояние. Постукиванием по стеклу устанавливается момент потери чувствительности, и только тогда приливают фиксатор (например, жидкость Шаудина, Буэна или осмиевые смеси). Хорошие результаты получают при окраске тотальных препаратов по Фёльгену. Другие методы дают худшие результаты, что связано с большими размерами инфузории.
Изучение морфологии. Тело трубача сильно сократимо, и его истинная форма в расправленном состоянии может быть видна только тогда, когда стеклышко с инфузориями некоторое время спокойно и трубачи имеют достаточное количество воды, чтобы расправиться.
В расправленном состоянии длина тела доходит до 1—2 мм. Наиболее узкий конец — задний, которым тело прикрепляется к субстрату и на котором могут для этого образоваться короткие псевдоподии. Кпереди тело постепенно расширяется и на переднем конце образует раструб, занятый перистомальным полем (рис. 84). S. coeruleus имеет свое
образную характерную окраску, зависящую от распределения в поверхностном слое цитоплазмы зерен пигмента стенторина. Общий цвет получается зеленоватосиневатый. Все тело трубача покрыто сплошь нежными ресничками, расположенными продольными рядами. На перистомаль-ном поле эти ряды проходят кольцами.
Цитоплазма у трубача имеет мелкопенистую структуру. В поверхностном ее слое дифференцируются сократимые и опорные элементы, сконцентрированные в особых продольных каналах. Придавливая живого трубача покровным стеклом, удается обнаружить эти каналы в виде просветов между пигментированными полосками, идущими параллельно рядам ресничек. Внутри удается обнаружить продольные сократимые ленты — мионемы (рис. 85). Последние обычно пробегают вдоль всего тела. На стороне же, где начинается ряд перистомальных мембранелл, заметна продольная зона, где мионемы сходятся под углом (рис. 86), вследствие чего
Рис. 84. Stentor coeruleus. Общий вид живого объекта (Х120) (из кн. Дофлейна): 1 — перистомальное поле, 2 — мембранеллы адоральной зоны, 3 — vestibulum, 4 — макронуклеус, 5 — микронуклеус, 6 — приводящие каналы сократительной вакуоли, 7 — резервуар сократительной
получается представление, как будто они ветвятся.
На перистомальном поле также должна быть отмечена система мионем, пробегающих
параллельно рядам ресничек. вакуоли
Перистомальное поле слегка
вогнуто и подразделяется на горизонтальный отдел, занимающий большее пространство, и на наклонный, меньший, преораль-ный отдел. Вокруг перистомального поля по самому краю располагаются одним рядом мембранеллы (адоральные). Каждая из них — высокая пластинка (рис. 87), склеенная из двух рядов ресничек. При этом высота краев каждой мембранеллы неодинакова. Наружный край значительно выше внутреннего. Получается общая форма трапеции (рис. 87) или даже треугольника. Ряд мембранелл располагается по спирали. Она начинается на периферии горизонтального отдела перистомального поля, обходит все поле вокруг по часовой стрелке и на
Рис. 85. Stentor coeruleus. Поверхность тела у придавленной живой инфузории (Х1700):
/ — пигментированные полоски, 2— каналы, 3 — мионемы
его преоральном участке уходит с края и спуска-ется к отверстию, ведущему в преддверие vesti-bulum) пищеварительной системы, где образует еще один маленький оборот. Начало спирали лежит значительно выше ее преорального участка, тело здесь выдается резко вперед в виде перистомального выступа. От последнего кзади по телу проходит вдоль легкая борозда (см. рис. 84).
Ротовое отверстие на дне преддверия ведет в короткую глотку. Пищевые вакуоли разбросаны в плазме. Пищей трубачу служат различные мелкие организмы, главным образом жгутиконосцы и мелкие инфузории. Выбрасывание непереваренных частичек производится в области сократительной вакуоли. Единственная сократительная вакуоль видна спереди — неподалеку от преддверия. Наполнение ее совершается посредством двух длинных приводящих каналов. Задний тянется почти вдоль всего тела, передний же полукругом идет вдоль края перистомального поля.
Ядерный аппарат у Stenor представлен
длинным четковидным макронуклеусом и многочисленными мелкими микронуклеусами (см. рис. 84). Отдельные части макронуклеуса имеют
Рис. 86. Stentor coeruleus. Расположение мионем (Х85) (из кн. Шуберта)
Рис. 87. Stentor. Строение и распо- Рис. 88. Stentor соег-ложение адоральных мембранелл uleus. Структура мак-(схематично) (из кн. Гелей): ронуклеуса (Х600)'
I — мембранеллы, 2 — край перистома, 3— (из KH. Дофлейна) система опорных фибрилл, связанных с основанием мембраиелл
грубозернистую структуру. Зерна сильно прокрашиваются и являются хроматиновыми. Между собой четки связаны тонкими перемычками гомогенного строения (рис. 88). Микронуклеусы в количестве свыше десяти обычно бывают приложены вплотную к фрагментам макронуклеуса. Каждый из них на препарате имеет темноокрашенный центр и широкий светлый ободок.
ОТРЯД HYPOTRICHA —БРЮХОРЕСНИЧНЫЕ
Stylonychia mytilus О. F. Miill.
Материал и методы изучения. Stylonychia mytilus из сем. Oxitrichidae, одна из наиболее крупных Hypotricha, живет в любом небольшом стоячем водоеме. В пробе, взятой из придонных слоев воды планктонным сачком, после недельного стояния без труда можно найти эту инфузорию.
Изучение ведут на живом материале, а также на тотальных препаратах, фиксированных сулемовыми или пикриновыми смесями. Окраска по Фёльгену, а также квасцовым кармином или гематоксилином. Для изучения цилиатуры хорошие результаты дает импрегнация серебром (с. 108).
Изучение морфологии. На сплющенном теле Stylonychia различают: расширенный, срезанный углом передний конец и закругленный задний (рис. 89), плоскую брюшную сторону, на которой открывается ротовое отверстие и на которой слева расположен перистом и главная масса ресничных образований, и наконец, спинную, слегка выпуклую. Длина тела колеблется между 100—350 мкм.
Прежде всего следует разобрать наиболее характерную для Hypotricha систему органоидов— ресничный аппарат. На спинной стороне неподвижно торчат редко расставленные, тонкие, короткие щетинки (рис. 90). Им условно придают осязательную функцию. На брюшной же стороне видны сложные ресничные образования — цирры (cir-
Рис. 89. Stylonychia mytilus. Общая организация, вид с брюшной стороны (Х450) (из кн. Ланга):
1 — вентральная передняя губа перистома, 2 — группа фронтальных (лобных) cirri, 3 — маргинальные cirri, 4 — спинные щетинки, 5 — пища, 6 — группа брюшных cirri, 7 — группа анальных cirri, 8 — каудальные cirri, 9 — макронуклеус, 10— микронуклеус, //—резервуар сократительной вакуоли, 12— правый край перистома, 13—прео-ральные реснички, 14 — перистомальное поле, /5— преоральная ундулирующая мембрана, 16 — приводящий канал сократительной вакуоли, 17 — мембраиеллы адоральной зоны
Рис. 90. Передвижение по субстрату Stylonychia mytilis (хЗОО) (из кн. Бючли):
1 — спинные щетинки, 2— резервуар сократительной вакуоли, 3 — лобные cirri, 4 — брюшные cirri, 5 — маргинальные cirri, 6 — анальные cirri, 7 — каудальные cirri, 8— приводящий канал сократительной вакуоли
ri), расположенные характерным образом в группы. Поверхность тела в промежутках между этими группами остается голой. Каждый цир-рус — это пальцевидный органоид с широким основанием, постепенно суживающийся и заканчивающийся заострением. При больших увеличениях может быть замечена его продольная штриховатость — указание на то, что он составлен из пучка ресничек, склеенных между собой. В некоторых случаях концы цирр размочаливаются, и тогда их ресничная природа становится совершенно очевидной.
У Stylonychia myiilus различают следующие категории брюшных цирр.
1. Лобные (фронтальные) в количестве восьми лежат справа от перистома и разбиваются на три категории по своим размерам. Наиболее крупные из них, грифелеобразные — три передних (см. рис. 89). Два других уступают передним по размерам и лежат ближе к перистому. Самые же тонкие последние три располагаются косым рядом ближе к правому краю тела.
2. Брюшные в количестве пяти занимают пространство позади перистома. Три из них группой сидят около самого перистома, две же отодвинуты назад (см. рис. 89). По размерам они более или менее одинаковы.
3. Анальные (трансверзальные) в числе пяти расположены на заднем конце брюшной стороны, три из них образуют косой ряд, две же более крупные отступают от этого ряда немного назад.
4. Каудальные — три, симметрично отходят от заднего конца тела и нередко бывают расщеплены на концах.
5. Краевые (маргинальные) располагаются двумя рядами на брюшной стороне вдоль правого и левого краев тела. Правый ряд тянется от заднего конца тела и заканчивается в области передних цирр фронтальной группы. Количество цирр здесь превышает пять десятков. На левой же стороне ряд короче и заканчивается, не доходя до уровня ротового отверстия, включает приблизительно половинное количество цирр по сравнению с правым рядом. В области каудальных цирр краевых нет. _
Функциональное назначение этих категорий цирр выявляется довольно хорошо, если наблюдать за Stylonychia в капле воды под микроскопом без покровного стекла. Тогда видно, что она главным образом ползает по различным частичкам в воде, подпираясь определенными группами цирр. Нормальное, спокойное передвижение осуществляется с помощью лобных и брюшных цирр и части анальных (рис. 90). Задние же два крупных анальных цирруса вступают в действие, когда Stylonychia совершает характерные для нее прыжки. Хвостовые и маргинальные цирры при этом субстрата не касаются. Зато они энергично работают, когда инфузория плавает.
Особой сложности достигает околоротовая система ресничных органоидов, составные части которой удается разобрать только на живом объекте.
Ротовое отверстие помещается на расстоянии несколько большем >/з длины тела от его переднего конца вблизи медианной линии. От ротового отверстия треугольником по левому краю тела располагается перистом. Его поверхность слегка вогнута. Наиболее мощно развитые ресничные элементы перистома образуют адоральную зону, проходящую по левому краю перистома (см. рис. 89) и огибающую передний конец тела, выходя на спинную сторону. С вентральной стороны пери
стом альное поле выдается вперед в виде особой губы (см. рис. 89, /). В состав адоральной зоны входят мощные треугольные мембраны.
С правой стороны перистом резко отграничивается от поверхности тела загибающимся внутрь перистомальным краем. С внутренней стороны к этому краю прикрепляются, во-первых, реснички прео-рального ряда (рис. 91) и, во-вторых, очень широкая преоральная же ундулирующая мембрана. Последняя прикрывает собой значительную часть перистома (см. рис. 89). В самой глубине перистома вдоль проходит внутренняя ундулирующая мембрана. Влево от нее видна еще одна более широкая— эндоральная мембрана. Наконец, косо по середине перистома проходит ряд эндоральных ресничек. Все эти образования своими задними концами сходятся к ротовому отверстию и входят внутрь глотки (рис. 91).
Вышеописанные составные части совместной работой загоняют пищу через ротовое отверстие в
Рис. 91. Stylonychia mytilus (из кн. Ланга). А—ресничный аппарат перистома с брюшной стороны (Х1000); Б — то же, на поперечном разрезе:
1 — правый край перистома. 2 — преоральная ундулирующая мембрана, 3— преоральные реснички, 4 — внутренняя ундулирующая мембрана, 5 — эндоральная ундулирующая мембрана, 6 — глотка, 7 — эндоральные реснички, 8 — адоральные мембранеллы, Р«-спиниые щетинки
глотку. Stylonychia — всеядное животное. Бактерии, водоросли жгутиконосцы, мелкие инфузории — все употребляется ею в качестве пищи. В плазме формируются пищевые вакуоли. Непереваренные остатки выбрасываются наружу через анальную пору, расположенную на спинной стороне тела, в задней его трети. Сократительная вакуоль одна, лежит слева на уровне ротового отверстия. Спереди к ней подходит приводящий канал. Опорожняется вакуоль на спинную сторону приблизительно через каждые 15—20—30 с. Макронуклеус двойной, обе его части связаны перемычкой (см. рис. 89). В ядре заметны довольно крупные хроматиновые гранулы и проходящая поперек каждой половинки неокрашивающаяся полоса — реорганизационная полоса, принимающая, как предполагают, какое-то участие в делении макронуклеуса, так как перед делением она смещается к концу каждой половины ядра. Два маленьких микронуклеуса прилегают к обеим половинкам макронуклеуса.
ПОДКЛАСС SUCTORIA —СОСУЩИЕ ИНФУЗОРИИ
Tocophrya quadripartita Clap, et Lachm.
Материал и методы изучения. Tocophrya quadripartita относится к сем. Acinetidae. Ведет сидячий образ жизни, прикрепляясь к различному субстрату с помощью ножки. Очень часто эта суктория садится на стебельки колониальных Peretricha, в част-
Рис. 92. Tocophrya quadripartita. А—общий вид инфузории сбоку (Х1000) (из кн. Бючли); Б — конец сосательных щупалец (X2000) (из кн. Ланга); В — инфузория сверху (Х1000) (ориг.):
1 — отверстие для выхода эмбриона, 2— сосательные щупальца, 3 — цитоплазматическое вздутие со Щупальцами, 4закладывающийся ресничный покров эмбриона, 5 — макрюнуклеус, 6*—стебелек, 7 — каналец внутри щупальца, 8 — пелликула щупальца, 9 — сократительная вакуоль
ности, Epistylis. Этим следует воспользоваться для получения материала. Колонии Epistylis plicatilis без труда удается находить на раковинках моллюсков Gastropoda, на подводных мелких предметах, веточках и т. д. в различных стоячих водоемах (лужах, заводях, прудах). Колонии Epistylis соскабливаются скальпелем или иглами в каплю воды на предметном стекле. Изучение ведут главным образом in vivo, но ядер-ный аппарат может быть разобран на тотальном препарате, окрашенном гематоксилином, — квасцовым кармином, или по методу Фёльгена.
Изучение морфологии. Тело Tocophrya постепенно суживается назад, в длину достигает 80—100 мкм и заканчивается стебельком (ножкой) более длинным, чем тело. Последнее четырехгранно в сечении и на переднем конце образует четыре вздутия с сидящими на них сосательными щупальцами (рис. 92). Цитоплазма обычно прозрачная с мелкими гранулами, в центре просвечивают ядро и сократительные вакуоли. Последних — две, чаще три, расположенных в передней части тела. Стебелек прикрепляется к субстрату расширенным основанием — базальным диском. В месте соединения ножки с телом видна ясная граница. Стебелек несократим и не способен к самостоятельным движениям, благодаря присутствию под пелликулой продольных эластичных поддерживающих фибрилл. Они хорошо видны в виде продольной штриховатости стебелька.
Сосательные щупальца сидят на каждом из четырех вздутий переднего конца в количестве больше десятка на каждом. Дистальный конец щупальца слегка расширен и представляет собой сосательное окончание. При больших увеличениях (с иммерсионным объективом) удается рассмотреть структуру щупалец: снаружи видна тонкая пелликула, утолщающаяся на дистальном конце щупальца и образующая вышеупомянутое сосательное окончание (рис. 92, Б). Под пелликулой виден слой цитоплазмы с канальцем внутри, наполненным водянистой жидкостью. Цитоплазма щупальца может выступать на конце в виде капли, вероятно клейкой, приклеивающейся к натыкающимся на щупальца инфузориям, жгутиконосцам и т. д. После приклеивания содержимое
Рис. 93. Tocophrya quadripartita. Последовательные стадии внутреннего почкования (Х800) (из кн. Бючли):
1 — отверстие для выхода эмбриона, 2—эмбрион, 3—сократительные вакуоли инфузории, 4 — макронуклеус, 5 — сократительные вакуоли почкн
Рис. 94. Tocophrya quadripartita. Свободные эмбрионы (Х100) (из кн. Филипьева)
добычи перекачивается по канальцу в плазму, где образуются пищевые вакуоли. Щупальца обладают способностью медленно удлиняться и укорачиваться. В спокойном состоянии они совершенно прямые. Когда же захватывается пища, то щупальца могут изгибаться в сторону добычи и приклеиваться к ней своими концами.
Т. quadripartita обладает вытянутым в длину ядром (рис. 92, А), которое расширяется спереди параллельно стенкам тела. На препаратах хорошо видна его зернистая структура. Небольшой микронуклеус прижимается вплотную к макронуклеусу и заметен только на окрашенных препаратах.
Развитие ресничного эмбриона. При наличии большого количества инфузорий обычно удается рассмотреть отдельные стадии внутреннего почкования. Почка — эмбрион формируется впереди от ядра. Ранее всего в плазме обособляется небольшая щелевидная полость, сообщающаяся с наружной средой посредством отверстия. Через него впоследствии эмбрион выплывет наружу. Щелевидный просвет в плазме отделяет в конце концов некоторый ее участок (рис. 93), на котором довольно рано формируется ресничный аппарат. В конце почкования эмбрион полностью отделяется от окружающей его плазмы и лежит поперек тела инфузории. В нем появляются сократительные вакуоли, и он может вращаться в своей плоскости. Вполне сформированный эмбрион имеет овальную форму. Плавает он благодаря работе ресничек, опоясывающих тело в 4—5 рядов ближе к переднему концу. На заднем конце эмбриона виден небольшой пучок ресничек (рис. 94).
Если попадутся стадии почкования на тотальных препаратах, то следует обратить внимание на отшнуровывание части от макронуклеуса материнского организма и перемещение ее в почку.'
Dendrocometes paradoxus Stein
Материал и методы изучения. Dendrocometes paradoxus (из сем. Dendrocometi-dae) паразитирует на жаберных листочках обыкновенного бокоплава (Gammarus pulex). Жаберные листочки легко отпрепаровываются у основания грудных ножек с помощью препаровальных игл. Инфузории, сидящие обычно вблизи краев листочка, хорошо заметны уже и при просмотре под лупой. Изучение материала ведут главным образом in vivo, хотя никакого затруднения не представляет изготовление тотального препарата из целого жаберного листочка с инфузориями, окрашенного гематоксилином или кармином после любой сулемовой фиксации.
Изучение морфологии. Тело паразита имеет форму полушара. Плоской стороной Dendrocometes прикрепляются к жаберному листочку. От тела под углом к поверхности отходят толстые отростки (руки), отдающие боковые ответвления с сосательными заостренными щупальцами. Количество рук варьирует, но чаще встречается четыре (рис. 95). Сосательные щупальца внутри имеют канальцы, по которым содержимое добычи перетекает в плазму инфузории (рис. 96, А). Можно специально в каплю воды с жаберными листочками прибавить густой взвеси (отцентрифугированной) с какими-нибудь мелкими инфузориями, хотя бы из навозной культуры. Тогда удается видеть захват инфузорий щупальцами (см. рис. 95) и наблюдать, как содержимое добычи перека-
Рис. 95. Dendrocometes paradoxus. Общий вид инфузории сверху (Х500) (из кн.
Ланга):
1 — инфузория, захваченная боковыми ответвлениями рук, 2 — рука, 3 — сократительная вакуоль, 4 — макронуклеус.
Рис. 96. Dendrocometes paradoxus. А — структура сосательных окончаний боковых ответвлений рук (Х2000) (из кн. Ланга); Б—ядерный аппарат (х800) (из кн. Пестеля):
1 — пелликула, 2 — каналец, 3 — цитоплазма, 4 — макронуклеус, 5 — микро^уклеусы
чивается в плазму Dendrocometes. Цитоплазма данной формы непрозрачна, переполнена темными гранулами. Единственная сократительная вакуоль лежит около пелликулы выпуклой стороны тела. Макронуклеус овальной формы с зернистой структурой можно хорошо рассмотреть только на окрашенном препарате. Микронуклеусы рассмотреть довольно трудно. Обычно их три (рис. 96, 5), располагаются они около макронуклеуса и по форме очень похожи на пищевые включения.
Тип Sporozoa —споровики
Изучение Sporozoa представляет большой интерес, так как позволяет познакомиться со сложными жизненными циклами простейших, включающими различные формы размножения. Предлагаемый ниже материал подобран так, чтобы в пределах каждого отряда познакомиться с одним представителем, цикл которого изучается по возможности полно. Среди грегарин изучается цикл Monocystis, среди кокци-дий — Eimeria. Кроме основного объекта более кратко рассмотрены и некоторые другие представители данного отряда. Наиболее подробно изучают Coccidiida и Haemosporidia, многие из них представляют большой практический интерес как возбудители заболеваний животных.
Изучение жизненных циклов Sporozoa в ряде случаев требует постановки специальных экспериментов для заражения хозяев. Ниже, по возможности полно, указывается методика и техника опытов. Постановка их представляет интерес не только потому, что это источник материала для изучения, но и потому, что прививает навыки эксперимен- . тальной работы.
Изучение жизненного цикла кокцидий проведено на одном виде — Eimeria magna.
В отношении Haemosporidia мы ограничимся рассмотрением кровяной части цикла возбудителей малярии. Хотя заболевание это в Советском Союзе в основном ликвидировано, но во многих медицинских и биологических учреждениях имеются препараты (кровяные мазки), которые могут быть использованы для изучения.
КЛАСС GREGARINIDA — ГРЕГАРИНЫ
ОТРЯД EUGREGARINARIA
Monocystis sp.
Материал и методы изучения. Род Monocystis принадлежит к подотр. Acephalina сем. Monocystidae. Acephalina характеризуются отсутствием расчленения тела на эпи-, прото- и дейтомерит.
Monocystis паразитируют в семенных мешках разных видов дождевых червей. К роду Monocystis относится большое количество близких и трудно различимых видов. Например, Берлин (1924), исследовавший фауну Monocystidae Швеции, нашел 27 различных видов. Очень часто в одном и том же экземпляре хозяина паразитируют несколько разных видов грегарин. В СССР фауна Monocystidae специально не исследо
валась, но естественно предполагать, что разнообразие видов у нас не меньше, а вероятно больше, чем в Швеции. Цикл развития протекает, однако, у всех более или менее одинаково, что позволяет говорить о всем роде вместе, лишь попутно указав на некоторые видовые отличия.
Для получения материала можно взять как обычного дождевого червя Lumbricus terrestis, так и дождевых червей других видов.
В семенных мешках разные стадии жизненного цикла грегарин встречаются очень часто. Процент заражения нередко достигает 100. У живого или усыпленного слабым спиртом дождевого червя вскрывают передний конец (см. вскрытие дождевого червя), причем обнажаются семенные мешки. Острыми маленькими ножницами отрезают небольшой кусочек семенного мешка, переносят в каплю воды или лучше физиологического раствора на предметное стекло, придавливают покровным стеклом и исследуют под микроскопом. В случае сильного заражения грегарины видны и простым глазом, так как в толще семенного мешка просвечивают многочисленные белые очень мелкие точки. Исследование in vivo позволяет познакомиться с основными стадиями развития Monocystis. Для более детального изучения внутренних процессов и, в частности, ядерных изменений следует изготовить препараты — мазки и разрезы.
При изготовлении мазков пинцетом берут небольшой кусочек семенного мешка, сильно зараженного грегаринами, и равномерно размазывают по покровному стеклу, после чего фиксируют жидкостью Шаудина. Для изготовления срезов небольшие кусочки фиксируют также по Шаудину. Толщина срезов не больше 5 мкм. Как мазки, так и срезы окрашивают гематоксилином Бёмера или же железистым гематоксилином с подкраской эозином. Для обнаружения гликогена следует использовать раствор Люголя (J+KJ).
Рис. 97. Часть среза через семенной мешок дождевого червя, зараженного разными видами Monocystis (Х65) (из кн. Веньона):
7— группа семенных клеток червя, 2 — циста с сизигием, в обоих грегаринах началось деление ядер, 3— циста с ооцистами, 4 — цисты с гаметами, 5 — ооцисты мелкого вида Monocystis
Рис. 98. Разные виды Monocystis (гамонты). А—М. magna (Х80) (из кн. Веньона); Б—М. agilis (Х140); В — М. caudata (Х480) (из кн. Берлина):
1 — ядро
Рис. 99. Monocystis sp. Гамонт, окруженный семенными клетками дождевого червя (из кн. Дофлейна)
Изучение препарата. При изучении живого материала, мазков и срезов через семенные мешки прежде всего бросается в глаза большое количество семенных клеток червя. Частью это зрелые сперматозоиды, частью половые клетки, находящиеся на разных стадиях созревания (рис. 97) (сперматогонии, сперматоциты). Последние собраны группами вокруг бластофоров, представляющих собой скопление клеток, имеющих опорное и питательное значение. Между половыми элементами червя разбросаны различные стадии развития грегарин (часто одновременно присутствует несколько видов).
Грегарины попадают в семенные мешки в стадии спорозоитов, которые выходят из случайно заглатываемых червем ооцист. Спорозоиты проникают в семенные мешки и внедряются в бластофоры, где и
начинается их рост, в результате которого они превращаются в гамонтов. Различные стадии роста так же, как взрослых гамонтов, следует отыскать на препаратах.
Форма тела и размеры выросших гамонтов у разных видов Monocystis различны. На рис. 98 изображены некоторые наиболее обычные в дождевом черве виды (М. agilis, М. caudata, М. magna)1. Размеры Monocystis разных видов также сильно варьируют. Длина выросшего гамонта М. caudata около 70 мкм, М. agilis 300—500 мкм, М. magna до 1 мм. На переднем конце у некоторых видов имеется небольшой хоботообразный вырост (М. agilis). Нередко гамонты Monocystis оказываются окруженными как бы длинными немерцающими ресничками (рис. 98, В; 99). На самом деле это не ресницы, а сперматозоиды хозяина. Указанные соотношения получаются потому, что грегарины внедряются в бластофор, вокруг которого развиваются семенные клетки. По мере роста грегарины и вытеснения ткани бластофора
сперматозоиды оказываются прилежащими непосредственно к телу грегарины1 2. В теле грегарины следует рассмотреть тонкий слой прозрачной эктоплазмы и гораздо более темную гранулированную эндоплазму. В последней при изучении материала in vivo просвечивает пузыревидное ядро с нуклеолой. При окраске живых грегарин раствором Люголя эндоплазма принимает интенсивный красно-коричневый цвет. Это зависит от присутствия в ней большого количества гликогена в форме зерен, для которого окраска по Люголю представляет одну из типичнейших реакций. Гамонты Monocystidae обладают некоторой подвижностью. Они медленно как бы скользят между тканями. Некоторые (М. magna) могут изгибаться и менять форму тела. По-видимо
1 Некоторые авторы рассматривают М. magna как отдельный род Nematocystis, основанием для чего служит главным образом нематодообразная форма тела гамонта.
2 Нужно, однако, иметь в виду, что существуют некоторые виды Monocystidae (род Rhynchocystis), у которых образуются настоящие цитоплазматические волосковидные выросты, не имеющие ничего общего со сперматозоидами червя.
му, у Monocystidae указанные формы движения зависят от наличия в эктоплазме сократительных волоконец (мионем).
Кроме самих гамонтов как на окрашенных препаратах, так и in vivo следует отыскать различные стадии их полового размножения и спорогонии. Половой процесс начинается с того, что две грегарины тесно сближаются друг с другом (конъюгируют) и одеваются общей оболочкой (рис. 100, Б), образуя таким путем сизигий. Цитоплазма обеих входящих в состав сизигия грегарин не сливается и граница между ними сохраняется.
В обеих грегаринах, заключенных в цисту, пузыревидное ядро разрушается и за счет хроматина его образуется первое веретено ка-риокинетического деления (рис. 100, В). Все эти ядерные изменения
Рис. 100. Monocystis magna (по Кэно из кн. Дофлейна). А — соединение двух грегарин и сизигий; Б — сизигий в цисте, ядра еще не приступили к делению; В — первое деление ядра грегарин в сизигии; Г — дальнейшие деления ядер, ведущие к формированию гамет:
2— ядро, 2— клетки эпителия семенного мешка, 3 — веретена деления
возможно рассмотреть лишь на срезах. Вслед за первым делением быстро следуют другие, в результате чего в цитоплазме обеих конъюгирующих грегарин образуется много мелких ядер. Вокруг каждого из них обособляется небольшой участок цитоплазмы. Получается
множество округлых мелких клеток, которые представляют собой гаметы. С образованием гамет гра-
Рис. 101. Monocystis magna (по Кэно из кн. Дофлейна). Копуляция гамет и образование ооцист. <4 — гаметы; Б — их копуляция; В — зигота; Г— вытягивание зиготы; Д — образование оболочки, в образующейся ооцисте 8 ядер; Е — ооциста со спорозоитами
ница между обеими грегаринами нарушается. Гаметы занимают по отношению ко всей протоплазматической массе преимущественно периферическое положение.
Далеко не вся цитоплазма идет на образование половых клеток. Большая часть ее остается в виде большого остаточного тела. Гаметы сближаются попарно и сливаются (рис. 101). Копуляция всегда осуществляется между гаметами, принадлежащими разным особям. Некоторые виды Monocystis характеризуются изогамией, т. е. размеры всех гамет одинаковы. У других описана анизогамия: обе копулирующие гаметы несколько разнятся по величине. Зиготы тотчас же после своего образования имеют сферическую форму (рис. 101, В); они отличаются от гамет большей величиной.
Дальнейшие процессы приводят к превращению каждой зиготы в ооцисту1. Происходит вытягивание зиготы в длину и образование вокруг нее оболочки (рис. 101, Д, Е). Получается характерная для Monocystidae веретеновидная форма ооцисты, заостренная на обоих вытянутых концах. Ядро зиготы трижды делится. Внутри оболочки ооцисты образуется 8 ядер. Вокруг каждого из них обособляется цитоплазма и формируются 8 червеобразных спорозоитов. На этом развитие ооцист заканчивается. Первоначально все они лежат под общей оболочкой цисты. Со временем последняя разрушается и ооцисты попадают в полость семенного мешка. Размеры ооцист у разных видов Monocystis различны. Наиболее крупными ооцистами обладают М. magna.
Все указанные выше стадии жизненного цикла Monocystis могут быть обнаружены на препаратах. Однако для того чтобы рассмотреть их, нужен очень большой материал. Чаще других попадаются взрослые гамонты, сизигии в начале гаметогонии, цисты с гаметами и цисты со сформированными ооцистами. Неодинаковая частота нахождений отдельных стадий зависит от их различной продолжительности.
Грегарины из подотряда Cephalina
Материал и методы изучения. Грегарины, относящиеся к Cephalina и характеризующиеся расчленением тела на эпи-, прото- и дейтомерит, паразитируют в кишечнике различных беспозвоночных животных. Особенно многочисленны они в членистоногих, в частности в насекомых. Материал добывают путем вскрытия животных-хозяев и изучают in vivo в капле воды или физиологического раствора NaCl. Кроме того, изготовляют тотальные препараты (мазки), фиксируемые жидкостью Шаудина н окрашенные гематоксилином Бёмера. Определение грегарин представляет затруднение, так как соответствующих определителей на русском языке пока не существует. Для этого можно использовать монографию Ватсон-Камм, 1922 (см. список литературы).
Здесь приведено описание трех родов грегарин, довольно часто встречающихся, изучение которых дает достаточно полное представление об организации Cephalina. Цикл развития не рассматривается, так как он в основном совпадает с Monocystidae, отмечаются только некоторые особенности в строении цист.
1 Ооцисты грегарин часто называют спорами. Эта терминология, однако, не точна. «Споры» грегарин полностью соответствуют ооцистам кокцидий, так как и те и другие представляют собой снабженную оболочкой зиготу. Споры у кокцидий формируются внутри ооцисты, у грегарин же образований, гомологичных спорам кокцидий, не выражено и формирование спорозоитов происходит непосредственно в ооцисте.
Достигают длины
Рис. 102. Gregarina blattarum (Х300). Два гамонта, соединенные в сизигий (из кн. Дофлейна): 1 — протомерит, 8 — дейтоме-рит, 3 — ядро
Изучение морфологии Gregarina Dufour (Clepsidrina Hammersch-midt). Представители этого рода, относящиеся к сем. Gregarinidae Labbe, обычны в кишечнике черного таракана, пруссака и в личинках жука Tenebrio molitor (мучных червях). В тараканах паразитирует Gr. blattarum Siebold (рис. 102), в Tenebrio — три вида того же рода (Gr. cuneata Stein, Gr. polymorpha Stein и Gr. steini Berndt.) (рис. 103, A—Б). Кроме того, в «мучных червях» встречаются грегарины из сем. Actinocephalidae — Steinina1 ovalis Leger et Dubosque (рис. 103, Г).
Грегарины, живущие в полости кишечника, почти всегда соединены попарно (см. рис. 102), образуя сизигий. Это соединение, совершающееся здесь очень рано, связано с половым процессом. Сизигии наиболее обычны для Tenebrio molitor Gregarina cuneata. ~ 350 мкм. В дальнейшем каждый сизигий инцис-тируется. Передняя и задняя грегарины, входящие в состав сизигия, несколько отличаются друг от друга морфологически и соответственно получают название примята и сателлита. Каждая из соединенных попарно грегарин обладает протомеритом и дейтомеритом. Протомерит сателлита прикрепляется к дейтомериту примита. В дейтомерите расположено крупное пузыревидное ядро с кариозомом. Эпимерит у грегарин, находящихся в просвете кишечника, не выражен. При большом увеличении ясно видно разделение цитоплазмы на светлую эктоплазму и гораздо более темную эндоплазму. Снаружи тело грегарины покрыто довольно толстой пелликулой с продольными бороздками. За ней идет тонкий слизистый слой и светлая зона эктоплазмы (рис. 104).
На живом материале и тотальных препаратах слизистый слой виден плохо. Граница между прото- и дейтомеритом образована эктоплазмой. Эндоплазма зернистая. В ней присутствует в большом количестве гликоген, который легко обнаружить при окраске иодом по Люго-лю. При изучении живого материала нередко пелликула отстает от протоплазматической массы на значительное расстояние.
Цикл развития Gregarina протекает сходно с Monocystis. Интересно строение цист. Они (рис. 105) обладают длинными спородуктами, служащими для выведения ооцист из полости цисты. Цисты бочонковидной формы, выходя из спородуктов, образуют характерные цепочки.
! Род Steinina в отличие от рода Gregarina характеризуется наличием подвижного пальцевидного эпимерита.
Рис. 104. Gregarina munieri. А — при малом увеличении в капле туши, видна выделенная на заднем конце слизь; Б — детали строения цитоплазмы (из кн. Шевякова):
1 — пелликула, 2 — слизистый слой, 3 — эктоплаз-ма, 4 — граница между прото- и дейтомеритом, 5 — мионемы, 6 — эндоплазма, забитая зернами парагликогена
Б В
Рис. 103. Грегарины из кишечника «мучных червей» (из кн. Ватсон). А — Gregarina steini; Б — Gregarina polymorpha; В — Gregarina steini; Г — Steinina avails, гамонт и его передний конец
Рис. 105. Gregarina cuneata — циста с ооцистами и со споропродуктами, из которых выводятся зрелые ооцисты, лежащие цепочкой (из кн. Кушакевича)
Gregarina представляют удобный объект для изучения движения. При наблюдении живых грегарин под микроскопом видно, что они медленно передвигаются в поле зрения, движение их носит характер равномерного скольжения, не сопровождающегося изменением формы тела. Если поместить грегарин в каплю мелко растертой в воде туши, то по мере движения животного за ним остается светлый след (см. рис. 104,А). Шевяков показал, что
этот след — не что иное, как выделяющаяся на заднем конце тела грегарины слизь. Последняя выделяется отдельными струйками через тонкие поры пелликулы. Частички туши прилипают к слизи. Самый механизм движения объясняется по-разному.
Шевяков предполагал, что выделяющаяся слизь — это как бы стебелек, при нарастании которого происходят пассивные движения самого тела грегарины. Однако за последние годы взгляды на механизм скользящего движения грегарин совершенно изменились. Исследования, проведенные с электронным сканирующим микроскопом, показали, что пелликула грегарин обладает системой продольно идущих по телу гребней. Эти гребни совершают колебательные (ундулирующие) движения, что и служит причиной скользящего поступательного движения грегарины. Вопрос требует еще дальнейших исследований, ибо механизм движений складок пелликулы остается нераскрытым.
Hoplorhynchus Carus относится к сем. Acti-nocephalidae. Один из видов этого рода (И. oli-gacanthus Schneider) нередко встречается в кишечнике как личинок, так и имаго различных стрекоз. Организация взрослых грегарин (гамонтов) типична для Cephalina. Размеры Н. oli-gacanthus довольно велики: они достигают длины 600 мкм, ширины 70 мкм. Отчетливо выражены ее три отдела тела: эпи-, прото- и дейто-мерит (рис. 106, Б). Эпимерит несет крону коротких, загнутых назад крючков. Протомерит конической формы, отделен перетяжкой от дей-томерита. В передней части последнего расположено пузыревидное ядро. Эндоплазма, как и у других грегарин, богата гликогеном.
Sciadophora phalangii Leger (сем. Actino-cephalidae) часто встречается в кишечнике сенокосцев (из родов Phalangium, Opilio). Это одна из самых крупных грегарин, длина ее достигает 2,5 мм (рис. 106, А). Небольшойэпимеритимеет
Рис. 106. Грегарины. А — Sciadophora phalangii (Х40) (из кн. Шнейдера); Б — Hoplorhynchus oligacanthus (Х200) (ориг.);
1—эпимерит, 2 —• протомерит, 3 ~ дейтомерит, 4 — ядро, 5 — грану* лы парагликогена
А
форму конического бугорка. Протомерит расширен, кутикула его несет многочисленные ребрышки. На заднем краю протомерита они продолжаются назад в виде коротких крючьев. Дейтомерит расширен в передней своей части, назад равномерно утончается. Задний конец заострен. Ядро помещается в передней части дейтомерита.
Если вскрытие сенокосцев производится осенью, то нередко удается обнаружить крупные цисты Sciadophora, находящиеся на разных стадиях развития, вплоть до образования ооцист. Спородукты у цист отсутствуют.
КЛАСС COCCIDIOMORPHA — КОКЦИДИЕОБРАЗНЫЕ
ОТРЯД COCCIDIIDA—КОКЦИДИИ
Eimeria magna Perard 1
Эндогенная часть жизненного цикла
Материал и методы изучения. В кишечпике кролика встречается несколько видов рода Eimeria. Наиболее обычны Е. magna, Е. intestinalis, Е. perforans, Е. media-, кроме того, Е. stiedae поражает печень.
Наличие паразита в кишечнике устанавливается путем исследования под микроскопом кала на присутствие ооцист. По ооцистам же ведется и определение видов Eimeria. Для этого поступают одним из следующих двух способов. Берут небольшой (4—5 мм), кусочек кала, растирают его с каплей воды на предметном стекле и исследуют под микроскопом. Зрелые ооцисты обладают толстой оболочкой и четырьмя спорами, но в свежем кале в ооцистах виден лишь протоплазматический шар, так как процесс спорогонии еще не закончен. Второй способ сводится к предварительному обогащению пробы ооцистами. Для этого кал растирают сначала с небольшим количеством насыщенного раствора поваренной соли, доливают затем большим количеством раствора, взбалтывают и дают отстояться в течение нескольких часов в небольшой пробирке. Объем осадка кала на дне ее должен составлять приблизительно Vs—V4 всего объема жидкости. После этого с поверхности жидкости при помощи петли из железной проволоки диаметром около 0,5 см берут каплю жидкости и исследуют под микроскопом. Ооцнсты, если они имеются в кале, всплывают наверх, и таким путем их легко обнаружить даже при относительно малом заражении кролика.
Необходимо заметить, что совершенно свободных от кокцидий кроликов почти не встречается. У взрослых животных число ооцист обычно бывает очень невелико, и для исследования эндогенной части цикла они не годятся.
Сильнее зараженными оказываются молодые кролики в возрасте 1—2 месяцев. Если найдено массовое заражение кролика, то его можно использовать для исследования (см. ниже).
Более богатый и, главное, однородный материал удается получить при экспериментальном заражении молодых животных. Для этого можно предположить следующую методику. Молодых кроликов в возрасте 10—12 дней отнимают от матери и содержат отдельно в особом помешении в продезинфицированной предварительно клетке. Особенно удобны для этого железные клетки, которые можно прокалить при помощи паяльной лампы. Кролика кормят молоком трижды в день из маленькой соски. Выкармливание их не представляет большого труда. Следует соблюдать особую осторожность (мытье рук, халат, стерилизация посуды), чтобы не заразить крольчат кок-цидиями раньше времени. Чтобы кролики не страдали от холода, следует сделать им подстилку из стерилизованной ваты.
1 Все последующее изложение жизненного цикла кокцидий дается на основании монографии Е. М. Хейсина «Кокцидни кишечника кролика». Уч. зап. Ленингр. пед. ин-та им. Герцена, т. 51, 1947.
Для заражения ооцистами Е. magna (или другим видом кокцидий) берут молодых кроликов в возрасте 18—22 дней. Предварительно, путем исследования кала, находят кролика, выделяющего ооцисты. Желательно найти такого кролика, который выделял бы ооцисты только Е. magna, что встречается довольно часто. Производят обогащение указанным выше методом с насыщенным раствором NaCl. Переносят каплю с ооцистами на предметное стекло и приблизительно подсчитывают их количество. Чтобы получить хороший результат, следует взять 1—2 тыс. ооцист (разумеется, никакой особой точности при подсчете не требуется). Каплю раствора NaCl с ооцистами с предметного стекла втягивают в пипетку и вносят в ротовую полость заражаемого кролика. Ему открывают рот руками и капают из пипетки на язык.
Выделение ооцист у зараженного кролика начнется через 8 суток (196—210 ч), в течение которых совершается эндогенный цикл (шизогония, образование гамет, оплодотворение). Желательно заразить не одного, а 3—4 кроликов.
Чтобы правильно выбрать момент для вскрытия зараженных животных и фиксации материала, необходимо учесть следующие сроки отдельных моментов жизненного цикла Е. magna (по Хейсину).
После заражения ооцистами (при отсутствии повторных инвазий) в кишечнике кролика паразит проделывает пять агамных поколений (т. е. 5 раз происходит шизогония). Начиная с третьего агамного поколения параллельно с бесполым размножением происходит и половой процесс, приводящий к образованию ооцист. Мерозоиты пятого агамного поколения дают начало исключительно гаметам.
После этого кролик освобождается от паразита, если не последует повторного заражения ооцистами per os. Более точно (в часах) продолжительность отдельных стадий выражается следующими цифрами. Первая шизогония заканчивается через 80— 96 ч после заражения, вторая—110—132, третья— 135—158, четвертая— 150—165, пятая— 175—208 ч. Появление первых гамет имеет место через 148—151 ч. Первые сформировавшиеся ооцисты появляются в кале через 180—186 ч. Необходимо отметить, что первые две агамные генерации протекают синхронно и все особи паразита находятся на одной и той же стадии, начиная же с третьей генерации, строгая синхроничность нарушается, что позволяет одновременно находить разные стадии жизненного цикла.
Для изучения эндогенной части жизненного цикла Eimeria зараженного кокци-диями кролика убивают (хлороформом, эфиром) и вскрывают. Е. magna локализуется в нижней части тонкой кишки на протяжении около 60 см от места ее впадения в толстые кишки. В части кишки, прилежащей к желудку, Е. magna никогда не встречается.
Маленькие участки кишки взрезают вдоль. При сильном заражении простым глазом ясно видно поражение кишечника, которое выражается в набухании слизистой и в красноватом оттенке его внутренней стенки. Для изучения паразита in vivo скальпелем производят соскоб, который рассматривают при разбавлении физиологическим раствором с иммерсией. При наличии достаточно сильного заражения с внутренней поверхности кишечника делают мазок на покровном стекле, фиксируют жидкостью Шаудина и окрашивают железным гематоксилином. Небольшие кусочки зараженного участка (около 1—2 см) фиксируют жидкостью Ценкера с уксусной кислотой. Срок фиксации кишки около 2 ч. Далее следует по обычному методу заливка в парафин, изготовление срезов (толщина 5—10 мкм) и окраска их железным гематоксилином с подкраской эозином или лихтгрюном.
Если имеется несколько кроликов, то можно рекомендовать следующие сроки вскрытия. Первое вскрытие производят через 120 ч после заражения. На препаратах— только взрослые шизонты и мерозоиты. Второе—через 144—145 ч. На препаратах— разные стадии шизогонии (нарушение синхроничности). Третье вскрытие — через 175—180 ч. На препаратах — гаметы и разные стадии формирования ооцист. В случае если можно вскрыть лишь одного кролика, то рациональнее это сделать через 150—160 ч после заражения, так как здесь — наибольшее богатство стадий.
В тех случаях, когда заражение кроликов произведено ооцистами не Е. magna, а других видов, техника работы остается той же. Однако при вскрытии нужно иметь в виду, что локализация паразитов в кишечнике будет иная. Е. perforans локализована в верхней части тонких кишок. Е. media главным образом в двенадцатиперстной кишке и ниже. Наконец, Е. stiedae поражает печень, где она образует характерные мелкие узелки. При фиксировании материала их и следует брать, так как они представляют собой места скопления кокцидий.
Изучение срезов, мазков и живого материала. Шизонтам первого
агамного поколения дают начало спорозоиты, выходящие в кишечнике из заглоченных ооцист. Все последующие поколения шизонтов так
же, как и гаметоциты, развиваются из мерозоитов предыдущего агамного поколения. Первые стадии развития шизонта протекают внутриклеточно в эпителиальных клетках ворсинок кишечника. По мере
Рис. 107. Eimeria magna (Х350) — ворсинка кишечника кролика с шизонтами в момент их распадения на мерозоиты (по Хейсину):
/—клетки эпителия, 2 — шизогония
разрушения клетки хозяина шизонт переходит в подлежащую соединительную ткань, где и заканчивается агамное размножение (рис. 107). На рис. 108 изображены последовательные стадии роста и развития шизонта. На самых ранних стадиях'он является одноядерным и имеет правильную сферическую форму. Деление ядра начинается на ранних стадиях роста (рис. 108, Б). Можно последовательно отыскать на срезах 2, 4, 8-ядерных шизонтов и т. д. Сами ядра обладают довольно крупным кариозомом. Картину митозов почти никогда наблюдать не удается. По мере роста шизонт постепенно переходит в соединительную ткань стенки кишки.
Процесс шизогонии завершается формированием мерозоитов (рис. 108, Д). Число последних варьирует в довольно широких пределах. Каждый шизонт дает начало от 8 до 60 мерозои-там по числу образовавшихся в нем во время роста ядер. Почти вся цитоплазма шизонта используется на образование мерозоитов, иногда часть ее остается в виде небольшого остаточного тела. Мерозоиты (рис. 109), особенно в тех случаях, когда их не очень много, располагаются друг около друга наподобие долек апельсина (рис. 108, Д). Они имеют веретеновидную форму (длина 8 мкм, ширина 2—3 мкм) и одно ядро. Изредка встречаются мерозоиты с двумя, тремя и даже большим числом ядер.
Строение отдельных мерозоитов также хорошо удается рассмотреть на мазках. Кроме ядра при очень большом увеличении в цитоплазме видна мелкая зернистость, располагающаяся с одной стороны ядра. Один конец мерозоита (передний) заострен и несет образование, резко красящееся гематоксилином и на-
Рис. 108. Eimeria magna (хЮОО)—рост шизонта и шизогония (по Хейсииу). А— молодой шизонт, ядро еще не приступило к делению; Б—Г—увеличение числа ядер путем деления и рост шизонта; Д — распад шизонта на мерозоиты, в центре видно остаточное тело
поминающее перфораторий сперматозоида многоклеточных (рис. 109).
Начиная со 148 ч, наряду с шизогонией можно наблюдать и различные стадии образования гамет. Самые ранние стадии развития макрогамет (макрогаметоциты) трудно отличимы от молодых шизонтов. На более поздних стадиях макрогаметы легко отличаются от шизонтов прежде всего тем, что ядро их не делится (рис. НО). Объем цитоплазмы значительно увеличивается, и в ней накапливается большое количество гранул. Из эпительных клеток макрогаметы по мере роста переходят в подлежащую соединительную ткань. Форма их сферическая, диаметр около 20 мкм. Выросшие макрогаметы обладают пузыревидным ядром с крупным кариозомом. Очень часто периферическая часть
к следующему, (рис. 111). Пласти-
Рис. 109. Eimeria magna (Х1500) — мерозоиты (по Хейсину)
не окрашивается, и в таких случаях отчетливо виден один лишь кариозом. Среди многочисленных цитоплазматических гранул макрогаметы, достигающих размера 1 мкм и больше, различают более темноокраши-вающиеся хроматоидные и более светлые пластиноидные гранулы или стеклообразующие тельца.
Дальнейшие изменения макрогаметы сводятся Форма клетки из сферической становится овальной ноидные гранулы приближаются к периферии и располагаются непосредственно в один слой под поверхностью. За их счет образуется оболочка, поэтому сами гранулы при этом исчезают. На одном из полюсов макрогаметы в оболочке остается отверстие (микропиле), служащее, вероятно, для оплодотворения. Самый процесс оплодотворения наблюдать не удается. После оплодотворения формируется вторая (внутренняя) оболочка, микропиле закрывается особой слизистой пробкой и зигота попадает в просвет кишечника. Обладающая двумя оболочками зигота кокцидий получает название ооцисты. Ее дальнейшее развитие осуществляется лишь во внешней среде. В кишечнике при отсутствии кислорода ооцисты Eimeria спорулировать не могут.
• При развитии микрогаметоцита, дающего начало микрогаметам, деление ядер начинается на
Рис. ПО. Eimeria magna (Х35О)~ различные стадии эндогенной части цикла в ворсинке кишечника кролика (по Хейсину):
1— эпителий, 2—макрогаметы, 3 — микрогаметоцит с микрогаметами, 4 — шизонт в начале роста, 5—мерозоиты, 6 — шизонт в конце роста с многочисленными ядрами
самых ранних стадиях роста. Оно совершается гораздо быстрее и чаще, чем при шизогонии. Параллельно с делением ядер осуществляется рост микрогаметоцита (рис. 112). Он достигает размеров, превышающих диаметр макрогаметы (см. рис. ПО). В цитоплазме располагаются многочисленные мелкие (в количестве нескольких сот), занимающие к концу роста преимущественно периферическое положение. Микрогаметы образуются путем вытягивания отдельных ядер. Тело их состоит из ядерного вещества. На переднем конце имеется два жгута (рис. 113). Строение микрогамет лучше всего изучать на мазках. Большая часть цитоплазмы микрогаметоцита не идет на образование гамет и остается в виде большого остаточного тела. Размеры микрогамет не велики. Длина их равняется 3—4 мкм. Длина жгутов гамет 5— 8 мкм.
Экзогенная часть жизненного цикла (развитие ооцисты)
Материал и. методы изучения. Ооцисты поступают из кишечника наружу вместе с калом. Процесс споруляции изучают в живом виде. Изготовление препаратов невозможно вследствие полной непроницаемости оболочек ооцист для красителей. Обычно кал с ооцистами помещают в 2%-ный К2СГ2О7. Последний не препятствует споруляции, так как не проникает через оболочки. Подавляя развитие бактерий, двухромовокислый калий делает более благоприятным снабжение ооцист кислородом. Свободный доступ кислорода— необходимое условие их развития. При 18°С продолжительность споруляции 70—75 ч. Необходимо иметь в виду, что развитие отдельных ооцист протекает ие вполне синхронно.
Изучение живого материала. Только что вышедшие из кишечника ооцисты имеют овальную форму (рис. 114). Цитоплазматическое содержимое их отделено от оболочки и в форме шара занимает центральную часть ооцисты Процесс споруляции начинается с того, что многочисленные сильно светопреломляющие гранулы концентрируются в средней части цитоплазматического шара. Эти гранулы входят в состав остаточного тела. На самом плазматическом шаре образуются четыре
1 Изредка попадаются ооцисты, в которых цитоплазма не отделена от оболочек. Такие ооцисты, по-видимому, не способны к дальнейшему развитию.
Рис. 111. Eimeria magna (X1000)—развитие макрогамет (по Хейсину). Д — молодой макрогаметоцит; Б — Д— последовательные стадии роста и формирования макрогаметы
Рис. 112. Eimeria magna (Х1000)—развитие микрогамет (по Хейсину). А — молодой микрогаметоцит с неразделившимся ядром; Б — Г — стадии роста микрогаметоцита, сопровождающиеся делением ядер; Д — формирование микрогамет, большая часть протоплазмы остается в виде остаточного тела
Рис. 113. Eimeria magna (X1700) — микрогаметы, каждая с двумя жгутиками (по Хейсину)
вздутия, отделяющиеся от остаточного тела и представляющие собой споробласты. Далее следует «стадия пирамид» (48 ч после начала споруляции при 18—20° С). Дистальная часть споробластов вытягивается, заостряется и доходит до оболочки; основание же, прилежащее к остаточному телу, остается широким. На остром конце каждой йирамиды располагается сильно преломляющее свет зернышко (Шнейдеровское тельце).
Споробласты после стадии пирамид вновь округляются и одеваются тонкой оболочкой с утолщением на одном полюсе (55—65 ч). Таким путем споробласты превращаются в споры. Внут
ри них происходит разделение протоплазмы на два спорозоита. При этом внутри каждой споры, кроме спорозоитов, остается небольшое остаточное тело. В каждом спорозоите обособляется светопреломляющее полярное тельце. Этим заканчивается процесс споруляции.
Размеры ооцист Е. magna варьируют в величине. Длина их 25— 40 мкм, ширина 18—30 мкм. Средняя величина длины 35,0 мкм, ширины 23,0 мкм. Диаметр остаточного тела 6,5—9,0 мкм.
Рис. 114. Eimeria magna (Х1000) —последовательные стадии споруляции ооцисты (по Хейсину). А— только что вышедшая из кишечника ооциста, цитоплазма в виде шара; Б — концентрация гранул в центре; В — Д — формирование «пирамид»; Е — округление споробластов; Ж — К — преврашение споробластов в споры с двумя спорозоитами в каждой. Ясно видно сферическое остаточное тело
Так как изучение споруляции имеет место на живом материале, деления ядер наблюдать не удается.
Ооцисты других видов кокцидий кролика. Наряду с Eimeria magna в кале кролика часто попадаются и другие виды кокцидий. Из них наиболее обычны Е. perforans, Е. media и Е. stiedae.
Рис. 115. Зрелые ооцисты трех видов кокцидий кролика (X1000). А — Eimeria stiedae; Б —
Е. media; В — Е. perforans
На рис. 115 при одинако-
вом увеличении изображены ооцисты указанных видов. Основные различия их сводятся
к следующему. Ооцисты
Е. perforans имеют овальную форму, микропиле плохо видно, оболочка в большинстве случаев бесцветная. От других видов Е. perforans отли-
чается наименьшей величиной ооцист (длина в среднем 25 мкм, ширина 14 мкм). При споруляции кроме четырех спор остается небольшое остаточное тело (2,5—4 мкм).
Ооцисты Е. media светло-бурого цвета с ясно выраженным микропиле. Размеры несколько крупнее Е. perforans (длина 29 мкм, ширина 17 мкм). При споруляции остается остаточное тело.
Ооцисты Е. stiedae окрашены в бурый цвет. Микропиле слабо заметно. Размеры ооцист наиболее крупные (длина 36,5 мкм, ширина 20,4 мкм). Морфологически оформленного остаточного тела при споруляции обычно не образуется, между спорами остаются мелкие зер
нышки.
Вместо кокцидий из кролика в качестве объекта для изучения как эндогенной, так и экзогенной части цикла можно взять представителей рода Eimeria, встречающихся в птицах. Цыплята довольно часто страдают кровавым поносом, возбудителем которого является Е. tenella и ряд других близких видов. Паразит этот локализуется в слепых кишках и при сильном заражении может дать обильный материал для изучения. Ход жизненного цикла Е. tenella близок к таковому Е. magna.
ОТРЯД HAEMOSPORIDIA
Plasmodium vivax Grassi et Felleti, P. malariae Laveran, P. falciparum Welch.1
Агамные поколения и гаметоциты в крови человека
Материал и методы изучения. Малярия как массовое заболевание на территории Советского Союза ликвидирована. Это одно из выдающихся достижений здравоохранения в нашей стране. Однако в медицинских учреждениях и на биологических факультетах некоторых университетов имеются препараты возбудителя малярии. Пре
1 Четвертый паразитирующий в человеке вид рода Plasmodium — Р. ovale Stephens встречается только в Африке и поэтому препараты его практически недоступны для изучения.
параты эти представляют собой мазки, окрашенные по Романовскому-Гимза. Ввиду большого интереса, который представляет изучение возбудителя малярии как в теоретическом, так и в практическом плане, приводим описание тех стадий жизненного цикла паразитов, которые протекают в крови человека. Описание жизненного цикла возбудителя малярии и соответствующие схемы имеются в любом учебнике зоологии, паразитологии' или протозоологии, поэтому нет необходимости повторять их в данной книге. Напомним лишь, что агамное (бесполое) размножение малярийного плазмодия осуществляется в два этапа. Первые поколения шизонтов, развивающихся непосредственно из спорозоитов, проникающих в кровь при укусе комара, протекают в клетках печени. Мерозоиты, возникающие в результате этой виеэритроцитариой шизогонии, внедряются в эритроциты, и дальнейшие агамные поколения, так же как и образование гаметоцитов, происходит в кровяном русле. Эти стадии жизненного цикла и описаны ниже.
При отсутствии препаратов человеческой малярии можно попытаться получить материал по другим видам плазмодиев, паразитирующих в грызунах и птицах. Об этом будет сказано ниже.
Шизонты и шизогония в крови человека. Ниже подробно описываются те стадии жизненного цикла Plasmodium vivax, которые можно обнаружить в крови человека. В отношении двух других видов (Р. malarias и Р. falciparum) укажем главным образом на отличие их от Р. vivax.
У Plasmodium vivax, возбудителя трехдневной малярии (febris tertiana), в эритроциты проникают мерозоиты, образовавшиеся в результате последней экзоэритроцитарной шизогонии.
Мерозоиты, образующиеся в результате агамного размножения (шизогонии), вновь внедряются в красные кровяные тельца, но наблюдать момент внедрения мерозоита почти никогда не удается. Он
Рис. 116. Plasmodium vivax из крови человека (по Дофлейну). А — типичное «кольцо», Б — амебоидная форма (видна Шюффнерова пятнистость) ; В — многоядерный растущий шизонт, Г — шизогония, Д — макрогамета, Е — микрогаметоцит
протекает, по-видимому, чрезвычайно быстро. Начальные стадии роста внедрившегося мерозоита, который получает название шизонта, чрезвычайно характерны. Они имеют вид колец диаметром около */з (от 'А до V2) эритроцита (рис. 116). Центр такого кольца занят вакуолью, стенки его состоят из протоплазмы паразита (на хороших препаратах голубая).
Ядро имеет вид зерна (обычно красного), расположенного где-либо по краю кольца. На дальнейших стадиях роста правильная кольцевидная форма шизонта утрачивается, но вакуоль обычно сохраняется (рис. 116). Очертания его становятся весьма неправильными и непостоянными, образуются многочисленные псевдоподиеобразные выросты и т. и. Ядро по-прежнему одно, оно располагается чаще всего близ вакуоли. Размеры ядра несколько возрастают, но не превышают 2 мкм.
Указанное непостоянство формы плазмодия зависит от его подвижности. Растущий шизонт Р. vivax внутри эритроцита производит активные амебоидные движения. К концу периода роста шизонт заполняет своим телом большую часть эритроцита. Параллельно с ростом как в. самом плазмодии, так и в эритроците происходят следующие чрезвычайно характерные для Р. vivax изменения. В шизонте отлагается коричневый пигмент в форме мелких зерен. Отложение пигментных гранул начинается приблизительно через 6 ч после внедрения мерозоита в эритроцит. В мелких кольцах он отсутствует. Объем эритроцита довольно значительно увеличивается, диаметр его возрастает почти в 1,5 раза. В цитоплазме эритроцита появляются многочисленные мелкие гранулы, окрашивающиеся, по Романовскому, в красный цвет — так называемая Шюффнерова крапчатость, или зернистость.
Через 36 ч после внедрения паразита в эритроцит начинается процесс шизогонии, который заканчивается к 48 ч. Вакуоль при этом исчезает, шизонт принимает правильную округлую форму. Ядро делится несколько раз. Деления эти протекают не вполне синхронно. В результате образуется от 12 до 24 ядер. Пигмент, распределенный вначале равномерно по цитоплазме, собирается в центре шизонта в виде немногочисленных более крупных темноокрашенных включений. Вокруг каждого из образовавшихся путем деления ядер обособляется участок цитоплазмы. Таким путем формируются мерозоиты. Пигмент, сконцентрированный в центре, образует остаточное тело. Число мерозоитов равно числу ядер. Чаще всего их образуется 16. Они лежат сначала неправильной кучкой. Каждый мерозоит — овальной формы. Размеры его очень малы (около 2 мкм). При разрушении эритроцита мерозоиты попадают в плазму крови и вновь внедряются в красные кровяные тельца.
Весь период развития шизонта от момента внедрения мерозоита до конца шизогонии занимает 48 ч. Все указанные стадии можно обнаружить в периферической крови. При сильном заражении удается нередко -наблюдать наличие в эритроците не одного, а двух и даже большего числа шизонтов.
Plasmodium malariae (рис. 117), возбудитель четырехдневной малярии (febris quartana), отличается от Р. vivax целым рядом особенностей строения шизонта и шизогонии. Начальные стадии роста шизон-
та («кольца») почти не отличимы от Р. vivax. В дальнейшем вакуоль исчезает, неправильной формы протоплазматические выросты, характерные для Р. vivax, не образуются. Шизонт принимает характерную форму ленты, пересекающей эритроцит. На этой стадии в цитоплазме происходит отложение зерен пигмента. Увеличение объема эритроцита и образование зернистости Шюффнера не имеет места. В процессе дальнейшего роста шизонт заполняет почти все тело эритроцита, причем характерная лентовидная форма его превращается в округлую.
Пигмент, отложившийся в цитоплазме, в значительном количестве начинает концентрироваться в центральной части шизонта. Ядро при этом делится. В результате образуется от 8 до 12 ядер, располагающихся близко к периферии тела плазмодия. После этого происходит распад тела паразита на мерозоиты, число которых соответствует числу ядер. Пигмент переходит в остаточное тело, мерозоиты же в отличие от Р. vivax располагаются более или менее правильной «розеткой» вокруг остаточного тела. После этого эритроцит разрушается и мерозоиты попадают в плазму крови. Подобно Р. vivax, все указанные выше стадии могут быть обнаружены в периферической крови.
Продолжительность цикла развития Р. malariae в крови человека (от шизогонии до новой шизогонии) равняется 72 ч. Возбудитель четырехдневной лихорадки встречается гораздо реже, чем Р. vivax.
У Plasmodium falciparum в отличие от обоих предыдущих видов далеко не все стадии роста шизонтов и шизогонии протекают в периферической крови. Он вызывает тропическую форму малярии (febris tropica). На мазках удается обнаружить в большинстве случаев лишь «кольца» — начальные стадии роста шизонтов. Кольца Р. falciparum отличаются очень маленькими размерами. Они равняются лишь V5— ’/б диаметра эритроцита. Впрочем, по мере роста они могут достигнуть ’/3 эритроцита. В последнем случае они оказываются почти неотличимыми от. соответствующих стадий Р. vivax и Р. malariae. В кольцах Р. falciparum иногда наблюдается по два и даже три ядра, и сами они нередко принимают линзообразную форму. Кроме того, в крупных кольцах Р. falciparum на стороне, противоположной ядру, наблюдается некоторое утолщение цитоплазмы, имеющее линзообразную форму (см. рис. 118).
В цитоплазме эритроцита, объем которого не увеличивается, нередко появляются немногочисленные довольно крупные, неправильной формы пятна, окрашивающиеся, по Романовскому — Гимза, в пурпурнокрасный цвет. Они обычно обозначаются в литературе как «Мауреров-ская пятнистость» и легко отличимы от Шюффнеровской крапчатости, вызываемой Р. vivax. Дальнейшие стадии роста шизонта и сам процесс шизогонии протекает в капиллярах внутренних органов. Лишь в редких случаях эти стадии появляются в периферической крови. Выросший шизонт tropica — меньших размеров, чем у обоих предыдущих видов; он занимает лишь V2—2/з эритроцита. В нем также накапливаются зерна пигмента. Мерозоиты очень мелки. Их образуется от 8 до 24 (чаще 10— 12) из одного шизонта. -
Продолжительность цикла в крови человека у Р. falciparum не отличается такой правильностью, как у Р. vivax и Р. malariae. Она рав-168
няется 40—48 ч, но самый процесс шизогонии может растягиваться на несколько часов, благодаря чему синхронность нарушается. Имеются указания на существование штаммов Р. falciparum с 24-часовым циклом. Большинство исследователей считает, однако, что в подобных случаях так называемого febris quotidiana имеет место двукратное заражение больного комаром.
Гаметоциты в крови человека. Шизогония не совершается в крови человека неограниченное число раз. После нескольких циклов агамного размножения часть внедрившихся в эритроциты мерозоитов превращается в гаметоциты. Последние представляют собой подготовительные стадии к половому процессу, который осуществляется в теле комара, насосавшегося крови малярика. Гаметоциты трех видов малярийного плазмодия отличаются друг от друга морфологически и требуют отдельного описания. Они встречаются в периферической крови. Кроме различий между разными видами в пределах одного и того же вида можно отличить макрогаметоцитов (будущие женские гаметы) от микрогаметоцитов (дающих в дальнейшем микрогаметы).
У Plasmodium vivax гаметоциты появляются в крови на 10—14-й день после первого появления шизонтов. Молодые гаметоциты отличаются от шизонтов отсутствием вакуоли и более правильными очертаниями тела — амёбовидные выросты отсутствуют (рис. 116). Зрелые гаметоциты почти целиком заполняют тело выросшего эритроцита, оставляя лишь тоненький ободок с Шюффнеровой зернистостью. В отличие от шизонтов у них имеется лишь одно ядро. Форма тела их приближается к сферической. В протоплазме имеются зерна пигмента. Отличие макрогаметоцитов от микрогаметоцитов сводится к следующему. Микрогамегоциты характеризуются более крупным ядром и более светлой протоплазмой, у макрогаметоцитов ядро меньше, а протоплазма более темная, с большим количеством включений.
У Plasmodium malariae гаметоциты (рис. 117) весьма напоминают таковые Р. vivax. Они отличаются от последних меньшими размерами, при этом величина эритроцитов не является гипертрофированной. Отсутствует также Шюффнерова зернистость. Различия между микро- и макрогаметоцитами те же, что и у Р. vivax. Образование гаметоцитов у Р. falciparum так же, как и шизогония, протекает во внутренних органах. Сформировавшиеся гаметоциты попадают в периферическую кровь и легко обнаруживаются на препаратах. Их строение чрезвычайно ха-
Рис. 117. Plasmodium malariae из крови человека (по Дофлейну), А —растущий шизонт в форме «пояска», Б — шизогония; В — макрогамета, Г — микрогаметоцит
л
в
Рис. 118. Plasmodium falciparum из крови человека (по Дофлейну). А —начало роста шизонта, мелкое «кольцо»; Б — «кольцо» с двумя ядрами; В — более крупное «кольцо»;
Г — макрогамета; Д — микрогаметоцит
Рис. 119. Plasmodium relictum в эритроцитах воробьиных птиц (по Тиованола из кн. Гарнэма). А— В — последовательные стадии шизогонии; Г, Д— гаметоциты
Рис. 120. Haemoproteus columbae стадии развития гаметоцита;
в эритроцитах голубя. А—Г — последовательные Д — микрогаметоцит; Е, Ж — макрогаметоциты
рактерно и служит безошибочным признаком при диагнозе тропической малярии. Они имеют бобовидную форму (рис. 118), слегка изогнуты на одну сторону. Длина их 9—14 мкм. Обычно гаметоцит окружен остатком эритроцита. Макрогаметоциты при окраске по Гимза окрашиваются в темно-синий цвет. Микрогаметоциты красятся в голубой или розовый цвет. Зерна пигмента у макрогаметоцитов сконцентрированы около ядра, тогда как у микрогаметоцитов распределены почти по всей плазме. Наконец, ядро у макрогаметоцитов значительно мельче, чем у микро
гаметоцитов. В крови гораздо чаще встречаются макрогаметоциты. Например, по подсчетам Ноуэльс, они наблюдаются в 10 раз чаще, чем микрогаметоциты. Это, возможно, объясняется тем, что мужские клет-кие быстрее дегенерируют.
Виды рода Plasmodium (сем. Plasmodiidae) широко распространены в природе во всех широтах. Они паразитируют в крови млекопитающих, птиц, рептилий. Общее число видов этого рода, которое приводится в монографии Гарнэма (Garnham, 1966, см. список литературы), превышает 80. В крови многих воробьиных, утиных и других семейств птиц в эритроцитах на мазках, окрашенных по Романовскому—Гимза1, удается обнаружить шизонты, гаметоциты Plasmodium relictum, Р. cathemerium (рис. 119) и другие виды. В последнее время в некоторых лабораториях в качестве модельного объекта для изучения кровепаразитизма используется Р. berghei. Этот паразит в естественной обстановке был обнаружен в Африке в грызунах Thamnomys surdaster и в других видах. Штаммы этого паразита поддерживаются на лабораторных грызунах (мыши, крысы, хомячки) путем пересева. Стадии развития Р. berghei очень напоминают Р. vivax.
Часто в крови многих птиц обнаруживаются виды рода Haemoproteus, относящегося к сем. Haemoproteidae. Они отличаются от Plasmodiidae тем, что шизогония у них протекает не в эритроцитах, а в эндотелии сосудов. В эритроцитах обнаруживаются лишь гаметоциты и стадии их развития (рис. 120).
' Технику изготовления и окраски мазков крови см. в кн.: Лабораторные методы исследования патогенных простейших/Под ред. Д. Н. Засухина. М., 1957.
Тип Cnidosporidia — книдоспоридии
КЛАСС MYXOSPORIDIA — СЛИЗИСТЫЕ СПОРОВИКИ
Myxidium lieberkiihni Biitschli
Материал и методы изучения. Myxidium lieberkiihni (отр. Bivalvulea, подотр. Platysporea, сем. Myxidiidae) весьма часто встречается в мочевом пузыре щук. Для получения миксоспоридий вскрывают свежую, только что убитую щуку и извлекают мочевой пузырь. Тонкими препаровальными ножницами его взрезают вдоль. Препаровальной иглой делают соскоб с внутренней стенки пузыря и изучают сначала в живом виде в небольшой капле воды. Кроме того, изготовляют мазки (на покровном стекле), фиксируют жидкостью Шаудина и окрашивают железным гематоксилином. Специально для спор можно рекомендовать окраску 1%-ным водным раствором метиленовым синим (окраска 30 мин — 1ч проведение, как обычно, через спирты и ксилол, препарат в канадском бальзаме). При этом окрашиваются полярные капсулы и ядра аме-боида. Споры миксоспоридий хорошо сохраняются, не изменяя своей формы, если их без предварительной фиксации смешать с теплым глицерин-желатином и покрыть покровным стеклом. Чтобы такие препараты не подсыхали, по краю покровного стекла следует обвести асфальтовым лаком. Такие препараты могут храниться годами.
Изучение живого материала и мазков. На препаратах следует отыскать различные стадии роста плазмодиев, а также изолированно лежащие споры Myxidium. Размеры плазмодиев в зависимости от стадии их роста различны. Наряду с очень мелкими (30—40 мкм), не приступившими еще к спорообразованию, встречаются крупные (300 мкм и больше), набитые спорами (рис. 121). Между теми и другими существуют всевозможные переходы. Форма плазмодиев варьирует, но в общем они более или менее выгнуты в одном направлении.
На мелких плазмодиях ясно видно разделение на прозрачную гомогенную эктоплазму и зернистую эндоплазму. На крупных экземплярах это разделение менее отчетливо. Эктоплазма образует псевдоподии (рис. 121, А), в которые иногда частично вовлекается и эндоплазма. Плазмодии обладают способностью менять свою форму и медленно передвигаться. В эндоплазме имеются многочисленные ядра (видны на окрашенных гематоксилином препаратах). Кроме того, присутствуют сильно преломляющие свет капли жира и красно-коричневые кристаллы гематоидина. Последние в молодых плазмодиях имеются в небольшом количестве или даже отсутствуют вовсе, в крупных же их образу-
Рис. 121. Myxidium lleberkuhni (Л — по Шредеру; Б — по Либеркюну; В — по Лангу; Г — Е— по Василевскому). А — молодой плазмодий; 5 — плазмодий с двумя спорами; В — бесполое размножение путем почкования; Г — плазмодий, набитый спорами; Д — отдельная спора; Е — то же, с выброшенными стрекательными нитями;
/ — псевдоподии, 2 — жировые капли, 3 — ядра, 4 — эктоплазма, 5 — эндоплазма
ется очень много. В мелких плазмодиях процесса спорообразования еще нет. Споры образуются в эндоплазме группами по две вместе. Это объясняется тем, что образованию спор предшествует обособление так называемых панспоробластов, которые представляют собой участок протоплазмы с 14 ядрами. В пределах каждого панспоробласта образуется две споры. В построении каждой из них участвуют по шесть ядер, два остающихся ядра панспоробласта в этом процессе участия не принимают. Детали развития спор на тотальных препаратах рассмотреть не удается, вследствие чего мы и не даем здесь описания этого процесса.
Споры Myxidium lieberkilhni имеют веретеновидную форму (рис. 121, Г, Д), длина их 18—20 мкм, ширина 5—6 мкм. Оболочка споры, состоящая из двух створок, исчерчена в продольном направлении. На заостренных концах споры располагаются две полярные стрекательные капсулы. Внутри оболочек имеется цитоплазматическое содержимое (амебоид) с двумя ядрами. При заражении спорами нового хозяина амебоид, выходящий из оболочки спор, дает начало плазмодию.
Кроме образования спор, Myxidium способен, по-видимому, и к бесполому размножению. Иногда наблюдается на крупных плазмодиях процесс почкования (рис. 121, В), приводящий к увеличению числа плазмодиев.
Myxobolus sp.
Материал и методы изучения. К роду Myxobolus (подотр. Platysporea, сем. Myxobolidae) относится несколько десятков видов миксоспоридий, паразитирующих в различных тканях пресноводных рыб. Чаще всего они локализуются в коже, на жабрах (рис. 122) и в мышечной ткани. Обычно Myxobolus образуют в пораженном органе цисты различных размеров (от долей миллиметра в поперечнике до сантиметра и даже более). Иногда же плазмодий паразита более или менее диффузно инфильтрирован между тканями хозяина.
Для определения видов, довольно трудно отличимых друг от друга, следует обратиться к монографии С. С. Шульмана (см. список литературы). Удобны для изучения цисты с жабр. В Ленинграде высокий процент зараженности Myxobolus обнаруживает судак из Невской губы. Для рассмотрения спор in vivo циста раздавливается и исследуется с иммерсионной системой. Изготовляют неокрашенные препараты в глицерин-желатине.
Кроме того, изготовляют обычным способом мазки, фиксируемые жидкостью Шаудина и окрашиваемые железным гематоксилином и метиленовым синим. Небольшие цисты фиксируют целиком (при фиксации тонкой иглой надо проколоть оболочку цисты), заливают в парафин, после чего изготовляют срезы (не толще 5 мкм), окрашиваемые каким-либо гематоксилином с подкраской эозином.
Рис. 122. Цисты Myxobolus на судаке (из кн. Догеля)
Рис. 123. Споры Myxobolus sp. (X1200) .А — со стороны створки; Б — со стороны шва; В — отдельная створка:
1 — стрекательная капсула, 2 — аме-боид, 3 —ядра амебоида, 4— иодо-фильная вакуоль, 5 — эндоплазма
Изучение живого материала и мазков. Споры Myxobolus овальной или эллиптической формы. Размеры их у разных видов различны. Длина варьирует приблизительно от 10 до 20 мкм, ширина 5—10 мкм. Толщина спор меньше ширины (рис. 123). Оболочка состоит из двух створок, плотно прилегающих друг к другу. Линия соприкосновения обеих створок называется швом или сутуральной (шовной) линией. Она обычно несколько приподнята и образует краевой валик, или гребень. На переднем конце споры располагаются две полярные капсулы, внутри которых видны стрекательные нити.
У большинства видов Myxobolus обе капсулы одинаковой величины. Некоторые виды характеризуются неодинаковыми размерами стрекательных капсул (Af. dispar) (рис. 124). Наконец, споры немногих видов имеют лишь одну капсулу (А4. misgurni). Среди спор попадаются
с выброшенными стрекательными нитями, длина которых значительно превышает длину споры (рис. 125).
Изучение срезов. На срезах через цисты Myxobolus в большом количестве присутствуют споры. В тех случаях, когда плазмодий еще относительно «молодой», наряду со сформированными спорами удается рассмотреть некоторые стадии их развития. При этом зрелые споры обычно занимают центральную часть цисты. В протоплазме плазмодия, в тех
участках его, где еще не закончился про-
цесс спорогонии, присутствуют многочисленные ядра и происходит формирование панспоробластов, споробластов и спор. Проследить детально все последовательные стадии этого процесса вряд ли удастся, так как благодаря наличию очень большого числа ядер и включений в протоплазме получается чрезвычайно запутанная и сложная картина. Легче всего отыскать панспоробласты, в которых уже закончился процесс деления ядер и начинается формирование спор (рис. 126). Панспоробласт представляет собой обособившийся из общей протоплазматической массы участок протоплазмы вытянутой овальной формы, в котором присутствуют 14 ядер, из которых 12 принимают участие в образовании двух спор. Два ядра остаются в качестве остаточных ядер. В образовании каждой споры участвуют шесть ядер. Из них два переходят в амёбоидный зародыш; два других тесно прикладываются к образующейся оболочке, сморщиваются и претерпевают пикноз. По-видимому, они играют активную роль в формировании двустворчатой оболочки споры. Наконец,
Рис. 124. Споры Myxobolus dispar со стрекательными капсулами различной величины (с жабер плотвы) (по Шульману)
Рис. 125. Споры Myxobolus schulmani с выстреленными и невыстреленными стрекательными нитями (с плавников белоглазки) (по Шульману)
еще два ядра располагаются в передней части формирующейся споры и участвуют в образовании стрекательных капсул. Таким образом, спора Myxobolus — довольно сложное образование, в развитии
которого участвуют шесть ядер. Оболоч-
ка цисты Myxobolus так же, как и других миксоспоридий, образуется не самим паразитом, а представляет собой разрастание соединительной
ткани хозяина, которая располагается концентрическими слоями.
Рис. 126. Myxobolus pfeifferl—развитие спор (Х1500) (из кн. Кеисселитца). А — панспоробласт; Б — незрелая спора; В — зрелая спора
Рис. 127. Henneguya acerinae (из кн. Грассе). А— участок жабры ерша с цистами; Б — спора:
1 — стрекательные капсулы, 2 — ядра, 3 — амебоид с двумя ядрами, 4 — ядра створок споры
Henneguya sp.
Материал и методы изучения. Род Henneguya (сем. Myxobolidae), подобно Myxobolus, включает много видов, паразитирующих в разных органах почти исключительно пресноводных рыб. Некоторые виды образуют цисты иа жабрах и в мускулатуре. Главный интерес представляет изучение спор. Последние рассматриваются как в живом виде, так и на фиксированных и окрашенных мазках, подобно Myxobolus.
Изучение строения спор. Характерной особенностью строения спор Henneguya служит наличие длинных отростков (рис. 127). На заднем конце споры обе створки несут длинные стилетообразные выросты.
Nosema apis Zander и N. bombycis Naegeli
Материал и методы изучения. Микроспоридия Nosema apis паразитирует в эпителии средней кишки медоносной пчелы, вызывая заболевание, известное под именем белого поноса пчел. Наличие заражения устанавливается путем микроскопического анализа кала, в котором обнаруживаются споры. Ввиду того, что они очень мелки, необходимо применение иммерсионной системы. Усыпив хлороформом или эфиром зараженную пчелу, ее вскрывают. Часть средней кишки фиксируют (жидкостью Шаудина или Ценкера) для изготовления срезов. Из другой части делают мазки и изучают in vivo, раздавив в капле физиологического раствора или воды под покровным стеклом. Срезы окрашиваются железным гематоксилином или по Маллори; мазки — железным гематоксилином.
Другой вид рода Nosema — N. bombycis является возбудителем тяжелого, почти всегда смертельного, заболевания гусениц тутового шелкопряда, называемого пебриной. Морфологически стадии развития и споры N. bombycis почти не отличимы от N. apis, за исключением меныпнх размеров. Но в отличие от N. apis N. bombycis локализуются не только в кишечнике, но и почти во всех других органах гусеницы, в том числе и в яйцевых клетках, что делает возможным осуществление трансовариальной передачи в тех случаях, когда больная гусеница все же окукливается и дает бабочку. Изучение N. bombycis осуществляется также на мазках и срезах.
Изучение материала. На мазках, а также in vivo рассматривают споры. Они имеют овальную форму и очень мелки (рис. 128). У N. apis длина спор 4,5—6,5 мкм, ширина 2,5—3,5 мкм, у N. bombycis соответственно 2—4 и 1—2 мкм. Имеется прочная оболочка, не являющаяся у Nosema в отличие от Myxosporidia двустворчатой. Внутри споры имеется один полярипласт, вакуоль, длинная спирально закрученная нить и амебоидный зародыш. Ввиду очень мелких размеров спор нить обычно не видна. На препаратах полярипласт и вакуоль имеют вид светлых пятен, расположенных на концах споры. Если живые споры поместить в довольно крепкую соляную кислоту (около 1О°/о), то споры разбухают и нередко происходит выбрасывание длинной (до 70 мкм) нити.
На срезах через кишечник видно, что эпителиальные клетки набиты спорами, которые обычно бывают расположены продольными рядами (рис. 129). Подобное расположение зависит от того, что проникающий в клетку из споры амебоид делится в одном направлении, обычно по продольной оси эпителиальной клетки. Образующаяся цепочка распадается на отдельные участки — споробласты, за счет которых формируются споры. При сильном заражении многочисленные споры обнаруживают также в просвете кишечника.
Рис. 128. Споры — Nosema apis (из кн.
Грассе):
/ — стенка споры, 2 — стрекательная нить, 3 — амебоид с ядрами
Рис. 129. Nosema bombycis (Х2000). Срез через эпителий кишечника гусеницы, набитый шизонтами и спорами (по Штемпелю из кн. Грассе)
Кроме Nosema apis и N. bombycis не представляет особых затруднений добыть материал по микроспоридиям, паразитирующих в рыбах. Чаще других встречается паразитирующая в колюшках Glugea anomala. Этот вид образует на теле рыб опухоли в форме горошин. Массовое заражение вызывает гибель рыб. Споры этого вида по своему строению сходны с таковыми Nosema.
Тип Spongia— губки
При изучении губок используют материал, легко добываемый в наших северных морях и в пресных водах. Это представители групп Сака-геа и Cornacuspongia. Наиболее ясное представление об общем плане организации губок можно получить при изучении одиночных известковых губок; поэтому в качестве основного объекта предлагаем разбор организации Sycon. Пример более сложно организованной губки дан в виде пресноводной бадяги.
Необходимо иметь в виду, что многообразие губок разобранными здесь примерами далеко не исчерпывается. Особенно разнообразно строение скелетных элементов губок.
КЛАСС CALCISPONGIA (CALCAREA) — ИЗВЕСТКОВЫЕ ГУБКИ
ОТРЯД HETEROCOELA
Sycon raphanus О. Schmidt ( = Sycandra raphanus Auct.)
Материал и методика изучения. Sycon raphanus (из сем. Sycettidae) — обычная форма, находящаяся на каменистом грунте, на глубине 15—20 м и больше вместе с красными водорослями в наших северных морях. Каждая драга с этих глубин обычно приносит несколько экземпляров данной губки. Для изучения лучше воспользоваться молодыми, более мелкими экземплярами не длиннее 4—5 мм. Разбор строения ведут на срезах (продольных и поперечных) из материала декальцинированного и из необработанного кислотой. В последнем случае изготовляют очень толстые срезы бритвой от руки, слегка подкрашенные квасцовым кармином. Такие срезы (особенно продольные) позволяют составить хорошее представление о расположении системы полостей в теле губки и особенно о расположении скелетных элементов. Из декальцинированных губок (после обработки 1%-ным раствором соляной или азотной кислоты в 70° спирте в течение 1—2 суток) изготовляют обычным способом срезы, но также сравнительно толстые (10—12 мкм). На этих срезах изучают гистологические особенности объекта.
Для фиксации применяют либо сулему с уксусной кислотой, либо какой-нибудь осмиевый фиксатор (например, крепкая жидкость Флемминга). Мелкие экземпляры фиксируются целиком, крупные же должны быть разрезаны на куски. Срезы окрашивают гематоксилином.
При изучении спикул материал вываривают в течение нескольких минут в 20%-ном
Рис. 130. Sycon raphanus. Общий вид губки (Х10) с вскрытой пара-гастральной полостью (со стенной таблицы Пфучеллера)
растворе едкой щелочи в жавелевой воде Осадок из спикул промывают многократно дистиллированной водой (лучше при помощи центрифуги), вылавливают пипеткой на предметное стекло, на котором и высушивают над пламенем спиртовки. Сухие спикулы заделывают в бальзам, причем препарат следует покрыть покровным стеклом с восковыми ножками.
Общая морфология. S. raphanus имеет вид вытянутого в длину конического, овального или веретеновидного мешка, прикрепляющегося суженным основанием к субстрату (рис. 130). Длина взрослых экземпляров достигает 1 см и больше. Поперечное сечение — правильно округлое. На свободном конце помещается, иногда сдвинутый несколько набок, osculum, обычно окруженный воронкообразным перистомом с оскулярной кроной спикул. Цвет губки обычно желтовато-серый.
Внутренняя парагастральная полость цилиндрической формы суживается в области osculum, ее стенка достигает наибольшей толщины в базальной части губки. С наружной по
верхности выдаются многочисленные собранные пучками ворсинки, шипи-ки — это выступают над поверхностью спикулы дермального скелета. Поверх
ность тела пронизана отверстиями (дермальными порами), ведущими в приводящие (интеркалярные) полости. Наличие последних устанавливается лучше всего на толстых срезах (рис. 131). В толще стенКи тела,
кроме того, залегают радиальные цилиндрические жгутиковые каналы (камеры), широкими отверстиями (апопилями) сообщающиеся с пара-гастральной полостью. Каждая камера сохраняет правильную цилиндрическую форму только у молодых экземпляров, в то время как у старых их концы разветвляются и анастомозируют друг с другом. Приводящие каналы сообщаются с жгутиковыми камерами порами (прозопилями) диаметром (на фиксированном материале)- 10—20 мкм.
Скелет. Скелетные элементы у S. raphanus представлены спикулами трех категорий. Их приходится рассматривать на препаратах из губок, вываренных в едкой щелочи. Первая категория — так называемые одноосные, монаксонные иглы, прямые, постепенно утончающиеся и за-
1 Жавелевая вода — крепкий раствор едкого натра, насыщенный хлором. Обращаться с осторожностью, так как легко проедает ткани и портит металлические предметы.
остряющиеся на концах (рис. 132). Размеры их различны. Наиболее крупные достигают 1 мм и более в длину, в то время как мелкие бывают всего в несколько десятков микрон.
Вторая категория спикул — четырехосные, тетраксонные, составлены из четырех ответвлений каждая. Три образуют базальный треугольник с широко расставленными концами, над которым поднимается апикальная четвертая ветвь (рис. 132, В).
Наконец, третья категория спикул — трехосные, триаксонные, составлены из трех ответвлений — двух базальных ветвей, иногда с таким большим углом между ними, что они являются как бы продолжением друг друга, и одной апикальной, часто более длинной, чем базальные (рис. 132). Базальные отростки спикул двух последних типов часто бывают слегка изогнуты по направлению к апикальному отростку. Каждая спикула известковая, в центре имеет тонкий каналец, заполненный органическим веществом. Его обнаружить удается при больших увеличениях. Располагаются спикулы в теле губки весьма закономерно и группируются следующим образом (разобрать на толстых, продольных
и поперечных срезах, сделанных из недекальцинированного материала). К поверхности па-рагастральной полости прилегают тонким слоем трех- и четырехосные иглы. Их базальные отростки ложатся параллельно эпителию, а каждый
Рис. 131. Sycon raphanus. Часть продольного разреза через стенку тела (схематизировано) (из ки. Коршель-
та и Гейдера):
J — прозопили, 2 — пора, 3 — интеркалярная полость, 4 — жгутиковая камера, 5 — апопили
Рис. 132. Sycon raphanus. Спикулы. А— общее расположение в области жгутиковой камеры (Х75) (из кн. Геккеля); — Б — четырехосная спикула — гелотроп; В — четырехосная игла — тризна; Г — склеробласт; Д — редко встречающийся тип одноосной иглы с зубчиками (Х240) (из кн. Шульце):
1 — трехосные иглы, один из отростков которых выдается в парагастральную полость, 2 — трех- и четырехосные иглы, расположенные вдоль жгутиковой камеры, 3 — одноосные иглы'
Рис. 133. Sycon raphanus. Фрагмент продольного разреза через стенку тела (Х400) (из кн. Шульце):
1 — звездчатые клетки мезенхимы, 2 — яйцевые клетки на разных стадиях созревания, 3— приводящие каналы (интеркалярные полости), 4— хоаноциты, выстилающие стенкн жгутиковых камер, 5—клетки плоского эпителия, выстилающего приводящие каналы, в разрезе, 6 — спикулы, 7 — клетки стенок приводящих канальцев, вид с плоскости
апикальный отросток либо выдается в парагастральную полость и торчит, слегка загибаясь к osculum (рис. 132), либо направляется вдоль радиальных жгутиковых камер, образуя их пристеночный скелет.
Кроме того, многочисленные трех- и четырехосные спикулы располагаются около радиальных камер, вытягиваясь вдоль их стенок своими апикальными отростками, а базальными — параллельно продольной оси тела. Дистальный конец каждой камеры одевается целой шапочкой (конусом) из спикул, преимущественно одноосных, выдающихся пучком над поверхностью тела. Эти пучки составлены из крупных спикул вперемежку с мелкими, очень тонкими элементами.
Наконец, последняя группа спикул залегает в области около озси-lum, поддерживая перистомальную воронку. Здесь видны главным образом трех- и четырехосные иглы, между которыми вклиниваются гигантские одноосные, изредка зазубренные, достигающие 1—3 мкм в длину и выдающиеся наружу. За их-то° счет и формируется оску-лярная крона спикул.
Гистология. На срезах через декальцинированную губку следует познакомиться с основными особенностями гистологического строения S. raphanus. Поверхность тела, парагастральная полость и приводящие каналы выстланы плоскими клетками эпителия со сплющенными ядрами (рис. 133).
Стенки жгутиковых каналов (камер) составлены из воротничковых жгутиковых клеток — хоаноцитов. На срезах и воротнички сохраняются очень плохо, и удается рассмотреть только тело этих клеток с ядром в центре каждой. Ядра богаты хроматином и поэтому хорошо видны на препарате в виде резко окрашенного слоя вблизи поверхности камер. Структуру хоаноцитов можно рассмотреть только in vivo, расщипывая губку иглами или изготовляя из нее от руки срезы и рассматривая их в воде. Тело
Рис. 134. Sycon raphanus. Хоаноциты различной формы (Х1350) (из кн. Шнейдера):
1 — жгутик, 2 — воротничок, 3 — базальное зерно жгутика, 4 — корне-* вая нить жгутика, 5 — ядро, 6 — сократительная вакуоль
Рис. 135. Sycon raphanus. Мезоглея на срезе (Х750) (из кн. Шнейдера):
I — спикулы, 2— звездчатые клетки, 3 — перерезанные приводящие ка-налы, 4 — археоцит
клетки суживается дистально, и от этого конца отходит цилиндрический воротничок, достигающий половины высоты клетки (рис. 134). Жгутик, выходящий изнутри воротничка, имеет длину, вдвое превышающую высоту клетки. В цитоплазме хоаноцитов заметны многочисленные зернистые включения, главным образом пищевые и сократительные вакуоли (одна или несколько). При этом удается заметить плазматические отростки, которыми эти клетки закрепляются в мезоглее.
В студенистой массе мезоглеи следует рассмотреть некоторые клеточные элементы. Во-первых, можно видеть разбросанные изредка звездчатые клетки с длинными отростками, зернистой цитоплазмой и ядром, занимающим значительную часть центрального отдела клетки. Это соединительнотканные элементы — колленциты (рис. 135). Отростки их ветвятся и могут анастомозировать с таковыми соседних клеток. Кроме того, удается рассмотреть и амебоидные элементы — археоциты и все переходы между ними и половыми клетками. Они также отличают-
Рис. 136. Sycon raphanus. Часть поперечного разреза стеики тела (Х550); (из кн. Шульце):
/•«-спикулы, 2 хоаноциты, 3 — крупные клетки амфибластулы* 4 — мелкие жгутиковые клетки амфибластулы, 5—археоцит, 6 — приводящие каналы, 7 — звездчатые клетки мезоглеи
ся крупным пузыревидным ядром. Цитоплазма археоцита окрашивается довольно интенсивно, чем они и выделяются среди других клеточных элементов. У крупных губок в мезоглее можно найти половые клетки и развивающиеся зародыши. На Ьрезах попадаются сформированные амфибластулы (рис. 136), в составе которых следует отметить крупные клетки нижнего полюса, лишенные ресничек, и мелкие верхнего полюса с ресничками. Наконец, в мезоглее можно разыскать и склеробласты — веретеновидные клетки с маленьким ядром и заложенным в цитоплазме зачатком спикулы.
КЛАСС DEMOSPONGIA — ОБЫКНОВЕННЫЕ ГУБКИ
ОТРЯД CORNACUSPONGIA — КРЕМНЕРОГОВЫЕ ГУБКИ
Бадяга
Материал и методы изучения. Бадяги — обычные пресноводные губки. Наиболее часто встречаются представители двух родов: Spongilla lacustris L., Ephydatia mullert (Lieberkiihn) и E. fluviatilis (L.) из сем. Spongillidae. Общий план строения этих видов чрезвычайно схож, различие заключается главным образом в деталях строения скелетных элементов, так что не имеет никакого значения, какой вид будет взят для изучения. Встречаются губки в различных как стоячих водоемах типа прудов, озер, так и в текучих — реках и ручьях. Прирастают губки к любому субстрату, избегая, однако, заиления. Даже живые объекты (например, раковины моллюсков) могут служить субстратом для бадяг. Наиболее многочисленны они вблизи берега и не заходят далеко вглубь. Добывают губок непосредственно на дне водоема или с берега, а также с лодки и вытаскивают руками или сачком, скребком.
Изучение ведут и in vivo, и на препаратах. Живые клеточные элементы рассматривают после расщипывания иглами кусочка губки в воде или используют особый род культивирования тонкого слоя губки на покровном стекле (см. ниже). Препараты изготовляют прежде всего в виде толстых срезов бритвой от руки из фиксированного объекта, окрашивают кармином и заключают в бальзам так же, как и любой тотальный препарат. При этом в разрез должны обязательно попасть геммулы. Далее для изучения спонгинового скелета следует кусочки или лучше толстые срезы мацерировать продолжительное время (неделями) в изредка сменяемой воде. После мацерации изготовляют тотальные препараты, окрашенные фуксином с пикриновой кислотой (объект выдерживают около 10 мин в насыщенном спиртовом растворе пикриновой кислоты, к одному кубику которой прибавляют 5—10 капель 1%-ного раствора кислого фуксина в воде). После окраски объект следует промыть в спирте, далее его обезвоживают, просветляют и заделывают в бальзам. Наконец, для изучения спикул следует выварить кусок губки с геммулами в серной кислоте или хромовой смеси. В химическую пробирку опускают кусочек губки, прибавляют 2—3 кубика разбавленной вдвое крепкой серной кислоты или хромовой смеси и кипятят в течение 1—2 мин, после чего ткань губки и геммулы разрушается. Осевшие на дно пробирки спикулы промывают многократно дистиллированной водой (лучше при помощи центрифуги), осадок переносят пипеткой на предметное стекло, высушивают над спиртовкой и заделывают в бальзам.
Определение бадяг следует вести по книге П. Д. Резвого «Губки», Фауна СССР (1936).
Морфология. Пресноводные губки определенной формы не имеют. Форма губок зависит от особенностей субстрата, на котором они сидят. Ephydatia остается всю жизнь в виде неправильных наростов и корок (рис. 137, Л), во взрослом состоянии достигающих толщины в не-
Рис. 137. Общий вид губок (из кн. Шредера). А — Ephidatia тйР leri (натуральная величина); Б — Spongilla lacustris (уменьшено)
сколько сантиметров. У Spongilla от таких плоских наростов поднимаются ветвистые выросты (рис. 137, Б). Размер колоний увеличивается с возрастом: осенью старая губка отмирает, за зиму обычно не успевает распасться и на ней развиваются новые молодые губки из старых геммул. Таким образом могут образоваться скопления массой в несколько килограммов. Цвет губок желтовато-серый, бурый, красноватый, в зависимости от цвета иловых частиц, заносимых во внутренние полости. На свету губки часто приобретают ярко-зеленую окраску, зависящую от присутствия внутри них зоохлорелл. Бадяги обладают своеобразным запахом, уловить который можно, растирая губку между пальцами.
Время от времени с поверхности тела губки поднимаются прозрачные оскулярные трубки (рис. 138), которые могут вытягиваться до 10 мм в длину при ширине 2—3 мм. Оскулярные трубки при прикосновении к ним или при сотрясении медленно втягиваются внутрь в течение нескольких минут. Вытягивание совершается гораздо медленнее. Через них вода выбрасывается из тела губки наружу, что можно хорошо наблюдать, впрыснув шприцем взвесь кармина в толщу губки. Струи воды с красителем начинают бить из трубок на расстояние нескольких сантиметров.
Поверхность губки покрыта дермальной мембраной, местами легко отстающей от подлежащих тканей. Содрав пинцетом участок мембраны, следует рассмотреть его под микроскопом, тогда хорошо видны по-
ры. Каждая из них является внутриклеточным просветом специальной клетки — пороцита (рис. 139). Диаметр пор в раскрытом состоянии — около 50 мкм. Засасывание воды через поры удается наблюдать в аквариуме, выпуская пипеткой около живой губки облачко карминовой
взвеси. Частички кармина как бы прилипают к поверхности тела и исчезают внутри.
Система каналов у взрослой губки не поддается рассмотрению. Можно только более или менее разобрать субдермальные полости, сообщающиеся с наружной средой посредством пор дермальной мембраны. На дне субдермальных полостей начинаются приводящие каналы — неправильные полости и протоки, пронизывающие тело губки. В стенках этих каналов имеются отверстия, ведущие в очень небольшие жгутиковые камеры (рис. 140). Рассмотреть последние можно только in vivo, использовав специальный метод выращивания тонких пластинок регенерирующей губки на покровных стеклах. Для этого лучше использовать быстрей растущую Spongllla lacustris. Цилиндрический отросток этой губки разрезают вдоль, небольшой кусочек плоскостью прикладывают к большому покровному стеклу и помещают в аквариум либо с проточной водой, либо с водой, сменяемой по крайней мере один раз в сутки. Ткань губки прирастает к стеклу, и от кусочка распространяется во все стороны тонкая пленочка, увеличивающаяся постепенно в толщину. Приблизительно через неделю в ней формируется система каналов и появляются жгутиковые камеры. Такое стекло, положенное на специальных стеклянных подставках в маленький сосуд с водой вниз губкой так, чтобы вода не покрывала стекла сверху, позволяет рассматривать в проходящем свете при любом увеличении (вплоть до иммерсии) детали устройства жгутиковых камер. Каждая из них шарообразной формы, имеет в диаметре 25—50 мкм (рис. 140). С приводящей системой эти камеры сообщаются несколькими узкими отверстиями (прозопилями) . В отводящую же систему они открываются очень широким апопилем. Жгутиковые воротничковые клетки (хоаноциты) выстилают внутренность камеры одним слоем и концентрируются главным образом около прозопилей (рис. 141), оставляя свободной стенку вблизи апопиля. Тела хоаноцитов располага-
Рис. 138. Ephidatia miilleri. Оскулярные трубки (слабо увеличено (из Резвого)
Рис. 139. Ephidatia miilleri. Дермальная мембрана с порами, вид с поверхности (Х250) (из кн. Резвого):
i — пузыревидные клетки, 2— цитоплазма пороцита, 3 — пора, 4 — ядра клеток покровного эпителия
Рис. 143. Ephidatia miilleri (из кн. Резвого). А — археоциты в движении (X 1 000); Б — пузыревидные клетки (Х/50)
Среди обрывков ткани губки можно разыскать амебоидные элементы (рис. 143, Л) и наблюдать за их движением. Диаметр археоцитов около 20 мкм. Звездчатые клетки, которым приписывается выделение студня мезоглеи, при таком способе изучения обычно не видны. У некоторых видов Ephydatia (Е. miilleri, например) мы замечаем в мезоглее особые пузыревидные клетки диаметром до 35 мкм. Каждая такая клетка имеет овальную форму и
характеризуется наличием громад-
ной вакуоли, наполненной прозрачным содержимым (см. рис. 143, Б). Далее можно обнаружить в мезоглее и половые клетки —• именно яйцевые, которые выделяются среди других клеточных элементов, своими крупными размерами (до 100 мкм). Они сохраняют амебоидный облик и обычно окружаются слоем археоцитов, образующих вокруг них род фолликула. В мезоглее же лежат и тельца бесполого размножения —• геммулы (см. ниже).
Скелет. В мезоглее располагается довольно хорошо развитый скелет. Прежде всего следует изучить препараты, изготовленные из мацерированного материала. На них удается без труда обнаружить скелетные элементы двух категорий: во-первых, кремневые спикулы, и, во-вторых, спонгиновые волокна. Спикулы собраны кучками и склеиваются друг с другом спонгином — образуется скелетная сеть из ячей неправильной формы. Количество спонгина у бадяги невелико, и роговые элементы лучше всего видны по углам ячеек (рис. 144). Среди пучков спикул выделяются главные, которые идут перпендикулярно к поверхности тела и упираются в дермальную мембрану, образуя на ней заметные снаружи мелкие конические возвышения — конули.
Спикулы рассматриваются на препаратах, изготовленных вывариванием в кислоте. Они у бадяги всегда бывают двух сортов: мегасклеры и микросклеры (рис. 145). Первая категория спикул составляет главным образом пучки скелета. У Spongilla lacustris мегасклеры слегка изогнуты, заострены на концах, имеют гладкую поверхность и достигают в длину 200 мкм. У нее же в состав пучков входят так называемые паренхимные микросклеры, более мелкие, изогнутые и заостренные, но покрытые массой мелких шипиков (рис. 145, Б). Наконец, микросклеры особого вида покрывают поверхность геммул. Эти гем-мульные микросклеры мелкие, шиповатые, но шипики посажены реже по сравнению с паренхимными микросклерами (рис. 145, В).
У Ephydatia мегасклеры большей частью шиповатые, но заостренные концы спикул обычно остаются голыми (рис. 145, Г). Микросклеры же у нее располагаются только на поверхности геммул и представлены своеобразными амфидисками (рис. 146)—короткими спикулами, составленными из двух параллельных, сильно вырезанных пластинок (звездчатых), соединяющихся сравнительно коротким (Е. miilleri) или,
/
Рис. 144. S pong ilia lacustris. Скелет после мацерации (X50) (из кн. Резвого):
/ — спикулы, 2— спонгин (изображен черным)
V
А
Рис. 145. Спикулы бадя-ги (из кн. Резвого). А — мегасклера Spongilla lacustris; Б — паренхимные микросклеры Spongilla lacustris; В — геммуль-ные микросклеры Spongilla lacustris; Г — мегасклера Ephidatia mulleri (Х350)
Рис. 146. Амфидиски.
А—Ephidatia mulleri; Б — Ephidatia fluviatilis (Х50) (из кн. Резвого)
Рис. 147. Spongilla lacustris. Гем-мула (Х60) (из кн. Резвого):
/ — поровое отверстие, 2 — мегасклеры, 3 — геммульные микросклеры
наоборот, длинным (Е. fluviatilis) стержнем. Амфидиски своими пластинками прилегают изнутри к поверхностной оболочке геммул, образуя правильный слой. Промежутки между ними заполнены воздухом.
В центре каждой спикулы (особенно это относится к мегасклерам) проходит осевая нить из органического вещества, хорошо заметная на готовых препаратах в виде канальца вдоль спикулы.
Геммулы. В мезоглее бадяги к концу лета (или в начале осени) начинают формироваться геммулы, призванные при отмирании губкизи-мой пережить и развиться следующей весной в новых губках, которые поселяются на отмершем материнском организме.
Геммулы у бадяги имеют правильную шарообразную форму (рис. 147). На одном из полюсов ее видно поровое отверстие с небольшой оторочкой у Spongilla lacustris или оно приподнимается воронкой у Ephydatia miilleri. Внутри геммулы собран комок археоцитов с запасом питательного материала, покрытый двойной оболочкой. Между наружным и внутренним слоем ее располагаются микросклеры. Их меньше у Spongilla, и они имеют типичный игольчатый характер. У Ephydatia амфидиски в большом количестве заполняют все пространство между обеими оболочками.
Геммулы выносят замораживание благодаря развитию теплоизоляционного воздушного слоя и могут высыхать, сохраняя жизнеспособность в течение нескольких лет.
Тип Coelenterata — кишечнополостные
I КЛАСС HYDROZOA - ГИДРОИДНЫЕ
Класс Hydrozoa представляет собой довольно обширную группу животных, большинство которых живет в морях. Изучение их лучше начать с пресноводных гидр, которых легко найти в природе и которые позволяют детально ознакомиться с организацией одиночного гидроидного полипа. Гидры имеют еще и то преимущество перед другими объектами, что их почти всюду можно иметь в живом виде, и, следовательно, можно поставить ряд наблюдений над живыми объектами.
Среди морских колониальных форм (отр. Leptolida) с организацией подотряда Athecata следует ознакомиться на примере Tubularia, позволяющей вместе с тем изучить строение гонофоров. Дополнительными объектами для Athecata взяты часто встречающиеся в наших северных морях представители родов Clava и Согупе. В качестве основного объекта изучения Thecaphora лучше всего взять широко распространенную в морях СССР Obelia, которая дает вместе с тем типичный пример метагенеза. Разнообразие форм Thecaphora не позволяет ограничиться одним представителем этого подотряда, и в качестве дополнительных объектов приводится описание Sertularia и Aglaophenia. Кроме медузы Obelia, являющейся представителем лептомедуз, необходимо изучить организацию антомедуз. В качестве представителя последних рассматриваются Sorsia. Отряд Trachilyda специально не рассматривается.
ОТРЯД HYDRIDA
Hydra oligactis Pallas — стебельчатая гидра
Материал и методы изучения. Пресноводных гидр легко найти в прудах, озерах и медленно текущих реках, на водяных растениях, камнях, сучьях и т. п. Чтобы обнаружить гидр, следует брать небольшие веточки растений (например, элодеи), переносить их в банку с чистой водой и просматривать на свет. При этом легко удается обнаружить гидр невооруженным глазом. Размеры их варьируют в пределах при-
1 Стебельчатая гидра в 1917 г. П. Шульце (Р. Schulze) была выделена из рода Hydra в самостоятельный род Pelmatohydra. Однако в 1948 г. Юер (Ewer) в результате обстоятельной ревизии систематики гидр вновь объединяет роды Hydra н Pelmatohydra, считая, что наличие стебля не является достаточным и надежным признаком для обоснования самостоятельного рода.
близительно от 2—3 мм до I —1,5 см (не считая длины щупалец) в зависимости от вида и физиологического состояния животного.
Гидры хорошо живут в аквариумах с водяными растениями. Чтобы они длительно жили и размножались, их следует регулярно кормить. Лучшей пищей являются дафнии. При отсутствии их, особенно зимой, гидр можно питать личинками Chirono-mus, нарезанными предварительно на куски, или даже маленькими кусочками дождевого червя. Если пища неподвижна, то приходится остроконечным пинцетом подносить ее непосредственно к щупальцам гидры.
В естественных условиях гидру удается находить в водоемах в северной и средней полосе СССР приблизительно с июня до конца сентября. В летние месяцы она размножается лишь вегетативным путем. Образование половых продуктов наблюдается обычно лишь осенью. После полового процесса гидры отмирают и весной вновь развиваются из оплодотворенных перезимовавших яиц.
В искусственных условиях в аквариумах можно содержать гидр в течение всей зимы, причем они размножаются путем почкования. Основными условиями для этого служат более или менее равномерная комнатная температура и регулярное кормление.
Встречающиеся в пресных водах гидры относятся к двум родам Chlorohydra и Hydra.
Hydra oligactis (см. рис. 149), обычно называемая стебельчатой гидрой, характеризуется относительно длинным стебельком. Chlorohydra обладает симбиотическими зелеными водорослями в клетках тела и поэтому окрашена в ярко-зеленый цвет.
Окраска других видов гидр (серая, коричневатая, красноватая) зависит от цвета энтодермы, клетки которой имеют многочисленные, главным образом пищевые включения. Изменяя характер питания гидр, можно менять их окраску.
При изучении гидры следует применить разнообразную методику. Многие черты строения ее можно разглядеть на живом объекте под лупой, бинокулярной лупой и микроскопом. Для изоляции отдельных элементов тканей применяется мацерация, которую производят одним из следующих способов. Живую гидру помещают на 20— 30 мнн в 30° спирт. После этого ее переносят осторожно пипеткой на предметное стекло в воду и слегка придавливают покровным. При этом гндра распадается и удается разглядеть отдельные клетки. Более совершенен метод, предложенный Роскиным. Живую гидру помещают на 1 мин в смесь, состоящую из 9 частей 5%-ного раствора уксусной кислоты и 1 части 2%-ного раствора осмиевой кислоты. После этого ее переносят в каплю воды на предметное стекло и расщепляют иглами или кисточкой. Получается большое число совершенно изолированных и хорошо сохранившихся клеток. Дополнительно препарат можно подкрасить каким-нибудь водным основным красителем, чтобы отчетливее выявить ядра. Рекомендуется использовать фазо-контрастное устройство.
Кроме мацерации для изучения строения гидры необходимо изготовить срезы как поперечные, так и продольные толщиной 5—7 мкм. Фиксировать гидру для срезов можно различными способами. Удовлетворительные результаты дает сулема с уксусной кислотой и смесь Буэна. Хорошо фиксирует гидр смесь Шампи. Окрасить срезы лучше всего железным гематоксилином с подкраской эозином. Хорошие результаты дает также окраска эозиназуром. Ее нельзя, однако, применять после фиксации по Шампи. Для окраски срезов можно также рекомендовать смесь Маллори, особенно отчетливо выявляющую основную пластинку.
Тотальные препараты гидр дают гораздо меньше для изучения, чем живой объект, поэтому изготовление их не имеет особенного смысла.
Для изучения пищеварения гидры можно применить некоторые специальные методы кормления окрашенной пищей, о которых будет сказано ниже.
Изучение живого объекта. Тело Hydra oligactis имеет более или менее правильную цилиндрическую форму. Одним концом гидра обычно прикрепляется к субстрату. На противоположном помещается ротовое отверстие, окруженное щупальцами. В самом теле гидры различают следующие части, терминологию которых мы применяем по Гелею (см. его работу в Zool. Anzeiger, Bd. LXIV, H, 5/6, 1925, с. 117—125). Верхний конец, окруженный щупальцами и несущий ротовое отверстие,
носит название гипостома. За ним следует желудочный отдел, переходящий в стебелек. Последний по сравнению с желудочным отделом имеет несколько меньший диаметр. Стебелек заканчивается подошвой, которая непосредственно и прикрепляется к субстрату. Желудочный отдел обычно отличается от стебелька и по окраске. Он окрашен в более темный коричневатый цвет. Это зависит от того, что в этом отделе совершается пищеварение и эктодермальные клетки его богаты включениями. Указанные отделы тела гидры отличаются и по гистологическому строению, о чем подробно будет сказано ниже.
Число щупалец у Н. oligactis варьирует от 5 до 8—9. Изредка можно встретить и большее число щупалец. Чаще всего наблюдается 6— 7 щупалец. Длина щупалец различна, так как они обладают способностью сильно вытягиваться и сокращаться. Особенно длинными бывают щупальца у голодающих гидр, где они во много раз могут превосходить длину тела. Поверхность щупалец не гладкая. При рассматривании животного под бинокуляром или при малом увеличении микроскопа отчетливо видны многочисленные небольшие утолщения. Они представляют собой батареи стрекательных клеток, расположенные в очень большом числе на щупальцах. Если слегка придавить гидру покровным стеклом, то можно рассмотреть строение разных типов стрекательных клеток. Их удобнее, однако, изучать на мацерированном материале.
Если содержать гидр в аквариуме, то иногда удается наблюдать их своеобразный способ движения (рис. 148). Он заключается в том, что гидра оральным концом прикрепляется к субстрату при помощи щупалец. После этого подошва отрывается от субстрата и гидра прикрепляется ею в новом месте. При этом нередко гидра в течение некоторого времени как бы «стоит на голове», прежде чем прикрепится вновь подошвой.
Рис. 148. Последовательные стадии передвижения гидры (по Трамблэ)
На живой гидре следует познакомиться со способностью ее тела и щупалец к сокращению. При механическом или ином раздражении гидра быстро сокращается. Тело ее укорачивается и становится толще, так что вся гидра превращается как бы в комочек. Щупальца также сильно укорачиваются и утолщаются. При прекращении действия раздражителя гидра довольно скоро вновь вытягивается и принимает обычную форму. Сокращение тела гидры происходит временами и без всякого раздражения извне. Такие «спонтанные сокращения», вероятно, играют роль при дыхании и, возможно, захвате пищи.
Кроме указанных форм движения и сокращения гидры способны еще перемещаться по субстрату путем медленного скольжения на подошве. Механизм этой формы движения в достаточной степени еще не выяснен.
На живом материале следует также провести наблюдения над почкованием. Чтобы вегетативное размножение имело место, необходимо регулярно питать гидр и содержать их при комнатной (не низкой) температуре. Для удобства просмотра и зарисовки материала рекомендуется рассадить гидр в небольшие кристаллизаторы.
У Н. oligactis почки никогда не образуются в области стебелька. Зона почкования располагается над стебельком. Почки образуются в известной последовательности. Первая почка формируется у самой границы желудочного отдела и стебелька. Следующая образуется несколько ближе к оральному концу и т. д. При этом самая зона форми-
Рис. 149. Hydra oligactis. Различные стадии почкования (рисунок с живого объекта при небольшом увеличении)
рования почек располагается по спирали вокруг продольной оси животного (рис. 149). Почка сначала имеет вид небольшого вздутия на теле материнского организма. Ее рост совершается довольно быстро. Вскоре на дистальном конце почки начинается образование щупалец. У Н. oligactis щупальца закладываются не все сразу. Сначала образуются лишь два щупальца, затем формируется третье, четвертое и т. д. до тех пор, пока не образуется нормальное их число.. Во время формирования щупалец образуется и ротовое отверстие. После того как образовались щупальца, дочерняя гидра отделяется от материнского организма. При благоприятных условиях температуры и питания весь процесс развития почки завершается в 2—3 дня.
Образование половых продуктов на живых гидрах удается наблюдать обычно лишь осенью. Гидры, приступившие к формированию гонад, почти никогда не почкуются. Н. oligactis в отличие от некоторых других видов гидр является раздельнополой. Гонады образуются в эктодерме в виде характерных набуханий. Порядок появления и характер расположения гонад в общем соответствует таковому почек. Семенники образуются в большем количестве, чем яичники (рис. 150). О гистологическом строении гонад будет сказано ниже, так как с ними придется познакомиться при изучении срезов.
Наконец, на живой гидре следует отметить еще одну деталь ее строения, которая часто ускользает от наблюдения. Дело в том, что ротовое отверстие не единственное, ведущее в гастральную полость, как это обычно указывается. На аборальном полюсе в центре подошвы существует еще небольшое отверстие — аборальная пора. У прикрепленной к субстрату гидры аборальная пора обычно закрыта. Если отделить гидру от субстрата и рассматривать ее подошву под бинокуляром, то обычно удается обна-
д ружить аборальную пору в виде очень не-
большого отверстия. Особенно отчетливо Рис. 150. Hydra oligactis (Х15). аборальная пора выступает, если предвари-с женс7имиКИго/а°дНаамДиМтельно накормить гидру окрашенной в ка-
Рис. 151. Эктодермальная эпителиально-мускульная клетка гидры (по Рос-кину)
красными водяными клещами сем. Hydracarina). Функция этого образования у гидры не вполне ясна. Оно, безусловно, не является анальным отверстием, так как непереваренные остатки пищи всегда выбрасываются через рот. Возможно, что аборальная пора играет известную роль при откреплении гидры от субстрата. По-видимому, подошва, при помощи которой прикрепляется гидра, функционирует отчасти как присоска. При откреплении гидры аборальная пора открывается и через нее из гастральной полости в полость присоски поступает жидкость, что облегчает отделение подошвы от субстрата
На живой гидре следует также провести ряд наблюдений над питанием и пищеварением. Это удобнее сделать после изучения ее гистологического строения, поэтому эта работа и излагается ниже (с. 207).
Мацерация гидры. Прежде чем приступить к изучению срезов, можно рекомендовать произвести мацерацию гидры. Изучение отдельных изолированных клеточных элементов эктодермы и энтодермы облегчит понимание тех соотношений между клетками, которые наблюдаются при изучении срезов. При этом следует иметь в виду, что на мацерированном материале удается отчетливо разглядеть лишь некоторые клеточные элементы тела гидры и для того, чтобы получить полное представление об ее гистологии, необходимо изучение срезов.
Следует применять параллельно оба, указанных выше (с. 193) метода мацерации. При мацерации спиртом получают очень отчетливые картины строения стрекательных клеток, но плохо видны другие клеточные элементы. При мацерации по методу Роскина хорошо сохраняются эпителиально-мышечные и некоторые другие клетки.
Из элементов эктодермы обращают прежде всего внимание на эпителиально-мускульные клетки (рис. 151). Каждая клетка состоит из цитоплазматической части и мускульного отростка. Последний в теле гидры обращен в сторону мезоглеи, причем все мускульные выросты эктодермальных клеток направлены параллельно длинной оси животного.
Цитоплазматическая часть эктодермальных эпителиально-мускульных клеток имеет более или менее цилиндрическую форму, часто несколько расширяется к дистальному концу. Высота клетки бывает раз-
1 Об аборальной поре и ее значении см. статью И. Канаева в Zool. Anzeiger, Bd. LXXVI, H, 1/2, 1928, с. 37—44.
лична в зависимости от того, на каком участке тела она расположена. На щупальцах эпителиально-мускульные клетки не высоки. На теле, напротив, их длинная ось во много раз превосходит ширину. Цитоплазма имеет обычно многочисленные включения в форме гранул и мелких вакуолей. Ядро пузыревидное с ясно видимым ядрышком. Цри мацерации по методу Роскина ядра очень хорошо видны без всякой специальной окраски. В мускульной части клетки залегает мускульное волоконце (фибрилла), оно отчетливо видно благодаря сильной лучепреломля-емости. Согласно исследованию Роскина сама фибрилла состоит из плотного футляра и более жидкого содержимого. Мускульный отросток имеет иногда довольно значительную длину, превосходящую высоту эпителиальной части клетки. Нужно, однако, иметь в виду, что концы муск-. льных выростов обычно обрываются. Иногда наблюдается ветвление мускульных отростков, особенно часто это имеет место у эпителиально-мускульных клеток эктодермы подошвы.
На мацерированных спиртом гидрах очень хорошо видны стрекательные клетки. Они располагаются в эктодерме и особенно многочисленны в щупальцах. Каждая стрекательная клетка состоит из протоплазмы с ядром (без ядрышка) и стрекательной .капсулы, называемой иначе книдой или нематоцистой, причем в мацерированных препаратах значительная часть книд лежит вне клеток.
Рис. 152. Hydra oligactis. Различные типы стрекательных клеток (по Шульце). А — пенетранта с невыброшенной стрекательной нитью; Б — пенетранта с выброшенной стрекательной нитью; В—пенетранта, стрекательная нить которой внедрилась в покровы добычи; Г — воль-вента; Д — глютинанта стрептолина; Е — глю-тинанта стреолина.
1 — стрекательная нить. 2 — шипики, 3 — стилеты, 4— шейка, 5— крышечка
От стрекательной клетки наружу выдается особый чувствительный волосок — книдоциль. Стрекательная капсула обладает плотной хитиноидной стенкой, наполнена жидкостью и в ней располагается скрученная спирально полая внутри нить, которая может выбрасываться наружу. Стрекательная нить представляет собой впяченное внутрь продолжение стенки капсулы. На препаратах обычно имеется некоторое количество стрекательных клеток с выброшенной нитью. Существует несколько типов стрекательных клеток, отличающихся друг от друга по строению стрекательных капсул.
У гидр имеется четыре типа стрекательных капсул (книд). Наиболее крупные пенетранты (рис. 152, А—В). Стрекательная капсула имеет здесь грушевидную форму. На своем дистальном конце она прикрыта крышечкой, раскрывающейся в
Рис. 153. Последовательные стадии выстреливания пенетранты (по Шульце из кн. Канаева)
момент выбрасывания нити. Непосредственным продолжением стенки капсулы является шейка, вокруг которой частично закручена нить. На месте перехода шейки в нить имеется три стилета и несколько рядов мелких шипиков. Пенетранты служат главными орудиями нападения. Их нить пробивает покровы добычи. До выстрела пенетранты три стилета (шипа) сложены вместе и направлены вперед (рис. 153). В момент выстрела они вылетают вперед первыми, внедряются в ткани добычи, а затем разворачиваются в разные стороны и назад, увеличивая ранку и закрепляясь в ней наподобие гарпуна. Тотчас же после этого (весь процесс измеряется долями секунды) в образовавшуюся ранку происходит
выстреливание нити, которая выворачивается, как палец перчатки, внося вместе с тем ядовитые для жертвы вещества. Шипы, однако, не всегда
проникают в ранку, иногда они остаются вне ее, и в ткань жертвы про-
никает лишь нить, снабженная очень шипиками. Длина выстреленной нити пенетранты превосходит общую длину книды примерно в 30 раз.
Вторую категорию стрекательных капсул представляют собой вольвенты. Они меньших размеров, чем пенетранты, но также приблизительно грушевидной формы. Стрекательная нить образует внутри них петлю (см. рис. 152, Г). При выбрасывании нити она не пробивает покрова добычи, а обвивается вокруг различного рода выступов и придатков (вокруг хитиновых волосков, щетинок и т. п.) (рис. 154).
мелкими направленными назад
Рис. 154. Вольвенты Hydra oligactis, стрекательные нити которых обвились вокруг хитиновых волосков конечности низшего рачка (по Шульце)
На нити вольвентов также имеются маленькие шипики, направленные назад в сторону книды.
Третью категорию стрекательных капсул представляют собой стрептолины (иначе большие глютинанты) (см. рис. 152, Д). Они несколько крупнее вольвент и вытянуты в длину. Обладают длинной нитью, закрученной в покоящейся книде, как в продольном, так и в поперечном направлении. Шейка, как и у вольвент, отсутствует, на нити имеются мелкие, расположенные по спирали шипики. Этот тип книд является, по-видимому, орудием зашиты.
Четвертая категория стрекательных капсул — стереолины (малые глютинанты) несколько мельче стрептолин. Нить их образует петли по продольной оси книды (см. рис. 152, Е) и лишена шипиков. При выстреле она оказывается липкой. Стереолины служат, вероятно, для прилипания к субстрату в процессе движения гидры. Стрептолины и стереолины нередко объединяют в общую группу, называемую глюти-нантами.
Процесс выбрасывания нити необратим. Стрекательная клетка, выбросившая нить, вскоре погибает. В течение всей жизни гидры происходит новообразование стрекательных клеток за счет особых недифференцированных элементов, так называемых интерстициальных или i-клеток. Последних, однако, на мацерированных гидрах рассмотреть не удается, они видны на срезах.
При хорошо удавшейся мацерации из эктодермальных элементов можно еще рассмотреть нервные клетки (рис. 155). Они звездчатые, мультиполярные и обладают длинными отростками. Ядро в нервных клетках крупное, пузыревидное.
Из элементов энтодермы при мацерации хорошо видны эктодермальные эпителиально-мускульные клетки. Они в общем напоминают по строению соответствующие клетки эктодермы. Отличается тем, что мускульный вырост здесь развит слабее, длина его меньше. В цитоплазме имеются более многочисленные включения, чем в клетках эктодермы. Среди этих включений различной формы и величины главная масса представляет собой пищевые включения, находящиеся на разных стадиях внутриклеточного пищеварения.
Изучение мацерированной гидры необходимо дополнить рассмотрением срезов.
Срезы через гидру.
(ПО Следует приготовить серию поперечных и про-
Рис. 155. Нервные клетки из эктодермы гидры Шнейдеру)
дольных срезов толщиной в 5 мкм. При рассматривании срезов даже при малом увеличении микроскопа ясно видно, что гидра — двухслойное животное — состоит .из двух слоев клеток: наружного — эктодермы и внутреннего — энтодермы, ограничивающих внутреннюю гастральную-полость. Между ними располагается тонкая бесструктурная прослойка мезоглеи — опорная пластинка (рис. 156). Гастральная полость продолжается также и в щупальца, которые являются полыми. Стенки щупалец состоят из тех же слоев, что и стенка тела. Общие гистологические различия между частями тела Н. oligactis сводятся к следующему. Эктодерма щупалец состоит из невысоких эктодермальных клеток. Энтодерма щупалец не имеет мускульных отростков. Опорная пластинка в щупальцах очень тонка. В туловище, а в особенности в стебельке и подошве, опорная пластинка значительно толще, чем в щупальцах. В области гипостома энтодерма образует несколько складок (рис. 157), прилегающих друг к другу наподобие долек апельсина. Соотношение этих складок хорошо поясняет прилагаемая схема. Число складок энтодермы в области гипостома обычно равно шести. Наличие их делает возможным растягивание ротового отверстия, что имеет место при заглатывании пищи, часто превосходящей своими размерами поперечное сечение тела гидры. При заглатывании пищи указанные складки в большей или меньшей степени расправляются.
Наиболее богат различными клеточными элементами желудочный отдел тела гидры. Стебелек на срезах окрашивается слабее, чем остальные части тела гидры. Это зависит от того, что клетки энтодермы-
Рис. 156. Hydra oligactis (Х80). Поперечный разрез (ориг.):
1 — эктодерма, 2 — энтодерма, 3 — опорная пластинка, 4 — стрекательная капсула, 5 — группа интерстициальных клеток, 6 — железистая клетка энтодермы
Рис. 157. Hydra oligactis. Поперечный разрез в области гипостома (по Канаеву):
Г —эктодерма, 2 —складки энтодермы
Рис. 158. Гистологическое строение разных отделов тела стебельчатой гидры (поперечные срезы, несколько схематизировано) (по Хайман из Канаева).
А— гипостом; Б — туловище; В — подошва; Г — стебель:
1 — эктодерма, 2 — ацидофильные железистые клетки энтодермы, 3—базофильные железистые клетки энтодермы, 4 — интерстициальные клетки, 5 — гранулы секрета в эктодермальных клетках подошвы
Рис. 159. Книды и их строение. А— батареи книд на щупальце гидры (по Корда); Б — схема строения батареи книд (по Бялашевичу из кн. Канаева):
1 — батарея книд, 2 — пенетранта, 3 — вольвенты, 4— ядро эпителиально-мышечной клетки
стебелька сильно вакуолизированы и относительно бедны включениями. Подошва окрашивается довольно сильно, благодаря наличию в эктодерме ее особых железистых клеток, выделяющих липкий секрет, служащий для прикрепления животного к субстрату.
После общего знакомства со строением эктодермы и энтодермы в различных отделах тела гидры следует перейти к более детальному изучению их гистологии (рис. 158). Отдельные клетки как экто-, так и энтодермы не резко отграничены друг от друга и богаты разнообразными включениями, что создает довольно сложную гистологическую картину, при изучении которой хорошо пользоваться иммерсионной системой.
Главная масса эктодермы состоит из эпителиально-мускульных клеток, строение которых уже рассматривалось выше. На срезах связи между цилиндрической эпителиальной частью клетки и мускульным выростом не видно. Но миофибриллы мускульного выроста, непосредственно прилежащие к опорной пластинке, особенно при окраске железным гематоксилином, выступают очень отчетливо. На продольных срезах они видны в форме волокон, на поперечных — в виде точек, так как мускульные выросты эпителиально-мышечных клеток проходят параллельно продольной оси гидры. По наружному краю эпителиально-мускульных клеток, граничащему с внешней средой, располагается ряд гранул, образующих в совокупности некоторое подобие кутикулы. Стрекательные клет
ки, подробное описание которых дано выше, хорошо видны и на срезах. Следует отметить их распространение в эктодерме. Вполне сформированные стрекательные клетки обычно внедряются внутрь эпителиально-мускульных клеток. Они особенно многочисленны в эктодерме щупалец, где образуют характерные батареи, хорошо видимые на живой гидре (с. 198). На срезах следует более подробно рассмотреть состав батареи. Каждая батарея помещается внутри одной эпителиально-мускульной клетки (рис. 159) и состоит из 3—15 книд. В центре располагаются одна-две пенетранты, по сторонам от них — стрептолины и стереолины, еще дальше к периферии — вольвенты. Стрекательные клетки, несущие глютинанты и вольвенты в своей базальной части, образуют выросты, направленные к мускульным волоконцам, к которым они, по-видимому, прикрепляются, как к якорю. В области гипостома стрекательные клетки имеются лишь в небольшом количестве. В области желудочного отдела они многочисленны, тогда как в эктодерме стебелька стрекательных клеток очень мало.
Книды разных типов распределяются по телу гидры далеко неравномерно. Об их расположении у Hydra oligactis дает представление следующая таблица, составленная Бялашевичем (1914) (в таблице стрептолины и стереолины объединены в общую группу — глютинанты).
Таблица соотношения разных типов книд в различных отделах тела гидр, %
Область тела П еиет-оанты Глюти - нан ты Вольвенты
1. Щупальца 2. Гипостом и передняя гаст- 28 7 65
ральная часть тела .... 30 65 5
3. Гастральная 44 56 0
4. Ножная 100 0 0
Из таблицы видно, что вольвенты сосредоточены исключительно в передней части тела, в заднем отделе встречаются только пенетранты. В энтодерме функционирующих стрекательных клеток нет, но в ней иногда встречаются перевариваемые отработанные книды, а также молодые, еще не созревшие, которые в дальнейшем попадут в эктодерму..
Среди эпителиально-мускульных и стрекательных клеток располагаются интерстициальные клетки (иначе кратко обозначаемые i-клетка-ми) (см. рис. 158, А, 4). Они небольших размеров, в несколько раз мельче эпителиальных клеток, цитоплазма их сильно воспринимает краску, форма их округлая или овальная. Ядро, по сравнению с массой цитоплазмы, велико. Интерстициальные клетки располагаются в главной своей массе у основания эпителиально-мускульных клеток, около опорной пластинки. Базальные части эпителиальных клеток не тесно прилежат друг к другу, между ними имеются просветы. В них, главным образом, и локализуются интерстициальные клетки, которые часто располагаются группами (см. рис. 158, 4). Больше всего их имеется в
эктодерме желудочного отдела. В стебельке они совершенно отсутствуют. Изредка на препаратах удается наблюдать митотическое деление этих клеток. Значение интерстициальных клеток в жизни гидры очень велико. Они представляют собой недифференцированные, эмбриональ-
яые элементы, за счет которых развиваются все другие клеточные эле-
Рис. 160. Группа клеток энтодермы гидры (по Шнейдеру из кн. Канаева):
1 — пищеварительная (эпителиально-мускульная), 2 — железистая, 3—чувствительная
Рис. 161. Железистые ацидофильные (тектиэпителиальные) эктодермальные клетки гидры (из кн.
Канаева)
менты как эктодермы, так и энтодермы На срезах, особенно через щупальца, нередко удается разглядеть различные стадии формирования стрекательных клеток из интерстициальных. В период половогс размножения за их же счет образуются и половые клетки.
Однако интерстициальные клетки — не единственный источник формирования клеточных элементов тела гидры. Эпителиально-мускульные и железистые клетки как эктодермы, так и энтодермы могут самостоятельно делиться. Лишь стрекательные клетки, по-видимому, совершенно не способны к делению и всегда образуются из интерстициальных клеток.
Кроме рассмотренных типов клеток в состав эктодермы входят нервные клетки. Рассмотреть их обычно на срезах не удается. Некоторые авторы описывают в эктодерме особые чувствительные клетки, которые также без специальных методов обработки не видны.
Энтодерма также слагается из нескольких типов клеток. Главную массу ее составляют пищеварительные клетки более или менее ясно выраженной цилиндрической формы, снабженные мускульным выростом, прилежащим к опорной пластинке.
На стороне, обращенной в пищеварительную _ полость, каждая клетка несет два жгутика. Число жгутов может изредка увеличиваться до трех, четырех и даже пяти у одной клетки. В цитоплазме у основания каждого жгутика располагается базальное тельце. Его удается разглядеть только при условии хорошо удавшейся фиксации. В этом отношении лучшие результаты дает смесь Шампи. Мускульные выросты эктодермальных клеток располагаются в кольцевом направлении, перпендикулярно к продольной оси гидры. Поэтому на продольных срезах они оказы
:2О4
ваются перерезанными поперек и видны в знде точек. Напротив, на поперечных срезах хорошо видны мускульные волоконца (фибриллы), лежащие в мускульном выросте эктодермальных клеток. Мускульные элементы энтодермы являются антагонистами мускульных выростов эктодермы. При сокращении их и расслаблении эктодермальной мускулатуры происходит вытягивание тела гидры. На срезах так же, как и на мацерированном материале, в пищеварительных клетках энтодермы видны многочисленные включения. Их особенно много у хорошо накормленных особей. Эти включения частью представляют собой пищевые частицы, частью — экскреторные гранулы. Последние окрашены в темный цвет. Ядро довольно крупное, с ядрышком, располагается в средней части клетки. Пищеварительные эпителиально-мускульные клетки способны к фагоцитозу и внутриклеточному пищеварению.
Кроме эпителиально-мускульных пищеварительных клеток в состав энтодермы входят железистые клетки (рис. 160). У гидры описаны два типа эктодермальных железистых клеток. Первый — это тектиэпители-альные, или ацидофильные, клетки (рис. 161). Секрет этих желёз элективно окрашивается кислыми красками (например, эозином), он вы
Рис. 162. Hydra oligactis. Продольный разрез в области мужской гоиады (ориг.):
1 = эктодерма, 2 — энтодерма, 3 мужская половая железа
Рис. 163. Сперматогенез гидры. А— В — разные стадии развития семенника; Г — образование и развитие сперматид; Д — созревающие и зрелые сперматозоиды в семеннике (па Танрейтеру из кн. Канаева);
1 — сперматогонии, 2 — сперматоциты, 3 — сперматиды и спермин
деляется в пищеварительную полость и обладает протеолитическим действием. Эти клетки не имеют ни мускульных выростов, ни жгутиков. Второй тип железистых клеток — это базофильные клетки. Они иногда имеют жгутики и небольшой мускульный вырост. Они обладают гранулами базофильного секрета. Ацидофильные клетки встречаются в энтодерме гипостома и туловища и отсутствуют в стебельке. Базофильные клетки расположены в основной массе в области гипостома (см. рис. 158, А).
Совершенно особый характер имеют эктодермальные клетки Н. oligactis в области стебелька. Они обладают многочисленными вакуолями, напоминая растительные клетки. На препаратах цитоплазма имеет вид
Рис. 164. Овогенез гидры (по Брияну из кн. Канаева):
1 — овогония, 2 — питательные клетки
Рис. 165. Яйцо гидры (овогоиия) в амебообразной стадии (по Клейненбергу из кн. Канаева)
тонких тяжей, располагающихся между объемистыми вакуолями. Пищевые включения отсутствуют.
В состав энтодермы входят еще интерстициальные клетки. Количество их, однако, здесь очень невелико. Кроме того, некоторые авторы описывали в составе энтодермы немногочисленные нервные клетки. Видеть их на срезах не удается.
Гидры, собранные осенью, позволяют рассмотреть на срезах строение гонад. Последние развиваются за счет интерстициальных клеток в эктодерме (об их расположении на теле гидры см. с. 203).
В мужской половой железе (рис. 162) находим различные стадии созревания мужских половых клеток, причем клеточные элементы здесь очень мелки. Сперматогонии располагаются в непосредственном соседстве с мезоглеей. Ближе к периферии лежат сперматоциты и зрелые сперматозоиды. Последние обладают небольшой цилиндрической головкой, короткой широкой шейкой и длинной хвостовой частью (рис. 163). Эпителиально-мускульные клетки в области семенников сохраняются. Они прикрывают гонаду снаружи, их проксимальные части продолжаются вплоть До основной пластинки.
В женской половой железе нахо
дятся яйцевые клетки на разных стадиях роста. Интересной особенностью яичника гидры является то.
что дефинитивных размеров в яичнике достигает обычно лишь одна яйцевая клетка. В процессе роста более крупные озоциты образуют псевдоподии и поглощают более мелкие. За счет этого фагоцитоза и происходит рост овоцитов. В результате в каждом яичнике лишь одна яйцевая клетка заканчивает рост и становится способной к оплодотворению. В зависимости от того, на какой стадии развития находится женская половая железа, на срезах удается обнаружить различные стадии указанного процесса (рис. 164).
В период роста яйцевая клетка образует многочисленные псевдоподии (рис. 165). В конце роста она становится шаровидной, прорывает эктодерму и выходит на поверхность гидры. Зрелое яйцо остается связанным с поверхностью гидры лишь при помощи тонкой цитоплазматической ножки. Самый процесс оплодотворения и первые стадии развития яйца происходят на теле гидры.
Вокруг оплодотворенного и развивающегося яйца образуется оболочка, называемая эмбриотекой. Форма эмбриотеки и характер ее скульптуры представляют собой важный систематический признак при определении гидр.
Питание гидры. На живом объекте следует проследить процесс захвата гидрой пищи. В качестве последней лучше всего использовать живых дафний. При соприкосновении со щупальцами гидры дафния как бы «прилипает» к ним. Это объясняется действием стрекательных клеток, которые частью пробивают покровы (пенетранты), частью же при помощи нитей обвиваются вокруг волосков добычи (вольвенты). В течение нескольких минут дафния производит резкие движения, пытаясь освободиться, что обычно не удается. Через короткий срок движения добычи прекращаются, что зависит от ядовитого, парализующего действия стрекательных нитей. После этого начинается процесс заглатывания пищи. Движением щупалец добыча приближается к ротовому отверстию. Последнее сильно растягивается, и добыча постепенно заглатывается в гастральную полость. Ротовое отверстие гидры обладает исключительной растяжимостью. Если добыча велика, то в момент заглатывания ее диаметр ротового отверстия превосходит диаметр гидры в несколько раз (3—4 раза). Через 4—5 ч пребывания пищи в гастральной полости непереваренные остатки вновь выбрасываются наружу через ротовое отверстие. В частности, если пищей служила дафния, то выбрасываются все хитиновые части, которые гидрой не могут быть переварены.
Изучению процесса пищеварения у гидры посвящено несколько исследований. Согласно работам Беутлер (1924, 1927) у гидры* имеет место как внеклеточное пищеварение в гастральной полости, так и внутриклеточное. Попадающая в гастральную полость пища подвергается действию ферментов, разжижающих белки. Отдельные клетки энтодермы параллельно с этим процессом при помощи псевдоподий заглатывают как твердые частички, так и капельки жидкости. В эктодермальных клетках протекает внутриклеточное пищеварение. Наличие его легко показать следующими простыми приемами, тоже указанными Беутлер. Живых дафний помещают в эмульсию кармина на 2—3 ч. После этого кишечник их оказывается в значительной степени запол
ненным кармином, который также в виде мельчайших частиц оседает на конечностях и других частях тела рачка. Дафнию убивают тонкими иглами, снимают панцирь и скармливают гидре. Через 5—6 ч накормленную гидру подвергают мацерации. В клетках энтодермы удается обнаружить в значительном количестве зерна кармина, которые лежат в пищеварительных вакуолях. Таким образом, кармин оказывается заглоченным эктодермальными клетками, чем и доказывается способность их к активному заглатыванию твердых частиц, попавших в гастральную полость. Скармливать гидрам нужно убитых, а не живых дафний потому, что при захвате живых дафний гидрой последние производят судорожные движения, во время которых часть кармина с них сбрасывается, а кишечник частично освобождается от содержимого. Вместо кармина можно воспользоваться тушью. При этом результаты получаются, однако, менее убедительными, так как в клетках энтодермы всегда имеются темноокрашенные экскреторные гранулы, которые легко спутать с заглоченными частичками туши.
Вместо мацерации можно прибегнуть к изготовлению срезов. При этом их не следует окрашивать, чтобы зерна кармина или туши в клетках энтодермы были видны достаточно отчетливо.
В процессе пищеварения гидра производит периодически сокращения тела, сопровождающиеся вытягиванием. Эти своеобразные перистальтические движения способствуют перемешиванию пищи и ее равномерному распределению в пищеварительной полости. Кроме того, пищеварительная кашица двигается в пищеварительной полости благодаря постоянной работе жгутиков эктодермальных клеток.
ОТРЯД LEPTOLIDA
Tubularia sp.
Материал и методы изучения. В наших морях встречается несколько видов рода Tubularia. Их можно найти в Баренцевом, Белом и Черном морях, а также вх Японском море. В Каспийском и Азовском морях и в опресненной части Балтийского моря Tubularia не встречается. На Мурманском побережье Т. larynx живут на небольших глубинах, так что добывание материала не представляет особых затруднений.
Общую форму колонии и строение отдельных гидрантов следует рассмотреть на живом или фиксированном формалином или спиртом материале при помощи лупы и бинокуляра. Изготовить тотальные препараты отдельных гидрантов и гонофоров, окрасив их квасцовым кармином. Кроме того, приготовить серию срезов, порезав гидранта с гонофорами в продольном направлении. Дополнительно желательно сделать и поперечные разрезы. Для срезов материал фиксируют сулемой с уксусной кислотой или жидкостью Ценкера. Срезы окрашивают железным гематоксилином или гематоксилином Бёмера с подкраской эозином.
Описание организации Tubularia мы даем применительно к Т. larynx, от которой другие виды, встречающиеся в наших морях, отличаются лишь некоторыми деталями строения.
Изучение живого объекта или тотальных препаратов. Колонии Tubularia (рис. 166) обладают слабо развитой гидроризой1, от которой
1 Гидроризой называются стелющиеся по субстрату корневидные выросты стволов колонии.
Рис. 166. Tubularia larynx. Общий вид колонии.
берет начало слабо ветвящийся гидрокаулусветви его заканчиваются отдельными, довольно крупными гидрантами. Здесь имеет место моноподиальный тип ветвления колонии. Это значит, что отдельные ветви колонии представляют собой разрастание в длину тела полипа, который остается на вершине оси. При этом зона роста и почкования помещается непосредственно у основания ветвей. Путем вытягивания базальной части тела отпочковавшихся полипов образуются побочные ветви колонии. Моноподиальный тип ветвления характерен для большинства представителей подотряда Athe-cata, к которму принадлежит и Tubularia. Гидрориза и гидрокаулус покрыты снаружи хитиноидной кутикулой, выделяемой эктодермой и носящей название перидерма, а также перисарка или тэки. Перидерм играет роль наружного скелета колонии. Его толщина у Tubularia невелика. На гидрантов перидерм не распространяется, они являются «голыми». Отсутствие тэки, прикрывающей гидрантов, представляет собой отличительную характерную черту подотряда Athecata.
Тело отдельных гидран* тов имеет форму бутыли
Рис. 167. Tubularia larynx (х25). Отдельный гидрант (по Альману): /—оральные щупальца, 2 — аборальные щупальца, 3 — гонофоры
1 Отходящие от гидроризы стволы колонии, несущие гидрантов, называются гидрокаулусом.
(рис. 167). Аборальная часть расширена, оральный отдел вытянут и образует гипостом, на конце которого помещается ротовое отверстие Каждый гидрант несет два венчика щупалец. Щупальца орального венчика коротки и непосредственно окружают ротовое отверстие. Абораль ные щупальца гораздо длиннее оральных и прикрепляются к телу поли па у его основания. Каждый венчик слагается из 15—20 щупалец.
От тела полипа, несколько ближе к оральному полюсу, чем осно
вание нижнего венчика щупалец, но в непосредственном соседстве с ни ми отходят особые щупальцевидные придатки, несущие гонофорь (рис. 167,5). Последние представляют собой редуцированное медузо идное поколение. В них развиваются половые продукты. Tubularia — раздельнополы. Поэтому на одной колонии присутствуют либо муж ские, либо женские гонофоры. Развитие и созревание их совершается I определенной последовательности. Дистально располагаются наиболее зрелые гонофоры. По своей структуре они приближаются к организа ции медузы, отличаясь от последней главным образом слабым разви тием мезоглеи в зонтике и отсутствием паруса (velum). Тип строени? гонофора, который имеет место у Tubularia и обладает основными чер тами организации медузы, называют эумедузоидом. Детали строени? гонофоров следует рассмотреть на срезах, но основные части их виднь
и на тотальных препаратах Зрелый гонофор имеет яйцевидную форму. По длинной оси его располагается spadix — часть, соответствующая ротовому стебельку свободноплавающих медуз В эктодерме этой части гонофора и развиваются половые продукты. Наружная стенка гонофора представляет собой несколько редуцированный зонтик со слабс развитой мезоглеей. В зрелых гонофорах spadix выдается наружу на дистальном конце.
У женских особей Tubularia оплодотворение яйцевой клетки-происходит в гонофоре, куда из морской воды проникают сперматозоиды. Здесь же протекает и развитие оплодотворенного яйца, которое в это время располагается между spadix и наружной стенкой гонофора. Из яйца развивается сначала личинка — планула,
Рис. 168. Tubularia larynx (ХЗО). Продольный разрез (по Кюкенталю):
1 — ротовое отверстие, 2 — эктодерма, 3 — энтодерма, 4— гонофор, 5 — валик у основания аборальных щупалец, 6 — гастральная полость
превращающаяся в свою очередь в так называемую актинулу. Последняя имеет уже два венчика щупалец и приближается по своей организации к полипу. Лишь достигнув стадии актинулы, личинка выходит из гонофора наружу. При изучении тотальных препаратов женских гонофоров в них нередко удается обнаружить указанные выше стадии развития. Актинулы по своим размерам приближаются к spadix гонофора.
Срезы через Tubularia. На продольном разрезе через гидранта Tubularia (рис. 168) рассматривают два слоя клеток — эктодерму и энтодерму, которые имеются и у гидры. В состав эктодермы входят те же основные типы клеток. Стрекательные клетки у Tubularia, особенно многочисленные в эктодерме щупалец, более однотипны, чем у гидры. Они обладают яйцевидными стрекательными капсулами. Эктодерма отделена от энтодермы тонкой бесструктурной опорной пластинкой. Энтодерма, выстилающая гастральную полость, в области гипостома образует некоторое количество складок, не обнаруживающих в своем расположении особой закономерности. Опорная пластинка в состав этих складок не вовлекается. Полость с выстилающей ее энтодермой продолжается в ствол колонии — гидрокаулус.
Щупальца в отличие от гидры не имеют внутренней полости. Их осевая часть сплошь заполнена клетками эктодермального происхождения. В околородовых щупальцах в дистальной их части клетки располагаются в один ряд. Ближе к основанию и у самого его основания они расположены в несколько рядов. От энтодермы, выстилающей внутреннюю полость, они отделены опорной пластинкой. Осевые клетки щупалец имеют своеобразную гистологическую структуру. Они сильно вакуолизированы, ядра оттеснены к периферии клеток. Имеется некото-
Рис. 169. Tubularia larynx. Разрез через основание аборального щупальца (из кн. Гофмана):
1—эктодерма, 2— хордоидная ткань валика у основания щупальца, 3 — энтодерм ма щупальца, 4 — основная пластинка
Рис. 170. Схема строения гонофора эумедузоидного типа (по Кюну):
1 — наружная эктодерма, 2 — внутренняя эктодерма, 3 — энтодерма, 4 — половые клетки, 5— spadix
Рис. 171. Tubularia sp. (X250). Продольный разрез через мужской гонофор (по Шнейдеру):
7 — эктодерма spadix, 2—кольцевой канал, 3 — полость, соответствующая субумбрелле, 4 — семенник, 5—энтодерма, 6—полость spadix, 7 — стебелек гонофора
ной пластинки она отграничена и от
рое сходство в их строении с клет-ками хорды позвоночных. Аборальные щупальца имеют ту же структуру, что и околоротовые за исключением своей базальног части. У их основания располагается особый валик соединительной ткани хордоидного типа, глубоко вдающийся в гастроваску-лярную полость (рис. 169). Это! валик, имеющий опорное значение, является непосредственные продолжением осевой, эктодермальной части щупалец и также развивается за счет энтодермы Он слагается из тесно располо женных друг около друга клетог неправильной формы, сильно ва куолизированных. Клетки эти более крупны, чем соответствующие элементы осевой части щупалец причем их большие размеры обу словлены особо сильным разви тием вакуолей !. Ядра распола гаются у самой периферии тел; клеток. От энтодермы, выстилаю щей гастральную полость, ткан! валика отделена опорной плас тинкой. Особым выростом опор аборальных щупалец (рис. 169)
У некоторых видов Tubularia (например, Т. coronata') такой же валик
но меньших размеров располагается и у основания ротовых щупалец
Выше уже указывалось, что гонофоры могут быть мужские ил! женские. Обычно на срезе попадается несколько гонофоров, перерезан ных в различных направлениях. Для изучения лучше всего выбрат гонофор, перерезанный в продольном направлении. На рис. 170 изо бражена схема строения гонофора эумедузоидного типа, рис. 171 изо бражает действительную картину продольного среза через мужской го нофор Tubularia. Наружный слой эктодермы соответствует эксумбрел ле типичной медузы. На дистальном краю гонофора эктодерма заги бается внутрь и ее внутренний слой отвечает субумбрелле. Межд?
1 В ряде руководств указанная ткань называется мезоглеей и самый валик мезо глеальным валиком. Эта терминологии нам кажется неправильной и может повести недоразумениям. Под мезоглеей понимают бесструктурную, неклеточную массу, рас полагающуюся между экто- и энтодермой и являющуюся продуктом выделения клето двух основных слоев тела Coelenterata. «Мезоглея» же аборальных щупалец Tubulari н некоторых других Athecata имеет клеточное строение и представляет собой не чт иное, как видоизмененную энтодерму щупалец. Происхождение ее из энтодермы под тверждается и историей развития Tubularia.
обоими слоями эктодермы мезоглея почти не развита (в отличие от свободноплавающих медуз), но имеется тоненькая прослойка энтодермы. По краю редуцированного зонтика гонофора, на месте перехода эксумбрел-лы в субумбреллу, энтодерма образует так же, как и у свободноплавающих медуз, кольцевой канал. Полость зонтика не выражена, и между субумбреллой и ротовым стебельком имеется лишь узкая щель, которая не всегда бывает выражена,. Ротовой стебелек, или spadix, снаружи одет эктодермой. Внутренняя полость его, сообщающаяся с полостью ствола, выстлана энтодермой, слагающейся из сильно вакуолизированных клеток. Она не сообщается с наружной средой. В эктодермальном слое spadix мужского гонофора развивается семенник (рис. 171,4). В нем можно рассмотреть разные стадии созревания половых клеток
Рис. 172. Tubularia sp. (Х200). Поперечный разрез через женский гонофор (по Шнейдеру):
1 — эктодерма эксумбреллы, 2 — эктодерма субумбреллы, 3 —- актинула, 4 — щупальце ак-тинулы, 5 — яйцевая клетка, 6 — spadix
вплоть до зрелых сперматозоидов.
Анатомическая и гистологическая картина строения зрелого женского гонофора (рис. 172) несколько сложнее, чем мужского, что зависит от того, что в нем протекает развитие оплодотворенных яиц вплоть
Рнс. 173. Tubularia sp. А, Б, В — последовательные стадии развития гонофора (по Шнейдеру):
/—«почечное ядро», 2 —эктодерма, 3 — энтодерма, 4 — гастральная полость, 5 — первичные поло* вые клетки, 6— энтодерма spadix. 7 — энтодерма зонтика. Я — кольцевой канал
ДО стадии актинулы, как это отмечалось выше (с. 210). В эктодермальном слое spadix располагается яичник. Между spadix и субумбреллой помещаются развивающиеся зародыши, находящиеся на разных стадиях онтогенеза (рис. 172), в том числе и личинки актинулы. В последних можно рассмотреть эктодерму и энтодерму, выстилающую гастровас-кулярную полость, а также щупальца. Наконец, в полости женского гонофора нередко удается обнаружить сперматозоиды, проникшие сюда из окружающей морской воды.
Наряду со зрелыми гонофорами на препаратах нередко попадаются и разные стадии их развития. Гонофоры развиваются из небольших почек, состоящих первоначально из одного слоя эктодермы и слепо замкнутых на дистальном конце. Формирование гонофора начинается с того, что на дистальном конце почки образуется утолщение эктодермы в форме трапеции, состоящее из двух слоев клеток' (рис. 173, А, Б) (так называемое «почечное ядро»). Постепенно разрастаясь, эктодерма ограничивает в средней части spadix (рис. 173, В). Наружный слой «почечного ядра» дает эктодерму субумбреллы. Между эксумбреллой и субумбреллой врастает энтодерма, дающая радиальные и кольцевой каналы зонтика.
Clava multicornis (Forskal)
Материал и методы изучения. Clava multicornis — весьма обычный вид на литорали Мурманского побережья, часто встречается и в Белом море. Колонии Clava по-
1 — ротовое отверстие, 2—щупальца, J — гонофиры
селяются на разных субстратах, но чаще всего на фукусах. Не встречается на заиленном грунте. Изучают живой материал или тотальные препараты, окрашенные квасцовым кармином.
Изучение живого объекта или тотальных препаратов. Clava multicornis обладает нитевидно стелющейся по субстрату гидроризой, на которой довольно часто на коротких ножках сидят отдельные гидранты. Сами полипы имеют веретеновидную форму. Щупальца более или менее беспорядочно располагаются в средней части полипа. Гипостом и нижняя часть тела лишены щупалец (рис. 174). Число их варьирует в довольно широких пределах (от 20 до 40). На оральном конце гипостома помещается ротовое отверстие. Размеры отдельных гидрантов тоже сильно варьируют (от 1,7 до 5,5 мм в длину). Сразу же под нижними щупальцами располагаются многочисленные почти шаровидные гонофоры. Последние устроены очень просто и утеряли почти все признаки организации медузы. Они представляют собой эктодермальные мешки, набитые развивающимися или зрелыми половыми продуктами. Поэтому более правильно было бы называть их споросаками. Число последних на одном полипе может достигать нескольких десятков (рис. 174,5). Перидерм выражен очень слабо. Он одевает стволы колонии и не заходит на гидрантов.
При жизни колония обычно бывает окрашена в розовый цвет.
Согупе sarsi (Loven)
Материал и методы изучения. Согупе sarsi часто встречается на литорали Баренцева и Белого морей, поселяясь на фукусах, камнях, раковинках моллюсков и т. п. Этот вид образует типичное поколение свободноплавающих медуз, развивающихся на колониях полипов. Медузы, относящиеся к Согупе sarsi, носят название Sarsia tubulosa Lesson '. Изучение полипоидного поколения осуществляется на живом материале или на тотальных препаратах, окрашенных кармином. Фиксировать полипов лучше всего сулемой с уксусной кислотой или Буэном.
Медуз изучают в живом виде или же после фиксации их 4%-ным формалином, который хорошо сохраняет внешнюю форму этих нежных организмов. Желательно дополнительно изготовить тотальные препараты в канадском бальзаме, окрасив их квасцовым или борным кармином. При этом, однако, нежный зонтик медузы сильно мнется.
Кроме Согупе sarsi на литорали часто встречается и другой вид того же рода — С. loveni М. Sars. Этот вид отличается от С. sarsi главным образом тем, что образующиеся на теле полипа медузоиды, хотя и имеют почти типичную организацию медуз, тем не менее не отрываются от материнской колонии и созревание половых продуктов у них происходит в прикрепленном к полипу положении.
Изучение полипоидного поколения. Согупе sarsi образует небольшие колонии высотой 10—15 мм. Гидрориза ветвится слабо. От нее вертикально отходят стволы гидрокаулуса. Последние либо непосредственно заканчиваются терминально сидящими гидрантами, либо образуют небольшое количество боковых веточек (рис. 175). Внутри ветвей колонии можно рассмотреть выстланный энтодермой канал. Тело от-
1 Различие видового названия полипа и медузы, являющихся разными поколениями одного и того же организма, обусловлено тем, что разработка систематики полипов и медуз осуществлялась независимо и лишь позже были установлены связи между теми и другими,
дельных гидрантов имеет веретеновидную форму, длина гидранта 0,5—0,6 мм, ширина 0,15—0,2 мм. Гидрориза и стволы колонии одеты хорошо выраженным перидермой, образующим слабо выраженные кольцевые перетяжки (рис. 176). Как и у других Athecata, тело гидрантов не одето перидермой. Однако на базальную часть полипов все же заходит нежная пленка, представляющая собой продолжение перидерма стволов колонии. Ротовое отверстие помещается на конце конусовидного гипостома. Щупальца располагаются довольно беспорядочно в средней части полипа, число их варьирует в пределах 10—16. На дистальном конце каждое щупальце несет мощную батарею крупных стрекательных клеток (рис. 176), образующую характерное булавовидное вздутие.
У основания гидрантов отпочковываются медузы, разные стадии развития которых следует рассмотреть на препаратах (рис. 176). Число одновременно отпочковывающихся медуз у одного гидранта может достигать шести.
Изучение медузоидного поколения. Медузоидное поколение Согупе sarsi носит название Sarsia mirabilis.
Рассматривают общую форму тела медузы, ротовой стебелек, щупальца. Sarsia mirabilis обладает высоким куполообразным прозрачным зонтиком (рис. 177). Высота колокола 0,5—1 см. Снизу к краю зонтика прикрепляются четыре довольно длинных щупальца. У основания щупалец помещаются особые вздутия эктодермы, богатые стрекательными клетками. Сами щупальца не гладкие, а несут многочисленные бугорки, также состоящие главным образом из групп стрекательных клеток. По краю зонтика, на месте перехода эксумбреллы в субум-бреллу располагается хорошо развитый парус (velum), представляющий собой складку эктодермы, в которую вдается тонкая пластинка мезоглеи. Сокращения паруса способствуют движению медузы. В центре субумбреллы берет начало длинный ротовой стебелек (manubrium), окрашенный у живых медуз обычно в красный цвет. Желудочный отдел гастроваскулярной системы помещается в полости ротового стебелька. В его верхней половине в эктодерме развиваются половые продукты, образующие иногда вздутия. В толще мезоглеи зонтика хорошо видны
Рис. 176. Coryne sarsi (из кн. Шульце). А — гидрант с медузой; Б — стрекательная клетка с выброшенной нитью:
1 — ротовое отверстие, 2 — щупальца, 3 — эктодерма, 4—энтодерма, 5 — перидерм, 6 — отпочковывающаяся медуза, 7 — пищеварительная полость
четыре радиальных канала гастроваскулярной системы, впадающих в кольцевой канал. У основания щупалец кольцевой канал образует расширения, от которых берут начало каналы, идущие в щупальца, являющиеся у Sarsia полыми внутри. Из органов чувств имеются четыре просто устроенных глазка в форме бокалов, расположенных у основания щупалец со стороны эксумбреллы. Они отчетливо видны ввиду наличия пигментных клеток.
Obelia sp. (= Laomedea)
Материал и методы изучения. Разные виды рода Obelia встречаются в Баренцевом и Белом, а также в Черном и дальневосточных морях. На Мурманском побережье чаще других встречаются Obelia geniculata L., О. longissima Pall., О. flexuosa Alder,
6
Рис. 177. Медуза Sarsia mirabilis (ориг.), рисунок Д. В. Наумова. А— общий вид живой медузы; Б — вид на медузу сверху, В — глазок:
/ — радиальные каналы, 2 —щупальца, 3 — ротовой стебелек, 4 — коль-цевой канал, 5глазок, 6 — подушечка эктодермальных клеток у основания щупальца
О. loveni (Allman). Все эти виды живут на литорали или на небольших глубинах в сублиторали. Медуз Obelia довольно часто можно найти в планктоне.
Для изучения полипоидного поколения надо изготовить тотальные препараты небольших веточек колонии, окрасив их квасцовым или борным кармином. Фиксировать лучше всего сулемой с уксусной кислотой.
В крайнем случае можно использовать материал, консервированный спиртом или формалином. Из медуз изготовить тотальные препараты, применив те же методы фиксации и окраски, что и для полипов. Кроме тотальных препаратов следует изготовить серию срезов, порезав медузу в направлении, перпендикулярном к плоскости зонтика. Для срезов медуз лучше фиксировать какой-либо осмиевой смесью, например жидкостью Флемминга. Окрасить срезы железным гематоксилином. Если медузы фиксированы не осмиевым фиксатором, то можно также рекомендовать окраску по Маллори, которая хорошо оттеняет мезоглею.
В дальнейшем описании мы ориентируемся преимущественно на О. geniculata, от которой полипоидные поколения других видов отличаются лишь некоторыми деталями строения гидротеки. Более существенны различия в строении гонангиев. Свободных медуз дает лишь О. geniculata, у остальных видов имеет место большая или меньшая степень редукции медузоидного поколения.
Изучение полипоидного поколения. Obelia образует довольно большие древовидные колонии, состоящие иногда из нескольких сот и даже тысяч особей. Характер ветвления иной, чем у Tubularia, так как здесь имеет место симподиальный тип ветвления. Это значит, что ветви колонии слагаются из осей последовательно отпочковывающихся полипов, причем ось каждого последующего полипа является надставкой к предшествовавшей части оси (рис. 178). Этот тип ветвления характерен для большинства представителей подотряда Thecaphora, к которым принадлежит Obelia. Ветви гидрокаулуса колонии снаружи одеты хорошо развитым перидермой, образующим местами кольцевые перетяжки, которые не затрагивают, однако, ценосарка. Ценосарком называется совокупность эктодермы, мезоглеи и энтодермы гидрокаулюса; в понятие ценосарка не входит перидерм.
Внутри ветвей проходит выстланный энтодермой канал, соединяющий, как и у большинства Hydrozoa, гастральные полости отдельных гидрантов. Перидерм продолжается на гидрантов, образуя гидротеку, имеющую форму колокольчика (рис. 179). Внутри гидротеки помещается гидрант. Наличие гидротеки представляет собой главную отличительную черту подотряда Thecaphora. В расплавленном состоянии тело гидранта и его щупальца выдаются из гидротеки. При раз-' дражении гидрант целиком втягивается в полость гидротеки. Тело гидранта несет кольцевую перетяжку, которая делит его на два отдела. Дистальную часть его иногда называют хоботком. На конце его помещается ротовое отверстие, ведущее в гастроваскулярную полость. Довольно длинные щупальца расположены одним венчиком. Они прикрепляются к телу гидранта несколько ниже кольцевой перетяжки. Внутри щупалец следует рассмотреть тяж эктодермальных клеток- Кюну)
Рис. 178. Схема симпо-диального ветвления (по
Рис. 179. Obelia geniculata (X25) (ориг.):
I — ротовой хоботок, 2— щупальца. 3 — гидротека, 4— перидерм, 5 —канал в стебельке, 6 — гастральная полость полипа
Наряду с гидрантами на препаратах попадаются разные стадии почкования. Зона, где образуется почка, располагается на гидрокаулусе, на некотором расстоянии от базальной части полипа (рис. 180). Почка в процессе роста образует стебелек более длинный, чем стебелек полипа, у основания которого она образовалась. Нередко еще до окончательного сформирования полипа, у основания его формируется почка второго порядка. В результате описанный способ почкования приводит к симподиальному типу ветвления всей колонии. На препаратах желательно отыскать последовательные стадии формирования гидранта в процессе развития почки (рис. 180).
Кроме гидрантов следует отыскать на препаратах гонангии, дающие начало ме-дузоидному поколению Obelia (рис. 181). Гонангии крупнее, чем гидранты, и не несут щупалец. Каждый гонангий снаружи прикрыт тэкой, которая здесь получает название гонотэки. Внутри гонотэки располагается видоизменный полип, на котором происходит отпочковывание медузок, носящий название бластостиля. Последний лишен ротового отверстия и щупалец. Дистальный конец его не несет почек и образует крышечку (Operculum). На бластостиле формируется довольно большое количество медузоидных почек, которые находятся на разных стадиях развития. У основания бластостиля располагаются самые молодые почки, у дистального конца его — готовые к отделению молодые медузы. Общее количество медузоидных почек, образующихся на одном бластостиле, около пятидесяти.
Изучение медузоидного поколения. В живом состоянии мелкие медузки Obelia (2—3 мм в поперечнике) очень активны. Они плавают благодаря частым сокращениям зонтика. Velum у них рудиментарен. Obelia относятся к лептомеду-зам, которые характеризуются широким плоским зонтиком и относительно слабым развитием, а иногда даже рудиментарным состоянием velum.
Рис. 180. Почкование полипа Obelia (по Кюну, Деляжу и Геруару). А—В — разные стадии почкования: Г—3 — последовательные стадии развития гидранта из почки:
1 — перидерм, 2— эктодерма, 3 — энтодерма, 4 — щупальца, 5 — гидротека
На тотальном препарате надо ознакомиться с расположением ор-
Рис. 181. Obelia geniculata (ХЗО). Гонангий (по Аль-ман):
1 — operculum. 2 — гонотэка, 3— формирующиеся медузы
ганов медузы. Зонтик имеет форму диска (рис. 182). По периферии его прикрепляются многочисленные короткие щупальца. У основания щупалец эктодерма образует утолщения, состоящие главным образом из стрекательных клеток. По краю зонтика располагаются также органы равновесия — статоцисты в количестве восьми. Они имеют
Рис. 182. Obelia geniculata (Х15). Медуза, вид со стороны ротового стебелька (ориг.): / — щупальца, 2 — кольцевой канал. 3 — гонада, 4— радиальный канал, 5 — ротовой стебелек, 6— стрекательные клетки у основания щупальца
Рис. 183. Obelina gelatinosa — медуза с вывороченным зонтиком, вид сбоку (по Геккелю): / — ротовой стебелек, 2 — гонада (яичннк), 3 — радиальный канал, 4—щупальца
вид небольших пузырьков со статолитом внутри. На тотальных препаратах статоцисты не всегда бывают видны. В центре субумбреллы расположен ротовой стебелек (manubrium), свисающий вниз и заканчивающийся ротовым отверстием. Хорошо видны четыре радиальных канала гастроваскулярной системы. Они берут начало от центральной полости гастроваскулярной системы (желудка) и впадают в кольцевой канал, проходящий по краю зонтика. Гонады в числе четырех располагаются с нижней стороны зонтика по ходу радиальных каналов. Гонады довольно велики (рис. 183), имеют более или менее правильную сферическую форму. Obelia раздельнополы. Яйцевые клетки у самок бывают ясно видны на препарате.
На срезах следует изучить- гистологию Obelia и уточнить некоторые анатомические отношения, трудно констатируемые на тотальных препаратах (рис. 184). Эктодерма эксумбреллы, субумбреллы и щупалец представляет собой однослойный плоский эпителий. Клетки эктодермы образуют мускульные выросты, расположенные главным образом на субумбрелле, по краю зонтика, вдоль щупалец, в эктодерме хоботка. Парус у взрослых медуз отсутствует. Эктодерма у основания щупалец имеет иной характер, будучи очень богата стрекательными клетками. Мезоглея представляет собой бесструктурную гомогенную массу, в которой изредка встречаются амебоциты. По краю зонтика проходит двойное нервное кольцо. Однако на препаратах оно обычно не бывает отчетливо заметно. Статоцисты, располагающиеся по краю зонтика, имеют форму пузырька, заключающего сферический статолит (рис. 185). Эктодермальные, клетки, образующие стенку статоциста,
Рис. 184. Obelia—медуза, схематический разрез (по Кюиу): / — эксумбрелла, 2 — кольцевой канал гастроваскулярной системы, 3— щупальце, 4 — гонада, 5 — субумбрелла, 6 — ротовой стебелек, 7 —ротовое отверстие, 8 — радиальный канал
частью чувствительные клетки и несут чувствительные волоски. При условии хорошей фиксации их удается разглядеть на препарате.
Гистологический характер энтодермы в разных частях гастроваску-лярной системы различен. Ротовой стебелек и желудочный отдел выстланы высокими цилиндрическими, сильно вытянутыми в длину клетками, среди которых много железистых клеток. Радиальные и кольцевой каналы ограничены плоским эпителием, также несущим железистые клетки. Между радиальными каналами в мезоглее зонтика зале-
о 1 — эктодерма щупальца, 2 — энтодерма. 3 —
гает ОДНОСЛОЙНаЯ пластинка ЭНТО* статоцист, 4— статолит, 5 — полость статоци-дермы (так называемая катаммаль- ста- «-чувствительные клетки ная пластинка). В щупальцах имеется один ряд эктодермальных клеток и внутренняя полость отсутствует (рис. 185). В тех местах, где радиальные каналы проходят над гонадами, они образуют слепые выросты, вдающиеся в виде мешочка в ткань половой железы (рис. 186). Наличие дивертикула гастроваску-лярной системы, вероятно, играет существенную роль в питании гонады.
В яичнике обычно удается рассмотреть разные стадии роста ооцитов. В семенниках — различные стадии созревания сперматозоидов. Снаружи гонада выстлана слоем плоских эктодермальных клеток, представляющих непосредственное продолжение эктодермы субумбреллы.
Рис. 186. Obelia geniculata — медуза, часть радиального среза в области половой железы (ориг.):
1 — эктодерма эксумбреллы, 2 — мезоглея, 3 — катаммальная пластинка, 4 — эктодерма субумбреллы, 5 —яйцевая клетка, 6— дивертикул гастроваскулярной системы в область гонады, 7 —» часть радиального канала
Другие представители гидроидных полипов
Кроме рассмотренных выше представителей Hydrozoa, желательно ознакомиться еще с несколькими видами, обратив внимание главным образом на различные типы образования колоний и разнообразные формы гонофоров.
Для этого следует изготовить тотальные препараты разных имеющихся налицо представителей гидроидных полипов, слегка окрасив их квасцовым или борным кармином. Для общей ориентировки и определения можно использовать указанные в списке литературы монографию Д. В. Наумова и определитель под ред. Н. С. Гаевской.
Ниже приводится краткое описание еще двух гидроидных полипов из подотряда Thecaphora, встречающихся в морях Советского Союза и представляющих сравнительно морфологический интерес.
Sertularia sp.
Различные виды этого рода широко распространены почти во всех морях, омывающих СССР. В Баренцевом море, в частности, Sertularia pumila L. в больших количествах встречается на водорослях в литоральной зоне. Sertularia образует колонии различных размеров, характеризующиеся большей частью перистым ветвлением (рис. 187) и до
Рис. 187. Sertularia abietina. Участок колонии (по Деляжу и Геруару)
Рис. 188. Sertularia ри.
Участок колонии при не! шом увеличении (ориг.
J — гидрант, 2 — гидротек;
вольно слабо развитой гидроризой. По ходу ветвей колонии гидранты располагаются супротивно с обеих сторон гидротеки1 (рис. 188). Наружный край гидротек несет большей частью 3—4 зубчика. Кроме того, имеется особая тонкая кожистая пластинка — operculum, которая прикрывает отверстие гидротеки, когда гидрант втягивается внутрь. У основания гидротек располагается перегородка, септа, прободенная отверстием, сквозь которое проходит ценосарк. Сами гидранты небольших размеров имеют более или менее правильную цилиндрическую форму и несут щупальца, располагающиеся в один круг. Гонангии отличаются от гидрантов большей величиной. Они располагаются с одной стороны ветвей колонии. Гонотека грушевидной формы. Внутри нее располагается бластостиль (рис. 189), на котором отпочковываются гонофоры, представляющие собой простые споросаки. Последние
Рис. 189. Sertularia tamarlsca. Мужской гонангий (по Альма-ну):
/ — operculum, 2 — споросаки, 3 — гонотека
представляют собой такую форму гонофоров, кото-
рые утеряли (в отличие от эумедузоидов) все черты организации медузы и представляют собой мешки, заполненные половыми продуктами. Sertularia раздельнополы.
Aglaophenia pluma (L.)
Один вид этого рода (A. pluma L.) (рис. 190) встречается в Черном море, где он селится преимущественно на небольших глубинах. Изучение его представляет интерес в том-отношении, что здесь имеет место диморфизм гидрантов и имеются особые защитные образования гонофоров, так называемые корзиночки или корбулы (corbulae).
Ветвление главных стволов колонии носит неправильный характер. От ветвей гидрокаулуса отходят мелкие боковые веточки (гидрокладии), причем их расположение перистое. Гидротеки располагаются на гидрокладиях в один ряд, имеют более или менее правильную треугольную форму, причем одна сторона треугольника прирастает к ветви колонии (рис. 190, А). Край гидротеки несет зубчики. У гидрантов, как у всех Thecaphora, — один венчик щупалец.
В связи с каждым гидрантом стоят два нематофора. Каждый не-матофор представляет собой пальцевидный придаток, лишенный щупалец и ротового отверстия и богато снабженный стрекательными клетками. В него заходит энтодерма и имеется очень узкая внутренняя полость, сообщающаяся с каналом ценосарка. Нематофоры способны сильно вытягиваться и сокращаться. Они представляют собой видоизмененных гидрантов. Каждый нематофор окружен тэкой, которая здесь получает название нематотэки.
1 Близкий к Sertularia род Sertularella характеризуется чередующимися, а не супротивно расположенными гидротеками.
Рис. 190. Aglaophenia sp. A — полип и часть гидрокладия; Б— корзиночка (по Кюну и Аль-ману):
/ — щупальца, 2 — нематофор, 3 гидрокладий
Гонангии располагаются группами и защищены корзиночкой (corbula). Кор-була (рис. 190, 5) представляет собой укороченную веточку колонии (гидрокладия), имеющую яйцевидную форму. С нижней стороны корбулы проходит стержень. На нем более или менее вертикально в виде ребрышек располагается несколько рядов видоизмененных нема-тотэк. Наружные края их спаиваются тонкой хитиноидной пленкой, благодаря чему образуется так называемая «закрытая корбула», внутри которой и располагаются обычно многочисленные гонофоры. У некоторых видов Aglaophenia хитиноидной пленки, соединяющей нематотэ-ки, не образуется и тогда получается «открытая корбула».
КЛАСС SCYPHOZOA— СЦИФОИДНЫЕ МЕДУЗЫ
Организация разных групп Scyphozot отличается значительным многообразием что не позволяет при прохождении прак тикума ограничиться рассмотрение, только одного представителя этого кла( са. В силу этого предлагаются для из? чения две формы {Aurelia и Haiclystus относящиеся к разным отрядам (Disct medusa и Lucernarida), довольно сущее венно отличающимися друг от друга i своему строению.
ОТРЯД SEMAEOSTOMAE
Aurelia aurita Lam.
Материал и методы изучения. Aurelia aurita представляет собой чрезвычайно i роко распространенную форму, встречающуюся почти всюду, начиная от Арктичес) морей и кончая тропиками. У нас она водится в Баренцевом, Белом и Черном моря? также на Дальнем Востоке. A. aurita достигает значительных размеров, диаметр s тика наиболее крупных экземпляров равняется 30—40 см. Для изучения лучше вз не очень крупные экземпляры, консервированные формалином. Внешнюю морфоло и расположение основных частей гастроваскулярной системы можно рассмотреть всякой окраски. Дополнительно полезно окрасить небольшой экземпляр (2—3 с диаметре) медузы квасцовым кармином и сделать тотальный препарат в канадс бальзаме. Органы чувств, так называемые ропалии, следует фиксировать, вырезав ножницами у живой медузы, жидкостью Флемминга или Ценкера. Готовят тоталг препараты, окрасив квасцовым кармином или не окрашивая (после фиксации по Ф. мингу). Изготовляют среды, залив в парафин, по продольной оси ропалии (т. е.
диально по отношению тела медузы). Срезы делают не толще 7,5 мкм, раскрасив их гематоксилином Бёмера или Деляфильда. Кроме взрослых Aurelia делают тотальные препараты из эфир (отобрать из планктона), окрасив квасцовым кармином.
Если работы проводятся на живом материале на морской станции, то следует изучить процесс выхождения планул из карманчиков ротовых лопастей и развитие из них полипоидного поколения — сцифистом. Подробнее об этом см. ниже с. 231—233.
Изучение строения медузы. Плоский зонтик медузы A. aurita имеет консистенцию студня, благодаря сильно развитой мезоглее. По краю его расположены многочисленные короткие щупальца, полые внутри (рис. 191). Край зонтика образует восемь неглубоких вырезов, в которых располагаются краевые тельца — ропалии. Парус, характерный для гидромедуз, у Aurelia, как представителя Scyphozoa, отсутствует1. В центре нижней стороны зонтика — субумбреллы расположен короткий ротовой стебелек (manubrium), на конце которого помещается четырехугольное ротовое отверстие. Края его вытянуты в четыре длинные, мощно развитые ротовые лопасти, образующие по своему нижнему краю желобок. Края желобка, особенно в своей дистальной части, образуют короткие щупальцеобразные выросты — так называемые диги-телли. У живой медузы эти лопасти подвижны и играют активную роль при поимке добычи. Их эктодерма богато снабжена стрекательными клетками.
Ротовые лопасти у половозрелых самок аурелий несколько длиннее и массивнее, чем у самцов, что обусловлено наличием в них особых выводковых камер — карманчиков, в которых происходит развитие оплодотворенных яиц до стадии планулы (см. с. 231). Таким образом, у аурелий наблюдается довольно редкий среди кишечнополостных случай полового диморфизма.
Ротовые лопасти вытянуты в радиальном направлении. На субумбрелле располагаются, чередуясь с ротовыми лопастями, четыре глубоких кармана — субгенитальные мешки, соответствующие по своему положению гонадам, лежащим в полости желудка.
Центральную часть гастроваскулярной системы образует объемистый желудок с четырьмя неглубокими карманообразными выступами. Последние располо-
Рис. 191. Aurelia aurita со стороны субумбреллы (по Кюкеиталю):
/ — щупальца, 2 — краевое тельце (ропалия), 3— перрадиальный (ветвящийся) канал, 4—интер-радиальиый (ветвящийся) канал, 5 — адрадиаль-ный (неветвящийся) канал, 6 — ротовая лопасть, 7 — гастральные нити в карманах желудка, 5 — кольцевой канал
1 Небольшая, имеющаяся у Aurelia по краю зонтика velarioid, отнюдь не играет роли velum.
складка, называемая
жены между ротовыми лопастями в интеррадиальном направлении. На дне их помещаются многочисленные гастральные нити. От желудочка берут начало многочисленные радиальные каналы, впадающие по краю зонтика в кольцевой канал. Часть радиальных каналов образует разветвления, часть не ветвится. Среди них различают каналы 1-го (перрадиальные), 2-го (интеррадиальные) и 3-го (адра-диальные) порядков. Каналы 1-го порядка (ветвящиеся) в числе четырех совпадают по своему направлению с ротовыми лопастями. Каналы 2-го порядка (ветвящиеся) тоже в числе четырех располагаются в промежутках между каналами 1-го порядка и представляют собой как бы продолжения' карманообразных выпячиваний желудка. Против центральных ветвей этих каналов располагаются по краю зонтика восемь краевых телец, или ропалий. Наконец, между каналами первых двух порядков проходят восемь каналов 3-го порядка, которые не ветвятся и не связаны с ропалиями. Радиальные каналы выстланы изнутри жгутиковым эпителием, наличие которого обеспечивает движение пищи по каналам.
Имея в своем распоряжении живых медуз, желательно воспроизвести опыты, осуществленные впервые И. А. Ветохиным, а затем Судвар-дом ', иллюстрирующие характер движения пищи в радиальных каналах разных порядков. Для этого живую медузу кладут в большое часовое стекло (по размеру зонтика) субумбреллой кверху. При помощи изогнутой стеклянной пипетки с оплавленным краем через ротовое отверстие вводят последовательно в четыре кармана желудка разбавленную морской водой в отношении 1 : 1 или 1 :2 кровь рыбы или млекопитающего. Наблюдают порядок заполнения кровью радиальных каналов.
В первую очередь заполняются неветвящиеся адрадиальные каналы 3-го порядка. По ним кровь двигается в центробежном направлении. Затем заполняется кольцевой канал, после чего начинается с периферии к центру заполнение ветвящихся каналов 1-го и 2-го порядков, по которым кровь движется в центростремительном направлении. Заполнение всей системы кровью занимает около часа.
Чтобы иммобилизовать медузу на время опыта, прекратив перио дические сокращения колокола, рекомендуется следующий прием. Мор ская вода насыщается углекислым газом и выливается в часовое сте кло, где лежит медуза. Следующий за этим наркоз не отражается н. движении жидкости в радиальных каналах, но препятствует сокращу нию зонтика. Движение инъецированной крови в каналах возможн рассмотреть, ввиду прозрачности медузы, под микроскопом (очень ш большое увеличение). При этом, особенно в крупных каналах, видн «завихрение» движущейся крови, происходящее из-за мерцания жг тиков эктодермальных клеток. Приблизительно через 24 ч происходг обесцвечивание инъецированной крови, вызванное процессами внутр! клеточного пищеварения.
1 Ветохин И. А. О работе мерцательного эпителия гастроваскулярной систек медузы Aurelia aurita. Работы Мурманской биологической станции, т. И, 195 с. 107—120. Southward A. J. Onservation on the ciliary currents of the Jelly-Fish Aure aurita. Journ. Mar. Biol. Ass. U. K., 1955, vol. 34, № 2.
Гонады у Aurelia развиваются в энтодерме желудка в карманообразных выпячиваниях. У живой медузы они окрашены в фиолетовый цвет и имеют вид подковообразно изогнутых валиков. Aurelia раздельнополы.
Мускулатуру зонтика можно частично рассмотреть на удачных тотальных препаратах небольших экземпляров медуз. Она слагается из кольцевой мускульной ленты, проходящей по краю зонтика, и из восьми радиальных лент, проходящих в перрадиальном и интеррадиальном направлениях. Мускулатура сцифомедуз состоит преимущественно из эпителиально-мускульных клеток.
Нервная система Aurelia на тотальных препаратах не видна. С некоторыми элементами ее можно познакомиться при изучении срезов через ропалии.
Строение ропалий. Ропалии, расположенные в числе восьми по краю зонтика, помещаются в особых выемках. Сверху каждое краевое тельце прикрыто покровной лопастью (рис. 192, 193), у основания которой с верхней стороны имеется «обонятельная ямка». По сторонам ропалии свешиваются две лопасти, прикрывающие ее с боков. Сама ропалия состоит из проксимального и дистального отделов, расположенных под тупым углом друг к другу. В дистальной части помещается орган равновесия — статоцист. На границе между обоими отделами ропалии с верхней и нижней стороны расположены глазки. На продольном разрезе через краевое тельце и покровную лопасть видно, что ропалия снаружи покрыта эктодермой и в нее заходит выстланный энтодермой канал гастроваскулярной системы (рис. 194). Покровная лопасть состоит только из эктодермы и довольно толстого слоя мезоглеи. Строение эктодермальных клеток разных частей ропалии неодинаково. В дистальной части, где располагается статоцист, эктодерма состоит из плоского эпителия. В проксимальной части ропалии клетки эктодермы цилиндрические, среди покровных здесь разбросаны чувствительные клетки и между эктодермой и опорной пластинкой мезоглеи
Рис. 192. Aurelia aurita — краевое тельце с окружающими его лопастями (по Шевякову):
.' — боковая лопасть , 2 — чувства-тельная лопасть, 3— краевое тельце (ропалия), 4 — кроющая лопасть
Рис. 193. краевые тельца Aurelia aurita (по Шевякову). А — сбоку; Б — со стороны субумбреллы:
1— глазное пятно, 2 —скопление отолитов, 3 — бо* каловидный глазок
Рнс. 194. Продольный разрез через ропалию Aurelia aurita (по Шевякову):
I — эктодерма, 2— нервное сплетение, 3— мезоглея, 4— глазок (ocellus), 5—отолиты, 6 — бокаловидный глазок, 7 — гастроваскулярная полость, <8 — «обонятельная ямка»
располагаются нервные элементы. Между экто- и энтодермой имеет тонкая прослойка мезоглеи. В дистальной части эктодермальный кан выполнен синтициальной протоплазматической массой с многочисле ными ядрами и кристаллическими конкрециями углекислой извес-представляющей собой отолиты'. Оба глазка в гистологическом oti
1 Необходимо отметить, что ряд авторов (Нагель, 1894; Мюрбах, 1904; Ветох 1926) на основании экспериментальных данных отрицают значение краевых те. медуз как органов равновесия. Другие исследователи (Харгит, 1930), напротив, с тают их органами статического чувства. Вопрос, по-видимому, требует дополните ных физиологических исследований.
шении устроены различно. Глазное пятно, расположенное на верхней умбеллярной стороне ропалии, состоит из многочисленных пигментных клеток, между которыми располагаются светочувствительные клетки (рис. 194). Глазок, расположенный на нижней субумбреллярной стороне, помещается под слоем эктодермы. Он имеет вид бокала и состоит из двух слоев. Внутренний пигментный слой образован энтодермальны-ми элементами. Внутри пигментного бокала располагаются чувствительные клетки. Их нервные отростки направлены кнаружи, в сторону покрывающей глазок эктодермы. Подобное положение чувствительных элементов в нижнем глазке Aurelia заставляет причислить его к глазам инвертированного типа, встречающемуся у Coelenterata весьма редко
Наблюдения над размножением и развитием Aurelia.Оплодотворение зрелых яиц у Aurelia происходит в гонадах самок, куда вместе с морской водой проникают сперматозоиды. Оплодотворенные яйца не выбрасываются в морскую воду, как это имеет место у большинства медуз, а, выходя из ротового отверстия, проходят по нижнему краю ротовых лопастей, попадают в особые эктодермальные впячивания, играющие роль выводковых камер (рис. 195). Последние представляют собой мешковидные выпячивания стенок ротовой лопасти, которые обращены своими отверстиями в сторону желоба лопасти (рис. 196).. Следует на живом объекте исследовать содержимое карманчиков, расщипывая их иглой. В них в течение почти всего лета удается найти разные стадии эмбрионального развития аурелий — от начальных стадий дробления до сформированных и покрытых ресничками планул.
Рис. 195. Aurelia aurita, ротовая лопасть с выводковыми камерами (из кн. Наумова): / — выводковые камеры
Рис. 196. Поперечный разрез через ротовую лопасть Aurelia aulita (схема) (из кн. Наумова):
1 — выводковая камера с эмбрионами, 2 — дигителли
1 Подробнее о краевых тельцах медуз см. W. Schewiakoff. Beitrage zur Kennthis. des Acalephenauges. Morphol. Jahrb.-, Bd. 15, 1889, c. 21—60.'
шении устроены различно. Глазное пятно, расположенное на верхней умбеллярной стороне ропалии, состоит из многочисленных пигментных клеток, между которыми располагаются светочувствительные клетки (рис. 194). Глазок, расположенный на нижней субумбреллярной стороне, помещается под слоем эктодермы. Он имеет вид бокала и состоит из двух слоев. Внутренний пигментный слой образован энтодермальны-ми элементами. Внутри пигментного бокала располагаются чувствительные клетки. Их нервные отростки направлены кнаружи, в сторону покрывающей глазок эктодермы. Подобное положение чувствительных элементов в нижнем глазке Aurelia заставляет причислить его к глазам инвертированного типа, встречающемуся у Coelenterata весьма редко'.
Наблюдения над размножением и развитием Aurelia.Оплодотворение зрелых яиц у Aurelia происходит в гонадах самок, куда вместе с морской водой проникают сперматозоиды. Оплодотворенные яйца не выбрасываются в морскую воду, как это имеет место у большинства медуз, а, выходя из ротового отверстия, проходят по нижнему краю ротовых лопастей, попадают в особые эктодермальные впячивания, играющие роль выводковых камер (рис. 195). Последние представляют собой мешковидные выпячивания стенок ротовой лопасти, которые обращены своими отверстиями в сторону желоба лопасти (рис. 196). Следует на живом объекте исследовать содержимое карманчиков, расщипывая их иглой. В них в течение почти всего лета удается найти разные стадии эмбрионального развития аурелий — от начальных стадий дробления до сформированных и покрытых ресничками планул.
Рис. 195. Aurelia aurita, ротовая лопасть с Рис. 196. Поперечный разрез через
выводковыми камерами (из кн. Наумова): ротовую лопасть Aurelia aulita
1 — выводковые камеры (схема) (из кн. Наумова):
1 — выводковая камера с эмбрионами, 2 — дигителли
1 Подробнее о краевых тельцах медуз см. W. Schewiakoff. Beitrage zur Kennthis-:es Acalephenauges. Morphol. Jahrb.-, Bd. 15, 1889, c. 21—60.’
L
Рис. 197. Сцифистома Aurelia aurita на стадии 8 щупалец (ориг.):
1 — щупальца, 2 — стебелек
В условиях аквариума легко получить дальнейшее развитие пла пул вплоть до образования сцифистом. Для этого половозрелую самк с заполненными эмбрионами карманчиками следует поместить на не продолжительное время (15—20 мин) в небольшой аквариум с мо{ ской водой. При этом из карманчиков при резких сокращениях зонтик выйдут многочисленные планулы, которые извлекают из аквариума пр помощи пипетки и рассаживают в кристаллизаторы с чистой морско водой. В течение некоторого промежутка времени (от 2 до 7 суток планулы плавают в воде, затем оседают на дно и стенки сосуда превращаются в полипоидное поколение медузы — сцифистому. От м< мента оседания планулы до сформирования сцифистомы при комнатнс температуре проходит 2—3 дня. Сцифистомы представляют собой н больших одиночных полипчиков, при помощи ножки прикрепляющихс к субстрату. Сначала у развивающейся сцифистомы прорывается рот вое отверстие и вокруг него образуются четыре щупальца. Затем во никают еще четыре щупальца (рис. 197). После этого развивается еп восемь щупалец. Стебелек сцифистомы аурелий состоит из двух чаете дистальная, прилегающая к полипу, слагается из мягких тканей (э тодермы, энтодермы и основной пластинки), проксимальная, прилета, щая непосредственно к субстрату (рис. 197, 2), имеет, кроме того, ei наружный скелет, весьма напоминающий перидерм гидроидных полипе
Внутри гастральной полости сци-фистомы имеется четыре продольные складки, образованные энтодермой и мезоглеей. Они называются тэниолями и напоминают септы коралловых полипов.
В условиях аквариума удается иногда наблюдать и почкование сци-фистом, сводящееся к отпочкованию на теле полипчика таких же дочерних полипов, в дальнейшем отделяющихся от материнского.
Кроме наблюдений за живыми сцифистомами следует изготовить из них тотальные препараты, окрасив их квасцовым кармином1.
Стробиляцию сцифистом и образование на них эфир (молодых медузок)
Рис. 198. Aurelia aurita — эфира (из кн. Аверинцева):
1 — краевая лопасть, 2 — краевое тельце, 3 — край диска, 4 — гастральные нити, 5 — ротовое отверстие
в условиях аквариума наблюдать обычно не удается. Эфиры аурелий следует отыскать в пробах морского планктона, где они встре-
чаются нередко в значительных количествах. Такой же тип развития планул в карманчиках ротовых лопастей имеет место и у крупной арктической медузы Cyanea arctica, часто встречающейся в Белом и Ба
ренцевом морях.
Изучение строения эфиры Aurelia. Qt взрослой формы эфиры Aurelia (рис. 198) отличаются меньшими размерами и целым рядом морфологических особенностей. Края зонтика не несут щупалец и образуют восемь глубоких вырезов. Адрадиальные каналы гастроваскулярной системы не развиты, а перрадиальные и интеррадиальные не ветвятся. Ротовой стебелек не образует еще ротовых лопастей. Ротовое отверстие имеет форму креста. Гастральные нити в желудке имеются в небольшом количестве. Ропалии развиты.
Имея достаточный материал по эфирам, можно подобрать разные стадии превращения ее в медузу. Отметить изменение формы зонтика, образование щупалец и ротовых лопастей, ветвление радиальных каналов и развитие каналов 3-го порядка.
ОТРЯД STAUROMEDUSAE
Haliclystus sp.
Материал и методы изучения. В Баренцевом и Белом морях нередко встречаются представители двух родов Lucernaria О. F. М. и Haliclystus J. Clark (оба эти рода относятся к сем. Eleutherocarpidae). В Черном море живет только одна Lucernaria. Для изучения одинаково пригодны представители и того и другого рода. Haliclystus представляет некоторые преимущества для изготовления срезов своими относительно небольшими размерами (2—3 см), тогда как Lucernaria quadricornis Mull из Баренцева
1 Более подробно о размножении аурелий см. статью Д. В. Наимова. К биологии размножения сцифомедуз аурелии и цианеи. — Природа, 1955, № 2.
моря достигает 10—12 см. Анатомия обоих родов весьма близка, на некоторые различия будет указано ниже. Haliclystus и Lucernaria живут на небольших глубинах, прикрепляясь своим стебельком к камням, водорослям и другим предметам.
Для изучения их организации следует рассмотреть, пользуясь бинокулярной и штативной лупами, экземпляры медуз, консервированные формалином, а также изготовить тотальные препараты из небольших экземпляров, окрасив их квасцовым или борным кармином. Эти препараты позволяют ознакомиться с внешней морфологией но не дадут достаточно полного представления о внутренней организации Haliclystus Поэтому необходимо прибегнуть к изучению срезов. Для этого следует фиксироват! Haliclystus каким-либо из обычных гистологических фиксаторов (сулемой с уксусно! кислотой, жидкостью Джильсона, Ценкера) и изготовить серию поперечных срезов тол шиной в 5—7 мкм. Окрасить срезы железным гематоксилином или гематоксилинов Бёмера с подкраской эозином или смесью Маллори.
Изучение консервированного формалином материала и тотальны: препаратов. Форма тела Haliclystus напоминает воронку. Аборальны) полюс вытянут в длинный стебелек, несущий на конце присоску, пр! помощи которой медуза прикрепляется к субстрату (рис. 199). Ораль ный полюс, несущий ротовое отверстие, направлен кверху. Таким обра зом, положение сидячих Lucernariidae в пространстве является обрат ным тому, которое имеет место у плавающих медуз и напоминает пс липов. Край зонтика Haliclystus образует восемь довольно глубоки выемок. По краю располагаются восемь коротких щупалец, представ ляющих собой по существу выросты края зонтика. Эти «первичны щупальца» несут многочисленные, тоже короткие, вторичные щупальцг расположенные пучками (рис. 199, 201). Каждое вторичное щупальп снабжено булавовидным утолщением. Расстояние между первичным щупальцами неодинаково, они несколько сближены попарно. В пром( жутках между щупальцами по краю зонтика располагаются ропалиог ды. Строение их изображено на рис. 200. Они не несут органов чувст'
Рис. 199. Haliclystus sp. — общий вид медузы (из кн. Деляжа и Геруара)
Рис. 200. Haliclystus sp. -строение ропалиоида (п Деляжу и Геруару):
/ — стрекательные клетки, 2 скопление железистых клето 3 — ножка. 4 — глазное пятно
за исключением небольшого пигментного пятна у основания. Каждый ропалиоид состоит из короткой ножки, из скопления железистых клеток, образующих расширение (подушечку), и из дистально расположенной группы стрекательных клеток. Ропалиоиды являются своеобразными органами прикрепления при передвижении медузы по субстрату.
В центре субумбреллы помещается короткий ротовой стебелек четырехгранной формы с небольшими ротовыми лопастями. Внутренняя поверхность зонтика Haliclystus образует четыре очень глубоких впя-чивания в виде карманов, благодаря чему весь зонтик приобретает форму воронки. Субумбреллярные карманы (рис. 201, 10) открываются на субумбрелле широкими отверстиями. Далее вглубь они становятся уже и продолжаются в полости так называемых колумелл, которые
тянутся вплоть до стебелька. Благодаря наличию колумелл и четырех
септ периферическая часть гастроваскулярной системы делится на
тыре кармана. Все эти довольно сложные отношения выяснить на тотальных препаратах полностью не удается, они выступают отчетливо при изучении срезов.
На препаратах видны гастральные нити, расположенные на колумеллах и вдающиеся в центральную часть полости (рис. 201, 6); располагаются у Haliclystus ближе к аборальной части зонтика. Гонады представлены восемью лентами (рис. 201, 4), лежащими в гастральной полости попарно. Гонады также прилежат к колумеллам; они тянутся в направлении от аборального полюса почти до основания щупалец. Соотношение между гонадами, колумеллами и септами следует разобрать на срезах. Haliclustus и Lucernaria раздельнополы. Со стороны субумбреллы тянутся продольные мышечные ленты (рис. 201, 12). Четыре мышечных пучка имеются и в ножке, чем обусловлена ее значительная сократимость.
Изучение срезов. Чтобы изучить внутреннюю организацию Haliclystus, желательно иметь серию поперечных
срезов, которые и нужно рассмотреть последовательно от орального к аборальному полюсу (рис. 202). При этом следует использовать рисунок, дающий общую схему строения животного. На первых срезах попадутся восемь групп мелких булавовидных щупалец (рис.
че-
Рис. 201. Схема строения Lucernarii-dae (часть зонтика удалена) (по Де-ляжу и Геру ару):
1 — щупальца, 2 — вторичные щупальца. 3— ропалиоид, 4 — гонады, 5 — колумелла, 6— гастральные нити, 7 — центральная часть гастроваскулярной полости, 8 — продолжение гастроваскулярной системы в стебельке, 9 — мышцы, 10 — субумбрелляриый кар* ман, 11 — кольцевой канал гастроваскулярной системы, 12 — мышечные ленты, 13 — периферическая часть гастроваскулярной системы, 14 — ротовое отверстие в центре ротового стебелька
202, А), сидящих на восьми «первичных» щупальцах. Они имеют узкий внутренний просвет, представляющий собой вырост гастроваскулярной системы, выстланный энтодермой. На последующих срезах обнаруживаются периферические части гастроваскулярной системы и субумбреллярные карманы, а также ропалиоиды. Представление о соотношении всех этих частей на уровне ропалиоидов дает рис. 202, Б. Наружная стенка зонтика образована эктодермой, за которой следует не очень сильно развитая мезоглея и слой энтодермы, выстилающей гастроваскулярную полость. Ропалиоиды расположены по краю (202, Б, 3). Они полы, полость их выстлана энтодермой. Их эктодермальный слой богат слизистыми клетками. В центре среза располагается ротовой стебелек, внутренняя стенка которого образует многочисленные складки. Он окружен четырьмя су-бумбреллярными карманами, которые, как было указано выше, глубоко вдаются в полость зонтика. Каждый субумбреллярный карман, в свою очередь, является трехлопастным, причем его средняя узкая лопасть в интеррадиальном направлении почти доходит до края зонтика, оставляя лишь небольшой просвет гастроваскулярной системы. В этом месте, но несколько ближе к аборальному полюсу, образуются септы. Пространство между субумбреллярными карманами и стенкой эксумб-реллы представляет собой периферическую часть гастроваскулярной системы и выстлано энтодермой. На уровне ропалиоидов гастроваску-лярная полость еще не поделена на четыре радиальных кармана и образует кольцевой канал. Гонады развиваются в энтодерме и располагаются в гастроваскулярной полости вдоль краевых лопастей субумб-реллярных карманов. Как указывалось выше, Haliclystus раздельнополы, так что на препарате обнаруживаются или семенники, или же яичники. И те и другие слагаются из ряда продольно идущих тяжей, в которых происходит образование половых продуктов. Последние после созревания, путем разрыва стенки гонады, попадают в гастроваскулярную систему.
На рис. 202, В изображен поперечный разрез Haliclystus несколькс ниже (ближе к аборальному полюсу) окончания ротового хоботка Гастроваскулярная полость состоит здесь из центрального, относительно небольшого, отдела (202, В,П), который при помощи четырех ра диально расположенных просветов сообщается с четырьмя объемисты ми радиальными карманами, которые отделены друг от друга при по мощи четырех интеррадиальных септ и колумелл (202, В, 14). Послед ние представляют собой продолжение субумбреллярных карманов. И: полость выстлана эктодермой и непосредственно сообщается на ораль ном полюсе с наружной средой. Колумеллы на поперечном разрез' представляются не вполне правильно трехлопастными. В ограничиваю щей их со стороны гастроваскулярных карманов энтодерме располага ются гонады (202, В, 7). Кроме того, на срезе видны многочисленные перерезанные в различных направлениях гастральные нити (202, В, 1 13), берущие начало также от эктодермальной выстилки колумелл.
На срезах, захвативших область, близкую к началу стебельк (рис. 202,Г), видно, что центральная часть гастроваскулярной систем! становится относительно больше, радиальные же карманы уменьшают
Рис. 202. Поперечные разрезы через Haliclystus sp. (Х15) (ориг.). А—в области щупалец; Б — на уровне глотки и ропалиоидов; В — через среднюю часть тела; Г-—в области гастральных нитей и колумелл; Д — через стебелек:
/-—вторичные щупальца, 2 — стрекательные клетки шупалец, расположенные группами, 3—ропали-оид, 4 — эктодерма эксумбреллы, 5 — мезоглея, 6 — энтодерма. 7 — гонады, 8 — ротовой стебелек, 9— мышечные ленты, 10 — периферическая часть гастральной полости, 11— центральная часть гастральной полости, 12 — полость субумбреллярного кармана, 13 — гастральные нити, 14 — септы, соединяющие колумеллу со стенкой тела, 15— мышцы стебелька, 16— выстланные энтодермой каналы стебелька
ся. Так же, как и на предыдущем срезе, видны четыре септы и колумеллы. Последние становятся меньше, но внутренняя полость в них, представляющая продолжение субумбреллярных карманов, отчетливо выражена. Гонады в этом отделе тела Haliclystus не развиты.
Чрезвычайно многочисленны гастральные нити, располагающиеся в полости радиальных карманов.
В месте соединения септы с колумеллой в толще стенки последней проходит мощно развитый продольный мускул (202, Г, 9), подобно тому как в септах актиний мускульные волокна располагаются вдоль многочисленных складок мезоглеи.
В. стебелек (рис. 2.02, Д) полость продолжается в виде четырех каналов, выстланных энтодермой и отделенных друг от друга мезогле-альными перегородками. Чередуясь с каналами, вдоль стебелька проходят четыре мускульных тяжа, обусловливающих его сильную сократимость. Эти мускулы представляют собой продолжение мышц, расположенных у основания колумелл и отмеченных на предыдущем срезе. Та часть гастроваскулярной системы, которая располагается в стебельке, носит название акрогастер.
У Lucernaria в отличие от Haliclystus акрогастер образует сплошную полость, не поделенную на каналы. Однако по стенкам ее и у Lucernaria проходят четыре продольных валика (тениоли), представляющих непосредственное продолжение колумелл.
У Haliclystus тениоли сильно разрастаются вплоть до соприкосновения друг с другом. Благодаря этому и образуются описанные выше каналы акрогастера.
КЛАСС ANTHOZOA— КОРАЛЛОВЫЕ ПОЛИПЫ
При изучении коралловых полипов (Anthozoa) необходимо детально ознакомиться с организацией представителей обоих подклассов: Octocorallia (восьмилучевых кораллов) и Hexacorallia (шестилучевых). В качестве объектов нами рассматриваются Alcyonium и Actinia equina.
ПОДКЛАСС OCTOCORALLIA — ВОСЬМИЛУЧЕВЫЕ КОРАЛЛОВЫЕ ПОЛИПЫ
ОТРЯД ALCYONARIA
Alcyonium sp.
Материал и методы изучения. Наиболее широко распространенными видами рода Alcyonium являются A. palmatum. Pall и A. digitatum L. Они обычны в Средиземном и Северном морях. Из морей, омывающих СССР, представители этого рода встречаются в Японском море *. Для изучения необходимо иметь колонию, фиксированную
1 Хотя Alcyonium не встречается в Баренцевом, Белом и Черном морях, тем не менее мы вынуждены остановиться иа описании этой формы как типичном представителе Octocorallia. Среди зоологических коллекций в вузах часто имеется Alcyonium
спиртом или формалином. Из отдельных расправленных полипчиков, отрезанных при помощи ножниц, готовят тотальные препараты, красят их квасцовым кармином или гематоксилином Бёмера. Из материала, фиксированного сулемой с уксусной или каким-либо другим гистологическим фиксатором (например, жидкостью Пенкера с формалином), готовят срезы, окрасив их железным гематоксилином. Готовят поперечные срезы из отдельных полипчиков в области глотки и через ствол колонии. Для изучения скелетных элементов небольшой кусочек колонии вываривают в 10—20 %-ном растворе едкой щелочи с тем, чтобы разрушить ткани и изготовить препарат склеритов так, как указано выше для скелета губок (с. 179).
Изучение общего строения колонии. Колония Alcyonium имеет неправильную форму, одним концом она прикрепляется к субстрату, на противоположном несет пальцевидные тупые выросты (рис. 203). На поверхности колонии располагаются многочисленные отдельные по-липчики, имеющие размеры в расправленном состоянии около 1 см. При помощи простой бритвы следует разрезать вдоль один из пальцевидных выростов колонии. При этом видно, что гастральные полости полипов продолжаются в виде. длинных трубок в толще колонии (рис. 204). Промежутки между ними выполнены мезоглеей. Некоторые полипчики оказываются втянутыми внутрь трубок, при этом отверстие последних замыкается прилежащими участками стенки колонии. Та часть полипа, которая выдается над поверхностью колонии и способна втягиваться внутрь, носит название антокордия. Длина гастральных полостей полипов в толще колонии оказывается различной. Одни тянут
ся до основания или почти до основания колонии, другие заканчиваются гораздо раньше. Это зависит от различия в возрасте. Наиболее длинные полипы являются вместе с тем и наиболее старыми. Более
молодые особи образуются путем почкования на каналах гастроваску-
лярной системы, соединяющих полости отдельных полипов между собой (эти каналы хорошо видны на срезах — см. ниже).
Изучение тотальных препаратов отдельных полипов. Нежное тело полипа (антокордия) Alcyonium имеет более или менее правильную цилиндрическую форму и несет на своем переднем конце восемь щупалец, окружающих ротовое отверстие (рис. 205). Щупальца расширены у основания и полые внутри, в них продолжается гастральная полость. Каждое щупальце несет два ряда боковых выростов — пиннул и имеет перистый характер.
При большом увеличении на пиннулах удается рассмотреть многочисленные стрекательные клетки. Ротовое отверстие в виде щели ведет в длинную эктодермальную глотку, хорошо видимую на препарате. Перегородки (септы) гастральной полости видны на тотальном препарате не очень отчетливо, в виде складок. По краям септ, направленным внутрь полости полипа, име
Рис. 203. Alcyonium palmatum. Общий вид колонии (по Деля-жу а Геруару)
ются утолщения, образующие извитые мезентериальные нити. Общее количество их равняется восьми, по числу септ. Не все они имеют одинаковую форму и строение. Шесть мезентериальных нитей не продолжаются глубоко в полость и образуют многочисленные извивы. Две соответствующие спинным сеп-
Рис. 204. Alcyonium sp. — схематический продольный разрез через колонию (по Деляжу и Геруару):
I — расправленный полип, 2 — втянутый полип, 3 — глотка, 4 — половые клетки, 5— мезентериальные нити, 6 — мезоглея, 7 — полость полипа, 8 — каналы, выстланные энтодермой, соединяющие полости полипов между собой
там (см. ниже) проходят почти прямо и доходят не только до основания полипа, но продолжаются и дальше в глубь колонии.
В толще стенки полипа следует рассмотреть разбросанные пооди-;;очке скелетные элементы (склериты), особенно многочисленные в верхней части, у основания щупалец.
Изучение срезов. Поперечные срезы через отдельных полипов следует изготовить и в области глотки и ниже глотки в области мезентериальных нитей. Снаружи тело полипа покрыто слоем эктодермальных клеток, образующих однослойный плоский эпителий. Эти клетки лишены мускульных выростов. За эктодермой следует тонкая прослойка бесструктурной мезоглеи.
На срезах в области глотки видны восемь септ, прирастающих к последней (рис. 206). Гастральная полость оказывается поделенной на восемь камер. Каждая септа имеет с обеих сторон выстилку из эндодермальных клеток, между которыми залегает тонкая пластинка мезоглеи. Границы между отдельными эндодермальными клетками видны плохо. Они образуют синцитий. Иногда удается рассмотреть короткие и очень нежные жгутики энтодермы, направленные в гастральную полость.
Рис. 206. Alcyonium palmatum. Поперечный разрез полипа в области глотка (по Шнейдеру):
1— эктодерма, 2 —энтодерма, 3 — дорзальная камера гастральной полости, 4 — дорзолатеральная камера, 5 — латеральная камера, 6 — латеровентральная камера, 7 — вентральная камера, 8 — сифоноглиф, 9 — просвет глотки
Рис. 205. Alcyonium palmatum (Х10). Отдельный полип (по Жаммес):
/ — щупальца с пиннулами, 2 — ротовое отверстие, 3 —глотка, 4 — септы с мезентериальными нитями, 5— мезоглея, 6 — каналы, выстланные энтодермой, 7— гонады
С одной стороны каждой септы располагается пучок мышц, образующий продольный, лежащий под энтодермой мышечный валик. На поперечном срезе он образует утолщение, состоящее из перерезанных мышечных волоконец. Расположение продольных мышечных валиков подчиняется определенной закономерности. Все они располагаются с одной и той же стороны септы. При этом в полость одной из камер, называемой условно спинной или дорзальной, не обращено ни одного мышечного валика. На противоположной стороне располагается брюшная камера, которая имеет два валика. В полость остальных шести камер обращено по одному мышечному валику. В соответствии с указанным расположением мышц сами септы получают следующие названия
дорзальные, справа и слева от них — дорзолатеральные, латеральные ближе к брюшной камере вентролатеральные и, наконец, вентральньп (рис. 206). Каждая септа кроме продольных мышц имеет поперечны» мышечные волокна, идущие от периферии к центру. Эти волокна н< образуют каких-либо специальных утолщений и у Alcyonium развитг слабо. На препаратах их удается рассмотреть обычно лишь с иммер сионной системой.
Глотка со стороны гастральной полости так же, как и септы, выст лана энтодермой. За энтодермой следует мезоглея. Просвет глотки выстланный эктодермой, в верхней части полипа имеет форму длинно щели, вытянутой по направлению от дорзальной к вентральной камер» В нижней части глотки ее эктодермальная стенка образует складки. С стороны брюшной камеры просвет глотки имеет расширение в виде ж» лобка, тянущееся от ротового отверстия до того места, где глотк открывается в гастральную полость. Этот желобок получил особе название — сифоноглиф. Он остается открытым даже тогда, когда гло' ка замкнута. Гистологический характер эктодермы глотки иной, че эктодермы, выстилающей снаружи тело полипа и щупальца. Она с< стоит из высоких веретенообразных и цилиндрических клеток, срег
Рис. 207. Alcyonium digilaium (по Хиксону из кн. Деляжа и Геру ара). А— поперечный разрез через мезентериальную нить спинной септы; Б — поперечный разрез мезентериальной нити других септ:
/ — мерцательный желобок, 2—эктодермальные клетки, 3 — энтодерма, 4 — железистые клетки
которых имеются железист! клетки. Эпителий глотки нео реснички. Особенно мощно ра виты ресницы в полости сиф ноглифа. У живого полипа oi постоянно находятся в состо нии мерцания по направлен! к полости, чем вызывается г прерывный ток воды. Септы области, лежащей ниже гл( ки, не доходят до центральн части полости, в центре ко, рой сохраняется пространст неподеленное на камеры.
Гистологическое строек мезентериальных нитей cm ных перегородок резко отлш ется от такового всех оста, ных септ (рис. 207). Они пр
Рис. 208. Alcyonium sp. Септа с половыми продуктами в поперечном разрезе (по Хиксону):
1 — крупный овоцит, 2 — группа мелких овоцитов, 3 — перерезанные пучки продольных мышц, 4 — энтодерма, 5 — мезоглея
ставляют собой утолщение края септы, несущее продольно идущий желобок (рис. 207, 4). В состав нити входят длинные цилиндрической формы клетки с ресничками. История развития показывает, что эти клетки эктодермального происхождения. У живого полипа реснички их гонят воду по направлению к ротовому отверстию (т. е. действие противоположно таковому ресниц сифоноглифа). Мезентериальные нити остальных шести септ (рис. 207, Б) не несут клеток эктодермального происхождения и не образуют желобка. Они богаты железистыми клетками и играют
важную роль в пищеварении, выделяя пищеварительные соки.
В связи с септами стоит развитие половых продуктов. Alcyonium раздельнополы. Гонады формируются на всех септах, кроме дорзальных. В период размножения они развиваются почти по всему протя-
Рис. 209. Alcyonium sp. Поперечный разрез части колонии. На срез попали полости двух полипов (по Кюкенталю). А — в области нижней части глотки; Б — ниже глотки: /—дорзальная камера, 2 — энтодерма, выстилающая гастральную полость, 3 — перерезанный мышечный валик септы, 4 — дорзолатеральная камера, 5 — латеральная камера, 6 — полость глотки, ' — мезоглея, 8 — сифоноглиф, 9 — латеровентральная камера, 10— вентральная камера, /У —мезоглея с разбросанными в ней спикулами, 12 — канал цененхимы, выстланный энтодермой, 13 — мезентериальная нить латеровентральной септы, 14 — мезентериальная нить дорзальной септы
жению перегородки, за исключением области глотки. Как и у всех Anthozoa, образование половых клеток протекает в энтодерме. Растущие овоциты вторично оттесняются в толщу мезоглеи септ (рис. 208). Зрелые половые продукты попадают в гастральную полость и через ротовое отверстие выводятся наружу.
Нервную систему, носящую диффузный характер, у Alcyonium на срезах, обработанных указанными выше методами, обнаружить не
удается.
Рис. 210. Alcyonium palmatum. Склериты (ориг.)
Рис. 211. Eunephtya sp. Общий вид колонии (по Кюкенталю)
На срезах через участок колоний прежде всего следует отметить многочисленные круглые полости, которые представляют собой гастральные полости отдельных полипов (рис. 209). Промежутки между ними выполнены мезоглеей (цененхимой), включающей скелетные и некоторые клеточные элементы. В полостях отдельных полипов следует рассмотреть восемь септ с мускульными валиками. Мезентериальные нити обычно со храняются лишь на дорзальных перего родках, где они имеют ту же структуру что и в полости полипа.
Нередко, если срез прошел близко ] поверхности колонии, попадаются полг пы с телом, втянутым внутрь КОЛОНИ! В таком случае получается довольн сложная картина, представляющая собс как бы двух вложенных друг в друга п< липов, причем у внутреннего из них им ются глотка и втянутые щупальца. Р зобраться в этих отношениях нетруд! по прилагаемому рисунку.
В толще мезоглеи проходят перер занные во многих направлениях выстла ные энтодермой каналы цененхимы. П помощи их осуществляется связь га, ральных полостей отдельных полип они служат местом почкования нов особей колонии. Кроме указанных ка лов в мезоглее имеются еще клеточг тяжи, не обладающие внутренней по стью. Их значение неясно. Высказы лись предположения, что они связан! секрецией основного вещества мезог; Кроме того, в мезоглее разбросаны дельные склериты. Нужно, однако, щу в виду, что если материал фиксирова жидкостью, содержащей кислоту, склериты нередко растворяются.
Склериты. На препаратах изолированных склеритов рассмотреть их форму. Последняя довольно неправильна. В основе построения склерита лежит палочка с многочисленными бугорками, иногда вторично ветвящимися (рис. 210). Склериты Alcyonium состоят из углекислой извести. Они разбросаны в основном веществе мезоглеи. Иногда несколько игол соединяются между собой, образуя нечто подобное друзам кристаллов. Склериты образуются интрацеллюлярно в мезоглее в особых клетках — склеробластах.
Дополнение. При отсутствии материала по Alcyonium он может быть частично заменен представителями родов Eunephthya и Gersemia. Последний род обычен в Баренцевом и Белом морях. У Gersemia несущие полипов ветви колонии довольно резко отделены от ствола (рис. 211). Склериты развиты в большом количестве, поэтому для срезов необходима предварительная декальцинация материала. Отдельные полипы сидят группами на концах ветвей. Они, в отличие от Alcyonium, не способны втягиваться внутрь колонии и гораздо меньших размеров, чем у последнего. Общая схема организации полипа та же, что и у Alcyonium, но объект менее удобен вследствие небольших размеров полипов.
ПОДКЛАСС HEXACORALLIA — ШЕСТИЛУЧЕВЫЕ КОРАЛЛОВЫЕ ПОЛИПЫ
ОТРЯД ACT1NIARIA
Bunodactis Stella Verrill 1
Материал и методы изучения. Bunodactis Stella форма чрезвычайно широко распространена. Она встречается, в частности, в больших количествах в Баренцевом и Белом морях. Живет она на небольших глубинах и встречается также в зоне отлива на литорали. В. stella характеризуется чрезвычайной изменчивостью окраски, варьируя от красного до зеленого с разнообразными переходами.
В. stella раздельнополы и живородящи. Развитие яиц протекает у них в гастроваскулярной полости вплоть до сформирования маленьких актиний. Для изучения следует зафиксировать как крупные половозрелые экземпляры, так и маленьких актиний, добытых непосредственно из гастроваскулярной полости.
Фиксирование актиний представляет значительные трудности: обладая мощно развитой мускулатурой, они легко втягивают щупальца и сжимаются. Между тем для изучения их морфологии желательно иметь расправленные экземпляры. Это в особенности относится к крупным половозрелым формам. Поэтому прежде чем приступить к фиксации, рекомендуется применить методы анестезии. К сожалению, для актиний они недостаточно разработаны. В качестве анестезирующих веществ разные авторы рекомендуют хлорал-гидрат, хлороформ, слабый спирт, сернокислый магний (MgSO4). Все эти вещества нужно подбавлять понемногу в сосуд, где находятся живые актинии. О. и Р. Гертвиги достигали хороших результатов, помещая сосуд с актиниями под стеклянный колпак, который наполнялся табачным дымом. Анестезированных
1 Живущие на литорали Баренцева и Белого морей небольшие актинии в течение многих лет, начиная с работ К. М. Дерюгина (1913), определялись как Actinia equina. Однако проверка их систематического положеня, проведенная недавно в Зоологическом институте АН СССР, показала, что это определение ошибочно и что актинии эти относятся к виду Bunodactis stella.
крупных актиний фиксируют спиртом или формалином. Полезно уплотнить их в 70 спирте. Этот материал послужит для анатомических целей. Маленьких актиний, добы тых из гастроваскулярной полости взрослых, фиксировать каким-либо быстро пронн кающим фиксатором (например, сулемой с уксусной, смесью Джильсона, Ценкера) Осмиевые смеси для этого объекта дают худшие результаты.
Вместо предварительной анестезии, особенно для мелких экземпляров актиниг удается добиться сохранения их в расправленном виде при быстрой фиксации горя ними фиксаторами (50—60°С), которые убивают их настолько быстро, что актини не успевают втянуть щупальца и сократиться. Из маленьких актиний можно изгс товить поперечные и продольные серии срезов, окрасив их железным гематоксилино) с эозином или смесью Маллори.
Для изучения стрекательных капсул следует сделать мазки, раздавив щупальп живой актинии между предметным и покровным стеклом, зафиксировав жидкость) Шаудина или Карнуа и окрасив железным гематоксилином с эозином.
Изучение общей анатомии. В расправленном состоянии тело актг нии имеет более или менее правильную цилиндрическую форму. К суб страту животное прикрепляется расширенной подошвой (рис. 212). Н противоположном конце помещается ротовое отверстие, слегка вытящ тое в форме овала. Оральный полюс В. stella несколько выпуклый. В( круг ротового отверстия в несколько рядов располагаются многочш ленные щупальца. Между щупальцами и ротовым отверстием имеете довольно широкая зона, не занятая щупальцами, которая носит назв:
ние перистома.
Если имеется живая актиния, то следует проследить процесс с<
крашения тела и втягивания щупалец при механическом раздражени и ловле добычи.
Для изучения общей анатомии нужно при помощи острой ручне бритвы провести несколько поперечных разрезов крупного экземпляр фиксированной актинии на разных уровнях, а также разрезать акт
нию вдоль примерно по середине тела в плоскости ротового отверсти На поперечных разрезах отчетливо видны многочисленные, распол
женные радиально перегородки, делящие гастральную полость на ps камер. Часть этих септ прирастает к глотке (полные перегородки часть более коротких не дох
Рис. 212. Actinia equina. Внешний вид (из кн. Бутта)
дит до нее (неполные neper родки). На продольном разр зе рассмотреть глотку, пре ставляющую собой доводы длинную трубку, свешива) щуюся в гастральную полост несколько сплющенную в о ной плоскости и со складка!' внутри. Щупальца полые, пр чем их полость представля собой продолжение гастровг кулярной системы.
Изучение срезов. Как на г перечных, так и на продо; ных срезах через В. stella г блюдается довольно сложи анатомическая и гистологи’
ская картина. Чтобы разобраться в ней, необходимо вспомнить общую схему организации, и, главное, расположение септ в отряде Actiniaria.
Число септ кратно. шести (рис. 213). Они располагаются парами, образуя несколько циклов, или порядков. Наименьшее возможное число септ равно шести парам, т. е. двенадцати. Септы одной пары сближены между собой так, что расстояние между ними меньше, чем расстояние между двумя соседними парами. Часть полости, заключенная между септами одной пары, носит название внутренней камеры или эндоцеля. Участки гастральной полости, расположенные между разными парами, называются промежуточными камерами или экзоцелями. Каждая септа несет на одной стороне продольную мышцу, образующую мускульный валик. Мускульные валики септ одной пары направлены всегда в полость эндоцеля. Исключение составляют две направительные камеры, расположенные на противоположных
Рис. 213. Adamsia diaphana — поперечный разрез, несколько схематизированный (по О. и Р. Гертвигам):
/ — септы 1-го порядка (цикла), 2 — септы 2-го порядка, 3 — септы 3-го порядка, 4 — септы 4-го порядка, 5 —эктодерма, 6 — мезоглея, 7 — энтодерма, 8 — продольные мышцы септ, 9— полость глотки, 10— направительные камеры, // — глоточные желобки (сифоноглнфы)
сторонах тела против сифонгли-
Рис. 214. Поперечные срезы через молодой экземпляр актинии (ориг.). А— на уровне середины глотки; Б — в нижней трети тела:
1 — септы 1-го порядка, 2 — септы 2-го порядка, 3~ эктодерма, 4 — мезоглея, 5 — энтодерма, 6 — продольные мышцы септ, 7 — полость глотки, 8 — направительные камеры, 9— енфоноглиф, 10 — мезентериальные нити
фов, глотки, которых у Actiniaria обычно два. Их мускульные валики обращены в сторону соседних экзоцелей. Септы первого порядка, или цикла, всегда полные, т. е. доходят до глотки и прирастают к ней. Перегородки последующих порядков располагаются в экзоцелях. Септ второго порядка шесть пар, причем в отношении их расстояния друг от друга и расположения мускульных валиков наблюдается та же закономерность, что и для септ первого порядка.
Септы могут быть или полными, или неполными, т. е. не прирастать к глотке. Септы последующих порядков также образуются в промежуточных камерах, причем по числу последних число пар септ 3-го порядка будет равно 12, четвертого порядка — 24 и т. д. Чем выше порядковый номер цикла, тем меньших размеров образуются септы, они не вдаются глубоко в гастроваскулярную полость и неполные. Свободный край септы образует характерное утолщение — мезентральные нити, подобно тому как это имеет место и у Octocorallia.
На поперечных и продольных разрезах (рис. 214) видно, что септы не являются прямыми перегородками, а образуют различного рода изгибы, складки и т. п., конфигурация которых в значительной мере зависит от степени сокращения животного. На продольных срезах (рис. 215)
в плоскость среза попадают части нескольких септ, складки глотки, пе-
ререзанные мезентериальные нити, благодаря чему получается доволь-
Рис. 215. Продольный разрез через тело актинин (ориг.):
I — щупальца, перерезанные в различных направлениях, 2 ~ внутренняя полость щупальца, 3 —продольные мышцы щупальца, 4 — эктодерма, 5 — мезоглея, 6 — энтодерма, 7 — продольные мышцы септы. 8 — часть продольного разреза через септу, 9 — подошва, 10 — мезентериальная нить, 11 — глотка, 12 — полость глотки
но сложная картина, разобраться в которой, исходя из общей схемы актинии, не представляет, однако, больших затруднений.
Применяя большое увеличение и иммерсионную систему, следует изучать гистологическое строение разных органов Bunodactis stella.
Эктодерма состоит i главной своей массе и: сильно вытянутых в дли ну клеток, несколько рас ширенных в своей прокси мальной, обращенной мезоглее части. Клетк эктодермы несут реснш ки (за исключением эг тодермы подошвы). Ядр
располагаются на разны уровнях. Благодаря этом эктодерма при повер. ностном просмотре пр1 изводит впечатление мн гослойного эпителия, чг
на самом деле не имеет места, так как клетки расположены в один слой. Среди покровных эктодермальных клеток располагаются многочисленные слизистые клетки, обладающие вакуолизированной цитоплазмой. Их диаметр обычно значительно больше, чем покровных клеток. Кроме того, в состав эктодермы входят белковые клетки. Они резко выделяются благодаря наличию в их цитоплазме эозинофильных белковых гранул. В эктодерме располагаются также стрекательные клетки, особенно многочисленные в щупальцах. Легко можно различить стрекательные клетки двух родов. Одни обладают тонкостенной удлиненной стрекательной капсулой, внутри которой просвечивает длинная закрученная спирально стрекательная нить; другие — несколько более короткой капсулой с толстой, по-видимому, двойной стенкой. Стрекательная нить внутри них обычно на срезах не видна. Тонкостенные капсулы преобладают в эктодерме щупалец, толстостенные — в эктодерме стенки тела. Внутренняя выстилка глотки также эктодермальная. Клетки ее в отличие от стенки тела и щупалец несут не ресницы, а жгутики. Особенно сильно развиты они в области двух сифоноглифов. Эктодерма глотки очень богата железистыми белковыми клетками. Непосредствен
Рис. 216. Anemonia sulcata — поперечный разрез концов септ с мезентериальной нитью. Слева — недалеко от глотки; справа — в базальной части септы (по Шнейдеру): / — железистая лопасть, 2 — мерцательная лопасть, 3— железистая слизистая клетка, 4 — белковая железистая клетка, 5 — мезоглея, 6 — стрекательная клетка
но под эктодермой щупалец залегает слой продольных мускульных волокон, которые у актиний в отличие от Hydrozoa представляют собой самостоятельные гладкие мускульные клетки, а не выросты эпителиальных клеток. В стенке тела у В. stella субэктодермальный слой мышц отсутствует1.
Мезоглея В. stella, располагающаяся между экто- и энтодермой, развита довольно мощно в стенках тела, откуда отходят прослойки ее септы. В щупальцах и стенках глотки мезоглея образует относительно тонкий слой, базальную пластинку. Гистологически мезоглея A. equina имеет волокнистую структуру, причем в ней разбросаны отдельные клетки соединительнотканного характера.
Энтодерма выстилает изнутри гастральную полость, стенки септ, полость щупалец и обращенную в сторону пищеварительной полости стенку глотки. Она слагается из высоких эпителиальных жгутиковых клеток, среди которых разбросаны многочисленные железистые клетки. Большинство эктодермальных клеток эпителиально-мускульные. Мускульные выросты их образуют субэндотермальный слой кольцевой мускулатуры, мощно развитой в теле В. stella.
Особый интерес представляет строение септ, изучить которые следует, сопоставляя поперечные и продольные срезы. С обеих сторон септы покрыты слоем эктодермальных клеток. Со стороны промежуточной камеры (за исключением септ, ограничивающих направительные
Рис. 217. Actinia equina (по Е. Павловскому и А. Штейну). 4 — мазок из щупальца; видны фуксинофильные стрекательные капсулы со спирально закрученной нитью и более темные толстостенные капсулы; Б — мазок на стенки тела близ подошвы — многочисленные толстостенные стрекательные клетки
1 У ряда других видов актиний под эктодермой стенок тела располагаются продольные мускульные волокна,
камеры, где отношение обратное, — см. с. 247) под энтодермой располагается тонкий слой мускульных волокон, идущих в радиальном направлении и граничащих с мезоглеей. В области продольного мускула перегородки (со стороны внутренней камеры) мезоглея образует в сторону энтодермы многочисленные тонкие ветвящиеся выросты, вдоль которых и располагаются мускульные волокна (см. рис. 214). Благодаря этому количество мышечных элементов сильно возрастает и в совокупности образуется мощный продольный мускул. На септах 1-го и 2-го циклов он развит сильнее, чем на последующих циклах.
Свободные края септ, непосредственно вдающиеся в полость, образуют характерное утолщение — мезентериальные нити. В базальной части септы мезентериальная нить представляет собой утолщение края септы, богатое железистыми клетками, а также стрекательными капсулами. Ближе к глотке мезентериальная нить становится явственно трехраздельной (рис. 216), что особенно отчетливо видно на поперечном разрезе. Средняя лопасть ее железистая, справа и слева образуется мерцательный желобок, клетки которого обладают мощно развитыми ресничками. Обе боковые лопасти также покрыты мерцательным эпителием. По-видимому, эпителий, выстилающий мерцательные желобки и боковые лопасти, — эктодермального происхождения.
В подошве следует рассмотреть сильно развитые мускульные волокна, идущие в радиальном направлении и образующие мускулатуру подошвы. Поскольку для разрезов берутся молодые особи В. stella, половые продукты у них не развиты и не могут быть обнаружены на препаратах.
Изучение мазков щупалец. На препаратах, представляющих собой мазки щупалец, хорошо видны стрекательные капсулы (рис. 217). Так же, как и на разрезах, обнаруживается наличие двух категорий стрекательных клеток: тонкостенных и толстостенных. Некоторые из них оказываются с выброшенными нитями.
Тип Ctenophora — гребневики
Практикум по гребневикам следует начинать с подробного изучения Pleurobrachia (отряд Cydippea) как типичного представителя этого класса. Эта форма представляет большое удобство и в том отношении, что в большом количестве встречается в Черном море.
Кроме Pleurobrachia более кратко рассматривается организация Вёгое (отряд Beroidea), один из видов которого водится в Баренцевом и Белом морях.
ОТРЯД CYDIPPEA
Pleurobrachia rhododactyla Fabr
Материал и методы изучения. Эта форма, относящаяся к сем. Pleurobrachiidae является одним из обычных компонентов планктона Черного моря. В зимние и осенние месяцы она в больших количествах встречается в поверхностных слоях воды, летоо спускается на глубины около 50—100 м. Добывается Pleurobrachia при помощи обыч ной планктонной сети.
Для изучения лучше всего использовать живой материал, на котором, благодар;
Рис. 218. Pleurobrachia rhododactyla (Х5). Общий вид (по Агассицу из кн; Деля-жа и Геруара):
1 — ротовое отверстие, 2 — глотка, 3 —канал воронки, 4 — гребные пластинки, 5 — щупальце, втянутое во влагалище, 6 — аборальный орган. 7 — воронка
прозрачности животного удается довольно детально рассмотреть внутреннюю организацию. При отсутствш живых объектов рассматривают при помощи биноку лярной лупы и малого увеличения микроскопа гребне виков, консервированных формалином, и делают то тальные препараты (фиксация — сулема с уксусной кис лотой и др ), слегка окрасив квасцовым кармином. Же лательно также, особенно при отсутствии живого ма териала, изготовить серию поперечных срезов, окраси их железным гематоксилином с эозином или смесы Маллори; фиксируют материал для срезов сулемовым смесями или же, что еще лучше, жидкостью Флеминг га. При заливке ввиду нежности объекта следует во; можно осторожнее проводить через спирты. Кром обычной шкалы спиртов возрастающей крепости реке мендуется ввести дополнительно 30, 50 и 80° спир' Обычно несмотря на предосторожности, избежать noj ностью деформации объекта (складки и морщины) вс же не удается.
Вместо Pleurobrachia rhododactyla (рис. 218) моя но в качестве материала использовать и другие вид этого рода (например, Р. rhodopsis из Средиземно; моря), отличающиеся лишь мелкими деталями. Близки к Pleurobrachia и вполне пригодным для изучен;-является также род Hormiphora, например Н. plumof или Н. palmata (рис. 219) из Средиземного моря, отл;
чающуюся от Pleurobrachia лишь некоторыми мелкими особенностями строения щупалец и длиной рядов гребных пластинок, которые у Hormiphora более коротки, чем у Pleurobrachia.
Изучение живого объекта и тотальных препаратов. Pleurobrachia rhododactyla обладает почти сферическим телом, лишь немного вытянутым в направлении от орального к аборальному полюсу (см. рис. 218). В живом состоянии почти совершенно прозрачна. На оральном полюсе помещается ротовое отверстие, имеющее форму щели. Та плоскость, в которой вытянута ротовая щель, носит название сагиттальной или ме-
Рис. 219. Harmiphora palmaia. Общий вид (по Хуну):
/ — ротовое отверстие, 2—глотка, 3 —канал воронки, 4 — гребные пла* стинки, 5 — щупальце, 6 — аборальный орган, 7 — воронка
диальной плоскости. На противоположном аборальном полюсе расположен аборальный орган, представляющий собой орган статического чувства. От орального к аборальному полюсу в меридиональном направлении тянутся восемь рядов гребных пластинок. У Pleurobrachia эти ряды начинаются, лишь немного отступив от аборального полюса, и тянутся почти вплоть до ротового отверстия. У Hormiphora они короче, занимают лишь немногим больше половины меридиана. Каждая гребная пластинка слагается из многочисленных слившихся ресничек особо дифференцированных эктодермальных клеток, детали строения которых следует рассматривать на срезах. Движение гребневика осуществляется благодаря мерцанию гребных пластинок, причем животное плавает аборальным полюсом вперед.
По бокам тела Pleurobrachia располагаются два очень длинных и сильно сократимых щупальца. Каждое щупальце несет многочисленные боковые веточки, так называемые тентиллы '. Щупальца могут втягиваться внутрь двух обширных карманов — щупальцевых влагалищ (см. рис.'218, 5), к внутренней стенке которых они и прикрепляются. Самые каналы влагалищ щупалец направлены к аборальному полюсу под углом к главной оси тела и открываются наружу двумя отверстиями недалеко от аборального органа чувств. Длина щупалец в расправленном состоянии во много раз превосходит размеры самого гребневика.
Если провести плоскость через основание щупалец, то она разделит тело гребневика пополам и окажется перпендикулярной к сагиттальной плоскости. Эта плоскость получает название латеральной. Сагиттальная (медиальная) и латеральная плоскости (см. рис. 221) определяют основные элементы симметрии гребневика1 2. Щупальца несут многочисленные клейкие клетки, или коллобласты,
расположенные главным образом на тентиллах и функционально замещающие стрекательные клетки Cnidaria. Они служат для улавливания добычи На тотальном препарате коллобласты видны в форме небольших утолщений в экто. дерме. Для более детальногс изучения рекомендуется раз давить кусочек щупальца, что разумеется, лучше всего еде лать на живом объекте. Строе
Рис. 220. Строение и развитие
коллобласта (Х1400) (по Коман). А — Е — последовательные стадии развития коллобласта; Ж— сформированный коллобласт
1 У Pleurobrachia все тентилл: одинаковы, имеют форму неболыпи нитевидных отростков. У Hormiphor тентиллы двух родов — болыпа часть нитевидная, некоторые же форме пластинок.
2 Сагиттальную и латеральну; плоскости можно также назвать рг диальными и перрадиальными.
ние коллобласта изображено на рис. 220. Выдающаяся на поверхность часть его имеет форму грибной шляпки и несет многочисленные зерна липкого секрета. От базальной части коллобласта отходят две нити, идущие к оси щупальца. Одна из них закручена спирально. Эти нити физиологически играют для коллобластов роль своеобразных «якорей», благодаря которым прилипающая к щупальцам добыча при активных движениях не вырывает их из эпителия.
Чрезвычайно характерно строение гастроваскулярной системы, состоящей из каналов, расположенных в мезоглее. На живом объекте удается рассмотреть все основные элементы, на тотальных препаратах, в зависимости от качества последних, обычно видны только некоторые части ее, и общую картину приходится дополнить изучением срезов. Чтобы не нарушить общей картины, мы даем описание строения гастроваскулярной системы Pleurobrachia, ориентируясь на живой материал. В дополнение к рис. 218 (общий вид гребневика) схемы, изображенные на рис. 221 и 222, поясняют соотношение отдельных частей гастроваскулярной системы.
Щелевидное ротовое отверстие ведет в глотку', также сплющенную в сагиттальной плоскости. Этот отдел гастроваскулярной системы выстлан эпителием эктодермального нам глотки проходят в виде валиков
Рис. 221. Схема расположения основных каналов и плоскостей симметрии у гребневиков (по Крумбаху). А — основные плоскости симметрии (аборальный полюс обращен кверху); Б — схематический поперечный разрез:
1 — экваториальная плоскость, 2 — сагиттальная (медиальная) плоскость, 3 — латеральная плоскость, 4 — аборальный орган, 5 — ротовое отверстие, 6 — глотка, 7 — воронка, 8 — перра-диальные каналы, 9 — интеррадиальные каналы. 10 — адраднальные каналы, 11— меридиональные каналы
происхождения. По обеим сторо-два утолщения, состоящие из же-
лезистых клеток, детали строения которых следует рассмотреть на срезах. У Pleurobrachia глотка тянется примерно на 2/3 длины тела. Она открывается довольно узким отверстием в следующий эктодермальный отдел — желудок, или воронку (рис. 222, 16). Последняя сплющена в
1 Нередко этот отдел гастроваскулярной системы получает название желудка (см., например, классическую монографию Хуна, 1880), однако ввиду эктодермального происхождения его по аналогии с другими кишечнополостными термин «глотка» более оправданный.
направлении, перпендикулярном таковому глотки, т. е. в латеральной плоскости. Воронка — довольно объемистый, но короткий отдел гастро-васкулярной системы. От нее берет начало ряд каналов. К аборальному полюсу по главной оси животного идет довольно узкий канал воронки. Немного не доходя до аборального полюса, канал воронки дихотомически дважды ветвится, давая начало четырем очень коротким тонким
Рис. 222. Схема организации гребневика из отр. Cydippea. Животное изображено рассеченным в латеральной плоскости (из кн. Деляжа и Геруара):
1 — ротовое отверстие, 2 — глотка, 3— каналы воронки, 4 — гребные пластинки, 5 — влагалище щупальца, 6 — меридиональный канал, 7— основание щупальца, 8 — адрадиальный канал, 9 — интеррадиальный канал, 10 — щупальце, 11 — «выделительные» каналы, 12 —* «пружинки» аборального органа, 13 — отолит, 14 — колокол, 15— ампула выделительного канала, 16 — воронка, 17 — канал щупальца
так называемым выделительным каналам1 (рис. 222, 11). На своем дистальном конце они почти доходят до аборального полюса, и концы их вздуты в виде ампул. Две из них (с противоположных сторон аборального органа) при помощи пор открываются наружу. Хун, вводя в гаст-роваскулярную полость гребневика тушь, экспериментально доказал, что через указанные поры содержимое каналов может выбрызгиваться наружу. Поэтому их обычно называют выделительными порами1 2.
,От воронки по направлению к оральному полюсу вдоль сплющенных стенок глотки отходят два довольно объемистых канала глотки, слепо кончающихся недалеко от ротового отверстия. Кроме того, в экваториальной плоскости в латеральном направлении от воронки отходят два коротких радиальных (перрадиальных) канала (у Hormiphora они почти не выражены), дихотомически ветвящиеся дважды, сначала на четыре интеррадиальных канала, затем на восемь адрадиальных (см. рис. 221, Б). Последние подходят к периферии и открываются в восемь меридиональных каналов (называемых иногда сосудами), которые тянутся под эктодермой от орального к аборальному полюсу, располагаясь непосредственно под рядами гребных пластинок.
По наружной стенке меридиональных каналов располагаются гонады. Строение каналов следует изучить на срезах. От средней части коротких перрадиальных каналов отходят два (по одному с каждой стороны) тоже коротких канала, идущих к внутренней стенке влагалища щупалец (рис. 222, 17). На границе с последней они делятся на два и загибаются вниз (т. е. к оральному полюсу), все время тесно соприкасаясь с основанием щупальца. Каналы щупальца также заканчиваются слепо3.
На аборальном полюсе, как уже указано выше, помещается аборальный орган, представляющий собой орган чувства равновесия, подобно статоцистам медуз. Рассмотреть детали его строения удается лишь на живом материале, поэтому ограничимся лишь кратким описанием. Аборальный орган помещается в небольшом углублении поверхности тела, причем сам он выдается довольно значительно над поверхностью. Центральную часть его составляет отолит, слагающийся из группы видоизмененных клеток с конкрециями фосфорнокислой извести (рис. 223, 224). Отолит располагается на четырех «пружинках», представляющих собой производные ресничек, лежащих под отолитом
1 На препаратах их обычно не удается отчетливо рассмотреть.
2 Последний термин не вполне физиологически точен, так как выведение содержимого гастроваскулярной системы наружу скорее можно сравнить с дефекацией, чем с выделением. Однако физиологически Ctenophora пока еще настолько мало изучены, что окончательное значение отделов гастроваскулярной системы в процессе пищеварения исследовано слабо.
3 В приведенном выше описании строения гастроваскулярной системы мы придерживались наиболее распространенной терминологии, разработанной в основном Хуном в его классической монографии «Ctenophora» (за исключением понятия «желудок», см. примечание иа с. 202) и принятой в большинстве советских и иностранных руководств. Однако в 1925 г. Крумбах, обработавший Ctenophora для известного «Hand-buch d. Zoologie» Кюкенталя, предлагает совершенно иную терминологию отдельных частей гастроваскулярной системы гребневиков. Мы не видим, однако, особых преимуществ в терминологии Крумбаха и поэтому оставляем старые установившиеся названия.
Рис. 223. Аборальный орган Eucharis sp. (Х170), вид сбоку (из кн. Хуна):
1 — колокол, 2 — отолит, 3 — эпителий, подстилающий аборальный орган, 4—«пружинки» аборального органа
эктодермальных клеток. Сверху отолит при крыт прозрачным колпачком, образующимс также в результате слияния особых длинны ресничек. От каждой «пружинки» берет начг ло ресничный шнур, направляющийся в мер! диональном направлении. Ресничные шнур дихотомически ветвятся, так что образуете восемь ресничных бороздок. Каждая из ни подходит к ряду гребных пластинок. Согласг Хуну, ресничные шнуры способствуют уст; новлению связи и передаче раздражений меу ду аборальным органом и рядами гребнь пластинок. Кроме указанных частей отмети еще, что эктодерма, окружающая аборальнь орган, образует два особо дифференцирова ных участка, покрытых мерцательным эпит лием. Возможно, что они способствуют пост янной смене воды в полости аборального о гана. Доказано, что при удалении аборальг
го органа нарушается координация движения гребных пластинок.
Изучение срезов. Снаружи тело Pleurobrachia (рис. 225), как вс гребневиков, покрыто плоским однослойным эктодермальным эпитет
ем, большинство клеток которого носит железистый характер. Особо дифференцирована эктодерма, подстилающая гребные пластинки. Она образует «базальные подушечки», состоящие из нескольких рядов, расположенных в один слой довольно высоких клеток (рис. 225, 2), несущих мощно развитые реснички. В результате склеивания ресничек и образуется гребная пластинка. Основания клеток, направленные к мезоглее, более широкие, чем их наружные части, несущие гребную пластинку. Благодаря этому проксимальная часть «базальной подушечки» в целом оказывается шире, чем дистальная.
Пользуясь результатами изучения тотальных препаратов или живого материала и приведенным выше описанием и рисунками, следует
Рис. 224. Аборальный орган Ноггг, hora plumosa, вид с аборального люса (из кн. Хуна):
1 — отолит, 2 ~ «пружинки», 3 — мерцат ные желобки
по серии поперечных разрезов восстановить соотношения частей гастроваскулярной системы. Обратить внимание на гистологию различных ее отделов. Глотка выстлана одно-
слойным мерцательным эпителием. Начиная приблизительно с середины, вплоть до отверстия в воронку по обеим плоским стенкам глотки проходит двойной валик гораздо более высоких, по-видимому, железистых клеток (рис. 225, 10), играющих, вероятно, существенную роль в процессе пищеварения.
Согласно Хуну, значительная часть пищеварительного процесса осуществляется в этом переднем отделе гастроваскулярной системы. В воронку поступают лишь жидкие, частично переваренные вещества. Это дает основание многим авторам называть ее желудком. Благодаря наличию валиков увеличивается также поверхность этого отдела гастроваскулярной системы. Остальные выстланные энтодермой отделы ее обладают по большей части плоским однослойным эпителием, клетки которого несут жгутики. Характер цилиндрического эпителия энтодерма принимает лишь в некоторых отделах пищеварительной системы. Так,
Рис. 225. Pleurobrachia rhododactyla (Х50)—поперечный разрез (по Шнейдеру):
1— гребная пластинка, 2 — утолщенная эктодерма, несущая реснички гребной пластинки, 3 — меридиональный канал, 4— мужская гонада, 5 — женская гонада, 6—щупальце, втянутое во влагалище, 7 — полость влагалища, 8 — канал воронки, 9 — глотка, сплющенная в сагиттальной плоскости, 10— продольный валик железистых клеток глоткн, И — мускульные волоконца, лежащие в мезоглее
Рис. 226. Ресничные розетки эктодермальных каналов Beroe ovata. А — изолированная розетка в профиль и сверху (нз кн. Хуна); Б — в разрезе (из Гертвига)
цилиндрические клетки находим на двух сторонах глоточных каналов и на наружной стенке меридиональных каналов. В эктодермальной части гастроваскулярной системы, особенна в стенках меридиональных каналов, нередко обнаруживаются «розетки» («Wimperrosetten» Хуна, рис. 226). Они представляют собой небольшие (20 мкм диаметром) углубления, на дне которых мезоглея непосредственно граничит с просветом канала. По краю углубления располагается двухслойный валик энтодермальных клеток, обладающих особо мощно разви
тыми ресничками, часть которых направлена в сторону просвета канала, часть же — в сторону мезоглеи.
Половые железы Ctenophora, в том числе и у Pleurobrachia, тесно связаны с меридиональными каналами гастроваскулярной системы. Гребневики — гермафродиты. Гонады развиваются в стенках меридиональных каналов, обращенных к эктодерме. В каждом канале располагаются мужская и женская половые железы, проходящие в виде утолщенной стенки вдоль всего канала (см. рис. 225, 4, 5). На поперечных срезах ясно' видны в яичнике довольно крупные ооциты. Семенники состоят из компактной массы мелких клеток, находящихся на разных стадиях сперматогенеза. Со стороны канала половые элементы прикрыты слоем эктодермальных клеток, непосредственно под которыми они и развиваются. Гонады расположены таким образом, что в двух соседних каналах на обращенных друг к другу сторонах всегда имеются железы одного и того же рода — или семенники, или яичники.
Довольно сложно гистологическое строение щупалец. Интересной особенностью их является наличие постоянного роста у основания на внутренней стенке влагалища. Это связано с тем, что дистальный конец длинных щупалец во время жизни животного обламывается. За счет постоянного роста проксимальной части щупальца осуществляетсг регенерация. Снаружи осевая часть щупальца так же, как тентил^ (с. 253), покрыта эпителием с многочисленными коллобластами. За
ним следует мощно развитая продольная мускулатура, заходящая и j тентиллы, обеспечивающая сильную сократимость щупальца. Осева; часть состоит из студенистого вещества, подобного мезоглее. Основа ние щупальца, представляющее собой область его постоянного роста образует три утолщения в виде валиков (рис. 227), проходящих вдол внутренней стенки влагалища, причем само щупальце отходит от сред него из этих валиков. Боковые валики слагаются из клеток эмбрионалг ного характера, за счет которых формируется наружный слой щупалг ца. Здесь можно наблюдать разные стадии развития коллобластов. Сред ний валик представляет собой очаг формирования мускулатуры расп щего щупальца и здесь же в него проникает центральная ось мезогле! Непосредственно под боковыми валиками проходят две ветви щупал!
цевых каналов гастроваскулярной системы.
Мезоглея Pleurobrachia представляет собой бесструктурное студенистое вещество, заполняющее все промежутки между каналами гастроваскулярной системы. В ней удается обычно рассмотреть отдельные, в большинстве своем звездчатые клетки соединительнотканного характера, а также пучки мышечных волокон, проходящие в различных направлениях.
Мускулатура Pleurobrachia (о мышцах щупалец сказано выше) слагается из гладких мышечных волокон, не связанных, как это имеет место у большинства Coelenterata, с эпителием. На хорошо фиксированных и окрашенных железным
Рис. 227. Гистология щупальца Pleurobrachia у его основания (по Шнейдеру):
1— стенка влагалища щупальца, 2 — полость влагалища, 3 — средний валик, 4 —боковой валик, 5— каналы щупальца, 6 — развивающиеся мышцы щупальца
гематоксилином препера-
тах можно рассмотреть следующие системы мускульных волокон. Под эктодермой, одевающей поверхность тела, располагается тонкий слой мышц, состоящий из наружного, продольного и внутреннего кольцевого слоя. Двойной, но очень слабо развитый слой мышц имеется также вокруг каналов гастроваскулярной системы. За его счет образуются два сильно развитых сфинктера. Один — вокруг ротового отверстия и второй— на границе между глоткой и воронкой. Третью систему представляют собой радиальные мышечные волокна, идущие от эктодермы через мезоглею к различным каналам гастроваскулярной системы и к влагалищу щупалец.
Нервную систему, изученную до сих пор у Ctenophora еще далеко недостаточно, обычно обнаружить на препаратах не удается. При фиксации осмиевыми фиксаторами на тангентально прошедших через эктодерму срезах иногда можно видеть отдельные мультиполярные нервные клетки субэпителиального нервного сплетения.
ОТРЯД BEROIDEA
Вёгое cucutnis Fabricius
Материал и методы изучения. Этот гребневик очень часто встречается в Баренцевом и Белом морях летом и осенью. Добывается планктонной крупноячеистой сетью.
Вёгое, благодаря его крупным размерам, можно вылавливать простым сачком на палке с борта шлюпки, так как животные хорошо видны в прозрачной морской воде. Вегое ведет пелагический образ жизни, типичный хищник.
Для общего ознакомления с организацией можно обойтись без изготовления препаратов. Используют живой или консервированный формалином материал. Чтобы рассмотреть глотку, нужно один экземпляр разрезать ножницами пополам в поперечном направлении. Вырезают небольшой кусочек стенки тела Вёгое с гребными пластинками и делают тотальный препарат, окрасив квасцовым кармином. На нем будет видно строение гребных пластинок и разветвления гастроваскулярной системы.
Изучение материала. Живые Вёгое плавают довольно быстро ротовым отверстием вперед. Тело их сплющено, вытянуто в направлении от
орального к аборальному полюсу и сплющено в латеральной плоскости (рис. 228), так что на поперечном разрезе представляется вытянутым овалом. Длина животного достигает 20 см. Весь оральный расширен-
ный полюс тела занят длинным щелевидным ротовым отверстием. Оно
может чрезвычайно сильно растягиваться, что имеет место нередко при новле добычи. К аборальному полюсу тело становится уже. Здесь рас-
рис. 228. Вегое cucumis (по Наумову):
1 — ротовое отверстие, 2 — ана-стохмозы. меридиональных каналов, г?—гонады, располагающиеся в выпячиваниях меридно-нальиых каналов
полагается небольшой аборальный орган типичного для гребневиков строения (с. 258). Меридиональные ряды гребных пластинок выражены хорошо и тянутся от аборального полюса почти до ротового отверстия. Сами гребные пластинки относительно невелики и расположены очень тесно. Щупальца, столь характерные для Pleurobrachia, у Beroidea отсутствуют.
Ротовое отверстие ведет в огромную глотку, которая здесь необычайно сильно развита. Она занимает большую часть внутренней полости Вёгое и почти доходит до аборальной полюса. Благодаря этому все тело гребневикг принимает вид сплющенного с боков колпачкг с полостью внутри. Последняя и представляв' собой полость глотки, все же остальные орга ны и ткани располагаются в стенках этог< колпачка. В глотке железистые валики, харак терные для многих Ctenophora, у Вёгое отсуз ствуют. По внутреннему краю ротового отвер стия располагаются особые упругие щетинк! способствующие удержанию пищи в полост глотки. Полость воронки очень невелика располагается близ аборального полюса. К: нал воронки отсутствуют, и от нее непосредс венно берут начало короткие выделительнь каналы.
Глоточные и меридиональные каналы х рошо развиты и тянутся до края рот вого отверстия, причем меридиональнь
как всегда, проходят непосредственно под рядами гребных пластинок. По краю ротового отверстия глоточный канал с каждой стороны разветвляется на два и в него впадают меридиональные каналы. Одна из наиболее характерных особенностей в строении гастроваскулярной системы Вёгое как представителя отряда Beroidea— наличие многочисленных ветвящихся анастомозов, отходящих по всей длине тела гребневика от меридиональных и глоточных каналов (рис. 228,2). Эти мелкие ответвления основных периферических каналов пронизывают всю мезоглею и образуют довольно густую сеть, хорошо заметную как на живых, так и на фиксированных формалином экземплярах. Вдоль меридиональных каналов в особых слепых выпячиваниях последних располагаются гонады (рис. 228, 3). У живых животных гонады окрашены в розовый цвет, причем семенники обладают более яркой окраской, чем яичники. Взаимное расположение их такое же, как было отмечено и для Pleurobrachia (с. 259).
Тип Plathelminthes — плоские черви
КЛАСС TURBELLARIA -
РЕСНИЧНЫЕ ЧЕРВИ, ИЛИ ТУРБЕЛЛЯРИИ
Ресничные черви занимают в практикуме весьма важное место — ознакомление с червями начинается именно с них. Разнообразие Tur-bellaria заставляет отвести на прохождение практикума в этом разделе значительное время. Удобнее всего начать разбор с отряда Seriata, где детальному рассмотрению подвергается обычная и достаточно крупная белая планария. Можно воспользоваться и другими пигментированными планариями, но, имея возможность предложить для использования ряд работ, детально освещающих строение именно Dendrocoelum lacte-ит, остановимся на этом объекте. Polycladida следует изучать сразу вслед за планариями. Их можно разобрать менее подробно, использовав одного представителя — Leptoplana, встречающегося в морях СССР. Наиболее трудную для изучения группу Neorhabdocoela (их приходится рассматривать только in vivo) оставляем под конец, после того как основные черты организации турбеллярий уже будут усвоены при разборе предыдущих объектов. Neorhabdocoela весьма распространены; однако здесь приходится дать ограниченное количество примеров типичных и наиболее обычных представителей. Подробнее разбирается классический объект для прижизненного наблюдения — Mesostoma ehrenber-gii, остальные более кратко. На примере Microstomum (отряд Macrosto-mida) рассматривают разнообразное и не часто встречающееся среди червей вегетативное размножение. Наконец, желательно ознакомиться с одним из представителей важного в филогенетическом плане отряда Acoela.
Однако не следует ограничиться только теми формами, которые фигурируют в практикуме. Необходимо ознакомление и с рядом других пресноводных Turbellaria, пользуясь при этом определительным! таблицами В. Н. Беклемишева в т. II руководства «Жизнь пресны: вод» и работами Карлинга, Лютера и Евдонина. --
ОТРЯД SERIATA—СЕРИАТЫ
Dendrocoelum lacteum (О. F. Muller) — белая планария
Материал и методы изучения. Dendrocoelum lacteum относятся к сем. Dendro-
coelidae подотр. Tricladida. Эта обычная форма стоячих и текучих водоемов живет под камнями, с нижней стороны опавших в воду листьев, под корой коряг, в пазухах листьев водных растений (в частности, ситниковых) и т. д. Прекрасно выносит содержание в аквариумах, хорошо кормится, например, водяными осликами (Asellus) с отрезанными конечностями (это облегчает планариям нападение иа добычу). Сгустки
свернувшейся крови также могут служить пищей планариям, но при таком способе питания следует тщательно убирать все остатки кормления, иначе вода загнивает и планарии быстро гибнут.
Изучение ведется частично на тотальных препаратах, а главным образом на сериях срезов. Тотальные препараты изготовляют из червей, фиксированных по Гелей (1928). Фиксатор изготовляют следующим образом: к 91 см3 дистиллированной воды добавляют 3 см3 крепкой азотной кислоты и 6 см3 продажного (40%-ного) формалина. Выбирают активно движущуюся плана-рию (из них получаются лучшие препараты) и бросают в чашечку с фиксатором, где она энергичными движениями мускулатуры тела вытягивается. При этом часто загибаются края и концы. Для расправления тела под планарию подводят лоскуток папиросной бумаги и животное вытаскивают вместе с бумагой на воздух. Осторожным разглаживанием кисточкой обычно удается планарию расправить совершенно. В случае удачи плаиарию прикрывают вторым кусочком бумаги и оставляют в таком виде на несколько минут. Далее объект переносят прямо в 96° спирт, промывают в нем и после обезвоживания заключают в бальзам. Перед заделкой планарию полезно слегка сплющить между стеклами. Выбирать следует объект с кишкой, окрашенной набитой в нее пищей. В таком случае дополнительная окраска препарата не нужна.
При изготовлении срезов гистологическая структура хорошо фиксируется жидкостью Ценкера с формалином (с. 12), но при этой фиксации плохо сохраняется форма тела — животное успевает сильно сморщиться. Применяя сулему с уксусной кислотой, удается чаще получить вытянутых, расправленных планарий. Главная серия срезов, на которой будет базироваться дальнейшее изложение, поперечная. При изучении анатомии очень помогут также фронтальная и сагиттальная серии. Толщина срезов 10—12 мкм. Окраска — любым гематоксилином, причем для гистологических целей несколько стекол обязательно должны быть окрашены железным гематоксилином.
Внешняя морфология. В нормальном подвижном состоянии тело сильно вытянуто в длину, имеет более или менее одинаковую ширину (слегка расширяется только в задней трети) и заострено сзади, а спереди срезано поперек (рис. 229). Тело в таком состоянии сильно уплощено. Раздражение червя любым способом (химическим, механическим) вызывает немедленную реакцию —сильное сокращение в продольном направлении; тело собирается в комок, медленно расправляющийся. В вытянутом состоянии длина тела достигает 26 мм при 6 мм ширины. Цвет тела молочно-белый. На этом фоне обычно хорошо выделяется кишечник, окрашенный в разные оттенки серого и ко-
рме. 229. Dendrocoelum lacteum. Внешний вид живой планарии (Х7) (ориг.)
Рис. 230. Dendrocoelum lacte-ит. Присасывательная бороздка на переднем конце фиксированного червя, вид с брюшной стороны
(Х25) (из кн. Кеннеля)
ричневого цвета в зависимости от характера пищи.
Передний конец отделен от остального тела легким пережимом — обособляется головная пластинка, подразделенная на три части. Средняя часть (лобный край) слегка вогнута, утолщается спереди, и под ней, с брюшной стороны, обособляется присасывательная бороздка, проходящая поперек тела. Эта бороздка лучше выделяется на фиксированном объекте, когда передний конец слегка сокращен (рис. 230). Когда животное спокойно скользит по субстрату, то
лобный край бывает слегка приподнят. При раздражении пла-нария плотно прикрепляется к субстрату присасывательной бороздкой, тело сильно сокращается и подтягивается к переднему концу. Далее судорожным движением головная лопасть выбрасывается вперед и снова прикрепляется. По бокам от лобного края выдаются в стороны боковые лопасти — щупальцеобразные выросты, короткие, широкие, с закругленными концами (см. рис. 229). Непосредственно позади располагаются два глаза черного цвета. Ротовое отверстие, обычно замкнутое, расположено на брюшной стороне кзади от середины тела. Позади ротового отверстия (приблизительно на половине расстояния между ним и задним концом тела) лежит общее половое отверстие. Выделительные отверстия — восемь пар боковых, дор-зально расположенных пар, могут быть с трудом рассмотрены только на срезах.
Анатомия. Кожно-мускульный мешок1. Тело снаружи покрыто ресничным эпителием. Эпителиальные клетки цилиндрической формы расположены в более или менее равномерной высоты слой, утолщающийся слегка только на краях тела (рис. 231). Ядра в клетках — округлой или овальной формы с многочисленными мелкими зернышками хроматина — лежат приблизительно посредине. В цитоплазме, вдоль клетки, пробегают поддерживающие фибриллы (рис. 232, А). Реснички у молодого животного видны по всей поверхности эпителия, у старого же клетки эпителия «лысеют» главным образом на боках тела. Работа ресничек in vivo видна только вблизи краев тела. Она выступает особенно отчетливо, если к воде прибавить мелко растертую тушь.
В клетках эпителия обычно заметны особые палочковидные образования— рабдиты. Каждая палочка in vivo сильно преломляет свет, окрашивается равномерно гематоксилином, слегка изогнута и обычно ориентирована перпендикулярно к поверхности эпителия. По размерам рабдиты весьма разнообразны. На спинной стороне тела их больше, чем на брюшной. На боках тела рабдиты обычно более длинные, чем в
1 Под кожно-мускульным мешком будем понимать наружный эпидермис, подлежащую соединительную ткань и кожную мускулатуру. В некоторых руководствах термин кожно-мускульный мешок применяется только для обозначения кожной мускулатуры.
9 АЙ
Рис, 231. Dendrocoelum lacteum. Поперечный разрез в области позади глотки (Х75) (из кн. Вильгельми):
1 — непарный отдел яйцевода. 2 — выделительные канальцы, 3 — кишечник. 4 — эпителий, 5 — дорзовентральные мышцы, 6 — краевые железы, 7 — желточный фолликул, 3 —продольный брюшной нервный ствол, 9 — подовая клоака, 10 — парный отдел яйцевода. // — семенники
Z9S
1
Рис. 232. Dendrocoelum lacteum. Эпителий. A — отдельная эпителиальная клетка на срезе (Х1500); Б — эпителий с рабдитиыми клетками на продольном срезе (Х830) (из кн. Гелей):
1 — реснички, 2 — их базальные зерна, 3 — рабдиты, 4 — опорные фибриллы, 5 — базальная мембрана, 6 — кольцевые мышцы, 7 — продольные мышцы. 8 — рабдитная клетка, 9 — диагональные мышцы
других частях эпителия. Расположены рабдиты или поодиночке, или (чаще) пучками. Они развиваются в специальных рабдитных клетках, лежащих под эпителием в паренхиме (рис. 232, Б) и связанных с эпителиальными клетками плазматическими мостиками, через которые рабдиты и проникают в эпителиальную клетку. Рабдиты при соприкос-t овении с водой расплываются и превращаются в слизь. Выход рабди-!ов из эпителия наблюдается обычно при прикосновении к поверхности тела планарии. Образующаяся при этом слизь имеет или защитноезна-
чение, или может помогать при улавливании добычи. Передний край тела с осязательными боковыми лопастями лишен рабдитов совершенно.
Плоской проксимальной поверхностью эпителиальные клетки прилегают вплотную к базальной мембране, подстилающей весь эпителиальный слой. Гелей (1912) в этой мембране различает тончайшую наружную перепонку, сильно окрашивающуюся гематоксилином, и более толстый,слабее окрашивающийся слой.
Рис. 233. Dendrocoelum lacteum. А — слизистая железа на срезе; 5—белковая железа (Х1000) (из кн. Шнейдера)
Время от времени между эпителиальными клетками встречаются промежутки — места выхода наружу протоков желез различных категорий. Иногда эти протоки пронизывают и толщу самих клеток. Удается рассмотреть железы двух категорий — слизистые (цианофильные, окрашивающиеся гематоксилином в синий цвет) и белковые (эритро-фильные, эозинофильные) (рис. 233). По форме обе категории желез похожи друг на друга. Их грушевидное тело погружено в паренхиму, выводные же протоки, разветвляясь, прободают базальную мембрану и открываются наружу на поверхности эпителия. В слизистых железах удается заметить на стадии формирования секрета крупные, слизистые вакуоли в плазме (рис. 233, Л) —этим они отличаются от белковых желез с мелкими белковыми гранулами (рис. 233, Б). Слизистые железы образуют особенно густое скопление на переднем конце тела в области присасывательной бороздки, вероятно, помогая своими выделениями прикрепляться к субстрату этой бороздкой. Белковые железы, видимо,
Рис. 234. Dendrocoelum lacteum. А — схематичное изображение тангентального разреза тела с расположением волокон кожно-мускульного мешка (по Ижима, с изменен.):
1 — поверхностные кольцевые мышцы, 2 — диагональные мышцы, 3 — внутренние продольные мышцы;
Б — участок поперечного разреза в области яичника (Х500) (ориг.):
J — мембрана яичника, 2 — ооциты с ядрами, 3 — брюшной нервный ствол, 4 — продольные мышечные волокна кожно-мускульного мешка, 5 — кольцевые волокна кожно-мускульного мешка, 6 — базальная мембрана эпителия, 7 — эпителий, 8 — рабдиты, 9 — дорзовентральные мышечные волокна
выделяют ядовитый секрет. Особенно много их концентрируется по краю тела с вентральной стороны (см. рис. 231).
Кожная мускулатура. Изучить кожную мускулатуру следует на поперечных разрезах и дополнить общую картину рассмотрением тангентальных срезов фронтальной серии.
Непосредственно к базальной мембране прилегает сплошной слой кольцевых мышц, расположенных в один ряд. За кольцевыми мышцами идет слой диагональных мышц, пучки волокон которого перекрещиваются друг с другом. Этот слой развит также не сильно. Наконец, самое внутреннее положение занимают пучки продольных мышц, отделенные друг от друга и от периферической мускулатуры прослойками паренхимы (рис. 234).
Паренхима. Паренхиматозные клетки заполняют промежутки между органами. Форма клеток улавливается с трудом. На хорошо зафиксированных препаратах можно видеть полигональные, неправильные, нередко с отростками клетки, рыхло соединенные друг с другом, и промежутки, заполненные гомогенным промежуточным веществом (рис. 235). Получается характер рыхлой соединительной ткани, в которой разбросаны железистые клетки, нервные волокна, мышечные волокна и проходят каналы выделительной системы.
Мускулатура паренхимы. В паренхиматозной мускулатуре различают дорзовентральные и поперечные мышцы. Дорзовентральные мышцы идут от спинной к брюшной стороне тела либо строго вертикально, либо косо, наклоняясь вперед или назад. Концы мышечных волокон при этом обычно расщепляются в виде кисточки и тончайшими окончаниями входят в толщу эпителия (рис. 236). Каждое мышечное волокно имеет эллипсоидальное сечение и по его периферии проходят миофибриллы, в середине же видна
Рис. 235. Dendrocoelum lacteum. Паренхиматозные элементы на срезе (Х600) (из кн. Гелей): / — ядро паренхиматозной клетки, 2 — мышечные волокна
прозрачная саркоплазматическая ось (рис. 237). Ядро каждой мышечной клетки расположено сбоку от волокна в участке саркоплазмы. Последний связывается с самим мышечным волокном плазматической перемычкой (см. рис. 236). Подобные детали рассмотреть удается с трудом, для их обнаружения обычно применяют метод прижизненного окрашивания метиленовым синим. Поперечные волокна в небольшом количестве пробегают между краями тела, главным образом вдоль брюшной стороны. Паренхиматозная мускулатура довольно тесно сближается со стенками кишечника. Нередко дорзовентральные мышцы оплетают разветвления кишечни-
2
Рис. 236. Dendrocoelum lacteum. Покровы на поперечном разрезе (Х550) (из кн. Гелей):
1 — протоки кожных желез, 2 — рабдиты, 3 — ядро эпителиальной клетки, 4— базальная мембрана, 5 — кольцевые мышцы, 6 — продольные мышцы,
7 — дорзовентральные мышцы, 8 — рабдитные клетки
ка — около них создается своеобразный мускульный слой, имеющий значение при движениях отдельных частей кишечника (см. ниже).
Пищеварительная систе-м а. Ротовое отверстие расположено на брюшной стороне задней трети тела. Оно ведет в объемистый глоточный карман, полость которого занята глоткой. Глоточный карман тянется вдоль тела вперед от ротового отверстия (соответствуя по длине глотке) и выстлан ресничным эпителием без рабдитов. Под эпителием видны два слоя мышечных волокон — периферический кольцевой и внутренний продольный. Глотка — цилиндрический, мускулистый орган. Иногда называют ее сосательным хоботом, учитывая ее функцию. Гистология глотки яснее
видна на ее поперечных разрезах. Поверхность глотки покрыта осо-
Рис. 237. Denrocoelum lacteum. Мышечные волокна кожно-мускульного мешка на продольном срезе (Х1500) (из кн. Гелей):
/ — базальная мембрана эпителия, 2 — кольцевые волокна, 3 — продольные волокна
бым ресничным, так называемым погруженным эпителием. Особенность этого эпителия заключается в том, что на поверхность выступают эпителиальные пластинки с ресничками, лишенные ядер и подостланные базальной мембраной. Ядра же лежат глубоко под базальной мембраной (рис. 238). Плазма, их окружающая, соединяется тонкими мостиками с эпителиальными пластинками, и тела клеток таким образом оказываются погруженными по сравнению с самими плас-
А
Рис. 238, Dendrocoelum lacieum. А — схематизированный поперечный разрез через стенку глотки (Х600) (из кн. Штейн-мана и Бресслау, с изменен.):
/ — реснички, 2— наружные эпителиальные пластинки, 3— базальная мембрана, 4 — слой продольных мышечных волокон, 5 — слой кольцевых мышечных волокон, 6 — тела клеток наружного погруженного эпителия, 7 — протоки желез наружной железистой зоны, 8 — нервное сплетение, 9 — радиальные мышцы, 10 — протоки желез внутренней железистой зоны, 11— тело клетки внутреннего погруженного эпителия, 12 — слой кольцевых и продольных мускульных волокон, 13— внутренние эпителиальные пластинки;
Б — клетки погруженного эпителия иа срезе (Х180) (из кн. Гелей):
1 — реснички, 2 — эпителиальная пластинка, 3 — безъядерные отроги цитоплазмы эпителиальных пластинок, 4— протоки слизистых желез, 5 — ядро клетки погруженного эпителия
тинками. От пластинок вглубь отходят еще и безъядерные отроги цитоплазмы (рис. 238, Б). Такой погруженный эпителий покрывает наружную поверхность глотки. Губы глотки лишены ресничек, на внутренней поверхности дистального конца глотки развит также погруженный эпителий, переходящий в обычный, кубический у проксимального конца. Рабдитов в эпителии глотки нет.
Мускулатура глотки развита хорошо. Непосредственно к наружной базальной мембране прилегает несколько слоев продольных мышц. Более мощный слой кольцевых мышц следует за ними (рис. 238, Л). Обе эти системы мышц образуют наружную мускулистую зону стенки глотки, составляющую около Vs толщины стенки. Внутренняя мускулистая зона более мощная и составлена у Dendrocoelum из продольных и кольцевых мышц вперемежку друг с другом. И внутренняя, и наружная мускулистые зоны ограничивают значительную внутреннюю область стенки глотки, через которую пробегают многочисленные пучки радиальных мышечных волокон (рис. 238, А).
В средней части глоточной стенки видны внутренний и наружный железистые слои и между ними нервно-паренхиматозный слой. Толща железистых слоев составлена из многочисленных эритрофильных и цианофильных желез. Условно их можно принять за слюнные и ядовитые. Выводные протоки этих желез открываются на вершине глотки в области губ глотки. Нервное сплетение (рис. 238, Л) состоит из сети нервных волокон, оплетенных паренхиматозными элементами. Движения глотки, подчас весьма сложные, несомненно, находятся под влиянием этого сплетения. Наконец, в толще стенки глотки можно заметить и перерезанные канальцы выделительной системы.
Общую топографию кишечника следует изучить или на живой планарии (см. рис. 229), или на тотальном неокрашенном препарате. Вперед от глотки идет передняя ветвь кишечника (редко прямо, чаще зигзагообразно), утончающаяся на дистальном конце. От нее отходят вправо и влево ответвления первого порядка, в свою очередь ветвящиеся,— образуются ветви второго и даже третьего порядка. Задние две ветви кишечника начинаются от основания передней ветви и тянутся вдоль глотки, огибают выводной комплекс половой системы и, сблизившись, идут до конца тела. Длина обеих ветвей обычно неодинакова. От задних ветвей также отходят отростки, но последние идут только лате-рально — внутрь изредка выдаются незначительные выросты.
Боковые ответвления главных частей кишечника обычно отходят несимметрично с правой и левой сторон, но общее количество ответвлений первого порядка с той и с другой сторон более или менее одинаково и колеблется от 20 до 30 и больше на одной стороне. Приблизительно половина ответвлений приходится на долю переднего отдела кишечника. Соседние разветвления высшего порядка (второго и третьего) нередко анастомозируют между собой. Анастомозы наблюдаются также между задними главными ветвями кишечника: позади полового отверстия внутренние выросты этих ветвей могут сливаться друг с другом (см. рИс. 229, 240).
На поперечном разрезе через планарию обычно попадаются перерезанные главные ветви кишечника и их боковые ответвления. Стенки
кишечника состоят из эпителиальной выстилки, базальной мембраны и мускулистого слоя. Клетки эпителия основаниями укреплены на очень тонкой базальной мембране. Главная масса эпителия составлена из так называемых питательных клеток различной высоты, утолщенных на своих свободных концах и способных выпускать псевдоподии (рис. 239). Ядра этих клеток обычно смещены к основаниям. В мелкозернистой протоплазме этих клеток у наевшихся животных видны захваченные внутрь пищевые частички. Общая толщина питательного эпителия неравномерна. Гелен (1928) заметил, что стенки кишечника, приближенные к поверхности тела, тоньше тех стенок, которые обращены в сторону большей массы паренхимы. По его мнению, эпителий утолщается на той стороне, куда должно поступать большее количество питательных веществ из кишечника для питания большей же массы паренхимы. Между питательными клетками в стенке кишечника изредка попадаются более низкие клетки с вакуолистым, грубозернистым содержимым (рис. 239). Это железистые клетки. Количество их заметно возрастает в эпителии основания передней ветви кишечника.
Добычей для Dendrocoelum служат различные водные придонные животные. Планария очень охотно поедает, например, водяных осликов. При этом она прикрепляется к добыче присасывательной бороздкой своего переднего конца; добыча становится неподвижной, видимо, ее обволакивает со всех сторон слизь из желез планарии, и рачок подводится к брюшиой стороне тела. Тогда высовывается через ротовое отверстие глотка и концом начинает ощупывать ослика, пока не присосется где-нибудь в промежутке между сегментами. Через короткое вре-
Рис. 239. Dendrocoelum lacteum. Разрез стенки кишечника (Х500) (из кн. Шнейдера):
1 — питательные клетки, 2 — железистая клетка, 3 — желточные клетки, 4 — паренхима
мя глотка уже проникает внутрь тела (действуют растворяющие выделения глоточных желез?) и перистальтическими ее движениями содержимое ослика перекачивается в кишечник планарии. Пища сперва по-
ступает в переднюю ветвь кишечника, которую и наполняет со всеми ее отростками. Время от времени сокращениями стенок этого отдела кишечника содержимое перекачивается в задние ветви. Следовательно, передняя ветвь выполняет функцию желудка. По окончании высасывания планария становится неподвижной, и тогда удается наблюдать постоянную циркуляцию пищевой кашицы вперед и назад благодаря периодическим сокращениям стенок кишечника. Подобные движения кишечника вызываются, несомненно, в первую очередь работой собственной мускулатуры кишечника, а во вторую — сокращениями дорзовентральных мышц, образующих, как это указывалось выше, постоянную обкладку вокруг кишечника. Переваривание и всасывание наиболее интенсивно идет в первые 1,5—2 ч. Частички пищи при этом захватываются свободными концами эпителиальных клеток кишечника и перевариваются интрацеллюлярно. Дефекация совершается в результате энергичного сокращения всего тела и особенно кишечника. Содержимое кишки при этом с силой выпрыскивается наружу через ротовое отверстие.
Выделительная система. Элементы выделительной системы in vivo можно рассмотреть только на молодых, недавно вылупившихся из кокона животных, слегка придавливая их покровным стеклом. Картину следует дополнить изучением серии поперечных срезов.
Два главных сильно извитых, с анастомозами между извивами канала выделительной системы тянутся вдоль всего тела вблизи его спинной стороны, непосредственно под кожно-мускульным мешком. Время от времени извивы главных каналов сплетаются в клубки и от этих клубков дорзально направляются очень короткие выводные канальцы, открывающиеся на спинную сторону тела выделительными порами (рис. 240, 241). Таких выделительных пор обычно насчитывается восемь пар, и расположены они через правильные промежутки на поверхности тела планарии. Главные каналы анастомозируют друг с другом только в области глаз. Тончайшие разветвления выделительной системы и терминальные клетки с мерцательным пламенем у Dendro-
Рис. 240. Dendrpcoelum lacleum. Общее строение выделительной системы (ХЮ) (из кн. Вильгель-ми):
Z — анастомоз между главными продольными каналами, 2 — кишечник, 3 — глаз, 4 — выделительные поры, 5— глотка, 6 — главный продольный канал
Рис. 241. Dendrocoelum lacteum (из кн. Вильгельмы):
А — выделительная пора иа срезе (Х120): / — пора, 2 — выделительные канальцы, 3 — кишечник,
Б— терминальные клетки протонефридиев на срезе (Х500): 1 — мерцательное пламя, 2 — выделительный капилляр
coelum обычно видны плохо. На срезах очень редко удается на концах таких канальцев найти терминальную клетку округлой формы с длинным мерцательным пламенем (рис. 241, Б).
Нервная система. При просмотре серии поперечных разрезов (а также и фронтальных) следует обратить внимание на попадающиеся на срезах различные участки нервной системы. Среди паренхиматозных клеток нервные элементы выделяются в виде почти неокрашенных образований пузырчатой структуры. Разобраться в общей топографии нервной системы рекомендуется, используя реконструкцию ее, изображенную на рис. 242. Иннервация внутренних органов, особенно половой системы, показана на рис. 243.
Особенностью центральной нервной системы D. lacteum является почти полное отсутствие утолщений в передней части брюшных нервных стволов — почти не дифференцированы церебральные, ганглиозные скопления. Их место занимают передние концы брюшных нервных стволов, спаянные между собой солидными комиссурами. Вторая 'особенность центральной нервной системы D. lacteum — это наличие специальных выростов церебральной части брюшных стволов, чувствительных лопастей с правой и с левой сторон (lobi sensorici), нервы от которых идут главным образом к боковым щупальцеобразным лопастям лобногс края тела.
Гистологические элементы центральной нервной системы такж< удается разобрать на срезах. В центре нервного ствола (в виде серд цевины) проходят обычно нервные волокна, нервные же клетки (ганг лиозные и глиальные) образуют род коры, распределяясь по периферии Ганглиозные клетки с двумя или многими отростками, с прозрачно! слабо окрашенной протоплазмой отличаются (не сильно) от глиальны: клеток с крупным ядром, темноокрашенной зернистой плазмой и такж^ с отростками. Последние, переплетаясь между собой, образуют основ 276
ную поддерживающую строму, в которую погружены нервные клетки. На срезах дифференцировать нервные и глиальные элементы удается с трудом.
Органы чувств. Из органов чувств в первую очередь следует остановиться на боковых лопастях переднего конца тела, выполняющих осязательную функцию. Они усажены более длинными ресничками по сравнению с таковыми на остальном теле.
Далее следует рассмотреть на срезах структуру глаз, устроенных по типу так называемых инвертированных глаз. Каждый глаз соединяется с центральной нервной системой специальным зрительным нервом (рис. 244). Глазной пигментный бокал ориентирован в паренхиме под кожно-мускульным мешком таким образом, что его отверстие направлено вбок и немного дорзально. Зрительный нерв подходит к отверстию бокала и распадается десятка на три волокон, подходящих к зрительным (ретинальным) клеткам. Последние имеют веретенообразную фор-
1
Рис. 242. Dendrocoelum lacteum. Реконструкция центральной нервной системы (ХЗО) (из кн. Гелей) :
1 — глаз, 2 — чувствительные окончания в боковых лопастях, 3 — глазной нерв, 4 —глазная передняя церебральная комиссура, 5 —lobus sensoricum, 6 — главная задняя церебральная комиссура, 7 — расчлененная церебральная комиссура, 8 — продольный брюшной нервный ствол, 9 — поперечные нервы заднего брюшного нервного ствола, 10 — вырезка, где помещался lobus sensoricum, 11 — церебральные нервы. 12 — передний продольный нервный ствол, 13 — вентральные комиссуры передних продольных стволов, 14 — вентральные комиссуры про^ дольных брюшных нервных стволов
Рис. 243. Dendrocoelum lacteum. Схема иннервации некоторых внутренних органов (Х15) (из кн. Гелей):
1 — поперечные комиссуры между продольными брюшными стволами, 2 — продольный брюшной нервный ствол, 3—глотка, 4 — ротовое отверстие, 5 — семяпровод, 6 — копулятивная сумка, 7 — пенис, 8 — половая клоака, 9 — наружное половое отверстие, 10 — мускулистый железистый орган
му и лежат вне бокала, около его отверстия. В каждой зрительной клетке видно ядро. Отростки зрительных клеток входят в полость бокала и продолжаются в так называемые зрительные колбочки или палочки — удлиненной формы образования (рис. 244) с тонкой исчерченностью, перпендикулярной поверхности. Эти палочки видны только при сильных увеличениях и на хорошо фиксированных препаратах. Стенка пигментного бокала составлена из массы мелких черных зернышек пигмента. Снаружи к бокалу тесно прижимается единственное ядро пигментной части глаза (пигментный бокал, таким образом, — производное одной клетки).
Половая система. Раз-
Рис. 244. Dendrocoelum lacteum. Разрез бирают половую систему глав-через глаз (х750) (из кн. Гессе): ным образом на срезах. Тоталь-
1 — пигментный бокал, 2 —зрительные колбочки, НЫ6 ПрвПарЭТЫ ПОМОГАЮТ МЯЛО — 3-ретинальные клетку-ядро зрительного бо- почтивсе детали МЛСКИруЮТСЯ темноокрашенными ветвями кишечника. Разбору серии срезов вначале предпошлем общее описание половой системы. При этом,, следует иметь в виду, что у D. lacteum наблюдается протерандрия: у молодых животных развиваются семенники, но нет еще, например, желточников; у старых, наоборот, максимально развиваются желточники, семенники же сохраняются лишь в редуцированном состоянии.
Выводные пути половой системы открываются в половую клоаку— полость, подразделенную кольцевой складкой на два отдела: передний, конический, куда выдается копулятивный орган (соответствует мужскому атриуму других планарий), и задний, куда впадают протоки некоторых дополнительных органов женской половой системы (соответствует женскому атриуму других планарий). Выводные протоки женских половых желез открываются около границы между обоими отделами в суженную часть переднего атриума (рис. 245).
Внутренняя поверхность половой клоаки покрыта ресничным эпителием. Под эпителием лежат два слоя мышц. Ближе к эпителию прилегает слой кольцевых мышц, глубже лежит слой продольных. Наружное половое отверстие окружено также кольцевыми мышечными волокнами и сообщает женский атриум с наружной средой.
Мужская половая система. Многочисленные семенник! (количество их у взрослого животного превышает 200—300) разброса ны в паренхиме над и под ветвями кишечника вблизи вентральных i
дорзальных сторон тела (см. рис. 250). Появляются они уже около яичников (передний конец тела), и область их распространения тянется до заднего конца тела. Около глотки семенники занимают только боковое положение. Каждый семенник имеет вид пузырька, обычно наполненного спермой или клетками на различных стадиях сперматогенеза (рис. 246). Спермин Dendrocoelum имеют сильно вытянутую головку (длиной до 175 мкм), явно подразделенную вдоль на ядерную часть (дающую типичную ядерную окраску) и плазматическую. Основание головки сильно сужается; образуется шейка, или соединительная часть, с отходящими от нее вперед (под острым углом) двумя длинными жгу
тами.
От семенников отходят тонкие семявыносящие канальцы (vasa effe-rentia). Они впадают в семяпроводы (vasa deffe-rentia), которые расположены вентрально около продольных стволов нервной системы. В области глотки и далее семяпроводы у половозрелого животного резко вздуваются и, переполняясь спермой, образуют ложные семенные пузыри. Стенки этих протоков составлены из плоского эпителия (без ресничек) и тонкой мускулистой обкладки. Оба семяпровода вливаются порознь в мешок копулятивного аппарата.
Копулятивный аппарат представлен пенисом и расположен позади глотки вблизи полового отверстия. Он подразделяется на два отдела: 1) мешок пениса (bulbus penis)—отдел, погруженный в толщу паренхимы, 2) выдающуюся от него в просвет половой клоаки папиллу пениса (papilla penis). Мешок пениса — полый шар с толстыми мускульными стенками. Полость меш
Рис. 245. Dendrocoelum lacteum. Общий вид выводных путей половой системы со спинной стороны (Х40) (из кн. Ижима):
/ — копулятивная сумка, 2 — семяпровод, 3 — эозинофильные железы, 4 — мускулистый железистый орган, 5 — задний атриум, 6 —парный отдел яйцевода, 7 — наружное половое отверстие, 8 — скорлупоьые железы, 9 — непарный отдел яйцевода, 10— передний атриум, // — папилла пениса, 12 — flagellum. 13 — мешок пениса, 14 — vesicula seminalis interna
ка — семенной пузырь (vesicula seminalis interna), выстлан эпителием с клетками различной высоты и поэтому образует многочисленные выросты. Мускулатура в стенках мешка состоит главным образом из многочисленных кольцевых волокон с пробегающими между ними радиальными. В промежутках между мышечными пучками проходят в полость мешка протоки эозинофильных желез пениса (см. рис. 245). Сами железы довольно глубоко погружены в паренхиму вокруг бульбуса, и их мелкозернистый секрет примешивается к массе спермы в просвете мешка.
Папилла пениса выдается конусом в мужской атриум. В толще ее мускулистых стенок, составленных также главным образом из кольцевых волокон, проходит узкий семяизвергательный канал (ductus ejaculatorius). Основание папиллы пениса вдается в полость бульбуса в виде своеобразной кольцевой складки вокруг проксимального отверстия семяизвергательного канала (см. рис. 245). Складка эта носит название flagellum, имеет обычно сморщенные стенки и в спокойном состоянии служит в качестве клапана, не позволяя сперме выливаться из полости бульбуса. При копуляции же flagellum выворачивается наружу, сильно удлиняется за счет расправления складок своей стенки и превращается в копулятивную трубочку, вводимую в половое отверстие партнера, так как сам пенис (его мускулистая часть) не способен выходить вообще за пределы половой клоаки (см. ниже).
Рис. 246. Dendrocoelum lacteum'. Разрез через семенник (ХбОО) (из кн. Шнейдера):
/ — сперматоциты, 2 — сперматиды на различных стадиях формирования сперматозоидов, 3 — семявыносящий канал
Рис. 247. Dendrocoelum lacteum. Поперечный раз-рез через яйцевод (Х750) (из кн. Гелей):
1 — ядра клеток погруженного эпителия, 2— гранулы гли* . - когена, 3 — реснички в просвете яйцевода
Женская половая система. Два яичника яйцевидной формы лежат в передней части тела, вентрально от разветвлений кишечника в области 4—5 боковых ответвлений последнего. На поперечных срезах видно также, что яичники располагаются медиально по отношению к продольным нервным стволам. Стенка яичника представлена тонкой бесструктурной оболочкой. Внутри яичника видна компактная масса многочисленных яйцевых клеток на разных стадиях созревания. Между ооцитами и яйцами разбросаны питательные клетки и клетки стромы.
От каждого яичника латерально отходит по яйцеводу. Последние тянутся вдоль тела вблизи продольных стволов нервной системы. Стенки яйцевода образуют высокие грушевидные клетки, своими расширенными концами погруженные в окружающую яйцевод паренхиму. От этого эпителия выдаются длинные реснички, располагающиеся в просвете яйцевода (рис. 247). Тонкий слой кольцевых мышц расположен между телами эпителиальных клеток.
В пределах яйцевода можно различить три основных отдела: первый, начальный (tuba) можно считать от яичника до впадения первых желточных протоков. Это короткий отдел, наполненный обычно спермой, который может быть сравним с семяприемником (receptaculum seminis), хотя расширения канала здесь и не наблюдается. Второй отдел яйцевода — область так называемых желточных воронок. Дело в том, что стенка яйцевода на всем протяжении пронизана многочисленными отверстиями — выводными протоками желточников. Каждый проток открывается в яйцевод желточной воронкой, нередко непосредственно связанный с желточником. У червей с недоразвитыми еще жел-точниками каждое отверстие прикрыто особой замыкательной клеткой. Наконец, третий отдел яйцевода, расположенный уже позади половой клоаки, — это железистый отдел, куда вливаются протоки скорлуповых желез. Железистый отдел начинается собственно с того места, где яйцевод перегибается и направляется к середине до места слияния с парным яйцеводом противоположной стороны. Непарный отдел яйцевода идет вперед и вливается в суженную часть переднего (мужского) атриума с дорзальной стороны (см. рис. 245). Скорлуповые железы (одноклеточные, с зернистым секретом) особенно сильно развиваются к моменту откладки коконов. Функция желез будет разобрана ниже.
Желточники у молодых червей — это тяжи из желточных клеток, ветвящиеся и анастомозирующие друг с другом. Плазма клеток обычно окрашивается довольно темно, по этому признаку их и находят на срезах. У червей, уже готовых к откладке коконов, желточники разрастаются, теряют резкие очертания и занимают на срезах значительное пространство между ветвями кишечника. Собственной оболочки такие желточники не имеют и представляют собой просто кучки желточных клеток, разбросанные в паренхиме.
Ядра желточных клеток относительно велики и богаты хроматином, отчего сильно окрашиваются (см. рис. 239, <?). Кроме желточных гранул и капелек жира в плазме желточных клеток удается обнаружить зерна скорлуповой субстанции (см. ниже).
Добавочные органы половой системы. С половой клоакой (именно с ее задней частью, с женским атриумом) связаны
6
Рис. 248. Dendrocoelum lacteum. Продольный сагиттальный разрез через копулирующих животных (Х20) (из кн. Бурра): -/ — железистый участок яйцевода, 2 — копулятивная сумка, 3 — мускулистый железистый орган, 4 — flagellum правой особи, введенный через половое отверстие в копулятивную сумку левой, 5 — мешок пениса, 6— задние концы обоих червей, загнутые при копуляции дорзально
два добавочных элемента половой системы. Первый из них представляет собой мешок со складчатыми стенками, расположенный впереди от копулятивного органа и дорзально от него (см. рис. 245). От этого мешка отходит тонкий каналец (стебелек), ведущий назад и впадающий либо прямо в атриум, либо в просвет добавочного органа половой системы1. Мешок выстлан внутри железистым эпителием, без ресничек. Мускульного слоя в его стенках нет. Каналец, наоборот, имеет ресничный эпителий и мускулистую обкладку из тонких слоев кольцевых (внутренних) и продольных (наружных) волокон. Функция данного органа сходна с функцией копулятивной сумки у Neorhabdocoela. При оплодотворении flagellum пениса вводится через половое отверстие именно в просвет мешка, куда и изливается сперма (рис. 248). Поэтому самое правильное название этого органа — копулятивная сумка (bursa copulat-rix), как это и указывает Бурр (1912). Старые же названия — матка (uterus), стебельчатый железистый мешок — едва ли могут быть приложимы в данном случае, так как первое название предусматривает развитие в нем яиц, чего никогда не бывает, а второй совершенно не выражает назначения этого органа. Термин «семяприемник» здесь также не подходит, так как его роль выполняет начальный отдел яйцевода.
Второй добавочный орган половой системы, так называемый мускулистый железистый орган, расположен слева от половой клоаки (см. рис. 245). По форме это грушевидное образование, вершиной вдающееся в полость половой клоаки и по размерам мало уступающее копуля-
1 Место впадения стебелька у D. lacteum варьирует. Например, Ижима (1884) изображает стебелек, впадающий внутрь мускулистого органа, в то время, как по Штейн-ман и Бресслау (1913), стебелек открывается прямо в половую клоаку. Возможно, что здесь имеют место неучтенные до сих пор видовые отличия между разными Dendrocoelum, тем более, что в нашей практике также приходилось сталкиваться с подобными вариациями.
дивному органу. Внутри этого органа — узкая вытянутая полость, вернее щель, выстланная железистым эпителием. Стенка мускулистого органа очень толста и составлена прежде всего из слоя внутренних, кольцевых мускульных волокон. Далее к периферии, между кольцевыми волокнами, вклиниваются продольные, и система приобретает довольно сложный характер. Назначение мускулистого железистого органа остается совершенно неясным. Бурр (1912) и Графф (1912—1917), например, считают, что он соответствует тем составным частям полового аппарата Acoela, которые специально приспособлены для поражения добычи, и они придают ему именно эту функцию. Мейкснер же (1928), наоборот, считает мускулистый железистый орган за новообразование, появляющееся впервые у Tricladida и выполняющее чувствительную функцию во время копуляции. Такую же чувствительную функцию этому образованию приписывают Штейнман и Бресслау (1913).
Образование кокона. D. lacteum откладывает яйцевые коконы 2— 3 мм в диаметре ярко-красной или коричневой окраски1. В состав кокона входят 5—40 яйцевых клеток и несколько сот (и даже тысяч) желточных. Все это поступает в передний отдел половой
/
Рис. 249. Dendrocoelum lacteum. Медиальный сагиттальный разрез через планарию с коконом в области позади ротового отверстия (х20) (из кн. Бурра):
I — мешок пениса, 2 — копулятивная сумка, 3 — глотка, 4 — глоточный карман, 5 — ротовое отверстие, 6 — наружное половое отверстие, 7 — задний атриум. 8 — железистый отдел яйцевода со скорлуповыми железами, 9 — кокон в переднем атриуме
1 Турбеллярии разделяются на две группы, которым иногда придается значение подклассов Archoophora и Neoophora. К первой группе относятся более примитивные отряды (Acoela, Polycladida, Alacrostomida и др.); у их представителей, лишенных желточников, яйца содержат желток, как у большинства многоклеточных животных (эндолецитальные яйца). Ко второй группе принадлежат отряды, характеризующиеся наличием желточников, которые производят женские половые клетки, богатые желтком, но не способные к развитию (желточные клетки). В связи с этим все Neoophora откладывают не яйца, а так называемые сложные яйца, или правильнее — яйцевые капсулы, содержащие помимо одного или нескольких яйцевых клеток, лишенных желтка (экзолецитальных яиц), много питательных желточных клеток. У Tricladida сравнительно крупные яйцевые капсулы получили название коконов. Все паразитические классы плоских червей также обладают желточниками и производят не яйца, а яйцевые капсулы. В паразитологической литературе обычно яйцевые капсулы для простоты именуются яйцами, в лучшем случае — сложными яйцами.
Рис. 250. Dendrocoelum lacteum. Схема общей организации, вид со спинной стороны (Х15) (из
Cambridge Natural History);
I — глаз. 2— ганглиозное скопление, 3 — семенники, 4 — яичник, 5 — жел* точники, 6 — яйцевод в области желточных вороиок, 7 — брюшиой нервный ствол, 8 — ложные семенные пузыри, 9 — семенные канальцы, 10 — мускулистый железистый орган, 11 — половое отверстие, 12 — парный железистый отдел яйцевода, 13—непарный отдел яйцевода, 14—
клоаки (в мужской атриум, рис. 249). Яйцевые клетки уже оплодотворены той спермой, которая собралась в начальном отделе яйцевода. Попадает она туда после оплодотворения из копулятивной бурсы. Образование капсулы вокруг такой кучки клеток происходит за счет скорлуповых гранул желточных клеток, склеиваемых вместе зернистым секретом скорлуповых желез (Бурр, 1912, и др.). Кокон при откладке приклеивается к субстрату, видимо, выделениями железистых клеток в стенках половой клоаки и особенно тех, которые расположены в области полового отверстия.
Изучение серии срезов. Серия поперечных срезов изучается, начиная со срезов через передний конец тела. Следует внимательно изучить каждый срез при малом и большом увеличении микроскопа и сделать схематические зарисовки попадающихся на срезах органов. Выгоднее одну и ту же систему органов отмечать на рисунках одним и тем же цветом. При разборе серии (рис. 251) обязательно следует иметь перед глазами общую схему строения D. lacteum (рис. 250).
Первые срезы в области присасывательной бороздки и боковых лопастей используют главным образом при рассмотрении многочисленных железистых клеток, открывающихся на переднем конце тела и для изучения морфологии присоски. Несколько далее назад на срезах появляются разветвления кишечника, нервная система (передние концы главных нервных стволов), глаза; далее видны яичники и отходящие от них яйцеводы. Последние должны быть прослежены до конца на всех следующих срезах. Вскоре после срезов с яичниками начнут попадаться срезы с семенниками или желточ-никами (в зависимости от того, в какой стадии созревания половых продуктов находится планария) или, что бывает ре-женский атриум, 15 — мужской атриум, 16 — пенис, 77— flagellum, 18— копулятивная сумка, 19 — задняя ветвь кишечника, 20 — глоточный карман, 21 — стенка глотки, 22 — передняя ветвь кишечника
же, с теми и другими. На таких срезах попадаются и семяпроводы (еще узкие). Далее назад срезы проходят уже через глотку. Кончается глотка, начинают попадаться различные части полового аппарата, сконцентрированные впереди от полового отверстия.
В первую очередь на срезах обнаруживается мешок копулятивной бурсы, далее копулятивный орган, рядом с которым (дорзально от него) виден стебелек (каналец) бурсы. Семяпроводы в области глотки уже вздуты (обязательно следует найти места их впадения в пенис с правой и с левой сторон порознь). Далее назад на срезах лежит передний отдел половой клоаки,в конце которого удается найти место впадения непарного протока после слияния яйцеводов, и на этих же срезах располагается мускулистый железистый орган. Следует найти место впадения протока копулятивной бурсы. Далее на срезах — задний атриум и половое отверстие. Здесь же еще находятся яйцеводы, именно их железистые отделы со скорлуповы-ми железами. Наконец, остаются срезы только с кишечником, чем и заканчивается серия.
По всем срезам проходят элементы нервной и выделительной системы. Выделительные канальцы удается заметить вблизи спинной стороны срезов только при большом увеличении (может быть даже при иммерсии).
Рис. 251. Dendrocoelum lacteum. Серия поперечных разрезов (полусхематично). А — разрез в области глаз; Б — в области яичников; В — в области ротового отверстия; Г—позади глоточного кармана; Д — в области основания пениса; Е — через мускульный мешок; Ж — перед половым отверстием; 3 — через половое отверстие (Х40) (ориг.):
/ — глаз, 2 — ветви кишечника, 3 —яичники, 4—брюшной продольный нервный ствол, 5 — глотка, 6 — глоточный карман, 7— семенники, 8 — яйцевод, 9 — семяпровод. 10— ротовое отверстие, 11— копулятивная сумка, /2—стебелек копулятивной сумки, 13 — пенис, 14 — передний атриум, 15 — мускулистый железистый орган, /6 — половое отверстие, 17 — задний атриум
Точно так же с большим трудом удается рассмотреть выделительные поры.
Полезно выводные пути половой системы и сопутствующие им органы реконструировать, пользуясь методом графической реконструкции по серии поперечных срезов. Для этого следует нарисовать с помощью рисовального аппарата при одном увеличении все срезы данной области и использовать их так, как это указано выше (с. 284).
Серия фронтальных срезов может быть разобрана без труда после того, как будут изучены поперечные срезы. То же относится и к серии сагиттальных срезов.
ОТРЯД POLYCLADIDA — ПОЛИКЛАДЫ
Leptoplana sp.
Материал и методы изучения. Род Leptoplana относится к сем. Leptoplanidae секции Schematommata подотр. Acotylea. Различные виды этого рода обитают в литоральной зоне морей СССР. На Мурманском побережье изредка попадаются L. borealis Bendl., L. kilkenihali Plehn, в Черном море около Севастополя довольно часто попадается L. alcinoi О. Schmidt, реже встречается L. tremellaris Oersted. В дальневосточных морях также встречаются представители этого рода. Живут Leptoplana около берега (хотя L. tremellaris заходит на глубину до 100 м) и искать их следует в воде под гниющими водорослями, под камнями и т. д. Этот объект редко попадает живым в руки проходящего практикум, поэтому при дальнейшем описании приходится ориентироваться на фиксированный материал, тем более, что наличие пигмента в паренхиме не позволяет подробно ознакомиться с внутренним строением червя in vivo.
Leptoplana фиксируется очень хорошо различными фиксаторами (в противоположность пресноводным планарйям, которые сильно сжимаются и свертываются при обработке). Для целей практикума хорошие результаты получаются от фиксации сулемой с уксусной кислотой, жидкостью Джильсона и особенно жидкостью Ценкера с формалином. Не особенно крупные экземпляры консервируют целиком. Внешний вид и общую топографию органов разбирают на тотальных препаратах, окрашенных квасцовым кармином. Детальное же ознакомление с гистологией и анатомией производят на сериях срезов — поперечных (в основном) и фронтальных (дополнительно). Вполне достаточно окрасить препараты гематоксилином и эозином.
В основу дальнейшего изложения положено описание строения легче добываемой черноморской L. alcinoi (частично использована и L. tremellaris), пригодное для изучения и других видов.
Внешняя морфология. Листовидное, плоское тело вытянуто в длину. У L. alcinoi края тела идут более или менее параллельно друг другу (рис. 252). У L. tremellaris тело впереди слегка расширяется. Передний конец обычно закруглен, задний заострен. Окраска животного довольно сильно варьирует. Природа ее двойная. Во-первых, в паренхиме под дорзальным эпителием разбросаны пигментные клетки, имеющие все оттенки от серого до красно-коричневого и коричневого цвета. У взрослых червей пигмент развивается настолько, что паренхима становится совершенно непрозрачной. Во-вторых, общая окраска зависит и от содержимого кишечника. Последний, будучи наполнен различной пищей, может быть белым, желтым, зеленым, фиолетовым, коричневым, черным, оранжевым и т. д. (чаще коричневым). Нижняя, лишенная пигмента сторона бывает сероватого или коричневатого цвета, и с этой стороны разветвления кишечника видны лучше, чем со спинной.
В передней части тела со спинной стороны следует рассмотреть многочисленные черные глазки (рис. 252). Они образуют около средней линии тела четыре группы. Две группы, составленные из относительно 286
A
Рис. 252. Leptoplana alcinoi (из кн. Ланга). А — внешний вид живой поликлады (Х7); Б — схема общей организации, вид со спинной стороны (ХЮ):
1 — непарный передний отросток главной кишки, 2 — группа щупальцевых глаз, 3— центральная нервная система («мозг») с расположенными над ним мозговыми глазами, 4 — парные боковые отростки главной кишки, 5 — матка, 6 — левый передний семяпровод, 7 — глотка, 8 — семенники, 9—наружная ветвь семяпровода, 10 — внутренняя ветвь семяпровода, 11 — мешок зернистых желез, 12— мужской атриум с пенисом, 13— мужское половое отверстие, 14 — женское половое отверстие, 15 — добавочный мешок («Лангов пузырь»), 16 — проток скорлуповых желез, 17 — семенной пузырь, 18 яичники, 19— главная кишка
мелких глазков, вытянуты в продольном направлении, лежат близко лруг к другу в области просвечивающего здесь «МОЗГИ» И НОСЯТ ПОЭТОМу название мозговых глаз (рис. 252, 3). Они сравнительно глубоко погружены в паренхиму, и количество их в каждой группе равно 15—20. Латерально от этих глаз лежат две группы более крупных глазков (рис. 252, 2). Эти глазки расположены под самым эпителием, покровы над ними слегка вздуваются, образуя небольшие выпуклости. Эти вздутия считаются за рудименты щупалец, развитые у других Polyclada. Поэтому глаза под ними носят название щупальцевых глаз. Однако обе категории глаз различаются не очень легко, особенно если их изучение ведется на фиксированном животном (на тотальном препарате).
На нижней стороне тела следует отметить, во-первых, ротовое отверстие — по медианной линии приблизительно посредине тела. Края его обычно плотно сомкнуты, и оно видно in vivo только при высовывании из него глотки. И, во-вторых, надо найти половые отверстия, мужское и женскоё, расположенные также медиально, одно за другим, приблизительно на расстоянии */6 длины тела от его заднего конца (рис. 252).
Анатомия. Изучение тотального препарата. На тотальном препарате удается разобрать некоторые детали внутреннего строения, поэтому прежде чем переходить к изучению срезов, следует ознакомиться с таким препаратом.
Прежде всего будут видны элементы пищеварительной системы. Центральная часть тела занята глоточным карманом с лежащей внутри складчатой глоткой (рис. 252). Общая форма глоточного кармана овальная, он вытянут вдоль тела. Главная кишка — отдел, от которого расходятся в стороны боковые ветви, располагается дорзально от глоточного кармана, но видна плохо. Зато боковые отростки главной кишки, ветвящиеся, в свою очередь, многократно, на препарате рассмотреть можно (рис. 252). Вперед отходит непарный отросток, остальные же все боковые — парные. Впереди от глотки видна двойная масса — ганглиозное скопление «мозга».
Позади глотки видны выводные пути мужской и женской половой системы. Первые представлены вздутым мешком, куда открываются зернистые железы и пенис. Семяпроводы с семенным пузырем заметить не удается. Из женской половой системы может быть виден расширенный отдел яйцевода со скорлуповыми железами. Многочисленные либо семенники, либо яичники (у Leptoplana наблюдается протерандрия, но при созревании яичников семенники еще функционируют), либо и те и другие вместе разбросаны в виде сравнительно мелких фолликулов между разветвлениями кишечника. Дифференцировать семенники от яичников на тотальном препарате трудно, хотя они и отличаются по своим размерам друг от друга (семенники мельче). Расположены семенники под разветвлениями кишки, ближе к вентральной стороне, в то время как яичники занимают область над кишечными дивертикулами.
Кожно-мускульный мешок (рис. 253). Тело покрыто однослойным, цилиндрическим ресничным эпителием, клетки которого более высоки на спинной стороне. Главная масса эпителиальных клеток — 288
о так называемые рабдитные клетки, т. е. такие, в плазме которых задаются собранные пучками рабдиты. Последние представляют собой >ямые, различной длины палочки с заостренными концами. Окраши-ются они равномерно и не всегда сохраняются при фиксации. В отли-е от Dendrocoelum происхождение этих рабдитов чисто эпителиаль->е. В паренхиме рабдитные клетки никогда не обнаруживаются. Ядра .бдитных клеток эпителия располагаются более или менее на одном овне, около середины клеток. Реснички отходят от свободной поверх-сти эпителиальных клеток (в том числе и рабдитных), каждая связа-с базальным зерном так, что непосредственно под поверхностью [Стальных концов клеток зерна расположены в ряд. Между рабдитны-I клетками разбросаны особые железистые клетки с зернистым секре-м. Они обычно ниже рабдитных клеток, ресничек на них нет в силу
Рис. 253. Leptoplana alcinoi. Часть поперечного разреза позади глотки (Х80) (из кн. Ланга):
/ — яичник, 2— рабдиты, 3 — дорзальный эпителий, 4—-базальная мембрана эпителия, 5 — продольные дорзальные мышцы, 6 — слой кольцевых дорзальных мышц, 7 — дорзовентральные мышцы, 3 — стенка кишечника, 9 — семяпровод, 10 — внутренний слой продольных вентральных мышц, 11 — внутренние вентральные кольцевые мышцы, 12 — наружные вентральные продольные мышцы, 13 — вентральный эпителий, 14 — нервный ствол, /5 — семенник, 16 — скорлуповые железы
того, что они вклиниваются в промежутки между основаниями других клеток эпителия. Совсем редко попадаются эпителиальные клетки с ресничками, но без рабдитов.
Все клеточные элементы эпителия имеют плоские основания, которыми они сидят на базальной мембране. Последняя очень толста, может достигать в толщину до '/з высоты эпителия (рис. 253). Структура базальной мембраны весьма сложная, но при обычной фиксации и окраске можно заметить только продольную ее штриховатость. Базальная мембрана — плотная, эластичная перепонка, выполняющая в теле животного основную поддерживающую функцию.
На спинной и брюшной сторонах тела заметны различно расположенные слои кожных мускульных волокон (рис. 253). На спинной стороне, идя последовательно от базальной мембраны вглубь, имеем: а) наружный, очень тонкий, кольцевой слой мышечных волокон; б) довольно толстый слой продольных волокон; в) слой диагональных волокон, проходящих в одном направлении; г) то же, расположенных под углом к первым, и д) еще один слой кольцевых волокон. На брюшной стороне слоев мышц больше: а) тонкий наружный слой кольцевых мышц; б) очень толстый слой тесно прижатых друг к другу продольных волокон; в) наружный слой диагональных мышц; г) снова тонкий слой кольцевых волокон; д) внутренний слой диагональных волокон, проходящих под углом к волокнам наружного, третьего, слоя мышц; е) снова сильно развитый слой внутренних продольных волокон. Обнаружить все перечисленные слои удается при комбинированном изучении поперечных и продольных срезов.
Паренхима. Все промежутки между отдельными органами заполнены паренхимой. Составлена она из клеток неправильной формы, полигональных, иногда вытянутых, с отростками. На обычных препаратах границы клеток заметить удается с трудом. Паренхима, примыкающая к кожно-мускульному мешку дорзальной стороны тела, содержит пигментные темные зернышки (рис. 253). Они-то и придают червю определенную окраску. В паренхиме разбросаны железы различных категорий. Из них пока следует остановиться на кожных одноклеточных слизистых железах. Своими протоками они открываются на поверхности покровов. Секрет этих желез начинает усиленно выделяться при раздражении животного, следовательно, выполняет защитную функцию. С другой стороны, клейкая природа секрета позволяет червю прикрепляться к субстрату.
Наконец, через паренхиму пробегают многочисленные дорзо-вент-ральные мышечные волокна. Концы их обычно разветвлены. Гистологию мышечного волокна на обычных препаратах рассмотреть не удается.
Пищеварительная система. Глоточный карман отделяется от главной кишки перегородкой, так называемой диафрагмой (рис. 254). Приблизительно посередине тела (немного впереди от середины) диафрагма пронизана кишечным ртом — отверстием, сообщающим глоточный карман с полостью главной кишки. От стенки глоточного кармана выдается в просвет глотка в виде кольцевой складки, разделяющей глоточный карман на дорзальную и вентральную половины (рис. 254).
Рис. 254. Leptoplana. Схема продольного разреза (из кн. Ланга):
1 — диафрагма, 2— кишечный рот, 3 —отверстия, ведущие в боковые ответвления, 4 — главная кишка, 5 — передний непарный отросток главной кишки, 6 — «мозг», 7 — дорзальная половина глоточного кармана, 8 — вентральная половина глоточного кармана, 9 — глотка, 10 — ротовое отверстие, // — мужское половое отверстие, 12 — женское половое отверстие
Оба эти отдела сообщаются друг с другом отверстием глотки. С наружной средой глоточный карман связан отверстием наружного рта. Стенки глоточного кармана выстланы плоским эпителием', очень тонким, непосредственно под которым залегают мускульные волокна, относящиеся, собственно, к общей системе дорзовентральных мышц.
Глотка Leptoplana относится к типу складчатой глотки (pharynx plicatus). На разрезах стенка глотки своими складками выполняет почти целиком глоточный карман. Следует разыскать место прикрепления глотки к стенкам последнего и также найти свободные концы складок — отверстие глотки.
Поверхность глоточной складки с обеих сторон покрыта безреснич-ным плоским эпителием — прямым продолжением такового глоточного кармана. Под этим эпителием залегает несколько слоев мышечных волокон, развитых сравнительно слабо и проходящих в различных направлениях. Середина глоточной стенки занята слоем кольцевых мышц, разделяющих всю стенку на два листка.
Главная кишка в виде сплющенной трубки тянется вдоль глоточного кармана и на срезах расположена дорзально от него. От кишки отходят многочисленные боковые ответвления — главные ветви. Количество их около 15 пар (см. рис. 252). Главные ветви разделяются в свою очередь на добавочные ветви, пронизывающие все тело до самого края и попадающиеся в разрезе многократно. В эпителии стенок разветвлений кишечника редко удается заметить границы между клетками, он носит характер синцития (см. рис. 253). Нередко весь просвет заполняется плазматической массой. Ядра в этом синцитии приближены к базальной части его. Плазма синцития переполнена гранулами различных размеров, это главным образом захваченная пища из просвета кишечника. Наоборот, в стенках главной кишки эпителий представлен типичными цилиндрическими клетками с ресничками. Между клетками эпителия кишки или в толще синцитиальной массы видны особые колбовидные клетки с зернистым секретом — это, видимо, железистые клетки. Вокруг главной кишки можно заметить незначительной толщины слой собственных кольцевых мышц. Около же стенок боковых ответвлений концентрируются пооходящие здесь дорзовентральные волокна.
Выделительная система. О выделительной системе у Leptoplana в литературе ничего не известно, и никаких элементов ее на срезах обнаружить не удается.
Нервная система. Элементы нервной системы всегда попадаются на поперечных разрезах, но лучше для целей ее изучения использовать серии фронтальных срезов. В передней части тела (впереди от глоточного кармана и под передней главной ветвью кишечника) следует отметить двураздельное ганглиозное скопление, мозг. От него отходят во все стороны нервные стволы, прилегая главным образом непосредственно к вентральной части кожно-мускульного мешка. Наиболее толстые из них тянутся по вентральной стороне тела назад и соответствуют продольным брюшным стволам других плоских червей. Между стволами замечаются многочисленные комиссуры — нервная система в данном случае имеет характер сплетения. В толще мозга удается рассмотреть ганглиозные клетки, разбросанные в массе основного вещества, между нервными фибриллами. Нервные клетки группируются около оснований боковых нервных стволов. Мозг заключен в соединительнотканную капсулу.
Из органов чувств специально следует обратить внимание на структуру многочисленных глазков. На продольном срезе особенно хорошо можно увидеть пигментный бокал каждого из них, состоящий из зернистого черного пигмента. Бокалу на его выпуклой стороне соответствует небольшой участок цитоплазмы с ядром (рис. 255). В полости бокала сконцентрированы концевые элементы отдельных зрительных нервов — зрительные палочки. Каждой из них соответствует, уже за пределами бокала, ретинальная клетка вытянутой формы, с ядром. Собственно зрительные нервы, отходящие от каждой ретинальной клетки, собираются все в общий зрительный ствол (рис. 255), который загибается в сторону от бокала и соединяется непосредственно с мозгом. Таким образом, и здесь имеем типичный инвертированный глаз. Все эти детали строения лучше выступают у более крупных щупальцевых глаз, система. На срезах мужская половая система представлена прежде всего многочисленными семенниками фолликулярного типа. Они разбросаны в паренхиме под ветвями кишечника, образуя около вентральной стенки тела целый слой (см. рис. 253). Слой этот прерывается в средней зоне тела. В пределах, ограниченных продольными нервными стволами, семенников нет. Каждый семенник окружен тонкой, бесструктурной tunica propria и наполнен созревающими половыми клетками и зрелыми сперматозоидами.
Тончайшие семявыносящие канальцы (vasa efferentia) обнаруживаются на срезах с трудом. Все они вливаются в два относительно толстых семяпровода (vasa deferen-tia). Последние тянутся вентрально почти
Мужская половая
Рис. 255. Leptoplana. Схема строения щупальцевого глаза
(из кн. Ланга):
1 — ретинальные клетки, 2 —- зрительные палочки, 3 — пигментный бокал, 4 — ядро клетки пигментного бокала, 5 — нервные волокна
вдоль всего глоточного кармана, на уровне заднего его края раздваиваются, и внутренние их ветви идут далее к копулятивному аппарату. Наружные же ветви, принимающие в себя семявыносящие канальцы из семенников заднего конца тела, идут назад и позади половых отверстий сливаются друг с другом (см. рис. 252). Стенки семяпроводов представлены плоским ресничным эпителием. Полость каналов чаще всего заполнена спермой. Обе внутренние ветви семяпроводов подходят позади глотки к середине тела и сливаются вместе в общий семяизвергательный канал (ductus ejaculatorius). В. самом начале этот непарный канал вздувается, образуя семенной пузырь (vesicula ceminalis externa). После него семяизвергательный канал входит внутрь копулятивного органа, который у L. alcinoi подразделяется на вздутую часть — так называемый мешок зернистых желез и на суженную часть — пенис. На поперечном разрезе видно, что стенка мешка зернистых желез в основном составлена из очень толстого слоя кольцевых мышц (рис. 256), окруженных снаружи продольно проходящими ретракторами пениса. Внутренняя полость мешка оказывается подразделенной радиальными перегородками на шесть камер или карманов, выстланных железистым эпителием с массой зернистого секрета в плазме клеток (рис. 256). Карманы открываются в просвет семяизвергательного канала вблизи основания пениса (см. рис. 258).
В
Рис. 256. Leptoplana alcinoi. Поперечный разрез в области копулятивного органа (Х80) (из кн. Ланга):
1 — кишечник, 2 — мускулатура копулятивного органа, 3 — ретракторы пениса, 4 — парные отделы семяпровода, 5 —камеры мешка зернистых желез, 6 — непарный отдел семяпровода, 7 — матка, 8 — семяизвергательный канал, 9 — скорлуповые железы, 10 — пигментные зерна под покровами спинной стороны, 11 — кольцевые мышцы, 12 — продольные мышцы, 13 — эпителий
Стенки пениса кроме толстого кольцевого слоя мышечных волокон и внутреннего из продольных волокон имеют еще и внутренний кольцевой слой, являющийся прямым продолжением кольцевого слоя в стенках мешка зернистых желез. Семяизвергательный канал в области копулятивного органа выстлан ресничным эпителием. Пенис большей своей частью выдается в полость мужского атриума (или как его еще иногда называют — влагалища пениса). Конец пениса заострен, оттянут и превращен в трубчатый стилет, видимо, твердый или во всяком случае более плотный, чем остальные части копулятивного аппарата (рис. 257). Поверхность свободной части последнего .покрыта плоским эпителием, переходящим на стенки мужского атриума. Снаружи в стенках атриума, видны мощные продольные мышцы, вероятно, выполняющие роль протракторов.
Функция копулятивного аппарата, видимо, не только связана с оплодотворением. При нападении на добычу стилет пениса вонзается многократно в ее тело, наносит поранения и, вероятно, отравляет выделениями зернистых желез. Сходная же картина наблюдается и у ряда Neorhabdocoela (см., например, ниже о Gyratrix).
Женская половая система. Многочисленные фолликулярные яичники так же, как и семенники, разбросаны в паренхиме, но в отличие от последних занимают область дорзально от ветвей кишечника. Яичники встречаются на срезах не через всякое животное, так как семенники развиваются раньше яичников и часто на срезах только они и попадаются. Каждый яичник одет снаружи тонкой оболочкой и внутри содержит созревающие яйцевые клетки и зрелые яйца. От каждого яичника отходят тонкие яйцеводы, анастомозирующие друг с другом и образующие сеть дорзально от кишечника. Стенка яйцевода — ресничный эпителий. Яйцеводы впадают в матку—канал, опоясывающий кольцом окологлоточный карман. У молодых животных, еще без яичников, матку найти очень трудно, так как это тоненький каналец, идущий вдоль брюшных стволов нервной системы (следовательно, занимающий вентральное положение). Хорошо видна матка только у впол-
Рис. 257. Leptoplana alcinoi. Схематический продольный разрез в области выводных путей половой системы (из кн. Ланга):
1 — камера мешка зернистых желез, 2 — семенной пузырь, 3 — семяпроводы, 4 — семяизвергательный канал, 5 — пенис, 6 — мужской атриум, 7 — стилет пениса, 8 — мужское половое отверстие, 9 — женское половое отверстие, 10 — добавочный мешок (Лангов пузырь), 11 — женский атриум, 12— маточный проток. 13 — проток скорлуповых желез
не половозрелых животных, когда она набита яйцами. Тогда ее про-
свет сильно расширяется и на серии срезов можно хорошо проследить ее расположение. Каналы матки справа и слева идут вдоль глоточного кармана и соединяются впереди него, сзади они также сливаются в один так называемый маточный проток. Стенки матки состоят из ресничного эпителия. При наполнении ее яйцами эпителий из цилиндрического превращается в плоский, так как, по-видимому, с возрастом червя количество клеток в стенках матки не увеличивается и эпителий просто растягивается. Мускульная оболочка матки (из кольцевых волокон) очень тонка и почти незаметна на срезах. Оплодотворение, по-видимо
му, происходит в матке..
В просвет матки открываются также многочисленные железы, за счет которых она наполняется жидкостью, в которой плавают взвешенные яйца. Короткий маточный проток вливается в проток скорлуповых желез. Эта часть женских
выводных путей снабжена мощной мускулатурой и тянется вдоль тела дорзально от копулятивного аппарата. Масса одноклеточных скорлуповых желез разбросана вокруг протока в паренхиме. Стенки этого протока сильно складчатые, и, расширяясь на конце, он превращается в небольшой женский атриум.
От начала протока скорлуповых желез отходит еще один каналец (рис. 257), сообщающийся с полостью так называемого добавочного мешка (Лангова пузыря), который лежит обычно кзади от женского полового отверстия. Добавочный мешок, видимо, функционирует как копулятивная сумка, так как в его просвете иногда наблюдается скопление спермы. Весьма вероятно, что этот орган вполне соответствует bursa copulatrix Tricladida и Neorhabdocoela.
Серия поперечных разрезов. Разбор серии поперечных разрезов начинается со срезов через передний конец тела. Уже на первых
Рис. 258. Leptoplana alcinoi. Часть поперечного разреза в области мужского атриума (Х80) (из кн. Ланга):
1 — проток скорлуповых желез, 2 — кишечник, 3 — пигментные зерна, 4— кожно-мускульный мешок спннной стороны, 5 — протоки скорлуповых желез, 6 — матка, 7 — дорзовентральные мышцы, 8~ полость мужского атриума, 9 — пенис, 10 — семяизвергательный канал. 11 — протракторы пениса, 12 — женский атриум
срезах следует обратить внимание на дивертикулы передней главной ветви кишечника. Далее на срезах попадаются глазки, и нужно обратить внимание на область, где покровы слегка вздуваются (рудиментарные щупальца). На следующих срезах под кишечником прекрасно виден двухлопастный «мозг» с отходящими от него нервными стволами. Далее кзади видны оба главных брюшных нервных ствола и половые железы с их протоками. Наконец, появляется глоточный карман. На этих срезах следует обратить внимание на соотношение складок глотки со стенками глоточного кармана и подразделение его на дорзальный и вентральный отделы. Следует обнаружить диафрагму, отделяющую главную кишку от глоточного кармана, найти кишечный и наружный рты. На этих же срезах, по бокам и вентрально от глоточного кармана, должны быть рассмотрены семяпроводы и матка, причем необходимо проследить слияние матки правой и левой сторон впереди от глоточного кармана.
На срезах позади глоточного кармана начинаются выводные пути мужской половой системы; нужно проследить впадение семяпроводов в копулятивный орган, найти те ветви семяпроводов, которые с каждой стороны огибают с боков части выводного аппарата половой системы, и проследить слияние их половых отверстий. При просмотре срезов с копулятивным аппаратом отметить подразделение его на мешок зернистых желез и на пенис. Далее назад на срезах появляется мужской атриум и мужское половое отверстие. В этой же области матки уже сливаются и виден проток, куда впадают скорлуповые железы (рис. 258). Тут же виден и добавочный «Лангов пузырь». Нужно проследить его сообщение с протоком скорлуповых желез, найти небольшой женский атриум и женское половое отверстие позади мужского. На срезах далее назад остаются только перерезанные ветви кишечника и .половые железы.
Полезно изготовить графическую реконструкцию половой системы (ее концевых отделов) по серии поперечных разрезов вроде той, что предлагалось сделать при изучении Dendrocoelum lacteum.
ОТРЯД NEORHABDOCOELA — ПРЯМОКИШЕЧНЫЕ
Mesostoma ehrenbergii (Focke) — мезостома Эренберга
Материал и методы изучения. Mesostoma ehrenbergii относится к сем. Typhlopla-nidae подотр. Dalyellioida. Живет в чистых небольших водоемах со стоячей или медленно текущей водой, с порослью тростника и ситника, с илистым дном. Черви сидят обычно неподвижно на растениях, подвесившись к ним на своеобразных слизистых «гамаках» или реже ползают по дну, по растениям, под поверхностью воды, скользя снизу по поверхностной пленке, или даже плавают. Основной метод лова применяется тот же, что и вообще для всех Rhabdocoela. Именно, планктоновым сачком (можно брать материал (газ) для сачка не очень мелкой ячеи) облавливают многократно воду на том. или ином участке. Предварительно ручкой сачка или просто палкой осторожно взмучивают самый поверхностный слой ила и особенно тщательно сбивают весь детрит, осевший на растениях. После облова планктоновым сачком в сосуде (лучше всего для содержания червей использовать батарейные стаканы или высокие четырехугольные аквариумные банки небольших размеров), куда сливают воду из сачка, должен осесть слой ила в несколько сантиметров, так что сачком должно быть собрано его значительное количество. Такие банки оставляют спокойно стоять и через сутки турбеллярии (в том числе и Mesostoma) начинают вылезать на стенки и ползают
по ним. Крупную М. ehrenbergii видно простым глазом, других же мелких червей улъхмжмлтъ г улгтаХл Уетл<жглк>х va 'глд\х га-
леткой и рассматривают главным образом in vivo — на тотальных препаратах удается видеть лишь ничтожное количество из тех деталей, что видны на живом черве. Срезы также удаются плохо, и не стоит тратнть время на их изготовление '. При изучении in vivo объект прикрывают покровным стеклом в большой капле воды без восковых ножек; постепенно оттягивая воду фильтровальной бумагой, следует придавить червя покровным стеклом настолько, чтобы он не мог свободно двигаться, но был бы сплющен еще незначительно и остался бы цел. При рассматривании выделительной системы помогает подкрашивание слабыми растворами витальных красителей, например нейтрального красного.
Mesostoma ehrenbergii, благодаря прозрачности своих тканей при почти полном отсутствии в них пигмента, представляет исключительный объект для изучения.
Внешняя морфология. Тело листовидной формы, слегка выпуклое на спинной стороне, достигает в длину 15 мм. М. ehrenbergii — одна из самых крупных рабдоцелид (см. рис. 268). Передний конец тела постепенно сужается и закруглен, задний же сужен резко и заострен. Тело совершенно прозрачное, среди паренхиматозных клеток замечаются некоторые слегка желтоватого цвета из-за имеющихся в них зерен светло-желтого пигмента пигментные клетки. У молодых животных этих клеток мало, у старых же количество их увеличивается, и паренхима приобретает коричневатый цвет. Внутренние органы выделяются на прозрачном фоне в виде белых менее прозрачных образований. Кишечник же, переполняясь пищей, имеет различную окраску в зависимости от характера добычи (чаще буро-коричневую). Зимние яйца также выделяются своим ярко-красным цветом.
На брюшной стороне тела заметны два отверстия: ротовое, сдвинутое несколько вперед от середины тела, и половое, расположенное позади ротового, но недалеко от него (приблизительно на расстоянии половины диаметра глотки).
Все тело покрыто ресничным эпителием. Реснички на брюшной стороне развиты сильнее, чем на спинной, где они плохо видны. Эпителиальные клетки многоугольные, иногда при большом увеличении микроскопа удается рассмотреть их границы и лопастное ядро в каждой (рис. 259). Реснички расположены тесными продольными рядами.
В эпителии заметны включения в виде палочек (рабдоидов) двух сортов. Одни разбросаны более или менее равномерно по всей поверхности тела: это сильно преломляющие свет, относительно небольшие (до 4 мкм длины) палочки— рабдиты (дермальные рабдоиды).
Рис. 259. Mesostoma ehrenber-gil. Эпителиальные клетки с лопастными ядрами (Х500) (из кн. Штейнмана и Бресслау)
1 При изготовлении разрезов несколько лучшие результаты получаются при очень быстрой (от 1 до 1,5 мин) фиксации Ценкерформолом, быстрым дальнейшим проведением через спирты (выдерживая в каждом 10—20 мин) и быстрой заливкой в парафин, тратя на всю заливку не больше 40 мпч
Рис. 260. Mesostoma ehrenbergii. Разрез через эпителий (из кн. Лютера). А — с рабдитами (Х2000); Б — с раммитами (Х1000):
I — базальные зерна ресничек, 2— рабдиты, 3— раммиты, 4 — проток раммитной железы, 5 — ядро эпителиальной клетки
Толщина их равномерная, они прямые или слегка изогнутые и имеют гомогенное строение (рис. 260,Л). Возникают рабдиты непосредственно
Рис. 261. Mesostoma ehrenbergii. Распределение желез в теле червя (Х10) (из кн. Штейнма-на и Бресслау):
1 — слизистые железы, 2 — «мозг», 3 — проток раммитных желез, 4 — раммитные железы, 5— глотка, 6 — кишка, 7 — слюнные железы
в эпителиальных клетках.
Вторая категория включений—раммиты (аде-нальные рабдоиды) тоже палочки, но гораздо более крупные (до 60 мкм в длину), несколько изогнутые, заостренные на проксимальном и закругленные на дистальном конце. Внутри каждого раммита замечается зернистая сердцевина, окруженная гиалиновым периферическим слоем (рис. 260, Б). Раммиты концентрируются по краям тела и особенно большие их скопления замечаются на переднем конце, где ими вызывается легкое помутнение покровов. Возникают они в специальных раммитных железах в паренхиме.
Кожные железы у М. ehrenbergii имеются двух типов: слизистые и раммитные. Слизистые
>железы одноклеточные, округлой, грушевидной формы, разбросаны по всей поверхности тела (непосредственно под эпителием) и открываются наружу особыми порами. В некоторых областях брюшной стороны, именно вдоль средней линии, слизистые железы достигают особенно крупных размеров, собираются в комплексы (рис. 261), которые раньше учеными авторами именовались комплексами «прядильных желез». Слизистый секрет этих желез выделяется в виде нитей и служит для подвешивания червя к растениям, к стенке сосуда, к поверхностной пленке воды и для захватывания добычи. Распуская нити, червь улавливает проплывающих мимо мелких живот-
ных или, активно касаясь их тем или иным участком тела, приклеивает к себе теми же слизистыми выделениями. Эта же слизь, обволакивая пойманную добычу, делает ее неподвижной.
Раммитные железы концентрируются главным образом группами в передней части тела по бокам кишки и нервной системы. От гроздьев
Рис. 262. Mesostoma ehrenbergii. Строение окологлоточной области (X80) (из кн. Фогга и Юнга). А — вид со спинной стороны придавленного червя; Б — продольный разрез:
1 — ротовое отверстие, 2 — глоточный карман, 3 — стенка глотки, 4 — проток слюнных желез, 5 —глоточные железы, 6 — пищевод, 7 — концевой поперечный ствол выделительной системы, S —слюнные железы, 9 — кишечник, 10 — просвет глотки
одноклеточных желез протоки идут четырьмя пучками вперед, образуются «Stabchenstrasse» старых авторов. В каждой железе (обычно округлой или грушевидной формы) виден пучок палочек (раммитов). По выводным канальцам раммиты подходят к поверхности тела (см. рис. 260, Б).
Анатомия. Пищеварительная система. Ротовое отверстие ведет в довольно объемистый глоточный карман, куда и выдается собственно глотка. В этот же глоточный карман, ближе к его вентральной поверхности, открываются также два основных боковых канала выделительной системы. Глотка М. ehrenbergii относится к типу pharynx rosu-latus (одной из модификаций ph. bulbosus). У слегка придавленного червя глотка видна сверху. К ее просвету сходятся по радиусу мышечные пучки и глоточные железы. Последние залегают в толще глотки в виде грушевидных одноклеточных образований (рис. 262) и протоками открываются в просвет глотки. В просвет же глотки открываются и более сильно развитые слюнные железы, гроздьями расположенные в паренхиме. Их выводные канальцы сходятся к глотке (рис. 261, 7; рис. 262, 8). Просвет глотки далее переходит в короткий пишевод, ведущий в свою очередь в кишечник. Кроме радиальных волокон в глотке есть и кольцевые — внутренние и периферические.
Функционирует вся эта система довольно своеобразно. Ротовое отверстие может замкнуться действием специальной кольцевой мускулатуры— сфинктеров. При высасывании добычи ротовое отверстие широко открывается и жидкая пищевая масса насасывается в глоточный карман. Просвет глотки при этом замкнут. После наполнения глоточного кармана ротовое отверстие смыкается, сокращаются радиальные волокна глотки и открывается ее просвет, куда и устремляется жидкость из глоточного кармана. Далее начинают смыкаться стенки глотки с наружного края, жидкость из полости глотки выдавливается в пищевод, далее в кишку. К этому времени снова открывается ротовое отверстие. Процесс дефекации совершается в обратном направлении. Эпителий, выстилающий глоточную часть, лишен ресничек (по Лютеру, 1904).
Кишечник имеет вид прямой трубки. Концы его отстоят на равные расстояния от обоих концов тела, приблизительно на 4$—'/е общей длины тела. Пищевод открывается в кишку в передней ее трети (рис. 263). Края кишки обычно гладкие, но у сильно наевшихся животных кишка значительно утолщается, появляются боковые выпячивания (рис. 263), иногда даже правильно расположенные.
Пищей М. ehrenbergii служат различные мелкие водные животные: Oligochaeta, личинки насекомых, Hydrachnidae и особенно мелкие рачки Entomostraca. Наиболее обычная пища — Cladocera. Наблюдать за питанием легко в чашечках с небольшим количеством воды и посаженными туда дафниями. Улавливаются они главным образом нитями секрета слизистых желез. Животных с мягкими покровами (например, червей) М. ehrenbergii проглатывают целиком, у раков же высасывают содержимое. На высасывание одной дафнии уходит около четверти часа, в день потребляется 6—8 рачков. Интересно отметить, что впервые внутриклеточное переваривание пищи было установлено Мечниковым (1878) именно на Mesostoma ehrenbergii,
Выделительная система. Благодаря прозрачности покровов на М. ehrenbergii удается прекрасно разобрать детали строения протонеф-ридиальной системы. Червя следует несколько придавить и рассматривать при большом увеличении. Сильно помогает разбору деталей подкрашивание слабым раствором нейтрального красного. Лучше при этом иметь голодных червей с пустым кишечником.
Два поперечных ствола выделительной системы, как уже было указано выше, впадают справа и слева в глоточный карман с вентральной стороны. Не дойдя половины пути до края тела, эти каналы загибаются на дорзальную сторону и над кишкой разделяются на передний и задний продольные главные стволы, идущие, не разветвляясь, до уровня концов кишечника (рис. 264). Передний ствол около мозга делает петлю и разделяется сначала на две ветви, потом уже на мельчайшие капилляры. Каждый задний ствол поворачивает на конце вперед, также раздваивается и после этого распадается на капилляры. Терминальные
Рис. 263. Mesostoma ehrenbergii, Кишечник, наполненный пищей (Х8) (из кн. Штейнмана и
Бресслау):
1 — «мозг», 2 — желточники, 2 — ротовое отверстие, 4 матка, 5 — семенники
Рис. 264. Mesostoma ehrenbergii. Расположение главных каналов выделительной системы. Вид с брюшной стороны (Х10) (из кн. Штейнмана и
Бресслау):
1 — мозг, 2 — передний про-дольный главный ствол, 3 — ротовое отверстие, 4 — поперечный концевой ствол, 5 — задний продольный главный ствол
Рис. 266. Mesostoma ehrenbergii. Строение глаза на разрезе (Х100) (из кн. Лютера): / — зрительные палочки, 2 — ретинальные клетки, 3 — зрительный нерв, 4 — пигментный бокал
Рис. 265. Mesostoma ehrenbergii. Терминальные органы выделительной системы (Х750). А — более крупный каналец; Б — концевой отдел выделительного капилляра (из кн. Бресслау в Krumbach — Kukenthal’s Handbuch):
1 — терминальные органы, 2 — мерцательное пламя, сидящее прямо на -стенке выделительного канала, 3 — ядро
органы располагаются обычно группами и представляют собой слегка вздутые, слепые боковые выпячивания капилляров. Каждое такое выпячивание заканчивается плазматической «головкой», от которой в просвет выдается группа ресничек, склеенных в плоское мерцательное пламя (рис. 265). Последнее у живого объекта находится в непрерывном колебательном движении. В более крупных сосудах мерцательное пламя нередко удается заметить сидящим прямо на стенке канальца без терминального органа.
В стенках концевых отделов капилляров кое-где видны вздутия — места, где помещается ядро (рис. 265, 3). Целая группа терминальных органов принадлежит одной единственной клетке в отличие от других плоских червей, где терминальный орган представляет самостоятельную, чаще звездчатую клетку.
Нервная система. Многие детали строения нервной системы также прекрасно удается разобрать на живом объекте. Более подробно топографию нервной системы следует рассмотреть на тотальном препарате после специальной обработки '.
1 Для изучения нервной системы на тотальном препарате Mesostoma следует фиксировать по van Gehuchten в смеси из 4 ч. 3%-ного KsCrjOrrl ч. 1 %-кого OsO4 (несколько часов). После основательной промывки (лучше в проточной воде — несколько часов) заключать в бальзам без окрашивания.
Центральное ганглиозное скопление — мозг — расположено в передней части тела, впереди от кишечника. Совершенно ясно видна двойная природа этого скопления. В толщу мозга погружены два глаза, типичные инвертированные, с пигментным бокалом из черных гранул. Полость бокала направлена вбок и из нее выходят пучки нервных волокон (рис. 266).
Главные нервные стволы отходят от ганглиозной массы: одна па-
ра вперед и одна назад, образуя вместе с Н (заметную даже при рассматривании под лупой). Более внимательное изучение нервной системы позволяет рассмотреть целый ряд деталей, изображенных на рис. 267.
Передние нервы, кажущиеся при малых увеличениях сплошными, на самом деле разбиваются каждый на две ветви (спинную и брюшную), которые в свою очередь распадаются на отдельные нервы. Вентральная ветвь разделяется на два пучка нервов, иннервирующих передний конец тела и несущих, по-видимому, осязательные функции. Боковые стороны головного конца тела иннервируются боковыми ответвлениями дорзальной ветви. Кроме главных стволов вперед идет несколько тоненьких нервов, начинающихся вентрально позади глаз и иннервирующих брюшную поверхность переднего (головного) конца (рис. 267, 12). С боков от «мозга» мускулатура и покровы иннервируются двумя брюшными и тремя спинными парами тонких нервов.
Назад от ганглиозного скопления идут также два главных ствола, занимающих вентральное положение (рис. 267, 7). Еще вначале от них отходят боковые ветви, иннервирующие эпителий тела и желточники. В области глотки стволы несколько сближаются, и между ними протягивается постфарингеальная комиссура. Тут же боковые короткие ветки соединяют продольные стволы с нервным кольцом внутри глотки. Позади глотки боковые ветви отходят медианно к половым железам (рис. 267, 11). Не доходя до конца кишки, вентральные стволы утончаются и совершенно сходят на нет.
С дорзальной стороны ганглиозного скопления назад отходит еще пара дор
мозгом фигуру в виде буквы
Рис. 267. Mesostoma ehrenbergii. Строение нервной системы. Вид с брюшной стороны (ХЮ) (из кн.
Штейнмана и Бресслау):
1 — вентральная ветвь переднего нервного ствола, 2— дорзальная ветвь переднего нервного ствола, 3 — передний главный ствол, 4—«мозг», 5 — глаз, 6— дорзальный задний боковой нерв, 7 — главный задний боковой нерв, 8— гл о* точное нервное кольцо. 9 — постфарингеальная комиссура, 10 — кишка, 11 — медиальный нерв, 12 боковые нервы
зальных нервов. Эти нервы занимают латеральное положение, и каждый из них разбивается на три боковые ветви (рис. 267, 6), направленные к поверхности тела.
Из органов чувств кроме глаз и осязательного переднего конца тела следует отметить особые ресничные пятна (слегка погруженные под поверхность тела) по бокам головного конца, соответствующие ресничным ямкам других турбеллярий. Эпителий пятен лишен рабдоидов.
Половая система. Рассматривать половую систему М. ehrenbergii следует на объектах, выдержанных 1—2 дня без пищи. Кишечник у них освобождается от пищевых остатков, уменьшается в объеме, делается прозрачным и позволяет во всех деталях рассмотреть выводные пути половой системы. Степень развития половой системы различна в зависимости от времени года и характера откладываемых яиц, или точнее яйцевых капсул. Дело в том, что в климатических условиях Средней Европы молодые Mesostoma, вылупившиеся из покоящихся яйцевых капсул весной, имеют недоразвитую половую систему и в их матке формируются так называемые летние яйца, развивающиеся здесь сравнительно быстро (2—3 недели). Из них в матке же вылупляются молодые особи— так называемые летние животные, также откладывающие сначала летние яйца. После периода развития летних яиц начинается новый период образования яиц, но уже другой категории, сопровождающийся развитием всей половой системы до максимума. Второй категории яйца имеют плотную оболочку, период их развития длительный — молодые черви из них выходят следующей весной — и называются эти яйца покоящимися или зимними. Освобождаются они из матки только после гибели Mesostoma (нормальная продолжительность жизни червя около 5—6 месяцев). В течение лета может пройти 2—3 поколения Mesostoma, производящих летние яйца. Последнее поздне-осеннее поколение уже производит только покоящиеся яйца. На следующей схеме (из кн. Штейнмана и Бресслау, 1913) последовательность поколений демонстрируется ясно:
Перезимовавшие зимние яйца
Весенние животные
яйца —>-Летние животные
Покоящиеся зимние '—>- Летние >-Летние животные
яйца . , яйца I
I--«-Летние—»-Осенние животные
Покоящиеся зимние яйца
яйца Покоящиеся зимние яйца Покоящиеся зимние яйца
Мужская половая система. Сначала следует рассмотреть строение органов мужской половой системы в период их максимального развития, т. е. в период формирования покоящихся яиц. Два семенника,
вытянутые в длину, — беловатые in vivo образования, лежат около краев тела справа и слева (рис. 268). Передний конец их выступает немного вперед от уровня глотки, задний же не доходит до конца кишки. С внутренней стороны контур семенника более или менее гладкий, с наружной же образуются в различном числе вздутия или боковые ответвления. Семяпроводы отходят от середины каждого семенника с медианной стороны двойным «корнем»1 и тянутся к половому отверстию позади глрт-ки (см. выше). Здесь они сходятся к основанию копулятивного органа (пениса). Внутрь последнего они входят уже общим семенным протоком (ductus semi-nalis). Пенис лежит с левой стороны от полового отверстия, он изогнут в виде реторты (рис. 269). Его вздутая часть, полая внутри, представляет собой семенной пузырь (vesicula semina-lis interna), загнутый же конец, снабженный сильно развитой мускулатурой, пронизан семяизвергательным каналом (ductus eja-culatorius) и представляет собственно копулятивный аппарат. Дополнительные железы с зернистым секретом лежат рядом с пенисом и открываются в семяизвергательный канал. Значение этого секрета, вероятно, — питание для спермы (Штейнман и Бресслау). Конец копулятивного органа выдается в половую клоаку (atrium genitale).
У молодых животных семенник развит значительно слабее, чем у взрослых. Тянется он на пространстве между уровнями
Рис. 268. Mesostoma ehrenbergii. Общий вид половой системы с брюшной стороны. С правой стороны рисунка показана половая система во время формирования покоящихся яиц, с левой же — во время развития летних яиц (ХЮ) (из кн. Рей-зингера и Граффа — скомбинировано): / — кишка, 2— летние яйца, 5—матка, 4 — желточник, 5 — семенник, 6 — копулятивная сумка, 7— семяпровод, 8— яичник, .9 —семяприемник, 10 —яйцевод, // — наружное половое отверстие, 12 — пенис, 13 — покоящееся яйцо
1 Двойное отхождени.е впервые было замечено Лейкартом и подтверждено Бресслау, другие же говорят об ординарном (Лютер).
Рис. 269. Mesostoma ehrenbergii. Дистальные отделы половой системы молодого животного, вид с брюшной стороны (Х80) (из кн. Штейнмана и Бресслау): / — ротовое отверстие, 2 — желточный проток, 3— копулятивная сумка, 4 — яичник, 5 — матка, 6 — семяприемник, 7 — семяпроводы, 8 — яйцевод, 9 — пенис, /0 —наружное половое отверстие
ротового и полового отверстий и значительно тоньше (см. рис. 268). Пенис у этих животных еще недоразвит, и оплодотворение летних яиц совершается путем самооплодотворения.
Зимние же яйца образуются после перекрестного оплодотворения или также после самооплодотворения.
Женская половая система. Рассмотрение ее лучше начать опять-таки у взрослого животного с покоящимися яйцами в матке. Яичник — маленький, непарный орган, расположен напротив копулятивного аппарата с правой стороны. Это компактный пальцевидный орган, закругленный на свободном конце и имеющий расширение у своего основания, — семяприемник (ге-ceptaculum seminis). Вершина яичника занята синцитиальной массой, где формируются яйцевые клетки, в средней же части уже обособленные яйцевые клетки сильно сдавливают друг друга, располагаясь в виде столбика монет (рис. 270). Короткий, слегка изогнутый, яйцевод ведет к половой клоаке (см. рис. 269). Неподалеку от последней в него вливается общий желточный канал и выводные протоки многочисленных скорлуповых желез.
Копулятивная сумка (bursa copulatrix) — мешок, часто со складчатыми стенками, раздвоенный на дистальном конце. Проксимальный конец сужен, превра-
Рис. 270. Mesostoma ehrenbergii. Разрез через яичник (Х120) (из кн. Штейнмана и Бресслау):
1 — синцитиальная вершина, 2 — ооциты, 3 — скопление спермы в семяприемнике, 4 — яйцевод
щается в каналец, которым сумка и сообщается с половой клоакой.. При копуляции пенис вводится в копулятивную сумку и в нее же изливается сперма. Действием кольцевой мускулатуры стенок мешка сперма перегоняется по яйцеводу в семяприемник.
Желточники — гроздевидные железы, вытянуты в длину и расположены между семенниками и кишечником. Они почти доходят до концов кишечника, выдаваясь за концы семенников. In vivo они мало прозрачны, хорошо заметны; их всего две пары. Каждый из них представляет собой гроздь желточных фолликулов, связанных по длине с продольным желточным каналом. Эти продольные каналы позади глотки соединяются в парные поперечные, которые уже общим желточным протоком вливаются в концевой отдел яйцевода (см. рис. 268). Желточные канальцы хорошо рассмотреть удается редко — только тогда, когда они наполнены желточными элементами.
Половая клоака (atrium genitale)—это небольшая полость с мускулистыми стенками, которая сообщается с наружной средой половым отверстием, замыкающимся хорошо выраженным сфинктером.
Наконец, следует отметить еще две матки — слепые выросты половой клоаки с правой и левой сторон. Форма каждой матки Т-образная, и в вполне развитом состоянии концы обеих маток заходят за окончание кишечника. Обычно матка вклинивается в промежуток между семенником и желточниками.
Зимние яйца, наполняющие матку, овальной, линзообразной формы, ярко-красные, коричневатые или темно-коричневые. Количество их бывает более или менее одинаково в обеих матках и не превышает 4—5 десятков. В каждом заключена одна половая клетка с несколькими сотнями желточных. Оболочка образуется за счет скорлу-пового секрета желточных клеток. Только что сформированные яйца имеют округлую форму и ярко-оранжевую или красную окраску. При изменении формы в окончательную, линзообразную, яйца сильно темнеют.
У молодых животных женская система развита слабее по сравнению с вышеописанным. У них, например, желточники значительно короче, фолликулы развиты слабо и выдаются в виде незначительных бугорков на поверхности продольных желточных каналов (см. рис. 268, слева). Содержимое фолликулов здесь более прозрачное по сравнению с таковым взрослых животных, и такие желточники видны плохо. Матка у молодых животных наполнена прозрачными, неокрашенными летними яйцами размером, значительно уступающим покоящимся. Оболочка летних яиц очень тонка, желточных клеток в них заключается всего несколько десятков. В матках образуется таких яиц больше, чем зимних. В редких, сравнительно, случаях зимние яйца начинают образовываться наряду с оставшимися еще в матке летними яйцами.
Dalyellia sp. — далиэллия
Материал и методы изучения. Dalyellia из сем. Dalyelliidае — обычнейшие формы самых различных мелких стоячих водоемов с растительностью. Dalyellia вместе с Microstomum и Stenostomum попадаются в каждой пробе, взятой специально планк-
тонным сачком. tkksss. Дтажм.. tstmw. 's??'»'-». г.
пустым кишечником, для чего выгодно отсаживать животных и заставлять их сутки поголодать. В материале могут встретиться различные виды данного рода. Безразлично, какой вид будет взят для изучения, их анатомия более или менее сходна. Возможный ассортимент форм легко предвидеть, если взять статью Н. В. Насонова (1924) о географическом распространении Neorhabdocoela в СССР.
Внешняя морфология. Тело вытянуто в длину, округлое в сечении. Наиболее широко оно посередине и в задней трети. Кпереди постепенно суживается, передний конец тела остается широким, тупо срезанным. Кзади тело, наоборот, резко сужается и заостряется (рис. 271). Здесь иногда наблюдаются небольшие папиллы. Длина тела колеблется у разных видов от 1—1,5 до 5 мм (D. viridis). Dalyellia обычно окрашены. В их паренхиме рассеян желтоватый или коричневатый пигмент. Зеленые формы приобретают такую окраску благодаря присутствию в теле зоохлорелл (D. viridis).
Вблизи переднего конца тела у всех Dalyellia резко выделяются парные глазные бокалы, направленные своими вогнутыми поверхностями наружу. Сразу позади глаз, а иногда и между ними лежит узкое ротовое отверстие. Пара выделительных отверстий расположена в задней половине тела на брюшной стороне (см. рис. 273), но их едва ли
1
Рис. 271. Dalyellia viridis. Общий вид (Х15) (из кн. Граффа):
1 — ротовое отверстие, 2 —* глаза, 3 — глотка, 4 — кишечник, 5 — яйцо
удастся увидеть, так как под ними как раз рас-положен кишечник, обычно с пищей. Несколько позади от них в задней трети тела, уже позади кишечника, видно наружное половое отверстие.
Анатомия. Пищеварительная с и ст е-м а. Ротовое отверстие ведет в довольно объемистый глоточный карман (рис. 271, 272). Туда вдается очень большая мускулистая глотка. По форме это бочонковидная глотка (pharynx dolii-formis), представляющая особую разновидность ph. bulbosus. Глотка вытянута вдоль тела, обычно слегка заостренная вершина ее направлена вперед. На слегка придавленном объекте удается хорошо рассмотреть систему взаимно перекрещивающихся продольных, кольцевых и радиальных мускульных волокон. На большей части глотки видна сетчатая структура, отсутствующая на переднем крае, где обособляется переднее кольцо (рис. 272). На последнем продольные волокна тесно приближены друг к другу, радиальные же и кольцевые развиты слабее и поэтому плохо заметны,
Глотка может двигаться взад и вперед действием группы ретракторов, прикрепленных главным образом к переднему ее краю. В полость глотки с обеих сторон сзади впадают протоки двух групп одноклеточных желез, так называемых слюнных. У основания глотки виден воротничок из округлых, зернистых клеток. Эта
Рис. 272. Dalyellia armigera. Передний конец тела (Х45) (из кн. Граффа):
1 — глаз, 2 — ротовое отверстие, 3 — переднее кольцо глотки, 4 — ретракторы глотки, 5 — сетчатая часть глот-ки, 6 — слюнные железы, 7 — клетки пищевода, 8 — жел-точиик, 9 — кишечник
Рис. 273. Dalyellia schmidtii. Общее расположение каналов выделительной системы (из кн. Граффа):
1 — ротовое отверстие, 2 — передний продольный ствол, 3 — задний продольный ствол, 4 — выделительная пора, 5 — наружное половое отверстие
часть трактуется как слабо выраженный пищевод (рис. 272). Далее идет мешковидная кишка, обычно переполненная пищей (различными мелкими водными животными, в том числе и инфузориями).
Выделительная система. Элементы выделительной системы могут быть видны при изучении придавленных животных. От выделительных отверстий вперед идут парные главные стволы (рис. 273), от которых отходят боковые ответвления, загибающиеся обычно назад. Наиболее крупные ответвления — самые задние — представляют собой задние продольные стволы. Передние концы главных стволов также загибаются назад. Терминальные клетки у Dalyellia рассмотреть почти невозможно.
Нервная система. In vivo можно рассмотреть только надглоточное парное ганглиозное скопление с несколькими парами нервных стволов (рис. 274). Передняя пара связана с глазами, задние же иннервируют туловище.
Мужская половая система. Два семенника сильно вытянуты в длину, расположены вдоль кишечника, между его стенкой и стенкой тела (рис. 274). Контур семенников гладкий, передние их концы, обычно расширенные по сравнению с задними, доходят до уровня глотки. Семяпроводы (просто суженные части семенников) идут назад и впадают порознь в семенной пузырь (vesicula seminalis interna) копуля-
Рис. 274. Dalyellia viri-dis. Общая анатомия половой системы (ХЗО) (из кн. Бресслау в Krumbach—Kukenthal’s Hand-buch):
1 — ротовое отверстие, 2 — глаз, 3 — надглоточные ганглии, 4—задние нервы, 5 — глотка, 6 — семенник, 7 — желточник, 8 — яйцо в паренхиме, 9 — семяпровод, 10 — семенной пузырь, 11 — копулятивный орган, 12 — половая клоака, 13 — наружное половое отверстие, 14 — копулятивная сумка, 15 — общий женский проток, 16— яичники, 17 — семяприемник, 18 — кишечник
тивного органа. Сюда же открываются протоки многочисленных желез с зернистым секретом.
Копулятивный орган (рис. 275) имеет на своем дистальном конце своеобразное хитиноидное вооружение, форма и структура которого — основной критерий для различения видов. Например, у D. expedite. 14—16 хитиновых зубцов направлены назад, расползаются в виде короны и у основания связаны между собой двойным хи-тинондным обручем (рис. 275,Л). В других случаях зубцы располагаются на парных стержнях, идущих вдоль пениса. Каждый стержень подразделяется тогда на дистальную часть, усаженную зубцами, и различно устроенную рукоятку. Оба стержня связаны между собой поперечными перемычками. У D. viridis видны двойные рукоятки (рис. 275,5). Дистальные концы при этом усажены по внутреннему краю 13—14 косо поставленными зубцами. Поперечная перемычка одна с сидящим на ней зубцом. У D. hallezii и других рукоятка ординарная (рис. 275, Г). В некоторых случаях (D. armigera, например) вооружение становится асимметричным. Боковые зубцы усаживают один из стержней, другой же в дистальной части не имеет зубцов, но зато вдоль него тянется дополнительная ланцетовидная лопасть (рис. 275, В). Оба стержня в данном случае соединены двойной перемычкой, от нее отходит назад длинный двойной шип. Известны случаи и отсутствия боковых зубцов. Оба стержня копулятивного вооружения оказываются подвижными один по отношению к другому и при копуляции, когда пенис вводится в половое отверстие партнера, дистальные концы вооружения расходятся в стороны и таким образом растягивают половое отверстие.
Копулятивное вооружение можно рассмотреть, только совершенно раздавив изучаемое животное и наставив иммерсионную систему. Конец
пениса выдается в половую клоаку нередко в специальном, обособленном ее отделе — мужском атриуме.
Женская половая система. Яичник обычно один (у D. viridis он парный), небольших размеров, расположен позади кишечника (см. рис. 274). Вершина яичника занята синцитиальной недифференцированной массой клеток, большая же часть его заполнена тесно прижатыми друг к другу яйцами. Короткий яйцевод впадает либо прямо в половую клоаку, либо в просвет пузырька семяприемника, и тогда приходится говорить об общем женском половом протоке (ductus communis).
Рис. 275. Половая система. А— вооружение пениса Dalyellia expedita; Б — дистальные отделы половой системы Dalyellia viridis: В — вооружение пениса Dalyellia hallezii; Г — дистальные отделы половой системы Dalyellia hallezii (X 150) (из кн. Граффа):
/ — семенной пузырь, 2 — семяпровод, 3 —рукоятка копулятивного вооружения, 4 — поперечная перемычка копулятивного вооружения, 5 — дистальные стержни копулятивного вооружения с зубцами, 6 — половая клоака, 7—наружное половое отверстие, 8 — общий женский проток, 9 — желточный проток, 10 — яичник, 11 — желточник, 12 — семяприемник, /3 — копулятиввая сумка, 14 — матка с лежащим в ней яйцом, 15 — стебелек семяприемника
В половую клоаку (часто дифференцируется ее женская половина) попадает проток семяприемника (receptaculum seminis) и открывается копулятивная сумка (bursa copulatrix). Семяприемник обычно шаровидной формы, наполнен спермой и сидит на тоненьком стебельке. В редких случаях он не обособлен и его функцию принимает на себя расширенная часть яйцевода (D. armigera).
Копулятивная сумка с мощно развитой мускулатурой в стенках обычно открывается в половую клоаку неподалеку от пениса. При оплодотворении копулятивный аппарат вводится через половое отверстие именно в эту сумку и сюда же поступает сперма.
Парные желточники сильно вытянуты в длину и обычно лежат рядом с семенниками, чаще медианно от них. Структура их очень характерна, края сильно изрезаны, выдаются многочисленные боковые лопасти. Желточники наполнены сильно преломляющими свет желточными клетками, отчего они кажутся в проходящем свете темнее окружающих тканей. Желточные протоки впадают самостоятельно в половую клоаку около отверстия яйцевода у D. hallezii и др. (рис. 275, Г) или же в общий женский проток (ductus communis) у D. viridis.
Скорлуповые железы в небольшом количестве вливаются в ductus communis или в половую клоаку около впадения в нее желточных протоков.
Рис. 276. Gyratrix hermaphrodi-tus. Общая морфология, вид с брюшной стороны (Х80) (из кн. Граффа);
I — влагалище, 2 — вершина хоботка, 3 — цилиндрическая часть хоботка, 4 — передний нерв, 5 — ретракторы хоботка, 6— глаза, 7 — мозг, 8 — кишечник, 9 — задний нерв, 10—ротовое отверстие, окруженное стенкой глотки, И — желточник, 12 — матка с яйцом, 13—желточный проток, 14 — женское половое отверстие, 15 — зернистые железы, 16 —. резервуар зернистых желез, 17 — копулятивная сумка, /5 — семяизвергательный канал, 19 — мужское половое отверстие, 20 — стилет н его футляр, 21 — выделительная пора, 22 — яичник, 23 — семе’нной пузырь, 24 — семяпровод, 25 — семенник, 26— продольный главный каналец выде* лительной системы
Наконец, у Dalyellia иногда обособляется в виде выпячивания стенки половой клоаки резервуар для яиц — матка. В тех случаях, когда матка есть (например, у Ь. hallezii), она развита слабо и служит для помещения всего одного яйца (рис. 275, Г, 14). В случае отсутствия матки (например, у D. viridis) яйцо из половой клоаки проникает в паренхиму и там остается до конца жизни червя. Освобождается яйцо в таких случаях только после гибели животного.
Gyratrix hermaphroditus Ehrbg. — гиратрикс
Материал и методы изучения. Gyratrix hermaphroditus из сем. Gyratricidae и подотр. Ка-lyptoi hynchia — один из наиболее подвижных Neorhabdocoela, широко распространен, и его можно встретить в любом не очень загрязненном стоячем водоеме. В пробе, взятой специальным планктонным сачком и отстоявшейся в течение суток, на стенках банки почти всегда можно найти Gyratrix. Изучение ведется только in vivo. Рационально подкрасить червя слабым раствором нейтрального красного.
Внешняя морфология. Тело, достигающее в длину 2 мм, чрезвычайно сократимо, и червь может сжаться совсем в комок или, наоборот, сильно вытянуться. В спокойно плывущем состоянии передний конец тела сужен, задний же расширен так, что наибольшая ширина приходится на расстоянии ]/з от закругленного заднего конца тела (рис. 276).
Вся поверхность тела покрыта сплошным ресничным покровом. Тело червя чрезвычайно прозрачно — отсутствие каких бы то ни было пигментов в паренхиме позволяет очень подробно изучить его организацию, следует только выбрать животное с кишкой, слабо набитой пищей.
На переднем суженном конце тела виден хоботок, погруженный в специальное хоботковое влагалище (рис. 276). Хоботок составлен из двух элементов. Свободно лежит в полости влагалища его конусообразная вершина, составляющая
впе-
Наконец, на спинной
меньше половины общей его длины. Эта вершина может высовываться наружу. Большая же цилиндрическая часть погружена в паренхиму и снабжена богатой кольцевой мускулатурой, что обычно хорошо видно. Свободная часть хоботка покрыта многочисленными мелкими папиллами. Хоботок очень подвижен. Его движения обусловливаются системой протракторов, ретракторов и фиксаторов (см. рис. 279). У основания его открываются протоки одноклеточных желез (см. рис. 279, 6). Функция хоботка, вероятно, осязательная.
Сразу позади хоботка видны два небольших пигментированных глаза, посаженных близко друг к другу. Ротовое отверстие занимает медианное положение несколько впереди от середины тела. Два выделительных отверстия открываются вентрально недалеко от заднего конца тела (рис. 276). Мужское половое отверстие открывается терминально на заднем конце тела, женское же смещено по брюшной стороне ред, не доходя двух третей расстояния до глотки, стороне, недалеко от заднего конца тела, открывается наружу влагалище, окруженное небольшим сфинктером.
Анатомия. Пищеварительная систе-м а. Ротовое отверстие ведет в небольшой глоточный карман и в глотку типа pharynx bulbosus именно той модификации, которую называют ph. rosulatus. С вентральной стороны глотка имеет правильную, округлую форму с радиально расходящимися мышечными волокнами (рис. 276, 10). Сбоку же видно, что глотка вытянута в длину, образуя глоточный bulbus (см. рис. 279, 11). Короткий пищевод ведет в мешковидный кишечник. Последний выдается от глотки вперед до уровня нервной системы и тянется назад почти до конца тела — задняя часть почти вдвое превышает переднюю. Кишка обычно бывает окрашена в различные цвета — пищевая масса внутри придает соответствующую окраску. Пищей Gyratrix служат главным образом мелкие рачки, которых он высасывает, прикладываясь к ним глоткой.
Выделительная система (рис. 277). Два главных канала выделительной системы извиваются по бокам тела и заканчиваются каждый ампулой. Последняя выделительной порой сообщается с наружной средой. Эти главные каналы доходят почти до переднего конца тела, становятся тоньше и поворачивают назад, отдавая от себя боковые ветви, в свою очередь разветвляющиеся и заканчивающиеся терминальными органами. При окраске витальными красками можно заметить атроциты или паранефроциты— кучки рыхлых клеток с большими ядрами, прилегающие вплотную к канальцам выделительной
Рис. 277. Gyratrix her-maphroditus. Выделительная система (Х80) (из кн. Рейзингера):
1 — хоботок, 2 —глаза, 3 — задняя часть главного канала, 4 — передняя часть главного канала, 5 — глотка, 6— атроциты, 7—ампула, 8 — стилет
системы. Это железистые образования, вероятно, участвующие в передаче экскреторной жидкости из паренхимы в просвет канальца (Бресслау).
Нервная система. In vivo удается рассмотреть только парную мозговую массу позади хобота и отходящие от нее вперед и назад две пары нервов (рис. 276).
Мужская' половая система. Единственный семенник расположен асимметрично с левой стороны тела. Он вытянут в длину, края
его слегка изрезаны и одним своим концом он почти достигает уровня нервной системы, другим же спускается немного ниже глотки (см. рис. 276). Сбоку от него (на уровне ротового отверстия) с внутренней стороны отходит назад семяпровод. Приблизительно посредине последний вздувается, образуется семенной пузырь (vesicula feminalis externa).'Далее он снова утончается и подходит к хитиноидному копулятив-
ному аппарату, который имеет довольно сложное строение и помещает-
ся внутри широкого
Рис. 278. Gyratrix herma-phroditus. Хитиноидный «копулятивный аппарат» (Х1200) (по Галлецу, с изменен.):
1 — зернистые железы, 2 — мешок зернистых желез, 3— футляр стилета, 4 — стилет, 5 — ручка футляра стилета, 6 — семяпровод
семяизвергательного канала. Копулятивный аппарат состоит из двух частей: стилета и футляра для него. Стилет — прямой на большем своем протяжении, слегка изогнут на проксимальном конце и заострен на дистальном в виде полой внутри трубки (рис. 278). На проксимальной части стилета есть бугорки, куда прикрепляются мышпы. Футляр для стилета с двумя лопастями треугольной формы охватывает стилет с боков. Обе лопасти спаяны продольно друг с другом по одному краю — образуется род желобка, в котором назад и вперед ходит стилет. На переднем крае свободные углы пластинок сливаются и получается кольцо. От этого кольца вперед отходит длинная изогнутая ручка (рис. 278). Проксимальный конец стилета связан с резервуаром, в который открываются многочисленные железы (рис. 278, 1) с зернистым секретом. Системой мышц (протракторов и ретракторов) стилет может выдвигаться далеко вперед и высовываться из полового отверстия или, наоборот, втягиваться глубоко внутрь. Футляр при этом сохраняет постоянное положение. Семявыносящий каналец впадает сбоку стилета и независимо от него в семяизвергательный канал, проходящий внутри футляра стилета (рис. 278). Стилет не принимает никакого участия в копу-
ляции и функция его заключается в умерщвлении добычи, в которую он втыкается многократно при нападении на нее Gyratrix. Секрет зернистых желез, видимо, ядовит, так как рачок перестает двигаться, прежде чем будет высосан червем. Строение копулятивного аппарата рассматривают, раздавив покровным стеклом Gyratrix.
28
Рис. 279. Gyratrix hermaphroditus. Общая схема организации, вид сбоку. Кишечник не изображен (Х60) (из кн. Рейзингера):
1— мышцы фиксатора хоботка, 2 — протракторы хоботка, 3 — влагалище хоботка, 4 — вершина хоботка, 5 — цилиндрическая часть хоботка. 6 — хоботковые железы, 7 — мозг, 8 — семенник, 9 — ретракторы хоботка, 10 — ротовое отверстие. 11 — глотка, 12 — начальный отдел кишечника, 13— се-менной пузырь, 14 — матка, /5 —желточный проток, 16 — железы, открывающиеся внутрь стебелька матки, 17 — семенной проток, 18 — женское половое отверстие, 19 — семяпровод, 20—мешок зернистых желез, 21 — ретракторы стилета, 22 — стилет, высовывающийся через мужское половое отверстие, 23—протрактор стилета, 24 — влагалище, 25 — копулятивная сумка, 26 — зернистые железы,
27 — яичник, 28 — желточник
Женская половая система. Небольшой цилиндрический яичник лежит слева от полового отверстия и наполнен яйцевыми клетками, расположенными в один ряд и сдавливающими друг друга. Короткий яйцевод впадает в очень маленький женский атриум. Сюда же спереди впадает и проток матки. Последняя обычно содержит лишь одно яйцо с расширенным на конце стебельком (см. рис. 276).
С правой стороны в этот же атриум впадает желточный проток, идущий от единственного желточника. Желточник лежит асимметрично на правой стороне тела вдоль почти всего кишечника и имеет характер сети из немногих толстых, ветвящихся и анастомозирующих трубок (рис. 276, 279).
Наконец, в состав женской половой системы входит еще копулятивная сумка (bursa copulatrix, рис. 279)—объемистая полость, распо-
ложенная позади женского полового отверстия и связанная с наружной средой влагалищем. Последнее открывается наружу, как было указано выше, на спинную сторону. Копулятивная сумка обычно наполнена комками сперматозоидов после оплодотворения и связана с женским атриумом специальным семенным протоком (ductus seminalis, рис. 279).
Оплодотворение, формирование сложного яйца (соединение яйцевой клетки с кучкой желточных) и образование яйцевой скорлупы происходят в постоянно существующей у данного вида матке. Скорлупа формируется за счет специальных гранул скорлупового секрета в плазме желточных клеток (Мейкснер, 1923). Стебелек же яйца (рис. 280) образуется из выделений специальных желез, впадающих в устье матки. Этот секрет затвердевает, как только выйдет из протоков
Рис. 280. Gyratrix hermaphroditus. Яйцевой кокон (Х160) (из Мейк-снера)
Рис. 281. Microstomum lineare. Цепочка из 16 зооидов (Х35, объяснение в тексте) (из кн. Граффа):
гл. — глазок, гл. ж. — гло* точные железы, к — кишеч-» ник, р — ротовое отверстие первого зооида, р. я. — peg* ничная ямка
желез, и поэтому стебелек сохраняет форму выводных путей матки. Специальный сфинктер выводного канальца регулирует толщину стебелька.
ОТРЯД MACROSTOMIDA —МАКРОСТОМИДЫ
Microstomum lineare (О. F. Muller) — микростомум
Материал и методы изучения. Microstomum lineare принадлежит к сем. Microstomidae. Это обычнейшая форма любого стоячего водоема, наверняка будет найдена почти в каждой пробе, взятой с илом со дна. Изучение ведется только in vivo.
Внешняя морфология. Животные вытянуты в длину, цилиндрической формы и выглядят в виде цепочки зооидов (рис. 281). Последние достигают длины 1,5—2 мм, цепочки же бывают длиной более 1 см. Передний и задний концы тела заострены и на заднем заметны мелкие хвостовые папиллы. Вблизи переднего конца тела'по бокам два ярко-красных пигментированных глазка. Каждый глазок представляет собой скопление зернышек пигмента в толще эпителия. Никаких элементов, воспринимающих свет, не обнаружено. Позади глазков видны также по бокам тела две чувствительные ресничные ямки, глубоко уходящие внутрь тела. На уровне ресничных ямок на вентральной стороне тела открываются наружу близко поставленные друг к другу два выделительных отверстия, однако заметить их обычно не удается. Наконец, позади них располагается медианно ротовое отверстие.
Тело окрашено в слабо-желтый, коричневатый или сероватый цвет. Паренхима прозрачная, но обычно кишечник, переполненный пищей, делает тело почти непрозрачным. Ресничный эпителий, покрывающий тело со всех сторон равномерно, имеет в большом количестве нематоцисты — стрекательные клетки съеденных червем гидр. На сильно придавленном объекте, особенно по его периферии, эти «клептокниды» удается рассмотреть без труда. При придавливании часть из них выстреливает свою стрекательную нить. Клептокниды представляют своеобразный пример «естественного культивирования» клеточных орга-
нелл за пределами того организма, которому они принадлежат.
Почти каждый выловленный Microstomum несет на себе признаки вегетативного размножения — поперечные перетяжки, разделяющие тело на неравные части (рис. 281). Интересно проследить последовательность появления перешнуровок и дочерних зооидов.
Одиночный зооид, приступая к вегетативному размножению, отделяет на своем заднем конце поперечной перетяжкой . —’/з часть.
Между этими дочерними зооидами первого порядка возникает и перегородка
Рис. 282. Схема деления Microstomum lineare (объяснение в тексте) (из Граффа)
первого порядка. Условно особей первого порядка можно обозначить: переднюю цифрой 1 и заднюю — 2 (по Бресслау, 1932, рис. 282). Перегородка тогда будет I (см. рис. 281). Задняя особь подрастает, в ней образуется спереди ротовое отверстие, закладываются головной мозг и органы чувств переднего конца — глазки и ресничные ямки. После того как зооиды первого порядка почти сравняются по своим размерам, каждый из них отшнуровывает снова по одному зооиду — образуются зооиды второго порядка. Прибавляя опять цифры 1 и 2 для переднего и заднего зооидов к предыдущим обозначениям, получаем для особей второго порядка следующие обозначения: передний—И, отделившийся от него— 12; следующий задний — 21 и отделившийся от него — 22. Перегородки между первыми двумя тогда следует обозначить П\, между задними //г. Отделившиеся зооиды опять подрастают, в них также регенерируют органы переднего конца, но они приступают к вегетативному размножению, не дорастая до размеров передних зооидов (11 и 21). Все четыре зооида при этом разом отделяют по маленькому зооиду и получаются особи третьего порядка с перегородками, обозначаемыми уже III с соответствующим порядковым номером (см. рис. 281). Тогда на стадии восьми зооидов замечаем особей трех размеров. Со стадии 16 зооидов (цепочка составлена особями четвертого порядка) обычно начинается распадение животного на отдельные части.
Вегетативное размножение наблюдается в течение всего лета. Половой процесс происходит только осенью.
Анатомия. Пищеварительная система. Ротовое отверстие ведет в глотку, лишенную специальной мускулатуры и называемую pharynx simplex. Характерная складка покровов, образующая глоточный карман у других типов глотки, здесь отсутствует. Стенки глотки пронизаны протоками многочисленных глоточных желез. Глотка ведет в объе
мистую, занимающую почти все тело червя кишку. Вперед от глотки выдается небольшой слепой вырост кишечника (см. рис. 281). Кишечник окрашен обычно в темный цвет благодаря наполняющей его пище. Последней служат мелкие рачки, черви и даже гидры. Для гидр Microstomum— серьезный враг и в аквариумах производит среди них большие
опустошения.
Выделительная система. Выделительная система видна плохо на фоне непрозрачного кишечника. Все же отдельные ее фрагменты могут попасться на придавленных червях. Два главных ствола идут от выделительных отверстий назад, и от них отдаются боковые ответвления. Часть их направляется вперед, часть же разветвляется в области глотки (рис. 283, А).
Половая система. У Microstomum половая система исследована плохо. До последнего времени остается неясным вопрос о причинах появления половозрелых особей осенью. У Microstomum, видимо, наблюдается протерандрия: сначала развиваются мужские половые железы в задней части тела, позже развивается яичник. Спорной является форма парных семенников. Имеются сведения об удлиненных и об овальных, компактных. Семяпроводы вливаются в объемистый семенной
пузырь, проток от которого проходит внутри хитиноидного копулятивного придатка — изогнутой, заостренной трубочки (рис. 283, Б). Муж
ская половая система развивается осенью, параллельно с вегетативным размножением, и тогда в пределах цепочки можно наблюдать закладку копулятивных трубочек сразу в нескольких зооидах. Яичник располагается кпереди от семенного пузыря и представляет собой ряд из 1—4 фолликулов с развивающимися в них яйцами (рис. 283, В). Короткий яйцевод с многочисленными железами, открывающимися в него, выходят наружу. В яичнике могут созреть и образоваться одно — три яйца. Некоторое количество яйцевых клеток не развивается, превращаясь в угнетенные, абортивные яйца.
-Л — выделительная система (Х20) (из кн. Келлера): 1 — выделительная пора, 2— ротовое отверстие, 3— главные стволы;
Б—копулятивная трубочка (Х250);
В — продольный разрез через женскую половую систему (Х500) (из кн. Мейкснера); 1 —> абортивные яйца, 2 — растущий ооцит, 3 — созревшее яйцо, 4 — яйцеводные железы. 5 — яйцевод, 6 — женское половое отверстие
ОТРЯД ACOELA—БЕСКИШЕЧНЫЕ
Convoluta sp. — конволюта
Материал и методы изучения. Различные виды рода Convoluta (сем. Convolutidae-отр. Acoela — бескишечные турбеллярии) населяют литораль Баренцева, Белого, Черного и Японского морей. Ловить их чрезвычайно просто: водоросли, собранные у берега, прополаскивают в банке с морской водой. Уже через несколько часов стояния такой воды на стенках банки можно обнаружить с помощью лупы ползающих Convoluta. Снимать их со стенки следует пипеткой и рассматривать главным образом в живом состоянии (на окрашенных тотальных препаратах почти ничего не удается рассмотреть). Можно, однако, изготовить и срезы после быстрой фиксации (1—1,5 мин) горячей смесью сулемы с уксусной кислотой, быстро проводя через спирты (выдерживая 10—20 мин в каждом) и быстро заливая в парафин (подобно рекомендованному для Rhabdocoela способу — с. 297). На серии поперечных срезов разбирают строение и гистологию червя, особенно же демонстративны толстые (10—12 мкм) продольные (сагиттальные) срезы.
В Белом и Баренцевом морях, на Мурмане, обычна атлантическая Convoluta convoluta Abidgaard, в Черном — С. hipparchia Perejaslavzewa, а в Японском — С. sagitti-fera Ivanov и С. bifoveolata Mamkaev.
Внешняя морфология. Тело Convoluta листовидное, 1—3 мм длиной. Спереди оно поперечно срезано с выемкой посередине, кзади заострено. Боковые края тела обычно подгибаются на брюшную сторону, и животное принимает форму воронки (рис. 284, Б), открытый конец которой при ползании направлен вперед и совершает ощупывательные движения. Добычу (диатомовых водорослей, мелких рачков) Convoluta захватывает передним концом, подминая ее под себя. Convoluta обычно бывает окрашена пестро в зависимости от наличия в паренхиме пигментных клеток и симбиотических водорослей. Тело Convoluta мало прозрачно: кроме пигментных элементов паренхима обычно бывает переполнена пищей.
На брюшной стороне Convoluta имеется три отверстия (рис. 284, А). Рот лежит посредине тела, ближе к заднему концу расположено женское половое отверстие и позади от него отдельно мужское. Чтобы рассмотреть близ переднего конца тела круглый, прозрачный статоцист с одним статолитом и два темных глаза по бокам от него, необходимо сильно придавить червя покровным стеклом.
Анатомия. На переднем конце тела терминально открывается мощный пучок одноклеточных фронтальных желез, играющих важную роль при удерживании добычи. В толще ресничных покровов по всей поверхности тела расположены крупные слизистые железы (рис. 284, В, /).
Рот ведет в очень короткую глотку простого типа, способную растягиваться в зависимости от размеров добычи. Из глотки пища поступает в центральную, пищеварительную часть паренхимы, отличающуюся синцитиальным характером и обилием вакуолей.
Выделительной системы (протонефридиев) у Acoeia нет. Нервную систему in vivo на тотальном препарате рассмотреть не удается, и может быть разобрана только половая система. Обособленных половых желез с собственными стенками нет, и половые клетки лежат непосредственно в паренхиме. Две группы семенных фолликулов с образующимися в них пучками спермиев находятся справа и слева в передней части тела, ближе к спинной стороне. Зрелые сперматозоиды двигаются
Б
5
Рис. 284. Представители рода Convoluta.
А — Convoluta convoluta. Живая, слегка придавленная (ХЮ) (из кн. Граффа): 1 — статоцист, 2— глаза, 3— грушевидный орган, 4 — рот, 5 — яичник, 6 — семенная бурса, 7 — мужское половое отверстие, 8 — копу-* лятивный орган;
Б — Convoluta hipparchia, живая, ползущая (Х10) (из кн. Граффа): 1— статоцист, 2 — глаза ярко-красные, 3 — пигментные клетки темно-зеленые;
В— Convoluta convoluta. Сагиттальный разрез (из кн. Бресслау): 1—• кожные клетки, 2 — фронтальный орган, 3 — статоцист, 4 — рот, ведущий в глотку, 5 —внутренняя паренхима с пищевыми включениями, 6— периферическая паренхима, 7 — хитиновый наконечник семенной бурсы, 8 — семенная бурса, 9 — отверстие влагалищного протока, 10 — мужское половое отверстие, // — копулятивный орган, /2 —ресничный покров, 13 — дорзовентральные мышцы
назад сквозь паренхиму, как бы прокладывая среди ее клеток временные боковые «дорожки» (ложные семяпроводы) и достигают семенного пузырька, который открывается в мужской совокупительный орган с мускулистыми стенками, способный выпячиваться наружу через мужское половое отверстие (рис. 284, В, 10, 11). Ооциты на разных стадиях созревания располагаются ближе к брюшной стороне двумя боковыми рядами, причем мелкие и молодые лежат впереди, более крупные и зрелые— позади них (рис. 284, А, 5). Наиболее зрелое яйцо оказывается лежащим перед семенной сумкой (бурсой), являющейся женским дополнительным органом. Сумка наполнена обычно спермой, попавшей в нее от партнера при копуляции, и спереди снабжена хитиноидным трубчатым наконечником. Через канал последнего в паренхиму выходят спермин, оплодотворяющие яйцо. С наружной средой сумка сообщается каналом влагалища (рис. 284, В, 9), открывающимся на брюшную сторону упомянутым выше женским половым отверстием. Во время спаривания копулятивный орган партнера вводится во влагалище. Впрочем, у других представителей бескишечных турбеллярий влагалище отсутствует, и копулятивный орган втыкается в любую точку брюшной стороны тела, сперма впрыскивается в паренхиму и по ней проникает в конце концов в семенную бурсу. Оплодотворенные яйца выводятся наружу из паренхимы через рот или путем разрыва стенки тела.
У большинства Acoela половые продукты созревают не одновременно— мужские раньше женских, т. е. имеет место протерандрия.
У Convoluta convoluta паренхима обильно заселена мелкими одноклеточными водорослями зелено-бурого цвета.
КЛАСС TREMATODA — СОСАЛЬЩИКИ, ИЛИ ТРЕМАТОДЫ
В настоящем практикуме группа сосальщиков подразделяется на два самостоятельных класса (Trematoda и Monogenea), как это было предложено Быховским (1937) и признано ныне большинством зоологов.
Из типичных сосальщиков можно использовать любого легко добываемого паразита рыб и лягушек, и свое описание мы основываем на материале из последних. Ознакомление с разнообразием сосальщиков опять-таки удобнее вести на паразитах рыб и амфибий, определяя их по книге Догеля (1932), Маркевича (1951) или по «Определителю паразитов пресноводных рыб СССР» под редакцией Б. Е. Быховского (1962).
Считаем необходимым также ознакомление с несколько аберрантной организацией печеночной двуустки Fasciola hepatica.
Dolichosaccus rastellus (Olsson)-Opisthioglyphe rastellus (Looss)
Материал и методы изучения. Dolichosaccus rastellus принадлежит к сем. Plagiorchidae отр. Prosostomata. Живет в тонких кишках Рапа temporaria. У R. escu-lenta его заменяет Opisthioglyphe гапае, сходный с ним по своей анатомии. Кроме этих двух видов для изучения анатомии трематод может подойти и Pleurogen.es
clamper, часто живущий вместе с обоими видами. Первые два вида более удобны для изучения из-за сравнительно слабого развития матки, не заслоняющей других внутренних органов.
Кишечник лягушки вскрывают ножницами вдоль, скальпелем соскабливают эпителий с внутренней его стороны в каплю воды или физиологического раствора на предметном стекле и соскоб просматривают под лупой. При этом следует иметь в виду, что сосальщики попадаются далеко не в каждой лягушке.
Материал изучают как in vivo, так и на тотальных препаратах, а также на сериях поперечных и продольных срезов. Для тотальных препаратов можно использовать живой материал, окрасив его по Блажину (с. 33). Сроки выдерживания в краске при этом способе должны быть небольшие (следует попробовать разные сроки в пределах нескольких минут); после окраски и некоторого уплотнения в спирте (70°) рекомендуется паразита довольно сильно сдавить. Очень хорошие препараты получаются также после фиксации спиртом 70° или лучше жидкостью Ценкера с формалином и окрашивания квасцовым кармином.
Для изготовления срезов лучше всего фиксировать жидкостью Ценкера с формалином, но можно пользоваться также любым другим сулемовым фиксатором. Dolicho-saccus и Opisthioglyphe можно заливать обычным способом прямо в парафин, Pleuro-genes же должен быть выдержан в смеси Петерфи 2—3 дня с последующей комбинированной заливкой в целлоидии-парафин. Делается это для улучшения резки объекта с большим количеством яиц в сильно развитой, заполняющей почти, все тело матке. При обычной заливке матка у Pleu.rogen.es при изготовлении срезов сильно рвется.
Следует изготовить поперечную серию срезов, фронтальную и сагиттальную. Окраска срезов может быть произведена любым гематоксилином с подкраской эозином или без подкраски, но лучшие результаты дает окраска по Маллори. При использовании этого способа получается дифференцировка в окраске разных органов и тканей (см. с. 34). Толщина срезов рекомендуется 10 мкм.
Внешняя морфология. Лучше всего морфологию D. rastellus изучить на тотальных препаратах и in vivo. Выгоднее взять экземпляры поменьше — молодые. Паразита придавливают слегка покровным стеклом в капле воды или физиологического раствора, и ряд деталей удается рассмотреть под большим увеличением или с применением иммерсионного объектива. С другой стороны, многое хорошо видно и на окрашенных препаратах.
Тело паразита вытянуто в длину, которая превышает ширину приблизительно в три раза и колеблется между 2—4 мм. Наибольшая ширина в передней его четверти. Цвет у живого объекта желтовато-коричневый с довольно темной просвечивающей через покровы маткой. Поверхность тела покрыта мелкими, направленными назад шипиками. Наиболее густы они в передней части тела, количество их убывает по направлению назад, и на самом заднем конце тела их нет совсем. Ротовая присоска занимает субтерминальное положение. Брюшная, почти равная по размерам ротовой, расположена на расстоянии !/з длины тела от его переднего конца. Половое отверстие видно кпереди от брюшной присоски, выделительное терминально на заднем конце тела (рис. 285).
Анатомия. Пищеварительная система. Ротовая полость внутри ротовой присоски ведет в резко расширенную короткую пред-глотку (praepharynx). Вслед за ней идет глотка с узким просветом, с мускулистыми стенками. Хорошо видна ее радиальная исчерченность— радиальные мышечные волокна. Сравнительно короткий пищевод неподалеку от глотки раздваивается и переходит в кишку. Каждая из ветвей кишечника тянется вдоль всего тела и заканчивается слепо, не доходя немного до заднего конца тела (рис. 285). Внутри кишечника всегда
имеется пища, всосанная действием глотки из просвета кишки лягушки. Кровяных элементов в кишечном содержимом D. rastellus не попадается.
Выделительная система. На тотальном препарате виден
концевой экскреторный пузырь, раздвоенный на проксимальном конце. Обе ветви тянутся далеко вперед и видны еще на уровне яичника (рис. 285). От раздвоений концевого пузыря отходят главные каналы выделительной системы вперед и назад, отдающие от себя боковые веточки с терминальными органами. Последние in vivo не видны.
Нервная система. На тотальных препаратах нервную систему рассмотреть почти не удается. Поэтому два наглоточных ганглиозных скопления, три пары продольных нервных стволов, связанных поперечными комиссурами, можно попытаться рассмотреть на срезах.
Мужская половая система. Два семенника довольно правильной овальной формы вытянуты слегка в поперечном направлении и расположены рядом один перед другим посредине тела таким образом, что передний смещен немного влево от медиальной линии тела, задний же — вправо (рис. 285). Семяпроводы обычно не видны (их удается рассмотреть на срезах). Они идут вперед и входят внутрь мешка цирруса, вливаясь в семенной пузырь (vesi-cula seminalis interna, рис. 286). От пузыря начинается узкий канал — семяизвергательный (ductus ejaculatorius), идущий внутри способного выворачиваться наружу копулятивного органа — цирруса (cirrus) и открывающийся в весьма незначительную по объему половую клоаку. Проксимальный конец семяизвергательного канала несколько вздувается и принимает в себя протоки многочисленных простатических желез (рис. 286). Наружное половое отверстие, сообщающее полость половой клоаки с наружной средой, лежит немного позади уровня раздвоения пищевода. Семенной пузырь обычно бывает переполнен спермой.
Женская половая система. Единственный яичник, более мелкий по сравнению с семенниками, правильной сфе-
Рис. 285. Dolichosaccus rastellus. Общий вид червя in vivo с брюшной стороны (Х50) (ориг.):
/ — ротовая присоска с лежащими впереди нее головными железами, 2 — предглотка, 3 — глотка, 4 — пи-» щевод, 5 — средняя кишка, 6 — брюшная присоска, 7 — передний конец правой ветки мочевого пузыря, 8«—яичник, 9 — матка, 10 — семенники, // — непарный отдел мочевого пузыря, /2 — выделительное отверстие, 13 — протонефридиальные канальцы, 14 — семенной пузырь сумки цирруса, /5—наружное половое отверстие, 16 — метратерм, 17 — семяизвергательный канал, 18 —
желточники
Рис. 286. Dolichosaccus rastellus. Дистальные выводные пути половой системы, вид с брюшной стороны in vivo (X125) (ориг.):
1 — стенка сумки цирруса, 2—простатические железы, 3 — брюшная присоска, 4 — семенной пузырь, 5 — семяпроводы, 6 — наружное половое отверстие, 7 — семяизвергательный канал, 8 — метратерм
рической формы, лежит сразу позади брюшной присоски, справа от нее (см. рис. 285). Внимательно присматриваясь, удается разобрать отходящий от него яйцевод с небольшим вздутием недалеко от яичника — камерой оплодотворения. Начало яйцевода расширено в виде воронки и снабжено кольцевой мускулатурой, сокращением которой яйцо выдавливается в просвет яйцевода из яичника. Далее яйцевод отдает от себя боковое выпячивание — семяприемник— и принимает Лауре-ров канал, открывающийся наружу на спинной стороне, плохо заметный in vivo и тем более на окрашенных препаратах. Рядом с ним в яйцевод впадает непарный желточный проток и ниже его яйцевод снова расширяется, принимая многочислен
ные скорлуповые одноклетные железы. Образуется оотип, где формируется яйцевая капсула или сложное яйцо (см. подстрочное примечание на с. 283, рис. 287). Комплекс скорлуповых желез образует тельце Мелиса, и функция их довольно важная при формиро-' вании сложного яйца сосальщика. После оплодотворения яйцевой клетки в камере оплодотворения яйцо, проходя мимо желточного протока, снабжается порцией желточных клеток. В оотипе клейкий секрет скорлуповых желез цементирует вместе составные части яйца. От поверхности желточных клеток отделяются гранулы скорлупообразной субстанции (например, см. Гофштейн, 1912, и др.). Вероятно, они удерживаются на поверхности тем же секретом скорлуповых желез. Кроме того, уже готовые яйца плавают в жидкости, видимо, также являющейся производным тех же скорлуповых желез (Фурман). Яйцевод и Лауре-
ров канал выстланы ресничным эпителием.
Вслед за оотипом яйцевод расширяется и превращается в матку — длинный, трубчатый резервуар для сложных яиц. Матка извивается в различных направлениях в промежутке между брюшной присоской и семенниками посредине тела (см. рис. 285). Конечный отдел ее выходит вперед перед брюшной присоской, резко суживается и превращается в метратерм (metraterm), снабженный хорошо развитой кольцевой мускулатурой и выстланный изнутри скульптурированной кутикулой (см.
Рис. 287. Opisthioglyphe гапае. Проксимальный отдел выводных путей женской половой системы in vivo (Х125)
(из кн. Лооса):
/ — яичник, 2 —камера оплодотворения яйцевода, 3 — наружное отверстие Лаурерова канала, 4 — Лауреров канал, 5 — оотип с впадающими в него протоками скорлуповых желез, 6 — яйцо в начале матки, 7 — желточный проток, 8 — семяприемник
рис. 286). Яйца в метратерме не задерживаются и их обычно в нем не видно.
Многочисленные желточники гроздьями разбросаны в передней и задней частях тела (см. рис. 285), в области матки их почти нет. Желточные протоки от них (передние и задние) с правой и с левой сторон соединяются в парные главные каналы, подходящие к области, где располагается яичник. Перед впадением в яйцевод эти протоки сливаются вместе и здесь образуется расширение, желточный резервуар (рис. 287). Только из него уже желточные клетки по непарному желточному протоку и попадают в яйцевод.
Изучение срезов. Гистология. Прежде всего следует изучить гистологию D. rastellus на срезах через среднюю часть тела. Поверхность тела покрыта синцитиальной цитоплазматической пластинкой кожного
Рис. 288. Dolichosaccus rastellus. Поперечный разрез через стенку тела в задней трети тела (Х600) (ориг.):
/ — стенка мочевого пузыря, 2 — экскреторные гранулы, 3 — паренхима, 4 — яд-ра клеток погруженного эпителия, ,5 — кутикулярные шипики, 6 — наружная пластинка погруженного эпителия, 7 — кольцевые мышечные волокна, 8 — продольные мышечные волокна, 9 — мускульная оболочка кишечника, 10— эпителий кишечника
погруженного эпителия ’. Однако детали строения покровов различимы только с помощью электронного микроскопа.
Под наружной пластинкой непосредственно залегают базальная мембрана и кожная мускулатура. Тонкий слой кольцевых мышц (на фиксированных препаратах мышечные волокна выглядят в виде зигзагообразных линий) располагается непосредственно под базальной мембраной, за ним следуют разбросанные в небольшом количестве продольные волокна (рис. 288). Между мышечными волокнами видны (особенно на срезах через передний конец тела) выводные канальцы кожных желез. Иногда видна на срезе и пора, которой каналец открывается наружу. Кнутри от обоих мышечных слоев видны ядра погруженного эпи-
1 Характеристика кожного погруженного эпителия, чрезвычайно широко распространенного у ресничных червей, дана на с. 272.
Несмотря на совершенно ясное определение термина «погруженный эпителий», давно существующее в сравнительной морфологии беспозвоночных животных, в паразитологической литературе недавно стал употребляться новый термин «тегумент» в отношении покровов паразитических плоских червей. Применение его крайне нежелательно, так как создает неправильное впечатление, что паразитические PJathelminthes обладают неким особым, им только свойственным типом кожного эпителия. В действительности их погруженный эпителий ничем существенным не отличается от такового турбеллярий и других беспозвоночных. Очевидно, нет никаких оснований обычное английское слово tegument (что значит покров), взятое из заголовков работ некоторых английских авторов, превращать в специальный гистологический термин.
телия, довольно правильным рядом расположенные под поверхностью среза.
Еще далее внутрь на срезе видны паренхиматозные клетки полигональной формы с отростками, образующие род рыхлой соединительной ткани, которая заполняет промежутки между отдельными органами. В паренхиме ближе к поверхности разбросаны многочисленные кожные одноклетные железы, окрашивающиеся, по Маллори, в ярко-красный цвет, благодаря чему они резко выделяются среди клеточных элементов паренхимы.
Структура нервных элементов на срезах выступает слабо. В области глотки перерезают часть центральной нервной системы — окологлоточного ганглиозного скопления. На срезах видны перерезанные в большом количестве нервные волокна, изредка нервные клетки, но картина получается неотчетливая.
Разбор серии срезов (рис. 289). После изучения гистологии следует просмотреть все срезы серии поперечных разрезов и проследить на них отдельные системы органов. Начинать просмотр следует со срезов, сделанных через передний конец тела. На первых срезах видна ротовая присоска (рис. 289,Л). В толще ее стенки хорошо видны радиальные мускульные волокна, переплетенные кольцевыми. В паренхиме вокруг ротовой присоски разбросаны в большом количестве так называемые головные кожные железы. При окраске по Маллори содержимое их окрашивается в ярко-красный цвет. Тут же появляются и первые жел-гочники (рис. 289, Б).
Вслед за ротовой присоской на срезах идет praepharynx (рис. 289, Б), сменяющийся далее мускулистой глоткой также со сложной системой мышечных волокон в ее стенках и с железистыми клетками между ними (рис. 289, В). Вокруг глотки в паренхиме желточники видны уже в большом числе. Каждый из них представлен кучкой желточных клеток с темноокрашенной цитоплазмой.
На следующих срезах виден пищевод. Изнутри он выстлан тонкой пластинкой так же, как и ротовая полость, praepharynx и глотка (рис. 289, Г). Пищевод на срезе занимает спинное положение. Далее пищевод раздваивается и стенки обоих ответвлений кишки покрываются однослойным цилиндрическим эпителием с цитоплазматическими нитевидными отростками, выдающимися в просвет кишки (рис. 289, Д). Под эпителием можно заметить тонкие мышечные продольные и кольцевые волоконца, образующие мускульную оболочку кишки.
Сразу же вслед за раздвоением кишечника, вентрально от него появляется в разрезе сумка цирруса. Стенки ее толстые, мускулистые (рис. 289, £), внутри виден просвет семяизвергательного канала и части комплекса простатических желез. На срезах следует найти наружное половое отверстие, через которое нередко высовывается наружу циррус (рис. 289, £). К этому же отверстию подходит и концевой отдел матки — метратерм с кольцевыми мышцами в стенках.
На дальнейших срезах появляется брюшная присоска (рис. 289,Ж), перерезанное основание мешка цирруса видно около спинной стороны среза и в нем семенной пузырь, обычно наполненный спермой. Появляется матка, набитая яйцами (перерезанная во многих
Рис. 289. Dolichosaccus rastellus. Серия поперечных разрезов (Х80) (ориг.): А—разрез в области пищевода; Д — в месте раздвоения пищевода; Е — разрез через половое К — в области семенника; Л — позади семенников; М — разрез позади окончания ки-/ — железистые клетки, 2— ротовая присоска, 3— предглотка, 4— желточники, 5 — глотка, 6 — отверстие, 10—брюшная присоска, 11 — метратер-м, 12 — яичник, 13 — яйцевод, 14— матка, 15^» ров канал, 13 — семенник
в области ротовой присоски; Б — в области предглотки; В — в области глотки; Г — отверстие; Ж — в области брюшной присоски; 3 — через яичник; И — позади яичника; шечника:
пищевод, 7 — кишечник, 8 — семенной пузырь внутри цирруса, 9— циррус, выпяченный через половое боковые передние ответвления мочевого пузыря, 16 — непарный отдел мочевого пузыря, 17 •• Лауре-
Рис. 290. Dolichosaccus rastellus. Сагиттальный разрез по медианной линии (Х35) (ориг.):
1 — ротовая присоска, 2 — предглотка, 3 — глотка, 4 — пищевод, 5 — метратерм, 6 — семенной пузырь копулятивного органа, 7 — Лауреров канал, 3 —кишечник, 9 — желточники, 10 — мочевой пузырь, 11— семенники, 12 — матка, 13— брюшиая присоска, 14—циррус, высунувшийся через половое отверстие, 15 — ротовое отверстие
местах — рис. 289,Ж). Желточники на срезах этой области попадаются единично на периферии среза.
На срезах далее кзади появляется яичник, исчезает мешок цирруса и становятся заметными два разветвления концевого пузыря выделительной системы (рис. 289, 3). В яичнике — стадии овогенеза и созревшие яйца. Около тонких стенок выделительного пузыря изнутри концентрируются гранулы темного пигмента, благодаря чему выделительная система очень отчетливо видна на срезе. Следует отыскать и оба семяпровода в виде очень тонких канальцев, проходящих по срезам.
Далее видны отходящий от яичника яйцевод (рис. 289,3) и Лауреров канал в виде тонкой извитой трубочки, надо проследить весь его ход до поры на спинной стороне тела. Тут же видны желточные протоки и можно найти и оотип со скорлуповыми железами. В этой области еще много перерезанных изгибов матки и, наконец, можно заметить, как обе ветви выделительного пузыря сливаются в непарный отдел, прилегающий на дальнейших срезах к спинному их краю (рис. 289, И, К)- Количество желточников начинает увеличиваться, зато уменьшается количество перерезанных изгибов матки и появляются на срезах семенники, сначала передний — левый, затем оба, наконец, остается опять один, но правый (рис. 289, К). Параллельно на всех этих срезах идут разрезы через обе ветви кишечника. Заканчиваются они уже довольно далеко вслед за семенниками (рис. 289, Л), и на последних срезах видны только непарный отдел выделительного пузыря (рис. 289, А!) и желточники.
При разборе поперечной серии полезно зарисовать 10—15 срезов из серии, расположив их на листе бумаги в определенной последовательности. Такие рисунки следует схематизировать, не вырисовывая, например, паренхимы и обозначая один и тот же орган каким-нибудь определенным цветом. Тогда при взгляде на всю серию рисунков легко представить себе картину изменений того или иного органа. Так же
следует просмотреть и сагиттальную серию, разобраться в которой не представит затруднений после изучения поперечной серии (рис. 290).
По серии фронтальных срезов (один из них см. на рис. 291) следует изготовить графическую реконструкцию главнейших систем органов пищеварительной, выделительной и половой. Для этой цели придется просмотреть всю серию, проследить по ней органы и нарисовать с рисовальным аппаратом все срезы при одном и том же увеличении. Далее поступать так, как это указано в главе о графической реконструкции (с. 46 — графическая изоляция по Кащенко). Окончательно реконструкция должна быть сведена на чистую бумагу и на ней разные органы могут быть закрашены условными цветами.
Fasciola hepatica (L.) — печеночная двуустка
Материал и методы изучения. Fasciola hepatica принадлежит к сем. Fas-ciolopsidae Odhner (Fasciolinae Looss) отр. Prosostomata Odhner. Паразитирует в желчных протоках печени крупного и мелкого рогатого скота. С бойнн привозят фасциолезную печень, выбракованную ветеринарным контролем. Места
Рис. 291. Dolichosaccus rastellus. Фронтальный разрез (X 50) (ориг.):
1 — ротовая присоска, 2 — предглотка, 3 — глотка, 4 — желточники, 5 — метратерм, 6 — кишечник, 7—матка, 5— мочевой пузырь, 9—семенник, 10— семяпровод, 11 — яичник, 12 — сумка цирруса с семяизвергательным каналом и семенным пузырем внутри
присутствия паразитов заметны уже при внешнем осмотре печени — желчные ходы вздуты, их стенки утолщены, обызвествлены. Разрезая осторожно ножницами такие ходы вдоль, всегда удается найти живых паразитов. Изучение ведут как in vivo, так и на окрашенных препаратах либо по Блажину (с. 33), либо просто квасцовым кармином, хотя бы после спиртовой фиксации. При изготовлении препаратов объект следует значительно сдавить (сплющить) между предметными стеклами и в таком поло-
жении дать ему уплотниться в спирте.
Изучение анатомии достаточно провести на тотальных препаратах, хотя, если позволит время, можно изготовить и срезы.
Внешняя морфология. Тело F. hepatica листовидной формы, равномерно суживаётся назад и наиболее широко в передней трети (рис. 292). Передний конец тела резко суживается и благодаря этому обособляется заостренный «головной» конец. В длину паразит достигает в некоторых случаях нескольких сантиметров. Живой паразит может несколько изменять форму тела, слегка сокращаясь и вытягиваясь,
края могут становиться волнистыми. На брюшной стороне помещается брюшная присоска и открывается наружное половое отверстие. При
рассматривании живого паразита
Рис. 292. Fasciola hepatica. Общий вид пищеварительной и нервной систем с брюшной стороны (Х8) (из кн.
Зоммера):
1— рот, 2 — глотка, 3 — пищевод, 4 — брюшная присоска, 5— главная ветвь кишки, 6 — скорлуповые железы, 7 — боковые ветви кишки, 8 — брюшной нервный ствол, 9 — подглоточная комиссура, 10 — боковые
нервы, 11 — мозг
з глаза бросаются красно-коричневые боковые поля и желтая (зеленовато-желтая) срединная зона.
На переднем конце тела расположена небольшая мускулистая ротовая присоска (в диаметре меньше 1 мм), ограничивающая ротовую полость. Ротовое отверстие открывается наружу, не строго терминально, а смещено слегка вентрально (рис. 293). Позади ротовой присоски на уровне заднего края «головного сужения» медианно на брюшной стороне лежит брюшная присоска также небольших размеров, но несколько крупнее ротовой (в диаметре больше 1 мм).
На заднем конце открывается терминально выделительная пора (рис. 294). Половое отверстие лежит кпереди от брюшной присоски. Наконец, на спинной стороне тела, назад от уровня брюшной присоски, открывается наружу тончайший Лауреров каналец. Его можно, однако, рассмотреть только на серии срезов в области половой системы. Покровы паразита вооружены мелкими шипиками, но самый задний конец тела этих шипиков лишен.
Анатомия. Пищеварительная система начинается ротовой присоской, ограничивающей ротовую полость. Вслед за ней идет небольшой отдел — предглотка (praepharynx), отделенный от ротовой полости дорзальной полулунной складкой (см. рис. 293). Сама глотка обладает относительно узким просветом и мускулистыми стенками. Она вытянута в длину, веретеновидной формы и обычно выдается своим передним концом в пред-глотку. В стенках глотки — сложная система мускулатуры. На периферии расположен сначала слой меридиональных волокон, далее кольце
вых, оба развиты незначительно. Большая же часть стенки глотки занята радиальными волокнами (см. рис. 293). К их слою внутри прилегает тонкий слой кольцевых мышц. Разобрать детально структуру глотки можно только на срезах.
И предглотка, и глотка функционируют в качестве своеобразного
глотательного или всасывающего пищу аппарата (Зоммер). Для понимания функций всей этой системы следует добавить описание специальных мышц, двигающих глотку вперед и назад. Мускул-протрактор глотки одевает предглотку и глотку снаружи мешком. Продольные мышечные волокна при этом прикрепляются своими концами к заднему краю глотки, а другими к ротовой присоске (рис. 295). Ретрактор глотки занимает спин
Рис. 294, Fasciola hepatica. Общий вид выделительной системы с брюшной стороны (Х8) (из кн. Зоммера):
1 — ротовое отверстие, 2— вентральные передние выделительные каналы, 3 — желточные протоки, 4 — главный ствол выделительной системы, 5 — боковые каналы, 6 — тончайшие выделительные канальцы, 7 — выделительное отверстие, 8 — дорзальный передний канал
Рис. 293. Fasciola hepatica. Продольный сагиттальный разрез через передний конец тела (Х200) (из кн. Зоммера):
1 — ротовая присоска, 2 — полулунная складка, 3 — надглоточная комиссура, 4 — глотка, 5 — ретрактор глотки, 6 — пищевод, 7 — подглоточная комиссура, 8 — предглотка
ное положение и проходит косо в виде пучка мышечных волокон от стенки глотки к кожно-мускульному мешку (см. рис. 293). Первый акт принятия пищи и передачи ее дальше в кишечник совершается путем сокращения ретрактора глотки. Тогда ее передний конец смещается назад, полость предглотки увеличивается главным образом за счет расправления полулунной складки и наполняется порцией пищи— желчью из желчного протока. Вслед за этим сокращается ротовая присоска, замыкая отверстие в предглотку, и пища из последней уже не может вытечь обратно. Тогда сокращаются радиальные волокна глотки, ее полость резко увеличивается в объеме и сокращением протракторов глотка смещается вперед. В результате пища выжимается в полость глотки. Далее расслабляются радиальные волокна, действием кольцевых мышц просвет глотки резко сужается и, поскольку ротовая присоска все еще сомкнута, пища может попасть только в кишечник. Частое повторение вышеописанного процесса ведет к наполнению кишечника пищей. Такой механизм функционирования глотки вероятен и для других сосальщиков (в частности, для описанного выше Dolichosaccus') .
Вслед за глоткой идет очень короткий пищевод, раздваивающийся впереди от брюшной присоски. Ротовая полость, предглотка, глотка и пищевод выстланы цитоплазматической пластинкой, что хорошо за-
Рис. 295. Fasciola hepatica. Фронтальный разрез переднего конца тела (х200) (из кн. Зоммера):
1 — присоска, 2 — полулунная складка, 3 — протрактор глотки, 4 — глотка, 5 — пищевод, 6 — кишка, 7 — брюшной нервный ствол, 8 — подглоточная комиссура, 9 — боковой нерв, 10 — левое окологлоточное ганглиозное скопление, 11 — передний нерв
метно и in vivo при сильном сдавливании червя. Две главные ветви кишечника тянутся вдоль средней линии тела до заднего его конца. В области брюшной присоски и следующего за ней комплекса выводных путей половых желез обе ветви несколько расходятся, но в задних 2/з тела они сближены (см. рис. 292).
От этих главных ветвей кишечника к периферии отходят обычно 16—17 (бывает и больше) боковых ответвлений, которые в свою очередь разветвляются и образуют сложную, сильно варьирующую, с большой поверхностью пищеварительную систему.
Все мельчайшие разветвления пищеварительной системы удается хорошо рассмотреть и на обычных тотальных препаратах (хотя этому частично мешают желточники), но лучше всего они видны на объекте, инъецированном раствором берлинской лазури, через ротовое отверстие. Перед инъекцией легким надавливанием и поглаживанием паразита следует опорожнить его кишечник через рот. Содержимое кишечника состоит из желчи. Зоммер находил в нем эритроцитов животного-хозяина, но Мюллер на основании собственных наблюдений категорически высказывается против присутствия крови в кишечнике печеночной двуустки.
Наблюдая за поведением двуустки в холодной воде, можно легко убедиться в наличии в стенках ее кишечника мускулатуры. Пища' вследствие сокращения стенок кишки начинает извергаться наружу через ротовое отверстие.
Выделительная система. Главный срединный ствол выделительной системы (соответствующий мочевому пузырю других Тгеша-toda) хорошо виден на обычных тотальных препаратах и тянется вдоль тела. Главный канал — широкий вначале — по направлению назад утончается и наименьший поперечник имеет в области выделительного отверстия (см. рис. 294). Остальные элементы выделительной системы можно рассмотреть только на объекте, инъецированном берлинской лазурью. Для этого конец пипетки или тонкую иглу шприца вводят осторожно в выделительное отверстие, причем следует избегать повреждений кишечника, иначе инъецироваться будут и его ветви.
Главный ствол лежит между главными ветвями кишечника и приближен к дорзальной стенке тела. От этого ствола в большом количестве отходят отростки, ветвящиеся в свою очередь многократно и сильно анастомозирующие друг с другом. Образуется сеть выделительных сосудов главным образом в' пределах срединной зоны тела, в дорзальной ее части над кишкой. В область периферической зоны от этой сети отходят тончайшие выделительные канальцы. Вперед от главного выделительного ствола отходят четыре боковых канала — два дорзальных и чдва вентральных, собирающих экскреты из передней части тела (см. рис. 294).
Нервная система. На препаратах удается рассмотреть и некоторые элементы нервной системы (правда, их лучше обнаружить на срезах). Легче всего рассмотреть центральную ее часть на переднем конце тела. Здесь два больших окологлоточных ганглиозных скопления соединяются друг с другом короткой толстой надглоточной комиссурой и тонкой, более длинной, подглоточной (рис. 295), благодаря чему об-
Рис. 296. Fasciola hepatica. Общий вид половой системы с брюшной стороны - (Х5) (из кн. Зоммера):
1 —- ротовая присоска, 2 — глотка, 3 — пищевод, 4—наружное половое отверстие, 5 — кишечник, 6 — копулятивный орган, 7 — брюшная присоска, 8 — матка, 9 — яичник, 10 — семяпровод заднего семенника, 11 — главные продольные желточные каналы, 12 — задний семенник, 13— желточные фолликулы с отходящими от них желточными канальцами, 14 — передний семенник, 15 — семяпровод, 16 —- комплекс скорлуповых желез, 17 — поперечный желточный проток, 18 — метратерм
разуется окологлоточное нервное кольцо. От ганглиозных скоплений отходят четыре пары стволов. Одна пара идет вперед к ротовой присоске; назад идут две пары тонких боковых нервов и одна пара мощных основных брюшных стволов. Последние тянутся вдоль всего тела вблизи кожно-мускульного мешка.
Мужская половая систе-м а. Два семенника располагаются один впереди другого. Каждый из них представляет собой трубчатую сильно разветвленную железу (рис. 296) из 3—4 главных ветвей, сходящихся к началу семяпровода. У переднего семенника это место расположено влево от медианной линии, у заднего — вправо от нее или почти на ней. Разветвления обоих семенников занимают все срединное поле тела паразита. Спереди ветви семенника доходят до поперечных желточных каналов, с боков они не заходят в пределы желточных полей и сзади заканчиваются, не доходя
До конца тела. Все разветвления семенников занимают вентральное положение по отношению к кишечнику и заканчиваются слепо, утолщаясь слегка на концах и не анастомозируя друг с другом.
Семяпроводы тянутся рядом, и левый из них, принадлежащий переднему семеннику, естественно, короче правого, идущего от заднего. В области брюшной присоски они сливаются вместе и входят внутрь сумки цирруса, где образуется расширение — семенной пузырь, наполненный зрелой спермой. Впереди семенной пузырь сужается и переходит в семяизвергательный канал. Начало его извивается и в него впадают многочисленные простатические железы (рис. 297), конец же окружен мускулатурой и образует цир-рус. В ввороченном состоянии стен-
ки цирруса морщинисты (рис. 297,Л). Нередко он виден и в вывороченном состоянии (рис. 297, Б). Мужское половое отверстие расположено
на конце цирруса и при ввороченном состоянии последнего открывается в небольшую половую клоаку. Выворачивание цирруса происходит в ре-
зультате сокращения мускулатуры стенок его мешка.
Женская половая система. Единственный яичник распо-
1
А
ложен в передней трети тела, впереди от по-перечных желточных каналов. Лежит он асимметрично с правой стороны тела, вентрально от кишечника. Это трубчатая железа с сильно ветвящимися двумя основными подразделениями. Ответвления второго и даже третьего порядка заканчиваются слепо. Внутри трубок яичника находятся клетки на различных стадиях овогенеза.
Яйцевод от яичника подходит к медианной линии тела, принимает в себя тонкий непарный желточный проток и после этого в него впадают многочисленные скорлупо-вые железы, образующие на тотальных препаратах шарообразное скопление (тельце
Рис. 297. Fasciola hepatica. Дистальные отделы выводных путей половой системы (Х60). А—цир-рус впячен внутрь сумки цирруса; Б — циррус вывернут через половое отверстие (из кн. Зоммера):
1 — мужское половое отверг стие, 2 — циррус, 3 — семяизвергательный канал, 4 — семенной пузырь, 5 — брюшная присоска, 6 — семяпроводы, 7 — метратерм, 8 — простатические железы, 9 — женское половое отверстие,
10 — половая клоака
Рис. 298. Fasciola hepatica. Проксимальный отдел выводных путей женской половой системы с брюшной стороны (X 150) (из кн. Зоммера):
I — яичник, 2 — яйцевод, 3 — семяпровод заднего семенника, 4 — скорлупоВые железы, 5 — желточный резервуар, 6 — поперечный желточный проток, 7 — непарный желточный проток, 6 = Лауреров канал, 9 — семяпровод переднего семенника, 10— матка
Мелиса, рис. 298). Специальное расширение яйцевода в этой области (оотип) у F. hepatica отсутствует так же, как и семяприемник. После впадения скорлуповых желез яйцевод принимает короткий тонкий Лау-реров канал и расширяется, превращаясь в матку. Извивы последней идут вперед, в области брюшной присоски она становится тоньше, подходит к сумке цирруса и открывается рядом с мужским половым отверстием в половую клоаку (см. рис. 297, А, 9). У взрослого червя матка набита зрелыми сложными яйцами.
Желточники у F. hepatica развиты очень сильно. Их фолликулы занимают всю толщу паренхимы боковых полей по всей длине тела. На заднем конце они обычно разделяются на правую и левую половины проходящим здесь главным каналом выделительной системы. Отходящие от фолликулов желточные канальцы впадают в главные продольные желточные протоки, нередко хорошо заметные на препаратах благодаря темноокрашивающемуся желточному содержимому. В передней четверти тела от продольных каналов отходят короткие (правые и левые) поперечные желточные протоки, занимающие вентральное положение, которые сливаются вместе и образуют желточный резервуар. От последнего короткий непарный проток идет на соединение с яйцеводом (рис. 298). Желточные клетки обычно набивают все эти каналы, отчего они хорошо могут быть рассмотрены.
Рис. 299. Сложное яйцо Fasciola hepatica (Х500) (из кн. Зоммера) :
1 — крышечка, 2 — яйцевая клетка, 5 — желточные клетки
Некоторые стадии жизненного цикла сосальщиков
Из матки любого сосальщика, хотя бы Fasciola hepatica, следует выделить сложные яйца и рассмотреть их при большом увеличении микроскопа, используя иммерсионную систему. Яйцевая скорлупка толстая, двухконтурная, коричневатого цвета, утолщенная на одном из полюсов. На противоположном полюсе видна маленькая крышечка с зазубренными краями (рис. 299). Внутри находится кучка из нескольких десятков желточных клеток с одной яйцевой между ними. Последняя отличается своей прозрачной цитоплазмой.
Мирацидий. Получение матери а-л а. Развитие мирацидия можно наблюдать в яйцах Fasciola hepatica, выдавленных из матки (или выделенных из нее после крестообразного разреза передней части тела). Яйца промывают в воде при помощи центрифуги и помещают в прудовую или речную (не водопроводную) воду в термостате при температуре в 28—ЗО°С. При этой температуре на развитие зародыша требуется около 14 дней. Развитие идет лучше в темноте.
Вылупление же мирацидиев происходит только на свету. Поэтому после указанного срока сосуд с яйцами выставляют на свет, и тогда начинается массовое вылупление зародышей прямо на глазах наблюдателя. При постановке опыта следует помнить, что для развития требуется кислород, поэтому необходимо изредка менять воду. Для вылупления мирацидиев имеет значение активная реакция среды — выход личинок в пределах pH равном 5,0—7,5 (по Скворцову). При вылуплении мирацидиев сначала открывается крышечка яйца и уже после этого в образовавшееся отверстие вылезает личинка. В воде мирацидии плавают? очень быстро, обладают резко выраженным положительным фототаксисом и могут жить после вылупления 1—2 суток. Рассматривать мирацидиев следует in vivo. Готовые препараты для изучения их морфологии дают очень мало.
Морфология. Мирацидий сильно вытянут в длину. Наиболее широк он в передней части и постепенно суживается кзади. Передний конец его слегка вдавлен и на нем выдается узкий хоботок (рис. 300). Поверхность мирацидия покрыта ресничными эпителиальными клетками, расположенными в 5 рядов. Между соседними клетками проходят сравнительно широкие полоски, лишенные ресничек, так что ресничный покров оказывается не сплошным, а разбитым на многоугольные поля, соответствующие отдельным клеткам эпителия. Эти полоски особенно хорошо видны после фиксации осмиевыми фиксаторами или после серебрения (см. с. 340). В переднем ряду эпителия — шесть мелких клеток, во втором — также шесть, чередующихся с первыми, и в третьем— три клетки: одна дорзальная и две вентральные; в четвертом — четыре клетки, лежащие симметрично по бокам, и в пятом — две клетки занимают латеральное положение (рис. 300, Б). Всего, следовательно, 21 полигональная клетка.
Из внутренних органов мирацидия удается рассмотреть ряд деталей именно in vivo. Бросается в глаза прежде всего двойной глазок темно-коричневого цвета в виде буквы X на переднем конце тела. В области глазка заметна нервная масса, в нее фактически и погружен глазок. Впереди от глазка видны две головные железы, открывающиеся на вершине хоботка и играющие существенную роль при проникновении личинок в моллюска. Терминально на хоботке открывается проток крупной апикальной железы (рис. 300, Л). Далее назад видны идущие вдоль боков тела два выделительных канальца. Они открываются наружу близ заднего конца мирацидия выделительными порами. Терминальные клетки с мерцательным пламенем обычно видны плохо. Во внутренней паренхиме обособляется половая полость, в которой видны зародышевые клетки (рис. 300, А, 11).
Партеногенетические поколения. Получение материала. Спороцист, редий и церкарий удобнее всего искать в наших пресноводных Gastropoda, в различных видах родов Lymnaea, Planorbis и др. У живого моллюска разбивают раковину и иглами вспарывают печень в капле воды. Контролировать следует под лупой и рассматривать различные стадии in vivo. Иногда хорошие результаты дает подкрашивание очень слабым раствором нейтрального красного, выявляющее более резко железистые образования,
I
Рис. 300. Мирацидий Fasciola hepatica. A—внутренняя организация; Б — расположение ресничных клеток (Х775) (из кн. Кое):
/ — сенсиллы, 2 — апикальная железа, •'/ —головные железы, 4 — глазки, 5 — субэпителиальный слой, 6 — мозг, 7 —ядра субэпителиального слоя, 8 — выделительная система, 5 —ядра эпителиальных клеток, 10 — границы между эпителиальными клетками, 11—зародышевые клетки, 12 — эпителиальные клет* ки, 13 — выделительные поры
Спороцисты. Они попадаются в моллюсках чаще редий. По форме это мешки, иногда вытянутые в длину (рис. 301,Л), внутри которых обычно из зародышевых шаров развиваются прямо церкарии. Особой структуры в стенках спороцисты заметить не удается, хотя и сохраняется пара выделительных канальцев и элементы нервной системы.
Реди и. Редии встречаются значительно реже. В пресноводных моллюсках чаще попадаются редии сосальщиков из сем. Echinostoma-tidae. Они имеют вытянутую форму и на одном конце терминально расположенное ротовое отверстие с мускулистой глоткой и иногда довольно длинным, неразветвленным, мешковидным кишечником. В задней части тела часто заметны два лопастных выроста (рис. 302). Внутри в полости располагаются зародышевые шары, формирующиеся в готовые
Рис. 301. Церкария Opisthioglyphe гапае. А — ее спороциста с церкариями; Б — церкария:
1 — стилет, 2 — ротовая присоска, 3 — протоки желез проникновения, 4 — предглотка, 5 — глотка, 6 — пищевод, 7 — железы проникновения, 8—брюшная присоска, 9 — кишечник, 10 — собирательный канал выделительной системы, 11 — мерцательные клетки, 12 — мочевой пузырь, 13 — цистогеиные железы, 14 — чувствительные волоски
Рис. 302. Редия сосальщика из сем. Echinosto-rnatidae из прудовика Lymnaea stagnalis (Х75) (из кн. Фурмана):
1 — глотка, 2 — кишечник, 3 — отверстие, через которое вылезают церкарии, 4 — jiq-пасти, 5—зародышевые клет* ки, б — церкарии
уже церкарии. Выходят наружу они через выводное отверстие в передней части тела. Протонефридиев обычно рассмотреть не удается, хотя
они и есть.
стилетные церкарии
Рис. 303. Метоцеркарии стилетной церкарии в личинке стрекозы Agrion. А — придавленная стеклом личинка, из полости тела которой высыпались метацеркарии (Х5); Б — метацеркария в цисте (X100) (из кн. Лут-та)
Церкарии. В пресноводных и морских моллюсках встречается большое число разнообразных церкарий, но наиболее распространены
;). Довольно часто попадаются церкарии Opisthioglyphe гапае (вида, очень близкого к рассмотренному выше Opisthioglyphe rastellus).
Внутреннее строение церкарий следует рассмотреть на живом материале, слегка подкрашенном нейтральротом. Для изучения выделительного аппарата желательно воспользоваться фазо-контрастным устройством микроскопа (см. рис. 301, Б).
Тело церкарии Opisthioglyphe гапае имеет овальные очертания. На заднем конце субтерминально к нему прикреплен хвост, служащий основным органом движения. Ротовая присоска расположена на переднем конце тела; она вооружена стилетом — заостренной кутикулярной палочкой, используемой при проникновении во второго промежуточного хозяина. Брюшная присоска лежит близ середины тела. Наружная цитоплазматическая пластинка погруженного эпителия церкарии вооружена мелкими шипиками.
Пищеварительная система начинается ртом, лежащим на дне ротовой присоски. За ротовой полостью следует шаровидная мускулистая глотка, от которой отходит узкий пищевод. Последний перед брюшной присоской соединяется с двумя ветвями кишки, доходящими до заднего конца тела. Протонефридиальная система представлена 18 парами терминальных клеток, которые узнаются по биению в них ресничек мерцательного пламени. От этих клеток отходят тонкие канальцы, сое
диняющиеся в толстые протоки, которые впадают в У-образный толстостенный мочевой пузырь в задней половине тела. Наружная пора мочевого пузыря лежит у основания хвоста. Имеется половой зачаток, но рассмотреть его на живых церкариях трудно. Хорошо заметны так называемые железы проникновения. Это две группы железистых клеток, лежащих ла-терально спереди от брюшной присоски. Плазма их зерниста, крупные ядра отчетливы. Два пучка желез открываются у основания стилета. Секрет желез, вероятно, разрушает ткани второго промежуточного хозяина при проникновении в него паразита. В задней части тела видны многочисленные цистогенные клетки, располагающиеся преимущественно на спинной стороне тела; нередко они маскируют остальные органы церкарии. Их секрет идет на построение стенки цисты.
Нервная система церкарии, слагающаяся из парного ганглия, лежащего впереди брюшной присоски, и продольных нервных стволов, может быть изучена на срезах. Многочисленные чувствительные волоски разбросаны по всему телу церкарии, на переднем конце тела они образуют скопление.
Метацеркарии. Некоторые виды стилетных церкарийлегко заставить инцистироваться и превратиться в метацеркарий. Для этого из печени моллюска выделяют церкарии в чашечку с водой, куда следует посадить несколько личинок водных насекомых (опыт хорошо удается с молодыми личинками стрекоз — Agrion, Lestes). Уже через полчаса после начала опыта церкарии начинают делать попытки проникнуть в личинку, отыскивая своим передним концом более удобное место для проникновения. Таким местом обычно является тонкий хитин в промежутках между сегментами. Работая стилетом, церкария проникает в полость тела второго промежуточного хозяина. Слабо связанный с телом церкарии хвост отбрасывается в момент проникновения и остается снаружи. Через сутки в полости тела личинки (после ее вскрытия) можно обнаружить много метацеркарий (рис. 303). Массовое проникновение церкарий в личинку часто приводит ее к гибели.
КЛАСС ASPIDOGASTRIDA — АСПИДОГАСТРИДЫ
Аспидогастриды — небольшая группа паразитических плоских червей—-долго причислялась к классу Trematoda. Однако ее представители резко отличаются от сосальщиков не только организацией, но и просто жизненным циклом, протекающим без чередования поколений, что издавна вызывало сомнения в родстве аспидогастр и трематод. Лишь недавно Aspidogastrida были выделены в самостоятельный класс (Тимофеева, 1975). Несколько десятков видов аспидогастрид паразитируют в моллюсках, рыбах и черепахах. Характерный представитель — Aspidogaster conchicola.
Aspidogaster conchicola Baer — аспидогастер
Материал и методы изучения. Aspidogaster conchicola принадлежит к сем. Aspi-dogastridae Poche. Живет в перикардиальной полости двустворчатых моллюсков р. Апо-donta, откуда можно добывать паразитов пипеткой или доставать просто кисточкой. Рассматривают прежде всего при падающем свете либо живой объект (в воде или в перикардиальной жидкости моллюска), либо фиксированный, но не заделанный в препарат и не окрашенный — специально для изучения структуры своеобразной брюшной присоски. Анатомию изучают на препаратах, окрашенных квасцовым кармином после любой фиксации (кроме осмиевых смесей). Главное внимание обращают на внешнюю морфологию.
Изучение морфологии. Живой Aspidogaster сильно метаболирует и может значительно вытягиваться в длину, достигая 3 мм. При этом особенно вытягивается передний конец тела, получается впечатление оттянутой шейки (рис. 304), сильно подвижной. На этом оттянутом: конце хорошо заметна воронкообразная ротовая полость, продолжаю-
Рис. 304. Aspidogaster conchicola. Общий вид живого -паразита с брюшной стороны (Х40)
(ориг.):
/ — ротовая полость, 2 — глотка, 3— кишечник, 4 — брюшная присоска.
Рис. 305. Aspidogaster conchicola. Половая система, вид со спинной стороны (Х35) (из кн. Станфорда):
1 — наружное половое отверстие, 2 — метратерм, 3 — семяизвергательный канал, 4— семяпровод, 5 —комплекс скорлуповых желез, 6 — оотип, 7 — непарный желточный-проток, 8 — семенник, 9—матка, 10 — Лау-реров канал, И — продольный желточный проток, 12 — поперечный желточный про* ток, 13 — яйцевод, 14 — яичник
щаяся в глотку со вздутыми мускулистыми стенками, далее переходящая в мешковидный, неразветвленный кишечник. Последний продолжается до заднего конца тела. Особой ротовой присоски нет.
Громадная, овальной формы плоская брюшная присоска занимает большую часть тела позади шейки (рис. 304). Продольными и поперечными перегородками она подразделяется на четыре продольных ряда ячеек — acetabula — по 20—30 шт. в каждом ряду. Acetabula срединных рядов имеют прямоугольную форму, краевые же закругляются на периферии. При этом ячейки располагаются и в правильные поперечные ряды.
На тотальном окрашенном препарате можно рассмотреть некоторые составные элементы половой системы. Единственный семенник овальной формы занимает медианное положение. Семяпровод идет от него вперед к копулятивному органу. Перед последним он вздувается, образуя семенной пузырь (рис. 305). Семяизвергательный канал открывается на конце цирруса, обычно ввернутого в сумку. Наружное половое отверстие расположено на вентральной стороне тела около переднего края брюшной присоски. Яичник лежит латерально справа посредине тела. Коленчатый яйцевод принимает Лауреров канал, который в противоположность трематодам не открывается наружу на спине и слепо замкнут. Далее в яйцевод впадает общий желточный проток, образующийся из двух поперечных протоков. После впадения желточного протока яйцевод расширяется и в него открываются скорлуповые железы. Далее после оотипа начинается матка, которая,извиваясь, идет сначала назад, потом вперед и открывается наружу общим отверстием с мужской половой системой. Матка заполнена зрелыми яйцами. Желточные фолликулы гроздьями расположены по бокам тела, и мелкие протоки их собираются в передние и задние продольные парные желточные каналы. Они в свою очередь идут поперек тела и сливаются в непарный впадающий в яйцевод проток. Обычно все эти протоки на тотальном препарате рассмотреть трудно, потому что над и под ними проходит маскирующая их матка, наполненная яйцами.
КЛАСС MONOGENEA- МОНОГЕНЕИ
Для разбора морфологии моногеней и изготовления серий срезов рекомендуется использовать одного из крупных (правда, менее типичного) паразитов мочевого пузыря лягушки — Polystoma. С разнообразием представителей этого класса следует ознакомиться на примере некоторых форм паразитирующих на жабрах рыб.
Polystoma integerrimum (Froelich) Rud.—многоустка
Материал и методы изучения. Polystoma integerrimum относится к сем. Polystoma-tidae подотр. Polyopisthocotylinae отр. Gyrodactyloidae (по Быховскому, 1937). Паразитируют во взрослом состоянии в мочевом пузыре лягушек (Rana temporaria R. аг-vatis) и жаб (Bufo viridis'). Наибольший процент заражения приходится на долю молодых лягушек, поэтому в поисках Polystoma не следует вскрывать очень крупных животных. Находить паразита не представляет никаких затруднений: благодаря крупным размерам он хорошо виден сквозь прозрачные стенки мочевого пузыря. Polystoma
рассматривают in vivo на окрашенных тотальных препаратах и изучают на сериях поперечных и продольных разрезов через него. Для срезов материал лучше фиксировать жидкостью Ценкера с формалином, срезы окрашивают гематоксилином, в том числе и железным. Толщина срезов для серий— 10 мкм, а для гистологии лучше брать более тонкие — 7,5 или даже 5 мкм. Для изготовления тотальных препаратов следует живого паразита слегка приплюснуть покровным стеклом, под которое сбоку прибавить крепкий спирт. Без такого предварительного придавливания получаются слишком толстые и непрозрачные препараты. Через некоторое "время (0,5—1 ч) стекло снимают с паразита, слегка подкрашенного квасцовым кармином, заделывают в препарат.
Рис. 306. Polystoma integerrimum. Общий внд червя с брюшной стороны (Х15) (ориг.):
1— ротовая присоска, 2— глотка, 3— наружное половое отверстие, 4 — влагалище, 5 — семяпровод, 6 — матка, 7 — поперечный желточный канал, 8 — кишечно-половой канал, 9 — желточники, 10 — кишечник, 11 — присоски прикрепительного диска, 12 — большие крючки прикрепительного диска,
13 — яйцевод, 14 — янчник
Внешняя морфология. Живой паразит способен сильно менять свою форму (метаболирует)—то вытягивается в виде узкой ленты, то сжимается, и тогда передний конец остается узким, а задний становится расширенным, отчего тело принимает треугольную форму (рис. 306). В вытянутом состоянии крупные Р. integerrimum достигают 1 см и даже более. На переднем конце тела субтерминально помещается ротовое отверстие, задний же конец продолжается в прикрепительный диск. Морфологию последнего лучше изучить на живом экземпляре. Прежде всего у взрослого паразита бросаются в глаза шесть присосок, расположенных попарно. Каждая из них правильной округлой формы с высоким мускулистым валиком на периферии. Уже in vivo хорошо видна радиальная исчерченность валика, заметны радиальные мышечные волокна. Две передние пары присосок расставлены широко, задние же сближены. Присоски частично выдаются за пределы прикрепительного диска. Наряду с присосками паразит вооружен и серией крючьев. У взрослого паразита хорошо заметны два больших крючка, торчащих наружу между присосками задней пары (рис. 306). Наружу выдается незначительная часть крючка (рис. 307), большая же укореняется в паренхиме прикрепительного диска. Если живого паразита основательно придавить, то хорошо видно раздвоение проксимального конца базальной, расширяющейся назад части
крючка. Хорошо видны и продольные бороздки на этой части (рис. 307), в то время как выдающаяся наружу загнутая, заостренная часть — гладкая.
Кроме двух больших крючьев на диске находится еще 16 маленьких крючков, обнаружение которых более затруднительно. У взрослого паразита на сильно сплющенном живом экземпляре при большом увеличении микроскопа удается рассмотреть две пары крючков позади больших крючьев и по одному крючочку на дне каждой присоски (рис. 308). Три же пары крючочков между обеими передними присосками видны только на молодом экземпляре, у которого кишка еще не заходит в прикрепительный диск и не затемняет всей картины. У взрослого паразита эти крючки можно обнаружить лишь в исключительных случаях. Все эти крючочки одинаковой формы и размера и сохраняются у взрослого червя от личинки. Их малые размеры объясняются тем, что они при метаморфозе не растут. Каждый крючочек характерной формы, которая напоминает форму крючьев у личинок Cestodes (см. ниже о широком лен-теце). Острие крючочка просовывается наружу сквозь своеобразное колечко — ушко овальной формы (рис. 308, Б). Весь прикрепи
Рис. 307. Polystoma integer-rlmtirn. Большой крючок прикрепительного диска (Х200) (из кн. Целлера):
1 — базальная часть, 2 — выдаю-щаяся наружу часть
Рис. 308. Polystoma integerrimum. А — прикрепительный диск молодого экземпляра (Х200) (из Целлера); Б — мелкий крючок с ушком (Х800) (ориг.):
I — кишечник, 2 — передние мелкие крючки, 3— крючки на дне присосок, 4 — большой крючок, еще слабо развитый, 5 — задние мелкие крючки
тельный диск отделяется от остального тела легким пережимом (см. рис. 306).
Далее при внешнем осмотре Polystoma следует обратить внимание на наружное половое отверстие, находящееся сразу позади раздвоения кишечника. Несколько назад (приблизительно на расстоянии Vs длины тела от переднего конца) по бокам тела выдаются два бугорка — парные влагалища с многочисленными отверстиями на поверхности. Рядом с влагалищами открываются наружу главные стволы выделительной системы двумя порами, но увидеть их трудно. Наконец, по бокам просвечивающей позади рта мускулистой глотки можно различать две пары черных глаз. Передние мельче задних.
Рис. 309. Polystoma integerrimum. Общий вид переднего конца взрослого экземпляра со спинной стороны (Х250) (из кн. Целлера) :
1 — кожные железы, 2 — ротовое отверстие, 3 — выделительный канал, 4 — глотка, 5 — слюнные железы, 6 — выделительная пора, 7 — бугорок влагалища с порами в каналами, 8 — кишечник, 9 — яичник, 10 — глаза
Анатомия. К и ш е чн и к. Прекрасно виден кишечник как in vivo, так и на тотальных окрашенных препаратах. Широкое ротовое отверстие ведет в ротовую полость и далее в мускулистую грушевидной фор-мы глотку. In vivo хорошо видны многочисленные железы, своими протоками впадающие в просвет глотки, которые условно называют «слюнными» (рис. 309). Вслед за глоткой кишечник раздваивается. Обе главные его ветви идут вдоль краев тела и отдают от себя многочисленные ответвления как наружу, так и внутрь. Последние анастомозируют друг с другом и получается сетевидная пищеварительная система (см. рис. 306). На заднем конце тела обе ветви кишечника соединяются и отдают после соединения ветви в прикрепительный диск. Весь кишечник наполнен темной (почти черной) массой всосанной паразитом крови лягушки и поэтому прекрасно виден.
Выделительной и нервной системы тотально обычно рассмотреть не удается — они заслоняются кишечником и желточни-ками.
Мужская половая система. Семенник у Poly stoma занимает срединное поле в теле, ограниченное с боков продольными ветвями кишечника, спереди женской половой системой, сзади прикрепительным диском. Семенник сильно изрезан, разбит на лопасти и смещен вентрально, что особенно хорошо видно на срезах. На тотальных же препаратах семенник не заметен, так как его закрывают малопрозрачные желточники.
Семяпровод начинается на уровне переднего анастомоза кишки и, слегка извиваясь, тянется вперед к половому отверстию. Конец семяпровода—семяизвергательный канал проходит внутри мускулистого копулятивного органа — пениса. На конце последнего in vivo и на срезах (см. ниже) хорошо видно вооружение в виде кроны из восьми крючочков (рис. 310). Все вооружение образует конус, вершина которого высовывается в половую клоаку.
Женская половая система. Яичник лежит в передней трети тела в области впереди от первого поперечного анастомоза
Рис. 310. Polystoma integerrimum. Вооружение пениса. А — продольный разрез пениса (Х650) (ориг.); Б — крона крючков (х800) (из кн. Целлера):
1 — семяизвергательный канал, 2 — мускулатура пениса, 3 — крючки, 4 — половая клоака
кишечника. Яичник вытянут в длину, суживается на обоих концах, и яйцевод выходит из него сзади. Спереди конец яичника загибается медианно. Положение яичника асимметричное: то с левой стороны (чаще), то с правой (см. рис. 306). Короткий яйцевод идет назад, соединяется с обоими подходящими сюда желточными протоками и отдает от себя кишечно-половой канал (canalis genito-intestinalis), через который протоки женской половой системы сообщаются с кишечником и по которому
Рис. 311. Polysioma integerrimum. (ориг.) Серия поперечных разрезов через взрослого червя (XI10). А—разрез в области ротовой полости; Б — в области глотки; В — в области влагалища; Г — в области яичника; Д— в области кишечно-полового канала;
1 — радиальные мышечные волокна, 2 — ротовая полость, 3 — надглоточная комиссура, 4 — глотка, вод, 11 — яичник, 12 — яйцевод, /3 —семенник, 14 — скорлуповые железы, /5 — кишечно-половой 18 — пучок мышечных волокон, прикрепляющихся ко дну присоски
в кишечник' выводятся излишние желточные клетки и снертодизовда. Далее яйцевод загибается вперед, принимает протоки многочисленных скорлуповых желез и переходит в резкое расширение — матку, сильно извилистый канал, содержащий сложные яйца только весной в период кладки. Матка открывается в половую клоаку рядом с мужским половым отверстием.
Е — разрез посредине тела; Ж — разрез через прикрепительный диск в области задних присосок:
5 — кишечник, 6 — желточники, 7 — влагалищный проток, 8 — влагалище, 9 — матка, 10 — семяпро-канал, 16 — полость присоски, 17 — базальные части больших крючков прикрепительного диска,
Желточные фолликулы у взрослого червя развиты чрезвычай сильно и заполняют все промежутки между ветвями кишечника и ( менником, вытесняя в значительной степени паренхиму. Их нет толь на самом переднем конце тела и в области расположения яичника половых протоков. Два передних и два задних боковых желточнг протока соединяются вместе позади яичника и в виде двух поперечит каналов подходят к яйцеводу. Передние протоки принимают в себя к налы правого и левого влагалища, начинающиеся по бокам тела i специальных бугорках. Эти бугорки имеют многочисленные поры, ( них отходят от каждой тончайшие канальцы, сливающиеся далее один общий вагинальный проток, вздутый посредине и обычно перепо. ненный спермой.
На тотальных препаратах многие элементы половой системы ра< смотреть трудно. Их можно разобр'ать на серии поперечных разрезо)
Изучение срезов. Гистология. Покровы на поверхности тел очень тонки. Контур их не гладкий, а образуются многочисленные выпя чивания, в которые входит подлежащий слой !. По всей поверхност образуются многочисленные, правильно расположенные валики. Коль цевые мышцы прилегают очень близко к поверхности. За ними в одш слой расположены продольные мышечные волокна. И те и другие за легают в паренхиме, которая на срезах представлена очень слабо, вы тесняясь, как было указано выше, желточниками. Только на разрезав через переднюю часть тела видна структура паренхимы — клетки рых лой ткани, неправильной формы, с отростками. Между ними здесь пробегают волокна дорзовентральных 'мышц, попадающиеся на остальных срезах только изредка.
Разбор серии поперечных срезов (рис. 311). Изучение следует начать с разрезов через передний конец тела. На срезах видна перерезанная поперек ротовая полость. В паренхиме, ее окружающей, видны многочисленные радиальные мышечные волокна (рис. 311,Д) — на долю ротовой полости, вероятно, падает и роль присоски. Далее назад в разрез попадает глотка (рис. 311, Б). В ее толстой стенке следует разобрать наружный слой продольных мышц, за ним слой кольцевых (и тот и другой тонкие). Вся же основная масса стенки пронизана большим количеством радиальных мышечных волокон. Между ними иногда встречаются крупные ядра. Изнутри в стенах глотки также есть кольцевые и продольные мышцы. Последние занимают самое внутреннее положение. На разрезах через глотку в задней части стенка ее прерывается с боков и в перерывы устремляются протоки многочисленных «слюнных» одноклеточных желез (см. рис. 309). В паренхиме вокруг глотки следует также рассмотреть элементы нервной системы, выделяющиеся своей волокнистой структурой и окрашенные слабее окружающей их паренхимы. Можно проследить надглоточные ганглии, связанные надглоточной комиссурой, и некоторые нервы, отходящие от этих ганглиев. Наиболее толстые из них — пара задних брюш-
1 Как и у Trematoda, покровы и здесь представляют собой эпителиальную пластинку, связанную с телами клеток погруженного эпителия, которые расположены в паренхиме. Рассмотреть это можно лишь с помощью электронного микроскопа.
Рис. 312. Polystoma integerrimum. Реконструкция центральной нервной системы по серии срезов, вид со спинной стороны (Х250) (из кн. Андре):
1 — передние медианные нервы, спинной и брюшной, 2 — глаза, 3 — передний брюшной латеральный нерв, 4 — окологлоточное ганглиозное скопление, 5 — глотка, 6 — главные задние брюшные стволы, 7 — боковой задний нерв, 8 — кишечник, 9 — задний дорзальный нерв, 10 — надглоточная комиссура, 11 — ротовая полость
них также могут встретиться на срезах в области глотки. Разобраться в нервной системе Р. integerrimum на срезах поможет прилагаемый рис. 312.
На тех же срезах около глотки можно хорошо рассмотреть и глаза с характерной светопреломляющей линзочкой, замыкающей вход в пигментный бокал.
Наконец, на срезах с глоткой уже видны перерезанные, заходящие вперед ветви кишечника и желточные фолликулы. Первые с очень тонкой оболочкой и крупными клетками неправильной формы, битком набитыми темно-коричневой переваривающейся кровью лягушки, частично находящейся и в просвете кишечника. В желточниках находятся желточные клетки, набитые очень темноокрашивающимся желтком.
На срезах за глоткой видны также перерезанные ветви кишечника и желточные фолликулы. Следует найти наружное половое отверстие, половую клоаку и обратить внимание на копулятивный аппарат. От мускулистого пениса, почти правильной округлой формы, со слоем кольцевых мышц по периферии, в просвет половой клоаки выдается вооружение, отмеченное уже выше (см. рис. 310,Д).
На следующих срезах следует проследить отходящие от половой клоаки матку и семяпровод — первая занимает более вентральное положение по сравнению с семяпроводом. У осенних и зимних Polystoma яиц в матке нет. Семяпровод удается отличить главным образом по наличию в его просвете сперматозоидов. Большая же часть среза занята здесь желточниками с вкрапленными среди них ветвями кишечника. По мере просмотра срезов далее назад следует отметить боковые бугорки открывающихся наружу влагалищ (см. рис. 311, А, В). От многочисленных отверстий на поверхности бугорков отходят трубочки,которые в толще бугорка собираются в хорошо выраженные вла- 7 галищные протоки. Последние впадают в желточные каналы, что также можно проследить на срезах.
По мере продвижения назад матка сильно извивается, и на срезах, где уже появляется яичник (см. рис. 311, А, Г), она
перерезается обычно в нескольких местах. В яичнике ооциты конусооб разной формы, основаниями направлены к периферии, и их ядра поме щаются у оснований. Вблизи дорзальных краев срезов все время тянет ся семяпровод. Далее назад на срезах появляются многочисленны! крупные скорлуповые железы (двух типов, окрашивающиеся различно) впадающие в начальный отдел матки, и становится виден яйцевод, выходящий из яичника.
На срезах, сразу за яичником, перерезаются поперечные желточные протоки и кишечно-половой канал (canalis genito-intestinalis см. рис. 311, Б, Д'). Уже в этой области наряду с желточными фолликулами появляется и семенник — его доли и лопасти обычно переполнены зрелой спермой. Семенник вплотную прилегает к вентральным краям срезов. Срезы через середину тела показывают одно и то же: вся поверхность среза занята желточными фол
10
Рис. 313. Polystoma integerrimum. Личинка, онкомирацидий, вид с брюшной стороны (Х400) (из кн. Быховского):
/ — концевая ресничная клетка, 2— рот, 3 — ротовая полость, 4 — передний пояс ресничных клеток, 5 — глотка, 6 — кишечник, 7 — средний пояс ресничных клеток, 8 — прикрепительный диск, 9 — задний пояс ресничных клеток, 10 — личиночные крючки, 11 — глаза
ликулами и семенником, между которыми видны ветви кишечника и изредка пробегают дорзовентральные мышцы (см. рис. 311, Д Д).
Интересно рассмотреть срезы в области прикрепительного диска. Хорошо видна мускулатура валиков присосок, особенно бросаются в глаза радиальные и кольцевые волокна. Последние окружают основную массу радиальных волокон и со стороны полости присоски, ис ее периферии (см. рис. 311, Б, Ж). Дно присоски связано тонким пучком мышц с противоположной (дорзальной) стенкой присасывательного диска (см. рис. 311, Б, Ж). Если разобрать срезы области задней пары присосок, то видны перерезанные поперек большие главные крючья (см. рис. 311, Б, Ж). В паренхиме присасывательного диска опять те же желточные фолликулы и небольшое количествоперерезанных ветвей кишечника.
Личинка. Получение материала.. Личинок Polystoma integerrimum . удается вывести ранней весной, когда у червей происходит яйцекладка, сопряженная с периодом спаривания лягушек, только что вышедших из-подо льда (под Ленинградом, это будет конец апреля — начало мая). Лягушек отсаживают поодиночке в полулитровые банки с небольшим количеством воды на дне. Достаточно поставить 5—10 банок, чтобы получить необходимое количество яиц Р. integerrimum. Через сутки выдерживания лягушек таким способом просматривают под лупой осадок в бан
ке, взятый пипеткой. При обнаружении яиц хотя бы в одной банке остальные можно ликвидировать, для изучения личинок будет вполне достаточно материала из одной лягушки. Яйца собирают в чистую воду в чашке Петри, и развитие личинок продолжается при комнатной температуре 2—3 недели. Вылупившиеся личинки вылавливают пипеткой, рассматривают in vivo, особенно же важно изготовить из них тотальные препараты, обработанные азотнокислым серебром, для детального рассмотрения ресничных образований. Для этого к капельке воды на предметном стекле с живыми личинками добавляют большее количество 3%-ного раствора AgNO3 на 3 мин. Далее следует промывка в дистиллированной воде, после чего объекты должны постоять 10—15 мин на дневном свету (на окне). Заключают личинок в глицерин-желатин.
Морфология. Личинка Р. integerrimum сравнительно крупна — в длину достигает 0,2 мм, и манипуляции с ней поэтому под лупой довольно просты. Тело личинки вытянуто в длину (рис. 313) и на заднем конце имеет прикрепительный диск округлой формы с 16 личиночными крючками. Ротовое отверстие расположено слегка отступя от переднего конца, оно ведет в узкую ротовую полость, заканчивающуюся мускулистой глоткой, от которой берет начало мешковидный кишечник с раздвоением посредине. По бокам глотки, впереди от нее, лежат две пары глаз, в точности соответствующие тому, что можно видеть у взрослой формы (у нее сохраняются именно личиночные глаза). Главное же внимание следует обратить на ресничные клетки. Одна занимает строго концевое положение на переднем конце. Далее на теле личинки клетки расположены в три ресничных пояса (рис. 313), каждый из двух рядов ресничных клеток. Один пояс расположен на уровне глотки, второй опоясывает тело за его срединой, а третий проходит в области прикрепительного диска, с его спинной стороны.
Diclybothrium armatum Leucart
Материал и методы изучения. Diclybothrium armatum относится к сем. Diclybot-hriidae подкл. Oligonchoinea (по Быховскому). Паразитирует на жабрах различных осетровых (стерляди, осетра, шипа, севрюги и др.) бассейнов Каспийского и Черного морей (Дунай), а также Амура и великих сибирских рек. Обычно встречается не больше 10—15 паразитов на одной рыбе, но иногда бывает до 80 экземпляров. Исследуются неокрашенный материал и тотальные препараты, окрашенные квасцовым кармином после спиртовой или лучше после сулемовой фиксации. Перед заделкой в препарат паразита полезно несколько сплющить.
Внешняя морфология. Тело этого крупного моногенетического сосальщика сильно вытянуто в длину, которая колеблется между 4 и 23 мм при наибольшей ширине в передней трети тела от 0,3 до 1,2 мм. Передний конец тела широко закруглен с двумя присасывательными бороздками, задние концы которых загнуты внутрь навстречу друг другу (рис. 314). Тело червя постепенно суживается кзади и заканчивается прикрепительным диском сердцевидной формы, расположенным на брюшной стороне и занимающим около l/io части общей длины тела (рис. 314). Расширенная часть диска несет три пары прикрепительных клапанов, позади которых выдается узкий придаток с четырьмя парами
различных категорий крючков (рис. 315). Каждый прикрепительный клапан составлен из двух поперечно расположенных мускулистых створок, сближением которых зашемляется жаберный лепесток и червь крепко фиксируется на нем. Возможность укрепления усиливается торчащими из передней створки каждого клапана загнутыми концами хитиноидных крючков (рис. 315, А), которых имеется три пары.
Придаток прикрепительного диска очень подвижен и сложен из двух массивных лопастей — передней и задней, занимающих брюшное положение. Под передней лопастью в глубине расположены в виде валиков два редуцированных клапана 'четвертой пары. В толще задней лопасти заключены три пары крючков — одна пара очень мелких (рис. 315, Б, 7), целиком погруженных в ткань и представляющих неизмененные краевые крючки личинок; вторая пара более крупных, прямых, острия которых выдаются из переднего края лопасти (рис. 315, Б, 6); третья пара, самые длинные из всех крючков, изогнутых дугой, и острия их выдаются наружу на заднем краю придатка (рис. 315, Б, 5); их передние концы тянутся далеко вперед и глубоко погружены в основание передней лопасти. В толще передней лопасти лежит еще одна пара из наиболее развитых крючков придатка. Они также сильно изогнуты, и их загнутые внутрь острия выдаются из заднего края передней лопасти (рис. 315, Б, 4).
Ротовое отверстие с небольшой ротовой воронкой расположено на брюшной стороне переднего конца тела. По бокам от него имеются две очень маленькие присоски. На
Рис. 314. Diclybothrium armatum. Общая организация. Вид с брюшной стороны (Х15) (из кн. Быхов-ского и Гусева):
/ — ротовое отверстие, 2 — ротовая присоска, 3—ротовая воронка, 4 — правая присасывательная бороздка, 5 — глотка, 6— боковые ответвления пищевода, 7 — кишечно-половой канал, <3—правая ветвь кишечника, 9 — непарный отдел кишечника, 10— прикрепительный диск, 11 — его придаток, 12—прикрепительные клапаны, 13—семенники, 14 — желточники, 15 — яичник, 16— общий ствол влагалищных протоков, 17 — семяпровод, 18 — матка, 19 — левое влагалище, 20 — левое влагалищное отверстие, 21 — внешний семенной пузырь, 22—мешок копулятивного органа, 23 — наружное половое отверстие
спине, на уровне задних концов присасывательных борозд, лежат две пары очень небольших коричневочерных глаз (передняя пара мельче). Единственное половое отверстие лежит на брюшной стороне позади уровня глаз. В передней же части тела на спину открываются два отверстия влагалищных протоков (см. рис. 314) и два отверстия выделительной системы впереди от влагалищных.
Анатомия. Пищеварительная система. Ротовая воронка тянется до уровня задних концов присасывательных борозд и заканчивается мускулистой глоткой овальной формы (см. рис. 314). Непарный отдел кишечника — пищевод отдает от себя боковые разветвления и раздваивается на уровне вагинальных отверстий. Обе ветви кишечника тянутся вдоль тела червя и, не дойдя до прикрепительного диска на Vs длины тела, сливаются воедино в непарный отдел, заходящий в область прикрепительного диска. Кишечные ветви образуют многочисленные боковые выпячивания, сильнее развитые с наружной стороны.
Выделительная система. Прослеживается плохо — более или менее удается заметить в задней части тела боковые продольные стволы, заходящие в область прикрепительного диска, где они сильно разветвляются и ана-
стомизируют друг с другом.
Нервная система. Состоит из мощного ганглиозного скопле-
Рис. 315. Diclybothrium armatum. А — прикрепительный диск, вид сбоку; Б — придаток прикрепительного диска, вид с брюшной стороны; В — концевой отдел мужской половой системы; Г — яйцо (из кн. Быхов-ского и Гусева):
1, 2, <3 — передняя, средняя и задняя пара прикрепительных клапанов с крючками, 4—крючок передней лопасти придатка прикрепительного диска, 5—крупный крючок задней лопасти придатка прикрепительного диска, 6 — маленький крючок задней лопасти прикрепительного диска, 7 — личиночный крючок, 8 — валик рудиментарной четвертой пары клапанов, 9 — половая клоака, 10— копулятивный орган, 11— семяизвергательный канал, 12 — внутренний семенной пузырь, 13 — стенка мешка копулятивного органа, 14 — спирально извитой канал, 15 — внешний семенной пузырь, 16 — семяпровод, 17 — крышечка яйца
ния впереди от глотки и над ней, от которого отходят продольные стволы, из которых наиболее сильно развиты два боковых, образующие сплетения в толщине прикрепительного диска. Глаза тесно прилегают со спинной стороны к ганглиозному скоплению.
Мужская половая система. Многочисленные округлые семенники (до 200) лежат между ветвями кишечника (см. рис. 314, 13) в два слоя — брюшной и спинной. Тонкий семяпровод вливается в объемистый внешний семенной пузырек округлой формы, с толстыми мускулистыми стенками, расположенный на уровне разветвлений кишечника. От семенного пузырька вперед отходит толстый, закрученный спиралью канал; он входит в толщу мешка копулятивного органа и заканчивается там внутренним семенным пузырем (рис. 315, В), окруженным простатическими железами. Семяизвергательный канал открывается на вершине способного вворачиваться копулятивного придатка (рис. 315, В), хитинизированного и покрытого продольными рядами многочисленных мелких шипиков. Копулятивный орган вдается в полость половой клоаки.
Женская половая система. Единственный яичник, трубковидный и извивающийся (см. рис. 314, 15), лежит впереди массы семенников и отдает вперед короткий яйцевод, в который последовательно впадают кишечно-половой проток (от правой ветви кишечника) и общий ствол влагалищных протоков. Последний раздваивается, образует два влагалища (см. рис. 314, 19), которые и открываются наружу на спинной поверхности тела двумя отверстиями, упомянутыми выше. Яйцевод далее заканчивается небольшим оотипом с многочисленными скорлуповыми железами. От оотипа вперед идет трубчатая матка, слабо извитая и содержащая не более 15—20 яиц одновременно. Матка открывается также в половую клоаку, которая половым отверстием сообщается с наружной средой. Яйца Diclybothrium овальной формы, с крышечкой (рис. 315,Г), но без всяких следов ножки, или филаментов. Желточников мало, расположены они сплошным слоем кнаружи от ветвей кишечника в промежутке между уровнем конца пищевода и начала непарного заднего отдела (см. рис. 314,74). Желточных протоков обнаружить не удается.
Dactylogyrus sp.
Материал и методы изучения. Виды р. Dactylogyrus относятся к сем. Dactylogy-rirae отр. Dactylogyridea подкл. Polyonchoinea. Очень мелкие формы, и их с трудом удается находить на жабрах карповых рыб. Для практикума лучше воспользоваться более крупными формами, в частности Dactylogyrus vastator Nybelin и D. solidus Ach-merov. Они прикрепляются к жабрам карасей и культурных пород карпов из рыбоводческих хозяйств. Из Dactylogyridae с промысловых рыб можно использовать более крупного D. sphyrna Linst. с плотвы, леща, густеры. Разыскивать паразитов приходится при малом и даже большом увеличении бинокуляра, просматривая жаберные лепестки. Последние придавливают слегка в капле воды покровным стеклом или сдавливают между двумя предметными. Рассматривать следует обязательно живой материал, так как тотальные препараты для изучения морфологии почти ничего не дают. Хитиноид-ное вооружение прикрепительного диска и полового аппарата можно рассмотреть только in vivo или на препаратах, заключенных в глицерин-желатин после фиксации 4%-ным формалином. Дальнейшее изложение будет базироваться на морфологии D. vastator, но оно может быть применено и к другим видам этого рода.
Внешняя морфология. Длина D. vastator колеблется от 0,6 до 1,1 мм (D. sphyrna и D. solidus немного крупней). Тело вытянуто в длину, суживается кпереди, расширено несколько в задней четверти и подразделяется на туловищную часть и прикрепительный диск, отделенный перехватом от туловища. На переднем конце тела 358
выдаются вперед четыре железистых подушки, на вершине которых открываются четыре пучка головных желез (рис. 316). Эти выросты паразитом используются для прикрепления. Относительно небольшой прикрепительный диск подразделен выемкой на заднем краю на две половины. На диске следует при большом увеличении микроскопа рассмотреть серию крючьев. 14 более мелких крючочков распределяются по периферии диска. Каждый краевой крючочек состоит из массивной, серповидной, выдающейся наружу части и тонкого прямого базального отростка. Основание серповидной части сильно утолщено. Из этих 14 крючков одна пара отступает несколько с периферии и ложится ближе к середине диска. В центре диска расположены два более крупных крючка. Изогнутые и заостренные их концы выдаются наружу на спинную сторону и направлены назад. Расширенное же и раздвоенное на проксимальном конце основание погружено в паренхиму. От оснований видны отходящие вглубь пучки мышц (рис. 316). Оба крючка связаны друг с другом узкой короткой хитиноидной соединительной частью (рис. 317).
Анатомия. Пищеварительная система. Неподалеку от переднего края тела на брюшной стороне следует рассмотреть ротовое отверстие, ведущее в мускулистую глотку. Около переднего конца глотки видны две пары глаз, причем передние мельче задних. За глоткой начинаются две ветви кишечника, они изгибаясь, идут до заднего конца туловищной час-
Рис. 316. Dactylogyrus vastator. Общая организация, с брюшной стороны (Х120) (из кн.
Быховского):
1 — головные железы, 2 — глаза, 3 — глотка, 4 — наружное половое отверстие, 5 — влагалище, 6 — наружное отверстие влагалища, 7 — кишечник, 8 — семяпровод, 9 — яичник, 10 — семенник, 11 — желточ-ник, 12 — пучок мышц, связанных с основанием центральных крючьев, 13 — краевые крючья, /4 — центральный крючок, 15 — яйцевод, 16 — желточный проток; 17— матка, 18 — копулятивный орган
Рис. 317. Dactylogyrus vastator. А—центральные крючья прикрепительного диска с соединительной частью; 5 — вооружение пениса (из кн. Быховско-го); В — Dactylogyrus sphyrna, вооружение пениса (Х400) (из кн. Нибелина); Г — Dactylogyrus solidus, вооружение пениса (из кн. Ахмерова);
трубка, 2 — крючковидное продолжение
ти тела, расширяются назад и сливаются вместе впереди от прикрепительного диска. В месте слияния кишечные стволы наиболее широки. Ни нервной, ни выделительной системы не видно.
Мужская половая система. Единственный семенник вытянутой формы занимает пространство как раз кпереди от места соединения обеих ветвей кишечника. Семяпровод тянется по спинной стороне тела
вперед и заканчивается ко-пулятивным аппаратом. Пенис имеет простатическую часть и семенной пузырь и вооружен специальными копулятивными хитиноидными приспособлениями. Главная
часть вооружения — хитино-идная трубка, сквозь которую выпрыскивается сперма при копуляции. Трубка у D. vastator короткая, слегка изогнута и на дистальном конце косо срезана, отчего образуется острие. Проксимальная часть трубки связана с выступающим вперед «крючковидным продолжением» (по Быховскому). Последнее подразделено на две части (рис. 317, Б) и выполняет поддерживающую и направляющую функцию при действии трубки; у D. sphyrna трубка достигает значительной длины и свивается в спокойном состоянии в спираль с двумя-тремя оборотами (рис. 317, В). Рассмотреть эти составные части копулятивного аппарата можно только при большом увеличении микроскопа (с иммерсионным объективом и сильно придавливая червя).
Женская половая система. Округлый яичник (несколько меньших размеров по сравнению с семенником) лежит впереди от семенника. Яйцевод принимает на себя оба желточных протока (см. рис. 316), здесь же в него вливаются протоки скорлуповых желез и сюда же впадает влагалище. Оно в виде довольно широкого протока идет к вентральной стороне тела и за пределами правой ветви кишечника открывается наружу вентрально. От места слияния всех этих протоков яйцевод превращается в матку, в которой помещается одно яйцо. Матка открывается наружу общим с мужской половой системой отвер-
стием.
Многочисленные желточные фолликулы распределены почти на всем пространстве тела, свободной от них остается только область впереди глотки, прикрепительный диск и центральное поле с основным комплексом половых желез.
Diplozoon paradoxum Nordmann — спайник парадоксальный
Материал и методы изучения. Diplozoon paradoxum относится к сем. Discocotyli-dae подкл. Oligonchoinea (по Быховскому, 1937). Паразитирует на жабрах различных карповых рыб (леща, густеры, плотвы и др.). В настоящее время D. paradoxum разбит на несколько подвидов. Из взрослых паразитов изготовляется тотальный препарат, окрашенный квасцовым кармином после спиртовой или любой иной фиксации. Изучение живого материала дает значительно больше, чем изучение фиксированного.
Внешняя морфология. Diplozoon paradoxum (рис. 318) дает пример срастания вместе крест-накрест двух гермафродитных особей. При этом срастании паразиты могут оплодотворять только друг друга в силу особой структуры выводных путей половой системы.
Каждая особь в длину достигает не более 0,5 см, имеет вытянутое тело, постепенно суживающееся кпереди с перехватом в месте сцепления
Рис. 318. Diplozoon paradoxum. А—-внешний вид (Х15); Б — хитиноидноз вооружение прикрепительного клапана в сложенном состоянии (Х250) (ориг.):
1 — ротовое отверстие, 2 — ротовая присоска, 3 — глотка, 4 — кишечник. 5 — желточники, 6 — комплекс половых желез, /—прикрепительные клапаны, 8, 9 — передняя и задняя хитиноидиые дуги клапана, /0 —срединная соединительная хитииоидная пружина, 11 — хитинондная дуга на дне клапана
с партнером (на расстоянии приблизительно !/з от заднего конца тела). На заднем конце тело расширяется, переходя в прикрепительный аппарат (рис. 318,Л). На брюшной стороне прикрепительного диска каждой особи по краям видны четыре пары хитиноидных прикрепительных клапанов. Каждый клапан имеет две створки с пережимом посредине. Клапаны снабжены хитиноидным скелетом в виде дуг (рис. 318, Б). Парные дуги (передние и задние) поддерживают края обеих створок клапана, парная же дуга залегает на его дне. Пережим клапана обусловлен наличием непарной хитиноидной соединительной пружины, вызывающей пассивное смыкание створок клапана. При складывании створок между ними защемляются жаберные лепестки, чем и осуществляется фиксация паразита на жабре. Кроме прикрепительных клапанов на заднем краю диска с дорзальной стороны торчат два совсем маленьких крючочка, сохранившиеся еще от личиночного состояния (см. рис. 320, Б).
Анатомия. Пищеварительная система. Ротовая полость открывается наружу субтерминально позади двух небольших щупальцеобразных выростов переднего конца тела. В сравнительно объемис-
Рис. 319. Diplozoon paradoxum. Строение половой системы (Х45) (из кн. Целлера):
/ — желточный проток, 2 — желточники, 3 — семяпровод, 4~ яичннк, 5 — матка, 6 — желточный пузырь, 7 — влагалище, 8 — семенник, 9 — спииные крючья, 10— прикрепительные клапаны, // — яйцевод, 12 — маточный проток, 13— место соединения семяпровода левой особи с влагалищем правой, 14—наружное маточное отверстие
той ротовой полости видны две присоски с мускулистыми стенками (рис. 318,2). Далее следует рассмотреть глотку — правильной овальной формы мускулистое образование, переходящее в мешковидную кишку с многочисленными боковыми выростами. В области комплекса половых желез кишка раздваивается, соединяясь снова за ним. У взрослого паразита кишка видна только в передней части тела, на остальном теле она маскируется чрезвычайно сильно развитыми желточниками.
Мужская половая система. Семенник правильной, округлой формы расположен под прикрепительным диском как раз между обоими рядами прикрепительных клапанов. Края его слегка вырезаны. Семяпровод тянется вперед, ближе к правой стороне каждой особи, и заканчивается резким сужением около наружного угла, образуемого краями тела обоих партнеров. Наружу, однако, семяпровод не открывается и соединяется прямо с влагалищем соседней особи (рис. 319). Никаких следов копулятивных приспособлений нет.
Женская половая система. Яичник лежит впереди от семенника, между ним и местом соединения обоих паразитов. Он вытянут в длину и сильно перегнут пополам так, что заостренная верхушка лежит рядом с основанием. От последнего, лежащего справа, идет поперек тела яйцевод, заканчивающийся расширением — маткой (рис. 319,72). Неподалеку от выхода яйцевода из яичника в него впадает влагалище, несколько дальше — желточный проток (_рис, 319). Матка — расширенная часть яйцевода, тянется вдоль левого края тела, от нее отделяется маточный проток, открывающийся наружу рядом с концом семяпровода на правой стороне тела.
Влагалище тянется от яйцевода вперед в виде извитого канальца, огибает яичник и выходит на левую сторону тела, где около наружного угла, образованного краями тела обоих животных, сообщается с семяпроводом своего партнера (рис. 319). Таким образом, и влагалище наружу не открывается.
Многочисленные желточные фолликулы занимают большую часть переднего конца тела. Желточный проток от них тянется назад, прилегает вплотную к яичнику, делая впереди от него петлю и спускаясь к месту впадения в яйцевод, резко расширяется в виде S-образного желточного мешка (рис. 319). Яйцевые капсулы Diplozoon снабжены весьма длинным филаментом (рис. 320, Я).
Отдельные составные части половой системы на тотальных препаратах рассмотреть не всегда удается. Лучше для этого использовать серию срезов.
Рис. 320. Diptozoon paradoxum. А •— сложное яйцо с филаментом (Х150) (ориг.); Б — спинные крючки (Х1000) (из кн. Целлера)
Б
КЛАСС CESTODA — ЛЕНТОЧНЫЕ ЧЕРВИ, ИЛИ ЦЕСТОДЫ
При изучении Cestoda рекомендуем ознакомиться с характерными представителями двух отрядов: Cyclophyllidea и Pseudophyllidea. Бычий солитер и широкий лентец изучают и тотально, и на сериях срезов, причем первый разбирается более подробно, так как на нем удобнее демонстрировать все особенности -^гистологии и анатомии Cestoda. С организацией ряда других червей из этих же отрядов (не расчлененных, с двойным комплексом половых желез в членике и т. д.) достаточно ознакомиться на тотальных препаратах. Для знакомства с прочими отрядами Cestoda предлагаем ограничиться изучением только сколексов наиболее характерной для них части тела. При этом в виде сравнения следует разобрать и ряд сколексов представителей вышеназванных отрядов.
Taeniarhynchus saginatus (Goeze) (-Taenia saginata Auct, Taenia mediocanellata Kuchenmeister) — бычий солитер
Материал и методы изучения. Taeniarhynchus saginatus относится к сем. Taeniidae отр. Cyclophyllidea. Материал добывают из больниц, с глистогонных пунктов, где он попадается далеко не часто. Изгнанного из человека паразита промывают многократно в воде, и отдельные части стробилы поступают в обработку. Сколекс с прилегающей к нему шейкой и началом стробилы фиксируют спиртом (70°) или формалином (4%-ный), и из него приготовляют тотальный препарат, окрашенный хотя бы квасцовым кармином. Для изучения морфологии отдельных члеииков лучше использовать метод окраски по Блажину (с. 33). Основная особенность этого метода — длительная мацерация свежего, нефиксированного материала. Поэтому фиксированный материал для этого метода непригоден. Можно обработать, по Блажину, и целую стробилу, раскладывая ее после окраски на большом стекле или листе бумаги и высушивая на воздухе.
При наличии уже фиксированного материала членики необходимо основательно отмыть в воде от спирта или формалина (вымачивание ведут несколько часов) и обработать в 5%-ном растворе КОН до тех пор, пока они не станут более или менее прозрачными. Тогда их промывают в воде, переводят в подкисленный спирт (с 1%-ной НС1) на 2—3 ч и затем окрашивают гематоксилином Деляфильда или Бемера.
Для изготовления срезов фиксировать лучше жидкостью Ценкера с формалином в течение 0,5—1 ч и окрашивать гематоксилином. Зрелые членики хорошо рассматривать также в глицерине в неокрашенном состоянии. При фиксации целой стробилы «впрок», во избежание сокращения и перекручивания стробилы, рекомендуется ее намотать на цилиндр (на бутылку, например) и в таком виде опускать в консервирующую жидкость (формалин 3%-ный или спирт 70°). Общая анатомия изучается на тотальных препаратах, многие же детали — на срезах.
Внешняя морфология. Тело одного из наиболее крупных ленточных глистов (длиной от 4 до 10 м и более) состоит из сколекса, шейки (наиболее узкой части тела) и членистой стробилы из 1000 и более члеников. Цвет паразита обычно молочно-белый.
Сколекс. Наиболее узкая передняя часть стробилы слегка утолщается— образуется сколекс грушевидной формы, в диаметре достигающий 1,5—2 мм. На сколексе расположены четыре овальные или округлые присоски, почти всегда пигментированные (рис. 321). Края присосок утолщены в виде валика, выступают над поверхностью сколекса и 364
радиально исчерчены, видны радиальные мышечные волокна. Терминально на сколексе расположено вдавление, соответствующее хоботку других Cyclophyilidea.
В паренхиме сколекса разбросаны пигментные (черные) зерна. Они концентрируются обычно вокруг апикального вдавления, вокруг присосок и позади них в виде дугообразных линий (рис. 321, Б). Кроме этих зерен хорошо бывают заметны в паренхиме известковые тельца. За сколексом следует короткая шейка, в сокращенном состоянии складчатая и по ширине мало уступающая самому сколексу (рис. 321, Я).
Стробила. Стробила состоит из прямоугольных плоских члеников (проглоттид). Форма члеников, их величина различны в зависимости от их местоположения в стробиле. Наиболее короткие и относительно наиболее широкие членики находятся в передней части стробилы (см. рис. 325, А, Б). Членики с гермафродитной половой системой (см. рис. 325, Е) тоже принадлежат к этой же категории. В задней части стробилы членики становятся квадратными (матка в них начинает образовывать боковые ветви — см. рис. 325, Ж)- Наконец, последние членики стробилы вытянуты в длину (см. рис. 326, Я). Членики, готовые оторваться от стробилы, сильно сужаются (см. рис. 326, Б).
Каждая проглоттида имеет передний (более короткий) и задний (более длинный) края, боковые края и сплющена дорзовентрально. Одна из плоских сторон, к которой приближены семенники, может быть обозначена мужской стороной или условно спинной, в то время как противоположная, к которой ближе расположен яичник, женской или брюшной.
Рис. 321. Taeniarhynchus saginatus. А— вид сколекса сбоку (Х15) (из Фурмана); Б — вид сколекса с вершины (Х45) (из кн. Скрябина и Шульца);
1 — терминальное вдавление, 2 — присоска, 3 — шейка, 4 — пигментные линии
Сбоку, приблизительно посредине каждого членика, взятого из задней половины стробилы, заметно углубление — наружное половое отверстие. Эти отверстия чередуются в стробиле неправильно — то справа, то слева. В молодых, относительно широких члениках краевые ямки имеют характер воронки. В гермафродитных же и зрелых члениках дно у них уплощается, края полового отверстия приподымаются над поверхностью членика, окружаются валиком и формируется половой сосочек (рис. 322). Наружное, широкое половое отверстие ведет в половую клоаку, куда общим отверстием открываются и семяизвергательный канал и влагалище (рис. 322, 7).
Первый зачаток краевой ямки Зоммер (1874) наблюдал на члениках, следующих на 360-м в виде еле заметной складки. После 440 члеников от начала стробилы краевая ямка приобретает характер воронки. Половой сосочек обособляется после 480-го членика (вся стробила в указанном случае состояла из 1220 члеников).
Анатомия. Выделительная система. На тотальных препаратах из органов, общих для всей стробилы, можно рассмотреть только
Рис. 322. Taeniarhynchus saginatus. Общий вид окрашенного гермафродитного членика (ХЮ) (из кн. Зоммера):
1 — матка, 2 — семенники, 3— внутренний дорзальный канал выделительной системы. 4 — наружный вентральный выделительный канал, 5 — семяпровод, 6 — сумка цирруса, 7 — половая клоака, 8 — влагалище, 9 — яичник, 10— поперечный анастомоз выделительной системы, 11 — скорлуповые железы, 12 — желточник, 13 — клапаны продольного выделительного кана’ ла, 14 — семенные канальцы
выделительную систему (нервную систему следует разобрать на срезах, см. ниже). Ее главные вентральные стволы тянутся вдоль по бокам стробилы и связаны в каждом членике задним поперечным анастомозом (рис. 322, 10). Эти сосуды особенно хорошо удается рассмотреть после инъекции выделительной системы раствором берлинской лазури. При инъекции тонкую пипетку или иглу шприца следует вводить в боковые сосуды стробилы с переднего конца, иначе клапаны, отмеченные еще Зоммером около поперечных анастомозов (рис. 322, 13), будут затруднять обратный ток краски. Дорзальные стволы выделительной системы, отмеченные на рисунках члеников из передней половины стробилы, на тотальных препаратах не видны; их можно рассмотреть на срезах.
Половая система. Гермафродитный половой аппарат образует самостоятельную систему в каждом членике и претерпевает определенные изменения в зависимости от положения на том или ином уровне стробилы. Эти изменения следует разобрать на тотальных препаратах из разных областей стробилы, но прежде чем заняться подобным разбором, следует детально познакомиться с отдельными составными частями половой системы в так называемом гермафродитном членике, где развиты и функционируют мужские и женские железы. Такие членики занимают приблизительно середину стробилы (яичник вполне сформировывается после 440—450-го членика от начала стробилы) и по форме еще относительно широки (рис. 322).
Семенники разбросаны главным образом в передней половине членика. В задней они занимают только боковые поля. Распространение их в стороны ограничено стволами выделительной системы. Округлые или овальные пузырьковидные семенники в развитом, функционирующем состоянии имеют в диаметре 120—190 мкм. Количество их в членике превышает 1000. Семенные канальцы (vasa efferentia) обычно видны слабо, хотя иногда удается заметить концевые их части, собирающиеся в середине членика в семявыносящий канал (семяпровод, рис. 322, 5). Последний (vas deferens) всегда виден очень хорошо, вначале он прямой, потом становится сильно извилистым и, выйдя за пределы бокового выделительного сосуда, входит внутрь так называемого мешка цируса, где превращается в семяизвергательный канал (ductus ejaculatorius). Мешок цирруса — мускулистое образование, вытянуто в длину, закруглено на проксимальном конце и заострено на дистальном (рис. 323), может высовываться в половую клоаку (sinus genitalis) и оттуда через половое отверстие наружу.
Относительно крупный двухлопастный яичник занимает значительную область задней части членика на брюшной его стороне. Левая его лопасть обычно развита сильнее, чем правая. Соединены они сравнительно узкой промежуточной частью (см. рис. 322). Устроен яичник по типу трубчатой железы и состоит из многочисленных трубчатых долек, изредка анастомозирующих друг с другом и образующих многочисленные слепые выросты и мешковидные придатки (см. рис. 322,9). Все трубочки сходятся к соединительной части.
Короткий, широкий, треугольной формы желточник распластывается вдоль поперечного анастомоза выделительной системы (см. рис. 322).
Так же, как и яичник, это трубчатая железа с большим, по сравнению с яичником, количеством анастомозов, благодаря которым получается типичная для этого органа сетеобразная структура. Желточник своей вершиной направлен вперед. Сюда сходятся отдельные трубочки, сливающиеся вместе в короткий общий желточный проток. Последний вливается в яйцевод в том месте, где в него впадают многочисленные скор-луповые железы, составляющие тельца Мелиса (см. рис. 322, И). Яйцевод (oviductus) отходит от соединительного отдела яичника назад, соединяется с желточным протоком и поворачивает вперед, где впадает в матку на уровне соединительной части яичника. Внутри яйцевод выстлан ресничным эпителием. Клетки скорлуповой железы плотно прилегают друг к другу и на окрашенных препаратах тельце Мелиса заметно в виде темноокрашенного округлого образования.
Неподалеку от скорлуповых желез (перед ними) в яйцевод впадает влагалище (vagina), начинающееся от половой клоаки кзади от мешка цирруса (см. рис. 322,5).. От половой клоаки влагалище в виде тонкого, почти прямого, без извивов канала (значительно более тонкого по сравнению с семяпроводом) идет на значительном пространстве параллельно ему, слегка только отклоняясь назад. В области же матки оно довольно резко поворачивает назад к месту впадения в яйцевод. Не доходя до места впадения в яйцевод, влагалище вздувается и превращается в веретеновидный семяприемник (receptaculum seminis), сое
Рис. 323. Taeniarhynchus saginatus. Дистальный отдел выводных путей половой системы (Х150) (из ки. Зоммера):
J — половой сосочек, 2 — половая клоака, 3 — общее отверстие семяизвергательного канала и влагалища, 4 — влагалище, 5 — семявыносящий канал, 6—сумка цирруса, / — семяизвергательный канал
Рис. 324. Taeniarhynchus sa-ginatus. Проксимальный отдел женских выводных путей половой системы (Х400) (из кн. Зоммера):
1 — влагалище, 2 — хитиноидный клапан, 3 — семяприемник, 4 — трубчатые дольки яичника. 5 —• участок яйцевода, направляющийся назад, 6 — комплекс скорлуповых желез, 7 — желточный проток, 8—матка, 9— отрезок яйцевода, направляющийся вперед
диненный коротким, узким семенным протоком (ductus seminalis) с яйцеводом (см. рис. 322 и 324). Семяприемник помещается между соединительным отделом яичника (дорзальноот него) и маткой. Непосредственно перед семяприемником в просвете влагалища заметен хитиноидный (коричневого цвета) воронковидный клапан, направленный суженной частью к семяприемнику и затрудняющий обратный ток семени (рис. 324,2). Влагалище изнутри выстлано кутикулой с отходящими от нее тончайшими шипиками. Направлены они своими концами в сторону семяприемника и заметны только при применении больших увеличений (с иммерсионным объективом). Стенки влагалища часто бывают пигментированы.
Наконец, следует рассмотреть и последний элемент женской половой системы — матку. В изучаемых члениках она еще развита слабо и представлена слегка изогнутой трубкой, проходящей посредине, почти вдоль всего членика. Передний конец матки слепо замкнут, задний, доходящий до уровня скорлуповых желез, принимает яйцевод. На препаратах матка чаще попадается уже с боковыми ответвлениями.
Разбор изменений половой системы в пределах стробилы ведут на тотальных препаратах члеников из разных мест стробилы (рис. 325). Изложение этих изменений составлено нами по Зоммеру (1874), который последовательно разобрал половой аппарат в стробиле из 1220 члеников.
В члениках сразу после шейки отсутствуют всякие следы половой системы. Первые зачатки ее в виде проходящего поперек паренхиматозного тяжа (будущих выводных протоков половых желез) начинают появляться после 140-го членика от начала стробилы (рис. 325,Л). Вначале этот тяж не доходит до выделительного ствола (начинаясь с середины членика), далее он заходит за выделительный канал и его проксимальный конец загибается назад (после 170-го членика, рис. 325,Б). Влагалище и семяпровод в пределах этого тяжа обособляются только после 260-го членика от шейки (рис. 325,В). В следующих члениках обособляется медианный продольный тяж — зачаток матки. Около заднего его конца заметен незначительных размеров зачаток соединительной части яичника и скорлуповых желез (после 285-го членика от шейки, рис. 325, Г). Первые зачатки семенников в виде разбросанных в паренхиме кучек клеток появляются значительно, позже, после 325-го членика. Краевая ямка (зачаток половой клоаки) обособляется после 360-го членика и вскоре формируется сумка цирруса. Одновременно развивается яичник (рис. 325, Д), становятся заметными обе его доли, развивается комплекс скорлуповых желез, увеличиваются в размерах семенники и обособляются желточники. Такая картина наблюдается в члениках после 375-го от шейки. Извилистый характер семяпровода, бывшего до сих пор прямым, замечается, начиная с 450-го членика. Около этого же места вполне сформировываются яичник и его выводные пути, а также влагалище с семяприемником. Начиная с 480-го членика от шейки, семенники получают связь с семяпроводом посредством развивающихся семенных канальцев, и в семяпроводе впервые заметна семенная жидкость — членик становится способным к оплодотворению. С этого момента членики приобретают характер на-
стоящих гермафродитных (рис. 325, Е). Первые яйца появляются в матке после 580-го членика. Боковые выпячивания матки становятся заметными только после 600-го членика от начала стробилы. После 790-го членика эти разветв-ления уже развиты хорошо, но они еще не очень длинны (рис. 325,/К), и матка уже доходит и спереди и сзади до границ членика.
Рис. 325. Taeniarhynchus saginalus. Изменение половой системы в пределах стробилы (ХЗО) (из кн. Зоммера): А — 140—143-й членик от шейки; Б — 180-й членик; В — 270-й членик; Г—290-й членик; Д — 380-й членик; Е — 570-й членик, Ж — 790-й членик:
I — внутренний канал выделительной системы, 2 —наружный выделительный канал, 3 матка, 4 — яичник, 5 — поперечный выделительный канал, 6 — влагалище, 7 — семяпровод, S — семенники» 9 — желточник, 10 — половая клоака
После 880-го членика начинается редукция яичника. Боковые ответвления матки увеличиваются в количестве параллельно с удлинением членика и достигают боковых каналов выделительной системы. После 980-го членика от яичника остается незначительный рудимент, скорлу-повые железы достигают максимального развития. Матка переполнена яйцами, но еще почти нет онкосфер с эмбриональной скорлупой. Только после 1000-го членика в матке замечаются уже многочисленные зародыши с эмбриональной скорлупой и начинает редуцироваться желточ-ник. На 1100-м членике он исчезает бесследно (рис. 326,А). Членики начинают сильно вытягиваться в длину, скорлуповые железы редуцируются. Связь между члениками ослабляется, последние членики стробилы отшнуровываются и ведут самостоятельное существование. В них максимально развита матка с 17—35 боковыми ответвлениями с той и с другой стороны и видны остатки семяпровода и влагалища — все остальные элементы половой системы исчезли полностью (рис. 326, Б).
Изучение срезов. После разбора морфологии Т. saginatus на тотальных препаратах следует изучить разрезы через его членик как по-
Рис. 326. Taeniarhynchus saginatus. Изменение половой системы в пределах стробилы (Х17). А— 1100-й членик от шейки; Б — 1215-й членик (из кн. Зоммера)
Рис. 327. Tdeniarhynchus saginatus. Покровы на поперечном срезе членика (Х160) (из кн.
Шнейдера):
/ — наружная цитоплазматическая пластинка покровов, 2 — пограничная пластинка, 3 — кольцевые мышцы, 4 — продольные мышечные волокна. 5 — клетки погруженного эпителия, (> —паренхима, /—известковое тельце
Рис. 328. Taeniarhynchus saginatus. Паренхима на разрезе (Х750) (из кн. Шнейдера):
1 — дорзовентральное мышечное волокно с мышечной клеткой сбоку, 2— нервная клетка, 3 — паренхима, 4 — терминальный орган выделительной системы, 5 — выделительные канальцы
перечные, так и продольные. Толщина срезов для разбора серий 10 мкм, для гистологии 5—7,5 мкм.
Гистология. Для изучения гистологии лучше воспользоваться серией поперечных разрезов через членик с маткой, которая имеет не особенно длинные ответвления (членик приблизительно из середины стробилы, 600—700-й от шейки). На срезе, проведенном впереди от полового сосочка и окрашенного железным гематоксилином, можно разобрать основные элементы гистологии ленточных глист.
Поверхность тела покрыта толстой цитоплазматической пластинкой погруженного эпителия (рис. 327). При очень большом увеличении на ее поверхности заметна тонкая исчерчен-ность — это слой густо расположенных микроворсинок (микротрихий). Пластинка изнутри подостлана тонким неклеточным слоем пограничной пластинкой (рис. 327,2). Это светлый слой, пронизанный тонкими нитями — окончаниями клеток погруженного эпителия. Под пограничной пластинкой залегает слой кольцевых кожных мышц, волокна которого, нередко извилистые, расположены в несколько рядов (рис. 327,3). Погруженные клетки цилиндрической или булавовидной формы занимают пространство сразу за кольцевыми мышцами. Дистальные концы клеток погруженного эпителия утончены, вклиниваются в
промежуток между мышечными волокнами и разветвляются на тончайшие отростки, пронизывающие пограничную пластинку. В промежутках между клетками погруженного эпителия видны единичные волокна продольной мускулатуры (рис. 327,4). Полная картина строения покровов может быть получена только электронным микроскопированием.
Промежутки между всеми органами заполнены паренхиматозной тканью. Ее звездчатые клетки соединяются своими отростками друг с другом, анастомозируют и образуют паренхиматозную сеть (рис. 328). Между клетками находится гомогенная межуточная субстанция с вакуолями и синусами, наполненными жидкой лимфой.
В паренхиме двумя слоями внутренних поперечных мышц (см. рис. 331, 334 и др.) отграничивается внутренная зона. Дорзально и вентрально к поперечным мышцам прилегает периферическая зона. В паренхиме внутренней зоны у Т. saginatus и помещаются основные органы членика.
Продольные мышечные волокна разбросаны в периферической зоне более или менее равномерно и только вблизи слоев внутренней поперечной мускулатуры концентрируются в рыхлый слой (см. рис. 331 и др.). Мышечные пучки мезоплевры проходят поперек и сближаются на боках членика (см. рис. 334). Далее в паренхиме видны еще дорзо-
вентральные мышечные волокна. Они больше заметны в центральной зоне, изучить структуру мышечного волокна. Тело мышечной клетки с округлым ядром плоской стороной прилегает сбоку к сократимому волокну (рис. 328).
В паренхиме разбросаны характерные для гистологии ленточных червей известковые тельца. Они округлой или овальной формы, на них видна концентрическая слоистость вокруг центрального, сильно окрашивающегося зерна (см. рис. 327,7). Каждое тельце залегает ин-трацеллюлярно, вокруг него можно рассмотреть тонкий слой протоплазмы с плоским плохо заметным ядром. Элементы нервной системы — чувствительные клетки, нервные волокна, разбросанные в паренхиме, на препаратах заметить почти не удается.
Наконец, в паренхиме при большом увеличении (с иммерсионным объективом) следует рассмотреть концевые элементы выделительной системы — выделительные капилляры и терминальные клетки прото-
пронизывают все ее зоны, но На этих волокнах очень удобно
6
Рис. 329. Taeniarhynchus saginatus. Терминальные клетки протонефридиев (на разрезах). А—детали строения (Х1200); Б — типичная группа из трех клеток (Х350) (из кн. Шнейдера):
I — выделительный каналец, 2 — мерцательное пламя, 3 — капиллярное кольцо, 4 — зона расположения базальных телец (базальная пластинка), 5 — ядро звездчатой клетки, 6 — ядро капиллярной клетки
Рис. 330. Taeniarhynchus saginatus. Фронтальный разрез гермафродитного членика в области соединения боковых каналов и поперечного анастомоза выделительной системы (Х18) (ориг.):
/ — боковой канал выделительной системы, 2— нервный ствол, 3 — клапан, 4 — яйца, 5 — поперечный анастомоз выделительной системы
нефридиев. Тончайшие канальцы пробегают на срезах в разных направлениях (рис. 328). Особенно хорошо заметны они во внутренней зоне. На концах некоторых из них можно заметить расширение, замкнутое звездчатой клеткой неправильной формы (рис. 328,4). В такой клетке (рис. 329) видно крупное ядро, занимающее большую ее часть. Обычно терминальные клетки располагаются группами по три клетки в каждой (рис. 329,5). В просвет расширенной части канальца от звездчатой клетки отходит пучок ресничек, склеенных в мерцательное пламя (рис. 329,2). У его основания сильно окрашивается гематоксилином базальная
пластинка. В стенках расширенной части капилляра заметно окрашивающееся утолщение — капиллярное кольцо (рис. 329,3).
Выводные пути выделительной системы на изучаемом срезе представлены двумя боковыми продольными каналами. В разрезе они имеют неправильные очертания (см. рис. 334,3) и занимают пространство.
между слоями внутренних поперечных мышц неподалеку от краев членика. Эпителиальная выстилка каналов отсутствует и вокруг них паренхима уплотняется, заменяя собственную стенку,. На фронтальных срезах (рис. 330) через такой же членик следует обратить внимание на место отхождения от главных каналов боковых анастомозов. Здесь прекрасно видны клапаны, не позволяющие жидкости в. каналах течь в направлении к сколексу. Каждый клапан — это скла-т дочка стенки канала, выступающая в его просвет и отходящая от внутренней стенки выше места впадения бокового анастомоза (рис. 330,3). Обычно около анастомоза боковой канал вздувается и клапан при обратном токе жидкости (например, при сокращении тела червя) прижимается как раз к стенке этого вздутия.
На поперечных разрезах (рис. 331) через более молодые членики из передней части стробилы (еще почти без половых желез — около 350-го членика) следует рассмотреть вторую пару выделительных каналов, значительно более тонких и расположенных ближе к дорзаль-
1
Рис. 331. Taeniarhynchus saginatus. Поперечный разрез через молодой членик (Х45) (ориг.):
/ — дорзальный продольный каналец выделительной системы, 2 — нервный ствол, 3 — боковой (вентральный) канал выделительной системы. 4 — зачатки половых желез
ному краю членика, и несколько ближе к середине (рис. 331,7). И на фронтальных срезах (рис. 332) через такой же молодой членик обе пары каналов могут быть видны, они идут рядом, параллельно друг другу (рис. 332, /, 2). На самом деле вторая пара выделительных каналов лредставляет непосредственное продолжение одного и того же общего
Рис. 333. Taeniarhynchus saginatus. Поперечный разрез гермафродитного членика. Часть среза около бокового канала выделительной системы (Х625) (из кн. Гофмана) :
1 — спинной добавочный нервный ствол, 2— боковой канал выделительной системы, 3 — главный нервный ствол, 4 — брюшной добавочный нервный ствол, 5 — боковой нерв, 6 — дорзовентральные мышечные волокна
Рис. 332. Taeniarhynchus saginatus. Фронтальный разрез через молодой членик (Х12) (ориг.):
1 — дорзальный каналец выделительной системы, 2 — боковой вентральный канал выделительной системы, 3 — зачаток выводных путей половой системы
Рис. 334. Taeniarhynchus saginatus. Серия поперечных срезов через гермафродитный ього сосочка; Г—срез в области яичника; Д — срез в области желточника; Е — срез 1 — семенники, 2 — дивертикулы матки, 3 — слей внутренних поперечных мышц. 4 — периферическая ствол, 8 — семяпровод, 9 — стенка сумки цирруса, /0 — семяизвергательный канал, // — половая дольки желточника, 17 — поперечный анастомоз выделительной системы
членик (ХЗО). А—срез впереди от полового сосочка; Б и В — срезы в области поло-в области поперечного анастомоза выделительной системы (ориг.):
зона паренхимы, 5 — покровы, 6 — боковой сосуд выделительной системы, 7 — продольный нервный клоака, 12— влагалище, 13 — выпяченный циррус, 14— дольки яичника. /5 — семяприемник, 16 -•
главного выводного канала — это начало главного канала, становится оно заметным только в гермафродитных члениках. Тонкий каналец идет вперед по дорзальной стороне членика, поперечных анастомозов не образует, в сколексе загибается назад и ближе к вентральной стороне членика проходит, сильно утолщаясь, до конца стробилы. Вентральные каналы обеих сторон связаны друг с другом поперечными анастомозами.
Из продольных стволов центральной нервной системы на поперечных срезах (рис. 333) удается рассмотреть только те, которые располагаются латерально от главных каналов выделительной системы. Здесь при удачной фиксации видны три ствола с каждой стороны. Один из них, средний, наиболее мощный (рис. 333, 3), главный, сопровождается тонкими добавочными продольными — вентральным и дорзальным— стволами (рис. 333, 1, 4). Последние видны не на всяком препарате. Эти шесть стволов лежат в пределах внутренней зоны, в то время как остальные четыре ствола — в вентральных и дорзальных — располагаются снаружи от слоя поперечной мускулатуры ближе к середине членика. На наших препаратах их рассмотреть не удается.
Структуру нервных стволов на разрезе лучше всего разобрать на крупных боковых стволах. Овальной формы разрез такого ствола окрашивается слабей окружающей паренхимы. Перерезают главным образом нервные волокна, они выглядят на препарате в виде округлых пространств различного диаметра. Нервные клетки и глиальные элементы на обычном препарате заметить не удается.
Разбор серии срезов. На серии поперечных разрезов (рис. 334) через тот же членик, на котором изучена гистология, следует проследить половую систему. Разбор серии удобнее начать с тех срезов, которые проведены в передней части членика (рис. 334,Л). Здесь видны многочисленные семенники, занимающие в центральной зоне дорзальное положение главным образом в боковых полях членика. Внутри них различные стадии сперматогенеза и уже готовые спермин. В середине же среза видна матка, перерезанная во многих местах и набитая яйцевыми капсулами. Матка также целиком располагается в центральной зоне паренхимы.
Далее следует обратить внимание на срезы в области половой клоаки. К ней подходит сильно извитой семявыносящий проток. На срезе он будет многократно перерезан (рис. 334, Б) и видно, что он набит спермой. Следует рассмотреть и семяизвергательный канал, проходящий внутри мешка цирруса. Последний на срезах нередко виден в выпяченном состоянии (рис. 334, В). Ствол выделительной системы проходит вентрально от выводных путей мужской половой системы. Следует обратить внимание на структуру стенки влагалища: оно покрыто внутри пластинкой с шипиками и в его стенках сосредоточена масса пигментных зернышек. На проксимальном конце влагалища обратить внимание на семяприемник (рис. 334, Г). На этих срезах кроме матки попадаются уже и трубочки яичника с ооцитами внутри. Здесь же могут быть рассмотрены скорлуповые железы.
На срезах, проведенных далее назад, появляются дольки желточ-ника (рис. 334, Д) с желточными клетками внутри (в этих клетках
характерна окрашивающаяся в темный цвет цитоплазма). Наконец, на срезах кончается половая система и появляется поперечный анастомоз, соединяющий оба продольных выделительных ствола (рис. 334, £).
Diphyllobothrium latum (L.) — широкий лентец
Материал и методы изучения. Diphyllobothrium latum относится к отр. Pseudophy-llidea, сем. DiphyUobothriidae. Паразитирует в тонких кишках человека в местностях, где рыба составляет существенный источник пресноводного промысла (Прибалтика, Карелия). Хозяевами широкого лентеца кроме человека являются собака, кошка, медведь, лисица и другие хищные животные. Материал удобнее всего получать на глистогонных пунктах, в больницах. Изгнанного червя следует тщательно промыть, в воде и осторожно распутать. Сколекс лучше рассмотреть на свежем материале и после этого уже сделать из него тотальный препарат, зафиксировав спиртом и окрасив кармииом.
Из члеников разных отделов стробилы следует приготовить тотальные препараты, окрашенные по методу Блажина. При наличии фиксированного заранее материала (что значительно хуже) членики окрашивают квасцовым кармином. Для изготовления срезов следует выбрать из середины стробилы такой членик, у которого матка развита не очень сильно. Фиксировать лучше жидкостью Ценкера с формалином. Заливку производят по Петерфи (выдерживать в целлоидин-гвоздике следует несколько суток). Окрашивать срезы рекомендуется гематоксилином. Желательно также изготовить срезы через сколекс, залитый обычным способом в парафин.
Внешняя морфология. Широкий лентец — один из самых крупных паразитов. Длина его стробилы у человека достигает 9 м и более (известны черви, достигавшие длины 15—20 м). Количество члеников может превышать 4000. Цвет паразита чаще грязно-белый, сероватый или желтоватый.
Сколекс. Яйцевидной формы сколекс (длиной около 2,5 мм, шириной 1 мм) закруг-
Рис. 336. Diphyllobothrium latum. Поперечный срез через сколекс (Х130)
(ориг.):
1 — полость ботрия, 2 — дорзальный каналец выделительной системы. 3 — вентральный каналец
Рис. 335. Diphyllobothrium latum.
Внешний вид сколекса (Х20) (из кн. Скрябина и Шульца)
лен на переднем конце и слегка сплющен с боков (рис. 335). Его вентральный и дорзальный края несут по глубокой, продольной борозде (ботрии) (рис. 335), которые сливаются на переднем краю. Особенно хорошо ботрии удается рассмотреть на поперечном разрезе через сколекс (рис. 336, /)'. Задний конец сколекса суживается и переходит в сократимую шейку, достигающую в растянутом состоянии 15 мм длины.
Стробила. Членики в стробиле прямоугольной формы. В отличие от Taeniarhychus saginatus они в задней части стробилы вытянуты в боковом направлении и ширина их значительно превышает длину. Зона наиболее молодых члеников, еще без признаков полового аппарата, составляет всего 3—4 см от шейки. В дальнейших члениках уже намечается закладка половой системы. Явственно половое отверстие видно на расстоянии около 15 см от шейки. На расстоянии 60 см заметна матка, но еще без яиц и слабо развитая. Около этого места происходит оплодотворение, и в дальнейших члениках матка наполняется яйцами и приобретает характер темной розетки благодаря появлению на ней сильных изгибов.
Для изучения анатомии следует взять отдельный членик на расстоянии 1 —1,5 м от сколекса. Прежде всего рекомендуется рассмотреть членик свежий или фиксированный, не сдавливая его и не окрашивая. На таком членике ясно видна брюшная сторона, куда открываются половые отверстия, и противоположная — спинная. Передний край членика несколько короче заднего. В передней четверти членика открывается наружу отверстием половая клоака. Позади полового отверстия самостоятельным отверстием открывается наружу матка. Половое отверстие (porus genitalis) занимает строго медианное положение, маточное же бывает расположено несколько сбоку (рис. 337, Л). Оба эти отверстия окружены кутикулярными сосочками.
Анатомия. При изучении анатомии прежде всего используют тотальные препараты. Главное внимание следует обратить на разбор половой системы, так как нервную и выделительную системы на таких препаратах обнаружить почти никогда не удается и это следует сделать на срезах.
Мужская половая система. Многочисленные семенники в количестве 600—700 расположены в один слой в центральной зоне паренхимы (см., например, поперечные срезы рис. 340) и занимают бо-
1 На разрезе полезно попутно обратить внимание на мышечные волокна — продольные и тангентальные — особенно сильно развитые в области ботрий. В толще паренхимы хорошо заметны четыре канала выделительной системы: два вентральных, более толстых, и два дорзальных, тонких. Нервная система сколекса заметна слабо.
Рис. 337. Diphyllobothrium latum. Общий вид средней части членика, взятого на расстоянии 1,5 м от сколекса (Х35) (из кн. Зоммера). А —вид с брюшной стороны; Б — вид со спинной стороны:
/ — отверстие половой клоаки, 2 — влагалищная пора, 3 — сумка цирруса, 4— матка, 5 — канал вы-делительной системы, 6 — наружное отверстие матки, 7 — семяпровод, 8 — влагалище, 9— желточные протоки, 10 — яичник, 11— семяприемник, 12 — желточные фолликулы, 13 — семяизвергательный канал, 14 — пропульсаторное вздутие семяпровода, 15 — семенники, 16 — семявыносящие канальцы, 17 — семенной пузырь, 18 — скорлуповые железы
Рис. 338. Diphyllobothrium latum. Циррус, выпяченный из полового отверстия (Х20) (из кн. Зоммера)
ковые поля членика по ооеим сторонам от женской половой системы. Форма их округлая, диаметр достигает 140 мкм. Семенные канальцы сходятся в задней половине членика к началу семяпровода. Последний, обычно выполняющий функцию семенного пузыря, вздут в виде резервуара, где собирается сперма (рис. 337,5,77). Семяпровод, сильно извиваясь, проходит по спинной стороне членика вперед (рис. 337,7) и заканчивается копулятивным аппаратом. Главная его часть — мешок цирруса — грушевидной формы со способным выпячиваться циррусом (рис. 338), что и попадается изредка на члениках. Стенки мешка снабжены кольцевой мускулатурой, сокращением которой обусловлено выпячивание цирруса. Внутри мешка цирруса проходит семяизвергательный канал, который открывается на конце цирруса в глубине половой клоаки (см. рис. 337,Л, 1). Непосредственно к мешку цирруса прилегает обособленный овальный мускулистый пропульсаторный аппарат (см. .рис. 337,
ляции и обусловливающий выпрыскивание спермы. Этот аппарат представляет расширение концевого отдела семяпровода.
Женская половая система. Двухлопастный яичник занимает середину заднего края членика (см. рис. 337). Обе его лопасти соединены вместе спереди поперечной соединительной частью и огибают начальные отделы половых путей и комплекс скорлуповых желез в виде переметной сумы. Края яичника слабо лопастные. Яичник на препаратах красится очень слабо, и его сетевидная структура (составлен он из массы извитых трубочек, анастомозирующих друг с другом) заметна плохо. Яйцевод отходит от соединительной части яичника назад. Начало его непосредственно у выхода из яичника охвачено кольцевыми мускула-
, 14 и 341, 3), действующий при копу-
8
Рис. 339. Diphyllobolhrium latum. Проксимальные отделы выводных путей женской половой системы (Х340) (из кн. Зоммера) :
1 — семяприемник, 2 — соединительный канал влагалища, 3 — скорлуповые железки, 4 — матка, 5 — желточный проток, 6 — яйцеьол» 7 — яичник, 8 «— влагалище
ми — образуется сфинктер, регулирующий выход яиц из яичника. Неподалеку от выхода из яичника в яйцевод впадает тонкий соединительный каналец влагалища, далее желточный проток (рис. 339, 5), после впадения которого в яйцевод открываются многочисленные скор-луповые железы (тельце Мелиса). От этого места дальше начинается матка (рис. 339, 4). Скорлуповые железы — одноклеточны, грушевидной формы, образуют скопление вокруг яйцевода почти правильной сферической формы. Секрет этих желез (по Нибелину, 1922) служит для склеивания вместе яйцевой клетки и желточных клеток при формировании сложного яйца перед выделением скорлупы. Последняя есть результат специальной секреции желточных клеток, отделяющих субстанцию скорлупы. Эти начальные отделы выводных путей половой системы рассмотреть довольно трудно — объект приходится сильно сплющивать и применять большие увеличения.
Матка в виде сильно извитого канала без боковых ответвлений проходит вдоль членика и открывается' наружу медианно самостоятельным отверстием позади половой клоаки. В задних члениках стробилы извивы матки располагаются в виде розетки. Матка набита яйцевыми капсулами.
Влагалище, как уже было сказано, связано с яйцеводом тонким соединительным канальцем. Проксимальный конец влагалища сильно вздут и образует семяприемник (см. рис. 337, А, 11; 339, /). От него влагалище в виде почти прямой трубки идет по вентральной стороне членика к половой клоаке, куда и открывается особой от мужского полового отверстия щелевидной порой (см. рис. 337, А, 2).
Иногда удается произвести инъекцию половых путей раствором берлинской лазури. Пипетку с тонко оттянутым концом водят в половую клоаку и при удачной инъекции наливаются и влагалище и семяпровод.
Желточные фолликулы разбросаны в боковых полях членика в периферическом слое паренхимы, и в толще членика они расположены, следовательно, в два слоя (см. рисунки срезов). Размеры желточных долек значительно уступают таковым семенников, диаметр у них достигает всего 65 мкм. Поэтому на тотальных препаратах их можно хорошо отличить от семенников. Количество их в членике превышает 6000. Желточные ходы обычно хорошо заметны. Они собираются в задней части членика посредине в вентрально расположенный желточный проток (см. рис. 337, А, 9). При этом изредка можно видеть, что желточные ходы идут и от желточников соседнего, заднего членика.
Изучение серий срезов. Серии поперечных, сагиттальных (рис. 340) и фронтальных срезов следует изготовить из членика, матка которого развита сравнительно слабо и мало еще наполнена яйцами; такой членик располагается в передней части стробилы на расстоянии, несколько меньшем 1 м от сколекса. Толщина срезов 10 мкм.
Начать изучение следует с разбора поперечной серии срезов. Прежде всего следует ориентироваться в расположении внутренних органов членика на срезе через его середину. На таком срезе выделяют срединное и боковые поля. Срединное поле занято перерезанными извивами матки — ее можно узнать по наличию в ней яиц (рис. 340, 3), извива-
Рис. 340. Diphyllobothrium latum. Серия поперечных срезов через членик, взятый на рас Б — разрез в области влагалищной поры; В — в области маточного отверстия;
Е—разрез на границе между члениками:
1 — мускулистая стенка сумки цирруса, 2— семяизвергательный канал, 3 — матка, 4 — покровы;, реиние мышцы, 8 — паренхима внутренней зоны, 9 — желточники, 10 — семенники, 11 — половая 15 — суженная часть матки непосредственно перед выходом ее наружу, 16 — семяпровод, /7 —яич-
yj г
3
д
Е
стоянии около I м от сколекса (Х35) (ориг.). А — разрез в области половой клоаки; Г — разрез через середину членика; Д — разрез в области яичника;
5 — паренхима периферической зоны, 6 — продольные мышечные волокна, 7 — поперечные внут* клоака, 12— пропульсаторное вздутие семяпровода, 13 — влагалище, 14 — влагалищная пора, ник, 18 — продольный канал выделительной системы, 19 — продольный нервный ствол
ми семяпровода около дорзального края членика (внутри него обычно видны сперматозоиды) и влагалищем около вентрального края среза (рис. 340, 13 и 16). Стенки влагалища составлены из довольно высокого эпителия, благодаря чему оно хорошо отличается от матки и от семяпровода с очень тонкими стенками.
Все перечисленные органы помещаются целиком во внутренней зоне паренхимы. Боковые поля заняты семенниками и желточными фолликулами. Семенники расположены во внутренней зоне в один слой. Внутри них на срезах видны разные стадии сперматогенеза и пучки зрелых сперматозоидов с длинными хвостиками и маленькой, шарообразной, сильно окрашивающейся головкой. Семенники изредка попадаются и в срединном поле между петлями матки. Желточные фолликулы расположены в периферической зоне в один слой на вентральной и дорзальной стороне членика. Продольная мускулатура периферического слоя концентрируется главным образом около слоев поперечных мышц. Здесь они образуют сплошной слой, чем это распределение и отличается от такового у Taeniarhynchus saginatus.
Разбор серии поперечных срезов удобнее начать со срезов в области задней границы между двумя члениками в той части, где на срезе еще не попадаются половые железы (рис. 340, Е). На таком срезе следует отметить главные каналы выделительной системы, которых всего два. Они обладают узким просветом и отличаются от лакун в окружающей паренхиме зернистым пигментом в полости канальца около стенки (рис. 340, Е, 18). Эти же зернышки пигмента помогают отличить выделительные каналы и дальше в членике, между семенниками, нс удается это с трудом.
На этом же срезе следует рассмотреть главные нервные боковые стволы, расположенные снаружи от каналов выделительной системы (рис. 340, Е, 19). На срезе это губчатая масса овальной формы, окрашенная слабее окружающей ее паренхимы. И выделительная системг и нервные стволы располагаются во внутренней зоне паренхимы приблизительно на расстоянии */з ширины членика от его краев.
Далее, просматривая срезы по направлению вперед, следует ос тановиться на таких, где в разрез попал яичник (рис. 340, Д). Егс трубочки переполнены обычно яйцевыми клетками. На этих же сре зах удается различить проксимальный конец влагалища с семяприем ником, желточные каналы; скорлуповые железы обычно плохо сохра няются на срезах. Тут же видно начало матки, набитой яйцевыми кап сулами.
Семяпровод начинается на срезах впереди яичника, и его ход еле дует проследить на серии параллельно следованию влагалища и мат ки. Семяпровод с очень тонкими стенками извивается и поэтому и. одном и том же срезе перерезается во многих местах (рис. 340, Г, 16) но все же эти извивы располагаются ближе к спинному краю члени ка. Матка также перерезается во многих местах. Влагалище боле прямое, слегка только меняет место на срезе около вентрального ег< края.
Просматривая срезы уже в передней трети членика, следует обна ружить маточное наружное отверстие. Оно открывается около сред 386
ней линии членика (рис. 340, В, 15). .’.атка около него значительно сужается. Далее по мере просмотра следующих срезов обнаруживается приближение влагалища к поверхности членика. Следует найти отверстие влагалища в половую клоаку (рис. 340, Б, 14).
Наконец, на срезах виден пропуль-саторный аппарат и следующий за ним мешок цирруса. Первый представляет собой шарообразное вздутие семяпровода с довольно толстыми мускулистыми стенками (рис. 340, Б, 12). Мешок цирруса грушевидной формы, губчатой структуры, снаружи покрыт слоем продольной и кольцевой мускулатуры (рис. 340, Д). Семяизвергательный канал извивается в толще этой губчатой массы и заканчивается мускулистым циррусом.
Из серии сагиттальных разрезов следует изучить срезы через срединное поле. Здесь видны те же составные части полового аппарата, что и на поперечных срезах, но при удачно про-. веденном разрезе можно увидеть сразу все три отверстия половой системы (рис. 341). Структуру мешка цирруса и пропульсаторного аппарата лучше всего разобрать именно на сагиттальных разрезах.
Фронтальные срезы можно использовать для изготовления графической реконструкции половой системы, помогающей разобраться в анатомии
Рис. 341. Diphyllobothrium latum. Сагиттальный разрез через членик, прошедший по его медианной линии
(Х50) (ориг.):
/ — мускулистая стенка сумки цирруса, 2— семяизвергательный канал, 3 — пропульса-торное вздутие семяпровода, 4 — матка, 5 — наружное отверстие матки, 6 — влагалище, 7 — влагалищная пора, 8 — половая клоака, 9 — мужское половое отверстие
членика широкого лентеца.
Развитие Diphyllobothrium latum
С жизненным циклом цестод удается познакомиться весьма детально, поставив эксперимент по развитию широкого лентеца. Для получения ранних стадий развития следует добыть с глистогонного пункта свежего паразита, промыть его как следует в воде и из задних члеников (с темной маткой) выделить яйца. Это удается лучше всего, надрезая членик в области матки ножницами крестообразно и прополаскивая такие членики в воде в чашечке Коха. Достаточное количество яиц должно покрыть дно чашечки, Воду используют прудовую (не водопроводную хлорированную).
Рис. 342. Diphyllobothrium latum. Отдельные стадии развития. А — яйцевая капсула Б — сформированный корацидий в яйцевой капсуле (х800); В — корацидий; Г—он косфера из полости тела Diaptomus на 4—5-й день после заражения; Д — вытянута в длину личинка на 6-й день после заражения; Е—процеркоид (Х450); Ж—цикло с процеркоидом и двумя онкосферами в полости тела (Х100); 3— плероцеркоид и мышц рыбы (Х10) (А, В — из кн. Скрябина и Шульца, Г—Ж—из кн. Розена):
] — синтициальный ресничный эпителий, 2 — крючки, 3 — вдавление переднего конца процеркоид; 4 — железистые клетки, 5 — известковое тельце. * — хвостовой придаток процеркоида, 7 — процерю ид, 8 — онкосферы, 9 — ботрий
Наблюдения над развитием следует начать с таких только что вы-..ленных из матки яиц. Каждое яйцо имеет крышечку на суженном -.онце (рис. 342, Л), на другом полюсе скорлупа утолщается, образуется .ебольшой шипик. Внутри — яйцевая клетка, окруженная несколькими эесятками желточных клеток. При попадании в воду яйцо начинает эазвиваться и из него через несколько дней вылупляется ресничная ли-:инка— корацидий. Срок развития зависит непосредственно от окружающей температуры: при 16°С корацидий вылупляется через 10— 14 дней, при 22—25°С на это требуется всего около шести дней. Вылупление совершается только на свету, что необходимо учитывать при постановке опытов в термостате. Темнотой можно задержать вылупление и наблюдать массовое вылупление после выставления на свет. При этом открывается крышечка, корацидий, уже сформированный внутри яйца (рис. 342, Б), протискивается через образовавшееся отверстие наружу и начинает плавать в воде. Вылупление совершается в течение минуты.
Корацидий должен быть рассмотрен при большом увеличении (с иммерсионным объективом). Он имеет правильную шарообразную форму и одет слоем ресничного эпителия с длинными ресничками (рис. 342, В). С помощью этих ресничек корацидий медленно плавает в воде, все время вращаясь. Эпителий корацидия особой природы, это синцитиальный слой, сильно вакуолизированный, с каплями жира и совершенно лишенный ядер.
Под ресничным эпителием лежит онкосфера с тремя парами эмбриональных крючков, расположенных у одного из ее полюсов, того, через который проходит продольная ось корацидия и который при движении всегда направлен назад. Диаметр корацидия колеблется от 42 до 49 мкм. Из.корацидиев хорошо получаются тотальные препараты после фиксации осмиевыми смесями (жидкостью Флемминга, Шампи, Бенда). Заключать их лучше всего в глицерин-желатин без окраски.
Для дальнейшего развития корацидии должны попасть в первого промежуточного хозяина — рачка: Cyclops strenuus, Diaptomus gracilis, D. gracilloid.es и др. из отряда Copepoda. Лучше всего развитие идет в Diaptomus. Наловив их в любом стоячем водоеме — пруде, озерке планктонной сеткой, следует подсадить несколько десятков штук в каждую чашку с выводящимися корацидиями в момент наибольшего их вылупления. Через день воду следует сменить (удалив этим самым вновь вылупляющихся корацидиев).
Подкармливать циклопов следует инфузориями, проще туфельками, разведенными на сенном настое.
Через каждые 2—3 дня следует брать по нескольку штук циклопов для обнаружения последовательных стадий развития личинки. Часть циклопов гибнет уже в первые дни эксперимента, и их обязательно следует просматривать, так как гибель их происходит в результате проникновения сквозь кишечник слишком большого количества онкосфер. Уже на 4—5-й день после заражения в полости тела рачков удается обнаружить при вскрытии (раздирая рачков иглами) онкосфер (рис. 342, Г), сбросивших ресничную обкладку и несколько
подросших по сравнению с тем, что было видно в корацидии. Они уже начинают вытягиваться в длину, и крючки помещены на одном из их полюсов. Дней через 6 после заражения (при температуре 21°С) личинка сильно вытянута в длину (рис. 342, Д) и на заднем ее полюсе в области крючков начинает обособляться округлый придаток. В таких личинках уже заметны известковые тельца, в небольшом количестве разбросанные в паренхиме личинки. Вполне сформированный процеркоид может быть обнаружен уже на 9-й, 10-й день после заражения рачков (приблизительно при 20°С). Размером он около 0,5—0,6 мм, сильно вытянут в длину и может сокращаться. На концах он сужается, и задний конец его несет хвостовой отросток, обычно шарообразной формы с шестью крючками и резким перехватом отделенный Ът тела. На переднем конце личинки находится небольшое впячивание, к
Рис. 343. Поперечный срез через Diaptomus с двумя (Х200) (ориг.):
/ — кишечник, 2 — мускулатура, 3 — процеркоиды, 4 — брюшная
процеркоидами в полости тел
нервная цепочка, 5 — сперматофор
которому сходятся многочисленные железистые клетки, образующие в паренхиме компактную центральную массу (рис. 342, £). Кутикула сильно утолщена и покрыта нежными, направленными назад кутикулярными шипиками, развитыми на переднем конце сильнее, чем на заднем. В паренхиме процеркоида разбросаны многочисленные известковые тельца.
Рассматривать материал из циклопов удобней всего in vivo. Тотальные препараты из онкосфер и процеркоидов выходят плохо и на них мало что удается видеть. Заключать их следует после формалиновой фиксации в глицерин-желатин. Можно изготовить из зараженных циклопов тотальные препараты, также заключив их в глицерин-желатин. В них удается рассмотреть процеркоидов (рис. 342, Ж).
На поперечных разрезах через зараженного Diaptomus (заливать в парафин следует, выдержав предварительно не меньше 3 суток в жидкости Петерфи), фиксированного любым сулемовым фиксатором, видно положение процеркоидов в полости тела (рис. 343).
Следующую личиночную стадию — плероцеркоидов — рекомендуется добыть из второго промежуточного хозяина — рыбы. Плероцеркоиды чаще встречаются в щуке и налиме, реже в окуне и ерше. Наиболее зараженными бывают мышцы. Содрав кожу, следует соскабливать скальпелем мышцы; в них легко обнаруживаются плероцеркоиды. Кроме мышц паразитов у крупной рыбы в порядочном количестве можно найти и в некоторых внутренних органах, например в печени. Это плоские, белые червячки длиной иногда больше 1 см, со складчатым нечленистым телом и двумя ботриями по бокам головного отдела (см. рис. 342, 3). Весь передний конец плероцеркоида часто втягивается совершенно, тогда легким подогреванием можно заставить сколекс выпятиться.
Тотальные препараты из плероцеркоидов выходят хорошо и из неокрашенных объектов, заключенных в бальзам.
Echinococcus granulosus Batsch. ( = Taenia echinococcus V. Siebold)—эхинококк
Материал и методы изучения. Ech. granulosus (отр. Cyclophyllidea, сем. Taeniidae) во взрослом состоянии живет в кишечнике хищных млекопитающих. Получить материал удается при вскрытии собак. Взрослого червя рассматривают на тотальном препарате, окрашенном квасцовым кармином. При работе с живыми половозрелыми экземплярами эхинококка требуется большая осторожность, так как яйца его могут попасть в организм человека и развиться там во взрослого эхинококка.
Строение половозрелой стадии. Ech. granulosus достигает в длину не больше 5—6 мм, и стробила его состоит из 3—4 члеников (рис. 344). Последний из них по длине обычно превышает всю остальную стробилу. Половозрелые эхинококки иногда имеются в коллекциях зоологических кафедр многих университетов.
Сколекс снабжен четырьмя присосками и хоботком с двумя рядами крупных и мелких крючьев (рис. 345). Чаще встречаются 35— 38 крючков. Шейка чрезвычайно коротка и по ширине не отличается от сколекса (см. рис. 344).
Рис. 345. Echinococcus granulosus. Крючья сколекса (Х180) (из Скрябина и Шульца)
Рис. 344. Echinococcus granulosus. Общий вид стробилы (Х15) (из кн. Фурмаиа в Krumbach-Kukenthal’s Hand-buch):
1 — семенники, 2 — матка,еще без яиц, 3 — сумка цирруса, 4 — половая клоака, 5— влагалище, (? —яичник, 7 — скорлуповые железы, 8 —желточннк, 9 — матка, набитая яйцами
Первый членик стробилы не имеет обычно никаких дифференцированных органов, половой комплекс закладывается только во втором членике. Третий членик становится гермафродитным. Мелкие, шарообразные семенники (40— 50 шт.) разбросаны по членику главным образом в его передней половине, но видны и в задней. Извитой семявыносящий канал подходит к краю членика около его середины и заканчивается хорошо развитой сумкой цирруса. Она открывается наружу на дне неглубокой половой ямки (клоаки).
Яичник двухлопастный, лежит в задней части членика. Позади него виден комплекс скорлуповых желез и компактный желточник (см. рис. 344). Сюда же подходит влагалище, начинающееся от половой клоаки и вздутое посредине. Впереди от яичника видна короткая, прямая матка.
Задний членик из всего полового комплекса содержит только мешковидную матку с боковыми дивертикулами, переполненную яйцами. Половая клоака сдвинута от середины членика назад, и около нее заметен мешок цирруса.
Наружные половые отверстия во всех трех члениках чередуются неправильно.
Dipylidium caninum (L.) ( = Taenia cucutnerina Leuc.) — цепень тыковидный
Материал и методы изучения. Dipylidium caninum (отр. Cyclophyllidea, сем. Dipylididae) добывают из тонкой кишки молодых кошек и собак. Сколекс фиксируют отдельно, и из него изготовляют тотальный препарат, окрашенный кармином. Членики из разных отделов стробилы лучше всего окрасить по Блажину.
Строение половозрелой стадии. Сравнительно короткая стробила (15—35 см в длину) состоит из удлиненных члеников. Задние из них имеют форму огуречного семени. Цвет паразита белый, последние членики часто имеют розовый оттенок.
Сколекс (рис. 346). На сколексе видны четыре присоски правильной округлой формы (рис. 346, Л). Терминально между ними расположен крупный хоботок, способный втягиваться, что чаще и бывает на препарате. Поверхность хоботка усажена несколькими рядами мелких крючков неодинаковых размеров. Наиболее крупные из них расположены ближе к вершине хоботка (рис. 346, Б). Каждый крючок сидит на овальной базальной пластинке, погруженной в паренхиму хоботка.
Половая система. Гермафродитные членики следует взять в середине стробилы, где они еще относительно не очень длинны (см. рис. 347). Обращает на себя внимание парность полового комплекса. Наружные половые отверстия открываются симметрично по обеим сторонам посредине членика (рис. 347, А).
Семенники правильной формы разбросаны в паренхиме по всему членику в пределах между главными стволами выделительной системы. Семенные канальцы от них собираются в боковые семявыносящие каналы, извитые, впадающие в сумки цирруса на правой и левой сторонах членика (рис. 347, Л). Циррусы открываются в половые клоаки каждой стороны.
Двухлопастный яичник с правой и левой сторон расположен неподалеку (назад) от мешка цирруса. Комплекс скорлуповых желез
виден позади каждого яичника, расположены сзади от комплексов скорлуповых желез (рис. 347, Л, 7). От половой клоаки отходит с каждой стороны по влагалищу, вздутому в виде семяприемника около скорлуповых желез.
На препарате последних члеников стробилы из описанных элементов половой системы остаются только концевые отделы выводных путей: мешки цирруса и влагалища. Матка такого членика распадается на яйцевые камеры (рис. 347, Б), наполненные каждая кучкой яиц, которые образуют так называемые яйцевые коконы (рис. 347, В~) из 8—20 яиц.
Компактные желточники дугой
Рис. 346. Dipylidium ccminum. А — общий вид сколекса (Х90) (из кн. Фурмана в Krumbach-Kukenthal’s Handbuch); Б — крючья хоботка сверху (Х40) (из кн. Скрябина и Шульца):
1 — хоботок, 2 — присоски
в ...Б-
Рис. 347. Dipylidium caninum. А —- гермафродитный членик из середины стробилы; Б — члеиик из конца стробилы (Х17); В— отдельные яйцевые камеры (Х110) (из кн. Фурмаиа в Krumbach-Kukenthal’s Hand-buch):
/ — семенники, 2 — семяпровод, 5—-сумка цнрру* са, 4 —половая клоака, 5 — влагалище, 6 —яичник, 7 — желточник, окружающий скорлуповые железы, 8 — яйцевые камеры, 9 — яйца в яйцевых камерах
Рис. 348. Caryophyllaeus laticeps. А— общий вид червя (Х7); Б—детали строения заднего конца тела (Х17) (из ки. Фурмаиа в Krumbach-Kukenthal’s Handbuch):
1 — сколекс, 2 — семенники, 3 — желточники, 4 — семяпровод, 5—сумка цирруса, 6"—-яйцевод, 7 — желточный проток, 8 — скора луповые железы, 9 — яичник, 10 — семя* приемник, // — влагалище, 12 — матка, 13 — женское половое отверстие, 14 — мужское половое отверстие, 15 — циррус, вы* пяченный наружу
Caryophyllaeus laticeps (Pall.) ( = C. mutabilis Rud.) — гвоздичник
Материал и методы изучения. Car. laticeps (отр. Pseudophyllidea, сем. Caryophyl-laeidae) живет в кишечнике различных карповых рыб. Наиболее интенсивно заражается лещ. В одной рыбе может встретиться несколько десятков паразитов. Изучение ведут на тотальных препаратах, окрашенных кармином.
Строение половозрелой стадии. Car. laticeps (рис. 348) :— пример нерасчлененного ленточного глиста с одним комплексом половых желез. Паразит сильно вытянут в длину (1—4 см), тело его закруглено сзади и расширено спереди (рис. 348, Л). Сколекс невооруженный с рядом фестонов по переднему краю. Ширина тела неодинакова, оно наиболее узко в передней части и постепенно расширяется назад.
Из внутренних органов удается рассмотреть только половой аппарат. Многочисленные пузыревидные семенники разбросаны в центральной зоне тела, главным образом в задней его половине. Сильно извитой семявыносящий канал (рис. 348, 4) подходит к округлой сумке цирруса и продолжается в семяизвергательный канал внутри способного сильно выпячиваться цирруса. Последний может высовываться из полового отверстия, расположенного в задней части тела (рис. 348, 15). Двухлопастный яичник, разделенный наподобие крыльев бабочки, занимает почти самый задний конец тела. Короткий яйцевод, соединившись с влагалищем и желточным протоком (здесь же впадают немногочисленные скорлуповые железы, рис. 348, Б, 8), продолжается в извитую, короткую, неветвистую матку. Она наполнена яйцами и открывается наружу сразу же позади мужского полового отверстия. Влагалище также подходит к этому отверстию. Оно посредине вздуто, превращаясь в семяприемник. Многочисленные желточные фолликулы располагаются двумя рядами по краям тела. Они заходят вперед дальше семенников (рис. 348, <3) и видны на самом заднем конце тела за маткой и яичником. Парные желточные протоки (плохо заметные на препарате) перед соединением с яйцеводом сливаются в непарный желточный проток.
Сколексы различных других Cestoda
Taenia solium (отряд Cyclophyllidea)—свиной солитер, или цепень вооруженный
Материал и методы изучения. Удобней воспользоваться финками с вывернутыми сколексами. Материал получают с бойни в свином мясе. Вывертывать сколексы можно, либо сдавливая финку пальцами, либо лучше заставить сколексы вывернуться в желчи при 37—39°С. Для этого используют термостат или осторожно подогревают их в чашечке. Вывертывание заканчивается через 20—30 мин после помещения финок в желчь. Очень удобно изучать финку in vivo. Окрашенные кармином тотальные препараты можно изготовить из всей вывернутой финки после фиксации спиртом. Полезно отрезать верхнюю часть сколекса и заделать в препарат хоботком кверху.
Изучение материала. На сколексе следует отметить четыре присоски округлой формы и хоботок (рис. 349, Л), способный втягиваться и высовываться наружу (что можно наблюдать in vivo). На хоботке рассматривают два венчика крючьев из 22—23 шт. Передний составлен из более крупных, задний из более мелких. Последние расположены в промежутках между более крупными (рис. 349, Б). Острия крючков направлены назад, у каждого из них есть базальный конец, которым они погружены в паренхиму хоботка. Между наружной и базальной частью крючок утолщен.
Tetrarhynchobothrium tenuicolla (отряд Tetrarhynchidea)
Материал. Добывают из спирального клапана кишечника севастопольских скатов, Raja clavata, где ими заражено около 30% рыбы. Рассматривают тотальные препараты, окрашенные кармином.
Изучение препарата. Сколекс сильно вытянут в длину. На переднем его конце (pars bothridialis) — четыре ботридия, вытянутых в дли
Рис. 349. Taenia solium. А — сколекс — вид сбоку (Х50); Б — крючья хоботка (X135) (из кн. Скрябина и Шульца):
1 — ввернутый внутрь хоботок, 2 — присоски
Рис. 350. Tetrarhyncho-bothrium tenuicolle. Сколекс (ХбО) (ориг.):
/ — хоботок, 2— ботридий, 3 — влагалища хоботков, 4 — мускулистое вздутие влагалища хоботка
ну. От их вершины отходят вперед четыре длинных хоботка, способных втягиваться внутрь (рис. 350). Средняя часть сколекса (pars vaginalis) занята влагалищами для каждого хоботка. Каждое влагалище заканчивается мускулистым вздутием у основания сколекса (pars bulbosa), которое от остальной стробилы отделено складкой покровов (velum). Хоботки покрыты многочисленными крючками. Движение каждого хоботка совершается главным образом благодаря работе мускульных вздутий (мускульных цилиндров) у основания влагалища и ретракторов хоботков. Вытягивание хоботка вызывается сокращением мускульного цилиндра, при котором жидкость из его полости выдавливается в полость хоботка. Последний выворачивается, как палец перчатки, и высовывается наружу при расслабленном ретракторе. При втягивании хоботка мускульный цилиндр расслабляется, приходят в действие ретракторы, прикрепленные одним своим концом к переднему концу хоботка, и последний вворачивается внутрь, пока совсем не втянется во влагалище.
Acanthobothrium coronatum (отряд Tetraphyllidea)
Материал. Добывают из спирального клапана кишечника севастопольских скатов— Raja clavata и Trigon pastinaca (около 20—25% заражения). Из фиксированного материала изготовляют тотальные препараты.
Изучение препарата. На сколексе видны четыре ботридия (рис. 351), подразделенные каждый двумя перегородками на три камеры. От передней стенки каждого ботридия поднимаются два раздвоенных согнутых шипа. На переднем полюсе видны четыре присоски.
Echineibothrium variabile (отряд Tetraphyllidea)
Материал. Добывают из спирального клапана кишечника Raja clavata в Севастополе (заражение около 60%). Рассматривают тотальный препарат.
Изучение препарата. На сколексе сидят четыре ботридия. Каждый продольной бороздкой подразделен на две половинки, а каждая половинка поперечными перегородками дополнительно делится на 7—8 камер. Терминально на сколексе помещается крупная присоска с железистым аппаратом, открывающимся на ее дне (рис. 352). Форма ботри-дий чрезвычайно изменчива.
Cyathocephalus truncatus (отряд Pseudophyllidea)
Материал. Добывают из пилорических придатков северных лососевых (в частности, форели). Рассматривают тотальный препарат.
Изучение препарата. Ботридии на сколексе сливаются в прикрепительный воронковидный орган, расположенный терминально (рис. 353),
Triaenophorus nodulosus (отряд Pseudophyllidea)
Материал. Добывают из кишечника щуки.
Изучение препарата. На тотальном препарате следует рассмотреть два ботрия, слабо выраженных, и две пары тройных крючков (рис. 354).
р. 351
Рис. 351. Acanthobothrium coronation. Сколекс (Х50) (ориг.):
1 — терминальные присоски, 2 — шипы, 3 — бот-ридин
Рис. 352. Echineibothrium variabile. Сколекс в продольном разрезе (Х50) (не ки. Фурмана):
/— железистый аппарат терминальной при соски, 2 — полость ботрндия
р. 353
Рис. 353. Cyathocephalus truncatus. Сколекс (Х40) (ориг.)
Рис. 354. Triaenophorus nodulosus. А — общий вид сколекса (ХЗО); Б — крючь! (Х70) (из ки. Фурмана в Krumbach Kukenthal’s Handbuch):
1 — крючья, 2 — ботрий
Pyramicocephalus anthocephalus (отряд Pseudophyllidea)
Материал. Добывают из tus) — в Карском море.
кишечника тюленя — морского зайца
Изучение препарата. На сколексе с широкой шейкой — мощные ботрии — образуется ряд присосок. Вперед терминально отходит головная пирамида — группа складок, собранная наподобие кочана капусты (рис. 355) и служащая для внедрения в стенку кишечника при прикреплении паразита.
Abothrium gadi (отряд Pseudophyllidea)
Материал. Добывают из кишечника трески с Мурманского побережья.
Изучение препарата. На тотальном препарате следует рассмотреть небольшой сколекс, совершенно лишенный прикрепительных элементов (рис. 356).
КЛАСС AMPHILINIDA — АМФИЛИНИДЫ
Обычная трактовка Amphilina и ее родичей в качестве представителей низшего подкласса ленточных червей — Cestodaria (или нерасчлененных цестод) вызывает серьезные сомнения. Правильнее, по-видимому, рассматривать эти формы как представителей особого класса—Amphilinida (Дубинина, 1974). Так называемых цестодарий и цестод объединяют главным образом отсутствие кишечника, наличие в паренхиме известковых телец, личинка процеркоид и сходные хозяева (ракообразные и рыбы). Первые два сходства легко объясняются как конвергенции, вызванные паразитизмом в позвоночных, а наличие процеркоида (не с шестью, как у цестод, а с десятью крючками на церкомере) говорит не только о известной близости амфилины к ленточным червям, но и родстве ее с мо-ногенеями и гирокотилидами.
Amphilina foliacea (Rud.) Wagener — амфилина
Материал и методы изучения. Amph. foliacea (отр. Amphili-nidea, сем. Amphilinidae) паразитирует в полости тела осетровых рыб в Понто-Каспийском бассейне. Наиболее заражены волжские стерляди и шипы в молодом возрасте. Изучают тотальные препараты мелких экземпляров, окрашенные квасцовым кармином.
(Erignatus barba-
Рис. 355. Pyramicocephalus anthocephalus. Сколекс (Х8) (из кн. Вагина) :
1 — головная пирами-мида, 2 — ботрий
Рис. 356. Общий вид переднего конца тела Abothrium gadi (хЮ) (из кн.
Мониеза)
Строение половозрелой стадии. Листовидный паразит со слегка выпуклой спинной и вогнутой брюшной поверхностью, заострен спереди и закруглен сзади (рис. 357). Длина тела достигает 5 см. Покровы из-
разбросаны в передних
борождены многочисленными мелкими кольцевыми складочками. Живой паразит желтоватого или лимонно-желтого цвета. Заостренный передний конец тела несет короткий, втянутый в фиксированном состоянии невооруженный хоботок, на вершине которого открываются мощные фронтальные железы (рис. 358, <?).
Из внутренних органов на тотальном препарате удается рассмотреть только половую систему. Семенники 2/з тела, в средней его части. Семявыносящий канал начинается позади всей массы семенных пузырьков. Он сильно извивается, его извивы функционируют как семенные пузыри (vesiculae seminalis). Концевой отдел его, семяизвергательный канал, начинается мускулистым пропуль-саторным аппаратом. Окруженный системой простатических желез, он открывается наружу терминально на заднем конце тела.
Небольшой, лопастный яичник виден посредине в задней четверти тела. Короткий яйцевод принимает в себя влагалище и после него непарный желточный проток (рис. 358, 8). В месте слияния всех трех протоков луповые
7
1Z
11
9
358.
ХГ 19-
13
10
Amphilina foliacea.
о°о о О Off.
о °
впадают многочисленные скор-железы, и отсюда
начи-
Рис. 357. Amphilina foliacea. Внешний вид (в нату-ральн. велич.) (из кн. Фурмана в Krumbach - Ku-kenthal’s Hand-buch)
Рис.
Общая организация (Х5) (из кн. Гейна):
/ — наружное отверстие матки, 2 — хоботок, 3 — фронтальные железы, 4 — семенники, 5 — матка, 6 — жел-точник, 7 — яичник, 8 — яйцевод, 9 — семяизвергательный канал, 10 — мужское половое отверстие, 11 — наружное отверстие влагалища, /2 — пропульсаторный пузырь, 13 — влагалище, 14 — семяприемник, 15 — семяпровод
нается матка. Влагалище идет наискось назад, перекрещивается с семяизвергательным каналом в области пропульсаторного аппарата и открывается наружу сбоку заднего конца тела, неподалеку от мужского полового отверстия. Желточные фолликулы двумя лентами тянутся вдоль всего тела по бокам. От каждой из них желточный проток идет назад в общий непарный желточный проток. Матка сначала идет, извиваясь, назад, поворачивается вперед, тянется вдоль всего тела до переднего конца, поворачивает опять назад, доходит до уровня яичника, снова поворачивается вперед и открывается наружу на переднем конце тела сбоку от хоботка. У взрослого червя матка набита «яйцами».
Десять задних прикрепительных крючков, характерных для личинки ликофоры и процеркоида, сохраняются и у взрослого животного (Дубинина, 1974). От небольшого, молодого экземпляра амфилины следует отделить препаровальными иглами крошечный кусочек тела позади мужского полового отверстия, просветлить его в молочной кислоте и сильно придавить покровным стеклом. На таком временном препарате под микроскопом следует найти 10 маленьких крючков, состоящих из продолговатого стерженька около 30 мкм длиной и изогнутого острия. Четыре крючка немного крупнее других и отличаются несколько своей формой. Крючки лежат в глубокой складке стенки тела.
Тип Nemertini — немертины
КЛАСС NEMERTINI — НЕМЕРТИНЫ
Организация немертин в общем настолько однообразна, что для ознакомления с этой группой достаточно изучить одного представителя. В качестве такового выбран Lineus gesserensis Mull. Из отряда Hetero-nemertini. Эта форма хорошо изучена и обычна почти во всех морях СССР.
Помимо того, полезно обратить внимание на некоторые анатомические особенности других отрядов. Поэтому в качестве дополнения после описания организации Lineus gesserensis рассматривают строение кожно-мускульного мешка в различных группах немертин и вооружение хобота у Hoplonemertini на примере Amphiporus.
Исключительный интерес онтогенеза немертин заставляет уделить некоторое место описанию наиболее обычных личиночных форм.
ПОДКЛАСС ANOPLA—НЕВООРУЖЕННЫЕ НЕМЕРТИНЫ
ОТРЯД HETERONEMERTINI —ГЕТЕРОНЕМЕРТИНЫ
Lineus gesserensis Miill. — линеус
Материал и методы изучения. Lineus gesserensis Miill. принадлежит к наиболее обычным обитателям прибрежной зоны Баренцева, Белого, Черного и Японского морей На Мурмане эта немертина встречается по всему побережью,. местами в массовые количествах, и легко собирается на отливе под камнями, на нитчатых водорослях, фукусах и т. д. В Черном море, в окрестностях Севастополя, L. gesserensis живет по/] камнями, лежащими у самой воды на мокром песке, но попадается также и в драг} на малых и средних глубинах.
Этот вид с успехом может быть заменен другими видами Lineus, например L. lac teus Rathke, в изобилии встречающимся в Черном море, где он обитает обычно вмест< с L. gesserensis. Сплошь и рядом под камнями находят целые клубки немертин, боль шую часть которых составляет L. lacteus.
Для определения немертин может служить определитель О. Бюргера (1904), 1 котором представлено большинство ныне известных видов.
Считавшиеся прежде за один вид Lineus gesserensis Miill. и L. ruber Miill. нын разделяются как самостоятельные виды. Главное отличие между ними, помимо неко торых внешних признаков, сводится к различиям в эмбриональном развитии и к раз личной способности к регенерации. L. gesserensis регенерирует очень хорошо, тогда ка1 L. ruber регенерирует плохо. В дальнейшем описании не делается различия между эти ми близкими формами,
Молодые экземпляры Lineus исследуют под микроскопом, будучи сжаты между двумя стеклами. Для детального ознакомления с организацией Lineus необходимо приготовить серии срезов. При фиксации червей разрезают на несколько кусков. Фиксировать следует сулемой с уксусной кислотой, жидкостью Джильсона или Ценкера. Заливку производят через ксилол или кедровое масло в парафин. Срезы окрашивают железным или иным гематоксилином; очень хорошие картины дает окраска по Маллори и азановым методом Гейденгайна. Срезы, окрашенные гематоксилином, подкрашивают эозином или другими плазматическими красками. Можно рекомендовать также окраску борным кармином in toto перед заливкой.
7
Рис. 359. Lineus gesse-rensis (по Мак-Интошу): 1 — глаза, 2 — головной отдел
Наблюдения над живыми объектами. Посаженные в аквариум L. gesserensis медленно передвигаются, производя слабые колебательные движения головным концом, при этом по телу червя от заднего конца к переднему проходит одна за другой волны сокращения. Будучи посаженными вместе в один сосуд, несколько экземпляров охотно собираются в кучу, переплетаясь друг с другом и образуя клубки. В таком состоянии они остаются долгое время.
L. gesserensis может жить в неволе годами, но обычно постепенно уменьшается в объеме вследствие отсутствия достаточно изобильной естественной пищи.
Внешняя морфология. Сильно вытянутое червеобразное тело L. gesserensis имеет почти круглое сечение, брюшная сторона слегка уплощена. На переднем конце различается головная лопасть, несколько расширенная с боков и притупленная терминально. Граница между ней и туловищем неотчетлива. Туловище лишено каких бы то ни было следов сегментации и к заднему концу постепенно суживается (рис. 359). Длина взрослых червей колеблется от 60 до 200 мм при ширине в 2—3 мм. Окраска варьирует в широких пределах. Обычно встречаются две цветовые разновидности: красно-бурая и оливково-зеленая. Нередко наблюдаются и переходные формы. Окраска более ярка на переднем конце тела и темнее на спинной стороне, чем на брюшной. Головная лопасть и область ротового отверстия окаймлены светлым краем. В области головного мозга наспинной поверхности нередко располагаются красноватые пятна.
Следует обратить внимание на отверстия хобота, ротовое и анальное. Первое, называемое ринхостомом, представляет собой небольшую пору, лежащую терминально на вершине головной лопасти (см. рис. 365, 18\ рис. 361, 6). Иногда червь выбрасывает из него хобот, который заметен в таком случае в виде длинного и тонкого, цилиндрического придатка. Ротовое отверстие расположено на брюшной стороне на границе между головной лопастью и туловищем, позади области головного мозга (см. рис. 365, 4;
рис. 361, 3). Небольшое анальное отверстие лежит терминально на заднем конце тела.
В период половой зрелости на боковых поверхностях туловища в лупу заметны крошечные, беловатые половые отверстия. Отверстия выделительных органов могут быть наблюдаемы лишь на срезах.
На головной лопасти, в передней части по бокам, заметны глаза в виде темных пигментных пятен (рис. 359, /; см. рис. 365,2). Количество их варьирует от трех до пяти пар, причем на одной стороне их может быть больше, чем на другой. На боковых поверхностях головной лопасти, начинаясь от переднего края, проходят продольные желобки, постепенно углубляющиеся к своим задним концам. Это так называемые головные щели, связанные с лежащими внутри церебральными органами, несущими функцию органов химического чувства. Наконец, в лупу или бинокуляр на вершине головной лопасти виден фронтальный орган, который представлен тремя небольшими возвышениями эпителия, покрытыми ресничками и способными втягиваться (см. рис. 365, /). Одно из них, медиальное, располагается над ринхостомом. Фронтальный орган несет функцию органа химического чувства и осязания.
Анатомия. Следует приготовить следующие серии срезов: поперечные переднего и заднего конца тела и кусочка из средней области туловища, а также сагиттальные передней части тела и средней области туловища. Изучение внутренней организации производится путем детального изучения серий срезов, сравнения их друг с другом и путем построения глазомерных и точных графических реконструкций. Очень рекомендуется, изучив срезы, построить общую реконструкцию организации Lineus (см. рис. 365).
Кожно-мускульный мешок. Как видно на поперечных и продольных срезах через среднюю область туловища, кожно-мускульный мешок слагается из покровного эпителия, соединительнотканного подкожного слоя cutis и трех мускульных слоев (рис. 360, 363, 364). Вся поверхность тела одета однослойным ресничным эпителием. Клетки последнего сильно вытянуты и прилегают своими внутренними концами к базальной мембране. Они содержат маленькие слегка вытянутые ядра (рис. 360, 1). Между обыкновенными покровными клетками рассеяны многочисленные одноклеточные железы, красящиеся эозином и пикриновой кислотой. На препаратах, окрашенных по способу Маллори, среди этих желез различаются два сорта: белковые и слизистые. Первые окрашиваются в ярко-красный, вторые — в синий цвет. Базальная мембрана бесструктурна и хорошо окрашивается гематоксилином и по Маллори (рис. 360, 2). Следующий слой — кутис — имеет сложное строение (рис. 360, 3). В основном он слагается из волокнистой соединительной ткани с мелкими ядрами (рис. 360, 15), но содержит также железистые и мышечные элементы. Часть соединительнотканных клеток содержит пигмент в виде мелких гранул. Непосредственно под базальной мембраной залегает тонкий слой волокон подкожной кольцевой мускулатуры (рис. 360, 17). В более глубоких слоях кутиса располагаются многочисленные пакеты погруженных железистых клеток. Это крупные железы, тонкие протоки которых направляются к поверхности тела и прободают покровный эпителий (рис. 360, 14). Секрет желез хорошо
окрашивается гематоксилином, кармином и по Маллори. Между железами кутиса проходят многочисленные волокна продольного подкожного мускулистого слоя (рис. 360, 16). Лежащие под кутисом мускульные слои характерны для отряда Heteronemertini. Это — наружный продольный, кольцевой и внутренний продольный слои, имеющие приблизительно одинаковую мощность (рис. 360, 4, 6 и 7). Между продольным мускульным слоем и кольцевым залегает тонкий слой нервной ткани (см. рис. 363, Б, 20), состоящий из фибрилл, отходящих от боковых нервных стволов, которые также лежат между этими двумя мускульными слоями (рис. 363, Б, 6\ рис. 360, 5). По направлению к заднему концу тела наружный продольный мускульный слой утончается, тогда как внутренний продольный становится толще кольцевого. Кроме того, имеются дорзо-вентральные мышечные волокна, которые развиты между боковыми выпячиваниями кишки (рис. 360, 13-, рис. 364, Б, 15). Мускулатура головной лопасти представляет собой главным образом продолжение наружного продольного слоя. Внутренний продольный и кольцевой
Рис. 360. Lineus gesserensis, Часть продольного разреза. Видно строение кожно-мускульного мешка и бокового нервного ствола (ориг.): 1 — эпидермис, 2 —базальная мембрана, 3 — кутис, 4 — наружный продольный мускульный слой, 5 — нервный ствол, 6 — кольцевой мускульный слой, 7 — внутренний продольный мускульный слой, 8 — паренхима, 9 — наружная неврилемма, 10 — фибриллярная сердцевина нервного ствола, //—-внутренняя неврилемма, /2 — ганглиозные клетки нервного ствола, "13—дорзо-вентральные мускульные волокна, 14 — железы кутиса, —/5 — соединительная ткань кутиса, 16 — продольный мускульный слой кутиса, 17 — кольцевой мускульный слой кутиса, 18 — реснички эпидермиса, 19 — кожные железы
слои не продолжаются в область, лежа-
щую впереди мозга, но вокруг влагалища хобота и головных кровеносных лакун они развиты хорошо (см. рис. 363, Б, 12 и 19). Вся мускулатура немертин состоит из гладких мускульных волокон. Каждое волокно представляет собой сильно вытянутую веретеновидную клетку с небольшим числом миофибрилл в протоплазме. Ядро лежит посредине клетки, прилегая сбоку к ней.
Хобот и хоботное влагалище. Хобот .немертин — образо-
вание чрезвычайно характерное, свойственное исключительно этому классу. Он представляет собой длинное трубкообразное впячивание покрова апикальной части головной лопасти (рис. 361, 1), которое открывается наружу посредством отверстия хобота, или ринхостома
72 11 10 .3
I Л (
8
Рис. 361. Lineus gesserensis. Медиальный разрез переднего конца тела. Схематизировано (Х35) (по Паннету):
1— хобот, 2 — пищевод, 3~ ротовое отверстие, 4 — вентральная церебральная комиссура, 5 — ринходеум, 6 ~ ринхостом, 7 — фронтальный орган, 8 — дорзальная церебральная комиссура, 9 — эпителий хобота,
10 — влагалище хобота, 11 — рицхоцельный эпителий, 12 — ринхоцель
(рис. 361, 6). Как видно на поперечных и продольных разрезах, сделан' ных из животных, зафиксированных со втянутым хоботом, большаг часть последнего лежит в особой полости хоботного влагалища, или i ринхоцеле (рис. 363, 1; рис. 361, 12). Однако передний отдел хобота гра ничит непосредственно с тканями головы и не. окружен ринхоцелем Эта часть хобота не может выворачиваться и носит название ринходеу
Рис. 362. Lineus gesserensis. Поперечный разрез ввернутого хобота (Х80) (по Паннету):
1 — перекрещивающиеся мускульные пучки, 2 — ринхоцельиый эпителий, 3 — эпителий хобота, 4 — нервный слой, 5 — слой кольцевых мускульных волокон, 6 — слой продольных мускульных волокон
ма (рис. 361, 5). Таким образом, рин хоцель не достигает переднего конц; тела, кончаясь на уровне. нервной кольца. Стенки влагалища хобота со стоят из слоя продольных мускульны: волокон, окруженного снаружи слое! кольцевых, и выстланы со сторон! ринхоцеля плоским эпителием (рис 361, И). Во втянутом состоянии хобо (рис. 362) лежит в ринхоцеле; его на ружная поверхность покрыта ринхс цельным эпителием (рис. 362, 2 рис. 361, 11). Внутренняя поверхност хобота (во втянутом состоянии) огра ничена высоким железистым эпителг ем, который впереди продолжается эпителий ринходеума (см. рис. 361, ‘ рис. 362, 3). Стенки втянутого хобот состоят из наружного продольног мускульного слоя, прилегающего ринхоцеломическому эпителию, и вну' реннего кольцевого, граничащего эпителием хобота (рис. 362, 6 и 5). Н
вывороченном хоботе расположение эпителиальных и мышечных слоев, естественно, обратное. В передней части хобота между хоботным эпителием и кольцевой мускулатурой залегает пара нервов (см. рис. 363, Л, 2). Далее назад хобот становится значительно толще. На поперечном разрезе через его заднюю часть видно, что вентрально и дорзально от кольцевого мускульного слоя отходит по два тонких мускульных пучка, волокна которых перекрещиваются и, проходя в косом направлении через продольный слой, прикрепляются к базальной мембране ринхоцельного эпителия (рис. 362, 1). Эти пересекающиеся пучки характерны для всех Lineidae. Эпителий хобота здесь сильно складчат и железист, непосредственно под ним развит тонкий слой нервных волокон, связанный спереди с нервами хобота (рис. 362, 4). Продольная мускулатура хобота продолжается позади этого органа в виде ретрактора. При помощи этого мускула хобот прикрепляется к спинной стенке хоботного влагалища приблизительно на границе между первой и второй третью длины тела. Ринхоцель также кончается несколько позади этого места.
Хобот является органом нападения и защиты. Он способен выворачиваться через ринхостом наподобие пальца перчатки. Совершенно замкнутый со всех сторон ринхоцель содержит бесцветную жидкость. Выворачивание хобота происходит благодаря давлению жидкости, которое вызывается сокращением мускулатуры стенок влагалища. Вворачивание хобота осуществляется сокращением мускулатуры его собственных стенок и ретрактора.
Паренхима. Полость тела у немертин отсутствует. Пространство между кожно-мускульным мешком и внутренними органами, в том числе ринходеумом и хоботным влагалищем, заполнено соединительной тканью паренхиматозного характера. У L. gesserensis она состоит из разветвленных клеток, лежащих в основном промежуточном веществе (см. рис. 360, 8).
Пищеварительная система. Пищеварительная система состоит из передней кишки, или. пищевода, средней кишки и короткой задней кишки.
У живых червей ротовое отверстие имеет форму удлиненной щели, расположенной на брюшной стороне как раз позади области головного мозга (см. рис. 365, 4). На фиксированных животных оно принимает округлую форму и окружено неровными складками.
Передняя кишка, называемая также пищеводом, выстлана высоким ресничным эпителием, образующим многочисленные продольные складки. Обильные железистые элементы этого эпителия представлены различными типами одноклеточных желез. Кроме того, большое количество железистых клеток залегает в соединительной ткани субэпителиально, окружая пищевод (рис. 363, Б, 18). Их тонкие протоки открываются в просвет последнего. Возможно, что железы передней кишки секретируют ферменты, поступающие затем вместе с пищей в среднюю кишку, где происходит переваривание и всасывание. На заднем конце пищевод сужен и сообщается со средней кишкой.
Длина пищевода приблизительно в три раза превосходит длину головной лопасти (см. рис. 365, 11). Средняя кишка проходит в виде
Рис. 363. Lineus gesserensis (по Паннету). А — поперечный разрез в области церебральных органов (Х45); Б — то же, в области ротового отверстия (Х45):
1 — ринхоцель, 2 — нерв хобота, 3 — спинной кровеносный сосуд, 4 — буккальная сосу-днстая комиссура, 5 — пищеводная нервная комиссура, 6—боковой нервный ствол. 7 — кутнс, 8 — церебральный ганглнй, 9 — церебральный канал, 10 — боковая кровеносная лакуна, 11 — эпидермис, 12— кольцевой слой мускулатуры, 13 — спинной нерв, 14 — хобот, 15 — эпителий пищевода, 16 — ротовое отверстие, 17— стоматогастрнческий нерв, 18 — субэпителиальные железы пищевода, 19 — внутренний продольный слой, 20 — нервный слой
прямой трубки через все туловище. Стенки ее образуют многочисленные метамерно расположенные боковые выпячивания, благодаря чему внутренняя поверхность кишки заметно увеличивается (см. рис. 365, 8). Кишка выстлана высоким ресничным эпителием, состоящим из узких, сильно сжатых клеток. Ядра занимают базальное положение. Плазма клеток содержит многочисленные округлые тельца, сильно красящиеся различными красками и представляющие собой белковые и жировые гранулы воспринятого питательного материала (см. рис. 368, А, 3). Самый задний, короткий отдел кишечника лишен боковых карманов и обозначается как задняя кишка. Анальное отверстие расположено терминально. Пищевые остатки в просвете кишечника на срезах наблюдаются редко, что, по-видимому, объясняется быстротой переваривания пищи ’.
Кровеносная система. Кровеносная система может быть изучена на сериях срезов, так как кровеносные сосуды на них хорошо видны. По строению стенок содержащие кровь полости разделяются на лакуны и сосуды. Первые развиты главным образом в головной лопасти
1 В полости кишки на срезах иногда попадаются паразитирующие здесь грегарины Diplocystis sp.
Рис. 364. Lineus gesserensis. A—поперечный разрез в области пищевода (Х40);
Б — то же, в области средней кишки (Х40) (по Паннету):
1 — спинной нерв, 2 — ринхоцельный эпителий, 3 — ринхоцель, 4— спииной кровеносный сосуд, 5 — полость пищевода, 6 — околопищеводные лакуны, 7 — нервный слой, 8 — боковой нервный ствол, 9— выводной канал протонефридия, 10 — канальцы протонефридия, 11 — боковая лакуна, 12 — кольцевой мускульный слой, 13— кутис, 14 — внутренний продольный мускульный слой. 15—дорзовентральная мускулатура, 16 — половой проток, /7 — яичник, 18 — боковой кровеносный сосуд, 19 — эпителий кишки, 20 — полость кишки
и в области передней кишки. Они окружены соединительной тканью и ограничены только тонкой мембраной. Сосуды развиты в области средней кишки и имеют более определенную гистологическую структуру. Полость их выстилается эндотелием с крупными ядрами. Эндотелий подстилается хорошо заметной мембраной, покрытой снаружи слоем крупных вакуолизированных соединительнотканных клеток с ясными границами (см. рис. 368, Б, 8). В прецеребральной области кровеносная система слагается из двух продольных боковых лакун, которые соединяются друг с другом на вершине головы поверх ринходеума. Вместе с влагалищем хобота они проходят сквозь нервное кольцо головного мозга (см. рис. 365, 17 и 5). На уровне вентральной церебральной комиссуры они связаны друг с другом медио-вентрально под ринхоцелем, образуя поперечную сосудистую комиссуру. От этой последней назад тянется медиальный дорзальный лакунарный канал (см. рис. 365, 6). Несколько сзади боковые лакуны образуют вторую вентральную комиссуру, от которой берут начало два маленьких буккальных сосуда, связанных с целой сетью лакун вокруг пищевода (рис. 364, А, 6). В области церебральных органов (см. ниже) боковые лакунарные стволы образуют расширения, охватывающие задние отделы этих органов (рис. 365, 14). Позади ротового отверстия боковые лакуны сообщаются с лакунарной сетью, прилегающей к пищеводу. На поперечных разрезах в этой области они отчетливо видны, отличаясь от других лакун большими размерами и более дорзальным положением (см. рис. 364, А, 11).
Дорзальный лакунарный канал у переднего конца внедряется в стенку хоботного влагалища и тянется назад медиально под ринхоцелем (см. рис. 364, А, 4). Непосредственно над ним—ринхоцельный эпителий, отделяющий его от ринхоцеля, принимает характер цилиндрического эпителия. Лакунарная сеть, окружающая пищевод, кончается вместе с этой
частью кишечника, а латеральные лакунарные каналы суживаются и
принимают характер не боковых нервных
8 9 10
Рис. 365. Lineus gesseren-sis. Схема организации (по Паннету):
/ — фронтальный орган, 2— глаза, 3— рииходеум, 4 — ротовое .отверстие, 5—боковая кровеносная лакуна, 6 — спинной сосуд, 7 — канал Протонефридия, 8 — боковой вырост кишки, 9 — сосудистая комиссура, 10—боковой сосуд, 11 — пищевод, 12 — протонефридий, 13 — боковой нервный ствол, 14 — церебральный орган, 15 — дорзальный церебральный ганглий, 16 — головная щель, 17 — головная боковая лакуна, 18 — ринхостом
сосудов. Эти последние проходят сначала на уров-стволов, но вскоре принимают более вентральное положение, проходя под средней кишкой недалеко от медио-вентральной линии (см. рис. 364, Б, 18). В этом же отделе тела спинной лакунарный канал выходит из стенки влагалища хобота, становясь настоящим сосудом. Его остальная часть лежит между влагалищем хобота и кишкой (см. рис. 364, Б, 4).
В области средней кишки латеральные и медиальный сосуды связаны серией поперечных сосудистых комиссур, проходящих между выпячиваниями кишки (рис. 365, 9). Они имеют лакунарную природу, но снаружи покрыты слоем вакуолизированных соединительнотканных клеток. Латеральные сосуды не имеют вентральных соединений.
Кровь бесцветна и содержит редкие форменные элементы. По дорзальному сосуду она течет назад, а по латеральным сосудам — вперед. Специальные органы дыхания отсутствуют, и газообмен происходит через покровы. Возможно, что кислород поступает также через стенку пищевода; за это говорит сильное развитие лакунарной сети вокруг этого органа.
Выделительная система. Органы выделения представлены протонефридиями, каналы которых лежат в передней части тела в непосредственной близости от латеральных кровеносных лакун. Они могут быть изучены на сре-
зах.
Протонефридиальные канальцы развиты только в области пищевода. Они начинаются несколько позади ротового отверстия и исчезают на том уровне, где латеральные лакуны принимают характер сосудов, а медиальный лакунарный сосуд выходит из стенки хоботного влагалища. Вместе с тем протонефридии лежат выше уровня боковых нервных стволов, никогда не располагаясь вентральнее околопищеводных лакун (см. рис. 364, А, 9 и 10). Каждый протонефридий слагается из тонкого ветвящегося канальца, прилегающего с внешней стороны к ла
теральной лакуне и снабженного выводным протоком. Последний направляется сквозь толщу кожно-мускульного мешка к наружному эпителию, прободает его и заканчивается на боковой поверхности тела несколько дорзально очень маленьким отверстием — нефропором.
Число протонефридиев, о котором можно судить по количеству выводных каналов, варьирует у разных особей и нередко неодинаково на одной и другой стороне одного и того же червя. Их бывает от 6 до 12 на каждой стороне. По-видимому, число протонефридиев увеличивается с возрастом животного. Нефридиальные канальцы состоят из кубического эпителия, который хорошо окрашивается самыми различными красками (см. рис. 368, В, 12). Протоплазма его клеток зерниста; ядра округлы. Иногда в просвете канальца видны длинные реснички (см. рис. 368, В, 11), в особенности вблизи слепых концов веточек нефридия, где они образуют пучок. Терминальные клетки с отчетливым мерцательным пламенем наблюдать не удается.
Нервная система. Центральная нервная система состоит из головного мозга, лежащего в головной лопасти, и двух продольных боковых стволов (рис. 365, 13 и 15). На срезах нервная система прекрасно видна. Головной мозг расположен впереди ротового отверстия (признак подкласса Anopla и состоит из пары спинных и пары брюшных церебральных ганглиев, рис. 366, Б, 8 и 10). Они связаны друг с другом короткими комиссурами, образуя нервное кольцо, сквозь которое проходит влагалище хобота (см. рис. 361, 4 и 8), но не передняя кишка, что так характерно для других червей. От задних концов вентральных церебральных ганглиев берут начало продольные нервные стволы (см. рис. 363, 6; рис. 364, 8). Граница между последними и ганглиями неяс-
Рис. 366. Lineus gesserensis (по Паннету). А — поперечный разрез вершины головного отдела (Х60); Б — то же, в области церебральных ганглиев (Х45):
1 — спинная бороздка головного отдела, 2 — фронтальный орган, 3 —кутис с железами, 4 — эпидермис, 5 — хобот, 6 — иерв хобота, 7 — ринхоцель, 8 —- вентральный церебральный ганглий, 9 — головная щель, 10 — дорзальный церебральный ганглий, 11 медиальный дорзальный нерв
на, так что трудно решить, где кончаются ганглии и начинаются стволы. Задние концы дорзальных ганглиев выдаются назад, образуя так называемые церебральные органы (см. ниже). Рекомендуется приготовить пластическую реконструкцию нервной системы (см. рис. 6).
Все ганглии головного мозга слагаются из центральной волокнистой части, представляющей сплетение нервных фибрилл и периферического слоя нервных клеток (рис. 366, Б, 8 и 10\ рис. 363, А, 8).
Боковые нервные стволы проходят вдоль всего тела. Они залегают между кольцевым и наружным продольным мускульными слоями кожно-мускульного мешка, а сзади соединяются тонкой коммиссурой, проходящей под задней кишкой. Гистология нервных стволов хорошо видна на поперечных и продольных срезах. Они состоят из внутренней зернисто-точечной части более или менее округлых очертаний, окруженной ганглиозными клетками (см. рис. 364, 8; рис. 360, 10, 12). Эти последние отсутствуют на внутренней стороне, обращенной к кольцевой мускулатуре, и немногочисленны снаружи.' Волокнистая сердцевина ствола одета очень тонким слоем — внутренней неврилеммой, которая отделяет ее от ганглиозных клеток (см рис. 360, 11). Снаружи ствол окружен таким же слоем — наружной неврилеммой (см. рис. 360, 9). Внутренняя неврилемма прободается нервными волокнами ганглиозных клеток, которые могут быть прослежены на продольных срезах на некотором расстоянии в волокнистой сердцевине ствола. Среди волокнистой ткани ствола разбросаны мелкие ядра, это ядра невроглиальных клеток, разветвленные отростки которых образуют опорную сеть.
Периферическая часть нервной системы хуже видна на срезах, но также может быть изучена довольно полно. От передних концов дорзальных церебральных ганглиев отходит несколько нервов, иннервирующих конец головной лопасти, фронтальный орган и глаза. Пара стома-тогастрических нервов отходит от задних концов брюшных ганглиев (см. рис. 363, Б, 17) \ они иннервируют кишечник. От этих же ганглиев берет начало пара нервов хобота (см. рис. 363, А, 2). На поперечном разрезе через переднюю часть хобота эти нервы хорошо видны, но в среднем отделе хобота они образуют сплошной нервный слой (см. рис. 362, 4). Наконец, в туловище между кольцевой и наружной продольной мускулатурой нетрудно обнаружить сплошной нервный слой (см. рис. 364, А, 7). Медио-дорзально он образует продольное утолщение, так называемый дорзальный нерв, связанный впереди с дорзальной комиссурой головного мозга (см. рис. 364, /; рис. 363, 13).
Органы чувств. Органы чувств Lineus представлены фронтальным органом, церебральными органами и глазами. Все они иннервируются от дорзальных церебральных ганглиев. Фронтальный орган состоит из трех небольших возвышений покровного эпителия, слагающихся из ряда высоких ресничных чувствительных клеток (см. рис. 365, 1). Медиальное возвышение расположено как раз над ринхостомом, латеральные— по сторонам от этого отверстия. Они способны несколько впячиваться и на срезах выглядят как маленькие ямки (см. рис. 361, 7; рис. 366, А, 2). Возле них располагаются отверстия головных желез, которые в виде небольших скоплений железистых клеток залегают субэпителиально в передней части головной лопасти над ринходеумом.
Фронтальный орган является хеморецептором, но имеет также и осязательную функцию.
Наиболее характерными органами чувств, свойственными немерти-нам, являются церебральные органы. У Heteronemertini они достигают высокого развития. На боковых поверхностях головной лопасти располагаются продольные головные щели (см. рис. 365, 16; рис. 366, Б, 9). На дне заднего отдела каждой щели имеется небольшое отверстие, ведущее в глубокий и узкий канал церебрального органа. Последний тес-
но связан с соответственным- дорзальным ганглием, проникая в его задний отдел. Ганглиозные клетки, окружающие канал, представляют собой собственно церебральный орган (рис. 367), который, таким образом, входит в состав дорзального церебрального ганглия, представляя его заднюю часть (см. рис. 363, А, 9). Вначале канал направляется назад, но затем загибается вперед и на внутреннем конце замкнут слепо (рис. 367, А, 3). В переднюю его часть, лежащую еще вне церебрального органа, открываются две группы грушевидных железистых клеток: одна непосредственно в начале канала, другая несколько сзади (рис. 367, А, 5, 4). Железы лежат внутри церебрального органа. Начальный отдел канала сформирован высоким ресничным эпителием без железистых элементов, но позади места впадения задней группы желез стенки канала имеют своеобразное строение. Как видно на срезах, на одной стороне они состоят из очень высоких клеток; их концы, обращенные в просвет канала, несут реснички (рис. 367, Б). На противоположной стороне канала клетки более специализированы. На поперечном срезе здесь различается пять таких клеток, одна средняя клетка,, по бокам от нее по одной узкой и по одной крупной широкой клетке. Дистальные концы этих пяти рядов клеток отделены друг от друга и от остального эпителия щелевидными пространствами и несут пучки слив
шихся ресничек (рис. 367, Б). Базальные отделы клеток состоят в тесной связи с нервными волокнами. Ганглиозные клетки церебрального органа образуют две группы. Одна из них занимает спинную, другая — брюшную часть органа; обе непосредственно связаны с ганглиозным слоем дорзального ганглия (см. рис. 363, А, 8; рис. 367, Л). Специализированные клетки церебраль-
Рис. 367. Церебральные органы немертин. А— схема фронтального разреза церебрального органа Heteronemertini (по Блоргеру); Б — поперечный разрез церебрального канала Lineus gesserensis (Х300) (по Паннету):
1 — дорзальный церебральный ганглий. 2— головная щель, 3 — церебральный канал, 4 — задняя группа желез, 5 — передняя группа желез
ного канала представляют собой рецепторные элементы. Церебральные органы являются очень чувствительными органами химического чувства.
Глаза расположены в
1
7
Рис. 368. Lineus gesserensis (ориг.). A— разрез яичника и боковых выпячиваний киш ки; Б — разрез кровеносного сосуда; В — разрез канала протонефридия:
1 — фолликулярные клетки, 2— соединительнотканная оболочка кишки, 3 — эпителий выпячивани средней кишки, 4 — железистая клетка, 5 — паренхима, 6 — ооциты, 7— соединительнотканная обе лочка яичника, 8 — базальная мембрана эндотелия, 9 —эндотелий, 10 — вакуолизированные соедр нительнотканные клетки, 11— реснички, 12— эпителий протонефридиальиого канала
передней части головной лопасти в соединительной ткани в количеств' 3—5 пар. Каждый глаз состоит из бокала пигментированных клеток внутри которого располагаются светочувствительные клетки. Тонко, строение глаз L. gesserensis еще недостаточно изучено. По всей вероят ности, они принадлежат к инвертированному типу.
Половые органы. Подобно громадному большинству немер тин, L. gesserensis — животное раздельнополое. Половой диморфизм от сутствует. Половые органы имеют чрезвычайно простое строение.
На срезах через половозрелых червей легко обнаруживаются гона ды. Они имеют вид более или менее округлых мешков и располагаютс: по бокам от средней кишки метамерно, чередуясь с боковыми кишечны ми выростами (см. рис. 364, Б, 17; 368, Д). Снаружи половые желез! одеты тонкой соединительнотканной оболочкой (рис. 368, А, 7). Кажда: имеет короткий простой половой проток (см. рис. 364, Б, 16), которы проходит сквозь стенку тела, заканчиваясь небольшим половым отвер стием. Последнее может быть обнаружено при изучении в лупу полове зрелых червей.
Период размножения L. gesserensis на Мурмане падает на июш Самки откладывают яйца на фукусах и под камнями. Кладки имеют ви колбасовидных слизистых шнуров, внутри которых находится больше количество яиц. Последние заключены по нескольку штук в особые обе лочки.
Другие немертины
Изучение организации немертин in vivo. Очень много дае изучение живых мелких форм под микроскопом или бинокуляро} но даже и они далеко не всегда достаточно прозрачны. Поэтому пр
рассматривании, как правило, следует придавливать червей между двумя стеклами. В качестве иллюстрации того, что можно увидеть при таком способе изучения, даем изображение организации Amphiporus lactifloreus Johnst. (отр. Но-plonemertini, сем. Amphiporidae, рис. 369).
Кожно-мускульный мешок. Строение кожно-мускульного мешка у немертин настолько разнообразно и характерно для разных групп, что послужило одним из основных признаков, на которых ряд авторов строили классификацию этого класса. Весьма также характерна глубина залегания центральной нервной системы. У низших форм она более или менее связана с эпидермисом и занимает более периферическое положение, нежели у высших.
Следует приготовить поперечные разрезы через среднюю часть тела следующих немертин; 1. Carinina grata Hubr. (подкл. Anopla, отр. Palaeonemertini, сем. Tubulanidae)—Черное море. 2. Се-phalotrix linearis Rathke (подкл. Anopla, отр. Palaeonemertini, сем. Cephalotrichi-dae) —Мурман, Белое и Черное моря. 3. Amphiporus lactifloreus Johnst. или другой вид этого рода (подкл. Enopla, отр. Hoplonemertini, сем. Amphiporidae) — Мурман, Белое и Черное моря.
Нужно разобрать эти поперечные разрезы, руководствуясь рис. 370, 371 и 372, и сравнить строение кожно-мускульного мешка всех этих форм друг с другом, а также с Lineus gesserensis Miill., обратив особое внимание на положение боковых нервных стволов.
Вооружение хобота Hoplonemertini. Интерес представляет особое вооружение хобота Hoplonemertini, отсутствующее у других немертин. Удобным объектом для изучения этого аппарата может служить один из видов рода Amphiporus, например A. lactifloreus Johnst., в изобилии встречающийся на Мурмане под камнями в отливной зоне, а также в Белом и Черном морях.
Рис. 369. Организация Amphiporus lactifloreus (по Бюргеру): 1 — фронтальный орган, 2 — ринхо-деум, 3 — церебральный орган, 4— протонефридии, 5 — боковой кровеносный сосуд, 6 — боковой нервный ствол, 7 — ринхоцель, 8 — хобот, 9 — стилет, 10— ретрактор хобота, 11 — баллон, 12 — кармашек с запасными стилетами, 13— яичник, 14 — боковое выпячивание кишки, 15—спинной кровеносный сосуд, 16 — передний слепой мешок кишки, 17 — дорзальный церебральный ганглий, 18— глаза, 19 ринхостом
Рис. 370. Carinina grata. Поперечный разрез (по Бюргеру):
1.— эпидермис, 2 — субэпителиальный основной слой, 3 — наружный кольХ цевой мускульный слой, 4— продольный мускульный слой, 5—внутренний кольцевой мускульный слой, 6 — передняя кишка, 7 — боковой нервный ствол, 8 — боковой кровеносный сосуд, 9 — ринхоцель, 10— хобот, 11 — медиальный .спинной нерв
Наиболее полное представление о вооружении хобота можно полу чить путем изучения срезов. Для этого следует зафиксировать хобо' Amphiporus, залить его в парафин и приготовить серию продольных сре зов через часть хобота, содержащую колющий аппарат. В результат) изучения срезов сделать графическую реконструкцию путем совмеще ния нескольких наиболее подходящих срезов (рис. 373).
Хобот Amphiporus, как и у других вооруженных немертин, делите; на три отдела. Передний отдел хобота наиболее длинен. Стенки ег< толсты и слагаются (при невывороченном хоботке) из внутреннего вы сокого железистого эпителия хобота, трех мускульных слоев и наруж ного плоского ринхоцельного эпителия (рис. 373, 4). Эпителий хобот; (рис. 373, 1) подстилается соединительнотканным слоем, являющимс: продолжением основного соединительнотканного слоя кожи, хорош; развитого у Amphiporus. Мускульные слои представлены внутренним i наружным кольцевыми слоями и средним — продольным (рис. 373, 2
Рис. 371. Cephalotrix sp. Поперечный разрез (ориг.):
1—эпидермис, 2 — субэпителиальиый основной слой, 3 — кольцевая мускулатура, 4 — продольная мускулатура, 5 — яичник, 6 — боковые нервные стволы, / — боковой кровеносный сосуд, 8 — средняя кишка, 9 — паренхима, /0 — боковой карман средней кишки, 11 — стенка ринхоцелома, 12 — ринхоцель, 13 — эпителий хобота, 14 — основной слой хоботного эттелля, 15 — продольная мускулатура хобота, 16 — кольцевая мускулатура хобота, 17 — спинной медиальный нерв
13, 3). В последнем залегают нервы хобота (рис. 373, 16). Только этот передний отдел хобота способен выпячиваться наружу, выворачиваясь наподобие пальца перчатки.
Следующий средний отдел снабжен характерным колющим аппаратом и распадается на две части:, переднюю и заднюю. Первая носит название диафрагмы и на своей передней стороне несет колющий стилет (рис. 373, 15). Стилет помещается в особом воронкообразном углублении, сообщающемся с полостью переднего отдела хобота. Толща диафрагмы прободается довольно тонким каналом, выстланным невысоким эпителием и называемым извергательным каналом (рис. 373, 8). Канал открывается рядом со стилетом и позади диафрагмы расширяется в пузыревидную полость, так называемый баллон (рис. 373, 10), который сзади в свою очередь связан с полостью заднего отдела хобота посредством более или менее длинного канала (рис. 373, 12).
Задний отдел хобота короче переднего. Стенки его тонки и слагаются из тех же слоев, что и стенки переднего отдела, но внутренний кольцевой слой отсутствует (см. рис. 373, И).
Рис. 372. Amphiporus sp. Поперечный разрез (орнг.): /—эпидермис, 2 — субэпителиальный основной слой, 3 — кольцевой мускульный слой, 4 — продольный мускульный слой, 5 — яичник, 6 — боковой нервный ствол, 7 — боковой кровеносный сосуд, 8 — средняя кишка, 9 — передний слепой карман кишки, /(7 — паренхима, 11— боковое выпячивание кишки, 12 — стенка ринхоцеля, 13 — ринхоцель, 14— хоботной эпителий, 15 — субэпителиальный основной слой хобота, 16 — продольная мускулатура хобота, 17 — кольцевая мускулатура хобота, 18 — нервы хобота, —медиальный кровеносный сосуд
Стилет представляет собой иглу, острие которой направлено вперед; он сидит на особом основании, вещество которого интенсивно окрашивается различными красками (рис. 373, 14). Основание стилета секретируется особыми грушевидными железистыми клетками, залегающими в толще диафрагмы. Содержимое их грубозернисто; тонкие протоки направляются к основанию стилета (рис. 373, 7). В толще диафрагмы по сторонам от стилета располагается несколько кармашков с запасными стилетами внутри (рис. 373, 6). Каждый кармашек — это одноклеточная железа, в которой образуются запасные стилеты. Последних обычно бывает несколько на разных стадиях образования (рис. 373, 5). Мускулатура диафрагмы образована продолжением продольной мускулатуры хобота. Мускульные волокна прикрепляются частью к основанию стилета и образуют под ним мускулистую подушку, а вокруг баллона — густое сплетение. В месте сообщения баллона с извергательным каналом и с полостью заднего отдела хобота имеются кольцевые мускульные пучки, играющие роль сфинктеров (рис. 373, 9).
Выворачивание хобота происходит лишь до диафрагмы. Когда пе-
редкий отдел выворачивается целиком, то стилет оказывается на конце выброшенного хобота. Хобот служит органом нападения на добычу. Стилет вонзается в тело жертвы, и в ранку через извергательный канал впрыскивается ядовитый секрет железистого эпителия заднего отдела хобота.
По строению колющего аппарата отряд вооруженных немертин (Hoplo-nemertini) делится на подотряды Polystylifera и Monostylifera. Первые имеют большое количество стилетов, сидящих на общем основании, вторые— только один действующий стилет. Amphiporidae относятся к этому последнему подотряду. Строение как самого хобота, так и его вооружения очень хорошо видно на свежем хоботе, отделенном от живой немертины и рассматриваемом под микроскопом между двумя стеклами.
Личиночные формы Nemertini
Работая летом на море, например на Мурмане, можно познакомиться с главнейшими формами личинок немертин. Для этого следует периодически просматривать живой планктон. Найденные личинки (рис. 374) изучают живыми под покровным стеклом. Если в распоряжении проходящего большой практикум имеется только фиксированный планктон с личинками немертин, то лучше изготовить из последних тотальные препараты, для чего наиболее пригодны личинки
Рис. 373. Средняя часть хобота Amphiporus sp. Графическая реконструкция по четырем срезам (ориг.): 1 — хоботной эпителий, 2 — кольцевой мускульный слой, 3 — продольный мускульный слой, 4 — ринхоцельный эпителий, 5 — запасные стилеты, 6 — кармашек запасных стилетов, 7 — железистые клетки, выделяющие основание стилета. 8 — извергательный канал, 9 ~ пучок кольцевых мускульных волокон, 10 — баллон, // — задний отдел хобота, 12— канал, соединяющий баллон с полостью заднего отдела хобота, 13— кольцевые мускульные волокна, 14 — основание стилета, /5 — стилет, 16 — нерв хобота
ПИЛИДИИ,
Пилидий по форме напоминает шлем или колокол, боковые участки которого продолжаются в две боковые, свисающие вниз лопасти (рис. 374, А, 11). Край колокола и лопастей окаймлен сплошным ресничным шнуром (рис. 374, А, 9). Вся поверхность личинки покрыта мелкими ресничками. На верхнем полюсе колокола находится утолщение покровов — теменная пластинка, снабженная теменным султаном ресниц (рис. 374, А, 1).
На нижней поверхности личинки, между основаниями боковых лопастей, располагается ротовое отверстие (рис. 374, А, 12), которое ве-
дет в короткую эктодермальную ресничную переднюю кишку (рис. 374, А, 13). Последняя открывается в округлую, слепо замкнутую среднюю кишку энтодермального происхождения; эпителий ее также ресничный (рис. 374, А, 2). Таким образом, на этой стадии развития задняя кишка и анальное отверстие отсутствуют.
Эктодерма пилидия представляет собой плоский ресничный эпителий, который заметно утолщен лишь в области теменной пластинки и ресничного шнура. Между стенками тела и кишечником развита первичная полость тела, заполненная рыхлыми звездчатыми мезенхиматоз-ными клетками и мускульными волокнами (рис. 374, Д, 17 и 18). Последние особенно многочисленны в боковых лопастях, которые играют роль плавательных придатков (рис. 374, Д, 7 и 10).
Развитие немертин, обладающих личинкой пилидием, носит ясно выраженный характер некробиотического метаморфоза. Во взрослого червя превращается лишь незначительная часть личинки; остальные ее части погибают. Центром, вокруг которого начинает формироваться тело будущего червя внутри пилидия, является эндодермальная средняя кишка. Эктодермальная стенка личинки образует особые впячивания числом семь, которые вскоре отшнуровываются от эктодермы и ложат-
Рис. 374. Личинки немертин (ориг.).
4 — пилидий: / — теменной султан, 2 —средняя кишка, 3 — ресничный покров эктодермы, 4 — спинной имагинальный мешок, 5—амниотическая полость спинного имагиналь-иого мешка, б— реснички мерцательного шнура, 7 — мускульные волокна боковых лопастей, 8 — соматические имагинальные мешкн, 9— ресничный шнур, 10— мускульные волокна лопастей, И — боковые лопасти, 12— ротовое отверстие, 13— передняя кишка, 14 — боковые имагинальные диски, 15 — головные имагинальные диски, 16 — зачаток хобота, 17 — мезен-химатозная клетка, 13—мускульные волокна;
Б — личинка Hoplonemertini и В — личинка Cephalotrix: / —передний султан, 2 — глаз, 3 — кишка, 4 — задний султан, 5 — вооружение хобота, 6 — хобот, 7 — личиночная эктодерма, 3 — дефинитивная эктодерма
ся возле кишки. Это так называемые имагинальные карманы. Шесть таких карманов возникают на нижней, ротовой стороне личинки: одна пара впереди ротового отверстия, другая — по бокам и третья — позади него. Помимо того, на задней стенке тела возникает седьмой имаги-нальный непарный дорзальный карман.
Отшнуровавшись от эктодермы, карманы превращаются в пузырьки, которые разрастаются в стороны по направлению друг к другу. Дно каждого пузырька утолщено по сравнению с другими частями их стенок и носит название имагинального диска. В конце концов имагинальные диски сливаются, образуя вокруг средней кишки сплошной слой дефинитивной эктодермы червя, а наружные стенки, слившись тоже, образуют тонкостенную оболочку — амнион, ограничивающую амниотическую полость. Между дефинитивной эктодермой и средней кишкой оказывается большая часть мезенхиматозных клеток. В основном сформированное уже внутри этой полости тело будущей немертины таким образом лишается связи с личиночной эктодермой и всеми остальными органами личинки.
Молодая немертина освобождается от покровов пилидия и растет в длину преимущественно в посторальной области, постепенно превращаясь во взрослое животное.
Имагинальные карманы, пузырьки и диски хорошо видны на живой личинке или тотальном препарате (рис. 374, А). Сравнивая их развитие у личинок различного возраста, легко представить весь процесс образования дефинитивной эктодермы и амниона.
Развитие других немертин совершается без стадии пилидия. У некоторых Heteronemertini, например у Lineus gesserensis, хотя из яйца выходит молодая немертина, в общем похожая на взрослую, тем не менее в яйцевых оболочках протекает особая стадия так называемой Де-зоровской личинки, которая отвечает стадии пилидия и характеризуется образованием имагинальных дисков.
Молодые плактонные стадии Nemertini
Очень часто в планктоне попадаются молодые стадии развития немертин, развивающихся без личинки пилидия и претерпевающие эво-лютивный метаморфоз. Таковы молодые стадии Hoplonemertini и Cepho-lotrix. Эти формы выходят из яйца в виде свободноплавающей личинки удлиненной или овальной формы (рис. 374, Б, В). Тело таких'личи-нок покрыто ресничками, а на переднем конце несет провизорный орган чувств с пучком длинных ресниц (рис. 374, Б, В, 1). Такой же пучок ресниц имеется и на заднем конце тела (рис. 374, Б, В, 4). Организация таких личинок в общем близка к таковой взрослых червей. Имеется уже хобот и ряд других органов (рис. 374, Б, В, 6).
Интересно, что в развитии Cephaloirix наблюдается некробиотичес-кий метаморфоз. У этой формы личиночная эктодерма при превращении сбрасывается, и под ней образуется новая дефинитивная. Нередко попадаются такие стадии, когда под личиночной эктодермой можно видеть дефинитивную, так же покрытую ресничками, как и первая (рис. 374, В, 8).
Тип Nemathelminthes — первичнополостные черви; немательминты
КЛАСС NEMATODES — КРУГЛЫЕ ЧЕРВИ, ИЛИ НЕМАТОДЫ
Объел? практикума не позволяет подробно рассмотреть все разнообразие обширной группы круглых червей. Поэтому ограничимся детальным разбором одного хорошо изученного крупного объекта — аскариды. Далее кратко разберем трихину и одну из почвенных нематод. На последнем объекте хорошо видны особенности строения свободно-живущих круглых червей.
Ascaris suum Goeze — свиная аскарида, или Parascaris equorum (Goeze) (= Ascaris megalocephala Auct.)—лошадиная аскарида
Материал и методы изучения. Свиная аскарида относится к сем. Ascaridae, отр. Ascaridida, подкл. Secernentea. Она паразитирует в тонких кишках свиньи и в некоторых местностях очень обычна. Материал приходится добывать с бойни. Если нельзя достать именно эту форму, то можно заменить близкой к ней лошадиной аскаридой — Parascaris equorum (Goeze) (= Ascaris megalocephala Auct.), которую удается получить на бойне главным образом от старых и покалеченных лошадей. Анатомически эта аскарида очень близка к Ascaris suum, так что все сказанное ниже применимо к обоим указанным видам.
Изучение ведут in toto на вскрытии и на разрезах. В первом случае полезно части тела, подвергающиеся изучению, просветлить в молочной кислоте (неразведенной), куда объект переносят на несколько часов из воды, спирта или формалина. После изучения объект может быть сохранен и дальше. Для этого его следует перенести обратно в консервирующую жидкость.
Вскрытие лучше производить на свежем нефиксированном объекте. При этом следует .иметь в виду ядовитые свойства полостной жидкости аскариды. Попадая случайно на слизистые оболочки, она вызывает сильное их воспаление. Жидкость в полости тела находится под некоторым давлением (тургор), поэтому при первом надрезе покровов она обычно выпрыскивается наружу. Чтобы избежать попадания жидкости в глаза и т. д., рекомендуется начинать и проводить вскрытие под водой. Вскрытие в фиксированном состоянии дает худшие результаты, но в ряде случаев приходится ограничиваться именно таким материалом, пользуясь аскаридами, фиксированными 4%-ным формалином или лучше спиртом. В последнем случае следует поместить их сначала в 5%-ный спирт на месяц, а затем постепенно перевести в 50%-ный спирт. При этом проще всего время от времени понемногу подливать крепкий спирт в сосуд с аскаридами, чтобы возрастание крепости спирта происходило постепенно.
Материал для разрезов фиксируют небольшими кусочками в жидкости Джильсона или Ценкера с формалином. Ввиду плотности кутикулы, плохо режущейся при простой заливке в парафин, следует применить комбинированную заливку в целлоидин-парафин по Петерфи или просто в целлоидин. Толщина целлоидиновых срезов должна быть не меньше 40—50 мкм, если желательно получить полные срезы через червя. При заливке в парафин (даже с целлоидином) полные срезы получают с большим трудом (толщина максимум 15—20 мкм). Для поперечных срезов лучше использовать самку, что дает возможность наряду с изучением гистологии детально познакомиться с половой системой, более сложно устроенной именно у нее.
Окраска срезов производится гематоксилином (несколько препаратов рекомендуется окрасить железным гематоксилином). Иногда хорошие результаты дает предварительная окраска кусочков борным кармином, и тогда срезы заделывают в препарат без дополнительных окрасок.
Внешняя морфология. Тело аскариды сильно вытянуто в длину, су-
живается равномерно к обоим концам и представляется веретеновидным
(правильно округлым в сечении, рис. 375). По форме и размерам у ас-
карид наблюдается довольно резко выраженный половой диморфизм.
Самка имеет прямое тело, достигающее в длину у взрослой лошадиной аскариды 18—37 см, у Ascaris lumbricoides и A. suum— до 40 см. Толщина при этом 5—6 мм. У самца задний /1
конец тела загибается крючком на брюшную сторону II
(рис. 375, Л) и в околоанальной области расположе- 1
ны многочисленные половые сосочки (см. ниже). Кро- /
ме того, самцы значительно мельче самок и длина их .
колеблется от 15 до 25 см (Parascaris equorum). j
Ротовое отверстие занимает терминальное поло- j
жение между тремя губами, сидящими на обособлен- / ?
ном посредством пережима переднем конце тела, так называемой «голове». Анальное отверстие распола- \
гается несколько впереди от заднего конца тела по j
брюшной стороне и имеет форму поперечной щели. I
Позади него обособляется хвостовой отдел тела. ; 1
У самки в передней трети тела на брюшной стороне * часто даже невооруженным глазом заметно женское II
половое отверстие со слегка приподнятыми над по- ц
кровами краями. Наконец, на вентральной же сторо- ; .
не, впереди, около самой шейки, отделяющей «голову» s
от тела (приблизительно на расстоянии 2 мм от голов- \ j ного конца), можно при внимательном изучении под (
лупой или бинокуляром заметить и выделительное ' :
отверстие. :
Изучение околоротовых выростов «головы» — |
именно губ — удобнее проводить, отрезав «голову» .
от тела, просветлив ее молочной кислотой и ориенти-ровав вершиной кверху. Ротовое отверстие тогда ока- А
зывается в центре, имея форму трехгранной щели (рис. 376). Губы вокруг рта располагаются следующим образом: одна, дорзальная, лежит над ротовым отверстием, две другие, по размерам несколько меньшие, занимают боковое положение с вентральной стороны. На каждой губе по медианной поверхности
Рис. 375. Parasca-ris equorum. Внешний вид. А — самец; Б — самка (2/з натур, велич.) (из кн. Скрябина и Ершова)
проходит горизонтальная борозда, отделяющая особую внутреннюю лопасть треугольной формы (рис. 376, 2). Край этой лопасти зазубрен. Внутри на просветленном препарате видна лежащая под кутикулой губы гиподерма (так называемая пульпа губы) в виде двух лопастей. Далее следует обратить внимание на чувствительные сосочки на поверх-
ности губ. Два двойных сосочка расположены симметрично у основания
Б
Рис. 376. Parascaris equorum. Строение губ, расположенных вокруг ротового отверстия. А — вид спереди (Х60) (из кн. Скрябина и Ершова); Б — вид. с брюшной стороны (Х40) (из кн. Иорка и Моплестона):
1 — горизонтальная борозда губы, 2 —внутренняя лопасть губы, 3 — ротовое отверстие, 4— пульпа губы, 5 — двойной чувствительный сосочек вентральной губы, 6 — одиночные чувствительные сосочки, 7 — промежуточная губа, 8 — двойной сосочек дорзальной губы, 9 —глотка
дорзальной губы ближе к ее краям (рис. 376, 8). На боковых губах такой двойной сосочек виден один — у основания губы приблизительно посредине (рис. 376, 5). Кроме него два простых сосочка приближены к дорзальному краю каждой из этих губ (рис. 376, 6). В промежутке между губами на «голове» слегка выдаются в сторону от ротового отверстия так называемые промежуточные губы.
Задний конец самки — хвост — имеет конический, закругленный на конце отросток и два довольно крупных боковых чувствительных постанальных сосочка (рис. 377, Л).
У самца задний конец тела слегка расширен, образуются небольшие боковые крылья (рис. 377, Б). На заднем конце тела у самца следует обратить внимание на так называемые половые сосочки в количестве 80—105 пар. Из них семь пар — постанальные, остальные преаналь-ные. Среди постанальных выделяется вторая пара (считая сзади) — конические и сдвоенные — четвертая и пятая, шестая и седьмая пары. Среди преаналь-ных, расположенных попарно, выделяется один непарный сосочек, сидящий на самом краю анального от-
верстия (рис. 377, Б). Если рассматривать просветленный задний конец, то внутри видны две спикулы равной величины, больше 2 мм в длину, слегка изогнутые вентрально. Иногда они высовываются наружу через анальное отверстие.
Сквозь покровы аскариды просвечивают перевитые клубками отдельные части половой системы. Кроме того, просвечивают четыре валика гиподермы (см. ниже), разделяющие кожно-мускульный мешок на четыре продольные ленты. Лучше видны боковые валики в виде боковых линий. Спинной и брюшной валики более узки по сравнению с боковыми.
Закончить внешний осмотр аскариды следует констатированием заметной под лупой кольчатой штриховатости кутикулы.
Вскрытие аскариды. Вскрытие производят со спинной стороны, которую и следует прежде найти у червя. У самца спинная сторона выявляется проще всего тем, что задний конец тела загнут на брюшную сторону. У самки для ориентировки животного приходится найти на брюшной стороне тела половое отверстие. Ориентировать тело аскариды можно также по боковым линиям, располагая его так, чтобы при боковом положении этих линий сверху на «голове» была бы одна губа (дорзальная), снизу — две (вентральные). Следует помнить, что анальное отверстие смещено на брюшную сторону.
Вскрытие начинается с середины тела. Поместив аскариду в ванночку для вскрытия (с восковым дном) спинной стороной кверху, двумя пальцами следует прижать ее к воску и провести острым скальпелем надрез покровов длиной 2—3 см. Края надреза отводятся в сторону и прикалываются к воску так, чтобы головки булавок были направлены в сторону от линии надреза. Булавки для этого вкалывают косо, чтобы они не мешали дальнейшей препаровке и рассматриванию внутренностей объекта. Разрез далее производят ножницами с тонкими концами вплоть до переднего и заднего концов тела червя. При этом всякий раз, как разрезается некоторый участок покро-
Рис. 377. Parascaris equorum. Морфология заднего конца (из кн. Скрябина и Ершова). А — у самки, вид сбоку; Б — у самца, вид с брюшной стороны (X 100): / — задняя кишка, 2 — анальное отверстие, 3 — боковой постанальный чувствительный сосочек, 4 — спикулы, 5 — преаналь-ные чувствительные сосочки, 6— постанальные шестая и седьмая пары сдвоенных сосочков, 7 — четвертая и пятая пары сдвоенных сосочков, 8—третья пара простых сосочков, 9 — вторая пара конических сосочков, 10 — первая пара простых сосочков, 11 — боковые крылья
bob, края разреза раздвигают и прикалывают булавками. При раздвигании краев разреза неизбежно разрушается та нежная изоляционная ткань, которая была описана Гольдшмидтом (1908) и которая в виде тонких лопастей соединительнотканного характера выполняет промежутки между отдельными органами. Лопасти эти лучше видны в передней части тела, далее же назад изоляционная ткань развита слабее.
После того как будет сделан разрез, следует приступить к препаровке половой системы. Последняя имеет трубчатый характер и петли ее оплетают со всех сторон кишечник и переплетаются друг с другом. Основное орудие при этом — препаровальные иглы. У живой (свежей) аскариды при их помощи в воде без повреждений (или, правильней, с минимальным их количеством) удается распутать многочисленные петли половых органов. У фиксированных объектов без повреждений отпрепарировать половую систему невозможно. Следует проследить все отдельные части половой системы (рис. 378).
У самки она парная, но открывается наружу единственным половым отверстием в передней трети тела. К половому отверстию подходит так называемое влагалище (vagina), короткая суженная на конце
Рис. 378. Parascaris equorum. Общий вид вскрытого червя (ориг.).
А— самка: 1 — губы, 2— нервное кольцо, 3 — глотка, 4— фагоцитарная клетка, 5 — пищевод, 6 — кишка, 7 — боковая линия, 3 — яйцевод, 9~ матка, 10 — яичник, 11— влагалище, 12— брюшной нервный ствол;
Б — самец: / — глотка, 2—пищевод, 3 — фагоцитарная клетка, 4 — кишка, 5 семяпровод, 6 — семенник, 7 —• семяизвергатель* ный канал
трубка. Влагалище формируется за счет слияния двух наиболее толстых составных частей половой системы — маток. Каждая из них тянется по бокам от кишечника, ближе к вентральной стороне, и, слегка изгибаясь зигзагообразно, доходит до заднего конца тела и поворачивает вперед. Матки на всем протяжении имеют более или менее одинаковый диаметр. После загиба они довольно резко суживаются, превращаясь в яйцеводы (oviducti). Каждый яйцевод в отличие от матки чрезвычайно извивается, образуя петли, его колена направляются то назад, то вперед. Постепенно яйцевод становится уже и без резкого перехода превращается в тончайшую нитевидную часть — яичник (ovarium), который также делает многочисленные петли и переплетается с остальными частями половой системы. Более точное разграничение вех трех составных частей половой трубки удастся сделать при изучении поперечных разрезов.
Мужская половая система непарная. Семяизвергательный канал (ductus ejaculatorius) вливается своим суженным концом в задний конец кишечника — клоаку, к которой он подходит с вентральной стороны. Семяизвергательный канал облекается со всех сторон складками кишечника, из-под которых его и следует высвободить. Он представляет собой цилиндрическую совершенно прямую трубку, по диаметру мало уступающую диаметру кишечника и тянущуюся вдоль приблизительно до середины тела. Трубка эта здесь резко сужается, превращаясь в семяпровод (vas deferens). Последний сильно извивается, образует многочисленные петли и, постепенно утончаясь, превращается в нитевидный семенник. Общая длина трубки мужской половой системы превышает длину тела аскариды по крайней мере в 5—6 раз (что может быть отнесено также к длине трубки женской половой системы).
После препаровки половой системы следует заняться разбором пищеварительной системы.
От ротового отверстия непосредственно начинается мускулистая глотка, округлая в сечении, длиной около 1 см. Вслед за глоткой начинается средняя кишка, передняя четверть которой сплющена дорзовент-рально; стенки ее в этом месте поперечно складчаты. Этот отдел носит не совсем правильное название пищевода. Собственно средняя кишка тянется вдоль всего тела, она совершенно прямая и стенки ее имеют глубокие продольные складки. Задняя кишка, резко не обособленная у самок, у самцов, наоборот, превращается в клоаку и, отделенная от средней кишки кольцевой складкой, подходит к анальному отверстию. Кроме того, у самцов следует отметить короткое влагалище спикул, открывающееся в клоаку с дорзальной стороны, ближе к анальному отверстию.
Рассмотрев половую и пищеварительную системы, их следует осторожно удалить из полости тела: особенно аккуратно следует обращаться с глоткой, которую нужно отделить от пищевода и оставить пока на месте. Тогда будут хорошо видны боковые линии, более широкие, и брюшная линия, более узкая, где проходит брюшной нервный ствол. В передней части тела, в области пищевода, к боковым линиям прилегают крупные фагоцитарные клетки обычно в количестве четырех (рис. 379). Расположены они чаще асимметрично и иногда в неполном
Рис. 379. Parascaris equorum (из кн. Насонова).
Д — фагоцитарные клетки на вскрытом черве (натур. велич.): 1 — глотка, 2— пищевод, 3 — фагоцитарные клетки, 4 — боковые линии, 5 — нервный ствол;
Б — отдельная фагоцитарная клетка (Х20): 1 — ядро, 2 — отростки
количестве (3, 2 и даже 1). Форма фагоцитарных клеток звездчатая (рис. 379, 5) с многочисленными тонкими отростками, цвет желтоватый, буроватый. Весьма полезно рассмотреть эти клетки отдельно, выделив их из полости тела. На тотальном препарате, окрашенном кармином, в такой клетке можно обнаружить ядро. Фагоцитарная природа этих клеток выявляется отчетливо, если живой аскариде впрыснуть в полость тела тонкую густую взвесь растертой в воде китайской туши или кармина в количестве Чг—1 см3. Впрыскивание удобнее производить шприцем вблизи заднего конца тела, глубоко вводя иглу параллельно поверхности тела1. После 6—12-часового выдерживания червя в физиологическом растворе в термостате при температуре 37°С на вскрытой аскариде уже можно наблюдать концентрацию введенных частичек в плазме фагоцитарных клеток, которые окрашивают в соответствующий цвет.
Далее следует заняться
изучением центральной нервной системы и концевого аппарата выделительной системы. Для этого разрез покровов должен быть доведен осторожно до самых губ. Тогда на расстоянии приблизительно 2 мм от переднего конца тела можно увидеть нервное кольцо, вплотную прилегающее к глотке. С вен-
тральной стороны, где от нервного кольца отходит сравнительно толстый брюшной нервный ствол, можно обнаружить вентральный двухлопастный ганглий. Боковые сосуды выделительной системы подходят как раз к лопастям ганглия с вентральной стороны (рис. 380): правый из них подходит (у Р. equorum) затем к левому, образуя поперечную
1 Чтобы взвесь вместе с полостной жидкостью не вылилась через место укола, аскариду впереди отверстия от иглы шприца можно туго перетянуть ниткой, хотя опыт удается и без этого.
Рис. 380. Parascaris equorum. Передний конец червя, вскрытый по спинной стороне и развернутый (Х5) (из кн. Гольдшмидта):
1 — брюшной нервный ствол, 2 — окологлоточное нервное кольцо, 3— левый боковой валик гиподермы, 4 — элементы изоляционной ткани, 5 — левый выводной проток выделительной системы, б-—рудимент переднего продольного канала, 7 — ядро выделительной клетки, 8 — задний продольный канал выделительной системы, 9 — поперечная перемычка выделительной системы
Рис. 381. Концевые отделы выделительной системы после инъекции anilinblau. А — Ascaris lumbricoi-des; Б — Parascaris equorum (X20) (из кн. Мюллера):
1 — изоляционная ткань, 2 — левый выводной проток выделительной системы, 3 — рудимент переднего продольного канала, 4 — местоположение ядра, 5 — задний продольный канал выделительной системы, 6 — поперечная перемычка выделительной системы, 7 — рудимент правого выводного протока
перемычку, левый же идет вперед, образуя асимметрично расположенный непарный выводной проток (рис. 381, Б, 2), открывающийся наружу выделительной порой почти под самым нервным кольцом. У А. 1ит-bricoides также выражен асимметричный характер выводной части выделительной системы, но правый сосуд от перемычки идет вперед и образует слепой вырост (рис. 381, А, 7). Левый сосуд вперед от перемычки также отдает слепой вырост, соответствующий переднему каналу других нематод (например, Anguillulata, Oxyuridae, Strongylidae). Перед поперечной перетяжкой левый боковой канал слегка вздувается, чем обозначается местоположение ядра (рис. 380, 7; рис. 381, 4)1.
1 Приводимые рисунки Гольдшмидта (1906) и Мюллера (1929) несколько не совпадают в деталях расположения канальцев. На рисунках первого они расположены симметрично, но изучение велось на окрашенных плоскостных тотальных препаратах. Поправки второго базируются иа инъекциях выделительной системы с помощью микроманипулятора. В условиях практикума эти инъекции едва ли удается воспроизвести, а без них тонкие различия по обеим схемам уловить можно с трудом.
Рис. 382. Parascaris equorum. A — продольный разрез кутикулы (из кн. Гольдшмидта); Б — кожно-мускульный мешок на поперечном срезе (Х335) (скомбинировано по Гартману и Шнейдеру):
1 — наружный слой кутикулы из кольцевых лент, 2— наружный корковый слой, 3— внутренний корковый слой, 4 — фибриллярный слой, 5 — гомогенный слой, 6 — внутренний слой из кольцевых лент, 7—волокнистый слой, 8 — базальный слой кутикулы, 9 — пограничная мембрана, 10 — гиподерма с фибриллами и ядрами, 11 — корковый слой (сократимые фибриллы) сократимой части мышечного волокна, 12— саркоплазматический слой сократимой части мышечного волокна, 13—ядро мышечной клетки, 14 — саркоплазматический мешок в поперечном разрезе, 15— саркоплазматический мешок мышечного волокна, 16—плазматический отросток мышечного волокна
Заканчивая вскрытие, следует отметить шероховатость внутренней стенки тела, обусловленную присутствием выдающихся в полость тела отростков мускульных клеток.
Изучение срезов. Дальнейшее изучение анатомии аскариды следует провести на срезах поперечных и продольных. Структуру отдельных органов рассматривают на срезах через середину тела.
Кожи о-м ускульный мешок. У аскариды кожно-мускульный мешок состоит из кутикулы очень сложной структуры, субкутикулярной гиподермы и кожной мускулатуры из одного слоя продольных мышц.
Кутикула. С наружной поверхности тело покрыто очень толстой многослойной кутикулой. Ее изучение приходится вести как на поперечных, так и на продольных срезах. Последние дополняют общую картину в весьма существенных подробностях. Детали лучше всего удается разобрать на препаратах, окрашенных железным гематоксилином, применяя иммерсионную систему. Общее расположение слоев кутикулы, начиная снаружи, следующее (рис. 382). Наружный, самый тонкий слой, не является сплошным, он слагается из отдельных лент, образующих кольца. Наличие их обусловливает полосатую штриховку кутикулы, отмеченную выше при внешнем осмотре аскариды. На поперечных разрезах этот слой кажется сплошным, прерывистая же его природа выступает на продольных разрезах (рис. 382, А). Следующий слой корковый, один из сравнительно тонких слоев кутикулы, подразделяется на наружный и внутренний пласты. Наружный гомоген-
ный— тоньше. Внутренний обладает штриховкой, направленной перпендикулярно к оси тела. Такое подразделение коркового слоя удается рассмотреть на поперечных разрезах. Далее фибриллярный слой, также тонкий, пронизанный сложной сетью фибрилл. Снаружи этот слой отграничен довольно резко, кнутри же его фибриллы переходят в соседний слой (гомогенный), и резкой границы здесь не заметно. Этот слой хорошо выделяется на продольных разрезах. На поперечных он сливается с подлежащим ему слоем. Следующий слой — гомогенный, наиболее толстый. На продольных разрезах видно, что через него перпендикулярно поверхности тела проходят фибриллы. Гомогенный слой подостлан тонким слоем, разбитым на кольцевые ленты и плохо заметным на препаратах. Далее видны три толстых волокнистых слоя: наружный, средний и внутренний, из которых последний, по сравнению с другими, более тонкий. Эти слои составлены из волокон, . проходящих главным образом перпендикулярно поверхности тела. Далее следует базальный слой с поперечной штриховкой, являющийся одним из тонких слоев, и, наконец, от гиподермы кутикула отделяется еще бесструктурной пограничной мембраной.
Итак, имеются следующие слои кутикулы: 1. Наружный из кольцевых лент. 2. Корковый: а) наружный, б) внутренний. 3. Фибриллярный. 4. Гомогенный. 5. Внутренний из кольцевых лент. 6 Волокнистый: а) наружный, б) средний, в) внутренний. 7. Базальный. 8. Пограничная мембрана.
Материал кутикулы — корнеин, вещество белковой природы, близ
кое к коллагену и эластину, растворимое в едких щелочах (Мюллер, 1929).
Гиподерма. Непосредственно под кутикулой залегает гиподерма. У молодых животных это слой явно эпителиальной природы, и можно хорошо различить клеточные границы. У взрослых животных гиподерма приобретает характер синцития с мелкими округлыми ядрами, разбросанными в его плазме. Толщину синцития пронизывают многочисленные поддерживающие фибриллы, главная часть которых проходит поперек гиподермы перпендикулярно к кутикуле, собирается пучками и связана, с одной стороны, с кутикулой, с другой — с оболочкой мышечных клеток, прилегающих к гиподерме (рис. 383). Гиподерма сплошным слоем под
Рис. 383. Parascaris equorum. Гиподерма на поперечном срезе (Х1000) (из кн. Дейнеки): / — кутикула. 2 — ядро гиподермального синцития, 3 — фибриллы гиподермы, 4 — оболочка мышечного волокна, 5 — сократимые ленты мышечного волокна, 6— поддерживающие фибриллы мышечного волокна
стилает кутикулу и имеет толщину, составляющую менее ’/4 всей толщины кутикулы. В четырех местах, именно по середине спинной и брюшной сторон и на обоих боках тела, гиподерма резко утолщается, образуя так называемые гиподермальные валики. Эти-то валики и просвечивают у целой аскариды при внешнем осмотре в виде продольных линий. Медианные валики меньше по своим размерам (они уже латеральных)) и имеют на поперечном разрезе грушевидную форму, выдаваясь расширенной частью над уровнем слоя мышечных элементов. Расширенная часть медианных валиков содержит главные продольные нервные стволы, волокна которых погружены в общую синцитиальную массу и выглядят на срезах в виде неокрашенных овалов и кругов различной величины (рис. 384). При этом вентральный нервный слой толще дорзального,
Рис. 384. Parascaris equorum. Медианный валик гиподермы на поперечном разрезе (Х400) (из кн.
Гофмана):
I — плазматические отростки мышечных волокон, 2 — нервные волокна, 3 — масса гиподермального валика, 4 — мышечные клетки, 5 — гиподерма, 6 — кутикула
Рис. 385. Parascaris equorum. Боковой валик ги-подермы на поперечном разрезе (Х500) (нз кн.
Шнейдера):
/ — внутренний слой кутикулы, 2 — железистая плазма, 3 — срединные клетки бокового валика, 4 — сублатеральный нерв, 5 —канал выделительной системы
поэтому на срезе через вентральный валик обнаруживается большее количество перерезанных волокон.
Боковые валики значительно шире по сравнению с медианными. Фибриллы гиподермы переходят в них и распределяются гуще под поверхностью валика и по его середине — получаются два участка грубоячеистой плазмы, расположенные ближе к основанию валика (рис. 385). Этим участкам приписывается секреторная функция (Гольдшмидт, 1906).
Вдоль свободного края бокового валика тянется канал так называемой выделительной системы. Стенки этого канала внутри выстланы тонкой кутикулой, под которой видна плазматическая стенка со слабо выраженной радиальной штриховатостью. Просвет каналов может быть самой различной формы и чаще сплющивается с боков благодаря давлению внутренних органов на боковые валики. Оба выделительных канала аскариды — производное одной-единственной клетки, ядро которой прилегает спереди к левому каналу. Штриховатая стенка канала есть не что иное, как плазма этой клетки; просвет канала, таким образом, является внутриклеточным. Выделительные каналы в силу указанного строения гомологичны шейной железе других круглых червей. Выделительная функция каналов сомнительна. Ряд авторов, начиная с Головина (1901—1902), описывают выделение раствора красителя, впрыснутого в полость тела, через выделительную пору. Мюллер же (1929) категорически отрицает выделительную функцию на основании ряда экспериментов — в стенке каналов и их просвете не наблюдалось концентрации витальных красителей, впрыснутых в полость тела, тем более их выведения через выделительную пору. Жидкость в просвете канальцев оказалась щелочной реакции (pH колебался от 7 до 8), т. е. выделение валерьяновой и других кислот, характерных для экскретов аскариды, происходит, видимо, не через каналы боковой линии. Несомненна только железистая природа этих каналов.
В толще боковых валиков разбросаны ядра боле крупные, чем в остальной гиподерме, проходят отдельные нервные волокна и, наконец, хорошо виден ряд обособленных клеток, тянущихся вдоль всего бокового валика, и прилегающих посредине непосредственно к кутикуле (рис. 385, 3).
Кожная мускулатура. Продольные мускульные волокна прилегают вплотную в один слой непосредственно к гиподерме. Продольными валиками последней весь кожно-мускульный мешок разбивается на четыре квадранта (см. рис. 392), тянущихся в виде двух латеродор-зальных и двух латеровентральных мышечных полей (лент) вдоль всего тела.
Внешнюю форму отдельных волокон можно рассмотреть на изолированных мышечных клетках. Для этого куски стенки тела длиной около 1 см переводят в глицерин и разрезают ножницами вдоль. Препаровальными иглами отделяют кутикулу и мышечные элементы расщепляют вдоль. Из выделенных клеток можно изготовить неокрашенные тотальные препараты, заключенные в глицерин-желатин. Хорошие результаты также дает мацерация стенки тела фиксированной аскариды 30%-ным едким кали в течение 30 мин. При этом разрушается кути-
\\ кусочка в пробирке
удается отделить мышечные клетки друг от друта-Ттосле лото -аак. клетки осядут на дно, едкий кали сливают и материал многократно промывают в воде. Из него можно изготовить тотальные, окрашенные гематоксилином и заключенные в бальзам препараты. «Третной» (т. е. 33%-ный) спирт, по Ранвье, также мацерирует мышечные элементы.
Каждая мышечная клетка состоит из мышечного волокна правильной веретеновидной формы, саркоплазматического мешка и длинных
Рис. 386. Parascaris equorum.. А, Б — вид мышечных волокон на тотальном препарате, окрашенном метиленовой синькой (ХЗО) (из кн. Дейнеки); В, Г — изолированные мацерацией мышечные волокна (Х50) (из кн. Гартманна):
/ — сократимая часть мышечной клетки, 2 — саркоплазматический мешок мышечного волокна, 3— плазматические отростки мышечных волокон, 4 — ядро мышечной клетки
плазматических мышечных отро-стков (рис. 386). Мышечное волокно достигает в длину 3 мм, постепенно заостряется на концах, сильно сплющено с боков (что хорошо будет видно дальше на срезах) и является сократимой частью клетки. К гиподерме прилегает только центральная утолщенная часть волокна, заостренные же концы отступают от гиподермы, вплотную прилегая к соседним мышечным волокнам. От мышечного волокна посредине отходит саркоплазматический мешок (рис. 386, 2), объемистый участок протоплазмы, сильнее развитый у клеток передней части тела. Ширина мешка значительно превосходит ширину волокна (см.срезы).
От саркоплазматического мешка обычно отходит несколько длинных плазматических отростков (рис. 386, 3). Они отходят перпендикулярно к волокну, вытягиваются по кривизне стенки тела и чаще достигают гиподермы одной из срединных линий, реже заканчиваются, не доходя до нее, и соприкасаются с подобными же отростками других мышечных клеток или же переходят в саркоплазматические мешки мышечных клеток соседнего квадранта. Длинные плазматические отростки на концах обычно древовидно разветвляются (рис. 386, А, 3). Этими разветвлениями отростки тесно прижимаются к поверхности медианных валиков гипо
дермы. Дейнека (1912) на основании изучения препаратов, окрашенных прижизненно метиленовой синькой, категорически отрицает непосредственную связь разветвлений мышечных отростков с нервными волокнами, отрицая этим самым и описываёмое ранее иннервационное значение мышечных отростков. Напротив, им описываются обычные для других животных концевые нервные аппараты, которыми заканчиваются двигательные нервные волокна, иннервирующие мышечные клетки, а мышечным отросткам у аскариды приписывается опорная роль.
Тончайшая структура мышечных клеток должна быть разобрана на поперечных разрезах. На срезе следует выбрать место, где перерезаны поперек и мышечное волокно, и саркоплазматический мешок. В последнем следует найти ядро и сеть опорных фибрилл, особенно густую около него. Мышечное волокно, сплющенное с боков, покрыто снаружи так же, как и саркоплазматический мешок, тонкой оболочкой. Осевая часть волокна занята саркоплазмой, а по периферии в виде подковы распределяются сократимые элементы волокна — образуется сократительный корковый слой. Последний составлен из так называемых сократительных лент (см. рис. 382, И). Они тянутся вдоль волокна, поставлены перпендикулярно к оболочке веретена и представляют собой
тонкие пластинки гомогенного сократимого вещества, сильно окрашивающиеся гематоксилином. Шнейдер (1902) изображает внутри пластинок сократимые фибриллы, наличие которых отрицают авторы, работавшие после него. В частности, Роскин (1925) при переисследовании вопроса о структуре сократимых элементов аскариды резко высказыва-
ется против наличия в сократимых лентах фибриллей и считает всю ленту кинетическим элементом. Между сократительными лентами в саркоплазме залегают опорные фибриллы, являющиеся продолжением общей фибриллярной системы саркоплазматического мешка.
Пищеварительная система. На срезах следует рассмотреть структуру стенки глотки и средней кишки.
Глотка имеет на срезе правильный округлый контур (рис. 387). Полость глотки имеет вид узкой трехгранной щели. В стенке глотки следует рассмотреть: 1) эпидермальные элементы (видны их ядра, прилегающие к периферии стенки глотки); 2) опорную фибриллярную пластинку, залегающую параллельно наружной поверхности глотки также на периферии (рис. 387, 2); 3) ради-
Рис. 387. Parascaris equorum. Поперечный разрез через глотку (Х110) (из кн. Крумбаха и Кюкенталя):
/ — ядра эпидермальных элементов глотки, 2 опорная фибриллярная пластинка, 3 —железистые клетки, 4 — радиальные мышечные волокна, 5 — просвет глотки, выстланный кутикулой
Рис. 388. Parascaris equorum. Стенка кишечника в поперечном разрезе (Х350) (из кн. Шнейдера):
/-—зона щеточной каймы (микроворсинки), 2 — слой мелкозернистой плазмы, 3 — гранулированная зона, 4 — бесформенные тельца базальной части клеток, 5 — ядро эпителиальной
клетки
альные мышечные волокна, собранные пучками (рис. 387, 4)-, 4) железистые клеточные массы с зернистым секретом, расположенные между мышечными пучками, и 5) внутреннюю кутикулярную выстилку.
Средняя кишка составлена из высоких цилиндрических клеток, расположенных в один слой на хорошо выраженной базальной бесструктурной мембране (рис. 388). На внутренней поверхности клеток, обращенной в просвет кишечника, выделяется особый слой, составленный из тесно примыкающих друг к другу пальцевидных выростов — микроворсинок. В совокупности они образуют щеточную кайму. Округлые ядра этих клеток располагаются более или менее на одном уровне вблизи базальных концов клетки.
В цитоплазме каждой клетки удается рассмотреть несколько зон. Непосредственно под щеточной каймой располагается зона мелкой зернистой цитоплазмы. Далее идет зона с множеством мелких, преломляющих свет гранул. Последние считались Шнейдером (1902) выделительными тельцами, Гольдшмидтом (1905)—пищеварительными частичками, а Кеймниц (1912) связывает их функционально с образующимся в этой зоне гликогеном и считает их зернами зимогена. Зона этих гранул приходится приблизительно посредине клетки. В базальной части клеток эпителия заметны крупные бесформенные тельца (рис. 388, 4), которые весьма вероятно представляют собой запасные питательные вещества.
Нервная система. На резрезах, окрашенных обычным способом, удается обнаружить только некоторые элементы центральной нервной системы. Для ориентации на срезах предлагается использовать прилагаемую схему распределения главных составных частей ее по Гольдшмидту (1908) (рис. 389, А). Лучше всего выражены главные продольные стволы, проходящие в медианных валиках гиподермы. Из них более толстый — брюшной. Эти стволы видны на любом из срезов через середину тела. Удается рассмотреть и так называемые сублатеральные нервы — брюшной и спинной с обеих сторон. Они лежат около 436
боковых валиков гиподермы в толще гиподермального синцития и представлены каждый пучком нервных волокон, более светло окрашенных по сравнению с окружающей их плазмой (см. рис. 385, 4). Так же можно обнаружить и тонкие волоконца латерального нерва, проходящего в толще боковых валиков. Нервное кольцо вокруг глотки удается рассмотреть на срезах, проведенных через передний конец тела, отступя приблизительно на 2 мм от ротового отверстия. Толща кольца представлена нервными волокнами, среди которых разбросаны ганглиозные клетки. Остальные части нервной системы обычно обнаружить не уда-
4 3 2 1
Рис. 389. Ascaris.
А — реконструкция центральной нервной системы переднего конца тела (вид с брюшной стороны) (из кн. Гольдшмидта):
1 — чувствительные сосочки губы с соответствующими нервами и ганглиями, 2 — боковая вентродорзальная комиссура, 3 — передний головной внутренний боковой ганглий, 4 — передняя вентродорзальная комиссура, 5 — задний головной внутренний боковой ганглий, 6 — боковая папилла, 7 — головные наружные боковые ганглии, 8— косая вентродорзальная комиссура, 9—глотка, 10 — боковой нерв, 11 — дорзальный сублатеральный нерв, 12 — вентральный сублатеральный нерв, 13 дорзальный нерв, 14 — вентральный нерв, 15 — вентродорзальная комиссура, 16 — задняя головная вентролатеральная комиссура, 17 — брюшной ганглий, 18— окологлоточное нервное кольцо;
Б — реконструкция центральной нервной системы заднего конца тела самца. Вид со спинной стороны (из кн. Брандеса):
1 — вентральный нерв, 2— вентральный сублатеральный нерв, 3 — боковой нерв, 4 — дор-зальный сублатеральный нерв, 5 — бурсальный нерв, 6 — околоанальные ганглии, 7 — анальное отверстие, 8 — чувствительные сосочки, 9 — околоанальное нервное кольцо, 10 — дорзаль’ ный иерв
Б
Рис. 390. Parascaris equorum (из кн. Шнейдера). Срезы через различные отделы женской половой системы. А — Г — через яичник; Д — через яйцевод; Е—сперматозоид (Х1000); Ж—через матку (Х100).
/—яйцевые клетки, 2— rhachis, 3 — клетки стенки гонады, 4 — мускулистая оболоч* ка стенки матки, 5—ядро, 6 — хондриозомы, 7 — блестящее тело
8
Рис. 391. Parascaris equorum. Поперечный разрез в области пищевода (Х15) (из кн. Кюкенталя и Крумбаха):
I — спинной медианный валнк гиподермы, 2—плазматические мышечные отростки, 3 —- саркоплазматические мешки мышечных клеток, 4—сократимые части мышечных клеток, б — кутикула, 6 — пищевод, 7 — боковой валик гиподермы с выделительным каналом, 8 — брюшной валик гиподермы, 9 — фагоцитарная клетка
ется, за исключением некоторых элементов, лежащих в заднем конце тела у самцов (см. ниже).
Половая система. На разрезах дифференцировка отдельных составных частей половой системы выступает очень резко. Поскольку главным образом изучаются поперечные срезы через самку, то подробнее будут разобраны особенности разных частей именно женской половой системы. На срезе через середину червя следует найти разрезы через яичники, яйцеводы и матку.
Самое начало (дистальный конец) яичника занято мелкими зародышевыми клетками, правильной округлой формы с маленьким ядром. Расположены они рыхло (рис. 390, А, Б). Несколько отступя от дистального конца, ооциты сильно растут и располагаются в просвете яичника правильным и характерным образом. Сдавливая друг друга, они принимают пирамидальную форму. Вершины ооцитов упираются в центральный стержень — rhachis, имеющий, видимо, питательную функцию (рис. 390, В, Г). Ядра ооцитов при этом располагаются всегда около основания клеток. В стенке яичника различают бесструктурную базальную мембрану, на которой внутри сидят эпителиальные клетки. Их тела отстоят друг от друга на некотором расстоянии, не образуя сплошного эпителиального слоя.
Яйцевод отличается от яичника кроме диаметра отсутствием стержня (рис. 390, Д). Ооциты теряют тесную связь друг с другом, лежат свободно в просвете яйцевода. В стенке яйцевода замечается кроме базальной мембраны синцитиальная эпителиальная масса с разбросанными беспорядочно ядрами в толще плазмы (рис. 390, Д, 3).
Наконец, наиболее крупные на срезе образова-
ния в числе двух представляют собой перерезанные поперек (см. рис. 392, 10) матки, набитые уже сформированными яйцами с толстыми оболочками на различных стадиях оплодотворе-
ния и редукционного деления. Стенки матки составлены из клеток, выдающихся в просвет и сидящих на базальной мембране, под которой заметен тонкий слой кольцевой мускулатуры (рис. 390, Ж, 4).
Между яйцевыми клетками и в яйцеводе, и особенно в матке, попадаются сперматозоиды. Они имеют трехгранную форму и лишены хвостика (рис. 390, Е). Ядро небольших размеров смещено к основанию сперматозоида. Большая же часть последнего занята так называемым блестящим телом.
Если придется изучать поперечные срезы через самца, то в структуре его половых элементов найдется много общего с женской половой системой. Семенник также имеет стержень, с которым связаны сперматоциты. В семяпроводе стадии развития сперматозоидов свободно лежат в просвете. Семяизвергательный канал отличается высокими ворсинкоподобными выростами эпителиальной выстилки (см. рис. 393,7).
Срезы в разных областях тела аскариды. Разбор анатомии аскариды рекомендуется закончить изучением поперечных
Рис. 392. Parascaris equorum. Поперечный разрез самки посередине тела (Х12) (ориг.):
1—спинной нервный ствол. 2 — плазматические отростки мышечных клеток, 3 — мышечные волокна, 4—яичиик в продольном разрезе. 5 — стенка кишечника, 6 — кутикула, 7 — боковой валик гиподермы. 8— выделительный каиал, 9 — яичник в поперечном разрезе, 10— матка, 11— яйцевод в продольном разрезе, 12 — брюшной нервный ствол, 13 — яйцевод в поперечном разрезе
Рис. 393. Parascaris equorum (из кн. Вольценлогель). А — поперечный разрез через самца в области спикул влагалища (Х20); Б — сагиттальный разрез через задний конец самца (Х15):
1 — спикула, 2—влагалище спикулы, 3—бурсальный нерв в боковом валике гиподермы, 4 — бурсальная мускулатура, 5 — мышцы дилататоры кишечника, 6 — нервные волокна брюшного нервного ствола, 7 — семяизвергательный канал, 8— кишечник, 9— волокна спинного нерва, 10— сфинктер, кишечника, 11 — мускул экстрактор спикулы, 12 — мускул фиксатор влагалища спикулы, 13 — клоака, 14 нервные элементы
срезов в области глотки, в области пищевода (рис. 391) и посредине тела (у самки) (рис. 392). У самца большой интерес представляет разбор поперечных и сагиттальных разрезов через задний конец тела в области клоаки и влагалища спикул. На разрезе в области глотки следует обратить внимание на структуру стенки глотки (см. выше). Кроме того, при хорошей фиксации сохраняются тяжи изоляционной ткани и на удачных срезах видны элементы окологлоточного нервного кольца.
Разрез в области пищевода позволяет хорошо разобрать структуру покровов и кожно-мускульного мешка. Очень хорошо в этой части тела выражены саркоплазматические мешки мускульных клеток (см. рис. 391, 5). Кишечник в этой части тела сплюснут дорзовентраль-но. Иногда на срезах в этой области попадаются фагоцитарные клетки (см. рис. 391, 9). В них следует рассмотреть отростки, зернистую плазму, довольно крупное ядро с многочисленными мелкими зернами хроматина.
На разрезе приблизительно посередине тела (рис. 392) удается рассмотреть структуру покровов пищеварительной и выделительной систем, отчасти нервной и особенно половой. Части половой системы при удачном разрезе можно видеть на одном и том же срезе. Из поперечных срезов заднего конца самца особый интерес представляет такой, который прошел через влагалище спикул и концевой отдел семяизвергательного канала (рис. 393, Л). На таком разрезе боковые валики гиподермы смещаются несколько дорзально, в них можно отметить утолщение брюшного сублатерального ствола, превращающегося в бурсальный нерв. Задний конец средней кишки охватывается двумя мускульными клетками (это дилататоры кишечника и одновременно компрессоры семяизвергательного канала), сократимые фибриллы которых пучками отходят по радиусам, прикрепляясь к гиподерме. Наискось проходят два пучка бурсальной мускулатуры (рис. 393, Л). Каждый из них прикрепляется к гиподерме вентрально от бокового валика, и оба они сходятся около медианного вентрального валика. Спикулы лежат дорзально от кишечника и окружены клетками влагалища. Следует отметить слоистость спикул, наличие кутикулярной выстилки и мускульной обкладки влагалища. Спикулы при этом выступают как типичные кутикулярные производные, так как наружный слой каждой из них переходит непосредственно на своем проксимальном конце в кутикулу влагалища.
Наконец, под кишечником виден разрез семяизвергательного канала с чрезвычайно высокими ворсинками, выдающимися в его просвет (рис. 393, А, 7). На срезе дальше, в области клоаки, обращает на себя внимание железистая обкладка этого последнего отдела кишечника, синцитиальная природа его стенки и кутикулярная выстилка.
Продольный разрез (сагиттальный) заднего конца самца должен быть разобран при помощи прилагаемого рисунка 393, Б. Особое внимание следует при этом обратить на разбор мускулатуры влагалища спикул, место впадения семяизвергательного канала в клоаку и т. д.
Trichinella spiralis (Owen) — трихина
Материал и методы изучения. Trichinella spiralis из сем. Trichinellidae, отр. Tri-chocephalata, подкл. Adenophorea паразитирует в половозрелом состоянии в кишечнике различных животных как хищных (домашних и диких), так и грызунов и копытных (свиней). В личиночном состоянии трихина инкапсулируется в мышцах тех же животных. Личиночный материал проще всего получить с бойни от трихинозных свиней, у которых интенсивнее всего поражены мышцы диафрагмы, межреберные, гортани, шеи. Инкапсулированные трихины изучают или после просветления в глицерине, или на окрашенных кармином и заделанных в бальзам препаратах. Мышцы с ними предварительно расщипывают иглами на отдельные волокна. Для изучения половозрелых трихин следует специально покормить одну, двух лабораторных крыс трихинозным мясом. Через 30—40 ч после заражения молодые трихины в тонкой кишке становятся половозрелыми, копулируют и через 6—7 дней после заражения самки внедряются в стенки кишечника, где и рождают живых личинок. Вскрывать крыс следует еще до момента внедрения червей в стенку кишки, т. е. через 4—5 дней после заражения. Разыскивать самок н самцов трихин следует в содержимом тонких кишок под лупой. Полезно соскоблить слизистую оболочку кишки скальпелем и соскоб рассматривать вместе с содержимым. Изучение взрослых трихин ведут in vivo или на материале, фиксированном 70° спиртом. Лучшие же результаты дает жидкость Барбагалла (3%-ныи формалин на физиологическом растворе). Объект просветляют в неразведенной молочной кислоте, куда его переносят прямо из спирта или формалина, в ней же и рассматривают, и можно обратно перекладывать в консервирующую жидкость.
От крысы же можно получить материал по ранним личиночным стадиям. Выселение личинок из кишечника в мускулатуру совершается в пределах от 10 до 20 дней после заражения. Сразу после этого срока в мышцах удается находить еще совсем молодых личинок. Инкапсулируются они полностью только через 7 недель после заражения. Таких молодых личинок лучше рассматривать в живом состоянии, расщепляя мышцы убитой крысы (диафрагму, шейные мышцы и т. д.) на волокна и придавливая между двумя предметными стеклами.
Живых вылупившихся из капсул личинок можно получить, обрабатывая трихинозные мышцы натуральным желудочным соком при температуре 37—40°С в часовом стекле. Через 10—15 мин после подобной обработки личинки начинают выходить из капсул и могут жить в желудочном соке около 6 ч.
Организация взрослой трихины. Самец. Сильно вытянутое тело имеет длину 1,4—1,6 мм. Наиболее широко оно в задней части, постепенно суживаясь спереди. На заднем конце тела видны две конические лопасти, между которыми позади анального отверстия располагаются две пары сосочков. Поверхность кутикулы гладкая.
Из внутренних органов удается рассмотреть пищеварительную и половую систему. Ротовое отверстие располагается терминально и ведет в глотку1, переходящую в пищевод (рис. 394, А, 1). Последний тянется по крайней мере за середину тела и представляет собой тонкую кутикулярную трубку, на дорзальной поверхности которой располагается ряд крупных клеток. На конце пищевода видны две одноклеточные железы. Далее пищевод переходит в среднюю кишку, представляющую трубку, составленную из мелких эпителиальных клеток, тянущихся до конца тела и переходящую в короткий отдел — клоаку. Анальное отверстие открывается наружу также терминально между лопастями заднего конца тела (рис. 394, А). Половая система представлена одним цилиндрическим семенником, расположенным в задней части тела (рис. 394, А, 3). Передний конец его, не дойдя до середины червя, превращается в тонкий семяпровод, поворачивающий назад и впадающий в
1 Около глотки можно заметить (не очень отчетливо) нервное кольцо.
клоаку, образуя расширение — семенной пузырь (vesicula seminalis, рис. 394, А, 5). Спикулы отсутствуют.
Самка. По длине она значительно превосходит самца, достигая во взрослом состоянии 3—4 мм. Общая форма тела напоминает форму тела самца, но без лопастей заднего конца. Структура кишечника
та же, что у самца, но задняя кишка здесь не имеет характера клоаки. Яичник располагается подобно семеннику в задней части тела, занимая почти всю полость тела в этой области и прижимая кишку к стенке тела (рис. 394, Б, 7). Бросаются в глаза крупные элементы яичника. Очень короткий, узкий яйцевод связывает яичник с широкой маткой,
А — самец (Х50) (из кн. Йорка и Моплестона): 7 — клетки пищевода, 2 — семяпровод, 3— семенник, 4 — кишечник, 5 — семенной пузырь;
5 — самка (5, В из кн. Лейкарта);
В— половой аппарат зрелой самки (ХЗО): 1 — нервное кольцо, 2 —клетки пищевода, 3 — половое отверстие, 4 — кишка, 5 — матка с личинками (8), 6 — семяприемник, 7 — яичник
у взрослых самок в начале переполненной яйцами, в конце — уже сформированными личинками. Тонким влагалищем матка открывается наружу в передней четверти тела. От заднего конца матки отходит небольшое вздутие в виде мешочка — семяприемник (receptaculum seminis).
Организация личинки. Вполне сформированная личинка (рис. 395, А) длиной 0,8—1,0 мм закручивается спирально в капсуле, образованной внутри дегенерировавшего мышечного волокна в первую очередь за счет саркоплазмы этого волокна; позже прибавляется плотная соединительная ткань из окружающих капсулу элементов. В самом волокне исчезает поперечная полосатость, его содержимое превращается в зернистую массу с немногими разбросанными в ней ядрами (рис. 395, Б, 1). Капсула имеет овальную, лимонообразную форму, достигая е длину 0,4—0,6 мм. Стенки капсул оказываются неоди-
каково прозрачными, они } наиболее старых капсул про питываются известью, что i затрудняет рассмотрена личинки. Процесс обызвест
Рис. 395. Trlchlnella spiralis (из кн. Клауса). Л — инкапсулированная личинка; Б— личинка, проникшая в мышечное волокно (Х200); В—различные фазы обызвествления капсулы (Х100):
/ — дегенерировавшее мышечное волокно, 2 — нормальное мышечное волокно, <3 —стенка капсулы, 4 — личинка
вления можно проследить — известь сначала откладывается на полюсах капсулы, распространяясь постепенно к экватору (*рис. 395, В). Появляется она в экспериментально зараженных животных через 6 месяцев после заражения, и весь процесс заканчивается через 15— 16 месяцев.
Морфологию личинок можно рассмотреть, освободив их из капсул, обработанных желудочным соком. Тело закругляется на обоих концах, ротовое и анальное отверстия терминальны. Пищеводный отдел кишечника тянется вдоль значительной части тела и характеризуется очень крупными клетками. В полости тела у таких личинок уже заложены половые клетки.
Совсем молодые личинки имеют гораздо меньшие размеры (0,08— 0,12 мм). Передний конец их снабжен заострением, которым они пользуются, пробуравливаясь во время миграции через ткани. На живом материале из крыс можно обнаружить их, проникающих в мышечные клетки и складывающихся поперек (рис. 395, Б) перед тем, как закрутиться в спираль. Капсулы в этот момент еще не образованы.
Rhabditis sp.
Материал и методы изучения. Род Rhabditis относится к сем. Anguillulidae, отр Rhabditida, подкл. Secernentea. Представители этого рода живут в земле, богатой гниющими остатками, перегноем и т. д. Лучший способ получить их в неограниченном количестве следующий. Живого дождевого червя разрезают вдоль, нарезают мелкими кусочками, последние помещают поверх слоя садовой земли в чашку Петри и прижимают сверху стеклом (оно должно касаться червя). Через несколько дней (3—5) на стекле можно обнаружить в массе мелких нематод. Чаще развиваются представители родов Rhabditis и Diplogaster. Червей следует снять кисточкой и рассматривать in vivo в капле воды. Фиксировать Rhabditis можно жидкостью Барбагалла, и изучение тогда ведется после просветления в капле молочной кислоты. Наконец, можно изготовить постоянный препарат, заключая червей в глицерин-желатин. Для этого из фиксатора их следует перенести в глицерин, разбавленный пополам водой, и оставить стоять в открытом сосуде несколько дней для испарения воды. Сосуд должен быть защищен хотя бы листом бумаги от пыли. Далее их переводят в чистый глицерин. Заключение производят в капле подогретого на спиртовке глицерин-желатнна.
Изучение тотального препарата. На дождевом черве очень часто развивается Rhabditis teres, к которому в основном и относится чаще описание.
У этой нематоды (рис. 396, 397) наблюдается половой диморфизм, что прежде всего выражается в различии размеров. Самка имеет в длину до 1,45 мм, в то время как самец —1,1 мм. Тело вытянуто в длину, веретеновидное, заостренное на обоих концах. У самки задний конец тела превращен в оттянутый хвост (рис. 396, Л), у самца же хвостовой отдел расширен с образованием копулятивной сумки. Поверхность тела покрыта гладкой кутикулой.
Ротовое отверстие терминально и окружено шестью мелкими губными сосочками. Оно ведет в ротовую капсулу, выстланную толстой двуконтурной кутикулой. Далее начинается мускулистый пищевод, перетянутый посредине, благодаря чему на нем обособляются два вздутия— бульбусы (рис. 396, А, 2 и 4). В полости заднего бульбуса следует найти кутикулярные зубчики (рис. 397, А, 6), образующие своеобразную цедильную систему. Вслед за пищеводом, тянущимся примерно на расстоянии ‘/в всей длины тела, начинается кишечник в виде цилиндрической трубки, не доходящей до заднего конца тела (рис. 396, А, 5). У основания хвостовой части тела кишечник резко суживается, превращаясь в заднюю, выстланную кутикулой кишку. Последняя открывается наружу анальным отверстием на вентральную сторону. Выделительная пора помещается позади заднего вздутия пищевода. Шейных желез, связанных с этой порой, их канальцев, на данном объекте рассмотреть не удается. Вокруг суженной части пищевода располагается несколько наискось нервное кольцо (рис. 397, А, 4). Хорошо можно рассмотреть его волокнистую структуру. По бокам от ротовой капсулы можно видеть боковые органы, или амфиды, просвечивающие е виде овальных образований и представляющие особые органы чувств вероятно улавливающие химические раздражения. Каждая из двух ам фид связана толстым пучком нервных волокон (плохо заметных) < нервным кольцом.
Мужская половая система представлена перегнутым пополам се менником, расположенным посредине тела (рис. 396, Б, 3). От него на
чинается широкий семяпровод, переходящий в семяизвергательный канал. Последний впадает в концевой отдел кишки — клоаку. Семенник заполнен зародышевыми клетками, в семяпроводе же видны сперматоциты и готовые спермин. Около клоаки просвечивают две короткие спикулы, слегка изогнутые и расширенные на проксимальном конце (рис. 397, Б, 1). Рядом с ними лежит парная небольшая добавочная часть овальной формы — рулек (gubernaculum). Хвостовой конец тела самца расширен в виде бурсы — копулятивной сумки. Тонкие прозрачные крылья бурсы (рис. 397, Б, 2) подпираются кутикулярными ребрышками, видоизмененными папиллами. Их девять с каждой стороны. Бурса охватывает хвост до конца.
Половая система самки представлена парными образованиями. Половое отверстие располагается вентрально посредине тела. Его края
Рис. 396. Rhabditis (из кн. Волькера).
4 — самка (Х55): 1 — ротовое отверстие, 2 — передний бульбус пищевода, 3 — нервное кольцо. 4 — задний бульбус пищевода, 5 — кишка, 6 — яйцевод с ооцитами, 7— семяприемник, 8 — влагалище и половое отверстие, 9— задняя матка, Ю— анальное отверстие, 11— задний яичник, 12— передний яичник;
Б — самец (Х55): / — пищевод, 2 — кишка, 3 — семенник, 4 — семяпровод, 5 — семяизвергательный каиал, 6 — бурса
Рис. 397. Rhabditis.
4—передний конец (Х200) (из кн. Раутера): 1 — ротовое отверстие с губными сосочками, 2—ротовая капсула, 3—передний бульбус, 4 — нервное кольцо, 5—задний бульбус, 6 —• кутикулярные зубчики глотки, 7 — кишка;
Б — задний конец тела самца (Х200) (из кн, Вюлькера): / — спикула, 2 — крыло бурсы, 3— папиллы—ребрышки бурсы, 4 — gubernaculum
слегка выдаются над поверхностью тела. От полового отверстия короткое влагалище ведет в обе матки, отходящие вперед и назад (см. рис. 396, А, 9) и содержащие некоторое количество развивающихся зародышей. Недалеко от влагалища матки суживаются, и в их просвете в этой области можно видеть скопление спермиев (см. рис. 396, А, 7), что дает право говорить о сужениях как о семяприемниках (receptaculum seminis). Далее видны сравнительно широкие яйцеводы (см. рис. 396, А, 6) не доходящие несколько до концов кишечника. Наконец, яйцеводы загибаются — передний назад, задний вперед — и превращаются в яичники. В яйцеводах можно видеть отдельные ооциты. В яичнике мелкие зачатковые клетки занимают его вершину, более же крупные располагаются ближе к яйцеводу (см. рис. 396, А, 11 и 12).
КЛАСС NEMATOMORPHA — ВОЛОСАТИКИ
Ознакомление с этой небольшой группой паренхиматозных Nema-thelmintes вполне достаточно произвести на одном из представителей — Gordius. Можно ограничиться внешней морфологией и разбором поперечного среза в середине тела.
Gordius aquaticus L. — волосатик
Материал и методы изучения. Gordius aquaticus принадлежит к сем. Gordiidae, отр. Gordioidea и паразитирует в личиночном состоянии и в молодом возрасте в полости тела многих насекомых, в частности водных. Взрослый червь выходит из хозяина. Нормально происходит это в воде, где и удается находить взрослых червей. Они попадаются во время водных экскурсий на маленькие стоячие или проточные пресные водоемы. Длинное тело червя обычно свито клубком.
Внешнюю морфологию можно изучить на формалиновом или спиртовом материа-
Рис. 398. Gordius aquaticus, самец (ориг.). А — внешний вид в натуральную величину;, 5 — передний конец червя; В — задний конец (ХЮ): /^клоакальное отверстие, 2—полулунная складка кутикулы
ле. Для разрезов же небольшие кусочки червя фиксируют любым сулемовым фиксатором. Залнвка производится в целлоидин-пара-фин по Петерфи, так как плотная кутикула затрудняет резку на микротоме. Толщина срезов 5— 7,5 мкм. Срезы окрашивают гематоксилином — лучше всего железным, или смесью Маллори. Из формалинового материала также удается получить удовлетворительные срезы. Для изучения анатомии следует иметь поперечные срезы через середину тела самки и самца.
Внешняя морфология. Цилиндрическое тело волосатика сильно вытянуто в длину, достигая 1 м и больше при максимальной толщине в 1 мм. Поперечное сечение совершенно округ-
Gordius момент Задний
Рис. 399. aquaticus в копуляции, конец самца охва-
тывает лопастями задний конец самки (Х15) (из ки.
Раутнера): 1 клоакальное отверстие, 2 — полулунная складка кутикулы, 3 — студенистая масса, выделяющаяся при копуляции
лое, цвет тела — коричневый, от светлых до темных оттенков, зависящий от окраски кутикулы. Передний конец тела узнается по светлому, терминально расположенному пятну, отграниченному сзади темной узкой перевязкой — полоской (рис. 398).
Волосатики раздельнополы, с резко выраженным половым диморфизмом. Самцы мельче самок и 'отличаются от последних структурой заднего конца тела. У самки он закруглен, с брюшной стороны на нем заметна бороздка, и клоакальное отверстие расположено терминально. У самца же задний конец расширен и раздвоен, а клоакальное отверстие смещается по брюшной стороне несколько вперед (рис. 398, В, /). Кроме того, у самца позади клоакального отверстия имеется полулунная темноокрашенная кутикулярная складка (рис. 398, В, 2). Концы полулуния направлены назад. Лопасти на заднем конце тела самца имеют копулятивное значение, так как в момент оплодотворения ими плотно охватывается задний конец самки (рис. 399). Поверхность тела Gordius гладкая, но может просвечивать структура внутреннего слоя кутикулы, составленного из перекрещивающихся друг с другом фибрилл. На плоскостном тотальном препарате, изготовленном из кутикулы, хорошо видна ромбическая структура последней (см. рис. 401, Л). Кроме того, местами из кутикулы выступают тонкие осязательные щетинки.
Ротовое отверстие совершенно отсутствует, так что передний конец тела гладкий. Передней кишки также нет, что можно констатиро-
Рис. 400. Gordius aquaticus. (ориг.). А — поперечный разрез через самку в средней части тела; Б — то же, через самца (Х320):
/ — кутикула, 2 —гиподерма, 3 —слой продольных мышечных волокон, 4 — паренхима, заполняющая полость тела, 5 — яйцевые клетки, 6 — брюшной нервный ствол, 7 — кишечник, я — околокишечный синус, 9 — семенные мешкн
1
0&вб9б8еаеваоеа №89889&8908^'
июэееДа
а&вбвеэаааэе&эа 08<мвеаэд8вй~ \ Z
ййа&ээе»8Мй^§
Б
Рис. 401. Gordius aquaticus (из кн. Раутера). А— плоскостной вид кутикулы (Х820); Б — кутикула в поперечном разрезе (Х1350): 1 — наружный слой кутикулы, 2 — волокнистый слой кутикулы, 3 — гиподерма вать на серии продольных срезов через передний конец тела (см. рис. 403).
Изучение срезов средней части тела. Прежде чем переходить к разбору деталей строения отдельных органов, следует ориентироваться в общем расположении органов на срезе. На периферии среза располагаются покровы — толстая кутикула снаружи, под ней тонкий слой гипо-дермальных клеток, за которым следует один слой продольных мышечных волокон кожно-мускульного мешка. Последний прерывается только в одном месте — на брюшной стороне, где образуется за счет гиподермы продольный валик с проходящими внутри волокнами нервного ствола. Далее под кожно-мускульным мешком полость тела заполняется паренхимой с синусами внутри. У самки различаем: 1) один продольный спинной синус, плохо отграниченный от окружающей паренхимы; 2) два продольных ряда боковых синусов — овариальных (у взрослой самки они переполнены яйцами и полость их исчезает); 3) продольный околокишечный синус, который проходит вдоль вентральной стороны тела и у самки обычно также заполняется яйцевыми клетками (рис. 400, Л). У самцов спинной так же, как и овариальные синусы, отсутствует, зато бывает хорошо выражен околокишечный (рис. 400, Б, 8). Кишечник на разрезе сдвинут вентрально вплотную к продольному нервному стволу (рис. 400, 7).
Половая система самки на разрезе представлена: 1) двумя широкими овариальными трубками, сближенными друг с другом, около медианной линии и сдвинутыми дорзально, и 2) овариальными дивертикулами— гроздевидными скоплениями яйцевых клеток, заполняющими обычно и полость овариального синуса. У взрослых самцов вдоль тела тянутся два семенных мешка, в которых формируется сперма и которые соответствуют овариальным трубкам самок.
Кожно-мускульный мешок. Толстая кутикула явно двухслойна. В наружном, очень тонком слое (рис. 401, Б, 1) особой струк-450
Большая часть нервного ствола на срезе занята нервными волокнами Последние разбиваются гиподермальными прослойками на три ясно различимые группы (рис. 402). Нервные клетки заметны только на периферии (главным образом с боков и с вентральной стороны), между ними вклиниваются глиальные элементы. Однако дифференцировать их на срезе затруднительно. Изучение передних отделов нервной системы можно произвести в том случае, если будут изготовлены продольные срезы через передний конец червя. На серии таких срезов можно проследить, что брюшной ствол приходит в связь с церебральным нервным кольцом. Центр этого кольца занят компактной массой нервных волокон, на периферии которых располагаются нервные клетки (рис. 403, 2).
Половая система самки. Вышеописанные овариальные трубки и овариальные дивертикулы представляют собой парные сложные яичники. Каждый из них имеет основную часть, выстланную собственным эпителием и заполненную внутри яйцевыми клетками. Это и
Рис. 403. Gordius aquaticus. Продольный разрез через передний конец тела (Х200) (из кн. Раутера):
/ — кутикула, 2 — нервные клетки церебрального нервного кольца, 3 — нервные клетки брюшного нервного ствола, 4 — нервные волокна брюшного нервного ствола, 5 — кишечник, 6 —паренхима, 7 — нервные волокна центральной массы церебрального нервного кольца
есть овариальная трубка, на заднем конце тела суживающаяся в яйцевод. От основной части в просвет овариальных синусов выдаются многочисленные овариальные дивертикулы, представляющие не что иное, как выпячивание овариальной трубки, где помещаются гроздья яйцевых клеток. Последние одеты эпителием основной части. Обычно у половозрелых самок яйца развиваются в таком количестве, что выполняют целиком овариальные синусы, и тогда теряется грань между дивертикулами и овариальными трубками (см. рис. 400, Л). Чтобы рассмотреть типичные взаимоотношения, срезы выгоднее делать или впереди от максимально развитой гонады, или сзади, где она переходит в яйцевод.
У самца только в молодом возрасте семенники имеют компактный вид, у взрослого же экземпляра видны по бокам среза семенные мешки без собственных стенок, наполненные и готовой спермой, и созревающими сперматоцитами (см. рис. 400, Б, 9).
Изучение среза задней части тела. Интересно изучить срез через самку в области яйцеводов. Здесь уже не видно синусов в паренхиме — ее клетки целиком заполняют полость тела. В дорзальной части среза видны оба яйцевода, наполненные яйцами. Вентрально от них вся середина среза занята обширным семяприемником с хорошо выраженной эпителиальной стенкой. Внутри видна масса спер-
Рис. 404. Gordius aquaticus. Схематизированный продольный разрез заднего конца тела (Х75) (изкн. Рау-тера):
7— паренхима, 2—продольные мышечные волокна, 3—гипо« дерма, 4 — кутикула, 5 — клоакальные мышцы, 6 — левый хвое-товой отросток, 7 — постклоакальная складка кутикулы, S—• клоака. 9 — семяпровод, 10— околокншечный синус, /7=-^кишеч« ник, 1$ — семенной мешок
мы. Кишечник при этом обычно оттесняется семяприемником в сторону.
Оба яйцевода далее впадают в так называемую матку — короткий объемистый отдел, принимающий в себя и семяприемник. Матка переходит в атриум, который уже непосредственно впадает в клоаку — очень короткий конечный отдел кишечника.
У самца в задней части тела на срезах можно проследить впадение семяпроводов (ими заканчиваются семенные мешки) в клоаку, окруженную системой радиальных мышц — дилататоров. Разобраться на срезах следует при помощи рис. 404.
КЛАСС ACANTHOCEPHALA - СКРЕБНИ
Acanthocephala — животные с очень однообразной организацией, представляющие в этом отношении монолитную группу. Поэтому достаточно полное представление об их строении можно получить по какому-нибудь одному объекту. Для этого вполне подходят паразиты рыб. Для описания мы выбрали Acanthocephalus lucii, наиболее обычную форму, встречающуюся всюду в окунях и других хищных рыбах. Это описание может быть использовано и при разборе морфологии других скребней (например, из рода Echinorhynchus или Acanthocephalus гапае, встречающийся в лягушках), отличающихся мелкими незначительными особенностями.
Скребни весьма удобны как объект для изучения. Крупные клеточные элементы, их небольшое количество, облегчают задачу проходящему практикум.
Acanthocephalus lucii (Miill) ( = Echinorhynchus angustatus Rud)
Материалы и методы изучения. Acanthocephalus lucii относится к сем. Echinorhyn-chidae и паразитирует в кишечнике ряда хищных пресноводных рыб (в окуне, ерше, щуке, налиме, угре, трехиглой колюшке и т. д.). Чаще этот паразит встречается в окуне и ерше, откуда его и добывают. Стенку кишечника взрезают ножницами вдоль— скребни сидят, внедрившись хоботком в стенку кишки. Извлечь их оттуда можно, потянув осторожно пинцетом за тело или, что лучше, соскоблив с внутренней поверхности кишки эпителий скальпелем вместе с паразитами и освободив их потом от слизи и тканей препаровальными иглами или кисточкой.
Вооружение хоботка лучше рассматривать in vivo. Чтобы червь не втягивал хоботка, следует придавить передний конец его покровным стеклом. Для тотальных препаратов в таком слегка придавленном состоянии и рекомендуется фиксировать, прибавляя фиксатор сбоку под покровное стекло. Для данных целей вполне пригоден 70° спирт или 4%-ный формалин. При изготовлении тотального препарата червя следует окрасить разведенным квасцовым кармином в течение длительного срока. Проведение через спирты должно быть постепенное, так как покровы скребня плохо проницаемы. Лучше к воде прибавлять понемногу спирт и выдерживать до прибавления следующей порции несколько часов. При просветлении в ксилоле следует особенно тщательно соблюдать постепенность, прибавляя ксилол понемногу к абсолютному спирту.
Для срезов лучшие результаты дает фиксация быстро проникающими фиксаторами, в частности сулемовыми (сулема с уксусной кислотой), причем надо разрезать червя пополам уже в фиксаторе. Изготовляя серию поперечных разрезов, можно также изготовить и продольные серии. Толщина срезов 10—20 мкм. Хорошие результаты дает окраска железным гематоксилином, но можно использовать и любой другой гематоксилин.
Изучение тотальных препаратов. Цилиндрическое тело, вытянутое в длину, слегка расширяется в передней части. У живого паразита при сокращении тела переднее расширение усиливается и обычно гладкая поверхность кутикулы собирается в кольцевые складки. У описываемого скребня наблюдается половой диморфизм, сказывающийся прежде всего в различии размеров: длина тела самки варьирует от 8 до 17 мм, у самца же — только от 4,5 до 8 мм (рис. 405).
Ориентировать тело Acanthocep-halus в пространстве следует условно таким образом: лемниски определяют боковые стороны тела; при фиксации тело слегка изгибается на брюшную сторону, а хобот, наоборот, загибается дорзально; у самца, кроме того, вентральная сторона определяется половым отверстием — оно открывается наружу субтерминально и именно на брюшную сторону. У самки трудно найти морфологические отличия брюшной и спинной сторон. Кроме вышеупомянутого искривления известное указание можно найти в расположении заднего отверстия маточного колокола; большинство авторов считают его расположенным дорзально, что будет принято и в нашем изложении1.
Тело у A. lucii подразделяется на две части: туловище и хоботок. Большая часть хоботка усажена крючьями, основание же, лишенное последних, называется обычно шейкой. Хоботок в длину достигает 0,5—0,7 мм, причем на долю шейки приходится около четверти (рис. 406). Крючья располагаются 14
Рис. 405. Acanthocephalus lucii (ориг.).
А — общий вид $ (Х15); 1 — хоботок,
2 — влагалище хоботка, 3 — лемниски, 4— ретрактор лемниска, 5 — ретинакулы, 6~ ретрактор влагалища хоботка, 7 — яйца и яйцевые комки, 8 — маточный колокол, 9 — матка, 10 — влагалище, 11—наружное половое отверстие;
5 — общий вид сГ (Х15): / — правый
лемниск. 2 — ретрактор влагалища хоботка, 3 — семенники, 4 — цементные железы, 5 мускулистый мешок, 6 — копулятивная бурса, 7 — ее выпяченная часть
1 Кайзер (1893), наоборот, помещает его вентрально, что лишний раз подчеркивает условность ориентировки тела Acantho-cephalus.
Рис. 406. Acathocephalus lucii. Хоботок (X75) (из кн. Люе)
продольными рядами по 8 шт. в ряду (редко бывает 7 или 9). Ближе к вершине так же, как и у самой шейки, крючья мельче. Наиболее крупные из них видны в середине каждого ряда. Каждый крючок выдается острием, направленным назад,над кутикулой хоботка, тогда как базальная пластинка крючка погружена под кутикулу и под гиподерму. Основания крупных крючьев имеют характерную форму, фигурирующую в качестве определительного признака. Форма пластинки ромбическая. Такой вид ей придают боковые крыловидные выросты на переднем конце пластинки, где отходит самый крючок (рис. 407, Л). Мелкие крючки вершины и основания хоботка не имеют такой пластинки (рис. 407, Б). Уже на тотальных препаратах, а особенно на срезах, видна структура крючьев. Выдающееся острие покрыто с поверхности утолщенной кутикулой, непосредственно переходящей в сравнительно тонкую кутикулу хоботка. Главная масса крючьев составлена из плотного гомогенного хитиноподобного материала. Внут-
ри же крючка проходит тонкий каналец, наполненный рыхлым, зернистым содержимым (рис. 407, В, 3).
Хоботок подвижен, может изгибаться и способен втягиваться внутрь тела, убираясь в специальный футляр — влагалище хоботка, называемое иногда receptaculum. Вворачивание его осуществляется действием специальных ретракторов (см. дальше о срезах), прикрепленных одними концами к вершине хоботка, а другими к концу влагалища. При их сокращении начинает вворачиваться внутрь полости хоботка его передний конец, затем весь хоботок втягивается внутрь, как палец перчатки. При этом жидкость из полости хоботка перекачивается во влагалище. При выпячивании же хоботка расслабляется его ретрактор. Сильным сокращением мускулистых стенок во влагалище создается давление, выворачивающее хоботок наружу, и жид-
Рис. 407. Acanihocephalus lucii. (из кн. Кайзера). Крючья хоботка. А — средний крючок (Х380) (из кн. Люе); Б — крючок с основания хоботка (Х380); В — продольный разрез через хоботок в области крючка (ХбОО):
/ — кутикула, 2 — гомогенная часть крючка, 3—каналец с рыхлым зернистым содержимым
кость из влагалища перекачивается обратно в полость хоботка.
Влагалище хоботка удерживается в определенном положении, во-первых, пучком мышц ретракторов влагалища (их можно рассмотреть и на тотальном препарате — см. рис. 405, и особенно на срезах) и, во-вторых, так называемым лигаментом. Ретракторы проходят наискось и прикрепляются одним концом ко дну влагалища, другим к вентральной стенке тела. Лигамент же тянется назад и представляет собой полый внутри тяж с мускулистыми стенками, прикрепляющийся сзади к выводным путям половой системы.
Передний конец тела червя также может несколько втягиваться внутрь действием специальной системы ретракторов шейки. Они прикрепляются к покровам у основания хоботка и сливаются задними концами с волокнами кожно-мускульного мешка на уровне заднего конца влагалища хоботка. Располагаются они кольцом в полости тела, и их лучше рассмотреть на срезах, чем на тотальных препаратах.
В стенке тела можно видеть лакунарную систему гиподермы. Две продольные боковые лакуны соединяют массу поперечных (кольцевых) лакун.
Наконец, на переднем конце туловища следует отметить два вытянутых в длину образования, расположенных в полости тела справа и слева от влагалища хоботка и несколько заходящие за его конец. Это лемниски (см. рис. 405, А, 3). Их структура на срезах (см. дальше) показывает, что они представляют собой своеобразные выросты гиподермы шейки хоботка. Внутри лемнисков можно заметить лакуны. Свободные концы лемнисков связаны со стенкой тела специальными мышцами (см. рис. 405, А, 4). Функция лемнисков неизвестна. Высказываемые предположения о значении их при втягивании и выпячивании хоботка (якобы жидкость из лакун лемнисков выдавливается в лакуны хоботка, чем и вызывается его выпячивание) кажутся весьма натянутыми так же, как и предположение о питательной их роли или выделительной.
В задней части влагалища хоботка, даже на тотальном препарате, можно увидеть нервный ганглий в виде овальной кучки клеток.
На тотальном препарате хорошо удается рассмотреть и половую систему. Два семенника располагаются один за другим (см. рис. 405, Б, 3). Передний выдается вперед, за середину тела. Форма у них овальная. Оба семенника подвешены на лигаменте, стенки которого облегают каждый семенник, и поэтому можно говорить о положении их в полости лигамента. От каждого семенника отходит тонкий, длинный семявыносящий каналец (vas efferens), по ходу которого образуется несколько вздутий, наполненных спермой, — ложные семенные пузыри. Оба эти канала сливаются вместе сразу позади комплекса цементных желез, образуя общий семяпровод (vas deferens). Последний вздувается и образует семенной пузырь (vesicula seminalis externa). Сразу позади заднего семенника располагается группа цементных желез. Всего их 6 шт.; они имеют колбовидную форму и расширенные их части располагаются на разных уровнях, из этих желез образуется гроздь (см. рис. 405, Б, 4). Протоки цементных желез, каждый самостоятельно, вливаются в семяпровод. Клейкий секрет этих желез после копуляции закупоривает женское половое отверстие. Семяпровод после впадения в него протоков цементных желез входит в толщу копулятивного
органа, переходя в семяизвергательный канал (ductus ejaculatorius). Тонкий вытянутый пенис выдается в просвет копулятивной сумки (bursa copulatrix).
Весь комплекс цементных желез сверху прикрывается стенкой ли-гамента, спускающегося с семенников. Перед копулятивной сумкой этот покров приобретает мощную мускулатуру и превращается в мускулистое влагалище, окружающее муфтой выводные пути половой системы. Непосредственно с копулятивной сумкой имеет связь при помощи протока еще один элемент мужской половой системы — мускулистый мешок («Markbeutel» немецких авторов). Он располагается в области мускулистого влагалища дорзально от выводных протоков цементных желез (см. рис. 405, Б, 5). Назначение его неизвестно. Попытка Штейн-штрассера (1936) объяснить его значение как органа, способствующего выпячиванию копулятивной сумки, на наш взгляд, мало обоснована. Копулятивная сумка подразделяется на две части: проксимальную — мускулистую шапочку и перехватом отделенную от нее, выпячивающуюся при копуляции наружу и охватывающую задний конец самки дистальную часть. Половое отверстие открывается на вентральной стороне заднего конца тела.
Яичник у взрослой самки A. lucii отсутствует. В полости тела у нее плавают в большом количестве так называемые яйцевые комки овальной формы. В их синцитиальной строме заключены ооциты на различных стадиях овогенеза. Зрелые яйца сильно вытянуты в длину, имеют веретенообразную форму и снабжены тремя оболочками (рис. 408).
Самая тонкая, внутренняя — прилегает непосредственно к яйцевой клетке или к эмбриону, средняя, довольно толстая — сильно преломляет свет и наиболее утолщенная, наружная — с заметной волокнистой структурой. Между средней и внутренней оболочками обычно видна щелевидная полость.
Яйцевые комки образуются еще у личинки в полости лигамента в результате распадения прикрепленных к его стенке зачатков половых желез. Детали формирования яичников, однако, прослежены до сих пор еще плохо, и неясно, за счет каких элементов возникают зачатки половых желез. Яйцевые комки выходят из полости лигамента и у взрослого животного их там нет. Созревшие яйца отделяются от яйцевых комков, плавают свободно в полостной жидкости и выбрасываются наружу через женскую выводную систему. Последняя слагается из так называемого маточного колокола, яйцеводов, матки и влагалища. Все эти элементы сконцетрированы в задней части полости тела червя и занимают пространство, равное — 1/б всей длины тела. Проксимальный отдел выводных путей сумки — маточный колокол (рис. 409), представляет собой мускулистую муфту с несколько суженным передним концом и слегка вздутым задним (рис. 409, А), Полость муфты сообщается с полостью
Рис. 408. Acantho-cephalus lucii. Яйцо (Х480) (из кн. Люе):
1 — наружная оболочка, 2 — средняя оболочка, 3 — яйцевая клетка
тела: во-первых, через незамкнутый передний конец (рис. 409, Б) и, во-вторых, через сравнительно узкое дорзальное отверстие в задней части колокола (рис. 409, А, 5). Определенное положение маточного колокола обусловлено тем, что он подвешен в полости тела на лигаменте. Последний входит внутрь колокола спереди и заканчивается двумя концевыми клетками, которыми и прикрепляется к дорзальной стенке колокола. С дорзальными клетками лигамента тесно
I
Рис. 409. Acanthocephalus lucii.
А — маточный колокол, общий вид (Х120) (из кн. Зевтиген): 1— лигамент, 2 — маточный колокол, 3—вентральные клетки лигамента, ? — дорзальные клетки лигамента, 5 — дорзальное отверстие маточного колокола, 6 — левый яйцевод, 7 — матка;
Б— продольный сагиттальный разрез через маточный колокол (Х120) (из кн. Кайзера): 1 — лцгамент, 2 — маточный колокол, 3 — концевая клетка лигамента, 4 — дорзальное отверстие маточного колокола, 5—дорзальная медианная клетка, соединяющая оба яйцевода, 6 — просвет яйцевода, 7—матка, 3—вентральные медиан-» ные клетки, соединяющие яйцеводы, 9 — вентральная клетка маточного колокола
связаны две вентральные клетки, также лежащие в полости колокола, но прикрепленные к вентральной стенке. Нижняя часть колокола, таким образом, подразделяется на две латеральные половины (см. рис. 418, В). Вентральная стенка колокола утолщена, и здесь помещаются одно за другим два ядра клеток колокола.
Сзади на дорзальной стороне маточный колокол имеет продольную щель. Края этой щели загибаются внутрь, за счет чего в полости колокола обособляются два боковых кармана (см. рис. 418, Г, 7), слепо замкнутые спереди. Задний конец щели раздваивается, и за счет этого возникает заднее дорзальное отверстие маточного колокола (рис. 409, А, 5). Боковые карманы являются производным двух особых клеток.
Задний конец маточного колокола сужен, и здесь прежде всего следует отметить продолжение обоих боковых карманов в виде двух узких протоков — яйцеводов, хотя подобное название применено не совсем по существу. По этим каналам действительно проходят яйца, но они никакого отношения к яичникам не имеют1. В состав каждого яйцевода входит по одной латеральной клетке, которые с медианной стороны связаны общей медианной клеткой (см. рис. 418, Е). Здесь губа дорзального отверстия колокола составлена из двух небольших самостоятельных клеток.
Яйцеводы дистальными концами глубоко вдаются в полость следующего отдела — матки (рис. 409, Б, 7). Стенки матки охватывают задний край колокола. Матка в виде узкой трубочки с мускулистыми стенками тянется до заднего конца тела (см. рис. 405, А, 9). Матка — производное всего двух клеток и их ядра — лежат в ее стенке у проксимального конца. Дистальный конец матки слегка расширен и охватывает головной отдел влагалища. Последнее представляет собой комплекс из четырех клеток в виде песочных часов, пронизанный узким выводным канальцем (см. рис. 405, А, 10).
Цитоплазма клеток влагалища обычно красится довольно темно, что свидетельствует, как считают, об их железистой функции. Снаружи
1 Яйцеводом обычно называют проток, связанный с яичником.
влагалище охвачено двумя сфинктерами. Внутренний сфинктер кольцом опоясывает влагалище посредине (рис. 410, 4); по периферии саркоплазмы этого кольца проходят мышечные волокна. Два ядра внутреннего сфинктера указывают на его двухъядерную природу. Наружный сфинктер покрывает собой и внутренний и большую часть влагалища (рис. 410, 3). Кольцевые волокна в нем также занимают периферическое положение и частично заходят в толщу саркоплазмы, благодаря чему сфинктер подразделяется на две-три сектора.
Маточный колокол выводных путей женской половой системы играет важную, сортирующую роль. Его мускулистые стенки испытывают перистальтические сокращения, при которых захватываются из полости тела плавающие там яйцевые комки и яйца. Веретеновидная форма яиц хорошо приспособлена к узкому просвету яйцеводов, куда они и попадают из колокола. Яйцевые комки, имея сравнительно большой диаметр, не могут пройти сквозь яйцеводы и выталкиваются обратно в полость тела через заднее дорзальное отверстие колокола.
Изучение срезов. Гистология покровов. Снаружи тело покрыто очень тонкой, бесструктурной плотной кутикулой (рис. 411). На хоботке кутикула утолщена по сравнению с таковой на туловище. Кутикула окрашивается довольно интенсивно гематоксилином.
Рис. 411. Acanthocephalus lucii. Поперечный разрез через стенку тела (Х1000) (по кн. Кайзеру с добавлен.):
1 — кутикула, 2 — параллельный слой субкутикулы, 3 кольцевые волокна субкутикулы, 4 — ядро гиподермы, 5 — кольцевые мышечные волокна, 6 — синцитиальная саркоплазма внутреннего слоя мышц, 7 — сократимые фибриллы внутреннего мышечного синцития, 8 —ядро мышечного синцития, 9 — гиподерма, 10 — продольные волокна субкутикулы
ного слоя.
2 /
Рис. 412. Acanthocepha-lus lucii. Тангентальный разрез стенки тела (Х150) (ориг.):
1 — продольная боковая лакуна, 2 — кольцевые лаку* ны, 3 — ядра гиподермы
Стенка тела под кутикулой сравнительно толстая (достигает ’/б диаметра тела), представляет собой сплошное синцитиальное образование без клеточных перегородок, но весьма сложной структуры. Она подразделяется на две основные зоны — периферическую субкутикулу (войлочный фибриллярный слой) и внутреннюю гиподерму (радиальный фибриллярный слой).
Субкутикула занимает менее '/з толщины стенки тела и составлена из нескольких систем взаимно перекрещивающихся волокон. Непосредственно к кутикуле прилегает тонкий слой волоконец, поставленных перпендикулярно к поверхности тела и образующих так называемый параллельный слой субкутикулы (рис. 411, 2).
Далее внутрь чередуются три слоя кольцевых волокон с тремя продольными (рис. 411, 3, 10). Некоторые волокна из этих слоев загибаются дуговидно и уходят в соседние, переплетаясь там с соответствующими волокнами. Такая картина вполне оправдывает название войлоч-
Гиподерма, занимая больше 2/з толщины покровов, устроена проще субкутикулы. В ее толще залегают только радиальные волокна, собранные пучками. Часть волокон выходит за пределы гиподермы и вклинивается в толщу субкутикулы, увеличивая этим ее войлочную структуру.
Фибриллы субкутикулярного слоя, видимо, имеют поддерживающее значение. В отношении гиподермальных фибрилл распространено мнение об их мускульной природе; считают, что их сокращения способствуют передвижению жидкости внутри лакунарной системы. Картины же, обычно наблюдающиеся на срезах, говорят против их мышечной природы, так как радиальные волокна часто имеют вид зигзагообразных нитей. Такую картину можно толковать именно как пассивное их укорочение в результате сокращения тела при фиксации.
Многочисленные ядра синцития стенки тела распределены только в лакунах гиподермы (рис. 411, 4).
Лакунарная система стенки тела связана исключительно с гиподермальной зоной. Между пучками волокон время от времени на срезах попадаются просветы, наполненные зернистым содержимым — свернувшейся жидкостью лакун. По всем срезам проходят две крупные боковые лакуны, имеющие характер продольных сосудов, связанных неправильной системой поперечных лакун. Последние особенно хорошо видны на продольных поверхностных срезах (рис. 412).
Лемниски. Основная толща лемниска занята гиподермальным слоем с радиальными волокнами и лакунами (см. рис. 415, Б, 11), непосредственно переходящими из гиподермы шейки хоботка. На продольных срезах удается проследить этот переход и следует подметить наличие резко выраженного отграничения гиподермы шейки и лемнисков от таковой стенки тела, обусловленного проходящей здесь кутикулярной прослойкой. Из лакун лемнисков следует обратить внимание на кольцевую лакуну шейки, проходящую в основании лемнисков. Многочисленные мелкие ядра помещаются в лакунах лемниска. Субкутикулярный войлочный слой также переходит на лемниски, но выражен слабо. Снаружи лемниски покрыты слоем продольных мышц, входящих в систему ретракторов шейки (см. ниже). Особым пучком мышц, отходящим от задних концов лемнисков, последние связаны со стенкой тела (см. рис. 405, А, 4).
Кожная мускулатура. В составе кожной мускулатуры у A. lucii различают два слоя: наружный кольцевой и внутренний продольный. Каждый из этих слоев мускулатуры представляет собой синцитиальное образование. В толще цитоплазмы каждого слоя распределены в том или другом порядке сократимые волокна и разбросаны в беспорядке немногочисленные ядра. В наружном синцитии сократимые кольцевые волокна вплотную прилегают к базальной мембране гиподермы. Они концентрируются в ленты, в которых фибриллы собраны пучками. Такое расположение хорошо заметно на продольных срезах (рис. 413, 5). Во внутреннем синцитии сократимые фибриллы расположены также прерывисто. Иногда продольные волокна образуют небольшие продольные желобки, заполненные саркоплазмой и открытой стороной смотрящие в полость тела. Чаще же эти желобки замыкаются с внутренней стороны, благодаря чему образуются сократимые сплющенные цилиндры (см. рис. 411, 7). Внутри цилиндров находятся саркоплазма и ядра, редко встречающиеся в этом слое. Фибриллярные цилиндры связаны общей саркоплазмой в сплошной слой, лежащий тонкой пленкой поверх сократимых волокон.
Ретракторы шейки и влагалища хоботка. Особенно мощную систему мышц представляют ретракторы шейки. Их структуру и характер расположения лучше разобрать на поперечных срезах в области лемнисков. Здесь эти ретракторы проходят сплошным кольцом вокруг влагалища хобота (см. рис. 415, Б, 7). Кольцо составлено из сократимых, сплющенных цилиндров, по периферии которых проходят продольные сократимые волокна, напоминающие структуру сократимых цилиндров внутреннего слоя кожно-мускульного мешка. В области каждого лемниска кольцо волокон раздваивается и огибает с обеих сторон лемниск, тесно к нему прилегая (см. рис. 415, Б). Лемниски оказываются таким образом заключенными в своеобразную мускульную тунику, функционирующую в качестве сжимателей (компрессоров). Синцитиальный характер мускулатуры сохраняется и здесь — кольцо оказывается сплошным за счет непрерывности саркоплазмы. Ядра ретракторов шейки располагаются внутри мускульных цилиндров. Они относительно велики, и цилиндры в этом месте сильно вздуваются.
Ретрактор влагалища хобота составлен из пучка таких же мышц, что и ретракторы шейки (см. рис. 415, В, 16).
Влагалище хобота. Влагалище хобота — своеобразный полый мускул. Его стенки составлены из двух слоев мышц также синцитиальной природы. В каждом из этих слоев сократимые фибриллы (поперечные, кольцевые) лежат у периферии, саркоплазматическая же часть — внутри. Фибриллы проходят не строго поперечно, а наискось по спирали, что хорошо видно на продольных срезах (рис. 413). У основания влагалища следует рассмотреть четыре ядра внутреннего слоя, расположенных попарно на самом дне влагалища, и два ядра наружного слоя.
В полости влагалища хоботка, непосредственно сообщающейся с полостью самого хоботка, тянется вдоль ретрактор последнего. На дне
Рис. 413. Acanthocephalus lucii. Сагиттальный разрез переднего конца тела (Х100) (ориг.): 1 — перерезанные крючья хоботка, 2 — ретракторы шейки, 3 — полость влагалища хоботка, 4 — косые мышцы стенки влагалища хоботка (внутренние и наружные), 5 — кольцевые волокна кожно-мускульного мешка
влагалища он сливается с волокнами рет-ректора влагалища, огибает двумя десятками цилиндрических волокон нервный ганглий и впереди от него все волокна сливаются в четыре крупных рукава, в саркоплазме которых следует найти в каждом по одному ядру. Далее вперед ретрактор снова разбивается на 10—20 трубчатых волокон (см. рис. 415, Б, 13), которые и входят в полость хоботка, где прикрепляются к саркоплазме его мускульного слоя. Таким образом, ретрактор хоботка — производное всего четырех клеток.
Лигамент. У самки лигамент тянется вдоль всего тела до маточного колокола. Его структуру лучше разобрать на срезах. В задней части тела лигамент становится сплошным и в таком виде прикрепляется к дорзальной стенке маточного колокола. Стенки лигамента в его передней части очень тонки, продольные складки вдаются в его просвет и разделяют его подчас на камеры. Стенки лигамента составлены из очень тонкого синцитиального слоя саркоплазмы, в котором разбросаны небольшими пучками сократимые продольные волоконца. В промежутках между этими пучками саркоплазма сильно утончается^ на срезе получается четковидная структура. Местами в утолщениях саркоплазмы видны ядра лигамента. У самца лигамент в общем выглядит так же, как и у самки, но он значительно короче. В области семенников полость лигамента сильно расширяется и его стенки покрывают оба семенника и. цементные железы общей мантией,
Нервная система. Центральное ганглиозное скопление нервных клеток расположено в полости влагалища хобота, в задней его части между волокнами ретрактора. Это скопление сплющено дорзо-вентрально и вытянуто вдоль. Количество клеток в нем доходит до 70. На срезах хорошо видно, что крупные нервные клетки располагаются по периферии, образуя род коры ганглия. Сердцевина же занята плазматической массой с пробегающими внутри нервными волокнами.
На срезах удается проследить и главные нервы, связанные с ганглием. Наиболее мощные из них — задние боковые. Они отходят от ганглия (рис. 414, А), пронизывают стенку влагалища хоботка и выходят в полость тела справа и слева, направляясь косо назад к стенкам тела. По выходе из влагалища нервы одеваются мускульной обкладкой — образуются так называемые ретинакулы (рис. 414, Б). Они видны некоторое время рядом с ретрактором влагалища хоботка, потом уходят в стороны. Структура ретинакул очень характерна — мышечные волокна с саркоплазмой и сократимыми фибриллами окружают центральную массу нервных волокон. Из других нервов можно проследить передний медианный нерв, начинающийся тремя корешками от ганглия и идущий сначала между волокнами ретрактора хоботка, позже подходящий к его дорзальной стенке. Боковые передние нервы, самые тонкие, можно обнаружить только около выхода их из ганглия. У самцов заметна еще пара боковых ганглиев, расположенных у основания мужского влагалища, впереди от копулятивной сумки; структура этих ганглиев такая же, как и переднего, хоботного.
Разбор серии поперечных срезов. Разбор следует начинать с переднего конца тела. Первые срезы проходят через хоботок, толща стенки которого пронизывается местами выходящими наружу крючьями. Кожно-мускульный мешок здесь состоит только из кольцевых мышц. В полости хоботка — мышечные волокна ретрактора. Далее на срезах появляется передний конец туловища. Поскольку при фиксации животное несколько сжимается, передний конец бывает несколько
Рис. 414. Acanihocephalus lucit* Поперечные разрезы (Х500) через нервный ганглий (А) и ретннакулу (5) (из Зефтнгина):
/ — боковой передний нерв, 2— задний боковой нерв, 3 — нервные клетки, 4 — нервные волокна, 5 — саркоплазма мышечных элементов, 6 — сократимые волокна
)5
Рис. 415. Acanihocephalus lucii. Серия поперечных разрезов через самку (Х150) (ориг.). А—срез в области втянутого переднего конца тела; Б — срез в передней части тела в области лемнисков; В — срез в области ретрактора влагалища хоботка; Г—срез в задней части тела до появления колокола:
1 — стейка тела, 2 — ввернутая внутрь стенка шейки, 3 — стенка ввернутого внутрь хоботка, 4— кутикула, 5 — субкутикулярный слой, 6— гиподерма, 7 — ретракторы шейки, 8—кольцевые волокна кожно-мускульного мешка, 9— продольные волокна кожно-мускульного мешка, 10 — продольная боковая лакуна, 11— лемниск, 12—-яйцевой комок, 13 — ретрактор хоботка, 14—внутренний слой мускулатуры влагалища хоботка, 15—наружный слой мускулатуры влагалища хоботка, 16 — ретрактор влагалища хоботка, 17 —
лигамевт
впячен действием ретракторов шейки хоботка. Поэтому на таких срезах виден еще хобот, появляется уже хоботковое влагалище и видны две стенки тела — наружная и впяченная внутрь (рис. 415, А, 1 и 2). Далее назад на срезах с боков появляются лемниски, видно влагалище хоботка с двухслойной стенкой и волокнами ретрактора хоботка ш видны кольцом расположенные ретракторы шейки хоботка (рис. 415, Б). Просматривая серию срезов через влагалище хоботка в задней его части, следует найти нервную систему и проследить отходящие от нее боковые нервы (особенно обратить внимание на ретинакулы и проследить их путь от влагалища к стенке тела). На срезах за влагалищем хоботка надо проследить пучок волокон ретрактора влагалища хоботка до места слияния с кожно-мускульным мешком на дорзальной стороне.
Далее у самки хорошо виден лига-мент (рис. 415, В, Г), идущий вместе с ретрактором и отличающийся от его волокон слабой окраской своих стенок и полостью внутри. У самца лигамент выглядит иначе, чем у самки, так как почти сразу же за влагалищем хоботка он сильно расширяется и переходит на передний семенник, образуя на нем наружную оболочку.
На разрезах через задний конец тела следует проследить выводные пути половых желез. У самца сначала идут срезы через передний семенник, далее через задний, рядом с которым тянется семяпровод от первого семенника. Далее появляются цементные железы (рис. 416, 3) с очень темно окрашивающимся зернистым секретом и разбросанными в его массе крупными ядрами. На срезах видно, что секрет есть не что иное, как разрушающаяся протоплазма клеток этих желез. Следует проследить протоки желез и отметить появление на брюшной стороне мускулистого мешка, а на
Рис. 416. Acanthocephalus lucii. Поперечный разрез через выводные пути мужской половой системы в области мускульного мешка (Х320) (из кн. Кайзера): /—семенной пузырь, 2—продольные мышцы, 3 — цементные железы, 4 — мускулистый мешок, 5 — стенка мужского влагалища
Рис. 417. Acanthocephalus lucii. Поперечный разрез в области выводного отверстия мужской половой системы (Х100) (ориг.):
1 — копулятивная сумка, 2 — половое отверстие
Рис. 418, Acanthocephalus lucii. Серия поперечных разрезов через выводные пути женской половой системы (Х400). А— срез через передний конец маточного колокола; 5 — срез через задний конец маточного колокола в области окончания лигамента; В — срез через задний конец маточного колокола в области прикрепления лигамента к стенке; Г — срез через основание маточного колокола в области продольной щели; Д — разрез в области дорзального отверстия маточного колокола; Е — разрез в области яйцеводов; Ж — разрез через матку; 3 — разрез в области влагалища (Х300) (рис. А, Ж, 3 — ориг., остальные — из кн.
Кайзера):
/«—стенка маточного колокола, 2 —лигамент, 3—концевые ядра лигамента, 4 — место прикрепления обеих клеток лигамента к дорзальной стенке маточного колокола, 5 — передний отдел бокового кармана - маточного колокола, 6 — вентральная клетка маточного колокола, 7 — боковой карман маточного колокола, 8 — концевые части лигамента (вентральные клетки), клетки стенок яйцеводов1,'. /0 —просвет яйцевода, // — медианная клетка, /2 — внутрений сфинктер, 13 — наружный сфинктер, 14 — стенка влагалища
спинной — слияние обоих семяпроводов и образование после этого большого семенного пузыря (рис. 416, /). Лигамент, покрывавший пленкой снаружи комплекс цементных желез, здесь получает толстую мускулатуру и образует мужское влагалище. Внутри влагалища следует отметить продольные мышцы (рис. 416, 2), вне влагалища — дорзальный пучок мышц, протягивающийся между его стенкой и стенкой тела. На срезах далее назад попадаются уже складки копулятивной бурсы, внутри- нее видны пенис и наружное половое отверстие (рис. 417, 2).
У самки следует найти на срезах маточный колокол (рис. 418, А), отметить место прикрепления к его дорзальной стенке заднего конца лигамента (рис. 418, Б, В), найти карманы колокола (рис. 418, Г, 7) и дорзальное заднее отверстие (рис. 418, Д). Далее надо разыскать оба яйцевода (рис. 418, Е) и проследить до конца матку (рис. 418, Ж). На заднем конце тела следует рассмотреть все составные части влагалища с окружающими его сфинктерами (см. рис. 410 и 418, 3).
Серию продольных срезов без всякого труда можно разобрать, получив полное представление об организации скребня после изучения поперечной серии.
В виде дополнения при ознакомлении с анатомилей скребней полезно применить своеобразное микровскрытие. Для этого удобны более крупные самки. Скребня прикалывают за хоботок под водой тонкой энтомологической булавкой к воску, застывшему в часовом стекле или небольшой чашечке. Острыми иглами (специально отточенными) под бинокуляром следует осторожно пропороть кутикулу, а вслед за ней и стенку тела. Очень легко после этого отпрепаровать и совсем выделить весь комплекс выводных путей женской половой системы, из которого можно сделать тотальный препарат. Точно так же хорошо удается рассмотреть и органы переднего конца тела. Наконец, теми же иглами вскрывают полость влагалища хоботка и в ней удается отпрепаровать нервный ганглий со всеми отходящими от него нервами.
КЛАСС ROTATORIA — КОЛОВРАТКИ
В пресных водах встречается большое количество видов коловраток, огромное большинство которых микроскопически малых размеров. Не все они одинаково пригодны для изучения внешней морфологии и анатомии. В качестве основного объекта рассматриваем Epiphanes (Hydatina) senta, относящуюся к отряду Monogononta, сем. Hydatini-dae. Этот вид довольно часто встречается в природе, а также разводится в аквариумах. Поэтому хорошо рассмотреть строение на живом объекте. Кроме того, он детально изучен в работах Мартини и других авторов. Организация коловраток, однако, настолько разнообразна, что не позволяет ограничиться изучением одного представителя. Поэтому кроме Epiphanes из того же отряда рассматривают роды Brachionus и Asplanchna и из сидячих форм Colloiheca. Для изучения цикломорфоза берется обычная в пресных водах Reratella (Апигеа). Представителем отряда Bdelloidea выбран столь же широко распространенный род Rotaria. Представителей отряда Seisonidae, паразитирующих на рачках Nebalia, не рассматривают вовсе.
Изучение коловраток проводят на живом материале. К изготовлению препаратов прибегать нет необходимости. Для более всестороннего
знакомства с Rotatoria желательно кроме изучения анатомии отдельных представителей ознакомиться с многообразием видов этого класса, живущих в разных экологических условиях. Для этого следует воспользоваться определителем коловраток Е. С. Неизвестновой-Жадиной в т. II «Жизни пресных вод» под ред. В. И. Жадина (1949) и монографией Л. А. Кутиковой (1970) (см. список литературы).
ОТРЯД PLOIMA
Epiphanes ( = Hydatina) senta (Muller)
Материал и методы изучения. Epiphanes senta (сем. Hydatinidae) относится к числу довольно крупных видов. Самки имеют в длину около 0,5 мм, самцы 0,25 мм. Эта форма нередко встречается в сильно загрязненных пресных водах, а также разводится в аквариумах. Для добывания материала из природы используется планктонный сачок. Обычно находят, как н у огромного большинства коловраток, лишь партеногенетических самок. Самцы встречаются редко. Все исследование ведется на живом материале. Для того чтобы рассмотреть некоторые детали внутренней организации, приходится придавливать коловраток и пользоваться иммерсионной системой.
Наблюдения над живым животным. Наблюдая живых коловраток при малом увеличении микроскопа, следует рассмотреть характер их движения (плавания) при помощи коловращательного аппарата, расположенного на переднем конце. Раздражая коловраток (например, постукиванием иглой по предметному стеклу), можно наблюдать втягивание переднего конца внутрь тела и его расправление после прекращения раздражения. Удается наблюдать также временное прикрепление Epiphanes к субстрату при посредстве вытянутого заднего конца тела с двумя придатками — «пальцами».
Желательно также рассмотреть процесс заглатывания и поступление пищи в кишечник. Для этого рекомендуется добавить к капле жидкости, в которой плавают коловратки, небольшое количество растертого с водой куриного желтка, взятого из яйца, сваренного вкрутую. Желток можно предварительно слегка окрасить нейтральным красным. Наблюдать поступление крупинок желтка в жевательный желудок — mastax и деятельность жевательного аппарата (см. ниже).
Организация самки. Внешняя морфология. Epiphanes senta (рис. 419) имеет удлиненное тело, длина его приблизительно в 2,5 раза превосходит ширину. Передний конец широкий, он определяется наличием мощно развитого ресничного, коловращательного аппарата, реснички которого непрерывно мерцают. Задний конец суживается и несет два выроста, при помощи которых осуществляется прикрепление коловратки к субстрату, — пальцы (рис. 419, 12). На конце их открывается наружу пара педальных желез, выделяющих липкий секрет. Резко отграниченной от туловищного отдела ноги, как это имеет место у многих коловраток, у Epiphanes нет. Снаружи тело покрыто довольно прочной, но тонкой волокнистой кутикулой, под которой располагается довольно тонкая однослойная гиподерма, имеющая характер синцития. Кутикула не образует панциря, свойственного многим другим видам Rotatoria (см. ниже Brachionus). На кутикуле наблюдаются поперечные борозды, образующие в совокупности некоторую внешнюю кольчатость 470
тела. Однако эта кольчатость не имеет ничего общего с сегментацией Annelides, так как не распространяется на внутренние органы.
Коловращательный аппарат. Имеет довольно сложное строение. Он слагается из двух рядов ресниц и их производных, окружающих передний конец (апикальное поле) и спускающихся на брюшную сторону к ротовому отверстию) (рис. 420). Наружный ряд носит название cingulum, внутренний— trochus1. Cingulum состоит из одного ряда мощно развитых ресниц. Он не образует совершенно сплошного ресничного кольца, прерываясь в четырех местах. Поэтому в состав cingulum входят пять секторов (дорзальный, два дорзолате-ральных и два вентральных), отделенных друг от друга небольшими промежутками. В них располагаются особые чувствительные волоски. На брюшной стороне cingulum образует глубокую выемку по направлению к ротовому отверстию.
Trochus дифференцирован более сложно, чем cingulum. Реснички в нем располагаются не в один, а в три ряда, причем наиболее мощно развит наружный ряд. В брюшной части реснички trochus непосредственно опускаются в ротовое отверстие. За счет trochus развивается ряд мембранелл, располагающихся на небольших выступах главным образом на спинной стороне (рис. 420). Из них наиболее мощно развит спинной пучок, слагающийся из И мембранелл, которые расположены в два ряда (семь мембранелл в переднем ряду и четыре в
Рис. 419. Epiphanes senta. Общий вид (схема) (по Плате):
1 — trochus, 2 — cingulum, 3 — выделительная система (терминальные клетки), 4 — жевательный желудок (mastax), 5 — пищевод, 6 — пищеварительные железы желудка, 7 — желудок, 8 — боковой нерв (ramus sensualis lateralis), идущий к боковым щупальцам, 9—яичннк, 10 — выделительный канал протонефридия, 11 — педальная железа, 12 — пальцы, 13 — мочевой пузырь, 14 — кишечник, 15 — желточник, 16 — ротовое отверстие
1 Некоторые авторы предпочитают применять для Epiphanes термины paracingu-lum и pseudotrochus, учитывая, что в состав коловращательного аппарата этой формы входят не только ресничные элементы циркумапикального пояса, ио также реснички околоротового (буккального) поля. Учитывая эту особенность происхождения и состава мерцательного аппарата Epiphanes, мы все же сохраняем старые привычные термины.
заднем). По обе стороны от данного пучка сидит еще по две группы мембранелл.
Ресничный аппарат cingulum и trochus образуется особыми крупными гиподермальными клетками, которые находятся непосредственно под коловращательным аппаратом и хорошо видимыми на живых животных. Число этих клеток не велико. В частности, согласно Мартини, cingulum образуется всего 13 клетками.
Мускулатура. Непосредственно под тонким слоем гиподермы располагается полость тела (первичная). Кожный мышечный слой (кожно-мускульный мешок) у Rotatoria отсутствует. В полости тела, наполненной жидкостью, располагаются внутренние органы и отдельные мускульные пучки. Кроме того, мускульные элементы связаны с некоторыми внутренними органами. Мы рассмотрим здесь сначала те мышцы Epiphanes, которые не связаны непосредственно с внутренними органами. Мышцы Epiphanes так же, как и других коловраток, состоят из немногочисленных клеток. В состав некоторых мускулов входит всего по одной клетке. Большинство мышц является поперечнополосатыми. Мускулатура Epiphanes довольно сложна, но, применяя иммерсионную систему, удается рассмотреть ее основные компоненты. На рис, 421
Рис. 420. Epiphanes senta. Коловращательный аппарат (Х430) (по Бошам):
1— внутренние ряды ресниц trochus, 2 — наружный ряд ресниц trochus, 3 — .cingulum. 4 — чувствительные волоски cingulum, 5 гиподермальные клетки коловращательного аппарата, 5 ~ вход в ротовое отверстие, 7— mastax
изображены главные мышцы Epiphanes. На переднем конце помещается мощный сфинктер (musculus sphincter coro-nae), обусловливающий сокращение переднего конца при втягивании коловращательного аппарата.
От переднего к заднему концу тянутся несколько сильно развитых ретракторов. Спереди они доходят вплоть до апикального поля и служат главным образом для втягивания переднего конца. К числу их относятся: 1) парный musculus retractor ventralis, располагающийся на брюшной стороне; 2) парный, состоящий из нескольких мышечных пучков musculus retractor dorsalis (на спинной стороне); 3) парный musculus retractor centralis, тянущийся от середины спинной стороны через полость тела к переднему сфинктеру. Кроме того, по сторонам тела проходит musculus retractor lateralis, состоящий из нескольких отделов (superior, medius и inferior).
Б поперечном направлении проходят восемь сфинктеров (mm. sphinc-teres corporis), образующих незамкнутые на брюшной стороне кольца. Они являются антагонистами ретракторов. При их сокращении происходит вытягивание тела коловратки. Кроме указан-
Рис. 421. Epiphanes senta. Мускулатура, нервная и выделительная системы (вид сбоку) (по Мартини) :
1—cingulum, 2 — musculus sphincter coronae, 3— надглоточный ганглий, 4 — спинной нерв (nervus sensualis dorsalis), 5 — m. retractor dorsalis, 6 — m. sphincter corporis, 7 — ядра гиподермы, 8 — педальный ганглий. 9 — яичник, 10 — m. retractor lateralis, 11— латеральная ветвь нерва (ramus sensualis lateralis) n. principalis, 12— m. retractor ventralis, 13—nervus principalis, 14— органы выделения, 15 — гиподермальные клетки коловра* щательного аппарата
Рис. 422. Epiphanes ta. Орган пищеварения (Х200) (по Бошам):
7 —mastax, 2 — oesophagus, 3 — пищеварительные (желудочные) железы, 4 — желудок, 5 — кишка, 6 — anus
з
ных главных мышц в теле Epiphanes имеется еше несколько мышечных пучков, которые здесь не указаны.
Органы пищеварения. Ротовое отверстие располагается спереди на брюшной стороне. В него, как указано выше, спускаются реснички trochus. Оно открывается при посредстве очень короткой глоточной трубки в передний отдел кишечника, называемый глоткой, жевательным желудком или mastax (рис. 422). Последний обладает толстыми мускулистыми стенками. Выстилающий его эпителий выделяет кутикулу. В полости mastax располагается чрезвычайно характерный для коловраток жевательный аппарат, состоящий из кутикулярных частей, образованных некоторыми специальными клетками стенки глотки. Для того чтобы детально рассмотреть структуру жевательного аппарата, следует довольно сильно придавить коловратку и воспользоваться иммерсионной системой.
У Epiphanes жевательный аппарат принадлежит к так называемому типу malleatus, в котором все основные элементы, слагающие аппарат,
выражены вполне типично. Он состоит из наковальни (incus) и двух молоточкцв (malleus) (рис. 423). Наковальня в свою очередь слагается из непарной пластинки — подпорки (fulcrum) и пары подвижных ветвей (rami). Каждый молоточек состоит из рукоятки (manubrium) и подвижных зубчиков (unci). Отдельные части жевательного аппарата подвижно соединяются друг с другом и со стенками mastax при помощи сложной системы мышц (Мартини различает у Epiphanes 18 мышц), которые обеспечивают чрезвычайную подвижность всего аппарата в целом. Он производит движения трех родов: хватательные, жевательные и глотательные, в чем следует убедиться, рассматривая живых коловраток. Число эпителиальных клеток, слагающих стенку mastax (не считая мышц и нервных клеток), не очень велико. Мартини насчиты
sen-
Б
Рис. 423. Epiphanes senta. Жевательный аппарат (Х440) (по Бошам из ки. Везенберг-Лунда): А — спереди; Б — сверху; В — с левой стороны:
1 — uncus, 2 — manubrium, 3 — ramus, 4 — fulcrum
вает 75 клеток с 91 ядром (некоторые клетки — двуядерные).
На заднем конце глотка открывается в довольно узкий и короткий пищевод (oesophagus) (см. рис. 422). В передней своей части он обладает кутикулярной выстилкой, в задней половине несет довольно длинные реснички, вдающиеся в следующий отдел — железистый желудок. Последний с брюшной стороны обычно бывает прикрыт гонадой, поэтому его удобнее рассматривать со спинной стороны.
Желудок представляет собой наиболее объемистую часть пищеварительного аппарата, где, по-видимому, и происходит в основном резорбция пищи. Стенки желудка состоят главным образом из довольно крупных железистых клеток (Мартини насчитывает их 60). Со стороны полости тела имеется несколько прилегающих к желудку мышечных клеток, обусловливающих способность его к сокращению. В переднюю половину желудка открываются две пищеварительные железы, имеющие бобовидную форму и лежащие по сторонам пищевода (см. рис. 422). На заднем конце желудок становится уже и переходит в довольно короткую среднюю кишку (см. рис. 422, 5), эпителий которой также несет реснички. Последним отделом пищеварительной системы является короткая клоака, открывающаяся отверстием на спинной стороне в задней четверти тела (см. рис. 419, 424). Начало клоаки и граница ее со средней кишкой определяются впадением протока яичника и несколько дальше — мочевого пузыря. Таким образом, отверстие клоаки является и анальным, и мочеполовым.
Специальные органы кровообращения и дыхания у Epiphanes, как и у всех коловраток, отсутствуют.
Органы выделения. Органами выделения служат типичные протонефридии. Справа и слева от кишечника прохо-
Рис. 425. Epiphanes senta. Терминальные клетки протонефридия, видно мерцательное пламя (по Мартини)
Рис. 424. Epiphanes senta. Схема организации, вид сбоку (по Жамму):
/ — головной ганглий, 2 — tr©-chus, 3 — ротовое отверстие, 4 — cingulum. 5 — mastax, б — терминальные клетки протонефридиев, 7 — выделительный канал протонефридиев, 8 — яичник, 9— мочевой пузырь, 10 — педальные железы, И — палец, 12—аналь“ ное отверстие, 13 — кишка, 14— желудок, 15 — пищеварительный железы
дят два выделительных сосуда (см. рис. 419, 424). Задним своим концом они открываются в непарный объемистый мочевой пузырь и тянутся кпереди вплоть до апикального поля. На уровне желудочковых желез и на переднем конце выделительные каналы бразуют петли (см. рис. 421). В области этих петель от них отходят по два коротких ответвления, слепо кончающихся колбовидной клеткой с пучком ресниц (мерцательным пламенем), направленным внутрь просвета канала (рис. 425).
Таким образом, каждый выделительный канал Epiphanes несет четыре терминальные клетки; общее их количество равняется восьми. Мочевой пузырь открывается в клоаку. Он обладает способностью периодически сокращаться и таким путем удалять накопляющуюся в нем жидкость. Протонефридиальная система коловраток, согласно современным представлениям, является не только выделительной, но также ос-морегуляторной системой, выводящей излишнюю воду, поступающую извне в тело животного.
Нервная система и органы чувств. На живой коловратке при достаточно внимательном изучении удается рассмотреть главные элементы нервной системы. Основной частью центральной нервной системы служит крупный надглоточный ганглий, или мозг, располагающийся в области апикального поля со спинной стороны и несколько кпереди от mastax (см. рис. 424, 1). Он включает большое количество нервных клеток (по Мартини в нем имеется 183 ядра), расположенных главным образом по периферии ганглия. Кроме того, под глоткой (точнее— в стенке самого mastax) имеется скопление нервных клеток — подглоточный ганглий (негомологичный подглоточному ганглию анне-лид), иннервирующий mastax и связанный нервами с надглоточным ганглием. В отличие от надглоточного ганглия его удается разглядеть с трудом, так как он сливается со стенками глотки. От надглоточного ганглия отходит ряд периферических нервов. Самый крупный — парный главный брюшной нерв — nervus principalis (см. рис. 421, 13), тянущийся вплоть до заднего конца и соединяющийся с небольшим ножным ганглием. От него отходит несколько мелких ответвлений, главным образом к мышцам. Самым крупным ответвлением n. principalis является ветвь, идущая к боковым чувствительным щупальцам (ramus sensualis lateralis, см. рис. 421, 11).
По ходу n. principalis разбросаны единичные, иногда собранные группами по две-три ганглиозные клетки. Например, мы находим их иногда на уровне гонады, небольшой ганглий образуется близ мочевого пузыря. Ножной ганглий располагается на уровне педальных желез и представляет собой довольно значительное скопление ганглиозных клеток (по Мартини — 23 клетки).
Кроме n. principalis от надглоточного ганглия на спинную сторону отходит довольно мощный парный нерв (и. sensualis dorsalis) (см. рис. 421, 4), идущий к спинному чувствительному щупальцу. Указанными стволами число периферических нервов, отходящих от мозга, не исчерпывается. Несколько мелких и трудно различимых парных нервов отходит от надглоточного ганглия в различных направлениях, причем большая часть их иннервирует различные части коловращательного аппарата и входящие в его состав чувствительные волоски.
Рис. 426. Epiphanes senta. Самец, вид сбоку (Х250) (по Везенберг-Лунду):
1 — trochus, 2 — cingulum, 3 — мышцы, 4 — протонефридий, $ латеральное щупальце с подходящим к нему нервом, 6 — нога, 7 — семенник, 8— дорзальное щупальце. 9 — мозговой ганглий
Органы чувств частично уже отмечены выше при рассмотрении ко-овращательного аппарата. Это боковые и спинные щупальца, являющиеся, вероятно, органами осязания, а может быть, и химического чувства. Они представляют собой небольшие выпячивания покровов, несущие чувствительные волоски. Кроме того, в числе ресничных элементов cingulum и trochus имеются осязательные волоски, не всегда легко отличимые от двигательных. Мартин описывает и еще ряд нервных окончаний, в кожном слое, преимущественно переднего конца тела, которые ледует, очевидно, рассматривать как рецепторы механических или хи-ических раздражений. К задней дорзальной части мозга прилежат чувствительные клетки, иногда сопровождающиеся пигментом (последний не всегда развит) и рассматриваемые как орган восприятия световых раздражений — глазок.
Тесно прилежит к мозгу также особый мешковидный железистый орган, носящий название ретроцеребрального органа, функция которого до сих пор остается совершенно неясной.
Половой аппарат. Женская половая железа Epiphanes представителя отряда Monogononta является непарной и дифференцированной на яичник и желточник. Она обладает довольно значительными размерами и располагается с брюшной стороны на уровне нижней части желудка (см. рис. 419, 424). При помощи яйцевода, который иногда получает название матки, поскольку здесь на короткий срок задерживаются яйца перед откладкой, половая железа открывается в клоаку. Яичник прилежит к желточнику спереди и по сравнению с последним обладает меньшими размерами. Наиболее мелкие ооциты в зачаточной зоне располагаются в его левой части. Справа лежат более крупные ооциты. По пути к яйцеводу яйцевые клетки тесно прикладываются к желточнику и обогащаются желтком, что осуществляется, по-видимому, непосредственно переходом последнего в яйцевую клетку через особое, временно образующееся отверстие, или трубку. Желточник имеет синцитиальную структуру. В нем удается различить восемь крупных ядер с нуклеолами. Epiphanes в отличие от многих других коловраток не носит с со-
бой развивающиеся яйца длительное время, а откладывает их в окру-
жающую среду.
Рис. 427. Brachionus rubens (Х320) (по Худсон-Госсе из кн. Везенберг-Лунда). А — организация самки, Б — жевательный аппарат:
1 — щетинки trochus, 2— чувствительные щетинки, 3 — cingulum, 4 — дорзальное щупальце, 5—мозговой ганглий, 6 мускулы ретракторы переднего конца, 7 — mastax, 8 — пищеварительные железы, 9 — панцирь, 10— канал протонефридия, 11—терминальная клетка протонефридия, 12 — боковой нерв и щупальце, 13— яичник, 14 — кишка, 15—anus, 16 —педальные железы, 17 — протоки педальных желез, 18— пальцы ноги, 19 — мочевой пузырь, 20 — яйцо, 21 — желудок, 22 — пищевод, 23 — глазок, 24 — uncus, 25 — manubrium. 26 — ramus, 27 — fulcrum
Организация самца. Самцы Epiphanes senta появляются в природе довольно редко — чаще всего осенью. Размеры их примерно в два раза меньше размеров самки. У самцов редуцированы некоторые органы и наблюдается гипертрофия половой системы. Общая организация самца дана на рис. 426. Коловращательный аппарат обнаруживает частичную редукцию trochus. Cingulum развит хорошо. Нога с педальными желе-
вами имеется. Мускулатура развита. Расположение основных мышц то же, что и у самки. Пищеварительная система полностью редуцирована. Протонефридии развиты, но мочевой пузырь отсутствует. Нервная система и органы чувств не отличаются существенно от того, что имеет место у самки. Половой аппарат развит чрезвычайно сильно. Объемистый семенник подвешен в полости тела на особом лигаменте, прикрепляющемся к стенке тела на переднем конце. Этот лигамент представляет собой рудимент кишечника. Сзади семенник переходит в семенной пузырек (vesicula semina-lis). Последний в свою очередь дает начало семяизвергательному каналу (ductus eja-culatorius), проходящему в центре объемистого мускулистого копулятивного органа (penis).
Отсутствие пищеварительной системы не дает возможности самцам питаться. Жизнь их кратковременна. Вскоре после копуляции они погибают.
При отсутствии материала по Epiphanes senta в качестве основного объекта при изучении коловраток можно взять представителей рода Brachionus. Организация их во многом напоминает Epiphanes, но в отличие от последней они имеют панцирь и хорошо развитую йогу. Разобраться в строении Brachionus не представит особых затруднений по рис, 427 и 428.
Asplanchna sp.
Материал и методы изучения. Род Asplanchna относится к сем. Asplanchnidae и является типичным представителем коловраток, ведущих исключительно пелагический образ жизни. Этот род включает несколько видов, широко распростра-
Рис. 429. Asplanchna priodonta самка (Х60) (из кн. Худсон-Госсе):
/ — cingulum, 2 — mastax, 3 —пищевод, 4 — пищеварительные железы, 5 — желудок, 6 — мочевой пузырь, 7 — яичник, 8 — продольный мускул-ретрактор, 9— спинной нерв, идущий к дорзальному щупальцу, 10 — ганглий, 11 — глазок
Рис. 428. Brachionus pala, самец (по Везенберг-Лунду):
1— trochus, 2 — cinqulum, 3 — мышцы ретракторы переднего конца, 4 — кольцевые сфинктеры, 5 — нога, 6— penis, 7 — латеральное щупальце, 8 — семенник, 9 — канал выделительной системы, 10 — дорзальное щупальце, 11 — глазок, 12 — мозговой ганглий
ненных в пресноводных водоемах. Особенно широко распространены A. priodonta Gosse и A. brightwelli Gosse.
Эти крупные формы, достигающие величины 1,5 мм, совершенно прозрачны. Последнее очень облегчает изучение их анатомии. Почти у всех видов рода Asplanchna описаны самцы. Добывают их планктонным сачком.
Организация самки. Asplanchna обладает мешковидным совершенно прозрачным телом (рис. 429). Нога и панцирь отсутствуют. Кутикула очень тонкая, нежная. Коловращательный аппарат расположен на переднем конце тела. Он состоит только из одного венчика ресниц, соответствующего cingulum (вернее paracingulum) и окружающего обширное поле. Последнее несет несколько выступов с отдельными пучками волосков, вероятно, чувствительного характера. Эти ресницы рассматриваются как остаток trochus. Коловращательный аппарат Asplanchna не участвует в захвате пищи (в отличие от Epiphanes, Brachionus и многих других коловраток) и служит лишь для движения.
Мускулатура Asplanchna довольно сложно дифференцирована. Расположение основных мышц показано на рис. 430. Особенно сильно раз-
Рис. 430. Asplanchna priodonta, расположение мускулатуры
виты пять пар продольно идущих ре ракторов. В передней части располаг ется сильный мускул — sphincter con пае. Несколько мышц расположено в о< ласти апикального поля. Имеется сист ма мышц, прикрепляющихся одним ко цом к внутренним органам, а другим -к стенкам тела (например, m. cutanei visceralis, т. retractor uteri — см. ри 432, 10). Эти кожно-висцеральные мыв цы обусловливают подвижность внутре: них органов.
Пищеварительная систем По сравнению с Epiphanes и Brachioni кишечник обнаруживает целый ряд ос бенностей. Ротовое отверстие, распол; гающееся с края апикального поля г стороне, которую рассматривают кг брюшную, при помощи короткой трубг открывается в объемистый, мешкови, ный, вытянутый в поперечном направл< нии mastax. Жевательный аппарат ш строен здесь по типу incudatus (рис. 431 Он характеризуется коротким fulcrur представляющим собой короткую пла тинку. Rami мощно развиты и образуй основную часть хватательного аппарат Mallei (manubrii unci) рудиментарш Жевательный аппарат Asplanchna м>
жет высовываться из ротового отверстия и служит для захвата доб! чи. Asplanchna преимущественно хищник, пищей ей служат различнь мелкие животные (простейшие, другие виды коловраток). Ма tax переходит в очень длинный пищевод (см. рис. 429). Он открываете в мешковидный, довольно объемистый желудок, кончающийся слепо. Средняя кишка и анальное //Т* отверстие отсутствуют. Стенки желудка состоят 1—///
из крупных железистых клеток. В пищевод не- III \\\
далеко от желудка открываются две бобовидные IIII I ]\
пищеварительные железы. Непереваренные ос- Пю.
татки пищи выбрасываются у Asplanchna через £ Ул/
рот. V n\ fa Js
Выделительные органы. Типичные xVc
протонефридии, представляют собой два длин- ,
ных извивающихся канала, тянущихся кпереди, °
вплоть до апикального поля. На заднем конце они открываются в мочевой пузырь (рис. 432). Последний открывается наружу на брюшной стороне каналом, общим с половой системой (у большинства коловраток клоака имеет отвер-
Рис. 431. Asplanchna s
Жевательный аппар (по Худсон-Госсе):
1 — malleus (manubrium+t cus), 2 — ramus, 3 — fi crum
стие на спинной стороне). На поверхности мочевого пузыря со стороны полости тела располагаются ветвящиеся мускульные клетки, обусловливающие его сокращение. По ходу выделительных каналов располагаются терминальные клетки с мерцательным пламенем (рис. 433). Число их у разных видов Asplanchna сильно варьирует. У A. priodonta каждый канал имеет 3—4 терминальные клетки (рис. 433), у A. brightwelli— 25, у A. sieboldi — около 50.
Нервная система.
Благодаря прозрачности Asplanchna нервная система может быть изучена довольно полно. Надглоточ-
Рис. 432. Asplanchna priodonta. Половая система и мочевой пузырь (по Нахтвей):
/—выделительный канал протонефридия, ' 2— брюшная ветвь neivus principalis, 3 — мочевой пузырь, 4 — ганглиозные клетки, 5 — мочеполовой канал, 6 — каудальный ганглий, 7 — sphincter uteri. 8 — uterus, 9— сократительные элементы стенки uterus, 10—musculus retractor uteri, 11— выросшее яйцо в матке, 12—желточник, /3— растущий ооцнт, 14 — яичник
ный ганглий (мозг) расположен над mastax ближе к дорзальной стороне (см. рис. 429, 10). От него берут начало девять пар нервов. Часть их иннервирует апикальное поле, коловращательный аппарат и его чувствительные элементы. Через полость тела тянутся три пары нервов. Одна пара направляется к дорзальному щупальцу (см. рис. 429, 9), вторая (латеральные нервы) идет по бокам тела и иннервирует главным образом мускулатуру, третья проходит ближе к брюшной стороне, дает ветвь к латеральным щупальцам и ряд ветвей к внутренним органам. В частности этот нерв, гомологичный, вероятно, n. principalis Epiphanes, иннервирует мочевой пузырь (см. рис. 432, 2), где имеются дополнительные ганглии. Из органов чувств кроме дорзального и лате-
ральных щупалец, а также чувствительных волосков апикального поля следует рассмотреть глазок, расположенный в непосредственном соседстве с мозгом. Глазок снабжен красным или черным пигментом. У некоторых видов имеется еще два дополнительных пигментных пятна (глазка) в области cingulum.
Половая система. Непарная половая железа (яичник с жел-точником) располагается в задней части тела. Яичник очень невелик (см. рис. 432, 14), и большую часть половой железы занимает желточник. У некоторых видов вся половая железа имеет подковообразную форму (A. brighlwelli). Начальная часть протока яичника (яйцевода) образует расширение, снабженное мускульными элементами,— матку. В ней задерживается на некоторое время яйцо. Далее яйцевод соединяется с протоком мочевого пузыря и общим отверстием открывается наружу. У места соединения обоих протоков расположена группа нервных клеток — ganglion caudale. Половой аппарат соединяется' со стенками тела при посредстве нескольких мышечных волокон (см. рис. 432).
Организация самца. Самцы Asplanchna (рис. 434) относительно мало редуцированы по сравнению с самками. Размеры их меньше приблизительно
Н"
Рис. 434. Asplanchna priodonta, самец (Х300) (по Везенберг-Лунду)
Рис. 433. Asplanchna priodonta, выделительная система (по Виллем):
1 — выводной канал протонефридия, 2— мочевой пузырь, 3 — соленоциты с мерцательным пламенем, 4 — экскреторная часть нефридия
в два раза. Коловращательный аппарат, мускулатура, органы выделения, нервная система и органы чувств мало чем отличаются от того, что имеется у самок. Пищеварительный канал редуцирован и превращен в лигамент, на котором подвешен семенник. Рудимент mastax в верхней части лигамента сохраняется. Семенник значительных размеров. Вдоль семяпровода располагаются особые дополнительные (предстательные) железы.
ОТРЯД PAEDOTROCHIDA
Collotheca Hurring (= Floscularia Oken)
Материалы и методы изучения. Различные виды рода Collotheca (самки) являются сидячими формами. Их можно нередко обнаружить в мелких водоемах на водяных растениях. Самцы мелкие, свободно плавающие. К роду Collotheca (сем. Collothecidae) относятся довольно многочисленные виды, отличающиеся главным образом строением переднего конца, несущего ресничный аппарат.
Мы рассмотрим только организацию самки, так как самцы мелки
и попадаются очень редко.
Организация самки. Размеры разных видов Collotheca варьируют в довольно широких пределах, приблизительно 0,2—1,0 мм. Большинство из них выделяет прозрачный слизистый домик, который окружает большую часть тела, за исключением переднего конца (рис. 435). Последний может втягиваться внутрь домика. Задний конец тела образует
длинную ногу (более половины длины тела) с кольцевыми перетяжка-
ми, при помощи которой коловратка прикрепляется к субстрату. Пальцы на конце ноги отсутствуют. На дистальном конце ее открываются
Рис. 435. Collotheca сого-zella. Общий вид (Х100) (по Худсон-Госсе)
протоки ножных желез. Туловищный отдел мешковидно вздут. Головная часть сильно расширяется и образует довольно глубокую воронку, на дне которой помещается ротовое отверстие. По краю воронки располагаются реснички, превращенные в длинные осяза-
Рис. 436. Различные формы переднего конца у разных видов Collotheca (по Романе). А—С mutabilis; Б—С. trilobata;
В—С. longicaudata; Г—С. coronella Д— С. heptabranchiata
Рис. 437. Collotheca. Анатомия (схематично в продольном разрезе) (по Деляжу):
1 — чувствительные волоски около* ротовых лопастей, 2— околоротовая лопасть. 3 — vestibulum, 4 — нерв дорзального щупальца, 5 — ганглий, 6 — mastax, 7 — желудок, 8 — anus, 9— продольные мышцы, 10—мочевой пузырь, 11 — канал протонефридия, 12 — яичник, 13— терминальная клетка протонефридия, 14 — нерв латерального щупальца
тельные волоски (рис. Tto форме околоротовой воронки, развитию' и расположению ресниц разные виды Collotheca довольно сильно различаются между собой. В простейшем случае край воронки гладкий, не образует
Рис. 438. Collotheca. Жевательный аппарат (по Романе). А — с брюшной стороны; Б — в изолированном виде:
1 — manubrium, 2 —ramus, 3—fulcrum, 4— subuncus, 5 — uncus
лопастей и несет реснички небольшой длины (например, С. edentatd). В большинстве же случаев края воронки образуют большее или меньшее количество лопастей (от 2 до 7), на которых длинные реснички располагаются пучками. Между последними иногда имеется еще непрерывный ряд более коротких ресниц, располагающийся по краю воронки. На рис. 436 представлено строение переднего конца некоторых наиболее обычных видов Collotheca.
У тех видов, у которых имеется несколько щупальцеобразных лопастей, спинная лопасть обычно развита сильнее других (рис. 436). В глубине воронки по краю ротового отверстия подковообразно расположен второй венчик коротких мерцающих ресничек. Среди мышц особенно сильно развиты ретракторы, служащие для втягивания переднего конца внутрь домика и тянущиеся через полость тела внутрь ноги.
1 Вопрос о морфологическом значении ресничек, расположенных по краю воронки Collotheca, не выяснен. Высказывались различные мнения. Плате сравнивал их с элементами cinguhim, Гудзон и Госсе, напротив, — с trochus, Де- Бошан видел в них дериваты околоротового ресничного поля.
Пищеварительная система Collotheca по сравнению со свободно плавающими коловратками имеет некоторые характерные особенности. Ротовое отверстие ведет в обширный vestibulum (рис. 437). Последний представляет собой не что иное, как глубокое впячивание покровов, отсутствующее у большинства других коловраток. На дне его помещается отверстие, ведущее в глоточную трубку и соответствующее ротовому отверстию большинства других Rotatoria. Глоточная трубка выстлана внутри ресничным эпителием, просвет ее довольно узкий. Она вдается в следующий довольно объемистый отдел пищеварительного аппарата— mastax. Передняя часть его, часто носящая название proventriculus, обладает тонкими стенками с небольшим количеством мускульных волокон. Задний отдел mastax мускулистый, в нем располагается небольшой по размерам жевательный аппарат типа uncinatus (рис. 438), характеризующийся слабым развитием fulcrum и manubria. Mastax открывается в очень короткий, анатомически почти не выраженный пищевод, ведущий в желудок. Последний имеет форму объемистого мешка, вытянутого по продольной оси животного. Стенки его состоят из крупных железистых клеток и несут реснички. У большинства видов Collotheca обособленные железы, открывающиеся в желудок, не выражены. Следующий отдел пищеварительной системы — средняя кишка — довольно короток. Она загибается на спинную сторону и переходит в прямую кишку, в которую открывается мочевой пузырь. Отверстие клоаки располагается на спинной стороне.
Выделительные каналы каждой стороны имеют у большинства видов Collotheca по пять терминальных клеток (но у С. triloba — по восемь клеток). Мочевой пузырь довольно большой.
Нервная система характеризуется хорошо развитым и довольно крупным мозговым ганглием, расположенным дорзально от vestibulum (см. рис. 437, 5). Глазки во взрослом состоянии у самок большинства видов не выражены (присутствуют у самцов и молодых самок). Имеются два коротких латеральных и одно дорзальное щупальце.
Половая железа непарная, лежит вентрально от желудка и дифференцирована на маленький яичник и крупный желточник. Ее связь с клоакой у Collotheca точно еще не установлена. Откладывающиеся яйца нередко прикрепляются к ноге, где они остаются до конца развития.
ОТРЯД BDELLOIDEA
Rotaria Scopoli ( = Rotifer Cuvier)
Материалы и методы изучения. Род Rotaria (сем. Philodinidae) — один из рас-пространеннейших в пресных водах. Представителей его можно найти всюду, начиная от озер и кончая мелкими лужами и канавами. Нередко разводятся также в аквариумах. Самцы у большинства Bdelloidea неизвестны и, по-видимому, совершенно отсутствуют.
Организация самки. Rotaria (а также Philodina и Callidind) обладают в большей или меньшей степени вытянутым в длину червеобраз-
Рис. 439. Roiaria citrinus. Самка (X100) (по Веберу из Коллен):
I trochus, 2 — хоботок, несущий два глазка, 3 — дорзальное щупальце, 4 — mastax, 5 — выде-чительные стволы, 6 — желудок, 5/—гонада, 8— мочевой пузырь, педальные железы, 10 — пальцы
ным телом. Ясно разграничены три отдела: головной, туловищный и нога (рис. 439). Размеры разных видов Rotaria варьируют в довольно широких пределах, приблизительно от 0,2 до 1,5 мм. На головном отделе располагается коловращательный аппарат чрезвычайно характерной структуры для всего отряда Bdel-loidea. Все остальное тело с ясно выраженной наружной кольчатостью, не распространяющейся, однако, на внутреннюю организацию. Нога, достигающая у некоторых видов большой длины (например, у R. neptunius, рис. 440), может частично втягиваться в туловищный отдел. На заднем конце она несет три коротких «пальца», на конце которых открываются хорошо развитые ножные железы (рис. 441). Кроме пальцев на предпоследнем «сегменте» ноги обычно имеется две довольно длинные «шпоры» (см. рис. 440).
Коловращательный аппарат состоит из хорошо развитых cingulum и trochus (рис. 442). Cingulum с брюшной стороны образует ресничный шнур с выемкой в области нижней губы, прикрывающей ротовое отверстие. На спинной стороне он не замкнут. Особенно характерно строение trochus, который располагается на двух выпячивающихся выростах переднего конца и слагается из двух замкнутых ресничных кругов. Весь коловращательный аппарат специальными мышцами-ретракторами может втягиваться внутрь. Кроме нижней губы имеется еще верхняя губа, расположенная над ротовым отверстием между обеими половинами trochus и прикрывающая ротовое отверстие сверху. На спинной стороне располагается непарный сократимый вырост — хоботок (см. рис. 439, 442), имеющий у разных видов Rotaria разную длину. Наконец, на спинной стороне, на границе между головным и туловищным отделами, расположено длинное дорзальное щупальце, несущее на своем конце пучок чувствительных волосков.
Мускулатура тела слагается из нескольких пучков продольных и кольцевых мышц. По брюшной стороне от переднего конца и почти до заднего конца тела тянутся два продольных брюшных мускула. Со спинной стороны подобных длинных мускульных пучков нет; здесь располагается несколько продоль-
Рис. 440. Rotaria Рис. 441. Педальные же-neptunius (Х90) дезы Rotaria soclalis (по (по Веберу из Кол- Бошам)
' лен)
ных, более коротких мускулов (рис. 443). Кольцевые мускулы образуют незамкнутые на спинной стороне кольца.
Ротовое отверстие, расположенное на переднем конце тела на брюшной стороне, ведет в короткую глоточную трубку, открывающуюся в mastax (рис. 444). По сравнению с другими отделами пищеварительного аппарата, mastax относительно небольших размеров, с мускулистыми стенками и жевательным аппаратом типа ramatus (рис. 445). Последний служит исключительно для размельчения пищи. Он характеризуется мощным развитием unci, которые
Рис. 442. Передний конец Rotaria (схематично). А — с брюшной стороны: Б — со спинной стороны:
1 — trochus, 2 —cingulum, 3 — дорзальное щупальце, 4 — хоботок
образуют жевательные пластинки с ясно выраженными поперечными бороздками, rami вытянуты в длину. Manubrii и fulcrum выражены слабо. В mastax открываются так называемые слюнные железы. Короткий пищевод (oesophagus) ведет в объемистый длинный желудок. Стенки его имеют многочисленные включения, благодаря чему весь орган коричневатый или желтый. Желудок Rotaria и других Bdelloidea с гистологической стороны характеризуется тем, что стенки его носят синцитиальный характер в отличие от представителей отряда Monogononta, где ясно видны границы отдельных клеток. Самый просвет желудка имеет вид довольно узкой трубки, покрытой ресничками. С передним отделом желудка связаны две пищеварительные железы (см. рис. 444, 2), тесно прилежащие друг к другу. Желудок переходит в довольно короткую, несколько расширен-
Рис. 443. Схема расположения мыши Rotaria (по Ремане). А — со спинной стороны; Б — с брюшной стороны
1
Рис. 444. Орган пищеварения Rota-ria (по Бошам):
1 — mastax, 2 — желудочные пищевари* тельные железы, 3 — реснички в просвете oesophagus, 4 — желу* док, 5 — кишечник, 6— конечный отдел выделительного канала, 7-* клоака
Рис. 445. Жевательный аппарат Rotaria (по Бошам). А— с брюшной стороны; Б — в изолированном виде:
1 — uncus, 2—manubrium, 3 — ramus
ную среднюю кишку. За ней следует rectum (клоака), принимающая отверстие мочевого пузыря и открывающаяся на заднем конце на спинной стороне (на границе с ногой ) наружу.
Органы выделения обычного типа. По ходу парных выделительных каналов, тянущихся вперед до головного отдела, имеется с каждой стороны по 5—6 терминальных клеток. Хорошо развит пульсирующий мочевой пузырь, открывающийся в клоаку.
Из элементов нервной системы можно хорошо рассмотреть мозг, располагающийся кпереди’от mastax со спинной стороны. Периферические нервы у Rotaria рассмотреть на живом объекте обычно не удаетсй. Иногда можно проследить отходящий от мозга парный брюшной нерв (nervus principalis), тянущийся до заднего конца (до каудального ганглия) и дающий ряд боковых веточек. -
Из органов чувств у Rotaria хорошо выражены два глазка, расположенные на головном отделе, на хоботке (см. рис. 439). Щупальце имеется только одно — дорзальное, как уже отмечалось выше (с. 486).
Половая железа у Rotaria в отличие от всех рассмотренных выше форм парная (характерная особенность отряда Bdelloidea). Имеет место дифференцировка на желточник и яичник. Располагаются гонады по сторонам кишечника (желудка). Связь между ними и клоакой, по-видимому, отсутствует. Развивающиеся эмбрионы прорывают стенку клоаки и таким путем попадают наружу.
Некоторые представители отряда Bdelloidea, относящиеся к родам Philodina и Callidina, обнаруживают замечательную способность к анабиозу в результате высыхания. В этом нетрудно убедиться. Если взять сухой мох или мусор (например, с крыши или непосредственно с почвы) и смочить его водой, то нередко уже через несколько часов можно наблюдать активные формы коловраток. Это своеобразное биологическое приспособление обнаружил впервые еще Левенгук.
Цикломорфоз некоторых коловраток
У большинства коловраток наблюдается гетерогония — чередование амфимиксиса и партеногенеза. Некоторые виды в природных условиях являются полициклическими (Polyarthra trigla), т. е. у них самцы появляются несколько раз в году, большинство же — моноцикличны и самцы появляются раз в год, обычно осенью. Однако и в пределах партеногенетической части цикла наблюдаются у многих видов в течение года значительные изменения, затрагивающие как размеры, так и различные морфологические признаки (шипы на панцире, его толщина, расположение отдельных пластинок и т. п.). Эти изменения, связанные с внешними факторами, носят название цикломорфозов. Они имеют место у родов Reratella (=Anurea), Brachionus, Notholca, Asplanchna и др.
При прохождении практикума желательно познакомиться с этим интересным биологическим явлением — цикломорфозом. Это можно легко сделать, если периодически брать пробы из одного и того же водоема.
Здесь не приведены подробные указания и рисунки, так как их можно найти в литературе, например в статье Муравейского в «Руководстве по зоологии», т. 1, под ред. проф. Л. А. Зенкевича или «Handbuch d. Zoologie» под ред. Крумбаха — Кюкенталя в статье Везенберг-Лунда, а также в монографии Л. А. Кутиковой по коловраткам фауны СССР (1970).
КЛАСС PRIAPULIDA - ПРИАПУЛИДЫ
К классу Priapulida относится всего лишь два рода — Priapulus и Halicryptus-, оба встречаются в морях СССР. Наиболее удобна для ознакомления с классом Priapulus caudatus (Lam.)
Priapulus caudatus (Lam.)
Материалы и методы изучения. Priapulus caudatus (Lam.) (сем. Priapulidae) встречается в Баренцевом и Белом морях, а также во всех арктических морях вплоть до Берингова моря, а на Дальнем Востоке проникает на юг, встречаясь в Охотском и Японском морях. На Мурмане, где Priapulus принадлежит к обыкновенным литоральным животным, эта форма встречается местами в массовых количествах в мелких илистых бухточках.
Черви ведут роющий образ жизни, глубоко зарываясь в мягкий грунт, в котором строят трубкообразные норки. Отверстия норок Priapulus легко узнают по насыпанным над ними кучками ила, чем они напоминают отверстия норок дождевых червей. Priapulus caudatus добывают во время большого отлива промывкой на решетках тут же на месте песчано-илистого грунта.
Изучение внешней морфологии Priapulus производят на живых или фиксированных животных. Для вскрытия червей убивают постепенным прибавлением спирта к морской воде.
Внешняя морфология. Цилиндрическое тело состоит из хобота и туловища (рис. 446), разделенных небольшой перетяжкой. К заднему
концу туловища прикрепляется пучок сократимых жаберных придат-
ков— хвостовая жабра (рис. 446, 3; рис. 447, 5). Длина тела достигает 80 мм. Хобот имеет приблизительно такую же ширину, как и туловище,
и способен впячиваться
Рис, 446. Priapulus caudatus (по Шиплею):
— /— хобот, 2 —туловище, 3 — хвостовая жабра, 4 — околорото-вые зубчики, 5 — ротовое отверстие
внутрь последнего. В состоянии полного выпячивания длина его равна приблизительно ]/з длины туловища, не считая хвостовой жабры. Поверхность хобота несет 25 продольных ребрышек с правильными рядами заостренных папилл. На его переднем конце лежит терминальное ротовое отверстие, окруженное хитиновыми зубчиками (рис. 446,4). Из них передние, более крупные, располагаются 5—7 кругами, причем каждый круг состоит из 5 зубчиков, а задние расположены неправильно. Поверхность туловища покрыта многочисленными кольцевыми складками и бороздками, а также неправильно разбросанными папиллами. Хвостовая жабра представляет собой длинный (иногда длиной с туловище) кистеобразный придаток, состоящий из многочисленных продолговатых долек (рис. 446, 3; рис. 447, 5). Жабра прикрепляется несколько вентральнее небольшого анального отверстия, которое лежит на заднем конце туловища терминально. Внутри жабры находится продолжение полости тела. Удлинение жабры совершается благодаря давлению целомической жидкости, а укорачивание — вследствие сокращения продольной мускулатуры осевой части жабры. Вполне впячиваться внутрь туловища жабра не может.
Тело Priapulus caudatus телесного цвета с металлическим отблеском. На брюшной сто
роне заметна медиальная светлая полоска — просвечивающий сквозь кожу брюшной нервный ствол. Снаружи тело покрыто довольно толстой кутикулой, которая может отставать, и под ней образуется новая кутикула. От времени до времени кутикула сбрасывается, т. е. происходит линька.
Анатомия. Свежий, только что убитый спиртом экземпляр Priapulus вскрывают в препаровальной ванночке с морской водой. Разрез стенки тела проводят по спинной или брюшной стороне вдоль от заднего конца до переднего, причем можно взрезать и основание хвостовой жабры. На вскрытом животном в объемистой полости тела заметны: мускулы ретракторы хобота, кишечник, нервная и урогенитальная (мочеполовая) системы (рис. 447). Следует обратить внимание на отсутствие каких бы то ни было следов внутренней сегментации, что совпадает с отсутствием наружной расчлененности.
Кожно-мускульный мешок состоит из покрытого кутикулой эпидермиса, слоя кольцевой мускулатуры и внутреннего продольного мускульного слоя. Полость тела имеет тонкую выстилку. На внутренней поверхности стенок тела вскрытого червя хорошо заметны пучки мускульных волокон продольной мускулатуры (рис. 447, 9). Сильно развитые, пересекающие полость тела ретракторы служат для впячивания внутрь туловища хобота, который является лишь нерезко отграниченным передним отделом тела. Помимо восьми очень длинных лентовидных больших ретракторов (рис. 447, 3) имеется еще целая серия коротких (рис. 447, 2). Все они прикрепляются к стенкам переднего конца тела (хобота) в об-
Рис. 447. Priapulus caudatus, вскрытый с брюшной стороны (по Элерсу):
1 — ротовое отверстие, 2 — малые ретракторы, 3 — большие ретракторы. 4 — орган мочеполовой системы, 5— жабры, 6 — отверстия, сообщающие полость жабры с полостями жаберных долек, 7 — задняя кишка, 8 — мезентерий, 9 — продольные мускульные пучки, 10— средняя кишка.
11 — глотка
ласти окологлоточного нервного кольца.
Кишечник представляет собой прямую или слегка S-образно изогнутую трубку и разделяется на глотку, среднюю и заднюю кишку (рис. 447, 11, 10, 7). Кровеносная система отсутствует. Нервная система развита очень слабо. Она состоит из окологлоточного нервного кольца и отходящего от него брюшного нервного ствола, которые можно обнаружить, препарируя иглами мускулатуру стенок тела медио-вент-рально и в области прикрепления передних концов ретракторов. Нерв-
ная система лежит в эпидермисе. Половой аппарат и выделительная система у Priapulus замечательным образом объединены в урогенитальную систему. Она состоит из двух продолговатых, расположенных по бокам от кишечника в задней части туловища органов (рис. 447, 4), слагающихся из выделительной и половой частей. Выделительная часть представлена протонефридиями, которые открываются вместе с протоками гонад в два урогенитальных канала. Эти последние сообщаются с наружной средой на заднем конце туловища урогенитальными отверстиями, а к стенкам тела подвешены посредством мезентериев (рис. 447, 8).
Протонефридии располагаются с одной стороны канала, именно на противоположной стороне от мезентерия. Они имеют вид нескольких небольших пучков, из коих каждый составлен многочисленными соленоцитами.
Половая железа развивается с той стороны урогенитального протока, с которой к нему прикреплен мезентерий. Она образует большое количество боковых выпячиваний, которые могут анастомозировать друг с другом и открываются в канал. В целом каждая гонада имеет вид продолговатого компактного тела, расположенного параллельно урогенитальному протоку.
Priapulus caudatus форма раздельнополая. Самцы и самки внешне неразличимы.
ЛИТЕРАТУРА
Общие руководства
Сводки и учебники
Беклемишев В. Н. Основы сравнительной анатомии беспозвоночных. Проморфология, 3-е изд. М., 1964, т. 1. Органология, 3-е изд., М., 1964, т. 2.
Главное внимание в книге уделяется анализу основных планов строения беспозвоночных и их развитию, а также наиболее крупным общим проблемам сравнительной анатомии. В целом книга подводит итог всему развитию сравнительной морфологии беспозвоночных.
Догель В. А. Сравнительная анатомия беспозвоночных. Л., 1938, ч. 1; Л., 1940, ч. 2.
Оригинальное, весьма полное руководство; в основном посвящено сравнительному обзору отдельных систем органов.
Догель В. А. Олигомеризация гомологичных органов как один из главных путей эволюции животных. Л., 1954.
Полное изложение принципа уменьшения числа гомологичных органов в процессе прогрессивной эволюции животных. Перечень примеров сопровождается теоретическими соображениями о приспособительном значении олигомеризации, о связи ее с павловским понятием о целостности организма и нервизма, и т. д.
Захваткин А. А. Сравнительная эмбриология низших беспозвоночных. М., 1949.
Данные по эмбриональному развитию низших беспозвоночных (губок и кишечнополостных), используются для построения оригинальной гипотезы о возможных путях происхождения Metazoa от колониальных Protozoa.
Иванов П. П. Общая и сравнительная эмбриология. М. — Л., 1938.
Большое полное руководство по эмбриологии. Второе, сокращенное издание было выпущено в 1945 г. под названием «Руководство по общей и сравнительной эмбриологии» и в него вошли новейшие данные.
Иванов А. В. Промысловые водные беспозвоночные. М., 1955.
Сводка данных по использованию водных беспозвоночных. Промысловые губки, кишечнополостные и черви на с. 214—220, 282—345.
Иванова-Казас О. М. Бесполое размножение животных. Л., 1977.
Книга представляет собой подробную критическую сводку мировой литературы, посвященную вопросам вегетативного размножения. Наибольшее внимание уделяется губкам и кишечнополостным. Рассмотрены пути возникновения колониальности.
Иванова-Казас О. М. Сравнительная эмбриология беспозвоночных животных. Простейшие и низшие многоклеточные. Новосибирск, 1975.
Подробное изложение форм размножения и хода онтогенеза у простейших, губок, кишечнополостных, гребневиков, плоских и круглых червей и скребней. Подробная библиография.
Ливанов Н. А. Пути эволюции животного мира. Анализ организации главнейших типов многоклеточных животных. М., 1955.
Оригинальный труд, освещающий основные пути эволюции животного мира.
Руководство по зоологии (коллектив авторов). Издание не доведено до конца (вышло 6 томов). Для данного тома «Большого практикума» используется 1-й том (под ред. Л. А. Зенкевича). М., 1937.
Включает Protozoa (В. А. Догель), Spongia (П. Д. Резвой), Coelenterata (В. А. Догель), Plathelminthes (В. Н. Беклемишев, Е. Н. Павловский), Nemertini (Н. А. Ливанов), Nemathelminthes (Е. Н. Павловский и др.), Rotatoria (С. Д. Муравей-ский).
Федотов Д. М. Эволюция и филогения беспозвоночных животных. М., 1966.
Так же как и в монографии Н. А. Ливанова, в книге освещены пути и закономерности эволюции беспозвоночных. Во многом трактовка проблем в названных двух работах различна.
Traite de Zoologie (под ред. Р. Р. Grasse), Paris, 1952, 1953, vol. Г, 1961, vol. 4; 1973, vol. 3.
Начавшее выходить после войны и еще не завершенное большое руководство по зоологии принадлежит перу различных авторов. Из ряда томов, изданных в настоящее время, материал данного тома «Большого практикума» содержится в двух половинах 1-го тома (1952—1953), посвященного простейшим (кроме инфузорий); в 3-м томе (1973)—губки, кишечнополостные и гребневики; 4-м томе — плоские и круглые черви (1961).
Это руководство — одно из лучших в мировой литературе. В составлении его приняли участие наиболее видные, преимущественно французские биологи. В руководстве освещена систематика, морфология, эмбриология, экология, а также вопросы филогении.
Hyman L. Н. The Invertebrata, Protozoa through Ctenophora, N. — Y., 1940, Vol. 1. Plathelminthes and Rhynchocoela, the acoelomate Bilateria, N. — Y., 1951, Vol. 2, Acanthocephala, Aschelminthes and Endoprocta, the pseudocoelomate Bilateria, N. — Y., 1951, Vol. 3.
Подробный учебник, содержащий данные по Protozoa, Spongia, Coelenterata.
Haestner A. Lehrbuch der speziellen Zoologie, Wirbelleren, zweite Auflage, Jena, 1965, Bd. 1.
Этот том учебника включает характеристику простейших, губок, кишнечнополост-ных, гребневиков, плоских червей, круглых червей, моллюсков, кольчатых червей и хелицеровых членистоногих.
Handbuch der Zoologie, gegriindet von W. Kukenthal, herausgegeben von T. Krumbach. Jena, 1923—1925, Bd. 1, 1928—1930, Bd. 2.
Фундаментальное многотомное руководство по зоологии, начавшее выходить в 1923 г. и незавершенное еще и до сих пор. Материал об отдельных группах животных написан разными специалистами. Разные части этого руководства, однако, весьма неравноценны как по объему, так и по качеству. Тем не менее данный Handbuch следует рекомендовать как пособие при углубленном прохождении практикума.
Практикумы, определители, техника исследования
Аверинцев С. В. Малый практикум по зоологии беспозвоночных. Простейшие — Protozoa и бесхордовые многоклеточные — Metazoa Achordata. М., 1947.
В книге приводится краткая характеристика основных представителей беспозвоночных и методические указания к их изучению.
Атлас беспозвоночных Дальневосточных морей (Колл, авторов под ред. П. В. Ушакова). М. — Л., 1955.
Руководство для определения беспозвоночных животных.
Быховская И. Е. Паразитологическое исследование рыб. Л., 1952.
Дубинина М. Н. Паразитологическое исследование птиц. Л., 1955.
В этих работах подробно изложена техника полного паразитологического вскрытия рыб и птиц и методы обработки найденных паразитов, как наружных, так и внутренних. Изображены наиболее часто встречающиеся паразиты.
Жизнь пресных вод СССР/Под ред. В. И. Жадина. Л., 1949, т. 2.
Определительные таблицы основных представителей пресноводной фауны: Protozoa (Н. С. Гаевская), Coelenterata (И. И. Канаев), Porifera (П. Д. Резвой), Gastrotricha, Rotatoria (Е. С. Неизвестнова-Жадина), Chaetopoda (Д. А. Ласточкин), Hirudinea (Г. Г. Щеголев), паразитические черви (Б. Е. Быховский), свободноживущие Nemato-da, Gordiacea (Е. С. Кирьянова), Turbellaria, Nemertini (В. Н. Беклемишев).
Животные и растения залива Петра Великого/Колл. авторов под ред. А. В. Жирмунского. Л., 1976.
Данная книга — необходимое руководство для определения животных Дальневос
точных морей (преимущественно Японского моря). Включает описание и изображение обычных видов беспозвоночных.
Зеликман А. Л. Практикум по зоологии беспозвоночных. М., 1969, с. 335.
Книга представляет собой хорошее руководство к обычным практическим занятиям по курсу зоологии беспозвоночных в высшей школе.
Определитель паразитов пресноводных рыб СССР / Колл, авторов под ред. Б. Е. Быховского. Л., 1962.
Руководство, необходимое для определения паразитов рыб — простейших, плоских и круглых червей, скребней, ракообразных и др.
Определитель пресноводных беспозвоночных европейской части СССР / Под ред. Л. А. Кутиковой и Я. И. Старобогатова. Л., 1977.
Полезная, хорошо составленная специалистами книга.
Определитель фауны н флоры северных морей СССР/Под ред. И. С. Гаевской. М., 1948.
Определительные таблицы для морской фауны Мурманского побережья и Белого моря. Protozoa (Гаевская, Щедрина, Яшнов), Porifera (Яшнов), Coelenterata (Березина и Яшнов), Nemertini (Яшнов), Rotatoria (Яшнов).
Паразитология человека / Под ред. Г. С. Первомайского и В. Я. Подоляна. Л., 1974.
Подробное руководство, по которому можно определить паразитов человека. Содержит обширный материал по вопросам паразитологии.
Ромейс Б. Микроскопическая техника. М., 1953.
Большой, переведенный с немецкого языка справочник по всем вопросам техники микроскопического исследования.
Роскин Г. И. и Левинсон Л. Б. Микроскопическая техника, 3-е изд. М., 1957.
Федин Л. А., Барский И. Я. Микрофотография. Л., 1971.
Лучшее руководство, очень полно освещающее все этапы микрофотографических работ.
Литература по отдельным группам Protozoa
Общие руководства
Догель В. А., Полянский Ю. И., Хейсин Е. М. Общая протозоология. Л., 1962.
Большая сводка по морфологии, физиологии, размножению, жизненным циклам и другим общим вопросам изучения простейших.
Райков И. Б. Ядро простейших. Морфология и эволюция. Л., 1978.
Наиболее полная в мировой литературе критическая сводка по кариологии простейших, охватывающая вопросы структуры и ультраструктуры интерфазных ядер, их классификаций, митоза, мейоза, эволюции ядерного аппарата.
Якимов В. Л. Болезни домашних животных, вызванные простейшими. Ветеринарная протозоология. М. — Л., 1931.
Подробный справочник по ветеринарной протозоологии, который может быть использован при прохождении соответствующих разделов практикума.
Эпштейн Г. В. Патогенные простейшие, спирохеты и грибки. М. — Л., 1931.
Первая русская протистология, включающая сведения о паразитических простейших человека.
Doflein — Reichenow. Lehrbuch der Protozoenkunde, 6-е изд. Jena, 1949—1953.
Основное руководство по простейшим, в котором прекрасно разработана общая часть (очерк морфологии, физиологии, размножения, экологии и т. д.) и дана подробная специальная часть, где большое внимание уделено паразитическим и патогенным простейшим.
Grell, К. Protozoology. Berlin — N. — Y., 1973.
Лучшее современное руководство по общим вопросам протозоологии. Включает также небольшую систематическую часть.
Kudo, R. Protozoology. Fiflh edition, Springfield. III., 1966.
Прекрасное руководство, рассматривающее преимущественно вопросы систематики и биологии простейших.
Тze-Tuan-Chen. Research in Protozoology. In four volumes.
Oxford, London, N. Y., 1967—1972.
Четырехтомный критический обзор основных проблем общей протозоологии.
Sarcodina
Аверинцев С. В. Rhizopoda пресных вод, ч. 1 и 2. — Тр. СПб об-ва естествоиспытателей. Л., 1906, т. 36.
Классическая монография, не утерявшая свое значение и в наше время. Включает подробные данные по морфологии и систематике раковинных корненожек.
Кашмен Д. Фораминиферы. М., 1933.
Перевод систематической сводки по Foramnifera современным и ископаемым. Систематическому обзору, доведенному до описания родов предпосылается хорошо составленная общая часть. Имеется подробный список литературы. Обязательное руководство при прохождении данной группы животных.
Радиолярии мирового океана. Исследование фауны морей. IX (XVII). Л., 1971.
Этот том содержит две важные монографические работы: М. Г. Петрушевской — Радиолярии Nasselaria в планктоне Мирового океана, и А. А. Стрелкова и В. В. Решетник — Колониальные радиолярии Spumellaria Мирового океана. В этих работах содержатся подробные данные не только по систематике и зоогеографии, но также по морфологии и филогении.
Решетняк В. В. Глубоководные радиолярии Phaeodaria Северо-западной части Тихого океана. Л., 1966.
Монография кроме систематики и зоогеографии включает подробный хорошо написанный морфологический очерк.
Решетняк В. В. Акантарии. Сер. Фауна СССР, ЗИН АНСССР. Л., 1981.
Фурсенко А. В. Введение в изучение фораминифер. Новосибирск, 1978.
Подробная монографическая работа, излагающая морфологию жизненных циклов, историю систем, филогению и другие вопросы.
Шевяков В. Т. Die Acantharien, Fauna und Flora des Golfes von Neapol. Monogr., 37. Roma — Berlin, 1926.
Классическая работа с большой морфологической частью, подробным систематическим обзором и атласом прекрасных цветных таблиц.
Эпштейн Г. В. Паразитические амебы. М., 1941.
Сводка по сравнительной морфологии паразитических амеб человека и животных, с большим атласом рисунков, многие из которых цветные.
Boltovskoy Е., Wright К. Recent Foraminifera. N. Y., 1976.
Монография кроме морфологии содержит подробный очерк экологии.
Jeon R. (edit.). The Biology of Amoeba. N. Y. •—London, 1973.
Обширный коллективный труд, посвященный всестороннему рассмотрению голых амеб, их морфологии, ультраструктуры, систематики, экологии, генетики.
Page F. An illustrated key to freshwater and soil Amoebae with notes on cultivation and ecology. Cambridge, 1976.
Книга, в которой сведены современные представления о систематике голых амеб и по которой можно определить их видовую принадлежность.
Mastigophora
Жуков Б. Ф. Определитель бесцветных свободноживущих жгутиконосцев подотряда Bodonina. — Тр. ин-та биолог, внутр, вод, вып. 21(24). М., 1971.
Единственный пока определитель пресноводных жгутиконосцев, позволяющий разобраться в их многообразии. Снабжен многочисленными рисунками.
Калинникова В. Д. Клеточная органелла кинетопласт. Л., 1977.
Важная работа по цитологии и цитохимии трипанозомид.
Киселев И. А. Панцирные жгутиконосцы (Dinoflagellata) морей и пресных вод СССР. Л., 1950.
Систематическая богато иллюстрированная сводка и определитель морских и пресноводных панцирных жгутиконосцев.
Определитель пресноводных водорослей СССР /Под ред. М. М. Голлербаха, В. И. Полянского и В. П. Савича. Л., 1960.
Серия выпусков включает все группы окрашенных жгутиконосцев.
Hoare С. The Trypanosomes of Mammals. Oxford — Edinburgh, 1972.
Обширная исчерпывающая монография по трипанозомидам.
Ciliophora
Догель В. А. Простейшие — Protozoa. Малоресничные инфузории Infusoria Oli-gotricha, Ophryoscolecidae. — Определители по фауне СССР. ЗИН АН СССР, 12. Л., 1929.
Систематическая сводка, включающая краткий сравнительноморфологический обзор.
Стрелков А. А. Паразитические инфузории из кишечника лошади и родственных ей Equidae (монография). — Уч. зап. Гос. пед. ин-та им. А. И. Герцена. Л., 1939, т. 17.
Corliss J. A. The Ciliated Protozoa. Characterization, classification and guide to the literature. The 2nd edition. Oxford — N. Y. 1979.
Наиболее полная современная сводка по инфузориям. Включает характеристику всех таксонов до семейств включительно с перечислением родов. Свыше 1000 рисунков. Приведена история изучения инфузорий, а также дана исчерпывающая библиография.
Kahl A. Urtiere oder Protozoa. I. Wimpertiere oder Ciliata (Infusoria). Die Tierwelt Deutschlands. Jena, 1930—1933.
Сводка по свободноживущим и эктокомменсальным инфузориям. Определительные таблицы доведены до видов.
Elliot A. (edit.) Biology of Tetrahymena. Dowden, 1973.
Обширная коллективная работа, всесторонне рассматривающая инфузорий рода Tetrahymena — их морфологию (в том числе ультраструктуру), систематику, физиологию, биохимию, экологию, генетику.
Van Wagtendonk В. (edit.). Paramecium. A. Current Survey. Amsterdam, 1974.
Обширная коллектиная монография рода Paramecium, охватывающая морфологию, систематику, физиологию, экологию, культивирование половой процесс и типы спаривания, движение, поведение, биохимию и другие вопросы. Работа представляет большой рбщебиологический интерес.
Wichterman R. The biology of Paramaecium. N. Y., 1953.
Подробная, но несколько устаревшая сводка по морфологии, физиологии, размножению, изменчивости и наследственности.
Sporozoa
Бейер Т. В., Шибалова Т. А., Костенко Л. А. Цитология кокцидий. Л., 1978.
Монография, подробно освещающая вопросы морфологии (в том числе ультраструктуры), жизненных циклов, культивирования кокцидий (в том числе токсоплазмы и саркоспоридий).
Хейсин Е. М. Жизненные циклы кокцидий домашних животных. Л., 1967.
В книге дан подробный анализ морфологии, жизненных циклов, эволюции, построения системы, а также описание видов кокцидий домашних животных.
Garnham Р. Malaria parasites and other Haemosporidia. London, 1966.
Монография, с исчерпывающей полнотой всесторонне описывающая кровяных споровиков. Множество цветных рисунков.
Watson-Kamm М. Е. Studies on Gregarines. Illinois Biol. Monogr., vol. VII, 1922.
Систематическая монография, несколько устаревшая, но все же полезная для определения грегарин.
Cnidosporidia
Шульман С. С. Микроспоридии фауны СССР. Л., 1966.
Исчерпывающая работа по морфологии, экологии, систематике миксоспоридий.
Spongia
Иванов А. В. Эмбриональное развитие губок (Porifera) и положение их в системе животного мира. — Журнал общей биологии, 32,5. М., 1971, с. 557—572.
Важная работа, в которой обсуждаются сложные вопросы положения губок в системе.
Колтун В. М. Кремнероговые губки северных и дальневосточных морей СССР. Л„ 1959.
Колтун В. М. Четырехлучевые губки северных и дальневосточных морей СССР. Л., 1966.
Обе работы посвящены в основном вопросам систематики.
Резвой П. Д. Губки. Пресноводные губки. Фауна СССР. Новая серия № 3. Л., 1936, т. 2, вып. 2.
Подробно рассмотрены морфология, физиология и систематика.
Haeckel Е. Die Kalkschwamme eine Monographic. Jena, 1872.
Классическая монография (в трех томах), положившая начало изучению губок.
Coelenterata
Канаев И. И. Гидра. Очерки по биологии пресноводных полипов. Л. 1952. Подробная монография по морфологии, физиологии гидры и ее регенерации. Наумов Д. В. Гидроиды и гидромедузы. Л., 1960.
Наумов Д. В. Сцифоидные медузы морей СССР. Л., 1961.
Монографии, включающие вопросы морфологии, жизненных циклов и описания видов, населяющих моря СССР.
Hickson S. Alcyonium. Liverpool Marine Biology Committee Memoirs on Typical British Marine Plants and Animals. Liverpool, 1901.
Небольшая монография, специально посвященная Alcyonium.
Ctenophora
Chun C. Die Ctenophoren des Golfes von Neapol. I Monographic. Roma — Berlin, 1880.
Классическое исследование организации гребневиков. Монография прекрасно иллюстрирована.
Turbellaria
Евдонин Л. А. Хоботковые ресничные черви Kalyptorhynchia фауны СССР и сопредельных стран. Л. 1977.
Подробное исследование организации, систематики, биологии, филогении хоботковых ресничных червей.
Иванов А. В., Мамкаев Ю. В. Ресничные черви, их происхождение и эволюция (филогенетические очерки). Л., 1973.
Монография, являющаяся одним из основных современных источников при изучении турбеллярий.
Иванов А. В. Бескишечные турбеллярии (Acoela) южного побережья Сахалина. — Тр. Зоолог, ин-та АН СССР, 12. М., 1952, с. 40—132.
Важная подробная работа по морфологии бескишечных турбеллярий (Acoela).
Dorjes J. Die Acoela (Turbellaria) der Deutschen Nordsekiiste und ein neues System der Ordnung. Z. zool. Syst. Evolutionsforsch., B. 6, s. 56—452, 1968.
Одно из основных и наиболее значительных исследований организации и систематики бескишечных турбеллярий.
Karting Т. Turbellarien fauna of the Baltik Proper. Fauna Fennicae. v. 27, 1974.
Определительные таблицы, рисунки, описания ресничных червей, встречающихся в водах Балтики.
Marcus Е. Systematische Ubersicht der Polykladen. Zool. Beitrage., N. F., B. 12, H. 3, s. 319—343, 1966.
Морфология и определительные таблицы Polyclada (до рода).
Reynoldson Т. В. A key to the British species of Freshwater Triclads. Freshwater Biol. Assoc. Scient. Publ., V. 23, 1967.
Работа для изучения морфологии и для определения пресноводных Turbellaria Triclada.
Trematoda и Monogenea
Быховский Б. Е. Моногенетические сосальщики, их система и филогения. Л., 1957.
Основное исследование по морфологии, систематике, биологии, филогении моно-геней.
Гинецинская Т. А. Трематоды, их жизненные циклы, биология и эволюция. Л., 1968.
Фундаментальная работа, освещающая все основные вопросы изучения трематод.
Скрябин К. И. Трематоды человека и животных. Основы трематодологии. М., 1947—1970, т. 1—24.
Многотомное издание, в котором с исчерпывающей полнотой описаны все известные виды трематод.
Шульц Р. С., Гвоздев Е. В. Основы общей гельминтологии. М., 1970, т. 1; М., 1972, т. 2.
Очень полное современное руководство, в котором рассматриваются все группы паразитических червей, их система, организация, биология, взаимоотношения хозяина и паразита. Следует широко использовать при прохождении большого практикума.
Looss A. Die Distomen unserer Fische und Frosche. Neue Untersuchungen liber Bau und Entwicklung des Distomenkorpers. Biblioteca Zoologica, Heft 16, 1894.
Классическая монография по строению Trematoda из рыб и лягушек. Текст снабжен атласом, многочисленными, прекрасно выполненными иллюстрациями.
Noble Е., Noble G.. Parasitology. The Biology of Animal Parasites. 4th edition, Phy-ladelphia, 1966.
Один из лучших современных курсов паразитологии, включающий многочисленные сведения по экологии, жизненным циклам, практическому значению разных групп гельминтов и других паразитов.
Cestoda
Спасский А. А. Аноплоцефаляты — ленточные гельминты домашних и диких животных.— В кн.: Основы цестодологии /Под ред. К. И. Скрябина. М., 1951, т. 1.
Монография по систематике возбудителей серьезных заболеваний домашних животных с большой общей частью, включающей морфологию, жизненные циклы и распространение аноплоцефалят.
Подъяполъская В. П., Капустин В. Ф. Глистные заболевания человека, 2-е изд. М„ 1950.
Описание возбудителей глистных заболеваний человека с изложением их морфологии, биологии, диагностики, методов лечения и профилактики. Приведены фотографические изображения паразитов и их яиц.
Скрябин К. И., Шульц Р. С. Гельминтозы человека (основы медицинской гельминтологии). М., 1929, т. 1.
Подробное изложение биологии, эпидемиологии и отличительных свойств ленточных глист человека.
Скрябин К. И., Шульц Р. С. Гельминтозы крупного рогатого скота. М.—Л., 1937.
Цестоды и цестодозы (233—360) изложены подробно. Следует специально обратить внимание на материал об эхинококке.
Скрябин К. И., Матевосян Е. М. Ленточные гельминты — гименолепиды домашних и охотничье-промысловых птиц. М., 1945.
Монография по систематике наиболее обычных птичьих цестод с большим очерком морфологии и биологии этих червей.
loyeux Ch. el Baer J. Cestodes. Faune de France, Paris, 1936, V. 3.
Фундаментальная сводка no Cestodes, паразитирующим в животных Франции. Может служить определителем при изучении ленточных червей. Материал разбит по хозяевам. Определение доведено до вида.
Wardle К- & Mcleod J. A. The Zoology of Tapeworms. Univ. Minnesota Press, Min-eapolis., 1952.
Обстоятельная, полная сводка, освещающая вопросы систематики, морфологии, биологии и филогении ленточных червей.
Nemertini
Шмидт Г. А. Исследование по сравнительной эмбриологии немертин.— Изв.
АН СССР, отд. биол. наук. М., 1940, с. 824—905.
Важная работа, в которой кроме эмбриологии обсуждаются общие вопросы положения немертин в системе их эволюции.
Bilrger О. Die Nemertinen des Golfes von Neapol. Fauna und Flora des Golfes von Neapol Monorg. 22, Roma — Berlin, 1895.
Bilrger O. Nemertini. Das Tierreich Lief, 2o, 1904.
Обе указанные выше работы Бюргера и до нашего времени не утеряли значения и являются классическими исследованиями по морфологии и систематике немертин.
N ematod.es
Определитель паразитических нематод/Под ред. Скрябина К. И.
Многотомное издание, отдельные тома которого посвящены разным группам паразитических нематод, издается начиная с 1949 г.
Основы нематодологии/Под ред. К- И. Скрябина.
Многотомное издание, издается начиная с 1949 г., посвященное подробным очеркам морфологии, биологии, практическому значению и систематике отдельных групп, круглых червей.
Бондаренко П. В., Поляков И. Я., Стрелков А. А. Вредные нематоды, клещи и грызуны. Л., 1969.
Часть книги, посвященная нематодам, дает краткий, но современный очерк нематод, вредящих сельскохозяйственным культурам.
Парамонов А. А. Основы фитогельминтологии. М., 1962, т. 1; М., 1964, т. 2.
Работа включает очерк организации нематод, написанный с позиций эволюционной морфологии и подробное описание системы и отдельных видов нематод — паразитов растений.
Филипьев И. 77. Нематоды, вредные и полезные в сельском хозяйстве.— М.—Л., 1934.
Книга содержит много сведений по морфологии и экологии нематод.
Chitwood В.. Chitwood М. An introduction to Nematodology. Baltimore, 1950.
Полезный очерк организации, систематики и биологии нематод.
Acanthocephq.la
Петроченко В. И. Акантоцефалы домашних и диких животных. М„ 1956, т. 1: М., 1958, т. 2.
Обстоятельная монография, освещающая вопросы морфологии, систематики, биологии скребней, их практического значения и филогении.
Kaiser J. Е. Die Acanthocephalen und ifire Entwicklung. Bibliotheca Zoologica. Heft VII, 1893.
Фундаментальная монография по скребням, представляющая сравнительный обзор их морфологии, физиологии и развития.
Rotatoria
Кутикова Л. А. Коловратки фауны СССР (класс Rotatoria, подкласс Eurotatoria, отряды Ploimida, Monimotrochida, Paedotrochida). Л., 1970.
Исчерпывающая монография, охватывающая большую часть коловраток. Кроме систематики (до вида) — подробный морфологический очерк, экология, распространение, филогения.
Martini Е. Studien Tiber die Konstanz histologischer Elemente. III. Hydatina senta. Zeitschrift der wissenschaftliche Zoologie, Bd. 102, 1912.
Исчерпывающее морфологическое исследование организации Hydatina (Epiphanes) senta, проведенное под углом зрения изучения постоянства клеточного состава.
Wesenberg-Lund С. Contributions to the Biology of the Rotifera. I. The male of the Rotifera. Rgl. Danske Vid. Selsk. Skr. Nat. Mat. Afd. 8, R, 4, Bind 4, 1923.
Подробное исследование биологии коловраток не только самок, но и самцов.
Priapulida
Fischer W., Priapulidae. Die Tierwelt der Nord- und Ostsee Lief, 1, 1925.
Подробный морфологический очерк и систематика.
Жинкин Л. Н. Особенности развития и систематическое положение Priapulida.— Уч. записки Гос. пед. ин-та им. Герцена. Л., 1955, т. ПО.
СОДЕРЖАНИЕ
Предисловие к третьему изданию................................................. 3
Введение ...................................................................... 5
О постановке практикума по зоологии беспозвоночных............................. 5
Микроскопическая техника ...................................................... 8
Изучение живых объектов...................................................... 8
Фиксация ................................................................... 10
Изготовление тотальных микроскопических препаратов.......................... 15
Декальцинация .............................................................. 19
Изготовление мазков......................................................... 19
Заливка и приготовление срезов ............................................. 20
Окраска препаратов.......................................................... 29
Некоторые цитохимические методы ............................................ 36
Методы выявления полисахаридов (гликогена и амилопектина)................ 39
Методы выявления жировых включений.......................................... 41
Вскрытие ..................................................................... 42
Инъекция...................................................................... 43
Рисование при прохождении зоологического практикума........................... 45
Методы реконструкций по срезам................................................ 46
Подцарство Protozoa Тип Plasmodroma
Класс Sarcodina — саркодовые.................................................. 58
Подкласс Rhizopoda — корненожки ............................................. 58
Отряд Amoebina.............................................................. 58
Amoeba proteus.............................'............................... 58
Отряд Testacea.............................................................. 62
Difflugia piriformis....................................................... 62
Euglypha alveolata......................................................... 63
Arcella vulgaris......................................................... 64
Отряд Foraminifera.......................................................... 65
Морфология раковинки различных Foraminifera................................ 65
Подкласс Heliozoa — солнечники ............................................... 70
Actinosphaerium eichhorni ................................................. 70
Подкласс Radiolaria—лучевики ................................................. 72
Acanthometra sp............................’............................... 72
Различные феодарии ........................................................ 74
Aulacantha scolymantha..................................................... 74
Circospathis sexfurca .................................................... 76
Tuscaretta tubulosa........................................................ 76
Castanidium variabile...................................................... 76
Класс Mastigophora — жгутиконосцы............................................. 76
Отряд Kinetoplastida........................................................ 77
Bodo sp.................................................................... 77
Trypanosoma lewisi......................................................... 78
Отряд Euglenoidina ......................................................... 80
Euglena viridis ........................................................... 80
Другие виды евглен......................................................... 82
Phacus sp., Trachelomonas sp. и Peranema sp................................ 82
Отряд Phytomonadina ........................................................ 84
Chlamydomonas sp........................................................... 84
Polytoma uvella............................................................ 86
Eudorina elegans.......................................................... 87
Volvox aureus........................................................... 90
Отряд Dinoflagellata.......................................................... “j?
Peridinium sp............................................................... J"?
Ceratium hirudinella .....................................................
Gymnodinium sp................................................................ ™
Отряд Polymastigina........................................................... 100
Trichomonas muris........................................................... 100
Lamblia ( = Giardia) muris................................................. Ю1
Отряд Hypermastigina ........................................................ 103
Lophomonas blattarum ..................................................... 103
Отряд Opalinina.............................................................. 105
Opalina ranarum........................................................... 105
Тип Ciliophora
Класс Infusoria — инфузории .............................................. 107
Подкласс Ciliata — ресничные инфузории......................................... 109
Надотряд Kinetofragminophora.................................................. Ю9
Отряд Gymnostoniata........................................................... НО
Отряд Entodiniomorpha........................................................ 114
Epidinium ecaudatum........................................................ 114
Надотряд Oligohymenophora.................................................... 121
Отряд Hymenostomata ........................................................ 121
Tetrahymena pyriformis .................................................... 121
Paramecium caudatum........................................................ 123
Отряд Peritricha............................................................. 130
Vorticella sp.............................................................. 130
Zoothamnium arbuscula ..................................................... 134
Надотряд Pilyhymenophora..................................................... 140
Отряд Heterotricha........................................................... 140
Stentor coeruleus .......................................................... 140
Отряд Hypotricha............................................................. 143
Stylonychia mytilus....................................................... 143
Подкласс Suctoria — сосущие инфузории.......................................... 146
Tocophrya quadripartita.................................................... 146
Dendrocometes paradoxus ................................................... 148
Тип Sporozoa
Класс Gregarinida — грегарины.................................................. 150
Отряд Eugregarinaria ........................................................ 150
Monocystis sp.............................................................. 150
Грегарины из подотряда Cephalina......................................... 154
Класс Coccidiomorpha — кокцидиеобразные ....................................... 158
Отряд Coccidiida ............................................................ 158
Eimeria magna ............................................................. 158
Отряд Haemosporidia.......................................................... 165
Plasmodium vivax, P. malariae, P. falciparum............................... 165
Тип Cnidosporidia
Класс Myxosporidia — слизистые споровики....................................... 172
Myxidium lieberkiihni-..................................................... 172
Myxobolus sp............................................................... 174
Henneguya sp............................................................... 176
Тип Microsporidia Nosema apis ............................................................. 177
Тип Spongia
Класс Calcispongia (Calcarea) — известковые губки.............................. 179
Отряд Heterocoela............................................................ 179
Sycon raphanus ............................................................ 179
Класс Demospongia — обыкновенные губки...................................
Отряд Cornacuspongia ..................................................
Бадяга ..............................................................
Тип Coelenterata
Класс Hydrozoa — гидроидные...................................................
Отряд Hydrida...............................................................
Hydra oligastis ..........................................................
Отряд Leptolida.............................................................
Tubularia sp..............................................................
Clava multicornis ........................................................
Coryne sarsi .............................................................
Obelia sp.................................................................
Другие представители гидроидных полипов...................................
Класс Scyphozoa — сцифоидные медузы...........................................
Отряд Semaeostomae..........................................................
Aurelia aurita............................................................
Отряд Stauromedusae ........................................................
Haliclystus sp............................................................
Класс Anthozoa — коралловые полипы............................................
Подкласс Octocorallia — восьмилучевые коралловые полипы.......................
Отряд Alcyonaria ...........................................................
Alcyonium sp..............................................................
Подкласс Hexacorallia — шестилучевые коралловые полипы........................
Отряд Actiniaria ...........................................................
Bunodactis stella ........................................................
Тип Ctenophora
Отряд Cydippea..............................................................
Pleurobrachia rhododactyla................................................
Отряд Beroidea..............................................................
Вёгое cucumis.............................................................
Тип Plathelminthes
Класс Turbellaria — ресничные черви...........................................
Отряд Seriata...............................................................
Dendrocoelum lacteum......................................................
Отряд Polycladida...........................................................
Leptoplana sp.............................................................
Отряд Neorhabdocoela ......................................................
Mesostoma ehrenbergii ....................................................
Dalyellia sp..............................................................
Gyratrix hermaphroditus...................................................
Отряд Macrostomida..........................................................
Microstomum lineare ......................................................
Отряд Acoela................................................................
Convoluta sp..............................................................
Класс Trematoda — сосальщики, или трематоды...................................
Dolichosaccus rastellus ..................................................
Fasciola hepatica.........................................................
Некоторые стадии жизненного цикла сосальщиков.............................
Класс Aspidogastrida — аспидогастриды.........................................
Aspidogaster conchicola...................................................
Класс Monogenea — моногенеи...................................................
Polystoma intergerrimum...................................................
Diclybothrium armatum ....................................................
Dactylogyrus sp...........................................................
Diplozoon paradoxum.........................................................
Класс Cestoda — ленточные черви, или цестоды..................................
Taeniarhynchus saginatus .................................................
Diphyllobothrium latum ...................................................
185
185
185
192
192
192
208
208
214
215
217
224
226
226
226
233
233
238
238
238
238
245
245
245
252
252
261
261
264 265 265 286 286 296
296 307 312 316 316
319 319 321
321 331 338 343 344
345 345 355 358 361
364 364 379
Развитие Diphyllobothrium latum ........................................ 387
Echinococcus granulosus.................................................... 391
Dipylidium caninum......................................................... 392
Caryophyllaeus laticeps ................................................... 395
Сколексы различных других Cestoda.......................................... 395
Класс Amphilinida — амфилиниды................................................. 399
Тип Nemertini
Класс Nemertini — немертины................................................... 402
Подкласс Anopla — невооруженные немертины................................... 402
Отряд Heteronemertini ....................................................... 402
Lineus gesserensis ........................................................ 402
Другие немертины.......................................................... 414
Личиночные формы Nemertini................................................. 419
Молодые планктонные стадии Nemertini....................................... 421
Тип Nemathelminthes
Класс Nematodes — круглые черви, или нематоды................................... 422
Ascaris suum, Parascaris equorum............................................ 422
Trichinella spiralis ....................................................... 443
Rhabditis sp................................................................ 446
Класс Nematomorpha — волосатики................................................. 448
Gordius aquaticus .......................................................... 448
Класс Acanthocephala — скребни.................................................. 454
Acanthocephalus lucii....................................................... 454
Класс Rotatoria — коловратки.................................................... 469
Отряд Ploima ................................................................. 470
Epiphanes senta............................................................. 470
Asplanchna sp............................................................... 479
Отряд Paedotrochida........................................................... 483
Collotheca Harring.......................................................... 483
Отряд Bdelloidea ............................................................ 485
Rotaria Scopoli ............................................................ 485
Цикломорфоз некоторых коловраток............................................ 489
Класс Priapulida — приапулиды................................................... 489
Priapulus caudatus.......................................................... 490
Литература ................................................;.................... 493
Артемий Васильевич Иванов, Юрий Иванович Полянский, Александр Александрович Стрелков
Большой практикум по зоологии беспозвоночных
Простейшие, губки, кишечнополостные, гребневики, плоские черви, немертины, круглые черви
Редактор В. С. Капышева. Младшие редакторы Л. Е. Кононова, Л. К. Архипова. Художественный редактор Т. А. Коленкова. Художник А. В. Алексеев. Технический редактор Т. Д. Гарина. Корректор С. К. Завьялова.
ИБ Ks 2946
Изд. № Е-374. Сдано в набор 26.03.81. Поди, в печать 18.09.81. Формат 70X90'/ie. Бум. тип. № 2. Гарнитура литературная. Печать высокая. Объем 38,85 усл. печ. л. 36,85 усл. кр.-отт. 38,62 уч.-изд. л. Тираж 12 000 экз. Зак. № 242. Цена 1 р. 80 к.
Издательство «Высшая школа», Москва, К-51, Неглинная ул„ д. 29/14.
Ярославский полиграфкомбинат Союзполиграфпрома при Государственном комитете СССР по делам издательств, полиграфии и книжной торговли. 150014, Ярославль, ул. Свободы, 97.