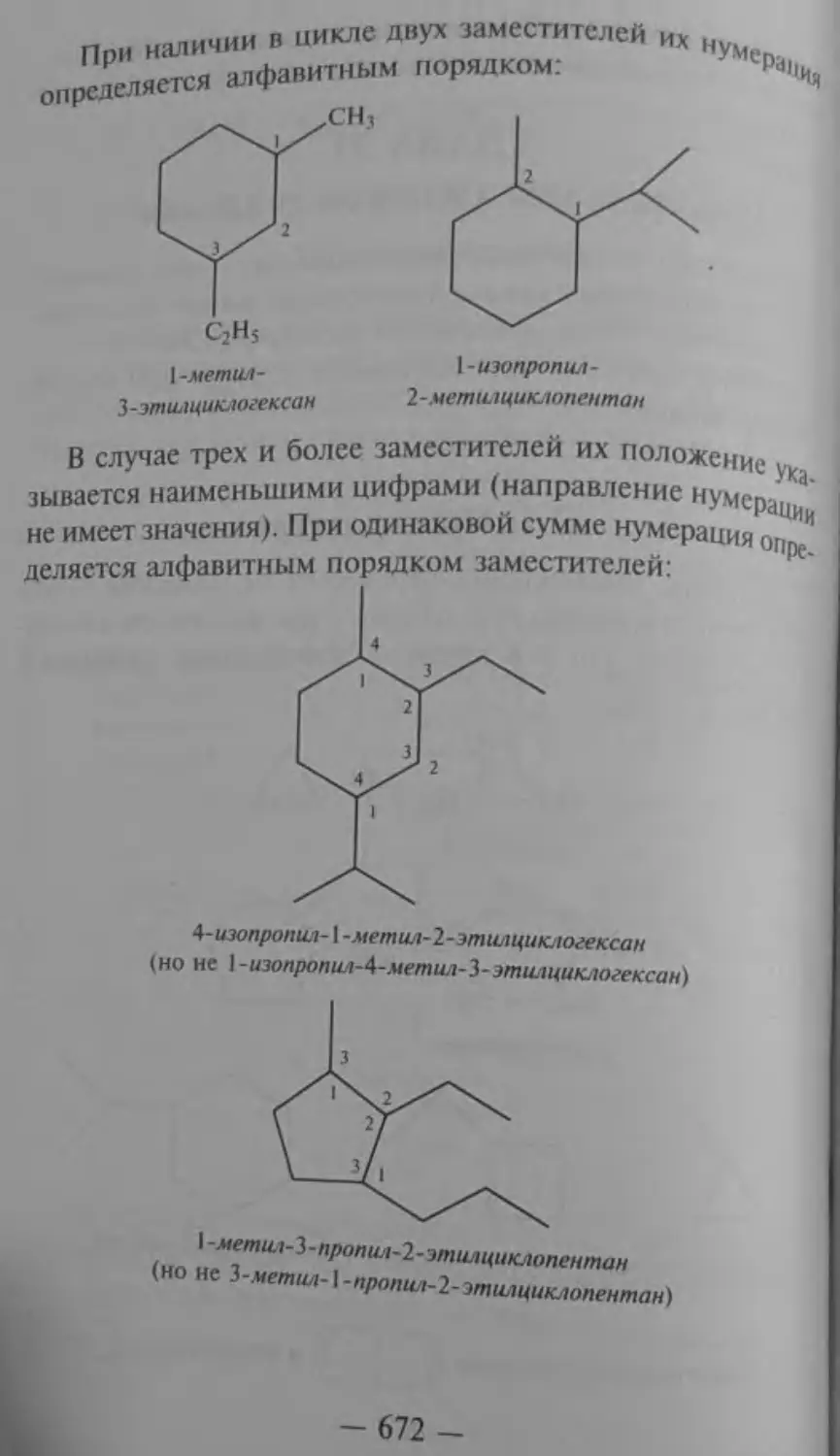
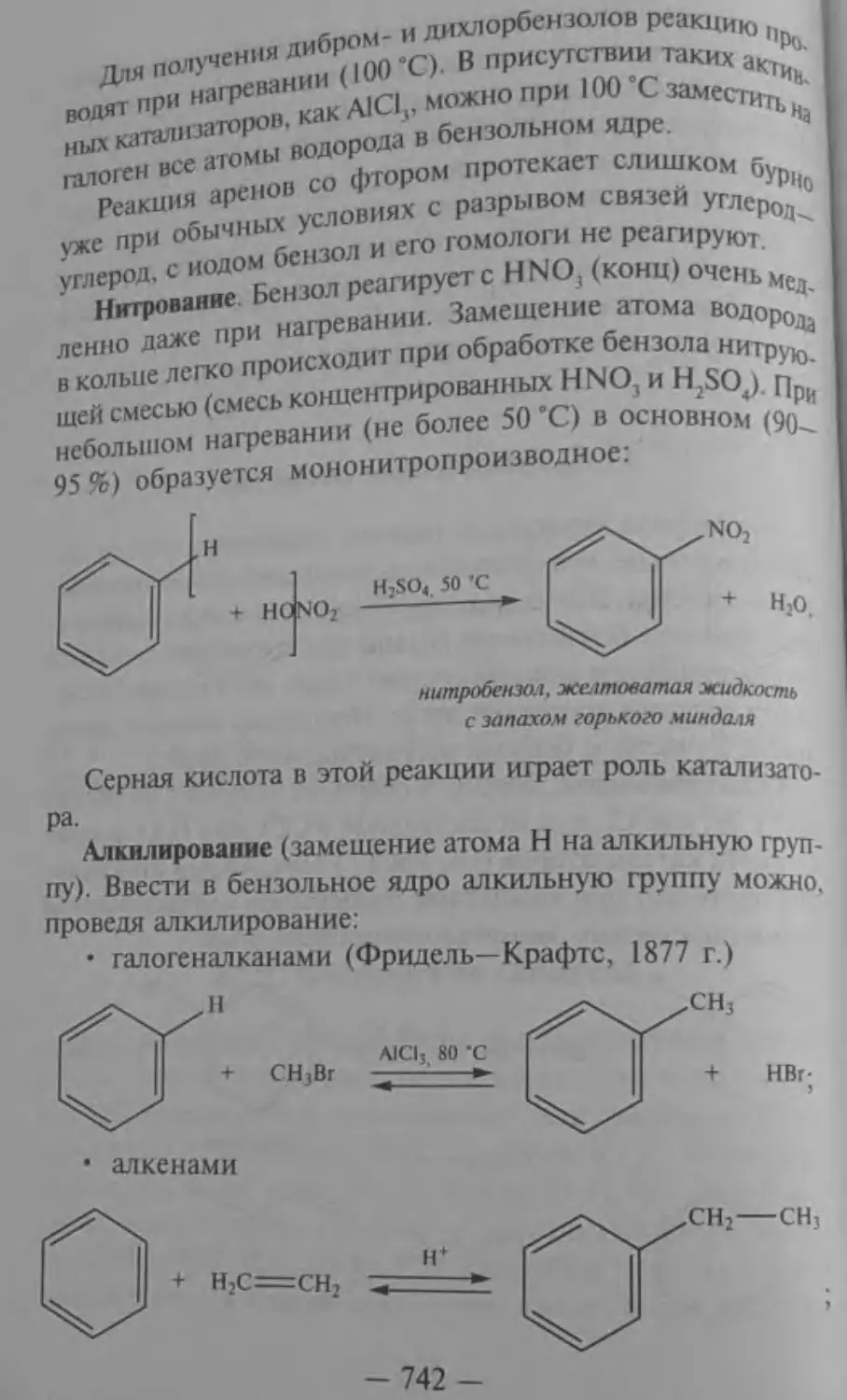
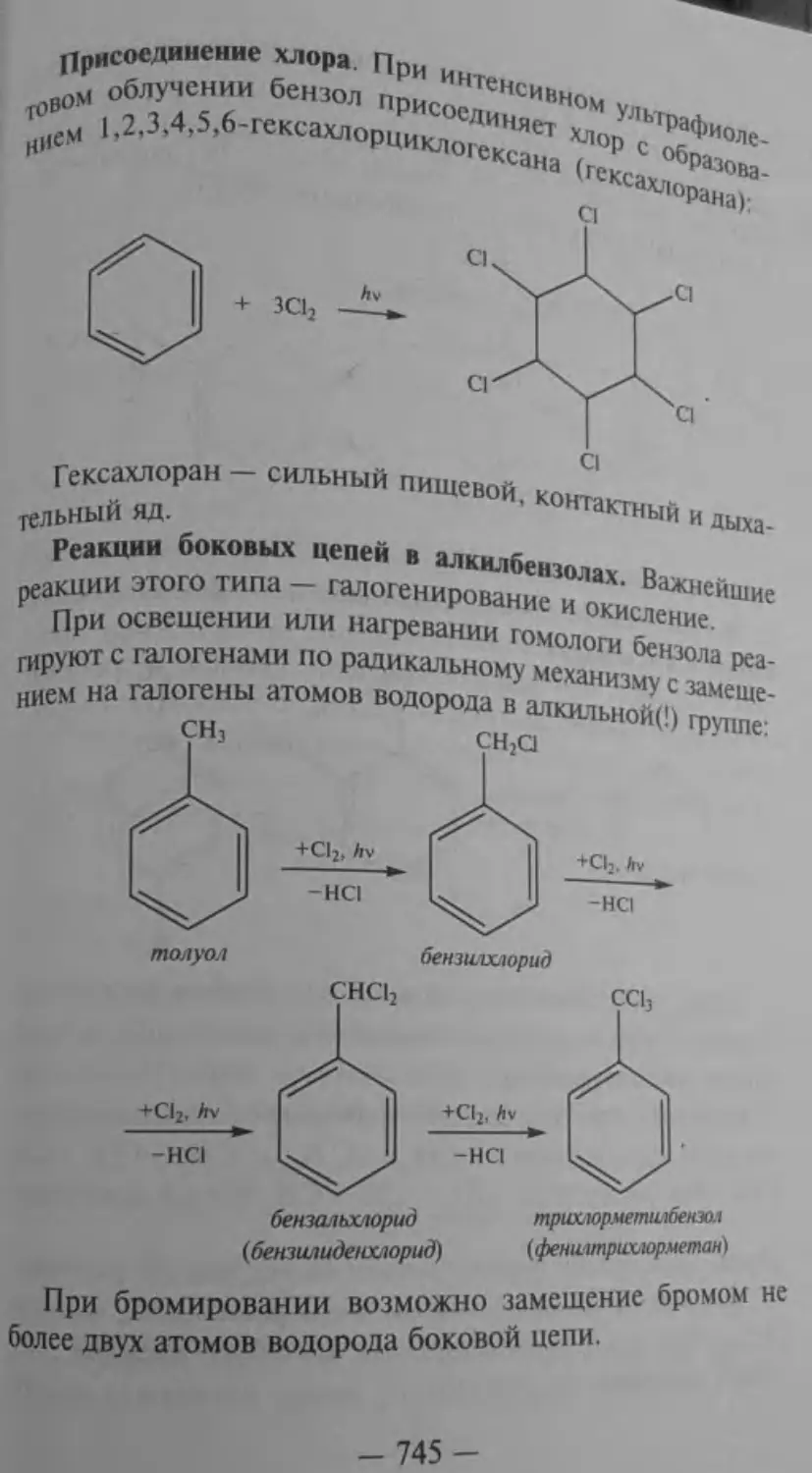
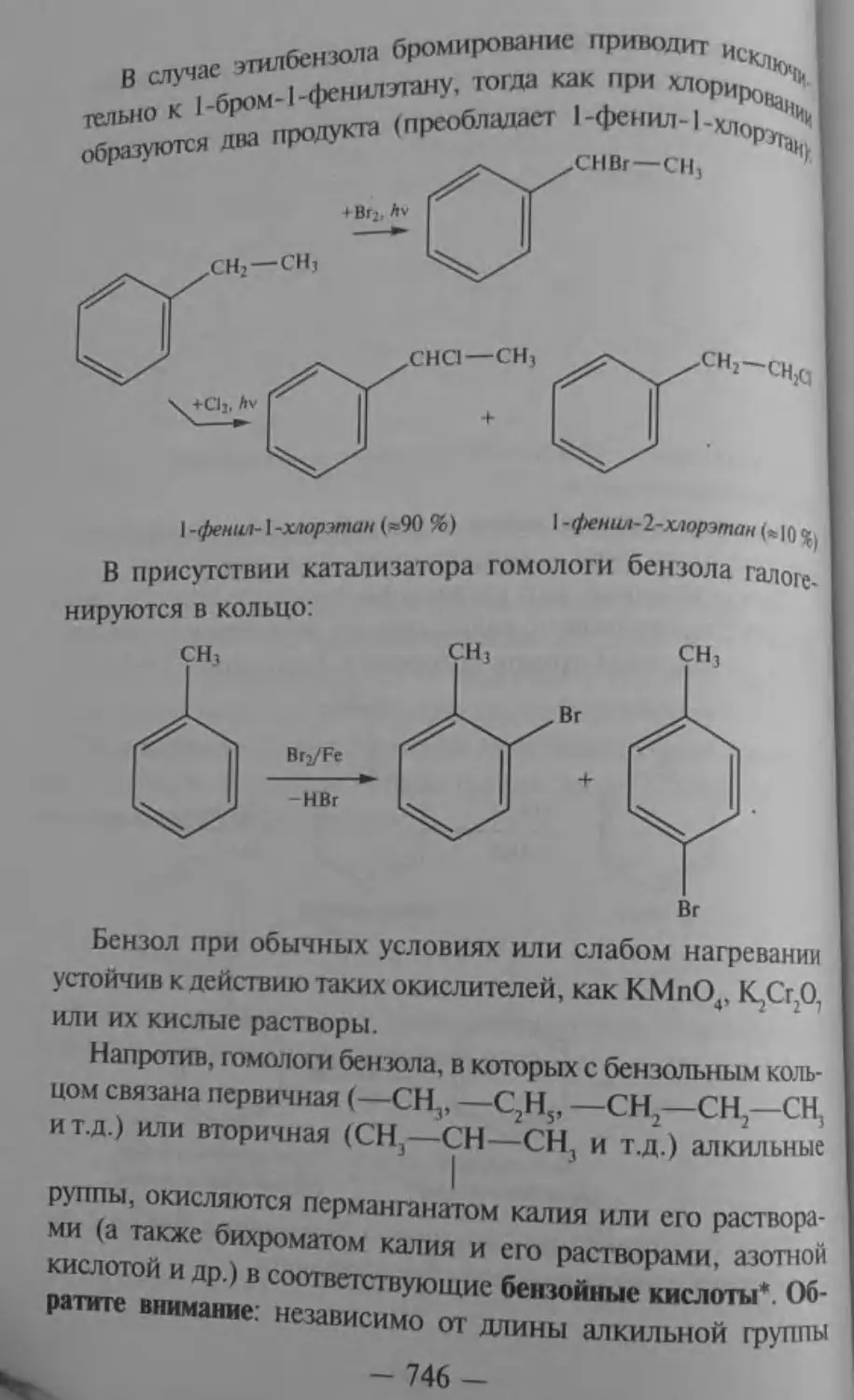
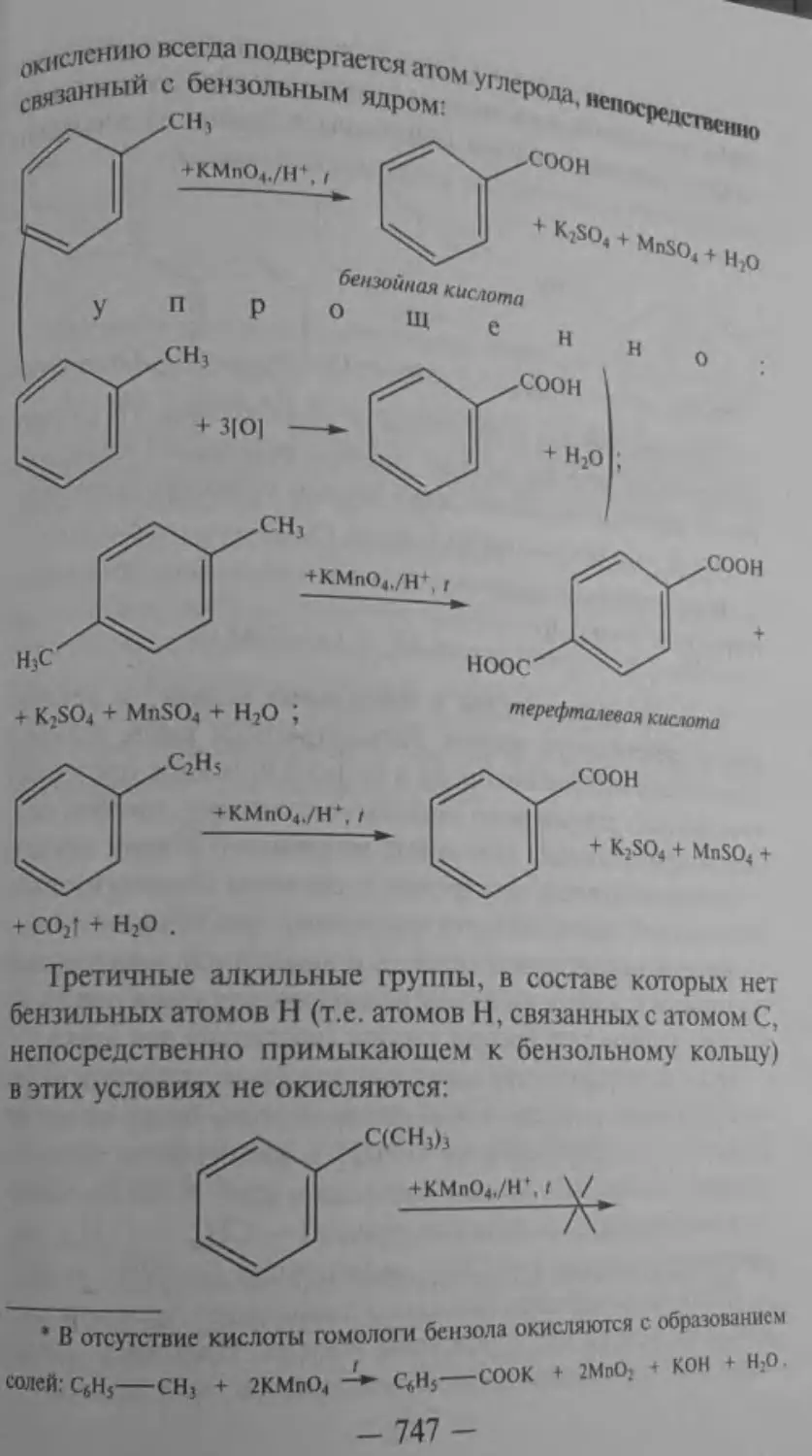
Текст
А. И. Врублевский
основы
ХИМИИ
ШКОЛЬНЫЙ КУТС
Школьный курс / А. И. Врублевский. -
УДК 54(075.3)
ББК24Я721
ВРУБЛЕВСКИЙ Александр Иванович
ОСНОВЫ ХИМИИ
ОТ АВТОРА
НОЛ ншш
Часть I Теоретические основы химии
ГЛАВА 2
ГЛАВА 5 Электроны в атоме
51. Электронные облака и атомные орбитали
Примерно через 20 лет после того, как Э. Резерфорд пред-шии свою планетарную модель строения атома, было ус-пяомено. что электрон обладает не только корпккумрны-« свойствами <т.е. свойствами частиц), но и волновыми. О по-сэелнихсвидетельствуют, например, обнаруженные в случае электронов и типичные для волн явления дифракции и аяерферениии. О корпускулярных свойствах электрона сви-
себе наглядный образ электрона как объекта, обладающего ^временно свойствам и и волны, и частицы. Для электрона эти свойства органичны, а мы на практике в зависимости от условий опыта получаем информацию либо о тех, либо о apyntt его свойствах. Нельзя поставить опыт, в котором одновременно проявлялись бы и волновые, и корпускулярные свойства электрона. В этом — особенность микромира, изме-
Ротному пересмотру характера ею движения в атоме. В насто
ит» Кмнтовой или волновой механики (т е. физики микро
лтамная орбитам - част, электронного облака, охват, жтшя ту область. внутри которой в. , ..тность обнтЛ электрон составляет не менее 90 %. ‘я|к
В литературе, особенно учебных пособиях для аби™, сиол сложилась определенная „ „ ,рафиче£
Р^мХИ “е1аронного 06 'ия атома м»
Хея X™ НаЛ° “СеГДа что конкрс»
Наибпп 4/1,1 ТОГО ИЛИ ИНОЮ рн; . нка.
можно ' |’онном °S“
перимента п~„„ основании с мысленною*»
ЧЫ “ СОС11'Я'™’ получитао»
«<•» “Г- > И»на . »-
Фотографии друг на лпч™ РеМ№" ,рис' 5J)' НалЯ’ м'рную картину мсктпоннпт Как ' ‘; 11 ГЮЛУЧИМЧЙ' привело н^ис5>^''а>С 'Юп еречное сеча* ““IC (густота точек больше > 2"6лизи’чра юктрон бй*1 «оетьобнаруад lleXnu ° мере >-^'снияотядраверя«'
^инемиХ^^^я (.успХчек* учесть, что сила притийа*
— 62 —
i атома волорола,
полуденные в разные промежутки времени
Каков физически и смысл рис. 5.2? Этот рисунок описывает вероятность нахождения электрона в некоторой области трех
плотность вероятности обнаружения электрона или просто
Например, в случае атома водорода она становится малой
- 63 -
ГЛАВА 6 Периодический икон и периодическая система элементе*
6.1. Периодический закон и периодическая система элементов
ытки систематизации химических элементов предпд,
И. В До6ерейиер(1817 г.) выделил триады элементов, ед,.
кургуз (1863 г.) обнаружил повторяемость свойств эдеме», гои при их расположении по спирали на поверхности цилиндра Английский химик Д. Ньюленде (1864 г.) замело
свойства первого элемента похожи на свойства восьмого, второго - на свойства девятого, третьего - на свойства десятого и тл. Наконец, немецкий химик Л. Мейер (1864 г I
носигельной атомной массы элемента
надлежит Д. И. Менделееву (1869 и и в настоящее врио
известных к тому времени простых веществ и соединен*
ва: свойства атомов химических элементов, а также сост^ и свойства образуемых ими веществ находятся в период свой зависимости от зарядов ядер атомов.
Периодическая система — отображение периодического ^кона. Ознакомимся со структурой периодической системы представленной в виде таблицы химических элементов (полулунный вариант, рис. 6.1).
Таблица содержит семь горизонтальных рядов элементов, называемых периодами. Период — последовательный ряд элементов (расположенных в порядке возрастания зарядов ядер их атомов на единицу), электронная конфигурация внешнего энергетического уровня которых изменяется от ns' до ns*njf (для первого периода от 1s' до 1s1).
Физический смысл номера периода — показывает число энергетических уровней, на которых находятся электроны в атомах данного элемента (т.е. число электронных слоев).
По числу элементов, входящих в состав периода, первые три периода называются малыми (2 или 8 элементов), остальные — большими (18 или 32 элемента). Каждый период (исключая первый) начинается щелочным металлом и заканчивается благородным газом.
Таблица содержит 18 вертикальных столбцов — групп, пронумерованных арабскими цифрами (1—18). Чаше пользуются традиционной нумерацией групп римскими цифрами с добавлением букв А или В. Группы А называются глав-
Деление на группы А и В обусловлено различным характером заполнения энергетических уровней и подуровней в атомах химических элементов. В атомах элементов А-групп
5- или р-подуровень. Например: 17С1: Х&Ю^ЗзЧр?.
уровня (4/-элементы - лант ниды). Например.
В-групп — как внешнего, так и предвнешнего (^-элементы) или внешнего, предвнешнего и третьего снаружи (/-элементы). Например, в атоме хлора (элемент A-группы) валентными являются электроны З^З/т5 (всего их 7, что совпадает с номером 1руппы). В случае атома марганца (группа В) валент-
что также совпадает с номером группы.
Таким образом, группа — вертикальный ряд элементов,
торые содержат одинаковое число валентных электронов.
Химические элементы одной группы имеют и сходные свойства, поэтому их иногда называют « элементы-аналоги».
Условная разделительная линия, проходящая в периодической системе в направлении бор-астат, разграничивает элементы на неметаллы (находятся справа вверху отразде-лительнои линии, включая водоро • > и металлы (распето-nXZee ₽азделительн°й линии). Расположенные вбмз« Разграничительной линии элементы В. Si. Ge. As, Те в Л иногда называют полуметаллами.
занолХс™ ле™ ?эгеРге™'«^™ подуровень (семейства) элеХов^"^Г“’различают че™ре™"’
— 78 —
кр.цементам относятся все элементы групп 1ПА - VII1A (кроме гелия);
полнение d-подуровня предпоследнего электронного слоя. К d-элементам относятся элементы В-групп, исключая лантаниды и актиниды;
полнение/-подуровня третьего снаружи электронного слоя. К /-элементам относятся лантаниды (4/-элементы) и актиниды (5/-элементы), которые вынесены за пределы таблицы. Все латаниды находятся в 6-м периоде и группе ШВ; все актиниды — в 7-м периоде и также группе ШВ.
таллов объединяет элементы IA-группы (Li, Na, К, Rb,
Ва. Ra, но не Mg и Be). Элементы VIПА- и VIA-rpynn получили соответственно названия благородных газов и
6.2. Изменение свойств атомов по периодам и группам
кихуровней и подуровней, содержащих вамнт-
tC ,.Si
элементов нескольких (но не одного!) периодов.
Периодически от заряда ядра изменяются следую^ свойства свободных или химически связанных атомов: 1) да.
пень окисления.
Рассмотрим более подробно эти свойства и их изменение на примере атомов элементов главных групп (группА) и 1—3 периодов.
I Атомные радиусы, г. Вследствие волновых свойства» трона атом не имеет строго очерченных размеров. На при
считанными так называемыми орбитальными радиуса-ми. равными расстоянию от центра ядра до максиму* главной радиальной электронной ч пости (рис. 5.6).
Радиус атома зависит от числа электронных слоев в н®* и заряда ядра, причем оба фактора действуют в противоположном направлении: рост / способствует более сильно*
В периодах с ростом Zради .тирует первая тенденция); в гр
необходи-
занного с ним электрона:
Энергию ионизации oct и но рассчитываютдая моля ато-
в периодах слева направо анергии ионизации в целом возра-С1ают, так как уменьшаются радиусы атомов и
рон слабее притягивается к ядру (рис. 6.3).
Однако наблюдаются и отклонения от этих зависимое» Например, во втором периоде Е„(Ве) > £,(В), £,(N) > £ф| а в третьем периоде £,(Mg) > £,(А1), £„(Р) > £,(S). Этообы. кается особой устойчивостью электронных конфитураИа
Наряду с первой энергией ионизации различают вторч Iотрыв двух молей электронов), третью (отрыв трех мои электронов) и гл. энергии ионизации.
Для каждого атома каждая после зующая энергия иоию циибатыне предыдущей, причем при переходе к заполнен» му энергетическому уровню (т.е. уровню, содержащему 8 я» тронов) энергия ионизации ре о > растает (рис. 6.4).
Отметим, что энергия ионизании характерисЯИН* .тированного атома в газовой фазе (невидно, £, может
му атому элемента Э:
— 82 —
электронов
Видим. что в ослом слева направо по периот, нием /сродство к электрону тоже во ipacrac,' *4» сима явного значения для атомов злемягтов VI |а“СЛ,,*1<* галогенов). Однако на зависимости Г от ZbmSk ные минимумы в случае атомов элементов с электронными конфи.урациями я? (Be, Mg) отвечающие полностью заполненному '-по.хчювню We' V нему энергетическому уровню. Также низкие знач^Ч характерны для атомов элементов с наполовину^1' ным р-подуровнем (N. Р). Для атомов металлов электрону небольшое или даже отрицательное поя^0’0' мы металлов практически не образуют устойчивый тельных заряженных ионов.
В группах с ростом заряда ядра атома сродство к элге>. ну в целом понижается, так как уменьшается сида mi™? ния электронов к ядру из-за роста радиуса атома. ОдиаиТ этом случае наблюдаются исключения от гладкой завис»,,' ста. например: £(С1) > £p(F), £p(S) > £ (О). ’
Отметим, что сродство к электрону — это тоже харвд. ристика изолированного атома. Очевидно, £ может отжить мерой окислительных свойств атома: чем больше £ тем последние выражены сильнее
4. Металлические и неметаллические свойства алии элементов. Под металлическим и сг яствами атомов элемента ПОНИМ.П..1 их с и.х.илн.к >1.те. • .... гсгчел»
отлает электрон, тем сильнее у него выражены метами» кие свойства*. Отсюда видно, что критерием металлиле® свойств элемента может являться энергия ионизации ат® чем она меньше, тем сильнее выражены металлические®* ства элемента. Можно сделать вывод, что с ростом Zb И» одах металлические свойства атомов элементов в целом!»' мют, а в группах — возрастают.
Под неметаллическими свойствами атома понимают'” способность присоединять электрон: чем охотнее он («*
можно только по отношению ।
^соединяет алейрон, тем сильнее у него выражены неметаллические свойства. Таким образом, критерием немс-тадлических свойств атомов (а, следовательно, и элементов) может являться сродство к алейрону: чем оно больше им данного атома, тем сильнее у соответствующего эле
мента выражены неметаллические свойства. Ввиду сложной зависимости Fp от Z можно говорить только об общих
тенденциях в изменении неметаллических свойств
гов в периодах и группах: с ростом Z неметаллические
группах — ослабевают.
5. Комплексной характеристикой атома, учитывающей
§
роотрицательностей.
шим критерием металлических и i
вообще — электроотрицательность атома фтора самая большая среди всех элементов периодической системы. Поэтому
ных соединениях атом фтора проявляет единственную степень окисления, равную -1
6.4. Изменение ионных радиусов
и энергий ионизации ионов
радиусов и энергий ионизации атомов, включив в рассмот-
Установлено, что для данного элемента радиус катиона
нейтрального атома. И это неудивительно: уменьшение чис-
кннание, а увеличение их числа (анион) усиливает межэ-
1ее< Для ионов одинакового заряда с электронной конф 2^ацией благородного газа радиус тем больше, чем больше 1ектронных слоев содержит ион. Так, /<К‘) > >>
МВг) > ит„ „ „остом заряда катиона
вочнмках по химии находим: /<Аг) = 0,192 нм; КК+) = 6дзз?
Аналогично: /<S- ) > г(С1) > /<К*) > z<Ca2+) > z^Sc3’).
Выше рассматривалась зависимость от Zэнергии иони'
ности. Если построить график зависимости десятичногол
пределах же одного электронного слоя (оболочки) энер-нопизянии нарастает плавно. Такой характер зависимос-^нергии ионизаций служит убедительным эксперимен-
^лнчакпея по энергии; 2) формируют энергетические уровни подуровни (электронные слои).
А сейчас зададим такой вопрос; для атома какого элемента энергия отрыва второго электрона будет больше — магния или натрия? Иными словами, в каком случае энергия
Нетрудно видеть, что катион Na+ имеет завершенную электронную конфигурацию атома благородного газа Ne, тогда
металла Na. Исходя из общих тенденций изменения £и, описанных выше, приходим к выводу: £„(Na+) > Д/Mg*), т.е. энергия отрыва второго электрона для атома Na больше, чем для атома Mg. Действительно, в справочнике находим, что
но равна 4564 и 1451 кДж/моль. При этом первая энергия ионизации атомов Na (496 кДж/моль) закономерно меньше, чем атомов магния (738 кДж/моль).
6.5. Изменение свойств простых и сложных веществ
формиРЛ111Щ1 I
лавденияи ‘ । ром и wJ 1
1еРатУра Плав. , достигая мц о^ьивещее,, । хтвам молецу. | давления в це. 1
момкул^^^Хомой существования щ
В соответствии'. 4~> их температуры п
и др. Например, во вто, псн""' °™^жении слева направо тем, ПС₽“М^Хх веществ вначале возрастает, XГ^мньтх кристаллов в случае пр SX IVA-труппы. при переходе к вещ< ирного строения температуры кипения и п лом постепенно понижаются, достигая мин, чения для благородных газов (рис. 6. /).
• Про.
В соответствии с изменением числа валентных электро-
>в по периоду закономерно изменяется состав высших ок-
элемента фтора вообще нет оксидов, а его соединение с кислородом OF, называется фторид кислорода, так как X(F) > Х(О)« Несколько по другому изменяется состав простейших водородных соединений элементов А-групп (табл. 6.2): от ЭН до ЭНД для групп IA—1VA и ЭН4 до ЭН для групп IVA—VIIА.
Таблица 6.2
Водородные соединения элементов IVA- и VIIA-групп при обычных условиях — летучие (газообразные) вещества (исключения: вода, гкнп = 100 °C; фтороводород, Гкнв = 19’С).
ного номера наблюдаются ослабление основных свойств водородных соединений и усиление их кислотных свойств. Например. гидрид натрия растворяется в воде с образованием
NaOH +Н2Т,
I VIA VI1A С ростом атомного номера кисло,.,, _____ше соединений возрастают: Нт '
теиденнии можно, принимая во внимание рост пол,?1 *• сжязм Э—Н по периоду с ростом Z атома элемент?'’’ ослаблением прочности связи Э—Н в группе с I
атомов элементов.
Закономерно изменяются также кислотно-основные евщ, став оксидов и гидроксидов элементов: при движении периоду слева направо основные свойства оксидов и | роксидов ослабевают. а кислотные — нарастают. В группа»д | ростом заряда ядра атома элемента, образующего оксид щ» гидроксид, основные свойства этих соединений усиливаю,, ся. а кислотные — ослабевают. Основные тенденции измене, ния свойств атомов элементов малых периодов и ихсоеди. нений суммированы в табл. 6.3.
ГЛАВА 7
Химическая связь
чем» алмаз твердый, а графт мягкий, ведь эти вещества Образованы агомамн одного и того же элемента углевода" u jL.-ateu почему белый <Ьос<Ьлл Кл— ___________
элементов- аналогов?
Ответить на эти и многие другие вопросы можно только опираясь на сведения о природе химических связей в перечисленных веществах. Однако современная теория химической
7.1. Электронная теория химической связи: ранние представления
Лишь немногие химические элементы при обычных условиях находятся в состоянии изолированных атомов (пример — одноатомные молекулы благородных газов). Атомы большинства элементов взаимодействуют между собой или «омами других элементов, образуя отдельные молекулы, •томные, ионные или молекулярные кристалы.
Ъшическая свял - это иектростатическоевшс
^’Хн^мйчХйсвяэи- процесс" "•’ьный и всегда сопровождается вьдау""е“ног£тоиной ** полная энергия молекулы (или другой м
1Ш5ш
.омлентные полярные и неполярные сыпи Молекулы полярные и неполярные
7 7 хзрактернстак» ковалентной связи
Модель ОВЭП учитывает и влияние ’t-связи на эй*, валентных углов. Считается, что электронная площо^'"* ной связи занимает больший объем, чем одинарнойп*11*' му. например, в плоской молекуле СОР; угол Свя * С—О больше угла связи F—С—F.
В табл. 7.3 суммированы данные по строению модеи ионов, предсказанные с помощью модели ОВЭП.
Структура некоторых частиц (молекул а ново»)
ГЛАВА 8
Ионная связь. Металлическая Типы кристаллических решеток уижмолекулярное взаимодейетаие Водородная связь
8.1. Ионная связь
| как уже <п металось, теоретические основы ионной с№и |К,,р.Ло,..ны в Косселем.
I И"""11" химичгскв>' «»»•
I «млгеииых ионон.
(вклинения с ионной связью называются ионными Ион шло свить можно рассматривать как предельный случай Ха.н.......яркой СВЯЗИ (рис. 8.1). Для бинарных ие-
......'xxs
po/moio пиа,
© о 9
123
8.2. Металлическая связь
б । ии_пкиионное взаимодействие — это взаимодействие между полярной и неполярной молекулами (Н,О и Вгг Н О
r?®oowoo
Возможность образования внутримолекулярной водоо, ной связи зависит от того, насколько удалены Другс/Г фрагменты молекулы, участвующие в ее образовании и пример, эта связь образуется в случае 2-гидроксибензой2 кислоты и не образуется для 4-гидроксибензойной кисло/
2-гидроксибензо иная
кислота
В свою очередь, между молекулами 4-гидроксибензойной кислоты эффективнее образуется межмолекулярная водород-ная связь, поэтому это вещество имеет (при равных малярных массах) более высокую температуру плавления.
ГЛАВА 9
Валентность. Степень окисления, координационное число
Что следует понимать под валентностью ' и как ее находить
•ипюсть - одно из основных, но одновременно и ол-МИ'амых сложных понятий химии. Понятие «валент-"J появилось в середине XIX в. после того, как было лаотжено, ЧТО вещества реагируют между собой в определит количественных соотношениях. Считалось, что ва-..„..„огобипсть атомов данного элемента со-
отошениях.
Первоначально за единицу валентности была принята шепшоегь атома водорода. Так возникло (и до сих пор иногда используется) понятие «валентность по водоро-Л-. например, в соединениях HF, Н;О. NHS, СН4 валентность по водороду атомов фтора Равна единице, ато-чо» кислорода — двум, атомов азота — трем, атомов ут-
лерола - четырем.
Затем возникло понятие «валентность по кислороду. Поскольку валентность атома кислорода равна двум (слезет из формулы воды), это позволяет легко определить ^н-нгность атомов других элементов в их соединениях 1 кислородом. Например, в соединениях СО, и SO, ва-Лснт”ость атома углерода по кислороду равна четырем, ’"Р*- шести.
с ""ВДж .валентность» использовал Д. И. Менделеев при Uui"« периодической системы элементов (ок же ввод поня-
CuCl, + 2K0H = Cu(OH)J Си* + 2OH = Cu(OH),|.
ны примерно одинаково (Al,O,, ZnO).
-3SO , =A1,(SO.),.
SiO, + 2NaOH « Na^iO, + H,O.
W, -* 2KOH
PA + 3Ca(OH), = CaJPO.j.i SO; + Ca(OH) SO, + 2NaOH
Al30, + 6NaOH + 3H,<) 2Na,|AUOH)J (гсксагидрокео-
ZnO + 2KOH Mio- K.|Zn(OH|J Оетрш'илроксомин « «г калия);
СгД + бКОН * 311,0 = 2K,|Cr(OH) j (ггксагидроКСО-’POMaTdll) кали,,,; J
„^)ЖОН 41111 1-1и«оН|,|(теп»пчйИ^^И
(ИЛИ SiO, + 2KOH = К SiO - и
'шпжгжшагмМ
о, ♦ к,О •- JK< ю. (хр„м„т кадиях -«
* > N<0 N„ z„o,(UHlualTHMOTiX
а в»о ЮПИ) |Г„.р,ишатвагнЮ-. I
'«4 лТ"”"’1'". "• *1 ~ ailWMHn
*4. Лад." часп. «ив: |ЛЦОН>,|’ . |/«ОН|,Г .
С-0, + 2MS - 2MgO + C°; S-O, + 2H,S - 3S” + 2HjO; Si-O, + 2C i S? + 2CO; Рг-О, + SC i SCOt - 2P‘; Si-O. + 2Mg i 2MgO +SP.
3N-O, + H,0 » 2HN”0, + N'JO|;
4N**O, + 0“ + 2H,0 « 4HN \
jkoh + 2N-0. -S- KN.Oj; KN„0 CaO + 3N-O, - Ca(N->0,), + N^.
5. Для оксида углер«аа(П) характер,),,, |1ыраже(1
2HgO - 2Hg+ 0,|.
11.2. Свойства нерастворимых
фенолфталеина - в малиновый;
Irh
же порядке возрастает; например, энергии связей Na 1 Al—ОН равны соответственно 330 и 540 кДж/молк В И I NaOH прочность связи Na—ОН много меньше, чем'7*''* ' О—Н, поэтому гидроксил натрия проявляет только |
ные свойства. При переходе к гидроксиду магния прс^"*’ I связи Mg—ОН возрастает, поэтому Mg(OH), более с основание, чем NaOH. В случае А1(ОН), прочности свд* А1—ОН и О—Н сравнимы, поэтому гидроксил алюминий | является амфотерным электролитом. В гидроксидах -ыемен I тов групп IVA — VIIA прочность связи элемент—кислоро
значительно выше, чем связи Н—О, поэтому гидроксиды ’ этих элементов диссоциируют только по типу кислоты.
В группах А с ростом атомного номера элемента прочность связи Э—ОН уже не возрастает, а уменьшается (растет радиус атома элемента). Это, в свою очередь, сопровождается закономерным усилением основных свойств гидроксидов элементов групп А с ростом атомного номера элемента.
Наконец, почему основные свойства гидроксида осла- . бевают, а кислотные — усиливаются с ростом степени j окисления атома элемента? Можно рассуждатьтак:при возрастании степени окисления атома Э увеличивается и j положительный заряд на атоме Э. Это приведет к усилению притяжения атома элемента к кислороду и упрочнению связи Э—О, следовательно, диссоциация гидроксида по типу основания с ростом степени окисления атома Э становится все менее предпочтительной, У1*”1' ваются кислотные свойства гидроксида.
ГЛАВА 12
Кислоты
12.1. Классификация кислот
Согласно теории электролитической диссоциации (С. Ар-рениус), кислотами называются электролиты, которые в водном растворе в качестве положительно заряженных частиц образуют только катионы водорода Н+ (точнее, ионы гидро-иония Н,0*)*.
Если принимать во внимание химическое строение моле-
стоящие из ионов водорода и анионов кислотного о Кислоты классифицируют по ряду признаков:
а) числу атомов водорода, способных к диссоциации: одноосновные (НО, HNO,, СН3СООН), двухосновные (H2SO4, Н2СО3, H2SO., H2S), трехосновные (Н3РО4, HjAsO4)
лородсодержащие (оксокислоты, кислотные гидроксиды) (H2SO4, HNO3, Н3РО4 и Т.Д.) И бескислородные (НС1, H,S, нвг,ш);
в) силе: к числу сильных кислот (т.е. кислот, поли Распадающихся на ионы при электролитической дкд НИИ) относятся НС1, H2SO4 и HNO,, а также НВг. HI.
Однако. Cu^HQ,^ А; 3. Реагируя с аммиаком или ею водными р* NH, HQ- NH.C1; NH, + H,SO4 = NH4HSO • NH, + Н*РО4 = NH4H2PO4; 2NH>+H,PO4-(NH4)1HPO4 «средняя соль (NH4),PO4 не образуется в растаоре неполного гидролиза). 4. Кислоты реагируют с основными и амфотерными ок- 5. Кислоты взаимодействуют с солями. Этот тип реакций + н^«.--в,вд + 2НС1; . HCI А*“^^рЯ1 кислота в силу «> Ю"теХЯ^о<М»№П. ыэтеенве, и, на и hno, ил» u КО кет необходимое™). ^“гйра hZ‘T,”=< khso‘+hno’,: KN0- * so “"'"г NaHso. + на): I yuci,.’ . м SO NBjSO, + 2HCII. jNaCI,,, + HjbUMwmu
СаСО, + 2НС1 = СаС^ + Н,О + СО/,' Na^iO, + Н2О + СО3 = Na.CO3 +HjSiOjj: I КНСО,+ СН,СООН = СН,СООК+Н.О + СО/; Г К,СО, + H,SO, = K^SO, + СО/ + H2O; ' KjCO, + SOj = KjSOj + CO/; Са,(РОД + 3H3SO4 = 3CaSO4| + 2H,PO4; FeS + 2HC1 = FeClj + H,Sf; б) в отдельных случаях более слабая кислота вьгп более сильную: CuSO4 + HjS = CuS j + H,SO4; й Это не противоречит условиям протекания р; мена, так как CuS не растворим в образующейся i ной сильной кислоте; ™ в) рамичи» в сие кислот H,s0--'«дао,»»’ £ однако взаимное вытеснение из семей этими™» можно. если осадок не Рае™°рим в об»»^ BMNO,)„„ + H,SO.„ - BaSO.I ♦ В концентрированной серной кислоте HCI и HNO. не растворяются и не диссоциируют: + HjSO^ -А Следует иметь в виду, что содержащие водород кислотные остатки двух- и более основных кислот (Н2РО,. НЮ, НСО;, HSO,, HS и тл.) тоже являются кислотами (диссоциируют с образованием ионов Н’). однако более слабыми, чем сами кислоты. Это связано с тем. что каждая птследующад стадия электролитической диссоциации идет ^нее эффективно, чем предыдущая. В приведенных ниже ^сила кислот слепа направо уменьшается: И-ГО. - Н3РО, НРО! ; НЛ0э - HSO,; м«'“нсо>- ‘Петит ”°^оста"ИТк слв*у*оии‘* P*J’ уменьшения ..нты 'СНои',!1'РО‘>сН,СООН>"н,СО, >Н,РО. ' HSO, <фвнол)> НСО, > НГО; - 195 -
< Н.СООН » К,РО, - К.НРО, » СНСООГ/ образуется H.POj. * *
СН.СООН ♦ N.,SO, - CH,COON. ♦ N.HSO
12.3. Способы получения кислот
«ериолу сила кислоты шпрясгает Так. Н,РО, бплсс си.и. «m'hpoH>8*0'’ * CWMO очсредь' И»80* смяы,м
4. Сила бескислородных кислот в группах А ста нога номера элемента возрастает, так как уменыа ность связи Н—Э из-за роста радиуса атома Э:
HF - НС1 - НВг - HI;
H2S - H2Se - Н2Те.
5. По периоду слева направо сила бескислородных возрастает. Так, НС1 более сильная кислота № S, a H,Se более слабая кислота, чем НВт. Это связано" личением полярности связи Н—Э е ростом атомного t
ГЛАВА 13
13.1. Классификация солей
Сали - сложные веществ, состоящие из катиона метши, щмпия) или другой сложной частицы (C<H!NH;, CH NHT ' т1ЮНа кислотного остатка.
Классификация солей в зависимости от состава показана на следующей схеме:
В настоящей главе мы рассмотрим только средние, кис-
Средние соли — продукты полного замещения атомов «Города в кислоте на катион металла: Na,PO4, CaSO4. Средние соли образуют катион аммония и амины: NH4C1, №4)г8О4, C,HsNH,CL
Средние соли возможны для всех кислот: как одно-, та и мн°гоосновных. _ ааме.
Кислые соли (гидросоли) - продукты неполно' .
Чения атомов водорода в кислотах катионами ^0., NaHCOr Кислые соли образуйся
иака или аминов с кислотами. NH4 з кислот. ^NH/HSO,-. Кислые соли возможны для всех Ч>°Ме одноосновных.
- 199 —
KHCO, + KOH = KjCO, + H2O; Ca(HCO3)2 + Ca(OH)2 = 2CaCOj + 2H.O.
И да.—caCO.RC'O I + H2o.
пр„ нагревании разлагается гидрокарбо-
«Ч? NH t + н 0 + со 1 <нет твеРдог0 °с"
+ 2NaOH = K,CO3
NaHSO, + Ba(OH)2 = BaSOj + NaOH + H O-2NaHSO3 + Ba(OH), = Na2SO, + BaSO + 2H O-NH4H2PO4 + NH3 = (NH4),HPO,.
КНДРО, A NH,t + HjPO4; (HH,Miro<i2NH,t + HJPO
KHCO3 + HC1 = KC1 + H,O +CO CafHCOj), + 2HNO3 = Ca(NO3), + H о NaHSO, + HQ = Naa + H20 + so,1;
Ba(HSO9)? + 2HC1 = BaCl, + 2H.O + 2 J KHS + HCI = КС] + H2sf.
KHSO4 + KC14
2NaHCOVil =T Na.COj + COJ + H3O;
2NaHCOJ(pOT Ка,СО3 + CO2t + H .O-
Cu(OH), + HQ= (CuOH)Cl + HO:
a) A1C13 + KOH = jAlOH)Cl, + K(
6) AlClj + 2KOH = [A1(OH)2]CI - - I
2Na,(Al(OH)6] + 4H,SO4 = 3Na,SO4 + |.AIi OH),)2SO4 + 8H.0;
NaJZn(OH)J + 3HC1 = 2NaCI + (ZnOH)CI + 3H2O.
(MgOH)Cl + HQ = MgCl, + H,O;
(MgOH)Cl + H,SO4 = MgSO4 +HCI
(MgOH)CI + KOH = Mg(OH)2|
(СиОН)аСО, - 2CuO -
Специфически сиойстиа солей
^NajSiOj + COjT.
KA1O,+ 2K0H + 2Н2О;
NaJZn(OH)J = Na2ZnO,+ 2H2O;
КА1Ог + HC1 + Н О К Cl <- Al(OH)3l; . a
AlOj 4H+ + H2O = Al(OH)3i;
KA1O2 + 4HC1 = KCI • AICI, + 2H2O;
A1O-+ 4H* = Al3' + 2H,O;
Na2ZnO2 + H3SO4 = Na.SO4 + Zn(OH)^;
ZoO^+lH* =• Zn(OH)2'l;
NajZnOj + 4HN0, = 2NaNO, + Zn(NO5)2 + 2H,O;
ZnOf 4 4H' = Zn" +2HjO;
2MA1(OH)6] + 3H,SO4 = 3K,SO4 + 2A1(OH)S1 +6H3O;
lAl(OH).,]' + 3H' = A1(OH),| + 3H2O; a
24lAl(OH)6| + 5H,SO4 = 3Na2SO4 + 2(A1OH)SO. + 10H2Q
MA1(OH)J + ЪНС1 = 3KCI + A1C). + 6H,O; J
*(0H)=- + 6H. = at- + 6HjO;
4lZn(OH)4) + 2HNO. = 2NaNO. + Zn(OH)J +2Н,О;
lZn(OH)J. +2H.=Zn(OHU+2HjO.
^IZn(OH)4| + 2H2SO, = Na,SO4 + ZnSO4 + 4H,Qi
,Zn<°H)4P +4H = ZnJ‘+ 4H,O. j
юти
кислот и оснований:
Cu(OH), = СиО + НгО;
H,SiO3 = SiO2 + HjO.
В свою очередь оксиды могут разлагаься на i
2Ag2O = 4Ag + O2t; 2HgO i 2Hg + O2f.
ГЛАВА 14
Классификация химических реакций неорганической и органической химии
уМ признакам: 1) по числу и составу исходных ве-продуктов реакции; 2) по изменению степеней окис-атомов элементов; 3) по направлению процесса; 4) участию катализатора; 5) по тепловому эффекту; 6) по дадачию поверхности раздела фаз.
Число и состав исходных веществ и продуктов реакции
По этому признаку все реакции можно подразделить на
1) реакции, идущие без изменения состава веществ:
ЗО2 = 20,; СН,—СН2—СН2—СН}' СН3—СН—СН3;
СНз
2) реакции, идущие с изменением состава веществ.
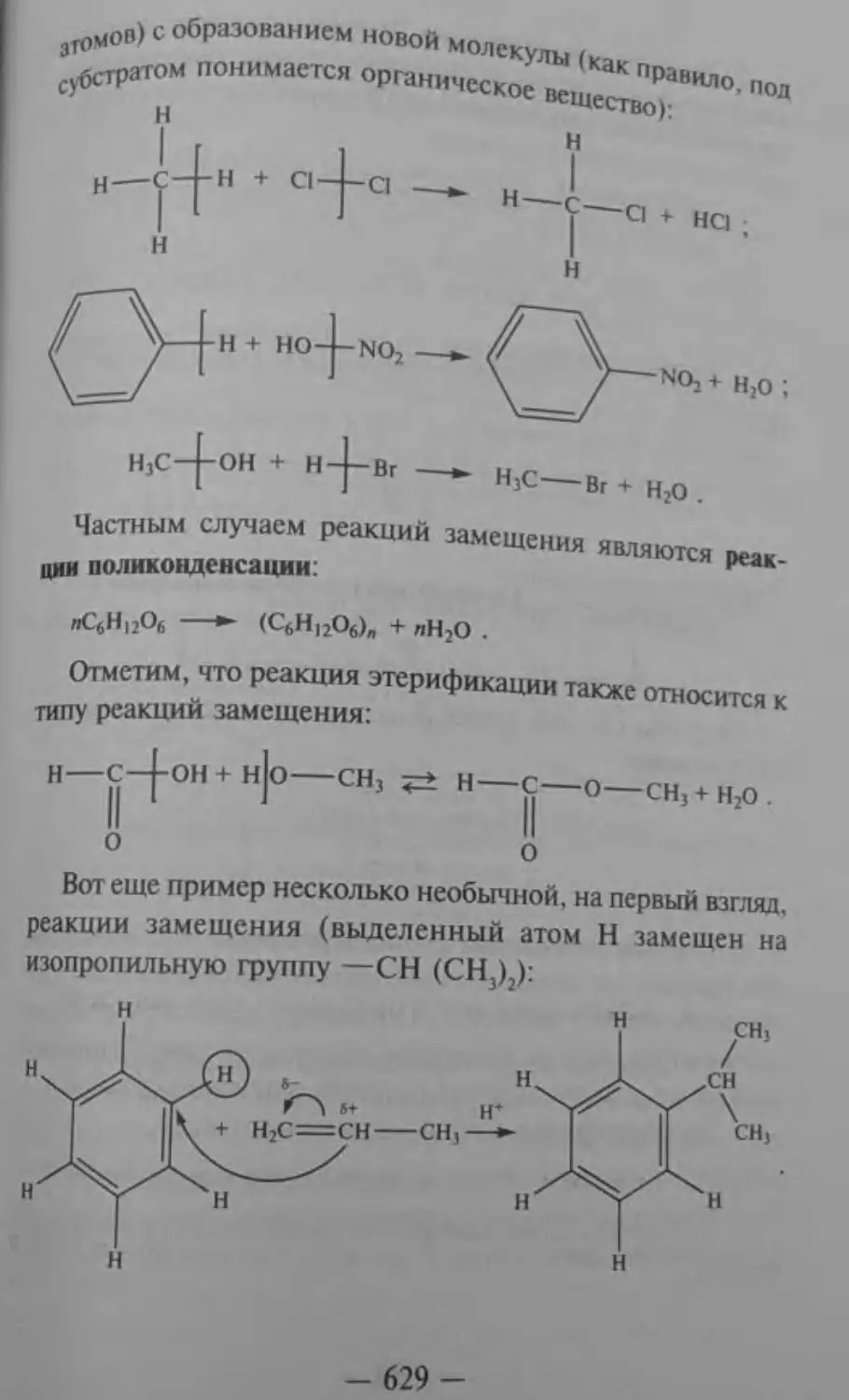
Последние в свою очередь подразделяются на пять типов: а) Реакции соединения (в неорганической химии) или *а<Ции присоединения — в органической химии. В ходе этих „’К"ий из нескольких исходных веществ образуется один "Р»Дукт:
Fe + S = FeS;
Сн'=сн, + н2о'“тсн,сн;он.
-215-
IH!h
Otyinrrt внимание мочение НОК для последнего «ж.
Й s й sb
15.7. 06 одной особенности окислительно-
Mn+7 + 5e~ = Mn+2 I 2 I 20* - 2«г = О* I 5 |
Таким образом, на окисление пяти молекул п водорода на самом деле расходуется две Формул^0* ницы перманганата калия, поэтому единственно*4* ное химическое уравнение в данном случае выгЛ5^’(,'Ь’
2КМпО, + 5Н,0, + ЗН S04 = K,SO4 + 2MnSO, + 8H!o+^ Еще ппимеоы. Реакция
:dawHduBH 0 Rioiniai эинэьвне чхни
2Hj(r) + °г(г) : им +
Например:
2А1(т) + j°2<r) = AWT>
3Fe,O4 + 8А1 = 4А12О3 + 9Fe + 3300 кДж.
алюминий получают электролизом расплава окоада в кри-
:u(T) + н,0(Г)
к теплота образования СиО (162 кДж),
связей в < и образованием новых
так и отрицательным:
ГЛАВА 17
Скорость химической реакции
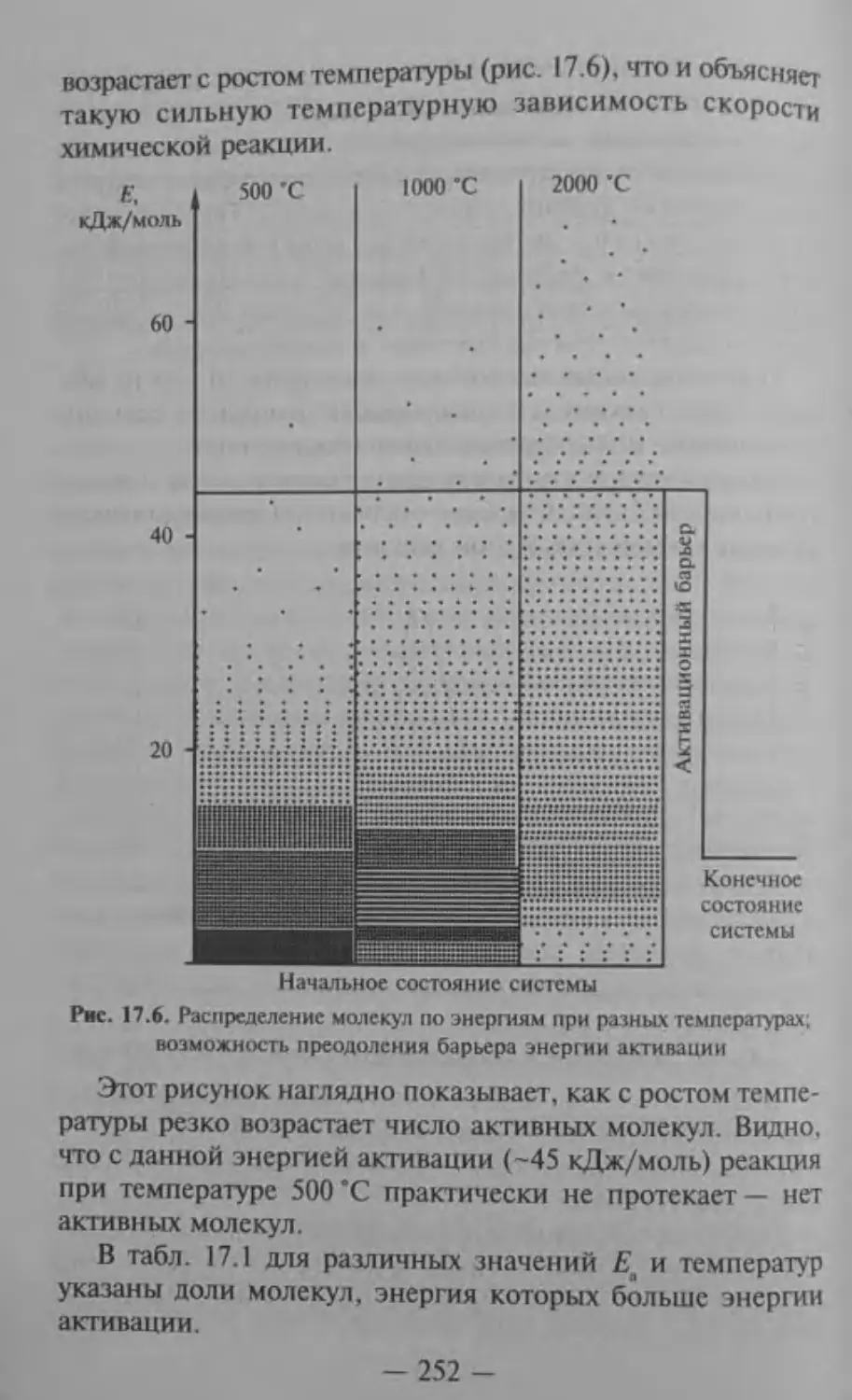
17.1. Скорость химической реакции
ih
ПОСКОЛЬКУ (Яр < °- ТО Е; < РИС’ ' £» ^р-
Энергии активации различных реакций изменяются в цдфОйи^ред^3* — от о до нескольких сотен кДж/моль
ГЛАВА 18
N + Ог ₽ 2NO;
N2 + ЗН2 2NH3;
2SO2 + О2 2SO3;
СН,СООН + CH3OH Ft CHjCOOCHj
12(т) Ft 2Н1(г).
янии химического равновесия.
ГЛАВА 19 Растворы
19.1. Растворы и их классификщщ,
скую индивидуальность;
крупными (диаметр более ИЮ мкм) частицами находя-
ШИМИСЯ ВО ктшемили .............. м ’
П». . “чира-шеляюг..я на: а) суспензии!»
примет, ceK0C™ И тве₽дог° ве,!'" " а или веществ,» «и (с^т„от ГЛИНЫ ” воды- смесь мелд и воли): в) эя?л' ««остей, бОЛ” "е Р'1! ' ’"’р"мь,х д₽уг ’ *" (смеси газов и жи Р' око' краски, майонез); в) о» "и™|: Г| ази) *ИД’С11стей: ниво, квас, газированные ЦТ И'Р - пыль ИЛИ жидкиССИ ТВердых веществ в газе, напр»-
' жидкие вещества.
/случае обращается внимание на устойчивость
т-е- неустойчивы во времени), непостоянство Устава (в самом деле, можно, например, приготовить
Последнее свойство роднит растворы со смесями.
>иение между смесями и химическими соединениями. Сопоставление некоторых свойств растворов, химических де-шненнй в механических смесей дано в табл. 19.1.
Таблица 19.1
Подобно смесям, растворы не подчиняются закону по-
химические свойства р,к.Т1ю„а „ Фи1н2>
Нвпример.р^^^^У^^ ~ ток <е^йХаХ’ **5ч ноский ток не проводя,, имеетба!? ****>? рушивши и более высокую тсмп”'™7»^ пк™с вода и хлорид натрия Вала н су,0^ Z Обычных условиях с железом нс nd p°KaoPw^ реагируег Вала и сухой хлоровол^од иГ^м’ "ТГ"" 1И’1рас1№р изменяет “'"’"“’«I»»' ^ .М-етоореняие w,Oe™, (ил^™^ 1 " '
н^егая ^с" "тр"иер> "‘ ““иеимоотеоот.
лег aoJ Р Р" ‘ М[И " “оиераспюритокиб,. «том^которая я „„.лияид. . ..к-ГОяниИЖШ.И
ниТ^, ” К'’М"'"'‘--'П1...
«то налолято» в одном aipcrai „„„ <(кгоянии горас1101>1. телем считается т<> ................ _
0ПКНМГНИИ жидкие растворы, в которых
растворы неэлектролитов (вола + спирт, ^**Lhu. иода + сахароза), молекулярно-ионные '*Д«рь| с1а6ых г1ектР<’1,,т,'п (вола + Уксусная кис-4 сероводородная кислота, вода + аммиак), ^^тктворы сильных электролитов: вола + гидроксид вод.» ♦ сульфат калия). Иногда эти три вила ра-объединяют одним названием — истинные раство-* В истинных растворах отдельные частицы нельзя уви-
неоднородных смесях частицы компонентов можно уви-
цхколад с ореховой начинкой), и во всех — с помощью аипнеского микроскопа.
Отличие свойств раствора от свойств индивидуальных ммпонентов указывает на то, что растворитель (воду) клии рассматривать как инертную среду, в которой ста-
в них вида — кристаллизационной. В табл. 19.2 приведены формулы и технические названия некоторых практи-
При нагревании природного гипса до температуры 180 °C получают алебастр (полуводный пшо):
CaSO/2HjO ' =с CaSO40,5H2O + l,5H2Of.
Алебастр используется в качестве вяжущего материала пгдум изготовлении лепных украшений, гипсовых повязок. Дм этого к нему добавляют избыток воды, далее протека-СТ химическая реакция и отвердение алебастра с образованием дигидрата сульфата кальция:
CaSO.O.SH.O + 1.5Н,0 - CaSO.2H;0.
T_(NaNO.) - (Na‘) + (NO,);
(NaNO.) = -699 + 410 + 310 » +21 (кДж/моль). r^HM обратом- “P" растворении в воле нитрата натрия 1м .мтеляется, Можете убедиться сами, что при раство-
«вате КС1 теплота поглощается (/\.,т - 730 кДж/молы ££-) - 33» кДж/моль; £TO(CI ) = 330 кДж/моль).
гидратации некоторых ионов приведены в
19.3 (I пм = 10-” м).
б) с ростом радиуса иона энергия гидратации умень-
в) с ростом заряда иона энергия гидратации растет.
В случае газов энергетические затраты на разрыв связей значительно меньше, чем для твердых веществ, поэтому при
растворении газов теплота, как правило, выделяется.
Творение кристаллогидратов (Кг) - чаще всего эндо-термический процесс, поскольку процесс ™Р=в этом стучае отсутствует <™чнес^я. ^е^итоштетК При ^НнИаИрКаГзр”иствтшической решетки, поэтому:
да объемов NH,
10.195 г на 100 г воды соответственно при 20 'С);
Jo, <0,00013 г> Практически нс растворимы друг и друге
жк. неограниченно смешиваются друг с другом вода и этанол,
гие-» то обратимый процесс, сопровождающийся выде-аеняем иди поглощением теплоты. Например, в случае твер-
вым раствором (т.е. раствором, в котором достигнут предел (створения вещества при данной температуре) и осадком:
пературы его растворимость уменьшается (равновесие
Растворимость жидкостей в воде с повышением температуры обычно возрастает.
ленис мало влияет на их растворимость. При растворении
г.е. растворение газов в воде сопро-
ождается уменьшением дав;
I (Вещество), (Вешесто),
-21
Согласно принципу Ле Шателье поВЬ| сместит это равновесие вправо, т.е. с пои ния растворимое
—, —у- ,-----г------- маадип НОПЦИИ п.
створите ля. это не влияет: кусковой сахар будет расгаортХ медленнее. однако в конце концов в данной порции тедыего
19.4. Качественные и количественные характеристики растворимости
температуре находится в равновесии с твердой фазой (осад-
достигнут предел растворения вещества. Насыщенный раствор
о, по отношению к которому раствор яв-
"данной температуре масса вещества больше предельно
gjjCOKun г---
пересышенных растворов - их крайняя неустойчивость.
являются качественными, кроме того, их применение зависит от природы вещества: соляная, кислота с массовой долей
вая доля H,SO4 больше 90 %; азотная кислота считается концентрированной при ее массовой доле более 63 %.
На следует смешивать разные понягич- '.насыщенный»
бавленный». Насыщенный раствор плохо растворимого ве-
^разбавленным, так и i
денный растворением
[ ИКОнцентрированным.
Например, в воде массой 100 г максимально при данной
сгворитвля или его вып^^^Ры.^ ~ порции вещества мо ™0Ра.,“СТ"°^?% латъ концентрированными (и наог»,^1'ниы' йЛ"Ч насыщенными (и наоборот) бч’от)‘
о౓ҙМИЯМЯУгся™-»иЧес™е1Оп._ '*
-««сывещее^
w(B)=—-ffiL
,, ' ’ ' "‘1Р1ЧТВ0РИТЫЯ)
Массовая доля может выражаться я „
^МоХ^ики1;еНнатрацияР f"” ° °’'° “
с(В) = _"(В)(моль) г(Р-ра В)(дм’)'
8 ₽аство₽е °6mm™ 2-5
Щелочи в таком п М“ССОЙ 80 г’ то м°лярная концентрата таком растворе равна (MNaOH) = 40 г/мояь): c(NaON) = —5(NaOH)_= a(NaOH)
80 r(p-paNa0H) "(№Wr(p-paNaOH)° ~ 4Q 2,5 = °’8 ^моль/ДМ3).
’'(р-ра)'
ГЛАВА 20
Электролитическая диссоциация
20.1. Электролиты и неэлектролшы
МОЖНО выделить два принципиально различных сига, растворения веществ в воде:
1) при растворении вещества в воде наряду с пирагаци-ей наблюдаются структурные изменения частиц растворен-
женных частно - ионов;
2) никаких структурных изменений, т.е. изменений в строении, кроме гидратации, с частицами растворенного вещества не пропело
Вещества, рас г» рение которых происходит согласно первому типу, называются электролитами, их водные растворы проводят Электре < кий ток.
Таким обр,. с.м пектрмиты-вещества, водные ростеры или раса - которых проводят
В первую очередь к , .ектролитам относяте иоснования. При рас,трении этих ве"^в “ ‘ „„.вы, лении появляются свободные пол"“"™ им1ы _ анионы ноны - катионы и отрицательно зарт натрия.
Например, при растворении в вол твецт.^^ * Q содержащего свя тайные между а („дарованные
ются свободно и хаотически дви*У в 11учае мороаоао-
катионы Na+7iH2O и анионы Cl jmn•яоо6ше1 „рн растго-рода, изначально не содержите лвижуш1кс» пора-
рении образуются свободно и ха „0)
тированные ионы Н' л(Н,О) .^ав элск,ра>И^Х
При внесении в раствор и- лвиЖение нон°» ноименно заряженных электрод»
_ 283-
H,SO, - 2H- + SO; .
НОН Й NH3 H2O + Н*;
+ НОН NHj HjO + НС1.
- НОН CuOH+ - НОН =t ZnOH*
Часть II
Химия элементов и их соединений
* 20, - СО, + 2Н,О;
•г I я
23.2. Водород
„«юз япкиииягаю ™ вил»» онютзЛюмга "Нс + Л - ’НО
nrodow. amaUrou il'U
(ВНИ1ГИНВ on BifOEHagodLHH эинэинонвюэов) о'нг + гны—'н’э 'не + 'on—‘н’э
(новдг + 1Ъ + Гн о иг + очй-
Р. W + W'o'sj a5i. <J IO‘ Ht. + (.«
«не + (Лол i7, (-нон + (Л’®.
:(‘о‘1*й® игаяш doiKHuum) внвии (аинатвйяаОи) omadafiHO» ft X« „онито».) (j) 'H + (JI оэ . (io + WO1” ’ I
О:НЕ + М э =t< 'НЕ + £ОМ :огН£ + элг а=п *he + ГоЧ1 !ОгН + ПЭ 3.0^, гН + О"Э
^«СНя+СО + И,
ii л
24.2. Галогеноводороды
24.3.3. Химические еиойстви мерк
CH. + CL - HC1 + ch,cl
2NaCl(T) + HjSO/kohu) = Na2SO4 + 2HCl(o,
4ИСМП + O,(r) Cl/0 + 2H,O(r).
КСЮ, + 6НСТ - КСИ- ЗС1,1 + ЗН.О;
JKCTO, + 6Р “ 5KCI + ЗРЮ,
Ni,AlF, Исполыуекя для п. сши CaFr Используется для по 1учения ф1
ГЛАВА 25
гР|1Ы: общая характеристика; I Ха-"’К° кислород; вода
51. общая характеристика элементов
— групповое название элемен-главной подин -.1, к кото-
I кислород о. сера S, селен Se,
полоний Ро. По юний является ме-X® а остальные элементы - неметаллы * ний, как и астат, радиоактивен и далее ^рассматривается). Строение внешнего элек-дюнного слоя атомов этих элементов ' гае „ _ номер периода элемента халькогена.
Халькогены относятся к семейству р-элемен-тов. Распределение валентных электронов по энергетическим подуровням для основного состояния атомов халькогенов следующее:
® ШЛИ. ла пр
Для атома кислорода как элемента второго периода высшая валентность равна четырем, ОДнако соединения с такой валентностью ато-*и кислорода довольно редки. Валентность, Равную трем, кислород проявляет, например, в Ионе гидроксония Н3О‘, монооксиде углерода СО. Наиболее рас ростр единения двухвалентного кислорода. В азотной кислоте и оксиде азота(У) согласно базовому школьному курсу химии имеются атомы кислорода, валентность которых равна 1.
2H 3 * MJ, - 230 ♦ 2H.0 (полное окисление);
2Н.Э ♦ О. • 2Н.О ♦ 29 (неполное окисление).
л также гмогетмм. H;SO((itohh). HNO,, КМпО4. К.Сг.О..
25.5. Кислород
253.1. Обише свелеш об иемеяте
25.4. Кис-юрспныс соединения халькогенов Мстжм»г»е<хме ^мвстм вгонов млыкиеми» вып*женн
AI S, • 6H,O - 2A1(OH),| + 3H,St;
CJijCOONH. + H,0 » CH.COOH + NH, H,O;
карАилов. фосфнлов, нитрилов:
Л14С, + 12Н,0 - 4AI(OH),l + SCH.t;
Cat’, + 2H,0 - Ca(OH), + СаН,1;
C»,P, + 6H,0 - 3Ca(OH),l + 2PH,|;
M»,N, + 6H,0 - 3Mg(OH);l + 2NH,f;
сложим» тфирон
CH)-----C----OCH) + HaO CH.COOH + CH,OH.
Нола яматтся к» тали «тором многих процессов. Напра-
во
ЛОМ, жшорсш ие релгеруст с клором, а смесь надораи и лором нс 1ирынаспц даже при сильном нагревании
ГЛАВА 26
Сера и ее соединения
26.1. Общая характеристика элемента. Физические свойства серы и ее нахождение в природе
Элемеит сера расположен в VIA-группе и третьем периоде периодической системы элементов, химический символ S атомный номер 16, относительная атомная масса Д,(8) = 32,066 (в химических расчетах принимается равной 32). В основном состоянии электронная конфигурация атома IflM/Http1, по валентным орбиталям электроны распределены следующим образом:
Наиболее характерные валентности атома серы в соедине-
сульфидах, содержащих мостиковую связь —S—S—степень окисления атома серы равна -1: H2S~', FcS?'_
В природе сера представлена четырьмя стабильными изотопами (в скобках указаны их массовые доли): ”S (95,018), as (0,75), “S (4,215), “S (0,017). Массовая доля элемента серы “земной коре составляет 0,048 % (15-е место среди всех элементов), по числу атомов сера также занимает 15-е место (0,027 % мольных). Атомные характеристики элемента ™ол.25.1) указывают на то, что сера — типичный неме-неметаллические свойства серы выражены слабее, чем
говении SO2 в воде устанавливаются два рав-
*Х+Н,0 * 8О, НгО;
(давание пирата оксида серы(1У))
SO Н,о - н++ HSO3-н* + SO|*.
(диссоциация гидрата оксида серы(В0)
Появление ионов Н' в растворе SO2 обязано последнему процессу, т.е. диссоциации гидрата оксида серы(ГУ). Поэтому водный раствор SO, ведет себя как кислота сред-
кислоты ее формулу представляют двояко: в виде HjSO,
KNO,<t> + H,SO,(«ohu) A KHSO, + HNO,|; CaF,(T) + H,SO,(xonu) A 2HFt + OSO,, КОМ + H,SO,(конц) A KHSO, + HClf; KdO.lT) + H.SO.Ikohu) A KHSO, + HCIO,t; Са,(ГО.),(т) + 3H,SO,(ko„U) A 3CaSO_ +
с^он ‘
епяяег воду or щавелевой Н2С,О4 и муравьиной НСООН
НСООН н =•' cot
о для H,SO4(kohu), а не для Н;5О4(разб): NajSO, + HjSOJkohu) = 2NaHSO4.
ляются HjSO/kohu).
H,SO, - 12С + ин,он,so.
(C.H.OJ. + H-SO. - бис
г. ГЛАВА 27
VA-rpyima. Азот и его соединения
rd и
Il
Me(NO3\ = Me(NOj
2KNO,’ KNO
2Cu(NO-’)2 = 2CuO 4AI(NO,), = 2A],O,
IВ этом случае w
шейном давлении; равновесие проце< тически полностью смещено вправо:
4NO2 + О2 + 2Н2О - 4HNO3.
Азотная кислота находит самое широкое применени получения красителей, взрывчатых веществ, азотных евИ рений, лекарств. Продукт нитрования целлюлозы иен808" зуется в изготовлении целлулоида, фотопленки. В лаб01"" торной практике азотная кислота и особенно ее смеДИ соляной («царская ицин используются для леревоивв створимое состояние металлов (Au, Pt), которые не растащи" ются в других кислотах. Нитраты применяются как сильные окислители, для производства стекол, в медицинских целях, как удобрения.
ГЛАВА 28
Фосфор и его соединения
28.1. Общая характеристика элемента и простого вещества
cjicMCHi фосфор - химический знак Р, атомный номер 15 относительная атомная масса ЛГ(Р) = 30,9738 (в хими-«юя расчетах округляется до 31). Электронная конфигура-цха атома восновном состоянии 1л?2.т2//,ЗгЗ/т’, по атомным орбиталям электроны распределяются следующим образом:
В природе элемент фосфор нреж гавлен только одним нуклидом }Р,т.е. фосфор — изотопно-чистый элемент. Массовая доля фосфора в земной коре составляет примерно 0,090% (12-е место по распространенное!иг а мольная 0.052 % (B-е место).
Ч*°Р • Природе в свободном виде не встречается, посколь-%г«имичсски гораздо более активен. Важнейшие прирол-Минералы фосфора — это фосфориты и апатиты, со-
*Р*ашис Са.(РО >
. Е Ферсман назвал фосфор •элементом жизни и
Шж пир.жампап,,-а С-ПОНИРО.), и различныхоргани-ПЩ соединений В ПЪной Шани _______а______________
И.РО,» н- + Н,РО, Н,го, в Н + НРО; : нго; » н* * ро;
Н.О + 2КОН + P.O, - 2КН.РО . „фосфатома); 4К0Н + P.O,» Н.0 + 2К.НРО, и»«„фосфатоли):
окон + Р0.+ P.O,-2К. !(>, : Н,0 * СИОН), + Р.О, - СФН.РО . ЗОИОН), + PjO,-2CaHPOk. + н,о, закон), + р.о, - с»,(род: + зн.о
СаДРО,), + 4Н3РО4 =
Са(Н,РО4)г + 2Са(ОН)г = Са3(РО4)Л + ЗСа}‘ + 2Н,РО; + 4ОН" = Са,(РО4).,
- 2ОН* = CaJ(PO4)J| + 2Н,О.
М5. Применение фосфора и его соединений
= 5720 л^. J
*< О,, малахит
= 2KHCO3l + HjSt
NH.HCO,:
НЛ-О.+ 2NaOH = Na,CO, т 2H .
^аНС0з(
- 2NaOH = NsuO-SiO.
ej^j^craKjO-SA^O^SiO,; асбест SMgOWyM 0;
Na.CO, + CaCO, + 6SiO, = Na3OCaO 6SiO_, + 2CO.I
иллов. придают стеклу требуемую окраску (Сг;О,
СаО + SiO, = CaSiO,.
AL0.-2SiO3-2H2O = Al.0,2SiO, + ZHjOf.
2AI ♦6КОН+6Н,О= 2К,|А1(0Н) | Ж’;
Zn ♦ 2NaOH(T) = Na^nCX - Н
Zn * 2КОН + 2Н,О « K,|Zn(OH > |
Ные в э/х РЯДУ за марганцем (нельзя и imw Довить до металла оксиды щелочных и шелоч-
_3H2 = W + 3H,Ot.
Многие металлы являются важными для нормалыюго|» витая растений и входят в состав микроудобрешй (Zn, Mi
Недостаток некоторых металлов в организме челоко приводит к серьезным заболеваниям. Например, при не® статка кальция замедляется рост скелета, а при недоел® железа развивается анемия.
ГЛАВА 31 Металлы IA-группы
liWk
к надпероксиды - — пРи
+2СО,-2К,С°! + 301’-
’ шелочпьк металлов к другим простым к. 1КТм ПРИ нагревании Ш“°ЧНЬК МеТШЛЫ Р'аГИРУВД C2Na + S = Na^S (сульфид натрия).
6Li + n2 = 2Li3N (нитрид лития).
Во влажном воздухе на поверхности лития одновремен-, образуются нитрид, оксид и гидроксид лития. Нитриды
1ми взаимодействуют только литий и натрий.
2Na + К = Na2K,
ся как более мягкий восстановитель вместо чистого натрия.
31.4. Взаимодействие щелочных металлов со сложными веществами
°т лития к цезию. Например, литий
41 5 Свойства оксидов и гидроксидов ...А ипчных металлов
сталлические вещей» ~ '” “7 г ’ —вдсп<Ые
(LLO Na.0), желтые (К^О, Rb2O) или оранжевый (а0) Термическая устойчивость оксидов с ростом атомного Но.
4Na + О2(недост) ' ='С 2NajO;
Na,O2 + 2Na = 2Na3O.
оксиды всех щелочных металлов являются основными Тах, они энергично (интенсивность взаимодействия усв-ливаете, в ряду ЦО - 0,0) реагируют с водой, образуя
Na,0 + Н,0 - 2NaOH.
основ™ 0Т°:НЫХ М™'“' "О”6"» В“М типичным C^Z Щ вмим®<'"»ут с кислотными ок-
N^O + N20j = 2№N0„
ЦО + 2НС|-2ис1+н ^o + H.so.^so.+^o
1^0 + 2А1(ОН)3 = 2КА1О2 + ЗН2О; ^0 + А12О3 = 2КА1О2.
номерно понижается от LiOH (473"С) до CsOH (346ЧС) Все гидроксиды (за исключением LiOH) при сильном
2LiOH= ЦО + HjOt.
влаги. Щелочи (кроме LiOH) также жадно поглощают уг-
рагируют со входящим в состав стекла SiO2, долго хранить
или частично ней
^(OH)2 + 2NaOH^WZh(OH)]
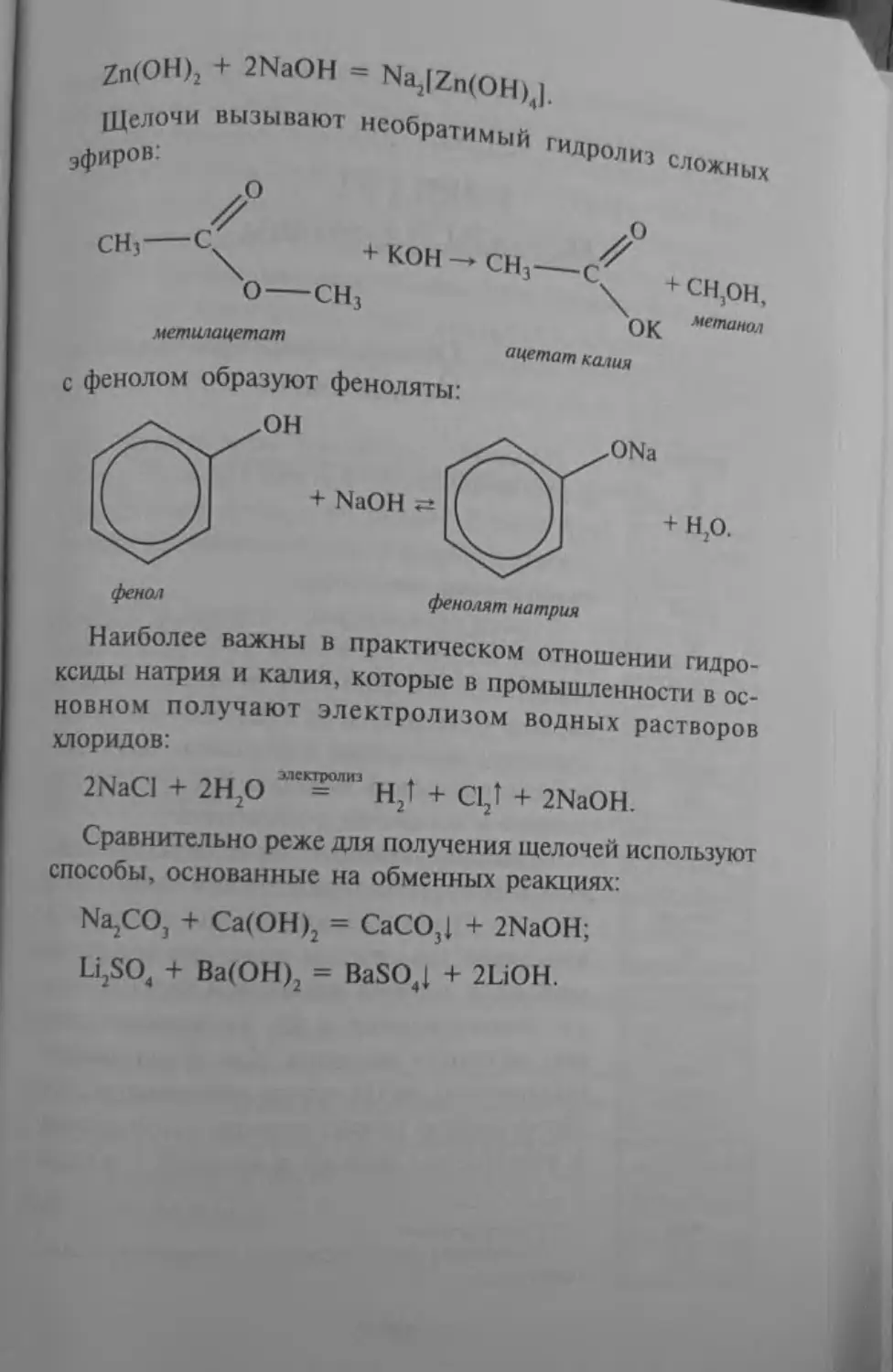
Сравнительно реже для получения щелочей используют способы, основанные на обменных реакциях:
NajCO, + Са(ОН)2 = СаСО3| + 2NaOH;
Niff
шш
Пр” жиании металлов ПА-грда^
2Mg + 02 = 2MgO.
SiO2 + 2Mg = 2MgO + Si; NbjO5 + 5Ca = 5CaO + 2Nb.
Сродство магния к кислороду столь велико, что за-
При нагревании металлы IIA-группы реагируют и с другими неметаллами: серой, азотом, фосфором, углеродом,
Mg + S = Mg S (сульфид магния); 3Mg + 2P = Mg3P2 (фосфид магния); 3Mg + N2 = Mg3Nj (нитрид магния); Mg + 2C = MgC2 (карбид магния); 2Mg + Si = Mg2Si (силицид магния).
Mg2Si + 4HC1 = 2MgCl2 ++SiH4t.
Mg + 2H2O = Mg(OH)2 + figf.
: MgO + H2|.
Ba + 2Н2О = Ва(ОН)2 + Н21.
Образующиеся при этом гидроксиды щелочноземель-
В концентрированных холодных азотной и серной кис-
Ве + 2NaOH + 2Н2О = NaJBe(OH)4]
UMg + 2НС1 = MgCl2 + H2t;
Mg + H3PO4 = MgHPO4l + H.T.
Mg + 4HNO3 = Mg(NO3)2 + 2NO2t + 2H2O;
3Mg + 8HNO3 = 3Mg(NO3)2 + 2NOt + 4H2O;
4Mg + 10HNO3= 4Mg(NO3)2 + N2Ot + 5H2O;
5Mg + 12HNO3 = 5Mg(NO3)2 + N2t + 6H2O;
4Mg + 10HNO, = 4Mg(NO3)2 + NH4NO3 + 3H,O.
одним из продуктов восстановления кислоты наряду с ам-
Ве + H2SO4 = BeSO4 + Ity;
Mg + H2SO4 = MgSO4 + H2f.
)нцентоаСТВй₽Т*” B Серной кислоте более высоких
Магний и щел<
а магний - и '
32.5. Свойства оксидов и гидроксидов । IIA-группы
Mg(OH)2 = MgO + HjO: MgCO3 = MgO + CO2t.
НИ
BeO + 2HC1 = BeCL, -
BeO + 2NaOH(T) = h
BeO + 2NaOH + Н2О = NaJBe(OH)J;
I В ряду MgO-BaO основный характер оксидов усиливается
ВаО + Н2О = Ва(ОН)2.
всо окси.™ ЯП» » кислотах;
MgO + 2HCI - М8С1, + Н,О, вяиммейсОТЯТ с КИСЛОТНЫМ» и амфотерными
MgO + SO, - MgSO.:
MgO + SiO, - MgSiO,;
образные вещества с конным типом связи (кроме Ве(он^ Их растворимость в воде сравнительно невелика н „ тает в ряду Ве(ОН), — Ва(ОН),. Все гидроксиды тервд, ски неустойчивы и при нагревании теряют воду, Пр е' Ве(ОН)2, Mg(OH)2 и Са(ОН)2 - еще до плавления: еМ
Mg(OH)2 = MgO + HjO.
литов (слабее — Ве(ОН)2), гидроксид бериллия - ;
Ве(ОН)2 + 2HNO3 = Be(NO3)2 + 2Н2О;
Ве(ОН)2 + 2КОН(р-р) = KJBeCOHJJ;
Ве(ОН)2 + К,СО3 = KjBeO2 + CO2t + H2O.
Ba(OH)2 + H2SO4 = BaSOJ + 2H2O;
Ba(OH)2 + CO2 = BaCO3l + НД Ba(OH)2 + 2CO3 = Ba(HCO3)2;
Ba(OH)2 + СиЦ= BaCl, + Cu(OH)2l.
32.6. Кальций и его соединения
номер 20, относительная атомная масса Лг(Са) - 40,078 (в химических расчетах округляется до 40,0), электронная
С,Н, + 2Н,0 = Са(ОН),! + 2Н>(5 Ca,N, + 6Н.° " ЗСа(ОНу + 2NHJ. Гидрил кальция сгорает „ кислороде СаН, + О, ’" - " С.<ОН>„
ти нагревании а вакууме раиагается: OHJ,"SXC.+H,t.
Кальций энергично реагирует с водой, кислотами
4Са + 10НМО,(раз6) - 4Ca(NOJ, + N,0I + SH,O;
4Са + 10HNO,(очень разб) - aCalNOj. + hh<NOj + знд Са + H.SO/разб) - CaSO.l + н,г.
Са(ОН)Д’
Са(ОН)2 -
Са(ОН)2 + Н28О4(разб) = CaSOj + 2Н2О; Са(ОН)2(иэб) + H^SO/очень разб) = (CaOH^O I + ж 0. Са(ОН)2 + 2Н,РО4(конц) = Са(Н2РО4)3 + 2НД’ ’ Са(ОН)2 + Н3РО4(разб) = СаНРО41 + 2Н2О-' ЗСа(ОН)2 + 2Н3РОч(разб) = Ca3(PO4)Jl + би 0.
Са(ОН)2 + СО2 = СаСО,1 + Н2О;
Са(ОН)2 + 2СО2 = Са(НСО,)2;
Са(ОН)2 + 2А1(ОН)3 = Са(Д1О2)2 + 4Н2О;
Са(ОН)2(р-р) + Zn(OH)2(p-p) = Ca[Zn(OH)J;
Са(ОН)2 + ZnO = CaZnO2 + Н2О.
Са(ОН)2 + Na2CO3 = СаСО,! + 2NaOH;
Ca(OH)2 + 2NH4C1 = CaClj+ 2NH,t + 2H2O.
2Ca(OH)2 + 2Clj = CaCl2 + Ca(C10)2 + 2H2O.
ми, например:
Са(СЮ)2 + 4
„оватиегай кисаош под действием Мад и^Х^ CafClO), + Н,О + СО, - CaCO.I + 2НС1О.
При разложении хлорноватистой кислоты (нао - НСН + О) выделяется сильный окислитель - атомарный ис.
2Cl7H„COONa -
При нагревании хлориды и сУльФа™ 7ЭТИХ Металлов подвергаются гидролизу, а гидрокарбона
- 583 -
CalHCOJ, + Na£O,i CaCO,) + 2NaHCOj;
SMfflCOJ, + 2Na,PO, - Ms,<PO,)„ + SNaHCO,.
Поскольку ортофосфаты менее растворимы, чем карбонаты, жесткость волы эффективнее устраняется с поме-
JC.SO, + 2Na,ro, - Сд,(РО<)1| + 3N‘W
ГЛАВА 33 Алюминий
III!
Nb,Ni.
СЛ + М4.2СГ + «,Ч. 3Mo,O.*WA’M" + 4A‘’ °-' avo.-noAiisv+sm
8А1 + ЗРе,О>4А1,О, + 9Р», С =
леза меньше (-1540 “С), <
i от оксидной пленки алюминий вытесняет
2А1(т) + 3CuSO4(p-p) = Al/SOJ^p-p)
м + бсдонАг^да/и-зн,!.
1В виде минерала кода*,, окрашев-- 592 -
Полученный разложением гидроксида при 200-300 ’С: 241(ОН),(т) = 41,0, (т) + ЗН,О(г)
оксид алюминия хорошо поглощает воду (химически с
241,0, + бНСКконн) ”-С 2Л1С1, + ЗН,О;
41,0, + ОМаОН(коиц) + ЗН,О ”-с 2Na,tAI(0H)J;
41,0, + 2№0Н(т) 2NaA10, + Н,0;
41,0, + Na,CO,(T) ° 2NaA10, + CO.t
41,0, + MgO х Mg(410,),;
Л1,О, + К,0 - 2КА1О,;
.241,0, + 9С '”'С 41,С,.+ 6C0t.
' 441 + 30,t.
- 593 -
икон), “ 4°,+ зн"0; 4AKNO,)?2A1,O1 + 12NOlt + 3O,t.
33.4. Гидроксил алюминия А1(ОН),
^юаима»^;^^—
>яЛда« “°" А1(0И)!+знс|
входит в катионную - AIC1, + 1Ц,о.
«И. 1“трых "“ходится в анионной™” °браз™т Л«ОН)5 + КОН(т) i КАЮ, + 2Нд
2ДЦОН), + СаО = ОЦАку, +
2А1(ОН), + ВаСО, i Ba(A10,), + CQ,t + 3H Q Гидроксил алюминия подучают по Обменным е ,..й алюминия со щелочами -71рат<)м амвдаы тытке умеренно кон-ЛИОН), не раство-
AIC1, + ЗКаОН - Л|(ОН).| + 3Naa.
AI/SO,), + SNHj-Hp = 2А1(ОН),| + 3(NHJ,SO,.
ГЛАВА 34 Железо
----------НИИ с образованием сульфата железа(П1) и, ”".”Хе“е»4аееры(1У):
2Ft + 6H2SO,(kohu> i Fc/SO.), + 3SO,t + 6H,O.
4Fe + IOHNOjCowm, разб) - 4Fc<NO;)2 + NH,NO, + 3H,0.
') - Fe(NO,), + 3Ag(T).
железа(Ш). который со *"
бистро) теРяет “ду ° “бриоваии™ к 1 FeO(OH): бда
<Fe(OH), + О, + 2Н,0 - 4Fe(OH),|;
2Fe(OH), + Н.о/разб) . 2Fe(OH),1;
4F«OH), i H,O + FeO(OH).
FeCI, + 2K0H - Fe<OH),| + 2KCI.
W + 20H- = Fe(OH),l.
Окем жмеза (П, III) l e,o, _ твердое содержит железо в степенях окисления
2ft,О, ”SC 6FeO + Oaf.
Смешанный оксид взаимодействует с кислотами:
ft,О, + 10HNO,(kohh) - 3Fe(NO,), + NO,t + 5Н,О;
4ft,О,
для гидроксида железа(Ш) условной формулой Fe(OH)3.
MOH^ + NaOHW^NaFeO^lH^.
шип
Fe2O3 + ВаО = Ba(FeO2);
2Fe(OH)3 + Na2CO3 = 2Ne
2Fe(OH)3 =
окислителями образуются соединения железа (VI) - соли
Fe2O3 + KC1O3 + 4KOH = гК^РеО, + KC1 + 2H20f.
FeCl3 + 3KOH = Fe(OH),| + 3KC1;
Fe(NO3)3 + ЗМОДО = Fe(OH)3l + 3NH4NOr
FeO + С = Fe + СО};
MnO + С = Мп + COt.
Часть HI
Органическая химия
ГЛАВА 35
Общие вопросы органической химии
35.1. Предмет органической химии.
Особенности органических веществ
i
Л1Ы
Н,С-|-ОН + Н-|—Br —► HjG----Br + H20 .
629 -
-94—01,
"г- Tnt
ро • дегидрогалогенирование (отщепление галогеноводо-
н2с=сн—он---------► Н3с—с=о.
5. Реакции крекинга. Это реакции, в результате которых происходит оазоыв связей углерод-углерод. Например, при крекинге алканов образуются алкен и алкан с меньшим
Процессы окисления независимо от природы
35.5.2. Стереоизомерия
IHHhi
ГЛАВА 36 Алканы
формул» гомологического рада шкавов с н
. . .* „оатгя целым числом. *
Молярная масса алканов равна: WW - 14л + 2 (г/молв).
36.1. Номенклатура
- 643 -
36.2. Строение
"структурная изомерия связана с изомерией
Алканы - вещества молекулярного строения, поэтому при обычных условиях представляют собой бесцветные газы (С- 1 Ч), легкокипящие бесцветные жидкости (С,-С15) или легкоплавкие твердые вещества белого цвета, жирные на ошупь
11Ш
36.6. Получение алканов
дай можно также получить тарированием XX бурого угля
"C+l^+DH. чЛ*"»
оксидов углерода (метод Фишера - Тропша):
| i £
1. Реакция Вюрца — взаимоде<
ется. Наилучшие результаты получаются в случае одинако-
- 667 -
ГЛАВА 37 иы <м"ноциклоалка«“*)
вдАи, """ А н<> - о
•И
, гидрированием аренов:
ГЛАВА 38
"Шоб« ™°” -
= |4и-2’
38.1. Номенклатура ациклических алкенов, их галоген- и нитропроизводных
। гибридизации участвуют одна 2j-AO и
38.3. Изомерия
ШШ
hit
или кислым раствором КМпО, является второй качест-
3) при использовании а качестве окислителей надкис циклические простые эфиры _ эпо°~ да (реакции И. А. Прилежаева):
исходавсоответствии с правилом Зайцева: атом водорода
ГЛАВА 39
Алкадиены
ГЛАВА 40
40.1. Номенклатура
JVw алкинов характерна структурная изомерия, связан-
Ihllh
Реакции полимеризации. При димерииции ацетилена образуется винилацетилен (бутен-1-ин-3) (сырье для по-
CaO + ЗС — CaCa + COf.
От менее гидрированного атома углерода:
ГЛАВА 40
40.1. Номенклатура
JVw алкинов характерна структурная изомерия, связан-
Ihllh
Реакции полимеризации. При димерииции ацетилена образуется винилацетилен (бутен-1-ин-3) (сырье для по-
CaO + ЗС — CaCa + COf.
От менее гидрированного атома углерода:
ГЛАВА 41
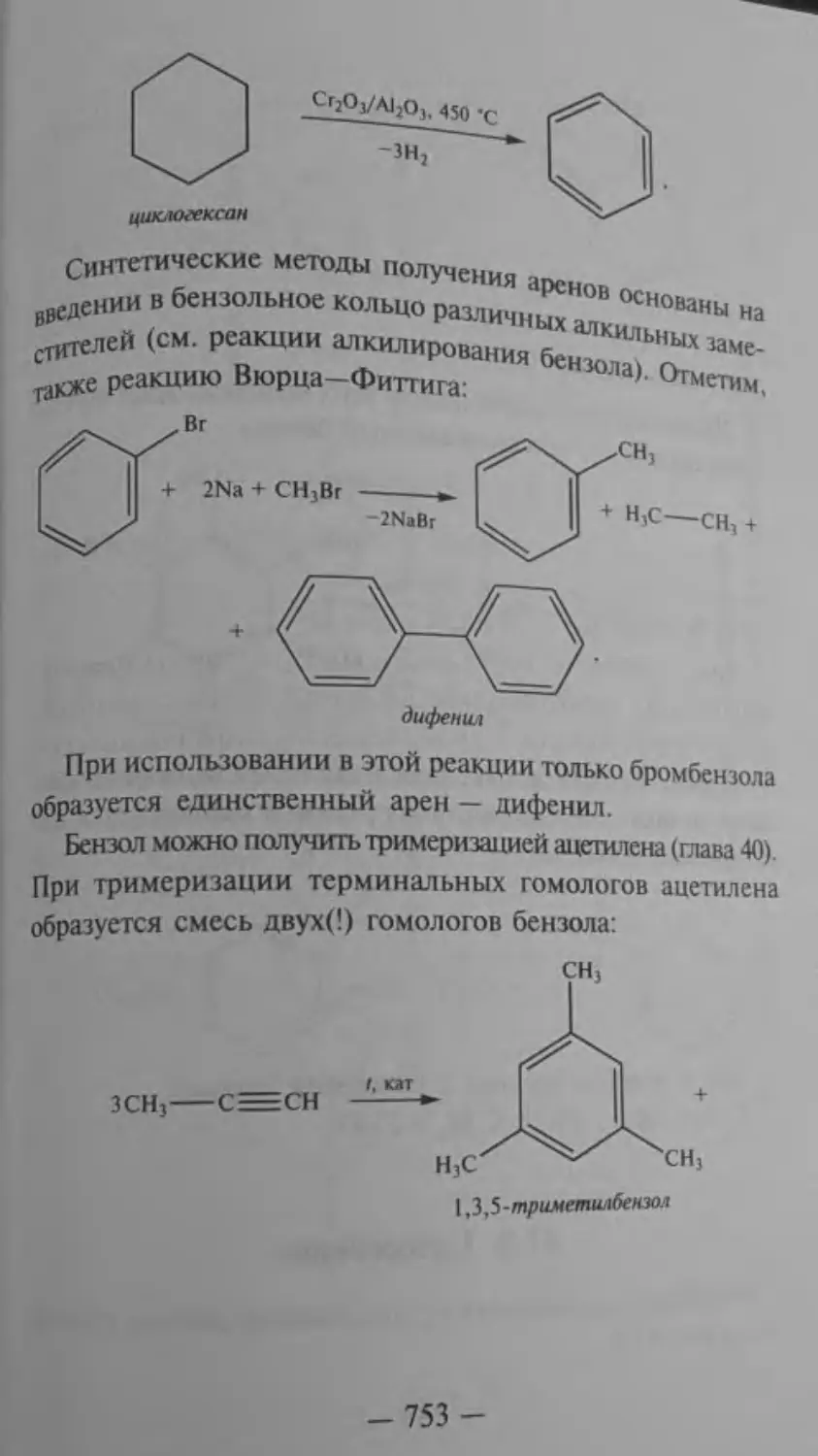
41.1. Строение молекулы бензола
ликой°РМУЛЫ С‘Н‘ “гаует’ “™ бСЩОЛ дшп!e,,
41.3. Изомерия
с,н12 существует 8 изомеров:
41.4. Физические свойства
CrC
шп.и
+K2SO4 + MnSO< + HjO ;
по^чен»ыеЛОЧЬЮ ()аналогичная Реакция используется для
0^ ~О"
tol f-4i
i Кчз fl । i-o-q- b-ft-l bl * bi
Поиродные источники углеводородов р И их переработка
ГЛАВА 43 Спирты (алкоголи)
43.1. Классификация
UhIIiu
нумерация атомов углерода опреде-
ГЛАВА 44 Многоатомные е„„рты
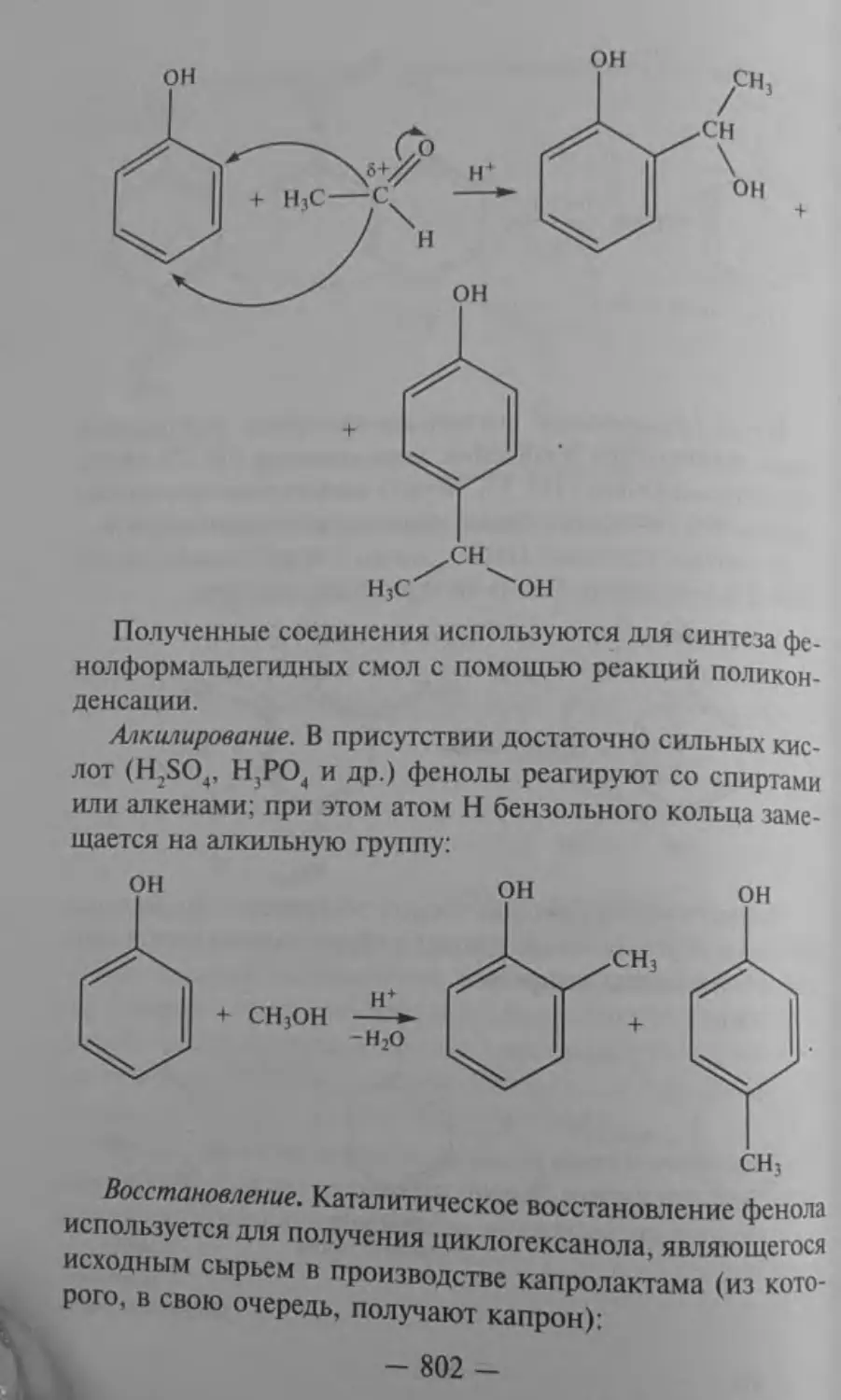
ГЛАВА 45 Фенолы
она
45.5. Химические свойства
акция - взаимодействие фенола с раствором FeCl;. наблю-
Обратите внимание, в каких жестких условиях происхо-«т замещение галогена на гидроксильную группу. В то же
45.7. Применение
ЮЯЯШ называют, ислолиуя суффикс он, с указание», еои нужно, номера атома углерода карбонильной грулщ.
•нянин
2[Ag(NH3)2]OH
46.6. Получение
ГЛАВА 47
Карбоновые кислоты
47.2. Номенклатура
47.4. Строение
порядка 30 кДж/моль, что боль
(«20 кДж/м оль).
для пентанола-1 она составляет 138 °C. Эго ризацией кислот за счет образования в<
замещения гидроксильной группы (отличие от спиртов, объясняется большей прочностью связи С—о) Как и в мо-в случае кислот повышенной
Аналогично карбоновые кислоты (лучше — их ангидри-
Для получения преимущественно а-хлорзамещенных кислот в качестве хлорирующего агента применяют CuClr
или же реакцию проводят в присутствии к количеств красного фосфора:
+Вг2, Р^" „ R—сн—соон-
R—СН2—СООН _НВг |
47.7. Кислоты со смешанными функциями
соединения с водой и галогеноводорода-иных свойств карбоксильвов (РУЛИ ак-у . _______ппеимхшествен-
риловая (и метакриловая) кислота всту но вопреки правилу Марковникова.
«« с Н
две двойные связи: содержит в молекул
Муравьиная кислота применяется качестве сильного восстановителя. Р" яяется, ве-
расгвор в спирте (муравьиный спирт) ПР
К - 851 -
ГЛАВА 48 функциональные производные
Химическая природа фрагмента Z может варьироваться
Только те функциональные производные, которые изуча-
48.1. Сложные эфиры
/
общая фор^^"1
I сложного эфира углеводород
_ 853 -
Э*ИР М0ЖН° НаЗМТЬ "Ропионовоме^овым;
из названия алкильной группы спирта и названия кислоты
Напримёр^соста^ С3Н6О2 отвечают два сложных эфи^а:
аспирин (ацетилсалициловая кислота)
49.1.2. Номенклатура и изомерия
ЕО--------С(О)—R|
О-----С(О)—Rj
ГЛАВА 50
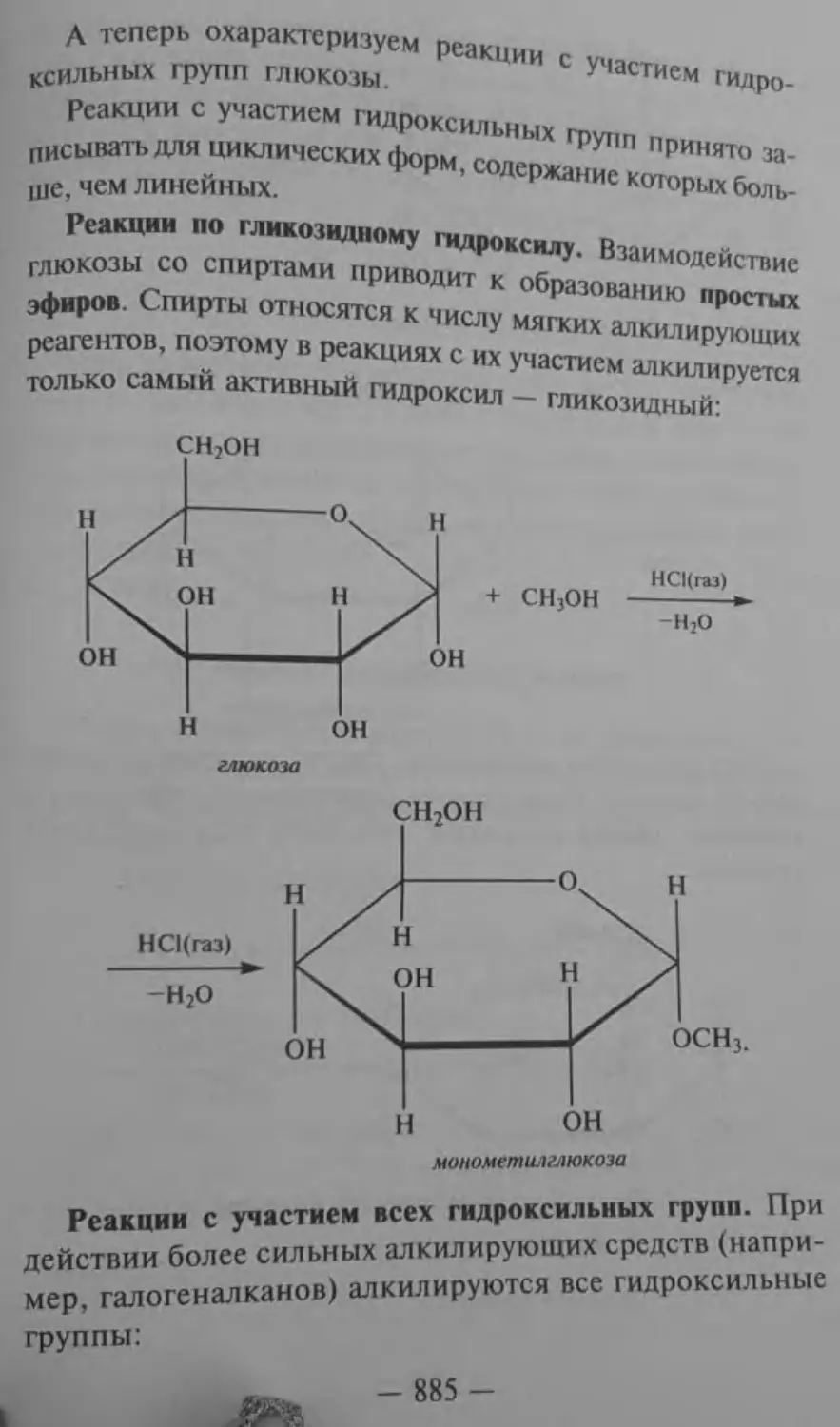
Углеводы (сахара)
40<NH, ед)и «онГпрм”^^^,Р™ 1
с Cu(OH)2 при нагревании, то можно наблюдать выпааеш осадка Си2О. Это доказывает, что при гидролизе крахи11'
CafflSO,), и п^ульф-—
ГЛАВА 51 Амины
51.6. Химические свойства
Н3С—NHS + ОН~
-912-
4С.Н,—NHj + 310г 24СОД + MH20 + I
H2N CH2 COOH + НС! —► ,|h,n—сн, СООНрСГ. I
Ида)м^иинокислоты> подо( 5но аминам, реагируют с ангид- 1
н,с-с4а+ н_|_ -N—сн2—соон _нс[»
ЙП •—N—СН2—соон.
3) Подобно аминам а-; —СН2—соон
о
А?
ГЛАВА 53 Белки
ГЛАВА 54
Понятие о высокомолекулярных соединениях
54.1. Классификация
Решай» полимеризации - ™ реакция соединения большого числа одинаковых молекул низкомолекулярных ве-
мер" "™“cZTH”CT“ П0ЛУЧают и дру™е «Гдаи- Напри и стирола обра-