Текст
,,к
А. А. ШИДЛОВСКИИ
ОСНОВЫ
ПИРОТЕХНИКИ
Издание третье
(переработанное и дополненное)
лись
эсти.
1Кет-
зные
Допущено Министерством высшего
и среднего специального образования РСФСР
в качестве учебного пособия
для технологических специальностей
химико-технологических
высших учебных заведений
НКИ»
IBOB,
ИКО-
хни-
IIИ М
(ает-
ен и я
ИЗДАТЕЛЬСТВО
«МАШИНОСТРОЕНИЕ,
1964
ткни
исок
: от-
:ето-
эвон
:та.л-
еннп
зему
юм у
:аву(
Тав-
заук
3
УДК 662.1(07)
Третье издание книги значительно переработано и содер-
жит новые материалы, отражающие достижения пиротехники
за последние годы.
В книге излагаются общие теоретические основы пиротех-
ники, современные методы составления и расчета пиротех-
нических составов, даются сведения о свойствах различных
видов пиротехнических составов.
Далее подробно описываются свойства компонентов, горю-
чих и окислителей; большое внимание уделено физической
природе рассматриваемых процессов горения. Отдельно рас-
сматриваются свойства различных видов пиротехнических
составов (осветительных, зажигательных, твердого ракетного
топлива и др.).
Книга является учебным пособием для студентов
ВТУЗов. Она будет также представлять интерес для научных
работников и инженеров промышленности, работающих в об-
ласти пиротехники и в смежных с. ней областях (взрывчатые
вещества, пороха, ракетостроение и др ).
>й7 _
3>8ЧО
А
НАУКОВА
* Б1БЛЮТЕКА
Рецензенты канд. техн, наук Н. Н. Иванова
и канд. техн, наук И. А, Бильдюкевич
ПРЕДИСЛОВИЕ
Со времени выхода в свет второго издания (19,54 г.) в пиротех-
нике "произошли очень большие изменения, вызванные новыми до-
стижениями оборонной техники.
Разработан ряд новых теоретических положений, появились
новые области применения пиротехнических составов, в частности,
они теперь широко используются в народном хозяйстве и в ракет-
ной технике.
При написании книги автором использованы опубликованные
работы как советских, так и иностранных специалистов.
Излагаемый в настоящей книге курс «Основы пиротехники»
состоит из двух частей.
В первой части дана классификация пиротехнических составов,
сведения о принципах их построения и рассматриваются физико-
химические свойства, общие для всех видов составов,
Вторая часть посвящена описанию отдельных видов пиротехни-
ческих составов, их специфических свойств и предъявляемых к ним
требований.
Описание устройства и действия пиротехнических средств дает-
ся лишь в общих чертах, поскольку это необходимо для уяснения
требований, предъявляемых к составам,
В книге излагаются также основы технологии и дан краткий
очерк истории развития пиротехники в России.
Кроме того, в книге приведен значительный п?> объему список
современной литературы по пиротехнике и по смежным с ней от-
раслям знания: физике и химии горения, термохимии, свето-
технике, химии окислителей (минеральных солей), порошковой
металлургии, химии полимеров и др,, с которыми приходится стал-
киваться специалистам-пиротехникам.
Автор выражает благодарность за помощь при составлении
учебного пособия канд. техн, наук И. И. Вернидубу, написавшему
XIV главу, канд. техн, наук Е. С. Шахиджанову, написавшему
XX главу, и инженеру А. В, Сметана, написавшему XX11I главу,
параграфы 6 и 7 главы ХШ и частично параграф 2 главы VIII.
Автор приносит благодарность докт- техн, наук нроф. В. Г, Пав-
лышину, докт. техн, наук проф. | К. К- Андрееву*], докт. техн, наук
7&0
Н. Ф. Жирову, докт. техн, наук Н. А. Силину, канд. техн, наук
Н. Н, Ивановой, канд. техн, наук Н. А, Бильдюкевич, канд. техн,
наук И. М. Бочарскому, канд, техн. наук|и. В, Быстрову!, канд,
техн, наук Н. П. Гадакчяну, канд, техн, наук А. Г. Соколову, канд.
техн, наук И, А, Челнокову, инж. И, В. Обезъяеву за многие
полезные советы и ценные замечания.
Читателям, которые сделают какие-либо замечания или ука-
жут на отдельные недостатки книги, автор будет весьма призна-
телен.
ЧАСТЬ ПЕРВАЯ
Глава I
ОБЩЕЕ ПОНЯТИЕ О ПИРОТЕХНИЧЕСКИХ СРЕДСТВАХ
И ПИРОТЕХНИЧЕСКИХ СОСТАВАХ
Слово «пиротехника» произошло от греческих слов: пир — огонь
и техне—искусство, уменье.
Пиротехника — это наука о способах производства и свойст-
вах пиротехнических составов и изделий.
Пиротехнические составы при сжигании (или взрыве) дают све-
товой, тепловой, дымовой, звуковой или реактивный эффекты,
используемые в военной технике и в народном хозяйстве (в про-
мышленности, на транспорте, в сельском хозяйстве, при киносъем-
ках и т- д.). Кроме того, пиротехнические составы используются
для устройства салютов и фейерверков.
Имеется ряд руководств по изготовлению фейерверков: Соло-
довникова В. М. [6], Цытовича П. С. [92], Иццо [12], Вейнгарта [15];
в настоящей книге изделия фейерверочной пиротехники не рас-
сматриваются.
Применению пиротехнических составов в народном хозяйстве
посвящена XXII глава.
§ I. КЛАССИФИКАЦИЯ ПИРОТЕХНИЧЕСКИХ СРЕДСТВ
И СОСТАВОВ
Пиротехническими составами снаряжаются следующие виды
средств военного значения:
1) осветительные средства (патроны, снаряды, бомбы и др.),
используемые для освещения местности в ночных условиях;
2) фотоосветительные средства (фотобомбы), используемые
при ночной аэрофотосъемке;
3) трассирующие средства, назначение которых заключается
в том, чтобы сделать видимой траекторию полета пуль и снарядов
(и других подвижных объектов) и тем самым облегчить пристрелку
по быстро движущимся воздушным и наземным целям;
4) ночные сигнальные средства (патроны, гранаты и др.), при-
меняемые для подачи сигналов на расстоянии;
5
5) дневные сигнальные средства (патроны, гранаты и др.), ис-
пользуемые для той же цели, но в дневных условиях;
6) зажигательные средства (пули, бомбы, снаряды и др.), на-
значением которых является уничтожение материальных ценностей,
средств нападения и обороны противника; специальные зажига-
тельные средства применяются также и для поражения живой силы
противника;
7) маскирующие средства (дымовые шашки, снаряды и Др.),
употребляемые для получения дымовых завес;
8) ракеты различного назначения и дальности полета; двига-
тель их снаряжается ракетными составами (твердое пиротехниче-
ское топливо);
9) учебно-имитационные средства, употребляемые как на ма-
неврах и ученьях, так и в боевой обстановке; они своим действием
имитируют действие различных боеприпасов (атомных бомб, фу-
гасных снарядов и бомб, средств химического нападения и т. п.)
или различные явления, имеющие место на поле боя (звук или
вспышка орудийного выстрела, пожар и др.), и могут этим дезори-
ентировать службу наблюдения противника;
10) целеуказательные средства (снаряды, бомбы и др.), назна-
чением которых является показ авиации иди артиллерии объектов
противника, подлежащих уничтожению.
Пиротехнические составы делят на следующие категории:
1) осветительные;
2) фотоосветительные (фотосмесп);
3) трассирующие;
4) составы ночных сигнальных огней;
5) составы цветных сигнальных дымов;
6) зажигательные;
7) составы белого, серого и черного маскирующих дымов;
Я) твердое пиротехническое топливо;
9) воспламенительные, содержащиеся в небольшом количестве
но всех пиротехнических средствах;
10) прочие (имитационные, свистящие и др.).
Многие категории составов применяются в самых различных
видах средств; так, например, осветительные составы часто исполь-
зуются в трассирующих средствах; составы белого и черного дымов
могут использоваться не только в маскирующих средствах, но и в
трассерах, в учебно-имитациониых средствах и т. д.
Пиротехнические составы можно классифицировать следующим
образом в зависимости от характера процессов, протекающих при
ах горении.
Пламенные составы
Белопламенные. Применяются в ракетных, осветительных, фото-
осветительных, трассирующих, учебно-имитационных, целеуказа-
I ельных и в зажигательных средствах.
6
Цветнопламенные. Применяются в трассирующих, ночных сиг-
нальных, учебно-имитационных и целеуказательпых средствах.
Термитные составы
Термитно-зажигательные. Применяются в зажигательных сред-
ствах.
Безгазовые (малогазовые). Применяются в дистанционных
трубках и взрывателях.
Дымовые составы
Составы белого, серого и черного дымов. Применяются в маски-
рх'ющих, трассирующих, учебно-пмитаниониых и целеуказательных
средствах.
Составы цветных дымов. Применяются в дневных сигнальных,
трассирующих, учебно-имитационных и целеуказательных сред-
ствах.
Вещества и смеси, сгорающие за счет
кислорода воздуха
Металлы и сплавы металлов. Применяются в зажигательных,
фотоосветительных средствах.
Фосфор, его растворы и сплавы. Применяются в зажигательных
средствах.
Нефтяные смеси. Применяются в зажигательных средствах
и в огнеметах.
Вещества и смеси, загорающиеся при соприкосновении с водой
или воздухом. Применяются в зажигательных и специальных сиг-
нальных- средствах.
§ 2. ГОРЕНИЕ СОСТАВОВ
В фор,.ме горения могут протекать высокоэкзотермические
химические реакции. Образование пламени или свечение не яв-
ляется непременным признаком горения; так, например, при горе-
нии дымовых пиротехнических составов пламени обычно не обра-
зуется и выделения света не наблюдается.
Основными признаками, отличающими процесс горения От дру-
гих форм, в которых могут протекать химические реакции, яв-
ляются:
1) наличие подвижной зоны реакции, имеющей высокую тем-
пературу и Отделяющей еще не прореагировавшие вещества от
продуктов реакции; этим процессы горения отличаются от таких
химических реакций, где температура одинакова или почти оди-
накова во всех точках реагирующей системы;
2) отсутствие скачка давления в зоне реакции (в пламени);
этим реакции горения существенно отличаются От процессов
взрыва.
7
Горение пиротехнических составов представляет собой окисли-
тельно-восстановительную реакцию, в которой окисление одних
компонентов состава — горючих — идет одновременно с восстанов-
лением других компонентов того же состава — окислителей. По сте-
пени гомогенности начальной системы различают несколько видов
горения.
Твердое или жидкое топливо, сгорающее за счет кислорода
воздуха, представляет собой (до начала горения) гетероген-
ную систему.
Известны и процессы горения гомогенных систем: взрыв-
чатых газовых смесей или индивидуальных взрывчатых веществ.
Пиротехнические составы, представляющие собой механиче-
ские смеси нескольких, большей частью твердых, тонко измельчен-
ных компонентов, по степени гомогенности находятся посередине
между конденсированным топливом и индивидуальными вещества-
ми (или гомогенными смесями).
Степенью гомогенности определяются многие свойства пиротех-
нических составов.
Горение пиротехнических составов осуществляется путем тепло-
передачи из зоны реакции к слоям, в которых идет подготовка
к процессу горения. На принципе теплопередачи основано и вос-
пламенение пиротехнических составов. Для возникновения горения
необходимо создать местное повышение температуры в пиротех-
ническом составе; это достигается обычно непосредственным воз-
действием на состав горячих пороховых газов или применением
специальных воспламенительных составов.
Когда пиротехнический состав приводится в действие огневым
импульсом и горение его происходит в открытом пространстве, то
скорость горения его невелика и в большинстве случаев измеряет-
ся миллиметрами в секунду.
Если же горение пиротехнического состава происходит в замк-
нутом пространстве или если в качестве начального импульса ис-
пользуется удар или капсюль-детонатор, то горение может перейти
во взрыв, скорость которого измеряется сотнями, а в отдельных
случаях и тысячами метров в секунду.
Иногда ускорение горения наблюдается также и при одновре-
менном сгорании в открытом пространстве большого количества
пиротехнических составов.
Для изготовления пиротехнического состава и снаряжения им
изделия или средства необходимо провести следующие основные
операции:
1) подготовку компонентов (измельчение и сушку);
2) приготовление порошкообразного состава (перемешивание
компонентов, гранулирование и сушку состава);
3) уплотнение и формование состава (путем прессования или
иным способом).
Для нормального действия пиротехнического состава необхо-
димо, чтобы компоненты его были хорошо измельчены и равио-
8
мерно смешаны друг с другом. В хорошо изготовленном составе,
за исключением термита, частицы отдельных компонентов обычно
уже неразличимы простым глазом.
Уплотнением состава достигается замедление процесса горения,
уменьшение объема, занимаемого составом в изделии, и сообщение
составу большой механической прочности. В большинстве пиротех-
нических изделий составы находятся в прессованном виде. Исклю-
чение составляют фотоосветительные составы, находящиеся в фото-
бомбах в виде порошков, и применяемые в некоторых случаях
гранулированные составы сигнальных дымов.
Предварительная подготовка компонентов неопасна, так как
ц горючие и окислители, применяемые в настоящее время для из-
готовления пиротехнических составов, взятые в отдельности,
в большинстве случаев нечувствительны к механическим воздейст-
виям (удару, трению) и не обладают взрывчатыми свойствами.
Этого нельзя сказать о различных видах горючих, рассеянных
в воздухе в виде пыли. Например, известны случаи сильных взры-
вов алюминиевой пыли. Исключением являются также окислите-
ли—.перхлорат аммония, цитрат аммония и хлораты металлов,
которые даже в чистом виде без горючих примесей при наличии
мощного начального импульса могут дать взрыв.
В некоторых случаях удар или трение могут вызвать местный
нагрев и воспламенение компонента,- например, наблюдалось вос-
пламенение красного фосфора при протирании его через металли-
ческие сита.
Смеси окислителей с горючими чувствительны к механическим
импульсам и при ударе или трении могут загореться. Иногда удар
или трение может быть достаточным импульсом и для возникнове-
ния взрыва в пиротехнических составах. Поэтому операции при>
готовления и прессования пиротехнических составов, в процессе
которых последние неизбежно подвергаются механическим воздей-
ствиям, как правило, являются опасными.
§ 3. ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ К ПИРОТЕХНИЧЕСКИМ
СРЕДСТВАМ И СОСТАВАМ
Основным требованием, предъявляемым к пиротехническим
средствам, является получение при их действии максимального
специального эффекта. Для различных видов пиротехнических
средств специальный эффект обусловливается различными факто-
рами. Этот вопрос подробно разбирается в главах, посвященных
описанию свойств отдельных категорий составов. Здесь же приво-
дится для иллюстрации только несколько примеров.
Для трассирующих средств специальный эффект определяется
хорошей видимостью траектории полета пули или снаряда. Види-
мость обусловливается силой света трассирующего состава
и в большой степени зависит также от цвета пламени.
9
Хороший специальный эффект зажигательных средств — безот-
казность поджигания ими соответствующих горючих материалов —
обусловливается (при наличии подходящей конструкции боеприпа-
са) созданием достаточно большого очага пожара, высокой темпе-
ратурой пламени и достаточной продолжительностью горения со-
става, количеством и свойствами шлаков, получающихся в процес-
се горения.
Для маскирующих дымовых средств специальный эффект зави-
сит от быстроты создания возможно большей густой и устойчивой
дымовой завесы.
Качество ракет определяется дальностью и правильностью их
полета, обеспечивающих достижение намеченной цели. Дальность
полета будет тем больше, чем больше единичный импульс
I (кг • сек/кг) ракетного состава и чем больше отношение веса со-
става к общему весу ракеты.
Все пиротехнические средства должны быть безопасными
при обращении с ними и при хранении.
Получаемый при их действии эффект не должен ухудшаться
после длительного хранения.
Материалы, используемые для изготовления пиротехнических
средств, должны быть по возможности недефицитны. Технологи-
ческий процесс изготовления средств должен быть простым, без-
опасным и допускающим механизацию и автоматизацию произ-
водства для осуществления массового выпуска.
Пиротехнические составы должны .обладать следующими каче-
ствами;
1) давать максимальный специальный эффект при минималь-
ном расходовании состава ';
2) сгорать равномерно с определенной скоростью;
3) обладать химической и физической стойкостью при длитель-
ном хранении;
4) иметь возможно меньшую чувствительность к механическим
импульсам;
5) не быть чрезмерно чувствительными к тепловым воздейст-
виям (не воспламеняться при небольшом подъеме температуры
и т. п,);
6) иметь минимальные взрывчатые свойства; редкие случаи,
при которых наличие у составов взрывчатых свойств является не-
обходимым, будут оговорены ниже;
7) не иметь в продуктах горения отравляющих веществ, кото-
рые могут препятствовать ликвидации пожаров на производстве;
8) иметь несложный технологический процесс изготовления;
9) не содержать в себе дефицитных компонентов;
1 Эффективность действия определяется не только рецептом состава, но так-
же конструкцией изделия, технологией изготовления состава и внешними усло-
виям ii (давление, температура), при которых происходит его сгорание,
10
10) не содержать в себе компонентов, оказывающих токсиче-
ское действие на человеческий организм.
Изделия из пиротехнических составов должны обладать доста-
точной механической прочностью, отвечающей требованиям экс-
плуатации.
Для изготовления пиротехнических составов, удовлетворяющих-
указанным выше требованиям, необходимо в каждом отдельном
случае тщательно продумать выбор горючего и окислителя и рас-
считать количественные соотношения между ними. При этом необ-
ходимо учитывать физико-химические характеристики горючего
и окислителя, используя имеющиеся в литературе данные о свой-
ствах пиротехнических составов и их отдельных компонентов.
' Разработка состава и расчет количественных соотношений
между его компонентами значительно усложняются еще тем, что
для удовлетворения всех требований двойной смеси (окислитель —
горючее) часто бывает недостаточно, и в состав приходится добав-
лять еще другие компоненты, выполняющие то или иное специаль-
ное назначение.
§ 4. НАЗНАЧЕНИЕ КОМПОНЕНТОВ СОСТАВА
Вещества, входящие в пиротехнический состав, можно разбить
на следующие категории;
а) горючие;
б) окислители;
в) цементаторы (связующие) — органические полимеры, обес-
печивающие механическую прочность уплотненных (спрессован-
ных) составов;
г) ускорители и замедлители горения;
д) флегматизаторы — добавки, уменьшающие чувствительность
составов к трению;
е) вещества технологического назначения (жирующие добавки,
растворители для вводимых в состав органических полимеров
и т. п.).
Кроме того, в составы сигнальных огней вводятся вещества,
сообщающие окраску пламени, а в дымовые составы— дымообра-
зующие вещества,
В некоторых случаях один и тот же компонент может выполнять
в составе несколько различных функций. Цементаторы (связую-
щие) всегда выполняют в составе функцию горючего, а иногда
и замедлителя горения.
В сигнальных составах нитрат стронция является окислителем,
и одновременно сообщает красную окраску пламени,
По вопросам, рассмотренным в § 1—4 этой главы, см, также
книги: Будникова М. А., Левковича И. А., Быстрова И. В. и др, [1],
Быстрова И. В. [2], Горста А. Г. [3], Жирова Н, Ф. [5], Шиллин-
га Н. А. [1561, Эллерна [9].
11
§ 5. ВОЗМОЖНЫЕ ВЫСОКОЭКЗОТЕРМИЧЕСКИЕ РЕАКЦИИ
Любая химическая реакция протекает с разрывом связей меж-
ду атомами и образованием других новых связей. Если энергия,
выделяющаяся при образовании новых связей, больше той энергии,
которая затрачивается на разрыв прежних уничтожаемых связей,
то мы имеем дело с экзотермической реакцией.
Очевидно, наибольшее количество тепла будет выделяться
в том случае, когда разрываемые связи будут слабыми, а вновь об-
разуемые— очень прочными.
Рассмотрение энергетики связей приводит к выводу, что наибо-
лее прочные связи образуются при соединении элементов, противо-
положных по своим свойствам, т. е. типичных металлов с типич-
ными неметаллами — фтором или кислородом, При взаимодейст-
вии их образуются ионные соединения. При соединении между
собой неметаллов (элементов V—VII групп периодической систе-
мы) имеем полярные соединения и большей частью энергетически
малопрочные связи.
Часто в качестве горючих в пиротехнике используются метал-
лы: магний, алюминий и др.; фтор и кислород являются при обыч-
ных условиях газами, что значительно затрудняет их применение
в пиротехнических изделиях. Поэтому в качестве окислителей
пытаются использовать соединения, в которых кислород или фтор
были бы связаны малопрочными связями с другими неметаллами.
Однако большинство таких соединений является или газами или
низко кипящими жидкостями.
Например: C1F3, OFa. NF3, N2F4, SFs, CI2O7, C1O2, NO2,
N2O4 и др.
Это обстоятельство, а также токсичность, и слишком большая
химическая активность этих веществ препятствуют их практическо-
му применению.
Эти свойства в значительной мере исчезают, когда мы (нанося
ущерб энергетике) соединяем окислы неметаллов (ангидриды)
с окисями металлов, например:
С12О7 + К2О=2КСЮ4,
NrL>Os+ K2O = 2KNO3 и т. п.
При этом образуются твердые вещества — соли, по своим свойст-
вам вполне пригодные для использования в пиротехнических со-
ставах. Они менее химически активны, порошки их при обычной
температуре могут быть смешиваемы с обычными горючими, и сме-
си эти являются достаточно химически стойкими.
Таковы обычно применяемые в пиротехнике окислители: пер-
хлораты, хлораты и нитраты щелочных (или щелочно-земельных)
металлов, например, КС1О4, KNOB, Ba(NO3)2 и др. Они удобны
для использования, но, конечно, значительно менее-энергетически
выгодны, чем элементарный кислород.
12
Другой тип используемых в пиротехнике окислителей — это
окислы малоактивных металлов, Очевидно, реакции вытеснения
их более активными металлами будут протекать с выделением
значительного количества тепла. Такова, например, реакция горе-
ния железоалюминневого термита:
Fe2O3 + 2А1=А12О3 + 2Fe+Q,
Аналогично этому можно было бы ожидать использования сме-
сей, в которых более активный металл вытеснял бы менее актив-
ный из его фтористых соединений, например:
FeF3 + Al=AlF3 + Fe + 70 ккал,
что соответствует 0,5 ккал/г смеси. Но содержание фтора в земной
коре невелико (0,03%); чаще всего фтор встречается в виде чрез-
вычайно термически устойчивого соединения — плавикового шпата,
переработкой которого получают большинство других соединений
фтора.
Кроме экономических соображений, применению в пиротехнике
фторидов в качестве окислителей препятствует еще и то обстоя-
тельство, что фтор (элемент чрезвычайно активный) образует
очень мало твердых соединений с мадопрочными -связями; следова-
тельно, в случае фторидов трудно было бы создать высококалорий-
ные смеси, Характер горения смеси (FeF3 + Al) будет совершенно
иной, чем смеси (Fe2O3 + 2Al); это определяется тем, что A1F3 суб-
лимирует при 1260°С,
В принципе было бы возможно применение в качестве окисли-
телей высших окислов некоторых металлов, например Мп2О7, СгОз
и др., но физико-химические свойства этих- соединений мало благо-
приятствуют их применению: Мп2О? — это химически мало устой-
чивая жидкость, СгОз—хромовый ангидрид — сильно гигроско-
пичен.
Взаимодействие этих соединений с окислами щелочных или ще-
лочно-земельных металлов Приводит к образованию приемлемых
для практического применения в качестве окислителей в пиротех-
нике соединений, например:
СгО3+ ВаО = ВаСгО4,
Мп2О7+КгО=2КМпО4.
Перекиси металлов выгодны по большему, по сравнению с оки-
сями тех же металлов, содержанию в них кислорода, но многие
из них мало устойчивы при нагревании (например СаО2) или по
Отношению к воде (например Na2O2). Практически пока из переки-
сей в пиротехнике используются только перекись бария—ВаО2
и в редких случаях перекись стронция — SrO2 [9],
Вернемся теперь к рассмотрению горючих. Кроме металлов,
прочные связи с фтором и кислородом дает водород; достаточно
13
прочные связи с кислородом образуют также бор, углерод, крем-
ний, фосфор. Значит, эти элементы, а также некоторые их соеди-
нения (бороводороды, углеводороды и др,) могут быть использо-
ваны в пиротехнике в качестве горючих. Но тут же невольно воз-
никает мысль: так как многие неметаллы (азот, хлор) дают
с кислородом, а также с водородом и углеродом малопрочные свя-
зи, то почему же не объединить атомы этих элементов в молекулу
таким образом, чтобы азот (или хлор) выполнял бы в ней роль
буфера, отделяя С и Н от кислорода:
С и Н | N I О.
При внешнем энергичном воздействии на такую молекулу буфер
будет выброшен, а при соединении СнНс кислородом с образова-
нием СОа и Н2О выделится большое количество тепла. Следова-
тельно, весьма экзотермическими могут быть и реакции внутри-
молекулярного горения.
Эта мысль совершенно справедлива и давно реализована.
Вещества, содержащие в молекуле между С и Н, с одной сто-
роны, и О — 'С другой, буфер —азот (или хлор), давно известны:
это нитросоединения или эфиры азотной (или хлорной) кислоты.
Вещества эти способны к внутримолекулярному горению. Но у этих
веществ имеется один с точки зрения пиротехники весьма сущест-
венный недостаток. Отсутствие гетерогенности в системе, малое
расстояние .между атомами в молекуле приводит к тому, что при
энергичном воздействии на молекулу извне разрушение ее может
протекать с большой скоростью, в форме взрыва, Иначе говоря,
описываемые нами вещества-—это вещества взрывчатые (далее
сокращенно ВВ).
Использование внутримолекулярного горения ВВ в пиротехнике
возможно, но сопряжено во многих случаях со значительным рис-
ком: при нарушении режима горения (см. далее в гл. Х1) может
произойти переход горения во взрыв.
Вместе с тем между двумя крайностями: гетерогенными систе-
мами — пиротехническими составами, с одной стороны, и гомоген-
ными системами — индивидуальными ВВ, с другой, возможна про-
межуточная ступень. Если в молекуле какого-либо вещества, со-
держащего буфер-азот, будет мало атомов горючих элементов
и избыток (конечно, до известного предела) атомов кислорода,
то такое вещество будет способно к реакции внутримолекулярного
горения, но тепло такой реакции будет невелико, температура
горения невысока, и вероятность перехода горения во взрыв будет
значительно меньше.
Именно такими веществами являются аммонийные соли некото-
рых кислородосодержащих кислот, например, нитрат или перхло-
14
рат аммония. При горении этих веществ выделяется свободный
кислород, а теплота и температура горения сравнительно невелики:
2NH4CIO4 = 4Н2О + N2 + С12 + 2O2.
2NH4NO3 =4H2O-l (1—x)N2 + (1—x)O2 + 2xNO.
Однако энергетику этих веществ легко исправить, добавив к ним
некоторое (по расчету) количество горючего (можно использовать
органическое связующее), чтобы целиком использовать избыточ-
ный кислород этих веществ. Если добавка горючего значительна
и вызывает нарушение гомогенности системы, то опасность пере-
хода горения во взрыв будет уменьшена.
Наряду с этим может быть реализован и другой вариант.
Имеются вещества с буфером-азотом, содержащие мало атомов
кислорода и избыток атомов С и Н. Такие вещества тоже будут
способны к реакциям внутримолекулярного горения, но тепло
и температура таких реакций будут невелики, а следовательно,
будет мала и вероятность перехода горения во взрыв. К таким ве-
ществам могут быть отнесены нитрогуанидин CN4H4O2, динитро-
толуол C7H6N2O4, полннитроуретацы, поливинилнитрат и др.
Энергетику этих веществ также легко исправить добавлением
к ним некоторого количества окислителя (из числа веществ, неспо-
собных к экзотермическому процессу разложения). В этом случае
происходит нарушение гомогенности и тем самым значительно
уменьшается возможность возникновения взрыва.
Все сказанное может быть проиллюстрировано следующей схе-
мой (см. табл, 1.1).
Таблица 1.1
Степень гетерогенности и взрывчатые свойства пиротехнических составов
№ по пор. Система Характе- ристика однородности системы Взрывчатые свойства
1 1. Горючее 2. Окислитель Г етерогенна М а л ы
2 1. Горючее: в нем немного азота (бу- фер) и немного кислорода 2. Добавочный окислитель Гетерогенна Средние
3 Окислитель: ц нем немного азота (бу- фер) и немного Н и С 2. Добавочное горючее Гетерогенна Срдлние
15
Продолжение
X* по пор* Система Характе- ристика однородности системы Взрывчатые свойства
4 Взрывчатое вещество: содержит азот (буфер), кислород и (C-j-H) в стехиомет- рических соотношениях Гомогенна Велики
§ 6. СПОСОБНОСТЬ К ГОРЕНИЮ РАЗЛИЧНЫХ ВЕЩЕСТВ
И СМЕСЕЙ
Пиротехника — наука молодая, она быстро развивается. Ставят-
ся новые задачи, выдвигаются новые требования и в соответствии
с ними разрабатываются новые составы и даже новые виды со-
ставов.
Пиротехник должен уметь оценить возможность протека-
ния в форме горения той или иной химической реакции,
В соответствии с принципом Бертло (который, безусловно, спра-
ведлив для высокоэкзотермических реакций, протекающих при
комнатной температуре) всякая химическая система, в которой мо-
жет протекать экзотермическая реакция, при подборе соответствую-
щих внешних условий должна оказаться способной к распростра-
нению в ней реакции горения.
Именно исходя из этого положения автор книги изучал и дока-
зал экспериментально способность к горению системы (HaO+Mg)
[39], ряда неорганических солей аммония [237]; солей гидразина,
а также гидроксила мин-сульф а та.
Безусловно, возможны реакции горения смесей магния со мно-
гими кислородсодержащими органическими веществами-—спирта-
ми, альдегидами, углеводами п др.; такие процессы легче реали-
зуются при использовании твердых, и с ббльшим трудом — при
применении жидких веществ.
Вполне возможна реакция горения в системе (ЗН2О + 2А1).
Нами дан также расчет экзотермичности реакций в системах
(ЗН2О+2В), (2H2O + Si) и (4НгО4-Р) [119, стр. 540]. Для послед-
ней системы реакция, но нашему мнению, .может протекать
по уравнению
8Н2О + 2Рбе:[=2НаРО4 + 5Н2 + 68 ккал,
что соответствует 0,33 ккал!г смеси реагирующих веществ.
В некоторых случаях оценка экзотермичности реакции имеет
уже другой смысл — она производится с целью оценки пожаро-
опасности (или взрывоопасности) системы.
16
Недавно установленная экспериментально при несчастном слу-
чае взрывоопасность перхлората серебра [44] могла быть предска-
зана заранее на основании термохимического расчета:
AgC104 = AgCl + 202 + 22 ккал.
Вещества или смеси, практически не способные к горению (или
взрыву) в условиях комнатной температуры, так как при разло-
жении их выделяется слишком мало тепла, приобретают эту спо-
собность при повышении в них запаса энергии, т. е. в условиях
повышенной температуры.
Примером этому может служить грандиозный взрыв расплава
хлората калия (Ливерпуль, 1899 г.) [19]. Добавка к хлорату калия
малых количеств горючего (1 % идитола + 5% катализатора МпО2)
делает его способным к горению при комнатной температуре (при
р = 1 ат).
Обширный материал по вопросу о неожиданных пожарах
н взрывах имеется в статье Лангханса [159], а также в статье Том-
линсона и Одрита [122].
Глава II
ОКИСЛИТЕЛИ
Смесь горючего с окислителем составляет основу всякого пи-
ротехнического состава.
Для того чтобы получить то количество тепла, которое необ-
ходимо для создания соответствующего специального эффекта, ка-
залось бы достаточно сжечь горючее, просто используя кислород
воздуха. Но сгорание горючих веществ в таких условиях протека-
ет обычно медленнее, чем сгорание их за счет кислорода окисли-
теля !, и поэтому для пиротехнических целей смеси, не содержащие
в себе окислителя (см. гл. XVII, § 6—8), используются реже, чем
составы с окислителями.
Чаще всего в пиротехнических составах в качестве окислителей
используются кислородные соединения, но встречаются иногда
и окислители, не содержащие в себе кислорода.
Можно привести такой пример бескислородной реакции го-
рения:
C2Cls+3Mg-2C+3MgCl2. (2. 1)
Гексахлорэтан в данной реакции является окислителем.
Многие активные металлы (магний, алюминий) при соединении
с фтором выделяют даже больше тепла, чем при соединении с кис-
лородом. Поэтому можно представить себе составы, окислителями
в которых будут служить фторорганические соединения.
1 Исключение представляет собой только тот случай, когда имеется большая
поверхность соприкосновения горючего с воздухом, г. е. когда имеется в наличии
взвесь тонкодисперспого порошка горючего в воздухе.
2
Л. A, [[iiuuioBCKiiii
17
Так, например, способной к горению будет смесь магния 1 с по-
литетрафторэтиленом («тефлоном»):
(C2F4)?1+2nMg=2«C-?-2«Mg'F2. (2,2)
Найденная расчетным путем теплота горения этой смеси состав-
ляет около 2,3 ккал/г.
В настоящей главе рассматриваются окислители только в узком
значении этого слова, т. е. вещества, окислительное действие кото-
рых обусловливается содержащимся в них кислородом, расходую-
щимся при горении состава на окисление горючего.
§ 1. ВЫБОР ОКИСЛИТЕЛЕН И ИХ КЛАССИФИКАЦИЯ
Окислитель должен представлять собой твердое вещество с тем-
пературой плавления не ниже 50—603 С и обладать следующими
свойствами:
1) содержать в себе максимальное количество кислорода;
2) легко отдавать кислород при горении пиротехнического со-
става;
3) представлять собой химическое соединение, устойчивое в ин-
тервале температур от —60 до +60° С и не разлагающееся от дей-
ствия воды;
4) быть негигроскопичным;
5) быть недефицитным и
6) не оказывать токсического действия на человеческий ор-
ганизм.
Однако до настоящего времени в пиротехнических составах
применяются также и окислители, которые обладают не всеми
перечисленными свойствами; например, NaNO3 или NaClO4 гигро-
скопичны, соединения свинца — токсичны,
В ряде случаев приходится мириться с некоторыми отрица-
тельными свойствами окислителей и учитывать их при технологи-
ческом процессе изготовления составов и изделий (например, гер-
метизировать изделие).
Особое внимание следует обращать на то, чтобы составы, изго-
товленные с применением выбранного окислителя, не были чрез-
мерно чувствительны к механическим импульсам и не обладали
значительными взрывчатыми свойствами.
Кроме этого, при выборе окислителя для пламенных пиротех-
нических составов следует еще во многих случаях учитывать интен-
сивность излучения продуктов распада окислителя в различных
частях спектра, Так, в составах сигнальных огней нельзя употреб-
лять окислители, введение которых изменяет окраску пламени
(например, нельзя вводить соли натрия в составы красного, зеле-
ного и синего огней).
1 Способность к горению смеси (CsF^n + Na указана в справочнике [233.
т. 1, стр. 592].
18
Чрезвычайно важно также, чтобы окислитель обеспечивал тре-
буемую скорость горения состава.
В качестве окислителей в пиротехнических составах чаще дру-
гих применяют следующие соединения:
Соли
а) нитраты —NaNO3, KNO3, Sr(NO3h, Ba(NO3)2;
б) хлорат—КСЮ3;
в) перхлораты — КСЮ4, NaClO4.
Перекиси
Перекись бария ВаО^.
О к и с л ы
а) железа — FesO4 и Fe2O3;
б) марганца — MnOsJ
в) свинца — РЬ3О4, РЬОг-
Кроме перечисленных окислителей, следует отметить возмож-
ность применения таких окислителей, как хроматы и бихроматы —
ВаСгО4, РЬСгО4, КгСггСР, перманганат калия — КМпО4, хлораты
натрия и бария — NaC103 и Ва(С1О3)2, нитрат свинца — Pb(NO3)2,
сульфаты — CaSO4, SrSO4, BaSO4, а также некоторые окисли
и перекиси — CuO, SiOa, перекись стронция — SrO2 и др.
Бихромат калия, используемый в ограниченном количестве в ка-
честве добавочного окислителя в спичечных составах, в других
случаях почти не применяется, так как количество кислорода, от-
даваемого им в процессе распада, составляет всего 16% от веса
окислителя; разлагается он сравнительно легко, так как первона-
чальная стадия его разложения протекает с поглощением неболь-
шого количества тепла:
ЗКаСгаО;— 2К2СгО44-Сг30з4-1,502 - 41 ккал. (2.3)
Следует также учесть, что порошки бихромата калия или пер-
манганата калия оказывают сильное разъедающее действие па
слизистые оболочки человеческого организма.
В пиротехнике в качестве окислителей используются также
способные к внутримолекулярному горению взрывчатые (и полт-
взрывчатые) вещества:
а) полинитросоединения — тринитротолуол (тротил), гексаген,
гексанитроэтан и др.;
б) аммонийные соли — перхлорат аммония NH4C1O4 и нитрат
аммония NH4NO3.
Однако при применении их во многих случаях сильно возраста-
ют взрывчатые свойства составов и значительно увеличивается
чувствительность составов к механическим импулИсам,
2* 19
Исследованиями последних лет [155] установлено, что йода
может выполнять роль окислителя в составах, содержащих в себе
в качестве горючего такие металлы, как магний или алюминий; эти
исследования имеют практическое значение хотя бы потому, что
меняют представления на роль в процессах горения кристаллиза-
ционной воды, которая может содержаться в некоторых окислите-
лях—солях (об использовании солей-кристаллогидратов см. [41]).
В- промышленных пирометаллургических процессах в качестве
окислителей в пиротехнических составах, используемых для полу-
чения чистых металлов, применяются окиси ряда металлов--Хро-
ма, ванадия и др.
Эллерн [9] отмечает, что изредка в пиротехнике в качестве
окислителей используются и такие окиси, как Cu2O, Bi2O3, W0O3,
а из перекисей — перекись натрия Na2O2 и даже перекись серебра
AgaCh — вещество малостойкое и разлагающееся при незначитель-
ном повышении температуры. Он же указывает, что окислители-
соли: броматы, йодаты, перйодаты и ферраты, — представляют
пока только теоретический интерес. Однако известно, что иодат
свинца РЬ(1О3)2 может использоваться в противоградовых соста-
вах (см. гл. XXII) для получения РЬ12.
§ 2, ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА ОКИСЛИТЕЛЕЙ
Наиболее важными свойствами окислителен, которые могут
быть количественно оценены, Являются:
1) плотность (при комнатной температуре);
2) температура плавления;
3) температура интенсивного разложения (если имеются доста-
точно надежные данные);
4) уравнение реакции термического разложения;
5) теплота реакции разложения;
6) вычисляемое на основании п, 4 процентное содержание
в окислителе активного (т. е. используемого на окисление горю-
чего) кислорода;
7) гигроскопичность;
8) токсичность;
9) температура плавления и кипения продуктов распада.
Температура плавления окислителя представляет интерес для
пиротехника, так как интенсивный распад окислителя в большин-
стве случаев протекает только при температуре, равной или даже
несколько более высокой, чем температура его плавления.
Понятие «температура интенсивного разложения», фигурирую-
щее во многих статьях и монографиях, является весьма неопре-
деленным; его следовало бы заменить значением температуры, при
которой парциальное давление кислорода над окислителем рав-
нялось бы какой-то определенной величине (например, 5 или
50 мм рт. ст.), до к сожалению, для большинства окислителей таких
данных пока не имеется.
20
Во многих химических справочниках Приводится уравнения ре-
акций термического разложения окислителей.
Эти сведения следует принимать во внимание, но вместе с тем
и учитывать, что в условиях горения пиротехнических составов
(высокая температура -F наличие восстановителя = горючего)
уравнение разложения окислителей выглядит иначе: разложение
становится более полным, так как весь (или почти весь) содержа-
щийся в окислителе кислород расходуется на окисление горючего,
Теплота реакции разложения, если известно уравнение разложе-
ния, вычисляется с использованием закона Гесса (см. гл. VI),
Возможность количественной оценки гигроскопичности будет
разобрана в этой главе несколько дальше.
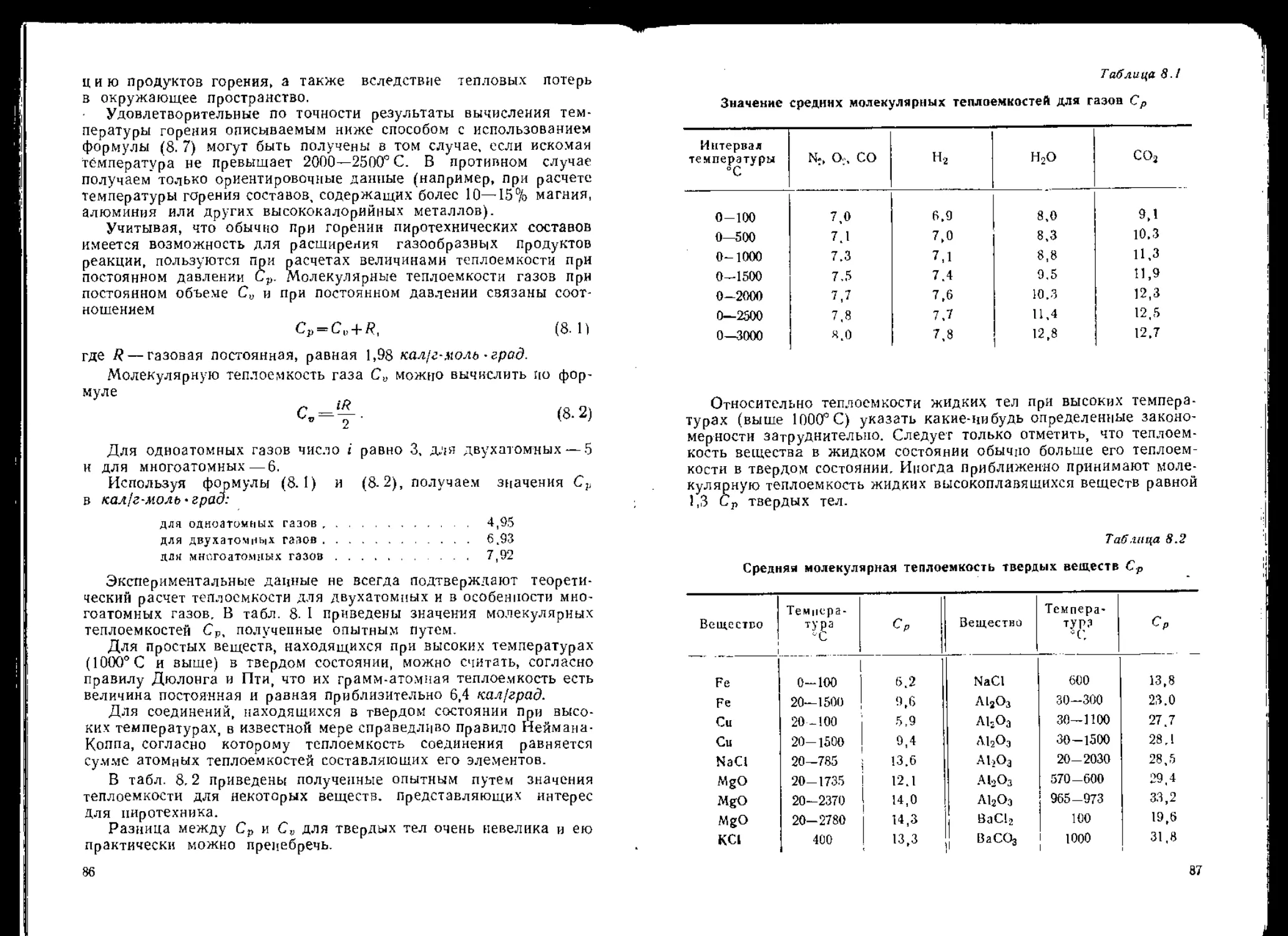
В табл, 2. I приведены свойства наиболее часто используемых
в пиротехнике окислителей (свойства NH4CIO4 и NH4NO3, исполь-
зуемых главным образом в ракетных составах, рассматриваются
в гл. XX). В графе 5 табл. 2. 1 приведены уравнения наиболее веро-
ятных реакций разложения окислителей в условиях горения пиро-
технических составов,
При медленном низкотемпературном разложении хлорат калия
разлагается с образованием перхлората
4КС1Оз = ЗКС1О4 + КС1. (2.4)
Но в условиях процесса горения продуктами его разложения будут
только хлористый калий и кислород
2КС1Оз = 2КС1 + ЗО2. (2.5)
Хлорат калия энергично разлагается только выше температуры его
плавления (370“ С); добавка катализаторов резко снижает темпе-
ратуру его разложения. Наиболее сильное каталитическое действие
при этом оказывают двуокись марганца и окись кобальта Со203.
Алексеенко [16] рассматривает сравнительную термическую
устойчивость хлоратов различных металлов и приходит к выводу,
что термический распад хлоратов должен происходить тем легче,
чем больше заряд и меньше радиус входящего в соль катиона ме-
талла.
Резкое уменьшение термической устойчивости хлоратов наблю-
дается по ряду Na, Mg, Al, а также по ряду Са, Mg, Be, (Эти же
соображения высказываются Алексеенко и при рассмотрении тер-
мической устойчивости нитратов),
Перхлораты калия и натрия при сильном нагревании (500--
600° С) разлагаются на хлориды соответствующих металлов и кис-
лород (см, табл. 2. I).
Согласно данным Гмелина [42, № 22], разложение КСЮ4 уско-
ряется в присутствии соединений Fe, Со, Ni и W, Особенно сильно
влияет на разложение КС1О4 добавление медных солей.
21
Свойства окислителей
Таблица 2.1
Форму.!!! МОлскуднрныП вес Идо птость ?/ск3 Температура иливдення " С' Уравнение реакции разложения в условиях, создающихся при горении состава Теплота образования ккял/.исм Тепл отв разложе- ния на уравнение реакции икал(моя Процент активно- го кислорода Количество окис- лителя, выделяю- щее при разло- жении ] г кисло- рода В каких составах используется
окисли- тели продукта 1 разломке- 1 НИЯ
I - 3 5 Я « 111 [[
ксю3 123 2,3 360 2КС1О3 = 2КС1 J-3O., 96 106 4-10 39 2,55 В дымовых, спичечных, реже в составах сигналь- ных огней
КСЮ4 139 2.S —610 2КС1О4 = 2КС! -с 4О2 1 । 103,6 1104,2 1 ~ 1,2 46 2,17 В зажигательных ц ра- кетных, реже в составах сигнальных огней
NaClOj 122 2,5 482 с раз- ложе - пнем 2NaClO4 = 2NaC]-i 40, 92 98 4-11 52 1,90 В осветительных, гигро- скопичен
NaNO;i 85 2.2 308 Ш 101 -121 47 2,13 В осветительных, в сос- тавах желтого огня, гнгрО' скогшчен
L _ L
KNO3 101 2,1 336 2KN03=K>20+N3+2,oO, 119 1 87 1 -151 1 40 2,53 В воспламенительных
Sr(NOs)2 212 2,9 64,5 Sr (NO3)2=-SrO+N2+2,50, 231 142 -89 38 2,65 В трассирующих, в со- ставах красного огн»
Ba (NO3)2 261 3,2 592 Ba(NO3)2=BaO-|-N24’250, 237 133 -104 .30 3,27 В осветительных, трасси- рующих, зажигательных, в составах зеленого огня
Fe3OM 232 1 5,2 1527 1636)4 — 3Fe 2Oj> 266 0 -266 28 3,34 В термитах и термнтно- зажнгательных
M nO2 87 5,0 (>530) MnO2 = Mu 4-0, 125 0 -125 37 2,72 В термитах и термитно- зажигательных; как ката- лизатор в спичечных
MnO2 = MnO-|-0,50, 125 93 -32 18 5,44
BaO, 169 5,0 (-700) BaO2 = BaO-j 0,5O2 150 133 -17 9 10,6 В воспламенительных
1 Цифра в скобках обозначает температуру разложения.
Процесс распада нитратов щелочных или щелочно-земельных
металлов протекает по стадиям [47], например:
2NaNO3 = 2NaNO2 + O2—47 ккал; (2. 6)
2NaNO2 — Na2O2+1^2+Оз—56 ккал; [2. 7)
Na2Oz = Na2O + 0,5O2—18 ккал; (2. 8)
суммируя (2.6), (2.7) и (2.8), получаем
2NaNO3 = Na2O + N2 + 2,5O2—121 ккал. (2.9)
В том случае, когда в качестве горючих в составах используют-
ся неметаллы; уголь, сера, фосфор или органические горючие, рас-
пад нитратов заканчивается образованием окислов металлов
(в данном примере Na2O); в тех случаях, когда температура горе-
ния состава невысока, в продуктах горения содержится значитель-
ное количество нитритов, как, например, при горении смеси нитра-
та натрия с молочным сахаром. Следует заметить, однако, что
нитриты щелочных и щелочно-земельных металлов менее термиче-
ски стойки, чем соответствующие нитраты; по этому вопросу
см. работу Воскресенской и Беруль [23]. В случае применения в ка-
честве горючих очень энергичных восстановителей — металлов
магния или алюминия, может произойти и более глубокий распад
окислителя — нитрата. Так, реакция горения смеси нитрата бария
с магнием может быть выражена уравнением
Ba(NO3)2+6Mg=Ba + N2+6MgO+646 ккал. (2. 10)
Следует заметить, что реакция взаимодействия магния с окисью
бария сопровождается выделением небольшого количества тепла:
BaO+Mg=Ba + MgO+11 ккал. (2. II)
При взаимодействии магния с окисью натрия тепла выделится
значительно больше:
Na2O + Mg = MgO+2Na +44 ккал. (2, 12)
Образование металлического натрия при горении смесей
(NaNO3+Mg), содержащих более 60% магния, было установлено
экспериментально при сжигании этих смесей в калориметрической
бомбе.
Шаргородским и Шором [38] были получены термограммы раз-
ложения нитратов Be, Са, Sr и Ва. В результате анализа термо-
грамм установлена температура разложения этих веществ* для
Ве(МО3)2 она равна 175—200° С, для Ca(NO3)2 480—500°С для
Sr(NO3)s 580—600° С и для Ba(NO3)2 555—600° С.
Хоган, Гордон и Кэмпбелл [45] сообщают, что смесь эквивалент-
ных частей Ba(NO3)2 и КС1О4 плавится при 520° С.
24
Из работы Эл лер на [9] следует, что окислители-соли в порядке
повышения температуры разложения (при одном и том же ка-
тионе) располагаются в следующей последовательности: перман-
ганаты, хлораты, нитраты, перхлораты, бихроматы, хроматы. Тем-
пература разложения натриевых солей ниже, чем температура
разложения калиевых солей с одним и тем же анионом.
При горении железоалюминиевого и марганцевоалюминиевою
термитов образуются свободные металлы; железо или марганец
ЗМпО3+4А1=ЗМп+2А12Оз. (2.13)
Но при горении составов, не содержащих активных металлов
(Mg, Al), двуокись марганца отщепляет только половину' содержа-
щегося в ней кислорода (см. табл. 2.1).
Перекись бария ВаО2 легко отдает только половину содержаще-
гося в ней кислорода, превращаясь при этом в ВаО,
В графах 6 и 7 приведены данные о теплоте образования окис-
лителей и продуктов их распада.
В графе 8 дана весьма существенная характеристика окисли-
теля: количество тепла, поглощаемое или выделяемое при разло-
жении окислителя.
Для получения при сгорании состава наибольшего количества
тепла выгодно, конечно, применять окислители, на разложение ко-
торых требуется минимальное количество тепла. Но, с другой сто-
роны, необходимо отметить, что такие составы обычно являются
наиболее чувствительными к механическим воздействиям. Особен-
но чувствительны к механическим воздействиям и обладают зна-
чительными взрывчатыми свойствами хлоратные составы, так как
при разложении хлоратов выделяется вполне ощутимое количество
тепла.
Так, например, тепло, которое выделяется при разложении
КСЮз, достаточно для саморазогрева этой соли от комнатной
температуры до температуры ее плавления, т, е. до 370° С.
Еще несколько более экзотермичпыми являются процессы раз-
ложения хлората натрия и, особенно, хлората бария:
2NaClC*3 = 2NaCl+ЗО2 + 25 ккал, (2. [4)
Ва (С1Оз)2 = ВаС13 + ЗО2-]-28 ккал. (2. 15)
Составы с хлоратом бария вследствие их большой чувствитель-
ности к трению и значительных взрывчатых свойств в настоящее
время практически не используются (см. также гл. XVI).
Окислители, распад которых протекает с выделением тепла,
могут обнаружить в известных условиях взрычатые свойства и без
смешения с горючими, а сами по себе — как индивидуальные ве-
щества. Так, например, хлораты калия, натрия или бария,
25
нагретые выше температуры плавления, взрываются от сильного
удара.
Перхлорат калия КСЮ4, взятый в отдельности, взрывчатыми
свойствами не обладает, так как разложение его протекает с край-
не малым выделением тепла, а именно, 0,6 ккал] мол ', что соответ-
ствует четырем малым калориям на 1 г.
Перхлорат натрия следует признать более опасным, чем пер-
хлорат калия, так как его разложение сопровождается большим
выделением тепла, а именно:
2NaC104 = 2NaCl-r402+ 10,8 ккал. (2. 16)
Из табл. 2. 1 видно, что нитраты щелочных и щелочно-земель-
ных металлов разлагаются со значительным поглощением тепла:
это существенно понижает общий тепловой баланс изготовленных
с их участием пиротехнических составов.
Еще резче расход тепла на разложение окислителя заметен
в случае использования окисей железа и марганца.
Затрата тепла на разложение перекисей, в данном случае пере-
киси бария, сравнительно невелика. Но содержание кислорода
в ВаО2 мало (см. табл. 2. 1) и это сильно снижает ее качество как
окислителя.
Легкость отдачи кислорода окислителем и количество тепла,
необходимое для распада окислителя, тесно взаимосвязаны. Так,
хлораты отдают кислород в процессе горения пиротехнического
состава значительно легче (при более низкой температуре), чем
нитраты; последние же отдают его легче, чем многие окислы.
Следует отметить, что окислы до настоящего времени применяются
в составах только в смеси с магнием, алюминием и некоторыми
другими веществами, выделяющими при горении большое количе-
ство тепла.
В графе 9 табл. 2. 1 указан процент активного кислорода или,
иначе говоря, количество грамм кислорода, освобождающегося
при распаде 100 г окислителя. Цифровые данные этой графы вы-
числены на основании приведенных в графе 5 уравнений реакций
разложения окислителя. Следует отметить, что наибольший инте-
рес представляет не общее количество кислорода, содержащееся
в окислителе, а то количество кислорода, которое активно участву-
ет в реакции и расходуется непосредственно на окисление горюче-
го; эти данные и помещены в графе 9.
Как видно из табл, 2, 1, количество кислорода, отдаваемого
окислителями, составляет не более 52% от веса соединения.
Здесь интересно провести сравнение с жидкими окислителями,
азотной кислотой и тетранитрометаном (ТНМ):
1 По данным С. И. Скуратова с сотрудниками [22], [33], реакция разложения
КС1О4 сопровождается выделением 2,5 ккал/мом тепла; цифра эта, однако,
не согласуется с данными других исследователей.
26
При разложении их по уравнениям
2HNO3 = H2O4-N2+2,5O2, (2. 17)
С (NO2)4 = Ct2N2 4-4 Оз (2, 18)
содержание активного кислорода в HNO3 получается при расчете
равным 63%, а для Т1ТМ—65%,
В перекиси водорода общее содержание кислорода очень вели-
ко— 94%, но содержание активного кислорода составляет 47%.
Данные графы 10 используются при расчетах процентного со-
держания компонентов в двойных смесях (см. гл. V).
В табл. 2. 2 приведены данные о температуре плавления и кипе-
ния некоторых продуктов распада окислителей; по этим данным
можно составить представление о наличии или отсутствии газовой
фазы и жидких шлаков при горении составов, об интенсивности
дымообразования в процессе горения и т. п.
Таблица 2.2
Вещество КС1 NaCl SrO BaO Fe Мп MnO
Температура плавления в °C 768 800 2450 2190 1527 1242 1785
Температура кипения в °C 1415 1465 — — 2740 1900 —
Окиси щелочных металлов Na2O и IGO плавятся при темпера-
туре красного каления, т. е. примерно при 800° С-
§ 3. ГИГРОСКОПИЧНОСТЬ ОКИСЛИТЕЛЕЙ
Многие соли, удовлетворяющие большинству предъявляемых
к окислителям требований, обладают большой гигроскопичностью.
Особенно гигроскопичными являются хорошо растворимые магние-
вые, кальциевые, натриевые и аммониевые соли.
Количество гигроскопической воды, поглощаемой солями, зави-
сит от влажности и температуры воздуха, от индивидуальных
свойств соли и от величины поверхности соприкосновения соли
с влажным воздухом.
Если относительная влажность воздуха в помещении больше
указанной в справочниках относительной влажности воздуха над
насыщенным раствором соли, то соль будет притягивать к себе
влагу из воздуха, образуя насыщенный раствор. Происходит рас-
плывание кристаллов соли па воздухе. Если же относительная
влажность воздуха в помещении меньше относительной влажности
воздуха над насыщенным раствором соли, то соль, наоборот, будет
27
подсыхать, а в некоторых случаях может наблюдаться и процесс
«выветривания» из кристаллогидратов кристаллизационной воды.
Так, нитрат натрия расплывается при относительной влажности
воздуха, большей 77%, а при меньшей влажности воздуха под-
сыхает.
Относительная влажность воздуха над насыщенным раствором
соли может быть вычислена делением давления водяного пара над
насыщенным раствором соли (р) на давление водяного пара над
чистой водой (ро) при одной и той же температуре. Давление во-
дяного пара обычно выражается в мм рт. ст.
Вычисленная таким способом относительная влажность над на-
сыщенным раствором нитрата натрия при температуре 20° С со-
ставит
Р 13,5 100 Р __ п.
= — =0,/7 или ---------=77%.
До 17,5
Имеющиеся в литературе данные о «гигроскопических точках»
окислителей-солей (т. е. данные об относительной влажности воз-
духа над насыщенными растворами окислителей) при температуре
20° С приведены в табл. 2.3,
Таблица 2.3
Гигроскопичность и растворимость окислителей
Окислитель lOOp A) при /=20= C Растворимость безводной солп в воде в г па 100 г раствора при температуре в =С
о 20 50 100
Хлораты
КС1О3 97 3 7 17 36
94 17 26 37 51
Na Cl Од 74 45 50 59 67
Перхлораты
КСЮ4 94 0,7 1," 5 18
NH4CIO4 96 11 18 30 ——
NaC104 69-73 — 66 71 75
Нитраты
Ba (NO3)2 99 4,8 8 15 25
KNO3 92,5 12 24 46 71
Pb (NO3)2 94 . 27 34 44 56
Sr(NO3)2 86 28 42 48 50
NaNO3 77 42 47 — 63
NH4NO3 67 54 64 78 91
28
В тех случаях, когда вообще не имеется данных о давлении
пара над насыщенным раствором соли, о гигроскопичности ее
можно судить по величине растворимости соли в воде. Суждение
это, правда, будет неточным, но все же можно считать, что гигро-
скопичность соли, как правило, при прочих равных условиях тем
больше, чем больше растворимость ее в воде.
Как видно из табл. 2.3, наименее гигроскопичными являются
соли: Ba(NO3)2, КСЮ4, КС1О3, а затем NH4C1O4, Ва(С1О3)2,
РЬ(МО3)2 и KNO3.
Соли, над насыщенным раствором которых упругость пара
меньше, чем упругость пара над насыщенным раствором нитрата
кадия, считаются гигроскопичными.
На практике затруднительна работа с солями, над растворами
которых относительная влажность меньше 75—80%.
Вследствие большой гигроскопичности совершенно не употреб-
ляются в пиротехнике такие окислители, как Mg(NO3)2, Ca(NO3)2,
Mn(NO3)2, A1(NO3)3, Sr(C]O3)2, Ва(СЮ4)2.
По той же причине нитрат натрия применяется в пиротехниче-
ских составах только при условии надежной изоляции состава
от влаги воздуха.
Нитрат стронция можно применять в пиротехнических составах
при условии, если в нем нет примесей магниевых и кальциевых
солей, повышающих гигроскопичность соли.
Полезные сведения о гигроскопичности солей можно .найти
в монографии Пестова [29].
Соли тяжелых металлов в качестве окислителей в пиротехнике
почти не применяются; причиной этого является их дефицитность,
относительно малое количество содержащегося в них кислорода
и то обстоятельство, что в смесях этих солей с такими металлами,
как магний, цинк и т. п., при наличии небольшой влажности мо-
жет легко протекать обменная реакция, например;
Pb (NO3) 2 + Mg = Pb + Mg (NO3) 2.
Вообще говоря, в пиротехнических составах, содержащих по-
рошки активных металлов (магний, цинк и др.), для обеспечения
достаточной химической стойкости состава при хранении следует
употреблять в качестве окислителей преимущественно соли метал-
лов, стоящих в ряду напряжений (см. табл. 2.4) выше металлов,
применяемых в составе.
В тех составах, в которые входит магний, из растворимых солей
в качестве окислителей (как это видно из ряда напряжений) прак-
тически можно использовать только соединения калия, бария,
стронция и натрия (литиевые соли дороги, а кальциевые соли
слишком гигроскопичны).
29
Таблица 2.4
Нормальные электродные потенциалы Еа при 25° С
(ряд напряжений)
Электрод в Электрод So в
U/Li । 1- +3,01 Tl/Tli- +0.34
К/Ю + 4-2,92 St|/Sn'- !• +0,14
Ва/Ва2+ +2,92 Pb/Pb1 2 3- +0,13
Sr/Sr2+ +2.89 Pt(Ii2)/Hi + +0,00
Са/Са2 + +2.84 Cii/Cu2^ -0,34
Na/Na'+ +2.7] Cu/C++ —0,51
Mg/Mg2 - +2.38 Hg/Hgl + —0,80
А1/АР+ +1,66 Hg/Hg2J- -0,80
Мп/Мп2+ Н 1,05 Ag/Ag1 -0,80
Zn/Zn2+ +0.76 Au/Aui ' -1.7
Fe/Fe2- +0,44 j Pi(F'-)A —2,8
§ 4. ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ
К ОКИСЛИТЕЛЯМ
К окислителям, применяемым в пиротехнике, в отношении ко-
личества содержащихся в них примесей предъявляются следующие
требования:
1, Максимальное содержание основного вещества (обычно
не менее 98—99%).
2. Минимальное содержание влаги (не более десятых долей
процента).
3, Минимальное содержание примесей гигроскопических солен
и солей тяжелых .металлов.
4. Реакция водных растворов окислителсй-солей должна быть
нейтральной.
5. Отсутствие горючих примесей и примесей твердых веществ
(песок, стекло и др.), повышающих чувствительность состава к ме-
ханическим воздействиям.
6. Отсутствие примесей, понижающих химическую стойкость
состава при его хранении (например, примеси броматов к хлора-
там), или примесей, ухудшающих специальный эффект состава.
Кроме того, порошок окислителя должен иметь необходимую
степень измельчения.
В качестве примера приводятся технические условия на барий
азотнокислый технический (ГОСТ 1713—53):
1. Чистый Ba(NO3);............................... не менее 99%
2. Влага......................................... не более 0,5%
3. Нерастворимый и воде остаток............. . не более 0,25ч;
30
4. Хлориды в пересчете па ВаС12................. не более 0,1%
5. Реакция водного раствора (на лакмус)......... нейтральная
6. Внешний нид и цвет................. мелкие кристаллы от
белого до слабо-жел-
того цвета
Хлориды являются нежелательными примесями в окислителях,
так как они довольно гигроскопичны, о чем свидетельствуют сле-
дующие данные об их «гигроскопических точках» (в % при 20° С):
КС1—86. NaCl—77, NH4C1—80, MgCl2 • 6HaO—33.
Как влияет добавка хлоридов па гигроскопичность соли, можно
видеть из следующих данных:
Состав соли .
Увлажнение соли а % после храпения
ее в течение суток при /=15-=-20°С
КС1О3 КС1О3 КСЮ3
химически -j-0,05%КС1 4-0,1 %КС1
чистый
0,1 0,3 0,9
§5. ПРОИЗВОДСТВО ОКИСЛИТЕЛЕН
Хлораты. Производство хлоратов в настоящее время осуще-
ствляется как электрохимическим, так и химическим способами.
Наибольшее промышленное значение имеют хлораты калия
и натрия. При химическом способе получения хлората калия сырь-
ем являются гашсная известь, хлор и хлористый калий. При взаи-
модействии этих веществ в растворе протекают следующие
реакции:
6 С а (ОН) 24-6С12 = Са (С Юз) 2 4-оСаС12 4-6 Н2О
и
Са(С10з)2 + 2КС-2КСЮ3 + СаС1а.
После охлаждения раствора из него выделяются кристаллы
хлората калия, которые отфильтровывают и сушат.
Существенным недостатком процесса является большое коли-
чество отходов: около 3 т СаС12 на 1 т КС1О3.
Достоинство электрохимического способа получения хлоратов
заключается в отсутствии отходов и простоте производства. Сырь-
ем является природный материал—хлорид щелочного металла.
Материалом для получения NaClOa служит раствор NaCl. Процесс
ведется в электролизерах без диафрагмы. Выделяющийся на аноде
хлор реагирует с катодной щелочью, причем в растворе образуется
хлорат натрия NaClO3.
В случае электролиза раствора КС1 процесс ведется до тех
пор, пока содержание КС1О3 в растворе не достигнет 200 г]л; При
охлаждении его выделяются кристаллы КС1О3. Маточный раствор
после добавления к нему сырья — хлористого калия — опять посту-
пает на переработку.
31
Перхлораты получаются электрохимическим окислением
хлоратов соответствующих металлов по суммарному уравнению
СЮз + Н3О = С10;+Н2.
Обычно таким путем получают перхлорат натрия.
Значительно труднее, чем NaC104, растворимый в воде пер-
хлорат калия получают путем обменной реакции:
КС1 -г- NaCIO4 = КС104 -i-NaCl.
Нитраты. Азотнокислый натрий добывался раньше из сели-
троносных земель в Чили, откуда экспортировался во все страны
и использовался в качестве удобрения, В настоящее время NaNO3
получается почти исключительно синтетическим путем — взаимо-
действием окислов азота с раствором соды.
Азотнокислый калий KNO3 встречается в природе в очень не-
больших количествах. Его получают из хлористого калия обменной
реакцией с NaNO3.
Нитраты стронция и бария могут быть получены растворением
природных солей SrCO3 (стронцианита) или ВаСОа (витерита)
в азотной кислоте,
Более сложен процесс получения нитратов Ва и Sr из их при-
родных солей BaSO4 (барита) и SrSO4 (целестина). Химизм этого
процесса рассматривается ниже на примере солей бария.
При обжиге в пламенных печах смеси барита с углем протекает
реакция
BaSO4+4C-BaS + 4CO,
затем следует обработка сульфида соляной кислотой
BaS + 2HCl = BaCk + H3S.
Образующийся хлористый барий обменной реакцией с раствором
нитрата аммония переводится в Ba(NO3)3:
BaC12 + 2NH4NO3 = Ba (NO3) 2 + 2NH4C1.
Нитрат бария вследствие его ограниченной растворимости в хо-
лодной воде легко выделить из раствора,
Подробное описание способов производства перечисленных
здесь солей можно найти в курсах и монографиях Вольфковича [21],
Позина [30], Биллитера [18], ШрайбмЗна [40], Миниовича [26],
Смирнова [34].
Перекись бария ВаО2 получается нагреванием пористой
окиси бария ВаО в токе горячего воздуха (около 500°С). Окись
бария получают прокаливанием углекислого или азотнокислого
бария. При соединении с водой перекись бария образует октагид-
рат ВаО2 8НаО.
Железная окалина Fe3O4 встречается в природе в огром-
ном количестве в виде минерала магнитного железняка. Для уда-
32
ления из железной окалины влаги и органических примесей опа
подвергается обжигу при температуре 400—500° С и затем измель-
чается.
Двуокись марганца МпО2 встречается в природе в виде
минерала пиролюзита, Может быть также получена искусственно
из солей марганца или из перманганата калия.
Глава III
ГОРЮЧИЕ ВЕЩЕСТВА
В данной главе рассматриваются свойства горючих веществ,
tie выполняющих в пиротехнических составах функции цементато-
ров (связующих). Описание свойств цементаторов дается в следую-
щей главе (гл, IV).
§ 1. ВЫБОР И КЛАССИФИКАЦИЯ ГОРЮЧИХ ВЕЩЕСТВ
При выборе горючего для пиротехнического состава необходимо
учитывать все требования, предъявляемые к составу, причем
одним из решающих факторов является достижение наилучшего
специального эффекта.
Наилучший специальный эффект в зажигательных, осветитель-
ных, трассирующих и фотоосветительных составах достигается при
высокой температуре их горения; в этом случае необходимо при-
менять высококалорийные горючие,
В твердом пиротехническом топливе также должны использо-
ваться высококалорийные горючие.
Для дымовых составов высокая температура горения во многих
случаях нежелательна; часто для их изготовления или выбирают
горючее со средней калорийностью или осуществляют неполное
сгорание горючего (например, сгорание углерода в СО),
Большую роль при выборе горючего играют также физико-хи-
мические свойства продуктов его окисления. Прежде всего необхо-
димо знать агрегатное состояние продуктов окисления при комнат-
ной температуре и при температуре горения состава. Для освети-
тельных составов важно соблюдать некоторое оптимальное
соотношение между количеством газообразных продуктов, кото-
рое сильно влияет на размеры пламени (а следовательно, на вели-
чину светящейся площади), и концентрацией (плотностью)
в пламени твердых и жидких частиц излучателей. Как избыток,
так и недостаточное количество газообразных продуктов вызыва-
ют снижение силы света.
В продуктах горения ракетных составов (твердого пиротехни-
ческого топлива) должно содержаться максимальное количество
газов и, по возможности, меньшее количество твердых веществ
(подробнее см. гл, XX, § 1).
В дымовых составах количество газов, образующихся при горе-
нии, должно быть весьма значительны.м, потому что это обусловли-
3 А. Л- Шидлоаскнй
33
вает своевременное выталкивание в атмосферу частичек дымооб-
разующих веществ. Продукты горения термита должны находиться
некоторое время в жидком состоянии, так как в противном случае
не будет достигнут требуемый эффект зажигания,
При выборе горючего для пламенных составов необходимо учи-
тывать интенсивность светового излучения продуктов его окисле-
ния, а также распределение энергии этого излучения по спектру.
Большую роль при выборе горючего играет также легкость,
с которой можно осуществить его окисление. Например, кремний
или графит с большим трудом поддаются окислению даже при при-
менении самых энергичных окислителей (горение в чистом кисло-
роде или смешивание с одним из наиболее энергичных окислите-
лей — хлоратом), вследствие чего применение их в качестве
горючих крайне ограничено.
Алюминий, взятый в виде достаточно топко измельченного по-
рошка или пудры, горит достаточно энергично как за счет кисло-
рода окислителя, так при некоторых условиях и за счет кислорода
воздуха (здесь имеется в виду горение взвеси алюминиевой
пудры в воздухе).
Магний, являясь одним из легко окисляемых веществ, даже
не будучи тонко измельчен может полностью сгорать за счет кис-
лорода воздуха. Способность сгорать за счет кислорода воздуха
является для горючего в пиротехнических составах весьма жела-
тельной.
Некоторые горючие окисляются чересчур легко, вследствие чего
смеси их с окислителями чрезмерно чувствительны к удару и тре-
нию или же обладают слишком низкой температурой воспламе-
нения. В качестве примера можно привести белый фосфор, который
не только нельзя смешивать ни с каким окислителем, но даже
нельзя хранить на воздухе во избежание самовоспламенения. При-
менение смесей красного фосфора с окислителями также весьма
ограничено: смеси красного фосфора с хлоратами почти неизбежно
подвергаются самовоспламенению, а смеси с другими окислителями
(например, с нитратами) обладают чрезмерно большой чувстви-
тельностью к удару и трению.
Желательно, чтобы для сгорания весовой единицы горючего
требовалось как можно меньше кислорода, так как большое со-
держание в составе окислителя невыгодно; оно ведет к уменьшению
количества горючего, а следовательно, и к уменьшению количества
выделяемого тепла.
Кроме того, при выборе горючего должна быть обеспечена до-
статочная химическая стойкость состава при хранении. Следует
учесть, что некоторые комбинации горючих с окислителями, на-
пример. смесь хлоратов с серой (подробнее см. гл. XII), являются
недостаточно химически стойкими-
Таким образом, применяемые в пиротехнических составах го-
рючие вещества должны удовлетворять следующим основным тре-
бованиям:
34
1) иметь теплоту горения, обеспечивающую наилучший специ-
альный эффект состава;
2) достаточно легко окисляться за счет кислорода окислителя
или за счет кислорода воздуха;
3) давать при сгорании продукты, обеспечивающие получение
наилучшего специального эффекта состава;
4) требовать для своего сгорания минимальное количество кис-
лорода;
5) быть химически и физически стойкими в интервале темпе-
ратур от —60 до + 60° С, быть по возможности устойчивыми к дей-
ствию слабых растворов кислот и щелочей;
6) быть негигроскопцчными;
7) легко измельчаться;
8) не оказывать токсического действия на человеческий орга-
низм;
9) быть доступными, ведефицитными материалами.
Горючие, применяемые для изготовления пиротехнических со-
ставов, можно разделить на следующие категории:
Неорганические горючие
1. Металлы высококалорийные: магний, алюминий; значительно
реже используются цирконий и титан.
2. Сплавы магния и алюминия; алюминий — магний (AM), маг-
ний — силиций, алюминий — силиций и др,
3. Металлы средней калорийности: цинк, железо, сурьма и др.
4. Неметаллы: фосфор, углерод (в виде сажи или древесного
угля), сера.
5. Неорганические соединения
а) сульфиды: сесквисульфид (P4S3), антимоний (Sb2S3), пирит
(FeS2) и др.;
б) прочие неорганические соединения: фосфиды, силициды, кар-
биды и др.
Органические горючие
1. Индивидуальные углеводороды: бензол, толуол, нафталин
и др.
2, Смеси углеводородов алифатического и карбоциклического
ряда: бензин, керосин, нефть, мазут, парафин и др.
3. Углеводы: крахмал, сахар (молочный, свекловичный), дре-
весные опилки.
4. Органические вещества других классов: уротропин, стеари-
новая Кислота (стеарин), дициандиамид, метальдегид и др.
§ 2. высококалорийные горючие
Наибольшее количество тепла при сгорании как за счет кисло-
рода воздуха, так и за счет кислорода окислителя выделяют сле-
дующие 12 элементов:
3*
35
металлы—литий, бериллий, магний, кальций, алюминий, титан
и цирконий
неметаллы — водород, бор, углерод, кремний и фосфор.
В табл. 3. 1 приведены данные о количестве тепла, выделяюще-
гося при сгорании этих элементов.
Таблица 3. 7
Теплота образования окнелов по данным [98; 94]
Элемент Окисел Теплота образования в ткал
Символ Атомный вес A Формула Моле- куляр- ный вес Al На моль □кисла 0 °-=^ О и 11
Al e т а л л и
Li 6,9 I-i2O 30 143 10,4 4.8 48
Be 9,0 BeO 25 142 15,8 5,7 71
Mg 24,3 MgO 40 144 5,9 3,6 72
Al 27,0 AljOs 102 400 7.4 3,9 80
Ca 40.1 CaO 56 152 3.8 2,7 76
Ti 47,9 TiO2 80 224 4,7 2,8 75
Zr 91,2 ZrO2 123 260 2,9 2,1 87
Нене галлы
H 1.0 H2O 18 68,4 (жид к.) 34,2 3,8 23
c 12,0 CO2 44 94 7,8 2.1 31
в 10,8 70 302 14,0 4.3 60
St 28,1 Sio2 60 208 7,4 3,5 69
p 31.0 p2o6 (42 367 5.9 2.6 52
Примечание: Для перехода к системе единиц СИ укажем соот-
ношение: 1 килокалория (ккйл)=4,1868 килоджоулей (кФж).
Характерйстикой калорийности элементов служат величины Qb
Qa и Сз-
Количество тепла Qb выделяющееся при сгорании 1 г элемента
(простого вещества) в окисел, может служить мерилом калорий-
ности горючего при условии его сгорания за счет кислорода воз-
духа.
1 К высококалорийным металлам следует отнести еще Nb, V, Sc и Y, цо
рассмотрение их в качестве пиротехнических горючих, по нашему мнению, еще
преждевременно. Эллери [9] приводит рецепты «экзотических составов» с ниобием
и танталом.
36
Qt вычисляется делением грамм-молекулярной теплоты обра-
зования окисла Q на величину т • А, где А — атомный вес, т — чис-
ло атомов элемента, входящее в молекулу окисла.
Количество тепла Q2, выделяющееся при образовании 1 г
окисла, может до некоторой степени служить мерилом калорийно-
сти состава, в котором то или иное горючее сгорает за счет кисло-
рода окислителя.
На фиг. 3. 1 показано, как изменяется значение 0,2 для окислов
в зависимости от места, занимаемого элементом в периодической
системе Д. И. Менделеева,
Фиг. 3. [, Зависимость теплоты образования окиси (ккал/г) от поряд-
кового номера элемента.
Количество тепла Q3, получаемое от деления грамм-молекуляр-
ной теплоты образования окисла Q на число атомов в молекуле
окисла п, позволяет судить в известной мере о температуре горения
элемента, так как в первом приближении температура горения
пропорциональна количеству тепла, которое приходится на
1 г-атом, т, е. пропорциональна Q3.
Наиболее высокую температуру при горении развивают метал-
лы: Цирконий, алюминий, магний в кальций.
Значительно более низкую температуру горения имеют водород,
углерод, фосфор и литий.
В настоящее время из этих элементов в широких масштабах
применяются только алюминий и магний и в несколько меньших —
фосфор и уголь (углерод).
Основным высококалорийным пиротехническим горючим следу-
ет считать алюминий — металл, содержащийся в большом количе-
37
стве в земной коре (8,8%) и добываемый в очень больших коли-
чествах: мировая добыча алюминия в 1960 г. составила более
4 млн. г.
Второе место принадлежит магнию, мировое производство ко-
торого в 1944 г. (во время войны) составило около 210 тыс. т, а в
1958 г. около 110 тыс. г. В последние годы СССР занял в мире
первое место по производству магния. Па рост магниевой промыш-
ленности большое влияние оказывает все увеличивающаяся потреб-
ность в магниевых сплавах, используемых в самолетостроении
и в ракетной технике; техническое значение имеют магниевые спла-
вы с Al, Zn, Мп и Zr; магний используется также при изготовлении
металлического титана [68].
Бериллий является элементом, мало распространенным в зем-
ной коре (0,0006%); добыча его руды (берилла) не превышала
в 1959 г. 10 тыс. т; как горючее в пиротехнике бериллий еще мало
изучен. Большим препятствием для его практического использо-
вания является весьма значительная токсичность бериллия [69],
особенно в тонко дисперсном состоянии. Высокая температура ки-
пения бериллия (около 24003 С) обусловливает трудность его
испарения при горении. Бериллий относится к трудно сгораемым
горючим. О свойствах бериллия см. [69].
Цирконий [62] является дорогим и дефицитным материалом,
содержание его в земной коре невелико (0,02%); составы с цирко-
нием имеют высокую температуру и большую скорость горения.
В настоящее время цирконий используется только в безгазовых
и воспламенительных составах (подробнее см. гл. XXI) в мало-
габаритных изделиях. К достоинствам циркония следует отнести
малое количество расходуемого на его сгорание кислорода и боль-
шую стойкость к коррозии.
О горении циркония см. статью Гаррисона [108].
Титан при температуре 400—600° С может легко реагировать
не только с кислородом, но и с азотом воздуха. Содержание тита-
на в земной коре значительно (0,6%). В США называют титан
«дитя войны» (1941 —1945 гг.). Мировое производство титана
в 1956 г. составляло около 20 тыс. т. Цока еще титан дорог, но пер-
спективы развития титановой промышленности велики [53; 63].
Имеются патенты на применение титана в пиротехнических соста-
вах. Так, например, указывается состав дымовой смеси: Tj—14%,
С2С16^3%, ZnO—43% (патент DBR 1.063.507).
В американском патенте 2.929.697 (I960 г.) рекомендуется со-
став ракетного пороха, содержащего КС1С^, графит, Ti — порошок
(8%) и органическое связующее.
Кальций не дорог и не дефицитен. Содержание его в земной
коре велико (3,6%), но производство его пока меньше, чем магния,
так как он не находит себе большого применения.
Использование в качестве горючего порошкообразного кальция
связано с серьезными затруднениями, так как кальций при комнат-
ной температуре энергично реагирует с влагой и кислородом воз-
38
духа. Кальций возможно применять в виде сплавов с другими
металлами.
Содержание лития в земной коре мало (0,006%). Применение
в пиротехнике лития и даже сплавов, заключающих в себе значи-
тельный процент лития, трудно осуществимо, так как литий пред-
ставляет собой металл, чрезвычайно энергично реагирующий
с влагой и кислородом воздуха [64].
Водород применяется только в связанном состоянии в виде ор-
ганических соединений.
Возможность применения в пиротехнике гидридов металлов
является проблематичной по причине малой химической стойкости
этих соединений [70]; к недостаткам гидридов следует отнести так-
же и их малую плотность.
Содержание бора в земной коре невелико (0,001%); но миро-
вое производство боратов и борной кислоты составляет сотни
тысяч тонн в год. Одно время использование бороводородных
топлив, являющихся более калорийными, чем обычные углеводоро-
ды, в ракетной технике широко рекламировалось в США. Однако
в 1959 г. появилось сообщение, что производство их прекращено
вследствие их высокой токсичности, трудности транспортировки,
а также из-за их высокой стоимости (см. например, статью Макс-
велла и Юнга [227].
Использование элементарного бора в пиротехнических соста-
вах связано с известными затруднениями; высокой температурой
плавления (2050°С) и кипения (255ОЭС) бора, а также низкой тем-
пературой размягчения (около 450° С) окиси бора В20з- Последнее
обстоятельство в известной степени препятствует получению высо-
ких температур при горении бора в пиротехнических составах, так
как тепло, выделяющееся при его горении, в значительной мере
затрачивается на плавление, а затем и на испарение окиси бора,
Имеющиеся в литературе указания, что кристаллический бор
способен к быстрому окислению, не дают еще полной уверенности,
что в дальнейшем бор найдет себе практическое применение в пи-
ротехнических составах.
Скорость окисления бора, как указывается в [82]; [228], в боль-
шой степени зависит от возможности быстрого удаления покры-
вающей его частицы оксидной пленки В20з- Подробнее о свойствах
бора см. в монографии Самсонова [65].
Применению в пиротехнике элементарного кремния препятст-
вует его трудная окисляемость; в виде сплавоз с магнием, алюми-
нием и другими металлами использование его, например, в осве-
тительных составах может дать неплохие результаты. О примене-
нии кремния, как добавки к взрывчатым веществам, см. в статье
Сарториуса [81].
Наряду с калорийностью горючего, отнесенной к единице веса
(см. табл, 3. 1), в пиротехнике во многих случаях большое значе-
ние имеет количество тепла, выделяющееся при сгорании единицы
объема горючего (Q4 ккал/слТ). Такие данные приведены в работе
[9]. Нами они даются в несколько измененном виде (см. табл. 3. 2).
Таблица 3.2
Количество тепла в ккал, выделяющееся при сгорании 1 г (Q^)
и 1 ем:1 (Q4) некоторых горючих
Вещество Qi (?4 i Вещество Qi Qi
Во 15,8 29 Nb 2,5 21
Л1 7,4 20 Мо 1,9 19
Mg 5,9 10 Fe 1,8 14
Са 3,8 6 Мп 1,7 12
Т1 4,7 20 Се 1,7 11
Zr 2,9 18 Та 1,4 23
В 14,0 33 Zn 1,3 9
Si 7,4 18 W 1,1 21
Рбел 5,9 11 Ni 1,0 9
Из табл. 3. 2 видно, что по объемной калорийности первое место
занимает бор (при расчете использована плотность, равная
2,3 г/слг3), а тяжелые металлы Zr, Nb, Мо, Та и W имеют объемную
калорийность, сравнимую с алюминием и значительно большую,
чем у магния.
В табл. 3. 3 для веществ (элементов), рассмотренных в табл. 3. 1
приведены те физико-химические свойства, о которых упоминалось
в § 1 этой главы.
Температура воспламенения порошков металлов в очень боль-
шой степени зависит от размеров и формы частиц порошка, а так-
же качества покрывающей эти частицы оксидной пленки. Чем выше
дисперсность порошка металла, тем ниже температура воспла-
менения.
Шихтер [161], сделавший выборку из зарубежной литературы,
указывает, что температура воспламенения порошка титана может
варьировать в пределах 300—600° С, а некоторые образчики мелко
дисперсного порошка циркония могут воспламеняться при комнат-
ной температуре,
Он же сообщает, что увлажненный порошок циркония горит
интенсивнее, чем сухой (система 2H2O + Zr способна к горению
и взрыву), а тушение горящего циркония допустимо только засып-
кой порошкообразными CaF2 или СаО, так как Н2О, CCh, СО2
и даже СаСОз энергично реагируют с цирконием.
Эллерн [9] .указывает, что при работе с тонко дисперсным по-
рошком циркония (2—5 мк) имел место ряд серьезных несчастных
случаев. ’
40
Таблица 3.3
Физико-химические свойства горючих и их окислов [95[; [25]; [27[
Горючее Окисел
Символ Плот- ность г^см^ Темпе- ратура воспла- менении порошка на воздухе °C Темпера- тура °C Количе- ство горю- чего г, сгораю- щее за счет 1 г кисло- рода Формула Температура °C
плавления | кипения плавления кипения
М е т а л л Ы
Li 0,5 180 181 1370 0,87 LigO 1430 (2600)
Бе 1,8 >800 1284 (2400) 0,56 Be О 2530 (4120)
Mg 1,7 550 650 1105 1,52 MgO -2800 —
Al 2,7 >800 660 — 2500 1,12 AhO3 2030 (-ЭДОО с раз- ложением )
Са 1,5 — 600 850 1420 2,50 CaO 2600 (3500)
Ti 4,5 300—600 1660 (3260) 1,50 TiO3 1920 (~3Q0Q с раз- ложением)
Zr 6,5 180—200 1868 (4750) 2,85 ZrO2 2700 (4300)
Н е м е т а л .1 ы
II 0,07 (жид- кость) — —259 -253 0,12 H2O 0 100
С Графит 2,2 — >3000 — 0,38 co2 —78 Сублими- рует
В кристал- лический 2,3 >900 2050 (2550) 0,45 B2O3 -450 (1500)
Si 2.3 >900 1430 2600 0,88 Si Од 1713 (—2950)
Ркраст 2,2 260 590 Суб- лими- рует 0,78 P2°5 580 605
Примечание. Указанная в скобках температура кипения окис-
лов—3000° С и выше—мало надежна.
Отмечено, что температура воспламенения тонко дисперсного
порошка циркония — около 85° С. Он перевозится и, поскольку воз-
можно, обрабатывается под водой.
Более грубые фракции Zr-порошков имеют температуру вос-
пламенения порядка 180—200° С. Цирконий всегда содержит следы
водорода и температура воспламенения его тем ниже, чем меньше
в нем водорода.
41
Zr-порошок с размерам частиц 10 мк и более расценивается [9]
как мало опасный в обращении.
Наибольшего количества кислорода для своего окисления тре-
буют водород и затем углерод при сгорании в СО2 (см. табл. 3. 3).
Отсюда следует, что составы, горючими в которых будут органи-
ческие вещества, должны содержать в себе очень много окислителя
и соответственно очень не-
много горючего.
Сравнительная терми-
ческая устойчивость туго-
плавких окислов (данные
заимствованы из [58])
показана на фиг. 3.2:
наиболее термически
устойчивыми являются
окислы СаО, ¥гО3, Еа20з
и ThO2.
Римскими цифрами на
фигуре показаны номера
групп периодической си-
стемы элементов.
Линиями соединены
окиси, имеющие одинако-
вые значения теплот обра-
зования, рассчитанные на
г же (при 25° С).
Редкая линейная штри-
ховка показывает сравни-
тельно небольшую терми-
ческую устойчивость оки-
Фиг, 3.2. Сравнительная термическая устой- СОЙ.
чивость тугоплавких окисей. Наиболее частой штри-
ховкой показана область
наибольшей устойчивости.
Одним из основных факторов, определяющих химическую устой-
чивость металлов, является их нормальный электродный потен-
циал. Эти данные указаны в табл. 2.4.
Возможность окисления металлов газообразным кислородом
определяется качеством покрывающей металл пленки окисла.
При наличии трудно испаряющегося окисла легкость окисле-
ния металла зависит от свойств образующейся пленки окисла.
Согласно правилу Пиллинга и Бэдворса [801; [170, стр. 43], если
объем образующегося окисла меньше объема замещаемого им ме-
талла, то пленка окисла имеет рыхлую, ячеистую структуру
и не может надежно защитить металл от дальнейшего окис-
ления,
Если же отношение объема окисла к объему металла больше
единицы, то образующаяся пленка окисла имеет компактную,
42
t
сплошную структуру, надежно изолирует металл от воздействия
газообразного кислорода и, следовательно, препятствует дальней-
шему окислению металла,
Коэффициент а Пиллинга и Бэдворса вычисляется по формуле
(1 44цк * Дцс
* ^ме ‘ П
где Мок —молекулярный вес окисла;
£)ок — плотность окисла;
Оме™плотность металла;
Лме— атомный вес металла;
п — число атомов металла в формуле окисла.
В табл. 3. 4 даются значения и для различных металлов и крем-
ния [242]; [80].
Таблица 3.4
Отношение объема окиси к объему металла
(а) по Пиллингу и Бэдворсу [242|; [80]
Na 0,55 Al 1,45 Ch 1 JO
К 0,45 Pb 1,31 Ti 1,73
Li 0,58 Cd 1,32 Fe 2,06
Sr 0,69 Su 1,33 Mn 2,07
Ba 0,78 Zr 1,45 Co 2,10
Са 0,64 Zo 1,59 Cr 3,92
Mg 0,81 Ni 1,68 Si 2,04
Как видно из табл. 3. 4, для легких металлов: щелочных, ще-
лочно-земельных и магния, а<1, для тяжелых металлов и алюми-
ния а]>1. Как указывают Пиллинг и Бэдворс, значение а опре-
деляет поведение металлов при высокотемпературной коррозии:
если а<1, то металл легко и быстро корродирует.
По-видимому, малое значение а для магния (а= 0,81) является
одной из причин, определяющих большую скорость горения маг-
ниевых составов,
Г, В. Самсонов и К- И. Портной [66] отмечают, что «при очень
больших значениях а оксидный слой получает значительные внут-
ренние напряжения, растрескивается и теряет защитные свойства.
43
поэтому наибольшими защитными свойствами обладают слои, для
которых а не очень значительно превышает 1»,
Наиболее важны для пиротехников физико-химические свойства
двух металлов: магния и алюминия,
Магний (по данным В, М. Гуськова [56[, X. Стрелец, А. Тайп
и др. [68], см, также справочник [79]). Теплота плавления и кипения
магния равна соответственно 2,1 и 30,5 ккал/г-атом (температуру
плавления и кипения см. в табл, 3.3), Теплота сублимации при тем-
пературе плавления 34,0±1,5 ккал/г-атом. Атомная теплоемкость
5,86 кал/г-атом • град при 0°С, 6,70 при 300° С, 7,58 при 650° С, для
жидкого магния — 8,10, парообразного — 4,97. Теплопроводность
0,37 кал'см • сек • град (при 20° С), Давление насыщенного пара
в мм рт. ст,-. 1 при 62 С, 5 при 702° С, 20 при TSO10С, 100 при
909° С [73].
Химически магний весьма активен, но примерно до 350° С
от окисления его в известной мере защищает окисная пленка
(см, статьи Маколкина и Вернидуба [61]), При нагревании до бо-
лее высокой температуры окисление магния быстро ускоряется.
При 500° С скорость окисления магния по данным Пиллинга
и Бэдворса [80] равна 0,52 мг/см? • час. Магний в виде крупных
кусков и пластинок воспламеняется на воздухе при 600—650° С,
порошкообразный — при температуре около 550° С. При сгорании
на воздухе магний образует окись магния MgO и частично нитрид
Mg3N2,
О механизме горения магниевой ленты в кислороде, на воздухе
и в других кислородных газовых смесях см. работы Коффина [143]
и Киршфельда [146]. В работе Делаво указывается, что добавле-
ния к воздуху 1 % по объему SiFi или BF3 достаточно, чтобы поту-
шить пламя горящего магния,
Окись магния—легкий белый порошок (плотность 3,6 г/смс-),
сильно прокаленная окись магния теряет способность соединяться
с водой и растворяется в кислотах.
Летучесть MgO заметна при температуре около 2000° С; темпе-
ратура ее плавления — около 2800° С. Опытным путем установле-
но, что температура кипения MgO превышает 2900° С. Большинство
приводимых в литературе значений для температуры кипения
лежит в пределах от 3000 до 3600° С. Так как по гомологическому
ряду Ba, Sr, Са, Mg температуры плавления и кипения возрастают
[7, стр. 36], а температура кипения СаО равна 2850° С, то, очевидна,
температура кипения MgO во всяком случае не ниже, чем
3100° С. Скрытая теплота возгонки MgO оценивается величиной
150 ккал!мол [68],
Окись магния широко используется при производстве огне-
упоров.
Нитрид магния MgaN2—твердое вещество серо-зеленого цвета,
легко разлагаемое водой: соединение магния с азотом сопровож-
дается значительно меньшим выделением тепла, чем соединение
44
i
магния с кислородом. Теплота образования Mg3N2 из элементов
равна 115 ккал/мол (для 3MgO 144-3=432 ккал),
Алюминий [201]; [55]. Теплота плавления и кипения алюми-
ния равны соответственно 2,5 и 69,6 ккал/г-атом, Атомная тепло-
емкость составляет 6,0 кал/г-атом • град при 0°С; 7,36 при 660° С,
жидкого алюминия 7,19 при 1000° С, Давление пара в лж рт. ст.:
2 - 10~5 при 660°С; 1 при 1284°С; 5 при 1421°С; 20 при 1555°С и 100
при 1749° С [73]. Теплопроводность—0,52 кал/см-сек-град при
20° С.
Алюминий химически активен, но в обычных условиях (в том
состоянии) окислению его препят-
числе и в порошкообразном
ствует покрывающая его поверх-
ность тонкая, но прочная оксид-
ная пленка. При накаливании по-
рошкообразный алюминий энер-
гично сгорает на воздухе. При
температуре красного каления он
активно соединяется с серой, да-
вая соединение A12S3, При 800° С
алюминий соединяется с азотом,
образуя нитрид A1N — белые кри-
сталлы с температурой плавления
2200° С (при давлении азота 4 ат).
В своих соединениях алюми-
ний трехвалентен, но при высоких
Фиг. 3.3. Диаграмма состояния
сплавов Mg—Al.
температурах существуют соеди-
нения одновалентного алюминия
(см. гл, XVI1, стр, 226 и книгу
Беляева и Фирсановой [196]),
Окись алюминия — белый по-
рошок, имеющий плотность: ко-
рунд (а = А12О3) 3,96, глинозем (у=А12О3) 3,42 г/см?. Зависимость
молярной теплоемкости в интервале 100—MOCf3 С от температуры
для А120з выражается формулой: СР=23,86+0,00673^. Температу-
ра плавления А12О3 2050° С. При высокой температуре (порядка
3000° С) АБОз в значительной степени диссоциирует с отщеплением
кислорода, образуя низшие окислы А1О и в восстановительной ат-
мосфере А12О, так что указываемая в справочниках температура
кипения A12O3 является весьма условной.
Из применяемых в пиротехнике сплавов металлов следует особо
указать на магниевоалюмипиевые сплавы (фиг, 3.3).
Интерметаллическое соединение Mg4Al3 (54 весовых % маг-
ния) имеет теплоту образования +49 ккал/моль\ плотность его
2,15, температура плавления 463° С. Этот сплав выгодно отличается
от соответствующих смесей магния с алюминием меньшей способ-
ностью к коррозии, он обладает большой хрупкостью, что дает воз-
можность легко осуществить процесс его измельчения.
45
Известно, что для интерметаллических соединений вообще ха-
рактерны значительная хрупкость и твердость большая, чем твер-
дость составляющих их компонентов.
Фиг, 3. 4. Диаграмма состояния сплавов
Mg—Si,
Сплавы магния с алюминием, содержащие 85—90% магния, по-
лучили название сплавов «электрон» *.
Диаграмма состояния сплавов магний — кремний дана на
фиг. 3.4.
§ 3. ТЕХНИЧЕСКИЕ ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ
К ПОРОШКАМ МЕТАЛЛОВ
К порошкам металлов в пиротехнике обычно предъявляют сле-
дующие требования:
1. Максимальное содержание активного (нсокисленного) метал-
ла (для разных металлов и разных сортов порошков от 90 до 98%).
2. Содержание примесей железа и кремния не более десятых до-
лей процента (за исключением специальных сплавов, содержащих
указанные элементы в качестве составной части).
3, Содержание примесей тяжелых металлов (меди, свинца) —
лишь в минимальных количествах (обычно — следы).
4. Содержание жиров — не более десятых долей процента;
в некоторых случаях совершенно не допускается их содержание.
5. Содержание влаги — не более десятых долей процента.
6. Порошок нормируется по степени измельчения.
Примесь кремния опасна, если кремний содержится в виде
соединений (песка, стекла), повышающих чувствительность со-
ставов.
( Свойства магниевых сплавов описаны в справочнике: Портной К. И.,
Лебедок А. А., Магниевые сплавы, Металлургиздат, 1952,
4G
Присутствие в порошке металла примесей меди, свинца и же-
леза (в особенности двух первых) может способствовать образова-
нию в увлажненном составе гальванической пары, что, несомненно,
ускорит процесс разложения состава при хранении.
Большое содержание жиров замедляет процесс горения и может
способствовать увеличению искрения.
Требования, предъявляемые к алюминиевому порошку по со-
держанию в нем активного металла и Примесей, следующие:
Активного алюминия....................... . не менее 96%
Окиси алюмин((!|................................ не более 3%
Примесей железа............... ................. не более 0,8%
Примесей кремния................................ не более 0,6%
Примесей меди п свинца .................... следы
Жиров........................................... нс более 0,5%
Влаги............. ................. не более 0,2%
Требования, предъявляемые к магниевому порошку по содержа-
нию в нем активного металла и примесей, следующие:
Актинного металла ................ . не мецее 98%
Окиси магнии .......................... нс более 1%
Железа................................ не более 0,35%
Кремния .............................. не более 0,15%
Влаги ................................ tie более 0,2%
Меди.................................. не допускается
Хлцристых солей .................... следы
Жиров , , , . ...................... не допускается
Измельчение (номер сита указывает ко-
личество отверстий на одни линейный
сантиметр):
Проходит через сито № 30 , ......... 100%
Проходит через сито №60............. не более 10%
§ 4. ПРОИЗВОДСТВО МЕТАЛЛИЧЕСКИХ ПОРОШКОВ
Для получения металлических порошков пользуются нескольки-
ми способами:
1) механическим измельчением;
2) распылением жидких металлов;
3) восстановлением окислов;
4) электролизом.
Механическое измельчение производится в шаровых или молот-
ковых мельницах. Этот способ наиболее удобен При измельчении
хрупких металлов или сплавов.
Распыление расплава металла (способ очень экономичный)
используется для получения порошков сравнительно легкоплавких
металлов, в том числе алюминия и Цинка. Существует несколько
47
вариантов этого способа: 1) распыление сжатым воздухом или га-
зом, 2) центробежный распыл, 3) грануляция посредством литья
металла в воду.
Методом термического восстановления окислов получаются,
например, порошки титана и ниобия.
Электролизом расплавленных сред получают порощки туго-
плавких металлов, циркония и Др. Фор,ма частиц порошков зависит
от способа их получения.
При распылении расплавов металлов частицы порошка имеют
каплеобразную или сферическую форму,
При восстановлении окислов металлов порошки получаются по-
ристыми, рыхлыми. У порошков, полученных электролитическим
путем,— форма неправильная, разветвленная (дендриты). Размер
частиц порошков металлов зависит от способа их получения
и варьирует в очень широких пределах — от 500 мк (грубые по-
рошки), 50—20 пос (тонкие порошки) и до 5—2 мк (сверхтонкие по-
рошки). Разумеется, чем порошок металла тоньше, тем больше его
реакционная способность и меньше объемный вес (г/см3) при сво-
бодной насыпке (или утряске).
Магний весьма химически реакционно способен, и поэтому маг-
ниевый порошок чаще всего получают механическим измельче-
нием.
Для приготовления магниевого порошка чушки магния превра-
щаются на специальных фрезерных станках в мелкую стружку.
Дальнейшее измельчение магния ведется в атмосфере инертного
газа в специальных шаровых мельницах,
Производство магниевого порошка опасно вследствие большой
химической активности тонко измельченного металла. Описан
и другой способ получения магниевого порошка путем охлаждения
паров магния в конденсаторе.
Алюминиевый порошок получают путем распыла расплавленно-
го металла сжатым воздухом или центробежного распыла [34],
Алюминиевая пудра получается измельчением алюминиевого по-
рошка (или листочков фольги) в шаровых или молотковых мель-
ницах.
Этот последний процесс значительного увеличения поверхности
алюминия сопряжен с риском его окисления. Во избежание этого
к порошку алюминия перед измельчением добавляется около 1%
жирующих добавок (стеарина и парафина), которые потом после
измельчения удаляются экстракцией или нагревом в вакууме.
В Германии в период 1939—1945 гг. производилось около
25 тыс, т алюминиевого порошка в год, а годовое производство по-
рошков из магния и магниевых сплавов составляло около
10 тыс. т [54].
Сведения о способах получения и свойствах порошков металлов
можно найти в книгах Бальшина [84], Айзенкольба [54], Эдвардса
и Врея [76].
48
Методы определения дисперсности порошков описаны в рабо-
тах Дерягина [57], Товарова [74], Энтелиса [75], Орра и Дела-
вадя [78],
§ 5, НЕОРГАНИЧЕСКИЕ ГОРЮЧИЕ СРЕДНЕЙ КАЛОРИЙНОСТИ
В тех случаях, когда не требуется большого выделения тепла
и высокой температуры горения, как, например, в дымовых или
в дистанционных составах, возможно применение в качестве горю-
чих цинка, сурьмы, железа, марганца, серы, и, возможно, некото-
рых других элементов, а также некоторых неорганических соеди-
нений.
Теплота образования окислов некоторых сравнительно мало ка-
лорийных элементов (считая по характеристикам и приве-
дена в табл. 3. 5.
Таблица 3,5
Теплота образования окислов
Элемент О к lie ел Теплота образования в ккал
Символ A Формула M Q m Л Q <?2=Д7 Д1 Q
Na 23,0 Ма2О 62 99 2,2 1,6 33
К 39,1 IGO 94 85 1,1 0,9 29
Сг 52,0 Сг^Оз 152 273 2,6 1,8 55
Ма 54,9 MnO 71 93 1,7 1Д 46
Ре 55,8 Ре2О3 160 195 1,7 1,2 39
Со 58,9 СоО 75 57 1,0 0,8 28
Ni 58,7 NiO 75 58 1,0 0,8 29
Zn 65,4 ZnO 81 83 1,3 1,0 41
Ga 69,7 Са20з 187 256 1,8 I,4 51
Ge 72,6 , GcO2 105 128 1,8 1,2 43
As 74,9 AS2O5 230 219 1,5 1,0 31
Мо 95,5 MOO3 144 180 1,9 1,3 45
Sb 121,8 i Sb2O5 321 230 0,9 0,7 33
S 32,1 I so2 54 71 2,2 1,1 24
С 12,0 co 28 20 2,2 0,9 13
В качестве горючих в пиротехнике могут использоваться
не только простые вещества (элементы) или сплавы металлов, но
и неорганические соединения.
Очевидно, теплота горения соединения при прочих равных
условиях будет тем больше, чем меньше теплота его обра-
4 А. Л. ИЫд.тоыскиб
49
зования из элементов. Таким Образом, вырисовывается принцип
отбора:
В качестве горючих в пиротехнике могут быть использованы со-
единения элементов, приведенных в тайл. 3. 1 и 3.5, имеющие не-
большую теплоту образования (Q2 ккал/г).
Небольшую теплоту образования обычно имеют соединения
с ковалентным типом связи. При рассмотрении таких соединений,
оценивая их с точки зрения пиротехника, следует обратить внима-
ние па соединения металлов с неметаллами 111, IV, V и V1 групп
периодической системы элементов, т. е. на бориды, карбиды, сили-
циды, фосфиды и сульфиды.
Многие из этих соединений еще не опробованы пиротехниками,
другие не подходят по свойствам, являясь либо слишком легко
(многие фосфиды), либо слишком трудно (силициды некоторых
металлов) окисляемыми.
Из бинарных неорганических соединении на практике исполь-
зуются сульфиды: пирит FeSs, антимоний Sb2Ss и некоторые другие
Свойства их приведены в табл. 3.6.
Таблица 3.6
Физико-химические свойства сернистых соединений
Форм}1 ла Молекулярный вес Плотность Темпера* Цвет Теплота образова- ния и ккал [моль Продукты сгорания (кроме SO2) Количество тепла в ккал от сгорания 1 г вещества Количество вещест- ва в г, сгорающее за счет 1 г кислорода
тура э °C
ПЛ.'ll! Л СИНЯ кипения 1
P<S3 220 1,3 172 407 Желтый 77 P2OS 3,9 0,86
FeS2 120 5,0 — — Серый 36 Ре2О3 I,7 1,36
AsjSs 214 3,5 320 565 Оранже - вый 19 A s о Од I,3 1,92
ASjSg 246 3,5 310 707 Желтый 20 Ак20з ’Л 1,71
SbsSg 340 4,6 548 — Черный 36 5Ь20з 1,1 2,36
§ 6. ОРГАНИЧЕСКИЕ ГОРЮЧИЕ
Жидкие углеводороды (бензин, керосин, нефть и др.) приме-
няются в зажигательных смесях, сгорающих за счет кислорода воз-
духа.
В табл. 3. 7 н далее в тексте дается характеристика различных
нефтеп родуктов.
50
Свойства нефтепродуктов
Таблица 3.7
Нефтепродукт Плотность Температура в °C
кипения вспышки
Петролейный эфир 0,64—0,67 50—60 —58
Бензин; а) легкий 0,67—0,72 60—100 —
б) тяжелый 0,72—0,76 100—120 '—
Лигроин — 120—160 от +5 до -J-15
Керосин: а) легкий 0,78—0,84 150—300 от 4-28 до 4-45
б) тяжелый 0,80—0,87 — —
Пиронафт — 270 100
Веретенное масло 0,88—0,89 — 160
Машинное и цилиндровое
масла 0,90—0,92 — 180—22(1
Мазут 0,91 300 100—140
Нефть 0,78—0,92 — 30—90
Бензол 0,88 80 от —12 до п К
Количество тепла Q1( выделяющееся при сгорании 1 г продукта,
составляет для бензина 11,2 ккал, для нефти 10,8 ккал и для бен-
зола 10,0 ккал. Бензин и керосин замерзают при температуре ниже
—80° С, бензол замерзает При 4-6° С. Содержание водорода в бен
зине составляет 14—15%, в бензоле 7,7%.
Скипидар получается из смолистых выделений хвойных де-
ревьев; главной составной частью его является непредельнь[й угле-
водород пинен (CioHie). Скипидар отличается от предельных угле-
водородов большей легкостью окисления; он легко воспламеняется
при соприкосновении с концентрированной азотной кислотой.
Если выделение большого количества тепла резко ухудшает
специальный эффект, то в качестве горючих используют обычно
различные углеводы. Количество окислителя, добавляемого к ним.
должно обеспечить сгорание углерода органического вещества
только в окись углерода СО.
Ниже указываются свойства некоторых углеводов.
Крахмал (СбНюО5)п=[СбН7Оэ(ОН)з]11. Геплота образования
1,66 ккал на I г, плотность 1,6; в холодной воде почти не раство-
ряется, в горячей растворяется значительно лучше; в кислой среде
крахмал гидролизуется до виноградного сахара:
(CgHuiOnJn + nHiO—«CsHl2O6 (cf— глюкоза).
4*
5J
Молочный сахар С12Н22О11 • Н2О. Плотность 1,5; вода уда-
ляется только при 125" С, плавится около 200° С (с разложением )
При комнатной температуре в 100 г воды растворяется 17 г сахара:
при нагревании растворимость в воде сильно увеличивается; в эти-
ловом спирте растворим очень трудно. Теплота образования
651 ккал на 1 г-моль.
Свекловичный (тростниковый) сахар С|211220ц. Плот-
ность 1,6; плавится при температуре около 160°С с небольшим
разложением, При комнатной температуре в 100 г воды растворяет-
ся 190 г сахара, В этиловом спирте растворим трудно,
Древесина (Древесные опилки) в большей своей части со-
стоит из клетчатки (СеН^О^и, содержание которой может дохо-
дить до 2/з от веса сухой древесины,
Теплота образования клетчатки (целлюлозы) составляет
1,55 ккал на 1 г; воздушно-сухая древесина дает при горении око-
ло 3—3,5 ккал; г. целлюлоза 4,2 ккал/г.
Из других органических горючих, используемых в пиротехнике,
следует отметить стеарин, нафталин, парафин, уротропин и дициап-
аиамид.
Стеарин или стеариновая кислота С17НЗЙСООН. Еше в руко-
водстве по пиротехнике конца Х1Х ст.1 указывается: «стеарин
(acidiim steannicum) — это одна из составных частей сала.
Употребляется в наскобленном виде, так как толочь его крайне
трудно, Используют для этой цели стеариновые огарки. Стеарин
не должен пахнуть салом и марать рук, Употребляется в составах
некоторых огней».
Температура плавления стеариновой кислоты С13НзеО2 71° С,
температура кипения 359—383° С (при атмосферном давлении),
плотность се 0,94. Стеариновая кислота принадлежит к числу по-
верхностно-активных веществ и поэтому особенно прочно адсорби-
руется на поверхности порошков компонентов состава. Теплота об-
разования из элементов стеариновой кислоты равна 223,8 ккал/мол
[111].
В настоящее время стеарин используется при изготовлении от-
вержденных горючих и как горючее (одновременно пластифика-
тор) во многих пламенных составах (осветительных, ракет пых
и Др.),
Технический стеарин представляет собой смесь стеариновой
И пальмитиновой кислот. Температура плавления пальмитиновой
кислоты С[бН32О2 623 С и температура кипения 268° С.
Нафталин С10Н3. Температура плавления 803С, температура
кипения 218°С, плотность (при 20эС) 1,16. Теплоемкость твердого
нафталина при 20° С равна 0,30 кал[г - град, жидкого нафталина
при 87° С 0,40 кал/г-град; скрытая теплота плавления 34,6 кал/г.
1 П. Ф. Симоненко, Пиротехника, СПБ. 1894.
52
скрытая теплота испарения 75,5 кал/г. Теплота образования нафта-
лина из элементов равна —16 ккал/мол. В пламенных составах наф-
талин используется как горючее; в составах белых дымов, имею-
щих низкую «Б00':1 С) температуру горения он частично сгорает
и частично сублимирует, выполняя функции дополнительного лымо-
.образователя.
П а р а ф и к — смесь насыщенных углеводородов. При стехио-
метрических расчетах можно использовать условную формулу
С26Нз4. Белая или немного желтоватая ,масса без вкуса и запаха.
Получается при переработке некоторых сортов нефти, бурого угля
или торфа, Температура плавления 44—-58° С, плотность 0,88-
0,91 г/с,и3. Химически менее реакционен, чем нафталин или стеа-
рин, Теплота сгорания парафина (при температуре плавления
52,5—53° С) равна 11,19 ккал/г [111].
Уротропин—гексаметилентетрамин, C6HI2N^. Подучается
При конденсации формальдегида с аммиаком. Содержит в себе
много азота и потому дает при горении бесцветное, почти не коп-
тящее пламя; это свойство особенно ценится при его использова-
нии в составах сигнальных огней.
Уротропин является главной составной частью употребляемых
в быту брикетов «твердого спирта» (имеется в виду подогрев
воды, пищи и т. ц.). Хорошо растворим в воде; при комнатной тем-
пературе 167 .г уротропина растворяется в 100 г воды; мало раство-
рим в абсолютном этиловом спирте, еще хуже — в бензоле.
Разлагается под действием кислот, Термически стоек —в ваку-
уме возгоняется при 230—270й С почти без разло-
жения.
Уротропин является эндотермическим соединением, т, е. имеет
еще более отрицательную, чем нафталин (см, выше), теплоту об-
разовапия из элементов, а именно — 30 ккал/мол. Широко исполь-
зуется в медицине; служит сырьем для изготовления мощного
ВВ — гексагена.
Ди ци ан д ц а мид —ДЦДА, C2N4H4, Nll2C(=NH)NH— С= N.
Используется как горючее и одновременно как пламягаситель в ды-
мовых составах. Получается димеризацией цианамида в присутст-
вии NH3. Температура плавления 20$Г С, плотность 1,40 г[см/’.
Трудно растворим в холодной воде (2,2 г в 100 г Н2О), негигроско-
пичен. Хорошо растворим в ацетоне, горячей воде и горячем алко-
голе, нерастворим в бензоле. При нагревании его свыше 180’ С.
отщепляет аммиак, образуя меламин СзМз(МН2)31 Теплота образо-
вания ДЦДА из элементов слабо отрицательная, а именно-—
4,5 ккал/мол [111].
Во время Второй мировой войны ДЦДА добавлялся как пламя-
гаситель в артиллерийские пороховые заряды (ср. 51, Bd, V, s. 827].
В промышленности ДЦДА используется для получения амино-
пластов.
Глава IV
МЕТОДЫ УПЛОТНЕНИЯ СОСТАВОВ И ИСПЫТАНИЕ
ПРОЧНОСТИ ЗВЕЗДОК. ЦЕМЕНТАТОРЫ: ОРГАНИЧЕСКИЕ
ПОЛИМЕРЫ
§ 1. МЕТОДЫ УПЛОТНЕНИЯ СОСТАВОВ.
НАЗНАЧЕНИЕ ЦЕМЕНТАТОРОВ
Уплотнение и формование пиротехнических составов можно про-
изводить различными способами: прессованием, шнекованием, за-
ливкой, а в некоторых случаях и набивкой вручную,
При снаряжении пиротехнических изделий способом шнекова-
ния рабочим инструментом является архимедов винт, называемый
в данном случае шнек-винтом, Шнек-винт служит здесь одновре-
менно и для подачи составов в оболочку изделий, и для их уплот-
нения внутри этой оболочки.
Уплотнение составов достигается путем приложения извне
к снаряжаемым изделиям (со стороны, противоположной той, отку-
да винтом подается состав) постоянного по величине усилия, пре-
пятствующего до определенного предела отходу изделия от шнек-
винта во время работы последнего [156].
Шнекование является производительным способом снаряже-
ния. Однако его применение в пиротехническом производстве за-
труднительно ввиду чувствительности пиротехнических составов
к механическим воздействиям. Мешает шцекованию и то обстоя-
тельство, что многие пиротехнические составы не обладают в до-
статочной мере той степенью пластичности, которая требуется при
этом методе снаряжения.
Менее чувствительными к механическим импульсам и достаточ-
но пластичными являются некоторые составы маскирующих дымов
(см. гл. ХУШ); для них снаряжение способом шнекования допу-
стимо.
Снаряжение способом заливки используется при работе с жел-
тым фосфором, его сплавами и растворами. Зажигательные бое-
припасы с жидкими, загущенными или отвержденными горючими
(ТГ, напалм и др.) также снаряжаются только путем заливки.
За последние годы снаряжение способом задивки используется
для смесевых порохов, содержащих в себе не менее 20% органиче-
ских веществ (см. гл. XX).
Главным препятствием для работы этим способом при снаря-
жении боеприпасов другими видами пиротехнических составов
является высокая температура плавления основных компонентов
пиротехнических составов—неорганических окислителей и метал-
лических горючих.
Содержание легкоплавких компонентов (имеющих температуру
плавления ниже 120—150° С) в пиротехнических составах, содер-
жащих в себе окислитель, обычно не превышает 10—15%; поэтому
54
а большинстве случаев не представляется возможным применить
тот прием взмучивания высокоплавящихся компонентов в жидком
расплаве, который применяется, например, при снаряжении залив-
кой высокопроцентных амматолов (60/40).
Наиболее часто применяющимся способом снаряжения пиро-
технических составов является способ холодного прессования на
гидравлических или механических прессах.
Прессование при повышенной температуре (60—100Q С), воз^
можно, несколько способствовало бы улучшению качества снаря-
жения, по такой способ работы был бы слишком опасен, так как
при повышении температуры резко увеличивается чувствительность
составов к удару и трению.
Как уже указывалось, уплотнение состава необходимо для того,
чтобы сделать горение состава более медленным и равномерным.
Уплотненный (спрессованный) состав должен обладать большой
механической прочностью. Особенно это бывает необходимо в тех
случаях, когда изделия (факела, звездки, сегменты и пр,) в момент
использования их в боевых условиях испытывают значительные
разрушающие механические усилия.
Изделие из спрессованного пиротехнического состава должно
обладать настолько большой механической прочностью, чтобы
ни при стрельбе, ни при горении состава не наблюдалось растрески-
вания, отколов или отвалов отдельных кусков состава.
Достигнуть высокой прочности спрессованных составов только
применением высоких давлений при прессовании не всегда пред-
ставляется возможным и целесообразным,
В целях увеличения прочности пиротехнических изделий в со-
ставы часто вводят связующие вещества, получившие название це-
ментаторов [.
Чаще всего в качестве связующих используются искусственные
и естественные смолы, каучук и некоторые другие органические
вещества; но в некоторых случаях возможно применение для этой
цели и неорганических веществ, как, например, серы и др,
В некоторых особых случаях введение цементаторов имеет
целью придать необходимую прочность зерненым пиротехническим
составам; при этом це.ментатор должен обеспечить необходимую
прочность зерен (гранул) при перевозке, хранении и действии из-
делия.
§ 2. ИСПЫТАНИЕ ПРОЧНОСТИ ЗВЕЗДОЙ
Большинство пиротехнических составов поступает на снаря-
жение боеприпасов уже в виде спрессованных изделий требуемой
формы.
1 Органические цементаторы одновременно являются горючими: введение их
также замедляет процесс горения многих составов н увеличивает химическую
стойкость составов.
55
Наиболее часто применяющимся в настоящее время методом
испытания прочности изделий из пиротехнических составов являет-
ся определение усилия (в кГ/см2), необходимого для раздавлива
ния опытного цилиндрика (звездки) из спрессованного пиротехни-
ческого состава. Делается это па специальных испытательных ма-
шинах (фиг. 4.1).
Фиг. 4. 1. Испытательная машина ИЛ1-4Р.
По своей конструкции машина ИМ.-4Р относится к типу испыта-
тельных машин, имеющих механический привод и рычажно-маят-
никовый силоизмеритс.тьный механизм. /Машина имеет самопишу-
щие диаграммные Приборы, на которых при производимых на ней
испытаниях автоматически вычерчиваются в крупном масштабе
кривые нагрузка—деформация 1.
1 Подробнее о конструкции и работе испытательных машин см. [83. стр. 49—
При работе е машиной ИМ-4Р пользуются специальным приспособлением —
реверсором. При работе с машиной ИМ-4Л необходимость в реверсоре отпадзет.
5Ь
Испытуемый образец спрессованного состава (обычно шашку
диаметром 20 лгм ц высотой 30 льи) помещают между двумя неболь-
шими стальными пластинами и, медленно и с постоянной скоростью
сближая эти пластины между eooofi, находят усилие, которое не-
обходимо для разрушения шашки.
Испытательные машины дают возможность точно определить
усилие разрушения шашки, обесценивают постоянство условий
испытания и прежде всего постоянство скорости нарастания на-
грузки, а также позволяют записывать кривую, отражающую
собой характер деформации шашки при увеличении нагрузки.
Предел прочности при сжатии испытуемого образна <т вычис-
ляется по формуле
з— ыгш.м-,
5
где Рдшх—усилие в кГ, необходимое для полного разрушения
звездки;
S — площадь поперечного сечения образца (звездки) в см2.
§ 3. ФАКТОРЫ, ВЛИЯЮЩИЕ НА ПРОЧНОСТЬ СПРЕССОВАННЫХ
СОСТАВОВ
Прочность спрессованного изделия зависит:
1) от свойств основной смеси окислитель-горючее;
2) от свойств цементатора и количества его в составе;
3) от степени измельчения компонентов и технологии изготов-
ления состава (порядок смешения компонентов, продолжитель-
ность смешения, тип смесительного аппарата и др.);
4) от способа введения цементатара в состав: в сухом виде,
в виде раствора (лака);
5) от концентрации раствора цеменгатора и т. п,;
6) от удельного давления прессования и времени выдержки при
прессовании;
7) от высоты одновременно прессуемого столба, площади прес-
сования и их соотношения между собой.
Несомненно, большое влияние на прочность спрессованного
изделия оказывают кристаллическая система и твердость кристал-
лов прессуемых компонентов. Составы, состоящие из компонентов,
обладающих большей твердостью, плохо поддаются прессованию
и дают при Прочих равных условиях изделия, обладающие меньшей
прочностью.
Прочность изделия повышается с повышением давления прес-
сования1 (см. табл. 4.1), но предел прочности изделия о при сжа-
тии обычно не превышает 20—25% от удельного давления прессо-
вания.
1 Это увеличение происходит до определенного предела. Для некоторых со-
ставов (содержащих алюминиевую пудру) наблюдалось явление «нерепрессо-
взния», т. е, уменьшение прочности при вь,соком давлении прессовании.
57
Таблица 4.1
Зависимость прочности изделия от давления прессования
(испытывались шашки диаметром 20 мм и такой же высоты)
Рецепт состава % Удель ное давление прессования к Г/см2 Предел прочности при сжатии
□ к Г 1см2 R % ОТ давления прессования
В a (NO3)2 80 1000 80 8,0
AJ (пудра) 20 2000 ]76 8,8
3000 288 9,6
Ba (NO3)2 55 1000 216 21,6
Al (пудра) 45 2000 384 19,2
3000 633 21,1
Высота одновременно прессуемого сто;:ба состава не должна
при одностороннем прессовании превышать диаметр прессуемого
изделия более чем в 1,5—2 раза. В противном случае передача
давления от слоя к слою уже не осуществляется в требуемой мере
и нижняя часть прессуемого столба остается недостаточно уплот-
ненной. При двустороннем прессовании это соотношение может
быть значительно увеличено.
Давление рп внутри состава па расстоянии h от пуансона мож-
но вычислить по формуле [84]
рп = р-с- А Л
где р—давление у пуансона;
е — основание натуральных логарифмов;
А — константа пропорциональности, изменяющаяся приблизи-
тельно обратно пропорционально диаметру прессуемого
изделия (определяется путем эксперимента).
В некоторых случаях дбетаточную прочность спрессованного
изделия удается получить и без добавления в состав специальных
связующих веществ — цемептаторов. Но обычно для получения до-
статочно прочных изделий приходится прибегать к введению цемен-
таторов.
Цемснтаторы увеличивают также и пластичность составов;
плотность и прочность составов, содержащих в себе цементатор.
при снижении удельного давления прессования уменьшаются в зна-
чительно меньшей мере по сравнению с составами, не содержа-
щими цементатора.
58
§ 4. КЛАССИФИКАЦИЯ ЦЕМЕНТАТОРОВ.
ИХ ФИЗИКО-ХИМИЧЕСКИЕ СВОЙСТВА 1
При изготовлении пиротехнических составов чаще других
используют цемептаторы:
1) искусственные смолы — идитол, бакелит и др.;
2) смолы естественного происхождения и продукты их перера-
ботки: канифоль, резинаты, шеллак;
3) высыхающие масла — олифа;
4) клей — декстрин.
Кроме того, возможно применение в качестве цемептаторов
различных асфальтов и битумов. В некоторых случаях применяют
растворы нитроклетчатки и каучука в соответствующих раствори-
телях.
Для нитроклетчатки растворителем может служить спирто-
эфирная смесь, ацетон, для каучука--бензол, бензин и др.
Характерными свойствами смол являются;
1) нерастворимость в воде;
2) растворимость в органических растворителях;
3) способность к образованию пленки при высыхании раствора
смолы;
4) липкость раствора;
5) полная сопротивляемость гниению (отличие от клеящих ве-
ществ животного происхождения).
Идитол представляет собой искусственную смолу (типа «пово-
лак»), получаемую путем конденсации избытка фенола с формаль-
дегидом в присутствии кислого катализатора (например, НС1).
Реакция конденсации в своей начальной стадии протекает
в следующем направлении;
СН2О + 2СД15ОН=СН2 (СвН4ОН)2 + Н2О.
Исходный продукт конденсации диоксидифелилметаи, полимери-
зуясь, переходит при нагревании в смолу.
В пиротехнике при расчетах для идитола употребляют услов-
ную формулу C|3Hi2O2.
Теплота образования технического образца идитола, вычислен-
ная на основании теплоты его горения, составляет 0,74 ккал/г,
плотность—1,25—1,30. Идитол хорошо растворяется в этиловом
спирте.
Новолачные смолы хорошо растворимы в алкоголях, практиче-
ски не растворимы в углеводородах и минеральных маслах.
Они стойки по отношению к воде, кислотам, аммиаку и слабым
растворам щелочи. Крепкий раствор щелочи разлагает их.
Технические образцы идитола всегда содержат большие или
меньшие количества свободного фенола, чем объясняется их крас-
новатая окраска.
1 Свойства связующих, используемых при изготовлении ракетных составов,
лаются в гл. XX.
69
Технические требования, предъявляемые к идитолу, сводятся
в основном к нормированию температуры его размягчения (для
разных сортов не ниже 90—973С), установлению пределов содер-
жания в нем фенола (для разных сортов от 0,1 до 3,0%) и испыта-
нию на отсутствие в нем примесей канифоли.
Бакелит — искусственная смола, получаемая путем конденса-
ции фенола с избытком формальдегида в присутствии щелочного
катализатора (например, аммиака).
Реакция в случае образования бакелита протекает по схеме
CII2O + C6HsOH^CsH4(OH)CH2OH.
Далее реакция конденсации протекает при нагревании с образо-
ванием бакелита А:
2CsH4(OH)CIl2Ol-l^(C6H4CH2OH)2O4-H2O.
Бакелит А С^Н^Оз имеет температуру размягчения 75—100° С,
хорошо растворим в этиловом спирте.
Нагревание его до более высокой температуры приводит к обра-
зованию бакелита В, которому иногда придают условную формулу
CjsHggO-.
При дальнейшем нагревании бакелита В при его полимериза-
ции образуется бакелит С.
Бакелит С представляет собой неплавкое (по размягчающееся
при нагревании) вещество, нс растворимое в большинстве обычных
органических растворителей. Он очень устойчив к химическим воз-
действиям и обладает большой механической прочностью.
Бакелит А образуется обычно при температуре, не превышаю-
щей 100° С. Переход же бакелита из формы А через форму В
в форму С осуществляется уже при более высокой температуре:
120 —150°С или даже выше (до 1803 С).
В пиротехнические составы бакелит А обычно вводится в виде
порошка или в виде спиртового лака; переход бакелита в форму С
(бакелизация) осуществляется нагреванием спрессованного соста-
ва 1 до температуры около 15СГС; плотность бакелитов 1,20—1,29.
При расчетах удобнее всего пользоваться условной формулой
СыНцОг (практически почти совпадающей по элементарному со-
ставу с формулой C«H3SO7).
Применяется бакелит в качестве цементатора в тех составах
и тех изделиях, от которых требуется особая механическая проч-
ность.
Шеллак — естественная смола, выделяется из деревьев, рас-
тущих в Южной Азии. Эмпирическая формула его С16Н24О3; плот-
ность 1,05—1,20. Шеллак хорошо растворим в этиловом спирте,
почти не растворим в бензине; он импортируется и в пиротехниче-
ских составах может быть заменен отечественными цементаторами.
Канифоль получают из смол хвойных деревьев. Главной со-
ставной частью канифоли являются ненасыщенные циклические
1 Имеются в виду термитно-зажигательные составы.
60
абиетиновые и пимароные кислоты. Абиетиновая кислота имеет
формулу С2оН3002.
Плотность канифоли температура размягчения должна
быть не ниже 65ЭС. Канифоль растворима в этиловом спирте,
эфире, бензоле и его гомологах, частично в бензине; при нагрева-
нии растворяется в олифе.
Резинатами называются продукты взаимодействия канифо-
ли с гидратами окисей или солями соответствующих металлов. Ре-
зинат кальция получается сплавлением канифоли с гашеной из-
вестью при температуре 230—240: С. Однако зга реакция не
протекает до конца; это видно из того, что резинат кальция характе-
ризуется определенным кислотным числом (не более 80), правда
значительно меньшим, чем для канифоли (160—180). Температура
размягчения резината кальция 120—150’ С. Состав резината каль-
ция с известным приближением может быть выражен формулой
(С|9Н29СОО)2Са.
В качестве растворителей Для резината кальция применяются
бензин или спирто-бензиновая смесь (в соотношении 1:1).
Из резинатов других- металлов возможно применение резината
стронция, имеющего некоторые преимущества в тех составах, в ко-
торых необходимо получить красную окраску пламени.
Эллерн {9] указывает на возможность использования в пиротех-
нических составах следующих мономеров, которые после полимери-
зации становятся связующими: метилметакрилата, винцлиденхло-
рида, стирола, акрилонитрила, винилацетата. В его работе даются
также значения теплот полимеризации, которые при расчете
на модь мономера равны соответственно 13,0; 14,4; 16,1; 17,3;
21,3 ккал, что отвечает 130—325 малым калориям на грамм веще-
ства.
Сведения о свойствах искусственных смол и органических поли-
меров можно найти в книгах Лосева и Петрова [87], Петрова и Ле-
вина [89], Лосева и Тростяиской [88], Лазарева и Сорокина [86],
в сборнике «Новые материалы в технике» [90], а также в литерату-
ре, указанной во втором издании нашей книги [7, стр. 53],
Из органических цементаторов, не относящихся к классу смол,
следует отметить еще олифу и декстрин.
Олифа натуральная (ГОСТ 7931—56) представляет собой
продукт полимеризации п частичной оксидации льняного или коно-
пляного масла. Это — вязкая жидкость светло-желтого или светло-
коричневого цвета. Плотность (у“) в пределах (для разных сор-
тов) 0,930—0,938, вязкость по вискозиметру БУ при 20° С в преде-
лах 12—16° С, Получают олифу продуванием воздуха через
нагретое до 160’С льняное (конопляное) масло. Для ускорения
высыхания олифы в нее добавляют сиккативы или «сушители» —
вещества, ускоряющие процесс высыхания. В качестве сиккативов
обычно употребляют резинаты или линолеаты марганца, свинца
или кобальта. В пиротехнике используют лучшие сорта олифы без
6!
сиккативов; иногда в качестве цементатора применяют раствор
канифоли в олифе; о свойствах олифы см. [85].
Д е к с т р и п — растительный клей, получается при нагревании
крахмала с разбавленными кислотами. Формула декстрина
(СбНюОз)^. Плотность 1,04. Декстрин легко растворяется в холод-
ной и горячей воде.
В табл. 4.2 сопоставлены некоторые физико-химические свойст-
ва органических горючих как цементаторов, так и веществ, не об-
ладающих цементирующими свойствами.
Таблица 4.2
Физико-химические свойства органических горючих веществ
гэ
Название и формула ; вещества ; i Плотность Г!с.м< Условный моле- кулярный все Количество веще- ства в г, сгораю- щее за счет 1 г кислорода Элементарный состав в %
до СО и Н2О до СО2 и Н2О С Н о
1 2 3 4 5
Идитол Ci3H12O2 1,3 200 0,74 0,42 79 6 15
Бакелит СДНцО^ 1,3 187 0.75 0,42 78 5 17
Шеллак СЩН24О5 1,1 269 0,80 0,47 65 8 27
Канифоль С20Н30О2 1,1 302 0,57 0,36 79 Ю 11
Резинат кальция 1,2 643 0,61 0,38 75 9 10
(С20Н29О2)2Са
Олифа С16Н2еО2 0,93 250 0,58 0,36 77 10 13
Крахмал (С6Н10О5Д 1,6 162 1,69 0,85 45 6 49
Молочный сахар 1,5 -360 1,88 0.94 40 7 53
С12Н24О12
Парафин C26Hj4 0,91 366 0,43 0,29 86 14 0
С.тсарин CiSH33O2 0,94 284 0.52 0,34 76 13 11
Нафталин СзнНв 1,14 128 0,57 0,33 94 6 0
Дициандиамид 1,40 84 1,31 0,88 29 4 0
Уротропин С6НТ2К4 — 140 0.73 0,48 51 9 0
Уголь древесный С3Н2О 1,5—1,7 90 0,94 0,48 81 2 17
Углерод (графит) : 2,2 12 0,75 0,38 100 —
Сол |1, о к р а и г и в а ю щ н е и л а м я
Оксалат натрияNa2C2O4 2,3 ’ 134 — 8,37 18 — 48
Оксалат стронция SrC2O4 — 176 — 10,98 14 — 36
62
Для упрощения расчетов в табл. 4.2 условные эмпирические
формулы даны и для высокомолекулярных соединений; формулы
эти получены на основании элементарного анализа соответствую-
щих веществ и имеют только рабочее значение.
Данные графы 4 используются при проведении расчетов содер-
жания компонентов в двойных смесях (см. гл. V). Элементарный
состав органических горючих и, в частности, содержание в них
кислорода играет большую роль при подборе горючего в пламен-
ных составах.
Из неорганических цементирующих веществ в пиротехнике
иногда применяют элементарную серу. При холодном прессовании
введение ее в состав мало отражается на его прочности. Однако
в случае горячего прессования при температуре, близкой к темпе-
ратуре плавления серы, наличие ее способствует увеличению проч-
ности состава.
§ 5. КОЛИЧЕСТВО ВВОДИМОГО В СОСТАВ ЦЕМЕНТАТОРА
Цементатор целесообразно вводить в пиротехнический состав
в количестве не более 10—12% (это не относится к ракетным со-
ставам).
Следует помнить, что все цементаторы органического происхож-
дения выполняют в составе одновременно и роль горючего, а сле-
довательно, требуют для своего сгорания и соответствующего рас-
хода окислителя.
При введении цементатора, особенно канифоли и резината
кальция, сильно замедляется процесс горения составов. Поэтому
для получения состава с необходимой скоростью горения в основ-
ную смесь окислитель — металл практически вводят иногда более
10—12% цементатора.
В табл. 4.3 показана зависимость прочности спрессованного со-
става от количества введенного цементатора при давлении прессо-
вания 3000 кПсм2.
Таблица 4.3
Влияние количества цементатора на прочность состава
(испытывались шашки диаметром 20 мм и такой же высоты)
Рецепты составов в % Предел прочности при сжатии а в кг[ем2
Ba (NO3)2 алюминиевая пудра идитол
80 20 0 288
78 20 2 408
76 20 4 460
74 20 6 530
72 20 8 562
63
При увеличении содержания цементатора в составе более 10—
12% прочность изделия повышается незначительно.
Наибольшее влияние на увеличение прочности состава органи-
ческие цементаторы оказывают в том случае, когда они вводятся
в составы в виде раствора в соответствующем растворителе (в виде
лака).
Глава V
ПРИНЦИПЫ СОСТАВЛЕНИЯ И РАСЧЕТА
ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
После выбора компонентов необходимо решить, в каких весовых
соотношениях они должны находиться в составе.
Основные положения для расчета двойных и многокомпонент-
ных смесей были даны во второй половине XIX столетия русским
пиротехником П. С, Цытовичем [92],
При расчете он исходил из положения, что все содержащееся
и двойных смесях горючее сгорает за счет кислорода окислителя;
возможность участия кислорода воздуха в процессе горения соста-
ва не учитывалась.
Тройные и многокомпонентные смеси рассматривались Цытови-
чем, как состоящие из двух иди большего числа двойных смесей.
Соотношение между двойными смесями, образующими многоком-
понентный состав, устанавливалось путем испытания многих ва-
риантов, из которых выбирали состав, дающий лучший пиротехни-
ческий эффект.
§ I. РАСЧЕТ ДВОЙНЫХ СМЕСЕЙ
Для получения рецепта двойной смеси требуется написать урав-
нение реакции горения и на основании его произвести расчет
весовых соотношений между окислителем и горючим.
Пример 1. Реакция горения двойной смеси, содержащей перхлорат калия
к магний, может быть выражена уравнением
KC10t+4Mg=KCl+4Mg0, (5.1)
На 139 а перхлората калия должно приходиться 24,3X4=97,2 г (округление
97 г) магния, Сложив г голу1 генные величины: 139 г -г 97 г = 236 г, получаем общее
количество состава в граммах. Отсюда нетрудно найти, что в 100 г состава будет
содержаться
глг-irx 139-100 -о „ ,, 97-100 „ .
КС1О4 -------= о8,9 г; Mg -----=41 I г.
4 23Б ь 236
Округляя полученные цифры, получаем рецепт состава:
59% КС1О4, 41% Mg.
Но далеко не всегда даже в Случае двойных смесей можно на-
писать состав конечных продуктов реакции с полной уверенностью
в том, что написанное будет соответствовать действительности.
64
Это можно сделать только в том случае, когда имеются данные
химического анализа продуктов горения; не имея их, можно гово-
рить только о вероятном уравнении реакции горения.
В связи с этим следует говорить о наиболее вероятных в дан-
ном конкретном случае уравнениях распада окислителя и наиболее
вероятных продуктах окисления горючего.
В табл. 2.1 приведены наиболее вероятные уравнения распада
окислителей, а в табл. 3.3 — продукты окисления неорганических
горючих. Пользуясь ими, во многих случаях можно написать ве-
роятное уравнение реакции горения двойной смеси и найти рецепт
состава.
Пример 2. Составить уравнение реакции горения и найти рецепт двойной
смеси, состоящей из нитрата бария и магния.
В табл. 2. 1 находим уравнение распада окислителя
Ba(NO3)2-BaO+N2+2r5Os, (5.2)
а в табл. 3.3 указание, что продуктом окисления мания является MgO.
Используя кислород, выделяющийся при распаде окислителя, на окисление
магния, получаем уравнение реакции
Ba(NO3h+5Mg=BaO+N2+5Mg0 (5.3)
ii определяем рецепт состава:
нитрат бария.............бй^.'о
магний...................3Wa
Этот состав может быть использован в качестве фотосмеси.
Известно, что при недостатке кислорода магний может реаги-
ровать н с азотом, и потому может быть написано другое уравне-
ние реакции горения (без участия кислорода воздуха):
Ba(NO3)2+8Mg=BaO +5MgO + Mg3N2. (5. 4)
Отсюда получаем рецепт состава:
цитрат бария . ...................... 57 %
магний..................................... 43%
Производя расчеты и составляя предполагаемые уравнения
реакции горения, следует руководствоваться термохимическими
соображениями. Так, например, в данном случае следует учесть,
что при соединении магния с азотом тепла выделяется примерно
в 3 раза меньше, чем при соединении магния с кислородом, и по-
этому направить реакцию в сторону образования нитридов
не всегда представляется выгодным1.
Еще П. С. Цытовичем было указано, что при составлении урав-
нений горения составов, содержащих уголь или органические горю-
чие, можно вести расчет 1) па полное окисление горючего с обра-
зованием углекислого газа и воды или 2) при уменьшенном содер-
жании окислителя рассчитывать на образование окиси углерода
и воды.
1 Значительный выигрыш в количестве тепла получится только тогда, когда
образующийся Mg3N2 сможет в пламени окислиться кислородом воздуха
До MgO..
о
А. А. Шцмовский
65
Пример 3, Составить уравнение реакции горения смесей нитрата калия с иди-
те лом.
Принимая для идитола упрощенную формулу CijHijO;, получаем два урав-
нения:
12KNO3 + С]зН|2^2 — 6КоО -J- t>N3 + 13СО2 -ф- 6Н3О, (5. 5)
34KNO3 + 5С13Н13Ог = 17К2О 4- 17N, -р 65СО + 30112О (5. б)
Рецепт по (5. 5) Рецепт по (5. 6)
Нитрат калия ........ 86°,'о. Нитрат калия................77п/о,
Идитол . , 14%, Идитол........................................23%
Уравнения (5.5) и (5,6) только в известной мере соответствуют
действительности; известно, что при горении смесей нитрата калия
с органическими горючими образуются и некоторые количества
нитрита и перекиси калия, а при соединении окиси калия с угле-
кислым газом образуется карбонат калия.
Подбор коэффициентов при расчете смесей (особенно с орга-
ническими горючими) требует много времени. В связи с этим
А. Н. Демидовым [91] было предложено пользоваться таблицами,
в которых указано, сколько граммов окислителя потребуется для
выделения 1 г кислорода и какое количество горючего может быть
окислено I г кислорода.
Эти таблицы составлялись следующим образом.
Известно, что в условиях горения составов перхлорат калия
разлагается по уравнению
КСЮ4=КС1+2О2. (5.7)
Отсюда следует, что для получения 1 г кислорода необходимо
затратить
139:64=2,17 г КСЮ4.
Окисление алюминия протекает по уравнению
2А1 +1 ,оО2== А13О3.
Следовательно, I г кислорода может быть окислено 54:48 =
= 1,12 г алюминия.
Такие данные для окислителей и горючих помещены в табл-
2.1, 3.3 и 4.2.
Пример 4. Найти рецепт состава, содержащего перхлорат калия в идитол,
если должно быть обеспечено сгорание идитола в углекислый газ и воду.
Для перхлората калия в табл. 2,1 находим число 2,17, а для идитола в гра-
фе 4 табл. 4,2 — число 0,42. Эти числа выражают весовые количества компонен-
тов, входящих в смесь (в г):
КС1О4 ........................2,17
идитол _ ....................0,42
Всего смеси...................2,59
или в процентах
КС1О4........................83.8%
идитол.......................16,2%
66
§ 2. СОСТАВЛЕНИЕ И РАСЧЕТ ТРОЙНЫХ
И МНОГОКОМПОНЕНТНЫХ СМЕСЕЙ
Во многих случаях тройные смеси можно рассматривать как
состоящие из двух двойных смесей, содержащих в себе один и тот
же окислитель.
Но иногда наличие в составе двух разных горючих резко изме-
няет направление реакции и тогда такой подход оказывается не-
приемлемым. Так, например, в случае состава нитрат бария — алю-
миний-сера происходит взаимодействие между алюминием и се-
рой с образованием сульфида алюминия AI2S3, который затем мо-
жет сгорать в Д12О3 и SO2.
В числе продуктов горения такого состава могут быть ВаО,
А12О3, Ва(А1О2)2, BaS, BaSCU A12S3, SO2, N2 и др.
Состав продуктов горения зависит не только от соотношения
компонентов в составе, но и от условий горения состава: от давле-
ния окружающей среды, от начальной температуры, от плотности
состава, от диаметра факела и к п.
При ориентировочных расчетах для тройных составов, содержа-
щих в себе окислитель, металлическое горючее и органическое го-
рючее (цементатор), может быть использован следующий прием.
Пример 5. Найти рецепт тройной смеси нитрат бария — магний-- идитол
при условии полного сгорания идитола в углекислый газ и воду.
Составляя уравнения реакции или используя таблицы А. Н. Демидова, нахо-
дим содержание компонентов в двух двойных смесях:
Нитрат бария............68% Нитрат бария.............................88%
Магний ,................32% Идитол...................................12%
Считая, что содержание 4% идитола в составе обеспечит достаточную меха-
ническую прочность осветительной звездки, выбираем соотношение двойных сме-
сей равным 2:1.
Исходя из этого условия, осуществляем расчет, который сводится к ариф-
метическим вычислениям и не требует пояснений:
„ й 68-2 88-1
Нитрат барня —— -т— 75%.
* J
32-2
Магний -~21%.
О
„ 12д ,
Иднтол — 4%.
Очевидно, выбранное наудачу соотношение между двумя двой-
ными смесями не является оптимальным, а полученный рецепт
является ориентировочным и подлежит экспериментальному уточ-
нению с учетом тех специальных требований, которые предъявляют-
ся к осветительным составам.
В некоторых составах сигнальных огней соль, окрашивающая
пламя (при формальном подходе без учета промежуточных продук-
тов горения), не принимает участия в процессе горения состава.
5*
67
Пример 6. [[анти рецепт состава красного oi hsr, содержащего в себе хлорат
калия, карбонат стронция и идитол. реакция горения этого состава может быть
приближенно выражена уравнением
]0КС[О3+ п SrCO3 + C|3HI2O2 = 10КС[ + п SrO + (13 -j- п) СО2 -f- 6Н2О (5.8).
Практика показывает, что для получения пламени хорошего красного цвета
достаточно взять 20—25% карбоната стронция, а остающиеся 80—75% распреде-
лить между хлоратом калия и идитолом ria основании написанного выше урав-
нения реакции.
При наличии в составе 25% карбоната стронция получаем рецепт:
Хлорат калия ..............64,4%
Карбонат стронция.........25%
Идитол ....................10,6%
§ 3. РАСЧЕТ СОСТАВОВ С ОТРИЦАТЕЛЬНЫМ КИСЛОРОДНЫМ
БАЛАНСОМ
Во многих случаях специальный эффект пиротехнических соста-
вов не снижается, а наоборот, повышается, если в процессе сгора-
ния горючего принимает участие не только кислород окислителя,
но и кислород воздуха.
Это происходит потому, что для очень многих видов составов
(осветительных, зажигательных и др.) специальный эффект повы-
шается с увеличением теплоты горения состава. Теплота горения
состава при прочих равных условиях будет тем больше, чем больше
в нем будет содержаться полностью сгорающего (хотя бы частич-
но и за счет кислорода воздуха) горючего.
Хороший специальный эффект от пиротехнических составов, со-
держащих в себе избыток горючего, получается обычно в тех слу-
чаях, когда горючее представляет собой легко окисляющееся ве-
щество, способное частично Сгорать за счет кислорода воздуха.
Наиболее типичным примером горючего, Сг.орацие которого
в составе может происходить частично и за счет кислорода возду-
ха, является магний. Во многих случаях рационально построение
на основе магния даже таких составов, где лишь половина его
окисляется за счет кислорода окислителя, а другая сгорает уже
за счет кислорода воздуха.
Наоборот, составы, заключающие в себе трудноокисляемос
горючее (грубодисперсные частицы алюминия или кремния),долж-
ны содержать достаточное для его полного сгорания количество
окислителя, так как в этом случае горючие уже не смогут сгореть
за счет кислорода воздуха.
Количество горючего, которое может сгореть за счет кислорода
воздуха, определяется опытным путем.
Пиротехнические составы, содержащие в себе избыток окисли-
теля сверх того, что необходимо для полного окисления горючего,
называют составами с положительным кислородным балансом; из-
быток окислителя, не участвующего активно в процессе горения
состава, является во всех случаях безусловно вредным. Составы
68
с положительным кислородным балансом в пиротехнике практи-
чески не применяются 1.
Составы, содержащие в себе только такое количество окисли-
теля, какое необходимо для полного сгорания всего содержащегося
в составе горючего (или горючих), называют составами с нулевым
кислородным балансом.
Составы, содержащие в себе окислитель в количестве, недоста-
точном для того, чтобы обеспечить поднос сгорание горючего, на-
зывают составами с отрицательным кислородным балансом.
Большинство применяемых в настоящее время пиротехнических
составов является составами с отрицательным кислородным балан-
сом. Эффективность действия таких составов в очень большой мере
зависит от того, в какой степени кислород воздуха может практи-
чески принять участие в процессе горения.
Под термином «кислородный бадане (п) состава» понимают
то количество кислорода в граммах, добавление которого необхо-
димо для полного окисления всех горючих элементов в 100 г со-
става.
Отношение количества окислителя, которое содержится в соста-
ве, к количеству окислителя, необходимого для полного сгорания
всего содержащегося в составе горючего, называют коэффициен-
том обеспеченности состава окислителем (А).
Кислородный баланс, при наличии которого в составе получает-
ся наилучший специальный эффект, называют оптимальным кисло-
родным балансом.
При расчете Двойных смсссн магния или алюминия с нитратами щелочных
или щелочно-земельных металлов используются понятия «активный» и «полный»
кислородный баланс.
Под термином «активный» кислородный баланс здесь понимается отдача
окислителем в процессе горения состава только непрочно связанного, так пазы-
ваемого «активного» кислорода, например:
Sr (NO3); -f- 5Mg = SrO + N2 +5MgO, (5.9)
В случае «полного» кислородного баланса в расчет принимается весь кис-
лород, содержащейся в окислителе, и уравнение составляется, исходя из пред-
положения, что по крайней мере в зоне пламени получается в свободном виде
металл, содержащийся в окислителе.
Приводимое ниже уравнение реакции составлено, исходя из «полного» кис-
лородного баланса:
Sr (NO3)2 + б,Mg = Sr + N3 -у 6:MgO. (5.10)
Составы с «полным» кислородным балансом явлнются, конечно, составами
С отрицательным кислородным балансом.
Ниже приводится пример расчета составов с отрицательным
кислородным балансом.
При расчете в качестве задания указывается требуемый кисло-
родный баланс (в граммах).
1 Исключением являются составы для «кислородных свечей» — см. [294]
и в гл. XXI [, стр. 296.
69
Пример 7. Рассчитать двойную смесь хлората калия — магний при условии,
что ее кислородный баланс п=— 20 г О2.
В табл, 2. 1 и 3.3 находим для хлората калия и магния соответственно чнс-
ла 2,55 в 1,52,
Вычисляем, что 20 г кислорода окисля|От 20X1.52=30,4 г магния.
Остающиеся 69,6 г состава должны быть рассчитаны обычнь;м путем на пу-
левой кислородный баланс.
Содержание хлората калии в составе получается равным
2,55-69-6
2,55 -f- 1,52
= 43,6%,
а магния в составе будет 100—43,6—56,4%,
За счет кислорода окислителя будет сгорать 56,4—30,4=26,0% магния.
Коэффициент обеспеченности состава окислителем будет в данном случае
ранен £ = 26,0:56,4 = 0,46.
Подобный расчет может быть аналогичным образом осущест-
влен и для многокомпонентных смесей.
Во многих случаях необходимо определять расчетным путем
рациональность уже имеющегося (разработанного) рецепта соста-
ва, В частности, вычисление кислородного баланса п и коэффи-
циента к дает возможность судить о степени необходимости
соприкосновения состава в момент его горения с кислородом воз-
духа; вычисление этих величин дает возможность выяснить причи-
ны искрения состава и т, п.
Порядок вычисления п и k показан в следующем примере.
Пример 8. Рассчитать п и k дли состава желтого огня, имеющего рецепт
(в процентах):
Хлорат калия ............................... 60
Оксалат натрия ..............................25
Шеллак.......................................[5
Из табл. 4.2 и 2.1 находим, что для сгорания в углекислый газ и воду
0,47 г шеллака или 8,37 г оксалата натрия необходимо 2,55 г хлората калия. Сле-
2,55-15 „ „
довательно, для сгорания 15 а шеллака требуется: хлората калия ---------=81,5 г,
0 47
„ 2,55-25
;г для сгорания 25 г оксалата натрия хлората калия ------------= i ,6 г,
8,37
Отсюда коэффициент обеспеченности состава окислителем для данного
.с става
60
£ “ -— — -у- 0,о; ,
81,54-7,6
Н:зчсп1ге кислородного баланса п для данного состава получим равным
60-(81.5 + 7.6)
л -----------------— = — 11,4г О2-
2,55
§ 4. РАСЧЕТ МЕТАЛЛОХЛОРИДНЫХ СОСТАВОВ
В металлохлоридных составах роль окислителя выполняет хлор-
органическое соединение, роль горючего — порошок активного ме-
талла.
70
Окислитель в составах этого типа должен быть взят в таком
количестве, чтобы содержащегося в нем хлора хватило бы на пол-
ное окисление металла.
Так, например, на каждый г-атом цинка необходимо взять окис-
лителя столько, чтобы в нем содержалось 2 г-атома хлора.
Исходя из этого, уравнение реакции между гексахлорэтапом
и цинком должно быть написано следующим образом;
C2Cl6-f-3Zn = 2C -f-3ZnCl2.
(5.11)
Для упрощения расчетов может быть использована табл. 5.1,
в которой указывается, какое количество окислителя отдает при
распаде I г хлора и количество металла, соединяющегося с 1 г
хлора.
Таблица 5. I
Хлорорганнческое соединение (окислитель) Молеку- лярный вес Количество вещества, отдающее 1 2 хлора Горючее- металл Атомный вес Количество металла, соединяю- щееся с 1 г хлора
Четыреххлористый углерод ССЦ 154 1,08 Цинк 65,4 0.92
Гексахлорэтан С3С1е 237 1,П Алюминий 27,0 0,27
Г ексахлорбензол CfiClg Г ексахлорцнклогек- сан (гексахлоран) С6Н6С[6 285 1,34 Магний 24,3 0,34
291 1,37 Цирконий 91,2 0,64
Поливинилхлорид (С2НаС1)п 60,5 1,76 Железо 55,8 0,53 (образуется ГеСЦ)
Железо 55,8 0.79 (образуется FeCl2)
Пример 9. Рассчитать процентное содержанке компонентов в двойной смеси
гексахлорэтан — алюминий, используя табл. 5. 1.
Гексахлорэтан............................................... 1,11 г
Алюминий................................................... 0,27 г
Всего смеси 1,38 г
или в процентах
1.11'100 „ ,
Гексахлорэтан........................................... — =^80,5?6
1,38
Алюминий .......................................... 100—80,5= 19,5%
Более сложным является расчет тройных смесей, содержащих
в себе хлорорганические соединения.
71
Пример 10. Рассчитать состав зеленого огня, содержащего нитрат бария —
гексахлорэтан — магний.
Практика показывает, что для получения пламени хорошей цветности со-
ставы зеленого и красного огнен с окислителями — нитратами должны содер-
жать в себе не менее 15% хлорорганических соединений. Отсюда вытекает по-
полнительное условие: состав должен содержать гексахлорэтана, углерод
которого должен быть как минимум окислен до СО.
Решение. Па соединение с 15% CjCle потребуется (свь табл. -5. 1)
15-0,34
— =4,6% магция,
15-24
Разлагаясь, гексахлорэтан образует ——— —1.5% углерода, который по
237
условию должен быть окислен до СО. Пользуясь табл. 2. I и 4. 2. находим в них
цифры 3,27 и 0,75 и вычисляем необходимое Для окисления углерода количество
цитрата бария:
0.75 — 3,27;
1,5 —л;
•V — 6,5% Ba (NO3)2.
Теперь нам известно, что в 100 а состава должно содержаться
15 г С2С16 -ф 4,6 г Mg б,Г> г Ba (N'O3)2. (5.12)
Узнаем, сколько граммов состава приходится на двойную смесь
В а (NO3) 2 + Mg.
z = 100 — 15 — 4.6 — 6,5 = 73,9 г.
Пользуясь табл. 2. 1 и 3.3, находим, что и 73,9 г смеси содержится
3,27-73 9
—-" = 48,7 г Ва(МО3)2 ц 25.2г Mg.
U “| 1
Подводя Итоги вычислениям, получаем рснепт:
Нитрат бария . ............................48.7-!-6,5=55,2%
Гексахлорэтан............................... 15%
Магний........................................... 25.2+4,6=29,8%
Твердыми продуктами горепия этого состава будут MgO, ВаО
и MgCi2; но в результате обратимой обменной реакции, протекаю-
щей в пламени BaO%MgCl2 — ВаС12 +MgO, образуется хлористый
барий, придающий зеленую окраску пламени.
При введении в эту смесь органического связующего — идитола,
получаем рецепт состава: Ba(NO3)2 59,5%, Mg 20,5%, C2Clg 15%
и идитол 5% (ср. также [7, стр. 62]).
§ 5. РАСЧЕТ СОСТАВОВ С ФТОРНЫМ БАЛАНСОМ
Этот тип расчета по своему принципу сходен с расчетом мегал-
лохлоридных составов.
Роль окислителя здесь выполняют соединения фтора (фториды
мало активных металлов или фтороорганические соединения),
роль горючего — порошки активного металла. Окислителя должно
72
быть взято столько, чтобы его хватило для полного окисления ме-
талла.
Для упрощения расчетов может быть использована табл. 5.2,
в которой указывается, какое количество окислителя отдает при
распаде 1 г фтора и количество металла, соединяющегося с 1 г
фтора.
Таблица 5.2
Окислитель- соединение фтора .Молеку- лярный вес Количество вещества, отдающее 1 г фтора Г орк.1, е е — металл Атомный вес Количество | металла^ i соединяю^ щееся !с I г фтора
CuF2 104 2,74 Be 0,0 0,24
AgF 127 6.68 Mg 24,3 : 0,64
PbF2 245 6,45 Al 27,0 1 0,47
(CaFOn 100 1,32 Zr 91,2 1,20
тефлон (мономера)
XeF4< 207 2,72
t Тетрафторкд ксенона- -недавно полученное твердое соеди| .ение, устой-
чивое при обычной температуре.
Пример 11. Рассчитать днощ.ею смесь тефлона с цирконием.
Решение. На соединение с 1,32 <? тефлона потребуется 1,20 г циркония.
Содержание тефлона в смеси будет равно 1.32:2,52 = 52,4%, а циркония 47.6%.
Горение составов, содержащих в себе избыток окислителя, мо-
жет сопровождаться в некоторых случаях выделением свободного
фтора. Наиболее вероятным образование свободного фтора будет
при использовании в качестве окислителей фторидов металлов
с переменной валентностью C0F3, MnF3, PbF$ и др., например:
6CoF3+2Mg=2MgF2 + 6CoFa + F2. (5.13)
Свойства соединений фтора описаны в монографиях Саймонса
[205] и Рысса [203]; см. также брошюру Кнунянца и Фокина [200]
и § 9 гл. XVII настоящей книги.
Глава VI
ТЕПЛОТА ГОРЕНИЯ ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
Количество тепла, выделяющееся при горении пиротехнических
составов, в значительной мере определяет их специальный эффект.
Теплота горения пиротехнических составов может быть определе-
на двумя путями:
73
I) вычислением с использованием закона Гесса,
2) экспериментально—сжиганием составов в калориметриче-
ской бомбе,
§ 1. ВЫЧИСЛЕНИЕ ТЕПЛОТЫ ГОРЕНИЯ
Расчеты проводят на основании закона Гесса, который форму-
лируется так: количество тепла, выделяющееся при химической
реакции, зависит только от начального и конечного состояния
системы, и не зависит от пути, по которому реакция протекает.
Для расчетов может быть использована другая формулировка
этого закона, а именно: «если система один раз переходит из со-
стояния I в состояние 3 непосредственно, а во второй раз—через
ряд промежуточных состояний, то теплота непосредственного пре-
вращения равна сумме теплот промежуточных реакций».
Иначе говоря:
Ql,3 = Ql,2 + Q2,3,
где Qii3 — количество теплоты, выделяемое или поглощаемое при
переходе системы из состояния I в состояние 3;
и <?2,з — количества теплоты, выделяемые или поглощае-
мые при соответствующих переходах системы из состояния I в со-
стояние 2 и из состояния 2 в состояние 3.
Из закона Гесса следует, что теплота образования из элементов
продуктов горения пиротехнического состава равна сумме теплот
образования компонентов состава, к которой следует добавить
количество тепла, выделяющегося при горении состава. Следова-
тельно, теплота реакции горения определяется как разность между
теплотой образования продуктов горения ц теплотой образования
компонентов состава:
Qa,3 = Q। з ~ Q\2
теплота горения теплота образования теплота образования
пиротехнического продуктов горения компонентов состава
состава
Горение пиротехнических составов протекает обычно со сравни-
тельно небольшой скоростью и большей частью в открытом про-
странстве; исходя из этого, можно считать, что горение происходит
при постоянном давлении. Так как в расчетных термохимических
таблицах обычно приводятся теплоты образования соединений при
постоянном давлении, то и по приведенной формуле вычисляется
теплота реакции Q2,3 при постоянном давлении Qp,
Этим расчет теплоты горения пиросоставов отличается от рас-
чета теплоты взрыва ВВ, при котором вычисляют теплоту реакции
при постоянном объеме Qv- Переход от Qp к Qy осуществляется
по формуле
Qv=Qp4-0,57 л,
где п — число молей газов,образующихся при реакции (ср. также
[7, стр, 64]).
74
При расчетах стандартные теплоты образования веществ
из элементов (—ДН^а) следует находить в справочниках Россини
[98], Брицке, Капустинского и др. [93], Карапетьянца [94], Глушко
(ред.) [233], монографии Кубашевского и Эванса [95]; Сводка теп-
лот образования многих веществ, заимствованная из работ Медара,
имеется в монографии Андреева и Беляева [III].
В табл. 6. 1 приведены значения теплот образования компо-
нентов пиротехнических составов и некоторых продуктов их го-
рения.
Данные о теплоте образования некоторых окислителей и про-
дуктов их распада приведены в табл. 2. I. а теплота образования
окнелов — в табл. 3.1 и 3.5 (см. гл. III).
В качестве примера вычисления приводим расчет теплоты го-
рения смеси:
3Ba(NO3)2+I0Af = 3BaO + 3N2-|-5AI2O3.
Теплота образования продуктов горения (взята из [98]).
5А1,О3 . . .400-5=2000
ЗВаО . . . 133-3 = 399___________
2399 ккал (Qi,3)
Теплота образования компонентов состава
ЗВа (NO3)3... 237 • 3 — 711 ккал (QI12).
Теплота реакции горения
С?2. з = 2399—711 = 1688 ккал.
Сумма по весу Ba(NO3)2 и алюминия
М = 261,4 • 3+27,0 • 10=1054.
Теплота горения состава в к.кал]г
1688 t СЛ1 ,
а = —— I 601 ккал г.
4 10,54 ’ 1
Такой метод расчета достаточно точен, но не дает наглядного
представления об энергетическом вкладе горючего и окислителя,
взятых в отдельности, в общий тепловой баланс состава. Анализ
этот можно провести, воспользовавшись несколько другими при-
емами расчета. Покажем это на примере смеси Ba(NO3)2 + Mg.
Стехиометрический расчет дает соотношение (стр. 67) компонен-
тов; Ba(NO3)2 68%, Mg 32%. Пользуясь табл. 3. I, находим, что
0,32 г магния при горении выделяют 0,32 -5,9=1,88 ккал.
Из табл. 2. I находим, что на разложение 261 г Ba(NO3)2 тре-
буется 104 ккал. Вычисляем, что на разложение 0,68 г Ba(NO3)s
75
Таблица 6.1
Теплота образовании (—Д/729е) компонентов пиротехнических составов
и некоторых продуктов их горения!
ое ди ir eiiije Теплота образо- вания в KKa.t ji- моль Соединение 1 Теплота образо- вания в к хал! г.- мо ль Соединение Теплота образо- вания в ккал;г- моль
NaF 136 , SrO2 154 Крахмал С6Н10О|5 227
Na3AlF6 758 Sr,N2 92 .Молочный сахар 651
Na2SrF6 Ц21-12ТО12
669 SrSO4 ,342 Этиловый спирт 57
NaHCO3 226 SrCL 198 жидкий С2НаО
Иа2СОй NajC^C^ 271 Вз СОд 1 ’ 285 Этиловый эфир жидкий 65
315 ; Ba3N2 90
Шеллак СщНмО.т 227
NaNO2 Na2SO4 88 , ZnCl2 99 Идитол 149
332 AIN 75 16
K2CO3 Тротил CfH5N3Oc
282 A1C1.} 167 ’
1 Гексаген — 31
K2SO4 342 AUS3 140 C3H6N6O6
Cu(OH)2 107 1 Pb (NO3)2 107 Уротропин —39
CuC O, 143 FeCl3 94
1 Г ексахлорэтан 54
CuCNS (-Ю) ' NH3r„ И С2С1а
CuCl 32 NH^Cl 75 1 Сероуглерод ' жидкий CS2 —21
CuCl2 53 HC[rl3 22
MgCO3 Пироксилин Н rj5'3
267 CCll ЖИДКИЙ 25 (13%N) C24IЦ9 (ONOj) j i Оа
MggN2
115 ,M ета и газ CH4 18
Коллодионный 4-639
MgS 84 Бензол жидкий -13 Х.1ОПОК
MgCI2 153 сан6 Нафталин С иДв -16 C^Hai (ONO2)aO[i
MgF2 264
SrCO3 290 Антрацен —32
С[Дю ]
SrC2O4 (288) 1
1 Цифровой материал дан с точностью, необходимой дли технических
расчетов; данные для шеллака и идитола вычислены на основании получен-
ных автором экспериментальных данных о теплоте горении этих веществ.
76
необходимо затратить 0,27 ккал. Сопоставляя данные, получаем
теплоту горения смеси
<1=1,88—0,27=1,61 ккал/г.
В данном случае на разложение окислителя затрачивается
0,27, 100: 1,88=14% от того количества тепла, которое выделяется
при горении магния, Используя тот же прием для вычисления теп-
лоты горения железо-алюминиевого термита- Fe3O4 75%, Al 25%,
находим, что тепловой баланс его равен #=1,82—0,86=0,96 ккал! г,
т. е. в данном случае на разложение окислителя расходуется уже
47% от теплоты, выделяющейся при горении алюминия.
В табл. 6.2 приведены данные о теплоте горения некоторых
пиротехнических составов; компоненты этих составов взяты в сте-
хиометрических соотношениях; теплота горения вычислена по зако-
ну Гесса.
Таблица 6.2
Теплота горения пиротехнических составов и твердого ракетного
топлива (ТРТ)
Рецепт состава в % Теплота горения в ккал {г Назначение состава
КС1О4—83, Be—17 3,19 На практике не применяется
КСЮ4—60, Mg=10 2,24 Фотосмссь
КС1О3—63, Mg—37 2,29 -
Ba(NO3)2_68, Mg—32 1,65 -
КС1О4—66, AI-34 2.45 Зажигательный
S’aNO3—60, Al—40 2.00 Осветительный (без цемецга- тора)
Fe2O3—75, Al—25 0.96 Термит
Ba(NO3)2—75, Mg—21, идитол—4 1.23 Осветительный
Ba(NO3)2—63, Al—27, сера—10 1,40 я
SrfNQ,,),—69, Mg—25, резинат каль- ция—6 1,48 Трассирующий
НГЦ—коллоидный порох 1,23 Ракетное топливо
Смесевой порох [228];
NH4CIO4—90, смола-10 1,26 То же
КН4С1О4—80, смола—20 1,01 я
Ва(С1О3)2-Н2О—88, идитол—12 0,99 Сигнальный, зеленого огня
КС1О3—57, SrCCb— 25, шеллак—18 0,61 Сигнальный, красного огня
CjCIb—81, Al—19 0,96 Дымовой маскирующий
С2С16-17, КС1О4-22, Zn-61 0,52 То же
77
Продолжение
Рецепт состава в % Теплота горения в ккал!г Назначение состава
КСЮ3—35, молочный сахар—25 краситель родамин—40 0,38 Дымовой, красного дыма1
KNO3—75, уголь—15, сера—10 0,66 Порох дымный
Mg—90, Al—10 6,10 Сплав .электрон" (горение за счет кислорода возду- ха)
I Практически при горении состава в известней мере происходит раз-
ложение красителя.
Если не считать веществ, сгорание которых подобно магниевому
сплаву «электрон» происходит за счет кислорода воздуха, то наи-
большую теплоту горения имеют составы фотосмесей, затем следу-
ют осветительные, трассирующие и ракетные составы; значительно
меньшее количество тепла выделяют при горении составы сигналь-
ных огней и, наконец, наименьшее количество тепла выделяется
при горении дымовых составов. Рецепты зажигательных составов
настолько многочисленны и входящие в состав компоненты на-
столько разнообразны, что теплота, получаемая при их горении,
изменяется в весьма широких пределах.
Составы с отрицательным кислородным балансом, если в про-
цессе их горения участвует кислород воздуха, дают большее коли-
чество тепла, чем составы из тех же компонентов, но взятых в сте-
хиометрических соотношениях.
В качестве примера можно привести состав, состоящий из 44%
КСЮз и 56% Mg с кислородным балансом « = —20 г О2; реакция
горения этого состава может быть представлена уравнением
KC103+6,5Mg+I,7502==KCl+6,5MgO.
Теплота горения этого состава равна
144 X 6,5 4-106 — 06
123 + 24,3 х 6,5
= 3,37 ккал/г.
По сравнению с приведенным в табл. 6.2 составом из тех же
компонентов, но взятых в стехиометрических соотношениях, полу-
чим увеличение теплоты горения на 47%.
§ 2. ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ ТЕПЛОТЫ
ГОРЕНИЯ
Для определения теплоты горения пиротехнических составов
экспериментальным путем сжигают определенную навеску соста-
ва в калориметрической бомбе, Количество выделившегося тепла
78
определяют как произведение теплоемкости системы (вода + ап-
паратура) на разность между конечной и начальной температурой
воды, в которую погружена бомба. Теплоемкость системы, называе-
мую иначе «водяным числом» калориметра, определяют специ-
альными опытами; в калориметрической бомбе сжигают вещества
с известной теплотой горения, например, бензойную кислоту.
Объем калориметрической бомбы составляет обычно 300—
400 сж3, вес воды в калориметрическом сосуде — около 3 кг (вода
взвешивается с точностью до I г).
Пиротехнический состав сжигают в большинстве случаев
в атмосфере воздуха, реже — в атмосфере азота или аргона. Сжи-
гать пиротехнический состав в атмосфере кислорода не имеет смыс-
ла, так как теплоту горения состава при полном окислении всех его
горючих элементов почти всегда можно вычислить достаточно точ-
но на основании закона Гесса.
Если требуется определить теплоту горения состава с отри-
цательным кислородным балансом при условии сжигания его на
воздухе, то стремятся обеспечить в калориметрической бомбе мак-
симальное количество воздуха, приходящееся на единицу веса
состава, для чего навеску состава уменьшают до предела, допуска-
емого точностью определения: ее берут обычно равной 0,5—1 г
с тем расчетом, однако, чтобы подъем температуры воды в кало-
риметрическом сосуде был не менее 0,3° С. Следует учесть, что
бомба объемом 300 см3, наполненная воздухом (р=1 ат), заключа-
ет в себе 0,1 г кислорода, которого хватит на окисление только
0,5 г состава, имеющего кислородный баланс п~—20 г О2.
В том, что кислород воздуха во многих случаях активно участ-
вует в процессе горения пиротехнических составов, имеющих отри-
цательный кислородный баланс, убедились на основании многих
экспериментальных данных.
В атмосфере азота сжигают только некоторые дымовые соста-
вы (кислород воздуха оказывал окисляющее действие, частич-
но или даже полностью сжигая дымообразующее вещество
и тем самым искажая результаты определения). По отношению
к составам, содержащим магний или алюминий, азот уже не яв-
ляется инертным газом, так как эти металлы реагируют с азотом,
образуя нитриды MgsNa или A1N.
Если необходимо полностью устранить влияние внешней среды
на процесс горения составов, содержащих магний или алюминий,
то сжигание целесообразно проводить в атмосфере инертного га-
за— например, аргона.
Для воспламенения многих пиротехнических составов вполне
достаточно прикосновения к ним ТОНКОЙ нихромовой проволочки,
нагреваемой докрасна электротоком. Если таким способом воспла-
менить состав не удается, то поверх сжигаемого основного состава
насыпают небольшое количество (сотые доли грамма) воспламени-
тельного состава, теплота горения которого должна быть опреде-
лена заранее. Введение воспламенительного состава снижает точ-
79
ность калориметрического определения ввиду возможности хими-
ческого взаимодействия между продуктами горения испытуемого
и воспламенительного составов. Поэтому воспламенительный
состав следует применять только в крайних случаях.
О методике проведения калориметрических опытов см. моногра-
фию Полова [97].
§ 3. СВЯЗЬ МЕЖДУ НАЗНАЧЕНИЕМ СОСТАВОВ
И ТЕПЛОТОЙ ИХ ГОРЕНИЯ
На основании расчетных данных, приведенных в табл. 62, а так-
же экспериментальных данных можно установить связь между
назначением составов и количеством тепла, выделяющегося при
их сгорании (табл. 6.3).
Таблица 6.3
Связь между назначением составов н теплотой их горения
Назначение составов Теплота горения ккал/г
Фотосмсси 17—3,0
Осветительные н трассирующие 1.5—2,0
Ракетные (ТРТ) без дожигания на воздухе:
а) коллоидные НГЦ—пороха 0,8-1,3
б) смесевые гороха (ориентировочные данные) 1,0-1,5 .
Зажигательные (с окислителем) 0,8—3,0
Ночные сигнальные 0,6-1,2
Маскирующих дымов 0.4—1,0
Цветных сигнальных дымов 0,3-0,6
Глава VII
ГАЗООБРАЗНЫЕ ПРОДУКТЫ ГОРЕНИЯ ПИРОТЕХНИЧЕСКИХ
СОСТАВОВ
Образование некоторого количества газообразных веществ при
реакции горения является характерным почти для всех видов пи-
ротехнических составов.
Из практически применяемых составов совсем не дает газооб-
разных Продуктов при сгорании, по-видимому, только жслезоалю-
миниевый термит
1 Однако при температуре реакции (~-2400- С) и в случае термита некоторая
(сравнительно небольшая) часть промежуточных продуктов и продуктов реак-
ции находится в парообразном состоянии.
80
В составах осветительных, трассирующих и сигнальных огней
и в фотосмесях образование газообразных веществ необходимо для
того, чтобы при горении получить пламя и таким образом увеличить
количество излучаемой световой энергии. Образование газообраз-
ных продуктов при горении твердых пиротехнических топлив—
необходимое условие для обеспечения тяги реактивного двигателя,
В дымовых составах наличие газовой фазы в продуктах реакции
горения необходимо для того, чтобы осуществить выталкивание
из сферы реакции в атмосферу частичек различных дымообразую-
щих веществ.
При горении зажигательных составов образование газообраз-
ных продуктов также желательно, так как это значительно рас-
ширяет создаваемый очаг пожара.
Наряду с газообразными продуктами при горении пиротехни-
ческих составов получается также известное количество твердых
продуктов реакции. Исключение составляют твердое пиротехнике*
ское топливо, а также некоторые горючие соединения или их смеси,
сгорающие за счет кислорода воздуха. Так, жидкие углеводоро-
ды—бензин, керосин, нефть и др., употребляемые в пиротехниче-
ских зажигательных средствах, дают при сгорании очень мало
твердых продуктов.
Соотношение между количеством газообразных и твердых про-
дуктов реакции горения определяется назначением состава и тре-
бованиями, предъявляемыми к нему в отношении специального
эффекта. Так, например, для осветительных и трассирующих со-
ставов газообразные продукты реакции составляют 15 — 25%
От веса состава. Дымовые составы выделяют при сгорании большое
количество газообразных продуктов.
Количество газообразных продуктов, получающихся в резуль-
тате сгорания I & пиротехнического состава, принято выражать
не по весу, а по объему, занимаемому ими при нормальных усло-
виях (0° С и 760 Л1,и рт. ст.). Этот объем газообразных продуктов
называется удельным объемом и обозначается через о0.
Обычно при вычислениях к объему, занимаемому образующи-
мися в процессе реакции горения газами (СОа, СО и др-), добавля-
ют еще объем, занимаемый при нормальных условиях образовав-
шимися парами воды.
Если известен объем v0, то объем vt газообразных продуктов
При температуре реакции горения вычисляется по общеизвестной
формуле Гей-Люссака
Vi=и0(1+ 0,00366 t).
При вычислении щ следует принимать во внимание не только
истинные газы и водяной пар, но и все вещества, находящиеся при
температуре реакции горения в парообразном состоянии.
Примером может служить смесь хлората калия и алюминия;
реакция горения протекает по уравнению
КС1О3+2А1 = КС1+А1гОз.
6 А. А. Шядловскн!
81
Так как температура горения этой смеси составляет около
3000° С, а хлористый калий кипит при 1415°С, то при температуре
реакции он будет целиком находиться в парообразном состоянии.
Этим и объясняется то явление, что в некоторых случаях горение
этой смеси может протекать со скоростью, приближающейся к ско-
рости взрыва.
Газообразные продукты реакции горения пиротехнических со-
ставов образуются в основном за счет окисления или распада ком-
понентов, содержащих водород, углерод, азот, серу и хлор. Пер-
вые два элемента входят в состав органических соединении, упот-
ребляемых в качестве компонентов для изготовления пиротехниче-
ских составов.
Азот содержится в органических нитро- или аминосоединениях,
а также в нитратах, являющихся в пиротехнике наиболее употре-
бительными окислителями, Сера применяется в виде сернистых
соединений (Sb2S3, пирит и Др.), а иногда вводится в пиротехни-
ческие составы и в элементарном состоянии.
Хлор содержится в хлороорганических соединениях; свободный
хлор и хлористый водород образуются при горении составов, со-
держащих перхлорат аммония NH1CIO4. В результате распада
и окисления соединений, содержащих указанные элементы, обра-
зуются Н2О, СО2, СО, N2, SO2, Н2, Cl2, НС1, а в некоторых случаях
и окислы азота NO и NO2.
В табл. 7. I указан объем, занимаемый при нормальных усло-
виях I г перечисленных выше газов.
Таблица 7.1
Объем I г газа при нормальных условиях в лгл
Газ мл [г Газ мл /г
н2 11200 НС1 614
Н2О 1247 СО, 509
со 800 зо2 350
N2 800 С12 315
Как видно из табл. 7. I, при равном весе наибольший объем
в газообразном состоянии занимает водород, а затем пары воды
и окись углерода СО. На основании этих данных можно сделать
практически важный вывод, что для получения большого количест-
ва (по объему) газообразных продуктов сгорания следует в каче-
стве горючих компонентов пользоваться органическими веществами,
содержав! и ми много водорода; количество вводимого в состав
окислителя следует рассчитать таким образом, чтобы сгорание го-
рючего происходило только до Н2О и СО или, если это диктуется
термохимическими соображениями, до И2О и СО2. Из твердых го-
82
рючих большое количество водорода содержат парафин, стеарин
и др.
Удельный объем газообразных продуктов реакции может быть
определен двумя способами.
1. Экспериментально — при сжигании пиротехнического соста-
ва в калориметрической бомбе, Газообразные продукты для изме-
рения их объема переводятся из калориметрической бомбы в газо-
метр [154]. Можно поступить и по-другому — измерить При помощи
ртутного манометра давление газов непосредственно в калоримет-
рической бомбе и воспользоваться полученной величиной (с учетом
температуры газов в бомбе) для вычисления объема газов. При
определении удельного объема следует учесть, что продукты горе-
ния после охлаждения будут иметь уже несколько иной состав,
чем в момент реакции. Это обстоятельство в некоторых' случаях
искажает результаты определения, Так, например, при охлаждении
продуктов горения «происходит конденсация хлоридов металлов,
образующихся при горении перхлоратных (или хлоратных) соста-
вов, кроме того, могут протекать реакции образования карбонатов
из СОа и окислов металлов; все это ведет к уменьшению Vo-
Следует отметить, что в определяемое опытным путем значение
удельного объема газов не входит объем, занимаемый парами
воды.
2. Расчетным путем—на основании уравнения реакции горе-
ния пиротехнического состава. Уравнение реакции может быть со-
ставлено двумя способами:
а) предположительно — на основании имеющегося экспери-
ментального материала о направлении реакции горения других
составов, сходных по рецепту с исследуемым;
б) более точно — на основании результатов химического ана-
лиза газообразных и твердых продуктов горения и определения
количества образовавшейся в результате реакции воды.
Удельный объем рассчитывают по формуле
22,4-п-ЮОО
=— ---------.
где п — число г-молей газообразных веществ, выделяющихся при
горении (сумма коэффициентов при газообразных вещест-
вах в правой части уравнения реакции);
ш —вес реагирующего состава в г.
Пример 1. Рассчитать для осветительного состава; 75% нитрата бария.
21% магния, 4% идитола,
Реакцию горения этого состапа приближенно можно выразить уравнением
14,6Ва (NO3)2 + 43,2Mg + Ci3H]2O2 = 14,6ВаО + 14,6N2 +
откуда
+ 43,2MgO + 13СО2 + 6НЕО,
22,4(14,6 + 13+6)-1000
14,6-261 +43,2-24,3 + 200
= 149 см^’г состава.
6*
83
В табл. 7. 2 приведены значения иа, рассчитанные для различных
составов; рецепты состава взяты из табл. 6.2.
Таблица 7.2
Удельный объем газообразных продуктов реакции горения
некоторых составов
Назначение состава Рецепт состава в % Газообраз- ные про- дукты реакции «о с.к-у г Вес га- зов в % от веса состава
фотосмесь Ba(NO3)2-68, Mg—32 n2 58 7
№ Ba(NO3)2—74, Л1-26 Na 61 8
Железо алюминие- вый термит FeaO4-7-S Л1-25 — 0 0
Осветительный Ba(NO3)2-75, Mg—21 идитол —4 n2, со,., н2о 144 21
Зеленый сигиалъ- НЬ|Й Ba(ClO3)2-HsO-88 идитол —12 со2, Н2О 330 43
Красный сигналь- ный KC10(-f7 ' SrCO3—25 шеллак—18 со, н2о 375 40
Красный дымовой КС 1CV 435 молодный сахар—25 родамин—40 со, н2о 365 39
Дымный порох KNO3—75, древесный уголь—15, S—10 СО, СОз, Н2О, Na 286 —
Можно установить некоторую связь между назначением состава
и удельным объемом газообразных продуктов его горения (см.
табл. 7. 2).
Цифровые данные, помещенные в табл. 7.3, следует рассмат-
ривать только как ориентировочные ввиду недостаточности как
литературного, так и экспериментального материала.
Следует отметить, что удельный объем газообразных продук-
тов для применяющихся сейчас пиротехнических составов (кроме
твердого ракетного топлива) значительно меньше, чем для основ-
ных взрывчатых веществ; так, для гексагена составляет
908 слР/< для тетрила 750 см?[г для тротила 688 скг1г.
В заключение следует указать, что для твердых ракетных топ-
лив используются другие более точные методы расчета количества
газообразных продуктов реакции (см. гл. XX).
24
Таблица 7.3
Связь между назначением состава и значением о0
Назначение состава Vo см"!г
Фотоосветитсдь и не 50—100
Осветительные ii трассирующие 100-300
Сигнальные ночные 300-450
Дымовые (кроме метал.юхлорндных смесей) 300- 500
Зажигательные (содержащие окислитель) 0—300
Твердое ракетное топливо 600—850
Глава VIII
ТЕМПЕРАТУРА ГОРЕНИЯ ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
Определение температуры горения пиротехнических составов
имеет большое значение, так как это дает критерий оценки сущест-
вующих составов и облегчает создание новых, иолее совершенных
рецептов.
Температуру горения пиротехнических составов можно опреде-
лить двумя способами:
I) вычислением по формуле (8.7). При этом используется об-
щеизвестное положение, что температура реакции равна ее тепло-
те, деленной па суммарную теплоемкость продуктов реакции;
однако при этом не учитываются потери в окружающее простран-
ство и, в частности, потери на излучение, которые для пиротехниче-
ских пламен являются довольно значительными;
2) непосредственным измерением (при помощи оптических пи-
рометров или термопар).
§ I. ВЫЧИСЛЕНИЕ ТЕМПЕРАТУРЫ ГОРЕНИЯ СОСТАВОВ
Следует с самого начала указать, что в разных зонах пламя
имеет разную температуру. Путем расчета находится только верх-
ний предел возможной температуры или, иначе говоря, максималь-
ная температура пламени.
Определение температуры горения составов расчетным путем
затрудняется отсутствием точных цифровых данных о теплоемкости
многих соединений при высоких температурах (выше 2000°С); для
многих соединений не определены или определены с недостаточной
точностью скрытые теплоты плавления и испарения.
Вычисляемые значения температуры горения являются только
верхним (практически недостижимым) пределом, так как в дей-
ствительности температура горения должна быть значительно
ниже вследствие затраты тепла на термическую диссоциа-
85
цию продуктов горения, а также вследствие тепловых потерь
в окружающее пространство.
Удовлетворительные по точности результаты вычисления тем-
пературы горения описываемым ниже способом с использованием
формулы (8. 7) могут быть получены в том случае, если искомая
температура не превышает 2000—2500° С. В противном случае
получаем только ориентировочные данные (например, при расчете
температуры горения составов, содержащих более 10—15% магния,
алюминия или других высококалорийных металлов).
Учитывая, что обычно при горении пиротехнических составов
имеется возможность для расширения газообразных продуктов
реакции, пользуются при расчетах величинами теплоемкости при
постоянном давлении Ср. Молекулярные теплоемкости газов при
постоянном объеме Си и при постоянном давлении связаны соот-
ношением
Ср = С„ + R, (81)
где R— газовая постоянная, равная 1,98 кал/г-моль -град.
Молекулярную теплоемкость газа Си можно вычислить ио фор-
муле
С„=‘4- (8-2)
Для одноатомных газов число i равно 3, для двухатомных — 5
и для многоатомных—6.
Используя формулы (8.1) и (8-2), получаем значения Ср
в кал/г-моль • град:
для одноатомных газов................... 4,95
для двухатомных газов................... 6,93
для многоатомных газов................. 7,92
Экспериментальные данные не всегда подтверждают теорети-
ческий расчет теплоемкости для двухатомных и в особенности мно-
гоатомных газов, В табл. 8- I приведены значения молекулярных
теплоемкостей Ср, полученные опытным путем.
Для простых веществ, находящихся при высоких температурах
(1000°С и выше) в твердом состоянии, можно считать, согласно
правилу Дюлонга и Пти, что их грамм-атомная теплоемкость есть
величина постоянная и равная приблизительно 6,4 кал!град.
Для соединений, находящихся в твердом состоянии При высо-
ких температурах, в известной мере справедливо Правило Неймана-
Коппа, согласно которому теплоемкость соединения равняется
сумме атомных теплоемкостей составляющих его элементов.
В табл. 8,2 приведены полученные опытным путем значения
теплоемкости для некоторых веществ, представляющих интерес
Для пиротехника.
Разница между Ср и С„ для твердых тел очень невелика и ею
практически можно пренебречь,
86
Таблица 8.1
Значение средних молекулярных теплоемкостей для газоа Ср
Интервал температуры °C N;, О;, СО Нг Н2О СО3
0-100 7,0 б.д 8,0 9,1
0—500 7.1 7,0 8,3 10.3
0-1000 7.3 7,1 8,8 П,з
0-1500 7,5 7.4 9,5 11,9
0-2000 7,7 7,6 10.3 12,3
0—2500 7,8 7,7 11,4 12,5
0-3000 8.0 7,8 12,8 12,7
Относительно теплоемкости жидких тел при высоких темпера-
турах (выше 1ООСГС) указать какие-нибудь определенные законо-
мерности затруднительно. Следует только отметить, что теплоем-
кость вещества в жидком состоянии обычно больше его теплоем-
кости в твердом состоянии. Иногда приближенно принимают моле-
кулярную теплоемкость жидких высокоплавящихся веществ равной
1,3 Ср твердых тел.
Таблица 8.2
Средняя молекулярная теплоемкость твердых веществ Ср
Вещество Темпера- тура lC cP Вещество Темпера- ТУРЗ ч; Ср
Fe 0-100 6.2 NaCl 600 13,8
Fe 20—1500 9,6 AljOj 30-300 23.0
Си 20-100 j 5.9 Al,Oa 30-1100 27.7
Си 20-1500 9,4 ai2o3 30-1500 28.1
NaCl 20-785 : 13.6 АЬОа 20-2030 28,5
MgO 20-1735 ! 12.1 Al2O3 570-600 29,4
MgO 20—2370 1 14,0 AljOa 965-973 33,2
MgO 20-2780 I 14,3 BaCl2 100 19,6
KCl 400 13,3 ВаСОз 1000 31,8
07
Скрытые теплоты плавления и испарения. Ри-
чардс и Комптон нашли, что для большинства Простых веществ
справедлива зависимость
2?-.=0,002 =0,003, (8.3)
7s
где Q1S-—теплота плавления в ккал/г-атом;
Т6— температура плавления в °К.
Зависимость эта оправдывается с достаточной точностью дале-
ко не для всех простых вешеств.
Скрытая теплота плавления для многих неорганических соеди-
нений. по нашему мнению, может быть Приближенно вычислена
по эмпирической формуле
2^=0,002-/?. (8.4)
где п — число атомов в молекуле соединения.
Величина скрытой теплоты испарения одного и того же вещест-
ва не является неизменной, а уменьшается с повышением темпера-
туры, при которой происходит испарение.
Так, для воды грамм-молекулярная теплота испарения состав-
ляет при О3 С 10,8 ккал, а при 100°С — 9,7 ккал.
Большой величины достигает теплота кипения жидкостей при
высоких температурах, Зависимость между теплотой кипения
(Q;( ккал (моль) и температурой кипения жидкости при 760 мм рт. ст.
(7\ в °К) выражается формулой Трутопа
«0,02. (8.5)
‘ JS
Для многих (в особенности высококипяших) неорганических
соединений скрытая теплота испарения может быть, по нашему
мнению, с большей точностью, чем по формуле Трутона, вычислена
по эмпирической формуле
=0,011 -а, (8.6)
где п— число атомов в соединении.
Очевидно, теплота испарения соединений значительно больше
теплоты их плавления.
Величины Qh и Qs Для высокоплавяшихся и высококипяших
неорганических соединений настолько значительны, что учет их
при вычислении температуры горения является безусловно обяза-
тельным.
Максимальную температуру горения вычисляют по формуле
; <= (
>/- р
88
где Q — количество теплоты, выделяющейся при реакции горе-
ния;
2 Ср — сумма теплоемкостей продуктов реакции;
S(Qs + Q*) — сумма скрытых теплот плавления и кипения продук-
тов горения;
t — искомая температура горения в °C.
Ниже приведены два примера вычисления температуры горе-
ния составов по этой формуле,
Пример 1, Вычислить температуру горсч’гя состава красного огня, состоя-
щего из 65% КСЮз, 20% SrCO3, и 15% С|31 ПаОа смолы (ндигола).
Реакция горения этого состава приближенно может быть выражена урав-
нением
7,lKCIOa+l,8SrCO3+C-|3t[i,O2=7JKCl-f-1,8SrC03 + 6H2O(iap +
+ 4,ЗСО2 + 8.7СО.
При втом допускается неточность, так как в пламери имеет место ре-
акция диссоциации StCOq % SrO СО2, а также реакция 2КС[ д. SrO "
- SrCl2 + K2O и 25гСЬ 2SrC[-[-СЬ (см. г.т- XVI).
Теплота горения вычисляется по закону Гесса, теплота образования идитола
принята равной 0,71 ккал/г-.
Для Н^Одар 6-57,4 = 344
Д.тя СО2 4,3-94 =404 Д.тя КСЮ3 7,1-96=682
Для СО 8,7-26=226 Д.тя СВНГ,О2 0.74-200 = 148
Для КС11П 7,1-106 =752
1726 ккал 830 ккал
Количество тепла, выделяющееся при реакции, равно
0=1726-830-896 икал.
II редис ла гаем, что температура горения будет около 1500’ С, и потому при
пимаем ыо пнимапие скрытые теплоты плавления и кипения KCI.
В справочниках находим [98]:
КС1 -= 6,3 ккал при 7G8°C,
Qh KCt — 40 ккал при 1415" С.
Отсюда (Qs -f- Q/J = 46,3-7,1 = 329 ккал
и Q —^(Qs + Q*) =896 —329 = 567 ккал.
Теплоемкость Ср газов н водяного пара в интервале 0—1500" С (см. табл. 8. 1 I
равна
Для Н2О........................... 6- 9,5 = 57,0
Для СО2..........................4,3-11,9 = 51,2
Для СО ...........................8,7- 7,5 =65,2
173,4
99
= 173.4 4- 148,5 = 321.9 кал‘град.
567-1000
"Ееплоемкость КС1 и SrCOj принимаем по правилу Неймана-Коппа равными
соответственно 12,8 н 32,0 кал/град моль.
Отсюда 12,8-7,1=90,9
32,0-1,8=57,6
"148Л
и окончательно
откуда
321,9 ' ~
Если бы мы приняли во внимание частично протекающую в пла-
мени термическую диссоциацию: SrCOaZ^SrO-l-COa—54 ккал, то
при расчете получили бы значение температуры порядка 1600° С.
Пример 2, Рассчитать температуру горения дымовой смеси, имеющей сле-
дующий состав: ССЦ—39®/о, Zn — 34%. NaClOj — [б’/п, NH«C1 — 9%, SiO2 (ки-
зельгур) — 3%.
Составим уравнение реакции горения:
0.257ССЦ + 0,5l4Zn -f- 0,137NaC10a 0,164NH4C14-
4-0,055SiO,=0.5l4ZnCl2 4-0,137NaC[ 0.164NH.|Ci+
+ 0,055Si02-f-0,103CO-f-0>154C02.
Кизельгур в данном составе играет роль поглотителя для жидкости СС14
н ис принимает участия в реакции горения. Q=47 2 ккал.
Длн ZnCl2 fs =365° С /* = 732° С;
Для NaCl /,$=800РС, (Й = [44(РС.
Температура сублимации хлористого аммония (NH4C1) равна 335° С.
Для SiOj fs-1470s С.
Для дымовых составов температура реакции редко превышает 1000” С;
поэтому в дальнейших расчетах скрытая теплота испарения NaCl и теплота
плавления SiO2 во внимание не принимаются.
Определим исходные величины:
^sznC[,=3>8 [рассчитана по формуле (8.4)];
QsNaCi =7-2' Q*ZrrCI, ^33;
Q сублимации NH«Ci=39 ккал.
Отсюда
+ <?*> =0,514(3.8 -f-33) 4-0.137X7,2-f- 0. [64x39 ^26,5 ккал.
Q — VjfQs-f-Qt)—ккал. ''
Вычисляем теплоемкости:
Для Zn Cl, 0,514-20 = 10.28
Для NaCl 0,137-13,6=1,87
Для NH4C1 0.164-36 =5,90
Для SiO2 0,055-18 =0,99
Для CO 0,103-7.3 =0,75
Для co2 0.154-11,3= 1,64
Ср 21,43,
20.7 1000
t = -т—2— - 965
21.43
90
В 1953 г. при расчете температуры горения алюминотермичс-
ских реакций Вентурини [109] внес некоторые изменения в мето-
дику вычисления. Для обычного железоалюминиевого термита
им при вычислении было получено значение 3500° К (3227° С), чте-
це согласуется с результатами экспериментальных определений
(см. ниже). По первому впечатлению термохимический расчет Вен-
турини достаточно обоснован, но существенная погрешность его за-
ключается в том, что, как указывает сам автор, им не принята во
внимание возможность испарения продуктов реакции горения.
В известной мере испарение имеет место и при алюминотерми-
ческих процессах. Именно неучет этого явления и послужил, по на-
шему мнению, причиной получения Вентурини сильно завышенных
данных.
Необходимо еще раз отметить, что если температура горения
превышает 2000—25СЮРС, то данные, полученные расчетным путем
по формуле (8.7), отражают только порядок величин, а потому
могут быть полезными только при сравнении между собой соста-
вов, резко отличающихся друг от друга по своему рецепту.
Для ракетных топлив требуется высокая точность расчета тем-
пературы горения и других характеристик продуктов сгорания.
В этом случае для вычисления температуры горения выполняются
весьма трудоемкие расчеты, при которых учитываются процессы
термической диссоциации и испарения продуктов реакции горения.
Исходные данные для таких расчетов приведены в справочни-
ке (233].
§ 2. ЭКСПЕРИМЕНТАЛЬНОЕ ОПРЕДЕЛЕНИЕ ТЕМПЕРАТУРЫ ГОРЕНИЯ
Температура горения большинства пламенных пиротехнических
составов лежит в пределах 2000—30СЮ° С.
Измерение температуры пламени при горении таких составов
проводится чаще всего при помощи оптических методов.
Основанием для применения оптических методов для измерения
температуры горения пиротехнических составов служит предпо-
сылка, что излучение пиротехнического пламени следует (хотя бы
приближенно) законам излучения абсолютно черного тела (АЧТ).
В этом случае излучение должно подчиняться:
1) закону Стефана-Больцмана
Е=с Т\
где Е — общая энергия излучения;
с — постоянная величина 5,73-1С№ вт/см2 град;
Т — абсолютная температура в °К;
2) закону смещения Вина
' 7'^2884,
если Amar измеряется в микронах;
91
3) закону излучения Планка
£х^с у-з 1..... ,
* _
ХГ
е — I
где с, равна 3,7-К)-5 эрг - сек~' см~2;
с2~ равна 14 380 мк/град;
е — основание натуральных логарифмов;
). — длина волны;
Е>.—интенсивность излучения с длиной волны Л и температурой
Т в °к.
На самом же деле излучение пламени пиротехнических соста-
вов по своему характеру в известной степени отличается от излу-
чения АЧТ.
Излучение АЧТ имеет непрерывный спектр.
Присутствие в пламени раскаленных твердых или жидких ча-
стиц обусловливает наличие непрерывного спектра пламени, Но на-
ряду с этим некоторые вещества находятся в пламени в газообраз-
ном состоянии, что, как известно, обусловливает наличие прерыви-
стого спектра (линейчатого иди полосатого). Исходя из этого пламя
пиротехнических составов имеет в большинстве случаев непрерыв-
ный спектр излучения с наложенным на него прерывистым спект-
ром излучения газовой фазы. Сравнительная интенсивность непре-
рывного и Прерывистого спектров зависит от многих факторов,
в том числе в первую йчсрсдь от температуры пламени и количест-
венного соотношения в кем твердой и газовой фазы.
Из сказанного следует, что в результате измерения температу-
ры пламени оптическим пирометром в большинстве случаев можно
получить лишь Приближенную оценку истинной температуры пла-
мени (для белых пламен погрешность составляет примерно от
+ 50 до ±100°С).
Наиболее доступны методы измерения яркостной и цветной
температуры пламени. Яркостная температура Тя — это темпера-
тура АЧТ, при которой яркость пламени для X —0,665 мк равна
яркости исследуемого излучателя для той же длины волны.
Цветная температура Гц — это температура АЧТ, при которой цвет-
ность его излучения одинакова с цветностью исследуемого излу-
чателя.
В этом случае интенсивность излучения АЧТ для двух различ-
ных длин волн и Ач равна интенсивности излучения данного
физического тела При тех же длинах волж Экспериментальное
определение цветной температуры тела сводится к определению
отношения интенсивностей излучения для двух различных длин
воли и к последующем^' нахождению по таблице темпе-
ратуры, при которой для АЧТ отношение интенсивностей излучения
для длин волн Zi и равно А.
92
Типы оптических пирометров
Оптический пирометр с исчезающей питью
(фиг. 8.1) представляет собой визуальный фотометр, в котором
яркость света, излучаемого исследуемым телом (пламенем), изме-
ряется путем сравнения с яркостью стандартного раскаленного
тела (нити лампочки) при одной и той же эффективной длине вол-
ны (Х = 0,665 МК).
Фиг. 8. I. Схема оптического пирометра с исчезающей нитью.
Z—линза объектная, 2—лампа, Зашкала. 4—стекло, 5 — подвижные ролики, 6—пере-
менное сопротивление, 7—выдвижной тубус окуляра,
В пирометре нить накала лампочки помещена в фокусе объек-
тива. который вместе с окуляром образует оптическую систему,
совмещающую изображение пламени с изображением нити накала
лампочки.
Изменяя напряжение тока, изменяют яркость нити накала
до совпадения ее с яркостью пламени. Это явление воспринимается
наблюдателем как исчезновение нити накала на фоне пламени; при
этом производят отсчет по шкале реостата, размеченной в градусах
яркостной температуры. Выпускаемый промышленностью пиро-
метр типа ОППИР-017 имеет две шкалы измерений, обеспечиваю-
щих измерение температуры в пределах 1500—2500° С и 2200—
6000° С,
Кинофотопирометр представляет собой обычный кино-
аппарат, снабженный красным светофильтром (А. = 0,665 .«к) и на-
бором ленточных ламп, устанавливаемых рядом с измеряемым
объектом (фиг. 8.2).
93
В основу этого метода измерения температуры положен прин-
цип фотографирования пламени в собственном свете; при этом
пламена с более высокой температурой дадут на фотопленке
большие плотности почернения, чем пламена с более низкой темпе-
ратурой, Фотографируя одновременно с пламенем ленточные
лампы с известной температурой, получаем на кинокадре плотности
почернения х для известных температур. Для области нормальных
плотностей строится градуировочный график s = f Имея опре-
деленную плотность, по графику находим яркостную температуру.
Для пиротехников этот метод представляет особый интерес, так
Фиг. 8.2, Схема кинофотопирометра.
[ ^ле)П’О’|«ые ламП|Дх 2—трансформатор. 3 —амперметр, 4—светофильтр. 5—кнео-
аппарат.
как с его помощью можно определять температуры в различных
участках пламени, а также фиксировать изменения температуры
во времени (фиг. 8.3).
Фотоэлектрический пирометр ФЭП-0,65 представляет
собой вариант оптического пирометра, разработанного специально
для измерения температуры пиротехнических пламен с фиксацией
данных измерения на осциллографе. С помощью ФЭП-0,65 изме-
ряют среднюю яркостную температуру и излучательную способ-
ность пламени (количество энергии определенной длины волны,
излучаемое с единицы поверхности тела в единицу времени при
температуре Г, т. е. £л в кал! м2 -час или вт£л2 [101]).
Для измерения излучательной способности позади пламени
помещается ленточная лампа с линзой (фиг. 8.4), которая ленту
лампы проецирует на исследуемый участок пламени. Между лам-
пой и линзой помещен вращающийся экран (модулятор), периоди-
чески с частотой Ю гц перекрывающий свет лампы.
94
Вначале на осциллографе фиксируется фототок от одной лампы
(in}. При горении пиротехнического состава, когда экран перекры-
вает лампу, фиксируется фототок, создаваемый одним пламенем
(in). Когда же свет лампы не задерживается экраном, фиксируется
фототок, создаваемый суммарно пламенем и лампой (1п+л)-
Фиг. 8.3. Данные о температуре пламени, полученные с помощью кино-
фотопирометра,
а —график изменения температуры во времени: <>—график изменения температуры
цо высоте п;кгмвцй. я—график температурных полей.
По измеренным величинам вычисляют коэффициент пропуска-
ния пламенц
а затем коэффициент поглощения пламени ах — t — т», который,
согласно закону КиРг0ФФа> равен излучательной способности пла-
мени £\.
При измерении яркостной температуры необходимы лишь дан-
ные о величине фототока от пламени (iu), с помощью которых
по графику определяют температуру, ее изменение во времени,
пульсацию температуры, максимальную и минимальную темпера-
туру на любом участке горения.
Цветной пирометр (красно-синего отношения) Представ-
ляет собой регистрирующий люксметр, измеряющий интенсивность
излучения в Красной и синей части спектра одновременно. Наибо-
лее распространенный вариант конструкции (фиг. 8. 5) представ-
ляет собой блок из двух фотоэлементов, перед которыми установ-
лен вращающийся диск с двумя рядами отверстий; на одном ряду
отверстий укреплены светофильтры (красный X—0,685 мк и синий
95
?» = 0,456 мк). Фотоэлементы установлены таким образом, что луч
одновременно попадает на оба фотоэлемента, Фотоэлемент без све-
тофильтра служит для внесения поправки на изменение светового
потока за время перемещения светофильтров.
Фиг. 8. 4. Схема определения издунательной способ-
ности пламени.
/-’леггто'шая лампа, 2—мр.чулятор. 5—линза, 4—пламя пиротех-
нического состава, 5—ФЭП-065.
Цветную температуру можно определить также спектральным
методом по сплошному спектру, используя тс его участки, где пет
наложенных на него полос и линий. Описание методов измерения
температуры пламен дается в литературе: см. книги Кадышевича
[101], Кириллица и Шейндлина [102], Дина [105], статьи Похила
[ЮЗ] и Соболева [|04].
фиг. 8. 5. Схема цветного пирометра,
/“Вращающийся диск. 2 “светофильтр, J •-фотоэлемент, 4—элек-
тромотор, э—выводы контактов, б—корпус, 7—осциллограф.
Значительно более точно, чем температура пламени, оптическим
пирометром определяется температура раскаленного твердого или
жидкого шлака, образующегося при горении пиротехнического
состава.
96
Вартенберг [7, стр. 87] определил оптическим методом темпера-
туру льющейся струп жслезоалюмшшевого термита и нашел ее
равной 2400±50с С.
Эггерт, Эдер и Джцобек [7, стр. 87] измерили интенсивность из-
лучения магниевых пламен в различных частях спектра и па осно-
вании этого вычислили «цветную температуру» пламени:
цветная температура пламени при горении магния в кислороде
равнялась ~ 3700е С, при горении магния на воздухе ~ 34000 С,
а цветная температура пламени фотовспышки Th(NO3^+Mg~
~ 3100° С.
Температура горения алюминия в кислороде, измеренная Квел-
лероном и Скартазпни при помощи яркостного пирометра, была
найдена равной ~ 3000—3200° С. Из этого следует, что При горе-
нии порошков Mg и А| может быть получена температура порядка
3000—3500° С.
Получению более высокой температуры препятствует большая
затрата тепла на испарение и частичное разложение окислов этих
металлов.
Наиболее высокая температура при горении металлических
порошков возникает при горении порошка циркония в ки'слороде.
Оценка ее при помощи термодинамических расчетов [106] дает
значение 4930° К>
Предел температуры здесь определяется температурой кипения
при р= 1 ат окисла ZrO2 (см. табл. 3. 3 на стр. 41).
Следовательно, возможность достижения очень высоких темпе-
ратур определяется не только высокой калорийностью горючего,
но и предельно высокой температурой кипения, а также большой
химической устойчивостью продуктов горения (окислов ме-
таллов) .
Еще более высокую температуру горения (5400° С) имеет газо-
вая смесь H2-J-F^[223, стр. 139].
Температура горения титана в кислороде по приближенной
оценке Гаррисона [108] (наблюдение испарения золота и платины)
лежит в пределах 2950—3500° С.
Зависимость между температурой горения элементов в кисло-
роде и порядковым номером элемента в периодической системе эле-
ментов показана ца фиг. 8.6.
Измеряя оптическим яркостным пирометром температуры пла-
мен, образующихся При горении спичечных масс, содержащих
около 40% хлората калия, Ардитти [7, стр. 88] получил Значения
температуры 1400—1500° С.
В заключение еще раз заметим, что температура в различных
зонах пиротехнического пламени различна, и когда говорят о тем-
пературе пламени, то подразумевают обычно температуру в самой
горячей зоне пламени.
Температуру горения некоторых медленно горящих дымовых
составов, для которых она лежит в пределах 360—600° С, можно
А, А. НТндловский
97
измерить кварцевыми ртутными термометрами, в которых ртуть
находится под давлением.
Необходимым условием получения при этих опытах значений
температуры, близких к истинной, является малая скорость горе-
ния составов, чтобы шарик ртутного термометра успевал достаточ-
но прогреться,
Тепмопаоа хоомель — алюмель может служить для измерения
температуры до 13ОО':С. Для измерения более высоких температур
О 10 20 30 Кг 4J 50 60 70 S0 90
Порядковый номер зпемента.
Фиг. 8. 6. Темне|татуса Отрыиы простых пещестп (элементов) в кисло-
роде в = К при р=1 ат [243].
до 1600°С можно воспользоваться термопарой, один проводник
которой сделан из платины, а другой—из сплава платины с 10—
15% родия (температура плавления платины 177Г С).
Термопары W—1г и W—Re могут быть использованы до темпера-
тур соответственно 2100 и 2700°С, но мало пригодны для исполь-
зования в пиротехнике, так как в этом случае требуется наличие
восстановительной или инертной среды.
Термопара 1г—Rli/Ir (40% 1г) градуируется и применяется
до 2100° С с точностью 10°, В течение ограниченного времени она
может применяться и на воздухе.
При изменениях температуры горения пиротехнических составов
при помощи термопары особое внимание следует обращать на теп-
ловую инерцию пирометра и всячески стремиться к ее уменьшению.
Близкие к действительности результаты можно получить только
в тех случаях, когда провода термопары будут изготовлены из пе-
98
армированной проволоки диаметром не более 0,05—0,1 лш или
ленточки такой же толщины; инерция регистрирующего прибора —-
милливольтметра — также должна быть по возможности мини-
мальной.
В зависимости от диаметра проводов термопары (неармирова
пой) для состава красного сигнального дыма (краситель — род.
мин) были получены следующие результаты;
31 Я
Диаметр проводов в мм .
0,5 0,2 0,1
Значение для дщксп.чллыюй температуры реакции
в 3С............................................ 338 897 837
Очевидно, температура реакции
в данном случае несколько выше
837° С; при дальнейшем уменьшении
диаметра проводников термопары
можно получить результаты, более
близкие к истине.
При измерении температуры ре-
акции двух других дымовых смесей
сигнальных дымов при помощи же-
лезо-копстантановой термопары с
диаметром проводников 0,1 лич были
получены следующие данные;
для смеси № 1 ,
для смеси № 2 .................. 1000Д'.
Расчетным путем для температу-
ры горения этих смесей были полу-
чены значения:
для смеси № 1 ............. 1262Е'С
для смеси К? 2 . ......... 1070'С
Фиг. 8.7. Максимальная тем-
пература при горении смесей
(измерено термопарой Pt/Pt—
Rh>.
Г-ВаОгт-Мо, 2—КМлО.-Мо.
UaO^rS. J—BnOj’-Fe, «5—КМпО^-Fc,
6—KiCt-lOv + Fc.
Хилл и Саттон при ломошп термопары исследовали изменение?
температур горения двойных смесей с изменением соотношснпf•’
между компонентами. Результаты этого исследования показанья
на фиг. 8. 7.
§ 3. СВЯЗЬ МЕЖДУ НАЗНАЧЕНИЕМ СОСТАВА
Й МАКСИМАЛЬНОЙ ТЕМПЕРАТУРОЙ ГОРЕНИЯ
На основании опубликованного в настоящее время экспсрнмып -
тального материала можно заключить, что имеется определенна
связь между назначением состава н максимальной температур ом
в зоне горения (табл. 8.3).
‘>9
7*
Таблица 8.3
Назначение состава н максимальная температура в пламени
Составы
Максимальная темпера-
тура в пламени
°C
Фотоосветнтельные
Осветительные п трассирующие
Зажигательные (содержащие окислитель)
Ракетные (твердое ракетное топливо)
Составы ночных сигнальных огней
Дымовые
2500—3500
2000-2500
2000—3500
2000—2900
1200—2000
400—1200
Глава IX
ЧУВСТВИТЕЛЬНОСТЬ ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
Под начальным импульсом понимается то минимальное коли-
чество энергии, которое необходимо для возбуждения реакции
горения (или взрыва) в пиротехническом составе.
Чем это количество энергии будет меньше, тем более чувст-
вительным к внешним воздействиям будет данный пиротехнический
состав.
Возбудить быструю реакцию в пиротехническом составе можно,
применяя различные виды энергии: тепловую, механическую, элек-
трическую, лучистую и др., по характер процесса, возникающего
при этом в пиротехническом составе, получается различным.
Для получения нормального эффекта при действии пиротех-
нических составов в большинстве случаев пользуются тепловым
начальным импульсом (луч огня, стопин, воспламенительные со-
ставы); только при работе с фотосмесямп и некоторыми зажига-
тельными составами применяют иногда в качестве начального
импульса воздействие па них взрыва ВВ (т. е используют комбини-
рованное воздействие мех'аничсского и теплового импульсов)
н этим намеренно вызывают взрыв в пиротехническом составе.
Испытания пиротехнического состава на чувствительность
имеют целью установить:
1. Правильные приемы его изготовления д такие условия хра-
нения, которые гарантировали бы отсутствие воспламенения или
взрыва.
2. Правильные приемы воспламенения, которые обеспечили
бы получение при действии состава требуемого специального эф-
фекта.
Испытания на чувствительность пиротехнических составов за-
ключаются в определении:
1. Температуры самовоспламенения.
100
2. Чувствительности к лучу огня.
3. Чувствительности к удару.
4. Чувствительности к трению.
Реже проводятся испытания:
1. На воспламеняемость от специальных вос1ь’1амеиителы1ых
составов.
2. На чувствительность к прострелу пулей (обычн°Ч или зажи-
гательной).
Каждый пиротехник, создавая новый пиротехнический состав,
должен при выборе компонентов для состава ясно отдавать себе
отчет в том, какой чувствительностью будет обладать созданный
им новый состав; в большинстве случаев это в общих чертах можно
предвидеть до проведения испытаний.
§ 1. ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ СОСТАВОВ
К ТЕПЛОВЫМ ВОЗДЕЙСТВИЯМ
Определение чувствительности пиротехнических составов
к тепловым воздействиям сводится к определений' температуры
их самовоспламенения и к определению чувствительности к лучг
огня.
Определение температуры самовоспламенения
Реакция разложения пиротехнических составов может проте-
кать с малой скоростью и при температурах бол<‘е низких, чем
температура их самовоспламенения.
Температурой самовоспламенения называется Т'я наименьшая
температура, до которой должен быть нагрет состав чтобы затем
произошло его самопроизвольное загорание, сопровождающееся
отчетливо воспринимаемым световым, звуковым илц дымовым эф-
фектом.
По современным воззрениям сущность явления самовоспламе-
нения заключается в следующем. При низкой температуре скорость
экзотермической реакции в пиротехническом cocTai*e мала и все
выделяющееся при этом тепло ьспевает отводиться н окружающую
среду.
При повышении температуры скорость реакции и теплоприход
в составе быстро возрастают и в известный момент теплоприхо.1
начинает превышать теплоотвод; начинается повыцЩние темпера-
туры за счет саморазогрева, резко увеличивается спорость Проте-
кающих в составе химических реакций и все это заканчивается
самовоспламенением состава.
Температура самовоспламенения для одного и тОГ0 же состава
не является вполне постоянной величиной, по з значительной сте-
пени зависит От созданных При ее определении услоВий теплопри-
хода и теплоотвода; поэтому на практике строго регламентируют
навеску состава и устройство прибора (способ и время нагрева).
101
Одни из возможных способов определения температуры само-
воспламенения пиротехнических составов заключается в следу-
ющем.
Специальную железную баню, наполненную сплавом Вуда,'на-
греваю]' до перехода сплава полностью в жидкое состояние, после
чего в баню погружают на треть длины три стеклянные пробирки,
в одну из которых вставлен термометр.
Затем баню нагревают до температуры, близкой к ожидаемой
температуре самовоспламенения состава. По достижении этой
температуры в дне оставшиеся незанятыми пробирки всыпают
цо 0,1 г пиротехнического состава и, выдерживая температуру бани
постоянной, регистрируют время до наступления самовоспламене-
ния состава (время индукции), В случае отсутствия само-
воспламенения в течение 5 мин испытание Прекраща-
ют и в журнале результат ено отмечают словом «Отказ»..
Ряд таких испытаний, проводимых при различных температурах,
каждый раз с новыми навесками состава дает возможность уста-
новить с точностью до 5° С минимальную температуру, ниже кото-
рой при времени испытания 5 мин самовоспламенения ire происхо-
дит. Эта температура и принимается за температуру самовоспла-
менения.
При желании результаты испытания можно дополнить, соста-
вив график, показывающий зависимость времени индукции (време-
ни задержки воспламенения) от температуры испытания.
Испытания составов, температура самовоспламенения которых
более 400—450’С, проводят, исщользу.я вместо бани электропечь;
в этом случае вполне достаточно определять температуру самовос-
пламенения с точностью до |03С.
В качестве иллюстрации ниже приводятся данные о темпера-
туре самовоспламенения некоторых двойных смесей, полученные
с использованием описанной выше методики,
Температура самовоспламенения двойных смесей, в состав
которых входят в качестве окислителя хлораты, например, хлорат
калия (табл. 9. 1 и 9,2), в большинстве случаев значительно ниже
Таблица 9.1
Температура самовоспламенения двойных смесей в °C
(окислитель и горючее взяты в стехиометрических соотношениях)
Температура самовоспламенения
сера МОЛгГГ лги! caxtip дрслсс- h еДЙ уголь магние- вый | порошок, а ;еЮ.\] in еейсиди пудра
Окне .ТИТС ль
Хлорат КЙ-ТИЯ 220 105 335 t 5 10 : 785
1 Герхлррат кадия 560 315 460 150 765
1Нпрат калия 440 390 415 565 >890
102
Таблица 9.2
Температура самовоспламенения двойных смесей с хлоратом калия
Г орючее Температура самовоспламене- ния н °C I ! Горючее I Температура самовоспламене- ния н “С
Шеллак 250 Антимоний 2<Й
Илитол 345 Г рафит 890
Канифоль 335
температуры самовоспламенения перхлоратных' или нптратлых
смесей (с теми же горючими).
Исключением из этого правила являются двойные смеси, содер-
жащие в качестве горючих порошки металлов.
Эллерн [9] разделяет пиротехнические горючие (без добавления
К ним окислителя) на три группы в зависимости от значения их тем-'
пературы вспышки, а именно:
1. Температура вспышки ............. ei пределах 200—ЗБО^С
2. То же............................. л пределах 350 гЛЮ'С
3. То же............................ выше 7003С
К первой группе он относит Zp Ti, PKI)ac„, S, Th и, как оц пишет,
возможно, Nb и Та; ко второй группе Mg (520—540° С),
Мп (492° С), сульфиды сурьмы и мышьяка, возможно, цинк и сили-
цид кальция; в третьей группе по Эллерну числится только алю-
миний. Надо думать, что чем ниже будет температура вспышки
горючего, тем, как правило, будет ниже н температура самовоспла-
менения изготовленного с участием этого горючего пиротехниче-
ского состава.
В 1943 г. 1 L Ф. Жировым был разработан и стандартизован но-
вый метод определения температуры самовоспламенения пиротех-
нических составов (ГОСТ 2040—43), По этой методике температу-
ру самовоспламенения определяют в электропечи, температура
которой измеряется термопарой, соединенной с милливольтметром.
При этой методике испытания наряду с температурой самовос-
пламенения и временем индукции находят также н так называемую
температуру вспышки, значение которой и принимают по ГОСТу
в качестве характеристики состава. За температуру вспышки при-
нимают температуру, при которой время индукции до самовос-
пламенения состава равно нулю.
Значение температуры вспышки находят на графике путем
экстраполяции (фиг. 9.1).
Температура вспышки (ГОСТ 2040—43) для многих составов
значительно выше, чем температура их самовоспламенения, опре-
деленная по старой методике на бане, причем полного соответствия
103
между данными, полученными при испытании одних и тех же
составов но этим двум методикам, нет (табл. 9.3).
Принятый в настоящее время в качестве основного метода испы-
тания .метод II. Ф. Жирова бодее сложен, чем описанный ранее.
Фиг. 9.1. График для определения темпера-
туры вспышки.
и каждое определение яв-
ляется, учитывая число
требуемых стандартом па-
раллельных испытаний,
более трудоемким. Одна-
ко при работе с трудно-
воспламенясмыми соста-
вами (зажигательными
и др.), где целью опреде-
ления является подбор к
испытуемому- составу со-
ответствующего воспламе-
нителя, применение мето-
да Н. Ф. Жирова имеет
несомненные преимущест-
ва перед старой методи-
кой, 4:
Таблица 9,3
Температура самовоспламенения и температура вспышки двойных смесей
№ по пор* Рецепт двойной смеси н % Температура самоноспла- менення (на бане) °C Температура вен ышки (ГОСТ 2040—13) “С
1 Хлорат казни— 86, идитол—14 345 510
2 Нитрат калия—86, идитол —14 460 570
3 Хлорат калия—63, магний—37 540 670 ’
4 Нитрат калия—63, магний—37 565 670 '
5 Нитрат натрия- 65, магний—35 - 610
6 Нитрат бария—68, магний—32 510 660
7 Нитрат натрия—66, алюминий (пуд- ры)—34 800
8 Дымный порох ЗШ 480
9 Воспламенительный состав: 445 555
нитрат калия—75, магний--10, идитол—15
Определение чувствительности к лучу огня
Определение чувствительности пиротехнического состава к огне-
вому импульсу имеет целью облегчить правильный подбор к нему
104
воспламенительного состава, который обеспечил бы в боевых усло-
виях его безотказное воспламенение.
Вместе с тем результаты этого испытания характеризуют так-
же степень огнеопасности состава, понимая под этим, например,
возможность его воспламенения при попадании на пего случай-
ной искры.
В качестве огневого импульса при этом испытании применяется
луч огня, образующийся при выбросе пламени из открытого пря-
мого среза горящего бикфордова шнура.
Характеристикой чувствительности состава при этом испытании
является то наибольшее расстояние между нижним срезом бикфор-
дова шнура и поверхностью состава, при котором еще происходит
воспламенение состава.
По предложению Н. Ф. Жирова чувствительность состава к лучу
Огня характеризуется:
а) верхним пределом чувствительности, т. е. тем наибольшим
расстоянием между срезом бикфордова шнура и поверхностью со-
става, при котором происходит 100%-ное воспламенение состава;
б) нижним пределом чувствительности, т. е. тем наименьшим
расстоянием между срезом бикфордова шнура и поверхностью
состава, при котором происходит 100% отказов (состав не воспла-
меняется);
в) фактором безотказности, т. е, тангенсом угла наклона пря-
мой, соединяющей полученные опытным путем точки на графике,
где по оси абсцисс отложено расстояние между срезом бикфордо-
ва шнура и поверхностью состава, а по оси ординат — процент
воспламенения,
Ниже приводятся результаты испытаний некоторых составов
по этой методике (см. табл. 9,4),
Таблица 9.4
Чувствительность составов к лучу огня
(eio данным И. И. Вернидуба гг В. А. Сухих)
Состав Верхний предел см Нижний п редел см Фактор безот- казности
Дымный порох марки № 1 2 15 0,7
Воспламенительный 3 13 0,8
Красного огня 0 2 3,0
Осветительный 0 3 1,0
Недостатком этого метода испытания является не вполне удов-
летворительная воспроизводимость результатов; метод должен
быть улучшен: вместо бикфордова шнура может быть использован
капсюль-воспламенитель.
105
Мало пригодны для практической оценки воспламеняемости
составов методы испытания, оспованные на длительном воздействии
на поверхность состава пламени газовой горелки, где. .мерой оценки
воспламеняемости состава служит период индукции, т. е. промежу-
ток времени от начала нагревания до момента воспламенения
состава.
Для составов, не воспламеняющихся вообще от луча огня
бикфордова шнура, проводят дополнительные, пока гее стандарти-
зованные, испытания для выявления их способности загораться
от воспламенительных составов, обладающих различной зажига-
тельной способностью. При этом постепенно переходят от более
слабых к более сильным воспламенительным составам.
До сего времени, к сожалению, не разработана методика опре-
деления чувствительности составов к воздействию на них лучистой
энергии; сравни [119, стр, 27].
§ 2, ОПРЕДЕЛЕНИЕ ЧУВСТВИТЕЛЬНОСТИ СОСТАВОВ
К МЕХАНИЧЕСКИМ ВОЗДЕЙСТВИЯМ
В процессе изготовления и уплотнения, как бы осторожно эти
Операции не проводились, пиротехнические составы неминуемо
подвергаются определенным Механическим воздействиям. Чаще
всего при этом возникают трушие усилия, но не исключена возмож-
ность толчков и ударов. Не исключена возможность удара и при
перевозке пиротехнических изделий.
При стрельбе артиллерийскими снарядами в момент выстрела
возникают значительные инерционные напряжения. Эти напряже-
ния могут повлечь .за собой сдвиги находящихся в снарядах пиро-
технических зарядов и других элементов снаряжения, причем мо-
жет возникнуть значительное трение.
В связи с этим изучение чувствительности пиротехнических со-
ставов к механическим воздействиям имеет большое значение.
При испытании составов на чувствительности к механическим
воздействиям производят обычно испытание на чувствительность
к удару к испытание на чувствительность к трепню.
Следует заметить, что иногда пиротехнические составы, более
чувствительные к трению, обладают и большей чувствительностью
к Удару, по полного соответствия между этими характеристиками
ист, так же как нет соответствия между температурой вспышки со-
ставов и их чувствительностью к удару или трепню. Это объясняет-
ся тем, что способность воспринимать энергию в данной ее форме
различна у разных пиротехнических составов; эта способность за-
висит от физических свойств составов я условий, при которых про-
изводится воздействие. См. также [111, стр. 2661,
Определение чувствительности к удару
Для определения чувствительности пиротехнических составов
к удару используют ту же аппаратуру, т. е. вертикальные копры
106
и роликовые приборчики, что и при аналогичном испытании взрыв-
чатых веществ (флг, 9.2).
Копры и роликовые приборчики перед пуском в эксплуатацию
проходят техническую приемку в соответствии с ГОСТом 4545—48.
Согласно указаниям ГОСТа 2039—43 при работе с пиротехни-
ческими составами на копре используют груз весом 10 кг; при
испытании более чувствительных составов применяется груз 5 кг.
Площадь состава, на которую приходится удар, составляет 0,5 см2,
а навеску состава берут равной 0,05 с,
В качестве характеристики чувствительности пцросоставов
К сдару в ГОСТе указывается две величины: 1) наименьшая вы-
Фиг. 9.3. График зави-
симости количества взры-
вов (в °/о) от высоты
падения груза.
Фиг. 9. 2. Роликовьи! при-
бор,
/—бо1‘.к, 2—направляющая
Муфта, 3—|рК01|И-ТЬНЯ» 4 -под-
дон.
сота падения груза, при которой получается 95±5% взрывов
из 25 параллельных испытаний, называемая верхним пределом чув-
ствительности, и 2) наибольшая высота падения груза, при которой
получается 100% отказов, называемая нижним пределом чувстви-
тельности.
Одновременно при аналогичных условиях испытывают эталон-
ные. составы и сравнивают между собой результаты испытаний
Опытных и эталонных составов.
При особо ответственных испытаниях проводят большое количе-
ство испытании при разных высотах падения груза и вычерчивают
график зависимости количества произошедших взрывов в процен-
тах (от 0 до 100%) от высоты падения груза (фиг. 9. 3).
В те\ случаях, когда кривые чувствительности получаются бо-
лее пли менее симметричными, можно находить ту высоту падения
груза, при которой получается 50% взрывов, а затем выражать
чувствительность к удару величиной работы (в кГ-м), отнесенной
к единице площади состава, по которой удар распространяется:
.__р-Ь кГ ‘М
~ S' см2 ’
107
где р— вес груза в кг;
h — высота его падения в м;
S — площадь поперечного сечения ролика в см2.
Ниже приводятся полученные таким способом данные о чувст-
вительности к удару некоторых двойных пиротехнических смсссй,
в которых окислитель и горючее взяты в стехиометрических соот-
ношениях (см. табл. 9. 5 и 9. 6).
Таблица 3.5
Работа удара в кГ-м/см" для двойных пиротехнических смесей
Горючее
Окислитель сера ПОЛОЧ- НЫЙ сахар древес- ный Vj ОЛЬ магнпе- пый порошок а .тв 1,ч jf- нцеваи и у др а
Хлорат калия 1,1 1,8 3.2 4,5 4,-“>
Перхлорат калия 1,2 2,9 4.2 4,4 <1
Нитрат калия 3,6 5 4,6 -
Опубликовано много работ о возможных способах математиче-
ского выражения чувствительности веществ к удару. Неоднократно
высказывались мнения, что надо учитывать высоту обратного
Отскока груза (/f) и оценивать чувствительность вещества или
смеси величиной работы, действительно поглощающейся при ударе
(A=p(h-h')/S).
Таблица 9.6
Чувствительность к удару двойных смесей, окислителем в которых
является хлорат калия
Горючее Работа удара к Г ~м)см9 Г орючее Работа удара кГ-м/см'1
Роданистый калий (KCNS) Реальгар (AsjSj) Парафин Сера 0,5 0,6 1,1. 1,1 Нафталин Железистосинероди- стый калий K4Fe(CN)s.HtO Антимоний Sb^Sj Графит । 1,3 2.2 3,5 Ю
Наряду с этим указывалось, что процент взрывов при одной
и той же работе удара в большой мере зависит от конечной ско-
рости падения груза; так, например, при падении груза 2 кг с вы-
108
? 2. 3
Фиг. 9. 4. Приборчик № 2.
/—боек, 2—нак0Ш1лькя, 3—направля-
ющая муфта.
соты 0,5 л! процент взрывов получается больший, чем при падении
груза 5 кг с высоты 0,2 м.
В различное время предлагались новые конструкции копров
и приборчиков для определения чувствительности к удару, но боль-
шинство из этих предлагавшихся подчас весьма сложных конструк-
ций не пашло себе широкого практического применения.
Особо следует отметить работу Н. А. Холезо, разработавшего
новую конструкцию приборчика, названного им «Приборчик № 2»
(фиг. 9.4).
Отличительной особенностью этого приборчика, как видно из
фигуры, является наличие кольцевой кацавки, выточенной внутри
матрицы. Эта особенность приборчика
позволяет испытуемому веществу в мо-
мент удара выдавливаться из-под ро-
лика в эту канавку.
Использование при работе этой но-
вой конструкции практически означает
введение нового комбинированного ис-
пытания, заключающего в себе как
элементы удара, так и элементы тре-
ния.
За последние годы появился ряд
работ по вопросу о механизме возник-
новения взрыва в ВВ п о .методах оценки чувствительности ВВ
к механическим воздействиям, а именно, работы Н. А. Холево,
К. К. Андреева с сотрудниками, Ф. Боудена [119, стр. 5—130;
111; 116]. В известной мере выводы, сделанные в этих работах, мо-
гут быть перенесены и на пиротехнические составы.
В частности, К. К. Андреев [I 19, Стр- 92] приходит к выводу, что
«испытание на копре в различных его вариантах (прибор № I
по ГОСТ 4545—48 и прибор № 2) имеет тот принципиальный не-
достаток, что оно характеризует преимущественно возможность
возникновения очагов реакции, а не распространения процесса».
В связи с этим оц указывает, что «в сочетании с определением
воспламеняемости (способности к горению) результаты испытания
на маятниковом приборе В. С. Козлова1, по-видимому, лучше, чем
другие методы, могут характеризовать опасность ВВ при механи-
ческих воздействиях». Это высказывание К. К. Андреева не озна-
чает. что испытания ударом на копре не нужны, но отражают его
мнение, что при испытании в приборчиках на копре не модели-
руются в достаточной мере те условия, которые могут возникнуть
При практической работе с В В.
Определение чувствительности к трению
Некоторые указания на степень чувствительности составов
к трению может дать растирание их в цеглазурованной фарфоровой Е
Е Описание прибора см. ниже.
109
ступке. Для этой цели обычно употребляют ступку диаметром
10 см и высотой 6 см, в которую помещают взятый на кончике ножи
пиротехн'нческнй состав (в количестве, не большем чем 0,02 —
0,03 г). Состав растирают пеглазуроваппым фарфоровым пести-
ком, причем производящий испытание должен иметь предохрани-
тельные очки (пз органического стекла). Это испытанно нс требует
Много времени и легко осуществимо, но имеет, конечно, суъектнв'
пый характер (зависит от приемов трения и сиды эксперимента-
тора).
Очевидно, в принципе возможно создать прибор, осуществляю-
щий вращательное и вибрирующее движение пестика в ступке
и вместе с те.м фиксирующий то давление, которое оказывает
пестик пр[I растирании им навески состава.
В 1938 г. G. Г. Добрыш разработал прибор для определения
чувствительности ВВ ц пиротехнических составов к трению.
Испытуемый состав в этом приборе растирается между двумя
параллельными стальными поверхностями, нижпяя из которых
(матрица) неподвижна, а верхняя (пуансон) вращается си ско-
ростью 150 об!мин. К, пуансону может быть Приложено давление
до 2000 кПсм2. Навеска состава 0,02 г; к ней для увеличения тре-
ния добавляется 0,002 с тонкого кварцевого песка. Продолжитель-
ность трения 10 сек. Чувствительность к трению оценивается коли-
чественно по минимальному давлению (в кг/см2), при котором прп
растирании испытуемого образна происходит воспламенение.
Для каждой нагрузки проводится шесть испытании; параллель-
но проводят опыты с эталонным веществом, чувствительность
к трению которого уже известна.
Описанный выше метод нуждается однако в значительном усо-
вершенствовании; многие составы при трении в этом приборе нс
взрывают даже при нагрузке в 2Q00 кГ/см2.
Чувствительность к Трению некоторых двойных смесей, испы-
танных на приборе Добрыща, показана в табл. 9.7; компоненты
этих смесей взяты в стехиометрических соотношениях.
Таблица 9.7
Чувствительность к трению двойных смесей различных горючих
с хлоратом калия
Горючее Чувствительность к трению КПСМ- I . j I орючсс 1 Чувствительность к тредню кГ;см'2
K3Fe(GN)t,- 8 1 г • Сера 65
KCNS 22 K4Fe(CN')6-H2O 85
Молочный сахар G0 Антимоний 90
Боуден и Гартон [111, стр. 322] разработали прибор для опреде-
ления чувствительности ВВ к трению. В этом Приборе навеска В В
ПО
в горизонтальном направ.
2 1
зажата между двумя горизонтальными параллельными стальными
поверхностями (роликом и стержнем). Под действием бокового
удара стальной стержень сдвигается
иии н при этом сдвиге ВВ подвер-
гается сильному, трепню.
В. С. Козлов видоизмени/! этот
Прибор- В приборе Боудена—Коз-
лова (фиг. 9.5) навеска ВВ сжи-
мается между двумя роликами диа-
метром 10 мм. Удар маятника пере-
дается верхнему подвижному' ролику
Д который перемещается при этом
в горизонтальном направлении меж-
ду- расположенным над ним непод-
вижным упором 2 и нижним роли-
ком 3. закрепленным в муфте 6. Чув-
ствительность ВВ в этом приборе
определяется по изменению частости
взрывов с изменением давления при-
жатия. Прибор позволяет увеличи-
вать последнее до 8000—
10000 кГ]см2. Тротил на этом при-
боре дает взрывы, начиная с давления прижатия около 5000 «Г/слш.
Так как при испытании обычно имеет место некоторый перекос по-
движного ролика при ударе, то в данном случае мы имеем дело не
с трением, а сочетанием трения со скользящим ударом.
Фпг. 9.5. Узел прибора !>:-у..е
Козловз для определения чувстви-
тельности ВВ к трению.
/-подвижный рол в к, 2-упор, З-нспод-
рпжньтй резчик, 4-[5В. -HoplncErh дли
передачи дтстсщнЕ пресса на ролик r?s
/7—муфта, Г-стерженн с головкой, пере-
дающий удар,
§ 3. ФАКТОРЫ, ВЛИЯЮЩИЕ НА ЧУВСТВИТЕЛЬНОСТЬ СОСТАВОВ
К НАЧАЛЬНЫМ ИМПУЛЬСАМ
Количество энергии, которое необходимо сообщить системе для
возникновения в ней быстрой химической реакции, определяется,
с одной стороны, внутренним сопротивлением системы, а с дру-
гой — возможностями ее собственной энергетики.
Влияние энергетики сказывается в способности реакции, начав-
шейся в малом объеме за счет внешнего импульса, к саморазвитию
за счет выделяющейся при ее протекании энергии. Чем эта склон-
ность к саморазвитию реакции будет больше, тем больше будет
вероятность распространения реакции даже при сравнительно сла-
бом начальном импульсе.
«Для того чтобы произошла химическая реакция, необходимо
разорвать существующие химические связи и образовать новые»,—
пишет Н- II. Семенов.
Внутреннее сопротивление системы определяется тем количест-
вом энергии, которое необходимо для разрыва связей; эту величину
принято называть энергией активации процесса.
Количество энергии, выделяющееся по завершении процесса,
определяется разностью количеств энергии, выделяющейся При
111
образовании новых связей, и энергии, необходимой для разрыва
первоначальных связей.
Абстрагируясь временно от влияния внешних физических фак-
торов, можно сказать, что чувствительность химической системы
к воздействию на нее начальных импульсов определяется прежде
всего величиной энергии активации и величиной теплового эффек-
та реакции.
И та и другая величины выражаются в одинаковой размерно-
сти — ккал/г • моль.
Но это безусловно справедливое общее положение во многих
случаях не дает возможности практически разобраться даже в чув-
ствительности индивидуальных веществ1 (ВВ), Тем более затруд-
нительным становится положение, когда мы рассматриваем такую
многокомпонентную и к тому же, что следует особо подчеркнуть,
гетерогенную систему, как пиротехнический состав,
При реальном рассмотрении возможности возбуждения реак-
ции в пиротехническом составе мы практически прежде всего долж-
ны обращать внимание на степень легкости осуществления отдель-
ных «элементарных» процессов: процесса распада окислителя
и затем процесса окисления горючего.
Исчерпывающими характеристиками этих более простых, но по
существу еще очень сложных процессов должны были бы опять
являться энергия активации и теплота реакция процесса.
Но практически нац приходится в большинстве случаев ограни-
читься рассмотрением теплоты реакции процесса, а вместо энер-
гии активации рассматривать значения температуры распада окис-
лителя или температуры вспышки или разложения горючего. Со-
ответствующий цифровой материал для различных компонентов
состава можно найти в таблицах, помещенных в гл. I! и Ш.
Чем меньше энергии требуется для осуществления распада окис-
лителя и чем ниже температура его распада, тем при прочих рав-
ных условиях (прежде всего, одно и то же горючее) состав будет
более чувствителен к начальным импульсам (см. табл. 9.1 и 9,5),
Из сравнения свойств составов с тремя различными окислите-
лями— хлоратом кадия, перхлоратом калия и нитратом калия —
мы видим, что наибольшей чувствительностью обладают хлоратные
составы, так как процесс распада хлората калия протекает уже при
сравнительно низкой температуре ~350°С и, что весьма существен-
но, в отличие от процессов распада большинства других окисли-
телей сопровождается выделением ощутимого количества тепла.
Несколько мецыцей чувствительностью обладают смеси с окис-
лителем перхлоратом калия (см. в табл. 2, 1 теплоту его реакции
разложения) и значительно меньшей чувствительностью — смеси
с окислителем нитратом калия (см, теплоту его разложения),
1 Основными затруднениями при этом являются: I) то, что реалЕЛгая энергия
активации процесса имеет очцееь мало общего с энергией активации термического
разложения, и 2) влияние различных физических факторов, связанное с равной
скоростью восприятия энергии, поступающей извне,
112
Наиболее трудно и при наиболее высокой температуре распа-
даются такие окисли металлов, как окись железа, закись-окнсь же-
леза и др.
Очевидно, изготовленные с их участием составы будут иметь
наименьшую чувствительность ко всем видам начальных импульсов.
Отметим, в частности, что железо-алюминиевый термит весьма
мало чувствителен к удару и трению, имеет температуру воспламе-
нения около 13003 С и не воспламеняется не только от луча огня
бикфордова шнура, но и при нагревании его пламенем газовой
горелки.
Значительно сложнее обстоит дело при рассмотрении чувстви-
тельности составов с одним и тем же окислителем, но с различны-
ми горючими.
Малую чувствительность имеют составы, в которые входят
только очень низкокалорийные горючие, а также окислитель,
требующий большого количества тепла на свое разложение.
К таким составам относятся, например, двойные смеси нитратов
с серой- Малую чувствительность имеют составы, содержащие
в себе только очень трудноокислясмые горючие с очень высокой
температурой воспламенения,, например, графит или кремний.
При рассмотрении чувствительности составов с различными го-
рючими очень большое значение приобретают индивидуальные фи-
зические свойства горючего — температура плавления и кипения,
теплопроводность, пластичность, твердость и т, п.
Именно в этом случае в наибольшей степени нарушается экви-
валентность в отношении чувствительности составов к различным
видам начальных импульсов н приходится уже разбирать отдель-
но, как с изменением горючего изменяется температура вспышки,
чувствительность к трению и т- п.
Из Отдельных двойных смесей следует отметить крайне высо-
кую чувствительность смесей хлората калия с фосфором; они взры-
ваются уже при легком растирании их резиновой пробкой или при
самом легком ударе.
Весьма чувствительны к удару и трению смеси хлоратов с се-
рой, селеном, металлическим мышьяком и сульфидами фосфора,
мышьяка и сурьмы. Особо высокой чувствительностью к удару
и трению обладают, как это видно из табл. 9.6 и 9.7, смеси хлора-
тов с роданистыми, железо- и железистосинеродистыми соедине-
ниями. Значительной чувствительностью к трению обладают смеси
хлоратов с различными органическими горючими: углеводами,
смолами и т. п.
Чувствительными к трению и очень опасными в обращении
являются двойные смеси хлоратов с порошками металлов — маг-
нием или алюминием.1
1 Ввиду большой взрывоопасности в некоторых странах запрещено изго-
товление смеси КС10з+А| [8].
8 .А. А. ГН пяловский 11'1
Из двойных смесей с нитратами металлов значительную чувст-
вительность к удару и трению имеют, не считая весьма чувстви-
тельных смесей с фосфором и сесквисульфидом, только смеси с по-
рошками высоко активных металлов — магния, алюминия, цирко-
ния и др.
Чувствительность смесей нитратов с органическими горючими
в большинстве случаев невелика.
Температура самовоспламенения алюминия значительно выше
температуры самовоспламенения магния и потому температура
самовоспламенения составов с алюминием значительно выше,
чем та же величина для составов с магнием; в связи с этим для
воспламенения составов с алюминием приходится применять вос-
пламенительные составы с более высокой температурой горения
От луча огня бикфордова шнура, как правило, легче воспламе-
няются составы, имеющие более низкую температуру вспышки.
Без труда воспламеняются от луца огня дымный порох, двойные
смеси нитрата калия с углем или идитолом и большинство хлорат-
ных составов.
Как правило, в спрессованном виде составы значительно менее
восприимчивы к лучу огня, чем в виде порошка.
Чувствительность составов к лучу огня увеличивается с умень-
шением величины зерна компонентов, поэтому наиболее опасными
в пожарном отношении являются составы, изготовленные из компо-
нентов, измельченных до «пылевидного» состояния.
На основании имеющегося фактического материала можно сде-
лать вывод, что более чувствительными являются те составы, в ко-
торых компоненты находятся в стехиометрических соотношениях
или имеется небольшой недостаток горючего; составы с большим
избытком горючего, как правило, менее чувствительны к началь-
ным импульсам.
Иэ факторов физического порядка следует отметить измельче-
ние компонентов. Рассматривая этот вопрос с теоретической сто-
роны, следует указать, что более тонкое измельчение входящих
в состав компонентов должно способствовать их более тесному
соприкосновению, а следовательно, и облегчать условия возникно-
вения реакции горения.
Действительно, как было уже указано выше, чувствительность
составов к лучу огня повышается при уменьшении размера частиц
компонентов состава; меньшее влияние степень измельчения ком-
понентов оказывает на температуру самовоспламенения 1 и чувст-
вительность к удару многих составов. Влияние измельчения компо-
нентов ла чувствительность составов к Грецию мало изучено:
1 В тех случаях, когда размеры частиц горючего очень малы (порядка микро
па и меньше), происходит очень большое увеличение поверхности вещества,
которое приводит к значительному снижению температуры самовоспламенения
горючего. Так, например, сублимированный магний, осевший на стенках сосуда
в виде мельчайших кристаллов, самовоспламеняется при соприкосновении с воз
духом уже при комнатцод температуре.
114
известно, что в отдельных случаях наличие крупных зерен твердого
окислителя может несколько увеличить чувствительность состава
к трению.
Увеличение плотности состава понижает его чувствительность
к начальным импульсам (кроме температуры самовоспламенения),
так как при большей плотности то же количество энергии прихо-
дится на большое количество (большую массу) состава, и эффек-
тивность воздействия на отдельные частицы состава оказывается
меньшей.
С увеличением начальной температуры чувствительность пиро-
технических составов к механическим воздействиям и к лучу огня
повышается, поэтому при сушке пиротехнических составов должны
быть приняты соответствующие меры предосторожности.
Введение различных примесей в пиротехнические составы ока-
зывает во многих случаях большое влияние на их чувствитель-
ность к механическим и тепловым импульсам.
Добавление к пиротехническим составам флегматизаторов —
мягких пластических веществ, например, таких, как парафин, вазе-
лин, стеарин, различные масла — уменьшает их чувствительность
к трению и чувствительность к лучу огня.
Чувствительность к трению уменьшается при этом вследствие
распределения усилия трения до большей массе состава.
Чувствительность к лучу огня понижается вследствие того, что
флегматизатор покрывает пленкой отдельные частицы состава
и тем самым затрудняет проникновение к ним тепла; сам же флег-
матизатор в большинстве случаев представляет собой малоактив-
ное трудновоспламенягощееся вещество.
На чувствительность к удару введение органических флегмати-
заторов оказывает незначительное воздействие; иногда при введе-
нии в состав парафина или сходных с ним веществ чувствитель-
ность к удару увеличивается, что, например, наблюдается в смеси
хлората калия с магнием.
Безусловными флегматизаторами, снижающими чувствитель-
ность составов ко всем видам начального импульса, если они вве-
дены в состав в большом количестве, являются инертные вещества,
не принимающие активного участия в процессе горения. К таким
веществам следует отнести окись магния, фторид магния, фторид
бария и др., а при отсутствии в составах свободных металлов —
также карбонаты, оксалаты и т. п.
Так, например, в составе красного огня, содержащего хлорат
калия — карбонат стронция — идитол роль флегматизатора играет
карбонат стронция; идитол же назвать флегматизатором в данном
случае нельзя, хотя он и представляет собой мягкое пластичное
вещество. В приведенном составе идитол является основным горю-
чим и принимает активное участие в процессе горения.
Примеси песка, стекла и других твердых веществ значительно
повышают чувствительность пиротехнических составов к механиче-
ским воздействиям и делают их очень опасными в обращении.
8*
11&
В некоторых случаях увеличение чувствительности составов к уда-
ру и трению происходит и при введении в них твердых порошков
металлов (например, ферросилиция) или твердых кристаллов неко-
торых окислителей.
Значение твердости по шкале Мооса можно для многих веществ
найти в справочниках или определить опытным путем.
При добавлении к составу очень твердого вещества механиче-
ские усилия (удар, трение) концентрируются па этих частицах,
Эта местная концентрация энергии приводит к увеличению чувст-
вительности состава.
Имеющиеся в литературе сведения о чувствительности пиротех-
нических составов скудны и разбросаны в качестве добавлений
в отдельных статьях в периодических изданиях.
Из сообщений, посвященных в основном чувствительности пиро-
технических составов, должны быть отмечены статьи Блинова [114],
Томлинсона и Одрита [122], Лангханса [139]. Существенные указа-
ния имеются также в пиротехнике Эдлерпа [9], который, отмечая
особую опасность хлоратных смесей, указывает также на большую
чувствительность смесей, окислителями Н которых являются пер-
хлораты аммония и щелочных металлов и некоторые кислородные
соединения свинца, в особенности РЬОг. Он же пишет, что опас-
ность случайного инициирования статическим электричеством вели-
ка в присутствии топких порошков (единицы мк) таких металлов,
как Zr, Mg и Al.
Глава X
МЕХАНИЗМ ГОРЕНИЯ Н ФАКТОРЫ, ВЛИЯЮЩИЕ
НА СКОРОСТЬ ГОРЕНИЯ ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
§ 1. МЕХАНИЗМ ГОРЕНИЯ СОСТАВОВ
Процесс сгорания Пиротехнических составов можно разделить
на три отдельные стадии: зажжение, воспламенение и горение.
Зажжение состава обычно осуществляется црц помощи теп-
лового импульса, который сообщается только ограниченному участ-
ку поверхности пиротехнического состава.
Воспламенением состава принято называть распростране-
ние горения по всей поверхности состава.
Собственно горением называют распространение про-
цесса в глубину.
Скорость воспламенения пиротехнических составов во много
раз больше, чем скорость их горения; подобное соотношение на-
блюдается и для порохов (как дымных, так н бездымных).
Для одного и того же состава скорость воспламенения зависит
от следующих факторов:
116
1, От степени измельчения компонентов: чем тоньше измельче-
ны компоненты, тем больше общая поверхность состава и тем лег-
че и быстрее идет воспламенение.
2, От плотности состава: чем больше плотность состава, тем
меньше становится его общая поверхность (уменьшается количест-
во пор в составе) и тем труднее и медленнее происходит его вос-
пламенение.
3. От начальной температуры состава: чем опа выше, тем легче
и быстрее протекает процесс воспламенения.
4, От внешнего давления: при повышении внешнего давления
скорость воспламенения сильно увеличивается; объяснить это мож-
но тем, что сжатые газы передают больше тепла в единицу времени
воспламеняемой ими поверхности конденсированной системы, чем
те же газы при атмосферном давлении.
5. От состава газовой фазы и, в частности, от содержания в ней
кислорода, который активно участвует в процессах воспламенения
многих пиротехнических составов (ср. [III, Стр. 154]).
Наибольшая скорость воспламенения наблюдается для Сдабо-
уплотненпых фотосмесей п для дымного пороха; скорость воспла7
мевення дорожки из дымного пороха в открытом пространстве со-
ставляет 3,5 м]сек.
Следует заметить, что процессы воспламенения как пиротехни-
ческих составов, так и порохов и ВВ еще недостаточно изучены,
и задачей ближайшего будущего должно явиться накопление фак-
тического материала и создание н.з его основе полной теории вос-
пламенения.
Процесс горения пиротехнические составов чрезвычайно сло-
жен. Изучению его до последнего времени уделялось Сравнительно
мало внимания. Наряду с этим в советской литературе за послед-
ние 10—15 лет опубликовано большое количество работ по вопро-
сам механизма горения В В и порохов.
Конечно, процесс горения пиротехнических составов имеет це-
лый ряд особенностей по сравнению с процессами горения В В или
порохов, по многие закономерности в обоих случаях аналогичны,
что было доказано целым рядом экспериментов.
Поэтому при дальнейшем изложении в некоторых случаях про-
водятся аналогии между закономерностями горения пиротехниче-
ских составов, с одной стороны, и закономерностями горения
взрывчатых веществ и порохов, с другой.
Процесс горения пиротехнических составов представляет собой
совокупность многих экзо- и эндотермических химических процес-
сов и физического процесса теплопередачи.
Если, Проводя грубое деление, расчленить процесс горения на
две стадии, то следует указать, что он начинается в конденсиро-
ванной физе и заканчивается в газовой фазе (в пламени).
Процессы, протекающие в конденсированной фазе, следует сум-
марно оценить как эндотермические или слабо экзотермические:
степень экзотермичностн реакции в конденсированной фазе завц-
117
сит как от рецепта состава, так и от условий его горения (внешнего
давления). Процессы, протекающие в газовой фазе (в пламени)
всегда суммарно, являются экзотермичными. Во многих случаях
процессы, протекающие в конденсированной фазе, могут осущест-
вляться только за счет тепла, поступающего туда из газовой фазы
(из пламени).
Это положение подтверждается наблюдением, что все исследо-
ванные до сего времени в этом отношении пиротехнические соста-
вы теряют способность к горению при низких давлениях (имеется
ввиду остаточное давление менее 1 рт. ст.).
Вопрос о соотношении количества тепла, выделяющегося
в конденсированной и газовой фазе, должен рассматриваться
индивидуально для каждого вида составов. Количественные дан-
ные по этому вопросу пока отсутствуют.
Согласно взглядам Андреева, при горении некоторых ВВ при
низких давлениях ведущей является экзотермическая реакция
в конденсированной фазе, при высоких — пламенная реакция. Оче-
видно, это положение применимо и к процессу горения многих
пиротехнических составов.
Непременным условием для осуществления нормального равно-
мерного горения является равенство теплоприхода и теплоотвода
во всех зонах реакции. При нарушении этого равенства горение
или затухает или становится неравномерным,— возникает пульса-
ция
Но расчленение процесса только на две стадии является первым
и притом весьма грубым приближением к действительности,
' Проводя более детальный разбор механизма горения пиросо-
ставов, следует заметить, что существенное различие между ВВ,
с одной стороны, и пиросоставамп, с другой, заключается в том. что
пиросоставы представляют собой гетерогенную систему.
Для осуществления быстрой реакции в гетерогенной системе
прежде всего должна быть обеспечена возможность тесного моле-
кулярного соприкосновения реагирующих между собой веществ.
В твердом состоянии этой возможности не представляется, поэто-
му реакции между твердыми веществами протекают, как известно,
очень медленно, даже при очень высоких температурах; тот факт,
что многие «малогазовые» составы горят довольно быстро, не про-
тиворечит высказываемому положению, так как является очень
вероятным, что основная реакция окисления горючего для этих
составов протекает в жидкой или в газовой фазе, имеющейся в на-
личии "при температуре горения.
Быстрое взаимодействие между двумя компонентами в пиротех-
ническом составе может начаться только тогда, когда хотя бы
один из них будет находиться в жидком или в газообразном со-
стоянии.
Подробнее о пульсирующем горении см. в работах Андреева [ПО].
П8
Если различать процессы по агрегатному состоянию реагирую-
щих веществ, то в конденсированной фазе возможно протекание
двух видов процессов: жидк. + тверд.; жидк. + жидк.
Компоненты составов часто имеют резко отличающиеся друг
от друга температуры плавления, а также температуры кипения
или термического разложения. Имея в виду это обстоятельство,
можно понять, почему во многих случаях реакции между компо-
нентами (или между продуктами их разложения) протекают
на поверхности раздела конденсированной и газовой фаз; в этом
случае возможны варианты; газ + тверд.; газ+жидк.
Ггппх
Фирипезнич.
состав
Реакция на
поверхности
развела, фаз
вмнден-,
____i . 1
Зона. ^ицовант
прогрева^1™
Зам
реакции
в газовой
фазе
Продукта!
реакции.
Фиг. 10. I. Схема горения пиротехнического со-
става.
Возможность протекания химических реакций в большой мере
будет определяться скоростью физических процессов: газовой
(и жидкостной) диффузии, а также возможностью быстрого удале-
ния из сферы реакции продуктов горения.
Наконец, в зоне наиболее высокой температуры все реагирую-
щие вещества будут находиться в газообразном (парообразном)
состоянии, и здесь реакция будет протекать в системе газ + газ,
т. е. в гомогенной газовой системе.
В этой последней стадии горения пиросоставов во многих слу-
чаях значительное участие принимает кислород воздуха. Следует
заметить, что температура в пламени многих пиротехнических со-
ставов значительно выше, чем температура в пламени горящего
при атмосферном давлении пороха или нитросоединения.
Все сказанное выше о .механизме горения пиросоставов может
быть наглядно проиллюстрировано схемой, во многом сходной
со схемой горения пороха, предложенной Я. Б. Зельдовичем
(фиг. 10.1).
Повышение температуры в зоне реакции в конденсированной
фазе может происходить как за счет тепла, передающегося из га-
зовой фазы или с поверхности раздела фаз, так иногда и за счет
тепла реакции, протекающей в самой конденсированной фазе.
Решению вопроса, какие процессы, в конденсированной или
в газовой фазе, доминируют при горении какого-либо конкретного
119
пиросостава, .может способствовать изучение зависимости скорости
горения от давления окружающей среды.
Чем больше скорость горения будет зависеть от давления, тем
больше будет удельный вес реакций, протекающих в газовой
или на поверхности раздела газовой и конденсированной фаз.
Однако описанная выше схема горения пиротехнического со-
става является упрощенной и нс вполне соответствующей действи-
тельности.
В настоящее время доказано экспериментально, что при горе-
нии пиротехнических составов при атмосферном давлении, так же
как и при горении трудно летучих ВВ '111, стр. 171], происходи!
диспергирование частиц нсирореагировавших компонентов состава,
в первую очередь частиц металлических порошков, магния пли алю
мпния, а также капель расплава окислителя (нитрата).
Это выбрасывание в газовую фазу частиц пепрореагировавших
веществ обусловливается неравномерностью протекания реакции
в близком к поверхности слое конденсированной фазы и тем, что
образующиеся в конденсированной фазе газообразные продукты
отрывают и увлекают за собой в пламя твердые (и жидкие) ча-
стицы компонентов состава. Следовательно, и в газовой фазе
во многих случаях сохраняется гетерогенность системы, и ближай-
шую к конденсированной фазе зону пламени следовало бы назвать
дымо-газовой зоной пламени. При дальнейшем движении в пла-
мени эти частипы нС'ПрОреагировавшдх веществ исчезают, реаги-
руя с окружающей их газовой средой.
В отдельных случаях выяснение механизма горения пирососта
вов облегчается рассмотрением свойств входящих' в состав компо-
нентов,
В качестве примера .можно привести рассмотрение механизма
горения состава, изготозлшшого из хлората кплпя и магния.
Укажем температуру плав лениокислителя и температуру
правления и кипения горючего.Хлорат калия плавится со сравни-
тельно небольшим разложением при ЗбО’С1; магнии — при более
высокой температуре G5CBC. а кипит при атмосферном давлении
при 1100° С.
Исходя из этого процесс взаимодействия этих двух ветссТ|.
можно представить себе следующим образом:
I. В конденсированной фазе:
а) КС1ОЗЖПТ(Г;Г + Mg-rn, -•
: г) КСЮзвдадк, —- КС1 б- кислород
2. На поверхности раздела конденсированной и газовой фаз
и в дымогазовой зоне пламени:
a) MgTв + кислород- -
б) MgW3t(. + кислород^
' 11ри наличии r хлорате кддия ката.тигичееких добавок |МпОг, Со;0;
и др.) раидожеиие его происходит уже ори температуре 200—250° С.
120
3. В газовой фазе (в пламени):
а) Mgnap+кислород-.
б) MgnaP+кислород воздуха^
§ 2. ФАКТОРЫ, ВЛИЯЮЩИЕ НА СКОРОСТЬ ГОРЕНИЯ СОСТАВОВ
Существует два способа количественного выражения для ско-
рости горения: можно вычислять линейную скорость горения
и в мм/сек, но можно также вычислят!, массовую скорость горения
им. выражаемую в размерности г/см- сск-, пм определяет собой
количество состава, сгорающее в 1 се.ч. с единицы горящей
поверхности; зная линейную скорость горения и плотность состава,
можно вычислить массовую скорость горении по формуле wM =
=0,1 и-cl, где d— кубическая плотность состава в г/сл?.
Как было уже указано, процесс горения протекает равномерно
лишь при достаточном уплотнении состава, По для того чтобы су-
дить о степени уплотнения состава, необходимо нс только знать его
кубическую плотность d, по и произвести вычисление' коэффициента
уплотнения К, представляющего собой частное от деления практи-
чески Достигнутой плотности а на предельную плотность состава
t/m.ix. находимую вычислением, исходя из плотноеги компонентов,
входящих в состав:
di г ’ dtl
где d], d2___ dn --плотность компонентов состава;
й, ft,. ., п — содержание этих компонентов в составе в %,
Для большинства спрессованных составов коэффициент уплот-
нения колеблется в пределах 0,7 -0,9 L Для порошкообразных со-
ставов так называемая насыпная плотность их составляет 40—60%
от r/niav
Для пиротехнических составов различных рецептов линейная
скорость их горения колеблется весьма значительно в пределах
от десятых долей мм/сек (для дымовых составов) до 20—30 мм/сек
(Для быстрогорящих осветительных составов).
От каких же факторов зависит скорость горения составов?
Скорость сложнейшего физико-химического процесса — горе-
ния— определяется скоростью отдельных (элементарных) химиче-
ских реакций и условиями теплопередачи из одной зоны реакции
в другую.
Условия теплопередачи при неизменном внешнем давлении
и начальной температуре, а также при условии неизменных плот-
ности состава и измельчения его компонентов в значительной мере
определяются разностью температур в различных зонах реакции-
1 11ористость состава будет характеризоваться значением (I —К). Следова-
тельно, пористсгсп, спрессованных составов лежит в пределах 0,3—0,1.
121
Опытным путем установлено, что, как правило, составы, имею-
щие наиболее высокую температуру пламени, являются одновре-
менно и наиболее быстро горящими.
Но наличие значительного числа отклонений и исключений из
этого Правила показывает, что высокая температура в пламени
является только одним из факторов, определяющих собой скорость
горения составов.
Скорость горения сильно зависит от отсутствия пли наличия
в составе низкоплавяшихея или легколетучих компонентов.
То тепло, которое при других условиях вызвало бы резкое по-
вышение температуры в зоне реакции и, следовательно, резкое
ускорение ряда химических процессов, при наличии в составе низко-
плавящихся или легколетучих веществ расходуется на перевод
этих веществ из одного агрегатного состояния в другое.
Именно этим последним обстоятельством объясняется, по наше-
му мнению, тот факт, что такие низкоплавящцеся органические
вещества, как смолы, парафин, стеарин и Др„ при введении их
в двойные смеси (окислитель — металл) резко уменьшают ско-
рость их горения. Еще более решающее влияние на скорость про-
цесса горения оказывает скорость отдельных (элементарных) хими-
ческих реакций.
Ведущими в процессе горения будут высокоэкзотермические
(пламенные) реакции.
Однако скорость сложного многостадийного процесса будет
в целом определяться той минимальной скоростью, с которой про-
текает наиболее трудно и медленно идущая стадия процесса. Наи-
более трудно и медленно протекают эндотермические химические
процессы.
Поэтому во многих случаях скорость горения составов опреде-
ляется именно скоростью процесса разложения окислителя.
Объективным показателем, характеризующим легкость распада
окислителя, может служить парциальное давление пад ним кисло-
рода при различных температурах.
Наиболее простыми по механизму своего распада являются,
по-видимому, окислы металлов, которые применяются в термитно-
зажигательных составах.
Как известно, константа скорости химической реакции К чрез-
вычайно сильно возрастает при повышении температуры по закону
где В — коэффициент пропорциональности (предэкспоненциаль-
ный множитель);
Е— энергия активации в ккал/г-молъ-,
R — газовая постоянная.
Но даже знание максимальной температуры и энергии актива-
ции процесса не дает нам полной возможности предварительного
вычисления скорости, так как «все явления горения связаны со ско-
122
ростью химической реакции, идущей в неизотермических усло-
виях» [137].
Безусловно, очень важно знание всех тех промежуточных ста-
дий, которые проходит процесс горения. Но для установления со-
става промежуточных продуктов реакции в большинстве случаев
требуется проведение весьма сложного экспериментального иссле-
дования; в настоящее время данные эти для большинства реакций
горения пиротехнических составов, к сожалению, отсутствуют.
Переходя к рассмотрению накопленного к настоящему времени
фактического материала, следует указать, что скорость горения
пиротехнических составов определяется как рецептом состава (хи-
мический фактор), так и условиями горения составов (физические
факторы).
Из рассмотрения данных о скорости горения сильно уплотнен-
ных составов (коэффициент уплотнения 700,85) в условиях атмо-
сферного давления и обычной температуры (~20°С) следует, что
одними из наиболее быстро горящих составов являются двойные
смеси нитратов щелочных (или щелочно-земельных) металлов
с магнием, содержащие в себе 50—60% магния. Также очень бы-
стро горят составы с цирконием и титаном.
Составы с алюминием При условии одинакового измельчения
металла горят значительно медленнее, чем составы с магнием.
Медленно горят составы, содержащие в себе в качестве основного
горючего бериллий, бор иди кремнии. Чем выше температура вос-
пламенения горючего, тем меньше при прочих равных условиях
скорость горепия состава на данном горючем. Возможно, имеется
также взаимосвязь между скоростью горения состава и числом
Пиллинга и Бэдворса для содержащегося в составах металла
(а также В и Si).
Для быстрогорящих металлов, Mg и Zr эти числа соответствен-
но равны 0,81 и 1,45; для Be, Si и В эти числа больше и равны
соответственно 1,75, 2,04 и 4,08 (см. также табл. 3.4 на стр. 43),
Скорость горения двойных смесей окислитель — металл быстро
возрастает с увеличением содержания в составе металлического
горючего (конечно до известного предела); для магния этот предел
равен 60—70%; такое увеличение скорости горения в известной
мере связано с повышением теплопроводности состава при увели-
чении в нем содержания металла.
При одинаковом содержании металла двойные смеси нитратов
щелочных металлов с магнием горят быстрее, чем смеси хлоратов
щелочных металлов с магнием. Возможно, причиной этого являет-
ся экзотермическое взаимодействие расплава нитрата с магнием
в конденсированной фазе; подробнее об окислении порошка магния
при повышенных температурах см. в работах Маколкипа и Всрни-
дуба [61].
Из смесей, не содержащих в себе металлических горючих, быст-
ро горят многие хлоратные смеси и дымный порох. За последнее
время появились работы Беляева, в которых рассматривалось
123
влияние серы на скорость горения дымного пороха [127, 128], а так-
же работа Бентура и др. [140] о влиянии на скорость горения поро-
ха различных органических добавок.
Среднюю скорость горения имеют смеси нитрата калия с углем
и идитолом,
Данные о скорости горения различных видов многокомпонент-
ных. пиротехнических составов приведены в табл. 10. 1,
Таблица 10.1
Назначение составом
Скорость горения
при атмосферном
давлений и /<>0,85
.илjeeк
Осветительные
Трассирующие
Сигнальных огнен
Термитно-зажнгательные
Дымовые
1—10
2-] 0
1—3
1—3
0.5—2
Составы с нитратами, не содержащие металлических горючих,
горят в большинстве случаев медленно и мало интенсивно.
Сравнительные данные о скорости горения некоторых хлорат-
ных и нитратных двойных смесей, нс содержащих металлических
горючих, приведены в табл. 10- 2.
Таблица 10.?
Линейная скорость горения двойных смесей в м,и/сек
(окислитель и горючие взяты в стехиометрических соотношениях;
/<=0,.5-Щ),6; составы сжигались в картонных трубках диаметром 16 м.и)
Горючее 1 Окислитель
КС1О3 KN'Oj NaNO3 Ba(NO3):
Сера 2 Не ropiiT Не горит —
Древесный уголь 6 2 1 0гЗ
Сахар 2,5 1 0,5 0,1
Шеллак 1 1 1 0,8
Олифа 0,5 — —
Введение олифы или канифоли в многокомпонентные составы
сильно замедляет процесс их горения.
124
Как видно из табл. 10.2, смеси хлората с серой горят довольно
энергично; смеси же нитратов натрия или калия с серой при обыч-
ной температуре зажигаются с большим трудом и горение их мало
устойчиво. Это объясняется, по-видимому, тем, что количество теп-
ла, выделяющееся при горении серы, недостаточно для того, чтобы
вызвать разложение нитрата и обеспечить, кроме того, прогрева-
ние соседних слоев состава.
При температуре до 300—35ТС реакция разложения нитратов протекает
г образованием нитритов ч предполагаемая реакция между нитратом натрия
и серой может быть виражсва уравнением
2NaN034-S=2NaNCH-S02-|-2I
При этом тепла выделяется всего 0,1 ккал на 1 г состава, и его недостаточно
для самостоятельного распространения реакции.
Однако при наличии сищ.пого начального импульса горение возможно, так
хак при полном восстановлении нитрата реакция сопровождается более значи-
тельным вы делением тепла:
2NaNO3-i-2S = Na2SO4+SO2 + N2J-]73 ккал,
но соответствует 0,7 ккал/г состава.
Е, П. Молчанову удалось в 1941 г. при обычной температуре и р=] ат
а картонной трубке диаметром 16 л.и зажечь состав: 68n/o NaNOj, 32*.'о S, ско-
рость горения состава ~0,4 мм/сек.
Легче зажечь составы, содержащие избыток серы и малый про-
цент нитрата натрия (17%); большая часть серы в таких составах
сгорает за счет кислорода воздуха; такие составы, разработанные
А. И. Сидоровым, нашли применение в народном хозяйстве (см.
гл, XXII).
Из физических факторов, влияющих на скорость горения, сле^
дуст указать на с.тедуюшце.
Увеличение плотности состава сильно уменьшает скорость горе-
ния большинства составов. Особенно сильно сказывается влияние
плотности на характер горения фотосмесей: 1 кг фотосмеси в по-
рошкообразном состоянии сгорает в течение десятых долей секун-
ды, а время сгорания такого же количества фотосмсси, спрессо-
ванной под давлением порядка 1000 кГ/см", выражается уже не-
сколькими десятками секунд.
Зависимость скорости горения одного из осветительных соста^
вов от удельного давления, применяемого при прессовании, выра-
жается следующими цифрами:
Давление при прессования ..... 1000 2000 3000 4000 кГ;см^
Скорость горения состава.......... 5,0 4,2 3,8 3,6 мм/сс‘К
Увеличение давления прессования выше 3000 кГ!см? уже срав-
нительно мало отражается на плотности состава, а следовательно,
н на скорости его горения.
Влияние плотности состава на скорость горения объясняется
тем, что с увеличением плотности состава уменьшается возмож-
ность проникновения горячих газов внутрь состава и тем самым
замедляется процесс прогрева и воспламенения более глубоких
слоев.
125
В связи с этим интересно было бы изучить газопроницаемость
уплотненных пиротехнических составов; это исследование надле-
жало бы провести в условиях повышенной температуры, стремясь
по возможности воссоздать реальные условия горения составов.
Для составов, не содержащих в себе металлического горючего
и имеющих более низкую температуру пламени, скорость горения
мало изменяется с изменением плотности состава '.
Следует заметить, что существуют и такие малогазовые соста-
вы, увеличение плотности которых способствует передаче тепла
в конденсированной фазе, и потому скорость горения их даже не-
много увеличивается с увеличением плотности; установление зави-
симости скорости горения от плотности составов в значительной
мере может способствовать выяснению в каждом отдельном случае
вопроса о том, насколько большую роль при горении состава
играют процессы, протекающие в конденсированной фазе.
Измельчение компонентов также в значительной мере влияет
на скорость горения составов. Чем меньше величина зерен, входя-
щих в состав компонентов, тем больше скорость горения изготов-
ленного из них состава [125]. Особенно сильно влияет па скорость
горения степень измельчения и форма частиц входящего в составы
алюминия. Составы, изготовленные на алюминиевом порошке, го-
рят в несколько раз медленнее, чем составы, изготовленные на
алюминиевой пудре.
Двумя важными факторами, влияющими на скорость горения
пиротехнических составов, являются температура и давление.
С повышением начальной температуры составов скорость их горе-
ния увеличивается; это станет понятным, если учесть, что при более
высокой начальной температуре состава для протекания реакции
горения требуется подача меньшего количества тепла из зоны пла-
мени в конденсированную фазу 1 2.
Согласно Андрееву [119, стр. 406]. температурный коэффициент
скорости горения тем меньше, чем выше температура пламени
(температура горения) и чем выше давление, при котором проис-
ходит горение, Температурный коэффициент для одного и того же
состава при неизменном давлении не является постоянным, но уве-
личивается при повышении начальной температуры состава [226.
стр. 95].
Низкое значение температурного коэффициента показывают
с.месевые ракетные пороха (см. гл. XX), имеющие высокую темпе-
ратуру поверхности конденсированной фазы [223. стр. 269].
По-видимому, меньший температурный коэффициент имеют ве-
щества или смеси, обладающие высокой температурой самовоспла-
менения.
1 Зависимость скорости горения ВВ от плотности см. в работе Андреева [ПО].
2 При повышении начальной температуры состава возрастает, хотя н неодно-
значно, температура пламени.
126
Для вычисления температурного коэффициента а скорости го-
рения используется формула [128]:
1 du.
а = — . — .
и dt
Для индивидуальных ВВ а обычно лежит в пределах от 3- 10~3 до
8- 103; это означает, что при изменении температуры на 1°С ско-
рость горения изменяется на 0.3—0,8% Для нитроглицеринового
коллоидного пороха JPN в интервале 20—60°С а = 4д-5*10~3.
Температурный коэффициент скорости горения пиротехнических
составов меньше, чем у ВВ или коллоидных порохов.
Из данных Баума [ИЗ] можно подсчитать, что в интервале от
—30° до +44° С температурный коэффициент Для дымного пороха
равен а = 0,65- 10-3. По нашим измерениям, температурный коэффи-
циент дымного пороха в интервале от 0 до 100° С равен при
р = 1 ат
а — (1,5±0,4) 10-3.
Температурный коэффициент для всех исследованных в этом
отношении пиротехнических составов не превышает 3*10-3 (при
максимальной начальной температуре не выше 100°С). Андреев
[110, стр. 166] дает температурный коэффициент как отношение
ul0C" к «0’. Исходя из этого, нм приводятся значения температур-
ного коэффициента для ряда ВВ и порохов, в том числе для нитро-
глицериновых порохов 2,9. а для дымного пороха 1,15.
Физический смысл влияния давления на скорость горения по
к. к. Андрееву заключается в том, что при большем давлении ско-
рость реакции в газовой фазе (в пламени) выше, и зона высокой
температуры придвигается ближе к поверхности конденсированной
фазы. Соответственно этому возрастает и количество тепла, пере-
даваемое в единицу времени из газовой в конденсированную фазу.
Поэтому с увеличением внешнего давления скорость горения пиро-
технических составов возрастает. Наоборот, в разреженном прост-
ранстве пиротехнические составы горят медленнее, чем при атмо-
сферном давлении, а при значительном разрежении (единицы
мм рт. ст.) вообще теряют способность к распространению гореция.
Как указывает К. К- Андреев [124], «существование минималь-
ного давления, ниже которого горение не распространяется, сле-
дует объяснить тем, что при уменьшении давления уменьшается
скорость реакции в газовой фазе н, соответственно, количество под-
водимого к конденсированной фазе от газов тепла». Так как ско-
рость теплоотвода по конденсированной фазе не зависит от давле-
ния, то при уменьшении последнего она становится больше
скорости теплоприхода и горение затухает.
Быстрее других теряют способность к горению при понижении
давления составы, содержащие большой избыток горючего против
стехиометрических соотношении или составы с трудно окисляемы-
ми горючими.
127
Для порохов и ВВ зависимость между скоростью горения и дав-
лением часто выражается формулой
и^А + Вр\ (10.1)
где Л, В и у — постоянные величины. Для ряда ВВ Андреев [119,
стр. 408] на основании данных экспериментальных исследований
принимает v = I; если в формуле н=Л + Вр скорость » дается в раз-
мерности г/см2 сек1 а давление р в кГ/см2, то барический коэффи-
циент В с ко пости горСн п я колеблется для бризантных ВВ в преде-
лах от 0,0071 (тротил) до 0,03] (желатинированный нитроглице-
рин 97:3).
Для современных нитроглицериновых порохов показатель сте-
пени v близок к 0,7 [111, стр. 190].
Беляев [127] указывает, что для большинства порохов и В В зна-
чение v лежит в пределах 0,5—1,0.
Если характеризовать зависимость скорости горения пиротехни-
ческих составов формулой (10. 1), то для всех составов показатель
степени v (в отличие от ВВ) будет значительно меньше единицы.
Однако известны Примеры и среди ВВ, и средн порохов, когда
зависимость u~f(p) с изменением давления существенно изменяет-
ся (например, для пикрата «алия [111, стр. 172] или для дымного
[[Ороха [127]).
Исходя из этого попытка характеризовать и =f(p), используя
одни и те же значения В и у в широком диапазоне давлений,
нс всегда приведет к правильным результатам.
Малая зависимость скорости горения от давления показывает,
что экзотермические реакции в значительной степени протекают
в конденсированной фазе.
По данным Баума [113], показатель у в формуле (10.1) для
трубочных порохов тем меньше, чем меньше объем газообразных
продуктов горения va на единицу веса пороха.
Зависимость скорости горения дымного пороха от давления по
Андрееву [НО, 123] в интервале от 2 до 30 ат выражается форму-
той «г=1,21 ра2А; где р — давление в ат, и — скорость горения
в см/сек.. Андреевым установлено, что дымный порох еще устойчи-
во горит при давлении 0,1 кГ/см2.
Беляев [127] предлагает описывать и—f(p) для дымного пороха
двумя формулами; для ат и- 0,88 p9|i и для р>5 ат и=1,5^
Казалось бы. что для безгазовых составов скорость горения
не должна вообще зависеть от внешнего давления. Но опытами Бе-
ляева и Комковой [126] установлено, что скорость горения алюми-
ниевых и магниевых термитов хотя и не сильно, по все же возра-
стает с повышением давления.
Так, для термитов Fe2O34-AI, MnOa + Al и Cr2O3 + ,Mg при уве-
личении давления с 1 до 150 ат скорость горения увеличивается
з 3—4 раза. Отсюда становится несомненным, что при горении
138
этих составов существуют реакции (возможно, реакция окисления
алюминия кислородом, образовавшимся при распаде окиси желе-
за), протекающие в газовой фазе или на поверхности раздела фаз.
Вместе с тем, эксперимент Беляева показал, что существуют и со-
ставы, для которых скорость горения не зависит от давления: так,
термит Сг20з + А1 горит с одинаковой скоростью, равной 2,4 мм/сск,
как при 1 ат, так и при 100 ат. Из этого, по-видимому, следует сде-
лать вывод, что в данном случае реакция горения от начала до
конца протекает в конденсированной фазе.
При горении составов, дающих при сгорании большое коли-
чество газов, в замкнутом или полузамкнутом Пространстве соз-
дается большое давление; скорость горения значительно возрастает
и горение может перейти во взрыв. Наиболее часто такое прогрес-
сивное ускорение горения, заканчивающееся взрывом, наблюдает-
ся для хлоратиых составов, содержащих большое количество
(80—90%) хлората, например, при горении состава зеленого огня:
Ва(С1Оз)г4-с.мола (подробнее о переходе горения во взрыв см.
гл- XI).
Интенсивность теплообмена с окружающей средой также отра-
жается на скорости горения составов. В связи с этим скорость го-
рения составов в узких трубках (малый диаметр изделия) должна
была бы быть несколько меньше, но в узких трубках в большей
мере затрудняется отток газов, создается избыточное давление,
особенно в случае быстро горящих составов, и потому практически
уменьшение скорости горения не всегда наблюдается. При очень
малых диаметрах теплопотери в окружающее пространство стано-
вятся настолько велики, что состав, находящийся в трубке малого
диаметра, вообще теряет способность к распространению горения.
Величина предельного диаметра трубки, при котором еще воз-
можно устойчивое горение состава, зависит от целого ряда факто-
ров: рецепта состава, начальной температуры, давления, материа-
ла и толщины стенок трубки и от плотности состава, Как правило,
чем больше тепла выделяется при горении состава в единицу вре-
мени, т. е. чем быстрее горит состав, тем меньше для пего значение
минимального диаметра.
В связи с теплопотерями в окружающее пространство следует
также разбирать вопрос о минимальной возможной скорости горе-
ния составов.
Осуществить при нормальных условиях температуры и давле-
ния процесс горения, имеющий очень малую скорость (например,
0,001 мм/сек), невозможно по той Причине, что вследствие малого
геплоприхода в единицу времени и относительно больших тепло-
потерь в окружающее Пространство не удается создать той зна-
чительной разности между температурой в газовой и конденсиро-
ванной фазах, которая является одной из самых характерных черт
процесса горения.
Одной из самых медленно горящих смесей является смесь
ИЗ 96% NH4NO3, 4% древесного угля, горящая при д— 1 ат, и 1=
9
А. А. Щьдлопский
129
= 20°C (d = 0,94 г/см3) со скоростью и = 0,08 мм/сек. Принимая
приближенно объем газов, образующихся при горении смеси.
иа = 700 см?1г и температуру горения 7 = 900° К, получаем скорость
течения газов в пламени, а следовательно, и скорость их горения:
—0,008-700- —17 см1сек.
293 '
Эта цифра близка к скорости горения самых медленно горящих
газовых смесей. Я. Б. Зельдович [130] указывает, что минимально
возможная при нормальных условиях скорость горения газовой
смеси СО + О2 должна составлять около 2 см/сек.
До сего времени не разрешена в достаточной мере проблема ка-
тализа при горении пиротехнических составов.
На практике катализаторы используются в твердом ракетном
топливе, содержащем окислитель-нитрат аммония (см. гл, XX):
в качестве добавок в этом случае применяются хроматы и бихрома-
ты калия или аммония или берлинская лазурь.
О влиянии каталитических добавок на зависимость u=f(p) для
коллоидных порохов см. [Ц[, стр. 191]. Введение катализаторов
в хлоратные составы, по данным Володиной, увеличивает скорость
горения двойных смесей КС103+оргацическое горючее (при п=
= 1 ат); хлоратные составы с малым процентом горючего (2—4%),
не способные при р=1 йг к горению, приобретают эту способность
в тех же условиях при добавлении катализатора (например,
МпО2). __________
Глййй XI
ВЗРЫВЧАТЫЕ СВОЙСТВА ПИРОТЕХНИЧЕСКИХ СОСТАВОВ ’
Большинство пиротехнических составов предназначено для
равномерного горения и потому желательно, чтобы такие составы
обладали минимальными взрывчатыми свойствами или не имели
их вовсе.
Производство составов, имеющих высокую чувствительность
к удару и трению и вместе с тем обладающих значительной скоро-
стью и силой взрыва, весьма опасный процесс.
Технологический режим производства пиротехнических соста-
вов во многом определяется взрывчатыми свойствами состава.
От них зависит также, какое количество состава может находиться
в мастерской, какие расстояния должны быть установлены между
отдельными мастерскими, тип производственных зданий и производ-
ственных помещений (толщина стен, наличие окон и потолка вы-
шибного типа, размер кабин, необходимость устройства огради-
тельных двориков и т- п.). Выбор аппаратуры (тип, размеры и за-
1 Для ознакомления с механизмом возникновения н распространения взрыва
и методами исследования взрывных процессов можно рекомендовать соответ-
ствующие разделы в курсах взрывчатых веществ [111], [1], [154]. [156]. [148], [152А].
130
грузка метателей, тип прессов, возможность массового прессова-
ния изделий и т. п.) также во многом определяется взрывчатыми
свойствами состава.
Кроме того, необходимо иметь ясное представление об усло-
виях, при которых начавшийся процесс горения пиросостава может
перейти во взрыв.
Для выяснения взрывчатых свойств пиротехнических составов
проводят лабораторные испытания, которые существенно отли-
чаются от испытаний взрывчатых веществ.
Испытания ВВ ставят своей целью дать характеристику мощ-
ности взрыва, сравнить между собой ВВ по эффективности их
действия.
Цель испытаний, проводимых с пиротехническими составами,—
прежде всего установить отсутствие или наличие у них способности
к возникновению и устойчивому распространению взрыва Только
в тех случаях, когда установлено, что состав способен к устойчи-
вому распространению взрыва, представляется целесообразным
проводить дальнейшие испытания по определению скорости рас-
пространения в нем взрыва и определению мощности взрыва.
Для того чтобы оградить себя от неожиданного проявления
в производственных условиях неизвестных ранее взрывчатых
свойств состава, следует при испытаниях его на способность к воз-
никновению взрыва в лабораторных условиях создать самые жест-
кие условия.
Это совершенно необходимо, так как взрыв в пиротехнических
составах, кроме хлоратных смесей и твердогб ракетного топлива
с окислителем NH4CIO4, в большинстве случаев возбуждается
значительно труднее, чем в обычных вторичных ВВ.
Жесткость условий испытания сводится к следующему:
I) употребление возможно больших по весу зарядов испытуе-
мых составов (не менее 50—100 а) в порошкообразном виде;
2) употребление мощного инициального импульса (дополни-
тельный тетриловый детонатор весом не менее 8 г);
3) помещение испытуемого заряда в прочную оболочку (желез-
ную трубу или еще лучше — в толстостенную свинцовую обо-
лочку) .
Практически испытание можно проводить в свинцовом блоке
Трауцля, увеличив диаметр его канала до 40 ллс Признаком нали-
чия у состава (навеска 50 а в порошке) способности к возникнове-
нию взрыва является значительное (^> 100 см3) расширение канала
свинцового блока после испытания.
Испытание способности состава к устойчивому распростране-
нию взрыва должно заключаться в подрыве удлиненных зарядов
пиросоставов диаметром не менее 40 мм и длиной не менее 15—
20 см. Для создания жестких условий необходимо и здесь приме-
1 При испытаниях должна быть обеспечена требуемая плотность пиротехни-
ческого состава.
9*
131
мять дополнительный детонатор и заключать состав в прочную
оболочку.
Подходящим «свидетелем» того, дойдет ли взрыв до другого
конца заряда или затухнет по пути, может служить свинцовый
столбик (диаметром 40 ли), используемый при пробе Гесса, или
пластинка из двухмиллиметровой жести.
Для составов, показавших способность к устойчивому распро-
странению взрыва, можно определить скорость распространения
взрыва (скорость детонации) по методу Дотриша. Более точно ско-
рость детонации определяют, используя фоторегистр с зеркальной
разверткой [III]. При проведении всех этих испытаний надо иметь
в виду, что способность к возникновению и устойчивому распрост-
ранению взрыва у большинства составов резко уменьшается с уве-
личением плотности состава. В спрессованных пиротехнических
составах взрывчатое разложение возбуждается весьма трудно,
и. будучи вызвано, легко и быстро затухает.
Поэтому наиболее опасны при изготовлении пиротехнических
составов те операции, когда состав еще находится в иеспрессован-
ном виде.
Следует еще раз подчеркнуть, что испытания взрывчатых
свойств пиротехнических составов по пробам, принятым для ВВ:
проба на бризантность, испытание в блоке Трауцля (в обычном
оформлении пробы), определение скорости детонации, являются
для пиротехнических составов мало характерными и проводить их
стоит только в тех случаях, когда имеется уверенность, что данный
пиротехнический состав способен к устойчивому распространению
взрывчатого разложения. Как показали опыты, взрывчатое разло-
жение легко возбуждается и надежно распространяется только
в хлоратных пиротехнических составах (содержащих в себе не ме-
нее 60% хлоратов), твердом ракетном топливе с окислителем
NH4CIO4 (см, гл. XX) или в составах, содержащих в себе добавки
взрывчатых веществ.
Смеси хлоратов с магнием или алюминием развивают при взры-
ве очень высокую температуру, но вместе с тем дают сравнительно
небольшое количество газов. Этим можно объяснить то, что смеси
хлоратов с магнием или алюминием обладают меньшими взрывча-
тыми свойствами, чем смеси тех же окислителей с органическими
веществами.
Взрывчатые свойства некоторых хлоратных смесей приведены
в табл. 11.1, 11.2, 11,3.
Для смеси из 69% хлората калия, 31% алюминия при испыта-
нии ее на бризантность по пробе Гесса величина обжатия свинцо-
вых столбиков получается равной 7 мм.
Введение в хлоратные составы большого количества инертных
примесей резко снижает их взрывчатые свойства, Так, составы мас-
кирующих и Цветных сигнальных дымов, содержащие большие
количества малоактивных веществ — NH4CI. органических краси-
телей и сравнительно малое количество КСЮ3 (не более 40—45%),
132
Таблица 11.1
Взрывчатые свойства состава зеленого огня и взрывчатых веществ:
хлоратнта-3 н тротила
Состав в % Расширение в r.«'J в блоке Трауцля; навеска состава 10 г Скорость детона- ции м!сек
Хлорат бария—81. смола—19 155 1600—2000
Хлоратнт-3; Хлорат калия—91, Керосин—9 255 3600
Тротил 285 6700
Таблица II .2
Взрывчатые свойства смесей хлората калия с различными горючими
Содержа- ние горю Горючее чего и со ставе % Испытание в блоке Трауцля Скорость детонации м!сек
количество л смеси |расширение 1
Древесная мука 25 10 Сахарная пудра 10 13 Сажа 10 13 Алюминий 25 10 220 105 160 160 2600 1500*
* Начальный импульс — дымный i Скорость детонации смесей хлора орох. Таблица /1.3 та калия с различными горючими
Г орючее г Содержа- ние горю- чего в со- ставе % Испытание на скорость детонации
ПЛОТНОСТЬ состава скорость детонации .и/сек
Древесный уголь Графит Сера 13 13 28 1.27 1,44 1,36 1620 500 1600
133
почти не способны к взрывчатому разложению. Сильное флегмати-
зирующее действие в хлоратных составах цветных сигнальных
огней оказывают также оксалаты или карбонаты щелочных или
щелочно-земельных металлов, введенные в количестве 20—30%.
Необходимым, но в отдельности еще недостаточным условием
для возникновения взрыва, является образование в результате
реакции значительного количества газообразных продуктов.
Поэтому безгазовые или очень мало газовые 1 составы практи-
чески не будут обладать взрывчатыми свойствами или будут обла-
дать ими в самой минимальной степени.
Железо-алюминиевый термит почти не образует газовой
фазы при горении и поэтому не обладает взрывчатыми свой-
ствами. Разбрасывание отдельных частиц при горении термита
осуществляется только за счет находящегося в нем воздуха,
который при повышении температуры расширяется и вызывает
искрение термита.
При горении зажигательных составов, содержащих наряду
с термитом и другие компоненты, как, например, нитраты бария
или калия, а также органические связующие вещества, образуется
некоторое, правда, незначительное, количество газа и, поэтому дан-
ные составы могут обладать взрывчатыми свойствами. Но практи-
чески вызвать взрывчатое разложение в составах, содержащих
более 50—60% железо-алюминиевого термита, чрезвычайно труд-
но; для этого необходимо наличие прочной оболочки, очень мощ-
ного начального импульса (значительное количество какого-либо
взрывчатого вещества), и все-таки результат опыта еще будет сом-
нительным.
Вторым непременным, но в отдельности недостаточным усло-
вием для того, чтобы система имела взрывчатые свойства, следует
считать высокую экзотермичность реакции.
Так как скорость химической реакции в очень большой степени
зависит от температуры, то реакция взрывчатого разложения мо-
жет осуществляться только в том случае, если развиваемая при
ней температура будет не меньше 500—6ОО°С.
Этому условию (/>500—600° С) удовлетворяют почти все пиро-
технические составы за исключением только некоторых составов
маскирующих дымов, содержащих в себе 40—50% такого малоак-
тивного вещества, как ЫН4С1.
Третьим условием, определяющим способность системы к воз-
никновению и развитию в ней процессов взрывчатого разложения,
является гомогенность системы — свойство, которым пиротехниче-
ские составы обладают лишь в весьма относительной степени.
Как отмечается в курсах теории ВВ, твердые взрывчатые смеси,
.не содержащие в себе проводников детонации— индивидуальных
ВВ, всегда мало бризантны, и процесс взрыва возбуждается и рас-
1 Здесь имеется в виду газовая фаза не при комнатной температуре, а при
температуре данной реакции.
134
пространяется в них с большим трудом1. Примером такой смеси
может служить дымный порох. Пиротехнические составы — это
твердые смеси. Сильно выраженными взрывчатыми свойствами они
могут обладать только при наличии в них проводника взрыва (де-
тонации) — индивидуального вещества, способного к экзотермиче-
ской реакции саморазложения.
Таким проводником в хлоратных пиросоставах является хлорат
калия, разложение которого не требует притока тепла извне,
а в твердом ракетном топливе (смесевых порохах) — перхлорат
аммония (или нитрат аммония).
Перхлорат калия разлагается с крайне малым выделением
тепла:
2KClO4=2KCl + 4O2+l,2 ккал,
и поэтому взрывчатое разложение в составах с КС1О4 должно воз-
никать и распространяться с большим трудом, чем в хлоратных.
Нитраты (кроме NH4NO3) для своего разложения требуют
очень большого притока тепла извне:
2KNO3 = K2O + N2 + 2,5Oa~15l ккал,
и потому процесс взрывчатого разложения в нитратных составах
(кроме составов с NH4NO3) возбуждается с большим трудом и,
наоборот, легко и быстро затухает.
Нитратные смеси обладают значительно меньшими взрывчаты-
ми свойствами по сравнению с хлоратными смесями.
Для возбуждения взрывчатого разложения в осветительных со-
ставах, содержащих в качестве окислителя нитрат бария, а в каче-
стве основного горючего — алюминиевый порошок или пудру, тре-
буется мощный начальный импульс.
В табл. Ц.4 приводятся сравнительные данные о взрывчатых
свойствах смесей перхлората калия или нитрата бария с алюминие-
вой пудрой.
Несколько легче возникает процесс взрывчатого разложения
в нитратных осветительных составах, содержащих магний. Но ско-
рость взрывчатого разложения нитратных осветительных составов
не превышает в большинстве случаев 1000 м/сек; скорость взрыв-
чатого разложения дымного пороха, который тоже можно рассмат-
ривать как нитратную пиротехническую смесь, не превышает
400 м/сек.
Взрывчатое разложение неуплотненных двойных смесей нитра-
тов с магнием или сплавом ДМ, если смеси эти взяты в сколько-
нибудь значительных количествах (более 50—100 г), возбуждается
легко не только от действия взрывного импульса (капсюль-детона-
тор), но и от действия огневого импульса (дымный порох, стопин).
1 Иначе обстоит дело со смешивающимися жидкостями, которые образуют
Растворы. В этом случае налицо молекулярная степень дисперсности и поэтому
взрывные волцы могут распространяться беспрепятственно.
135
Таблица 11,4
Взрывчатые свойства двойных смесей перхлората калия
или нитрата бария с алюминием
Окислитель Содержание окислителя в составе % Расширение в блоке Трауцля в с.и3; навеска состава—10 г Испытание на скорость детонации
плотность состава скорость детонации м;свк
ксю4 66 172 1.2 760
Ba(NOa); 73 34 1 Л Отказ
Прим е ч а гг и е. Скорость детонации определялась в железных
трубах диаметром 30 мм и длиной 250 мм; начальный импульс капсюль-
детонатор № 8-J-тетриловая шашка (10 г).
Вследствие этого последнего обстоятельства подобные смеси
следует считать одними из наиболее опасных пиротехнических со-
ставов: обращаться с ними надо с большой осторожностью.
В связи с этим полезно заметить, что высокая температура горе-
ния благоприятствует переходу горения во взрыв как в случае
пиротехнических составов, так и в случае ВВ.
К- К- Андреев указывает, что горячие газы, проникая в поры
заряда, воспламеняют частицы ВВ тем легче, чем выше их (газов)
температура. При этом увеличение поверхности горения и связан-
ное с ним повышение давления приводят к образованию детонаци-
онной волны. Высокая склонность к переходу горения во взрыв
тэна и гексагена по сравнению с другими вторичными ВВ объяс-
няется именно их высокой температурой горения £15]; 119, стр. 4] I].
Горение хлорнокислого аммония не переходит во взрыв в тех
условиях, при которых этот переход легко происходит в случае
тэна. Достаточно однако добавить к хлорнокислому аммонию не-
много тонкодисперсного алюминия, чтобы горение смеси при возра-
стающем давлении переходило во взрыв столь же легко, как у тэна
или гексагена [151]. Влияние алюминия заключается в повышении
температуры продуктов горения: проникая в пористый порошок,
более горячие газы легче воспламеняют его частицы.
Рассмотрим теперь поведение составов при действии на них
различных видов начальных импульсов. Удар (или трение), прихо-
дящийся на отдельный участок поверхности пиротехнического со-
става при отсутствии условий, способствующих повышению давле-
ния при горении, вызывает обычно только местный взрыв состава;
остальная масса состава сгорает нормально, как при воздействии
обычного теплового импульса.
Попадание в пиротехнические изделия пули, сохранившей еще
значительную скорость, может вызвать во многих случаях воспла-
136
менение, а в том случае, когда состав находится в прочной оболоч-
ке, ивогда и взрыв состава,
В замкнутом пространстве (например, при вспышке во время
прессования в стальной матрице) и во всех тех случаях, когда
состав заключен в очень прочную металлическую оболочку, нара-
стание давления вызывает увеличение скорости горения, и процесс
во многих случаях заканчивается взрывом даже при употреблении
в качестве начального импульса обычных огневых средств.
Такое же нарастание давления, вызывающее переход горения
во взрывчатое разложение, возникает в некоторых случаях при
одновременном сжигании большого количества (10 кг и более)
порошкообразных быстро горящих составов.
Фиг. II. I. Трубка К- К, Андреева для определения воз-
можности перехода горения во взрыв.
J—стальной дискь 2—наниюная головка, 3—воспламенительная ша-
-/—корпус трубки, 5—провод для электровосл л вменения, б—ис-
пытуемый состав, 7—гимс.
Очень простое приспособление для выяснения возможностей
перехода горения ВВ в замкнутом объеме во взрыв было предло-
жено К- К, Андреевым [153, стр, 59], Это приспособление представ-
ляет собой прочную и замкнутую со всех сторон железную трубку
(длиной 200 мм и внутренним диаметром 40 мм), которая частично
заполняется ВВ (50 а); ВВ поджигаются шашечкой воспламени-
тельного состава. Процесс горения в воспламенительном составе
возбуждается тонкой проволочкой, накаливаемой электротоком
(фиг. И. 1).
Дробление трубки fra большое число осколков (пять-шесть и бо-
лее) указывает на то, что горение переходит во взрыв (фиг, 11.2).
Таким же образом может быть определена и способность пиро-
технических составов к переходу горения во взрыв в замкнутом
объеме; при желании это испытание может быть дополнено взвеши-
ванием осколков и вычислением среднего веса осколка,
В последнее время К- К- Андреевым с сотрудниками [149] раз-
работано испытание на способность к переходу горения во взрыв
137
сжиганием в манометрической бомбе маленьких зарядов ВВ,
запрессованных в плексигласовых стаканчиках (инициатор —♦дым-
ный порох, изменение давления фиксируется на пленке осцилло-
графа).
Этот метод дает возможность по характеру манометрической
кривой проследить за всем течением процесса, в то время как при
работе с трубкой Андреева фиксируются лишь конечные результа-
ты испытания.
Фиг. 11,2. Характер деформации трубки К. К. Андреева
при горении (а) и при переходе горения во взрыв (б).
Недостатками этого нового метода, по нашему мнению, являют-
ся малая навеска (несколько граммов) испытуемого вещества
и то, что заряд горит только с торца. Это до известной степени от-
даляет условия испытания от тех условий, при которых на практике
может происходить горение ВВ (или пиротехнических составов).
В некоторых случаях интересно проследить поведение состава
при его горении в полузамкнутом объеме, т. е. при сильном огра-
ничении возможности оттока газов.
Для этой цели могут быть использованы железные трубки
К. К. Андреева при условии, что в стальном диске, закрывающем
один из торцов трубки, предварительно высверливается сквозное
отверстие соответствующего диаметра (от 2 до 12 jhjh).
Ту же цель выяснения поведения пиросостава при горении в по-
лузамкнутом объеме преследует и испытание в блоке Трауцля
с применением в качестве начального импульса не капсюля-дето-
натора, а небольшого заряда дымного пороха.
138
: Как видно из табл. 11.5, при пользовании огневым начальным
импульсом расширение в блоке Трауцля получается равным при-
мерно 50% от нормального, а для малочувствительных составов
(состав 3) в этом случае вообще горение во взрыв не переходит
И расширения канала не получается.
Таблица 11.6
Зависимость расширения в блоке Трауцля от характера начального
импульса
№ по пор. Состав (неспрессованный) % Расширение в £.«3; навеска со- става 20 г; начальный импульс
бикфордов шнур капсюль-детона- тор № 8
1 Перхлорат калия—85 Древесный уголь—15 198 318
2 Перхлорат калия—59 Магний—41 49 88
3 Нитрат бария—89 Идитол—11 0 120
4 Тротил спрессованный (для срав- нения) — 718
В заключение следует отметить, что в некоторых случаях опас-
ность взрыва не исключена и при обращении с отдельными компо-
нентами, употребляющимися для изготовления составов.
Так, например, взрыв может последовать при наличии в возду-
хе больших концентраций пыли алюминиевой пудры, магниевого
порошка тонкого измельчения, порошка сплава AM, порошков
циркония, титана, а также пыли других горючих веществ, напри-
мер угля, углеводов, порошков смол и т. п. Подробнее см. в книге
Годжелло (152], а также [111, стр. 152]. Найдено, в частности, что
нижний предел взрывчатости алюминиевой пудры (дисперсность
0,1—0,3 мк) соответствует ее содержанию 40 мг на 1 л воздуха,
а магниевого порошка—25 мг на 1 л воздуха.
Взрывчатыми свойствами при определенных условиях обладают
смоченные водой порошки многих металлов. Реакция взаимодейст-
вия магния или алюминия с водой протекает с очень большим вы-
делением тепла и значительного количества газов:
H2O+Mg=MgO + H2 + 76 ккал.
В пересчете это дает 1.82 ккал/г смеси реагирующих веществ;
количество газа равно 530 смя1г. Таким образом, имеются в наличии
139
необходимые условия для возникновения взрыва. Как показано
в работе [155], взрыв этот может быть осуществлен при применении
начального импульса достаточно большой силы (фиг. 11.3).
Однако отсутствие молекулярного соприкосновения между ча-
стицами окислителя (воды) и горючего, т. е. негомогенность смеси
приводит к тому, что данная система, обладая способностью к воз-
никновению взрыва, вместе с тем, как показал эксперимент [160],
не обладает способностью к его устойчивому распространению.
Фиг. И.З. Толстостенный свинцовый цилиндр
до (справа) и после взрыва в нем 50 г смеси
HjO + Mg в стехиометрических соотношениях; ини-
циатор — капсюль-детонатор № 8.
О возможности окисляющего действия воды на неметаллы (В,
Si и Р) и низшие окислы элементов см. работу [119, стр. 540]).
Взрыв отдельного компонента — хлората калия, имеющий боль-
шую разрушительную силу, может произойти только в том случае,
если в нем имеются значительные примеси горючих веществ (бо-
лее 1%).
Количество тепла, выделяющееся при распаде чистой соли (без
Примесей), имеющей комнатную температуру, мало (0,08 ккал/г);
поэтому если при очень мощном начальном импульсе и произойдет
взрывчатое разложение КСЮз, то все же разрушительное действие
взрыва будет незначительно.
О взрывчатых свойствах окислителей — перхлората аммония
и нитрата аммония см. в гл. XX.
Глава ХИ
ФИЗИЧЕСКАЯ и химическая стойкость
ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
Под термином стойкость пиротехнических составов понимают
их способность сохранять свои свойства при хранении в течение
продолжительного времени.
§ 1. ИЗМЕНЕНИЯ, ПРОИСХОДЯЩИЕ В СОСТАВАХ ПРИ ХРАНЕНИИ
В пиротехнических составах при хранении на складах пиротех-
нических изделий происходят физические и химические изменения.
Изменения эти в некоторых случаях настолько существенны, что
Изделия становятся негодными для употребления, а иногда даже
и опасными в обращении. Поэтому в каждом отдельном случае
следует установить характер изменений в составе, а также влия-
ние, оказываемое различными факторами на скорость процессов
разложения состава.
В результате исследований устанавливаются условия храпе-
ния, при которых процессы разложения протекают в наименьшей
степени, а также допустимые сроки хранения отдельных видов пи-
ротехнических изделий.
Физические изменения, происходящие в составе при хра-
нении, чаще всего обусловливаются увлажнением состава. При
этом происходит частичное растворение компонентов состава, из-
менение плотности и формы спрессованного заряда.
Реже причиной деформации заряда (факела или звездки) яв-
ляются механические воздействия или изменения температуры
окружающей среды.
Особо следует отметить изменения в рецепте состава, обуслов-
ливаемые возгонкой летучих компонентов состава (например, воз-
гонка нафталина, гексахлорэтана и др-).
Гигроскопичность состава зависит в основном от гигроскопич-
ности его компонентов, а также от плотности и состояния поверх-
ности состава, подверженной действию влажного воздуха. Как пра-
вило, составы в прессованном состоянии притягивают влагу из воз-
духа в значительно меньшей степени, чем взятые в виде порошка.
Гигроскопичность состава при сохранении прочих условий увеличи-
вается с увеличением степени измельчения его компонентов.
Для предохранения состава от поглощения им влаги из воздуха
в тех случаях, когда почему-либо невозможна полная герметизация
Изделия, частицы состава или частицы входящих в него отдельных
компонентов покрывают защитной пленкой какого-либо пластич-
ного органического вещества. Наиболее часто употребляют для
Этого минеральные масла, стеарин и Стеараты различных металлов,
парафин, а также лаки на основе различных искусственных и есте-
ственных смол, олифу и Др.
141
Защитное действие смол особенно сильно сказывается при вве-
дении их в состав в виде лаков; в сухом виде (в порошке) смолы
значительно хуже предохраняют состав от проникновения в него
влаги.
Химические изменения, происходящие в составах, могут
быть весьма разнообразными, что является следствием чрезвычай-
но большого ассортимента употребляемых для их производства
компонентов. Но все же можно установить некоторые общие поло-
жения.
Составы, содержащие порошки металлов и неорганические
окислители
Фиг. 12. 1. Повышение
температуры металличе-
ских порошков при до-
бавлении к ним воды,
I-Mg+lCW» нго. 2—AI+1D»,1»
ню.
Во многие пиротехнические составы входит в качестве горючего
магниевый или алюминиевый порошки. Разложение этих составов
начинается с коррозии этих порошков при наличии влаги в со-
ставе:
Mg+2H2O = Mg(OH)2 + Н2.
Al + ЗН2О = А) (ОН) з +1,5Hg.
Реакция взаимодействия магния с водой протекает гораздо
энергичнее реакции алюминия с водой. Пленка окиси магния яв-
ляется пористой, непрочной и недостаточ-
но защищает металл от дальнейшей кор-
розии. Алюминиевый порошок (или пуд-
ра) обычно окисляется только с поверх-
ности, а от дальнейшего более глубокого
окисления алюминий предохраняет обра-
зующаяся на его поверхности плотная
оксидная пленка.
На фиг. 12. 1 приведен график, пока-
зывающий изменение температуры в зави-
симости от времени, происходящее при
добавлении к магниевому или алюминие-
вому порошку 10% воды.
Так как при реакции магния или алю-
миния с водой выделяется значительное
количество тепла, то при сильном увлаж-
нении двойных смесей окислителей (например, нитратов) с порош-
ками этих металлов может произойти разогрев состава; если масса
его велика (килограммы) или состав химически нестоек (см. ниже),
то может произойти его самовоспламенение.
Коррозия порошков металлов подчиняется тем же закономер-
ностям, как и коррозия монолитных металлов, но протекает гораздо
интенсивнее вследствие очень большой удельной поверхности по-
рошков.
Общеизвестно, что коррозия магния протекает интенсивно
в кислой среде, в щелочных же растворах магний устойчив. Объяс-
142
няется это свойствами оксидной пленки магния, легко растворяю-
щейся в кислотах и нерастворяющейся в щелочах.
Оксидная пленка алюминия растворяется как в кислотах, так
и в щелочах. Особенностью алюминия является его интенсивная
коррозия в сильно щелочной среде.
Если окислители, присутствующие в составе, увлажняясь,
создают кислую или щелочную среду, то, очевидно, наличие окис-
лителя будет отражаться па интенсивности коррозии порошка
металла.
В случае нитратов щелочных или щелочно-земельных металлов
водород, образующийся при коррозии металлов, восстанавливает
нитраты до аммиака.
Реакция разложения увлажненной смеси Ba(NO3)2 + Mg может
быть выражена уравнениями
8Mg4-16H2O = 8Mg(OH)2 +16Н(8Н2)
' Ba (NO3)2 + 16Н (8Н2)=Ва(ОН)2 4Н.0 + 2NH3
Ba (NO3)2 + 8Mg +12Н2О = Ва (ОН),+2NH3+8Mg(OH)2
В данном случае продукты разложения, в том числе и Ва(ОН)2,
создают в увлажненном составе щелочную среду и это замедляет
дальнейшую коррозию магния.
Многолетний опыт показал, что составы, содержащие магний
и нитраты щелочно-земельных или щелочных металлов, устойчивы
при хранении, особенно в том случае, если они содержат в себе
несколько процентов органического связующего (цементатора).
Реакция разложения увлажненной смеси NaNO3 + Al может
быть выражена уравнениями
3Na NO3 + 8А1 + 18Н2О=3NaC)H + 8AI (ОН)3+3NH3
+3NaOH + ЗА1 (0H)3=3NaA10,-j- 6H2O
3NaNO3 + 8Al+ 12H2O =3NaAIO,+5Al(OH)3+3NH3
В этом случае образующийся в результате разложения NaNO3
раствор едкого натра значительно ускоряет коррозию алюминиево-
го порошка. Смесь NaNO3H-Al обладает низкой химической стой-
костью и может быть использована только при непременном усло-
вии ее надежной защиты от влаги воздуха жирующими добавками
или герметизацией изделия.
Стойкость нитратных составов, содержащих порошки металлов,
сильно зависит от наличия влаги в составе, и, следовательно, от
гигроскопичности окислителя. Отсюда можно заключить, что при
одинаковых условиях хранения наименьшие химические изменения
будут происходить в составах, содержащих в качестве окислителя
наименее гигроскопичную соль — нитрат бария.
Составы, содержащие алюминий, за исключением смесей с нит-
ратами щелочных металлов являются, несомненно, более химически
стойкими, чем соответствующие составы с магниевым порошком.
143
Это справедливо даже при употреблении крупного магниевого по-
рошка и топко измельченной алюминиевой пудры.
Как было уже сказано ранее, наличие органического цемента-
тора значительно затрудняет доступ влаги к частицам состава.
Поэтому осветительные и трассирующие составы с органическими
цементаторами при отсутствии надежной герметизации изделия
будут более химически стойкими, чем соответствующие им двойные
составы типа фотосмесей.
Добавление серы в смесь бариевой селитры с алюминиевой
пудрой или порошком не понижает химической стойкости этих
смесей. По литературным данным, алюминий не реагирует с серой
даже тогда, когда сера находится в расплавленном виде. Смеси,
состоящие из бариевой селитры, алюминия и серы, принадлежат
к числу наиболее стойких при хранении пиротехнических составов.
Смеси серы с магнием являются химически нестойкими, что
было отмечено еще русскими пиротехниками XIX столетия
Ф. Ф. Матюкевичес и А. Ордынским.
Д. И. Менделеев [165, гл. 20] отмечает влияние больших давле-
ний на способность твердых тел к взаимному соединению. «При
давлении в 6000 атм, — пишет он, — сера способна соединяться
с многими металлами при комнатной температуре»; см. также [164].
При увлажнении смеси магния с серой, в которой уже содержится
MgS, протекает реакция
MgS+2H,O^Mg(OH)2+H2S.
Смеси, содержащие одновременно магниевый и алюминиевый
порошки, более чувствительны к воздействию влаги, чем анало-
гичные составы с одним из названных выше металлов. Так, при
увлажнении водой состав, содержащий порошки обоих металлов,
разогревается значительно сильнее состава с одним магнием. Это
объясняется, тем, что во влажном составе образуются микроскопи-
ческие гальванические элементы (металл—раствор соли — другой
металл), наличие которых значительно ускоряет коррозию магния.
Составы, содержащие порошки сплавов AlMg, значительно бо-
лее химически стойки, чем составы, содержащие смесь порошков
этих двух металлов. Это происходит потому, что частицы сплава
покрыты плотной защитной пленкой окиси алюминия.
Смеси нитратов тяжелых металлов Pb(NO3)2 или Cu(NO3)2
с магнием при увлажнении химически не стойки вследствие про-
текания обменных реакций, например:
Pb(NO3)2+Mg=Pb + Mg(NO3)2.
Относительно смеси Pb(NOa)2 + Al имеются указания, что в дан-
ном случае алюминий покрывается слоем основного цитрата, свин-
ца, который предохраняет алюминий от дальнейшего воздействия
раствора.
141
Хлоратные смеси с порошками металлов. Смеси
хлората калия с магниевым порошком в условиях повышенной
влажности показывают значительные химические изменения и по-
тому не могут быть рекомендованы для длительного хранения.
Возможно, что быстрое окисление магния в смеси с КСЮ3 в зна-
чительной мере происходит за счет каталитического действия окис-
лителя. В связи с этим следует напомнить о малой гигроскопично-
сти хлората калия и отметить, что эта соль не может быть хорошим
передатчиком влаги от воздуха к порошку магния.
Смесь хлората калия с алюминием, дающая при сгорании зву-
ковой эффект, является значительно более химически устойчивой,
чем смесь его с магнием.
Смеси металлических порошков с перманганатом калия, по ли-
тературным данным, обладают малой химической стойкостью.
Смеси перекиси бария с порошками металлов.
При соприкосновении безводной перекиси бария с водой она гидра-
тируется, образуя ВаО2 • 8Н2О. Взятая в отдельности, перекись ба-
рия при комнатной температуре разлагается водой лишь в очень
небольшой степени; при О3 С константа равновесия реакции в рас-
творе
ВаО2+2Н2О^Ва--+2ОН'+Н2О2
составляет К— 18-10-12.
В том случае, когда влажная перекись бария смешана с алю-
миниевым порошком, ноны ОРГ расходуются на взаимодействие
с оксидной пленкой па алюминии, равновесие реакции разложения
смещается вправо, и процесс разложения состава проходит весьма
энергично.
Опыты показали, что при увлажнении смеси BaO» + AI темпе-
ратура ее повышается в зависимости от взятого сорта алюминия
на 60—100° С.
Железо-алюминиевый термит и термитные составы
являются весьма химически стойкими. Содержащийся в них окис-
литель не способен к распаду при низких температурах. Для изго-
товления термитных составов употребляется очень крупный алю-
миниевый порошок, це обладающий при обычной температуре
сколько-нибудь значительной реакционной способностью по отно-
шению к влаге.
Влияние солей аммония. Добавление в составы, содер-
жащие магний, аммониевых солей и, в частности, хлорида аммония
нежелательно, так как соли аммония сильно гигроскопичны, а обра-
зующиеся водные растворы аммониевых солей сильных кислот
вследствие гидролиза имеют кислую реакцию (например 10%-ный
раствор NH4C1 имеет pH^-5):
NHiCl + HOH^HCl + NHiOH.
Образующиеся п^и гидролизе содей сильные кислоты реагируют
с оксидной пленкой, покрывающей частицы порошка металла,
10
А. А. ШндловскиЗ
145
а освобожденный от оксидной пленки магний интенсивно корроди-
рует в кислом растворе.
Возможно, что в растворе NH4NO3 коррозия магния будет про-
текать медленнее, чем в растворе МН4С1, так как ион СГ является
стимулятором коррозии.
Коррозия алюминиевого порошка лишь немного ускоряется при
введении в составы аммонийных солей (см. [167А]), В работе [1621
отмечалось, что в опытах с алюминиевыми стружками, залитыми
концентрированным раствором NH4NO3, наблюдалось, хотя и очень
медленное при комнатной температуре, выделение газа; при 60° С
оно шло значительно быстрее и давало свыше 1 слР/чпс; газ в этих
опытах содержал 6—13% водорода и 45—60% закиси азота.
Следует также избегать введения в составы, содержащие по-
рошки металлов, и, в особенности магний, всех тех солей, водные
растворы которых вследствие гидролиза имеют кислую реакцию.
В водном растворе хлорида калия, имеюшем нейтральную реак-
цию, коррозия магния идет несколько быстрее, чем в воде, но во
много раз медленнее, чем в растворах солей аммония.
Коррозия алюминиевого порошка сильно ускоряется в присут-
ствии меди и особенно ртути, а также в присутствии растворимых
солей этих металлов, а потому добавление их в составы является
совершенно недопустимым.
В спрессованных составах, компоненты которых теснее со-
прикасаются между собой, химические изменения в некоторых
случаях протекают быстрее, чем в порошкообразных составах,
несмотря на то, что составы в порошке более гигроскопичны.
По вопросам коррозии металлов (в том числе и металлических
порошков) могут быть рекомендованы монографии Эванса [170].
Акимова [163] и Томашова [168].
Составы, содержащие порошок металлического железа, в боль-
шинстве случаев являются химически нестойкими, так как про-
цесс окисления тонко измельченного железа в присутствии влаги
протекает весьма быстро. В фейерверочных составах с железными
опилками последние, во избежание их окисления, перед изготовле-
нием состава подвергают операции воронения — обработке горячим
льняным маслом; подробнее см. в книге Солодовникова [6].
Составы, не содержащие порошков металлов
При увлажнении таких составов в большинстве случаев нс
происходит значительных химических изменений. Исключение со-
ставляют смеси, в которых присутствуют две растворимые соли,
способные в растворе вступать в реакцию двойного обмена с обра-
зованием осадка.
Обменные реакции. Примером такой нежелательной ком-
бинации солей может служить состав желтого огня, в который
входит смесь цитрата бария с сернокислым, углекислым или щаве-
левокислым натрием. При увлажнении таких смесей происходят
146
обменные реакции с образованием трудно растворимых бариевых
солей, например:
В a (NOg) 2 + NaaCOs—>-ВаСОз + 2МаМОз
Образование в результате подобных реакций гигроскопичной
соли NaNO3 обусловливает дальнейшее увлажнение состава, вслед-
ствие чего в образующемся растворе реакция в некоторых случаях
может пройти почти полностью.
Составы сигнальных огней, не содержащие порошков металлов
и гигроскопичных солей (а также комбинаций солей, способных
к двойному обмену), не претерпевают обычно при хранении сущест-
венных химических и физических изменений. Примером весьма
стойкого При хранении состава может служить состав красного
огня: хлорат калия — карбонат стронция — смола.
Составы сигнальных дымов, содержащие хлорат калия, сахар
Или крахмал и какой-либо органический краситель, являются до-
вольно гигроскопичными, но не претерпевают в процессе хранения
каких-либо существенных химических изменений. То же наблю-
дается во многих случаях и для составов маскирующих дымов, не
содержащих порошков металлов.
Образование нестойкой соли — хлората аммо-
ния. При увлажнении составов маскирующих дымов, содержащих
наряду с хлоратом калия дымообразующее вещество — хлористый
аммоний, теоретически возможно протекание обменной реакции
КС10з+NH4CI = КС1+ NH4CIO3
с образованием хлората аммония, способного к саморазложению
и даже самовзрыванию при небольшом повышении температуры
(30—60° С). Тем не менее практика показывает, что составы
маскирующих дымов, содержащих наряду с хлоратом калия и хло-
ристым аммонием большое количество нафталина или антрацена
(например, смесь Ершова), являются довольно устойчивыми при
храпении [211]; случаев самовозгорания дымовых смесей, подобных
смеси Ершова, до настоящего времени не наблюдалось.
Ввиду опасности протекания обменной реакции с образованием
хлората аммония недопустимо введение в хлоратные составы амми-
ачной селитры. Совместное применение аммиачной селитры и хло-
ратов запрещено и во взрывчатых смесях. Согласно литературным
указаниям, смесь хлората калия со стехиометрическим количеством
нитрата аммония взрывает уже при 120° С.
О самовоспламеняющихся от действия воды хлоратных соста-
вах, содержащих NH4NO3, медные соли и порошки металлов
см, [7, стр. 133].
Нестойкие смеси хлоратов с серой. Эти смеси со-
вершенно не употребляются для снаряжения изделий, предназна-
ченных к долговременному Храпению. Особеннно велика возмож-
ность самовоспламенения смесей KC103-f-S в тех случаях, когда
1П*
147
сера содержит следы серной кислоты. Введение в такие смеси до-
бавки карбонатов (например, мела — СаСО3), нейтрализующих
следы кислоты, снижает вероятность самовоспламенения, но,
ло-видимому, не исключает се совсем.
К весьма быстро самовоспламеняющимся смесям относится
смесь глицерина с тонкоизмельчепным перманганатом калия, ко-
торая самовоспламеняется через Ю—20 сек, после смешения ком-
понентов [4],
Смесь хлората калия с красным фосфором, как уже указыва-
лось, настолько чувствительна, что взрывает уже при легком рас-
тирании ее резиновой пробкой. При весьма осторожном изготов-
лении этой смеси самовоспламенение может, по-видимому, после-
довать спустя непродолжительное время без какого бы то ни было
внешнего воздействия. Скорость окисления чистого красного фос-
фора увеличивается с повышением температуры окружающей
среды; окисление красного фосфора значительно замедляется при
обработке частиц его идитоловым (или шеллачным) лаком.
§ 2. МЕТОДЫ ОПРЕДЕЛЕНИЯ ГИГРОСКОПИЧНОСТИ
И ХИМИЧЕСКОЙ СТОЙКОСТИ СОСТАВОВ
При обычных условиях хранения пиротехнических изделий, т. е.
при влажности воздуха пе более 80% и температуре, отвечающей
климату данной местности (имеется в виду сухой неотапливае-
мый склад), увлажнение составов Протекает весьма медленно;
также медленно в большинстве случаев протекают в этих условиях
и процессы химического разложения составов.
Заметные химические изменения при хранении стойких пиро-
технических составов в таких условиях происходят только по про-
шествии ряда лет- Для того чтобы искусственно вызвать в лабо-
ратории эти изменения за сравнительно короткий промежуток
времени, состав храпят в течение определенного времени при повы-
шенной влажности, а иногда одновременно и при повышенной тем-
пературе,
Под термином «проба на химическую стойкость пиротехниче-
ского состава» обычно понимают выдерживание состава в искус-
ственно созданных «жестких» условиях и изучение изменений, про-
исшедших в пиротехническом составе (путем взвешивания, хими-
ческого анализа, измерения давления газов над составом и т. п,).
Установить определенную закономерность в характере и вели-
чине изменений, происходящих в пиротехнических составах в зави-
симости от изменений условий хранения, чрезвычайно трудно.
Нельзя указать заранее, через какой промежуток времени при
хранении пиротехнических изделий в обычных складских условиях
в находящихся в них составах произойдут те изменения, которые
при испытании по «пробе на х’имическую стойкость» произошли
в лаборатории в течение определенного гораздо более короткого
промежутка времени.
148
Обычно химические изменения, обнаруженные в составе после
его испытания «по пробе», сравнивают с изменениями, происшед-
шими при испытании по той же «пробе» в химически стойком со-
ставе. Исследуемый состав признается химически стойким и пу-
скается в производство, если данные испытаний «по пробе» не пре-
вышают изменений химически стойкого состава, т. е. состава, уже
проверенного на практике.
Однако окончательное суждение о химической стойкости соста-
вов может и должно быть составлено только на основании наблю-
дений за изменениями, происходящими при долговременном хра-
нении снаряженных ими изделий в реальных условиях.
Г и гр оскопи чн ост ь составов определяется обычно в гиг-
ростатах, т. е. приборах, в которых сохраняется постоянной опре-
деленная влажность воздуха. Наиболее часто применяемым типом
гигростата является эксикатор, на дно которого налита вода или
насыщенный раствор соли. Испытуемый состав в бюксах или ма-
леньких кристаллизаторах помещают на подставку эксикатора.
Существенный недостаток такого гигростата состоит в том, что
от изменения температуры окружающей среды абсолютная влаж-
ность внутри прибора может изменяться в довольно больших пре-
делах, а неизменной фактически остается только относительная
влажность. Испытание это будет более совершенным, если эксика-
тор поместить в термостат.
Для создания определенной влажности воздуха внутри эксика-
тора па дно его наливается или вода (испытание при 100%-ной
относительной влажности), или растворы солей.
Над насыщенным раствором нитрата калия создается при 20° С
относительная влажность 9%5%, над насыщенным раствором хло-
рида натрия при той же температуре •— относительная влаж-
ность 77,5%,
Если испытание на гигроскопичность проводят с порошкообраз-
ным составом, то на подставку эксикатора помещают в открытом
стаканчике определенную навеску состава (например, 10 а); иногда
испытанию в гигростатах подвергают звездки и даже целиком
снаряженные мелкие пиротехнические изделия.
При сравнительном испытании многих составов обязательно
сохранение постоянной поверхности увлажнения (пользование
стаканчиками стандартного размера), а также обеспечение неболь-
шой толщины слоя увлажняемого состава, для чего диаметр ста-
канчиков при навеске в Юг должен быть не менее 50мм.
Во время испытания периодически взвешивают состав. Общая
продолжительность испытания состава на гигроскопичность в том
случае, если оно проводится при комнатной температуре (20° С),
составляет обычно не менее 30 сугок.
По окончании опыта можно вычертить график (фиг. 12.2), по-
казывающий изменение состава в весе в зависимости от времени
выдержки его в эксикаторе. Па оси абсцисс при этом откладывают
время выдержки состава в эксикаторе в сутках, а на оси ординат —
144
относительное увеличение веса состава в процентах от первона-
чального веса.
Существуют нормы на увеличение состава в весе после 10 суток
испытания в гигростате при t = 20° С и 100%-ной относительной
влажности: результат испытания считается вполне удовлетвори-
тельным, если увеличение состава в весе не превышает 2%.
Для дымного пороха увеличение его веса после выдержки его
при комнатной температуре при 92,5% относительной влажности
в течение одних суток не должна превышать 1.75%.
Время вдержки состава Время St>icyufuffama
8 гигростате S сутках состаВа в часах
при 20аС при 00-45°С
Фиг. 12.2. Изменение состава в весе при выдержке
его при повышенной влажности н последующем высуши-
вании.
Следует заметить, что испытание составов выдержкой при по-
вышенной относительной влажности нельзя назвать только испы-
танием гигроскопичности состава, так как при выдержке составов
по данному методу одновременно определяется ряд параметров,
характеризующих собой химическую стойкость состава.
Химическая стойкость пиротехнических составов может
быть определена различными способами.
В отношении проб на химическую стойкость пиротехнические
составы часто разделяют на 3 категории:
1) составы, содержащие порошки металлов и неорганические
окислители;
2) составы, содержащие порошки металлов и органические
окислители, содержащие хлор;
3) составы, не содержащие порошков металлов.
В большинстве применяемых в настоящее время методах испы-
тания на химическую стойкость в той или иной форме предусмот-
рено воздействие влаги на пиротехнический состав.
Обычно составы выдерживают в эксикаторах при повышенной
относительной влажности в течение не менее чем 30 суток. Выемку
состава (взятие пробы) производят через 10, 20 и 30 суток. Если
в испытуемых составах имеется порошок металла (Mg или А1),
то во взятых пробах определяют изменение активности металла,
150
остаточный привес (см. ниже) и составляют график зависимости
этих величии от времени выдержки.
Так как вес порошков металлов при окислении за счет взаимо-
действия их с водой увеличивается, состав, подвергшийся действию
влаги, после высушивания обычно не возвращается к своему перво-
начальному весу. Для того чтобы определить стойкость составов
(осветительных и др.), содержащих порошки металлов, достаточно
знать только увеличение в весе (остаточный привес) состава после
испытания (см. фиг. 12. 2).
Вместе с тем необходимо отметить, что остаточный привес
не может быть мерилом для оценки химической стойкости пиротех-
нических составов в том случае, если в составе содержатся летучие
компоненты.
Давление, развиваемое газообразными продуктами реакции
разложения увлажненного состава, измеряется сравнительно ред-
ко; этот метод контроля химической стойкости состава до сего вре-
мени не считается надежным, так как водород, выделяющийся при
разложении многих составов, может частично расходоваться
на восстановление окислителей (нитратов и др.).
Полный анализ составов [ при испытании их на химическую
стойкость обычно не проводится не только вследствие того, что
на это требуется большая затрата времени, но и по той же причи-
не. что в большинстве случаев при существующих методах анализа
на основании полученных данных трудно оценить истинные измене-
ния. произошедшие в составах.
§ 3. ПОНИЖЕНИЕ ЭФФЕКТИВНОСТИ СОСТАВОВ ПРИ ХРАНЕНИИ
И ДОПУСТИМЫЕ СРОКИ ИХ ХРАНЕНИЯ
Увлажнение составов приводит обычно к снижению специаль-
ного эффекта. Влажные составы горят медленнее, при горении
развивают более низкую температуру, излучают меньшее количе-
ство света. Снижение «активности» металлов вследствие Процессов
разложения, протекающих в осветительных, трассирующих и дру-
гих составах, приводит к таким же результатам (см. табл. 12. 1).
Таблица 12.1
Эффективность действия состава: 64% нитрата
бария, 24% магния, 12% идитола
Активность порошка ме- талла % Показатели при сжигании состава
сила света в ты- сячах свечей время горения сек
95 56 5,5
88 35 6,4
1 О методах анализа пиротехнических составов см, статью Денвера и Голь-
денсона [171]: методы анализа некоторых компонентов пиротехнических составов
описаны в первом издании нашей книги (1943 г.).
151
Поэтому для пиротехнических изделий приходится устанавли-
вать максимально допустимые сроки хранения, в течение которых
они должны быть использованы. Эти сроки, в зависимости от ре-
цепта состава и степени герметичности изделия, могут изменяться
от одного-двух лет до нескольких десятков лет.
Нормальным сроком Хранения изделий считается 10 лет и более.
К наиболее стойким составам следует отнести составы сигналь-
ных огней, не содержащих порошка металла. Из осветительных,
а также зажигательных составов наиболее химически стойкими яв-
ляются составы, содержащие в качестве основного горючего только
алюминий, а в качестве окислителя — нитрат бария.
Добавление магния в такие составы снижает их химическую
стойкость и уменьшает возможные сроки хранения содержащих
их пиротехнических изделий. Так как составы в порошкообразном
состоянии при прочих равных условиях более подвержены действию
влаги, чем спрессованные, то возможные сроки хранения для фото-
смесей приходится принимать несколько меньшими, чем для Других
видов пиротехнических составов.
При полной герметичности изделия допустимые сроки хранения
пиротехнических изделий могут быть в большинстве случаев весьма
значительными и исчисляться десятками лет.
В отдельных случаях по истечении допущенных сроков Хранения
пиротехнические изделия могут подвергаться испытаниям на эф-
фективность действия и на химическую стойкость состава. При
удовлетворительных результатах испытаний срок хранения изделий
может быть Продлен еще ца известный промежуток времени.
ЧАСТЬ ВТОРАЯ
Глава XIII
ОСВЕТИТЕЛЬНЫЕ СОСТАВЫ '
§ I. СПЕЦИАЛЬНЫЕ ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ
К ОСВЕТИТЕЛЬНЫМ СОСТАВАМ
Кроме общих требований к составам, указанных в первой части
книги, осветительные составы должны удовлетворять еще двум спе-
циальным требованиям.
1. При сгорании весовой единицы осветительного состава
должно выделяться максимальное
меряемой в люмен-секундах). Из-
лучаемый свет должен обеспечить
наблюдателю, кроме достаточной
четкости наблюдения, еще и пра-
вильное различение цветов. По-
этому излучение осветительного
состава не может быть .монохро-
матическим, — оно должно содер-
жать световую энергию всех ча-
стей спектра.
Желательным для случаев ви-
зуального наблюдения явилось бы
количество световой энергии (из-
распределение интенсивности из- фиг [3 L Зависимость
относительной
лучения по спектру, олизкое видноои от длины вол^ы.
к солнечному излучению, к кото-
рому привык и приспособился человеческий глаз. Чувствительность
человеческого глаза к свету с различной длиной волны показана
на фиг. 13. 1.
Следует, однако, указать, что если до последнего времени основ-
ным приемником излучения был человеческий глаз, то в настоящее
Время используются и различные физические приемники лучистой
энергии: фотоэлементы, фотосопротивлепия, термоэлементы и др.
1 Необходимые сведения
Ландсберга [ 178], Мешкова
во оптике и светотехнике
[182; Гершуиа [175].
можно найти
в книгах
153
В связи с этим спектральный диапазон используемого излучения
расширился вместо прежних 0.4—0.7 мк до 0,4—5 лис.
2. Линейная скорость горения спрессованных осветительных
составов должна составлять единицы миллиметров в секунду.
Для крупных осветительных изделий (факелы осветительных
помб и снарядов), где требуется достаточно большое общее время
горения, пользуются обычно осветительными составами, имеющими
скорость горения в уплотненном состоянии не более 1—2 лцн/сек;
для мелких же осветительных изделий (осветительные звездки для
пистолетных патронов и винтовочных гранат) употребляются со-
ставы, имеющие в запрессованном состоянии скорость горения 5—
10 мм)сек.
Для выполнения первого требования необходимо подобрать ком-
поненты осветительного состава таким образом, чтобы состав при
своем сгорании выделял максимальное количество тепла.
Практикой доказано, что достаточно большое количество лучи-
стой энергии получается только при сгорании составов, выделяю-
щих не менее 1,5 ккал[г. Эта цифра служит одним из критериев
для проверки правильности подбора тех или иных компонентов
осветительного состава.
Световой коэффициент полезного действия осветительных соста-
вов является функцией количества тепловой энергии, преобразуе-
мой в пламени в световую.
Числовое значение светового к. п. д., получаемого при горении
осветительных составов, определяется многими факторами: излуча-
тельной способностью продуктов горения, спектральным составом
излучения, размерами и оптическими свойствами пламени, ско-
ростью горения составов и др.
Для получения наибольших значений светового к. п. д. следует
путем подбора соответствующего рецепта состава и конструкции
изделия стремиться к тому, чтобы образующееся при горении со-
ставов пламя имело максимальную температуру, содержало в себе
достаточное количество твердых или жидких частичек, хорошо из-
лучающих свет в накаленном состоянии, имело наибольшую по-
верхность излучения.
К увеличению поверхности пламени следует стремиться по той
причине, что количество световой энергии, излучаемой пламенем
в единицу времени, зависит только от средней яркости пламени
в стильбах и от поверхности излучения в ди2.
F (лж)=лВ (сб) -S (сл12) !.
1 Указанная зависимость справедлива лишь к первом приближении, так как
свечение пламени является не плоскостным, а объемным; но во многих случаях
при достаточно больших размерах пламени и при большом коэффициенте погло-
щения собственного излучения пламена осветительных составов следует считать
источниками не объемного, а поверхностного излучения, так как значительная
часть излучения внутренних зон поглощается внешними слоями пламени.
154
Все сказанное выше относится и к мощности лучистого потока
в спектральных пределах, превышающих спектральную чувстви-
тельность человеческого глаза. В данном случае следовало бы
говорить не о световом к. п. д., а о к. п.д. лучистого излучения,
указывая в каждом конкретном случае в зависимости от приемника
излучения спектральный интервал излучения.
Восприятие лучистой энергии, излучаемой пиротехническими
пламенами, во многих случаях затрудняется дымностью пламени.
Дым получается при охлаждении по выходе из пламени мелко
дисперсных частичек окисей металлов. Присутствие в пламени оки-
сей металлов (MgO, AI2O3, ZrCh и др.) необходимо, так как именно
они обусловливают яркое свечение пламени. Отсюда следует, что
уменьшить дымность осветительного состава можно, ио полностью
избавиться от дыма — нельзя.
В связи с тем, что при дальнейшем изложении будут употреб-
ляться светотехнические термины, ниже приводятся определения
основных светотехнических единиц: свеча, люмен, люкс, стильб.
1. Основной светотехнической единицей является условная еди-
ница— новая свеча (св), равная 1/60 силы света, получаемой
с 1 см2 поверхности черного тела в направлении нормали при тем-
пературе затвердевания платины (2046,6° К)-
2. Единицей светового потока является люмен (лл1) — поток,
излучаемый источником света силой в 1 св внутри телесного угла
в 1 стерадиан.
Источник, обладающий в любом направлении силой света в 1 св,
излучает световой поток
4л 12,5 лм.
3. В качестве единицы освещенности применяется люкс (л/с) —
освещенность, создавае,мая световым потоком в 1 лм, равномерно
распределенным на площади в 1 ,иа.
4- За единицу яркости берется стильб (сб) — яркость равно-
мерно светящейся поверхности в направлении нормали, испускаю-
щей в том же направлении свет силой в 1 св с 1 см2.
§ 2. ТЕПЛОВОЕ И ЛЮМИНЕСЦЕНТНОЕ ИЗЛУЧЕНИЕ
Каждое тело, если его температура выше абсолютного нуля,
непрерывно испускает лучистую энергию.
Процесс превращения тепловой энергии в лучистую называется
тепловым излучением.
Причиной теплового (или термического) излучения является
движение атомов и молекул твердых и жидких тел.
Повышение температуры тел увеличивает их энергию за счет
увеличения скорости движения (колебательного и вращательного)
атомов или молекул.
Тепловое излучение твердых и жидких тел подчиняется законам
излучения АЧТ (см. § 2 в гл. VIII).
155
При высоких температурах (500° С и выше) тепловое излучение
увеличивается и в нем появляется заметное на глаз световое излу-
чение, т. е. тела начинают светиться.
Наличие в пламени осветительного состава накаленных твер-
дых и жидких частичек безусловно необходимо, так как накален-
ные пары и газы (без которых вообще не может быть пламени)
сами по себе излучают сравнительно малое количество световой
энергии. Свечение присутствующих в пламени твердых и жидких
частичек, как было уже сказано, подчиняется законам излуче-
ния АЧТ.
В связи с этим, принимая во внимание закон Стефана — Больц-
мана, энергия, излучаемая пламенем, быстро увеличивается с по-
вышением его температуры.
В табл. 13.1 показана зависимость яркости и светоотдачи абсо-
лютно черного тела от температуры.
Таблица 13.1
Яркость и светоотдача абсолютно черного тела при различных
температурах
Темпера- тура 5К Яркость сб Световая отдача Темпера- тура Яркость сб Световая отдача лм/вт
1600 2 0.2 2800 1552 13,9
2000 44 1,5 3000 2872 19,2
2200 136 3,2 3500 9432 34,7
2300 223 4,4 4000 2,34-10' 50,3
2400 350 6,6 5000 8,41-104 74
2600 779 9,4 6000 1,98'105 84
Спектральное распределение энергии излучения АЧТ (при
3000° К) > излучения пламени типичного осветительного состава,
а также кривая водности глаза показаны на фиг. 13.2.
Осветительные составы, имеющие температуру пламени ниже
2000° С, вообще применять нецелесообразно, так как количество
выделяемой ими при горении световой энергии весьма мало (свето-
вой к, п. д. абсолютно черного тела при этой температуре состав-
ляет всего только 0,7 %)
Тела, которые при нагревании дают спектральную кривую рас-
пределения энергии излучения, аналогичную кривой абсолютно
черного тела, имеющего ту же температуру, но только с меньшими
ординатами, называются серыми излучателями. К числу таких из-
лучателей относятся углерод и некоторые черные окислы. Суммар-
ная излучательная способность графита при температуре 100—
1500° С составляет 52% от излучения абсолютно черного тела, на-
гретого до той же температуры.
156
Спектр излучения таких белых окислов, как MgO или А12О3,
излучение которых используется в осветительных составах, являет-
ся непрерывным, как и спектр абсолютно черного тела; излучаемая
энергия также быстро возрастает с повышением температуры. Из-
лучательная способность белых окислов как монохроматическая,
так и суммарная меньше, чем абсолютно черного тела.
Фиг. 13.2. График распределения энергии по спектру,
f—АЧТ при ЗООО3 К, 2—осветительный пиротехнический состав, 3—кри-
вая падкости чслоьечсского глада.
Некоторые данные по излучательной способности окислов при
высоких температурах приведены в табл, 13.2,
Таблица 13.2
Наименование окисла Rif АкНОф Температура ° К Излучательная способность окислов в % от излучательной способности АЧТ
Длина волны в ммк
750 700 650 600 550 500 450
Окись алюминия А|;О3 1600 24 25 31 40 53 81 90
Окись алюминия АНО,- 1900 31 33 38 50 65 89 99
Окись магния MgO 1500 — 23 — 35 45 65 —
Окись магния MgO 1900 37 41 — 53 61 65 83
Двуокись тория ThO2 2000 — 47 — 48 49 49 50
Окись бериллия ВеО 1700 Об 08 —- 19 30 45
Окись хрома Cr2O3 1500 — 78 — 78 64 43 —
157
Окислы магния и алюминия при высокой температуре особенно
интенсивно излучают в области коротких волн, где их излучение
становится в некоторых случаях почти равным излучению абсолют-
но черного тела.
Кроме теплового излучения, в пламени осветительных составов
во многих случаях наблюдается и излучение люминесцентное.
Причиной возникновения люминесцентного излучения следует
считать изменение энергетических- свойств (уменьшение запаса
энергии) электронов в атомах и молекулах (возбужденных в ре-
зультате разрыва или возникновения химических связей).
Отсутствие или наличие люминесцентного излучения в пламени
пиротехнических составов может быть установлено в соответствии
с критерием Вавилова—Видемана [183], согласно которому люми-
несценция четко отделяется от других процессов радиации. Вави-
лов рассматривает люминесценцию как избыток над тепловым
излучением тела в том случае, когда это избыточное излучение
обладает конечной длительностью, значительно превышающей пе-
риод световых колебаний.
Наличие в спектрах излучения пламен осветительных составов
отдельных линий и полос нельзя считать безусловным доказатель-
ством наличия люминесцентного излучения, так как в данном слу-
чае линии и полосы могут быть обязаны своим происхождением
и тепловому- возбуждению атомов и молекул.
Явления люминесценции в пламени осветительных составов еще
мало изучены, и влияние многих «пламенных* добавок на свето-
вые показатели и характер излучения пламени остается еще в зна-
чительной мере невыясненным.
§ 3. СВЕТОВЫЕ ХАРАКТЕРИСТИКИ СОСТАВОВ
При испытаниях осветительных звездой или факелов находят
экспериментальным путем следующие величины;
1) вес сжигаемого состава в граммах т;
2) диаметр и высоту сжигаемой звездки или факела d и h;
3) среднюю силу света в свечах /;
4) время горения звездки или факела в секундах t;
5) иногда путем фотографирования фиксируется форма пли
мели и по снимку вычисляют поверхность пламени в см2.
Следует заметить, что ни сила света, ни время горения не могут
служить характеристиками для осветительных составов; эти вели-
чины показывают только качество изделий (факелов, звездок), из-
готовленных из осветительных составов.
Светотехническими характеристиками, относящимися непосред-
ственно к осветительным составам, являются:
1) удельная светосумма (св-с/г);
2) световая отдача С (лм/вт);
3) световой к.п.д. К (в %);
4) яркость пламени В (в сб);
158
5) линейная скорость горения и (в мм/сек) при непременном
указании плотности спрессованного состава d.
Практически наиболее важными характеристиками являются
удельная светосумма и линейная скорость горения.
Удельная светосумма. Количество световой энергии, вы-
деляющейся при сгорании 1 г осветительного состава, конечно, пра-
люмеп-секуида
вильнее выражать в размерности —граым или сокращенно
лм-с'/г, но, учитывая, что при испытании осветительных изделий на-
ходится не световой поток, а сила света в свечах, под удельной све-
тосуммой понимают количество се-с получаемое от 1 г сгоревшего
состава:
Lo =---св-с г
т
Пример 1. Вычислить значение удельной светосуммы для осветительного
состава, если спрессованная из него звездка весом 50 г горит в течение 9 сеч.
развивая при этом силу света, равную 100 000 св;
100 000-9
£°= 50
= 18 000 св-с/г.
Для перехода от люмена к свечам и обратно пользуются фор-
мулой
F лм=4 л • / (се).
Световая отдача. Под световой отдачей,С подразумевают
отношение общей светосуммы L у общей энергии Q, затрачиваемой
для получения данного количества света:
С = -~- лм[вт.
Из полученных экспериментальных данных о сиЛе света соста
ва световую отдачу вычисляют по формуле
4*
/•i• 3 003
——!—лм>сек1дж или лл1вт,
<н, 18-1000 те-q- 1000 '
с=—
т
где q— количество тепла в ккал, выделяемое 1 & осветительного
состава при сгорании;
4 • 18 — коэффициент перехода от малых калорий к джоулям.
Пример 2. Вычислить световую отдачу для осветительного состава, если
его удельная светосумма L<1= 18 000 се- с/г, а теплота сгорания q —1,65 ккал/г.
Решение:
1800 • 3,003
ТсТю6Г = 32>7 лм‘ат-
Световой к. п. д. Световым коэффициентом полезного дей-
ствия называется отношение световой отдачи данного источника
света к максимальной световой отдаче, получающейся при
100%-ном переходе всей энергии в световую; для монохроматиче-
159
ского света с длиной волны 555 ммк последняя величина равна
621 лм!вт, откуда
^_С-100
— 621
Для источников света со сложным составом излучения вычис-
ление светового к. п. д. по такой формуле нс представляется воз-
можным. В этом случае необходимо принимать во внимание кри-
вую относительной видностн человеческого глаза (см. фиг. 13-2).
Как указывает Н. Ф. Жиров [5]. световой к. и. д. для белых пламен
с известным приближением можно вычислить по формуле
С-100
— 248
Средняя яркость пламени выражается в стильбах. Она
вычисляется путем деления значения силы света I в свечах на по-
верхность пламени S в см2, подсчитанную по фотографическому
снимку [:
В = -^~ св[сл12
Линейная скорость горения выражается в мм/сек.
Вычисляется путем деления высоты сжигаемой звездки или факела
Л в мм на время горьния состава t в сек:
Л ,
/z=— .MMjceK,
Таблица 13,3
№ по пор. Тип лампы Источник света Темпе* ратура Спето- ван от- дача лм!вт Яркость сб
1 Накаливания ДаЛ[1[Ы накаливания га- зополные 1000 ат 2990 20 1220
2 Накаливания Лампы накаливания га- зополные специального назначения 250 впг 3350 26 —
3 Дуговые Угольная дуга 4200 12 70.000
4 Дуговые Дуга с интенсивными углями 5000 35 120.000
5 Газосветные Натриевые лампы заво- да „Светотехник" — 50 Малая
Газосветные Ртутные лампы сверх- высокого давления с во- ляпыч Охлажденном SP-800 -— 62 91.000
1 Это вычисление является очень приближенным, так как точно определить
истинную поверхность пламени невозможно; пламя не имеет правильной геомет-
рической формы и размеры его во время горения изменяются.
160
Линейная скорость горения состава не является постоянной ве-
личиной, но зависит от плотности состава d, поэтому величину и
всегда сопровождают примечанием: «при такой-то плотности со-
става».
Для возможности сравнения в дальнейшем светотехнических
показателей пиротехнических и электрических источников света
в табл. 13.3 приведены некоторые характеристики последних.
Как видно из таблицы, наилучшую световую отдачу имеют газо-
светные лампы, дающие люминесцентное излучение.
§ 4. СОСТАВЛЕНИЕ ДВОЙНЫХ СМЕСЕЙ
Основой каждого осветительного состава служит двойная смесь:
горючее — окислитель.
Суммарное количество других компонентов в осветительном со-
ставе редко превышает 10—15% и поэтому качества состава
в основном определяются выбором двойной смеси: горючее — окис-
литель.
Для такой двойной смеси горючего и окислителя необходимо
установить еще наивыгоднейшие количественные соотношения
между ними.
Выбор горючего
При рассмотрении различных- горючих принимается во внима-
ние количество тепла, выделяющееся при их сгорании, а также дру-
гие физико-химические свойства как самого горючего, так и про-
дуктов его окисления.
В качестве горючих для осветительного состава выбирают эле-
менты, для которых теплота образования 1 г окиси Q2 составляет
не менее 2,0 ккал.
Из табл. 3. 1 видно, что к числу таких горючих относятся следую-
щие элементы:
Li, Be, Mg, Al, Ca, Ti, Zr, H, С, B, Si, P.
При выборе горючего следует принимать во внимание, что
основная или, во всяком случае, значительная часть продуктов
горения пиротехнического состава должна плавиться при весьма
высокой температуре и не испаряться при температуре реакции
горения, чтобы в пламени находилось значительное количество
твердых и жидких частиц.
Поэтому необходимо выбирать Для осветительных составов та-
кое горючее, продукты горения которого представляли бы собой
высокоплавяшиеся и труднолетучие вещества.
Водород, углерод и фосфор не удовлетворяют этому требова-
нию и потому не могут быть применены в качестве основных горю-
чих в осветительных составах. Следует заметить, что температура,
развивающаяся при горении фосфора на воздухе, не превышает
11
А. Л. Шндлы некий
161
Все источники света, основанные на использовании горения
органических веществ, имеют очень малую световую отдачу (не
более 1 лм/вт) (5]. Элементарный углерод при сгорании в атмо-
сфере кислорода дает световую отдачу всего 1,9 лм/вт.
На практике едва ли могут быть использованы в качестве го-
рючих в осветительных составах бериллий и цирконий. По количе-
ству энергии, выделяющейся при сгорании этих металлов, пред-
ставляет интерес только бериллий.
Данные о количествах тепла, выделяющегося при горении не-
которых составов, где в качестве горючих взяты указанные метал-
лы, а в качестве окислителя — нитрат бария, приведены
в табл. 13.4.
Таблица 13А
№ состава Состав в % Теплота горения ккал! г
горючее нитрат бария
1 Бериллий—15 85 1,94
2 Цирконий—46 54 1,12
3 Магний—32 68 1,66
Ожидать выделения большого количества световой энергии при
горении состава 2 (см. табл. 13.4) можно было бы только в том
случае, если бы световая отдача для циркония оказалась значи-
тельно выше, чем для магния. Но опыт показывает, что световая
отдача циркония даже при создании наиболее благоприятных усло-
вий для его сгорания получается лишь немного большей, чем для
магния. Так, Ван-Лимпт указывает, что световая отдача циркония
при сжигании его в атмосфере кислорода составляет 36 лм/вт,
в то время как световая отдача магния при сжигании его в тех же
условиях получается равной 28 лм/вт.
Опыты, поставленные И. В. Быстровым по фотометрированию
осветительных составов с цирконием, показали, что удельная све-
товая энергия для этих составов получается даже еще меньшей,
чем это можно было бы предполагать.
Для состава, состоящего из 49% Zr, 51% Ba (NO3)2, С —
= 20 лм/вт, что соответствует удельной светосумме Бо=74ОО се>
сек/г [2].
Бериллий в качестве горючего в осветительных составах до сего
времени ие испытывался.
Остающиеся шесть элементов Al, Mg, Са, В, Si и Ti являются,
следовательно, наиболее подходящими для применения их в каче-
стве горючих в осветительных составах.
Некоторые характеристики этих элементов приведены
в табл. 13.5.
162
Таблица 13.5
Рецепты двойных смесей в % Теплота горения ккал[г Светоотдача в лм/вт при сжи- та пни элемента в кислороде
горючее нитрат бария
Алюминий--26 74 1,57 26
Магний—32 68 1,65 28
Кальций—43 57 1,44 —
Бор—12 88 1,37 —
Кремний—21 79 1,28 —
Титан—31 69 1,18 25
Как видно из таблицы, наибольшее количество тепла получает-
ся при сгорании двойных смесей нитрата бария с магнием или
алюминием. Окислы этих металлов обладают, кроме того, хорошей
излучательной способностью. Все это вместе взятое является до-
статочным основанием для применения в качестве горючих в осве-
тительных составах, главным образом, алюминия или магния,
а также их сплавов или смесей.
Применение кальция или его сплавов в осветительных соста-
вах ввиду их большой коррозионной способности не представляется
возможным.
Применение в качестве горючих любых сплавов, содержащих
значительное количество бора или кремния, по всей вероятности,
не даст возможности получить осветительные составы с достаточно
хорошими световыми показателями. Такие сплавы могут вызвать
только замедление горения осветительных составов^ что в некото-
рых случаях является необходимым.
Световая отдача титана при сгорании его в кислороде полу-
чается несколько меньшей, чем магния и алюминия, испытанных
в тех же условиях (см. табл. 13.5). Количество тепла, выделяюще-
еся при сгорании титана, также меньше, чем при сгорании магния
или алюминия. Поэтому нет оснований ожидать хороших световых
показателей от осветительных составов, изготовленных с примене-
нием металлического титана или его сплавов.
Выбор окислителя
Для того чтобы получить высококалорийный осветительный со-
став, следует выбирать для него окислитель, требующий минималь-
ного количества тепла на свое разложение.
Но смеси, содержащие хлораты, обычно весьма чувствительны
к механическим воздействиям. Поэтому, несмотря на то что изго-
товленные на этих окислителях составы выделяют при своем сго-
рании наибольшее количество тепла, они все же практически
не применяются в осветительных составах.
11*
163
В меньшей мере те же соображения относятся к окислителям —
перхлоратам. Перхлорат бария — вещество чрезвычайно гигроско-
пичное— до сего времени в пиротехнике не используется.
За последние годы в зарубежной литературе (в статье Тавернье
[185] и в книге Иццо [12]) появились указания на возможность
применения в качестве окислителя в осветительных составах пер-
хлората натрия — NaC104. Действительно, составы на этом окис-
лителе могут иметь высокие световые показатели; однако NaC104
весьма гигроскопичен (гигроскопическая точка при комнатной тем-
пературе 69—73%), вследствие чего изготовление составов без
риска их увлажнения возможно проводить только в атмосфере
с пониженной влажностью, Иццо [12] приводит рецепт освети-
тельного состава для факелов: NaC104—65%, Al — 30%, смола
(гуммиарабик)— 5%.
Наиболее часто в качестве окислителей для. осветительных со-
ставов применяются нитраты.
Изготовленные в стехиометрических соотношениях смеси нитра-
тов с магнием или алюминием выделяют при своем сгорании от 1,5
до 2,0 ккал на 1 г состава.
Из нитратов в осветительных составах чаще других применяют-
ся нитрат бария—соль нсгигроскопичная и нитрат натрия — соль
гигроскопичная, но имеющая то преимущество, что при введении
ее в состав в пламени возникает интенсивное излучение в желтой
части спектра.
Смеси горючих с сульфатами дают при сгорании меньшее ко-
личество теплоты, чем смеси с нитратами тех же металлов. Поэтому
применение сульфатов, а также перекисей в качестве окислителей
в обычных осветительных составах не представляется целесооб-
разным.
В табл. 13.6 приведены сравнительные характеристики соедине-
ний бария: нитрата, сульфата и перекиси, а также состав и теплота
сгорания смесей этих соединений с магнием.
Таблица !3.6
Термохимические характеристики двойных смесей
Окислитель количество затрачиваемо' го тепла на выделение из окислителя 1 г кислорода ккал % магния в смеси Уравнение реакции горения C&I сси Теплота горения ккал! г
Ba(NO3), -1,2 32 Ba(NO3),-4-5Mg=BaO+ +5.MgO+N2 1,7
BaSO4 -3,7 23 BaSO4+4Mg=BaS+4MgO 1,2
В a Oj —0,7 13 BaO2+Mg=BaO+MgO 0,7
164
В качестве общего правила При выборе окислителей для
осветительных составов можно указать, что при прочих
равных условиях следует стремиться применять в качестве
окислителей соли металлов, имеющих малый атомный вес, так как
эти соли содержат большое количество кислорода, а изготовленные
с их участием составы выделяют при сгорании большое количество
теплоты.
На нежелательность применения в качестве окислителей солей
тяжелых металлов (например, Pb(NO3)2 и др.) уже было указано.
Следует также указать, что применение калиевых солей в качестве
окислителей в осветительных составах также нежелательно ввиду
невысоких световых показателей таких составов (см. табл. 13.7).
Таблица 13,7
Световые показатели двойных смесей с различными окислителями
(диаметр звездок 24 мм, оболочка картонная)
Состав двойкой смеси % Плотность смеси г'см-' Коэффици- ент уплот- нения Линейная скорость горения м м/сек Удельная светосумма св•ci г
Ba(NO3)2-60, Mg—40 1,94 0,80 8,0 13 000
NaNO3—60, Mg—40 1,71 0,85 11,0 15 200
KNO3—60, Mg—40 1,69 0,87 8,7 10 600
NH4NO3—60, ,MgT40 1,72 0,99 1,8 5 600
Ba(NO3)2—60 Al—40 2,70 0,90 4,9 15 600
NaNO3-60, Al—40 2,17 0,89 2,6 15 300
KNO3-6O, Al—40 2,18 0,94 0,8 1300
NH4NOj-GO, Al—40 2,02 1,00 1,6 800
Введение в осветительные составы натриевых солей, наоборот,
повышает световые показатели составов. Нитрат натрия является
одним из лучших окислителей, обеспечивающим высокие светотех-
нические показатели составов (см. табл. 13.7).
Значения удельной светосуммы составов, окислителями в кото-
рых являются бариевые и стронциевые соли, близки друг к другу
н могут быть признаны достаточно высокими. Соли бария придают
пламени осветительного состава слегка зеленоватый оттенок; соли
стронция сообщают пламени бледно-розовую окраску.
Нитрат стронция редко применяется в качестве окислителя
в осветительных составах, так как соль эта более гигроскопична,
чем нитрат бария.
165
Установление количественного соотношения между
окислителем и горючим в двойной смеси
Окислитель и горючие в двойных смесях для осветительных со-
ставов берут или в стехиометрических соотношениях или же дает-
ся некоторый избыток горючего с таким расчетом, чтобы сн мог
сгореть за счет кислорода воздуха.
Так, например, содержание магния или сплава AM в двойных
смесях для осветительных составов может достигать в некоторых
случаях 50—60%.
Однако не всегда представляется возможным употреблять двой-
ные смеси с большим содержанием в них металлических порошков,
так как скорость горения осветительных составов значительно воз-
растает с увеличением содержания в них металлического горючего.
Световые характеристики некоторых двойных смесей с магние-
вым порошком приведены в табл. 13.8 (сжигание производилось
в картонных оболочках диаметром 24 лш).
Таблица 13,8
№ состава Состав в % Плот- ность г[см'$ Линей- ная ско- рость горения мм/сек Удель- ная сне- тосумма св-с/г Теплота горения ккал/г Светоот- дача лм/вт
нитрат натрия магний
1 70 30 1,9 4.7 9 800 1,3 22,6
2 60 40 1,7 11,0 15 200 2,0 25,0
3 50 50 1,7 14,3 20 000 2,6 23,0
Реакция горения смесей, характеристики которых помещены
в табл. 13.8, могут быть приближенно представлены уравнениями:
1) 2NaNO3+3Mg=Na2O+N2 + 3MgO-|-O2-
2) 2NaNO3 + 4,7Mg= Na2O +N2+4,7MgO+0,15O2;
3) 2NaNO3 + 7Mg+O2 (кислород воздуха) =Na2O + N2 + 7MgO.
Средняя яркость пламени при горении смеси 3 (см. табл. 13.8)
составляет по нашим подсчетам около 600 сб.
Светоотдача пиротехнических составов, выраженная в лм!вт,
такого же порядка, как для электрических ламп накаливания (ср.
габл. 13.8 и 13.3).
В табл. 13.9 приводятся данные, показывающие зависимость
светотехнических показателей двойных смесей от содержания
в них алюминия. Сжигались 24-Л1.И звездки в картонных оболочках.
Реакция горения состава 1 (см. табл. 13.9) может быть выра-
жена уравнением
ЗВа (NO3) 2 + 10А1 = ЗВаО + 3N2 + 5А12О3,
что соответствует, по расчету, выделению тепла 1,6 хкол/г.
166
Таблица 13.9
№ состава Состав в % Плотность г/см? Линейная скорость горения мм/сек Сила света 1 тыс, св. Удельная светосумма ^0 св с/г
нитрат бария алюми- ниевая пудра
1 74 26 2,7 3,0 51 13 800
2 64 36 2,7 5,0 66 14500
3 61 39 2,6 5,5 87 13 300
4 55 45 2,6 6,6 82 10 700
5 49 51 2,6 5,9 G0 8600
Световая отдача состава 1 равна 27 лм/вт.
Составы 2—5 содержат избыток горючего, который частично
сгорает за счет кислорода воздуха, а частично образует нитрид
A1N. Как видно из табл. 13,9, скорость горения увеличивается
с увеличением содержания алюминия в составе, но только до
определенного предела (45%); лучшими световыми показателями
обладают составы с умеренной перегрузкой состава горючим (со-
держание алюминия 36—39%).
§ 5. МНОГОКОМПОНЕНТНЫЕ ОСВЕТИТЕЛЬНЫЕ СОСТАВЫ
Как уже было сказано ранее, основными показателями освети-
тельного состава являются удельная светосумма и линейная ско-
рость горения.
Реальный рецепт осветительного состава создают, исходя
из заданной линейной скорости горения, стремясь при этом
получить значение удельной светосуммы не меньше чем
20 000—25 000 св • сек!г. К описанным выше двойным смесям
окислитель — порошок металла с целью замедления процесса
горения состава, придания ему прочности в спрессованном виде
и увеличения его химической стойкости добавляют различные ор-
ганические вешества: смолы, минеральные масла, олифу, парафин,
стеарин и др.
Обычно построенные таким образом многокомпонентные соста-
вы имеют значительно меньшую линейную скорость горения, чем
соответствующие двойные смеси, но и значительно меньшую силу
света.
Удельная светосумма составов с магниевым порошком снижает-
ся от введения органических вешеств гораздо меньше, чем это
наблюдается для составов, содержащих в качестве горючего алю-
миниевую пудру или алюминиевый порошок,
167
Эллерн (9] приводит два рецепта осветительных составов для
парашютных факелов (в весовых %):
1 11
Магний............................... 52 48
Нитрат натрия......................... 39 42
Полиэфирная смола..................... 9 8
Поливинилхлорид ...................... — 2
Он указывает, что в полиэфирную смолу добавляется катали-
затор полимеризации; состав 1 горит быстрее, чем состав И, и дает
большую силу света с 1 сл12 горящей поверхности.
В качестве примера осветительного состава, содержащего нит-
рат натрия, .может быть также Приведен рецепт;
Магний.................................. 45%
Нитрат натрия .......................... 48%
Связующих веществ........................ 7%
Звездки весом 36—38 г из этого состава горят в течение 10 сек.
и дают силу света около 120 тыс св. Отсюда удельная светосумма
получается равной
Lo ~ 30000 св-с]г.
Эллерном [9] приводятся рецепты осветительных составов
с окислителем — нитратом бария (с небольшой добавкой нитрата
стронция):
111 IV
Магний............................... 52 17
Алюминий.............................. — 15
Нитрат бария......................... 38 55
Нитрат стронция ...................... 7 5
Льняное млело ........................ 3 3
Асфальтит............................. — 5
Состав IV имеет почти такую же скорость горения, что и со-
став Ц, но меньшую сиду света.
В качестве примера трехкомпонентного состава можно при-
вести состав, состоящий из 30% магния, 66% нитрата бария,
4% идитола.
Составы с алюминием при употреблении грубо измельченного
алюминия или при введении в них большого количества органиче-
ских связующих часто при горении сильно искрят.
Явление искрения заключается в том, что частицы нссгоревше-
го металла и раскаленные шлаки выбрасываются из пламени обра-
зующимися при горении состава газами. При внимательном наблю-
дении через синие очки можно заметить, что раскаленные частицы
металла имеют большую яркость и по окраске своей сильно отли-
чаются от темно-красных частиц цесгорсвшего шлака.
168
Выбрасывание из пламени несгоревших частиц металла назы-
вается «фарсовым» искрением в отличие от другого вида искре-
ния — шлакового искрения.
Понижение световых характеристик составов с алюминием при
введении в них органических связующих вероятнее всего объяс-
няется тем, что при наличии «форсового» искрения не Происходит
полного сгорания металла, вследствие чего значительно понижает-
ся температура горения состава.
Кислородный баланс осветительных составов при введении
в них значительного количества органических веществ обычно ста-
новится резко отрицательным.
Таким образом, надо полагать, что введение в осветительные
составы органических связующих и сходных с ними по свойствам
органических веществ в количестве, превышающем 5—6%, в боль-
шинстве случаев представляется мало целесообразным. Тем более
это следует иметь в виду, что давно известны и другие способы
замедления горения составов, вполне приложимые, в частности,
и к осветительным составам, а именно: 1) изменение степени дис-
персности металлических порошков; 2) добавление в алюминиевые
составы серы — легкоплавкого и малоактивного вещества.
Окисление алюминия в осветительных составах, содержащих
серу, происходит при горении частично и за счет серы, причем об-
разуется сернистый алюминий A!2S3. Но сернистый алюминий
является только промежуточным продуктом реакции, так как во
внешней зоне пламени происходит его окисление кислородом воз-
духа. Температура плавления AhS3 составляет 1100° С.
Реакция взаимодействия алюминия с серой
2А1 -h 3S = AI2S3 4-140 ккал
легко протекает при высоких температурах, чем и можно объяс-
нить, что осветительные составы, содержащие серу, при горении
сравнительно мало искрят даже в том случае, когда для их изго-
товления взят грубозернистый алюминий.
Введение более 10% серы в алюминиевые составы ведет к сни-
жению их световых показателей.
Как показала практика, добавление серы в алюминиевые осве-
тительные составы является вполне целесообразным.
Состав времен первой мировой войцьг
Нитрат1 бария........................... 76W
Алюминиевая пудра ...................... 10%
Алюминиевый порошок..................... 8И>
Сера..................................... 4%
Касторовое масло......................... 2%
При диаметре факела 10,5 см показатели этого состава следую-
щие; плотность 2,3 г/см3, и = 1,7 мм/сек, Lq — 11600 св -с/г.
169
Для повышения световых показателей осветительных составов
в них часто вводят несколько процентов, так называемых «пламен-
ных добавок».
Чаще других для этой цели употребляются негигроскопичные
плохо растворимые натриевые соли, как, например, фтористый нат-
рий, КрИОЛИТ и др.
Повышение световых показателей состава при введении в него
подобных добавок редко превосходит 15—20%, На скорость горе-
ния осветительных составов эти добавки (введенные в состав в ко-
личестве нескольких процентов) большого влияния не оказывают.
С целью уменьшения пыления составов, содержащих тонкоиз-
мельченные компоненты (например, алюминиевую пудру), в неко-
торых случаях добавляют к ним различные жирующие вещества.
В качестве такой технологической добавки чаще других веществ
применяются различные масла. Введение жирующих веществ спо-
собствует также увеличению стойкости составов при хранении.
Для защиты металлических порошков от коррозии и замедле-
ния процесса горения в осветительные составы вводят иногда и та-
кие вещества, как стеариновую кислоту или стеараты некоторых
металлов,
Для получения порошков Mg и А1, стабильных при хранении
по отношению к воде и водным растворам солей, в американском
патенте 2.894.864 (1959 г.) предлагается осуществлять обработку
порошков 10%-ным раствором стеариновой кислоты в бензольно-
спиртовом растворе (1‘-1).
В качестве добавочного окислителя в осветительных составах
наряду с нитратами металлов могут цспользоваться также различ-
ные ВВ (нитросоединения).
Так, в норвежском патенте 99,194 (1961 г.) указывается следую-
щий рецепт осветительного состава:
Нитраты щелочнцх металлов.......... 50—00%
Динитротолуол ..................... 13—25И
Магний , . . ...................... 20 —28%
Целлюлоза.......................... 4—8^
Во время второй мировой войны в германской армии использо-
вались гипсовые осветительные составы [9J:
V VI
Сплав Mg- -А( . . ................. 41
Магний............................... - 40
NaNOa............................... 11 13
CaSO4.0,5H,O...................... ,32 40
Вода ................................ 1 7
СаСОа............................. 15
Гипс с входящей в него водой в этом случае использовался
и как связующее, и как окислитель, частично заменяющий нитрат
натрия.
170
Эффективным осветительным составом, горящим под водой
[9], является состав по рецепту:
Магний.................................. 16%
Алюминий.............................. 12W
BaSO4 . . .............................. 40^
Ba(NO3)2................................. 32%
В качестве связующего добавляется 8 частей льняного .масла
и 1 часть МпОг. Это — экспериментальный рецепт времен второй
мировой войны.
При горении такого состава в воде могут иметь место вторичные
слабо экзотермические реакции:
MgO + H2O — Mg(OH)2 + 9 ккал,
BaS+ 2Н2О—Ba(OH)2 + H2S + 5 ккал.
§ 6. ОСНОВЫ ФОТОМЕТРИРОВАНИЯ И РАДИОМЕТРИРОВАНИЯ
ПЛАМЕН ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
Лучистая энергия пиротехнических пламен используется на
практике для воздействия на человеческий глаз, на фотоматериа-
лы, на фотоэлементы и другие электронные устройства.
Как видно из фиг. 13.2, энергия излучения осветительных со-
ставов распределяется по спектру таким образом, что основная ее
часть Приходится на инфракрасную часть (ИК) спектра, а макси-
мум излучения приходится на длины волн 1,2—1,8 мк.
Благодаря развитию инфракрасной техники эту ранее теряемую
часть лучистой энергии оказалось возможным использовать для
целей ночного фотографирования, видения в темноте и т. п.
[177]: [181].
Пиротехнические излучатели имеют известные преимущества
перед электрическими источниками лучистой энергии; они, будучи
выполненными конструктивно, например, в виде осветительных или
сигнальных патронов, имеют малые размеры, не требуют электро-
питания, легко забрасываются в расположение противника; недо-
статком их является кратковременность действия.
По вопросу источников ИК-излучения и их использования
в военной технике см. книги Анго [172], Дерибере [176], Ю. А. Ива-
нова и Б. В, Тяпкина [177], М- Л. Марголина и Н, П. Румянце-
ва [181].
При воздействии лучистой энергии на человеческий глаз
используют для количественной характеристики источника света
и оценки интенсивности освещенности уже знакомые иам величины
(см. § 1 этой главы); свечу, стильб, люкс.
При воздействии излучения на различные фотоэлектронные
устройства пользуются терминами: сила излучения, энергетическая
яркость, облученность. Взаимосвязь и размерность этих величин
описаны в курсах оптики [178]; в табл. 13. 10 приведены некоторые
справочные данные.
171
Таблица 13.10
Размерность и единицы энергетических характеристик излучения
-San)
Энергетические величины Формула Единица измерения
Сила излучения d ф* а emjcmep
Облученность d Ф р вн rfS ЫП’СМЪ
Энергетическая яркость эн dS впТстер-cAfl
* Ф — лучистый поток.
Фиг. 13,3. Кривые спектральной чувствитель-
ности фотоэлементов.
/—селеновый, 2—сер к и сто ‘Висмутовый, сернигто-
свинцовый, 4 — сел ei гнил о-свннцов1>гйь 5—тер модеме «г.
В основу практического фотометрирования и радиометрирова-
ния пламен положен принцип измерения освещенности или облу-
ченности как мера воздей-
ствия на соответствующий
приемник.
По освещенности или
облученности рассчитыва-
ют силу света (излучения),
пользуясь уравнением
/=£ •
Приемниками лучи-
стой энергии для видимой
части спектра в основном
служат фотоэлементы. Для
ИК-излучения наряду с
фотоэлементами и фотосо-
противлсниямп приме-
няются термоэлементы,
болометры и оптико-аку-
стические приемники.
Основными характери-
стиками для любого при-
емника излучения являются его спектральная и интегральная чув-
ствительность, а также их стабильность во времени.
Спектральная чувствительность — это чувствитель-
ность приемника к излучению с различной длиной волны; она опре-
деляется природой вещества, из которого сделан в приборе свето-
чувствительный слой, и может изменяться в широких пределах от
0,3 до 5 мк (фиг. 13.3).
Такие приемники лучистой энергии как термоэлементы, боло-
метры, оптико-акустические приемники не обладают избирательной
способностью к излучениям в различных участках спектра.
172
Фяг. 13.4. Селеновый фото-
элемент.
/—железная пластинка, 2—слой
селена, 3—полупрозрачный золо-
той слой, '/—контактное мет алл и *
чсскоз ко-пыщ.
Вместе с тем на практике часто требуется измерить силу излу-
чения не в широком диапазоне спектра, воспринимаемого прием-
ником, а на узком участке, соответствующем чувствительности
человеческого глаза, фотоматериала или оптической системы.
Для осуществления этой задачи применяются светофильтры, пред-
ставляющие собой пластинки, пропускающие только излучение
определенного спектрального состава. Для видимой части спектра
используются цветные стекла, для ИК-фильтров — специальные
стекла, слюда, фтористый литий, каменная соль, сильвин, броми-
стый калий и др.
Фотоэлементы непосредственно пре-
образуют лучистую энергию в элек-
трическую; это явление называется фо-
тоэлектрическим эффектом. Величина
фотоэффекта характеризуется двумя
законами;
1. Законом Столетова: фотоэлектри-
ческий ток прямо пропорционален па-
дающему па фотоэлемент лучистому
потоку,
2. Законом Эйнштейна: максималь-
ная энергия фотоэлектронов линейно
возрастает с увеличением частоты па-
дающего света независимо от его ин-
тенсивности. Измеряя фототок, образу-
ющийся в фотоэлементе, можно определить освещенность (облучен-
ность) , создаваемую источником излучения.
В настоящее время силу света осветительных средств измеряют
при помощи различных объективных фотоэлектрических приборов
(люксметров). Фотоэлектрический люксметр состоит из двух основ-
ных частей: светоприемника, состоящего из одного или нескольких
фотоэлементов, снабженных соответствующими светофильтрами,
и электроизмерительного прибора для измерения фототоков,
При фотометрировании пиротехнических пламен широкое при-
менение нашли селеновые фотоэлементы [179].
фотоэлемент (фиг. 13.4) представляет собой железную круг-
лую пластинку / толщиной 1—2 мм, диаметром 30—60 мм, на ко-
торую нанесен тонкий слой селена (или другого светочувствитель-
ного материала) 2. На верхний слой селена путем катодного на-
пыления нанесен полупрозрачный слой золота 3; на этот слой
накладывается металлическое кольцо 4, служащее проводником.
Между селеном и полупрозрачным слоем образуется запирающий
или вентильный слой, не пропускающий электроны в направлении
от полупрозрачного слоя через селен к железной пластинке. Обрат-
ному движению электронов (от железной пластинки через селец на
полупрозрачный слой) запирающий слой не мешает.
Если на фотоэлемент падает свет со стороны полупрозрачного
слоя, то он, достигая селена, освобождает электроны, которые мо-
173
гут двигаться лишь от селена к полупрозрачному слою; при этом
последний заряжается отрицательно, а железная пластинка —
положительно.
Замыкая кольцо 4 с железной пластинкой проводником тока —
проводом, получаем в цепи электрический ток, сила которого срав-
нительно продолжительное время остается пропорциональной ко-
личеству падающего па фотоэлемент света.
Сила полученного тока определяется двумя основными харак-
теристиками: 1) общей или интегральной чувствительностью
и 2) спектральной чувствительностью фотоэлемента.
Фиг. 13.5. Кривые спектральной чувствитель-
ности селенового фотоэлемента (/), человече-
ского глаза (2) и селенового фотоэлемента
с компенсационным светофильтром (3).
Интегральная чувствительность — это отношение
силы тока, полученной в цепи фотоэлемента, к вызывающей ее све-
товой мощности. Для современных селеновых фотоэлементов она
составляет 400—500 мка/лл (микроампер на люмен) при площади
фотоэлемента «Ю см2.
Как видно из графика (13.5), спектральная чувствительность
селенового фотоэлемента (кривая 7) близка к кривой спектральной
чувствительности среднего человеческого глаза (кривая 2).
Для точного приведения чувствительности фотоэлемента к чув-
ствительности человеческого глаза пользуются желто-зелеными
компенсационными светофильтрами (кривая 3), Компенсационные
светофильтры подбирают индивидуально к каждому фотоэлементу
с таким расчетом, чтобы значительное ослабление силы света при-
ходилось на область длин волн 400—530 и 580—700 мяк. Для удоб-
ства пользования фотоэлемент со светофильтрами вставляют
в оправу (фиг, 13.6), которая имеет оптический визир для точной
наводки фотоэлемента, контактные винты для подключения прово-
дов и резьбовое отверстие для установки фотоэлемента на штатив.
174
Электроизмерительные приборы, применяемые при фотометри-
ровании (радиометрировании), конструктивно оформляются или
в виде стрелочного гальванометра или в виде шлейфного осцилло-
графа [174]. Основной частью осциллографов является шлейф или
вибратор (фиг. 13.7). Как видно из фигуры, в магнитном поле по-
стоянного магнита помещена петля шлейфа 1 из тонкого провод-
ника. К петле прикреплено небольшое зеркальце 2 квадратной или
круглой формы площадью около 1 мм2. При прохождении электро-
тока от фотоэлемента по проводнику под действием пары силы
от взаимодействия тока с магнитным полем петля вместе с зеркаль-
Фиг. 13.G. Селеновый фото-
элемент в оправе.
Фиг, 13.7. Схема
шлейфа осциллографа,
/—петля шлейфа, 2—зер-
кальце,
цем поворачивается вокруг вертикальной оси. Если при этом зер-
кальце шлейфа освещается, то поворот отраженного луча будет
показывать угол поворота зеркальца.
Схема установки для измерения силы света изображена на
фиг. 13.8.
Луч света от осветителя 2 через диафрагму 3 попадает на зер-
кальце шлейфа 4. Отраженный луч фокусируется линзой 5 и попа-
дает на движущуюся фотобумагу или фотопленку 6. При равномер-
ном движении фотоматериала и при изменении величины фототока
вследствие изменения освещенности фотоэлемента в процессе
горения факела на фотоматериале записывается осциллограмма
процесса горения. К электроизмерительным приборам, применяю-
щимся для замера фототоков, предъявляются следующие требо-
вания:
а) чувствительность по току должна быть не менее 1 * 10~6 а
на одно деление шкалы или на 1 мм ширины осциллограммы;
б) минимальное внутреннее сопротивление не должно превы-
шать 100 ом;
175
в) температурный коэффициент, т. е. изменение показаний, об-
условленное переменой температуры, должен быть не более 0,2%
на 1° С;
г) число делений шкалы для гальванометра должно быть
не менее 50, а для осциллографа высота ординаты должна быть
не менее 35 мм;
д) минимальный период затухающих колебаний должен быть:
для стрелочных приборов 3—5 сек, для шлейфных осциллогра-
фов—не менее 25 гц;
е) наличие корректора для установки стрелки или «зайчика».
Фнгь 13.8. Схема измерения силы света.
/—фотоэлемент^ 2—осветитель, 5—диафрагма. 4—шлейф,
5—линза, б— фотобумага.
Приборами, изготовляемыми промышленностью и удовлетво-
ряющими этим требованиям, являются ПОБ-14 (Н-700) и милли-
вольт-миллиамперметр М-82.
Для того чтобы перейти от электрических величин к световым
(или энергетическим), необходимо приемник с электроизмеритель-
ным Прибором Проградуировать по эталонному источнику излу-
чения.
Таким образом, градуировка заключается в определении цены
деления шкалы гальванометра или цепы 1 мм высоты осциллограм-
мы а люксах или вт/мм. В качестве эталонных источников види-
мого излучения применяют светоизмерительные лампы, в качестве
эталонов инфракрасного излучения — различные модели абсолютно
черного тела.
В первом случае градуировка состоит в создании при помощи
светоизмерительной лампы на светоприемнике различных освещен-
ностей путем изменения расстояния между телом дакала свето-
измерительной лампы и светочувствительным слоем светоприемни-
176
ка. Градуировка проводится для 6—10 значений освещенности
с соблюдением при этом следующих условий;
а) освещенность на поверхности светоприемника не должна
превышать 2000 лк;
б) показания приборов должны быть в пределах 10—90% от
ширины осциллографией бумаги или шкалы гальванометра;
в) светоизмерительная лампа должна быть прогрета, а свето-
приемцик выдержан под действием света в течение 3—5 мин.
Градуировка люксметров и радиометров производится на так
называемой фотометрической скамье, представляющей собой на-
правляющий рельс, на котором крепятся штатив для лампы, карет-
Фиг. 13.9. Схема градуировки люкс-
Мег ра,
С с!-етоф]М ьт]], Ф—фотоэлемент, Г ‘-гальвано*
метр, ь7—лампа. Л— амоерметр, Л—реостат,
V’—вольтметру Л'—выклюй ат ел ь.
ка для установки светоприемника и ряд вспомогательных приспо-
соблений (измеритель расстояния, экраны, осветители и т. д,),
фиг. 13.9.
Фотометрическая скамья, применяемая для градуировки, долж-
на обеспечивать перемещение светоприемника вдоль оптической
оси от 0,2 до 3 м. Точность измерения расстояния между телом на-
кала лампы и светочувствительным слоем должна быть в пределах
±1 мм. Также должны быть обеспечены ограждение свстоприем-
ника от попадания на него отраженного н постороннего света
и параллельность тела накала лампы и светочувствительного слоя
светоприемника.
Прп градуировке необходимо соблюдать следующую последова-
тельность операций:
а) установить на фотометрической скамье лампу и светопрнсм-
ник;
б) подключить еветоприемник к одному из вибраторов осцил-
лографа или к гальванометру;
в) при закрытом светоприсмнике записать нулевую линию на
осциллографе или, сняв арретир, установить стрелку гальваномет-
ра на нуль;
12 А. А. Шид.-товскнй 177
г) записать отклонение светового луча на планке илн стрелке
гальванометра, вызываемые различными освещенностями;
д) после проявления пленки измерить на осциллограмме орди
налы отклонений и по ним построить график в лиг (фиг. 13. 10).
отклонение
Фиг. 13. 10. График градуировки люксметра.
Иногда не строят график, а определяют пену деления прибора
в люксах, но это менее точно, так как при этом принимается сред
ияя цена деления.
По данному вопросу можно рекомендовать следующую литера
туру: Мешков [182], Бурьянов [174], Бельский и Бессекерский [173].
Лукьянов [179], Марголин и Румянцев [181], Шкурин [184], Ланд
сберг [178], Жиров [о].
§ 7. ВЛИЯНИЕ УСЛОВИИ СЖИГАНИЯ НА СИЛУ ИЗЛУЧЕНИЯ
ПЛАМЕНИ И УСТАНОВКИ ДЛЯ СТАЦИОНАРНОГО ИСПЫТАНИЯ
Сила излучения пламени определяется температурой и спект
ральным составом излучения пламени, а также размерами и фор
мой его. Два первых фактора зависят в основном от рецепта
состава, а размер и форма пламени— не только от диаметра факе
ла, но и от условий горения состава,
В зависимости от условий, создаваемых при горении состава
пламя пиротехнических изделий может принимать различную фор
му и размеры. Особенно большое влияние на силу излучения ока
зывают обдув пламени воздухом с большой скоростью (более
100 ж/сек), горение составов в вакууме или под давлением и по
глошение излучения остывшими продуктами горения составов
(дымом).
178
Меньше влияют на излучение пламени отражение его окружаю-
щими предметами, прозрачность воздуха, температура и влажность
атмосферы, но и эти факторы при определенных условиях могут
в больших пределах изменять силу излучения, а при измерениях
ее вносить значительные погрешности.
Определение эффективности пламенных пиротехнических со-
ставов целесообразно производить в полевых условиях; однако,
помимо неэкономичности таких опытов и больших затрат времени,
при этом практически невозможно обеспечить стабильность и вос-
производимость результатов измерений.
Фиг. 13. 11. Схема фотометрической камеры.
/—осциллограф, 2—светопркемник, <?—жалюзи, 4—подъемник, 5—вентилятор,
дымовая труба.
Сравнительно простыми установками для измерения силы све-
та и времени горения пиротехнических изделий являются фотомет-
рические камеры. Эти установки до некоторой степени стабилизуют
влияние внешних условий, обеспечивают удаление дыма по мере
горения изделия и создают возможность проведения испытаний
в дневное время.
Типовая фотометрическая камера большой модели представ-
ляет собой агрегат, в который входят горно для сжигания, коридор
(как база для фотометрирования) и вытяжная вентиляционная си-
стема (фиг. 13.lt).
Фотометрическая камера имеет вид коридора прямоугольного
сечения шириной 2—-3 м, высотой 2,5—4 м и длиной 40—50 м, окан-
чивающегося, с одной стороны, помещениями для аппаратуры и
персонала, а с другой,— горном для сжигания и вентиляционной
системой.
Горно для сжигания представляет собой вертикальную шахту
круглой или прямоугольной формы, футерованную изнутри огне-
упорным кирпичом и снабженную воздуховодами для поступления
воздуха и удаления продуктов горения.
12*
179
Вентиляционная система, обеспечивающая удаление продуктов
горения и создание необходимой скорости воздуха вокруг горящего
изделия, состоит обычно из двух мощных вентиляторов (ВРС № 8
или № 10), воздуховодов и дымовой трубы.
Существенный недостаток измерения силы излучения пламени
состоит в том, что в фотомерической камере стены горна в процессе
белыми шлаками, многократно отра-
жающими световой поток, идущий от
пламени, и создающими па приемнике
лучистой энергии дополнительную об-
лученность, которая в некоторых слу-
чаях может Превышать основную. От-
ражательная способность стен горна
не остается постоянной и в зависимости
от режима эксплуатации и метеороло-
гических условий изменяется в преде-
лах от 40 до 150%, что приводит к зна-
чительным погрешностям в результатах
измерения.
С недавнего времени принята мето-
дика определения во время испытаний
отражательной способности (коэффи-
циента многократного отражения т|)
горна: с помощью чувствительного фо-
томера измеряют освещенность, созда-
ваемую лампой накаливания мощно-
стью не менее. 5 кет. Лампу устанавли-
вают в горне для сжигания на месте
сжигаемого изделия. При этом на све-
топриемник попадает как прямой свет
от лампы, так и свет, многократно от-
раженный от стенок горна.
Коэффициент многократного отра-
жения рассчитывается по формуле
Лзбш —
71 = /о0111 ’
света (лампы4-отраженный свет);
% — сила света лампы.
По полученному коэффициенту многократного отражения вно-
сят поправку в измеренную силу излучения.
В зависимости от назначения того или иного пиротехнического
изделия оно устанавливается соответствующим образом в потоке
воздуха в камере (фиг. 13. 12),
Расположение пиротехнических изделий при их фотометриро-
вании имеет значение, так как пиротехническое пламя, так же как
и любой другой реальный источник света, в различных направле-
ниях излучает различное количество света [2, стр. 192%
180
эксплуатации покрываются
Фотоэлемент Вбеэдка
(I--------------
, Вездеt *
Д)
Вводу* ।
Фотоэлемент j
—и
Фотоэлемент
Booty*
<9
Фиг. 13. 12. Расположение
осветительных изделий при
фотометрироварии.
д—ежимцие псяотителъиых звез-
дой» б—сжигание парашютных
осветительных изделий, в—еж ига ’
вне артиллерийских осветитель-
ных изделий.
где — суммарная сила
Во время сжигания пиротехнических изделий фиксируют
не только силу света, но также время горения и характер горения
(равномерность, пульсация и т. д.).
Перед началом фотометрирования рассчитывают расстояние
между фотоэлементом и изделием по формуле
где / — расстояние в лг;
/ — предполагаемая сила света в св;
а — цена одного деления (гальванометра или осциллографа)
в лк;
п— желаемое отклонение стрелки гальванометра или высота
осциллограммы.
При фотометрировании соблюдают следующий порядок опе-
раций:/
а) ромещают изделие на место сжигания (как указано выше);
б) устанавливают фотоэлемент на необходимом расстоянии
и наводят его на изделие таким образом, чтобы пересечение нитей
оптического визира приходилось на высоте пламени;
в) проверяют действие люксметра, для чего освещают фото-
элемент и в это время наблюдают, отклоняется ли стрелка гальва-
нометра или «зайчик» осциллографа в нужную сторону;
г) включают вентилятор;
д) поджигают изделие;
е) засекают секундомером начало горения;
ж) записывают показания гальванометра и наблюдают за ха-
рактером горения;
з) засекают конец горения.
Отсчет показаний гальванометра ведется через каждые 3—
5 сек; через такие же промежутки времени замеряются и ординаты
осциллограммы (см, ниже).
Пользуясь законом, согласно которому освещенность обратно
пропорциональна квадрату расстояния от источника света, полу-
чаем формулу
откуда
1-E-R-,
где Е — освещенность в лк;
I — сила света в се;
R.— расстояние в м.
Средняя освещенность определяется как средняя величина от
всех записанных отклонений гальванометра или всех ординат
осциллограммы, умноженная на цену деления:
_ Л]^-П2 + гг34-. . , +/!;
£ср =--------~:------------— Я,
1Я1
где п — числовые значения отдельных показаний гальванометра
или ординат осциллограммы;
t— общее число отсчетов;
а — цена деления.
Подставляя значение £ср в формулу закона освещенности, полу-
чаем среднюю силу света
/ — Н~ Ч- - • • +»< а П2
Глава XIV
ФОТОСМЕСИ
§ 1. НАЗНАЧЕНИЕ ФОТОСМЕСЕИ. НОЧНОЕ ВОЗДУШНОЕ
ФОТОГРАФИРОВАНИЕ. ФОТОМАТЕРИАЛЫ
Фотосмеси, или фотоосветительпые составы, предназначаются
для получения световых импульсов («вспышек») очень малой про*
должительности, не превышающей обычно нескольких десятых до-
лей секунды.
Фотовспышки применяются в бытовой фотографии в качестве
искусственного источника света в ночное время в тех случаях, ког-
да нет возможности воспользоваться достаточно мощными электри-
ческими осветительными установками, фотолампами и т. и. В годы
второй мировой войны фотосмеси, идущие для снаряжения фото-
осветительных авиабомб, получили широкое применение в ночном
воздушном фотографировании.
Для осуществления ночного воздушного фотографирования не-
обходимо наличие следующих элементов;
1. Источника света —бомбы, снаряженной фотосмесью (фото-
бомбы — ФОТАБ).
2. Ночного аэрофотоаппарата.
3. Фотоматериала для ночного воздушного фотографирования.
К фотосмесям, применяемым в бытовой наземной съемке
ночью, предъявляется требование минимальной продолжительно-
сти вспышки для получения четких снимков движущихся объектов.
В еще большей мере это требование относится к фотосмесям, при-
меняемым в ночном воздушном фотографировании.
Необходимость такого требования обусловливается тем, что
самолет, несущий аэрофотоаппарат, перемещается с большой ско-
ростью относительно фотографируемого участка земной поверх-
ности. При экспонировании все точки изображения фотографируе-
мого объекта вследствие перемещения аэрофотоаппарата в воздухе
сдвигаются на некоторое расстояние1. Сдвиг изображения при
1 Кроме поступательного движения самолета, сдвиг изображения обуслов
лииается продольными и поперечными вибрапнямн самолета,
182
экспонировании является особенностью воздушного фотографиро-
вания, затрудняющей получение четкого снимка. При значитель-
ной величине сдвига изображение становится нерезким, аэросни-
мок трудно или совсем невозможно дешифровать.
При наземном фотографировании фотоаппарат в момент экспо-
нирования находится в неподвижном положении; объект съемки
или неподвижен, или движется с малой скоростью. Поэтому при
фотографировании с помощью фотовспышек пользуются обычно
фотоаппаратом с постоянно открытым затвором. Продолжитель-
ность выдержки в этом случае определяется длительностью самой
вспышки. Так как длительность свечения фотовспышек колеблется
в пределах от сотых до нескольких десятых долей секунды, то сним-
ки даже движущихся объектов обычно получаются достаточно
четкими.
В ночном воздушном фотографировании вначале также пользо-
вались аппаратами, не имеющими затвора, т. е. время экспонирова-
ния равнялось времени излучения вспышки.
Однако аэрофотоснимки, полученные таким путем, имели боль-
шой сдвиг изображения вследствие относительно большого вре-
мени экспозиции и были непригодны для детального дешифро-
вания.
Кроме того, в случае высокочувствительных пленок щмело ме-
сто засвечивание кадра различными посторонними наземными
источниками света (пожары, различные огни, разрывы снарядов
и др.), которые оставляли па пленке продольные следы, сильно
затруднявшие дешифрование кадра.
После многочисленных исследований эти трудности были пре-
одолены применением ночного аэрофотоаппарата с затвором, авто-
матически действующим при помощи фотоэлектрического реле от
вспышки фотобомбы.
Интенсивность излучения при взрыве фотобо,мбы во времени
изменяется: в начале вспышки она резко возрастает от нуля до ка-
кой-то максимальной величины, а затем сравнительно медленно
падает от максимума до нуля. Поэтому при фотографировании
с автоматически действующим затвором чрезвычайно важно, что-
бы объектив фотоаппарата был открыт как раз в момент наиболь-
шей интенсивности вспышки. Достигается это путем тщательной
регулировки спускового механизма и увязки графика работы за-
твора с графиком «свет — время» вспышки фотобомбы.
На фиг. 14.1 приведены совместные графики работы затворов
и изменения интенсивности излучения вспышки фотобомбы по
Сафронову [188]. Практически используется только незаштрихо-
ванная площадь. Следует также отметить, что чрезмерное умень-
шение времени вспышки f нерационально, так как это может при-
вести к неполноте использования световой энергии (сокращению
эффективной светосуммы фотовспышки) вследствие инерционности
механизма открывания затвора, составляющей около 14 мсек.
183
Номенклатура фотоматериалов [186], [187] для ночного воздуш-
ного фотографирования, применяемых в настоящее время, очень
разнообразна. Фотоматериалы различаются по светочувствитель-
ности, контрастности и по кривой спектральной чувствительности.
Светочувствительность характеризуется величиной, обратно
пропорциональной количеству освещения, создающему на данном
фотографическом слое заданный фотографический эффект (крите-
рий светочувствительности).
В качестве критерия светочувствительности выбирается такой
фотографический эффект, который может быть выражен количест
венно (некоторая оптическая плотность, градиент и т. л.).
а) 5) в)
Фиг. 14.1. Совместные графики работы затворов и излучения вспышки
фотобомбы.
а—для затпсра приближенной синхронизации (во все время вспышки отверстие объ-
ектива открыто), б—дая затаора, работающего на открывание, в—для затаора, рабо-
тающего на открывание и закрывание.
По ГОСТу 2817—50 за критерий светочувствительности принята
плотность почернения, равная Дп + 0,2, где До — плотность вуали,
а за единицу количества освещения, вызывающего при определен-
ных условиях проявления этот эффект, Но— I лк- сек.
При ночных аэрофотосъемках используются пленки высокой
светочувствительности. Это обусловливается увеличением высоты
фотографирования в связи с усилением средств противовоздушной
обороны. '
Изменение плотности почернения фотоматериала в зависимости
от изменения действующих на него количеств освещения при раз-
личных условиях проявления определяется контрастностью, кото-
рая численно выражается в виде коэффициента контрастности у.
Фотоматериалы неодинаково чувствительны ко всем лучам
спектра. По спектральной чувствительности современные фотомате-
риалы подразделяют на следующие группы,
I, Несенсибилизированные, имеют чувствительность в сице-фио-
летовой части спектра с границей до 500 ммк, что соответствует
естественной чувствительности галоидного серебра.
2. Ортохроматические и изоортохроматические фотоматериалы,
имеют чувствительность также в зеленой и в желтой зонах спектра
с пределом сенсибилизации соответственно до 580 и 600 ммк.
3. Изохроматические фотоматериалы, чувствительны ко всем
видимым лучам и сенсибилизированы до 640 ммк.
184
4, Панхроматические фотоматериалы, чувствительны к лучам
всего видимого спектра до 680—700 ммк, но имеют небольшое сни-
жение светочувствительности в желто-зеленой части спектра (500—
550 лс«лс).
5. Инфрахроматическце фотоматериалы, чувствительны ко всем
видимым лучам и, кроме того, обладают чувствительностью в не-
видимой инфракрасной части спектра.
НесенсиЬилизироЬанная
Изоорто
»Г-Л
.iflf ф* Вь
Изохром
Панхрам тип
и пфра „ 7Л7*
Цифра „800"
Фиг. 14.2. Спектрограммы различно сенсибилизированных
эмульсий, полученные при освещении гюлуваттиои лампой.
Па фиг. 14.2 приведены спектрограммы различных фотомате-
риалов [186].
Спектральный состав излучения пламен фотосмесей отличается
от состава естественного дневного света. Цветная температура
излучения пламени фотос.меси приблизительно соответствует
2500° К. Поэтому для лучшего использования световой энергии
фотобомбы необходимо применять панхроматические материалы
с максимумом чувствительности в оранжево-красной части спектра.
18&
Гак как максимум излучения н спектре фотовспышки лежит
в инфракрасной части, то наилучшего фотографического действия
следовало бы ожидать при пользовании инфрахроматическими
фотоматериалами. Однако эти материалы имеют относительно низ-
кую светочувствительность и поэтому при ночном фотографирова-
нии их не применяют.
§ 2. ФОТОБОМБЫ
Для использования при ночном воздушном фотографировании
фотосмеси помещают в оболочки фотоосветительных авиабомб
(сокращенно ФОТАБ).
Фотобомба должна удовлетворять ряду специальных требова-
ний. Главное из них состоит в том, чтобы при взрыве ФОТАБ да-
вала вспышку с заданными характеристиками (сила света, дли-
тельность вспышки, спектральный состав излучения), которые
должны быть согласованы с работой затвора аэрофотоаппарата,
общей и спектральной чувствительностью применяемой фото-
пленки.
Конструктивные н баллистические качества бомбы должны
обеспечивать устойчивость бомбы в полете и разрыв ее в заданной
наиболее выгодной точке траектории.
В зависимости от высоты и скорости полета, качества применяе-
мой фотопленки, светосилы объектива аэрофотоаппарата, объекта
фотографирования и т. и. положение точки разрыва фотобомбы
может изменяться. Конструкция фотобомбы должна допускать
возможность регулирования высоты разрыва в зависимости от из-
менения перечисленных выше условий.
Должно быть обеспечено однообразие характеристик фотобомб.'
причем сила света вспышки и продолжительность ее для отдель-
ной бомбы не должны сильно отклоняться от величин, установлен-
ных для фотобомб данного типа.
Кроме того, к фотобомбам обычно предъявляют также требо-
вания простоты и безопасности процесса снаряжения и эксплуата-
ции, сохранности основных характеристик при долговременном
хранении и ряд Других специальных требований.
На вооружении военно-воздушных сил различных стран имеет-
ся большое количество фотобомб различных типов.
На фиг. 14.3 показана фотобомба BLC-50, состоявшая на во-
оружении ВВС бывшей германской армии.
В американском патенте 2.775.938 от 1/1 1957 г. [190J описана
фотобомба, существенно отличающаяся от описанных выше по сво-
ей конструкции и действию.
В оболочке 1 (фиг. 14.4) помещен взрыватель 2. Детонацион-
ный шнур 3 проходит от взрывателя до расположенного в центре
бомбы разрывного заряда 4, Вокруг разрывного заряда 4 разме-
щен магниевый порошок 5, В патенте указывается, что для тех же
186
целей может быть использован и тонкодисперсный алюминий.
Полнота сгорания разбрасываемого разрывным зарядом магниево-
го (алюминиевого) порошка мо-
Фиг. 14.3. Фотобомба ВЕС-50.
/—зиги жесткости, 2—стабилизатор, 3—
отверстии для креплении ревунов. 4—ле-
реход вое кольцо для крепления слабили*
затора. 5—диафрагма переходного коль-
ца, прокладка нз поПлока» 7—пиро-
технический состаз. корпус бомбы,
9—фасонный штампованный цилиндр,
10—бугель, //“взрыватель, /2—диа-
фрагма» /3—штампованное оживало,
//—бетой, /5—подвижная диафрагма
с четырьмя уголками, /$—карточная
прокладка. /7—вышибной зарнд [черный
порох), /5—7-мм диафрагма. /3—стопи-
новый огнепровод. 20—дер еа ян Нан do
бышка. 2/—литой ваконечник
кундах; /mai — время от начала
мума.
жет быть достигнута, согласно
указаниям патента, если частицы
порошка покрыть тонкой пленкой
натрия. Это осуществляется в ат-
мосфере инертного газа при
/=200—250° С; натрий исполь-
зуется в количестве 5—25% от
веса металлического порошка.
фиг. 14.4. Принцип конструк-
ции фотобомбы (амер, патент
2.775.938).
§ 3. МЕТОДЫ ОПРЕДЕЛЕНИЯ
ХАРАКТЕРИСТИК ФОТОВСПЫШЕК
К количественным характери-
стикам фотовспышек относятся:
^шах—максимальная сила света
вспышки в свечах; /Общ— продол-
жительность всей вспышки в се-
вспышки до наступления макси-
187
В ряде случаев при сопоставлении различных фотосмесей вы-
числяют также светосумму вспышки L. представляющую собой
интеграл J l-dt и выражаемую в секундо-свечах, удельную свето-
о
сумму вспышки Lo, представляющую собой отношение общей све-
тосуммы вспышки L к весу сжигаемого состава а также эффектив-
ную светосумму ЛЭф, т. е, светосумму, воспринимаемую фотоаппа-
ратом для заданного времени выдержки затвора, например,
г —1/25 сек.
Полная качественная характеристика излучения вспышки обес-
печивается наличием:
а) кривой спектрального распределения энергии вспышки;
б) цветной температуры вспышки;
в) изменения цветной температуры и спектрального распреде-
ления энергии в течение всего времени вспышки.
Определение количественных и качественных характеристик
фотовспышек представляет значительные трудности ввиду чрез-
вычайной кратковременности световых явлений, сопровождающих
взрыв или сгорание зарядов фотосмесей. Точное измерение количе-
ственных характеристик излучения фотовспышек стало возможным
только после разработки описанных выше (гл. ХШ, § 6) регистри-
рующих фотоэлектрических люксметров, дающих возможность
получать запись изменения интенсивности свечения в продолжение
вспышки.
Общую продолжительность вспышки и другие временные харак-
теристики вычисляют путем деления длины осциллограммы на ли-
нейную скорость перемещения фотоматериала.
Для того чтобы вычислить максимальную силу света вспышки
по высоте наибольшей ординаты осциллограммы, производят
градуировку люксметра при помощи светоизмерительной лампы
с известной силой света. Затем по графику находят величину осве-
щенности, соответствующей наибольшей высоте осциллограммы.
Умножая эту освещенность на квадрат расстояния между фотоэле-
ментом и исследуемой вспышкой, определяют Zmrix.
Для определения качественных характеристик излучения фото-
вспышек применяют спектрографы различных систем.
На фиг. 14.5 показаны спектрограммы излучения некоторых
фотосмесей. Во всех случаях на снимках спектров излучения фото-
вспышек виден интенсивный сплошной спектр, на фоне которого
видны линии и полосы.
Сплошной спектр обусловлен излучением раскаленных частиц
твердых и жидких продуктов сгорания фотосмеси. Интенсивность
сплошного спектра и положение максимума энергии излучения
зависят от температуры пламени фотовспышки и от природы излу-
чающих продуктов. Появление в спектре фотовспышек линий
и полос вызывается атомарным и молекулярным свечением про-
дуктов горения, пребывающих в состоянии газа или пара. Система
188
Фиг. bl.5. Спектрограммы пламени горящего магния и различных фотосмссей.
полос и линий в спектре существенно изменяется при изменении
состава фотосмеси.
Путем соответствующей обработки спектрограмм строят график
распределения энергии в спектре излучения фотовспышки.
На фиг. 14.6 приведена типичная кривая спектрального распре-
деления энергии излучения вспышки фотобомбы. Как видно, мак-
Фиг. 14.6. Кривая спектрального рас-
пределения энергии суммарного излуче-
ния вспышки фотобомбы.
риал, перемещающийся с известной
симум излучения вспышки ле-
жит в инфракрасной части
спектра.
Надо заметить, что приве-
денные выше спектрограммы
и построенные на их основе
кривые спектрального распре-
деления энергии характеризуют
суммарное действие всего из-
лучения вспышки от начала го-
рения фотосмеси до полного
затухания свечения.
Иногда важно знать спект-
ральный состав излучения в от-
дельные моменты вспышки.
В таком случае спектрограмма
снимается не на неподвижной
фотопластинке, а на фотомате-
скоростью в фокальной плоско-
сти спектрографа.
Анализ спектрограмм, развернутых во времени, показал, что
спектральный состав излучения на протяжении всего времени
вспышки непрерывно изменяется. При этом наиболее продолжи-
тельным является излучение в красной области спектра, а наибо-
лее кратковременным — излучение в фиолетовой области. Наибо-
лее высокая цветная температура вспышки, характеризуемая
излучением всех длин волн видимого спектра, наступает в момент,
соответствующий моменту достижения максимальной силы света.
Отсюда следует, что интенсивность излучения и эффективность
фотовспышек при прочих равных условиях определяется в первую
очередь температурой пламени.
§ 4. ФОТОСМЕСИ. ТРЕБОВАНИЯ К НИМ. ФАКТОРЫ,
ВЛИЯЮЩИЕ НА ОПТИЧЕСКИЕ ХАРАКТЕРИСТИКИ ВСПЫШЕК
И СВОЙСТВА ФОТОСМЕСЕЙ
Одним из первых составов фотовспышек были порошки или
тонкие ленты магния и некоторых других легкогорючих металлов,
которые сжигались в воздухе. Однако сгорание магниевого и дру-
гих металлических порошков в воздухе протекает сравнительно
медленно, а интенсивность излучения относительно невелика. Не-
190
сколько лучших результатов удавалось достигнуть при вдувании
металлических порошков в пламя газо-воздушной горелки.
В кислороде сгорание магния, алюминия, их сплавов, циркония
и некоторых других металлов в виде тонкой проволоки или фольги
протекает с большими скоростями и с большой светоотдачей.
Чаще всего фотосмеси приготовляют путем смешивания порош-
ков магния или других металлов с различными солями, содержа-
щими достаточное количество кислорода.
К фотосмесям предъявляются следующие специальные требо-
вания;
I. Минимальная продолжительность вспышки.
2. Максимальная сила света.
3. Наибольшее соответствие спектрального состава излучения
вспышки спектральной чувствительности аэрофотопленки.
Продолжительность вспышки, т. е. время, в течение которого на-
блюдается свечение пла,мени, и время, в течение которого фото-
смесь сгорает, неидентичны и определяются двумя совершенно
различными процессами. Если время горения определяется ско-
ростью химической реакции взаимодействия горючего и окислите-
ля, то длительность свечения пламени определяется протеканием
физических процессов нагревания и остывания продуктов горения
за счет теплоты, выделяющейся в результате реакции горения.
Однако все же скорость реакции горения является решающим
фактором, определяющим продолжительность вспышки.
Скорость сгорания фотосмеси в свою очередь зависит от:
1) рецепта состава, т. е. от природы применяегчых компонентов
и от их соотношения в составе;
2) степени измельчения компонентов;
3) плотности фотосмеси;
4) природы и интенсивности начального импульса;
5) количества одновременно сжигаемой фотосмесп и ее распо-
ложения в пространстве.
Фотосмеси с алюминиевым порошком горят медленнее, чем сме-
си с магниевым порошком.
Скорость горения фотосмесей в большой мере зависит от при-
роды применяемых- в них окислителей. Смеси с перхлоратом калия
и с другими подобными высокоактивными окислителями сгорают
быстрее, чем смеси с цитратами, окислами или сульфатами метал-
лов. Так, например, по данным Катца [7, стр. 170], в американских
стандартных фотобомбах М-46 максимальная сила света (500 млн.
свечей) достигается в случае состава с перхлоратом калия пример-
но через 0,013 сек от начала вспышки, а в случае применения
составов, содержащих нитрат бария, максимум интенсивности
вспышки достигается примерно через 0,025 сек.
Д- Харт [10] указывает, что фотобомба, содержащая 10 кг соста-
ва, даст силу света 800 млн. свечей при общем времени сгорания
0,04 сек.
191
Из работы Юцевича [189] следует, что «вспышка ФОТАБ при
высоте полета порядка 8—10 км происходит и а расстоянии 6—8 км
от самолета». Он же сообщает, что при высоте полета 10 км и ско-
рости полета 800 км!час средняя освещенность на местности будет
порядка 200 лк, Если принять высоту разрыва ФОТАБ над мест-
ностью 5 км, то для создания такой освещенности потребуется сила
света 5 • Ю9 св.
В табл. 14. 1 приведены данные о продолжительности вспышки
для некоторых магниевых фотосмссей.
Таблица 14.1
Смесь ВОТО 1 г матине* порошка Продолжи- I тильностъ вспышки : сек | Смесь ВОГО ] z матине* порошка Продолжи- тельность вспышки сек
с_0,75 г КМпО4 0,03 с 1,00 г Sr(NO3)2 0,10
с 1,00 г KNO3 0,07 с: 1,00 г Th(NO3)4 0,22
cl,00г Ba(NO3)2 0,07 с 0,50 г T1i(NO3)4 0,24
Как правило, самые короткие но времени вспышки дают смеси,
в которых компоненты взяты в стехиометрическом соотношении.
Смеси же, в которых имеется избыток горючего пли избыток окис-
лителя, дают вспышки бодее продолжительные.
Чем тоньше измельчены компоненты фотосмеси, тсм быстрее
она сгорает. При этом большее Значение имеет степень измельче-
ния металлического горючего.
Фотосмеси обычно применяются в порошкообразном состоянии.
При этом они сгорают с большими скоростями, которые измеряют-
ся сотнями, а иногда и тысячами метров в секунду. До тех пор,
пока сохраняется порошкообразное состояние фотосмеси, плотность
набивки порошка существенно пе сказывается на скорости горе-
ния состава.
Однако будучи запрессованными под большими давлениями
в брикеты, фотосмсси сгорают как быстрогорящие осветительные
составы с постоянной скоростью 10—15 мм/сек.
Скорость сгорания фотосмеси заметно зависит От характера
и интенсивности начального импульса, а также от расположения
его в заряде смеси. Для уменьшения общего времени сгорания
фотосмеси применяется не тепловой импульс (электрозапал, заряд
черного пороха, бикфордов шнур и т. п.), а взрывной импульс
(капсюль-детонатор, шашка какого-либо ВВ и т, п.).
Имеет большое значение также и количество одновременно
сжигаемой фотосмеси. С увеличением количества одновременно
сжигаемой фотосмеси скорость горения се возрастает. При сжига-
нии фотосмсси в количествах, превышающих несколько десятков
граммов, горение уже переходит во взрыв, Заряд фотосмесп, раз-
192
мещенный в виде компактной массы, сгорает быстрее, чем тот же
заряд, рассыпанный в виде длинной дорожки.
Однако, хотя при увеличении одновременно сжигаемого заряда
фотосмеси скорость горения смеси увеличивается, продолжитель-
ность фотовспышки не уменьшается, а возрастает. Объясняется это
увеличением общего времени горения при увеличении количества
смеси, а также увеличением времени остывания продуктов сгора-
ния смеси.
В табл. 14. 2 приведены данные о продолжительности вспышки
для зарядов различного веса.
Таблица 14.2
Количество состава г Общал продолжитель- ность вспышки сек Врсмл от начала вспышки до максиму- ма излучения сек
50 0,028 0,011
100 0,040 0,013
500 0,074 0,017
1000 0,080 0,026
1400 0,120 0,030
Сила света фотовспышки определяется следующими факторами:
1) теплотой сгорания смеси и зависящей от нее температурой
пламени;
2) наличием в пламени твердых и жидких частиц продуктов го-
рения с высокой излучательной способностью;
3) химическим составом фотосмеси, от которого зависят факто-
ры 1 и 2, а также спектральный состав излучения вспышки;
4) величиной заряда фотосмеси;
5) величиной пламени вспышки;
6) прочностью оболочки, в которую помещается заряд фото-
смеси.
Для получения интенсивных вспышек фотосмеси должны обла-
дать максимальным тепловым эффектом (более 2 ккал/г). Поэтому
в качестве горючих в фотосмесях применяют порошки металлов
с наиболее высокой теплотворной способностью: магний, цирконий,
титан, магниевые сплавы, алюминий. При выборе металлического
горючего и окислителя для фотосмесей руководствуются теми же
соображениями, что и при выборе металлических горючих для
медленно горящих осветительных составов.
В некоторых случаях в фотосмеси для получения необходимого
времени горения, необходимого цвета пламени и т. п. к основной
двойной смеси окислителя и горючего прибавляют специальные
вещества, окрашивающие пламя, и другие добавки.
13 А. А. Шидлавскмй
193
В настоящее время запатентовано большое количество различ-
ных составов фотовспышек, в том числе и с применением редко-
земельных элементов в чистом виде и в виде соединений. Многие
из этих рецептов не иашли широкого практического применения
ввиду дефицитности применяемых в них соединений.
Наиболее эффективными и доступными для широкого практиче-
ского использования оказались смеси нитратов бария или нитрата
стронция с порошками магния и других металлов.
Так, например, панхроматическая смесь из 60% нитрата строн-
ция и 40% магниевого порошка дает интенсивное излучение в крас-
ной части спектра, обусловленное свечением окиси стронция, и по-
тому с успехом может быть использована для ночной съемки на
панхроматических фотоматериалах.
Фотосмеси с нитратом и нитритом натрия не применяются
вследствие большой гигроскопичности этих солей.
Известно, что вспышки с наибольшей силой света дают фото-
смеси с некоторой перегрузкой металлом. При этом избыточное ко-
личество горючего сгорает за счет кислорода воздуха. Суммарный
тепловой эффект при этом соответственно повышается, а размеры
пламени также увеличиваются,
Результатом одновременного повышения температуры пламени
и излучающей поверхности пламени является увеличение интенсив-
ности фотовспышки при сгорании фотосмеси, перегруженной ме-
таллом.
С увеличением количества фотосмеси, сжигаемой одновремен-
но, интенсивность вспышки возрастает. Однако это увеличение
силы света вспышки непропорционально увеличению количества
смеси. Из табл. 14,3 видно, что удельная сила света на I а соста-
ва, характеризующая собой светоотдачу вспышки, резко падает
с увеличением количества сжигаемого состава.
Таблица 14.3
Количество фотосмеси г Максимальная С]1ла света в млн. Удельная сила света в тысячах свечей на 1 г cMecv Площадь проек- ции пламени м"
50 8.5 170 0,36
100 15,3 153 0,75
200 22,6 113 1,35
500 43,7 88 3,60
1000 50,2 50 6,50
1400 52,9 38 7,30
Как видно из табл. 14.3, величина пламени возрастает до неко-
торых пределов почти пропорционально количеству взятой для
194
сжигания фотосмеси, а при дальнейшем увеличении заряда фото-
смеси возрастание величины пламени, так же как и увеличение
силы света, постепенно замедляется и все больше отстает от воз-
растания количества одновременно сжигаемой фотосмеси.
Некоторое влияние на светоотдачу вспышки и особенно на ее
продолжительность оказывает прочность оболочки, в которую за-
ключен состав, В прочных металлических оболочках фотосмесь
сгорает быстрее, чем в картонных.
Весьма важным является чувствительность фотосмесей к меха-
ническим и к тепловым воздействиям. Это свойство определяет со-
бой степень опасности технологического процесса производства
фотосмеси, снаряжения ею фотобомб, а также возможность их
безопасной эксплуатации.
Наиболее чувствительны к удару и трению смеси, содержащие
в качестве окислителей хлораты и перманганаты.
Томлинсон и Одрит [122] указывают, что хлораты, смешанные
с порошкообразными металлами, чувствительны к удару и трению,
'Зарегистрированы случаи взрывов таких смесей. Поэтому предпо-
читают применять, где только возможно, более стойкий перхлорат
калия. Эти же авторы отмечают, что смеси, содержащие перманга-
наты и порошкообразные металлы, очень чувствительны к удару
и трению.
Одна из наиболее широко применяемых фотосмесей, состоящая
из тонкоизмельченных порошков — нитрата бария и сплава алюми-
ния с магнием, по их мнению, не только легковоспламеняема, но
чрезвычайно чувствительна к трению и к удару.
Особенно чувствительными к удару фотосмеси становятся в том
случае, когда в них имеются даже незначительные примеси органи-
ческих веществ.
В качестве стандартной фотосмеси (смесь Ф), используемой
в американской армии, Эллерн [9] приводит состав по рецепту:
Алюминий .пульиеризованный".......... 40%
Нитрат бария......................... 30%
Перхлорат калин ..................... 30%
Он же приводит световые характеристики ФОТАБ, снаряженных
этой смесью Ф (см. табл. 14.4).
Из табл. 14.4 видно, что с увеличением веса заряда фотосмеси
сила света увеличивается, но светосумма (секХсв) уменьшается
(сравни с табл. 14. 3). Из сравнения силы света двух бомб с весом
заряда 32—36 кг и 104 кг видно, что создание крупногабаритных
ФОТАБ сосредоточенного действия малорационально,
В немецких «дуст-бомбах» окислителя нет, а только алюминие-
вая пудра или алюминиевый порошок тонкого помола, окружаю-
щие центральный разрывной заряд. Однако, как указывается в [9],
алюминиевому порошку следует предпочесть сплав AM, который
используется за рубежом в настоящее время,
13» 195
Таблица 14,4
Световые характеристики ФОТАБ иностранных армий
Тип снаряжения Рецепт состава Вес состава кг Макси- мильная сила света в млн, сп, Свсто* сумма В МЛ1Ь Свето- сумма сек. се, на 1 г металла
Фотопатрон Смесь Ф 0,20—0,23 120 1,5 16 700
Фотопатрон 0,7 400 5,0 15 700
ФОТАБ 32-36 3200 76—90 5 500
ФОТАБ 104 4500 111 1 100
Немецкая дуст- бомба Только алюмини- евая пудри 15 450 63 4 200
То же Только пульпе- риз. алюминий 30 800 —
Фотопатроны и ФОТАБ, кроме их основного назначения —
ночной аэрофотосъемки,— могут использоваться и в качестве ими-
тационных средств, а именно; для имитации взрыва снарядов,
вспыщкн при стрельбе из орудий, атомных взрывов.
Глава XV
ТРАССИРУЮЩИЕ СОСТАВЫ
§ 1 КРАТКИЕ СВЕДЕНИЯ ОБ УСТРОЙСТВЕ ТРАССЕРОВ.
СВЕТОТЕХНИЧЕСКИЕ РАСЧЕТЫ
Для тоге чтобы сделать видимой как ночью, так и днем траек-
торию полета снарядов, пуль или других двигающихся с большой
скоростью объектов, применяют специальные устройства, называе-
мые трассерами [191].
Трассер представляет собой металлическую оболочку, в кото-
рую под большим давлением (от 3 до 8 т/см2) запрессован трасси-
рующий состав.1
Трассеры используются для наблюдения за полетом;
Т) самолетов-ракет;
2) реактивных противотанковых снарядов;
3) пушечных снарядов;
4) трассирующих пуль.
1 Мелкокалиберные снаряды, как правило, снаряжаются непосредственной
запрессовкой трассирующего состава в корпус снаряда.
196
Трассеры I и 2-й групп приводятся в действие электровоспла-
менительными средствами, питаемыми от бортовой электросети.
Воспламенение снарядных трассеров может осуществляться
либо непосредственно от пороховых газов (трассеры с «лучевым
воспламенением»), либо от взрывателей (типа «Бофоре»). Трасси-
рующие пули имеют обычно «лучевое воспламенение».
Трассирующие снаряды и пули предназначаются для поражения
быстродвижушихся целей: самолетов, танков, бронемашин и др.
Снарядные трассеры помещаются
рукции снарядных трассеров
бывают весьма разнообразны.
в донной части снаряда. Конст-
5
Фиг. 15.2. Трассер.
/—корпус трассере (стальной}; 2—
трассирующий состав, кольцо,
4—гайка, 5—целлулоидный кружок.
Фиг. 15. I. Трассер к взрыва-
телю МД-5,
/—гайка, 2—стаканчик, 5—трасси-
рующий состав, 4—целлулоидный
кружок.
Так, например, в бронебойных снарядах стаканчик 2 с запрес-
сованным в него составом 3 вставляется в гайку Л которая затем
прикрепляется к взрывателю (фиг, 15.1).
В некоторых случаях трассер представляет собой массивную
металлическую оболочку (втулку), заполненную трассирующим со-
ставом (фиг. 15.2).
В малокалиберных осколочных снарядах зенитной артиллерии
теплота, развиваемая трассирующим составом в момент его дого-
рания, часто используется для взрывания снаряжения с целью
самоликвидации снаряда в полете (фиг, 15.3). При выстреле заго-
раются воспламенительный состав 1 и трассирующий состав 2,
запрессованные непосредственно в корпус снаряда 3 в донной его
части. Снаряд имеет взрыватель ударного действия 4 и разрывной
заряд 5. В случае непопадания снаряда в цель трассирующий со-
став выгорает, тепло от его горения передается пиротехническому
ликвидатору 6, представляющему собой металлическую оболочку
с запрессовкой пороха, а тепло от горения последнего передается
через металлический стержень 7 детонатору 8, который взрывает
разрывной заряд 5.
197
Конструкции трассирующей и бронебойно-трассирующей пуль
показаны на фиг, 15,4 и 15.5.
Применение в условиях дневных стрельб в трассирующих сред-
ствах дымовых составов целесообразно при протяжении трассы не
более 1—2 км.
В литературе периода первой мировой
войны имеются указания о применении
трассирующих пуль, наполненных в каче-
Фиг 15.3 Осколочно-
трассирующий снаряд
с самоликвидацией.
/—воспламенительный состав.-
2—трассирующий состав. J—
корпус, 4—‘взрыватель, 5—раз-
рывной заряд, 6—ликвидатор,
7—стержень, Я—догони тор.
Фис. 15. 4. Трас-
сирующая пуля
т-зо.
/—Пульная оболоч-
ка, 2—свинцовый
сердечник, J-cra-
какчвк, 4—-основ-
ной (трассирую-
щий) состав, 5—
воспламенительный
состав, б—-колечко.
Фиг. 15.5. Бро-
небойно-трасси-
рующая пуля
БТ-32.
/—пульная оболоч-
ка, 2—свинцовая
рубашка, J—сталь-
ной сеодечнкк,
стаканчик, б-трас-
сирующиЯ слетав,
б—колечко^
стве дымообразующего вещества желтым фосфорам. Делались так-
же попытки применения для получения дымовой трассы составов,
близких по своим рецептам к составам сигнальных дымов,
В настоящее время трассеры снаряжаются преимущественно
огневыми составами. Путем увеличения силы света пламени доби-
ваются видимости огневой трассы и в дневных условиях.
198
Расчет необходимой силы света пламени
трассирующих составов
Восприятие глазом светящейся точки, находящейся па большом
расстоянии, зависит прежде всего от общей освещенности мест-
ности и яркости фона, на котором она (точка) наблюдается.
Яркость фона может в зависимости от времени суток и погоды
изменяться в весьма широких пределах: яркость ночного неба при
новолунии составляет только 1•10-8 сб; яркость белых облаков
в полдень находится в пределах 0,5—3 сб.
Для восприятия глазом светящейся точки необходимо, чтобы
освещенность, создаваемая ею на поверхности зрачка, превышала
величину пороговой освещенности, соответствующей данной ярко-
сти фона
Значения пороговой освещенности в ночных и дневных условиях
приводятся в табл. 15.1.
Таблица 15.1
Цвет огня Пороговая освещен- ность ^пор Цвет огня Пороговая освещен- ность £пор лк
НОЧЬЮ днем ночью днем
Красный 0,8-10-6 0,5-Ю-з Желтый 2,0-10-5 1,0-10—и
Зеленый 1,2- 10-п 0,9-10—3 Белый । 3,0-ю-e 1,5-10-з
Как видно из таблицы, днем чувствительность глаза значитель-
но уменьшается.
Для того чтобы, например, наблюдать днем белую трассу на
расстоянии до 2 км, следует обеспечить при горении состава полу-
чение силы света, не меньшей чем /=Дпор г2 —1,5 -10~3(2 103)2 =
=6000 се.
Поглощение света атмосферой вызывает необходимость приме-
нения в качестве трассеров источников света с еще большей силой
света. С учетом поглощения света атмосферой минимальная, тре-
буемая от трассера сила света / выразится формулой
J ^ПОр’Т2
юоо
а
где а — коэффициент прозрачности слоя атмосферы толщиной
в 1 КМ;
г— расстояние от светящейся точки до глаза в м.
1 Пороговой освещенностью называется минимальная освещенность, еще
воспринимаемая человеческим глазом.
199
Связь между коэффициентом прозрачности и состоянием атмо-
сферы характеризуется данными, приведенными в табл. 15.2.
Таблица 15.2
Зависимость между коэффициентом прозрачности и состоянием атмосферы
Балл по коду Коэффициент прозрачности а Визуальная оценка состояния атмосферы
0 Очень сильный туман
1 --- Сильный туман
2 0,0004 Средний туман
3 0.02 Слабый туман
4 0,14 Очень сильная дымка
5 0,38 Сильная дымка
6 0.67 Слабая дымка
7 0,82 Удовлетворительная видимость
8 0,92 Хорошая видимость
9—10 0,97 Исключительно хорошая видимость
Дальность видимости точечного источника света зависит только
от силы его света, но не от яркости.
§ 2. ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ К ТРАССИРУЮЩИМ СОСТАВАМ
Прежде всего трассирующие составы должны удовлетворять
требованиям, аналогичным тем, какие предъявляются к освети-
тельным составам, а именно:
1) выделять при горении максимальное количество световой
энергии;
2) гореть с определенной небольшой скоростью, выражающейся
в единицах миллиметров в секунду.
Кроме того, к трассирующим составам предъявляются еще не-
которые дополнительные требования, которые обусловливаются
жесткими и весьма специфичными условиями, в которых протекают
процессы их воспламенения и горения. Эта специфичность заклю-
чается в следующем.
1. Б большинстве случаев (в частности, при работе тех конст-
рукций трассеров, которые показаны на фиг. 15.1 —15.5) трасси-
рующие составы непосредственно подвергаются действию тех боль-
ших давлений, которые развиваются при горении пороха в канале
ствола оружия.
2. Б момент выстрела весь снаряд в целом, а следовательно,
и состав, находящийся в трассере, испытывает очень большие меха-
нические напряжения.
200
3. Вращение снаряда в полете (скорость вращения малокали-
берных снарядов измеряется десятками тысяч оборотов в минуту)
обусловливает возникновение в составе, а также и в продуктах его
горения очень большой центробежной силы,
4. Во время свободного полета снаряда за донной его частью
возникает разрежение и создаются вихревые потоки воздуха,
5. Связанные с малым габаритом трассеров малые размеры пла-
мени способствуют большому его охлаждению.
Таким образом, трассирующие составы, кроме всего прочего,
должны удовлетворять следующим условиям:
1. В спрессованном виде иметь прочность, значительно боль-
шую, чем все другие виды пиротехнических составов.
2. Находясь в сильно уплотненном состоянии, безотказно
воспламеняться от соответствующих воспламенительных со-
ставов.
3. Оставлять в оболочке трассера после сгорания максимальное
. количество шлаков.
Невыполнение первого условия приводит к частичному или пол-
ному выгоранию составов в канале ствола, следствием чего
является «короткая» трасса или вообще отсутствие трассы в по-
лете и преждевременный износ оружия.
Второе условие делает необходимым введение в состав легко
воспламеняющихся горючих (например, магния).
Последнее условие актуально только при использовании тех
боеприпасов, в которых вес трассирующего состава значителен
по сравнению с общим весом боеприпаса. Требование это вызы-
вается необходимостью создания правильной траектории полета
трассирующей пули или снаряда. Чем больше шлаков будет оста-
ваться в изделии после сгорания состава, тем меньше будет потеря
снаряда в весе и тем меньше будет его отклонение от нормальной
траектории. Особенно большое значение шлакообразование имеет
для трассирующих пуль, вес состава в которых равен примерно
10% от общего веса пули.
Вместе с тем следует отметить, что на практике это последнее
требование не всегда выполняется в достаточной степени. Хотя,
как правило, вес твердых продуктов реакции составляет не менее
60—80% от веса состава, но часть их потоком газов выбрасывается
из зоны реакции в атмосферу.
Опытные данные [2, стр. 109] показывают, что вес шлака, остаю-
щегося в трассере, составляет 35—45% от первоначального веса
состава.
Кроме перечисленных основных требований, желательно, чтобы
трассирующий состав в порошкообразном состоянии имел хоро-
шую сыпучесть, так как отмеривание дозы состава, необходимой
для запрессовки, производится обычно по объему при помощи спе-
циальных насыпных приборов,
201
Фотоэлемент
Фиг. 15.6. Р ас положе-
ние трассирующих из-
делий при фотометри-
ровании.
магний.
§ 3. РЕЦЕПТЫ ТРАССИРУЮЩИХ СОСТАВОВ
МЕТОДЫ ИСПЫТАНИЯ
Принципы построения и рецепты трассирующих составов (осо-
бенно составов белой трассы) весьма близки к принципам построе-
ния осветительных составов.
Обязательными компонентами для любого трассирующего со-
става являются: 1) окислитель, 2) горючее, 3) связующее-цемен-
татор.
Воздействие находящихся под высоким давлением горячих га-
зов порохового заряда на трассирующий состав создает большую
опасность возникновения в нем ускоренного горения. В связи
с этим, указывает Эллерн [9], в трассирую-
щих составах в качестве окислителей
нельзя использовать ни перхлораты, ни
тем более, хлораты.
Наиболее употребительными окислите-
лями для трассирующих составов являют-
ся нитрат бария, в составах красной трас-
сы — цитрат стронция; в составы желтой
трассы добавляется оксалат натрия.
Основным горючим в трассирующих
составах является почти исключительно
алюминия в качестве горючего в трассирую-
щих составах встречает большие затруднения из-за трудной вос-
пламеняемости таких составов.
Замедление процесса горения трассирующих составов можно
осуществить, вводя в них некоторое количество органического це-
ментатора, иапри.мер, резината кальция, шеллака, асфальтита,
эт ил целлюлозы и др.
Некоторые рецепты составов бедой, красной и желтой трассы
и их светотехнические характеристики приведены в табл. 15.3.
Связующим в составах 1 и 2 (см, табл. 15.3) является шеллак,
в составе 4 —резинат кальция.
Кроме компонентов, указанных в табл, 15.3, в трассирующих
составах применяются перекись стронция, карбонат и фторид
стронция, графит, силицид кальция и др.
Рецепты и технология изготовления немецких трассирующих
составов, использовавшихся во время второй мировой войны, опи-
саны в [192].
Силу света и время горения трассирующих составов опреде-
ляют иногда путем сжигания их в стационарном состоянии
(фиг. 15. 6).
Однако испытания такого рода в большинстве случаев не могут
дать представления о том, каковы будут сила света и время горе-
ния трассирующего состава в полете. Обычно в полете скорость
горения составов несколько увеличивается по сравнению со ско-
202
Таблица 15.3
Рецепты и характеристики составов белой (1—5), краевой (6—7)
и желтой (8) трассы. Составы 4, 7 и 8 заимствованы из [J[
Компоненты Номера составов и процентное содержание компонентов
1 2 3 4 5 6 7 8
Магний 35 25 36 35 44 30 33
Сплав AM — —- — — — —, 37 —
Нитрат бария 55 65 49 — 39 — — —
Нитрат стронция — — 32 ’—- 60 56 40
Перекись бария — — — 31 3 — — —
Оксалат натрия — — — — 8 — — 17
роливиннлхлорид — — — — — 7 —
Связующее — смола 10 10 15 2 6 10 — 10
Скорость горения в мм1сек 3,1 4,0 — — 3,1 —
Удельная светосумма в св-с/г 5300 4400 6500 — — 4400 —
Примечание,
около 10 мм.
Испытания проводились в оболочке диаметром
ростью горения в стационарном состоянии, а также несколько
изменяется и сила света.
Наиболее желательным было бы производить лабораторные
испытания трассирующих составов в условиях, возможно более
близких к условиям их практического применения, т. е. обеспечить
при испытаниях вращение трассирующего стаканчика и само испы-
тание вести в аэродинамической трубе или в другой подходящей
аппаратуре при обдуве воздухом со скоростью, близкой к скорости
полета снаряда.
Кроме этих испытаний, большое значение имеет определение
плотности трассирующих составов в запрессованном состоянии.
Иногда для выявления трещин исследуют под микроскопом качест-
во запрессовки трассирующих составов. В некоторых случаях
определяют также скорость горения трассирующих составов при
пониженных и повышенных давлениях.
Окончательную оценку качества трассирующих изделий можно
дать только после их полигонных испытаний.
При оценке эффективности пиротехнических трассеров необхо-
димо учесть, что;
203
а) йламя трассера подвергается воздействию набегающего по-
•тока воздуха с весьма большими скоростями;
б) полезный лучистый поток проникает через дымовой шлейф,
создаваемый трассером;
в) трассеры в некоторых случаях работают на больших высо-
тах в условиях разреженной атмосферы.
Для воспроизведения этих условий применяются специальные
стенды, состоящие из устройства для крепления и обдува трассе-
ра, компрессора и пульта управления.
Глава XVI
СОСТАВЫ СИГНАЛЬНЫХ ОГНЕН
. § 1. СИСТЕМЫ СИГНАЛИЗАЦИИ.
ТРЕБОВАНИЯ, ПРЕДЪЯВЛЯЕМЫЕ К СОСТАВАМ
Составы сигнальных огней предназначаются для подачи сигна-
лов иочью и днем.
Наиболее употребительной системой сигнализации при помощи
огневых пиротехнических составов является сигнализация трех-
цветная — с применением красного, желтого и зеленого огней.
Желтый огонь в случае необходимости может быть заменен
белым огнем, получающимся при горении осветительных составов.
Применение четырех- или пятицветной сигнализации, из кото-
рых последняя включает в себя красный, желтый, зеленый, синий
и белый (лунно-белый) цвета, едва ли можно признать вполне ра-
циональным, так как различимость цветов на больших расстоя-
ниях в этом случае становится недостаточно надежной.
Применяемыми в настоящее время пиротехническими средства-
ми ночной сигнализации являются сигнальные патроны, винтовоч-
ные сигнальные гранаты и мощные сигналы ночного действия.
Составы сигнальных огней должны, удовлетворять требованиям,
общим для всех видов пиротехнических составов (см. гл. 1, § 3) и,
кроме того, следующим специальным требованиям:
1. Пламя, получающееся ири сгорании составов сигнальных
огней, должно иметь достаточно характерную окраску, дающую
возможность четко различать цвета сигналов.
При количественной оценке цвета пламени указывается, что
«чистота» цвета (см. § 2 этой главы) должна быть не менее
70-75%. 1
2. Количество световой энергии, выделяющейся при сгорании
составов, должно быть максимальным; удельная светосумма соста-
вов должна выражаться величиной, не меньшей чем несколько ты-
сяч св-с/а.
Сила света сигнальных звездой для обеспечения их четкого
наблюдения в ночных условиях должна быть не меньшей, чем не-
сколько тысяч свечей.
204
Солнечный
спекпт
Солнечный спектр и спектр паров металлов Li, Na, Т1 In, Ba.
Зак. 750
Барий Индий Таллий натрий Литий
Так, например, для наблюдения сигнала зеленого огня в ноч-
ных условиях на расстоянии 10 км (104 л) при пороговой освещен-
ности 1,2- IO-® лк и коэффициенте прозрачности атмосферы а =
=0,8 (см. табл. 15.1 н 15. 2 в гл. XV) сила света его должна быть
не меньше, чем
3. Горение составов должно протекать с определенной скоро-
стью, выражающейся в единицах миллиметров в секунду. Обычно
сигнальные звездки горят со скоростью 3--—6 мм/сек.
§ 2. ХАРАКТЕР ИЗЛУЧЕНИЯ ПЛАМЕНИ
Идеальным составом сигнального огня следовало бы признать
такой состав, излучение пламени которого приходилось бы целиком
иа какую-либо одну часть спектра. В этом случае излучение пла-
мени можно было бы назвать монохроматическим и чистота цвета
пламени такого состава равнялась бы 100%. В действительности
же, пламя составов сигнальных огней имеет некоторое, хотя и бо-
лее слабое, излучение и в других частях спектра.
Отношение интенсивности монохроматического излучения пла-
мени к интенсивности всего видимого излучения ЕОбщ назы-
вается чистотой цвета пламени р и обычно выражается в про-
центах.
Так, например, чистота цвета пламени составов красного огня
может быть выражена уравнением
• 100 Е (620 -г- 760 ммк) • 100
р =-------=--------------------.
Еобщ Е (400 760 ммк)
При расчетах Ех и ЕОбщ можно выражать как в единицах све-
тового потока — люменах, так н в пропорциональной люмену вели-
чине, т. е. в свечах.
В некоторых случаях для определения чистоты цвета пламени
удобнее использовать выражение
Е,-100
Р=--------,
Ех+ Ебел
где Ебел — интенсивность белого цвета, которым разбавляются
монохроматические лучи.
Пламя, имеющее малую чистоту цвета, не может при наблю-
дении на глаз иметь резко выраженный цвет, так как обычный
белый цвет может быть получен смешением Уз красного, Уз зеле-
ного и Уз синего световых потоков.
Вещества, находящиеся в газообразном состоянии и приведен-
ные тем или иным способом в возбужденное состояние, дают пре-
рывный спектр излучения — линейчатый или полосатый.
Следовательно, в пламени составов сигнальных огней, в про-
тивоположность пламени осветительных составов, должно преоб-
ладать излучение газовой фазы.
Линейчатый спектр излучения дают только одноатомные пары
и газы, почему он и получил название атомарного. Линии в таком
спектре располагаются закономерными характерными группами,
называемыми сериями.
Для получения цветного пламени на основе атомарного излуче-
ния используют элементы, имеющие яркие спектральные линии
только в какой-либо одной части спектра. В первую очередь к та-
ким элементам относятся натрий, литий, таллий и индий.
Они имеют характерные яркие линии.- натрий — желтые 589
и 589,6 ммк, литий — красную 671 ммк и оранжевую 610 ммк, тал-
лий— зеленую 535 ммк и индий — синюю 451 ммк. Соли этих
металлов при высоких температурах (1000° С и выше) легко
диссоциируют, в результате чего в пламени появляется линейчатый
спектр паров металла.
Практически излучение лития, таллия и индия в сигнальных.
огнях не используют вследствие дефицитности соединений этих ме-
таллов.
Атомарное излучение паров натрия широко используется в со-
ставах желтого огня.
Полосатый спектр состоит из одной полосы или ряда полос раз-
личной ширины, приходящихся на различные участки спектра.
Однако при помощи сильного спектроскопа, дающего большую
дисперсию, можно заметить, что полосы эти состоят из большого
числа весьма близко расположенных друг к другу линий.
Полосатый спектр получается при излучении молекул веществ,
находящихся в газообразном состоянии, и поэтому его называют
молекулярным спектром.
§ 3. ПРИНЦИПЫ ПОСТРОЕНИЯ СОСТАВОВ И ОСНОВНЫЕ
ТРЕБОВАНИЯ К ИХ КОМПОНЕНТАМ
1. Количество энергии, выделяющееся при горении состава,
должно быть достаточным для возбуждения или ионизации нахо-
дящихся в пламени в парообразном состоянии атомов или мо-
лекул.
Практически достаточно мощное цветное излучение получается
при сжигании составов, теплота горения которых не меньше
0,8 ккал!г.
2. При использовании молекулярного излучения температура
пламени составов не должна превышать пределов, при которых
уже наблюдается диссоциация молекул излучателей.
Так, например, температура пламени составов зеленого огня не
должна превышать 2000° С.
3. В пламени должно быть лишь небольшое количество твердых
продуктов реакции.
206
Введение в составы сигнальных огней большого количества
(больше 15—20%) порошков металла (магния или алюминия),
дающих при сгорании трудно летучие окиси, сильно увеличивает
яркость пламени, но вместе с тем понижает чистоту его цвета.
4. Компоненты состава должны быть подобраны таким обра-
зом, чтобы нежелательное излучение газообразных продуктов реак-
ции в других частях спектра было по возможности минимальным.
Это достигается соответствующим подбором окислителя, а также
и других компонентов состава.
5. Получающиеся при горении состава элементы или соедине-
ния, сообщающие окраску пламени, должны быть легколетучими
и уже при температуре 1000—1200° С полностью переходить в паро-
образное состояние. Поэтому для получения цветного пламени
часто используют излучение легколетучих хлоридов щелочно-зе-
мельных металлов.
Составы сигнальных огней обычно содержат следующие компо-
ненты:
1) окислители;
2) органические горючие — цементаторы;
3) соли, окрашивающие пламя.
Кроме того, в них довольно часто присутствуют:
4) вещества, улучшающие окраску пламени,— хлорорганиче-
ские соединения;
5) неорганические горючие — порошки магния или алюминия.
Используемые в составах сигнальных огней окислители долж-
ны быть солями того металла, соединения которого обеспечивают
требуемую окраску пламени. Так, например, в составах желтых
огней—это соли натрия, в красных — соли стронция и т. д. Если
же Это по какой-либо причине (например, гигроскопичность соли)
не представляется возможным и используемый окислитель являет-
ся солью другого металла, то продукты разложения такого окисли-
теля должны создавать минимальное излучение в пламени с тем,
чтобы не ухудшить в значительной мере цвета пламени. В качест-
ве таких окислителей часто используются соли калия.
Органические связующие, употребляемые в составах сигналь-
ных огней, не должны при горении портить окраску их пламени.
Идеальным Связующим явились бы такие вещества, которые
при сгорании давали бы почти бесцветное пламя подобно тому,
какое дает при горении на воздухе сера, водород или окись угле-
рода.
По данным Тидемана и Сниборского [7, стр. 197], при сжигании
на воздухе органических веществ пламя их будет почти бесцвет-
ным в том случае, если эти вещества содержат не менее 50% кис-
лорода.
Желтая окраска пламени, получающаяся при сгорании на воз-
духе органических веществ, содержащих мало кислорода, объяс-
няется наличием в пламени несгоревших твердых частиц углерода.
207
Так как большинство составов сигнальных огней построено
с отрицательным кислородным балансом, то условия, создающие-
ся при их горении, нельзя считать благоприятными для полного
сгорания цементаторов.
Следовательно, органические вещества, употребляемые для из-
готовления составов сигнальных огней, должны содержать, по воз-
можности, максимальное количество кислорода; особенно актуаль-
ным это требование является для составов зеленого огня.
Элементарный состав наиболее часто применяемых в составах
сигнальных огней органических веществ приведен в табл. 4.2
(гл. IV).
Из рассмотрения ее следует, что одним из лучших связующих
с этой точки зрения является идитол и наихудшими — канифоль
и ее производные.
Крахмал и сахар не являются связующими, но ввиду большого
содержания в них кислорода частичная замена ими связующих
является вполне возможной и иногда даже выгодной.
Метальдегид (С2Н4О)4 одно время усиленно рекомендовали
в качестве горючего в составах сигнальных огней. Он представляет
собой продукт полимеризации уксусного альдегида при низких тем-
пературах.
В патентных сообщениях указывается, что в составы цветных
огней полезно вводить некоторое количество уротропина. Уротро-
пин CeHI2N4 (см, гл. Ill стр. 53) содержит в себе 51,4% углерода;
8,6% водорода; 40,0% азота; он имеет отрицательную теплоту
образования, горит на воздухе почти бесцветным, слегка синеватым
пламенем. Цементирующими свойствами уротропин не обладает.
Поливинилхлорид — хлорорганическое вещество, наиболее ча-
сто применявшееся во время второй мировой войны в составах
красного и зеленого сигнальных огней, имеет формулу (СН2 —
= СНС1)п. Это вещество представляет собой белый порошок или
зерна с температурой размягчения около 80° С, плотность при ком-
натной температуре—1,4, содержание хлора — 56%. Поливинил-
хлорид растворим в дихлорэтане и других хлорзамещенных алифа-
тических углеводородах, пластифицируется трикрезил фосфатом
или дибутил фталатом. При нагревании примерно до 16СР С начи-
нается разложение поливинилхлорида с выделением хлористого
водорода [86].
§ 4. СОСТАВЫ ЖЕЛТОГО ОГНЯ
Для получения желтого пламени в пиротехнической практике
используется только атомарное излучение натрия.
Входящие в составы желтых сигнальных огней натриевые соли
должны легко диссоциировать при высоких температурах, иметь
возможно большее содержание натрия и по возможности быть не-
гигроскопичнымн.
Интенсивность линии натрия в пламени пропорциональна вве-
денному в пламя количеству натрия.
208
Кроме желтой D-линии натрия (589—590 jwjkk), при высоких
температурах могут появляться и другие линии натрия (616, 568,
509 и 498 ммк), но интенсивность их сравнительно мала и практи-
ческого значения они не имеют.
Наибольшее количество (до 60—70%) солей натрия можно
ввести в состав в том случае, если натриевая соль используется
в качестве окислителя. Окислитель нитрат натрия NaNO3 несмотря
на его гигроскопичность применялся в составах желтого огня во
время второй мировой войны (физико-химические свойства NaNO3
описаны в гл, II).
Из других окислителей в составах желтых огней используются
почти исключительно соли калия, так как они дают сравнительно
слабое излучение в пламени.
Образующиеся в пламени соединения калия дают атомарное
излучение калия, но линии калия имеют малую интенсивность по
сравнению с D-линией натрия, и поэтому присутствие в пламени
паров калия почти не отражается на чистоте цвета пламени, равной
80—85%. Из солей калия в качестве окислителей используются
нитрат калия KNO3, а также хлорат калия и перхлорат калия.
В этом случае в качестве солей, окрашивающих пламя в желтый
цвет, чаще других из натриевых солей применяются оксалат нат-
рия, фторид натрия, криолит и кремнефтористый натрий. Некото-
рые физико-химические свойства этих солей приведены в табл, 16, 1.
Вследствие незначительной растворимости в воде эти соли мало
или даже совсем негигроскопичны.
Таблица 16.1
Вещество, формула Молеку- лярный вес Содер- жание натрия в % Плот- ность Раствори- мость соли (в г) в 100 г раствора при 20° С Примечание
Оксалат натрия МадСдО^ 134 34 2,3 3,7 Распад с обра- зованней Na2CO3 и СО начинается уже при 200°С
Фторид натрия NaF 42 55 2,7 4,1 гпл=Я92° С, ^кяп—1695° С
Криолит Na3AlF6 210 33 2,9 Трудно растворим /«4=920° С
Крейнефтористый натрий Na^SiFg 188 24 2,7 0,65 Диссоциирует при 1000° С почти полностью на 2NaF4-SiF4
14
А. А. ШндловекиА
209
Старые рецепты составов желтого огня содержат обычно в ка-
честве окислителя хлорат калия и в качестве горючего — смолу.
Можно привести, например, состав, состоящий из следующих ком-
понентов: 60% КС1О3, 25% Na2C2O4, 15% идитола. Продуктами
его горения являются: КО, Na2CO3, Н2О, СО2 и СО. Такие составы
выделяют при сгорании мало тепла (меньше 1,0 ккал/г) и пламя
их имеет небольшую силу света.
Составы желтого огня, имеющие большую яркость пламени,
содержат в себе магний, а в качестве окислителя — нитраты калия
или натрия,
В качестве примера приведем рецепт:
нитрат калия............. 37% магний.................... 30%
оксалат натрия ......... 30% смола ..................... 3%
Такой состав при горении выделяет значительное количество тепла
(> 1,0 ккал/г), его удельная светосумма составляет около
4000 св-с/г.
Во время второй мировой войны в Германии использовался
состав:
Нитрат натрия . ........................ 56%
Магний.................................. 17%
Поливинилхлорид......................... 27%
Сила света звездок желтого огня диаметром 22 мм, изготовлен
ных из этого состава, получается равной 11000 св.
Для американских составов сигнальных огней является типич-
ным использование в качестве окислителя перхлората калия. При-
мером может служить состав [9]: 19% Mg, 50% КС1О4, 15% Na2C2O4,
7% CeCle, 9% гильсонита (органического вешества); вариантом
этого состава является состав, дающий пламя янтарного (amber)
цвета; 25% Mg, 50% КС1О4, 13% Na2C2O4, 2% С6С16, 10% резината
натрия.
Применение в составах желтого огня хлорорганических ве-
ществ — поливинилхлорида или гексахлорбензола, по-видимому,
не обязательно, так как желтый огонь имеет атомарный характер
свечения.
§ 5. СОСТАВЫ КРАСНОГО ОГНЯ
Получение красного пламени осуществляется на практике
исключительно введением в состав соединений стронция. Свечение
атомарного стронция не может быть использовано, так как его из-
лучение приходится на коротковолновую часть спектра (линия
461 ммк).
Окись стронция дает широкую размытую полосу в оранжево-
красной части спектра с максимумом излучения около 606 ммк.
Идентичный спектр дает и нитрат стронция (фиг, 16.1).
Пламя, получающееся при излучении окиси стронция, имеет
практически не красную, а лишь розовую окраску, так как вслед-
210
14*
211
ствие высокой температуры возгонки окиси стронция (выше
2500° С) создать в пламени значительную концентрацию ее паров
трудно.
Хлористый стронций при высоких температурах диссоциирует,
образуя монохлорид стронция и отщепляя свободный хлор:
2SrCl2^2SrCl + Cl2.
Монохлорид стронция SrCl может быть получен при нагрева-
нии смеси SrCh и Sr до 1000° С в атмосфере аргона.
Спектр SrCl показывает характерные дублетные полосы, Отно-
сительная интенсивность Е этих полос равна
1 688 674 661 648 636
Е 3 10 10 10 10
Хлорид стронция SrCI2 имеет температуру плавления 870° С;
выше этой температуры он обладает значительной упругостью па-
ров. Температура его кипения, вычисленная путем экстраполяции,
составляет 1250°С. В атмосфере кислорода при нагревании он по-
степенно переходит в SrO.
Хлорат стронция дает в пламени спектр излучения, идентичный
со спектром хлорида стронция.
Фторид стронция имеет в видимой части спектра две системы
полос; в красно-оранжевой части спектра от 678 до 628 ммк
и в желто-зелеиой части—от 586 до 562 ммк. Последнее обстоя-
тельство исключает возможность применения фторида стронция
в составах красного огня.
Построение составов красного огня практически осуществляется
только на основе излучения окиси стронция или монохлорида
стронция, причем излучение последнего гораздо интенсивнее и,
кроме того, лежит ближе к крайней красной части спектра..
Этим объясняется стремление ввести хлор во все рецепты соста-
вов красного огня.
Хлорат стронция применять нецелесообразно из-за его гигро-
скопичности и большой чувствительности составов, изготовленных
с его участием, к механическим импульсам.
Хлорид стронция также редко применяется из-за его гигроско-
пичности. Гигроскопическая точка SrCl2-6H2O равняется 65,6%.
Чаще всего хлор вводится в состав в виде хлората или перхло-
рата калия, или хлорорганических соединений.
В качестве солей, окрашивающих пламя, применяются карбо-
нат, оксалат, нитрат или, гораздо реже, сульфат стронция.
В табл. 16.2 приведены физико-химические свойства этих со-
лей, кроме нитрата стронция, свойства которого уже были описа-
ны в гл. II.
Все приведенные в таблице соли стронция очень трудно раство-
римы в воде.
Рецепты некоторых составов красного огня приведены
в табл. 16.3.
212
Таблица 16.2
Вещество, формула Молеку- лярный нес Содер- жание стронция % Плот- ность Примечание
Стронцианит SrCO? 148 70 3,6 Диссоциирует пол- ностью при 1300°С на SrO и СО2
Оксалат стронции SrCjO^-HjO 196 53 — При 150°С полностью теряет воду Разложение оксалата начинается при 200°С
Целестин SrSO4 184 56 3,9 Разложение начина- ется при 1130°С; тем- пература плавления 1605е С
Чистота цвета пламени составов 1—2 находится в пределах
80—90%; смолой в них является идитол. Состав 3 заимствован
из [9].
Звездки диаметром 22 мм, изготовленные из состава 4, дают
при горении силу света около 10 000 св.
Таблица 16.3
Рецепты составов красного огня
Компоненты Номера составов и процентное содержание компонентов
1 2 3 4 5 6
Хлорат калия 60 60 — — —
Нитрат стронция — — 30 57 52 55
Карбонат стронция 25 — — — — —
Оксалат стронция — 25 — — —
Магний -- — 40 23 20 30
Смола 15 15 5 — —
Гексахлорбензол 5 — — —
Поливинилхлорид — 20 15 15
Моностирол — —• — 13 —
Перхлорат калия -- 20 —
213
Затвердевание (полимеризация) содержащегося в составе 5 не-
насыщенного углеводорода — моностирола может осуществляться
при введении в него катализатора — четыреххлорисгого олова.
Составы красного огня выгодно строить с отрицательным кисло-
родным балансом, так как наличие в пламени восстановительной
атмосферы, препятствующей окислению SrCI в SrO, способствует
увеличению чистоты цвета пламени.
Наличие в пламени избытка свободного хлора сдвигает равно-
весие влево
2SrCl + O2zi2SrO + С12
и тем самым также способствует улучшению цвета пламени. Мож-
но вводить в составы красного огня хлорорганические соединения
(например, поливинилхлорид, гексахлорбензол и др.). В этом слу-
чае хлораты могут быть полностью заменены другими окислителя-
ми, что понижает чувствительность составов к механическим воз-
действиям.
Хлорорганические соединения должны содержать максимальное
количество хлора (не менее 50%), быть негигроскопичными и не-
летучими.
Относительно соединений кальция следует заметить, что они
придают пламени оранжево-красную окраску нехарактерного цвета
(см. спектр СаС12, фиг, 16. I) и в составах красного огня не могут
быть использованы.
§ 6. СОСТАВЫ ЗЕЛЕНОГО ОГНЯ
Зеленое пламя в пиротехнике практически получается только
при использовании соединений бария.
Излучение атомарного бария не может быть использовано, так
как атомарный барий (см. фиг. 16.2) дает целый ряд линий в раз-
личных частях спектра (668, 611, 597, 554, 455, 429 ммк и др.);
из них наиболее интенсивными являются желто-зеленая 554 ммк
и синяя 455 лж
Окись бария — высокоплавящееся и труднолетучее соединение,
дает широкие размытые полосы в желтой и зеленой частях спектра.
Пламя при введении в него ВаО окрашивается в тусклый желто-
зеленый цвет.
Идентичный спектр дает в пламени и нитрат бария.
Хлористый барий диссоциирует в пламени, образуя монохлорид
бария и отщепляя свободный хлор:
2ВаС1а^2ВаС1+С12.
Спектр испускания ВаС1 состоит из многочисленных полос в зе-
леной части спектра (фиг. 16.2).
Температура плавления хлористого бария ВаС12 960° С; темпе-
ратура его кипения, вычисленная путем экстраполяции, равна
1835° С.
214
Фиг. 16.2. Спектры соединений бария
В окислительном пламени может протекать реакция разложе-
ния монохлорида бария с образованием соответствующих количеств
окиси бария
2ВаС1 + О»^2ВаО+С12.
Наличие этой реакции всегда ведет к значительному ослабле-
нию зеленого цвета в пламени.
Хлорат бария дает в пламени спектр излучения, идентичный
со спектром хлорида бария.
Фтористый барий при нагревании диссоциирует с отщеплением
фтора, образуя монофторид бария, BaF. Последний имеет ряд по-
лос излучения в зеленой (от 494 до 505 ммк) и красной частях
спектра; это обстоятельство, естественно, исключает возможность
применения фтористого бария в составах зеленого огня.
Получение хорошего чисто зеленого пламени на практике мо-
жет быть осуществлено только на основе излучения монохлорида
бария. Следовательно, в составы зеленого огня обязательно долж-
ны входить какие-либо соединения, содержащие хлор.
Обычно в составы зеленого огня из содержащих хлор веществ
входят: I) хлораты бария или калия, или перхлорат калия.
2) хлорорганические соединения.
Применение перхлората бария не представляется возможным
из-за его чрезмерной гигроскопичности.
Реакция горения состава: хлорат бария—89%, идитол—11%,
может быть выражена уравнением
5Ва (О Оз) 2 • Н2О 4- С^Н^Оа=5ВаС12 4-1ЗСО2 4-11 Н2О.
Чистота цвета пламени состава равна 70—80%; ввиду большого
содержания в нем хлората бария состав этот обладает высокой
чувствительностью и значительными взрывчатыми свойствами
и в настоящее время не изготовляется.
Составы с хлоратом калия содержат в качестве соли, окраши-
вающей пламя, чаще всего нитрат или карбонат бария. Примером
может служить состав, содержащий 27% хлората калия, 53% нит-
рата бария, 20% шеллака.
Чувствительность таких составов сравнительно невелика, но
и цвет пламени только желто-зеленый.
Замена в составах зеленого огня с хлоратом калия смолы серой
заметно улучшает цвет пламени, но вместе с тем составы стано-
вятся очень чувствительными, а при недостаточно чистой сере
и склонными к самовоспламенению.
Введение в составы зеленого огня хлорорганнческих веществ
создает в пламени высокую концентрацию хлора и тем самым спо-
собствует улучшению окраски пламени,
В качестве примера составов, не содержащих в себе хлоратов
и потому мало опасных в обращении, можно привести составы, со-
стоящие из следующих компонентов;
215
1. Нитрат бария.......... 40%
Магний................. 28%
Гексахлорбензол ....... 30%
Льняное масло 2%
2. Нитрат бария........... 59%
Магний ................ 19%
Поливинилхлорид .... 22%
Сила света при горении звездки диаметром 22 мм, изготовлен-
ной из состава 2, получается равной около 3500 св.
Американские составы зеленого огня часто содержат перхлорат
калия. Например [9]: Mg — 26%, Ba(NOa)2 — 45%, K,ClOt— 16%,
CeCle — 7%, CuO — 2%, масло (растительное)—2%, гильсо-
нит— 2%.
Описание рецептов и технологии немецких составов сигнальных
огней, использовавшихся во время второй мировой войны, дается
в [195].
Медные соли окрашивают пламя горелки в интенсивно зеленый
цвет. Но получить на основе соединений меди удовлетворительный
по качеству состав зеленого огня до настоящего времени никому
не удалось. Для военной пиротехники задача эта не представляет
особого интереса вследствие дефицитности и гигроскопичности
большинства медных солей.
Наличие в составах соединений бора придает пламени зеленую
окраску, но чистота цвета пламени получается недостаточной.
§ 7. СОСТАВЫ СИНЕГО И БЕЛОГО ОГНЯ
Хорошие составы синего огня, дающие при сгорании пламя до-
статочной яркости и резко выраженного синего цвета, до сего вре-
мени неизвестны.
Синее пламя получают почти исключительно на основе излуче-
ния монохлорида меди CuCl.
Наличие в пламени соединений меди сообщает ему зеленую ил-
синюю окраску. Цвет пламени зависит в этом случае от взятого
соединения меди, температуры пламени и его восстановительной
способности. Синее излучение монохлорида меди -может быть по-
лучено лишь в восстановительной зоне пламени и при температу-
рах, не превышающих Ю00—1200° С.
В составах синего огня обязательно должны присутствовать
хлор содержащие соединения. Один из типичных составов синего
огня имеет рецепт:
Хлорат калия......................... Ы%
Горная синь 2СнСОз-Си(ОН)2........... 19%
Сера................................ 20%
При отсутствии серы монохлорид меди в пламени не образуется.
Сера в этом случае взаимодействует с хлоратом калия с выделе-
нием свободного хлора:
КСЮз + S-— KaSOt + SOa + Cla.
217
Реакция горения состава может быть приближенно выражена
схемой
КС1О3+2С.иСОз • Си (ОН) з + S —»CuCIj + КС1 +
+ K2SO4 + СО2 + Н2О + SO2.
Этот состав синего огня чувствителен к механическим воздейст-
виям и химически мало устойчив.
Кроме горной сини, в составах синего огня могут применяться
и другие соли меди: малахит СиСО3 Си (ОН) 2, сернистая медь
Cu2S, роданистая медь CuCNS, а также металлическая медь.
В составах синего огня возможно применение и хлорорганиче-
ских соединений. Наличие серы в таких составах уже не является
обязательным.
Чистота цвета плалгени лучших составов синего (точнее говоря,
голубого) огня не превышает обычно 25—30%.
Немецкий состав белого огня, использовавшийся во время вто-
рой мировой войны, был составлен по следующему рецепту:
Нитрат бария............................ 56%
Нитрат калия......................... 11%
Фторид бария , . ........................ 6%
Алюминий................................ 19%
Сера...................................... 8%
Нитрат бария сообщает пламени зеленоватый оттенок, нитрат
калия — розоватый; при совместном их присутствии в составе пла-
мя получается не яркого белого цвета.
§ 8. МЕТОДЫ ИСПЫТАНИЯ
Специальные испытания составов сигнальных огней заключают-
ся в определении силы света и цветности их пламени.
Сила света составов сигнальных огней определяется при помо-
щи фотоэлектрического люксметра по той же методике, какая при-
нята для определения силы света осветительных составов.
Определение цветности пламени сводится к установлению цве-
тового тона и чистоты цвета пламени.
Различия, выражаемые определениями «красный», «зеленый»,
«желтый» и т. п., и есть различия по цветовому тону.
Если говорят, что цветовой тон пламени равняется Z = 520 ммк
и чистота цвета пламени р = 40%, то это следует понимать в том
смысле, что цветовое ощущение человеческого глаза от восприятия
такого пламени будет одинаковым с цветовым ощущением от све-
тового потока, получаемого смешением 40% монохроматического
излучения с длиной волны % = 520 ммк с 60% излучения белого
источника света.
Первая попытка количественного определения цветности пла-
мени пиротехнических составов принадлежит русскому ученому
К- И. Константинову (1846 г.). По существу, предложенный им
218
метод, основанный на использовании нескольких цветных свето-
фильтров, применяется для этой же цели и до сего времени.
В настоящее время цвет, в том числе и цвет окрашенных пла-
мен, измеряют по международной системе (XYZ) [193], согласно
которой качество цвета определяется его трехцветными коэффици-
ентами А, У, Z, т. е. той пропорцией, в которой следует смешать три
основных цвета; А (красный), У (зеленый), Z (синий), для того,
чтобы качество смеси совпало с качеством заданного цвета. Затем,
пользуясь специальной диаграммой (фиг. 16.3), переходят от трех-
цветных коэффициентов XYZ к цветовому тону, которым опреде-
ляется длина волны того монохроматического излучения, которое
должно быть добавлено к белому излучению для воспроизведения
интересующего нас цвета.
По тому же графику XYZ определяют вторую величину, харак-
теризующую цветность излучения, а именно, чистоту цвета.
Еще в конце 30-х годов коэффициенты X, У, Z для цветных пла-
мен определяли трехцветным колориметром ГОИ системы
Л. И. Демкиной, работа на котором состояла в визуальном подбо-
ре двух одинаковых по цветовому тону и яркости полей зрения.
Кратковременность процесса сгорания сигнальных звездок значи-
тельно затрудняла эту и без того нелегкую работу.
Некоторые полученные при работе на этом приборе данные
приведены в табл. 16.4.
1' Таблица !6.4 Определение цветности пламени составов сигнальных огней на трехцветном колориметре системы Демкиной
Ивет пламени Компоненты состава Коэффициенты Насто- вой тон X мм к Чистота цвета р %
X У Z
Красный Хлорат калия—о&ёалат стронция —идигол/ 0,65 0,31 0,04 622 87
Желтый Хлорат калия — нитрат бария — оксалат натрия — — идитол 0,53 0,39 0,08 593 80
Зеленый Хлорат бария—идитол 0,33 0,53 0,14 556 75
Примечание; Сумма X, У и Z во всех случаях равна 1. Для пе-
рехода от сжЛриы X, У, Z к значениям р и X следует на графике 16.3
найти точку с |Оординатами X и У. Значение р (чистота цвета) опре-
деляется положением цайденной точки на одной из дуг, огибающих
точку В (белый веточек света). Лучи, расходящиеся из точки В, ука-
зывают значение X (цветового тона) в ммк.
219
За последние годы разработаны объективные регистрирующие
фотоэлектрические трехцветные колориметры, обеспечивающие вы-
сокую точность измерений.
К числу их относится универсальный фотоэлектрический коло-
риметр ВЭИ конструкции Шкловер и Иоффе [194].
Основной и наиболее ответственной деталью колориметра
является колориметрическая головка, заключающая в себе три се-
леновых фотоэлемента, закрытые цветными светофильтрами. Свето-
фильтры подогнаны таким образом, что каждый из трех приемни-
ков воспроизводит по спектральной чувствительности кривую соот-
ветствующей компоненты: красный — кривую компоненты X, зеле-
ный— У и синий—Z.
Переднее отверстие в колориметрической головке закрыто стек-
лом, поглощающим ультрафиолетовое излучение и, кроме того, за-
щищено от попадания постороннего света съемным тубусом.
Основные узлы колориметра, т. е. колориметрическая головка
и эталонные лампы, крепятся на метровой оптической скамье.
Измерение фототоков, возникающих в фотоэлементах, произво-
дится при помощи чувствительных гальванометров (чувствитель-
ность 5*Ю~В а!мм) или многошлейфного осциллографа. Процесс
измерения цвета на указанном приборе сводится к отсчету показа-
ний гальванометров и расчету определяемых величин X, У, Z по за-
ранее полученным градуировочным уравнениям. Для упрощения
расчета имеется специальная номограмма.
Градуировка колориметра производится по эталонным электро-
лампам с паспортами ВНИИМ. По точности измерений данный ко-
лориметр превосходит лучшие из визуальных колориметров.
Кроме измерения цветности, этот же прибор может быть
использован и для измерения силы света пиротехнических источ-
ников света, так как приемник У (желто-зелеиый) по спектральной
чувствительности воспроизводит кривую относительной видностн.
Глава XVII
ЗАЖИГАТЕЛЬНЫЕ СОСТАВЫ
Назначением зажигательных составов является уничтожение
всевозможных горючих материалов.
Кроме того, с помощью зажигательных составов (например,
термита) приводят в негодность металлические сооружения.
Особо следует выделить применение зажигательных составов
по живым целям (огнеметные составы).
§ I. ПОДЖИГАЕМЫЕ МАТЕРИАЛЫ
При помощи зажигательных составов может быть вызвано горе-
ние на воздухе ряда веществ и материалов. Однако чаще других
осуществляется поджог следующих материалов:
221
— дерева в виде строительных материалов, топлива, деревян-
ных строений и т. п.;
— травы и злаков в сухом виде (фураж, зерновые склады) или
на корню (посевы);
— жидких нефтепродуктов в виде легкого топлива (бензин, лиг-
роин, керосин и др.) или тяжелого топлива (нефть, мазут, тяжелые
масла и др.).
Одни из указанных материалов зажигаются с трудом, другие —
без особых трудностей.
Для зажжения различных по легкости воспламенения материа-
лов должны применяться и различные зажигательные составы
и средства. Для того чтобы с наименьшей затратой средств осу-
ществить поджог различных материалов, надо знать их свойства.
Поэтому ниже приведены некоторые свойства дерева и других го-
рючих материалов.
Дерево. Содержание влаги в дереве может колебаться в весь-
ма широких пределах. Так, сырое дерево на корню, являющееся
наиболее трудно воспламеняемым, содержит около 100% влаги (по
отношению к весу абсолютно сухого дерева); воздушно-сухое
дерево содержит от 15 до 35% влаги.
Температура воспламенения дерева находится в пределах от 300
до 400° С.
Процесс горения дерева заключается в выделении из него при
нагревании летучих составных частей и их последующем сгорании.
Можно следующим образом характеризовать процессы, происходя-
щие при нагревании дерева.
При 110э С дерево подсыхает; начинают выделяться летучие ве-
щества.
При 110—150° С происходит пожелтение и более сильное выде-
ление летучих составных частей.
При 150—230° С дерево приобретает коричневый оттенок и на-
чинается обугливание.
При 230—300” С происходит обугливание, а выше 300° С дерево
начинает гореть.
Назначение зажигательного состава при зажжении дерева сво-
дится к прогреву какой-то, по возможности, большей ча'сти дере-
вянного сооружения до температуры 300—400° С.
Большим препятствием к этому является плохая теплопровод-
ность дерева.
Дальнейшее распространение горения после воспламенения де-
рева происходит уже за счет тепла, выделяющегося при горении.
Теплотворная способность 1 кг воздушно-сухого дерева составляет
4000 ккал. Температура горения дерева равняется примерно 800—
1000° С. Горение дерева протекает интенсивнее пои большем досту-
пе воздуха к горящим поверхностям.
Сырое дерево зажечь очень трудно, так как большое количество
тепла расходуется на испарение из него влаги.
222
. Трава и злаки поддаются воспламенению значительно легче,
чем дерево. Особенно легко воспламеняется сухое сено.
Жидкие нефтепродукты. Воспламеняемость жидких
нефтепродуктов определяется их температурой вспыщки. Бензин,
лигроин и другие жидкости, имеющие низкую температуру вспыш-
ки, воспламеняются тотчас же при поднесении к ним пламени.
Такие жидкости, как нефть, пиронафт и др., температура вспышки
которых (см. табл. 3.7 в гл. III) значительно выше комнатной тем-
пературы, требуют для воспламенения предварительного подогре-
ва. Следует указать, что горят не жидкости, а только их пары,
и воспламенение поэтому может наступить только тогда, когда над
поверхностью горючей жидкости будет создана минимальная кон-
центрация ее паров, при которой может произойти вспыщка паро-
воздушной смеси.
Приведем минимальные концентрации паров веществ в мг на
1 л воздуха, необходимые для вспышки:
Этиловый спирт............................ 73
Ацетон.............................• . . . . 65
Бензол .................... ...... ....... 49
Эгилоаый эфир............................. 39
Бензин.................................... 33
Поясним сказанное примером. При 0° С концентрация паров
этилового спирта составляет 34 м.г1л, а для значительно более ле-
тучего этилового эфира — 780 м,г[л.
Концентрация паров этилового спирта при 0°С ниже указан-
ной минимальной концентрации и поэтому этиловый спирт при
О3С не воспламеняется (температура его вспышки +12°С); кон-
центрация паров эфира при 0°С значительно превышает указанную
величину, и поэтому эфир безотказно воспламеняется не только при
0°С, но и при более низкой температуре (его температура вспыш-
ки—20° С).
О горении органических жидкостей см. монографию Блинова
и Худякова [197] и статью Худякова [206].
§ 2. КЛАССИФИКАЦИЯ ЗАЖИГАТЕЛЬНЫХ СОСТАВОВ
И ПРЕДЪЯВЛЯЕМЫЕ К НИМ ТРЕБОВАНИЯ
Все существующие зажигательные составы, если их рассматри-
вать с точки зрения потребности при горении в кислороде воздуха,
можно разделить на две большие группы.
I. Составы с окислителем
1. Термиты и термитно-зажигательные составы, в которых
основным окислителем является окисел металла.
2. Составы, окислителем в которых является кислородсодержа-
щая соль.
223
И,Составы без окислителя
1, Нефтепродукты,
2. Сплав «электрон»,
3. Фосфор и его соединения,
4. Прочие зажигательные вещества и смеси.
Иногда из группы II особо выделяют огнеметные смеси и веще-
ства, самовоспламеняющиеся при соприкосновении их с водой или
с кислородом воздуха (металлический натрий и Др.).
Все виды зажигательных составов должны удовлетворять сле-
дующим требованиям;
I. Иметь по возможности более высокую температуру горения;
температура горения любого зажигательного состава должна быть
не ниже 800—ЮОСРС.
2. Гореть с определенной скоростью, наиболее выгодной для
воспламенения данных поджигаемых материалов.
Следует заметить, что скорость горения зажигательных соста-
вов изменяется в зависимости от назначения и конструкции зажига-
тельного изделия в весьма широких пределах; так, сгорание соста-
вов, помещаемых в зажигательные пули, происходит почти мгно-
венно; скорость горения запрессованных термитных составов изме-
ряется миллиметрами в секунду; жидкие нефтепродукты горят еще
медленнее.
3. Легко воспламеняться от обычных воспламенительных соста-
вов, так как применение переходных составов во многих случаях
является нежелательным,
§ 3. ТЕРМИТЫ
В 60-х годах прошлого столетия выдающийся русский ученый
Н. Н. Бекетов осуществил реакцию взаимодействия между окисью
бария и алюминием, и этим, а также дальнейшими своими иссле-
дованиями по получению щелочных металлов действием на их со-
единения металлического алюминия положил начало новой отрасли
металлургии — алюминотермии.
Реакции, протекающие по схеме
МО+ М] =М(0 + М + Q ккал.
где МО — окисел металла и М| — металл, применяющийся для
восстановления (алюминий), были названы алюмино-термическими
реакциями, а реакционноспособные смеси окислов металла с дру-
гим металлом получили название термитов,
В качестве примера можно привести хорошо известную реак-
цию горения железо-алюминиевого термита;
Не2Оз + 2А1=А12Оз + 2Ре + 205 ккал.
Алюмино-термические реакции нашли большое применение
в гражданской промышленности для получения в большом коли-
честве чистых безуглеродистых металлов: хрома, марганца и др.
224
[201] . Железо-алюминиевый термит широко применяется для свар-
ки^черных металлов (алюмино-термическая сварка рельсов) [283;
Характерными особенностями, отличающими процесс горения
термитов от горения других пиротехнических составов, являются*.
1) почти полное отсутствие при горении газообразных продук-
тов реакции, что обусловливает беспламенность горения;
2) высокая температура реакции горения; для большинства
применяемых термитов она находится в пределах 2000—2800°С;
3) образование при горении расплавленных огненно-жидких
шлаков.
Также следует указать на трудность воспламенения термитов
(температура самовоспламенения всех алюминиевых термитов
выше 800° С, температура самовоспламенения железо-алюминие-
вого термита составляет 1300° С). Термиты имеют большую
плотность, так как для их изготовления применяют окисли,
имеющие большую плотность (например, FezO3 — плот-
ность 5,1).
Термиты, применяемые в качестве зажигательных составов,
должны удовлетворять следующим требованиям;
1) выделять при горении максимальное количество тепла;
2) давать высокую температуру горения;
3) шлаки, образующиеся при их горении, должны быть легко
растекающимися, легкоплавкими и труднолетучими;
4) легко воспламеняться;
5) трудно тушиться обычными огнетушительными средствами;
6) линейная скорость горения их должна выражаться единица-
ми миллиметров в секунду.
Применяющееся в термитах горючее (металл) должно:
1) выделять при своем сгорании максимальное количество
тепла;
2) образовывать легкоплавкую и труднолетучую окись;
3) иметь большую плотность.
По опытам С. Ф. Жемчужного, количество тепла, выделяющего-
ся при горении термитов, должно быть не менее 0,55 ккал на I г
состава; в противном случае реакция горения протекает с трудом
и не доходит до конца. Исходя из этого положения и учитывая
то большое количество теплоты, которое должно быть затрачено
на разложение окисла металла, становится очевидным, что в тер
митах могут быть использованы только высококалорийные го-
рючие.
Свойства некоторых простых веществ, характеризующие воз-
можность их применения в термитах, приведены в табл. 17. 1.
Наиболее подходящим горючим для термитов как по калорий-
ности и значительной плотности, так и по сравнительно низкой
температуре плавления (2050эС) является алюминий.
Принято считать, что алюминий в своих соединениях всегда
трехвалентен.
15 А. А. Шидлоиский
225
Горючие для термитов
Таблица 17 1
Горючее Плотность горючего Формула окиси Теплота об- разования окиси, счи- тая на 1 г-amQM кислорода, ккал Рецепт термита % Теплота сгорания 1 г термита ккал
Fe2O3 горючее
А1 2,7 А120з 133 75 25 0,93
Mg 1.7 MgO 144 69 32 1,05
Са 1,5 СаО 152 57 43 0,93
Т1 4,5 TiO2 109 69 31 0,57
S1 2,3 SiOs 104 79 21 0,58
в 2,3 В2О3 101 88 12 0,59
Однако существуют и соединения одновалентного алюминия
(А12О, A12S, AIF и др.) [196], устойчивые в газообразном состоя-
нии при высоких температурах и распадающиеся при охлаждении
на металл и соответствующие соединения трехвалентного алю-
миния.
Даутценберг [208] указывает, что испарение продуктов горения
железо-алюминиевого термита обусловливается в основном обра-
зованием летучей при 1450эС субокиси алюминия А12О. Она воз-
никает при взаимодействии горячей окиси алюминия А12О3 с непро-
реагировавшим алюминием
А12О3 + 4А1-ЗА1,О
и окисляется затем на воздухе до А12О3. Образующийся при горе-
нии железного термита дым (особенно заметный при сжигании
больших количеств термита) состоит главным образом из глино-
зема А1аО3.
Применению магния, кроме экономических соображений и ма-
лой плотности, препятствует еще высокая температура плавления
его окиси (2800° С). Опытом установлено, что железо-магниевый
термит совсем не дает жидких растекающихся шлаков.
Применение в термитах Са, Ti, Si и В в качестве индивидуаль-
ных горючих не представляется целесообразным, но сплавы их мо-
гут представлять в этом отношении некоторый интерес.
Гольдшмидт [7, стр. 206] указывает, что термит, в котором
в качестве горючего был взят сплав CaSi (в весовом соотношении
2:1), давал весьма легкоплавкие шлаки.
Понижение температуры затвердевания шлаков происходит
за счет образования силиката кальция CaSiO3, имеющего темпера-
туру плавления 1512°С.
226
Окисел, применяющийся для изготовления термитов, должен
удовлетворять следующим требованиям;
1) иметь минимальную теплоту образования;
2) содержать достаточное количество кислорода (не менее
25—30%);
3) иметь по возможности большую плотность;
4) восстанавливаться в металл, имеющий низкую температуру
плавления и высокую температуру кипения.
Свойства некоторых окнслов приведены в табл, 17,2.
Таблица 17.2
Свойства некоторых окислов
Окись Теплота об- разования, считая на 1 г/атом кислорода, ккал Содержа- ние кисло- рода в окисле % Плотность окисла Рецепт термита % Теплота сгорания 1 г термита ккал
содер- жание окисла содер- жа ние алюми- ния
BjOa 101 69 1,8 56 44 0,73
S1O2 104 53 2,2 63 37 0,56
Сг20з 90 32 5,2 74 26 0,60
MnOj 62 37 5,0 71 29 1,12
FejOg 66 30 5,1 75 25 0,93
Fe3O4 66 28 5,2 76 24 0,85
CuO 38 20 6,4 81 19 0,94
Pb3o4 43 9 9.1 90 10 0,47
Данные о свойствах продуктов восстановления окисей см,
в гл. II и III. Хром плавится при 1800° С, кипит при 2300° С, Медь
плавится при 1083° С, кипит при 2360° С.
Окиси элементов с малым атомным весом мало пригодны к упо-
треблению в термитах, так как они имеют значительную теплоту
образования и малую плотность.
Применению окисей металлов с большим атомным весом (на-
пример, РЬ3О4) препятствует малое содержание в них кислорода;
термиты, изготовленные с их участием, содержат мало горючего
и выделяют при сгорании недостаточное количество тепла.
Наиболее целесообразным следует считать применение в тер-
митах окислов металлов, имеющих средний (примерно От 40 до 80)
атомный вес (см, табл, 17,2),
Окись меди в присутствии соответствующих восстановителей
весьма легко отдает свой кислород; горение медно-алюминиевого
термита протекает с большими скоростями и напоминает собой
взрыв (аналогичная картина наблюдается и для РЬ3О4, и, в осо-
бенности, для РЬО2).
15*
227
Выделяющийся при горении марганцево-алюминиевого термита
металлический марганец имеет по сравнению с железом более низ-
кую температуру кипения (2000° С); при горении происходит его
бурцре .испарение:
ЗМпО2 4-4А1=ЗМп + 2А12Оз + 425 ккал.
...Хромово-алюмиииевый термит горит сравнительно медленно,
но выделяет при горении значительно меньшее количество тепла,
чем другие: термиты:
" : Сг2Оз + 2А1 = 2Сг+А12О3+ 130 ккал.
Наиболее приемлемым со всех точек зрения следует считать
применение в качестве зажигательного состава железо-алюминие-
вого, термйта.
Добавление S1O2 (песка) в железо-алюминиевый термит не-
сколько Снижает Температуру затвердевания его шлаков за счет
образования сплава FeSi, йо при этом несколько понижается и ка-
лорийность термита. Температура плавления сплава FeSi, содержа-
щего 22% Si, составляет ; 1250° С.
Для изготовления железо-алюминиевого термита чаще применя-
ют не окись железа (Fe2O3), а железную окалину Fe3O4 (закись —
окись-железа). Уравнение реакции горения термита в этом случае
следующей:
3Fe3O44-8A1^4Al2O34-9Fe + 802 ккал.
.76% 24% 45% 55%
Одним из недостатков железо-алюминиевого термита следует
считать малую, текучесть и быстрое затвердевание образующихся
при его горении шлаков.
Порошкообразный железо-алюминиевый термит имеет гравимет-
рическую плотность 1,8—2,0, спрессованный (с добавкой несколь-
ких процентов цементатора) — 3—3,4.
На прессах большой мощности, позволяющих осуществить дав-
ления порядка 3000—6000 кГ[см2, термит хорошо прессуется и без
добавки цементатора; спрессованный термит имеет большую ме-
ханическую прочность.
Для-изготовления Термита берут железную окалину и грубо из-
мельченный (сито № 8—10) порошок; применение мелко дисперс-
ного алюминия не допускается, так как в этом случае ускоряется
процесс горения термита.
Образцы термита обычного измельчения без запрессовки весом
в I кг сгорают за 15—20 сек‘ те же образцы, но спрессованные
под давлением 200 кГ!см-, сгорают за 35—50 сек.
По сообщению Горлова [199], термитный брикет весом в 1 кг,
имеющий форму цилиндра высотой 15,5 см и диаметром 5,5 см,
сгорает за 40 сек. По его же сообщению, 50 г термита проплавляют
лист железа толщиной 2 мм в течение нескольких секунд.
228
.tl'JpOfOffufi макать
- веттменп/петныи совпав
-Переходный состав
— Термит
Чистый железо-алюминиевый термит, не содержащий добавок,
не обладает взрывчатыми свойствами, не чувствителен к прострелу
пулей и весьма мало чувствителен
как к механическим, так и к теп-
ловым воздействиям. Воспламене-
ние железо-алюминиевого терми-
та нельзя осуществить ни при по-
мощи спичек, ни от стопина, ни от
обычных воспламенительных со-
ставов.
Для воспламенения порошко-
образного термита предложено
несколько различных смесей. Все
они содержат в качестве горючего магниевый порошок или тонко-
измельченную алюминиевую пудру.
Фиг, 17, 1. Схема воспламенения
спрессованного термита.
MnOj Алюминиевый 68,0% ВаО2 . . . Магнии . .
порошок < . Алюминиевая 7,5%
пудра . . , Магниевый по- 7,5%
рошок > , . 17%
. . 88% ВаОг 31%
. . . 12% Fe3O4 , 29%
Алюмииневый по-
рошок (тонкий) 40%
Кроме того, для воспламенения порошкообразного. термита
можно применять обычные осветительные составы.
Спрессованный термит воспламеняется значительно труднее
порошкообразного; для его воспламенения применяют переходные
составы, содержащие 40—60% термита (фиг. 17. 1).
§ 4. ТЕРМИТНО-ЗАЖИГАТЕЛЬНЫЕ СОСТАВЫ
Термитно-зажигательными составами в отличие от термитов
называются многокомпонентные смеси, содержащие наряду (^тер-
митом и другие вещества (добавки). Содержйние термита в таких-
термитных составах составляет чаще всего 50—80%.
Введение в термит различных добавок имеет целью увеличить
его теплоту горения, создать пламя при его горении, облёгчить .вос-
пламенение термита, ускорить (или замедлить) процесс его
горения, придать прочность спрессованным термитным составам.
В качестве примера термитного состава, содержащего допол-
нительный окислитель — соль, можно привести рецепт <]месй; упо-
треблявшейся для снаряжения зажигательных авиабомб^
Нитрат бария ........................ 26%
Железная окалина................ . . . . 50%
Алюминий.............................. 24%
Теплота горения этого состава около 1,1 ккал!?;. При горении
состава образуется 2,5% по весу газообразны* продуктов и 97,5%
твердых шлаков.
229
Для снаряжения русских 76-ж.м снарядов употреблялся прессо-
ванный термитно-зажигательный состав:
Нитрат бария............ 44% Алюминий ............ , 13%
Нитрат калия............. 6% Магний.................. 12%
Окись железа ........... 21% Связующие вещества .... 4%
Количество газообразных продуктов, выделяющихся при горе-
нии такого состава, больше; температура вспышки состава нахо-
дится в пределах 600—700° С.
Добавка нитратов в термит повышает его тепловой эффект,
создает пламя при горении н снижает температуру его вспышки,
но вместе с тем делает состав более чувствительным к механиче-
ским воздействиям.
Из других окислителей — солей в термитные составы могут вво-
диться также сульфаты бария или кальция.
В качестве связующих веществ в термитные составы вводят
серу, жидкое стекло или органические цементаторы — смолы.
Эллерн [9] приводит следующий рецепт состава: термит 69%,
нитрат бария 29%, сера 2%.
Сгорание термитов, содержащих серу, сопровождается образо-
ванием пламени вследствие частичного сгорания серы в SO2; полу-
чающиеся шлаки более легкоплавки и текучи, так как наряду
с окисью алюминия они содержат сернистые соединения
(табл. 17.3).
Таблица 17.3
Свойства сернистых соединений
Соединение Молекуляр- ный нес Теплота обра- зования ккал/г-моль Примечание
AI2S3 150 140 A|2S3 плавится при 1100° С, раз- лагается водой с образованием H2S
MgS 56 84 Разлагается водой
CaS 72 111 То же
FeS 88 23 Нерастворим и воде; плавится при 1193° С
MnS 87 44 Трудно растворим в воде
SiS2 92 34 —
Как указывает А. П. Горлов [199], для равномерного смешения
термита с расплавленной серой во избежание комкования требует-
ся нагрев компонентов до температуры 120—140° С и устранение
возможности их быстрого охлаждения при смешении. Последнее
обстоятельство делает работу по уплотнению термитов весьма тру-
доемкой и требующей большой осторожности.
230
Введение в термитные составы в качестве цементатора жидкого
стекла (15%-ный водный раствор силиката натрия) вызывает не-
обходимость последующей сушки состава. Расдвор силиката нат-
рия имеет резкощелочную реакцию; при сушке может наблюдаться
весьма энергичная коррозия алюминиевою порошка, сопровождаю-
щаяся в некоторых случаях значительным разогреванием состава
(до 100° С).
Из органических цементаторов в термитно-зажигательных со-
ставах применяют асфальты, канифоль, олифу, бакелит и др.
§ 5. ЗАЖИГАТЕЛЬНЫЕ СОСТАВЫ С ОКИСЛИТЕЛЯМИ-СОЛЯМИ
Наиболее эффективными являются смеси
нием порошков магния или алюминия:
II
Нитрат калия . . 65%
Алюминий ... 26%
Древесный уголь 9%
Перхлорат ка-
лия .......... 66%
Алюминий , . . 34%
с большим содержа-
Ш
Перхлорат ка-
лия ......... 50%
Магний .... 50%
Обычно термитно-зажигательными составами снаряжаются
крупные изделия (снаряды среднего калибра, авиабомбы), соста-
вы же с окислителями — солями более пригодны для снаряжения
малокалиберных снарядов или зажигательных пуль, предназначае-
мых для зажжения жидкого топлива.
Составы, подобные смеси III, совсем не дают при своем сгора-
нии жидких шлаков, и зажигательное действие их основано исклю-
чительно на непосредственном воздействии пламени.
К ним предъявляются следующие требования:
1) пламя, образующееся при сгорании составов, должно обла-
дать максимальной температурой и иметь значительные размеры;
2) воздействие пламени на жидкое горючее должно происхо-
дить в течение не слишком короткого промежутка времени (на-
пример, десятых долей секунды).
Приведение в действие таких составов может осуществляться
как от механического импульса (удар о броню), так и иницииро-
ванием при помощи помещаемых в том же изделии взрывчатых ве-
ществ. В последнем случае горение составов может происходить
с весьма большими скоростями, выражающимися десятками, сотня-
ми и даже тысячами метров в секунду.
Как своеобразные зажигательные смеси, можно рассматривать
н смеси ВВ с алюминиевым порошком или пудрой.
Во время второй мировой войны было установлено, что зажи-
гательное действие ВВ от добавления к нему порошков металлов
сильно повышается.
В качестве примера можно привести взрывчатую смесь для не-
мецких 20-.мд снарядов: 76% гексагена, 20% алюминия, 4% флег-
матизатора.
231
§в. ЖИДКИЕ НЕФТЕПРОДУКТЫ И ОТВЕРЖДЕННЫЕ ГОРЮЧИЕ.
ОГНЕМЕТНЫЕ СМЕСИ
Жидкие нефтепродукты. Во время второй мировой вой-
ны нашли большое применение в различных зажигательных изде-
лиях, Так, например, зажигательные бомбы наполнялись нефтью,
мазутом, керосином, бензином и другими нефтепродуктами. В не-
которых случаях с целью увеличения времени горения и уменьше-
ния распыления указанных жидкостей ими пропитывалась вата,
хлопок или хлопчатобумажные концы.
Главными достоинствами жидких нефтепродуктов при их при-
менении в качестве зажигательных веществ являются;
1) большой тепловой эффект (1 г керосина дает при сг&рЛши
10 ккал, термит — 0,8 ккал);
2) образование при горении большого пламени, а следователь-
но, и создание большого очага пожара;
3) малая скорость горения;
4) сравнительно низкая стоимость и достаточно широкая сырье-
вая база. .
Недостатками их являются; -
1) низкая температура горения (700—900°С, термит развива-
ет при горении температуру 2400? С);
2) малая плотность (0,7—0,8, плотность спрессованного терми-
та составляет 3—3,4);
3) отсутствие твердых продуктов сгорания — шлаков;
4) чрезмерно большая подвижность и растекаемость;
5) излишняя легкость испарения, следствием чего является бур-
ный процесс горения при сообщении жидкости достаточно мощного
теплового импульса.
Два последних недостатка можно в значительной мере устра-
нить, если применять жидкие нефтепродукты в так называемом
отвержденном виде.
Отвержденные горючие. Так называют горючие жидко-
сти (углеводороды), превращенные путем соответствующей обра-
ботки в студнеобразное состояние.
Отвержденное горючее как самостоятельно, гак и в комбинации
с термитом может применяться для наполнения тяжелых бомб,
предназначаемых для поджога крупных деревянных строений
(фиг. 17,2).
Получение отвержденных горючих может осуществляться ра-
створением в нефтепродуктах стеариновой кислоты с последующей
обработкой полученного раствора спиртовым раствором едкого
натра.
Протекающая при смешении этих двух растворов реакция мо-
жет быть выражена уравнением
С17Н35 СООН + NaOH= CnHajCOONa + НаО.
Стеариновая Мыло
кнелота
232
Z
3
10
Фиг. 17.2. Зажигатель-
пая бомба комбинирован’
мого снаряжения ЗАБ-50
/—корпус, 2—воспламенитель-
ная звездна, 5—переходной со-
став, ^“гермятно--1ажнгатель
ный осноююй состав, дна
фоагма, б— отвержденное го
рючее, 7—донная пробка, 8—
ст а Сил и: । и тс D, 0 “гязоотдод
ныс отверстия, W—очко под
взрыватель.
Горячую жидкость через шланги разливают в корпуса зажнга-
' тельных бомб, где, охлаждаясь, она превращается в студнеобраз-
ную массу.
По указанному способу получают «твер-
дую нефть», «твердый керосин» и т. п.
На практике для получения отвержден-
ных горючих можно воспользоваться ие
стеариновой кислотой, а техническим стеари-
ном, представляющим собой смесь стеари-
новой н пальмитиновой кислот, последняя
имеет формулу С^НзгОа. Свойства этих
кислот см, в гл. IV, стр, 52,
К отвержденным горючим предъявляют-
ся следующие специальные требования:
( 1) малая летучесть;
2) легкость воспламенения;
3) максимальная теплота горения;
•< 4) высокая температура горения;
5) неизменность консистенции при пере-
: возках и при хранении,
! 6) отсутствие явлений синерезиса при
' резких колебаниях температуры (от —30 до
; -Но?С).
! Отвержденные обычным способом бензин
( и керосин легко воспламеняются.от горящей
спички.
Калорийность отвержденного горючего
близка к калорийности соответствующего
нефтепродукта, но все же несколько ниже,
. особенно в том случае, если количество
отверждающих добавок превышает 10—15%
1 от общего веса горючего. Температура плав-
1 ления отвержденных горючих составля-
ет ~60° С, плотность их близка к плотности
соответствующего нефтепродукта.
Другим видом отвержденного горючего
( является «загущенное» горючее.
В США загущенное горючее получило название напалм [209].
1 Это наименование присвоено там как загущенному горючему,
так и загущающему его порошку.
Загущающий порошок — напалм — представляет собой смесь
алюминиевых солей олеиновой, нафтеновой и других органических
кислот.
Сырьем для его изготовления являются:
I) олеиновая кислота, нафтеновая кислота и жирная кислота
кокосового масла;
233
2) водный раствор NaOH;
3) водный раствор алюминиевых квасцов.
При смешении этих веществ (фиг. 17.3) происходит осаждение
алюминиевых солей; полученная суспензия центрифугируется, в ре-
зультате чего содержание воды в ней уменьшается до 35%.
Затем влажный напалм подается во вращающуюся сушилку,
где подвергается действию горячего воздуха, имеющего температу-
ру около 160? С. После сушилки содержание воды в напалме со-
ставляет 0,4—0,8%.
Сухой напалм измельчается в порошок на мельницах. Порошок
напалм употребляется для загущения газолина; количество вводи-
Жирные кислоты
NaOH дл квасцы
г
центрифуга
! Подача горячего
Р-. / воздуха
Мыльный Мешалка
раствор
Транспортер Шнек
вваща-
ннцаяся
сушилка
Фиг, 17.3, Схема получения напалма.
мого в газолин напалма в зависимости от требуемой степени загу-
щения составляет от 4 до 11%. Загущенный газолин используется
как для целей огнеметания, так и для заполнения корпусов зажи-
гательных бомб. Отличительными свойствами загущенного горюче-
го напалма являются значительная вязкость и липкость, что делает
его подходящим средством для поджога деревянных строений.
Приготовление, транспортировка, хранение и применение «твер-
дого бензина» в народном хозяйстве описано в [202]. Отвердителями
служат казеин, мочевино-формальдегидные смолы или растворы
поливинилового спирта. Отвердителем для поливинилового спирта
является формальдегид. Содержание по объему бензина в «твердом
бензине» равно 87—90%.
Огнеметные смеси. Огнемет нашел боевое применение
впервые во время первой империалистической войны в 1915 г. С по-
мощью огнеметов выбрасывали струю пламени. Дальность дей-
ствия огнеметной струи не превышала 40 м.
Во второй мировой войне в 1940 г. немцы также использовали
огнеметы. Радиус действия огнеметной струи, выбрасываемой лег-
ким танком, составлял по сообщениям иностранной печати SO-
TS м.
Огнеметные жидкости должны удовлетворять следующим тре-
бованиям:
1) иметь возможно большую плотность (для обеспечения необ-
ходимой дальности действия струи);
2) безотказно воспламеняться от соответствующего запального
приспособления;
234
3) развивать при своем сгорании максимальную температуру;
4) не слишком быстро гореть на воздухе (при быстром горении
лишь незначительное количество ее достигнет цели).
В качестве огнеметных жидкостей чаше всего употребляются
смеси различных жидких углеводородов или масел.
Так, например, в США употреблялась для огнеметания смесь,
содержащая 25% бензина, 25% керосина и 50% нефти.
Также использовались и загущенные горючие жидкости типа
напалма.
Раствор фосфора в CS2 в качестве огнеметной жидкости не на-
шел значительного применения.
Температура пламени, образующегося при горении огнеметной
струи из жидких нефтепродуктов, не превышает 700—900° С.
Согласно патентным сообщениям (Брит, патент 656.089, 1951),
повышение температуры в пламени огнеметной струи может быть
достигнуто введением в нефтепродукты значительного количества
магниевого порошка (до 50—60%) и одновременно добавлением
10% безводного сульфата натрия.
Воспламенение огнеметной струи осуществляется при помощи
специального запального патрона.
В работе [199] указывается на возможность добавки тетранитро-
метана в огнеметные смеси. Добавка C(NO2)4 понижает темпера-
туру вспышки смеси, увеличивает скорость ее горения и делает
ее взрывоопасной.
§ 7. СПЛАВ «ЭЛЕКТРОН»
Легкий сплав «электрон» содержит около 90% магния, а также
алюминий, цинк, марганец и другие металлы.
Примерный состав электрона для изготовления корпусов зажи-
гательных бомб следующий:
Магний , ........................ 90—94%
Алюминий.......................... 0,5—8%
Цинк и марганец .................. . 1,5—5%
Сплав электрон имеет плотность 1,80—1,83 и обладает высоки-
ми механическими качествами. Температура плавления его 630—
635° С. Он вполне стоек по отношению к щелочным растворам,
но легко корродирует под действием даже слабых растворов кислот
или аммониевых солей. При сгорании электрон развивает высокую
температуру (до 200(Р С) и выделяет значительное количество теп-
ла (~6 ккал!г).
Как зажигательное средство электрон применяется для изго-
товления различных зажигательных изделий и в первую очередь
для изготовления корпусов мелких авиабомб (весом около 1 кг).
Электрон в этих изделиях горит за счет кислорода воздуха. При
этом образуется небольшое ослепительно яркое белое пламя и вы-
деляется некоторое количество белого дыма окиси магния.
235
Воспламеняется электрон при помощи спрессованных или по-
рошкообразных термитов или термитно-зажигательных составов.
помещаемых внутри корпусов электронных бомб
(фиг. 17.4),
Окисление электрона может при горении его осу-
ществляться не только за счет кислорода (и азота)
воздуха, но и за счет кислорода, содержащегося в со-
прикасающейся с ним древесине.
§ 8. ФОСФОР И ЕГО СОЕДИНЕНИЯ
Фосфор, его растворы и соединения применяются
обычно для зажжения легковоспламеняющихся мате-
риалов.
Основное преимущество белого фосфора перед дру-
гими зажигательными веществами заключается в том.
что он в мелкораздробленном состоянии самовоспла-
меняется и сгорает на воздухе:
Фиг. 17.4. 4Р + 5Оз=2РйО5.
1-кг элек- При сгорании образуется желтовато-белое пламя
тронная бом- и выделяется большое количество весьма устойчивого
ва> на воздухе белого дыма — пятиокиси фосфора.
^рпуГ'г-те^ Как указывает А. П. Горлов [199], фосфорные мины
митний состав, или ручные гранаты оказались весьма эффективными
в окопной борьбе. Взрыв таких мин, создавая большое
количество дыма, действует на противника деморализующе. Мель-
чайшие брызги расплавленного горящего фосфора, прожигая одеж-
ду и поражая тело, наносят тягчайшие поражения коже.
К преимуществам белого фосфора, как зажигательного сред-
ства, следует еще отнести способность к повторному самовоспламе-
нению после его тушения.
Белый фосфор представляет собой мягкое воскоподобное веще-
ство бледно-желтого цвета. Плотность его 1,83, температура плав-
ления 44° С, температура кипения 29(Р С.
Основными недостатками белого фосфора как зажигательного
вещества являются низкая температура горения (не выше ЛОСКУ* С),
а также трудности, возникающие при снаряжении им соответствую-
щих изделий; заливка белого фосфора в зажигательные изделия
во избежание его самовоспламенения должна производиться под
водой.
Следует также отметить, что белый фосфор очень ядовит (доза
0,1 г белого фосфора является смертельной).
Значительно менее активный красный фосфор весьма редко
применяется в качестве зажигательного вещества. В некоторых слу-
чаях, однако, зажигательные изделия снаряжаются смесью красно-
го и белого фосфора.
236
Растворы ф о с ф о р а. Лучшим растворителем для белого
фосфора является сероуглерод (100 г насыщенного раствора при
(ГС содержит 81 г фосфора); кроме того, белый фосфор хорошо
растворим во многих органических растворителях, например, в бен-
золе, скипидаре и др.
При испарении раствора фосфора в CS2 (весьма летучем раст-
ворителе) остающиеся на облитом предмете мельчайшие частицы
фосфора легко воспламеняются на воздухе и поджигают окружаю-
щие их пары сероуглерода.
Для замедления процесса горения в раствор фосфора в серо-
углероде добавляют иногда жидкие нефтепродукты, дегтярное
масло, нитросоединения и другие вещества.
Красный фосфор в сероуглероде не растворим.
Соединения фосфора. Из соединений фосфора чаще
других применяются в качестве зажигательных веществ сульфиды
фосфора и, в первую очередь, сесквисульфид P4S3.
Некоторые свойства сульфидов фосфора показаны в табл. 17.-1.
Таблица 17.4
Свойства сульфидов фосфора
Формула соединения Содержание фосфора % Плотность Температура н “С
плавления кипения
P4S10 27,9 2,06 290 514
P4S7 35,6 2,19 310 523
P4S3 56,3 2.09 172 408
W Сесквисульфид P4S3 хорошо растворяется в CS2 (100 г CS2
V- при (ГС растворяет 27 г P4S3), хуже — в бензине. Чистый P4S3
* при комнатной температуре устойчив по отношению к воде, в кипя-
Е* щей воде он разлагается с выделением сероводорода.
S Высшие сульфиды P4S7 и P4S10 не устойчивы по отношению
к воде (разлагаются с выделением H2S); хуже, чем P4S3, раство-
№) ряются в сероуглероде и других растворителях.
к При смешении при комнатной температуре белого фосфора
J с серой образуется жидкий сплав; содержание фосфора в эвтектике,
г затвердевающей при температуре — 7° С, составляет пример-
j но 75%.
Сплав P4S3 с фосфором дает эвтектику, затвердевающую при
— 4(ГС. На фиг. 17.5 показана диаграмма состояния; сера — фос-
фор [48, vol. 8].
Фосфиды. Фосфид кальция в сухой атмосфере совершенно
- устойчив, во влажном же воздухе или при смачивании водой
ои разлагается на гидрат окиси кальция и фосфористый водород:
С Са3Рг + бН2О=ЗСа(0Н)2 + 2РН3.
237
Фосфористый водород ввиду наличия в нем, кроме РН3, еще
и других фосфинов (Р3Н2), самовоспламеняется на воздухе.
По внешнему виду Са3Р2 представляет собой красно-бурые кри-
сталлы, имеющие плотность 2,5. Получение фбсфида кальция при
Содержание фосфора 8 %
Фиг. 17.5. Диаграмма состояния соеди-
нений и сплавоа фосфор — сера.
горении смеси Са3(РО4)2 +
+ А1 и использование Са3Р2
^для возникновения вторич-
• наго очага пожара описано
в патенте ФРГ [210],
В настоящее время фос-
фид кальция чаще приме-
няется не в качестве зажи-
гательного вещества, а для
снаряжения им специальных
сигнальных изделий во
флоте,
Фосфид магния по своим
свойствам аналогичен фос-
фиду кальция, но при своем
разложении водой выделяет
несколько большее количе-
ство тепла.
§ 9, ГАЛОИДНЫЕ СОЕДИНЕНИЯ ФТОРА
Свободный фтор крайне энергично соединяется с органически-
ми веществами; в результате этой реакции выделяется большое
количество тепла и происходит воспламенение горючих материалов.
Однако применение свободного фтора в качестве зажигатель-
ного вещества практически невозможно, так как фтор является
трудносжижаемым газом (температура кипения при р=1 ат—
187°С).
Галоидные соединения фтора (галогенфториды), обладая во
многих случаях достаточно большой химической активностью,
вместе с тем имеют более высокую температуру кипения и пред-
ставляют собой либо жидкости, либо сравнительно легко сжижае-
мые газы.
Оценка таких соединений может быть Произведена по следую-
щим показателям:
1, Содержание фтора (в весовых процентах),
2. Температура кипения при р = 1 ат.
3. Плотность в жидком состоянии (при /=25° С).
4. Теплота образования из элементов в ккал]г.
В табл, 17.5 приведены физические свойства галогенфторидов
[207], [94].
Наибольший интерес для пиротехников представляет трифторид
хлора C1F3, так как он из всех галогенфторидов обладает макси-
мальной реакционной способностью.
238
Таблица 17.5
Соедине- ние Содержа- ние фтора % Темпера- тура кипе- ния °C Плотность при 25° С г!см-1 Теплота образо- вания в ккал Примеча- ние
на моль на г
C1F3 61,6 П,7 1,81 37,9 0,41 Газ
CIF 34,9 -101 — 13,3 0,25 Газ
BrFs 54,3 40 2,46 124(газ) 0,71 Жидк,
BrF3 41,6 125 2,80 75 0,55 Жидк.
BrF 19,2 20 — 18,4 0,19 Жидк.
IF7 51,2 4 2,75 232 0,89 Газ
IFs 42,8 100 3,19 204,7 0,92 Жидк.
Монофторид хлора содержит в себе меньший процент фтора
и трудно сжижается.
Соединения иода имеют значительную теплоту образования
и в соответствии с этим являются менее реакционно способными.
Практическое значение галогенфторидов для промышленности
обусловлено их применением в качестве фторирующих агентов.
Трехфтористый хлор CIF3—это бесцветный легко сжижающий-
ся газ. Температура плавления его — 76,3° С. Зависимость давле-
ния пара CIF3 от температуры выражается уравнением
1g р ^=7,42-^. (17.1)
Критическая температура C1F3 лежит в Пределах 154—174° С, вы-
численное критическое давление 57 ат. Молярная теплоемкость
при +5° С составляет 28,0 кал/мол • град.
Теплота распада
CIF3 = C1F-|-F2—26,б ккал.
Мягкая сталь стойка по отношению к CIF3 (до 250°С); еще
более стойки медь (до 400° С) и никель (до 750° С); C1F3 бурно
реагирует с водой;
3H2O + 4C1F3=6HF+3F2O + C12. (17.2)
Органические вещества, как правило, реагируют с C1F3 с воспла-
менением. Получается C1F3 при непосредственном взаимодействии
хлора и фтора,
В Германии во время второй мировой войны было организовано
опытно-промышленное производство C1F3 для применения его в ка-
честве зажигательного вещества.
239
За последние годы C1F3 широко рекламируется в США и как
фторирующий агент, и как окислитель в реактивных двигателях.
Следует отметить, что работа с C1F3 вследствие его большой реак-
ционной способности связана с большими трудностями и весьма
опасна для экспериментатора; все время надо помнить как о ток-
сичности CIF3 и продуктов его распада, так и о возможности взры-
ва его при контакте со многими веществами.
§ 10. ПРОЧИЕ ЗАЖИГАТЕЛЬНЫЕ ВЕЩЕСТВА И СМЕСИ
Из простых веществ, кроме магния и фосфора, в качестве за-
жигательных веществ нашли применение щелочные металлы — ка-
лий и особенно натрий.
Основное преимущество металлического натрия перед другими
зажигательными веществами заключается в том, что он бурно
реагирует ;с водой, выделяя водород:
2Na + 2H2O=2NaOH д-Н2+135 ккал.
При известных условиях водород может образовать с воздухом
гремучую смесь, при взрыве которой частицы воды и горящего ще-
лочного металла разбрасываются во все стороны и увеличивают
число очагов пожара.
Недостатками щелочных металлов как зажигательных веществ
являются: 1) малая плотность (натрия — 0,97; калия —0,86)
н 2) значительная инертность по отношению к сухому воздуху.
Щелочные металлы в сухом воздухе зажигаются с трудом
и, даже загоревшись, легко могут потухнуть.
Температура горения щелочных металлов на воздухе невысока
(не более lOOCFC).
"Щелочные металлы в зажигательных изделиях применяются ис-
ключительно в комбинации с другими зажигательными веществами
или составами: фосфором, жидкими нефтепродуктами, отвержден-
ным горючим и термитом.
Технология снаряжения зажигательных изделий металлическим
натрием или калием несколько осложняется тем, что эти металлы
во избежание их окисления во влажном воздухе приходится хра-
нить в керосине.
Металлический натрий плавится при 98° С, кипит при 877° С; ме-
таллический калий плавится при 63° С, кипит при 762° С.
Эвтектический сплав металлического натрия и калия представ-
ляет собой жидкость с содержанием натрия в сплаве 23%, затвер-
девающую при 12,5° С [67].
В литературе описано много различных самовоспламеняющихся
на воздухе веществ, которые при желании могут быть использова-
ны в зажигательных средствах.
К ним, кроме описанных выше белого фосфора и фосфинов,
должны быть отнесены силаны, образующиеся при взаимодействии
силицидов металлов (например Mg2Si) с соляной кислотой.
240
Аналогично этому бороводороды (бораны) получаются при
взаимодействии боридов металлов (например Mg3B2) с разбавлен-
ными кислотами.
К числу самовоспламеняющихся веществ относятся также самые
различные алкил металлические соединения, например, диметил-
цинк, алкильные дериваты магния, алюминия и др. Еще более
активными являются алкильные соединения щелочных металлов,
К самовоспламеняющимся на воздухе материалам должны быть
отнесены также пирофорные металлы. Металлы в пирофорном
состоянии отличаются, кроме весьма тонкого измельчения, тем,
что вследствие особого способа приготовления (восстановительная
атмосфера) на их поверхности не имеется затрудняющей окис-
ление оксидной пленки. Большинство .металлов (кроме благород-
ных) может быть тем или иным приемом получено в пирофорном
состоянии.
§ II. МЕТОДЫ ИСПЫТАНИЯ ЗАЖИГАТЕЛЬНЫХ СОСТАВОВ,
ТУШЕНИЕ ЗАЖИГАТЕЛЬНЫХ СОСТАВОВ
Передача тепла зажигаемому предмету осуществляется при го-
рении зажигательного состава как при помощи твердых или жид-
ких раскаленных шлаков, так и непосредственным воздействием
пламени. Суммарное количество тепла, переходящее от горящего
зажигательного состава к зажигаемому предмету, будет за-
висеть:
1) от средней разности между температурой шлаков и пламени
зажигательного состава и температурой зажигаемого предмета Д/т;
2) от поверхности соприкосновения шлаков и пламени с зажи-
гаемым предметом F;
3) от времени их соприкосновения t;
4) от коэффициента теплопередачи от продуктов горения зажи-
гательного состава к зажигаемому материалу k:
Q=k./\tm- F-t.
В некоторых случаях полезно выделить отдельно количество
тепла Q', передающееся зажигаемому Предмету при помощи твер-
дых или жидких шлаков, и количество тепла Q", передающееся
зажигаемому предмету газообразными продуктами реакции — пла-
менем:
Q--Q' + Q", (17.3)
F't'+k".&t" F” • t". (17.4)
Обычно для составов, дающих при сгорании сколько-нибудь
значительное количество шлаков, Q' значительно больше Q''; это
означает, что большая доля тепла передается зажигаемому предме-
ту шлаками, а не пламенем. Происходит это потому, что
k'>k" и Г>Г.
16 А. А. Шкдловскнй
241
С(?сг??а&
Фиг. 17.6. Схе-
ма устройства ка-
лориметра.
Ввиду того, что коэффициент k для случая теплопередачи от
продуктов горения зажигательных составов к дереву и Другим за-
жигаемым материалам неизвестен, проведение каких бы то ни было
тепловых расчетов на основании приведенных формул не пред-
ставляется возможным.
Кроме общего количества тепла, сообщаемого поджигаемому
материалу, весьма большое значение имеет также «тепловой на-
пор», т. е. количество тепла, передающееся от состава к поджигае-
мому материалу в единицу времени Q// ккал/сек. Очевидно, «теп-
ловой напор» при горении термита будет значительно больше, чем,
например, при горении отвержденного
горючего.
Экспериментальное определение эф-
фективности зажигательных составов мо-
жет сводиться к определению количества
тепла, отдаваемого 1 г состава при его
сгорании плоской поверхности какого-
либо материала. Для получения резуль-
татов, близких к истине, желательно,
чтобы теплопроводность выбранного ма-
териала была близка к теплопроводности поджигаемых материалов
(например, дерева).
Величина так называемой граммовой теплоотдачи состава бу-
дет, конечно, в значительной мере зависеть от условий испытания
(от материала плиты, навески состава, его расположения на плите),
и поэтому можно сравнивать только результаты, полученные при
одних и тех же условиях. На фиг. 17.6 схематически показано
устройство калориметра для определения «граммовой теплоотдачи
зажигательных составов».
Я. М. Паушкин определил граммовую теплоотдачу ряда спрес-
сованных зажигательных составов и горючих веществ при сжига-
нии их в открытой стальной чашке, помещенной в калориметр.
Эти данные, представляющие значительный интерес н дающие
возможность количественного сравнения эффективности зажига-
тельных составов, приведены в табл. 17.6.
Параллельно с этими опытами Паушкиным были проведены
испытания по сжиганию наиболее эффективных зажигательных ве-
ществ и составов на плоском деревянном предмете, помещенном
в калориметрический сосуд. Несмотря на то, что, как указывает
сам автор, эти данные следует рассматривать как ориентировочные
вследствие некоторого выгорания дерева, они являются весьма
интересными, так как дают представление о количестве тепла, пе-
редающегося от зажигательных веществ в реальных условиях
(табл. 17.7).
Из табл. 17.6 и 17-7 видно, что наиболее эффективными зажи-
гательными веществами по граммовой теплоотдаче являются маг-
ний (или электрон), нефтепродукты и затем железо-алюминиевый
термит.
242
Таблица П .6
Состав илн вещество Теплоотдача в стальной чашечке ккал j г. Теплота горения состава ккал /г Коэффициент по- лезного исполь- зования тепла %
KNOg+Mg 0,17 1,8 10
Ва(МОз)з4-М£ 0,49 1,6 31
KC!O4-|-Mg 0,42 2,4 17
BaO2-|-Mg 0,33 0,5 63
Fe2O3+Mg 0,62 1,1 60
Ре20з4-А1 0,63 0,9 75
Сг20з-|-А1 0,48 0,6 80
MnO2-|-AI 0,47 1,1 42
Магний 1,90 6,1 30
Керосин 1,50 10,0 15
Примечание, Компоненты составов взяты в стехиометрических
соотношениях.
Из других специальных лабораторных испытаний, имеющих
целью выяснить эффективность зажигательных составов, И. И. Вер-
нидуб и В. А. Сухих указывают на следующие:
1) определение количества твердых шлаков (в процентах от пер-
воначального веса состава), остающихся на поверхности зажига-
емого материала;
2) определение растекаемости шлаков — измерение площади,
занимаемой шлаками после сжигания определенной навески соста-
ва на горизонтальной и наклонной плоскостях;
3) определение температуры затвердевания шлаков; для легко-
плавких шлаков (температура плавления меньше 1500° С) это
определение можно провести при помощи термоэлектрического
пирометра (термопары);
Таблица ПЛ
Зажигательное вещество или состав Теплоотда- ча на дере- ве ккал [г Коэффициент полезного использования тепла %
Железо-алюминиевый термит 0,15 17
Керосин 0,40 4
Магний 0,50 8
16*
243
4) определение размеров пламени, получающегося при сгора-
нии состава (фотографирование пламени);
5) испытание зажигательных составов на непосредственное
воспламенение ими соответствующих видов горючих материалов
(жидкого топлива и др.).
Для некоторых видов зажигательных составов (например, тер-
митов) иногда проводят испытания на проплавление железных ли-
стов определенной толщины и на приплавление шлаков к соответ-
ствующим металлическим изделиям.
Тушение зажигательных составов. Тушение пожа-
ров, возникающих после сгорания зажигательных составов, можно
в большинстве случаев осуществить обычными огнетушительнымн
средствами, Тушение самих зажигательных составов весьма затруд-
няется малым временем горения современных зажигательных
средств (не более 5 — 10 мин), и поэтому успех операции в значи-
тельной мере зависит от своевременности начала тушения.
При тушении термитно-зажигательных составов малыми коли-
чествами воды может происходить ее разложение и образование
взрывоопасных смесей водорода с воздухом.
Но экспериментальным путем установлено [199], что подаваемая
в большом количестве под давлением сильной струей вода
является лучшим средством тушения термитно-зажигательных
и электронных бомб, так как в этом случае она вызывает резкое
местное понижение температуры и прекращает процесс горения.
Термитно-зажигательные и электронно-зажигательные бомбы
весом до 5 кг можно тушить, просто затопляя их в возможно боль-
шем количестве воды. Для ограничения действия зажигательных
бомб следует применять песок.
При тушении термитных составов, содержащих серу, следует
учесть, что при действии на горящий состав воды происходит вы-
деление больших количеств сероводорода;
AI2S3 + 6H2O = 2A1(OH)j + 3H2S.
При тушении металлического натрия или калия применение
воды или водных растворов недопустимо. Самыми надежными
средствами для их тушения являются песок или сухая сода.
Для тушения фосфора лучшими средствами являются водные
растворы КМпС>4 или CuSO4. Действие раствора КМпО4 основано
на образовании на поверхности фосфора защитного покрова дву-
окиси марганца; при действии же раствора медного купороса обра-
зуется весьма плотный защитный слой металлической меди.
Тушение отвержденных горючих осуществляется теми же сред-
ствами, что и тушение жидких углеводородов. Наиболее пригодны
густопенные огнетушители, распыленная вода, а также концентри-
рованные водные растворы аммонийных солей.
Современные методы тушения горючих жидкостей детально
описаны в монографии [197].
Глава XVIII
СОСТАВЫ МАСКИРУЮЩИХ ДЫМОВ
§ I. ОБЩИЕ СВЕДЕНИЯ ОБ АЭРОЗОЛЯХ
В истинных растворах частицы растворенного вещества состоят
из отдельных молекул, атомов или ионов; в коллоидных же систе-
мах число входящих в частицу атомов или молекул измеряется
многими сотнями и тысячами.
Коллоидные системы состоят из дисперсионной среды и раз-
дробленного в ней вещества—дисперсной фазы,
В том случае, если дисперсионной средой является воздух, кол-
лоидная система носит название аэрозоля.
Если находящаяся в воздухе дисперсная фаза представляет со-
бой жидкость, то такая система называется туманом, если же дис-
персная фаза находится в твердом состоянии, то такой аэрозоль
называют дымом.
Следовательно, дымом называется тончайшая взвесь твердого
вещества в воздухе. Размеры частиц различных дымов и туманов
находятся в пределах от 10 мк до 1 ммк (от 1 -10-3 до 1 -10-7 см),
Радиус частиц аэрозолей, применяемых для маскирующего дымо-
образования, колеблется в более узких пределах — от 8-10“5 до
2-10-5 см.
Пылью обычно называют взвесь в воздухе более крупных ча-
стиц твердого вещества размером от 1 • 10-3 до 1 • 10-2 см.
В промышленности дымы представляют собой в большинстве
случаев вредное явление и изучаются главным образом с целью
найти способы их удаления; удаляют дымы или с помощью силь-
ного электрического поля, или при помощи разнообразных
фильтров.
В военной технике дымы и туманы находят применение для
создания нейтральных маскирующих завес; цветные дымы употреб-
ляются для целей дневной сигнализации (см. гл, XIX).
Концентрация дымов и туманов может выражаться двумя спо-
собами:
1) по весу в г на 1 м3 (или в мг на 1 л) — Ср;
2) по количеству частиц дыма или тумана, приходящихся на
единицу объема (на 1 мл),— последняя величина называется
частичной концентрацией.
Весовая концентрация Ср дымов, применяемых для создания
маскирующей завесы,'выражается обычно в десятых долях мг!л,
что соответствует содержанию в 1 мл воздуха нескольких миллио-
нов дымовых частиц,
Частицы дыма или тумана непрерывно движутся в воздухе.
Это движение обусловливается силой тяжести, которая заставляет
частицы падать вниз. Скорость падения частиц, радиус которых
245
меньше J • 10~3 см. остается постоянной и может быть вычислена
по формуле Стокса
v = -^~r2-g ~ см/сек,
где v — скорость падения частицы в см!сек.\
г — радиус частицы в см,
g — коэффициент ускорения силы тяжести, равный 981 см/сек2-,
q — плотность частицы;
q' — плотность среды (в данном случае воздуха);
т] — вязкость воздуха, выражающаяся в пуазах, равная
1,81 • 10“* г1см-сек,.
Величина q' для воздуха настолько мала, что ее вполне можно
принять равной нулю. Заменяя 2^/9ц постоянной величиной k, по-
лучим для аэрозоля формулу Стокса в более простом виде:
и = k • r2Q,
где k = 1,2 • 10fi см21г сек.
Путь S (в с;н), пройденный частицей под действием силы тя-
жести за время t, вычисляется по формуле
S — k'r2>Q’t.
Частицы дыма (или тумана) находятся одновременно в постоян-
ном беспорядочном движении, которое носит название броунов-
ского н является следствием ударов, получаемых частицами аэро-
золя от молекул газовой среды,
Наиболее энергичное броуновское движение показывают самые
мелкие частицы дыма или тумана.
Частицы дыма одновременно движутся вместе с самой средой,
т. е. вместе с потоками воздуха. Небольшие дымовые облака, раз-
мер частиц которых ие превышает 1 • 1О*4 см, рассеиваются обык-
новенно от атмосферных токов воздуха, не успев осесть под дейст-
вием силы тяжести или рассеяться под влиянием ударов молекул
газовой среды. Поэтому при исследовании физико-химических
свойств дыма (оптических, электрических и пр.) часто пользуются
для защиты от рассеивающего действия конвекционных токов воз-
духа камерой со стеклянными стенками, чтобы можно было
наблюдать происходящие в системе процессы. Иногда в целях тер-
мической изоляции стенки камеры делают двойными с воздушной
прослойкой между ними.
1 При выводе формулы Стокса предполагается, что частицы аэрозоля осе-
дают, не коагулируя, и имеют шарообразную форму; последнее предположение
справедливо только для туманов, дымовые же частицы могут иметь самую разно-
образную форму. Для частиц, имеющих радиус меньше чем 4- IO-S см, перестают
соблюдаться положенные в основу формулы Стокса предположения об однород-
ности среды и об отсутствии скольжения. Для вычисления скорости падения
таких малых частиц следует пользоваться формулой Кеинингема, см. 1211],
246
Одной из основных задач физико-химического исследования
цымовой системы является установление размера частиц дыма.
Для этого частицы аэрозоля улавливают на стеклянные пла-
стинки, а затем просматривают визуально через микроскоп или
фотографируют. При этом подсчитывают и число частиц в поле
Зрения.
Для определения концентрации частиц в воздухе используют по-
точный ультрамикрофотометр Дерягина
частиц подсчитывают в отраженном свете
лом объеме, через который просасывают
аэрозоль.
Этот прибор позволяет в полевых
условиях учитывать концентрации аэро-
золей, содержащих более 10 млн. частиц
в 1 CJH3.
Кроме того, существуют методы опре-
деления размеров и формы частиц дымов
(MgO, ZnO, А120з и др.) при помоши
электронного микроскопа.
В большинстве случаев дымы и тума-
ны являются полидисперсными система-
ми, т. е. содержат частицы различных
размеров(фиг. 18. 1).
Следует также знать электрические
свойства дымов и туманов, так как от
знака и величины заряда частиц зависит п
ствования дыма или тумана.
В аэрозолях, начиная с момента их образования, наблюдается
явление коагуляции.
Коагуляцией аэрозоля называется укрупнение (слипание) ча-
стиц дыма или тумана. Образование очень крупных частиц приво-
дит к быстрому выпадению их из газовой среды. Скорость коагу-
ляции аэрозолей прямо пропорциональна квадрату их частичной
концентрации. Для дымов процесс коагуляции часто называют
флокуляцией (от англ, flocks — хлопья). Способность дымов к фло-
куляции уменьшается при наличии на частицах одноименного элек-
трического заряда или пленки адсорбированного газа; отсутствие
же заряда или, в особенности, наличие разноименных зарядов на
частицах облегчают флокуляцию дымов.
Получать свой заряд частицы дыма могут:
а) при трении о газовую среду;
б) вследствие диссоциации частиц в момент образования дыма;
в) путем захвата газовых ионов из дисперсионной среды.
и Власенко [57]. Число
в микроскопически ма-
dq
dr
0.8. К)-1* см
8,5 1
2,10-“ см
Фиг. IS. I. Распределение
частиц дыма хлористого ам-
мония по размерам.
dq/dr—весовой процент дымовых
частиц, имеющих значении ра-
диуса г, отложенные па осн
абсцисс.
суще-
§ 2. ОПТИЧЕСКИЕ СВОЙСТВА АЭРОЗОЛЕЙ
Присутствие в воздухе дыма или тумана понижает его прони-
цаемость по отношению к свету. Входящий пучок света лишь ча-
247
стично проходит через него; значительная часть света поглощается
или рассеивается частицами дыма или тумана.
Явление рассеяния света коллоидными частицами получило на-
звание эффекта Тиндаля. Интенсивность рассеянного света опреде-
ляется на приборе, называемом тиндальметром.
В дымах, размеры частиц которых больше длины волны света,
интенсивность рассеянного света Ц выражается формулой
I
s г '
где k— коэффициент пропорциональности;
С — весовая концентрация аэрозоля в мг/л;
г—радиус частиц аэрозоля.
В том же случае, когда размер частиц аэрозоля значительно
меньше длины волны проходящего через него света, интенсивность
рассеянного света быстро возрастает с увеличением размера
частиц;
Наибольшее светорассеяние, а следовательно, и наилучшую мас-
кирующую способность показывают аэрозоли, частицы которых
имеют размеры, близкие к длинам волн видимого света, т. е.
I • 1СН—1 • 10“5 см.
Интенсивность рассеивания света значительно увеличивается
с уменьшением длины его волны. Согласно формуле Рэлея, интен-
сивность рассеянного света для какой-либо одной дисперсной си-
стемы будет выражаться формулой
/
$ ” ?4 ’
где /0 — интенсивность падающего света;
Z— длина волны падающего света.
Менее всего дымами и туманами рассеиваются длинноволновые,
красные и особенно инфракрасные лучи.
Количественная зависимость между поглощением света аэро-
золем, концентрацией аэрозоля и толщиной поглощаемого слоя
может быть в случае неизменной дисперсности аэрозоля выражена
формулой Ламберта — Буге — Бэра:
где /0~ интенсивность света, входящего в поглощающий слой;
/ — интенсивность света, выходящего из поглощающего слоя;
I — толщина этого слоя;
е — основание натуральных логарифмов.
Для маскирующих дымов большое значение имеет понятие
«кроющая способность» дыма.
248
«Кроющая способность» дыма тем больше, чем меньше, при про-
чих равных условиях, отношение интенсивности прошедшего света
К интенсивности света, вошедшего в дым.
На практике кроющую способность (оптическую плотность)
D дыма часто определяют по формуле
D=—
I '
где I — толщина слоя дыма, который делает невидимым свет лам-
пы, служащей эталоном при измерении.
Так, например, при некоторых испытаниях использовалась лам-
па в 25 вт, а само испытание проводилось в камере, имеющей ши-
рину и высоту 1,8 м, а длину 2,4 ж.
Для характеристики сравнительной ценности дымообразующих
веществ иногда пользуются так называемой величиной полного
затемнения W=v-D, где v — объем дыма или тумана, получаемого
из единицы веса дымообразователя, a D — кроющая способ-
ность дыма. Величина IT выражает собой площадь завесы
в Xi2, получаемой из 1 кг дымообразователя и дающей полное за-
темнение,
Значения величины полного затемнения для некоторых дымооб-
разующих веществ и горючих смесей по данным Прэнтисса приве-
дены в табл. 18.1.
Таблица 18.1
Дымообразующее вещество или смесь Величина полного затемнения W м-!кг
Белый фосфор 1042
NH3+1 ICt 567
Американская смесь НС на основе гексаклорэтана 466
TSC14 430
SIC14 340
SO3'HC1 317
§ 3. СПОСОБЫ ПОЛУЧЕНИЯ АЭРОЗОЛЕЙ
Получение дымов или туманов осуществляется методом диспер-
гирования и методом конденсации.
Эти два способа различаются тем, что при диспергировании
удельная поверхность исходной системы возрастает, а при конден-
сации уменьшается.
249
Получение дыма или тумана методом диспергирования сводится
к измельчению твердого (или жидкого) вещества путем его раз-
малывания (разбрызгивания) или распыления при помощи взрыва.
Затрата энергии, необходимая для получения аэрозолей мето-
дом диспергирования, сводится к совершению известной механиче-
ской работы.
Процесс конденсации идет самопроизвольно и требует только
затраты некоторого количества энергии для получения пересыщен-
ного пара. При конденсации пара отдельные молекулы сцепляются
между собой, образуя большие агрегаты — коллоидные частички.
Пересыщенный пар может быть получен двумя способами:
1) охлаждением нагретого пара;
2) получением из газообразных продуктов твердого или жидкого
вещества, пересыщающего своими парами пространство.
Обычно методом диспергирования аэрозоли получают с более
крупными частицами, чем методом конденсации. Это обстоятель-
ство, а также применение для диспергирования во многих случаях
довольно сложной и громоздкой аппаратуры приводят к тому, что
на практике для получения аэрозолей чаще пользуются методом
конденсации.
В некоторых случаях при получении аэрозолей могут быть
использованы одновременно методы и диспергирования и конденса-
ции, что можно назвать комбинированным методом получения
аэрозолей.
Создание маскирующих дымовых завес осуществляется на прак-
тике следующими способами:
1. Диспергированием в воздухе легколетучих жидкостей (напри-
мер SnCh), которые образуют дым, реагируя в тонкораспыленном
состоянии с влагой воздуха:
SnC14 + 4H2O=Sn(OH)4+4HCL
Некоторые физико-химические свойства жидких дымообразую-
щих веществ такого типа приведены в табл. 18.2.
Таблица 18.2
Дымообразующее вещество Плот- ность Темпе- ратура плавле- ния °C Темпе- ратура кипения =С Продукты взаи- модействия с влагой воздуха
Четыреххлористое олово 2,2 —33 + 114 Sn(OH)4, НС1
Четыреххлористый титан I,8 —23 -f’ 136 Ti(OH)4, HCI
Четыреххлористый кремний 1,5 —69 +59 Si(OH)4> HCI
Хлорсульфоновая кислота 1,8 —80 +158 H2SO4, HCI
Трехокись серы 1,9 + 17 +45 HsSO4
250
2. Сжиганием на воздухе различных веществ, продукты горения
. которых при охлаждении конденсируются в воздухе. Чаще всего
’для этой цели употребляют белый фосфор:
4Р + 5О2=2Р2О5.
: ’ Пары фосфорного ангидрида реагируют с влагой воздуха, обра-
. Зуя метафосфорную и ортофоофорную кислоты, имеющие при ком-
; натной температуре весьма малую упругость паров.
3. Испарением или неполным сжиганием масел; в первом слу-
чае испарившееся масло конденсируется в воздухе в виде мелких
капель, образующих туман; во втором случае при неполном сго-
: раним масла часть углерода выделяется в свободном состоянии
в виде сажи, образуя черные облака, вначале хорошо закрывающие
предметы от наблюдения. Но сажа все же весьма быстро флокули-
рует. Ее частицы при соприкосновении слипаются вместе и обра-
зуют все увеличивающиеся в размерах хлопья, которые быстро
падают на землю. Черный дым имеет плохую кроющую способность.
Промежуточным способом является осуществление неполного
сгорания масла с одновременным испарением его избытка, В этом
случае жидкие частицы масла обволакивают черные частицы сажи
и этим вначале препятствуют флокуляции. Такой туман серо-чер-
ного цвета является более постоянным до тех пор, пока не испа-
рится одна из составных частей — масло. Таким образом, флокуля-
ция тумана лишь несколько отдаляется.
4. Сжиганием пиротехнических составов
которые содержат или образуют в процессе
личные дымообразующие вещества.
маскирующих дымов,
реакции горения раз-
§ 4. СОСТАВЫ МАСКИРУЮЩИХ ДЫМОВ
И ПРЕДЪЯВЛЯЕМЫЕ К НИМ ТРЕБОВАНИЯ
К составам маскирующих нейтральных дымов предъявляются
следующие специальные требования;
1) полученный в результате реакции горения дым должен иметь
максимальную кроющую способность (не ниже 500'ж-/кг) и быть
достаточно устойчивым в воздухе;
2) при сгорании в дымовых шашках составы не должны давать
Пламени;
3) образующийся при горении составов шлак должен быть рых-
лым (пористым) и не должен препятствовать прохождению через
него дыма.
Продукты горения составов, предназначенных для установле-
ния дымовой завесы в расположении своих войск, не должны ока-
зывать вредного влияния на здоровье бойцов.
Существует два вида резко отличающихся между собой соста-
вов маскирующих дымов. Одни из них содержат дымообразующие
вещества в готовом виде, в других дымообразующие вещества по-
лучаются при горении (металлохлоридные дымовые смеси).
251
Составы первого типа содержат следующие компонен-
ты: окислитель, горючее и дымообразующее вещество.
В качестве дымообразующих веществ применяют легковозго-
няющиеся вещества—хлористый аммоний (нашатырь) и аромати-
ческие углеводороды — нафталин, антрацен и др.
Процесс дымообразования сводится к возгонке содержащихся
в таком составе дымообразующих веществ и образованию дыма при
переходе их вследствие охлаждения в воздухе в твердое состояние.
Хлористый аммоний хорошо растворим в воде, плотность его
1,52. Заметная возгонка хлористого аммония начинается уже при
250° С, а при 339° С давление его пара составляет уже 760 м.и рт. ст.
Температура плавления хлористого аммония в замкнутом про-
странстве составляет 520° С. Теплоемкость хлористого аммония
0,39 кал1г-град.
Наряду с возгонкой хлористого аммония при повышенных тем-
пературах происходит его диссоциация на аммиак и хлористый
водород:
nh4ci^nh3+hci.
Реакция обратима и при охлаждении смещается влево1.
Степень диссоциации хлористого аммония в интервале темпера-
тур 200—400° С составляет от 57 до 79%.
Применение в качестве дымообразующего вещества в дымовых
составах сернокислого аммония едва ли целесообразно, так как он
гораздо менее летуч, чем хлористый аммоний. Мало нригоден
в качестве дымообразующего вещества и фтористый аммоний, уже
при комнатной температуре частично распадающийся на аммиак
и фтористый водород.
Из других неорганических соединений большую летучесть при
сравнительно невысоких температурах (ниже 1000° С) имеют га-
лоидные соединения многих металлов (цинка, железа, алюминия),
но они содержат кристаллизационную воду и являются настолько
гигроскопичными, что обезвоживание их представляет большие
трудности.
Из органических соединений в качестве дымообразующих ве-
ществ могут быть использованы углеводороды как жирного, так
и ароматического ряда, Так, например, без разложения могут испа-
ряться веретенное, машинное, цилиндровое .масла.
Из ароматических углеводородов наибольшее применение в ка-
честве дымообразующих веществ в пиротехнических составах на-
шли нафталин и антрацен.
Физико-химические свойства нафталина описаны в гл. IV
(стр. 52). Существенным недостатком нафталина является его зна-
чительная летучесть уже при комнатной температуре.
Антрацен С14Н10 представляет собой белые кристаллы; плот-
1 Хлористый аммоний при повышенной температуре может окисляться кис-
лородом воздуха:
2NH4ClTB4-2Os=4H;Onap + N2+Cl2480 ккал.
252
ность 1,25, температура плавления 218° С, температура кипения
342° С.
Антрацен легко возгоняется уже при температуре около 200рС.
Фенантрен СцНю — изомер антрацена — имеет температуру
плавления 99° С и температуру кипения 240° С; легко возгоняется
при температуре около 200р С.
Часто в качестве дымообразователя в дымовых составах упот-
ребляют также технический антрацен, представляющий собой зе-
леновато-желтую массу, содер-
жащую антрацен (до 25%), фе-
нантрен, карбазол (C12H9N) и
другие углеводороды.
Температура вспышки сырого
антрацена 150—162° С.
В качестве горючего в соста-
вах маскирующих дымов иногда
применяется древесный уголь.
Нафталин и антрацен выпол-
Фиг. 18.2. Открытая и закрытая
няют в некоторых составах наря- дымовые шашки,
ду с функциями дымообразовате-
ля также и функции горючего, частично возгоняясь, а частично
сгорая. В качестве окислителя в составах маскирующих дымов
обычно применяют хлорат калия.
Типичные дымовые составы, подобные смеси Ершова, содержат:
Хлорат калия......................... 20—30%
Хлористый аммоний.................... 50%
Нафталин (или антрацен).............. 20%
Уголь древесный...................... 0—10%
Небольшое содержание в составе хлората и большое содержа-
ние малоактивного вещества — хлористого аммония — обеспечивает
сравнительно малую чувствительность таких составов к механиче-
ским воздействиям,
Кислородный баланс дымовых смесей, подобных смеси Ершова,
является резко отрицательным, а газовая фаза, образующаяся
при горении, содержит значительное количество СО и легковоспла-
меняющихся паров нафталина или антрацена. Такие составы при
снаряжении их в объекты заключают в оболочку, снабженную от-
дельными выходными или выхлопными отверстиями, которая
предохраняет горящую поверхность состава от проникновения
к нему кислорода воздуха (фиг. 18.2).
Несмотря на принимаемые меры предосторожности, дымовые
составы дают иногда вспышки при сгорании. Равномерность горе-
ния при этом нарушается, у. отверстий шашки появляется пламя,
количество выделяющегося дыма резко уменьшается и дым при-
обретает сероватый оттенок.
В слишком активные дымовые составы поэтому добавляют спе-
циальные вещества — пламегасители.
253
Наилучшими пламегасителями являются углекислые соли; сода,
мел, углекислый магний, выделяющие при своем разложении угле-
кислый газ, который в некоторой степени разбавляет способные
к горению на воздухе газообразные продукты реакции.
В зависимости от свойств дымового состава содержание в нем
пламегасителей может доходить в отдельных случаях даже до
10—15%.
Составы второго типа — металлохлоридные дымовые
смеси. В таких составах дымообразующие вещества получаются
в результате реакции горения.
Примером этого может служить реакция
CCl4 + 2Zn = C + 2ZnCb.
Образующийся здесь дым окрашен в серый цвет, так как наря-
ду с белыми частицами хлористого цинка он содержит черные ча-
стицы углерода.
Хлористый цинк представляет собой белые чрезвычайно гигро-
скопичные кристаллы; плотность хлористого цинка 2,91, темпера-
тура плавления 365° С, температура кипения 732я С.
Во влажном воздухе хлористый цинк частично гидролизуется.
Свойства CCU см. [7, стр. 235].
Кроме двух основных компонентов,— хлорорганического соеди-
нения и порошка металла — металлохлоридные дымовые смеси со-
держат ряд компонентов, играющих вспомогательную роль.
Все смеси с CCU содержат поглотитель для этой жидкости. В каче-
стве поглотителей чаще других применяются инфузорная земля
(ЭЮэ), окись цинка или углекислый магний. Подробнее о поглоти-
телях см. [211, стр. 159].
Кроме того, иногда в металлохлоридные дымовые смеси вводят
также дополнительный окислитель — NaCIO3, КС1О3 или КС1О4
и дополнительный дымообразователь — хлористый аммоний.
При наличии в смеси добавочного окислителя — хлората (или
перхлората), дым получается значительно белее, так как углерод,
образующийся при горении смеси, сгорает, образуя СО (или СОг).
В настоящее время, как указывает Эллерн [9, стр. 48], смеси
с СС14 более не употребляются *.
Четыреххлористый углерод в современных дымовых смесях за-
менен твердыми хлорорганическими соединениями — гексахлорэта-
ном, гексахлорбензолом, гексахлорциклогексаном и др. При уда-
лении из смеси жидкого CCU исключается необходимость вводить
в состав поглотители.
Примером дымообразующей смеси, состоящей только из твер-
дых компонентов, может служить следующий состав:
Гексахлорэтан.......... 30% Хлорат калия............ 29%
Цинк................... 38% Древесный угдль.......... 3%
1 О применении маскирующих дымов в армии США см. статью Павло-
ва [212].
254
Во время второй мировой войны немецкие дымовые шашки сна-
ряжались составом, состоящим из следующих компонентов:
Гексахлорэтан ............................. 53%
Цинк...................................... 44%
Окись магния................................. 3%
Одним из недостатков гексахлорэтана является его значитель-
ная летучесть при комнатной температуре, превосходящая даже ле-
тучесть нафталина. Так, при 60эС давление пара нафталина равно
2 мм, а гексахлорэтана — 6 лис
В этом отношении гораздо лучшие свойства имеет гексахлор-
бензол.
Гордон и Кэмпбелл [213] исследовали тройную смесь А, состоя-
щую из цинка, С6С1в и КС1О4, а также двойные смеси из тех же
компонентов. По их данным, теплота горения смеси А равна
0,52 ккал] г, а объем газов 0о=77 мл/г (85% СО и 15% СО2).
Температура инициирования смеси А равна 321ГС, а двойной
смеси Б—Zn/KClO4 (65/35)—520°С. Теплота горения смеси Б со-
ставляет 0,82 ккал/г. На основании своих исследований авторы
пришли к выводу, что прединициирование, инициирование и горе-
ние смеси А осуществляется за счет последовательного протекания
трех реакций:
1. 32п + С6С1б — 3ZnCl2 + 6C.
2. 4С + КС1О4 —KCl+4CO( + COs).
3. 4Zn + KClO4^KCl+4ZnO.
Некоторые свойства твердых хлорорганических соединений при-
ведены в табл. 18.4.
Таблица 18.4
Соединение и формула % хлора в соеди- нении Молеку- лярный вес Плот- ность Температура в °C
плавле- ния кипения
Гексахлорэтан С2С1в 90 237 2,1 185 Энергично возгоняется при 185°
Гексахлорбензол С0С1е 75 285 1,6 227 323
Пектахлорбензол CgCljll 71 250 1,8 86 277
Октохлорнафталнн C^Cls 70 404 .— 203 —
В книге Эллерна [9] упоминается, что металлохлоридные смеси
вполне устойчивы при хранении в сухом виде, но в присутствии
влаги в некоторых из них может произойти саморазогрев и даже
самовоспламенение. Поэтому смесь (C2Cle + Zn) теперь больше не
используется.
255
Кроме цинковой пыли, в металлохлоридных дымовых смесях
могут быть использованы порошки алюминия, железа, силицида
кальция.
Горение таких смесей протекает с образованием хлоридов соот-
ветствующих металлов:
С2С16-г2А1=2С + 2А1С13,
C2Cl6 + 2Fe=2C + 2FeCl3.
Ниже приведены рецепты двойных смесей металлических по-
рошков с гексахлорэтаном, полученные путем расчета при условии
полного окисления горючего:
Гексахлорэтан......... 81,4% Гексахлорэтан......... 67,9%
Алюминий ........ 18,6% Железо .............. 32,1%
Смесь гексахлорэтана с алюминием горит интенсивно; чтобы
замедлить процесс ее горения, к ней добавляют значительное коли-
чество веществ, являющихся одновременно дополнительными дымо-
образователями (хлористый аммоний, окись цинка и Др.). Так, на-
пример, состав белого дыма НС имеет рецепт [9]:
С2С13 .......................... 45—47 %
ZnO.................................. 47—48%
Al . ,................................ 5—8%
ZnCO3................................. 0—1%
Борат цинка........................ 0—1%
При горении смеси, содержащей немного алюминия, протекает
реакция [9]
2AI+9ZnO+3C2Cl6=Al2O3-f-9ZnCl2+6C0.
Однако дым, образующийся при горении такой смеси, содержит
некоторое количество сажи и по цвету скорее кажется серым, чем
белым.
Новые американские рецепты содержат С2СЦ, ZnO и NH4CIO4
и смачиваются раствором поливинилацетата. Такие смеси могут
снаряжаться без давления, а после испарения растворителя стано-
вятся прочными и вместе с тем эластичными.
Хлористый алюминий, образующийся при горении смесей, со-
держащих С2С1в и значительный процент алюминия, представляет
собой белое легко возгоняющееся, чрезвычайно гигроскопичное
вещество.
Смесь гексахлорэтана с порошком железа горит медленно
и мало активно, выделяя при горении бурый дым хлорного железа.
Безводное хлорное железо FeCl3 возгоняется уже при 250° С, ки-
пит с частичным разложением при 316° С. На воздухе оно жадно
поглощает влагу, образуя шестиводный кристаллогидрат
FeCl3 • 6Н2О.
256
При наличии взрывного начального импульса (капсюль-детона-
тор № 8) и прочной оболочки в двойных смесях ССЦ или CjCle
с магнием или алюминием может возникнуть взрыв, но сила взры-
ва, судя по полученным данным (табл, 18.5) и учитывая взятую
для испытания навеску смеси,— невелика.
Таблица 18.5
Результаты испытания металлохлоридных смесей
в бомбе Трауцдя
(навеска смеси—20 г; вместо обычной засыпки
песком в канал бомбы вставлен свинцовый
стержень)
Состав смеси % Расширение в бомбе Трауцлн слз
СС14 76, Mg 24 215
CCI4 81, Al 19 156
CjCl6 81,5, Al 18,5 64
При взаимодействии гексахлорэтана с силицидом кальция об-
разуется легколетучий тетрахлорид кремния SiCl4, дающий при
взаимодействии с влажным воздухом дым кремниевой кислоты.
В качестве примера дымовой смеси с силицидом кальция можно
привести рецепт:
Гексахлорэтан ............................. 45%
Окись цинка . ,............................ 45%
Силицид кальция ........................... 10%
Глава XIX
СОСТАВЫ ЦВЕТНЫХ ДЫМОВ
Составы цветных дымов используются в военном деле для сиг-
нализации в дневных условиях; они применяются также для при-
стрелки и целеуказания при бомбометании и артиллерийской
стрельбе. На транспорте они используются для подачи сигналов
бедствия (аварийные сигналы) в наземных условиях и, особенно,
на море.
§ 1, СИГНАЛИЗАЦИЯ ПРИ ПОМОЩИ ЦВЕТНЫХ ОБЛАКОВ
И СПОСОБЫ ИХ ПОЛУЧЕНИЯ
Для дневной сигнализации употребляются, главным образом,
Дымовые облака четырех цветов: красного, желтого, зеленого и си-
него.
17
А. А. Шндловскнй
257
Глаз
Иногда встречаются указания о возможности применения для
дневной сигнализации и черного дыма, причем черный цвет дается
или в качестве пятого сигнала или им заменяется один из указан-
ных цветов (синий или зеленый). Хуже других, особенно при боль-
ших дистанциях наблюдения, различаются между собой синий и зе-
леный дымы.
Основным недостатком дневной сигнализации, осуществляе-
мой при помощи цветных дымов, является зависимость четкости
наблюдения дыма и надежности определения его цвета от метеоро-
логических условий.
Факторами, более все-
го отражающимися на ре-
зультатах наблюдения
дымовых сигналов, яв-
ляются:
I) форма и размеры
цветного дымового об-
лака;
2) яркость и цвет фо-
на, на котором проекти-
руется дымовой сиг-
нал;
положение наблюдателя по
s хорошие s
Убовлетво'- ч условия^ /Неблагоприятные
рительные х условия
устная уС 'f
Глаз
Солнце
Глаз
OiBQKt}
Фиг. 19. 1. Зоны различных условий наблю-
дения цветных сигнальных дымов.
3) высота солнца над горизонтом и
отношению к солнцу и дымовому облаку;
4) скорость ветра;
5) атмосферные осадки (снегопад, дождь, туман).
Наилучшую видимость и различимость цвета дымовые облака
имеют в ясную тихую погоду при скорости ветра не более 2—
3 м/сек.
При скорости ветра более 6 м/сек дымовое облако очень быстро
рассеивается. Хуже всего цвет дымового облака воспринимается
в том случае, когда оно находится на прямой линии между солн-
цем и глазом наблюдателя (фиг. 19.1); при наблюдении в таких
условиях многие цветные облака кажутся почти белыми, Наоборот,
в том случае, когда солнце находится за спиной наблюдателя, цвет-
ное облако приобретает темную окраску.
Наилучшими условия для наблюдения за цветом облака бы-
вают тогда, когда угол, образованный солнцем, дымовым облаком
и глазом наблюдателя, находится в пределах 45—135°.
На стабильность сигнального облака в воздухе большое влия-
ние оказывают его форма и величина.
Парашютные сигнальные изделия при своем действии дают
обычно цветную дымовую ленту. Лента эта быстро рассеивается
токами воздуха, но в атмосферу из дымовой шашки поступают все
новые и новые порции дыма.
В изделиях, не имеющих парашюта, дымообразование прихо-
дится осуществлять почти мгновенно: в воздухе образуется ком-
пактное цветное облако, четкое наблюдение которого в зависимости
258
f от количества использованного дымового состава и метеорологиче-
ских условий возможно в течение от нескольких десятков секунд
! до нескольких минут.
Получение сигнальных цветных дымов методом диспергирова-
ния осуществлялось распылением тонкоизмельчеиных минеральных
красок при помощи взрывчатых веществ или пороха.
В качестве минеральных красок употреблялись сурик, киноварь,
; синий ультрамарин.
Однако практика показала, что для получения удовлетворитель-
ного по качеству и времени наблюдения цветного облака лриходит-
' ся расходовать слишком большое количество красящих веществ
(1—2 кг). Было замечено также, что цветной дым, полученный
механическим распылением минеральных красок, весьма скоро
I’ рассеивается, так как частицы его имеют слишком большие разме-
( ры (порядка 1 10-а—1 -10”3 cjh) и быстро оседают.
Получение цветных дымов конденсационным методом при помо-
। щи химических реакций, протекающих между неорганическими ве-
• ществами, также особого успеха не имело.
Почти все предложенные смеси давали при испытании мало
' удовлетворительные результаты как по количеству получаемого
дыма, так и по его цветности.
i Относительно неплохие результаты были получены только для
составов черного дыма, который было предложено получать при
горении металлохлоридных смесей, содержащих в качестве третьего
компонента богатые углеродом соединения ароматического ряда.
В качестве примера можно привести состав сигнального черного
1 дыма по рецепту:
Гексахлорэтан .......................... 60%
Магний.................................. 19%
Нафталин (или антрацен)................. 21%
По литературным данным, смесь горит со скоростью 4 ми/сек
и дает густой черный дым; смесь эта чувствительна к удару. Не-
достатки ее— быстрое улетучивание из нее гексахлорэтана и наф-
талина, а также низкая температура плавления смеси гексахлор-
этана с нафталином. Смесь 8 частей нафталина с 20 частями гекса-
хлорэтана плавится при 53° С. Поэтому оказалось целесообразным
заменить нафталин антраценом.
Горение таких смесей должно протекать при свободном доступе
воздуха, иначе нафталин или антрацен будут не сгорать, а возго-
няться, и дым получится не черный, а серый.
Составы черного дыма, не содержащие хлорорганических соеди-
нений, имеют рецепты;
Хлорат калия........................... 45%
Нафталин............................... 40%
Древесный уголь......................... 15%
или
Хлорат калия........................... 55%
Антрацен ............................... 45%
17*
259
Особенностью таких смесей черного дыма по сравнению с со-
ставами маскирующего белого дыма является отсутствие в них
хлористого аммония и большое содержание хлората калия; в этом
случае значительно повышается температура горения смеси
и в процессе ее горения происходит уже не возгонка нафталина,
а неполное его сгорание, сопровождающееся выделением большо-
го количества сажи.
Из цветных дымов, получающихся при химической реакции, по-
видимому, заслуживает некоторого внимания только состав желто-
оранжевого дыма [9]: Mg 16%, С2С16 48%, Fe2O3 36%- Окраску
дыму придает образующееся при горении хлорное железо FeClj.
Наилучшие по качеству сигнальные дымы всех цветов (красно-
го, желтого, зеленого, синего) были получены при возгонке органи-
ческих красителей.
В составах, содержащих окислитель, горючее и органический
краситель, последний за счет тепла, выделяющегося прн горении,
переходит в парообразное состояние и выталкивается газообразны-
ми продуктами реакции в атмосферу, где происходит конденсация
его паров с образованием цветного дыма.
Примером смесей, в которых получение дыма основано на воз-
гонке органических красителей, может служить состав синего
дыма:
Хлорат калия ........................... 35%
Молочный сахар.......................... 25%
Синтетический индиго ................. 40%
§ 2. КРАСИТЕЛИ, ПРИМЕНЯЮЩИЕСЯ В СОСТАВАХ
СИГНАЛЬНЫХ ДЫМОВ
К органическим красителям, применяющимся в составах сиг-
нальных дымов, предъявляются следующие специальные требова-
ния:
1) они должны быстро возгоняться уже при температуре 400—
600° С;
2) возгонка их должна сопровождаться минимальным разложе-
нием красителя;
3) образующийся при конденсации в воздухе паров красителя
цветной дым должен иметь резко выраженную специфичную
окраску (красную, желтую, синюю) и быть достаточно устойчивым
в воздухе.
Быстрота возгонки красителя прежде всего зависит от упруго-
сти его паров при высоких температурах.
Упругость паров некоторых красителей при 260° С и скрытые
теплоты их возгонки см. [7, стр. 243].
Несомненно, что скорость возгонки будет зависеть также от теп-
лоемкости и от скрытой теплоты возгонки красителей; краситель
будет возгоняться тем быстрее, чем меньше тепла надо расходо-
вать на превращение его в парообразное состояние.
260
К Средняя удельная теплоемкость большинства применяемых кра-
сителей в интервале температур 20—2СХГС составляет 0,3—
К 0,4 кал]град.
К' Быстрое осуществление возгонки органических красителей He-
В. обходимо потому, что органические красители при длительном воз-
М: действии на них высокой температуры будут разлагаться.
К Качественное испытание красителя на его термическую стой-
В кость и способность к образованию окрашенных паров заключает-
ся в том, что взятую на кончике ножа щепотку красителя вносят
К в нагретый на обыкновенной газовой горелке до 400—600° С Фар-
S' форовый тигелек. Если краситель образует окрашенные лары, это
указывает, что он является относительно термически стойким и что
К. следует провести дальнейшие испытания его в пиротехнических Co-
К. ставах. Если же краситель при испытании разлагается, выделяя
В при этом бесцветные или окрашенные в грязно-серый цвет пары, то
В он непригоден для применения в составах сигнальных дымов.
В Экспериментально установлено, что наиболее термически стой-
В кимн являются красители, обладающие наиболее простой химиче-
В ской структурой.
В Кроме того, выяснено, что некоторые химические группировки
К в органическом красителе могут явиться причиной того, что при его
нагревании не образуется окрашенных паров.
И К группировкам, наличие которых в красителе препятствует его
К переходу в парообразное состояние, следует отнести:
№ 1. Сульфогруппу в виде R— SO3H или R— SO3K или R —
® SO3Na.
ж 2. Группу R —О — Me (Me — металл).
(К 3. Бензидиновую группировку--N- —N=
И в том случае, если она содержится в азокрасителях.
Ж Также не дают окрашенных паров, а следовательно, и являются
< не пригодными для сигнального дымообразования не растворимые
Ж, в воде сернистые красители.
> Чаще других для получения цветных дымов употребляются мо-
Ж нонитроаминосоединения (полупродукты), азокрасители, дифенил-
метановые, трифенилметановые, тиазиновые и антрахиноновые
’’> красители (классификацию красителей см. [214]).
Чаще других в составах цветных дымов используются следую-
£ щие полупродукты и красители;
1. Паранитроанилин — дым желтого цвета.
2. Аурамин О — дым желтого цвета (используется с добавкой
коричневого красителя хризоидина).
3. Жирооранж (бензолазобетанафтол) — дым оранжевого
цвета.
4. Родамин Б—малиново-красный дым.
।
261
5. Судан красный (2-анизидин-азобетаиафтол) — красный
дым,
6. Метиленовая голубая -—дым синего цвета.
7. Индиго — дым синего цвета.
Сведения о химическом составе и свойствах этих красителей
можно найти во втором издании книги [7].
Для получения цветных дымов могут быть использованы
и антрахиноновые красители.
Примером этого класса красителей является 1,4-диметил-
аминоантрахинон
О NfCH^
О N(CH3)2
CI8Hl8N2O2
дающий при возгонке хороший дым синего цвета,
К антрахиноновым красителям относится и «судам синий G».
представляющий собой 1-мегиламино, 4-паратолуилаитрахинон
О NH-CH,
применявшийся в немецких составах синего дыма.
1-метиламиноантрахинон употребляется для получения красно-
го дыма.
§ 3. СОСТАВЫ ЦВЕТНЫХ ДЫМОВ
Возгонка органических красителей для получения цветных сиг-
нальных дымов осуществляется за счет тепла, выделяющегося при
сгорании так называемой «термической смеси», состоящей из окис-
лителя и горючего.
Термическая смесь должна выделять количество тепла, необхо-
димое для перехода красителя в парообразное состояние, но не
должна развивать при горении высокой температуры, чтобы не вы-
звать разложения красителя.
262
Кроме того, термическая смесь должна выделять при горении
значительное количество газообразных продуктов реакции, которые
способствовали бы быстрому удалению паров возгоняющегося кра-
сителя из сферы реакции горения. По этим причинам порошки ме-
таллов не могут быть использованы в качестве горючего в соста-
вах цветных дымов.
Из горючих наиболее пригодными в этом случае являются орга-
нические вещества.
На практике в качестве горючих в составах сигнальных дымов
чаще всего употребляют углеводы, так как они образуют при своем
сгорании большое количество газообразных продуктов реакции
и выделяют не слишком большое количество тепла (табл. 19.1).
Таблица 19.1
Теплота реакции сгорания и удельный объем газообразных продуктов
реакции двойных смесей
№ смеси Реакция горения смеси Содержа- ние горю- чего в сме- си % Теплота горения ккал/г Удельный объем газо- образных продуктов реакции см$!г
1 вКСЮз+С.оНиОц • Н2О=8КС14- 26,9 1,06 401
+ 12СО24-12Н2О
2 4KClO34-ClsH2,OirH2O=4KCl+ -Н2СО+12Н2О 42,3 0,63 632
Из табл. 19.1 видно, что наилучшие показатели имеет смесь 2,
где сгорание молочного сахара осуществляется только до окиси
углерода. Опыт показывает, что применение в составах цветных
дымов такой термической смеси, рассчитанной на неполное сгора-
ние горючего, дает возможность получать дым наилучшего ка-
чества.
Из углеводов в составах цветных дымов применяют молочный
или свекловичный сахар, крахмал1, древесные опилки.
В качестве окислителя в составах цветных дымов употребляют
почти исключительно бертолетовую соль; однако изредка в зару-
бежной литературе приводятся рецепты составов с окислителем —
перхлоратом калия. Бехер [8] указывает, что термическая смесь
хлората калия с углеводами может быть при желании заменена
нитроцеллюлозой.
Количество красителя в составах цветных сигнальных дымов
колеблется от 40 до 60% в зависимости от химической природы
самого красителя и требуемой скорости сгорания состава.
1 Эти вещества являются продуктами пищевой промышленности; возможна
их замена горючими, применяющимися в инсектисидных дымовых составах, на-
пример, дициандиамидом (см, гл. Ш, стр. 53).
263
В отдельных случаях в составы вводится некоторое количество
вещества, препятствующего воспламенению паров красителя. Та-
кие вещества получили название пламягасителей. В качестве та-
ких веществ используют, например, NaHCOg. Роль пламягасителя
сводится к понижению температуры в составе и образованию при
разложении инертного газа (СО2), наличие которого уменьшает
контакт паров красителя с воздухом.
Эллерн [9] в качестве состава цветного дыма с «пластическим
связующим» приводит рецепт (в %):
Органический краситель ... 51 КСЮ3 ........................ 23
Сахар (тростниковый): .... 18 NaHCOg......................... 8
-Сверх 100% смеси в нее вводят 2,2 части ноливинилацетата,
растворенные в 50 частях днхлорметана (ДХМ удаляется при
сушке состава).
Содержание компонентов в хлоратных составах цветных сиг-
нальных дымов, не содержащих пламягасителя, составляет при-
мерно:
Хлорат калия ...... 30±10% Краситель............... 50±5%
Углевод ............. 20±5% Цементатор — смола . . . 0—5%
Введение цементатора необходимо только в том случае, когда
производится гранулирование дымовых составов. Операция грану-
лирования проводится для того, чтобы увеличить поверхность гоне-
ния состава и тем самым уменьшить общее время дымообразова-
ния. Кроме того, гранулирование состава способствует улучшению
цвета дыма, так как в гранулированном составе пары красителя
быстрее могут удаляться из сферы реакции и не должны прохо-
дить через нагретый до высокой температуры шлак, имеющий
в некоторых случаях весьма плотную консистенцию. Диаметр изго-
товляемых гранул хлоратных составов составляет от 2 до 5 мм.
Грануляция состава устраняет его расслоение во время транспор-
тировки, снаряжения и применения.
Составы сигнальных дымов должны сгорать без доступа к ним
кислорода воздуха. Для этого состав помещают в пористую обо-
лочку— мешковину или в картонную, или жестяную шашку с ря-
дом отверстий для выхода дыма. При доступе кислорода воздуха
температура горения состава значительно повышается за счет дого-
рания окиси углерода 2СО4-О^==2СО2+136 ккал, что сопровож-
дается образованием пламени и ведет к почти полному сгоранию
окрашенных паров красителя.
Но и при взаимодействии компонентов состава без образова-
ния пламени все же происходит частичное разложение красителей.
Количество дыма, образующегося при сгорании хлоратных дымо-
вых составов, составляет обычно от 30 до 70% от первоначального
веса красителя и, кроме того, в самом дыме содержится лишь 60—
80% красителя (остальные 20—40% приходятся на продукты его
разложения — смолы).
264
Рецепты хлоратных составов сигнальных дымов см. [7, стр. 252].
Из составов, содержащих нитраты, можно указать следующий:
25%
35%
40%
'l
Нитрат натрия ....
Опилки древесные . .
Родамин........... .
Существенным недостатком этого состава является его большая
гигроскопичность.
Для артиллерийской пристрелки в условиях боя (особенно при
одновременной стрельбе из многих орудий) часто бывает необхо-
димо отметить место падения осколочно-фугасных снарядов или
их воздушных разрывов.
В дневных условиях это достигается образованием при разры-
ве снаряда облака интенсивно окрашенного цветного дыма. Такие
снаряды могут использоваться и при противовоздушной обороне.
। Известно, что для образования при артиллерийской стрельбе
цветных дымовых разрывов употребляют смеси органических кра-
. сителей с различными ВВ. При взрыве заряда происходит возгонка
органического красителя с последующим образованием цветного
дыма.
’ Немецкие целеуказательные снаряды в 1941—1945 гг. снаряжа-
лись смесями высокоэффективных ВВ (тэн, гексаген) с азокрасите-
лями. Содержание красителей в таких смесях составляло 55—65%.
В американском патенте (218] дается следующее описание
с устройства и снаряжения 3 и 5-ти дюймовых целеуказательных
снарядов.
Окрашенные вещества (органические красители) располагаются
в корпусе снаряда так, что при взрыве они превращаются в паро-
образное состояние; соприкасаясь затем с холодным воздухом,
сублимированные красители конденсируются в виде тонкого интен-
сивно окрашенного дыма.
Красители, составляющие по весу около 10% от веса разрывно-
го заряда, не должны смешиваться с ВВ, но размещаться между
стенками корпуса и центральным разрывным зарядом. Для низко-
плавящихся красителей (температура плавления менее 15СРС)" воз-
можно снаряжение методом центробежной заливки; для понижения
температуры плавления краситель может быть смешан с парафи-
ном или термопластичной смолой.
В качестве ВВ особенно пригодны, так как почти не дают при
Взрыве темного облака сажи; 1) нитрогуанидин, 2) смесь пикра-
та аммония с нитратом аммония (NH4NO3 от 40 до 75%).
В качестве красителей, показавших хорошие результаты, указы-
ваются:
1. Красный или оранжевый дым: жирооранж и диэтил-т-амино-
фенол фталеингидрохлорид;
2. Желтый дым: аминоазотолуол и бензолазодиметиланилин;
3. Синий дым: хинизарин синий, антрахинон виолет.
265
Лучше других наблюдаются в воздухе разрывы оранжево-крас-
ного дыма.
Эллерн [9] указывает, что для получения цветных дымов может
быть использован бездымный порох ЕС, и приводит рецепт состава:
Органический краситель ................... 50%
Порох ЕС ............................. 50%
Порох ЕС — это смесь частично желатинированной нитроцеллю-
лозы (НЦ) с добавкой нитратов, а именно:
НЦ.................................... 80,4%
KNO3................................... 8,0%
Ва(МО3)2................................ 8.0%
Крахмал................................. 3,0%
Дифениламин............................. 0,6%
Рецепты составов сигнальных дымов, использовавшихся во вре-
мя второй мировой войны, см. также в [216].
§ 4. МЕТОДЫ ИСПЫТАНИЯ СОСТАВОВ ЦВЕТНЫХ ДЫМОВ
Специальные исследования составов цветных дымов заключают-
ся в изучении свойств образующегося при их сго,рании цветного
дыма. Чаще других производятся следующие испытания:
1) определение общего количества дыма, получающегося при
сгорании 1 г дымового состава;
2) определение устойчивости дыма в воздухе, а также опреде-
ление размеров дымовых частиц;
3) определение цветности дыма.
Эти испытания проводятся в такой же дымовой камере, как
и для исследования свойств маскирующих дымов.
Определение общего количества дыма, образующегося при сжи-
гании в камере дымового состава, производится взвешиванием до
и после опыта стеклянных пластинок (9x12 си), помещаемых на
дно и боковые стенки камеры.
Устойчивость цветного дыма в воздухе можно определить по
любому из методов, принятых для исследования стабильности
аэрозолей.
Цветность дымов можно определять методами, применяемыми
для измерения цвета окрашенных тканей и вообще всех цветных
материалов. Правда, здесь приходится иметь в виду лишь опреде-
ление цвета дыма в отраженном свете, но именно это определение
и представляет собой наибольшую ценность.
При определении цветовых характеристик сигнальных дымов
в отраженном свете на спектрофотометре Пуль фр и ха были полу-
чены результаты, приведенные в табл. 19.2.
Работы по определению цветности дымов проводились и за ру-
бежом [217].
266
Таблица. 19.2
Цветовые характеристики сигнальных дымов
Состав сигнального дыма в % Цветовые характеристики дыма
цветовой той ммк чистота цвета р % яркость ды- ма в отно- сительных единицах
Хлорат калия—40, аурамин—26, хри- зоидин—14, углеводы—20 584 75 12,6
Хлорат калия—40, жирооранж—20, родамин—20, углеводы—20 600 54 8,9
Хлорат калия—40, оксалат аммо- ния—7, метиленовая голубая—40, уг- леводы—13 487 11 14.1
Определение цвета дыма в проходящем свете не представляет
для пиротехников особого интереса и не позволяет судить о качест-
ве получаемого дыма.
Глава XX
ТВЕРДЫЕ ПИРОТЕХНИЧЕСКИЕ ТОПЛИВА1
§ 1. КЛАССИФИКАЦИЯ И ЭНЕРГЕТИЧЕСКИЕ ХАРАКТЕРИСТИКИ
В настоящее время разработаны разнообразные твердые
пиротехнические топлива. По назначению их можно разде-
лить на четыре характерных типа:
1) топлива для прямоточных реактивных двигателей (ПВРДТ)
или ракетно-прямоточных двигателей (РПДТ);
2) топлива для гидрореактивных двигателей (ГРД);
3) топлива для комбинированных двигателей (КРД);
4) ао своей природе к твердым пиротехническим топливам
близки также смесевые топлива для ракетных двигателей (РДТТ).
Назначение топлива определяет его состав и свойства. У всех
реактивных двигателей источником энергии является энергия, вы-
деляющаяся при горении топлива. При истечении продуктов реак-
ции из сопла реактивного двигателя энергия топлива превращает-
ся в кинетическую энергию струи.
Для определения энергетических характеристик твердых топлив
(а также характеристик продуктов их сгорания) необходима высо-
кая точность расчетов и максимальный учет всех физико-хим иче-
1 Термин «твердое пиротехническое топливо» не является общепринятым.
Он введен нами с тем, чтобы выделить из многочисленных видов твердых топлив
для реактивных двигателей такие, которые по своему составу и свойствам близки
к тем или иным пиротехническим составам,
267
скнх процессов, происходящих при горении топлива и истечении
продуктов сгорания из сопла. Обычно принято считать, что процесс
истечения продуктов сгорания из сопла происходит изоэнтропиче-
ски, т. е. Д5=0.
Поэтому изменение кинетической энергии струи при истечении
из сопла происходит за счет изменения теплосодержания продук-
тов сгорания топлива:
где Д/ — изменение теплосодержания продуктов сгорания
в ккал/кг;
Gt — расход топлива в кг/сек\
ис — скорость истечения газов на выходе из сопла в м/сек\
«к.с — скорость истечения газов в конце камеры сгорания
в м/сек;
g — ускорение силы тяжести.
Таким образом, задача сводится к определению теплосодержа-
ния продуктов сгорания топлива в камере сгорания и на срезе соп-
ла. С этой целью проводят специальные термодинамические рас-
четы, в основе которых лежит равенство полного теплосодержания
топлива полному теплосодержанию продуктов реакции при данном
давлении, а также принцип полного термодинамического равнове-
сия в продуктах сгорания при данной температуре н давлении [224];
[221]; [232]; [229]. При этом принимаются во внимание теплота об-
разования компонентов топлива, изменение термодинамических
характеристик продуктов сгорания с изменением температуры [233],
учитывается диссоциация продуктов сгорания при высокой темпе-
ратуре в камере сгорания.
В результате таких расчетов определяют температуру продук-
тов сгорания топлива при различных давлениях, состав и характе-
ристики продуктов сгорания, удельную тягу (удельный импульс)
при заданном давлении в камере. Результаты этих расчетов являют-
ся исходными для последующих расчетов двигателя и различных
ороцессов, протекающих в двигателе при горении топлива, а имен-
но, расчета сопла, геометрии заряда твердого топлива, условий
течения продуктов сгорания по камере двигателя или по каналу
заряда, расчетов теплоизоляции двигателя и тепловых потерь.
Превращения энергии у различных реактивных двигателей про-
исходят по-разному.
1. Прямоточный воздушно-реактивный двига-
тель на твердом топливе развивает тягу в полете за
счет изменения количества движения струи воздуха, протекающей
сквозь двигатель. Схема этого двигателя представлена на фиг. 20. 1.
Изменение количества движения струи воздуха в двигателе про-
исходит вследствие подвода тепла, выделяющегося в камере сго-
рания при горении топлива. Таким образом, воздух, поступающий
268
в двигатель через специальный воздухозаборник (диффузор),
является в данном случае и окислителем, и рабочим телом.
В качестве основных характеристик прямоточного двигателя
используют обычно удельную тягу двигателя и коэффициент тяги.
Удельная тяга I характеризует экономичность двигателя. Величи-
на коэффициента тяги Ся определяет максимальную величину
тяги, которая может быть получена на данном топливе в опреде-
Фиг- 20.1. Схема прямоточного воздушно-реактивного дви-
гателя иа твердом топливе-
]—сверхзвуковая часть диффузора, 2—дозвуковая часть диффузора.
5—заряд твердого топлива, V—камера сгорания, 5—выходное сопло.
ленном двигателе. Из теории ПВРД известно, что величина удель-
ной тяги и коэффициент тяги зависит от скорости и высоты полета
[222]; [219]; [230]:
I R a-Lp-V^
Gt g
1 \
S" 2S
где /? —тяга двигателя в кг;
GT —расход топлива в кг[сек;
а—коэффициент избытка воздуха;
Lp —стехиометрическая постоянная;
Vfi- скорость полета в м!сек\
р — коэффициент прироста массы, равный отношению расхода
продуктов сгорания к расходу воздуха;
6 —относительный подогрев воздуха;
Sp — площадь поперечного сечения ракеты в м2;
— плотность воздуха на высоте полета в кг]м3.
Стехиометрической постоянной топлива Lp называют количество
воздуха в кг, теоретически необходимое для сгорания 1 кг топлива.
Относительный подогрев fl при работе двигателя на твердом топ-
269
ливе зависит от теплотворной способности топлива Ни и соотноше-
ния между расходом воздуха и расходом топлива wLo'.
6—-U-------------------
Гв (14-a-£0)<W
где Гсг — температура торможения продуктов сгорания в °К;
Тв — температура торможения набегающего потока воздуха
в °К;
Ср — теплоемкость продуктов сгорания в ккал/кг.
Поэтому наибольшую экономичность ПВРДТ или наибольшую
удельную тягу можно получить, применяя топлива, которое имеют
наибольшую теплотворную способность (в ккал/кг) при сжигании
их в воздухе.
Пример I, Вычислить удельную тягу J ПВРДТ при Ver=500 м/сек на высо-
те 10 kjw; расход воздуха через двигатель 20 кГ/сек. GT=2 кГ/сек. Топливо —
магний.
При заданных Va и высоте полета 10 км Гв^355°/<. Теплоемкость продук-
тов сгорания можно принять равной Ср=0,3 ккал/кг град, Теплотворная спо-
собность магния 5880 ккал/кг.
GB
Комплекс ц-7.0 = -— = 20/2=10,
Gt
1де GB—расход воздуха.
Относительный подогрев
_ 5880
+(1 + 10)0,3-355 ~ ’
Удельная тяга
10-500 г-
Пример 2. Вычислить удельную тягу 1 при тех же условиях, что и в при-
мере 1.
Топливо — алюминий.
Теплотворная способность алюминия — 7350 ккал/кг.
7350 „
8 = 1 т------------=. 7 27
(10 + 1)0,3-355
Удельная тяга
10-500 .— кг-сек
/=-т-т-(1,1/?,27-1)=1000--------.
Для получения большого коэффициента тяги CR, который требует-
ся в случае полета со сверхзвуковой скоростью, необходимо топ-
ливо с высокой теплопроизводительностью:
Ни
1
270
Теплопронзводительностью называется количество тепла, приходя-
щееся на 1 кг продуктов сгорания при стехиометрическом составе
смеси топлива с воздухом. Поэтому твердые топлива для ПВРДТ
наряду с высокой теплотворной способностью должны иметь как
можно более низкое значение стехиометрической постоянной То.
В частности, жидкие углеводородные топлива, имеющие высокую
теплотворную способность 9000—10000 ккал!кг, не удовлетво-
ряют последнему требованию, так как имеют вместе с тем высокую
стехиометрическую постоянную 1.0=13-^15 [222]. Обычно твердые
Топлива для ПВРДТ состоят из металлического горючего, органи-
ческого горючего — связки и специальных добавок [258]. Некоторые
топлива для ПВРД содержат также окислитель, В качестве метал-
лического горючего используют легкие металлы — Mg, Al и их спла-
вы [258]; [268]. Эти металлы имеют относительно высокую тепло-
творную способность и теплопроизводительность. Наилучшие тео-
ретические характеристики обеспечивает Be, однако обычно указы-
вают на высокую стоимость и неполноту сгорания этого метал-
ла [268].
Использование металлов в топливах для ПВРДТ особенно не-
обходимо при высоких скоростях полета (когда в камере сгорания
развивается очень высокая температура), так как продукты сгора-
ния металлов обладают высокой термической стойкостью.
По литературным данным известно, что существует быстрогоря-
щее топливо для ПВРДТ, состоящее из сплава магния с алюми-
нием, небольшого количества связки и небольшого количества окис-
лителя [258]. Заряды из такого топлива готовят методом прессова-
ния при высоком удельном давлении.
Медленно горящие топлива для ПВРДТ наряду с металлом
и окислителем содержат до 50% эпоксидной смолы. Заряды из та-
кого топлива готовят методом литья в оболочку или камеру, где '
оно затвердевает. Типичными формами зарядов твердого топлива
для ПВРДТ являются заряды или торцового, или радиального го-
рения [253]; [265].
В некоторых случаях целесообразно применение ракетно-прямо-
точного двигателя. Этот двигатель представлен? собой органиче-
ское сочетание в единой конструкции ракетного (РДТТ) и прямо-
точного двигателя [258]. Твердые топлива для таких двигателей
наряду с высокой теплотворной способностью должны иметь также
достаточно высокую собственную удельную тягу. В состав твердо-
го топлива для РПДТ также желательно вводить легко воспламе-
няющиеся дисперсные частицы металла [230]. В то же время топ-
лива для РПДТ должны иметь высокую температуру сгорания
и давать при сгорании достаточное количество газообразных про-
дуктов реакции, Характеристики прямоточных двигателей сущест-
венно зависят от полноты сгорания топлива в двигателе [222]; [219];
ее характеризуют коэффициентом полноты сгорания tpCr- Коэффи-
циентам полноты сгорания называется отношение прироста тепло-
содержания продуктов сгорания к химической энергии вводимого
271
в камеру топлива. Получение высокой полноты сгорания требует |
решения таких важных вопросов, как смешение продуктов сгора- '
ния топлива и воздуха, дожигание в условиях камеры сгорания
газообразных и твердых частиц. При испытании топлив на основе
сплава алюминия с магнием и эпоксидной смолы в зависимости
от условий испытания была получена полнота сгорания от 0,4 до
0,8 [258].
2. Г и д р о р е акт н в и ы е двигатели (ГРД) используют
в качестве окислителя забортную морскую воду. Схема такого дви-
гателя дана на фиг. 20.2. Гндрореактивные двигатели применяют
в торпедах [256]; при движении торпеды морская вода поступает
Фиг, 20,2. Схема гидр оре акт и в но го двигателя па твердом топливе.
f—выгодное сопло, 2—коллектор и головкэ с форсунками для распыла воды, 3—заряд
твердого топлива, 4—капал длэ ввода воды. 5—(Корпус двигателя, 6’—эодозвборннк.
через специальные водозаборники в двигатель и используется и как
окислитель, и как рабочее тело. В камере сгорания тепловая энер-
гия топлива затрачивается на испарение воды. Смесь паров воды
и продуктов сгорания топлива при истечении из сопла обеспечи-
вает получение необходимой тяги. Для подводных двигателей
определяющей является удельная объемная тяга, т. е. тяга, разви-
ваемая двигателем при сгорании одного литра топлива в секунду.
Поэтому важнейшей характеристикой гидрореактивного топлива
является тепло, выделяющееся при сгорании одного литра топлива
при взаимодействии с водой, и количество воды Lq (в кг), необхо-
димое для сгорания 1 кг топлива.
Высокая удельная теплота реакции (в ккал/л) с водой является
одним из основных требований к гидрореагирующему топливу.
Кроме того, вещества, применяемые в качестве топлива, должны
энергично реагировать с водой [264].
Некоторые металлы, такие, как Al, Zr, Mg, а также 1Л н его
сплавы, обладают весьма высокими энергетическими характери-
стиками как при использовании забортной воды в качестве окис-
лителя, так и при использовании окислителя, входящего в состав
топлива ]256]; [261].
Необходимость обеспечения высокой полноты сгорания топлива
в двигателе требует особых путей решения проблемы. Одним
из способов изготовления заряда твердого гидрореагирующего
топлива является запрессовка смеси порошков металла и окисли-
272
теля [256]. Такое топливо должно иметь отрицательный кислород-
ный баланс; в качестве окислителей могут быть использованы
церхлораты. Иногда с целью повышения скорости горения топлива
в иих вводят добавки тонко измельченных порошков металлов:
кобальта, меди, феррованадия, свинца или олова. Для изготовления
зарядов тщательно перемешанную смесь компонентов топлива
прессуют при высоком удельном давлении [248]. Однако наиболь-
ности гидро реагирующих
топлив показаны на
фиг. 20. 3 [256].
3. Топлива для
комбинированных
двигателей — КРД
являются сравнительно
новым виДом твердых
топлив. КРД работают на
Фиг. 20.3. Зависимость удельного импуль-
са (/) ГРД от избытка воды в молях [я].
/—2А1+Л HiO, 2-Zr+n Н,О. Н,О.
7 объемный удельный импульс в кГ »сек/л,
----— 7 весовой удельный импульс в кГ * сек/кг.
Да яле ине в камере двигателя 23,2 кГ/ем*, давление
в а срезе сопла 1,14 кГ/с.н2,
твердом топливе и жидком окислителе
и принадлежат к числу ракетных двигателей.
При заданном давлении в камере ракетного двигателя удель-
ная тяга не зависит от условий полета и окружающей среды, а оп-
ределяется лишь свойствами применяемого твердого топлива
и жидкого окислителя. Ракетные двигатели на смешанном топливе
(твердо-жидком), т. е. КРД, имеют значительные преимущества
перед РДТТ, так как имеют более высокую удельную тягу, допус-
кают регулирование тяги двигателя и его многократный запуск
посредством изменения расхода и отсечкн жидкого компонента
[252]. Одна из возможных схем комбинированного двигателя пока-
зана на фиг. 20.4.
В качестве жидкого окислителя применяют азотную кислоту
HNOa, окислы азота (например, NaO4), фтористый перхлорил
FC1O4, перекись водорода Н2Оа или трехфтористый хлор CIF3.
С точки зрения эксплуатации двигателя наилучшие характери-
стики обеспечивают топлива, способные к самовоспламенению
18 А. А. Шидловскнй
273
при контакте с жидким окислителем. В настоящее время известны
многокомпонентные твердые топлива, обеспечивающие при нали-
чии жидкого окислителя достаточно высокое значение удельного
импульса {252]. Это топливо состоит из порошка металла, термо-
пластиков, гипергольного компонента и его пластификатора. Из ме-
таллов применяются Al, Be, Mg или Li, причем частицы металла
должны быть размером не более 10 мк.
В качестве термопластиков применяются полихлорвинил, пла-
стифицированный бутилфталатом, каучуком или полиуретаном
[252]. В качестве гипергольных компонентов применяют твердые
Фиг. 20.4. Схема комбинированного ракетного двигателя.
/—выходное сопло, 2—заряд твердого топлива, 5—канал, 4—отсечной клапан я го*
ловка с форсунками для распыла жидкого окислителя, 5—бак с жидким окислителем,
б—форсунка, 7—бак со сжатым газом,
амнны, например паратолуидин, парафенилендиамины, 1,5-диами-
нонафталин и др. [252].
Введение в твердую фазу до 20% перхлората аммония приво-
дит к снижению времени задержки воспламенения и образованию
более чистой свободной поверхности горения, что улучшает харак-
теристики горения [252].
4. Ракетные двигатели на твердом топливе —
РДТТ [244]; [251]; [266] получили за последнее время значительное
развитие благодаря разработке высокоэнергетических смесевых
топлив (composite propellants).
Типичная схема РДТТ показана на фиг. 20.5. Основными преи-
муществами РДТТ являются: сравнительная простота конструкции,
постоянная готовность к действию, удобство и относительная без-
опасность в эксплуатации и высокая степень надежности действия.
При сгорании топлива в РДТТ выделяется большое количество
газов, имеющих высокую температуру. При этом в камере сгора-
ния развивается давление порядка нескольких десятков атмосфер.
При истечении из сопла газообразные продукты реакции расти-
раются до внешнего давления. Процесс расширения сопровождает-
ся ускорением движения газа в сопле, т. е. происходит преобразова-
ние тепловой энергии в кинетическую энергию движения газов.
274
Тяга двигателя определяется из уравнения сохранения количества
движения
Я=~«с+(Л-А/)5с,
где /? — тяга двигателя в кг;
GT — расход топлива в кг!сек;
«с — скорость истечения газов на выходе из сопла см.] сек;
рс — давление на срезе сопла в кГ/см2;
рн~~ атмосферное давление в кГ/см\
So — площадь выходного сечеиия сопла в см2.
Фиг. 20.5. Схема ракетного двигателя на твердом топ-
ливе.
/—воспламенитель, 3—корпус двигателя, 5—заряд твердого топлива,
4—сопло, 5—графитовый вкладыш, 6—топливо, 7—бронировка, 8—за-
зор, 9—теплоизоляция и стенка корпуса-
Основной характеристикой топлива является удельная тяга,
т. е. тяга, развиваемая двигателем при расходе топлива 1 кг/сек-.
рЛ k
р / J
где А —показатель адиабаты газообразных продуктов сгорания;
Л1 —средний молекулярный вес газообразных продуктов сгора-
ния;
Л?газ— универсальная газовая постоянная в кг-м[град- моль;
Т и р—температура и давление в камере.
18*
275
Пример. Рассчитать удельную тягу смесевого топлива при р=40 кГ/си2; тем-
пература горения топлива Г=2790° К. Л4=25,5, k—1,22, /?гДц=848.
2-1,22
1,22—1
848
25,5-9,81
1,22 —
Т/гТ
= 227 сек.
Методы расчета и измерения удельной тяги изложены доста-
точно полно в работах [224]; [221]; [232]; [229]. Наибольшую величи-
ну удельной тяги будут иметь топлива, продукты сгорания которых
имеют наименьший молекулярный вес и высокую температуру сго-
рания. Из всех видов твердых топлив для ракетных двигателей
наиболее полно удовлетворяют этим требованиям смесевые ракет-
ные топлива. Эти топлива обычно состоят из тщательно перемешан-
ных органических горючих-связующих и твердых кристаллических
окислителей [230]. Для повышения удельного импульса таких
топлив в их состав обычно вводят 10—20% легких металлов или
их сплавов —Al, Mg, Li, Be [221]; [247]; [265]. Обладая высокой
теплотой реакции и образуя при сгорании термически стабильные
продукты, эти металлы позволяют повысить температуру продуктов
сгорания топлива, а следовательно, и удельную тягу топлива.
Однако продукты реакции этих металлов с кислородом и хлором,
являясь высокоплавящимися и высококипящнми веществами
(см. гл. 111), даже при температуре сгорания в значительной сте-
пени находятся в конденсированном виде. Поэтому введение в со-
став ракетных топлив значительного количества металла нецеле-
сообразно.
Наибольшее повышение удельной тяги получается при введе-
нии в ракетное топливо двойных сплавов или смесей легких метал-
лов, При этом количество металла (например, А1), соединяющегося
с кислородом, и количество металла (например, Li), соединяю-
щегося с галогеном, должны соответствовать содержанию кисло-
рода и галогена в используемом окислителе [241]. Оптимальная
величина удельной тяги получается у топлив, имеющих отрица-
тельный кислородный баланс вследствие пониженного значения
среднего молекулярного веса продуктов сгорания и меньших
потерь энергии на диссоциацию, чем у стехиометрических
топлив.
Используемые на практике топлива содержат обычно 80—85%
окислителя, при этом могут быть обеспечены удовлетворительные
технологические свойства топлива и в некоторых случаях устранена
склонность перхлоратного топлива к детонации [221]. Смесевые
топлива могут иметь самый различный состав и обладать различ-
ными механическими свойствами. Краткие сведения о составе
и свойствах смесевых топлив даны в книге Курова и Должанского
[226]. Более подробный разбор их с указанием как смесей, так
и свойств отдельных компонентов дан в книге Паушкина [228],
справочнике Цериигера [262], книгах [220]; [225], статьях Максвелла
276
и Юнга [227], Тавернье [259], ряде других статей, опубликованных
в иностранной печати [236]; [245]; [241]; [243]; [247]; [254], а также
в рефератах [239].
В табл. 20. 1 приведены некоторые типичные смесевые топлива
для РДТТ.
Таблица 20.1
Компоненты топлива Удельная тяга сек Фнзико-ме- хаиические свойства Где предпола- гается применить Литера- турный источник
NH4C1O4 Сополимер бута- диена и акриловой кислоты AI 230—250 (/>=70 кГ/слА) Хорошие Минитмэн, I ступ. Скаут, II ступ. Ника — Зевс Сей- ба р [266] [265]
NH4CtO4 ] 80% Al до 20% / Сополимер бута- диена и акриловой кислоты Пластификатор, отвердитель -245 Хорошие Проект „РоКит- дайн" [267]
NH4CIO4 Поливинилхлорид Пластификаторное масло А1 до 20% 250 кГ^см?) Хорошие t сохраняют- ся при низ- ких темпе- ратурах Сержант Лакросс Метеор Бомарк Фалкор [265] [263]
Характеристики смесевых топлив для РДТТ, не содержащих до-
бавок металлических горючих, приведены в табл. 20. 2, заимство-
ванной из [221].
Таким образом, рассмотренные четыре типа твердых топлив
для различных реактивных двигателей принципиально представ-
ляют собой гетерогенные системы, являющиеся смесями неор-
ганического окислителя, органического горючего
и металлического горючего. Неорганический окислитель
и металлическое горючее вводятся в состав топлива в виде тонко-
измельченных порошков. Состав топлива, технология изготовления
и характеристики определяются главным образом типом реактив-
ных двигателей. В табл. 20.3 приведены составы различных
типов твердых пиротехнических топлив и даны их характери-
стики.
277
Температурный коэффици- ент 278 Плотность в Г!см~ Скорость горения в см/сек при />=70 tcrjcM^ Показатель степени ч при />=70 кГ!см* Удельная тяга / сек при />=70 кГ[см- Температура изобаричес- кого горения в °К Показатель адиабаты Молекулярный вес продук- тов сгорания Состав топлива
s-Ol'lVs'l 1,56 5’1— 9'0 О ~ГЙ. 224 2420 1 1 1 1-^ ю 5^ 24 75% NH4C1O44- -j-25% горюче- го и добавок
Е-01 ->*2-5-5* I * to 0,8-2,0 236 2790 55’1 S*S5 80% NH4C1O4+ -j-20% горюче- го и добавок
to oi о 1 w 1,55 0,2—0,3 195 1755 1,26 22 80% ЫН^ОзН- -|-20% горюче- го и добавок Габлаца 20.2
- mii.wwhwwwihb
Таблица 20.3
Назначение топлива Специальные требования Состав топлива Технология изготовле- ния заря- дов Удельная тяга Примечания
органическое горючее окислитель металлическое горючее
Для ПВРДТ Высокая теп- лотворная спо- собность. вы- сокая полнота сгорания с воз* духом Типа эпок- сидной смолы до 50% Кристалличе- ский, содержа- ние в топливе невелико Mg. Al. Li и их сплавы» Со- держание в топливе раз- лично Литье или прессова- ние 500—800 сек I дана для диапазона и-£0=8,5 и чи- сел М=1,5=3,2 [258]
Для РПДТ То же, зна- чительный соб- ственный им- пульс То же То же, со- держание в топливе повы- шенное То же Нет све- дений Нет све- дений
Для прямо- точных ГРД Высокая удельная теп- лота реакции с водой, значи- тельная ско- рость реакции с водой —“ Неорганиче- ские соли(пер- хлораты) Mg, Al или их сплавы >30% Прессова- ние при вы- соком удельном давлении 1200—1600 2* сек еж3 I дана для коэффициента избытка воды at—1,33-5-5,7 [256]
Для КРД Высокая удельная тяга с жидким окис- лителем, само- воспламенение при контакте с жидким окис- лителем Полихлорви- нил, каучуки, полиуретаны, амины ИН4С1О4 до 20% Al, Mg, Li или их сплавы до 20% Литье 250-290 сек при р-70 кГ1сл& % металла указан по от- ношению к ве- су твердого топлива и жид- кого окислите- ля
Смссеьые твер- дые топлива для у РДТТ «о Высокая удельная тяга, нпакнЯ моле- кулярный вес про- дуктов сгорания Каучуки, смолы, виниловые полиме- ры. полиуретаны и др» 15—25% Нитраты, перхло- раты до 80% A!. Mg. L1 или их сплавы 10—20% Свободное литье, иод дав» лопнем или под вакуумом 230—250 сек при р-70 я
§ 2. ЭКСПЛУАТАЦИОННЫЕ ТРЕБОВАНИЯ
Кроме рассмотренных ранее специальных требований, все виды
ракетных топлив должны удовлетворять целому ряду других общих
требований.
1. Высокая плотность твердого топлива. Увеличение плотности
топлива во всех случаях приводит к уменьшению объема камеры
сгорания и уменьшению веса конструкции двигателя. Плотность
современных топлив не превышает 1,8 г/ся3.
2. Достаточная механическая прочность и высокий модуль
упругости сформованного заряда. Разрушение заряда твердого
ракетного топлива при хранении или в процессе горения недопу-
стимо, так как ведет к увеличению поверхности горения, повыше-
нию давления в камере и разрыву камеры.
3. Однородность по составу всех частей заряда. В противном
случае ие может быть обеспечено равномерное горение заряда,
а следовательно, и баллистические качества ракеты.
4. Стабильность характеристик топлива при его хранении
и изменениях температуры окружающей среды.
5. Устойчивое горение в камере двигателя при пониженных
давлениях порядка 15—35 ат [236]; [226]. Высокое давление в каме-
ре требует увеличения толщины стенок камеры, что приводит
к увеличению веса конструкции.
6. Минимальная зависимость скорости горения от начальной
температуры заряда. Эта зависимость характеризуется темпера-
турным коэффициентом скорости горения. Твердые пиротехниче-
ские топлива имеют наиболее низкий температурный коэффициент
(реальные значения температурного коэффициента пиротехниче-
ских составов см. в гл. X).
7. Возможно меньшая зависимость скорости горения топлива
от давления. Топлива, имеющие слабую зависимость скорости го-
рения от давления, имеют более низкое значение показателя сте-
пени v. Такие топлива обеспечивают наиболее стабильные внутри-
баллистические характеристики, так как случайные колебания
давления не вызывают в этом случае заметного изменения скоро'
сти горения топлива.
8. Возможность изготовления из твердого пиротехнического
топлива крупногабаритных зарядов, обладающих необходи-
мыми физическими свойствами (см. п. 2). Технологический
процесс изготовления заряда должен быть предельно про-
стым.
В большинстве случаев при горении зарядов твердого топлива
в двигателе вдоль горящей поверхности существует поток продук-
тов сгорания. Если скорость этого потока выше некоторого порого-
вого значения, то наблюдается так называемое эрозионное горение,
сопровождающееся увеличением линейной скорости горения
топлива. Приближенно закономерность увеличения скорости
280
горения топлива и при эрозионном горении определяют выра-
жением
“эр . .
—- = 1+К»р(щ—опвр
“О
где ио — нормальная скорость горения топлива;
Кэр — постоянная величина для данного топлива;
у— скорость патока продуктов сгорания вдоль горящей по-
верхности;
Упор — пороговое значение скорости потока газов.
Например, если оПор=200 м!сек, /<эр=0,002 сек!м, а о = 450 м/сек,
то увеличение скорости горения топлива при эрозионном горении
составит
= 1 + 0,002 (450 - 200) = 1,50.
“о
Эрозионный эффект обычно проявляется при высокой плотности за-
ряжания и должен учитываться прн разработке натурных зарядов
из твердого топлива.
§ 3. ОКИСЛИТЕЛИ
Выбор окислителя в большой степени определяет свойства топ-
лив. В качестве окислителей для твердых пиротехнических топлив
находят практическое применение нитраты и перхлораты калия,
натрия, лития и аммония. Некоторые свойства этих окислителей
приведены в табл. 20.4.
Таблица 20.4
Физико-химические свойства окислителей для твердых пиротехнических
топлив
Формула Молекулярный вес Плотность г/смЯ Темпе- ратура плавле- ния °C Теплота образо- вания ккал МОЛЬ Процентное содержание кислорода Гигро- скопиче- ская точка при 20° С Раство- римость в 100 г Н,0 при 25° С
обще- го ак- тив- ного
NH4CIO4 117 1,95 — 69 55 27 96 24,9
LiClO4 106 2,4 247 92 61 61 — 59,7
ксю4 139 2,5 -610 103,6 46 46 99 2,5
kno3 101 2,1 336 119 48 40 92,5 38,1
NaNO3 85 2,2 308 111 56 47 77 91
ЫЩМОз 80 1,7 169 88 60 20 67 180
281
Высокое содержание свободного кислорода и высокая плотность
окислителя особенно важны для литьевых топлив, так как позволя-
ют ввести в топливо большое количество органического связующе-
го и обеспечить хорошие технологические свойства топлива. Наи-
более дешевым и производимым в массовых масштабах является
нитрат аммония. При разложении нитрата аммония в зависимости
от условий, в которых протекает этот процесс, могут получаться
различные продукты реакции.
Ниже приводятся только два из многих возможных уравнений
разложения нитрата аммония:
0,5 NQj 4-2^0^4-0,75^23 ккал
nh4no4
Nj -J- 2 HjOnap -J- 0,5 О2 4~ 27 ккал
Теплота реакции соответствует выделению 0,29—В,34 ккал]г.
Экспериментально установлена способность к горению NH4NO3 при
повышенном давлении [246]; [237], а при наличии катализатора —
и при атмосферном давлении ]237].
Термическое разложение нитрата аммония с различными ката-
литическими добавками изучалось за последние годы Хайнером,
Гуиошон и Жак, Розианом; [166], а также автором книги [237];
[119, стр, 401].
Установлено, что на термическое разложение нитрата аммония
сильное каталитическое воздействие оказывают соединения хрома
(VI): хромат калия или бихромат аммония [223, стр. 344], а также
трехокись хрома; в меньшей степени влияет хлорид меди (II).
Горение нитрата аммония с каталитическими добавками изучалось
Тэйлором [260], а также автором книги [237]. Соединения хрома,
сильно увеличивающие при 20010 С скорость термического разло-
жения NH^NOs, при добавке их в количестве 5—10% в нитрат аммо-
ния делают его способным к горению при обычных условиях темпе-
ратуры и давления.
Нитрат аммония при комнатной температуре не чувствителен
к трению в фарфоровой ступке и мало чувствителен к удару.
Взрыв в нем возбуждается трудно, температура взрыва около
1000*° С; скорость детонации от 1000 до 1500 м[сек.
Все проверенные твердые топлива с нитратом аммония не дают
достаточно высокого значения удельной тяги. Поэтому ему обычно
предпочитают более дорогой н более опасный в обращении пер-
хлорат аммония. Свойства перхлората аммония описаны в книгах
Каста, Эскалеса, а также в монографии Блинова [19].
Как индивидуальное вещество перхлорат аммония обладает
взрывчатыми свойствами: температура взрыва около 120CF С, ско-
рость детонации колеблется в пределах 2500—3500 м!сек. Получе-
ние перхлоратов, их свойства и применение описаны в монографии
Шумахера [49].
282
Термическое разложение NH4CIO4 с различными каталитиче-
скими добавками за последние годы изучалось Джекобсом [249];
Арденом, Полингом и Смитом [240], Шольмоши и Ревесом [238],
а также автором книги совместно с Шмагиным [237].
Приближенно термическое разложение перхлората аммония
можно выразить уравнением [223]:
10NH4C]O4=6O2+4N2O+2NOC]+2Cl2+HClO4+3HC! + 18H2OIiap,
причем тепла выделяется 256 ккал/кг. Сильно ускоряют термиче-
ское разложение NH4CIO4 соединения меди (окислы и хлориды)
и по работам Биркумшоу [235, стр. 329] двуокись марганца.
Скорость горения NH4CIO4 с каталитическими добавками ис-
следовалась Фридманом, Нугентом и др. [246],
Скорость горения топлив на основе перхлората аммония состав-
ляет 0,4—2 см/сек (при р=70 кГ/см2). Эти топлива имеют невысо-
кий показатель степени v в уравнении u=A + Bpv и отличаются
низким температурным коэффициентом скорости горения.
Разложение таких окислителей как перхлораты лития и калия
является весьма слабо экзотермичным процессом. Суммарные
реакции их разложения могут быть выражены уравнениями
LiC104=LiCI + 202+5,9 ккал,
КСЮ4=КС1:+202-|-0,6 ккал.
Скорость последней реакции возрастает в присутствии галогенидов
калия в порядке KCl<KBr<KJ [223]. При разложении окислителей
LiC104 и KCIO4 образуются хлориды, представляющие собой
сравнительно высококипящие соединения.
Топлива на основе КСЮ4 имеют довольно низкий удельный
импульс (180—220 сек). Хотя эти топлива имеют высокую
плотность (1,7—2 г/см3) и высокую скорость горения от 3 до
6 мм/сек (при р=70 кГ/сж2), горение их при давлениях ниже
70 кГ/см2 является неустойчивым,
В качестве окислителей для ТРТ предлагались также перхлорат
нитрония NO2CIO4 и нитрозил перхлорат NOCIO4, но эти соедине-
ния слишком гигроскопичны и при наличии влаги в воздухе гидро-
лизуются с образованием свободных кислот [228].
§ 4. ОРГАНИЧЕСКИЕ И МЕТАЛЛИЧЕСКИЕ ГОРЮЧИЕ
С точки зрения энергетики топлива горючие-связующие долж-
ны содержать максимальное количество водорода, иметь неболь-
шую теплоту образования и высокую плотность. Для смесевых
топлив к РДТТ представляют определенный интерес горючие, со-
держащие кислород (например, в группах С — О — NO2), так как
они позволяют вводить в состав топлива близкое к оптимальному
количество окислителя.
283
Выбор горючего-связующего чаще всего определяется техноло-
гическими соображениями и требованиями к физико-химическим
характеристикам топлива.
Для больших двигателей наиболее приемлем способ изготов-
ления зарядов заливкой топлива непосредственно в корпус двига-
теля. Исходя из этого связующее до снаряжения должно пред-
ставлять собой жидкость. Жидкость эта должна быть достаточно
вязкой, чтобы добавляемый к ней порошок окислителя не оседал
на дио смесителя. Вместе с тем образующаяся масса должна со-
хранить текучесть прн наличии в ней 75—85% твердого компо-
нента.
Для обеспечения необходимых свойств топлива температура за-
мерзания связующего должна быть низкой. Высокий модуль упру-
гости заряда достигается в том случае, если связующее является
высокомолекулярным соединением (полимером).
Полимеризация связующего (с добавкой катализатора) осуще-
ствляется уже после изготовления топлива (смешения связующего
с окислителем) и заливки топлива в корпус двигателя; процесс
полимеризации может проводиться как при комнатной температу-
ре, так и при подогреве.
В качестве связующих применяют синтетические каучуки, раз-
личные смолы (фенольные, полиэфирные, эпоксидные) и различные
полимеры: полисульфиды, полиуретаны, полиакрилат, полиамиды,
полиэтилен, полибутадиен, полиизобутилен и др. [221].
Полисульфидный каучук получается прн реакции поликонден-
сации дигалондалкилов с полисульфидами щелочных металлов,
например, дихлорэтана с тетр а сульфидом натрия:
S S
х Na2S4+x С2Н4С12— [ - СН2 - СН2 - S—S - L+ 2х NaCL
Полнсульфидные каучуки («тиоколы»), полученные с использова-
нием дихлорэтилового эфира, имеют эмпирическую формулу
C4H8OS4 и теплотворную способность 5600 ккал[кг.
Исходными продуктами для приготовления полиуретанов яв-
ляются диизоцнанат (например, гексаметилендиизоцианат
О — N=C—(СНг) 6—C=N = 0) и двухатомные спирты (например,
бутандиол Н—О—(СНа)4—О—Н). Реакция полимеризации между
этими соединениями начинается при комнатной и заканчивается
прн повышенной температуре (до 2WC). Молекулярный вес по-
лучаемого материала увеличивается с повышением температуры
и достигает 10 000—15 000. Упругие свойства полиуретанов сохра-
няются прн низких температурах.
Полиуретаны содержат радикалы—(СНг)п —и группы >NH
и О = С<.
284
По Церингеру [262] структура полимерной цепи полиуретанов
может быть выражена как
О О
11 П
[- R-NH-C- О-R'-O- C-NH-]X.
Принимая условно состав радикалов /? и /?' как (СНг)б и (СНгЬ,
получаем эмпирическую формулу для полиуретана C12H22O4N2. Теп-
лотворная способность полиуретанов равна 7250 ккал]к.г.
Введение в состав ракетных топлив до 20% металлического го-
рючего в виде порошков легких металлов или их сплавов повышает
удельную тягу твердого ракетного топлива. В таких топливах как
топлива ПВРДТ или ГРД металлическое горючее является основ-
ным компонентом. Во всех случаях применения таких топлив осо-
бенно серьезной является проблема полноты сгорания металличе-
ского горючего. Успехи в этой области непосредственно связаны
с результатами исследования механизма горения твердых пиротех-
нических топлив. Вопросы горения топлив и металлов достаточно
полно освещены в работах [223]; [225]; [221]; [229]; [134]. Основные
закономерности горения топлив весьма близки к закономерностям
горения различных пиротехнических составов.
Глава XXI
ВОСПЛАМЕНИТЕЛЬНЫЕ СОСТАВЫ.
ПРОЧИЕ ВИДЫ ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
§ 1. ВОСПЛАМЕНИТЕЛЬНЫЕ СОСТАВЫ И ПРЕДЪЯВЛЯЕМЫЕ
К НИМ ТРЕБОВАНИЯ
Воспламенительные составы предназначаются для зажжения
основных пиротехнических составов (осветительных, дымовых, твер-
дого ракетного топлива и Др.) ’. Действие воспламенительного со-
става заключается в прогревании некоторого участка поджигаемого
основного состава до температуры воспламенения.
Отсюда следует, что чем выше температура самовоспламенения
(вспышки) основного состава, тем более «сильный» воспламени-
тельный состав требуется для возбуждения в нем реакции горения.
Воспламенение составов, температура вспышки которых не
рыше 500—600° С, не представляет особых затруднений.
Составы, температура вспышки которых превышает ЮООР С, вос-
пламеняются с большим трудом. Для воспламенения таких соста-
вов (например, термитов), особенно если они находятся в запрес-
сованном состоянии, приходится подбирать специальные воспламе-
нительные и переходные составы.
1 Воспламенительные составы, содержащие инициирующие ВВ и предназна-
чающиеся для снаряжения капе юл ей .вое пламени гелей, здесь ие рассматриваются.
По данному вопросу см. [270],
286
к воспламенительным составам предъявляются следующие спе-
циальные требования:
1) они должны легко воспламеняться от сравнительно неболь-
шого теплового импульса; температура вспышки любого воспла-
менительного состава должна быть не выше 500° С;
2) температура горения воспламенительных составов должна
быть на несколько сот градусов выше, чем температура вспышки
поджигаемых ими основных составов.
Кроме того, в некоторых случаях требуется, чтобы воспламени-
тельный состав выделял при горении мало света, чтобы избежать
демаскировки бойцов.
Иногда к воспламенительным составам предъявляется также
требование выделять при горении минимальное количество газов;
такие воспламенительные составы не вполне точно называются
«безгазовыми» воспламенительными составами.
Зажигательное действие воспламенительных составов обуслов-
ливается главным образом тем количеством тепла, которое пере-
дается основному составу от образующихся при горении шлаков.
Таким образом, зажигательное действие воспламенительного соста-
ва будет тем сильнее, чем выше температура его горения и чем
большее количество шлака останется после его сгорания на поверх-
ности поджигаемого основного состава.
У жидких шлаков поверхность соприкосновения с поджигаемым
составом будет больше, чем при образовании неплавящихся твер-
дых шлаков, а следовательно, больше будет и количество тепла,
передаваемое ими основному составу в единицу времени.
Опытом установлено, что наилучшее зажигательное действие
оказывают медленно горящие воспламенительные составы, обеспе-
чивающие достаточное время для передачи тепла зажигаемому
основному составу. Поэтому в пиротехнических средствах воспла-
менительные составы применяются почти всегда в спрессованном
виде.
При составлении воспламенительных составов должны быть ис-
пользованы окислители, легко и по возможности при сравнительно
невысокой температуре отдающие свой кислород, и легко окисляю-
щиеся горючие.
Окислителей, легко отдающих свой кислород — много. К числу
их относятся перманганаты, хлораты, нитраты щелочных металлов
и др. Но исходя из требования невысокой чувствительности состава
к механическим воздействиям значительно чаще других в качестве
окислителя в воспламенительных составах используют нитрат
калия.
В качестве легко окисляемых горючих часто применяют дре-
весный уголь, идитол, затем антимоний и др.
Для легко воспламеняющихся основных составов (хлоратных
составов сигнальных дымов или хлоратных составов сигнальных
огней) вполне возможно применение воспламенительных составов,
близких по своим рецептам к дымным порохам.
236
Например, можно привести рецепт:
Нитрат калия............................. 75%
Древесный уголь.......................... 15%
Идитол................................... 10%
Для усиления зажигательного действия воспламенительных со-
ставов в них вводят в качестве дополнительного горючего магние-
вый порошок, оставляющий после сгорания твердый шлак окиси
магния.
И. В. Быстров [2] указывает, что для воспламенения многих
осветительных составов можно применять состав:
Нитрат калия............................ 75%
Магний.................................. 15%
Идитол.................................. 10%
Для воспламенения составов, содержащих в качестве основного
горючего алюминий и имеющих высокую, температуру вспышки,
следует употреблять воспламенительные составы, содержащие
не менее 15—20% магниевого порошка.
При изготовлении воспламенительных составов к трассирующим
изделиям в качестве окислителя чаще других используют перекись
бария ВаОа.
Перекись бария отдает свой кислород при более высокой тем-
пературе, чем нитрат калия, но процесс ее распада требует затра-
ты очень небольшого количества тепла:
ВаОг— ВаО+0,50г—17 ккал.
При распаде ВаОа вес твердого остатка составляет 91% от веса
окислителя.
В качестве примеров воспламенительных составов для трассе-
ров можно привести следующие рецепты:
I
Перекись бария............ 80%
Магний.................... 18И
Цементатор ............... 244
11
Нитрат бария............... 48%
Перекись бария............. 30%
Магний .................... 13%
Идитол...................... 9%
Многочисленные воспламенительные составы для трассеров,
применявшиеся во время второй мировой войны, содержали, кроме
перекиси бария, магния и цементаторов, следующие вещества;
нитрат бария, свинцовый сурик, пикрат стронция, тетранитрокар-
базол, силицид кальция, оксалат натрия, графит, стеараты каль-
ция, цинка и др.
Сильным воспламенительным действием обладают составы тер-
митного типа:
I II
Окись железа....... 69%
Магний................... 31%
Двуокись кремния ......... 55%
Магний.................... 45%
287
Однако воспламенение этих составов (особенно состава II)
осуществляется не легко, так как они имеют высокую температуру
воспламенения.
Легко воспламеняются н обладают хорошим воспламенитель-
ным действием составы, содержащие порошок циркония. Примера-
ми таких составов, используемых для воспламенения трассы, мо-
гут служить [12]:
I. Черный порох 75%, KNO3 12%, Zr 13%.
2. KNO3 48%, Zr 52%.
Воспламенительные составы для трассы не должны содержать
большого количества легкоплавких веществ; иначе в момент про-
хождения снаряда по каналу ствола при горении будет происхо-
дить выдавливание жидкости из горящего слоя.
В том случае, когда даже усиленными воспламенительными со-
ставами не удается зажечь основной пиротехнический состав, при-
меняют так называемые переходные или промежуточные составы.
Переходные составы получают, смешивая в известных пропор-
циях воспламенительный и основной составы. Один из случаев при-
менения переходного состава был уже разобран на примере вос-
пламенения спрессованного железо-алюминиевого термита (см.
фиг. 17.1).
Для зажжения некоторых особо трудно воспламеняющихся
основных составов приходится иногда применять одновременно не-
сколько переходных составов, из которых переходный состав, не-
посредственно соприкасающийся с основным составом, содержит
наименьшее количество воспламенительного состава.
Особым видом воспламенительных составов являются терочные
составы, воспламенение которых осуществляется трением о них
каким-либо предметом («теркой»), на который также нанесен спе-
циальный пиротехнический состав.
Рецепты терочных составов близки к рецептам составов, упо-
требляющихся в спичечном производстве, например, один из те-
рочных составов содержит 60% хлората калия; 30% антимония
и 10% смолы.
Терку для данного случая покрывают фосфорной массой, со-
стоящей из 56% красного фосфора, 24% стеклянного порошка,
20% идитола.
Терочные составы очень чувствительны к трению и весьма
опасны в обращении.
§ 2. ВОСПЛАМЕНИТЕЛЬНЫЕ СОСТАВЫ ДЛЯ РАКЕТНЫХ
ДВИГАТЕЛЕЙ
Известно, что надежность работы ракетного двигателя в зна-
чительной степени зависит от наличия эффективной системы вос-
пламенения. Существовавшие раньше воспламенители на основе
черного пороха не удовлетворяли требованиям, предъявляемым
к воспламенению смесевого твердого топлива и баллиститных по-
рохов. В связи с этим американские фирмы разработали ряд кон-
288
струкций пиротехнических воспламенителей, которые в настоящее
время используются для РДТТ и ЖРД-
Пиротехническая система воспламенения наиболее распростра-
нена и применяется в ракетных двигателях самых различных ти-
пов, в частности, в двигателях ракет Титан, Полярис, Минитмэн
[266]. Такая система надежна и безопасна, обеспечивает быстрый
запуск двигателя на большой высоте, для включения системы тре-
буется источник энергии малой мощности.
Образующийся в результате работы пиротехнического воспла-
менителя факел пламени имеет высокую температуру и достаточно
большие размеры (большую площадь воспламенения).
В литературе описано большое количество конструкций пиро-
технических воспламенителей: роликовые, корзиночные, «ракета
в ракете» и др. [274].
На первой стадии отработки в пиротехнических воспламените-
лях были использованы двойные смеси, например, смесь алюми-
ниевого порошка с КСЮ4 [266]. Эта смесь, известная как смесь
«А]с]о», является высококалорийной (см. гл. VI), интенсивно горит,
температура ее воспламенения около 360° С.
Позднее в смесь Aldo стали вводить этилцеллюлозную связку.
Для воспламенения смесевых топлив с высоким содержанием
NH4CIO4 применяется пиротехническая смесь:
KCIO4 —26—50%, Ba(NO3)2—15—17%, сплав Zr/Ni (50/50) —
32—54%, этилцеллюлоза — 3% [273].
Находят применение и воспламенительные составы, содержащие
бор, например: KNOa— 71%, В (аморфный)—24%, каучук — 5%.
Отработка пиротехнических воспламенителей связана с необхо-
димостью проведения многочисленных испытаний по определению
их рабочих характеристик при различных условиях.
Отправными моментами при разработке пиротехнических вос-
пламенителей являются [266]:
1) заданный габарит;
2) способ крепления в ракетном двигателе;
3) минимально необходимая температура факела пламени;
4) характеристика продуктов сгорания (максимально допусти-
мое количество конденсированных окислов, степень дисперсности
твердых частиц и др.);
5) условия работы (вибрация, перегрузки, давление окружаю-
щей среды, максимальная и минимальная рабочие температуры
и др-).
§ 3. ПРОЧИЕ ВИДЫ ПИРОТЕХНИЧЕСКИХ СОСТАВОВ:
БЕЗГАЗОВЫЕ, ИМИТАЦИОННЫЕ, СВИСТЯЩИЕ
Кроме рассмотренных выше видов пиротехнических составов,
существуют еще пиротехнические составы, использующиеся для
различных специальных целей. Иногда они по своим рецептам до-
вольно близки к зажигательным, осветительным нли к другим уже
описанным составам; в других же случаях специальное их назна-
19
А, А, ШвдлояскиЯ
289
челне определяет й необходимость создания нового своеобразного
рецепта.
Чаще других для специальных целей применяются следующие
виды составов;
]. «Безгаэовые» или малогазовые составы, находящие себе
применение в дистанционных трубках и взрывателях, в электроза-
палах замедленного действия и в некоторых специальных нагрева-
тельных изделиях.
2. Имитационные и свистящие составы, назначение которых
понятно из самого названия.
Кроме того, существуют специальные рецепты пиротехнических
составов, используемых при изготовлении фейерверков и при кино-
съемках [284].
Фейерверочные пиротехнические составы не рассматриваются
в данной книге; описание их изготовления и свойств дается в спе-
циальной литературе [6]; [15].
«Безгаэовые» и малогазовые составы. Отличитель-
ное свойство, присущее большинству составов этого типа, — малая
зависимость скорости горения от внешнего давления [ИЗ]. Это их
свойство является весьма ценным в том случае, когда эти составы
используются в дистанционных трубках и взрывателях.
В этом последнем случае также должен быть невелик и темпе-
ратурный коэффициент (см. гл. X, § 2) скорости горения; этому
требованию, однако, удовлетворяют далеко не все «безгазовые»
составы.
Кроме того, составы для дистанционных трубок должны удо-
влетворять всем требованиям, предъявляемым к обычным трубоч-
ным порохам; особо следует выделить легкую воспламеняемость
составов и безотказность воспламенения с их помощью следующего
звена огневой цепи (например, капсюля-воспламенителя).
Термин «безгаэовые» составы ставится нами в кавычки по той
причине, что в самый момент реакции, протекающей при высокой
температуре, эти составы образуют некоторое количество газооб-
разных продуктов, при охлаждении превращающихся в твердые
вещества. Но количество газообразных продуктов так невелико,
что их можно назвать малогазовыми составами уже без кавычек.
В качестве окислителей в малогазовых составах используют
чаще всего соединения свинца, хрома и марганца, например РЬзО4,
PbO, PbCrO4, BaCrOj, КгСггО?, КМпО<, а также ВаО2, дающие при
распаде металлический свинец (температура кипения 1744° С)
и труднолетучие окиси: Сг20з, ВаО, МпО и др.
В качестве горючих в малогазовых составах используют Zr, Sb,
St. Мп, FeSi и др.
В патентной литературе указано много рецептов малогазовых
составов. В качестве примера приводятся шесть рецептов (номера
патентов см. [7, стр. 260]).
]. СпО — 60%, Zr —40%.
2. Pb3O^ —35^-80%, Zr — 65-?20%.
290
3. PbCrOi — 40%, Pbo—44%, FeSi2—16%. ’
4. Pbgth — 764-84%, Si—18-?22%, нитроцеллюлоза — 3-4-5%'.
5. PbCrO4— 63%, Pb3O< — 25%, Si—12%, нитроцеллюлоза —
0,3% (сверх 100%).
6. Pb3O4 — 70%, Si —30%.
Для изготовления замедлителей к электрозапалам замедлен-
ного действия, по литературным данным [260], находит себе приме-
нение безгаэовый состав, содержащий 56% КМпО^ и 44% Sb, реак-
ция горения которого может быть выражена уравнением
3KMn0< + 3Sb = K3Sb04-|-3MnO4-Sb205-l-269 ккал.
Для такой же цели может быть использован и состав, содер-
жащий 5% хлората калия, 47% селена и 48% металлического вис-
мута (амер, патент 2.607.672, 1952 г.).
«Безгазовые» составы находят себе применение и для подогрева
пищи (консервов, супа и пр.) в фронтовых условиях. Для этой
цели во время второй мировой войны англичане использовали со-
став; магнитная окись железа 81% и силицид кальция 19%, про-
цесс горения которого может быть выражен уравнением;
5Fe3O4-l-4CaSi2 = 4CaSiO3-f-4SiO2-|-15Fe.
В заключение следует отметить, что многие «безгаэовые» или
малогазовые составы по своим свойствам близки к термитам или
к термитно-зажигательным составам, но отличаются от них боль-
шей легкостью воспламенения, а в некоторых случаях — и большей
скоростью горения.
Имитационные составы предназначаются для снаряже-
ния ими различных учебных пиротехнических изделий, при дейст-
вии которых должен создаваться внешний эффект, близкий к эф-
фекту настоящих боевых изделий. Имитационные изделия не обла-
дают поражающим действием: это достигается изготовлением
их оболочки из картона, пластмассы или других подобных мате-
риалов.
Назначение некоторых имитационных изделий — имитация эф-
фекта, получающегося при разрыве фугасных снарядов, винтовоч-
ных гранат и т. л. Такие имитационные изделия должны создавать
при своем действии сильный звук, напоминающий звук разрыва
фугасного снаряда или другого объекта; кроме того, желательно,
чтобы действие имитационных изделий сопровождалось образова-
нием некоторого количества дыма, сходного по цвету с дымом, об-
разующимся при взрыве ВВ.
Для получения сильного звукового эффекта имитационные из-
делия снаряжают зерненым порохов или смесью перхлората калия
с алюминиевой пудрой. В частности, для этой цели может быть
использован состав из 70% перхлората калия и 30% алюминия,
близкий по своим свойствам к составам фотосмесей. Такой состав,
взятый в порошкообразном состоянии, при воздействии на него
19*
291
обычным тепловым импульсом сгорает почти мгновенно с сильным
звуковым эффектом и световой вспышкой, выделяя при этом неко-
торое количество белого дыма.
Имитационные составы, выделяющие при своем сгорании серый
или черный дым, должны содержать известное количество богатых
углеродом органических соединений (нафталина, антрацена и т. п.).
Существуют также имитационные изделия, выделяющие при
своем действии цветной дым; такие изделия применяются во время
маневров для условного обозначения места попадания химических
или зажигательных снарядов или бомб, взрыва минных полей
и т. п. Для снаряжения этих изделий употребляют обычные соста-
вы цветных дымов, для замедления горения которых иногда добав-
ляют в состав некоторое количество древесных опилок.
Свистящие пиротехнические составы. Звуковой
эффект, похожий на свист, можно получить при сжигании состава,
содержащего 75 % хлората калия и 25 % галловой кислоты
С6Н2(ОН)3СООН. Звуковой эффект объясняется большой ско-
ростью горения состава.
Бехер [8] указывает, что свист при горении дают смеси хло-
ратов (К или Ва) с фенольными производными и что, кроме галло-
вой кислоты, для этих же целей возможно использование резор-
цина, флороглюцина, а также пикриновой кислоты.
Однако смеси, содержащие пикриновую кислоту, и, в особенно-
сти пикрат калия (например, смесь из 60% пикрата калия
CsHaNsOzK и 40% KNO3), слишком опасны в обращении и теперь
не используются.
Опыты, проведенные Максвеллом [271], показали, что получае-
мая при горении этих составов частота звуковых колебаний тем
меньше, чем больше длина трубки (картонной), в которую запрес-
сован состав. Вместе с тем частота колебаний тем больше, чем
больше скорость горения состава.
Глава XXII
ПРИМЕНЕНИЕ ПИРОТЕХНИЧЕСКИХ СОСТАВОВ
В НАРОДНОМ ХОЗЯЙСТВЕ. СПИЧЕЧНЫЕ СОСТАВЫ
Использование пиротехнических средств и составов в народном
хозяйстве, в искусстве и при исследовательских работах становится
с каждым годом все более разнообразным и все более значи-
тельным.
Термитные составы находят себе очень большое и разнообраз-
ное применение. Уже в течение многих лет они используются для
получения редких и ценных металлов [291; 208].
При помощи алюминотермических процессов могут быть полу-
чены следующие металлы и сплавы: Сг, Мп, Ti, W, Mo, Ni, Со, Zr,
V и др.
292
Фиг. 22.1. Сварочный пиро,
патрон до и после сварки.
Эллери [9] указывает, что в там случае, когда получение метал-
ла при помощи обычной алюминотермической реакции затрудни-
тельно, можно рекомендовать несколько вариантов для осущест-
вления этих процессов:
1. Добавление более активного окислителя к низшему окислу
например, хроматов к окиси хрома.
2. Добавление сильных окислителей, увеличивающих тепловой
эффект реакции и облегчающих протекание процесса, например,
ВаО2, PbO2, NaaSjOg, КСЮз и др.
3. Добавление к алюминию дру-
гих сильных восстановителей, на-
пример, Са, Mg, Si или СаС2.
4. Проведение процесса при
предварительном подогреве (в
печи). Этот вариант рекомендуется
для получения титана и циркония при
восстановлении их иэ окислов при
помощи магния.
Вариант с подогревом подробно
рассматривается для различных сме-
сей в работе Вентурини [109]. Полу-
чение металлов путем металлотер-
мических реакций в лабораторных
условиях описано в [20].
Ниобий и тантал могут быть по-
лучены восстановлением из их суль-
фидов порошком алюминия. Разделение продуктов реакции до-
стигается в этом случае испарением А125з при температуре боль-
шей, чем 1550° С.
Применение термитных составов для сварки рельс общеиз-
вестно [283]. Сравнительно недавно разработаны новые термитные
составы, используемые при сварке телефонно-телеграфных про-
водов.
А. Каждая [7, стр. 277], описывая приемы сварки стальных про-
водов при помощи пиропатронов, указывает, что «пиропатрон (см.
фиг. 22. 1, а) представляет собой цилиндрическую шашку с про-
дольным отверстием, спрессованную из магниевого термита и вос-
пламенительного состава и снабженную запальной головкой». Раз-
меры пиропатронов невелики, а вес их в зависимости от диаметра
свариваемых проводов составляет всего от 7 до 16 г. При горении
магниевого термита развивается высокая температура, вполне до-
статочная для осуществления сварки проводов, а шлак,
остающийся после его сгорания, сохраняет форму пиропатрона
(фиг. 22.1,6 и в).
Как видно из фиг. 22. 2, при сварке концы проводов сближаются
при помощи специальных клещей. Надетую на место стыка прово-
дов термомуфельную шашку поджигают; когда она сгорит, концы
293
проводов сжимают клещами. После остывания проводов образуется
прочный сварной шов.
Разработанный в ЦНИИ МПС рецепт медного термита, состоя-
щий из 64% СиО, 16% ферромарганца (80% Мп), 20% сплава
СиА1 (46% Al), нашел себе широкое применение для приварки
к рельсам стыковых соединений. Получающийся при горении «вос-
становленный металл представляет собой беспористую марганцо-
Фиг. 22.2. Устройство
для сварки Проводов при
помощи пиропатрона.
вистую оронзу, надежно свариваю-
щую конец стыкового соединителя
с головкой рельса
Для приварки заземляющих про-
водников к металлическим конструк-
циям употребляют термит, состоя-
щий из 72,5% Fe3O4, 18% Al, 4,5%
Mg, 5% сплава FeMn (~1 : 1).
Было предложено также исполь-
зовать термит при земляных рабо-
тах для оттаивания зимой мерзлого
грунта [286]. Однако расчет показы-
вает [288], что при объемной влаж-
ности грунта 25% для оттаивания
1 м3 мерзлого грунта потребуется
не менее 40 кг термита. По мнению
Киселева [282], практический рас-
ход термита для частичного размо-
раживания грунта составляет около
8 кг на 1 м3 грунта.
Сотрудниками Московского гор-
ного института были проведены
опыты по вторичному дроблению
руды брикетированным термитом
[280]. Во время войны 1941—45 гг.
для подогрева консервов использо-
вались термитные составы, помещаемые в металлическом патроне
внутрь консервной банки. По указанию [208], термит может быть
использован для подогрева воды, пищи и разогрева паяльников
и заклепочных болтов. В некоторых случаях полезно применение
термита и для борьбы с ледяными заторами.
В 1958 г. термит был использован для создания натриевого
облака в высших слоях атмосферы. Астроном И. С. Шкловский
предложил использовать фотометрические наблюдения за ско-
ростью диффузии натриевого облака в качестве метода определе-
ния плотности атмосферы. Соответствующий опыт был проведен
в СССР 19 сентября 1958 г. Для испарения металлического натрия
использовался железо-алюминиевый термит. Натрий дробился на
небольшие кусочки, смешивался с термитом, и вся смесь помеща-
1 А. Н. Кук и и. Новые виды термитной сварки. Трансжелдорнздат, 1955.
294
лась в стальной цилиндр. При горении термита натрий испарялся
и пары его выбрасывались через выхлопное отверстие в цилинд-
ре [290].
Дымовые составы, содержащие инсектисидные вещества
(или образующие их в процессе горения), широко используются
для борьбы с вредными насекомыми [276, стр. 118—145; 293]. Эти-
ми дымовыми составами снаряжаются дымовые шашки. Состав
содержит токсическое вещество и термическую смесь (ср. гл. XIX,
стр. 262). При горении термической смеси осуществляется возгонка
токсического вещества.
В качестве окислителя используется чаще всего КСЮз, в каче-
стве горючего — антрацен, дициандиамид (ДЦДА), уротропин
и др. В качестве токсикантов используются гексахлоран (гекса-
хлорциклогексан, сокращенно ГХЦГ), гексахлорэтан С2С1е, ДДТ
и др. [287].
Примером может служить состав ГХЦГ —50—52%, КС1О3 —
23-26%, NH4Cf —9—12%, антрацен —9—12% ДЦДА — 4-6%.
Известны также фунгицидные составы (от лат. фунгус —гриб).
Это смеси, содержащие вещества, применяющиеся для борьбы
с грибными, бактериальными и вирусными заболеваниями расте-
ний. В качестве примера такой дымовой смеси можно привести
состав по рецепту (в % %): дихлорнафтохинон — 58, КС1О3 — 22,
NH4C1—-10, ДЦДА — 5 и антрацен — 5.
Разработаны также специальные акарицидные дымовые соста-
вы (акарициды — это химические средства борьбы с клещами).
Например, состав, в который входят компоненты (в %): тедион
[25, т. I, стр. 82] технический — 50, КСЮз — 20, ДЦДА — 30. Ды-
мообразование этого состава беспламенное, развиваемая при горе-
нии температура около 250° С. Для обеззараживания теплиц и пло-
доовощехранилищ используется сернистый газ SO2, получаемый
при горении безоболочных пиротехнических шашек (весом 500
и 100 а), в состав которых входят сера — 75%, калиевая селитра
KNO3—17% и диатомит — 8% (разрыхлитель и катализатор го-
рения), разработанных А. И. Сидоровым [279]. Этот состав имеет
резко отрицательный кислородный баланс и нуждается поэтому во
время горения в свободном доступе воздуха.
Дымовые составы используют также для защиты садов (в осо-
бенности цитрусовых) от заморозков [276, стр. 104—126], для ис-
следования воздушных потоков в атмосфере и в различных уста-
новках.
Составы цветных огней и составы белого, черного
и цветных дымов широко используют при киносъемках—съемка
цветных фильмов немыслима сейчас без применения пиротехниче-
ских средств [284]. Различные пиротехнические сигнальные сред-
ства нашли применение в морском и речном флоте, на воздушном
и железнодорожном транспорте.
Для уменьшения усадки и предотвращения образования рако-
вин при разливке стали в изложницы в верхнюю ее часть поверх
295
жидкого металла засыпают пиросостав, содержащий 70% FeSi
(1:3), 10% алюминиевого порошка и 20% NaNOa.
Недавно были разработаны пиротехнические противоградовые
ракеты и патроны.
Исследования, проведенные за последние годы как в Советском
Союзе, так и за рубежом, показали, что, вызывая в облаках искус-
ственную кристаллизацию переохлажденных водяных капель, мож-
но воздействовать на микрофизические процессы. Это создает прин-
ципиальную возможность регулирования естественных процессов
с целью предотвращения выпадения града, увеличения осадков
и рассеяния переохлажденных облаков и туманов. Наиболее актив-
ными веществами, вызывающими кристаллизацию переохлажден-
ных капель воды, являются иодиды серебра (AgJ) и свинца (РЫг).
Теоретические соображения об искусственном воздействии на пере-
охлажденные облака и туманы даны в работах [285]; [278].
Обычный не пиротехнический способ использования иодидов
свинца и серебра состоит в том, что коллоидные растворы их вво-
дятся в облако или в туман путем распыления с самолета.
При использовании пиротехнических составов возможны два ва-
рианта: 1) AgJ или РЫг содержатся в составе в готовом виде:
2) эти же вещества образуются в результате химической реакции,
протекающей прн горении состава.
Рецепт состава первого варианта: AgJ или PbJ2— 40—60%,
NH4C1O4 — 24—45%, идитол—10—25% и графит (или индустри-
альное масло) — 1,5—2%.
В составы, относящиеся kg второму варианту, входят: поро-
шок свинца и иодсодержащие вещества — NHJ, CHJa (йодоформ)
или CsJ-iOa (иоданил). К этим веществам добавляется термическая
смесь из горючего и окислителя: идитол + NH4C1O4. Примером
может служить состав по рецепту: порошок свинца — 20—25 %,
NH4J— 25—34%, NH4CIO4 — 20—30%, смола (идитол) — 10—20%.
Газообразный кислород, имеющий достаточную чистоту и ис-
пользуемый при дыхании, например, на подводных лодках или
в авиации, может быть получен при горении пиротехнических со-
ставов [294]. Применяемые для этой цели приспособления назы-
ваются хлоратными свечами или хлоратными брикетами; основным
компонентом в составах, которыми снаряжаются хлоратные свечи,
является хлорат натрия (или хлорат калия).
Так как при разложении хлората натрия выделяется мало
тепла:
2 N аС 1 Оз = 2NaC 1 + 302-1-24 ккал,
го для повышения теплового эффекта (это необходимо для обес-
печения устойчивости горения) к нему добавляется небольшое ко-
личество горючего. При выборе горючего необходимо иметь в виду,
чтобы при его сгорании не образовывалось токсических газообраз-
ных продуктов (примесь небольшого количества СОг, по-видимому,
является допустимой). Часто в качестве горючего используется по-
296
рошок железа; при сгорании его не образуется газов, а образую-
щаяся при горении окись железа Fe2O3 является хорошим катали-
затором для разложения хлоратов,
В литературе [294] приводятся такие рецепты: NaClOs— 74—
80%, Fe—10%, ВаО2— 4%, стеклянное волокно—12—6%.
ВаОг добавляется для того, чтобы избежать при горении выде-
ления свободного хлора.
Состав, содержащий 80% NaCJO3 в прессованном виде, имеет
плотность 2,45±0,05 а/см3; вес получающегося газообразного кисло-
рода составляет 34% от веса свечи. Теплота горения таких смесей
составляет около 200 кал! г состава, температура горения (измерен-
ная термопарой) 500—700° С. Такие смеси могут снаряжаться
литьевым способом (температура плавления NaClOa 255° С). Вос-
пламенительный состав содержит те же компоненты, но в иных
соотношениях, обеспечивающих температуру горения 900—1000°С:
NaClO3 — 60%, Fe — 20%, ВаО2—10% и стеклянное волок-
но —10%.
Имеются литературные указания, что пиротехническая смесь
(CsC1O4 + A1) может быть использована для получения цезиевой
плазмы [292].
В заключение, оценивая дальнейшие возможности использова-
ния пиротехнических составов в народном хозяйстве, 'Следует за-
метить, что развитие может идти в двух принципиально различных
направлениях.
Во-первых, использование энергии (тепловой, световой и других
ее видов), выделяющейся при горении пиротехнических составов.
Во-вторых, использование веществ (простых или сложных), яв-
ляющихся продуктами горения пиротехнических составов.
Пока что этот второй вариант используется в сравнительно
ограниченных масштабах; алюминотермия (получение металлов,
а также получение искусственного корунда Д12Оз), получение кис-
лорода (кислородные брикеты), получение SO2 в инсектисидных
составах и получение AgJ и PbJ2 в противоградовых составах.
Однако возможно получение пиротехническим путем ряда га-
зов: Н2 [9], С12 (возможно, и F2), N2O и др., а также многих неор-
ганических солей и окисей металлов. Эта малоизученная область
ждет еще своих исследователей-экспериментаторов.
Спичечные составы. В настоящее время (1964 г.) во всем
мире вырабатываются в основном так называемые безопасные
спички, т. е. спички, воспламеняющиеся только при трении о на-
мазку спичечной коробки. Безопасные спички начали изготовлять
вначале в Швеции в 1855 г., поэтому они н получили название
шведских.
Мировое производство спичек выражается числом порядка де-
сятка миллиардов коробок в год (так как население земного шара
составляет около 3 млрд., то расход спичек на человека в год
составляет в среднем около 10 коробок). На одну коробку спичек
297
расходуется около 1 г спичечной массы. Следовательно, расход
спичечной массы в мировом масштабе составляет десятки тысяч
тонн в год,
Очевидно, при таком масштабе (десятки млрд, коробок) про-
изводство спичек должно быть автоматизировано. Действительно,
на спичечных фабриках сейчас работают весьма совершенные
автоматы,
Химизм воспламенения современных спичек таков: при трении
спичечной головкой о намазку па коробке происходит экзотерми-
ческая реакция между красным фосфором (в намазке) и бертоле-
товой солью (в головке спички). От тепла этой реакции происходит
воспламенение спичечной головки.
Основой состава спичечной головки, как и всех других пиро-
технических составов, является система окислитель — горючее.
Окислителем является пока исключительно КС1О3, как вещество,
легко отдающее свой кислород. Горючих обычно в спичечном со-
ставе два: сера и животный (костный) клей. Выбор горючих обос-
нован и химически, и технологически: смесь КСЮз-i-S имеет
сравнительно низкую температуру вспышки (220° С) и обеспечи-
вает легкость воспламенения состава; животный клей вводится
в состав в виде водного раствора (при сушке вода удаляется),соз-
дает необходимую консистенцию массы и Предохраняет при хра-
нении спичек их головки от увлажнения. Однако обычно зажига-
тельные спичечные составы содержат 6—8 компонентов, так как
в них входят еше добавочные окислители (К^Сг^От), катализаторы,
ускоряющие разложение бертолетовой соли (MnOj), наполнители
(железный сурик Fe3O4. цинковые белила ZnO и Др.), вещества,
повышающие чувствительность (по терминологии , спичечников
«чуткость») спичечной головки к трению (молотое стекло), а также
небольшое количество (доли %) Органических красителей (рода-
мин, заугрюн и др,),
В качестве примера можно привести состав в % %:
КСЮ3....................... 51 Fe3O4...................... 6
Молотое стекло ............ 15 S........................ 5
Животный клей.............. 11 МпОч , , ................. 4
.ZnO ....................... 7 К^СсаОт............... . . , 1
Фосфорная масса (намазка на коробке) имеет состав (в % %):
Фосфор красный........... 37,2 Декстрин................. 7,0
Sb2S3.................... 33,5 МпОо .................... 3,4
Животный клей.............. 9,3 СаСО3 (мел) . ........... 2,0
Сурик железный............. 7,0 Молотое стекло........... 0,6
Современный американский
массы таков [9] (в % %):
КСЮ3................... 45—55
Силикатные наполнители 15—32
Животный клей 9—11
Инфузорная земля .... 5—6
рецепт зажигательной спичечной
S....................... 3-5
ZnO или СаСО3........... 3
Крахмал или декстрин . . , 2—3
298
Американская фосфорная масса имеет рецепт [9] (в % %):
Фосфор красный.........., , . . ,...... 50
Молотое стекло . ................... 25
Животный клей (или казеин).............. 16
ZnO или СаСОз............................ 5
Сажа 4
Качество спичек обычно оценивается;
1) по результату их контрольного зажигания (здесь одновре-
менно проверяется качество и спички, и намазки);
2) определением «чуткости» (на особом приборе);
3) определением влагостойкости спичек При выдержке их в те-
чение 24 час при комнатной температуре и при 99,4%-ной относи-
тельной влажности; затем проводится контрольное зажигание;
4) определением температуры вспышки спичечных головок;
5) определением адгезии между спичечной головкой и соломкой
спички.
Спичечная соломка перед изготовлением спичек во избежание
ее тления пропитывается 1,5%-ным раствором Н3РО4, а затем пара-
финируется (окунание в расплавленный парафин).
Кроме обычных (бытовых) спичек, изготовляются еще спички
специальные:
1. Штормовые, горящие на ветру, в сырости и под дождем.
2. Термические, развивающие при горении более высокую тем-
пературу и дающие При сгорании головки большее количество
тепла.
3. Сигнальные, головки которых При горении дают цветное
пламя.
4. Фотографические, дающие мгновенную яркую вспышку, ис-
пользуемую при фотографировании, и др.
Детальное знакомство с химией и технологией спичечного про-
изводства можно получить из литературы [277; 289].
В США изготовляются также спички, воспламеняющиеся при
трении о любую шероховатую поверхность (так называемые спич-
ки SAW (strike anywhere). Особенностью таких составов является
наличие в них сесквисульфида Р433. Например, [9];
КС1О3...................................................... 32
Молотое стекло и другие наполнители....................... 33
P4S3......................................................... Ю
Живо-рный клей.............................................. И
ZnO .......................................................... й
Канифоль .................................................... 4
Замедлитель (exlender)....................................... 4
Глава XXIII
ОСНОВЫ ТЕХНОЛОГИИ ПИРОТЕХНИЧЕСКОГО
ПРОИЗВОДСТВА
Производство пиротехнических изделий вследствие высоких тре-
бований к качеству продукции, а также пожароопасности и взрыво-
опасности составов представляет собой довольно сложный техно-
жидкие
300
логический процесс. Он должен проводиться с соблюдением сле-
дующих условий:
1. Высокое качество компонентов (обычно 1-й сорт).
2. Чистота производственных помещений и оборудования.
3. Низкая относительная влажность (не более 65%) в помеще-
ниях.
4. Тщательное измельчение и просейка компонентов.
5. Точная дозировка компонентов.
6. Высокое качество смешения компонентов.
7. Соблюдение мер предосторожности и правил техники без-
опасности.
Технологический процесс имеет следующие фазы:
I. Подготовка компонентов: сушка, измельчение и просеивание.
II. Приготовление составов: дозировка, смешение компонентов,
грануляция и сушка составов.
III. Уплотнение и формование составов: дозировка и уплотне-
ние прессованием, шиекованием, набивкой (или заливкой).
IV. Снаряжение изделий: подготовка корпусов и деталей, сбор-
ка изделий, упаковка.
В качестве типового технологического процесса на стр. 300 при-
водится схема производства осветительных авиабомб.
§ 1. ПОДГОТОВКА КОМПОНЕНТОВ
Компоненты составов и другие материалы допускаются в про-
изводство, если они удовлетворяют по данным химического ана-
лиза требованиям ГОСТа или ТУ. Компоненты, не удовлетворяю-
щие требованиям по влажности, сушат. Обычно содержание влаги
-в компонентах нормируется в пределах 0,1—0,5%.
Сушка компонентов
Наиболее часто сушат окислители. Горючие . и цементаторы
(связующие) обычно содержат мало влаги и не требуют сушки.
Сушка окислителей обычно производится при 70—80° С ' с исполь-
зованием в качестве теплоносителя воды отопительной системы или
па ра низкого давления.
Небольшие количества компонентов (не более десятков кг)
сушат в сушильных шкафах, представляющих собой металличе-
ские конструкции с полками для лотков, где под лотками или по
боковым стенкам расположены секции труб для обогрева. Для
сушки больших количеств окислителей применяют трубчатые или
вакуумные сушилки.
Трубчатые сушилки (фиг. 23.1) достаточно экономичны
и производительны, безотказны в работе и легко очищаются про-
мывкой.
Материал, загружаемый в бункер сушилки, через питатель по-
падает в верхнюю часть барабана. Вращающиеся диски со скреб-
1 Температуру сушки как окислителей, так и всех других материалов, уста-
навливают с учетом физико-химических свойств материалов.
301
ками непрерывно перемешивают материал, забрасывая его на на-
гретые паром трубы. Некоторый наклон барабана обеспечивает
передвижение материала к разгрузочному люку.
Производительность трубчатых сушилок 200—500 кг!час. Рас-
ход пара при максимальной загрузке около 500 кг!час. При 7—
8 оборотах в минуту барабана и угле его наклона 3° потребляемая
мощность не превышает 2,5 кв.
Испаряемая влага удаляется естественной тягой воздуха, по-
ступающего через разгрузочный люк и выходящего через верхний
Фиг. 23. I. Трубчатая сушилка.
1—корпус сушилки, 2—трубы обогрева, <?—скребки, выходвой па-
трубок, 5—бункер, 6—питатель, 7—привод, 8—паропровод, 5—слив
ковдевсата, J0—разгрузочный люк.
патрубок. Недостатки трубчатой сушилки — трудность герметиза-
ции вращающихся трубопроводов и выделение пыли из разгрузоч-
ного люка.
Вакуумные сушилки (фиг. 23. 2). Это горизонтально рас-
положенные прямоугольные или цилиндрические камеры, снабжен-
ные рядом горизонтальных полых плит, через полость которых
пропускается пар или горячая вода.
Противни с подлежащим сушке материалом помещают на пли-
ты. Камеры закрывают днищами — дверями с герметизирующими
резиновыми прокладками и специальными прижимными устройст-
вами. Разрежение достигается с помощью вакуум-иасосов РМК № 2
или № 3. Одновременная загрузка сушилки объемом 3 .м3 не пре-
вышает 120—150 кг. Продолжительность сушки при 40—50° С
и разрежении 200—250 ммрт.ст. составляет для материалов со
средней влажностью около 1 часа.
Вакуумная сушилка по сравнению с другими типами сушилок
имеет существенные преимущества: уменьшение возможности воз-
горания высушиваемого материала (или паров удаляемых из него
горючих жидкостей), отсутствие выделения ныли и ускорение про-
цесса сушки, К недостаткам ее следует отнести периодичность
302
работы, низкую производительность, значительную затрату ручного
труда (загрузка и выгрузка противней, насыпка и ссыпка с них
материала).
Фиг. 23,2. Вакуумная сушилка.
1—корпус, 2—крышка, 5—полые нагревательные плнты^ 4—паро-
провод для удаления испаренной aJiarn.
Измельчение компонентов
Размеры частиц компонентов пиротехнических составов должны
не превышать десятых долей мм, а иногда и сотых долей ж.и
(т. е. десятки микрон)!. Основные компоненты (окислители и горю-
чие) поступают обычно уже в измельченном виде, поэтому машины
для крупного и среднего помола в пиротехническом производстве
почти не применяются. Как правило, окислители в процессе сушки
слипаются в комки, а кроме того, сами по себе размеры кристал-
лов значительно превышают размеры частиц, указанные в техни-
ческих условиях.
Металлические горючие измельчаются и просеиваются завода-
ми-изготовителями. По тонине помола металлические горючие под-
разделяются на несколько марок. При подготовке компонентов
металлические горючие подвергают лишь контрольному просеву,
и только для получения очень мелкой дисперсности (единицы ми-
крон) их измельчают дополнительно.
Для измельчения компонентов применяются дезинтеграторы
и дисмембраторы, шаровые вращающиеся мельницы и вибромель-
ницы, реже — бегуны и вальцовые мельницы.
Дезинтегратор (фиг. 23.3) состоит из двух вращающихся
стальных дисков, заключенных в цилиндрический корпус. На каж-
дом диске по окружности расположены стальные шпильки. Распо-
ложение их таково, что каждый ряд шпилек одного диска входит
в пространство между рядами шпилек другого диска. Диски укреп-
лены на концах валов, вращающихся в противоположные стороны.
Измельчаемый материал из бункера при помощи питателя посту-
303
пает в середину мельницы, затем попадает в зазоры между шпиль-
ками и здесь интенсивно измельчается.
Дезинтеграторы, применяемые для подготовки компонентов,
имеют диаметр дисков 600—800 мм и длину шпилек 100—160 мм.
Производительность этих машин очень высока, при вращении дис-
ков со скоростью 1000—1200 об/мин она достигает 1000 кг/час
и более.
Дисмембратор (фиг. 23.4) в Отличие от дезинтегратора
имеет только один вращающийся диск, на котором имеются скреб-
Фнг. 23.3. Дезинтегратор.
7—вал, 2—шкив. J—бункер, Т—диски с кольцами.
ки, предохраняющие корпус от налипания измельчаемого мате-
риала,
В дисмембратор, кроме того, вставляется барабан с ситом для
предварительного просева и удержания неизмельченного материа-
ла. Наличие истирающих элементов в дисмембраторах позволяет
измельчать в них вязкие и волокнистые материалы (идитол, кани-
фоль, асбест и др,).
Производительность дисмембратора при скорости вращения
диска 2500—3000 об/мин в зависимости от свойств измельчаемого
материала составляет 500—1000 кг/час.
Недостатками, общими как для дезинтегратора, так и для дие-
мембратОра, являются:
1. Необходимость особо тщательной подгонки и балансировки
подвижных деталей, так как при больших оборотах даже легкое
касание их друг о друга приводит к серьезным авариям.
2. Засасывание большого количества воздуха, вследствие чего
происходит интенсивное пыление, требующее специальной венти-
ляции,
3. Сложность разборки и чистки, особенно у дезинтегратора.
.304
/
Шаро вые мельницы представляют собой вращающиеся
барабаны. Измельчение производится при помощи шаров, которые
вследствие трения о стенки барабана и друг о друга периодически
то поднимаются на некоторую высоту, то скатываются обратно
вниз. При измельчении взрывобезопасных (инертных) компонентов
обшивка внутри барабана выполняется из металла, а шары — из
стали или бронзы. Для измельчения взрывоопасных или горючих
материалов обшивку выполняют нз кожи, а шары —из твердого де-
рева (или керамики).
Фиг. 23. 4. Лисмембратор.
/—корпус, 2—неподвижный чугунный диск, 3—i нт алеющийся Стальной
Лиек, 4--горч:иигта.!1гный ва.-|, -f—сито, 1'г--за|'рузочная воронки.
Время измельчения зависит от свойств и количества материала,
скорости вращения барабана и требуемой тонины помола; время
устанавливается обычно опытным путем.
Вибромельницы (фиг, 23.5) пока еще мало применяются
в пиротехническом производстве, однако они имеют следующие до-
стоинства: высокую производительность при самой высокой тонине
помола, возможность измельчения металлических горючих в инерт-
ной среде и небольшие габариты.
Вибромельница в сечении имеет круглую или корытообразную
форму. В мельницу загружаются шары (мелющие тела) и измель-
чаемый материал. При вращении разбалансированного вала вибро-
мельница совершает частые колебания (до 3000 в минуту), перпен-
дикулярные оси вращения вала. Вследствие этого весь загружен-
ный материал приходит в круговое движение в направлении, про-
тивоположном направлению вращения вала, а шары вращаются
20 Л- Л- 305
вокруг своей оси, При этом происходит интенсивное измельчение
материала, Главными недостатками, присущими как вибрационным,
так и вращающимся шаровым мельницам, являются значительный
Фиг 23.5. Вибрационная мельница.
корпус, 2—вал разбалавсвро&аиныЙ, Л—система охлаждения,
4—соединительная гвбкан муфта, 5—электродвигателе 6“рама(
7—амортизаторы, 5—загрузочный люк^ 3—пружины.
расход энергии и большой шум, создаваемый в рабочих помеще-
ниях. Кроме того, за счет истирания шаров происходит некоторое
загрязнение измельчаемого материала, что тоже является нежела-
тельным.
Просеивание компонентов
Измельченный материал просеивается для получения порошка
с частицами, относительно близкими по своим размерам, а также
отделения случайно попавших механических примесей.
В качестве сит используются шелковые или металлические
сетки, Для шелковых сит номер сетки указывает на число отвер-
стий на линейный сантиметр (среднее по двум направлениям, по
основе и по утку), а для металлических сит номер сита опреде-
ляет размер отверстий в сзету (в лш).
В пиротехническом производстве применяются обычные сита —
трясучки и вибросита.
Сито-трясучка (фиг. 23.6) —это деревянный ящик, имею-
щий внизу форму усеченной пирамиды, В ящике под наклоном
3—5° устанавливается натянутое на раму сито. Ящик вместе с си-
том закрепляется на плоских металических пружинах. СитО-трясуч-
ка приводится в действие от мотора или трансмиссии через эксцен-
трик, который придает ситу возвратно-поступательное движение
со скоростью 200—300 колебаний в минуту,
Вибросито (фиг. 23.7) —это металлический стол, на крыш-
ке которого установлены электромотор, инерционный вибратор
306
и круглый бункер с сеткой, укрепленной на резиновых пробках,
вставленных в специальные гнезда. Материал засыпают в бункер
на сито в количестве 2—
5 кг и, закрыв его крыш-
кой, включают мотор,
Электромотор через
ременную передачу при-
водит в движение инер-
ционный вибратор, кото-
рый, будучи жестко скреп-
ленным с бункером-ситом,
передает ему колебания
с частотой от 1500 до
2000 в минуту, Прошед-
ший через сито материал
через воронку ссыпается
в сборный ящик.
Основные недостатки
сита-трясучки и виброси-
та — выделение пылн и
большая затрата ручного труда. При выполнении любой операции
по подготовке компонентов необходимо всегда иметь в виду, что
Фиг, 23. 7. Вибросито.
/—электромотор, 2—вибратор. 3—буккер,
4—резиновые пробки. 5—конус, 6—вытяжная
вентилицвя, 7—ящик для материала.
Фиг, 23. 6, Сито-трясучка,
1—кривошипный механизм, 2—сито, 5—вытяжной
зонт, 4—ссыпка отсева, 5--к он ус.
пыль окислителей, смешиваясь
с парами или пылью органиче-
ских веществ или пылью метал-
лических горючих, может обра-
зовывать взрывчатые смеси.
Поэтому все операции следует
проводить в разных помещени-
ях, причем всюду должны
быть вентиляционные уста-
новки,
При подготовке компонен-
тов часто применяют для суш-
ки, измельчения и просеивания
их отдельные машины, чаще
всего устанавливаемые в раз-
ных помещениях, При этом ма-
шины загружаются н разгру-
жаются вручную, транспорти-
ровка материала также произ-
водится или на ручных
тележках или переноской на
руках, Все это создает тяжелые
условия труда и низкую про-
изводительность. Гораздо целе-
сообразнее производить все
операции в одной машине —
750 20*
307
сушильно-размольном агрегате; это ооеспечивает высокую про-
изводительность труда и значительно улучшает условия работы
на производстве.
§ 2. ПРИГОТОВЛЕНИЕ СОСТАВОВ
Пиротехнический состав должен быть однородным. Проба, взя-
тая в любом месте состава, должна по содержанию в ней компо-
нентов соответствовать рецепту состава. Получить вполне однород-
ную смесь, даже длительное время перемешивая сухие сыпучие
материалы, трудно, поэтому органические добавки часто вводят
в виде растворов (лаков); это улучшает смешение и одновременно
увеличивает прилипание частиц друг к другу; чтобы в дальнейшем
избежать слипшихся комков и получить однородный состав, по-
следний после смешения подвергается операции грануляции.
Для удаления органических растворителей составы после грануля-
ции сушат.
Приготовление составов — это пожаро- и взрывоопасная опера-
ция. При нарушении правил по технике безопасности возможны
и человеческие жертвы.
Основные меры, обеспечивающие безопасность при изготовле-
нии составов, следующие:
1) операция смешения компонентов производится в отдельном
обвалованном здании, удаленном на безопасное расстояние от дру-
гих зданий;
2) смесители устанавливаются в прочных железобетонных ка-
бинах по одному в каждой;
3) управление смесителем (пуск, остановка и выгрузка) осу-
ществляется в безопасном месте и на должном расстоянии от каби-
ны смешения;
4) должна соблюдаться чистота помещений и оборудования;
недопустимы скопления пыли, прилипание состава к деталям сме-
сителя, рассыпание состава в помещении;
5) должны строго соблюдаться инструкции по технике безопас-
ности для каждого рабочего места;
6) дозировка окислителей и горючих должна производиться
в разных помещениях.
Из большого количества различных типов смесителей, исполь-
зуемых в разных отраслях промышленности, условиям пиротех-
нического производства более или менее удовлетворяет только ло-
пастный смеситель.
Лопастный смеситель (фиг, 23.8) имеет корытоподобный кор-
пус, через который проходит вращающийся вал с лопастями спе-
циальной конструкции. Корпус смесителя укреплен на станине
таким образом, что он может опрокидываться для высыпания со-
става. Лопасти смесителя приводятся во вращение ременной пере-
дачей через редуктор от электродвигателя. Последний обязательно
должен быть взрывобезопасным.
308
между центрами вращения колена с помощью регулировочного
винта.
«Сборки» представляют собой несколько матриц (от 4 до
80 шт.), смонтированных в одной плите, и столько же пуансонов,
тоже вделанных в общую плиту и с общим поддоном. «Сборка»
с насыпанным составом ставится на подвижную подушку; при
включении механизма за один поворот маховика производится
прессование.
Механические прессы имеют значительные преимущества по
сравнению с гидравлическими по скорости прессования и простоте
конструкции, однако ограниченность их мощности и хода, а также
невозможность выдержки составов под давлением при прессова-
нии на этих прессах ограничивают их применение.
§ 4. СНАРЯЖЕНИЕ ИЗДЕЛИЙ
На фазе снаряжения производят подготовку всех деталей изде-
лия, соединение их в узлы конструкции и сборку самого изделия.
Снаряжение каждого вида изделий имеет свои особенности, зави-
сящие от их габаритов и устройства.
Снаряжение пиротехнических изделий производят обычно в об-
щем помещении на конвейере или столах, но к сборочному залу
всегда примыкает ряд кабин, в которых выполняются подготови-
тельные операции, ^асто являющиеся пожаро- и взрывоопасными.
Общими подготовительными операциями для большинства
изделий являются:
а) подготовка корпусов изделий — раскупорка, снятие осадки,
разборка деталей;
б) приготовление вышибного заряда — навеска пороха, насып-
ка в мешочки или целлулоидные коробки и заклейка их;
в) укладка парашютов — разборка купола и строп, проверка
крепежного троса и укладка;
г) подготовка пиротехнических шашек (факелов) — обрезка
картонных гильз, клепка обтюраторов, присоединение парашю-
та и др.;
д) подбор картонных прокладок и крепежных деталей.
Собственно сама сборка заключается в укладке в подготовлен-
ный корпус всех деталей и узлов с соблюдением последовательно-
сти, предусмотренной технологическим процессом и чертежом из-
делия.
Наиболее ответственной операцией сборки многих видов изде-
лий является досылка подготовленной шашки (факела) с парашю-
том в корпус изделия. Наличие на пиротехнической шашке обтюра-
торов, ограниченность объема в изделии для парашюта требуют
применения значительных усилий при их досылке в корпус.
Для этой цели применяют фрикционные или винтовые прессы.
‘Фрикционный пресс (фиг. 23. 12) состоит из двух колонн, соеди-
ненных траверсой, на которых укреплен механизм привода. Через
313
траверсу проходит прижимной винт, на верхнем конце которого
закреплен горизонтальный фрикционный диск. С помощью рукоят-
ки, меняя нажим вертикальных фрикционных дисков, приводят
в движение вниз или вверх прижимной виит. Для ограничения
фиг. 23.12, Фрикционный пресс.
электромотор, 2—вертикальные фрикционные
AHCKHt 3—горизонтальный фрикционный диск,
-/—рукоятка, 5—прижимкой винт» ff—колонны
пресса.
После этой операции крепят
и сборка изделия закончена.
Для предохранения от влаги и
хода винта применяют автома-
тические выключатели.
Операция досылки снаря-
жения в корпус выполняется
следующим образом:
а) подготовленный корпус
с помещенным в него вышиб-
ным зарядом устанавливают в
гнездо под пресс и закрепля-
ют хомутом к штанге;
б) шашку (факел) с наде-
тыми на нее обтюраторами
вручную, без усилия, опускают
в корпус;
в) укладывают соедини-
тельный трос к парашюту;
г) кладут сверху парашют,
предварительно стянутый вспо-
могательными стропами;
д) досылают парашют в
корпус, освобождают его от
вспомогательных строп и при
помощи пресса поджимают па-
рашют с факелом, пока они не
займут необходимого объема,
хвостовую или донную часть
обеспечения надежности изде-
лия при длительном хранении места соединения состава с деталями
лакируют, а места соединения в корпусе замазывают герметизи-
рующей замазкой и покрывают масляной краской или парафином.
Описание машин и аппаратов, рассмотренных в этой главе, мож-
но найти в литературе [295—300].
краткий очерк истории развития пиротехники
В РОССИИ
Искусство создания огня и управления им возникло в глубокой
древности.
Еще около столетия назад под словом «пиротехника» понима-
лась вся совокупность знаний и приемов, необходимых для изго-
товления пороха, взрывчатых смесей и разнообразных пиротехни-
ческих составов. Однако эти отрасли военной техники настолько
расширились, что теперь каждая из них представляет собой само-
стоятельную отрасль знания.
314
Известно, что первый вошедший в употребление пиротехниче-
ский состав — черный порох — уже в XV в. производился на Руси
в большом количестве и хорошего качества.
При Иване Грозном пушкари и пороходельцы были преимуще-
ственно из коренных русских. В 1563 г. артиллерия войска Ивана
Грозного состояла из 200 пушек. В то же время ежегодно произво-
дилось до 20 тысяч пудов пороха.
В 1607—1621 гг. пушечным мастером Онисимом Михайловым
был написан дошедший до нас «Устав ратных, пушечных и других
дел, касающихся до военной науки». В этом уставе, представляю-
щем собой практическое руководство для артиллеристов, изложены
и сведения о ракетах.
В 1674 г. в г. Устюге был устроен фейерверк и пущено несколь-
ко ракет и шутих.
При Петре I фейерверки становятся неотъемлемой частью уве-
селений, устраиваемых по случаю каких-либо торжественных собы-
тий. Петр I собственноручно приготовлял ракеты, колеса, огнен-
ные картины; им же было основано специальное «Ракетное заве-
дение». По его приказу осветительные ракеты применяли в армии
как средство сигнализации.
Тогда же в Петербурге был основан Охтенский пороховой завод
и значительно увеличено производство пороха.
Гениальный ученый М. В. Ломоносов (1711 —1765) за годы пре-
бывания в Академии Наук поставил немало выдающихся фейер-
верков. Сохранилась гравюра, изображающая фейерверк, изготов-
ленный «по изобретению г. советника и профессора Ломоносова
обер-фейерверкером Матвеем Мартыновым и сожженный в Москве
на новый 1754 г.».
Наибольшего блеска и изящества русские фейерверки дости-
гают во второй половине XV111 века. Фасады фейерверочных
фронтов делались в то время огромных размеров; до 50 сажен
в длину и до 25 сажен в вышину.
Развитию пиротехники помогала и литература. В 1779 г.
М. В. Данилов (1722—1790) выпустил в Москве руководство, «по
которому всякий может приготовить и делать фейерверки и разные
иллюминации».
В 1824 г. издана книга пиротехника Ф. С. Челеева «с присово-
куплением приготовления военных огнестрельных и зажигательных
вещей», в пяти частях.
Начиная с 30-х годов Х1Х столетия в России стали изготовлять-
ся составы цветных огней с бертолетовой солью.
В 1832 г. при Охтенских пороховых заводах была создана Пиро-
техническая артиллерийская школа с пятилетним курсом. Там обу-
чали пороходелию, военно-лабораторному делу и приготовлению
фейерверков. Стали применяться ракеты с парашютами, а боевые
ракеты использовались при пуске фейерверков.
К 40-м годам относится начало деятельности выдающегося рус-
ского пиротехника К. И. Константинова (1819—1871).
315
П. С. Цытович (1833—1894).
С 1847 г. К. И. Константиновым проводились систематические
работы по конструированию и производству боевых ракет.
С 1850 по 1859 гг. К- И. Константинов возглавлял Петербург-
ское «ракетное заведение»; в этот период он осуществил ряд серь-
езных научных экспериментов, создал несколько новых систем
ракет, которые успешно применялись в Крымской войне.
К- И. Константинов написал более 50 научных работ, в том чис-
ле книги «О боевых ракетах», «Боевые ракеты в России в 1867 г.»
и большую статью «Усовершенствование фейерверков».
Образованная в 1855 г. из офицерских классов артиллерийского
училища Михайловская Артиллерийская Академия, в которой чи-
тал лекции и К- И. Константинов, стала научным центром военной
технической мысли. Там же производили и специальные пиротехни-
ческие исследования. ’
Во второй половине XIX столетия в пиротехнические составы
начали вводить много новых материалов.
В 1869 г. в «Артиллерийском журнале» появилась статья
А. И. Плесцова «Об употреблении магния в пиротехнике».
В 1887—1889 гг. там же помещаются статьи капитана А. Ордын-
ского, Ф. Ф. Матюкевича, П, С. Цытовнча.
В 90-х годах выходит ряд руководств по приготовлению фейер-
верков, лучшими из которых следует считать обширные труды
П. С. Цытовнча и Ф. В. Степанова.
316
С, П, Вуколов (1861 — 1940),
В начале XX столетия в пиротехнике начали применять термит-
ные составы, которые открыл и изучал еще в 1865 г. академик
Н. Н. Бекетов. Ближайший помощник Д. И. Менделеева С. П. Ву-
колов работал (с 1907 г.) над усовершенствованием сигнальных
средств и над созданием первых образцов трассирующих снарядов.
В результате значительного развития военной техники ко вре-
мени мировой войны 1914—1918 гг. русская армия получила на во-
оружение ряд сигнальных, осветительных, зажигательных и дымо-
вых средств.
Русские пиротехники Ершов, Санников, Погребняков, Артемьев
и др. создали дымовые шашки, осветительные и термитно-зажига-
тельные снаряды и другие пиротехнические боеприпасы.
Библиография трудов русских пиротехников XIX и начала
XX столетия дана во втором издании нашей книги [7, стр. 275].
Работы отечественных пиротехников за последние годы не мо-
гут быть полностью изложены в столь кратком очерке.
Отметим лишь, что силами советских ученых и инженеров соз-
дано большое количество новых пиротехнических составов и пиро-
технических средств, нашедших применение во время Отечествен-
ной войны 1941—1945 гг. и показавших своп высокие качества,
разработана технология их изготовления и созданы новые методы
испытания пиротехнических составов.
ПРИЛОЖЕНИЯ
Приложение I
Теплота образования окисей, фторидов, хлоридов и сульфидов
некоторых элементов (98:94]
Элемент Соединение Молекуляр- ный вес соединения Теплота образования в ккал
на г-моль соединения Q на 1 а элемента Qi на 1 г соедине- нии ог на г-атом соединения Qa
Li2O 30 143 10,4 4,8 48
Li LiF 26 146 20,8 5,5 73
LiC( 42 96 13.7 2,3 48
Li2S 46 112 8,0 2,4 37
BeO 25 142 15,8 5,7 71
Be BeFj 47 240 26,7 5,1 80
BeClj 80 122 13,6 1,5 41
BeS 41 56 6,2 1.4 28
MgO 40 144 5,9 3,6 72
Mcr MgFs 62 264 10,9 4,2 88
MgCl2 95 153 6,4 1,6 50
Mgs 56 84 3,5 1,5 42
A12O3 102 400 7.4 3,9 80
д I AIF3 84 329 12,1 3,9 82
A1CI3 136 167 6.2 1.2 40
A!2S3 150 140 2,6 0,9 28
318
Продолжение
Теплота образования в ккал
Эле мент Соединение Молекуляр- ный вес соединении на г-молъ соединения Q на 1 г элемента Qi на 1 г соедине- ния Qi на г-атом соединения <2з
СаО 56 152 3,8 2,7 76
Са CaFa 78 290 7,2 3,7 97
CaCh 111 188 4,7 1,7 63
CaS 72 115 2,9 1,6 57
TiOj 80 224 4,7 2,8 75
Ti TiF4 TiCl4 124 190 392 196 8,2 4,1 3,2 1,0 78 39
TiS? 112 (80) (1,7) (0,7) (27)
ZfOj 123 260 2,9 2,1 87
Zr ZrF4 ZrCl4 167 233 445 232 4,9 2,3 2,7 1,0 99 46
ZrSj 155 (148) (1.6) (1,0) (49)
HjOjk 18 68,4 34,2 3,8 23
н HFrM НС1газ 20 36 64 22 63,5 21,8 3,2 0,6 32 11
HjSras 34 5 2,5 0,1 2
co2 44 94 7,8 2,1 31
cf4 88 165 13,7 1,9 18
с CC14 154 25 2,1 0,2 5
cs2 70 —21 —1,8 —0,3 —7
B2O3 70 302 14,0 4,3 60
в BF3ras ВС13ж 68 117 270 103 25,0 9,5 4,0 0,9 78 26
Ba S3 118 57 5,3 0,5 11
S1O2 60 208 7.4 3,5 69
Si SIF4 104 360 12.8 3,5 72
SIC14 170 150 5,3 0,9 30
SiS2 92 34 1.2 0.4 И
319
Продолжение
Элемент Соединение Молекуляр- ный вес соединения Теплота образования в ккал
на 2-моль соединения Q на 1 2 элемента Qi на 1 2 соедине- ния Qi на г-атом соединения Qa
₽2о5 142 367 5,9 2,6 52
Р PFa 88 —. — — —
РС1ЗЖ 137 79 2,5 0,6 20
P£S5 222 (60) (2,0) (0,3) (0)
Na2O 62 99 2,2 1.6 33
Na NaF 42 136 6,0 3,2 68
NaCl 58 98 4,3 1,7 49
Na2S 78 87 1,7 1,1 29
ZnO 81 83 1,3 1,0 41
ZiiF2 103 179 2,8 1,7 60
£Л1 ZnCl2 136 100 1,5 0,7 33
ZnS 97 48 0,7 0,5 24
CuO 80 38 0,6 0,5 19
CuF2 102 130 2,0 1,3 43
U11 CnCl2 134 52 0,8 0,4 17
CuS 96 12 0,2 0,1 6
PbO 223 52 0,3 0,2 26
РЪ PbF2 245 160 0,8 0,6 53
PbCl2 278 86 0,4 0,3 29
PbS 239 22 0,1 0,1 11
HgO 217 21 0,1 0,1 И
Hg HgF3 239 (Ю0) (0,5) (0,4) (33)
HgCl2 271 54 0,3 0,2 18
HgS 233 16 0,7 0,07 8
полученные пред-
Примечание. В скобки поставлены данные,
варительным вычислением |94].
‘ 320
Приложение 2
Рецепты дистанционных составов
(Delay compositions) по Эллерну [9]
1. Zr/Nt сплав . ......................... 54%
BaCrO4................................... 31%
КС1О4 ................................... 15%
Время горения составов при использовании сплавов с содержа-
нием 70, 50 и 30 % Zr относится как 1:2:3. Соотношение окислите-
лей также может варьировать.
Рецепты с аморфным бором
2. В/ВаСгО4.......................... 5/95
>
3. В/ВаСгО4............................. 10/90
Время горения состава 2—1 сек! см, состава 3—0,2 сек/см.
Рецепты с металлическим марганцем:
4 5 6
Марганец .................. 44 37 33
ВаСгО4 ................... 3 20 31
РЬСгО4 ................... 53 43 36
Время горения этих составов равно соответственно 1,5, 3 и
5 се к! см.
«Экзотические» диета нци о н н ы е составы
7 8 9 10 11
Ниобий . . 15 18 50 — —
Тантал . , . . — — — 29 50
ВаСгО4 . . 85 82 50 71 50
Экспериментальные составы разрабатываются в США главным
образом в направлении создания «безгазовых» смесей.
21 А. А. Шидлонский
321
/7риложение 3
Средние значения давления и температуры воздуха на разной высоте
в умеренных широтах
Высота над уровнем моря км Давление мм рт. ст. Темпера- тура °C Высота над уровнем моря км Давление мм рт. ст. Темпера- тура °C
0 760 — 30 9,5 44
2 608 +5 40 2,4 —и
4 486 —6 50 7,6-10-1 —2
6 372 —20 60 2,2.10-1 —20
8 281 —35 70 5,5.10-2 —55
10 205 -48 80 1,1-10-2 —68
12 152 —50 90 2,0-Ю-з —54
14 114 -50 100 6,0.10-1 33
20 42 - -60
Приложение 4
480
V™
3
*3Z0
Z3
g
15 zuo
Ct
R 160
80
Теплота образования окисей
номера элемента
как функция порядкового
Асги3
2
n
11
J_L
I 1
Li2Q
Mj
OD
I ICTjOj
LdjOi
flZrO
I 1
J—
J
_____I
5roj>
i{MoOz
“t------
I
1 I
5n0z |
ft 4»BcO
\HfOj 1
\ J
Vwo3 I
ГеОЦ,»
CoD tj
NiO
Rb:O
CujO
CdO Cs2°
0 10 20 30 40 50 SO
Порядковый номер элемента
I ^PbO
PtD^-YHjO
TO 80 Ж
J
f
I
*3
£
Фиг. 1. Теплота образования окисей (ккал/моль) как функция порядкового
номера элемента.
322
/<7 Н 3 2 О UDJ
Л
§
V
Фиг, 2, Зависимость теплоты образования окиси (Q? ккал/г) от положения элемента в периодической
системе элементов.
21*
323
Л ИТЕРАТУРА
Глава t
1. Будников М. А.. Левкович И. А., Быстров И. Вг, '"против-
ск ий В. Ф., Шехтер Б. И., Взрывчатые вещества и пороха, Оборонгиз, 1955,
стр, 216—264.
2. Быстров И. В., Краткий курс пиротехники ч. ], Оборонгиз, 1940.
3. Горст А. Г., Пороха и взрывчатые вещества, Оборонгиз, 1957,
стр. 160—180.
4. Демидов П. Г.. Горение и свойства горючих веществ Минкомхоз,
РСФСР, 1961.
5. Жиров Н. Ф., Свечение пиротехнических пламен, Оборонгиз, 1939.
6. Солодов циков В. М., Пиротехника (производство и сжигание
фейерверков). Оборонгиз, 1938.
6А. Те р е пт ье в А. П., Яновская Л. А.,,- Химическая литература
и пользование ею, 1964 М., Изд-во «Химия».
7. ШидловскийА. А,, Основы пиротехники. Оборонгиз, 1954, изд. 2-е.
8. Becher W., Пиротехника, статья в [51], Band 14, 490—595 1963.
9. ЕНегп Н. Modern Pyrotechnics. Fundamentals of applied physical
Pyrochemistry, N. ¥,, 1961.
10, Hart D., Военная пиротехника, статья в [46], vol 11, рр. 328—332.
И- Hart D., Периодичность химических и термодинамических функций,
J. phys, Chem., 1952, 56, 202 214-
12. Izzo A., Pirotechnica е fuochi artificial!, Milano, 1950.
13- Langhans A., Feuer-Fundaniental-Klassifiration, Band I—11,1950,
Stuttgarl.
14. Sanderson R, T., Chemical Periodictty, N. Y.—London. 1960.
15, W e i n g a r t G., Pyrotechnics, N, Y., 1947.
Глава 11
16. Алексеенко Л. А., Влияние внутримолекулярных поляризационных
явлений на термическую устойчивость нитратов и хлоратов, Труды Томского
Университета. |954, 126, 201—226.
17. Беляев А. И. и др., Физическая химия расплавленных солей, Метал-
аургиздат, 1957.
18. Биллитер Ж., Промышленный электролиз водных растворов, Госхим-
издат, 1959.
19. Блинов И. Ф., Хлоратные и перхлоратные взрывчатые вещества, Обо-
ронгиз, 1941.
20. Брауэр Г., Руководства по препаративной неорганической химии, ИЛ,
1956.
21. ВольфковичС. И, Егоров А, П., Эпштейн Д. А., Общая хими-
ческая технология, т. 1 и 2, Госхимиздат. 1952—1959.
22. Воробьев А. ф., Привалова Н. М, Монаенкова А, С .
Скуратов С. М., Стандартные энтальпии образования хлорной кислоты и не-
которых перхлоратов, ДАН СССР, 1960, 135, № 6. 1388.
324
' Q23y В о с к р е с е н с к д н Н. К., Беру ль С, Л!., Термоустойчивость легко-
плавкой смеси нитратов и нитритов натрия н калия, ЖНХ, 1956, 1, № 8.
24. Карякин Ю. В., Ангелов И. И., Чистые химические реактивы
Химиздат, 1955.
25. Краткая химическая энциклопедия (ДХЭ), 1961—1964, т. 1, 2 и 3,
(изд. продолжается).
26. Миниович М. А., Соли азотной кислоты (нитраты), Госхимиздат, 1946
27. Некрасов Б. В., Курс общей химии, Госхимиздат, 1961.
28. Орлова Е. Ю., Химия и технология бризантных взрывчатых веществ,
Оборонгиз, I960.
29. Пестов Н. Е., Физико-химические свойства пористых и порошкообраз-
ных продуктов, АН СССР, 1947.
30, Поз и и М. Е., Технология минеральных солей, Госхимиздат, 1961.
, 31. Проценко П. И., Шокина О. Н., Исследование тройной системы
из нитратов иатрня, калия и бария. ЖНХ, 1959, 4, № 11, 2554—57.
32. Реми Г., Курс неорганической химии, т. 1, ИЛ, 1963.
Remy Н. Lehrbuch d. anorg. Chemie. 9 Aufl. Band 1 n 2 Leipzig, 1957—
1959.
33. Скуратов С, M.., Воробьев А. Ф., Привалова H. M,, К вопро-
су об энтальпии образования некоторых перхлоратов. ЖНХ 1962, 7 № 3
677—679.
34, Смирнов В. Я., Пиротехнические материалы, Оборонгиз, 1939.
35. Справочник по плавкости систем из безводных неорганических солей.
Под ред. Н. К- Воскресенской,, т. 1 н 2, АН СССР, 1961.
36. Справочник по растворимости. Под ред. В. Б. Когаи, т. 1, кн. 1 и 2, Гос-
химнздат, 1961.
37. Справочник химика, изд. 2, т. 1—111, Госхимиздат, Л.— М., 1962—1963.
38. Ш а р г о р о д с к и й С. Д., Ш о р О. И., Изучение термического разложе-
ния нитратов и карбонатов Be, Са, Sr и Ва, Украинский химический журнал
1954, 20, № 4, 357,
' I 39, Ш и д л о в с к и й А. А., Вода как окислитель в пиротехнических соста-
вах, ДАН СССР, 1946, 51, № 2, 127.
40. Ш р а й б м а н С. С., Производство бертолетовой соли и других хлора-
тов, ГОНТИ, 1939.
41. Fitzpatrick J. А., Выделяющие водород пороховые композиции,
Амер. Патент 2. 885, 277, 1959.
42. GmeBns Handbuch der anorg. Chemie. 8 Aufl. В. 1932—1964 (изд. про*
должается). Особенно рекомендуются выпуски №21—Na №22—К; №23—
Arnnioniuin; №27—Mg; №29—Sr; №30—Ba; №35—Al.
43, Gordon S., Campbell С., Дифференциальный термический ана-
лиз неорганических соединений: нитратов и перхлоратов металлов, Anal.
Chem., 1955, 27, No. 7, 1102.
44. Н е i п F., Chem Technik (Berlin), 1957, 9, 97.
45- H о g а п V. D., О о г d о п S., С a m р Ь е 11 С., Дифференциальный тер-
мический анализ и термогравиметрия применительно к системе перхлорат
калия—алюминий—нитрат бария, Anal. Chem, 1957, vol. 29, No. 2, 306.
46, Kirk R. E., Othmer D. E,, Encyclopedia of Chemical Technology,
N. Y., 1947-1956, vol, 1-15.
47. Leschewsky К,, Термическое разложение нитратов натрия н ка-
лия, Berichte, 1939, 72, 1763—77.
48. Mellor L. W., A Comprehensive Treatise on inorganic a. theoretical
Chemistry, new impresion, London—N. Y.—Toronto, 1946—1947, vol. 1—16.
49. Schumacher J. C., Perchlorates, their Properties, Manufacture and
Uses, N. Y.—London, I960,
50. S n e e d M. C. and other, Comprehensive Inorganic Chemistry, N. Y,—
London.—Toronto, 1956—1963, vol. I—8 (изд. продолжается).
750 325
51. Ullmanns Encyktopadie d. technlschen Chemie(3 Aufl, MOachen—Berlin,
1951—1964, Bd. 1—14.(изд. продолжается).
52. W i n n а с к e г—К й c h 1 e r, Chemische Technologie, Mflnchen, 1959—
1961, Bd. 1-5.
Глава 111
53. Абковиц С., Бурке Д., Хилц P,, Титан в промышленности, nep
с англ., Оборонгиз, 1957.
54. Айз ей кольб Ф., Порошковая металлургия, пер. с нем., Металлург-
издат, 1959.
55. Беляев А, И., Металлургия легких металлов. Металлургия дат, 1954
56. Гуськов В. М,, Магний, статья в КХЭ [25], 1963, т. 2, стр. 1008—12.
57. Дерягин Б. В., Новый метод измерения удельной поверхности пори-
стых тел и порошков, «Заводская лаборатория», 1951, 17, № 3, 324; Деря-
гин Б. В, и Власенко Г. Я., Поточно-ультрампкроскопический метод
дисперсионного анализа, «Коллоидный журнал», 1951, 13, № 4, 249—55.
58. Исследования при высоких температурах. Сборник обзорных статей под
ред. В. А. Кириллина, ИЛ, 1962.
59. Крымов В. В., Техника безопасности при работе с магниевыми спла-
вами, Оборонгиз, 1955.
60. КубашевскийО., Гопкинс Б., Окисление металлов и сплавов. ИЛ,
1960.
61, Маколкин И. А., Верн иду б И. И. и др., Кинетика окисления
мелких порошков магния при повышенных температурах, ЖПХ, I960, 33, 824—
831; Маколкин И, А., Кинетика газовой коррозии магниевых сплавов, ЖПХ.
1957, 30, 1542.
62. Миллер Г. Д„ Цирконий, ИЛ, 1955. См. также «Металлургия циркония».
Под ред. Г, А. Меерсона, ИЛ, 1959.
63. М о р о з Л, С., Чечулин Б, Б., Полин И. В. и др.. Титан и его
сплавы, Судпромгиз, 1960.
64. Остроушко Ю. И. и Др-, Литий, его химия и технология. Атом
изд ат, 1960.
65. Самсонов Г. В. и др.. Бор, его соединения и сплавы, АН СССР.
Киев, 1960,
66. Самсонов Г. В., Портной К. И., Сплавы на основе тугоплавких
соединений, Оборонгиз, 1961.
67. Ситтиг М., Натрий, его производство, свойства и применение, Атом-
издат, 1961.
68. Стрелец X., Т а й ц А., Г у л я н и ц к и й А., Металлургия магния, Me
таллургиздат, I960.
69. У а н т Д., Барке Д., Металлический бериллий, ИЛ, 1961. Токсиколо-
гия бериллия, Сборник статей, пер. с англ., Под ред. А. А. Летавет, ИЛ, 1953.
69А. Ф и л я н д М. А,, Семенова Е. И., Свойства редких элементов, 1964,
М., Металлургнздат.
70. Херд Д,, Введение в химию гидридов, ИЛ, 1955.
71. Несмеянов Ан. Н., Давление пара химических элементов, АН СССР.
1961.
72. Славинский М. П., Физико-химические свойства элементов, Метал-
лу ргиз дат, 1952.
73. Стэлл Б. Д. Р., Таблицы давления паров индивидуальных веществ.
ИЛ, 1949.
74. Т о в а р о в В., Измерение удельной поверхности порошкообразных ма-
териалов, «Заводская лаборатория», 1948, 14, № 1, 68—76.
75. Э н т е л и с С. Г. и др., Измерение удельной поверхности пористых тел
н порошков методом истечения разреженного газа, ЖФХ, 1958, 32, № 9, 2187
76. Е d w а г d s Y. D., Wray R. D., Aluminium Paint a. Powder, N. Y.,
1955.
77. H a tn p e 1 C. A., Rare Metals Handbook, N. Y. 1961, 2-nd Edit.
326
78. Or г C., Jr. Delavallc J. M., Fine Particle Meassurement N. Y.r
1959.
79. Pannet E. V,, Magnesium, its Production a. Uses, London, 1949.
80. Pilling N. B., Bed worth R. E,, Окисление металлов при вы-
соких температурах, J. Inst. Metals, 1923, 29, 529—91.
81. Sartorius R., Выявление возможности применения кремния во
взрывчатых смесях, Mem. poudres, 1952, 34, 205—220.
82. Т а 11 е у С. Р., Горение элементарного бора, Aerospace Engng, 1959,
18, No 6, 37—40, перевод см. [225].
Глава IV
83. Авдеев Б. А,, Техника определения механических свойств металлов.
Мета л лур гиз дат, 1949.
84. Залыгин М. Ю., Порошковое металловедение, Металлургнздат, 1948
85. Киселев В. С., Абашина А. Ф., Производство лаков. Олиф и кра-
сок, изд. 2-е, Химиздат, 1961.
86. Лазарев А. И., Сорокин М. Ф., Синтетические смолы для лаков,
Химиздат, 1953.
87. Лосев И, П., Петров Г. С., Химия искусственных смол, Хймиздат,
1951.
88. Лосев И. П., Тростя некая Е. Б., Химия синтетических полимеров.
ГНТИ, 1964.
88А. Пакен А. М., Эпоксидные соединения н эпоксидные смолы, 1962.
Госхимиздат, Л,
89. Петров Г. С., Левин А. Н., Термореактивные смолы и пластические
массы, Госхимиздат, 1959,
90. Тростянская Е. Б., Колачев Б. А., Сильвестровнч С. И.,
Новые материалы в технике, ГНТИ, 1962.
91.
92.
Глава V
Демидов А. Н, Введение в пиротехнику. Воедиэдат, 1939—
Цытовнч П, С., Опыт рациональной пиротехники, СПБ, 1894.
Глава VI
93. Бринке Э. В,, Капуст и некий А. Ф., и др.. Термические констан-
ты неорганических веществ, изд. АН СССР, М.—Л., 1949.
94. Карапетьянц М. X,, Карапетьянц М. Л., Таблицы некоторых
термодинамических свойств различных веществ. Труды МХТИ им. Д. И. Мен-
делеева, вып. 34, 1961.
95. Кубащевский О., Эванс Э., Т ермохимия в металлургии, ИИЛ,
1954; Kubaschewski О., Evans Е., Metallurgical Thermochemistry, 2-nd Ed.,
N. Y., 1956.
96. Латимер В. M., Окислительные состояния элементов и их потенциалы
в водных растворах, ИЛ, 1954.
97. Попов М. М., Термометрия и калориметрия, изд, МГУ. 1954.
97А. Скуратов С. М., Колесов В. П,, Воробьев А. Ф, Термохимия,
ч. 1. 1964, изд. МГУ.
98. Rosslnj F., V agm а п D., Evans W-, LevinS., J a f f е I., Selec-
ted Values of chemical thermodynamic Properties Washington 1952, Clrc 500.
Глава VIII
99, Гейдон A„ Спектроскопия и теория горения, ИЛ, 1950,
100. Гейдон А.Вольфгард X., Пламя, его структура, излучение н тем-
пература, ИЛ, 1959.
101, Кадышевнч А. Е., Измерение температуры пламени, Металлург-
из дат, 1961-
327
102. Кириллин В. А., Шейн д л йв А, Е., Исследования термодинамиче-
ских свойств веществ, Энергоиздат, М,—Л„ 1963 (в том числе определение вы-
соких температур и калориметрия. А. Ш.),
103. Пожни П. Ф.. Мальцев В. М„ Гальперин Л. М., Установка
для определения температуры по высоте факела пламени пороха, Ж ФХ, 1960, 34.
ХЬ 5, 1131—33.
104. Соболев Н. И„ Оптические методы измерения температуры техниче-
ских пламен. Труды ФИАН СССР, 1956, 7, 161.
105- Dean J. A., Flame Photometry, N. Y., 1960.
106. Doyle W. L., Conway J. B., Grosse A. V-, Горение циркония в
кислороде, J, Inorg, a nuclear Chemistry, 1958, 6, No, 2, 138—144.
107. Grosse A. V., Conway J, В., Горение металлов в кислороде,
Ind. a. Engng., Chem., 1958, 50, No. 4, 668—72.
108. Harrison P. Сжигание титана и циркония. См. [147], 7-th
Symp., рр. 913—918.
109, Venturini J., Металлотермические реакции и классификация эле-
ментов, Вычисление температуры металлотеринческих реакций и влияние
подогрева, Metaux et Corrosion, 1953, 28, 293—301, 396—405.
Глава IX
у/11 0. А и д р е е в К. К., Термическое разложение и горение взрывчатых
веществ, Энергоиздат. М.—Л., 1957.
j, 111. А н д р ее в К- К-. Беляев А. Ф., Теория взрывчатых веществ,
Оборонгиз, 1960.
112. Афанасьев Г. Т., Боболев В. К., О флегматизации взрывчатых
веществ, ДАН СССР. |38, № 1, 186, 1961.
113. Баум Ф. А., Станюкович К. П., Шехгер Б. И.. Физика взры-
ва, Физматиздат, 1959.
114. Блинов И. Ф,, Влияние химической природы окислителей на чув-
ствительность смесей. Труды МХТИ им. Д. И, Менделеева, вып, 20, 1955, 289—298.
115. Боуден Ф., Иоффе А., Возбуждение и развитие взрыва в твердых
и жидких веществах, ИЛ, 1955.
116. Боуден Ф^, Иоффе А. Быстрые реакции в твердых веществах,
ИЛ, 1962,
117. Р е м п е л ь Г. Г., Ликин В, А., Безопасность труда при работе
с взрывчатыми веществами, Оборонгиз, 1963.
118. Семенов Н. Н.. О некоторых проблемах химической кинетики и ре-
акционной способности, АН СССР, 1954.
119. Теория взрывчатых веществ. Сборник статей под ред. Андреева К. К-,
Беляева А. Ф., Гольбиндера А. И., Горста А. Г., Оборонгиз, 1963.
120, Freeman Е. S.. Gordon S-, Термическое воспламенение систем:
нитрат', лития и магний, нитрат натрия и магний. J. phys. Chem., 1956, 60,
No. 7, 867—70.
121. Ра tai S., Hoffman E,f Прединициальные реакции некоторых го-
рючих с твердыми окислителями, J. applied. Chem. London, 1952, 2, 8—11.
122. Tomlinson W., A ud r t e t h L., Неожиданные химические взрывы,
1, Chem. Educ. 1950, 27, No. 11, 606.
' Глава X
123. Андреев К К, Зависимость скорости горения бикфордова шнура
от давления, ДАН СССР, (945, 49. № 6, 437.
124. Андреев К- К-, О горении взрывчатых веществ при низких давле-
ниях, ЖФХ. 1946. 20, 484.
125. БахмаИ Н. Н.. Беляев А. Ф., Влияние размера частиц на ско-
рость горения смесей на основе KClOf. ДАН СССР I960, 133, № 4, 866,
126. Беляев А, Ф;, Комков» Л. Д., Зависимость скорости Горения
термитов от давления, ЖФХ, 1950, 24, № 11, 1302,
328
127. Беляев А. Ф., Мазнев С, Ф., Зависимосгь'скорости горения дым-
ного пороха от давления, ДАН СССР, 1960, 131, № 4, 887.
128. Беляев А, Ф., Лука меня Г. В., О температурном коэффициенте
скорости горения дымного пороха, ЖФХ, 1962, 30, № 5, 1050.
129. Беляев А, Ф., Циганов С, А„ Горение при повышенных давлс
ниях конденсированных смесей с нелетучим и неразлагающимся горючим,
ДАН СССР, 1962, 146, № 2, 383,
130. Зельдович Я. Б., Горение и детонация в газах, изд. АН СССР, 1944.
131, 3 е л ь д о в и ч Я. Б., Об устойчивости режима горения пороха в полу-
замкнутом объеме, Журнал прикладной механики и технической физики, 1963,
№ 1, 67—76.
132, Зельдович Я. Б., Цепные реакции в горячих пламенах, «Кинетика
и катализ», 1961, 2, № 3, 305—318.
133. Марголин А. Д., О ведущей стадии горения, ДАН СССР, 1961,
141, № 5, 1131. .
134. Маркштейн Г., Горение металлов, «Ракетная техника и космонав-
тика», 1963, 1, № 3, 3—19.
135. Похил П. Ф., Ром од а нов а Л. Д,, Дииятротолуол в ракетном
топливе, ДАН СССР, 1959, |28, № 1, 133.
136. Семенов Н. Н., Цепные реакции в теории горения, «Успехи химни»,
1957 26, № 3, 273—93.
137. С е м е и о в Н. Н., Теория гомогенного горения однородных газовых
систем, Изв. АН СССР, ОТН, 1953, № 5, 708.
138, Хилл Р., Коттрелл Т,, Исследование процессов горения твердых
горючих. Статья в четвертом симпозиуме по вопросам горения и детонационных
волн. 1958, М., Оборонгиз, стр. 246—249.
139, Ш и д л о в с к и й А. А., Оран^ереев С, А., Исследование про-
цессов горения неорганических солей, бихромата и трихромата аммония, ЖПХ.
1953, 26, № 1, 25,
140. В е n t и г е S., Ish-Shatone М., L е п ] I L., Т г о с k е г М, Замедление
горения черного пороха посторонними веществами: Proc. Roy. Soc-, Ser, A.,
1955, 280, No. 1180. 33—46.
141. C a tn p b e 11 C., W e i n g а г t Q., Воспла мененне и горение черного
пороха, Trans. Far. Soc., 55, Pari 12, 221—228, 1959.
142. C a s s e 1 H. M., Liebtnan I., Горение частиц магния, Comb, a
Flame, 1962, 6, No. 3, 153-156 и 1963, 7, No, 1, 79—81.
143. Coffin К. P., Изучение горения магниевой ленты. См. [147], 5-th
Symp., 267—276,
144. Fettlng F., Успехи в исследовании процессов горения, Chemie—
Ing,—Technik, 1961,33, No 3, 166—172, Fettlng F., Пламена и горение, Отд.
выпуск из Fortschrltte Verfahrentechnik, 1958—1959, Bd 4, s. 739—776 (библио-
графия 486 наименований).
V
144А, F г i е d tn a n R., Macek А,, Горение частиц алюминия в атмос-
фере горячих газов, Comb. a. Flame, 1962, 6, 9—19.
145, Hershkowitz F., Schwartz F., Kaufman F. V- R., Горение
иеуплотненной смеси порошков перхлората калия и алюминия. См. [147],
8-th Symposium, 1962, рр. 720—727.
146. Kirschfeld Z., О скорости горения проволоки из легких метал-
лов, Metal, 1960, No. 3, 213—219.
147. I—IX, Symposium on Combustion (Intern,), 1946—1962, U, S- A.—Eng-
land.
Глава XI
148, Аванесов Д. С., Практикум по физико-химическим испытаниям ВВ,
Оборонгиз, 1959,
149. Андреев К- К., Горбунов В. В., Исследования по переходу
горения ВВ во взрыв, ЖФХ, 1963, 37, № 9, 1958.
150, Андреев К- К-, О механизме возникновения детонации ВВ,
Изв. АН СССР, ОТН, «Энергетика и автоматика», 1959, № 4, 188.
329
151, Андреев К К„ Об основных причинах различия между инициирую-
щими и вторичными ВВ, ДАН СССР, 1962, 146, № 2, 413,
152. Годжелло М. Г,, Взрывы промышленных пылей и их предупреж-
дение, изд, МКХ РСФСР, 1952,
152А, Гольбиидер А, И,, Лабораторные работы по теории ВВ, 1963,
Росвузиздат,
153, Сборник статей по теории взрывчатых веществ. Под ред. К, К, Андреева,
Оборонгиз, 1940.
154, Снитко К,, К-, Теория взрывчатых веществ, изд. 2-е, ч, 1 и 2, 1936,
Л., изд. Артакадемии,
155, Ш и д л о в с к и й А. А., Взрывчатые смеси воды и метилового спирта
с магнием и алюминием, ЖПХ, 1946, 19, № 4, 371—378.
156, Шиллинг Н. А,, Взрывчатые вещества и снаряжение боеприпасов,
Оборонгиз, 1946.
157, Cook М. A., Science of high Explosives, N, Y., 1958.
158, G г о d г 1 n s k I J,, Низкотемпературные взрывы перхлората калия
с горючими, J. appl, Chem,, 1958, 8,No,8, 528.
159. Langhans А., Неожиданные взрывы, Приложение к Z, Schiess—
u, Sprengstoffw. 1930,
160. Medard L., Взрывчатые свойства смесей магния или алюминия с
водой или метанолом, Mem. poudres, 1951, 33, 492—503.
161. Sc h 1 с h ter G, Взрывчатость порошков титана и циркония, Neue
Matte, 1958, 3, No 3, 187.
Глава XII
162, Андреев К. К., Кригер Г. Э., Хот В. Г., Об образовании
горючих газов при взаимодействии алюминия с водой и растворами аммиачной
селитры, ЖПХ, 1962, 35, 2569.
163. Акимов Г. В, Основы учения о коррозии и защите металлов, Метал-
лургиздат, 1946,
164. Воскресенский Н. П., Аналитические реакции между твердыми
химическими веществами и полевой химический анализ, Геолтехиздат, 1963,
164А . Коррозия металлов, Сборник статей, Пер, с франц. Мет а л лургиздат,
М„ 1964,
165, М е и д е л е е в Д, И,, Основы химии, Госхимиздат, 1947.
166, Розмаи Б, Ю„ О рациональном подборе ингибиторов термического
разложения аммиачной селитры, ЖПХ, 1960, 33, 1258.
167. Романов В. В„ Коррозия магния, АН СССР, 1961,
167А. Светлов Б. Я., Солнцева Р. М., О химической стабильности
алюминия в составе промышленных ВВ, Сборник «Взрывное дело», 52/9, Госгор-
техиздат, 1963, стр. 67—80.
168. Том а шов Н. Д., Теория коррозии и защиты металлов,
изд. АН СССР, 1959,
169, Шишаков Н. А, Андрущенко Н. К., Окисные пленки на маг-
нии, ЖФХ, 1956, 30, № 9, 1966—74.
170, Эванс Ю, Р., Коррозия и окисление металлов, Машгиэ, 1962,
171. Danner С. Е., Со Id еп son Y, Анализ термитно-зажигательных
составов и пиротехнических смесей, Апа[, Chem,, 1947, 19, 627—30.
Глава XIII
172. Айго М. А., Инфракрасное излучение, Эиергоиздат, 1957,
173. Бельский М., Бессекерский В,, Донской А,, Общая элек-
тротехника, Госэнергоиздат, 1951.
174, Бурьянов Б. П., Магнитоэлектрический осциллограф, Госзнерго-
яздат, 1952,
175, Г е р ш у и А . А., Избранные труды по фотометрии и светотехнике, Физ-
матиздат, 1956.
330
176. Дерибере M.F Практическое применение инфракрасных лучей. Гос-
энергоиздат, М.—Л., 1959.
177. Иванов Ю. А., Тяпкин Б, В., Инфракрасная техника в военном
деле, «Советское радио», 1963.
178. Л а н д с б е р г Г. С., Оптика, Гостехнздат, 1952,
179, Лукьянов С. Ю„ Фотоэлементы, АН СССР, 1948,
180. Малышев В. И., Инфракрасное излучение, Статья в физическом
да варе, т. 2, 1962.
181. Марголин М, Л., Румянцев Н. И, Основы инфракрасной тех-
ники, Оборонгиз, 1957.
182. М е ш к о в В. В., Основы светотехники, Энергоиздат, 1957.
183, Оптика в военном деле Сборник статей под ред. С. И. Вавилова,
АН СССР, 1945,
184. Шкур ин Г. П., Справочник по радиоизмерительной и электроизмери-
,ельной аппаратуре, Воениздат, <1956.
185. Т a v е г n i е г Р-, Изучение осветительных смесей, Мет. poudres.,
1949, 31, 309-426,
Глава XIV
186. Михайлов В. Я-, Фотография н аэрофотография, Геодезиздат, 1952.
187. Рождествин Н. П„ Аэрофотография, Воениздат, 1947.
188. Сафронов Л. Т., Ночное воздушное фотографирование, Воениздат,
1947,
189. Юцевич Ю, К-, Воздушное фотографирование ночью, «Вестник воз-
душного флота», 1956, № 5, 39—45.
190, Vaid Р. К-, Вспышечная бомба, Амер. пат. 2. 775. 938, 1957.
Глава XV
191, Т р е т ь я к о в Г, М., Боеприпасы артиллерии, Воениздат, 1947.
192. Е р р ig Н., German (racer Composition, London, 1945,
Глава XVI
193. Гуревич М. М., Цвет и его измерение, изд. АН СССР, 1950,
194, Шкловер Д. А., Иоффе Р. С., Универсальный фотоэлектриче-
ский колориметр ВЭИ, Изв. АН СССР, ОТН, 1951, № 5, стр. 667—681.
195. Е рр ig Н,, The chemical Composiilon of german pyrotechnic colored
signal Lights, 1945, London,
Глава XVII
196, Беляев А. И., Фирсанова Л. А., Одновалентный алюминий
а металлургических процессах, Металлургиэдат, 1959.
197, Блинов В. И., Худяков С. Н., Диффузионное горение жвдко-
тен, АН СССР, 1961.
198. Ван-Везер Д, Р,, Фосфор и его соединения, ИЛ, 1962.
199. Горлов А, П. Зажигательные средства, их применение и борьба
с ними, изд, Наркомхоза РСФСР, М.—Л., 1943.
200, Кнунянц И. Л., Фокин А, В., Покорение неприступного элемента
(фтора), АН СССР, 1963,
201. Лайнер А. И„ Алюминотермия, Статья в КХЭ [25], т .1, стр, 162.
202, Лосев Б. И., Кемский М. С., Троянская М. А., Твердый
бензин, Госгоптехиздат, 1959,
203. Р ы с с И. Г., Химия фтора и его неорганических соединений, Химиз-
дат, 1956.
204. Толмачев И. П,, Производство алюминиевого порошка, алюминие-
вой пудры и термита, Металлургиэдат, М,—Л., 1938.
205, Фтор и его соединения, Сборники статей под ред. Дж. Саймонса, тт. 1
н 2, ИЛ, 1953 и 1956.
331
206. Худяков Г. Н., Метод оценки горючести жидкости, Изе. АН СССР,
ОТН. № 4, 579—589, 1948.
207. Шишков Ю. Д., Опаловскнй А. Л., Физико-химические свой-
ства трифторида хлора, «Успехи химии», 1960, 29, № 6, 760—773.
208. Da utzenberg W., Алюминотермия, См. [51], Bd, 3, s. 423—436.
209. Н a J е k Н. V.t Напалм, Explosivstoffe, 1957, 5, No. 6, 121—126.
210. Ritter H. E., Зажигательные смеси двойного действия, содержащие
алюминий. Пат. ФРГ 1.114.419, 1962; реф. журнал «Химия», 1963, № 20, Н 387.
Глава XVI11
211. Вейцер Ю. М., Лучинский Г. М., Маскирующие дымы, Хим-
издат, 1947; Вейцер Ю. М., Лучинский Г. М., Химия и физика маски-
рующих дымов, Оборонгиз, М.—Л., 1939.
212. Павлов В., Применение маскирующих дымов в армии США, «Воен-
ный вестник» 1950, 1, 55—60.
213. Gordon S., Campbell С., Реакции прединнциирования и воспла-
менения в системе Zn/C6CI6/KC104. См. [147], 5-th Symp., рр. 277—284.
Глава XIX
214. Коган И. М-, Химия красителей, изд. 3-е, 1956, М., Госхимиздат.
215. Colour Index, 1956, Bradford, vol. I, 2 ed. (справочник).
216. Eppig H., The chemical Composition of german pyrotechnic smoke
Signals, London, 1945.
217. N i m m e г о f f J-, Wilson S- W., Колориметр для определения
цветности пиротехнических дымов J. Res. Bur. Stand, 1954, 52, No. 4, 195—199.
218. Tuve Р., SprlngS., Пиротехнический отметчик. Амер, пат-
2. 469. 421, 1949.
Глава XX
219. Абрамович Г. Н., Газовая динамика воздушно-реактивных двига-
телей, Изд. БНТ, 1946.
220. Алемасов В. Е., Теория ракетных двигателей, Оборонгиз, 1962.
4. 221. Баррер М., Жоммот А., Вебек Б., В а н д ен к а р к х о в е Ж..
Ракетные двигатели, Оборонгиз, 1962.
222. Бондарюк М. М., Ильященко С. М., Прямоточные воздушно-
реактивные двигатели, Оборонгиз, 1958.
223. Жидкие и твердые ракетные топлива, Сборник статей под
ред. Ю. X. Шаулова, пер. с англ., ИЛ, 1959.
224. лЗ е л ь д о в и ч Я. Б., Ривин М. А., Франк-Каменецкий Д. А..
Имодлъс реактивной силы пороховых ракет, Оборонгиз, 1963.
^225. Исследование ракетных двигателей на твердом топливе. Под
ред?--М. Саммерфилда, ИЛ, 1963.
226. Куров В. Д., Должанский Ю. М., Основы проектирования по-
роховых ракетных снарядов, Оборонгиз, 1961.
227. Максвелл В., Юнг Г., Большие двигатели на ракетном топливе.
«Вопросы ракетной техники», 1962, 12, № 1, 3—20.
v 228. П а у ш к и и Я - М., Химия реактивных топлив, АН СССР, 1962.
,-229. Процессы горения, Сборник статей под ред. Льюис Б,, Пиз Р., Тэйлор X..
Физматгнз, пер., с англ., 1961.
229А. Ракетные двигатели твердого топлива (обзор), «Вопросы ракетной
техники» 1964, Ns 6, 32—74.
230. Реактивные двигатели. Сборник статей под ред. Ланкастера О- К-,
пер. с англ., Воениздат, 1962.
231. С е р е б р я к о в М. Е., Внутренняя баллистика ствольных систем
и пороховых ракет, Оборонгиз, 1962.
232. Синярев Г. &, Добровольский М. В., Жидкостные ракетные
двигатели, Оборонгиз, 1957.
332
К233. Термодинамические свойства и иди в н дуальных веществ, Справочник
в двух томах под ред, В. П. Глушко, изд. 2-е, АН СССР, 1962.
234. Ф е о д о с ь е в В. И., Синярев Г. Б., Введение в ракетную тех-
нику, изд. 2-е, Оборонгиз, 1961.
235. Химия твердого состояния. Коллективный труд группы английских уче-
ных под ред. В. Гарнера, ИЛ, 1961,
236. Холмс Дж., Прогресс в области производства твердых топлив, «Во-
просы ракетной техники», 1960, № 6, 20—26; Штутгарт Б., Основные тенден-
ции развитии ракетных топлив; там же, стр. 3—17.
237. Шидловский А. Д, Термическое разложение и горение прн атмо-
сферном давлении аммиачной селитры с различными добавками. Известия ВУЗов,
серия «Химия и химическая технология», 1958, 1, № 3, 105—110, там же, Способ-
ность к внутримолекулярному горению неорганических солей аммония,
3, № 3, 405—407, 1960; Шидловский А. А. и ШмагинЛ. Ф., Термиче-
ское разложение и горение перхлората аммония; там же, 5, № 4, 529—32, 1962.
238. Шольмоши Ф., Ревес Л., Термический распад перхлората аммо-
ния в присутствии окиси железа, «Кинетика и катализ», 1963, 4, № 1, 88—96.
239. Реферативный журнал, серия «Авиационные и ракетные двигатели».
1963, № [—12.
240. Arden Е. А-, Pawling J., S m i t h W. A. W., Исследование го-
рения перхлората. Comb. a. Flame, 1962, 6, No. 1, 21—23.
241. Blackman A. W., Kuehl D. K-, Использование смесей в спла-
вов легких металлов в качестве добавок к твердым порохам, ARS—Journal,
1961, 31, No- 9, 1265—72.
242. Br z ц s t о w s k i T. А., О горении добавок металлов в ракетных
двигателях твердого топлива, Canad. Aeron, a Space Journal 1963, 9, No 5,
141—149.
243. Dekker А- О., Твердые пороха, J. chem. Educ, 1960, No.ll, 597—602.
244. Engel R. Предел мощности классических твердых топлив, Rake-
tentechnlk it. Raumfahrtforschung, 19®, 3, Heft 1, 14—18.
245. F a r b e r M., Твердые пороха на основе соединений фтора, Astro-
nautics, 1960, No- 8, рр 34 40, 42.
246. Friedman R., Nugent R, G-, Rumbell R. E., Scurlock A-,
Горение перхлората аммония, Статья в [147], 6-th Symp. 612—618.
247- Gordon S., Химия высоких температур и ракетные топлива на
основе металлов, Jet Propulsion, 28, No. 11, 1958, 769—770.
248. Higgins H. M., Oongwer С. В., Твердые ракетные топлива, Амер,
пат. 2.967 . 097. 1961.
249. Jа с о bs Р. W. М., Kureishy A. R. Т., Термическое иницииро-
вание системы из перхлората аммония и закиси меди, J. chem Soc. London,
1962, No. 2, 556—561, см. также статьи в [147] 8-th Symp., рр. 656—710.
250. Kit В., Eve red D. S., Rocket Propellant Handbook N. Y., 1960.
251- M e g u I г e, Роль твердого топлива возрастает, Miss. a. Rockets,
1959 5. No. 31, 31—34, 27/VII.
25ZW о it t e t A-, Mo utet H., Усовершенствование гипергольных систем,
ибнользуемых в ракетах, Франц, патенты 76.768. 1961 и 78-084, 1962.
253. Munter Р- Z., Исследование возможности использования прямо-
точных воздушно-реактивных двигателей твердого топлива, JAS Paper, 1961,
No. 129,
254- Olson W. T., SetzeP. S., Некоторые проблемы горения высоко-
эффективных топлив для авиадвигателей, См. [147], 7-th, Symp., рр. 883—893.
255- Paleari С-, R е n z а п i g о F., Пороха для ракет, Журнал La Rivista
dei Combustibili, 1957, 11, No. 12, 841—873.
256- Part el G., Подбор топлива для реактивных торпед, Rivista di
Ingegneria, 1962 No. 11, 1199—1206.
257. Ratz H., Petters W., Ракетные топлива, статья в [51], 1963, Bd,
14, 561—574.
258. S 1 a u g t h е г L., Разработка метеорологической ракеты с прямо-
точным двигателем твердого топлива, ARS-Preprint, 2343—62.
333
259. Tavernier P., Brisson J., Изготовление н свойства твердых
смесевых порохов, Метл, poudres, 1960, 42, 305—320.
260. Т а у 1 о г X, Solid Propellant a. exothermic Composition, London,
1959.
26L White W- D., Литий и натрий для подводных реактивных двига-
телей, Astronautics, 1957, No. 4, 38—39.
262. Zaehringer A. L, Solid Propellant Rockets, 1958, Michigan.
263. Zlmney Ch. M,, Одноступенчатая ASP—ракета на твердом топ-
ливе, Jet Propulsion 1957, 27, No. 3, 274,
264. Zwlcky F., Реакции, используемые в устройствах, работающих
под водой., Амер, патент 2. 461. 797, 1949.
265. Aviation Week, 1960, 72, No. 14, 78—91; там же, 1957, 67, No. 15
123.
266. Miss a Rockets 1960, 6, No. 30; там же, 1959, 5, No. 41.
267. Chem. Week, 1961, 88, No. 2, 61—62-
268. U- S. Dept, Comm. OHice Techn, Serv. AD 260, 1961; Chem. Abstr-
1963, 58, No. 1, 401.
Глава XXI
269. Баум Ф. A-, Трубочные порох и дистанционные составы, Обо-
ронгиз, 1940.
270. Бубнов П. Ф-, С у х о в И. 11., Средства инициирования, Оборон-
гнз, 1945.
271. Максвелл Б., Пиротехнические свистки. Статья в четвертом
симпозиуме по вопросам горения и детонационных волн, пер. с англ. Обо-
ронгиз^ 1958.
272. Johnson L.B., Замедляющие составы, Ind. a engng Chem., 1960,52,
No. 10, 868-
273. Амер, патент 2.988,876, 1961.
274. ARS-Preprlnt, 977—59.
Глава XXII
275. Аксенов М. Я., Вернидуб 14- И., Г а й в о р о п с к и й И. 14.,
Карцивадзе А. И., Плауде М. О., Соловьев А. Д., Шишлии-
цев В. В, Получение льдообразующего аэрозоля с помощью пиротехнических
составов, Труды Центр. Аэрологии, обсерватории, 1962, 44, 63. Аксенов М. Я
и др., Исследование льдообразующей активности йодистого серебра, генерируе-
мого при горении пиротехнических составов. Труды ин-та Геофизики
АН Груз. ССР, 1962, т. 20.
276, Аэрозоли в сельском хозяйстве. Сборник статей, Под ред. А. Г. Амелина,
Сельхозгиз, 1956.
277. Быстров Г. П,, Спичечное производство, Лесбумиздат, М.—Л., 1950.
278. Верни дуб 14. И, Жихарев А. С., Мед а лиев X. X.,
Правдун Н. С., Сулаквелидзе Г. К-, Чумакова Г, Г., Исследо-
вание льдообразующих свойств иодисторо свинца, Изв. АН СССР, серия геофи-
зическая, 1962, № 9, 1286—1293,
279. Герасимов Б. А., Осницкая Е. А., Сидоров А. И., Серные
шашки, «Защита растений от вредителей и болезней», 1960, № 10, 34—35.
280. Жигалов М . Л., Исследование вторичного дробления руды брике-
тированным термитом, Сборник трудов Моск. Горн, ин-та, 1958, № 24, 157—178.
Каплунов Р. П., Жигалов М. Л., Вторичное дробление руды брикетиро-
ванным термитом, «Безопасность труда в промышленности», 1958, № 8, 26—28,
281. 3 а л к о в ев М., Гридунов А., Фасонное литье из термической
стали, изд. ГУМОСДОР МВД СССР, 1950,
282. Киселев 14. И., Термитный способ размораживания мерзлых грун-
тов, «Строительная промышленность», 1957, № i. 30.
283. Л а ц ш и н В. В., Логинов М. Н., Термитная сварка рельс на пу-
тях Московского трамвая, изд. МКХ РСФСР, 1951.
334
284, Лихачев В. А., Пиротехника в кино, Госкинонздат, 1944.
285. Мейсон Б. Д., Физика облаков, Гидрометеоиздат, 1961, Никаид-
ров В. Я-, Искусственные воздействия на облака и туманы, Гидрометеоиздат, Л.,
(959.
286. Николаев В., Новые средства, применяемые при разработке мерзлых
грунтов, Военноинженерный журнал, 1954, № 1, 26.
287. Сидоров А. И., Аэрозольные ташки. «Зашита растений от вреди-
телей и болезней», 1960, № 2, 8, 38—39.
288. Слободкин Д, С., Невыгодность способа оттаивания мерзлых грун-
тов горящим термитом, Горны^ журнал, 1955, № 10, 58.
289. Справочник спичечннка, Лестехиздат, 1947,
290. Шкловский И. С., Курт В. Г„ Искусственные спутники земли
<ИСЗ), 1959, вып. 3, стр. 66, см. также сборник «На пороге в космос», ИЛ,
i960, стр. 315.
291. Burchell Т., Алюминотермический процесс и приготовление ком-
мерческих чистых хрома и марганца. Статья в сб. The Refining of Non-fer-
rous Metals, London, 1950, pp. 477—505-
292. F a g g Z. W., Friedman R., Твердые пороха как источники цези-
евой плазмы, «Ракетная техника", 1961, №1,122.
293. М а г R е D., Lilly С., Образование инсектисидных дымов, J.Sci Food
Agr., 1951, 2, 56-
294. S с h е с 1 е г W- Н., Miller А. А-, a A h е г я. Хлоратные свечи как
источники кислорода, Ind. a. Engng. Chem., 1950, 42, No 11,2348—58.
Глава ХХ1Н
295, Булавин И. А., Силенок С. г,, Машины для производства
строительных материалов, Машгиз, 1959.
296. В о ж и я к Е., Производство пиротехнических средств. Добавление
к польскому переводу книги А. А, Шидловского «Основы пиротехники», 1957,
Варшава,
297. Воронцов И. И., Вспомогательные процессы и аппаратура анило-
красочной промышленности, Госхимиздат, 1949.
298. Лебедев П. Д., Расчет и проектирование сушильных установок, Гос-
энергоиздат, 1963.
299. Плановский А. Н. и др.. Процессы и аппараты химической тех-
нологии, Госхимиздат, 1962.
300. Смирнов В. Я-, Введение в технологию пиротехнических произ-
водства, Оборонгиз, 1939.
Авторские свидетельства
1, Бурлей В. В., Набоков В. А., Казакова В. 14., Состав дли изго-
товления инсектицидных дымовых шишек. Авт. свид. № 100910, 1953.
2. Вер ни ду б 14. И., Шищминнев В. В., Пиротехнический состав для
снаряжения противоградовых ракет и патронов. Авт. сьид. № 140630 1961.
3, Вернидуб 14. 14., Королев А. 14., Чумакова Г. Г. н К о т о-
н а А. Г„ Способ изготовления пиротехнических составов для противоградовых
ракет и патронов. Авт. свид. № 146127, 1962.
4. Н о в и к о в В. А., Казакова В. И., 14 в а в о в а 3. В., Малини-
на М. С,, Инсектицидный дымообразующий состав. Авт, свид. № 139053, 1961.
5. Новиков В. А., Казакова В, 14., Иванова 3, В., Малини-
на М. С., Инсектицидный дымообразующий состав. Авт. свид. № 631302, 1962.
6. Сидоров А, И., Герасимов Б. А., Осницкая Е. А.,Митрофа-
нов П. И., Фунгицидный состав для изготовления аэрозольных таблеток и ша-
шек. Авт. свид. № 140292 1961.
7. Сидоров А, И., Митрофанов П. И., Акарицидная аэродольная
смесь. Авт. свид. № 147666, 1962.
8. Сидоров А, И., Митрофанов П. И., Терентьев С. Н., Акари-
цидная аэродольная смесь. Авт. свид. № 148998, 1962,
ОГЛАВЛЕНИЕ
Стр.
Предисловие............................................................ 3
ЧАСТЬ ПЕРВАЯ
Г лава /. Общее понятие о пиротехнических средствах и пиротехнических
составах ........................................................ 5
§ 1. Классификация пиротехнических средств и составов............. 5
§ 2. Горение составов............................................. 7
§ 3. Требования, предъявляемые к пиротехническим средствам и со-
ставам ........................................................... 9
§ 4. Назначение компонентов состава........................ 11
§ 5. Возможные высокоэкзотермические реакции.........*..... 12
§ 6. Способность к горению различных веществ и смесей .... 16
Г лава II. Окислители................................................ 17
§ 1. Выбор окислителей и их классификация.................. 18
§ 2. Физико-химические свойства окислителей................ 20
§ 3. Гигроскопичность окислителей ............................... 27
§ 4. Технические требования, предъявляемые к окислителям ... 30
§ 5. Производство окислителей.............................. 31
Г лава III. Горючие вещества ... . ................................ 33
§ 1. Выбор и классификация горючих веществ................. 33
§ 2. Высококалорийные горючие.............................. 35
§ 3. Технические требования, предъявляемые к порошкам металлов 46
§ 4. Производство металлических порошков................... 47
§ 5. Неорганические горючие средней калорийности........... 49
§ 6. Органические горючие........................................ 50
Г лава IV. Методы уплотнения составов и испытание прочности звездок.
Цементаторы: органические полимеры ,............................ 54
§ 1. Методы уплотнения составов. Назначение цементаторов ... 54
.§ 2. Испытание прочности звездок................................ 55
§ 3. Факторы, влияющие на прочность спрессованных составов . . 57
§ 4. Классификация цементаторов. Их физико-химические свойства 59
§ 5. Количество вводимого в состав цементатора................... 63
Г лава V. Принципы составления и расчета пиротехнических составов . . 64
§ 1. Расчет двойных смесей . . , . .............................. 64
§ 2. Составление и расчет тройных и многокомпонентных смесей . 67
§ 3. Расчет составов с отрицательным кислородным балансом ... 68
§ 4. Расчет металлохлоридных составов . . . ..................... 70
§ 5. Расчет составов с фторным балансом.......................... 72
336
Стр.
Глава VI. Теплота горения пиротехнических составов . , . .'............ 73
§ 1. Вычисление теплоты горения...............................« 74
§ 2. Экспериментальное определение теплоты горения............... 78
§ 3. Связь между назначением составов и теплотой их горения . . 80
Глава VII. Газообразные продукты горения пиротехнических составов . . 80
Г лава VIII. Температура горения пиротехнических составов.............. 85
§ 1. Вычисление температуры горения составов..................... 85
§ 2. Экспериментальное определение температуры горения .... 91
§ 3. Связь между назначением состава и максимальной температу-
рой горения...................................................... 99
Г лава IX. Чувствительность пиротехнических составов.................. 100
§ 1. Определение чувствительности составов к тепловым воздейст-
виям ........................................................... 191
§ 2. Определение чувствительности составов к механическим воз-
действиям ...................................................... 106
§ 3. Факторы, влияющие на чувствительность составов к начальным
импульсам....................................................... 111
Глава X. Механизм горения и факторы, влияющие на скорость горения
пиротехнических составов ПО
§ 1. Механизм горения составов . . . . ,........................ 116
§ 2. Факторы, влияющие на скорость горения составов............ 121
Глава XI. Взрывчатые свойства пиротехнических составов ............... 130
Глава XII. Физическая и химическая стойкость пиротехнических составов 141
§ 1. Изменения, происходящие в составах при хранении............ 141
§ 2. Методы определения гигроскопичности и химической стойкости
составов........................................................ 148
§ 3. Понижение эффективности составов при хранении и допусти-
мые сроки их хранения . , . . ........................ 151
ЧАСТЬ ВТОРАЯ
Глава XIII. Осветительные составы..................................... 153
§ 1. Специальные требования, предъявляемые к осветительным со-
ставам ....................................................... 153
§ 2. Тепловое и люминесцентное излучение........................ 155
§ 3. Световые характеристики составов........................... 158
§ 4. Составление двойных смесей................................. 161
§ 5. Многокомпонентные осветительные составы.................... 167
§ 6. Основы фотометрирования и радиометрирования пламен пиро-
технических составов............................................ 171
§ 7. Влияние условий сжигания на силу излучения пламени и уста-
новки для стационарного испытания............................... 178
Глава XIV. Фотосмеси ................................................. 182
§ 1. Назначение фотосмесей. Ночное воздушное фотографирование.
Фотоматериалы.............................................. 182
§ 2. Фотобомбы.................................................. 186
§ 3. Методы определения характеристик фотовспышек............... 187
§ 4. Фотосмеси. Требования к ним. Факторы, влияющие на оптиче-
ские характеристики вспышек и свойства фотосмесей............... 190
Глава XV. Трассирующие составы . . . ................................. 196
§ 1. Краткие сведения об устройстве трассеров. Светотехнические
расчеты......................................................... 196
22 А. А. Шидловский 337
Стр.
§ 2. Требования, предъявляемые к трассирующим составам . . . 200
§ 3. Рецепты трассирующих составов. Методы испытания............ 202
Г лава XVI. Составы сигнальных огней................................. 204
§ 1. Системы сигнализации. Требования, предъявляемые к составам 204
§ 2. Характер излучения пламени................................. 205
§ 3. Принципы построения составов и основные требования к их
компонентам................................................... 206
§ 4. Составы желтого огня....................................... 208
§ 5. Составы красного огня...................................... 210
§ 6. Составы зеленого огня...................................... 214
§ 7. Составы синего и белого огня............................... 217
§ 8. Методы испытания . . , .................................... 218
Г лава XVII. Зажигательные составы................................... 221
§ 1. Поджигаемые материалы...................................... 221
§ 2. Классификация зажигательных составов и предъявляемые
к ним требования . . . . >...................................... 223
§ 3. Термиты.................................................... 224
§ 4. Термитно-зажигательные составы............................. 229
§ 5. Зажигательные составы с окислителями-солями................ 231
§ 6. Жидкие нефтепродукты и отвержденные горючие. Огнеметные
смеси........................................................... 232
§ 7. Сплав «электрон»........................................... 235
§ 8. Фосфор и его соединения . . . . ,.......................... 236
§ 9. Галоидные соединения фтора................................. 238
§ 10. Прочие зажигательные вещества и смеси..................... 240
§11. Методы испытания зажигательных составов. Тушение зажига-
тельных составов . « , , ....................................... 241
Г лава XVII1. Составы маскирующих дымов.............................. 245
§ 1. Общие сведения об аэрозолях............................... 245
§ 2. Оптические свойства аэрозолей.............................. 247
§ 3. Способы получения аэрозолей............................... 249
§ 4. Составы маскирующих дымов и предъявляемые к ним требо-
вания .......................................................... 251
Г лава XIX. Составы цветных дымов . t , ...................... 257
§ 1. Сигнализация при помощи цветных облаков и способы их по-
лучения ........................................................ 257
§ 2. Красители, применяющиеся в составах сигнальных дымов . . . 260
§ 3. Составы цветных дымов . . . , ,............................ 262
§ 4. Методы испытания составов цветных дымов.................... 266
Г лава XX. Твердые пиротехнические топлива........................... 267
§ 1. Классификация и энергетические характеристики.............. 267
§ 2. Эксплуатационные требования................................ 280
§ 3. Окислители . . . ......................................... 281
§ 4. Органические и металлические горючие....................... 283
Г лава XXI. Воспламенительные составы. Прочие виды пиротехнических
составов....................................................... 285
§ 1. Воспламенительные составы и предъявляемые к ним требования 285
§ 2. Воспламенительные составы для ракетных двигателей .... 288
§ 3. Прочие виды пиротехнических составов: безгазовые, имитацион-
ные, свистящие.................*................................ 289
Г лава XXII. Применение пиротехнических составов в народном хозяйстве.
Спичечные составы............................................ 292
Г лава XXIII. Основы технологии пиротехнического производства .... 300
338
§ 1. Подготовка компонентов................................... 301
§ 2. Приготовление составов................................... 308
§ 3. Уплотнение (формование) составов......................... 310
§ 4. Снаряжение изделий ..................................... 313
Краткий очерк истории развития пиротехники в России ............ 314
Приложения ....... ............................................... 318
1. Теплота образования окисей, фторидов, хлоридов и сульфидов
некоторых элементов...........................................
2. Рецепты дистанционных составов..........................в-
3. Средние значения давления и температуры воздуха на разной
высоте в умеренных широтах...................................
4. Теплота образования окисей как функция порядкового номера
элемента.....................................................
Литература . . . ......................................... . . .
Замеченньп э опечатки
Стр. Строка Напечатано Следуе! ' читать
41 21 снизу 0,07 Н 0,07
103 24 снизу Zn Z г
198 Подпись к фиг. 15.4 относится к фиг. 15.5 и наоборот
209 Табл. 16. 1. В графе 6 7 снизу ^пл— =292°С 6ui=992°C
Заказ 750/1894 SSlS'l
ОСНОВЫ ПИРОТЕХНИКИ
. Александр Александрович Шидловский
Редактор И. А. Суворова Техн, редактор М. С. Владимирова
Г12402 Подписано в печать 3/IX 1964 г. Учетно-изд. л. 21,90
Формат бумаги 60Х90|Лб= 10,63 бум. л.—21,25 печ, л,+1 цвети, вклейка.
Цена 92 коп. Тираж 4000 экз. Бланк заказа № 22 Заказ 750/1894
Московская типография № 26 «Главполиграфпрома»
Государственного комитета Совета Министров СССР по печати
Ул. Чернышевского, 9.