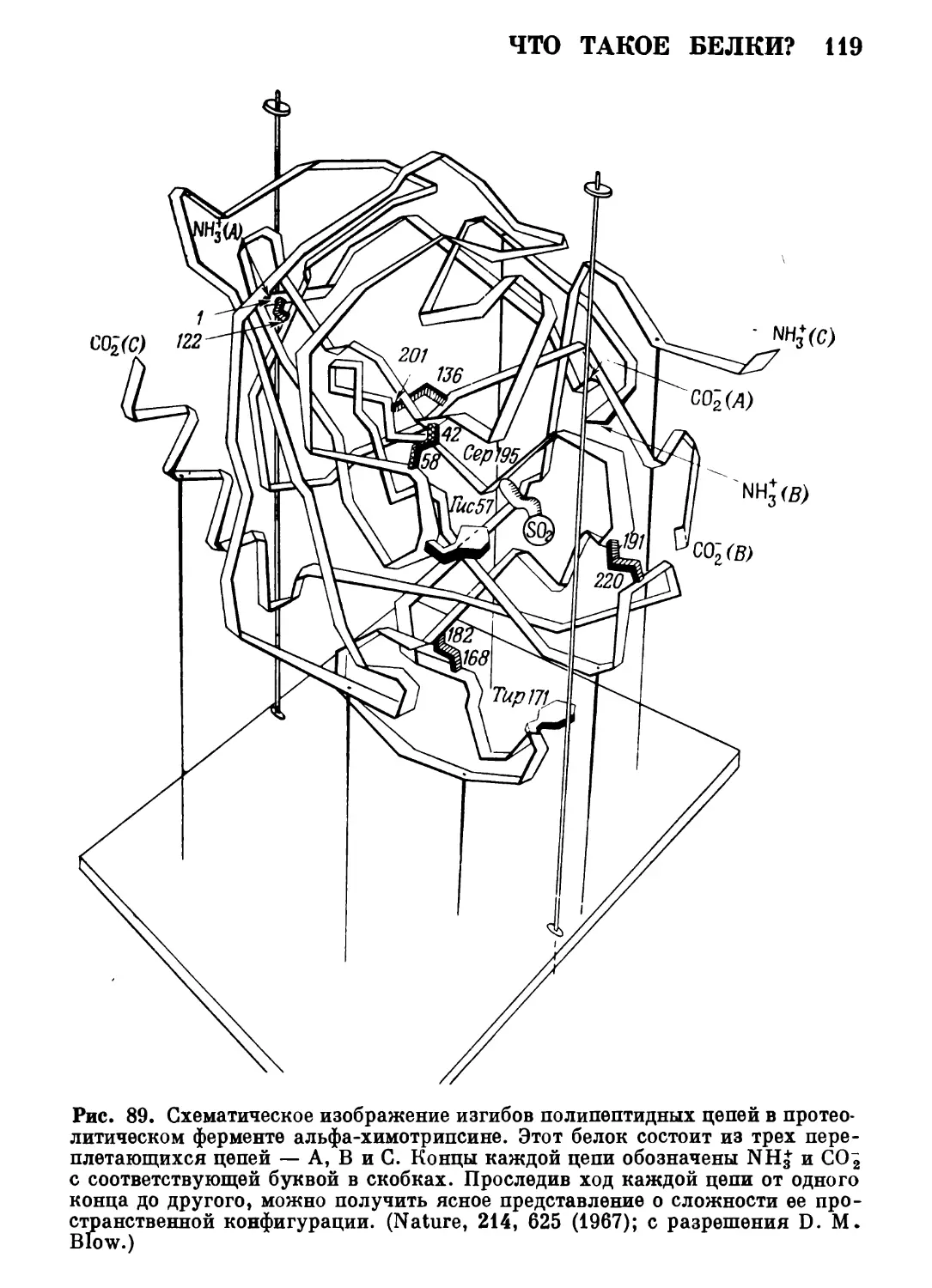
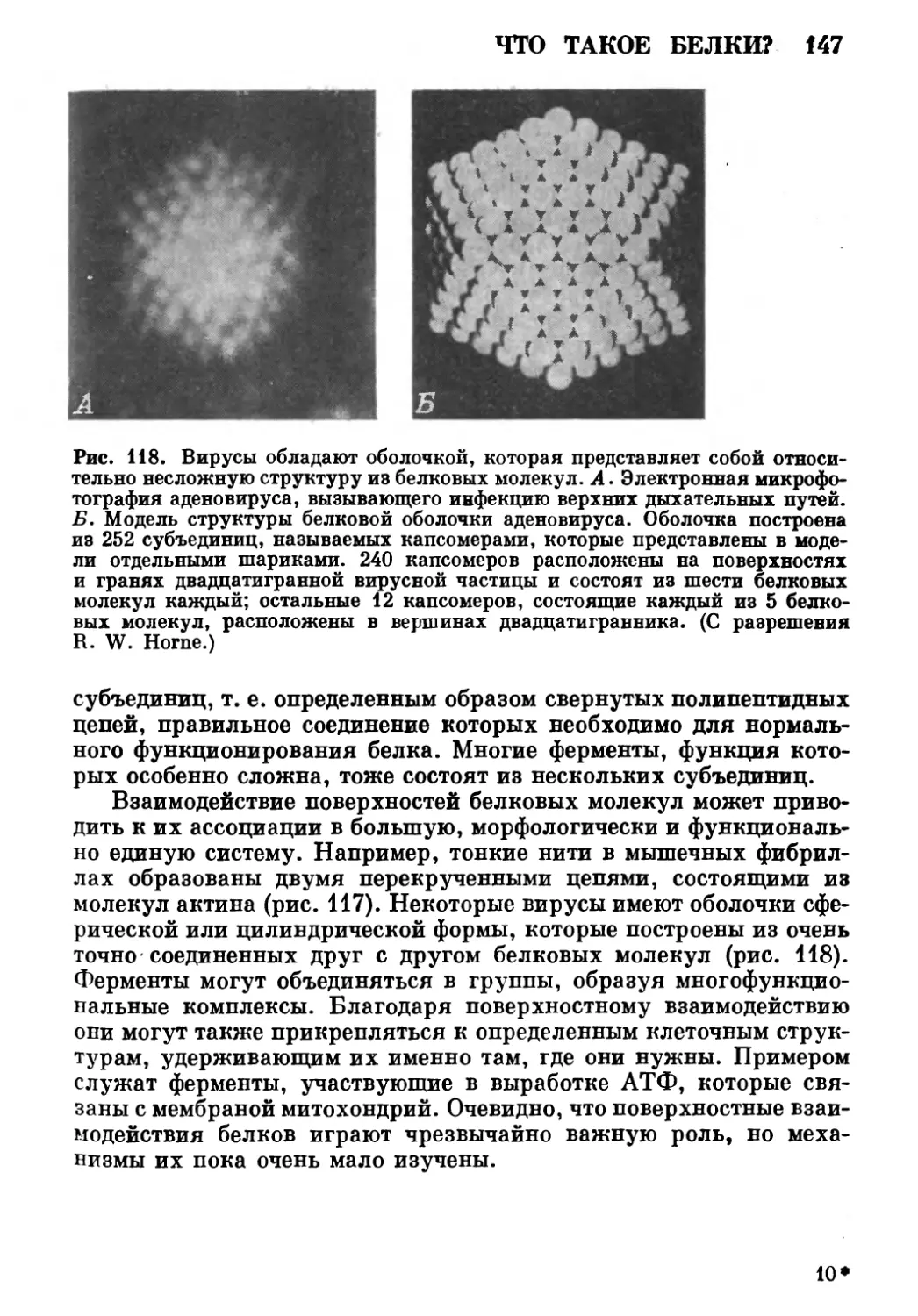
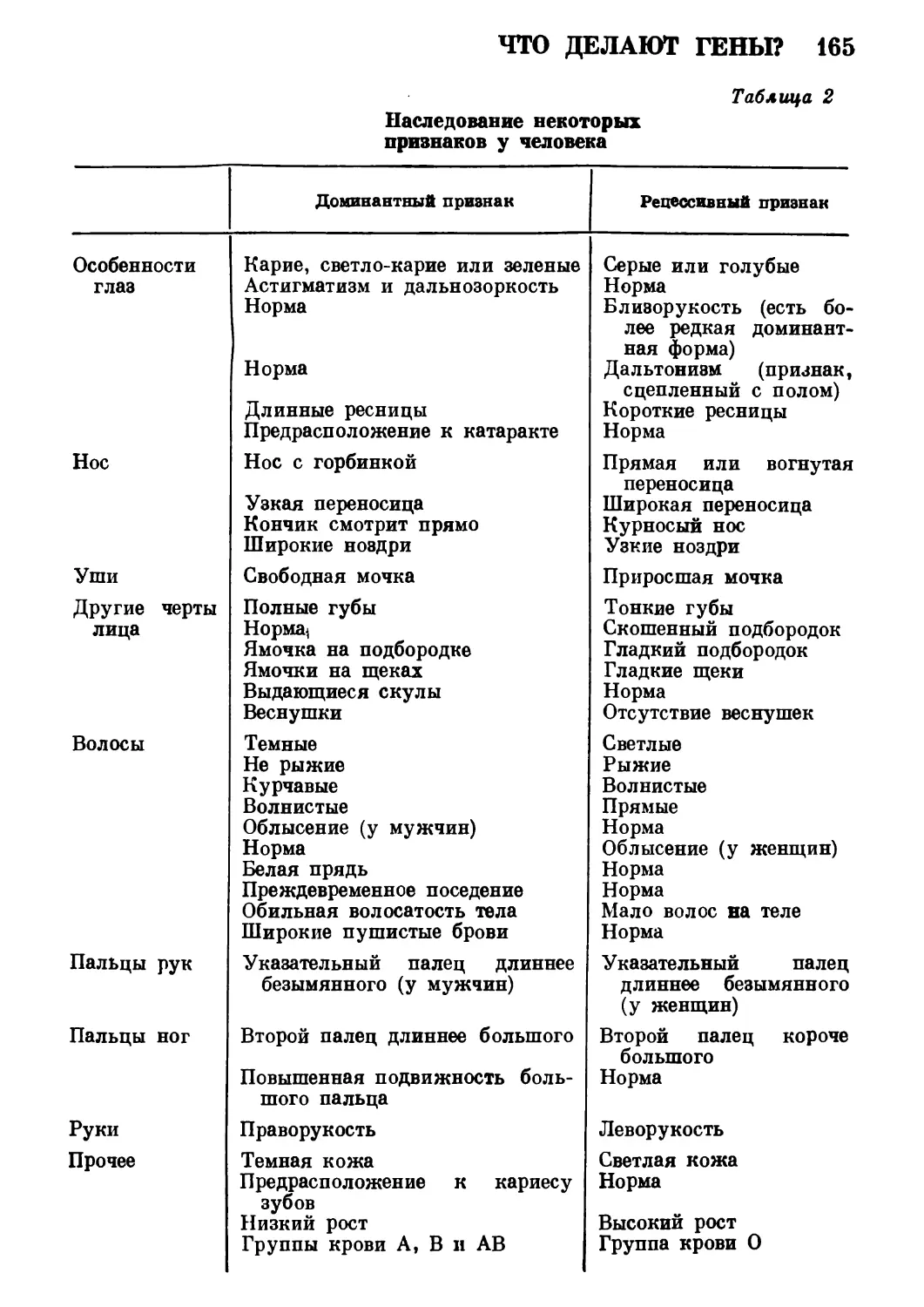
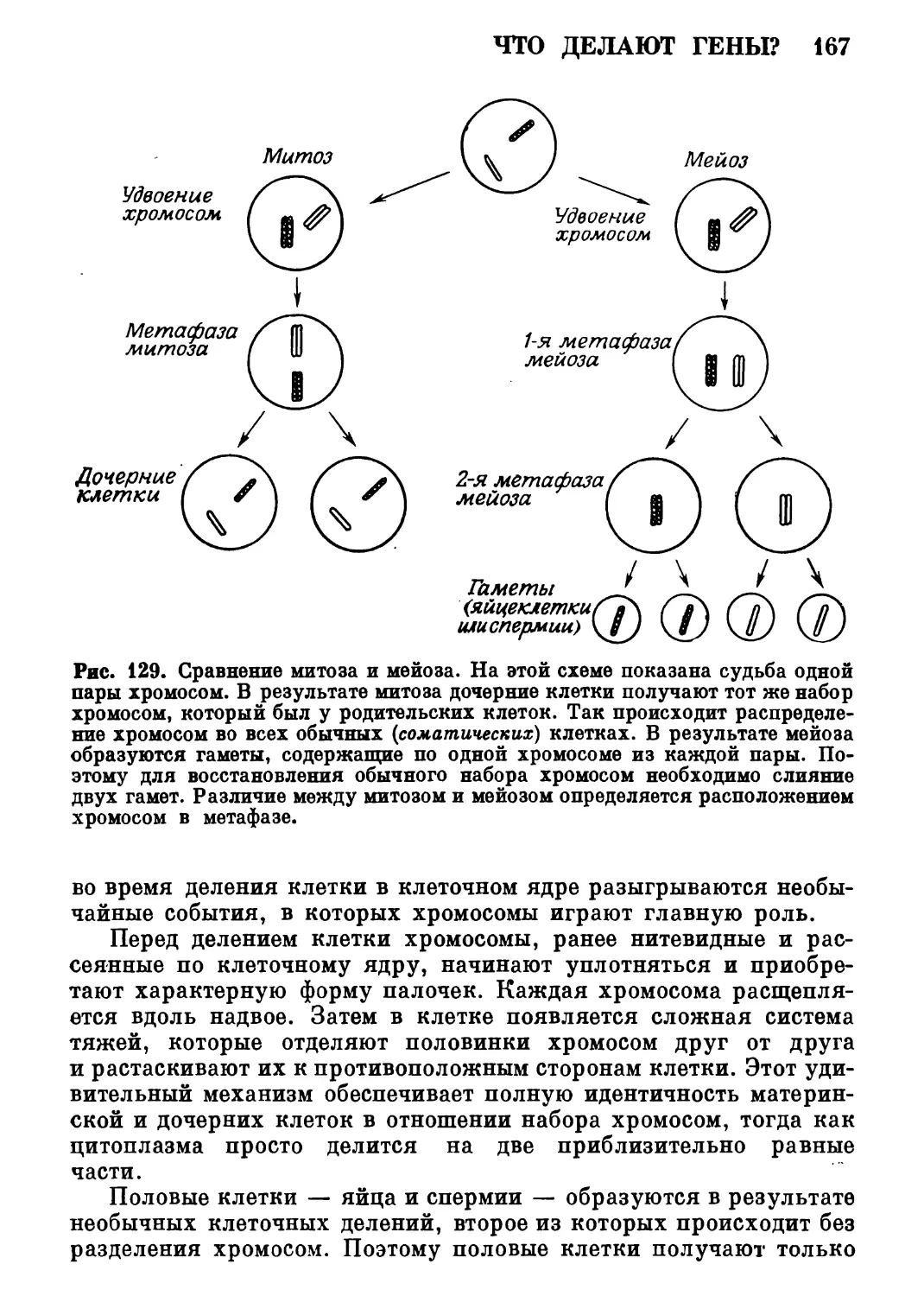
Автор: Роллер Э.
Теги: биология клетки и субклеточных частиц цитология биология эволюционный процесс
Год: 1978
Текст
ОТКРЫТИЕ ОСНОВНЫХ
;'; ю&*?^&&?&ШШ
^Ш^Ш^^^ШШ^ШП ЯI/ П11П П
«шшШОНОВ
WW
Г4Ж
Роллер
ш
F.Wilkins, J. D. Watson, F. Crick
МАЯ СПИРАЛЬ
•enberg
1ЕСКИЙ КОД
tiAA,GA(?
'GUG.GUQGUAN
UGUGUGUGU.
UGUGUfrUGl
.ALTCAUCAITC,
AAAAAG,
Ш^^^Ш1^ШИ^^^^Ш^Ш^ШШ^ШШ^В^ВШ^
DISCOVERING
THE BASIS
OF LIFE
AN INTRODUCTION
TO MOLECULAR BIOLOGY
ANN ROLLER
MCGRAW-HILL BOOK COMPANY
NEW YORK, 1974
ЭНН РОЛЛЕР
шщ
Перевод с английского
А. М. Колчинского
и В. М. Родионова
Под редакцией
д-ра биол. наук В.
М. Родионова
ИЗДАТЕЛЬСТВО «МИР»
МОСКВА 1978
УДК 576.3
В книге изложены история развития и основные
достижения молекулярной биологии — от открытия живой клетки
до выяснения механизмов биосинтеза белка, строения и
функционирования генов. Рассмотрены перспективы дальнейшего
развития молекулярной биологии и значение ее достижений
для расшифровки таких сложных процессов, как дифферен-
цировка, рост, высшая нервная деятельность и т. д. Книга
написана живо и увлекательно, на достаточно высоком научном
уровне, хорошо иллюстрирована.
Предназначена для широкого круга читателей —
биологов, медиков» физиков, химиков, математиков, инженеров,
а также для студентов и учащихся старших классов школы.
Редакция биологической литературы
р21001т11211278 © 1974 by McGraw-Hill, Inc.
41(0i)-78 © Перевод на русский язык, «Мир», 1978
ПРЕДИСЛОВИЕ
К РУССКОМУ ИЗДАНИЮ
Предлагаемая читателю книга Энн Роллер рассказывает
о предыстории, возникновении и достижениях молекулярной
биологии.
Четверть века назад в знаменитой статье Уотсона и Крика
впервые была описана двойная спираль ДНК, ставшая теперь
привычным узором, многократно повторенным на обложках
различных изданий, в эмблемах научных конгрессов и симпозиумов,
на проспектах и рекламах фирм.
Биологически важные молекулы изучали и раньше. Было
очевидно, что от их формы и химических особенностей зависят
свойства и функции некоторых веществ и тканей в живом организме.
Но только после выяснения пространственной конфигурации
молекулы ДНК оказалось возможным понять одно из самых
таинственных биологических явлений — передачу потомкам
признаков родителей. Возникла новая дисциплина — молекулярная
биология. И хотя ни задачи, ни методы молекулярной биологии
не отличаются от задач и методов классических биологических
дисциплин (генетики, биохимии, вирусологии и др.)* новое
направление, сулившее объяснение самых сокровенных тайн жизни,
необычайно повысило престиж биологии, интерес к ней и число
желающих посвятить себя этой науке. Тому способствовали
многочисленные более или менее популярные публикации,
знакомившие широкий круг читателей с результатами поразительно
быстро прогрессировавших исследований.
К этому роду публикаций принадлежит и книга Роллер.
Однако у нее есть особенности, свойственные далеко не всем
популярным работам. С одной стороны, книга Роллер доступна
читателю без специальной подготовки в области химии и биологии.
Это свявано не только с тем, что в первых главах автор дает необ-
6 ПРЕДИСЛОВИЕ К РУССКОМУ ИЗДАНИЮ
ходимые элементарные сведения, но и с манерой изложения
(которую мы старались сохранить при переводе). О самых сложных
вещах автор рассказывает очень просто, последовательно и,
главное, очень интересно. С другой стороны, читатель найдет в книге
описание совсем недавних, еще не вошедших в учебники
экспериментов, интересных и для биологов-специалистов. В ряде
случаев автор указывает на предварительный характер
полученных данных, на необходимость дальнейших доказательств.
Описывая тот или иной опыт, Э. Роллер рассказывает не только о его
результатах, но достаточно подробно останавливается и на
примененном методе, так что читатель может представить себе
технику эксперимента и трудоемкость работы. Несколько небольших
разделов книги посвящены нерешенным вопросам, проблемам,
ждущим своих исследователей. Четкое изложение, остроумные
аналогии, прекрасные иллюстрации делают чтение книги
увлекательным.
Книгу с удовольствием прочтет каждый, кто хотел бы следить
за развитием современной науки. Особенно ее можно
рекомендовать школьникам старших классов, задумывающимся над выбором
своей будущей профессии.
Всем интересующимся можно рекомендовать и ряд других
книг по проблемам современной биологии, выпущенных
издательством «Мир»: Дж. Уотсон, «Двойная спираль», 1969; Г. Боген,
«Современная биология», 1970; А. Лёви и Ф. Сикевиц, «Структура
и функции клетки», 1971; Д. Гриффин и Эл. Новик, «Живой
организм», 1973, а также отдельные статьи в сборниках «Молекулы
и клетки», вып. 1—5 (1966—1970), вып. 6 (1977).
В. М. Родионов
ПРЕДИСЛОВИЕ
Молекулярная биология привлекает сейчас всеобщее
внимание. Структуре дезоксирибонуклеиновой кислоты, этой основе
молекулярной биологии, посвящаются передовые статьи
ведущих журналов, а их обложки украшаются двойной спиралью
— Уолтер, объясни еще один раз про эту ДНК, и я не буду больше к тебе
приставать!
ДНК. Газеты сообщают о достижениях молекулярных биологов,
приближающих нас к разгадке тайны происхождения жизни,
к окончательной победе над раком, к пониманию природы самой
жизни, смерти и болезней.
8 ПРЕДИСЛОВИЕ
Задача этой книги — помочь всем интересующимся, даже
если их подготовка в области биологии и химии весьма
ограниченна, понять волнующие события, происходящие в молекулярной
биологии. С этой целью в главах 1, 2, 3 и 6 даются элементарные
сведения по эволюционной теории, химии, цитобиологии и
генетике, а все изложение ведется по возможности без употребления
узкоспециальных терминов.
Достижения молекулярной биологии — это результат
многочисленных экспериментов, и многие из них подробно описаны
в книге; рассматриваются не только опыты, ставшие уже
классическими, но и некоторые сообщения с «переднего края» науки —
новейшие данные, смысл которых, может быть, еще не вполне
ясен. Надеюсь, что такое изложение материала позволит
читателю оценить остроумие и изящество использованных методов,
почувствовать увлекательность самого процесса исследования.
Щедрый вклад в написание книги внесли и друзья, и
незнакомые мне люди. Многие предоставили мне фотографии, за что я им
чрезвычайно благодарна. Я хочу также поблагодарить
издательства и авторов, разрешивших воспроизвести уже
опубликованные рисунки. Источники этих материалов во всех случаях
указаны.
Мне приятно выразить свою признательность за помощь всем,
кто прочел рукопись и сделал свои замечания. В течение всей
работы я неизменно пользовалась ценными советами и очень
важной для меня поддержкой Р. Джинера. Чрезвычайно полезна
была обстоятельная критика Фрэнсиса Крика и Ренэ Тома: она
помогла мне избавиться от многих ошибок и в некоторых случаях
упростить текст. Наконец, я благодарю моих двух молодых
рецензентов Элен Роллер и Кристофера Дарнелла за их многочисленные
и весьма полезные советы. Большая часть замечаний этих и
других рецензентов нашла свое отражение в тексте. Ответственность
за все оставшиеся ошибки лежит только на мне.
Энн Роллер
1 ОСНОВНЫЕ ЧЕРТЫ
ЖИЗНИ
Рыбы, птицы и звери, черви и насекомые, травы, деревья
и водоросли — поразительно разнообразие живых существ,
населяющих Землю! В воде и на суше, в почве и в воздухе нашей
планеты обитает более 300 000 видов растений и больше миллиона
видов животных. По всей видимости, разнообразие — одна из
самых характерных особенностей жизни. И это действительно
так. Однако парадокс заключается в том, что столь же
фундаментальной, хотя и менее очевидной особенностью живых
организмов является их глубокое сходство. Доказательства этому
биологи накапливали понемногу, в течение нескольких
веков.
Первым шагом была классификация растений и животных —
объединение их в группы по сходству. Используя этот принцип,
Джон Рэй (1627—1705) выделил несколько семейств растений
и опубликовал первую систему классификации животных, В/основу
которой он положил особенности строения их пальцев и зубов.
Вслед за ним великий систематик Карл Линней (1707—1778)
разработал формальную систему классификации и номенклатуры,
которой пользуются до сих пор.
Широко раздвинул границы познания окружающего нас мира
микроскоп, изобретенный в 1590 году Захариасом Янсеном и
постепенно усовершенствованный в течение последующих столетий.
Успехи микроскопии привели в XIX веке к фундаментальному
обобщению: стало ясно, что все живые существа состоят из
мельчайших, сходных между собой «строительных блоков»—
клеток.
10 ГЛАВА 1
Рис. 1. Карл Линней
(1707—1778) —
замечательный шведский ботаник,
провозгласивший принцип
классификации растений и
животных. Линней
впервые ввел бинарную
номенклатуру живых организмов,
употребляемую до сих пор.
Он включил в свою
систему и человека, дав ему
наименование Homo sapiens.
(С разрешения Linnean
Society of London.)
КЛЕТКИ —
ОСНОВА ЖИЗНИ
Первым человеком, увидевшим клетки, был Роберт Гук (1635—
1703). Посмотрев в микроскоп на тонкий срез пробки (коры
пробкового дуба), он обнаружил в ней «маленькие ячейки или
клеточки... похожие на пчелиные соты, но не столь правильной формы».
Огромное впечатление на современников произвели бесчисленные
открытия Антона Левенгука (1632—1723). Ему впервые удалось
наблюдать живые клетки — сперматозоиды, красные кровяные
тельца, простейших (одноклеточных животных) и даже
крошечных бактерий. Однако все значение «клеток», обнаруженных
и в древесине, и в застоявшейся воде, и в крови, тогда еще никто
не мог оценить по достоинству. Для признания универсальности
клеточного строения живых организмов потребовались еще
полтораста лет наблюдений и, в частности, открытие крупного (по
внутриклеточным масштабам) образования — ядра, которое было
найдено и в животных, и в растительных клетках.
ОСНОВНЫЕ ЧЕРТЫ ЖИЗНИ И
Ядра клеток впервые были обнаружены в 1831 году
английским ботаником Робертом Брауном (1773—1858) при
микроскопическом изучении орхидей. Семь лет спустя М. Я. Шлейден
(1804—1881) опубликовал гипотезу, согласно которой клетки
образуются путем кристаллизации жидкости вокруг ядра. В этом
Шлейден ошибся. Однако тогда же он предположил, что все
части растений представляют собой сообщества клеток или
являются продуктом их жизнедеятельности, и эта важная гипотеза
оказалась верной.
В следующем году Теодор Шванн (1810—1882) распространил
эту гипотезу на животных и таким образом сформулировал
клеточную теорию: «Клетки — это организмы, а животные и
растения представляют собою агрегаты этих организмов, построенные
по определенным законам».
Клеточная теория Шлейдена и Шванна оказала огромное
влияние на биологию и медицину, вызвав волну новых исследований,
и спустя 20 лет уже сложилось ясное представление о
фундаментальном значении клеток. Были установлены основные черты
их строения: клетка состоит из ядра и окружающей его
протоплазмы. Химики, несмотря на зачаточное состояние своей науки,
Рис. 2. Этот рисунок
приводит в своей работе
Теодор Шванн (1810—1882),
чтобы проиллюстрировать
глубокое сходство между
растительными и
животными клетками. Он пришел
к выводу, что клетки
представляют собой
элементарные живые единицы, из
которых построены все
организмы. (Т. Schwann, Mic-
rosc. Res., 1847.)
12 ГЛАВА 1
совершенно правильно заключили, что все клетки животных,
растений и простейших построены из веществ одного и того же
типа. Сперматозоиды и яйца были признаны отдельными клетками.
Важнейшим этапом в развитии клеточной теории было
осознание того, что клетки могут возникать только путем деления
ранее существовавших клеток. В 1858 году Рудольф Вирхов
(1821—1902) опубликовал свою блестящую теорию: «Если
существует клетка, то ей должна была предшествовать другая клетка,
точно так же как животное может возникнуть только от животного-
Рис. 3. В XIX веке
спермин (сперматозоиды),
плавающие наподобие
головастиков, и огромные
наполненные желтком яйца
были признаны одиночными
клетками. На фото^ виден
спермий африканской
шпорцевой лягушки {Xenopus
laevis), лежащий на
поверхности яйца; на переднем
плане штопоровидная
головка спермия, хвост
уходит влево. Студенистая
оболочка, покрывающая
яйцо, удалена; видны ее
остатки, приставшие к
поверхности яйца и к спер-
мию. (Микрофотография,
полученная с помощью
сканирующего
электронного микроскопа. С
разрешения R. D. Gray.)
,mJ
Рис. 4. Делящиеся
растительные клетки из кончика
корня, как они видны в
современный микроскоп.
(McLeish and Snoad,
Looking at Chromosomes,
Macmillan, New York, 1958.
С разрешения В. Snoad.)
ОСНОВНЫЕ ЧЕРТЫ ЖИЗНИ 13
и растение только от растения». Клетки были теперь
окончательно признаны простейшими образованиями, способными к жизни,
росту и размножению, структурными элементами, из которых
построены все организмы — как растения, так и животные.
Удивительное единство разнообразных форм жизни на Земле
стало очевидным.
ЭВОЛЮЦИОННОЕ
ОБЪЯСНЕНИЕ
жизни
Как же объяснить это сочетание видимого многообразия
жизни с глубоким сходством ее основных проявлений? Загадка
была, разрешена в 1859 году, когда Чарлз Дарвин (1809—1882)
опубликовал свою книгу «Происхождение видов путем
естественного отбора, или сохранение благоприятствуемых пород в борьбе
за жизнь».
Дарвин собрал исчерпывающие аргументы для подтверждения
своего тезиса, который он выразил следующим образом: «Так
как рождается намного больше индивидуумов каждого вида, чем
их может выжить, и так как в результате они часто вступают
в борьбу за существование, из этого следует, что любое существо,
хотя бы немного отличающееся от других в выгодном для себя
отношении,... будет иметь больше шансов остаться живым,
т. е. сохраниться в процессе естественного отбора» г. Иными
словами, в борьбе за существование чаще выживают особи,
обладающие хотя бы небольшим преимуществом перед себе
подобными.
Существование различий между представителями одного вида
и появление особей, имеющих в данных условиях некоторые
преимущества перед другими,— это необходимая предпосылка
эволюции путем естественного отбора. Дарвин не только
демонстрирует индивидуальную изменчивость диких видов, но и указывает,
что только благодаря этой изменчивости людям удалось вывести
особые формы домашних животных: в течение многих веков
человек использовал для их разведения особей, более подходящих
для его целей. Затем Дарвин спрашивает: «Если человек
благодаря своему терпению отбирает вариации, наиболее полезные
для него, то почему природа не могла бы отбирать изменения,
наиболее полезные ее живым творениям в постоянно меняющихся
условиях жизни?» А если естественный отбор существует, то оче-
1 Все цитаты, приводимые в этом разделе, взяты из книги Дарвина
«Происхождение видов».
14 ГЛАВА 1
Рис. 5. Чарлз Дарвин (1809—1882), автор книги «Происхождение видов
путем естественного отбора, или сохранение благоприятствуемых пород
в борьбе за жизнь». Портрет, написанный Джорджем Ричмондом в 1840 году.
Дарвин не первым высказал идею эволюции, но он дал ей научное
объяснение и подтвердил свою гипотезу огромным фактическим материалом.
Дарвиновская теория эволюционного происхождения видов составляет идейную
основу биологии. (С разрешения Down House.)
видно, что «в соответствии со всеобщим принципом
наследственности любая отобранная разновидность будет иметь тенденцию
сохранять свои особенности в последующих поколениях».
Такова в двух словах суть механизма естественного отбора.
Индивидуальная изменчивость создает материал для отбора
ОСНОВНЫЕ ЧЕРТЫ ЖИЗНИ 15
Рис. 6. Сходство общего плана строения скелета у позвоночных. Л —
лягушка; Б — обезьяна; В — летучая мышь. Самое удивительное — это
скелет крыла летучей мыши, состоящий из костей плеча, предплечья и пальцев
(шпора на «запястье» образована костью большого пальца). (А и Б — с
разрешения «Turtox Collection» CCM General Biological, Inc.; В — с
разрешения Ward's Natural Science Establishment, Inc., Rochester, New York.)
«лучших» особей, наиболее приспособленных для выживания
и размножения в данных условиях; наследственность
обеспечивает передачу отобранных усовершенствований потомству. Как
выражается Дарвин, «накопление бесчисленных мелких
изменений, каждое из которых полезно его обладателю», за несколько
миллиардов лет постепенно привело к созданию существующего
ныне разнообразия обитателей Земли.
Теория Дарвина об эволюционном происхождении видов путем
естественного отбора сразу же после опубликования вызвала
жестокие споры и между учеными, и среди широкой публики.
Возможность рационального объяснения органического мира,
которую давала эта теория, значительно способствовала вытеснению
канонической библейской веры в божественное сотворение видов.
Среди множества фактов и находок, которые объяснила
эволюционная теория, был и парадокс, упомянутый в самом начале
этой главы: бесконечное разнообразие и вместе с тем глубокое
сходство живых организмов.
16 ГЛАВА 1
Рис. 7. Ископаемая
бактерия Eobacterium isolatum,
жившая 3,2 миллиарда лет
назад, когда Земля,
которой сейчас 4,5 миллиарда
лет, была еще юной. Эта
бактерия найдена в
скальной породе из Южной
Африки. Хотя это самый
древний из известных
сейчас организмов, он очень
похож на некоторых
современных бактерий по своим
размерам и видимой
структуре клеточной стенки.
(С разрешения Elso S. Ваг-
ghoorn.)
Дарвин понял, что разнообразие — это логическое следствие
борьбы за существование. Чем более сходны организмы, тем
острее будет конкуренция между ними. Различия, возникающие
в результате изменчивости и расхождения признаков, должны
уменьшать эту конкуренцию и поэтому благоприятны для
организмов. 'Необыкновенное разнообразие животных и растений
обеспечит в конце концов проникновение их во все
«экологические ниши», существующие в природе. «Естественный отбор
неизбежно приводит к вымиранию многих менее
приспособленных форм жизни и к тому, что я называю расхождением
признаков»,— говорит Дарвин. Вместе с тем черты удивительного
сходства между, казалось бы, совершенно различными
организмами объясняются их происхождением от общих предков.
«Сходное расположение костей в руке человека, крыле летучей мыши,
плавнике дельфина и ноге лошади, одинаковое число позвонков
в шее жирафа и слона и бесчисленное множество других
подобных фактов легко объясняются теорией общего происхождения
с накоплением мелких последовательных изменений».
Дарвин не только постулировал родство всех древних и ныне
живущих форм. Он пошел еще дальше. На основании известных
ему скудных фактических данных он сделал основной вывод: «Все
живые существа имеют между собой много общего в своем
химическом составе, строении своих зародышевых пузырьков,
структуре клеток и законах, управляющих их ростом и размножением...
Из этого следует заключить, что все живые существа, когда-либо
населявшие нашу планету, являются потомками одной
первоначальной формы, в которой впервые пробудилась жизнь».
Итак, все живые организмы произошли от одного общего
предка? Воистину дерзкая гипотеза! Однако вот уже более ста
лет она подтверждается все большим числом исследований.
ОСНОВНЫЕ ЧЕРТЫ ЖИЗНИ 17
Рис. 8. Микрофотография
бактерий (1500-кратное
увеличение). (С разрешения Polaroid
Corporation.)
Единое происхождение всех живых существ прекрасно
объясняет черты их сходства, которые в нашем двадцатом веке
становятся все более очевидными.
Девятнадцатый век утвердил клетку в качестве «общего
знаменателя» в конструкции организмов. Значительно
усовершенствованный световой микроскоп и особенно электронный
микроскоп открыли сложнейшую внутриклеточную анатомию,
общую для всех клеток. На протяжении всей этой книги
читатель будет убеждаться в том, что основные внутриклеточные
процессы одинаковы во всех клетках, поскольку вещества,
составляющие химическую основу жизни, одни и те же и у бактерии,
и у человека, и у любого другого организма. Абсолютной
идентичности здесь, конечно, нет: нужно помнить о последовательных
мелких изменениях, которые накапливались в течение двух
или трех миллиардов лет биологической эволюции.
«...Пока наша планета кружилась и кружится в соответствии
с неизменным законом тяготения ... на ней возникали и
продолжают развиваться бесчисленные формы жизни, изумительно
совершенные и прекрасные».
2-0414
18 ГЛАВА 1
МНОГООБРАЗИЕ КЛЕТОК
Разнообразие клеток столь же удивительно, как и очевидное
разнообразие высших растений и животных. Проще всего
устроены клетки сине-зеленых водорослей и бактерий: они лишены
многих структур, присущих клеткам более сложных организмов;
в них, например, нет ядра. Тем не менее по химическим
основам своей жизнедеятельности они очень сходны с клетками,
имеющими ядро. Именно поэтому молекулярные биологи так
часто обращаются к изучению этих скромных созданий. Особенно
ценными объектами для исследования фундаментальных
процессов, общих для всех клеток, оказались бактерии.
Но даже и среди этих простейших клеток велико
разнообразие. Некоторые виды сине-зеленых водорослей живут как
одиночные клетки, однако большинство их образуют нитевидные
цепочки из клеток, иногда разветвленные. Более того, лишь
около половины этих водорослей действительно имеют
сине-зеленую окраску; остальные виды — красные, голубые, пурпурные,
коричневые или синевато-черные.
Бактерии — самые мелкие и самые многочисленные из
одноклеточных организмов. К счастью, большинство их безвредны
или даже полезны человеку, и только некоторые — вредны.
Бактериальные клетки могут быть округленными,
палочковидными, изогнутыми или скрученными. Клетки шарообразных
бактерий (кокков) способны склеиваться друг с другом, образуя
Яйцеклетка
человека,
амеба-ЮОмкм*
Эвглена-35 мкм
Рис. 9. Сравнительные размеры
различных клеток, одноклеточных
организмов и вируса. Значительные
различия в размерах существуют
даже между близко родственными
формами. Например, у различных
видов Euglena длина клетки
варьирует в пределах от 15 до 500
микрометров (1 микрометр равен
1/1 000 000 доле метра).
Средняя клетка чело- £
веческого тела-20мкм \
Эритроцит человека;
дрожжевая клетка- в
вмкм
Эритроцит челоч
века
Бактерия-J мкм
Вирус гриппа - 0,1мкм
Масштаб
увеличен
в 10 раз
ОСНОВНЫЕ ЧЕРТЫ ЖИЗНИ 19
Рис. 10. Амеба. (С разрешения Carolina Biological Supply Company.)
пары, комочки, пленки или длинные цепи. Палочковидные
бактерии (бациллы) могут образовывать пары или цепочки, но чаще
живут как одиночные клетки.
Огромное число организмов, подобно многим сине-зеленым
водорослям и бактериям, существуют как отдельные клетки.
Эти одноклеточные формы чрезвычайно разнообразны. Дрожжи,
благодаря которым подходит тесто, бродит вино или пиво,
относительно малы — они лишь в несколько раз больше бактерий.
Размеры и внешний вид простейших весьма различны: амебы
раз в пятнадцать больше дрожжевых клеток и даже видимы
невооруженным глазом; некоторые простейшие еще крупнее,
а многие значительно меньше амеб.
«Движения большинства из этих анималькул в воде столь
быстры и разнообразны — вверх, вниз и кругом каруселью, — что
представляли поразительное зрелище». Так Левенгук
описывал в 1674 году простейших с их удивительным внешним видом
и сложными способами передвижения и питания.
Подобно одноклеточным организмам, клетки
многоклеточных растений и животных могут выглядеть совершенно
по-разному. Сложный организм может состоять из многих видов клеток,
каждый из которых вносит свой вклад в общую организацию;
при этом жизнеспособность каждого вида клеток в свою очередь
зависит от целостности организма. Человеку, как и всем прочим
позвоночным, необходимы нервные клетки, мышечные клетки,
2*
20 ГЛАВА 1
клетки печени, щитовидной железы, костной ткани и многие
другие. Разнообразию их форм и размеров соответствует такое же
разнообразие функций. Например, клетки кожи и клетки,
выстилающие кровеносные капилляры, сильно уплощены, тогда как
форма печеночных клеток близка к сферической. Клетку печени
можно считать животной клеткой средней величины. Она в
несколько раз больше дрожжевой, но значительно меньше амебы или
яйцеклетки человека. В организме есть и гораздо более крупные
клетки. Раздражение, переданное от кончика большого пальца
ноги в мозг, проходит по нервной клетке, имеющей около метра
в длину у человека и несколько метров — у жирафа.
Не только форма и общий вид, но и «внутренние органы» клеток
видоизменяются, приспосабливая каждую из них для ее
специальной функции в организме. Клетки разных тканей высших
растений и животных настолько различны, что с помощью
подходящей методики можно каждый вид клеток узнать под
микроскопом.
Рис. 11. Два
одноклеточных организма: дидиниум
и его добыча — парамеция.
(С разрешения Carolina
Biological Supply Company.)
Рис. 12. Клетки,
выполняющие разные функции, мо-
tyr сильно различаться по
внешнему виду. На
микрофотографии видны две
спинномозговые нервные клетки
и множество интерстициаль-
ных клеток
(многочисленные темные пятнышки —
ядра этих клеток). (С
разрешения Carolina Biological
Supply Company.)
ОСНОВНЫЕ ЧЕРТЫ ЖИЗНИ 21
ЧТО ДЕЛАЮТ
КЛЕТКИ?
Каждая клетка осуществляет все основные жизненные
функции, которые свойственны любому живому существу. Что же
это за функции, одинаково необходимые для поддержания жизни
как бактерии, так и человека? Наиболее очевидна необходимость
получать пищу, воду и кислород и освобождаться от ненужных
отходов. Другая важнейшая особенность всякого организма — это
способность реагировать на изменения окружающей обстановки,
помогающая, например, человеку избежать столкновения с
уличным транспортом. И наконец, способность к размножению обес-
печирает непрерывность цепи индивидуумов, сохранение видов
и в конечном итоге — самой жизни на Земле.
Через 20 лет после того, как Шлейден и Шванн
предположили, что клетки — это миниатюрные организмы, Луи Пастер
(1822—1895) провел свою знаменитую серию опытов,
показавших,, что клетки — по крайней мере бактерии и
дрожжи—действительно питаются, дышат, выделяют отходы, реагируют на
изменение внешней среды и размножаются.
ОБМЕН ВЕЩЕСТВ
У МИКРООРГАНИЗМОВ
И ЧЕЛОВЕКА
Микроорганизмы, подобно всем клеткам, превращают пищу в
энергию и в вещества, из которых построены они сами, а также
освобождаются от отходов. Иными словами, у них существует
обмен веществ, или метаболизм. Это было доказано Пастером.
. Пастер показал, например, что дрожжи (которых относят тет
перь к микроскопическим растениям), сбраживая солод в
процессе приготовления пива, используют часть содержащегося
в солоде сахара для синтеза вещества клеточных стенок. Большая
часть сахара используется для получения энергии и при этом
превращается в спирт. Дрожжевым клеткам спирт не нужен,
и поэтому он выводится в окружающую среду. Совершенно
так же бактерии, вызывающие скисание молока, освобождаются
от молочной кислоты, вырабатываемой ими вместо спирта.
Процессы питания, дыхания, поглощения воды и выведения
отходов у многоклеточных организмов — растений, животных
и человека — служат для удовлетворения метаболических пот-
22 ГЛАВА 1
Рис. 13. Луи Пастер (1822—1895). Портрет работы Эдельфельда. Пастер
революционизировал медицину, доказав, что микроорганизмы являются
возбудителями болезней, а также вызывают брожение. Кроме того, он развернул
работу в области предохранительных прививок. Исследования Пастера
поразительно разносторонне и результаты их сыграли огромную роль в
развитии биологии и медицины. (С разрешения Institut Pasteur, Paris.)
ребностей клеток, из которых эти организмы состоят. У
животных питательные вещества, вода и кислород
транспортируются из кишечника и легких к каждой клетке с помощью системы
кровообращения. В кровь поступают и отходы клеточного
метаболизма.
Потребность клеток многоклеточного организма в
питательных веществах можно изучать с помощью так называемого
метода культуры тканей (хотя чаще выращивают, или культивируют,
совсем не ткань, а просто группы клеток). В начале нашего
столетия биологи, следуя по пути бактериологов, научившихся
успешно «разводить» в лаборатории бактерий, нашли способы
выращивать в искусственных условиях клетки, выделенные из
многоклеточных организмов — растений или животных. Теперь
растительные и животные клетки могут жить и размножаться
в лабораторной культуре десятки лет.
Метод культуры тканей дал возможность изучать не только
метаболизм клеток многоклеточного организма. Клеточные
культуры стали объектом бесчисленных исследований, касающихся
ОСНОВНЫЕ ЧЕРТЫ ЖИЗНИ 23
Рис. 14. Метод культуры тканей — выращивание живых клеток (или
ткани) вне организма. Ткань, полученная от растения или животного,
обрабатывают таким образом, чтобы растворить вещества, удерживающие клетки
вместе {А). Небольшое количество клеток помещают в сосуд с питательной
средой (Б). Клетки опускаются на дно сосуда и растут там до тех пор, пока не
покроют всю поверхность дна сплошным слоем (В). Часть этих клеток
извлекают и помещают в новый сосуд со свежей питательной средой, где они
продолжают расти и делиться; эту процедуру можно повторять
неограниченное число раз.
различных функций клеток, реакций их на гормоны и
лекарственные вещества, межклеточных взаимодействий, вирусной
инфекции и злокачественного перерождения. Вакцины против
полиомиелита, например, были разработаны на культурах ткани
человеческой или обезьяньей почки. Некоторые опыты,
осуществленные на клетках, выращенных в культуре ткани, будут
описаны в последующих главах.
ПРИСПОСОБЛЕНИЕ
К ИЗМЕНЕНИЯМ СРЕДЫ
Даже бактерии — наиболее просто устроенные клетки —
реагируют на изменения окружающей их среды. Чтобы выжить
в условиях постоянной конкуренции, они должны быть
способны адаптироваться к изменениям в составе имеющейся пищи.
Пастер показал, например, что пивовары и виноделы
получают спирт только в том случае, если дрожжи растут в
отсутствие кислорода. Точно так же некоторые бактерии
превращают сахар в молочную кислоту и створаживают молоко только
в бескислородных условиях. В присутствии кислорода сахар
используется другим, более выгодным способом, и тогда в
качестве отходов образуются уже не молочная кислота или спирт,
24 ГЛАВА 1
Кислород Углекислота
"*" и вода
Сахар ( Кислород
v Без кислорода (дрожжи) л л
4 Спирт I
или мышцы) кислота
Рис. 15. Биохимические превращения сахара. В присутствии кислорода
дрожжи, молочнокислые бактерии и мышцы превращают сахар в С02 и воду,
получая при этом большое количество энергии из небольшого количества
сахара. В отсутствие кислорода дрожжевые клетки превращают сахар в спирт,
а молочнокислые бактерии и мышечные клетки — в молочную кислоту,
получая при этом сравнительно немного энергии из значительного количества
сахара. В присутствии кислорода и спирт, и молочная кислота могут быть
превращены в С02 и воду (с освобождением большого количества энергии).
а вода и углекислый газ (углекислота). Спиртовое и
молочнокислое брожение — это не что иное, как приспособление
микроорганизмов к отсутствию кислорода.
Мышечные клетки адаптируются к нехватке кислорода таким
же образом, как и молочнокислые бактерии. Во время
напряженной мышечной работы дыхательная и кровеносная системы
не в состоянии снабжать мышечные клетки кислородом в нужном
количестве. Поэтому работающая мышца [не может получить
необходимую ей энергию за счет полного окисления глюкозы
до углекислоты и воды. В этом случае необходимую энергию
дает превращение гораздо больших количеств глюкозы в
молочную кислоту. Накопление кислоты в мышцах вызывает чувство
утомления. Одышка после тяжелой работы обеспечивает
необходимую доставку кислорода, который используется для окисления
небольшой части накопившейся молочной кислоты до углекислоты
и воды. За счет освобождающейся при этом энергии остальная
молочная кислота превращается обратно в сахар.
Описанные превращения сахара — это лишь одна из
многочисленных адаптации, к которым способны бактериальные,
человеческие и другие клетки. Может показаться, что подобные
химические приспособления к изменяющимся условиям среды
очень далеки от сложных форм поведения высших животных
и человека. Но так ли это в действительности?
Каждое растение, каждое животное имеет свои собственные,
неразрывно связанные с его образом жизни механизмы,
благодаря которым оно может реагировать на изменение среды.
Одноклеточная водоросль эвглена обладает светочувствительностью.
ОСНОВНЫЕ ЧЕРТЫ ЖИЗНИ 25
Рис. 16. Эвглена (Euglena) —
род одноклеточных
водорослей, плавающих с
помощью бичевидного
жгутика в пресной или
солоноватой воде или в иле, где они
живут. Жгутиковые рода
Euglena всегда движутся на
свет, который они
воспринимают глазным пятном,
расположенным у
основания жгутика. (С
разрешения Carolina Biological
Supply Company.)
Она всегда движется по направлению к свету, ударяя по воде
своим бичевидным жгутиком. Ее глазное пятно содержит
светочувствительный пигмент, в химическом отношении идентичный
желтому пигменту моркови. Высшие животные тоже
воспринимают световые раздражители и могут на них реагировать. Их
глаза вместе с нервной и мышечной системами образуют
сложный механизм, который получает из окружающей среды
информацию, перерабатывает ее и обеспечивает надлежащую реакцию.
Этот механизм позволяет животным находить пищу и избегать
опасности.
Некоторые из химических механизмов, благодаря которым
человек или животное может чувствовать и действовать, уже
выяснены. Например, особые клетки в сетчатке глаза содержат
светочувствительные пигменты. Один из них почти идентичен
пигменту глазного пятнышка эвглены. Как только на сетчатке
возникает световое изображение, информация о нем
передается по нервным волокнам в мозг с помощью хорошо изученного
механизма; Но как эта информация перерабатывается и
сохраняется — до сих пор остается тайной.
Способы адаптации бактерий, например реакции их на
изменения в снабжении питательными веществами и кислородом,
уже достаточно ясны. Нет сомнений в том, что и более сложные
формы поведения высших животных, механизмы, с помощью
1 X
26 ГЛАВА 1
которых они воспринимают изменения во внешней среде и
приспосабливаются к ним, со временем станут до конца понятными.
Все это будет когда-нибудь «разложено» на множество химических
реакций, которые возникают в специализированных клетках
под влиянием изменений во внешнем мире и в других клетках.
РАЗМНОЖЕНИЕ КЛЕТОК
ПУТЕМ ДЕЛЕНИЯ
Жизнь на Земле сохраняется благодаря тому, что организмы
воспроизводят себе подобных. Дрожжи размножаются
почкованием, бактерии, как и большинство клеток,— делением
материнской клетки на две дочерние, приблизительно равной
величины.
Рост и размножение высших животных — это тоже
результат роста и деления клеток. Человек начинает свое
существование в виде оплодотворенного яйца. Таким образом, и здесь,
как и у большинства организмов, все начинается с одной-един-
-ственной клетки. Эта клетка делится на две; затем из этих двух
образуются четыре клетки, потом восемь, шестнадцать и в конце
концов — многие миллиарды клеток, составляющие тело ново-
Рис. 17. Микрофотографии дрожжевой клетки в процессе почкования,
расположенные во временной последовательности (3600-кратное увеличение).
Белое пятно у нижнего полюса клетки — это вакуоль, заполненная
пищеварительным соком. Светло-серая область между вакуолью и образующейся
почкой — клеточное ядро. А, Б и В. Ранние стадии. Г. Ядро проникает в
почку. Д, Е и Ж. Ядро делится; при этом оно сначала удлиняется, и в его
средней зоне образуется перетяжка. 3 — образовались два ядра, по одному в
каждой клетке (в нижней клетке ядро лежит левее и ниже светлой круглой
вакуоли).
ОСНОВНЫЕ ЧЕРТЫ ЖИЗНИ 27
Рис. 18. Ранние стадии развития лягушки. Л. Первое деление
оплодотворенного яйца на две клетки. Б. Восемь клеток; неодинаковые размеры клеток —
первое проявление их специализации. В. Различие в величине клеток на 32-
клеточной стадии свидетельствует о возникновении зачаточных структур.
(С разрешения Carolina Biological Supply Company.)
рожденного ребенка. Чтобы ребенок превратился во взрослого
человека, нужны еще всего лишь несколько циклов клеточного
деления.
Разумеется, одного деления клеток еще не достаточно для
того, чтобы из оплодотворенного яйца получился ребенок. У
такого сложного существа, как человек, жизненно важные функции
выполняют специализированные органы: желудок и кишечник,
легкие, печень, нервная система и многие другие; значит, должны
образоваться специализированные клетки — мышечные,
нервные, печеночные и т. д. Эти клетки во многом отличаются друг от
друга.
Однако некоторые функции, необходимые для поддержания
самой жизни, одинаковы у всех клеток, и их осуществляют
особые структуры, так называемые органеллы, что значит
«маленькие органы». Эти структуры подробно описаны в главе 3. Но
прежде чем исследовать внутренность клетки, познакомимся
сначала с веществами, из которых состоит живая и неживая
природа.
2 ВЕЩЕСТВА
И ИХ ПРЕВРАЩЕНИЯ
Люди всеядны — они употребляют и животную, и
растительную пищу. Но значит ли это, что они состоят просто из
смеси съеденного? В одном месте кусочек помидора, в другом —
ломтик ветчины или сыра? Если вы ничего не едите, кроме
свинины, не станете ли вы в конце концов свиньей? Конечно, нет! Еще
больше разница между растением и его «пищей»: ведь оно
поглощает главным образом воду и газ (углекислоту).
Жизнь поддерживается благодаря поглощению пищи и
превращению ее в вещества, необходимые клеткам. Растения
получают из внешней среды простые вещества и превращают их
в сложные соединения, из которых они сами состоят. В
организме человека и животных получаемые с пищей вещества сначала
расщепляются: растительный крахмал — до сахара, белки мяса —
до аминокислот. В клетках из этих продуктов расщепления
крупных молекул строятся собственные белки тела, гликоген
(животный крахмал) и другие компоненты тканей. Некоторое
количество пищи сгорает, чтобы снабдить организм необходимой
энергией.
Это непрерывное превращение веществ, получаемых с пищей, —
одна из основных особенностей жизни. Это результат
множества реакций, протекающих в каждой клетке. Благодаря
работам химиков и биохимиков XIX и XX столетий многие из этих
реакций стали теперь понятными и могут быть воспроизведены
в пробирке.
Что такое химическая реакция? Как, например, сахар может
превращаться в воду и газ, в спирт, целлюлозу или крахмал?
Для того чтобы понять химическую реакцию, необходимо
сначала познакомиться с реагирующими веществами. Что
представляет собой сахар, который называют глюкозой? (Это не тот сахар,
ВЕЩЕСТВА И ИХ ПРЕВРАЩЕНИЯ 29
что стоит на вашем столе; тот называется сахарозой.) Что такое
спирт? Что такое крахмал? Что представляет собой пигмент
сетчатки глаза, кстати сказать, родственный пигменту моркови?
Что такое витамин А? Наконец, что такое вода и воздух, кислоты,
основания и соли? Мы знаем, например, столовую соль,
английскую соль, но есть еще тысячи других солей. До XIX века
природа веществ, из которых состоит мир, оставалась загадкой.
ПРИРОДА ХИМИЧЕСКИХ
ВЕЩЕСТВ: ЭЛЕМЕНТЫ
И СОЕДИНЕНИЯ
В течение двух тысячелетий думали — в соответствии с
теорией древних греков, — что все вещества состоят из четырех
элементов: огня, земли, воды и воздуха. В XVIII веке ученые
начали экспериментировать. Смешивая, нагревая и сжигая
различные вещества, они многое узнали о природе материи.
В конце XVIII века Антуан Лоран Лавуазье (1743—1794),
вооруженный накопленными до него знаниями, впервые понял,
что существуют только два рода чистых веществ — соединения
и элементы. Соединения могут быть разложены на элементы;
элементы же нельзя разложить на другие вещества. Например, вода —
это соединение, состоящее из элементов водорода и
кислорода.
Лавуазье дал многим элементам, включая кислород и водород,
их современные названия и ввел систему химической
номенклатуры, используемую до сих пор. Он стал называть вещества так,
чтобы можно было понять, из каких элементов они состоят.
Например, соединения металлов с кислородом он назвал окислами
металлов, а соединения металлов с двуокисью углерода —
карбонатами. Такое выражение, как «уголь плюс дефлогистонирован-
пый воздух дает связанный воздух», вскоре уступило место более
ясному, предложенному Лавуазье: «углерод плюс кислород
дают двуокись углерода».
АТОМНАЯ ТЕОРИЯ
В 1803 году Джон Дальтон (1766—1844) высказал мысль, что
материя не может быть бесконечно делима на все меньшие и
меньшие частицы: в конечном счете всякое вещество состоит из
неделимых частиц — атомов. Вещества, которые не могут быть
химически разложены на другие вещества, Лавуазье еще ранее
30 ГЛАВА 2
Рис. 19. Основоположник современной химии Антуан Лоран Лавуазье
(1743—1794) со своей женой. Портрет работы Жака Давида. Вопреки
существовавшему представлению о том, что сгорающие вещества выделяют
таинственное «огненное начало»— флогистон, Лавуазье показал, что на самом деле
они соединяются с кислородом — незадолго до того открытым газом.
Установив действительный состав металлов и их соединений, Лавуазье ввел понятие
«элемента». Его ясная концепция помогла ему совместно с другими химиками
выработать логичную систему химической номенклатуры. (С разрешения
Rockefeller University.)
назвал элементами. Теперь Дальтон предположил, что каждый
элемент соответствует определенному виду атомов. Он
правильно догадался, что в сложных химических веществах атомы
соединены в определенных пропорциях, образуя молекулы.
Молекула воды, например, состоит из двух атомов водорода и одного
атома кислорода; в молекуле двуокиси углерода (углекислоты)
один атом углерода и два атома кислорода.
Что же тогда представляет собой химическая реакция? Это
просто перегруппировка, разъединение или соединение атомов.
Дальтон понимал, что вес атомов разных элементов
различен, но прошло целых пятьдесят лет, прежде чем научились
определять относительные веса атомов — атомные веса. Вес
самого легкого из атомов, атома водорода, был принят за
ВЕЩЕСТВА И ИХ ПРЕВРАЩЕНИЯ 31
Рис. 20. Образование воды из водорода и кислорода. А. Смесь молекул
водорода (Н2), каждая из которых состоит из двух атомов, и молекул
кислорода (02), которые тоже состоят из двух атомов. Б. Молекулы воды (HgO),
образовавшиеся в результате реакции водорода с кислородом. (L. Pauling,
College Chemistry, 3d ed., Freeman, San Francisco, 1964.)
единицу; атому кислорода, оказавшемуся в шестнадцать раз
тяжелее атома водорода, был присвоен атомный вес 16, и так
далее для всех элементов г.
Как только были установлены атомные веса, появилась
возможность определить и молекулярные веса сложных веществ,
представляющие собой просто сумму весов атомов, входящих
в состав данного соединения. Например, молекула воды,
состоящая из двух атомов водорода и одного атома кислорода, имеет
молекулярный вес 1+1+16=18. А каков молекулярный вес
двуокиси углерода? В ее молекуле один атом углерода,
имеющего атомный вес 12, и два атома кислорода, так что
получаем: 12+16+16=44.
.Атомная теория Дальтона позволила исследовать атомный
состав сложных веществ и перегруппировки атомов при
химических реакциях, но о природе самих атомов ничего не было
известно до конца XIX века. До начала нашего столетия
подвергалось сомнению даже их существование; только открытия,
касающиеся строения атомов, сделали очевидной их реальность.
1 В настоящее время атомные веса рассчитывают по отношению к
углероду, атомный вес которого принят равным 12. При такой системе расчета
для водорода получается величина 1,008, а для кислорода — 15,9994.
32 ГЛАВА 2
СТРОЕНИЕ АТОМА
Атомы не являются неделимыми, как думал Дальтон.
Напротив, они обладают сложнейшей структурой. Однако даже
упрощенная модель атома поможет нам разобраться в некоторых
свойствах материи. Как выяснилось, атом состоит из частиц трех
видов: электронов, протонов и нейтронов.
ЭЛЕКТРОНЫ
Первыми из субатомных частиц были открыты электроны.
Уже в начале XIX века можно было догадываться о связи между
атомами и электричеством. Было, например, известно, что
пропускание электрического тока ведет к разложению некоторых
веществ, в частности воды, на составляющие элементы. В конце
концов пришли к выводу, что электричество существует в форме
дискретных, неделимых частиц — электронов, —
взаимодействующих с атомами. Экспериментально существование электронов
было доказано сэром Дж. Томсоном (1856—1940) в 1897 году.
За свои блестящие работы, касавшиеся электропроводности,
Томсон был удостоен Нобелевской премии по физике. Ему
удалось показать, что электрон — это частица с отрицательным
электрическим зарядом, вес которой во много раз меньше веса
любого атома.
Открытие отрицательно заряженного электрона явилось
первым указанием на сложную природу атомов и их делимость.
Атомы электронейтральны, у них нет ни отрицательного, ни
положительного заряда, и тем не менее в них как-то включены
отрицательно заряженные электроны. Значит, в атоме должна быть
также часть, заряженная положительно.
АТОМНОЕ ЯДРО
В 1911 году Эрнест Резерфорд (1871—1937) поставил опыт,
который позволил ему заключить, что в атоме имеется ядро. Резерфорд
бомбардировал чрезвычайно тонкую золотую фольгу
альфа-частицами, т. е. положительно заряженными атомами гелия.
Оказалось, что большинство альфа-частиц проходит через фольгу
насквозь, как будто на ее месте ничего нет; однако некоторые
частицы, примерно одна из 10 000, отскакивали назад, как если
бы они встречали на своем пути нечто непроницаемое (рис. 21).
Из результатов этого эксперимента, открывшего новую эру
в физике, Резерфорд заключил, что большая часть атома
представляет собой пустоту: ведь почти все альфа-частицы свободно
проходили через кусочек золотой фольги. (В этом пустом прост-
ВЕЩЕСТВА И ИХ ПРЕВРАЩЕНИЯ 33
Экраны, покрытые сернистым цинком, на которых
в местах удара альфа-частиц возникают световые
Рис. 21. Схема эксперимента, показавшего, что ядро занимает лишь очень
малую долю объема атома. Когда Резерфорд поставил этот важнейший опыт,
он уже был лауреатом Нобелевской премии, которую он получил в 1908
году за работы по радиоактивности. (По L. Pauling, College Chemistry, 3d ed.,
Freeman, San Francisco, 1964.)
ранстве вращаются отрицательно заряженные электроны.)
Положительно заряженная часть атома сосредоточена в очень малом
объеме — атомном ядре; лишь те немногие альфа-частицы,
которые наталкивались на ядра атомов золота, отскакивали в сторону.
Рис. 22. На 1-м Сольвеевском физическом конгрессе собрались крупнейшие
физики мира. Стоят: Гольдшмидт, Планк, Рубенс, Зоммерфельд, Линдеман,
де Бройль, Кнудсен, Хазенёрль, Остеле, Герцен, Джине, Резерфорд, Камер-
линг-Оннес, Эйнштейн, Ланжевен. Сидят: Нернст, Бриллюэн, Сольве,
Лоренц, Варбург, Перрен, Вин, Кюри, Пуанкаре.
3-0414
34 ГЛАВА 2
Спустя два года, в 1913 году, великий датский физик Нильс Бор
(1885—1962), тогда еще молодой человек, работавший в
лаборатории Резерфорда, опубликовал подробную модель атома с ядром.
Его вдохновляли не классические законы физики, с помощью
которых, как он понял, атом описать невозможно, а новая
квантовая теория Макса Планка и Альберта Эйнштейна. Модель Бора,
за которую ее автор получил в 1922 году Нобелевскую премию,
послужила основой для разработки современной теории
строения атома.
НА ЧТО ПОХОЖ АТОМ?
Сказать точно, как выглядит атом, конечно, невозможно:
во-первых, он слишком мал и его нельзя увидеть ни в какой
микроскоп; во-вторых, его электроны все время находятся в
чрезвычайно быстром движении. Задать подобный вопрос — это все
равно что спросить, на что похож вращающийся пропеллер
самолета. При достаточно быстром вращении он кажется едва
видимым прозрачным диском. Точно так же и сферическая форма
атома определяется «размазанными» следами вращающихся
электронов. Они заполняют все пространство вокруг атомного
ядра, подобно тому как лопасти пропеллера «расплываются»
в сплошной круг.
Первоначально Бор предполагал, что электроны движутся
вокруг ядра по орбитам, как планеты вокруг Солнца. В
дальнейшем выяснилось, что их движение гораздо сложнее, что они
перемещаются также «вверх и вниз», т. е. к ядру и от него, а боро-
вские орбиты соответствуют тем расстояниям от ядра, на которых
электроны оказываются чаще всего; это наиболее плотные области
сферы, образованной размазанными следами электронов, или,
как говорят, «электронного облака».
Атомное ядро необычайно мало по сравнению со всем атомом:
если бы его диаметр был равен одному дюйму, то внешний «край»
атома находился бы от него на расстоянии целой мили. Но
поскольку электрон почти ничего не весит, практически вся масса
атома (как мы увидим в следующем разделе) сосредоточена
в атомном ядре. Таким образом, ядро обладает невероятной
плотностью: один кубический дюйм плотно упакованных атомных
ядер весил бы 4 миллиарда тонн.
АТОМЫ, ИЗОТОПЫ
И РАДИОАКТИВНОСТЬ
Атомное ядро состоит из частиц двух видов — протонов
и нейтронов. Его положительный электрический заряд
обусловлен зарядами протонов, каждый из }которых равен +1. Атому
ВЕЩЕСТВА И ИХ ПРЕВРАЩЕНИЯ 35
00
'н 2н Зн
Рис. 23. У всех изотопов водорода в ядре один протон, но у них разное число
нейтронов. В ядре атома обычного водорода (ХН) нет ни одного нейтрона.
В ядре изотопа 2Н, который встречается как примесь к обычному водороду
в количестве около 0,015%, один нейтрон. Радиоактивный изотоп — тритий
(3Н) — получают искусственным путем; в ядре его атома два нейтрона.
каждого элемента свойственно определенное, характерное для
него число протонов. Число электронов, каждый из которых
имеет заряд—1, равно числу протонов в ядре, так что в целом
атом электронейтрален.
В 1932 году было обнаружено, что в атомном ядре содержатся
и незаряженные, электрически нейтральные частицы,
получившие название нейтронов. Нейтрон и протон обладают почти
одинаковыми массами. Масса нейтрона в 1839 раз, а масса
протона в 1836 раз больше массы электрона. На шкале атомных
весов вес протона или нейтрона очень близок к 1; поэтому
атомный вес любого элемента близок к сумме чисел протонов и
нейтронов, содержащихся в ядре его атома.
В обычном атоме легчайшего элемента — водорода —
нейтронов нет вовсе. Он состоит из одного электрона с зарядом—1
и одного протона с зарядом +1, так что в целом он, как и все
атомы, электронейтрален. Его атомный вес, 1, обусловлен
наличием одного-единственного протона. Его химические свойства, как
и у' всех атомов, определяются числом электронов, которое здесь
тоже равно 1.
В водородной бомбе нет водорода с атомным весом 1,
обозначаемого ХН. Она наполнена двумя другими разновидностями,
или, как говорят, изотопами водорода: 2Н, который обычно
называют дейтерием, или тяжелым водородом, и 3Н, или тритием.
В атомах всех трех изотопов содержится по одному протону и
соответственно по одному электрону, поэтому с точки зрения
химика это один и тот же элемент — водород. Однако изотопы
различаются по числу нейтронов в ядре: наиболее
распространенный изотоп водорода не содержит нейтронов и, значит, имеет
атомный вес 1; в ядре атома 2Н один (протон и один нейтрон, его
3*
36 ГЛАВА 2
атомный вес равен 2, а в атоме 3Н один протон и два нейтрона,
его атомный вес 3. В природе большинство элементов
представляют собою смеси изотопов. Рекорд в этом отношении
принадлежит олову: оно представлено 10 изотопами.
Число нейтронов в ядре не изменяет химических свойств
атома, но может существенно влиять на его стабильность. Так,
например, ХН и 2Н совершенно стабильны, а 3Н нестабилен.
Ядро этого атома может в любой момент «взорваться», т. е.
подвергнуться распаду. Поэтому изотоп 3Н радиоактивен, так же как и
все другие нестабильные изотопы.
Изотопы — и стабильные, и радиоактивные — стали
важнейшим инструментом биохимических исследований. При помощи
изотопов изучают, например, судьбу пищевых веществ в
организме. Для этого используют «меченые» вещества, в которых один
или несколько стабильных атомов замещены их
радиоактивными изотопами; присутствие радиоактивных атомов можно
обнаружить с помощью счетчика Гейгера. Первым важным результатом
такого рода исследований было открытие факта постоянного
обновления веществ, входящих в состав организма. Молекулы
этих веществ постоянно разрушаются и заменяются новыми.
Даже кости и зубы, которые кажутся столь инертными,
могут обменивать часть своего кальция на кальций крови. Метод
меченых атомов сделал возможным детальное изучение путей
метаболизма. Многие опыты с использованием радиоактивных и
стабильных изотопов будут описаны в последующих главах
этой книги.
ЭЛЕКТРОНЫ
И ХИМИЧЕСКИЕ
СВОЙСТВА ЭЛЕМЕНТОВ
Сто с лишним элементов, известных в настоящее время, можно
расположить в ряд по числу протонов в ядрах их атомов. На
первом месте будет стоять водород — элемент с одним протоном.
Второе место займет элемент с двумя протонами, двумя нейтро-
йами и двумя электронами, с атомным весом 4 — газ гелий,
используемый для наполнения воздушных шаров и дирижаблей. Гелий
отличается от большинства других элементов своей химической
инертностью, неспособностью соединяться с какими-либо другими
элементами. Известны еще пять таких инертных элементов, и
все они газы: неон, аргон, криптон, ксенон и радон. Все они
составляют группу элементов, называемых благородными
газами.
ВЕЩЕСТВА И ИХ ПРЕВРАЩЕНИЯ 37
Рис. 24. Распределение
электронов в атомах благородных газов.
Показано последовательное
расположение электронных
«оболочек». (L. Pauling, College
Chemistry, 3d ed., Freeman, San
Francisco, 1964.)
Почему же благородные газы неспособны к химическим
реакциям? Дело в том, что у этих элементов все электроны
образуют так называемые заполненные электронные оболочки. У гелия
такая оболочка (гелиевая) заполнена двумя электронами. Неон
обладает не только гелиевой оболочкой с двумя электронами,
но и еще одной — неоновой, заполненной восьмью электронами.
У радона целых шесть заполненных электронных оболочек, или
электронных слоев:
Гелиевая оболочка 2 электрона
Неоновая » 8 электронов
Аргоновая » 8 »
Криптоновая » 18 »
Ксеноновая » 18 »
Радоновая » 32 электрона (таким обраэом,
всего в атоме радона 86
электронов).
Химические свойства элементов зависят от числа
электронов в их атомах. Атомы стремятся достичь ближайшей
стабильной конфигурации, т. е. такого состояния, когда их внешняя
оболочка окажется заполненной. Это может быть осуществлено
разными способами: атом может отдать свои электроны,
позаимствовать чужие или поделить один или несколько электронов
с другим атомом.
38 ГЛАВА 2
Некоторые биологически
важные элементы
Таблица 1
Элемент
Водород
Бор
Углерод
Азот |
Кислород
Натрий
Магний
Фосфор
Сера
Хлор
Калий
Кальций
Железо
Кобальт
Иод
Символ 1)
Н
В
С
N
О
i Na
Mg
Р
S
С1
к
Са
Fe
Со
I
Атомный
номер 2)
1 i
5
6
7
8
11
12
15
16
17
19
20
26
27
53
Биологическая функция
Входит в состав воды и биологических веществ
Необходим некоторым растениям
Входит в состав биологических веществ
Входит в состав многих биологических веществ
Входит в состав воды и биологических веществ
Главный внеклеточный положительный ион
В малых количествах нужен животным
У растений — необходимый компонент зеленого
пигмента хлорофилла
Входит в состав многих биологических веществ.
Используется при переносе энергии в
биохимических реакциях
Входит в состав многих биологических веществ,
в частности белков
Главный отрицательный ион в организме животных
Главный положительный ион внутри клеток
Основной компонент костей и зубов
Входит в состав многих веществ, в частности
гемоглобина—красного белкового пигмента,
содержащегося в крови
Входит в состав витамина Bi2
Входит в состав гормона щитовидной железы
дще несколько элементов, например марганец, медь и цинк, также
необходимы организмам в следовых количествах.
!) Каждый элемент обозначается символом, состоящим из одной или двух букв.
2) Атомный номер элемента равен числу протонов в его ядре.
МЕТАЛЛЫ-ДОНОРЫ
ЭЛЕНТРОНОВ
Если расположить элементы в ряд по числу протонов,
содержащихся в ядрах их атомов, то в этом ряду после каждого из
благородных газов будет стоять элемент, атомы которого будут
обладать соответствующей заполненной оболочкой и еще одним
«лишним» электроном. Например, за гелием в таком ряду следует
литий. В атоме лития три протона и, следовательно, три
электрона. Таким образом, у атома лития заполнена гелиевая
оболочка из двух электронов и, кроме того, есть еще один электрон
из восьми, необходимых для заполнения следующей оболочки —
неоновой. Литий стремится избавиться от этого «лишнего»
электрона и приобрести стабильную электронную конфигурацию
гелия.
ВЕЩЕСТВА И ИХ ПРЕВРАЩЕНИЯ 39
Атом ион
Рис. 25. Литий, натрий и калий относятся к элементам, у которых во
внешней электронной оболочке только один электрон. Отдавая этот электрон,
такие атомы приобретают стабильную структуру одного из благородных
газов, а также заряд, равный +1. Атомы, отдавшие или принявшие
электроны и получившие благодаря этому электрический заряд,
называются ионами.
Подобно литию, одним «нежелательным» электроном обладает
и натрий. В атоме натрия 11 электронов, из которых два
заполняют гелиевую оболочку, восемь — неоновую, а один
оказывается первым из восьми, необходимых для заполнения
аргоновой оболочки. К этой же группе элементов относится калий с
40 ГЛАВА 2
одним электроном на криптоновой оболочке и заполненными
внутренними оболочками. Элементы этой группы называются
щелочными металлами. К ним относятся литий, натрий, калий,
рубидий, цезий и франций.
Самая важная особенность щелочных металлов — это их
чрезвычайная химическая активность: они всегда готовы отдать
свой «лишний» электрон, чтобы приобрести стабильную
электронную структуру, свойственную благородному газу. Этот электрон
может быть отдан любому атому, способному его принять. Отдав
электрон, атом щелочного металла приобретет заряд, равный+1,
так как число положительно заряженных протонов в ядре будет
теперь на единицу больше числа электронов. Такие электрически
заряженные атомы называются ионами. Щелочные металлы в
природных условиях находятся в состоянии весьма устойчивых
положительных ионов с зарядом +1.
Атомы всех металлов стремятся приобрести стабильную
электронную структуру, отдав электроны и превратившись в
положительные ионы. Атом любого из щелочных металлов может
отдать лишь один электрон. Так называемые щелочноземельные
металлы могут отдавать два электрона, и поэтому они обычно
находятся в состоянии ионов с зарядом +2. К этой группе
элементов относятся магний, кальций, стронций, барий и
радий. Атом алюминия может отдать три электрона.
ОТРИЦАТЕЛЬНО
ЗАРЯЖЕННЫЕ ИОНЫ
И ИОННЫЕ СОЕДИНЕНИЯ
Кому же металлы отдают свои «лишние» электроны? С
особенной жадностью захватывают электрон элементы группы галогенов:
фтор, хлор, бром и иод. В атомах этих элементов для
заполнения внешней оболочки недостает как раз по одному электрону.
Они так же стремятся заполучить добавочный электрон и
приобрести таким образом структуру ближайшего благородного газа
и заряд —1, как щелочные металлы стремятся отдать свой
избыточный электрон. Поэтому галогены обычно находятся в
состоянии ионов с зарядом —1.
Противоположно заряженные ионы сильно притягивают
друг друга. Связь, обусловленная таким притяжением, носит
название ионной связи. Ионные соединения состоят из
отрицательных и положительных ионов, противоположные заряды
которых равны по величине, что обеспечивает
электронейтральность молекулы в целом.
Примером ионного соединения может служить поваренная
соль, или хлористый натрий (NaCl). Это вещество состоит из
ВЕЩЕСТВА И ИХ ПРЕВРАЩЕНИЯ 41
Атом Нон
Фтор (F)
Атомный номер 9
+ е
Хлор (CD
Атомный номер77
+е
Рис. 26. Фтор и хлор относятся к элементам, у которых в атомах на один
электрон меньше, чем в атомах соответствующих благородных газов.
Принимая электрон, их атомы достигают стабильной электронной конфигурации
н приобретают заряд, равный —1, т. е. становятся отрицательными ионами.
ионов натрия (Na+) с зарядом +1 и ионов хлора (С1~) с зарядом —1.
Как и хлористый натрий, большинство ионных соединений — соли.
КИСЛОТЫ-ДОНОРЫ
ПРОТОНОВ;
ОСНОВАНИЯ - АКЦЕПТОРЫ
ПРОТОНОВ
Кислоты, например соляная кислота (НС1), могут отдавать
ион водорода. Положительно заряженный водородный ион (Н+),
т. е. атом водорода, потерявший свой единственный электрон, —
это не что иное, как протон. Поэтому кислоту можно
определить как вещество, способное отдавать протоны (донор
протонов).
Кислоты отдают свои протоны основаниям — веществам, которые
можно поэтому назвать акцепторами протонов. Примером
сильного основания, или щелочи, может служить едкий натр, исполь-
42 ГЛАВА 2
Рис. 27. Реакция гидроокиси натрия (едкого натра, NaOH) с соляной
кислотой приводит к образованию воды и соли. Раствор гидроокиси натрия
содержит ионы натрия, Na+, и ионы гидроксила, ОН" (А); раствор соляной
кислоты содержит водородные ионы, Н+, и ионы хлора, С1~ (Б). После
смешивания этих растворов ионы Н+ и ОН~ соединяются, образуя молекулы воды
(Н20), а ионы Na+ и С1" остаются в свободном состоянии (В).
зуемый при прочистке канализационных труб. Едкий натр, или
гидроокись натрия (NaOH) — одно из многих оснований, в
которых акцептором протона служит ион гидроксила (ОН"),
обладающий зарядом —1. Ион гидроксила — отрицательно
заряженная группа из двух атомов, водорода и кислорода. Если этот
ион (ОН") встретится с протоном (Н+), то они соединятся,
образовав молекулу воды (Н20). Если, например, смешать гидроокись
натрия с соляной кислотой, они прореагируют с образованием
воды и хлористого натрия (поваренной соли):
NaOH + HCl —> NaCl + H20.
Кислота и основание, содержащее гидроксил, дают воду и соль.
Ион гидроксила — это по существу молекула воды, лишенная
одного протона.
«ОБОБЩЕСТВЛЕНИЕ»
ЭЛЕКТРОНОВ:
КОВАЛЕНТНЫЕ СВЯЗИ
В молекуле воды кислород соединен с водородом не ионными,
а ковалентными связями. Это наиболее распространенный тип
химических связей. Ковалентно связанные атомы не принимают
и не отдают электронов. Они как бы совместно владеют
определенными электронами, или, точнее, парами электронов.
В молекуле воды каждая пара электронов, поделенных между
атомом водорода и атомом кислорода, включает один электрон,
ВЕЩЕСТВА И ИХ ПРЕВРАЩЕНИЯ 43
Рис. 28. Распределение
электронов в одиночных атомах
водорода (слева) и в молекуле Н2,
состоящей из ковалентно
связанных атомов (справа). В молекуле
два электрона, по одному от
каждого водородного атома,
движутся главным образом в
области, лежащей между двумя
ядрами. (Плотность «электронного
облака» соответствует яркости
различных участков на рисунке;
наибольшая плотность — в
области ядер.) Пара электронов,
поделенных между двумя атомами,
удерживает ядра вместе, образуя
между ними ковалентную связь.
принадлежавший ранее водороду, и один электрон,
принадлежавший кислороду:
н.+н. + .о.1)—> н:о:н
• • • •
Такие спаренные электроны, образующие ковалентную связь,
принадлежат одновременно двум атомам —и водороду, и кислороду.
В результате этого каждый водородный атом становится как бы
обладателем двух электронов и, следовательно, приобретает
стабильную конфигурацию гелия, а у кислорода оказываются
8 электронов, создающие стабильную неоновую конфигурацию.
Атомы, у которых немного меньше электронов, чем это нужно
для стабильной конфигурации, могут создать такую
конфигурацию двумя способами: они должны либо принять необходимое
число электронов и в результате стать отрицательными ионами,
либо разделить часть электронов с другими атомами и образовать
таким образом ковалентную связь. Например, молекула
газообразного хлора (С12) состоит из двух атомов хлора (у которых по 7
электронов в неоновой оболочке), соединенных ковалентной
связью: :С1:С1: . Молекула кислорода состоит из двух атомов
(каждый с 6 электронами в неоновой оболочке), соединенных
двойной ковалентной связью; общими здесь будут по два элект-
• • • •
рона от каждого атома: ЮНО:. Поскольку спаренные
электроны принадлежат здесь обоим ковалентно связанным атомам,
атомы хлора и атомы кислорода в молекулах соответствующих
газов приобретают стабильную 8-электронную неоновую
конфигурацию.
На самом деле в атоме кислорода не 6, а 8 электронов: два в
заполненной гелиевой оболочке и шесть в незаполненной неоновой. Но, поскольку
в химических реакциях участвуют только те электроны, которые находятся
в незаполненном слое, обычно только их и указывают на схемах.
44 ГЛАВА 2
О Ион Нч(протон)
Атом
водорода
Ион Н"
(гидрид-ион)
Коеалентная
связь (как е
газообразном
водороде)
Рис. 29. Атом водорода может приобрести стабильную электронную
конфигурацию в результате отдачи или принятия электрона. Отдав электрон, атом
превращается в ион Н+, т. е. протон. Он может также принять один электрон
и превратиться в гидрид-ион (Н~) или вступить в совместное владение
электронами с атомом другого элемента и установить с ним ковалентную связь;
в этих случаях он приобретает стабильную двухэлектронную конфигурацию
гелия. Водород может поделить электроны с кислородом, образуя воду.
В бесчисленном множестве органических веществ он делит электроны с
углеродом, кислородом и азотом. Два водородных атома «обобществляют» свои
электроны, образуя газ водород (Н2).
Во многих химических соединениях есть одновременно и
ковалентные, и ионные связи. Из самых обычных веществ к таким
соединениям относятся (помимо гидроокиси натрия) сернокислый
магний (MgS04), азотнокислое серебро (AgN03),
употребляемое для дезинфекции глаз у новорожденных, однозамещенный
углекислый натрий (NaHC03), чаще называемый бикарбонатом
натрия или питьевой содой. Соду принимают при расстройстве
желудка и употребляют при выпечке хлеба, одну или в смеси с
однозамещенным фосфатом натрия (NaH2P04), т. е. в виде
пекарского порошка. Отрицательные ионы этих веществ имеют
следующую структуру:
:о: :о: :о: :о:
:o:s:o: :o:n::o :o;c:o:
•о*
:о:р::о:
":о: "
сульфат-ион нитрат-ион карбонат-ион фосфат-ион
(SO!-) (NOj) (CO|-) (РОГ)
ВЕЩЕСТВА И ИХ ПРЕВРАЩЕНИЯ 45
Положительные ионы металлов в этих соединениях могут быть
заменены протонами с образованием соответствующих кислот:
серной (H2S04), азотной (HNOs), угольной (Н2С03) и
фосфорной (Н3Р04).
ОКИСЛЕНИЕ,
ВОССТАНОВЛЕНИЕ
И ЭЛЕКТРОНЫ
Что происходит, когда какое-то вещество горит? Сгорающие
в присутствии воздуха вещества соединяются с кислородом.
Водород, соединяясь с кислородом, образует воду; углерод,
соединяясь с кислородом, образует углекислоту (двуокись углерода).
Такие процессы называют реакциями окисления и говорят, что
водород или углерод окисляется:
2Н2 + 02-*2Н20;
С + 02—>С02.
Некоторые реакции с участием других неметаллов (вместо
кислорода) настолько сходны с приведенными выше, что и их
называют реакциями окисления. Например, водород, соединяясь с
серой, образует сероводород:
H2-J-S ^ H2S,
а натрий, сгорая в атмосфере хлора, образует хлористый натрий:
2Na + Cl2-»2NaCl.
Во всех подобных реакциях, которые правильнее называть
окислительно-восстановительными, один из реагентов (в приведенных
примерах Н, С или Na) окисляется, тогда как о другом (О, S или С1)
говорят, что он восстанавливается. Теперь принято определять
окисление как отнятие электрона от атома или группы атомов
(например, от атома натрия), а восстановление — как
добавление лишнего электрона (например, к атому хлора).
Окислительно-восстановительные реакции играют
важнейшую роль в Живых клетках. При синтезе Сахаров в растениях,
как мы увидим несколько позже, происходит восстановление
углекислоты. При окислении Сахаров и их производных выделяется
энергия, необходимая для жизнедеятельности клетки (эти
процессы описаны в главе 3).
46 ГЛАВА 2
ОРГАНИЧЕСКАЯ ХИМИЯ,
ИЛИ ХИМИЯ УГЛЕРОДА
Среди химических элементов имеется один, который
особенно тесно связан с живыми организмами: почти везде, где его
находят, есть жизнь (или она когда-то была). Этот элемент — углерод.
Углерод с его четырьмя электронами на незаполненной неоновой
оболочке не может образовать стабильную структуру, отдав или
приняв 4 электрона; ионы с такими большими зарядами, как
+4 или -4, не образуются. Однако углерод — такой мастер
устанавливать ковалентные связи, что сейчас известно уже больше
миллиона веществ, построенных на его основе. Особенно
интересна уникальная способность атомов углерода вступать в ковален-
тную связь друг с другом, образуя молекулы в виде длинных
цепей (прямых или разветвленных), колец и других, более
сложных структур. Такие молекулы могут объединять самое различное
число углеродных атомов — от нескольких щтук или десятков до
сотен тысяч и даже] миллионов.
УГЛЕВОДОРОДЫ
Простейшими углеродными соединениями являются
углеводороды, содержащие только углерод и водород. Самый простой из
них — метан (СН4), в молекуле которого один атом углерода и
четыре атома водорода соединены четырьмя парами общих электро-
Н
нов: НгС:Н. Эти пары электронов, образующие ковалентные
Н
Н
I
связи, обычно изображают черточками: Н—С—Н.
Метан входил в состав первичной атмосферы, окружавшей
Землю в начальный период ее существования. Жизнь зародилась
в этой атмосфере, и, возможно, метан был древнейшим
родоначальником бесчисленных углеродсодержащих соединений,
возникавших по мере развития жизни. В современных живых
организмах обнаружено лишь несколько углеводородов. К ним
относится, например, каучук, получаемый из сока каучукового
дерева; он построен из бесконечно длинных цепей углеродных
атомов с периодически повторяющимися двойными связями.
Углеводородом является также пигмент каротин, сообщающий
моркови, маслу, яичному желтку и помидору их характерный
цвет.
ВЕЩЕСТВА И ИХ ПРЕВРАЩЕНИЯ 47
н н 9
н:ё:н н«с~н о#-о
н А *
А Б В
Рис. 30. Три способа схематического изображения структуры метана (СН4).
Каждая пара электронов, поделенных между атомами углерода и водорода -—
имеющих, так сказать, «двойное подчинение», может быть представлена парой
точек (Л) или черточкой (Б и В). На схеме В атом углерода обозначен
большим черным кружком, а атомы водорода — маленькими светлыми кружками.
Эти обозначения будут использованы и в последующих рисунках (атомы
других элементов будут обозначаться кружками с соответствующим символом
внутри, например О — кислород, Р — фосфор).
4< 4- 4-
Рис. 31. Часть молекулы каучука.
НЕКОТОРЫЕ ДРУГИЕ
ОРГАНИЧЕСКИЕ ВЕЩЕСТВА
В большинстве углеродных, или органических, соединении
наряду с углеродом и водородом содержатся и другие элементы.
Так, например, углеводород каротин (провитамин А)
превращается в витамин А после расщепления его молекулы пополам
и присоединения к концевому углеродному атому каждой
половинки водорода и гидроксила (ОН). Еще одно небольшое
изменение концевой группы, и витамин А превратится в ретиналъ —
вещество, содержащееся в сетчатке (ретине) глаза и необходимое
для ночного зрения (рис. 32).
И витамин А, и ретина ль содержат один атом кислорода.
Ретиналь, в молекуле которого кислород присоединен двойной
связью, относится к классу веществ, называемых альдегидами.
Витамин А, как и все органические вещества с гидроксильной
группой, является спиртом. В пиве, вине и виски содержится
этиловый спирт.
В отличие от гидроксильного иона ОН", легко реагирующего
с водородным ионом Н+, гидроксильная группа спиртов,
поскольку она ковалентно связана с углеродом, не имеет заряда и не
обладает значительной реакционной способностью.
В органических основаниях нет гидроксильных групп, но
они содержат азот. Аммиак (NH3) является основанием; его
молекула притягивает водородный ион, т. е. протон, и превращается
Витамин А
Ретиналь
Каротин
00
>1
N5
Рис. 32. Каротин — оранжевый
пигмент растений — при расщеплении
его молекулы надвое и окислении
превращается в витамин А. При
дальнейшем окислении образуется
ретиналь — пигмент, необходимый для
ночного зрения.
ВЕЩЕСТВА И ИХ ПРЕВРАЩЕНИЯ 49
в положительный ион NHJ:
н н +
h++:n":h—> h:n:h.
н н
Аммиак может ковалентно присоединиться к углероду
связью азот—углерод, способной заменить одну, две или даже
все три связи между азотом и водородом. В образующихся при
этом органических соединениях азот часто все еще сохраняет
основные свойства и притягивает протон.
Этиловый
спирт
Изопропиловый
спирт
Рис. 33. Структура двух часто
используемых спиртов.
Наиболее распространенными органическими кислотами
являются карболовые кислоты, в которых донором водорода служит
карбоксильная группа. Наш обычный уксус представляет собой
слабый, обычно 5—7-процентный, раствор одной из карбоновых
кислот — уксусной кислоты. Многие биологически важные
соединения представляют собой органические производные
фосфорной кислоты (Н3Р04) (см., например, рис. 38).
АМИНОКИСЛОТЫ
И ФЕНИЛКЕТОНУРИЯ
Органические молекулы могут содержать одновременно и
кислые, и основные группы, связанные между собой
углеродными атомами. Примером могут служить аминокислоты — карбо-
новые кислоты, содержащие аминогруппу (они будут подробно
рассмотрены в главе 5). В природе встречается много различных
аминокислот. В молекуле простейшей из них — глицина — к
атому углерода присоединены два атома водорода, аминогруппа
N
4^ ч. —4V.
Уксусная кислота
+ о+
А Щ)
- Ацетат-ион+Водородный ион
Рис. 34. Уксусная кислота — одна из обычных карбоновых кислот
(карбоксильная группа обведена пунктиром). Бе молекула может диссоциировать на
ион ацетата и водородный ион.
4-0414
50 ГЛАВА 2
Глицин Глутаминовая Фенилаланин Тирозин
кислота
Рис. 35. Структура четырех аминокислот.
и карбоксильная группа. Другой представитель класса
аминокислот — глутаминовая кислота — содержит две карбоксильные
группы, т. е. это дикарбоновая аминокислота. Натриевая соль
глутаминовой кислоты (глутамат натрия) используется в
качестве приправы в кулинарии, особенно в Китае, улучшая вкус
и аромат пищи. На рис. 35 приведены структурные формулы
еще двух аминокислот — фенилаланина и тирозина.
Хотя аминокислоты и необходимы для живых существ, их
излишки должны выводиться из организма. У человека удаление
избытка фенилаланина начинается с превращения его в тирозин.
У детей, страдающих редкой наследственной болезнью фенилке-
тонурией, организм не способен осуществлять эту реакцию.
Пока не была выяснена биохимическая основа этой болезни,
такие дети получали обычную пищу и у них возникали
глубокие нарушения обмена веществ, приводившие в конце концов
к слабоумию. Теперь они могут развиваться нормально, если
получают специальную диету с низким содержанием фенилаланина.
САХАРА
И АСИММЕТРИЧНЫЙ
УГЛЕРОДНЫЙ АТОМ
Различия между разными сахарами едва уловимы. Глюкоза
и галактоза, например, имеют почти одинаковую структуру.
Химическая формула для обоих Сахаров одна и та же: С6Н1206,
оба содержат цепочку из шести углеродных атомов, к пяти из
которых присоединены гидроксильные группы, а шестой
соединен двойной связью с кислородом (образует альдегидную
группу).
И все же глюкоза и галактоза различны, и это различие может
определить судьбу ребенка с редкой наследственной болезнью
ВЕЩЕСТВА И ИХ ПРЕВРАЩЕНИЯ 51
Б В
Рис. 36. Асимметричные атомы углерода можно представить в виде
четырехгранников с разными группами у всех четырех вершин. Как бы вы ни
поворачивали эти фигуры, их никогда не удастся совместить, поскольку они
являются зеркальными отражениями друг друга.
галактоземией. Такие дети не усваивают галактозу, которой
так много в молоке. Если они получают пищу, в которой
галактоза заменена другим сахаром (например, глюкозой), то они
развиваются нормально, если же получают обычную пищу, —
становятся слабоумными.
Различие между глюкозой и галактозой определяется
пространственной конфигурацией асимметричного углеродного
атома. Если атом углерода соединен с четырьмя различными
группами, то возможны два варианта относительного расположения
этих групп. Каждая из таких двух конфигураций будет
зеркальным отображением другой, т. е. они будут отличаться друг от
друга как правая рука от левой.
И в глюкозе, и в галактозе асимметричны второй, третий
четвертый и пятый атомы углерода. Эти два сахара различаются
пространственным расположением групп у четвертого атома.
Изменив расположение групп при любом из четырех
асимметричных атомов, мы получим новый сахар, отличающийся по
свойствам от других, например маннозу, талозу и т.д.; таким
образом можно получить 16 разных Сахаров.
Сахара могут различаться и по другим особенностям
структуры. Обычно в молекуле сахара гидроксильные группы имеются
при всех углеродных атомах, кроме одного, соединенного
двойной связью с атомом кислорода. В глюкозе и галактозе
кислород, присоединенный двойной связью, находится у первого
углеродного атома. В молекуле фруктозы (плодового сахара) такой
кислород связан не с первым, а со вторым углеродным атомом.
Не все сахара содержат шесть атомов углерода, как глюкоза,
галактоза и фруктоза. Молекулы некоторых биологически
важных Сахаров имеют углеродную цепь из пяти, четырех, трех или
семи атомов.
4*
Рис. 37. Структура Сахаров. В воде лишь небольшая доля молекул сахара сохраняет линейную структуру.
Большая часть их приобретает циклическую конфигурацию, которую изображают в виде шести- или пятиугольников так,
как будто они лежат под прямым углом к плоскости бумаги (ближайшую к читателю связь между углеродными
атомами обозначают утолщенной линией).
ВЕЩЕСТВА И ИХ ПРЕВРАЩЕНИЯ 53
Молекулы Сахаров могут соединяться концами друг с другом.
Сахароза — наш обычный сахар, который мы кладем в чай, —
состоит из глюкозы и фруктозы. Другой дисахарид, лактоза
(молочный сахар), таким же образом построен из глюкозы и
галактозы. Соединяясь друг с другом, сахара могут образовывать и
очень длинные, иногда разветвленные цепи; примерами таких
соединений могут служить крахмал, целлюлоза и гликоген.
Сахара и такие образованные из них вещества, как крахмал,
называются углеводами.
КАК ВЕЩЕСТВА
СИНТЕЗИРУЮТСЯ?
В результате любой химической реакции образуются новые
вещества. При взаимодействии едкого натра с соляной
кислотой синтезируется вода. Углерод и кислород, реагируя друг с
другом, образуют двуокись углерода. Реакции, происходящие
внутри клетки, приводят к образованию аминокислот, Сахаров,
витаминов и других сложных соединений, необходимых живому
организму-
Биохимические реакции принципиально ничем не отличаются
от любых других реакций, но у них есть свои особенности и
сложности. Чтобы пошла реакция между едким натром и соляной
кислотой, достаточно их смешать: не понадобится никаких особых
условий, никаких добавок. Синтез соли и воды будет идти
самопроизвольно, и при этом раствор сильно разогреется в
результате выделения энергии. Когда уголь или любой органический
материал, например дерево, сжигают в атмосфере кислорода,
сама собой образуется двуокись углерода и при этом выделяется
энергия в форме тепла и света. Выделением энергии
сопровождаются все самопроизвольные, или спонтанные, реакции, т. е.
такие реакции, которые протекают сами по себе, не требуя
затраты энергии, подобно тому как камень сам скатывается с горы.
СОЛНЕЧНЫЙ СВЕТ
И РЕАКЦИИ, ТРЕБУЮЩИЕ
ЗАТРАТЫ ЭНЕРГИИ
Жизнь зависит от множества химических реакций, которые,
в отличие от реакции между едким натром и соляной кислотой
или сгорания угля, не протекают спонтанно. Эти реакции скорее
напоминают втаскивание камня на гору; для их осуществлений
нужно затратить энергию. Первичным источником энергии,
необходимой для живых организмов, служит солнечный свет.
54 ГЛАВА 2
Энергия солнечного света превращается в химическую
энергию в хлоропластах зеленых растений (эти органеллы будут
описаны в главе 3). Здесь в результате сложной цепи реакций,
известных под общим названием фотосинтеза, из углекислоты
(С02) и воды при участии световых квантов (hv) образуются
кислород и сахар:
6C02 + 6H20 + fcv —> С6Н12Ов + 602.
Фотосинтез начинается с поглощения света зеленым
пигментом хлорофиллом. Световая энергия используется для
регенерации (воспроизводства) молекул, необходимых для синтеза
глюкозы. Одна из таких молекул — это НАДФ-Н
(восстановленный никотинамидадениндинуклеотидфосфат). НАДФ» Н
доставляет электроны, необходимые для восстановления С02 до
глюкозы; при этом он превращается в НАДФ+, который должен быть
снова восстановлен до НАДФ-Н при участии света.
Световая энергия используется также для регенерации АТФ
(аденозинтрифосфата) — вещества, которое можно было бы
назвать «энергетической валютой» клетки: оно служит
источником энергии почти что для всех реакций, не протекающих
самопроизвольно.
АТФ- ДВИГАТЕЛЬ РЕАКЦИЙ,
ТРЕБУЮЩИХ ЗАТРАТЫ
ЭНЕРГИИ
В хлоропластах световая энергия улавливается в форме
фосфатных связей АТФ: в результате сложной последовательности
химических реакций она используется для того, чтобы ковален-
тно присоединить третий остаток фосфорной кислоты к АДФ
(аденозиндифосфату) — остатку использованной молекулы АТФ,
отдавшей свой концевой фосфат (см. рис. 38).
Весьма значительная энергия, затраченная на присоединение
третьего фосфата к АДФ, запасается в образовавшейся молекуле
АТФ. Как же она может быть использована для
осуществления реакций, идущих с повышением уровня энергии? Рассмотрим
для примера восстановление карбоновой кислоты до альдегида.
Эта реакция не идет самопроизвольно, поскольку энергия
карбоксильной группы меньше энергии альдегидной группы.
Необходимое повышение уровня энергии обеспечивается переносом
третьего фосфата АТФ на карбоксильную группу. Эта реакция
идет легко, так как она приводит к понижению уровня энергии
всей системы: фосфорилированная карбоновая кислота и АДФ
обладают меньшей энергией, чем исходные вещества —
карбоновая кислота и АТФ.
Фосфорилированная карбоксильная группа восстанавливается
до альдегидной группы. Донором водорода (вернее, электрона,
ВЕЩЕСТВА И ИХ ПРЕВРАЩЕНИЯ 55
+ М
Фосфат-ион + АДФ(аденозиндифосфат) + Световая энергия
\
АТФ (аденозинтрифосфат)
Рис. 38. В хлоропластах зеленых растений энергия света (hv) используется
для синтеза АТФ из АДФ и фосфата. Молекула АТФ включает цепочку из
трех фосфатных групп, присоединенных к сахару рибозе (изображена в
циклической форме), которая в свою очередь соединена со слабым азотистым
основанием — аденином. Соединение аденина с рибозой называется аденозином,
отсюда и название «аденозинтрифосфат» (АТФ).
56 ГЛАВА 2
-e-V*
Карбоновая®
кислота
Альдегид
+Аденозин-Ф-Ф-Ф •
Карбоновая .Тф
кислота Al*
+Аденозин-Ф-Ф
Фосфокислота АДФ
НАДФ-Н
+ НАДФ+
Фосфокислота
Альдегид Фосфат-ион
Рис. 39. Восстановление карбоксильной группы до альдегидной (А) — это
реакция, требующая затраты энергии. И все же она может осуществиться,
если будет сопряжена с гидролизом АТФ до АДФ (Б и В), так как при этом
гидролизе выделяется даже больше энергии, чем нужно для восстановления
карбоновой кислоты до альдегида. Именно таким образом в хлоропластах
фосфоглицериновая кислота превращается в дифосфоглицериновую, а затем
восстанавливается до фосфо глицера льде гида. Это важнейшая реакция в
процессе восстановления углекислоты до глюкозы.
переносимого в составе водородного атома) для этой цели служит
НАДФ'Н. Это тоже реакция, идущая с понижением уровня
энергии.
Таким образом, использование энергии, заключенной в
фосфатной связи АТФ, позволяет заменить реакцию, идущую с
повышением энергии (карбоновая кислота ->■ альдегид), двумя
реакциями, идущими с понижением энергии: 1) карбоновая
кислота + АТФ -+ фосфорилированная карбоновая кислота +АДФ
и 2) фосфорилированная карбоновая кислота + НАДФ-Н ->-
-+альдегид -{-фосфат + НАДФ (см. рис. 39). Эти реакции
относятся к важнейшим этапам фотосинтеза глюкозы из
углекислоты и воды.
ФОТОСИНТЕЗ ГЛЮКОЗЫ
Около 25 лет назад Мелвин Кальвин (род. в 1911 г.) из
Калифорнийского университета в Беркли начал исследования с целью
выяснить путь превращения углекислоты и воды в глюкозу.
ВЕЩЕСТВА И ИХ ПРЕВРАЩЕНИЯ 57
Растущие водоросли
®=Ф=®
получают
радиоактивную
углекислоту
синтезируют
радиоактивную фосфоглице-
ри новую кислоту
Рис. 40. Для того чтобы расшифровать отдельные этапы фотосинтеза
глюкозы из углекислоты и воды, М. Кальвин выращивал водоросли в среде с
радиоактивной углекислотой (14С02) и изучал последовательность, в которой
различные соединения приобретают радиоактивную метку. Первой включала
метку фосфоглицериновая кислота. За выяснение последовательности
биохимических реакций в процессе фотосинтеза Кальвину в 1961 году была
присуждена Нобелевская премия по химии.
Он поместил фотосинтезирующие водоросли на несколько секунд
в среду с углекислотой, в которой обычный изотоп 12С был
замещен радиоактивным изотопом 14С (в атоме 14С на два нейтрона
больше, чем в атоме обычного углерода). Затем он быстро убил
клетки и определил, какие соединения стали радиоактивными.
Оказалось, что раньше всех радиоактивным становится трех-
углеродное соединение — фосфоглицериновая кислота (см. рис. 40).
Последующие опыты показали, что радиоактивным
становится только один из трех углеродных атомов фосфоглицериновой
кислоты, а именно углерод карбоксильной группы. Значит,
это вещество не могло образоваться из трех молекул
радиоактивной С02. Может быть, радиоактивная углекислота
присоединилась к какому-то двууглеродному соединению? Такое
предположение казалось вполне логичным, но позже было установлено,
что С02 присоединяется к фосфорилированному пятиуглеродно-
му сахару — рибулозодифосфату, образуя шестиуглеродное
соединение, которое затем расщепляется на две молекулы
фосфоглицериновой кислоты.
Цепь химических превращений, приводящих к образованию
глюкозы из рибулозодифосфата, углекислоты и воды, показана
на рис. 41. Каждая новая молекула глюкозы с ее шестью углеро-
дами образуется не в результате присоединения одной молекулы
С02 к одному рибулозодифосфату: она представляет собой
конечный продукт цикла реакций, в котором шесть молекул С02
связываются с шестью молекулами рибулозодифосфата. Большая
часть фосфоглицеральдегида, образующегося на третьем этапе
58 ГЛАВА 2
Фруктозодифосфат
XX,
Фруктозофосфат Глюкозофосфат
Рис. 41. Фотосинтез глюкозы из углекислоты и воды.
ВЕЩЕСТВА И ИХ ПРЕВРАЩЕНИЯ 59
этой цепи реакций, никогда не превращается в глюкозу. Вместо
этого он (как показано стрелками) следует по кругу и
возвращается к исходной точке, чтобы вступить в новый цикл. Этот
возвратный путь включает ряд этапов, на которых образуются
четырех-, шести- и семиуглеродные сахара; трехуглеродные
молекулы глицеральдегида объединяются, частично разрушаются, и в
конце концов это приводит к образованию пятиуглеродного
рибулозодифосфата, регенерация которого необходима для того,
чтобы весь цикл мог начаться снова.
ОКИСЛЕНИЕ ГЛЮКОЗЫ
И ОСВОБОЖДЕНИЕ ЭНЕРГИИ
В растениях, так же как и в организме животных, глюкоза
окисляется до углекислоты и воды, и при этом значительная часть
энергии, затраченной на ее синтез, переходит в форму АТФ. Первые
этапы окисления глюкозы напоминают последние этапы ее синтеза,
но идут в обратную сторону: происходит постепенное укорочение
углеродной цепи глюкозы до фосфоглицериновой кислоты. Еще
через несколько этапов фосфоглицериновая кислота
превращается в пировиноградную кислоту. На самых последних этапах
пировиноградная кислЪта окисляется до углекислоты и воды в
органеллах, называемых митохондриями, которые будут
описаны в следующей главе.
Почему расщепление глюкозы идет таким сложным путем?
При полном окислении глюкозы выделяется много энергии. При
постепенном, поэтапном ее окислении эта энергия освобождается
не сразу, а сравнительно небольшими порциями, как раз
достаточными для образования молекул АТФ с минимумом
бесполезных потерь. В результате около двух третей энергии,
извлекаемой из молекулы глюкозы при ее полном окислении, переходит в
форму АТФ. Автомобильный мотор, в котором сгорает не
глюкоза, а бензин, не обеспечивает и половины той эффективности, с
которой энергия окисления может использоваться в живом
организме.
ДРУГИЕ ХИМИЧЕСКИЕ СИНТЕЗЫ
АТФ, полученный при окислении глюкозы, обеспечивает
энергией химические реакции, сокращение мышц, передачу
нервных импульсов. Это вещество действительно играет роль
разменной монеты, с помощью которой все энергетические расходы
клетки оплачиваются энергией солнечного света. Кроме того,
соединения, образующиеся на различных этапах синтеза или распада
глюкозы, могут использоваться как исходные вещества для
синтеза других соединений. Крахмал, целлюлоза и другие
углеводы образуются из глюкозы. Жиры представляют собой конеч-
60 ГЛАВА 2
ные продукты длинного ряда химических реакций,
начинающегося с превращений фосфоглицериновой кислоты и фосфоглицер-
альдегида. С фосфоглицериновой кислоты начинается путь,
ведущий к образованию аминокислот и других карбоновых кислот.
Таким образом в результате сложных цепей химических
реакций создаются вещества, составляющие основу жизни: растения
синтезируют их из углекислоты и воды с помощью солнечного
света, некоторые бактерии — из сахара и солей, а человек — из
продуктов переваривания своего завтрака, обеда и ужина.
Описание всего, что известно сейчас о путях биохимических
превращений веществ в организме, могло бы заполнить много томов.
В последующих главах этой книги будут описаны лишь
некоторые процессы, наиболее ярко иллюстрирующие специфику
химизма живых клеток.
U АНАТОМИЯ КЛЕТКИ
Длинный путь прошел микроскоп со времени его
изобретения в конце XVI века, и огромным было его влияние на все
развитие биологии. В микроскоп XVII столетия Роберт Гук
увидел клетки растений, вернее их целлюлозные стенки. Левен-
гук различал уже гораздо более мелкие объекты, например
бактерии. В начале XIX века было открыто клеточное ядро,
вскоре признанное обязательной принадлежностью всякой
клетки. В то время ядро и окружающая его цитоплазма
представлялись состоящими из аморфной студенистой массы.
К концу прошлого века благодаря усовершенствованию
микроскопа, техники приготовления препаратов и их окраски стало
очевидным, что это студенистое вещество далеко не однородно.
В цитоплазме можно было различить несколько структур, а в
ядре были обнаружены причудливой формы палочки —
хромосомы. На усовершенствование микроскопа, обеспечившее эти
открытия, потребовалось 200 лет.
Электронная микроскопия развивалась быстрее. В 1924 году
Луи де Бройль (род. в 1892 г.) высказал мысль, что электроны
в некоторых отношениях ведут себя подобно свету (открытие,
за которое он в 1929 году получил Нобелевскую премию по
физике). Восемь лет потребовалось для создания электронного
микроскопа в его первоначальной примитивной форме, а еще через
20 лет он был усовершенствован почти до своего теоретического
предела. Замена светового луча пучком электронов сделала
видимыми объекты в несколько тысяч раз меньше тех, что были
видны в обычный микроскоп.
Методы приготовления и окраски препаратов для светового
микроскопа оказались непригодными для электронной
микроскопии. Однако в 50-х годах нашего столетия электронным мик-
роскопистам удалось разработать методы, позволившие выявить
62 ГЛАВА 3
Рис. 42. Биология многим обязана микроскопу. А. Микроскопы Левенгука
(XVII ьек). Б. Микроскоп, которым пользовался Пастер (XIX век). В.
Современный световой микроскоп. Г. Современный электронный микроскоп.
[С разрешения Bettmann Archive (A), Institut Pasteur, Paris (Б), American
Optical Company (В) и Perkin-Elmer Corporation (Г).]
АНАТОМИЯ КЛЕТКИ 63
Рис. 43. Ультравысоковольтные электронные микроскопы, такие, как
изображенный здесь миллионовольтный микроскоп фирмы «Хитачи», только
начинают использоваться для изучения биологических объектов.
Проникающая способность их электронного луча делает возможным изучение объектов
значительно большей толщины, чем с помощью обычного электронного
микроскопа. Эту способность проникать вглубь можно видеть на
стереоскопических фотографиях (см., например, рис. 66). (С разрешения Perkin-Elmer
Corporation.)
до того невидимые структуры, заполняющие клетку. Теперь
можно было различить даже сложную архитектуру этих
образований — клеточных органелл.
В этой главе будет описана анатомия клетки, изученная с
помощью электронного микроскопа. Этот прибор позволяет
исследовать лишь очень тонкие срезы ткани — толщиной около
тысячной доли диаметра средней клетки. Не только клетку, но и
содержащиеся в ней органеллы приходится резать на ломтики, как
булку. По электронным микрофотографиям этих ультратонких
срезов микроскопист должен восстановить трехмерную
структуру органеллы; это подобно тому, как можно было бы,
рассматривая кусочки нарезанного лимона, представить себе его
64 ГЛАВА 3
Рис. 44. Строение одноклеточного организма Euglena: микрофотография,
полученная с помощью сканирующего электронного микроскопа. Эту
микроскопическую водоросль заморозили, а затем часть клетки скололи, чтобы
можно было видеть ее внутреннюю анатомию. Цитоплазма состоит из
губчатого на вид материала — эндоплазматического ретикулума (ЭР), в который
погружены хлоропласты (Хл), митохондрии (М), зерна парамила (П) (пара-
мил — это характерная для эвглены форма резервного углевода) и полостей
(Пол), которые были заполнены парамиловыми зернами. Видна часть ядра
(Я). Жгутик (Жг), базальное тельце (БТ), маленький второй бездействующий
жгутик (Ж2) и глотка (Гл) представляют собой органеллы, отсутствующие
у большинства других клеток. Клетка покрыта гибкой пелликулой (Пел),
лежащей снаружи от клеточной стенки. (С разрешения Helene N. Guttmann.)
АНАТОМИЯ КЛЕТКИ 65
форму, дольчатое строение, расположение семян, толщину
кожуры.
Электронный микроскоп уже сейчас дает богатейшую
информацию о структуре и организации клетки и ее органелл. В
семидесятых годах следует ожидать дальнейших успехов в этой облас-
сти, так как уже вышла из экспериментальной стадии
разработка двух новых типов электронного микроскопа
—сканирующего и ультравысоковольтного — и получены поразительные
трехмерные изображения клеток и их отдельных частей,
ОБЩИЙ ПЛАН
СТРОЕНИЯ КЛЕТКИ
Подобно тому как в любом сложном организме, например в
организме человека, основные функции разделены между
специализированными структурами и органами (кожей, пищеварительной
системой, легкими, печенью и т.д.), в клетке их тоже
выполняют специализированные структуры и органеллы. Как видно из
приведенных микрофотографий (рис. 44 — 49), эти органеллы
выявляются с помощью электронного микроскопа (конечно, не
всегда их можно увидеть все сразу — потому же, почему семена
попадают не в каждый срез лимона); можно также заметить, что
внутренняя анатомия клеток разного типа несколько различна,
в связи с приспособлением к той или иной специальной функции.
Рассмотрим общий план строения клетки, прежде чем перейти
к детальному изучению каждой органеллы.
От внешнего мира клетка отделена оболочкой — клеточной
мембраной. Внутри клетки синтезируется множество веществ.
Обычно все эти синтезы связаны с эндоплазматическим ретику-
лумом — сложным лабиринтом из мембранных структур,
который иногда заполняет почти всю цитоплазму. Мембраны ретику-
лума могут быть усеяны множеством рибосом — мельчайших
телец, необходимых для синтеза белка; рибосомы бывают также
свободно взвешены в цитоплазме. Аппарат Гольджи
представляет собой систему расширенных полостей эндоплазматического
ретикулума, в которых формируются гранулы из веществ,
вырабатываемых клеткой «на экспорт». Кроме того, в аппарате Гольджи
происходит заполнение «пищеварительными соками» специальных
мешочков, называемых лизосомами. Лизосомы участвуют в
переваривании поглощенных клеткой частиц или нежелательного
материала.
Для многочисленных химических синтезов, происходящих в
клетке, нужна энергия. Ее первичным источником служит сол-
5-0414
66 ГЛАВА 3
I
'к
Рис* 45. Часть типичной хрящевой клетки. Такие клетки вырабатывают
окружающее их основное вещество хряща (ОВ). Хорошо видны аппарат Гольд-
жи (Г) и эндопла8матический ретикулум (ЭР); мельчайшие зернышки в
цитоплазме — это рибосомы. (С разрешения J.-P. Revel.)
нечный свет, энергия которого преобразуется в хлоропластах
зеленых растений (рис. 48, Хл) в химическую энергию углеводов
и других веществ. И животные, и растительные клетки
извлекают необходимую им энергию из этих веществ путем их окисления.
Получаемая энергия используется для синтеза АТФ, главным
образом в органеллах, называемых митохондриями.
Разнообразная химическая активность клетки
координируется и контролируется сигналами, поступающими из ядра^ъ
котором хранятся программы управления клеткой. Ядро окружено
ядерной мембраной. Внутри ядра расположена хорошо заметная
Рис. 46. Внешнесекторные
клетки из поджелудочной
железы (увеличение 12 000).
Вещества, необходимые
для пищеварения,
синтезируются в полостях эндо-
плазматического
ретикудума. Эти вещества,
упакованные в зимогеновые
гранулы (ЗГ), поступают через
проток (Пр) в тонкую
кишку. На этой электронной
микрофотографии видны
две секреторные клетки,
разделенные клеткой стенки
протока (КД). Виден также
кровеносный капилляр
(Кап). (С разрешения J. D.
Jamieson и Sabatini.)
*t
*1|Шк
Рис. 47. Участки двух
печеночных клеток
(увеличение 19 000). В таких клетках
содержатся гранулы
гликогена (Гл) — вещества,
молекулы которого
представляют собой разветвленные
цепи, построенные из
остатков глюкозы. В такой форме
организм животного
запасает глюкозу. Гликоген
содержится главным
образом в печени и мышечных
клетках. (С разрешения D.
Sabatini.)
Рис. 48. Клетка табачного
растения (Nicotiana taba-
сит) с хлоропластами
(увеличение 3000). Хлоро-
пласты (Хл) содержат
крахмальные зерна (К).
Крахмал представляет собой
смесь прямых и
разветвленных цепей,
составленных из молекул глюкозы,
и служит у растений
резервным углеводом. В зрелых
растительных клетках
большую часть цитоплазмы
занимает крупная вакуоль
(В), содержащая
клеточный сок. (С разрешения R.
W. Home.)
Рис. 49. Растительная
клетка при большом
увеличении. Можно видеть ядро (Я),
ядерную мембрану (ЯМ),
митохондрии (М), рибосомы
(р) и плазматическую
мембрану (ПМ), лежащую
непосредственно под
толстой целлюлозной стенкой
(С). Целлюлозная стенка,
так же как и большие
вакуоли (В), характерна для
зрелой растительной
клетки. (G разрешения R. W.
Ноте.)
АНАТОМИЯ КЛЕТКИ 69
органелла — ядрышко, функция которого связана с синтезом
рибосом.
Структура и функция всех этих органелл будет описана
подробнее в последующих разделах.
ПЛАЗМАТИЧЕСКАЯ
МЕМБРАНА
Растительные клетки окружены хорошо видимой целлюлозной
стенкой, однако все клетки, как растительные, так и животные,
имеют на своей поверхности плазматическую мембрану, которая
в клетках растений лежит непосредственно под стенкой из
целлюлозы.
Плазматическая мембрана обеспечивает целостность клетки.
При повреждении мембрана часто может восстановиться, но до
этого часть клеточного содержимого вытекает наружу. Однако
плазматическая мембрана — это не просто оболочка, не
позволяющая клетке растекаться. Через мембрану должны пройти
почти все вещества, проникающие в клетку или выходящие иэ
нее. Как мы увидим, некоторые вещества сами свободно прохо-
Рис. 50. У многих клеток плазматическая мембрана образует множество
пальцевидных выступов, называемых микроворсинками. Это во много раз
увеличивает поверхность клетки и облегчает перенос веществ через
мембрану.
А. Внутренняя поверхность двенадцатиперстной кишки куриного
эмбриона (увеличение 1200). Стенка кишки образует глубокие складки, что
значительно увеличивает ее площадь. Шероховатые бугорки — это отдельные
клетки.
Б. То же при большем увеличении (10 000). Видно, что шероховатость
клеток, заметная на фото А, обусловлена множеством белых выростов
(микроворсинок), занимающих часть поверхности этих незрелых, эмбриональных
клеток (поверхность зрелых клеток еще гуще усеяна микроворсинками).
Обе микрофотографии получены с помощью сканирующего электронного
микроскопа. (Grey R. D., J. Morphol., 137, 193 (1972), с разрешения автора.)
70 ГЛАВА 3
Рис. 51. Плазматическая
мембрана яйцеклетки
обычно покрыта
микроворсинками. Это видно на
приведенной микрофотографии
фрагмента яйца
африканской шпорцевой лягушки
{Xenopus laevis).
Фотография сделана с помощью
сканирующего электронного
микроскопа. Справа видна
цитоплазма с желточными
гранулами (Ж). (С
разрешения R. D. Grey.)
дят через мембрану, другие клетка активно перекачивает
внутрь или наружу, а кое-что может попадать в клетку, даже не
проходя через мембрану.
НЕКОТОРЫЕ ВЕЩЕСТВА
ДИФФУНДИРУЮТ
ЧЕРЕЗ ПЛАЗМАТИЧЕСКУЮ
МЕМБРАНУ
Неживые мембраны обычно либо пропускают, либо не
пропускают то или иное вещество; иными словами, они или
проницаемы, или непроницаемы для него. Например, целлофановая
пленка проницаема для малых молекул — для воды, солей,
Сахаров и т. п. (упаковочный целлофан обычно подвергают
специальной обработке, чтобы сделать его непроницаемым).Такого рода
мембраны напоминают сито, пропускающее через свои
микроскопические поры мелкие молекулы и задерживающее более
крупные частицы. Бактерии, например, слишком велики, чтобы
пройти сквозь эти поры, поэтому целлофан непроницаем для бактерий.
Если сосуд разделить целлофановой мембраной на две части и
в одну из них налить чистую воду, а в другую раствор сахара,
то сахар будет проходить сквозь мембрану в отсек с чистой водой.
В конце концов концентрация сахара в обоих отсеках станет
одинаковой. Это передвижение растворенного вещества в сторону
его меньшей концентрации носит название диффузии.
АНАТОМИЯтКЛЕТКИ 71
Проницаемая
мембрана
Проницаемая
о о о о »о о о о
о о oJL о о о
о о о оХо о о о
о о о J- о о о
о о о o-Lo о о о
о о о J_ о о о
о о о o_Lo о о о
о о
I
о о о
о ^_
о о о oJLo о о о
О О О J- О О О
о о о о ' о о о о
Передвижение молекул воды
одинаково в обоих
направлениях
Б
о о о о.
о о о \
о о о о.
о о о ^
О О О О-^О • О •
о о о ^
о о о о.
о о о ^
о о о ^
о о о о
II
.о • о •
. • о •
.о • о •
. • о •
, • о •
.о • о •
• о •
о о о о_^о • о •
- • О •
о • о •]
Молекулы сахара
диффундируют из камеры II в
камеру Г, в передвижении
молекул воды несколько
преобладает обратное направление
Рис. 52. Диффузия обусловлена беспорядочными движениями молекул.
А. Сосуд, наполненный водой, разделен мембраной на две камеры, I и II.
Молекулы воды при своих случайных перемещениях могут проходить через
мембрану из одной камеры в другую, но, поскольку обе камеры заполнены
водой, число перемещений в ту и в другую сторону одинаково и суммарный
результат их равен нулю.
Б. Камера I заполнена чистой водой, а камера 77 — раствором сахара.
Молекулы сахара диффундируют через мембрану в чистую воду. Пока их
концентрация по обе стороны мембраны не уравняется, из камеры II в камеру I
будет переходить больше молекул сахара, чем из камеры I в камеру П. После
уравнивания концентраций сахара в обеих камерах количества'молекул,
переходящих туда и обратно, будут равны. Кроме того, слева направо вначале
будет переходить больше молекул воды, так как в камере I ее начальная
концентрация выше, чем в камере II.
А
Рис. 53. Процесс диффузии идет чрезвычайно медленно; в этом легко
убедиться, наблюдая за диффузией чернил в воде. Для этого в пробирку или
стакан наливают немного концентрированного раствора сахара, интенсивно
окрашенного чернилами (А). Поверх окрашенного раствора сахара
осторожно наслаивают чистую воду (Б, Б); это можно сделать, не смешивая жидкости,
благодаря высокой концентрации сахара в нижнем слое. Если сосуд не
трясти, то для равномерного распределения чернил по всему объему жидкости
(Г) потребуется много недель (конечно, диффундировать будет и сахар, но он
бесцветен, и поэтому заметна будет только диффузия чернил).
72 ГЛАВА 3
Поверхностные мембраны клеток проницаемы для таких
веществ, как некоторые липиды — нерастворимые в воде вещества,
к которым относятся, в частности, жиры и масла. Они легко
диффундируют в обоих направлениях, так что их концентрация
во внутреннем содержимом клетки и в окружающей ее среде более
или менее одинакова. Но плазматическая мембрана ведет себя
несравненно сложнее, чем кусочек целлофана. Например,
вещества, для которых она непроницаема, могут активно
«перекачиваться» ею внутрь клетки или из клетки наружу.
НЕКОТОРЫЕ ВЕЩЕСТВА
«ПЕРЕКАЧИВАЮТСЯ»
ЧЕРЕЗ ПЛАЗМАТИЧЕСКУЮ
МЕМБРАНУ
Концентрация многих солей внутри клетки и в окружающей
среде существенно различна. У животных во внеклеточной среде,
т. е. в крови, лимфе и тканевой жидкости, омывающей
большинство клеток, из положительно заряженных ионов в наибольшем
количестве содержится натрий, тогда как в клетке этот ион почти
полностью отсутствует. Напротив, концентрация калия почти
в 40 раз, а магния в 15 раз выше внутри клеток, чем в
окружающей их среде. Во внеклеточных жидкостях положительные ионы
нейтрализуются главным образом ионами хлора, в клетке же эту
роль выполняет в первую очередь фосфат.
Поддержание этих различий в концентрациях ионов—одна ив
функций плазматической мембраны. Заключенные в ней
белковые «насоси» (мы подробнее расскажем о них в следующей главе)
откачивают из клетки такие нежелательные ионы, как натрий,
и накачивают внутрь нужные ионы, в частности ион калия.
Постоянный перенос ионов, осуществляемый этими нососами,
требует энергии в форме АТФ.
В экономике жизни растения выполняют две важнейшие
функции. Живые организмы нуждаются не только в углероде, но и в
15 —20 минеральных элементах, таких, как натрий, калий, магний,
кальций, железо, сера, хлор, фосфор. Как мы уже знаем, с
помощью фотосинтеза растения переводят углерод атмосферной
углекислоты в форму, доступную для животных; но они, кроме того,
концентрируют соли, содержащиеся в почве в виде чрезвычайно
слабых растворов, что позволяет животным получать нужные
им ионы. Поэтому ионные насосы в плазматических мембранах
клеток корней столь же"необходимы для поддержания всей наземной
жизни, как и хлоропласты листьев.
Способность поддерживать разность концентраций солей —
свойство, присущее всем клеткам. Исключительно важна эта
АНАТОМИЯ КЛЕТКИ 73
способность для нервных; клеток. Различия в концентрациях
ионов внутри и вне нервного волокна обеспечивают передачу
нервного импульса. В двух словах этот механизм заключается в
следующем. При раздражении кончика нервного волокна
возникает распространяющаяся по волокну зона, в которой ионы натрия
входят внутрь волокна и в результате на его поверхности
создается отрицательный заряд. Этот заряд быстро нейтрализуется
ионами калия, выходящими из волокна наружу. Нормальное
состояние — натрий снаружи, калий внутри —
восстанавливается очень быстро, примерно за тысячную долю секунды, и нерв
снова готов к передаче импульса.
Кроме солей, в клетку «накачиваются» многие другие
вещества, и для каждого нужен свой особый «насос». Насосы для
некоторых питательных веществ появляются только тогда, когда
клетка испытывает нужду в этих веществах. Таким
образом/мембранные насосы составляют часть механизма, с помощью которого
клетка приспосабливается к изменениям среды — омывающей
ее внеклеточной жидкости.
НЕКОТОРЫЕ ВЕЩЕСТВАХ
И ПИЩЕВЫЕ ЧАСТИЦЫ
ПЕРЕХОДЯТ ВНУТРЬ КЛЕТКИ
В МЕШОЧКЕ
ИЗ ПЛАЗМАТИЧЕСКОЙ
МЕМБРАНЫ
Соли и питательные вещества в большинстве случаев
проникают в клетки путем диффузии через плазматическую мембрану
или благодаря работе мембранных насосов. Однако некоторые
частицы, служащие пищей одноклеточным организмам
(простейшим), слишком велики, чтобы пройти через плазматическую
мембрану.
Такие частицы захватываются путем фагоцитоза. Этот
процесс позволяет амебам и другим одноклеточным животным
поедать еще более мелкие растительные и животные организмы
без того, чтобы жертва проходила через мембрану. Амеба,
похожая на капельку слизи, передвигается, как бы перетекая
постепенно с одного места на другое. Примерно так же она поедает
свою пищу. Встретив на пути добычу, амеба обтекает ее, пока ве
окружит полностью. Как только это произойдет, окружающий
добычу мешочек из плазматической мембраны отрывается от
остальной мембраны и оказывается теперь внутри амебы. Этот
мешочек — пищеварительная вакуоль — сливается с
пузырьками, содержащими пищеварительные соки, и переваривание
добычи происходит внутри вакуоли. Освобождающиеся при этом
74 ГЛАВА 3
Фагоцитоз
Шноцитоз
„Выталкивание"
Рис. 54. Л. Крупные частицы захватываются путем фагоцитоза: клетка
окружает частицу своей плазматической мембраной, которая затем отделяется
от поверхности и образует внутриклеточную вакуоль. Б. Капельки жидкости
поглощаются с помощью аналогичного процесса, называемого пиноцитозом.
В, Вакуоль, содержащая отбросы или вещества, предназначенные для
выделения в окружающую среду, выталкивается из клетки в результате
процесса, прямо противоположному фаго- и пиноцитозу.
питательные вещества переходят в цитоплазму амебы через
мембрану, окружающую вакуоль. Непереваренные остатки
выделяются с помощью процесса, обратного фагоцитозу:
пищеварительная вакуоль сливается с плазматической мембраной и
открывается наружу, выбрасывая свое содержимое.
Фагоцитоз свойствен не только одноклеточным организмам.
Специализированные клетки, например лейкоциты (белые
кровяные клетки), очищают организм многоклеточного
животного от частичек пыли, бактерий, остатков погибших клеток и
других отбросов с помощью фагоцитоза. Мембрана лейкоцита
обволакивает частицу, втягивает ее внутрь клетки, края мембраны
сливаются и частица оказывается заключенной в вакуоли. Этот
процесс не имеет отношения к питанию лейкоцита и даже часто
заканчивается гибелью клетки, но он способствует защите всего
организма от вредных или ненужных включений. Клетки
высших животных не нуждаются в фагоцитозе как способе питания.
Пища переваривается в желудочно-кишечном тракте, и клетки
получают питательные вещества в уже готовом для усвоения виде
через системы лимфо- и кровообращения.
Поглощать жидкость, «пить», клетки могут с помощью
другого, сходного с фагоцитозом и еще более распространенного
процесса — пиноцитоза. В этом случае тот же механизм используется
для захвата капелек жидкости. Вакуоль с жидкостью отрывается
АНАТОМИЯ КЛЕТКИ 75
от поверхностной мембраны и оказывается внутри клетки. Пино-
цитоз нужен клетке не для «питья» воды, а для получения веществ,
растворенных во внеклеточной жидкости.
Пиноцитоз можно наблюдать у одноклеточных организмов и
некоторых специализированных клеток, например в мышцах и
в кишечнике. Стенки кровеносных капилляров выстланы
клетками, переносящими некоторые вещества из крови с помощью
пиноцитоза и последующего выбрасывания их в окружающие
ткани. На поверхности клетки, обращенной внутрь капилляра,
образуются вакуоли, заполненные кровяной плазмой; они
перемещаются к противоположной поверхности клетки и сливаются
там с плазматической мембраной, выталкивая содержимое в
межклеточную тканевую жидкость.
СТРУКТУРА ПЛАЗМАТИЧЕСКОЙ
МЕМБРАНЫ
Каково строение плазматической мембраны и позволяет ли
оно понять ее свойства? Этому вопросу было посвящено много
исследований. Электронный микроскоп выявил трехслойную
структуру, и уже давно было высказано предположение, что
мембрана состоит из слоя липидов (жироподобных веществ),
зажатого между двумя слоями белка (о белках мы расскажем
в следующей главе). Данные, полученные в последние годы, в
общем подтверждают такое представление, хотя его и пришлось
несколько видоизменить.
Рис. 55. Явления
пиноцитоза в клетках,
выстилающих капилляры диафрагмы
крысы, через 24 часа после
внутривенной инъекции
раствора ферритина
(железосодержащий белок с очень
большой молекулой)
(увеличение 87 000). Ферритин
виден в плазме крови (&),
в пиноцитозных пузырьках
(ф2) клетки, выстилающей
капилляр, и смежной с нею
клетки (ниже), а также в
межклеточных
пространствах, окружающих эти
клетки (ф3). Некоторые
пиноцитозные пузырьки сообщаются с просветом капилляра, другие
полностью окружены цитоплазмой, третьи открыты в межклеточное
пространство. Пиноцитоз служит здесь для переноса плазмы крови через стенку
капилляра в межклеточную жидкость, омывающую клетки. (С разрешения
G. E. Palade.)
НИ
■V-*'":-. \i':-:"':":¥,::
:..V>
ннн
76 ГЛАВА 3
Рис. 56. Плазматические мембраны трех смежных клеток. Видна
двухслойная структура мембран. (С разрешения J. D. Robertson/
Внутренний двойной слой мембраны состоит из липидов —
длинных молекул с водорастворимой «головкой» (в ее состав
входят фосфат и другие водорастворимые группы) и двумя
нерастворимыми в воде углеводородными «хвостами». Липиды
образуют две пластинки, каждая из которых состоит из одного слоя
молекул. В каждой пластинке водорастворимые головки липид-
ных молекул направлены наружу, а водоотталкивающие хвосты
— внутрь. Таким образом, и внешняя, и внутренняя
поверхности двойного липидного слоя по самой своей природе
приспособлены к контакту с водой (или, как говорят, гидрофильны),
тогда как его внутренняя область стремится избегать такого
контакта (она, как говорят, гидрофобна).
Липидный слой плазматической мембраны надежно отделяет
содержимое клетки от окружающего мира. И снаружи, и внутри
клетки находится вода с растворенными или взвешенными в
ней веществами. Но ни вода, ни растворимые в ней вещества
(например, соли или сахара) не могут в заметном количестве
проходить через среднюю водоотталкивающую часть липидного
слоя.
Тогда каким же образом эти вещества проникают внутрь или
выходят из клетки? Липидный слой с обеих сторон густо усеян
молекулами белков. Однако ни с внешней, ни с внутренней
стороны белковые молекулы не образуют сплошной однородной
пленки. Хотя основная масса белка лежит вне липидного слоя,
многие белки внедряются в него, а некоторые даже пронизывают
Гидрофильная
„головка"
Гидрофобный
„хвост"
ооооооооо
6 6 6 6 6 6666
Рис. 57. А. Структура одного из фосфолипидов — типичных сложных липидов плазматической мембраны. На одном
конце молекулы — на ее «головке» — находятся две заряженные группы: отрицательно заряженный фосфат и
положительно заряженный аминный азот, что придает этому концу гидрофильные свойства. Другой конец молекулы,
«хвост», представляет собой углеводородную цепь, состоящую только из атомов углерода и водорода, и обладает
поэтому гидрофобными свойствами. Б. В клеточной мембране липиды располагаются головками наружу, а
хвостами _ внутрь. Это обеспечивает гидрофильный характер поверхностей мембраны и гидрофобность ее внутреннего
слоя.
>
3
S
»
я
и
и
н
я
В
^1
^1
78 ГЛАВА 3
Рис. 58. Схематическое изображение структуры мембраны по данным,
полученным в 70-х годах. Некоторые белковые молекулы пронизывают
бимолекулярный слой липида насквозь, другие частично погружены в него, а
большинство лежит на его поверхности. Белки составляют примерно от 10 да
20% вещества «липидного» слоя.
его насквозь, так что «липидный» слой, вероятно, содержит
10 — 20% белков. По крайней мере некоторые из этих белков
должны быть теми клеточными насосами, которые переносят
растворенные в воде вещества через мембрану. Может быть, они
действуют наподобие паромов, а может быть — связывают
переносимое вещество с одной стороны мембраны, затем каким-то
образом переворачиваются и освобождают его с другой стороны;
это пока неизвестно. Мы не знаем также, каким образом
отделяются от мембран вакуоли при пиноцитозе или фагоцитозе.
Описанное распределение белков в плазматической
мембране обеспечивает удивительную гибкость ее функции. Теперь
легко можно| представить себе включение в структуру
мембраны новых белков, когда клетке — например, при изменении
условий питания — необходим какой-то новый насос. Как мы
увидим дальше, мембраны составляют также важную часть
других клеточных органелл. Электронный микроскоп показал, что
плазматическая мембрана и мембраны клеточных органелл
построены в основном однотипно, хотя их функции, будучи в
общем сходными, все же не вполне одинаковы. По-видимому,
общая структурная организация во всех случаях одна и та же,
несмотря на различия! в составе липидов и белков, несомненно
связанные с особенностями функции тех или иных мембран.
АНАТОМИЯ КЛЕТКИ 79
Л ИЗОСОМЫ—МЕШОЧКИ
С ПИЩЕВАРИТЕЛЬНЫМИ
СОКАМИ
Электронный микроскоп выявил в клетках много различных
органелл, в том числе пищеварительные и пиноцитозные
вакуоли, а также открытые Ш. де Дювом мешочки, содержащие
клеточные пищеварительные соки. Эти мешочки были названы
лизосомами, что значит «растворяющие тельца». Лизосомы могут
быть разной величины и формы, но они всегда окружены
мембраной, похожей на плазматическую мембрану клетки.
Лизосомы участвуют не только в переваривании пищи, но и во
многих других процессах. Если клетка непоправимо повреждена
или больна, она может быть переварена собственными лизосо-
Рис. 59. Электронная микрофотография клетки из печени крысы. Видны
плотные тельца — лизосомы (л), лежащие у края желчного протока; по
другую сторону протока расположены четыре митохондрии (М). (С разрешения
P. Baudhuin и С. de Duve.)
80 ГЛАВА 3
мами. Разрушение клеток играет существенную роль в
процессах развития у животных; примером может служить утрата
хвоста во время превращения головастика в лягушку.
При голодании лизосомы переваривают некоторые клеточные
органеллы, не убивая саму клетку. Такое частичное
самопереваривание обеспечивает клетке экстренное снабжение
пищей.
Теперь известно, что некоторые редкие наследственные
болезни человека обусловлены отсутствием того или иного компонента
в пищеварительном соке лизосом. Например, при болезни Таи-Сак-
са неспособность лизосом переваривать некоторые вещества
приводит к их накоплению, особенно в головном мозгу;
трагический результат этой болезни — идиотизм ребенка.
ЭНДОПЛАЗМАТИЧЕСКИЙ
РЕТИКУЛУМ—
МЕСТО
ХИМИЧЕСКИХ СИНТЕЗОВ
Жизнь каждой клетки зависит от непрерывного превращения
питательных веществ во множество различных соединений. Даже
у взрослых животных некоторые клетки, например
кроветворные клетки костного мозга, постоянно растут и делятся. Такие
клетки должны все время синтезировать материал для новых
мембран, умножать число органелл и вообще увеличивать массу
всех своих компонентов. Даже нерастущие клетки постоянно
обновляются, отбрасывая и заменяя сносившиеся части.
Специализированные клетки вырабатывают гормоны, слюну, слизь,
молоко. Местом большинства этих химических синтезов служит
так называемый эндоплазматический ретикулум, что в переводе
означает «внутриклеточная сеть». В клетках разного типа эта ор-
ганелла может выглядеть не совсем одинаково, но во всех случаях
она состоит из мембран. По-видимому, она образуется из сложно
разветвленных впячиваний клеточной мембраны, которые
превращаются в более или менее параллельные слои крошечных
трубочек, занимающих значительную часть цитоплазмы.
Различают два типа эндоплазматического ретикулума: гладкий и
шероховатый, с каждым из которых связан свой тип химических
синтезов.
Липиды (например, жировые вещества мембран), гормоны
(половые и др.) и углеводы (крахмал, гликоген, целлюлоза)
синтезируются на гладком ретикулуме. Почему все эти вещества
АНАТОМИЯ КЛЕТКИ 81
Рис. 60. А. Гладкий эндоплазматический ретикулум в печеночной клетке
крысы (увеличение 50 000). Темные гранулы — отложения гликогена; видны
также митохондрии (М). (С разрешения G. E. Palade.) Б. Шероховатый
эндоплазматический ретикулум (ШЭР) в печеночной клетке крысы (увеличение
82 000). Мелкие темные зернышки — рибосомы. В верхнем левом углу видны
элементы гладкого эндоплазматического ретикулума (ГЭР). (С разрешения
D. Sabatini.)
синтезируются на мембране? Дело в том, что каждое из них —
конечный продукт ряда химических реакций, которые должны
осуществляться в определенном порядке. По-видимому,
эндоплазматический ретикулум служит поверхностью, на которой
все этапы химических превращений совершаются один за другим,
последовательно во времени и пространстве. Гладкий ретикулум
делает возможной организацию такого химического конвейера.
Кроме того, полости эндоплазматического ретикулума служат
тем руслом, по которому перемещаются вещества,
предназначенные «на экспорт» из клетки.
На шероховатом ретикулуме синтезируются белки. Эти
соединения выполняют такое множество функций, что составляют
основную массу плотного вещества почти каждой клетки (за редким
исключением специализированных клеток, например клеток,
в которых откладывается резервный жир). Выяснение механизма
белкового синтеза — одно из величайших достижений биохимии
(подробнее об этом будет рассказано в главе 9). Важнейшую роль
в синтезе белка играют очень мелкие сферические органеллы,
получившие название рибосом. Иногда рибосомы свободно
плавают в цитоплазме, а иногда бывают прикреплены к мембранам
эндоплазматического ретикулума, что и придает ему
«шероховатость».
Большинство белков, предназначенных для использования
в той же клетке, синтезируется на свободных рибосомах. Белки,
в-0414
82 ГЛАВА 3
Рис. 61. Бактериальная
рибосома (частично
диссоциировавшая нал большую
и малую субчастицы, из
которых она состоит);
сфотографирована с помощью
высоковольтного
сканирующего электронного *
микроскопа при увеличении
более чем в 2 миллиона раз.
(С'разрешения А. V. Crewe.)
предназначенные «на экспорт», а также те, которые должны быть
заключены в мембрану (например, белки содержимого лизосом),
синтезируются на шероховатом ретикулуме.
АППАРАТ ГОЛЬДЖИ —
«ОТДЕЛ УПАКОВКИ»
Некоторые клеточные продукты должны быть особым образом
«упакованы». Пищеварительные соки упаковываются внутри
лизосом, и это предохраняет клетку от самопереваривания.
Вещества, предназначенные для использования вне клетки,
сначала упаковываются в гранулы и только после этого
выводятся из клетки с помощью процесса, обратного фагоцитозу и пино-
цитозу. К таким «экспортируемым» продуктам относятся
гормоны, молоко, защитные материалы (например, слизь,
предохраняющая клетки желудка от переваривания), межклеточное
вещество кости и хряща и даже зубная эмаль.
Окончательная химическая «доводка» таких материалов и их
упаковка происходит в аппарате Гольджи — органелле,
открытой в 1898 году итальянским гистологом Камилло Гольджи
(1843—1926), которому позднее, в 1906 году, была присуждена
Нобелевская премия за микроскопические исследования нервной
системы. Роль аппарата Гольджи и механизм его
функционирования до сих пор еще полностью не выяснены.
Как показало изучение с помощью электронного
микроскопа, аппарат Гольджи является продолжением эндоплазматиче-
ского ретикулума. Он состоит из мембран, которые образуют
уплощенные мешочки, уложенные стопками. Вещества,
синтезированные в эндоплазматическом ретикулуме, собираются в мешоч-
Hi
АНАТОМИЯ КЛЕТКИ 83
Рис. 62. Электронная
микрофотография аппарата
Гольджи. (С разрешения
А. V. Grimstone.)
ки, лежащие в основании стопки, и здесь происходит
присоединение к ним углеводов. Разбухшие мешочки перемещаются к
верхнему краю стопки — возможно, под давлением новых
мешочков, образующихся ниже. На вершине стопки от мешочков
отделяются многочисленные пузырьки или глобулы — готовые лизо-
сомы или секреторные гранулы.
ХЛОРОПЛАСТЫ —
ВНУТРИКЛЕТОЧНЫЕ
ОРГАНЫ ФОТОСИНТЕЗА
Чтобы клетка могла расти и делиться, выполнять
специальные функции и даже просто поддерживать свое существование,
она должна все время расходовать энергию. Как уже говорилось
в предыдущей главе, первоисточником этой энергии служит
солнечный свет. Фотосинтез — процесс, в котором энергия света
используется для синтеза глюкозы и других углеводов и от
которого зависит вся жизнь на нашей планете, — осуществляется
в клетках зеленых растений, в органеллах, называемых хлоро-
пластами. ,
Обычно хлоропласт содержит граны — стопки плоских
мембранных мешочков; между собой граны тоже соединены
мембранами, образующими параллельные слои. Мембраны гран состоят
6*
«4 ГЛАВА 3
Рис. 63. Электронная
микрофотография хлоропласта.
Видны граны (Гр),
содержащие хлорофилл, и
крупные зерна крахмала (Кр),
а также две митохондрии
(М), примыкающие к
хлоропласту снаружи.
(С разрешения R. W. Home.)
из белка и липида. Расположение молекул еще точно не
установлено, но можно думать, что здесь, как и в других клеточных
мембранах, липид образует бимолекулярный слой, частично
покрытый, а в некоторых местах и пронизанный молекулами белка.
В гранах находится хлорофилл, возможно в комплексе с белком.
Таким образом, именно в гранах происходит улавливание
световой энергии.
Очень важную роль в этом процессе играет мембранная
организация гран. Чистый хлорофилл поглощает свет и в пробирке,
но в этом случае свет тотчас же вновь излучается — хлорофилл
начинает флуоресцировать и световая энергия рассеивается.
В сложной структуре гран энергия света, поглощенного
хлорофиллом, передается на систему молекул, использующих ее для
регенерации НАДФ-Н (восстановленного НАДФ) из НАДФ+
и АТФ из АДФ.
Материал, заполняющий промежутки между гранами,
называется стромой. При синтезе глюкозы и других углеводов,
происходящем в строме, используются НАДФ- Н и АТФ,
образовавшиеся в гранах при участии световой энергии.
АНАТОМИЯ КЛЕТКИА 85
Хлоропласты описанного типа характерны для высших
растений; они содержатся, например, в клетках листьев шпината
или деревьев. В такой клетке может быть много хлоропластов —
50 и более. Некоторые одноклеточные фотосинтезирующие
организмы обладают только одним большим хлоропластом,
занимающим почти всю клетку. Все хлоропласты в основе своей
построены одинаково, все содержат хлорофилл и во всех
осуществляются одни и те же фотосинтетические реакции.
В клетках растений встречаются также пластиды иного типа,
не содержащие хлорофилла. Существуют бесцветные пластик
ды — лейкопласты; они могут быть местом накопления крахмала,
как, например, в клубнях картофеля. Цвет моркови,
помидоров и многих цветков зависит от присутствия хромопластов,
в которых содержатся пигменты, отличные от хлорофилла.
Хлоропласты, лейкопласты и хромопласты очень сходны по
своей структуре и развиваются из мелких, бесцветных незрелых
пропластид.
МИТОХОНДРИИ —
СИЛОВЫЕ СТАНЦИИ
КЛЕТКИ
В хлоропластах синтезируются глюкоза и другие углеводы,
из которых в растительных и животных клетках образуется
множество других органических веществ. Эти вещества могут
подвергаться окислению и таким образом доставлять необходимую
энергию, которая запасается в форме АТФ.
Окисление глюкозы до пировиноградной кислоты (см. главу 2)
не связано ни с органеллами, ни с какими-либо другими
видимыми структурами; это относится и к первым этапам окисления
других веществ, например жиров. На этих первых этапах из
окисляемой молекулы извлекается и запасается в форме АТФ
лишь небольшая доля всей заключенной в ней энергии.
Дальнейшее окисление промежуточных продуктов до
углекислоты и воды происходит в органеллах, называемых
митохондриями. Именно здесь образуется большая часть клеточного
АТФ и используется большая часть кислорода, который мы
вдыхаем. Кислород соединяется с водородом, освобождающимся
в цепи окислительных реакций, и образует воду.
Митохондрии есть и в растительных, и в животных клетках.
В клетке может быть только одна большая митохондрия, как,
например, у паразитических простейших трипаносом, а может
быть несколько сотен и даже много тысяч. Больше всего их в
клетках, расходующих много энергии, например в мышечных
86 ГЛАВА 3
Рис. 64. Электронная
микрофотография
митохондрии. Ясно видны двойные
мембраны. Внутренняя
мембрана образует
складчатые структуры, вдающиеся
внутрь митохондрии (места,
где это особенно хорошо
видно, указаны стрелками).
Складки в огромной
степени увеличивают
внутреннюю поверхность
митохондрии. Темные пятнышки в
полости митохондрии —
фосфат кальция (ФК).
Здесь сфотографирована
митохондрия в клетке
поджелудочной железы летучей
мыши, окруженная
шероховатым эндоплазматичес-
ким ретикулумом (ШЭР),
мембраны которого усеяны
рибосомами. Видны также
зимогеновые гранулы (З/1),
такие же, как на рис. 46,
и участок аппарата Голь-
джи (Г). (С разрешения
К. Porter.)
волокнах. Митохондрии разных клеток могут несколько
различаться по внешнему виду, но обычно они напоминают по форме
сардельку. В современный световой микроскоп можно наблюдать
митохондрии в живой клетке, где они могут разбухать,
укорачиваться, сжиматься, делиться на части, а в некоторых клетках
перемещаться в цитоплазме.
Как же устроены эти органеллы, эти «силовые станции»,
вырабатывающие основную массу необходимого клетке АТФ?
Митохондрия заключена во внешнюю мембрану, очень похожую
на плазматическую. Под этой мембраной, отделенная от нее
узкой щелью, лежит другая, внутренняя мембрана, складки
которой глубоко вдаются внутрь митохондрии. Поверхность
внутренней мембраны усеяна мелкими частицами, сидящими на
тонкой ножке. О значении митохондриальных мембран говорит
такой факт: у бактерий, которые сами близки по величине к
митохондриям и потому лишены их, все окислительные реакции
связаны с клеточной мембраной.
Сахара
i
Пировиноградная
кислота
Жиры
\
/
Аминокислоты Ацвтил-КоА
Фумаровая
кислота
Янтарная
кислота
Альфа-кетоглутаровая
кислота
Рис. 65. Цикл лимонной кислоты, или цикл Кребса. Продукты расщепления
различных веществ вступают в этот цикл в форме ацетилкофермента А —
остатка уксусной кислоты (ацетата), присоединенного через атом серы к
сложной молекуле, называемой коферментом А (КоА). Этот ацетат присоединяется
к четырехуглеродной щавелевоуксусной кислоте, превращая ее в шестиуг-
леродную лимонную кислоту. Из лимонной кислоты в конце концов снова
образуется щавелевоуксусная кислота. Это обратное превращение включает
7 этапов; при этом два атома углерода отщепляются в виде С02. Удаляются
также четыре атома водорода, которые затем переходят с одного соединения
на другое в серии реакций, которые еще не до конца изучены и на схеме не
показаны. В этих реакциях энергия, освобождающаяся при окислении
атомов водорода, используется для регенерации АТФ из АДФ. В конце концов
водород соединяется с кислородом, образуя воду.
88 ГЛАВА 3
В полости митохондрии протекает замкнутая цепь реакций,
составляющая «центральный узел» метаболизма в большинстве
клеток. Эту цепь называют циклом трикарбоновых кислот,
циклом лимонной кислоты или циклом Кребса — по имени
выдающегося английского биохимика сэра Ганса Кребса (род.
в 1900 г.), который в 1937 году построил соответствующую схему
и показал, что она позволяет объяснить полное окисление пиро-
виноградной кислоты до трех молекул С02.
Пировиноградная кислота вступает в цикл Кребса после
реакции, в которой она окисляется до С02 и ацетата (отрицательно
заряженный ион уксусной кислоты); ацетат присоединяется
к веществу, называемому коферментом А. Многие другие вещества,
например жиры, вступают в цикл Кребса только после их
превращения в ацетил-КоА, т. е. кофермент А с присоединенным к
нему ацетатом. (Биохимики, открывшие кофермент А, — Фриц Лип-
ман и Ганс Кребс — получили в 1953 году Нобелевскую премию
по физиологии и медицине.)
В первой реакции цикла Кребса ацетил-КоА
взаимодействует со щавелевоуксусной кислотой с образованием лимонной
кислоты. Лимонная кислота постепенно окисляется, теряет две
Рис. 66. Структура митохондрии. Две электронные стереомикрофотографии,
на которых видна сложная система складок, образуемых внутренней
мембраной. Эти снимки получены при использовании 800 000-вольтного пучка
ультравысоковольтного электронного микроскопа. (С разрешения К. Наша.)
(Пары стереофотографий, помещенные в этой книге, следует рассматривать
с помощью карманного зеркальца. Поставьте зеркальце между
фотографиями отражающей поверхностью влево, прямо против своего носа; закройте
правый глаз и найдите такое положение зеркала, чтобы отражение левого
рисунка совместилось с плоскостью страницы; затем откройте правый глаз. Важно,
чтобы оба изображения были одинаково освещены и чтобы зеркальце не
затеняло одно из них.)
АНАТОМИЯ КЛЕТКИ 89
Рис. 67. Реконструкция внутренней мембраны митохондрии.
A. Фрагменты внутренней мембраны с прикрепленными к ней
сферическими тельцами; эти фрагменты, как и целая мембрана, способны
осуществлять всю цепь реакций, приводящих к образованию АТФ из АДФ.
Б. Неактивные фрагменты, лишенные сферических телец.
B. Изолированные сферические тельца, также неактивные (опи
расщепляют АТФ до АДФ, т. е. их действие в изолированном состоянии,
по-видимому, противоположно их функции в интактной митохондрии).
Г. Реконструированная мембрана. Если смешать изолированные
сферические тельца и лишенные их фрагменты мембран, то из них снова
образуются активные мембраны, имеющие характерный вид и способные
регенерировать АТФ. Другие опыты, в которых производится все более глубокое
разделение внутренних мембран на составные части и их обратная «сборка»,
дают ценную информацию о строении и функционировании митохондрий.
(С разрешения Е. Racker.)
молекулы С02 и в конце концов превращается опять в щавеле-
воуксусную кислоту. После этого цикл повторяется с участием
новой молекулы ацетил-КоА. Результатом окислительных
реакций цикла Кребса является не только освобождение двух
молекул углекислоты, но и перенос электронов (в составе атомов
водорода) на молекулу акцептора. На конечном этапе цепи
реакций, происходящих на складчатой внутренней мембране
митохондрий, водород соединяется с кислородом, образуя воду.
Если газообразный водород смешать с кислородом и
поджечь, произойдет взрыв — образуется вода и при этом мгно-
30 ГЛАВА 3
венно освободится большое количество энергии. На внутренней
мембране митохондрии энергия водородного атома отводится
постепенно, и в конце концов водород, обладающий теперь
малым запасом энергии, спокойно реагирует с кислородом.
Освобождающаяся в этом процессе энергия используется для
синтеза АТФ из АДФ и фосфата.
Важную роль играют складки внутренней мембраны
митохондрий: они во много раз увеличивают поверхность, на которой
протекают реакции, связанные с мембранами. Возможно, что
синтез АТФ происходит на упомянутых выше частицах,
прикрепленных к мембране.
Благодаря интенсивному изучению митохондрий сейчас о них
известно очень многое. В 70-х годах биохимики сумели
осторожно разделить митохондриальную мембрану на мелкие фрагменты,
изучить их свойства и вновь соединить их в функционирующие
кусочки мембраны. Можно надеяться, что такие эксперименты
в конце концов позволят воссоздать полную картину строения
и функции митохондрий,
ЯДРО—
ЦЕНТР
УПРАВЛЕНИЯ КЛЕТКОЙ
Клетка постоянно превращает питательные вещества в
материалы, из которых состоит она сама, или в вещества, необходимые
организму в целом. В результате этого она живет, растет, делится,
выполняет специальные функции. В ней непрерывно и
гармонично протекают тысячи реакций, образуются тысячи различных
веществ, из которых одни — уже готовые конечные продукты,
другие — необходимые для их синтеза промежуточные
соединения.
Клетка не могла бы! выдержать ни избытка, ни недостатка
какого-либо из этих разнообразных веществ. Их избыток
вызвал бы очень скоро переполнение клетки, а недостаток привел
бы к замедлению всего клеточного метаболизма. Каким же образом
все эти совершающиеся в клетке процессы могут быть так точно
скоординированы, так тонко уравновешены? Как и чем они
контролируются?
Управляющим центром клетки служит ядро — самая
крупная и раньше всех открытая органелла. Из ядра в рабочую часть
клетки — цитоплазму — поступают приказы, определяющие
прямо или косвенно, что*нужно синтезировать, в каких количествах
и каким образом. Но откуда узнаёт ядро, какой именно приказ
АНАТОМИЯ КЛЕТКИ 91
должен быть послан и какое именно вещество необходимо сейчас
синтезировать? Это определяется концентрацией в цитоплазме
самих контролируемых веществ. Если какого-то вещества
слишком мало, его недостаток действует на ядро как сигнал. Если
вещества слишком много, сигналом служит его избыток. Таким
образом, координация процессов, протекающих в цитоплазме,
достигается тончайшим взаимодействием между цитоплазмой
и ядром.
Как нам удалось узнать об управляющей роли ядра к клетке?
Эта роль была продемонстрирована во многих опытах. Например,
если амебу разрезать надвое, то половинка, содержащая ядро,
оправляется от травмы, начинает питаться, расти и в конце
концов делится — это маленькая, но вполне нормальная амеба.
Другая же, безъядерная, половинка через 1—2 недели погибает,
если только не ввести в нее новое ядро.
Определяя, какие вещества клетка должна производить, ядро
определяет и самый тип клетки. Это хорошо видно в опыте с
тропической зеленой водорослью Acetabularia, которая состоит из
корневидного основания, тонкого стебелька и «шляпки» на его
верхнем конце. Все растение высотой 2—3 сантиметра
представляет собой одну клетку с ядром в основании стебелька. Два вида
этой водоросли, A. mediterranea и A. crenulata, различаются по
форме шляпки. Если на основание A. mediterranea пересадить
стебелек A. crenulata без шляпки, то на этом гибриде вырастет
такая же шляпка, какая бывает у нормальной A. mediterranea.
Таким образом, основной видовой признак у Acetabularia
определяется крошечным основанием, содержащим ядро, а не
длинным цитоплазматическим стеблем.
Свою ответственность за жизнедеятельность клетки ядро
в известной мере делит с некоторыми органеллами. Так,
например, образование хлоропластов и митохондрий определяется
отчасти сигналами из ядра, а отчасти — механизмом, заложенным
в них самих. Новые функционирующие митохондрии и хлоропла-
Рис. 68. Зеленая водоросль
Acetabularia mediterranea.
Видны ее стебельки и
шляпки. (С разрешения
«Turtox Collection», GCM
General Biological, Inc.)
92 ГЛАВА 3
A.mediterranea
Цитоплазма
А. сгеп.
Ядро Amed.
Рис. 69. Водоросль Aceta-
bularia обладает
корневидным «основанием»,
содержащим ядро, и стеблем, на
верхушке которого
находится шляпка. Два вида —
А. mediterranean A. crenulata
— различаются по форме
шляпки. Эксперимент, в
котором стебель одного
вида пересаживали на
основание другого вида,
содержавшее ядро, показал, что
форма регенерирующей
после этого шляпки
зависит от фрагмента, содер- Регенерирует шляпка
жащего ядро. типа Amed.
Цитоплазма
Amed.
Регенерирует шляпка
типа А сгеп.
сты не могут быть построены без участия ядерной информации.
Не могут они возникнуть и в том случае, если их до этого в клетке
не было. Митохондрии и хлоропласты, как и сама клетка, могут
образоваться только из предсуществующих митохондрий или
хлоропластов, и то лишь при большом содействии со стороны
ядра.
Как же устроено ядро? Оно окружено двухслойной
мембраной, в которой с помощью электронного микроскопа можно
видеть множество пор. Ядерная мембрана без перерыва переходит
в мембраны эндоплазматического ретикулума, на которых
осуществляется так много химических синтезов.
Ядро содержит ряд более мелких органелл. Из них хромосомы
играют столь важную роль, что в этой главе им будет посвящен
специальный раздел. Рибосомы, на которых идет построение
белковых молекул, частично синтезируются в хорошо заметной
АНАТОМИЯ КЛЕТКИ 93
Рис. 70. Электронная
микрофотография участка ядерной мембраны
(ЯМ). Стрелками указаны две
поры. В цитоплазме видны
митохондрии (М) и эндоплазматический рети-
кулум (ЭР)у усеянный рибосомами.
(С разрешения D. Sabatini.)
органе л ле, носящей название ядрышка. В ядре может быть одно
или несколько ядрышек. Еще одна самовоспроизводящаяся орга-
нелла — центриолъ — расположена около самого ядра. Эта орга-
нелла имеет прямое отношение к сложнейшим событиям,
разыгрывающимся в ядре перед делением клетки.
ХРОМОСОМЫ —
ХРАНИЛИЩЕ
ИНФОРМАЦИИ
Вся информация, необходимая для построения клетки и
управления ею, хранится в ядре, в органеллах, называемых
хромосомами. Хромосомы хорошо видны в световой микроскоп во время
клеточного деления, когда они укорачиваются и утолщаются.
В этом состоянии каждую хромосому можно распознать по ее
характерной палочковидной форме. В другое время хромосомы
разрыхляются, теряют свою форму и превращаются в почти
невидимые нити.
У каждого вида растений и животных клетки содержат вполне
определенное число хромосом; например, у человека их 23 пары,
т. ev 46. Меньше всего хромосом у круглых червей — по две в
каждой клетке, а больше всего у папоротников — около 500.
94 ГЛАВА 3
Рис. 71. Так выглядят
хромосомы человека перед самым
делением клетки. Они уже
сконденсировались, приобрели
характерную палочковидную форму
и удвоились, образовав две так
называемые сестринские
хромосомы, еще соединенные друг с
другом в одной точке. После
разделения клетки каждая из
дочерних клеток получит по одной из
каждых двух сестринских
хромосом. (С разрешения Carolina
Biological Supply Company.)
Огромный экспериментальный материал, накопленный с
начала нашего века и частично описанный в главе 6, не оставляет
сомнений в том, что именно хромосомы содержат план построения
и деятельности клетки. Совсем недавно найден новый
многообещающий метод, с помощью которого можно детально изучить
роль хромосом у мыши и человека. Клетки животной ткани можно
отделить друг от друга и, обеспечив им надлежащие условия
и необходимое питание, заставить расти и делиться на дне
стеклянного сосуда. Этот метод, уже описанный в главе 1 (см. рис. 14),
называется методом культуры тканей. В 60-х годах было
обнаружено, что если клетки разного рода выращивать вместе в одной
посуде, то иногда, хотя и очень редко, две разнотипные клетки
сливаются, образуя одну гибридную клетку.
В 1967 году Мэри Вейсс и Говарду Грину из медицинской
школы Нью-йоркского университета удалось «скрестить»
мышиные клетки с человеческими. Деление гибридных клеток обычно
сопровождается потерей хромосом человека, поэтому в таких
клетках остаются главным образом мышиные хромосомы, так что
гибридная клетка больше похожа на мышиную родительскую
клетку, чем на человеческую. По своим биохимическим
особенностям она тоже ближе к мышиной, но все-таки она синтезирует
некоторые вещества человеческого типа. Было даже показано,
что природа таких «человеческих» веществ, синтезируемых
гибридной клеткой, зависит от того, какие именно хромосомы
человека в ней сохранились. Оказалось, например, что белок тими-
динкиназа синтезируется гибридной клеткой только в том случае,
если клетка содержит человеческую хромосому, обозначаемую
Е-17.
Эксперименты с гибридными клетками продолжаются. Можно
надеяться, что благодаря им мы в конце концов будем точно
знать, как распределена работа управления клеткой между
двадцатью тремя парами хромосом человека.
*>
.\]
ч1 ^'w
АО*
ш
АНАТОМИЯ КЛЕЦ(И 95
Рис. 72. Микрофотографии клеток, растущих
в культуре ткани (получены с помощь^ свето_
вого микроскопа). А. Клетки человека> £т
Клетки мыши. В. Гибридные мышин0_челове1
ческие клетки. Гибридные клетки содержат
почти все мышиные хромосомы и только около
одной трети человеческих хромосом; он^ и похо.
жи гораздо больше на мышиные клетку чем на
человеческие. (М. С. Weiss, H. Gre^ ргпг
Natl. Acad. Sci. U.S., 58, 1104^ (1967). с
разрешения Н. Green.)
КЛЕТКА И ОРГАНЕЛЛЫ
Функцию клетки можно в общих чертах связать с ее сТруКТу_
рой и с ее органеллами, каждая из которых выполняет соверШенно
определенную работу. В настоящее время изучение струКТурЫ
и функции клеточных органелл быстро продвигается вперед.
Электронные микроскописты выясняют их удивительное
тончайшее строение. Биохимики узнают все больше и болыщ 0б Их
функциях и о химической структуре веществ, из которых они
построены. Однако конечная цель пока еще не ДОС7ИГНута:
еще нет полного4 представления о молекулярной ст|>уКТуре
органелл, которое позволило бы объяснить все подробн^сти их
функции.
В этой области, так же как и в других областях биолог%еского
знания, еще остаются огромные пробелы. Однако пораз^тельны
и успехи, достигнутые в раскрытии тайн клетки, а значит, и тайн
самой жизни. Очень многое известно о протекающих в клетке
химических реакциях и о механизмах, регулирующих э\
реакции; о структуре, функциях и синтезе белков — соед^нений,
свойственных только живой материи и придающих непов70рИМЫе
черты каждой клетке и каждому организму; и наконец, о в^ществе
хромосом, в котором зашифрован генеральный план ж%недея_
тельности клетки и организма. Об этих блестящих успеха*
молекулярной биологии мы расскажем в других главах.
«ЧТО ДЕЛАЮТ
БЕЛКИ?
Белки, или протеины,— это материал жизни, основной
плотный компонент живого организма. Существуют тысячи белков,
и у каждого своя, только ему свойственная функция. Некоторые
из них уже упоминались: насосы клеточных мембран, в
значительной части сама мембрана, пищеварительные соки кишечника
и лизосом — все это белки, так же как волосы, перья или рыбья
чешуя. Гемоглобин, переносчик кислорода, окрашивающий кровь
в красный цвет, некоторые гормоны — это тоже белки. Мышцы
состоят в основном из белков. Иммунитет к кори или свинке
зависит от белков. Каждая из тысяч реакций, происходящих в
клетках, осуществляется при участии белков. О первостепенной роли
этих сложных веществ догадывались еще в самом начале XIX
века, когда им дали название протеинов — от греческого слова
протос, что значит «первый».
МНОГИЕ
ХОРОШО ЗНАКОМЫЕ ВАМ
ВЕЩЕСТВА—БЕЛКИ
Что же это такое—белки? На что они похожи? Некоторые
белковые вещества, например желатина, яичный белок или материал,
из которого состоят волосы, всем хорошо знакомы.
Волосы прочны, эластичны, нерастворимы в воде. Это
свойства кератина, основного белка волос. Кератин вьющихся волос
несколько отличен от белка прямых волос. К цвету волос кера-
ЧТО ДЕЛАЮТ БЕЛКИ? 97
тин отношения не имеет; как большинство белков, он бесцветен.
Различный цвет волос зависит от содержащихся в них
пигментов. У животных защитные покровы тела и их придатки —
наружный слой кожи, перья, чешуя, когти, рога, шерсть — тоже состоят
из кератина.
Яичный белок, богатый протеином, служит незаменимой пищей
для невыл упившегося цыпленка. Однако до того, как он будет
использован, он выполняет и другую роль — образует своего
рода мягкую подушку вокруг желтка и развивающегося эмбриона.
Амортизирующие свойства яичного белка зависят от его густоты
и вязкости, которые в свою очередь определяются его составом.
Консистенция яичного белка типична для концентрированных
белковых растворов. Основной белок яйца, называемый яичным
альбумином, подобно многим другим белкам, хорошо растворим в воде.
Яичный белок становится белым только после того, как яйцо
сварено. Высокая температура повреждает яичный альбумин,
как и большинство других белков, и делает нерастворимым в воде.
Поэтому растворы белков после кипячения теряют прозрачность
и становятся белыми. Это явление называется денатурацией,
что означает утрату естественного, натурального состояния.
Денатурацию могут вызывать и другие воздействия; например, кислота
денатурирует яичный белок, превращая его в белый нерастворимый
сгусток.
Желатина — еще один бесцветный, растворимый в воде белок.
Именно она позволяет приготовить желе, и благодаря ее
присутствию превращается в студень вода, в которой варились рыба,
цыплята или свиные ножки. Продажная желатина —
поблескивающий, почти белый порошкообразный или хлопьевидный продукт—
выглядит так же, как очень многие другие высушенные белки.
Желатина не денатурируется при нагревании; напротив, она
растворяется в кипящей воде. Но это исключение из правила:
дело в том, что желатина — необычный, уже измененный белок,
она образуется при длительном кипячении другого белка —
Рис. 73. Электронная
микрофотография хряща.
Видны длинные фибриллы
коллагена, окруженные
однородным основным
веществом. (С разрешения
J.-P. Revel.)
7-0414
98 ГЛАВА 4
коллагена, составляющего около одной трети всего белка, который
содержится в теле животного. Прочные волокна коллагена можно
обнаружить в костях, хряще, сухожилиях и других
соединительнотканных образованиях. В особенности сухожилия, крепкие, как.
канаты, обязаны своей прочностью проходящим в них пучкам кол-
лагеновых волокон.
Кератин и коллаген относятся к структурным белкам. К ним
же можно отнести и яичный альбумин, пока он не используется
как питательное (вещество. Эти белки выполняют свою роль
благодаря своим физическим свойствам: кератин отличается
твердостью, коллагеновые волокна — прочностью на разрыв, альбумин—
большой растворимостью, определяющей вязкость его
концентрированных растворов.
Однако у большинства белков совсем иные функции. Одни белки
обеспечивают мышечное сокращение, другие — иммунитет к
болезням, третьи необходимы для протекания биохимических реакций.
Рассмотрим эти три] группы белков отдельно.
СКОЛЬЗЯЩИЕ БЕЛКИ
МЫШЦ
Если вы захотите поднять тяжелый предмет, сгибая руку, или
просто продемонстрировать свои бицепсы, вы легко заметите,
что эти мышцы становятся выпуклыми и укорачиваются. Если
мышца не расслаблена, она делает только одно — укорачивается,
или сокращается. Этот единственный акт вполне достаточен, так
как он обеспечивает все движения животных.
Произвольные мышцы приводят в движение все части тела
позвоночного животного — конечности, голову и хвост.
Волокнистость жесткого мяса сразу выдает внутреннюю структуру
мышечной ткани. Эта ткань состоит из длинных волокон, которые тянутся
по всей длине мышцы от одного сухожилия до другого. Мышечные
волокна построены из микроскопических миофибрилл. Именно эти
миофибриллы и сокращаются. Но каким образом они это делают?
Свертываются в спираль или, может быть, складываются
гармошкой? С помощью электронного микроскопа X. Хаксли и А. Хаксли1
смогли детально изучить структуру миофибрилл и в 1975 году
1 Это не. родственники, хотя несколько знаменитых Хаксли состоят
друг с другом в родстве: А. Хаксли, получивший в 1963 году Нобелевскую
премию по медицине и физиологии за работы по нервной проводимости,—
брат писателя Олдуса Хаксли и сэра Джулиана Хаксли, биолога и философа;
все трое внуки биолога Т.*Хаксли (Гексли), известного пропагандиста идей
Дарвина.
■:■
*.
Б
Jh*
Рис. 74. Одиночная мышечная клетка, выделенная из мускулатуры
желудка жабы Bufo marinus. A — в расслабленном состоянии, Б — в состоянии
сокращения. (Bagby R. M. et al., Nature,! 243,■ 351 (1971). С разрешения
R. M. Bagby.)
'.
*«3*f •
*^ v^*
t 5S
**<&
,*»#**'*
7
: _"****
*.,*•*
««£«*
*•**"*
*
,*H?
Рис. 75. Электронная микрофотография произвольной мышцы лягушки.
Видны поперечные полосы, характерные для мышечной ткани.
Митохондрии (М) и гликогеновые гранулы (Гл) свидетельствуют о большой
потребности мышцы в энергии. (С разрешения В. СессагеШ и D. Sabatini.)
7*
100 ГЛАВА 4
Рис. 76. Электронные микрофотографии миофибрилл растянутой и
покоящейся мышцы. А. Мышца растянута так, что толстые и тонкие нити
перекрываются лишь концами, как это показано на схеме. Б. В покоящейся
мышце толстые и тонкие нити перекрываются на значительном протяжении. (С
разрешения Н. Е. Huxley.)
раскрыли тайну мышечного сокращения. Они обнаружили, что
миофибриллы построены из нитей двух типов — толстых и тонких.
Тонкие нити лежат параллельно друг другу, чередуясь по длине
миофибриллы с толстыми нитями; при этом концы одних входят
в промежутки между другими. Тонкие нити прикреплены одним
концом к поперечным «перегородкам» фибриллы (рис. 76).
ЧТО ДЕЛАЮТ БЕЛКИ? 101
Рис. 77. На этой электронной микрофотографии видны поперечные мостики
между толстыми и тонкими нитями. Между каждыми двумя толстыми
нитями можно различить две тонкие. В трехмерной структуре миофибриллы
каждая толстая нить окружена шестью тонкими, расположенными (на
поперечном разрезе) в углах шестиугольника. (С разрешения Н. Е. Huxley.)
Q_D_Q П О—Q П D_Q П S_
muQmuQmuQmli &~tt-
Рис. 78. Модель расположения мостиков по отношению к толстой нити. Эти
мостики соединяют толстую нить с окружающими ее тонкими нитями. (Н.[Е.
Huxley, W. Brown, J. Mol. Biol., 30, 383 (1967). С разрешения Н. E.[Huxley.)
При сокращении мышцы две группы тонких нитей сближаются;
дальнейшее сокращение может привести даже к перекрыванию
концов тонких нитей. При этом толстые и тонкие нити скользят
друг по другу, заполняя свободные пространства и укорачивая
мышцу.
Механизм этого скольжения пока точно не известен.
Непосредственного контакта между толстыми и тонкими нитями нет, но
с помощью электронного микроскопа можно видеть, что они
соединены тонкими мостиками. Вероятно, эти мостики прикрепляются
к тонким нитям, подтягивают их на небольшое расстояние,
отделяются от них, возвращаются в исходное положение, а затем снова
прикрепляются чуть подальше и снова подтягивают тонкие нити.
Так, шаг за шагом, толстые нити внедряются в промежутки между
тонкими. Энергию, необходимую для такого «скольжения» нитей
и, следовательно, для сокращения мышцы, доставляет АТФ:
Молекулы АТФ используются одна за другой на каждом шаге этого
процесса» При сокр,апдении миофибриллы на каждый из множёстйа
мостиков расходуется от 50 до 100 Молекул АТФ и секунду. .
П-е
102 ГЛАВА 4
МЫШЕЧНЫЕ БЕЛКИ
АКТИН И МИОЗИН
Миофибриллы почти всецело состоят из двух белков — миозина
и актина. Если мышечную ткань промыть солевым раствором,
толстые нити в ней исчезнут. Исчезнет и миозин: он растворится
в соленой (воде. Из этого очевидно, что толстые нити состоят из
белка миозина. Аналогичным методом было показано, что тонкие
нити состоят в основном из актина.
Миозин и актин, растворенные в концентрированном солевом
растворе и затем смешанные, соединяются и образуют комплекс,
называемый актомиозином. Если этот раствор разбавить водой,
актомиозин, нерастворимый при низкой концентрации соли,
выпадет в осадок в форме длинных волокон. Биохимик, нобелевский
лауреат Альберт Сент-Дьёрдьи обнаружил, что добавление к этим
искусственным мышечным волокнам АТФ вызывает их сокращение
ГЕМОГЛОБИН —
БЕЛОК, ПЕРЕНОСЯЩИЙ
КИСЛОРОД
Клеткам животных необходим кислород. Он нужен
митохондриям, чтобы доводить окисление питательных веществ до
углекислоты и воды. По системе сосудов кровь проникает во все уголки
тела, доставляя клеткам пищу и кислород. Крупные животные
не могут обходиться без системы кровообращения, так как большая
часть их клеток не имеет прямого контакта с пищей и воздухом.
Доставка кислорода тканям — задача нелегкая, так как
кислород, подобно большинству газов, плохо растворим в воде, а
значит, и в крови. У людей, как и у других млекопитающих, эта
задача успешно разрешается с помощью переносящего кислород
белка — гемоглобина. Но если бы весь гемоглобин, необходимый для
транспорта кислорода, был растворен непосредственно в плазме
крови, то кровь сделалась бы вязкой, как сырой яичный белок,
и ее невозможно было бы проталкивать через сосуды. Поэтому
гемоглобин упакован в красные кровяные клетки (эритроциты),
подобно тому как пух, который мог бы наполнить всю комнату,
упакован в подушку.
Эритроциты млекопитающих — это просто мешочки с белком,
90% которого составляет гемоглобин. Когда они покидают
кроветворную ткань и переходят в кровяное русло, у них даже нет ядра.
Красные кровяные клетки других позвоночных содержат ядра.
Некоторые кольчатые черви, моллюски и ракообразные обходятся
ЧТО ДЕЛАЮТ БЕЛКИ? 103
совсем без эритроцитов. У них сравнительно небольшое количество
гемоглобина растворено прямо в плазме. Осьминоги, кальмары
и некоторые брюхоногие моллюски обладают в полном смысле
слова «голубой кровью». Они используют не гемоглобин, а содержащий
медь белок голубого цвета, называемый гемоцианином. Этот белок,
так же как и содержащий железо зеленый белок, обнаруженный
у некоторых кольчатых червей, в отношении транспорта кислорода
менее эффективен, чем гемоглобин,
ГЕМОГЛОБИН ОТЛИЧНО
ПРИСПОСОБЛЕН
ДЛЯ СВОЕЙ РОЛИ
Гемоглобин должен забирать кислород в легких, где
концентрация этого газа высока, и освобождаться от него в тканях, где она
ненамного ниже. Это похоже на то, как если бы вы взяли
отсыревшую подушку из одной комнаты и попытались высушить ее в
другой комнате, почти такой же сырой, как и первая. Ваша подушка
никогда бы не просохла как следует. Гемоглобин тоже не отдает
тканям весь свой кислород. И все-таки он поразительно
эффективен. Гемоглобин так чувствителен к изменениям концентрации
кислорода, что отдает его больше тем тканям, которые в нем больше
нуждаются, например работающим мышцам. Другой очень
сходный с гемоглобином белок, миоглобин, тоже красного цвета и тоже
содержащий железо, находится в мышцах. Присоединяя кислород,
миоглобин создает его резерв в мышечной ткани.
Миоглобин и гемоглобин изучены едва ли не лучше всех других
белков. Особый интерес представляет гемоглобин, поскольку
существует много болезней, особенно анемий, так или иначе связанных
с гемоглобином. Анемия самого обычного типа, при которой
уменьшено количество эритроцитов, развивается при недостатке железа,
необходимого для выработки гемоглобина. Значительно реже
встречается наследственная форма анемии, при которой количество
эритроцитов остается нормальным. Сравнительно недавно было
установлено, что причина этой наследственной анемии —
измененный гемоглобин, лишь слегка отличающийся от нормального.
Структура гемоглобина столь совершенна и так хорошо
соответствует его функции переносчика кислорода, что малейшее изменение
почти всегда ухудшает ее.
104 ГЛАВА 4
АНТИТЕЛА—БЕЛКИ,
ЗАЩИЩАЮЩИЕ
ОТ БОЛЕЗНЕЙ
Большинство людей, однажды переболевших корью, больше
не заражаются этой болезнью. Это относится и ко многим другим
болезням. Почти все перенесшие свинку, ветряную оспу или
полиомиелит приобретают пожизненный иммунитет к этим
инфекциям. Важнейшую роль в борьбе организма с болезнью, особенно
в явлениях иммунитета, играют циркулирующие в крови белки,
называемые антителами.
Антитела вырабатываются в ответ на проникновение в
организм чужеродных веществ, называемых антигенами. Носителями
антигенов могут быть вирусы, бактерии, а также эритроциты,
попадающие в организм при переливании крови, если группа
крови донора несовместима с группой крови больного. Антигеном
может быть чужеродный белок, например бактериальный токсин
(дифтерийный и т. п.) или белок змеиного яда.
Заболевание корью создает иммунитет только к кори и ни к
какой другой болезни. Специфичность — типичное свойство антител.
Они реагируют только с теми антигенами, которые вызвали их
синтез. Если, например, кролику ввести куриный яичный
альбумин, то примерно через неделю у него в крови появятся новые
антитела. Сыворотка крови иммунизированного кролика будет осаждать
куриный яичный альбумин из раствора в пробирке. Однако
антитела настолько специфичны, что даже с таким сходным белком,
как яичный альбумин индейки, они будут реагировать очень
слабо.
Когда людям делают прививки, им вводят вакцину, а вместе
с ней и соответствующий антиген. Слово «вакцина» (от латинского
vacca — корова) было введено Пастером в память Эдуарда Джен-
нера (1749—1823), который еще в конце XVIII века открыл, что
человека можно иммунизировать против оспы, привив ему
безвредную коровью оспу (антитела, образовавшиеся под действием
вируса коровьей оспы, достаточно хорошо реагируют с очень
близким антигеном вируса настоящей оспы).
Почти через сто лет после открытие Дженнера Пастер
разработал вакцины против нескольких болезней. Они готовились из
бактерий и вирусов, убитых нагреванием или химическими
веществами, или из ослабленных возбудителей, уже неспособных
вызвать заболевание. Особенно известны пастеровские прививки
против бешенства. Теперь такая прививка может быть дополнена
введением сыворотки животного, уже иммунизированного против
бешенства. В этом случае человек получает готовые антитела.
ЧТО ДЕЛАЮТ БЕЛКИ? 105
Кровь первого
ребенка (Rh*)
Кровь
матери (Rh-)
• • • { О О О
• • 1 О •
• • •4*° ° °
• • 1 О О
• • •-[**о о •
О , О * О
# О "О *
о ' о чо
ч О Ф О
О ч О • О
О / О ч О
/ О % О *-
о • о * о
* о о »-
О ч О * О
• • • ] О/ О ' О
• • -^ О "-4 '
• • • 1 О * О %0
• • *-V о * о
1 •' • • 1
ОЧ 0-«4 1
Кровь второго
ребенка (ЙЛ+)
!• • t
г> *
• ¥ •
Г*"* •
!ч • д
Рис. 79. Проникновение антител из крови матери в кровь ее еще не
рожденного ребенка при резус-несовместимости может иметь трагические
последствия.
A. При рождении первого ребенка некоторое количество его Rh-положи-
тельной крови попадает в кровоток матери.
Б. У Rh-отрицательной матери образуются антитела К| эритроцитам
ребенка, так как эти эритроциты содержат чуждый организму материГанти-
ген Rh.
B. Последующие дети получают от матери (наряду с другими
антителами) антитела к антигену Rh, способные разрушить у Rh-положительного
ребенка значительную часть эритроцитов и вызвать смертельную анемию.
Г. Этой опасности можно избежать, если вводить Rh-отрицательной
матери сразу же после рождения у нее первого (и каждого последующего) Rh-
положительного ребенка антитела к Rh-положительной крови; эти Rh-анти-
тела, разрушая эритроциты ребенка, которые могли попасть при его
рождении в кровеносную систему матери, предотвратцакуг образование в ее
организме собственны* Rh-антагел. ~ '%.■'. ■■;,■;- :v> *• ^
106 ГЛАВА 4
Рис. 80. Эритроциты,
агглютинированные антителами.
<С разрешения Ortho Dia-
.gnostics, Raritan, N. J.)
Тот же самый прием использует и природа. Теленок получает
готовые антитела с первыми глотками материнского молока. И в его
жизни это единственные белки, попадающие неповрежденными из
кишечника в кровяное русло.
Ребенок получает от матери готовые антитела перед самым
рождением. Обычно это единственные белки, переходящие в кровь
ребенка из организма матери. Эти антитела могут быть причиной
возникновения серьезной проблемы, если кровь матери относится
к резус-отрицательному типу (Rh~) и если еще не родившееся дитя
является ее вторым ребенком с резус-положительной кровью
{Rh+). При рождении первого резус-положительного ребенка его
эритроциты могут попасть в кровеносную систему матери и вызвать
образование Rh-антител. Если это произойдет (а это зависит от ряда
факторов), то, попав в кровь второго Rh-положительного ребенка
перед самым его рождением, Rh-антитела могут вызвать
разрушение его эритроцитов, а это в свою очередь может привести к
тяжелой анемии и даже к смерти ребенка.
В конце 60-х годов был разработан метод, позволяющий
избежать этой опасности. Резус-отрицательным матерям, только что
родившим резус-положительного ребенка, сразу же вводят анти-
резусные антитела. Эти антитела разрушают все
резус-положительные эритроциты, которые могли попасть в кровеносную
систему матери, прежде чем ее организм начнет вырабатывать против
них собственные антитела. Этим предотвращается опасность для
следующего ребенка.
КОМПЛЕКС
АНТИГЕН-АНТИТЕЛО
Антитела, Соединяясь с антигеном, вызвавшим их синтез,
образуют стойкий комплекс антиген — антитело. Как это может
способствовать борьбе с болезнью? Ядовитые белки, токсины,
соединившись С антителами, становятся безвредными. Антитела могут
также вызывать склеивание бактерий или вирусов, делать их чув-
*ч:Шг,*.§Ёл
Шт
ЧТО ДЕЛАЮТ БЕЛКИ? 107
Рис. 81. Молекула антитела (Am) имеет два участка, которые могут
связываться с антигеном (Аг). Если и антиген имеет два антигенных участка, то
могут образовываться огромные цепи, в которых чередуются антигены и
антитела. Если у антигена больше двух антигенных участков
(таковы,'например, эритроциты и бактерии), то возможно образование разветвленных
структур вроде изображенной на этом рисунке. Необходимо только иметь
в виду, что в действительности эритроциты или бактерии неизмеримо крупнее
молекул антитела.
ствительными к повреждающему действию других белков крови
пли облегчать их поглощение фагоцитами.
Как происходит соединение антитела с антигеном и почему
эта реакция столь специфична? Точного ответа пока нет, но можно
надеяться, что через несколько лет этот вопрос будет разрешен.
Известно, что каждое антитело имеет два участка, способных
связывать антиген. По-видимому, эти участки имеют определенную
форму, соответствующую только данному антигену, и химические
свойства, необходимые, чтобы его присоединить. Так как каждое
антитело имеет два связывающих участка, возможно образование
очень крупных агрегатов с чередующейся последовательностью
антитело — антиген — антитело — антиген и т. д. В пробирке
эти агрегаты образуют осадок (преципитируют), как это можно
наблюдать, например, в случае яичного альбумина или
чужеродных эритроцитов. В организме животного такая агрегация может
приводить к обезвреживанию антигенов — бактерий, вирусов или
чужеродных веществ.
ФЕРМЕНТЫ— х
БИОЛОГИЧЕСКИЕ \
КАТАЛИЗАТОРЫ
Клетка состоит из сложных химических компонентов, которые
ей приходится синтезировать из относительно простых веществ.
Сахара, крахмал, жиры, витамины, пигменты, гормоны, белки —
108 ГЛАВА 4
все это конечные продукты многочисленных химических реакций
(в некоторых случаях синтез может включать сотни этапов).
К этому следует добавить еще множество реакций, связанных с
расщеплением сложных веществ с целью выведения их из организма
или для использования заключенной в них энергии. Несколько
таких реакций было описано в предыдущих главах. В большинстве
клеток постоянно осуществляются тысячи подобных реакций.
Физические условия внутри клеток не способствуют быстрому
протеканию реакций. Внутриклеточная среда обычно нейтральна
(она не кислая и не щелочная), температура ее невысока — 37° С
у теплокровных животных, включая человека, и значительно ниже
у холоднокровных животных и у растений. В этих условиях
большинство реакций идет очень медленно.
Химики хорошо знают это. Обычно они ускоряют течение
реакций, нагревая реакционную смесь или добавляя в нее металл,
например железо или платину, а еще чаще — кислоту или щелочь.
Однако живые клетки не способны переносить ни высокую
температуру, ни присутствие щелочей и кислот, так как все эти
факторы вызывают денатурацию белка. И тем не менее химические
реакции в живых клетках протекают чрезвычайно быстро. Все дело
в том, что они осуществляются при участии катализаторов.
КАТАЛИЗАТОРЫ
УСКОРЯЮТ РЕАКЦИИ
Что такое катализатор! Это вещество, ускоряющее
химическую реакцию. Катализатор соединяется с исходным веществом
(реагентом), т. е. с той молекулой, которая должна принять
участие в данной реакции; иногда между ними даже возникает кова-
лентная или ионная связь. Но как только реакция завершилась
и [исходное вещество превратилось в продукт реакции, катализатор
2NO + 02 —> 2N02
2N02 + 2S02 —> 2NO + 2S03
02 + 2S02( + 2NO) -> 2S03( + 2NO)
Рис. 82. Классический пример катализа. Окисление газообразным
кислородом двуокиси серы до серного ангидрида значительно ускоряется при
добавлении окиси азота. Сначала окись азота окиедяется кислородом до двуокиси
азота. Затем двуокись азота окисляет двуокись серы до серного ангидрида
и сама восстанавливается при атом до исходного вещества — окиси азота.
Таким образом, окись азота, как всякий катализатор, вступает в реакцию, но
в конечном результате возвращается в исходное состояние. Как и все
катализаторы, окиСь азота ускоряет течение ре акции;поскольку две реакции, в
которых она участвует, протекают гораздо быстрее, чем прямое окисление
двуокиси серы газообразным кислородом.
ЧТО ДЕЛАЮТ БЕЛКИ? 109
освобождается и готов соединиться с новой молекулой того же
вещества. Для того чтобы полностью уяснить себе, каким образом
катализатор ускоряет данную реакцию, необходимо точно знать,
как осуществляется эта реакция.
Биологические катализаторы называются ферментами.
Рассмотрим в качестве примера ферментативное разложение перекиси
водорода (Н202). Тот, кто употреблял перекись водорода как
отбеливающее или дезинфицирующее средство, знает, что она
нестойка. Время от времени бутылочку с раствором Н202 в вашей
аптечке приходится заменять новой, так как в ней Доказывается
просто вода: перекись водорода постепенно разлагается на воду
(Н20) и кислород (02):
Н202 -> H20+V202.
Эту рекацию необычайно ускоряет фермент каталаза, который
имеется во многих растительных и животных клетках. Каталаза
вступает в реакцию, образуя комплекс с перекисью водорода,
но, в то время как перекись разлагается, каталаза остается
неизмененной:
Н2Оа + Каталаза —> Н202—Каталаза —> Н20 + */202 + Каталаза.
Одна молекула каталазы может осуществить эту реакцию 18
миллионов раз в минуту. Этот фермент относится к числу самых
активных.
Клетка содержит тысячи ферментов. Для каждой из дюжины
реакций, приводящих к синтезу глюкозы, нужен отдельный
катализатор. Фактически каждую химическую реакцию,
осуществляемую в живом организме, катализирует свой специфический
фермент.
Молекулярные насосы, находящиеся в клеточной мембране
и поддерживающие разность концентраций солей и других
веществ внутри и вне клетки,— это тоже не что иное, как ферменты.
О большинстве этих «транспортных» ферментов мы почти ничего
не знаем. Фермент, ответственный, по-видимому, за поддержание
низкой концентрации натрия и высокой концентрации калия
внутри клетки (несмотря на обратное соотношение между этими
ионами во внеклеточной жидкости), найден в эритроцитах, в
нервных клетках и во многих других тканях. В пробирке этот
фермент расщепляет АТФ на АДФ и фосфат при условии, что в
реакционной смеси присутствуют оба иона — и натрий, и калий.
Когда этот фермент находится в клеточной мембране, на него
действуют только внутренние ионы натрия и только наружные ионы
калия. На каждую использованную молекулу АТФ из клетки
выталкиваются три иона натрия, а два иона калия всасываются
внутрь клетки. Механизм этого процесса до сих пор остается
предметом догадок.
НО ГЛАВА 4
Некоторые ферменты действуют вне клеток, хотя они
синтезируются в клетках, которые их затем выделяют. Такие
ферменты участвуют, например, в переваривании пищи в желудке и
кишечнике. Под действием амилазы крахмал расщепляется до сахара.
Другие ферменты, такие, как трипсин, химотрипсин и пепсин,
разрушают белки. Еще один протеолитический (т. е.
расщепляющий белки) фермент — папаин — получают из дерева папайи.
Это активное вещество используют в пищевой промышленности
для уменьшения жесткости мяса.
ФЕРМЕНТЫ
-ЭТО ТОЖЕ БЕЛКИ
Ферменты называют также энзимами. Термин «enzyme» был
изобретен в 1878 году, смысл его не имеет отношения к катализу:
буквально это слово означает «в дрожжах». Дрожжи
использовались для разрыхления теста и приготовления пива и вина еще
в древние времена — жители Месопотамии пили пиво еще 8000 лет
Рис. 83. Джеймс Бэтчеллер Самнер (1887—1955) в 1926 году впервые
получил фермент в кристаллической форме. За это замечательное достижение,
доказавшее, что фермент может быть очищен, Самнеру (вместе с Нортропом и
Стэнли) была присуждена в 1946 году Нобелевская премия по химии. (С
разрешения New York State College of Agriculture at Cornell University.)
ЧТО ДЕЛАЮТ БЕЛКИ? lit
Рис. 84. Кристаллы фермента трипсина. (С разрешения М. Kunitz и
Rockefeller University Archives.)
назад. Однако только в XIX веке химики начали изучать реакции,
вызываемые дрожжами и известные под общим названием брожения.
Долгое время считалось, что для брожения, например для
превращения сахара в спирт, обязательно нужны живые дрожжи.
В 1897 году Эдуард Бюхнер (1860—1917) приготовил дрожжевой
«сок» (экстракт), не содержавший живых клеток, но все еще
способный вызывать брожение. Этим он нанес смертельный удар
витализму — представлению о том, что живые организмы наделены
особой «жизненной силой», которая ставит их вне законов физики
и химии и делает происходящие в них процессы недоступными для
человеческого понимания. Открытие Бюхнера послужило
стимулом для проведения множества работ, касавшихся
ферментативной активности клеточных экстрактов и внеклеточных жидкостей,
например желудочного сока, способность которого растворять
мясо была давно известна.
В 1926 году было установлено, что ферменты являются белками.
Для того чтобы выяснить природу ферментов, необходимо была
их очистить. Это оказалось очень трудной задачей, отчасти потому,
что один определенный фермент составляет лишь ничтожную
долю всего сухого вещества клетки. В конце концов Дж. Самнер
112 ГЛАВА 4
Рис. 85. Джон Ховард Норт- Уэнделл Мередит Стэнли (род.
роп (род. в 1891 г.) в 1931 году в 1904 г.) изучал химическую
закристаллизовал протеолити- природу вируса табачной мо-
ческий фермент трипсин, а в заики. Нортроп, Стэнли и
последующие годы — еще ряд Самнер разделили Нобелев-
пищеварительных ферментов. скую премию 1946 года по
(С разрешения Rockefeller химии, присужденную им за
University Graphic Services.) работы по изучению
ферментов и вирусных белков. (С
разрешения Nobel Foundation.)
(1887—1955) получил чистые кристаллы фермента уреазы и
установил, что уреаза является белком; одним из доказательств было
разрушение ее под действием протеолитических ферментов.
Четыре года спустя Дж. Нортроп (род. в 1891 г.) получил в
кристаллическом виде протеолитический фермент пепсин. Вскоре
были закристаллизованы и многие другие ферменты, включая
большинство здесь упоминавшихся. Когда выяснилось, что это
тоже белки, был сделан вывод, что все ферменты являются белками,
специализированными для выполнения определенной функции —
ускорения химических реакций.
КАКИМ ОБРАЗОМ ФЕРМЕНТЫ
КАТАЛИЗИРУЮТ РЕАКЦИИ
Катализ был известен задолго до открытия ферментов. Вначале
так называли расщепление перекиси водорода, катализируемое
не каталазой, а металлом, например платиной. Кислоты и щелочи,
часто употребляемые химиками для ускорения химических
реакций, тоже действуют как катализаторы. Ферментативный катализ
во многих отношениях напоминает каталитическое действие ме-
ЧТО ДЕЛАЮТ БЕЛКИ? ИЗ
таллов, кислот или щелочей. Некоторые ферменты, в том числе
и ката лаза, действительно содержат атом металла, подобно тому
как гемоглобин содержит атомы железа.
Однако в двух отношениях ферментативный катализ
представляет собой уникальное явление. Каталитическая способность
ферментов совершенно феноменальна. Химик счел бы
достижением, если бы ему удалось увеличить скорость химической реакции
до одной миллионной той скорости, которую обеспечивает
фермент. Кроме того, каждый фермент высокоспецифичен — он
реагирует только с одним определенным веществом; такое вещество
называют субстратом данного фермента.
Специфичность соединения фермента с субстратом очень
напоминает специфичность реакции между антителом и антигеном.
Полагают, что сходен и механизм обоих процессов. По-видимому,
связывающие участки каждого антитела обладают формой и
химическими свойствами, необходимыми для присоединения одного
определенного антигена. В 1967 году было доказано, что в
молекуле фермента лизоцима действительно есть такого рода участок —
активный центр, связывающий субстрат. Относительно антител
аналогичных данных пока нет, отчасти из-за трудности получения
индивидуальных антител (например, чистых противокоревых).
Эту трудность удалось преодолеть только в самое последнее время.
Однако сведения о структуре антител быстро накапливаются,
и еще быстрее продвигается вперед изучение ферментов. Это
связано с общим прогрессом в понимании природы белков.
Что же представляют собой белки? Об этом мы расскажем в
следующей главе.
\
8-0414
ЧТО ТАКОЕ
БЕЛКИ?
Физические свойства белков могут быть весьма различными.
Большинство белков бесцветны, однако гемоглобин и миоглобин
имеют красный цвет; яичный альбумин и желатина растворимы
в обычной воде, миозин и актомиозин — только в соленой воде,
а кератин почти совсем нерастворим. Белки выполняют самые
различные функции: коллаген служит структурным элементом
соединительнотканных волокон; гемоглобин переносит кислород,
который в мышцах может накапливаться, связываясь с миогло-
бином; десятки тысяч белков-антител «узнают» специфические
антигены и соединяются с ними — каждый со своим; и еще, возможно,
около 10 000 белков-ферментов служат катализаторами такого же
числа химических реакций. Каким же образом у белков могут
быть столь различные свойства и столь разнообразные функции?
Какова химическая природа этих удивительных веществ?
БЕЛКИ- ПОЛИМЕРЫ
АМИНОКИСЛОТ
Белки — очень крупные молекулы и, подобно большинству
таких молекул, представляют собой полимеры. Полимерные
вещества построены из небольших молекул, соединенных концами
друг с другом. Например, крахмал — это полимер, состоящий из
соединенных в цепочку молекул глюкозы, а найлон —
искусственный, созданный человеком полимер, построенный из
чередующихся молекул двух разных типов. Белки представляют собой
5
ЧТО ТАКОЕ БЕЛКИ? 115
цепи из аминокислот (полипептиды). В белках обычно находят
до двадцати различных аминокислот, но в отличие от найлона,
в котором малые молекулы правильно чередуются (А—Б—А—
—Б—А—Б...), в белках чередование аминокислот
нерегулярно.
Таким образом, молекула белка похожа на поезд, составленный
из вагонов двадцати различных сортов: разного рода пассажирских,
товарных, платформ, цистерн и т. д. Все вагоны могут быть
сцеплены одним и тем же способом, что позволяет соединить их в любом
порядке. Совершенно так же и в белках все аминокислоты
соединены друг с другом однотипной химической связью, получившей
название пептидной связи. Каждая из двадцати аминокислот
отличается от других (так же как и каждый тип вагонов, составляющих
поезд), но те части, которыми каждая аминокислота (или каждый
вагон) соединяется со своими двумя соседями, везде одинаковы.
Белковые молекулы невероятно крупны. Сравните
молекулярные веса некоторых белков и тех веществ, с которыми они
реагируют:
Вещество
Газообразный кислород (02
Гемоглобин ■— переносчик 0%
Миоглобин — белок, связывающий резервный кислород
в мышцах
Перекись водорода (Н202)
Каталаза — фермент, расщепляющий H2Of
Мочевина
Уреаза — фермент, расщепляющий мочевину (первый
^фермент, полученный в кристаллическом виде)
Аденозинтрифосфат (АТФ)
Миозин — мышечный белок, отщепляющий от АТФ
концевую фосфатную группу
«Небольшие» белки, такие, как миоглобин, состоят примерно
из 150 соединенных в цепь аминокислот. В белках средней
величины, таких, как гемоглобин, около 600 аминокислот, а в миозине
их уже 6000! Полипептидные цепи белков чрезвычайно длинны,
и вряд ли их можно сравнить в этом отношении с каким-либо
поездом: длина поезда, составленного из 6000 вагонов, достигла бы
70 миль. Тем не менее белки реагируют с молекулами, которые
в том же масштабе соответствовали бы одному вагону. Почему же
молекулы белков столь велики? Имеет ли величина белковых
молекул какое-то отношение к их функции?
Молекулярный вес
32
68 000
17 000
19
225 000
60
\ 480 000
«500
620Г0ОО
116 ГЛАВА 5
>ff<^ >-ff^ XfiH^
Глицин (Гли) Алании (Ала) Валш(Вал) Лейцин (Лей)
Изалейиин
(Иле)
Фенилаланин
(Фен)
Тирозин
(TUp)
Триптофан
(Три)
*■
Цистеин (Цис)
Метионин (Мет) Пролин (Про)
Аспарагиновая
кислота
(Асп)
Аспарагин
(АЬн)
/лутаминоеая
кислота
(Щ)
Глутамин (fit
ЧТО ТАКОЕ БЕЛКИ? 117
Оксилизин
Оксипролин
Тироксин
jS-Аланин Пеницилламин
Рис. 86. Некоторые аминокислоты, встречающиеся в природе. В первых
пяти рядах представлены двадцать аминокислот, входящих в состав белков;
в последнем ряду — пять редких аминокислот. Оксилизин и оксипролин
найдены только в одном белке — коллагене, тироксин — только в белке тирео-
глобулине (гормон, выделяемый щитовидной железой). р-Аланин входит в
состав кофермента А, пеницилламин — в состав антибиотика пенициллина.
Алании
Глицин
Пептидная
связь
Рис. 87. В белках аминокислоты соединены друг с другом пептидными
связями. Карбоксильная группа каждой аминокислоты (на этом рисунке — ала-
нина) соединяется с аминогруппой следующей аминокислоты (в данном
случае глицина); при этом освобождаются ионы Н+ и ОН", образующие молекулу
воды.
118 ГЛАВА 5
Цистеин Треонин Аспарагиновая кислота Алании Алан...
Рис. 88. Аминокислоты в молекуле белка соединены совершенно
одинаковыми пептидными связями, подобно тому как вагоны разного типа сцеплены
в'поезде одним и тем же способом. Благодаря этому двадцать различных
аминокислот могут соединяться в любом порядке.
БЕЛКИ ИМЕЮТ
СЛОЖНУЮ ФОРМУ
Полипептидные цепи белков действительно очень длинны,
однако они не болтаются свободно, как вареные макаронины, а
изогнуты, закручены и «скомканы»— у каждого белка совершенно
определенным характерным образом. В результате молекулы
большинства белков приобретают более или менее округлую, как
говорят, глобулярную форму (отсюда названия «гемоглобин» и
«миоглобин»). Молекулы глобулярных белков, к которым
относятся и ферменты, напоминают клубки. Где-то на поверхности или
внутри глобулы фермента изгибающаяся цепь образует активный
центр, соответствующий по своей конфигурации субстрату (а в
молекуле антитела — антигену).
Способ укладки полипептидной цепи, придающий белковой
молекуле ее характерную форму, всецело определяется
расположением в ней аминокислот. В цепи каждого белка
последовательность аминокислот уникальна, поэтому каждый белок приобретает
свою собственную неповторимую форму. Кроме того, некоторые
белки состоят из двух или даже большего числа соединенных
между собой полипептидных цепей. Примером может служить
гемоглобин: он состоит из четырех цепей, определенным образом
свернутых и соединенных друг с другом.
Биологическая активность белка зависит от всех этих
особенностей его структуры — от последовательности аминокислот
ЧТО ТАКОЕ БЕЛКИ? 119
Рис. 89. Схематическое изображение изгибов полипептидных цепей в протео-
литическом ферменте альфа-химотрипсине. Этот белок состоит из трех
переплетающихся цепей — А, В и С. Концы каждой цепи обозначены NHJ и COg
с соответствующей буквой в скобках. Проследив ход каждой цепи от одного
конца до другого, можно получить ясное представление о сложности ее
пространственной конфигурации. (Nature, 214, 625 (1967); с разрешения D. М.
Blow.)
120 ГЛАВА 5
в цепи, от того, каким образом эта цепь сложена в трехмерную
структуру, а в некоторых случаях и от характера объединения
двух или большего числа таких структур. Разобраться в
«конструкции» столь сложной молекулы чрезвычайно трудно, но
благодаря гигантским успехам белковой химии, достигнутым в
последние годы, сейчас уже полностью определена структура нескольких
белков. Мы даже можем довольно точно представить себе, как
работают некоторые ферменты.
Изучая структуру того или иного белка, прежде всего
определяют его аминокислотный состав и последовательность
аминокислот в его молекуле.
АМИНОКИСЛОТНЫЙ
СОСТАВ БЕЛКОВ
Белки отличаются друг от друга не только общим числом
аминокислот в цепи и их последовательностью; существуют также
различия в аминокислотном составе, т. е. в относительных
количествах тех или иных аминокислот. Например, в миоглобине
отсутствует аминокислота цистеин, так что его цепь содержит только
19 из двадцати обычных аминокислот. Особенно своеобразен состав
белка коллагена: в нем отсутствуют цистеин и тирозин, но по
сравнению с другими белками очень много глицина (почти треть
от общего числа аминокислот) и пролина. Кроме того, коллаген
Глицин
Пептидная
связь
Рис. 90. Аминокислоты, соединенные пептидной связью, можно разделить
при помощи гидролиза, т. е. разрыва пептидной связи с присоединением
компонентов, составляющих молекулу воды (Н+ и ОН"). Гидролиз пептидной
связи — процесс, обратный ее образованию (см. рис. 87). Гидролиз можно
осуществить путем кипячения в кислоте или с помощью протеолитических
ферментов.
ЧТО ТАКОЕ БЕЛКИ? 121
Рис. 91. Пример разделения веществ с помощью
хроматографии на бумаге. Чернила (для этой
иллюстрации были использованы черные чернила
фирмы «Паркер») нанесли в виде небольшого
пятнышка на фильтровальную бумагу и
высушили, а затем полоску бумаги подвесили в
закрытом сосуде, содержавшем немного воды.
Пропитывая бумагу, вода поднималась по полоске вверх,
увлекая и разделяя различно окрашенные
компоненты чернил.
содержит две необычные аминокислоты — оксипролин и оксили-
зин, которых нет в других белках.
Чтобы определить аминокислотный состав очищенного белка,
сначала разрывают пептидные связи в его цепи, затем отделяют
полученные свободные аминокислоты друг от друга,
идентифицируют их и определяют содержание каждой из них. Первый этап
не представляет больших трудностей. Пептидные связи гидроли-
зуют длительным кипячением белка в концентрированной кислоте
(гидролизом называется разрыв связи с присоединением
компонентов воды, Н+ и ОН"). Второй этап — разделение смеси
аминокислот — был необычайно упрощен благодаря
усовершенствованию в начале 40-х годов метода хроматографии. При хроматогра-
фировании на бумаге смесь веществ наносят в виде пятна на
бумажную полосу недалеко от ее нижнего конца; этот конец
опускают в растворитель, который постепенно пропитывает всю бумагу
и увлекает за собой вещества, составляющие смесь. Скорость,
с которой каждое вещество движется вверх по бумажной полосе,
зависит от его растворимости в использованном растворителе.
Используя подходящий растворитель и достаточно длинную
полоску бумаги, можно разделять даже сложные смеси веществ.
(Какое значение имеет длина бумаги? Представьте себе, что две
машины отправились в путь из одного и того же пункта и движутся
с несколько различной скоростью, скажем 20 и 25 километров в час.
Через час езды их будет разделять расстояние в 5 км, а череа
10 часов — 50 км. Точно так же и два вещества могут быть лучше
разделены, если они движутся дольше и путь их длиннее.)
122 ГЛАВА 5
Хроматография на бумаге — метод несложный. Полоска
газетной бумаги может (прекрасно служить для разделения красителей,
входящих в состав черных чернил. В отличие от красителей
аминокислоты бесцветны, поэтому для их выявления хроматограмму
опрыскивают реактивом, который образует с ними окрашенные
соединения. По интенсивности окраски отдельных пятен
определяют количество [каждой аминокислоты в смеси.
ПОСЛЕДОВАТЕЛЬНОСТЬ
АМИНОКИСЛОТ В БЕЛКАХ
Метод хроматографии намного упростил определение
аминокислотного состава белков. Кроме того, он сделал возможным
решение задачи, казавшейся ранее совершенно безнадежной,—
позволил определять последовательности аминокислот в белках.
За это невероятно трудное дело взялся английский биохимик
Фредерик Сэнгер. Объектом для анализа он избрал инсулин, белок
с относительно небольшим молекулярным весом — 5733.
Инсулин — это гормон,^)выделяемый в кровь поджелудочной железой
и регулирующий обмен сахара у позвоночных. У больных
диабетом этого гормона нет или он вырабатывается в недостаточном
количестве.
Как был определен порядок соединения 51 аминокислоты в
молекуле инсулина? Прежде всего установили, какие аминокислоты
находятся на концах цепи. Одна из этих аминокислот имеет
свободную аминогруппу (NH2), а другая, на противоположном конце
цепи — свободную карбоксильную группу (СООН), поэтому их
Фен ' Вал I ' Лиз ' Ала
N-конеи С-конец
Рис. 92. У полипептидной цепи, естественно, два конца. Аминокислота,
находящаяся на одном конце, имеет свободную, не участвующую в пептидной
связи аминогруппу. Этот конец называют iV-концом. У аминокислоты,
расположенной на другом конце, остается свободной карбоксильная группа.
Этот конец называют С-концом. (Здесь в качестве примера взята длинная цепь
инсулина.)
ЧТО ТАКОЕ БЕЛКИ? 123
называют N-концевой и С-концевой аминокислотами. Сэнгер нашел
соединение, названное ДНФ (по динитрофенильной группировке),
которое присоединялось только к N-концевой аминокислоте,
окрашивая ее в ркелтый цвет. Это дало возможность отличить N-
концевую аминокислоту от других. В конце концов Сэнгер
определил последовательность всех аминокислот в молекуле инсулина,
используя хроматографию на бумаге, ДНФ плюс
изобретательность и настойчивость.
Чтобы проиллюстрировать подход к решению этой задачи,
попробуем определить последовательность аминокислот в небольшом
фрагменте белковой молекулы, состоящем из шести аминокислот.
Прежде всего мы обработаем этот фрагмент ДНФ и гидролизуем
его в кипящем растворе кислоты; затем исследуем полученную
смесь аминокислот с помощью хроматографии на бумаге. На
полученной |хроматограмме окажется одно желтое пятно, по
положению которого (по расстоянию от старта) можно заключить, что
оно принадлежит ДНФ-производному аминокислоты серина.
Таким образом, мы узнали, что N-концевой аминокислотой
изучаемого фрагмента является серии. Предположим, что дальнейший
анализ хроматограммы выявил также присутствие в изучаемом
фрагменте аланина, валина, глутаминовой кислоты, гистидина
и лейцина. Теперь, используя принятые сокращения названий
аминокислот, состав фрагмента можно записать следующим
образом:
Сер-(Ала, Вал, Гис, Глу, Лей).
Серии поставлен на первое место, так как мы знаем, что это N-
концевая аминокислота. Другие аминокислоты выписаны в
алфавитном порядке, заключены в скобки и разделены запятыми, чтобы
показать, что их последовательность пока неизвестна (черточки
вместо запятых означали бы, что аминокислоты расположены
именно в указанной последовательности).
Чтобы выяснить расположение остальных пяти аминокислот,
мы должны все начать снова. На этот раз мы проводим кислотный
гидролиз фрагмента в более мягких условиях. При мягком
кислотном гидролизе некоторые пептидные связи не разрываются,
поэтому в полученной смеси будут содержаться все возможные обрывки
изучаемого фрагмента, содержащие одну, две, три или четыре
аминокислоты (не надо забывать, что мы одновременно
гидролизуем огромное число молекул; в одних разорвутся одни связи,
в других — другие). Например, при неполном гидролизе
фрагмента, содержащего три аминокислоты Сер-Гис-Лей, иногда будет
разрываться связь между серином и гистидином, а иногда —
между гистидином и лейцином; в первом случае это даст Сер и
Гис-Лей, а во втором — Сер-Гис и Лей.
124 ГЛАВА 5
Таким образом, в результате неполного гидролиза мы получим
много мелких кусочков изучаемого фрагмента. Теперь обработаем
их ДНФ и разделим смесь с помощью хроматографии на бумаге.
Для тех кусочков, которые могут быть выделены в достаточных
количествах, определим аминокислотный состав и N-концевую
аминокислоту. (К счастью, для определения последовательности
аминокислот нет необходимости исследовать все мелкие кусочки.)
Сопоставим полученные результаты:
1. Определение N-концевой аминокислоты и аминокислотного
состава дало:
Сер-(Ала, Вал, Гис/ Тлу, Лей).
2. Те же определения для четырех кусков фрагмента,
полученных при его неполном гидролизе, предположим, дали:
Сер-Гис
Гис-(Лсй, Вал,:Глу)
Вал-Глу
Вал-(Глу, Ала)
3. Из этих данных можно заключить, что последовательность
аминокислот в изучаемом фрагменте имеет такой вид:
Сер-Гис-Л ей-Вал-Глу-Ала.
ПОСЛЕДОВАТЕЛЬНОСТЬ
АМИНОКИСЛОТ
В ИНСУЛИНЕ
Как мы видели, определение последовательности аминокислот
всего лишь в небольшом фрагменте белковой молекулы — уже
довольно трудная задача. Понятно, что аналогичный анализ всей
молекулы требует огромного труда, даже если она, как у инсулина г
&
о-ф-о
очв>-#—•—<&°
Цистеин
Рис. 93. Аминокислота цистеин обладает сульфгидрильной группой (—S—Н).
Окисление цистеина приводит к потере водородных атомов и соединению
двух молекул через атомы серы. Получается цистин — «двойная»
аминокислота, содержащая дисульфидную связь (—S—S—).
4T0JTAK0E БЕЛКИ? 125
Рис. 94. Молекула инсулина состоит из короткой и длинной цепей,
соединенных двумя дисульфидными связями. Третья дисульфидная связь образует
петлю в короткой цепи. На этой схеме дисульфидные связи обозначены
заштрихованными полосками.
невелика. Прежде всего нужно было определить аминокислотный
состав и N-концевую аминокислоту. В инсулине оказались две
N-концевые аминокислоты. Так было установлено, что молекула
инсулина состоит из двух аминокислотных цепей. Эти цепи
соединены друг с другом дисульфидными связями (—S—S—):
аминокислота цистеин содержит атом серы, который может образовать
связь с атомом серы другой молекулы цистеина.
Дисульфидные связи между цистеинами соединяют между собой
различные цепи во многих белках. Такие связи возможны и между
цистеинами, находящимися в отдаленных участках одной и той же
цепи. В этом случае образуется петля. Две цепи инсулина
соединены двумя дисульфидными связями; третья дисульфидная связь
образует петлю в короткой цепи.
После разрыва дисульфидных связей обе цепи были выделены
порознь, каждая из них подвергнута неполному кислотному
гидролизу и полученные фрагменты исследованы описанным выше
методом (взятый нами в качестве примера фрагмент составляет часть
молекулы инсулина). Ряд полученных последовательностей удалось
объединить, но между ними все еще оставалось несколько
разрывов. Тогда был использован новый прием. Цепи были гидролизова-
ны не кислотой, а протеолитическими ферментами: трипсином,
химотрипсином и пепсином. Протеолитические ферменты тоже
разрывают пептидные связи между аминокислотами, но в отличие
от кислоты они рвут не все связи. Химотрипсин, например, гидро-
лизует только те связи, в которых участвуют аминокислоты
триптофан или тирозин. Поэтому ферментами белковые цепи
расщепляются лишь на несколько больших фрагментов. Определение их
Последовательность
аминокислот в длин- Фен-Вал-Асн~Глн-Гис-Лей-Цис-Гли-СерТис-Лей-Вал-Глу-Ала-№йТир-Л^
Короткие
фрагменты, полученные при
неполном
кислотном гидролизе
Последовательности,.
выведенные на основа-
нии анализа корот-
ких Фрагментов
Отрезки,
полученные при гидролизе
протеолитическими ферментами
Полная
последовательность
Рис. 95. Определение последовательности аминокислот в длинной цепи инсулина. Был произведен анализ
множества коротких фрагментов, полученных при кислотном гидролизе длинной цепи. Результаты этого анализа привели
к определенному заключению о последовательностях аминокислот в пяти крупных фрагментах. Однако порядок
расположения этих фрагментов не был определен и между ними оставались незаполненные промежутки. С помощью
гидролиза длинной цепи разными протеолитическими ферментами были получены длинные отрезки, анализ которых
позволил определить расположение более коротких фрагментов и заполнить остававшиеся разрывы.
ЧТО ТАКОЕ БЕЛКИ? 127
Рис. 96. Фредерик Сэнгер (род. в 1918 г.). За выдающееся достижение —
определение последовательности аминокислот в белке инсулине — ему
в 1958 году была присуждена Нобелевская премия по химии. (С разрешения
Central Office of Information.)
N-концевых аминокислот и аминокислотного состава дало
достаточно информации для заполнения оставшихся пробелов и
выяснения всей последовательности. Все фрагменты, полученные при
кислотном и ферментативном гидролизе длинной цепи инсулина,
представлены на рис. 95.
Но это было еще не все: оставалось неизвестным положение
дисульфидных связей, соединяющих обе цепи инсулина и
образующих петлю. В инсулине шесть остатков цистеина и три дисульфид-
ные связи между ними. С каким из цистеинов соединен цистеин
1 — с цистеином 2, 3, 4, 5 или 6?
Когда Сэнгер попытался выяснить этот вопрос, гидролизовав
инсулин, в котором предварительно не были разорваны дисуль-
фидные связи, он обнаружил, что цистеин 1 может быть соединен
с любым из остальных цистеинов, как будто цепи инсулина
соединяются всеми возможными способами. Потом оказалось, что в кислой
среде происходит перегруппировка дисульфидных связей между
различными фрагментами молекулы. Для того чтобы найти способ
химически подавить эту перегруппировку и выяснить
действительное положение дисульфидных связей, пришлось затратить немало
труда.
128 ГЛАВА 5
Рис, 97. Полная последовательность аминокислот в инсулине.
Наконец, и эта задача была решена. Впервые удалось
установить полную последовательность аминокислот и положение дисуль-
фидных связей в молекуле белка. Это эпохальное достижение
явилось результатом десяти лет работы.
ПОСЛЕДОВАТЕЛЬНОСТЬ
АМИНОКИСЛОТ
В ДРУГИХ БЕЛКАХ
Через шесть лет после первого успеха Сэнгера была
расшифрована последовательность аминокислот во втором белке. В 1960 году
к инсулину с его 51 аминокислотой добавился фермент рибонуклеа-
за со 124 аминокислотами. У. Стейн и С. Мур, определившие
порядок аминокислот в молекуле рибонуклеазы, видоизменили хро-
матографический метод, используемый для разделения
аминокислот: их разделение производится теперь автоматически.
Дальнейшее усовершенствование методов настолько упростило работу,
что сейчас уже известна последовательность аминокислот во
многих белках.
При сравнении этих последовательностей обнаружилось много
интересного. Сэнгер изучал инсулин крупного рогатого скота.
Но все ли инсулины одинаковы? Сэнгер предпринял сравнение
инсулинов, полученных от коров, собак, лошадей, свиней,
кроликов, овец, китов и человека. Он обнаружил, что они почти
идентичны: все состоят из 51 аминокислоты, из которых 47 всегда
одинаковы. Скажется ли замена какой-либо из этих 47 аминокислот
на способности инсулина регулировать углеводный обмен? Это
пока неизвестно.
Сэнгер обнаружил замену четырех аминокислот.
Последняя, С-концевая аминокислота длинной цепи инсулина — почти
всегда аланин, однако в инсулине человека на этом месте стоит
ЧТО ТАКОЕ БЕЛКИ? 129
Рис. 98. Места, в которых обнаружены замены аминокислот в инсулинах
восьми разных млекопитающих: коровы, собаки, лошади, свиньи, кролика,
барана, кита и человека. Различия были найдены только в четырех
аминокислотах (из 51).
треонин, а в инсулине кролика — серии. Три другие аминокислоты,
подверженные заменам, расположены в петле, образованной дисуль-
фидной связью, и непосредственно примыкают друг к другу. В
инсулине крупного рогатого скота это Ала-Сер-Вал. У некоторых
животных аланин замещен треонином, но не другой
аминокислотой; серии может быть замещен глицином, а валин — изолейцином
или треонином. Таким образом, различия совсем незначительны.
МЕЖВИДОВЫЕ РАЗЛИЧИЯ
В БЕЛКАХ
Сравнение последовательности аминокислот в белках разных
животных показало, что белки, выполняющие одну и ту же
функцию, почти одинаковы, кому бы они ни принадлежали. Чем ближе
друг к другу виды животных, тем более сходны их белки. Меньше
всего различий в белках, выполняющих важнейшие
биологические функции. Это не удивительно, поскольку естественный отбор
должен сильнее всего воздействовать именно на те белки,
функции которых жизненно важны. Тот белок (или, точнее, тот вариант
последовательности аминокислот), который лучше всего подходит
для данной функции, отбирается особенно строго и сохраняется
неизменным благодаря уничтожению особей с менее эффективным
вариантом того же белка.
Необычайно сходным у самых различных организмов оказался
фермент цитохром с. Этот фермент играет ключевую роль в
митохондриях, улавливая энергию, освобождающуюся при окислении
уксусной кислоты. Структура цитохрома с всюду одинакова —
9-0414
130 ГЛАВА 5
в клетках человека и мыши, цыпленка и змеи, мухи и лягушки,
цветной капусты и пшеницы, плесени и дрожжей. Может ли это
быть случайностью? Конечно, нет! Такое сходство — один из
самых веских доводов в пользу того, что вся земная жизнь
произошла от общего предка.
РАЗЛИЧИЯ МЕЖДУ
ГЕМОГЛОБИНАМИ
Нормальные эритроциты имеют округлую форму. При
наследственном заболевании, называемом серповидноклеточной анемией 1Т
они могут принимать характерную форму, напоминающую серп;
это связано с тем, что они содержат необычный гемоглобин,
который, если он не насыщен кислородом, собирается в глыбки*
В 1949 году выдающийся американский химик Лайнус Полинг
обнаружил химическое различие между нормальным и серповид-
ноклеточным гемоглобинами: первый оказался несколько более
кислым. Это могло указывать на то, что в нормальном гемоглобине
содержится немного больше кислых аминокислот. Однако Полинг
не смог обнаружить никакого различия в аминокислотном составе
обоих гемоглобинов — применявшиеся тогда методы не были
достаточно точными, чтобы выявить замену одной или двух аминокислот
в белке, состоящем примерно из 600 аминокислотных остатков.
В 1959 году Верной Ингрэм разработал особый хроматографи-
ческий метод, предназначенный для выявления небольших
различий в аминокислотном составе белков и намного упростивший
определение полных последовательностей аминокислот. Этот метод
называют методом «отпечатков пальцев». Прежде всего Ингрэм
приготовил триптический гидролизат, обработав гемоглобин
протеолитическим ферментом трипсином. Трипсин гидролизует
только те пептидные связи, которые следуют за одной из двух
аминокислот — лизином или аргинином. Так как в гемоглобине 30
остатков лизина и аргинина, трипсин расщепляет гемоглобин на 31
фрагмент. С помощью обычной хроматографии на бумаге эти фрагменты
полностью разделить невозможно: многие пятна будут
накладываться друг на друга. Чтобы избежать этого, Ингрэм сначала нанес
гидролизат на угол квадратного листа бумаги, смоченного буфер-
1 В США около 10% негритянского населения — носители гена
серповидноклеточной анемии. В некоторых частях Африки эта величина
достигает 60%. Носители, т. е. те, кто унаследовал ген только от одного из
родителей, не страдают от анемии, как это бывает с теми, кто унаследовал ее
от обоих родителей (такие люди обычно умирают в детском возрасте).
Распространение гена серповидноклеточной анемии в Африке объясняется тем,
что он обусловливает относительную невосприимчивость к малярии.
ЧТО ТАКОЕ БЕЛКИ? 131
Рис. 99. При низкой концентрации кислорода эритроциты людей,
страдающих серповидноклеточной анемией, принимают причудливую форму, иногда
напоминающую серп. Нормальные эритроциты имеют диско видную форму.
(С разрешения М. Bessis.)
ным раствором, и поместил его в электрическое поле. Под
действием этого поля каждый из фрагментов продвинулся вдоль края
бумажного листа на определенное расстояние, которое зависело
от электрического заряда данного фрагмента, т. е. от его
кислотных или основных свойств. После этой процедуры Ингрэм
повернул лист на 90° и следующий этап разделения провел с помощью
обычной хроматографии, при которой скорость движения
фрагментов зависит от их растворимости.
Когда Ингрэм приготовил «отпечатки пальцев» нормального
и серповидноклеточного гемоглобинов, он обнаружил, что почти
все пятна на обоих хроматограммах одинаковы. На второй хрома-
тограмме не было только одного «нормального» пятна, но там
появилось одно новое пятно. Различие в положении этих двух
пятен указывало на то, что исчезнувшее «нормальное» пятно яри-
9*
132 ГЛАВА 5
0
о
0
0
0
0
0
А Б ^ . В
Рис. 100. Для разделения сложной смеси фрагментов белковых молекул
используют метод «отпечатков пальцев» (или «пептидных карт»).'Сначала
раствор частично гидролизованного белка наносят на один из углов большого
квадратного листа хроматографической бумаги (Л). Этот лист бумаги
помещают в электрическое поле. Находящиеся в растворе фрагменты белковых
молекул движутся вдоль края бумаги со скоростью, пропорциональной их
заряду, т. е. их кислотности или щелочности (Б). Затем бумагу поворачивают
на 90° и производят дальнейшее разделение с помощью обычной
хроматографии; перемещение фрагментов зависит теперь от их растворимости в
используемом растворителе (В),
надлежит фрагменту более кислому, чем новый фрагмент,
обнаруженный в гидролизате серповидноклеточного, гемоглобина.
Это совпадало с предсказанием Полинга.
Пользуясь методом Сэнгера, Ингрэм определил
последовательность аминокислот в неидентичных фрагментах обоих гемогло-
бинов. Оказалось, что они различаются только одной
аминокислотой: кислая глутаминовая кислота «нормального» фрагмента была
замещена в измененном фрагменте нейтральной аминокислотой
валином. Таким образом, люди, наследующие смертельную
болезнь — серповидноклеточную анемию,— наследуют гемоглобин,
содержащий только одну «ошибочную» аминокислоту:
Гемоглобин А ... Ва л-Гис-Л ей-Тре-Про-Глу-Глу-Л из..»
(нормальный)
Гемоглобин S Р..Вал-Гис-Лей-Тре-Про-Вал-Глу-Лиз..,
(серцовидноклеточный)
Тем же методом Ингрэм исследовал гемоглобин больных
другой анемией, тоже наследственной. Он обнаружил, что та же
глутаминовая кислота замещена здесь лизином. Оказалось, однако,
что это не единственное место, где в молекуле гемоглобина
возможна замена аминокислоты: в настоящее время изучено около
100 аномальных (патологических) гемоглобинов, и таких мест
найдено довольно много.
ЧТО ТАКОЕ БЕЛКИ? 133
Гемоглобин А Пшоглобин S
т
•Г* *
» #
f#
тШ В -*
Гемоглобин А
0<Ъо ~ о
Гемоглобин S
S1
Рис. 101. Пептидные карты белковых фрагментов, полученных при трипти-
ческом гидролизе нормального гемоглобина (гемоглобина А) и гемоглобина
от больного серповидноклеточной анемией (гемоглобина S). Почти все пятна,
каждое из которых соответствует фрагменту белковой молекулы, в обоих
случаях одинаковы; только одно пятно, имеющееся на пептидной карте
гемоглобина А, отсутствует на карте гемоглобина S, но вместо него здесь есть
другое пятно, которого нет на карте гемоглобина А. (С разрешения V. Ingram).
ЗАМЕНЫ АМИНОКИСЛОТ
«Ассортимент» аминокислотных замен, обнаруженных в
аномальных гемоглобинах, ограничен. Рассмотрим аминокислоты
несколько подробнее. Все они имеют карбоксильную группу и
аминогруппу. Эти две реактивные группы образуют пептидные
связи, соединяющие каждую аминокислоту с ее соседями. Всякий
белок представляет собой цепь пептидных связей, от которой
в стороны выступают боковые цепи аминокислот, т. е. группы
атомов, не участвующие в образовании пептидных связей.
Глутаминовая и аспарагиновая кислоты носят кислый
характер, так как обе они имеют по две карбоксильные группы. Эти
аминокислоты придают белку кислотные свойства. Есть
аминокислоты с выраженными основными свойствами; большинство же
аминокислот нейтральны. Девять из 20 обычных аминокислот —
гидрофильные, они способствуют большей растворимости белка
134 ГЛАВА 5
в воде; среди них есть и кислые, и основные, и нейтральные
аминокислоты (их структурные формулы приведены на рис. 86 в 4-м
и 5-м рядах). Остальные одиннадцать аминокислот —
гидрофобные. Их боковые группы в основном представляют собою
углеводородные цепи, состоящие из атомов только двух элементов —
углерода и водорода. Эти аминокислоты, структурные формулы
которых приведены на рис. 86 в трех верхних рядах, уменьшают
растворимость белков в воде.
Замены, обнаруженные в аномальных гемоглобинах, почти во
всех 100 случаях затрагивают гидрофильные аминокислоты.
Почему так редки гемоглобины с заменой гидрофобных аминокислот?
Оказывается, функция таких молекул столь сильно нарушена,
что они даже не могут участвовать в транспорте
кислорода.
До последнего времени роль гидрофобных аминокислот в
белковой молекуле оставалась неизвестной. Сейчас, однако,
установлена полная трехмерная структура нескольких белков, в том
числе и гемоглобина. Петли их сложно изогнутых полипептидных
цепей фиксируются в надлежащем положении главным образом
благодаря взаимодействию между гидрофобными аминокислотами,
поэтому замена таких аминокислот ведет к катастрофическим для
молекулы последствиям.
ТРЕХМЕРНАЯ СТРУКТУРА
БЕЛКОВ
Извилистые цепи из аминокислот нельзя увидеть ни в какой
микроскоп. Как же тогда определяют трехмерную структуру
белка?
В начале нашего столетия физик Макс фон Лауэ (1879—1960)
открыл явление дифракции, или рассеяния, рентгеновских лучей
при прохождении их через кристалл. Это открытие, за которое
Лауэ в 1914 году получил Небелевскую премию по физике, было
чрезвычайно важно для понимания природы лучей Рентгена, так
как доказывало их сходство с обычным светом. Сэр Лоуренс Брэгг
(1890—1971) и его отец сэр Уильям Брэгг (1862—1942) поняли,
что дифракция рентгеновских лучей не только объясняет их
природу, но и может служить мощным инструментом изучения
структуры самих кристаллов. Они разработали метод рентгенострук-
турцого анализа, с помощью которого оказалось возможным
определять трехмерную структуру молекул.
ЧТО ТАКОЕ БЕЛКИ? 135
Рис. 102. Сэр Лоуренс Брэгг. В 1915 году в возрасте 25 лет получил
Нобелевскую премию по физике вместе со своим отцом Уильямом Брэггом за
разработку метода исследования структуры кристаллов с помощью
рентгеновских лучей. Лоуренс Брэгг умер в 1971 году в возрасте 81 года, став
свидетелем революционизирующего влияния рентгеновской кристаллографии —
науки, созданной им еще в молодости,— на минералогию, металлургию,
химию и, быть может в наибольшей степени, на молекулярную биологию.
(С разрешения Nobel Foundation.)
РЕНТГЕНОСТРУКТУРНЫЙ
АНАЛИЗ
Для того чтобы определить структуру какого-либо вещества
с помощью рентгеновских лучей, необходимо получить это
вещество в кристаллической форме. В кристалле атомы расположены
в закономерно повторяющемся порядке во всех трех измерениях.
Например, в очень простой кристаллической решетке поваренной
соли каждый ион натрия окружен шестью ионами хлора: один
находится сверху, один снизу, по одному справа и слева и по одно
му спереди и сзади. Таким же образом каждый ион хлора
окружен шестью ионами натрия.
Если вы посмотрите на такую кристаллическую структуру
сверху, снизу, по диагонали, спереди или сзади, вы увидите ионы
натрия расположенными на одинаковых друг от друга, равномерно
повторяющихся расстояниях. Это относится к любым атомам
в любом кристалле, как бы ни были сложны состав и расположение
136 ГЛАВА 5
Рис. 103. Для всякого кристалла характерно регулярное расположение
атомов. Здесь изображены кристаллы вируса полиомиелита в инфицированной
клетке. (S. Dales et al., Virology, 26, 379 (1965); с разрешения S. Dales.)
образующих его молекул: если в определенных направлениях
провести через кристалл прямые линии, то одинаковые атомы будут
повторяться на них периодически, с одинаковыми интервалами.
Через эти ряды повторяющихся атомов можно провести
параллельные плоскости, причем это можно сделать разными способами.
Три таких способа, дающих для кристалла хлористого натрия три
набора параллельных плоскостей, показаны на рис. 104.
Рис. 104. Расположение атомов в кристалле хлористого натрия. Регулярно
повторяющиеся атомы образуют несколько систем параллельных плоскостей.
На схеме показаны три такие системы.
ЧТО ТАКОЕ БЕЛКИ? 137
Рис. 105. Распределение-
пятен, образующихся на
фотопластинке при
прохождении рентгеновских
лучей через кристалл белка
миоглобина. (С разрешения
J. Kendrew.)
Рис. 106. Лайнус Полинг (род. в 1901 г.) не только сделал много блестящих
открытий в области химии; он был также искренне озабочен социальными
последствиями научного прогресса. Так, в значительной мере благодаря его»
усилиям была осознана опасность радиоактивных осадков. В 1954 году По-
лингу присудили Нобелевскую премию по химии за исследование химических
связей, а в 1963 году — Нобелевскую премию мира. (С разрешения Nobel
Foundation.)
138 ГЛАВА 5
Когда пучок рентгеновских лучей проходит через кристалл,
эти наборы параллельных плоскостей действуют как система
зеркал, расположенных под разными углами: они отражают часть
лучей в разных направлениях. Если позади кристалла поместить
•фотопластинку, то на ней появится очень интенсивное центральное
пятно от прямого луча, окруженное множеством мелких пятен,
соответствующих отражениям от различных групп параллельных
плоскостей кристалла. Измерив положение и интенсивность
каждого пятна и сочетая сложнейшие вычисления с более или менее
обоснованными догадками, можно определить расположение
повторяющихся атомов в кристалле и, следовательно, структуру
молекул, если только она не очень сложна. Однако молекулы белков
чрезвычайно сложны.
АЛЬФА-СПИРАЛЬ
И АНТИПАРАЛЛЕЛЬНЫЙ
СКЛАДЧАТЫЙ СЛОЙ
Несмотря на все трудности, Лайнус Полинг в 1951 году смог
высказать ряд верных предположений относительно внутренних
•структур белковой молекулы. Ему удалось это сделать после того,
как он с группой сотрудников в Калифорнийском технологическом
институте в течение 15 лет занимался рентгеноструктурным
анализом более простых молекул — аминокислот и пар аминокислот,
соединенных пептидной связью. Предложенные Полингом
структуры были основаны на взаимодействии между атомом кислорода
одной пептидной связи и аминным водородом другой.
Эта так называемая водородная связь очень слаба, значительно
слабее ионной или ковалентной связи. Однако Полинг рассчитал,
что некоторые структуры должны быть стабильными благодаря
множеству водородных связей, усиливающих друг друга. Одна
из таких структур была названа альфа-спиралью.
Вскоре с помощью рентгеноструктурного анализа было
показано, что молекула кератина (белка волос) закручена в альфа-
спираль, предсказанную Полингом. Как предположили Полинг
и работавший в Кембридже (Англия) Фрэнсис Крик, кератин
построен из белковых структур, напоминающих кабель: каждая цент-
)►=© нв(
Ряс. 107. Водородная связь может образоваться между водородом,
обладающим слабым положительным зарядом (например, атомом водорода,
соединенным с азотом), и атомом, обладающим слабым отрицательным зарядом
{например, атомом кислорода). Это относительно слабая связь: для того что-
■бы ее разорвать, достаточно затратить 1/10 энергии, необходимой для разрыва
обычной ковалентной связи.
ЧТО ТАКОЕ БЕЛКИ? 139
Рис. 108. Модель альфа-спирали, предложенная Лай-
нусом Полингом. Идущую по винтовой линии
полипептидную цепь удерживают на месте водородные связи,
обозначенные здесь пунктирными линиями. (Боковые
цепи аминокислот не показаны; они просто обозначены
кружками с буквой R.)
Рис. 109. Суперспираль составлена из
белковых молекул, закрученных в альфа-
спирали. Центральная альфа-спираль
окружена шестью другими спиральными
структурами, каждую из которых образуют
две альфа-спирали, обвивающие друг друга.
ральная альфа-спираль оплетена шестью тяжами, каждый из
которых образован двумя закрученными одна вокруг другой
альфа-спиралями. В конструкции жгутика — длинного «хвоста»,
с помощью которого многие микроорганизмы передвигаются в
воде, — использована спирализация еще более высокого порядка:
семь первичных тяжей скручены в кабель, а семь таких кабелей —
во вторичный кабель.
Полипептидные цепи глобулярных белков, например
ферментов, спирализованы лишь в отдельных участках. Так, в молекуле
фермента альфа-химотрипсина имеется только один спирализован-
ный участок на карбоксильном конце так называемой С-цепи
[см. рис. 89, где этот конец обозначен GOj(G)].
Водородные связи не только стабилизируют альфа-спираль.
Полинг предположил, что они также соединяют отдаленные части
одной и той же полипептидной цепи. Структура такого типа, в
которой цепи удерживаются одна возле другой, получила название
антипараллельного складчатого слоя. Долгое время подобные
структуры не пользовались достаточным вниманием со стороны
химиков-белковиков. Предполагалось, что они характерны лишь
для некоторых фибриллярных белков и не встречаются в более
интересных для биолога глобулярных белках. I |
Однако это оказалось ошибкой. Сейчас у ряда глобулярных
белков известен каждый изгиб, каждый поворот полипептидной
цепи, и в некоторых из них структуры типа антипараллельного
складчатого слоя занимают не меньшее место, чем альфа-спирали.
Структуры этих двух типов выполняют различные функции. Аль-
140 ГЛАВА 5
Рис. НО. Эти две белковые структуры, предсказанные, как и альфа-спираль,
Полингом, поддерживаются водородными связями между аминным
водородом и кислородом пептидной связи. Эти связи соединяют друг с другом
параллельные полипептидные цепи. Структура А получила название
антипараллельного складчатого слоя, а структура В — параллельного складчатого
слоя.
фа-спираль придает жесткость некоторым отрезкам цепи, тогда
как антипараллельный складчатый слой соединяет вместе ее
разные участки. Кроме того, были обнаружены такие модификации
параллельных и спиральных структур, о которых ранее не
подозревали; они тоже помогают поддерживать трехмерную
конфигурацию белковой молекулы.
Разработав схемы альфа-спирали и антипараллельного
складчатого слоя, Полинг сделал первый крупный шаг к раскрытию
тайн трехмерной структуры белков. Однако методы рентгенострук-
турного анализа, которые мог применять Полинг, были совершенно
непригодны для выяснения структуры глобулярных белков.
Нужно было разработать новые методы как в белковой химии, так
и в рентгеноструктурном анализе. Это сделали английские ученые
Макс Перутц и Джон Кендрью из Кембриджа, которые
расшифровали структуру гемоглобина и миоглобина.
СТРУКТУРА
ГЛОБУЛЯРНЫХ БЕЛКОВ
Впервые неясные контуры белковой молекулы начали
вырисовываться в 1957 году. Это был белок миоглобин, связывающий
резервный кислород в мышцах. Изучавший его исследователь —
Джон Кендрью — первым увидел, каким образом полипептидная
цепь изгибается, идет по прямой, затем поворачивает, изменив
ЧТО ТАКОЕ БЕЛКИ? 141
Q
Рис. 111. Джон Кендрыо
(род. в 1917 г.) —
английский рентгенокристалло-
граф, впервые
расшифровавший трехмерную
структуру белка миоглобина.
Этого успеха он достиг,
анализируя пятна,
возникающие на фотопластинке
после прохождения
рентгеновского луча через
кристалл миоглобина (см.
рис. 105). В результате
анализа многих десятков
тысяч пятен с
использованием быстродействующих
вычислительных машин
удалось построить
детальную модель молекулы
миоглобина, в которой было
указано положение почти
каждого^из ее 2600 атомов.
(С разрешения Medical Re*
search Council, Cambridge,
England.)
1 #1ИЬ w -*■
\m *,* Ж-
[:*:• Щ
*
§^Ш Iх
' Si
flj
W
яК ^
w5r-
^ •^l
#" ¥
f
..-■ ■ :г*:,: ' ■■
P^^^^^^^™
$|М
•
Ш
i
_.
m
Щ
Рис. 112. Макс Перутц
(род. в 1914 г.) — пионер в
области рентгеноструктур-
ного анализа белков,
завершивший в 1968 году
исследование пространственной
структуры гемоглобина. В
1962 году Перутц и]Кендрью
разделили Нобелевскую
премию по химии, которая
была присуждена им за
блестящие достижения,
открывшие путь к
детальному изучению механизмов
действия белковых
молекул. (С разрешения Medical
Research Council,
Cambridge, England.)
142 ГЛАВА 5
Рис. 113. Такие кристаллы
гемоглобина были
использованы для начала работы
по определению полной
структуры этого белка. (С
разрешения J. Kendrew.)
Рис. 114. Одна из первых
моделей молекулы
миоглобина. Видны изгибы
полипептидной цепи, но распо
ложение отдельных
аминокислот и другие детали
структуры еще не отражены.
Более темной окраской
выделена молекула тема,
в центре которой
находится атом железа. Молекула
кислорода представлена
здесь двумя шариками,
связанными с атомом
железа. (Темный блестящий
шарик — атом тяжелого
металла, химическим путем
введенный в молекулу
миоглобина. Включение такого
атома было необходимо для
расшифровки структуры
молекулы.) (С разрешения
J. Kendrew.)
направление, потом снова и снова поворачивает, в результате
образуя нечто вроде мячика. Поскольку метод Кендрью был еще
недостаточно точен, нельзя было различить, какие участки цепи
спирализованы; зато уже можно было видеть лежащую в этой
сложной структуре, как в люльке, небольшую молекулу гема —
группу, содержащую железо, к которой присоединяется кислород.
В 1961 году Кендрью уже знал положение почти каждого из
2600 атомов молекулы миоглобина. В 1968 году пионер рентгено-
кристаллографии белков Макс Перутц — после 30 лет работы! —
завершил расшифровку структуры гемоглобина. Его молекула
вчетверо больше молекулы миоглобина, и определить ее строение
было, естественно, во много раз труднее.
ЧТО ТАКОЕ БЕЛКИ? 14$
Рис. 115.
Детализированная модель молекулы
миоглобина. (С разрешения
J. Kendrew.)
Гемоглобин и миоглобин выполняют сходные функции —
связывают кислород. У них есть и химическое сходство: в структуру
обоих белков включены железосодержащие молекулы тема. Но
в то время как молекула миоглобина состоит из одной
полипептидной цепи, в гемоглобине таких цепей четыре; эти цепи попарно
одинаковы, но каждая пара несколько отлична от другой. Каждая из
цепей той и другой пары сходна по величине с целой молекулой
миоглобина, каждая содержит гем и каждая может связать одну
молекулу кислорода. Миоглобин и оба типа цепей гемоглобина
оказались очень близкими по аминокислотному составу и
пространственной структуре.
В 1964 году сэр Лоуренс Брэгг сказал: «Интересно было бы
знать, сколько пройдет времени, прежде чем в другой лаборатории
будет получена молекулярная модель белка с такими же деталями г
какие сейчас твердо установлены для миоглобина. Я думаю ... на
это потребуется от 5 до 10 лет...» Спустя всего лишь два годаг
в 1966 году, в лаборатории самого Брэгга была столь же детально
определена структура фермента лизоцима. Лизоцим содержится
в тканях, в слезах и яичном белке; он растворяет клетки многих
бактерий, гидролизуя одно из веществ, входящих в состав их
клеточной стенки.
Дальнейший прогресс был поразительно быстрым. Сейчас
полная последовательность аминокислот и изгибы аминокислотной
цепи известны для доброй дюжины белков. Это позволяет сделать
некоторые обобщения относительно структуры этих веществ.
Белки компактны. Белковые молекулы чрезвычайно
компактны. На помещенных здесь рисунках, иллюстрирующих структуру
этих молекул, показаны только изгибы их «скелета»— линии, по-
144 ГЛАВА 5
Рис. 116. Полипептидная цепь протеолитического фермента карбоксипеп-
тидазы. Каждый короткий прямой отрезок соответствует одной аминокислоте.
Активный центр фермента содержит атом цинка, который представлен здесь
в виде белого шарика. Дисульфидная связь изображена двумя черными
шариками. Эти стереоизображения получены, как сейчас нередко делается, с
помощью вычислительной машины. (I. A. Hartsuck, W. N. Lipscomb, in: The
Enzymes, v. 3, 3d ed., 1971, Academic, New York; с разрешения W. N.
Lipscomb.)
О том, как рассматривать эту фотографию, см. в подписи к рис. 66,
стр. 88.
которым расположены пептидные связи. Боковые группы,
отходящие от этого скелета в стороны, здесь не показаны. Если бы они
были изображены, то на рисунке ничего нельзя было бы разобрать,
так как все пространство оказалось бы заполненным. Как
выяснилось, белковая молекула — это почти сплошная масса без каких-
либо пустот. В большинстве случаев внутрь не могла бы
проникнуть даже молекула воды — она слишком велика для этого.
Белки «сухие» внутри. Второе обобщение, относящееся к
структуре белков, состоит в том, что внутренность белковой молекулы
водонерастворима, гидрофобна, поскольку там находятся только
гидрофобные аминокислоты. Каково значение такой структуры?
Извилистые полипептидные цепи удерживаются на своем месте
не теми сильными ионными взаимодействиями, которые могут
возникать между остатками гидрофильных аминокислот; вместо
этого трехмерную структуру белковой молекулы стабилизирует
тонкий механизм, включающий слабые силы двоякого рода.
С одной стороны, водородные связи между атомами кислорода
и азота более или менее отдаленных пептидных связей
поддерживают структуру альфа-спиралей и антипараллельных складчатых
слоев, предположенных Полингом (а также различные вариации
зтих структур). С другой стороны, положение полипептидной
ЧТО ТАКОЕ БЕЛКИ? 145
цепи фиксируют также очень слабые силы притяжения между
многочисленными остатками гидрофобных аминокислот. Это то
самое притяжение, которое поддерживает целостность капельки
масла. С такой капелькой и можно сравнить внутренность
молекулы глобулярного белка.
Гидрофобная сердцевина белковой] молекулы отталкивает
воду, омывающую белок снаружи, и таким образом остается «сухой»,
безводной. Это очень важно для функции некоторых белков. В
гемоглобине атом железа находится в состоянии, нужном для
связывания кислорода, благодаря тому, что он упрятан внутри
молекулы и защищен таким образом от воды. По крайней мере одному
ферменту — лизоциму — безводность внутренней части молекулы
необходима для сохранения каталитической активности.
Снаружи белки «мокрые». Мы сравнили молекулу белка с ка-
пелькой^масла. Однако масло не растворяется в воде, а белки
растворяются; Как это объяснить? Дело в том, что гидрофобное ядро
белковой молекулы окружено слоем гидрофильных аминокислот.
Это еще одно обобщение, которое можно сделать относительно
структуры белков: остатки водорастворимых аминокислот
расположены снаружи, на поверхности молекулы.
Теперь легко понять, почему денатурированный белок,
например белок вареного яйца, нерастворим в воде. Давно известно,
что денатурированный белок утрачивает присущую ему
трехмерную структуру и его цепь развертывается. При этом
многочисленные остатки гидрофобных аминокислот, спрятанные прежде
внутри молекулы, обнажаются и значительно уменьшают растворимость
белка.
Вероятно, перечисленные выше особенности — гидрофобность
внутренних частей молекулы, поддерживающая ее трехмерную
конфигурацию, и гидрофильность наружного слоя, делающая
белок] растворимым в воде,— свойственны всем глобулярным
белкам. Однако у каждого белка есть своя особая функция, и это
обусловливает некоторые вариации общего плана строения.
Например, внутри молекулы гемоглобина имеются два остатка
гидрофильных аминокислот. Они фиксируют молекулу тема,
содержащую железо. Такую же роль играют эти две аминокислоты в мио-
глобине. Один или два остатка гидрофильных аминокислот
обнаружены во внутренних частях молекул некоторых ферментов, где
они выполняют каталитические или структурные функции.
Некоторые белки «липнут» друг к другу. Роль поверхностных
аминокислот можно рассмотреть хотя бы на примере гемоглобина.
Некоторые из них способствуют его растворимости в воде, другие
же выполняют иную функцию. Дело в том, что гемоглобин состоит
из четырех цепей, каждая из которых свернута в шар, и эти четыре
цепи объединяются в общую структуру благодаря
взаимодействию их поверхностей. Одинаковые цепи связаны между собой
1 0 — /j 1 i
146 ГЛАВА 5
Рис. 117. Тонкие нити в мышечных фибриллах построены из цепей,
образуемых молекулами белка актина. А. Электронная микрофотография тонкой
нити. (Р. В. Moore et al., J. Mol. Biol., 50, 279, 1970.) Б. Модель структуры
тонкой нити; каждый шарик изображает молекулу актина. (Н. Е. Huxleyr
W. Brown, J. Mol. Biol., 30, 383 (1967); с разрешения Н. Е. Huxley.)
взаимодействием гидрофильных аминокислот, а разные —
взаимодействием гидрофобных аминокислот. Среди 100 известных сейчас
аномальных гемоглобинов есть несколько таких, у которых одна
из поверхностных гидрофильных аминокислот, способствующих
растворимости белка, заменена другой. Большинство таких замен
мало влияет на функцию гемоглобина. Напротив, замены
аминокислот, ответственных за соединение цепей, так же как и замены
«внутренних» аминокислот, влекут за собой чрезвычайно серьезные
последствия, вплоть до полной потери способности переносить
кислород.
Функция многих белков зависит от взаимодействия их
поверхностей. Гемоглобин — это только один из белков, состоящих из
ЧТО ТАКОЕ БЕЛКИ? 147
Рис. 118. Вирусы обладают оболочкой, которая представляет собой
относительно несложную структуру из белковых молекул. А. Электронная
микрофотография аденовируса, вызывающего инфекцию верхних дыхательных путей.
Б. Модель структуры белковой оболочки аденовируса. Оболочка построена
из 252 субъединиц, называемых капсомерами, которые представлены в
модели отдельными шариками. 240 капсомеров расположены на поверхностях
и гранях двадцатигранной вирусной частицы и состоят из шести белковых
молекул каждый; остальные 12 капсомеров, состоящие каждый из 5
белковых молекул, расположены в вершинах двадцатигранника. (С разрешевия
R. W. Home.)
субъединиц, т. е. определенным образом свернутых полипептидных
цепей, правильное соединение которых необходимо для
нормального функционирования белка. Многие ферменты, функция
которых особенно сложна, тоже состоят из нескольких субъединиц.
Взаимодействие поверхностей белковых молекул может
приводить к их ассоциации в большую, морфологически и
функционально единую систему. Например, тонкие нити в мышечных
фибриллах образованы двумя перекрученными цепями, состоящими из
молекул актина (рис. 117). Некоторые вирусы имеют оболочки
сферической или цилиндрической формы, которые построены из очень
точно соединенных друг с другом белковых молекул (рис. 118).
Ферменты могут объединяться в группы, образуя
многофункциональные комплексы. Благодаря поверхностному взаимодействию
они могут также прикрепляться к определенным клеточным
структурам, удерживающим их именно там, где они нужны. Примером
служат ферменты, участвующие в выработке АТФ, которые
связаны с мембраной митохондрий. Очевидно, что поверхностные
взаимодействия белков играют чрезвычайно важную роль, но
механизмы их пока очень мало изучены.
10 ♦
148 ГЛАВА 5
КАК ФЕРМЕНТЫ
КАТАЛИЗИРУЮТ
РЕАКЦИИ
Каким образом работают ферменты? Рассмотрим какую-нибудь
реакцию — пусть, например, перекись водорода разлагается на
воду и газообразный кислород. Если эту реакцию катализирует
фермент (скажем, каталаза), то он прежде всего соединяется со
своим субстратом (перекисью водорода), связывая его своим
активным центром. Как это происходит и как фермент
катализирует реакцию? Для того чтобы это понять, необходимо знать не только
структуру самого фермента, но и структуру комплекса фермента
с его субстратом.
Что представляет собой активный центр фермента? Как и
предполагали, складки полипептидной цепи образуют на поверхности
молекулы борозду или впадину, соответствующую по форме
субстрату. Изгибы цепи настолько, сложны, что в активном центре
могут оказаться рядом очень отдаленные друг от друга остатки
аминокислот. Например, в молекуле фермента рибонуклеазы в
активном центре находятся аминокислоты, занимающие в цепи 12-е
и 119-е места; в активном центре протеолитического фермента
химотрипсина сближены аминокислоты, стоящие по ходу цепи
в положениях 16, 57 и 195 (см. рис. 89).
Аминокислотные остатки могут играть в активном центре
различную роль. Одни выполняют каталитические функции; другие,
притягивая определенные участки молекулы субстрата, придают
ей надлежащее положение и удерживают на месте. В молекуле
гидролитического фермента лизоцима аминокислоты 62, 63 и 108
(считая по ходу цепи) играют важную роль в связывании субстрата,
а аминокислоты 35 и 52 катализируют гидролиз.
Форма активного центра может не совсем точно соответствовать
форме субстрата. В некоторых случаях активный центр
деформирует молекулу субстрата, изменяя ее пространственную
конфигурацию таким образом, что это облегчает протекание катализируемой
реакции. В то же время при связывании субстрата может
деформироваться и молекула самого фермента. Гемоглобин (который
не является ферментом, так как не катализирует никакой реакции,
но в некоторых отношениях ведет себя как фермент) тоже
претерпевает деформацию, когда первая молекула кислорода
присоединяется к одной из его четырех субъединиц. Это значительно
облегчает связывание остальных трех молекул кислорода, чем отчасти
и объясняется чувствительность гемоглобина к незначительным
изменениям концентрации 02.
В случае гидролитического фермента лизоцима деформация
белка позволяет по крайней мере частично понять механизм
катализа. Когда субстрат попадает в щель, где находится активный
ЧТО ТАКОЕ БЕЛКИ? 149
Рис. 119. Фермент лизоцим, содержащийся в яичном белке, слезах и других
биологических жидкостях, лизирует клетки многих бактерий: он вызывает
гидролиз одного из компонентов клеточной стенки.
А. Модель молекулы лизоцима. Активный центр расположен в щелеоб-
разном углублении, точно соответствующем полисахаридному субстрату.
В этой щели наряду с другими аминокислотами находятся три остатка
триптофана, стоящие в полипептидной цепи на 62-м, 63-м и 108-м местах. Эти
остатки связывают субстрат. Остатки глутаминовой и аспарагиновой кислот,
находящиеся в цепи на 35-м и 52-м местах, катализируют гидролиз
(карбоксильные группы этих аминокислот в модели значительно увеличены).
Б. Модель молекулы лизоцима, связавшей молекулу субстрата.
Углубление, в котором находится активный центр, вмещает шесть соединенных
друг с другом остатков сахара. В результате гидролиза разрывается связь,
соединяющая два таких остатка. (С разрешения D. С. Phillips).
О том, как рассматривать эти фотографии, см. в подписи к рис. 66,
стр. 88.
центр, молекула фермента слегка изменяет свою форму, смыкаясь
подобно пасти, схватившей молекулу субстрата. При этом два
остатка кислых аминокислот очень близко подходят к связи,
подлежащей гидролизу, и катализируют ее разрыв. Такого рода
ферментативный гидролиз — это как бы усовершенствованный
вариант обычного метода, которым часто пользуются химики, когда
они катализируют гидролиз кислотой (вспомните, например, кис-
150 ГЛАВА 5
Рис. 120. Активный центр карбоксипептидазы А (полная структура
молекулы показана на рис. 116). Этот протеолитический фермент гидролизует
последнюю пептидную связь в белке, отщепляя С-концевую аминокислоту.
А, Активный центр карбоксипептидазы включает атом цинка (Zn),
удерживаемый в структуре белка тремя аминокислотами — гистидином (Гис-69),
глутаминовой кислотой (Глу-72) и еще одним гистидином (Гис-196); с атомом
цинка связана не показанная здесь молекула воды. Один из атомов азота ар-
ЧТО ТАКОЕ БЕЛКИ? 151
лотный гидролиз инсулина, примененный Сэнгером). Однако химик
вынужден добавлять к своему раствору бесчисленное количество
молекул кислоты, чтобы сделать его достаточно кислым. Фермент
достигает того же самого, используя всего лишь два остатка
кислых аминокислот. Они делают свое дело даже в том случае, если
фермент находится в нейтральной жидкости, так как молекула
белка, в состав которой они входят, создает для них «сухое»
микроокружение.
Лизоцим, как и многие другие ферменты, обладает еще одним
преимуществом перед обычными химическими агентами —
необыкновенной избирательностью действия. В субстрате этого
фермента есть много связей, которые могут быть гидролизованы
и действительно гидролизуются в кислом растворе. Фермент же
разрывает только одну определенную связь. Вероятно, это
происходит потому, что при изменении формы фермента, захватившего
молекулу субстрата, два остатка кислых аминокислот приходят
во взаимодействие только с одной из многих гидролизуемых связей
субстрата,
НЕРЕШЕННЫЕ ВОПРОСЫ
Все ли субстраты деформируются, присоединяясь к активному
центру фермента? Все ли ферменты изменяют свою конфигурацию,
связывая субстрат? Пока еще рискованно делать обобщения, так
как изучено слишком мало ферментов и фермент-субстратных
комплексов. Если такие деформации — не исключение, а правило, то
это, возможно, позволит объяснить самую удивительную
особенность ферментов — их эффективность. Способность их ускорять
химические реакции поистине феноменальна. Энзимологи
надеются, что в ближайшее десятилетие им удастся проникнуть в тайну
гинина-145 соединен водородной связью с кислородом пептидной связи между
аминокислотами 155 и 156. Обратите внимание на положение кольца
тирозина (Тир-248). Вверху слева — субстрат карбоксипептидазы, в котором
изображены только две аминокислоты — глицин (Гли) и С-концевой тирозин
(Тир), соединенные пептидной связью (указана стрелкой).
Б. Субстрат сблизился с активным центром фермента, который может
теперь гидролизовать пептидную связь между глицином и тирозином
(указана стрелкой). Атом цинка соединяется с кислородом, участвующим в этой
пептидной связи (и замещающим теперь молекулу воды, которая была
связана с атомом цинка). Кольцо тирозина-248 повернулось таким образом, что
его гидроксильная группа соединилась водородной связью с азотом
пептидной связи. Именно эта гидроксильная группа и атом цинка служат
фактическими катализаторами реакции. Два атома азота ар гинина-145, обладающие
основными свойствами, связывают кислотную карбоксильную группу
остатка тирозина в субстрате. Таким образом, только С-концевая аминокислота
со свободной карбоксильной группой может быть связана активным
центром. (D. M. Blow, Т. A. Steitz, Ann. Rev. Biochem. (1970), 63; с разрешения
D. M. Blow.)
152 ГЛАВА 5
необычной мощи каталитического действия ферментов, хотя пока
еще неясно, какой путь приведет к цели.
Изучение структуры белков продолжается. Однако многие
белки из-за величины их молекулы или по другим причинам все еще
недоступны для современных методов рентгеноструктурного
анализа. Молекулярный вес антител, например, составляет около
160 000; тем не менее можно ожидать быстрого прогресса в
изучении этих интереснейших белков, так как недавно удалось
преодолеть другую серьезную трудность, стоявшую на пути их
изучения,— отсутствие гомогенных препаратов, в которых все
молекулы были бы одинаковы. Сейчас уже есть возможность получать
такие препараты; источником их служат культуры чистых линий
клеток, вырабатывающих антитела.
Не исключено, что сделанные выводы о трехмерной структуре
белков еще нельзя распространять на белки живого организма.
Ведь рентгеноструктурный анализ, на результатах которого
основаны эти выводы, может применяться только при изучении
кристаллических препаратов; в клетке же белки не образуют
кристаллов, они находятся там в растворенном состоянии. К счастью,
есть основания думать, что кристаллизация белка не приводит
к существенному изменению структуры его молекул. Многие
кристаллические ферменты выдержали в этом отношении решающую
проверку: оказалось, что они сохраняют способность
катализировать специфическую реакцию (хотя она протекает не так быстро,
как в присутствии растворенного фермента).
КАК СИНТЕЗИРУЮТСЯ
БЕЛКИ?
Клетки содержат тысячи разных белков, и каждый из них
уникален по чередованию аминокислот в цепи и по форме
молекулы. Как же синтезируются все эти белки?
Первый этап представить себе нетрудно: каждая аминокислота—
это конечный продукт ряда ферментативных реакций. Многие
из сотен ферментов, необходимых для синтеза двадцати
аминокислот, известны. Синтез любой аминокислоты ничем принципиально
не отличается от синтеза сахара, жира, пигмента или какой-
нибудь другой небольшой молекулы.
Конечный этап — складывание полипептидной |цепи в
трехмерную структуру активного белка — совершается самопроизвольно.
Этот процесс может происходить даже в пробирке. Белок можно
денатурировать с помощью высоких концентраций определенных
солей. Добавив другие вещества, можно разорвать дисульфидные
ЧТО ТАКОЕ БЕЛКИ? 153
Рис. 121. Молекулу белка, трехмерная
структура которой поддерживается частично ди-
сульфидными связями, можно заставить
«развернуться», воздействуя на нее
определенными веществами (мочевиной или меркап-
тоэтанолом). Дисульфидные связи и
первоначальная пространственная структура могут
самопроизвольно восстанавливаться.
связи, скрепляющие цепи друг с другом или образующие петли.
Если теперь все эти вещества осторожно удалить, соблюдая
необходимые условия, то развернувшиеся цепи опять свернутся в
трехмерную структуру и образуют дисульфидные связи. Такие связи
возникнут только в нужных местах, хотя в принципе возможны
и другие варианты. Укладка полипептидных цепей тоже
произойдет единственным «правильным» способом, несмотря на
бесчисленное множество иных возможностей. В результате будет точно
восстановлена исходная структура молекулы. Эта точность
выдерживает самую строгую проверку: фермент снова обладает
каталитической активностью. Такого рода опыты доказывают, что
структура' белка всецело зависит от последовательности аминокислот
в его молекуле.
Здесь-то мы и подходим к главной проблеме. Чем определяется
последовательность аминокислот в каждом из многих тысяч
существующих белков? Откуда клетка, синтезирующая белки, может
знать, что в полипептидной цепи данного белка на 294-м месте
должна находиться, например, аминокислота глицин, а за ней
должен следовать гистидин? Точное построение нужной
последовательности аминокислот — это и есть решающий момент в
биосинтезе белка.
Все клетки содержат информацию, необходимую для синтеза
их белков. Кроме того, очевидно, что при делении каждой клетки:
154 ГЛАВА 5
зта информация передается дочерним клеткам: они тоже «знают»,
как синтезировать свои белки. Передача информации должна быть
•очень точной. Люди, унаследовавшие серповидноклеточную
анемию, унаследовали информацию, в которую вкралась всего лишь
одна ошибка — в одной из цепей их гемоглобина глутаминовая
кислота, которой следовало бы стоять в положении 6, заменена
валином. Информация, необходимая для синтеза цитохрома с,
передавалась из поколения в поколение столь длительное время,
что теперь мы находим этот фермент в более или менее неизменном
виде у всех живых организмов. В процессе эволюции он сохранялся
в легко опознаваемой форме более миллиарда лет!
Как это стало возможным? Чем определяется чередование
аминокислот в белке и каким образом необходимая информация
передается при делении клеток? Открытия, позволившие ответить на
эти вопросы, создали основу для понимания химии жизни и
ознаменовали рождение новой области исследований — молекулярной
■биологии. Полученный ответ был конечным итогом целого
столетия упорной экспериментальной работы в области генетики,
науки о наследственности.
6 ЧТО ДЕЛАЮТ
ГЕНЫ?
Подобное рождает подобное. Прелестный темноволосый
ребенок, копия своей матери, вырастает высоким статным брюнетом.
Он может быть таким же умным и так же облысеть, как его отец,
может любить музыку и страдать сенной лихорадкой, как его мать,
и, как оба его родителя, смотреть на мир голубыми глазами.
Всякий знает, что потомки похожи на родителей — лишь немногие
наследуют деньги, но каждый наследует свой нос.
НАСЛЕДСТВЕННОСТЬ
И ГЕНЫ
Генетике, раскрывшей тайну наследования признаков, мы
обязаны одним из самых блестящих и важных достижений биологии.
На первый взгляд проявления наследственности кажутся крайне
запутанными, беспорядочными и случайными. У потомства мы
находим не просто мозаику материнских и отцовских черт,
собранных вместе. Какие-то черты и признаки исчезают, другие
появляются неизвестно откуда.
Разумеется, в действительности все наследуемые признаки от
кого-нибудь да переходят к потомку — если не от родителей, то
от бабушки с дедушкой, от прадеда или прабабки. Более того,
оказалось, что передача этих признаков от поколения к поколению
подчиняется простым правилам, составляющим основные законы
генетики. Как же удалось разобраться во всей видимой сложности
передачи наследуемых признаков? Это удалось сделать, изучая
(по крайней мере на первых порах) наследование избранных
единичных признаков — каждого в отдельности.
156 ГЛАВА 6
Рис. 122. Скрещивание
красноцветковой формы
львиного зева с белоцветко-
вой формой дает потомство
с розовыми цветками. При
самоопылении растений с
розовыми цветками или
скрещивании их между
собой большая часть
потомства имеет розовые
цветки, однако получаются
также растения с красными
и с белыми цветками. (По
Р. В. Weisz, The Science
of Biology, 3d ed., McGraw-
Hill, New York, 1967; с
разрешения Мс Graw-НШ.)
ПРОСТЕЙШИЙ ГЕНЕТИЧЕСКИЙ
ЭКСПЕРИМЕНТ
Простой, но весьма поучительный опыт можно поставить на
обычном садовом цветке — львином зеве. Если растение с
красными цветками опылить пыльцой от растения с белыми цветками,
т. е. скрестить эти две формы, то из полученных семян вырастет
львиный зев с розовыми цветками. Вряд ли это кого-нибудь удивит,
поскольку смесь красного и белого как раз и дает розовый цвет.
Но если теперь розовый львиный зев самоопылить или скрестить
с таким же растением с розовыми цветками, то у значительной
части потомства цветки будут, как и у родителей, розовыми, однако
появятся также растения с красными и с белыми цветками.
Красные и белые? Это может показаться очень странным. Ведь два
первоначальных цвета, казалось бы, уже смешались, как краски на
палитре, в результате чего и получился розовый цвет, а теперь
они опять разделились! С красками на палитре этого никогда не
бывает.
ГЕНЫ НЕ< СМЕШИВАЮТСЯ
Итак, признаки {окраска цветка), оказывается, могут
смешиваться — при скрещивании белоцветковой формы с
красноцветковой получилось потомство с розовыми цветками. Однако
генетические факторы, определяющие окраску цветка, не смеша лисьи не
слились — некоторые потомки растений с розовыми цветками
унаследовали чисто белую или чисто красную окраску цветка.
Наследование признаков определяют элементы, называемые генами. Гены
дискретны, т. е. не смешиваются и не сливаются. Это основа,
главный принцип генетики.
Красный Белый
i
Розовый
I
Розовый Розовый Красный Белый
ЧТО ДЕЛАЮТ ГЕНЫ? 157
ГЕНЫ ПРЕДСТАВЛЕНЫ
ПАРАМИ
Очевидно, что на развитие львиного зева с розовыми цветками
оказали влияние оба родителя. Это влияние проще всего
объяснить, предположив, что растение с розовыми цветками
унаследовало от одного из своих родителей ген красной окраски
(обозначим его Кр), а от другого — ген белой окраски (Б). Если у
смешанной формы окраску цветка определяют два гена, то надо
полагать, что у родителей и потомков таких растений окраска цветков
тоже определяется двумя генами. Гены образуют пары: Б Бу
Кр Кр или Кр Б.
Родительские
растения
Кр Кр
(с красными
цветками)
Б Б
(с белыми
цветками)
Гаметы
(мужские и
женские)
Опл одотворенные
женские гаметы
Потомство
Кр Б
(с розовыми
цветками)
Рис. 123. У растения с красными цветками имеются два гена, определяющих
красную окраску цветка, Кр Кр, а у растения с белыми цветками два гена
белой окраски — Б Б. Каждый потомок от скрещивания этих растений
получает по одному гену от каждого родителя и, следовательно, имеет один ген
Кр и один ген Б, что приводит к розовой окраске цветков. (По Р. В. Weisz,
The Science of Biology, 3d ed., McGraw-Hill, New York, 1967; с разрешения
McGraw-Hill.)
158 ГЛАВА 6
Родительские растения
Гаметы (мужские
и женские)
Оплодотворенные женские ш „„ „
гаметы \ пР *Р
Кр Б
(с розовыми цветками)
Потомство
(с красными
цветками)
Кр Б
(с розовыми
цветками)
Кр Б
(с розовыми
цветками)
Б Б
(с белыми
цветками)
Рис. 124. Растение с розовыми цветками содержит два гена, определяющих
окраску цветка: один Кр и один Б. Поэтому половина его гамет (как мужских,
так и женских) несет ген Кр, а другая половина — ген Б, При самоопылении
этих растений или скрещивании их между собой половина женских гамет
типа Кр будет оплодотворена мужскими гаметами Кр и половина — гаметами
Б. Так же будет обстоять дело и с женскими гаметами Б. Поэтому в
полученном потомстве численное соотношение растений Кр Кр, Кр Б и Б Б (т. е.
соответственно с красными, с розовыми и с белыми цветками) будет 1 : 2 : 1. (По
Р. В. Weisz, The Science of Biology, 3d ed., McGraw-Hill, New York, 1967;
с разрешения McGraw-Hill.)
Белоцветковое растение с генами Б Б обязательно передаст
своему потомству ген Б, а красноцветковое растение с генами Кр Кр
передаст ген Кр. В результате скрещивания таких растений
получатся семена, содержащие один ген Кр и один ген Б. Из этих семян
вырастут растения с розовыми цветками. От каждого родителя
наследуется по одному гену из каждой пары.
Если гены действительно представлены парами, а передаются
от каждого родителя по одному, то каково должно быть потомство
от скрещивания двух растений с розовыми цветками (или от само-
ЧТО ДЕЛАЮТ ГЕНЫ? 159»
опыления такого растения)? У львинЬ^о зева с розовыми цветками
половина гамет (половых клеток), как мужских, так и женских,
будет содержать ген Кр, а другая половина — ген Б. Женская
гамета Кр, оплодотворенная мужской гаметой Кр, даст семя с
генами Кр Кр, из которого разовьется растение с красными цветками.
Если же она будет оплодотворена мужской гаметой Б, получится
семя с генами Кр Б и, значит, растение с розовыми цветками.
Женская гамета Б, оплодотворенная мужской гаметой Кр, тоже
даст растение Кр Б, т. е. с розовыми цветками. И наконец,
оплодотворение ее мужской гаметой Б даст семя Б Б ж растение с
белыми цветками. Таким образом, четвертая часть всего потомства
получит гены Кр Кр, половина — гены Кр Б и еще одна
четверть — гены Б Б: у четверти потомства цветки будут красные,
у половины — розовые и у четверти — белые.
Итак, четверть, половина и четверть, т. е. 1:2:1. Можно
предсказать, что таково будет численное соотношение разных форм
в потомстве гибридов — растений, которые происходят от
различающихся между собой родителей (розовоцветковые растения
являются гибридами, так как это потомки от скрещивания растенинг
с красными и с белыми цветками). Соотношение 1:2:1 вытекает
из гипотезы, согласно которой у растения имеется по два гена для
каждого признака, и тот или другой из этих генов с одинаковое
вероятностью может быть передан любому из потомков. Поскольку
эта гипотеза позволяет сделать столь точное предсказание, ее
можно проверить. И действительно, гипотеза эта была высказана-
и экспериментально проверена основателем генетики Грегорою
Менделем 100 лет назад.
МЕНДЕЛЬ И ЗАКОНЫ
НАСЛЕДСТВЕННОСТИ
Трегор Мендель (1822—1884) на протяжении восьми лет
экспериментировал с разными сортами гороха, росшими в саду
австрийского монастыря, где он был монахом. В 1866 году он опубликовал'
результаты своих опытов и выводы, признанные теперь
основными законами наследственности.
Работа Менделя представляет собой блестящий образец
научного метода. Мендель ясно представил себе существо проблемы^
нашел путь к ее разрешению; поставил соответствующий
эксперимент, скрупулезно учитывая возможные источники ошибок;
интерпретируя полученные результаты, сделал все логически
вытекающие из них выводы; и наконец, провел специальные опыты
для проверки своей гипотезы.
160 ГЛАВА 6
Рис. 125. Грегор Мендель
<1822—1884) —
основоположник научной генетики.
Мендель установил, что
передача наследственных
признаков потомству
определяется независимыми и
яесмешивающимися
факторами, которые позже
получили название генов. (G
разрешения Radio Times Hul-
ton Picture Library.)
ПЛАН ЭКСПЕРИМЕНТА
Мендель очень четко сформулировал проблему, определив тем
самым и экспериментальный подход к ее решению. Он хотел найти
-«общеприменимый закон, управляющий формированием и
развитием гибридов» г. Он прекрасно понимал все значение такого
закона, который явился бы «решением вопроса, имеющего
немаловажное значение в связи с историей развития органических форм».
Какие средства для решения этой проблемы нашел Мендель?
ч<Кто пересмотрит работы в этой области, тот убедится, что среди
многочисленных опытов ни один не был произведен в том объеме
и таким образом, чтобы можно было определить число различных
форм, в которых появляются потомки гибридов, с достоверностью
распределить эти формы по отдельным поколениям и установить
их взаимные численные отношения».
1 Работа Менделя, которую мы цитируем в этом и следующих разделах,
•была опубликована в трудах Брюннского общества естествоиспытателей
в 1865 году.
ЧТО ДЕЛАЮТ ГЕНЫ? 161
Такова была тройственная основа менделевской работы, три
условия, необходимость выполнения которых впервые осознал
Мендель: нужно выявить все возможные формы в потомстве
гибридных растений, расклассифицировать их по поколениям и,
наконец, сосчитать их. Какая гениальная интуиция, какая
проницательность нужна была, чтобы прийти к мысли о подсчете!
Какого рода растения нужны были для опытов? «Выбор
растительной группы, которая будет служить для опытов подобного
рода, должен быть сделан с наивозможной осторожностью, если
мы не хотим подвергнуть риску самый успех опыта». Главная
опасность заключалась в том, что «искажения результатов из-за
опыления чужой пыльцой... могли бы привести к совершенно ошибочным
представлениям». Мендель выбрал различные сорта гороха —
потому, что они отвечали его требованиям, включая и самое
главное: цветы гороха обычно самоопыляются, но могут быть опылены
и искусственно.
Какие признаки следовало изучать? «Часть приведенных
признаков не допускает... точного и резкого разграничения, и
различие основывается на трудно подчас определяемом «более или
менее». Подобные признаки были непригодны для отдельных
опытов, и последние ограничивались только сопоставлением
особенностей, выступавших у растений ясно и определенно». Высокие
растения должны быть очень высокими, а низкие — очень низкими,
чтобы можно было их безошибочно различить и сосчитать.
Начав с 34 разновидностей гороха, Мендель выбрал для
изучения семь признаков. «По каждому из перечисленных выше семи
признаков гибрид настолько сходен с одной из родительских форм,
что признак другого родителя либо совсем ускользает от
наблюдения, либо не может быть выявлен с достоверностью... В дальнейшем
изложении те признаки, которые передаются при гибридизации
неизмененными или почти неизмененными и поэтому сами
составляют характерную черту гибрида, будут обозначаться как
доминантные, а те, которые становятся при гибридизации
латентными, — как рецессивные». Например, высокий стебель доминирует
над низким; все гибридные растения — высокие.
Почему Мендель выбрал признаки, по которым гибриды в
основном идентичны одной из родительских форм — доминантному
родителю (случай довольно частый), а не те, по которым гибриды
занимают промежуточное положение между обоими родителями
(как, например, розовая окраска цветка в примере с львиным
зевом)? Такой выбор создавал некоторые трудности: для того чтобы
отличить гибридные формы, в потомстве которых часть особей
имела рецессивный признак, от чистых доминантных форм, у которых
все потомство обладало доминантным признаком, нужно было
разводить растения лишний год (например, и гибридные, и чистые
доминантные формы имели высокий стебель, и только в потомстве
11-0414
162 ГЛАВА 6
Родительское
поколение
ТТ
ss
Гибридное поколение
Ts
Потомство
гибридов,
1-е поколение
ТТ
Ts
TS
ss
Потомство
гибридов,
2-е поколение
Все высокие Высокие:низкие
Высокиеяизкие 3-1 Всенизкш
.1:1
Рис. 126. Наследование признака, определяемого двумя генами. При
скрещивании высокого растения, имеющего два доминантных гена Т 7\ с низким
растением, имеющим два рецессивных гена ss, получаются высокие гибриды Ts.
В потомстве этих гибридов численное отношение высоких растений к низким
равно 3 : 1. В этом поколении из каждых трех высоких растений только одно
представляет собой «чистую» высокую форму (ТТ)\ два других — гибриды,
так как четверть их потомков — низкие растения. Таким образом, в потомстве
гибридов всегда получаются чистые высокие {ТТ), гибридные высокие (Ts)
и чистые низкие (ss) растения в предсказанном соотношении 1 : 2 : 1.
гибридных форм появлялись низкие растения). Однако
доминантность обладала и существенным преимуществом: Менделю не
приходилось отличать крайние формы от промежуточного типа,
что может быть затруднительным.
ЧТО ДЕЛАЮТ ГЕНЫ? 163
РЕЗУЛЬТАТЫ И ВЫВОДЫ
Первый этап эксперимента заключался в том, чтобы скрестить
различающиеся по данному признаку растения и получить
гибриды. После этого Мендель мог получить (с помощью самоопыления)
и исследовать второе поколение гибридов. Что же он обнаружил?
«В этом поколении наряду с доминирующими признаками вновь
появляются также рецессивные со всеми их особенностями и
притом в ясно выраженном среднем отношении 3:1, так что из
каждых четырех растений этого поколения три получают
доминантный признак и одно — рецессивный».
Совпадает ли это с тем, чего можно было ожидать, если потомок
действительно получает по одному гену для каждого признака
от каждого родителя? Посмотрим, что Мендель говорит дальше.
«Доминантный признак может иметь здесь двоякое значение,
именно: исходного признака или гибридного признака. В котором
из двух значений встречается он в каждом отдельном случае,
можно выяснить только по следующему поколению. Если это родо-
начальный признак, он должен передаваться всем потомкам без
изменения; если же это гибридный признак, то он должен вести
себя так же, как и в первом поколении».
Мендель провел соответствующие опыты и нашел, что «те
формы, которые получают в первом поколении рецессивный признак,
во втором поколении уже больше не варьируют в отношении этого
признака; они остаются в своих потомках константными».
Растения с коротким стеблем всегда давали потомство с таким же
коротким стеблем.
«Иначе обстоит дело с теми формами, которые в первом
поколении обладают доминирующим признаком. Из них две доли дают
потомков, среди которых доминирующий и рецессивный признаки
распределяются в отношении 3 : 1, т. е. они ведут себя совершенно
так же, как гибридные формы; только одна доля с доминирующим
признаком остается константной». Так Мендель показал, что во
втором поколении гибридов, в котором три четверти растений
проявляют доминантный признак, одну четверть составляют чис-
Рис. 127. В печатке кукурузы каждое зерно — это зародышевая стадия
одного потомка. Отношение числа темно-красных зерен к числу желтых зерен,
равное в данном случае 3:1, наглядно иллюстрирует простейший случай
менделевского наследования признаков. (С разрешения «Turtox Collection»,
ССМ General Biological, Inc.)
11*
164 ГЛАВА 6
■\ШтЫ:-ЖЩ:г!':::■:.'.;..■ ::;:■::.•,>:?-;-...-:->:•;'-. ,::;, Ж::.
Рис. 128. Как видно на этой фотографии двух детских рук, указательный
палец может быть или длиннее, или короче безымянного. Длинный
указательный палец — доминантный признак у мужчин и рецессивный у женщин.
тые доминантные формы, половину — гибриды и еще одну
четверть — чистые рецессивы (1:2:1). Такое отношение было
получено в опытах со всеми семью исследованными признаками, что
говорило о его фундаментальном значении.
А что происходило, если родительские растения были
гибридными более чем по одному признаку? Мендель обнаружил, что
в этом случае возможные для каждого признака результаты
встречались во всех возможных комбинациях. Если, например,
родительские растения были гибридными по высоте стебля и окраске
цветков (пурпурные X белые), то потомство от их самоопыления
распадалось на четыре группы: высокие растения с пурпурными
цветками, низкие с пурпурными цветками, высокие с белыми
цветками и низкие с белыми цветками.
«Так как одним и тем же растением и даже в одном и том же
цветке этого последнего производятся различные константные
формы, то логично будет признать, что в завязях гибридов
образуется столько различных зачатковых клеток (зародышевых
пузырьков) и в пыльниках столько различных пыльцевых клеток,
сколько возможно константных комбинаций 1... Действительно,
теоретическим путем можно показать, что этого предположения
совершенно достаточно, чтобы объяснить развитие гибридов
в отдельных поколениях, если в то же время допустить, что
различные виды зачатковых и пыльцевых клеток у гибридов
образуются в среднем в одинаковом числе».
Мендель провел много опытов. Математический анализ
полученных результатов показал, что 1) передачу признаков
осуществляют пары дискретных несмешивающихся элементов, теперь назы-
Т. е. сколько возможно комбинаций генов.— Прим. Э. Роллер.
ЧТО ДЕЛАЮТ ГЕНЫ? 165
Наследование некоторых
признаков у человека
Таблица 2
Особенности
глаз
Нос
Уши
Другие черты
лица
Волосы
Пальцы рук
Пальцы ног
Руки
Прочее
Доминантный признак
Карие, светло-карие или зеленые
Астигматизм и дальнозоркость
Норма
Норма
Длинные ресницы
Предрасположение к катаракте
Нос с горбинкой
Узкая переносица
Кончик смотрит прямо
Широкие ноздри
Свободная мочка
Полные губы
Норма^
Ямочка на подбородке
Ямочки на щеках
Выдающиеся скулы
Веснушки
Темные
Не рыжие
Курчавые
Волнистые
Облысение (у мужчин)
Норма
Белая прядь
Преждевременное поседение
Обильная волосатость тела
Широкие пушистые брови
Указательный палец длиннее
безымянного (у мужчин)
Второй палец длиннее большого
Повышенная подвижность
большого пальца
Праворукость
Темная кожа
Предрасположение к кариесу
зубов
Низкий рост
Группы крови А, В и АВ
Рецессивный признак
Серые или голубые
Норма
Близорукость (есть
более редкая
доминантная форма)
Дальтонизм (признак,
сцепленный с полом)
Короткие ресницы
Норма
Прямая или вогнутая
переносица
Широкая переносица
Курносый нос
Узкие ноздри
Приросшая мочка
Тонкие губы
Скошенный подбородок
Гладкий подбородок
Гладкие щеки
Норма
Отсутствие веснушек
Светлые
Рыжие
Волнистые
Прямые
Норма
Облысение (у женщин)
Норма
Норма
Мало волос на теле
Норма
Указательный палец
длиннее безымянного
(у женщин)
Второй палец короче
большого
Норма
Леворукость
Светлая кожа
Норма
Высокий рост
Группа крови О
166 ГЛАВА 6
Продолжение табл. 2
Доминантный признак
Предрасположение к варикозному
расширению вен
Норма
Норма
Норма
Норма
Норма
Норма
Рецессивный признак
Норма
Фенилкетонурия
Предрасположение к
шизофрении
Врожденная глухота
Предрасположение к
сахарному диабету
Гемофилия (признак,
сцепленный с полом)
Альбинизм
Примечание. На степень проявления генов часто влияют условия среды, а также
другие гены. Кроме того, эффект некоторых генов может неодинаково проявляться на
двух сторонах тела у одного и того же человека (например, ямочка может быть только
на одной щеке),
ваемых генами; 2) оба родителя вносят в целом одинаковый вклад
в наследственную конституцию потомка; 3) каждая женская и
каждая мужская гамета с равной вероятностью получает тот или
другой ген из каждой пары; 4) гены, определяющие различные признаки,
могут перегруппировываться, создавая все возможные комбинации.
Это основные законы, управляющие наследственностью.
Современники Менделя не поняли его математической логики
и не смогли оценить важность сделанных им выводов. Его работа,
хотя она имелась во всех крупнейших библиотеках мира,
пролежала в забвении*35 лет. В 1900 году три ботаника получили те же
результаты, что и Мендель. Изучая более ранние работы, они вновь
открыли его статью. Слава пришла к Менделю через 16 лет после
его смерти.
ХРОМОСОМЫ, ГЕНЫ
И НАСЛЕДСТВЕННОСТЬ
В конце XIX столетия в ядрах клеток были открыты мелкие
сильно окрашивающиеся образования. Они были названы
хромосомами, что значит «цветные тельца». Когда появились более
сильные микроскопы, удалось рассмотреть, что хромосомы имеют
форму палочек разной длины, иногда согнутых; оказалось также, что
Митоз
Удвоение
хромосом
Метафаза /\РГ\
митоза ( Ш \
/ \
Дочерние
клетки
ЧТО ДЕЛАЮТ ГЕНЫ? 167
Me и оз
2-я метафаза/
мейоза
Гаметы
(яйцеклетки\
илиспермии)
0)0)0)0)
Рис. 129. Сравнение митоза и мейоза. На этой схеме показана судьба одной
пары хромосом. В результате митоза дочерние клетки получают тот же набор
хромосом, который был у родительских клеток. Так происходит
распределение хромосом во всех обычных (соматических) клетках. В результате мейоза
образуются гаметы, содержащие но одной хромосоме из каждой пары.
Поэтому для восстановления обычного набора хромосом необходимо слияние
двух гамет. Различие между митозом и мейозом определяется расположением
хромосом в метафазе.
во время деления клетки в клеточном ядре разыгрываются
необычайные события, в которых хромосомы играют главную роль.
Перед делением клетки хромосомы, ранее нитевидные и
рассеянные по клеточному ядру, начинают уплотняться и
приобретают характерную форму палочек. Каждая хромосома
расщепляется вдоль надвое. Затем в клетке появляется сложная система
тяжей, которые отделяют половинки хромосом друг от друга
и растаскивают их к противоположным сторонам клетки. Этот
удивительный механизм обеспечивает полную идентичность
материнской и дочерних клеток в отношении набора хромосом, тогда как
цитоплазма просто делится на две приблизительно равные
части.
Половые клетки — яйца и спермин — образуются в результате
необычных клеточных делений, второе из которых происходит без
разделения хромосом. Поэтому половые клетки получают только
168 ГЛАВА 6
Рис. 130. «Митозом» называют деление ядра, предшествующее разделению
клетки. Митоз характеризуется удвоением хромосом, за которым следует
точное распределение идентичных сестринских хромосом между двумя
дочерними клетками; таким образом, каждая из этих клеток получает набор
хромосом, идентичный набору материнской клетки. На этих микрофотографиях
показаны стадии митоза оплодотворенной яйцеклетки червя Ascaris megalocepha-
la, у которого всего лишь две пары хромосом.
Л. Профаза. В ядре спермия и в ядре яйцеклетки хромосомы уже
удвоились и начинают уплотняться; ядерная мембрана исчезает.
Б. Поздняя профаза. Хромосомы уплотнились и стали видимы; в
действительности каждая из видимых хромосом представляет собой пару
идентичных сестринских хромосом, лежащих параллельно друг другу.
В. Метафаза. Хромосомы расположились в одной плоскости.
Образуемую ими фигуру, которая делит клетку на две половины, обычно называют
экваториальной пластинкой.
Г. Экваториальная пластинка: вид сбоку. По обе стороны от нее можно
различить центриоли. Центриоль с расходящимися от нее во все стороны
нитями называют звездой, а совокупность нитей, протянувшихся между двумя
центриолями через экваториальную пластинку,— веретеном.
Д. Ранняя анафаза. Нити веретена прикрепились ко всем дочерним
хромосомам и тянут каждые две сестринские хромосомы в противоположные
стороны.
Е. Поздняя анафаза. Хромосомы полностью разделились на два
идентичных комплекса.
Ж. Ранняя телофаза. Хромосомы разошлись к противоположным
полюсам клетки (концы каждой хромосомы пассивно тянутся за тем участком, где
прикреплена нить веретена); начинается деление цитоплазмы.
3. Поздняя телофаза. Образуются два новых ядра; начинается деспира-
лизация хромосом.
И. Две дочерние клетки уже разделены плазматической мембраной;
образуется ядерная мембрана; хромосомы удлиняются, истончаются и
становятся неразличимыми.
(С разрешения Carolina Biological Supply Company.)
ЧТО ДЕЛАЮТ ГЕНЫ? 169
Рис. 131. Микрофотография метафазной хромосомы, сделанная с помощью
сканирующего электронного микроскопа. Две сестринские хромосомы
соединены в том месте, где к ним прикрепляются нити веретена, которые тянут их
в разные стороны. (W. Schcid, H. Traut, Mut. Res., 11, 253 (1971); с
разрешения авторов.)
половину того числа хромосом, которое содержится в остальных
клетках тела, например в клетках печени, селезенки или мозга.
В обычных клетках хромосомы представлены парами: имеются
по две хромосомы каждого типа; половые же клетки содержат
только по одной хромосоме из каждой такой пары. При оплодотворении
яйцеклетки спермием их ядра сливаются и в результате
восстанавливается двойное число хромосом. Половина хромосом в
оплодотворенном яйце, а значит, и во всех клетках организма,
развившегося из этого яйца, происходит от матери и половина — от
отца.
Все это, так же как и то, что для каждого вида характерны
свое число и своя форма хромосом, было уже известно в начале
нашего века, однако смысл этих фактов еще не был понят.
170 ГЛАВА 6
Рис. 132. Фигуры митоза в делящихся растительных клетках. (С разрешения
Carolina Biological Supply Company.)
ГЕНЫ НАХОДЯТСЯ
В ХРОМОСОМАХ
В 1900 году работа Менделя была вновь открыта и получила
широкое признание. В 1902 году Уильям Сэттон (1876—1916),
в то время аспирант Колумбийского университета, сопоставил
менделевские законы наследственности с поведением хромосом.
Подобно генам, хромосомы парны: каждая клетка содержит два
их набора — один отцовского, другой материнского
происхождения. Мендель предполагал, что половые клетки содержат только
по одному из двух генов, определяющих каждый признак; и в
самом деле, в каждой половой клетке имеется лишь по одному набору
хромосом, т. е. по одной хромосоме из каждой пары. Мендель
нашел, что каждый признак наследуется независимо от других;
Сэттон обратил внимание на то, что половая клетка получает ту
ЧТО ДЕЛАЮТ ГЕНЫ? 171
или иную хромосомуиз каждой пары совершенно независимо,
случайным образом.
Таким образом, Сэттон усмотрел параллелизм между
наследованием генов и хромосом и сформулировал «хромосомную теорию»:
факторы, определяющие наследственность, т. е. гены, находятся
в хромосомах.
Чтобы с полной несомненностью доказать, что хромосомы
действительно являются носителями генов, потребовались многие
годы. Первые данные, подтверждавшие эту теорию, были вскоре
получены. Сэттон задался вопросом: может быть, гены и
хромосомы — это одно и то же? Нет, заключил он, хромосомы не могут
быть генами, так как в клетке их сравнительно мало, а генов,
несомненно, должно быть великое множество. Каждая хромосома
должна нести в себе много генов. Исходя из этого Сэттон высказал
предположение, что гены, заключенные в одной хромосоме, будут
наследоваться вместе. Два года спустя была открыта пара
сцепленных генов, т. е. генов, склонных передаваться совместно. Если
скрестить две разновидности душистого горошка, одну с красными
цветками и округлой формой пыльцевых зерен, а другую с
пурпурными цветками и продолговатыми пыльцевыми зернами, то в
потомстве гибридов почти все растения будут сходны с той или другой
из первоначальных родительских форм. Гены, определяющие
окраску цветка и форму пыльцевых зерен, сцеплены, т. е.
наследуются совместно; поэтому можно думать, что они находятся в
одной и той же хромосоме.
НАСЛЕДОВАНИЕ, СЦЕПЛЕННОЕ
С ПОЛОМ
В 1909 году эмбриолог Томас Хант Морган (1866—1945), в то
время сомневавшийся в существовании генов, начал заниматься
генетикой. Он вместе со своими сотрудниками и студентами не
только доказал, что наследственность обусловлена генами, но и
установил местоположение отдельных генов в соответствующих
хромосомах; эти работы окончательно подтвердили, что правила
наследования генов определяются правилами наследования
хромосом.
Объектом своих исследований Морган избрал широко
распространенное насекомое — плодовую мушку Drosophila melanogaster.
Оэычно эти мушки толкутся вокруг испорченных фруктов. От
растений, дающих, как правило, одно поколение в |год, плодовые
мушки отличались очень выгодным для Моргана свойством: они
давали новое поколение каждые две недели. Однако был у них
и свой минус. Различные полезные сорта многих растений были
давно выведены, и их семена можно было купить (Мендель,
например, просто покупал семена нужных ему разновидностей гороха
172 ГЛАВА 6
Рис. 133. Томас Хант Морган
(1866-1945). В 1933 году ему
была присуждена Нобелевская
премия по медицине и
физиологии за выяснение механизма
хромосомной наследственности.
(С разрешения California Institute
of Technology.)
в семенной лавке). Морган был первым человеком, которому
понадобились разновидности плодовой мушки. Он начал сам
разводить мух и в поисках различных вариантов исследовал их
тысячами. Почти через год его труд был, наконец, вознагражден. Среди
своих красноглазых мушек он обнаружил одного самца с белыми
глазами.
Откуда мог появиться этот белоглазый самец среди морганов-
ских чистопородных красноглазых мух? Подобные происшествия
связаны с возникновением мутаций — белоглазая муха была
мутантом. Мутациями называются изменения, которые, раз
возникнув, передаются затем из поколения в поколение. Это
наследственная изменчивость, обусловленная необратимой
перестройкой генов. Мутации появляются очень редко, но имеют
огромное значение, и не только для генетических исследований. Они
поставляют материал для дарвиновского естественного
отбора.
Что же сделал Морган со своим белоглазым самцом? Следуя
примеру Менделя, он скрестил его с обычной красноглазой
самкой. Все потомство оказалось красноглазым: красный цвет глаз
был доминантным признаком. Затем гибридов скрещивали друг
с другом. В соответствии с простой менделевской схемой четверть
потомства должна была быть белоглазой, генетически чистой
рецессивной, половина — красноглазой, генетически гибридной и еще
одна четверть — красноглазой, генетически чисто доминантной.
ЧТО ДЕЛАЮТ ГЕНЫ? 173
Но вместо этого Морган обнаружил, что у всех самок глаза были
красные, тогда как половина самцов имела красные глаза, а
половина — белые. Цвет глаз был сцеплен с полом.
НАСЛЕДОВАНИЕ,
СЦЕПЛЕННОЕ С ПОЛОМ,
И ПОЛОВЫЕ ХРОМОСОМЫ
У самок плодовой мушки четыре пары хромосом: пара очень
коротких, две пары длинных V-образных и пара длинных прямых,
называемых Х-хромосомами. У самцов три из четырех пар
совершенно такие же, как у самок, но у них только одна длинная и
прямая Х-хромосома. Ее партнер — так называемая Y-хромосома —
имеет на конце крючок (рис. 134). Таким образом, самка имеет
хромосомную конституцию XX, а самец — XY.
Очевидно, что сцепленное с полом наследование окраски глаз
как-то связано с этим различием в хромосомных наборах. Но как
именно? Оказывается, эта связь обусловлена тем, что мужская Y-
хромосома не содержит почти никаких генов. Встречаются мухи,
у которых только одна Х-хромосома, а Y-хромосомы нет. Такие
особи стерильны, потому что Y-хромосома нужна для образования
Самец (6) Самка (?)
Рис. 134. Самец и самка плодовой мушки и их хромосомы.
174 ГЛАВА 6
Ш"
•^.;-
Белоглазый Красноглазая
самец самка
Все мухи красноглазые
Белоглазые
самцы
25%
Красноглазые Красноглазые
самцы самки
25%
50%
Рис. 135. Наследование рецессивного признака, сцепленного с полом
(белый цвет глаз). (По Т. Моргану.)
спермы, но во всем остальном это совершенно нормальные самцы*
Мухи с набором XXY представляют собой нормальных плодовитых
самок, и это еще раз подтверждает, что влияние Y-хромосомы
незначительно.
Ген окраски глаз лежит в Х-хромосоме. У него нет дубликата
в Y-хромосоме. Так как самки имеют по две Х-хромосомы, то
и генов окраски глаз у них по два. Самки, у которых оба гена
обусловливают красный цвет глаз, а также гибридные самки будут
красноглазыми. Если же оба гена обусловливают белый цвет,
самка будет белоглазой. Но у самцов только одна Х-хромосома и
поэтому только один ген окраски глаз. Если это будет «красный»
ген, то и глаза у самца будут красными, а если «белый», то и глаза
будут белыми. Очевидно, что эту единственную Х-хромосому,
ЧТО ДЕЛАЮТ ГЕНЫ? 175
Рис. 136. Механизм определения пола у плодовой мушки. Особи,
получившие одну Х- и одну Y-хромосому, становятся самцами, а получившие две X-
хромосомы — самками.
а с ней и единственный ген окраски глаз самец наследует от своей
матери.
Почему Морган во втором поколении потомства своего
белоглазого самца нашел только красноглазых самок, тогда как
половина самцов была с красными, а половина с белыми глазами? Мор-
гановский исходный мутант с геном белой окраски глаз в своей
единственной Х-хромосоме был скрещен с самкой, имевшей
«красные» гены в обеих Х-хромосомах. Самки в полученном потомстве
были гибридны: от отца-мутанта они унаследовали Х-хромосому
с геном белой окраски глаз, а от матери — Х-хромосому с геном
красной окраски. Самцы же, унаследовавшие свою единственную
Х-хромосому и единственный содержащийся в ней ген красно-
глазости от матери, были обычными красноглазыми самцами.
Затем Морган скрестил этих самцов, которых он ошибочно
считал гибридными, с их действительно гибридными сестрами. В
полученном потомстве все самки имели отцовскую Х-хромосому с
геном красноглазости и поэтому все были с красными глазами
(конечно, половина этих самок, получившая свою вторую
Х-хромосому от гибридных матерей с геном белоглазости, генетически была
гибридной). Среди самцов этого поколения половина унаследовала
176 ГЛАВА 6
сГ с* 9 9
Белоглазый Красноглазый Красноглазая Красноглазая
самец самец самка самка
Рис. 137. Наследование рецессивного гена, сцепленного с полом (ген белых
глаз, который на схеме обозначен буквой W; R — ген красной окраски глаз).
Во втором поколении все самки будут красноглазыми (хотя половина из них
гибриды); у половины самцов глаза будут красными и у половины —
белыми. Это кажущееся отклонение от законов Менделя объясняется отсутствием
гена окраски глаз в Y-хромосоме.
от своих матерей-гибридов Х-хромосому с геном красноглазости
и глаза красного цвета, а половина — другую материнскую X-
хромосому с геном белоглазости и имела белые глаза (см. рис. 137).
ЧТО ДЕЛАЮТ ГЕНЫ? 177
ГЕНЕТИЧЕСКИЕ
РЕКОМБИНАЦИИ
И ПЕРЕКРЕСТ ХРОМОСОМ
(КРОССИНГОВЕР)
Время от времени Морган находил в своей коллекции других
мутантных мух. Все они были самцами, несущими рецессивные
мутации, сцепленные с полом. Это не удивительно, поскольку
рецессивные мутации встречаются чаще, чем доминантные, и если
они возникают не в Х-хромосоме самца, то маскируются
доминантным геном другой хромосомы данной пары.
Изучение наследования двух различных мутаций, возникших
в Х-хромосоме, дало странные результаты. Путем соответствующих
скрещиваний Морган получил мух-самок, гибридных по двум
генам, по одному в каждой Х-хромосоме. Например, самка могла
иметь в одной из этих хромосом рецессивный ген белой окраски
глаз, а в другой — рецессивный ген желтой окраски тела (вместо
нормальных доминантных генов красной окраски глаз и серого
Рис. 138. Без кроссинговера (А) сцепленные гены наследуются совместно.
При кроссинговере (Б) две парные хромосомы обмениваются участками, что
ведет к разъединению сцепленных генов. Представленный здесь кроссинг-
овер Х-хромосом возможен только у самки, так как у нее две Х-хромосомы.
Результат этого кроссинговера проявляется у мужского потомства, поскольку
у самцов он не маскируется генами второй Х-хромосомы. W — ген белых глаз;
R — ген красных глаз; G — ген нормальной (серой) окраски тела; у — ген
желтой окраски тела.
12-0414
178 ГЛАВА 6
Рис. 139. Перекрест
хромосом кузнечика (в первой
профазе мейоза). Парные
хромосомы обвивают друг
друга. Каждая хромосома
уже удвоена и состоит из
двух сестринских хромосом.
Кроссинговер произошел
в четырех местах, где
хромосомы перекрещивались.
(А. М. Winchester, Genetics,
Houghton Mifflin, Boston,
1966; с разрешения автора.)
цвета тела; см. рис. 138). Половина мужского потомства таких
самок получала Х-хромосому с геном белой окраски глаз, а
другая половина — Х-хромосому с геном желтого цвета тела. Таким
образом, половина должна была иметь белые глаза и серое тело,
а другая половина — красные глаза и желтое тело. У
большинства мух признаки распределялись именно таким образом. Однако
Морган обычно находил также нескольких самцов с белыми
глазами и желтым телом, т. е. самцов, в единственной Х-хромосоме
которых содержались оба мутантных гена; одновременно можно
было найти и нескольких самцов с красными глазами и серым телом,
единственная Х-хромосома которых, по-видимому, вообще не
содержала мутантных генов. Здесь появлялись, таким образом,
новые комбинации генов: эти самцы были генетическими реком-
бинантами.
Такого рода рекомбинация генов соответствовала уже
известному в то время явлению перестройки хромосом, получившему
Рис. 140. Частота рекомбинаций между генами прямо
пропорциональна расстоянию, разделяющему их в хромосоме.
Кроссинговер чаще происходит между далеко отстоящими друг
от друга генами А и В, чем между близко расположенными
генами В и С. (Максимальная частота рекомбинаций — 50%;
такая частота означает, что гены расположены так далеко
друг от друга и кроссинговер происходит так часто, что они
могут с одинаковой вероятностью оказаться и в одной
хромосоме, и в разных хромосомах.)
>£
ЧТО ДЕЛАЮТ ГЕНЫ? 179
название кроссинговера. Перед тем как клетка приступает к
делениям, в результате которых образуются половые клетки, парные
хромосомы сближаются, ложатся рядом и слегка обвивают друг
друга. В тех точках, где они скрещиваются, может происходить
механический разрыв хромосом и обмен их частями, или
кроссинговер. Если два гена, например ген окраски глаз и ген окраски тела,
расположены в хромосомах по разные стороны от места их
разрыва и воссоединения, кроссинговер приводит к рекомбинации
этих генов.
Здесь мы опять-таки видим, что передача генов потомству
непосредственно определяется поведением хромосом. Более того,
характер взаимосвязи между кроссинговером и генетической
рекомбинацией говорит о том, что каждый ген занимает в хромосоме
определенное положение; это еще один веский довод в пользу
реального, физического существования генов.
ПОСТРОЕНИЕ ГЕНЕТИЧЕСКИХ
КАРТ
А. Стертеванту (1891—1970), который был учеником, а позднее
сотрудником Моргана, пришла в голову мысль, что частота
рекомбинации генов зависит от расстояния, разделяющего их в хромо^
соме. Таким образом, этот исследователь стал первым
«генетическим картографом», первым составителем хромосомных карт.
Среди мужского потомства самок с геном белых глаз в одной
Х-хромосоме и геном желтой окраски тела в другой насчитывалось
1,2% рекомбинантов, обладающих обоими мутантными или обоими
нормальными генами. Иными словами, частста рекомбинации
этих генов составляла 1,2%. Это сравнительно небольшая частота,
она указывает на то, что гены расположены довольно близко
друг к другу; поэтому вероятность разрыва хромосомы между
ними мала. Частота рекомбинаций между геном окраски тела и
геном длины крыльев значительно выше (35,5%); следовательно,
эти гены расположены далеко друг от друга.
Определяя частоты рекомбинаций, Стертевант смог установить
взаимное расположение шести сцепленных с полом генов,
известных в 1913 году. Все гены расположились в линейной
последовательности, и это соответствовало видимой в микроскоп линейной
форме хромосом, лишенных каких-либо разветвлений или петель.
Нахождение мутантной мухи долгое время оставалось редким
случайным событием. Однако в 1927 году Г. Дж. Мёллер (1890—
1967), другой блестящий ученик и сотрудник Моргана, показал,
что можно вызывать мутации, подвергая мух воздействию
рентгеновских лучей. (Уже тогда впервые прозвучал предостерегающий
голос Мёллера: облучение людей рентгеновскими лучами может
12*
180 ГЛАВА 6
Рис. 141. Мутантные
мухи — потомки облученных
самцов. В 1946 г. Г. Дж.
Мёллеру (1890 — 1967) за
открытие мутагенного
действия рентгеновского
излучения была присуждена
Нобелевская премия по
медицине и физиологии.
(С разрешения Brookhaven
National Laboratory.)
привести к появлению наследственных дефектов в будущих
поколениях.)
Рентгеновские лучи позволили открыть у мух сотни генов.
Когда было определено их взаимное расположение, оказалось, что
они распадаются на четыре группы, получившие название групп
сцепления. Гены каждой из групп сцеплены друг с другом, т. е.
обнаруживают тенденцию передаваться совместно. Гены окраски
глаз, цвета тела и длины крыльев, находящиеся в Х-хромосоме,
сцеплены друг с другом. Однако гены одной группы сцепления
передаются независимо от генов трех остальных групп. Четыре
группы сцепления — четыре пары хромосом. Это убедительно
подтверждало теорию, согласно которой гены сосредоточены в
хромосомах.
ГЕНЕТИЧЕСКИЕ
АНОМАЛИИ
И ДЕФЕКТЫ ХРОМОСОМ
Окончательное подтверждение хромосомной теории было
получено при изучении гигантских хромосом, обнаруженных в слюнных
железах личинок плодовой мушки. Гигантские хромосомы
образуются в некоторых специализированных клетках насекомых бла-
yellow (у) —у-г ^— О
scute (sc) у + /V 0+
hairy wing (HW) /Т\ 0+
white (w) // T \ 1,5
facet (fa) ATA 3,0
echinus (ec) / I \ 5,5
ruby(rb) 7,5
crossveinless (cv) -4- 13,7
cut (cf) -1 20,0
singed (sn) \ 21,0
aristaless (al) -p
star (s) +
dumpy (dp)
clot (cl)
lozenge (Iz)
vermilion (v)
miniature (m)
sable (s)
garnet (g)
forked (f) ^
bar (B) -^ "
cornation (car)
bobbed(bb)
27,7
33,0
36,1
43,0
44,4
^ 56,7
*- 57,0
62,5
66,0
dachs(d)
jammed (J)
black (b)
reduced (rd)
purple (pr)
bristle (Bl)
light (It)
cinnabar(en)
engrailed (en)
vestigial (vg)
lobe(L)
curved (c)
humpy (hy)
plexus (px)
brown (bw)
speck (sp)
0
1,3
13/)
16,5
roughoid (Tu) =p
veinlet (ve) "^
+ 93,3
javelin (jv) 4-
31,0
41/)
48,5
51,0
54,5
54,8
55,0
57,5
62/)
67,0
72,0
75,5
sepia (se)
hairy (h)
dichaete (D)
glued (G)
thread (th)
scarlet (st)
deformed (D)
pink (p)
curled (cu)
stubble (sb)
spineless (ss)
bithorax (bx)
stripe (sr)
glass (gl)
delta (Dl)
hairless (H)
ebony (e)
cardinal (cd)
0
0,2
19,2
26/)
26,5
41,0
43,2
"- 44,0
47,5
"" 48Д)
""- 50,0
^ 58,2
58,5
^ 58,7
62/)
""* 63,0
+ 66,2
69,5
^ 70,7
+ 74,7
rough (ro) 4-
100,5 claret (ca) \ 100,7
100,7
-L 107,0
minute-g (Mg) -*- 106,2
91,1
Длинные Крас-
Длинные Длинные лапки Серое ные длинные Прямые Красные
аристы крылья (бнлеников) тело глаза крылья крылья глаза
аристы крылья (5 члеников) теле
Х^ f #
13
31
48,5 . 54,5 67 75,5
al dp
47
99^2 104
Kopom- Hedopas- Короткие Темное Пурпур- \ Искривлен-
кие витые лапки тело ныегла- \ ные крылья
bw
- Л
ные крылья \ S
ные крылья Корин-Щ
аристы крылья (4нленика) за Рудиментарные МРЙМЙ
крылья
глаза
Рис. 142. Карта трех больших групп сцепления (т. е. трех длинных
хромосом) плодовой мушки. Слева от каждой хромосомы приведены названия и
сокращенные обозначения генов. Внизу — часть хромосомы 2 в увеличенном
масштабе. (С. В. Anfinsen, The Molecular Basis of Evolution, Wiley, New
York, 1959.)
182 ГЛАВА 6
Рис. 143. Результат инверсии
большого участка в одной из
двух парных хромосом, как
он выявляется при
исследовании гигантских хромосом
плодовой мушки (А —
микрофотография, Б — схема).
В одной хромосоме сохранена
нормальная
последовательность генов a-b-c-d-e-f-g-h-i-j,
а в другой образовалась
последовательность a-b-h-g-f-e-d-
c-i-j (участок c-d-e-f-g-h
перевернут). Поскольку
идентичные участки на всем
протяжении парных хромосом
совмещены (а с a, b с b и так далее),
в области генов c-d-e-f-g-h
образуется петля. (С
разрешения Carnegie Institution of
Washington.)
годаря тому, что увеличение количества хромосомного материала
не сопровождается здесь делением клеток и самих хромосом.
В 1933 году Т. Пайнтер обнаружил, что каждой гигантской
хромосоме свойствен определенный рисунок окрашивающихся
поперечных полос, изменение которого можно связать с определенными
генетическими явлениями.
Морган нашел, что у некоторых редко встречающихся мутант-
ных мух обычная последовательность генов может быть извращена
(скажем, acbd вместо abed). Изучение гигантских хромосом у
личинок таких мутантов показало, что соответствующий участок
хромосомы у них действительно физически перевернут. Иногда с
помощью генетических экспериментов можно было обнаружить
исчезновение гена или даже нескольких сцепленных генов, и этому
соответствовало видимое выпадение (делеция) участка гигантской
хромосомы. Если генетически выявлялось наличие разрывов
и транслокаций (присоединение части одной хромосомы к другой),
то эти аномалии можно было наблюдать и на гигантских
хромосомах.
г Исследование гигантских хромосом дало возможность
устанавливать физическое местоположение гена в хромосоме. Например,
•4v
т
10*
J*
А
ЧТО ДЕЛАЮТ ГЕНЫ? 183
извращенную последовательность генов можно было
непосредственно связать с перевернутым участком хромосомы. Такие
сопоставления наглядно демонстрировали точность и изящество методов
формальной генетики: последовательность генов, установленная
путем микроскопического изучения аномальных гигантских
хромосом, совпадала с картой, основанной на данных о частоте
рекомбинаций.
Закономерности передачи генов у гороха, расшифрованные
Менделем, и механизмы передачи хромосом у плодовой мухи,
выясненные главным образом Морганом, Стертевантом и другими
учеными в Колумбийском университете, оказались
универсальными: таким же образом наследуются гены и хромосомы у человека,
у мышей, у растений и даже у бактерий и вирусов, хотя, конечно,
в каждой группе организмов есть свои специфические особенности.
Наиболее детально генетические карты разработаны для мух,
бактерий, плесневых грибов и вирусов, поскольку это самые
удобные объекты для экспериментальных исследований. Однако даже
у человека — вида, на котором проведение генетических
экспериментов недопустимо, а наблюдения затруднены очень медленной
сменой поколений и большим числом хромосом (23 пары),—
известны те же самые генетические явления.
У человека тоже обнаружены сцепленные гены, главным
образом в Х-хромосоме. Например, находящийся в этой хромосоме
ген гемофилии сцеплен с геном цветовой слепоты (11,4%
рекомбинаций), который в свою очередь сцеплен с геном еще одного
заболевания крови (6,5% рекомбинаций). Известен и ряд других
случаев сцепления. Несомненно, еще много таких генов будет открыто
в результате изучения гибридных клеток (см. рис. 72) и
использования флуоресцирующих красителей. В 1968 году было
обнаружено, что некоторые из таких красителей выявляют в
хромосомах человека сложную картину поперечных полос, сравнимую
с той, которая была столь успешно использована при изучении
гигантских хромосом плодовой мушки.
Хромосомные аномалии, подобные описанным у мух, известны,
к сожалению, и у человека. Так же как и у мух, женский пол у
человека в норме определяется наличием двух Х-хромосом, а
мужской — сочетанием Х- и Y-хромосом. Таким образом, и у мух,
и у человека пол потомка зависит от отцовской половой клетки.
Однако у человека (в отличие от мух) в Y-хромосоме находятся
гены, определяющие развитие мужских признаков (и, возможно,
некоторые другие гены, например ген, определяющий волосатость
ушей).
Люди с добавочной Х-хромосомой, т. е. с набором половых
хромосом XXY,— мужчины, но несколько недоразвитые в половом
отношении, феминизированные (это так называемый синдром
Клайнфелътера). Мужчиной оказывается даже индивидуум с набо-
184 ГЛАВА 6
♦ ...-, , , [-....1 , , , ,-....
Xg Ich Ос Alb Ang Хт Пей G6PD Pro Нет
Рис. 144. Некоторые гены, находящиеся в X-хромосоме человека (указаны
зависящие от них признаки): Xg — группа крови Xg; Ich — кожная болезнь
ихтиоз; OcAlb — альбинизм глаз (форма альбинизма, затрагивающая только
глаза); Ang — кожная болезнь ангиокератоз; Хт — группа крови Хт;
Deu — дейтеранопия (одна из форм цветовой слепоты); GbPD — глюкозо-6-
фосфатдегидрогеназа (фермент, который можно обнаружить в крови); Pro —
протанопия (другая форма цветовой слепоты); Нет — гемофилия А (одна
из форм гемофилии).
ром XXXXY. Самцы с дополнительной Х-хромосомой известны
также у кошек. Трехцветные кошки-самки довольно обычны,
однако бело-рыже-черные коты чрезвычайно редки (1 на 250 000),
так как гены, определяющие цвет шерсти, находятся в Х-хромо-
соме, и поэтому трехцветный кот должен иметь две Х-хромосомы.
У человека известны и другие хромосомные аномалии. Деле-
ция (нехватка) целой хромосомы для человека, так же как и для
других организмов, по-видимому, гибельна. Наличие добавочной
хромосомы (47 хромосом вместо 46) сопровождается резким
умственным недоразвитием и другими серьезными симптомами.
Появление добавочной хромосомы № 21 приводит к так называемой
болезни Дауна, для которой тоже характерно слабоумие.
МЕДИЦИНСКАЯ ГЕНЕТИКА
Объединенными усилиями генетиков, биохимиков и медиков
создается сейчас новая увлекательная область науки —
медицинская генетика. Она делает пока еще свои первые шаги, но со
временем, быть может, позволит значительно сократить
распространение дефектных генов среди населения земного шара. Для
этого нужно уметь выявлять аномалии у зародыша на ранних
стадиях его развития, когда аборт может быть произведен с
минимумом медицинских, юридических и психологических трудностей.
(Следует иметь в виду, что каждый человек, вероятно, носит в себе
примерно полдюжины вредоносных рецессивных генов. Этот факт
должен умерить пыл каждого, кто мечтает о полном уничтожении
подобных генов.)
Женщине, два брата которой страдали мышечной дистрофией,
обусловленной сцепленным с полом рецессивным геном, прежде
чем обзавестись ребенком, следует обратиться к специалисту-
генетику за консультацией. Так же должен поступить каждый,
кому известно, что в его роду встречались наследственные болезни,
например тяжелая врожденная анемия. Не должны пренебрегать
консультацией специалиста и супруги, решившие иметь ребенка
ЧТО ДЕЛАЮТ ГЕНЫ? 185
Рис. 145. Приготовление
кариограммы человека.
Берут увеличенную
микрофотографию метафазных
хромосом в давленом
препарате. Изображения
отдельных хромосом вырезают и
располагают парами в
соответствии с их размерами
и формой. (С разрешения
World Health Organization.)
невзирая на возраст жены — свыше сорока лет — и,
следовательно, на риск рождения ребенка с синдромом Дауна.
Консультация генетика и новейшие диагностические методы
уже сейчас иногда позволяют избежать опасности рождения
неполноценного ребенка в таких рискованных с генетической точки
зрения случаях. Для этого берут пробу амниотической жидкости,
окружающей плод (такую операцию называют амниоцентезом).
Амниотическая жидкость содержит некоторое количество клеток
плода. Используя метод культуры ткани, из них выращивают
крупную колонию, в которой можно определить активность некоторых
ферментов и исследовать каристип (хромосомный набор) клеток.
Если вы будете предупреждены, что из каждых двух ваших
сыновей один может быть поражен мышечной дистрофией, а
хромосомный анализ клеток из амниотической жидкости обнаружит
наличие в них Х- и Y-хромосом (т. е. мужского кариотипа), то
вряд ли вы захотите сохранить такую беременность, как и любую
If J) Й К И Мюш и п
VI
±J
*»ю и ж
iliili и it u iff **»* I
t*# \f 18 ,
Рис. 146. Кариограмма человека; хромосомы расположены в определенном
порядке. (С разрешения Carolina Biological Supply Company.)
186 ГЛАВА 6
последующую, при которой будет определен мужской пол плода.
Приводим реальную историю женщины, которая, будучи сама
совершенно здоровой, имела аномальный набор хромосом (в нем
была обнаружена так называемая DIG-транслокация, т. е. две
хромосомы были соединены между собой, так что общее число
отдельных хромосом уменьшилось до 45 вместо обычных 46). Эта
генетическая аномалия могла стать причиной рождения детей с
синдромом Дауна.
Миссис Р. К. обратилась в медико-генетическую консультацию в связи
с тем, что трое из ее братьев и сестер страдали синдромом Дауна.
Исследование клеток периферической крови показало, что у нее 45 хромосом,
из них две X-хромосомы и одна комплексная хромосома — результат
D/G-транслокации. Миссис Р. К. не желала брать на себя риск произвести
на свет ребенка с синдромом Дауна. Однако она хотела бы иметь детей.
На 15-й неделе беременности были исследованы клетки плода; хромосомный
анализ показал, что они содержат 46 хромосом, включая Х- и Y-хромосомы
и D/G-транслокацию. Такой кариотип позволяет предполагать
транслокационную форму синдрома Дауна. Миссис Р. К. решила прервать
беременность и на 19-й неделе ей был произведен аборт. Через три месяца миссис
Р. К. снова забеременела, и 14 недель спустя вновь была взята проба амнио-
тической жидкости путем амниоцентеза. В клетках плода были обнаружены
46 хромосом, включая две Х-хромосомы, при нормальном кариотипе. В
надлежащее время миссис Р. К. родила нормальную девочку х.
ГЕНЫ ЗАВЕДУЮТ
ФЕРМЕНТАМИ
Гены определяют окраску цветка и цвет глаз, высоту стебля
у растения и рост человека — они влияют на все признаки у всех
организмов. Как они это делают, в чем состоит их действие?
В 1908 году, когда генетика и биохимия находились еще в
младенческом возрасте, английский врач сэр Аричальд Гэррод (1857—
1936) высказал предположение, что некоторые болезни наследуются
и что они связаны с отсутствием какого-нибудь фермента. Эти
болезни он метко назвал «врожденными ошибками метаболизма».
Тридцать лет спустя эта блестящая догадка Гэррода подтвердилась,
и теперь мы знаем, что гены (по крайней мере многие из них)
действительно определяют молекулярную структуру ферментов. Под
влиянием мутантных генов образуются дефектные ферменты,
неспособные выполнять свою функцию. (Это позволяет понять,
почему мутации большей частью рецессивны: присутствие мутантного
гена маскируется нормальным геном, так как нормальный фермент,
работая «за двоих», компенсирует бездействие мутантного
фермента.)
1 Из учебника по генетическому консультированию под ред. д-ра Арно
Мотульски (готовится к печати), с разрешения д-ра Генри Нэдлера.
Дефектный
иермент:
Ъёнилкето-
Меланин
(пигмент кожи)
а Дефектный
\ фермент:
\ альбинизм
\
Дефектный
фермент:
алкаптонурия
Фенилаланин
Тирозин
Оксифенилпировино- Гомогентизино- Малеилацетоуксусная
градная кислота вая кислота кислота
Рис. 147. Фенилаланин может превращаться в тирозин, а затем — двумя различными путями — или в кожный
пигмент меланин, или в вещество, которое проникает в митохондрии и окисляется там до углекислоты и воды с
одновременным образованием АТФ из АДФ. Как показано на схеме, ряд наследственных болезней человека связан
с мутациями, влияющими на какой-либо фермент, необходимый для этих превращений.
I
м
>
И
X
00
^1
188 ГЛАВА 6
Алкаптонурия — одна из болезней, на которые указывал Гэр-
род,— представляет собой сравнительно безобидное нарушение
обмена, однако каждая мать больного ребенка, несомненно,
обратит внимание на это расстройство из-за цвета пеленок: моча
ребенка со временем приобретает черный цвет. Сейчас, когда
основные принципы генетики известны, пути метаболизма выяснены
и природа ферментов хорошо изучена, стал понятен во всех
подробностях и механизм нарушения обмена при алкаптонурии.
При этом заболевании дефект гена приводит к отсутствию
одного фермента (оксидазы гомогентизиновой кислоты), который
участвует в окислении избытка аминокислоты фенилаланина до
углекислоты и воды. В организме накапливается гомогентизиновая
кислота, которая затем выводится с мочой и при
соприкосновении с воздухом превращается в черный пигмент. Отсутствие
ферментов или нарушение их функции установлено теперь при
многих наследственных болезнях. Некоторые из этих болезней, в том
числе фенилкетонурия, связаны с дефектами в ферментах той же
цепи реакций, в которой имеется дефект при алкаптонурии.
Homo sapiens — организм весьма неудобный для изучения, но
зато привлекающий к себе особое внимание. У человека как
объекта для исследования есть и свои преимущества. Например,
изменение цвета мочи у человека будет замечено скорее, чем у плодовой
мухи. Умственная отсталость или расстройство пищеварения у мух
также могут легко ускользнуть от внимания наблюдателя. Поэтому
нет ничего удивительного в том, что действие генов у человека
изучено лучше, чем у какого-либо животного, и что первые данные
о биохимических эффектах генов касались наследственных
нарушений обмена веществ у человека.
ОДИН ГЕН —
ОДИН БЕЛОК
Решающие опыты, доказавшие, что каждому гену соответствует
фермент (так называемая концепция «один ген — один фермент»),
были все же поставлены не на человеке, а на хлебной плесени
Neorospora crassa.
Плесень эта удобна тем, что в ее жизненном цикле есть только
одна клетка, имеющая двойной набор хромосом. Это та клетка,
которая образуется после слияния двух половых клеток; она
сразу же делится без предварительного удвоения хромосом, так
что дочерние клетки и все последующие содержат по одной
хромосоме из каждой пары. А один набор хромосом — значит, и
и один набор генов. Поэтому у хлебной плесени рецессивные
мутации не маскируются доминантными генами, как у организмов,
имеющих парные хромосомы.
ЧТО ДЕЛАЮТ ГЕНЫ? 189
Рентгеновские луни
f /// или ультрафиолет
15
+витамины,
Ж)
^■аминокислоты
Рис. 148. С помощью метода,
представленного на этой схеме, Бидл и
Татум выделяли мутантов хлебной
плесени с изменениями
определенных биохимических процессов. 1.
Чтобы вызвать мутации, на споры
воздействуют ультрафиолетовыми
или рентгеновскими лучами. 2.
Облученные споры проращивают
индивидуально на полной среде {ПС). 3.
Определяют способность плесени
расти на минимальной среде (МС).
В изображенном здесь случае она
на такой среде не растет;
следовательно, это мутантная форма. 4.
Исследуют способность мутанта
расти на среде, обогащенной набором
витаминов или аминокислот.
Добавка витаминов способствует росту. 5.
Мутантную плесень выращивают на
минимальной среде с добавкой того
или иного витамина. Росту
способствует только один витамин — пан-
тотеновая кислота. Значит, у
данного мутанта инактивирован один
из ферментов, необходимых для
синтеза пантот^новой кислоты.
^^О^ЛСКМР?
уШ ШС\ \МС\ \МС\ \МС\ \МС\ \МС\ \МС\ \MCJ
+тиамин Ь+пиридоксин\ л-ниацин 4 + инозит | +фолиевая
+рибо<рла- +пантотено- +аминобензой- +холин
вин вая кислота мая кислота
В 1941 году Дж. Бидл и Э. Татум решили выяснить,
контролируют ли гены биохимические реакции, и если да, то каким
образом. Подход этих исследователей к решению проблемы был
основан на весьма остроумной идее. Их предшественники пытались
обнаружить у мутантов биохимические дефекты — например,
установить стадию, на которой блокируется синтез красного
пигмента у белоглазых мух. Бидл и Татум действовали обратным
методом — они разработали способ отбора мутантов, неспособных
к осуществлению какой-то определенной биохимической реакции.
Хлебная плесень, как многие другие организмы, например
некоторые бактерии, способна обходиться чрезвычайно простой диетой:
она прекрасно растет на среде, состоящей из минеральных солей,
одного витамина (биотина) и какого-нибудь источника углерода —
190 ГЛАВА 6
Рис. 149. Джордж Бидл
(род. в 1903 г.) вместе с
Эдуардом Татумом
разрабатывал биохимический подход
в генетических
исследованиях, используя красную
хлебную плесень Neurospora
crassa. В 1941 году они
установили, что гены
контролируют синтез витаминов и
аминокислот. Их работы
привели к представлению
о том, что гены определяют
структуру ферментов. На
этом снимке Бидл
изображен среди растений
кукурузы: в настоящее время
он проводит генетические
опыты на кукурузе в
Чикагском университете,
ректором которого он является.
(С разрешения G. W.
Beadle.)
глюкозы или иного сахара. Из этих несложных исходных веществ
плесень синтезирует аминокислоты, жиры, различные витамины
и углеводы. Если мутация гена действительно приводит к утрате
или «порче» какого-то фермента, то мутант должен быть неспособен
синтезировать хотя бы одно из необходимых ему сложных
соединений. Он сможет расти на простой среде только в том случае,
если в нее добавить то вещество, которое он не в состоянии
синтезировать.
Практически Бидл и Татум ставили свои опыты следующим
образом: они вызывали мутации, облучая споры плесневого гриба
рентгеновскими или ультрафиолетовыми лучами; облученные
споры проращивались затем на «полной» питательной среде, т. е.
на среде, содержавшей аминокислоты, витамины и другие
сложные соединения; мутантов выявляли по их неспособности расти
после переноса на простую («минимальную») среду, лишенную
веществ, которых они сами синтезировать не могли.
Каким же образом различали отдельных мутантов друг от
друга? Методом проб и ошибок. Будет ли мутант расти на
минимальной среде, дополненной витаминами? Или ее нужно дополнить
аминокислотами? Какая из двадцати аминокислот обеспечит рост
плесени? Пробуя различные добавки к минимальной среде и
выясняя, какая из них обеспечивает рост мутанта, можно было
определить и характер мутации.
В своих первых опытах Бидл и Татум выявили трех мутантов,
причем случайно оказалось так, что каждый из них был неспособен
синтезировать один из витаминов. За десять лет работы было
ЧТО ДЕЛАЮТ ГЕНЫ? 191
Рис. 150. Эдуард Л. Татум
(род. в 1909 г.) совместно
с Бидлом разработал
биохимическую генетику
хлебной плесени. Несколькими
годами позже Татум и
Джошуа Ледерберг
открыли удивительное явление —
половой процесс у
бактерий; появилась
возможность использовать эти во
многих отношениях
удобные организмы в
генетических исследованиях. В 1958
году Бидл, Татум и
Ледерберг получили
Нобелевскую премию по медицине
и физиологии. (С
разрешения Н. Boudakian и
Rockefeller Univ. Graphic
Services.)
собрано около пятисот мутантов. Результаты их изучения проще
всего было объяснить на основе гипотезы «один ген — один
фермент»: почти каждый из найденных мутантов приобретал
способность расти при добавлении всего лишь одного вещества,
например определенной аминокислоты или витамина.
В некоторых случаях «врожденные ошибки метаболизма»,
возникшие у плесневого гриба в результате облучения, можно было
охарактеризовать еще более точно. Некоторые мутанты нуждались
в одних и тех же добавках, например в одной и той же
аминокислоте, но удалось показать, что у них были блокированы разные
этапы синтеза этой аминокислоты. У нескольких мутантов было
даже установлено отсутствие одного определенного фермента
при наличии всех других, участвующих в синтезе данного
вещества.
Таким образом, мутации, возникавшие в разных генах,
приводили к различным биохимическим дефектам. Гипотеза «один
ген — один фермент» была подтверждена. Она сохраняет свое
значение и по сей день, но с одной небольшой поправкой. Дело
в том, что все ферменты — это, конечно, белки, однако не все
белки — ферменты. Однозначное соответствие существует не
только между генами и ферментами, но вообще между генами и всеми
белками: один ген — один белок.
192 ГЛАВА 6
Что означает такое соответствие? Белки — это длинные
последовательности аминокислот. Свойства каждого белка
обусловлены специфическим расположением аминокислот в его молекуле.
Значит, каждый ген должен каким-то образом точно определять
последовательность соединения аминокислот в молекуле белка.
Но как именно? Это мы узнаем из последующих глав.
7 ЧТО ПРЕДСТАВЛЯЮТ
СОБОЙ ГЕНЫ?
Гены обладают тремя удивительными свойствами. Они сами
себя удваивают в каждом поколении клеток: гены способны
неопределенно долгое время воспроизводить себя (реплицироваться) без
изменений. Чрезвычайно редко ген может измениться, и этот
измененный, мутировавший ген в свою очередь воспроизводится и
передается новым поколениям клеток без каких-либо вариаций: редкие
изменения, называемые мутациями, таким же образом
воспроизводятся неопределенно долго. Все множество генов находится в
однозначном соответствии ко всему множеству белков, имеющихся
в клетках данного организма: принцип «один ген — один белок»
означает, что каким-то образом ген точно определяет
последовательность аминокислот в молекуле белка.
Поскольку доказано, что гены находятся в хромосомах —
особых структурах, видимых в микроскоп,— сейчас уже нет
никаких сомнений в реальном, физическом существовании самих генов.
Что же такое гены? Какое вещество может обладать такими
необычными свойствами?
КАКОЕ ВЕЩЕСТВО
МОЖЕТ БЫТЬ
ГЕНЕТИЧЕСКИМ
МАТЕРИАЛОМ?
В 1941 году, когда была четко сформулирована гипотеза «один
ген — один фермент» и были получены ее первые подтверждения,
и даже через десять лет после этого большинство биологов были
совершенно уверены, что они уже знают, из какого вещества пост-
19—0414
194 ГЛАВА 7
роены гены,— конечно, из белка! Тогда предполагали, а сейчас
это точно известно, что белки — самые сложные вещества;
естественно, что они и должны выполнять самую сложную функцию.
Действительно, было только два кандидата на роль
генетического материала; ведь хромосомы состоят в основном только из
двух веществ: белка и ДНК (дезоксирибонуклеиновой кислоты).
ДНК была открыта в XIX веке. Было известно, что это полимер,
состоящий из четырех различных мономеров, а именно из четырех
оснований — А, Ц, Г и Т (аденина, цитозина, гуанина и тимина),
соединенных друг с другом. Поскольку в тех немногих образцах
ДНК, которые были подвергнуты анализу, все четыре основания
содержались в примерно равных количествах, был сделан
ошибочный вывод, что молекула ДНК состоит из правильно
повторяющихся последовательностей, например АЦГТАЦГТАЦГТ... и так далее
без конца.
Разве можно было представить себе, что такая скучная
молекула играет столь важную и сложную биологическую роль? Разве
могла бы регулярная последовательность оснований определять
чередование аминокислот в таких разнообразных соединениях,
как белки? Можно провести аналогию между белками с их
двадцатью аминокислотами и ДНК с четырьмя основаниями, с одной
стороны, и английским алфавитом из 26 букв и азбукой Морзе
из трех знаков (точка, тире, пауза) -—[с другой.
Последовательность точек, тире и пауз соответствует буквам, словам'и
предложениям. Например —• — •— (тире, точка, точка, пауза, тцре,
точка, пауза, точка, тире) соответствует буквам DNA х, но такое
монотрнное повторение, как — • • — • — • — •, кодирует только
буквы DDDD, ничего не означающие. Совершенно так же
полимерная молекула с последовательностью мономеров
АЦГТАЦГТАЦГТ... не может кодировать ничего интересного, не
может содержать никакой информации.
И тем не менее опыты, проведенные в 1944 году, а затем
в 1952 году, показали, что генетическим материалом на самом деле
служит именно ДНК.
ТРАНСФОРМАЦИЯ
БАКТЕРИЙ
В 1928 году в*английском журнале Journal of Hygiene
появилась совершенно необыкновенная статья. Фрэд Гриффите,
английский медик, интересовался этиологией пневмонии, которую
вызывают особые бактерии — пневмококки. Существует довольно
, г Сокращедие, слоэ 4еохУпЬопис1е1с acid, т. е. дезоксирибонуклецнр-
вая кислота.— Прим. пёрев.
ЧТО ПРЕДСТАВЛЯЮТ СОБОЙ ГЕНЫ? 195
много слегка различающихся типов пневмококков. Гриффите
обнаружил, что на протяжении болезни иногда можно бывает выявить
пневмококки разного типа; это навело его на мысль: не может ли
один тип пневмококков превращаться в другой?
УБИТЫЕ БАКТЕРИИ
ТРАНСФОРМИРУЮТ
ЖИВЫХ БАКТЕРИЙ
Гриффите поставил опыт, чтобы выяснить, возможна ли такая
трансформация. Он ввел мышам небольшое количество живых
неболезнетворных пневмококков и вместе с ними — большое
количество пневмококков инфекционного типа, убитых
нагреванием. Если эти бактерии вводились порознь, то ни живые
безвредные, ни убитые инфекционные не вызывали у мышей пневмонию.
Если, однако, оба типа вводились вместе, то мыши гибли от
пневмонии. Больше того, несмотря на то, что все инфекционные
пневмококки перед введением были убиты, из погибших мышей можно
живых пневмококков
инфекционного типа. Мыши погибали
от пневмонии
живых неинфекционных
пневмококков Пневмония не развивалась
убитых пневмококков инфекцион-
1— ного типа + живых
неинфекционных пневмококков. Мыши погибали
от пневмонии
Рис. 151. Фрэд Гриффите сделал удивительное открытие. Введение мышам
живых неинфекционных или убитых инфекционных пневмококков не
вызывает заболевания. Введение же смеси тех и других, вызывает у мышей
пневмонию. При этом у заболевших мышей могут быть обнаружены живые
инфекционные бактерии.
13*
196 ГЛАВА 7
было выделить живых инфекционных бактерий. Мертвые
инфекционные бактерии превращали живых неинфекционных в живых
инфекционных.
Инфекционные пневмококки заключены в капсулу,
предохраняющую их от действия защитных факторов организма мыши.
Неинфекционные пневмококки лишены капсулы и поэтому легко
уничтожаются. В опыте Гриффитса мертвые инкапсулированные
пневмококки передали неинфекционным бактериям, лишенным
капсулы, способность синтезировать эту капсулу.
Гриффитса эти результаты интересовали лишь с медицинской
точки зрения, однако многие биологи были поражены необычайной
возможностью вызвать столь специфические изменения в живом
организме. Еще более удивительным оказалось то, что эти
специфические изменения наследовались. Способность синтезировать
материал для новой капсулы передавалась в потомстве
трансформированных бакгерий из поколения в поколение. В ряде
лабораторий опыты Гриффитса были повторены; результаты их
подтвердились и позже были дополнены новыми данными.
ТРАНСФОРМИРУЮЩИМ
ФАКТОРОМ СЛУЖИТ ДНК
Гриффите тщетно пытался вызвать превращение пневмококков
в пробирке. Через несколько лет трансформация в пробирке была
успешно осуществлена в лаборатории О. Эвери в Рокфеллеровском
институте. Вскоре был найден новый метод трансформации
пневмококков экстрактом из инфекционных бактерий. Этот экстракт,
нечто вроде бактериального сока, не содержал целых бактерий.
Какое же вещество, содержащееся в экстракте, ответственно за
трансформацию? Пути для поисков ответа на этот вопрос были
теперь открыты.
«В течение последних двух лет, сначала с Мак-Леодом, а сейчас
с д-ром Мак-Карти, я пытаюсь выяснить химическую природу того
вещества в бактериальном экстракте, которое вызывает эти
специфические изменения,— писал О. Эвери своему брату, д-ру Рою
Эвери, в 1943 году.— Попробуй найти в такой сложной смеси
активное начало!... Изнурительное, головоломное занятие. Но в
конце концов мы его, кажется, поймали».
Эвери и его коллеги выделили вещество, вызывавшее
трансформацию бактерий даже при разведении в 100 миллионов раз.
«Это мощная штука», писал Эвери. Но что это за вещество?
Очевидно, не белок: оно не расщеплялось протеолитическими
ферментами; и не РНК (рибонуклеиновая кислота), находящаяся
в рибосомах и других компонентах клетки, так как выделенное
вещество не инактивировалось рибонуклеазой — ферментом, гид-
ролизующим РНК. Не действовал на него и фермент, разрушающий
ЧТО ПРЕДСТАВЛЯЮТ СОБОЙ ГЕНЫ? 197
Капсульные
пневмококки
+
о
ТФ
(трансформирующий
фактор)
Бес
капсульные пневмо
кокки
Капсульные
пневмококки
+
Нет белков,
нет РНК,
нет липидов,
нет
материала капсулы
о
Бескапсуль-
ные
пневмококки
Капсульные
пневмококки
+
О —О
Нет ДИК
Бескапсуль-
ные
пневмококки
Бескапсульные
пневмококки
(трансформации
не происходит)
Рис. 152. Из певмококков с капсулами О. Т. Эвери и его сотрудники
выделили в высокоочищенном виде фактор, способный даже в очень малых
количествах превращать бескапсульную форму пневмококков в капсульнуго
(инкапсулированную) форму. Трансформирующий фактор оставался активным
после обработки, разрушающей белки, РНК, липиды или материал капсулы,
но терял способность вызывать трансформацию после обработки,
разрушающей ДНК. Вывод: вещество, превращающее бескапсульных пневмококков
в инкапсулированных,— не что иное, как ДНК.
капсулу инфекционных пневмококков; значит, это не был материал
самой капсулы. Трансформирующий фактор не растворялся в
спирте, эфире и хлороформе, т. е. не был и липидом. Его можно было
инактивировать только одним ферментом — дезоксирибонуклеа-
зой. Этот фермент расщепляет только ДНК. Значит,
трансформирующее вещество — это ДНК? «Кто бы мог подумать об этом!»—
писал Эвери.
«Если мы правы, а это, конечно, еще не доказано, то это значит,
что нуклеиновые кислоты — не просто структурные компоненты,
а важнейшие вещества, определяющие биохимическую активность
и специфические особенности клеток, и что с помощью известных
химических веществ можно вызывать предсказуемые и наследуемые
198 ГЛАВА 7
Рис. 153. Освальт Т. Эвери
(1877—1955). В течение
10 лет он работал над
очисткой трансформирующего
вещества и достоверным
установлением его
химической природы. Он
добился успеха перед самым
уходом на пенсию из
Рокфеллеровского института. На
этой фотографии Эвери
держит чашку Петри, в которой
растут колонии бактерий.
(С разрешения Roy Avery.)
изменения в клетках... . Однако сегодня, чтобы убедить каждого,
что свободная от белков ДНК может быть наделена такой
биологической активностью и такими специфическими свойствами,
нужна масса хорошо документированных данных, и эти данные мы
сейчас пытаемся получить. Очень забавно пускать мыльные
пузыри, но лучше прокалывать их самому, прежде чем это сделает кто-
нибудь другой».
Хорошо документированные данные о том, что вещество,
превращающее один тип пневмококков в другой,— это ДНК, были
опубликованы в 1944 году в знаменитой теперь статье Эвери,
Мак-Леода и Мак-Карти. Прошло почти десять лет, прежде чем
ее значение было осознано всеми. Почему? Может быть, биологи
немного туповаты?
В 1944 году результаты Эвери и его коллег были единственными
данными в пользу того, что гены и ДНК — одно и то же. Поэтому
они не могли быть приняты как достоверное доказательство.
Можно было думать, что трансформация пневмококков — какой-то
феномен особого рода, специфический для капсул бактерий и не
имеющий отношения к другим признакам и, следовательно, к
генетике в целом. Может быть, в трансформации участвовал не ген,
а вирус (а что такое вирус, в то время тоже по существу не знали).
ЧТО ПРЕДСТАВЛЯЮТ СОБОЙ ГЕНЫ?|^199
Но самое главное то, что структура белков и ДНК была еще
слишком мало изучена. Поэтому сведения о химической природе генов
не могли пролить свет на химические основы наследственности.
Чтобы возбудить интерес к структуре ДНК, потребовалось второе,
более убедительное доказательство ее генетической роли. Такое
доказательство было получено при изучении вирусов.
ГЕНЕТИЧЕСКИЙ
МАТЕРИАЛ
БАКТЕРИОФАГОВ
Бактерии}не так уж малы. Во всяком случае, их можно
отфильтровать с помощью специальных бактериальных фильтров. Через
эти фильтры они не проходят. В конце XIX века были открыты
еще более мелкие возбудители болезней. Фактор, вызывающий
одну из болезней растений — табачную мозаику,— проходил
сквозь бактериальный фильтр. Скоро обнаружили, что и ящур
крупного рогатого скота вызывается «фильтрующимся вирусом».
Теперь известно много вирусных заболеваний и у растений, и у
животных. К вирусным болезням человека относятся оспа, корь,
свинка, ветряная оспа, полиомиелит, бешенство и обычный грипп.
Вирусы очень разнообразны. Они различаются по тем болезням,
которые они вызывают, и по хозяевам, которых'способны заражать.
Существуют вирусы растений, вирусы животных, вирусы
насекомых. Даже бактерии подвержены вирусным заболеваниям.
ОТКРЫТИЕ БАКТЕРИАЛЬНЫХ
ВИРУСОВ
В 1917 году французский бактериолог Ф. д'Эрель открыл то, что
он назвал антимикробом,— убийцу бактерий. В пробирку с
питательной средой, похожей на ту, которой' пользовались Бидл
и Татум для выращивания хлебной плесени, д'Эрель добавил
несколько капель испражнений больного, выздоравливавшего от
дизентерии. Внесенные при этом дизентерийные бактерии росли
некоторое время в пробирке, но затем вдруг погибли и лизирова-
лись, т. е. подверглись разрушению, растворились. Д'Эрель
профильтровал содержимое пробирки через бактериальный фильтр.
Одна капля этого не содержавшего бактерий фильтрата,
добавленная в другую пробирку с растущими дизентерийными бактериями,
вызвала их гибель и лизис. (Лизис бактериальной культуры
наблюдать легко. Концентрированная культура 'кажется -мутной
и даже темной. После лизиса бактерий среда становится про-
200 ГЛАВА 7
Рис. 154. Электронный
микроскоп позволяет увидеть
детали строения фага Т4.
Этот фаг состоит из
шестигранной головки и
длинного «хвоста» с отходящими
от него тонкими нитями.
С помощью нитей фаг
прикрепляется к бактерии.
Фаг Т4 и родственный ему
фаг Т2 — одни из наиболее
изученных организмов.
Хорошо изучены и другие
фаги; многие из них
устроены еще проще — это
сферические частицы без каких-
либо придатков. (С
разрешения Virus Laboratory,
Univ. of California at
Berkeley.)
зрачной — видны лишь комочки из слипшихся остатков
бактериальных клеток.) Капля, взятая из второй пробирки и
перенесенная в третью, вновь вызвала лизис культуры, и то же самое
повторялось на протяжении 50 переносов.
Таким образом, д'Эрель доказал, что «убийца бактерий», или
«антимикроб»,— это невидимое, но живое существо. Только
непрерывно размножающийся живой организм мог сохранить активность
после пятидесяти переносов, в результате которых несколько
капель испражнений, взятых в исходном опыте, подверглись такому
разбавлению, что от них фактически ничего не осталось.
Антимикроб, активный против одного штамма бактерий, после
нескольких переносов мог стать убийцей другого штамма. «Адаптация
свойственна только живым организмам», писал д'Эрель. Он не
нашел даже двух совершенно одинаковых рас антимикробов.
«Изменчивость,— писал он,— это неотъемлемая характеристика
жизни». В конце концов удалось показать, что антимикробы, хотя
они и оставались невидимыми даже в лучшие микроскопы того
времени (вирус можно увидеть только с помощью электронного
микроскопа), представлены отдельными частицами, отдельными
индивидуумами, как и все другие живые существа.
Д'Эрель продемонстрировал это следующим образом.
Несколько капель концентрированной микробной культуры вместе с
несколькими каплями разведенной в миллион раз среды,
содержавшей «антимикроб», были равномерно распределены по
поверхности твердой питательной среды (для получения твердой среды
ЧТО ПРЕДСТАВЛЯЮТ СОБОЙ ГЕНЫ? 201
Рис. 155. Подсчет фаговых частиц. А. Пустая чашка Петри. Б. Чашка Петри
с питательной средой, затвердевшей благодаря добавлению к ней особого
вещества — агара. В. Поверхность агара покрыта плотной пленкой из
бактерий. Чтобы получить такую пленку, по поверхности агара равномерно
распределяют относительно небольшое количество бактерий (около 100
миллионов); они растут в течение ночи, и на другой день их оказывается во много
раз больше. Г. Во многих местах на бактериальной пленке видны прозрачные
пятна — колонии фагов, возникшие из одиночных фаговых частиц. На агар
были равномерно нанесены бактерии и около 50 частиц фага. По мере того как
бактерии росли, распространяясь по всей поверхности агара, то одна, то
другая фаговая частица вступала в контакт с бактерией и варажала ее; потомство
одной частицы заражало и убивало бактерий, росших поблизости: возникало
«стерильное пятно» (или «бляшка»), в котором бактерии расти не могут.^
Подсчитав количество таких пятен и учтя разведение исходной взвеси, можно
определить число содержавшихся в ней фаговых частиц.
добавляют специальное вещество агар, застывающее при комнатной
температуре). Выросшие бактерии покрыли поверхность плотной
пленкой. Однако кое-где в этой пленке были видны прозрачные
точки, как будто пленка была чем-то продырявлена. Д'Эрель
справедливо предположил, что каждая прозрачная зона представляет
собой колонию антимикробов, образовавшуюся из одного-единст-
венного антимикроба, попавшего на это место. В этих местах —
зонах лизиса — размножающиеся антимикробы уничтожили
бактерий. Подсчитав число этих зон и учтя степень разведения,
д'Эрель определил количество антимикробов в исходном растворе
(подобный метод подсчета вирусных частиц применяется до сих
пор). Концентрация химического вещества не может нарастать
в ограниченных зонах; значит, антимикробы должны быть живыми
организмами.
Численность антимикробов возрастала только тогда, когда
их смешивали с живыми, растущими бактериями. Д'Эрель
справедливо заключил, что они не могут расти сами по себе и,
следовательно, являются облигатными паразитами, т. е. способны вести
только паразитический образ жизни. Он назвал их
бактериофагами, что значит «пожиратели бактерий». Так их называют и по сей
день, только чаще употребляют сокращенное название фаги.
202 ГЛАВА 7
\ я
?\
Шг Jam
Sp?
■ **$ШрРг^
Jim
i 1
Рис. 156. М. Дельбрюк из
Калифорнийского технологического института,
А. Херши из лаборатории в Колд-
Спринг-Харбор и С. Луриа из Масса-
чусетского технологического института,
изучавшие фаговую инфекцию и
генетику фагов, положили начало
плодотворнейшему направлению
биологических исследований. Они разобрались
в экспериментальных данных,
ставивших в тупик более ранних
исследователей, и выяснили механизм фаговой
инфекции. В 1969 году за важный
вклад в познание фундаментальных
процессов, протекающих в клетке, им
была присуждена Нобелевская премия
по медицине и физиологии. (С
разрешения Nobel Foundation.)
ЖИЗНЬ БАКТЕРИОФАГА
Работа д'Эреля привлекла всеобщее внимание, так как
появилась надежда лечить с помощью фагов бактериальные болезни
(антибиотиков в те времена еще не было). Хотя фаги никогда не
применялись для этого непосредственно, изучение их принесло
немалую пользу. Знание жизни и «повадок» бактериофага
проливало свет и на природу других, патогенных, вирусов, которые
труднее было изучать, так как они заражали более сложные клетки
животных и растений. Эксперименты с фагами позволили раскрыть
тайну многих фундаментальных процессов, протекающих в клетке,
особенно генетических
ЧТО ПРЕДСТАВЛЯЮТ СОБОЙ ГЕНЫ? 203
Рис. 157. Заражение бактерии фагом начинается с прикрепления фаговой
частицы к стенке бактериальной клетки. Затем генетический материал фага
спрыскивается в клетку и там размножается (некоторые фаги разрушают
при этом генетический материал самой бактерии). Примерно через 12 минут
в бактериальной клетке уже содержится несколько полностью
сформированных дочерних фаговых частиц. Спустя 25—35 минут бактерия лизируется,
освобождая 100—200 фаговых частиц, каждая из которых может теперь
инфицировать другие бактериальные клетки.
Жизненный цикл фага был в общих чертах описан Максом
Дельбрюком в 1939 году. Фаг прикрепляется к бактерии, а через
20 минут бактерия разрушается и из нее выходят около ста новых
фаговых частиц. Что же происходит в течение этих 20 минут, до
лизиса бактериальной клетки? Поиски ответа на этот вопрос
стали возможны после того, как в 1951 году А. Дерман обнаружил,
что цианид вызывает преждевременный лизис зараженной клетки.
Как это ни казалось странным, в начале инфекции в клетке вообще
нельзя было найти никаких фагов — не было даже той частицы,
которая вызвала заражение. Фаги появлялись не раньше чем
через 10 минут.
Что означает это исчезновение инфицирующего фага? Ответ на
этот вопрос был получен в 1952 году в одном очень важном экс-
204 ГЛАВА 7
>
are # ^^ ш
# А* А*
^^ ^ЯЯ Ш? ]Ш
• • * * А Ш
мального фага Т4; крупные т j ^^ ™
колонии принадлежат
измененной форме того же фага— jtfb #^
мутанту rll. (С разрешения тъ ^т* *
S. Benzer.) Щ^ ^#
Рис. 158. Темные пятна —
это зоны лизиса, т. е. коло- ц
нии фагов, как будто
продырявившие плотную
пленку, образованную
бактериями (на фотографии эта ^^
пленка кажется белым
фоном). Мелкие пятнышки
с ореолом — колонии нор-
S
перименте. Мы расскажем о нем в следующем разделе, после тогог
как скажем еще несколько слов о фагах и фаговой
инфекции.
Еще в ранний период изучения фагов были обнаружены фаги-
мутанты. Некоторые из них различались тем, что инфицировали
разные штаммы бактерий. Другие давали необычные зоны лизиса
(или, как их называют, «бляшки») в бактериальных культурах
на агаре: очень мелкие, очень крупные или окруженные ореолом.
Если фаг, подобно высшему организму, может мутировать, то
у него должны быть гены. Генетическое сходство между фагами
и другими организмами стало еще более очевидным в 1946 году,
когда два крупнейших исследователя фагов — М. Дельбрюк
и А. Херши — независимо друг от друга обнаружили рекомби-
нантные формы фагов в потомстве, полученном при
одновременном заражении бактерий двумя фагами-мутантами с мутациями
в разных генах. (Фаги, так же как бактерии и некоторые другие
микроорганизмы, например плесневые грибы, очень удобны для
ЧТО ПРЕДСТАВЛЯЮТ СОБОЙ ГЕНЫ? 205
Г
* I
% : Дм^П!!!^^,,
t * '*■ ^^^■^^'•2-1
IIWJ
; .^|ШШ1Ш ш,- ^
Рис. 159. На этой серии
электронных
микрофотографий можно видеть развитие
фаговой инфекции. Вверху
(A) изображена неинфици-
рованная бактерия,
светлые области — это
скопление бактериального
генетического материала. Через
2 минуты после заражения
(Б) генетический материал
рассеян; видна фаговая
частица, прикрепившаяся к
стенке бактериальной
клетки (внизу справа). Спустя
8 минут после заражения
(B) бактерия уже наполнена
генетическим материалом
фага и фаговым белком, а
спустя 12 минут (Г)
внутри клетки можно видеть
первые дочерние частицы
фага. Через 32 минуты после
заражения (Д) бактерия
наполнена многочисленным
фаговым потомством. (С
разрешения Е. Kellenberger.)
генетических экспериментов, поскольку их единственная
хромосома содержит только один набор генов; этим они отличаются от
таких высших организмов, как горох, плодовая мушка или
человек, обладающих двойным набором хромосом и парными
генами.)
Что происходит, когда фаг инфицирует бактерию?
Бактериальная клетка — это крошечная фабрика, производящая все
материалы, необходимые для собственного роста и деления. Работа этой
фабрики направляется и контролируется бактериальными генами,
в которых содержатся все «рабочие чертежи» для воспроизводства
клеток. При инфекции эта фабрика переходит под управление
генов фага и начинает работать по инструкциям для
воспроизводства фагов. Все сборочные линии перестраиваются на выпуск
компонентов фага. Каковы эти компоненты? Их всего два: ДНК
и белок. Какое же из этих веществ служит генетическим
материалом фага — веществом, из которого построены его
гены?
Ответ на этот вопрос, а вместе с тем и объяснение таинственного
исчезновения инфицирующего фага дали в 1952 году А. Херши
и Марта Чейз. Они показали, что только ДНК фага
проникает в бактерию. Белок фага остается вне бактериальной
клетки.
\Встряхи\
\вание
\е смесил л
теле 1
% 1
мм J
Рис. 160. Этот классический опыт, поставленный А. Херши и Мартой:
Чейз, показал, что именно ДНК фага, а не его белок заражает бактерию
и обусловливает размножение фага в бактериальной клетке.
А. Сначала был получен фаг, меченный радиоактивными изотопами
серы и фосфора; к бактериям, растущим на радиоактивной среде,
добавляли нормальный фаг, и этот фаг заражал бактерии, которые, лизируясь,
освобождали уже радиоактивное фаговое потомство; путем
высокоскоростного центрифугирования радиоактивный фаг выделяли и очищали от
радиоактивной среды.
Б. Нормальные бактериальные клетки, растущие в нерадиоактивной
среде, заражали радиоактивным фагом; культуру встряхивали в смесителе
Уоринга, а затем центрифугировали при малой скорости, чтобы осадить
инфицированных бактерий. Анализ жидкости, полученной после
центрифугирования, показал, что в ней осталась почти вся радиоактивная сера.
Так как сера может содержаться только в белке фага, это означало, что
этот белок остался в культуральной среде. Анализ зараженных бактерий,
а позже и дочерних частиц меченого фага показал, что в них содержится
большая часть радиоактивного фосфора. Так как фосфор мог находиться
только в фаговой ДНК, это означало, что только ДНК родительского фага
проникла в бактериальные клетки и была передана фаговому потомству.
Вывод: гены фага, несущие информацию для синтеза всех его
компонентов, состоят из ДНК, а не из белка.
ЧТО ПРЕДСТАВЛЯЮТ СОБОЙ ГЕНЫ? 207
В БАКТЕРИЮ ПРОНИКАЕТ
ТОЛЬКО ДНК
Для своего классического опыта Херши использовал
радиоактивный фаг, полученный из бактерий, росших на среде с
радиоизотопами. К этой среде добавляли радиоактивный изотоп серы
36S или радиоактивный изотоп фосфора 32Р. Белки содержат серу,
а в ДНК ее нет; поэтому серой 35S метились только белки фага.
Между тем ДНК содержит фосфор, тогда как в белках фага
фосфора нет; поэтому фосфор 32Р включался только в ДНК фага.
Херши заражал радиоактивным фагом свежих, выращенных
на нерадиоактивной среде бактерий. После того как фаг прикреплял -
ся к бактериям, культуру подвергали обработке в специальном
приборе — смесителе Уоринга. Инфицированные бактериальные
клетки, не поврежденные этой обработкой, отделяли от жидкой
среды центрифугированием. Затем Херши определял
радиоактивность жидкости и зараженных бактерий. Оказалось, что большая
часть радиоактивной серы, т. е. фагового белка, находится в жид-
■
•*-% *М
Рис. 161. Частицы фага Т2Г
прикрепившиеся к
фрагменту стенки бактериальной
клетки. ДНК фага
содержится в его шестигранной
головке. Оболочка,
покрывающая головку, и хвост
состоят из белка. На этой
электронной
микрофотографии у двух фаговых частиц
хвосты толстые, как у фага
на рис. 154; у остальных
частиц, в том числе у
лежащей в нижнем ^правом
углу, хвосты толстые в
верхней части и тонкие в
нижней. Это объясняется темг
что внешняя оболочка
хвоста (так называемый чехол)
сократилась и частично
обнажила внутренний
стержень. Сокращение чехла
сопровождается
выталкиванием ДНК. Таким
образом, прикрепившаяся к
бактерии фаговая частица
как бы впрыскивает свою
ДНК в бактериальнуя
клетку. (С разрешению
R. W. Home.)
208 ГЛАВА 7
Рис. 162. Головка этой ча
стицы фага Т2 лопнула и
содержавшаяся в ней ДНК
освободилась в виде
необычайно длинной нити.
Обратите внимание на то, что
у этой нити только два
конца, т. е. это одна гигантская
молекула ДНК
(молекулярный вес 120 миллионов).
(А. К. Kleinschmidt et al.,
Biochim. Biophys. Acta, 61,
857 (1962); с разрешения
А. К. Kleinschmidt.)
кости, а большая часть радиоактивного фосфора, т. е. фаговой
ДНК,— в бактериях. Благодаря интенсивной обработке культуры
в смесителе белок фага отделялся от бактерий, однако это не
влияло на дальнейшее развитие инфекции. Херши выделил потомство
фагов, полученное в результате этой инфекции, и обнаружил, что
оно унаследовало значительную часть 32Р, но в нем не было и
следов 35S.
Какова роль фагового белка? Он окружает и таким образом
защищает ДНК, пока частица не натолкнется на подходящую
бактерию. Тогда с помощью белковых нитей она прикрепляется
кповзрхности бактериальной клетки. После этого белковая
оболочка фага действует подобно шприцу, впрыскивая ДНК в клетку.
На этом функции белка заканчиваются.
В бактерию проникает только ДНК — только она необходима
для превращения бактерии в мастерскую, изготовляющую
фаговые частицы. Только ДНК передается потомству. Из всего этого
был сделан единственно возможный вывод: гены фага состоят из
ДНК. А так как у фагов гены обладают теми же свойствами, что
и у других организмов, то можно думать, что все гены состоят
из ДНК.
ЧТО ПРЕДСТАВЛЯЮТ СОБОЙ.ГЕНЫ? 209
ЧТО ТАКОЕ ДНК?
В 1953 году^ ДНЩоказалась в центре внимания. Биохимики,
специалисты по рентгеноструктурному анализу и генетики
соревновались в расшифровке ее,строения.
МОЛЕКУЛЫ ДНК&КРУПНЕЕ
ВСЕХ ДРУГИХ
Высокополимерная природа ДНК была уже известна. Эвери
определил молекулярный вес трансформирующей ДНК,
выделенной им из пневмококков, и,он оказался равным около 500 000—
больше, чем почти у любого белка. В действительности, несмотря
на очень мягкую процедуру очистки, примененную Эвери,
выделенные им|молекулы были разорваны на части. Теперь известно,
что эта ДНК с молекулярным весом в полмиллиона, казавшимся
тогда огромным, представляла собой смесь обрывков
первоначальных молекул. Молекулы, у которых длина в миллион раз больше
толщины, рвутся очень легко. Для этого достаточно помешать
раствор, в котором они находятся!
Чем совершеннее становились методы, чем лучше удавалось
оберегать столь хрупкую молекулу от разрывов, тем больше
и больше становился ее молекулярный вес. Теперь известно, что
фаг Т2, на котором Херши поставил свой знаменитый опыт,
содержит всего лишь одну молекулу ДНК с молекулярным весом 120
миллионов. Бактерия, которую инфицирует этот фаг, тоже содержит
одну-единственную молекулу ДНК, но она в пятнадцать раз
больше: молекулярный вес ее около полутора миллиардов! Даже самые
крупные белковые молекулы по сравнению с таким великаном
кажутся лилипутами.
Молекула ДНК изящна и гибка — ее толщина соответствует
примерно десяти атомам. Однако это восполняется необыкновенной
длиной: если растянуть одну молекулу бактериальной ДНК, то ее
длина составит около миллиметра. Как может такая молекула
уместиться в бактериальной клетке, длина которой раз в 1000
меньше? Очень легко: ведь толщина молекулы ДНК чрезвычайно
мала, поэтому объем ее составляет всего лишь около 1/500 объема
бактериальной клетки.
ДНК-ПОЛИМЕР,
СОСТОЯЩИЙ ИЗ МОНОМЕРОВ
ЧЕТЫРЕХ ТИПОВ
ДНК состоит из структурных единиц четырех различных типов.
В состав каждой из них входит сахар дезоксирибоза, к которому
присоединены фосфатная группа и основание. Основанием может
14—0414
210 ГЛАВА 7
\~т
\-ц
ы
Рис. 163. Участок цепи
ДНК с изображением
структуры всех
оснований — Т, Ц, А и Г (тимина,
цитозина, аденина и
гуанина). Цепь состоит из
чередующихся остатков фосфата
и сахара (дезоксирибозы).
Основания присоединены
к остаткам сахара, что
схематически показано справа.
быть любая из четырех слабоосновных органических молекул:
аденин (А), цитозин (Ц), гуанин (Г) или тимин (Т). Соседние
мономеры соединены связью между сахаром одного мономера и
фосфатной группой следующего. Таким образом, ДНК представляет
собой длинную цепь, в которой чередуются остатки сахара и
фосфата, а основания присоединены сбоку к остаткам сахара.
ЧТО ПРЕДСТАВЛЯЮТ СОБОЙ ГЕНЫ? 211
В начале 50-х годов биохимик из Колумбийского университета
Эрвин Чаргафф определил состав ДНК со значительно большей
точностью, чем это делалось раньше. В своей работе он использовал
ДНК разных животных и растений и из разных тканей одного и
и того же животного. Полученные им результаты опровергли
теорию, согласно которой ДНК состоит из повторяющихся групп
типа АЦГТ-АЦГТ-АЦГТ... Он обнаружил, что содержание
четырех оснований в ДНК вовсе не соответствует соотношению
1:1:1:1. Это соотношение зависит от источника ДНК. В ДНК
человека, например, содержится около 30% А независимо от того,
получена ли она из печени, спермы или любой другой ткани, а
в ДНК туберкулезных палочек птичьего типа — всего лишь 15%.
То, что состав ДНК различен у разных организмов, но
одинаков в различных органах одного и того же организма, еще раз
подтверждало, что именно ДНК составляет химическую основу
наследственности. Данные Чаргаффа указывали также на то, что
в молекуле ДНК, по-видимому, возможна любая
последовательность оснований, а если это так, то она могла бы содержать и
информацию, необходимую для управления клеткой. Эта
информация могла бы кодироваться наподобие того, как кодируются мысли
двадцатью шестью буквами английского алфавита или точками,
тире и паузами в азбуке Морзе.
Особенно поразило Чаргаффа то, что независимо от источника
исследованной ДНК количество содержащегося в ней А всегда
было равно количеству Т, а содержание Г было всегда равно
содержанию Ц. Например, в ДНК человека оказалось 30% А, 30% Т,
20% Г и 20% Ц, а в ДНК из туберкулезных палочек птичьего
типа — 15% А, 15% Т, 35% Г и 35% Ц. Вряд ли это могло быть
простым совпадением. И действительно, это открытие послужило
ключом к разгадке структуры ДНК.
СПИРАЛЬНАЯ СТРУКТУРА ДНК
ДНК энергично изучали не только биохимики, но и
специалисты по рентгеноструктурному анализу. К 1953 году трехмерная
форма остатков оснований и сахара, а также углы, образуемые
остатками сахара, основания и фосфата, были уже хорошо
известны. Дальше, однако, возникло препятствие: ДНК не
кристаллизовалась, а только кристаллы обеспечивают получение действительно
хороших рентгенограмм.
М. Уилкинс, занимавшийся рентгеноструктурным анализом
ДНК, за неимением кристаллов изучал волокна, образованные
из ее молекул. Такие волокна получить было легко, поскольку
длинные молекулы ДНК имеют тенденцию вытягиваться друг
возле друга рядами. На основании своих данных Уилкинс
заключил, что молекула ДНК имеет спиральную, скрученную конфигу-
14*
212 ГЛАВА 7
Рис. 164. Изображение,
получаемое на
фотопластинке после прохождения
пучка рентгеновских лучей
через нить ДНК. На
основании этой
рентгенограммы М. Уилкинс смог
установить, что молекула ДНК
имеет спиральную форму,
и вычислить толщину
спирали и расстояние между
витками. (С разрешения
М. Н. F. Wilkins.)
•
рацию. Кроме того (и это очень важно), Уилкинс смог определить
общие размеры спирали, ее диаметр и расстояние между витками.
Любая детальная модель ДНК должна была соответствовать этим
размерам.
Уилкинс, работавший в Королевском колледже в Лондоне,
обсуждал свои идеи с Фрэнсисом Криком, физиком, который стал
биологом, и с молодым американским генетиком Дж. Уотсоном,
работавшим в то время вместе с Криком в Кембридже, в
нескольких часах езды от Лондона. Незадолго до этого Уотсон и Крик
разработали интереснейшую модель структуры ДНК, основанную
на данных Чаргаффа и на имевшихся ранее сведениях о
пространственной структуре сахара и оснований. Оказалось, что эта
модель прекрасно соответствует размерам, установленным Уил-
кинсом! В 1953 году модель Уотсона и Крика, опубликованная
рядом с результатами Уилкинса, взбудоражила и вдохновила
биологов во всем мире.
ДВЕ КОМПЛЕМЕНТАРНЫЕ
ЦЕПИ ДНК
Уотсон] и Крик предположили, что молекула ДНК состоит не
из одной цепи, а из двух параллельных цепей. Обвивая друг
друга, эти цепи образуют знаменитую двойную спираль Уотсона
и Крика. Однако самое интересное в этой структуре — не
спиральная конфигурация, а отношение комплементарности
(взаимодополнительности) между двумя цепями: основанию А в одной цепи
всегда соответствует Т в другой, а против основания Г всегда стоит Ц.
Ф» «т
'Ш* «s£
Ж X
, ж ж
т*» «#0-
шт- *Ш*:''
г^^^^^Ш^Ш.-:
чщВВР^
ЧТО ПРЕДСТАВЛЯЮТ СОБОЙ ГЕНЫ? 213
ННН jSSSk^ji
^т
Щ у
Рис. 165. М. Уилкинс (род. в 1916 г.) с аппаратом^для рентгеноструктурного
анализа, который был им использован для определения структуры ДНК.
(С разрешения Central Office of Information.)
Рис. 166. Дж. Д. Уотсон (род. в
1928 г.) был молодым стажером, когда
он и Фрэнсис Крик (род. в 1916 г.)
предложили модель структуры ДНК,
которую теперь называют моделью
Уотсона и Крика. Уотсон был по
образованию генетиком, а Крик — физиком.
Их взаимодополняющая подготовка как
нельзя лучше соответствовала
поставленной задаче — определить структуру
генетического материала. В 1962 году
Уотсону, Крику и Уилкинсу за
сделанное ими важное открытие была
присуждена Нобелевская премия по
медицине и физиологии. (С разрешения
J. D. Watson.)
214 ГЛАВА 7
ж
Ль
■ч, ** ,
х &■
Г1
ч
*
^ай
1к#
t
.# ;
>
#ф»
"' *#Й
м
щ
< К*'
«** ..
* 1
?*£ •
41 **
щ
,
'л. ■£
С % "
-*з|ч&?*
J* **
L* *# >
^ ^ 1С
**¥*
Щ ъ
^% ^>й*
J* *■#$ ,
>*♦#.
>' '"*'' «Ж ■•
**$ #
* ■&»*#*,
^| %%
■#Щ <*
% Ь # т
т - Jr% "■
^Щ Ь
\**Л
"■*/ $
% »^f#»
Рис. 167. А. Пространственная модель
структуры ДНК. Б. Проекция этой
модели на плоскость. Сахарно-фосфатные
цепи обвивают друг друга, образуя
знаменитую двойную спираль. (С
разрешения М. Н. F. Wilkins.)
Поэтому, скажем, группе оснований АЦГТТ в одной цепи
всегда будет соответствовать последовательность ТГЦАА в другой.
Поскольку основания А и Т всегда спарены, так же как и
основания Г и Ц, количество А в молекуле ДНК всегда будет равно
количеству Т, а количество Г — количеству Ц. Таким образом,
удивительная особенность состава ДНК, открытая Чаргаффом,
нашла свое объяснение.
Но почему же именно эти пары, а не какие-нибудь другие?
Дело в том, что именно в таких комбинациях основания хорошо
«подходят» друг к другу: А очень точно соединяется с Т двумя
водородными связями, а Г с Ц — тремя водородными связями.
Пары оснований лежат между сахарно-фосфатными каркасами
двух цепей, подобно ступенькам винтовой лестницы, и, что очень
важно, обе пары, А-Т и Г-Ц, образуют «перекладины» одинаковой
длины. Другие были бы слишком длинны или слишком коротки
и искривили бы всю лестницу.
ЧТО ПРЕДСТАВЛЯЮТ СОБОЙ ГЕНЫ? 215
Т= А А
ц = г ч
г = ц-\
А=Т \
Рис. 168. Две комплементарные цепи двухцепочечнои ДНК соединены друг
с другом водородными связями. Между тимином (Т) и аденином (А) две
такие связи, а между цитозином (Ц) и гуанином (Г) — три. Справа — схема
структуры2двухцепочечной ДНК.
Водородные связи между членами пар А-Т и Г-Ц удерживают
две цепи ДНК вместе и, кроме того, обеспечивают правильное
спаривание оснований. Благодаря этим связям ДНК оказывается
единственной известной молекулой, способной к самоудвоению.
ДНК И ГЕНЕТИКА
В своей статье о возможной структуре ДНК Уотсон и Крик
сделали следующее скромное замечание: «От нашего внимания не
ускользнуло, что постулируемое нами специфическое спаривание
оснований прямо наводит на мысль о возможном механизме
копирования генетического материала». Каков же этот механизм,
с помощью которого дочерняя клетка получает точную копию
генетического материала (т. е. ДНК) родительской клетки? Механизм
этот заключается в следующем. Две нити двухцепочечнои
родительской молекулы разъединяются; затем к каждой из них
синтезируется комплементарная ей новая цепь. В результате вместо
одной двухцепочечнои молекулы мы имеем две, причем каждая из
них — точная копия родительской и каждая содержит по одной
родительской цепи (рис. 169).
Обычно дочерняя клетка получает точные копии всех
родительских генов, хотя изредка возникают мутации. Обычно две новые
К цепи
д< К цепи
К цепи (а
216 ГЛАВА 7
Рис. 169. Комплементарность
оснований в двух цепях ДНК сразу же
навела Уотсона и Крика на мысль
о возможном механизме репликации
генетического материала: цепи
разъединяются, а затем последовательность
оснований в каждой из двух цепей
определяет последовательность
оснований в новой комплементарной
цепи*
А =
Ц =
•Г =
Т =
Т =
Ц =
-А = Т-
-Ц=Г-
-г = ц-
-Т = А-
-Т = А -
= Т
= Г
= ц
= А
= А
= Г
А = Т
[-Т=А
ЬТ = А
А = Т
ЦнГ
1-ГеЦ-
Lt=A-
Lt = A-
молекулы ДНК представляют собой точные копии родительской
молекулы, хотя изредка случаются и ошибки. Химические
свойства оснований не исключают образования (в чрезвычайно редких
случаях) водородных связей между А и Ц или между Г и Т, так
что иногда могут возникать «ошибочные» пары. Если молекула
ДНК с такой «ошибочной» парой реплицируется, то две дочерние
молекулы уже не будут идентичными: в ]том месте, где в одной из
них образуется пара А-Т, в другой будет |пара Г-Ц. Уотсон и Крик
высказали предположение, что в основе феномена, который
генетики называют мутацией, по крайней мере в некоторых случаях
лежат ошибки в образовании пар (рис. 170).
ЧТО; ПРЕДСТАВЛЯЮТ СОБОЙ ГЕНЫ? 217
ГА =
г Це
[■ г =
Гц~
гт =
-ц =
: т 1
■ г н
= ц I
=АЧ
А Н
г -I
А =
Ц =
Г =
ащ
т =
ц=
1
А = Т -1
Ц=М
г^цН
Ц = Н
Т =А-|
Ц =
М
= т I
ЕГ I
^ц I
= А I
= АН
hA =
гUi
ГГе
гт=
гт=
hU =
= Т-
5Г 1
ЕЦ 1
= АЧ
:/Н
5 Г* —|
Рис. 170. Уотсон и Крик
высказали предположение, что некоторые
мутации иогут быть вызваны
ошибками, возникающими в процессе
репликации. Так, на этом рисунке
показан случай, когда против
аденина (А) ошибочно присоединился
цитозин (Ц). При репликации такой
ДНК будут построены две дочерние
молекулы, различающиеся одной
парой оснований: там, где в одной
молекуле находится пара Ц-Г, (1в
другой будет пара А-Т.
Каким же образом действуют гены? Генетики провозгласили:
один ген — один белок. Но как ДНК может определять структуру
белка? Чередование оснований в ДНК кодирует
последовательность аминокислот в белке. В ДНК всего лишь четыре вида
оснований, в расположении которых должна быть зашифрована
последовательность двадцати различных аминокислот в белке.
Очевидно, что каждую аминокислоту должна кодировать группа из
нескольких оснований, подобно тому как группа точек и тире
кодирует каждую букву алфавита.
В последовательности оснований ДНК зашифрована
генетическая информация клетки. Каков объем этой информации? В каж-
218 ГЛАВА 7
Рис. 171. Отрезок молекулы ДНК,
увеличенный в 7,3 миллиона раз.
Видны цепи, скрученные в двойную
спираль. (С разрешения J. Griffith
и J. Bonner.)
дой клетке нашего тела 46 хромосом. Общая длина всех молекул
ДНК, содержащихся в этих 46 хромосомах, составляет почти два
метра! Если бы здесь были закодированы не аминокислоты, а
английские буквы, то ДНК одной клетки хватило бы для того, чтобы
зашифровать около 1000 полновесных томов. Как заметил
Фрэнсис Крик, вот сколько информации нужно для создания организма,
способного размышлять о самом себе!
Структура ДНК, материального носителя наследственности,—
это ключ к пониманию химии жизни. Изучение этой структуры,
столь очевидно и тесно связанной с функциями генов,
несомненно, способствовало решению многих вопросов — как
воспроизводятся гены, какова природа мутаций, каким образом гены
определяют структуру белка и т. п. Однако все ответы, подсказанные
знанием структуры ДНК, представляли собой новые гигантские
проблемы, поскольку функция ДНК оставалась, а отчасти и сейчас
остается не разгаданной во многих деталях и, кроме того, все эти
ответы требовали экспериментального подтверждения. Раскрытие
структуры ДНК вызвало лавину биологических исследований;
важнейшие из полученных результатов будут описаны в
последующих главах.
8
РЕПЛИКАЦИЯ
И РЕКОМБИНАЦИЯ
ДНК
Живым организмам свойственны рост и размножение.
Бактериальная клетка растет, затем делится, и возникают две новые
бактерии. Оплодотворенное яйцо начинает делиться и делится до
тех пор, пока не исполнятся все предначертания, записанные
в хромосомах, и не будет создан еще один человек.
Для размножения необходимо, чтобы все «рабочие чертежи»
индивидуума и вида передавались невредимыми от клетки к
клетке, от поколения к поколению. Эти чертежи — не что иное, как
набор генов, поэтому при клеточном делении каждая дочерняя
4?^ ^*
Рис. 172. Делящиеся
клетки сига. Без деления клеток
поддержание жизни на
Земле было бы
невозможным. Деление должно
сопровождаться удвоением
всех генов, с заключенными
в них «рабочими чертежами»
клетки. Гены объединены
в хромосомы. На этой
микрофотографии видны
фигуры, образуемые
хромосомами на разных
стадиях митоза. (С
разрешения «Turtox Collection»,
С.С.М. General Biological,
Inc.)
220 ГЛАВА 8
клетка должна быть обеспечена копиями, или точными
дубликатами, всех генов. Как же снимаются копии с генов? Гены — это
ДНК; как происходит ее удвоение, или репликация?
КАК ПРОИСХОДИТ
РЕПЛИКАЦИЯ ДНК?
Когда Уотсон и Крик разработали модель структуры ДНКГ
им казалось, что они нашли ответ на этот вопрос. Две
комплементарные цепи разъединяются; каждая из них служит матрицей для
синтеза дополняющей ее новой (комплементарной) цепи; таким
образом возникают две молекулы ДНК там, где раньше была только
одна; каждая из этих молекул идентична исходной, родительской
молекуле и каждая содержит одну новую цепь и одну старую,
родительскую цепь. Эта схема Уотсона — Крика была названа по-
луконсервативной, поскольку в каждой из дочерних молекул
сохранялась («консервировалась») в неизмененном виде одна из
половинок родительской молекулы.
Но так ли происходит репликация ДНК в действительности?
Может быть, она осуществляется консервативным путем, т.е.
одна из дочерних молекул синтезируется полностью заново, а
другая представляет собой просто никак не измененную
родительскую молекулу? Или, быть может, ДНК реплицируется диспер-
сивно — родительская молекула распадается на мелкие
фрагменты, которые вместе с вновь синтезированными кусочками
включаются в дочерние молекулы? Наконец, можно представить себе
и другие способы удвоения ДНК.
Действительный механизм репликации можно было выяснить
только экспериментальным путем. Однако придумать такой
эксперимент, который позволил бы ясно различить консервативный,
полуконсервативный и дисперсивный способы репликации, не
так легко.
При всех трех способах репликации дочерняя ДНК состоит
из равных количеств родительской и вновь синтезированной ДНК.
Различно только распределение родительской ДНК в дочерних
молекулах: при консервативной репликации половина дочерних
молекул построена полностью из нового материала и половина —
полностью из старого; при полуконсервативной и дисперсивной
репликации каждая из дочерних молекул строится наполовину [из
старого материала, наполовину из нового. Однако
полуконсервативную и дисперсивную схемы можно различить после
репликации дочерних молекул: при полуконсервативной репликации 50%
Полуконсервативная
репликация
Родительские
молекулы ДНК
консервативная
репликация
Диспёрсивнай
репликация
1-е поколение
дочерних
молекул
2-е
поколение
дочерних молекул\
Рис. 173. Три возможных механизма репликации ДНК. Уотсон и^Крик предположили, что ДНК реплицируется
полу консервативным способом: две комплементарные цепи родительской молекулы разъединяются, и каждая служит
матрицей для синтеза новой комплементарной цепи; поэтому каждая дочерняя молекула [состоит из одной «старой»
цепи и одной вновь синтезированной. При [консервативной репликации родительская молекула сохраняется
полностью и становится одной из дочерних молекул, а обе цепи другой дочерней молекулы синтезируются вновь. При
ёисперсивном способе репликации родительская ДНК; распадается на фрагменты, которые включаются в обе
дочерние молекулы, объединяясь с вновь синтезированными участками.
3
а
н
>
я
»
я
§
И
S
I
в
X
3=)
я
to
222 ГЛАВА 8
дочерних молекул второго поколения будет состоять наполовину
из нового, наполовину из старого материала (как и молекулы
первого поколения), а другие 50% — полностью из нового материала;
при дисперсивной репликации все молекулы второго поколения
будут содержать одну четверть старого материала и три четверти
нового (рис. 173).
РЕПЛИКАЦИЯ
БАКТЕРИАЛЬНОЙ ДНК
Для того чтобы выяснить способ репликации ДНК, нужно было
найти метод, позволяющий отличать родительскую ДНК от вновь
синтезированной и разделять молекулы в зависимости от
содержания в них старого и нового материала. В 1957 году Мэтт Меселсон
и Фрэнк Сталь в Калифорнийском технологическом институте
поставили необыкновенно изящный опыт, решивший этот вопрос.
Меселсон и Сталь выращивали бактерии на синтетической
питательной среде с сульфатом аммония [(NH4)2S04], содержавшим
изотопную метку: обычный изотоп азота 14N был заменен
стабильным «тяжелым» изотопом 16N. ДНК содержит атомы углеродаг
кислорода, водорода, фосфора и азота. Примерно 15% ее веса
приходится на долю азота. При замене азота с атомным весом 14
на азот с атомным весом 15 получается «тяжелая» ДНК,
плотность которой почти на 1 процент больше, чем у обычной «легкой»
ДНК. Меселсон и Сталь изучили распределение «тяжелой» ДНК
в молекулах первого и второго поколений, синтезированных
после переноса бактерий из питательной среды с 15N в среду с
обычным азотом (14N).
В случае полуконсервативной репликации по схеме Уотсона
и Крика следовало ожидать, что после удвоения числа бактерий
в питательной среде с 14N все родительские молекулы ДНК с
двумя «тяжелыми» цепями исчезнут и будут заменены новыми — с
одной «тяжелой» родительской цепью и одной «легкой»,
синтезированной вновь. По своей плотности такие «гибридные» молекулы
должны занимать промежуточное положение между «тяжелыми» и
«легкими», т. е. должны быть на полпроцента легче «тяжелой»
родительской ДНК (см. рис. 173).
Если бы репликация происходила по дисперсивной схеме,
результаты были бы те же: все дочерние молекулы ДНК оказались
бы гибридными, т. е. имели бы промежуточную плотность (хотя
в этом случае они состояли бы не из одной «тяжелой» цепи и одной
«легкой», а из двух цепей с перемежающимися «легкими» и
«тяжелыми» участками).
РЕПЛИКАЦИЯ И РЕКОМБИНАЦИЯ ДНК 223
При репликации по консервативной схеме первое дочернее
поколение состояло бы из равных количеств «тяжелой»
родительской ДНК и вновь синтезированной «легкой» ДНК. Плотность
этих двух видов молекул различалась бы на 1 процент.
ЦЕНТРИФУГИРОВАНИЕ
В ГРАДИЕНТЕ ПЛОТНОСТИ
Но как можно распознать два типа молекул, если различие
в их плотности составляет всего лишь полпроцента или хотя бы
1 процент? Меселсон и Сталь вместе с Джеромом Виноградом
блестяще решили эту проблему. Они использовали улътрацентри-
фугу. У обычной центрифуги скорость вращения ротора не
превышает нескольких тысяч оборотов в минуту. При таких скоростях:
под действием центробежной силы осаждаются лишь относительно
крупные объекты (например, бактерии). Ротор ультрацентрифуги
делает 50 000 и больше оборотов в минуту; при такой скорости
могут осаждаться уже гораздо более мелкие частицы, даже такиег
как молекулы ДНК.
Молекулы солей в ультрацентрифуге не осаждаются, однако
и они испытывают действие центробежной силы; поэтому их
концентрация возрастает по направлению к дну центрифужной
пробирки. Этим и воспользовались Меселсон, Сталь и Виноград. Ведь
если увеличивается концентрация соли, то в том же направлении
возрастает и плотность раствора. Значит, при
ультрацентрифугировании солевого раствора создается градиент плотности. На
этой основе и был разработан метод, позволяющий разделять даже
мало различающиеся по плотности молекулы ДНК.
Исследователи взяли раствор хлористого цезия (CsCl; это
аналог хлористого натрия, NaCl, т. е. поваренной соли) такой
концентрации, чтобы его плотность была равна плотности ДНК.
После центрифугирования этого раствора при высокой скорости
в течение нескольких часов в нем устанавливался градиент
плотности: в середине пробирки плотность раствора не изменялась, но
выше этой зоны она уменьшалась, а ниже — увеличивалась.
Если раствор содержал не только хлористый цезий, но и ДНКГ
то в процессе установления градиента ДНК, находившаяся в
верхней части пробирки, оказывалась в растворе с плотностью
меньшей, чем ее собственная, и поэтому начинала как бы тонуть,
двигаясь по направлению к дну пробирки. ДНК, находившаяся на
дне пробирки, оказывалась в среде, плотность которой выше ее
собственной, и поэтому она всплывала, подобно сливкам, вверх.
В конце концов вся ДНК, вначале равномерно распределенная
по всему объему раствора, концентрировалась в узкой зоне в
средней части пробирки, где плотность среды была равна плотности
Ячейка
Ротор
Рис. 174. Аналитическая ультрацентрифуга вроде той, какой пользовались Меселсон, Сталь и Виноград при
изучении репликации ДНК. Исследуемый раствор помещают в ячейку, зажатую между двумя стеклянными дисками
(на рисунке не показаны). Ячейку вставляют в гнездо ротора, подвешенного на струне в левой части центрифуги
В аналитической центрифуге раствор можно фотографировать во время вращения ротора, чтобы непосредственно
наблюдать за процессом седиментации (осаждения) изучаемого материала. В этом объемистом аппарате большую
часть внутреннего пространства занимают мотор, вакуумная и оптическая системы. (С разрешения Beckman In-
Зьгитепьз, inc.)
Центр вращения
Рис. 175. Образование градиента плотности. Сначала в центрифугу
помещают однородный солевой раствор (4). Центрифугирование его при высоких
скоростях вращения ротора ведет к частичному смещению соли в сторону дна
ячейки (Б). Создается градиент концентрации (а значит, и плотности)
раствора: по направлению к дну ячейки концентрация соли постепенно возрастает,
в сторону центра вращения — уменьшается, а где-то в середине ячейки
остается такой же, какой была вначале.
Часы
о Г
2>{
I
4,3
6,4
I
10,7;
■щщ
14,9 ^
f?,i
19,2
21,3
23,5
36,5
43,5
Рис. 176. Серия фотографий
центрифужной ячейки,
сделанных в разное время при
вращающемся роторе.
Можно видеть постепенное
концентрирование ДНК в
градиенте плотности
хлористого цезия. По мере того как
формируется градиент
концентрации соли, ДНК
собирается в узкой зоне,
где плотность раствора
соли равна плотности самой
ДНК, в данном случае в
середине ячейки. (С
разрешения М. Meselson.)
15-0414
226 ГЛАВА 8
Рис. 177. Зоны
концентрирования «тяжелой» и «легкой»
ДНК. Молекулы «легкой»
(с 14N) и «тяжелой» (с 16N)
ДНК собираются в разных
зонах градиента плотности
хлористого цезия. А.
Фотография вращающейся
ячейки. Б. Кривая оптической
плотности (денситограмма),
снятая с этой фотографии
при помощи денситометра
и позволяющая рассчитать
количество ДНК в каждой
зоне. (С разрешения М.
Meselson.)
самой ДНК. Молекулы ДНК с несколько иной плотностью
концентрировались немного выше или ниже этой зоны.
Если плотность первоначального раствора хлористого цезия,
а значит, и плотность раствора в средней части пробирки (после
центрифугирования) будет равна плотности «тяжелой» 151М-ДНК,
то эта «тяжелая» ДНК соберется в средней части пробирки.
«Легкая» 141Ч-ДНК сконцентрируется в зоне, расположенной
несколько выше зоны «тяжелой» ДНК, поскольку ее плотность немного
меньше. «Гибридная» ДНК с промежуточной плотностью займет
промежуточное положение между зонами «тяжелой» и «легкой»
ДНК
ПОЛУКОНСЕРВАТИВНАЯ
РЕПЛИКАЦИЯ
ДНК У БАКТЕРИЙ
Усовершенствование этого нового метода, названного
центрифугированием в градиенте плотности, позволило доказать
полуконсервативный характер репликации ДНК. Так спустя четыре
года предположение Уотсона и Крика подтвердилось. *
Из бактерий, размножавшихся в течение нескольких
поколений в питательной среде с 16N, выделяли «тяжелую» ДНК. Это
была родительская ДНК высокой плотности. Другую культуру
бактерий, росших в тех же условиях, переносили в питательную
среду с обычным изотопом 14N. Через различные промежутки
времени часть растущих бактерий изымали и экстрагировали из них
ДНК. Полученную ДНК исследовали в градиенте плотности.
В этих опытах Меселсон и Сталь обнаружили, что чем дольше
размножались бактерии в среде с легким изотопом, тем меньше они
содержали «тяжелой» ДНК и тем больше появлялось ДНК с
промежуточной плотностью. После одной смены поколений, т. е.
после того, как число бактерий, перенесенных в «легкую» среду,
РЕПЛИКАЦИЯ И РЕКОМБИНАЦИЯ ДНК 227
'NS ОПЫШ:-
Поколения
\
;
щ
1
г
I
II
11
ж Ш
'■
/к •
з,с
1 11 О и 1,9,
И снЕшаяы
z О и 4.1,
1 смешаны
Рис. 178. Этот эксперимент показал, что бактериальная ДНК реплицируется
полуконсервативным способом, как это и предполагали Уотсон и Крик.
Бактерий выращивали на «тяжелой» питательной среде, а потом переносили на
«легкую» среду (с этого момента и ведется счет поколений). Затем в различные
сроки отбирали пробы растущей культуры; с помощью ультрацентрифуги-
рования бактериальной ДНК в градиенте плотности хлористого цезия
определяли ее плотность, а значит, и содержание в ней «тяжелой» родительской
ДНК. В начале опыта («нулевое» поколение) вся ДНК была «тяжелой» (на
рисунке плотность увеличивается слева направо). После того как количество
бактерий удвоилось на «легкой» среде (время одного поколения), «тяжелую»
ДНК полностью заменила ДНК, состоящая наполовину из родительских,
наполовину из вновь синтезированных цепей: об этом говорит ее
промежуточная плотность. Некоторое количество такой «гибридной» ДНК оставалось
и в дальнейшем, но наряду с ней появилась «легкая», полностью вновь
синтезированная ДНК, относительная доля которой постепенно возрастала.
(С разрешения М. Meselson.)
удваивалось, «тяжелая» ДНК полностью замещалась гибридной.
При дальнейшем размножении бактерий в «легкой» среде наряду
с ДНК, имеющей промежуточную плотность, появлялась «легкая»
ДНК, причем ее относительное количество неуклонно возрастало
(рис. 178). «Эти результаты,— писали Меселсон и Сталь в своем
очень осторожном заключении,— позволяют сделать следующие
15*
228 ГЛАВА 8
выводы относительно репликации ДНК в условиях настоящего
опыта:
1. Азот молекулы ДНК распределен поровну между двумя
субъединицами, которые сохраняются неизмененными в течение
многих поколений.
2. В процессе репликации каждая дочерняя молекула получает
одну родительскую субъединицу.
Результаты настоящего опыта находятся в полном
соответствии с ожиданиями, (основанными на модели репликации ДНК
Уотсона и Крика».
РАСКРУЧИВАНИЕ ДНК
С репликацией молекул ДНК связан ряд сложных, в основном
еще не решенных проблем. Как, например, разъединяются две
родительские цепи?
Разъединение двух цепей ДНК — задача не такая простая,
потому что эти цепи закручены одна вокруг другой, как два
провода в электрическом шнуре. Если разделить концы проводов
Рис. 179. Для репликации
ДНК необходимо, чтобы цепи
родительской молекулы
разъединились. Поскольку в двух-
цепочечной молекуле цепи
обвивают друг друга, их
разъединение должно
сопровождаться вращением еще не
раскрученной части молекулы.
РЕПЛИКАЦИЯ И РЕКОМБИНАЦИЯ ДНК 229
и потянуть их в разные стороны, шнур начнет вращаться и
каждому его обороту будет соответствовать один расплетенный виток.
Чтобы две цепи ДНК разъединились, ее молекула должна быть
раскручена примерно таким же образом; в случае бактериальной
ДНК для этого потребуется почти полмиллиона оборотов!
В начале 70-х годов у фагов, у бактерий и в животных клетках
был найден особый «расплетающий» фермент. Этот фермент
раскручивает двухцепочечную ДНК и вытягивает родительские цепи,
подготавливая их к репликации. Существует ли какое-нибудь
специальное приспособление, которое не позволяло бы
крутящемуся концу молекулы хлестать по всему окружающему во время
репликации ДНК? Пока ничего такого не найдено.
ФЕРМЕНТАТИВНЫЙ
СИНТЕЗ ДНК
Каждая цепь ДНК имеет определенную ориентацию из-за
асимметрии молекул сахара, входящих в состав сахарно-фосфатного
остова (идти от первого углеродного атома сахара к пятому — не
то же самое, что от пятого к первому, так же как идти от большого
пальца к мизинцу — не то же самое, что от мизинца к большому
пальцу). Две комплементарные цепи идут в молекуле ДНК в
противоположных направлениях — одна «вверх», другая «вниз».
Поэтому при репликации молекулы ДНК две новые цепи тоже
должны иметь разное направление: новая цепь, комплементарная
цепи, направленной «вниз», должна быть направлена «вверх», и
наоборот.
Может ли один фермент синтезировать новые цепи ДНК в
обоих направлениях? Это кажется маловероятным. Пока найден
только один фермент, синтезирующий ДНК, и он способен
осуществлять полимеризацию оснований только в одном
направлении.
Здесь не было бы никакой проблемы, если бы две родительские
цепи полностью разделялись до начала репликации. Тогда
фермент, синтезирующий ДНК, мог бы начать полимеризацию
оснований на одной из родительских цепей с одного конца, а на
другой — с другого, синтезируя таким образом обе цепи в одном
направлении (по отношению к их собственной структуре)
(рис. 180, А). Однако в действительности новые цепи обычно
строятся одновременно с разъединением двух старых цепей, и
поэтому одна из них должна синтезироваться по направлению «вверх»,
а другая — «вниз».
Каким образом это происходит? Может быть, одна из новых
цепей синтезируется небольшими отрезками, по мере того как ро-
230 ГЛАВА 8
II
А Б В
Рис. 180. Структурно две комплементарные цепи ДНК ориентированы
противоположно друг другу. Поэтому при удвоении молекулы новые цепи также
должны идти в разных направлениях. Это не создавало бы проблемы, если
бы перед репликацией цепи родительской молекулы полностью
разъединялись {А). В этом случае один и тот же фермент мог бы осуществлять синтез
обеих новых цепей в одном направлении (по отношению к их структуре):
одна цепь синтезировалась бы с одного конца, а другая — с
противоположного конца. Бели же синтез новых цепей начинался бы еще до полного их
разъединения, со свободных концов {Б), то для этого потребовались бы два
фермента, так как в этом случае одна из новых цепей синтезировалась бы в
одном направлении (по отношению к ее структуре), а другая — в
противоположном. В действительности существует, по-видимому, только один фермент;
поэтому возможно, что в большинстве случаев одна из новых цепей
синтезируется целиком, тогда как синтез другой новой цепи химически
ориентирован в том же направлении, но осуществляется по частям (В): родительские
цепи разъединяются на некоторое расстояние, и сразу же синтезируется
фрагмент новой цепи; разъединение идет дальше — синтезируется следующий
фрагмент и т. д.
дительские {цепи разъединяются? Это кажется правдоподобным,
но для окончательного решения вопроса нужны дополнительные
данные о ферментах, участвующих в синтезе ДНК. Пока,
несмотря на интенсивные исследования, об этих важных ферментах
известно очень немногое.
В 1956 году Артур Корнберг открыл фермент, по-видимому,
синтезирующий ДНК. Этот фермент, названный ДНК-полимера-
зой, был найден во всех клетках. В пробирке он полимеризовал
основания и таким образом синтезировал новую ДНК только в
присутствии уже готовой ДНК — модели для нового синтеза.
Фермент Корнберга часто вызывал образование разветвленных цепей
ДНК и никогда не синтезировал биологически активной ДНК.
Некоторые скептики сомневались в том, что именно он
осуществляет синтез ДНК в клетке, но другого фермента никто не мог
найти.
В 1970 году Джон Кэрнс обнаружил мутантную форму
бактерий, полностью лишенную ДНК-полимеразы Корнберга, но не
РЕПЛИКАЦИЯ И РЕКОМБИНАЦИЯ ДНК 231
потерявшую способности к нормальному синтезу ДНК. Очевидно,
что фермент Корнберга не синтезирует ДНК в клетках; сейчас
предполагают, что он относится к группе ферментов, участвующих
в восстановлении молекул ДНК, поврежденных, например,
ультрафиолетовым или космическим излучением.
Где же тогда находится настоящая ДНК-полимераза? Надежно
прикрепленная к клеточной мембране, она ускользала от всех
попыток ее обнаружить вплоть до 70-х годов. Сейчас,
по-видимому, выясняется, что ДНК скорее всего синтезирует группа
ферментов, организованных в сложный, многофункциональный
механизм репликации ДНК. Какова роль отдельных компонентов
этого механизма, пока неизвестно.
ФОРМА
РЕПЛИЦИРУЮЩЕЙСЯ
ДНК
В 1963 году Джону Кэрнсу удалось, как он выразился,
застигнуть интактную молекулу бактериальной ДНК в момент ее
репликации. Кэрнс использовал метод радиоавтографии, при котором
молекула ДНК оставляет свой отпечаток на фотопластинке.
Кэрнс приготовил радиоактивную ДНК, выращивая бактерий
на питательной среде, к которой был добавлен тимин
(специфическое для ДНК основание), меченный тритием — радиоактивным
изотопом водорода. ДНК, синтезированная бактериями в этих
условиях, содержала радиоактивный тимин. Эту ДНК осторожно
распределяли на предметном стекле, которое затем покрывали
фотоэмульсией и выдерживали в темноте в течение двух месяцев.
Распадавшиеся за это время атомы трития «засвечивали»
отдельные зерна эмульсии. После проявления можно было видеть под
микроскопом цепочки из мелких черных точек — изображения
радиоактивных молекул ДНК.
БАКТЕРИАЛЬНАЯ ДНК:
КОЛЬЦО С ПЕТЛЕЙ
Линейная молекула ДНК, застигнутая во время акта
репликации, должна была бы иметь форму буквы Y. Однако Кэрнс
обнаружил вместо этого кольцо с петлей. Длина окружности таких колец
составляла около миллиметра. Из этого Кэрнс заключил, что
обнаруженная им структура соответствует всей бактериальной
хромосоме, которая, таким образом, состоит из одной кольцевой
молекулы ДНК с молекулярным весом около 2 миллиардов.
232 ГЛАВА 8
Рис. 181. Джон Кэрнс обнаружил, что бактериальная ДНК представляет
собой кольцевую молекулу. Во время репликации такой молекулы образуется
петля. Бактерий выращивали в присутствии тимина, меченного тритием;
затем выделяли из таких бактерий ДНК и расправляли ее молекулы на
фотопленке. Распадающиеся атомы трития «засвечивали» фотоэмульсию. На
проявленной пленке молекула ДНК отображалась в виде цепочки из черных
точек. (На помещенной вверху схеме пунктиром обозначен участок, где черные
точки лежат менее густо; это та часть молекулы, в которой только одна цепь
содержит тритий.) (С разрешения J. Cairns.)
Кэрнс предположил, что репликация этого гигантского кольца
начинается в какой-то определенной точке — точке инициации,
а затем этот процесс идет по кругу в одном направлении, пока
вновь не возвратится к исходному пункту. Сейчас, однако,
кажется более вероятным, что процесс репликации идет от точки
инициации в обоих направлениях.
РЕПЛИКАЦИЯ И РЕКОМБИНАЦИЯ ДНК 233
Начальная
тонка
Начальная
точка
Рис. 182. Процесс репликации кольцевой молекулы ДНК может идти по
кругу либо в одном направлении (4), либо в обоих направлениях (Б) от
начальной точки.
КОЛЬЦЕВАЯ ДНК
И РЕПЛИКАЦИЯ
ПО ПРИНЦИПУ
«РАЗМАТЫВАЮЩЕГОСЯ
РУЛОНА»
К концу 60-х годов, в значительной мере благодаря разработке
новых методов приготовления препаратов ДНК для электронной
микроскопии, стало очевидно, что кольцевая структура
характерна для многих молекул ДНК. Кольцевой формой обладает не
только бактериальная ДНК, но и ДНК различных фагов, многих
вирусов животных, а также ДНК, содержащаяся в митохондриях.
ДНК фага, называемого фагом лямбда, имеет линейную формуг
Соединяющий
фермент
Рис. 183. ДНК фага лямбда, пока она находится в фаговой частице,
представляет собой линейную структуру. Будучи «впрыснута» в бактериальную
клетку, она приобретает кольцевую форму благодаря наличию у нее «липких»
концов: на каждом конце одна из цепей длиннее другой, и эти свободные
концевые участки комплементарны друг другу. В результате спаривания
оснований они «слипаются», и молекула замыкается в кольцо. Это происходит
при участии особого фермента.
234 ГЛАВА 8
Рис. 184. Молекула ДНК
фага лямбда в процессе
репликации. Она имеет
форму, открытую Кэрн-
сом, — образует кольцо с
петлей. (Электронная
микрофотография; с
разрешения D. Dressier.)
пока она находится в фаговой частице, но замыкается в кольцо,
когда попадает в бактериальную клетку (рис. 183).
Для образования кольца имеется особое приспособление. На
каждом конце линейной молекулы одна из цепей несколько
длиннее другой, так что 12 оснований остаются неспаренными. Такие
одноцепочечные участки на обоих концах молекулы
комплементарны друг другу. Поэтому в результате спаривания оснований
одноцепочечный участок одного конца «слипается» с таким же
участком, находящимся на другом конце. Специальный фермент
завершает образование правильной двухцепочечной кольцевой
структуры.
Обнаруженная Кэрнсом фигура — кольцо с петлей — хорошо
объясняет механизм репликации ДНК у бактерий, некоторых
фагов и вирусов животных. Репликация ДНК других фагов, а также
бактериальной ДНК во время конъюгации (спаривания) бактерий,
по-видимому, лучше соответствует другой схеме, предложенной
в 1968 году Давидом Дресслером и Уолтером Гилбертом из
Гарвардского университета и названной ими репликацией по
принципу «разматывающегося рулона».
В этой схеме кольцевая форма молекулы ДНК становится уже
обязательным условием репликации. Суть этой модели состоит
в следующем. Одна из цепей реплицирующейся молекулы ДНК
РЕПЛИКАЦИЯ И РЕКОМБИНАЦИЯ ДНК 235
Рис. 185. Репликация ДНК по принципу разматывающегося рулона. Одна
цепь двухцепочечной кольцевой молекулы ДНК разрывается, и один из ее
концов отделяется от другой цепи. Новые цепи ДНК синтезируются на
обнажившейся части кольца и на отделяющемся от конца участке; в последнем
случае новая цепь синтезируется отдельными кусочками, которые затем
соединяются.
все время сохраняет форму кольца. Другая цепь разрывается
в определенном месте — в точке «старта». Один из образовавшихся
концов этой цепи отслаивается от кольца и служит матрицей для
синтеза новой цепи. С другого конца разорванная цепь все время
наращивается, причем матрицей здесь служит обнажающаяся
часть кольцевой цепи (рис. 185).
Такая схема помогает объяснить ряд интересных наблюдений.
Например, фаг фХПА содержит одноцепочечную кольцевую
молекулу ДНК. После ее проникновения в бактериальную клетку на
ней синтезируется комплементарная цепь, так что молекула
становится двухцепочечной. Эта новая цепь начинает действовать
^^Cvk:v;-.^vi\4;<^\^^^St^ VAC
£-£—^ ; ^-^J
Рис. 186.
Реплицирующаяся ДНК фага фХ174 —
двухцепочечное кольцо
с одноцепочечным
«хвостом». Хвост непрерывно
сходит с кольца, а новая
ДНК, комплементарная
кольцу, синтезируется на
его обнажающемся участке;
таким образом, цепь,
образующая хвост,
наращивается с другого конца. Одно-
цепочечный хвост
разрезается на куски
определенной длины, которые
упаковываются в фаговые частицы
нового поколения. (С
разрешения D. Dressier.)
236 ГЛАВА 8
Рис. 187.
Стереофотография конъюгирующих
бактерий. «Женская» клетка
(внизу, с нитями) находится
в процессе деления. Вверху
«мужская» клетка. Концы
клеток соединены друг с
другом трубчатым
мостиком, через который ДНК
переходит из «мужской»
клетки в «женскую». (С
разрешения Т. F. Anderson,
Е. L. Wollman и F. Jacob.)
О том, как
рассматривать эту фотографию, см.
в подписи к рис. 66, стр.88.
как вращающаяся матрица, с которой сходит непрерывная одно-
цепочечная фаговая ДНК. Эта непрерывная цепь распадается на
линейные отрезки, которые замыкаются в кольца и упаковываются
в белковые оболочки. По-видимому, иногда эта цепь достигает
довольно большой длины, прежде чем разделяется на отрезки,
соответствующие обычным молекулам фаговой ДНК: с помощью
электронного микроскопа случалось наблюдать кольцевые
структуры с длиной окружности, в два и более раз превышающей длину
нормальных колец ДНК фага фХПА. Увеличенные кольца и
линейные отрезки необычной длины наблюдались и у других фагов,
например у фага лямбда. Схема «разматывающегося рулона»
позволяет объяснить эти наблюдения.
Такая модель асимметрична в том смысле, что две цепи ДНК
не равнозначны: точка старта есть только на одной из них.
Некоторые предсказания, вытекающие из этой асимметрии,
подтвердились. Одно из них касалось конъюгации бактерий. У некоторых
бактерий при соприкосновении «женской» и «мужской» клеток
между ними образуется соединительная трубка, затем «мужская»
ДНК реплицируется и одна из ее копий переходит в «женскую»
клетку. Репликация по схеме рулона приводила бы к асимметрии:
в «женскую» особь попадала бы только одна определенная цепь
ДНК — та, которая сходит с рулона. И действительно,
эксперименты показали, что при конъюгации бактерий в другую клетку
всегда переходит одна определенная цепь.
ДРУГИЕ ФОРМЫ РЕПЛИКАЦИИ
Даже два механизма репликации ДНК могли бы показаться
излишеством; однако в 1972 году были открыты еще два новых
способа! Джерому Винограду удалось разобраться в сложной
схеме репликации митохондриальной ДНК — в значительной мере
благодаря тому, что он сумел расположить в правильном порядке
РЕПЛИКАЦИЯ И РЕКОМБИНАЦИЯ ДНК 237
Рис. 188. Репликация кольцевой митохондриальной ДНК. Только после
удвоения примерно 60% одной цепи начинается репликация другой (А — Г).
Две дочерние молекулы разделяются, когда одна из цепей еще только
частично реплицировалась (Е и Ж). Поскольку синтез двух новых цепей идет в
противоположных направлениях, он мог бы осуществляться с помощью одного
и того же фермента.
различные фигуры репликации, обнаруженные им с помощью
электронного микроскопа.
Две цепи кольцевой митохондриальной ДНК могут быть
разделены центрифугированием в градиенте хлористого цезия; так как
они имеют разную плотность (вследствие различия в составе
оснований), одну из цепей называют «легкой», а другую «тяжелой».
Репликация начинается с определенной точки легкой цепи и идет,
по-видимому, по кругу в одном направлении, отслаивая нерепли-
цирующуюся тяжелую цепь. Репликация тяжелой цепи начинается
только после того, как реплицируется около 60% легкой цепи.
При этом на большой одноцепочечной петле образуется двухцепо-
чечный участок.
Репликация легкой цепи заканчивается, естественно, задолго
до конца репликации тяжелой цепи. Перед самым завершением
репликации легкой цепи две кольцевые структуры разъединяются,
и мы имеем теперь отдельное двухцепочечное кольцо (результат
репликации легкой цепи) и одноцепочечное кольцо с двухцепочеч-
ной зоной (результат неполной репликации тяжелой цепи). После
завершения репликации тяжелой цепи и это кольцо становится
двухцепочечным.
В том же 1972 году Давид Дресслер с помощью электронного
микроскопа обнаружил реплицирующуюся линейную молекулу
ДНК фага Т7. Ее репликация начиналась не с конца, а ближе к
середине.
238 ГЛАВА 8
Рис. 189. Серия электронных микрофотографий с пояснительными схемами,
иллюстрирующая различные стадии репликации митохондриальной ДНК.
Пунктирные линии на схемах — одноцепочечные отрезки ДНК.
Соответствующие стадии обозначены теми же буквами, что и на рис. 188. (С
разрешения J. Vinograd.)
РЕПЛИКАЦИЯ И РЕКОМБИНАЦИЯ ДНК 239
А Б
Г А Б
Рис. 190. Репликация ДНК фага Т7. А. Линейная молекула ДНИ фага. Б.
Репликация начинается в точке, отстоящей от одного из концов молекулы
примерно на 1/в ее длины; при этом образуется петля. В. Увеличение этой
петли приводит к тому, что молекула приобретает форму буквы Y. Г. Некоторые
молекулы начинают второй цикл репликации еще до того, как первый
завершится образованием двух линейных молекул. В этом случае на одной из
ветвей Y-образной фигуры образуется новая петля.
В этом случае начало репликации обозначается небольшой
петлей или «пузырьком» на расстоянии от конца молекулы, равном
примерно 17% всей ее длины. В этом месте две цепи ДНК начинают
расходиться. По мере распространения процесса репликации
в обе стороны «пузырек» увеличивается. До ближнего конца
молекулы репликация доходит раньше, и молекула приобретает тогда
Y-образную форму. Когда репликация завершается и на другом
конце, одна Y-образная молекула превращается в две линейные.
Второй цикл репликации может начаться еще до окончания
первого: иногда можно видеть появление нового «пузырька» на одной
из ветвей Y-образной молекулы (рис. 190 и 191).
Таким образом, были открыты четыре различные формы
репликации ДНК: Кэрнс обнаружил двухцепочечное кольцо с двухце-
почечной петлей; Дресслер и Гилберт предложили модель
«разматывающегося рулона», чтобы объяснить происхождение
найденной ими структуры — двухцепочечного кольца с одноцепочечным
хвостом; Виноград наблюдал двухценочечные кольца, снабженные
в течение большей части репликационного периода одноцепочеч-
ной петлей; наконец, Дресслер нашел палочковидную молекулу
ДНК с двухцепочечной петлей, приобретавшую затем
Y-образную форму.
240 ГЛАВА 8
НИВ'
•
Щд
;'•
/ *-/ г ' * V/. '*<'■■ '
4 ' ' - •
Рис. 191. Электронные микрофотографии реплицирующейся ДНК фага Т7.
Соответствующие стадии репликации обозначены теми же буквами, что и на
рис. 190. (С разрешения D. Dressier.)
Кажется вероятным, что механизм такого жизненно важного
и универсального процесса, как репликация ДНК, в основе своей
одинаков во всех клетках. Быть может, дальнейшие углубленные
исследования выявят фундаментальное сходство всех четырех
способов репликации, которое пока еще неочевидно.
РЕПЛИКАЦИЯ И РЕКОМБИНАЦИЯ ДНК 241
МОЛЕКУЛЯРНЫЕ ОСНОВЫ
ГЕНЕТИЧЕСКОЙ
РЕКОМБИНАЦИИ
Гены, расположенные в одной хромосоме, обычно наследуются
все вместе, но так бывает не всегда. При кроссинговере хромосомы
обмениваются участками, а следовательно, и группами генов.
Индивидуум, у которого в одной хромосоме расположены два гена,
находившиеся у его предков в двух разных хромосомах, является
генетическим рекомбинантом.
Генетическая рекомбинация — явление очень
распространенное. Мы все, например, генетические рекомбинанты, поскольку
у человека кроссинговер очень характерен для первого из двух
специализированных клеточных делений (мейоз), приводящих к
образованию половых клеток — яиц и спермиев. В каждой из 23
хромосом, унаследованных вами от матери, благодаря кроссинго-
веру имеются гены, которые она получила от своей матери, и гены,
которые она получила от своего отца. Это относится, конечно,
и к отцовским хромосомам.
Генетические рекомбинации у плодовой мушки были открыты
и изучены Морганом, а у хлебной плесени — Бидлом и Татумом.
Татум и Ледерберг обнаружили генетическую рекомбинацию у
бактерий, происходящую после переноса ДНК из «мужской»
клетки в «женскую». В 1946 году, в котором был открыт половой
процесс у бактерий, два исследователя — М. Дельбрюк и
А. Херши — открыли рекомбинацию у фагов. Таким образом,
генетическая рекомбинация, наблюдаемая и у человека, и у
плесени, характерна для всех живых организмов.
Столь широкая распространенность генетической
рекомбинации сама по себе говорит о важности этого явления. Почему
естественный отбор способствовал выработке у всех растений и всех
животных такого образа жизни и такого способа размножения,
которые обеспечивали бы возможность соприкосновения и
перегруппировки генетического материала двух особей? Несомненно,
потому, что рекомбинации способствуют генетическому
разнообразию организмов, максимально увеличивая число различных
индивидуальных вариаций, а тем самым и шансы на выживание
вида. Не только биологам, но также философам и политикам
следует понимать действительную цену единообразия; изменение
внешней среды может уничтожить всех представителей данного вида,
если они идентичны. Изменчивость, в которой Дарвин видел «пищу»
для естественного отбора,— это необходимое условие выживания.
Генетическая рекомбинация увеличивает изменчивость и
разнообразие, поскольку она создает новые сочетания генов. Но как
16-0414
242 ГЛАВА 8
все это происходит в действительности? Одна из задач
молекулярной генетики состояла в том, чтобы выяснить механизм
генетической рекомбинации на молекулярном уровне.
ПОСТРОЕНИЕ КАРТЫ
ОТДЕЛЬНОГО ГЕНА
Если ген — это участок непрерывной молекулы ДНК, то как
гены отделяются друг от друга? Ответ состоит в том, что сама ДНК
(или, точнее, последовательность оснований в ней) определяет
конец одного и начало другого гена. Влияют ли эти внутренние
«разделительные знаки» на те химические события, которые
приводят к генетической рекомбинации? Всегда ли разрыв
генетического материала происходит между генами или он возможен
и внутри гена?
Рекомбинацию в пределах одного гена впервые'наблюдали как
очень редкое явление у плодовой мушки. Редкость такого события
вполне понятна. Чем ближе расположены мутации, тем меньше
частота их рекомбинаций, а мутации в пределах одного гена,
естественно, расположены очень близко друг к другу. Поэтому
плодовая мушка — неподходящий объект для изучения рекомбинаций
внутри одного гена: невозможно просматривать миллионы мух
в поисках редких рекомбинаций. Поэтому| Сеймур Бензер —
исследователь, занимавшийся этим вопросом,— обратился к
изучению фага Т4.
ВЫЯВЛЕНИЕ РЕДКИХ
РЕКОМБИНАНТОВ
СРЕДИ МУТАНТОВ ФАГА
Для того чтобы показать, что рекомбинация может
происходить и внутри гена, Бензер использовал некоторые свойства так
называемых rll-мутантов фага Т4 (см. рис. 158). В конечном
результате ему удалось составить карту гена rll, т. е. расположить
множество мутаций этого гена в линейной последовательности.
Бензер нашел способ выявления нормальных рекомбинантов,
чрезвычайно редко появляющихся в результате скрещивания двух
мутантов rll. На бактериях одной разновидности — штамма В —
растут и нормальные фаги, и мутанты по гену rll, но Бензер
обнаружил, что другая, несколько отличная от предыдущей
разновидность тех же бактерий — штамм К — может быть
инфицирована только нормальным фагом. Если после одновременного
заражения бактерий штамма В двумя разными г11-мутантами фага Т4
в результате рекомбинации появляются нормальные фаги, то эти
РЕПЛИКАЦИЯ И РЕКОМБИНАЦИЯ ДНК 243
5-,
CD
Ь
CD
®_@
9
ч
CD
-(g)j-^W-CD-(?
Рис. 192. Сеймур Бензер разработал метод, позволяющий выявлять
чрезвычайно редкие рекомбинации между фагами, несущими мутации в одном и
том же гене — rll. Бензер воспользовался тем, что на бактериях одного
штамма (В) могут расти и нормальный фаг, и r-мутанты, а на бактериях другого
штамма (К) — только нормальный фаг. Если после одновременного
заражения штамма В двумя разными мутантами, га и гь, в результате рекомбинации
появится нормальный фаг, то его можно будет обнаружить даже среди
миллионов мутантных потомков, так как только он сможет расти на бактериях
штамма К.
рекомбинанты могут быть выявлены по их способности
размножаться на штамме К, на котором их родители-мутанты
размножаться не могли.
Бензер подсчитал, что неспособность rll-мутантов
размножаться в бактериях штамма К позволит ему выявить одного
нормального рекомбинанта среди 100 000 000 мутантов. Этого было бы
вполне достаточно, чтобы обнаружить рекомбинации между двумя
соседними основаниями в молекуле ДНК.
ТОЧЕЧНЫЕ МУТАЦИИ
И ДЕЛЕЦИИ
Бензер начал с того, что выделил несколько тысяч rll-мутан-
тов. Затем их следовало охарактеризовать. Большинство
выделенных форм, судя по их свойствам, были носителями точечных
мутаций, возникающих при повреждении очень малого участка гена,
а у некоторых, по-видимому, были делеции, т. е. мутации,
связанные с утратой значительного отрезка ДНК.
16*
244 ГЛАВА 8
Мутант а »
Мутаит Ь •-
Мутант с
Мутант d •
Рис. 193. Точечные мутации и делеции у фага. У мутантов а и Ъ точечные
мутации, и их рекомбинация приведет к появлению нормального фага (а
также двойного мутанта). Мутант с имеет делецию, включающую места,
измененные у мутантов а и Ь, и поэтому не может дать нормальных потомков при
рекомбинации с этими мутантами. Однако рекомбинация между мутантами с
и d может привести к появлению нормального фага, поскольку точечная
мутация лежит вне области делеции с. Таким образом, результаты рекомбинации
с различными мутантами, несущими точечные мутации, позволяют определить
размеры делеции.
Наличие делеции и их величину можно установить по
аномальному поведению мутантов при скрещиваниях: мутанты с
делециями не дают рекомбинантов при скрещивании с некоторыми
«точечными» мутантами (хотя эти последние дают рекомбинантов при
скрещивании друг с другом). Это наблюдается в тех случаях, когда
делеция включает те участки, где находятся точечные мутации.
Если же мутанта с делецией скрещивать с мутантом, у которого
точечная мутация лежит вне области этой делеции, то в этом
случае появляются рекомбинанты (рис. 193).
ПОСТРОЕНИЕ КАРТЫ
ГЕНА rll
Бензеру пришлось скрещивать бесчисленные пары мутантов,
чтобы определить частоты рекомбинаций и таким образом
установить локализацию тысяч отдельных мутаций гена гП. Наличие
мутантов с делециями значительно упрощало задачу. Каждый
новый мутант скрещивался со «стандартным» мутантом, заведомо
имеющим делецию в области гена гП. Если при скрещивании
появлялись рекомбинанты, это означало, что новая мутация лежит
вне области делеции, т. е. вне того участка гена гН, который
отсутствует у стандартного мутанта. Если же рекомбинантов не
было, это указывало на то, что мутация лежит в пределах этого
участка. Положение каждой мутации уточняли путем ряда скрещиваний,
в которых использовались стандартные мутанты со все более
узкими границами делеции (рис. 194).
РЕПЛИКАЦИЯ И РЕКОМБИНАЦИЯ ДНК 245
Ген г \\
Этап 1
Этап 2
1ID1
ЭтапЗ цп 2
11D3
Этап 4
с х
Сегмент IID2
Рис. 194. Локализацию точечной мутации в гене гН можно определить путем
ряда скрещиваний с мутантами, несущими делеции, размеры и положение
которых известны. Первый этап. Нормальные рекомбинанты могут быть
получены при скрещивании мутанта х с мутантами 77, III\ и IV, но не
получаются при скрещивании х с мутантом /, у которого делеция включает
местоположение точечной мутации х. Следовательно, мутация х лежит в
сегменте 77. Второй этап. Мутанта х скрещивают с другими мутантами, у которых
делеции оканчиваются в сегменте 77. Нормальные рекомбинанты получаются
только при скрещивании мутанта х с мутантом IID. Из этого следует, что
мутация х лежит в сегменте 777). Третий этап. Аналогичным образом
определяют положение мутации х в сегменте IID2. После этого (четвертый этап)
находят ее положение относительно других точечных мутаций, лежащих в этой
сравнительно небольшой области гена гН.
Какие выводы смог сделать Бензер в результате успешного
определения локализации нескольких тысяч мутаций в гене гИ?
Данные о высших организмах, например о плодовой мушке,
показали, что гены образуют линейную последовательность,
соответствующую линейной форме хромосом. Все мутации, изученные
Бензером, находились в одном и том же гене и тоже располагались
в линейном порядке — в соответствии с линейностью самой
молекулы ДНК. Опыты Бензера пролили свет на природу генетической
рекомбинации, при которой даже соседние основания в молекуле
,u?y , ^м. flf fHi jJJ? i ,M,
—г г т » т г
-4- п-г* »?t9.H*.E
Ala Albl
А1Ь2
А2а A2bA2cA2dA2e A2f
A2q
1 ^£ор
A4d A4c A4b A4a A3i A3h A3g A3f A3e
A2h1
A2h2 j,
A4e
A4f
i tii ААЛ 1i1
A3a d A2h3 Jj^
v
A4g
A5a A5b A5c1 A5c2
B6 B5
A5d
B4
A6a1
ВЗ В 2
A6a2 A6b
B1
i»l.tlhi 4+1*4 9»ly? ,M, Им ++ +
B9a
1С
rfs
00
B9b BIO
Рис. 195. Карта мутаций в области rll фага Т4. Каждый квадратик соответствует одному случаю возникновения
мутации в данной точке. (С разрешения S. Benser.)
РЕПЛИКАЦИЯ И РЕКОМБИНАЦИЯ ДНК 247
ДНК могут быть отделены друг от друга. Более ясной стала и
природа мутаций, так как расчеты показали, что исследованные Бен-
зером точечные мутации связаны с изменением всего лишь одного
основания в молекуле ДНК.
«ГОРЯЧИЕ ТОЧКИ»
В МОЛЕКУЛЕ ДНК
Бензер обнаружил любопытные факты, окончательно не
объясненные до сих пор. Он нашел такие места, в которых спонтанно
мутации никогда не возникали, хотя и могли быть вызваны
ультрафиолетовыми лучами или мутагенными химическими веществами.
Он обнаружил также горячие точки — места, в которых мутации
возникали чрезвычайно часто. Более 600 точечных мутаций,
т. е. одна пятая всех нанесенных на карту, были локализованы
в самой «жаркой» из горячих точек и около 300 — в точке,
занимающей второе место (рис. 195).
Молекулярная основа горячих точек, обнаруженных Бензе-
ром, оставалась совершенно непонятной в течение целого
десятилетия после публикации его классических опытов. Только в 1972
году Джордж Стрейзингер из Орегонского университета в
Юджине получил важные данные, относящиеся к этому вопросу. Он
изучал ген фага Т4, ответственный за синтез фермента лизоцима.
Этот фермент лизирует зараженную клетку, освобождая
заключенное в ней потомство фага.
Стрейзингер обнаружил в гене лизоцима мутацию, которая ре-
вертировала (т. е. ген возвращался в нормальное состояние) в сто
раз чаще, чем другие мутации. Следовательно, эта точка была
в высшей степени «горячей». Стрейзингер определил
последовательность аминокислот в измененном участке молекулы мутантного
лизоцима и в соответствующем участке нормального фермента.
Пользуясь генетическим кодом (см. главу 10), позволяющим
установить соответствие между группами оснований в ДНК и
аминокислотами в белке, Стрейзингер определил вероятную
последовательность оснований в мутантном сегменте ДНК и в
соответствующем сегменте нормальной ДНК фага. В «горячей точке»
нормального гена скорее всего была такая последовательность:
АЦАААААГТ,
а в мутировавшем гене —
АЦААААААГТ
Таким образом, в мутантном гене здесь идут подряд шесть А
(аденинов), а в нормальном их всего пять. По данным Стрейзин-
гера и в некоторых других горячих точках этого гена имеются
последовательности из одинаковых оснований. Возможно, что
248 ГЛАВА 8
именно эти монотонные ряды и являются причиной чрезвычайно
частых ошибок репликации, приводящих к выпадению или
вставке одного основания.
РАЗРЫВ И
ПЕРЕКРЕСТНОЕ
ВОССОЕДИНЕНИЕ
МОЛЕКУЛ ДНК
Что происходит с молекулами при генетической рекомбинации?
В 1961 году Мэтт Меселсон и Джин Уэйгл показали, что у фага
лямбда рекомбинация обусловлена молекулярным кроссингове-
ром, т. е. разрывом и перекрестным воссоединением молекул ДНК.
Генетические эксперименты на фагах позволяли предположить
два механизма рекомбинации: разрыв и смену матриц.
Если у вас есть две совершенно одинаковые магнитофонные
записи с дефектами в двух разных местах, то можно получить одну
хорошую запись двумя способами. Во-первых, можно разрезать
обе ленты в таком месте, чтобы в одной из них дефект оказался
в первом, а в другой — во втором куске, а затем склеить хорошие
куски обеих лент. Во-вторых, можно хорошие части обеих
записей переписать на третью ленту. Так же и рекомбинантные
молекулы ДНК могли бы получаться или в результате разрыва и
«перекрестного» воссоединения, или в результате перехода с одной
молекулы-матрицы на другую в процессе репликации ДНК.
Следует заметить, что в случае разрыва и воссоединения должны
появиться рекомбинанты с ДНК, состоящей из сегментов
родительских молекул, тогда как при смене матриц возникали бы
рекомбинанты с вновь синтезированной ДНК (рис. 196).
В 1911 году Морган предположил, что генетическая
рекомбинация обусловлена разрывом и перекрестным воссоединением
хромосом. В 1931 году Дж. Беллинг для объяснения наблюдаемой
цитологической картины выдвинул гипотезу о механизме смены матриц,
но через два года отказался от нее, так как ее нельзя было
согласовать с некоторыми генетическими данными.
В 1949 году по ряду причин снова вспомнили об этом
механизме. Например, при скрещивании фагов в их потомстве находили
неравное число частиц каждого из двух рекомбинантных типов.
Было ли это результатом каких-то экспериментальных трудностей?
Или (и это считали более вероятным) действительный механизм
рекомбинации не связан с разрывом и перекрестным
воссоединением и допускает асимметрию в образовании рекомбинантов?
Позже гипотеза о смене матриц была привлечена для объяснения
РЕПЛИКАЦИЯ И РЕКОМБИНАЦИЯ ДНК 249
Рис. 196. Два возможных механизма рекомбинации. А. Разрыв и
перекрестное воссоединение: две молекулы ДНК разрываются в одном и том же месте
и обмениваются образовавшимися фрагментами. Б. Смена матриц: при
синтезе новой цепи ДНК копируются участки двух разных молекул ДНК.
X
Разрыв и перекрестное
воссоединение
ь<\
или
Г
а
\b b
или
Смена матриц
Рис. 197. При разрыве и перекрестном воссоединении возможные рекомби-
нанты аЬ и -]—\- появляются всегда в равном числе. При смене матриц в
результате одного акта рекомбинации появляется только один из двух
возможных рекомбинантов; поэтому число тех и других рекомбинантов может быть
неодинаковым.
интеграции фрагментов ДНК с бактериальной хромосомой,
например при трансформации пневмококков и при спаривании
(конъюгации) бактерий. Смена матриц, казалось, позволяла понять
некоторые факты, необъяснимые на основе разрывов,— такие, как
появление нечетного числа рекомбинантных форм при
взаимодействии фрагментов ДНК с бактериальной хромосомой.
Эти и некоторые другие наблюдения заставляли до 1961 года
считать смену матриц более вероятным механизмом рекомбинации,
250 ГЛАВА 8
I
10е
5 w
5г
CD
5
10'
io-
io'
W
Потомство Я—
(и) Ф
■Ы-Я—
+ +
108
ю7
ю6
10ь
ю4
W3
Потомство Я-+
-
(и)
/ \
к |
(ТГ) / \
1у^Д
+ +
-Плотность
— Плотность
Рис. 198. Распределение по плотностям фагового потомства, полученного
после заражения бактерий, растущих на «легкой* среде, одновременно
«тяжелым» фагом X и «легким» фагом Х-\—К А. Высокая плотность некоторых
потомков типа X говорит о сохранении у них нереплицированной
«тяжелой» ДНК, полученной в неизмененном виде от родительской формы X .
Большая часть родительской ДНК многократно реплицировалась
полуконсервативным способом; поэтому некоторые потомки содержат ДНК
промежуточной плотности — с одной цепью, полученной в неизмененном виде от
родительской формы, а у большей части потомства вся ДНК синтезирована
заново. Б. Сходным образом распределяется по плотности и рекомбинантное
потомство типа X—f. Поскольку рекомбинанты типа X—|- могут возникнуть
только при кроссинговере, происшедшем вблизи конца молекулы ДНК,
наличие у этих рекомбинантов «тяжелой» родительской ДНК говорит о том,
что они унаследовали большую часть «тяжелой» молекулы — либо нерепли-
цированной, либо реплицированной полуконсервативным способом.
(Потомки типа Х++ и Х-]— здесь не показаны; те и другие имеют плотность «легких»
фагов, так как у них вся или почти вся молекула ДНК синтезирована заново.)
(С разрешения М. Meselson.)
по крайней мере у фагов и микроорганизмов. В 1961 году Месел-
сон и Уэйгл показали, что рекомбинанты могут содержать
родительскую ДНК и, следовательно, рекомбинации осуществляются
путем разрыва и перекрестного воссоединения.
Меселсон и Уэйгл проводили свои опыты на фаге лямбда (X),
меченном тяжелыми нерадиоактивными изотопами азота и
углерода (16N и 13С). Бактерий, выращенных на нормальной, «легкой»
среде, заражали одновременно «тяжелым» и «легким» фагами, раз-
РЕПЛИКАЦИЯ И РЕКОМБИНАЦИЯ ДНК 251
личавшимися не только по своей плотности, но и по двум генам:
«тяжелый» фаг был мутантом по обоим генам (X ), тогда как
«легкий» фаг был нормальным (Х++). Потомство этих фагов
центрифугировали в градиенте плотности, чтобы определить
плотность фаговых частиц и, следовательно, содержание в них
«тяжелой» родительской ДНК.
Меселсон и Уэйгл обнаружили, что небольшая доля «тяжелой»
родительской ДНК не подвергается репликации, большая же
часть ее многократно реплицируется полуконсервативным
способом. Среди потомства типа X было некоторое количество
частиц с неизмененной «тяжелой» родительской ДНК и с ДНК
промежуточной плотности; большая же часть содержала «легкую»
ДНК (все потомки типа Х-++ обладали, конечно, «легкой» ДНК,
как и родительская форма Х++).
Какова же была плотность ДНК у потомков-рекомбинантов?
Если рекомбинация связана со сменой матриц, то все рекомбинан-
ты должны были содержать «легкую», вновь синтезированную
ДНК. Если же здесь действует механизм разрыва, то некоторые
рекомбинанты могли бы содержать и «тяжелую» родительскую
ДНК. Поскольку в данном эксперименте оба исследуемых гена
лежали близко к одному из концов молекулы ДНК, присутствие
«тяжелой» ДНК, унаследованной от «тяжелого» родительского
фага X , можно было бы обнаружить только у рекомбинантов
типа X—h рекомбинанты типа Х-{— могли содержать лишь очень
малые, неуловимые количества «тяжелой» ДНК.
И действительно, Меселсон и Уэйгл обнаружили, что некоторые
рекомбинанты X—(- содержат почти полностью «тяжелую» ДНК,
унаследовав ее без репликации, но после того, как осуществилась
генетическая рекомбинация. Другие рекомбинанты того же типа
обладали почти полностью гибридной ДНК, унаследованной после
рекомбинации и полуконсервативной репликации.
Обнаружение рекомбинантов с родительской ДНК доказало,
что генетическая рекомбинация — результат разрыва и
перекрестного воссоединения молекул ДНК. Кроме того, данные о
количестве родительской ДНК в рекомбинантных частицах
показали, что расстояния между генами, определяемые по частоте
генетической рекомбинации и используемые для построения
генетических карт, действительно соответствуют физической длине
участков ДНК.
С 1961 года стали накапливаться данные о том, что при
трансформации бактерий, при их конъюгации и в некоторых других
случаях фрагменты молекулы ДНК бактерии-донора включаются
в ДНК бактерии-реципиента. Таким образом, эти явления тоже
связаны с разрывом и воссоединением молекул ДНК; можно
думать, что такова физическая основа рекомбинации у всех
организмов.
О СИНТЕЗ БЕЛКА
Грандиозная биохимическая загадка в настоящее время в
основном разрешена; важнейшие части решения найдены и сведены
воедино. Механизм, с помощью которого живая клетка
синтезирует белок, может быть описан почти во всей своей сложности.
Синтез белка радикально отличается от синтеза всех
остальных компонентов клетки. Небольшие молекулы, такие, как сахара,
жиры, витамины, гормоны, основания ДНК и аминокислоты,
входящие в состав белков, строятся постепенно, шаг за шагом из
простых веществ в результате многочисленных реакций,
катализируемых ферментами. Другие ферменты сцепляют такие молекулы
вместе, образуя из них полимеры: из молекул сахара — крахмал,
гликоген и целлюлозу, из азотистых оснований — ДНК, из
аминокислот — белки.
Хотя сами по себе реакции соединения оснований ничем в
принципе не отличаются от любых других ферментативных реакций,
тем не менее синтез ДНК — самовоспроизводящейся молекулы —
обладает уникальной особенностью: последовательность
оснований в новой ДНК определяется!их последовательностью в предсу-
ществующей ДНК. Синтез белка обладает подобным же свойством:
последовательность аминокислот тоже определяется структурой
предсуществующей молекулы — последовательностью оснований
в некотором участке ДНК.
Однако копирование структуры одной молекулы ДНК при
построении другой молекулы ДНК — процесс гораздо менее
сложный, чем трансляция (перевод) этой структуры в структуру
молекулы белка. Последовательность оснований новой цепи ДНК
устанавливается в результате прямого «сравнения» со старой
цепью: выбор каждого основания определяется его химическим
сродством к соответствующему основанию в старой цепи, т. е.
СИНТЕЗ БЕЛКА 253
его способностью образовать с последним пару А-Т или Г-Ц. Из-за
отсутствия химического сродства между группой из трех
оснований и аминокислотой, которую они кодируют,
последовательность аминокислот должна устанавливаться путем непрямого,
опосредованного «сравнения» с ДНК. Для такого
опосредованного сравнения необходим сложный механизм.
РНК—ПОСРЕДНИК
В СИНТЕЗЕ БЕЛКА
В 1941 году Ж. Браше и Т. Касперсон независимо
обнаружили, что клетки, синтезирующие большие количества белка,
особенно богаты веществом, называемым рибонуклеиновой кислотой
(РНК). Как выяснилось позже, большая часть РНК находится
в частицах, получивших название рибосом. В клетках, очень
активно синтезирующих белок, на электронных микрофотографиях
можно видеть множество рибосом в цитоплазме (см., например,
рис. 60, Б), т. е. именно там, где по данным других исследований
главным образом протекает синтез белка.
Хотя синтез белка происходит в основном в цитоплазме,
информация о структуре белка закодирована в последовательности
оснований ДНК, которая (за исключением небольшого количества,
находящегося в митохондриях и хлоропластах) содержится только
Рис. 199. Эти радиоавтографы, полученные после скармливания животному
радиоактивной аминокислоты, демонстрируют наличие прямой корреляции
между синтезом РНК и синтезом белка. Ткань окрашена красителем, который
связывается молекулами РНК. Сердечная мышца содержит относительно
немного РНК (поэтому не так сильно окрасилась) и синтезирует мало белка
(поглощение радиоактивной аминокислоты минимально; об этом
свидетельствует малое число черных точек, соответствующих молекулам
радиоактивной аминокислоты). Кишечник, наоборот, богат РНК (поэтому ткань сильно
окрасилась) и интенсивно синтезирует белок (препарат густо усеян черными
точками). (A. Ficq, J. Brachet, Exp. Cell Res., II, 135 (1956); с разрешения
A. Ficq).
254 ГЛАВА 9
Рис. 200. РНК синтезируется в ядре, а затем переходит в цитоплазму. Л.
Радиоавтограф клетки, которую 15 минут выдерживали в присутствии
радиоактивного цитидина (один из химических компонентов РНК). Большая часть
РНК, синтезированной за это время, находится в ядре. Б. Радиоавтограф
клетки, которую 12 минут выдерживали в среде с радиоактивным цитидином,
а затем 88 минут — в среде с нерадиоактивным цитидином. За эти 88 минут
синтезированная ранее меченая РНК перешла в цитоплазму. (D. M. Prescott,
Prog. Nucleic Acid. Res., Ill, 35, 1964; с разрешения автора.)
в ядре. Тем не менее синтез белка часто продолжается некоторое
время и после удаления клеточного ядра. Очевидно,
информация, закодированная в ДНК, должна быть перенесена на какое-то
другое вещество, которое и служит непосредственным «шаблоном»,
или матрицей, при синтезе белка.
Казалось, именно РНК особенно подходит для роли такой
матрицы. По ряду важных особенностей она напоминает ДНК. И
ДНК, и РНК — полимеры с сахаро-фосфатным остовом; в ДНК
(дизоксирибонуклеиновой кислоте) этот сахар — дезоксирибоза,
которая лишь незначительно отличается от рибозы — сахара,
входящего в состав РНК (рибонуклеиновое кислоты). И в РНК,
и в ДНК к остову прикреплены основания четырех различных
типов; в РНК три из них — А, Г и Ц — те же, что в ДНК, а
четвертое — урацил (У) — очень сходно с тимином (Т) ДНК. У, как
и Т, способен образовывать пару с А. Было очевидно, что
последовательность оснований в РНК может быть копией
последовательности в ДНК, только с заменой Т на У. В пользу этого
говорило и то, что РНК, подобно самой ДНК, как выяснилось, всегда
синтезируется в присутствии ДНК.
Однако наряду с этими важными чертами сходства есть и
существенное различие: если] ДНК состоит из двух цепей, то РНК —
одноцепочечная молекула. Поэтому, если в ДНК химически
активные участки оснований обычно образуют водородные связи,
соединяющие две цепи, то в РНК эти участки свободны. Таким
СИНТЕЗ БЕЛКА 255
Рис. 201. Структура ДНК и РНК в основе
своей сходна: это полимеры, построенные из
четырех различных оснований. Но между ними
есть следующие различия: 1) основание Т (ти-
мин), содержащееся в ДНК, заменено в РНК
очень сходным основанием У (урацилом); 2)
молекулы ДНК состоят из двух цепей, а РНК —
из одной (хотя основания РНК могут
образовывать такие же пары, как и основания ДНК, с
заменой Т на У); 3) остов цепи ДНК состоит из
остатков сахара дезоксирибозы, связанных
фосфатными группами, тогда как в РНК ту же роль
играет другой, очень сходный сахар — рибоза.
образом, основания могут быть химически идентифицированы, и
закодированное «сообщение» может быть прочитано.
В связи с этим в 50-х годах многие предполагали, что рабочей
матрицей для синтеза белка служит РНК — вероятно, рибосом-
ная РНК.
ИНФОРМАЦИОННАЯ РНК:
ГИПОТЕЗА
В 1960 году| Франсуа Жакоб и Жак Моно в] Пастеровском
институте в Париже высказали предположение, что рибосома — это
неспецифическая] белоксинтезирующая машина, РНК которой не
определяет какую-либо последовательность аминокислот. Скорее,
полагали они, любая рибосома может синтезировать любой белок,
если получит необходимые инструкции, закодированные в
последовательности оснований РНК особого рода — информационной
РНК. Каждый ген синтезирует собственную информационную
РНК, которая с помощью неспецифической рибосомы направляет
синтез белка, кодируемого данным геном.
Информационная РНК недолго оставалась гипотетическим
фактором. В 1961 году, еще до появления в печати статьи Жакоба
и Моно, существование информационной РНК было доказано.
ИНФОРМАЦИОННАЯ РНК:
ФАКТ
При заражении бактерии фагом Т4 синтез бактериальных
белков, РНК и ДНК прекращается и в то же время начинается синтез
фаговых белков, фаговых РНК и фаговой ДНК. Ф. Жакоб из
Парижа, С. Бреннер из Кембриджа (Англия) и М. Меселсон
объединили свои усилия в Калифорнийском технологическом инсти-
1
нл=г-
ьг=л-
[ц^г-
\-Т = А-
1г = ц-
1 1
■ 1
1 ПНК 1
1
1
1
1
1
i
1
-А
-у
-ц
-У
-г
-г
PHI
256 ГЛАВА 9
Рис. 202. Бреннер, Жакоб и Меселсон показали, что РНК,
синтезируемая после заражения бактерии фагом и
направляющая синтез фаговых белков, присоединяется к
бактериальным рибосомам. Из этого можно было заключить, что
фаговая РНК — специфическая информационная РНК,
а рибосомы — неспецифические приспособления для
синтеза белков.
При центрифугировании в градиенте хлористого цезия
бактериальные рибосомы собираются в слое с определенной
плотностью (отмеченной вертикальной линией) (А). Через 3
минуты после заражения бактерии фагом Т4 в среду
добавляли радиоактивный компонент РНК, чтобы пометить
фаговую РНК; 2 минуты спустя из зараженных бактерий
выделяли рибосомы и центрифугировали их в хлористом цезии.
РНК, синтезированная после заражения фагом (ее можно
было узнать по радиоактивности), собиралась в слое той
же плотности, что и бактериальные рибосомы (Б). Может
быть, после заражения фагом синтезируются фаговые
рибосомы? Или же образуется нерибосомная РНК, которая затем
связывается с предсуществовавшими рибосомами? Чтобы
выяснить это, эксперимент повторили с тем отличием, что бактерии до
заражения росли на среде с тяжелыми изотопами 16N и 13С; поэтому
бактериальные рибосомы были тяжелее, чем обычно. Бактерий заражали фагом
и одновременно переносили на среду с обычными «легкими» атомами 14N
и 12С. Через 2 минуты вносили радиоактивный предшественниц РНК;
таким образом, фаговая РНК была радиоактивной и «легкой». Затем из
зараженных бактерий выделяли рибосомы и центрифугировали их в хлористом
цезии. Легкая радиоактивная фаговая РНК собиралась в слое с плотностью,
соответствующей тяжелым рибосомам, т. е. рибосомам, синтезированным до
заражения (В). Это означало, что матрицей для синтеза фаговых белков
служит РНК, синтезируемая после заражения и связанная с бактериальными
рибосомами. (По S. Brenner, F. Jacob, M. Meselson, Nature, 190, 576, 1961.)
туте, чтобы доказать, что РНК, синтезируемая после заражения
фагом Т4,— это и есть гипотетическая информационная РНК,
переносчик информации от генов фага к неспецифическим
бактериальным рибосомам.
Уже было известно, что фаговая РНК обладает одним
необходимым свойством такого посредника: соотношение оснований
в ней близко к соотношению оснований в фаговой ДНК; можно
было предполагать, что она является копией этой ДНК.
Фаговая РНК имеет еще одно любопытное свойство, которое
говорит в пользу ее информационной функции: в отличие от
стабильной рибосомной РНК фаговая РНК нестабильна и постоянно
разрушается по мере того, как синтезируется новая. Быстрое
переключение с синтеза бактериальных белков на синтез фаговых
белков после заражения указывает на то, что бактериальная
информационная РНК на рибосомах быстро замещается фаговой.
Такое быстрое замещение позволяет предположить, что
информационная РНК, по крайней мере у бактерий, нестабильна.
Бреннер, Жакоб и Меселсон осуществили эксперимент, который
показал, во-первых, что после заражения фагом белок синтези-
В
к
СИНТЕЗ БЕЛКА 257
Рис. 203. Так выглядят гены в действии. Электронная микрофотография
крошечного участка ламповой щетки (особый тип хромосом) из незрелого яйца
амфибии; этот участок транскрибируется в РНК. Осевая линия — собственно
хромосома, состоящая из ДНК и белка; она испещрена черными точками —
молекулами РНК-полимеразы. От каждой молекулы полимеразы тянется
тонкая нить — молекула информационной РНК, которую в данный момент
синтезирует фермент. (О. L. Miller, В. R. Beatty, J. Cell Physiol., 74 (suppl. 1),
225 (1969); с разрешения авторов.)
руется на рибосомах, которые существовали до заражения, так
что рибосомы, очевидно, неспецифичны; и, во-вторых, что
нестабильная РНК, синтезированная после заражения, связывается
с бактериальными рибосомами и таким образом, видимо, снабжает
их специфической информацией, необходимой для синтеза фаговых
белков. Следовательно, нестабильная РНК, синтезируемая после
заражения фагом,— это и есть постулированная информационная
РНК.
Позже, в 1961 году, другие исследователи показали, что и у
самих бактерий имеется информационная РНК, которая тоже
нестабильна и составляет несколько процентов всей РНК незара-
женной клетки. В том же году был открыт фермент,
синтезирующий информационную РНК,— ДНК-зависимая РНК-полимера-
за — и удалось заставить его работать в пробирке: в присутствии
ДНК и четырех оснований РНК (А, У, Г и Ц) он катализировал
синтез РНК, состав которой соответствовал составу оснований
ДНК. Информационная РНК, как и ДНК-зависимая РНК-поли-
мераза, была найдена и в клетках высших организмов, как у
растений, так и у животных, т. е. она имеется во всех клетках.
17-0414
258 ГЛАВА 9
ТОЛЬКО ОДНА ЦЕПЬ ДНК
ТРАНСКРИБИРУЕТСЯ1
В ИНФОРМАЦИОННУЮ РНК
Кажется крайне маловероятным, что обе цепи ДНК кодируют
структуру белков. Последовательности оснований в двух цепях
направлены в противоположные стороны. Таким образом,
последовательность ЦЦГАЦА в одной из цепей ДНК будет
транскрибироваться в последовательность ГГЦУГУ (в РНК), которая
кодирует аминокислоты глицин и цистеин (расшифровка кода будет
описана в следующей главе). В другой цепи ДНК
комплементарная последовательность ГГЦТГТ будет из-за противоположной
химической направленности цепей транскрибироваться в
обратном направлении и даст в РНК кодоны АЦА-ГЦЦ, кодирующие
треонин и аланин.
ДНК Транскрипция Информаци- Трансляция Аминокисло-
онная РНК ты в белке
ЦЦГАЦА
ГГЦТГТ
Транскрипция
/слева направо
Ч Транскрипция
Ч >
справа налево
ГГЦУГУ
АЦАГЦЦ
Трансляция
Трансляция
Гли-Цис
Тре-Ала
ТРАНСПОРТНАЯ РНК—
МОЛЕКУЛА-АДАПТОР
На данном участке ДНК может быть синтезировано любое
число молекул информационной РНК, так что клетка получает
много одноцепочечных копий гена, работающих в качестве
матриц. Таким образом, информационная РНК обеспечивает синтез
больших количеств необходимых белков. Однако открытие
информационной РНК еще не разрешает главного вопроса: каким
образом последовательность оснований определяет
последовательность аминокислот, несмотря на отсутствие химического
соответствия между группой из трех оснований (кодоном) и
аминокислотой, которую она кодирует?
1 Копирование последовательности оснований ДНК в виде
последовательности оснований РНК называется транскрипцией: ДНК
транскрибируется в РНК. Соединение аминокислот в последовательность,
определяемую основаниями РНК, называется трансляцией: последовательность
оснований транслируется в аминокислотную последовательность, т. е. в
полипептидную цепь белка.
СИНТЕЗ БЕЛКА 259
В 1956 г. Фрэнсис Крик высказал предположение, что эта
проблема может быть разрешена с помощью молекул-адапторов.
Каждая такая молекула должна присоединяться одновременно
к аминокислоте и к ее кодону, обеспечивая таким образом связь
между ними.
Адапторные молекулы были обнаружены в следующем году.
Это сравнительно небольшие молекулы РНК, называемые
транспортными РНК; каждая из них специфична по отношению к одной
аминокислоте и соответствующему ей кодону в информационной
РНК. Молекула транспортной РНК готова к выполнению своей
функции, когда к ней присоединена ее аминокислота под действием
фермента, который узнаёт одновременно аминокислоту и
транспортную РНК и соединяет их ковалентной связью (затрачивая
на это одну молекулу АТФ). Так, например, специфический
фермент присоединяет аминокислоту глицин к молекуле
«глициновой» транспортной РНК с антикодоном ГЦЦ, комплементарным
кодону ГГЦ в информационной РНК, кодирующему глицин и рас-
<
положенному в обратном направлении (ЦГГ).
Что именно представляет собой молекула транспортной РНК?
Может быть, это просто цепочка из полудюжины оснований с
антикодоном на одном конце и другим концом, предназначенным для
присоединения аминокислоты? Оказалось, однако, что
транспортные РНК гораздо сложнее: молекулы их состоят из 75—85
оснований.
Роберт Холли из Корнеллского университета поставил своей
целью выяснить структуру транспортной РНК. Сначала он
потратил 4 года, чтобы выделить большое количество «аланиновой»
РНК, очищая ее от транспортных РНК для других аминокислот.
Затем он стал определять последовательность оснований в ней.
Его метод был аналогичен методу, который использовал Сэнгер,
чтобы установить последовательность аминокислот в инсулине:
Холли разрывал цепь транспортной РНК на все более мелкие
кусочки с помощью ферментов, расщепляющих РНК, и определял
состав оснований и концевое основание каждого кусочка. Эту
задачу облегчало присутствие в транспортной РНК необычных,
химически модифицированных оснований. Наконец, еще через 3 года
(в 1965 году) Холли составил полную последовательность 77
оснований аланиновой транспортной РНК.
При изучении последовательностей оснований в аланиновой
РНК и в других транспортных РНК, исследованных позже, была
обнаружена сложная структура. Молекула транспортной РНК
может быть сложена так, чтобы комплементарные участки
оказались друг против друга; в результате спаривания оснований эти
участки как бы «слипаются», подобно комплементарным цепям
ДНК. Наиболее стабильная, а значит, и наиболее вероятная
17*
260 ГЛАВА 9
Рис. 204. Роберт Холли (род. в 1922 г.) с моделями транспортных РНК.
Холли определил последовательность оснований в аланиновой транспортной
РНК; за это ему в 1968 году была присуждена Нобелевская премия по
физиологии и медицине. (С разрешения R. W. Holly.)
структура транспортной РНК — та, что содержит максимальное
число спаренных оснований; такая структура имеет форму
«клеверного листа» с двухцепочечным стеблем и тремя одноцепочеч-
ными петлями на концах двухцепочечных участков (рис. 205).
Все известные последовательности оснований транспортных
РНК могут быть сложены в форме клеверного листа. У них есть
и другие черты сходства. На конце стебля каждая из них содержит
одноцепочечную последовательность ЦЦА, к которой
присоединяется аминокислота. Средняя петля всегда содержит три
основания антикодона. Одна из двух других петель, изображенная
справа, очень сходна во всех транспортных РНК; возможно, что эта
петля прикрепляется к неспецифическому связывающему участку
рибосомы. Какова функция остальных частей молекулы,
составляющих больше половины всей ее цепи? До 1973 года не было даже
известно, как ферменты, присоединяющие аминокислоты, узнают
цужную транспортную РНК; было только установлено, что анти-
кодон не является участком узнавания.
С помощью рентгеноструктурного анализа удалось определить
трехмерную конфигурацию фенилаланиновой транспортной РНК,
выделенной из дрожжей. Трехмерная структура зависит от
конфигурации выступающих одноцепочечных участков клеверного
ХЗалин
^MlJTlJ^
►в <
-i—n
n—>
с—t-
< >
I I I I I
j1 УЦЦГГ?^
<—<
c—t-
д—c-
•в- <
n—>
<—<
<—<
<—<
VIA. агц^ЦАГг.^
< —<
J= L.
-* C5
^ .<
'tytftf*
Аланииовая тРНК
Валы новая тРНК
Фенилаланйн
J=—и
П £Т
-J >
> >
<—<
Тирозин
<
-в <
>—>
Фенилаланиновая тРНК
с—u
<—u
dJWJ*. ч: Mill?
^ my i!rurTf
<*w*r f *
i 1 ^ E-^
>->
>->
-J—sJ
Тирозиновая тРНК
Рис. 205. Четыре молекулы транспортных РНК (тРНК), представленные
в конфигурации клеверного листа. Помимо четырех оснований, обычных для
РНК (А, Г, Ц и У), здесь встречается много модифицированных оснований,
таких, как диметил-Г (т2Т), ацетил-Ц (АсЦ) и другие. Аминокислота
прикрепляется к одноцепочечной последовательности ЦЦА на конце «стебля»
транспортной РНК, как показано на рисунке. Три основания в средней петле,
выделенные жирным шрифтом, образуют антикодон, который связывается
с ко доном информационной РНК. В настоящее время известна
последовательность оснований в молекулах более 15 транспортных РНК 1.
1 В настоящее время — более 80.— Прим. ред.
262 ГЛАВА 9
Место
присоединения
аминокислоты
Рис. 206. Схематическое
изображение трехмерной
конформации фенилалани-
новой транспортной РНК.
(S. H. Kim et al., Science,
179, 285, 1973.)
листа; они изогнуты так, что молекула напоминает по своей форме
букву L. Биохимические данные, полученные позже (в 1973 году),
подтверждают эту структуру и позволяют предполагать, что в
узнавании определенной транспортной РНК соответствующим
ферментом ключевую роль играет трехточечное присоединение к
изгибу в области угла буквы L.
РИБОСОМЫ —
БЕЛОКСИНТЕЗИРУЮЩИЕ
МАШИНЫ
Рибосома — это приспособление для синтеза белков. Один
за другим она спаривает кодоны информационной РНК с антикодо-
нами транспортных РНК, несущих аминокислоты, и при этом
каждый раз присоединяет к цепи по одной аминокислоте.
Что это за частица, координирующая работу
информационной РНК, транспортных РНК и ряда факторов (белков или
ферментов), о роли которых в синтезе белка можно сейчас только
догадываться? Структура рибосомы и механизм ее действия были
настолько непонятны, что эту частицу окрестили «черным ящиком
синтеза белка». Однако тайна рибосомы начинает понемногу
раскрываться.
Рибосомы бактерий состоят из двух компонентов, называемых
30S- и бОЭ-субчастицами (такое обозначение характеризует
скорость, с которой частица осаждается в ультрацентрифуге). 30S-
Петля антикодона
СИНТЕЗ БЕЛКА 263
Рис. 207. Бактериальная
рибосома (увеличение 800 000).
(С разрешения М. Lubin.)
Рис. 208. Электронная
микрофотография смеси 30S- и 50S-
субчастиц, полученных в
результате диссоциации интакт-
ных рибосом (увеличение
450 000). Цифрами указаны
субчастицы, видимые с двух
различных сторон. Полная
рибосома, состоящая из одной
30S- и одной бОБ-субчастицы,
показана на рис. 207.
субчастица примерно вдвое меньше, чем 50S, и состоит из одной
большой молекулы РНК и двух десятков различных белков;
503-субчастица — из двух молекул РНК (одной очень большой
и одной маленькой) и примерно 30 белков. 50 различных белков
в одной крошечной рибосоме! Видимо, устройство ее должно быть
необычайно сложным.
КАК СИНТЕЗИРУЕТСЯ
БЕЛОК
Синтез белка в принципе несложен. Молекулы транспортной
РНК служат адаптерами — подбирают аминокислоты в
соответствии с последовательностью оснований. Они выстраиваются
одна за другой в порядке, определяемом кодонами информационной
РНК, с которыми связываются антикодоны транспортных РНК
путем спаривания оснований. Затем аминокислоты,
прикрепленные к транспортным РНК, соединяются пептидными связями.
Рибосомы координируют эти реакции и способствуют их
протеканию. Таковы основные принципы синтеза белка.
На самом деле все это значительно сложнее, отчасти потому,
что рибосома имеет только два участка для связывания двух
молекул транспортной РНК. Поэтому удлинение (элонгация)
белковой цепи происходит путем многократного повторения довольно
сложного цикла. Аминокислота, связанная с молекулой
транспортной РНК, находящейся в так называемом акцепторном участке,
264 ГЛАВА 9
Рис. 209. Схема синтеза полипептидной цепи белка.
/ — IV. Инициация. ЗОЭ-субчастица рибосомы (изображена в форме
полумесяца) прикрепляется к информационной РНК в том месте, где
расположен инициирующий триплет АУГ (/*), образуя с ней комплекс (ТУ) (на этом
этапе необходим фактор инициации F3). Формилметиониновая транспортная
РНК с присоединенным к ней формилметионином связывается с кодоном АУГ
(77/) (для этого требуются факторы F1 и F2). В результате присоединения
бОБ-субчастицы образуется полная рибосома (IV).
V—VII. Элонгация. Подходящая транспортная РНК (в данном случае
аланиновая) связывается со следующим кодоном информационной РНК
(в данном случае ГЦУ) (F); для этого необходимы факторы Ти и Ts. Формил-
СИНТЕЗ БЕЛКА 265
присоединяет к себе (акцептирует) растущую белковую цепы
между ними образуется пептидная связь. Транспортная РНК,
к которой теперь прикреплен растущий белок, вместе с
информационной РНК перемещается в донорный участок. В этом
положении транспортная РНК служит донором растущей белковой цепи
для следующей аминокислоты, присоединенной к другой
транспортной РНК, которая только что заняла освободившийся
акцепторный участок. Этот процесс, называемый элонгацией, повторяется
снова и снова, создавая длинную молекулу белка. Ему
способствуют факторы элонгации — белки с неизвестной функцией.
Своеобразным сложным этапом является инициация синтеза
новой белковой цепи. У бактерий синтез белка начинается с ини-
циаторного кодона, расположенного где-то в молекуле
информационной РНК, не обязательно в ее начале. В этом месте
присоединяется ЗОЭ-субчастица рибосомы вместе с несколькими недавно
открытыми и пока еще мало изученными факторами инициации
и молекулой транспортной РНК, несущей специальную инициа-
торную аминокислоту формилметионин (эта аминокислота —
производное обычной аминокислоты метионина — впоследствии
отщепляется). Этот «инициаторный комплекс» присоединяется
к бОЭ-субчастице, образуя с ней полную рибосому. При этом
на стыке обеих субчастиц создается акцепторный участок,
который может принять вторую транспортную РНК.
Некоторые функции 30S- и 50Э-субчастиц рибосомы известны.
ЗОЭ-субчастица связывает информационную РНК, обеспечивая
спаривание кодона информационной РНК с антикодоном
подходящей транспортной РНК. 508-субчастица присоединяется к этой
транспортной РНК и затем катализирует присоединение ее
аминокислоты к растущей белковой цепи, прикрепленной к другой
транспортной РНК в донорном участке. Донорный участок
находится на ЗОЭ-субчастице.
Присоединение аминокислот к растущей цепи белка
прекращается, когда рибосома доходит до терминирующего кодона инфор-
метионин переносится со своей транспортной РНК на вторую
аминокислоту — аланин (VI). Информационная РНК и транспортная РНК с
присоединенным к ней формилметионилаланином перемещается с акцепторного
участка на свободный донорный участок (VII). Эти этапы повторяются много раз,
и полипептидная цепь постепенно удлиняется.
VIII—X. Терминация. В процессе элонгации образуется, наконец,
комплекс VIII, в котором законченная полипептидная цепь, привязанная к
транспортной РНК, занимает донорный участок. Поскольку следующий кодон,
УАА, предписывает окончание синтеза, в акцепторном участке не
связывается никакая транспортная РНК. При участии особого фактора готовая
полипептидная цепь и, возможно, транспортная РНК отделяются от
рибосомы (IX). Одна молекула информационной РНК может кодировать несколько
белков; если уже синтезирован последний из них, то комплекс IX распадается
на отдельные компоненты — информационную РНК и две субчастицы
рибосомы (X). (По Ann. Rev. Biochem., 1971, 698; с разрешения S. Pestka.)
266 ГЛАВА 9
Рис. 210. Рибосомы из
печени крысы, соединенные
в цепочки молекулами
информационной РНК,
которую они транслируют в
белок. (G. Nomomura et
al., J. Mol. Biol., 60, 303
(1971); с разрешения D.
Sabatini.)
мационной РНК. Тогда законченная белковая цепь отделяется
от последней транспортной РНК при участии факторов термина-
ции. Теперь вся система может распасться на основные части —
30S- и 503-субчастицы рибосомы и информационную РНК.
Так в общих чертах происходит синтез белка у бактерий.
Сходным образом протекает он и в животных клетках: здесь тоже
участвуют информационная РНК, транспортные РНК и рибосомы;
однако информационная РНК здесь более стабильна, инициаторной
аминокислотой служит метионин, а не формилметионин, и
рибосомы несколько крупнее и поэтому, вероятно, имеют более
сложную структуру. Хотя неизбежно обнаружатся и другие отличия,
они будут, без сомнения, не столь значительными, поскольку
сейчас уже ясно, что механизм белкового синтеза в основе своей
одинаков во всех клетках.
В животных клетках компоненты белоксинтезирующего
аппарата первоначально образуются в ядре; затем они перемещаются
в цитоплазму, где в основном протекает синтез белка. С помощью
электронного микроскопа в местах активного синтеза белка можно
СИНТЕЗ БЕЛКА 267
Рис. 211. Бактериальные гены в действии. На
этих! трех электронных микрофотографиях
видны участки бактериальной хромосомы, на
которых идет синтез белка. Нить хромосомы
состоит из ДНК. С нее свисают нити
информационной РНК с рибосомами,
расположенными по всей их длине; рибосомы,
несомненно, синтезируют белок, считывая
информационную РНК с дальнего конца по
направлению к хромосоме. В месте прикрепления
каждой информационной РНК к ДНК
находится гранула неправильной формы —
молекула РНК-полимеразы, синтезирующая
информационную РНК. Одна молекула полиме-
разы (Б, указана стрелкой) расположена
в той точке хромосомы, где происходит
инициация синтеза информационной РНК. По
мере удаления от точки инициации молекулы
информационной РНК становятся все длиннее
и к ним прикреплено все больше рибосом.
Весь участок хромосомы от стрелки (Б) до
последней полирибосомы достаточно длинен,
чтобы кодировать несколько белков. Видна
также неактивная хромосомная нить, около
которой нет полирибосом. Препарат, изображенный на фото В, был
подготовлен для электронной микроскопии другим методом; более сильное
увеличение позволяет лучше рассмотреть рибосомы и РНК-полимеразу.
Увеличение: Л — 72 000; Б — 92 000; В — 306 000. (А и Б: О. L.
Miller et al., Science, 69, 392 (1970); В: О. L. Miller, Barbara A. Hamkalo, Int.
Cytol., 33 (1972); с разрешения О. L. Miller, jr.)
•
268 ГЛАВА 9
видеть цепочки из рибосом, связанных тонкой нитью —
информационной РНК (рис. 210).
В более простых и намного меньших по своим размерам
бактериальных клетках синтез белка почти буквально «наступает на
пятки» синтезу информационной РНК. На изящных
микрофотографиях, полученных в последнее время с помощью электронного
микроскопа (рис. 211), видны нити информационной РНК,
свисающие с ДНК; на каждой такой нити сидит много рибосом,
которые прицепились одна за другой к концу цепи информационной
РНК и теперь движутся по направлению к ДНК, транслируя в
белок генетическую информацию, содержащуюся в РНК.
ВЗАИМОДЕЙСТВИЕ
ВИРУСА С КЛЕТКОЙ-
ХОЗЯИНОМ
Путь информации, связанной с синтезом белка, можно
представить формулой
-*ДНК -* РНК —► Белок.
Эта формула получила название «центральной догмы»
молекулярной биологии. Она означает, что информация, содержащаяся
в ДНК, т. е. последовательность оснований ДНК, направляет
синтез новой ДНК и РНК, а информация, содержащаяся в РНК,
направляет синтез белка. Этот путь передачи информации
представляет собой химическую основу жизни.
Вирусы тем или иным способом внедряются в цепь биосинтезов
«ДНК -►• РНК -*■ белок» своих хозяев. Многие вирусы содержат
ДНК; вирусная ДНК может сосуществовать с ДНК
клетки-хозяина или вытеснять ее. Другие вирусы содержат РНК; вирусная
РНК инициирует в клетке новые синтетические процессы — синтез
самой вирусной РНК или даже ДНК.
ДНК-СОДЕРЖАЩИЕ
ВИРУСЫ
Способ включения вирусов в цепь «ДНК ->■ РНК ->- белок»
клетки-хозяина можно проиллюстрировать на примере ДНК-
содержащих фагов. При заражении клеток этими вирусами
возможны два различных исхода.
Фаг Т2, так же как очень сходный с ним Т4 и многие другие,—
вирулентный фаг, который вызывает активную инфекцию хозяина.
СИНТЕЗ БЕЛКА 269
%-, 9-^ ^
(Ш (о)
Рис. 212. Фаг лямбда может вступать в длительные более или менее
«мирные» взаимоотношения с бактерией-хозяином. В этом случае фаговая ДНК
после проникновения в бактерию встраивается в бактериальную ДНК и
становится неотличимой от нее. До тех пор пока она остается включенной
в ДНК бактерии-хозяина, она реплицируется вместе с этой ДНК и переходит
во все дочерние клетки. В обычных условиях ее способность вызывать
активную инфекцию с образованием фагового потомства подавлена.
Как мы уже говорили (см. рис. 157 и 159), после введения ДНК
Т2 в бактериальную клетку биохимические механизмы бактерии
переключаются на синтез фаговых ДНК, информационной РНК
и белка, что приводит к образованию сотен новых частиц фага и
лизису клетки.
Фаг лямбда способен вызывать активную инфекцию; это
зависит от штамма бактерий и от некоторых условий. В других
случаях устанавливаются длительные взаимоотношения, более или
менее безвредные для бактерии: ДНК фага лямбда, вместо того
чтобы инициировать собственную репликацию и синтез фаговых
белков, физически объединяется («интегрируется») с ДНК
хозяина; ее способность к активной инфекции не проявляется, и
размножения фага не происходит.
ДНК фага лямбда удваивается вместе с бактериальной ДНК,
в которую она включена, и передается всем дочерним клеткам.
Однако бактерия, несущая такую ДНК, подвергается все же
некоторому риску: фаговая ДНК может вдруг «вырваться из
подчинения» и вызвать активную инфекцию, приводящую к образованию
фагового потомства и гибели клетки. Обычно такая судьба ждет
примерно одну бактериальную клетку из 100 тысяч, хотя
некоторые воздействия, например облучение ультрафиолетом,
провоцируют активную инфекцию во всех клетках.
Ветряная оспа, свинка и бешенство вызываются вирулентными
ДНК-содержащими вирусами; инфекция животных клеток этими
вирусами во многих отношениях сходна с активной инфекцией
бактериальных клеток фагом Т2. Однако вирулентные вирусы
животных обычно высвобождаются из зараженных клеток постепенно,
а не лизируют их с одновременным выходом всех вирусных частиц,
как вирулентные фаги.
270 ГЛАВА 9
Рис. 213. Два ДНК-содержащих вируса, поражающих человека. А. Вирус
орфа, вызывающий пустулярный дерматит у человека и овец; он может
состоять из гибкой спирали, скрученной в структуру, похожую на кокон.
(С разрешения R. W. Home.) Б. Вирус папилломы, вызывающий бородавки;
его частицы имеют простую сферическую структуру. (С разрешения Virus
Laboratory, Univ. of California at Berkeley.)
Один из ДНК-содержащих вирусов животных — вирус
простого герпеса — удивительно напоминает по своему поведению
фаг лямбда. Этот вирус заражает маленьких детей, вызывая чаще
всего появление пузырьков на коже, которые исчезают спустя
1—2 недели. В последующей жизни повышенная температура,
эмоциональное напряжение или излишнее пребывание на солнце
может снова вызвать кожные высыпания — активировать вирус
герпеса, никак не проявлявший себя в течение многих лет.
ВИРУС ТАБАЧНОЙ
МОЗАИКИ-РНК-СОДЕРЖАЩИЙ
ВИРУС
Некоторые вирусы содержат не ДНК, а РНК. Палочковидный
вирус, вызывающий мозаичную болезнь табака,— вирус табачной
мозаики (ВТМ) — представляет собой цилиндр, состоящий из
бесчисленного множества белковых молекул, уложенных по
спирали; внутри этого цилиндра лежит скрученная молекула РНК.
В 1957 году Френкель-Конрат из Калифорнийского университета
СИНТЕЗ БЕЛКА 271
Рис. 214. Палочковидный вирус, вызывающий мозаичную болезнь табака.
А, Электронная микрофотография вирусных частиц; в палочке имеется
продольный канал, как можно видеть на коротком сегменте, видимом с торца.
(С разрешения Virus Laboratory, Univ. of California at Berkeley.) Б. Модель
вируса табачной мозаики; вирус состоит из идентичных белковых
субъединиц, уложенных по спирали, внутри которой проходит спираль РНК. (С
разрешения D. L. Caspar и A. Klug.)
в Беркли показал, что эта РНК служит генетическим материалом
ВТМ и определяет тип белковых молекул, образующих
цилиндрическую оболочку.
Френкель-Конрат обнаружил, что ВТМ, обработанный слабой
щелочью или детергентом, распадается на белок и РНК. Он
очистил оба эти компонента; ни тот, ни другой по отдельности не
вызывал заражения листьев табака. Затем Френкель-Конрат
соединил их в слегка кислом растворе, и тогда снова образовались
типичные палочки, способные вызывать мозаичную болезнь.
После этого Френкель-Конрат приготовил «смешанные»
вирусы из белка и РНК, взятых от разных штаммов — обычного ВТМ
и штамма HR. На листьях табака, зараженных вирусными
частицами из РНК ВТМ и белка HR, образовались расплывчатые
желтые пятна, типичные для инфекции ВТМ; на листьях, зараженных
частицами из РНК HR и белка ВТМ, образовались мелкие
округлые поражения, типичные для инфекции HR. Таким образом, РНК,
и только РНК, определяла тип поражений.
Самое интересное то, что белок потомства смешанного вируса
был в химическом отношении подобен белку того штамма, от кото-
272 ГЛАВА 9
Рис. 215. Вирусные ,
поражения на листьях табака. А и Б.
Листья, зараженные обычным
вирусом табачной мозаики,
покрыты грязно-желтыми
пятнами неправильной формы. >В.
Листья, зараженные штаммом
HR вируса табачной мозаики,
покрыты крапинками. (Л и
Б—с f разрешения К. R.
Keller и G. V. Gooding, jr;
Б—с разрешениям. Williams.)
рого взяли РНК, а не того, от которого взяли белок. Белковый
цилиндр штамма HR содержит две аминокислоты (гистидин и ме-
тионин), которых нет в белке ВТМ. У потомства смешанного
вируса, составленного из РНК HR и белка ВТМ, белковый цилиндр
содержал эти аминокислоты, т. е. это был белок HR; напротив,
у потомства вируса, скомбинированного из РНК ВТМ и белка
HR, не было в белке ни гистидина, ни метионина, т. е. оболочка
состояла из белка ВТМ (табл. 3).
Это был ключевой эксперимент, доказавший, что генетическим
материалом вируса табачной мозаики является РНК. Вскоре
после этого двум немецким ученым — Альфреду Гиреру и Гер-
харду Шрамму — удалось заразить листья табака очищенной
РНК ВТМ без примеси вирусного белка. Генетическая роль
вирусной РНК была теперь установлена с полной достоверностью.
СИНТЕЗ БЕЛКА 273
Таблица 3
Функция РНК и белка
вируса табачной мозаики
Родительский вирус
РНК
ВТМ
HR
ВТМ
HR
белок
ВТМ
HR
HR
ВТМ
Тип поражений на листьях
Расплывчатые желтые
пятна
Мелкие округлые
поражения
Расплывчатые желтые
пятна
Мелкие округлые
поражения
Белок вирусного потомства
ВТМ (нет гистидина и ме-
тионина)
HR (содержит гистидин
и метионин)
ВТМ (нет гистидина и ме-
тионина)
HR (содержит гистидин и
метионин)
ДРУГИЕ РНК-СОДЕРЖАЩИЕ
ВИРУСЫ
РНК служит генетическим материалом многих вирусов. К
вирулентным РНК-содержащим вирусам относятся все известные
вирусы растений, некоторые фаги и многие болезнетворные
вирусы животных (полиомиелит, желтая лихорадка, грипп и
энцефалит — примеры болезней человека, вызываемых РНК-содержа-
щими вирусами). Такие вирусы прекрасно вписываются в систему
«ДНК ->• РНК ->- белок» хозяина: вирусная РНК заменяет
информационную РНК хозяина на рибосомах, заставляя их
синтезировать вирусные белки. Таким образом, вирусная РНК — это
информационная РНК.
Среди вирусных белков есть один уникальный фермент —
РНК-зависимая РНК-полимераза, которая синтезирует РНК, ис-
Рис. 216. Вирус кустистой
карликовости томата — сферический
РНК-содержащий вирус, сильно
отличающийся по виду от вируса
табачной мозаики. (С разрешения
Virus Laboratory, Univ. of California
at Berkeley.)
18-0414
274 ГЛАВА 9
Рис. 217. Два РНК-содержащих вируса, поражающие человека. А. Вирус
полиомиелита; сферические частицы. Б. Вирус гриппа; имеет сложно
устроенную оболочку, которая образуется, по крайней мере частично, из клеточной
мембраны, когда вирус выходит из зараженной клетки. (С разрешения Virus
Laboratory, Univ. of California at Berkeley.)
Рис. 218. Миксовирусы — класс РНК-содержащих вирусов животных;
к одной их подгруппе относится вирус гриппа, к другой — вирусы,
вызывающие свинку, корь и парагрипп (острое респираторное заболевание у детей).
А. Модель структуры миксовирусов: вирус состоит из гибкой белок- и РНК-
содержащей спирали, скрученной внутри сложной оболочки. Б. Электронная
микрофотография вируса парагриппа. Видны субъединицы гибкой спирали
в форме бублика. Подобного рода микрофотографии использовались при
построении модели. (С разрешения R. W. Home.)
IraPi '
Hell
™ щ
"JI
/;JH
м
■ . ..
СИНТЕЗ БЕЛКА 'J275
пользуя вирусную РНК в качестве матрицы. Первым этапом
удвоения одноцепочечной вирусной РНК является синтез
комплементарной цепи с образованием двухцепочечной молекулы РНК.
Этот этап аналогичен первому этапу удвоения одноцепочечной
ДНК вирулентного фага 0 Х174; как мы уже знаем, там тоже
сначала образуется двухцепочечная молекула. Реовирус (один из
вирусов животных) и некоторые вирусы растений (вирус
карликовости риса и вирус раневых опухолей) сами содержат двухцепо-
чечную РНК.
ОПУХОЛЕРОДНЫЕ ВИРУСЫ
Вирус раневых опухолей растений — это лишь один из
многочисленных вирусов, вызывающих опухоли. Бородавки, например,
возникают под влиянием ДНК-содержащего вируса; аналогичные
доброкачественные опухоли собак, коров, лошадей, кроликов,
мышей и хомячков также вызываются ДНК-содержащими
вирусами. Пока не был выяснен жизненный цикл фага лямбда,
отсутствие вируса в этих опухолях казалось совершенно непонятным.
Сейчас в некоторых случаях удалось показать, что вирусная ДНК
включена в ДНК клетки-хозяина и передается таким образом
дочерним клеткам. Вирусная ДНК (в отличие от ДНК фага лямбда)
трансформирует клетки — превращает нормальные клетки в
опухолевые, и они начинают более или менее бесконтрольно расти и
делиться. Очевидно, что механизм такой трансформации
представляет огромный интерес, но он пока неизвестен.
Наиболее интересны для исследователей РНК-содержащие
опухолеродные вирусы, так как известно, что у животных они
вызывают злокачественные опухоли и лейкозы. Пока еще не удалось
достоверно установить вирусное происхождение какой-либо формы
рака у человека. В 1970 году был достигнут значительный
прогресс в изучении этих РНК-содержащих вирусов: Ховард Темин
из Висконсинского университета и Дэвид Балтимор из Массачу-
сетского технологического института открыли
вирус-специфический фермент РНК-зависимую ДНК-полимеразу, которая
синтезирует ДНК по образцу вирусной РНК (при этом вначале
образуется двухцепочечная гибридная молекула РНК — ДНК).
Это открытие служит сильным доводом в пользу гипотезы Те-
мина, выдвинутой еще в 1964 году, согласно которой
опухолеродные РНК-содержащие вирусы ведут себя подобно фагу лямбда:
вирусная ДНК включается в ДНК клетки-хозяина.
РНК-зависимая ДНК-полимераза была найдена в клетках, зараженных
всеми известными РНК-содержащими вирусами, вызывающими
злокачественные и доброкачественные опухоли, но ее не находили
при заражении вирулентными РНК-содержащими вирусами,
вызывающими обычную инфекцию.
18*
276 ГЛАВА 9
РНК-зависимая ДНК-полимер аза была обнаружена в белых
кровяных клетках у больных лейкозом. Эти и многие другие
данные указывают на то, что у человека, так же как и у животных, по
крайней мере некоторые формы рака имеют вирусное
происхождение. Но, даже если это будет окончательно установлено *, еще
много вопросов останется без ответа. Что ограничивает рост и
деление клеток в норме? Какие изменения приводят к безудержному
инфильтрирующему росту злокачественных клеток? Регулятор-
ные механизмы, действующие в животных клетках, до сих пор
в основном неизвестны; их выяснение, безусловно, будет в
огромной мере способствовать борьбе против рака.
1 Сейчас РНК-зависимая ДНК-полимераза (или, как ее еще называют,
обратная транскриптаза) найдена не только в онкогенных (вызывающих
злокачественную опухоль), но и в неонкогенных вирусах, а также в
нормальных клетках мыши и человека, полученных как от взрослых
организмов, так и от эмбрионов. Темин предположил, что обратная транскриптаза
может играть важную роль в таких процессах, как дифференцировка,
образование антител, запоминание. [См. Дэвидсон Дж., Биохимия
нуклеиновых кислот, изд-во «Мир», М., 1976, стр. 269; Scolnick E. M. et al.,
Nature, 229, 318 (1971).] —Прим. ред.
ГЕНЕТИЧЕСКИЙ КОД
В 1957 году Верной Ингрэм показал, что гемоглобин больных
наследственной серповидноклеточной анемией отличается от
нормального гемоглобина одной аминокислотой: глутаминовая
кислота замещена в нем валином. Из этого было ясно, что структура
гена определяет аминокислотную последовательность белка.
Каким образом ген определяет структуру белка, как
последовательность оснований кодирует последовательность
аминокислот? Как прочитывается закодированная информация? Какая
именно группа оснований соответствует данной аминокислоте?
Эти вопросы составляли труднейшую проблему кодирования, как
ее стали называть. В 1960 году решение этой проблемы казалось
делом далекого будущего. Но уже через несколько лет она была
решена.
ОБЩИЕ ОСОБЕННОСТИ
ГЕНЕТИЧЕСКОГО КОДА
Сколько оснований образуют кодон — отрезок цепи ДНК,
соответствующий определенной аминокислоте? Четыре основания
ДНК должны кодировать 20 аминокислот, входящих в состав
белков. Если одной аминокислоте соответствует одно основание,
то четыре основания могут кодировать только четыре
аминокислоты. Если аминокислоту кодируют два основания, то с помощью
четырех разных оснований можно закодировать 16 аминокислот
(четыре различных основания могут образовать 4x4, т. е. 16
различных пар: АА, АЦ, АГ, AT, ЦА, ЦЦ, ЦГ, ЦТ, ГА, ГЦ, ГГ,
ГТ, ТА, ТЦ, ТГ, ТТ). Этого еще не достаточно. Наконец, если каж-
10
278 ГЛАВА 10
дой аминокислоте соответствует триплет, т. е. группа из трех
оснований, то таких триплетов может быть уже 64 (4 X 4 X 4), и
этого более чем достаточно, чтобы кодировать 20 аминокислот.
Значит, кодон — группа, кодирующая одну аминокислоту,—
должен состоять по меньшей мере из трех оснований.
Однако триплетных кодонов получается даже слишком много.
Может быть, большая часть их «не имеет смысла», т. е. не
кодирует никаких аминокислот? Или код является вырожденным —
одна аминокислота может обозначаться более чем одним кодоном?
Не отделяются ли кодоны друг от друга особыми знаками вроде
«запятых», роль которых могли бы, например, выполнять
«бессмысленные» триплеты, не кодирующие аминокислоту?
В 1961 году Фрэнсис Крик вместе с несколькими коллегами
ответил на все эти вопросы и заложил, таким образом, основу для
полной расшифровки генетического кода.
СЧИТЫВАНИЕ ГЕНЕТИЧЕСКОЙ
ИНФОРМАЦИИ НАЧИНАЕТСЯ
С ОПРЕДЕЛЕННОГО МЕСТА
Для выяснения общей природы генетического кода Крик
использовал мутацию фага Т4, которую он назвал FGO. Мутация
FGO в гене rll, который был тщательно изучен С. Бензером,
возникла при обработке фага акридином — веществом, вызывающим
мутации. Крик полагал, что под действием акридина происходит
вставка или выпадение (делеция) одного основания в ДНК (позже
это предположение подтвердилось). Другие химические вещества,
индуцирующие мутации, вызывают обычно замену одного
основания другим.
Среди мутантов FCO изредка встречались ревертанты — фаги,
которые казались нормальными, так как давали обычные бляшки,
или зоны лизиса (см. рис. 155). Крик скрестил этих ревертантов
с нормальными, немутантными фагами. Если бы у ревертантов
Внешне
нормальный
ревертант
Истинно
ИППЛАП JlhHhlfj -
фаг
FC0
•
FCx
FC0
—^-
FCx
Рис. 219. Крик обнаружил, что при скрещивании фагов-ревертантов,
кажущихся нормальными, с действительно нормальными фагами среди
потомства встречаются генетические рекомбинанты, несущие либо исходную
мутацию FCO, либо другую, расположенную вблизи нее мутацию того же гена
rll. Таким образом, исходный ревертант должен был иметь обе эти мутации,
которые вместе делали его внешне нормальным.
ГЕНЕТИЧЕСКИЙ КОД J[279
Правильное уТАГ.ТАГ.ТАГ.ТАГ^АГ.ТАГ.ТАГ.ТАГ,
считывание ~т ' • 1 • • ' ' •"
Неправильное туа гт,агт >агт хагт\агт\агт {агт\аг
гмыты&аыие I ' ■ I 1 г—1 I
Неправильное ТА,ГТА,ГТАХГТАТТАХГТАТТАХТАТ
считывание
Вставка с
УюслОуютй ^лг^таг^га^та.гтА[гта]Таг{тлг{
делецией t »
Делеиия с *'"""** Дв2еция
Шедующей ]ТАГ{ТАГ{АГТ]АГТ{АГТ^Ги^ТАГ]ТАГ]
вставкой a t
Деления Вставка
Рис. 220. Если кодоны для отдельных аминокислот состоят из трех
оснований и если последовательность оснований считывается по триплетам с
определенной начальной точки и ничто не указывает, где кончается один кодон
и начинается другой, то существует только один правильный и два
неправильных способа группировки оснований в триплеты. (На рисунке
последовательность оснований упрощена: она сводится к повторению триплета ТАГ.)
Вставка (или же делеция) основания приводит к неверному считыванию
триплетов; однако правильное считывание восстанавливается после делеции
(или вставки) другого основания.
тоже не было мутаций, то все потомство было бы немутантным.
Однако Крик обнаружил в потомстве мутантов по гену rll,
несущих исходную мутацию FGO или другую мутацию rll,
расположенную вблизи FGO. Появление этих rll-мутантов в результате
генетической рекомбинации между ревертантом и нормальным
фагом показало, что на самом деле ревертант несет две мутации —
одну прежнюю и одну новую.
Как вторая мутация, расположенная вблизи первой, может
подавлять (супрессировать) ее действие? Предположим, код ДНК
считывается от определенной начальной точки группами по три
основания. Тогда в случае неверного выбора начальной точки
неправильной будет и разбивка цепи на тройки оснований. В самом
деле, правильный способ группировки оснований в триплеты
только один, а неправильных два.
Точно так же вставка или делеция одного основания в любом
участке гена приведет к неверному считыванию, неверной
группировке оснований в кодоны, начиная с этой точки. Но если
поблизости от мутации (например, вставки лишнего основания),
впереди или позади нее, возникнет мутация противоположного типа
(делеция), считывание будет неверным только в промежутке между
двумя мутациями. На участке после второй мутации ДНК снова
будет считываться правильными группами по 3 основания.
280 ГЛАВА 10
Исходя из этих рассуждений Крик приписал мутации FCO
знак «плюс» (хотя он не знал, была ли здесь делеция или
вставка основания), а супрессирующим мутациям — знак
«минус».
Среди фагов, содержащих супрессорную мутацию, Крик стал
искать и нашел ревертантов. Они опять-таки содержали две
мутации гена гП: супрессорную мутацию «минус» и мутацию,
подавляющую действие супрессора (супрессор супрессора), которую
Крик обозначил знаком «плюс». Наконец, и для таких мутаций он
нашел супрессоры (это были уже супрессоры супрессоров
супрессора!). Им он снова приписал знак «минус». Всего он выделил
таким образом 80 мутантов «плюс» и «минус».
Из них Крик сконструировал двойных мутантов с новыми
парами мутаций. Двойные мутанты с плюс- и минус-мутациями часто
оказывались нормальными, в то время как две плюс- или две
минус-мутации никогда не подавляли друг друга. Эти результаты
подтверждали гипотезу о том, что основания ДНК считываются
тройками и что считывание начинается в определенной начальной
точке. Поэтому вставка одного основания нарушает правильную
группировку оснований по 3; это нарушение может быть
исправлено делецией другого основания, но не вставкой.
ВЫРОЖДЕННЫЙ ХАРАКТЕР
КОДА
Большинство двойных мутантов, имеющих плюс- и минус-
мутации, выглядели нормальными, поскольку область гена гП,
изученная Криком, не существенна для функционирования белка
гИ. Поэтому даже при замене нескольких аминокислот в
небольшом участке между плюс- и минус-мутациями белок гП остается
более или менее активным.
Но Крик обнаружил несколько двойных мутантов
«плюс-минус», которые не были нормальными. Он заключил, что в этих
случаях в результате неверного считывания получались
«бессмысленные» триплеты, которые не кодируют никакую аминокислоту
(но могут означать, например, терминацию синтеза белка).
Если бы для кодирования 20 аминокислот, входящих в состав
белков, использовались только 20 из 64 возможных триплетов, то
пары мутаций «плюс-минус» в большинстве случаев порождали бы
«бессмысленные» триплеты. Поскольку очевидно, что это не так,
Крик сделал вывод, что код является вырожденным, т. е.
аминокислоты могут обозначаться более чем одним триплетом.
ГЕНЕТИЧЕСКИЙ КОД 281
Нормальная ,ТАГ,ТАГ,ТАГ,ТАГ,ТАГ,ТАГ,ТАГ,ТАГ,
ДНК ~* ' ' ' ' ' ' ' *~
Тривставки хТЛГ{ТЛГртуТАЛГТрГЦТАГ{ТЛГ{
tit
Вставка Вставка Вставка
Рис. 221. Вставка или дслецня всего лишь одного основания приводит к
образованию мутантного фага. В результате вставки (или делеции) двух
оснований также получается мутантный фаг. Но вставка (или делеция) трех
оснований дает фаг, который кажется нормальным. Правильная группировка
оснований в кодоны, нарушенная после первой и второй вставки (или
делеции), восстанавливается после третьей; из этого следует, что кодоны должны
быть триплетными.
КОДОНЫ
«ЭТО ДЕЙСТВИТЕЛЬНО
ТРИПЛЕТЫ
Наконец, Крик поставил вопрос: действительно ли кодон
состоит только из трех оснований? И он выяснил это весьма
остроумным способом. Он совмещал три плюс-мутации или три минус-
мутации в тройных мутантах, следя за тем, чтобы не получались
«бессмысленные» кодоны. Эти тройные мутанты оказывались ре-
вертантами. Одна плюс- или одна минус-мутация дает аномальный
фаг; две плюс- или две минус-мутации тоже дают аномальный
фаг; однако три плюс- или три минус-мутации дают нормальный
по виду фаг — поистине невероятный результат! Вывод: вставка
или делеция трех близко расположенных оснований
восстанавливает нормальное считывание, и, значит, кодон состоит из трех
оснований.
КАКИЕ ТРИПЛЕТЫ
КОДИРУЮТ
ТУ ИЛИ ИНУЮ
АМИНОКИСЛОТУ?
Крик показал, что кодон состоит из трех оснований и что
триплеты считываются один за другим, начиная с определенной точки.
Бреннер, Жакоб и Меселсон установили, что белки синтезируются
на неспецифических рибосомах, транслирующих
последовательность оснований информационной РНК в последовательность
аминокислот. Опираясь на эти и ряд других открытий, а также
благодаря некоторому везению и большой изобретательности Map-
282 ГЛАВА 10
Рис. 222. Маршалл Ниренберг (род. в 1927 г.). Ему принадлежит заслуга
расшифровки генетического кода. Полученные им данные о соответствии
триплетов оснований определенным аминокислотам были подтверждены в
работах X. Гобинда Кораны (род. в 1922 г.). Ниренберг и Корана за свою работу
по генетическому коду и Роберт Холли за определение последовательности
оснований в одной из транспортных РНК получили в 1968 году Нобелевскую
премию по физиологии и медицине. (С разрешения U.S. Public Health Service.)
шалл Ниренберг из Национальных институтов здоровья в Бетесде
(штат Мэриленд) сумел расшифровать код — выяснить, какие
именно триплеты обозначают ту или иную аминокислоту.
Ниренберг использовал систему бесклеточного синтеза белка
в пробирке, которую в течение нескольких лет разрабатывали
Пол Замечник и Малон Хоглэнд из Гарвардского университета.
Для синтеза белка в пробирке необходимо следующее:
1) аминокислоты;
2) транспортные РНК;
3) ферменты, присоединяющие каждую аминокислоту к
соответствующей транспортной РНК;
4) АТФ, доставляющий энергию для этой реакции;
5) рибосомы;
6) ГТФ — вещество, сходное с АТФ, но содержащее гуанин
вместо аденина. Как сейчас полагают, ГТФ служит источником
энергии для передвижения рибосомы вдоль информационной РНК;
вероятно, на каждую аминокислоту, присоединенную к растущей
белковой цепи, затрачиваются 2 молекулы ГТФ;
7) клеточный экстракт, роль которого только сейчас начинает
выясняться: он содержит факторы инициации, элонгации и тер-
минации;
ГЕНЕТИЧЕСКИЙ КОД 283
8) еще кое-какие добавки, например ионы магния.
Смешав все эти компоненты, гарвардская группа смогла
синтезировать очень небольшое количество белка.
Однако в 1961 году Ниренберг понял, что в пробирке
отсутствовал важнейший компонент — информационная РНК. Когда
он добавил информационную РНК, выделенную из вируса
табачной мозаики, синтез белка увеличился в 200 раз. После этого
Ниренберг сделал решающее открытие, которое в конце концов
привело к расшифровке кода: оказалось, что искусственная матрица
(искусственная информационная РНК) также стимулирует синтез
белка. Сначала он попробовал добавить полиуридиловую кислоту
(поли-У) — синтетическую «РНК», содержащую только одно
основание — урацил. Поли-У очень активно стимулировала
образование полипептидных цепей, но только из одной аминокислоты —
фенилаланина, которая полимеризовалась в искусственный белок
полифенилаланин. Теперь Ниренбергу был известен первый кодон:
триплет УУУ в информационной РНК кодирует аминокислоту
фенилаланин.
Ниренберг приготовил другие синтетические матрицы,
состоявшие из различных оснований в варьирующих соотношениях, со
случайной последовательностью. Каждая синтетическая матрица
вызывала полимеризацию только нескольких определенных
аминокислот. Сопоставляя вычисленную частоту встречаемости
каждого возможного триплета в данной матрице с содержанием
различных аминокислот в полученном полимере, Ниренберг смог
выяснить состав триплетов, кодирующих многие аминокислоты,
хотя и не мог еще установить последовательность оснований в них.
Это был шаг вперед в расшифровке кода, но задача не была еще
решена.
В 1965 году Ниренберг нашел путь к полному раскрытию кода.
Он смешивал рибосомы с транспортными РНК, несущими свои
аминокислоты, и синтетической «мини-матрицей», состоявшей всего
лишь из трех оснований, т. е. представлявшей собой один кодон.
Оказалось, что если пропустить такую смесь через специальный
фильтр, то рибосомы, триплетная матрица и одна из транспортных
РНК с присоединенной аминокислотой задерживаются на фильтре.
Каждый триплет вызывал связывание с рибосомами и,
следовательно, задержку на фильтре транспортной РНК, несущей только
одну аминокислоту. Например, в присутствии триплета ГГЦ это
была транспортная РНК, с которой связана аминокислота глицин.
С помощью этого метода Ниренберг выяснил, какие именно
триплеты кодируют ту или иную аминокислоту. Генетический код
был расшифрован.
Как это и предсказывал Крик, оказалось/ что большинство
кодонов — 61 из 64 — означают определенные аминокислоты.
Как правило, каждой аминокислоте соответствуют несколько ко-
284 ГЛАВА 10
Вторая буква
Первая
буква
У
ц
А
Г
У
УУУ^
УУЦ/Фен
ууг) Леи
ЦУУ1
АУУ1
АУЦ Шле
AyAj
AynXuJ
лоь
ГУ У)
ГУЦ >Вал
ryAj
ло»
ц
уцА><-ер
ЦЦУ|
ццА>"РО
4UrJ
АЦУ|
Ж*
AUrJ
гцг]
А
УАУ1
УАЦ/ТиР
УАА^
УАГ I *Стот
ЦАУ1
ЦАЦ/Гис
ЦАА\
ЦАГ/Глн
ААУ1
ААЦ / Асн
ААМ .х
ААГ)Лиз
ГАУ\а
ГАЦ/АСП
ГАА\Г
ГАГ/ГЛУ
Г
УГУ \
УГц)Цис
УГА) «Стоп»
УГГ} Три
ЦГУ1
АГУ>
АГЦ/СеР
АГА\ л
АГГ)Арг
ГГУ")
Ж'»
rrrj
Третья
буква
У
ц
А
Г
У
ц
А
Г
У
Д
А
Г
У
ц
А
Г
Рис. 223. Генетический код. Первое основание каждого триплета указано
слева, второе — вверху и третье — справа. Аминокислоты обозначены
сокращениями. Можно видеть, что все аминокислоты, кроме триптофана (Три),
кодируются двумя или большим числом триплетов, которые обычно
различаются только третьим основанием.
донов, различающихся только третьим основанием. Например,
фенилаланин кодируют триплеты УУУ и УУЦ, а глицин — ГГУ,
ГГЦ, ГГА и ГГГ.
Какова роль трех «бессмысленных» кодонов (УАА, УАГ и УГА)?
Вскоре было установлено, что они играют роль знаков
препинания: каждый из них — это «точка», означающая, что синтез
белковой цепи должен быть окончен. Два других кодона, АУГ и ГУГ,
могут означать, что «цепь начинается здесь», и тогда у бактерий,
как было описано выше, в этом месте связывается транспортная
РНК, несущая формилметионин; в любом другом месте, кроме
начала белковой цепи, АУГ кодирует метионин, а ГУГ — валин.
ГЕНЕТИЧЕСКИЙ КОД 285
ПОДТВЕРЖДЕНИЕ
ГЕНЕТИЧЕСКОГО КОДА
Использовав триплетные мини-матрицы и нитроцеллюлозные
фильтры, Ниренберг сумел соотнести кодоны с аминокислотами.
Но, может быть, он нашел код, работающий только в пробирке?
Или это, в самом деле, истинный генетический код, используемый
живыми клетками для трансляции последовательности оснований
ДНК в последовательность аминокислот при построении белка?
Гобинд Корана в Висконсинском университете смог
синтезировать матрицы с заранее определенной регулярной
последовательностью оснований; затем он установил, какие
последовательности аминокислот синтезируются рибосомами при участии этих
матриц. Оказалось, например, что матрица УГУГУГ...,
считанная как последовательность чередующихся триплетов УГУ-ГУГ-
УГУ-ГУГ..., направляет синтез полимера из двух
чередующихся аминокислот — цистеина и валина. Последовательность
...АУЦАУЦАУЦ... может быть прочитана тремя способами в
зависимости от начальной точки (АУЦ-АУЦ-АУЦ..., УЦА-УЦА-
УЦА... или ЦАУ-ЦАУ-ЦАУ-...); она направляет синтез трех
различных «белков», состоящих из одной аминокислоты,— полиизо-
лейцина, полисерина и полигистидина.
Использовав синтетические матрицы, более сходные с
природными, чем простые триплеты, Корана подтвердил значения кодо-
нов, установленные Ниренбергом, включая несколько
сомнительных. Оставался, однако, нерешенным вопрос: действительно ли
эти кодоны используются в живой клетке?
ИЗУЧЕНИЕ
АНОМАЛЬНЫХ БЕЛКОВ
ПОДТВЕРЖДАЕТ КОД
Данные Вернона Ингрэма о заменах аминокислот в аномальных
гемоглобинах показали, что триплеты Ниренберга — вероятно,
истинные триплеты. Ингрэм обнаружил, что глутаминовая
кислота нормального гемоглобина у больных серповидноклеточной
анемией замещена валином, а в гемоглобине С (это другой
аномальный гемоглобин) — лизином. Если мы рассмотрим код
Ниренберга, то увидим, что обе эти замены могут быть обусловлены мутацией
с изменением всего лишь одного основания. Глутаминовая кислота
кодируется триплетами ГАА и ГАГ, валин — ГУУ, ГУЦ, ГУА и
ГУГ, а лизин — AAA и ААГ. Если в информационной РНК для
нормального гемоглобина глутаминовой кислоте соответствует
кодон ГАА, то замена второго основания даст ГУА — один из ко-
286 ГЛАВА 10
донов валина, а замена первого основания даст AAA — один из
кодонов лизина.
Сейчас множество аномальных гемоглобинов
проанализировано различными исследователями с точки зрения замен
аминокислот. Френкель-Конрат определил аминокислотные замены
в белках многочисленных мутантных штаммов вируса табачной
мозаики. Чарлз Яновски из Стэнфордского университета изучил
замены аминокислот в бактериальном ферменте триптофансинтазе
более чем у дюжины различных мутантов. Во всех случаях
нормальной аминокислоте и аминокислоте, заменивший ее в мутант-
ном белке, соответствовали триплеты, различающиеся только
одним основанием.
Еще более убедительное подтверждение кода получил Джордж
Стрейзингер. Он сравнил аминокислотную последовательность
одного участка в цепи фермента лизоцима, выделенного из
нормальных фагов, с последовательностью того же участка у мутанта,
несущего две мутации («плюс» или «минус») вроде тех, какие были
столь успешно использованы Криком для изучения общих свойств
кода. Были получены следующие результаты:
Нормальный участок: Ли з-Сер-Про-Сер-Л ей- Асн- Ала-Ала
Мутантный участок: Лиз-Вал-Гис-Гис-Лей-Мет-Ала-Ала
Сопоставление с кодонами аминокислот позволяет построить
единственную последовательность оснований, кодирующую
нормальный белок, которая при делеции одного основания и вставке
другого (поблизости от первого) превращается в
последовательность, кодирующую мутантный участок:
t
Нормальная последовательность: ААР-АГУ-ЦЦА-УЦА-ЦУУ-ААУ-ГЦ?
Мутантная последовательность: ААР-ГУЦ-ЦАУ-ЦАЦ-УУА-АУГ-ГЦ?
t
Интересно, что три аминокислоты, повторяющиеся в этих
фрагментах дважды,— серии, лейцин и гистидин — обозначаются
каждый раз разными кодонами, что подтверждает вырожденность
кода.
ПРЯМАЯ ПРОВЕРКА КОДА
Наиболее прямые и наглядные подтверждения были получены
в 1969 году и позже, когда были определены последовательности
оснований протяженных участков РНК нескольких РНК-содер-
жащих фагов и установлено их соответствие известным
последовательностям аминокислот в белках, которые они кодируют.
Фредерик Сэнгер с помощью методов, аналогичных тем,
которые он разработал для определения последовательности
аминокислот, впервые расшифровал последовательность оснований
ГЕНЕТИЧЕСКИЙ КОД 287
в информационной РНК. (Почему в РНК, а не в ДНК? Потому,
что только в 1973 году главный мастер этого дела — Сэнгер —
создал соответствующие методы для ДНК.) Сопоставив участок
РНК фага R17 длиной в 57 оснований с участком белка оболочки
того же фага длиной в 19 аминокислот, Сэнгер и его коллеги
нашли, что и здесь все соответствует коду Ниренберга; полная
последовательность аминокислот в белке оболочки была еще раньше
выяснена Клаусом Вебером из Гарвардского университета. С тех
пор был определен ряд других последовательностей оснований
в РНК; некоторые из них мы сейчас рассмотрим.
Джоан Стейтц придумала остроумный метод выделения
фрагментов РНК, соответствующих определенному фрагменту белка —
его начальному участку. Такие фрагменты РНК представляют
большой интерес, так как они включают группу оснований, с
которой начинается синтез белковой цепи. Эти фрагменты выделяли,
смешивая фаговую РНК с рибосомами и формилметиониновой
транспортной РНК в условиях, когда в местах инициации
образуется инициаторный комплекс (см. рис. 209, /—7Т), но не идет
синтез белка. Затем добавляли ферхменты, расщепляющие РНК,
и они разрушали всю цепь РНК, кроме участков, близких к
точкам инициации, которые были защищены рибосомами.
Д-р Стейтц использовала этот метод для изучения участков
инициации в РНК фага R17. Этот фаг, подобно другим
родственным фагам, индуцирует синтез всего лишь трех белков: белка
оболочки, из которого образуются частицы фага, так называемого
белка А (белка созревания) и полимеразы (РНК-зависимой РНК-
полимеразы), синтезирующей фаговую РНК. С помощью
описанного метода удалось определить последовательность оснований
около точек инициации генов, кодирующих все три белка.
Независимо была определена последовательность оснований
в концевом участке гена, кодирующего белок оболочки, так что
теперь известна полная последовательность оснований от конца
этого гена до начала гена полимеразы. У другого РНК-содержа-
щего фага — QP — расшифрован небольшой фрагмент РНК,
кодирующий первые 6 аминокислот белка оболочки, и определены
10 предшествующих оснований.
Сравнение изученных участков РНК этих фагов с известными
аминокислотными последовательностями их белков дает наиболее
прямое подтверждение генетического кода. Кроме того, здесь
возникают интересные вопросы относительно «знаков препинания».
Инициирующий кодон во всех \этих четырех случаях — АУГ
и никогда не ГУГ. Может быть, это случайное совпадение? Или
экспериментальные данные о том, что ГУГ тоже играет роль
инициирующего код она, ошибочны? Терминирующий кодон, во всех
случаях УГА, всегда предшествует инициирующему кодону и
отделен от него группой из 2—9 оснований. Зачем нужна эта
фМет Ала Сер Асн Фен
АГА ГЦЦ УЦА АЦЦ ГГГ fyy УГА АГЦ АУГ ГЦУ УЦУ ААЦ УУУ
Белок оболочки
фМет Apr Ала Фен Сер
ЦЦ УАГ ГАГ ГУУ УГА ЦЦУ АУГ ЦГА ГЦУ УУУ АГУ Г
«А»-белок
Гли Иле Тир фМет Сер Лиз Тре Трс Лиз
ГГУ АУЦ УАЦ УАА УАГ АУГ ЦЦГ ГЦЦ АУУ ЦАА АЦА УГА ГГА УУА ЦЦЦ АУГ УЦГ ААГ АЦА АЦА ААГ
Белок оболочки Полимерава
Рис. 224. Последовательности оснований вблизи точек инициации для двух
белков в РНК фага R17 и полная последовательность от конца гена одного
из этих белков до начала следующего гена. Частично эти отрезки кодируют
аминокислоты (указаны над триплетами). Синтез всех трех белков начинается
с ко дона АУГ, означающего «начало». В конце гена для белка оболочки
расположены рядом два ко дона, УАА и УАГ, означающие «стоп». Участок между
этим двойным сигналом «стоп» и ко до ном АУГ («началом») всегда содержит
еще один стоп-триплет и не транслируется в белок; функция этого участка
неизвестна.
. . . (Г)-АУА-ГАГ-ЦЦЦ-УЦА-АЦЦ-ГГА-ГУУ-УГА-АГЦ-АУГ-
ГЦУ-УЦУ-ААЦ-УУУ-АЦУ-ЦАГ-УУЦ-ГУУ-ЦУЦ-ГУЦ-ГАЦ-ААУ-ГГЦ-ГГА-АЦУ-ГГЦ-ГАЦ-ГУГ-АЦУ-ГУЦ-ГЦЦ-ЦЦА
Ала Сер Асн Фен Тре Глн Фен Вал Лей Вал Асп Асн Гли Гли Тре Гли Асп Вал Тре Вал Ала Про Сер Асн Фен
15 10 15 20 25
ГЦУ-ААЦ-ГГГ-ГУЦ-ГЦУ-ГАА-УГГ-АУЦ-АГЦ-УЦУ-ААЦ-УЦГ-ЦГУ-У^
Ала Асн Гли Вал Ала Глу Три Иле Сер Сер Асн Сер Apr Сер Глн Ала Тир Лиз Вал Тре Цис Сер Вал Apr Глн
30 35 40 45 50
АГЦ-УЦУ-ГЦГ-ЦАГ-ААУ-ЦГЦ-ААЛ-УАЦ-АЦЦП'АУЦ-ААА-^^
Сер Сер Ала Глн Асн Apr Лиз Тир Тре Иле Лиз Вал Глу Вал Про Лиз Вал Ала Тре Глн Тре Вал Гли Гли Вал
55 60 65 70 75
ГАГ-ЦУУ-ЦЦУ-ГУА-ГЦЦ-ГЦА-УГГ-ЦГУ-УЦГ-УАЦ-УУА
Глу Лей Про Вал Ала Ала Три Apr Cep> Тир Лей Асн Мет Глу Лей Тре Иле Про Иле Фен Ала Тре Асн Сер Асп
80 85 90 95 100
УГЦ-ГАГ-ЦУУ-АУУ-ГУУ-ААГ-ГЦА-АУГ-ЦАА-ГГУ-ЦУЦ-ЦУА-ААА
Цис Глу Лей Иле Вал Лиз Ала Мет Глн Гли Лей Лей Лиз Асп Гли Асн Про Иле Про Сер Ала Иле Ала Ала Асн
105 110 115 120 125
УЦЦ-ГГЦ-АУЦ-УАЦ-УАА-УАГ-АЦГ-ЦЦГ-ГЦЦ-АУ
Сер Гли Иле Тир Сер Лиз Тре Тре Лиз Лиз
129 1 5
Рис. 225. Часть цепи РНК фага MS2: последовательность оснований в гене белка оболочки и примыкающих к нему
участках. Под соответствующими кодонами указаны 129 аминокислот этого белка, а также первые 6 аминокислот
следующего белка — полимеразы. Участок РНК, предшествующий гену белка оболочки, и отрезок между концом
этого гена и началом гена полимеразы не транслируются в белок, и их функция неизвестна. (W. Min Jou et al.,
Nature, 237, 82 (1972); с разрешения W. Fiers.)
290 ГЛАВА 10
промежуточная группа? В одном случае, когда известен весь
участок РНК, соответствующий концу одного белка, началу
следующего и промежутку между ними, терминация обозначена
двойным сигналом, двумя последовательными кодонами терминации
УАА и УАГ. Типично ли это? И для чего нужны 30 оснований,
отделяющие кодоны терминации от следующего инициирующего
кодона АУГ? Эти 30 оснований не транслируются в белок.
ПОСЛЕДОВАТЕЛЬНОСТЬ
ОСНОВАНИЙ
И СТРУКТУРА ГЕНА
В 1972 году В. Фирс и его сотрудники из Гентского
университета сообщили о поразительном успехе — об определении
последовательности оснований в целом гене. Этот ген кодирует белок
оболочки другого РНК-содержащего фага, MS2, очень сходного
с R17. Была определена структура не только самого гена, но и
примыкающих к нему с обеих сторон участков, которые не
транслируются в белок, а также начало следующего гена — гена
полимер азы.
Последовательность, расшифрованная Фирсом и включающая
49 кодонов, опять-таки подтверждает генетический код.
«Пунктуация» и почти вся последовательность из 30 оснований,
отделяющая белок оболочки от полимеразы (за исключением одного
основания), одинаковы у MS2 и R17, так что этот участок, видимо,
важен для функционирования РНК.
Помимо обнаружения обширных нетранслируемых участков
в РНК этих фагов (из примерно 3400 оснований только 2800
кодируют три белка) неожиданным результатом было открытие ее
сложной вторичной структуры. Ряд данных позволяет в
настоящее время предполагать, что цепь РНК складывается, образуя
двухцепочечные участки с петлями на концах. Сэнгер, изучив
расшифрованную им последовательность из 57 оснований в РНК фага
R17, нашел, что здесь возможна структура, в которой 38 оснований
образуют между собой водородные связи, подобные связям в
парах оснований ДНК. Последовательности, расшифрованные
позднее, тоже могли бы укладываться в сложные, частично
двухцепочечные структуры.
Фирс предложил невероятно сложную структуру для
длинного участка РНК, который он расшифровал. Он исходил из
принципа спаривания максимального числа оснований, т. е. условия,
при котором структура будет наиболее стабильной. Так он
сконструировал конформацию, которую удачно назвал моделью цветка:
длинный двухцепочечный «стебель» увенчан радиально
расходящимися двухцепочечными «лепестками» (рис. 226). Ряд данных
указывает на то, что эта модель в основном верна.
А А4
„Начало" V г
ц~г V-4 &^Р
У-А
i \^\ £С# *AV*
— "ГАГЦГГЦАА^ГЦГГУ A ^.Jfy-% ?-Ц ?-/ hV^
,АГУ
гуЦ u * A *Л"А tt-F. К?
•V
цЦААГЦААЦУУЦГАЦГГГГУЦЦУГААУГгА ^ „Г V4, >
I I I I I I Г! I И I II I I II y„UV YAyyryV A TI
ьиАГААГЦУГУЦЦЦАГГАЦУУАЦЦ УЦЦ j||||[ J M
ЪЬ*Ь А 0*\ Ау цГУАА^Г* S
^ „СКОПИЛ \Г 11 **Ф> §
у^^ В.
Рис. 226. Модель «цветка» — предполагаемая структура гена для белка оболочки фага MS2. Триплеты, означающие g
«начало» и «стоп», выделены жирным шрифтом. Указаны также триплеты 6, 50, 54 и 70 (во всех случаях ЦАГ),
обсуждаемые в тексте. (W. Min Jou et al., Nature, 237, 82 (1972); с разрешения W. Fiers.)
CD
292 ГЛАВА 10
В модели «цветка» кодон АУГ, обозначающий начало белка
оболочки, образует одноцепочечную петлю на конце двухцепочеч-
ного участка. Другой кодон АУГ, с которого начинается
следующий белок — полимераза,— расположен в двухцепочечном
стебле. Это позволяет объяснить одно странное генетическое явление.
Мутация, при которой замена основания дает терминирующий
кодон (например, ЦАГ -*■ УАГ), должна вызывать
преждевременную остановку синтеза белка. Такая мутация в кодоне 6 белка
оболочки не только останавливает синтез самого этого белка, но
также препятствует синтезу следующего белка — полимеразы.
Между тем мутации того же типа в кодонах 50, 54 или 70 (см.
рис. 226) останавливают синтез только белка оболочки.
Модель «цветка» подсказывает возможное объяснение. Когда
синтез белка оболочки доходит до кодона 50, двухцепочечный
стебель уже пройден; в процессе трансляции его двухцепочечная
структура, вероятно, разрушается, и инициирующий кодон гена
полимеразы, который был спарен в стебле, становится доступным.
Если же синтез белка останавливается на кодоне 6, то стебель
сохраняет двухцепочечную структуру и точка инициации
полимеразы остается "недоступной для присоединения рибосом; в
результате этот ген не транслируется в белок.
У РНК-содержащих фагов РНК выполняет три функции. Как
все информационные РНК, она кодирует белок, но в отличие от
других информационных РНК она должна также узнаваться
собственной полимеразой и служить затем матрицей для синтеза
новой фаговой РНК; и, кроме того, она упаковывается в зрелые
фаговые частицы. В какой степени эти удивительные свойства
фаговой РНК — ее «знаки пунктуации», длинные вставки, не
кодирующие белок, сложнейшая структура из одно- и двухцепочечных
участков — отражают ее специфические функции и в какой
степени они общи для всех информационных РНК? Исследователи
пытаются сейчас расшифровать структуру информационных РНК,
кодирующих молекулы гемоглобина, антител и других белков;
только тогда, когда они достигнут успеха, можно будет ответить
на эти вопросы.
код
УНИВЕРСАЛЕН
Генетический код был раскрыт в экспериментах,
проводившихся в пробирке, с искусственными матрицами и бактериальными
рибосомами. Впервые он был подтвержден на вирусе табачной
мозаики, бактериофагах и гемоглобине человека. Не только
результаты этих ранних работ, но и все данные, полученные
впоследствии, показывают, что код универсален: он одинаков у
животных, бактерий, вирусов и растений.
«РЕГУЛЯТОРНЫЕ
МЕХАНИЗМЫ
КЛЕТКИ
Как координируются и регулируются сотни или даже тысячи
химических реакций, постоянно протекающих в живой клетке?
Для построения белков, например, должны синтезироваться
аминокислоты, но не все в одинаковых количествах. Глицин — весьма
распространенная аминокислота, триптофан же встречается
сравнительно редко, и ради экономии клеточных ресурсов он должен
синтезироваться в относительно небольшом количестве; а если
клетка может получать готовый триптофан, его синтез должен
полностью прекращаться. И он действительно тотчас же
прекращается, как было показано в 50-х годах. При этом не только
подавляется активность имеющихся ферментов, участвующих в
синтезе триптофана, но и синтез самих этих ферментов быстро
останавливается.
Синтез всех необходимых клетке веществ, таких, как
аминокислоты или основания ДНК и РНК, контролируется тем же
способом: если вещество становится доступным в достаточном
количестве, то это ведет к подавлению синтеза как его самого, так и
ферментов, участвующих в его образовании. Таким образом,
синтез необходимых веществ регулируется двумя негативными
(отрицательными) воздействиями — подавлением (ингибированием)
активности ферментов и подавлением (репрессией) их синтеза.
Некоторые вещества, обычно сахара, расщепляются для
получения энергии. В качестве источника энергии клетки
предпочитают глюкозу, но если глюкозы нет, тогда (и только тогда) они
вырабатывают ферменты, необходимые для перекачивания внутрь
клетки и расщепления какого-либо другого доступного источника
энергии. Такая система регуляции, когда синтез необходимого
294 ГЛАВА 11
фермента индуцируется в присутствии его субстрата, т. е.
вещества, на которое он действует, была открыта в начале нашего века.
Если дрожжи перенести с питательного раствора, содержащего,
скажем, глюкозу, на питательную среду с лактозой (молочным
сахаром), они перестают расти и не растут много часов. В течение
этого периода адаптации синтезируется несколько белков —
фермент, который не был нужен для обмена глюкозы, но необходим
для обмена лактозы, и белки или ферменты, которые сообщают
клеточной мембране, ранее непроницаемой для лактозы,
способность концентрировать этот сахар в клетке. После завершения
такой реорганизации рост дрожжей возобновляется.
Эта система кажущегося позитивного контроля, когда синтез
фермента, необходимого для расщепления какого-нибудь вещества,
индуцируется в присутствии этого вещества, интенсивно
изучалась в течение полувека. Наконец, в 50—60-х годах Франсуа
Жакоб и Жак Моно в Пастеровском институте (Париж) в
результате блестящего анализа расчленили регуляторную систему на ее
составные части. Они продемонстрировали ее принципиальную
простоту и показали, что и эта форма регуляции, кажущаяся
позитивной, и негативная регуляция на самом деле одинаковы: это
как бы две стороны одной медали.
ИНДУКЦИЯ
И РЕПРЕССИЯ
СИНТЕЗА ФЕРМЕНТОВ
Жакоб и Моно изучали влияние мутаций на проявление трех
бактериальных генов, контролирующих синтез трех ферментов,
необходимых для расщепления сахара лактозы. Эти гены,
расположенные рядом, образуют так называемую лактозную область.
Один ген кодирует фермент бета-галактозидазу, расщепляющий
дисахарид лактозу на составляющие его сахара — галактозу и
глюкозу. Два других гена кодируют ацетилазу — фермент с
неизвестной функцией — и пермеазу, которая способствует
проникновению лактозы внутрь бактериальной клетки.
Клетка, растущая на сахаре, отличном от лактозы,
синтезирует ничтожно малые количества трех ферментов лактозной
области: она содержит, например, всего несколько молекул бета-
галактозидазы. При росте на лактозе клетка содержит уже 5000
молекул бета-галактозидазы. Таково действие регуляторной
системы, контролирующей синтез ферментов в зависимости от
присутствия их субстратов.
РЕГУЛЯТОРНЫЕ МЕХАНИЗМЫ КЛЕТКИ 295
I
II
Р
I
Добавлен
индуктору
Общее количество
белка
Рис. 227. Индукция синтеза бета-
галактозидазы в растущей культуре
бактерий. До внесения индуктора
фермент не синтезируется. Сразу
после добавления индуктора
начинается синтез фермента; он
продолжается до тех пор, пока в среде есть
индуктор.
ИНДУКЦИЯ:
ИНДУКТОР
ПРЕПЯТСТВУЕТ
ВЗАИМОДЕЙСТВИЮ
РЕПРЕССОРА
С ОПЕРАТОРОМ
Каким образом лактоза индуцирует синтез этих ферментов?
Был установлен важный «наводящий» факт: оказалось, что
некоторые вещества, химически сходные с лактозой, служат отличными
индукторами, хотя и не являются субстратами ферментов, синтеь
которых они индуцируют. Это указывало на то, что сами ферменты
не участвуют в собственной индукции.
Жакоб и Моно предположили и затем доказали существование
двух различных генетических систем. Одна система состоит из
структурных генов, каждый из которых определяет структуру
фермента или другого белка (три структурных гена лактозной
области кодируют последовательность аминокислот в трех
ферментах — бета-галактозидазе, пермеазе и ацетилазе). Другую
генетическую систему образуют гены-регуляторы, ответственные за
«включение» и «выключение» структурных генов, так что
соответствующие белки синтезируются или не синтезируются.
Если действительно существуют гены-регуляторы, отличные
от структурных генов, тогда, рассуждали Жакоб и Моно, должны
существовать мутанты с нормальными структурными генами, но
с изменениями в регуляторных генах. Такие мутации могли бы
приводить к синтезу ферментов даже в отсутствие индуктора или
же к неспособности синтезировать ферменты даже в присутствии
296 ГЛАВА И
Рис. 228. *Ф. £;Жакоб, А. Львов и
Ж. Моно из Пастеровского института
в Париже получили в 1965 году
Нобелевскую премию по физиологии и
медицине за блестящие работы по
выяснению регуляторных механизмов у
бактерий. (С разрешения Jnstitut
Pasteur.)
индуктора. Кроме того, одиночная мутация в регуляторном гене
могла бы одновременно влиять на проявление нескольких
взаимосвязанных структурных генов, таких, как три гена лактозной
области. Зная, что нужно искать, Жакоб и Моно нашли
предсказанные типы мутаций.
Так называемые конститутивные мутанты неспособны
остановить синтез ферментов лактозной области. Для максимальной
выработки фермента им не нужен индуктор: фермент бета-галак-
тозидаза составляет 6—7% всего их белка.
liti
РЕГУЛЯТОРНЫЕ МЕХАНИЗМЫ КЛЕТКИ 297
I | Оператор \ Промотор \
I Ген бета- \ s ч i
,галак/гиииапц (/•-»)_!_
Репр^сор РНК-палимвраза
Информационная РНК
для репрессора
Репрессор
Ген , Ген бета- \0nepamop \Промотор . Ген
s- s-^лгл .репрессора
I Ген
хацетилазы \ пермеазы \галактШ§азы\
РНК-полимераза
Рис. 229. ^Механизм индукции синтеза белка
в «лактозной системе» бактерий. А. В отсутствие
лактозы репрессор, синтезируемый
геном-регулятором, присоединяется к оператору и
предотвращает таким образом транскрипцию трех
«лактозных»геновРНК-полимеразой. Б. Лактоза
индуцирует синтез ферментов, необходимых для
ее проникновения в клетку и расщепления,
связываясь с репрессором и инактивируя его. Так
как комплекс репрессора с индуктором не
присоединяется к операторному участку,
РНК-полимераза может пройти этот учясток и
транскрибировать «лакто^ные» гены.
Информационная
РНК для репрессора
Репрессор
+ СО
Индуктор
(лактоза)
i>o
Неактивный комплекс
репрессора с индукторам
Жакоб и Моно картировали мутацию, приводящую к такому
неконтролируемому синтезу лактозных ферментов. Оказалось,
что она находится непосредственно перед тремя структурными
генами. Тот факт, что эта одиночная мутация приводила к
неограниченному синтезу всех трех ферментов и что мутировавший ген
физически отличен от структурных генов лактозной области,
подтверждал гипотезу о существовании особого гена-регулятора —
гена, управляющего синтезом специфического регуляторного
вещества.
У мутанта это регуляторное вещество должно отсутствовать
или быть дефектным вследствие мутации. Таким образом, фермент
может синтезироваться именно в отсутствие регуляторного
вещества. Значит, оно должно быть репрессором, препятствующим
синтезу фермента в отсутствие индуктора. Жакоб и Моно
предположили, что репрессор выполняет эту функцию, препятствуя
298 ГЛАВА 11
транскрипции структурных генов в информационную РНК. В
присутствии же индуктора, в данном случае лактозы, репрессор
связывается с ним, инактивируется и теряет способность подавлять
синтез информационной РНК.
В каком месте действует репрессор? Жакоб и Моно назвали
это место оператором. Оператор, как они правильно догадались,—
это участок ДНК, примыкающий к структурным генам. По
другую сторону оператора расположен участок ДНК, получивший
название промотора. Промотор был открыт в 1968 году, к нему
прикрепляется фермент, синтезирующий информационную РНК,—
ДНК-зависимая РНК-полимераза. Таким образом, чтобы
транскрибировать структурные гены в информационную РНК, полиме-
раза должна миновать "операторный участок. В отсутствие репрес-
сора полимераза движется дальше и транскрибирует все
структурные гены, контролируемые оператором, в одну длинную молекулу
информационной РНК; но если на операторе сидит молекула ре-
прессора, доступ к структурным генам закрыт и они не могут быть
тр анскрибир ованы.
РЕПРЕССИЯ:
КОМПЛЕКС РЕПРЕССОРА
С КОНЕЧНЫМ ПРОДУКТОМ
ПРИСОЕДИНЯЕТСЯ К
ОПЕРАТОРУ
Описанная выше схема объясняет, каким образом регулируется
синтез ферментов, расщепляющих такие вещества, как лактоза.
Естественно, эти ферменты нужны только тогда, когда есть
вещество, которое они расщепляют; в противном случае их синтез
должен быть репрессирован.
С другой стороны, ферменты, участвующие в построении
необходимых веществ, например аминокислот, нужны только в том
случае, если этих веществ не хватает. Поэтому присутствие
достаточных количеств конечного продукта репрессирует синтез таких
ферментов.
Механизм этой репрессии отличается от индукции только
одной деталью: в случае индукции свободный репрессор
связывается с оператором, в то время как комплекс репрессора с
индуктором не связывается, так что синтез белка происходит только
в присутствии индуктора; в случае же репрессии именно комплекс
репрессора с конечным продуктом присоединяется к оператору,
тогда как свободный репрессор не связывается, поэтому синтез
белка происходит только в отсутствие конечного продукта.
Таким образом, процессы индукции и репрессии, несмотря на
противоположность их конечных эффектов, в принципе однотипны:
РЕГУЛЯТОРНЫЕ МЕХАНИЗМЫ КЛЕТКИ 299
I Ген Л i Ген В \ Ген С i Опе^атор\Промотор<
_| 1 1 1 — ' " '
Ген i
lenpeccopa \
Комплекс ре- РНК-паяимераза I
прессора с ко- т
нечным про- Информацион-
дуктом пая РНК для
репрессора
Ген А
ТЬнВ
Ген С \Onepamop
WpoMornop |
' Ген '
wenpeccopd
РНК-полимераза
Информационная РНК для
репрессора
Рис. 230. Механизм репрессии! синтеза белка
Когда конечный продукт работы ряда
ферментов присутствует в клетке в достаточном
количестве, синтез этих ферментов подавлен.
Механизмы репрессии и индукции различаются
только тем, что в системе с индукцией синтез
фермента подавляется одним лишь репрессором,
а при репрессии для этого нужен комплекс
репрессора с конечным продуктом. Ген репрессора
ГоГрых3^^рСол0ир0уеетН ДаЛеК° °Т СТр™*" "-». 'Ранскрипцию
Неактивный
репрессор
в обоих случаях мы имеем дело с негативной регуляторной систе-
ГИ' в соответствующих условиях подавляющей синтез ферментов
(рис. zoU).
Механизмы индукции и репрессии могут совместно
использоваться для тонкого управления синтезом ферментов. Рассмотрим,
например, цепь метаболических реакций, в результате которых
миндальная кислота расщепляется до уксусной и янтарной
кислот: г
► Бензоилмуравьиная кислота (В) _>
Уксусная кислота + Янтарная кислота (I).
В первой реакции миндальная кислота (А) превращается в бен-
зоилмуравьиную (В) под действием фермента а; во второй реакции
В превращается в С под действием фермента бит. д.
Миндальная кислота (А) _!
^ с d е / g н
300 ГЛАВА 11
Синтез ферментов этого метаболического пути от а до h
контролируется тремя операторами. Оператор 1 контролирует первые
три фермента — с, 6 и с, синтез которых индуцируется веществом
А (миндальной кислотой) и репрессируется веществом D —
конечным продуктом этих трех реакций; оператор 2 управляет синтезом
фермента d, который индуцируется веществом D и репрессируется
веществами Е и I; оператор 3 контролирует синтез остальных
ферментов от е до h, которые индуцируются Е и репрессируются I.
Несомненно, существуют метаболические пути, регуляция
которых еще сложнее!
ВЫДЕЛЕНИЕ РЕПРЕССОРОВ
Представление о репрессорах, которые в отсутствие индуктора
или в присутствии конечного продукта связываются с оператором
и препятствуют транскрипции структурных генов, было развито
Жакобом и Моно главным образом на основе генетических данных.
Их блестящие теоретические разработки получили 5 лет спустя
прямое биохимическое подтверждение: были выделены в чистом
виде два репрессора.
Чтобы очистить репрессор от других веществ, надо было найти
дпособ идентифицировать его. Какое свойство репрессора может
быть использовано для его идентификации? При выделении двух
репрессоров были использованы две различные идеи.
Уолтер Гилберт, профессор Гарвардского университета, решил,
что лактозный репрессор можно идентифицировать по его сродству
к индуктору «лактозных» ферментов. Он выбрал самый сильный
из известных индукторов — изопропилтиогалактозид (ИПТГ) —
в предположении, что он эффективен именно потому, что лучше
всего связывается с репрессором.
Гилберт поместил целлофановый мешочек с концентрированным
экстрактом бактерий в раствор ИПТГ. Вещества с крупными
молекулами, например белки, не могут проходить через целлофан
и остаются внутри мешочка. Молекулы ИПТГ невелики, они
свободно проходят в мешочек, так что концентрация их внутри и
снаружи должна уравняться (см. главу 3). На самом же деле Гилберт
обнаружил, что концентрация ИПТГ внутри мешочка становится
немного выше, чем снаружи,— крупные молекулы репрессора,
находившиеся внутри, связывали некоторое количество ИПТГ.
Путь к очистке репрессора был теперь открыт. Можно было
применить классические методы очистки белков, испытывая
каждую фракцию на присутствие репрессора по способности
привлекать избыток ИПТГ в целлофановый мешочек.
Тем временем Марк Пташне в том же Гарвардском
университете работал над выделением репрессора фага лямбда. Когда этот
фаг проникает в клетку, он может, как мы уже знаем, вызвать
РЕГУЛЯТОРНЫЕ МЕХАНИЗМЫ КЛЕТКИ 301
• • ' 1 * 1 *.*•
• • • ••"■"• • '.•.
• •••••' >*ъ
h\vjtf@
/
.4
• • • * • *|
, •. V» •. • J
■fir» • *• "• «1
/••••• -1
• • • . • • н
r'-v.-.ч
•Л:*в.ч
Рис. 231. Для выделения репрессора «лактозных» генов была использована
его способность сорбировать индуктор. А. Концентрированный экстракт
бактериальных клеток, содержащий репрессор, заключен в целлофановый
мешочек, помещенный в раствор изопропилтиогалактозида (ИПТГ) —
эффективного синтетического индуктора. Небольшие молекулы ИПТГ свободно
проникают внутрь мешочка, тогда как молекулы белка слишком велики, чтобы
выходить наружу через микроскопические поры в целлофане. Б. ИПТГ
проник в мешочек. Его конечная концентрация внутри мешочка чуть выше, чем
снаружи, так как небольшое количество его связалось с молекулами
репрессора. Гилберт работал много месяцев, прежде чем нашел способ
концентрировать бактериальный экстракт в достаточной степени, чтобы можно было
заметить различие между концентрациями ИПТГ снаружи и внутри мешочка.
Тем самым был найден метод, позволяющий выявлять присутствие репрессора;
после этого уже нетрудно было выделить репрессор с помощью стандартных
методов очистки белка.
активную инфекцию, произвести потомство и убить клетку; в
других случаях ДНК фага включается в бактериальную ДНК и
вместе с нею пассивно удваивается, не причиняя вреда бактерии.
От чего зависит исход инфекции? От присутствия или отсутствия
репрессора.
Этот репрессор, кодируемый регуляторным геном фага лямбда
(cl), предотвращает транскрипцию тех генов фага, которые
необходимы для его активного размножения. Если фаговая ДНК
включена в ДНК бактерии, она остается в неактивном состоянии
благодаря непрерывному синтезу репрессора.
Пташне смог выделить репрессор, создав условия, в которых
репрессор составлял значительную часть (5—10%) всего белка,
синтезируемого зараженными бактериями. Он выращивал
культуры этих бактерий на среде с аминокислотами, меченными
радиоактивным водородом 3Н (тритием); таким образом, белки,
синтезированные после заражения, включая, конечно, и репрессор,
были помечены 3Н. Другие бактерии, отличавшиеся только тем, что
они не синтезировали репрессора, росли на среде с
аминокислотами, меченными радиоактивным углеродом (14С); их белок, не
содержащий репрессора, был помечен 14С.
Пташне смешал те и другие культуры, выделил из этой смеси
белки и стал фракционировать их. Почти все фракции содержали
302 ГЛАВА 11
Рис. 232. Выделение репрессора фага лямбда. Бактерий определенным
образом заставили синтезировать лямбда-репрессор в количестве 5—10% всего
клеточного белка и поместили для роста в среду, содержавшую радиоактивный
изотоп водорода 8Н (А). Другие бактерии, идентичные первым, но не
синтезировавшие репрессора, росли в среде с радиоактивным углеродом 14С (Б).
Эти две культуры смешали и сконцентрировали (В)у а затем из бактерий
приготовили экстракт (Г). Многочисленные белки этого экстракта разделили
хроматографическим методом, аналогичным хроматографии на бумаге. Все
фракции содержали 8Н и 14С, за исключением одной, содержавшей только
3Н (Д); это и был лямбда-репрессор — единственный белок,
синтезировавшийся только в присутствии 3Н (в культуре А).
РЕГУЛЯТОРНЫЕ МЕХАНИЗМЫ КЛЕТКИ 303
Рис. 233. Электронная микрофотография лямбда-репрессора, связанного
с ДНК — по-видимому, с лямбда-оператором. (С разрешения J. Griffith.)
и 3Н и 14С, но одна фракция содержала только 3Н — это и был
репрессор фага лямбда.
Таким образом, лактозный и фаговый репрессоры были
выделены совершенно разными способами. Успех Гилберта и Пташне
подтвердил то, о чем раньше только догадывались,— что
репрессоры являются белками.
К тому же это, оказывается, крупные белки: лактозный реп-
рессор состоит из 4 субъединиц с молекулярным весом 38 000
каждая, а репрессор фага лямбда — из 4 субъединиц с
молекулярным весом 28 000.
Кроме того, опыты с очищенными репрессорами подтвердили
гипотезу Жакоба и Моно о прямом присоединении репрессора
к ДНК — к тому ее участку, который эти авторы назвали
оператором. Гилберт и Пташне установили, что репрессор фага лямбда
связывается только с ДНК этого фага и ни с какой другой, а
лактозный репрессор связывается только с ДНК, содержащей «лак-
тозные» гены, и отделяется от нее при добавлении индуктора.
304 ГЛАВА 11
КАК РЕПРЕССОР
ПРИСОЕДИНЯЕТСЯ К ДНК
В 1972 году Бенно Мюллер-Хилл, сотрудничавший с
Гилбертом при выделении лактозного репрессора, вместе с несколькими
коллегами предложил интересную модель связывания этого
репрессора определенным участком ДНК — оператором.
Сначала исследователи выделили большое число мутантов по
репрессору. Построение генетической карты показало, что все
мутации^ в том конце гена, который соответствует N-концевому
участку белка, лишают репрессор способности связываться с
оператором. Из этого был сделан вывод, что N-концевой фрагмент
репрессора содержит ДНК-связывающий участок. Все эти
мутации группировались в области, кодирующей всего пятьдесят N-
концевых аминокислот белка.
Затем Мюллер-Хилл и его сотрудники определили
последовательность этих пятидесяти аминокислот. «Играя» (как они выра-
Рис. 234. Модель взаимодействия «лактозного» репрессора с ДНК. (К. Adler
et al., Nature, 237, 322 (1972); с разрешения В. Muller-Hill.)
РЕГУЛЯТОРНЫЕ МЕХАНИЗМЫ КЛЕТКИ 305
жались) с моделью двойной спирали ДНК и моделью пептида из
этих аминокислот в наиболее вероятной трехмерной конфигурации
(альфа-спираль Полинга), они обнаружили, что участок от 17-й
до 33-й аминокислоты хорошо укладывается в большую бороздку
спирали ДНК, связываясь одновременно с фосфатами остова ДНК
и с основаниями. Взаимодействие с фосфатами позволяет репрес-
сору присоединяться к ДНК; взаимодействие с основаниями
«уточняет адрес»: оно обеспечивает присоединение только к
специфическому участку — оператору.
Если модель Мюллер-Хилла окажется верной, это будет
первый случай, когда связывающий участок белковой молекулы
представляет собой выступ, а не щель или желоб, как у всех
ферментов, трехмерная структура которых известна. Но самое
интересное то, что Мюллер-Хилл и его сотрудники предсказали
последовательность из 8 пар оснований, которая узнается
выступающим концом репрессора. Эти 8 пар оснований, возможно, повто-
Ц, А Т А Г, Т Ц, А
Г, Т А Т Ц, А Г, Т
12 3 4 5
Рис. 235. Предполагаемая последовательность пяти оснований ДНК,
узнаваемых лактозным репрессором. Пары оснований в положениях 2 и 3 — Т-А
и А-Т — не вызывают сомнений. Модель репрессора Мюллер-Хилла не
позволяет, однако, выбрать одну из двух возможностей в положениях 1,4 и 5;
в положении 1 должна быть пара Ц-Г или А-Т, в положении 4 — Г-Ц или Т-А
и в положении 5 — Ц-Г или А-Т. Поскольку лактозный репрессор состоит
из четырех идентичных субъединиц, эта последовательность из пяти
оснований, вероятно, повторяется четыре раза, причем повторы разделены
несколькими парами оснований.
ряются 4 раза, так что каждая из четырех субъединиц молекулы
репрессора узнаёт одну и ту же последовательность ДНК.
Правильна ли модель Мюллер-Хилла? Так ли происходит
узнавание последовательности оснований белком? Совпадает ли
последовательность, предсказанная Мюллер-Хиллом и его
коллегами, с действительной структурой оператора?
Экспериментальных данных, которые позволили бы ответить на эти вопросы, пока
нет 1.
1 Сейчас такие данные получены; в частности, Гилберт и его
сотрудники расшифровали последовательность оснований лактозного оператора.
Модель Мюллер-Хилла оказалась неверной (Gilbert W. et al., in: Cold Spring
Harbor Symp., 38, 845—855 (1973); Gilbert W. et al., in: Protein-Ligand
Interactions, W. de Gruyter and Co., Berlin, 1975, p. 193—210).— Прим. перев.
20—0414
306 ГЛАВА 11
ПОЗИТИВНАЯ РЕГУЛЯЦИЯ
СИНТЕЗА БЕЛКА
При репрессии и индукции синтез белков регулируется
негативным воздействием: репрессор (или комплекс репрессора с
конечным продуктом в случае индукции) препятствует транскрипции
генов; синтез информационной РНК, а значит, и белка может
происходить только в отсутствие репрессора. Но репрессия и
индукция — не единственные способы регуляции белкового синтеза.
Даже у простейших организмов есть и другие регуляторные
приспособления.
При заражении бактерий фагами лямбда или Т4 успешное
развитие событий, ведущих к образованию фагового потомства,
зависит от последовательного действия регуляторных механизмов,
которые до сих пор изучены лишь частично. Синтез так
называемых ранних белков в начале инфекции — необходимая
предпосылка для удвоения фаговой ДНК, и только после того, как будет
запущен синтез ДНК, начинается синтез так называемых поздних
белков, включающих структурные белки, из которых строятся
дочерние фаговые частицы.
Регуляторные механизмы фага лямбда, изученные главным
образом Рене Тома в Брюссельском университете, наиболее близки
к полному выяснению. Они включают не только систему
негативного контроля (подавление синтеза информационной РНК белком-
репрессором), но и активный позитивный контроль, при котором
синтез информационной РНК зависит от активатора.
Лямбда-репрессор — продукт гена с/, расположенного ближе
к одному из концов молекулы фаговой ДНК,— может связываться
с двумя близлежащими операторами, по одному с двух сторон от
cl; в этом случае любая транскрипция, кроме той, которая
необходима для синтеза самого репрессора, будет репрессирована.
В отсутствие репрессора, т. е. при активной инфекции, синтез
информационной РНК идет от двух операторов в
противоположные стороны — влево на одной цепи ДНК и вправо на другой.
Однако при этом транскрибируются лишь очень небольшие
участки ДНК, так как для продолжения транскрипции нужен
активатор. Этот активатор, так называемый белок N — продукт
гена N, расположенного вблизи с/, слева от него. По-видимому,
активатор присоединяется к РНК-полимеразе, синтезирующей
информационную РНК, и сообщает ей способность продолжать
синтез по направлению к концам ДНК. Но и эта видоизмененная
РНК-полимераза останавливается, не дойдя до одного из концов
ДНК. Для транскрипции последних оставшихся генов необходим
продукт гена Q.
РЕГУЛЯТОРНЫЕ МЕХАНИЗМЫ КЛЕТКИ 307
Q Я
+■
Ncl OP
iii ii
Образование фаговых частиц Включение рР1ГПМ.
А альнуюДНК
N с/,
О Р
1 ■ I V» I I
^—Репрессор-^
Белок N
0 Р
1
*>***+***»*4\+***^*АЩ**Л*****Щ**^
\
^*A^^<^S^^^^A<WW^>
Белок Q
Рис. 236. Регуляция проявления генов фага лямбда.
A. Генетическая карта фаговой ДНК. Показаны участки, ответственные
за образование дочерних частиц фага, включение фаговой ДНК в ДНК
бактерии-хозяина (см. рис. 212), генетическую рекомбинацию, регуляцию
(гены Ny с/, О, Р и (?) и синтез лизоцима — фермента, который лизирует
зараженную клетку, освобождая фаговое потомство.
Б. Участок, ответственный за регуляцию, в более крупном масштабе.
Показано, как подавляется образование потомства: продукт гена cl — ре-
прессор, который связывается с двумя операторами, 0L слева от него и 0R
справа; это препятствует транскрипции всех генов, кроме с/, кодирующего
сам репрессор.
B. Здесь еще более детально показана область, ответственная за
регуляцию,— сложная система позитивного контроля, регулирующая синтез
фагового потомства. В отсутствие репрессора cl, т. е. при активной инфекции,
транскрипция ДНК идет в обе стороны от гена с/, налево по одной цепи ДНК,
направо — по другой. Справа транскрипция останавливается на гене Q\
слева транскрипция гена N приводит к синтезу белка N, который
модифицирует РНК-полимеразу и таким образом делает возможной транскрипцию гена Q.
После этого белок Q инициирует мощную волну транскрипции, которая идет
направо и захватывает гены, необходимые для образования фагов (на
генетической карте А эти гены показаны слева от (?, но при заражении, когда ДНК
переходит в кольцевую форму, они располагаются справа от Q).
Позитивная регуляция была обнаружена не только у фагов,
но и в системах, управляющих активностью некоторых групп
бактериальных генов,— она была одновременно открыта Рене Тома
у фага лямбда и Эллисом Энглесбергом у бактерий. Когда будут
открыты и детально изучены новые факты позитивной регуляции,
20*
308 ГЛАВА 11
она, безусловно, займет свое место рядом с негативным контролем,
с которым она взаимодействует в процессе регулирования синтеза
белков.
ПРИНЦИП
ОТРИЦАТЕЛЬНОЙ
ОБРАТНОЙ СВЯЗИ
В РЕГУЛЯЦИИ
АКТИВНОСТИ ФЕРМЕНТОВ
Синтез белков, в том числе ферментов, регулируется
механизмами репрессии, индукции и позитивного контроля. Что же
касается регуляции активности самих ферментов, то она часто
осуществляется по принципу обратной связи — путем ингибирова-
ния (торможения) конечным продуктом. Например, аминокислота
треонин в результате пяти последовательных реакций
превращается в аминокислоту изолейцин; если в клетке имеется
достаточное количество изолейцина, он ингибирует первый фермент
в этой цепи — треониндезаминазу — и выключает таким образом
собственный синтез.
Отрицательная обратная связь — весьма обычный механизм
регуляции, встречающийся не только в клетках. Например, когда
вода из туалетного бачка спущена, он снова наполняется до нуж-
о-ф-о
о-4-<о)-о тд^
Треонин
Алъфа-кешомасляная
кислота
Изолейцин
Рис. 237. Ингибирование конечным продуктом. Первый этап биосинтеза
аминокислоты изолейцина из аминокислоты треонина — превращение
треонина в альфа-кетомасляную кислоту, катализируемое ферментом треонин-
дезаминазой (ТД). Если изолейцина в клетке достаточно, он взаимодействует
с треониндезаминазой и подавляет ее активность, приостанавливая таким
образом свой собственный синтез.
РЕГУЛЯТОРНЫЕ МЕХАНИЗМЫ КЛЕТКИ 309
ного уровня благодаря системе обратной связи: притоку воды
в бачок обычно препятствует пробка, соединенная с поплавком;
при снижении уровня воды поплавок опускается, отталкивает
пробку от отверстия и вода начинает течь в бачок. Когда бачок
будет заполнен, поплавок поднимется, пробка встанет на место
и снова перекроет воду. В этой наиболее древней механической
системе обратной связи приток воды отключает сам себя с помощью
поплавка, когда вода доходит до нужного уровня. Подобным же
образом термостатическое устройство под действием тепла
отключает систему обогрева комнаты, а наполненный желудок через
посредство сложной нервной цепи выключает чувство голода.
Ингибирование конечными продуктами, иногда при участии
нескольких веществ, может дополнять репрессию синтеза
ферментов для обеспечения тонкой регуляции сложных биохимических
превращений. Рассмотрим, например, следующий случай. Из
аспарагиновои кислоты в результате разветвленной цепи реакций
синтезируются четыре аминокислоты -±- лизин, треонин, метио-
нин и изолейцин. Первый фермент в этой цепи превращений, ас-
партаткиназа, катализирует превращение аспарагиновои кислоты
в аспартил-бета-фосфат — предшественник всех четырех
аминокислот. Если бы эта первая реакция регулировалась только
одним из четырех конечных продуктов, например изолеицином, то
избыток изолейцина вызывал бы нехватку трех остальных амино-
/
— Лизин
. \
Аспарагиновая Аспартил-
кислота "*"бета-фосфат'
I
\ Изолейцин
1 *
1 >
i / /
1 > /
— -^Треонин
! \ 1
_^ Аспартат-бета-_
семиальдегид
I
Цистеин
- Гомосерин
1 \
Метионин
i
Рис. 238. Регуляторные связи в системе реакций, ведущих к образованию
различных аминокислот — лизина, изолейцина, треонина и метионина — из
аспарагиновои кислоты. Прерывистые линии идут от конечных продуктов
к ферментам, которые они контролируют, подавляя активность фермента или
репрессируя его синтез.
310 ГЛАВА 11
кислот. Очевидно, что регуляция активности аспартаткиназы
должна быть множественной.
У некоторых бактерий для осуществления такого
множественного контроля имеются три разновидности аспартаткиназы,
причем каждая кодируется особым геном и регулируется
концентрацией «своей» аминокислоты: активность одного фермента ингиби-
руется треонином, другого — лизином, который также подавляет
его синтез, а синтез третьего репрессируется метионином. У других
бактерий имеется, вероятно, только одна аспартаткиназа,
активность которой не подавляется какой-либо одной аминокислотой,
а только совместным действием лизина и треонина; синтез ее
частично репрессируется метионином.
регуляция и
АЛЛОСТЕРИЧЕСКИЕ
БЕЛКИ
Каким образом лактоза, присоединяясь к лактозному репрес-
сору, лишает его способности связываться с лактозным
оператором? Конечно, лактоза не может непосредственно помешать
связыванию репрессора с ДНК — маловероятно, чтобы небольшая
молекула сахара занимала тот же участок репрессора, где
присоединяется гораздо более крупный и совершенно отличный в
химическом отношении фрагмент ДНК длиной, возможно, в 8 пар
оснований. Как изолейцин ингибирует фермент треониндезамина-
зу? Изолейцин не может помешать треонину — субстрату
фермента — попасть в активный участок фермента (его каталитический
центр), просто заняв этот участок, так как треонин и изолейцин
имеют мало общего между собой, если не считать того, что оба
они — аминокислоты. Активный центр не может обладать
способностью связывать и треонин, и изолейцин.
Отсутствие химического сходства между компонентами
регулируемой системы и регулирующей молекулой (индуктором,
конечным продуктом или ингибитором) — одна из основных
особенностей регуляторных механизмов. Эта особенность расширяет
возможности тонкой регуляции множества взаимодействующих
химических реакций. Она дает также ключ к пониманию механизма
действия регуляторных веществ.
В 60-х годах Жакоб, Моно и Жан-Пьер Шанжё высказали
предположение, что белки (например, ферменты), активность которых
регулируется с помощью обратной связи, имеют по меньшей мере
два различных связывающих участка и могут существовать в двух
трехмерных формах, или конформациях. Они назвали такие белки
аллостер ическими.
РЕГУЛЯТОРНЫЕ МЕХАНИЗМЫ КЛЕТКИ 311
@ @
А Б
Рис. 239. Регуляция активности аллостерического фермента (полагают, что
такие ферменты всегда состоят из нескольких одинаковых субъединиц,
в данном примере из двух). В активной форме (А) фермент может
присоединять субстрат (Суб) или активатор (Ак), но не может связывать ингибитор
(Ин). В другой, неактивной, форме (Б) фермент может связывать ингибитор,
но не может присоединять субстрат или активатор.
Регулируемый фермент треониндезаминаза имеет участок для
связывания субстрата (треонина) и, кроме того, отдельный
участок для связывания ингибитора (изолейцина). В каталитически
активной конформации субстратный участок имеет форму,
подходящую для связывания треонина, а ингибиторный участок
деформирован и не может связывать изолейцин. В отсутствие
ингибитора большая часть молекул фермента находится именно в этой
конформации, которая стабилизируется при связывании
субстрата.
В неактивной конформации ингибиторный участок фермента
имеет форму, подходящую для связывания изолейцина, а
субстратный участок деформирован и не может связывать треонин.
В присутствии изолейцина большая часть фермента находится
в неактивной конформации, так как эта конформация закрепляется
в результате связывания ингибитора.
Взаимодействие с небольшой регуляторной молекулой может
привести не только к понижению, но и к повышению активности
фермента. В этом случае связывание регулятора (активатора)
с соответствующим аллостерическим участком стабилизирует
активную конформацию фермента.
По-видимому, сходным образом действуют и репрессоры.
случае индукции связывание индуктора, например лактозы, будет
312 ГЛАВА 11
благоприятствовать неактивной конформации репрессора, в
которой он неспособен присоединяться к оператору. В случае
репрессии связывание регуляторной молекулы будет способствовать
образованию активной формы репрессора, в которой он
присоединяется к оператору и препятствует транскрипции ДНК.
Вероятно, в большинстве случаев действует не один механизм
регуляции. Например, фермент может ингибироваться одним или
несколькими конечными продуктами и активироваться
веществами, образующимися при расщеплении конечных продуктов, а
также молекулами, участвующими в других биохимических
превращениях (что позволяет обеспечить нужное соотношение таких
веществ, как, например, аминокислоты); кроме того, активатором
может быть предшественник субстрата или даже сам субстрат.
Каждая небольшая молекула, играющая роль регулятора,
присоединяется к собственному участку фермента, находящегося
в той или иной конформации.
Такой тонкой и сложной регуляции способствуют различия
в силе связывания. Если, например, активатор прочно связывается
со своим участком, а ингибитор — слабо, то относительно
небольшое количество активатора будет оказывать значительное действие
даже в присутствии больших количеств ингибитора.
Теперь нам понятны механизмы «включения» и «выключения»
ферментов. А как же достигаются промежуточные уровни их
активности? Действительно, каждая отдельная молекула белка
в данный момент находится либо в активной, либо в неактивной
конформации. Однако доля молекул, находящихся в той или
другой конформации, может быть различной — она зависит от
концентрации ингибитора и активатора или, в случае множественной
регуляции, от относительных концентраций ингибиторов и
активаторов. Возьмем простой пример: только значительный избыток
изолейцина сможет ингибировать все молекулы треониндезами-
назы; меньшие количества изолейцина будут ингибировать лишь
некоторую долю молекул фермента, и эта доля будет изменяться
с изменением концентрации изолейцина.
РЕГУЛИРОВАНИЕ
ПУТЕМ ХИМИЧЕСКОЙ
МОДИФИКАЦИИ
ФЕРМЕНТОВ
Регуляторные механизмы, описанные выше, с достоверностью
установлены у бактерий. Вероятно, нечто подобное существует
и в клетках высших организмов, но доказать это, к сожалению,
РЕГУЛЯТОРНЫЕ МЕХАНИЗМЫ КЛЕТКИ 313
до сих пор не удается, так как решающие генетические
эксперименты на этих клетках пока невозможны.
Но бактерии и вирусы не всегда оказываются впереди. Другой
регуляторный механизм — химическая модификация ферментов —
был открыт и изучен главным образом в животных тканях и
только недавно стал привлекать внимание при исследовании бактерий,
где его важность в настоящее время общепризнана.
Известно несколько типов химической модификации. Фермент
может «включаться» при соединении двух сульфгидрильных групп
(—SH) с образованием дисульфидной связи (—S—S—) и
«выключаться» при обратном изменении, или наоборот. Другие ферменты
«включаются» и «выключаются» в результате присоединения и
отщепления фосфата; в одних случаях активен фосфорилированиый
фермент, в других — дефосфорилированный. Иногда такую же
роль может играть присоединение и отщепление аденозина,
составляющего часть молекулы АТФ —«энергетической валюты»
клетки. Обычно такие химические модификации осуществляются
двумя регуляторными модифицирующими ферментами, один из
которых активирует, а другой инактивирует молекулу основного
фермента.
Отличительная особенность регулирования путем химической
модификации состоит в том, что обе формы фермента стабильны.
Это позволяет поддерживать «включенное» или «выключенное»
состояние фермента (от которого иногда зависит характер всего
клеточного метаболизма) даже в отсутствие регуляторного
сигнала, который вызвал химическую модификацию.
Действие некоторых гормонов по крайней мере отчасти
связано с тем, что они вызывают химическую модификацию белков
в определенных клетках. Под влиянием инсулина, например,
происходит дефосфорилирование гликогенсинтетазы, приводящее
к ее активации (гликогенсинтетаза — фермент, полимеризующий
глюкозу в гликоген; в форме гликогена организм животного
запасает глюкозу). «Гормон стресса» адреналин вызывает химическое
видоизменение других ферментов: он активирует ферменты,
расщепляющие гликоген до глюкозы, и тем самым повышает
содержание глюкозы в крови, обеспечивая организм источником энергии
на случай экстренной необходимости. Какие регуляторные
сигналы вызывают обратные химические изменения, пока не
выяснено.
314 ГЛАВА 11
МНОГОЕ ОСТАЕТСЯ
НЕИЗВЕСТНЫМ
Индукция, репрессия и позитивная регуляция синтеза
ферментов, ингибирование и активация ферментов с помощью алло-
стерических воздействий и химических модификаций — это еще
далеко не все способы регуляции. В частности, у высших
организмов весьма вероятно существование гораздо более сложных
регуляторных систем, чем те, что были обнаружены у бактерий
и вирусов. Из-за нерешенных методических проблем и крайней
сложности самих объектов изучения достоверно известно лишь
очень немногое. Как мы увидим, механизмы регуляции и
координации в животных клетках остаются одной из главных, наиболее
интригующих загадок.
МОЛЕКУЛЯРНАЯ
«БИОЛОГИЯ
ЗАВТРАШНЕГО
ДНЯ
В этой книге было рассмотрено много проблем и поставлено
много вопросов. На некоторые из них уже есть ответы. Другие
вопросы исследователи пытаются разрешить — хотя бы в
отношении бактерий. В не столь отдаленном будущем молекулярные
биологи, без сомнения, создадут полное описание своей маленькой
любимицы — бактерии Escherichia coli. Понимание работы клеток
высших организмов — дело гораздо более трудное.
СЛОЖНЫЕ КЛЕТКИ
ВЫСШИХ ОРГАНИЗМОВ
Что происходит в клетках высших организмов? В основе своей
все клетки очень сходны. Их генетический материал — это всегда
ДНК, которая удваивается, вероятно, одинаковым способом, еще
не вполне ясным. Генетическая информация ДНК —
последовательность оснований — транскрибируется в информационную
РНК. Белок синтезируется с помощью этой информационной РНК
при участии транспортных РНК, рибосом и различных
специальных факторов почти одинаковым образом и с использованием в
точности одинакового кода во всех клетках. Еще не установлено
окончательно, есть ли в животных клетках те механизмы, которые
регулируют синтез белка игактивность ферментов у бактерий;
судя по многим данным, они, вероятно, здесь тоже существуют,
и было бы удивительно, если бы их не оказалось.
Но клетки высших организмов — растений и животных — во
многом существенно отличаются от бактериальных клеток, и эти
316 ГЛАВА 12
Рис. 240. Стереофотографии части гигантской хромосомы плодовой мушки,
сделанные с помощью сверхвысоковольтного электронного микроскопа при
напряжении 1 миллион вольт. Видно, что хромосома — цилиндрическая
структура, состоящая из сегментов, где тонкие нити (в основном ДНК и белок)
проходят почти прямо, и сегментов, где эти нити скомканы в плотную массу.
(Увеличение 14 000.) (Н. Ris, J. de Microscopie, 8, 761 (1969); с разрешения
автора).
О том, как рассматривать эти фотографии, см. в подписи к рис. 66,
стр. 88.
отличия неизбежно должны быть связаны с взаимодействиями на
уровне молекул, неизвестными у бактерий. Клетки высших
организмов имеют ядро, отделенное от цитоплазмы ядерной мембраной;
оно содержит «генеральный план» всего организма: здесь находится
ДНК, организованная в хромосомы (структура которых еще
недостаточно изучена). К тому же эти клетки гораздо крупнее
бактериальных; митохондрии, которых в клетке может быть несколько
тысяч, близки по размеру к бактериям.
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ ЗАВТРАШНЕГО ДНЯ 317
В связи с такими размерами животных клеток возникает ряд
сложных вопросов относительно их структуры и переноса веществ.
Наглядный пример — нервная клетка, ядро которой,
расположенное в спинном мозгу, содержит генетическую информацию для
синтеза особых ферментов, которые нужны в окончаниях отростков,
иногда удаленных от ядра на десятки сантиметров. Очевидно,
информационные РНК или сами ферменты, если они синтезируются
вблизи ядра, должны каким-то образом переправляться к месту
назначения.
КАК ПРОИСХОДИТ
СПЕЦИАЛИЗАЦИЯ
КЛЕТОК?
Клетки высших животных (и менее изученных высших
растений) отличаются от бактерий не только более сложной внутренней
структурой; у них, кроме того, другой образ жизни: они
существуют как специализированные элементы многоклеточного
организма. Каким образом происходит их специализация? Какой
механизм координирует развитие различных клеток, организует
построение из них органов и тканей? Эти процессы до сих пор
остаются почти такими же загадочными, каким был механизм
наследственности до работ Менделя. Невероятную трудность
проблемы можно осознать, если вспомнить, что человек во всей его
сложности, с работающими и взаимосвязанными печенью,
сердцем, мышцами, нервной системой начинает свою жизнь как одна-
единственная неспециализированная клетка — оплодотворенное
яйцо.
Как происходит развитие организма? С тех пор как был
изобретен микроскоп, эмбриологи ищут ответ на этот вопрос.
СПЕЦИАЛИЗАЦИИ
ПРЕДШЕСТВУЕТ
ДЕТЕРМИНАЦИЯ
Первая стадия, ведущая к специализации клетки,— это
детерминация (предопределение) ее будущей роли: станет ли она
печеночной, мышечной или нервной клеткой. Судьба клетки
определяется на раннем этапе эмбриональной жизни и зависит от ее
местоположения в эмбрионе. Например, у зародыша саламандры,
когда он еще выглядит как почти бесформенный комок, можно
взять кусочек кожи с места будущей передней конечности и
пересадить его на бок другого эмбриона. Позже на этом необычном
318 ГЛАВА 12
Рис. 241. Стадии внутриутробного развития человека. Л. Оплодотворенное
яйцо разделилось на две клетки. Б. Четырехдневный эмбрион, состоящий
из 58 клеток. Здесь уже можно различить наружный слой, массу внутренних
клеток и полость. В. У этого 26-дневного зародыша образовались зачатки
глаз, ушей, легких. Г. В возрасте 37 дней ясно видно, что эмбрион станет
человеческим существом. Д. В 19 недель зародыш кажется совершенно
сформировавшимся, хотя и крошечным (17 см в длину) ребенком. (С разрешения
Carnegie Institution of Washington.)
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ ЗАВТРАШНЕГО ДНЯ 319
Ряс. 242. Пересадка конечности у саламандры. Кусочек ткани, который
должен стать конечностью, пересаживают от одного зародыша на бок другого.
Этот зародыш развивается в пятиногую саламандру. (С разрешения Н.
Hamburger и «Encyclopaedia Britannica».)
месте разовьется передняя конечность — добавочная передняя
лапа, растущая на боку саламандры. Очевидно, судьба
пересаженного кусочка кожи была уже необратимо предопределена.
Молекулярный биолог спросит: что представляет собой
начальный этап специализации — какое химическое событие (или ряд
событий) предопределяет судьбу клетки? Ответа на этот вопрос
до сих пор нет.
СПЕЦИАЛИЗАЦИЯ
И СИНТЕЗ БЕЛКОВ
Через некоторое время после того, как определится будущая
роль клетки, эта клетка или ее потомки начинают готовиться к
выполнению своих специальных функций. Эритроциты синтезируют
гемоглобин; в железистых клетках образуются механизмы,
которые нужны для выработки соответствующих продуктов и выве-
320 ГЛАВА 12
дения их из клетки; нервная клетка синтезирует ферменты,
структурные белки и эффекторы, необходимые для того, чтобы
воспринимать и передавать нервные импульсы. Короче говоря, каждая
клетка синтезирует белки, необходимые для выполнения
определенной работы.
Какие регуляторные механизмы обеспечивают синтез таких
белков в специализированной клетке? Есть надежда, что в 70-е
годы этот вопрос будет хотя бы частично разрешен, так как в
начале десятилетия уже были получены важные данные. Возможно,
что в животных клетках существуют (и играют важную роль в
специализации) такие же механизмы, какие были обнаружены в
бактериальных клетках, зараженных фагами.
Как мы уже знаем, в случае фага лямбда позитивная
регуляция осуществляется, по крайней мере отчасти, путем модификации
РНК-полимеразы: модифицированный фермент узнаёт, видимо,
промоторные участки, которые он раньше не узнавал, и поэтому
может транскрибировать в информационную РНК гены, бывшие
прежде недоступными. Возможно, что у животных РНК-полиме-
раза определенных специализированных клеток эффективно
синтезирует лишь определенные виды информационной РНК. Таким
образом, клетки каждого типа могли бы обладать собственной
РНК-полимеразой, специально приспособленной для узнавания
и транскрипции только тех генов, которые кодируют белки данной
клетки.
Специфичность клеток в отношении синтеза белка может
проявляться и на другом уровне. Было установлено, что после
заражения бактерий фагом Т4 бактериальные рибосомы сразу же
модифицируются таким образом, что они теперь плохо синтезируют
белок на бактериальной информационной РНК и хорошо — на
фаговой. Причина этого, видимо, в том, что при фаговой инфекции
появляется новый набор факторов инициации, необходимых для
первого этапа синтеза белка — прикрепления рибосом к
инициирующим кодонам; фаговые факторы инициации эффективны только
в отношении фаговой информационной РНК.
Животные клетки тоже могут различаться по факторам
инициации. Есть, например, данные о том, что информационная РНК,
кодирующая мышечный белок миозин, не транслируется в белок
рибосомами из эритроцитов, если не добавить факторы инициации
из мышечных клеток.
Очевидно, что специализированная РНК-полимераза и
специализированные факторы инициации могли бы играть важную роль
в определении специфического набора белков, синтезируемого той
или иной клеткой.
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ ЗАВТРАШНЕГО ДНЯ 321
СПЕЦИАЛИЗИРОВАННЫЕ
КЛЕТКИ
ОБРАЗУЮТ ОРГАНЫ
Клетки, предназначенные для выполнения определенной
функции, по мере роста и деления становятся все более и более
специализированными и группируются в оформленный и, наконец,
зрелый орган. Эмбриологи установили, что этот процесс
совершается с невероятной точностью. Поразительный пример — рост
тысяч нервных волокон из сетчатки глаза по направлению к
зрительным центрам мозга.
Чтобы животное правильно видело, волокна зрительных
нервов должны соединиться с соответствующими нервными клетками
мозга. Только тогда изображение на сетчатке будет
преобразовываться в надлежащую картину импульсов в мозгу. Каждое
нервное волокно каким-то образом точно связывается с нужным
центральным пунктом. Это было показано в опытах с поворотом
глазного яблока у зародыша рыбы или саламандры; операцию
производили задолго до того, как зрительный нерв начинал расти по
направлению к мозгу (или же переворачивали глаз у взрослого
животного после перерезки зрительного нерва). Хотя в растущем
зрительном нерве волокна по всей видимости основательно
перепутываются, тем не менее каждое из тысяч волокон находит свое
собственное место в мозгу, так что бедное животное прекрасно
видит мельчайшие детали, но (из-за того, что глаз был
перевернут) — вверх ногами!
Рис. 243. У этой лягушки на спине белое пятно, потому что на стадии
головастика ей была пересажена сюда белая кожа с живота. Если пощекотать это
место, лягушка почешет живот, а не спину. Такая неправильная реакция
говорит о невероятно точном установлении связей между определенными
участками центральной нервной системы и соответствующими тканями.
(R. E. Baker, Nature, 236, 235 (1972); с разрешения автора.)
21 — 0414
322 ГЛАВА 12
Какие ориентиры дают возможность каждому волокну
зрительного нерва найти дорогу к месту назначения? Какие
химические взаимодействия управляют развитием самого глаза — столь
совершенного и сложного органа с роговицей из пяти слоев,
хрусталиком, многослойным как луковица, сетчаткой, включающей
больше двадцати различных видов специализированных клеток,
организованных в 10 слоев? Как возникает структура любого
органа? Мы этого не знаем.
Как из одной-единственной клетки — оплодотворенного
яйца — развиваются работающие органы, построенные из множества
специализированных клеток и объединенные в целостный
организм?
Молекулярные основы развития все еще остаются глубокой
тайной.
КАК МЫ МЫСЛИМ?
Как мы думаем, запоминаем, решаем задачи, принимаем
решения? Как вообще головной и спинной мозг вместе с
периферической нервной системой обеспечивает регулирование и интеграцию
функций организма и связь индивидуума с внешним миром?
Работа мозга непонятна ни на каком уровне, не только у человека,
но и у низших животных. -
Психолог неспособен подробно ответить на многие вопросы,
касающиеся поведения. Каким образом животное суммирует
информацию, поступающую из внешнего мира через органы чувств?
Как оно избирает тот или иной образ действий в зависимости от
этой информации? Как животное запоминает и в чем различие
между механизмами кратковременной и долговременной памяти?
Как происходит обучение — почему поведение животного меняется
под влиянием новой информации? Наконец, как работает
воображение? Вероятно, это самая характерная функция человеческого
мозга, которой обладают лишь немногие из высших животных, да
и то в гораздо меньшей степени. Способно ли животное
«проигрывать» перед своим мысленным взором будущее, формировать в
голове задачу, которая должна быть решена, и затем вырабатывать
решение? Именно эта способность, тесно связанная со
способностью говорить, дает человеку возможность с успехом охотиться
или работать в лаборатории, используя орудия, созданные им
самим. Побочный продукт этой способности — то, что она
позволяет человеку осознавать собственное существование, предаваться
мечтам, желаниям и стремиться к своим целям, хорошим или
дурным.
Нейрофизиолог изучает не поведение, а физиологию нервной
системы. Он пытается, например, построить функциональную
«карту» мозга — выяснить, какая его часть ответственна за ту
Рис. 244. Распределение сенсорных (связанных с ощущениями) и двигательных функций в коре головного мозга
у человека. Хотя двигательные зоны на самом деле лежат в обоих полушариях впереди участков, ответственных за £3
ощущения, на рисунке они изображены в одной плоскости. Обратите внимание, что, например, для кисти руки И
больше места отведено движению, чем ощущению, а для губ — наоборот. (W. Penfield, Т. Rasmussen, The cerebral EQ
Cortex of Man, Macmillan, New York; 1950; с разрешения Macmillan Company.)
324 ГЛАВА 12
или другую из его многочисленных функций. В некоторых
случаях были достигнуты значительные успехи. Нервные импульсы,
приходящие от органов чувств, попадают в точно известные
участки мозга; команды, идущие к мышцам, выходят из других
участков, локализация которых так же хорошо изучена (рис. 244).
Чувство удовольствия возникает при возбуждении специального
центра; обезьяна с электродом, вживленным в этот центр, будет
снова и снова нажимать кнопку, которая включает электрический
ток, возбуждающий нервные клетки в этой области.
Однако пока еще обширные участки мозга не картированы и
локализация многих наиболее интересных функций установлена
весьма приближенно. Где вырабатываются планы действий? Это
важный вопрос, так как без плана или программы невозможен
даже простейший волевой акт. Где хранятся воспоминания? По-
видимому, каждый хранящийся в памяти «след» распределен на
значительном пространстве, поскольку даже обширное
повреждение мозга иногда|может очень мало сказываться на памяти.
Нейрофизиологов и создателей вычислительных машин
чрезвычайно интересует также следующий вопрос: как организованы
связи между нервными клетками в'Центральной нервной системе?
Ведь у человека число таких клеток составляет около 100
миллиардов, а число связей может достигать нескольких сотен на одну
клетку! Некоторые нейрофизиологи пытаются найти путь к
решению этого вопроса, изучая нервные системы низших организмов,
таких, как раки, крабы или моллюски, у которых число нервных
клеток невелико. Они обнаружили, что поведение самих нервных
клеток достаточно сложно: возбужденная клетка может давать
быстрый или медленный импульсный разряд, может возбуждать
или тормозить другие нервные клетки.
К тому же одиночные нервные клетки могут воздействовать на
целую группу мышц. Например, электрическая стимуляция
различных одиночных клеток в центральной нервной системе рака
вызывает сокращение разных групп мышц, что приводит к
сгибанию, выпрямлению и другим движениям брюшка и хвостовых
лопастей. В рефлекторных реакциях человека могут участвовать
такие же врожденные связи, но при обучении, несомненно, должны
создаваться новые нервные пути.
Используя свои устройства, намного уступающие нервной
системе по числу и сложности элементов, создатели вычислительных
машин пытаются имитировать работу человеческого мозга. Они
добились некоторого успеха, так как машина может решать многие
классические задачи, предлагаемые для оценки умственного
развития. Ей пока еще далеко до гениальности, но скромный уровень
«интеллекта», который уже достигнут, видимо, подтверждает
мысль о том, что в основе разума, принятия решений, мышления
лежит сложная организация взаимосвязанных элементов.
МОЛЕКУЛЯРНАЯ! БИОЛОГИЯ ЗАВТРАШНЕГО ДНЯ 325
А б
Рис. 245. Стимуляция одной центральной нервной клетки у рака может
вызвать сложную реакцию. А — брюшко подогнуто; Б — стимуляция
вызывает выпрямление брюшка, в котором участвуют все его сегменты.
И наконец, как работает нервная система на молекулярном
уровне? Каким образом происходит, например, передвижение
импульса по нервному волокну? До некоторой степени этот вопрос
выяснен. По плазматической мембране волокна быстро пробегает
, • i
*>
.'
t*4
» А
-
444*
«#*
Рис. 246. Соединение между мышечной и нервной клетками очень сложно.
Окончание нервного волокна, или аксона (Л), тесно сближено с мышечным
волокном (М). (Ш — участки другой клетки — шванновской.) Возбуждение
нерва ведет к разрушению синаптических пузырьков (СП), из которых
высвобождаются вещества, диффундирующие через щель между клетками и
передающие таким образом возбуждение с нерва на мышцу. (В. СессагеШ et
al., J. Cell Biol., 1972; с разрешения В. СессагеШ и D. Sabatini.)
326 ГЛАВА 12
волна изменения проницаемости, и это позволяет ионам натрия
войти в клетку; таким образом, внутренность волокна становится
электроположительной, а окружающая жидкость —
электроотрицательной. Молекулярный механизм изменения проницаемости,
от которого зависит распространение нервного импульса,
неизвестен.
Как нервный импульс перескакивает с одной нервной клетки
на другую? Нервные клетки не примыкают друг к другу вплотную:
в месте их соединения, которое называется синапсом, они
разделены узкой щелью. Через эту щель и должен проскочить импульс.
Передатчиками здесь служат определенные вещества, и некоторые
из них уже известны — это ацетилхолин и норадреналин. Очень
сложная структура нервных клеток в области синапса привлекает
большое внимание, и детали ее постепенно выясняются.
Почему синапсы вызывают такой интерес? Весьма возможно,
что все высшие функции мозга — запоминание, обучение (т. е.
изменение существовавших реакций и выработка новых), решение
задач, принятие решений — зависят от неизвестных химических
процессов, облегчающих или тормозящих передачу нервных
импульсов через синапсы. Это приводило бы к изменению связей
между определенными нервными клетками и в результате —
к стойкому изменению реакций на определенные стимулы.
Вероятно, самое интересное для человека биологическое
явление — это работа его собственного мозга. Мы хотели бы знать
механизмы его функционирования на всех уровнях. На любом
уровне мы пока еще сталкиваемся с глубокой тайной.
ЗАЧЕМ НУЖНА
МОЛЕКУЛЯРНАЯ
БИОЛОГИЯ?
Почему вообще необходимы научные исследования? Потому
что человек более любознателен, чем кошка, и требует ответа на
свои вопросы. Потому, что раскрытие тайн природы — дело
увлекательное. Потому, что всякое познание дает глубокое
удовлетворение.
Но знания приносят и практическую пользу. Данные
молекулярной биологии важны для медицины, и мы видели это на ряде
примеров. Развитие современной медицины неразрывно связано
с успехами молекулярной биологии. Например, определение
активности некоторых ферментов лежит в основе диагностики
многих заболеваний, а иногда позволяет следить за течением болезни,
как, скажем, в период восстановления после инфаркта миокарда.
МОЛЕКУЛЯРНАЯ БИОЛОГИЯ ЗАВТРАШНЕГО ДНЯ 327
Данные молекулярной биологии позволили понять природу
многих болезней и в некоторых случаях открыли путь к их
диагностике, лечению или предупреждению. Возможно, что скоро будут
найдены средства борьбы с вирусными болезнями: в 1970 году было
показано, что синтетическая РНК стимулирует образование
интерферона — белка, который в норме синтезируется только в клетках,
зараженных вирусом, и защищает здоровые клетки от вирусной
инфекции. И наконец, есть надежда, что молекулярная биология,
исследуя тайны клетки и организма, раскроет природу рака,
сделает возможным его предупреждение и эффективное лечение.
Будущее новой, бурно развивающейся науки нельзя
полностью предсказать заранее. Научные открытия, дающие сегодня
ответ на теоретические вопросы, завтра могут изменить всю нашу
жизнь. Могли ли великие исследователи основных законов
электричества в XVIII—XIX веках предвидеть, что когда-то их
открытия дадут миру движение и свет?
РЕКОМЕНДУЕМАЯ
ЛИТЕРАТУРА
Asimov /., A Short History of Chemistry, Educational Services,
Inc.,Washington, 1965.
Berrill N. /., Developmental Biology, McGraw-Hill Book Co., New York, 1971.
Brock T. D. (ed.), Milestones in Microbiology, Prentice-Hall Englewood Cliffs,
N.J., 1961. (Оригинальные статьи Левенгука, Пастера, Дженнера,
д'Эреля и других авторов.)
Crick F., Of Molecules and Man, University of Washington Press, Seattle, 1966.
Darwin Ch., On the Origin of the Species by Means of Natural Selection, or the
Preservation of Favoured Races in the Struggle for Life, available from
several publishers. (Ч. Дарвин, Происхождение видов, Сельхозгиз,
1952.)
Dickerson R. Б., Geis /., The Structure and Action of Proteins, Harper and
Row, New York, 1969.
Encyclopaedia Britannica. (Статьи по химии и биологии.)
Gamow G., The Atom and Its Nucleus, Prentice-Hall, Englewood, Cliffs, N.J.,
1961.
Pauling L., College Chemistry, 3d ed., Freeman, San Francisco, 1964. (Л. По-
линг, Общая химия, изд-во «Мир», М., 1974.)
Peters J. A. (ed.), Classic Papers in Genetics, Prentice-Hall, Englewood Cliffs,
N.J., 1959. (Оригинальные работы Менделя, Морганами других
исследователей.)
Scientific American. (Статьи в этом журнале можно особенно рекомендовать
тем читателям, которые хотели бы следить за новейшими достижениями
молекулярной биологии.)
Stent G. S. (ed.), Papers on Bacterial Viruses, 2nd ed., Little, Brown, Boston,
1965. (Оригинальные работы д'Эреля, Дельбрюка, Херши, Бензера
и других исследователей; трудный, но интересный материал.)
Stern С, Sherwood E. R. (eds.), The Origin of Genetics, a Mendel Source Book,
Freeman, San Francisco, 1966.
Sturtevant A. #., A History of Genetics, Harper and Row, New York, 1965.
Swanson C. P., The Cell, 3d ed., Prentice-Hall, Englewood Cliffs, N.J., 1969.
Taylor /. H. (ed.), Selected Papers on Molecular Genetics, Academic, New York,
1965. (Оригинальные работы Полинга, Ингрэма, Херши и Чейз, Уот-
сона и Крика, Меселсона и Сталя; трудный, но интересный материал.)
Toner P. G.f Carr К. Е., Cell Structure, 2d ed., Churchill Livingstone,
Edinburgh, 1971.
Winchester A. M., Genetics, Houghton Mifflin, Boston, 1966.
ПРЕДМЕТНО-ИМЕННОЙ УКАЗАТЕЛЬ
Аденин (см. также ДНК)
— структура 210, 215
Аденозиндифосфат см. АДФ
Аденозинтрифосфат см. АТФ
Адреналин 313
АДФ 54—56
Акридин 278
Активатор 311—312
Активный центр (ферментов) 11,3
118, 148-151
Актин 102, 146, 147
Актомиозин 102
Алкаптонурия 187, 188
Аллостерические белки 310—312
Альбинизм 187
Альбумин (яичный) 97, 107
Альфа-спираль 138—140, 141
Амеба 73
Аминокислоты 49—50, 116—118
— концевые 122—124, 139
Антиген 106—107, ИЗ
Антиген—антитело комплекс 106—
107, 113
Антикодон 259, 261—263
Антипараллельный складчатый
слой 139, 140, 144
Антитела 104—107, ИЗ, 152
Аппарат Гольджи 65, 82—83
Атом 29—36
Атомная теория 29—31
Атомный вес 30
АТФ, в клеточных «насосах» 72, 109
— и мышечное сокращение 101
— и фотосинтез 54—56, 84
— образование при окислении 59,
85, 86
— структура 55
Ацетабулярия (Acetabularla) 91—92
Ацетилкофермент А (ацетил-КоА)
87—89
Бактерии 23, 25, 194—199, 205,
251
Бактериофаги (фаги), белок 205—
208, 306-308
— ДНК 205-208
— жизненный цикл 202—205
— инфекция 268—270
— карта гена гН 244—248
— открытие, свойства 199
— подсчет частиц 200—201
— рекомбинация 248—251
— РНК 286-290
Белки, аминокислотный состав
120-122
— взаимодействие молекул 145—147
— денатурация 97, 145
— замены аминокислот 133—134,
146
— молекулярный вес 115
— последовательность
аминокислот 122—129
— свойства 96—98, 114
— синтез 152—154, 252—276
— структура 116—118
— — трехмерная 134—152
Бензер С. 242—247
Бета-галактозидаза 294, 295
Бидл Дж. 189—191, 241
Биохимические реакции,
потребность в энергии 53
роль АТФ 54—56, 59
Бор Н. 34
Браун Р. 11
330 ПРЕДМЕТНО-ИМЕННОЙ^УКАЗАТЕЛЬ
Браше Ж. 253
Бреннер С. 256, 281
Брожение 21, 22, 24, 111
Бройль Л. де 61
Брэгг Л. 134, 135, 143
Брэгг У. 134
Бюхнер Э. 111
Вакцина 104
Вакцинация 104
Вебер К. 287
Вейсс Мэри 94
Виноград Дж. 223, 224, 236
Вирус табачной мозаики (ВТМ)
270 273
Вирусы 107, 136, 268-276
— бактериальные 199 (см. также
Бактериофаги)
— оболочка 147
Вирхов Р. 12
Витализм 111
Витамин А 48
Водород, строение атома 35
Водородные связи 138
— — в белке 140,' 144
в ДНК 214-215, 254
Волосы 97, 138, 165
Восстановление 45
«Врожденные ошибки метаболизма»
186
Галактозе ми я 51
Галактозидаза 294—297
Гем 142-143
Гемоглобин 96
— замены аминокислот 130—133
— молекулярный вес 115
— структура 140—143
— функция 102—103
Генетика, основные законы 155—159
Генетическая рекомбинация см.
Рекомбинация
Генетические карты 179—184
Генетический код см. Код
генетический
Гены 156,186-188, 306—307
— локализация в хромосоме 141,
175-184, 244-246
— рекомбинация 177—179, 248—251
— репликация 193
— структурные 295, 298
— сцепленные 177, 180—183
с полом 173—176
— теория «один ген — один
фермент» 188—192
— у человека 165—166
Гены-регуляторы 295
Гибридные клетки 94—95
Гильберт У. 234, 239, 300, 301, 303,
305
Гликоген 28, 67, 313
Глутаминовая кислота 50, 133, 285
Глюкоза, биосинтез 56—59
— окисление 59, 85—90
— структура 57
Головной мозг 322—326
Гольджи аппарат 65, 82—83
Гольджи К. 82
Гормоны, влияние на ферменты 313
«Горячие точки» (мутационные) 247
Градиент плотности (при
центрифугировании) 223—226, 250, 251
Граны 83
Грин Г. 94
Гриффите Ф. 194—196
Гуанин, структура 210, 215
Гук Р. 10, 61
Гэррод А. 186
Дальтон Дж. 29—32
Дарвин Ч. 13—16
Дезоксирибонуклеиновая кислота
см. ДНК
Делеции 243—246
Дельбрюк М. 202—204
Денатурация 97, 145
Дженнер Э. 104
Дисульфидная связь 125—128, 313
Диффузия 70—72
ДНК, радиоавтография 231, 232
— репликация 220—240
— синтез ферментативный 215—218
— структура 209—218
— транскрипция в РНК 258
— центрифугирование 223—226
ДНК-полимераза 230—231
Доминантные признаки 161,163—166
Дресслер Д. 237, 239
Дрожжи 21, 23—24, 26, 110—111
Дрозофила см. Плодовая мушка
Д'Эрель Ф. 199—201
Естественный отбор 13—16
Жакоб Ф. 255, 256, 281, 294—298,
300, 303, 310
Желатина 97
Замечник П. 282
Зрительный нерв 322
Изотопы 35
Иммунитет 104—106
Ингрэм В. 130-132, 277, 285
ПРЕДМЕТНО-ИМЕННОЙ УКАЗАТЕЛЬ 331
Индуктор 295—298
Индукция (синтеза ферментов) 294 —
308
Инсулин 124—129, 313
Интерферон 327
Информационная РНК 255—258
— — и синтез белков 263—268
и регуляция синтеза
ферментов 297—299, 306, 320
и специализация клеток 320
синтетическая (и расшифровка
генетического кода) 283
Ионная связь 40—44
Ионы 40—42
— перенос 72—73
Калий 39, 40, 72, 73, 109
Кальвин М. 56, 57
Карбоксипептидаза 150—151
Карбоновые кислоты 49
Кариотип 173, 185
Каротин 48
Касперсон Т. 253
Каталаза 109, 115
Катализатор 107—110
Кендрью Дж. 140—142
Кератин 96—97, 138
Кислород 29, 38, 42, 43, 45, 85, 86,
89, 102
—* строение атома 31
Кислоты 41—42, 49, 149
—■ каталитическое действие 108, 112,
113, 151
Клетки 10—13
— величина 20
— деление 26—27
— жизненные функции 21—26
— многообразие 18—20
— специализация 317—322
Клеточная теория 11—12, 17
Ко валентные связи 42—45
Код генетический 277—292 (см.
также Кодоны)
— — таблица 284
Кодоны 263, 277—278, 284
— «бессмысленные» 280, 281, 284
— таблица 284
— триплетная природа 281—284
Коллаген 98
Конъюгация (у бактерий) 241
Корана X. Г. 282, 285
Кофермент А 88
Кребс Г. 88
Кребса цикл (цикл лимонной
кислоты) 88-89
Крик Ф. 138, 212-218, 227, 259,
278-281, 283, 286
Кристаллы, структура 135—138
Кроссинговер (перекрест) 177—179,
241
Культура ткани 22—23, 95
Кэрнс Дж. 231—232, 234, 239
Лавуазье А. 29, 30
Лактоза 53, 294
«Лактозные» гены 294—297
Лаурэ М. 134
Левенгук А. 10, 19, 61, 62
Лизосомы 65, 79—80
Лизоцим 113, 143, 145, 148—149, 151
Линней К. 9, 10
Липиды 72, 75—78
Липман Ф. 88
Луриа С. 202
Львиный зев 157—159
Львов А. 296
Магний 38, 44, 72, 73
Медицинская генетика 184—186
Мейоз 167, 241
Мёллер Г. 179, 180
Мембраны см. Плазматическая
мембрана; Ядерная мембрана
Мендель Г. 159-164, 166, 170, 171
Метаболизм см. Обмен веществ
Микроскоп 9—10, 61—65
— электронный 61, 63—65
Миоглобин 103, 115
— структура 140—143
Миозин 102, 115
Миофибриллы (мышечные фибриллы)
98-102, 146
Митоз 167—170
Митохондрии 59, 66, 85—90, 93
Мозг 322—326
Молекула (определение) 30
Молекулярный вес (определение) 31
Моно Ж. 255, 294-298, 300, 303, 310
Морган Т. 171-177, 179, 182
Мур С. 128
Мутанты 278—280, 296 (см. также
Гены; Мутации; Рекомбинации)
Мутации 172
— в генах-регуляторах 295
— индукция акридином 278
— молекулярные механизмы 215—
218, 248, 278-281
— супрессия 279
— точечные 243—247
— у плодовой мушки 172, 180
— у фага 204, 242-247
Мышечное сокращение 98—102
Мышечные белки 98—102
Мышечные клетки 19, 24
Мышление 322—326
332 ПРЕДМЕТНО-ИМЕННОЙ УКАЗАТЕЛЬ
Мышцы 98—102
Мюллер-Хилл Б. 304—305
Наследственность 155—166 (см.
также Гены; Хромосомы)
— основные законы 164, 166
Наследственные болезни 184—188
«Насосы» мембранные 72—73, 109
Натрий 38-41, 72, 73, 109
— структура атома 39
Нейтроны 32, 34—36
Нервный импульс, передача 73, 326
Ниренберг М. 282—283, 285, 287
Нортроп Дж. 112
Нуклеиновые кислоты см. ДНК;
РНК
Обмен веществ 21—23
— — «врожденные ошибки
метаболизма» 186, 188
Окисление 45, 85—90
Оператор 298—300, 304, 305
Опухолеродные вирусы 275—276
Органеллы 27, 63, Х>5
Основания 41—42
— ДНК 194, 209-211, 215
«Отпечатки пальцев» 130—133
Пайнтер Т. 182
Пастер Л. 104
Пепсин НО, 112, 125
«Пептидные карты» 132, 133
— связи 115
Перекрест см. Кроссинговер
Перутц М. 140—142
Пиноцитоз 74—75
Плазматическая мембрана 69—79
— структура 77—78
Пластиды 85
Плесень хлебная 188—191, 241
Плодовая мушка, генетические
карты 181-182, 242
— — гигантские хромосомы 180,182
— — наследование, сцепленное с
полом 173—177
— — рекомбинация и кроссинговер
177—179, 241
Пневмококки 194—198
Полимеры 114, 209
Полипептиды 114
Полинг Л. 130, 132, 137—140
Проницаемость (мембран) 70—72
Протеолитические ферменты 125, 126,
130
Протоны 32, 34—35, 41—42
Протоплазма 11
Пташне М. 300—303
Радиоавтография 231—232
Радиоактивность 34—36
Разрыв и воссоединение ДНК 248—
251
Регуляторные механизмы клетки
293—314
Резерфорд Э. 32—33
Резус-фактор 105—106
Рекомбинация (генетическая) 241 —
242
— ДНК, механизм 248—251
— у плодовой мушки 177—179
— у фага Т4 242—246
Рентгеноструктурный анализ 135—
138
Репрессия (синтеза ферментов) 293,.
298-300
Репрессор 294—300
— взаимодействие с ДНК 304—305
— выделение 300—303
Ретиналь 48
Рецессивные признаки 161, 163—166-
Рибонуклеаза 128
Рибонуклеиновая кислота см. РНК
Рибосомы 65, 66, 81, 253
— роль в синтезе белка 262—268
РНК 196 (см. также Информационная
РНК, Транспортная РНК)
— вирусов 270—276
— последовательность оснований
287 292
— структура 254—255,287—288, 291
РНК-зависимая ДНК-полимераза
275-276
Рэй Дж. 9
Самнер Дж. 110—112
Сахара, окисление 85—90
— превращения 21, 23—24
— структура 50—53
Связи (химические), водородные
138-140, 144, 214-215, 254
— ионные 40—44
— ковалентные 42—45, 138
Сент-Дьёрдьи А. 102
Серповидноклеточная анемия 130 -
133
Смена матрицы 248—249
Соли 42, 72-73, 109
Специализация (клеток) 317—322
Спирты 47, 49
Сталь Ф. 222—224, 226, 227
Стейн У. 128
Стейтц Джоан 287
Стертевант А. 179, 183
Стрейзингер Дж. 247, 286
Стэнли У. 112
Субстрат, определение 115
ПРЕДМЕТНО-ИМЕННОЙ УКАЗАТЕЛЬ 333
Суперспираль (в белке) 139
Сэнгер Ф. 123, 127, 128, 256, 286, 287
Сэттон У. 170—171
Татум Э. 189—191
Тимин, структура 211, 215
Тома Р. 306, 307
Томсон Дж. 32
Транскрипция 258 (см. также
Информационная РНК)
Транс локация 182, 186
Трансляция 258 (см. также Белки,
синтез; Информационная РНК)
Транспортная РНК 258—266
Трансформация (бактерий) 194—
198, 251
Трансформирующий фактор 196—198
Триплеты см. Код генетический,
Кодоны
Трипсин НО, 111, 125, 130
Углеводороды 46—47, 76
Углеводы 53
Углерод 46—53
Уилкинс М. 211—213
Уотсон Дж. 212, 213, 227
Урацил 254
Уреаза 112, 115
Уэйгл Дж. 248, 250, 251
Фаги см. Бактериофаги
Фагоцитоз 73-75
Фенилкетонурия 49—50, 187, 188
Ферменты 107—113
— активный центр ИЗ, 118,148—151
— аллостерические 310—312
— каталитические функции 109,
112-113
— механизи катализа 148 —151
— регуляция активности 308—313
— химическая природа 110—112
Фотосинтез 53—59, 83—85
Френкель-Конрат X. 270, 271, 286
Фтор, структура атома 39
Хаксли А. 98
Хаксли X. 98
Херши А. 202—206, 241
Химические реакции 53 (см. также
Биохимические реакции)
— соединения 29
— элементы 29—45
Химотрипсин НО, 119, 125
Хлор, структура атома 39
Хлоропласты 83—85
Хлорофилл 54
Хоглэнд М. 282
Холли Р. 259, 260, 282
Хроматография 121—122, 130—133
Хромопласты 85
Хромосомы 166—186
— гигантские 180, 182, 316
— и клеточное деление 166—170
— плодовой мушки 171—177
— половые 173—176, 183—184
— функция 92—95
— человека 183—186
Центриоль 93
Центрифугирование в градиенте
плотности 223—226, 250, 251
Цикл лимонной кислоты (Кребса)
88-89
Цитозин, структура 210, 215 (см.
также ДНК)
Цитохром с 129
Чаргафф Э. 211, 214
Чейз Марта 205, 206
Шанжё Ж.-П. 310
Шванн Т. И, 21
Шлейден М. 11, 21
Эвглена (Euglena) 25, 64
Эвери О. 196—198
Эволюция 13—17, 129—130
Электронные оболочки 37, 39, 41,
43-44
Электроны 32, 34, 36—45
Элементы химические 29—45
Энглесберг Э. 307
Эндоплазматический ретикулум 65,
80—82
Энзимы см, Ферменты
Эритроциты 102, 130—133
Ядерная мембрана 66, 93
Ядро атома 32—36, 39, 41
— клеточное 66, 90—93, 316, 317
— — открытие 10, 11, 61
Ядрышко 69, 93
Яичный альбумин 97, 107
Яновски Ч. 286
Янсен 3. 9
ОГЛАВЛЕНИЕ
ПРЕДИСЛОВИЕ К РУССКОМУ ИЗДАНИЮ 5
ПРЕДИСЛОВИЕ 7
1. ОСНОВНЫЕ ЧЕРТЫ ЖИЗНИ »
Клетки — основа жизни 10
Эволюционное объяснение жизни 13
Многообразие клеток 18
Что делают клетки? 21
2. ВЕЩЕСТВА И ИХ ПРЕВРАЩЕНИЯ 28
Природа химических веществ: элементы и соединения .... 29
Атомная теория 29
Строение атома . 32
Электроны и химические свойства элементов 36
Органическая химия, или химия углерода 46
Как вещества синтезируются? 53
3. АНАТОМИЯ КЛЕТКИ 61
Общий план строения клетки 65
Плазматическая мембрана 69
Лизосомы — мешочки с пищеварительными соками 79
Эндо плазматический ретикулум — место химических синтезов 80
Аппарат Гольджи —«отдел упаковки» 82
Хлоропласты — внутриклеточные органы фотосинтеза ..... 83
Митохондрии — силовые станции клетки 85
Ядро — центр управления клеткой 90
Хромосомы — хранилище информации 93
Клетка и органеллы 95
ОГЛАВЛЕНИЕ 335
4. ЧТО ДЕЛАЮТ БЕЛКИ? 96
Многие хорошо знакомые вам вещества — белки 96
Скользящие белки мышц 98
Гемоглобин — белок, переносящий кислород 102
Антитела — белки, защищающие от болевней 104
Ферменты — биологические катализаторы 107
5. ЧТО ТАКОЕ; БЕЛКИ? 114
Белки — полимеры аминокислот 114
Белки имеют сложную форму 118
Аминокислотный состав белков 120
Последовательность аминокислот в белках 122
Трехмерная структура белков 134
Как синтезируются белки? ...... 152
6. ЧТО ДЕЛАЮТ ГЕНЫ? . 155
Наследственность и гены 155
Мендель и законы наследственности 1591
Хромосомы, гены и наследственность 166
Генетические аномалии и дефекты^ хромосом 180
Гены заведуют ферментами 186
Один ген — один белок 18&
7. ЧТО ПРЕДСТАВЛЯЮТ СОБОЙ ГЕНЫ? 193
Какое вещество может быть генетическим материалом? 193
Трансформация бактерий 194
Генетический материал бактериофагов 199
Что такое ДНК? 209
ДНК и генетика 215
8. РЕПЛИКАЦИЯ И РЕКОМБИНАЦИЯ ДНК 219
Как происходит репликация ДНК? 220
Репликация бактериальной ДНК 222
Раскручивание ДНК 228
Ферментативный синтез ДНК 229
Форма реплицирующейся ДНК 231
Молекулярные основы генетической рекомбинации 241
Построение карты отдельного гена . 242
Разрыв и перекрестное воссоединение молекул ДНК 248
9. СИНТЕЗ БЕЛКА 252
РНК — посредник в синтезе белка 253
Транспортная РНК — молекула-адаптор 258
Рибосомы — белоксинтезирующие машины 262
Как синтезируется белок 263
Взаимодействие вируса с клеткой-хозяином 268
10. ГЕНЕТИЧЕСКИЙ КОД . 277
Общие особенности генетического кода 277
Какие триплеты кодируют ту или иную аминокислоту? .... 281
336 ОГЛАВЛЕНИЕ
Подтверждение генетического кода 285
Код универсален 292
11. РЕГУЛЯТОРНЫЕ МЕХАНИЗМЫ КЛЕТКИ 293
Индукция и репрессия синтеза ферментов 294
Позитивная регуляция синтеза белка 306
Принцип отрицательной обратной связи в регуляции активности
ферментов 308
Регуляция и аллостерические белки 310
Регулирование путем химической модификации ферментов . . . 312
Многое остается неизвестным 314
12. МОЛЕКУЛЯРНАЯ БИОЛОГИЯ ЗАВТРАШНЕГО ДНЯ
Сложные клетки высших организмов 315
Как происходит специализация клеток? . 317
Как мы мыслим? 322
Зачем нужна молекулярная биология? . . 326
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА 328
ПРЕДМЕТНО-ИМЕННОЙ УКАЗАТЕЛЬ 329
ИБ—983
Э. Роллер
ОТКРЫТИЕ ОСНОВНЫХ ЗАКОНОВ ЖИЗНИ
Редактор Ю. Лашкевич
Художник Л. Муратова
Художественный редактор В. Бисенгалиев
Технический редактор И. Кренделева
Корректор Л. Панова
Сдано в набор 23.09.77. Подписано к печати 30.01.78.
Бумага тип. М 1 60x90i/ie = 10,50 бум. л. 21 печ. л. Уч.-изд. л 19,83
Ивд. J* 4/9217. Цена 1 р. 60 к. Зак. М 0414"
ИЗДАТЕЛЬСТВО «МИР» Москва, 1-й Рижский пер., 2
Ордена Трудового Красного Знамени Московская типография JST» 7 «Искра революции»
Союаполиграфпрома при Государственном комитете Совета Министров СССР
по делам издательств, полиграфии и книжной' торговли
Москва, К-1, Трехпрудный пер., 9
D[
firm, M. Perulz
странственная структура
i-;a
!Г
!ДОВАТЕЛЬНОСТЬ
ИНОКИСЛОТ
сов, J.
1ЯЦИЯ БИОСИНТЕЗА
iinii. 0. liltiimr
АЯ ТРАНСКРИПЦИЯ