Автор: Артюхов B.Г. Наквасина М.А.
Теги: материальные основы жизни биохимия молекулярная биология биофизика медицина биология микробиология биология клетки
ISBN: 5-7455-1162-1
Год: 2000
В. r. АРТЮХОВ, М. А. НАКВАСИНА
БиолоrИЧЕСКИЕ
МЕМБРАНЫ:
структурная орrанизация,
фун ции,моДификация
физико",химическими
аrентами
Допущено lvfинuсmерсmвом образования
Российской Федерации
в качестве учеБНО20 1Z0собtlЯ для студе1lтов
высиLИХ учебных заведеиuй, обучаlOщихся
по спецuалыюстu "БUОЛО2ия"
Издательство
Воронежскоrо rосударственноrо университета
2000
УДК 577.15:577.353
Артюхов B.r., Наквасииа М.А. БИОЛОI'ические мембраны:
структурная орrанизация, фУНКЦИИ, модификация Физико хими
ческими аrентами: Учеб. пособие. Воронеж: Издательство Bo
ронежскоI'О rосударственноrо университета, 2000. 296 с.
ISBN 5 7455 1162 1
в учебном пособии, IlOдrотовленном на базе спецкурсов "Биофизика мембран" и
"Молекулнрная фО1'обиолоrия", представлр.нJ>I cOBpeMeн:нъre воззреШ1Я о составе и c'rpyк.
турно.функциональной ОРr!lННзации биомембран, путях передачи информации в клетке,
роли :vrембрuнных КОМJlонеН1'ОВ в осущеС1'влении и реrулированни метаболических
Пlюцессов. Обсуждаются молекулярные механизмы фУНКЦИОНИРО,вания биомембран в
норме и в условиях воздействия модифицирующих ментов (Уф. и ионизирующих
излучений, химических соединений), а также вопросы разВИ1'ИЯ naтолоrических со-
c-rояниЙ ОрI'анизма, связанных с накоплением активных форм КИCJlорода.
Издание предназначено для ,студентов, мarистров и аспирантов БИОЛOJ'ичес.
ких фдкули'етов университетов, а также может быть использовано студентами
медицинских, фармацев'rических и сельскоховяйственных вузов.
Ил. 62. Табл. 21. I3иблиоrр., 29' IUU'fB.
Рецензенты:
кафедра биофизики биолоrическоrо факультета
OCKoBCKoro rосударственноrо университета
(зав. ЮlфедроЙ д p биол. наук, член кор. РАН, проф. А. Б. Рубин),
д p биол. наук, проф. В. Л 3uolпa
(Киевский rосударственный унивеРСИ'l'ет)
A:rtyukhov V.G., Nakvasina М.А. Вiological membranes:
structur'al orgallization, functions, modificatio!l Ьу physical and
chemical agellts. Voronezh: Voronezh University Press, 2000.
296 р.
This textbook focIlses оп tlle Пlоdеrn views concerning comp08ition, structuraJ I\nd
fIlnctional organizatioll of biological тетЬтnеа, the ways of infоrшаtiОIl transIllission
iIl t!le сеН, D,nd ro!e of шеIl1ЬrUllе components ill realization and regu!atioll о! tlle
шеtaЬо1isПl. Other aspects described illcl ude шо!есu!аr шесhanisП1S о! ЫОll1ешЬrаllеs
fIlnctioning in the nornla! state and under the infllJence of u nUll1ber о! Illodifyl!lg
agents (UV. and ionlzing radiation, сllешiсal substances). Particu!ar attentio!l is given
to t!le ro]e of actlve fоrшs о! oxygen in deve!oping о! sоше human pat!lo!ogies.
Fig. 62. ТаЫ.21. BibI.: 89.
ISBN 5 7455 1162 1
@ АртIOХОВ B.r., Наквасила М.А., 20UlJ
@ Издательство Воронежсн:оrо
roсударственлоrо университета, 2000
оrЛАВЛЕНИЕ
Предисловие............' .......... ................. ......, ......... ................7
rлапа 1. Состав и СТРУК'l'урв:о Фуш\:циопальпая орrапи"
зация молекуляриых КОМlIонев:тов био:мембраи ........... 11
1.1. Липиды биомембран: классификация, состав, структура,
физико-химические и динамические свойства, функции'......'..... 11
1.1.1. Классифюсация, состав и структура ЛШIидов мембран ...........11
1.1.2. Физико-химические и динамические свойства
и функции ЛИПИДDВ мембран.......... ............... ........................... 19
1,2. Мембранные белки ................... ....................... ....................... 26
1.2.1. Классификация, CTPYI<Typa и функции мембранных
белков.. .......... .............. ....... ." .... ..... . .. .. .............. .... .. ..,.... .. .. 26
1.2.2. Цитоскелет (мембранный каркас) .................................... 31
1.2.3. Интеrральные белки биомембран..................................... 34
1.2.4. Структура, Фу:н:кциональные и неКО'l'Орые физико-
химические свойства Na+, К+ -АТФазы ......... ....... ................'35
1.2.5. Структура, функциональные и некоторые физико-
химические свойства ацетилхоли:нэстеразы .......................... 5 О
1.3. 'Уrлеводы мембран .......... ......... .................... .......... ................ &6
1.4. 'rипы взаимодействий мембранных компонентов
и их роль в функционировании биомембран .............................. 58
Контрольные вопросы ................................................................... 62
rлапа 2. Участие I\:омпонептов био:ме:мбрав: в осуществлс"
иии и реryлировапии метаБОЛП1Jеских процессоп ......... 64
2.1. Общая характеристика процессов передачи информации
в клетке.................................................................................. 64
2.1.1. Особенности структуры и функций мембранных
рецеп'l'ОрОВ ....,.................................,.................................. 65
2.1.2. Аденила'fЦиклазный путь передачи сиrнала ..................... 71
2.1.3. Фосфоинозитидный путь переда IИ информации ............... 72
2.2. Роль ионов в осуществлении метаболических процессоВ
с участием мембран " .................. ....... ... .........., ........................ 74
2.3. Молекулярные механизмы интеrрации l<леточноrо
метаболизма.... .... .. .... ........,... ........ ...... .................. .. ....... .. ....... 18
2.3.1. Механизмы реrулирования функциональной аК'J.'ИВНОСТИ
ферментов и ферментных сис'!'ем в кле'rке ........................... 78
2.3.2. Адсорбционный механизм реryляции метаболи.зма:
понятие ометаболоне, ero струк'!'ура, физио.лоrическое
значение образования.......................................................... 82
2.3.3. Пути реrулирования активно ти
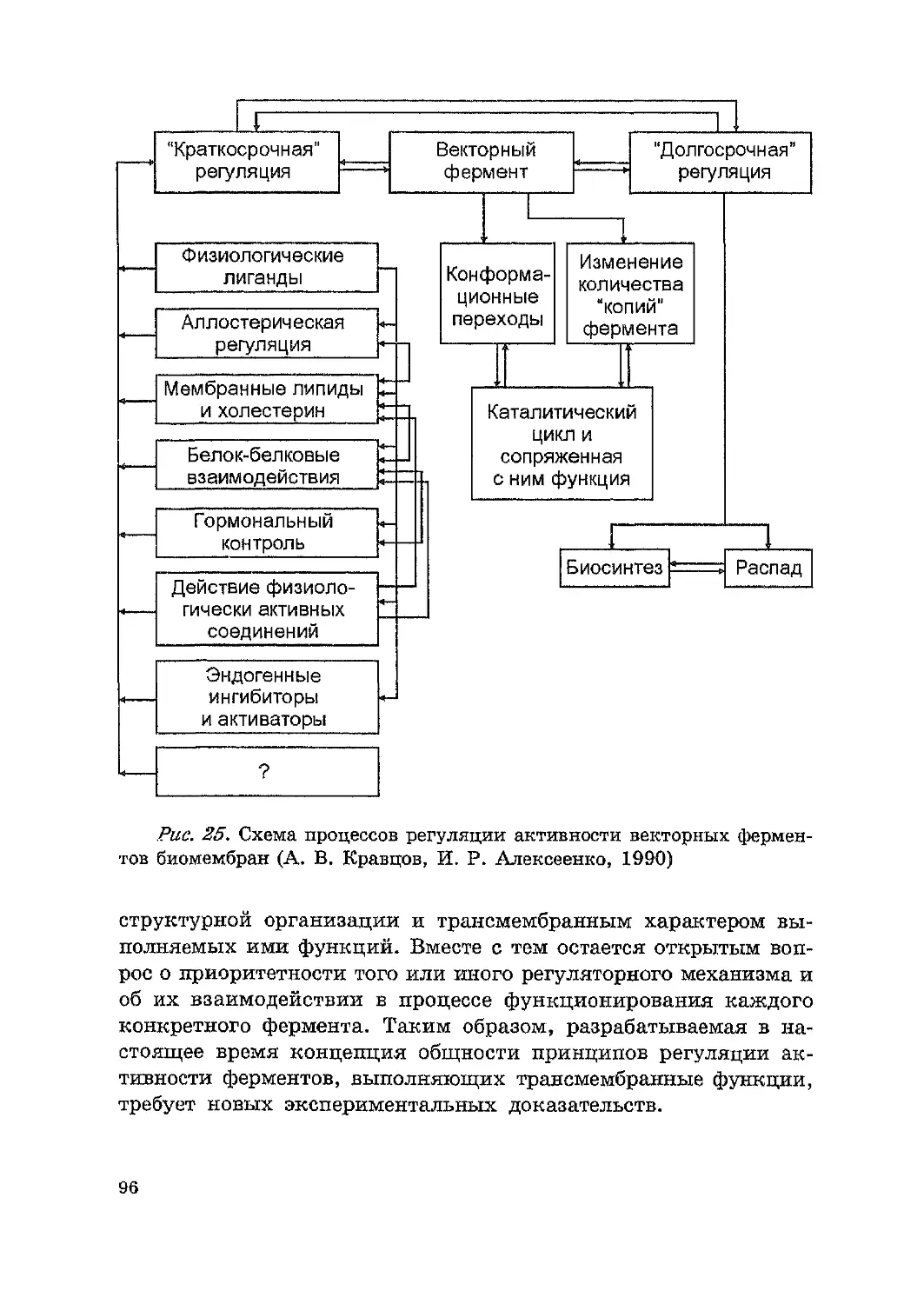
векторных фЕ'рмен'fОВ биомембран .............,......................... 91
2.3.4. Молекуллрные механизмы нейроrуморальной реrу.JIЯЦИ:И
функций кле.rок............................................;..................... 97
3
Контрольные вопросы.....................'.. ................................ ......... 100
rлава 3. Механизмы модификации JlЮМlIонентов
биомембран при патолоrических состояниях:
роль кислородных метаболитов .....................................102
3.1. Пероксидное окисление липидов I aK один из ключевых
механизмов модификации структурно функциональноrо
состояния биомембран ....................................... .................... 102
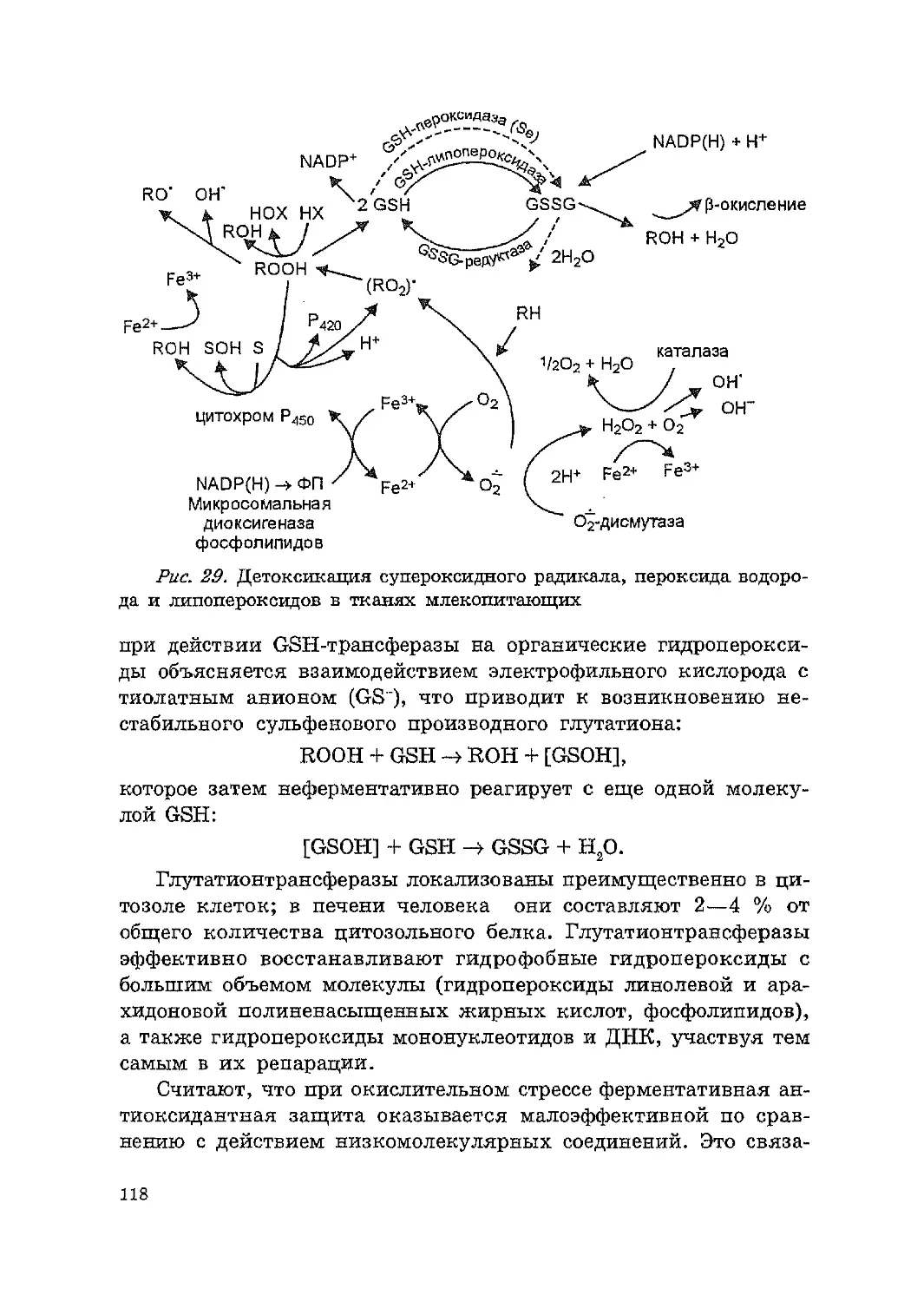
3.2. Роль активных форм кислорода в р ryлировании метаболи
ческих процессов в биосистемах .............................................107
3.3. Пути реrулирования уровня свободнорадикальных продук-
тов и активных кислородных метаболитов ..............................114
Контрольные вопросы... ................................ .............. ................ 124
rлава 4. Структурно-фувкциональ:иы:е модификации
молекулярных КОМIIоне:итов биомембран под
воздействием физико-химических areHTOB ...................126
4.1. Фотохимические и радиационно х:имические превращения
компонентов биомембран в условиях различноrо
микроокружения .... ....... ............... ............ .............. ............... 126
4.1.1. Структурно-функциональные модификации молекуляр
ных компонентов биомембран под действием УФ-излучения. 126
4.1.2. Радиационно химические превращения
CTPYK'I'YPHblX компонентов биомембран ...............................142
4.2. УФ-индуцированные изменения CTPYKTYPHO-ФУНIЩИОНальноro
состояния мембраносвязанных ацетилхолинэстеразы и Na+, K+
АТФазы в присутствии некоторых химических МОДИфИКаторов ... 149
4.2.1. Функциональная активность мембраносвязанной
аце'rилхолинэстеразы после УФ облучения в присутствии
бензиловоrо спирта и конканавалина А.............................. 149
4.2.2. Фоточувствительность ацетилхолинэстеразы эри'rроци
тарных мембран в присутствии фосфолипа:3Ы D и аскорби-
новой кислоты....................................... .............. ............. 157
4.2.3. УФ. индуцированные изменения функционалЬНЫХ
свойств мембраносвязанной Na+, К+.АТФазы в присутствии
фосфолипRзы D......................... ................................ ........ 169
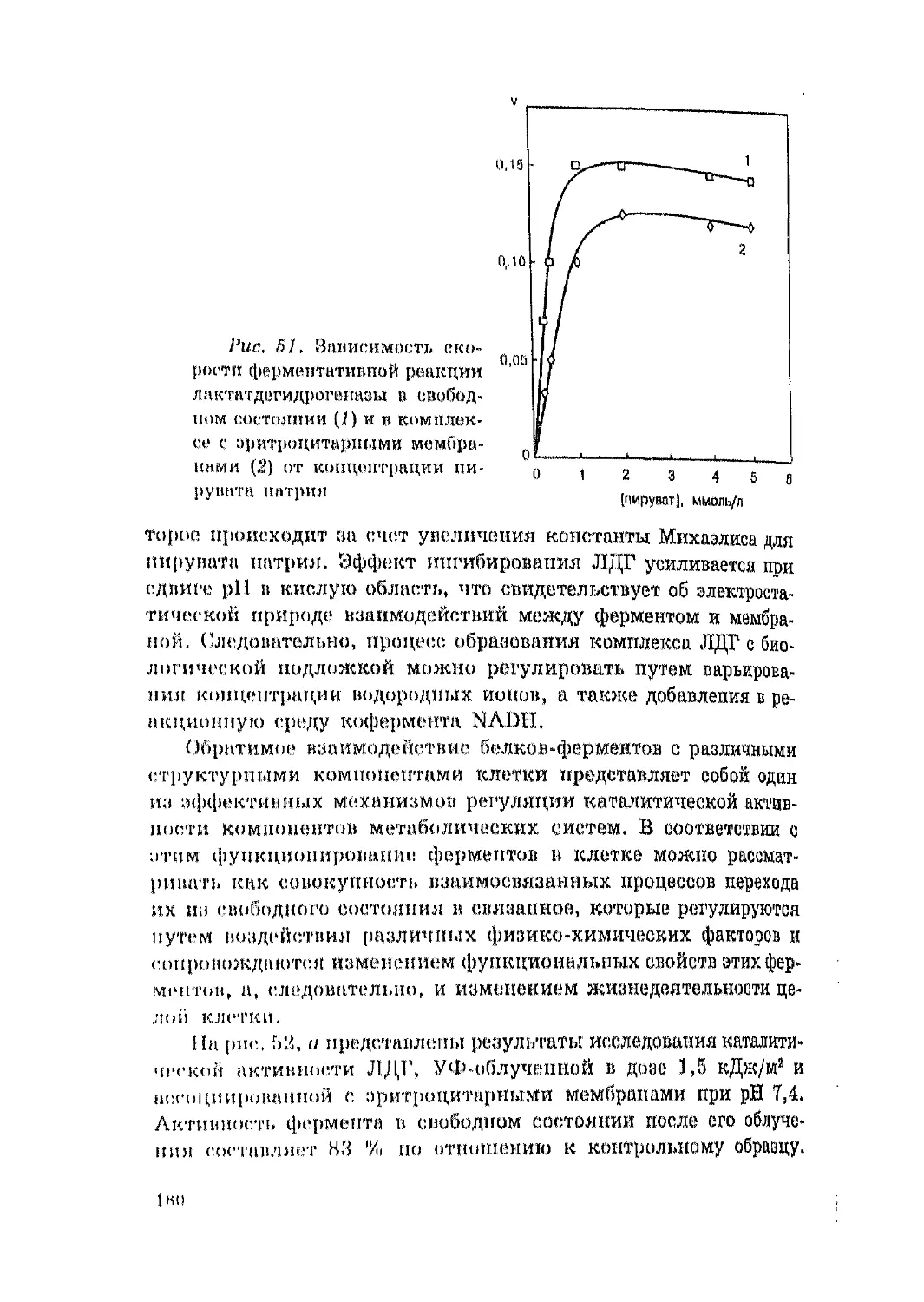
4.3. Функциональные свойства лактатдеrидроreназы в комплек,
се с эритроцитарными мембранами и их компонентами
в интактном состоянии и после УФ облучения ........................172
4.4. Исследование роли активных форм кислорода в процессах
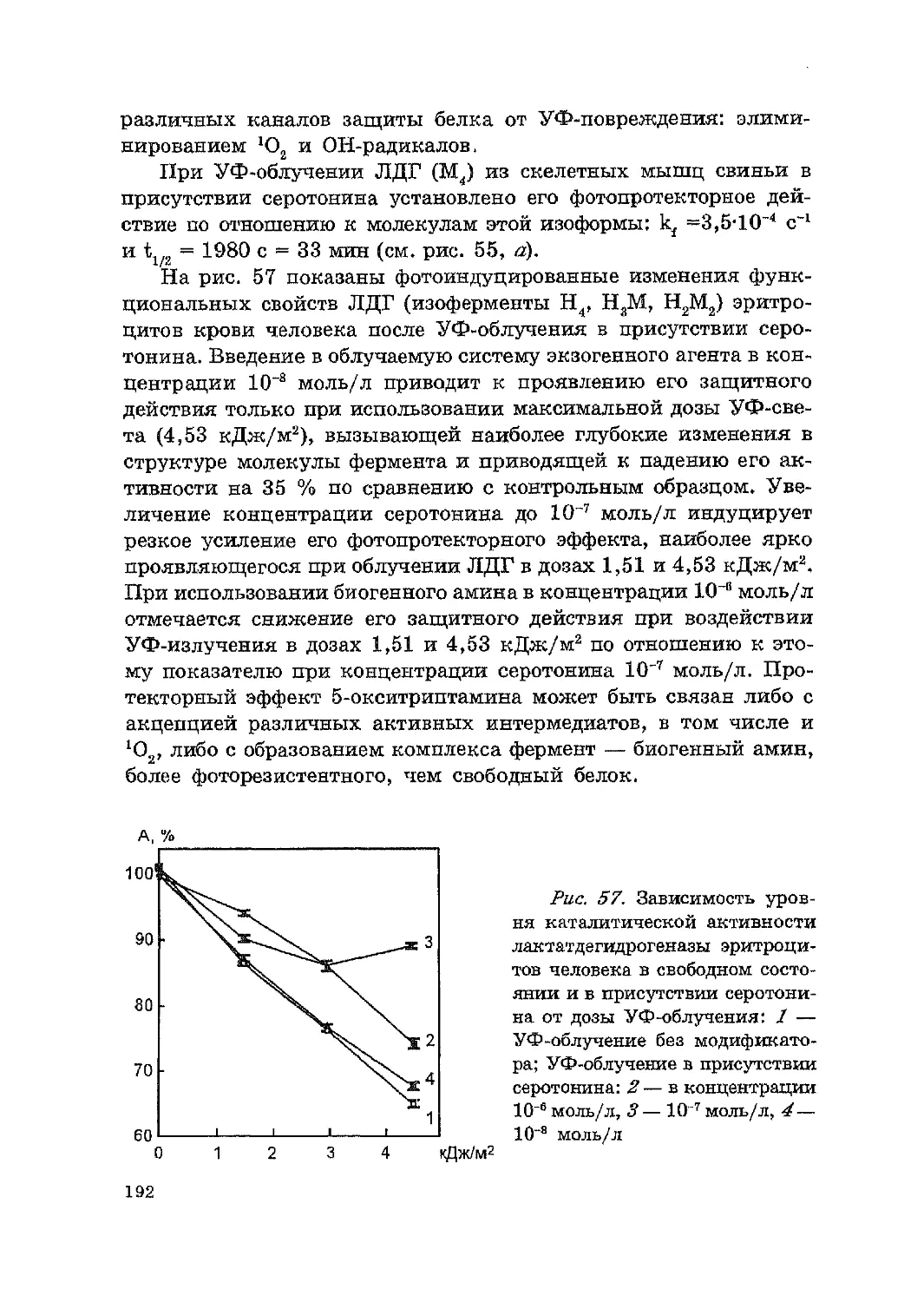
УФ модификации лактатдеrидроrеназы .................................. 184
Контрольные вопросы...............................'..........' ................... ... 200
rлапа 5. Характеристика некоторых методов изуч:еlШЯ
биолоrкческ:в:х мембран ..................................................202
5.1. Краткий обзор rpупп методов исследования биомембран ........ 202
5.2. Выделение и разделение мембран ......................................... 217
4
5.3. Оценка чистоты мембранных фракций .................................. 222
5.4. Выделение и очистка мембранных белков .............................223
5.5. Выделение и фрющионирование ЛИl1ИДОВ мембран ................. 227
Контрольные вопросы..... ..... ......................... .............................. 228
rлава 6. ИсслеДОВQllие cTpyKTypIlo-фyImц:иоIIQлыlrоo
СОСТОIOIИЯ отдельв:ых I\:о:мп:оиеитов биомембраи в
в:орме и при ВОЗДействии раз.пи.ш:ых физико-хими-
ческих факторов .... ........ ..... ........... ........... ...... ................. 230
6.1. Выделение эритроцитарных мембран ....................................230
Лабораторная работа М2 1. Выделение эритроцитарных
мембран из крови доноров ................................................. 231
Лабораторная работа М2 2. Определение концентрации белка
плазматических мембран по методу Лоури ......................... 232
Лабораторная работа М2 3. Количественное опреДелеНие белка
по биуретовой реаЕ.ЦИИ ...................................................... 235
6.2. Исследование функциональной активности мембраносвязан
ных ферментов в норме и при Боздействии ФИЗИRо-химических
факторов............................................................................... 236
Лабораторная работа N2 4. Определение функциональной а1"ТИВ
ости ацетилхолинэстеразы эритроцитарных мембран ............. 237
Лабораторная работа NQ 5. Исследование 'УФ индуцированных
изменений функциональной активности ацетилхолинэсте-
разы эритроцитарных мембран ..........................................238
Лабораторная работа N2 6. Исследование ферментативной
активности свободной и мембраносвязанной ацетилхолин-
эстеразы в интактном состоянии и после УФ-облучения ..... 240
Лабораторная работа N'2 7. Определение функциональной
активности ацетилхолинэстеразы эритроцитарных мембран
после индукции пероr"сидноrо окисления: липидов .............. 240
Лабораторная работа N2 8. Исследование функциональной
активности мембраносвя:занной Na+, К+.АТФазы ................. 241
Лабораторная работа N'2 9. Изучение 'Уф индуцированных
изменений функциональных свойств Na+, Е+.АТФазы
эритроцитарных мембран ................. .................. ............... 243
Лабораторная работа N2 10. Определение ферментативной
активности Na+, К+.АТФазы эритроцитарных мембраfI
после индукции пероксидноrо окисления: липидов .............. 245
6.3. Исследование интенсивности протекания: процесса цероксид
Horo окисления: липидов мембран ........................................... 245
Лабораторная работа М! 11. Определение уровня продуктов
пероксидноro окисления: липидов мембран с использова-
нием тиобарбитуровой кислоты ......................................... 246
6.4. Изучение изменений CTPYKTYPHoro состояния биолоrических
мембран методом флуоресцентных зондов ................ .............. 248
5
Лабораторная работа N2 12. Исследование фотоиндуцированныx
изменений CTPYETypHoro состояния ЭрИ'I'роцитарных мембран
методом флуоресцентных зОндОв....................................... 250
6.5. Исследование устойчивости эритроцитарных мембран
Е действию различных химическИХ areHToB при помощи
метода реrистрации осмотичеСI<.ИХ и ЕИСЛОТНЫХ эритроrрамм... 252
Лабораторная работа N2 13. АвтоматичеСIЩЙ метод реrистра.
ции осмотичеСЕИХ и кислотных эритроrpамм .....................253
6.6. Количественное определение липидноrо состава эритроцитов ...256
Лабораторная работа N2 14. Определение фосфолипидов эрИТрО
ци:тарных мембран методом ТОНЕОСЛОЙНОЙ хроматоrрафии.... 257
6.7. Определение функциональной аЕТИВНОСТИ некоторых
антиоксидантных ферментов крови......................................... 260
Лабораторная работа N2 15. Исследование н.аталитичеСI<ОЙ
активности супероксиддисмутазы в эритроцитах крови
доноров ..... ................. ......... ....... ......................... ............. 260
Лабораторная работа М 16. Определение активности каталазы
в эритроцитах крови человека спектрофотометрическим
методом ................................................,...... ........ ............. 262
Лабораторная работа N2 17. Исследование функциональной
ан,тивноети rлутатионредуктазы эритроцитов .....................264
6.8. Изучение участия аЕТИВНЫХ форм кислорода в процессах
'Уф модификации беЛI<,ОВЫХ молеЕУЛ ......................................265
Лабораторная работа N2 18. Исследование каталитической
активности лактатдеrидроrеназы спеЕтрофотометрическим
методом.. ........................................................ .................. 267
Лабораторная работа N2 19. Выделение лактатдеrидроrеназы
из сердца свиньи.... ...... ...... '" ............. ............. .................. 269
Лабораторная работа М 20. Исследование изоферментноro
спектра лактатдеrидроrеназы методом электрофореза
в полиакриламидном rеле.................................. ...... ......... 271
Лабораторная работа N2 21. Исследование 'УФ ЧУВСТВИ'I'ель.
ности лактатдеrидроrеназы в присутствии некоторых
модифицирующих areHTOB................................................. 273
I онтрольные вопросы......... ....................,................... ...........,.... 274
Спи СОЕ основной литературы .. .................................................... 276
СПИСОЕ дополнительной литературы................. ........,...... ............ 277
Проrрамма спецкурса «Биофизика мембран» ...............................282
ПРИЛОЖЕНИЯ.................................................. ... ......... ........... 285
Rачественный и количественный соетав липидов различных
орrанизмов ............................ ........................................... 285
Приrотовление буферных растворов......... ............................... 288
Предметный УI<азатель. ........................ ....................... ........... 290
ПРЕДИСЛОВИЕ
Мембранолоrия современная, стремительно развивающа
яся междисциплинарная область ещ'ественных наук, находяща
яся на стыке биофизики, биохимии, молекулярной биоло1'ИИ,
иммунолоrии, физиолоrии, rенетики, физической и Н:ОЛЛОИДJ:IOЙ
химии и др. Она изучает состав, структуру, свойства, функции,
локализацию I'.:омпонентов БИОЛО1'ических мембран, их молеку
лярную и динамическую орrанизацию, особенности межмоле
кулярных взаимодействий и фазовые переходы липидов и бел
ков в мембране, транспорт веществ через мембраны, участие био
мембран в осуществлении и ре1'улировании метаболических про
цессов в клет:ке, механизмы действия различных физико хими
ческих факторов на мембранные системы и ДРУ1'ие вопросы, свя
занные с исследованием состояния :компонентов биомембран и
от дельных :клеток.
Одним из центральных разделов мембранолоrии является
биофизика мембран, котора,я: рассматривает, прежде Bcero, фи
зико-химические механизмы их функционирования в норме и
в условиях воздействия разнообразных модифицирующих a:reH
тов, а та:кже при развитии nаТОЛО1'ичес:ких состояний отдель-
ных систем ОР1'анизма человека. Спецкурс "Биофизика мемб
ран" в объеме 24 ч читается студентам 4-1'0 и 5-1'0 курсов I'.:a-
федры биофизИI'.:И и биотехнолоrии дневно1'О и вечерне1'О OTдe
лений биолоrо почвенно1'О факультета Воронежскоrо rосудар-
CTBeHH01'O университета. Одна:ко невозможно освоить npo1'paM-
му этоrо курса без 1'лубоко1'О изучения друrих разделов мемб-
ранолоrии. Оrраниченный объем учебных часов не позволяет
подробно рассмотреть МНО1'ие аспекты мембранолоrии как меж-
дисциплинарной области знаний. МНО1'ие вопросы проrраммы
курса мембранолоrии отражены в ряде МОНО1'рафий, учебни-
ков, научных обзоров ведущих отечественных и зарубежных
специалистов (В. r. Ивков, r. н. Берестовекий, 1981; 1982;
В. Ф. Антонов, 1982; Я. KaraBa, 1985; В. А. Твердислов и со-
авт., 1986; С. В. I\:OHeB, 1987; А. А. Болдырев, 1985, 1998;
В. П. Скулачев, 1989; 3. И. Rрутецкая, А. В. Лонский, 1994;
Р. rеннис, 1997, и др.), которые заложили фундаМI?НТ препо-
давания в вузах этой важнейшей научной дисциплины. BMec
те с тем ряд учебников и учебных пособий по биофизи:ке и
мембранолоrии не содержит разделов, посвященных пробле-
7
мам, l{асающимся выявления ключевой роли БИОЛО1'ических
мембран в осуществлении и ре1'улировании различных MeTa
болических процессов в норме и в условиях воздействия раз
личных физико химических факторов, в развитии патолоrи
ческих состояний орrанизма человека, а также проявлении Te
рапевтическо1'О действия эффективных методов лечения
аутотрансфузии "УФ облученной крови (АУФОК) и эндоваску
л.ярноrо лазерноrо облучения крови (ЭЛОК), широко использу
емых в современной медицинской практике. Следует отметить,
что библиотеки мноrих, в том числе и известных в стране BЫC
тих учебных заведений (университетов), не MorYT обеспечить
возрастающие научные потребности аспирантов, маrистров,
студентов биофизиков и биохимиков, обучающихс.я на ДHeB
ном, вечернем и заочном отделениях и выполняющих KYpco
вые и дипломные работы, направленные на выявление молеку
лярных механизмов функционирования биополимеров и их
надмолекулярных комплексов. Кроме Toro, проведение "Боль
moro практикума" в рамках учебноrо плана ПОДI'отовки био
ЛО1'а биофизика предусматривает выполнение ряда лаборатор
ных работ, связанных с изучением мембранных структур, что
требует не только знания принципов современных физико хи
мических методов анализа биосистем, но и теоретических oc
нов той или иной научной проблемы мембранолоrии.
Настоящее учебное пособие является дальнейшим разви
тием и существенным дополнением к разделу "Мембраноло
rия" учебника по биофизике, наnисанноrо коллективом aBTO
ров кафедры биофизики и биотехноло1'ИИ Воронежскоrо rocy
дарствен:в:оrо университета (В. r. Артюхов, Т. А. :Ковалева,
В. П. Шмелев, 1994). В нем более детально изложены вопро
сы, касающиеся структурно функциональной орrанизации MO
лекулярных компонентов биомембран, в том числе и с точки
зрения участия последних в осуществлении процессов клеточ
Horo метаболизма (rлава 1), Большое внимание уделено pac
смотрению проблем передачи информации в клетке и роли
биомембран в реrулировании активности важнейших фермен
тов и ферментных систем (на примере адсорбционно1'О Mexa
низма реrуляции 1'ликолитическо1'О комплекса). Представле
ны современные воззрения о взаимосвязи механизмов интеrра
ции метаболических процессов, нейроrуморальной реrуляции
функций клеток, путях реrулирования векторных ферментов
8
биомембран (rлава 2). rлава 3 посвящена проблеме выяснения
молекулярных механизмов модификации компонентов биомем
бран при патолоrических состо,яниях ОР1'анизма: рассмотрена
ведуща,я роль пероксидно1'О окисления мембранных липидов;
подробно охарактеризованы активные формы кислорода, их
свойства, БИОЛО1'ическос действие, процессы образования и пути
их утилизации, значение в реализации ВНУТРИltлеточноrо Me
ханизма редокс ре1'УЛЯЦИИ метаболизма; описаны классифика
ци,я, свойства и механизмы функционирования антиоксидант
ных систем ОР1'анизма как реrуляторов уровня свободноради
кальных продуктов и активных кислородных метаболитов. В
rлаве 4 ИЗложены вопросы, касающиес,я исследования законо
мерностей функционирования биомембран и их компонентов
в условиях воздействия различных физико химических фак.
торов (Уф и ионизирующей радиации, химических areHTOB).
Пособие содержит и материалы собственных исследований авто.
ров, посвященных изучению фотоиндуцированных изменений
структурно.функциональноrо состояния компонентов биомемб
ран (ацетилхолинэстеразы, Na+, к'+.АТФазЬ1 эритроцитарных MeM
бран, лактатдеrИДРОI'еназы в комплексе с эритроцитарными
мембранами и их компонентами) в норме и после воздействи,я:
УФ излучения в условиях различно1'О микроокружения. rла
ва 5 включает обзор методов изучения биомембран, а в rлаве 6
представлено описание 21 лабораторной работы, которые про
вод,ятс,я: в рамках "Большоrо практикума" и предусматривают
не только решение задач учебноrо плана (т.е. освоение CTyдeH
тами методов и методик), но и обсуждение ряда научно.иссле
довательских проблем, связанных с ин'rерпретацией получен
ных результатов, установлением причинно.следственных .свя
зей, выдвижением рабочих rипотез.
В конце каждой rлавы приведены контрольные вопросы, а в
конце учебно1'О пособия список основной и дополнительной
литературы, учебная проrрамма спецкурса "Биофизика мембран".
В приложении даны таблицы, материал которых дополняет све.
дения rлавы 1. о качественном и количественном' составах липи-
дов биомембран различных орrанизмов.
Авторы надеются, что настоящее учебное ПО.собие расширит
объем обязательноrо учебно1'О материала, предназначенноrо дл,я
изучения студентами в рамках спецкурсов "Биофизика мемб.
ран" и "Фотобиолоrия", "Больmо1'О практикума" и общеrо кур-
9
са биофизики, поможет студентам, маrистрам и аспирантам био
лоrических, химических, медицинских специальностей l'лубже
освоить теоретические основы мембранолоrии, получить преk
ставление о' современном уровне исследований в данной облас
ти. ознакомиться с ее фундаментальными проблемами, MeToдa
ми их разработ:ки, источниками современной учебно научной
литературы, а та:кже приобрести навыки работы с мембранны
ми препаратами.
Авторы выражают rлубо:кую бла1'одарнос ь зав. кафедрой био-
физи:ки биолоrическоrо факультета MOCKOBCKOl'O I'осударствен
Ho1'o университета, члену-корреспонденту РАН, профессору
А. Б. Рубину и профессору кафедры биофизи:ки Rиевскоl'О rocy-
дарственноrо университета В. Л. Зиме за труд по рецензирова
нию учебноI'О пособия и ценные замечания, а также сотруднику
:кафедры биофизИ:RИ и биотехнолоrии Воронежскоrо rосударствен
Horo уни:верситета К. П. Пенс:кому за большую помощь в ПОД1'о-
товке рукописи к изданию.
rJIaBa 1
СОСТАВ И СТРУКТУРНО ФУНКЦИОНАЛЬНАЯ
оРrАНИ3АЦИЯ МОЛЕКУЛЯРНЫХ
КОМПОНЕНТОВ БИОМЕМБРАН
1.1. ЛИП ИДЫ БИОМЕМБРАН: IСЛАССИФИКАЦИЯ,
СОСТАВ, СТРУКТУР А, ФИ3ИКО ХИМИЧЕСКИЕ
И ДИНАМИЧЕСКИЕ СВОЙСТВА, ФУНКЦИИ
1.1.1. lCлассuфuкацu.я, состав u структура лuпui308 мембран
Липиды обширный класс химических соединений, содержа-
щих алифатические или ароматические yrлеводородные 1'руппы,
плохо растворимых в воде в мономерной форме. Липиды ПОдРазде-
ляют на 3 класса: нейтральные, амфифильные или дифильные,
жирорастворимые витамины. R нейтральным относятся жиры (ди-
и триацИЛ1'лицериды), воска (смесь длинноцепочечныХ парафи
нов, спиртов и эфиров спиртов и жирных кислот), каротиноиды и
стероиды. Они хорошо растворимы в неполярных растворителях,
таких, как н алканы и бензол; в обычных условиях не способны к
образованию в Боде ламеллярных структур. Амфифильные (дифиль-
ные) липиды малорастворимы и в неполярных растворителях (н ал-
канах, бензоле, четыреххлористом yrлероде). При небольших I\:OH-
центрациях они формируют мицеллы и бислойные структуры. R
ним относят фосфолипиды и rликолиnиды, жирные кислоты и их
соли, моноаЦИЛ1'лицерИДЫ, длинноцепочечные амиды.
В состав клеточных мембран прокариотических и эукарио
тических орrанизмов в основном входят амфифильные фосфо и
I'ликолипиды, В плазматичеСI\:ИХ мембранах эукариот содержат
ся в значительных количествах стероиды. Большинство нейт
ральных липидов присутствует в мембранах в качестве продук
тов метаболизма и, по-видимому, слабо влияет на структур НО-
функциональную Ор1'анизацию клеточных мембран. Жирораство
римые витамины А, Д, Е и R блaroдаря небольшой полярной 1'руппе
и протяженной У1'леводородной части хорошо встраиваются в
мембрану, однако их роль в функционировании мембранных
структур изучена далеко не полностью. Известно, что витамины
rруппы Е (токоферолы) представляют собой антиоксиданты (rла
ва 3) и тем самым стабили:шруют липидный бислой. Фосфоли-
пиды, r ликолипиды и стероиды, составляющие основную часть
липидноrо компонента мембран различных ОР1'анизмов, Ha3ыв
ют структурообразующими (рис. 1).
11
a'9H2 a
.../C{i I
U CH2...()... --O'""'\.... :::::
О О ......
о ФОСфОЛИПИД
. 'сН 2
О I O
/C{i I
НО CH 2 ...()...P--о....... N + .....
11
О ......
о ЛИ30фОСфОЛИПИД
. 'СН 2
О I O
I
C! CH 2 ..-Оi'=О
О О
I
СН 2
I
СНА Н
O'CH 6Н 2
О I 2 1
.../C{i 9
U CH2 O F=a
о a
Кардиолипин
O
'СН 2
I a
СН I
vvvvvvv,./:f" 'cH2..-О N:::::
о .....
ПЛ6змалоrен
pH
СН
I O
/C{i I
vvvvvvvy NH CH2..-О f N:::::
о О .....
Сфинrомиелин
?" T"' H
Ну уН ?Н2
ен NH ОН
11 I
"! r Ц'р'бро,,,,
pH
СН
I
qi
/V'V"v'\./VVN'H CH2--о---Glс Gаl---GlсN Ac--Gal
11 I I
О NeuNAc NeuNAc
rанrлиозид
Холестерин
Ситостерин
Стиrмастерин
Рие. I. Структурные формулы соединений некоторых классов мем.
браниых липидов
ОбоЗНllчениSl: Gal rалактоза; Glc rтокоза; NeuNAc N ацетил
нейраминовая кислота (сиалОВ8S1 кислОО'а); GlcNAc . N 'ацетилI'ЛЮКоза:мин
12
O
I +
""O P O CH2....cH 2 N н з
11
О
Фосфатидилэтаноламин
O
1
O P O CH COO
11 1
О +NН з
Фосфатидилсерин
о сн з
I 1+
""O .P""O C н 2....с н 2 N....c н з
11 I
о сн з
Фосфатидилхолин
O
I
O P""() C н 2 CH....cH20 Н
11 I
О он
Фосфатидилrлицерин
он он
[1
О CH CH
I / "
""O P""O CH сн....он
11 " /
о сн....сн
I I
ОН ОН
Фосфатидилинозитол
Рис. 2, C'rpYKTypa полярных rОЛОВО:Е\ наиболее распространенных
rлицерофосфолипидов
ФОСфО.1luпuаы подразделяют на 1'J1ицерофосфолипиды и сфин
1'ОфОСфОJ1ИПИДЫ (рис. 1, 2). В rлицерофосфолипидах две первич
ные I'идроксильные rруппы I'J1ицерина этерифицированы жир
ными кислотами, а третья ОН I'руппа образует сложную эфир
ную связь С фосфорной кислотой:
о
1 11
О CH2...()
11 21
c""()--CH O
31 I
с H2...() P"'() X
11
О
в положении 2 остатка rлицерина находитс-я ненасыщенная
жирная кислота. Х спиртовая 1'ру,ппа азотистое (холин, эта
ноламин) или безазотистое (инозит, 1'лицерин) основание, этери
фицированное фосфорной кисло'rой. Номенклатура 1'лицерофос-
фоли:пидов основана на системе стереоспецифической нумерации
(sп-система) и связана с наличием асимметрическоI'О атома уrле
13
рода (хиральноrо центра) в 1'лицериновом остатке, что приводит
к появлению L и D стереоизомеров:
1
CH2 OH
21
НО....С.....Н
31
СН2 О РОзН2
sп rлицерил 3 фосфаТ
(L r лиц ерил 3 фосфат,
D-rлицерил 1-фосфат)
yHt-ОРОзН r УН2 РОЗН2 J
Н.....С.....ОН НО....с.....Н
I I
cH2 OH СН 2 ОН
sп rлицерил 1 фосфат
"У1'леродный атом на вершине проекции Фишера обознача
ется C l, если уrлеводородная цепь или ОН-rруппа, присоеди
ненная к С-2, направлены влево. У большинства 1'лицерофосфо-
липидов фосфатная rруппа находится в sп 3-положении rлице
рина. Производные 1'лицерофосфолиuидов, утратившие в резуль
тате rидролиза одну из двух ацильных 1'рупп, получили назва
ние ЛИЗ0фОрМ или лизофосфолипидов. rлицерофосфолипиды
широко представлены в мембранах зу- и прокариотических кле
ток, за исключением архебактерий. Фосфатидилхолин OCHOB
ной компонент мембран животных клеток, фосфатидилэтанола
мин часто входит в состав бактериальных мембран. К rлицеро
фосфолипидам относятся также кардиолипины димерные
формы фосфолипидов. В большом количестве они содержатся
во внутренней мембране митохондрий, в мембране хлоропластов
и некоторых бактериальных мембранах. rлицерофосфолипиды,
у которых одна из У1'леводородных цепей представляет собой
виниловый эфир, называются плазмалоrенами. Этаноламиновые
плазмаЛО1'ены содержатся в м:и:елине и саркоплазматическом
ретикулуме сердца,
СфИН1'офосфолипиды построены на основе ДЛИННОЦепочечно
1'0 ненасыщенно1'О аминоспирта сфинrозина. Наиболее распрост-
раненный сфинrофосфолипид плазматических мембран живот-
ных клеток (особенно клеток МОЗ1'а) СфИН1'омиелин. В мемб
ранах растительных и бактериальных клеток СфИН1'офосфоли-
пиды встречаются редко.
Fлщсолuпui3ы содержат MOHO или ОЛИ1'осахаридный остаток,
соединенный с липидной частью rликозидной связью без учас
ти;я фосфата. Они локализованы, как правило, на наружной по
верхности плазматической мембраны и определяют ее антиrен
ные, рецепторные и, возможно, механические свойства. rлико
14
липиды делятся на цереброзиды и 1'анrлиозиды. rоловку моле-
кулы цереброзидов образует полярная rидрофильная yrлеводная
rруппа, чаще Bce1'o 1'алактоза, а неполярная часть представлена
остатками СфИНl'озина и э'rерифицированной жирной кИСлотой.
Это нейтральные липиды, в значительных количествах содержа
щиеся в миелиновых оболочках нервных стволов, Сульфоэфиры
цереброзидов, образованные при участии ОН-1'руппы уrлеводно-
ro компонента, называют сульфоцереброзидами или сульфатида-
ми. rан1'ЛИОЗИДЫ представляют собой сиалО1'ликосфинrолипиды,
которые включают в свой состав один или несколько остатков
сиаловой КИСЛО'l'ы (N аце'rилнейраминовой кислоты). Они coдep
жатся преимущественно в мембранах нервных клеток и являют-
ся кислыми липидами.
rликосфинrолипиды мембран эритроцитов несут аНТИ1'ены
rpупп крови. В клетках аденокарциномы накапливаются фукози
лированные rликосфинrолипиды, l<оторые можно использовать дл,я
обнаружени,я этих l<леток и контроля за развитием опухоли.
Стероиоы ПРИСУТС'l'вуют во мноrих мембранах растений, жи
вотных, МИКРООР1'анизмов. Широко распространен среди них xo
лестерин. Ero молекула состоит из четырех колец (rидрофобное
ядро), одно из r,оторых соединено с 1'идроксильной 1'руппой, вы-
полняющей роль полярной rоловки, а пя:rичленное кольцо свя-
зано с разветвленной У1'леводородной цепочкой из восьми атомов
уrлерода. Холестерин содержится в плазматических мембранах
животных кле'l'ОК (составляет около 30 % массы мембранных
липидов), лизосомах, аппарате rольджи. Нарушение содержания
холестерина в ТI<анях может приводить к развитию ряда патоло-
rических состояний человека (желчнокаменной болезни, a'repo
склероза). В высших растениях обнаружены ДРУ1'ие стероиды,
чаще Bce1'o ситостерин и СТИ1'мастерин.
Как правило, при нейтральных значениях рН молекулы ли
пидов электронейтральны или заряжены отрицательно. Поэто-
му удобно классифицировать липиды по заряду полярной rруп-
пы, что особенно важно дл,я изучения функционирования био
мембран, так как зарядовое состо,яние поверхностных участков
мембраны влияет на ar<тивность мембранных белков ферментов.
В связи с этим выделяют; нейтральные липиды, пол,ярные 1'o
ловки которых не несут зар,яда (ТРИ1'лицериды, холестерин, цe
реброзиды); цвиттерионные липиды, в полярных rоловках кото-
рых положительный и отрицательный заряды нейтрализуют дру1'
15
дрУ1'а (СфИН1'омиелин, фосфатидилхолин, фосфатидилэтаноламин);
кислые липиды с отрицательно заряженными rоловками (фосфа
тидилсерин, фосфаТИДИЛ1'лицерин, фосфатидилинозитол, кардио-
ЛИIIИН, rанrлиозиды).
Жирные кислоты, входящие в состав мембранных липидов,
представлены насыщенными стеариновой (18:0), IIальмитино
вой (16:0), миристиновой (14:0) и ненасыщенными олеиновой
(18:1), линолевой (18:2), линоленовой (18:3), арахидоновой (20:4)
жирными кислотами. Почти все IIриродные жирные кислоты ха-
рактеризуются цис конфиrурацией двойных связей. Уrлеводо-
родная цепь в такой конфиrурации имеет излом, что нарушает
упаковку липидных молекул в бислое. O1'poMHoe разнообразие
фосфолипидов и различия в их физико,химических свойствах
обусловлены возможностью комбинирования полярных l'оловок
с различными кислотами. Лизоформы липидов, имеющие одну
уrлеводородную цепь, при высоких концентрациях действуют по
добно детерrентам и способны разрушать клеточные мембраны.
Примером является лизолецитин (1- или 2-ацилrлицерофосфо
ХОЛИН), образующийся из фосфатидилхолина (лецитина) под дей
ствием фОСфОЛИIIаз А! и А 2 . В e1'o присутствии происходит рас-
пад клеточных мембран, что может служить одной из причин
смерти при укусе змей. В молекулах одно цепочечных диольных
липидов вместо l'лицерина содержатся более простые спирты
этиленrликоль или пропандиол. Предпола1'ают, что они способ
ны выполнять ре1'УЛЯТОРНУЮ роль в функционировании биомем
бран. Синтез этих липидов резко усиливается в случае возраста-
ния функциональной активности клеток (например, в созреваIO
щих семенах и клетках ре1'енерируIOЩИХ тканей).
Общее содержание ЛИIIИДОВ в биомембранах варьирует от He
скольких процентов у IIpOкариот (например, 6 9 % у Bacillus mega
terium) до 60 80 % в мембранах миелина эукариот. В среднем
липиды составляют 15 50 % от сухой массы мембраны (табл. 1).
Причем среди них преобладают амфифильные фосфолипиды. Oд
ним из основных структурообразующих липидов на всех уровнях
биолоrической ОР1'анизации является фосфатидилэтаноламин.
В состав липидов бактерий в значительных количествах BXO
дЯТ фосфатидилэтаноламин, фосфатидилrлицерин, кардиолипин,
а в небольших фосфатидная кислота, фосфатидилинозитол,
фосфатидилсерин, фосфатидилхолин. К специфическим "бакте-
риальным" липидам относят ами:ноацилфосфолипиды у rpампо-
16
'l'аблица 1
СоiJержанuе дипиоов в раздuч-ных мембра1lах
Общие ФОсфОЛИПИДЫ, Стероиды,
Вид мембраны липиды, % от сухой % 0'1' общих
% от сухой
массы массы липидов
Плазматическая:
печени :крысы 50,0 67,5 13
скелетной мъuuцыкролцка 15,8 48,5 32,5
аксода моз 'а быка 13,5 52,2 20,1
СИН8П'l'осом мозrа крысы 50 71 16
эритроцита кролика 40 65,8 28,9
амебы А. castellani 42 59 29
бактерии Е. соН 45,3 96
Вдутренняя мембрана мито
хондрий печени крысы 17 87 1,5
СаРl<.опдазматичеСl{ИЙ рети.
кулум скелетной МЪПliцы
к роли:к а 25 90 10
ФО'l'орецеП'l'орная мембрана
сетча'l'КИ кальмара 25 74 17
ЛО"кительных бактерий, липид А ЛИПОПОJIисахарида у rpaMOT
рицательных и "rибридные" фОСфО1'ликолипиды у МИl{оплазм
и молочнокислых бактерий.
Особенностью липидноrо состава эукариотических клеток
.является наличие фосфатидилхолина и стероидов. Фосфатидил
холин обладает исключительной способностью существовать в виде
бимолекулярных слоев в широком диапазоне ионных KOHцeHTpa
ций и температур. :Кроме Toro, он формирует стабильные ламел
лярные структуры при смешивании с ДРУ1'ими липидами, которые
не МОl'УТ образовывать бислои при данных условиях. В мембранах
эукариот суммарное содержание цвиттерионных липидов (фосфа
ТИДИЛХОJIИн + фосфатидилэтаноламин + сфинrомиелин) составля
е'l' 75 90 % от общеI'O количества фосфолипидов (табл. 2).
Мембраны вирусов содержат практически те же классы ли
пидов, что И мембраны клетки хозяина, однако их соотношение
может быть друrим. В состав вирусных фосфолипидов входит
значительно больше насыщенных жирнокислотных остатков, чем
2. Заказ 3788
17
Таблица 2
Липионыu состав мембран высших животных
Содержание фосфолипидов, Содержание
Тип мембраны мол. % от суммы ХС,
ФХ ФЭ СМ ФС КЛ ФИ лизо- моль/моль ФЛ
формы
Плазматическая 39 23 16 9 1 8 2,3 0,37
Митохондриальная 40 34 1 17 7 1 0,03
Ядерная 44 3 16 4 1 6 1
Аппарат rольджи 50 20 8 6 1 12 3 0,21
Саркоплазматиче 68 15 8 3 2 3 0,21
ский ретикулум
Обозначения: ФЛ фОСфОЛШ1иды, ФХ фосфатидилхолин, ФЭ
фосфатидилэтанолам:ин, СМ СфИН1'омиелин, ФС фосфатидилсерин,
КЛ кардиолШ1ИН, ФИ фосфатидилиноз:итол, ХС холестерин.
В состав липидов клеток хозяина, в основном, за счет BblcoKoro
содержания СфИН1'омиелина. Кроме тоro, молярное отношение xo
лестерин/фосфолипид в вирусных мембранах обычно близко к
единице, а в клетках хозяина составляет O,2 O,4. Эти особенно
сти липидно1'О состава вирусов обеспечивают плотную упаковку
липидных молекул и способствуют более эффективной защите
вирусных частиц.
Липидный состав клеточных мембран, скорость обмена мемб
ранных ЛИI1ИДОВ существенно изменяются в ходе развития и транс-
формации клеток. Изменения в функционировании мембран, про
исходящие на разных этапах развития клеток, обусловливают из
менения в относительном содержании липидов, вязкости yrлево-
дородной части бислоя. Так, например, в растущих и делящихся
клетках содержится больше ненасыщенных жирных кислот и ли
пидов В целом. При созревании эритроцитов по мере уменьшения
функциональной активности их мембран происходит возрастание
микровязкости последних. Увеличение вязкости У1'леводородной
части мембран может происходить за счет повышения содержа-
ния холестерина. Акклиматизация различных ОРl'анизмов к хо-
лоду неизменно сВязана с увеличением степени ненасыщенности
жирнокислотных остатков фосфолипидов, что находит отражение
в повышении содержания полиненасыщенных жирных кислот.
Фосфолипидный состав мембран изменяется также в зависимости
от сезона и режима питания живых РР1'анизмов.
18
1.1.2. ФЩJUlCо-хuJ/tuчеСlCuе ц аипами",еские свойства
u фуltlCЦUU лuпuiJов .м.е.м.бран.
В водной среде мембранные лип иды ведут себя как анизо-
тропные жидкости, обладающие свойствами жидких кристаллов.
В жидком кристалле сочетаются особенности кристалла (даль-
ний порядок орrанизации, двулучепреломление) и жидкости (об-
разование капель и текучесть). Всем жидким кри:сталлам свой
ствен полиморфизм, т. е. они MorYT существовать в нескольких
жидкокристаллических фазах. Даже индивидуальные очищен-
ные липиды в rидратированном состоянии Moryт находиться в
нескольких структурных модификациях. Преобладание '1'01'0. или:
иноro типа структуры определяется целым рядом факторов: кон-
центрацией липида, температурой, величиной рН, ионной силой,
давлением. Формирование мезоморфных структур фосфолипи-
дов мембран зависит от соотношения липид/вода (Jluотропный
меао.м.орфuам) и от температуры (тepMbтpoтtblU .м.езоморфuз.м.).
Сочетание в молекуле липида полярноrо и неполярноro KOM
понентов, т. е. дифильность, обусловливает ее амфицатические
свойства и, следовательно, способность к образованию мембран.
Наиболее энерrетически ВЫ1'одным положением для молекул JIИ
пидов является формирование мономолекул.ярно1'О слоя на по-
верхности раздела масло вода или вода воздух (рис. 3). При
достижении определенной концентрации липида крИТИ1:rес-
кой концентрации мицеллобразования (КЕМ) ero молекулы объе-
диняются в замкнутые аrреrаты мицеллы, в которых поляр-
ные rоловки обращены к воде, а 1'идрофобные хвосты напраgле
ны внутрь. Для большинства липидов КЕМ составляет менее 1 %.
При более высокой концентрации формируется бимолекулярный
липидный слой (ламеллярная структура). Для ламеллярной жйд
кокристаллической фазы (L,,) характерно упорядоченное распо-
ложение слоистых структур при значительной неупорядоченно-
сти ацильных цепей. Считают, что именно в этой фазе находится
основная масса липидов биомембран. Ламеллярная rелевая фаза
(Lp) образуется при низкой температуре теми ЛИDидами, которые
формируют слоистые структуры. В этой фазе молекулы упакова
ны более плотно (на молекулу приходится меньшая ПЛОЩадь по-
верхности), а У1'леводородные цепи более упорядочены и Haxo
дятся преимущественно в транс-конфиrурации. Так как цепи Maк
симально вытянуты, толщина бислоя в фазе rел.я: выше, чем в
жидкокристаллической фазе. В случае образования rl;JКсаrональ
2*
19
А
, ,
Б .
1
''',,1
J .J
ТУ""
. ....1.
4
't.
...., '""'"
--=.. er; Vj- --=..
2
' ,.P
7,'\:
:J-t.. "\.1,1"
.rJ..... J,.9 7 '\:
7{
'.;. ,.P
<l"J..... ......1,1" 7',>::;:
7','\: Ф
5
Jll t
1 f
1. з
;::.o. ....:
1"': -
r ;;r
'-"" y
-1" " -=-
J) t'"
'1e?
: '\. .f'-
: :.&:.
K
6
,
- -
Рис, 3, Типы СТРУRТУРНОЙ ОРI'ани:зации ВОДlIО ЛИПИДНЫХ систем: А
ВОЗДУХ; Б вода; 1 монослой липидов; 2 мицелды фосфодипидов
в воде; 3 ламеллярная ЖИД:КОltристаллическая фаза L,,; " ламел-
лярная: rелевая: фаза L ; 5 rеRсаrональная фаза типа 1; 6 reRcaro-
нальная фаза ТИТIа II
ной фазы 1 (Н Х ) лип:и:дные молекулы формируют цил:и:ндриче-
сн:ие структуры, поверхность которых образована полярными ro
ловками :и: контактируе'l' с водой. Цилиндры упаковываются с
образованием rе:ксarональной решетки. Липиды в 1'екса1'ональ
ной фазе П (НН) также образуют цилиндры, но полярные 1'руппы
обращены внутрь цилиндра и формируют водный канал. Следу-
ет отметить, что некоторые липиды (ненасыщенные фосфати-
ДИЛЭ'L'аноламины, моноrалактозилдиацилrлицерол) не образуют
стабильные бислои, а находятся в rексarоналыюй фазе Н п . Для
изучения ти:пов структурной орrанизации водно липидных сис
тем исполъзуют метод дифракции рентrеновс:ких лучей, а также
дифференциальную сканирующую ::калориметрию, электронную
микроскопию и метод ямр.
Термотропный мезоморфизм это зависимос'l'Ь состояния
липидных молекул от температуры. В твердой или rелеобразной
фазе уrлеводородные цепи ориентированы cTpo1'o параллельны-
ми зиrзarами. После фазово1'О перехода в жидкокристалличес-
кое состояние, который определяется температурой и ав:ало1'И
чен процессу плавления, yrлеводородные цепи становятся под
вижными. "Жидкое" состояние мембранных липидов необходи
20
МО для нормалыюrо функционирования всех биомембран, при
чем степень вязкости зависит от функциональных особенностей
мембраны. В среднем вязкость нормальной мембраны COOTBeT
ствует примерно вязкости ОЛИВI\,ОВО1'О масла. Термотропный ме-
зоморфизм существенно зависит от природы жирных ltислот И
полярной 1'оловltи липидов. Так, увеличение числа двойных свя-
зей И укорочение уrлеводородных цепей при ВОДЯТ к снижению
температуры фазовоrо перехода.
Вышеописанные свойства липидов взаимосвязаны дру!' с др у-
rOM. Температура фазово1'О перехода зависит от содержания ВОДЫ
в анализируемой СИС'l'еме.
Различные липиды способны к формированию разных мезо
морфных структур, что обусловлено особенностями строения MO
лекул и соотношения объемов полярных rоловок и У1'леводород-
ных хвостов. Липиды С электронейтралыroй 1'оловкой (фосфати-
дилхолин, фосфатидилэтаноламин, сфннrомиелин) образуют ла
меллярв:ую фазу. Лип иды с отрицательно заряженными 1'олов
ками вследствие действия электростатичесltих сил отталкивания
формируют мицеллярные или rексаrональные структуры. В слу
чае равенства объемов, занимаемых полярными rоловками и yr
леводородными хвостами, молекулы липида имеют цилиндри
ческую форму и образуют бислой (фосфатидилхолин). Если объем
полярной rоловки болъше объема УI'леводородных цепей (лизо
фосфолипиды), то молекула имеет форму перевернутоrо конуса
и в водном растворе находится в мицеллярной фазе. Если объем
полярной rоловки меньше объема У1'леводородных цепей (HeHa
сыщенный фосфатидилэтаноламин, ltардиолипин в ПРИСУ'fСТВИИ
ионов Са 2 +, фосфатидная ltислота), то молекула липида имеет фор
му конуса и образует 1'ен:саrоналъную фазу типа П. В целом crro
собы упаКОБIШ различных липидов с учетом 1'еометрической
формы их молекулы определяются следующими параметрами:
молекулярным объемом неполярной части молекулы V, макси-
мальной длиной это1'О участltа 1, оптимальной площадью поверх
ности, занимаемой полярной rоловкой 80' :Критический пара
метр упаковки липидов представляеТ собой величину V /180'
Фазовые перехооы липидов сопровождаются значительным
повышением ионной проницаемости мембран. По видимому, ми
целлярная и 1'еltса1'ональная фазы, способные формировать сltвоз-
ные поры, более проницаемы для ионов и воды, чем бислойная
ламеллярная структура. Способность мембранных фосфолипидов
21
к образованию в ВОДНОЙ среде мезоморфных структур в физиоло
rическом оптимуме температур обусловливает ион-реryляторную
функцию мембранных липидов. Так, для заряженных фосфоли
пидов, фосфатидилэтаноламина и лизолецитина возможны фазо-
вые переходы из бислоя в мицеллярную и 1'ексаroнальную фазы.
Для фосфатидилхолина характерен вид бислойной ламеллы с фа-
зовыми переходами термотропно1'О характера из жидкокристал
лическо1'О состояния в 1'ель и обратно. В связи с этим выяснение
молекулярных механизмов полиморфных переходов в липидной
фазе необходимо для изучения процессов транспорта веществ че-
рез биомембраны.
Динамическое состояние липидно1'О бислоя, являющееся ос-
новой функционирования мембраны, определяется целым рядом
факторов: вращательной и латеральной диффузией отдельных
молекул фосфолипидов, ПОДВИЖНОСТЬЮ их уrлеводородных цe
пей, транс-rош-изомеризацией остатков жирных кислот. Лабиль
ность мембранных беЛI<ОВ, в свою очередь, зависит от фазово1'О
состояния и вязкости ЛИПИДНО1'о матрикса мембраны. С помо-
щью метода ЭПР показано, что для молекул фосфолипидов в MeM
бранах характерны движения двух типов:
1) латеральная диффузия перемещение в пределах одноro
слоя липидной фазы параллельно поверхности мембраны;
2) трансбислойный переход типа "фЛ}1П фЛОП" перемеще-
ние из ОДНО1'О монослоя ЛИПИДНО1'О матрикса в ДРУ1'ой. E1'o час-
тота в везикулах яичноrо лецитина около 2'10-5 c- I , ОН происхо
дит на 12 порядков медленнее, чем латеральная диффузия.
"Флип флоп" переходы молекул фосфолипидов характеризуются
высокими значениями энер1'ИИ активации (= 80 КДЖ/МОЛЬ), а
обмен в пределах одноrо монослоя липидов более низкими
(= 21 кДж/моль).
Движение У1'леводородных цепей состоит из торсионныx (вра-
щательных, крутильных) колебаний с относительно малой амп-
литудой « 200) BOKpyr каждой из связей (время корреляции вра-
щев;ия =10-14 с) и tpaHC-1'ош изомеризации отдельных звеньев
(= 10-10 с). Минимальной энерrией обладает TpaHC , а максималь-
ной цис-конформация У1'леводородных цепей. Уrлеводород-
ные цепи в полной транс конформации представляют собой ли-
нейные структуры. rош-конформации (1'ош "+" и roш " "; пово-
рот на :t:120 Q относительно транс конформации) мало превыша-
ют по уровню энерr:ии транс конформацию (на 2 3 кДж/моль),
22
но эти состояния разделяет энеР1'етический барьер высотой при
мерно 12 17 кДж. Появление одиночной rош конформации при
водит к искривлению пространетвенной конформации уrлеводо
родной цепи примерно на 1200, что затрудняет появление оди-
ночных rош конформаций. При последовательном повороте цепи
на +120 и 1200, т. е. при образовании двух 1'ош конформаций
("+" и " ") пространственная структура цепи сохраняется пря
молинейной. Участок цепи, на.ходящийся в 1'ош "+" транс-1'ОШ
" " конформации, формирует в У1'леводородной цепи петлю, на-
зываемую КИllКО.llt. Образование кинка сопровождается уменьше-
нием эффективной длины уrлеводородной цепи примерно на
0,127 нм, а объем, занимаемый молекулой липида, увеличивает
ся (рис. 4). Формирование кинков кооперативный процесс,
приводящий к возрастанию разупорядоченности уrлеводородной
зоны и ее плавлению. Этот процесс стимулируют двойные (ЦИс-)
связи в ненасыщенных цепях мембран. Для образования кинка в
таких участках необходимо появление лишь одной 1'оm конфор
мации при искривлении цепи на 800. Поэтому высока'я текучесть
уrлеводородной зоны мембран в жидкокристаллическом состоя
нии объясняется возрастанием амплитуды крутильных осцил
ляций BOKpyr С С связей, появлением rош-конформаций.
С текучестью мембран тесно связаны функциональная актив
ность мембраносвязанных ферментов, а TaK e фун:кционирова-
ние систем пассивно1'О транспорта. Формирование кинков, обус
ловленное появлением в липидном бислое флуктуирующих объе
мов, является одним из возможных механизмов трансмембран
j
0,127 нм
{ <
транс 1 rош транс, rош
rош..................... I ЦИ.У [
l
!.. 0,15 нм :
1 2 3
Рис. 4. Конформация УI'леводородных цепей липидов в мембране:
1 полная 'l'ранс конформация; 2 I'ош транС I'Ol!н\:онформация; 3
цис транс-I'ОШ КОНфОРМация
23
Ho1'o переноса воды и ионов. Вопросы, касающиеся выяснения
роли мембранных липидов в процессах транспорта ионов и Mexa
низмов образования ионных каналов при фазовых превращени
ях липидов, подробно изложены в МОНО1'рафии В. Ф. Антонова
"Липиды и ионная проницаемость мембран" (1982).
Динамическая модель липидно1'О бислоя показана на рис. 5.
Липидный матрикс состоит из области полярных 1'рупп Р И облас
ти У1'леводородных цепей Н. Уrлеводородная часть представлена
как бы тремя слоями: двумя упорядоченными толщиной 0,8 нм,
приле1'ающими к полярной области, и центральным "изотропным" ,
подобным короткоцепочечному жидкому У1'леводороду. Толщина
этоI'O центральноro слоя для бислоев ДИIIальмитоил , димиристоил
и дилауроиллецитина составляет соответственно 0,85 и 0,2 им. По
видимому, существование "изотропной" области необходимо для
Т01'o, чтобы бислой был непроницаем для ионов и малых молекул.
Повышение проницаемости липидноrо матрикса связано с образо
ванием кластеров и динамических дефектов. Кластеры это обла
сти с сохраняющимся ближним порядком молекул, упаковка ко-
торых близка к кристаллической. :Кластеры представляют собой
динамические (M1'HoBeHHble) образования с временем жизни 10 7 С,
включающие 40 60 уrлеводородных цепей (20 30 молекул фос-
фолипидов). В них ближайшие к полярным rоловкам учас'l'КИ Y1'
леводородных цепей имеют несколько более плотную упаКОВ:RУ,
чем в "твердом" бислое. По направлению к центру бислоя плот
ность упаковки уменьшается, как и на rpаницах кластеров, KOТO
Н,О
* ** 1 *Jp
, f r / f f 11 f ;7 i 1 ! f f t
н
]} JJ j} }
а
}Р
Рис. 5. Динамическая орrанизация ЛШIидноrо бислоя: Р области
полярных rрупп; Н области уrлеводородных цепей; а упорядочен
ная "анизотропная" область; i "изотропная" область; J, динамиче
СRие дефеRТЫ
24
рые непрерывно распадаются и образуются, перемещаясь вдоль
бислоя. При этом rраничные области между кластерами представ
ляют собой динамические дефекты в бислое. Последние также но-
сят динамический характер, поэтому степень проницаемости ли
пидной мембраны должна зависеть от времени жизни дефектов.
Увеличение времени их жизни путем фиксации части кластеров
при отвердевании бислоя приводит к резкому (на 1 2 порядка)
возрастанию npoницаемости мембраны.
Необходимо отметить, что на ориентацию и динамику поляр
ных rоловок липидов влияет образование межмолекулярных во-
дородных связей на поверхности мембраны. Донорами и акцеп
торами при образовании этих связей M01'Y'l' служить фосфати
дилсерин, фосфатидилэтаноламин, 1'ликолипиды. Однако не ясно,
каким образом водородные связи воздействуют на структуру MeM
браны. С точки зрения термодинамики, основной силой, стаби
лизирующей rидратированные ЛlШидные a1'peraTbl, являются 1'ид
рофобные взаимодействия. К друrим стабилизирующим факто
рам относятся водородные связи и ван дер-ваальсовы силы (ко-
роткодействующие слабые силы притяжения между соседними
rидрофобными цепями).
Важнейшим свойством ЛИПИДноrо бислоя мембран является
стРУlCтУРJlа.я асu.мJ/otетрu.я различное распределение липидов
между внутренним и наружным монослоями. Анализ распреде-
ления фосфолипидов в мембранах микросом, аппарата rольджи,
ЛИЗ0СОМ, Ядер, митохондрий показывает, что фосфатидилзтано
лам:ин и фосфатидилсерин расположены преимущественно на ци
топлазматической стороне, СфИН1'омиелин, кардиолипин и фос
Фатидил:инозитол на внутренней, тополоrичной наружной сто-
роне плазматических мембран, а фосфатидилхолин более или Me
нее равномерно распределен между обеими сторонами. В наруж
ном монослое липидов мембран эритроцитов человека содержится
44 % фосфатидилхолина, 44 % СфИН1'омиелина и 12 % фосфати
дилэтаноламина, во внутреннем 48 % фосфатидилэтаноламина,
28 % фосфатидилсерина, 10 % сфинrомиелина и 14 % фосфати
дилхолина.
Уrлеводородные цепи, входящие в состав фосфатидилхолина
и СфИН1'омиелина, более насыщены по сравнению с теми, I{OTOpble
находятся в составе фосфатидилэтаноламина и фосфатидилсери-
на. В связи с этим асимметрия в распределении полярных rоло
вок сопровождается асимметрией распределения жирно кислот-
25
ных XBOC'l'OB. Это может привести к тому, что текучесть BHyтpeH
He1'O монослоя будет несколько больше, чем внешнеrо. Известно
также, что отрицательно заряженный фосфатидилсерин локали
ЗОБан во внутреннем монослое, следовательно, две стороны бис
Лоя существенно различаются и по заряду. Феномен асимметрич
Horo распределения липидов необходим для проявления функ
циональной активности МНО1'их мембраносвязанных ферментов.
Так, при активации протеинкиназы С она связывается с цитоп
лазматической стороной плазматической мембраны, rде KOHцeHT
рируется фосфатидилсерин, необходимый для работы фермента.
Асимметрия распределения ЛИПИДОБ определяется не только ли
пид белковым взаимодействием, но и асимметрией липидно1'О
синтеза, различиями ионноrо состава BHe и внутриклеточной cpe
ды. Асимметрия бислоя обеспечивается ферментами липидноro
обмена и липидпереносящими белками (липазами, системами об
мена холестерина, метилазами фосфатидилэтаноламина).
Липиды в биомембранах выполняют множество функций. Bo
первых, они обеспечивают структурную орrанизацию и стабиль
ность клеточных мембран. BO BTOpЫX, выполняют барьерную и
транспортную функции. В третьих, иrрают фундаментальную
роль в передаче информации и ре1'улировании метаболических
процессов в клетке. Последняя функция мембранных липидов
включает участие их в реакциях биосинтеза; поддержании опти
мальной активности белков ферментов мембран; выполнении ре-
цепторных функций, обеспечивающих про.явление иммунолоrи-
ческих свойств и ответственных за взаимодействие клеток; а TaK
же в процессах накопления, передачи и хранения энерrии. Ли-
пиды участвуют в механизмах кратковременной и ДОЛ1'овремен-
ной памяти. В дальнейшем вопрос о выполнении липидами ре-
ryляторной роли в различных процессах метаболизма будет pac
смотрен более подробно в 1'лавах 2, 3.
1.2. МЕМБРАННЫЕ БЕЛКИ
1.2.1. Клаесифшсацил, структура и ФУJlкции
.ме.lltбраJlJlЫХ белков
Белки обеспечивают выполнение мембранами их специфичес
ких функций. Поэтому содержание и типы бел:ков в различных
мембранах значительно варьируют. Так, в миелиновой мембране,
выполняющей функцию изолятора, белки составляют около
20 % массы мембраны. Цитоплазматическая мембрана животных
26
клеток на 50 % состоит из белка, во внутренней мембране мито
хондрий на ero долю приходится около 75 % (табл. 3). Плотность
мембран прямо пропорциональна содержанию в них белка.
Обычно мембранные белки подразделяют на наружные (пери
ферические) и внутренние (интеrральные). При этом критерием
служит степень жесткости обработки, необходимой для извлече
ния этих белков из мембраны. Перuферu'tескuе беЛ/си высвобож
даются при промывании мембран буферными растворами с низ
кой ионной силой, с низким или высоким значением рН, в при
сутствии растворов хелатирующих a1'p.HToB (ЭДТА), связывающих
двухвалентные катионы. Такие белки контактируют с поверх
ностью мембраны в основном за счет слабых электростатических
взаимодействий с полярными 1'оловками тшидных молекул либо
с молекулами дРуrих белков. В определенных условиях с биомем
бранами MOryт взаимодействовать некоторые водорастворимые ци
топлазматические белки. Поэтому возникла необходимость в Дo
полнительной классификации периферических белков, которые
делятся на две 1'руппы: собственно периферические и поверхност
ные. Собственно периферические белки, как правило, связаны с
мембраной электростатическими силами и MOryT быть частично
поrpужены в ее rидрофобную область. Поверхностные белки при
I{репл.яются I{ мембране только за счет электростатических взаи
модействий. К периферическим белкам относят 1'ексокиназу, свя
занную с белком порином, локализованным во внешней мембране
митохондрий; цитохром С, который образует комплекс с мембран
ным белком цитохромоксидазой; креатинфосфокиназу, взаимо
действующую с кардиолипином внутренней мембраны митохонд
рий. В rруппу периферических :включают и белки цитоскелета:
актин и миозин, ассоциированные с внутренней поверхностью MeM
браны в клетках эукариот, а таlCже спектрин эритроцитов. 'у эука
риот к числу периферических белков относят коллаrен, фибро
нектин, ламинин, расположенные на внешней поверхности мемб
раны, входящие в состав экстраклеточноrо матрикса. Это rлико
протеины, выполняющие сиrнальную и структурные функции.
По функциям периферические белки делятся на следующие
1'руппы:
1) реryЛЯТОРНО СИ1'нальные (белки экстраклеточноrо матрикса);
2) CTPYKTypHO KapKaCHыe (актин спектривовые комплексы);
3) белки, обеспечивающие подвижность клеток и субклетоq
ных структур (белки микротрубочек и микрофиламентов).
27
Таблица 3
Белковый u лuпuiJныu состав некоторых .lИе.мбраи ЖU80тиых
u бактерuалъиых !Слеток
Отношение
Мембраны Основные белки Основные липиды липид/белок
по массе су-
XOI'O вещества)
Миелин Основный ФХ 10 %, 3 4
человек белок ФЭ 20 %,
липофилин ФС 8,5%,
протеолипид CM 8,5%,
rанrлиозиды 26 %,
холестерин 27 %
Мембраны Родопсин ФХ 41 %, 1
дисков бык ФЭ 39%,
ФС 13 %,
следы холестерина
Эритроциты Белок полосы 3, ФХ 25 %, 0,75
человек rликофорин, ФЭ 22 %,
спектрин, ФС 10 %,
rлицеральде- CM 17 %,
rид.3-фосфат холестерин 25 %
деI'llдроrеНRза
Мембраны АцетиJIXОЛИНО' ФХ 24 %, 0,5 0, 7
ХОЛИНерrиЧе вый рецептор ФЭ 23%,
CKOro рецеп- ФС 9,6 %,
тора Torpedo холестерин 40 %
marmorata
Саркоплазма. Ca 2 +-АТФаза ФХ 66 %, 0,66 0, 70
тический ФЭ 12,6 %,
ретикулум ФИ 8,1%,
кролик холестерин 10 %
ПУРПУРНая Бактериородоп- Фосфатидилrлицерол 0,2
мембрана СИН фосфат 52 %,
Halobacterium rликолипиды 30 %,
llalobium нейтральные лили.
ды 6%
Для высвобождения из мембраны интеrpальных белков необ
ходимо использовать детерrенты или ОР1'анические растворите-
ли. Детерrенты разрушают липидный бислай И связываются с
неполярными участками мембранных белков, контактирующи-
ми с 1'идрофобной областью бислоя. Ин.теzральн.ые белJCU пред
ставляют собой rлобулярные амфифильные макромолекулы, Бза
имодействующие и с 1'идрофобными, И С rидрофильными компо
28
нентами мембраны. Ос()бенностью их структуры ЯDЛJIe'l'С l НЫСО'"
кое содержание а спиральных учас'l'КОВ и учас'rков с кон:ф()рrvrа
цией статистическо1'О клубка. Степень поrружени,я ИН'l'er'раЛl,'"
ных белков в липидный матрикс определяется их аМИlЮl<:ИСJ!О'['"
ным составом (количеством аминокислотных остаткОВ с Ilt ПО
лярными боковыми радикалами) и трехмерной прос'rранс'l'Нt.Ш:
ной С'l'руктурой. Эти белки выполняют в мембране 'rранспОР'1'-
ную, рецепторную и ферментативную функции. К ним 0'1'110<':>1'1'
rликофорины, А'l'Фазы, цитохром Ь 5 , родопсин, бaI<:'l'ериоро,дон.,
син и др. Следуе'l' O'l'ме'I'ИТЬ, что с высоким разрешением yc'ra.
новлена CTpYК'I'ypa 'I'ОЛЬ:КО бактериородопсина, однако и 11 ,УХ'ОМ
случае положение белка относительно липидно1'О БИСJIОЯ не он,
ределено однозначно. Детальное исследование и:нтю'раЛЬJ:10I'О
мембранноrо белка должно включать эксперимеН'l'аЛЫIое иаУЧt, .
ние ero ТОПО1'рафии. Для ЭТО1'о используют целый арсеиал ме'I'О..
дов: протеолиз, ИММУНОЛО1'ические методы (применение мОНtll<:ЛО-
нальных и поликлональных антител про'rив пептидов, COO'l'Ht '1'"
ствующих определенным областям беЛI<а), химическую модифн..
кацию (например, солями диазония), 1'енетические подходы.
Различия периферических и интеrральных беш<.оn оnредеДJ-I"
ют степень связывания их с мембраной, но не способ их nРИ1(.Р( 11-
ления к бислою. На рис. 6 показаны способы прикрепле:ния БСJI-
ков к мембране:
1 связывание с "якорными" белками, поrруженными в би
слой. Примеры: Fl qaCTb Н+ А'I'Фазы связана с F о .час'1'ЬЮ, lЮI'РУ.
женной в мембрану; сукцинатдеrидроrеназа, неl<:оторые 6СJп."и
ци'rоскел:ета;
2 связывание с поверхностью бислоя. Эти взаимодеЙ:с 'l'ВИ,Н
имеют либо электростатичеСI{УЮ природу (а), например. миелIХ-
новый основный белок, либо l'идрофобную, но практи:чеСI<:И бt З
поrpужения в бислой (6), например, пируватоксидаза, фОСфС>.1IИ.
пазы;
3 связывание с помощью 1'идрофобноро "якоря". Ци'rо..
хром Ь 5 имеет короткий концевой сеl'мент из неполярных амино
кислотных OC'I'aTKOB (а). Некоторые белки использую'r 13 качо..
стве "якоря" ковалентно связанные с ними жирные :КИслО'!'Ы
или фОСфОЛИIlИДЫ, например, щелочная фосфатаза эукариот (б);
-1 пересечение мембраны 'I'рансмембранными бел:ками. I'ли
кофорин имеет одиночный трансмембранный cerMeHT (а), а лаI<:..
топермеаза и бактериородопсин нескодько (6).
2Н
{f
..
1
а
б
а
б
r f
3
а
б
4
Рис. 6. Способы прикрепления белков к мембране. Объяснения в тексте
Мембранные беЛЕИ эукариот MorYT быть ковалентно связаны
с липидами. Их подразделяют на три rруппы:
белки, связанные с миристиновой кислотой (14:0): катали
тическая субъединица сАМР зависимой протеинкиназы, NADPH
цитохром Ь5 редуктаза;
белки, связанные с пальмитиновой кислотой (16:0): poдo
псин, анкирин;
белки, связанные с rликозилфосфатидилинозитолом: аце-
тилхолинзстераза, 5'-нуЕлеотидаза, щелочная фосфатаза.
Белки, связанные с жирными кислотами, по-видимому, лока
лизован:ы в основном на цитоплазматической поверхности плаз
матической мембраны, а беЛЕИ, взаимодействующие с фосфатиди
линозитолом, на наружной. Миристиновая кислота присоеди
няется к белку через амидную связь с N-концевым rлицииом, паль
митиповая: путем образо:ван:и:я тиоэфирной связи с цистеином
ИЛИ mдроксиэфирной СВЯЗИ с серином и треонином. Эти амипо
кислотные остатки расположены внутри основной части полипеп-
тида вблизи трансмембранных участков, как правило, на цито
плазматической стороне. Связь белков с производными фосфати
дилинозитола локализована на С-концевом участке аминокисло
ты. Липиды присоедин:.яются к белку либо посттрансляционно, либо
одновременно с трансляцией на рибосомах (котрансляционно ).
Поверхностные белки клеток млекопитающих, а также боль-
шинство рецепторов и транспортных белков почти все1'да rликози
30
лированы. ОлиТ'осахаридные остатки Moryт защищать белки от npо
теолиза или участвовать в узнавании и адrезии. Выделяют две rруп
пы олиrосахаридных структур мембранных rликопротеи:нов:
N rликозидные ОЛИ1'осахариды, связанные с белками через
амидную Т'руппу аспарarина;
О 1'ликозидные олиrосахариды, связанные через rидро
ксильные 1'руппы серина или треонина.
rликофорин А мембраны эритроцитов rликозилирован пу
тем присоединения одно1'О N rликозидноrо олиrосахарида и 15 ce
рин/треонин связанных олиrосахаридов.
Наиболее детально исследован белковый состав эритроцитов
млекопитающих (табл. 4).
Классической работой по электрофоретическому разделению
белков мембран эритроцитов человека является исследование
Фейрбанкса и соавт. (1971), в котором предложена номенклату
ра rrолипептидных полос, выявляемых в солюбилизирова:нной с
помощью додецилсульфата натрия (ДСН) мембране. Этой HOMeH
клатурой пользуется в настоящее время большинство ученых.
Наличие сетчатой структуры, выстилающей внутреннюю повер
хн ость мембраны эритроцита, было обнаружено непосредственно
с помощью электронной МИКРОСI<.ОПИИ после обработки клеток
неионным детерrентом тритоном X lOO. При определенных
эксперимен'rальных условиях (в среде с высокой ионной силой и
при низкой температуре) применение ЭТОТ'О детерrента позволя
ет полностью солюбилизировать липидный бислой и интеrраль
ные белки. При э'l'ом остается сеть белков, сохраняющая ИСХОk
ную форму клетки, которая представляет собой me-мбраltliЫЙ СICе.
лет (lcapICac) эритроцита. Он 'l'естируется в виде двухмерной сети
филаментов, длина которых зависит от особенностей приrотов-
ления препарата для микроскопии. Необходимо отметить, что
белки, близкородственные компонентам цитоскелета эритроци
тов, обнаружены в ряде неэритроидных клеток. В связи с уни
версальностыо данной системы следует более подробно paCCMOT
реть структуру и свойства некоторых цитоскелетных белков.
1.2.2. ЦuтОСICе.лет (-ме-мбранпый ICарICас)
Основными компонентами мембранноrо скелета эритроцита
являются спектрин, актин, анкирин, а также белки полосы 4.1 и
4.9. Мембранный скелет содержит около 50 % всех белков, npи
СУТСТВУ1ОЩИХ в мембране.
31
Таблица 4
Свойства, степень ассоциации и ФУJtlщии Jtшсоторых эритро-
цuтарJtых мембранных беЛlCов
Число
Пептидю:ur Молекуляр. моле. Степень Связь с
н 11Я масса кул на Функция белками
фрroщия субъединицы клетку, ассоциации
х 10 5
Полоса 1 240000 2,2 Димеры Участвует в Полоса 3
(спектрин) 260000 (а) полос 1 и 2 формировании (сдолосоi1: 1),
Полоса 2 220000 ( ) образуют м:ембранноrо анкирин (с
(спектрин) те1'рамеры и скелета полосой 2),
ОШ1rомеры полоса 4.1
Полоса 2.1 215000 1,1 Мономер Связывает спек. Спектрин,
165000 трин с мембра. полоса 3
ной через белок
(анки рин) полосы 3
Полоса 3 89000 95000 12 Тетрамер в Транспорт не. Анкирин,
равновесии орrанических полосы 4.1 и
с димерами анионов, вза:и. 4.2, rликоли,
мосвязъ с мем- тические
бранным ске. ферменты
летом
Полоса 4.1 78000 80000 2,3 Димер Связывает СпеКТРЩI,
мембранный rликофорин
скелет с инте.
rральными бел.
ками; стабили.
зирует спект.
рин .актин овые
взаимодействия
Полоса 4.5 52000 59000 О, 7 1,4 ? Системы '1
транспорта
моносахарИДОJl
и нуклеозидов
Полоса 4.9 45000 48000 1 ? Связывание Актин
актина
Полоса 5 43000 5,1 ОЛИI'Омеры Участвует ]! Спектрин,
(актин) из 12 17 формировании полоса 4.1
субъединиц мембранноrо
скелета
Полоса 6 35000 4,1 Те1'рамер rлицералъде. Полоса 3
I'Ид-з.фосфаТде-
rидроreназа
rликофо- 29000 31000 2 Димер Место Полоса 4.1
ринА прикрепления
rликофо 23000 мембранноrо
рин В скелета
rликофо- 25000 29000
рин С
32
Спектрин (рис.7), по данным электронной микроскопии, .я:в
л.я:ется 1'ибкой молекулой в виде тяжа длиной 100 нм И пред
ставляет собой rетеродимер, составленный из двух полипептид
Hыx цепей а. и , уложенных антипараллельно, Однако в эритро
ци'rах in situ основной формой спектрина является тетрамер, об
разованный путем самоассоциации rетеродимеров конец в :кo
нец. На обоих хвостовых концах тетрамера имеются центры свя
зывания актина и белка полосы 4.1. Путем латеральной ассоци
ации тетрамер спектрина прикреплен к актину, ПрИСУ'l'ствующе
му винтактной клет:ке в виде олиrомеров из 12 17 субъеди
ниц. Каждый такой протофиламент а:ктина соединен в среднем с
6 тетрамерами спектрина, :которые друrим концом связаны с co
седними протофиламентами актина. Предполаrают, что белок
полосы 4.1 облеrчае'r ассоциацию спе:ктрина с актином.
Спе:ктрин имеет также центры связывания анкирина, Haxo
дящиеся на субъединице и расположенные на расстоянии 20 нм
от центра тетрамера. С помощью этоrо якорно1'О белка актин
спектриновая сеть прикреплена I мембране через цитоплазмати
ческий участок белка полосы 3. По видимому, это основной Me
ханизм прикрепления каркаса к мембране. Цепь бело:к полосы
3 анкирин спеr трин представляет собой путь, св.я:зываю
щий наружную и внутреннюю поверхнос'I'И мембраны эритроци
та, позволяющий осуществлять контроль за протеrсанием BHYТ
риrшеточных событий на уровне ОР1'анизма (см. 1'лаву 2), Ycтa
новлено, что поддержание нормальной структуры мембранно1'О
каркаса эритроцита возможно при определенном оптимальном
содержании АТР и двухвалентных катионов (прежде Bcero Са 2 +)
внутри клеток. По-видимому, степень фосфорилирования KOM
4
Ри,,', 7. Схема орrанизации спектрин аК'l'ИНОБОЙ сети: 1 липидный
бислой; 2 интеI'pальные белки; S актин; 4 'reтpaмep спек'rрина
3. Заказ 3788
33
понентов мембранноrо скелета определяет сродство Ca 2t к мемб
рапным белкам. В свою очередь, ионы Са2\- обусловливают проч-
ность связи отдельных компонентов мембранноrо каркаса. В связи
с этим реrулирование свойств последне1'О, а, значит, и целой клет
ки, может осуществляться за счет изменения соотношения
[АТР]/[Са 2 +].
Мембранный скелет эритроцита наиболее полно охарю,те
ризованная разновидность цитоскелета эукариотической клет
ки. В прокариотических клетках наличие цитоскелета не выяв
лено. В целом цитоскелет эукариот представляет собой слож-
ную сеть волокон, обеспечивающих механическую опору для плаз
матической мембраны, определЯIOЩИХ форму клетки, местополо
жение клеточных орrанелл и их перемещение при делении клет
ки. Цитоскелет образуют три типа волокон:
1) микрофиламенты (диаметр около 6 нм), состоящие из aK
тина 11 связанных с ним белков;
2) промежуточные филаменты (диаметр 8 10 пм), состоящие
из кератинов;
3) микротрубочки (диаметр 23 нм), состоящие из тубулина.
По видимому, микрофиламенты участвуют в таких мембран-
ных процессах, как рецепторзависимый эндоцитоз, пэтчиНl' и кэп-
пин1' аНТИ1'енов на клеточной поверхности, цитокинез, клеточная
подвижность. Микротрубочки образуют цитоплазма'l'ическую
сеть, связывающую плазматическую мембрану с различными суб
кле'l'ОЧНЫМИ н:омпонентами.
Следует отметить,что одной из за,цач мембранолоrии является
выявление молекулярных механизмов взаимодействия отдельных
компонентов цитоскелета клетки и путей ето реryлирования, KOTO
рые обеспечивают нормальное функционирование биосистем.
1.2.3. Ннтеtра-ЛЫlые белlCИ био.меhlбраll
в: настоящему времени накоплены сведения о структуре, BHYT
римембранной орrанизации, структурной динамике и механиз-
мах функционирования некоторых ключевых интеrральных бел
ков, 'l'аких как rликофорин, цитохром b s , родопсин, бактериоро
допсин, а,ценилатцю;:лаза, транспортные АТФазы и др. OxapaKTe
ризуем некоторые из них.
rликофорин А является rлавным сиалоrликопротеином плаз
матической мембраны эритроцита, определяющим ряд антиrе-
нов rрупп крови. Концевые участки ero молекулы выступают по
34
обеим сторонам липидноrо бислоя. На наружной поверхности
клетки rликофорин имеет центры, связывающие лектины и ви
русы.
На долю белка полосы 3 приходите.!! около 25 % обще1'О KO
личества мембранных белков ЭрИ'l'роцитов человека. Этот белок
имеет два высокоспециализированных домена. С-концевой дo
мен встроен в липидный бислой мембраны и отвечает за перенос
ХЛОРИk, бикарбонат , фоефат аиионов, поэтому белок полосы 3
называют анионным обмеНRИКОМ. Ero цитоплазматический
N-концевой участок представляет собой полипептид с молеку
лярной массой 43 кДа, который может быть отщеплен от мемб
раны протеолитическими ферментами. Эта область белка поло
сы 3 способна связывать аикирин, белки полос 4.1 и "1.2, rемоI'ЛО
бин, некоторые rликолитические ферменты. К нему MOryT при-
соединяться и дрyrие внутриклеточные белки и ферменты, Ha
пример, аденилатци:клаза.
Мембраносвязанные ферменты катализируют реакции, как
правило, полностью протекающие по одну сторону биомембра-
ны. Интеrральные белки-ферменты присоединяют субстраты на
одной стороне мембраны и выделяют продукты на ПРО'l'ивопо-
ложной C'I'OpoHe. Поэтому каталитическая реакция носит BeK
торный (направленный) характер, а сами мембраносв.язанные
ферменты называю'l' eelCтOpllbtMU. При этом О1'раниченная про
ницаемость мембран обеспечивает разделение Itомпонентов ре-
акции и образование концентрационных 1'радиентов. I вектор-
ным фермеН'I'ам биомембран относят аденилатциклазу (см. раз
дел 2.1.2), продуктом каталитической реакции которой являет
ся сАМР универсальный реrул.!!тор важнейших метаболичес-
ких процессов в клетке, а также транспортные АТФазы. В табл. 5
преДС'I'авлены сведения о классификации, виде транспортируе
мых ионов и локализации различных типов АТФаз.
1.2.4. Струюпура, фуlllcцuою2Jlыlеe U llюсоторые фU3UlСО'
хuмuч.еСlCuе свойства Na+, K'/'-АТФазы
В 1957 1'. J. Skou' k обнаружил в rOMoreHaTe периферических
нервов краба АТФазу, активируемую ионами Na+ и К+ И инrиби-
руемую специфическим блока'l'ОРОМ активноrо транспорта одно-
* Б 1997 I'. ему была присуждена НобелевскаJI Пр\JМИЯ совместно с П. Войе
ром, д. Уолкером за изучеlIИе бещtoц-ферментов, обеспечивающих преобраэование
химической и электрической энерrии в Rлетке.
3*
35
Таблица 5
Некоторые АТФазы, уztаствующuе в транспорте UOftOB
Тип АТФаз и
транспортируемые ИСТОЧНИК Мембрана
ионы
1. Е 1 Е 2 -тип
Н+ Нкзшие эукариоты Плазматическая
дрожжи и rрибы
Н+ Высшие эукариоты Плазматическая
Растения
Животные
К+ Прокариоты Е. соН Цитоплазмати.
ческая
Высшие эукариоты животные Плазматическая
Na+/K+ « «
Са 2 + « «
Са 2 + « Саркоплазмати
ческая
2. F1Fо тип
Н+ Большинство бактерий Цитоплазматиче
ская
Н+ Эукариоты Внутренняя ми.
животные и растения тохондриальная
Н+ Растения 'l'ИЛI!КОИДЫ
хлоропластов
3. Ва.куолярный тип
Н+ Низшие эукариоты ДРОЖЖИ и Вакуоли
rpибы
Н+ Высшие эукариоты растения Тонопласты
Н+ Высшие эукариоты животные ЛИЗ0СОМЫ
Н+ « Секреторные
rpанулы
Н+ « Запасающие
I'lнш:улы
Н+ « Окаймленные
везикулы
валентных катионов уабаином. В 70 e rr. L. Е. Hokin было по
казано, что Na+, К+ АТФаза, очищенная до 1'OMoreHHoro состояния,
при встраивании в лецитиновые липосомы способна обеспечить
сопряжение 1'идролиза АТР с активным переносом (навстречу дру1'
друry) ионов Na+ и К+ со стехиометрией Na+/K+/ATP == 3/2/1, Т.е.
той же, что обнаружена и для нативных мембран (эритроцитов).
Основной функцией Na+, К+ АТФазы (Na+ Hacoca), присутствую
36
щей в мембранах БОЛЬШИНС'l'ва эукариотических клеток, является
установление rpадиентов ионов Na+ и К+, что служит необходи
мым условием ре1'УЛЯЦИИ объема клетки, внутриклеточноrо зна
ченил рН, процессов дыхания и 1'ликолиза, трансмембранно1'О пе
реноса сахаров, аминокислот и нейротрансмиттеров. В возбуди
мых клетках rpадиент N а+ составляет движущую силу для быст
po1'o e1'o тока внутрь клетки при возбуждении (потенциал дей
ствия), для контроля за внутриклеточным содержанием Са 2 + че
рез N а + /Са 2 + обменный механизм.
Na+, К+ АТФаза локализована в различных op1'aHax и тканях.
Особенно велико ее содержание в opraHax, осуществляющих BЫ
делительную функцию (почки, солевые железы) или выполняю
щих электрическую работу (мозr, электрические opraHbl).
Na+, К+ АТФаза все1'да обнаруживается в наружных плазма
тических мембранах клеток и является их маркерным фермен
том. Она представляет собой интеrральный белок, пересекающий
мембрану насквозь, контактируя как с внеклеточной средой, так
и с цитоплазмой. rидролитический центр фермента "обращен"
внутрь клетки. Изнутри осуществляется также и активация фер
мента натрием. Присутствие калия требуется снаружи. Как 1'Иk
ролитический центр, так и участки ионной активации распола
1'аются в 1'идрофильном окружении в тех частях молекулы, KO
торые выступают из фОСфОЛИПИДНО1'о бислоя (рис. 8).
Молекула фермента состоит из двух субъединиц: <х (липопро
теидной природы), содержащей rидролитический центр, способ
ный фосфорилироваться в присутствии АТР, и. (rликопротеин).
<х субъединица (каталитическая) "прошивает" липидный матрикс
и несет на себе каталитический центр, центры связывания и пе
реноса ионов натрия и калия, уабаина и ДРУ1'их сердечных rли
козидов (ДИ1'италис рецептор), ионов ма1'НИЯ, ДРУ1'их функцио
нально важных продуктов. р субъединица обеспечивает правиль
Бую ориентацию Na+, К.j. АТФазы, отвечает за ее антиrенные свой
ства, участвует в ре1'УЛЯЦИИ связывания ионов калия с фермен
том. Сиалоrликопротеидный компонент обнаружен и в а субъеди
нице Na+, K+-АТФазы почек кролика, электрическоrо opraHa рыб
и наплиуса креветок. Считают, что а субъединица, судя по ами
но кислотному составу, более rидрофобна, хотя р субъединица свя
зывает большее количество фосфолипидов (табл. 6). Методом
амперометрическо1'О титрования нитратом серебра установлено
наличие в Na+, К+ А'l'Фазе почек свиньи пяти дисульфидных свя
37
Цитоплазма
с
Iз субъединица
а. субъединица
Центр связывания А тр
Петля между второй и
третьей колоннами
участвует в связывании ионов
Рис. 8. Схема расположения Na+, R+.АТФазы в клеточной мембране
(А. А. Болдырев, 1998)
зей и 20 свободных остатков цистеина, большинство из которых
относится к разряду замаскированных.
Анализ профиля rидрофобности показывает, что в полипеп
тИдной цепи а-субъединицы содержится от 6 до 10 потенциаль
ных трансмембранных фрarментов (колонн), состоящих из 17
25 3МJiнокислот, уложенных в а спираль (см. рис. 8). N- и C KOH
цевыв фраrменты а субъединицы располarаются в цитоплазме. N-
концевая часть полипептидной цепи представляет собой rибкий
неспирализованный участок, обоrащенный остатками лизина, 1{0
торый принимает участие в конформационных переходах и, воз
можно, реrулирует чувствительность фермента к катионам. В
N-концевой половине а субъединицы присутствует 4 трансмемб-
ранных фра1'мента (M1 M4), а в С концевой половине, по види
мому, еще 6 (M4 Ml0). Между трансмембранными фраrментами
М2 и М3 располarается малая цитоплазматическая петля, а между
М4 и Мб большой цитоплазматический домен, в состав которо-
38
Таблица 6
ФОСфО.lluпuiJJtыЙ u У2левоi}JlЫй состав uзолuроваllllЫХ
а. u {З.суtJ'ОеiJUllUЦ Na+, К+:АТФаЗbl (А. А. ВО.llаырев, 1985)
ФОСфОЛИl1ИДЫ, - % с/'.Субъедиюща j3 Субъединица
Сфинrомиелин 23::1: 6 17 ::1: 4
Фосфатидилхолин 31::1: 5 37::1: 2
Фосфатидилсерин 11::1: 2 11::1: 2,5
Фосфа'l'ИДИЛИН 03ИТОJI 1::1:1 1::1:1
ФосфатидилэтШlОЛамин 33::1: 7 33::!: 4,5
Уrлеводы, :моль/100 :молей а.субъединицu Р.субъединица
аминокислот
Манноза 0,3 :!: 0,1 2,5 :!: 0,1
rалar{тоза 0,9::1: 0,1 5,5 ::!: 0,4
r JIЮКОЗ!l 0,9::1: 0,2 2,0::1: 0,5
r JIЮI{ОЗU:МИН 2,0 ::1: 0,2 10,1::1: 0,5
rалю{тозамин Отсутствует 0,3::1: 0,1
СиаJIовые I{ИСЛОТЫ 0,35::1: 0,05 3,2 ::1: 0,2
1'0 входит более 400 аминокислотных остатков (Х субъединицы.
Большой цитоплазмаТИ'tIeСКИЙ домен состоит из чередующихся (X
спиральных и складчатых участков. Характерной ero особев:но
стью является наличие центральноrо ядра, представленно1'О cтpyк
турой, которое окружено. о: спиральными участками, соединенны
ми rибкими петлями. АТР связывающий центр расположен, Bepo
юно, в С концевой части CTPYKTYPЫ. В большом цитоплазмати
ческом домене о: субъединицы находится фосфорилируемый oc
таток аспара1'ИНОВОЙ кислоты (Asp 369). Полиnептидная цепь
субъединицы уложена в антипараллельные CTPYKTYPЫ. Все изо
формы субъеДиницы содержат три дисульфидные связи (Cys121
Cys150, Cys160 Cys176, Cys215 Cys278 в l изоформе).
Молекулярная масса белковых субъединиц в среднем составля
ет 90 130 (а.) и 35 57 ( ) кДа. В очищенных nрепаратах Na+,
К+ АТФазы рядом исследователей отмечено присутствие низкомо
лекулярно1'О протеолипида с молекулярной массой 10000 15000
выраженной 1'идрофобной природы. Ero называют у субъединицей
Na+ Hacoca. Предполаrают, что подобные протеолипиды способству
ют образованию трансмембранных ионных кав:алов в мембране
или обеспечивают взаимодействие ОЛИI'омерных белков с бислоем.
39
Основной формой Na+, К+ АТФазы, встречающейся у млеко
питающих, является изофермент «l l типа. В 1986 {'. G. Е. Shll11
et al. опубликовали данные о полной последовательности трех
клонов кДНЕ из мозrа крысы, соответствующих трем различ
ным изоформам I<аталитической субъединицы белка «(1, «2, аЗ)
и npедставляющих собой продукты трех неодинаковых reHoB. У
различных видов животных обнаружено пять изоформ субъ
единицы, входящих в состав Na+, К+ АТФазы и Н+, К+ Аrl'Фазы
( 1, 2, 3, Н, E и Ы).
Деление протомера фермента на « и I) субъединицы услов
но: под электронным микроскопом « -протомер выrлядит как
цилиндр с диаметром 5,4 нм и высотой 8,0 нм. Для проявления
функциональной активности фермента необходим по меньшей
мере димер с молекулярной массой 265 000. Однако в последнее
время получены активные препараты Na+, К+ АТФазы, находя-
щиеся в мономерном состоянии.
Na+, K+-АТФаза представляет собой векторную систему пер-
вично-активноrо транспорта, обеспечивающую сопряжение энер-
1'ии ферментативноrо rидролиза А ТР с трансмембранным проти
воrрадиентным переносом Na+ и К+;
АТР + HP ----7 ЛDР + Р п'
3Na+ + 2К+ + АТР н 3Na+ + 2Е+ + ЛDР + Р .
Dll СП СП DII n
Свободная энерrия rидролиза АТР составляет в условиях клет
ки "'" 55 кДж/моль, а для транспорта указанных ионов требуется
== 46 кДж/моль, Т.е. коэффициент полезноrо действия натриево-
1'0 насоса равен 84 %. Натриевый насос работает в элеКТРО1'ен-
ном режиме: за каждый транспортный цикл из клетки "BЫHO
сится" один положительный заряд. В результа'l'е на внутренней
стороне плазматической мембраны создается отрицательный по
тенциал порядка 90 мВ.
Используя технику миллипоровоrо фильтрования, У. Топо-
mura (1979) обнаружил в ферменте, выделенном в чистом виде
из почек свиньи, участки специфическоrо связывания Na+ (3 MO
ля/моль фермента) и К+ (2 моля/моль фермента), что СО1'ласуется
как со стехиометрией транспорта ионов в оптимальных услови
ях (Na+ /К+ I АТР == 3/2/1), так и с результатами определения KO
эффициентов кооперативности для ионов, рассчитываемых по aK
тивации калием и натрием АТФазной реакции. Еоэффициенты
Хилла по ионам равны: п н по К+ 1,7; по Na+ 2,3. Кд для Na+
40
в Nа' центрах составляе'l' O,2 0,8 ммоль/л, а в K+ цeHTpe
2,2 ммоль/л. Ион К+ обнаруживает высокое сродство не только к
собственным центрам (K d "" 0,04 ммоль/л), но и к Nа' центрам.
Каждый протомер Na+, К+ АТФазы содержит ОЩIН НУl<леотид
связывающий центр, локализованный на а субъединице. В при
сутствии N а +, M g 21 , АТР он может фосфорилироваться, образуя
ацилфосфат на карбоксиле аспара1'ИНОВОЙ кислоты. Образование
фосфофермента одна из стадий 1'идролиза субстрата Na',
К+ АТФазой, а К I обеспечивает ero быстрое дефосфорилирование
(K d для АТФ 0,1+1,0 мкмоль/л). Показано существование двух
типов АТР связывающих цен'rров, что позволяет получить ДBYX
фазную кривую субстратной зависимости фермента.
Предложены три rипотезы функционирования фермента
(R. W. Albers R. IJ. Post, 1969; J. D. RоЫпsоIl, 1975; К. R. Н. Rep
ke, 1979), основанные на результатах как экспериментальных ис.
следований, так и теоретическоrо анализа.
В основу реакционной схемы (А. G. 8ен, R. W. Albers,
R. L. Post, 1969), включающей стадию, протекание которой Tpe
бует наличия ВЫСОl\.ОЙ концентрации Mg2+ , положен тот факт,
что для ПрОцесса фосфорилировани,н требуе'l'СЯ присутствие 1'o
раздо меньшеrо количества Mg 2 + , чем для полноrо 1'ИДРОЛИ'l'И
ческоrо цикла:
Nя+ M g 2t К:'
A'rp + Е 1 -----7 Е 1 Р -----7 Е 2 Р -----7 Е 2 + Р n'
Однако этой 1'ипотезе противоречили некоторые эксперименталь
ные данные: одновременная, а не последовательная активация
Атфазы ионами Na+ и К+ (J. D. RоЫпsоп, 1983); образование в
реакционном цикле фосфофермента EIP дО фосфофермента Е 2 Р
в отсутствие К+ (У. Tonomura, 1973).
В соответствии со схемой J, D. RоЬinsоп (1975)
Е Р м едлен: о Е + Р
1 cnOH'raHHO 1 "
Mg2+
К+
Е 2 Р .. Е 2 + Рn
быстро
существуют две 1'руппы субстратов, 1'идролизующихся фермен
том разными путями: "калиевые субстраты" (82) должны взаи
модействовать с конформацией фермента Е2' "натриевые субстра
81 + El
Na+
t
82 + Е 2
41
ты" с конформацией EJ' АТР проходит путь, включающий обе
н.онформации фермента и стадии активации обоими ионами.
Переход Е 2 н Е] сопряжен с отщеплением ADP и изменением
сродства к Na+ и К".
Эта схема соrласуется с представлениями о функционирова
нии Na+, К+ АТФазы в виде димера, протомеры Koтoporo работа
ют соrласованно, но находятся на разных стадиях ферментатив
Horo цикла: активация натрием одноrо протомера совпадает по
времени с активацией калием друrоro.
Соrласно rипотезе К. R. Н. Repke (1979) Na+, К+ АТФазная
активность осуществляется мономерной формой фермента.
Присутствие К+ пере водит фермент в димерную форму. В этих
условиях присоедив:ение А ТР к центру с низким сродством
к субстрату индуцирует "сбрасывание" ADP с соседнеrо цeHT
ра, обладающеrо высоким сродством. Это синхронизирует ра-
боту димера в противофазе так, что эндерrоническая стадия
ферментативной реакции у одно1'О протомера совпадает по Bpe
мени с экзерrонической стадией реакции, осуществляемой дpy
rим протомером. В пользу этой 1'ипотезы служат результаты
исследовав:ий, свидетельствующие о существовании rеометри,
ческих различий между нуклеотидсвязывающими центрами
двух типов, соответствующих двум значениям КМ для АТР.
Однако различные модификации схемы R. W. Albers
R. L. Post не имеют принципиальной разницы и основаны на воз-
зрениях, соrласно которым каталитический цикл Na+, К' -АТФа
зы представляет собой чередование двух основных конформаций
фермента (Е] и Е 2 ) в фосфорилировавном и дефосфорилирован-
ном состояниях:
3Na+,ATP
Е "-
1 1
"
3Na+' E1'ATP
" [3Na+]E] Р
2
2K+ 6
2К+
3 3Na+
[2К+]Е 2
..
2К+' Е 2
Н 2 О
./
4
Е 2 Р
5
Катализ начинается, КО1'да фермент находится в конформа
ции El' Эта конформация обладает высоким сродством к АТР и
42
ионам натрия с цитоплаrзматической стороны мембраны. Связы
вание ионов натрия активирует фосфорилироnание фермента по
остатку аспара1'ИНОВОЙ кислоты. Добавление ионов калия к фос
фоферменту активирует rидролиз ацилфосфатной связи и при
водит к освобождению неОР1'аническо1'О фосфата, причем ион К'
действует с внен:леточной стороны мембраны. В формировании
представлений о механизме переноса ионов через мембрану cbI1'
рало свою роль открытие в середине 80 x 1'1'. окклюдированных
(поrлощенных) катипНОR. Было установлено, что на определен
ных стадиях катали'rическо1'О цикла ионы натрия и калия ока.
зываются недоступными с обеих сторон мембраны, Т.е. он:клюди
рованы внутри последней.
Открытие окклюдированных ионов явилось дополнительным
apryMeHToM в пользу модели транспорта катионов Na+, К+ АТФа
зой, описывающей перенос катионов через мембрану как их пepe
мещение через канал с калиткой (Р. Lallgel', 1991). СО1'ласно этой
модели (рис. 9) l<атионы перемещаются через канал, образуемый
полипептидной цепью а субъединицы фермента. При этом BOKpy1'
катиона происходит формирование энерrетическо1'О барьера (Ka
литки), которая О'l'крывается и закрывается при фосфорилирова
нии дефосфорилировании белка. Собственно перемещение ИОНОВ
представляет собой серию ДИСlсретных стадий, КО1'да катион, co
еДИБИВШИЙСЯ с l<атион связывающим центром (при этом канал
открыт только с одной стороны), переходит в окклюдированвое
состояние внутри канала (lСанал ОТКРЫТ.с обеих сторон), а затем
освобождаетс.!-I с противоположной стороны мембраны (канал OT
крыт с противоположной стороны мембраны).
Т. НеХllт et 1'1.1. (1970), изучая влияние рН на КМ и v шах мемб
paHOCB.!-Iзанной Na', К+ АТФазы из ткани МОЗ1'а крысы, показали
наличие в фермент субстратном комплексе ионизирующихся
1'рупп со значениями рК: 7,1; 7,5; 7,6, которые соответствуют
величинам рК для амино1'РУПП rистидина, цистина и а амино
кислот соответственно.
А. В. Кравцовым (1978) при исследовании солюбилизирован
ной ДИ1'итонином Na+, К+ АТФазы из ткани МОЗ1'а быка было по
казано, что в фермент субстратном комплексе выявляются две
ионизирующиеся 1'руппы со значениями рК 7,25 и 7,70 (т.е. близ
кими к приведенным выше значениям для мембраНОСВ.!-Iзанноro
фермента) рис. 10, а. Величины рК этих 1'рупп соответствуют
значениям для а NН2 1'РУПП аминокислот и а NН2 1'РУППЫ цис
43
Среда
Рис. 9. Схема реalЩИОННОI'О цикла Na+, К+.А'l'Фазы (А. А. Болдырев,
1998)
Примечание. Шесть основных последовательных реющий вклю,
чают связывание ионов натрия Е1,конформером, eI'O взаимодействие с
А'l'Р и образование фосфорилированноI'О ИН'l'ермедиата (стадия 1), ОК'
клюзию ионов Na+ конформацией EIP (стадия 2), активируемый иона.
ми MgZ+ переход EIP ---+ Е 2 Р, приводящий к высвобождению ионов Na+
во внеклеточную среду и связыванию с ионным центром внеклеточно.
I'O калия (стадия 3), окклюдирование ионов К+ (стадия 4.), дефосфори.
лирование фермента, вследствие KO'l'OpoI'O ионы н:+ высвобождаются во
внутриклеточное пространство (стаДИJi 5), и переход конформации Ez в
конформацию Ер обусловливающий начало HOBOI'O цикла (стадия 6).
тина. :Км,АТР для солюбилизированной Na+, :К+ АТФазы зависит от
рН среды: при переходе от фИЗИОЛО1'ических значений рН в ще
лочную область КМ существенно уменьшается (рис. 10, 6). Кри
вая зависимости Р:К М от величины рН представляет собой BOCXO
дящую ветвь, что свидетельствует о присутствии в фермент суб
стратном комплексе ионизирующейся rруппы с р:К 7,60. Таким
образом, и в случае rидролиза субстрата солюбилизированным
ферментом процесс контролируется аминоrруппами со значени
ями р:К в узком интервале рН: 7,25 7,70.
:Ее моменту создания модели активно1'О центра Na+, K-1 АТФа
ЗЫ, реконструированной с помощью методов ЯМР и ЭПР спект
роскопии, не была установлена природа rруппы, высвобождаю
щей протон при переходе из К формы В Nа форму (или акцепти
рующей erO при превращении). Ею может быть NН2 rруппа ли
44
2,5
2,0' /
1,5
,
,
1,0 1,0
6 7 8 9 6 7 8 рН
а б
Рис. 10. 3ависимоC'lЪ Щ<ТИВНОС'I'И солюБИJIИЗИРОВанной Na+, К' АТФа.
зы от рIl: а рII.заВИСИМО< 'lЪ Nа',К+.АТФаэы (lg v f(pH)); 6 записи.
мос'1Ъ KJA'I'P) Na+, К'.АТФазы от рН
зина (J. 8koll, 1983) или ОН rруппа тироаина, имеющая близкое
значение рК ( 8,0). Обе rруппы идентифицированы Б активном
центре Na+, Кt АТФазы.
Для N а 1, К' Аrl'Фазы обнаружена нелинейная зависимость фер
ментативной активности от температуры 13 I<оордина'l'ах Аррениуса
(рис. 11). В температурном интервале 10 . 35 "С наблюдается "пе
ре1'иб" на rpафике Аррениуса в области 20 "С, при этом энер1'ИЯ
активации каталитичеСI\ОЙ реакции повышается с 18 Iщал/моль при
температурах выше 20 "С дО 30 юшл/моль при более низких темпе
ратурах (А. А. Болдырев, 1988). На основании результатов сравни
тельноro изучения темпера'I'УР
ной зависимости активности v, МI<МОЛЬ Pn/Mr В Ч
Na", К' А'l'Фазы и исследования
ме'родом ЭПР параметров, xa
рактеризующих струн:турное co
G'Тояние мембранных липи,цов,
автором сделано заключение о
том, что коиформационный пе
реход молекул фермента при из
менени:и температуры в состоя
иие с более высокоЙ энеР1'ией aK
тивщии обусловлен фазовыми
rrерестройками липи,цноro OIёpy
жения при условии взаимодей
ствия белковых молекул с ли
пи,цным матриксом с участием
rидрофобныx и элеК'l'ростати
ческих сил. Примеча'I'ельным
19v
2,0
I
I
I
I
о,
1,5 r-..,
.,
r-..,
r
1
I
I
РК м
200
20 ос
100
50
20
10
I
3,З
3,4
3,5
10ЗIТ,к 1
Рис. 11. ТеМIIера'l'урная зависи
мость начальной CI<орости I'идроли.
за АТР Na+, К+.АТФазоЙ МОЗI'а
15
является тот факт, что нелинейный характер rpафиков Аррениуса
для Na+, К+ АТФазы наблюдается лишь в случае использования Б
качестве субстрата Arrp, что свидетельствует о выполнении после
дним не только функции субстрата, но и МОДИфИI:Cатора.
Na+, К+ АТФаза способна 1'идролизовать большое количество
субстратов: нуклеозидтрифосфаты, ацетилфосфат, умбеллиферон
фосфат, карбамоилфосфат, динитрофенилфосфа'r, фурилакри
лоилфосфат. Сложная кинетика ферментативной реакции, харак-
теризующаяся наличием двух значений К м ' проявляется только
при 1'идролизе АТР и СТР; превращения друrих субстратов под
чиняются кинетике Михаэлиса. Na+, К+ АТФаза активируется при
одновременном присутствии ионов Na+ и К. в среде. Вид зависи-
мости активности фермента от соотношения Na+/K+ определяет
ся природой субстрата реакции.
Считают, что струн:турной единицей Na+, Kf-АТФазы являеТСJI
димер (a )2' а минимальной функциональной единицей
(а ) протомер (или а-субъединица). Олиrомерный ансамбль
((а )2 димер) АТФазы подцерживается в основном за счет взаимо-
действий а субъединиц с цитоплазматической стороны в "районе"
АТР-св.язывающих центров, что обеспечивает стабильность четвер
тичной структуры, необходимой для проявления функциональной
активности белка. Вместе с тем с фунн:циональной точки зреНИJI
каждаJI а субъединица в стабилизированном состоянии обладает
полной rидролитической и транспортной активностью. Однако воп,
рос о биоло1'ИЧеской роли олиrомеров фермента, образуемых в MeM
бране, изучен далеко не полностью. По видимому, наличие оли1'о-
мерной структуры Na+, K+-АТФазы обеспечивает возможность pea
лизации "rибких механизмов", контролирующих активность MeM
браносвязанно1'О фермента (см. раздел 2.3.3).
Данные, касающиеся кооперативных взаимодействий междУ
ионными центрами и 1'идролизующими субстрат участками, слу
жат основой для пред ставлен ий о том, что Na+, К+ А'l'Фаза не
только структурно орrанизована, но и использует взаимодеЙстви,н
между протомерами для реrуляции их активности. При этом
величины коэффициента Хиюrа пн по ионам-активаторам отра-
жают взаимодействие между ионными центрами, локализован..
ными на каждом протомере, а по субстрату взаимодействие
между протомерами. Чувствительность n H по АТР к фазовому
состоянию мембранных ЛИПИДОБ подтверждает, что эта величина
отражает взаимодействие разных протомеров АТФазно1'О комп-
46
лекса. Напротив, независимость величин 1111 по ионам активато,
рам от фазовоrо состояния мембраны свидетельствует о том, что
взаимодействующие ионные центры находятся на одном и том
же протомере .
Характеризуя натрпевый насос эритроцитов, I. М. GlYnll и
8. J. Karlisll указали на существование четырех "дискретных pe
жимов" e1'o работы, соответствующих определенным частным
биохимическим реакциям АТр.фосфоrидролазной последователь.
ности: 1) N а" /К '-обмена; 2) нес()пряженно1'О выхода из клетки
Na+; 3) Nаl/Nа"-обмена; 4) IC+/IC. обмена.
При отклонении от оптимальных условий насосная функция
Nat, К+ АТФазы существенно изменяется. В ОТСУТС'l'вие К+ во внеш-
ней среде и в присутствии Na' с обеих сторон мембраны система
осуществляет эквимолярный обмен ионов Na+ через мембрану,
измеряемый с помощью изотопов Na+. Для этоrо процесса требу-
ется присутствие АТР и ADP. Неrидролиауемые анало1'И А1'Р, в
том числе P,y-NН-А'l'Р, заменить аденозинтр:ифосфат не Mo1'YT
(1. М. Karlish, S. У. GlYnll, 1975). Na" /Nа+ обмен сопровождается
АТР / ADР обменом:
АТР, MgZ+, NIl'
Е . . E P
ADP, Mg2" , NI"
Аналоrичным образом в отсутствие ВI3:у'l'рикле-fочноrо N а 1, но
В ПРИСУ'!'ствии К I С обеих сторон мембраны N al-Hacoc осущеСТDЛЯет
неэлеКТРО1'енный обмен К' через мембрану, не ПрИБОДЯЩИЙ к со-
зданию калиевоrо rpадиента. При э'!'ом требуется присутстnие внут-
риклетОЧНОl'О Р" или АТР. Кt/КI- обмен осуществляется OДHOBpe
менно с реакцией;
К'
E P _........... Е 2 + Р Н
Р,К'
В отсутствие К. и Na+ во внешней среде Na'-Hacoc может обес
печивать несопря:женный выброс Na+, осуществляющИйся в про-
цессе 1'идролиза АТР. Стехиометрия работы насоса в этом режи
ме составляет 2 3 иона Na+ на 1 моль АТР.
Nа+.А'rФазная реакция отличается по ряду свойств от Na+, К+-
АТФазной реакции: она подчиняется кинетике Михаэлиса, :имеет
линейный rра.фик Аррениуса, требует меньшей концентрации MgC1 2
и инrибируется высокими I\Онцентрациями А'!'Р, хотя почти He
47
чувствительна к Рп' Разница между несопряженным и сопряжен
ным выбросами Na+ состоит в чувствительности к АТР. Несопр.я:
.iI}енныЙ выброс N а + ДОСТИ1'ает максимальной скорости уже при
1 мкмоль/л A'l'P, а Nа+/К+ обмен требует миллимолярных KOHцeH
траций субстрата. Следовательно, два типа функционирования
Na+ Hacoca, как и два способа работы А'l'Фазы, отличаются функ
ционированием лишь субстратных центров с высоким сродством
(Na+, К+ АТФаза) или обоих типов субстратных центров.
Чувствительность Na+, K-I АТФазы и Na+ Hacoca к одновалент
ным катионам одинакова. Этот факт можно рассматривать как
доказательство идентичности центров активации Na+, К+ АТФа
зы натрием и калием и центров, обеспечивающих их транслока.
цию. Об этом же свидетельствует соответствие стехиометрии
транспорта ионов (Na+/K+ == 3/2) количеству ионсвязывающих
участков на одной молекуле фермента.
Процесс переноса ионов через мембрану с помощью натриево
ro насоса не требует затрат энерrии, если исключить работу по
переносу нескомпенсированно1'О заряда Na+ против трансмемб
ранноro потенциала при электроrенном транспорте. На Э'l'0 YKa
зывает существование в схеме натриевоrо насоса Na+ /Na+ и
К+ /К+ обменов, для которых АТР требуется лишь кюс Iщфактор,
но не источник энерrии. Можно предпола1'ать, что энеРl'ИЯ A'l'P
при работе Na+, К+ АТФазы затрачивается на "узнавание" ионов
Na+ и К+, Т.е. на связывание и сбрасывание ионов с "нужной"
стороны мебраны. В норме катионы связываются с той ее CTOpO
ны, 1'де их мало, а сбрасываются туда, rде их концентрация вели
ка. Такие изменения сродства ионсвязывающих центров сопря
жены с конформационными изменениями фермента, которые и
ЯВЛJIЮТСЯ rлавными энер1'оакцепторными стадиями реакцИИ.
Ионы Na+ и К+ транспортируются Na+ HacocoM в частично
деrидратированном состоянии. Модификаторы rидрофобных вза
имодействий влияют в первую очередь на калиевую активацию,
а вещества, разрушающие водородные связи, на натриевую.
Из ЭТО1'о можно сделать вывод, что связывание Na+ опосредовано
"жесткими" структурами белка, стабилизированными BOДOPOД
ными связями наподобие ИОRОфОрНЫХ структур. Ионы Na+ дe
rидрируются при переходе из водной фазы в полярную полость
молекулы фермента. Ионы К+ де1'ИДРИРУЮТСЯ при переходе в
rидрофобную область молен:улы. Следовательно, Na+, К+ АТФаза
"различает" ионы Na+ И К+, ис[юльзуя различные пути их rидра
48
тации. При отсутствии внеклеточно1'О К+ Nа+/К+ насосы Mo1'YТ
.осуществлять элеКТРО1'енный транспорт протонов, и этот TpaHC
порт осуществляется, по видимому, конформацией Е 2 насосов.
К инrибиторам Na+, К+ АТФазы относятся олиrомицин, уаба
ин, диметилсульфоксид, уксусный альдеrид, ДИ1'итонин, Тимеро
зал, этилмеркуриат. Вместе с тем необходимо отметить, что дей
ствие этих соединений на N а+, К+ АТФазную активность может
быть различным.
Механизм деЙСТВИJI модификаторов трудно поддается клас
сификации: здесь есть areHTbl направленно1'О действия (8H pea
reHTbl: тимерозал, этилмеркуриат, уксусный ан1'ИДРИД), веще
ства, модифицирующие rидрофобные взаимодействия (диметил
сульфоксид, ОЛИ1'омицин, диrитонин), специфический инrиби
тор Na+, К+ /АТФазы уабаин ( строфантин G), препятствующий
rидролизу фосфорилированно1'О фермента. rидролиз одним и
тем же ферментом разных субстратов в различных условиях
неодинаково чувствителен к модификаторам, что можно объяс
нить тем, что исследуемые "частные" реакции ферментативной
активности осуществляются разными олиrомерными состояни
ями Na+, К+ АТФазы.
Таким образом, на современном уровне знаний Na+, К+ АТФаза
представляется олиrомером, в котором взаимодействие между
протомерами выражено сильнее, чем между rлобулами белка и
e1'o липидным окружением. Количество протомеров в таком KOM
плексе определяется, по видимому, той конформацией белка, KO
торую ему диктует ЛИПИДное микроокружение. Сами взаимодей
ствия между протомерами контролируются липидами. Показа
но, что взаимодействия между протомерами фермента в nроцессе
rидролиза АТР не остаются постоянными: доля крупных ассоци
атов АТФазы возрастает на стадии взаимодействия ее с ионами
калия, а подвижность этих ассоциатов в мембране резко увели
чивается при связывании АТР.
Особый интерес представляет проблема вовлечеНИJI N а + ,
К+ АТФазы в общие пути передачи СИ1'нала в клетке, а также ее
фосфорилирование протеинкиназами и взаимодействие с BHYT
риклеточными белками (см. 1'лаву 2). 'Установлено, что а субъ
единица фермента является мишенью для сАМР зависимой' про
теинкиназы (протеинкиназы А) и фосфолипидзависимой проте
инкИназы С н ионов кальция. Противоречивые данные (инrиби
рование, активация, отсутствие эффекта) о характере влияния
4. 3аказ 3788
49
фосфорилирования: Na+, K-1. АrrФазы протеинкиназой А связыва
ют с зависимостью "ответной реакции" белка от e1'o конформа
ционноrо состояния, измен,яющеrося в результате взаимодей
ствия фермента с белками цитоскелета, в частности, аJ:\ТИНОМ.
Однако более детальные исследования по этому вопросу пока
отсутствуют.
1.2.5. Структура, функциональные и некоторые физико,
ХИlftи<tеСlCце свойства ацетЦЛХОJlUllэстеразы
Один из важнейших биохимических механизмов, лежащих в
основе деятельности нервной системы, это химический про
цесс, связанный с биосинтезом, выделением и распадом ацетил
холина. Скорость ферментативно1'О rидролиза последнеrо И1'рает
ключевую роль в функционировании нервной системы. Измене
ния в кинетике ферментативно1'О разрушения ацетилхолина при
водят к серьезным нарушениям функций этой системы. Одна из
областей фармаколо1'ИИ разрабатывает способы лечения заболе
ваний нервной системы путем применения лекарственных
средств, влияющих на кинетические параметры rидролиза aцe
тилхолина холинэстеразами.
После обнаружения Дейлом в 1914 1'. в крови фермента, ка.
тализирующе1'О процесс расщепления ацетилхолина, было пока
зано ШИрОJ:\ое распространение это1'о фермента в различных TKa
нях животных. В 40 e 1'1'. было высказано предположение о cy
ществовании двух основных типов ферментов, 1'идролизующих
эфиры холина, "истинных холинэстераз" и "псевдохолинэсте
раз". Эти ферменты относятся к сериновым 1'идролазам и COOT
ветствуют двум rpуrшам БИОЛО1'ичеСJ:\ИХ катализаторов: ацетил
холинэстеразе (ацетилrидролаза ацетилхолина, ЕФ 3.1.1.7) и xo
линэстеразе (аЦИЛ1'идролаза ацилхолинов, КФ 3.1.1.8). Холин
эстер азы наряду с 1'идролизом ацетилхолина Mo1'YT участвовать
также в межклеточных взаимодействиях. С этим связана специ
фическая экспрессия холинэстераз в эмбриоrенезе в определен-
ных структурах до формирования ХОЛИНЭР1'ичеСJ:\ИХ синапсов, а
также обнаружение их в нехолинэрrических тканях.
Ферментативное расщепление ацетилхолина преДС1'авляет co
бой реакцию 1'идролиза, протекающую с образованием уксусной
кислоты и холина:
(СН)зN+СН2СНРС(О)СНЗ + Н 2 О (СНз)зN+СН2СНРН + СНзСООН
50
Основное наЗI:lачение холинэстеразы нервной ткани быст
рый rидролиз выделяюще1'ОСЯ ацетилхолина, без KOToporo невоз
можна передача нервных импульсов. Обнаружено, что фермента
тивный I'ИДРОЛИЗ ацетилхолина может осуществляться не толь
ко нервной, но и дРУ1'ими тканями: присутствие холинэстеразы
было выявлено в сыворотке и эритроцитах крови, в мышечной
ткани, печени, поджелудочной железе. Считают, что холинэсте
раза эритроцитов И1'рает важную роль Б клеточной проницаемо
сти. Холинэстераза крови и тканей рассматривается как своеоб
разный защитный (<<аварийный") фермент на случай знач:итель
ных выходов в кровяное русло ацетилхолина при перевозбужде
нии нервной системы.
К ацетилхолинэстеразам относятся ферменты нервной ткани
и эритроцитов, а к холинэстеразам ферменты сыворотки KpO
ви, печени, поджелудочной железы и ДРУ1'их opraHoB. Ацетилхо
линэстераза катализирует rидролиз ацетилхолина и ацетил
метилхолина и не вли,я:ет на rидролиз бензоилхолина и бути
рилхолина. ХОJIинэстераза катализирует rидролиз БУТИРИЛХОJIИ
на, ацетилхолина, беНЗ0илхол:ина и пропионилхолина, но не дей
ствует на ацетил метилхолин. Активность ацетилхолинэстера
зы характеризуется отчетливым максимумом при концентра-
ции ацеТИЛХОJIина 2'lO 4 моль/л и тормозится при ее увеличе
нии, в то время как на активность ХОJIинэстеразы не влияет из-
бы'rок ацетилхолина. Оптимум pH-действия составляет для aцe
тилхолинэстеразы 7 ,5 8,O, а для холинэстеразы 8,5 (рис. 12).
В каталитическом действии холинэстераз обоеrо типа при-
нимает непосредственное участие 1'идроксильна,я: rруппа ОДНО1'о
из остатков серина, раСПОJIоженноrо на активной поверх:в:ости
фермента. Однако такой rидроксил должен быть специфически
активирован, чтобы приобрести способ:а:ость к участию в катали-
тическом действии. Эта активация может быть осуществлена пу-
тем взаимодействия с rруппировкой белковой молекулы, харак-
теризующейся величиной рК 5,8 7,O. Предпола1'ают, что такой
1'руппировкой является остаток 1'истидива. Доказано наличие в
холинэстеразах обое1'О типа аниОнной rpуппировки, несущей еди
ничный отрицательный заряд и взаимодействующей с катион-
ной rруппировкой субстрата ацетилхоли:в:а, а также катион-
содержаЩИХ инrибиторов. В активном центре холинэстеразы
вблизи серина находитс,я: остаток rлутаминовой кислотЫ. Прове
дены расчеты электростатическо1'О потенциала и электрическо1'О
4' к
51
поля BOKpyr наиболее важноro в Ka
талитическом отношении "roрла"
ацетилхолинэстеразы, включаю
щеrо серив, rистидин и I'лутэ.мат.
Из результатов исследования
рН зависимости действия холин
эстераз следует, что их активность
связана с функциями rpуппиров
ки, рК которой составляет 8,5
10,0. К таким rpуппировкам MO
2 жет быть отнесен I'идроксил тиро
зина. В образовании фермеЕ:т суб
10 cTpaTHoro комплекса ацетилхолин
эстеразы участвует в качестве обя
зательных не менее трех связей.
Во всех современных схемах Me
ханизма действия холинэстераз
фИ1'урируют: 1'идроксил серина,
связанный с и:м:идазолом I'истиди
Ha t в качестве постулированной "Уилсоном нуклеофильной 1'руп
пировки эстеразноro центра; ионизированная карбоксильная 1'руп
па в качестве анионно1'О центра; 1'идроксил тирозина в каче
стве кислотной rруппы эстеразно1'О центра.
Считают, что каталитический процесс (рис. 13) начинается с
образования электростатической связи между катионом субстрата
и анионной 1'руппировкой фермента. Нейтрализация отрицатель
H01'O заряда одной из 1'рупп белковой молекулы в сочетании с
взаимодействием трех метильных 1'рупп при атоме азота aцe
тилхолина с окружающими анионный центр rpуппами приводит
к существенным изменениям конформации фермента. В резуль
тате это1'О 1'руппировки эстеразно1'О центра и соответствующие
rруппы субстрата занимают положение, обеспечивающее YCTaHOB
ление "наилучшей" комплементарности, а затем образуются свя
зи между У1'леродом поляризованной карбонильной 1'руппы и
кислородом 1'идроксильной rруппы серина и, возможно, между
эфирным кислородом и водородом КИСЛОТНОЙ 1'руппировки (OCTa
ток тирозина). Далее происходит переход протона к холину с
образованием ацетилированно1'О по I'идроксилу фермента и про
тонированно1'О имидазола. Следующий элементарный акт с учас
тием воды осуществляется после TOro, как молекула холи на по
v, %
100
80
60
40
20
о
5
8
рН
Рис. 12. Зависимость CKOpO
сти I'идролиза ацетилхол:ина от
рН для ацетилхолинэстеразы
Torpedo marnlOrato (1) и холин
эстеразы сыворотки крови (2)
6
7
9
52
кинет анионный центр фер
мента и восстановится отри
цательный заряд анионной
rpуппировки. Молекула BO
дЫ образует связи с карбо
нильным кислородом и кис
лородом тирозина, в резуль
тате че1'О происходит пере
ход протона к I"идроксилу ce
рина. При этом выделяется
второй продукт реакции
уксусная кислота и pe1'e
нерируется фермент В исход
ной конформации.
Эксперименты Е. Krejci и
соавт. (1991) с направлен
ным :м:ута1'енезом показали,
что консервативный для эс
тераз и липаз остаток аспа
раI"ИНОВОЙ кислоты необхо
дим для осуществления ими
каталитических функций.
По видимо:м:у, электростати
ческие особенности поверх
ности молекулы ацетилхо
линэстеразы не влияют на
скорость катализа, которая
не зависит от диффузии MO
лекул субстрата, а стабили
зация переходных состояний
в катаЛИТIIческом центре He
чувствительна к электроста
тическим взаимодействиям.
Для выделения ацетилхо
линэстеразы из эритроцитов
используют метод экстрак
ции фермента из стромы ще
лочным буфером В присут-
ствии нейтрально1'О дeTep
reHTa :rвин 20 с последую-
CHz
N:1 \.....
NH
I
CH z COO
1 I
ОН I
, +
"..COCHzCHzN (СНз)з
НзС 11 HO тир
О
I I
CH z СН
k'Gн i9 2 I
H I
I I +
';: OCHzCHzN (СНз)з
НзС I
I
Н
(Ь
I
t
CHz
HNrI
'\.....NH
I
COO
1+
N (СНз)з
I
9Н2 o
9Нz
он
I I
СН 2 f1 СН
HNt> . t 2
НзС"" "'(I Н
О Н
1
1
I
1
O
I
Рис. 13. Схема механизма дей.
ствия холинэстераз
53
щим фракционированием сульфатом аммония и отделением 1'e
моrлобина с помощью кальций фосфатноrо rеля. Молекулярная
активность (т.е. число молекул субстрата, претерпевающих пре
вращение на одном активном (каталитическом) центре фермен
та в 1 мин в условиях насыщения фермента субстратом) ацетил
холинэстеразы составляет (3 3,5)'105 мин l И превышает в 4
5 раз таковую для холинэстеразы сыворотки крови.
Зависимость 19 v от l/Т для фермевтативно1'О 1'идролиза эфи
ров холи на холинэстеразой сыворотки крови лоmади (1'рафик Ap
рениуса) в интервале температур lO 25 'с является линейной
(рис. 14). В случае 1'идролиза ацетил метилхолина константа
Михаэлиса не зависит от температуры, для ацетилхолина и бен
зоилхолина не значительно
растет по мере ее повышения,
а для бутирилхолина суще
ственно увеличивается.
Ацетилхолинэстераза эри
троцита расположена на ввеш
ней поверхности мембраны и
составляет O,2 O,3 % от Bce
1'0 мембранно1'О белка. Она яв
ляется rликопротеином, в co
став KOToporo входят 1'ликано
вые компоненты, содержащие
последовательность: этанола
мин фосфатманноза l'лю
козамин инозитол. Фермент
может быть экстраrирован в
форме активноrо липопротеи
3 на при обработке мембраны
растворами высокой ионной
силы, Nа дезоксихолатом или
3,5
1/Т.10 З тритоном X 100. Удаление
липида приводит к полной по
тере активности фермента, а
последующее добавление фос
фатидилсерина (липида, с KO
торым он выделяется из MeM
браны) к восстановлению ее
функциональных свойств.
Ig(v max ' 1 0--8)
2
4
2,4
1,6
0,8
3,3
3,4
Рис. 14, 38БИСИМОСТЬ 19v от 1fТ
для ферментативноrо rидролиза
эфиров холина при действии холин
эстеразы сыворотки крови лошади:
1 ацеТИЛХQЛИН; 2 бутирилхо
лин; 3 ацетил,Р метилхолин; 4
бензоилхолин
54
Ацетилхолинэстераза состоит из двух одинаковых субъединиц
с молекулярной массой, равной 70 90 кДа. Каждая субъединица
имеет два центра связываНИJI: активный и аллостерический. Aк
тивность фермента зависит от ионно1'О состава среды и специфи
чески инrибируется ионами тетраметиламмония, производными
карбаминовой кислоты и фосфоорrаническими соединениями.
Показано, что хлорпирофосметил (ХПМ) являеТся сильным HeKOH
курентным инrибитором ацетилхолинэстеразы из эритроцитов че
ловека. При растворении ацетилхолинэстеразы в тритоне X 100 ее
активность и кинетические свойства не изменяются, а также co
храняется чувствительность к ХПМ. Предполarают, что на участ
ки связывания ацетилхолинэстеразы и ХПМ не влияет 1'идрофоб
ное окружение мембран эритроцитов. Ацетилхолинэстераза явля
ется aJtлотопньt.М фер.JИентом: каталитические свойства ее суще
ственно различаются в растворе и в составе биомембран.
Каталитическая активность мембранной ацетилхолинэсте
разы находится под контролем CTPYKTYPHoro состояния ли
ПИДIЮЙ фазы эритроцитарной мембраны. Фосфолипазы (А 2 , С
и D) оказывают на мембраны близкое модифицирующее дей
ствие, хотя они характеризуются не только различной специ
фИЧНОСТЬЮ (природой разрываемых в ЛИI!идах связей), но и
пространственной асимметрией действия. Панкреатическая
фосфолипаза А 2 и фОСфОЛИIIаза D 1'идролизуют липиды, pac
положенные на обеих сторонах эритроцитарной мембраны, а
фосфолипаза С rидролизует фосфолипиды, расположенные на
внутренней ее стороне. Модификация ЛИПИДНОI'О бислая с внут-
ренней стороны мембраны приводит к изменеFj:ИЮ CTPYKTYP
Horo состояния липидов, а затем и белков, расположенных
снаружи. Косвенным свидетельством возможности такой
трансмембранной передачи CTPYKTypH01'o сиrнала может слу.
жить отрыв ацетилхолинэстеразы от мембраны под влиянием
фосфолипазы С (И. Д. Волотовский И соавт., 1987). Обработка
любыми фосфолипазами как бы превращает мембраносвязан
ный фермент в квазисвободный.
Следует отметить, что поскольку функциональные свойства
ацетилхолинэстеразы существенно зависят от CTPYKTypHoro co
стояния мембраны, то определение уровня ее активности исполь
зуют в качестве конформационноrо маркера для оценки различ
HOI'O рода модификаций мембранных компонентов под влияни
ем физико химических факторов (см. 1'лаву 4).
55
Кроме To1'o, активность холинэстераз изменяется при МНО1'их
патолоrических процессах: заболеваниях печени, почек, остром
инфаркте миокарда, онкозаболевавиях, в послеоперационном пе
риоде, при интоксикации фосфорорrаническими соединения:м:и,
поэтому эта характеристика белковой молекулы может быть ис
пользована в энзимодиа1'ностике.
1.3. уrЛЕВОДЫ МЕМБРАН
Уrлеводные компоненты биомембран входят в состав rлико
липидов, rликопротеинов и мукополисахаридов. В табл. 7 CYM
мированы сведения о составе, локализации и функциях выше-
названных структурных элементов мембран.
Таблица 7
У'zлееоiJные компоненты 6иомем6ран
Соединения Уrлеводные Друrие ЛО1Сализация Функции
1Сомпоненты компоненты
r ликолипиды rлюкозз., rаЛaRтоза, Цервмид. Плазматиче- Участие в
(т ликосфинrо- проиэводные эми- N.ацилъное ская: мембра- меж:клеточных
липиды) носахаров rлю1СОЗ- производное нз.,мембрана взаимодей-
амин а и rалактоз- сфинrозина митохоид- ствиях, обеспе-
вмина, ФУRоза, сиа. рий и эндо- чение антиrен-
ловые Itислоты плазматиче- ных свойств
ской сети мембран
rликопро- 4 8 OCTaTRoB БеЛRИ Плазматичес- Обеспечение
теины сахз.ров: rлюкоза, (rликозиль, :кие мембра- антиrенных
rалактоза, манноза, ную связь ны, ме-мбра. свойств ме-м-
производные rлю- образуют ас- ны зндопла.з- брав, участие в
Rозэмнна и парarиноJШЯ мз.тической иммунолоrиче-
rалактозамина и rлутамино-- се')'и с:ких реакци-
вая RИСЛОТъr, ях; в процес-
серии, трео- синrе пост-
ннн) трансляцион-
ном формиро-
вании слож.
ных молеltул
со специфиче-
скими Фун:к-
циями; в ста-
билизации бел-
:ковых молекул
Му:кополисаха- IIлaзматиче- Участие в фор-
риды ская: мембра- мировании по-
rиалуроно:ва.я Мономер дисаха- иа верхностиоro
кислота рид (rлю:куроноJШЯ потенциала, в
1<.ислота + ацетил- осуществлении
rлюкозамин) межклеточных
Хондроитин, r люкуроновая: Сульфат контактов и
сульфат кислота + ацетил- транспорте
rалактозамин веществ
56
В состав клеточных мембран некоторых орrанизмов входит
хитин rомополимер ацеТИЛ1'люкозамина (у беспозвоночных
животных). муреин или пеПТИДО1'ликан (у бактерий), мономером
KOToporo является дисахарид муропептид (ацеТИЛ1'люкозамин +
+ ацетилмурамовая: кислота).
В плазматической мембране количество уrлеводов невелико
по сравнению с белками и липидами и составляет от 2 до 10 %
сухой массы мембран. В распределении уrлеводов также, как бел
ков и липидов, наблюдается асимметрия: они локализованы на
той стороне мембраны, котора.я: не контактирует с цитозолем. В
качестве биохимическоrо маркера для изучения локализации и
выделения локусов плазматической мембраны, содержащих y1'
леводы, используют лектины белки растительноrо и животно
1"0 происхождения, специфически связывающие сахара. Их Ha
зывают уrлеводраспознающими белками, отличающимися от фер
ментов и антител и не вызываЮЩIJМИ ХIJмические превращения
в распознаваемом ЛИ1'анде.
К классу лектинов (фитоreмar1'ЛЮТИНИНОВ), которые способны
а1'1'лютинировать клеТIJ,;И млеКОI!ИТающих, относится KOHKaHaBa
лин А. Он является 1"ликопротеином, С9СТОJIЩИМ из двух субъеди
ниц (изолектинов) с молекул.я:рной массой 260 кДа; каждая coдep
жит 237 аМИНОКIJСЛОТНЫХ остатков; при рН > 7,0 представляет
собой тетрамер. Этот rликопротеин имеет два центра связывания
Са 2 + , два центра связывания ДРУ1'их металлов, два центра связыва
ния сахаров. Кон канав алин А способен к взаимодеЙСТВIJЮ со спе
цифическими уrлеводными rруппами на поверхности клеток, а
именно с D 1"ЛЮКОЗОЙ и D маннозой интеrpальных белков и, в час
тностц, 1'ликофоринов. Образует нерастворцмые комплексы с био
полимерами, содержащими множественные а D 1'люкошrранозиль
ные, а D маннопираноз:ильные и D фруктофуранозильные OCTaT
ки в качестве невосстанавливающих :r:сонцов.
Лектины IJмеют важное практическое значение для медиц:й:
ны, связанное с их способностью "различать" эритроциты трех
rpупп крови (А, В, О) по структуре ОЛИ1'осахаридных компонен
тов rликофорина. Специфические 1'ликопротеИБЫ обнаружива
ются на поверхности не только эритроцитов. но IJ ДРУ1'их клеток
живых тканей. Именно вследствие валичия этих 1'ликопротеи
нов при трансплантации op1'aHoB неоБХОДIJма идентичность TKa
ней донора и реципиента. Кроме тoro. установлено, что HeKOTO
рые лектины вызывают избирательную а1'rлютинацию злокаче
57
ственных опухолевых клеток, указывающую на различия в CTPYК
туре их поверхности по сравнению с нормальными клетками.
Связывание лектинов с поверхностью плазматической мембраны
может индуцировать изменения в расположении поверхностных
беЛ1<ОВ и rликопротеинов, физическом состоянии липидов мемб
ран, проницаемости их для различных веществ и активности MeM
бранных ферментов.
Выявлены основные типы взаимодействий, приводящих к об
разованию уrлевод-белковых комплексов с участием лектинов:
rидрофобные взаимодействия боковых радикалов аминокислот с
пиранозными циклами сахаридов; водородные связи между ато-
мами боковых радикалов Asn, Asp, Arg, амидных и карбониль-
ных rрупп уrлеводраспознающе1'О саша и rидроксилами caxa
ридных остатков; ван-дер ваальсовые взаимодействия; участие
молекул воды в образовании водородных связей; участие ионов
двухвалентных металлов в комплексообразовании (О. С. Мирош-
ниченко, 1999). Установлено, что в распознавании лектинами
остатков Gal, в отличие от остатков Glu и Мап, большую роль
И1'рает положение в rексозах rидроксила 4 OH. "Уrлеводраспоз
нающие сайты Mo1'YТ быть сформированы различными участка-
ми полипептидной цепи. Получены доказательства способности
лектинов распознавать помимо уrлеводных функционально по-
добные пептидные ЛИ1'анды (по карбоrидратнезависимому пути).
Были идентифицированы пептиды, имитирующие связывание
метил а D м:аннозида и а D маннозы с кон:канавалином. Счита
ют, что лектины и ле:ктиноподобные белки, которые представля-
ют собой мулътидоменные молекулы, вовлекаются в различные
типы взаимодействий с разными веществами при участии отлич
ных от У1'леводраспознающих доменов. Критическим парамет
ром лиrанда для успешноrо распознавания леl(тинами является
e1'o конформация. В заключение следует подчеркнуть, что лек
тины способны участвовать в широком спектре реrуляторных
процессов: эмбриоrенезе, иммунолоrических реакциях, oHKore-
незе, белковом синтезе и др.
1.4. ТИПЫ ВЗАИМОДЕЙСТВИЙ
МЕМБРАННЫХ КОМПОНЕНТОВ И ИХ РОЛЬ
В ФУНКЦИОНИРОВАНИИ БИОМЕМБР АН
в природной мембране взаимосвязь белковой молекулы с ли-
пидным бислоем определяется, по всей вероятности, балансом
58
водородных связей, электростатических и ван дер ваальсовых вза
имодействий между липидом, водой и "соседними" белковыми
молекулами. Липид белковые взаимодействия условно подраз
деЛЯIOТ на взаимодействия типа белок липидный монослой, бе-
лок липидный бислой, а также липид беЛIi.овые взаимодействия,
включающие липид-зависимые ферменты.
Термин "поrраничный липидный слой" был введен в связи с
появлением и развитием концепции о существовании особоrо
"стационарно1'О" слоя липидов, связанно1'О с поверхностью бел
ковой молекулы, в котором физико химические параметры ли
пидов отличаются от таковых в основной части бислоя. Под "CTa
ционарностью" понимают отсутствие липидноrо обмена за Bpe
мя, сравнимое с временем оборота фермента (",10 З с). ПО1'ранич
ные лип иды называют также aJtJiY.1LflpllblMU. В то же времн нет
убедительных экспериментальных доказательств различноrо по
ведения ПО1'раничных липидов и липидов основной части бислоя.
Это связано с использованием разных методов исследования, для
которых характерны неодинаковые временные интервалы изу
чения динамики липидных молекул.
В 70-е 1'1'. первым исследованием упаковки липидов вблизи
мембранно1'О белка в небольших временных интервалах (:::; 10 8 с)
было определение подвижности спин меченной жирной кислоты
в реконструированной системе цитохромоксидаза ЭНДО1'енные
митохондриальные фосфолипиды методом ЭПР. в дальнейшем
подобные эксперименты проводились с использованием цито-
хромоксидазы и цитохрома Ь 5 и липидных бислоев, содержащих
1'рамицидин А, а также мембраны микросом печени крысы, эрит-
роцитов, вирусов Синдбис и везикулярноrо стоматита. Было по-
казано, что значительная часть липидов в этих мембранах иммо-
билизована за счет белок-липидных взаимодействий. Количество
иммобилизованных липидов при температурах 20 40 'с COCTaB
ляет примерно 0,2 м!' на 1 м!' беЛI<а (47 молекул фосфолипидов на
белковый комплекс) цитохромоксидазы, что соответствует при
близительно одному слою липидов BOKpy1' белковой rлобулы. При-
мерно такое же количество (45 90) молекул иммобилизуется за
счет взаимодействия с Са2+ АТФазой саркоплазматическо1'О ре-
тикулума. Понижение температуры может приводить к возрас
танию количества иммобилизованных липидов в 2 3 раза.
Существование участков липидно1'О бислоя (аннулы липидов)
с более плотной упаковкой и меньшей подвижностью У1'леводо
59
родных цепей в модельных и природных биомембранах. было по
казано также и с помощью ДРУ1'их физико химических метоДОВ
(ямр, комбинационное рассеяние света, метод флуоресцентных
зондов). Однако впоследствии концепция "поrранично1'О липи
да" была подверrнута критике. Результаты, полученные с помо-
щью метода 2Н Я:М:р, свидетельствуют о том, что поrpаничные
липиды быстро обмениваются с основной массой липидов в бис
лое (скорость обмена весьма велика 107 C l). Кроме Toro, в
присутствии белков упорядоченность связанных липидов (т.е.
транс rom-конформации ацильных цепей) почти не изменяется,
а скорость переориентации У1'леводородных цепей слабо YMeHЬ
шаетсн (= на 20 %) в частотном диапазоне 109 C l. По данным
яМР, трансмембранные белки весьма незначительно влияют на
ориентацию и динамику липидных молекул и их полярных ro-
ловок. Эти результаты были подтверждены и некоторыми дpy
rими методами, например, инфракрасной спектрофотометрией с
фурье преобразованием.
Противоречивые данные получены также при исследовании
избирательности связывания белков с различными фосфолипи
дами. Так, селективность взаимодействия фосфолипидов, несу-
щих определенные полярные rруппы, была выявлена для родоп
сина, Na+, К+ АТФазы из Squalus acantus, цитохром с оксидазы,
Са2+ АТФазы. Вместе с тем мноroчисленные эксперименты по ре-
активации выделенных мембранных ферментов путем добавле
ния ЭКЗО1'енных липидов и детер1'ентов показали, что в больmин
стве случаев не существует специфических белок-липидных вза-
имодействий, обеспечивающих ферментативную активность; раз
ные типы липидов Mo1'YT одинаково влиять на функционирова
ние мембраносвязанных белков. Несмотря на то, что взаимодей-
ствие липидов с инте1'Ральными белками носит в основном 1'ид
рофобный характер, электростатические силы связывания заря
женной 1'идрофильной части белковой молекулы и полярных
rрупп окружающих липидов MorYT существенно влиять на xa
рактер липидноrо микроокружения белка. Кроме TOro, для акти-
вирующеro действия липидов по отношению к некоторым мемб
равным ферментам важны такие факторы, как степень подвиж
ности ацильных цепей и способность липидов образовывать ми-
целлы. По видимо:м:у, сродство разных липидных молекул к бел
кам мембраны определяется не спецификой белков, а специфи-
кой липидных молекул.
60
В последнее время внимание МНО1'их исследователей cocpeдo
точено на изучении связывания с липидным бислоем перифери
ческих мембранных белков. Ряд периферических белков взаи
модействует с мембраной путем связывания с интеrралъными бел
ками. В то же время значительное количество белков связывает
ся непосредственно с поверхностью липидноrо бислоя, причем
некоторые из них способны к взаимодействию 'l'олько в опреде
ленных условиях и на непродолжителъное время. Иноrда такое
взаимодействие является необходимым условием проявления
функциональной активности мембранно1'О фермента (протеинки
наза С, пируватоксидаза, фю,торы свертывания крови).
По видимому, типы взаимодействия между периферически
ми мембранными белками и фосфолицидным бислоем весьма
разнообразны: связывание с участием амфифильных о; сцираль
ных участков, электростатичеСI<ИХ сил, 1'идрофобных взаимодей
ствий, ионов Са 2 +. Для изучения связывания цериферических
белков с фосфолицидами используют следующие методы: ЯМР,
ИЕ сцектрофотометрию, люминесценцию, светорассеяние и др.
В настоящее время активно исследуется роль цроцессов адсорб
ции и десорбции ферментов важнейших метаболических путей в
реrулировании их функциональной ак'l'ИВНОСТИ (раздел 2.3.2).
Белок белковые взаимодействия в мембранах характеризуют
ся высокой специфичностью и ПРОЯВЛЯIOтся В виде обратимой
внутримембранной аrреrации мембранных белков, которая co
провождается изменением функциональной активности всей си
стемы. При температурах ниже температуры фазовых переходов
липидов белки находятся в аrреrированном состоянии, а при TeM
пературах выше фазовых переходов в диспеР1'ированном co
стоянии. Считают, что это происходит вследствие "выталкива
ния" белковых молекул из упорядоченной rелевой фазы. CTe
пень дисперrированности белков в мембране контролируется
фазовым состоянием липидов. Имеются данные, свидетельству
ющие о том, что при частичном удалении липидов из мембраны
цроисходит усиленная а1'реrация белков, а при введении в мемб
рану небольших количеств детер1'евта наблюдается диссоциация
олиrомерных молекул, например, Са 2 + АТФазы.
Степень аrреrированности белков определяется несКОJ[ЬКИМИ
факторами: энтропией смешивания "раствора" белков :в липиде;
прямыми белок белковыми взаимодействиями, включающими
ковалентные, водородные, солевые связи, электростатические и
61
дисперсионные силы притяжения, способствующие в целом об
разованию белковых arperaToB; равновесием в системе ПО1'ранич
ный липид общая липидная фаза с учетом количества моле
кул ПО1'раничных (аннулярных) липидов. Процессы аrре1'ации
дезаrpе1'ациИ мембранных белков проявляются при пиноцитозе,
взаимодействии и слиянии мембран, на разных стадиях клеточ
Ho1'o цикла.
Необходимо подчеркнуть, что для инте1'ральных белков MeM
бран, по-видимому, характерно формирование иммобилизован
Horo кольца (аннулы) ПО1'раничных липидов с нарушенной упа
ковкой ацильных цепей, контактирующих с 1'идрофобной час
тью молекулы белка. Однако комплекс белка с поrраничным
липидом представляет собой динамическое образование, Bpe
мя существования KOTopo1'o исчисляется микросекундами. Ли
пидное кольцо является более "твердым" по сравнению с ос-
тальной частью бислоя, если последний находится в жидком
состоянии. но более "жидкое", если бислой нахор;ится в 1'елеоб
разном состоянии. По всей вероятности, состав и фазовое со-
стояние (а именно жидко кристаллическое) липидов аннулы
важ.ны, прежде Bce1'o, для функционирования мембранных бел
ков ферментов .
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Дайте характеристику основных rpynn лиnидов мембран про. и
эукариотических орrанизмов.
2. Какие особенности структуры мембранных ЛИIIидов обеспечива-
ют выполнение ими различных функций?
3. Опишите основные свойства ЛШlидов биомембран и типы связей
меж.ду ними.
4. Что представляют собой фазовое состояние и фазовые переходы
липидов в мембране? Какие факторы влияю'!' на фазовое СОС,!'ОЯНИе MeM
бранных липидов?
5. Обоснуйте утверждение: "Фазовые переходы липидов обуслов
ливают функциональное состояние мембраны".
6. Что такое аннулярные липиды, в чем состоят особенности их
структурно-функциональноrо состояния и значение для Функциониро
вания мембран?
7. На ка.кие rpynnbI подразделяют мембранные белки?
8. Каковы особенности строения молекул интеrральных белков MeM
бран в связи с выполняемыми ими функциями?
9. Что ТаЕое асимметрия компонентов мембран, каковы ее причины
и значение для нормальноrо функционирования биомембран?
62
10. Какова роль периферических белков в С'l'абилизации биомемб.
ран?
11. Какие функции выполняют мембранные АТФазы? Раскройте
механизм фующионирования Na+, К+ АТФазы плазматических мемб.
ран.
12. Каковы особенности структуры мембранных yrлеводов в связи с
выполняемыми ими функциями?
13. Что представляют собой 6елок липидные взаимодействил в мем,
бранах? Какие типы связей участвуют в их поддержании?
14. Используя ма.териал rлавы 1 и приложения, ОПИIШIте С'rроение
и функции эритрОцитарных мембран.
15., Что понимают под терминами "кинки" и "динамические дефек,
ты", какова их роль в функционировании биомембран?
16. Используя материал rлав 1 и 5 (раздел 5.1), ОIIИIIШте методы (с
указанием их принципов, ДОС'l'оинств И недостатков), :которые исполь.
зуются длл:
а) изучения белок липидных взаимодействий в мембранах;
6) изученил фазовых переходов в липи,цном бислое;
в) исследования особенностей :конформационноrо состояния мемб.
ранных белков.
17. Какова роль мембранных липидов в осущеС'l'влении важнейших
метаболических процессов в клетке?
I'ла:ва 2
УЧАСТИЕ КОМПОНЕНТОВ БИОМЕМБРАН
В ОСУЩЕСТВЛЕНИИ И РЕI'УЛИРОВАНИИ
МЕТАБОЛИЧЕСКИХ ПРОЦЕССОВ
в настоящее время не вызывает сомнений тот факт, что биоло
1'и:ческие мембраны иrpают ключевую роль в процесс ах приема,
переработки и передачи информации в клетке, обеспечивающих
СО1'ласованное протекание множества биохимических реакций ц&-
лостноrо орrанизма. Изучение молекулярных механизмов реryля.
ции клеточноrо метаболизма с помощью внешних (перви:чных) и
внутриклеточных (вторичных) СИ1'налов (проблемы клеточной сиr
нализации) является предметом пристальноI'О внимания биофи
зиков, биохимиков, молекулярных биолоI'ОВ, иммунолоrов. Эта стре-
мительно развивающаяся область мембранолоI'ИИ как комплеКС.
ной научной дисциплины начала развиваться во второй половине
хх века после открытия Е. Сазерлендом (Нобелевский лауреат,
1971) циклическоI'О аденозин 3,5.монофосфата (сАМР) и создания
концепции вторичных сиrналов (мессенджеров). Рассмотрим бо
лее подробно основные принципы функционирования систем по-
лучения и переработки информации в клетке.
2.1. ОБЩАЯ ХАРАКТЕРИСТИКА ПРОЦЕССОВ
ПЕРЕДАЧИ ИНФОРМАЦИИ В I ЛЕТКЕ
Внешний СИ1'нальный a1'eHT, называемый lzервu't/;н.ы.м .мессе",-
джером, как правило, не проникает внутрь клетки, а специфи
чески взаимодействует с рецепторами наружной клеточ:вой мем-
браны. В качестве первичных мессенджеров выступают различ
ные химические соединения (1'opMoHbl, нейромедиаторы) или фи
зические факторы (квант света). Однако I'идрофобные стероид-
ные и тиреоидные I'ормоны способны диффундировать через ли
пидный бислой внутрь клетки и связываться с растворимыми
рецепторными белками. Если внешняя СИ1'нальная молекула воз
действует на рецепторы клеточной мембраны и активирует их,
то последние передают полученную информацию на систему бел
ковых компонентов мембраны, называемую каскадом передачи
сиrнала. Мембранные белки каскада передачи СИI'нала подразде-
ляют на белки преобразователи, связанные с рецепторами, и фер
менты-усилители, связанные с белками-nреобразователями и ак-
тивирующие вторичные внутриклеточные мессенджеры, перено
64
с,ящие информацию ВНУТРЬ клетки. В роли вториl/ЛЫХ .мессе но-
жеров выступают малые молекулы и ионы: сАМР, циклический
I'уанозин 3, 5 монофосфат (cGMP), инозитол l ,4,5 трифосфат (IP з)'
диацилrлицерол (DG), арахидоновая кислота, ионы кальция. BTO
ричные мессенджеры характеризуются следующими свойствами;
имеют небольmую молекулярную массу и с высокой СКОрОС'l'Ью
диффундируют В цитоплазме; быстро расщепляются и быстро yдa
ляются из цитоплазмы (например, ионы кальция выкачиваются
во внешнюю среду или поступают во внутриклеточные депо с
помощью Са2+ А'l'Фаз). В противном случае система передачи ин
формации будет функционировать в ОТСУТС'fвие первичноrо Mec
сенджера, что приведет к нарушению протекания :м:етаболичес
ких реакций в клетке и возникновению патолоrических состоя
ний орrанизма. rrаким образом, процесс передачи внешнеrо сиr-
нала с помощью внутримембранных :компонентов каскада пред
ставляет собой совот упность последовательных стадий измене-
ния конформационноrо состояния и функциональной активнос
ти белков, связанных друr с дPY1'oM непосредственно или опосре
дованно с участием ДРУ1'их стру:ктурных элементов мембран.
2.1.1. Особенности структуры и функций
.lftе.мбраШtых рецепторов
В плазматических мембранах про- и эукариотических кле-
ток локализованы различные специализированные рецепторн:ые
системы, процессы функционирования которых включают реа-
лизацию следующих стадий:
связывание первичноrо мессенджера с рецептором;
передачу информации о связывании внешнеrо сиrнала с
рецептором на мембранные беJIковые компоненты каскада;
формирование первичноrо и вторичноrо клеточноrо ответа.
Обнаружены суперсемейства рецепторных белков со сходной
первичной структурой, но различными фующиями, взаимодей
ствующих с определенным типом лиrандов и вызывающих раз
витие специфическоrо клеточно1'О ответа (табл. 8).
Большинство рецепторов представлены олиrомерны::м:и мемб-
ранными белками rЛИI(.опротеинами. Функции рецепторов мо-
ryт выполнять И мембранные rан1'ЛИОЗИДЫ. Взаимодействие pe
цепторов с ЛИ1'андами специфично: молекулы инициаторы
трансмембранной передачи сиrнала активируют рецепторы, воз
действу,я на последние в :концентрациях 10-8 моль/л и менее.
5. Заказ 3788
G5
Таблица 8
Некоторые суперсе.мейства структурно роосmвеЮlЫХ
рецепторов .ме.ll'lбран эукарuот
м Суперсемейство рецепторов Функции
п/п
1 Иммуноrлобулиновое суперсемейство: Развитие иммуно-
Т клеточный рецептор лоrических реакций
r ла:вный комплекс rистосовместимости
класса II
IgА/IgМ рецепторы
Поверхностные иммуноr лобулины
2 Интеrрины: Связывание с :КОМПО-
Фибронектиновые рецепторы нентами внекле-
rликопротеиновый комплекс точноrо матрикса и:
тромбоцитов белками адrезии
ЛеЙl<оцитарные беЛl<И адrезии
3 Рецепторы митоrенов факторов роста, Стимуляция
обладающие ТИРОЗИНl<иназной аl<ТИВ- l<леточноrо роста
ностью:
Рецептор фактора роста эпидермиса
Рецептор фактора роста производных
тромбоцитов
J1нсулиновый рецептор
4 Рецепторьt нейромедиаторов ионные ка- Каналы,
налы: функционирующие
Никотиновый ацетилхолиновый как рецепторы
рецептор
Рецептор 'У-аминомасляной l<ИСЛОТЫ
r лициновый рецептор
5 Рецепторы, активирующие G беЛЮ1: Участвуют в
f3-АдренерrичеСl<ие рецепторы а!,тивации G -беЛl<ОВ
а-Адренерrические рецепторы
Опсины родопсин
Мускариновые ацетилхолиновые
рецепторы
Для обеспечения рецепторной функции молекулы белков дол-
жны отвечать ряду требований:
а) обладать высокой избирательностью к ЛИ1'анду;
б) :кинетика связывания ЛИ1'анда должна описываться кривой
с насыщением, соответствующим состоянию полной заня'rости всех
молекул peцeIIТOpoB, число которых на мембране О1'раничено;
в) рецепторы должны обладать тканевой специфичностью,
отражающей наличие или отсутствие данных функций в р;лет
ках орТ'ана мишени;
r) связывание лиТ'анда и e1'o клеточный (фИЗИОЛО1'ический)
эффект должны быть обратимы, параметры сродства должны co
ответствовать фИЗИОЛО1'ическим концентрациям лиТ'анда.
66
ЛИ1'анд рецепторные взаимодействия реализуются при помо
щи слабых нековалентных сил: эле:КТРОСТ8.'fических, ион диполь
ных, ван дер в8.альсовых и 1'идрофобных взаимодействий, BOДO
родных связей.
Рассмотрим основные СВОЙС'l'ва рецепторов плазматической
мембраны клетки и формирование первично1'О ответа.
1. Рецепторы, сопряжщшые с G-белкам:к
Эти рецепторы образуют KOMnJIeI(C с мембранными GТР свя
зывающими белками (G-белн:ами). Первичными сиrналами для
этих рецепторов служат низкомолекулярные 1'ормоны и нейро
трансмиттеры(адреналин,норадреналин,ацетилхолин,серотонин,
rистамин), пептидные и беш(овые ropMoHbI (адреНОI(()РТИКОТРОП
ный ropMoH, соматостатин, вазопрессин, 1'онадотропные ropMo-
ны). Один и тот же первичный мессенджер может инициировать
передачу сиrнала с участием последовательности разных рецеп
'Х'оров G-бел:ков. Эти рецеП'I'ОРЫ ПрЕ)ДС'l'авляют собой моно мерные
интеrраЛЫlые мембранные бещ(и, lюлипеП'l'идная цепь которых
семь раз lIересеl(ает клеточную мембрану. При связывании ли
rанда с рецептором измеJ:шется I:tонформационное состояние ком-
плекса рецептор G белка G беЛ(щ. В результате облеrчается
обмен связанноrо с G беЛl(ОМ GDP на G'rp (рис. 15). Аюивиро-
Лиrанд
---+
беЛОК 6
мишень ..........,..
сАМР
Вторичный
ответ
Рис. 1.7. Схема эффеI 'rов, индуцируеМ"IХ присоединением лиrан,ца :к
рецетору (R), COl1p-яжеш-IOМУ с: G-бел:кпм (РI1зви'rие первичноrо OTBe'l'a)
АТР
\lIGDP 1 ..........
+Рп
5'"
67
ванный таким образом G белок, связанный с GTP, может OTдe
литься от рецептора, а e1'o субъединица а взаимодействует в pe
зультате это1'о с мембранными белками мишенями (аденила'r
циклазой, ионными каналами, фосфолипазой С).
Обнаружено около 20 типов различных G белков*. Они явля
ются 1'етеротримерами, которые состоят из субъединиц трех ти
пов: а, р, 'У. В норме две последние субъединицы функционируют
как единый Р'У комплекс. На а субъединице локализован центр
связывания 1'уаниловых нуклеотидов. В табл. 9 представлены
характеристики некоторых G белков.
Все G белки прочно связаны с плазматическими мембрана
ми, за исключением трансдуцина, который in vitro ле1'КО OTcoe
диняется от мембраны. Ни одна из субъединиц не является TpaHC
мембранным белком. Однако а субъединица может быть ацили
рована и при соединяется к мембране с помощью ковалентно свя
занной жирной кислоты.
При переходе СИ1'нала в каскаде: рецептор G белок
эффекторный белок исходный внешний СИ1'нал способен к MHO
1'ократному усилению (амплификации). Это связано с тем, что
одна молекула рецептора, находясь в активированном состоя
нии В результате присоединения ЛИ1'анда, переводит в активи
рованную форму несколько молекул G белка. При Э'l'ом коэф
фициент усиления внешнеrо сиrнала может составлять 102
103, так как на каждую молекулу рецептора приходится He
сколько сотен или тысяч образующихся молекул G белка. На
следующей стадии каскада (G белок ----+ эффекторный белок)
каждая молекула активированно1'О G белка взаимодействует
только с одной молекулой эффекторно1'О белка, но в ответ на
это в цитоплазме образуется (распадается) большое количество
молекул вторичноrо мессенджера. В результате суммирования
процессов амплификации внешнеrо сиrнала в каскаде: рецеп
тор ----+ G белок ----+ эффекторный белок коэффициент усиления
может составлять 105 100.
"Выключение" каскада передачи внешнеrо СИ1'нала осуще
ствляется различными способами: путем диссоциации СИ1'наль
ной молекулы из комплекса с рецептором; путем фосфорилиро
вания реце пторов с участием протеинкиназ; в результате rид
'" За открытие G белков и изучение их роли в трансдукции сиrнала
в клетке А. fuлману иМ. Родбеллу в 1994 r. присуждена НобелеВСltая
премия.
68
Таблица 9
Свойства и функции некоторых G-tJеЛКО8
Моле!(улярна.я:
Рецепторпый Бело!( масса субъеди- Чувстви.
G-беЛОR беЛОI( (беЛRИ) (беЛIШ)- ФУННЦИЯ ниц, нДа тельность
мишень а. у ,( тО!(сину
Gs (очищен -Адреп()рrиче- Адепилат- Стиму- 45 52 35 36 8 Холерный
до I'OMOl'eH- СI(ие рецепторы цит,лаза ля:ция токсин
HOI'O со- ([31 И ,)
СТОЯНИЯ)
Gi (очищен а.Адренерrиче- Аденилuт ИПl'иби 41 35 36 8 КОRJПОШ-
ДО rOMoreH СIШИ рецептор цюшаза ровапис ВЫЙ
поl'О co Мускариновый токсин
стояния) холинерrичесний
рецеп 'ор
Аl адспозиповыи
рецептор
Д2-дофаМИIIОВЫИ
рецептор
Опиатпыи
рецептор
Gt (трапе- Родопсин cGMP-спе- Стиму 39 36 8 Коклюш
дудин, цифичная Jt5ЩИЯ ныи И
очищен до фосфоди- холерпый
l'oMoronno- ОC'I'ераза токсипы
1'0 состоя Фосфоли-
ПИЯ) паза А."
Go (очи- ОПИ!\ТIIЫЙ Потеп- 3Ш,РЫШI- 39 35 36 8 КО!<JДОШ
щен до I'o рецептор (Мозr) цимзапи !пre ный
MOronnOI'O симыи !(ав: ала ТОI,СИН (1)
СОСТОЯНИЯ) Са 2".I<uнал
Gp МУСI(ариновыи Фосфати- Стимуля.
холиперrи'Iесн:ии ДИJIИнози ция
рецептор толеl1еци
Вазопрессиновый фичпая
рецептор фосфоJIИ
АнrиотеII3ИВIIЫИ паза С
рецептор
rgE-рецептор с
высоким cpoд
ством
Gk МУСI(ариповый К' I(Uнал OTI(pLIBa 1
холиверrичесн:ий (?) ние
рецептор I<анала
Дофаминовый
рецептор
rистамиповый
рецептор
ролиза связанноrо с G-белками GTP дО G DP, а также восстанов-
ления исходноrо уровня внутриклеточноrо вторичноrо мессенд-
жера в цитоплазме.
69
2. Ионные каналы, фуmtциопярующие Italt реIJ;епторЫ
Они представляют собой интеl'ральные мембранные белки,
полипеПТИДные цепи которых несколько раз пронизывают ли
пидный бислой. Связывание аrониста с рецептором при водит к
открыванию канала и селективному изменению ионной прони-
цаемости мембраны. К таким рецепторам ионным каналам
относят лиrандуправляемые ионные каналы, ЯВЛЯIощиеся рецеп
торами нейротрансмиттеров (см. табл. 8).
Наиболее I'лубоко изучены никотиновые ацетилхолиновые
рецепторы (холинорецепторы) в скелетных мышцах и электри-
ческих opraHax ската и Уl'ря. Холинорецептор состоит из четы
рех Т'ликозилированных субъединиц ()', (50 кДа), [3 (54 кДа),
у(56 кДа) и 0(58 кДа) с молярным соотношением 2:1:1:1, имеет
"rрибовидную" форму и ориентирован перпендикулярrrо поверх-
ности мембраны. Катионпый канал холинорецептора открывает-
ся при взаимодействии двух молекул а1'ониста (ацетилхолин, Kap
бамилхолин, суберилхолин) с участками связывания двух ()',-субъ-
единиц рецептора. Малоселективные катиоrmые каналы нико-
ТИНОВОl'о ацетилхолиновоТ'о рецептора неnpоницаемы для ионов.
3. Рецепторы, обладаIOщие ферментативв:ой: активностыо
Представляют собой моно- или ОЛИl'омерные белки, имеющие
центр связывания первичноrо мессенджера, локализованный на
внешней поверхности мембраны. На внутреннюю (цитоплазма
тическую) сторону мембраны обращен каталитическ й участок,
активируемый в результате воздействия на молекулу рецептора
внешнеrо сиrнала. К рецепторам, обладающим ферментативной
активностью, относят рецепторные протеинкиназы, способные
аутофосфорилироваться и фосфорилировать беЛIщ-мишени по ти-
розиновым остаткам, а также протеинтирозинфосфатазы, дефос
форилирующие фосфотирозиновые остатки беЛЕ.ов-мишеней. Опи
участвуют в реryлировании процессов деления клетю-r, их диф-
ференцировании, развитии ИММУННОl'о ответа. Рецепторные rya-
нилатциклазы, катализирующие синтез cGMP из GTP, необходи
мы для реryляции водно-солевоl'О обмена и тонуса сосудов.
Развитие вторичноrо (н:леточноrо) ответа в результате фУНЪ:-
ционирования компонентов каскада передачи внешнеl'О сиrнала
реализуется на разных уровнях: транскрипции, трансляции и на
уровне изменения ctpyktypho-фун:кциопалыIOI'О состояния I<ЛIO
чевых внутрин:леточных белков. Последний мехапизм ВI<лrочает
обратимую ковалентную модификациIO белков (фосфорилирова
70
ние, метилирование, ацилирование), изменение функциональных
свойств белков непосредственно или опосредован но под действи
ем вторичных мессенджеров, модуляцию свойств олиrомерных
белков посредством ассоциации ДИссоциации субъединиц, об
ратимые переходы белков из свободно1'О состояния в связанное
(изменение компартментализации)*. Более подробно некоторые
из вышеназванных способов реrулирования метаболических про
цессов описаны в разделе 2.3.
2.1.2. А;;еНUJlатЦI.tJслаЗIiЫй путь переоач.u CUZfla.1la
Наиболее полно охарактеризованы два основных пути пере
дачи информации в клетке, I{OTOpbIe различаются природой и
свойствами вторичных мессевджеров. В аденилатциклазном пути
в качестве внутриклеточноI'О посредника выступает цикличес
кий аденозинмонофосфат. В фосфоинозитидном пути действует
rруппа мессенджерОБ: ионы кальция и образующиеся из мемб
равных фосфолипидов инозитолтрифосфат и диацилrли:церол.
Схема аденилатциклазно1'О пути передачи информации в клет
ке представлена на рис. 16.
Стимулирующий
внешний сиrнап
...
Инrибирующий
внешний сиrнал
t
белок
е Выкпючение r ( )}
t неактивныи
АТР сАМР + А киназа:(2: КсАМР + С Р
I белок-Р
4- (активный)
+
клеточный
ответ
Рис. 16. АденилаТЦИI ла3IIЫЙ: ПУТ!, передачи информации: R. и R,
соответственно стимулирующие и инrиБНРУIOщне рецепторы; G. и G 1
соответственно стимулирующие и Юlrибирующие G-бещ и; АС aдe
нилаТЦlшлаза; А юшаза протеИШШ:Н<lЗ8 А; R и С реrУЛЯТОРП8Я и
r<RталитичеСI<. ая субъедипицы протеинRиназы А
: За ОТI рытие обратимо!'о фосфорилировав:ия: бещюв I Щ БИQлоrи
чес]иТ'о реТ'УЛЯТОрIIО!'О механизма Э. Фишеру и Э. Кребсу в 1992 1'.
ПрИСУЖД6па НобелеВСI<.ая Пр6МИЯ.
71
.Стимулирующие Gs белки взаимодействуют со стимулиру
ющими рецепторами G белков (Rs), а ИН1'ибирующие Gi белки
с инrибирующими рецепторами (Ri). Связывание внешней СИ1'
нальной молекулы с рецептором индуцирует конформационные
изменения последнеrо, которые передаются на G белки. В OT
вет на это G белок приобретает способность присоеДИБЯТЬ GTP
и воздействовать на функциональную активность адеНИJIатцик
лазы ('f.e. "усилительноrо" фермента). Gs белок активирует aдe
нилатциклазу, а Gi белок инrибирует ее (см. табл. 9), Актив
ность комплекса Gs GTP подавляется в результате rидролиза
GTP дО GDP, катализируемоrо 1'уаНОЗИН'J.'рифосфатазой. Инrи
бирование этоrо фермента холерным токсином приводит к YBe
личению времени жизни комплекса G белок GTP. Клетка
начинает вырабатывать сАМР независимо от действия внешне
ro сиrнала. В клетках кишечника сАМР вызывает сильную сек-
рецИЮ жидкости, что приводит К тяжелой диарее, которой CTpa
дают больные холерой.
Конечные стадии передачи сиrнала осуществляются с участи-
ем сАМР зависимых протеинкиназ (А Iщназ). сАМР специфи-
чески связывается с ре1'УЛЯТОРНОЙ субъединицей протеинкина-
зы. Это приводит К активации каталитической субъединицы белка
и ее отделению от реI'УЛЯТОРНОЙ. IСаталитическа-я: субъединица в
свободном состоянии может фосфорилировать определенный бе
лок, активация KOToporo и обусловливает ответ клетки на воз-
действие внешнеrо сиrнала.
2.1.3. ФосфоultозuтuiJный путь nepeiJartu uнформациu
В этом механизме передачи СИ1'нала в клетку активное учас
тие принимают мембранные фосфолипиды, в частности, фосфа
тидилинозитол, на долю KOTopo1'o приходится от 2 до 8 % фосфо-
липидов клеточных мембран.
Внешний СИ1'нал после взаимодействия с рецептором акти-
вирует Gр белок (рис. 17), а затем "усилительный" фермент
фосфодиэстеразу (фосфолипазу С), которая расщепляет фосфа-
тидилинозитол-4,5 дифосфат (PIP 2) на водорастворимый инози-
тол-l,4,5-трифосфат (IР з ) и липидораСТБОрИМЫЙ диацилrлице
рол (DG). Инозитолтрифосфат и диаЦИЛ1'лицерол являютс-я: вто-
ричными мессенджерами. rидрофильный инозитолтрифосфат
диффундирует в цитоплазму и вызывает освобождение ионов
Са 2 + из внутриклеточных депо (ЭНДОIJлазматический ретикулум,
72
Мембрана
белок
J IP3 (не:: t: :IЙ) ...... Клеточный
(активный) ответ
е t
Са 2 + -4 Ca2' СаМ -4 киназа
t
белок
Эндоплазмвтический (неактивный)
ретикулум
Рис. 17. ФосфоинозитидныЙ ЛY'lЪ лередачи сиrнала: PIP 2 фосфа.
ТИДИЛИlIози:тол-4.,5 дифосфа'r; ФлС фОСфОЛИП8З8 С; IР з ИНОЗИ'l'ол
1,4.,5 трифосфа'l'j DG диацилrлицерОЛj С-киназа лротеинкинаЗ8 С;
РВ фосфатидилсеРИНj СаМ калъмодулив:
митохондрии). Ионы кальция образуют I(.омплекс с Са2 свя
зывающим белком кальмодулином (СаМ), ar<тивируIOЩИМ ки-
назу, катализирующую фосфорилирование неак'!'ивноrо белка.
Активация фосфорилированноrо белка обусловливает развитие
клеточноrо ответа.
Оставшийся в мембране диаЦИЛ1'лицерол активирует проте
инкиназу С (С киназу). Протеинкиназа С в присутствии кислоrо
фосфолипида фосфатидилсерина и ионов кальция катализи
рует присоединение фосфата к неактивному белку. В результа'rе
фосфорилирования белка развивается ответная реакция клетки.
ДиаЦИЛ1'лицерол может подвеР1'аться дальнейшим превраще
ниям. Диацилrлицеролкиназа в присутствии А'!'Р фосфорилиру
ет диаЦИЛ1'лицерол с образованием фосфатидной кислоты. Пред
пола1'ают, что последняя способна выполнять роль ионофора (под
вижно1'О переносчика) для ионов кальция. При переносе этих
ионов через плазматическую мембрану образуются участки с не-
бислойной структурой, Т.е. каналы для проникновения ионов Са 2 +.
Кроме Toro, под действием диаЦИЛ1'лицероллипазы из диацил-
1'лицерола образуется арахидоновая кислота, окисляющаяся за
тем до БИОЛО1'ически активных метаболитов эйкозаноидов, KO
торые сами являются эффективными модуляторами разнообраз
78
ных реакций в клетке. Фосфоинозитиды реrулируют процессы
деления клеток, секреции ropMoHoB, транспорта ионов.
Структурные аналоrи диацилrлицерола форболовые эфи
ры способствуют развитию злокачественных опухолей. Они
имитируют действие диаЦИЛ1'лицерола и обеспечивают передачу
пролиферативно1'О сиrнала, однако в орrанизме не расщепляют
ся:. Вследствие этоrо каскад передачи сиrнала функционирует
непрерывно и способствует активации процессов клеточноrо дe
ления. Изучение действия токсинов и химических a1'eHToB, спе
цифически взаимодействующих с компонентами системы пере
дачи сиrнала, необходимо для выявления молекул.ярныIx Mexa
низмов внутриклеточной СИ1'нализации, а также развития пато
лоrических состояний орrанизма человека.
Необходимо отметить, что вышеописанные механизмы пере
дачи информации имеют MHoro общих черт и включают реализа
ЦИIO трех основных этапов:
взаимодействие рецептора с первичным мессенджером;
изменение конформации и функциональных свойств MeM
бранных белков посредников (белка "преобразователя" и фермен
Ta "усилителя");
активацию вторичных мессенджеров, взаимодействие ко-
торых с определенными структурными компонентами клетки ин-
дуцирует быстрое распространение сиrнала по всей клетке.
2.2. РОЛЬ ИОНОВ В ОСУЩЕСТВЛЕНИИ
МЕТАБОЛИЧЕСКИХ ПРОЦЕССОВ
С УЧАСТИЕМ МЕМБРАН
Ионная ре1'УЛЯЦИЯ является одним из важных механизмов
управления внутриклеточными процессами. Изменения ионной
силы или ионноrо состава в клетке влияют на arpe1'aTHoe состоя-
ние и характер движения протоплазмы, функциональное COCTO
яние орrанелл, конформацию и взаимодействие биомакромоле
кул, изменяют активность и специфичность ферментов и муль
тиферментных систем и Т.д. В осуществлении и реrулировании
различных метаболических процеССQБ в клетке активное учас
тие принимают, прежде Bcero, ионы металлов. Одновалентные
катионы участвуют в реrуляции внутриклеточноI'О рН, являют-
ся кофакторами МНО1'их ферментов, обеспечивают электрические
свойства мембран клеток. Установлено, что они контролируют
активность и специфичность более 100 ферментов. Большинство
74
белков активируется калием; функциональная активность HeKO
торых подавляется натрием, Например, 1'ликолитические фер
менты стимулируются ионами калия цитоплазмы. Эксперимен
тальные данные, свидетельствующие о взаимосвязи активноrо
транспорта одновалентных катионов с уровнем клеточноrо ды
хания, леrли в основу создания концепций ионной ре1'УЛЯЦИИ
температуры тела теплокровных животных, соrласно которым
скорость метаболических процессов и соответственно теплопро
дукции ре1'улируется концентрацией ионов в клетках и среде.
Ионь'I Na+ и К! широко распространены в неживой природе.
В клетке эти ионы распределены неравномерно: ионы натрия
выбрасываются из клетки, ионы калия накапливаются в ней. В
результате создается разность концентраций одновалентных ионов
на клеточной мембране, необходимая для rенерации возбужде
ния в нервных и мышечных кдетках. Первично ю тивный тpaHC
порт ионов, осуществляющийся с использованием энерrии АТР
или окислитеЛЫIO восстановительных реакций, происходит с уча
стием транспортных АТФаз (см. раздел 1.2.4). Однаl О 1'радиент
концентрации одновалентных ионов необходим и для функцио
нирования систем вторично аl ТИВНО1'О транспорта (в том числе
сахаров и аминокислот). В клетке ионы :калия являются актива
торами МНО1'их ферментативных процессов, та:ких как синтез aцe
тилхолина, синтез белка на рибосомах, дыхание митохондрий,
ДНК полимеразная и РНК полимеразная реакции, фосфо
фруктокиназная реакция.
В противоположность ионам калия ионы натрия aI<ТИВИРУ
ют лишь синтез липидов и являются инrибиторами МНО1'их кле
точных реакций. Кроме Toro, одновалентные катионы участвуют
в реrулировании осмотическоrо баланса орrанизма, а та:кже мо-
дифицируют конформационное состояние молекул белков и HYK
леиновых кислот.
Важную роль в жизнедеятельности клетки иrрают ДBYXBa
лентные катионы Са 2 + и Mg2+.
Ионы кальция представляют собой единственный универ
сальный вторичный мессенджер животных и растительных кле
ток. Различают три состояния кальция в клетке:
Са2+, локализованный внутри клеточных ОР1'анелл (эндо
плазматическоrо ретикулума, митохондрий);
хелатированный кальций, связанный с анионами и белка
ми цитозоля;
75
свободный или ионизированный Са 2 +, находящийся в paB
новесии с хелатированным кальцием.
Внутриклеточные процессы реrулирует свободный или иони
зированный кальций. В состоянии покоя концентрация кальция
в цитоплазме поддерживается на уровне 10 6 10 7 моль/л. Низ
кий уровень этих ионов в состоянии покоя связан с функциониро
ванием специализированных мембранных систем: Ca 21 -АТФазы
плазматических мембран, вьшачивающей Са 21 против концентра-
ционноrо 1'радиента из клетки во внешнюю среду; Na+ /Са2+ обмен-
ника, осуществляющеrо в зависимости от условий обмен внутри
клеточноrо Са 2 + на внеклеточный Na'; Ca 21 -АТФазы мембран эн-
доплазматическоrо ретикулума, откачивающей кальций из цито
плазмы и накапливающей e1'o внутри замкнутых цистерн ретику
лума; транспортной системы митохондриальных мембран, перека
чивающей Са 2 + из цитоплазмы в матрикс митохондрий (рис. 18).
Стимуляция клетки путем воздействия ropMoHoB на специ-
фические рецепторы плазматической мембраны и активация вто-
ричных мессенджеров приводит к резкому кратковременному YBe
личению концентрации Са 2 + в клетке до 10-5 моль/л. Ионы каль-
ция взаимодействуют с особыми кальцийсвязыающимии белка-
ми и тем самым влияют на разнообразные метаболические про-
цeccы. К таким белкам относят кальмодулин, тропонин С сер-
дечных и скелетных мышц, кальбиндин кишечника, кальрети-
нин нейронов, онкомодулин плаценты и опухолей и др.
Са 2 + -связывающие белки ре1'улируют в клетке транспорт каль-
ция, активируют ферменты, реrулируют состояние цитоскелета
клетки и клеточный цикл, способны контролировать процессы
транскрипции и апоптоз (ПРО1'раммируемую 1'ибель клетки).
Са2+-связывающие белки, секретированные во внеклеточное про-
странство, Moryт выступать в качестве факторов роста, влияют
на хемотаксисы, взаимодействуют с компонентами внеклеточно-
1'0 матрикса.
В эритроцитах действие ионов Са 2 + опосредуется кальмоду-
лином. Наиболее вероятными мишенями для кальмодулина cpe
ди белков цитоскелета эритроцита являются спектрин, белок по-
лосы 4.1, аддуцин (белок цитоскелета, обеспечивающий взаимо-
действие спектрина с актином). Кальмодулин инrибирует взаи-
модействие в цепи спектрин актин белок полосы 4.1. YBe
личение I<онцентрации Са 2 + в цитоплазме приводит к изменению
формы, снижению деформабильности, уменьшению продолжи
76
Реrуляция метаболизма
Са"
Na' Са2+
АТР
Са 2 > 'СВ>l3ЫВi:lющие
белки
1
Реryляция метаболизма
Са 2 >
Рис. 18. СхеМllтичес!{ое изображение неКО'l'ОРЫХ мембранных си.
стем клетки, учаС'fВУЮЩИХ в 'l'ранеПОР'l'е ионов Са 2 +: 1 Ca2'I-каналы
плазМa'rическоЙ мембрнны; 2 Сн 21 .АТФнза плазма'l'ическоЙ мембра.
НЫ; 3 Na+/Ch 2t -оБМfiННИК; i фосфоипозитидныЙ ПУ'fЬ передачи ин
формации В кле'rку (Н рецеП'l'Ор, G G белOI{, ФлС фосфолипазаС,
PIP 2 фосфаТИДИЛИНОЗИ'fол 4,5 дифосфа'l'; lРз ИНОЗИ'l'0J[ 1,4)5 три
фосфат); 5 Са2+-каналы эндоплазматичесн:оro ретикулума (ЭР); (j
Са 2 +.АТФаза эндоплнзматическоrо ре'l'и!;:улума
тельности жизни эритроцитов. Кальций и каЛЬМОДУJtин вызыва
ют обратимое снижение стабильности мембран эритроцитов.
Инкубация эритроцитов с подвижными переносчиками (ионофо
рами) Са 21 " при МИЛЛИМОЛЯРНЫХ eI:'o I<онцентрациях индуцирует
сфероцитоз и уменьшение площади кле'I'ОЧНОЙ поверхности. KOH
центрация Са 2 + в эритроцитах определяется балансом между ero
активным транспортом из цитоплазмы в плазму крови и пас
сивным потоком в обратном направлении, который лимитиру
ется активностью рецептор и потенциалуправляемых кальцие
Bыx каналов мембраны. Следовательно, в клетке осуществляется
тесная взаимосвязь между состоянием мембранно1'О скелета, ypOB
77
нем протекания метаболических процессов и функционирова
нием систем пассивно1'О и активно1'О транспорта.
Ионы Mg2+ способны модифицировать конформационное co
с'rояние молекул белков, выступать в качестве субстра'rсвязыва
ющих ионов и переносчиков электронов. Mg2.' необходим в Ka
чеС'l'ве кофактора для более чем сотни ферментов, входит в co
став фотосинтетическо1'О ПИ1'мента растительных клеток хло.
рофилла.
В табл. 1 О приведена сравнительная характеристика KOHцeH
траций ионов внутри и снаружи типичной животной клетки.
Анализ приведенных в ней данных дает возможность констати
ровать, что значительные различия в ионном составе цитозоля
и внеклеточной жидкости позволяют клеточным мембранам aK
кумулировать потенциальную энерrию в виде 1'радиентов KOH
центраций ионов, используемую для осуществления различных
процессов клеточноrо метаболизма.
Таблица 10
Концентрации ионов внутри и снаружи животной lCлетlCИ
Компонент
Катионы:
Na+
К+
Mg2+
Са+
Н+
Анионы:
CI
Внутриклеточная
концентрация, ммоль
Внеклеточная концентрация,
ммоль
5 15
140
0,5
10 4
8'10 5 10 7.1 моль или рН 7,1
145
5
1 2
1 2
4-10 5 10 1.4 моль или рН 7,4)
5 15
110
2.3. МОЛЕКУЛЯРНЫЕ МЕХАНИЗМЫ ИНТЕrРАЦИИ
КЛЕточноrо МЕТАБОЛИЗМА
2.3.1. Механизмы реzулирования фующион.алыiйй щстИ81wсти
ферментов и ферментн.ых систем в lC.летlCе
Биомембраны не только представляют собой места локализа
ции МНО1'их важнейших ферментов и ферментных систем клет
ки, но и принимают непосредственное участие в их осуществле
нии и реrулировании. Р. Б. rеннисом (1997) предложена услов
ная классификация типов ферментов, функцио:нирование KOTO
рых тесно связано с мембранами:
78
1. Трансмембранные ферменты, ка'rализирующие сопряжен
ные реакции на противоположных сторонах мембраны. Они име
ют несколько активных центров, сопряжение между которыми
осуществляется с помощью потока электронов, rенерирующих
трансмембранный элеКТI)ический потенциал. К ним относятся
фотосинтетические реакционные центры растений и бак'rерий,
цитохром С оксидаза митохондрий, рецепторы, обладающие про
теинкиназной активностью.
2. Трансмембранные ферменты, учаС'fВyIOщие в транспорте Be
ществ, Это транспортные АТФазы, охарактеризованные в l'лаве 1.
3. БеЛIШ, являющиеся компонентами электронтранспортных
цепей. Наиболее типичные ферменты ЭТО1'о класса компонен
ты дыхательной цепи митохондрий, ферменты системы элект
pOHHo1'o транспорта микросом, элементы фотосинтетической элек
тронтранспортной цепи в тилакоидах (в частности, различные
цитохромы). Остается открытым вопрос об образовании устой
чивых комплексов ферментов названных CTPYI<TYP и длительно
сти их жизни.
4. Ферменты, способные использовать мембраносвязанные суб
страты. Это ферменты, участвующие в метаболизме :компонентов
мембран: фосфолипидов, rликолипидов, стероидов; в процессин
1'e мембранных и секреторных белков; их примером являются
ра:шичные фосфолипазы,
5. Ферменты, использующие водорастворимые субстраты. 'raK,
ацетилхолинэстераза, каталиэирующая 1'идролиз ацетилхолина,
фиксируется, по-видимому, в постсинаптичеСI<ОЙ мембране с по
мощью IФвалентной сшивки с фосфатидилинозитольным f'лико
липидом.
6. Ферменты, способные обраэовывать мембраносвязанный
комплекс. Мембрана при этом служит своеобразным орrанизу
ющим каркасом, с которым св,я:зываются rrериферичеСlше фер
менты с образованием мультиферментно1'О комплекса. Это фер
менты 1'ликолиза и цикла триr<арбоновых кислот.
7. Ферменты, совершающие челночные перемещения между
цитозолем и мембраной, активность которых модулируетс,я: пу
тем связывания с мембраной. Такие ферменты способны взаимо
действовать либо с поверхностью фОСфОЛИПИДЕоrо бислоя, либо
со специфическими беЛlСОВЫМИ рецепторами. К ним следует OT
нести пируватоксидазу из Е. соН, протеинкиназу С, некоторые
ферменты касн:ада свертывания I<РОВИ,
7Н
В целом механизмы реrулирования функциональной актив
ности ферментов и ферментных систем клетки подразделяют на
две 1'руппы (Б. И. KypraHoB, 1986): реrуляторные механизмы,
направленные на поддержание концентраций ключевых метабо
литов на постоянном уровне (механизмы поддержания клеточ
Horo rомеостаза), и ре1'уляторные механизмы "слежения" ("MO
ниторинrа") за сиrналами, поступающими от нервной, 1'ормональ
ной и иммунной систем, реализующиеся с участием вторичных
посредников (рис. 19). Механизмы поддержания rомеостаза и "сле
жения" за состоянием биосистем реализуются на различных ypOB
нях их Ор1'анизации. В частности, механизмы "слежения" зани
мают более высокое положение в иерархической системе ypOB
ней контроля клеточноrо метаболизма по сравнению с м:еханиз
м:ами поддержания rомеостаза.
Для низкомолекулярных катализаторов основными механизма
ми контроля являются механизмы uзосmерUlf.есlCОЙ реzул.я.цuu, pea
лизующиеся в результате прямоrо воздейC'l'ВИЯ модификатора. При
переходе к высокомолекулярным катализаторам возможность ocy
ществления изостерических механизмов сохраняется. Однако в дей
ствии модификаторов изостер:и:ческоI'O типа (например, KOHKypeHT
Механизмы
реl)'ЛИрО8ЭНИЯ
ферментных комплеКСО8
Механизмы
поддержания
rомеостаза
Механизмы
"слежения" с участием
8ТОРИЧНЫХ мессенджеров
Anлостерическая
реryляция
ферментных
комплексов
Адсорбционная
реryляция
ферментных
комплеКСО8
Изостерическая
реl)'ЛЯЦИЯ
ферментных
комплексов
Рис. J 9. Схема механизмов реrулирования активности ферментов 11:
ферментных систем в клетке
80
ных инrибиторов) появляется аллостеричеСI<ая составляющая в том
случае, если фермент олиrомерный и имеет несколько активных
центров. Модификатор, связывающийся в районе а1<ТИВНОro цент-
ра, действует как модификатор изостерическоrо типа на уровне
субъединицы и при этом может по аллостерическому механизму
влиять на функционирование активных центров, локализованных
на друrих субъединицах фермента (т.е. действует как аллостери
ческий эффектор на уровне ферментноrо олиroмера).
Механизм аллоетеРUllеСJCО20 ре2улuрова1iU.я процесса функ
ционирования ферментов обеспечивается узнаванием и связыва
нием метаболита реrулятора в аллостерическом цеН'l'ре. В pe
зультате происходит изменение конформационноrо состояния и
каталитических свойств активно1'О центра белковой молекулы.
Конечный этап заключается в воздействии по принципу обрат
ной связи на источник возникновения ре1'улирующе1'О СИ1'нала:
изменение скорости образования продуктов ферментативной pe
акции, ПОС'I'упающих в цепь последовательных метаболических
реакций, приводит к изменению функционирования фермента,
продуцирующе1'О метаболит реrулятор.
АiJcорt5ЦUО1i1iЫЙ мехаllИ.1М ре2улuроеания активности фермен
тов и ферментных комплексов реализуется при соблюдении сле
дующих условий:
существуе'l' обратимое равновесие между свободной фор
мой фермента и адсорбированным ферментом;
каталитические характеристики фермента изменяются при
ero адсорбции;
обратимое равновесие между свободной и связанной фор
мами фермента является чувствительным к воздейс'rвию кле
точных метаболитов.
Физиолоrическая важность обратимо1'О связывания фермен
тов субклеточными структурами рассматривается в следующих
аспектах:
адсорбция ферментов может приводить к изменению их
каталитических и реrуляторных свойств и, следовательно, явля
ется фактором, реryлирующим активность ферментов;
адсорбция ферментов может обеспечивать компартмента
лизацию метаболитов у поверхности, на которой адсорбированы
эти ферменты;
адсорбированные ферменты способны образовывать упо
рядоченные мультиферментные СТРУl<ТурЫ (метаболоны), блаrо
в. Заказ 3788
81
даря чему появляется возможность реryлировать метаболичес
кий процесс как единое целое;
ферменты, адсорбированные на белковых порах мембран,
Mo1'YТ участвовать в активном транспорте метаболитов через мем,
брану;
адсорбированные ферменты более стабильны, чем свобод
ные ферменты. Таким образом, адсорбция может служить фак
тором, снижающим скорость деrрадации ферментов в клетке.
Рассмотрим адсорбционный механизм реrулирования функ
циональной активности ферментов важнейших метаболических
путей более подробно, так как он реализуется с участием различ
ных мембранных структур клетки.
2.3.2. АiJеорбцuонный .механиз.м реzул.яцuи .метаболиз.ма:
понлтuе о .метаболоне, ею структура,. ФU3UОЛОZUlfДСlCое
значение образованUJl
В последние 1'оды наряду с "классической" энзимолоrией, pac
сматривающей ферментные системы как rомоrенный раствор со
свободно плавающими ферментами: и метаболи:тами, выделилось
направление, основанное на пространственной и структурной opra
низации ферментных систем. В рамках этоrо направления разра
ботаны разли:чные методические подходы для решения пробле
мы надмолекулярной орrанизации метаболических процессов в
клетке. Так, целый ряд работ посвящен экспериментальному ис
следованию. взаимодействия различных структурных компонен
тов клетки с ферментами важнейших метаболических путе,Й, в
частности, 1'ликоли:за.
Впервые взаимодействие rликолитических ферментов со cтpyк
турными белками мышц было описано Н. Arl101d, D. Pette (1968),
которые установили, что на долю F актина приходится больще свя
занных ферментов 1'ликолиза, чем на долю миозина, актомиозина и
белков стромы. Из ферментов наибольшим сродством к F акти:ну
обладает альдолаза, несколько меньшим 1'ли:церальдеrид-3 фос
фатдеrидроrеназа. Определенную способность к взаимодействию
ПРОЯВЛЯIот также фрсфофруктокиназа, 3 фосфоrлицераткиназа, пи
руваткиназа и лактатдеrидРОI'еназа. F. М. Claxke, С. J. Masters (1975)
изучили способность ферментов rликолиза образовывать фермен-
тативно-активные комплексы с F актином и F актин тропомио-
ЗИН тpQпонином из мышц быка. Они показали, что такие фермен
ты, как фосфофруктокиназа, альдолаза, пируваткиназа, лактатде-
82
rидроrеназа, rлю:ко:зо 6 ф()сфатизом:ерааа, леrко ассоциируют с
F актином и нативным тонким филв-м:е:атом. Причем наибольшее
сродство эти ферменты проявляют к I'tомплексу F аЕТИН тропоми
озин тропонин. 'l'риозофосфа'l'изомераза, фосфоrлицераткиназа,
фосфоrлицератмутаза, енолаза и reКСО:Киназа связываются roраздо
медленнее. Наилучшие условия ассоциации наблюдались при фи
ЗИОJIоrическОЙ концентрации солей ". 5,0 мм:оль/л KCl и высокой
концентрации МИО1'ена 35 М1'/мл. Это взаимодействие чувстви
тельно к изменению ИОЕШОЙ силы; :КС1 в :концентрации 150 ммоль/л
предотвращает образование КОМПJlе:ксов.
В опытах по экстра:кции ферментов из I'рудной мышцы КурИ
цы также была показана специфичес:кая адсорбция 1'ликолити
ческих ферментов, особенно I'лицеральдеI'ид 3-фосфатде1'идроrена
зы и лактатдеl'ИДРО1'еназы (J. D. El1rrlann, Н. О. Hu1tin, 1973;
R. L. Me1rlick, Н. О. Hu1tin, 1973), Кив:етические параметры обоих
ферментов при связывавии измен.я:лисъ: максимальная скорость
и КОIхстанта Михаэлиса выше для свободной rлицеральдеI'Иk3
фосфатдеI'идроrеназы; при переходе лю,татдеI'идроrеназы в свя
занную форму предотвращается ее инrибирование пируватом:.
Предположение о существо1Ц'\НИИ на мембране эритроцитов
CTPYK'rypHo УllорядоченrюI'О IЩМПЩН'tса rликолитических фермен
тов было ВЫCl,азан:о еще в 1965 1:'. D. Е. Green et al. Позднее с
использованием ме'rода седиментации на препарате МИОI'ена было
обнаружено увеличение кажущихс.н молекулярных масс альдола
зы, лактатде1'идроrеназы, lIИруваткинаэы и фосфофруктокиназы
(F. М. C1arke, С. ,Т. Masters, 1973). IIолученные результаты подтвер
дИJIИ наличие полиферментных комплеI"сов rликолитических KOM
понен.тов при физиолоrичеСIШХ условиях рН и ионной силы.
На основе анализа данных по ВНУТРИl'tлеточном:у распределе
нию фермен'l'ОВ rликолиза в мышечных :клетках D. Pette (1975)
пришел :к заключению о существовании упорядоченно1'О мульти
фермеIlТНOI'О компле:кса rЛИI<Qлитических ферментов, адсорбирован
ных на СТРУI<ТУРНЫХ беJII\ах мышц. rис'rохимичес:кими исследова
ниями подобный комплекс ферментов был выявлен в изотропной
зоне миофибрилл мышечных ВОЛОI<ОН (Р. 8ige1, D. Pette, 1969).
J. Mowbray, У. Моэеэ (1976) обl:!аружили мультиферментный
комплекс, обладающиЙ аI,ТИlШОСТЯМИ всех ферментов 1'ли:коли
за, в растворимой фрarш;ии разрушенных механическим путем
сферопластов Esc1lericl1ia соН. F. Е. Opperdoes и Р. Borst (1977)
выявили, что полный набор ферментов 1'ликолиза африканской
в..
83
трипаносомы Trypanosoma brucei упакован в примембранной opra
нелле, названной ими "rЛИКОСQМОЙ".
При изучении обратимо1'О связывания ферментов 1'лико
лиза в скелетных мышцах было высказано предположение о
том, что ассоциация диссоциация э'rих ферментов с
сократительным аппаратом является ре1'УЛЯТОРОМ rликоли
тическоrо пути (Т. Р. Walsll et al., 1981).
В ряде работ обс ждается ВОЗМОЖНЫЙ характер прос'rрыrС'l'вен
ной орrанизации комплекса ферментов rликолиза. П. Фридрих
предложил rипотетическую схему расположения ферментов в
мембране эритроцитов (рис. 20). Идея схемы состоит в наложе
нии последовательно расположе:нных ферментов центральной ча-
сти 1'ликолиза на пучок "хвостов" белка полосы 3, имеющих весьма
специфичные участки для связывания каждоrо фермента. Схема
учитывает 'l'!j.Кже возможное участие белков цитоскелета (а:Еt'l'И
на) в процессе связывания отдельных ферментов.
Б. И. KypraнoB и соавт. (1986, 1988) ВЫДВШ'IУЛИ rипотетичес
кую модель структур комплекса 1'ликолитических ферментов в CKe
летных мышцах, а также на. внутренней поверхности мембраны
эритроцитов. Возможность объединения 1'ликолитических фермен-
тов в комплекс предопределена тем, что их молекулы имеют цeHT
ры узнавания своих "соседей", а однозначность сборки ДОСТИ1'ается
тем, что в ней принимает участие якорный белок подложки, на
N N N N N N
Рис. 20. rипотетическая cxelVIa расположения ферlVIентов в lVIеlVIбране
эритроцитов (П. Фридрих, 1986). Димеры B 3 P (белка полосы 3) nOI'PY-
жениые в мембрану reI сaroнальНЫе структуры. Их N К9НЦЫ формируют
В ЛИ1IИДНОIVI бислое каналы для анионов и выступают в цитоплазму. фrк
3 фосфоrлицераткиназа; нь rемоrлобин; rАФД rJПщеральдеrид 3
фосфатдеrидроreназа; Альд. альдолаза; ФФК фОСQюфруктокиназа
Мембрана
Внутри
84
которой формируется комплекс. Комплексы отдельных 1'ликоли
тических ферментов непрочны, что затрудн,я:ет их изучение в pa
створе. :Кооперативность процесса ассоциации при:водит к тому, что
ассоциация должна протекать по принцилу "все или ничеro". KOM
плекс 1'ликолитичесн:их ферментов формируется на тонких нитях
изотропной зоны миофибрилл мышечных волокон, образованных
F -актином и реryляторными белками тропомиозином и тропо-
вином, или на димерах бет а полосы 3, поrруж.енных в мембрану
эритроцитов. ФИЗИОЛО1'ический смысл формирован:ия комплекса
ферментов, участвующих в общем метаболическом пути, на под-
ложке биолоrической природы состоит в том, что клетка получает
возможность pery лировать метаболичеСI УЮ систему как единое
целое с помощью химических СИ1'налов, воздействующих на "якор-
ный" белок подложки (Б. И. KypraнOB, 1986).
ПредполаrаIOТ, что в скелетных мышцах rликолитическая
система стимулируетс,я: ионами Са 2 + , связывающимися с "якор
ным" белком подложки тропонином С. Первый этап сборки
комплекса это, по всей веро,я'l'НОСТИ, посадка фосфофруктоки
назы на "якорный" белок. Остов "ядра" комплекса, так называе
мое "ядрыmко". образуют в мышечной ткани, кроме фосфофрук
'roкиназы, альдолаза и rлицеральде1'идфосфатдеrидроrеназа. В со-
став "ядра" входят rлюкозофосфатизомераза, пируваткиназа,
лактатдеrидроrеназа и фОСфО1'лицераткииаза. Остальные компо
ненты комплекса (фосфоrлицеромутаза, еиолаза, триозофосфати-
зомераза, rлицерол З.фосфатде1'ИДРО1'еназа) занимают, очевидно,
положения на периферии комплекса (рис. 21).
11
CD
Q Q Q Q
I (1) 11 (5) 111 (13) IV (21)
зародыш ядрышко ядро комплекс
Рис. 21. Этапы сБОРI<И I<омплекса ферментов I'ликолиза: n ,я:кор
ный белок подлож:ки; 2 I'ЛЮI<озофосфатизомеразаj 3 фосфоФрук
токиназа; 4 альдолаза; 5 I'лицеральдеrидфосфатдеI'ИДрОI'еназа; 6
фосфоrлицеРa'I'I<иназа; 7 фОСфОI'лицеромутаза; 8 енолаза, 9 пи
руваТЮIназа, 10 лактатдеI'ИДрОI'еназа; 11 триозофосфатизомераза;
12 rлицеРОJI-3-фосфатдеI'ИДРОI'еназа. В СI<обках указаs:о число моле-
кул ферментов в состояниях I IV КОМlшекса
85
. Сборка rликолитическо1'О метаболона на внутренней поверх
ности мембраны эритроцитов происходит на reKcaMepax (триме-
рах димеров) белка полосы 3, имеющих ось симметрии TpeTbero
порядка, перПеНдикулярно к плоскости мембраны. Первым эта
пом сборки комплекса rликолитических ферментов является ад-
сорбция 6 фосфофруктокиназы (ей принадлежит ключевая роль)
на олиrомерах белка полосы 3 (В. И. Kyp1'aHoB, А. Е. Любарев,
1988). Метаболон содержит тройной набор ферментов, ero моле
кулярная масса составляет 4,5'106 Да (рис. 22). Метаболон явля
ется мобильной структурой и находится в подвижном paBHOBe
сии со свободными ферментами, которое контролируется клеточ
ными метаболитами (В. И. KypraHOB и соавт., 1986). Микроком-
10 нм
11
Рис. 22. I1шотетич:еская структура комплекса ферментов rликоли
за, формирующеrося на внутренней поверхности мембраны эритроци-
тов (три проекции) (В. и. KYPl'aнOB, А. Е. Любарев, 1988): Q димер
белка полосы 3; 1 rлюкозофосфатизомераза; 2 6-фосфофруктоки-
наза; 3 фруктозобисфосфатальдолаза; -4 rлицеральдеrидфосфатде
rидроrеназаj 5 фосфоrлицератжиназа; б мультифунжциональный
фермент, обладающий фосфоrлицеромутазной, бис-фосфоrлицеромутаз-
ной и БИС-фОСфОl'шщератфосфатазной акТИБностями; 7 еНОЛ83аj 8
пир'уваткиназа; 9 лактатдеl'идроrеназа; 10 триозофосфатизомера-
за; 11 rлицерол-3-фосфатдеrидроrеназа
86
партмент имеет вход(ы) для поступления исходных субстратов и
выход(ы) конечных продуктов метаболическо1'О пути. "Места"
выхода АТР продукта rли:колитическоrо пути в комплексе
ферментов 1'ликолиза находятся вблизи фосфоrлицераткиназы и
пируваткиназы. По видимому, АТР, продуцируемый фОСфО1'ли
цераткиназой, утилизируется Na+, Kt-АТФазой.
Таким образом, комплекс rликолитических ферментов, aд
сорбированный на димерах белка полосы 3, может находиться в
контакте с Na+, К+ АТФазной системой и обеспечивать потреб-
ности последней в А ТР. Взаимодействия ферментов, входящих
в состав мультиферментно1'О комплекса, обеспечивают вовм:ож
ность ре1'улирования функциональной активности комплекса
как единоrо цело1'О. Роль фаr{торов контроля отводится в дaв:
ном: случае не интермедиатам метаболическоrо процесса, а BHe
mни:м факторам вторичным посредникам, с помощью KOTO
рых осуществляется оптимальное функционирование мульти"
ферм:ентноrо комплекса в рамках системы более BbIcoKoro ypOB
вя сложности, Т.е. в клетке. Рассмотрим это на следующем
примере. Димер белка полосы 3 эритроцитарных мембран спо
со бен взаимодействовать с ионами кальция. Концентрация ионов
кальция в эритроцитах составляет 10 20 мкмольfл. Внутри-
клеточная концентрация кальция может повышаться в ответ
на связывание ropMoHoB и нейромедиаторов соответствующими
рецепторами, встроенными в мембрану эритроцитов (см. раз
дел 2.1.). Изменение степени насыщения якорноrо белка иона
м:и кальция будет приводить к конформационным изменениям:
якорноrо белка и, следовательно, молекул ферментов комплек
са, находящихся в непосредственном контакте с якорным бел-
ком:. В результате изменяются каталитические свойства всех
ферментов rликолиза. Кроме '1'01'0, происходит снятие стеричес
ких затруднений для входа субстратов в микрокомпартм:ент и
дальнейшей химической трансформации в микрокомпартмен
те. Якорный белок центр управления rликолитическим: KOM
плексом может фосфорилироваться с участием протеинки-
ваз, которые активируются сАМР вторичным мессенджером.
Следовательно, сборка ферментов, участвующих в общем MeTa
болическом пути, ПРИВОДИТ I ослаблению изостерических и алло-
стерических м:еханизмов и обеспечивает возможность реализации
иерархически более "BblcoKoro" реryляторно1'О механизма, осуще
ствляющеrо контроль функционирования метаболической систе-
87
мы как целою. Этот механизм контроля реализуется с участием
вторичных мессенджеров, Т.е. является механизмом слежения,
переключающим функционирование метаболической системы в
новый режим в соответствии с СИ1'налами, поступающими от более
высоких уровней контроля метаболизма. Механизм контроля фун-
кционирования мультиферментно1'О комплекса как цело1'О осуще-
ствляется с более высокой скоростью в сравнении с изостерически
ми и аллостерическими механизмами ре1'УЛЯЦИИ.
Мультиферментные комплексы, формирующиеся на подлож
ках БИОЛО1'ической природы, являются мобильными образовани-
ями, которые находятся в равновесии со свободными фермента-
ми. Это обстоятельство определяет возможность эффективноrо
осуществления и взаимодействия в клетке и механизмов 1'OMeo
стаза, и механизмов слежения.
Ферменты, связанные общими ме'l'аболитами или кофермен
тами, находятся в метаболоне рядом дрyr с дрУ1'ом. Это обеспечи
вает эффективное продвижение интермедиатов по конвейеру ак-
тивных центров в микрокомпартменте, образующемся при сбор-
ке метаболона (В. И. KypraнoB, А. Е. Любарев, 1988).
На основе данных о пространетвенной орrанизации метаболи-
ческих процессов в цитоплазме эукариотической клетки А. r. Ря
занов и А. С. Спирин (1989) построили эстафе'l'нyIO модель работы
ферментов в клетке, которая объясняет молен:улярный механизм
компартментализации. Модель основана на трех постулатах: ассо-
циации ферментов с субклеточными структурами, передачи мета-
болитов междУ ферментами без диффузии в растворе идесорбции
ферментов с поверхностей внутриклеточных структур в процессе
К8ЖДоro акта катализа (рис. 23). Важным преимуществом Mexa
низма "эстафеты у поверхности" является то, что он приводит К
Е(Ф Е(1ф .
o \ V Е 2 \ "\
Е,( 1Cif! Е 2 / 11
E2
.... О ......... Ф ......... Ф ......... . ......
Рис. 23. Схема эстафетной передачи метаболитов между фермента
ми у поверхности внутриклеточной cTpyI Typы
88
концентрированию и компартментализации ферментов данно1'О
метаболическоro пути вблизи места ПO'l'ребления конечно1'О про-
дукта. Те или иные МОДИфИI ации ферме1I'l'ОВ или поверхности,
изменяющие их взаимное сродство, создают возможности HOBoro
механизма ре1'УЛЯЦИИ метаболических процессов за счет простран-
cTBeHHoro перераспределения ферментов в клетке,
Концепция метаболической ре1'УЛЯЦИИ посредством динами.
чесн:ой сборки и разборки ферментных комплексов обсуждается
также в работе J. Ovadi (1988).
J. Batke (1989) предложена схема процессов взаимодействия
между ферментами rликолиза в мышцах (рис. 24).
На основании анализа результатов исследования взаимодей-
ствия ферментов цикла трикарбоновых кислот (ЦТК), связанно-
ro со множеством анаболических и катаболических процессов, с
внутренней мембраной митохондрий, а также белок-белковых вза-
имодействий А. Е. Любаревым и Б. И. Кур1'ановым (1987) раз
работана модель, описывающая пространственную структуру KOM
плекса ферментов ЭТО1'о центральноrо метаболическоrо пути.
ПреДПОЛCiжение о существовании комплекса ферментов ЦТК ими
было высказано с учетом следующих экспериментальных дан-
Рис. 24. Схема взаимодействия между ферментами r.JXиколиза в мыш-
цах: ФФI'I: фосфофруктокиназа; фдф фруктозо-l,6 дифосфатаза;
rАФД rлицеральдеrидфосфа1'дех'идроrеназа; фrI'I: фосфоrлицера1'-
киназа; ПI'I: пируваткиназа; лдr лаятатдеrидроrеназа; ТФИ три
озофосфатизомераза; fФД rлицерол 3-фосфатдеrидроrеназа; СаМ
кальмоду.JXИН. Линиями обозначена возможность комплен:сирования in
vitro, цифрами представлены значения Rd в микромол.ях
89
ных И теоретических расчетов: концентрация белка в матриксе
митохондрий, rде локализованы ферменты ЦТК, составляет
40 вес. %; в этих условиях затруднена диффузия молекул фер-
ментов и их кофакторов; среднее расстояние между внутренни
ми поверхностями внутренней мембраны митохондрий сердца со-
ставляет 15 30 нм.
Авторы считают, что комплекс ферментов ЦТК представляет
собой 1'ексамер из шести идентичных асимметричных субъеди
ниц, каждая из которых содержит тетрамер транссукцинилазы,
по одной молекуле остальных ферментов и "якорный" белок. Ком-
плекс "зажат" между противоположными поверхностями BHYT
ренней мембраны митохондрий, причем с мембранами контакти
руют все ферменты, за исключением а. кеТО1'лутаратдеrидроrе
назы и аспарта'l'аминотрансферазы. В качестве "якорных" бел
ков выступают интеrральные белки внутренней митохондриаль-
ной мембраны, в том числе сукцинатдеrИДРО1'еназа. Они обеспе
чивают сборку комплекса ферментов ЦТК на мембране, высота
KOToporo вдоль оси симметрии TpeTbero порядка составляет 20 нм,
а диаметр 50 им. Молекулярная масса (без учета сукцинатде-
1'ИДРО1'еназъr) равна 8 мДа. Структура предложенной модели до-
пускает возможность взаимодействия это1'о комплекса с ДРУ1'ими
ферментами и мультиферментными ансамблями, с которыми он
связан общими метаболитами, и, прежде Bcero, с комплексами
цепи переноса элеl<ТРОНОВ внутренней мембраны митохондрий.
Кроме To1'o, метаболон ЦТК должен взаимодействовать с ДРУ1'и-
ми ферментами матрикса. Для митохондрий сердца в качестве
таких беЛl<ОВ выступают nируватдеrидроrеназный l<омплекс и фер
менты -окисления жирных кислот, поставляющие в ЦТК aцe
тилкофермент А.
Комплекс фермен'rов ЦТК мобильная СТРУЕ тура, находя
щаяся в равновесии со свободными ферментами матрикса. Обра
тимое равновесие между свободными и связанными ферментами
контролируется целым рядом факторов: концентрациями опре
деленных метаболитов в матриксе митохондрий (цитрата, OKca
лоацетата, кофермента А, ацетилкофермента А, Mg2+-ATP и др.),
концентрацией белка, энерrетическим состоянием митохондрий.
Взаимодействия ферментов, входящих в состав метаболона ЦТК,
обеспечивают функционирование ЭТО1'о надмолекулярноrо l<ОМП-
лекса ферментов как целостной, кооперативно действующей сис
темы.
90
В то же время нет убедительных доказательств существова-
ния надмолекулярноrо комплекса kaK01'o-либо метаболическоrо
пути или e1'o фраrмента. Прямым подтверждением существова-
ния .метаболона (надмолеI<,улярноrо I<.омплекса ферментов, ката-
лизирующих последовательные стадии ферментной системы) мо-
жет быть либо ero выделение, либо реконструкция in vitro и эк-
спериментальное доказательство туннелирования между фермен
тами-соседями (r. л. Ермаков, 1993). Такие попытки предприни
маются, например, для ферментов rликолиза, цикла :Кребса и
цикла мочевины.
Та:ким образом, в настоящее время широко обсуждается про-
блема пространствеюlО СТРУКТУРНОЙ орrанизации ферментных
систем. Вместе с тем отсутствуют исчерпывающие данные, Kaca
ющиеся изучения фермент ферментных, фермент мембранных
взаимодействий, взаимосвязи физико-химических хараI<:теристик
белков с их способностью образовывать надмолекулярные KOM
плексы, выяснения роли цитоскелета клетки в ОР1'анизации кле
точноrо метаболизма. Кроме '1'01'0, схемы надмолекулярной op1'a-
низации компонентов метаболических систем 'l'ребуют экспери-
ментальных доказа'l'елъств.
2.3.3. Пути ре3УЛllровани'я aJстибности
векторных фер.ментов 6'ио.ме.м6'ран
Одним из наиболее ан:туальных вопросов современной мем-
бранолоrии является выяснение принципов и механизмов ре-
rуляции векторных ферментов биомембран (в том числе Na ,
:K+-АТФазы), выполняющих разнообразные "жизненно важные"
функции не только для отдельных мембранных структур, но и
для клетки в целом. Полифункциональный характер Na+, :К+ АТФа
зы (см. раздел 1.2.4) , Т.е. сочетание в ней метаболической, транс-
портной и рецепторной функций, определяет существование до-
статочно сложных механизмов ее реryляции. :Кроме тo1'o, изуче
ние механизмов функционирования и реrулирования транспорт-
ных АТФаз на уровне отдельных I леток и субклеточных компо
нентов актуально не только в теоретическом, но и в практичес
ком аспекте для оценки степени и характера нарушений этих
механизмов при некоторых паТОЛО1'ических состояниях, связан-
J:Iыx с изменением ионноrо состава среды и накоплением актив
ных форм кислорода (см. rлаву 3). Рассмотрим основные пути
реrулирования функциональной активности одно1'О из ключевых
91
векторных ферментов плазматических мембран I леток Na+, K+
АТФазы.
По современным представлени.ям, Na+, К+ АТФаза является
типичным липидзависимым ферментом: для формирования e1'o
функционально ак'rивной конформации необходимы кислые ли
пиды. Показано, что мембранные rликолипиды, локализованные
преимущественно в наружной половине бислоя, обеспечивают
правильную ориентацию Na+, К+ АТФазноJ:'О комплекса относи
тельно плоскости мембраны (т.е. они отвечают за проявление BeK
торных свойств фермента). Вместе с тем остается неясным, KaKO
ва специфическая роль мембранных фосфолипидов в обеспече
нии транспортной функции Na+, К+ АТФазы. По видимому, фун
кционирование центров связывания нуклеотидов и катионов на
молекуле фермента не зависит от ЛИПИДов, тоrда как для осуще
ствления конформационных церестроек в ферментном беЛI е важ
на ero связь с мембранными липидами. Кривые, описывающие
зависимость ферментативной активности от концентрации ли
пида, имеют сиrмоидиую форму, что свидетельствует о I<.оопера
тивном характере связывания ЛИl1ИДОВ с белком. Однако абсо
лютная потребность фермента в тех или иных фосфолипидах (или
их полярных rоловках) экспериментально не дон:азана. Так, опыты
по ферментативному превращению одних фосфолипидов в дру-
1'ие (например, фосфатидилсерина в фосфатидилэтаноламин) в
препаратах мембраносвязанной Na+, IC+ АТФазы показали, что
фермент может функционировать без отрицательно заряженных
фосфолипидов, но с уменьшением молекулярной активности.
Получены данные, свидетельствующие о том, что липиды,
создающие микроокружение Na+, IC+ АТФазы в биомембранах,
характеризуются сравнительно низкими энерrиями взаимодей
ствия с ферментом. Существует мнение, что Na+, IC+ АТФаза не
имеет аннулюса в традиционном понимании этоrо термина. BMe
сте с тем исследования с использованием ЭПР спеКТРОСI<'ОПИИ
спин меченных фосфолипидов показали, что фермен'l' оказывает
существенное влияние на фосфолипидный состав ближайше1'О
микроокружения в мембране, преИМyJЦественно связывая отри-
цательно заряженные фосфолипиды. Оказалось, что сродство Na+,
IC+ АТФазы к отрицательно заряженным фосфолипидам в cpeд
нем в 4 раза больше, чем к положительно заряженным, и
"" в 2,5 раза больше, чем к нейтральным. Эта избирательность фер
мента по отношению к заряду молекул фосфолипидов может
92
быть связана с наличием положительно заряженных боковых
цепей аминокислотных остатков во внутримембранном домене
Na+, К+ АТФазы, взаимодействующем с полярными 1'ОЛОВl(8МИ
фосфолипидов из ближайщеrо мин:роокружения. Для ряда ин
теrральных мембранных беЛl(ОВ обнаружены такие боковые
цепи остатки ар1'инина и лизина, преимущественно взаимо
действующие с о'!'рицательно заряженными фосфолипидами би
слоя. Получены доказа'rельс'rва To1'o, что изменение физическоrо
СОС'!'ОЯЮIЯ липидноrо окружения Na', K АТФазы под влиянием
температуры, содержания в нем холестерина, длины цепи и c're
пени ненасыщенности жирных кислот, входящих в СОС'!'8В фос
фолипидов, може'!' влиять на активность ЭТОI'О фермен'rа.
1. J. De POIlt et а1. (1978) ПОI азали, ч'ro rидролиз различных
фосфолипидов, содержащихся в высокоочищенном препарате Na+,
IC+.АТФазы из '!'КaIШ почек крокодила с помощью фосфолипа
зы С, существенно не влияе'!' на активность фермента. С друrой
стороны, удаление 60 % фосфолипидов из 'l'aKorO же npelIapa'l'a
белка с помощью фосфолипазы А приводило l( nO'l'epe 70 %
А'l'Фазной активности, в то время как число уабаин связываю
щих центров оставалось неизменным. 'l'акой разброс данных о
липидной "по'rребности" Na , К+ АТФазы объясняется тем, что
снижение ферментативной активности обусловлено не толы(o
уменьшением содержания фосфолипидов, но и инrибирующим
действием жирных кисло'!', образующихся при rидролизе фос
фолипидов фосфолипазами.
Все вышеизложенное свидетеЛЬС'l'вует о 'l'OM, что целыЙ ряд воп
росов, I асающихся детальноrо выяснения роли ЛИПИДИО1'О маТрИl(
са в функционировании мембранОСDЯЗ8ННОЙ Na+, К АТФазы, OC'l'a
етс.я недос'rаточно изученным.
По всей вероя'1'НОСТИ, Na+, К+.АТФаза нахОДИ'l'ся в 'rеСJ:IОЙ про
странственной и функциональной взаимосвязи не только с липи
дами, но и с мембранными белками. Были получены доказатель
ства взаимодействия этоrо фермента с периферическим белком
мембраннOI'О скелета анкирином, УС'l'ановлена ero связь с ани-
онным переносчиком белком полосы 3, выявлено ре1'УЛЯТОР
ное влиm:-Iие на ar<'l'ивнос'rь АТФазы спектрин-а.ктиново1'О комп-
лекса. Имеются данные, указывающие на возможность образо
вания за счет белок белковых взаимодействий в мембране эрит
рОЦИ'l'Oв сложных мультиферментных комплексов, состоящих из
rлицеральдеrид 3 фосфат деrидроrеназы, фОСфО1'лицераткиназы,
93
фОСфО1'лицератмутазы и Na+, КI АТФазы. Между указанными фер
ментами существует функциональное сопряжение, за счет ];cOTO
poro субстраты 1,3-дифосфоrлицерат и АТФ непосредствен
но транспортирую'rся от ОДНО1'о компонента системы ];с дрУ1'ому.
Известно, что Na+, K+-АТФаза может быть функционально
связана с такими мембранными системами как, N а+ jCa 2 ' -обмен-
ник, рецептор инсулина, адренорецепторы, cAMP-зависимая
протеинкиназа, аденилатциклаза.
Обсуждается вопрос о существовании in vivo пространствен
ной и функциональной взаимосвязи между мембраносвязанны-
ми Na', К' АrrФазой и ацетилхолинэстеразой. Субстрат ацетил-
холинэстеразной реакции ацетилхолин был одним из первых
соединений, идентифицированных как нейротрансмиттеры. Он
принадлежит к 1'руппе нейропередатчиков, вызывающих депо
ляризацию постсинаптических мембран, которая приводит к воз
никновению ПИКОВО1'о потенциала и торможению активности Na+,
К+ А'I'Фазы. Действие ацетилхолина в основном устраняется пу
тем e1'o энзиматическо1'О расщепления ацеТИЛХОЛИНэс'rеразой.
Ре1'уляторные механизмы, в реализации которых, очевидно,
участвуют вторичные мессенджеры (например, СаН и сАМР), 1'ор-
моны, БИОI'енные амины, нейротрансмиттеры и друrие факторы,
наименее изучены. Однако не вызывает сомнений, что именно
блаrодаря им происходит более тесное сопряжение натриевоrо
насоса с важнейшими процессами клеточноrо метаболизма.
Существенное значение для проявления: функциональной ак-
тивности N а+, К+ A ТФазы и ДРУ1'их векторных ферментов
(Ca 2 +-АТФаза, аденилатциклаза, цитохромоксидаза), состоящих из
нескольких субъединиц, имеют степень олиrомеризации и коо-
перативные взаимодействия субъединиц или доменов в составе
олиrомерных молекул, которые находятся под контролем BHYТ
ренних и внешних факторов. Все вышеперечисленные ре1'УЛЯ-
торные звенья, а именно: взаимодействие фИЗИОЛО1'ических ли
1'андов со специфическими центрами связывания; индуцируемые
ЛИ1'андами взаимодействия доменов внутри субъединиц, отдель-
ных субъединиц, протомеров, ОЛИ1'омерных комплексов; модуля-
торные эффекты липидноrо матрикса лежат в основе KpaTKO
срочной (быстрой) или "оперативной" реryляции активности век-
торных ферментов биомембран при изменении Функционально-
1'0 состояния клетки. Этот механизм реализуе'l'СЯ за счет элект-
ростатических, rидр фобных, ван-дер ваальсовых взаимодействий,
94
водородных, ковалентных связей, участвующих в поддержании
липид белковых, белок-белковых, липид липидных взаимодей-
ствий (раздел 1.4).
"Долrосрочный" механизм реrул:ирования активности мемб
ранных ферментов реализуется за счет белоксинтезирующей си
стемы клетки и заключается в поддержании оптимальноrо соот-
ношения между скоростью биосинтеза и распада этих фермен
тов. Он направлен на обеспечение б:ИО1'енеза необходимOI'О коли-
чества функционально активных молекул и олиrомерных комп
лексов векторных ферментов, приходящихся на единицу площа-
ди поверхности мембраны. "Долrосрочный" механизм связан с
действием различных 1'ормонов, вторичных мессенджеров и дpy
rих факторов на плазматическую мембрану клетки.
Биосинтез векторных ферментов биомембран на начальных
стадиях происходит анало1'ИЧНО синтезу бодылинства белков эука
риотических клеток, однако имеет и ряд особеннос'rей. Так, MeM
бранные белки синтезируются, как правило, в виде неактивных
форм (проферментов), которые с помощью селективно1'О протео-
лиза превращаются в активные формы в ходе пос'rтрансляцион-
ной МОДИфИI'(ации. Вероятно, биосинтез различных субъединиц
олиrомерных молекул мембранных беЛl{ОВ происходит на раз
ных мРНК в шерохова'rой (rранулярной) эндоплазматической
сети. Полаl'ают, что эффективность синтеза мембранных беЛI'(ОВ
знаЧИ'l'еJIЬНО повышается за счет объединения отдельных рибо-
сом в полисомы. Однако более детальные исследования, касаю
щиеся выявления важных аспектов БИО1'енеза мембранных бел-
ков, остаются не выясненными до настоящеrо времени.
"Краткосрочный" и "ДОЛ1'осрочный" механизмы реl'улирова
ния активности мембранных ферментов в реальных условиях ill
vivo дополняются мноrочисленными компонентами: функцио
нальным "сопряжением" одноrо фермента с дрyrими, наличием
каскадных механизмов реrуляции, "модуляцией" активности
белков мембран в результате воздействия физических a1'eHTOB. В
целом процесс реrулирования функционирования векторных
белков ферментов биомембран рассматривается как сложное вза
имодействие "подсистем" универсальноrо реrуляторноrо механиз
ма, обеспечивающее CTPYIi.typho-функциональную 'интеrрацию
компонентов мембран и поддержание клеточноrо rомеос'rаза
(рис. 25). Универсальность основных реrуляторн:ых механизмов
векторных ферментов биомембран обусловлена сходством их
05
Физиолоrические
лиrанды
Аллостерич еская
реryляция
Мембранные липиды
и холестерин
Белок-белковые
взаимодействия
rормональный
контроль
Действие физиоло-
rически активных
соединений
ЭндоrеННЬ1е
инrибиторы
и активаторы
?
Конформа
ционные
переходы
Изменение
количества
"копий"
фермента
Каталитический
цикл и
сопряженная
с ним функция
Рис. 25. Схема процессов реrуляции активности векторных фермен
тов биомембран (А. В. Кравцов, И. Р. Алексеенко, 1990)
структурной ОР1'анизации и трансмембранным характером BЫ
полняемых ими функций. Вместе с тем остается ОТRрытым воп-
рос О npиоритетности To1'o или ШЮ1'О реrуляторно1'О механизма и
об их взаимодействии в процессе функционирования каждоrо
KOHKpeTHoro фермента. Таким образом, разрабатываемая в Ha
стоящее время концепция общности принципов ре1'УЛЯЦИИ ак-
тивности ферментов, БЫПОЛНЯЮЩИХ трансмембранные функции,
требует новых экспериментальных доказательств.
96
2.3.4. Молекулярные MexaHU3J1tbl
нейроzу.;и;оральной реzуляцuи ФУНlCций lCлетOlС
Функционирование клеток раЗЛИ<J:НЫХ 'rканей в составе цело
CTHoro орrанизма обеспечивается взаимосвязанными механизма
ми неЙРО1'уморалъной реrуляции с участием нейромедиаторов и
ropMoHoB, синтезируемых соответственно нервными клетками и
железами внутренней секреции. Следуе'l' подчеркнуть, что OCHOB
ные механизмы (рис. 26) такой реrуляции реал:изуются при He
посредственном участии различных молекулярных I омпонентов
биомембран. Охарактеризуем более подробно представленные на
этом рисунке пу'1'И ре1'УЛИрОl!ания функций I леток.
Первый механизм осуществляется с участием нейромедиато
ров, взаимодействующих с мембранными рецеП'1'орами клеток,'
КО'1'орые представляют собой ионные каналы, Напомним, что ион
ные каналы Э'1'о ин'rеrральные беJ1I И (1'ЛИКОl1ротеины), прони
зывающие липидный бислой мембраны и С110собиъrе в результа
те внешних воздействий (изменение мембранноI'O потенциала, дей
ствие медиатора или ropMOHa.) избирательно изменять проницае
мость мембраны для определенных ионов. Ионным каналам свой
I Нейроryморальная реryляция
Нейромедиатор
С меМбранные
рецепторы
каналоформеры
Белково пептидные
ropMOHbI, катехолами
ны, простаrландины
идр.
Биолоrический
эффект
(миллисекунды)
Изменение мембран
НОСО потен циала
Химическая моди
фикация белков
Биолоrический
эффект (минуты)
Стероидные и
тиреоидные
ropMOHbI
Внутриклеточные
рецепторы
Ядро
мРНК
Синтез белка
Биолоrический
эффект (часы)
Рис. 26'. Схема основных путей неЙРОl'уморальной реrуляции функ-
ций кле'l'ОК (В. А, Ткачук, 1998)
7. 3акаа 3788
97
ственны избирательная проницаемость для ионов (селективность)
и способность открываться и закрываться при различных воз
действиях на мембрану (воротная функция). Воротный механизм
работы каналов реryлируется сенсором внешнеrо стимула. В за
висимости от локализации сенсора ионные каналы подразделя
ют на две rруппы. К первой rруппе относятся каналы, имеющие
собственный сенсор внешне1'О СТИмула (первичноrо посредника),
Т.е. внешний сиrнал воздействует непосредственно на MaKpOMO
лекулу ионноrо канала. Эта rруппа включает два семейства ион
ных каналов: потенциал и ЛИ1'андуправляемые. Потенциал
управляемые ионные каналы (Na+, К+, Са 2 +, Cl' каналы) OTKpЫ
ваются и закрываются при изменении электрическоrо потенциа
ла на мембране. Лиrандуправляемые ионные :каналы обеспечи-
вают быструю передачу СИ1'налов в химических синапсах. Они
открываются при связывании с рецептором специфических aro
нистов (ацетИJIXолина, rлутамата, у аминомасляной кислоты). В
каналах второй 1'руппы сенсор внешнеrо сиrнала (рецептор пер
вичноrо посредника) пространственно разобщен с каналом. Взаи-
модействие сенсора и канала осуществляется с помощью paCTBO
римых внутриклеточных посредников (мессенджеров). Это ре-
цепторуправляемые ионные каналы; каналы, опосредованно уп-
равляемые химическими сиrналами. R ним относятся каналы,
управляемые О-белками, которые активируются при связывании
лиrанда с рецептором (см. раздел 2.1.1).
В результате взаимодействия ЛИ1'анда нейромедиатора (на-
пример, ацетилхолина) с холинерrическим рецептором никоти-
HOB01'O типа, формирующим ионный канал, происходят измене
ние конформации белка ионноrо канала и переход ero в активи-
рованное состояние. Через устье канала, в формировании KOTO
fk>ro участвуют субъединицы олиrомерноrо комплекса, внутрь
клетки поступают ионы натрия. Происходит деполяризация, а
затем rиперполяризация мембраны. Возникающий на постсинап
тической мембране потенциал действия, вызываемый ацетилхо-
лином, возникает и 1'асится за 1 2 млс, при этом синапс спосо-
бен проводить от аксона на иннервируемую клетку до 500 имп/с.
Быстрое развитие и rашение сиrнала возможны блarодаря BЫCO
кой скорости связывания ацетилхолина (полумаксимальное насы-
щение рецепторов наблюдается в присутствии ацетилхолина в KOH
центрации 10'" моль/л) с рецептором и разрушения ero ацетилхо
линэстеразой, локализованной на мембране вблизи холинорецеп
98
тора. Возвращение ИОННО1'о канала в закрытое состояние происхо
дит в результате диссоциации rормон рецепторно1'О комплекса.
Второй механизм реrулирования функций клеток реализу
ется с участием ropMoHoB, действующих через мембранные pe
цепторы и системы вторичных посредников, стимулирующих хи
мическую модификацию белков (см. раздел 2.1). В качестве при
мера можно привести функционирование муска.РИНОВОI'О холи
неРI'ическо1'О рецептора, локализованно1'О преимущественно вне
синапса. Он активируется ацетилхолином и алкалоидом MYCKa
рином. Четыре типа близких по структуре мускариновых рецеп
торов сопряжены с различными G белками. Так, М холинорецеп
торы способны стимулировать фосфолипазу С, I'идроли:зующую
фосфоинозитиды, И Mo1'YT ИН1'ибировать аденилатциклазу, синте
зирующую сАМР и активирующую К+ I):аналы. БИОЛОI'ический
эффект при этом развивается и I'асится в течение десятков ми
нут. Это связано с кинетическими особенностями связывания ли
rандов с рецепторами, последовательным развитием этапов Kac
кадной передачи СИI'налов через мембрану в цитозоль, медленно
протекающими химическими реакциями СИН'l'еза, вторичных Mec
сенджеров, фосфорилироваюrя и дефосфорилирования внутри
клеточных белков.
В каждой клетке имеются 7 10 различных типов рецепто
ров, взаимодействующих со специфическими ре1'уляторами (ней
ромедиаторами, 1'ормонами, проста1'ландинами, факторами poc
та). Для каждоI'О реrулятора характерны определенные пара
метры: продолжительность и аМПлитуда сиrнала, соотношение
аКТИБностей компонентов систем вторичных мессенджеров и др.
Третий механизм реrулирования функционирования клеток
реализуется в том случае, если секретируемые эндокринными
железами С'l'ероидные и тиреоидные ropMOHbl, имеющие липо
фильную природу , взаимодействуют с цитозольными или ядер
ными рецепторами. Эти рецепторы характеризуются высоким
сродством к указанным 1'ормонам (полумаксимальное насыще
ние рецепторов происходи:т в присутствии ropMoHa в KOHцeHTpa
ции 1O 9 10 lO моль/л). Образующийся rОрМон рецепторн:pIЙ KOM
плекс, стабильный в течение 1 3 ч, связы1аетсяя с дик и белка
ми хроматина и Блияе'l' на экспрессию определенных 1'енов. TpaHC
ляция синтезируемой мРНК на рибосомах приводит к появле-
нию 3 7 новых белков, опосредующих биолоrический эффект
стероидных и тиреоидных ropMoHOB. Этот тип ре1'УЛЯЦИИ осуще
7*
99
ствляется в течение 3 6 ч после поступления рормона в pOBЬ, а
прекращается через 6 12 ч. Не исключается возможность и реп
рессирования отдельных ренов, что rrриводит к уменьшению KOH
центрации определенных белков в клетке.
rOpMOHbI контролируют синтез не только различных фер
ментов, участвующих в процессах анаболизма и катаболизма
кле'l'КИ, но и протеинкиназ, фосфопротеинфосфатаз, рецепторов
каналоформеров, реrулЯ'l'ОРНЫХ белков и ферментов, участвую
щих в функционировании систем передачи информации в клет
ке с участием вторичных посредников. Это один из путей ин
те1'рации и взаимовлияния отдельных механизмов нейроrумо
ральной реrуляцИИ функций клеток в составе целостно1'О opPa
низма.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1, Что представляют собоЙ вторичные мессенджеры?
2. Какими свойствами характеризуютс,я мембранные бещ,и-рецеп-
торы?
3. Что понимают под "каскадом" передачи внешнеrо сиrнала через
клеточнУ1О мембрану?
4. Назовите основные типы мембранных рецеп'rоров, охарактери-
ЗУЙ1'е их свойства и функции.
5. Каковы функции G белков?
6. Что 'rю<ое амплификация внешнеrо СИI'нала.?
7. Охарaz<теризуйте этапы передачи информации в клетку по аде-
иилаТЦИI{лазному пути.
8. Какие внутриклеточные мессенджеры учаС'l'вую'r в передаче сиr-
нала через клеточную мембрану по фосфоинозитидному пути?
9. Какова роль мембранных фосфолипидов в реализац= фосфоино-
зитидноrо механизма передачи информации?
10. Какова роль ионов кальция в реализации различных процессов
клеточноrо метаболизма?
11. КаЕие мембранные Tpaнcnop'rIIbIe системы ПРИНИМ810Т участие
в реrулировании УРОВНЯ кальция внутри I етки?
12. Какие факторы обеспечивают асимме'l'ричное распределение Ok
новалентных ионов ВНY'l'ри и вне клетки?
13. Охарактеризуйте основные мехаIIИЗМЫ реrулирования: функци-
ональной активности ферментов и ферментных систем в клетке.
14. Какова рОЛЬ мембран в интеrрации процессов кле'l'очноrо мета"
болизма?
15. Ч'l'О понимают под адсорбционным механизмом рerулирования:
ферментативной активности?
16. Что называют мета.болоном?
100
17. Какие теоретические 1.[ экспери:меН'I'альные предпосылки послу-
жили основой для создани.я концепции о пространс'rвеННО-СТРYR'rурной
орrанизации важнейших метаболичеСI ИХ систем клетки?
18. Каково физиолоrическое значение образования rликолитичес-
Koro мета.болона.?
19. Какие факторы Оказывают вли.яние на функционирование ком-
понентов мета болона?
20. ОхарактеРИЗУIЪ'е сущность эстафетной модели функционирова-
ния ферментов в клетке.
21. Что понимают под "краткосрочной" и "долrосрочной" реrул.я
цией активности векторных ферментов биомембран?
22. Предложите план проnедения экспеРИМЕ'.Н'I'ОВ по вы.явлению роли
отдельных компонен'rов биоме:мбран в функционировании ключевоrо
фермента ионноrо rо:меостаза клетки Na+, K+-АТФазы.
23. В чем заключается взаимосвязь трех основных механизмов ней-
роryморальной реrул.яции функций клеток?
rлава 3
МЕХАНИЗМЫ МОДИФИКАЦИИ
КОМПОНЕНТОВ БИОМЕМБР АН ПРИ
ПАтолоrИЧЕСКИХ СОСТОЯНИЯХ: РОЛЬ
АКТИВНЫХ КИСЛОРОДНЫХ МЕТАБОЛИТОВ
В основе мноrих патолоrических состояний орrанизма чело
века лежат изменения структурно функциональных свойств MO
лекул.ярных компонентов биомембран, индуцированные воздей
ствием внешних факторов среды (фармаколоrические аrенты, яды,
токсины, аллеР1'ены, ионизирующее и УФ излучение и др.) или
внутренними функциональными расстройствами. К заболевани
ям подобно1'О рода следует отнести rипертонию, атеросклероз,
ишемическую болезнь сердца, стрессорные заболевания сердца,
бронхоле1'очные заболевания, различные воспаления, злокаче
ственный рост клеток. В связи с этим всесторонние исследова
ния механизмов функционирования биомембран в норме и при
патолоrии необходимы как для разработки методов лечения и
профилактики вышеназванных заболеваний, так и для создания
высокоэффективных лекарственных препаратов.
3.1. ПЕРОКСИДНОЕ ОКИСЛЕНИЕ ЛИПИДОВ
КАК ОДИН ИЗ КЛЮЧЕВЫХ МЕХАНИ3МОВ
МОДИФИКАЦИИ СТРУКТУРНО ФУНКЦИОНАЛЫiоrо
СОСТОЯНИЯ БИОМЕМБР АН
Ведущую роль в развитии МНО1'их патоло1'ИЧеских состояний
орrанизма иrрает свободно радикальное пеРOJссианое окисление
липшJов (ПОЛ). Наиболее вероятным субстратом ПОЛ в opra
низме являются полиеновые лип иды биомембран. В roMoreHHbIX
системах процесс ПОЛ протекает по свободнорадикальному цеп
ному механизму. Первичные свободные радикалы появляются в
ходе реакции инициирования цепи или катализа, которую счи
тают начальным этапом ПОЛ. Инициирующими факторами ПОЛ
в мембранах выступают ферментные системы природных мемб
ранных структур (например, NADРН зависимая система), иони
зирующее и УФ излучение, различные активные формы кисло
рода (АФК). Последние способны индуцировать ПОЛ как в TeM
новых процессах (например, при фа1'оцитозе), так и при воздей
ствии УФ света, фото повреждении сетчатки 1'лаза и др.
102
Реакция инициирования цепи имеет вид
х' + RH ХН + R" ,
rде Х' свободный радикал, инициирующий цепь; RH HeHa
сыщенная жирная кислота липида; R' алкилъный свободный
радикал липида.
Затем следуют
реакции продолжения цепи:
k
R' + 02 RO"2'
k
RO + RIH .3> ROOH + R' l , (2)
rде RO' 2 пероксидный раДИI:\ал липида; ROOH 1'идроперок
сид липида.
Константа СI:\ОрОСТИ k 1 реакции составляет l07 l08 л/моль' с,
а энер1'ИЯ аI:\тивации практически равна нулю. Следовательно,
при обычных концентрациях кислорода (>10 6 моль/л) все pa
дик алы R' превращаются в RO' 2 . Реакция (2) также имеет низ
кую энер1'ИЮ аI:\тивации и высокую I-юнстанту скорости k 2 , вели
чина которой зависит от типа окисляющеrося соединения.
Разветвление цепи осуществляется в соответствии с реакцией
(1)
k
ROOH a RO' + ОН',
(3)
rде RO' алкоксильный радикал; ОН' 1'идроксильный ради
кал.
С реакциями продолжения конкурируют реакции, приводя
щие к обрыву цепи. Возможны следующие варианты спонтанно
ro обрыва цепи:
k
R' + R" 4 R R, (4)
k
RO' 2 + R' ROOR, (5)
k
RO' 2 + RO' 2 молекулярные продукты. (6)
Сущность цепно1'О процесса окисления состоит в чередовании
двух реакций образования пероксидноrо радикала липида RO' 2 ,
а также 1'идропероксида ROOH и noBOro радикала липида R';
RH RH
R' i RO' 2 f R' i R0 2 } R' --+ RO'z
ROOH ROOH
103
Таким образом, в процесс вовлекаются все новые молекулы
липида (RH) и кислорода, при этом накапливаются 1'идроперок
сиды, а число радикалов R. и RO' 2 не изменяется в соответствии
с принципом неуничтожимости свободной валентности.
rенерирование липопероксидов в ОР1'анизме сопряжено с HOp
мальными метаболическими реакциями, осуществляемы:м:и специ
ализированными ферментными системами: NADРН зависимыми
микросомальными оксиrеназами, ЦИКЛООКСИ1'еназами и лиnоокси
1'еназами, и служит источником биосинтеза внутриклеточных Me
диаторов ПР()СТaI'ландинов, тромбоксанов, простациклина, лей.
котриенов и липоксинов. Свободная полиненасыщенная жирная
кислота, в частности арахидоновая. образовавшаяся в результате
ферментативноrо 1'идролиза -ацилов лецитинов фосфолипазой А2'
может окисляться по двум альтернативным: путям цикло или
лиnооксиrеназному. При ЦИКЛООКСИ1'еназном окислении арахидо
ната образуются цикличеСI<.ие эндопероксиды простarландины
П2 и Н 2 . служащие универсальными метаболическими предшествен-
никами различных ПрОСТaI'Л8НДIllЮВ (РПЕ 2 , РПЕ/ , PGD 2 ), тромбок
санов (ТХА 2 , ТХВ 2 ) и простациклина (PGI 2 ). Продуктами липоок
СИ1'еназноrо окисления арахидоната являются алифатические 1'ид
ропероксиды 1'идропероксиэйкозатетраеновые кислоты
(НРЕТЕ) промежуточные продукты биосинтеза HOB01'o класса био
ЛО1'ически аЕТИВНЫХ веществ лейкотриенов (LTA 4 , LTB4' LTC 4 ,
LTD,j) рис. 27. Производные С20 полиненасыщенных жирных
кислот типа арахидоновой, ТаЕ называемые эйкозаноиды, участВУ
ют в осуществлении защитных реаЕЦИЙ клеток желудка, сердца и
дрyrих opraнoB от повреждений, способствуют развитию воспале-
ния, стимулируют сокращение 1'ладкой мускулатуры. Циклоокси-
1'еназные системы обнаружены в большинстве тканей животных,
липооксиrеназные в различных животных клетках и тканях:
лейкоцитах, тромбоцитах, ретикулоцитах; ле1'КИХ, селезенке, ce
менниках. Между лиnооксиrеназным и циклооксиrеназным ny
тями окисления полиненасыщенных жирных кислот в Ор1'анизме
существует тесная взаимосвязь. ИН1'ибирование циклооксиrеназ
H01'o пути окисления этих клеток in vivo сопровождается аЕтива
цией их ЛИПООКСИ1'еназноro окисления, Т.е. Jllшооксиreназный путь
окисления может использоваться для быстрой утилизации избы
точноro субстрата биосинтеза простarлэндинов.
Ре1'УЛЯЦИЯ процессов ПОЛ в Ор1'анизме ТаЕже осуществляет-
ся ферментативным путем. В микросомах наряду с фермента-
104
OOH
Арахидоноваякислота
NАDРН эависимая
диоксиrеназа МИКрОGОМ
""'Д
Ji
'"
ro
:r:
ф
!s:
()
'"
о
о
:s:
::r
?'7'/ COOH
6-.
... ООН PGG2
?'7'/ COOH
6-.
ОН PGH2
ЛеЙI(ОЦИТЫ
( o Н)
ООН
C OOH
ООН
(....QH)
(5,12 DIHPETE)
(5,12-L ТВ)
ООН
r 1Дроперокси-
фосфолипид
Липоксиrенаэа
ЛеrКИе
: OOH
&;'н (11 HPETE)
(....QH) (11 HEТE)
ТромБОЦИТ!:>1
OOH
ОН (12-НРЕТЕ)
(....QH) (12-НЕТЕ)
Рис. 27. Основные пути ферментативноrо биосинтеза перо:ксидов
липидов в тканях млекопитаюЩИХ (В. 3. Ланкин, 1984): НЕТЕ - rид-
ро:кси:козатетраеновые :кислоты; НРЕТЕ rидропероксиэй:козатетра-
еновые :кислоты; DIHPETE диrидроперо:ксиэйкозатетраенова.я кисло-
та; LTB лейкотриены; PGG 2 , PGH 2 - простаrландины
тивным синтезом пероксидов липидов происходит и их фермен
тативная утилизация, так как терминальная оксида за цепи пере
носа электронов в микросомах цитохром Р 450 может функ
ционировать как активная пероксидаза. В цитозоле клеток со-
держатся восстанавливающие перОЕСИДЫ липидов 1'лутатионпер-
оксидазные и rлутатион S трансферазные системы, одной из фун-
IЩИЙ которых является О1'раничение распространения нефер
ментативных реакций ПОЛ в случае "утеЧЕИ" свободнорадикаль-
ных продуктов ферментативноrо ПОЛ. Существование специа-
лизированных ферментных систем синтеза и утилизации актив-
ных форм кислорода и пероксидов липидов делает маловероят-
ным (если не невозможным) протекание в нормальных ТЕ анях
животных неспецифическоrо процесса неферментативноrо
ПОЛ с фИЗИОЛО1'ически значимой интенсивностью.
105
Необходимо отметИ'l'ь, что в клетке существует несколько пус
ковых и защитных систем, которые рассматриваются как факто
ры, влияющие на скорость окисления липидов на разных стадиях
(зарождение и продолжение цепи; разветвление; обрыв цепи):
системы, ответственные за cTpo1'o определенную CTPYKTYP
ную ОР1'анизацию липидов и влияющие на скорость окисления
липидов на разных стадиях (зарождение и продолжение цепи;
разветвление; обрыв цепи);
системы ферментов, ответственных за образование и rи
бель активных форм кислорода и свободных радикалов или уча
ствующих в разложении пероксидов нерадикальным путем;
системы, ре1'улирующие обмен фосфолипидов мембран и
влияющие на скорость инициирования и продолжения цепей пу
тем изменения состава ненасыщенных жирных кислот фосфо
липидов;
системы низко молекулярных реrуляторов, выполняющих
роль инициаторов, ИН1'ибиторов и влияющих на стадию иниции
рования, разветвления и обрыва цепи.
ПОЛ представляет собой один из важнейших универсальных
процессов повреждения мембранных систем, изменяющий хими
ческий состав, физические параметры, ультраструктурную ОР1'ани
зацию и функциональные характеристики биомембран. ПОЛ BЫ
зывает обновление липидноrо состава мембран вследствие удале
ния леrко окисляющихся ЛИIIидов фосфатидилсерина, фосфати
дилэтаноламина, фосфатидилинозитола. При пол возрастает CKO
рость процессов "флип-флоп" переходов. ПОЛ приводит к увели
чению вязкости мембран в результате уменьшения содержания жид-
ких липц.цов В бислойных участках, появления поперечных меж-
молекулярных сшивок и возрастания доли упорядоченных липи
дов с оrраниченной подвижностью. Отрицательный заряд на по-
верхности мембран увеличивается, что обусловлено вторичными
ПРОдУктами ПОЛ (эпоксиды, кетоны, малоновый диальдеrид и др.),
содержащими карбонильные и карбоксильные rруппы. Мембраны
эритроцитов, митохондрий, саркоплазматическоrо ретикулума, ли
зосом становятся проницаемыми для различных ионов, неэлект
ролитов, макромолекул. Изменяются свойства мембранных белков:
Са 2 + АТФазы, N а+, К+ АТФазы, родопсина, фоСфОЛИIIазы. Эти фун
кциональные проявления ПОЛ определяют формирование мноrих
паТОЛО1'ических состояний орrа.низма, возникающих при неблаrо-
приятных условиях и повреждающих воздействиях.
106
Как уже было отмечено выше, в I-сачестве инициаторов ПОЛ
выступают alстUШlые Фор)/tbl lCuслороijа или активные кислород
ные метаболиты. Рассмотрим более подробно механизмы их об
разования и пути утилизации, функциональное значение и роль
в развитии патолоrических состояний ОР1'анизма человека.
3.2. РОЛЬ АI\:ТИВНЫХ ФОРМ КИСЛОРОДА
В РЕI'УЛИРОВАНИИ МЕТАБОЛИЧЕСКИХ ПРОЦЕССОВ
В БИОСИСТЕМАХ
в дыхательной цепи митохондрий аэробных клеток (помимо
ПОЛНО1'о четырехэлектронно1'О восстановления молекулы кисло
рода до воды) всеrда происходит OДHO И трехэлектронное BOCCTa
новление с последовательным образованием различных АФК:
+4ё + 4Н+
I +е +е
+е .j,. +е. ,J-.
02 ---+ 02 t Н 2 О 2 ---+ ОН t 2Н 2 О,
+2Н+ +2Н+
{'де O супероксидный анион радикал; НР2 пероксид BOДO
рода; ОН' rидроксильный радикал.
К активным формам КИCJIорода, кроме O , Н 2 О 2 , ОН', относятся
также СИН1'летный молекулярный кислород 102' перrидроксилъный
радикал НО;, 1'иrю1'алоиды, пероксидный радикал RO;, алкоксилъ
ный радикал ЕО', Они M01'YТ 1'енерироваться в разнообразных фер
ментативных и неферментативных реакциях во всех частях клет
ки. Наибольший вклад в их образование вносит дыхательная цепь
митохондрий, а также система цитохрома Р 450' локализованная в
эндоплазматической сети. АФК возникают как спонтанно, так и
ферментативно (например, с участием NАDРН оксидазы дыхатель
Ho1'o "взрыва" в плазматической мембране и ксантиноксидазы в
1'иалоплазме). Они вызывают образование ОР1'анических rидропер
оксидов ROOH при взаимодействии с биоJ;:О1'ическими молекулами
(ДНК, белками, липидами), Совокупность реакций, индуцируемых
АФК и приводящих к формированию 1'идропероксидов и затем
вторичных окисленных продуктов (спиртов, алъдеrидов, эпокси
дов), называют оксидативной модификацией молекул.
В табл. 11 представлены данные, хараК1'еризующие механиз
мы образования, свойства, биолоrическое действие и пути утили
зации АФк'
107
Таблица 11
АlCтивирова"'/tые lCuслороiJ",ые .метаболuты (АКМ) в орtа",uз-
.ме .млеlCопuтающuх: образовш/.uе, свойства, утuлuзаЦUJl
(по Е. В. МеньщltJсовой, Н. К. 3еюсову, 1993)
Форма АКМ, 'Механизмы
время жизни, образования в живых Биолоrическое Инrибиторы
радиус действие
действия сиc-rемах
1 2 3 4
Супероксид- ОДНО[lлектронное вос- Образованио перокси- Супероксиддисму-
ный анион становление кислоро- да водорода, rидрок- таза, аскорбиновая
радикал o ; да ксантнноксидазой, СИJlьноrо, перrндрок кнслота, церуло-
10-6 с; NADРН-оксидазой сильноrо радикалов и плазмнн, rлута-
0,3 мкм фаroцитов, оксидаза- синrлетноrо кислоро- тион
ми аминокислот; об- да, индукция ПОЛ,
разование в цепи разрушение мембран
транспорта [Iлектро- эритроцитов, усиление
нов митохондрий и пролиферации лимфо-
микросом; при окис- цитов, внутрю<леточ-
лении оксиreмоrло- нан реryляция, вазомо-
бина торное действие
Перrидрок- Присоединение Н. к Индукци.я: ПОЛ, цито- Аскорбиновая
еильный O в кислой среде токсическое действие, кислота, мочевая
радикал HO ; (рКа 4,8); реакция образование пероксида кислота, убихи-
10-3 с; Н.О. с орrаннчеСIЩМИ водорода и супе рок- нон, о:-токоферол
10 мкм пероксидами; проме- СИдноro анион-радика-
жуточный продуl'Т в ла при взаимодейС1'-
реакциях восстано- вии с орrаническими
влени.я: флавинов сО. молекулами
Пероксид Двухэлектронное ВОС- Цитотоксическое де1\:- Внутриr<леточные
водорода становление кислоро- ствие, образование l'аталаза и
н 2 о 2 , да ксантиноксидазой rИдРОКСИЛЬНОro ради- rлутаТИОlшер
стабилен и флавиновыми окси- кала в реакциях типа оксид азы,
дазами; реl!-КЦИЯ: дис- Фентоновской, ЛОI<аль- церу лоплазмин
мутации о; с учаc-rи ное закисление среды,
ем или без участия сосудосуживающее
супероксиддисмутазы действие, инrnбирова-
ние пролиферации
лимфоцитов
rидрокCRЛЬ- Разложение перокси- Сильный окислит.ель, Одно- и MHOro
ный радикал да водорода ионами юrдуцирующий раз- атомные спирты,
ОН; 10.. с; металлов переменной рыв СН-связей; индук аскорбиновая
< 10 нм валентности (ре8.IЩИЯ ция ПОЛ; вызывает I<ИСЛ01'в., мочевая
Фентона); дейc-rвие довреждени.я: молекул кислота, тиомоче-
ИОНЩЩ:РУЮIЦИх иалу- белков и нуклеиновых вина, урацил, ди
чений на воду; обра- кислот; оказывает метилсульфоксид
зование при микросо- сильное цитотоксиче-
мальном окислении; ское, мутэreнное и
при взаимодействии с канцероreнное
0-'- действи.я:
3
108
Окончание табл. 11
1 2 3 4
Сию'летный ФОТОИНДУЦированные ИНДУIЩИSl ПОЛ, вызы- AIщеII1'ОРЫ и 'I'Y-
кислород 102; рсar,ции, СОПУ'l'с'rВУIО- вщ 'r IIовреждени.я: мо- ши'rели: кароти-
10 B с; щий продукт в реак, лекул лков и ну- иоиды, азидЫ,
0,3 мкм ЦНЯХ с пероксидаза- кдеиновых кисдот; амиДЫ, а-токофе-
МИ; образуется при оказывает цитотокси рол, !UIКeHbl, про-
спонтанной дисмута- чеСIСое и МУ'l'аrеиное НЗВОДJilые фУР!lпа,
ции суперor,сидноrо действие ароматичсские yr.
анион-радиrЦlЛа леводороды, ходе-
стерии, r'JoIC'I'ИДЮI,
аскорБИIlОВD.Я: и
мочевая ItИСЛОТЫ
rипоrзлоиды Реакция пероксида Индукция: и инrибиро- Церулоплазмюr,
OC1- н HOCl водорода смиелопер- вание ПОЛ, ЮI8R1'ива- мочевая кислота.
OBr- н НОВ!' ОКСИД8ЗОЙ лейкоци- ция инrибиторов про- альбумин, амино-
OJ- н HOJ тон И пероксидазой теаз; цитотоксическое кислоты (1UIаюIН,
эозинофилоп деЙствае ССрЮI, валии,
rлицин)
Пероксид- ВзаимодеЙствис Itис- Образование !UIКиль- a-ТОRоферол,
ИЫЙ радикал лорода с ОРl'!lНичеСIШ- Hыx радикалов ЛИПН- уБНХЮIОИ,
RO ; 10 с ми радикалами; peart Дов и rИДРОIIерor,сидов аскорбиновая
ции супероксидноrо КИСЛО1'а, мочuвм
юшон-радикала, сип- кислота
rлетноrо кислор()да,
rидроксильиоl'О ради-
кала, алкоксилы!ro
радикала с неиасы-
Щенными ЖИРНЫМИ
кислотами ЛИIIИДОВ
Алltоксидь- Разложение орrани ИНДУIЩЮI ПОЛ; ЦИТО- Аскорбиновая
ный радикал ческих ПСрО!tсидов токсичеСI,ое и Шlнце- кислота, убихи-
RO'; 10" с ионами Me'l'IUUIOB пере- роreпное деЙствия нои, а'1'ОIЩфСРОЛ,
меиной В1JЛснтности мочевая ю!сло'rа
Супероксидны:й анион радикал образуе'l'СЯ путем одноэлект
pOHHo1'o восстановления кислорода иди одноэлеК'l'рщшоrо ОКИс
ления пероксида водорода. Мембраны фarоцитирующих клеток
'rканевых макрофа1'О:В, моноцитов и rранулоци'rов крови со-
держат ферментный комплеlСС NADPH-OIссидазу, которая ОКИС-
ляет NADPH дО NAD+, rrри э'rом происходит ОДIIоэлектро:нное
восстановление молекулярно1'О кислорода до супероксид-радика
ла. Супероксидный анион-радикал является важным фактором
токсическоrо действия КИСJIорода, обладает высокой реакцион
ной способностью по отношению к различным компонентам био-
систем. Предполаrают, что 02::" либо атакует днк непосреДС'l'вен-
но, либо при водит к образованию вторичных радикалов,
109
воздействующих на дик. Супероксидный радикал может вызы
вать деполимеризацию кислых полисахаридов, а также иниции
ровать ПОЛ. При нормальном протекании метаболических про
цессов 02:' не накапливается в клетках в результате ero обезвре
живания супероксиддисмутазой:. Однако он плохо проникает че
рез клеточную мембрану и оказывает токсическое действие в yc
ловиях интенсивноrо образования свободных радикалов и сни
жения активности антиоксидантпых систем клетки.
Пероксид водорода наиболее стабильный интермедиат BOC
становления кислорода способен покидать клетку как более
rидрофобное соединение по сравнению с 02:" Он наименее peaK
ционноспособен и наиболее леrко определяется. Н 2 О 2 можно по-
лучить прямым двухэлектронным восстановлением 02 с после
дующей дисмутацией 02:" Пероксид водорода токсичен, вызыва
ет окисление сульфrИДРИЛЫIЫХ соединений и метионильиых ос-
TaTI OB белков, а также пероксидное окисление полиненасыщен
ных жирных кислот.
СупероксиТ\ный аrrиои радикал и пероксид водорода способ
ны 1'енерировать чрезвычаЙно активный окислитель 1'ИДрОI -
сильный радикал в слеДYIощей цепной реакции:
Fe 2 + + НР2 ---+ Fe8+ + ОН- + ОН',
ОН' + Н 2 О 2 ----7 ир + Н+ + 02\
02:' + НР2 ----7 02 + ОН' + ОН- (Реакция rабер Вейса),
Fе З + + Н О ---+ Fe 2 + + 2If+ + О :.
2 2 2 '
Fе З + + 02:' ----7 Fe 2 + + 02'
Смесь солей железа с пероксидом водорода называется реакти-
вом Фентона и широко используется 'Как 1'идроксилирующий areHT.
I'идРОКСИЛЫIЫЙ радикал образуется и при радиолизе воды, что ле-
жит в основе повреждающеrо деЙствия ионизирующе1'О излуче-
ния на биосистемы. I'идроксильный радикал повреждает нуклеи
новые кислоты, оказывая как мутационное, так и летальное дей-
ствие на клетку, инициирует реarщии ПОЛ, инактивирует фермен-
ты, Т.е. обладает сильнейшим цитотоксичес'Ким деЙствием.
Супероксидный анион радикал, перОI СИД водорода и пеР1'Иk
роксильныЙ радикал способны rенерировать СИН1'летный кисло-
род. Он отличается от друrих активных форм rщслорода тем,
что для e1'o получения требуется лишь поrлощение энерrии без
110
химической модификации кислородных молекул. Следует под
черкнуть, что основное состояние молекул 02 является триплет
ным, однако при поrлощении энерrии молекулы кислорода спо
собны заселять относительно низколежащие СИН1'летные уровни
lI. g + И l6. g . Для заселения lI. g + необходима энер1'ИЯ, соответствуIO
щая фотонам с л == 760 нм, для заселения 16. с л == 1270 нм. В
g
состоянии lI. g + неспаренные электроны находятся на различных
орбиталях и пространственно раздt'.лены: (и).
в 16. состоянии занята одна и та же орбиталь: (и ).
g
Таким образом, СИП1'леТIIЫМ кислородом называют электрон
}1О возбужденпое состояние молекулы 02' паходящейся на одном
из указанных синrле'ПIЫХ уровней. Одним из самых эффективных
механизмов образования 102 является, по-видимому, процесс e1'o
1'енерации в результате перепоса ::шер1'ИИ на кислород от триплет-
пых молекул различных соединений. Э'l'от механизм определяет
фотосенсибилизированпое образование синrлетноrо кислорода в ра-
створах разнообразных сенсибилизаторов в аэробных условиях.
В ходе миелопероксидазной реакции пероксид водорода фер
ментативно превращается н rипохлорит аниоп, R,оторый является
активной формой хлора и представляет собой МОIЦНЫЙ окисли-
тель. В присутствии ионов железа он способен превращатъся в ОН'.
Миелопероксидазная реакция осуществляется в макрофа1'ах и не-
обходима для борьбы с инфекциями и устранения повреждепия
клеток. Макрофаrи миrрируют в очаr воспаления, rAe reперируют
супероксидный IНIИон-радикал и сипrлетный кислород за счет
NADРН-оксидазной реакции, пероксид водорода с помощью супер-
ОI(сиддисмутазы и rипохлорит-анион OCI (рис. 28).
NО-радикал (NO') вырабатывается фермептативно NО СИН'l'а
зой фаrоцитов и 1'ладкомъпuечпых клеток сосудов и выполняет
роль расслаБЛЯIOще1'О фактора дЛЯ: 1'Л8ДI<.ИХ мышц вследствие aK
тивации rуанилаТЦИR,лазы. Это соединение рассматривают кан;
вторичный мессепдж.ер вследствие R,онтролируемо1'О способа об
разовапия, высокой скорости ПРОНИКIIовения через клеточную
мембрану и длительною времени жизни (несколько секуНд);.... В
клетке NO' взаимодействует с пизкомолекулярными тиолами, об-
разуя мопо и ДИНИТРОЗИЛЫIые I(ОМПЛeI СЫ, ТОI сичные для J{лет
ки. МОНОПИТРОЗО1'лутатион мож.ет вызывать проrраммируемую
1'ибель клет ки апоптоз.
," За ОТI",рытие роли ОI",сида азота Ш I< сиrнаЛЫIОЙ МОJIЫ",УЛЫ в сер-
деЧI-IO СОСУДИСТОЙ системе Р. Фурчrотту, Л. Иrнарро и Ф. Мыорэду в
1998 r. rrрИСУЖДена НuбелеВСI<aJ=I премия.
11]
a: "'" $; ,,;('(1 [
N О ('(1b
« 8('(1 OQ)IDc:;O:x:
:а t::; i:i r:::I: р. b (J, Q)
(т] о t1I :S: :J: ''0 :S;> Ф
!I: C:+:I: t::; ('(10 L",
:S: :S:'-.... 2:8 .,,,, Е M N ,О :S: '
::r с:; .........:;;: () , О ro :I: О (т]
:S: ('(10 t::; X:S: !I: tirJ + ,u .g
:х: -& О ('(1 "'':r.t '" :s: z о з: N О (u
!;;: g С: 8 9.+ lU g-t:!:
t--- «-& !ii 'N :J: r::
:S;<-- О
5- :::r О t::;
!I: Х т ""' / /'
g- :iIQ)
glD LL
8.2: a +:S;
о o:s; О r:: ф r::+
g-Jj :;; ::2 @()
cOC:;c:[\Dj: roi:L
'f? ...-/0 3-:I:
Ф k" + x
LLC";,,; (U1Xl <=Ф
t:::r8!З "'8 :!:а. Ф 8
N "'Ф03('(1
+ф g 5 !!1
LL L::;:s:@:=if :r.LI
'--' [
c\ij
N Х
О
:f'
:r
::;; .:s;
<" о
+ а.
tf
.0+::;;+ .LI
:J: с:;
::s:
::r
о
о..
....
::s:
о..
(т)
t
N
+
Ф
U.
('(1
'"
('(1 N
...,.. 9. .....'0
'" :J: q:
8. О
()
112
']:
o t::;
!s! о
с:; с
t
'f
+
'"
Ф
:!:
'"
(т]
('(1
(J
'"
о
а.
Q)
r::
i
о
:s;
t--
[
С
,--..
C"I
Ф
м
J
I
"'"
lЗ:i
"-"'
a:I
t:(
О
g<
i<:
111
р<
to::
р<
ffi
'-'
a:J
t:r
о
З
Ж
АКМ называют 'rакже пРОOlссuоаиталtu, Т.е. веществами,
усиливающими разветвление цепи окисления в результате вза
имодействия с 1'идроксипероксидами биомолекул. Постоянное
образование прооксидантов в ЖИJIых ОР1'анизмах находится в
равновесии с их дезактивацией антиоксидантами, что лежит в
основе внутриклеточно1'О механизма реrуляции метаболических
процессов реООlCс,ре2УЛ.fU./ult. Сдви1' баланса антиоксидантов и
прооксидантов в тканях в сторону прооксидан'l'OВ называют окис-
литеЛЫlЫМ стрессом. Следствием окислительно1'О (оксидатив
Horo) стресса является окислительное повреждение тканей, KO
торое сопровождае'r различные па'!'ОЛО1'ические состояния (бо
лее 60 болезней) различные воспаления, ревматоидный apT
рит, 1'ас'rрит, язва, колит, цистит, бронхолеrочные заболевания,
канцероrенез, сахарный диабет, атеросклероз, старение, нейро
де1'енеративные процессы (паркинсонизм, болезнь Альцrейме
ра) и др. Однако до недавнеI'О времени рассматривалась пре
имущественно патоrенная функция АФR, реализующаяся по
средством активации ПОЛ в мембранах. Иеследования после
дних лет выявили участие АКМ в реrуляции тонуса сосудов,
клеточной пролиферации, синтезе проста1'ландинов, микроби
цидном действии фа1'ОЦИТОВ, ре1'УЛЛЦИИ метаболических про
цессов в качестве внутриклетопных мессенджеров, индукции
иммунных реакций. Поэтому сейчас весьма актуальным явля
ется вопрос о соотношении IIOложи'!'ельной и о'rрицательной роли
АФR в осуществлении и ре1'улировании клеточно:rо мета60ЛИЗ
ма, а также о ре1'улировании динамическоrо равновесия про и
антиоксидантов и О целесообразности ИВ1'ибирования синтеза
АФК в определенных условиях.
ПаТОЛО1'ические состоя нил возникаю'!' при чрезмерном накоп
лении AI'l:M и ИН'l'еНСИфИl,:ации оксидативной модификации Maк
ромолекул. В качестве факторов, индуцирующих оксида'l'ИВНЫ:Й
стресс, выделяют избыток 02 (особенно при rипербарической OK
СИ1'енации и реперфузии), сильные воспалительные процессы с
акт.rвацией неЙтрофилов и МaJ:<.рофа1'ОВ, ионизирующее и УФ из
лучение, избыток 1'ема, Fe2+, действие ксенобиотиков, больших
доз витаминов А и D. АФК в высоких концентрациях вызывают
мутации, ИН1'ибирование синтеза ДНК и деления клеток, способ
ны аI<.ТИВИРОllать аПОIIТОЗ. В результате оксидативной модифи
кации белков происходят нарушение их C'l'PYK'l'ypHo1'o состояния
и функциональных свойств, аrpе1'ация и денатурация их моле
8. Наказ 3788
113
кул. Продукты ПОЛ проявллют мута1'енный и цитотоксический
эффекты. Кроме TOro, избыток некоторых эйкозаноидов индуци-
рует тромбоз и 1'ипертонию (тромбоксаны), rиперчувствительность,
участие в развитии инфаркта JVl:иокарда, язвы желудка, бронхи-
альной астмы (лейкотриены).
3.3. ПУТИ PEry ЛИРОВАНИЯ УРОВНЯ
СВОБОДНОРАДИКАЛЬПЫХ ПРОДУКТОВ
И АКТИВНЫХ КИСЛОРОДНЫХ МЕТАБОЛИТОВ
Реrулирование уровня активных кислородных метаболитов
и свободнорадикальных продуктов ПОЛ осуществляется анти-
OlCCUOa1lтHbtMU системами, снижающими активность радикаль
ных окислительных процессов. В настоящее время под антиок-
сидантами понимают широкий класс соединений, инrибирующих
окислительные процессы по одному или нескольким механиз-
мам:
11 lV Уl
III V VH
. RH 02 RH Me n + ROH,
.:.. ,(. R ,(. Щ)2 t Rбон R==O, R C::'
02' НО 2 , 102 ---+ ---+ ---+
OH,RO t 1
t IP' Me(n+1)+
Различают превентивные антиоксиданты (пути: П измене-
ние структурной Ор1'анизации субстрата, замеДЛЯIOщее окисле-
ние; IV снижение концентрации 02; VI связывание или окис
ление ионов металлов переменной валентности, индуцирующих
разложение пероксидов и образование радикалов; УН перевод
пероксидов в стабильные продукты окисления: спирты, альде1'И-
ды, кетоны) и ИН1'ибиторы .АКМ (пути: 1 инrибирование ради
кальных форм .АКМ, способных инициировать образование op1'a-
нических радикалов; ПI и V прерывание окислительной цепи
посредством взаимодействия с ОР1'аническими радикалами). Дей
ствие инrибиторов .АКМ является специфичным.
Часто антиоксиданты классифицируют в соответствии с ве-
личинами их молекулярных масс. К 1'руп:ае высокомолекуляр
ных соединений ферментов антиоксидантной защиты и бел
ков, связывающих катализаторы свободнорадикальных процес-
сов ИОВЫ Fe и Cu, относят соответственно суПероксиддисмута
зу (СОД), церулоплазмин, пероксидазу, каталазу, rлутатионзави-
114
симые ферменты и альбумин крови, трансферрин, ферритин. rруп
пу низкомолекулярных ан'rиоксидантов составляют а токоферол,
аскорбат, rлутатион, мочевая кислота, мочевина, билирубин, He
которые аминокислоты.
Ферментативные антиоксиданты (АО) хара.ктеризуются BЫ
сокой специфичностыo действия, а также клеточной и ОР1'анной
локализации, использованием в качестве катализаторов HeKOTO
рых металлов (Си, Zn, Fe, Se). Уровень внутриклеточных фер
ментативных АО находится под rенетическим контролем. У жи
вотных В условиях 1'ипоксии И 1'ипероксии, усиливающих обра
зование ММ, повышается уровень внутриклеточных фермента
тивных АО, что связано с механизмами поддержания устойчиво-
сти орrанизмов к окислительному стрессу.
Супероксиддисмутаза (I{Ф 1.15.1.11, СОД) катализирует peaK
цию дисмутации суперо:ксидно1'О анион радикала: 200:' + 2Н+ ---+
Н 2 О 2 + 02' Обнаружено НеСКОЛЬКО изоферментов этоrо" белка, раз
личающихся локализацией, строением активно1'О центра и He
которыми физико химическими свойствами. Си, Zп содержащая
СОД чувствительна к циан иду и содержится в цитозоле и в меж
мембранном пространстве клеток эукарио'r. Цианидрезистент
ная Мl1 СОД (железосодержащий изофермент) локализована в
митохондрилх эукариот и найдена у прокариот. В пла.зме coдep
жится цианидчувствительнал экстрацеллюлярная СОД, представ
ляющая собой Cu, Zп содержащую тетрамерную молекулу
(Mr 120 135 кДа) из четырех 1'ЛИКОПРО'l'еиновых субъединиц.
Предпола1'ают, что экстрацеЛЛIOлярная СОД выполняет функцию
защиты клеток эндотелия во всем ОР1'анизме. Однако активность
СОД в плазме крови HaMHo:ro ниже, чем для цитозольно1'О фер
мента. По-видимому, это связано с накоплением н:онечноrо про
дукта реакции пероксида водорода, являюще1'ОСЯ ИН1'ибито
ром фермента. В клетн:ах перОI{СИД водорода быстро разрушает
ся внутриклеточными каталазой и 1'лутатионпероксидазой.
Несмотря на высокую специфичность фермента, в определен
ных условиях Сu СОД может взаимодействовать спероксидом
водорода и выступа'rь в качестве прооксиданта, инициируя обра
зование радикалов 02 и ОН':
Сu2+ СОД + НР2 Сul СОД + 02 + 2Н+,
Cи+ COД + НР2 н Си 2 +.СОД + ОК + OH .
В настоящее время исследуются ВОЗМО.жности клиническо1'О
применения СОД, обладающей выраженным защитным эффе:к
8*
115
том при воспалительных, ишемических и стрессовых поражени
ях. С целью повышения стабильности фермента и предотвраще
ния ero быстро1'О разрушения во внеклеточном пространстве ис
польауют IIрепараты фермента, ковалентно связаННОI'О с иммуно
rлобулинами, СЫВОРО'1'очным альбумином, полиэтилеН1'ликолем.
Катала за (I-CФ 1.11.1.6) ускоряет процесс двухэлектронно1'О
восстановления пероксида водорода до воды, используя Н 2 О2 как
донор электрона. Молекула каталазы состои'1' из четырех иден
'rичных субъединиц и четырех 1'рупп 1'ематина. Молекулярная
масса фермента из различных источни:ков составляет 225
250 кДа. Каталаза ЛОI<ализована преимущественно в пероксисо
мах Iшеток, {'де ее концентрация ДОСТИ1'ает lO O моль/л. Макси
мальное содержание фермента обнаружено в эритроцитах, пече
ни и почках. Разложение пероксида водорода каталазой осуще
ствляетсн в два этапа:
J!"е3+ каталаза + 2Н 2 О2 н окисленная каталаза + Н 2 О2 н
Н Fе3+ I<аталаза + 2НР + 02'
В окисленном состоянии каталаза работает и кан: пероксида
за, ка.тализируя реакции окисления спиртов или альде1'ИДОВ:
окисленная каталаза + АН 2 -..+ Fе3+ каталаза + 2НР + А,
{'де АН 2 ДОБОр элеК'rрОБОВ.
Церулоплазмин один из основных антиоксидантов плаз
мы, проявляющий как специфическую, так инеспецифическую
антиоксидантную активность. Специфическая ю<тивность, свя
занная со снижением уровня АКМ, обусловлена реализацией трех
возможных механизмов; 1) церулоплазмин обладает феррокси
ДRЗНОЙ активностью, окисЛяя ионы Fe 2 + без образования супе
рОКСИДНОI'о анион радикала; 2) он способен вызывать дисмута
цию супероксидных радикалов, которая имеет не ферментатив
ный, а стехиометрический характер (это обусловливает ИН1'иби
рование цеРУЛОПJrазмином ПОЛ в липопротеинах); 3) церулоп:
лазмин ина1<тивирует АФК, 1'енерируемые миелопероксидазой, и
тем самым защищает аН'fипротеиназу от окислительно1'О повреж
дения 1'И110хлори'rом.
Неспецифическая антиоксидантна.я: активность церулоплаз
мина связана с образованием комплексных соединений с медью,
Ч'1'Q препя:тствует возможности их участия в реакциях Фентона и
rабер Вейса.
Антиоксидантной активностью обла.дает также трансферрии
116
плазмы. E1'o действие носит в основном неспецифичеCIСИЙ xa
раК'l'ер, обусловленный связыванием ионов железа. При Hacы
щении железом белка до 100 % трансферрин может проявлять
прооксидантное действие, связанное с rенерацией rидроксильных
радикалов. Избыток железа при полном насыщении трансфер
рина связывается неспецифически с поверхностью бел:ка и в Ta
кой форме может участвовать в реакции rабер Вейса.
К rpуппе высокомолекулярных антиокси:дантов ОТНОсятся 1'лу-
татионзависимые ферменты rлутатионпероксидаза, rлутати
онредуктаза, rлутатионтрансфераза.
rлута тионперо:кидаза (КФ 1.11.1.9) эффективно утилизирует
токсичные липопероксиды в орrанизме при помощи фермента
тивной реакции
ROOH + 2 G8H ----7 ROH + GSSG + нр.
в тканях млекопитающих обнаружены по крайней мере два
фермента, способные ле1'КО восстанавливать орrанические rидро
пеРОl<с.иды. Селенсодержащая 1'лутатионпероксидаза с высокой
скоростью утилизирует как пероксид водорода, так и орrаничес
кие 1'идроперОl<СИДЫ, в том числе липопероксиды пероксиды
жирных кислот, аЦИЛ1'лицеридов, стероидов и простаrландинов.
Неселеновая rлутатионпероксидаза II, напротив, актИВНО BOCCTa
навливает исключительно ОР1'анические rидропероксиды. Se co
держащая 1'лутатионпероксидаза локализована в цитозоле ( 70 %)
и митохондриях (20 30 %) :клеток млекопИтаЮЩИХ.
В ре1'УЛЯЦИИ обмена липопероксидов (рис. 29) важную роль
И1'рае1' сопряженное действие rлутатионпероксидазы и 1'лутати
онредуктазы (КФ 1.6.4.1), приводящее к инактивации перокси-
дов жирных кислот И превращению их в соответствующие ОI<СИ
кислоты. rлутатионредуктаза катализирует восстановление окис
ленно1'О 1'лутатиона:
GS8G + NADPH + н+ ----7 2 G8H + NADP+.
rлутатионтрансферазы (КФ 2.5.1.18) представляют собой 1'руп
пу ферментов, катализирующих начальную стадию биосинтеза
меркаптуратов конъюrацию 1'лутатиона с ксенобиотиками (RX),
содерЖащими электрофильвый атом:
RX + G8H ----7 R8G + ИХ.
Однако продуктом ферментативно1'О nревращения неI<ОТОрых
субс'rратов, в том числе орrанических 1'идропероксидов, являет
ся не тиоэфир (R8G), а окисленный rлутатион. Образование GSSG
117
е\,о"СИ Д <1За (,
<Qy.:> ... &j NADP(H) + Н+
NADP+ / . "\\,,nOnepOkCtt " /
" ,<>y..- i'J.;"', У
RO' ОН' , " / ;.r"4
НОХ НХ 2 GSH GS G
RO / /
ROOH ............ GS8 рер. э."''3. / 2Н 2 О
Fе З + (R0 2 )'
Fe 2 +
ROH ЗОН S
р,окисление
ROH + Н 2 О
1 { Н О каталаза
202 + Q
ОН'
OH
Н2 0 2+ 0 2
H . e '"
02'дисмутаза
Fе З + Х О2
",,"Р'М Р,., Х
NADP(H) --+ ФП Fe2+ O
Микросомальная
диоксиrеназа
фосфолипидов
Рис. 29. Детоксикация супероксидноrо радикала, пеРОКСИДR водоро-
да и дипопероксидов в тканях млекопитающих
при действии G8Н трансферазы на орrанические 1'идроперокси
ды объясняется взаимодействием электрофильно1'О кислорода с
тиолатным анионом (G8' ), что приводит к возникновению He
стабильно1'О сульфеново1'О ПРОИЗВОДНО1'о rлутатиона:
ROOH + GSH -..+ ROH + [GSOH],
которое затем неферментативно реа1'ирует с еще одной молеку-
лой GSH:
[GSOH] + GSH -..+ G8SG + Н 2 О.
rлутатионтрансферазы локализованы преимущественно в ци-
тозоле клеток; в печени человека они составляют 2 4 % от
обще1'О количества ЦИТОЗОЛЬНО1'о белка. rлутатионтрансферазы
эффективно восстанавливают 1'идрофобные rидропероксиды с
большим объемом молекулы (1'идропероксиды линолевой и ара-
хидоновой полиненасыщенных жирных кислот, фосфолипидов),
а также 1'идропероксиды мононуклеотидов и ДНК, участвуя тем
самым в их репарации,
Считают, что при окислительном стрессе ферментативная ан-
тиоксидантная защита оказывается малоэффективной по срав-
нению с действием низкомолекулярных соединений. Это связа.
118
но с тем, что ферменты антиоксиданты локализованы внутри
:Клеток, а в БИОЛО1'ических жидкостях обнаруживаются лишь
следовые их количества. Кроме Toro, при оксидативном повреж
дении происходит быстрая ИНа&тивация КОНСТИТУТИВНО1'о пула
ферментов свободными радикалами. Поэтому необходимо значи-
тельное время для индукции их синтеза. В этих условиях повы
шается роль низкомолен:улярных антиоксидантов, не только сни
жающих интенсивность свободнорадикальных процессов, но и
выполняющих важные метаболические функции.
Эффективными перехватчиками свободных радикалов явля-
ются фенольные аНТИОI<сиданты, СОДержащие ароматическое коль-
цо, связанное с одной или несколькими 1'идроксильными 1'руппа-
ми. Блаrодаря наличию в структуре ароматическоrо кольца обоб-
щенной системы 1t-электронов происходит смещение отрицатель-
HOro заряда на кислород, в результате KOTOpOl'O осуществляется
достаточно ле1'КИЙ отрыв атома водорода ОН-1'руппы с образо-
ванием разных изо мерных форм фенокси радикала. Такие co
единения вы тупают в качестве перехватчиков пероксидных и
алкоксильных радикалов в следующих реакциях:
RO' + АтОН ----7 ROH + АтО',
RO + АтОН ----7 ROOH + ArO',
1'де ArOH ароматичесrще кольцо фенольно1'О антиоксиданта,
связанное с rидроксильной 1'руппой.
Взаимодействие фенольных аНТИОI<.сидантов с ОР1'анически
ми радикалами приводит 1< образованию феноксильных радика
лов (АтО'), которые Mo1'YT участвовать в реакциях диспропорци
онирования с образованием хинолидных пероксидов:
ЛrО' + RO ----7 R0 2 ArO;
АтО' + АтО' ----7 Ar 2 0 2 .
Распад хинолидных перOI<СИДОВ приводит к образованию хи-
нонных форм молекул, которые в нормальных условиях не обла
дают антиоксидантными свойствами, однако при дефиците кис
лорода Mo1'YT тормозить окисление путем взаимодействия с ал-
килъными радикалами:
O Aт O + R' ----7 'O Ar OR.
в: фенольным соединениям, обладающим выраженной анти-
оксидантной активностью, относят витамИны Е (а токоферол) и К,
триптофан, тирозин, фенилаланин, убихиноны, каротиноиды,
119
флавоноиды, фенокарбоксильные кислоты и др. Они инrибир -
ют супероксидный анион радикал кислорода., СИН1'летный моле
кулярный кислород, 1'идроксильный радикал и индуцированные
ими процессы ПОЛ.
Вместе с тем бла1'одаря способности ле1'КО отдавать и захва-
тывать электроны фенольные АО MorYT выступать и в качестве
восетановителей. Например, в условиях 1'ипоксии при действии
ряда дыхательных ядов в митохондриях убихинон окисляется
кислородом с образованием супероксидно1'О анион радикала, т. е.
проявляет прооксидантные свойства. а,- Токоферол способен BOC
станавливать ионы металлов переменной валентности и действо
вать как прооксидант, в частности, при индуцированном ионами
железа окислении липосом:. Взаимодействие фенольных АО с пе
роке идами приводит к образованию алкоксильных радикалов,
которые Moryт индуцировать окислительные реакции:
АтОН + ROOH ---+ RO' + HP + АУО',
Аскорбиновая кислота способна выступа'rь 'в качестве донора
и акцептора водорода бла1'одаря наличию в ее структуре двух
енольных rрупп. Аскорбат образуется у животных в виде конеч-
Ho1'o продукта из разветвлений 1'люкуронатноro пути обмена rлю-
козы. При окислении витамина С в тканях животных и челове
ка образуется де1'идроаскорбат, превращающийся затем в дике-
тоrулонат. При расщеплении последнеrо образуется щавелевая
кислота, а при декарбоксилировании ксилулоза, превращаlO
щаяся в 1'люкозу. У растений окисление аскорбата с образовани
ем деrидроаскорбата катализирует медьсодержащая аскорбат-
оксидаза. Эту же функцию выполняют и дрyrие терминальные
оксидазы растительных и животных тканей цитохромоксида-
за, фенолоксидаза, некоторые металлы. Одновременно с окисле
НИ-еМ аскорбата в орrанизме происходит ферментативное и не-
ферментативное восстановление де1'идроаскорбата до аскорбата,
осуществляющееся при участии восстановленно1'О 1'лутатиона.
Второй путь быстро1'О образования аскорбата в Ор1'анизме вос-
становление моноде1'идроаскорбата при участии NADH.
Способность аскорбата и де1'идроаскорбата ле1'КО подверrать
ся окислительно восстановительным превращениям лежит в
основе широкоrо участия витамина С в обмене веществ: дыxa
нии и фотосинтетической активности, транспорте электронов,
окислении и восстановлении никотинамидных коферментов.
120
Аскорба'r необходим для нормальноrо развития орrанизма, по
вышает эффективность адаптации к воздействию факторов внеш
ней среды, участвует в обмене беЛI>.ов, липидов, У1'леводов, yCKO
ряет процессы реrенерации, стимулирует деятельность желез BНYT
ренней секреции.
Окисленная и восстановленная формы аскорбата способны
провикать через мембранные структуры животных клеток. Бла
rодаря большей липофильности деrидроаскорбат ЛeI'КО диффун
дирует через биомембраны, чем существенно отличается от ac
корбата. Де1'идроаскорбат как транспортная форма витамина С
проникает в биолоrические структуры посредством простой или
обле1'ченной диффузии. В нормальных фИЗИОЛО1'ических услови
ях основную роль в процессах трансмембранноrо переноса и nOk
держания фИЗИОЛО1'ическо1'О уровня аскорбата в клетках иrpает
механизм активно1'О транспорта, опосредованный участием спе
цифических белков и зависящий от наличия энер1'ИИ.
Аскорбиновая кислота обладает чреавычайно широким спект
ром антиоксидантных свойств: обезвреживает rипоrалоиды, супер
оксидный анион радикал кислорода, перrидроксильный радикал,
пероксидный радикал, СИН1'летный кислород, rидроксильный pa
дикал, восстанавливает (), токоферильный радикал, возвращая
а токоферолу антиоксидантные свойства, а также тиильный (CS")
и тиопероксильный (GSO ) радикалы. Витамин С превосходит дpy
rие антиоксиданты плазмы крови в защите липидов от пероr"сид
Horo окисления, так как 'l'олько это соединение достаточно реакци
онноспособно для эффективноrо ИН1'ибирования ПОЛ. Анти:окси
дантные свойства аскорбата основаны на функционировании OДHO
электронных циклических переходов между ДИ1'идро , семидиrид
po и деrидроаскорбатными формами. Скорость этих npевращений
зависит от присутствия металлов переменной валентности, дРуrих
пар окислитель восстаНОвитель и величины рН. Способностью He
посредственно взаимодействовать с АФЕ характеризуется BOCCTa
новленная форма аСI>,орбиновой кислоты.
Витамины С, А, D и F, при окислении и аутоокислении KOTO
рых образуются промежуточные радикальные формы, Mo1'YT BЫ
полнять роль инициаторов окисления и ускорять ПОЛ, увеличи
вая скорость зарождения цепей реакций в мембранах. Кроме Toro,
в присутствии ионов железа и меди аскорбиновая кислота CTaHO
витс,Я мощным прооксидантом, что УI"азывает на необходимость
in vivo надежной секвестрации свободных ионов металлов Пере
121
менной валентности. Проявление аскорбатом анти- или проок
сидантных свойств зависит также от концентрации субстрата и
условий протекания окислительных реакций. Такая ее функци
ональная пластичность необходима для осуществления в биосис-
темах механизма редокс реrуляции.
Антиоксидантные свойства 1'лутатиона (G8H) трипептида,
образованноrо цистеином, 1'лутаминовой кислотой и rлицином,
определяются как непосредственным взаимодействием с АФЕ и
обменныъш реaJ:ЩИЯМИ с дисульфидными связями, так и функцио-
нированием rлутатионзависимых ферментов (см. выше). Mexa
низм защитноrо эффекта 1'лутатиона связан с инактивацией BЫ
сокореакционных кислородных и орrанических свободных ра-
дикалов вследствие переноса атомов водорода с молекулы тиола.
Образующиеся активные частицы обладают меньшим повреж
дающим эффектом по сравнению с радикалом, у KOTopo1'o неспа-
ренный электрон локализован на атоме уrлерода:
G8H + ОН' G8' + ОН-,
GSH + 02"'- GS' + HO ,
GS' + GS' GSSG.
Ти:и:льные радикалы эффективно удаляются из реакционной
среды вследствие образования дисульфидов 1'лутатиона.
rлутатион необходим для нормально1'О функционирования
эритроцитов и кроветворной ткани, в норме он практически весь
ассоциирован с форменными элементами крови и находится в
восстановленной форме (до 96 %). GSH участвует в восстановле-
нии метrеМО1'лобина. Ферменты синтеза rлутатиона находятся в
эритроцитах. Процесс восстановления ero происходит с участи
ем rлутатионредуктазы, а также NADPH и зависит от активнос
ти пентозофосфатно1'О пути. Клеточный rлутатион участвует в
поддержании пула восстановленно1'О аскорбата: перенос BOCCTa
новленных эквивалентов с GSH на аскорбат осуществляется 1'лу
татионде1'идроаскорбатредуктазой.
Мочевая кислота по своим свойствам близка к енольным
антиоксидантам и может выступать синер1':И:СТОМ с радикалами
а, токоферола и аскорбиновой кислоты. Она способна инактиви
ровать синrлетный кислород, 1'идроксильный радикал, связывать
ионы железа с участием аминоrpупп, инrибировать ПОЛ и BOC
станавливать метreмоrлобин с образованием радикала урата.
Разные 1'руппы антиоксидантов функционируют в тесной вза-
122
имосвязи: снижение концентрации или активности одних KOM
понентов антиокислительных систем приводит к изменению ypOB
ня друrих, что обеспечивает поддержание окислительно-восста-
новительноrо rомеостаза клеток. Антиоксидантные ферменты и
низкомолекулярные соединения катализируют последовательные
этапы превращения АФВ:, например:
СОД каталаза, rлутатионпероксидаза
02 ----+ Н 2 О 2 ) Н 2 О
RO ----+ (токоферол) ----+ (асКорбиновая) . ----+ мочевая )"
кислота кислота
NADPH Х Деrидроаскорбиновая Х Мочевая
GSH кислота кислота
NADP Аскорбиновая Радикал
GSSG кислота мочевой
кислоты
Высказано представление об антиоксидантных цепях переноса
электронов, эффективность функционирования которых обеспечи
вается работой всех компонентов антиш\Ислительных систем.
Автиоксиданты, модифицируя структуру и функциональную
активность мембран, оказывают воздействие на клеточный метабо-
лизм различными способами: в результате взаимодействия со сво-
бодными радикалами, рецепторами, путем инrибирования и акти
вирования ферментов, непосредственноrо встраивания в мембрану,
взаимодействия с reнетическим аппаратом клетки (рис. 30).
Необходимо отметить, что выяснение множественных Mexa
низмов действия антиоксидантов в орrанизме, включающих и
воздействие их на скорость ПОЛ, и влияние :на различные про-
цессы клеточноrо метаболизма, представляет сложную научную
задачу. Это связано с проявлением ими активности в широком
интервале концентраций (10 lB 10 2 моль/л) и реализацией в каж-
дом интервале концентраций различных механизмов:
протеканием реакций инrибиторов со свободными ради
калами;
взаимодействием с клеточными рецеПТОР8;МИ;
изменением текучести липидов мембран и мезофазных
переходов в них;
123
Активность ферментов
перОКСИДНоrо окисления
Активность мембрано-
связанныx ферментов
Вязкость мембран
Активность липоли'i'ических
ферментов
Рис. 30. Схема процессов реrушщии клеточноrо метаболизма с уча-
стием окислительных реакций в ЛШIидах мембран (К. Е. l:Cруrлякова,
Л. Н. ШИШ:ЕСина, 1992)
непосредственным влиянием на активность ферментов;
влиянием на лиrаНkбелковые отношения через парамет-
рический резонанс.
Переход от одноrо механизма к дPyroмy обусловливает слож
ную немонотонную, полимодальную зависимость "доза эффект"
(Е. Б. Бурлакова, 1998).
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. ОПИIШrте основные механизмы МОДИфИI<ации белковых и ЛШIИД
ных ROMnoHeHToB биомембран при воздействии экстремальных факто-
ров внешней среды и развитии патолоrических состояний орrанизма.
2. Что такое перОRсидное окисление липидов, какие факторы ини-
циируют этот процесс, RaR.OBa последовательность стадий ero развития?
3. В чем состоит сущность цепноrо окисления липидов?
4. В чем разница между ферментативным инеферментативным
перОRСИДНЫМ окислением липидов?
124
5. Что 'l'a}<.oe ак'l'ивные формы кислорода, какова их роль в развИ'l'ИИ
различных патолоrических состояниЙ орr8Низма?
6. Каковы мех8НИЗМЫ образования различных ак'rИ:Е!.ных форм кис
лорода?
7. Опишите свойства и пути утилизации сynероксидноrо анион-ра
дик ала и перОКСИД!l водорода.
8. В чем отличие синrлети:оrо молекулярноrо кислорода от др 'Тих
активных I<'ИСJIОрОДНЫХ метаболи'rОВ?
9. Какова роль NО радикала в реrУЛИРОВ81IИИ ДРОЦессоВ кле'l'ОЧRОro
ме'rаболизма?
10. Что называю'r оксида'rивной модификацией макромолекул и
OlШСЛИ'rельным стрессом?
11. Дайте определение ПОНЯ'l'ия "антиоксид8НТЫ".
12, Каковы основные механизмы инrибирования ан'l'ИОКСИД8Нтами
ОКИСЛИ'l'ельных процессов?
13. ОхараI<.теризуй'rе основные компоненты системы ВЫСОI<.Омоле-
кулярныlx антиоксидан'l'ОВ.
14. Какова роль rлутатионзависимых ферментов в реrулиров8НИИ
уровня свободнорадикальных продуктов ПОЛ и активных I<.ИСЛОРОД
ных ме'l'аболитов?
15. В чем отличия ПРООКСИД8Нтов от 8Нтиоксидан'l'ов?
16. Опишите СВОЙС'l'ва, механизмы дейс'rвия и метаболические функ
ции основных НИЗI<.омолеКУЮlРНЫХ I<.омпонентов антиоксидан'rНОЙ сис
темы.
17. 060снуЙ'rе утверждение: "Биомембраны непременные уч:аст-
НИI<.И совокупности процессов возникновения и развития ряда патолО
rических СОС'rояний орrанизма человека".
fлапз 4
СТРУКТУРНО ФУНКЦИОНАЛЬНЫЕ
МОДИФИКАЦИИ МОЛЕКУЛЯРНЫХ
КОМПОНЕНТОВ БИОМЕМБРАН
ПОД ВОЗДЕЙСТВИЕМ
ФИЗИКО-ХИМИЧЕСКИХ АfЕНТОВ
4.1. ФОТОХИМИЧЕСКИЕ И РАДИАЦИОНПО-
ХИМИЧЕСКИЕ ПРЕВР АЩЕНИЯ КОМПОНЕНТОВ
БИОМЕМБР АН В УСЛОВИЯХ Р Азличноrо
МИКРООКРУ:/КЕНИЯ
4.1.1. СтруктУРНО-ФУНlСЦUОllальные .м.оiJuфuкацuu
.м.олекуЛJlРн.ых ко.м.пОllен.тов tfuо.ме.мбран поа аеuствие.м
УФ-U3JlУ'lеНUJl
БИОЛО1'ически значимое УФ-излучение занимает участок
спектра от 200 до 400 нм И подразделяется на три области: ко-
ротковолновую (200 280 нм), средневолновую (280 315 нм) и
длинноволновую (315 400 нм). Поверхности Земли достиrает
УФ-свет в диапазоне длин волн 287 400 нм с энеР1'ией квантов
3 4 эВ. Коротковолновая часть спектра УФ излучения Солнца
полностью ПО1'лощается озоновым слоем атмосферы.
В биосистемах УФ-свет индуцирует 1'лавным образом фото-
деструктивные реакции, связанные с фотохимическими превра-
щениями белков и нуклеиновых кислот, относящихся к основ-
ным акцепторам УФ излучения в клетке. Однако в биомембра-
нах и ДРУ1'их липидных системах под действием УФ излучения
эффективно протекает процесс пероксидноrо фотоокисления
(ПФО) ненасыщенных жирных кислот липидов, который приво-
дит К значительным изменениям структурно функциональноrо
состояния всех мембранных компонентов. Таким образом, био-
мембраны содержат различные хромофорные rpYnnbl, ПО1'лоща-
ющие энерrию УФ излучения в разных диапазонах длин волн,
ароматические и серо содержащие аминокислоты мембраносвя
занных белков, полиненасыщенные жирные кислоты липидов, а
также коферменты, включающие пиридиннуклеотиды, флавины,
кофермент Q, железопорфирины, витамины.
Результаты исследования фотохимическо1'О действия опти
ческоI'O излучения на биомембраны клеток показывают, что наи-
более эффективным является "УФ излучение с длинами волн ко-
126
роче 300 нм. rлавный пу'l'Ь фотолиза мембранных липидов фо
тоокисление цепей полиненасыщенных жирных кислот фосфо
липидов. Следует отметить, что липиды ПО1'лощают УФ-свет в
корот:коволновой области спектра (1.< 240 нм), а максимумы по
rлощения ненасыщенных жирных I{ИСЛО'l' находятся в области
< 220 нм. Однако фотоокисление липидов развивается при воз
действии на мембраны более длинноволново1'О излучения, что обус-
ловлено ПО1'лощением УФ-света rидропероксидами липидов, при
сутствующими В норме в липидных системах вследствие проте
кания ферментативных процессов ПОЛ (см. rлаву 3). Диеновые
rидропероксиды жирных :кислот имеют максимум светопо1'ЛО
щения при 233 нм, а триеновые I'идропероксиды при 270 нм.
Процесс ПФО липидов можно представить в общей форме в виде
сово:купности элементарных реа:кций:
(а)
ko
ROOH ROO.;
l1v
k 2
(6) ROO. +RH ROO. + ROOH;
02
(в)
k6
ROO. +ROO. Pl +Р2;
k7
(1')
k7
ROO. +InH ROOH+ln.;
k 10
In. +RH ROO. +InH;
02
(д)
k",
(е) InH Pa.
hv
В этой схеме RH, ROOH, ROO' ,I!lH и In' обозначают COOTBeT
ственно окисляющийся липид, eI'o 1'идропероксид, пероксидный
свободный радикал липида, антиоксидант и свободный радикал
антиоксиданта; Рl' Р 2 , Ра некоторые продукты реа:кций; k o ' k 2
и др. I{OHCTaнTbI СI{оростей рею{ций. Реа:кции (а) и (е) фото
химические, реа:кции (б) (д) темновые. Реакция (а) носит Ha
звание реа:кции фотоинициирования, если ROOH предсуще
127
ствующие 1'идропероксиды, или разветвление цепей окисления,
(б), (в), (r), (д) соответственно продолжение цепи, "квадратич
ный" обрыв цепи (диспропорционирование радикалов ROO'), "ли
нейный" обрыв цепи на антиоксидаН'l'е, инициирование цепи окис
ления свободным радикалом антиоксиданта. УФ облучение MeM
бран и дру1'их ЛИПИДных систем индуцирует темно вое пероксид
ное окисление ненасыщенных жирных кислот липидов. Процесс
автоокисления в облученных мембранах протекает rораздо Meд
леннее фотоокисления, но за длительный темновой период он
может приводить даже к более сильному OIшслению мембран
ных липидов, чем фотоокисление. Темновое автоокисление ли
пидов в облученных мембранах блокируется антиоксидантами в
низких конценТрациях. Под действи€м УФ ИЗЛУЧ6НИЯ в HeKo'ro
рых :клетках стимулируется темновое ферментативное перо:ксид
ное окисление липидов с участием ЦИI{ЛОСКСИ1'еназы, в результа
те KOTopo1'o образуются проста1'ландины. &1'0 явление обнаруже
но в коже и иrрает важную роль в развитии эритемной рею{ции
в ответ на УФ облучение.
Следует подчеркнуть, что процесс пероксидноrо фотоокисле
ния липидов (ПФОЛ) является двухквантовым и протекает по
сложному механизму. Первая фотохимическая стадия e1'o re
нерация rидропероксидов в результа'l'е присоединения кислоро
да; вторая стадия, не зависящая от присутствия :кислорода,
фотолиз 1'ИДрОIIероксидов до вторичных проду:ктов (аЛЬД61'ИДОВ
и кетонов), ПО1'лощающих УФ излучение в диапазоне длин волн
260 280 нм. При воздействии видимо1'О света и длинноволново
ro УФ излучения процесс за:канчивается в основном на стадии
образования rидропероксидов, а при облучении липидных сис
тем более :коротковолновым светом (л 233 нм) накапливается
большое :количес'rво вторичных продуктов.
Один ИЗ вторичных продуктов ПОЛ малоновый диальде1'ИД
при взаимодействии с тиобарбитуровой IШСЛОТСЙ (ТЕК) дает OI{
рашенное соединение, ПОl'лощающее свет с длиной волны 533 нм.
эту реакцию используют для определения уровня интенсивности
протекания ПФОЛ. Второй подход, ПОЗВОЛЯЮЩИЙ судить об эф
фе:ктивности пероксидноrо окисления липидов, связан с реrистра.
цией хемилюминесценции, являющейся следствием реакции дис
пропорционирования перо:ксидных радюшлов липидов.
Ка:ково же значение пероксидно1'О окисления липидов в фо
топовреждении биолоrических мембран? Фотолиз липидQв MO
128
жет приводить прежде Bce1'o к существенным нарушениям CTPYK
турной орrанизации компонентов биомембран. Продукты фото
окисления липидов обладают ДОС'l'аточно выраженными токси
ческими свойствами. Пероксиды липидов и продукты их даль
нейших превращений (альде1'ИДЫ и Ke'l'OHbI) морут ИНдУЦировать
повреждение белковых молекул, в частности, их СУЛЬф1'идриль
ных rрупп. Повреждение белков может быть обусловлено как их
окислением, так и образованием стабильных ковалентных свя
зей между молекулами белков и прОДУI{тами пероксидно1'О фо'rо-
окисления липидов. Последние способны инактивировать MHO
1'ие мембраносвязанные ферменты. I poMe '1'01'0, вышеуказанные
продукты окисляют также такие биолоrически важные соедине
ния, как цистеин, 1'лутатион, нуклеотиды, витамины А и Д, липо
евую кислоту и др.
Таким образом, действие УФ излучения приводит к значи-
тельным модификациям структурно функциональною состоя
ния компонентов различных мембранных структур и их взаим:о
действий: изменяется пассивная проницаемость липидноrо бис-
лоя для ионов, разобщается окислительное фосфорилирование,
изменяются конформация и каталитическая активность мембра
носвязанных ферментов, нарушаются межклеточные взаимодей
ствия, происходит набухание и лизис клеток и их ОРl'анелл.
Ряд исследователей считает, что мембранные эффекты УФ.
облучения в основном индуцированы ПФОЛ и лишь частично
обусловлены фотохимическими превращениями белков. Напом
ним, что происходящие в белках под воздействием УФ излуче
ния нарушения их структурно-функциональноrо состояния ин
дуцируютс.я: в основном ПО1'лощением энер1'ИИ 'УФ-света остат-
ками ароматических аминокислот: триптофана, тирозина, фенил-
аланина, а также остатками серосодержащи:х аминокислот цис
теина и цистина. Под влиянием УФ-света происходит фото
ионизация остатков аминокислот с образованием сольватирован
ною электрона и катион-радикала аминокисло'l'Ы:
АН ----t АН* ---7 A'Hf + е.
.
ICатион-радикал сильная кислота и при 77 140 IC диссо-
циирует на протон и нейтральный радикал:
АН-' ---7 А' + H f .
Нейтральные радикалы являются неустойчивыми соеДинени
.я:ми и при температуре выше 200 К вступают в дальнейшие пре-
9. 3аказ 3788
129
вращения. Взаимодействуя с соседними 1'руппами полипептид
ной цепи, они м:o1'YT образовывать межмолекулярную сшивку,
являющуюся стабильным фотопродуктом:
А'Н+ ---7 А' + Н+ ---7 A B (сшивка).
В присутствии кислорода происходит фотоокисление трипто
фана, тирозина и фенилаланина. Большое значение в фотохимии
белков имеют фотосенсибилизированные реакции с участием
сольватированноrо электрона. Наибольшим сродством к электро
ну обладают цистин и цистеин, Они быстро разрушаются в резуль
тате взаимодействия с сольватированными электронами ез , выби
тыми из ароматическоrо кольца:
R---CН2 S S---CН2 R + e. ---7 (R---СН2 S---Щ R) ---7 R---CH2 S + 'S CН2 R
ЦИСТИН радикал цистина цистеин радикал
цистеина
Если фотолизу подвеР1'ается остаток аминокислоты, Henocpeд
ст:венно входящей в состав активно1'О центра фермента, уже это
ro может быть достаточно, чтобы белок потерял ферментатив-
ную активность. Если сшивка находится вне активно1'О центра
фермента, то. она способна изменить баланс водородных, 1'идро
фобных и друrих слабых связей (множественные разрывы свя
зей), поддерживающих нативную конформацию макромолекулы.
В большинстве случаев конечным результатом действия УФ света
на белки является их инактивация, Т.е. потеря ферментативной,
реrуляторв:ой, транспортной, 1'ормональнсй, ИММУНОЛО1'ической
и друrих видов активности. Вместе с тем для ряда белков (Kap
боксипептидаза А, супероксиддисмутаза, цитохром С, 1'ем:оrло
бив:) выявлена их активация под влиянием УФ излучения.
Необходимо отметить, что фоточувствительв:ость мембрано-
связанноrо белка может существенно отличаться от таковой для
это1'О же биополимера в свободном состоянии (в растворе), что
обусловлено особенностями микроокружения белковых молекул
в мембране, их взаимодействием с ДРУ1'им:и: компонентами Haд
молекулярноrо комплекса.
Иными словами, уровень фоточувствительности мембранных
белков ферментов будет эффективно контролироваться CTPYKTYP
ным состоянием их микроокружения.
Доказательства мембранно1'О контроля УФ-чувствительности
ферментов были получены С. В. Коневым и И. Д. Волотовским:
(1979) на основании анализа изменений величины поперечно1'О
130
сечения инактивации ацетилхолинэстеразы в свободном состоя
нии, в составе интактной мембраны, в мембране, обработанной
фосфслипазами А2' С и D, в мембране, обедненной по холестери
ну. Под поперечным сечением инактивации (а) понимают про
изведение поперечноrо сечения поrлощения (8) активноrо света
и KBaHToBo1'o выхода инактивации (<(», т. е. cr '=' S . «>. Квантовый
выход фотохимической реаIЩИИ это отношение числа проре
аrировавших (химически измененных) молекул к числу моле
кул, поrлстивших фотоны. Следовательно, поперечное сечение
поrлощения представляет вероятность поrлощения кванта света
при про хождении e1'o через молекулу. Физический смысл фото
чувствительности вероятность, с которой фотон вызывает хи
мическую реакцию превращения молекулы,
В ходе проведения экспериментов было выявлено, что попе
речное сечение инактивации мембраносвязанной ЭрИТрОЦитар
ной ацеТИЛХОJIинэстеразы больше, чем у своБОДЕ!О1'О фермента.
Нарушение CTPYKTYPHOro состояния эритроцитарной мембраны с
помощью фосфолипаз приводит к уменьшению фоточувствитель-
ности ацетилхолинэстеразы. Такой же эффект вызывает и yдa
ление из мембраны значительно1'О количества холестерина, опре
деляюще1'О текучесть липидной фазы мембраны. Влияние мемб
paHHo1'o окружения на УФ-чувствительность ацетилхолинэсте
разы реализуется, по крайней мере, двумя путями: посредством
изменения конформационноrо СОС'l'ояния фермента за счет меж-
молекулярных взаимодействий и посредством повреждения бел
ковой молекулы ПРОДУI{тами фотохимических превращений ли
пидов. То есть состояние мембранно1'О фермента зависит не толь
ко от эффективности протекания фотохимических процессов в
самом белке, но и от фотохимических реакций в "соседних" KOM
понентах, инициирующих структурные перестройки мембраны.
При сравнении кинетики УФ-инактивации свободной и мем-
браносвязанной ацетилхолинэстеразы обнаружено, что при изу
чении мембранноrо фермента наблюдается отклонение от кине
тики реакции первоrо порядка, проявляющееся в искажении ли
нейной зависимости остаточной активности от дозы облучения.
Одновременно изменяются и каталитические параметры остаточ-
ною фермента.
Необходимо подчеркнуть, что при УФ облучении свободных
ферментов в растворе представлены только активные (немоди
фицированные) и полностью ин активированные молекулы бел
0*
131
ка. Это значит, что при ИНlштивации ферментов в растворе
УФ свет выступает в роли необратимо1'О HeKoHKypeHTHo1'o ин
rибитора: по мере облучения снижается только максимальная
скорость ферментативной реакции, а величина константы Ми
хаэлиса остается неизменной. В отличие O'f растворимой формы
ацетилхолинэстеразы мембраносвязанный фермент фотоинак.
тивируется по типу смешанноrо ИН1'ибирования с OДHOBpeMeH
ным изменением значений максимальной скорости реакции и
константы Михаэлиса.
Е одной из 1'лавных особенностей УФ повреждения белков в
составе биомембран относится так называемый феномен фотохи
мической аллотопии. Под ним понимают эффект изменения
структурно.функционально1'О состояния фермента в составе био
мембраны, обусловленный стерическим возмущением ero KOH
Формации вследствие фотомодификации друrих структурных
компонентов мембраны. Проявление феномена фотохимической
аллотопии связывают преимущественно с фотохимическими по
вреждениями белков, способных под влиянием УФ света взаи
модействовать с соседними мембранными компонентами за счет
образования межмолекулярных ковалентных сшивок.
Модификация структуры биомембран с помощью ферментов
(например, фосфолипаз, трипсина, неЙраминидаз) или в резуль.
тате дезинтеrрации мембраны ультразвуком вызывает исчезно
вение названноrо феномена. Следовательно, феномен фотохими.
ческой аллотопии характерен только для интактных мембран.
В целом УФ-индуцированные изменения С'l'руктурно функ
ционалъноrо состояния мембранных беЛКQВ MOryT быть обуслов.
лены реализацией несколысих возможных процессов:
собственными фотопревращениями белка в реЗУJlьта'rе по
1'лощения энерrии УФ.излучения e1'o ароматическими и cepoco
держащими аминокислотными остатками;
интенсификацией ПФОJI, накоплением e1'o продуктов (пер
вичных и вторичных), влияющих на конформационное состоя.
ние мембраносвязанно1'О белка и e1'o "ближайшеrо" липидноrо
окружения или способных непосредственно повреждать белко
вую rлобулу;
ПО1'лощением квантов длинноволново1'О УФ излучения BOC
становленными пиридиннуклеотидами, флавинам:и, железоrюр.
фиринами, фотосенсибилизацией ими процессов ПОЛ, а также
влиянием их фотохимических продуктов на структуру молеку
132
лы белка (фермента), e1'o активноrо центра и ближайших "coce
дей" биополимера в мембране.
Рассмотрим совокупность фотопроцессов, связанных с ПО1'ло
щением УФ света хромофорными rруппами 6иомембран TpeTьe
1'0 типа, Т.е. различными кофакторами мембранных ферментов.
В некоторых случаях в качестве первичных акцепторов энерrии
излучения выступают вещества, которые передают эту энер1'ИЮ
на друrие молекулы, а сами при этом обычно не претерпевают
химических превращений. Такие вещества называют фотоееlt-
сut!uлuзаторамu, а процессы, в которых они участвуют, фото-
сенсut!uлuзuроваIlIlЫ,М,U. Фотосенсибилизаторы индуцируют хи
мические реакции, которые в их отсутствие не происходят. Они
имеют две системы электронно возбужденных состояний син
rлетную ев) и триплетную (38).
Отметим, что пероксидное фотоокисление полиненасыщенных
жирных кислот фосфолипидов мембран может происходить при
ПО1'лощении квантов света как липидо:м:, так и друrи:м:и молеку
лами фотосенсибилизаторами. Фотосенсибилизирующим дей
ствием обладают триптофановые и тирозиновые хромофоры бел
ков, порфирины, флавины, пиридиннуклеотиды. Следовательно,
ПОЛ может инициироваться не только УФ излучение:м:, но и ви
димым светом.
Как правило, фотосенсибилизировавное окисление происхо
дит с участием сенсибилизатора в триплетном состоянии, так
как оно является более длительным (lO 4 lO с). Поэтому наибо-
лее эффективными являются сенсибилизаторы, образующие дол
rоживущие триплетные состояния с высоким квантовым BЫXO
дом. К ним относятся мноrие синтетические красители (метиле
новый rолубой, бенrальский розовый, эозин), природные пиrмен-
ты (хлорофилл, 1'ематопорфирин, флавины) и ароматические yr
леводороды (рубрен, ню оторые антрацены). Большинство из них
ПО1'лощает видимый и длинноволновый УФ свет, поэтому эти ди-
апазоны длин волн наиболее эффективны при фотосенсибилизи
рованном окислении.
Молекулы сенсибилизатора в триплетном состоянии MorYT
химически взаимодействовать с молекулами субстрата в реакци-
ях переноса электронов или атомов водорода. При переносе элек
трона на 02 образуется супероксидный анион радИRал кислоро
да. При переносе электрона или атома водорода на друrие суб
C'l'paTbI кислород взаи:м:одействует с короткоживущими проме
133
жуточными соединениями, образуя продукты фотоокисления.
Друrой путь фото сенсибилизированных реакций КОСRенный:
молекула сенсибилизатора в триплетном состоянии химически
не участвует в реакции, а передает энер1'ИЮ возбуждения на MO
лекулярный кислород, образуя электронно возбужденное состоя
ние кислорода СИН1'летный кислород 102' Активность послед
Hero в окислительных реакциях в 100 раз выше, чем невозбуж
денноrо кислорода. Фотопроцессы с участием 102 настолько pac
пространены, что их часто выделяют в особый тип реакций, Ha
зываемый фотореакциями типа П:
80 ---7 18* ---7 38' ---7 80 + 102 (lA g или 1 L:g) ,
102 + D ---7 Dox.
Все остальные реакции по этой классификации относятся к
типу 1. Оба типа реакций широко распространены. Кроме окис
ления ОР1'анических соединений в химических системах, они оп
ределяют фОТОИН1'ибирование фотосинтеза и фотодеструкцию фо
тосинтетическоrо аппарата при высоких интенсивностях осве-
щения, участвуют в фотоповреждении сетчатки и хрусталика
1'лаза, определяют фототоксичность некоторых лекарственных
препаратов, обусловливают фотодеструктивное действие порфи-
ринов при их избыточном накоплении в клетках растений и
животных, используются для "разрезания" ДНЕ, уничтожения
вирусов, в фотодинамической терапии раковых заболеваний.
Основная часть изученных фотосенсибилизированных процес
сов осуществляется с участием кислорода. Фотоповреждение био
систем в присутствии сенсибилизаторов с участием молекулярно
ro кислорода называют фотодинамическим действием. Ero paCCMaT
ривают как частный случай фотосенсибилизированных процессов.
Еислороднезависимых фотосенсибилизированных реакций
известно сравнительно мало. В качестве примера можно привес-
ти фотолиз цист ина в макромолекулах белков при действии Уф
излучения с длинами волн более 280 нм. Фотосенсибилизатора
ми в этом случае служат ароматические аминокислоты трипто
фан и тирозин. Е кислороднезависимым фотосенсибилизирован-
ным процессам относят и фотоприсоединение псораленов к пи-
римидиновым основаниям ДИК.
ТИП фотосенсибилизированной реакции зависит также от I1Pи
роды сенсибилизатора и субстрата, в частности, от их способнос
ти вступать в окислительно восстановительные реакции.
134
Биомембраны являются основной мишенью повреждающе
1'0 действия света в присутствии порфириновых соединений, OT
носящихся к ЭНДО1'енным сенсибилизаторам. Изучение Mexa
низмов направленно1'О сенсибилизированноrо фотоповре)Кдения
опухолевых клеток с участием порфиринов, избирательно Ha
каПЛивающихся в них, леrло в ОСНОВУ метода фоторадиацион
ной терапии злокачественных новообразований. С друrой CTO
роны, в настоящее время необходимо разрабатывать защитные
меры от сенсибилизированнс1'О фотоповреждения биосистем в
присутствии ЭКЗО1'енных соединений (красителей, ароматических
У1'леводородов).
Особенности фотосенсибилизированных процессов, протека
ющих в мембранных системах, определяются ЧУЕствительностью
липидов и белков к сенсибилизированным фОТОПОЕреждениям.
Сенсибилизированному фотоокислению наиболее эффе:ктив
но подверrаются не насыщенные жирные :кислоты, а также холе
стер ин. Процессы их фотоокисления сходны с таковыми, проте
:кающими при пероксидном окислении липидов. Сенсибилизи
рованное фотоокисление липидов может осуществляться и по pe
а:кциям типа II и типа 1. Тип реа:кции фотоокисления различ
ных мембранных структур зависит от соотношения KOHцeHTpa
ций сенсибилизатор ЛИПИД и от способности МОЛ8:КУЛ сенсиби
лизатора образовывать arpe1'aTbI.
Более подробно изучены фотосенсибилизированные повреж
дения белковых макромолекул с участием синrлетнО1'О кислоро
да. Следует подчер:кнуть, что 102' с одной стороны, является уча
стником МНО1'их фотосенсибилизированных реакций, а с дрyrой
степень ero участия в фотопроцессах служит I<ритерием для вы-
явления механизма их протекания.
К настоящему времени установлено, что процесс rенерации
102 в результате переноса энерrии на кислород от трицлетных
молекул различных соединений является одним из самых эф
фе:ктивных механизмов образования этой а:ктивной формы кис
лорода. Он определяет фото сенсибилизированное образование 102
в растворах сенсибилизаторов в аэробных условиях, приводит к
появлению СИН1'летноrо :кислорода в темновых химических и био-
химических реакциях, если они сопровождаются образованием
возбужденных молекул ОР1'анических соединений в СИН1'летном
и триплетном состояниях. Кроме Toro, суперокс:ИДНЫЙ анион-
радикал, пероксид водорода, перrидроксильный радикал, образу-
135
ющиеся в разнообразных ферментативных инеферментативных
реакциях, способны 1'енерировать СИН1'JIетный кислород (см. rлаву
3). Вероятность фотоиндуцированноrо образования 102 особенно
велика в клетках, содержащих значительное количество поrло
щающих свет пиrментов. Тю<, эффективными фотосенсибилиза
торами образования СИН1'летно1'О молекулярно1'О кислорода яв
ляются основные ПИ1'ментЫ фотосинтеза (хлорофиллы, бактсрио
хлорофиллы, феофитины), основной ПИ1'мент зрения ретиналь,
флавины, порфирины.
Наиболее разработаны в методическом отношении способы
обнаружения СИН1'летноrо кислорода в 1'азовой фазе. Наличие в
системе 102 можно зареrистрировать методом эмиссионной спек
троскопии. Важным преимуществом 3'1'01'0 метода является то,
что он позволяет обнаружить lL1 и 1}:; + состояния СИН1'летноro
g g
молекулярно1'О кислорода в широком диапазоне давления, ТО1'да
как методом ЭПР можно определить lL1 состояние СИН1'летноrо
g
кислорода при давлениях в несколько мм рт. ст. Потенциалы
ионизации молекул 102 в состояниях lL1g и l}:;g+ ниже, чем для
OCHoBHo1'o состояния З}:;. На этом базируется фотоионизацион
ный метод обнаружения возбужденно1'О кислорода. Широкое pac
пространение имеет метод активации реакций путем замены Н 2 О
тяжелой водой. Эффект связан с тем, что время жизни 102 в D 2 0
значительно больше, чем в Нр, и поэтому активность СИН1'лет
Horo кислорода в D 2 0 также значительно выше. Современная Tex
ника люминесцентных измерений позволяет наблюдать и иссле
довать инфракрасную люминесценцию СИН1'леТIIО1'О кислорода
практически в любых растворителях в ходе фотосенсибилизиро
BaнIIbIx или темновых процессов. Однако реrистрация образова
ния синrлетноrо кислорода прямыми методами осложняется из
за ниЗкой e1'o стационарной концентрации вследствие взаимо
действия 102 с различными акцепторами и тушителями. Поэтому
широкое распространение получили методы обнаружения син1'
летноrо кислорода, основанные на применении акцепторов и TY
шителей, способных эффективно и более или менее избиратель
но взаимодействовать с СИН1'летным кислородом, приводя к ero
физической дезактивации или образованию специфических про
дуктов окисления. В качестве акцепторов 102 применяются алке
ны, производные фурана, ароматические У1'леводороды, холесте
рин; в качестве тушителей каротиноиды, азиды, амиды, (), TO
коферол. Возможно самотушение СИН1'летно1'О CL1) кислорода
g
136
триплетным еЕ) КИСЛОРОДОМ в растворах. Физическое тушение
g
Il:gt во MHoroM определяется возможностью перехода ll:g Ib. g в
колебательном движении молекул тушителя.
Обсуждаются два механизма тушения синrлетно1'О кислоро
да. Во первых, тушение осуществляется через образование комп
лекса с пере носом заряда, в котором 102 выступает в роли акцеп
тора электрона. Этот комплекс формируется лишь в момент co
ударения и не находится в равновесии с реа1'ентами, BO BTOpЫX,
тушение 102 происходит путем переноса энер1'ИИ от синrлетноrо
кислорода на электронный уровень тушитеJIЯ при условии He
посредственно1'О KOHTaK'ra электронных оболочек 102 и акцепто
ра энерrии. При физическом тушении не происходит дeCTpYK
ции тушителя. Химическое тушение приводит к окислению TY
шителя, накоплению 1'идроперОI{СИДОВ, образованию свободных
радикалов и развитию; свободнорадикальных процессов окисле
ния.
В нефотосинтези:рующих клеТI{ах самыми сильными туши
телями 102 являются аминокислоты и белки. Среди амИНОКИСJIОТ
наиболее эффективны триптофан, rистидин, метионин :и: цисте ин
(табл. 12). Для оценки способности соединений взаимодейство
вать с 102 используют константу скорости тушения, I{ОТОрую pac
считывают по уравнению Штерна Фольмера на основе измере
ний тушения люминесценции 102 или ИН1'иби:рования фотодест
рукции акцепторов СИН1'летноrо кислорода:
(СРох}) (СР")Ч == (CP1)j(q>I)'l == ('СА}of('С д \ == 1 + kq('CA).,[Q],
rде СРох квантовые выходы (или СI{ОРОСТИ) ОКИСJIения акцепто
ров 102; <Р! квантовые выходы (или интенсивности) люминес
ценции 102 ; 'СА время жизни 102; [Q] концентрация тymите
ля; параметры, измеренные в отсутствие тушителя, обозначают
ся индексом "о", а в присутствии тушителя "q".
Вклэд химическоrо тушения в активность аминокислот MO
жет составлять от 10 до 100 %. Оно приводит К существенным
изменениям структурно функциональноrо состояния белков. Фи
зическое тушение 102 аминокислотами и белками определяется
образованием комплексов с переносом заряда.
Липиды существенно более слабые тушители 102 по cpaB
нению с белками. Активность фосфолипидов в ОР1'анических pa
створителях практически равна сумме активностей составляю
щих жирных кислот. Ненасыщенные жирные кислоты и холес
терин тушат 102 преимущественно по химическому механизму
137
Таблица 12
КОJl.станты ClCOpOCmU тушенuл СUН2летН020 lCuслоро(}а
HelCoтopblMU 6UОЛОZU'lесlCU.мu .молеlCула.мu
Тущитель Условия проведения k q , моль I.с-1
эксперимента
Триптофан D 2 0, рН 7 8, метод 3,2 5,6 '107
тушения фосфоресценции
fистидин « 4,0 4,6 '107
Метионин « 1,3'107
L-цистеин « 0,9 5 '107
Тирозин « 2 5 '106
DL-фенилаланин « 7'105
rлиц:ин « < 105
Сывороточный альбумин « 2,6'108
быка
Сывороточный альбумин « 1, 7 7,8 .108
человека
r люкоза « 1,4'10'
Сахароза « 2,5'10'
Аскорбинова.я: кислота « 0,5 16 '107
fуанозин « 4 6 '106
АМР « 4'10'
A'l'P « 3 5 '101
а-то:коферол Растворитель СС!., метод 1 7 '108
тушени.я: фосфоресценции
Хлорофилл а « 1 7 '108
Ба:ктериохлорофилл а « 109
каротин « 7 8 .109
Яичный « 5 10 '10'
фосфатидилхоJПIН
Фосфатидилхолин « 105
сетчатки
Фосфатидилэтаноламин « 105
сетчатки
Вода « 2,8'103
с образованием rидропероксидов и далее свободных радикалов,
инициирующих ПОЛ. Примечательно, что хлорофиллы, бакте
риохлорофиллы и порфирины сочетают способность 1'енериро
вать и тушить 102 по физическому механизму. Это позволяет
указанным пиrментам ВЫПОлнять роль протекторов фотосинте
тических мембран от 1"енерируемоrо ими же синrлетноI'O IШСЛО
рода.
138
Фотосенсибилизированное окисление аминокислотных OCTaT
ков белков биомембран является первичным световым процес
сом. Оно приводит К образованию сшивок полипептидБыx цепей
биополимеров, т. е. к вторичному процессу, не требующему дo
полнительной световой активации. Различные типы сшивок MO
1'УТ формироваться между ФОТООI<.исленными аминокислотными
остатками ( в основном 1'истидина) и функциональными rруппа
ми белков (NH2 ' SH ).
Фотосенсибилизированные изменения CTPYKTYPHoro состоя
ния липидов И белков биомембран приводят к существенным
нарушениям их функционирования: изменению проницаемос
ти, процессов транспорта, катали'rической активности мембран
ных ферментов (их инrибированию). Степень фотоповреждения
мембран зависит от цело1'О ряда факторов: коэффициента pac
пределения сенсибилизатора между мембранной фазой и paCTBO
рителем, KBaHToBo1'o выхода триплетно1'О состояния красителя,
e1'o заряда, присутствия про и антиоксидантов.
В целом совокупность фИ3Иl<о химических процессов, инду
цированных воздействием УФ излучения и при ВОДЯЩИХ к Hapy
шениям ctpyktypho-функционально1'О состояния компонентов
мембраны и, в конечном итоrе, к изменению протекания метабо
лических процессов в клетке, может быть представлена в виде
следующей схемы (рис. 31).
Изучение молекулярных механизмов действия УФ излучения
на БИОllOлимеры, их надмолеl<,улярные комплексы и биомембра
ны представляет собой одну из актуальных проблем биофизики,
биохимии и мембранолоrии в связи с особой значимостью реше
ния задач в рамках важнейших разделов медицины и ЭRолоrии.
Так, в настоящее время в ХИРУР1'ических, акушерско-rинеколо
rических и терапевтических Rлиниках широко используется
метод аутотрансфузии УФ облученной RрОВИ (АУФОR). Целесо
образность rлубокой разраБОТI<.И вопроса оприменении это1'о :мe
тода и выявлении механи;змов e1'o положительноI'О ("тераП6ВТИ-
чеСRОro") действия была убедительно показана при лечении боль
ных с rнойно воспалительными и кожными заболеваниями, в
случае острых инфекций, заболеваний, связанных с иммунопато
ЛО1'ией. Доказана высокая эффеRТИВНОСТЬ АУФОК при лечении
сосудистых заболеваний нижних конечностей и ишемической
болезни сердца. Терапевтический эффект этоrо метода связыва
ют с усилением оксиrенации крови, купированием rИПОI<.сичес
139
hv (240---290 нм)
Интеrральные белки
Пиридиннуклеотиды,
железопорфирины,
флавины, витамины
Ароматv.ческие и
серосодерЖащие
аминокислотные
остатки
Фотоионизация
ароматических
аминокислотных
остатков, фотолиз
S S- и С S связей
Образование 102 или
радикальных интер
медиатое
Фотосенсибилизиро
ванное окисление
аминокислотных OCTaT
ков иненасыщенных
жирных кислот липидов
+
Образование белковых
сшивок
Изменение функцио
нальных свойств
мембранных белков
(инактивация или
активация)
I
I
I
I
I
I
I
I
I
I
I
I
I
I
I
I
,
I
I
I
I
.... ...................................
Нарушение
транспортных
свойств
мембран
Нарушение
рецепторных
свойств
мембран
Нарушение
фУНКЦИонирова
ния ферментных
комплексов
hv (220---290 нм)
Липиды
rидроr.ероксиды
не насыщенных
жирных кислот
Накопление
вторичных
продуктов ПОЛ
Нарушение
белок липидных
взаимодействий
Изменение барьер
ных и транспортных
свойств мемб аны
Изменение метаболических Процессов в клет!(е
Рис. 31. Схема физико-химических процеССОБ, индуцированных B03
действием УФ-излучени.я: и приводящих R нарушениям CTPYKTYPHO
ФУНRциональноrо состояния компонентов биомем5ран
140
ких сос'rояний, с повышением бактерицидных и нормализацией
реолоrических СВОЙС'l'В УФ облученной крови, а 'l'акже с'rимуля
цией факторов клеточноrо и rуморальноrо иммунитета. Вместе с
тем молекулярные основы формирования клиническоrо эффеI\:
та указанноrо метода исследованы Д Iеко не полностью. Прак-
тически не обсуждался вопрос о механизме протекания первич-
ных фотохимических процессов в Itрови под уrлом зрения их
роли в лечебно-оздоровительном дейс'l'ВИИ АУФОк.
В 1969 r. В. r. Ар'rюховым был O'l'крыт эффект усиления
оксиrенации молеItул rеМО1'лобина мышей под воздействием
УФ-света. Последующие исследования клиницистов подтверди-
ли сильнейшее оксиrенирующее действие УФ излучени.я на кровь.
Природа этоrо явления изучена недоста'rочно: мноrие аспекты
e1'o нуждаются в детализации, уточнении и КQнкретизации. Од-
ним ИЗ подходов к решению данной задачи является выяснение
механизмов деЙС'l'ВИЯ УФ-излучения на с'rруктурно функциональ
ные свойства важнейших белковых компонентов транспортной,
иммунолоrичесн:ой, антиоксидантной и окисли'rельной систем
крови орrанизма человека и животных.
На кафедре биофизики и биотехнолоrии Воронежскоrо 1'ocy
дарствеННОI'О унинеРСИ'l'ета в 'l'ечение длителыrorо времени прово-
дя'rся систематические исследования по изучению влияния УФ-ра
диации на структуру и фУНКЦIШ молекул OДHO и двухкомпонент
ных белков (rеМО1'лобина человека и некоторых животных, CЫBO
роточноrо альбумина, к,аталазы, пероксидазы, цитохрома с, лак
татде1'ИДРО1'еН8ЗЫ, белков системы комплемента) и их н:омпле:ксов,
иммобилизованных ферментов и биомембран в условиях различ-
Horo МИКрООItружения, в широком диапазоне рН и 'l'емператур, в
присутствии модифицирующих areH'l'OB (серотонина, NAD(H) , ac
корбиновой кислоты, тре'rичноro бута нола, манНИ'l'а, а-токоферола
и др.). Определены величины I\:вантовых выходов, констант CKO
рост ей , энер1'ИИ активации и термодинамических параметров pe
акции фотомодификации белковых молекул.
Установлено, что 1'лавной особенностью действи.я: УФ-света
на rемопротеиды явл.яе'rся фотосенсибилизаци.я: ОС'l'атками apo
матических аминокислот простетических rpупп (1'eMoB) и ини
циация путем фотомодификации последних локальных I\:ОНфОр
мационных изменений апобелков.
Воздействие УФ-света на растворы супероксиддисмутазы
(СОД) индуцирует повышение ее фу:ющиональной ак'l'ИВНОСТИ.
141
Эффект фотоак'rивации СОД наиболее выражен при экстремаль
ных для проявления ее ферментативной активности значениях
рН и определяется конформационным состоянием белковой 1'ло
булы.
Ин активация молекул лактатде1'идроrеназы (лдr) под влия
нием УФ света обусловлена разворачиванием ее ОЛИ1'омерных
молекул. Важную роль в процессах фотопревращений отдель
ных изоферментов лдr иrрают активные формы кислорода (син
rлетный молекулярный кислород, 1'идроксильный радикал). Pe
инфузия УФ облученной крови больным бронхиальной астмой
приводит к снижению функциональной активности лдr, что сви
детельствует об уменьшении интенсивности окислительных про
цессов, протекающих в крови пациентов.
Определяющая роль в УФ индуцированных изменениях 1'e
молитической активности системы комплемента принадлежит
оrюсредованному через продукты радикальной природы (преиму
щественно продукты пероксидноro окисления липидов) действию
УФ света. Отмечено корре1'ирующее дейС'rвие АУФОЕ терапии
на структурно-функциональное состояние эритроцитарных MeM
бран и систему комплемента крови больных бронхиальной aCT
мой и язвой желудка.
Исследование уровня функциональных свойств и CTPYKTYP
Horo состояния важнейших ферментов транспортной, иммуноло
1'ической, антиоксидантной и окислительной систем крови боль
Ных С различной этиолоrией и паТО1'енезом до и после проведе
ния сеансов АУФОК и ЭЛОI{ терапии, сопоставление результа
тов биофизическоrо и биохимическоrо анализов изучаемых по-
I,<азателей с клинической картиной развития паТОЛО1'ических co
стояний позволит осуществить математическое и физическое
моделирование динамики развития заболеваний на различных
стадиях ero лечения, разработать рекомендации индивидуально
дифференцированноrо подхода к использованию АУФОК и ЭЛОК
при лечении конкретных патолоrий и внедрить прикладные про
rpaмMbI использования фотоrемо и лазеротерапии в медицине.
4.1.2. Раf}цаЦlLоюю-хuмurtескuе прееращенUJl
структурных lCO.1ItlZOHellmoe бцоме.мбран
Процесс свободнораДИlCllЛЬНО1'О пероксидноrо окисления ли
пидов мембран рассматривают в настоящее время как один из
механизмов "биохимическоrо усиления" эффекта ионизирующей
142
радиации, который иrрает важную роль в развитии лучево1'О по
ражения живых систем.
При первичном взаимодействии (физическая стадия) ионизи
рующе1'О излучения электромаrнитной или корпускулярной при
роды с атомами вещества образуются положительно и отрицатель
но заряженные ионы, а также возбужденные электронные состоя
ния атомов и молекул. В элементарном акте ионизации pacxoдy
ется около lO 12 эВ энер1'ИИ ионизирующей радиации (IJотенци
ал ионизации). Если передаваемая элы{трону энерrия больше этой
величины, то он сам становится источником ионизации дРУ1'их
атомов; если меньше потенциала ионизации, имеет меб'О возбуж-
дение атома (молекулы). Физико химическая стадия воздействия
радиации на биообъеI{ТЫ существенно зависит от особенностей их
структурно-функциональной Ор1'анизации. При этом большое зна-
чение имеет процесс радиолиза воды:
н 2 о
возбуждсние
н 2 о
ИОlI1шu.ЦИrI
» HzO* » н'+ он,
» н 2 о + + ё t Н,О
H20 """"""'"
+ 1:1"
н' + OH
н
+ И,О
еrи.цр
Молекулярный кислород, растворенный в биолоrическнх жид
костях, вступая в реакцию с продуктами первичноro радиолиза,
является источником образования супероксидно1'О анион-ради-
кала, 1'идропероксидов, орrан:ических пероксидов, эпоксидов:
н 2 о ----7 н' + он' + ё rидр + Н 2 + Н 2 О 2 + НзО+;
ё rидр + 02 ----7 O н' + 02 ----7 HO .
Все последующие реакции, развивающиеся в живых систе
мах под влиянием вышеуказанных продуктов взаимодействия
ионизирующей радиации с веществом, носят свободнорадикаль
ный характер (см. 1'лаву 3). Вклад KOCBeHH01'O действия (т. е. с
участием воды) ионизирующеrо излучения на БИОJIО1'ические
молекулы СОС'l'авляет 85 90 %. АФЕ, образующиеся при луче-
вом воздействии, индуцируют окислительные реакции в MaKpo
молекулах по ОI{сидазному или ОКСИ1'еназному пути. В реЗУЛЬ'l'а
те ферментативноrо или неферментативноrо оксиrеназноJ'O окис
143
ления образуются перOIссидные ПРОДУК'l'ы, способные к повреж
дению биомаКРОМОЛeIСУЛ и су6клеточных структур.
Сравнительный анализ величин ради:ационно хи:мичеСlсоrо
выхода G (paBHo1'o числу изменившuхся или вновь образован
ных молекул на 100 эВ поrлощенной энерrии), используемоrо
для хараК'l'еристики радиочувс'rвительности молекул, показал,
что наиболее радиочувствительным компонентом клеТIСИ .я:в
ляются фосфолипиды (G> 1), выступающие в качестве ИС'l'очни
ка образования первичных продуктов радиолиза орrаничес
ких радикалов и пероксидов, участвующих в реакциях иници
ации, продолжения и разветвления цепей свободнорадикально
1'0 окисления.
Активные радикальные ме'fаболиты (0,\ ОН', н0 2 ', Н', е ) и
rnдp
продукты радиолиза липидов мембран индуцируют в белках про
цессы окисления т:иоловых и аминоrрупп, образования вну'rри
и межмолеКУJIЯРНЫХ СШИБОК, сопровождающиеся их инактива
цией. В нуклеиновых кислотах и нуклеотидах происходят OДHO
и двутяжевые разрывы, модификация азо'l'ИСТЫХ оснований, об
разование сшивок ДHK ДHE и ДНК белок.
Таким образом, в результате воздействия ионизирующей pa
диации на биомембраны происходи'l' нарушение с'rpуктурной op1'a
низации всех ее компонентов, изменяется про'rекание транспорт
ныx и метаболических процессов, становится возможным выход
ллзосомальных ферментов (в частности, протеаз и нуклеаз), раз
рушение вJIy'l'риклеточныx структур и rибелъ lслетки,
Важную роль в инактивацин токсичных продуктов ПОЛ иr
рают фосфолиnазы, особенно фосфолипазы А2' В процесс е фосфо
липазноI'О rидролиза происходит удаление из мембран наиболее
I'лубоко де1'радированных фраrментов ненасыщенных жирных
кислот липидов. В результате токсичные прОДУК'fЫ ПОЛ пере
ходят в rидрофильное окружение и подверrаютс,я ипактивации с
участием монооксиrеназной системы (в том числе цитохрома
P 450) ЭRДоплазматичеCIсоrо реТИ1сулума.
В 60 x rr. было показано, что ион-изирующее излучение инrи
бирует работу на'rpиевоrо насоса эритроцитов человека. TOPMO
жение активноrо оттока Na+ наблюдается уже после облуqени,я в
дозах 8,9 89 тр. При повышении дозы радиациц до 200 rp транс-
порт Na+ и К+ В эрИ'rроцитах полностью инактивируется. После
облучения эритроцитов крысы в дозе 7 I'p также выявлено cy
щественное торможение активности Na+, Е+ АТФазы.
144
Результаты исследования влияния обще1'О рент:rеиов'Скоrо об
лучения на фую:щиональные свойства Na\ IС+ АТФазы мембран
клеток печени крысы показали, что торможение удельноii aI<
тивности фермента отмечается в течение длительноrо времеIlИ
(1 ч 60 сут) после прекращения воздействия радиации. Чс
рез 1 ч потеря активности фермента составляла 87 %. Через 30
и 60 сут У выживших животных наблюдалась полная ИlIаI<.ТI1
вация фермента.
Следовательно, инrи6ирование акТИВНО1'о мембранноrо TpaHC
порта под действием ионизирующе1'О излучения происходит в
клетках различных типов, в разных условиях облучения :в l11И
роком диапазоне доз. ПреДIюлаrаIOТ, что сохранение ЖИЗIlедея
тельности клеток при деЗ81 ТИВации натриевOI'О насоса связано
с включением компенсаторных механизмов поддержания roMeo M
С'rаза. Например, в мембранах эритроцитов при торможении ан,;м
тивности Na+, К+ АТФазы активность са2+.Атфазы превы:w:аст
контрольный уровень, а в плазматических мембранах печени
увеличиваетсз Мg2i АТФазная активность. Известно, что Са 21 11
Мg2+ способствуют связыванию белков, в том числе АТФаз, с MCM
браной. В ЛИlIИДНЫХ бислоях Са 2 + обеспечивает образование мо-
стиков между фосфатидами, в реЗУЛЬ'l'зте KOToporo упаковка ли
пидной фазы с'rановится более плотной и уменьmается прО,Н:И
цаем ость мембраны. Кроме Toro, после рентrеиовскоrо облуче
иия животных в дозе 5 rp обнаруживается повышение аI<ТИ:В
ности щелочной фосфатазы, свззанной с плазматическими MeM
бранэми клеток печени мышей. Щелочная фосфатаза И"I1:тех'м
ралъный фермент плазматических мембран некоторых клеток
участвует в а!(ТИВНОМ транспорте ионов Na+ и К+.
Воздействие ионизирующеrо излучения приводит к сущес'l'ВСНм
ному подавлению аКТИВJюс'rи друrоrо 'I'ранспортноrо белка
НСОз АТФазы плазматических мембран клеток печени и ЭрИТ
роцитов, В результате KOToporo возможно нарушение КИСЛОТlХО
щелочноro равновесия в клетке л орrанизме.
Торможение функциональной активности АТФаз, участ:вую
щих в активных транспортных процессах, коррелируе'r с Hapy
шепием баланса элек'rролитов в облученной клетке, а 'l'a:f(.же с
изменением прОНлцаемости плазматических и внутриклеточных
мембран, вслеДС'I'вие чеrо реrистрируется выход внутриклеточ-
HOro калия, подавление окислительноrо фосфорилирования, Y'I'еч-
ка К+ из МИ'l'охондрий.
10. ЗакlIЗ 3788
141i
Функциональная активность мембраносвязанной 5' нуклео
тидазы печени крыс значительно возрастает при действии иони
зирующей радиации как в ранние, так и в поздние сроки после
облучения. Считают, что повышение активности ЭТО1'о фермента
не связано с синтезом фермента de novo, а обусловлено перерас
npеделением белка в растворе и в составе мембран.
По видимому, механизмы пострадиационной вариабильнос
ти активности мембранных белков предусматривают реализацию
реrуляторных эффектов целоrо ряда факторов: например, влия
ния нейроэндокринной системы на функционирование фермен
тов в облученном ОР1'анизме, биолоrически активных веществ,
продуктов пероксидноrо окисления липидов, изменений зарядо
Boro состояния поверхностных участков мембраны и др.
Ионизирующее излучение ИНдУцирует снижение общеrо YPOB
ня мембранных фосфолипидов и повышение содержания холе
стерина, что сопровождается возрастанием коэффициента холе
стерин/фосфолипиды до 1,05 при норме 0,60. Однако уровень
индивидуальных фосфолипидов изменяется разнонаправленно:
происходит накопление сфинrомиелина и фосфатидилсерина и
снижение содержания фосфатидилхолина, фосфатидилэтанол
амина и особенно фосфатидилинозитола. В целом коэффициент
насыщенности мембранных липидов повышается. Все это приво
дит К значительным нарушениям текучести мембраны, увели
чению ее ВЯЗlСОСТИ, изменениЮ функциональных свойств мемб
ранных белков. Предполаrают, что механизм пострадиационной
модификации состава и содержания структурных липидов в плаз
матических мембранах животной клетки связан с изменением
npоцессов синтеза и распада липидпереносящих белков, фермен
тов липидно1'О обмена, нарушением внутримембранной динами
'ки липидных компонентов.
Вместе с тем необходимо отметить, что липиды клеточных
мембран животных защищены от процесса ПОЛ при воздей
ствии ионизирующей радиации по сравнению с искусственны
ми мембранными структурами, в частности, липосомами. Ha
копление холестерина может препятствовать приросту уровня
пероксидов липидов и приводить К торможению ДРУ1'их про
цессов в мембране, связанных с развитием лучевой патоло1'ИИ.
Кроме To1'o, в мембранах локализованы собственные низкомо
лекуля:рные антиоксиданты (например, олокоферол) и защит
ные антиокислительные ферментные системы. Так, результаты
146
модельных исследований свидетельствуют о том, что витамин Е
образует комплексы с мембранными фосфолипидами, содержа
щими остатки арахидоновой кислоты. Формирование этих KOM
плексов способствует стабилизации и снижению проницаемос
ти клеточных мембран с высоким содержанием полиненасы
щенных жирных кислот.
При изучении влияния минимальных летальных доз
(154,8 мКлjкr) peHT1'eHoBcKoro излучения на активность HeKO
'l'OpbIX фермен'l'ОВ У1'леводно1'О обмена клеток KocTHoro мозrа крыс
выявлено, что после облучения в популяциях миелокариоцитов
активность лактат , малат- и rлюкозо 6-фосфатдеrидроrеназ зна
чителъно уrнетается в течение 72 ч после облучения и ДОСТИ1'а
ет минимальноrо значения на 3-и сутки эксперимента. На 10 e
сутки наблюдается увеличение значений скорости реющий, Ka
'l'ализируемых, малат- и лактатде1'ИДРО1'еназой, при снижении
активности rлюкозо 6 фосфатдеrидроrеназы. Следовательно, в
ранние сроки после воздействия ионизирующей радиации на
орrанизм животных происходит усиление интенсивности анаэ
робных процессов и ослабление дыхания и пентозофосфатно1'О
пути.
Облучение животных ионизирующей радиацией вызывает не
только изменения активности МНОl'ИХ ферментов, реrулирующих
процессы клеточно1'О метаболизма, но и относительноrо содержа
ния изоферментов. Так, в ряде работ показано, что у-облучение
влияет на активность изоферментов лактатде1'идроrеназы, l ИС-
лой фосфатазы, неспецифической эстер азы. Причем при более
низких дозах облучения величина изменений в относительном
содержании изоформ может быть больше, чем при высох их. При
анализе относительноrо содержания фракций изоферментов вы-
шеуказанных белков в различные сроки после у-облучения в дозе
1 rp установлено, что воздействие радиации вызывает существен
ные изменения в относительном содержании изоформ изучен
ных ферментов, которые имеют, по видимому, фазовый харак-
тер. Считают, что эти результаты связаны с интенсивной пере
стройкой 1'енетическоrо аппарата клетки в период до 7 суток
после облучения. Новому структурно функциональному состоя-
ниlO rенетическоro аппарата соответствует иной уровень процес
сов метаболизма, происходит запуск адаптивных систем, нивели-
руlOщих нарушения, возникающие в результате воздействия иони
зирующе1'О излучения на орrанизм.
10'"
1-17
А. И. Дворецким (1986) предложена 1'ипотеза вероятной пос
ледовательности процеССОБ нарушения энеР1'етичеСRИХ и ре1'УЛЯ
торно транспортных функций мембран в условиях воздействия
ионизирующей радиации.
Инициирующим процессом при действии лучевоrо фактора
является аRтивация пероксидноrо окисления липидов в клетке,
происходящая на фоне резко1'О усиления эндоrенноrо фосфоли
пазноrо rидролиза. В результате накопления продуктов пол про
исходит изменение баланса между эндоrенными радиопротекто
рами и радиосенсибилизаторами в пользу последних.
Окисление мембранных липидов и повышенный эндоrенный
фосфолипазный rидролиз приводят к нарушению проницаемос
ти биомембран для катионов. Это вызывает уменьшение уровня
калия, увеличение содержания натрия и возрастание KOHцeнтpa
ции кальция в цитозоле, поэтому происходи'r насос зависимое
увеличение объема клетки, нарушение структурно функциональ
Ho1'O состоя:ния Na+, К+ АТФазы за счет конформационных изме
нений молекул фермента на фоне липид белковых перестроек в
мембране. В ответ на изменение ионноrо rомеостаза возможно
компенсаторное увеличение количества молекул Na+, К+ АТФазы
за сче'l' "резервных". Однако вследствие деэнерrизации клетки,
индуцированной нарушением окислительноrо фосфорилирова
ния и дефицита АТР, функционирование Na+, К+ АТФазы оказы
вается затрудненным. Изменяется и активность Са 2 + АТФазы. Все
это, наря:ду с нарушением пассивной проницаемости, вызывает
резкое увеличение уровня внутриклеточноrо кальци.я:. В резуль
тате выявляются необратимые последствия, связанные с модифи
кацией мембранно1'О скелета и изменением формы клетки. Cy
щественным моментом в патофизиолоrии клеточной 1'ибели яв
ляется вторичная активация фосфолипаз кальцием. Это приво
дит К фосфолипазному истощению мембран клеток и внутрикле
точных ОР1'анелл и возрастанию их проницаемости. Нарушения
в функционировании всех клеточных систем способны индуци
ровать необратимые изменения в процессе жизнедеятельности
клеток.
Необходимо отметить, что компоненты биолоrических мемб
ран иrрают ключевую роль в развитии свободнорадикальных pe
акций в клетках и тканях, индуцируемых воздействием ионизи
рующе1'О излучения, и патоrенезе лучево1'О поражения живых
орrанизмов. Процессы нарушения липидноrо состава, текучести
148
липидных компонентов, подвижности ЛИПИДБЫХ и белковых MO
лекул, липид белковых взаимодействий, изменения активности
мембраносвязанных фермеи:тов, собственных систем антиради
кальной защиты представляют собой комплексный и взаимосвя
занный механизм, индуцирующий пострадиационные cтpyKTyp
но-функциональные перестройки биомембран и обеспечивающий
переход клеток и орrанизма на новый метаболический уровень
функционирования.
4.2. уф иIIдуцировАнныE ИЗМЕНЕНИЯ
СТРУКТУРНО ФУПКЦИОНАЛЫIоrо СОСТОЯНИЯ
МЕМБР АНОСВЯЗАПНЫХ АЦЕТИЛХОЛИНЭСТЕР АЗЫ
И NA+, К+ АТФА3Ы В ПРИСУТСТВИИ НЕКОТОРЫХ
ХИМИЧЕСI<:ИХ МОДИФИКАТОРОВ
4.2.1. ФУIl,кциОliальна.Jl активность мем{fраносв.Jl.юшюй
ацетилхолинэстерааы после УФ-облу'"енU.Jl в присутствии
{fензuловоzо спирта и КOllкаllаеаЛltна А
Значительный вклад в решение проблемы, касающейся изу-
чения CTPYKTypHoro состояния, локализации, особенностей функ-
ционирования отдельных компонентов в составе Бадмолекуляр
Ho1'o комплекса, характера их взаимодействия с ближайшим
молекулярным окружением, Moryт внести методичеСI<ие подхо-
ды, связанные с модификацией тех или иных структурных эле
ментов мембран. В :качестве модиФицирующих a1'eHToB, приме
няемых как для исследования свойств интактных мембран, так и
для реryляции метаболических процессов, осуществляющихся с
их участием, активно используются разнообразные естественные
и синтетические соединения, ферменты, физические факторы
УФ излучение и температура.
Информативным тестом для оценки нативно1'О состояния
эритроцитарной мембраны, а также исследования структурных
перестрое:к и изменений в функционировании ее основных :КOM
понентов липидов и белков, индуцированных воздействием
целоrо ряда физико химических areHToB, является определение
фун:кциональной активности конформационноrо маркера мемб-
раны ацетилхолинэстеразы (см. раздел 1.2.5).
На рис. 32 показаны изменения функциональной активности
мембран ос вязанной P.LКЭ после облучения мембран эритроцитов
челове:ка УФ светом в интервалах длин волн 240 390 нм и зоо
400 нм. Видно, что при воздействии УФ излучения (240 390 им)
149
А,%
100
2
Рис. 32. ФУН1щионмьнал aк
ТИВНОСТЬ ацетилхолинэстеразы
мембран эритроцитов человека,
модифицированных воздействи-
ем УФ-излучения: 1 I{ОНТРОЛЬ;
2 УФ облучение в ин'rервале
ДЛИН ВОЛН 300 400 нм; 3
УФ облучение в ИН'I'ервале длин
волн 240 390 нм. Каталитиче
скую активность реrистрировали
по методу Хестрина, йС:а:ован:аому
на колориметрическом оnpеделе
нии концентрации ацеТИJIXолина
80
60
40
20
о
3
на суспензию эритроцитарных мембран активность исследуемо
ro фермента статистически достоверно возрастает на 12 %. Облу
чение мембран длинноволновым 'УФ светом приводит к СНИ.же
нию функциональной активности АХЭ на 50 %. Таким образом,
фоточувствительность мембранной АХЭ сутцественно зависит от
спектральноrо состава УФ света, а значит, она определяется po
лью различных хромофоров мембран при их облучении в YKa
занных диапазонах длин волн.
УФ излучение в интервале длин волн 240 390 нм эффективно
поrлощается такими структурными компонентами эритроцитарной
мембраны, как полиненасыщенные жирные кислоты фосфолипидов,
а также ароматические и серо содержащие остатки интеrpальных
белков. Необходимо отметить, что мембранные эффекты УФ облу-
чени.я: в значительной степени вызываются пероксидным окисле
нием липидов и лишь частично обусловлены фотохимическими
превращениями белков. Следовательно, поrлощение 'УФ излучения
в интервале длин волн 240 390 нм указанными выше хромофора
ми эритроцитарных мембран индуцирует такие структурные пере-
стройки липидноrо бислоя и интеrpальных белков, которые, в свою
очередь, затрarивают конформационное состояние АХЭ и приводят
К увеличению ее функциональной активности.
И. д. Волотовским: И соавт. (1978), С. В. Коневым и И. Д. Во-
ЛОТОвским (1979) при изучении влияния CTPYKTypHoro состоя-
ния липидной фазы мембран эритроцитов на эффективность фо-
150
тохимичеСRОЙ МОДИфИI{ации АХЭ, связанной с мембраной, обра
ботанной фосфолипазами, а 'l'акже обедненной холестерином, cдe
лано заключение о важной нефотохимической роли липидной
фазы мембран в определении характера и эффективности дей-
ствия УФ-света на активность фермента,
Учитывая эти данные, можно констатировать, что ПФОЛ,
индуцированное УФ излучением в интервале длин волн 240
390 нм, не приводит к фотодеструкции мембранной А.ХЭ, а по-
средством изменения контролирующих конформацию фермента
белок-белковых и белок-липидных взаимодействий способствует
более эффективному протеканию каталитической реакции. На
наш взrляд, интересным представляется тот фаRТ, что облучение
мембран эритроцитов длинноволновым 'УФ-светом индуцирует
резкое снижение каталитической активности А.ХЭ. Хромофорами
УФ-света в данных условиях эксперимента являются различные
(восстановленные) пиридиннуклеотиды, флавины, железопорфи-
рины. Итак, инrибирование мембранноl'О фермента в указанном
случае может быть обусловлено фотохимическими превращени
ями вышеназванных хромофоров 'УФ-излучения. Не исключена
вероятность локализации этих акцепторов УФ света на мембра
не в непосредственной близости I{ исследуемому белку. Вместе с
тем учитывая то обстоя:тельство, что хромофорные 1'руппы мем-
бран (порфирины, флавины, нуклеотиды) выступают в Rачестве
сенсибилизаторов ПФОЛ, можно предположить, что в процессы
модификации А.ХЭ вносят ВRлад преимущественно фотохимичес
кие превращения указанных Rомпонентов биомембран, а таRже
фотосенсибилизированное ими пероксидное окисление липидов.
На рис. 33 представлены результаты исследования фермента
тивной активности мембранной А.ХЭ в присутствии ROHRaHaBa-
лина А из канавалии мечевидной (Concanavalia ensiformis) в
Rонцентрациях 0,4 и 0,8 моль/л. Конканавалии А относится к
классу лектинов, связывание которых с поверхностью плазмати
ческой мембраны клеток имеет самые разнообразные последствия,
например, вызывает изменение в расположении поверхностных
белков и l'ликопротеинов, физическом состоянии липидов мемб
ран, проницаемости их для различных веществ и активности мем-
бранных ферментов (см. раздел 1.3). Rонканавалин А, избира
тельно модифицируя CTPYRtyp.ho-функциональное состояние ин
теrpальных мембранных белков, способен изменять и фоточув
ствительность AJ{Э.
151
А,%
о
Рис_ 33. Ка'rалитическая актив-
ность ацетилхолинэстеразы мемб-
ран эритроцитов человека в при
СУТСТБИИ кон:канавалина: 1 KOH
троль; 2 конканавалин Б KOH
центрации 0,4 моль/л, соотноше
ние суспензии :мембран и KOHKa
навалина 1:0,05; 3 KOHKaнaвa
ЛИН Б концентрации 0,4 моль/л, со-
отношение 1:0,2; {/ KOHKaнaвa
ЛИН Б концентрации 0,4 моль/л, со-
отношение 1:1; 5 конканавалин
в концентрации 0,8 моль/л, COOT
ношение 1: 1
100
80
60
40
20
2
3
4
5
Из рис. 33 видно, что обработка мембран эритроцитов YKa
занным модифицирующим areHToM вызывает снижение функ-
циональной активности фермента. При использовании объемных
соотношений суспензии мембран иконканавалина 1:0,05 не за
реrистрированы статистиqески достоверные различия величин
активности мембранной АХЭ в нативном состоянии и в присут
ствии лектина. С увеличением этих соотношений до 1:0,2 и 1:1
активность фермента статистически достоверно снижается по
сравнению с контролем на 16 и 42 % соответственно. Примене
ние конканавалина в концентрации 0,8 моль/л и соотношении
суспензии мембран и экзоrенноrо модификатора 1:1 вызывает
инrибирование мембранной АХЭ на 75 %.
Основные структурные особенности биолоrической мембра
ны и, следовательно, ее функциональная динамичность опреде
ляются свойствами липидноrо бислоя, существенно влияющеrо
на подвижность белковых молекул и их ассоциацию в мембране.
Известно, что бензиловый спирт, взаимодействул преиму
щественно с rидрофобными участками липидной фазы, увеличи
вает аодвижность последней, а также изменяет подвижность ее
отдельных компонентов.
На рис. 34 показаны изменеНl1Я функциональной активности
мембраносвлзанной АХЭ в присутствии бензиловоrо спирта. Ин
кубирование суспензии мембран с этим модификатором ариво-
152
дит К снижению каталитической активности исследуемо1'О фер-
мента на 16 18 % по сравнению с контролем. Увеличение объе-
ма добавляемоro спирта до 1 мл не вызывает усиления ero ИН1'и
бирующеrо действия по отношению к активности молекул АХЭ.
Таким образом, увеличение подвижности ЛИПИД:ЕОЙ фазы с по
мощью бензиловоrо спирта и, тем самым, модификация БЛИж'ай-
ше1'О окружения мембраносвязанной АХЭ фосфатидилсерина
индуцирует снижение ее ферментативной активности.
На рис. 35 пред ставлены данные, полученные при исследова-
нии функциональной активности АХЭ мембран эритроцитов, УФ
облученных в интервале длин волн 300 400 нм в присутствии
конканавалина А. УФ облучение интактных мембран эритроци-
тов индуцирует снижение каталитической активности АХЭ на
50 %, обусловленное, по всей вероятности, поrлощением энер1'ИИ
'УФ света ПИРИДИН:Еуклеотидами, флаВИRами, ЖeJrезопорфири
нами, витаминами, входящими в состав мембраны. При воздей-
А, % А,%
100
100
80
80
60 -
60
40 40
20 20
О 2 3 4 о 2 3 4
Рис. 34, Функциональная актив
ность ацетилхолинэстера.зы мембран
ЭРИТРОЦИТОВ человека, модиф -
ванных 2 % -ным раствором бензи-
ловом спирта: 1 контроль; 2
соотношение суспензии мембран и
беНЭИJIОБоrо спирта 1:0,05; 3 со-
отношение эти:х Компонентов 1:0,2;
{/. соотноше:ние 1: 1
P . 35. Ферментативная актив
ность ацетилхолинэстеразы мембран
Эр:И'J.'роцитов челове}(а., облученных
УФ-светом в области 300 400 нм
в присутствии }(ОНR8Н8В8лина А:
1 контроль; 2 активность УФ
облученной АХэ; ,'9 активность
АХЭ в присутствии }(он}(анавалина;
'4 активностъ УФ-облучеmюй АХЭ
в присутствии конканавалина
153
ствии УФ излучения на суспензию мембран эритроцитов в при
сутствии конканавалина А функциональная активность мембра
носвязанной АХЭ возрастает на 45 % по отношению к исследуе
мому параметру при облучении нативных мембран. KOHKaHaBa
лин А характеризуется спектром ПО1'лощения с Л Il18Х при 280 нм,
что обусловлено свеТОПО1'лощением остатков ароматических ами
нокислот, входящих в состав ero молекулы. Следовательно, из
менение фоточувствительности мембранной PLКЭ в присутствии
лектина может быть связано с влиянием на ее структурное coc
тояние продуктов фотохимических превращений нуклеотидов,
коферментов, железопорфиринов и витаминов, интенсивно по
1'лощающих свет в данной области спектра.
На рис. 36 показаны изменения ферментативной активности
АХ.Э, модифицированной воздействием УФ-излучения (зоо
400 нм) в присутствии бензилово1'О спирта. Из анализа рисунка
следует, что облучение суспензии эритроцитарных мембран в при
сутствии указанноrо химическо1'О areHTa индуцирует резкое воз
растание каталитической активности белка: 210 % по cpaBHe
нию с ее уровнем при УФ облучении интактных мембран (50 %).
Наблюдаемый эффект активации мембранной АХЭ может быть
связан, по всей вероятности, со структурными перестройками MO
лекул ближайшеro липидноrо окружения фермента, обусловлен-
ными воздействием на Hero бензиловоrо СIIирта и, прежде Bce1'o,
ero фотохимических продуктов. Вследствие разрыхления липид
ной фазы мембраны, модифицированной бензиловым спиртом, и
увеличения подвижности ее отдельных компонентов возможно
ослабление связей АХ.Э с молекулами, находящимися в Heaocpeд
ственном контакте с ней, а именно фосфатидилсерина. Результа
том этих процессов, по-видимому, являются конформационные
превращени.я всей молекулы АХЭ и демаскирование ее активноro
центра на поверхности эритроцитарной мембраны, проявляющи
еся в резком возрастании функциональной активности фермента.
При УФ облучении мембран в диапазоне длин волн 240
390 нм в присутствии указанных экзоrенных модификаторов Ha
блюдаются противоположные по направлению изменения функ
ционирования P.L[Э.
На рис. 37 пред ставлены результаты исследования катали
тической активности мембраносвязанной АХЭ при воздействии
УФ излучения (240 390 нм) на суспензию мембран эритроци
тов В присутствии канканавалина А (фИТО1'емаrrлютинина). Из
154
А,%
А,%
200
100
80
150
60
100
40
50
20
о
о
2 3 4
Рис. .16. Каталюическал акТИБ
насть ацетилхолинэстеразы мембран
эрюроцитов человека, облученных
'УФ светом в области 300 400 нм
в присутствии 2 % Horo бензилово
1'0 спирта: 1 контроль; 2 aк
ТИБность 'УФ облученной АХэ; 3
активность АХэ в присутствии бен
зиловоrо спирта; 4 активность
УФ-облученной АХЭ в присутствии
бензиловоrо спирта
1 2 3
Рис. 37. Фующио:в:альнал aк
тивность аце'l'ИЛХОЛИНЭС'l'еразы
мембран эритроцитов человека, об
лученных УФ-светом в области
240 390 нм в присутствии кон-
канавалина: 1 I-tон'l'рОЛЬ; 2
активность УФ облученной АХЭ;
3 аК'l'ИВНОСТЬ АХЭ :в присут-
ствии конкана:валина; 4 актив-
ность УФ облученной АХэ в при-
сутствии конканавалина
анализа рисунка вытекает, что УФ облучение мембран эритроци
тов в e1'o присутствии индуцирует значительное снижение aK
тивности этоrо фермента до 12 % (против 112 % при облучении
интактных мембран). Вероятно, инrибирование мембраносвя:зан
ной АХЭ в данном случае происходит за счет конформационных
изменений молекул фермента, обусловленных воздействием на
последние, а также на молекулы интеrpальных белков продуктов
фотолиза конканавалина и приводящих, по-видимому, К стери
ческому экранированию активноrо центра. Необходимо отметить,
что УФ облучение буферноrо раствора (рН 7,6) конканавалинаА
вызывает статистически достоверное снижение величины опти-
ческой плотности в максимуме ПО1'лощения при 280 нм, связан
ное либо с разрушением части хромофоров УФ-света лектина
ароматических аминокислотных остатков, либо с их экранирова
155
А,%
100
80
60
40
20
О 1
Рис. 38. Фермен'rатИБНал aк
тивность ацетилхолинэстеразы
мембран эритроцитов человека,
облученных УФ-светом в облас
ти 240 390 нм в присутствии
2 % -НОl'О бензиловоl'О спирта:
1 КОНТрОЛЬ; 2 акТИВНОСТЬ
УФ облученной АХЭ; 3 актив
НОСТЬ JLКЭ в ПРИСУТСТВИИ бензи
ЛОВОl'О спирта; -1 акТИВНОСТЬ
УФ облученной АХЭ в присут
ствии бензиловоro СПИРТа"
2
3
4
нием на поверхности белковой rлобулы. Однако не исключена
веро.я:тность и прямоrо воздействия 'УФ излучения на АХЭ.
При УФ облучении (240 390 нм) эритроцитарных мембран
в присутствии бензиловоrо спирта обнаруживается практически
полное инrибирование мембранной АХЭ (рис. 38). По видимому,
наблюдаемый эффеI{Т может быть обусловлен реализацией He
скольких параллельно протекающих процессов, индуцированных
воздействием УФ излучения на эритроцитарные мембраны и при-
водящих к экранированию аКТИВНОl'О центра:
1) возможная интенсификация ПФОЛ вследствие увеличе
ния подвижности липидной фазы мембран под влиянием бензи
ловоrо спирта, образование продуктов ПФОЛ, влияющих на KOH
формацию АХЭ и ее активноrо центра непосредственно или опос-
рер';ованно через взаимодействие с интеrральными белками;
2) фотоrrревращения инте1'Ральных белков мембраны, поrло
щающих свет в данной области спектра, в том числе и caMoro
фермента (однако в незначительной степени);
3) поrлощение квантов УФ-излучения с длинами волн ззо
370 нм пирИдиннуклеотидами, флавинами, коферментами, же-
лезопорфиринами; фотосенсибилизация ими процессов ПФОЛ;
непосредственное влияние их фотохимических продуктов на
структурное состояние АХЭ и ее активноrо центра.
Таким образом, путем модификации отдельных структурных
компонентов эритроцитарных мембран различными химически-
156
ми аrентами и выбора условий их УФ-облучения в завис:имОС'l'И
от природы и содержания хромоФорных 1'рупп можно существен
но изменять фО'fОЧУВСТБительность мембранных белков, в том:
числе АХ.Э.
4.2.2. ФотОЧУ6с:nzвиnzе.JllJнос:ть ацетиJlХОJlUllЭс:теразы
эритроцuтаРIiЫХ мембран в пpиcyтncтnвии фОСфО.lluпазы D
U аСlCорБUltовой жиС.llоты
Е rpynne естественных модиф:vща'fОРОВ, изменяющих лип:ид
ный состав мембран в на'fИВНОЙ кле'fке, относятся липидперено
сящие белки, фермен'l'Ы обмена фосфолипидов фосфолипазы,
диметилазы и др., а также системы обмена холестерина. Всдед-
ствие их деятельности осуществляются выраженное изменение
содержания лизоформ отдельных липидов, накопление в бисдое
жирных кислот, обладающих детерrентным деЙС'fвием, измене-
ние соотношения фосфатидилхолип/фосфатидилэтав:олам:ин :и
фОСфОЛИПИДЫ/ХОJIестерин. Все э'rИ факторы управляют м:икрО-
вязкостью мембраны и оказывают влияние на ПОДВИЖIIОСТЬ ее
компонентов,
ФОСфОJIипазы обширный класс ЛИПОЛИ'l'ических фермен-
тов, имеющих пер во степенное значение ДЛя реl'улирования: раз-
нообразных процессов жизнедеятельности всех живых ОрI'аниз
мов. Это СВ5IЗано с МНО1'ообразием их функций. Во первых, они
участвуют в обновлении мембранных фосфолипидов, что опреде-
ляет стаБИJIЬНОС'l'Ь и биохимическую активность мембран и в lCO-
нечном :ИТОI'е функциоюшьное состояние целой клетки. Bo :в'('o-
рых, продукты фосфолипазной реакции (жирные кислоты, .лжю
фосфа'l'ИДИЛХОЛИН, холин, ДИ1'лицерид, фосфОРИJIXолин и др.) ЯН-.
ляются мощными эффекторами мембранных процессов. В тре'l'Ь
их, фосфолипазам принадлежит :ключевая роль в биосинтезе про-
С'l'а1'ландинов, леЙКО'l'риенов и друrих продуктов превращенИЯ
араХИДОНОБОЙ кислоты. Так, реющию 1'идролиза фосфолипидов,
приводящую к образованию свободной арахидоновой кислоты,
I{атализирует фосфолипаза А 2 . Эта реакция является лимитиру-
ющей стадией в "каскаде" ферментативных реакций биосинтеза
фИЗИОЛО1'ически активных эйкозаноидов.
Вместе с тем всестороннее изучение с'rруктурно-функциональ-
ных свойств фосфолипаз имеет важное не толы{О теоретическое,
но и пра:ктическое значение для медицины и фармаколо1'ИИ. Мао-
rие паТОЛО1'ические процессы, в том числе ишемия и воспаление,
157
сопровождаются увеличением активности внутриклеточных фос-
фолипаз. Предполаrают, что продукты метаболизма арахидоно-
вой кислоты участвуют в защитной реакции ОР1'анизма при об-
лучении, а также комбинированном радиационно-термическом
поражении e1'O отдельных систем.
Фосфолипазы (фосфатидацилrидролазы, ЕФ 3.1) фермен-
ты, катализирующие rидролитическое расщепление сложноэфир-
ных связей в различных фосфолипидах. Фосфолипазы А[, А2' В,
С, D различают в зависимости от Toro, какая из четырех эфир
ных связей, имеющихся в молекулах фосфатидов, rидролизуется
ферментом. Существует также цифровая номенклатура фосфо
липаз соответственно положению расщепляемой сложноэфирной
связи: 1,2,3,4 (рис. 39).
Фосфолипазы различноrо происхождения способны также
катализировать реакции ферментативноrо трансалкилирования
(фосфолипаза D) и трансацилирования (ДРУ1'ие фосфолипазы).
Липолитические ферменты 1'ИдРолизуют водонерастворимые
субстраты, следовательно, они должны функционировать на rpa-
нице раздела фаз. Обычно их молекулы состоят из трех участ
ков: rидрофобноrо, который создает необходимую ориентацию
фермента на поверхности субстрата, и активноrо центра, находя-
А 1 (1) О
1I
О H2 C RI
11 I
R2 C ! O C I H О СН З
11 I
А 2 (2) СН2......().......Р"""О......с;Н2 СН2 N......с;Нз (Х)
/,)fl, I
С(З) ОН 0(4) СН З
О О H2C OH
11 11 I
H2C----O C R2 R O......c;H О
I /'" I 11
HO CH О / H2c O P O x
I 11 в I
H2c O P O x О
I
O
Рис. 39_ Схема действия и номенклатура фосфолипзз
158
щеrося вблизи rоловки, но не идентично1'О ей, и l'идрофильноrо
хвоста, стабилизирующеl'О ориентацию белковых молекул.
По анало1'ИИ с ДРУ1'ими rидролитическими ферментами для фос
фолипаз предполarаroт наличие различных типов активных цeHT
ров: сеРИН1'истидиновоrо, карбоксил карбоксилатноrо, Zll21 карбо
ксилатноrо, цистеин 1'ИСТИДИНОВОro. Именно с участием этих rрупп
происходит осуществление каталитическо1'О акта 1'идролитически
ми ферментами.
Фосфолипаза D (фосфатидилхолин-фосфатидатrидролаза, фос
фолипаза 4) 1'идролизует эфирную связь между фосфатной rpуп-
пой и rидрофильным спиртом в фОСфО1'лицеридах и соответству-
ющую связь в сфинrомиелинах. Фермент был впервые обнаружен
в корнеплоде моркови и листьях шпината, он содержится таК.же и
в ДРУ1'их растениях: свекле, брюссельской и савойской I апусте.
Субстра1'ами фосфолипазы D являются фосфолипиды и их лизо-
производные. Ле1'КОСТЬ rидролиза уменьшается в ПОСJIедователь
ности: фосфатидилrлицерин, лизофосфатидилхолин, дифос
фаТИДилrлицерин. Ферментативные процессы с участием paCТBO
римых фосфолипаз и нерастворимых субстратов протекают на 1'ра-
нице раздела фаз: лип ид вода. Эти процессы предпола1'ают пер-
воначально реакцию иммобилизации водорастворимоrо фермента
на поверхности субстрата. Поэтому фосфолипаза D может исполь-
зова'lЪСЯ в качестве модели для исследования reTeporeHHoro фер-
ментативноrо катализа и изучения примем6ранных ферментов.
А,%
120
100
Рис. 40. Фермента'rивная актив"
ность ацетилхолинэс'rеразы ЭрI1'I'РО"
ци'rарных мембран, модифициро-
ванных фОСфОЛШIaЗОЙ D, после УФ.
облучения Б дозе 1,5 :кДж/м 2 : 1
контроль (НWI'ИВНЫЙ фермент); 2
УФ-облучение; 3 моДификация
фосqюлиnазоЙ D; 4 УФ-облуче-
ние модифицированных фосфоли-
пазоЙ D мембран
80
60
40
20
о
;2
з
4
159
На рис. 40 показаны УФ-индуцированные изменения функ-
циональной а тивности АХЭ мембран эритроцитов, модифици
рованных фосфолипазой D, в интактном состоянии и после УФ
облучения в дозе 1,5 кДж/м 2 . Предварительная обработка эрит
роцитарных мембран раствором фосфолипазы D в концентра-
ции 10 6 молъ/л (рН 5,6; 0,03 моль/л CaCl) с последующим yдa
лением модифицирующеrо .a1'eHTa путем центриФУ1'ирования
практически не влияет на величину каталитической активности
мембранной АХэ: уровень изучаемоrо параметра 105 % по
отношению к таковому для нативных мембран (100 %). Однако
УФ облучение эритроцитарных мембран, обработанных фосфо-
липазой D, индуцирует рез ое снижение функциональной актив
нос'rи АХЭ дО 8 %. Следовательно, воздейс'rвие УФ света на мем-
браносвязанный фермент после модификации липидной фазы MeM
бран вызывает ero инактивацию, т. е. выявляется эффект, проти-
воположный наблюдаемым изменениям (активация) исследуе-
Moro параметра при облучении интактных мембран. Таким об-
разом, в случае химической модификации липидноrо компонен-
та мембраны путем 1'идролиза фосфоrлицеридов и сфинrомиели
на как на внешней, так и на внутренней поверхности мембраны
фоточувствительность эритроцитарной АХЭ существенно изме-
няется.
Аналоrичные результаты были получены и при исследова-
нии функциональной активности АХЭ мембран эритроцитов, мо-
дифици:рованных фосфолипазой, в нативном состоянии и rюсле
УФ облучения в дозе 3,0 кДж/м 2 (рис. 41). Воздействие УФ из-
лучения в дозе 3,0 I Дж/м2 на эритроцитарные мембраны, обра
ботанные фосфолипазой D, приводит к практически полному ин-
rибировавию фермента. Следовательно, и в этом случае модифи-
ация липидной фазы мембран вызывает инактивацию АХЭ
эффект, противоположный изменениям активности белка, реrи-
стрируемым при облучении интактных мембран.
На рис. 42 показаны изменения ферментативной активности
мембраносвязанной JLКЭ после обработки мембран фосфолипа-
зой D и воздействия УФ-света в дозе 4,5 кДж/м 2 . Видно, что В
результате УФ облучения модифицированных мембран фоточув-
ствителъность фермента изменяется незначительно. Активность
АХЭ в интактных мембранах после облучения снижается на 44 %,
а в обработанных фосфолипазой на 52 % по отношению к
контрольному образцу.
160
А,% А,%
120 100
100
80
80
60
60
40
40
20 20
О 2 3 4 О 2 3 4
Рис. 41. КаталИ'l'ичес:кая а:ктив
ность ацетилхолинэстеразы ЭРИ'l'
роцитарных мембран, модифициро-
ванных фосфолипазой D, после УФ-
облучения в дозе 3,0 кДж/м 2 : 1
контроль (нэ.'l'ивный фермент); 2
УФ облучение; 3 модификаци.я:
фосфолидазой D; 4 УФ-облуче-
ние модифицированных фосфоли-
дазой D мембран
Рис. 43. ФОТОЧУВС'l'витель-
насть ацетилхолинэстерэ.зы
ИН'l'актных и модифицирован-
ных фОСфОJIида:юй D ЭРИ'l'РО-
цитарных мембран: 1 ин-
TaK'l'HbIe мембраны; 2 мо-
дифицированные мембраны
11. 3аказ 3788
Рис. 42, Функциональная ilКТИВ-
ность ацетилхолИ1tэС'rеразЫ 9РИ'1'f)О
цитарных. мембран, модифицирован-
ных фОСфОЛИl1азо:й D, после УФ об-
лучения в дозе 4,5 кДж/м 2 : 1
:контроль (наТИВIiЫЙ фермент); 2
УФ-облучение; 3 модифиющил
фосфолипазой D; 4 УФ-облуче-
ние модифици:рованных фосфолипа-
зой D мембран
А,%
20
1,5
3
4,5 КДЖ/М"
lбl
На рис. 43 представлены данные, характеризующие зависи
м()сть функциональных свойств мембранной АХ.Э от дозы облу
чения для интактных и обработанных фосфолипазой D эритро
цитарных мембран. Полученные результа'rы свидетельствуют о
том, что Ф чувствительность мембраносвязанной ацетилхолин
эстер азы существенным образом зависит от CTPY!<TypHoro COCTO
яния фосфолипидных компонентов биомембраны.
Фосфолипаза D катализирует отщепление I'идрофильноrо
спирта от фОСфО1'лицеридов и сфинrомиелинов. В результате
отщеплен ия полярных rоловок от молекул фосфолипидов MO
1'ут нарушаться электростатические взаимодействия фермента
с молекулами окружающих ero фосфолипидов, в частности, кис
лоrо липида фосфатидилсерина, являюще1'ОСЯ, по видимому,
аннулярным липидом для ацетилхолинэстеразы. Фосфатидил
серин, а также фосфатидилэтаноламин локализованы преиму
щественно во внутренней половине ЛИПИДНОI'О бислоя. Можно
предположить, что 1'идролиз фосфолипидов И фосфатидилсери
на не вызывает конформационных изменений молекул фермен:
та, затраI'ивающих ero активный центр, поэтому активность АХЭ
при обработке мембран фосфолипазой практически не изменя-
ется. Необходимо отметить, что обработка мембран фосфолипа
зой индуцирует изменения упаковки и подвижности фосфоли
пидов, вязкости И асимметрии липидной фазы, белок-липидных
взаимодействий. Воздействие УФ излучения на модифицирован
ные мембраны приводит к нарушениям в фунr-щионировании
мембраносвязанной АХ.Э, отличающимся по направленности от
таковых при облучении интактных мембран. Эти нарушения
являются результатом изменения конформационво1'О состояния
продуктов rидролиза фосфолипидов в мембране при воздействии
Ф света.
Е. А. Лапшина, И. Б. 3аводник (1995) установили, что взаи
модействие свободных жирных кислот (пальмитиновой, лаури
новой, каприловой) и их производных С эритроцитарной мембра
ной вызывает ИН1'ибирование АХ.Э целыlхx эритроцитов и изо
лированныx эритроцитарных мембран. Авторы считают, что воз
действие жирных кислот и их ПРОИЗВОДных на мембрану приво
дит к изменению белод липидных контактов, возмущению Ha
ТИВНО1'о липидно1'О окружения фермента, нарушению максималь
ной комплементарности между rидрофобной поверхностью мем-
бранных белков и их липидным окружением. Обработка эритро
162
цитов малоновым диальдеrидом, способным модифицировать
амино и сульфrидрильные rруппы белков, образуя ряд стабиль-
ных инестабильных аддуктов, внутри и межбелковые сшивки,
приводила к инrибированию активности АХЭ по бесконкурент
ному механизму.
Таким образом, выявляется различная УФ-чувствительность
АХЭ интактных и модифицированных фосфолипазой D эритро
цитарных мембран, обусловленная нарушением нативной KOH
формации фермента вследствие воздействия на He1'o фотохими-
ческих продуктов rидролиза фосфолипидов.
Большой интерес в настоящее время представляют вопросы,
касающиеся BcecTopoHHe1'o изучения процессов фото модификации
отдельных компонентов биомембран в присутствии химических
соединений с различным механизмом действия, способных ини-
циировать, усиливать или ослаблять фотохимичеCI{ие реакцИИ. Од-
ним из факторов системы низкомолекулярных ре1'УЛЯТОроВ, вы-
полняющих роль инициаторов, катализаторов, ИН1'ибиторов и
влияющих на стадию инициирования, разветвления и обрыва цепи
свободнорадикальных реакций, лвляются низкомолекулярrrые ком-
поненты антиоксидан'fНОЙ системы (ем. раздел 3.3).
Содержание аскорбиновой кислоты, обладающей чрезвычайно
широким спектром антиоксидантных свойств, составляет в плаз-
ме крови 50 200 мкмоль/л. Вместе с тем известно, что низкомо
лекулярные антиоксиданты способны проявля').'ь свои защитные
А,"/о
200
150
100
Рис, 44. ФермеН'l'ативна,я акТИВ-
ность ацетилхолинэстеразы ЭРИТРОЦИ-
тарных мембран В ПРИСУТСТБИИ аскор- 50
биновой кислоты В различ:ных KOH
центрациях (моль/л): 1 :контрою>
(на'l'ИБнъrе мембраны); 2 0,5'10..:1;
3 10-4; 4 10-5; 5 10-6; 6 10- R
11*
о
2
3
4
5
6
163
функции в широком интервале концентраций: от 10 2 до 10 !8
моль/л. На рис. 44 локазаны изменения функциональной актив
ности АХЭ эритроцитарных мембран в присутствии аскорбата в
различных концентрациях. Из анализа данных, представленных
на этом рисунке, следует, что добавление к суспензии эритроци-
тарных мембран аскорбиновой кислоты в концентрациях O,5'10 3,
10 \ lO 5, 10 6 моль/л индуцирует статистически достоверное сни
жение уровня каталитической активности АХЭ. Использование
экзоrенноrо areHTa в минимальной концентрации (10 8 моль/л)
приводит к активации фермента на 93 % по отношению к KOHT
рольному образцу (100 %).
Витамины А,С, D и F, при окислении и аУ'l'Oокис.лении кото-
рых образуются промежуточные радикальные формы (например,
пероксид водорода), Mo1'YT выполнять роль инициаторов окисле
ния и ускорять ПОЛ, увеличивая скорость зарождения цепей в
мембранах. Кроме тоro, в присутствии ионов железа и меди, со-
держащихся в эритроцитарной мембране, аскорбиновая кислота
становится мощным прооксидантом, что указывае'l' на необходи
мость iil vivo надежной секвестрации свободных ионов металлов
переменной валентности. Проявление аскорбатом анти и про-
оксидантных свойств зависит также от концентрации субстра'rа
и условий протекания ОКИСЛИ'1'ельных реакций.
Следовательно, в интервале используемых концентраций
О,5'1О 3 10--в моль/л аскорбиновая кислота проявляет проокси-
дантные свойства, что находит отражение в снижении функцио
нальной активности мембраносвязанной ацетилхолинэстеразы. Про-
межуточные радикальные формы, образующиеся при окислении
аскорбата, усиливают и ускоряют ПОЛ, в результате котороro на-
капливаются пероксидные продукты. Ацетилхолинэстераза при-
надлежит к числу ферментов мембран, леrко инактивируемых при
пероксидном окислении ненасыщенных жирных кислот. Наибо-
лее важные изменения в белковых молекулах, вьшываемые окис-
ленными липидами, заключаются в образовании комплекса окис
ленный липид белок, ассоциации белковых молекул и разруше-
нии аминокислот, в частности, содержащих 8H-r'РУППЫ.
На рис. 45 представлены данные, полученные при исследова-
нии уровня функциональной активности АХЭ эритроцитарных
мембран, УФ облученных в дозе 4,5 кДж/м 2 в присутствии ас-
корбиновой кислоты. УФ облучение интактных мембран вызы
вает снижение активности фермента на 44 %. COBMec'rHoe дей-
164
А,%
А,%
100
100-
75
75
50
50
,..............
25
25
о
о
2
3
А,%
а
А,%
2
б
3
100
300
75
200
50
25
100
о
2
3
о
2
3
8 r
Рис. 45. Изменения каталитической активности мембраносвлзан-
ной аце'rИЛХОJ1ИНЭС'l'еразы, УФ-облученной в присутствии аскорбата: 1
контроль (нативные мембраны); 2 в присутствии ас кор ба та; 3 УФ об
лучение в ПРИСY'l'ствии аскорбаоrа. Концентрация аскорбата, моль/л: а
10-4; б 10 б; в 10 6; z 10 8
ствие УФ.излучения и аскорбата в концентрациях 10 \ lО б,
lO 6 моль/л индуцирует полное ИН1'ибирование мембранной АХЭ.
УФ-облyrlение мембран эритроцитов в комплексе с моДифициру
ющим a1'eHTOM (10-8 моль/л) приводит к резкому повышению
функциональной активности белковой молекулы.
При изучении ПОЛ в мембранах митохондрий и микросом
было установлено, что существенное усиление накопления перок-
165
сидных продуктов может быть вызвано добавлением солей ДBYX
валентноrо железа, аскорбиновой кислоты и соединений, coдep
жащих СУЛЬф1'идрильные rруппы, например, цисте ина или rлу
татиона. В 1959 1'. Оттолен1'И обнаружил, что накопление перок
сидов связано с наличием в изучаемой среде двухвалентноrо
железа. Он предположил, что ионы Fe 2 + оказывают каталитичес
кое действие на образование пероксидов. При этом Fe 2 + окисля
ется до Fe3+, а функция аскорбиновой кислоты заключается в
реrенерации ионов за счет обратно1'О восстановления Fea+ до Fe 2 +.
Ведущую роль ионов Fe 2 + в процессе ПОЛ в биомембранах опре-
деляет совокупность следующих реакций:
ROOH + Fe 2 + ---7 RO' + OH + Fe 3 +,
Fe 2 + + 02 + Н+ ---7 Fe 3 + + НО;,
Fe 2 + + RO; ---7 Молекулярные продукты,
Fe 2 + + R' ---7 Молекулярные продукты.
Следует подчеркнуть, что скорость ПОЛ определяется COOT
ношением Iшнцентраций ионов Fe 2 +, 1'идропероксидов, свобод
ных радикалов R0 2 '. Ионы железа И1'рают одновременно функ
цию про И антиоксидантов. Их антиокислитель ное действие
IIpоявляется только при достаточно высоких концентрациях Fe 2 +
(>lО Б lО 4 моль/л),
По всей вероятности, инrибирование мембраносвязанной АХЭ
при ее УФ облучении в присутствии аскорбата (10 4 10 6 моль/л)
представляет собой результат параллельноrо протекания перок
сидноrо фотоокисления ненасыщенных жирных кислот фосфоли
пидов И аскорбатзависимоrо ПОЛ с участием ионов Fe 2 +. Причем
эти процессы взаимоусилива.ют друр друра. Антиоксидантный и
активирующий эффекты аскорбата по отношению к уровню фун
кциональной активности мембраносвязанной АХЭ зареrистриро
ваны только в присутствии ЭКЗО1'енноrо a1'eHTa в концентрации
lO 8 моль/л. В данном случае реализуются процессы обезврежи
вания аскорбиновой кислотой активных форм кислорода (супе
роксидно1'О анион радикала, синrлетно1'О кислорода, rидроперок
сидноro радикала, rидрокси:льноrо радикала, пероксидных ради
калов липидов), восстановления а токоферильноrо радикала.
Изучение фоточувствительности мембраносвязанной АХЭ в
присутствии химических арентов, модифицирующих липидную
фазу мембраны, позволяет расширить современные представле
ния о молекулярных механизмах реrулирования активности важ
нейших компонентов биомембран. На основании собственных эк
166
Мембрана
АХЭ
Интеrральные
белки
Липиды
Серосодержащие
и ароматические
аминокислотные
остатки
hv (240 З90 HM
Ароматические
серОСОДерЖаЩие НЖК липидов
аминокислотные
остатки
Фотоионизация ароматических
аминокислотных остатков,
фотолиз S s и С S связей
Накопление пер
вичных и вторич-
ных продуктов ПОЛ
Изменение
CTPYKTypHoro
состояния липидов
Нарушение белок ли
пидных взаимодей-
ствий
hv (240 З90 нм)
Пиридиннуклеотиды,
железопорфи ри ны,
флавины
Возбужденные
состояния
Образование
102 или раДИКаль
ных интермедиатов
Окисление
аминокислотных
остатков мембран-
ных белков, в том
числе /J.Y..Э
Образование
белковых
сшивок
Изменение конформации АХЭ и ее активноrо центра
Изменение функциональных своЙств АХЭ
(активация или ИНактивация)
Рис. 46. Схема процеССОБ, ПрИБОДЯЩИ:Х 1< фОТОМОДИфИЕации мемб.
ранной ацетилхолинэстеразы
167
спериментальных и литературных данных предложена схема про-
цессов, приводящих к фотомодификации мембранной АХЭ, учи
тывающая вклад УФ превращений caMo1'o фермента, а также OT
дельных структурных компонентов мембран (рис. 46). Кроме TOro,
Изменение состава
фосфолипидов мембраны,
микровязкости и текучести
липидной фазы
Изменение интенсивности ПФО
вследствие влияния на ско-
рость инициирования и продол
жения цепи окисления липидов
-t
Накопление первичных и
вторичных продуктов ПОЛ
Нарушение белок липидных
вза имодействий
Прооксидантное
Де йстви е
-t
Влияние на стадию
инициирования,
разветвления и
обрыва цепи ПОЛ
Ан тиоксидантное
действие
-t
Взаимодействие
с АФК: О;, НО;;,
Н 2 О 2 , ОН', 102'
RO;, RO'
Аскорбат
Предотвращение
(полное) фотолиза
или снижение cтe
пени фотолиза
мембранных анти-
оксидантов
Изменение конформации АХЭ
и ее активноrо центра
Изменение УФ чувствительности
мембраносвязанной АХЭ
Рис. 47. МОДУЛЯЦИЯ фоточувствителъности мембраносвязанной аце-
тилхолинэстеразы
разработана схема модуляции фоточувствительности ацетилхо-
линэстеразы путем модификации CTPYKTYPHo1'o состояния липид
ной фазы эритроцитарной мембраны в присутствии фосфолипа-
зы D и аскорбиновой кислоты (рис. 47).
Выявлены важная роль микроокружения в процессах фую,
ционирования АХЭ и возможность целенаправленноrо реrули
рования степени ее УФ-чувствительности путем введения в изу
чаемую систему ЭКЗО1'енных areHToB, модифицирующих конфор-
168
мацию ближайших "соседей" фермента в биомембране. Исследо
вания подобноrо рода полезны при обсуждении вопросов, касаю-
щихся выяснения механизмов влияния УФ излучепия на струк-
турно функциональное состояние эритроцитарных мембран в HOp
ме и в присутствии ряда химических соединений. Они расширя:
ют современные представления об особенностях фотохимических
превращений белков ферментов в составе мембран клеток и МО-
ryт быть использованы для разработки новых физико-химичес-
ких подходов к мембранному скрининrу разнообразных по своей
природе и механизмам действия химических соединений, а так-
же к выявлению структурных нарушений компонентов мембран,
обусловленных действием указанных внешних факторов.
4.2.3. УФ UltfjуцирО8аltltые иЗ.JItен.еltUJl фуюсциОJtальных свойств
.lItе.м.ffраносв.я.:ШJtlюй Na+, B:+-АТФазы 8 присутствии
фОСфОJlипазы D
На рис. 48 представлены данные по исследованию фоточув
ствительности мембря.носвязанной N а+, Е+ -АТФазы при возде]}'r
ствии УФ излучения (240 390 нм) в дозах 1,5 и 3,0 кДж/м 2 на
интактные мембраны эритроцитов человека. Из анализа рисун
ка следует, что при облучении мембран происходит статистичес
ки достоверное снижение уровня каталитичес:кой активности ис
следуемоrо фермента.
А,%
Рис. 48. УФ-индуциро-
ванные изменения функци-
ональной аКтивнос'rи Na+,
K+-АТФазы ЭрИТрОЦИ'l'арных
мембран, модифицирован-
ных фосфолипазой D: 1
УФ-облучение интактных
мембран; 2 УФ-облучение
модифицированных фосфо
липазой мембран
о
1,5
3,0 кДж/м2
169
В состав активноro центра Na+, К+ АТФазы входят BЫCOKO
реакционноспособные остатки тирозина и цистина, ПОl'лощение
"УФ СJ3ета которыми оБУСЛОJ3Jшвает процесс фотомодификации
фермента.
Воздействие длинноволновоrо "УФ света в интервале длин волн
320 390 нм (л'mnx == 365 нм) в течение 30 мин приводит К полному
инrибированию ферментативной активности N а +, К+ АТФазы. Xpo
мофорами УФ света в этом диапазоне длин волн являются различ
ные (восстановленные) пиридиннуклеотиды, флавины, железопор
фирины. Таким образом, инактивация мембраносвязанноrо фер
мента в данном случае может быть обусловлена фотохимическими
превращениями вышеназванных хромофоров. Не исключена веро-
ятность локализации этих акцепторов УФ излуч:ения на мембране
в нецосредственной близости к исследуемому белку. Вместе с тем,
учитывая то обстоятельство, что хромофорные rруппы мембран
(порфирины, флавины, нуклеотиды) выступают в качестве сенсиби
лизаторов пероксидноro окисления липидов, можно предположить,
что в процесс модификации Na!, К+ АТФазы вносят вклад преиму-
щественно вышеуказанные компоненты эритроцитарных мембран,
а ты,же фотосенсибилизированное ими пероксидное окисление ли
пидов. При УФ облучении выделенных микросом МОЗ1'а крыс обна-
руживается корреляция между снижением а:ктивности N а +,
R+ АТФазы и пероксидным окислением липидов, оцениваемым по
содержанию полине насыщенных жирных кислот и накоплению
малоново1'О диальде1'ида (J. Jamme et а1., 1995). Подавление актив
ности Na+, К+ АТФазы при облучении микросом УФ светом сни
жалось тушителем свободных ради:калов тиомочевиной и не из
менялось в присутствии "защитника" тиолов дитиотреитола. Aв
торы считают, что эффект ПОЛ опосредуетс.я нарушением целост
ности мембран, а не структурными изменениями саморо фермента.
В 1967 р. Liberman показал, что УФ-излучение (255 285 нм)
ИН1'ибирует Na+, К+ АТФазную активность нервных волокон кра-
ба. Видимый свет инrибировал Na+, К+ АТФазу различных типов
клеток, сенсибилизируемых метиленовым синим, бенrальским
розовым или протопорфирином, блаrодаря фотодинамическому
эффекту. Однако чувствительность Na " , КI' АТФазы к видимому
свету в отсутствие экзоrенных фотосенсибилизаторов не показа
на. Воздействие излучения арроноворо лазера (488 нм, 0,1 Вт/см 2 )
индуцировало ИН1'ибирование Na+, R+.АТФазы из мозrа крыс дo
зозависимым образом.
170
в состав a (более 1'идрофобна) И В субъединиц молеlСУЛ этоro
белка входят некоторые фОСфОЛИПИДЫ, среди которых преобла-
дают фосфатидилэтаноламин, фосфатидилхолин, СфИНl'омиелип.
Вероятно, модификация ЛИПИДНОl'О бислоя при облучении мемб-
ран затраrивает конформационное состояние не только поrра-
ничных (аннулярных) липидов АТФазы, но и непосредственно
фосфолипидных компонентов ее а-субъединицы, что ПрИБОДИТ К
изменению структуры активноЮ центра фермента и нарушению
ero функциональных свойств.
При изучении УФ индуцированных изменений ферментатив
ной активности Na+, К+ АТФазы ЭРИ'l'РОЦИ'l'арных мембран, мо-
дифицированных фосфолипазой D, было установлено, что пред-
варительная обработка мембран фосфолипазой (lO E! моль/л,
рН 5,6; 0,3 моль/л CaC1 2 ) приводит к увеличению уровня это1'О
параметра на 33 % по сравнению с контрольным образцом
(100 %). Фосфолипаза D, как уже отмечалось, катализирует 0'1'-
щепление rидрофильно1'О спирта от фОСфО1'лицеридов и сфинro
миелинов. В результа'l'е О'l'щеIlJlения полярных 1'оловок от моле
кул фосфолипидов Mo1'YT нарушаться электростатичесн:ие взаи
модействия мембраносвязанных ферментов с молекулами окру-
жающих их фосфолипидов. А. Johannsson et al. (1981) показали,
что увеличение или уменьшение толщины липидноrо бислоя
может влиять на активность Na+, К АТФазы за счет перемеще
ния полярных 1'оловок фосфолипидов, обращенных к фермент
ному белку. По видимому, rидролиз фосфолипидов мембраны, в
том числе и аннулярных для Na+, К -А'l'Фазы, вызывает конфор
мационные изменения молекул фермента, затрarивающие e1'o
активный центр, что находит отражение в увеличении уровня
ан:тивности исследуемоrо белка.
На рис. 48 показаны УФ-индуцированные изменения функ
циональной активности Na+, К+ АТФазы эритроцитарных MeM
бран, обработанных фосфолипазой D. После модификации фос-
фолипидов мембраны фото чувствительность связанноrо фермен-
та существенно изменяется. Воздействие УФ света. на обрабо-
танные фосфолипазой мембраны приводит к нарушениям в фун
кционировании Na+, K+'-АТФазы, отличающимся по направлен
ности от 'l'aKOBbIx при облучении ИНТaIСТНЫХ мембран, т. е. про-
исходит фотоактивация модифицированноrо фермента. Следо
вательно, обработка липидной фазы фосфолипазой нивелирует
протекание процессов, обусловливающих фотоинактивацию N а+,
171
К+ АТФазы в Ф облученных интактных мембранах, и повы
ПIает фотостабильность фермента.
Изменения в функционировании мембраносвязанной Na+,
К+ АТФазы в "УФ облученных мембранах, предварительно моди
фицированных фосфолипазой D, являются, по видимому, резуль
татом изменения конформационно1'О состояния аннулярных ли
пидов, нарушения белок липидных взаимодействий, OTBeTCTBeH
H:ыx за проявление каталитической активности фермента.
Обобщая результаты вышеописанных исследований по изу-
чению УФ индуцированных изменений функциональной актив
ности Na+, Кt АТФазы и АХЭ эритроцитарных мембран, обрабо
танных фОСфоЛИIIазой D, можно заключить, что в присутствии
последней проявляется различная фоточувствительность этих фер
ментов, обусловленная нарушениями их нативной конформации
вследствие модификации бело:к липидных взаимодействий, а TaK
же влияния фотохимических продуктов молекул мембранных
фосфолипидов.
Такие различия в "ответной реакции" двух мембранных бел
ков на воздействие физико химических факторов (-УФ излуче
ние, действие фосфолипаз) связаны с различиями в их локализа
ции на мембране, в расположении их а:ктивн:ыx центров, в xapaK
тере взаимодействия с "ближайшими" липидными молекулами
и их химическим строением. Однако экспериментальные дaH
ные, касающиеся возможности модуляции фоточувствительнос
ти мембранных ферментов, Na+, К+ АrrФазы и ацетилхолинэс
термы, возможно, взаимореryлируемых субстратами их реакций,
свидетельствуют в пользу представлений об общности основных
реrуляторных механизмов функционирования для мноrих BeK
торных ферментов биоме:м:бран.
4.3. ФУНКЦИОНАЛЬНЫЕ СВОЙСТВА
ЛАКТАТДЕrИДРОI'ЕВА3Ы В IЮМПЛЕКСЕ
С ЭРИТРОЦИТАРНЫМИ МЕМБР АВАМИ И их
IЮМПОНЕВТАМИ В ИНТАкmом СОСТОЯНИИ
И ПОСЛЕ УФ.ОБЛУЧЕНИЯ
в настоящее время считается общепризнанным, что
"классическое" исследование ферментов in vitr'o без учета их вза
имодействия с различными суб:клеточными структурами не MO
жет дать aдeEBaTHoro представления о закономерностях и Mexa
низмах их функционирования в составе целой :клетки. Поэтому
172
широко обсуждаются вопросы, связанные с локализациеЙ 1'ЛИI(О
литических ферментов в клетке (см. раздел 2.3.2) и, в чаС'l'БОСТИ:,
лактатде1'ИДРО1'еназы,
L.лактатдеrИДРО1'еназа (L лыи'а'r:N AD+ -оксидореДУl<таз а,
КФ 1.1.1.27) 1'ликолитический фермент, относящийся к I,Jlac
су оксидоредуктаз. Он катализирует обратимое оки:сленин
L лактата до пирувата с использованием в качестве кофермен
та NAD+.
Лактатдеrидроrеназа (ЛДr) принадлежи'l' к наиболее ИН'I'е:н
сивно изучаемым белкам, тю, как она является ключевыМ фер
ментом, функционирующим на «развилке» пу'rей аэробноI'О и
анаэробноro превращения уrлеводов в тканях.
Молекула лдr представляет собой Te'rpaMep, состоящий из
субъединиц двух типов Н и М (от анrл. heart сердце и
muscle мышца). Молекулярные массы Te'l'paMepa и !:\аждой
субъединицы составляют 140 и 35 кДа соответственно, РЕ:!комби
нация двух типов субъединиц дает различные изоформ:ы фщ)
мента: rOMOTeTpaMepbl Н! и М4 И 1'ибридные Te'l'paMepbl (re'repo
тетрамеры) НзМ, Н 2 М 2 и: НМ з . Это количество изоферментов обус
ловлено наличием двух rенетических локусов, которые кодиру
ют синтез субъединиц М и Н .
Субъединица М синтезируе'rся 1'лавным образом в т'КаН:>1:Х с
анаэробным метаболизмом, в то время как субъединица Н присY'I'
ствует в тканях с преобладанием аэробных процессов. В цитозоле
rерминативных клеток, в частности в сперматозоидах, ПРИСУТС'l'ву
ет лдr.х, составляющая 80 % активности лдr. Показано, '1'1'0
лдr х также является тетрамером и состоит из субъединиц ЛДI' Х,
которые по аминокислотному составу отличаются от Н и М.
Изоферментам лдr при:сущи разные lшнетические xapaKT(O!
ристики, величины рН, при которых они проявляют маН.сим:аЛ:F)"
ную активнос'l'Ь, сродс'rво 1, субстра'l'ам и I<офакторам. Для опре
деления относи'rельноrо содержания изоферментов ИСПОЛЬЗУЮТ
ряд физико химических методов: электрофорез, ионообменную
хроматоrрафию, различия в кинетичеСIШХ пара.метрах отдель
ных изоферментов, дифференцированную чувствительцос'l'Ь 'к су б..
стратам и ИН1'ибиторам, иммунохимические методы.
lIолипеп'rидная цепь обеих субъединиц содержит 330 ам:ино
кислотных остатков; различия в их последовательности в еубr:Е)е
диницах обнаружены на протяжеции более чем 25 % длины по.
липептидной цепи.
17:-1
в субъединицах фермента выделяют два домена: каталити
ческий и центр связывания кофер:м:ента. Аминокислоты, образу
lOщие NAD+ связывающий домен, расположены в середине моле
кулы лдr. Структура названно1'О домена состоит из шести склад
чатых слоев ( A F), соединенных между собой о: спиралями.
Лактатде1'ИДРО1'еназа связывает лактат или пируват только в
присутствии кофермента, причем первым связывается кофер
мент. NAD+ (NADH) находятся в 1'идрофобной полости В ИЗО1'ну
Той конформации молекулы лдr.
в каталитичесн:ом центре лдr находятся полярные 1'руппы,
участвующие в связывании кофермента и субстратов и катализе:
остатки Arg 109, Arg 171, Arg 101, Glu 102, Asn 140, а также
существенный остаток His 195, способный И1'рать роль ДOHopa
акцептора Ht в ходе реакции. Кроме To1'o, для проявления
активности фермента необходима сульфrидрильная rруппа, одна
на субъединицу.
Оптимум рН для реакции восстановления пирувата в лак
тат 6,5 7,5, а для обратной реакции 8,5 9,O. ИН1'ибируют
фермент высокие концентрации NAD, фторпируват (необрати
мо), о: меркаптокислоты (конкурентно по отношению клактату),
СУЛЬф1'идрильные peareHTbI. В последнем случае инrибирование
предотвращается коферментом и снимается цистином и 1'лута
тионом.
Получены сведения о взаимодействии лдr со структурными
белками мышц и миофибриллами, субклеточными частицами,
искусственными подложками, :м:икросомами и мембранами cap
коплазматическоrо ретикулума.
Установлено, что взаимодействие лдr с F актином и натив
ным тонким филаментом приводит к уменьшению каталити
ческой активности фермента. При связывании с F актином про
исходит увеличение значения константы Михаэлиса дЛЯ NADH и
уменьшение максимальной скорости реакции. Для свободной и
связанной форм ЛДr выполняется уравнение Михаэлиса MeH
тен. Предпола1'ают, что обратимое взаимодействие изофермента
М4 лдr с F актином является специфическим и обусловлено об
разованием белок белковоrо комплекса.
ИсследоваIiие кинетических параметров лдr в растворе и в
суспензии 1'OMoreHaTa субклеточных частиц скелетных мышц
цыпленка позволило выявить, что изофермент лдr Н4 не связы
вается субклеточными чаС'l'ИЦaIVIИ, ЛДr М 2 полностью и лдr Н 2 М 2
174
частично находя'l'СЯ в связанном состоянии. Связывание изо
фермен'rов М4 и Н 2 М 2 приводит К значительному снижению Be
личины максимальной скорости реакции, а также KOHc'raHTbI Ми
хаэлиса для пирувата.
При взаимодействии ЛДr с митохондриальной фраlщией и
митохондриальным ИН1'ибитором из скелетных мышц кролика
отмечено снижение активности фермента. Причем зависимость
скорости реакции от концентрации субстра'l'ОВ для связанной ЛДr
была не1'иперболическоЙ, а зависимость 1/у от 1/[пируват]1/2
или 1/[NADH]3/2 была линейной.
Описано связывание лдr М4 с ИСКУСС'l'венными подложками,
карбоксиметилцеллюлозой и декстрансульфа'rом. Взаимодействие
лдr из мышц свиньи с декстрансульфатом приводит к появле-
нию положительной кооперативности по концентрации NADH,
не характерной для фермента в растворе.
В. И. Лущак (1991) изучил физико химические своЙства лдr,
свяэанной с микросомальными мембранами из белых мышц ши-
повато1'О ската. Исследование l{ине'l'ических хараК'l'еристик для
мембраносвязанноrо и изолированно1'О ферментов показало, что
константа Михаэлиса для данных форм (состояний) ЛДr прак-
тически одинакова. В то же время данный показатель дЛЯ NADH
у связанноrо фермента в 4 раза ниже, чем у изолированноrо.
Цитозольная форма лдr из белых мышц шиповато1'О ската ин
rибируется наполовину при н:онцентрации пируната 14 ммоль/л,
а связанная проявляет в этих условиях полную активность. Свя
занная ЛДI' обладает более высокой стабильностью, чем свобод
ная: перевод фермента в раствор в 2,5 3,0 раза ускоряет про
цесс e1'o инактивации трипсином. 'l'акие факторы, как рН, ион-
ная сила, субстраты и коферменты, влияют на процесс экстрак
ции лдr из микросом. При щелочных значениях рН удается
солюбилизировать 48 (% активности фермента, но не менее 20 %
лдr остается в мембраносвязанном виде. Степень экстра1'ируе-
мости фермента из микросом возрас'rает по мере увеличения
ионной силы раствора. При ней'rральных значениях рН среды
NADH экстра1'ИРУет 68 % лдr. По видимому, с микросомами из
белых мышц шиповатоrо ската связано два пула лдr. Фермент
одноrо пула взаимодействует с мембраной за счет электростати
ческих сил, фермент дрУ1'оrо пула за сче'l' 1'идрофобных взаи
модействий. Наличие двух пулов ЛДI' приводит к дополнитель-
ной возможности реrуляции свойств фермента путем el'O пере
175
распределения между разными клеточными компартментами.
Т. В. Есаковой иМ. В. Ивановым (1992) показано, что связы
вание лдr с мембранами саркоплазма'rическоrо ретикулума Be
дет к снижению удельной активности фермента на 60 70 %.
Высказано предположение о '!'Ом, что взаимодействие фермента с
мембранами происходит в участках с высоким и низким cpoд
СТВОМ. Добавление NADH, NAD+, а также повышение ионной силы
pac'rBopa вызывает солюбилизацию связанноrо фермента. Сни
жение активнос'l'И лдr в связанном состоянии можно объяснить
как маскировкой некоторых субъединиц, диффузионными за
труднениями при связывании субстратов, конформационными пе
рестройками молекулы лдr, так и изменениями физико хими
ч:еских свойств среды при переходе фермента из раствора в при
мембранный слой.
Взаимодействие мембран эритроци'rов с лдr приводит к сни-
жению ее ка'l'алитичеС1ЮЙ активности. На рис. 49 представлена
зависимость фермента'rивной активности мембраносвязанной ЛДI'
оТ величины рН среды инкубирования. В условиях оптимума
рН 7,4 активнос'l'Ь ее снижается на 25 %; при значениях рН 6,0 и
4,0 соответственно на 33 и 46 %. Сдви1' рН в щелочную область
приводит к уменьшению эффекта инrибирования лдr. При
рН 9,0 активности свободноrо и связанно1'О ферментов статисти
чески достоверно не отличаются.
По видимому, с увеличением отрицателъноrо заряда молеку
лы белка веРОЛ'l'НОСТЪ образования e1'o комплекса с мембраной
уменьшается. Можно предположить, что участки связывания фер-
мента на мембране несут отрицательный заряд.
Эти данные коррелируют с результатами исследования
А, %
100
80
60
Рис. 49. Зависимость фер
ментативной ruктивности Л8Е
Т8тдеI'ИДроl'еН!lЗЫ, связанной с
мембранами ЭрИ'l'роцитов
(2'10 B моль/л, 0,15 МI'/МЛ бел
ка мембран), от величины рН
(З8 100 % прин.ята aIСТИВНОСТЬ
СБободноrо фермента при тех
же значениях рН)
40
контроль 4,0 0,0 7,4 8,5 9,0
рН
176
В. И. Лущака (1991,1992), который изучил влияние рН среды
на экстракцию лдr из микросом плавательных мышц шипо
ваторо ската и показал, что степень экстраrируемости ферм:е:н
та из микросомаль:ных мембран увеличивается при щелочных
значениях рН. Т. В. Есакова, и М. В. Иванов (1992) считаЮТ,
что для взаимодействия лдr из скелетных мышц свиньи с м:eм:
бранами саркоплазматическо1'О ретикулума важен отрица
тельный заряд мембраны. Кроме TOI'O, на поверхности мембра
ны существует положительный заряд, затрудняющий связы
вание лдr.
Падение активности фермента в связанном состоянии может
быть обусловлено следующими причинами (Б. И. Kyp1'aHoB,
Н. И. Лобода, 1977; Б. И. 1{YPl'aHOB, 1984):
а) стерическим экранированием активных центров при aд
сорбции;
б) изменением конформациоююI'О СОСТОЯНИЯ белковой моле
кулы (или преимущественной адсорбцией одной из конформаци
онных форм фермента, находящеrося в растворе);
в) изменением микроокружения фермента при переходе из
раствора в примембранный слой (концентрации водородных ионов
и субстратов в растворе и на поверхности Mo1'YT различаться вслед
ствие их взаимодействия с подложкой).
Однако убедительных доказательств в пользу КaIЮ1'о либо oд
HOro из этих предположений не получено.
Таким образом, процесс ассоциации ЛДr с эритроцитарной
мембраной можно ре1'улировать путем варьирования значений
рН среды. Следовательно, важную роль в образовании компле:к
сов фермента с различными клеточными структурами иrрают
электростатические взаимодействия.
При взаимодействии лдr с тенями эритроцитов, обработан:н:ы
ми тритоном X 100, наблюдалось снижение каталитической a:к
тивности лдr, однако степень инактивации фермента была выше,
чем в случае ero ассоциации с препЭ,ратами нативных мембран.
Так, связывание Лдr с эритроцитарными мембранами и их "три
тоновыми" тенями при рН 7,4 ПрИВОДИJIО к снижению ее аКТИВЕО
сти на 25 и 82 % соответственно (рис. 50). При рН 9,0 катаЛИ'rи
ческая активность ЛДr в присутствии нативных и ТРИТОНОВ:ЫХ
теней статистически достоверно не отличалась от таковой дЛЯ CBO
боДНОI'о фермента. Полученные нами результаты свидетельствуют
о том, что ЛДr эффективнее взаимодействует со спектрин аКТИЕО
12. Заказ 3788
177
А, %
100
80
60
40
20
О
7.4
9,0 рН
Рис. 50. I'i:аталитическая
активность лактатдеrидроrе-
назы в комплексе с эритроци-
тарными мембранами и трито
новыми тенями эритроцитов
(2'10 B моль/л, 0,15 мr/мл бел
ка мембран): D изолиро
ванные мембраны; b.SJ три-
тоновые тени
вой сетью, представляющей основу мембранно1'О каркаса клетки.
Можно предположить, что преобладающий вклад в образование
комплекса фермента с эритроцитарной мембраной вносит ero ассо-
циация с элементами цитоскелета, прежде Bcero актином и спектри
ном. Это соответствует ко'Нцепции о центральной роли актина как
белка координатора в реryл.яции обменных процессов в клетке,
предложенной Б. Ф. ПО1'лазовым и соавт. (1983).
При взаимодействии эритроцитарной лдr с нативными и мо-
дифицированными тритоном Х-100 мембранами ЭрИ'l'роцитов aK
тивность связанНО1'о фермента снижается при рН 7,4 на 21 и
30 %, а при рН 5,4 на 35 и 41 % coo'rBeTCTBeHHO. Следователь
но, изменения каталитической активности фермента из скеле'l'
ных мышц и ЭРИТРОЦИ'l'ов В ассоциированном с эритроцитарными
мембранами состоянии имеют идентичный характер и указывают
на единый механизм ассоциации мембран эритроцитов с лдr из
названных источников.
В ПРИСY'l:ствии восстановленно1'О кофермента в среде ИН1\:уби-
рования: лдr и мембран ее активность статистически достоверно
не отличается от таковой для свободно1'О фермента. Итак, получен
ные результаты можно объяснить тем, что NADH, соединяясь с
апоферментом, вызьшает ero конформационные изменения, KOTO
рые затрудняют адсорбцию- фермента на подложке биолоrической
природы. Эти данные соrласуются с результатами ряда работ
178
(R. L. Melnick, Н. О. Hultin, 1973; r. Л. Ермаков, 1993; А. Dabrowska
et а1., 1989), в которых было показано, что NADH способствует дe
сорбции фермента, связанноrо с мышечными ВОЛОRНами лосося,
липосомами и мембранами саркоплазматическоrо ретикулума.
ИН1'ибирование лдr, ассоциированной с субклеточн:ыми части-
цaMи' происходит за счет увеличения константы Михаэлиса для
пирувата, а не изменения максимальной скорости реакции
(А. Dabrowska et al., 1989). Н. П. Сyrробовой И соавт. (1983) показа-
но, что связывание лдr с F актином не изменяет характера зави-
симости скорос'rи реакции от концен'l'Рации суБС'l'рата a KeTO
1'лутарата. В результате взаимодействия лдr с F актином макси
мальна.я скорость реакции снижается в 1,6 раза, а константа Миха-
элиса увеличивается в 2,5 раза. Друrие результаты получены при
исследовании лдr, ассоциированной с митохондриальной фР9.1щи
ей печени цыпленка (М. L. Sagrista, J. Bosa1, 1987). Зависимость
каталитической активности связанноrо фермента от концентра:ции
пирувата О'l'клоняется от 1'ипербол:ической формы, а при измене-
нии концентрации NADH описывается в paMI,ax l<инетики Ми
хаэлиса Ментен.
Считают, Ч'l'О имеющиеся в литературе противоречивые дан-
ные по этому вопросу можно оБЪЯСНИ'l'Ь двумя причинами: осо-
беННОС'l'ЯМИ природы биолоrической ПОДЛОЖRИ и природой само-
уо фермеН'l'а.
На рис. 51 показаны результаты исследования зависимости
скорости фермеН'l'ативной реакции лдr, связанной с мембрана-
ми эритроцитов, от концентрации пирувата натрия при рН 7,4.
КинетичеСRие кривые для свободно1'О фермеН'l'а и комплекса фер-
мент мембрана подчиняются уравнению Михаэлиса Ментен.
Величина константы Михаэлиса для лдr в растворе равна
0,25::1:0,02 ммоль/л пирува'l'а, а для мембран ос вязанной
0,60::1:0,04 ммоль/л. Максимальная СЕОростЬ ферментативной ре-
акции при взаимодействии лдr с мембраной эритроцитов сни
жается в 1,2 раза. Значит, инrибирование фермента происходит
за счет увеличения в 2,4 раза KOHCTaH'rbl Михаэлиса для пиру
вата натрия.
Суммируя результаты проведенных эх,спериментов, можно
констатировать, Ч'l'О ассоциация лдr с эритроцитарным:И мемб
ранами и их белковыми компонентами, представляющими собой
мембранный каркас клетки, при различных значениях рН среды
приводит к снижению каталитической активности фермента, KO
12*
179
v
(!,15
0,,10
J,иc. 51, 811I1ИСИМОСТI. тш
рщ"rl! ф !РМЮ!ТtlТИIIНОЙ реtlIщии
ЛI\I<'J'!IТДI)['ИДРО!'LШI\ЗЫ n t:! ()бt)д
110М СЩ:'fЩIlНШ (1) и ТI !(ОМI!JlЮ{-
Cl' е >\JИ1'(ЮЦИТ!'РIlЫМИ M(JMflp!I
1IIIMI1 (2) ОТ !tOlЩШI'rрIЩЮ! ни-
JlУШI'['!\ ШIТ(\ЮI
0,05
(J
()
2 3 4 5
[пирумтj, ММОЛЬ/Л
'1'орtЮ ПРЩН:ХОДИТ ан ече'I' УВСЛПЧ(ШИЛ KOHt1TfiHTbl Мшcnэлиса для
1I11(1YIII\'1'1l 1П1'I'(НШ. ЭффeltТ Iш{'ибироlЩПИЛ JIдr усиливается при
СДНИ!'!) р11 11 юtСJlУЮ оБJЩС:'1't., что СllиrЦj'rеШ,С'l'вует об элеКТроста-
'1'ичш'коtf щш{!оде В:НtIIМ(JДСЙС1'l:IИЙ между ферментом и мембра-
!lОЙ. СJНЩОII/l'l'ОЛЫIO, процесс обрааоnaни.я I,oMnJleI{CIJ. лдr с био-
JlЩ'lfческоЙ ШIДЛОЖКОЙ можно реl'УJШIЮJ3аТI. путем nаРЬИроВа-
шш Щ)JЩСII'rрtЩI1Н ВОДОрОдНЫХ ИUllOtl, а твлже добавлепия n ре-
!IIЩНШШУЮ срtЩУ ItоферМ<НI'rt\ NАШ:I.
ОБРI\ТI1М<Н! IШIIИМtщеЙе'I'ЮЩ БНЛRо,g.ферментов с различными
<:'I'РУН:'l'У[НIЫМИ I,ОМПОIНШ'ЩМИ Юfl.!Т1<И нреДСТt\IIJшет собой ОДИН
на ЭФФЩ<"fIIННЫХ МtJХ!!JшаМОtr реl'УJlJПЩИ Ю1.ТIlJlитической актцв-
ШН:'I'И ROMllOllell'1'OH меТt\БЩП'lЧN:КИХ СИС'N:М. В соответствии с
a'I'IIM фУIIIЩИОIIИIЮШШIН! ферМtШ"С!II 11 ItJIC'1'I<e можно рассмат-
[НllIIt'I'I. Ш1К СОllUltУfПlOС'n lI:шим()(тпзанпых процессов перехода
их 11:1 еllоБОДIIО1'О еОСТОШШJI 11 СnШI!lll'ное, ко'rорые рсrулируютса
IIY'fCM lIоаД('ЙС'I'НИ'н рfl:lJlИЧIlЫХ физика-химических факторов 11
СШ(lНJIНlЖl(l\ю'rI:Н Н lм(!неllием фУШЩИОШ\ЛЫJЫХ свойств этихфер-
MI'[l'l'l/lI, 11, следощtтелыlO, и И:JМtJнением жизиеДелтелыхости це.
J10ii 1<:J1("I'ЮI.
1 111 pт , ;):;" tI ПР(ЩС'I'IШJltты !,<::JУЛЬ'I'fiТЫ ищтедоnапия Еft.Талити.
'II'('КОЙ I\к'rИНIIIЮ'I'И Jl) I" Уф.(){jлученшоЙ 11 дозе 1,5 кДж/м 2 и
Ш!('ОI(lIщщт\!шоЙ r. ;)IН1'rРОЦИ'I'I'tрНЫМИ мембрюшми при рН 7,4,
ЛI{'!'ИН1!Щ:'!'t. феРМОП'fа н свободном с()(:'rо.ннии после ero облуче.
IIIШ ('()I"['H)l.'tН{ T H: 'Х, по о'rЮIIШНlИЮ к КШI'1'IЮJlЫIОМУ обращу.
IHII
Д, % д, % Д, %
100 100 100
85 85 85
70
70
70
55
55
55
40
40
40
2 3 2 3 2
а 6 8
Рис. 52. АКТИnJlOстr> .7Iактатдеrидроrепазыt УФ облученной в дозе
1,5 кДж/мИ, в комплексе с :Jритроцитарными мембранами при рН 7,4 (а),
5,4 (15), 4,5 (в): 1 активность УФ об.7Iученной ЛДr; 2 активность
лдr в ПРИСУТСТВИИ :JРИТРОЦИ'I:'арных мембран; 3 ан:тиюroстъ ЛДr.
УФ.облученной в дозе 1,5 н:Дж/м 2 и ассоциированной с эритроцитар
ными мембранами
3
Rатали'rичеСI ая ю тивность УФ мод:ифицированной лдr, acco
циированной с эритроци'rарными мембранами, статистически дo
стоверно уменьшается па 8 'Уо по сравнению с активн:остыo CBO
бодноrо УФ.облученноrо фермента.
Таким образом, степень инактивации УФ-модифицированной
лдr при рН 7,4 n связанном с эритроцитарными мембранами
состоянии выше, чем в свободном состоянии (табл. 13).
На рис. 52, б приведены результаты исследования катали-
тической активности JIдr, модифицированной УФ излучением
и ассоциированной с эритроцитарными мембранами при рН 5,4.
Активность фермента в свободном состоянии после ero 'УФ-облу
чения составляет 65 'Уо по отношению к контрольному образцу.
Каталитическая активн ость УФ облуч:енной лдr и ассоцииро
ванной с эритроцитарными мембранами увеличивается на 21 %
по сравнению с каталИТИчеСJ ОЙ активностыо УФ-облученн:оrо CBO
бодно1'О фермента.
Друrими словами, степень инактивации лдr, УФ-облученной
и связанной с эритроцитарныии мембранами, при рН 5,4 ниже,
чем п'ри облучении свободно1'О фермента (см. табл. 13),
181
Таблица 13
СтеnеllЬ UllаJCтuвацuu ЛДF, УФ-облуч-еllllОЙ при рН 7,4/
5,4; 4,5 в свободllОМ состОЯllии ц. в lCо;nnлеlCсе с эритроцитпар-
llыми .ме;nбрана;nи
рН
Степень инактивации АА =' Ан.. А об ", %
в связанном с эритроци
тарными мембранами
состо.янии
в свободном состо.янии
7,4. 17 21
5,4 35 6
4,5 14 2
Пр и: м е ч а н И е. АВА. каталитическая активность JЩI' в натив-
ном состоянии; А обх каталитическая а:ктивность УФ облученной лдr;
АА разность величин каталитической активности лдr в наТИБНОМ и
УФ.облученном состояниях.
На рис. 52, в II01<a3aнbl результаты исследования каталитической
активности лдr, УФ облученной и ассоциированной с эритро
цитарными мембранами при рН 4,5. Каталитическая а1<ТИВНОСТЬ
УФ облученной лдr в комплексе с эр:итроцитарными мембранами
при этом значении рН статистически достоверно увеличивается
на 12 % по сравнению с активностью свободноrо УФ облученно1'О
фермента. Степень инактивации лдr, модифицированНОЙ УФ све
том и связанной с эритроцитарными мембранами, 01<азывается ниже,
чем при облучении свободно1'О фермента (см. табл. 13).
Следовательно, степень инактивации лдr, УФ облученной и
ассоциированной с эритроцитарными мембранами, при рН 4,5 и
5,4 уменьшаетсд по сравнению с та1<ОВОЙ для УФ модифициро
BaHHoro свобо,ЦНО1'О фермента при тех же значениях рН.
Можно предположить, что такое изменение функциональной
активности лдr, модифицированной воздействием УФ света и
ассоциированной с эритроцитарными мембранами, может быть
связано с изменением м:икроокружения активноrо центра УФ
облученноrо фермента при ero адсорбции на мембране.
Веродтно, УФ модификация и ассоциация лдr с эритроци
тарной мембраной при рН 7,4 приводит 1< стерическому экра
нированию активных центров лдr, а при рН 5,4 и 4,5 создают
сд более оптимальные условия для катализа. Но нельзя исклю
чить и то обстоятельство, что при УФ облучении и последую
щей иммобилизации фермента на мембране происходит изме
182
нение участков ero локализации на подложке биолоrической
природы.
С целью проверки справедливости высказанных преДIIоложе
ний были исследованы флуоресцентные свойства l анилинона
фталин 8 сульфоната в комплексе с мембранами эритроцитов и
лдr, УФ облученной при значениях рН 7,4; 5,4 и 4,5.
На рис. 53 представлены результаты исследования значений
интенсивности в максимуме флуоресценции АНС (479 нм) в при
сутствии мембран эритроцитов и лдr, модифицированной воз
действием УФ облучения при рН 7,4; 5,4 и 4,5.
Из анализа рисунка следует, что при взаимодействии
эритроцитарных мембран с лдr, облученной УФ светом при YKa
занных значениях рН, не выявляются статистически достовер-
ные отличия значений интенсивности флуоресценции зонда в
комплексе "мембраны лдr в нативном состоянии" и в комп-
лексе "мембраны УФ облученный фермент".
Полученные данные, вероятно, указывают на то, что при УФ
облучении фермента не происходит модификация тех ero участ-
ков, которые ответственны за связывание с эритроцитарными мем-
бранами.
Iфл Iфл Iфl1
0,3 0,3 0,3
0,2 0,2 0,2
0,1 0,1 0,1
О О О 2
2 2
8 б в
Рис. 53_ Интенсивность флуоресценции зонда 1,8-АНС в компле:ксе
с эритроцитарными мембранами и лдr, модифицированноЙ "УФ-излуче-
нием, при рН 7,4 (а), 5,4 (О), 4,5 (8): 1 интенсивность флуоресценции
АНС Б комплеЕсе с эритроцитарными мембранами и лдr Б нати:вном
состоянии; 2 интенсивность флуоресценции АНС в Еомплексе с эрит-
роцитарными мембранами и "УФ облученным ферментом
183
4.4. ИССЛЕДОВАНИЕ РОЛИ АКТИВНЫХ ФОРМ
КИСЛОРОДА В ПРОЦЕССАХ УФ МОДИФИКАЦИИ
ЛАКТАТДЕrидроrЕНА3Ы*
в настоящее время возрос интерес исследователей к проблеме
окислительноrо стресса. Ключевую роль в развитии окисл:итель
Horo повреждения И1'рают активные формы кислорода (АФК):
синrлетНЫЙ молекулярный кислород 102' супероксидный анион
радикал, пероксид водорода Н 2 О 2 , rидроксильный радикал ОН',
перrидроксильный радикал, rИПО1'алоиды (см. разделы 3.2, 3.3).
Образование АФЕ и оксидативная модификация макромолекул
нормальные и важные реryляторные процессы, участвующие в
синтезе эйкозаноидных ropMOHOB (простаноидов и лешштриенов)
и иодтиронинов, в воспалительных и иммунолоrических peaK
циях. В норме ОР1'анизм имеет мощную аптиоксидантную (за
щитную) систему, но при различных патолоrических состояниях
и действии экстремальных факторов (избыток 02' активация ней-
трофилов и фarоцитов, избыток 1'ема, ионов Fe 2 + и Си 2 +, ионизи
рующее и УФ и:злучение, некоторые ксенобиотики) необходимо
предусматривать дополнительные меры, повышающие устойчи
вость макромолекул (белков и нуклеиновых кислот) 1< ОКСИДа
тивной модификации и, в частности, фотоокислению.
Существенную роль в процессах: TeMHoBoro и фотоокисления
биолоrических структур И1'рают СИН1'летный кислород и ради
кал 1'идроксила, обладающие наибольшим модифицирующим эф
фектом. Одним из широко используемых методов исследования
роли тех или иных активных интермедиатов в процессе УФ мо-
дификации белка является элиминирование их при помощи спе
цифических акцепторов и тушителей.
Рассмотрим более подробно результаты исследования фото
индуцированных изменений структурно-Функциональных свойств
изоферментов лактатде1'идроrеназы из различных источников в
интактном состоянии и в присутствии ряда химических соеди-
нений, способных взаимодействовать с активными формами кис
лорода.
Каталитическая активность растворов изофермента М4 лдr
(0,2-10-8 моль/л) из скелетных мыщц свиньи при действии УФ-
света (240 390 нм) в дозах O,15 4,53 кДж/м 2 снижается с poc
ТОМ дозы облучения (В. r. Артюхов и соавт., 1997, В. r. Артю-
* Раздел написан с участием Ю. А, Лысенко и Н. В. А!'ишевой.
184
хон, М. А. Накнасина, 1991). NADH (2,4'10 7 моль/л) оказывает
фотосенсибилизирующее действие по отношению к молекулам
фермента при УФ.облучении их смеси. Падение каталитичеСI<ОЙ
активности лдr происходит под влиянием УФ-излучения, по-
rлощаемо1'О как anоферментом (Л- 280 нм), та:к и :коферментом
(1-.2260 нм). По-видимому, Н IIроцесс фотоинактивации лдr HHO
сят в:клад преимущественно фотохимические превращения апо-
белка, связанные с ПО1'лощением энер1'ИИ УФ-света остатками apo
матических (триптофана, тирозина входит н активный центр
лдr, фенилаланина) и серосодержащих аминокислот белка. При
сутствие указанных аминокислотных OC'l'aTKOB в молекуле MЫ
шечной изоформы фермента было продемонстрировано IIрИ иссле-
довании ее аминокислотноrо состава (табл. 14).
Таблица 14
Соf}ержанuе отf}елыtых а.мU7f.Olсuслот
в .lItо.леJCу.ле лаJCтатf}еzuf}РО2еJl.аЗbl
АмИНОКИСЛОТЫ Количество, % на Аминокислоты Количество, % на
100 r белка 100 r белка
Авр 7,820 Met 3,693
Thr 4,250 Не 4,819
Ser 3,294 Lel! 10,579
Glu 9,640 Tyr 3,793
Pro 6,273 Phe 4,078
Gly 4,006 НiB 2,937
Ala 4,092 Trp 2,068
"Полуцисти}! " 1,141 Lys 9,610
Val 8,626 Arg 6,388
Наблюдаемые IIрИ ВОЗДействиИ УФ света нарушения струк.
TypHo1'o состоянид и функциональной 'активности лдr являются
результатом разворачивания белковой 1'лобулы, что находит от-
ражение в изменении оптических и 1'ель хромаТОl'рафических
свойств УФ.облученно1'О фермента.
Продуктом фотоде1'радации остатков ТРИIIтофана являют-
ся кинуренины и формилкинуренины. Показано, что IIрОИЗ-
водные ТРИIIтофана СIIособны выполнять функцию фотодина-
мических сенсибилизаторов, в частности, 1'енерировать СИНl'-
летный кислород. В качестве источника 102 рассматриваю'!'
процессы тушения кислородом ТРИIIлетных состояний apOMa
тических или карбонильных соединений, которые входят в
185
состав МЮ,ёромолекул или присутствуют в них В виде приме
сей. На потенциальную возможность I'енерации 102 в реакции
триплетных возбужденных состояний белков указывает
И. И. Сапежинский (1979). Образование СИНI'леТlIOI'О I,ёислорода
может происходитъ в короткоживущих Iщмплексах с перено
сом зарЯда: ароматический уrлеводород (аминокислотный oc
таток) кислород.
С целью получения дополнительной информации о механиз
ме фотопревращений лдr необходимо исследовать УФ-индуци
рованные изменения с'rРУКТУрIIо функционалЫIЫХ свойств и I,ёИ
нетики фотоинактивации различных изофермептов лдr в ши
роком спектральном диапазоне У<Р излучения для выяснения
возможно1'О участия модифицированных триптофанилов в каче
стве (.внутримолекулярных аутосенсибилизаторов». Для изуче
ния роли активных кислородных метаболитов в процессах 'Уф
превращений белка используют их специфические акцепторы и
тушители: азид натрия, D маннит, Р каротин, I'истидин, cepOTO
нин. Применяемые концентрации вышеНазванных соединений
не должны оказьmать заметноI'О влияния на уровень активности
иативноI'О фермента.
Распространепным тушителем синrлетноrо кислорода явля
ется азид натрия, защитное действие KOTopo1'o было продемонст
рировапо по отношению к сенсибилизированному окислению раз
личных ОР1'анических субстратов. 1C0нстанта скорости e1'o peax<,
ции с 102 2'108 л,(моль.с) l, 2.109 л,(моль.с) l. Азид натрия TY
шит триплетные состояния возбужденных молекул, но KOHCTaH
та скорости данной реакции в последнем случае на 2 порядка
ниже. Для подбора концентрации N aN 8 можно использовать пред-
положение о простом конкурентном перехвате СИНI'леТIIоrо кис
лорода в исследуемой модельной системе и в соответствии с изве
стными- :константами скорости взаимодействия 102 с компонента-
ми этой системы. Для ЛДr такая константа не определена, но в
первом приближении можно принять ее значения равными 109
1010 л,(моль.с) 1 (И. И. Сапежинский, 1988). Суммируя известные
литературные данные (В. Рэнби, Я. Рабек, 1978, В. Я. Шляпин
тох, 1979, Х. Фут, 1979, Н. А. Шинкаренко, В. В. АлеСКОВСI<.ИЙ,
1981, Ю. А. Владимиров, А. Я. Потапенко, 1989), взаимодействие
СИН1'летноrо кислорода. с возможными субстратами реакции MO
жет быть представлено с помощью следующей упрощенной фор-
мально кинетической схемы:
186
kd За;!
k К,
G 102 А0 2
+02 +Д
k q 302 + Q
+0
)- ОО 2
{'де G источник, rенерирующий 102; k'i константа дезактива
ции 102 растворителем; k r константа скорости реакции 102 с
акцептором (окисляемым веществом); k константа скорости
'1
тушения (или химическоrо взаимоде;i:IСТВИЯ) с потенциальным
протек't'ором.
В присутствии двух l'\:ОНКурИрУЮЩИХ за 102 соединениЙ (А и
Q) квантовыЙ выход окисления акцеп't'ора определяется по ypaB
нению
= [ I+ kd+kчIQ] } .
CfJЛО 2 <P 1 02
Реакционная способность орrапическоrо соединения и туши-
теля характеризуется параМетрамИ: f3 А ::: kd f k r и PQ::: kd f kq . Эф-
фективная защита молекулы от повреЖдающеrо действия 102 в
присутствии тушителя возможна при соблюдении условия
k L1 [Q]» kd + kJA]. Следовательно,
[Q]»Si+!..r..[A] и [Q]» f3 Q +- [А]
k ч kq k L1
Время жизни 102 в Н 2 О составляет 3,1+3,2 мкс, значит,
kd == 1/1: == (3,2+3,1)'105 C I" Если принять k для азида натрия
2'108+2'109 л,(моль.с) I, k r (Лдr) 10 U +10 1 'b л,(моль.с) 1, то полу
чаем:
(N aN 3)== 1,6'1 O 3(---4),
r- ] З(-4) 109(10) r ]
lNaN J »1,6,10 + 2.lо 8 (9) :t!ЩI.
Величина ВТОРОI'O сла1'аемоrо в правой части неравенства бу
дет пренебрижимо мала по сравнению с первым до значений кон-
центраций фермента 10 б моль/л. Следовательно, в этом случае
187
А,%
100
90
80
70
60
50
,...........
,...........
А,% А,%
АI 100 А1 100 А1
90 90
80 80
А2 70 А2 70 А2
60 60
5С1 50
2 3 2 3
2 3
а б liI
Рис. 54. Изменение ФОТОЧУВСТБительности лдr в присутствии азида
натрия (а), каротина и D маннита (6), rи:стидина (6). По оси абсцисс
КOIщентрации модификаторов, моль/л; по оси ординат ферментатив
нм 8RТИВНОСТЬ, % . Аl 8RТИВНОСТЬ наТ!iШНОro фермента, Az УФ облу
ченноrо фермента. Концентрации модификаторов: 8) 1 6,6'10 б моль/л;
2 6,6'10 4 моль/л; 3 3,2'10 З моль/л; б) ,[ 3,3'10-6 моль/л
ф каротин); 2 5,5'10 5 молъ/л (D маннит); 3 -каротин + D маннит;
в) 1 1,3'10 З моль/л; 2 1,3'10 Z моль/л; 3 3,3'10 2 моль/л
концентрация азида натрия для проявления фотопротекторноrо
эффекта должна превышать 1,6'10 3( 4) моль/л.
Эти теоретические расчеты были подтверждены результа
тами экспериментов по изучению УФ чувствительности (доза
облучения 2,27 кДж/м 2 ) изофермента М4 лдr (2'10 8 моль/л)
в присутствии азида натрия в концептрациях 6,6'10 5; 6,6'10 4;
3,2'10 3 моль/л (рис. 54,а). Из анализа рисунка следует, что
NаN з в концентрации 3,2'10 3 моль/л практически полностью
восстанавливает ферментативную активность исследуемоrо бел
ка. При изучении спектрально люминесцентных характерис
тик лдr (lO 6 моль/л) после ее облучения в свободном COCTO
янии и В присутствии азида натрия (3,2'10 3 моль/л) выявле
но, что воздействие УФ света на смесь фермент азид натрия
при водит к восстановлению до уровня контрольноrо образца
величин интенсивности люминесценции модифицированноrо
белка в e1'o максимуме (340 нм) и светопоrлощения в миниму
ме (250 нм) и в более длинноволновой области (>290 нм), что
связано, вероятно, с защитой хромофорных rpупп лдr от дей
ствия 'УФ излучения.
На рис. 55, а показаны кривые зависимости остаточной
ферментативной активности мышечной изоформы лдr от Bpe
мени облучения. Для количественною описания данно1'О процес
188
In(A/Ao) t, мин In(A/Ao) t, мин
О 10 20 30 40 50 60 О 10 20 30 40 50 60
0,2
...0,1
0,6 ...0,2
1,0 2 0,3
...0,4
1,4
0,5
1 ,8 Q ...0,6 Q
а Q
Рис. 55. Кинетические кривые фОТОИНаЕТИВации ЛаЕТ8.тдеrидроre
Н8.зы из мышц (а) и сердца (6) свиньи в присутствии некоторых фото
протекторов: а) 1 на 'ивная лдr; JIдr, УФ облученная: в присутствии
модификаторов: 2 азида натрия (з,2'10 3 моль/л); 3 D маннита
(5,5'10-5 моль/л); 4 серО'l'онина (1'1O 5 моль/л); б) 1 нативная ЛДr;
2 ЛДl', УФ-облученная в присутствии азида натрия (3,2'10-3 моль/л)
са мы использовали константы фотоинактивации (k f ), рассчитан-
ные по TaHreHcy уrла наклона линейной анаморфозы исходной
кривой «доза эффект!) в координа'l'ЮС [ln(A/ Ао); t]. Для натив
ной ЛДr k f оказалась равной 5,39'10-4 c- 1 . Эн:споненциальный
характер кривой фотоинактивации свидетельствует об отсутствии
процессов реактивации УФ модифицированно1'О белка и позво-
ляет отнести rюследовательность фотохимических реакцИЙ Лдr
к катеrории мономолекуля:рныХ реакций перво1'О порядка. Bpe
мя полупревращени:я лдr (период, в течение KOТOPOI'O каталити
ческая активность белка уменьшается на 50 %) в этом случае
составит: t 1 !2== ln 2/k == 0,693/k == 1286 с == 21 мин. При KOHцe:в:
трации фермента 0,2'10-8 моль/л (щреддиссоциационной,» фор
ма кинетической кривой фотоинаК'l'ивации не изменяется, однако
k, существенно увеличивается и становится равной 3,05'10-3 c- 1 , а
t 1 !2 == 227,2 с == 3,8 мин. Следовательнd, уф-чувствительность
ЛДr возрастаеТ при разведении ее растворов.
Добавление азида натрия (3,2'10-3 моль/л) при облучении paCT
вора изоформы М4 ЛДr (2'10 8 !j10ЛЬ/Л) вызывает частичное
восстановление каталитической активности фермента. Однако
189
дозовая зависимость описывается прямой, а в IIOЛУЛО1'арифми
чес:ких :координатах :квадратичной функцией (см. рис.55, а).
Это свидетельствует о постоянстве скорости ина:ктивации лдr в
изучаемом диапазоне. Та:ким образом, протекторный эффект
NaN з на разных стадиях фотомодификации фермента неОДИна
ков. Защитное действие азида натрия может быть обусловлено
тушением 102' а 'I'акже ero комплексированием с белковой
макромоле:кулой и, возможно, образованием внутримолекуляр
ных сшивок некоторых функциональных 1'рупп лдr, Ч'rо индуци
рует повышение фоторезистен'l'НОСТИ зафиксированной конформа
ции биополимера. Не исключено также тушение азидом натрия
возбужденных состояний белка и e1'o взаимодействие со свобод
ными радикалами, обра:зующимися Б процессе УФ модификации
молекул фермента.
На рис. 55, б представлена зависимость «доза эффект»
для: изоформы лдr из сердца свиньи в ПОЛУЛО1'арифмичес:ких
координатах. Эта зависимость удовлетворительно описывается
прямой. Константа скорости инактивации фермента составляет
1,41'10 4 c l и t 1 / 2 ==1690 с == 28 мин, что позволяет сделать вывод
о меньшей фоточувствительности изофермента Н4 по cpaBHe
нию с М4' При добавлении :к раствору лдr до облучения азида
натрия остаточная ферментативная активность оказалась выше
таковой для облученной в соответствующих дозах свободной
ИЗ0фОРМЫ (см. рис. 55, 6).
A1 A2, %
30
10
25
20
15
5
о 1,51 3,02 4,53 6,04 7,55 9,06
кДж/м2
190
Рис. 5б. Сравнение протекторно
ro эффекта азида натрия по отноше-
нию к сердечной и мышечной изо
формам лдr при различных дозах
УФ облучения: 1 протекторный
эффект NaN 3 для мышечной изофор
мы; 2 для сердечной изоформы.
По оси ординат отложена разнос'l'Ъ
между уровнями ферментативной aк
тивности ЛДI', УФ-облученной в CMe
си с азидом натрия (A l ) и Б СБобод
ной форме (А 2 )
На рис. 56 представлена зависимость протекторноrо эффекта
азида натрия от дозы УФ облучения по отношению к мышечной
и сердечной изоформам лдr. Анализ полученных данных по
зволяет сделать заключение о неоднонаправленном характере дей
ствия модификатора: максимальное защитное действие азида Ha
трия наблюдается для лдr (M,j) при дозах облучения з,О2 6,О4
кДж/м 2 , а по отношению к ЛДr (Н) 6,04 9,06 кДж/м 2 . Если
предположить, что основной вклад в фотопротекторный эффект
NaN a вносит процесс тушения 102' то э'rот активный интермедиат
оказывает влияние на изменение ферментативной активносТИ изо
форм лдr при вышеун:азанных дозах облучения.
Наиболее широко распространено пред(:та13ление о том, rro дезак
тивация 102 каротином, взаимодействующим с ним IIреимуще
ственно по физическому механизму, связана с переносом энерrии
от СИН1'летноrо кислорода на низколежащий триплетный уровен!>
каротина. Обсуждается вопрос о вкладе в рассматриваемый процесс
комплекса с переносом заряда между 102 и каротином. Константа
скорости дезактивации синrлетно1'О КИCJIорода близка к диффузи
онной И составляет для CC1 4 7'109 л,(моль.с) I. rисти:дин относят к
типу акцепторов 102: ero дезактивация осуществляется химичес-
ким путем. Константа скорости k для Э'l'ой аминокислоты COCTaB
cj
ляет 5.107 л,(моль,с) 1 В метаноле; в D 2 0 108 л,(моль.с) l. В реаК-
цию с 102 вступает только неIIротонированная форма rИС'l'идипа.
Из анализа рис. 54, б следует, что Р каротин в концентрации
3,3'10 5 моль/л оказывает защитное действие по отношению 1':С
молекулам лдr (М): активнос'l'Ь УФ-облученноrо в дозе
2,27 кДж/м 2 белка восстанавливается на 18 % по сравнению с
таковой в отсутствие протектора. rистидин в концеН'l'рarJ;ИИ
3,3'10-2 моль/л снижает степень инак'rивации лдr на 19 % (см.
рис. 54, в), что СО1'ласуется с данными, полученными при исполь
зовании Р каротина.
Облучение лдr в присутствии D-маннита, являющеrося aK
цептором ОН радикалов, сопровождается снижением ее фото
чувствительности: константа ин активации составила 4,0'10-4 c 1 ,
а t 1 / 2 "'" 1732 с == 29 мин (рис. 55, а). Дозовая кривая имеет экспо
ненциальный характер. При изучении сочетанно1'О воздейс'rВИ,fI
Р каротина и D-маннита на уровень активности УФ облученн()й
лдr выявлен четко выраженный эффект аддитивнос'rи дейс'l'ВИЯ
этих areHToB (рис. 54, в). Полученные результаты свидетельству
ют о том, что их протекторное действие связано с реализацией
1IП
различных каналов защиты белка от УФ повреждения: элими
нированием 102 и ОН радикалов.
При 'УФ облучении лдr (М 4 ) из скелетных мышц свиньи в
присутствии серотонина установлено e1'o фотопротекторное дей
ствие по отношению к молекулам этой изоформы: k f =:3,5'lO 4 c 1
И t 1 / 2 == 1980 с=: 33 мин (см. рис. 55, а).
На рис. 57 показаны фотоиндуцированные изменения функ
циональных свойств лдr (изоферменты Н4' НзМ, Н 2 М 2 ) эритро
цитов крови человека после УФ облучения в присутствии cepo
тонина. Введение в облучаемую систему экзоrенноrо a1'eHTa в KOH
центрации 10 8 моль/л приводит к проявлению ero защитно1'О
действид только при использовании максимальной дозы 'УФ све
та (4,53 кДж/м 2 ), вызывающей наиболее rлубокие изменения в
структуре молекулы фермента и приводящей к падению ero aк
тивности на 35 % по сравнению с контрольным образцом. 'YBe
личение концентрации серотонина до 10 7 моль/л индуцирует
резкое усиление e1'o фотопротекторно1'О эффекта, наиболее ярко
проявляющеrося при облучении лдr в дозах 1,51 и 4,53 кДж/м 2 ,
При использовании биоrенно1'О амина в концентрации 10 6 моль/л
отмечаетсд снижение ero защитноrо действия при воздействии
УФ излучения в дозах 1,51 и 4,53 кДж/м 2 по отношению к ЭТО
му показателю при концентрации серотонина lO 7 моль/л. Про
текторный эффект 5 окситриптамина может быть связан либо с
акцепцией различных активных интермедиатов, в том числе и
102' либо С образованием комплекса фермент БИО1'енный амин,
более фоторезистентноrо, чем свободный белок.
А,'Уо
80
70
60
О
з
4
2
192
кДжJм2
Рис, 57. Зависимость ypOB
ня каталитической тивности
л та'rдеrидроrеназы эритроци
тов челове:ка в свободном COCTO
.янин и в присутствии серотони-
на от дозы УФ-облучения: 1
УФ-облучение без модификато
ра; УФ-облучение в присутствии
серотонина: 2 в концентрации
10 6 моJIЬ/Л, 3 10 7 моль/л, 4
10 8 моль/л
С целью детализации IIредставлений, касающихся выяснения
механизма защитно1'О действия серотонина по отношению к MO
лекулам лдr, при помощи метода И:К: спектрофотометрии были
исследованы особенности вторичной структуры изофермента М4
из скелетных мышц свиньи в нативном состоянии и в присут
ствии БИО1'евно1'О амина.
Анализ соотношения интенсивностей ПО1'лощения в полосах
амид 1 и амид II на частотах, являющихся характеристическими
для отдельных элементов вторичной структуры, свидетельствует
о том, что присутствие БИО1'енно1'О амина индуцирует увеличение
доли беспорядочной структуры в молекуле _фермента (табл. 15).
При этом отмечаемый прирост ее реализуется за счет как <Х. СIIИ
ральных участков, так и складчатых слоев. Б случае соотноше
Н;liЯ молекул лдr и экзоreнноrо модификатора 1: 1 наблюдаемый
эффект в большей стеIIени обусловлен участием <Х. СIIиралей, BXO
дящих в состав белка.
Таблица 15
Соотllошенuе полос поzлощенu.а., харшстерuаующuх основные
типы вторштой cтpYlCтypbt tJеЛlCовой молекулы, O.1lJl
лаJCтшпое8UОРО8енааы в свобооном состОЛlши
u в присутствuи серотонина
Соотношение Исследуемые образцы
интенсивностей полос лдr + серотовин лдr + серотонин
поrлощения НаТИ1l:НЫЙ беЛОЕ 11 соотноще:нии 11 соотвощении
моле'Кул 1:1 :МОJЩ'КУЛ 1:10
1656 (беспорядочная 1,423 :!: 0,092 1,406:1: 0,021 1,596 :!: 0,107
структура):
1650 (а.-спираль) c:м '
1535 (беспорядочная 1,488 :!: 0,092 2,297 :!: 0,078* 1,658:1: 0,109
структура): 1516
(а-спираль) CM l
1685 ф-С'КЛIJД'Ки): 0,926':1: 0,007 0,932:1: 0,028 0,752:!: 0,040*
1656 (беспорядочная
CTPYRтypa) cм '
1550 ([3-СRЛIJДRИ) : 1535 1,342 :!: 0,058 1,072:1: 0,029* 1,160 :!: 0,033*
(беспорядочная
CTPYRTypa) см-'
1650 (а-спираль): 0,746:1: 0,050 0,756:!: 0,029 0,764 :!: О, 046
1685 (I3-СRЛIJДКИ) c:м '
1516 (а.-спираль): 0,538:1: 0,029 0,407:!: 0,009* 0,535 :1: 0,019
1550 (I)-СRЛIJДКИ) CM '
* Отличие от контроля статистичес:ки достоверно.
13, 3!lRаз 3788
193
Изменение спектральных характеристик фермента удается
обнаружить и на ДРУ1'их участках спектра. При соотношении
молекул ЛДr и серотонина 1:1 статистичес!\и достоверно YMeHЬ
шается интенсивность поrлощения образцов на частотах 1468,
1420 CM l по сравнению с нативным белком; отмечается появле
ние HOBo1'o максимума на частоте 1502 CM l.
Повышение концентрации ЭКЗО1'енноrо модификатора в 10 раз
сопровождается снижением интенсивности поrлощения на час-
тоте 1432 CM l. Вместе с тем в области 1440 1380 CM l реrистри
руется выраженный пик с максимумом при 1404 CM l. Для Ha
тивно1'О белка ПО1'лощение в этом участке незначительно, а при
соотношении компонентов изучаемой системы 1:1 практически
отсутствует. ИК спектр свободноrо фермента характеризуется Ha
личием широкой полосы поrлощения в области 1370 1180 CM l
Добавление к e1'o раствору серотонина приводит к ее С1'лажива-
нию и при соотношении молекул Лдr БИО1'енный амин 1:10 в
данном диапазоне отмечается практически монотонное убыва-
ние светопропус!\ания образца.
Таким образом, выявлен выраженный фотопротекторный эф
фект серотонина по отношению к молекулам изоферментов Н4'
НзМ, Н 2 М 2 ЛДr эритроцитов человека, обусловленный образова
ни ем комплекса ЛДr серотонин, формирование KOToporo зат
раrивает вторичную структуру белка. Возможно, комплексиро-
вание биоrенно1'О амина с молекулами фермента происходит и в
. растворе. Однако полученные результаты не исключают и Bepo
ятность дезактивации серотонином АФЕ, в том числе 102'
Динамический комплекс с молекулами ЛДr способен образо-
вывать и ero кофактор NADH, что может существенно изменять
фоточувствительность фермента. С целью расширения представле-
ний, касающихся выдвления механизма УФ-модификаций лдr в
присутствии кофермента, были проведены эксперименты по изуче
НИI0 фотостабильности молекул лдr (М 4 ) из скелетных мышц сви
ньи В условиях различной занятости ее а!\тивных центров этим
кофактором. Степень занятости активных центров фермента NADH
рассчитывали по формуле (Ч. Кантор, П. Шиммел, 1985):
у = [NADH]
K dis +[NАDН]'
rде у степеЕЪ насыщения белка лиrандом; [NADH] концен-
трация кофактора; Kdi. !\онстанта диссоциации комплекса бе
194
лок ЛИI'анд (в качестве Кш. использовали значение константы
Михаэлиса 2,5'10 5 моль/л для NADH по отношению к изоформе
М 4 ) (С. Е. Северин, r. А. Соловьева, 1989) .
Установлено, что предварительное добавление NADH
(4'10-8 моль/л) к лдr (10 8 моль/л), УФ облучаемой в дозе
3,02 кДж/м 2 , не вызывает статистически достоверных изменений
степени инактивации свободноI'О белка (32 %). У в данном слу
чае 0,16 %. При концентрации NADH 4'10 7 моль/л (У == 1,57 %)
обнаруживается эффект сенсибилизации (13 %). Фотомодифика
ция лдr в присутствии кофермента в КОНцентрациях 4'10 в
(У == 13,8 %) и 2,5'10 5 моль/л (У==50 %) приводит К ре1'ИСТРации
llpOTeKTopHOI'O эффекта NADH по отношению к ферменту: степень
УФ инактивации белка в этом случае соответст!3еННО на 9,3 и 16,0 %
ниже уровня активности лдr, облученной без кофактора.
Путем одноэлектронноI'О окисления NADH и при BOCCTaHOB
лении NAD+ может образовываться радикал NAD', взаимодей
ствующий с кислородом С образованием супероксидноI'О анион
радикала 0/, поражающеI'О белковую 1'лобулу. Вместе с тем BOC
становленная форма кофактора обладает способностью дезакти-
вировать 102: константа скорости тушения СИН1'летноI'О кислоро
да в системе СНзСN : DP (4:1) 7,5'107 л,(моль.с) l; В DP
2,1'107 л,(моль.с)-l. Следовательно, значение ее дЛЯ NADH COCTaB
ляет 1,7'10 4 1,5'10-2 моль/л. NADH способен взаимодейство
вать с 02\ причем выявлено, что e1'o окисление супероксидом
идет быстрее, если кофактор образует ,комплекс с лдr: констан-
та скорости окисления NADH в последнем случае по меньшей
мере на 4 порядка выше таковой для свободноI'О ЛИ1'анда. Окис
ление NADH в активном центре фермента, по-видимому, должно
происходить по цепному механизму и существенным образом
изменять химические свойства кофактора.
Спектр ПОI'лощения комплекса лдr (2'10 в моль/л) NADH
(2'10-8 моль/л) характеризуется двумя полосами ПО1'лощения с
"'шах при 268 и 340 нм. Присутствие полосы с "'шах 268 нм В спек-
тре ПО1'лощения изучаемой системы можно объяснить индукци
ей структурных изменений молекулы апофермента путем при
соединения'кофактора. D. Scherr и соавт. (1973) исследовали спек
тральные свойства двойных комплексов, образующихся при вза-
имодействии аналО1'ов или фра1'ментов NADH с лдr из сердца
свиньи. Комплексообразование вызывало спектральные измене.
ния в области 280 нм, что указывает на участие в этом Процессе
13*
195
ароматических аминокислот. Авторы постулировали rидрофоб
НЫЙ характер взаимодействия адениновой части коэнзима с апо-
белком.
Таким образом, суммарный реrистрируемый эффект измене-
ния :каталитической активности лдr при ее УФ-облучении бу
дет зависеть от соотношения процессов сенсибилизации и проте:к
TopHoro эффе:кта NADH. Защитное действие :кофермента (У == 13,8
и 50 %) может быть обусловлено реализацией следующих воз-
можных процессоВ:
1) формированием более фоторезнстентиой конформации лдr
в :комплексе с NADH по сравнению с апоферментом;
2) миrрацией энерrии с возбужденных амино:кислотных ос-
тат:ков белка (в частности, триптофана) на :кофермент;
3) а:кцептированием АФК е02 и 02 );
4) экранирующим эффектом NADH в областн длин волн 240
280 нм.
Фотосенсибилизирующий эффект NADH по отношению к ЛДТ,
по-видимому, объясняется образованием при УФ-облучении бел-
:ка сольватироваиноrо электрона, акцептируемоrо NAD+, в резуль-
тате чеrо в присутствии 02 возможен циклический процесс пере-
хода NAD+ NAD' с 1'енерированием 02:' и друrих а:ктивных
интермедиатов (NAD', НР2)' Кроме TOro, вследствие конформа-
ционных переходов протомеров лдr при фотоокислении NADH
Moryт формироваться субъединицы, занятые одновременно вос-
становленной и о:кисленной формой :кофактора, что существенно
изменяет характер УФ-превращений, индуцнруемых в системе
фермент :кофермент .
Изучение роли АФК в процессах фотомодифи:кации белка cy
щественно дополняют исследования фотосенсибилизированно1'О
метиленовым rолубым (мr) фотоокисления изофермента М4 ЛДТ.
Механизм действия красителя связан с 1'енерацией 102 или
непосредственным взаимодействием возбужденной моле:кулы Mr
с молекулой бел:ка. Преобладание в системе тех или иных про
цессов зависит от соотношения :концентраций биополимера и :кpa
сителя в облучаемой Системе.
Из аналнза данных, представленных на рис. 58, а, следует, что
облучение :красным светом изофермента М4 (10--8 моль/л) в тече
ние 15 мин с Mr (10-7 моль/л) не вызывает статистически досто-
верных изменений функциональных свойств лдr по сравнению с
уровнем активности белка, облученноrо в отсутствие красителя.
196
А,%
100
.:::::::::::::::::::::::::::::::::::::::::::::::::::::::::: до
90 2 1
а
80
70
60
10 7
А,%
120
110
100
б
/1
10...б 10 5 10--4
cMr, молЬ!л
2 1
Ао
60
10 7
А,%
10...б
/1
10-..5 10--4
CMr, молЬ!л
100
80
Ао
в
70
/1
10 7 10...б 10 5 10--4
CMr, моль/л
Рис, 58. Зависимость ферментативной активности лдr (М 4 ), облу-
ченной красным светом в присутствии азида натрия (3,2'10-3 моль/л),
от концентрации метиленовоrо rолубоrо: а концентрация фермен
та 10-8 МОЛЬ/Л; б 10 6 МОЛЬ/Л; в 10-7 МОЛЬ/Л; Ао активность
фермента, облученноrо в течение 15 мин красным светом без модифи-
каторов; 1 лдr; 2 лдr+Nа.N з
197
Добавление Mr в концентрациях 1041, 10"" и 10--4 моль/л сопровож
далось эффектом сенсибилизации: активность лдr снижалась на
26,7::!::6,0; 11,0::!::1,8 и 17,4::!::2,6% соответственно. В присутствии
NaN g остаточная активность фермента после ero облучения с Mr
(10 6 моль/л) составляет 87 , 8::f::3 ,6% , что свидетельствует об учас
тии 102 В процессе фотоинактивации лдr (10--8 моль/л).
При использовании растворов фермента (10 6 моль/л)
максимальный сенсибилизирующий эффект мr обнаруживается
при ero концентрации 1041 моль/л и составляет 30,0::!::4,0 %, а OCTa
точная активность белка, облученноrо в присутствии азида натрия,
равна 90,3::f::2,4% (рис. 58, 6). АналО1'ичные результаты были полу
чены при исследовании фотосенсибилизированноrо окисления cep
дечной изо формы лдr с участием мr (1041 моль/л).
Для JЩr (1O 1 моль/л) в присутствии Mr характер изменения
функциональных свойств лдr от концентрации красителя при об
лучении их смеси оказался иным: активность фермента убывает с
ростом концентрации Mr, а степень ин активации ДОСТИ1'ает Maк
симальной величины (23,2::!::4,5%) при концентрации сенсибили
затора 10 4 моль/л (рис. 58, в), При добавлении в систему азида
натрия значения исследуемоro параметра не отличались от TaKO
ВЫХ: для лд:r, фотомодифицированной в свободном состоянии.
Взаимодействие фермента с синrлетным кислородом может ocy
ществляться при относительно высоких концентрациях белка, так
как 102 характеризуется малым временем жизни. Этим, вероятно,
объясняется отсутствие протекторноro действия NaN з для низких
концентраций фермента. При определенных концентрациях Mr
(lО б и 10 4 моль/л) возможно тушение ero триrrлетноro состояния
своими же молекулами или взаимодействие их с 102; этот поража
ющий areHT не достиrает активно1'О центра белка. Кроме тoro, фо
тоинактивация лдr может быть связана с комплексированием MO
лекул красителя с поверхностными участками белковой 1'лобулы,
что блаroприятствует протеканию реакций по типу !, Т.е. обуслов
лена непосредственным химическим взаимодействием триплет
ных состояний сенсибилизатора с аминокислотными остатками
фермента.
Суммируя результаты исследования УФ ИНдУцированных из
менений структурно Функциональноrо состояния изоферментов
лдr в условиях их различно1'О микроокружения, можно заклю
чить, что основной тип УФ модификации каталитической актив
ности ИЗ0фОрМ лдr (мышечно1'О и сердечноrо типов) фото
198
инактивация ее молекул. На основании определения величин KOH
станты скорости инактивации и времени полупревращения изо
ферментов лдr показано, что сердечная форма фермента (Н 1 ) бо
лее фотостабильна по сравнению с мышечной (М 1 ). Использова-
ние широкоrо спектра ЭКЗО1'енных соединений (азида натрия, -
каротина, D-маннита, rистидина, серотонина, NADH), способных
акцептировать АФК и проявлять в определенных концентраци-
ях фото протекторное действие по отношению к молекулам лдr,
позволило выявить существенную роль СИН1'летно1'О моле
кулярноrо кислорода в процесс е фотоинактивации лдr. При
исследовании сенсибилизированноro Mr фотоокисления изоформ
hv
(о; 280 нм)
+
ОН+
Конечные
стабильные
фото продукты
Первичные и вторичные
продукты фотоокисления
аминокислотных остатков
(His, Trp, Tyr, Met, Cys---Cys)
Нарушение конформации лдr (в том числе разворачивание белковой rлобулы)
и ее активноro центра
Фотоинактивация лдr
Рис. 59. Схема возможных фИЗИко хи:м:ических процессов, приводя
ЩИХ :к фотоинактивации молекулы лактатдеrидроrеназы
199
фермента по:казана возможность о:кисления лдr (М,,) СИН1'лет
ным :кислородом при ero экзоrенной 1'енерации.
На рис. 59 представлена схема возможных процессов, способ
ных приводить :к фотоинактивации лдr.
Результаты проведенных исследований У1'лубляют современ-
ные представления об особенностях фотохимических превраще
ний и фун:кциональных нарушений отдельных изоферментов лдr,
индуцированных воздействием УФ излучения. Их необходимо
учитывать при изучении первичных и начальных процессов УФ
изменений сложных белков с доменной структурой. Кинетичес
:кие исследования фотоокисления лдr в присутствии протекто-
ров, акцептирующих активные промежуточные продукты фото-
превращений белка, позволят оценить реальный вклад каждой
элементарной стадии (реакции) в сложный процесс УФ модифи-
кации субъединич:в:ой молекулы ЭТО1'о фермента.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Какие компоненты биомембран являются акцепторами УФ-излу-
чения?
2. Что понимают под термином "пеРО1<сидное фото окисление ли
пидов" мембран?
3. Каковы механизмы протекания процесса пероксидноrо фотоокис-
ления ЛШIидов мембран?
4. Чем обусловлены изменения стрУктурно функциональноrо состо-
яния простых и сложных белкоВ ПОД влиянием УФ излучения?
5. В чем заключаются особенности фотохимических превращений
мембраносвязанных белков по сравнению со свободными?
6. Что представляет собой эффект фотохимической аллотолии? Ка-
ковы условия проявления и исчезновения феномена фотохимической
аллотопии?
7. Что называют фотосенсибилизаторами?
8. Каковы механизмы протекания фотосенсибилизированных реак-
ций?
9. В чем состоит роль синrлетноrо молекулярноrо кислорода В pea
лизации фото сенсибилизированных лроцессов?
10. Охарактеризуйте методы выявления и оцешш роли синrлетноro
кислорода в различных фотосенсибmrnзированных и темповых реакциях.
11. Что называют акцепторами и тушителями синrлетноrо молеку
лярноro кислорода? Как оценивают способность этих соединений взаи-
модействовать с 10 з ?
12. Какие биолоrические молекулы являются наиболее эффектив
ными тymителями синrлетноrо кислорода, а какие малоэффектив
ными?
200
13. В чем заключаютс.я различия химическоrо и физическоro меха-
низмов тушения 102 биомакромолекулами?
14. Каковы "последствия" фотосенсибилизированноrо повреждения
молекулярных компонентов биомем6ран?
15. Опишите последовательность реакций, индуцированных воздей
ствием УФ света на отдельные мембранные компоненты и npи:водящих
к нарymенШIМ структурно-функциональноro состояния биомембран.
16. Какое теоретическое и практическое значение для медицины
имеют исследования, направленные на изучение закономерностей фо
тохимических превращений биополимеров, их надмолекулярных KOМn
лексов и биомембран?
I'лава 5
ХАРАКТЕРИСТИКА НЕКОТОРЫХ МЕТОДОВ
И3УЧЕНИЯ БИОЛОI'ИЧЕСКИХ МЕМБРАН
5.1. КРАТКИЙ ОБЗОР rрупп МЕТОДОВ
ИССЛЕДОВАНИЯ БИОМЕМБРАН
Методы исследования биолоrических мембран весьма разно
образны и условно объединены в 5 rрупп: биохимические, физио
ЛО1'ические, иммунолоrические, rенетические, биофизические.
Биохимические методы позволяют разделять, выделять и
анализировать в чистом виде липидные и белковые компоненты,
изучать их физико химические свойства в свободном состоянии и
в составе надмолекулярных комплексов в условиях воздействия
различных внешних факторов (температуры, концентрации BOДO
родных ионов И др.), исследовать их время «жизни», пути биосин
теза и распада этих компонентов. К ним относят методы выделе
ния (недеструктивные и включающие разрушение клеТОI<); разде
ления субклеточных фраrментов (хроматоrрафия, электрофорез,
центрифyrирование, иммуноаффинные методы); идентификации
и оценки чистоты субклеточных фракций; выделения орrанелл и
мембранных систем; экстракции липидов и разделения их по клас
сам; количественноrо определения фосфолипидов; исследования
трансмембранно1'О распределения липидов; солюбилизации мемб
ранных белков, их реконструкции и определения функциональ
ной активности реконструированных мембран, выделения и MO
дификации мембранных белков.
ФИЗИОJIОl'ические методы используют для изучения функ
ционирования естественных и искусственных мембран, Они по
зволяют исследовать пропицаемость мембран, процессы возбуж
дения, торможения, проведения HepBHo1'o импульса, распределе
пия и выведения ио13:0в и молекул из клеток и тканей, измене
нил фИЗИОЛО1'ических функций клеток.
Им:мунОJIОl'ические методы широко используются для иден-
тификации мембранных компонентов, их локализации, оценки
количества, выделения. Это методы получения поликлональных
и моноклональных антител к компонентам мембран, иммуно
блоттин1' (электрофорез в полиакриламидном rеле в присутствии
додецилсульфата н рия с перенесением разделенных белков на
нитроцеллюлозные фильтры для последующеrо выявления с по
202
мощью антител), иммунолоrическая очистка субклеточных фраl<
ций, иммунолоrическое выделение мембранных компонентов,
использование антител для отбора комплементарных ДИК, I O
дирующих мембранные белки.
rеиетические методы основаны на использовании мутанто!!,
дефектных по синтезу определенных мембранных белков. ОНИ
позволяют исследовать функции мембранных белков, их роль в
функционировании мембран, проблемы саМООР1'анизации мемб
ран.
Биофизические ме'l'ОДЫ позволяют изучать динамичеСI<УЮ
орrанизацию биомембран, получить представления об ynal<OBl (!
и движении липидных молеr<ул в природных и модельных MeM
бранах, их взаимодействии дРУХ' с дрУ1'ом и молекулами белкОв,
исследовать фазовые переходы и друrие процессы. I{ ним OTHO
сятся дифракционные методы (рентrеновская дифракция, ди:ф
ракция нейтронов), резонансные методы, метод электронноЙ мик
роскопии, оптические методы (круroвой дихроизм, дисперсия ()Il
тическоrо вращения, абсорбционная спектроскопия, люминесцев
ция, метод флуоресцентных зондов), метод дифференциальноЙ
сканирующей микрокалориметрии, метод моделирования и иo
лучения искусственных мембран и др.
Дифракционные .методы основаны на взаимодействии элеl<'.rро
маrнитноrо излучения или частиц с длиной волны, соизмеримой
с межатомным расстоянием, и компонентов мембраны. Их ис
пользуют для определения reометрических параметров CTpYl<TY
ры: типа липидной мезофазы и ее периодичности, толщины би
слоя, среднеrо расстояния между уrлеводородными цепями. К
этим методам относятся реНТ1'еновская дифракция (peHTreHO
структурный анализ) и дифракция нейтронов.
В основе peHTreHocTpYKTypHoro анализа лежит вааи
модействие peHTreHoBcKoro излучения с электронами вещества, в
результате KOToporo возникает дифракция рентrеновских лучей
с длиной волны 0,1 нм. Последние рассеиваются на элеl<ТРОН
ных оболочках атомов. Интерференция волн, рассеянных веrде
ством, приводит к возникновению дифракционной картины, что
позволяет зареrистрировать peHT1'eHorpaMMY. При рассеянии :на
кристалле можно рассматривать дифрarщию как отражение peH
тrеновских лучей плоскостями кристаллической решеТl'\:И. Ди
фракция наблюдается, если рассеянные волны находятся в фазе,
Т.е. разность хода лучей равна целому числу волн n.
20а
Условие дифракции (отражения) описывает формула Брэ1'
rа Вульфа:
nЛ- == 2 d sin 0,
rде л. длина волны; d расстояние межДУ кристаллическими
плоскостями; 0 уrол между направлением па,цающеrо луча и
кристаллической плоскостью.
На основании дифракционной картины, получаемой для peHT
1'еновских лучей с известной длиной волны, определяют пара
метр d. Дифракционная картина зависит от длины волны peHT
rеновских лучей и строения объекта. Анализ дифракционных
максимумов позволяет установить распределение электронной
плотности в кристалле. РеНТl'еноструктурный анализ дает ин
формацию о расположении атомов в молекулах и кристаллах.
Для построения профилей электронной плотности, а также
для изучения ориентации и характера упаковки уrлеводороД
ных цепей используют мультислои липидов или смесей липидов
и белков, ориентированные на твердой подложке. Их получают
путем постепенноrо нанесения липидов при MHorOKpaTHoM про
хождении стеклянной пластины сквозь моно слой ЛИПИДа на rpa
нице раздела вода воздух или путем спонта:нноrо образования
мультислоев, параллельных подложке, при испарении орrаничес-
Koro растворителя из капли липидноro раствора.
Метод реНТl'еновской дифракции позволяет установить нали
чие бислойной структуры в природных И модельных мембранах
и определить параметры бислоя. На основании анализа дифрак-
ционной картины можно исследовать состояние уrлеводородных
цепей мембранных липидов и зареrистрировать фазовый пере-
ход из rелеобразноrо в жидкокристаллическое состояние. Одна-
ко из-за высокой лабильности и сравнительно малой упорядо-
ченности структуры биомембран метод peHTreHocTpYKTypHoro
анализа не позволяет изучить локализацию мембранных белков.
Лишь в мембранах, СОДержащих упорядоченные белковые комп
лексы, удается выявить наличие и ориентацию а-спиральных
участков интеrpальных белков.
С помощью метода дифракции нейтронов, дополня-
юще1'О реНТ1'еноструктурный анализ, определяют расположение
молекул и их частей в бислое путем изотопно1'О замещения водо-
рода на дейтерий. В отличие от peHT1'eHoBcKoro излучения, неЙт
роны практически одинаr<,ово эффективно рассеиваются леl'КИ-
204
Mf1 И тяжелыми атомами. Взаимодействие с некоторыми ядрами,
имеющими соответствующие резонансные уровни энерrии, при
водит к изменению знака амплитуды рассеяния. Амплитуда KO
repeHTHoro рассеяния ядром (Ь) связана с эффективным сечени
ем (О') соотношением: Ь = .JO' 147& . Различие в рассеянии нейтро-
нов атомами водорода и дейтерия позволяет широко использо-
вать эффекты изотопноrо замещения для изучения биомембран.
Резонансные .метоаы анализа веществ подразделяют на ме-
тод ядерноrо маrнитноrо резонанса (ЯМР) и метод электронноrо
парамаrнитноrо резонанса (ЭПР).
М е т о Д Я М Р основан на резонансном по1' лощении в силь-
ном внешнем маrнитном поле знерrии электрома:rнитноrора-
диочастотно1'О поля системой атомных ядер, обладающих Ma1'
нитным моментом. Он позволяет получать сведения о подвиж-
ности молекул липидов биомембран, об упаковке фосфолипид
ных молекул в бислое, используется для реrистрации изменений
значения р:Н в частицах малО1'о размера (искусственные мемб-
раны, митохондрии), изучать процессы латеральной диффузии
липидов и трансбислойноrо движения ("флип флоп" переходы)
молекул.
Положение спектральной линии ЯМР относительно некото-
рой эталонной линии называют химическим СДВИ1'ом. Химичес
кий сдвиl' (о) это отношение СДВИ1'а частоты поля (Д(О) к эта
лонному значению «(00)' умноженное на 106:
О (д<о!<оо) . 106 ДНjН о ' 106,
1'де Но напряженность постоянноrо маl'нитноrо поля.
Величина О для в.лифатических протонов варьирует от O,5
дО 2,0, ароматических протонов от 6,0 до 8,5. В качестве
эталона для протонноrо резонанса орrанических соединений ис
пользуют тетраме'1'илсилан (СНЗ)4Si, а для водных растворов био-
полимеров 2,2-диметил-2-силанпев:тан-5-сульфоновую кисло-
ту (дсс). При высоком разрешении наблюдается сверхтонкая
(мультиплетная) структура линий ЯМР, возникающая вследствие
маrнитно:rо взаимодействия между ядрами, передаваемоrо через
электроны связи (непрямое спин-спиновое взаимодействие).
К недостаткам метода ЯМР следует отнести низкую чувстви
тельность (концентрация образца должна быть не менее
10-3 моль/л), а также малую эффективность в изучении крупных
молекул, Т.е. мембранных белков.
205
Метод ЭПР это резонансное поrлощение энерrии элеRТРО
маrнитных колебаний в сантиметровом или миллиметровом ди
апазоне длин волн веществами, содержащими парамаrнитные ча
стицы (молеRУЛЫ, атомы, ионы, свободные радикалы, слабо свя
занные с атомом электроны). Условие резонанса, при соблюде
нии KOTopo1'o образец поrлощает электрома1'НИТНУЮ энер1'ИЮ, опи
сывают уравнением
hv '= E == gPH,
1'де h постоянная Планка; v частота переменно1'О электро-
ма1'НИТНОI'О поля; E разность энерrий между маrнитными под
уровнями, которые образуются в результате расщепления ypOB
ней энер1'ИИ парамаrнитной частицы в постоянном ма1'НИТНОМ
поле Н; g фаЕТОР расщепления (отношение маrнитноI'О MO
мента парамаrнитной частицы к ее механическому моменту (спи
ну); /3 ммнетон Бора.
Метод ЭПР основан на введении в липидный бислой napaMa1'
НИТНЫХ меток и зондов. Основу спиновых меток и зондов COCTaB
ляет стабильный свободный иминоксильный (нитроксильный)
радикал с неспаренным электроном, локализованным преиму-
щественно у атома азота:
н в () ()НЗ
N O
НзС СНЗ
Если производное TaKOI'O радИRала присоединя:ется к бел.ку
или липиду ковалентной связью, то такое npоизводное называют
спиновой меткой, а если с помощ;ью электростатических сил и
rидрофобных взаимодействий . o спиновым зондом.
Выбор спиновоrо зонда или метки определяется задачами ис
следоваEi:ИЯ:. Так, для иq:учения характера движения липидных
молекул используют липофильные спин меченные жирные кис
лоты, rЛИRО и фосфолипиды. Последние применяют также для
исследования латеральноrо фазовоrо разделения липидов и ли-
пид белковых взаимодействий.
Некоторые амфифильные зонды, в частности 2,2,6,6.TeTpa
метилпиперидин N-оксил (ТЕМРО), растворяются частично в yr-
леводородной зоне мембраны, а частично в ее полярной облас
ти. Поэтому ИХ спектры зависят от полярности окружения. Рас-
206
пределение TaKoro зонда в мембране опреде.тrется фазовым co
стоянием липидов и "чувствительно" к их фазовым переходам.
rидрофильные спиновые зонды, представляющие собой MO
дификацию зонда ТЕМРО и изменяющие свой заряд в зависимо
сти от величины рН, способны связываться с различными участ
ками ПОЛЯРНЫХ rруrш мембраны за счет электростатических вза
имодействий. Их используют для исследования поверхностноrо
потенциала и плотности заряда мембранной поверхности.
Более предпочтительным для изучения биомембран являет
ся одновременное применение нескольких зондов, по разному вза
имодействующих с компонентами мембран, что позволяет иссле
довать цитоплазматическую и наружную поверхности мембран
клеток и клеточных орrанелл.
Таким образом, метод ЭПР применяют для изучения фазо
вых переходов в липидном бислое, микровязкости мембран, под
вижности У1'леводородных цепей, латеральной диффузии и "флип
флоп" переходов. Недостаток этоrо метода заключается в том,
что введение зонда изменяе'r структуру БИСJIОЯ и свойства мемб
раны. Метод ЭIIP более чувствителен по сравнению с методом
ЯМР, так как маrнитный момент электрона в 1000 раз выше,
чем ядра.
С помощью .lltето(}а Э.1lelстJю1tftой .lltикроскопии (разрешающая
способность электронноrо микроскопа нахОДИТСJI в диапазоне 2
4 нм И превышает таковую для оптическоrо микроскопа более
чем в 500 раз) исследуют МОРфОЛО1'ию внутренних поверхностей
двух монослоев, распределение фаз в мембране, трехмерную моле
кулярную структуру мембранных белков, форму и размеры солIO
билизированных мембранных белков. Однако необходимость про
ведения обезвоживания, фиксации и кон'rрастирования объекта
солями тяжелых металлов приводит к существенной модифика
ции cTpyKTypHoro состояния компонентов мембран.
Разновидность метода эле:ктронно:й: микроскопии "замора
живание скалывание". Ero применяют для изучения хара:ктера
связывания белков с мембранами. Для это1'о образец; не требую
щий химической фи:ксации, замораживают в жидком азоте, а
затем раскалывают в плоскости наименьшеrо сопротивления xo
лодным ножом в вакууме. Плоскость наименьшеrо сопротивле
ния проходит между двумя слоями липидной фазы мембраны.
Далее поверхность образца покрывается платиной и уrлероДОМ,
e1'o растворяют и отпечато:к (реплику) рассматривают в элек'l'
207
ронный микроскоп. Если лед возrоняют с поверхности образца,
то модификацию метода называют "замораживание травление".
Onmu'teC1Cue .иетоiJы позволяют получить информацию о Me
ханизме фотосинтеза, электронном транспорте, транспорте кис
лорода в тканях, транспорте ионов, взаимодействии )3еществ раз-
личной природы с мембранами, белок-липидных взаимодействи-
ях и друrих процессах. Они основаны на присутствии в изучае
мой системе эндоrенных или экзоrенных (вносимых в систему
экспериментатором) хромофорных rpупп. К эндоrеннЬJМ XPOMO
форам относятся порфирины, флавины', каротиноиды, пиридин
нуклеотиды, цитохромы, rемоrлобин, миоrлобин, которые поrло-
щают свет в видимой области спектра. Акридины, нафталин-
сулъфонаты, цианины являются ЭКЗО1'енными хромофорами. К
оптическим методам относят абсорбционную спектрофотомет
рию, люминесценцию, метод флуоресцентны:х. зондов, а также кру-
rовой дихроизм, дисперсию оптическоro вращения. Последние
наряду с ИК-спектроскопией и спектроскопией комбинационно
1'0 рассеяния используются для определения содержания различ
ных элементов вторичной структуры молекулы белка, позволя-
ют изучать ее конформационные переходы.
Л ю м и н е с Ц е н Ц и я наблюдается в результате поrлощения
веществом энер1'ИИ возбуждения, пере:х.ода ero частиц из OCHOB
HOro в возбужденное электронное состояние и обратно. Она пред-
ставляет собой свечение атомов, ионов, молекул и их комплек-
сов, возникающее в результате электронно1'О перехода из возбуж
денноrо состояния в основное.
Все известные виды люминесценции подразделяют на два
больших класса: флуоресценцию и фосфоресценцию. Под флу
оресценцией понимают свечение, MrHOBeHHO (10-0 с) затухаю-
щее после прекращения возбуждения. Квант флуоресценции
испускается при переходе из синrлетноrо возбужденноrо со-
стояния 81 (с ero нижнеrо колебательно1'О подуровня) в синr-
летное основное состояние 80: 81" ----? 80 + hv фл' Фосфоресцен-
ция свечение, продолжающееся в течение длительно1'О про
межутка времени (>10-0 с) после прекращения возбуждения.
Квант фосфоресценции высвечивается при переходе (с обра-
щением спина) электрона из триплетноrо возбужденноrо co
стояния Т 1 В основное состояние: Т 1 ----? 80 + hv фас'
Есть и друrие виды классификации люминесценции: по типу
возбуждения свечения и кинетике процесса люминесценции. Так,
208
в случае возбуждения вещества световыми квантами возникаю
щее при этом свечение называется фотолюминесценцией.
В зависимости от кинетических характеристик свечения вы-
деляют резонансную, спон'rанную, вынужденную и рекомбина
ционную люминесценцию.
Резонансная флуоресценция основа процесса атомной лю-
минесценции представляет собой излучение фотонов той же
энерrии, что и у поrлощенных фотонов возбуждающеro света;
наблюдается в rазах и кристаллах.
При спонтанной люминесценции после возбуждения молеку-
ла сначала переходит на высокий возбужденный электронный
уровень 82' а затем путем безызлучательноrо перехода на бо
лее низкий возбужденный уровень 81' Квант люминесценции BЫ
свечивается при перех.оде 81 ---7 80' поэтому e1'o величина оказыва
ется меньше, чем у ПОI'лощенноrо кванта. Спонтанная люминес
ценция наблюдается у паров. растворов сложных молекул, моле-
кулярных кристаллов.
Вынужденная люминесценция характерна для сложных opra-
нических молекул, находящихся: при низкой температуре или в
жестких средах. В этом случае при возбуждении молекула пере
ходит из состояния 80 в возбужденные состояния 82" и 81"' затем
безызлуч:ательным путем в Т (триплетное), переход из KOTO
poro в 80 запрещен правилами отбора. За счет внутренней коле-
бательной энерrии или сообщенной извне тепловой энерrии ocy
ществляется перех.од в основное состояние с испусканием кванта
люминесценции.
Спонтанный и вынужденный типы излучения наиболее xa
рактерны для молекулярных систем и поэтому их называют мо-
лекулярной люминесценцией.
Рекомбинационная люминесценция наблюдается у rазов и
сложных неорrанических кристаллов в случае рекомбинации ра-
дикалов или ионов с образованием их возбужденных молекул.
Спектром люминесценции вещества называют зависимость
интенсивности люминесценции от длины волны (частоты) изме
ряемо1'О света. Спектр возбуждения люминесценции это зави-
симость интенсивности люминесценции от длины волны воз-
БУЖД81Ощеrо света.
Теоретически спектры возбуждения люминесценции молекул
должны быть идентичны по форме их спектрам поrлощения и
не зависеть от длины волны измерения флуоресценции. Однако
14. Заказ 3788
209,
чаще Bce1'o на практике эти спектры о'rличаются вследствие раз
личий физико химических свойств молекул в основном и воз
бужденном состояниях. Например, в возбужденном состоянии
Moryт изменяться rеометрические параметры, межатомные pac
стояни.я: и, следовательно, дипольные моменты молекул, степень
диссоциации последних. Для устранения кажущихся различий
между спектрами поrлощения и возбуждения необходимо соблю
дение следующих условий: а) одинаковой интенсивности возбуж
дающе1'О света во всем диапазоне частот; б) отсутствие вторично
ro ПО1'лощения исследуемо1'О излучения.
Форма спектра люминесценции (правило Каши) и квантовый
выход (закон Вавилова) не зависят от длины волны возбуждаю
щеrо света. Это обусловлено тем, что при ПО1'лощении больших
квантов возбуждающеro света происходит переход молекул из
O.cHoBHoro состояния 80 в возбужденные 82"' 8З-, однако излуча
'тельный переход осуществл.я:ется только из состояния 81' (люми
несценция), а переходы 82' ---+ S/, 8З- ---+ 8/ происходят безызлуча
тельно.
Соrласно правилу Стокса частоты возБУЖДaIOще1'О света Bce
1'да больше или равны частотам люминесценции: V.о.б>V. юм , т. е.
одна часть ПО1'лощаемой молекулой энер1'ИИ Идет на возбужде
ние люминесценции, а друrая расходуется на увеличение ее KO
лебательной энерrии и развитие безызлучательных переходов.
Однако cTporoe выполнение правила Сток са наблюдается у aTO
мов и простых молекул в rазовой фазе. Спектры поrлощения и
люминесценции молекул MOI'YТ перекрываться, Т.е. значения ча
стот переходов между электронными уровнями при поrлощении
Moryт быть меньше, чем при испускании. Следовательно, наблю
дается нарушение правила Стокса. Часть спектра люминесцен
ции, rде выполняется правило Стокса, называетс.я: стоксовой об
ластью, а 1'де оно нарушается антистоксовой. Поэтому это пра
вило характеризует одиноЧ:'Ный акт поrлощения и испускания
света молекулой.
В соответствии с законом Стокса ЛоммеJLЯ спектр излуче
ния и ero максимум всеrда сдвинуты по сравнению со спектром
ПО1'лощения и ero максимумом в сторону более длинных волн:
hv люм < hv доrл.
КD..ICC ыnш
Э-rот закон носит статистический характер и описывает по
rлощательные и излучательные свойства совокупности молекул
210
исследуемо1'О образца. Поэтому образование антистОКСОВОЙ об
ласт и спектра люминесценции не противоречит за.кону coxpa
нения энерrии: колебательная энерrия молекул частично пре
образуется в энерrию их люминесценции, что удовлетворяет yc
ловию: hv > hv .
ЛЮМ поrл
Закон Стокса Ломмеля явл-яется качественным выражени
ем правила зеркальной симметрии спектров поrлощения и лю
минесценции Левшина, :которое rласит: спектры поrлощения и
люминесценции зеркально симметричны относительно прямой,
проходящей перпендикулярно Ее оси частот (длин волн) через
точку пересечения спе.ктров.
Эффективность процесса превращени-я энер1'ИИ возбуждаю
щеrо света в энер1'ИЮ люминесценции характеризуется KBaHTO
вым выходом люминесценции. Это отношение числа высвечен
ных квантов люминесценции к числу поrлощенны:х квантов воз.
буждающеrо света.
Молекулы люминесцирующих веществ оптически аНИЗ0
тропны, поэтому люминесцентное излучение каждой молеку
лы частично поляризовано. Если анизотропные молекулы ори-
ентированы хаотично, то вещество в целом становится изо
тропным, а ero люминесценция неполяризованной. При воз-
буждении вещества линейно пол-яризованным светом e1'o по-
rлощение осуществляется молекулами, у которых ПOl'JIощаю
щий осциллятор параллелен электрическому вектору падаю
щеrо света. Поэтому поrлощение полностью oTcyтcTBye'r у МО,
лекул, поrлощающий осциллятор которых перпендикулярен
электрическому вектору возбуждающеrо света. В этом случае
измеряют поляризационные спектры флуоресценции зави-
симость степени поляризации флуоресценции объекта от дли
ны волны возбуждающеrо света (поляризационные спектры
по поrлощению) или длины волны ре1'истрации при фиксиро
ванной длине волны возбуждени-я (пол:яризационные спектры
по испусканию).
Для количественной оценки поляризованной люминесценции
используют степень поляризации (Р) люминесценции:
р == (I!l IJ/(I!l + 1),
rде I п и IJ. соотве1'ственно параллельна.я и перпендикулярная
электрическому вектору возбуждающе1'О света составляющие по
ляризоваНЕОЙ люминесценции.
14*
211
Степень анизотропии (r ) излучения определяется по форму
ле:
r == (l п 1.L)j(l п + 21.L)'
Использование этой характеристики для описания процессов
поляризованной люминесценции более корректно, так как учи
тывает третью составляющую, перпендикулярную электрическому
вектору возбуждающе1'О света (т.е. в знаменателе уравнения для
определения r находится величина, пропорциональная суммар-
ному значению интенсивности).
Связь междУ величинами Р и r отражает следующее уравне-
ние:
r == 2Р/(3 Р).
Анизотропия оптической среды проявляется: каЕ при испус-
кании, так и при ПО1'лощении света. Для характеристики ани-
зотропии поrлощения света используют степень дихроизма d:
d == (D п D.L)/(D Il + D},
1'де DIl и D.L оптические плотности, измеренные при облучении
исследУемоrо образца линейно поляризованным светом с коле
баниями электрическоrо вектора, параллельными и перпендику-
л.ярными 1'лавной оптической оси системы.
Перреном и Яблонским установлена связь междУ Степенью
поляризации (Р) флуоресценции и вязкостью среды (11):
l/P 1/3 == (l/P o 1/3)' ('tRT/Vll + 1),
rде РО предельное значение поляризации при T/ll ----? о; R
универсальная rазовая постоянная; Т абсолютная температу-
ра; V объем моля флуоресцирующих молекул; "с время жиз-
ни возбужденноrо состояния. Этой формулой пользуются для рас-
чета значений "С.
Варьируя уrол направления поляризации флуоресценции, ус-
танавливают нarrравление и степень ориентации молекул в ана-
лизируемом образце. Исследование поляризации флуоресценции
позволяет изучать МИrpацию энерrии в биосистемах, определять
размеры биомакромолекул и время жизни их. возбужденно1'О co
стояния. Поляризацию флуоресценции определяют для Toro, что-
бы судить о МИЕРОВЯЗКОСТИ мембраны.
Так, микровязкост:ь мембраны изучают путем измерения Р для
флуоресцентноro зонда, введ нноrо в исследуемую систему. Метод
флуоресцентных зондов подробно рассмотрен в разделе 6.4.
212
в целом флуоресцентный метод анализа один из безынер-
ционных, высокочувствительных методов исследования, приме-
няемых для качественно1'О и количественноrо анализа смесей ве-
ществ, изучения механизма фотофизических и фотохимических
процессов в биосистемах и конформационных свойств биомакро-
молекул.
Ин фр а к расн ая (ИК) сп ектроск о п ия занимается
анализом молекулярных спектров, так как в ИЕ-области спект-
ра (10 000 400 CM l) расположено большинство колебательных
и вращательных спектров молекул. В ИR диапазоне поrлощает
ся свет тех частот, которые равны частотам колебаний атомов в
молекуле. ИК спектр поrлощения, возникающий в результате по-
l'лощения ИК излучения при прохождении el'o через вещество,
состоит из большоrо числа полос, причем часть полос поrлоще
ния обусловлена колебаниями отдельных атомных rруппи:ровок,
более или менее сохраняющих свои свойства в разных молеку-
лах. Характеристики ИЕ-спектра (число полос ПО1'лощения, их
положение, определяемое частотой v или длиной волны Л, шири-
на и форма, интенсивность поrлощения в максимумах) определя
ются структурой и химическим составом поrлощающеrо веще-
ства и зависят от e1'o CTpYКTypHoro состояния, а также темпера-
туры, давления и друrих факторов. Метод ИЕ-спектроскопии
позволяет определять структуру молекул, их химический состав,
моменты инерции, величины сил, действующих между атомами
в молекуле, про водить качественный и количественный анализ
смесей различных веществ.
Сущность одноrо из видов метода ИК спектроскоnии ИК--ди
хроизма заключается в измерении разности поrлощения CBe
та, поляризованноrо вдоль оси ориентаци:и и перпендикул.я:рно
этой оси ориентации молекулы. С помощью измерения ИК-дих-
роизма можно установить, как направлены важнейшие rpуппы
белка (> С == О и NH) по отношению к оси ero макромолекулы.
Необходимыми для определения частотами пептидной связи бел
ков явл.я:ются следующие: 3330 CM- l дл.я: валентноrо колебания
NН-rруппы (колебание ядер вдоль линии связи между атомами в
молекуле), 1660 CM- l для валентноrо колебания >СО rpуппы и
1550 CM- l для деформационноrо колебания (колебания, обуслов-
ленные периодическими изменен:иями У1'ла межДУ связями от-
дельных атомов в молеI<уле ) NН-rруппы. Анализ смещеlfИЯ этих
полос поrлощения, изменения их ширины, формы, велич:ины по-
213
rлощения позволяет судить о состоянии вторичной структуры
белков и полипептидов.
Дисперсия оптическоrо вращения (оптической aK
тивности) зависимость уrла вращения (поворота) плоскости
поляризации света (с:р) или удельной оптической активности
(удельноrо вращения [а]) от ДЛИНЫ волны л. оптическоro излуче
ния, проходящеrо через среду:
q> == [а] 'с,
.rде 1 толщина слоя активноrо вещества или ero раствора; с
концентрация этоrо вещества.
IIOBOPOT плоскости поляризации В данной среде происходит
либо по часовой стрелке (q»O), либо против часовой стрелки (с:р<О),
если смотреть навстречу ХОДУ лучей. В связи с этим вещесТва,
проявляющие естественную оптическую активность, не вызыва
емую наличием внешних полей, разделяют на правовращающие
(положительно вращающие d, <р>0) и левовращающие (отри
цатеJj;ЬНО вращающие 1, <р<0). Ж. Вио (1815) установил, что в
случае чистых ЖИДкостей, растворов и паров мноrих орrаничес
ких веществ уrол вращения плоскости поляризации q> тем MeHЬ
ше, чем больше л. (q> л. 2). Такая дисперсия оптическоI'О враще
ния (ДОВ) хаРal терна для нормальной оптической плотности
вдали от Длин воЗIН л. о ' на которых в оптически активном веще
стве происходит резонансное поrлощение. Э. Коттон, изучавший
оптическую активность для излучений с Л, близкими к Л О (212 нм),
обнаружил аномальную оптическую активность увеличение q>
с ростом л.
IIри анализе оптической активности веществ, в том числе
белков и полипептидов, наиболее удобной величиной является
молярное вращение [М]).., связанное с удельным вращением [а])..
следующим уравнением:
[М]).. == [а).: Mjl00.
В качестве молекулярной массы М применяют среднюю Mac
су :м: аминокислотноrо остатка из числа остатков, составляющих
полипептидную цепь белковой макромолекулы. Кривые диспер
сии оптическоrо вращения и KpyroBoro дихроизма в области
эффекта Коттона, rде поrлощение обусловлено основной поли
пептидной цепью, отражают вторичную структуру белковых MO
лекул. Изучение и анализ кривых ДОВ и KpyroBoro дихроизма
для таких конформаций, .как а спираль, CTpYKTypa, неупорядо
214
ченная конформация, проводятся на основании результатов ис
следования синтетических полипептидов (полиrлутаминовой
кислоты или полили зина), а также по экспериментальным дaE
ным для белков, структура которых установлена методом peHT
reHocTpYKTypHoro анализа.
Круrовой дихроизм (эффект Кот тона) это разли
чие поrлощения для света правой и левой KpyroBbIx поляриза
ций. Эффект Коттона является одним из лучших современных
методов х.арактеристики природы спиральных конформаций и
оценки степени спиральности белковых молекул.
Мuкрокалорu.метрuft информативный метод исследования
термодинамических характеристик вещества, в частности, TeM
пературноrо хода теплоемкости. Современные чувствитеЛЬЕые
микрокалориметры используют для исследования фазовых пepe
ходов (определения изменений энтальп:ии и энтропии этих про
цессов) в водно липидных суспензиях с использованием неболь
ших (несколько Mr) количеств материала. Принцип метода диф
ференциальной сканирующей калориметрии состоит в измере
ЕИИ количества тепла, необходи:м:оI'О для увеличения температу
ры объекта на очень малую величину в пределах узкоrо TeMпepa
TypHoro интервала при постоянном давлении.
Для изучения фазовых. переходов при плавлении фосфоли
ПИДЕЫХ бислоев измеряют теплоемкость С суспензии фосфоли-
р
пидов при разных температурах в области фазовоrо перехода.
Показано, что в этой .области происходит резкое возрастаЕие зна-
чения С . Максиму:м: теплоемкости на кривой зависимости С от
р р
температуры соответствует температуре плавления. Площадь под
пиком на указаНЕОЙ кривой соответствует общему количеству
тепла, ПОI'лощаемому при переходе из твердо1'О состояния липид
EOro слоя в жидкое (фазовый переход). Для чистых липидов Be
личины изменения энтальпии и энтропии для перехода крис-
талл жидкий кристалл линейно зависят от длины уrлеводо
родных цепей. В целом те:м:пература плавления понижается в
рядУ: холины этаноламины серины. Типичные зависимос-
ти избыточной уДельной теплоемкости от температуры для ди
пальмитоилфосфатидилхолина имеют два максимума. Максимум
при более высокой температуре соответствует собственно пере
ходу при температуре ТП (температуре плавления), друrой xapaK
теризует так называемый предпереход, при котором происходит
трансформация одномерной ламелляр:е:ой решетки в двумерную,
215
образованную искаженными слоями липида и нарушенную пе
риодичеСRИМИ складками.
Водные дисперсии, содержащие два или более липидных KOM
понентов, проявляют rораздо более сложные термотропные свой
ства.
Метоо .мооелировон.uя и получения иС1Сусствеян.ых .ме.мб
ран. основан на получении и исслеДовании MOHO и бимолеку
лярных липидных слоев, везикул, липосом и протеолипосом.
Существует два основных типа искусственных мембран: клас
сические плоские и сферические мембраны различноrо разме
ра. Для получения искусственных мембран используют различ
ные фосфатиды, нейтральные rЛИЦериды, смеси липидов биоло
1'ическоrо происхождения, добавляя к ним холестерин, a TOKO
ферол и ДРУ1'ие минорные добавRИ. Потенциальная ценность
искусственных мембран для исследований зависит от возмож
ности включения в них природных белков, в особенности тех,
которые обладают транспортными свойствами. Липосом:ы, co
стоящие из белков и липидов, стали получать в 60 e rr.; термин
"протеолипосомы" был введен В. П. Скулачевым. В настоящее
время разработан целый ряд методов приrотовления различных
типов липосом и протеолипосом, а также их стандартизации по
размерам, структуре, rомоrенности, стабильности и друrим xa
рактеристикам. Липосомы используют для достаВRИ в клетку
лекарственных и химических соединений, стабилизации фер
ментов в инженерной энзимолоrии, введения в клеточные мем-
браны молекул зондов, модифицирующих и моделирующих их
поверхность. Большой интерес для rенной инженерии и меди
цины представляют работы по введению в клетки при помощи
липосом нуклеиновых RИСЛОТ и вирусов. В липосомы включа
ют митохондриальные компоненты и изучают на таких модель
ных системах процессы rенерации энерrии в клетках. Ультра
тонкие искусственные мембранные CTPYRTYPbl полислои Лен-
1'мюра Бложе (ПЛБ) применяют для получения био- и им
муносенсоров. Создаются ПЛБ с иммобилизованными фермен-
тами и компонентами иммунолоrических систем. При исполь
зовании смешанных липид-беЛКQВЫХ пленок ПЛБ получают
информацию о функционировании белков и о липид белковых
взаимодействиях в мембране. Результаты изучения физичес
ких характеристик, проводимости, проницаемости и друrих
свойств искусственных липидных мембран имеют большое зна
216
чение для понимания структурно-функциональной орrанизации
нативных БИОЛО1'ичес'Ких мембран.
Необходимо отметить, что для решения определенной науч-
ной задачи применяю'{' не один, а целый ряд методов, что позво
ляет скомпенсировать недостаТl<И и оrраничения каждоrо из них
за счет достоинств дру1'их методов. Так, например, для исследо-
вания белок липидных взаимодействий используют методы ЭПР,
ЯМР, измерения флуоресценции, комбинационноrо рассеяния, ик-
спектрофотометрии и др.
5.2. ВЫДЕЛЕНИЕ И Р А3ДЕЛЕНИЕ МЕМБРАН
Выделению мембран предшествует этап разрушения клеток
и тканей. Для этоrо подбирают методику, позволяющую не толь-
ко эффективно разрушать клетки, но и сохранять нативную струк-
туру мембран, подлежащих выделению. При выделении большин-
ства мембран животных клеток используют I'Oмоreнизацию в I'O-
моrенизаторах Даунса и Поттера со стеклянными стенками и теф-
лоновым пестиком. Для разрушения клеток применяют также
вращающиеся ножевые rомоrенизаторы. Предварительно свеже-
выделенную ткань измельчают и промывают водой. В I'Oмоrени-
заторе клетки разрушаются за счет СДВИ1'овых УСИЛИЙ, возника-
ющих при продавливании суспензии через узкий зазор между
тефлоновым пестиком и стеклянной стенкой. При rомоrениза-
ции следует тщательно подбирать значение рН, ИОннуlO силу и
состав буферноrо раствора. Часто в качестве суспендирующей
среды используют раствор сахарозы в концентрации 0,25 моль/л
с добавлением хлорида мarния, комnлексообразователей (напри-
мер, ЭДТА) , восстановителей (дитиотреитол, -меркаптоэтанол).
С целью облеrчения последующеrо разрушения растительных,
rрибных и бактериальных .клеток их сначала обрабатывают фер
ментами, расщепляющими компоненты 'Клеточной стенки (лизо-
цим, целлюлаза). Более жесткая обработка клеток предусматри
вает их растирание с помощью абразивных материалов (стеклян-
ных. шариков, песка, оксида алюминия), разрушение ультразву-
ком и путем экструзии (продавливание суспензии клеток через
отверстия под давлением). Полученный 1'OMoreHaT кле'l'ОК проце-
живают и используют дальше для получения мембран.
Чаще Bcero для разделения мембран применяют .метод цент-
рuфуzuроеанUJl. Мембранные частицЫ разделяют по скорости их
седиментации (зональное центрифуrирование) или по плавучей
217
плотности (изопикническое центрифуrирование). Коэффициент
седиментации (8) определяется по формуле:
8 =' vjw2r == т(1 Vp)jf,
1'де v скорость движения частицы; w уrловая скорость Bpa
щения ротора; r расстояние до центра вращения; m масса
часТИцы; f коэффициент трения; р плотность растворителя;
V парциальный удельный объем частицы (равный увеличе
нию объема, вызываемоrо прибавлением единицы массы paCTBO
ряемо1'О вещества к раствору).
Величина коэффициента седи:ментации зависит от несколь
ких факторов: концентрации раствора, скорости движения час
тиц, заряда, формы и массы частиц. Введено понятие CTaндapTHO
ro значения константы седи:ментации, опред ляемое в системе,
имеющей вязкость и плотность воды при +20 ос (8 o).
Для выделения различных :мембранных структур из rOMore
ната, имеющих разные величины коэффициента седиментации,
применяют зональное центрифуrирование в rрадиенте плотнос
ти определенных веществ. Исследуемый раствор наносят на пред
варительно ПРИ1'отовленный в центрифужной пробирке rради
ент плотности и центрифуrируют. I'pадиент создается путемпо
следовательноrо наслоения растворов rрадиентной среды YMeHЬ
шающейся концентрации (плотности) в центрифужной пробир
ке. Субклеточные структуры разделяются на отдельные зоны в
соответствии с их относительной плотностью. Для создания rpa"
диента плотности необхо о подбирать вещества в чистом co
стоянии, не взаимодействующие с компонентами суспензии и
реarентами исследуемоrо раствора. Чаще Bce1'o для ЭТО1'о исполь-
зуют сахарозу, однако ее растворы с высокой концентарцией
имеют большую вязкость, вследствие чеrо происходит деrидра-
тация орrанелл или их лизис. Кроме Toro, серьезным недостат-
ком ЭТО1'о метода является проницаемость МЕО1'их ОР1'анелл для
сахарозы, что вызывает их осмотическое разрушение и измене-
ние эффективной плотности. Поэтому в настоящее время для
создания rрадиента ПЛОТНОСТИ предпочитают применять друrие
среды: фиколл, перколл и др, (табл. 16).
Основные компоненты клетки осаждают в такой последова
тельности: целые клетки и их фраrменты, ядра, митохондрии,
лизосомы, микротельца, микросомы (фраrменты эндоплазмати
ческой сети и плазматических мембран), отдельные типы мемб-
ранных структур.
218
Таблица 16
Харщстерuстщса некоторых zpa(}ueJl.mHblX сре(} для вы(}елеltu.я
.мембраН-ltых компонентов .мето(}ом цен-трuфузuрован-uя
Кон- Плот- Вяз- Осмоляль
Среда Структура цeHT ность, кость, ность, Преимущества или
рация, r/мл сП мOcM/Rr неДОC'l'атки
% Н 2 О
Сахароза Дисахарид 20 1,06 30 700 rипертонические раство-
С '2 Н 2 Рll ры способны вызывать ли-
исорrанелл
ФИКОЛЛ fидро- 30 1,10 49 130 Низкое осмотичеСRое дaв
фильный ление позволяет создавать
полимер растворы, изотоничные во
(400 RДа) сем диапазоне Rонцент-
сахарозы раций блa.roдаря допол-
нительному в.ключению
r:a.харозы или солей. Вы-
оо:кая ВЛЗRQСТЬ растJlОрОВ и
нелинейн8Я за;висимость
ВSIЗROC'l'И И осмолярности
от Rонцентрации
Пер.колл Коллоид- 26 1,13 10 10 РаСТJlОрЫ имеют низкую
н8Я суспен- ВSIЗROC'l'Ь и осмолярн ОСТЬ,
зип сили- не проник!\Ют через мемб-
кareля, рану. Большой размер
частицы частиц при умеренных
KOTOporo скорOC'l'ЯХ оборота ело-
покрыты обствует формированию
поливн- rрадиента. ПЛОТИОС1'И и
нилпирро- быстрому разделению_
лндоном Среда разделения может
быть изотоничиой
блa.roдаря ВIслючению
сахарозы или солей
Необходимо отметить, что получаемые при разрушении кле
ток мембранные фраrменты способны самопроизвольно образо
вывать замкнутые пузырьки везикулы. К ним ОТНОСЯт мик
росомы, субмитохондриальные частицы из внутренней митохон-
дриальной мембраны, синаптосомы, образующиеся при отрыве
нервных окончаний в области синаптических контактов. CKO
рость оседания таких. частиц при центрифyrировании определя-
ется их размерами, зависящими от метода разрушения клеток и
состава среды. Для сохранения замкнутости мембранных opra
нелл используют среду, изоосмотичную их внутреннему содер-
жимому (сорбитол, маннитол, сахарозу).
, Следует подчеркнуть, что препаративные типы центрифуr при-
меняют для получения и очистки клеточных орrаиелл или Maкpo
молекул, т. е. чистых фракций (препаратов). Аналитические цент-
219
рифуrи П03ВОJIЯЮТ анализировать распределение веществ в про
бирке в течение вcero опыта. Поэтому они снабжены оптической
системой (mлиреновской, :и:втерференционной, абсорбционной).
Для выделения мембран из клеточных roMoreHaToB использу*
ют и друrие методы: хроматоrрафию, электрофорез, адсорбцию.
РаспреiJелuтеЛЫШJl ХрО.!ltаmоzрафия основана на различиях
в распределении разделяемых веществ между двумя фазами: под*
вижной (растворитель) и неподвижной (сорбент). Ее разновидно
стями являются хроматоrpафия на бумаrе, тонкослойная, коло
ночная, rазожидкостная. Большой разрешающей способностью
характеризуется тонкослойная хром:атоrрафия: она ПОЗВОJIяет об
наружить 1 нмоль вещества. Слой сорбента (толщина до 0,5 мм)
rотовится из с:и:ликаrеля, оксида алюминия, целлюлозы. При этом
обеспечивается низкое отношение массы pacTBopeHHo1'o вещества
к массе сорбента (до 1/108) и большое отношение поверхности к
объему. Разрешающая способность метода колоночной xpOMaTO
rрафии на несколько порядков ниже, чем для тонкослоЙной, так
как отношение массы растворенных веществ к массе сорбента
равно 1/50.
А(}сор(fЦUОН-1tая хро.!ltаm02рафuя основывается на различной
способности молекул смеси адсорбироваться на поверхности HO
сите.тr (силикаrель, окись алюминия, активированный уroль)
при пропускании через Hero подвижной фазы. Принцип метода
ионообменной хроматоrрафии разновидности адсорбционной
хроматоrрафии заключается в способности ионообменника (OT
рицательно заряженноrо катионита или положитеJIЬНО заряжен
Horo анионита) обратимо адсорбировать заряженные молекулы
при определенных значениях рН. Мембранные белки и уrлеводы
разделяют на ионнообменниках на основе целлюлозы, декстрана,
полиакриламида.
FельпРОlluтсающaJ{, хро.!ltаm02рафUJl успешно применяется для
разделения и очистки мембранных белков ферментов, так как
позволяет фракционировать вещества в широких диапазонах рН,
температуры, ионной силы без адсорбции на носителе молекул
разделяемых соединений. Метод основан на принципе обратноrо
молекулярноro сита: более крупные молекулы быстрее проходят
через слой мелких частиц носителя, а более мелкие (с диаметром
меньше или равным диаметру пор в частице) медленнее, так
как диффундируют через поры инертноrо материала. В качестве
молекулярных сит используют декстрановые, а1'арозные и поли
220
акриламидные rели. Преимущество этоrо метода заключается в
том, что он позволяет не только разделять, но и очищать и KOH
центрировать макромолекулы (например, при добавлении к ис
следуемому раствору сухих rpанул rеля с диаметром пор MeHЬ
ше, чем диаМетр молекул).
Для выделения различных мембранных структур использу
ется и аффUllНДЯ хро.матоzрафuя.. Принциn этоrо метода заклю
чается в способности выделяемоrо вещества специфически свя
зываться с ЛИrандом, "пришитым" к нерастворимому носителю,
при про пускании раствора через матрицу. В качестве последней
применяют сефарозы (аrарозные rели), активируемые путем свя
зывания различных ЛИ1'андов: кофакторов, инrибиторов, субстра
тов мембранных белков ферментов, лектинов в случае выделе
ния: rликопротеинов; 1'ормонов, бромциана, конканавалина А
соответственно при получении мембран, антител или целых Кле
ток. Элюирование исследуемоro вещества осуществляют в усло
виях диссоциации комплекса лиrанд вещество и сохранения
нативной структуры выделяемо1'О соединения.
Заряженные компоненты биомембран разделяют .lltетоао.м
электрофореsа по скорости их движения в электрическом поле,
которая зависит от величины заряда, молекулярной массы и фор
мы молекул. Максимальное разделение макромолекул (в частно
сти, мембранных белков) обеспечивается при использовании Me
тода диск электрофореза в полиакриламидном rеле (ПAAI'). Ero
название "диск" происходит от дискретноro напряжения элект
рическоrо поля, что обусловлено прерывис'l'ЫМ rpадиентом рН в
системе. Верхняя часть полимеризующе1'ОСЯ rеля: в стеклянной
вертикальной трубке, на которую наносится исследуемый обра
зец, имеет меньшую концентрацию, а нижняя часть (разделяю
щий rель) большую. За счет большо1'О размера пор верхних
слоев 1'ел.я и большоro rрадиента электрическоrо поля происхо
дит быстрое движение и накопление вещества на верхней rpани
це раздел.яющеl'О rеля, в котором в зависимости от подвижности
разделяемых белков образуются различные зоны, I<:OTOpble иден
тифицируют после удаления rеля из трубки. Для определения
молекулярной массы мембранных белков используют SDS
ПААr электрофорез с применением додецилсульфата натрия
(ДСН, SDS), связываЮЩеrося с белком и вызываЮЩе1'О ero диссо
циацию. Подвижность белка в комплексе с ДСН будет опреде
'Ляться только молекулярной массой биополимера, а заряд дo
221
децилсульфатом (при постоянстве количества связываемоro лю
боrо типа белка додецилсульфатом: 1,4 1,5 r дсн на 1 r белка).
Количественные измерения проводят оптическим методом с ис
пользованием денситометра.
Разновидность электрофореза изоэлектрическое фокуси
рование. Метод основан на электрофоретическом разделении сме-
си белков в rрадиенте рН с достижением изоэлеК'l'рической точ
ки (ИЭТ) каждоrо белка и ero "фокусированием" в отдельной
зоне и применяется для быстроrо и эффективноrо фракциониро-
вания больших количеств (несколько rpaMMoB) образца на на-
чальных стадиях ero очистки.
5.3. ОЦЕНКА ЧИСТОТЫ МЕМБРАННЫХ ФРАКЦИЙ
Наиболее часто для оценки чистоты выделенных мембран
ных фракций используют методы исследования удельной актив
ности ферментов, называемых маркерами. Маркерные ферменты
должны быть локализованы в определенном типе мембранных
структур и катализировать реакции, соответствующие специфи
ческим функциям этих мембран. Ероме TOro, фермент можно
использовать как маркер, если он прочно связан с мембраной и
не подверrается активации или инrибированию при разделении
мембранных фракций (табл. 17). Активность маркерных фермен
Таблица 17
Биохu.мultеСJCuе .маркеры,
uспользуе.мые ОЛJl контроЛJl 'щстоты .ме.мбранных фракций
Мембранная фракция МаРRерный фермент
ПлазматичеСRие мембраны 5"НУRлеотидаза (КФ 3.1.3.5)
Щелочная фосфатаза (КФ 3.1.3.1)
АденилатциклаЗIl (КФ 4.6.1.1)
Na+, K+-АТФаза (КФ 3.6.1.3)
Ядра NAD-ЛИРОфОСфОРИЛ8за (КФ 2.7.7.1)
ЭндоллазматичеСRая сеть rЛЮRозо-6-фосфатаза (КФ 3.1.3.10)
Мик})осомы NADрН.деrидроreназа (КФ 1.2.1.16)
Пероксисомы Каталаза (КФ 1.11.1.6)
Лизосомы Кислая РНКаза (КФ 3.1.4.8)
Кислая фосфатаза (КФ 3.1.3.2)
Саркоплазматическнй ретику лум Са 2 +АТФаза (КФ 3.6.3.з)
Мптохондрии:
наружная мембрана МоноаМИНООll:сидаза (КФ 1.4.3.4)
внутрення:я: мембран Цитохромоксидаза (КФ 1.9.з.1)
Цптохром-с-редуктаза (КФ 1.6.9.3)
Цитозоль Лактатдеrндроreназа (КФ 1.1.1.27)
222
тов контролирую'r на каждом этапе выделения и разделения
мембран в исходном rOMoreHaTe и в каждой фракции с целью
определения стадии осаждения и выхода исследуемых мембран
ных структур, а также потерь мембранных фракций. rOMoreH
ность выделенноrо препарата мембран анализируют на OCHOBa
нии увеличения активности MapKepHoro фермента ( OB) в нем по
сравнению с исходным 1'OMoreHaToM клеток. Часто используют
не один, а два три мембранных маркера. Однако необходимо по
мнить, что и мембраны одноrо типа способны проявлять 1'eTepo
reHHocTb, связанную с асимметрией белковоrо, липидноrо и уrле
водноrо состава мембран, в результате чеrо фермент может Haxo
диться в латентной форме из за нарушения ориентации мембра
ны инедоступности активноrо центра для субстрата, например, в
обращенных мембранных везикулах. Наиболее леrко из внутри
клеточных орrанелл идентифицируют митохондрии и ядра, за
тем лизосомы и пероксисомы, наиболее трудно плазмати
ческие мембраны и мембраны эндоплазматической сети. Слож
ность разделения последних обусловлена близостью величин ди
апазона плотностей этих структур, поэтому разделение по CKOpO
сти седиментации осуществляется в 'l'OM случае, если плазмати
ческие мембраны представлены крупными фраrментами.
С целью преодоления недостатков вышеуказанноrо метода для
оценки чистоты мембранных фракций удобнее использовать не
ферменты, а специфические рецепторы лектинов, ropMoHoB, aH
тител. В том случае, если мембрана имеет четкие морфолоrичес
кие признаки, в качестве критерия применяют метод ЭЛeI<ТРОН
ной микроскопии. Если хорошо изучен химический состав опре
деленноrо типа мембран, то для контроля чистоты мембранных
структур используют анализ белковоI'О и липидноrо состава (Ha
пример, методом электрофореза в ПAAI' в присутствии ДСН или
путем определения содержания холестерина).
5.4. ВЫДЕЛЕНИЕ .и ОЧИСТКА МЕМБРАННЫХ БЕЛКОВ
Исследование структурно фу:нкциональноrо состояния мемб
ранных белков осуществляют после проведения двух важнейших
этапов:
выделения и очистки определенноrо белка;
анализа полученной фракции для определения ее чистоты
и исследования структуры чистоrо компонента.
223
в разделе 5.2. были охарактеризованы методы выделения MeM
бранных структур, которые широко используются и для получе
ния мембранных белков. Поэтому остановимся на некоторых воп
росах, касающихся очистки интеrральных мембранных белков с
применением детерrентов.
Детерrенты это rруппа а:м:фифильных соединений, KOTO
рые способны связываться с rидРофобными участками мембран
ных белков, контактирующими с липидной фазой мембран, тем
самым разрушая ее структуру. В ходе солюбилизации мембран
детерrентами последние модифицируют бислой липидов, разрых
ляя ero, затем образуют смешанные (белок липид детерrентные)
мицеллы, а в конечном итоrе детерrент белковые и лиnид
детерrентные мицеллы. Для сохранения мембранных белков в
растворимом состоянии необходимо постоянное присутствие дe
TepreHTa. Ero удаление приводит к аrреrации и последующему
осаждению молекул белка.
Основной проблемой очистки белков является подбор дe
TepreHTa и оптимальных условий солюбилизации их молекул.
Детерrент не должен нарушать высшие типы пространствен
ной орrанизации белков, а лишь замещать молекулы липидов,
контактирующие с rидрофобными участками белковой rлобу
лы. Критерий максимальной солюбилизации белка переход
ero молекул в надосадочную жидкость после осаждения мемб
ран. Причем важным требованием процедуры солюбилизации
является сохранение функциональной активности биополиме
ра и ero стабилизация. Для это1'О в исследуемую систему дo
бавляют экзоrенные фосфолипиды, rлицерин, инrибиторы про
теаз. Следует отметить, что получаемые при очистке белок
детерrентные комплексы Moryт содержать значительные KO
личества связанных фосфолипидов, что необходимо учитывать
при дальнейшем разделении и характеристике получаемоrо
препарата белка.
При выборе детерrента необходимо учитывать:
1) критическую концентрацию мицеллообразования и размер
мицелл детерrента;
2) заряд детерrента;
3) возможность осаждения при определенном значении рН;
4) возможность светопоrлощения в диапазоне длин волн, ис-
пользуемом при определении концентрации белка оптическим
методом (при 280 нм).
224
Если концентрация детерrента превышает критическую
концентрацию мицеллообразования, то детер1'ен'l' полностью
солюбилизирует мембранные структуры. В противоположном
случае (концентрация меньше !{:КМ) детерrент :модифицирует
мембрану, не разрушая полностью ЛИПИДFIЫЙ бислой. Кроме
Toro, необходимо учитывать зависимость этоrо параметра от
температуры и ионной силы среды. Детерrенты с низкой КЕМ,
образующие крупные мицеллы, вследствие низкой KOHцeHT
рации мономеров не способны полностью удаляться при диа
лизе или ультрафильтрации, что может привести к дeHaTypa
ции белка при накоплении молекул детер1'ента. Поэтому удоб
нее пользоваться детерrентами с высокими значениями :К:КМ
(цвиттерионные детерrенты, соли желчных кислот, ОI<тилrлю
козид). Еще одной характеристикой детерrента является ero
аrреrационное число. Это количество молекул, входящих в
состав одной мицеллы. Детерrенты с высоким аrреrационным
числом образуют выраженные :мицеллярные структуры, KO
торые внедряются в липидный бислой и солюбилизируют ero.
Детер1'енты с низким аrреrационным числом не способны
образовывать собственные мицеллы и лишь встраиваются в
бислой липидов.
Выбор детерrента для выделения и очистки определенноrо
мембранно1'О белка осуществляется методом проб и ошибок, oд
нако исследователи стремятся к использованию минимальных
концентраций детерrента с целью сохранения нативно1'О CTPYK
турно функциональноrо состояния изучаемоrо белка. Наиболее
эффеr<тивными считают неионные детерrенты (тритон X lOO, OK
тилrлюкозид), соли желчных кислот (холат, дезоксихолат), цвит
терионные де'I'ер1'ентЫ.
На рис. 60 приведены структурные формулы, а в табл. 18
описаны свойства некоторых детерrентов, используемых дЛЯ BЫ
деления и очистки мембранных белков. Необходимо отметить,
что свойства растворов солей желчных l<ИСЛОТ существенно за
висят от температуры, рН, ионной силы. Эти соединения способ
ны к образованию 1'елей при сдвиrе рН на единицу выше рЕа
(для холата 5,2, для дезоксихолата 6,2).
15. Заказ 3788
225
Додецилсульфат натрия
О
11
'V'V'VVVO S O Na +
11
О
Холат натрия
О
НО 11
. C'01<a'
НО ОН
Сульфобетаины
(Цвиперrенты)
СНз О
1 11
N+ S",,()
I 11
СНз О
f) D Октилrлюкозид
СН 2 ОН
VVVVO
ОН ОН
Дезоксихолат натрия
О
11
. C'O.Na'
НО
Лаурилдиметиламиноксид
(Додецилам ин N о ксид)
СНз
1
N+ O
I
СНз
Эфиры жирных кислот полиоксиэтиленсорбитана
(Сх сорбитан Еп) серии Твин
О (ОСН 2 СН 2 )с ОН
11 I 9
A/V'VV'V С (ОСН2СН2)W""О СНт-СН I(OCH2CH2)y OH
(OCH2CH2), OH
n=w+x+y+z
Полиоксиэтилен пара трет октилфенолы (TpeT Ce eJ Еп):
Тритон X 100, n = 9 10
ТритонХ 114, п=7 8 .1. 1
Нонидет Р-40, n = 9 (ОСН2СН2)П ОН
Рис. 60. Структурные формулы HeKO'l'OpbIX детерrентов, используе
МЫХ Е мембранолоrии
226
Таблица 18
Свойства некоторых iJeтepzellll108
ККМ, Молеку- Размер Arpera- У дельный
Детерreн'I'Ы ля:рная ЦИОllное объем,
ММОJIЬ/Л масса мицеJIЛ число мл/r
Додецилсульфа1' натрия 1,33 288 24500 85 0,864
(анионный AeTepreHT)
Холат на1'рИЯ 3 408 2100 5 0,778
(0,15 ммоль/л NaCl, 20 'С,
рН 9,0)
ДеЗОКСИХОJIа'l' натрия 0,91 392 2300 55 0,771
(0,15 ммоль/л NaCJ, 20 'С,
рН 9,0)
Тритон Х-100 0,24 628 90000 1'10 0,908
(незаряженный детерrето)*
Твин 80 0,012 1300 76000 60 0,896
(незаря:жеНllЫЙ детерrент)*
[3-D-ОКТилrJJlОКОЗИД 25 293 8000 27 0,820
(незаряж.енный. детерrент)
ЛаурилдиметилщvIИНОКСИД 2,2 229 17000 75 1,112
(ЦВИ'l'теРИОНllЫЙ детерreит)
Цвнттерrент 3 12 3,6 335 0,957
(цвиттериоиный детерrент)
* Полидисперсная смесь, приБедены средние ЗНllчения.
5.5. ВЫДЕЛЕНИЕ И фр AIСЦИОНИРОВАIIИЕ
ЛИПИДОВ МЕМБРАН
Выделение липидов мембран осуществляют сразу после по
лучения мембранной фракции, которую необходимо защищать
от деЙствия ПрО'l'ео и липолитических ферментов, аБтоокисле
ния. Обычно все процедуры проводят при низкой температуре,
поддерживая определенные значения рН и ионноЙ силы. Для
экстракции липидов используют смесь хлороформ метанол. Для
одновременной экстракции белков и ЛИПИДОБ из теней эритро
цитов их экстраrирую'r смесью БY'I'анол вода. При этом боль
шая часть белков переходит в водный, а липида в бутаноль
ный слой.
Дальнейший анализ липидов ПрОБОДЯТ методами rидролиза
и количественноrо определения компонеитов сложных смесеЙ фос-
фолипидов. В результате избирательноrо rидролиза липидов MeM
бран образуются продукты, которые можно разделить по поляр-
ности или по остающимся неполярным 1'руппам. Описаны раз
личные способы щелочноrо или кислотноrо rидролиза мембран-
ных липидов. При использовании ферментативноrо rидролиза
15'<
227
(например, с помощью фосфолипаз) расщепляются только cTporo
определенные связи при сохранении всех остальных,
:Количественный анализ сложных смесей фосфолипидов про
водят хроматоrрафически:ми методами. Для препаративных цe
лей в основном используют хромаТО1'рафию на колонках. Для
микроаналитических исследований успешно применяют TOHKO
слойную хромато, rpафию с помощью которой можно разделить
практически все классы липидов, локализовать и идентифици
ровать их при использовании специальных реактивов.
Для тонкослойной хромаТО1'рафии липидов применяют слои
мелкозернистоrо силикаrеля (силикаrель Н). ДЛЯ аналитических
целей используют слой сорбента толr:u;иной 0,25 мм, для препара
тивных 0,5 мм. Размер стеклянной пластинки для разделения
чаще Bce1'O 20х20 см. Для разделения различных классов JIИ
пидов используют разные системы растворителей. Например, по
лярные ФQСФОЛИПИДЫ и rликосфинrолипиды разделяют в смеси
хлороформ метанол, содержащей аммиак или разведенную YK
сусную кислоту. Элюирующая способность смесей растворителей
определяется полярностью ее составных компонентов.
По элюирующей способности растворители распола1'аются в
следующем возрастающем порядке: петролейный эфир, цикло
reKcaH, четыреххлористый уrлерод, толуол, бензол, хлороформ,
диэтиловый эфир, этилацетат, ацетон, н пропанол, этанол, Meтa
нол, вода. После пропускания растворителей пластинку высуши
вают на воздухе и идентифицируют липиды с помощью окраши
вания специфическими реаrентами. Для количественноrо опре
деле ия фосфолипидов, разделенных тонкослойной xpoMaTorpa
фией, используют спектрофотометрические методы.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. КaRие методы исследования биомембран относят к биохимичес-
ким?
2. КЭЕовы особенности биофизических методов изучения биомемб-
ран?
3. Дайте хаРaRтеристику оптических методов исследованил биомем-
бран.
4. Охарактеризуйте основные этапы выделения и разделения био-
мембран.
5. КaRие методы используют для выделения мембран из rOMoreHa-
тов клеток и тканей?
228
6. Какие I<ритерии применяют для оценки чистоты мембранных
фракций?
7, Какие требования предъявляют к маркерным ферментам? На-
зовите маркерные ферменты различных мембранных структур клетки.
8. С какой целью в мембранолоrии применяют детерrенты? Что
они представлНIОТ собой, каковы их свойства?
9. Почему критическую концентрацию мицеллообразования счита-
ют важной характеристикой детерrентов?
10_ Опишите принципы, класси:фикациIO и области применения Me
тодов хроматоrрафии и электрофореза для исследования биомембран.
11. Охарактеризуйте стадии выделения, разделения и количествен-
HOro определения липидноrо состава мембран.
12. Какова физическая природа ЛIOми:несценции?
fла:ва 6
ИССЛЕДОВАНИЕ CTPYKTYPHO
ФУНКЦИОНАЛЬНОfО СОСТОЯНИЯ
ОТДЕЛЬНЫХ КОМПОНЕНТОВ БИОМЕМБРАН В
НОРМЕ И ПРИ ВО3ДЕЙСТВИИ РА3ЛИЧНЫХ
ФИ3ИКО ХИМИЧЕСКИХ ФАКТОРОВ
6.1. ВЫДЕЛЕНИЕ ЭРИТРОЦИТАРНЫХ МЕМБРАН
Удобной моделью для изучения ctpyktypho-функциональны1x
модификаций биомембран, индуцированных воздействием цело
ro ряда физико химических ментов, являются эритроцитарные
мембраны и клетки, что обусловлено следующими причинами:
однородностью мембранно1'О препарата, леrкостью e1'o по
лучения с сохранением нативных свойств;
выполнением эритроцитарными мембранами различных
функций: барьерной, транспортной, рецепторной, механической,
метаболической и др.;
наличием в эритроцитарных мембранах и клетках фер
ментных систем, реrулирующих энерrетические, ОIшслительные
процессы, транспорт ионов, пероксидное окисление ЛИIIИДОВ; 1'e
нерирующих и утилизирующих активные формы кислорода.
Тени эритроцитов, полученные путем rипоосмотическо1'О re
молиза и отмытые от rемоrлобина в изотоническом буфере, co
держат около 50 % белков, 43 % липидов и 7 % уrлеводов.
Белковые компоненты мембраны были идентифицированы Me
тодом электрофореза в п r в присутствии додецилсульфата
натрия. В соответствии с локализацией их подразделяют на пе
риферические и интеrральные (см. 1'лаву 1). Периферические
белки расположены на поверхности мембраны и им соответству-
ют полипептидные полосы 1, 2, 4, 5 и 6, Интеrральные белки
поrpужены Б липидный бислой и в некоторых случаях пронизы
вают ero. Основным интеrральным белком является белок по
лосы 3, осуществляющий транспорт анионов через мембрану. Ero
N конец находится с цитоплазматической стороны, а C KOHeц
поrружен в бислой с наружной стороны мембраны. Перифери
ческие белки взаимодействуют друr с дрУ1'ом, образуя двумерный
каркас, выстилающий внутреннюю поверхность эритроцитарной
мембраны, который называют мембранным скелетом. Он coдep
230
жит около 50 % общеrо количества белков эритроцитарной MeM
браны. Ero основными компонентами являются спектрин (поло
сы 1 и 2), актин (полоса 5), а также белки полосы 4.1. и 4.9.
(см. раздел 1.2.1). Считают, что актин спектриновая сеть с помо-
щью якорноrо белка анкирина связана с фосфолипидным мат-
риксом через цитоплазматический участок белка полосы 3.
Липиды в мембранах эритроцитов находятся почти исклю
чительно в форме бислоя. По данным ЯМР, в эритроцитах чело
века таких липидов не менее 97 %. Вязкость ЛИПИДНО1'о бислоя
мембран эритроцитов выше, чем для дрyrих мембран. Это обус-
ловлено высоким содержанием в них холестерина. В табл, 2 4
"Приложения" дана подробная количественная характеристика
состава липидов и фосфолипидов мембран эритроцитов млеко
питающих, а также жирнокислотноrо состава фосфолипидов в
эритроцитах человека и быка.
Лабораторн.ая работа .м 1
Выделение эритроцитариых мембран из I рОВИ доноров
Материалы и оборуiJованuе: кровь доноров с антикоаrулян-
том, хлорид натрия, трисrидроксиметиламинометан (трис), соля
ная кислота, этилендиаминтетраацетат (ЭДТА), центрифужные
upобирки, центрифужные весы, центрифуrа MPW 360, центри
фуrа ЦЛР-1.У 4.2, pH-метр, пастеровские пипетки, фильтроваль
ная бума1'а.
Ход работы
Кровь с антикоаryлянтом (3,8 % ный раствор цитрата на-
трия в соотношении кровь: цитрат 9:1) необходимо центри
фуrировать при 3000 об/мин на центрифyrе MPW 360 в течение
10 мин. Плазму и верхний слой лейкоцитов аккуратно отобрать
пастеровской пипеткой и удалить. Эритроциты три раза промыть
охлажденным раствором, содержащим 0,145 моль/л NaCl в
0,02 моль/л трис НСl буфере (рН 7,6 при 20 'С), каждый раз осаж
дая клетки в том же режиме (при 3000 об/мин в течение 10 мин).
Мембраны эритроцитов J:юлучают с помощью rипоосмотическо1'О
rемолиза их раствором, содержащим 10 ммоль/л ЭДТА в
10 ммоль/л трис НСl буфере (рН 7,6 при 20 'С). ДЛЯ ЭТО1'о один
объем отмытых эритроцитов быстро и энер1'ИЧНО перемешать с
20 объемами охлажденной до +4 'С 1'емолизирующей среды и
выдержать при этой температуре в течение 15 мин. rемолизат
231
цеНТРиФУ1'ировать на центрифуrе ЦЛР l У4.2 при 18000 об/мин
в течение 15 мин. Надосадочиую жидкость удалить, а осадок
мембран про мыть три раза 20 объемами 10 ммоль/л трис НСl
буфера (рН 7,6 при 20 ОС), каждый раз осаждая мембраны в том
же режиме.
В экспериментах использовать свежеприrотовленную суспен
зию мембран.
Препараты мембран эритроцитов можно получить с помощью
метода молекулярноrо сита. Для этоrо применяют rель хрома
тоrрафию на сефарозе 4В ("Pharmacia", Швеция). Сефароза 4 В
представляет собой rель а1'арозы, которая поставляется в набух
тем состоянии. Преимущество этоrо 1'еля по сравнению с друrи
ми носителями для хроматоrpафии З3Елючается в ero способнос
ти разделять комплексы биополимеров, полисахариды, мембра
ныI и фрarменты клеток. Для эффективно1'О отделения rемоrло
бина от мембран необходимо лизировать эритроциты не менее,
чем двумя объемами буфера. V станов лены оптимальные усло
вия для разделения на сефарозе 4В: 4 ммоль/л фосфатный буфер
(рН 7,5). На колонку размером 1,5x5,1 см МОЖЕ:О наносить до
1 мл rемолизата (rемолизат должен быть приrотовлен из расчета
1 объем эритроцитов: 1 объем rемолизирующей среды), при
этом выход мембран составляет до 1 мл. Методом электрофоре-
за в ПАAr в присутствии додецилсульфата натрия показано, что
мембраны, выделенные rель хромаТО1'рафией, содержат тот же
набор белков, что и мембраны, полученные методом промывания
и цеНТРиФУ1'ирования.
Лабораторная работа .м 2
Определение концентрации белка плазматических мембран
по методу Лоури
При выделении препарата мембран оценивают количествен
ный выход белка. Метод Лоури (1951) наиболее распростра
ненный и высокочувствительный метод определения KOHцeH
трации белка, основанный на измерении интенсивности OK
раски раствора, зависящей от концентрации белка. Принцип
метода заключается в том, что при взаимодейс'l'ВИИ белка с
реактивами, используемыми в определении, осуществляются
по меньшей мере две цветные реакции на белок. Одна из них
биуретовая реакция между пептидными 1'руппами и ионами
меди. Возникающая сине фиолетовая окраска обусловлена об
232
разованием КОМПЛeI СНО1'О соединения биуреТОБоrо MeДHO
ro комплекса:
O
I
С== NH
HN/ О
"6 == NH ,)'
Си
O
I
HN ==С
i/ о " NH
, HN == 6/
Такое комплексное соединение претерпевает в щелочной cpe
де енолизацию по схеме:
О Н О
11 1 11
H 2 N С N С NH 4 <=> HN"'" С NH.:... С "'" NH
1 I
ОН ОН
Две молекулы диенольной формы биурета взаимодействуют с
I'Идроксидо:м: меди (П) и образуют комплексное соединение, в I<:O
тором координационные связи образованы за счет электронных
пар атомов азота -иминных rрупп:
R/I
I
СН С N
/ I / ......CHR",
N............... О I
11 I с.....он
C O Cu 11
R'H( /
N CHR//1
11 '-.
к- С ОН в цепь
в цепь
ТЭЕие медные комплексы обладают преимущественно фиоле
товой и синей окраской.
Вторая реакция это реакция реактива Фолина с ТИрОЗИНо
выми И цистеиновыми радикалами молекулы белка. Это реак-
ция восстановления ?меси фосфорно вольфрамовой и фосфорно-
молибденовой кисло'):' (реактив Фолина) с образованием комп
лексноrо соединения синеrо цвета. Полarают, что в реакции вос-
становления принимают участие комплексные соединения меди,
возникающие при взаимодействии белка со щелочным paCTBO
ром сульфата меди. Эта реакция не очень специфична, но BЫCO
233
кочувствительна. Преимущества метода Лоури состоит в возмож-
ности определения белка в сильно разбавленных растворах (де-
сятки мкr).
Материалы и оборуiJованuе: вольфрамат натрия Na 2 WO 4'2НР,
молибдат натрия Na 2 Mo0 4 '2H 2 0, 80 % ная фосфорная кислота,
концентрированная соляная кислота, сульфат лития, бром, rид-
роксид натрия, карбонат натрия, тартрат натрия, сульфат меди,
бычий сывороточный альбумин, суспензия мембран, фотоэлект
роколориметр КФК-3 или спектрофотометр СФ-46 , стеклянные
кюветы для В:ФВ:, стеклянные пробирки, пипетки, фильтроваль-
ная бумarа.
ХОД работы
Реактив Фол ина 1'отовят следующим образом: 100 l' вольфра
мата натрия и 25 r молибдата натрия растворяют в 700 мл воды
В круrлодонной колбе на 1 л, снабженной пришлифованным хо-
лодильником Либиха. Прибавляют 50 мл 80 % -ной фосфорной
кислоты и 100 мл концентрированной соляной кислоты. Поме
щают в колбу несколько капилляров. Смесь кипятят в колбе с
обратным холодильником в течение 10 ч. Далее прибавляют
150 r сульфата лития, 50 мл воды И несколько капель брома. Для
удаления избытка брома кипятят содержимое колбы в течение
15 мин без обратноrо холодильника под ТЯ1'ой. Раствор охлажда
ют, доводят водой до 1 л и IIропускают через стеклянный фильтр.
Реактив Фолина хранят в химической посуде из TeMHoro стекла.
На всех этапах приrотовления реактива цвет реакционной смеси
должен быть желтым. Реактив Фолина титруют 1 н раствором
щелочи и на основании полученных данных рассчитывают ero
кислотность. Перед использованием реактив Фолина разбавля-
ют водой до кислотности, соответствующей 1 н раствору соляной
кислоты.
Далее 1'отовят рабочий раствор: в цилиндр на 100 мл налива
ют 50 мл 2 % Ho1'o раствора Nа 2 СО з , в отдельную пробирку
0,5 мл 2 % Horo тартрата натрия и 0,5 мл 1 %-Horo сульфата
меди. Содержимое пробирки выливают в ЦИлиндр и образовав-
mейся смесью ополаскивают проб ирку и опять выливают в ци
л:индр. Смесь перемешивают и оставляют на 10 мин.
В проб ирки разливают по 0,1 мл суспензии мембран, затем
по 0,1 мл 0,4 н раствора NaOH (пробирки можно HarpeTb для
лучmеrо Itастворения белка). Добавляют бидистиллированную
234
воду до 0,4 мл. Смешивают с 2 мл рабочеrо раствора, перемеши
вают содержимое пробирок и оставляют при комнатной темпе
ратуре на 10 мин. Затем добавляют 0,2 мл реактива Фолина,
перемешивают и оставляют на 30 40 мин для развития OKpac
ки. Измеряют оптическую плотность растворов при длине волны
750 нм на спектрофотометре или фотоэлектроколориметре. Co
держание белка в пробах определяют по калибровочному 1'рафи
ку, построенному с использованием бычье1'О СЫВОРОТОЧНО1'о аль
бумина. Для этоrо rотовят серию paC'I'BOpOB белка с содержанием
от 20 до 400 MKr в 1 мл. Определение ведут так же, как и для
опытных растворов (см. выше), количество повторностей для
каждой концентрации белка не менее 5. Строят калибровоч
ный rрафик, откладывая по оси абсцисс содержание белка в про
бе, а по оси ординат ее оптическую плотность при 750 нм.
Лабораmорн.ая рабоmа .м 3
IСоличественное определение белка по биуретопой реаКЦИИ
Материалы и 060руiJование: сульфат меди, rидроксид натрия,
хлорид натрия, тартрат натрия-калия, йодид калия, бычий CЫBO
роточ:ный альбумин, суспензия мембран, фотоэлектроколориметр
В:ФК 3 или спектрофотометр СФ 46, стеклянные кюветы дЛЯ КФК,
стеклянные пробирки, пипетки, фильтровальная бумаrа.
Ход работы
Для приrотовления биуретово1'О реактива в мерную посуду
на 250 мл вносят 0,375 r сульфата меди; 1,5 r тартрата натрия-
калия и растворяют в 150 мл воды. При энерrичном перемеши
вании добавляют 75 мл 10 % Horo раствора NaOH и 1 r йодида
калия и доводят содержимое до 250 мл водой. Реактив хранят в
полиэтиленовом сосуде, покрытом изнутри парафином, так как
он не подлежит длительному хранению.
В пробирки помещают по 0,2 мл исследуемоrо раствора, со-
держащеrо белок, доводят бидистиллированной водой до 1 ил,
добавляют 4 мл биуретовоrо реактива и перемешивают. В конт-
рольную пробирку вместо белка наливают воду. Через 30 мин
измеряют оптическую плотность проб (разви!3ается сине-фиоле-
товое окрашивание за счет пептидных связей) при длинах волн
540 650 нм против контроля (для более точноrо определения
зареrистрировать спектр поrлощения проб и выявить л'mnx про
тив контрольноrо раствора).
235
Содержимое белка в пробах определяют по калибровочному
rрафику с использованием бычье1'О сывороточноrо альбумина.
Стандартные растворы бычьеrо сывороточноro альбумина долж
ны содержать от 1 до 10 Mr белка в 1 мл 1 % Horo раствора хло
рида натрия. Определение ведут так же, как в случае опытных
проб.
6.2. ИССЛЕДОВАНИЕ ФУНКЦИОНАЛЬНОЙ
АI'ТИВНОСТИ МЕМБР АНОСВЯЗАННЫХ ФЕРМЕНТОВ
В НОРМЕ И ПРИ ВОЗДЕЙСТВИИ
ФИЗИКО-ХИМИЧЕСКИХ ФАКТОРОВ
Для исследования отдельных свойств нативных мембран Кле
ток, а также для изучения молекулярных механизмов реrулиро
вания метаболических процессов, осуществляющихся с участи
ем мембранных компонентов клетки, используются различные
физико химические методы модификации мембран.
Химические способы модификации мембранных структур свя
заны с использованием естественных и синтетических соедине
ний. в: rруппе естественных модифицирующих areHToB, изменя
ющих липидный состав мембран в нативной клетке, относятся
липидпереносящие белки, ферменты обмена фосфолипидов
фосфолипазы, диметилазы, системы обмена холестерина. Они
реrулируют микровязкость и подвижность мембранных компо
нентов, которые являются важнейшими факторами поддержа
ния нормальной структурно функциональной орrанизации и обес
печения взаимодействия мембран.
Синтетические БИОЛО1'ически активные вещества используют
для индукции проницаемости природных и искусственных MeM
бран. К ним относятся ионофоры (валиномицин, обеспечиваю
щий проникновение ионов калия через мембрану; крауны MaK
роциклические полиэфиры, обеспечивающие проницаемость MeM
бран для ионов натрия, кальция, маrния) и каналообразователи
(например, аламетицин, способствующий проникновению через
мембрану АТР).
К физическим методам модификации липидных и белковых
компонентов биомембран относят ионизирующее и УФ излуче
ние, температуру.
236
Лабораторuал работа .м 11
Определение функциональной активности
ацетил:холипэстеразы эритроцитарпы:х мембран
Метод Хестрина основан на колориметричеСI<ОМ определении
ко:нцентрации ацетилхолина. Ero чувс'rвительность составляет
5 мк!' ацетилхолипа. Ошибка определения :J::1 %. Достоинство это-
ro метода при определении а:ктивнос'rи АХЭ состоит в том, что
011 позволяет исследовать кинетику фермента'1'ИВНОЙ реакции при
различных условиях, позволяет работа'rь в широком интервале
:концентраций субстрата, производить массовые определения, удо-
бен для ре1'истрации активности АХЭ различноrо происхожде-
ния в стандартных условиях (определенные концентрэ.ции фер-
мента и субстрата, стандартное время реакции при условии со-
блюдения нулевоrо порядка).
Принцип метода: при взаимодействии ацетилходина с ще
лочным: раствором rидроксиламинхлорида образуется ацетил
1'идроксамовая кисдота, которая в кислом растворе дает с хлор
ным железом цветную реакцию:
(СН з )N+СН 2 СН 2 ОС(О)СН з + NHPH == (СНз)зN+СН2СН20Н +
+ СНзС(О)NНОН
Материалы и об0руаование: 2 моль/л раствор солянокисло-
ro rидроксиламина, 1 О % ный раствор хлорноrо железа, приro-
товленный на 0,1 моль/л растворе соляной кислоты, 3,5 моль/л
раствор rидро:ксида натрия, 0,1 моль/л раствор соляной кисло
ты, ацетилхолинхлорид, фотоэле:ктроколориметр КФК 3 или
спектрофотометр СФ 46, кровь доноров, стеклянные пробирки,
пипетки, фИЛЬ'I'ровальная бумаrа.
Ход работы
Предварительно выделить мембраны эритроцитов из :крови
соrласно ме'1'одике, описанной в лабораторной работе N2 1.
Для ПОС'1'роения l<алибровочноrо rрафика необходимо приro
товить растворы ацетилхолинхлорида с l\онцентрациями 0,1; 0,5;
1,0; 1,5; 2,0; 2,5; :3,0; 3,5; 4,0 ммоль/л ацетилхолинхлорида. Оп-
ределить оптическую плотность этих растворов против раствора
сравнения (последовательность операций см. ниже), Построить
:калибровочный 1'рафик, rде по оси ординат отложена оптичес
кая плотность растворов ацетилхолинхлорида, а по оси абсцисс
концентрация ЭТО1'о вещества. В пределах УI<азанных I<онцент
237
раций ацетилхолина калибровочная прямая должна подчинять-
ся закону Буrера Ламберта Бера.
Для приrотовления раствора сравнения в пробирку налить
реактивы в такой последовательности: 2 мл раствора ХЛОРНО1'о
железа, 2 мл соляной кислоты, 1 мл щелочно1'О rидроксиламина,
1 мл 2,5 ммольjл раствора ацетилхолинхлорида и 1 мл дистил
лированной воды. Цвет смеси должен быть лимонно желтым.
В контрольную и опытную проб ирки налить соответственно
по 1 мл бидистиллированной воды и суспензии мембран эрит
роцитов. Затем добавить в них по 2 ил 2,5 ммольjл раствора
ацетилхолинхлорида и поместить проб ирки в термостат при 37.С
на 15 мин. После термостатироваиия прилить по 1 мл раствора
щелочноrо rидроксиламина (rотовят перед употреблением пу
тем смешивания равных объемов раствора солянокислоrо rИk
роксиламина и rидроксида натрия). Через 15 мин в опытную и
контрольную пробы добавить. по 2 мл раствора соляной кисло
ты И по 2 мл раствора хлорноrо железа. Через 20 мин оптиче
скую плотность опытной и контрольной проб измерить на фо
тоэлектроколориметре против раствора сравнения. Для расчета
активности фермента из величины оптической плотности KOHT
рольной пробы вычитают величину оптической плотности опыт-
ной пробы. Активность ацетилхолинэстеразы выражают в
ммольj л ацетилхолина с использованием калибровочноrо {'pa
фика.
ЛаБQраторн.ая работа М 5
Исследование УФ-индуцироваииых измеиеиий
фуикционаJIЬПОЙ активности ацеТИJIХОJIииэстеразы
эритроцитариьrx мембраи
Материалы u 060руiJоваuие: 2 моль/л раствор солянокисло
ro rидроксиламина, 10 % ный раствор хлорноrо железа, ПРИ1'о
товленный на 0,1 моль/л растворе соляной кислоты, 3,5 моль/л
раствор rидроксида натрия, 0,1 моль/л раствор соляной кисло
ты, ацетилхолинхлорид, фотоэлектроколориметр КФК 3 или
спектрофотометр СФ-46, установка для УФ-облучения, кровь до-
норов, стеклянные пробирки, пипетки, фильтровальная бумаrа.
Ход рабо.ты
Предварительно выделить мембраны эритроцитов из крови
соrласно методике, описанной в лабораторной работе N9 1.
238
Один объем (3 мл) суспензии мембран эритроцитов использо
вать в качестве контрольноrо образца и разлить по трем пробир-
кам, второй (9 мл) разделить на три части (по 3 мл) И подвер
rHYTb воздействию. УФ-света в дозах 0,75; 2,27; 3,78 кДж/м 2
при помощи УСТ8]IOвки для ультрафиолетово1'О облучения биоси
стем, которая подробно описана в учебном пособии В. r.P.lртю
хова, О. В. Путинцевой (1996). Облучение суспензии мембран эрит-
роцитов в трис НСl буферном растворе (рИ 7,6) проводят в cTeI<-
л.я:нной термостатируемой кювете (20:1:1 'С) при постоянном пе
ремешчвании с помощью ма1'НИТНОЙ меmаЛI<И излучением лам
пы типа ДPT 400 через светофильтр УФС l (с полосой пропуска
ния 240 390 нм). Интенсивность облучения через этот CBeTO
фильтр составляет 0,151 кДж/м 2 в 1 мин. Затем определить Ka
талитическую активность ацеТИЛХОЛИнэстеразы в контрольных
и опытных (при всех дозах облучения) пробирках по меТОДИI<е,
описанной в лабораторной работе N!! 4. Полученные даЕные заЕе
сти в табл. 19.
Таблица 19
ФерментатUВНДJl ахтивность ацетuлхолuнэстераsы
.lItембраll эритроцитов 'tеловеха 00 и rюсле УФ-оt5.llу'tеllи.я
Активность ацеТИJIхолинэстеразы, ARтивность АХЭ,
Обрааец ммодь/д ацетилхолина % от исходноro
1-е опреде- 2-е опреде- 3-е опреде- A:l:S A УРОВНЯ
леНИе ленив ленив
Контроль 100 %
Доза
0,75 кДж/м 2
Доза
2,27 кДж/м'
Доза
3,78 "Дж/м'
Сделать вывод о степени и характере изменений функцио-
нальной активности ацетилхолинэстеразы эритроцитарных MeM
бран, модифицированных воздействием УФ света в различных
дозах. Какие процессы, протекающие при УФ-облучении эритро
цитарных мембран, обусловливают изменения I<аталитической ак-
тивности мембраносвязанной АХЭ? Какова зависимость фермен
тативной активности P.lХЭ эритроцитарных мембран от дозы УФ
облучения?
239
Лабораторная работа .м 6
Исследование фермеnтаТИВRОЙ активиости свободной
и мембраиосвsзаппой ацеТИЛХОЛИRэстеразы
в J!Jштактном состоянии и после УФ облучеrm:s
Материалы и оборудование: 2 моль/л раствор солянокисло
1'0 1'идроксиламина, 10 %-ный раствор хлорноrо железа, приrо
товленный на 0,1 моль/л растворе соляной :кислоты, 3,5 моль/л
раствор rидроксида натрия, 0,1 моль/л раствор соляной кисло
ты, ацетилхолинхлорид, фотоэлектроколориметр КФК-3 или
спектрофотометр СФ-46, установка д.ця УФ облучеllИЯ, кровь дo
норов, rотовый препарат ацетилхолинэстеразы из эритроцитов
бы:ка, стеклянные IIробир:ки, пипетки, фильтровальная бумаrа.
ХОД работы
ПредваРИ'l'ельно выдели'l'Ь мембраны эритроцитов из крови
соrласно методи:ке, описанной в лабораторной работе N2 1. Ис-
пользуя описание методи:ки в лабораторной работе N2 5, провести
определение каталитичес:кой активности JCКЭ эритроцитарных
мембран в норме и при воздействии УФ-излучения в дозах 1,5;
3,0; 4,5 кДж/м 2 . Данные занести в таблицу, анало1'ИЧНУЮ табл. 19.
Те же эксперименты провести с буферными растворами свобод-
ной ацетилхолинэстеразы (10-8 моль/л). Оформить табл. 19 для
фермента в свободном состоянии. Результаты представить в виде
rрафи:ка, 1'Де по оси абсцисс отложены величины доз УФ света, а
по оси ординат значения активности АХЭ, выраженные в про-
центах от уровня контрольноrо образца, для свободноrо (кривая 1)
и мембраносвязанноrо (кривая 2) фермента. Сделать вывод об
уровне фоточувствительности разных форм фермента. Чем МО-
rYT быть обусловлены различия в характере УФ-индуцирован-
ных изменений функциональной активности свободной и свя
занной АХЭ?
Лабораторная работа .м 7
Определение фуикциональной активности ацстилхолип-
эстераз:ы: эритроцитарн:ы:х мембран ПОСJlе ИВ:ДУI'ЩИИ
пероксидпоrо окисления JlИПИДОВ
Мембранные ферменты изменяют свою активность под влия-
нием продуктов ПОЛ, что может быть обусловлено образовани
ем комплекса окисленный лип ид белок, ассоциаЦИей бел:ко-
240
вых молекул и разрушением аминOIШСЛОТ, в частности, coдep
жащих 8Н 1'РУППЫ.
Цель работы выявление изменений функциональной aK
тивности АХЭ эритроцитарных мембран после индукции aCKOp
батзависимоrо пероксидноrо окисления липидов. Ионы Fe 2 + OKa
зывают каталитическое действие на образование пероксидов. При
этом Fe 2 + окисляется до Fe 3 +, а функция аскорбиновой кислоты
заключается в реrенерации ионов за счет обратноrо восстановле
ния Fe 3 + до Fe 2 +.
Материалы u оf50ру80вание: 2 моль!л раствор солянокисло
1'0 1'идроксиламина, 10 % ный раствор хлорно1'О железа, приro
товленный на 0,1 моль/л растворе соляной кислоты, 3,5 моль/л
раствор 1'идроксида натрия, 0,1 моль/л раствор соляной кисло
ты, ацетилхолинхлорид, сульфат железа Fe80 4 . аскорбиновая кис
лота, фотоэде:ктроколориметр В:ФК-3 иди сnек'rрофотометр СФ-
46, кровь доноров, стеклянные пробирки, пипетки, фидьтрова.)'IЬ
ная бума1'а.
Ход работы
Выделить эритроцитарные мембраны по методике, описанной
в лабораторной работе М 1. К 1 мл суспензии эритроцитарных
мембран д06ави'l'Ь 150 мкл смеси растворов FeS0 4 (100 мкмоль/л)
и аскорбиновой кислоты (2 ммо,:н,!л) и инкубировать 5, 15,30.45 и
60 мин при 37 'С. Затем ПрОl ести определение ферментативной
активности АХЭ нативных и модифицированных мембран. Па-
раллельно исследовать уровень ТБН: реактивных продуктов пе-
рОКСИДНОl'о окисления липидов (см. лабораторную работу N2 11).
После завершения экспериментов сопоставить динамику изме
нений величин актИВНОСТИ АХЭ в процессе развития ПОЛ эрит-
роцитарных мембран и уровня накопленных окисленных про-
дуктов липидов.
Лабораmорnа.я рабоmа М 8
Исследование функционалъной активности
мембрав:освязав:ной Na\ I +-АТФазы
Распространенные методы изучения функциональной актив
ности Na+, К+ АТФазы основаны на определении количества :e:e
Qрrаническоrо фосфата, содержаще1'ОСЯ в исследуемом растворе.
Существуют различные методы обнаружения фосфата в биообъ-
ектах. Но все они основаны на том, что в кислой среде молибде-
16. Заказ 3788
241
новокислый аммоний и фосфорная кисло'rа (ее соли) взаимодей-
ствуют между собой с образованием фосфомолибдата аммония,
восстановление KOTopo1'o приводит к ,образованию смеси различ-
ных оксидов молибдена, имеющих синий цвет. Появившаяся ок-
раска устойчива в течение 1 2 ч. Для ее стабилизации применя-
ют CuS0 4 . Различные методы отличаются природой восстанови-
теля и кислотностью среды, что определяет скорость реакции и
чувствительность метода.
Материалы и оборуоован.uе: хлорид натрия, хлорид калия,
хлорид ма1'НИЯ, строфантин, ЭДТА, АТР, трис-НСl буфер (рН 7,4),
трихлоруксусная кислота, термостат, аскорбиновая кислота, мо-
либдат аммонии, однозамеЩеННЫЙ фосфат калия, фО'I'оэлектро-
'Колориметр КФК 3 или спектрофотометр СФ-46, кровь доноров,
стеклянные п.робирки, пипетки, фильтровальная бумarа.
Ход работы
Получить препарат мембран эритроцитов по методике, опи-
Gанной в лабораторной работе N2 1. В пробирки для определения
общей АТФа:зной и M g 2+-АТФазной активности внести по 1 мл
суспензии мембран. В контрольные пробы вместо мембран вне-
сти 1 мл трис-НСl буфера. Добавить в пробирки для определения
M g 2+-АТФазной активности по 0,3 мл строфантина (0,025 %), в
контрольные и опытные пробирки для определения общей
АТФаз:ной активности по 0,3 мл буфера, перемешать и через
30 мин в каждую пробирку внести по 1 мл инкубационной сре-
ды. Она содержит: 100 ммоль/л NaCl, 10 ммоль/л ECl, 3 ммоль/л
MgCl2' 1 ммоль/л ЭДТА, 5 ммоль/л АТР, 50 ммоль/л трис-НСl
буфер (рН 7,4). Далее термостатировать содерЖИмое пробирки в
течение 1 ч при 37 "С. Реакцию остановить добавлением 0,5 мл
20 % ной трихлору:ксусной кислоты. Велок удалить центрифу-
1'ированием при 5000 об/мин в течение 10 мин.
Количество образующеrося фосфата определяют по методу с
применением аскорбиновой кисло'rой, который включает исполь-
зование следующих реактивов:
а) аскорбиновая кислота 10 % -ный раствор;
б) молибдат аммония 0,42 %-НЫЙ раствор, ПРИ1'отовлен-
ный на 1 н серной кислоте;
в) смесь, состоящая из одноrо объема раствора (а) и шести
объемов раствора (б). rотовится непосредственно перед работой
и хранится в течение дня в ледяной бане.
242
Е 0,9 мл исследуемоrо раствора, содержащеrо 0,03
0,2 мкмоль неОР1'авическоrо фосфата, добавить 2,1 мл реактива
(в). Перемешать и инкубировать 20 минут при 45 'с или 60 мин
при 37 .С. После охлаждения измерить величину оптической
плотности при 620 нм против контрольной пробы, содержащей
вместо исследуемоI'О раствора бидистиллированную воду. По раз
нице между полученными значениями общей АТФазной и Mg 2 +
АТФазной активности найти активность Na+, К+ АТФазы эрит
роцитарных мембран с ПОМощью калибровочно1'О rрафика.
Для построения :калибровочной прямой в пробирки налить по
0,15; 0,30; 0,50; 0,70 и 0,90 мл cTaндapтHo1'o раствора неорrани
ческо1'О фосфата, содержащеro 0,23 м:кмоль/л фосфата (ЕН 2 РО 4 ) в
1 мл. Довести объем в каждой пробирке до 1 мл бидистиллиро
ванной водой и далее обрабатывать, как указано выше. 3аре1'ИСТ
рировать оптическую плотность проб и полученные данные изоб
разить rpафически, откладывая по оси абсцисс содержание фосфа
та в пробе, а по оси ординат оптическую плотность при 620 нм.
. Активность фермента рассчитывают по формуле:
А = (до общ ДD Мg ) . 106
K.j.t.31
'"
I' д е D б == D б D разность величин оптической плотности
ощ ощ к
раствора для определения общей АТФазной активности и KOHT
ролъно1'О раствора; DMg == D Mg D" разность величин оптичес
кой плотности раствора для определения Mg2+ -АТФазной актив-
ности и КОНТРОЛЪНО1'о раствора; К калибровочный :коэффици-
D
ент, определяемый по формуле: К = (D в абсототных величи-
е
нах для определенной концентрации, с значение концентра-
ции); j количество белка в пробе; t время инкубации (мин);
31 молекулярная масса фосфора.
Активность Na+, К+.АТФазы выражают в RМОЛЪ Pn/M1' (белка)
в мин или в мкмоль/л Р)мл теней в час.
Лабораторnая работа М 9
Изучение УФ иидуцированных изменеиий фушщ:ионазп.-
ных свойств Na+, K+-АТФазы эритроцитарных мембран
Материалы и оборуiJованuе: хлорид натрия, хлорид калия,
хлорид маrния, строфантин, ЭДТА, АТР, трис НСl буфер (рИ 7,4),
16*
243
трихлоруксусная кислота, термостат, аскорбиновая кислота, MO
либдат аммония, однозамещенный фосфат калия, сульфат желе
за, фотоэлектроколориметр В:ФI.с з или спектрофотометр СФ 46,
установка для УФ облучения биообъектов, ЕрОВЬ доноров, c'reK
лянные пробирки, пипетки, фильтровальная бумаrа.
Ход работы
Предварительно выделить мембраны эритроцитов из крови
СО1'ласно методике, описанной в лабораторной работе М 1.
Один объем (3 мл) суспензии мембран ЭРИТРОЦИТОВ использо
вать в качестве КОНТРОЛЬНО1'о образца и разлить по трем пробир
кам, второй (9 мл) разделить на три части (по 3 мл) И подвер
I'HYTb воздействию УФ света в дозах 0,75; 2,27; 3,78 кДж/м 2 при
помощи установки для ультрафиолетовоI'О облучения биосистем.
Облучение суспензии мембран эритроцитов в трис НСl буферном
растворе (рН 7,6) проводят в стеклянной термостатируемой кю-
вете (20:1:1 .С) при постоянном перемешивании с помощью MaI'
нитной мешалки излучением лампы типа ДРТ 400 через CBeTO
фильтр УФС l. Затем следует определить l\аталитическую ак-
тивность Na+, К+ АТФазы в контрольных и опытных (при всех
дозах облучения) пробирках по методике, описанной в лабора
торной работе N!! 8. Данные занести в табл. 20.
Таблица 20
Фермен.тативна.я. шстивность Na+, C"-АТФазы мембран
эритроцитов ItеловеJCа после УФ-облуltен.u.я.
Активность Na+,K+-АТФазы, МКМОЛЬ/Л Активность
Образец р /МЛ теней в час АТФазы, % от
1-е опреде- 2-е опреде- 3-е опреде- Ad:S А исходноrо УРОВЮI
ление ление ление
Контроль 100 %
Доза
0,75 кДж/м'
Доза
2,27 кДж/м'
Доза
3,78 КДЖ/М'
Сделать вывод о хараЕтере изменений функциональной aE
тивности Na+, K'I-.АТФазы эритроцитарных ме:м:бран, модифици
рованных. воздействием УФ-света в различных дозах.. Какие про
цессы, протекающие при УФ-облучении эритроцитарных мемб
244
ран, обусловливают изменения каталитической активности MeM
браносвязанной АТФазы? Какова зависимость ферментативной
активности Na+, К' АТФазы эритроцитарныХ, мембран от дозы
УФ облучеНИJ'I?
Лабораторная. работа N 10
ОпределеlШе ферм:е:итативпой активпост:и Na+, :К+ АТФазы:
эритроцитар:иых м:ембра:и после и:идУКЦИИ пероксидноrо
окисле:иия липидов
Материалы и 060ру()ован-ие: хлорид натрия, хлорид калия,
хлорид маrния, строфантин, ЭДТА, АТР, трис НСl буфер (рИ 7,4),
трихлоруксусная кислота, термостат, аскорбиновая кислота, MO
либдат аммония, однозамещенный фосфат калия, фотоэлектро
колориметр КФК 3 или спектрофотометр СФ 46, кровь доноров,
стеклянные пробирки, пипетки, фильтровальная бума1'а.
ХОД работы
Выделить эритроцитарные мембраны по методике, описан
ной в лабораторной работе N2 1. К 1 мл суспензии эритроцитар
ных мембран добавить 150 мкл смеси растворов FeS0 4
(100 мкмольjл) и аскорбиновой кислоты (2 ммольjл) и инкуби
ровать 5, 15, 30, 45 и 60 мин при 37 'с. Затем провести определе
ние ферментативной активности Na+, К+ АТФазы нативных и MO
дифицированных мембран. Параллельно исследовать уровень
ТБК реактивных продуктов пероксидно1'О окисления липидов (см.
лабораторную работу N2 11). После завершения экспериментов
сопоставить дин амику изменений величин активности N а + ,
К+ АТФазы в процессе развития ПОЛ эритроцитарных мембран
и уровня накопленных окисленных продуктов липидов.
6.3. ИССЛЕДОВАНИЕ ИНТЕНСИВНОСТИ ПРОТЕI АНИ.я
ПРОЦЕССА ПЕРОRсидноrо ОКИСЛЕНИЯ ЛИПИДОВ
МЕМБРАН
в зависимости от конкретной цели исследований MorYT быть
использованы различные физико химические методы количе
cTBeHHo1'o определения молекулярных продуктов ПОЛ мембран
или общей оценки динамики протекания свободнорадин:альных
процессов окисления. При количественном изучении первичных,
промежуточных и конечных продуктов пероксид:аоrо окисле:аия
определяют разность концентраций радикальных интермедиа
245
тов ДО И после процесса окисления с использованием оптических
методов анализа, хроматоrрафии, поляроrpафии, амперометричес
Koro титрования. При оценке интенсивности свободнорадикаль
ных реакций ПОЛ получают информацию, суммарно характери
зующую соотношение скоростей образования и разложения пер
оксидов, изменения активности антиокислительных ферментов,
уровня анти и прооксидантов в модифицированных мембранах.
Так, например, йодометрический- (амперометрический) метод
количественной оценки продуктов ПОЛ основан на определении
концентрации свободноro йода или трийодина, образующихся при
восстановлении пероксидных rpупп йодид ионом.
R оптическим методам количественно1'О анализа продуктов
пероксидво1'О окисления липидов относят целый ряд методов:
УФ сцектрофотометрию для обнаружения rидроперО1<СИДОВ, ис
следование уровня rидропероксидов с использованием тиоциа
вата аммония, определение промежуточных продуктов ПОЛ по
реакции с 2 тиобарбитуровой J:ШСЛОТОЙ (ТБR тест), диеновых KOHЪ
Ю1'атов ненасыщенных жирных кислот, флуоресцентный анализ
шиффовых оснований конечных продуктов пол и др.
Хемилюминесцентные методы, используемые для. инте1'Раль
ной оценки процессов ПОЛ, основаны на ре1'истрации оптичес
Koro излучения, возникающе1'О в результате спонтанных или ини
циируемых в биолоrических пробах химических реакций.
Лабораторная работа М 11
Определение уровня прОдyRтов nepORCJIДHoro окислении
ЛRПИДОВ мембран с использованием тиобарбнтуровоi
кислоты
В основе метода лежит реаКЦИЯ 2 тиобарбитуровой кислоты
(ТБК) с промежуточными продуктами ПОЛ, в результате KOTO
рой образуе'fСЯ окрашенный триметиновый комплекс с максиму
мом поrлощения при 532 нм:
ОН Н Н Н
N N:Y "N
2 .Л + ---+ А л
HS N ОН HS N ОН НО N S
Считают, что 1'лавная роль при образовании этоrо окрашен
HOro продукта принадлежит малоновому диальде1'ИДУ (МДА).
246
Материалы и оборуаоеан:.ие: тиобарбитуровая кислота, три
хлоруксусная кислота, буферный расТВОр с рН 7,4 (см. табл.7
Приложения), цеНТРиФУ1'а, водяная баня, фотоэлектроколориметр
КФК 3.
ХОД работы
Тканевой 1'OMo1'eHaT или суспензию мембран в буферном pa
створе (рН 7,4) в объеме 2,5 мл поместить в центрифужные про
бирки и добавить 1 мл 17 % Horo раствора 'fРИХЛОРУКСУСНОЙ кис
лоты. Центрифуrировать 10 мин при 4000 об/мив. Отобра'fЬ Ha
досадочную жидкость и 2 мл ее перенести в пробирку, в которую
налить 1 мл 0,8 % Ho1'o раствора ТЕК, и закрыть ее. Пробирку
поместить на водяную баню при 100 ос на 10 мин. Затем пробу
охладить и зареrистрировать оптическую плотнос'I'Ь на фотоэлек
троколориметре КФК 3 при длине волны 532 нм. В качестве KOH
троля использовать буферный раствор вместо супернатанта. Ko
личество промежуточных продуктов ПОЛ (МДА) рассчитывают
по формуле
К == (A Q А,)/Е,
rде К количество продуктов ПОЛ; AQ оптическая плотность
ОП:ЫТНО1'о раствора; А" оптическая плотность контрольноrо
раствора; Е молярный коэффициент экстинкции, равный в дaH
ном случае 1,56'105 моль l'CM l.
Образование комплекса ТЕI{ МДА реrистрируют также флуо
ресцентным методом. Для Э'1'О1'о к 0,1 мл 3% HOro раствора дoдe
цилсульфата натрия добавляют 1,5 мл 2 моль/л ацетатноrо бу
фера (рН 3,6) и 0,8% Horo раствора ТБК, доводят бидистиллиро
ванной водой до 4 мл. Полученную смесь инкубируют при 95 ос
в течение 60 мин. После охлаждения добавляют 1 мл 0,2 н соля
ной кислоты и 5 мл смеси н бутанол пиридин в объемном COOT
ношении 15:1 и перемешивают. Центрифу1'ИРУЮТ 15 мин при
3000 об/мин, отделяют надосадочную жидкость и реrистрируют
ее спектр флуоресценции в области длин волн 450 600 нм. За
тем определяют интенсивность люминесценции в ее маl<симуме
(",,515 нм). Чувствительность метода по стандарту МДА составля
ет 0,5 нмоль при использовании чистых образцов ТВК.
247
6.4. ИЗУЧЕНИЕ ИЗМЕНЕНИЙ CТPYKTYPHOrO
СОСТОЯНИЯ БиолоrИЧЕСКИХ МЕМБРАН МЕТОДОМ
ФJIУОРЕСЦЕНТНЫХ зондов
Современным биофизическим методом исследования, позво
ляющим изу'Чать структурное состояние биомембран, транспорт
ионов, трансмембранный потенциал, взаимодействие веществ раз
личной природы с мембранами и ДРУ1'ие процессы, признан Me
тод флуоресцентных зондов.
"Универсальным" мембранным флуоресцентным зондом, pe
аrирующим на самые разнообразные перестройки, которые MO
1'УТ происходить В мембранах, служит l-анилинонафталин 8 суль
фонат (АНС):
@
00
АНС был первым зондом, который использовал Д. Лоуренс в
1952 1'. для исследования мембранных структур. Он является клас
сическим примером зонда, распределяюще1'ОСЯ между водной и
мембранной фазами в измеримой nропорции. АНС флуоресциру-
ет практически только в связанном с мембраной состоянии. При
чем флуоресценция связанноro с мембраной красителя заметно
отличается по своим характеристикам от e1'o флуоресценции в
водной фазе, что позволяет делать заключение о характере мик
роо:кружения хромофорных rpупп молекул зонда.
Исследователя, использующеrо флуоресцентные зонды, инте
ресует положение максимумов их спектров ПО1'лощения и флуо
ресценции не только в связи с необходимостью выбора правиль-
ных условий возбуждения и измерения флуоресценции, но и по-
тому, 'Что величина стоксова сдвиrа (длинноволновый сдви1' мак-
симума флуоресценции по отношению к максимуму IIоrлощения)
отражает такое важное свойство среды, как полярность. Величи-
на стоксова сдвиrа определяется следующими условиями:
а) изменением диполъноrо момента молекулы при переходе
из OCHoBHoro в возбужденное состояние;
б) электронной и ориентационной поляризуемостью окружа-
ющих зонд молекул.
248
Спектр ПО1'лощения АНС в водном растворе имеет максимум
в области длин волн 350 360 нм, а спектр флуоресценции
при 4 78 480 нм.
При СВЯЗывании данно1'О красителя мембранами или белками
в определенной мере изменяются все параметры ПО1'лощения и
флуоресценции, так как зонд оказывается в среде менее полярной
и менее текучей, чем водный раствор. При взаимодействии АНС с
различными мембранами происходит изменение положения MaK
симумов поrлощения и флуоресценции, интенсивности и степени
поляризации флуоресценции, анизотропии поляризованной флуо
ресценции. Эти изменения позволяют количественно оценить CTe
пень связывания зонда с мембранами. Вместе с тем следует учиты
вать и тот факт, что характеристики связавшеrося зонда сильно
зависят от состава исследуемых мембран (митохондриальных, фос
фолипидных, плазматических). Еще более чувствительным пара
метром является интенсивность флуор ценции, так как она оп
ределяется еще и количеством связавте1'ОСЯ зонда.
Сейчас трудно однозначно ответить на вопрос о локализации
АНС в белково липидных мембранах. Предпола1'ают, что молеку
ла зонда не может 1'лубоко поrpузитьс.я: в липидный бислой:, так
как заряженная СУЛЬфо1'руппа должна оставаться на поверхности.
Кроме Toro, rоризонтальная ориентация длинной оси eI'O молеку
лы не позволяет поrрузить в бислой фенильное кольцо. Скорее
всею, в плазматических мембранах часть АНС связана с беJIRЭМИ,
а часть с липидами. В пользу это1'О представления привод.я:т
данные о двух компонентах кривой затухания флуоресценции АНС
в белково липидных мембранах, из которых компонента с боль
тим временем жизни преимущественно обусловлена молекула-
ми зонда, связанными с белками, а вторая с липида:м:и.
1 Диметиламино 5 нафталиносульфохлорид (DANS) способен
ковалентно присоединяться к свободным аминоrруппам и явля
ется хромофором МНО1'их флуоресцентных зондов. DAN8 1'ЛИЦИН
имеет следующую структурную формулу:
(;t!з УНз
(х)
o o=s=o
'\ I
P CH2 NH
О
249
Аминоrруппа DAN8 rлицина, с ОДНОЙ стороны, сопряжена с
1t электронНОЙ системой нафталина, а 9 друroй взаимоде:й:ству
ет с растворителями, полностью изменяя как спектр поrлощения
нафталина, так и ero флуоресцентные свойства. При возбужде
нии молекулы аМИНО1'руппа поворачивается в одну плоскость с
кольцами нафталина, при этом дипольный момент молекулы YBe
личивается. Появляется большой стоксов сдвиr спектра флуорес
ценции, сильно зависящий от полярности растворителя. Взаимо
действие аминоrруппы с протонодонорными растворителями (oco
бенно водой) приводит к тушению флуоресценции, причем D р
тушит флуоресценцию DAN8 в 2 3 раза слабее, чем нр. Если
аминоrpуппа присоединяет протоны, то в процесс взаимодействия
вступает электронная пара атома азота, ранее связанная с :коль
цом. В результате сопряжение исчезает, а вместе с ним длин
новолновая полоса поrлощения и связанная с ней флуоресцен
ция.
Предполаrают, что возбужденная молекула DAN8 может Ha
ходиться в двух различных состояниях, различающихся степе
нью чувствительности к полярности микроокружения.
Лабораторная работа М 12
Исследование фотоицдуцироваииых изменений
CTPYKтypHoro состояния ЭрИТрОЦRтарJlЫХ мембрап
метоДОМ ф.луоресцентных зондов
Материалы и оборуiJованuе: свежеприrотовленные препара
ты мембран эритроцитов человека, 1 анилинонафталин 8 суль
фонат, DAN8 rлицин, акридиновый желтый, флуоресцеин, NaOH,
родамин 6Ж, акридиновый оранжевый, установка для реrистра
ции спектров люминесценции.
Ход работы
Для ре1'ИСТРации спектров флуоресценции зондов 1,8 AНC и
DANS rлицина в комплексе с нативными и УФ облученными эрит
роцитарными мембранами необходимо использовать установку,
описанную в работе В. r. Артюхова, О. В. Путинцевой (1996). В
ней в качестве источника света применяют ртутную лампу
СВД 120. Возбуждающий свет выделяется с помощью светофиль
тра сзс 7 2 и падает на кювету с исследуемым образцом. Лю
минесценцию растворов ЗОНДов измеряют при помощи MHo1'oxo
довой кварцевой кюветы объемом 4 мл с зеркальными CTeHKa
250
ми. Ре1'истрируемый свет проходит через монохроматор спект
рофотометра СФ 4А и фиксируется фотоумножителем ФУЭ 18А.
Напряжение на ФЭУ составляет 1 кВ. Ширина щели 1 мм.
СИI'нал с ФЗУ через входной блок подается на вход ПРQ1'рамм:и
pyeMoro цифровоrо вольтметра В 7 43 и обрабатывается nq BCTpO
енной проrpамме Р4 ("среднее арифметическое из n измерений").
С целью проверки правильности работы при бора про водят eI'o
калибровку по стандартным растворам красителей: акридино
Bo1'o желто1'О, флуоресцеина в 0,1 н растворе NaOH, родамина
6 Ж, акридиновоro оранжево1'О.
Для работы необходимо приrотовить раствор АНС (препарат
фирмы "8igma", СIПA) на бидистиллированной воде, имеющий
исходную концентрацию 5'10 3 моль/л, и спиртовой раствор
DAN8 rлицина (содержание спирта не более 10 %) с исходной
концентрацией 10 4 моль/л.
Для исследования спектров флуоресценции 1,8 AНC в комп
лексе с суспензией нативных и УФ-облученных мембран указан
ные растворы в объеме 1,5 мл надо проинкубировать с 1,5 мл
1'10 4 моль/л водноrо раствора АНС при 20 ОС в течение 15 :мин,
затем смесь внести в !{ювету и заре1'истрировать спектр флуорес
ценции в интервале длин волн 430 500 нм.
Для изучения спектров флуоресценции зонда DAN8-rлицина
в комплексе с суспензией нативнцх и УФ модифицированных
мембран эритроцитов указанные растворы в объеме 1 мл необхо
димо смешать с 0,5 мл раствора зонда и 1,5 мл 10 ммоль/л
трис-НСl буфера (рН 7,6 при 20 ОС) и инкубировать смесь в тече
ние 15 мин, затем ре1'истрировать спектры флуоресценции в ин
тервале длин волн 500 550 нм.
1 вариант
Предварительно заре1'истрировать спектры поrлощения и флу
оресценции водноrо раствора зонда 1,8 AНC (контроль). Затем
снять спектры люминесценции зонда в присутствии суспензии
эритроцитарных мембран с учетом эффекта разведения. Полу
ченные данные изобразить rpафически, откладывая по оси абс
цисс длину волны измеряемоrо света, а по оси ординат, интен-
сивность флуоресценции опытных образцов. Сделать вывод о ха-
рактере изменений люминесцентных свойств 1,8-АНС в присут
ствии мембранноro препарата.
Провести УФ облучение эритроцитарных мембран соrласно
методике, описанной в лабораторной работе J\/'g 5, в дозах 0,76;
251
1,51; 3,02; 2,26; 4,53 кДжjм 2 и зареrистрировать спектры фJIУО
ресценции зонда в присутствии модифицированных мембран.
Построить rpафик зависимости средНих значений интенси:в:нос
ти флуоресценции АНС в e1'o максимуме в присутствии н:а.т:и:в
ных и УФ..облученных мембран от дозы УФ"света. Сделать Bыодд
о причин ах изменений люминесценТНЫХ характеристик АН С в
комплексе с модифицированными мембранами, индуцирова:в:В::ых
воздействием УФ излучени.я в широком диапазоне длин во.л:в: а
также о характере структурных нарушений облученных эритро
цитарных мембран.
II вариант
В качестве зонда использовать DАNS 1'ЛИЦИН, все опер ации
npоводить анало1'ИЧНО описанным в варианте 1 этой раБОТЪ:J:..
6.5. ИССЛЕДОВАНИЕ УСТОЙЧИВОСТИ
ЭРИТРОЦИТАРНЫХ МЕМБРАН К ДЕЙСТВИЮ'
РАЗЛИЧНЫХ ХИМИЧЕСКИХ АI'ЕНТОБ ПРИ ПОМО:П:ЦИ
МЕТОДА РЕrистРАЦИИ ОСМОТИЧЕСКИХ
и КИСЛОТНЫХ эритроrРАММ*
Осмотическая резистентность клеточных популяций крови
являетс.я важным показателем, характеризующим проницае:rv.rостъ
эритроцитарных мембран, белок липидные взаимодействия13 м:eM
бране, состояние белковых структур цитоскелета клетки.
rемолиз эритроцитов под действием rемолитиков oCYJ:I.J;eCTB
л.яется через ряд последовательных стадий: npедrемолитичес:кую,
стадию осмотическоrо и химическоrо 1'еМО1'лобинолиза, CTpOMa
топороза и строматолиза. rлавными показателями преД1'е1У.[ОЛИ..
тической стадии .являются выход ионов калия в окружа:к>щую
среду и сферул.яци.я эритроцитов. Протекание 1'еМО1'лоб:инолиза
зависит от физико..химических свойств rемолит:ика. Так, при ос..
мотическом rеМО1'лобинолизе набухание эритроцитов до крити
ческоrо уровня приводит к повреждению мембраны, в резу .льта
те чеrо свободная фракция внутриклеточноl'О rеМО1'лобив:а диф-
фундирует наружу. Осмотический тип rемолиза не СОПрО:ВО:>Еда
ется химическими изменениями состава эритроцитов, сох.раня"
ются также и e1'o электрические свойства. Так как осмот:ичес
кий rем лиз вызывает только частичный выход rеМО1'лоб:и:.на, то
из этоrо следует, что часть rемоrлобина находится в связанной со
"* Раздел написан С. r. Резваном:.
252
стромой форме в виде rемолипостроматиново1'О комплекса (co
единение rеМО1'лобина с лип идами и холестерином). Реализация
процесса освобождения связанной фракции происходит в стадии
химическоrо rемоrлоБИЕолиза, осуществляющейся под действи
ем поверхноство активных веществ (саrrонин, ДИ1'итонин и др.).
При ЭТОМ наблюдается ВЫХОД связанноrо rемоrлобина вследствие
распада rемолипостромативовоrо комплекса.
Все вышеперечисленные стадии протекают без нарушевия
МОРфОЛО1'ической целостности эритроцита. Стадия строматопо
роза, характеризующаяся проводимостъю эритроцитами элект
рическо1'О тока при сохранении МОРфОЛО1'ической целостности
клетки. наступает при действии на эритроциты концентрирован
ных растворов сапонина.
Полная дезинте1'рация структуры н:летки (строматолиз) про
исходит ПОД влиянием холево , дезон,сихолево и олеиновокис
лоrо натрия.
Принцип метода ре1'истрации осмотических и кислотных эрит-
porpaMM заключается в фотоме'rрической реrистрации кинети
ки распада эритроцитов под действием 1'емолитика в определен-
ной дозе. Мерой стойкости эритроцитов является время, в тече-
ние KOTopo1'o происходит их разрушение. Мноrостадийный про
цесс вовлечения эритроцитов в rемолиз позволяет построить эрит
porpaMMY зависимость их распределения по стойкости во Bpe
мени.
Лабораторnая работа М 13
Автоматический метод реrистрации
осмотических и :кислотных эритроrрамм
'Установка для реrистрации эритроrрамм, разработанная
С. r. Резваном на кафедре биофизики и биотехноло1'ИИ Воронеж-
CKoro rосударственноrо университета, позволяет измерять степень
повреждения мембран ЭрИТрОЦИ'l'ов по действием различных хи-
мических areHToB. Оптический БЛОI{ установки состоит из фото-
электрическоrо колориметра ФЭR-56 М со встроенным диффе
ренциальным усилwrелем. Реrистрационный блок представлен
двухкоординатным реrистратором ЛКД 4 003, цифровым вольт
метром В7.20. ДЛЯ термостатирования суспензии ЭрИтрОЦИТОВ
применяют ультратеРМОС'l'ат UTU-6 и термостатируемые кюве
'l'ы. Электрическая схема предварительноrо усилителя позволя-
ет получить линейную зависимость между истинным коэффи
253
циентом светопропускания (Т) и выходным СИI'налом YCTa
новки.
Темолиз эритроцитов ПрОБОДЯТ в кюветах с наружными раз
мерами 20x40xlO мм и рабочим объемом 4 мл. Точность хода
луча ФЭКа составляет 0,01 мм. Для увеличения точности хода
лучей О1'раничивают диаметр центрально1'О о:кна кюветы до 0,8 см.
Чувствительность ФЭКа при этом уменьшается, но результаты
становятся более стабильными за счет уменьшения вклада CBeTO
рассеяния. Измерение светопропускания про водят при длине
волны 490 нм, так как в данном случае коэффициент молярной
экстинкции ОКСИ1'еМОI'лобина минимален. Следовательно, при ис
пользовании ЭТОI'О метода реI'истрации тестируется не сам reMo
лиз (выход 1'еМО1'лобина в среду инкубирования), а повреждение
мембран эритроцитов: светорассеяние исследуемых образцов из
меняется за счет разрушения мембраны, в том числе ее цитоске
лета. Выход rеМО1'лобина явление вторичное и при длине вол-
ны 490 нм практически не влияет на ре1'истрируемый СИ1'нал.
При проведении reмолиза эритроцитов в одной кювете YCTa
новка ре1'истрирует S образную инте1'Ральную :кривую, форма ко-
торой отражает суммарное изменение величины светорассеяния
('t) в исследуемом растворе во времени, т. е. 't == f(t) рис. 61. В
процессе rемолиза с:корость расrщца эритроцитов Дj:}стиrает Maк
симальноI'О значения примерно в середине кривой. При диффе-
ренцировании СИI'нала интеrральной кривой, Т.е. зависимости
dT /dt, в области максимальной скорости I'емолиза эритроцитов
G,%
100
90
80
70
60
50
40
30
20
10
О
10
О
3
5
2
4
6
7
254
8 9
t, мин
Рис. 61, Интеrральнва кри
вая осмотическоrо (кислотноro)
rемолиза эритроцитов: 1 фаза
сфеРуЛЯ:ЦИИj 2 максимальная
с:корость rемолиза (у МАХ); 3 Bpe
ми 50 % rемолиза (t 50 ); -1 KO
нечная: фаза rемолиза. ПО оси аб
сцисс времн rемолиза; по оси
ординат степень rе:м:олиза
эритроцитов
появляется rлобальный максимум. :Кинетический метод реrист
рации процесса раЗРУDIения эритроцитов позволяет оценивать
следующие параметры:
t лат время латентно1'О периода reмолиза, с;
t G собственное время 1'емолиза;
t 50 время половинноrо 1'емолиза, с;
v ltUlX максимальная скорость rемолиза, ота. ед.;
G sf , G степень сферуляции и rемолиза эритроцитов, %.
ЛатентныЙ период (t""T) отражает время, ПрОDIедшее с MOMeH
та введения rемолитика в кюве'rу до перво1'О появления 1'емоrло-
бина вне эритроцита (участок "O l"Ha рис. 61). Смещение ин-
теrральной кривой вниз от нулевой линии вызвано повышением
интенсивности рассеяния света суспензиеЙ эритроцитов в резуль
тате их сферуляции. Истинный rемолиз, отраженный в виде
8-кривой, предстаВЛJ1ет собоЙ процесс последовательноro вовле
чения всей массы эритроцитов (участок "1 4"); в первое время
происходит разрушение самых старых эритроцитов, являющих-
ся наименее стойкими (участок "1 2"). Появление 'И:зrиба на ин-
те1'Ральной кривой перед выходом на плато (участок "3 4") ха-
рактеризует кинетику разрушения молодых, наиболее стойких
эритроцитов. Плато на кривой (точка "4") означает, ч'rо rемолиз
окончен, Т.е. все эритроциты rемолизированы.
Линейный участок S образной кривой отражает кинетику рас-
пада основной массы эритроцитов. Но и в этой фракции есть
1'руппа клеток, rемолиз которых происходит со скоростью, пре
ВЫDIающеЙ скорость распада любоЙ ДРУ1'ой rруппы данной по
пуляции эритроцитов. Точка "2", расположенная примерно в се-
редине кривой, соответствует времени распада эритроцитов, про
исходящеrо с максимальной скоростью (у та)' Она соответствует
положению максимума дифференциальной кривой.
Промежуток времени до начала раЗРУDIения самых нестой
ких клеток (точка "1") до :конца процесс а (точка "4") представ-
ляет собственное время rемолиза. Время, ПрОDIедшее с момента
введения rемолитика в кювету до выхода кривой на плато,
общее время l'емолиза. ИНО1'да удобнее пользоваться временем
ПОЛОВИННО1'о rемолиза t БО (точка "3"). Это время, за которое про-
исходит распад 50 % эритроцитов. При исследовании кинетики
rемолиза эритроцитов, индуцированноrо действием химических
a1'eHToB, используются 1'ипоосмотические растворы этих соедине
ний с различной концентрацией в 0,55 % NaCl.
255
6.6. КОЛИЧЕСТВЕННОЕ ОПРЕДЕЛЕIIИЕ липидноrо
СОСТАВА ЭРИТРОЦИТОВ
При изучении биомембран обычно имеют дело с относитель
но небольшими количествами липидов, поэтому для их разделе
ния чаще Bcero используют метод тонкослойной хроматоrрафии
(ТСХ) на силикаrеле, позволяющий проводить и качественный, и
количественный анализ липидов различных Классов. ТСХ ocy
ществляют в тонком слое силикаrеля, нанесенном на подлож
ку стеклянную, пластИIФВую или алюминиевую пластинку. В
качестве адсорбентов можно применять и ДРУ1'ие вещества (OK
сид алюминия, сефарозу, целлюлозу). Силикarель может быть с
кальциевой связующей добавкой (силикаreль G) или без нее (си
ликаrель Н). ДЛЯ разделения липидов используют xpoMaTo1'pa
фические камеры, стенки которых выстилают изнутри фильтро-
вальноЙ бумаrой для ускорения насыщения ее парами раствори
теля. Камеру 1'отовят предварительно (примерно за 1 ч или более
до эксперимента), залив в нее достаточное количество раствори
теля на rлубину около 1,5 см. Фильтровальная бумаrа, выстила
ющая стенки камеры, должна пропитаться растворителем. Необ
ходимо плотно закрывать камеру крышкой (если необходимо
использовать вазелиновую смазку). В камеру обычно помещают
одновременно не более двух пластинок так, чтобы поверхность
подложки была обращена в сторону выстилающей камеру бума
rи, а слои адсорбента находились на максимальном удалении друr
от друrа. Слой адсорбента не должен соприкаса'l'ЬСЯ с боковыми
стенками камеры.
Для лучше1'О разделения липидов рекомендуют активировать
хроматоrрафические пластинки, ПРОI'pев их при 110 оС в тече
ние 30 мин. Исследуемые образцы в полярном раС'l'ворителе Ha
носят на расстоянии около 2,5 см от I<Рая пластинки в виде по
лос или пятен при помощи микропипетки с тонким на.конечни
ком. Прежде чем начинать разделение, необходимо убедиться,
что растворитель полностью испарился из нанесенных образцов.
Уровень растворителя в камере должен быть примерно на 1 см
ниже уровня нанесенных образцов. Разделение заканчивают, коrда
фронт растворителя доходит до уровня на 1 2 см ниже BepXHe
1'0 края пластины. Последнюю вынимают из камеры, осторож:в:о
отмечают карандашом фронт растворителя и высушивают в BЫ
тяжном шкафу.
256
При разделении смеси липидо:е сложноrо состава ПрО130ДЯТ
двумерную хромаТО1'рафию с использованием двух систем paCT
ворителей. Для этоrо образец наносят в одном уrлу пластинки и
проводят разделение в первой системе растворителей, причем
пятна ли:пидов располаrаются вдоль одноrо Ерая пластинки. Ее
высушивают, поворачивают на 90" (пятна должны расцола1'аться
внизу) и проводят разделение во второй системе растворите.n:ей.
Все классы липидов нельзя разделить в одной системе раствори
телей. Поэтому выбирают систему ра<;творителей для разделе
ния определенноrо класса липидов. В случае полноrо анализа
липидов используют неСН:ОЛЬЕО сис'rем растворителей.
Лабораторная работа.м 14
Определение фОСфОДИПИДОВ эритроцитарВJdХ мембраи
методом ТОИRОСДОЙИОЙ хроматоrрафии
Материалы и оборуаован-ие: хлороформ, метанол, бензол, си
ЛИЕаrель В:СК или Н, стеклянные IIлаСТИНЕИ 6х6 см (9х12 см),
активированный 1'ипс (.или карбонат натрия). 25 % ный водный
раствор аммиака, ацетон, ледяная УЕСУСНая: Еислота, серна.я: кис
лота, бутанол, НИН1'идрин, раствор Драrендорфа, 42% ная хлор
на.я: кислота, молибдат аммония, аскорбиновая Еислота, кровь
доноров, стеЕлянные проБИРI{И, пипетки, центрифуrа, роторный
испаритель, хроматоrpафическая Еl\мера, шаровая мельница, во'"
дяна.я: баня, фотоэлектроколориметр КФR 3.
Ход pa OTЫ
Получить хорошо отмытые эритроциты по методике, описан
ной в лабораторной работе N2 1. 5 мл отмытых эритроци'l'ОВ обра
бо'rать 15 мл смеси хлороформ ме'l'анол (1:2). Смесь перемешать
стеклянной палочкой и ост ить в холодильнике ва 10 12 ч,
затем отцентрифуrироватъ при 5000 об/мин и отделить супер
натант и поместить ero в холодильник. Осадок реэкстра1'ИРОЕатъ
19 мл смеси хлороформ метанол вода (1:2;0,8) и снова цeHT
РиФУ1'ировать при тех же условиях. Супернатааты, цолученные
в результа'l'е двух экстракций, разбавwrь 10 мл хлороформа и
10 мл воды. В результате образуется двухфазная СIюrема, ниж-
ний слой которой состоит из хлороформа с растворенными в нем
липидами, свободными от за1'рязнений, а верхний из смеси
метанола и воды, содержащий водорастворимые нелипидные при
меси. Отделить хлороформную фрarщию, разбавить ее равным
17. 3аказ 3788
257
по объему количеством бензола и упарить на роторном испари
теле или под ТЯl'ой на водяной бане при 40 50 'с. Липиды взве
сить и растворить в нужном объеме хлороформа для получения
концентрации 10 мl'/МЛ.
Для ПРИl'отовления силикаrеля 220 r силика1'еля КСК, размо
лотоrо на шаровой мельнице, залить 2 л дистиллированной воды,
тщательно размешать и оставить для осаждения на 40 мин. За-
тем надосадочную жидкость слить в друrой стакан и довести
водой объем до 2 л. Осадок, накопившийся в течение 2 ч, пере
мешать в минимальном количестве воды и оставить на ночь.
Перед использованием к осадку добавить равное по объему ко-
личество воды для приrотовлениЯ рабочей суспензии. При ис-
пользовании силика1'еля Н 1,5 r носителЯ размешивают в 5 мл
раствора безводноrо карбоната натрия (6,8 м!' на 100 мл воды).
I
Для анализа фосфолипидов используют стеклянные пластин
ки размером 6х6 (9х12) см с закрепленным слоем силикаrеля.
Для это1'О к 25 мл 50 % ной суспензии силикаrеля добавить 80 мr
просеянно1'О и активированноrо rипса. 1 мл тщательно переме
шанной смеси нанести на предварительно обезжиренную CTeK
лянную пластинку и оставить влажную пластинку для Bыcыxa
НИЯ на rоризонтальной поверхности. Пластинки можно хранить
в эксикаторе над безводным хлористым кальцием.
Раствор 100 мк!' липидной фракции в 10 мкл хлороформа
нанести микрошприцем в уrол пластинки на расстоянии 1 см от
края. Предварительно хроматоrрафическая камера дожна быть
насыщена парами растворителей в течение 20 30 мин. XpOMa
тоrрафию провод.я:т сначала в вертикальном направлении в сис
теме 1 (хлороформ метанол 25 % ный водный раствор аммиа
ка в соотнОшении 13:7:1) до момента достижения BepXHero края
пластинки фронтом растворителей. После извлечения из KaMe
ры и просушивания пластинку поместить в друrую камеру с си
стемой 2 (хлороформ ацетон метанол ледяная уксусная кис
лота вода в соотношении 10:4:2:2:1) и хроматоrрафировать ли
пиды в перпендикулярном направлении. Затем необходимо вы-
сушить пла:стинку, опрыснуть 10 % ной серной кислотой в мета-
ноле и про.я:вить в течение 20 мин при 180 'с. В результате xpo
матоrpафическоrо разделения каждый фосфолипид занимает оп
ределенное место в виде пятна на пластинке (рис. 62). Индивиду
альные пятна фосфолипидов идентифицируют с помощью ЦBeT
ных реакций. Фосфатидилэтаноламин и фосфатидилсерин опре-
258
\)4
()З
оО 2
5 О
Рис. 62. Расположение индиви
дуальных фосфолипидов после npo
веденШI двумерной хроматоrрафJlli в
тонком слое СИЛИК8rеЛJl (Н. Ю. Каль
нова, 1992): 1 лизофосфатидилхо
лин; 2 сфиШ'омиелин; 3 фосфа
тидилхолин; {/ фосфатидилэтаноЛ
а.мlШ; 5 фосфатидилсерин
деляют с помощью НИНI'идрина. Для этоrо высушенные xpOMa
TorpaMMbl опрыскивают раствором НИН1'идрина (0,3 моль/л) в
бутан оле; после высушивания и наrревания пятна, соответствуIO
щие этим липидам, окрашиваются в розовый цвет. Для об:аару
жения холинсодержащих фосфолипидов пластинки опрыскива
ют раствором Драrендорфа. При этом пятна, содержащие фос
фатидилхолин, СфИН1'омиелин и лизофосфатидилхолин, окраш:и
ваются в ЯрКО рОЗ0ВЫЙ цвет.
Содержание фосфолипидов определяют по уровню неорrав:и
ческоro фосфата по калибровочной прямой, полученной при по
мощи однозамещенноro фосфорнокислоro калия СО1'ласно MeTO
дике, описанной в лабораторной работе N2 8. Предварительно после
высушивания на воздухе пластинок их проявдяют в парах йода.
Затем пятна быстро и аккуратно "обкалывают" иrолкой, потом
снимают специальной лопаточкой и переносят в пробирки. В каж
дую пробирку добавляют 0,1 мл 42 % ной хлорной кислоты, Ha
1'ревают при высокой температуре до обесцвечивания силикаrе
ля и испарения кислоты. После охлаждения добавляют 0,49 мл
хлорной кислоты, 0,81 мл воды, 0,4 мл 1,25 % Horo раствора
молибдата аммония и 0,4 мл 5 % ной аскорбиновой кислоты.
выдерживают в кипящей водяной бане в течение 5 мин и фото
метрируют.
17*
259
6.7. ОПРЕДЕЛЕНИЕ ФYJIIСЦИОНАЛЬНОЙ АКТИВНОСТИ
НЕКОТОРЫХ АНТИО!ССИДАНТНЫХ ФЕРМЕНТОВ
КРОВИ*
Лабораторная работа .м 15
Исследование каталитической активиости
су:пеРОRсиддисм:утазы в ЭрИТрОЦИ'1'ах крови доноров
Супероксиддисмутаза (СОД) .осуществляет защитную реакцию
в отношении супероксидноrо радикала кислорода, катализируя
реаJЩИЮ дисмутации 02 L с образованием пероксида водорода (см.
раздел 3.1). Б ОР1'анизме человеI,а СОД найдена практически во
всех op1'aHax и тканях; наиболее высокий уровень фермента об
наружен в эритроцитах, мозrе, печени, щитовидной железе.
Молекула СОД состоит ИЗ двух идентичных субъединиц с MO
лекулярной массой 1'6300 Да, связанных между собой дисуль
фидной связью.
СОД является одним из быстродействующих ферментов: кон-
станта скорости реаКЦИИ ферментативной дисмутации анион ра
дикаЛов составляет 2.1011 моль l. л l.
СОД как один из основных ферментов антиоксидантной сис
темы орrанизма участвует не только в реrуляции уровня высоко-
реакционноспособных супероксидных анион радикалов, но и KOH
тролирует концентрацию продуктов ПОЛ на стадии иницииро
вания цепей окисления.
AI<.тивная 1'енерlЩИЯ 02 L при воспалительных процессах co
пряжена с мобилизацией антиоксидантной системы, приводящей
:к' ИЕrду:кции синтеза СОД. При увеличении длительности токси
ческо1'О воздействия кислорода наблюдается истощение системы
антио:кислитеЛъной защиты орrанизма, повышается скорость pe
акций ПОЛ.
Применение лекарственных форм СОД или ,СОД активных
соединений позволяет снижать :концентрацию 02 L . Таким обра
зом, состояние антиоксидантной защиты и, в частности, уровень
СОД, отражает компенсаторные возможности орrанизма при раз
личных состояниях, связанных со своБОДЕ!ОРадикальной патоло
rией.
Материалы u otfopyiJosaltue: кровь доноров, хлорид натрия,
хлороформ, этанол, 0,01 моль/л Nа фосфатный буфер (рН 8,5),
* Раздел написан с участием О. В. Вашариной.
260
этилендиаМИlIтетраацетат натрия (ЭД'l'А), тетраметилэтилендиа-
мин ('l'ЭМЭД), нитросиний тетразолиевый (НСТ), рибофлавин,
калий йодистый, цеНТРиФУ1'а MPW 340, центрифужные весы,
спектрофотометр СФ-46, кварцевые кюветы для спектрофотомет-
ра, стеклянные пипе'rки, проб ирки, фильтровальная бумаrа.
Ход работ:ы
Метод определения активности СОД основан на ее способно-
сти конкурировать с красителем нитросиним тетразолиевым за
супероксидные анион радикалы, образующиеся при reнерации их
в системе тетраметилэтилендиамин рибофлавин. В ходе реак-
цИИ НСТ восстанавливается с образованием 1'идразинтетразолия,
xapaI-i.теРИ3УlOщеrося максимумом ПОl'лощ ния при 540 нм. В
присутствии СОД степень восстановления НСТ уменьшается.
Выделить эритроциты из крови доноров СО1'ласно методике,
описанной в лабораторной работе Nй. 500 мкл эритроцитов re-
молизировать на холоде с равным объемом дис'rиллированной
воды. Для удаления rеМО1'лобина эритроциты обработать 400 мкл
хлороформ-этаноловой смеси (3: 5 ),добавить 100 мкл воды И ос-
тавить на 30 мин при +4 'С. rемолизат центрифуrировать при
4000 об/мин в течение 10 мин, отобрать 50 мкл супернатанта и
смешать с 600 мкл дистиллированной воды.
Реакционная смесь содержит;
1. Фосфатный буфер 0,5 мл;
2. ТЭМЭД (0,05 моль/л) в 0,2 моль/л ЭДТА 0,5 мл;
3. НСТ (0,85 ммоль/л) 0,5 мл;
4. Вода дистиллированная 2,5 мл;
5. Раствор, содержащий СОД, 50 мкл;
6. Рибофлавин (0,034 ммоль/л) 1 мл.
В контрольную пробу раствор фермента не добавлять. PeaK
ция инициируется облучением лампой дневно1'О свет (мощность
20 Вт) на расстоянии 20 см в течение 5 мин. Для остановки
реакции прилить 0,5 мл раствора KJ (1 %). Оптическую плот
ность зареrистрировать на спектрофотометре СФ 46 при 540 нм.
За единицу активности фермента принимают такое e1'o количе
ство, которое обеспечивает ИН1'ибирование восстановлени.я: НИТ-
росине1'О тетразолиевоrо на 50 %. Активность СОД рассчитыва
ют по формуле
А'= (К O)/K'lOO %,
261
rде А активность фермента в усл. единицах; К оптическая
плотность контрольной пробы; О оптическая плотность опыт-
ной пробы.
Лабораmорnая рабоmа ом 16
Определение активности катал:а3Ы в эритроцитах крови
человека спектрофотометрическим методом
Каталаза (пероксид водорода: пероксид водорода оксидоре
дуктаза, 1.11.1.6) разрушает пероксид водорода, образующийся
прямым путем при восстановлении кислорода или более слож.
ным путем при дисмутации супероксидных радикалов. Этот фер
мент катализирует двухэлектронное восстановление Н 2 О 2 дО Н 2 О,
используя Н 2 О 2 как донор электрона. Каталаза в клетке локализо-
вана в микротельцах (пероксисомах), входит в состав лизосом.
Молекулярная масса каталазы из различных источников
составляет 225 251 кДа. Молекула каталазы состоит из 4 иден.
тичных субъединиц и 4 l"рупп 1'ематина.
Следует отметить, что каталаза проявляет и умеренную
пероксидазную активность, Т.е. катализирует реакцию окисле
ния ОР1'анических веществ пероксидом водорода.
Считают, что каталаза все1'да присутствует в биосистемах, 1'де
происходят процессы клеточноrо дыхания с участием цитохро
мов, Т.е. там, rде в результате восстановления кислорода образу-
ется пероксид водорода, который весьма токсичен для живой клет
ки и поэтому должен быть удален.
В связи с тем, что каталаза локализуется преимущественно в
печени и эритроцитах, целесообразно определять ее активность
в сыворотке крови при заболеваниях печени и 1'емолитических
процессах.
Материалы и оборуаование: кровь доноров, хлорид натрия,
хлороформ, этанол, 0,01 моль/л Nа-фосфатный буфер (рН 6,7),
этилендиаминтетраацетат натрия (ЭДТА), пероксид водорода,
10 % ный раствор серной кислоты, ЦентриФУ1'а МPW.340, цент-
рифужные весы, спектрофотометр СФ.46, кварцевые кюветы для
спектрофотометра, стеклянные пипетки, пробирки, фильтроваль.
ная бума1'а.
Работа включает 3 этапа (а, б, в).
а) Получение эритроцитов
Эритроциты получают из цельной крови человека путем
центрифуrирования на цеНТРиФУ1'е' MPW.340 при 1500 об/мин
262
в течение 15 мин. Сыворотку отбирают с помощью пастеровской
пипетки, добавляют к эритроцитам равный объем 0,9 % Horo
раствора NaCl и повторно центрифу1'ИРУЮТ в том же режиме.
Эритроциты отмывают таким способом в растворе N aCl 3 раза.
Затем 2 мл эритроцитов разводят 0,9 % HЫM раствором NaCl в
соотношении 1:1000 до значений оптической плотности D==0,7
при 410 нм, что соответствует концентрации 1,5'108 кл/мл.
б) Получение rемолизата эритроцитов, свободно1'О от rемо1'ЛО
бина
К 0,5 мл эритроцитов добавляют 0,5 мл бидистиллированной
воды для нарушения целостности эритроцитарных мембран и oc
тавляют на холоде в течение 15 20 мин.
rеМО1'лобин осаждают хлороформ этаноловой смесью (1 :5). Для
ЭТО1'о к 1 мл 1'емолизата добавляют 200 мкл хлороформ этаноло
вой смеси. Затем rемолизат центрифу1'ИРУЮТ в течение 10 мин
при 3000 об/мин. Отбирают супернатант и в нем определяют
активность ка.талазы, предварительно разбавив e1'o бидистилли
рованной водой в соотношении 1:10.
в) Определение функциональной активности каталазы
Принцип метода. Опредsление активности каталазы OCHOBa
но на ее способности БЫСОI<оэффективно катализировать peaK
цию разложения перо:ксида водорода на воду и кислород.
Реакционная смесь содержит следующие растворы:
1. Фосфатный буфер (0,01 моль/л), рН 6, 7' 0,5 мл.
2. Этилендиаминтетраацетат натрия (ЭДТА) (10-4 моль/л)
0,5 мл.
3. Пероксид водорода (0,015 моль/л) 2 мл.
4. Исследуемый образец 0,1 ил.
ДЛЯ определения активности каталазы в контрольную и опыт
Бую пробы, содержащие исследуемый ферментный раствор, дo
бавляют фосфатный буфер, перо:ксид водорода и ЭДТА. Пр06ир
ки оставляют на 10 мин при комнатной температуре, предвари
тельно остановив реакцию в контрольной пробе добавлением '1 мл
10 % Horo раствора серной кислоты. 'l'акой же объем серной
кислоты добавляют в опытную пробу после окончания инкуба
ции. Каталазную активность определяют на спектрофотометре
СФ 46 при ДЛИне волны 250 нм.
Холостая проба для учета спонтанной реакции разложения
пероксида водорода отличается тем, ,Ч,то вместо образца, содержащеro
каталазу , в нее добавляют такой жf4 объем фосфатноrо буфера.
263
За единицу активности (А) принимают такое количество (в MO
лях) пероксида водорода, которое- раЗJfОЖИЛОСЬ при иrщубации в
единицу времени:
А = ДО . У[ . с[ . n (моль/мин на 1 MI:' беЛI а),
Dx . У 2 . С 2 . t .
rде D разность оптических плотностей опытной и контрольной
проб; Dx оптическая плотность холостой пробы; V j общий
объем инкубациоппой смеси; V 2 объем исследуемOf'О образца;
С ! концентрация НР2; С 2 концентрация белка в пробе; n
фактор разведения; t время инкубации.
Лабораторная работа М 17
Исследование функциональной активцости
rлутатионреДyIстазы эритроцитов
rлутатионредуктаза (NAD(P)H: окисленный rлутатион оI<'.СИ-
доредуктаза), фермент класса оксидоредyR'l'аз, катализирующий
восстановление окисленноrо rлутатиона:
GSSG + NADPH + Н+ 2GБН + NADP+,
Т'де GS остаток rлутатиона; NADPH и NADP+ COOTBeTCTBeH
но восстановленные и окисленные формы кофермента никотин-
амидадениндинуклеотидфосфа та.
rлутатионредуктаза состоит из двух одинаковых субъединиц
с молекулярной массой каждоЙ 50 55 тысяч: полость между
ними в ходе реакции' занимае'l' 1'лутатион. Субъединицы содер-
жа'l' но 4 структурных домена, на одном конце KOTopo1'O располо-
жен остаток флавипадениндинуклеотида, на дрyroм NAD(Р)Н свя
зыающиеe участки. Наиболее полно изучено строение 1'лутати-
овредуктазы эритроцитов человека, субъединица которой состо-
ит из 478 аминокислотных остатков и содержит по 30 % а-сни-
ралей и P CTPYI TYP.
Активность 1'лутатионредуктазы в сыворотке крови повыша-
ется при инфаркте миокарда, онколоrичесн:,их заболевэ-ниях и 1'e-
натитах, а в эритроцитах при наследственной неДОС'l'аТОЧНОС'fИ
rлюкозо-6-фосфатде1'ИДРО1'еназы, что позволяет использовать оп-
ределение уровня 1'лутатионредуктазы в диarностических целях.
Материалы и оборуJоеаJiuе: кровь допоров, хлорид натрия,
хлороформ, эта:нол, 0,067 моль/л Na-фосфа'I'НЫЙ буфер (рН 6,6),
окисленный I'лутатион, NADPH, центрифyrа MPW-340, центри-
фужные весы, спектрофотометр СФ-46, кварцевые юоветы для
264
спектрофотометра, стеклянные пипетки, пробирки, фильтроваль
ная бумаrа.
ХОД работы
Получить отмытые эритроциты по методике, описав:ной в ла
бораторной работе ;м 1. 0,5 мл эратроцитарной массы 1'емолизи
ровать с 10 мл 0,067 моль/л фосфатноrо буфера (рН 6,6) и O Ta-
вить на холоде 15 мин.
е целью осаждения 1'еМОl'лобина к 1 мл 1'емолизата добавить
0,2 мл хлороформ-этаноловой смеси (1:5), тщательно переме
шать, выдержать на холоде 5 мин и цеНТРиФУ1'ировать при
5000 об/мин в течение 10 мин. Супернатант использовать для
определения активности 1'лутатионредуктазы.
0,1 мл супернатанта добавить в спектрофотометрическую КЮ
вету, содержащую 2,9 мл 0,067 моль/л фосфатв:оro буфера (рН 6,6)
с 0,027 ммоль/л окисленноro rлутатиона и 0,02 ммоль/л NADPH.
Оптическую плотность раствора измерить при длине волны 340 нм
на спектрофотометре СФ-46 сразу после добавления сynернатанта
и через 5 мин после инкубации реакционной смеси. Активность
1'лутатиов:редУктазы (А) рассчитывают по формуле
А= ДD З40 ,У lIр . q
в . / . V СУl1ер . t '
rде .1D 840 "" D 1 D 2 изменение величкны оптической плотнос-
ти реакционной смеси за 5 мин; V конечный объем пробы
пр
(3 мл); q фактор разведения эритроцитов; f молярный коэф-
фициент ПО1'лощающеrо соединения (NADPH), равный 6,2'103 л
(моль-l,см l); 1 длина оптическо1'О пути, см; V объем до-
cynep
бавленно1'О супернатанта (0,3 мл); t время инкубации реакци-
онной смеси (5 мин).
Каталитическую активность rлутатионредуктазы выражают
в мкмолях превращенноrо NADPH в 1 мин на 1 мл эритроцитов.
6.8. ИЗУЧЕНИЕ УЧАСТИЯ АКТИВНЫХ ФОРМ
КИСЛОРОДА В ПРОЦЕССАХ УФ-МОДИФИКАЦИИ
БЕЛКОВЫХ МОЛЕКУЛ
Для выявления участия активных форм кислорода в про-
цессах фотомодификации белковых молекул проводят МОДель-
ные ЭI<.сперименты с использованием растворов биополимеров (в
частности, лактатде1'идроrеназы), а также акцепторов и тушите-
лей активных r<.ислородных :метаболитов.
18. Заказ 3788
265
Одним из распространенных тушителей синrлетноrо молеку
лярноrо кислорода является азид натрия NаN з . Это соединение
обладает широким спектром действия, что обусловлено элеК'l'
ронной конфиrурацией e1'O молекул. !'руппа N з линейна:
N == N+== N: N N+ "" N: N N == N:+
Ее строение представляет собоЙ суперпозицию трех резонан
сных структур с частичными зарядами у различных атомов азо
та. ВероЯ'l'НО, это способствует взаимодействию иона азида с ком-
плементарными участками аминокисло'rных остаТIЮВ беЛIЮВОЙ
rлобулы. Азид натрия используе'l'СЯ КЮС эффективный ионофор,
e1'o орrанические производные применяют в химической энзи-
МОЛО1'ии в качестве фотореактивируемых поперечносшивающих
a1'eElToB.
D маннит ШИрОlСО распространенное в природе вещес'l'ВО
обладает сродством к ОН-радикалам. :Кроме To1'o, e1'o фотопро-
текторное действие может быть связано с образованием комп
лекса белок спирт, более резистентно1'О, чем свободный биопо
лимер.
Серотонин (5-1'идрокситриптамин) является БИОЛО1'ичеCIШ ак-
тивным веществом из 1'руппы индолилалкиламинов:
HOWCH'4CH' NH'
N
I
Н
Он принимает участие в различных фИЗИОЛО1'ических про
цессах. E1'o рассматривают как химический медиатор нервных
возбуждений, антидиуретический 1'ормон, 1'емостатичеСl':ИЙ a1'eH'r,
фактор роста, медиа'rор аллерrических реакций и др. У становле-
ЕЮ, что серотонин проявляет выраженный фотопро'rекторный эф-
фект по отношению к молекулам rемопротеидов (феррицитох-
рома С, каталазы и ОКСИ1'емоrлобина). По всей вероятности, за
щитное действие это1'о биоrенноrо амина может быть обусловле-
но как конкуренцией e1'o молеl':УЛ за активные частицы (первич
ные и пероксидные радикальr) Уф..фо'roЛ>oJЗа водных растворов
белков, так и образованием комплекса серотонин биополимер,
более резистентноrо по сравнению со свободным белком.
Лактатде1'идроrеназа rликолитический фермент, катали-
зирующий обратимую реакцию окисления молочной кислоты с
266
образованием пировиноrрадной кислоты в присутствии I-,офер
мента NAD (см. раздел 4.3).
лдr обнаруживается во всех клетках и биолоrических жид-
костях. Следует обратить внимание на 'l'OT фак').', что уровен:ь фер-
мента в эритроцитах в 100 раз выше, чем в сыворотке. Поэтому
при определении erO активности в сыворотке крови 1'емолиз эрит-
роцитов должен быть полностью исключен. Также необходимо
быстро отделять crycToK от сыворотки. Активность лдr моl'УТ
подавлять rепарин и оксалат,
Повышение активности лдr имеет место при некрозе TKa
ней, особенно при остром поражении сердца, повреждении эрит
роцитов, почек, скелетных мышц, печени, ле1'КИХ и кожи. Значи-
тельное увеличение активности фермента сопровождает rемоли-
тические анемии, связанные с дефици'roм витамина В 12 и фолие-
вой кислоты, а также эритремию. Возрастание уровня лдr ха-
рактерно для острой фазы и:в:фекционно1'О rеnа').'ита.
Определение изоферментноrо CneI<Tpa лдr также использу-
ют в диа1'ностических цеЛЯХ. Изоферменты сывороточной лдr
выявляются после электрофореза при рН 8,6 на крахмальном,
ю'аровом или полиакриламидном rелях. При инфаркте миокар
да обнаруживается увеличение содержания лдr 1. Относитель
ное повышение уровня лдr 4 и 5 наблюдае'rся при остром 1'епа
ТИ'l'е, тяжелом мышечном повреждении, дерматомиозите, мышеч-
ной дис'rрофии.
Лабораторная работа М 18
Исследование каталитической аltтивпости лактатдеr:идроrе-
пазы спектрофотометричес:ким метоДОМ
Принцип метода. n основе даИНОl'О определения функциональ
ной активности лдr лежит ме'I'ОД Берr Мейера, сущность КОТО-
poro заключается в оценке скорости окисления NADH, реrистри-
руемой спектрофотометрически при длине волны 340 им.
Материалы u оооруаование: 0,1 моль!л Nа фосфатный бу
фер (рН 7,4), пируват натрия, буферный раствор J):актатде1'ИДрО-
1'еназы из сердца свиньи или скелетных мышц свиньи, спектро
фотометр СФ-46, кварцевые кюветы, стеКЛЯНБые пипетки и про-
бирки, фильтровальная бума1'а, секундомер.
18*
267
Ход работы
Если в работе используется коммерческий препарат лдr из
мышц свиньи (кристаллическая суспензия в 2,2 моль/л сульфа
те аммония), то он должен быть предварительно обессолен MeTO
дом rель хромаТО1'рафии на колонке (15хl,5 см), упакованной
сефадексом G 25. Выделение лдr из сердца свиньи провод.ят по
методике, описанной в лабораторной работе N2 17.
Концентрацию растворов фермента определяют на cneKTpo
фотометре СФ 46 при длине волны 280 нм с использованием
коэффициента молярной экстинкции 1,96'105 Л (моль l. см Ч для
мышечной и 0,196-105 л (моль l 'CM l) для сердечной изоформы.
Реактивы (указаны конечные концентрации)
а) для лдr из мышц свиньи:
1. Nа фосфатный буфер 0,1 моль/л (рН 7,4).
2. лдr (буферный раствор) 10 8 моль/л.
3. Пируват натрия (буферный раствор) 1,5'10 3 мо:m./л.
4. NADH (буферный раствор 5,4'1O 5 моль/л.
б) для лдr из сердца свиньи:
1. Nа фосфатный буфер 0,1 моль/л (рН 7,4).
2. лдr (буферный раствор) 10 8 моль/л.
3. Пируват натрия (буферный раствор) 0,15'10 3 моль/л.
4. NADH (буферный раствор 5,4'10 5 моль/л.
В кварцевую кювету для спектрофотометра поместить 2,8 мл
раствора фермента и 0,1 мл NADH. На спектрофотометре СФ 46
при длине волны 340 нм измерить оптическую плотность Dl'
Затем в кювету прилить 0,1 мл пирувата натрия и через 30 с
зареrистрировать оптическую плотность D 2 . Каталитическую aK
тивность лдr (А) рассчитывают по формуле
А = ДD З40 . V llp
е .f. t '
1'де LJ)З40 == Dl D 2 изменение величины оптической плотности
реакционной смеси при 340 нм; е молярный коэффициент по-
1'лощающе1'О соединения (NADH), равный 6,22'103 л (моль-l,.см l);
1 длина оптИческоrо пути (1 см); t время инкубации реакци-
онной смеси (30 с); V np конечный объем реакционной смеси
(3 мл). Активность лдr выражают в микромол.1IX превращенно-
ro NADH в минуту.
268
Лабораторная работа .м 19
'Выделение лактатдеmдроrенаЗJld из сердца свиньи
Материалы и оборуiJО8aJше: 0,2 моль/л Nа фосфатны:й бу
фер (рИ 7,2), 0,1 моль/л Nа фосфатны:й буфер (рН 7,2),0,1 моль/л
Nа фосфатны:й буфер (рН 7,5), сульфат аммония мелкоизмель
ченный, сульфат аммония (0,5 насыщения), ацетон, хлорид Ha
трия"(лед), ХЛОРИД калЬЦИЯ, концентрированный раствор аммиа
ка, 1'ОМО1'енизатор ("Honiogenizer type 302", Польша), маrнитная
мешалка, цеНТРиФУ1'а MPW 360, центрифужные npобирки, CTeK
лянная посуда, фильтровальная бумаrа.
Ход работы
Для ПРИ1'отовления кал:ьций фосфатноl"О 1'еля к 0,5 л
0,44 моль/л Na 2 HP0o\ при энерrичном перемешива:s:ии быстро дo
бавить 0,5 л 0,66 МОJfЬ/л CaC1 2 . Концентрированным раствором
аммиака довести рН раствора до значений 8,2 8,6. Полученную
суспензию поместить в стеклянный цилиндр объемом 2 л, Ha
лить бидистиллированную воду и перемешать. После оседания
1'еля жидкость декантировать. Оставшуюся суспензию вновь за
лить водой, перемешать и отстаивать. Анало1'ИЧНУЮ процедУРу
повторять до тех пор, пока в промывны:х. водах не исчезнут ионы
хлора. После этоrо общий объем суспензии довести водой до 1 л.
rель надо 1'отовить за 1 2 дня до использования и хранить в
холодильнике.
Все работы с растворами фермента необходимо проводить :в:а
ледяной бане и в холодной комнате.
ЭкстраlCЦlJ.Я,. Охлажденные свиные сердца освободить от жиро
вой и соедииитеJfЬНОЙ ткани и l"омоreнизировать при 10090 об/мин
("Homogenizer type 302", Польша). Около 400 l' измельченной TKa
ни залить 1,5 л холодной бидистиллирован:ной воды, перемешать в
течеI;l:ие 20 мин при помощи маmитной меmалв:и, отжать через
несколько слоев марли и фильтровать для удаления жира через
стеклянную вату.
Обработка lCальций-фосфатным zеле.м.. К экстракту при ne
ремещивании добавить 0,3 л суспензии кальций фосфатноro 1'еля.
Пере.:мешивание продолжать еще 5 мин и. затем отстаивать. Че
рез 30 мин прозрачную жидкость над осадком просифонировать
и отбросить, а оставшуюся суспензию цеНТРиФУ1'ировать 15 мин
при ;2000 g на рефрижераторной цеНТРиФУ1'е МPW-360 (Польша).
269
К осадку добавить 0,2 л 0,2 моль/л фосфатноrо буфера с рН 7,2,
перемешать до получения однородной суспснзии и центрифу1'И-
ровать 15 мин при' 2000 g. Надосадочв:ую жидкость слить, а к
осадку добавить 0,15 л 0,2 моль/л фосфатноrо буфера (рН 7,2).
Тщательно перемешать и центрифуrировать 15 мин при 2000 g.
Первое осажrJенuе сульфатом ШИМOltltJl. К объединенным цен-
ТРиФУ1'атам, полученным на предыдущей стадии, при перемеши
вании отдельными порциями добавить сульфат аммония до 0,6
насыщения. Перемешивать еще 15 мин, затем центрифуrировать
при 2600 g в течение 30 мин.
Первое осажrJеlluе ацетоном. Осадок растворить в 40 мл
0,1 моль/л фосфатноrо буфера с рН 7,2 и к полученному pac'rBo
ру добавить' предвари'rельно охлажденный до 15 'С ацетон в
количестве 60,4 мл на каждые 100 мл ферментативно1'О раство-
ра. Поднять температуру до 13 'С и инкубировать смесь 10 мин,
затем центрифуrировать при 2600 g в течение 15 мин. К осадку
добавить 20 мл сульфата аммония 0,3 насыения.. Пере мешать
до получения однородной суспензии и через 30 мин центрифуrи
ровать 40 мин при 2600 g.
Второе осажоение сульфатом аММОНИJl. R центрифуrату до-
бавить сульфат аммония до 0,5 насыщения. Перемешать в тече-
ние 10 мин и оставить в холодильнике на 6 8 ч. Центрифуrиро
вать 40 мин при 2600 g и осадок растворить в 5,5 мл холодной
бидистиллированной воды.
Второе осажоеJtuе ацетоном. К ферментному раствору, как
и в первый раз, добавить ацетон, охлажденный до 15 'с. Темпе
ратуру поднять до 18 'С, выдержать 10 мин, затем центрифуrи
ровать 15 мин при 2600 g. Осадок суспендировать в 2 мл сульфа
та аммония 0,3 насыщения.
ICристаллuзаЦИJl. К ферментному раствору присыпать суль
фат аммония до 0,5 насыщения. Перемешать и оставить в холо
дильнике на ночь. ЦентриФУ1'ировать 20 мин при 2600 g и oca
док растворить в сульфате аммония 0,3 насыщения. К суспензии
добавить сульфат аммония до 0,5 насыщения. Описанную проце-
дуру повторить три раза. Суспензию кристаллов фермента xpa
нить в холодильнике.
В процессе выделения лдr содержание белка на различных
стадиях необходимо контролировать по методу Лоури (см. лабо
раторную работу М 2).
270
Степень rомоrенности полученноrо препарата анализируют
методом диск электрофореза в полиакрилаМИДRОМ rеле (см. ла-
бораторную работу N2 20).
Лабораторная работа М 20
Исследование изофермеитиоrо спектра лактатдеrидроrена
зы методом электрофореза :в полиакриламидиом rелс
Определение изофеРМI:JНТОВ ЛДr методом ДИСI<"электрофоре
за в полиакриламидном rеле основано Шl различиях в зарядо
вом СОСТОянии и электрофоретической подвижности молекул
разных изоформ белка.
Материалы u оборуiJоваltuе: соляная кислота, ТРИС1'идрокси
метиламинометан (трис), ТЕМЕД, а:криламид, би:са:криламид (БИС),
персульфат аммония, рибофлавин, сахароза, бромфеноловый си
ний, феназинметасульфат, нитросиний тетразолиевый, хлорид
ма1'НИЯ, хлорид натрия, фосфатный буфер (р:Н 7,4), NADH, лак
тат натрия, уксусная кислота, парафин, установка для диск-элек
трофореза, термостат, денситометр, РТУТlIO кварцевая лампа.
Ход работы
Для получении мелкопористоrо (5,5 %) rеля, в котором ocy
Ществляется разделение веществ в соответствии с их зарядом и
молекулярной массой, необходимо смешать 1 объем раствора А щ
(48 мл 1 н HC1, 36,6 l' трис и 0,23 мл ТЕМЕД на 100 мл бидистил-
лированной воды), 2 объема В (28 l' а:криламида и 0,735 l' БИС в
щ
100 мл дистиллированной воды), 4 объема раствора 2 (0,14 % ный
щ
раствор пер сульфата аммония) и добавить 1 объем ДИСТИЛJIИро-
ванной воды. Осторожно перемеrлав стеклянной палочкой полу
ченную смесь, внести по 2 мл ее в каждую трубку (один :конец
трубки заклеить и заrерметизировать расплавленным парафи-
ном). Для предотвращения ИН1'ибирования молекулярным :кис
лородом процесса полимеризации 1'еля и формирования ровной
поверхности последне1'О сверху раствора наслоить бидистилли-
рованную воду на высоту 5 7 мм. Процесс полимеризации за-
канчивается через 30 40 мин, о чем свидетельствует появление
четкой rраницы раздела между rелем и водой и леrI{ое HarpeBa-
ние трубок.
На слой разделяющеrо I'еля нанести 0,2 МЗI I{онцентрирую
щеrо крупнопористоrо 1'еля (7 %), который 1'отовят смешивани
ем 1 объема Б щ (24 мл 1 н HC1, 2,99 l' трис и 0,23 мл ТЕМЕД на
271
50 мл бидистиллированной воды), 2 объемов раствора r (5 l' aK
щ
риламида и 1,25 l' БИС в 50 мл воды), 1 объема Дщ (0,004 % ный
раствор рибофлавина) и 4 объемов раствора Е (40 % ный pa
щ
створ сахарозы). Полимеризация протекает за 10 15 мин в yc
ловиях облучения светом ртутно-кварцевой лампы. Для исклю-
чеF.IИЯ контакта с кислородом воздуха на rель также аккуратно
наслоить воду на высоту 3 5 мм.
С поверхности заполимеризовавше1'ОСЯ концентрирующеrо
1'еля удалить воду и внести образец (смесь изоферментов лдr,
разведенную 40 % -ным раствором сахарозы в отношении 1:1) в
количестве 0,2 мл. Наслоить раствор лидирующею красителя
(0,001 % ный раствор бромфенолово1'О СИF.Iе1'О). Эта часть колон
ки непосредственно соприкасается с электродным буфером при
электрофорезе, поэтому верхнее наслаивание заканчивается элек-
тродным буфером. Наслаивание проводят очень осторожно, из
беrая: перемешивания образца с буфером, во избежание потери
вещества.
Состав электродноrо буфера (рН 8,3): 6 r трис и 28,8 r 1'лици
на на 1 л бидистиллированной воды. Перед использованием ero
F.Iеобходимо разбавить в 10 раз.
Собрать прибор для диск-электрофореза, поместить e1'o в xo
ЛОДИЛЪF.Iик И подсоединить к соответствующим полюсам выпря
мителя тока. Первые 15 20 мин электрофореза сила тока не
должна превышать 0,002 А на каждую трубочку. Такая низкая
величина тормозит движение мелких частиц образца в раствор
Bepxнero сосуда. По истечеmm этоrо срока силу тока увеличить
дО O,004 0,005 А на 1'ель.
После окончания электрофореза извлечеНF.Iые столбики по
местить в красящую смесь для проявления изоферментов лдr.
в основе тетразолиевоrо метода выявления локализации
ферментов в rелях лежит образование нерастворимых хромо-
reHHыx веществ формазанов. Схематически их образование
может быть представлено последовательностью реакций:
NADH + феназинметасулъфат (ФМС) ФМС
посет
ФМС ВОССТ + нитросиний тетразолиевый (НСТ)
НСТ во . ст (диформазан, окрашенный продукт)
ФМС выступает в качестве переносчика электронов в цепи
реакций.
272
В состав инкубационной средЫ входят 8 мл 1 моль! л раство-
раЛllliтата натрия, 4 мл. раствора NADИ (10 мr/мл), 8 мл 0,1 моль/л
раствора NaCl, 8 мл 0,005 молъ/л раствора MgC1 2 , 10 мл
0,05 моль! л фосфат:в:оrо буфера (рИ 7,4), 2 мл раствора ФМС
(1 мr/мл) и 20 мл НСТ (1 М1'/мл).
Каждый столбик ПAAr поместить в отдельную пробирку, за
лить инкубационной смесью и поставить в термостат при 'rемпе
ратуре 37 'с на 1 1,5 ч (или инкубировать при комнатной тем-
пературе в тече:в:ие ночи). ПО истечении срока инкубации rели
ополос:в:уть водой и перенести в пробирки, содержащие раствор
уксусной кислоты (7 %). При температуре 5 'с и в темноте диск
электрофореrраммы изоэнзимов лдr MorYT сохраняться не более
7 дней. В течение этоrо срока их денситометрируют, изобража-
ют 1'рафически изоферментный спектр лдr (по оси абсцисс
длина столбика 1'еля, по оси ррдинат оптическая плотность),
затем определяют содержание каждоrо изофермента весовым
методом.
Лабораторная работа .м 21
ИССJIедование УФ-чувствитеJIЬИОСТИ JIактатдеrидроrев:азы
в присутствии некоторых :модифицирующих areJITOB
Материалы и оборуiJ08ание: 0,1 моль/л Nа-фосфатный бу-
фер (рИ 7,4), пируват натрия, NADH, буферный раствор Лllliтат-
де1'идроrеназы из сердца свиньи или скелетных мышц свиньи,
спектрофотометр СФ-46, кварцевые кюветы, стеклянные пипет-
ки и пробирки, фильтровальная бума1'а, секундомер, установка
для УФ облучения биосистем.
Ход работы
1 вариант
Объектом исследования является roтовый препарат фермен
та, обессоленный путем rель-хроматоrрафии на сефадексе G-25
(см. лабораторную работу N2 18). Преподаватель выбирает один
из вариантов эксперимента. В качестве модифицирующе1'О ыeH
та используется раствор:
а) азида натрия (3,2'10-3 моль/л);
б) D-маинита (5,5'10-5 моль/л);
в) серотонина (1.10-.5 моль/л).
Затем необходимо провести определение функциональной Illi
тивности:
273
1) нативно1'О фермента (см. ла60ра'rорную работу NQ 18);
2) УФ облученно1'О в дозе 3,02 кДж/м 2 свободноrо фермента;
3) фермента в присутствии модифицирующеrо арента;
4) фермента, УФ облученноrо в той же дозе в присутствии
модификатора.
УФ облучение образцов проводи'l'Ь соrласно меТОДИI е, опи
санноЙ в лабораторной работе N!! 5. Данные представить в виде
табл. 21.
Таблица 21
УФ-иноуцированные И:Jмененu.л ферментативноЙ aJстивности
JlаJCmаmiJеi!иiJроzeна:Jbt в прuсутст6UИ .lIf.ооифuцuрующе20
а8ента
Фсрментативнал АКТИВRОС1'Ь лдr, '% от
Bap!IaHT опыта aI ТИВНОСТЬ лдr, активности нативноrо
МRМОЛЬ/МИН фермента
Нативный фермент 100 %,
лдr, УФ-облучеIШая в
свободном состоянии
лдr + модифицирующий
ar'eHT
лдr, УФ-облученная в
прn:сутствии химичеСRОro
RI'eHTa
На основании полученных результатов сделать заключение о
причинах и XapaRTepe изменений величин ферментативной Ю
тивности ЛДr при УФ-облучении белка в свободном СОС'l'оянии
и в присутствии модификатора. Какое действие может оказы
вать модифицирующий арент (азид натрия, D маннит, серотонин)
на структурно Функциональное состояние белковой молекулы при
УФ облучеF.IИИ растворов исследУемо1'О фермента?
II вариант
В качестве объекта исследоваF.IИЯ используют препарат фер
мента, полученный из сердечной МЫШЦЫ свиньи по методике,
описанной в лабораторной работе NQ 17.
КОНТРОЛЬНЫЕ ВОПРОСЫ
1. Опишите методику выделения эритроцитарных мембран из I pO
ви доноров.
2. Какие химические реакции лежат в основе определения содер-
жания белка в мембранных стру:ктурах по методу Лоури?
274
3, Н:акие принципы лежат в основе определения ферментативной
активности мембрнносвязuнных ацетилхолин:эстеразы и Na', I\.'-АТФа-
зы?
4. Что предстаВЛЯЮ1' собой флуоресцентные зонды? Назовите пара-
метры, используемые для харar теристики флуоресцентных зондов.
5. Кarщвы направления использования флуоресцентных зондов в
мембранолоrии?
6. Что предстаВ.'Iяет собой спеI 'rр люминесценции вещества?
7. Почему люминесцентные свойства флуоресцентных зондов изме-
няются при связывании их с рааJIИЧНЫМИ мембранными структурами?
8. Опишите фи:зико химические методы модификar и:и биомембран.
9. Почему фосфолипазы относят к химическим модификаторам био
мембран?
10. На каком основании Iщтuлазу относят к антиоксидантным фер-
ментам?
11. Кarше фУНIщии в Iшетке выполняет rлутатионредуктаза?
12. Кarше методы используют для обнаружения и доказательства
фактов участия aI<ТИВНЫХ форм кислорода в УФ превращения:х био-
МaI ромолеI УЛ? I aIЮВЫ их преимущества и недостатки?
список ОСНОВНОЙ ЛИТЕРАТУРЫ
Алоертс В., Врей д., Льис Дж. и ар. Молекул.ярнал биолоrи.я клет
ки: В 3 x т. М.: Мир, 1994. Т. 1. 517 с,
АllтоJЮВ В. Ф. Липиды и ионная проmщаемость мембран. М.:
НауЕа, 1982. 151 с.
Артюхов В. r., Вашарu1Ш О, В., Вашаllов Р. А., На1СваСИllа М. А.,
ПутUllцева О. В. ОЛИI'омерные белки: структурно-функциональные MO
дификации и роль субъединичных контактов. Воронеж: Изд-во Bry,
1997. 264 с.
Артюхов В. Р., Ковалева Т. А., Шмелев В. П. Биофизика: Учебное
пособие. Воронеж: Изд-во BrY, 1994. 336 с.
Артюхов В. Р., ЛутUllцева О. В. Оптические методы анализа ин-
ТВЕТНЫХ И модифицированных биолоrических систем. Воронеж: Изд-
во BrY, 1996. 240 с.
Биолоrические мембраны. Методы! ПОД ред. ДЖ. Б. Финдле.я,
У. r. Эванза. М.: Мир, 1990. 424 с.
Биофизика: Учебник! Под ред. П. r. Костюка. Киев: Выща ШR.,
1988. 504 с.
Биохимическое исследование мембран! Под ред. Э. Мэдди. М.:
Мир, 1979. 460 с.
БолiJырев А. А. БИОЛО1'ические мембраны и транспорт ионов. М.:
Изд во мrY, 1985. 208 с.
Введение в биомембраноло1'ИЮ: Учебное пособие ! Под ред.
А. А. Болдырева. М.: ИЗk:ВО МI'Y, 1990. 208 с.
ВлаiJuмuров Ю. А., Apv:a1CoB А. Н. Перекисное окисление ЛШIИ,Цов в
БИОЛО1'ических мембранах. М,: Наука, 1972. 252 с.
Влаоимиров Ю. А., Доорецов Р. Е. Флуоресцентные зонды в иссле
довании биолоrических мембран. М.: Наука, 1980. 320 с.
Влаоu.м.ирое Ю, А., Потапен.ко А. Л. Физико-хцмические основы
фотобиолоrичеСRИХ процессов. М.: Высшая Школа, 1989. 199 с.
rеllн.ш: Р. Биомембраны: Молекулярная структура и функции. М.:
Мир, 1997. 624 с.
Некое В. Р., Берестовский r. Н. Динамическая СТРуЕтура ЛШIидно-
1'0 бислон. М.: НауЕа, 1981. 293 с.
Н еков В. Р., ВерестовС1Сий r. Н. Липидный бислой биолоrических
мембран. М.: НауЕа, 1982. 224с.
Кшаеа Л. Биомембраны. М.: Высш. шк, 1985. 303 с.
Лонев С. В. Структурная лабильность БИОЛО1'ических мембран и ре-
rул.яторные процессы. Минск: НауЕа и теХНИка, 1987, 240 с.
ЛрутецкШl 3. н., Лонскuй А. В. Биофизика мембран: Учебное посо
бие. СПб.: Изд :во СПб. YH Ta, 1994. 288 с.
Рощупкин Д. Н., Артюхов В. Р. Основы фотобиофизИRИ. ВОРО-
неж: Bry, 1997. 116 с.
276
Рубuн. А. Б. Биофизика: В 2-х кн. Кн. 2: Биофизика клеточНЫХ
процессов. М.: Высш. шк., 1987. 303 с.
l'вердuслов В. А., Тихон.ов А. н., .fIlCовешсо Л. В. Физические меха-
низмы функционирования биолоrически:х мембран. М.: Изд-во Моск.
ун-та, 1986. 189 С.
Фридрих П. Ферменты: четвертичная структура и надмолекуляр
ные комцлексы. М.: Мир, 1986. 374 с.
Черн.ицlCUЙ Е. А., Воробей А. В. Структура и функции эритроци-
тарных мембран. Минск: Наука и техника, 1981. 216 с,
СПИСОК ДОПОЛНИТЕЛЬНОЙ ЛИТЕРАТУРЫ
Ас/СО.ри А. Реryтщия Na-Hacoca липонуклеоти,цами: механизм и фи-
зиолоrическое значение / / Биол. науки. 1990. N2 6. С. 7 15,
Болдырев А. А. Возможные причины нешmейности rрафиков Арре-
ниуса для Na, К зависимой аденозинтрифосфатазы. 1. Роль мембран-
ных лиnидов / / Биомакромолекулы в методе спиновых меток и зон
дов. М.: Наука, 1988. С. 80 92.
Болды.рев А. А. Nа/Е АТФаза свойства и БИОЛОI'ическая роль / /
Соросовский образоват. журн. 1998. N2 4. С. 2 9.
БРОlCерхоф Х., Джен.сен. Р. Липолитические ферменты. М.: Мир,
1978. 282 с.
Владимиров Ю. А. Свободные радИRалы в первичных фотобиолоm-
ческих ироцессах / / Биол. мембраны. 1998. Т. 15, М 5. C.517
529.
ВолотОВСlCиu Н. д, ШейlCО Л. м., Кон.ев С. В. Вли,щше состояния
липидной фазы мембраны на эффективность фотохимической модифи
кации эритроцитарной ацетилхолинэстеразы / / Молек. биол. 1978.
Т. 12, выи. 3. С. 533 538.
Добрецов Р. Е, Флуоресцентные зонды в исследовании клеток, мем-
бран и лиnопротеинов. М.: Наука, 1989. 277 с.
Дубuн.uн.а Е. Е. Антиоксидантн8Я система плазмы крови / / Укр,
биохим:. журн. 1992. Т. 64, N2 2. С. 3 15.
Ep..J&alCOB r. Л. Надмолекулярная орr8НИЗация ферментных систем.
1. Структурный аспект проблемы / / Биохимия, 1993, Т, 58, вып. 5.
С. 659 674.
Есамова Т. В., Нван.ов М. В. Взаимодействие лактатдеrидроreназы
и мембран саркоплазматическоrо ретикулума/ / Биохимия. 1992.
Т. 57, вып. 2. С. 253 266.
3ен.sбуш П. Молекулярная и клеточная биолоrия. М.: Мир, 1982.
Т. 1. С. 263 271,
Исследование активности ферментов yrлеводноI'О обмена клеток KO
CTHoro мозrа крыс в условиях лучевоI'О поражения/ Б. Ф. Сухомлинов,
Ю. С. I'pИНЮк, Н. А. Сибирная и др.// Радиобиол. 1990. Т. 30,
BЫn. 5. С. 619 622.
277
f{азеннов А. М., Маслова М, Н. Структурно биохимические своЙ-
ства мембраны безъядерных эритроцитов 11 Физиол. журн. ИМ. И- М. Ce
чеНQва. 1987. Т. 73, .N2 12. С. 1587 1598,
КаЛЬНО8а Н. Ю. Количественное определение состава липидов эрит
рОЦИ'I'ов и плазмы крови 11 Исследование синтетических и природных
антиоксидантов in vitro и iп vivo: Сб. науч. ст. М.: Наука, 1992.
С. 95 99.
JCенu.я М. в., Лумош А. и., FYCbM08 Е. П, Роль низко:м:олекулярных
антиоксидантов при окислительном c'rpecce 11 Успехи соврем. биол.
1993. Т.113, вып.4. С. 456 470.
Конев С. в., Волотовсмuй И. д. ФО'I'обиолоr'ИЯ. Минск: Изд-во
Белорус. ун-та, 1979. 383 с.
JCоШ!в С. в., ВолотовС1СUй И. Д. Действие УФ света на белки в pa
створе и в составе БИОЛОr'ических мембран 11 Фотобиолоr'ИЯ животной
клетки. Л.: Наука, 1979. С. 23 34.
Коч.етов r. А. I1рактичес.:кое руководство по ЭНЗИМОЛОr'ии. М.:
Высшая школа, 1980. С. 71.
f{расновскuй А. А., .м.л. ФосфоресцеН'l'НЫИ анализ СИНI'летНОr'О 11010-
лекулярноI'О кислорода в фотобиохимических системах 11 Виол. мембр.
1998. Т, 15, N2 5. С. 530 548.
КраСllО8СКUЙ А. А., .м.л. Механизм образования и роль синrле'1'ноrо
кислорода в фотоБИОЛОI'Ических лроцессах 11 Молекулярные механиз
мы биолоrическоrо действия оптическоrо излученил. М.: Наука, 1988.
С. 23 41.
Kp.ljzJlJllcoea К. Е., Ш иШКUllО Л. Н. Общие представленил о меха-
низме действия антиоксидантов 11 Исследование синтетических и при
родных антиоксиданто:в in vitro и in vivo: Сб. науч, ст. М.: Наука,
1992. С. 5 8.
Кулuнский В. И. Активные фор:м:ы кислорода и оксида'.rИБная мо-
дификация макро:м:олекул: польза, вред и защита 11 Соросовский обра
зо:ват. журн. 1999. .N2 1. С. 2 7.
Kypzaltoe Б. И'. Принципы интеrрации клеточноr'О метаболизмаll
Малек. биол. 1986. Т. 20, вып. 2. С. 369 377.
Куреонов Б. Н. Роль МУЛЬ'l'иферментных комплексов Б интеrрации
:клеточноrо метаболизмаll Молек. биол. 1986. т. 20, вып. 6.
С. 1530 1538.
НУРЮllов Б. и., люtfарев А. Е. I'ипотетическая. структура ферментов
rликолиза (rЛИКОЛИ'1'ич:ескоrо мета60лона), формирующеrося на :мембране
ЭРИТРОцитов11 Молек. биол. 1988. Т. 22, вью. 6. С. 1605 1613.
KypzalloB Б. И. Физико химические механизмы реrуляции актив-
ности ферментов. 1\11.: Наука, 1992. 59 с.
.f{ypzalioe Б. и., Люоарев А. Е. Принципы орrRlШЗации и функцио
нирования микрокомпартмента метаболона 11 Биохим:ия:. 1989.
Т. 54, вып. 5, С- 716 718.
278
Jlактатдеrидроrеназа в диаrНОСТИI<е инфаркта миокарда: ди
arностические и методические аспек'r:ыl В. П. 'l'И'l'О:В, В. А. Амелюшки-
на, '1'. И. КО'l'КЮIa, А. В. Шапошников IIJlабор. дело. 1988. М 11.
С. 31 41.
ЛОЮ(Ull В. 3, Ферментативное перекисное окисление липидо:в /1
Укр. биохим. журн. 1984. Т. 56, .N2 3. С. 317 331.
Лuтвumсо Н. М, Кuсель М А. Эндоrенные фосфолиnазы А 2 : струк-
тура и функции. МИ:НСI<: Наука и техника, 1991. 270 с.
Лопuна О. Д'. Na+, К+ АТРаза: cTpYK'rypa, механизм И реrуляция
ак'rивности // Биол. мембр. 1999. Т. 16, .N'2 6. С. 584 603.
Лущшс В. И. Взаимодействие ла:ктатдеrидроrеназы со структурными
компонентами клетки: возмо:лrnое физиолоrическое значение/ 1 Био
химия. 1992. Т. 57, вып. 8. С. 1142 l154.
Л.lJЩД/с В. И. Характеристика связанноЙ с микросомами лак
та'rде!'идроrеназы из белых МЫШЦ cI<o'l'a/1 Биохимия. - , 1991. Т. 56,
БЫП. 12. С. 2173 2180.
МеllЬЩlшова Е. В., 3еll/Сов' Н. К. Ан'rИОКСИДЮ'I'l'Ы и инrибиторы pa
дикмьных окислительных процессов 11 Успехи соврем. биол. 1993.
Т. 113, вып. 1. С. 442 455.
А:fuроuиш..tеmсо О. С, JIектины и распознавание белковых лиraii
дов/I Укр. биохим. жури. 1999. Т. rl1, .N'2 5. С. 5. 9.
Норбu Й. Представлени.я об олиrомериой структуре и функции Na,
K-АТФазы, основанные Шl реЗУЛЬ'I'атах изучения и связывания лиrан-
дов и определении размеров молекулярноЙ мишени // Биол. науки.
1990. .N2 6. С. 120 131.
lIереки:сное окисление и радиация 1 В. А. Барабой, Н. Э, Орел,
И. М. Карнаух 1/ OrB_ рад. I'pОДЗИRСI<ИЙ д. М. Киев: Наук. думка,
1991. 256 с.
ПерМ.JtICО8 Е. А. Кальцийсвязывaroщие белки. М.: Наука, 1993,
192 С.
ПОi!.IIа:JО8 Б. Ф. Ре!'удяторные функции ак'l'ЮIа в кле'l'кеll Известия
АН СССР, Сер. биол. 1983.. N2 5. С. 667 67'1.
РеrУJI.яция ак'l'ИВНОСТИ фермен'l'ОВ в адсорбциоиных фермеН'l'НЫХ си
стемах. lIl. Бзаимодействие ЛiШ'l'атдеТ'идр()!'еназы из :мышц свиньи с B'
актииомl Н, П. Суrробова, Т, Б. Еронина, Н, А. Чеботарева И ДР./I
Молекул. биолоrия. 1983. Т. 17, ВЬШ. 2. С. 430 436.
РощупlCUIl Д. И. Молекулярные механизмы фотоповреждения био
лоrических мембран // ФотобиолоI'ИЯ животной клетки, Л.: Наука,
1979, С. 23 34.
РощупlCuft Д. и., Муриllа М А. Фотобиолоrические процессы в био
мембранах при дейс'l'ВИИ: ультрафиолетовоrо излучения: на клетки, TH:a
НИ и орrанизм животных 1/ Биофизика. 1993. Т. 38, ВЬШ. 6.
C. 1053 1068.
279
Рыетсулова С. Т. Радиационная биолоrия плазматических мембран.
М.: Энерrоатомиздат, 1986. 125 с.
PJl3aItOS А r., Спирин А. С. Орrанизация ферментов на внутрикле
точных структурах: эстафета у поверхности 1/ Биохимия. 1989.
Т. 54, вып. 5. С. 709 715,
Сапежuн.стсuu И. И. Сенсибилизированное фОТООIOfсление белков и
друrих веществ. Возможное значение этих процессов в фотобиолоrии
/ / Молекулярные механизмы биолоrическоro действия оптическоrо из
лучения. М.: Наука, 1988. С. 92 101.
Tтca'iYТC В, А. Молекулярные механизмы нейроэндокринной реryля
ции // Соросовский образоват. журн. 1998. N 6. С. 1б 20.
Фершт 9. Структура и механизм действия ферментов. М.: Мир,
1989. С. 344 356.
Фuлuппов П. П. Кro<: внешние сИrналы передаются внутрь клетки
11 Соросовский обраэоват. журн. 1998. N2 3. С. 28 34.
Фотопревращение мембранных липидов и ero роль в изменении фу:н
КЦИЙ биомембран под действием УФ излученW1 1 д. И. Рощупкин и
др. 11 Молекулярные механизмы биолоrическоrо действия оптическо
ro излучения. М.: Наука, 1988, С. 79 92.
ФРUО08Uч. И. Радикалы кислорода, перо:r<си,ц водорода и токсичность
кислорода 11 Свободные радикалы в биолоrии. М.: Мир, 1979.
Т. 1. С. 272 308.
Фут Х. Фотосенсибилизированное окисление и синrлетный кисло
род. Биолоrическое действие 11 Там же. Т. 2. С. 96 143.
ХОЛМОi?оров В. В., lCрылентсов Д А., Османов М. А. Первичные фо-
топроцессы в крови и ее компонентах при действии оптическоrо излу
чения 11 Молекулярные механизмы биолоrическоrо действия оптичес
КОl"о излучения:. М.: Наука, 1988. С. 164 177.
Храпова Н. Ю. Перекисное окисление лиnидов и системы, реrули
рующие ero интенсивность /1 БиохимW1 липидов И их роль в обмене
веществ. М.: Наука, 1981. С. 147 155.
Ча.я:.ло П. П., Протас А. Ф. Изоферментный спектр лактатдеrидро-
rеиазы, малат,цеrидроreназы, эстеразы и IOfслой фосфатазы клеток ro
ловноrо мозrа крыс в ранние сроки после внешнеrо 'У облучения: в дозе
1 I'pll Радиобиол. 1992. Т, 32, вып. 6. С. 815 819.
ЧернuцlCUЙ В. А., Воробей А. В. Фотосенсибилизированное повреж-
дение биолоrических мембран 11 Молекулярные механизмы БИОJIоrи-
ческоro действия: оrrrическоrо излучения, М.: Наука, 1988, С, 102
111.
ШuнтсаренlCО Н. А., .АлеСlCовсlCUй В. Б. Синrлетный кислород, мето-
ды получения и обнаруженияll 'Успехи химии. 1981. Т. 50, вып. 3.
С, 406 428.
Ш ляпuнтох В. Л. Фотохимические превращения и стабилизация
полимеров. М.: Химия, 1979. 344 с.
280
Ш.1lлпин.тох В. .9., ИваltО6 В. Б. Тушение синrлетноrо кислорода//
Успехи химии. 1976. 'f 45, вып. 2. С. 202 223.
Л,сов.1lев В. А. Кинетика ферментативноro катализа. М.: Наука,
1965. 247 с.
Arпold н., Реие Р. Binding of glycolytic enzymes to structure proteins
of the muscle// Eur. J. Biochem. 1968. Yol. 6, N 2. Р. 163 171.
Association of integrated metabolic pathways with membranes. 1.
Glycolytic еnхутев of the red blood corpuscle and yeast/ D. Е. Green,
Е. Murer, Н. О. НиШn et а1.// Arch. Biochem. Biophys. 1965.
Vol.112. Р. 635 647.
Clarke Р. М, Masters С. J. Multienzyme aggregates: new evidence for
IШ association of glycolytic сотроnеntз/I ВiocЫт. et Biophys. Acta.
1973. Vol. 327, М 1. Р. 223 226.
Clarke Р. М., Masters С. J. on the association о! glycolytic enzymes
with structural proteins of skeletal muscle// Biochem et biophys. acta.
1975. Yol. 381, М 1. Р. 37 46.
Melпick Е. L., НиШп Н. О. Studies оп the nature о! the subceHular
localization о! lactate dehydrogenare and glyceraldehyde 3 phosphate
dehydrogenase in chicken skeleta.1 muscle/ / J. СеН. Physiol. 1973.
Vol. 81. Р. 139 148.
19. З!ll а:;l 3788
проrрАММА СПЕЦКУРСА «БИОФИЗИКА МЕМБРАН
Введение в мембранолоrию. Краткая история мембраноло1'ИИ.
Мембрана универсальный компонент биолоrических систем.
Методы исследования биомембран: биохимические, физислоrи-
ческие, иммунолоrические, rенетические, биофизичеСI{ие (ди-
фракционные: ре;В:Т1'еновская дифракция, дифракция нейтронов;
резонансные: ядерный маrнитный резонанс, электронный пара
маrнитный резонанс; оптические: абсорбционная спектроскопия,
флуоресценция и метод флуоресцентных зондов, дисперсия оп
тическоrо вращения, круrовой дихроизм, инфракрасная спект
рофотометрия; дифференциальная сканирующая микрокалори-
метрия; метод радиоактив:е:ых меток; метод моделирования мем-
бран).
Состав и структурно-фу:е:кциональная орrанизация молекуляр-
ных компонентов биомембран. Классификация, состав, структура,
физико химические и динамические свойства, фукции мембран-
ных липидов. Особенности липидноrо состава мембран клеток про-
кариот, эукариот и вирусов. ЛИОТРОIIНЫЙ И термотропный мезо-
морфизм липидов биомембран. Кинки, механизм их образования.
Динамическая модель ЛИIIИДНОro бислоя. Структурная асиммет-
рия ЛИIIИДОВ. Фазовые IIереходы липидов в мембране. Связь меж
ду фазовым состоянием ЛИIIИДОВ и функцией мембран.
Классификация, структура, функции и локализация мембран-
ных бl!лков. Структурно функциональная орrанизация мембран-
Horo каркаса эритроцитарной клетки. ХарактеРИСТИI{а основных
белков ЭРИ'l'роцитарной мембраны: 'спектрина, актина, бедка IIO-
лосы 3, rликофоринов и др. Понятие о векторных ферментах
биомембран. Структура, функциональные и некоторые физико-
химические свойства интеrральных мембранных белков на при-
мере Na+, К+.АТФазы и ацетилхолинэстеразы.
Хара:Ктеристика У1'леводных компонентов биомембран. Ис
пользование уrлеводраСIIознающих белков лектинов в мемб-
ранолоrии и медицине.
Структура и функции плазматических мембран на примере
мембран эритроцитов.
Особенности межмолекулярных взаимодействий в мембранах.
Физические основы внутримембранных взаимодействий. Лип ид-
липидные, беЛОК-ЛИIIидные и бедок-белковые взаимодеЙС'l'ВИЯ в
мембранах, их роль в функционировании биомембран. Понятие
об аннулярных липидах,
282
Развитие представлений о структурной орrанизации биомем
бран. Модели биомембран; Даниэлли и Давсона, Робертсона, 3ИR
1'ера и Никольсона, :Конева и сотр. и др.
Искусственные мембраны, липосомы и протеолипосомы, Me
тоды их получения, строение, свойства, применение в различных
областях биолоrии и медицины. Взаимодействие липосом с клет
ками. Методы модификации природных и искусственных мемб-
ран.
Транспорт веществ через мембрану. Проницаемость биомемб
ран. Проницаемость липидных мембран при фазовых превраще
ниях липидов. Проницаемость липидных мембран для воды. Ион
ная проницаемость липосом. Влияние холестерина на ионную
проницаемость биомембран. Методы изучения проницаемости.
Движущие силы и механизмы процесса переRоса вещества через
мембрану. Электрохимический потенциал. Активный и пассив
ный транспорт. Термодинамические уравнения и критерии про
цессов пассивноrо и активноrо транспорта. 'Уравнения диффу
зии, проницаемости, константа проницаемости.
Ионный транспорт через селективные каналы. :Классифика
ция ионных каналов. Воротные механизмы действия потенциал
зависимых ионных каналов. СТРУК'l'урно функциональная opra
низация ионных каналов мембран (потенциалзависимые калие
вые, на'rриевые, кальциевые каналы). Молекулярные. основы
функционирования систем первично активноrо и вторич ак
тивноrо транспорта. Структура, фУНIщиональные и физи:Erо\хи
мичеСl<ие свойства Na+, K+ АТФазы и Са2+ АrrФазы. АТР кю<
реrулятор активноrо транспорта ионов Na и :К. Механизм сопря
жения rидролиза АТР и Ca2+ Hacoca. .липидный контроль за меж..
субъсдиничными взаимодействиями в олиrомерных ансамблях
транспортных АТФаз.
Индуцированный ионный транспорт. Подвижные переносчи
ки (ионофоры). Использование ионофоров в исследованиях MeM
бран и медицине.
Медицинские аспекты мембранолоrии. Свободнорадикальное
пеРОl<сидное окисление липидов мембран в норме и при патоло
1'ичеСlСИХ процессах. Активные формы кислорода, механизм их
образования, свойства, пути утилизации, роль в ре1'улировании
метаболических Процессов в биосистемах. АНТИО1<сиданты, их
классификация, локализация, свойства, механизм биолоrическоrо
действия. Понятие о прооксидавтах и окисли'rельном стрессе.
19*
283
Редокс-реryляция один из механизмов реrулирования метабо
личеСRИХ процессов.
Участие компонентов биомембран в осуществлении и ре1'УЛИ
ровании метаболических процессов в клеТRе. Общая характери-
СТИRа процессов передачи информации в клетке. Понятие о пер-
вичных и вторичных мессенджерах. КлаССИфИRация, особеннос
ти структурно-функциональной орrанизации мембранных бел
ков рецепторов. ХарактеРИСТИRа адепилатциклазноI'О и фосфо
инозитидноrо пути передачи СИ1'нала в клетку. Роль ионов в осу-
ществлении метаболических процессов с участием мембран. Ад-
сорбционный тип реrуляции метаболизма. Понятие о метаболо-
не, физиолоrическое значение ero образования. Пространствен-
но-структурная орrавизация ферментных систем клет1tИ (на при-
мере rликолитичеСRоrо Rомпле1tса и ЦИRла Кребса). ЭRсперимен
тальные исследования взаимодействия ферментов 1'ликолиза с
различными структурными компонентами RлеТRИ. Модели струк-
туры rЛИRолитическоrо RомплеRса в скелетных МЫШцах и на
внутренней поверхности мембран эритроцитов. Эстафетный ме-
ханизм работы ферментов в клетке. Механизмы реrулирования
функциональной активности векторных ферментов биомембран.
Пути нейроrуморальной реryляции функций клеток.
Энерrосопряrающие мембраны: определение, классификация,
особенности строения и фУНRционирования. СОПРЯ1'ающие фак-
торы, сопряrающие ионы.
Структурно-функциональные модификации молекулярных
компонентов БИQмемБран под воздействием физико-химичеСI{ИХ
areHToB (ионизирующеrо и 'УФ-излучения). Роль пероксидноrо
фотоокисления липидов в фото повреждении биомембран. Осо-
бенности фотохимических превращений мембранных белков (фер-
ментов). Феномен фотохимической аллотопии. Понятие о фото-
сенсибилизаторах. Фотореакции типа 1 и П. Фотосенсибилиз.и-
рованное окисление белковых молен:ул с участ.ием синrлетноrо
кислорода.
ПРИЛОЖЕНИЯ
Приложение 1
Качествеllпыii: 111 I ОJIичествеппыii: состав Л:ИВИДОВ
разл х орrапизмов
Таблица 1
Лuпu8ный состав плаз.матU'lесlCUХ .мембран u оболочек
zрамотрuцатеЛbltbtХ баюперuй Salmonella tuphimurium
Содержание, Состав фосфолипидов
Фракция фосфоли.
липоцоли- ФЭ Фr КЛ
пидов сахаРИДОБ
Общм: 21 18 74,9 22,1 3,0
ПлазматичеСI(ие
мембраны:
фракция 1 37 1,8 60,3 33,3 6,4
фракция П 34 2,5 60,0 32,9 7,1
Наружная оболочка 18,5 19,7 81,3 17,1 1,6
При м е ч а н и е. ФЭ фосфатидилзтаноламин; Ф Х фосфатидил-
холин; ФС фосфатидилсерин; фr фосфатидилrлицерин; ФИ
фосфатидилинозитол; ФК фосфатидная I,,:ислота; КЛ I..:ардиоли-
пин; СМ сфинrомиелин; лизоФХ лизофосфатидилхолип
Таблица 2
Состав дипи80В эрuтроцuтарных .Jtембран
Содержан:ие ЛИП:ИДОIl, мол. %
Вид животно!'о общие друrие фосфолип:иды
холестерил rанrлиозидr.r лиl1иды
Кошка 26,8 8,8 3,1 61,3
Корова 27,5 5,5 2,2 64,8
Собака 24,7 11,8 10,9 52,6
Коза 26,2 5,7 17,9 50,2
Морская свинка 27,0 2,2 15,2 55,6
Лоmадь 24,5 15,5 8,0 52,0
Свинья 26,8 3,8 10,1 59,8
Кротш 28,9 4,5 0,8 65,8
Крыса 24,7 6,з 2,0 67,0
Овца 26,5 7,8 2,5 63,2
285
Таблица 3
Состав фосфолипи808 эритроциmаРllЫХ .ме.мбра/t
Содержание фосфолипидов, мол. %
Вид жи:вотноI'O ФХ ФЭ ФС ФИ ФК СМ Ли:зоФХ
Крыса 47,5 21,5 10,8 3,5 0,3 12,8 3,8
Кролик 33,9 31,9 12,2 1,6 1,6 19,0 0,3
Свинья 23,3 29,7 17,8 1,8 0,3 26,5 0,9
Собака 46,9 22,4 15,4 2,2 0,5 10,8 1,8
Лошадь 42,4 21,3 18,0 0,3 0,3 13,5 1,7
Овца. 26,2 14,1 2.9 0,3 51,0
Корова 29,1 19,3 3,7 0,3 46,2
Коза 27,9 20,8 4,6 0,3 45,9
Кошка. 30,5 22,2 13,2 7,4 0,8 26,1 0,3
Морская свинка 41,1 24,6 16,8 2,4 4,2 11,1 0,3
ЧеЛОВе]( 28,9 27,2 13,0 1,3 1,3 2,2 26,6
Таблица 4
Жuрнокислотн.ый состав фосфолипи80в
8 эритроцитах человека и быка
Содержание жирных ЮIСЛОТ в фосфолипидах ЭРИ'J'РОЦИ1'ОВ, мол. %
Жирная челове:ка быка
кислота
ФХ СМ ФЭ ФС СМ + ФХ ФЭ ФС
15:0 Следы 1 Следы Следы 2,1 Следы Следы
16:0 35,4 30,0 24,2 3,3 17,1 4,9 9,1
16:1 2,6 1,8
17:0 1,9
18:0 13,7 7,8 19,8 49,0 4,2 12,4 30,0
18:1 22,5 2,6 16,3 5,2 2,2 37,2 33,4
18:2 20,7 1,0 4,5 3,3 3,7 21,4 15,8
18:3 Следы 1,8 3,1 1,5
20:0 Следы 2,1 Следы Следы Следы
20:3 Следы Следы Следы 1,8 1,2 1,3
20:4 7,5 23,0 20,9 Следы 7,7 2,6
22:0 Следы 7,4 Следы 10,7
22:4 Следы 5,0 3,1 Следы
22;5 Следы 2,2 3,3 1,4 1,0
22:6 Следы 3,2 11,9 Следы Следы
23;0 Следы 2,2 Следы Следы 3,2
24:0 Следы 15,7 следыI 42,2 .
24:1 30,5 Следы Следы 10,5
286
Таблица 5
ЛuпuiJы мембран_ ne1teJtu крысы
Содержание липидов, Mr на Mr Содержание JIИПИ- Молярное
Тип беЛRа ДОВ, % от суммы отношение
мембраны Общие Фосфо- Ней- Холе- Фосфо. Ней- холестерин!
липиды тральные стерин липиды тральные фосфолипиды
l1лазмати- 0,994 0,672 0,322 0,128 68 32 0,38
чеСI,ая
Аппарат 1,166 0,825 0,341 0,078 71 29 0,19
rольджи
МИ1'ОХОНД- 0,202 0,175 0,027 0,003 87 13 0,034
риальные
Ти:п Состав фосфолипидов, % от общеl'О фосфора
мембраны ФХ ФЭ СМ кл ФС ФИ ФК ЛизоФХ Ли:зоФЭ
l1лазмати:- 39,3 23,3 16,0 1,0 9,0 7,7 0,5 1,0 1,3
чеСRЗЯ
Аппарат 49,6 19,6 7,6 1,2 5,6 12,2 0,4 1,4 1,6
rольджи
Митохонд- 40,3 34,6 0,5 17,8 1,7 4,6 0,6
риальные
Таблица 6
ЛuпuiJный состав мембран сартсоплазматU1lеско;::о ретuтсулу-
ма стселетных мышц некоторых :JICивотных
Вид Содержание ,J'Iипидов Состав фосфолилидов, % от суммы
живот- общих, фосфоли- холеC'l'е-
ною % сухой пидов, 'Ус рин, % от ФХ ФЭ СМ ФС ЛизоФХ
массы от суммы суммы
Кролик 22 25 72 90 8 10 68 70 15 1 7 4 8 3 7 ..3
Омар 36 90 10 70 17 4 7 Следы
Рак 28 70 6 65 22 8 2 3
Приложение 2
Прв:rото:вл:еJШие буферJШЫх. растворов
Таблица 7
Фосфатный буфер, 0,1 .мОЛЬ/.lt
Двузамещенныйфосфат натрия (Na 2 НP0 4 '2H 2 0), отно.сит. мол.
масса 178,05; однозамещенный фосфат натрия (NaH2P04'HP), OT
носит. мол. масса 138. Объем раствора доводят дистиллирован
ной водой до 200 мл.
0,2 моль/л 0,2 моль/л 0,2 моль/л 0,2 моль/л
рН раствор раствор рН paC'J'BOp раствор
Na,НPO., мл N аН 2 РО., мл N а,НРО., мл NaН,PO., мл
5,8 8,0 92,0 7,0 61,0 39,0
6,0 12,3 87,7 7,2 72,0 28,0
6,2 18,5 81,5 7,4 81,0 19,0
6,4 26,5 73,5 7,6 87,0 13,0
6,6 37,5 62,5 7,8 91,5 8,5
6,8 49,0 51,0 8,0 94,7 5,3
Таблица 8
Трuс-НСZ-буфер, 0.05 .моль/ л
Трис (трисrидро:ксиметиламинометан), относит. мол. Mac
са 121,14. Объем раствора доводят дистиллированной водой до
100 мл
рН при 0,2 моль/л 0,1 моm./л рН при 0,2 мот! л 0,1 моль!л
температуре раствор раствор HOl, температуре раствор раствор HOl,
23'С 37'0 трис, мл мл 23'0 37 'с трис, мл мл
9,10 8,95 25 5,0 8,05 7,90 25 27,5
8,92 8,78 25 7,5 7,96 7,92 25 30,0
8,74 8,60 25 10,0 7,84 7,73 25 32,5
8,62 8,48 25 12,5 7.77 7,63 25 35,0
8,50 8,37 25 15,0 Т,66 7.52 25 37,5
8,40 8,27 25 17,5 7,54 7,40 25 40,0
8,32 8,18 25 20,0 7,20 7,22 25 42,5
8,23 8,10 25 22,5 7,05 25 45,0
8,14 8,00 25 25,0
288
Таблица 9
Ацетатный буфер, 0,2 моль/л
Ацетат натрия (СН з СООNа'3НР), относит. мол. масса 136,09
0,2 моль/л 0,2 моль/л 0,2 МОЛЬ/Л 0,2 МОЛЬ/Л
рН раствор ацетата раствор уксус- рН раствор ацетата раствор (:yc-
ной :юrСЛОТЫ, ной юrслот:ы,
натрия,мл мл натрия, мл МЛ
3,6 0,75 9,25 5,0 5,90 4,10
3,8 1,20 8,80 5,2 7,00 3,00
4,0 1,80 8,20 5,4 7,90 2,10
4.2 2.65 7,35 5,6 8,60 1,40
4,4 3,70 6,30 5,8 9,10 0,90
4,6 4,90 5,10
ПРЕДМЕТНЫЙ
Arонист 70
Аддуцин 76
Адеиилатциклаза 35,71,222
Адеиилатциклазиый путь персдачи
информации 71
Азид FIатрин 186 200
АкТИВFIые формы кислорода 107 114
F-Актин 31,32,33,82
Акцепторы 102 136 138
АлКОКСИЛЬFIЫЙ радикал 103, 107 109'
, АлЛОТОIШЫЙ фермент 55
Альдолаза 82,83, 85
Аминоацилфосфолипиды 16
у-Амииомаслкная кислота 98
Амплификация сиrнала 68
АМР циклический (сАМР) 35, 65, 71, 87
1-Анилиноиафталии-8-сульфонат 183,
248 252
Анкирин 30, 31, 32
Аниуляриые лишщы 59
Антиоксидаиты 114 124
Алоптоз 76
Аскорбинован кислота 108, 109, 120, 121,
157 169
АТФазы: 29, 34
E j E 2 -тип 36
H+ 29,36
К+ 36
Na+ / К+: 35, 36, 9l 94, 222
изоферменты 40
каталитические свойства 43, 44,
45,47
локализаци.я 37
механизм действия 41, 42, 44, 48
молеку.л:.ярная масса 39
определение активности 241 243
особенности фотохимичеcr,их
превращеШ1Й 169 172
структура 37, 38
фосфолипидный и уrлеводный
состав 39
функции 36, 37
Са 2 + 36, 76, 77, 222
Аутотрансфузия УФ-облучеНFIОЙ крови
(АУФОК) 8, 142
Ацетилrалактозамии 56
АцетилrЛIОКОЗамин 56
Ацетил- -метИJIХОЛИН 51
Ацетилхолин 50,51,98
илхолиновый рецептор 70
Ацетилхолинэстераза: 30, 50
29')
УКАЗАТЕЛЬ
активный центр 51
ка'l'алитические свойстnа 52, 54
локалиэация 51
механизм действи.я 51, 53
определение активности 237 238
особенности фотохимических
превращений 149 169
CTPYK'l'ypa 54,55
функция 50, 51
Бю(териородопсин 29
Бактериохлорофиллы 136
Белки мембранные:
интеrральные 27, 28, 29
клаССИф>fКаци.я 27
периферические 27
поверхностные 27
собственно периферические 27
содержание 26,27
функции 27
эффекторные 68
БеЛОI,-белковые взаимодействия 61
Белок полосы 3 32, 35, 85, 86
Бензиловый спирт 149 156
Бензоилхолин 51
Бимолекулнрный липидный слой:
ламеллярная reлевая фаза 19, 20
ламеллкрная ЖИДRокристалличе
ская фаза 19, 20
Бутирилхолин 51
Векторные ферменты 35, 91
Вторично-ar(тивный транспорт 75
Вторичные мессенджеры 64
rалактоза 56
rалактозамин 56
rанrлиозиды 12, 14
G-беJ!НИ: 67
белки мишени 67
классификацик 69
молекулкрна.я масса 69
свойства 69
функции 68, 69
GDP 67
rексокиназа 83
rемоrлобин 35, 84
rемолизэритроцитов252
rиалуроновая кuслота 56
I'и,цРОКСИJIьный радикал 103, 108 1l0
rидропероксиды липидов 103, 127
rипо!'алоиды 107 109
rИС'I'ИДИН 186, 200
rликозилфосфатидилинозитол 30
rликолипиды 11,14,56
rликолитический комплекс 84 87
rликопротеины 56
rликосфинrолипиды15,56
rликофорины: 29
А 32, 34
B 32
С 32
rлицеральдеrид-3-фосфатдеrидро!'ена-
за 82, 83, 85
rлицерофосфолипиды 13,14
rлутамат 98
rлутатион 108, 109, 117,118, 122
rлутатионпероксндаза 108, 117, 118
rлутатионреДУI;:таза 117, 118
rлутатионтрав:сфераза 117,118
rЛlокоза 56
rлIOКОЗамин 56
rЛIOI;:Qзо-6-фосфатаз8. 222
r лю!;:озо-6-фосфатизомераза 85
rлюr;:уроновая кислота 56
з,5-GMP ц:иr;:лический (cGMP) 65
fОМОl'енн:заторы Даунса и Поттера 217
rомоreЮlзация мембран 217
fOPMOHbl: 99
белковые 67
I'онадотропиые 67
низr;:омолеRулярн:ые 67
пептидные 67
GTP 67
Дезоr;:сихолат натрия 226 227
Де1'ерreнты: 224
аrреl'аЦИОННое число 225
критическая :концентрация
мицеллообразования (ККМ) 225
свойства 224 227
структурные qюрмулы 226
ДиацИЛl'лицерол(DG)65,72,73
Диметилазы 157
1 Диметиламино-5-нафталиносулъфо-
хлорид (DANS) 249 252
Дисперсия оптичесr;:оl'О вращения 214
Дифракция:
нейтронов 204
реНТl'еновская 204
Додецилсульфат натрия 31,221,
226 227
Енолаза 83, 85
:нtuрные н:ислоты:
. арахидоновая 16, 65, 104
ЛIIllOлевая 16
линолен:овая 16
миристиновал 16, 30
олеиновая 16
пальмитиновая 16, 30
стеариновая 16
Жирорастворимые витамин:ы 11
Заr;:он Вавилова 210
Закон CTOI;:ca-Ломмеля 210
Излучение:
ионизирующее 102, 142 149
ультрафиолетовое (УФ-) 102, 126
Иммун:облоттин!' 202
Инозит 13
ИlIОЗlIтол-1,4,5-трифосфат (IP з ) 65,72,73
Инфраl;:расная спетроскопия
(НК-спектроскопия) 213
Инфраt;:расный дихроизм
(НК-дихроизм) 213
Ионная реryляция 74
Ионы:
К' 75
Na+ 75
Mg+ 75
Са 2 + 65, 73, 75, 76, 77
ИО!шые каналы: 97 98
воротная функция 98
ЛИl'андулравляемые 70
потенциалуправляемые 98
рецепторуправЛЯемые 98
селеКТИВtIOСТЬ 98
Ионофор 77
Н:аJ1ъБИНДИII 76
Кальмодулин 73, 76, 77
Кальретинин 76
Каналообразователи 236
Кардиолипин 12, 14
Каротин 186 200
Каротиноиды 109
Каталаза 108, 116,222
Квантовый выход фотохимической
реакции 131
I инки '23
I инуренин 185
Кислая РНКаза 222
I ислая фосфатаза 222
Кластеры 24, 25
Коллаl'ен 27
291
Комплекс с переносом заряда 137
Конканавалип А 57, 149 156
Константа скорости тушения 10. 137
Копформация уrлеводородных цепей
ЛИIIИдов:
rош 22, 23
транс 22, 23
цис 22, 23
Коэффициент седиментации 217
Крауны 236
Креатинфосфокиназа 27
Критическая концентрация мицеллооб
раЗОВаЕ:ИЯ (ККМ) 19
Круrовой дихроизм 215
Лактатдеrидроrен:аза: 82, 85, 172, 222
изоферменты 173
каталитические свойства 174, 175
локализация 174 180
молекулярная масса 173
особен:нос'1'И фотохимических
Превращений 180 200
свойства 1 7 4 180
структура 173
функции 173
ЛаRтопермеаза 29
Лами:вин 27
Лейкотриены 104
Лекти:вы 57,58
Лиr8Нд-рецепторные взаимодействия 67
Лизолецитин 16
ЛизофосфолиIШДЪ! 12,14
Лmшды:
амфипатичес:кие свойства 19
амфифильиые (дифильные) 11
rексarона.льные структуры 20,21
динамические свойства 22,24
кислые 15
классификация 11, 15
латералыrая диффузия 22
мицеллярные структуры 19, 20. 21
нейтральные 11, 15
содержание 16, 17, 18
состав 13 14, 16
структура 13,14
структурная асимметрия 25
ТР81lсбислойный переход ("флип-
флоп") 22
фазовые переходы 21
физико-химические свойства 19
функции 26
цвиттериоиные 15
Липид А ЛШ10полисахаридз 16
292
Липид-белковые взаимодействия 59
Липокс:и:nы 104
Липооксиrеназа 104 105
Липофилин 28
Люминесценция:
вынужденная 209
поллризованнал 211
поляризационные спектры 211
резонансн:ая 209
рекомбинационная 209
спектр nозбуждения 209
спектр ИСПУСRания 209
спонтанная 209
D-Маннит 186 200
Манн:оза 56
Маркерный фермент 222
Мезоморфизм:
Л1IОТРОПНЫЙ 19
термотропн:ый 19, 20
Мезоморфные структуры 21, 22
Мембрана:
внутриклетОЧНЫХ орrа:в:оидов 17, 18,
25,28
митохондриа.льная 17, 18
плазматическаJi 17. 18
эритроцитарная 17, 25, 31
Мембранный :каркас (скелет) 31
Метаболон: 82
модели структуры 84, 85
физиолоrическое значение образо-
вания 85
Метод Лоури 232
Методы исследования биомембран:
биофизические 203
биохимические 202
rенетические 203
дифракционные 208
иммуиолоrич:есI(ие 202
моделирования и получения
искусственных мембран 216
оптические 208
резонансные 205
физиолоrические 202
злектронной :микроскопии 207
Меха:в:измы реrулирова:в:ия активности
ферментов: 78
адсорбционный 81, 82
8ЛЛостерическиц 81
изостерический 80
Миелоперокс:идазнМI реакция 111
Микрока.лориметрия 215
Микрокомпартмент 88
Моноаминооксидаза 222
Моноацилrлицериды 11
Мочевая кислота 108 109, 122
Мукополисахариды 56
Мультиферментные комплексы 83
Мускарин 99
NAD-пирофосфорилаза 222
NADРН деrидроreназа 222
NADPH-ЦИТОХРОМ Ьа реДУI(таза 30
Натриевый насос 47
Нейроryморальвая реryляция функ
ций клеток 97 100
Нейромедиаторы 64, 98
5' НУКJIеОТИДllза 30, 222
Окислительный стресс 113
ОККJIюдированные катионы 43
ОксиrеНIIЗЫ МИКРОСОМaJIьиые 104
-D Октилrлюкозид 226- 227
Онкомодулин 76
Оптическая активность 214
Перви'Шо-акТИВIIЫЙ транспорт 40
Первичные мессенджеры 64
Перrидроксильвый: радикал 107,108
ПеРОКСИДllза 116
ПерОRСИД водорода 108 110
Пероксидный радИКIJ.Л 103, 107 109
Пероксидное окисление липи"
дав 102 106
Пероксидное ФОТООlшсление липи-
дов 126 128
Пиридин нуклеотиды 133, 151
Пируваткиназа 82,85
ПиРУВIIтокеидаза 29
ПлаЗМlJ.Лоrен 12, 14
Полислои ЛеrМIора Бложе 216
Поперечное сечение фотоинактива-
цин 131
Порин 27
Порфирины 133
Правило:
Каши 210
OroKca 210
ПрооltСИДанты 113
ПропаНДИОJI 16
ПростarланДИНJ>I 104
Простациклин 104
Протеинкиназа:
С 26, 73
cAMP-зависимал (А-ltиназа) 30, 72
Процессинr 56
Радиолиз воды 143
Реакция биуре'rовал 235
Реакция rабер Вейса 110, 116
Реакция Фентона 108, 116
Редоке-реryшщил 113
РентrеНОСТРУКТУР IЫЙ шализ 203
Ретин аль 136
Рецепторы: 65
классификация 66
СВОЙС'I'ва 66, 70
структура 65, 67, 70
фуюш,ии 65,67,70
Родопсин 29, 30
Сахароза 219
Серотонин 186 200
Сефароза 4 В 232
Сиаловые кислоты 12, 15
Синrлетный кислород 102 107 1l1,
134 138
СитоетеРИl:112,15
Спеl(ТРИН 31, 32, 33
СПИl:10вая метка 206
СnИl:10ВЫЙ ЗОI:1Д 206
Степень поляризации люминесцен-
ции 211
СтереоспецифическаJ'I нумерациn
липидов 14
Стероиды 11, 15
Стиrмас-rерин 12, 15
СукцинатдеI'Идроrеназа 29
Сульфоцереброзиды (судьфатиды) 15
СупеРОКСFIддисмутаза 108, 1l5 116
Супероксидный ав.ион-ради-
кал 107 110
СФИl:1rОЗИI:1 14
Сфинrомиелин 12
Сфинrофосфолипиды 13,14
Твин 80 227
'!'еМI:10вое автоокисление липидов 128
Тирозин 119,130
аЛокоферол 108 109, 119
Трансляция 70
Трансферрин 112, 116
ТриозофсюфатизомераЗI\ 83, 85
ТРИПТОфа1I 119, 130
Тритон Х-100 31, 225 227
Тромбоксаны 104
Тропомиозин 82, 85
Трепонии С 85
Тушение 102 макремолекуЛI\МИ:
ФИ3FIчеСI(ое 137
293
химическое 137
'I'ушители СИlII'летноrо КИСJ10рода
136 138
'Уабаи:н 36, 38, 49
Убихинон 108, 109
ФенилалаНИII 119, 130
Феоф:итин 136
Ферритин 115
Фибронектин 27
ФИКОJIЛ 219
ФJ1аВlIНЫ 133, 136, 151
ФлаВОRОИДЫ 120
Форболовые эфиры 74
Формилкинуренины 185
Фосфатидилrлицерин 13, 16
Фосфатидилинозитол 13, 16
Фосфатиди:линозитол 4,5 дифосфат 73
Фосфатидилсерин 13,16,73
Фос<раТИДИЛХОЛИIr 13, 14, 16
ФосфаТИДИЛЭ'l'8.Ноламин 13, 14, 16
ФосфатиднаJi кислота 16
3-Фосфоrлицераткпназа 83, 85
Фосфоrлицеромутаза 85
Фосфоинозитидный путь передачи
информации: 72
Фосфолипазы: 29, 157
А 1 158
А 2 157, 158
В 158
c 73
D 157 169
ФОСфОJIИПИДЫ 11, 13
Фосфорная кислота 13
ФосФОФРУК1'окиназа 82,83,85
Фотодинамическое деЙСТВI!е 134
Фотоионизация аМИНОКИСJIОТ 129
Фотолиз липидов 128
Фотопротект;:,р 190
Фотосенсибилизатор 133
ФотосенсиБПJIизированные реакции
133
Фотохимическая аJIЛОтопиЯ 132
ФоточувствитеJIьнос'rь 131
Химический сдвиr 205
ХлОрОфИJIЛЫ 136
Холат nатрия 226,227
ХолеС1'ерин 12, 15
Холии 13
ХОJIинэстераза 50, 51
294
Хрома'rоrрафия:
адсорбциоинм 220
аффинная 221
rеЛЬ IIроникающм 220
распределительнм 220
тонкослойнм 228
Хромофорные rруппы 126
Хондроитинсульфат 56
Цвиттерrент 226, 227
Центри:фуrирование:
зональное 217
изопикническое 218
Церсброзиды 12, 14
ЦеРУЛОIIЛазмин 108, 109, 116
ЦИКЛОOJtcиreназы 104 105
Цитоскелет 31, 34
Цитохром:
C27
Ь Б 29, 59
Цитохром с-редуктаза 222
Цитохром()ксидаза 29, 222
ЩелочнаJi фосфаТ8.за 29,30,222
Эйкозааои:ды 104, 157
ЭкстраклеТОЧIIЫЙ матрикс 27
Электронный парамаrIШТИЫЙ резонанс
(ЭПР) 206
Электрофорез 221
ЭндоваСКУШIРНое лазерное облучение
ItрОВИ (ЭЛОI ) 8, 142
Эc-rафетн:ая модель работы ферментов в
клеТItе 88
3таноламин 13
Этиленrликоль 16
Ядерный маrнитный резонанс (ЯМР)
205
Учебное издание
Артюхов Валерий rРИI'орьевич,
lIаквасина Марина Александровна
БиолоrИЧЕСКИЕ МЕМБРАНЫ:
СТРУКТУРНАЯ opr АНИ3АЦИЯ, ФУНКЦИИ,
МОДИФИКАЦИЯ ФИ3ИКО-ХИМИЧЕСКИМИ
АrЕНТАМИ
Редактор В. В, Пуш/Сарен.ICО
Художественный редактор Л. А. Клоч./СО8
Электронная верстка К. П. Пен.с/Соzо
Корректор ll. J[, А1аслен.н.u/Сова
ИЕ NQ 2600
ПР 040088 от 24.03.97. Подп. 13 пе'l. 16_08.2000.
Форм. бум. 60х84/16. БУМ(lrа офсетная NQ 1. Офсетная печать.
Усл. печ. л. 17,2. У«. изд. л. 17,8.
Тираж 800. Заказ 3788.
Издательство Воронежскоrо rосударственноro университета
394000 Воронеж, ул. Ф. Энrельса, 8
Издательско полиrрафи'!еская фирма «Воронеж»
394000 Воронеж, пр. Революции, 39