Текст
Открытый Лицей
ВСЕРОССИЙСКАЯ ЗАОЧНАЯ
МНОГОПРЕДМЕТНАЯ ШКОЛА
Биологическое отделение
В.А. Фуралев
ЦИТОЛОГИЯ
Структура и функции клеточных органелл
Москва
1998
В. А. Фурале в
Цитология: Структура и функции клеточных
органелл. I Учебное пособие. - М.. ОЛ ВЗМШ,
1998. - 96 с., ил.
Печатается по решению
Учебно-методической комиссии
Биологического отделения ОЛ ВЗМШ
В книге изложены современные представления о строе-
нии клетки, химическом составе и молекулярной органи-
зации ее органелл, их функциональном значении и меха-
низмах деятельности. Материал позволяет понять связь
между структурой макромолекул и их функциями, а также
специфические особенности строения органелл в различных
клетках и тканях.
Пособие предназначено для учащихся X-XI классов
и преподавателей биологии.
© Фуралев В.А., 1998
© Открытый лицей ВЗМШ, 1998
§ 1. Постулаты клеточной теории
Основы клеточной теории были разработаны
в середине-конце XIX века (XX век внес лишь неболь-
шие изменения.) У ее истоков стояли немецкие ученые
М. Шлейден, Т. Шванн и Р. Вирхов.
Что же утверждают постулаты клеточной терии?
1. Клетка - элементарная единица живого.
2. Клетки разных организмов гомологичны между
собой.
3. Размножение клеток происходит путем деления
исходной клетки.
4. Многоклеточные организмы представляют
собой сложные ансамбли клеток, объединенные в
целостные системы тканей и органов1.
Разберем каждый из постулатов.
"Клетка - элементарная единица живого." На пер-
вый взгляд это понятно, но при более внимательном
рассмотрении возникают парадоксы. Из школьного
учебника известны признаки, отличающие живое от
неживого: способность к размножению, подвижность,
раздражимость, обмен веществ. Каждая из этих функ-
ций может быть свойственна и отдельным клеточным
органеллам. Например, подвижность мышечных
клеток обеспечивается актомиозиновыми комплексами
(см. § 15). Размножаться (делиться) могут ядра и мито-
хондрии. Обмен веществ идет в самых разных орга-
неллах. Но наличие всех признаков живого (полная со-
вокупность функций) присуще только клетке в целом.
Возникает вопрос: а живые ли вирусы?
Вирусы - это бесспорно не клетки. Есть вирусы
очень простенькие: всего-навсего нуклеиновая
1 Так сформулированы постулаты в учебнике Ю.С. Ченцова
"Общая цитология".
3
кислота, обернутая молекулами белка. Тем не менее
вирус обладает целой кучей перечисленных выше
клеточных функций.
Очевидна способность вирусов к размножению.
Что касается подвижности, то ведь бывают и непо-
движные клетки: какие-нибудь кокки сидят себе и
делятся, никуда не двигаясь. Гораздо сложнее с обме-
ном веществ. При размножении вирусов синтезиру-
ются их новые молекулы - белки и нуклеиновые
кислоты (а иногда и другие соединения). Обмен
веществ у вирусов необычен: они все получают от
клетки-хозяина. Однако есть и клетки, паразитиру-
ющие на других клетках. Так, риккетсии1 живут лишь
внутри других клеток, но не самостоятельно.
Все же между вирусом и клеткой есть четкая
грань. Любая клетка2 может сама синтезировать белок.
Пусть материалы дает хозяин, но у клетки есть
свои рибосомы - органеллы, синтезирующие белок.
А вирус, даже самый сложный3, использует "хозяйские"
рибосомы. Это различие можно считать коренным.
"Живой" вирус или "неживой"? С точки зрения
редукциониста4 этот вопрос чисто терминологический.
Можно договориться, что граница жизни - собственный
аппарат синтеза белка: клетка живая, вирус неживой.
1 В качестве примера назовем риккетсию Провачека, являю-
щуюся возбудителем сыпного тифа.
2 А есть клетки и попроще риккетсий. Некоторые хламидии,
например, даже АТФ и другие богатые энергией соединения
получают от хозяина.
3 Такие вирусы, как вирус оспы, по размерам и сложности
"начинки" сопоставимы с мелкой паразитической клеткой.
4 Редукционизм - философское течение, утверждающее,
что все сложные явления сводимы к более простым. С этой
точки зрения биология - сложная химия, химия - сложная
физика, а физика - матерь всего на свете.
4
Передвинем границу - и вирусы тоже станут “живыми”
(в соответствии с новым значением термина).
Второй постулат: все клетки гомологичны между
собой.
Заметим, что в разных областях биологии тер-
мин "гомология" употребляют в весьма разных
смыслах. В данном случае под гомологией
подразумевается общее происхождение и хоть
какое-то сходство строения. (В сравнительной
анатомии совсем другие, гораздо более жесткие
критерии гомологии.)
Несомненно сходство структур, выполняющих
одни и те же функции у разных клеток. Ядро - везде
носитель наследственной информации; митохондрия -
везде "энергетическая станция"; рибосома - везде
аппарат синтеза белка1.
Вопрос о происхождении гораздо сложнее.
Понять, как возникли современные клетки и их орга-
неллы, нелегко. Согласно теории симбиогенеза (см.
§ 23), митохондрии и хлоропласты когда-то были само-
стоятельными бактериальными клетками: хлоропла-
сты - фотосинтезирующими, митохондрии — окисляю-
щими. Так что эти органеллы гомологичны прокарио-
тическим клеткам. Другой вопрос - существовала ли
протоклетка, от которой произошли и прокариоты,
и эукариоты, или же было несколько независимо воз-
никших генетических систем. Точного ответа дать
нельзя, но имеются сильные аргументы в пользу пер-
вой точки зрения. Действительно, у всех организмов:
- генетический код в общем одинаков;
- есть передача информации ДНК-РНК-белок;
1 В некоторых специализированных клетках органеллы могут
нести и дополнительные функции. Так, в мышечных клетках
эндоплазматический ретикулум служит для накопления
ионов кальция.
5
- похоже устроены рибосомы;
- клетки состоят из сходного материала (напри-
мер, мембрана у всех организмов, кроме архебак-
терий, - липидный бислой).
Так что, видимо, все клетки имеют общее про-
исхождение.
Третий постулат: клетки размножаются делением.
Здесь никаких трудностей не возникает. Правда, само
деление может быть разным. Кроме правильного де-
ления (например, митоза), при котором каждой новой
клетке достается полная копия генетического мате-
риала, бывает и неправильное деление - амитоз -
со случайным распределением генетического мате-
риала. Амитоз - явление редкое. Очень часто при
таком делении одна из дочерних клеток оказывается
дефектной. Распространен амитоз у раковых клеток -
а они и так уже "ненормальные". При амитозе некото-
рые из дочерних клеток быстро гибнут, а другие резко
меняют свойства из-за аномального числа хромосом.
Этот постулат ставился под сомнение в нашей
стране в 50-е годы. О. Б. Лепешинская - старая
большевичка, полезшая в науку, - выдвинула
теорию о "живом веществе". Утверждалось, что
клетки могут сами собой собираться из бесструк-
турного "живого вещества". Его Лепешинская
находила и в хрящах, и в соединительной ткани,
и даже у себя под ногтями. В старых книгах
можно прочитать о том, что "советские ученые
открыли” способность клеток зарождаться само-
произвольно. Реальных данных, подтверждав-
ших эти воззрения, не было и нет. Всерьез они
обсуждалась в XIX веке; так считал, например,
Шлейден. Беда в том, что у нас эти концепции
возродились спустя сто лет.
Итак, любая клетка размножается только путем
деления. Все клетки возникают при делении исходных.
Делятся и некоторые органеллы (митохондрии и
6
хлоропласты), но для клеток этот признак обяза-
телен.
Четвертый постулат чисто описательный. В много-
клеточных организмах ("сложных ансамблях") клетки
могут дифференцироваться, претерпевая серьезные
изменения. Например, нейрон, который тянется у нас
от спинного мозга до мышц стопы, имеет длину около
метра. А диаметр эритроцита - около 8-10 мкм.
Очевидны и различия по форме. Эритроцит представ-
ляет собой двояковогнутый диск; нейроны имеют
длинные, направленные во все стороны отростки; лей-
коцит - в общем круглая штука; макрофаг похож на
амебу; печеночная клетка (гепатоцит) как будто взята
из уроков геометрии, у нее правильная полиэдриче-
ская форма. Неодинаково и содержание. Например,
наши эритроциты лишены ядер. А мышечные клетки
напичканы митохондриями1.
Несмотря на различия, все клетки многоклеточ-
ного организма происходят от одной-единственной
оплодотворенной яйцеклетки. В. первом приближении
их генетический аппарат остается одинаковым (за
исключением эритроцитов, выбрасывающих ядро).
Двойной набор хромосом, образовавшийся при слия-
нии сперматозоида с яйцеклеткой, сохраняется во
всех клетках взрослого организма.
§ 2. Основные черты строения клеток
бактерий, растений и животных
Знакомясь со строением клеток, мы не будем
продвигаться от простого к сложному, а сразу начнем
с клеток растений и животных. Поскольку эти клетки
1 Ясно, что ’’энергетические станции" нужны для сокращения
мышц.
7
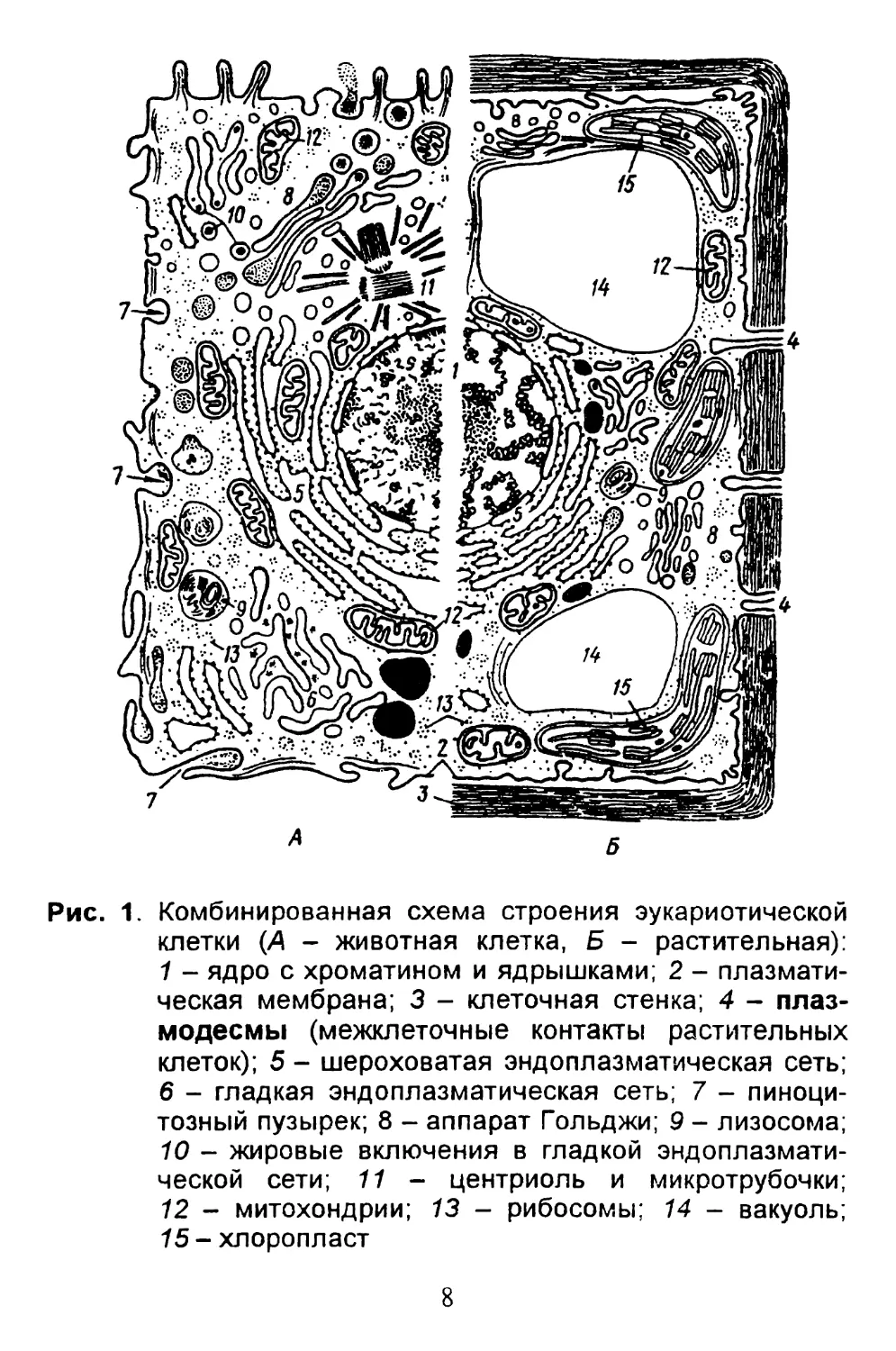
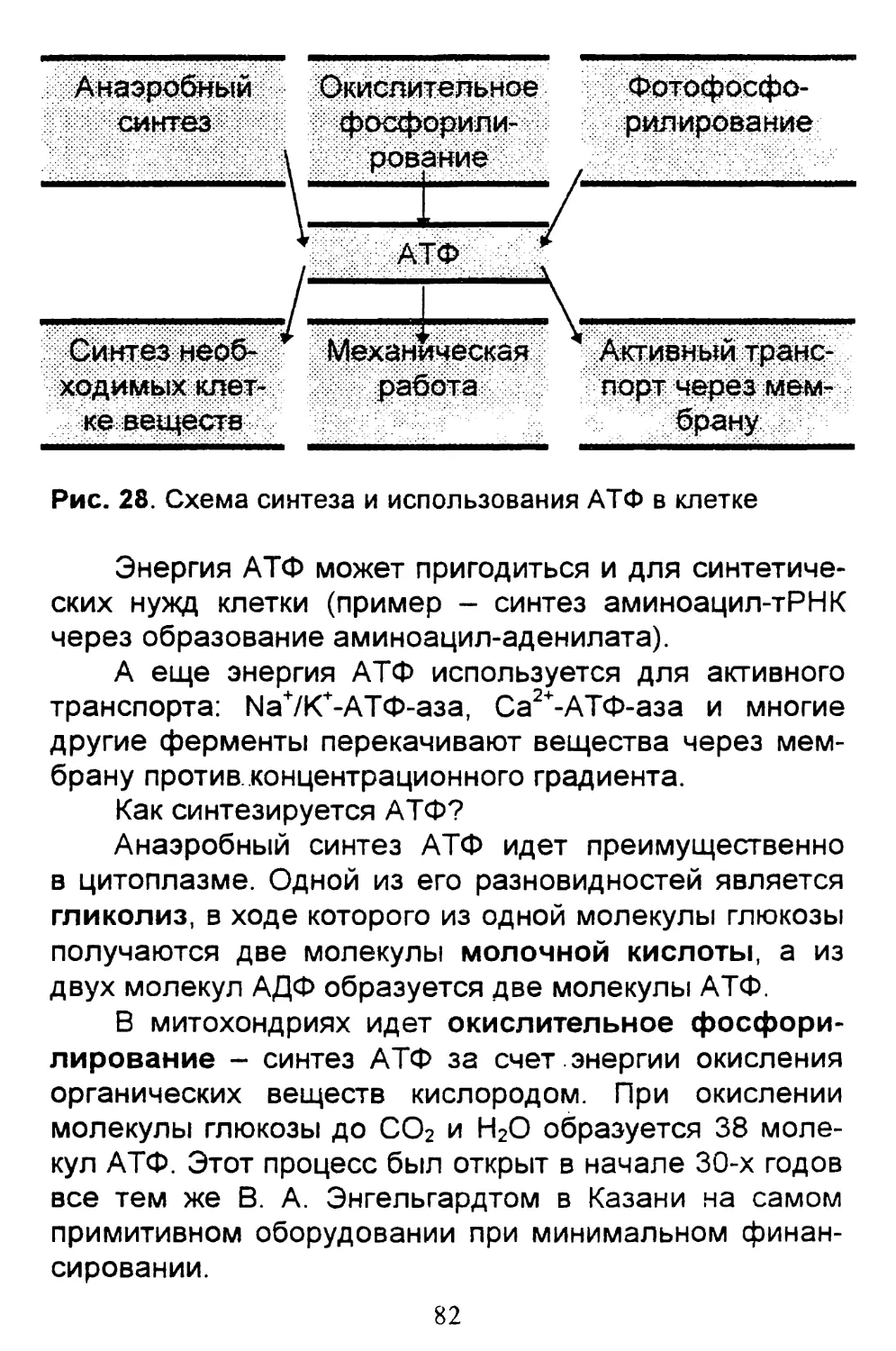
Рис. 1. Комбинированная схема строения эукариотической
клетки (Д - животная клетка, Б - растительная):
1 - ядро с хроматином и ядрышками; 2 - плазмати-
ческая мембрана; 3 - клеточная стенка; 4 - плаз-
модесмы (межклеточные контакты растительных
клеток); 5 - шероховатая эндоплазматическая сеть;
6 - гладкая эндоплазматическая сеть; 7 - пиноци-
тозный пузырек; 8 - аппарат Гольджи; 9 - лизосома;
10 - жировые включения в гладкой эндоплазмати-
ческой сети; 11 - центриоль и микротрубочки;
12 - митохондрии; 13 - рибосомы; 14 - вакуоль;
15 - хлоропласт
8
обычно имеют ядро, их называют эукариотическими
(эу - настоящий, карион - ядро). Основные состав-
ляющие эукариотической клетки показаны на рис. 1.
Все клетки имеют наружную мембрану. У растений
она окружена плотной клеточной стенкой, содер-
жащей целлюлозу. У животных клеточной стенки нет1.
В клетках эукариот есть ядро, окруженное двойной
мембраной с порами. Внутри ядра имеются уплотне-
ния - ядрышки; их может быть одно или несколько.
В цитоплазме клеток растений и животных нахо-
дятся органеллы, окруженные двойной мембраной, -
митохондрии. У растений есть и другие двухмемб-
ранные органеллы - пластиды. В зеленых пластидах -
хлоропластах - происходит фотосинтез. Встречаются
также неокрашенные и оранжево-красные пластиды -
лейкопласты и хромопласты.
И у растений, и у животных в цитоплазме имеются
длинные мембранные трубочки - эндоплазматическая
сеть, или эндоплазматический ретикулум. На неко-
торых участках его поверхности сидят рибосомы: это
шероховатый ретикулум. На других участках рибосом
нет: это гладкий ретикулум. Кроме "сидячих", есть и
свободные рибосомы, рассеянные в цитоплазме.
В клетках растений часто имеется вакуоль,
отграниченная мембраной от остальной цитоплазмы
и заполненная клеточным соком; у животных вакуоли
обычно отсутствуют.
Зато у животных есть центриоль — органелла,
участвующая в делении клеток. В клетках высших
сосудистых растений (цветковых и голосеменных)
центриоли нет, хотя у многих водорослей и у низших
сосудистых она имеется.
1 Среди одноклеточных - протистов - некоторые организмы
с животным типом питания тоже имеют клеточную стенку.
9
Наконец, в клетках растений и животных присут-
ствуют расположенные стопочкой мембранные "цис-
терны" - аппарат Гольджи, а также мембранные
пузырьки - лизосомы.
Клетки прокариот (бактерий) устроены намного
проще. Они тоже имеют наружную мембрану - это
обязательный элемент любой клетки. Над мембраной
обычно расположена клеточная стенка1. Имеется один
или несколько жгутиков, но многие бактерии их лише-
ны. В центральной части цитоплазмы сосредоточен
плохо различимый под микроскопом нуклеоид,
настоящего ядра с оболочкой нет. В цитоплазме есть
рибосомы. Для прокариот внутриклеточные мембран-
ные органоиды в целом не характерны.
Далеко не все детали этой картины различимы
в световой микроскоп. Например, рибосомы в него
увидеть невозможно. Казалось бы, нетрудно изго-
товить линзы с достаточно большим увеличением
Можно решить и проблему прозрачности клеточных
структур, обработав их подходящим красителем.
Однако в световой микроскоп видны структуры лишь
немногим меньше 1 мкм. Почему?
Причина - в волновой природе света. Видимый
свет охватывает волны длиной примерно от 400 нм
(фиолетовый) до 800 нм (красный). Оказывается,
нельзя увидеть предметы меньшие, чем половина
длины волны соответствующего света. Волна просто
огибает такие предметы (как морская волна огибает
маленький камушек), не отражаясь и не меняя формы.
Так что в световой микроскоп принципиально невоз-
можно увидеть объекты меньше 1/4 мкм. Эту задачу
удается решить с помощью электронного микроскопа.
У электронов тоже есть волновые свойства, но длина
1 У некоторых паразитических бактерий она отсутствует.
10
волны электрона гораздо меньше - доли ангстрема.
Если эти волны сфокусировать с помощью магнитного
поля, то они будут взаимодействовать с мелкими
объектами, подобно свету отражаясь и рассеиваясь.
Поэтому электронный микроскоп дает изображения
даже отдельных молекул.
§ 3. Строение и функции
клеточной мембраны
Приступим к более подробному знакомству с орга-
неллами. Наша задача — понять, из чего они состоят
и как работают. Постараемся также по возможности
установить связь между их структурой и функциями.
Начнем с наружной мембраны, которая есть
абсолютно у всех клеток.
Ее первая и основная функция - отграничение,
поддержание целостности. Мембрана нужна, чтобы
содержимое клетки не растеклось по окружающему
пространству (а у внутриклеточных паразитов -
не смешалось с цитоплазмой хозяина).
Раз есть функция отграничения, поневоле возни-
кают и другие функции. Наиболее очевидная из них -
транспорт веществ: питательных - внутрь, отбросов
и отходов - наружу.
Еще одна вынужденная функция - рецепция,
"ощущение" внешних сигналов. Любое живое существо
должно реагировать на то, что происходит снаружи.
Отвечать на изменения среды необходимо даже
самому простому микробу. Скажем, стало очень сухо
или очень голодно - неплохо бы образовать спору.
Естественно, сигналы должны или как-то проходить
через мембрану, или восприниматься ей самой.
К рецепции близка и еще одна функция, суще-
ственная для многоклеточных организмов, - узнавание
И
соседних клеток и формирование контактов с ними.
Например, в нашей печени все гепатоциты прочно
сцеплены. Поэтому печень довольно плотная, разре-
зать или разорвать ее непросто. А вот кровь - жидкая.
Если поместить кровь в пробирку и обеспечить усло-
вия, предотвращающие свертывание, то в нижней
части пробирки постепенно образуется неплотный,
аморфный осадок из клеток. Встряхнем пробирку -
и клетки снова перемешаются с плазмой. Итак, неко-
торые клетки сцепляются друг с другом, формируя
прочные, иногда очень плотные органы1, а другие -
не образуют контактов. Межклеточные контакты тоже
обеспечиваются мембранами; различия контактов
зависят от свойств разных мембран.
Разговор о строении мембраны начнем с ее
состава. В состав большинства органелл входят
макромолекулы: белки, углеводы и нуклеиновые кис-
лоты, имеющие огромную массу. Молекулярная масса
воды - 18 дальтон, серной кислоты - 98, поваренной
соли - 58,5, а молекулярная масса крахмала, который
запасается в клубнях картофеля и в других расте-
ниях, - несколько сотен тысяч дальтон. Молекулярная
масса белка миозина из мышечных клеток - около
500 000 дальтон, овальбумина (главного белка кури-
ного яйца) - 44 000 дальтон, ДНК из хромосомы чело-
века - сотни миллиардов дальтон. Вот с такими моле-
кулами обычно имеет дело биология.
Мембрана в этом плане - исключение. Основную
роль в ее формировании играют фосфолипиды
Молекулярная масса фосфолипидов - всего несколько
сотен дальтон. И из таких небольших молекул
без участия ковалентных связей построена органелла.
Как же удается это сделать?
1 В их состав часто входят клетки нескольких типов.
12
Чтобы разобраться, познакомимся со строением
молекул фосфолипидов. На рис. 2 показана структур-
ная формула одного из них.
сн3
I
CH3-N*-CH3
СН2
I
сн2
а О 1
О-Р-О-
Н Н О 1 1 1
1 1 ' Н-С С — сн2 1 1
<!> о
1 1 с=о с=о
1 1 сн2 сн2
1 1 сн2 сна
1 1 сн2 сн2
1 1 сн2 сн2
1 1 сн2 сн2
сн2 сн2
б 1 1 сн2 сн2
1 1 сн2 сн
1 II
сн2 сн
1 1 сн2 сн2
1 1 сн2 сн2
1 1 сн2 сн2
1 1 сн2 сн2
1 1 сн2 сн2
1 1 сн2 сн2
1 1 сн2 снг
1 1 CHS СН3
Рис. 2. Фосфатидилхолин (а -
полярная “головка”; б -
неполярные “хвосты”)
13
Чем интересна эта молекула? Ее "головка" и два
"хвоста" имеют резко отличающиеся свойства.
Химики используют понятие "электроотрицатель-
ность": одни атомы притягивают электроны сильнее,
другие - слабее. В зависимости от соотношений элек-
троотрицательности атомов ковалентные связи в
молекуле бывают полярные и неполярные.
Связи в молекуле воды сильно полярны: атом
кислорода оттягивает на себя электронную плотность,
на нем образуется частичный отрицательный заряд,
а на атомах водорода - частичный положительный
заряд1.
Что произойдет, если насыпать в воду порошок
соединения, молекулы которого тоже поляризованы?
Молекулы воды своими кислородами притянутся к час-
тичным положительным зарядам на молекулах этого
вещества, а водородами - к частичным отрицатель-
ным зарядам. Эти электростатические взаимодействия
в данном случае называются водородными связями.
Каждую молекулу порошка облепят молекулы воды,
и вещество быстро растворится.
Рассмотрим другой случай: в воду насыпали
порошок соединения, связи в котором неполярны.
Молекулы воды с этим веществом взаимодействовать
не будут. Им гораздо выгоднее реагировать друг с дру-
гом: ведь между молекулами воды тоже образуются
водородные связи. Вещество с неполярными связями
как бы вытеснится из воды. Если вещество жидкое,
оно будет отделяться от воды. Например, хорошенько
взболтав в воде керосин, можно получить эмульсию -
1 Так происходит почти всегда, если в состав молекулы вхо-
дит кислород: этот элемент очень электроотрицательный,
и только в оксиде фтора (который можно считать фторидом
кислорода) электроны смещены от кислорода к фтору.
14
взвесь очень мелких капелек. Но оставьте эту смесь
в покое - и она очень быстро расслоится: керосин
окажется сверху, а вода - внизу. Настоящий раствор
получить не удается - молекулы воды “предпочитают"
взаимодействовать друг с другом, вытесняя керосин.
А вот глицерин, в котором есть поляризованные
связи, растворяется в воде хорошо: в любых
соотношениях.
Итак, соединения с неполярными ковалентными
связями не растворяются в воде. Они называются
гидрофобными (гидро - вода, фобос - страх, т. е.
"боящиеся воды"). Твердые гидрофобные вещества
несмачиваемы водой. Вещества с ковалентными
полярными связями или хорошо растворяются в воде,
или хорошо смачиваются водой. Их называют гидро-
фильными (фило — любить).
Вернемся к фосфолипидам. Их "головка" гидро-
фильна: в ее состав входит кислород, и связи поляри-
зованы. Кое-где "головка" еще и заряжена: кислород
остатка фосфорной кислоты несет отрицательный
заряд, азот аминогруппы - положительный. Вода
охотно будет взаимодействовать с "головками" фос-
фолипидов. "Хвосты" состоят из СН2-групп. Нельзя
сказать, что связь С-Н вовсе не поляризована; но
поскольку значения электроотрицательности углерода
и водорода очень близки, поляризация слабая. Так что
"хвосты" вполне гидрофобны1 и поэтому "стремятся"
избежать взаимодействия с водой.
Понимания того, что фосфолипид состоит из гид-
рофильной "головки" и гидрофобных "хвостов",, доста-
точно, чтобы мысленно собрать мембрану. Приступим
к решению этой задачи.
1 ’’Хвосты" фосфолипидов без “головок” — не что иное, как
молекулы керосина.
15
шшдшшш
Рис. 3. Устойчивые системы фосфолипид-вода: 1 - моно-
слой фосфолипида на поверхности раздела воздух-
вода; 2 - бислой в пленке, разделяющей две части
водного раствора; 3 - мицеллы; 4 - липосома
Как поведут себя молекулы фосфолипидов, ока-
завшись на поверхности воды? Ясно, что “головки"
будут обращены в воду, а “хвосты” - вытолкнуты
из воды (рис. 3). Образуется монослой - пленка тол-
щиной в одну молекулу.
Ну, а если "затолкать" молекулы фосфолипидов
в воду? Тогда “головки” будут обращены к воде (нару-
жу), а “хвосты” - от воды (внутрь). Получатся мелкие
16
скопления молекул - мицеллы. Сильно вытянутая
мицелла может замкнуться в пузырек, внутри и сна-
ружи которого находится вода. В стенке пузырька
(липосомы) молекулы фосфолипидов образуют би-
слой - расположатся в два ряда “головками” к воде, а
“хвосты” спрячутся внутрь стенки. Неполярные "жир-
ные" части молекул взаимодействуют друг с другом,
а полярные — с водой.
То, что молекулы в биомембранах действительно
расположены в два слоя, показали изящным опытом.
Была вычислена площадь поверхности эритроцитов -
клеток, имеющих постоянные размеры и форму.
Известное число эритроцитов отделили от остальных
клеток крови и экстрагировали липиды их наружной
мембраны (внутренних мембран у эритроцитов практи-
чески нет). Затем эти фосфолипиды вылили на
поверхность воды, где они образовали пленку. Когда
пленку “поджали”, получив сплошной монослой, его
площадь оказалась вдвое больше площади поверх-
ности клеток.
Вот так из небольших молекул формируется мак-
роструктура — мембрана. Ее толщина — всего 7-8 нм.
Тем не менее мембрану можно "увидеть" и в световой
микроскоп, поскольку на поверхности клетки происхо-
дит преломление света.
Липидный бислой можно получить искусственно.
Он прекрасно выполнит ограничительную функцию,
но чувствовать ничего не сможет, да и транспортиро-
вать будет лишь те вещества, которые способны про-
никать через него сами.
Эти функции мембраны "возложены" на белки.
Их расположение иллюстрирует модель "липидного
озера" (рис. 4).
Согласно этой модели (правильность которой
сейчас доказана), в “липидном озере” - мембране -
17
плавают “айсберги” - белки. Некоторые из них торчат
по обе стороны мембраны, пронизывая ее насквозь;
другие выступают только изнутри или только снаружи.
Сравнение с озером не случайно. Мембрана
скорее похожа на подсолнечное масло, чем на
сливочное. Это - не жесткая структура, а тонкий
текучий слой, пленочка жира между водой. Бел-
ки в плоскости мембраны свободно диффунди-
руют (действительно напоминая айсберги).
Рис. 4. Строение клеточной мембраны согласно модели “ли-
пидного озера”
Функции этих белков различны. Многие из инте-
гральных белков, пронзающих мембрану насквозь,
осуществляют транспорт веществ. Белки, обращенные
внутрь, часто выполняют регуляторные функции.
18
Многие из обращенных наружу белков служат рецеп-
торами.
Особую группу транспортных белков мембраны
составляют ионные каналы и ионные насосы. Они
создают мембранный потенциал. На мембранах
любых клеток (и уж, конечно, нервных и мышечных)
имеется разность потенциалов. Электрические заряды
по разные стороны мембраны неодинаковы, что свя-
зано с разными концентрациями ионов внутри и
снаружи клетки.
В проведении нервного импульса и ряде других
клеточных процессов особую роль играют два иона -
калий и натрий. Натрия много снаружи и мало внутри
клеток; для калия картина обратная. Как обеспечи-
вается эта разность концентраций? Натрий-калиевая
АТФ-аза, специальный мембранный белок, выталки-
вает наружу натрий и закачивает внутрь калий. Ионы
движутся против градиента концентрации; естествен-
но, при этом расходуется энергия связей АТФ
(активный транспорт). Разлагается АТФ самим транс-
портным белком. Заряд же на мембране возникает
потому, что при расщеплении молекулы АТФ выкачи-
вается три иона натрия и закачивается два иона калия.
Нетрудно сообразить, что внешняя сторона мембраны
заряжена положительно, внутренняя - отрицательно .
Хотя мембрана имеет гидрофобный слой из “хво-
стов” фосфолипидов, она все же проницаема для
воды. Мелкие молекулы воды "расталкивают" гидро-
фобный слой и свободно перемещаются в клетки и из
клеток. Любой дурак может в этом легко убедиться,
1 На самом деле образование мембранного потенциала -
значительно более сложный процесс (см. § 11); работа
натрий-калиевой АТФ-азы дает меньшую часть потенциала,
чем другие механизмы.
19
введя себе под кожу немного стерильной дистиллиро-
ванной воды (умный поверит на слово). Это место
сразу же покраснеет, опухнет и будет болеть. Почему?
Да потому, что вода проникает внутрь клеток1. Мем-
браны разбухших клеток лопаются, и клетки гибнут.
А дальнейшие последствия - это и покраснение
(повреждены стенки мелких сосудов), и боль, и мест-
ная воспалительная реакция.
Можно поступить гуманнее: добавить дистилли-
рованную воду в пробирку с клетками крови.
Произойдет то же самое - вода начнет посту-
пать внутрь клеток, и они полопаются.
Но для ионов металлов мембрана почти непрони-
цаема. Они преодолеют ее только при участии особых
транспортных белков. Поэтому раз созданному гради-
енту ничего не грозит.
Есть и белки, которые осуществляют пассивный
транспорт - без затрат энергии, просто по градиенту
концентрации. Именно так работают ионные каналы,
пропускающие сквозь мембрану различные ионы.
Существуют особые каналы для натрия, калия, хлора
и других ионов. Так же проходят в клетку и некоторые
другие вещества - например, глюкоза. Сквозь липид-
ный бислой молекулы глюкозы проникнуть не могут: их
переносит специальный белок. Как правило, глюкозы
в клетке мало (она расходуется на синтез разных
веществ, на получение энергии), и по градиенту кон-
центрации глюкоза проникает снаружи.
Макромолекулы не могут прямо переноситься
через мембрану. Их транспорт в клетку и из нее обес-
печивают процессы экзоцитоза и эндоцитоза (рис. 5).
1 По градиенту концентрации - внутри клеток раство-
рены различные вещества, а значит, содержание воды там
меньше, чем снаружи.
20
Рис. 5. Схема процессов экзоцитоза (1) и эндоцитоза (2): а -
стадия слипания; б - стадия слияния. Обратите вни-
мание на то, что экзоцитоз и эндоцитоз не повторяют
друг друга в обратном порядке: при экзоцитозе сли-
паются Два монослоя плазматической мембраны,
обращенные к цитоплазме, а при эндоцитозе - два
наружных монослоя мембраны
Благодаря экзоцитозу клетка секретирует (выде-
ляет) различные вещества - гормоны, ферменты и пр.
Эти вещества упаковываются в специальные окру-
женные мембраной секреторные пузырьки. Затем
пузырьки сливаются с наружной мембраной, а их
содержимое выбрасывается наружу.
21
При помощи эндоцитоза клетка поглощает
вещества извне. В процессе эндоцитоза от наружной
мембраны вовнутрь отшнуровывается пузырек, в кото-
ром оказывается необходимое клетке вещество. Этот
пузырек сливается с определенными органеллами
внутри клетки. Специфичность слияния обеспечивают
белки, расположенные на мембранах пузырьков и
органелл.
Выделяют две разновидности эндоцитоза: пино-
цитоз и фагоцитоз. В ходе пиноцитоза жидкость
и растворенные вещества захватываются в небольших
(до 150 нм) пузырьках. А при фагоцитозе поглоща-
ются большие частицы (микроорганизмы, обломки
клеток и др.); при этом образуются крупные (>250 нм)
фагосомы, иначе называемые пищеварительными
вакуолями.
К фагоцитозу способны лишь специализирован-
ные клетки, тогда как пиноцитоз используют
практически все клетки.
В некоторых тканях (например, в эпителиальной)
имеются щелевидные контакты - узкие (несколько
нанометров) мостики, соединяющие цитоплазмы со-
седних клеток. Благодаря этим контактам низкомоле-
кулярные вещества могут переходить из одной клетки
в другую на протяжении всего эпителиального пласта.
§ 4. Строение ядра
Ядро окружено двойной мембраной. Каждая из
мембран ядра - такой же липидный бислой, как и
наружная мембрана клетки. В некоторых местах ядер-
ные мембраны как бы смыкаются. Эти участки назы-
ваются ядерными порами. Но расположена здесь
не дырка, а сложный комплекс белковых молекул
Он регулирует транспорт веществ из цитоплазмы
22
в ядро и из ядра в цитоплазму (через простую дырку
что угодно влетало бы и вылетало). Внутри ядра
можно разглядеть не окруженное мембраной ядрыш-
ко (одно или несколько). Есть в ядре и нечто расплыв-
чатое: то плохо видимые глыбки, то островки, а то
и вовсе нечто совсем диффузное. Это - хроматин.
При митозе хроматин конденсируется в хорошо разли-
чимые хромосомы. В неделящейся клетке четких
хромосом, как правило, не видно.
Хроматин состоит из ДНК и белков. В ДНК запи-
сана наследственная информация. Что это за инфор-
мация и как она “записывается”, подробно рассказано
в пособии ВЗМШ “Наследственная информация и ее
реализация в клетке”, поэтому нет смысла повто-
ряться.
§ 5. Митоз и клеточный цикл
Перейдем к рассмотрению клеточного цикла —
жизни клетки от деления до деления.
Эукариотические клетки обычно делятся путем
митоза. Что должно случиться, чтобы клетка прошла
путь от одного митоза до другого? Прежде всего,
удвоение ДНК (иначе утратится часть генетического
материала). Это происходит в течение S-фазы. Между
митозом и синтезом ДНК нужно время на подготовку
(G1-период): расплетание хромосом и др. Необходим
переход и от S-фазы к митозу (С2-период). Весь про-
межуток от конца одного митоза до начала следую-
щего называется интерфазой.
Делятся далеко не все клетки организма. Некото-
рые клетки в принципе утрачивают эту способность
(например, нервные). Другие клетки способны к деле-
нию, но в норме не делятся.
23
Таковы, например, гепатоциты. Но если выре-
зать у человека часть печени (даже 75%),
оставшиеся клетки начнут делиться и быстро
"дорастят" печень до нормальных размеров.
Точно так же клетки нижнего слоя кожи - фиб-
робласты - в покое почти не делятся, но если
кусок кожи вырезан, начинают делиться и
достраивают его.
Состояние покоя (GO-период) соответствует вре-
мени между митозом и Gl-периодом.
Перед митозом - в конце С2-периода - у клетки
имеется ядерная оболочка и другие органеллы (рис.
6). В ходе интерфазы удваивается не только ДНК, но и
крайне важная для митоза органелла - центриоль.
Около центриоли располагается центр организации
микротрубочек (ЦОМТ); именно от него растут нити
митотического веретена. В клетках высших растений
центриолей нет, а ЦОМТ все равно есть. Его структура
и в световой, и в электронный микроскоп видна плохо.
Митоз начинается с профазы, во время которой
происходит несколько событий1. Хромосомы посте-
пенно конденсируются, уплотняются, принимая харак-
терный для делящейся клетки облик. Исчезает ядрыш-
ко, поскольку синтез рибосом прекращается. Центри-
оли перемещаются к полюсам клетки. Ядерная обо-
лочка постепенно разделяется на мелкие пузырьки,
которые отходят в цитоплазму (в световой микроскоп
кажется, что оболочка ядра растворилась).
Около центриолей образуются пучки микротрубо-
чек, идущих в разные стороны, - это начинает расти
митотическое веретено2. Некоторые нити веретена
присоединяются к особым участкам хромосом -
1 Их порядок в разных клетках может отличаться.
2 Строго говоря, оно растет не совсем от центриоли, а от
расположенного рядом ЦОМТ.
24
Рис. 6. Стадии митоза: 1 - интерфаза (а - цитоплазма; б -
центриоли; в - клеточная мембрана; г - ядерная
мембрана; д - ядрышко; е - хроматин); 2 - ранняя
профаза; 3- средняя профаза; 4 - ранняя метафаза;
5 - метафаза; б - ранняя анафаза; 7 - поздняя ана-
фаза; В - ранняя телофаза; 9- поздняя телофаза
центромерам, или кинетохорам. На каждой хромосо-
ме имеется одна центромера. К центромере присое-
диняются микротрубочки, идущие от обеих центрио-
лей. Пока с центромерой связаны микротрубочки от
25
одной центриоли, связь слабая и хромосома легко
открепляется. Как только к центромере присоединятся
микротрубочки (хотя бы одна) от другой центриоли,
связь становится прочной.
С этого момента начинается метафаза. Ее моле-
кулярные механизмы загадочны. Под микроскопом же
видно, как хромосомы начинают "ерзать" взад-вперед
между центриолями. К концу метафазы они выстраи-
ваются четко посредине между центромерами, причем
ориентируются перпендикулярно линии, соединяющей
центриоли. Образуется так называемая метафазная
пластинка. Микротрубочки, подходящие к хромо-
сомам, сохраняют связь с центромерами и имеют рав-
ную длину.
Наступает анафаза: каждая центромера делится
пополам, и половинки хромосом - хроматиды - начи-
нают перемещаться к противоположным полюсам.
Полюса-центриоли тоже раздвигаются к самым краям
клетки. Хромосома как бы откусывает микротрубочку
и по ней же движется. Движение центриолей обеспе-
чивают нити веретена, но не присоединенные к хромо-
сомам, а другие - так называемые непрерывные
нити. Еще недавно думали, что они тянутся от одной
центриоли к другой. На самом деле они оканчиваются
в цитоплазме, причем микротрубочки от разных
центриолей перекрываются. Перед раздвиганием цен-
триолей микротрубочки сначала наращиваются, а
потом “скользят” друг по другу. Механизмы движения
с помощью микротрубочек мы рассмотрим в § 20.
После разделения хромосом на половинки начи-
нается телофаза. Этот процесс в определенном смы-
сле обратен профазе. Хромосомы деконденсируются,
появляются ядрышки, из пузырьков собирается ядер-
ная оболочка, образуются ядерные поры. Естественно,
эти события происходят в обеих половинках клетки.
26
Наконец, делится сама клетка, причем у животных
и растений по-разному. У клеток животных на месте
метафазной пластинки образуется и затем сужается
перетяжка - стягивающий поясок. У клеток растений
мембранные пузырьки, которые всегда есть в цито-
плазме, транспортируются к области бывшей мета-
фазной пластинки. Здесь они сливаются сначала друг
с другом, а затем - с наружной мембраной. Итог тот
же - клетка разделяется на две. Содержимое пузырь-
ков образует так называемую срединную пластинку,
которая в зрелых тканях скрепляет соседние клетки1.
Разные способы деления в конце телофазы и от-
сутствие центриолей - вот, собственно, и все отличия
митоза у клеток высших растений и у животных клеток.
Разберемся теперь с количеством ДНК. Если обо-
значить количество ДНК в половых клетках как 1с,
то содержание ДНК в оплодотворенной яйцеклетке
(зиготе) сразу после слияния гамет составит 2с - по 1с
от отца и от матери. В любой клетке тела сразу после
митоза столько же ДНК - 2с (ведь там пара однохро-
матидных хромосом - по одной от отца и матери).
После S-периода ДНК вдвое больше - 4с.
У прокариотических клеток митоза нет. Их ДНК
прикреплена к клеточной оболочке. После реплика-
ции так же закрепляется и новая хромосома. Затем
клеточная стенка растет и разделяет две хромосомы
в двух дочерних клетках.
§ 6. Мейоз. Кроссинговер
При слиянии гамет количество ДНК суммируется.
В зиготе оно вдвое больше, чем в каждой из гамет.
1 Для растительных клеток деление перетяжкой непригодно
из-за наличия жесткой клеточной стенки.
27
При митозах (в ходе развития многоклеточного орга-
низма из зиготы) это количество остается постоянным.
Ясно, что при образовании гамет оно должно умень-
шиться вдвое: иначе в череде поколений количество
ДНК будет расти в геометрической прогрессии.
Такое уменьшение происходит при созревании
гамет (у высших растений - при созревании спор) во
время особого клеточного деления - мейоза. В сверх-
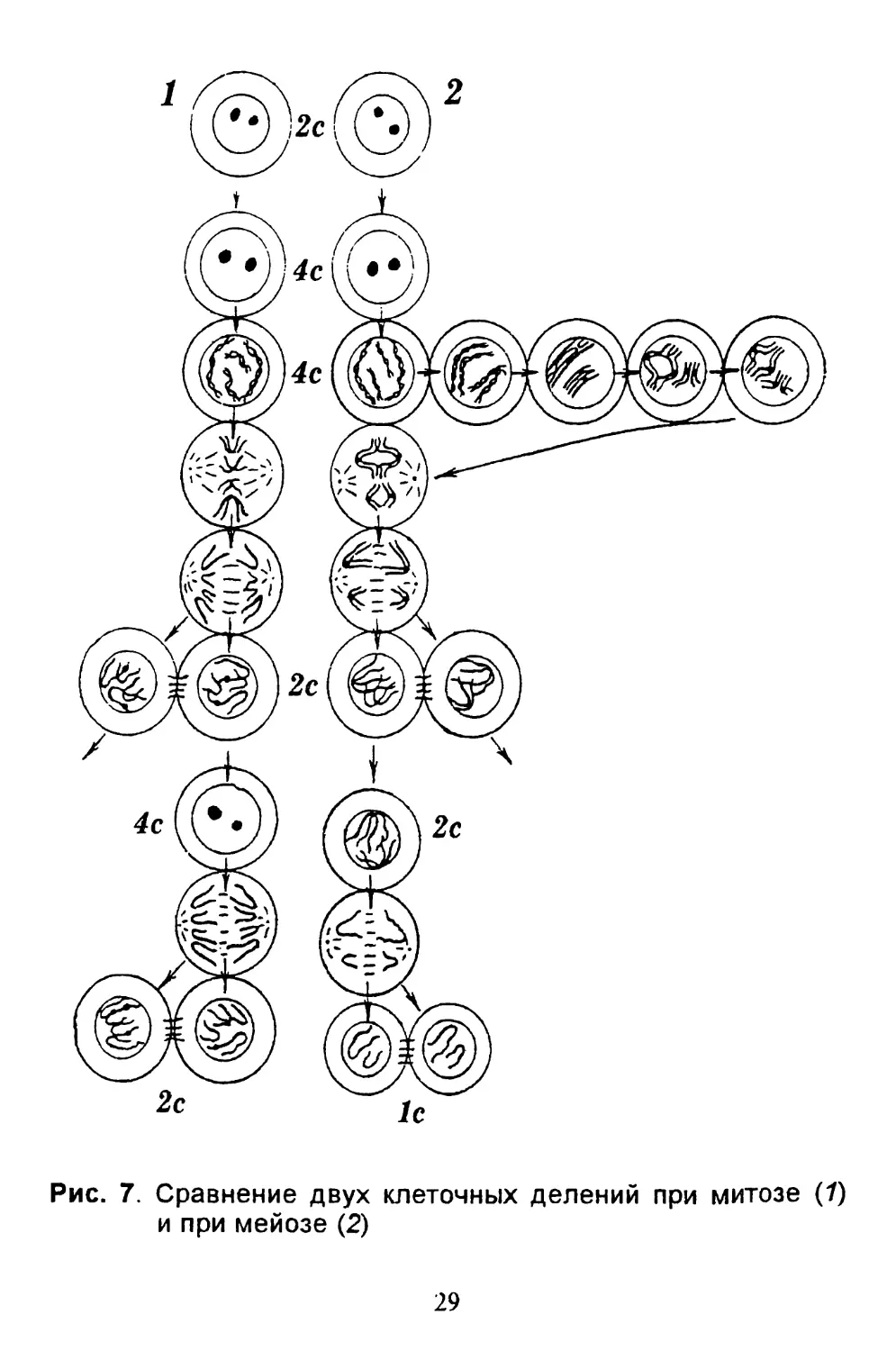
грубом приближении мейоз - это два митоза без
S-фазы между ними. За время мейоза дважды обра-
зуется веретено деления, а количество ДНК умень-
шается в четыре раза.
Однако такая модель упускает из виду существен-
ные особенности (рис. 7), прежде всего обмен участ-
ками гомологичных хромосом - кроссинговер. Он
происходит в профазе первого деления мейоза.
У вас почти наверняка 46 хромосом: 23 от папы
и 23 от мамы. Если не считать половых хромосом,
которые сильно отличаются друг от друга, остальные
22 от папы и 22 от мамы кодируют вроде бы одно и то
же. Например, на одной и той же хромосоме и от папы,
и от мамы закодирован гемоглобин1, на другой хромо-
соме - ДНК-полимераза, на третьей - кератин и т. п.
Но папино и мамино "одно и то же" - не совсем одно и
то же. Допустим, определенный участок хромосомы
кодирует глобин. Однако папин глобин может отли-
чаться от маминого на одну-две аминокислоты. Эти
варианты гена называют аллелями. Гомологичными
называют хромосомы, несущие аллели одних и тех же
генов. Гены гомологичных хромосом отвечают за одни
и те же белки, но иногда в разных вариантах - алле-
лях, так что и белок образуется двух несколько отли-
чающихся "сортов".
1 Точнее, глобин, поскольку гем - небелковое соединение.
28
Рис. 7. Сравнение двух клеточных делений при митозе (7)
и при мейозе (2)
29
В ходе кроссинговера могут случаться ошибки:
дупликация (удвоение) или делеция (потеря) какого-
то участка, или обмен негомологичными участками,
при котором в одной хромосоме оказываются два
аллеля одного гена, а в гомологичной — два аллеля
другого гена. Но это ошибки: тогда и получаются раз-
ного рода гении и уроды. А когда речь идет про
“добропорядочную серость”, никаких негомологичных
обменов не происходит.
В общем-то непонятно, зачем кроссинговер нужен.
Чтобы создавать новые комбинации аллелей? Но у
потомства удачные в эволюционном отношении ком-
бинации тот же кроссинговер разрушит, перетасует.
Другая гипотеза состоит в следующем. Поскольку
функция гена сильно зависит от его окружения, то
"плохие" аллели при кроссинговере могут попадать в
"хорошее" окружение, где их проявление будет подав-
ляться, или в еще более "плохое" окружение - тогда
они будут легче удаляться из популяции. Эта идея
тоже не все объясняет. Тем не менее обмен гомоло-
гичными участками ДНК есть у большинства организ-
мов - даже у бактерий, хотя и не в таком красивом
виде- как у нас.
Итак, в первой профазе мейоза происходит крос-
синговер. Еще одна особенность мейоза - в его пер-
вой профазе, в отличие от митоза, активно синтезиру-
ются ДНК и РНК. Часть синтеза ДНК - "залечивание",
исправление повреждений ДНК, которые возникают
при кроссинговере. Зачем синтезируется остальная
ДНК- неясно. Если подавить синтез ДНК, мейоз оста-
новится. Зачем синтезируется РНК, более понятно.
Для развития из яйцеклетки понадобится много бел-
ков. Нужно синтезировать и запасные питательные
белки (особенно если развитие происходит вне мате-
ринского организма), и регуляторные белки, и пр.
30
После кроссинговера хромосомы, обменявшись
участками, отходят друг от друга. Перед метафазой
хромосомы выстраиваются возле экватора клетки;
образуется веретено - вроде бы так, как и при митозе.
Однако к полюсам расходятся не хроматиды, а двух-
хроматидные хромосомы - по одной гомологичной
хромосоме из каждой пары. Разрыва центромер
и разделения хроматид не происходит, и в результате
к одному полюсу движется одна гомологичная хромо-
сома (например, отцовская с материнскими вкрапле-
ниями, полученными при кроссинговере), а к другому -
Другая.
Клетки, образовавшиеся в результате первого
деления мейоза, по количеству ДНК не отличаются от
клеток - продуктов митоза; но по числу хромосом
отличие принципиальное. Каждая из гомологичных
хромосом представлена одной копией; такой набор
называется гаплоидным. (Набор, содержащий по две
копии каждой из гомологичных хромосом, называется
диплоидным.)
При втором делении мейоза к полюсам расходят-
ся уже хроматиды - как и при митозе. Однако между
делениями мейоза нет интерфазы и S-периода.
Исходно в клетке было 4с ДНК, а в каждой клетке,
образовавшейся при первом делении мейоза, - по 2с
ДНК. После короткой передышки клетка строит новое
митотическое веретено, и второе деление мейоза
идет точно так же, как митоз. В результате образуется
четыре клетки, в каждой из которых - по 1с ДНК.
Интервал между первым и вторым делением
мейоза иногда очень велик. Например, яйцеклетки
человека первое деление проделывают еще в ходе
внутриутробного развития, а второе - при половом
созревании, причем оно останавливается на метафазе
и заканчивается только после оплодотворения.
31
Суммируем отличия мейоза от митоза.
Главное: при мейозе число хромосом уменьша-
ется вдвое, а при митозе остается тем же. Мейоз про-
исходит только в диплоидной клетке и дает в итоге
гаплоидные клетки. В результате же митоза число
хромосом не меняется; он может идти как в диплоид-
ных, так и в гаплоидных клетках.
Вторая особенность мейоза - обмен генетическим
материалом между хромосомами (кроссинговер).
Третья особенность мейоза - синтез ДНК и РНК
в первой профазе.
§ 7. Как белки попадают
в эндоплазматическую сеть
Некоторые белки синтезируются на рибосомах
эндоплазматического ретикулума, а другие - на сво-
бодных рибосомах цитоплазмы. На ретикулуме синте-
зируются белки самого ретикулума, аппарата Гольджи,
лизосом, наружной мембраны и секреторные белки.
В цитоплазме синтезируются белки цитоплазмы, ядра,
а также те белки митохондрий и хлоропластов, кото-
рые закодированы в ядерном геноме.
Как обеспечивается это разделение? Может,
рибосомы ретикулума и цитоплазмы отличаются друг
от друга? Оказывается, нет. Тогда остается допустить,
что все белки, синтезируемые на рибосомах ретику-
лума, имеют что-то общее между собой и отличное от
белков, синтезируемых на рибосомах цитоплазмы.
Оказалось, что в самом начале генов белков,
синтезируемых на ретикулуме, закодирована особая
последовательность примерно из тридцати аминоки-
слот — так называемый лидерный пептид. Вскоре
после синтеза лидерный пептид вырезается, и в зре-
32
лых белках его нет. В генах ядерных, цитоплазматиче-
ских, митохондриальных и хлоропластных белков
лидерный пептид не закодирован. Если из гена белка,
который должен синтезироваться на ретикулуме,
вырезать кодировку лидерного пептида, то белок
будет синтезироваться в цитоплазме и не попадет
в нужную органеллу.
Когда иРНК выходит из ядра в цитоплазму, она
в любом случае связывается с обычной цитоплазмати-
ческой рибосомой, и начинается синтез белка. Если
в иРНК закодирован лидерный пептид, то он при
синтезе постепенно вылезает из рибосомы и торчит
наружу. Оказывается, в цитоплазме имеется специ-
альный белок - рецептор лидерного пептида. "Обна-
ружив" лидерный пептид, рецептор тут же связывается
с ним - и синтез белка останавливается (рис. 8). Рибо-
сома не отваливается от иРНК, не сбрасывает лидер-
ный пептид, а просто "замирает".
Такой комплекс диффундирует в цитоплазме и
рано или поздно подплывает к эндоплазматическому
ретикулуму. На мембране ретикулума расположен
особый белок, узнающий этот комплекс. Условно назо-
вем данный белок "рецептор рецептора". Как только
"рецептор рецептора" свяжется с рецептором ли-
дерного пептида, весь комплекс перестраивается,
в результате чего:
- лидерный пептид через мембрану ретикулума
"засовывается" в его полость;
- рецептор лидерного пептида отваливается и
уходит назад в цитоплазму;
- рибосома продолжает работу, "пропихивая"
полипептидную цепь через мембрану ретикулума.
В чем заключается эта перестройка - неясно.
Вероятно, "рецептор рецептора" имеет канал,
по которому протягивается белковая цепочка.
33
Рис. 8. Транспорт белков в полость эндоплазматической
сети (а - мРНК; б - тРНК; в - свободный А-участок
рибосомы; г - лидерный пептид новосинтезирован-
ного белка; д - рецептор лидерного пептида; е -
“рецептор рецептора” в мембране ЭПР): 1 - связы-
вание рецептора лидерного пептида вызывает паузу
в трансляции; 2 - рибосома, связанная с рецептором
лидерного пептида, прикрепляется к “рецептору
рецептора” в мембране ЭПР; 3- рецептор лидерного
пептида удаляется и возвращается в круговорот,
трансляция продолжается, начинается перенос
белка в полость ЭПР
Итак, рибосома оказалась на ретикулуме. Сквозь
мембрану не прошел бы белок с третичной структу-
рой - огромная глобула не пролезет через липидный
бислой. Но развернутую полипептидную цепь пропих-
нуть куда легче. Синтезированный белок сворачива-
ется в полости ретикулума. После завершения синтеза
34
рибосома отходит от ретикулума, а лидерный пептид
остается заякоренным на мембране. Специальный
фермент отщепляет этот пептид, после чего белок
освобождается с мембраны ретикулума в его полость.
§ 8. Эндоплазматический ретикулум
(эндоплазматическая сеть)
Мы фактически уже начали рассматривать сле-
дующую органеллу - эндоплазматический ретикулум
(ЭПР). Он представляет собой систему сообщающихся
цистерн. Полость ЭПР - единое целое. Она отделена
мембраной от цитоплазмы, но соединяется с прост-
ранством между мембранами ядра. Полость ретику-
лума изолирована также от наружной среды клетки,
внутриядерного пространства, митохондрий и других
органелл.
ЭПР выполняет очень важные функции:
1) здесь синтезируются липиды всех клеточных
мембран1;
2) существенная часть белков синтезируется на
поверхности ретикулума, транспортируется через его
мембрану, а затем попадает туда, куда нужно;
3) в ретикулуме белки подвергаются ряду
модификаций; например, из них вырезается лидерный
пептид;
4) многие (но не все) клетки хранят в ретикулуме
запасы кальция.
Теперь вернемся к рассмотрению пути белков,
попавших в полость ЭПР.
От ретикулума постоянно отшнуровываются мем-
бранные пузырьки, которые движутся к аппарату
1 Исключение - митохондрии и хлоропласты; они частично
синтезируют липиды сами.
35
Гольджи и сливаются с его цистернами. Содержимой
этих пузырьков оказывается в аппарате Гольджи, бла
годаря чему белки лизосом, наружной мембраны и
секреторные белки могут транспортироваться дальше
(рис. 9).
ЭПР
Первичные
лизосомы
Аппарат
Гольджи
^^р^трр^ые
пузырьки
Рис. 9. Клеточный транспорт
с белками от ЭПР
мембранных пузырьков
Однако не хотелось бы, чтобы в отшнуровы-
вающиеся пузырьки попадали белки ЭПР. Как же избе-
гать такого расточительства?
С мембранными белками ситуация проста. Клетка
умеет при отшнуровывании пузырьков не включать
в них неподходящие белки и концентрировать нужные.
Как она это делает - неизвестно. Но в результате
мембранные белки, нужные в самом ретикулуме,
при отшнуровывании пузырьков не попадают в их мем-
брану, а значит, не теряются.
С растворимыми белками дело сложнее. Плавая
в жидкой фазе, белок будет диффундировать во все
закоулки ЭПР и неминуемо попадет в отшнуровы-
вающиеся пузырьки. Как же растворимым белкам,
нужным в ретикулуме, удается не оказаться в аппа-
рате Г ольджи?
36
Оказалось, что у всех растворимых белков ЭПР
есть одна и та же последовательность из четырех
аминокислот. Белки, уходящие из ретикулума в аппа-
рат Гольджи и далее, не имеют такой последователь-
ности, а все растворимые белки ЭПР - имеют.
Эта последовательность служит меткой, означающей:
"Мое место - в ретикулуме".
Одной метки мало - нужен рецептор, который бы
ее узнавал. На мембране эндоплазматического рети-
кулума имеются рецепторы, способные связывать
метку (а значит - и белки, которые ее содержат).
Работать эти рецепторы начинают в отшнуровавшемся
пузырьке (рис. 10). Понятно, зачем: свободнопла-
вающие белки должны осуществлять свою функцию
в растворе, а не “торча" на мембране.
Рис. 10. Обратный транспорт белков в ЭПР: а - мембрана
ЭПР; б - белки, содержащие последовательность
из четырех аминокислот; в - белки, не содержащие
последовательность из четырех аминокислот; г -
“рецептор четырех аминокислот”; д - транспорт
в аппарат Гольджи
37
При отшнуровке пузырька в его мембране кон
центрируются молекулы "рецептора четырех амино-
кислот". Растворимые белки попадают в пузырек "без
разбору": и те, кому нужно оказаться в аппарате Гольд-
жи, и те, кому положено работать в ретикулуме.
Белки, содержащие последовательность из четы-
рех аминокислот, после отшнуровки пузырька присое-
диняются к рецептору. Это обусловлено двумя причи
нами.
Во-первых, в ретикулуме много Са2+ - специаль-
ный фермент закачивает туда этот ион; а в пузырьке,
куда фермент не попадает, концентрация Са2+ посте
пенно снижается. Кальций мешает рецептору связы-
вать последовательность из четырех аминокислот
Поэтому когда концентрация Са2+ в пузырьке снизится,
белки, содержащие эту последовательность, будут
связываться с рецептором. Белки же аппарата Гольд-
жи, лизосом, наружной мембраны и секреторные,
не имеющие этой последовательности, останутся
свободными.
Во-вторых, рецепторы на мембране пузырька
расположены гораздо гуще, чем на мембране ретику-
лума. Если бы даже рецептор в ретикулуме сохранил
некоторую способность, несмотря на наличие Са2+,
связывать "белки с четырьмя аминокислотами", эти
белки присоединялись бы лишь на малое время,
а потом откреплялись, находясь преимущественно
в растворе. В отшнуровавшемся пузырьке плотность
рецепторов гораздо выше, и белок, едва отойдя
от одного рецептора, тут же свяжется с другим; так
что большую часть времени он проводит в связанном
виде.
Для возвращения белков в ретикулум осталось
сделать один шаг: отшнуровать от пузырька неболь-
шой "пузыречек" и загнать туда все "рецепторы четы-
38
рех аминокислот" с сидящими на них белками. "Пузы-
речек" сольется с мембраной ретикулума, и белки
вернутся на свое место работы, освободившись от
рецептора. Остальной же пузырек теперь не содержит
белков ретикулума - и он пойдет к аппарату Гольджи.
§ 9. Аппарат Гольджи
Цистерны аппарата Гольджи, в отличие от рети-
кулума, не образуют цельной системы. Некоторые из
них соединены друг с другом, но общей полости нет.
Обычно в аппарате Гольджи выделяют три части: цис-
Гольджи (туда поступают пузырьки из ЭПР), проме-
жуточный аппарат Гольджи и транс-Гольджи (от
него отходят пузырьки к лизосомам и наружной мем-
бране). Транспорт меящу этими частями осуществ-
ляется путем отшнуровки и слияния пузырьков.
Аппарат Гольджи выполняет две важнейшие
функции.
Первая - это сортировка белков в соответствии
с тем, куда им надлежит двигаться. Сортировка бывает
по органеллам и направлениям в пространстве.
Из аппарата Гольджи белки транспортируются
в лизосомы или в особые пузырьки, которые потом
сольются с наружной мембраной (туда идут секретор-
ные белки и белки мембраны). Именно аппарат
Гольджи “решает”, какие белки в какую органеллу
отправлять. Делает он это на основании специальной
метки: при наличии в структуре белка метки он идет
в лизосому, при отсутствии - в секреторный пузырек.
Аппарат Гольджи осуществляет и пространствен-
ную сортировку белков по разным областям клетки.
Зачем это нужно? У многих клеток (например,
эпителиальных и нервных) полюса существенно
отличаются по свойствам. Следовательно,
39
и набор белков в разных "углах" клеток должен
быть разный. К какому концу клетки какой белок
транспортировать, обычно определяется в аппа-
рате Гольджи, хотя иногда этот вопрос "решает"
уже наружная мембрана.
Вторая функция аппарата Гольджи - модифи-
кация белков. Здесь отрезаются определенные фраг-
менты, привешиваются остатки углеводов и т. д.
Эти модификации идут во всех частях аппарата
Гольджи, но каждой части свойственны специ-
фические реакции.
§ 10. Лизосомы и пероксисомы
Следующая органелла - лизосома. Лизосомы
осуществляют внутриклеточное пищеварение. В них
находятся ферменты, расщепляющие белки (проте-
азы), липиды (липазы), углеводы (гликозидазы),
нуклеиновые кислоты (нуклеазы) и др. Большинство
из этих ферментов в нейтральной среде неактивно1,
а в кислой - активно. Внутри лизосом pH близок к 5,
что оптимально для работы большинства их фер-
ментов.
Все лизосомальные белки имеют свойственную
только им последовательность аминокислот. Специ-
альный фермент в аппарате Гольджи, обнаружив
эту последовательность, навешивает на содержащий
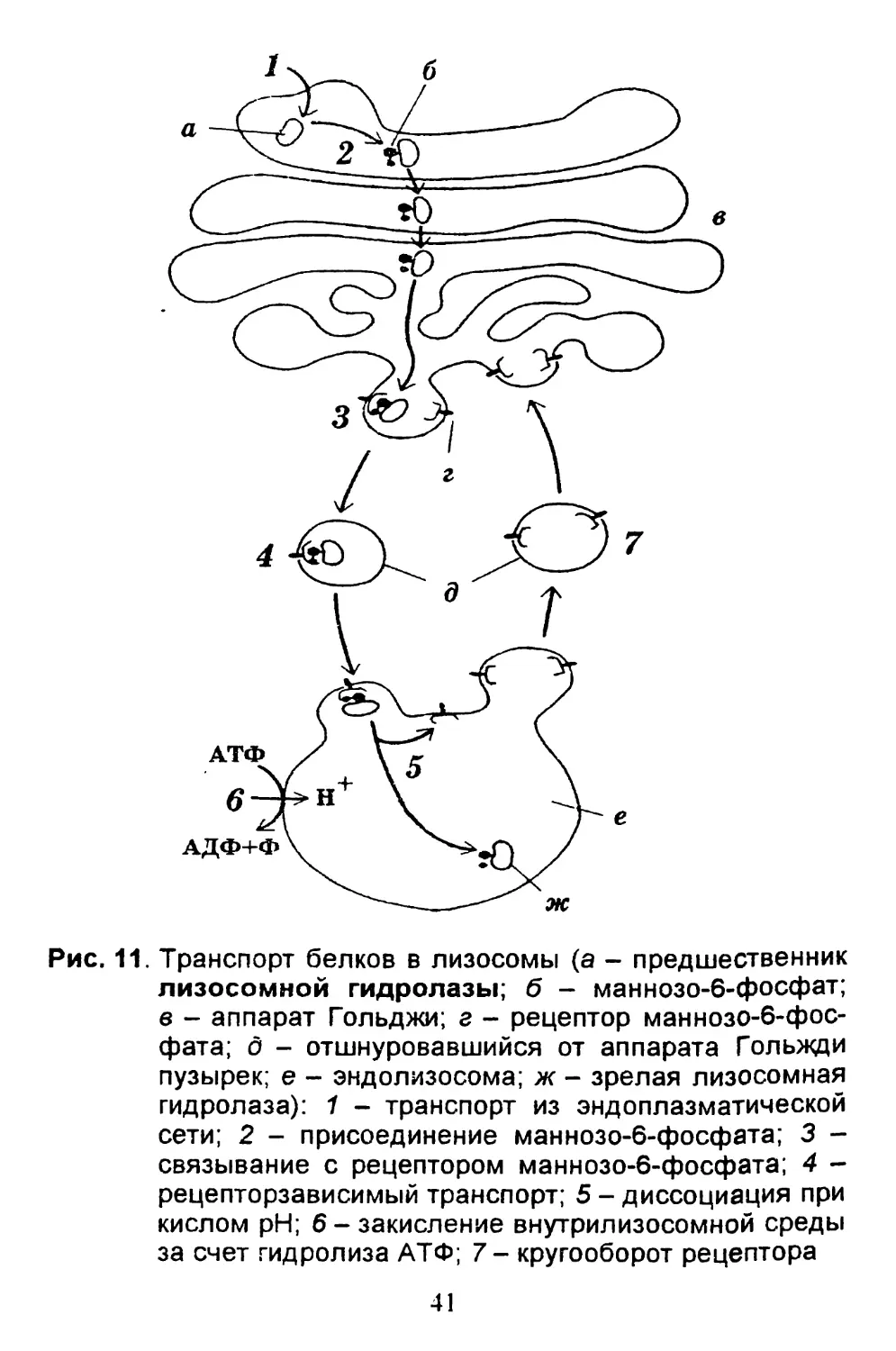
ее белок метку - маннозо-6-фосфат (рис. 11).
В мембране аппарата Гольджи есть рецептор
маннозо-6-фосфата. Он отшнуровывается в специ-
альные пузырьки. Разумеется, туда попадают и все
белки с маннозо-6-фосфатом, т. к. они связаны с
рецептором.
1 И слава богу, иначе они переварили бы ретикулум с аппа-
ратом Гольджи.
40
Рис. 11. Транспорт белков в лизосомы (а - предшественник
лизосомной гидролазы; б - маннозо-6-фосфат;
в - аппарат Гольджи; г - рецептор маннозо-6-фос-
фата; б - отшнуровавшийся от аппарата Гольжди
пузырек; е - эндолизосома; ж - зрелая лизосомная
гидролаза): 1 - транспорт из эндоплазматической
сети; 2 - присоединение маннозо-6-фосфата; 3 -
связывание с рецептором маннозо-6-фосфата; 4 -
рецепторзависимый транспорт; 5 - диссоциация при
кислом pH; б-закисление внутрилизосомной среды
за счет гидролиза АТФ; 7 - кругооборот рецептора
41
Эти пузырьки сливаются с первичной лизосомой.
В мембране лизосомы (пузырька размером около
0,3 мкм) имеется особый фермент1, который закачи-
вает внутрь ионы водорода, закисляя содержимое
этой органеллы. Лизосомальные ферменты отсоеди-
няются от рецептора маннозо-6-фосфата (он работает
только в нейтральной среде) и становятся активными.
Обратите внимание: метка дублируется! Особая
аминокислотная последовательность показывает, что
на белок надо вешать маннозо-6-фосфат, а маннозо-6-
фосфат - что белок следует отправить в лизосому2.
А куда девается рецептор маннозо-6-фосфата?
От эндолизосомы отшнуровываются пузырьки, в кото-
рых этот рецептор концентрируется. Пузырьки движут-
ся к цистернам аппарата Гольджи, сливаются с ними и
возвращают рецептор для повторного использования.
Ну, а как лизосома переваривает пищевые час-
тицы? На первом этапе клетка поглощает частицу
путем фагоцитоза. Частица оказывается заключенной
в мембранном пузырьке - фагосоме, или эндосоме.
Затем эндосома сливается с первичной лизосомой;
получается вторичная лизосома, в которой фермен-
ты расщепления встречаются с пищевой частицей.
Частица переваривается, а низкомолекулярные про-
дукты реакций всасываются через мембрану лизо-
сомы. В лизосомах могут перевариваться и собствен-
ные органеллы (например, МйЧзохондрии), если они
"состарились" и плохо функционируют.
Раньше считали, что лизосомы играют важнейшую
роль в защите организма от микробных инфек-
1 Этот фермент доставляется в лизосомы через те же
пузырьки, отшнуровывающиеся от аппарата Гольджи.
2 Почему у лизосомальных белков метка двойная, а во всех
остальных случаях одинарная - неизвестно.
42
ций: нейтрофилы и макрофаги, фагоцитировав микро-
бов, переваривают их своими лизосомальными
ферментами. Однако патогенные микробы оказались
вовсе не беззащитными. Многие из них выработали
устойчивость к лизосомальным ферментам, а неко-
торые “до того обнаглели”, что размножаются во вто-
ричных лизосомах.
Тем не менее для незваных пришельцев фагоци-
тирующие клетки крови - серьезный барьер. В их
работе оказываются весьма полезными особые орга-
неллы - пероксисомы. Пероксисомы - небольшие
мембранные пузырьки, они есть в клетках растений,
клетках печени, имеются и в нейтрофилах. В разных
клетках пероксисомы играют разную роль. Главная их
функция в растительных клетках и клетках печени -
метаболическая: в пероксисомах протекают специфи-
ческие реакции обмена веществ. А вот в пероксисомах
нейтрофилов накапливается много перекиси водоро-
да (Н2О2), токсичной для микробов1. Мало того, в пе-
роксисомы нейтрофилов активно накачиваются ионы
СГ, которые под действием Н2О2 превращаются в вы-
сокотоксичные окисленные производные хлора. После
фагоцитоза фагосома сливается с пероксисомой, и
именно ее “крутая смесь" окислителей убивает микро-
ба. А потом за дело принимаются лизосомальные си-
стемы.
Пероксисомы - уникальные органеллы. Они раз-
множаются делением (а не отшнуровываются от аппа-
рата Гольджи, как лизосомы). При этом пероксисомы
не содержат ни ДНК, ни РНК, ни рибосом, ни даже соб-
ственной системы синтеза липидов. С помощью бел-
ков-переносчиков пероксисомы получают липиды от
1 Не зря врачи рекомендуют обрабатывать царапины иодом
или перекисью водорода.
43
ЭПР. Белки пероксисом синтезируются на свободно-
плавающих рибосомах и потом транспортируются
через мембрану органеллы1 * *. Когда клетка испытывает
повышенную потребность в деятельности пероксисом,
транспорт липидов и белков в пероксисомы усили-
вается, они увеличиваются в размерах и делятся
Возможно, пероксисомы образовались путем симбио-
генеза (см. § 23), но не исключено, что столь экзотиче-
ский способ самоподдержания этой органеллы возник
вторично, для удобства регуляции.
§ 12. Потенциал покоя
Мы уже говорили, что на наружной мембране
клетки имеется разность потенциалов; внутренняя
сторона несет заряд "минус", наружная - "плюс"
В генерации потенциала важную роль играет Na+/K4-
АТФаза. Однако большая часть мембранного потен-
циала образуется по другому механизму, который был
установлен в экспериментах Доннана.
Он разделил стеклянный сосуд искусственной
мембраной из коллодия, пропускавшей низкомолеку-
лярные вещества (воду, ионы металлов), но не пропу-
скавшей высокомолекулярные соединения (белки
и нуклеиновые кислоты).
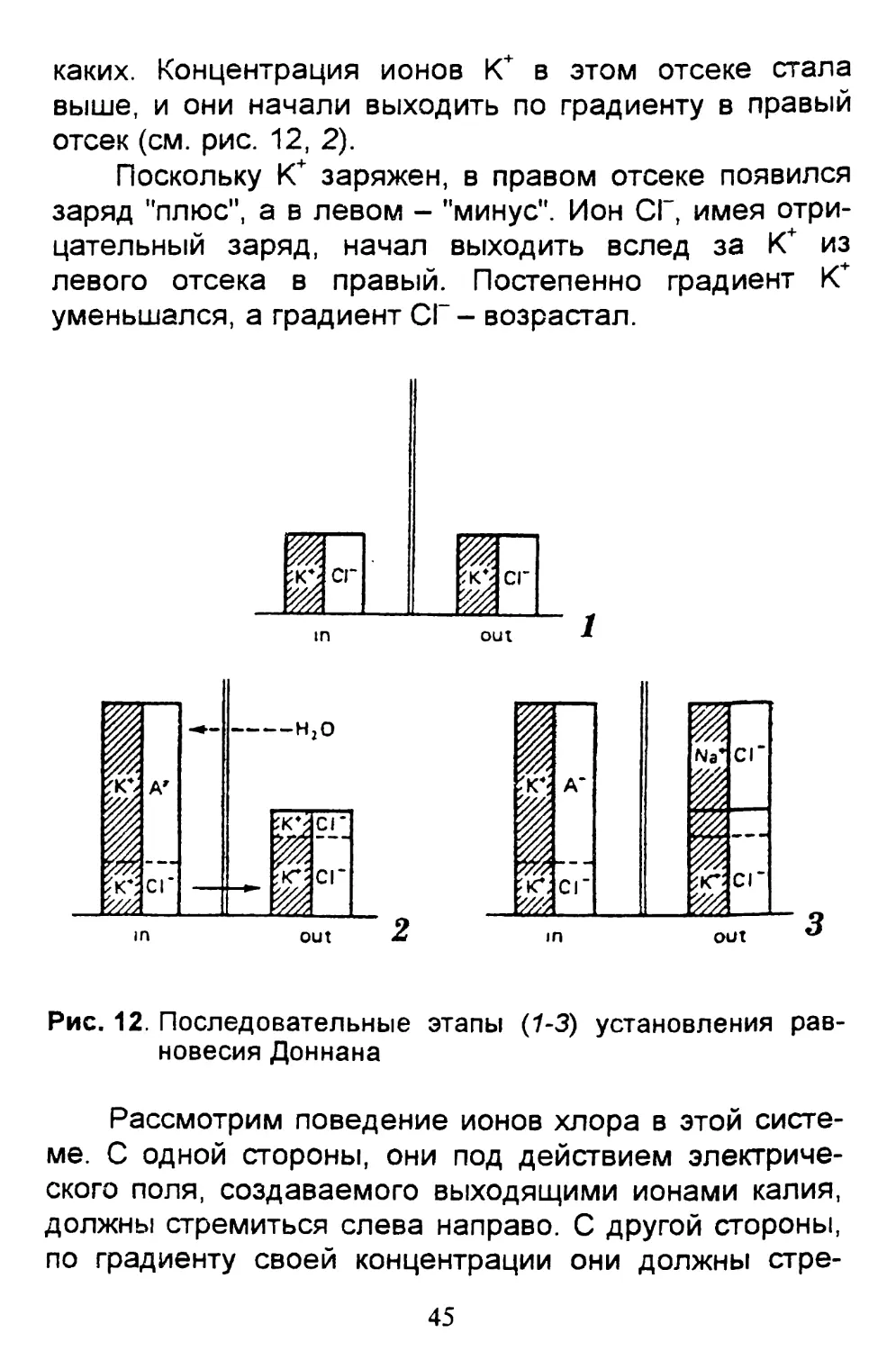
Сначала Доннан добавил в оба отсека равное
количество KCI. Ионы К+ и СГ диффундировали через
мембрану, их концентрации по обе стороны не отлича-
лись, потенциала на мембране не было (рис. 12, 1).
Затем в один из отсеков (левый) Доннан добавил
калиевую соль высокомолекулярных анионов, неважно
1 Механизм этого переноса плохо изучен, но, вероятно, он
похож на механизм переноса белков в митохондрии, о кото-
ром мы будем говорить в $ 22.
44
каких. Концентрация ионов К+ в этом отсеке стала
выше, и они начали выходить по градиенту в правый
отсек (см. рис. 12, 2).
Поскольку К+ заряжен, в правом отсеке появился
заряд "плюс", а в левом - "минус". Ион СГ, имея отри-
цательный заряд, начал выходить вслед за К+ из
левого отсека в правый. Постепенно градиент К+
уменьшался, а градиент СГ - возрастал.
Рис. 12. Последовательные этапы (1-3) установления рав-
новесия Доннана
Рассмотрим поведение ионов хлора в этой систе-
ме. С одной стороны, они под действием электриче-
ского поля, создаваемого выходящими ионами калия,
должны стремиться слева направо. С другой стороны,
по градиенту своей концентрации они должны стре-
45
миться справа налево. Сперва эффект электрического
поля сильнее, но постепенно градиент СГ становится
все значительнее, и в конце концов "калиевая" сила
уравновешивается "хлорной" силой. Наступает дина-
мическое равновесие: сколько СГ выйдет из каждого
отсека, столько же и зайдет: точно такая же картина
и для К+. В этом равновесии, называемом доннанов-
ским равновесием, соотношение концентраций К'
и СГ определяется формулой.
К in / К out ~ Cl out / Cl in-
На полупроницаемой мембране создается раз-
ность потенциалов, получившая название доннанов-
ский потенциал
Рассмотренная система - хорошая модель живой
клетки. Мембрана клетки имеет каналы для К* и СГ.
обеспечивающие проницаемость для этих ионов. Для
высокомолекулярных же ионов (белков и нуклеиновых
кислот) мембрана непроницаема. Потенциал на
клеточной мембране называют потенциалом покоя.
Заметим, что суммарная концентрация солей
неодинакова по разные стороны мембраны: внутри
клетки она больше, чем снаружи. Следовательно,
внутри клетки создается осмотическое давление. Для
растительной клетки с ее жесткой клеточной стенкой
это не страшно, а вот животная клетка в таких усло-
виях лопнула бы. У морских животных внутреннее
осмотическое давление уравновешивается высоким
содержанием NaCI в морской воде. Мы же с вами
вынуждены таскать "морскую воду" внутри себя: высо-
кая концентрация NaCI в крови и межклеточной жид-
кости уравновешивает осмотическое давление клеток,
и клетки благоденствуют в изоосмотической среде
Потенциал покоя на мембране нервных и мышечных
клеток составляет около -70 мВ
46
§ 12. Потенциал действия
В обычном состоянии мембрана почти непрони-
цаема для ионов натрия: концентрация Na* снаружи
животной клетки высока, внутри - мала. На мембране
нервных (и мышечных) клеток имеются потенциал-
зависимые натриевые каналы - белки, обладающие
хитрыми свойствами. Пока потенциал на мембране
превышает1 некоторое пороговое значение (у нерв-
ных клеток - около -50 мВ), каналы закрыты. В состоя-
нии покоя потенциал на мембране составляет -70 мВ,
и значит, через натриевые каналы ничего не идет.
Если каким-либо способом (например, с помощью
электродов) слегка деполяризовать мембрану -
допустим, до -60 мВ - каналы не откроются, a Na*/K*-
АТФаза быстро восстановит прежний потенциал.
Но если мембрана будет деполяризована до порого-
вого значения, каналы откроются. Na+ пойдет по гра-
диенту концентрации внутрь клетки, вызывая в этом
участке мембраны сперва деполяризацию, а потом и
обратную поляризацию - до +35 мВ (рис. 13).
Как только мембрана окажется обратно поляризо-
вана, потенциал-зависимые натриевые каналы закро-
ются. Более того, некоторое время они не смогут реа-
гировать на новое изменение потенциала - наступит
состояние рефрактерности. А в это время ионы калия
будут выходить из клетки: ведь снаружи клетки этих
ионов гораздо меньше, чем внутри, а потенциала на
мембране в данном участке нет. По мере выхода К*
потенциал восстановится и остановит это движение
(ведь отрицательный потенциал электрически препят-
ствует выходу катионов). Клетка вернется в прежнее
Мы сравниваем абсолютные значения (модули) мем-
бранного потенциала.
47
состояние, если не считать того, что часть К+ вышла из
клетки, а часть Na+ - вошла. Вскоре Иа+/К+-АТФ-аза
выкачает из клетки лишний натрий и закачает калий.
Весь этот всплеск изменений получил название
потенциала действия, или нервного импульса.
Рис. 13. Развитие потенциала действия при достижении
мембранным потенциалом порогового значения (а -
пиковый потенциал; б - порог активации; в - потен-
циал покоя)
§ 13. Распространение нервного импульса
Как же потенциал действия распространяется
по мембране нервной клетки?
Допустим, потенциал действия возник на некото-
ром участке мембраны (рис. 14). Na+ через открытые
каналы проходит в клетку. Поскольку на этом участке
его концентрация уменьшается, то сюда будут пере-
мещаться ионы натрия из соседних областей. Возни-
кает "продольный" натриевый ток. Соседние участки
мембраны с падением концентрации Na+ деполяризу-
48
ются. Когда потенциал достигнет порогового значения,
откроются потенциал-зависимые натриевые каналы,
и потенциал действия возникнет уже и по соседству.
Рис. 14. Схема распространения потенциала действия по
мембране нейрона (а - цитоплазма аксона; б -
тканевая жидкость): 1 - возникновение потенциала
действия на небольшом участке мембраны; 2 - рас-
пределение зарядов через некоторое время
Теперь понятно, зачем нужна рефрактерность.
Пусть в каком-то участке возник потенциал действия:
натриевые каналы открылись и вновь закрылись.
В процессе его распространения открываются натрие-
вые каналы на соседних участках. Вызываемая этим
деполяризация могла бы вновь открыть каналы на
исходном участке, и потенциал действия никогда бы
не прекратился. Однако поскольку натриевые каналы
на исходном участке будут рефрактерны, они не отве-
тят на изменение потенциала соседних участков,
и в результате потенциал действия распространится
в виде волны деполяризации.
49
Последнее, что нужно сказать о нервном импуль-
се, - откуда он берется в организме. Как мембранный
потенциал опускается до порогового?
В организме возбуждение приходит от нейронов:
мышечная клетка возбуждается нейроном, а нейрон -
другим нейроном. В месте контакта длинного отростка
(аксона) нейрона к каким-то участком другого нейрона
(отростком-дендритом или телом клетки) образуется
особая структура - синапс1 (рис. 15).
Рис. 15. Схема строения синапса (а - окончание аксона; б -
синаптический пузырек; в - пресинаптическая мем-
брана: з - синаптическая щель; д - постсинаптиче-
ская мембрана; е - каналы, связанные с рецепто-
ром; ж - потенциалзависимый канал: з - синаптиче-
ский пузырек, слившийся с мембраной)
Нейрон, который посылает сигнал через синапти-
ческий контакт, называется пресинаптическим, а ней-
рон, который воспринимает сигнал. - постсинаптиче-
; Химические синапсы служат не только для связи нейрона
с нейроном, но и для связи нейрона с мышечной клеткой.
50
ским. Ширина промежутка между ними (синаптиче-
ской щели) в химических синапсах1 обычно составля-
ет 20-30 нм. В аксонах нейронов, образующих химиче-
ские синапсы, имеются мембранные пузырьки, запол-
ненные особыми веществами - нейромедиаторами.
При прохождении нервного импульса по пресинап-
тическому нейрону эти пузырьки сливаются с наружной
мембраной. Нейромедиатор освобождается в синап-
тическую щель. На мембране постсинаптического ней-
рона есть рецепторы нейромедиатора - это натриевые
каналы, открывающиеся в ответ на нейромедиатор.
Пока через первый нейрон не проходит потенциал
действия, весь нейромедиатор расположен в пузырь-
ках, его нет в синаптической щели и на рецепторах
второго нейрона, натриевые каналы закрыты. При про-
хождении потенциала действия нейромедиатор выде-
лится в синаптическую щель и свяжется с рецепто-
рами. После этого откроются натриевые каналы. Na*
пойдет в постсинаптический нейрон, вызывая деполя-
ризацию мембраны. В ответ на падение потенциала
потенциалзависимые натриевые каналы откроются,
и импульс начнет распространяться по постсинапти-
ческому нейрону.
Основной медиатор при передаче возбуждения
с нейрона на скелетную мышцу - ацетилхолин. При
выделении порции медиатора постсинаптическая
клетка на некоторое время возбуждается, а потом
возвращается в состояние покоя, т. к. ацетилхолин
расщепляется ферментом ацетилхолинэстеразой.
При передаче возбуждения с нейрона на нейрон
в головном мозге основным медиатором явля-
ется глута мат-ион
Кроме рассмотренных ниже химических синапсов, бывают
и электрические синапсы.
5I
§ 14. Цитоскелет
Рассмотрев органеллы, находящиеся в цитоплаз-
ме, немного поговорим о ней самой. Цитоплазма -
это не просто жижа, в которой болтаются мито-
хондрии, эндоплазматический ретикулум и т. д. В ней
имеются тонкие структуры - цитоскелет. Правильнее
говорить о трех цитоскелетных системах: это микро-
филаменты, микротрубочки и промежуточные фила-
менты. Цитоскелет осуществляет такие важные и
взаимно противоречивые функции, как структурная
функция и обеспечение подвижности (и органелл,
и клетки). Анализ функций цитоскелета начнем с хо-
рошо изученных, хотя и весьма специализированных
клеток - мышечных.
§ 15. Механизм мышечного сокращения
Поперечно-полосатая мышца (рис. 16) состоит из
отдельных волокон - миофибрилл. Под микроскопом
видно, что они как бы поперечно исчерчены: какие-то
зоны темнее, какие-то - светлее.
Перегородки, расположенные поперек миофиб-
риллы, называются Z-линиями, нити, отходящие от
Z-линии, - тонкими филаментами, а расположенные
между ними более толстые пучки - толстыми фила-
ментами.
При сокращении мышцы длина филаментов
не меняется. Согласно теории скользящих нитей,
которую на сегодняшний день можно считать доказан-
ной, тонкие филаменты скользят по толстым, как бы
подтягиваясь друг к другу. Таким образом, сокращение
мышцы - явление, происходящее на уровне органа, -
можно свести к скольжению филаментов - явлению
клеточного масштаба.
52
a
Рис. 16. Уровни ор1анизации скелетной мышцы: 1 - мышца
(а - сухожилие, б - кость); 2 - мышечные волокна;
3 — отдельное мышечное волокно; 4 — миофибрилла
(в — саркомер; г — Н-зона; б — A-диск; е — l-диск; ж —
Z-линии)
Ну, а чтобы ответить на вопрос: "Почему фила-
менты скользят друг по другу?", придется рассмотреть
события на молекулярном уровне.
Толстые филаменты образованы белком миози-
ном. Молекула миозина симметрична и состоит из
двух половинок (рис. 17). Каждая половинка имеет
головку и хвост, подвижно соединенные шейкой - как
на шарнире.
Рис. 17. Строение молекулы миозина (а - головка; б - шей-
ка; в - хвост)
В составе толстого филамента молекулы миозина
упакованы "хвост к хвосту", а их головки торчат наружу
(рис. 18).
б
Рис. 18. Схема строения толстого филамента (без соблю-
дения масштаба): а - “голая” зона; б - головки мио-
зина
Из белков, составляющих тонкий филамент,
сейчас для нас важен актин. Его молекулы имеют
54
форму шариков; тонкий филамент напоминает две
закрученные друг вокруг друга цепочки бус, в которых
отдельная бусинка - молекула актина. Концы этой
спирали неравнозначны: на Z-линии закреплен (нако-
нец, а (-)конец свободен. При скольжении толстый
филамент всегда подтягивается от (-)конца к (+)концу.
Мышца сокращается за счет энергии АТФ. Спо-
собность миозина расщеплять АТФ обнаружил еще
в середине 40-х годов советский ученый В. А. Энгель-
гардт. Благодаря этому процессу химическая энергия,
освобождающаяся при гидролизе АТФ, переходит
в механическую энергию сокращающейся мышцы.
Теперь разберем молекулярные механизмы
скольжения филаментов1 (рис. 19).
Миозин существует в двух конформациях: с вытя-
нутой и с согнутой головкой. Конформация миозина
определяется тем, что находится в его активном
центре: АТФ, АДФ+фосфат, только АДФ или же ничего.
Если в активном центре АТФ или ничего нет, головка
изогнута. Если там АДФ или АДФ+фосфат, головка
вытянута. Связывание миозина с актином тоже зависит
от того, что находится в активном центре миозина.
Если АТФ или АДФ+фосфат, то миозин не будет свя-
зываться с актином. Если просто АДФ или ничего -
будет.
Для простоты запоминания можно считать, что
"выпрямленность" головки определяется АДФ:
если он там есть (только АДФ или АДФ+фос-
фат), то головка вытянута, если нет - изогнута.
Ну, а связывание с актином определяется
третьим фосфатом (в составе АТФ или вместе
с АДФ), который мешает связыванию с актином;
если же его нет, то связывание возможно.
Существует несколько моделей, мы рассмотрим наиболее
вероятную.
55
АДФ+Ф
2
Рис. 19. Цикл работы (1-4) миозиновых головок (а - тонкий
филамент; б - толстый филамент; в - “шарнир"; г -
миозиновая головка)
Пусть в активном центре миозина имеется АТФ
(первый этап) - головка миозина изогнута, он не свя-
зан с актином. Миозин расщепляет АТФ, и в активном
центре оказываются АДФ и фосфат (второй этап) -
головка выпрямляется, но миозин все еще не связан
с актином. Из активного центра уходит фосфат (третий
этап) - головка останется вытянутой, но миозин сразу
же связывается с актином. После этого из активного
центра уходит АДФ (четвертый этап) - миозин еще
связан с актином, но его головка изогнулась, позволяя
56
подтянуть тонкий филамент. Филаменты продвинулись
навстречу на один шаг. Наконец, активный центр мио-
зина связывает новую молекулу АТФ и отсоединяется
от актина. Цикл начинается сначала, и тонкий фила-
мент подтягивается еще на один шаг.
На рис. 19 сокращение показано на плоскости, но
поскольку в состав толстого филамента входит множе-
ство молекул миозина, он подтягивает все соседние
тонкие филаменты.
§ 16. Регуляция сокращения
поперечно-полосатой мышцы
Если руководствоваться приведенным выше опи-
санием, то мышца будет сокращаться все время, пока
в клетке есть АТФ. Пользы от подобной судороги мало.
Поскольку мышца сокращается только когда нужно -
особенно поперечно-полосатая1, она должна вклю-
чаться и выключаться.
Чтобы понять эту регуляцию, разберем строение
тонкого филамента в деталях, воспользовавшись
рис. 20.
Рис. 20. Строение актинового филамента (а - тропомиозин;
б - актин; в - тропониновый комплекс)
! Поперечно-полосатые сокращаются под контролем созна-
ния, гладкие - без этого контроля.
57
Две цепочки актиновых шариков в тонком фила-
менте заплетены друг вокруг друга. Между участками
из семи шариков актина (в каждой цепочке) сидят две
молекулы белка тропонина. Длинные тяжи от одного
тропонина до другого образованы белком тропомио-
зином. Тяжей два на каждом участке тонкого фила-
мента, они облеплены шариками актина. Итак, если
толстый филамент состоял из одного белка - миозина,
то тонкий - из трех: актина, тропонина и тропомиозина.
На один участок тонкого филамента приходится две
молекулы тропонина, четырнадцать - актина и две -
тропомиозина.
Сокращения поперечно-полосатой мышцы регу-
лируются с помощью ионов кальция. Са2+ присоеди-
няется только к тропонину, но все белки тонкого
филамента тесно связаны. Белок, взаимодействуя
с каким-то веществом, может резко изменить конфор-
мацию (вспомните миозин и АТФ). Это и происходит
при реакции Са2+ и тропонина. Но тропонин тесно свя-
зан с тропомиозином, и изменение конформации тро-
понина влияет на положение тропомиозиновых тяжей,
как бы сдвигая тропомиозин относительно актиновых
нитей. Чтобы нагляднее представить эти изменения,
рассмотрим поперечный срез (рис. 21).
На этом рисунке, в отличие от предыдущего, пока-
зана также головка миозина. Два шарика изображают
молекулы актина. Остальные двенадцать актинов
расположены вне плоскости рисунка. Они образуют
две скручивающиеся нити (вспомните рис. 20). При
отсутствии Са2+ тропомиозин, вклинившись между
актином и миозином, препятствует их контакту. Теперь
абсолютно все равно, связана ли молекула миозина
с АТФ или АДФ: раз тропомиозин мешает соединиться
миозину с актином, то мышечное сокращение невоз-
можно. Расход энергии сразу прекращается. А по-
58
скольку тропомиозиновые тяжи идут вдоль всех глобул
актина, то без Са2+ контакт миозина с актином невоз-
можен на всем протяжении тонкого филамента.
Рис. 21. Взаимодействие в комплексе актин (а) - миозин
(6) - тропомиозин (в). Положение тропомиозина
в активированном состоянии обозначено сплошной
линией, в состоянии расслабления - пунктирной
Пусть теперь в цитоплазме появился кальций
(откуда - разберемся чуть позже). Са2+ реагирует
с тропонином, и тот меняет конформацию. Но “пере-
строившийся” тропонин тут же "утягивает" тропомио-
зин, освобождая место контакта актина с миозином.
Теперь все шарики актина могут связываться с миози-
ном, и происходит скольжение филаментов.
Откуда берется Са2+? Выше мы говорили, что Са2+
запасается в эндоплазматическом ретикулуме. Там его
концентрация очень высока (порядка 1 мМ), а в цито-
плазме - обычно низка (порядка 0,01 мкМ). Осво-
бождаясь из ЭПР, Са2+ и запускает рассмотренные
выше процессы.
59
Осталось понять, почему Са2+ выходит из ЭПР
именно тогда, когда мышце нужно сокращаться.
Все, что говорилось выше (см. § 13) о распростра-
нении потенциала действия по мембране нервной
клетки, относится и к мембране мышечной клетки.
Выделившийся в нервно-мышечном синапсе ацетил-
холин свяжется с рецепторами на мембране мышеч-
ной клетки. В рецепторах откроются натриевые кана-
лы, деполяризация начнет распространяться по мем-
бране. В мышечной клетке находятся цистерны ЭПР,
кое-где - очень близко к наружной мембране. Когда
потенциал действия приходит на участок, где к наруж-
ной мембране близко подходит ЭПР, возбуждение
передается на его мембрану. Кальциевые каналы
открываются - и Са2+ выходит в цитоплазму. Как
только концентрация Са2+ в цитоплазме повысится, он
свяжется с тропонином, тот изменит конформацию,
вытянет тропомиозин из зоны контакта актин-миозин,
и пойдет мышечное сокращение.
Как передается возбуждение с наружной мембра-
ны на мембрану ретикулума, никто толком не знает.
Правда, есть несколько разумных версий.
Первая - электрическая. Потенциал наружной
мембраны должен влиять на потенциал располо-
женных поблизости мембран ЭПР. Деполяризация на-
ружной мембраны изменяет потенциал на мембране
ретикулума, что может вызвать открывание кальцие-
вых каналов и выход Са2+.
Версия вторая — химическая: когда проходит
потенциал действия, начинает работать какой-то
фермент, и полученное с его помощью вещество
диффундирует к цистернам ЭПР, открывая кальцие-
вые каналы. Вариант: при прохождении потенциала
действия в клетку входит какой-то ион, он диффунди-
рует к ЭПР и открывает каналы.
60
Третья версия - механическая. Она утверждает,
что в местах тесного приближения мембрана ретику-
лума и наружная мембрана скрепляются какими-то
белками. При прохождении потенциала действия
конформация некоторых белков наружной мембраны
меняется. Но они связаны с белками, расположенными
под мембраной. В результате и у этих белков конфор-
мация меняется. Изменение конформации передается
с одного белка на другой, как в системе шестеренок.
Последний белок в этой цепочке, сидящий на ретику-
луме, открывает Са2+-каналы.
Разбирая мышечное сокращение, мы все время
спрашиваем: "Почему это происходит?" и "Почему это
не происходит постоянно?" С первым вопросом вроде
бы разобрались. Ну, а почему Са2+ не остается в цито-
плазме насовсем? Куда он потом девается?
Ответ очень прост: на мембране ретикулума есть
фермент Са2*-АТФ-аза, который за счет энергии АТФ
закачивает Са2+ обратно. Выходит из ретикулума Са2+
без затрат энергии: ведь его концентрация в цито-
плазме гораздо ниже. Для обратной же закачки нужна
энергия АТФ. Са2+-АТФ-аза не включается специально,
а работает постоянно. Ведь пассивный выход через
каналы - очень быстрый процесс. Пока каналы
открыты, Са2*-АТФ-аза не может накачать Са2+ в рети-
кулум - он тут же выходит через каналы. Но как только
они закрываются (возбуждение прекратилось),
Са2+-АТФ-аза быстро закачивает Са2+ обратно.
§ 17. Регуляция сокращения
гладкой мышцы
Поговорим теперь о гладких мышцах. Они могут
сокращаться с очень большой силой. В норме гладкие
мышцы не подконтрольны сознанию, они работают
61
сами по себе1. У гладких мышц есть и другие особен-
ности. Например, на нервный импульс поперечно-
полосатые мышцы реагируют, грубо говоря, мгно-
венно, а гладкие начинают реагировать через секунды.
Но зато после окончания сигнала гладкие мышцы
сокращаются дольше. (Их трудно раскачать, но трудно
й остановить.)
Ясно, что существенные различия в свойствах
должны сопровождаться различиями в- строении и в
регуляции. Различия в строении не очень велики:
в гладких мышцах тоже есть актин и миозин, хотя
организованы они не настолько правильно, как в попе-
речно-полосатой. Поэтому все, что говорилось о пере-
движении головки миозина по актиновому филаменту,
справедливо и для гладких мышц.
А вот регуляция сокращений отличается. Хотя
в тонком филаменте гладкой мышцы нет тропонина,
но Са2+ играет ключевую роль в регуляции. Связывать
Са2+ в тонком филаменте некому, и регуляцией “зани-
мается” толстый филамент.
Миозин в гладких мышцах не такой, как в попереч-
но-полосатых. Он тоже имеет головку, хвост и шарнир
между ними - без этих частей миозин не обеспечит
скольжение филаментов. Но миозин гладких мышц
просто так с актином не связывается: для этого его
нужно фосфорилировать - к строго определенной2
аминокислоте головки ковалентно присоединить
остаток фосфорной кислоты. После фосфорилирова-
ния конформация головки изменяется (рис. 22). Она из
"плохой" становится "хорошей". Миозин гладких мышц,
совсем как миозин поперечно-полосатых, приобретает
1 Мы не рассматриваем всяческих йогов, которые могут кон-
тролировать и гладкие мышцы.
2 Не входящей в активный центр.
62
способность расщеплять АТФ, взаимодействовать
с актином и т. д.
2
Рис. 22. Активация миозина в гладкомышечных и немышеч-
ных клетках (а - легкие цепи миозина; б - фосфо-
рилирование; в - акгин-связывающий участок; г -
освободившийся хвост миозина): 1 - неактивное
состояние, легкие цепи не фосфорилированы; 2 -
активное состояние, легкие цепи фосфорилированы
Но как выход Са2+ из ретикулума вызывает фос-
форилирование головок миозина?
В цитоплазме гладкомышечных клеток есть
фермент - киназа легких цепей миозина. Расшиф-
ровка этого устрашающего названия проста. Киназы -
ферменты, которые ковалентно присоединяют фосфат
к чему-нибудь. Что фосфорилирует данный фермент,
тоже понятно: головку миозина.
Фермент работает только в присутствии Са2+.
В цитоплазме покоящихся гладких мышц кальция
63
очень мало, киназа легких цепей миозина не работает,
к головкам миозина не присоединен фосфат, миозин
не может скользить по актину. Когда появляется Са2+,
он связывается с киназой, та активируется и начинает
фосфорилировать миозин. Активный миозин скользит
по актину - мышца сокращается!
Теперь ясно, из-за чего гладкие мышцы медленно
сокращаются и расслабляются: при активации сокра-
щения нужно, чтобы фермент успел профосфорилиро-
вать миозин, а когда сокращение нужно закончить,
другой фермент (протеинфосфатаза) снимает с мио-
зина фосфат. Протеинфосфатаза работает постоянно,
но в присутствии Са2+ более активная киназа навеши-
вает фосфаты быстрее, чем фосфатаза их снимает1.
§ 18. Микрофиламенты
Актиновые филаменты есть и в немышечных клет-
ках (здесь их обычно называют микрофиламенты),
даже у растений. Толщина микрофиламентов - около
5-7 нм. Они очень похожи на тонкие филаменты мы-
шечных клеток, состоят в основном из актина, имеются
и другие белки, но тропониновая система отсутствует.
Микрофиламенты немышечных клеток, в отличие
от тонких филаментов поперечно-полосатых мышц,
могут собираться, когда клетке это нужно, прикреп-
ляться к тому, что нужно, и снова разбираться.
Так обстоит дело и в подвижных (макрофаги, фибро-
бласты), и в неподвижных (печеночных и т. п.) клетках.
Мы уже говорили, что актин представляет собой
небольшой глобулярный белок, его молекулярная
1 Сравните с регуляцией концентрации Са2+ в цитоплазме:
там тоже один процесс активируется, а другой идет посто-
янно.
64
масса - около 42 000. Актин способен связывать АТФ.
Для мышечного сокращения это не имеет значения,
а вот для сборки и разборки актиновых филаментов
в немышечных клетках очень важно.
Сборку и разборку актиновых филаментов можно
наблюдать в пробирке. Актин в комплексе с АТФ спо-
собен полимеризоваться в нити микрофиламентов.
Этот процесс не требует расщепления АТФ и идет
самопроизвольно: если концентрация актина высока,
он будет полимеризоваться. Новые молекулы актина
будут присоединяться только с концов нити, но не в ее
середину. Если сильно уменьшить концентрацию сво-
бодного актина1, то нить рассыплется на отдельные
шарики (отваливаться они будут тоже с концов). (+) и
(-)концы (см. § 15) в актиновом филаменте неравно-
ценны: актин в комплексе с АТФ гораздо быстрее
садится на (+)конец, но и слезает быстрее с него же.
Актин не просто связывает АТФ - он может его
и расщеплять. Свободный актин почти не обладает
этой способностью, а в составе микрофиламента он
постепенно расщепляет свой АТФ до АДФ и фосфата.
Актин в комплексе с АДФ очень быстро отсоединяется
от микрофиламента с любого конца. Освободившись,
актин легко обменивает АДФ на АТФ из раствора2.
Рассмотрим, что произойдет, если поместить в
пробирку АТФ и актин в достаточно высокой концент-
рации. Комплекс актин-АТФ будет полимеризоваться
в филаменты, растущие в основном с (+)конца.
На (+)конец филамента садятся все новые и новые
шарики актина. Молекулы актина, которые сели
первыми, постепенно расщепят свой АТФ на АДФ
1 Например, быстро разбавив раствор.
2 Концентрации всех нуклеотидтрифосфатов в клетке выше,
чем соответствующих нуклеотиддифосфатов.
65
Поскольку филамент постоянно растет, эти
ут уже далеко от (+)конца и куда ближе
<омплексы актин-АДФ легко отсоединяются
;нта, в растворе они обменивают АДФ
могут опять присоединиться к (+)концу.
те филаменты все время наращиваются
। укорачиваются с (-конца так, что их длина
•имерно постоянной1.
:сы полимеризации и распада актиновых
в постоянно идут и в живой клетке; там,
□т пробирки, они тщательно регулируются,
ые белки могут ускорять рост и укорочение
ментов, а могут “затыкать” концы филамен-
ые белки - (+)концы, некоторые - (-)концы)
зировать их, предотвращая любые изме-
гие из этих белков уже известны, но детали
ых процессов пока не изучены.
умеет строить упорядоченные пучки,
актиновые филаменты расположены не под
и углами друг к другу, а параллельными
эриентированными в одну сторону концами
учки не столь регулярны и упорядочены, как
иламенты поперечно-полосатой мышцы),
чки филаментов связываются с клеточной
i; обычно это происходит в местах прикреп-
ки к субстрату.
ie клетки имеют рецепторы к белку фиб-
стину, входящему в состав соединитель-
нного матрикса и базальных мембран,
ептору, связавшему фибронектин, с учас-
вспомогательных белков присоединяется
ец актинового филамента. В результате
дь не вечный двигатель: для процесса нужно
> АТФ, и как только запасы АТФ в пробирке
я, все филаменты развалятся.
66
филамент стабилизируется - больше не растет
и не распадется.
В упорядоченных пучках с актином может связать-
ся миозин. Такой пучок приобретает способность
скользить относительно соседнего. Это скольжение
играет важную роль в разделении после митоза
дочерних животных клеток. Актиновые пучки образуют
кольцо по экватору клетки, прикрепленное к ее наруж-
ной мембране. Скользя друг по другу, пучки посте-
пенно сужают стягивающий поясок, что приводит
к разделению клеток.
Миозин может присоединиться и к какой-нибудь
органелле; тогда органелла будет перемещаться по
актиновому филаменту. Благодаря этому процессу
осуществляется, например, постоянное движение
цитоплазмы и органелл в клетках водорослей Chara
и Nite Па.
В большинстве животных клеток имеются не толь-
ко цитоплазматические микрофиламенты, но и густая
сеть актиновых нитей, скрепленных белком филами-
ном. Эта сеть, прикрепленная к цитоплазматической
мембране, называется клеточный кортекс. Строение
кортекса различно у разных клеток и даже в разных
участках одной клетки. Иногда он представляет собой
плотный гель: актиновые нити образуют трехмерную
структуру, недоступную для органелл. А иногда кор-
текс похож на плоскую сеть. В живых клетках кортекс
находится в постоянно натянутом состоянии. Поэтому
если клетка не имеет жесткой оболочки и не прикреп-
лена к субстрату, она приобретает форму шара1 (ведь
у шара при данном объеме минимальная поверх-
ность).
1 Кортекс можно сравнить с резиновой оболочкой воздушного
шарика, которая тоже находится в постоянном натяжении.
67
Пока неизвестно, что поддерживает натяжение
кортекса: то ли взаимодействие актиновых нитей
с помощью миозина, то ли какие-то иные силы.
§ 19. Амебоидное движение
Клетка умеет расслаблять кортекс в определен-
ных участках своей поверхности.
Как регулируются натяжение кортекса, образо-
вание и распад микрофиламентов, пока неясно.
Эта способность клетки очень важна для амебо-
идного движения. Мы изложим наиболее распростра-
ненную из нескольких теорий, объясняющих механизм
данного типа движения (рис. 23). Хотя клетка - всего
лишь куча разных молекул, нам будет удобнее описы-
вать события так, как будто клетка умеет думать.
Пусть амебоидная клетка (амеба, фибробласт или
макрофаг) решила куда-то ползти (на рис. 23 - напра-
во). С этой стороны может быть какой-то привлека-
ющий фактор: для амебы, скажем, высокая концен-
трация аминокислот (амеба охотно поглощает их из
раствора); для макрофага - вещество, выделяемое
добычей-микробом. На переднем крае клетки кортекс
начнет расслабляться, а на заднем крае натяжение
сохраняется. В результате содержимое клетки будет
выдавливаться вперед, как крем из тюбика, - клетка
выпустит псевдоподию (ложноножку). В псевдоподии
интенсивно полимеризуется актин - удлиняющиеся
микрофиламенты буквально подпирают изнутри кле-
точный кортекс.
Согласно другой гипотезе, псевдоподия выбра-
сывается из-за роста актиновых филаментов.
По мере выпускания псевдоподии в ней образу-
ются актиновые филаменты; их (-)концы находятся
внутри клетки, а (+)концы - упираются в мембрану.
68
Рис. 23. Возможный механизм амебоидного движения (а -
актиновый кортекс; б - ложноножка; в - кортекс под
натяжением; г - движение неполимеризованного
актина; д - адгезивные контакты): 1-4 - последова-
тельные стадии перемещения; стрелки показывают
направление движения клетки
Но от болтающейся псевдоподии толку нет, даже
от вытянутой: она должна закрепиться на субстрате.
Мы уже говорили (см. § 18), что на клеточной поверх-
ности имеются рецепторы, позволяющие клетке
связываться с белками субстрата. С их помощью мем-
брана псевдоподии прикрепляется к субстрату. На ре-
цепторах закрепляются актиновые филаменты, и вся
псевдоподия “заякоривается".
69
Итак, псевдоподия прочно прикрепилась к суб-
страту. Теперь натяжение кортекса, благодаря кото-
рому она выдавилась, будет подтягивать к псевдопо-
дии всю клетку. Вероятно, в это время органеллы ак-
тивно транспортируются к переднему концу клетки по
микрофиламентам с помощью миозиновых "моторов".
Представим себе аналогию: вы разлили по столу
сахарный сироп, положили на лужу надутый воз-
душный шарик и сдавили его сзади. Часть возду-
ха перейдет в передний конец шарика, и он раз-
дуется. Теперь прижмем передний конец к лип-
кому столу, - и весь шарик постепенно "подпол-
зет" к закрепленному краю.
Мы рассмотрели функционирование одной из
цитоскелетных систем - микрофиламентов. В попе-
речно-полосатых мышцах она работает со страшной
силой и скоростью; в гладких - со страшной силой,
но без особой скорости; в немышечных клетках изме-
нения совсем медленные (ведь нужно время не только
на регуляцию, но и на сборку-разборку самих фила-
ментов).
Вкратце коснемся промежуточных филаментов.
Их диаметр - около 10 нм. В разных типах клеток они
состоят из разных белков (в эпителиальных клетках
это прежде всего кератин). Функции промежуточных
филаментов изучены плохо. Возможно, именно они,
обеспечивая опору и поддержание формы, являются
настоящим скелетом клетки.
§ 20. Строение и функции микротрубочек
Перейдем ко "второму скелету" - системе микро-
трубочек. Они играют важную роль в подвижности и
поддержании формы клетки; они же обеспечивают
митоз. С участием микротрубочек осуществляется жгу-
70
тиковое движение1. Микротрубочки, как и микрофила-
менты, есть во всех эукариотических клетках.
Внешний диаметр микротрубочки - 25 нм, внут-
ренний - 14 нм. Состоит она из белка тубулина.
Шарики тубулина в микротрубочке лежат один над
другим, но по горизонтали они спирально смещены.
На срезе микротрубочки (рис. 24) видны тринадцать
молекул тубулина.
Рис. 24. Схема строения фрагмента микротрубочки {1 - вид
сбоку; 2 - поперечный разрез). 13 продольных
рядов (протофиламентов - а) образованы молеку-
лами тубулина (б), представляющими собой
димеры из субъединиц аир. Микротрубочка -
полярная структура: а- и p-концы тубулина обра-
щены к разным ее концам
Спираль микротрубочки асимметрична. У нее, как
и у микрофиламента, есть (+)конец и (-)конец. Как и
! У человека с помощью жгутиков передвигаются спермато-
зоиды; реснички, по внутреннему строению очень похожие
на жгутики, имеются в эпителии носоглотки, трахеи и брон-
хов - они выгоняют наружу пыль и микробов.
71
микрофиламенты, микротрубочки способны к само-
сборке и саморазборке. Если белок микрофиламентов,
актин, может связывать АТФ, то белок микротрубочек,
тубулин, может связывать другое богатое энергией
соединение - ГТФ (гуанозинтрифосфат). Актин в со-
ставе микрофиламента начинает расщеплять АТФ (см.
§ 19). Точно так же и тубулин в составе микротрубочки
обладает ГТФ-азной активностью. Тубулин в комплек-
се с ГТФ может садиться на концы микротрубочек,
и тогда спираль удлиняется виток за витком. Этот про-
цесс может идти в пробирке. Комплекс тубулин-ГДФ
может и самопроизвольно отваливаться от микро-
трубочки, причем только с концов (из ее середины
ничего не вываливается). А поскольку в клетке нуклео-
тидтрифосфатов гораздо больше, чем нуклеотидди-
фосфатов, тубулин тут же меняет ГДФ на ГТФ и вновь
становится пригоден для сборки.
Несмотря на сходство “поведения” актиновых и
тубулиновых филаментов в пробирке, в живых клетках
наблюдаются существенные отличия. Дело в том,
что (—)концы микротрубочек, как правило, находятся
в центре организации микротрубочек (ЦОМТ). Там они
прикрыты какими-то неизвестными белками и не могут
ни удлиняться, ни укорачиваться. Рост и распад микро-
трубочек в клетке идут с (+)конца. Поскольку от посто-
янной самопроизвольной сборки и разборки мало про-
ку, имеются системы регуляции этих процессов. Когда
регуляторные белки садятся на (+)конец микротрубоч-
ки1, она перестает расти и разрушаться. Кроме того,
клетка умеет в соответствии со своими потребностями
ускорять процессы самосборки и саморазборки.
Понятно, что манипуляции с микротрубочками -
удовольствие для клетки весьма дорогое: сами
1 (-)Конец обычно закрыт ЦОМТ.
72
по себе рост и расщепление микротрубочки
сопровождаются распадом ГТФ, а регуляция
требует дополнительных затрат энергии.
Как вы помните, по толстым филаментам мышеч-
ной клетки скользят тонкие, а по микрофиламентам
амебоидных клеток могут скользить даже здоровенные
органеллы. Но для транспорта органелл по клетке
чаще используются микротрубочки. Кинезины и дине-
ины - белки, похожие по принципу действия на мио-
зин, - обеспечивают скольжение по микротрубочкам
чего угодно. Этот транспорт тоже АТФ-зависимый:
кинезины и динеины расщепляют АТФ. Микротрубочка
асимметрична, и каждый белок может двигаться вдоль
нее лишь в одном направлении. Некоторые кинезины
двигают органеллы только от (-) к (+)-концу, некото-
рые - от (+) к (-)-концу. Динеины обычно осущест-
вляют транспорт от (+) к (-)-концу. С помощью динеина
и кинезина микротрубочки могут скользить и друг по
другу. Зачем это нужно - станет понятно чуть позже.
Теперь перечислим функции микротрубочек.
Во-первых, они участвуют в поддержании формы
клетки1.
Вторая функция - транспортная. В любой клетке
(не обязательно амебоидной или жгутиковой) микро-
трубочки служат "рельсами". Например, в нейронах по
ним осуществляется и доставка пузырьков медиатора
в аксон, и обратный транспорт органелл из аксона.
Оказалось, что микротрубочки определяют рас-
положение в клетке цистерн ЭПР и аппарата
Гольджи. Если обработать клетку веществом,
разрушающим микротрубочки, то все цистерны
ЭПР сосредоточатся в середине клетки, а
пузырьки аппарата Гольджи отойдут к ее краям.
1 Ясно, что при амебоидном движении микротрубочки долж-
ны претерпевать серьезные перестройки.
73
Третья функция - участие в образовании жгутика
(см. § 21).
Наконец, из микротрубочек состоит митотическое
веретено. Рассмотрим подробнее роль микротрубочек
в митозе.
В профазе микротрубочки начинают расти от
ЦОМТ. У животных клеток ЦОМТ расположен рядом
с центриолями. В состав центриолей входит тубулин.
Как центриоли удваиваются - неизвестно; нуклеино-
вых кислот в них, скорее всего, нет1.
(-)Концы микротрубочек обращены к ЦОМТ, а их
нарастание идет с (+)концов.
В метафазе некоторые микротрубочки, удлинив-
шись, присоединяются к хромосомам* 2, а другие -
остаются свободными.
Прикрепившись к микротрубочкам, хромосомы
начинают скользить по ним с помощью особых разно-
видностей кинезинов и динеинов. "Поерзав” взад и
вперед, хромосомы в конце концов выстраиваются
точно по экватору клетки. В анафазе особый фермент
перерезает центромеры пополам. Получившиеся хро-
матиды связываются каждая со своей микротрубочкой.
Центромера, оставаясь присоединенной к микротру-
бочке, "выкусывает" димеры тубулина (рис. 25). При
этом микротрубочка разрушается с (+)-конца.
Кроме того, в анафазе свободные микротрубочки
раздвигают полюса веретена. В начале анафазы
эти микротрубочки удлиняются, увеличивая степень
перекрывания между ними. Затем они скользят друг
по другу, и полюса веретена отдаляются.
' Сообщения о наличии нуклеиновых кислот в центриолях
публиковались, но потом эти данные опровергали.
2 К одной центромере с каждой стороны может присоеди-
ниться одна или несколько микротрубочек.
74
Рис. 25. Движение хромосомы приводит к разборке микро-
трубочки (7), а разборка микротрубочки - к движе-
нию хромосомы (2): а - кинетохорная микротрубоч-
ка; б - “шагающий белок”; в - кинетохор; г - хромо-
сома. Стрелка' показывает направление движения
хромосомы
§ 21. Жгутик
У эукариот и прокариот жгутики совершенно
не похожи. Жгутик бактерий - жесткий вращающийся
штопор, с помощью которого клетка "ввинчивается"
в воду или "вывинчивается" из нее. Жгутик эукариот -
гибкий хлыст, бьющийся в воде. Эукариотический жгу-
тик движется за счет энергии АТФ. Микробный -
за счет энергии электрохимического потенциала;
у основания жгутика прокариот находится настоящий
электромотор.
На поперечном срезе эукариотического жгутика
или реснички (рис. 26) видны две микротрубочки в цен-
тре и девять пар (дублетов) по периферии. В каждой
периферической паре одна из микротрубочек "полная";
в ней по кругу размещены 13 димеров тубулина,
а вторая - "недокруглая": в ней всего 10 тубулиновых
димеров. (-)Концы микротрубочек находятся в его
основании жгутика, а (+)концы - на конце.
75
Дублеты соединены друг с другом с помощью tx.-ji
ка нексина. Его функция - поддержание структуры
"Ручки", отходящие от одной микротрубочки и касаю-
щиеся соседней, состоят из динеина. А раз есть дине-
ин — значит, каждый периферический дублет может
скользить по соседу.
Рис. 26. Схема поперечного среза реснички: а - радиальная
спица; б - внутренняя динеиновая ручка; в - наруж-
ная динеиновая ручка; г - нексин; д - плазматиче-
ская мембрана; е - центральная пара одиночных
микротрубочек; ж - внутренняя капсула; з - пери-
ферический дублет, состоящий из А-трубочки (а)
и В-трубочки (к)
76
Скользя друг по другу, микротрубочки устреми-
лись бы вон из жгутика. Но, к счастью, все они свя-
заны. Если скольжение начнется ближе к основанию
жгутика, то оно, изменив угол динеиновых ручек,
изогнет жгутик (рис. 27). Дальше достаточно передать
"возбуждение" по динеину вверх и по кругу1. По жгутику
пойдет волна, и он начнет вращаться.
Рис. 27. Взаимное скольжение двух дублетов микротрубочек
приводит к смещению (7), если между ними нару-
шены сшивки, либо к изгибу реснички (2), если
сшивки скрепляют дублеты на одном из концов: а -
А-трубочка; б - В-трубочка
1 Как конкретно оно передается - неизвестно.
77
Какой механизм "запускает” биение - ион но
На изолированных жгутиках, вызвав начало
изгибания в середине, удается добиться распро
странения волны в обе стороны. Еще одна
загадка - согласованность работы множества
жгутиков.
§ 22. Строение митохондрий и хлоро*
пластов. Путь белков в митохондрии
и хлоропласты
Осталось рассмотреть органеллы, обладающие
высокой автономностью: митохондрии и хлоро-
пласты. Они окружены двумя замкнутыми мембра-
нами, весьма различными по липидному и белковому
составу. В процессах, обеспечивающих клетку энер-
гией, участвуют белки внутренней, складчатой мем-
браны. Внутреннее содержимое митохондрии назы-
вается матрикс; между мембранами находится меж-
мембранное пространство. В хлоропластах имеются
уплощенные пузырьки - ламеллы; у высших растений
и части водорослей они образуют стопки - граны.
В клетках некоторых водорослей хлоропласт всего
один, но очень крупный; он называется хроматофор.
А в некоторых типах клеток1 митохондрии как бы сли-
ваются, образуя один гигантский митохондрион.
Многие белки митохондрий и хлоропластов зако-
дированы в генах ядра. Они синтезируются на рибо-
сомах, плавающих в цитоплазме: прямого пути из
ретикулума в митохондрии нет. Как же эти белки попа-
дают внутрь митохондрий? Они имеют метку - особую
N-концевую последовательность примерно из 25 ами-
нокислот. "Свежесинтезированные" белки с такой
1 Например, в мышечных клетках.
78
меткой узнаются особыми цитоплазматическими бел-
ками, необходимыми для транспорта в митохондрии.
Будущие митохондриальные белки навиваются на эти
белки, как нитка на катушку.
В митохондриях есть участки, где наружная и
внутренняя мембраны соединяются с помощью слож-
ного белкового комплекса. Этот комплекс содержит
рецептор N-концевой метки митохондриальных белков.
У "навитых" белков метка всегда экспонирована (тор-
чит наружу); поэтому они связываются с участками
соединения двух мембран митохондрий.
Будущий митохондриальный белок переносится
сквозь мембранный белковый комплекс с помощью все
того же транспортного белка. Благодаря ему мито-
хондриальный белок не свернут в глобулу. Как только
N-концевая метка связалась с рецептором, белок
начинает просовываться сквозь мембрану внутрь
митохондрии1. Поскольку это происходит в местах кон-
такта наружной и внутренней мембран, белок попадет
сразу в матрикс. Транспортный белок остается в цито-
плазме, N-концевая последовательность отрезается,
и белок внутри митохондрии сворачивается в глобулу.
Белки межмембранного пространства митохон-
дрий имеют более сложную судьбу. У них две метки:
N-концевая последовательность аминокислот, отве-
чающая за транспорт в матрикс митохондрии, и распо-
ложенная сразу за ней особая гидрофобная последо-
вательность, которая служит сигналом для переноса
из матрикса в межмембранное пространство. Вначале
эти белки попадают в матрикс митохондрии (см.
приведенное выше описание). N-конец отрезается,
и обнажается гидрофобная последовательность.
Узнав ее, специальные белки на внутренней мембране
1 Разумеется, с расходованием АТФ.
79
митохондрий транспортируют белок в межмембранное
пространство. После этого гидрофобная последова-
тельность какое-то время держит белок заякоренным
на мембране. Затем она отрезается - и белок оказы-
вается в межмембранном пространстве.
Примерно так же транспортируются белки в хло-
ропласты1 - через соединения наружной и внутренней
мембран. Внутри хлоропластов есть замкнутые мем-
бранные пузырьки - тилакоиды. Белки тилакоидов
имеют две сигнальные последовательности аминокис-
лот: N-концевую для переноса в матрикс хлоропласта
и гидрофобную для транспортировки в тилакоид.
§ 23. Теория симбиогенеза
Как вы помните, согласно теории симбиогенеза
митохондрии и хлоропласты - потомки симбиотиче-
ских прокариот (см. § 1). Некая фототрофная бактерия
была проглочена, но не переварена, и превратилась
в хлоропласт. Ну, а некая проглоченная и не перева-
ренная окисляющая бактерия стала митохондрией.
Напомним признаки сходства митохондрий и хло-
ропластов с прокариотами:
- способность делиться;
- наличие рибосом прокариотического типа;
- свой генетический материал (геном), причем
ДНК обычно кольцевая и не связана с гистонами.
Несмотря на определенную автономию митохон-
дрий и хлоропластов, для их работы недостаточно
собственных геномов. В ходе эволюции постепенно
снижалось количество белков, синтезируемых в мито-
хондриях и хлоропластах, и содержание в них ДНК.
1 Распознаваемая N-концевая последовательность амино-
кислот у хлоропластных белков, естественно, другая.
80
С продвижением по эволюционной лестнице все
большая и большая часть этих белков оказывается
закодированной в ядре: генетический материал "пере-
текает" в ядро.
В качестве примера приведем Н+-АТФ-азу. Этот
фермент собирается из девяти полипептидных цепо-
чек. У хлоропластной Н+-АТФ-азы шесть из них зако-
дированы в геноме хлоропластов, а три - в ядре.
У дрожжей две цепочки закодированы в геноме мито-
хондрий, остальные - в ядре. А у млекопитающих
в митохондриях кодируется только одна цепочка.
Еще один пример - супероксиддисмутаза.
Она обезвреживает супероксид-ион (Ог-), образую-
щийся при некоторых реакциях с участием кислорода.
У нас две формы этого фермента: митохондриальная
и цитоплазматическая. Митохондриальная по амино-
кислотной последовательности весьма похожа на мик-
робный фермент (что свидетельствует в пользу теории
симбиогенеза), а цитоплазматическая - нет. Тем не
менее обе формы фермента закодированы в ядре, г
§ 24. Роль АТФ в клетке. Синтез АТФ
Самая главная функция митохондрий - это синтез
АТФ. В биоэнергетике1 клетки АТФ играет централь-
ную роль (рис. 28).
Она используется для механической работы.
Вспомните сокращение мышцы (миозин расщепляет
АТФ), движение эукариотического жгутика (динеин
расщепляет АТФ) и движение органелл (с помощью
кинезина).
1 Биоэнергетика - наука о превращениях энергии в живом
организме. К ней не относится шарлатанство экстрасенсов,
Джуны Давиташвили, колдунов, магов и пр.
81
Анаэробный Окислительное Фотофосфо-
синтез фосфорил и- рилирование
порт через мем-
брану
ходимых клет- работа
ке веществ
Рис. 28. Схема синтеза и использования АТФ в клетке
Энергия АТФ может пригодиться и для синтетиче-
ских нужд клетки (пример - синтез аминоацил-тРНК
через образование аминоацил-аденилата).
А еще энергия АТФ используется для активного
транспорта: Ма+/К+-АТФ-аза, Са2+-АТФ-аза и многие
другие ферменты перекачивают вещества через мем-
брану против концентрационного градиента.
Как синтезируется АТФ?
Анаэробный синтез АТФ идет преимущественно
в цитоплазме. Одной из его разновидностей является
гликолиз, в ходе которого из одной молекулы глюкозы
получаются две молекулы молочной кислоты, а из
двух молекул АДФ образуется две молекулы АТФ.
В митохондриях идет окислительное фосфори-
лирование - синтез АТФ за счет .энергии окисления
органических веществ кислородом. При окислении
молекулы глюкозы до СО2 и Н2О образуется 38 моле-
кул АТФ. Этот процесс был открыт в начале 30-х годов
все тем же В. А. Энгельгардтом в Казани на самом
примитивном оборудовании при минимальном финан-
сировании.
82
Кроме синтеза АТФ, в митохондриях протекает
много других реакций, нужных для жизнедея-
тельности клетки.
Фотофосфорилирование, т. е. синтез АТФ за
счет энергии света, осуществляют хлоропласты в ходе
фотосинтеза. Во время световой фазы фотосинтеза
световая энергия используется для синтеза НАДФН
(никотинамидадениндинуклеотидфосфата) и АТФ,
а во время темновой фазы фотосинтеза с помощью
этих веществ из СО2 и Н2О образуются молекулы
сахаров.
83
ВОПРОСЫ И ЗАДАЧИ
1. Какой микроскоп позволяет рассматривать более
мелкие объекты: инфракрасный или ультрафиоле-
товый?
2. №+/К+-АТФаза транспортирует ионы против их
градиента за счет гидролиза богатого энергией
соединения - АТФ. Придумайте другие способы
транспортировать вещества против их градиента.
3. Мы писали, что любая клетка возникает только при
делении другой клетки. Но есть и исключение. Что
это за клетка?
4. Если в воду насыпать порошок соединения с поля-
ризованными связями, то он должен раствориться.
Но BaSCXi или AgNO3 в воде не растворяются, хотя
имеют не просто поляризованные, а ионные связи.
Почему?
5. Мембрана архебактерий состоит из одного слоя
молекул. Как должна выглядеть такая молекула?
6. Перечислите, что входит в ядро через ядерные
поры и что выходит через них.
7. Нарисуйте графики изменения количества ДНК и
числа хромосом:
а) в ходе клеточного цикла;
б) в ходе мейоза.
84
8. Сколько II.ip I OMOI1OI ИЧНЫХ Х|М>МО<.ОМ КОНЫО1ИРУ»О1
при меиозс клоюк человека?
9. Во время мейоза хромосомы часто видны как
структуры типа "ламповых щеток" (рис. 29),
а во время митоза - нет. Объясните, почему они
так выглядят именно во время мейоза и что проис-
ходит на "торчащих" участках.
Рис. 29. Хромосомы типа “ламповых щеток”: 1 - участок хро-
мосомы с петлеобразными деспирализованными
нитями; 2- схема строения отдельной петли
10. На каких рибосомах (свободных или “сидячих”)
синтезируются:
а) гистоны - белки, которые вместе с ДНК
формируют хромосомы;
б) Ма+/К+-АТФаза;
85
в) фермент, отрезающий лидерный пептид;
г) глобин;
д) антитела;
е) гормон роста?
11. Щелочные аминокислотные остатки гистонов в S-
фазе клеточного цикла могут подвергаться ацети-
лированию (модификации, которая снимает поло-
жительный заряд), а в G-фазе ацетильные группы
убираются. Как вы думаете, для чего нужен этот
процесс?
12. а) Некоторые нейромедиаторы открывают калие-
вые каналы на мембране. Являются ли эти медиа-
торы тормозными или активирующими?
б) Некоторые нейромедиаторы открывают мем-
бранные каналы, попускающие хлорид-ионы.
Являются ли эти медиаторы тормозными или акти-
вирующими?
13. Некоторые боевые отравляющие вещества инги-
бируют ацетилхолинэстеразу. Отчего наступает
смерть при их действии?
14. Миозин моллюска морского гребешка способен
связывать Са2+. Подумайте, как у этого моллюска
регулируется мышечное сокращение.
15. Соединение колхицин нарушает . сборку микро-
трубочек. К каким последствиям приведет обра-
ботка клетки колхицином перед митозом?
86
16. Мышцы бывают красные и белые. Какие из них
работают в основном на гликолизе, а какие — на
окислительном фосфорилировании?
17. Вы - генный инженер. Ваша задача - заставить
клетку секретировать один из белков матрикса
митохондрий, закодированный в ядре. Что вы
предложите?
87
СЛОВАРЬ
Аксон 50
Активный транспорт 19
Актин 54
Аллель 28
Амебоидное движение 68
Амитоз 6
Анафаза 26
Аппарат Гольджи 39
Ацетилирование 86
Ацетилхолин 51
Ацетилхолинэстераза 51
Биоэнергетика 81
Бислой 17
Вакуоль 9
Водородная связь 14
Вторичная лизосома 42
Гамета 27
Гаплоидный набор 31
Геном 80
Гепатоцит 7
Гидрофильное
вещество 15
Г идрофобное
вещество 15
Гистон 85
Гладкий ретикулум 9
Гликозидаза 40
Гликолиз 82
Глутамат-ион 51
Г омологичные хромо-
сомы 28
Гомология 5
Грана 78
Г уанозинтрифосфат
(ГТФ) 72
Делеция 30
Дендрит 50
Деполяризация 47
Динеин 73
Диплоидный набор 31
Доннановский потен-
циал 46
Доннановское равно-
весие 46
Дупликация 30
Дублет 75
Зигота 27
Интегральный белок 18
Интерфаза 23
Ионный канал 20
Кальциевая АТФ-аза 61
Кератин 70
Киназа 63
Киназа легких цепей
миозина 63
Кинезин 73
Кинетрхор см. Центро-
мера
Клеточный кортекс 67
Клеточный сок 9
Клеточная стенка 9
88
Клеточный цикл 23
Колхицин 86
(+)Конец филамента 55
(-)Конец филамента 55
Кроссинговер 28
Ламелла 78
“Ламповые щетки” 84
Лейкопласт 9
Лидерный пептид 32
Лизосома 40
Лизосомная
гидролаза 41
Липаза 40
Липосома 17
Ложноножка см. Псевдо-
подия
Макромолекула 12
Маннозо-6-фосфат 40
Матрикс 78
Межмембранное
пространство 78
Мейоз 28
Метафаза 26
Метафазная
пластинка 26
Микротрубочка 24
Микрофиламент 64
Миозин 54
Миофибрилла 52
Митотическое
веретено 24
Митохондрион 78
Митохондрия 78
Мицелла 17
Модель "липидного
озера" 17
Молочная кислота 82
Монослой 16
Натрий-калиевая
АТФ-аза 19
Нейромедиатор 51
Нексин 76
Неполярная связь 14
Непрерывная нить 26
Нервный импульс см.
Потенциал действия
Никотинамид аденин-
динуклеотидфосфат
(НАДФН) 83
Нуклеаза 40
Нуклеоид 10
Обратная поляризация 47
Окислительное фосфори-
лирование 82
Пассивный транспорт 20
Первичная лизосома 42
Перекись водорода 43
Пероксисома 43
Пиноцитоз 22
Пищеварительная вакуоль
см. Фагосома
Плазмодесма 8
Полярная связь 14
Пороговое значение
потенциала 47
Постсинаптический
нейрон 50
89
Потенциал действия
(нервный импульс) 48
Потенциал покоя 46
Потенциал-зависимые
натриевые каналы 47
Пресинаптический
нейрон 50
Прокариот 10
Промежуточный аппарат
Гольджи 39
Промежуточный фила-
мент 70
Протеаза 40
Протеинфосфатаза 64
Профаза 24
Псевдоподия (ложно-
ножка) 68
Рецептор лидерного
пептида 33
Рецептор маннозо-
6-фосфата 40
"Рецептор рецептора" 33
"Рецептор четырех
аминокислот" 37
Рецепция 11
Рефрактерность 47
Риккетсия 4
Световая фаза фотосин-
теза 83
Секреторный пузырек 21
Секреция 21
Синапс 50
Синаптическая щель 51
Срединная пластинка 27
Стягивающий поясок 27
Супероксид-ион 81
Супероксиддисмутаза 81
Телофаза 26
Темновая фаза фотосин-
теза 83
Теория симбиогенеза 5
Теория скользящих
нитей 52
Тилакоид 80
Толстый филамент 52
Тонкий филамент 52
Транс-Гольджи 39
Тропомиозин 58
Тропонин 58
Тубулин 71
Фагосома (пищеваритель-
ная вакуоль, эндо-
сома) 22, 42
Фагоцитоз 22
Фибробласт 24
Фибронектин 66
Филамин 67
Фосфолипид 12
Фосфорилирование 62
Фотосинтез 83
Фотофосфорилиро-
вание 83
Хлоропласт 78
Хроматида 26
Хроматин 23
Хроматофор 78
Хромопласт 9
90
Хромосома 23
Центр организации мик-
ротрубочек (ЦОМТ) 24
Центриоль 24
Центромера (кинето-
хор) 25
Цис-Гольджи 39
Цитоплазма 52
Цитоскелет 52
Шероховатый ретику-
лум 9
Щотшидный контакт 22
Экзоциюз 21
Экспонирование 79
Элекгроогрицатель-
Hocib 14
Эмульсия 14
Эндоплазматический
ретикулум (ЭПР,
эндоплазматическая
сеть) 35
Эндосома см. Фагосома
Эндоцитоз 22
Эукариот 9
Ядерная пора 22
Ядрышко 23
GO-период 24
G1-период 23
02-период 23
Н+-АТФ-аза 81
S-фаза 23
Z-линия 52
91
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Альберте Б. и др. Молекулярная биология клет-
ки. - В 3 т. - М.: Мир, 1994.
Биохимия человека. - В 2-х т. - М.: Мир, 1993.
Гоин Г., Стаут У., Тейлор Д. Биология. - В 3-х т. -
М.: Мир, 1993.
Де Дюв К. Путешествие в мир живой клетки. -
М.: Мир, 1984.
Ленинджер А. Основы биохимии. - В 3-х т. -
М.: Мир, 1989.
Мартьянов А. А., Тарасова О. С. Как работает
нейрон. - “Биология в школе”, 1995, N 2, сс. 47-56.
Фуралев В. А. Белки: Пособие для учащихся
Биологического отделения ВЗМШ. - М.: ВЗМШ, 1988.
Ченцов Ю. С. Общая цитология. - М.: Изд-во МГУ,
1995.
92
ОБ АВТОРЕ
ФУРАЛЕ В ВЛАДИМИР АЛЕКСАНДРОВИЧ родился в
Москве и 1960 । Окончил Биологический факультет МГУ по
специальное.!и “Биохимия” Старший научный сотрудник
НИИ канцоршенеза Онкологического центра РАМН. Канди-
дат бионо1ичос.ких наук, автор 25 научных работ. Область
научных интересов - биохимия, молекулярная и клеточная
биология
Член Учебно-методической комиссии Биологического
отделения ВЗМШ с 1982 г. Автор ряда пособий ВЗМШ:
“Белки" "Иммунология” (совместно с Е.М. Кленовой), “Моле-
кулярная генетика” (совместно с В.В. Алешиным, В.Л. Габа-
ем, Е.М Кленовой и Е.М. Тульчинским), “Наследственная
информация и ее реализация в клетке" (совместно с С.М.
Глаголевым) В основу пособия “Цитология", которое вы
держите в руках, положен курс лекций, которые читались
автором в биологических спецклассах Московской гимназии
на Юю Западе (N 1543).
В.А. Фуралев на протяжении ряда лет участвует в про-
ведении Всероссийской олимпиады школьников по биологии.
Он является одним из авторов учебного пособия “Биология:
Сборник тестов, задач и заданий с ответами” (М.: “Мнемо-
зина" 1998), подготовленного на основе материалов Все-
российских и Международных олимпиад.
93
ОГЛАВЛЕНИЕ
§ 1. Постулаты клеточной теории.......... 3
§ 2. Основные черты строения клеток
бактерий, растений и животных..... 7
§ 3. Строение и функции клеточной
мембраны.......................... 11
§ 4. Строение ядра...................... 22
§ 5. Митоз и клеточный цикл............. 23
§ 6. Мейоз. Кроссинговер................ 27
§ 7. Как белки попадают в эндоплазмати-
ческую сеть............................. 32
§ 8. Эндоплазматический ретикулум (эндо-
плазматическая сеть).................... 35
§ 9. Аппарат Гольджи..................... 39
§ 10. Лизосомы и пероксисомы............. 40
§11. Потенциал покоя.................... 44
§12. Потенциал действия................. 47
§ 13. Распространение нервного импульса.. 48
§ 14. Цитоскелет......................... 52
§ 15. Механизм мышечного сокращения...... 52
§ 16. Регуляция сокращения поперечно-
полосатой мышцы.......................... 57
94
§17. Регуляция сокращения гладкой
мышцы................................. 61
§18. Микрофиламенты................... 64
§19. Амебоидное движение.............. 68
§ 20. Строение и функции микротрубочек..... 70
§ 21. Жгутик............................... 75
§ 22. Строение митохондрий и хлоропластов.
Путь белков в митохондрии и хлоро-
пласты ........................... 78
§23. Теория симбиогенеза................. 80
§ 24. Роль АТФ в клетке. Синтез АТФ....... 81
Вопросы и задачи.................... 84
Словарь............................. 88
Рекомендуемая литература............ 92
Об авторе........................... 93
95
Фуралев Владимир Александрович
ЦИТОЛОГИЯ:
Структура и функции
клеточных органелл
Учебное пособие
Отв. за выпуск — А. В. Жердев
Подготовка к печати — С. М. Гпаголев
Подписано в печать 18.11.98.
Печ. л. 6,0. Тираж 700 экз.
Открытый лицей
“Всероссийская заочная многопредметная школа”.
117234, Москва, Воробьевы горы,
Московский государственный университет,
ОЛ ВЗМШ, Биологическое отделение.