Автор: Юрина Н.А. Гусев Н.Б. Шубникова Е.А.
Теги: анатомия анатомия человека сравнительная анатомия эмбриология, анатомия и гистология человека биология гистология
ISBN: 5-225-04565-0
Год: 2001
Текст
Учой»а;1
ntrgp<if/p<i
яргл сту/Kwroo
мелицгжкия
dyaou
и униавр<;йте*гоп
Учебная литература для студентов
медицинских вузов и университетов
Е.А.Шубникова,
Н.А.Юрина], Н.Б.Гусев,
О.П.Балезина, Г.Б.Большакова
МЫШЕЧНЫЕ
ТКАНИ
Под редакцией
профессора Ю.С.Ченцова
Допущено Департаментом образовательных
медицинских учреждений и кадровой политики
Министерства здравоохранения Российской
Федерации в качестве учебного пособия
для студентов медицинских вузов и университетов
Москва
"Мецициня11
2001
УДК 611-018.6(075)
ББК 28.86
М96
Рецензенты: IO.С.Ченцов, академик РАЕН, профессор,
зав. кафедрой цитологии и гистологии биологического
факультета МГУ; Т.Т. Березов, академик РАН
Мышечные ткани: Учеб. пособие/Авт.: Е.А.Шубникова,
М96 |Н.А.Юрина|, Н.Б.Гусев, О.П.Балезина, Г.Б.Большакова/
Под ред. Ю.С.Ченцова. — М.: Медицина, 2001. — 240 с.:
ил.: [1] л. ил. (Учеб. лит. Для студ. мед. вузов).
ISBN 5-225-04565-0
В пособии изложены основные вопросы морфологии, биохи-
мии и физиологии мышечных тканей.
Пособие состоит из трех частей. В первой части представлены
данные о микро- и ультраструкгуре соматической, сердечной и
гладкой мускулатуры, гистогенезе, регенерации и морфологи-
ческих изменениях этих тканей в условиях патологии. Приво-
дятся сведения по сравнительной гистологии и эволюции мы-
шечных тканей. Вторая часть содержит данные по физиологии
мышечного сокращения. Рассматриваются особенности и меха-
низмы функционирования мышечных тканей в условиях нормы
и патологии. В третьей части приведены основы биохимии мы-
шечных тканей. Представлены современные данные о структуре
мышечных белков, их свойствах, взаимодействиях; расшифров-
ка биохимических основ сокращения разных типов мышц.
Большое число схем, микрофотографий, рисунков и графи-
ков облегчает усвоение материала.
Для студентов, аспирантов.
ББК 28.86
ISBN 5-225-04565-0 © Коллектив авторов,
2001
Все права авторов защищены. Ни одна часть этого издания не может быть
занесена в память компьютера либо воспроизведена любым способом без предва-
рительного письменного разрешения издателя.
КОЛЛЕКТИВ АВТОРОВ
ШУБНИКОВА Елена Алексеевна — доктор биологических наук, профессор кафедры цитологии и гистологии биоло- гического факультета МГУ.
ЮРИНА Нина Алексеевна — доктор медицинских наук, профессор.
ГУСЕВ — доктор биологических наук, профессор
Николай Борисович кафедры биохимии биологического фа- культета МГУ.
БАЛЕЗИНА — доктор биологических наук, ведущий на-
Ольга Петровна умный сотрудник кафедры физиологии
человека и животных МГУ.
БОЛЬШАКОВА — кандидат биологических наук, заведую-
Галина Борисовна щая лабораторией морфологического
сканирования и пластикации Института
морфологии человека РАМН.
СПИСОК СОКРАЩЕНИЙ
ADP мАКТ нмАКТ АТР ГМК ГЭР — аденозиндифосфат — мышечный актин — немышечный актин — аденозинтрифосфат — гладкомышечная клетка — гранулярный эндоплазматический
DHP-рецепторы КЛЦМ КМЦ ММК Мол. масса МП МФ пд РиР СП СР тмм цнс ЭМС ретикулум — дегидроперидиновые рецепторы — киназа легких цепей миозина — кардиомиоцит — межмитохондриальные контакты — молекулярная масса — мембранный потенциал — миофибрилла — потенциал действия — рианодиновый рецептор — синаптический потенциал — саркоплазматический ретикулум — тяжелый меромиозин — центральная нервная система — электромеханическое сопряжение
Светлой памяти Нины Алексеевны Юриной,
доктора медицинских наук, профессора, заве-
дующей кафедрой гистологии и эмбриологии
медицинского факультета Российского универ-
ситета дружбы народов, члена-корреспонден-
та Российской академии естественных наук,
действительного члена Нью-Йоркской акаде-
мии наук — замечательного человека, талан-
тливого ученого и преподавателя, отдавшего
свои последние силы работе над этой книгой,
посвящается.
ПРЕДИСЛОВИЕ
В современной медицине все больший интерес вызывают
вопросы лечения и профилактики сердечно-сосудистых забо-
леваний, возникновение которых в значительной мере связано
с нарушением структуры и функций мышечных тканей (атеро-
склероз, инфаркт миокарда, гипертензия, астма и др.)- Пато-
логия беременности и родов также связана с нарушениями
деятельности и строения мускулатуры миометрия. Повышен-
ная мышечная нагрузка и гипокинезия, а также ряд заболева-
ний (миастения, дистрофия Дюшенна и др.) обусловлены в
значительной степени изменениями в соматической мускула-
туре. В связи с необходимостью более глубокого изучения
этиологии и патогенеза заболеваний мышечной системы, по-
знания механизмов, лежащих в основе этих состояний, возрос
интерес к фундаментальным исследованиям структурно-функ-
циональных особенностей и биохимии мышечных тканей. Это
и побудило авторов к написанию данной книги. Ее содержание
легло в основу расширенного курса лекций, читаемых в уни-
верситетах на биологических и медицинских факультетах для
студентов старших курсов в течение многих лет.
В книге излагаются современные сведения о микроскопи-
ческом и ультрамикроскопическом строении, развитии и реге-
нерации мышечных тканей, их физиологических и биохими-
ческих особенностях и специфических изменениях этих тканей
при некоторых патологических состояниях. Приведены также
сведения по сравнительной гистологии и рассмотрены вопросы
эволюции мышечных тканей.
Книга написана опытными преподавателями, содержит как
данные отечественной и зарубежной литературы, так и ориги-
нальные материалы; снабжена многочисленными микрофото-
графиями, схемами и графиками.
Часть первая, посвященная микроскопической и электрон-
5
но-микроскопической организации мышечных тканей, их гис-
тогенезу, регенерации, а также вопросам сравнительной гисто-
логии и эволюции, написана доктором биологических наук,
профессором кафедры цитологии и гистологии биологического
факультета МГУ Е.А.Шубниковой. Глава по гладкой мускулатуре
написана в соавторстве с доктором медицинских наук, членом-
корреспондентом РАЕН, заведующим кафедрой гистологии и
эмбриологии медицинского Факультета Российского универси-
тета дружбы народов профессором Н.А.Юриной. Ими же в
соавторстве с кандидатом биологических наук, заведующей
лабораторией морфологического сканирования и пластикации
Института морфологии человека РАМН Г.Б.Болыиаковой изло-
жены вопросы патологической гистологии поперечнополоса-
той мускулатуры. Вторая часть, в которой рассматриваются
физиология и патофизиология мышечных тканей, написана
доктором биологических наук, ведущим научным сотрудником
кафедры физиологии человека и животных биологического
факультета МГУ О.П.Балезиной. В третьей части пособия, на-
писанной доктором биологических наук, профессором кафед-
ры биохимии биологического факультета МГУ Н.Б.Гусевым,
рассматриваются основы биохимии мышечных тканей. Цвет-
ные иллюстрации микропрепаратов выполнены Г.Б.Большако-
вой.
Авторы будут признательны коллегам за все замечания и
пожелания.
ЧАСТЬ ПЕРВАЯ
Строение, развитие,
сравнительная и патологическая
гистология мышечных тканей
Глава 1
ОБЩАЯ ХАРАКТЕРИСТИКА
И КЛАССИФИКАЦИЯ
МЫШЕЧНЫХ ТКАНЕЙ
Все мышечные ткани специализированы на функцию со-
кращения и развиваются на одной основе: гипертрофии и
видоизменений сократимой механической актин-миозиновой
системы.
В разных группах животных в процессе эволюции мышеч-
ные ткани, вероятно, возникали неоднократно и независимо.
Наиболее древние соматические и висцеральные мышцы фор-
мировались из эпителиально-мышечных клеток кожного и ки-
шечного эпителиев и напоминали эпителиально-мышечные
клетки современных кишечнополостных. У целомических жи-
вотных часть мышечных тканей формировалась из целомичес-
кой выстилки. В эволюции, как полагают И.Н.Борисов и соавт.
(1986), источниками для миосимпластов соматической муску-
латуры и миокардиоцитов были разные участки целомодермы,
т.е. выстилки целома. Сходство сократительного аппарата этих
двух тканей отражает их генетическое родство. Доказательст-
вом могут служить два примера: у личинок оболочников мио-
циты хвоста очень похожи на миокардиоциты, но относятся к
соматической мускулатуре; у десятиногих раков миокардиоци-
ты сопровождаются сателлитами, которые отсутствуют в сер-
дечной мускулатуре других животных и всегда обнаруживаются
в соматической мускулатуре.
У современных высших многоклеточных к целомической
мышечной ткани относится сердечная мышца, а у насекомых —
и часть висцеральной мускулатуры.
В ходе эволюции миоэпителиальные клетки целомической
выстилки стали развиваться в разных направлениях и дали
симпластическую мышечную ткань с миосателлитами (сомати-
ческая мускулатура) и кардиомиоциты (отдельные клетки без
миосателлитов). По мнению И.Н.Борисова и соавт., филоге-
нетическим предшественником гладкой мускулатуры целоми-
7
ческих животных является также цел омодерма (миоэпители-
альные клетки). Только гладкая мускулатура ресничного тела
(радужки) в филогенезе связана не с цел омодермой, а с ней-
роэктодермой: в онтогенезе она развивается из эктомезенхимы
глазного бокала.
Висцеральная мускулатура позвоночных в онтогенезе фор-
мируется на основе видоизмененных оседлых клеток тканей
внутренней среды и является мезенхимной.
Предложен ряд классификаций мышечных тканей. Так,
И.Н.Борисов использует генетическую классификацию мышеч-
ных тканей.
Генетическая классификация мышечных тканей и пути типичной
эволюции сократимых элементов (по И.Н.Борисову и др.)
8
У высших позвоночных по генетическим признакам И.Н.Бо-
рисов выделяет две группы мышечных тканей: целомические
(мезодермальные) и нейродермальные. По морфологическим
признакам он делит мышечные ткани на 4 вида: поперечнопо-
лосатую миосимпластическую, сердечную, гладкую и пигментную
(радужная часть сетчатки, где преобладают миоэпителиальные
клетки, содержащие пигмент).
А.А.Заварзин (1985) предложил делить мышечные ткани
многоклеточных на 3 подтипа:
1) поперечнополосатую и косоисчерченную мускулатуру
(с упорядоченным расположением миофибрилл);
2) гладкую мускулатуру беспозвоночных;
3) гладкую мускулатуру позвоночных.
Эта классификация основана на структурной организации
сократимого аппарата.
По физиологическим особенностям мышечные ткани делят
на произвольные и непроизвольные, а также на тонические (глад-
кая и сердечная мускулатура) и тетанические (поперечнополо-
сатые мышцы). Различают висцеральную мускулатуру (мышцы
внутренних органов) и соматическую (двигательную).
Наиболее подробная гистогенетическая классификация мы-
шечных тканей предложена Р.К.Даниловым (1994). Автор, по-
мимо мышечной, выделяет группу клеток, имеющих большое
сходство с мышечными, которые называет миоидными.
Классификация мышечных и миоидных тканей
позвоночных животных (по Р.К.Даннлову, 1994)
Мышечные ткани
I. Мезодермальные И. Эктодермальные
1. Спланхномезенхимная 1. Нейральная (мионейральная)
(висцеральная и сосудистая) 2. Эктомезенхимная (дермаль-
2. Миотомная (соматическая, ная)
переднего отдела пищева-
рительной трубки, лимфа-
тических сердец и электри-
ческих органов)
3. Целомическая (кардиомио-
циты)
Миоидные клетки
I. Мезодермальные
Спланхномезенхимные (мио-
фибробласты, миоидные клет-
ки семенных канальцев, мио-
идные клетки ЮГ-комплекса,
ренинсекретирующие миоци-
ты матки, перициты)
II. Эктодермальные
1. Эктомезенхимные (миоидные
клетки ЦНС)
2. Эпидермальные (миоэпите-
лиальные клетки, миоидные
клетки эпидермиса)
3. Прехордальные (миоидные
клетки тимуса и аденогипо-
физа)
9
Чаще, однако, пользуются классификацией мышечных тка-
ней позвоночных, приведенной в табл. 1.
Таблица 1. Краткая характеристика трех разновидностей мышечных
тканей позвоночных животных
Признаки Разновидности мышечных тканей
гладкая скелетная сердечная
Расположение в организме Во внутренних органах В скелетных мышцах В миокарде
Микрострукту- ра Клеточная Симпластичес- кая Клеточная
Наличие мио- фибрилл Нет миофиб- рилл, есть про- тофибриллы Есть миофиб- риллы Миофибриллы неправильной формы
Происхождение Из мезенхимы (спланхноме- зенхимы) Из миотомов Из спланхно- плевры (цело- мической вы- стилки)
Характер сокра- щения Непроизволь- ный, тоничес- кий Произвольный, тетанический (редко тоничес- кий) Непроизволь- ный, тоничес- кий, ритмичес- кий
Глава 2
СОМАТИЧЕСКИЕ (СКЕЛЕТНЫЕ)
МЫШЕЧНЫЕ ТКАНИ
Мышечные ткани можно разделить на две труппы: 1) мыш-
цы, которые прикрепляются к скелету: костям, сухожилиям —
и таким образом осуществляют движение тела (сомы) или его
частей, формируя двигательный аппарат; 2) мышечные волок-
на, которые связаны с мягкими тканями и не участвуют в
локомоторных функциях всего организма. Эти мышцы способ-
ствуют двигательным процессам внутренних органов (верхние
отделы пищевода, язык и др.). Первую группу мышц относят
к локомоторным (соматическим), а вторую — к нелокомоторным
(висцеральным).
Соматическая мускулатура позвоночных животных пред-
ставляет собой локомоторную поперечнополосатую (исчерчен-
ную, или скелетную) мускулатуру.
10
ОБЩАЯ ХАРАКТЕРИСТИКА СОМАТИЧЕСКОЙ
ПОПЕРЕЧНОПОЛОСАТОЙ (ИСЧЕРЧЕННАЯ,
ЛОКОМОТОРНАЯ, СКЕЛЕТНАЯ) МЫШЕЧНОЙ
ТКАНИ ПОЗВОНОЧНЫХ ЖИВОТНЫХ
Скелетная мышечная ткань состоит из поперечнополосатых
волокон, являющихся структурными единицами мышц. Мы-
шечные волокна окружены соединительнотканными прослойка-
ми — эндомизием, содержащими фиброциты, соединительно-
тканные волокна, нервные терминали и капилляры. Длина
мышечных волокон колеблется от нескольких сотен микро-
метров до 10—12 см, а поперечник составляет несколько де-
сятков или сотен микрометров. Группы мышечных волокон
образуют пучки, покрытые более толстой соединительноткан-
ной оболочкой — перимизием, а вся мышца окружена мощно
развитым эпимизием, богатым сосудами, нервами и большим
числом соединительнотканных волокон. В наиболее крупных
мышцах наружная оболочка очень богата коллагеновыми во-
локнами и называется фасцией (рис. 1; 2, а; рис. 2, б,в —см.
вклейку).
Индивидуальное мышечное волокно окружено плазмолем-
мой толщиной 8—9 нм, называемой сарколеммой, которую
покрывает базальная мембрана (гликокаликс) толщиной 30—
50 нм. Часто сарколеммой называют плазмолемму вместе с
гликокаликсом. Гликокаликс состоит из фибриллярных структур
и аморфного вещества, богатого гликозаминогликанами и про-
теогликанами. В аморфное вещество впаяны зрелые коллаге-
новые и аргирофильные филаменты эндомизия.
Своими концами поперечнополосатые волокна прочно со-
единяются с плотной соединительной тканью сухожилия, при-
крепленного к кости, хрящу, надкостнице, или с плотной
соединительной тканью кожи.
Р. К.Данилов (1994, 1996) под мышечным волокном предла-
гает понимать образование, состоящее из двух частей: симплас-
тической и клеточной (миосателлиты), объединенных общей
базальной мембраной сарколеммы. При таком понимании тер-
мина “мышечное волокно” как экстра-, так и интрафузальные
волокна скелетно-мышечной ткани представляют собой кле-
точно-симпластические системы, формирующиеся в эмбрио-
нальном миогенезе и сохраняющие свою организацию в пост-
натальном онтогенезе и после травмы.
В цитоплазме мышечного волокна есть все обычные орга-
неллы и многочисленные ядра, расположенные у высших по-
звоночных по периферии волокна. Специфическими органел-
лами являются миофибриллы. В каждом мышечном волок-
не несколько сотен миофибрилл. Они видны в световой
11
1
Рис. 1. Строение мышцы человека. Световая микроскопия (по R.Krstic,
1991).
а: 1 — мускульные волокна, 2 — эндомизий, 3 — первичные пучки, 4 — перими-
зий, 5 — вторичный пучок, 6 — вторичные пучки, образующие мышцу, 7 —
фасция, 8 — эпимизий, 9 — укрепляющее сухожилие, 10 — периост; б — попе-
речный срез: 1 — фасция, 2 — эпимизий, 3 — наружный перимизий, 4 — эндо-
мизий, 5 — мышечные волокна, 6 — сарколемма, 7 — ядра, 8 — поля Конгей-
ма; в — продольный срез: 1 — мышечное волокно, 2 — ядро, 3 — эндомизий.
12
1 о
4
8
Рис. 2. Строение поперечнополосатой мускулатуры.
а — схема пучка мышечных волокон: 1 — коллагеновые волокна перимизия;
2 — коллагеновые волокна эндомизия; 3 — перимизий; 4 — ядра мышечных
волокон; 5 — саркомер; 6 — миосателлит; 7 — капилляры; 8 — безмякотное
нервное волокно; 9 — мякотное нервное волокно; 10 — интрафузальные волок-
на мышечного веретена (по R.Kistic).
13
микроскоп, так как их толщина более 0,2 мкм (предел разре-
шения светооптического микроскопа) и достигает 1—2 мкм.
Каждая миофибрилла имеет поперечную исчерченность. Бла-
годаря упорядоченному расположению миофибрилл поперечная ис-
черченность видна и во всем волокне.
При световой микроскопии в волокне выявляются темные
и светлые диски. Первые обладают двойным лучепреломлени-
ем и называются дисками А (анизотропные), а вторые — дис-
ками I (изотропные). В середине диска I находится линия
(полоса) Z, а в середине диска А — тонкая линия М (полоса М),
ограниченная полосами Н.
УЛЬТРАСТРУКТУРА ПОПЕРЕЧНОПОЛОСАТОГО
МЫШЕЧНОГО ВОЛОКНА И ОСНОВНЫЕ БЕЛКИ
МИОФИБРИЛЛ
Структурной единицей миофибрилл является саркомер (см.
рис. 1, 2). Он имеет длину 2,5—3,0 мкм и состоит из дисков:
72 I + А + l/i I и ограничен линиями Z (рис. 3). Под
электронным микроскопом в миофибрилле обнаруживаются
сотни протофибрилл, состоящих из толстых (диаметр 10—
12 нм) и тонких (5—8 нм в поперечнике) нитей, или миофи-
ламентов. Длина толстых филаментов 1,5—1,7 мкм, а тон-
ких — около 1 мкм. У позвоночных животных вокруг одной
толстой нити располагается 6 тонких. И толстые, и тонкие
миофиламенты упакованы гексагонально и при этом таким
образом, что одна тонкая нить на поперечном срезе распола-
гается в середине мнимого треугольника, образуемого толсты-
ми филаментами.
Толстые нити состоят главным образом из скоплений молекул фиб-
риллярного белка миозина (мол. масса 450 000—500 000). В одной
толстой нити содержится около 360 продольно ориентированных мо-
лекул миозина. Эти молекулы полярны и состоят из двух головок
диаметром 20 нм и хвоста, длина которого 150 нм, а толщина 2—3 нм.
Молекулы миозина поляризованные и со сдигом по длине, соединя-
ются хвост к хвосту. Благодаря наличию двух шарнирных устройств
головки миозиновых молекул могут перемещаться и вступать во
взаимодействие с молекулами актина. Располагаясь параллельно друг
другу, молекулы миозина скрепляются между собой минорными бел-
ками, а их головки располагаются по спирали таким образом, что на
один виток приходится шесть парных головок. Против каждой пары
головок на поперечном срезе миофибрилл обнаруживается по одной
поперечно срезанной нити актина. В толстой нити пучки молекул
миозина биполярны и ориентированы хвостами друг к другу (см.
Часть третья).
Тонкие инти (миофиламенты) состоят из фибриллярного ак-
тина. Актин образует псевдодвойную спираль из глобулярных моле-
кул (диаметр 5,5 нм), в борозде которой находятся молекулы тропо-
миозина, тропонина и других дополнительных белков. В одной цепи
14
Рис. 3. Ультрамикроскопическая организация миофибрилл попереч-
нополосатого мышечного волокна (по R.Krstic).
а — расслабленная миофибрилла; б — сокращенная миофибрилла, продоль-
ный срез; в—ж — поперечные срезы миофибриллы на разных уровнях; 1 —
актиновые филаменты; 2 — миозиновые филаменты; А —диск А; I—диск I;
М — линия М; Н — полоса Н; Z — линия Z.
актина 200 мономеров актина (400 на двойную цепь), на каждую
половину оборота этой спирали, длина которой по оси равна 40 нм,
приходится 13—15 мономеров актина.
В желобке спирали фибриллярного актина располагается тропо-
миозин — линейная молекула, а тропонин образует глобулярный ком-
плекс, состоящий из тропонинов I, С, Т. Тропонин Т связывается с
тропомиозином, тропонин I препятствует взаимодействию актина с
миозином, а тропонин С связывает 4 иона Са2+ и снимает блокаду,
препятствующую взаимодействию актина с миозином. При соедине-
нии с ионом Са2+ участок, связывающий миозин на молекуле актина,
освобождается благодаря ионам Са2+-зависимому перемещению тро-
помиозина.
Детальную характеристику белков миофибрилл и процессов, про-
исходящих при их сокращении, — см. главу 7.
15
Z-ниш
Рис. 5. Взаимное расположение тонких (актиновых) филаментов на
уровне линии Z (схема).
я — актиновые филаменты переходят в тонкие Z-нити, располагающиеся ор-
тогонально и связывающие актиновые филаменты смежного саркомера; б, в —
проекции актиновых филаментов на уровне линии Z. Показаны прямо (б) или
косо (в) отходящие Z-нити, связывающие тонкие филаменты соседних сарко-
меров; г — связь толстых филаментов с линией Z при помощи нитей титина в
сокращенной миофибрилле.
Саркомеры ограничены линиями Z. Обычно в медленных
мышцах саркомеры шире, чем в быстрых (поперечник 100—120
и 30—60 нм соответственно). В линии Z тонкие актиновые
филаменты, имеющие гексагональную упаковку, перестраива-
ются с образованием тетрагональной укладки и формировани-
ем Z-нитей (филаментов). Каждая Z-нить одного саркомера
находится в центре квадрата; образованного четырьмя анало-
гичными нитями смежного саркомера (рис. 4 —см. вклейку;
рис. 5—7).
Размер линии Z 30 х 3,5 нм (у позвоночных). Линии Z связывают
концевые части актиновых филаментов. Между ними находится мат-
рикс, содержащий белок аморфин (мол. масса 85 000). Во всех линиях
Z содержится а-актинин (мол. масса 100 000), имеющий «-спираль-
ную структуру (длина молекулы 30—40 нм, поперечник 2—4 нм).
16
Рис. 6. Ультраструктура поперечнополосатых мышц.
а — продольный срез быстрой мышцы лягушки с хорошо выраженными три-
адами, расположенными на уровне изотропных дисков.
17
Рис. 6. Продолжение.
6 — поперечный срез наружной абдоминальной мышцы. Видны Т-трубочки (te),
тесно прилежащие к миофибриллам на уровне линий Z (по N.Garamvolgyi).
Альфа-актинин образует сшивки вдоль нити актина, его считают
структурным компонентом нитей полосы Z. В линии Z обнаружива-
ются также белки цитоскелета, взаимодействующие с актинином.
Выделяют центральную часть (внутримиофибриллярная) линии Z,
связанную с актином, а-актинином и коннектином, и периферичес-
кую, где, кроме актина, находятся филамин, спектрин, винкулин,
у-актин, а также креатинкиназа и липиды. Винкулин, спектрин и
у-актин расположены также на сарколемме в виде костомерной
(реброобразной) структуры. Спектрин и винкулии через анкирин
связываются с интегральными белками мембраны. Таким образом,
промежуточные филаменты необходимы для объединения частей со-
кратительной системы, а-актинин нужен для сборки и сохранения
микрофиламентов в этой системе.
Филаменты цитоскелета располагаются в миофибриллах как ради-
ально, связывая линии Z с саркоплазматической сетью, Т-системой
и сарколеммой, так и тангенциально, объединяя миофибриллы друг
с другом (рис. 8, а, б; рис. 8, в — см. вклейку). Спектриновый цито-
скелетный домен, который локализуется главным образом иа цито-
плазматической поверхности сарколеммы, связан с линиями Z и М.
При сокращении спектрин обеспечивает сохранение формы и струк-
туры сарколеммы. Виментин н десмин объединяются в мышечном
волокне в единые филаменты и идут от сарколеммы внутрь волокна,
18
Рис. 7. Поперечный срез через линию Z мышечного волокна лягушки
(а) и человека (б). Видно тетрагональное расположение филаментов
(по N.Garamvolgyi).
окружая миофибриллы на уровне линии Z. Еще один большой н
эластичный белок титан располагается вдоль миозиновых нитей и
связывает их с линиями Z (см. рис. 5, 6). С-белок прикрепляется к
толстым филаментам.
Белок небулин расположен по всей ширине 1-диска параллельно
тонким филаментам, с которыми он связан, обеспечивая механичес-
кую стабилизацию тонких филаментов.
Линия М расположена в середине саркомера, где отсутст-
вуют головки миозиновых молекул. Белки этой линии образу-
ют пять поперечных сублиний на расстоянии друг от друга
21—22 нм. Они формируют мостики, объединяющие толстые
нити между собой, и являются местом прикрепления цитоске-
лета. К белкам линии М относят изозим креатинкиназы (мол.
масса 80 000), М-белок (мол. масса 165 000) и миомезин (мол.
масса 165 000). Креатинкиназа катализирует перенос фосфо-
рильного остатка с креатинфосфата на ADP с образованием
АТР. Особенно много его в белых быстрых мышцах. В крас-
ных, богатых миоглобином и более медленно сокращающихся
мышцах меньше М-белка и миомезина, чем в белых. Детальная
характеристика минорных белков дана в главе 4.
19
Рис. 8. Мостики, соединяющие линию Z миофибрилл друг с другом
н с плазмолеммой.
а — мостик, соединяющий линии Z соседних миофибрилл в летательной
мышце пчелы (по N.Garamvolgyi); б —мостик Zbr, соединяющий линию Z
периферической миофибриллы с сарколеммой; att — прикрепляющее тельце;
ст — сарколемма (по N.Garamvolgyi).
САРКОПЛАЗМАТИЧЕСКАЯ СЕТЬ И Т-СИСТЕМА
Саркоплазматический ретикулум — СР, или саркоплазмати-
ческая сеть, имеет в мышечном волокне вид канальцев, идущих
преимущественно вдоль миофибрилл. Эти канальцы анастомо-
зируют друг с другом и вместе с поперечными Т-каналами,
представляющими собой трубчатые впячивания плазмолеммы,
образуют комплексы, называемые Т-системами. Предполагают,
что между каналами СР и Т-трубочками этой системы суще-
ствуют поры или специализированные кальциевые каналы,
обеспечивающие перенос ионов Са2+ из внешней среды через
Т-каналы в саркоплазму и СР. В каждом саркомере СР имеет
латеральные расширенные участки — терминальные цистерны,
окаймляющие Т-канальцы с образованием “триад". В лате-
ральных зонах СР происходит накопление ионов Са2+, необ-
ходимых для сокращения миофибрилл. Продольные каналы СР
анастомозируют между собой, образуя “кружевную” манжетку,
охватывающую фибриллу со всех сторон. Ее иногда называют
“продырявленным воротничком” (рис. 9).
Саркомеры соседних миофибрилл имеют общий СР, а СР двух
последовательно расположенных саркомеров изолированы по ли-
нии Z (с редкими исключениями).
На поперечных срезах Т-каналы в области триады выглядят
сплюснутыми и находятся на уровне линии Z (у рыб и амфи-
бий) или на границе дисков А и I (у круглоротых, рептилий, птиц
и млекопитающих). В последнем случае в каждом саркомере
имеется по 2 канала. Впервые в отечественной литературе под-
робное описание Т-системы было дано А.С.Кроленко (1975).
В покоящихся мышцах все ионы Са2+ располагаются в СР,
главным образом в терминальных (латеральных) цистернах.
Деполяризация поверхностной мембраны передается через Т-
трубочки к СР и вызывает резкое увеличение проницаемости
его мембран для ионов Са2 . Концентрация последних в сар-
коплазме увеличивается в 5—10 раз, что активирует сокраще-
ние миофибрилл. Быстрая реабсорбция ионов Са2* происходит
против химического градиента при участии АТРазы мембран.
(Подробнее см. в главе 5].
НЕСПЕЦИФИЧЕСКИЕ ОРГАНЕЛЛЫ МЫШЕЧНОГО ВОЛОКНА
Центриоли обычно не обнаруживаются в зрелых мышечных
волокнах, однако они присутствуют в промиобластах, миоблас-
тах и миосателлитах. Иногда их находят и в миосимпластах, а
также в зрелых волокнах при патологии.
Рибосомы в мышечных волокнах сравнительно немногочис-
ленны. Установлено, что актиновые нити синтезируются на
полисомах, состоящих из 15—25 рибосом, а миозиновые — на
полисомах из 70—75 рибосом. Актинсинтезирующие полисомы
21
1
Рис. 9. Объемная схема скелетного мышечного волокна [Krstic R.,
1991J.
Каждая миофибрилла (1) окружена саркоплазматическим ретикулумом (2);
3 — терминальные цистерны; 4 — триады; 5 — трубочки Т-системы; 6 — плаз-
молемма; 7 — базальная мембрана; 8 — коллагеновые микрофибриллы; А ~
анизотропный диск; I — изотропный диск; Т — Т-каналы.
в миосимпластах скелетных мышц появляются раньше, чем
миозинсинтезирующие, еще позже появляются тропомиозино-
вые полисомы.
Митохондрии в скелетных мышечных волокнах хорошо раз-
виты. В ряде мышц, например в диафрагмальной, обнаружен
“митохондриальный ретикулум”, который виден на поперечных
средах мышечных волокон на уровне линии Z [Бакеева Л.Е.,
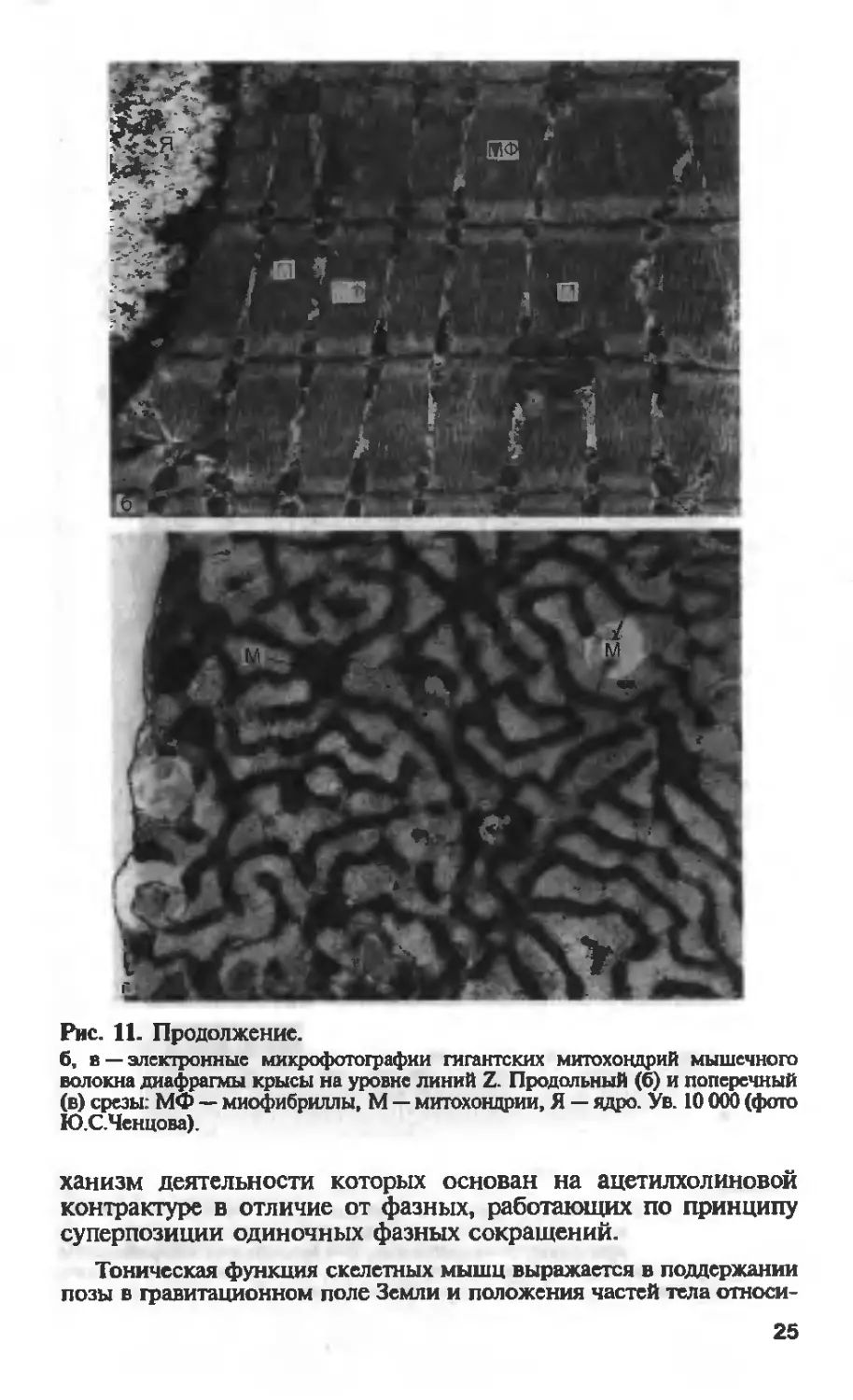
Ченцов Ю.С., 1980]. На рис. 10 (см. вклейку) и 11 видно, что
мышечные митохондрии представляют собой паукообразные
структуры, отростки которых могут ветвиться и простираться
на большие расстояния, иногда через весь поперечник мышеч-
ного волокна. Разветвления митохондрий окружают каждую
миофибриллу в мышечном волокне, снабжая его АТР, необхо-
димым для мышечного сокращения.
Митохондрии на уровне линии Z-диска представлены типич-
ным митохондриальным ретикулумом — единой митохондриаль-
ной системой. Такой “этаж” митохондриального ретикулума
повторяется дважды на каждый саркомер, а все мышечное во-
локно имеет тысячи поперечно расположенных “поэтажных”
пластов митохондриального ретикулума.
Между “этажами” митохондриального ретикулума вдоль ми-
офибрилл располагаются нитчатые митохондрии, соединяю-
щие эти митохондриальные пласты. Тем самым создается трех-
мерная организация митохондриального ретикулума, проходя-
щего через весь объем мышечного волокна (см. рис. 10 на
вклейке; рис. 11). Между ответвлениями митохондриального
ретикулума, так же как между этими ответвлениями и нитча-
тыми митохондриями, существуют специализированные меж-
митохондриальные соединения, или контакты (ММК). Они
образованы плотно прилегающими наружными митохондри-
альными мембранами контактирующих митохондрий; межмем-
бранное пространство и мембраны в этой зоне имеют повы-
шенную электронную плотность (см. рис. 11). Предполагают,
что с помощью этих специальных образований может проис-
ходить функциональное объединение соседних митохондрий и
митохондриальных ретикулумов в единую кооперативную
энергетическую систему [Ченцов Ю.С., 1997].
Аппарат Гольджи — это органелла, в соматической мускула-
туре развита слабо и представлена отдельными диктиосомами,
расположенными вблизи ядер.
Лизосомы также немногочисленны. Встречаются и отдель-
ные липидные включения и отложения гликогена.
ТОНИЧЕСКАЯ И ФАЗНАЯ МЫШЕЧНЫЕ ТКАНИ
ПОЗВОНОЧНЫХ ЖИВОТНЫХ
У большинства позвоночных существует разделение двига-
тельной функции на тоническую и фазную. В процессе эволю-
23
Рис. 11. Митохондриальный ретикулум скелетной мышцы.
а — схема трехмерной организации митохондриального ретикулума (по Л.Е.Ба-
кеевой и др., 1980).
ции происходило совершенствование той и другой функций.
В соответствии с этим делением различают фазные и тоничес-
кие мышечные волокна.
Фазными называются поперечнополосатые мышечные во-
локна, развивающие напряжение на основе суперпозиции (на-
ложения) одиночных (фазных) кратковременных сокращений.
Они способны отвечать на одиночный стимул кратковремен-
ным одиночным сокращением.
Тоническими называются мышечные волокна, не способные
отвечать сокращением на одиночный стимул, но длительно
удерживающие стойкое (неколебательное) сокращение (кон-
трактуру) в ответ на серию ритмических электрических стиму-
лов.
Фазные мышцы делятся на быстрые (быстро утомляющиеся)
и медленные (малоутомляющнеся). Часто их называют соответ-
ственно белыми, или волокнами II типа, и красными, или во-
локнами I типа. Есть и ряд переходных форм (рис. 12, табл. 2).
Кроме того, существуют тонические (медленные) мышцы, ме-
24
Рис. 11. Продолжение.
б, в — электронные микрофотографии гигантских митохондрий мышечного
волокна диафрагмы крысы на уровне линий Z. Продольный (6) и поперечный
(в) срезы: МФ — миофибриллы, М — митохондрии, Я — ядро. Ув. 10 000 (фото
Ю.С.Ченцова).
ханизм деятельности которых основан на ацетилхолиновой
контрактуре в отличие от фазных, работающих по принципу
суперпозиции одиночных фазных сокращений.
Тоническая функция скелетных мышц выражается в поддержании
позы в гравитационном поле Земли и положения частей тела относи-
25
a
Рис. 12. Ультраструктура мышечных волокон млекопитающих (по
R.Krstic).
а — волокно белой (быстрой) скелетной мышцы и миосателлит: 1 — плазмо-
лемма, 2 — базальная мембрана, 3 — ретикулярные волокна, 4 — коллагеновые
волокна (из микрофибрилл), 5 — сарколемма, 6 — миозиновые миофиламенты
(15 мкм), 7 — актиновые миофиламенты (5—7 нм), 8 — саркомер, 9 — сателлит,
10 — центриоль. Остальные обозначения как на рис. 3.
26
5
Рис. 12. Продолжение.
б — волокно красной (медленной) скелетной мышцы: 1 — липидные капли,
2 — миофибриллы, 3 — гладкий саркоплазматический ретикулум, 4 — терми-
нальные цистерны, Т — Т-канал, 5 — капилляры. Белые мышечные волокна
толще красных, но беднее митохондриями, в них больше миофибрилл.
27
Таблица 2. Краткая характеристика фазной мускулатуры млекопита-
ющих
Признаки Типы МЫШЦ
I — красные II — белые
Цвет Красный Белый
Диаметр Малый Большой
Миофибриллы Ширина и количество меньше, чем в белых Ширина и количество больше, чем в красных
Саркоплазма Больше, чем в белых Меньше, чем в крас- ных
Миоглобин Много Мало
Митохондрии Многочисленные Более редкие
Линии Z и М Линии Z широкие, ли- нии М слабо выраже- ны или отсутствуют Линии Z и М выраже- ны
Жир Много Мало
Гликоген Мало Много
Активность липаз Высокая Низкая
Активность фосфо- рилазы Низкая Высокая
Активность оксидаз Высокая Низкая
Активность щелоч- ной фосфатазы Очень высокая Умеренная
Активность кислой АТРазы Низкая Высокая
Активность сукци- натдегидрогеназы Высокая Низкая
Кровоснабжение Обильное Малое
Сокращение Длительное, медлен- ное Кратковременное, бы- строе
тельно друг друга. Эта функция осуществляется разными механизма-
ми. Один из них базируется на сокращении тонических волокон
(контрактуре), удерживающих слитное напряжение при минимальной
затрате энергии. Это наиболее древний способ, распространенный
главным образом у низших наземных позвоночных. Другой механизм
тонуса основан на асинхронной работе разных фазных медленных
мышц и является менее экономным, но дающим преимущество в
подвижности, которая необходима животным с высокой двигательной
активностью. Это “нервный”, или “центральный”, тонус, присущий
высшим позвоночным.
Тоническая мускулатура развита главным образом у амфи-
бий. У млекопитающих эта мускулатура полностью исчезла из
локомоторных мышц, но приобрела значение в работе органов
28
чувств (например, глазодвигательные мышцы). Тоническая функ-
ция переходит к медленным фазным нейромоторным едини-
цам, осуществляющим подвижный динамический “централь-
ный” тонус у млекопитающих.
В тонических мышечных волокнах на поперечных срезах
миофиламенты образуют разные по величине и форме поля
(поля Конгейма), а не четко округлые в сечении миофибриллы,
как в фазных быстрых волокнах. Для тонических волокон
характерны также множественная иннервация и образование
нервных окончаний в виде виноградной кисти. Отсутствие ПД
и высокое сопротивление поверхностной мембраны также при-
сущи тоническим волокнам.
В медленных фазных (переходных) волокнах миофибриллы
также распределены в виде неравномерных групп, но при этом
индивидуальные миофибриллы сохраняются.
В тонических волокнах в отличие от фазных линия Z ши-
рокая, непрямая и не содержит квадратной регулярной решет-
ки, а линия М отсутствует (рис. 13). В этих мышцах крайне
мал ответ на одиночный электрический стимул, но весьма
выражены суммация одиночных ответов, большая длительность
одиночного сокращения и очень медленное расслабление.
Фазные мышцы, напротив, дают быстрое (в 50 раз быстрее
тонических) и сильное сокращение.
В тонических мышцах весь процесс сокращения, вплоть до рас-
слабления, зависит от уровня мембранного потенциала (МП). У них
нет рефрактерности, медленнее происходит деполяризация, меньше
площадь контакта СР с Т-системой, менее быстро вдет выброс Са*+
из депо, повышена вязкость саркоплазмы. Перемещение поперечных
мостиков (головок миозина) в толстых филаментах происходит в
тонических мышечных волокнах в 15 раз медленнее, чем в фазных;
мала в них активносп» миозиновой АТРазы, медленнее происходят
связывание ионов Са^+ в СР и диссоциация поперечных мостиков,
падение напряжения. Более инертные связи тонких и толстых фила-
ментов обеспечивают феномен “запирания” (catch, spemung), т.е. под-
держания длительного высокого напряжения без признаков утомле-
ния.
Возбуждение тонических волокон не подчиняется закону
“все или ничего” и имеет характер локального ответа, поэтому
ограничивается областью нервно-мышечного окончания или
тем участком, к которому непосредственно приложено раздра-
жение. Охват возбуждением всего волокна возможен лишь
потому, что на каждом мышечном волокне множество нервных
окончаний. Одновременное поступление к этим окончаниям
нервного импульса и вызывает сокращение всего волокна.
При сокращении как фазных, так и тонических волокон про-
исходит скольжение толстых нитей относительно тонких, при-
водящее к укорочению саркомеров, а значит, и всех миофибрилл
и волокна в целом.
29
Рис. 13. Мышечные волокна лягушки. Электронные микрофотографии,
а — продольный срез быстрого мышечного волокна. Видна организация сар-
коплазматического ретикулума (СР). Триады на уровне линий Z; М — линии
М; Т — каналы Т-системы, в центре — триада. Много разветвленных трубочек
СР (указаны стрелками), сливающихся вблизи Т-каналов, окружающих все
миофибриллы и переходящих из одного саркомера в другой. Ув. 60 000; б —
медленное мышечное волокно; трубочки СР ориентированы продольно; линии
М не выражены. Ув. 80 000.
30
Г.М.Франк на тонических волокнах во время ацетилхоли-
новой контрактуры наблюдал укорочение дисков А на 20 % и
утолщение толстых филаментов с увеличением составляющих
их единиц. При этом, по-видимому, происходит молекулярная
перестройка толстых нитей, что приводит к фиксации достиг-
нутого состояния укорочения волокна (“запирание”). Эти кон-
формационные изменения не требуют затрат энергии.
Тонические и медленные (но фазные) мышцы позвоночных
имеют более слабо развитые СР и Т-каналы, чем быстрые
фазные.
В тонической мускулатуре СР состоит из продольных тру-
бочек, которые соединяются друг с другом многочисленными
поперечными мостиками, а не сливаются в сплошную муфту,
как в фазных волокнах. Часть трубочек переходит из саркомера
в саркомер, а Т-каналы располагаются обычно на уровне ли-
ний Z, проходят перпендикулярно волокну, окружая каждую
миофибриллу, и образуют ветви, идущие вдоль миофибрилл.
Они тоньше каналов СР. Триады имеются не в каждом сарко-
мере, а по одному на пять, их центр может быть расположен
не только перпендикулярно длине волокна, а и продольно.
Встречаются триады и диады вдали от линий Z.
Медленные мышцы по характеру обмена являются оксида-
тивными, а быстрые — гликолитическими. Быстрые в свою оче-
редь Moiyr быть гликолитическими, быстро утомляющимися,
белыми и оксидативно-гликолитическими, менее утомляющи-
мися, красными. В последних много митохондрий.
ИННЕРВАЦИЯ МЫШЕЧНЫХ ВОЛОКОН
Скелетная мускулатура обладает двигательной и чувстви-
тельной иннервацией. В передних рогах спинного мозга нахо-
дятся двигательные а-нейроны, иннервирующие скелетную
мускулатуру. Один нейрон и его аксон вместе с группой ин-
нервируемых им мышечных волокон образует “двигательную
единицу” (ДЕ). ДЕ может состоять только из белых или только
из красных мышечных волокон. Наибольшую скорость прове-
дения возбуждения и сокращения имеют ДЕ с быстро утомля-
ющимися мышечными волокнами с гликолитическим метабо-
лизмом. При электрическом раздражении мотонейрона либо
все мышечные волокна ДЕ сокращаются, либо не сокращаются
совсем. Фазные мышечные волокна, относимые к одной ДЕ,
распределены по всей мышце, поэтому даже слабые сокраще-
ния, при которых работает одна или несколько ДЕ, обеспечи-
вают функционирование всего мышечного органа. Сила сокра-
щения мышцы зависит от количества ДЕ, участвующих в со-
кращении.
Место контакта аксона с мышечным волокном называется
аксомышечным синапсом. Наблюдаемые в световом микроскопе
31
аксонные окончания мотонейронов называют “моторными
бляшками”. На одном мышечном фазном волокне у взрослых
млекопитающих обычно имеется одна “моторная бляшка”
(рис. 14). У новорожденных их больше, но в дальнейшем часть
синапсов дегенерирует.
У тонических мышечных волокон один аксон образует
много терминалей (окончаний) на одном и том же волокне.
В нервно-мышечном синапсе различают пресинаптическую
часть (терминали аксона) и постсинаптическую зону (участок
мышечного волокна). Эти два структурных образования разде-
лены межклеточным пространством — синаптической щелью.
Нервно-мышечный синапс является химическим. При его функ-
ционировании из терминали аксона выделяется медиатор аце-
тилхолин, который вызывает возбуждение мышечного волокна,
приводящее к сокращению. В терминалях аксона находятся
синаптические пузырьки диаметром 30—60 нм, содержащие аце-
тилхолин, а также мелкие митохондрии со светлым матриксом
и немногочисленными кристами, микротрубочки и нейрофи-
ламенты. Терминали аксона снаружи окружены леммоцитами,
или шванновскими клетками (рис. 15; см. рис. 14). Участки
терминалей, где происходит выведение медиатора, называются
активными зонами. От их размера и числа зависит уровень
секреции медиатора.
На примере мышц озерной лягушки — тонического пучка
(musculus craralis) и фазной мышцы (musculus sartorius) пока-
заны особенности строения активных зон, связанные с отли-
чиями в количестве высвобождаемого медиатора [Безгина Е.Н.,
1988].
В фазной портняжной мышце лягушки одиночная терминаль
имеет протяженность 50—200 мкм. Диаметр одиночной терми-
нали уменьшается от центральных участков к конечным,
уменьшается и длина сечения синаптического контакта в 1,5—
2,5 раза. Количество синаптических везикул также сокращается
в 2—3 раза от центра к дистальным участкам терминали, и
уменьшается ширина синаптической щели. Терминаль состоит
из нескольких варикозных расширений, соединенных перехва-
тами, т.е. не представляет собой однородную трубку, как счи-
талось ранее. Такое строение терминали обусловлено тем, что
шванновские клетки в определенных участках заходят в синап-
тическую щель, нарушая этим контакт терминали с мышечным
волокном на протяжении около 10 мкм, и, следовательно,
контакт прерывист. Участки, где отсутствуют синаптические
контакты, были названы “обхватами”. В среднем на одну тер-
миналь приходится 4—7 “обхватов”. В последних резко меньше
диаметр терминали, отсутствуют синаптические везикулы.
В свою очередь варикозные расширения делятся на участки за
счет внедрения в синаптическую щель пальцевидных отростков
шванновских клеток. Эти участки названы “синаптическими
32
Рис. 14. Иннервация фазных мышц лягушки (по Е.Н.Безгиной, с
изменениями).
а — микроскопическое строение двигательной единицы. Ветви аксона распре-
делены в соседних мышечных волокнах и образуют “моторные бляшки”; б —
схема ультраструкгурной организации нервной терминали в зоне “обхвата” на
поперечном срезе; в — схема взаимного расположения пре- и постсинаптичес-
ких мембран в синапсе. Активные зоны в виде бороздок, заполненных синап-
тическими пузырьками; г —схема поперечного среза терминали на уровне
активной зоны; д — схема нервной терминали и участка мышечного волокна;
БМ — базальная мембрана; ШК — шванновская клетка; Т — терминаль; АЗ —
активная зона; О — “обхват”; С — “синаптический отдел”; МВ — мышечное
волокно; ПС — постсинаптическая мембрана.
Рис. 15. Нервная терминаль портняжной мышцы (m. sartorius) лягуш-
ки (фото Е.Н.Безгиной).
а — ув. 40 000; б — ув. 160 000; 1 — “обхват”; 2 — скопления синаптических
пузырьков около активной эоны; 3 —базальная мембрана в синаптической
щели; 4 — постсинаптическая мембрана; 5 — пресинаптическая мембрана; 6 —
синаптические пузырьки; 7 — саркоплазма мышечного волокна; 8 — активная
зона.
отделами". Каждое варикозное расширение, таким образом,
состоит из нескольких “синаптических отделов”. Центральный
участок терминали содержит меньше пальцевидных отростков,
чем дистальный. В нем также выше уровень секреции медиатора,
так как больше площадь синаптических контактов, открытость
терминали и синаптических пузырьков (см. рис. 14, 15).
Субневральный аппарат фазных мышц характеризуется тем,
что на постсинаптической мембране располагаются лентовид-
ные образования с холинэстеразной активностью. Они состоят
34
Рис. 16. Нервная терминаль тонической мышцы (m. cruralis) лягушки
(фото Е.Н.Безгиной).
1 — базальная мембрана; 2 — пресинаптическая мембрана; 3 — синаптические
-узырьки; 4 — постсинаптическая мембрана; 5 — миофиламенты. Ув. 56 000.
из поперечно расположенных пластинок наподобие палисад-
ника толщиной 0,2 мкм, а щель между ними — 0,4 мкм.
В фазных мышцах хорошо выражена складчатость постси-
наптической мембраны. Постсинаптические складки в порт-
няжной мышце в центральных участках терминали имеют
меньший периметр, чем в дистальных, и меньше разветвлены.
Скелетная мышца позвоночных животных является одним
из немногочисленных примеров органа, получающего только
один вид эфферентной иннервации. Большинство других ор-
ганов позвоночных, а также мышцы беспозвоночных чаще
всего иннервируются двумя группами нервов — возбуждающи-
ми и тормозящими. Другой важной особенностью нервно-мы-
шечного синапса является то, что он специализирован для
передачи главным образом пусковых сигналов. Некоторые
нервные клетки и мышцы беспозвоночных обладают собствен-
ной ритмической активностью, а приходящие синаптические
влияния лишь взаимодействуют с нею. В мышцах позвоночных
передаваемый через синапс нервный импульс является един-
ственным сигналом, способным побудить мышцу к действию
[Магазаник Л.Г., 1979].
Синаптический аппарат тонических мышц своеобразен (рис.
16). В нем отсутствует генерация ПД. Деполяризация мембра-
ны тонического волокна, необходимая для активации сокра-
щения, осуществляется самим синаптическим потенциалом
(СП). Вдоль волокна располагается несколько синапсов, поэ-
тому СП, распространяясь электротонически от каждого си-
напса, может охватить деполяризацией все волокно и активи-
ровать его без помощи ПД. На одном тоническом мышечном
волокне располагается от 4 до 13 синапсов. Тонические волок-
на более тонкие, чем фазные.
35
Активные зоны терминалей тонических мышц отличаются
от регулярно расположенных таких же зон фазных мышц.
В тонических мышцах активные зоны представляют собой
образования неправильной формы, разные по величине и ори-
ентации относительно оси терминали, а плотность везикул
велика (см. рис. 16). Терминали тонических мышц состоят из
нескольких варикозных расширений, разделенных обхватами
протяженностью до 1 мкм (2—3 обхвата), а пальцевидных от-
ростков шванновских клеток нет. Синапсы булавовидные, по-
перечник 6—7x2—3 мкм, они образуют грозди. В них мало
синаптических складок.
Постсинаптический (субнейральный) аппарат тонических
волокон отличен от такового фазных. В тонических мышцах
он имеет малые размеры и слабую ацетилхолинэстеразную
активность.
В тонических мышцах лягушки СП не инициирует ПД, а сам
непосредственно запускает сократительный механизм.
ИСЧЕРЧЕННЫЕ МЫШЕЧНЫЕ ТКАНИ
НЕЛОКОМОТОРНОГО АППАРАТА
До сих пор речь шла о поперечнополосатой мускулатуре
двигательного аппарата, о мышцах, прикрепляющихся к кос-
тям, сухожилиям и т.д., т.е. о скелетной мускулатуре. Однако
существует поперечнополосатая мускулатура, входящая в со-
став стенок ряда внутренних органов, например верхнего от-
дела пищевода, лимфатических сердец амфибий, истинных го-
лосовых связок, глазодвигательного аппарата, электрических
органов рыб. Это мышечная ткань нелокомоторного аппарата.
Как отмечалось, в ходе эволюции наземных позвоночных
произошла редукция тонической мускулатуры, и она полнос-
тью исчезла из локомоторных мышц млекопитающих, но по-
лучила развитие у некоторых нескелетных мышц. Примером
может служить глазодвигательный аппарат, перемещающий
глазное яблоко: верхние, нижние, наружные и внутренние пря-
мые мышечные волокна, верхние и нижние косые. В этих
волокнах есть поля миофиламентов, но и отдельные миофиб-
риллы. По ультраструктуре они напоминают тонические мыш-
цы амфибий. Диаметр их меньше, чем у фазных мышц, но есть
М-полосы, которые извилисты, как и линии Z. Синапсы рас-
полагаются густо. Другой пример — интрафузальные мышеч-
ные волокна (мышечные веретена).
ИНТРАФУЗАЛЬНЫЕ МЫШЕЧНЫЕ ВОЛОКНА,
ИЛИ МЫШЕЧНЫЕ ВЕРЕТЕНА
Интрафузальные мышечные волокна входят в состав чувст-
вительных аппаратов, рецепторов растяжения, или мышечных
36
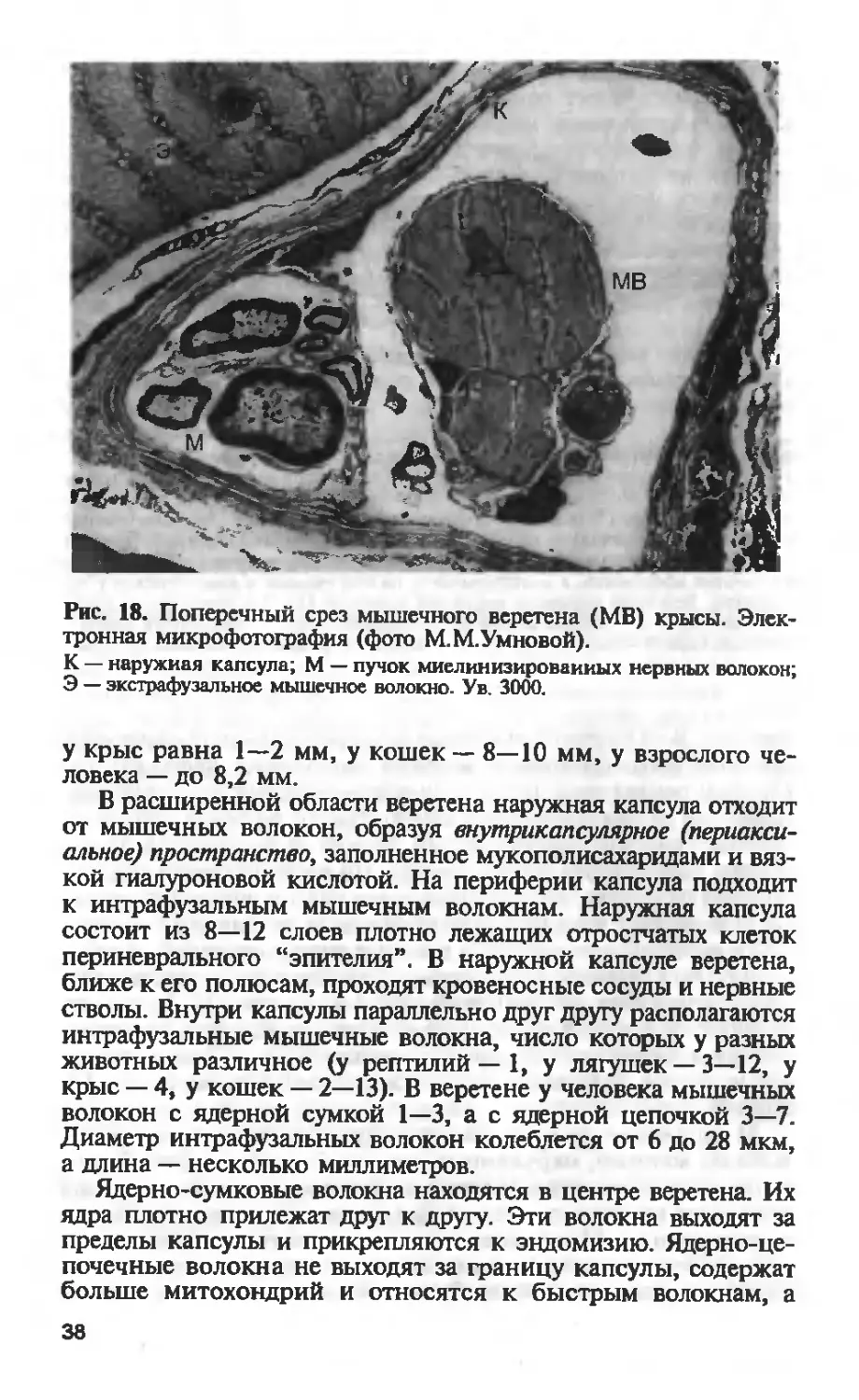
5
Рис. 17. Мышечное веретено крысы.
а — схема строения мышечного веретена. Оно содержит четыре интрафузаль-
ных мышечных волокна: два адерно-цепочковых статических (6), ядерно-сум-
ковое статическое (7) и адерно-сумковое динамическое (8). Показана чувстви-
тельная (афферентная) и двигательная (эфферентная) иннервация. Чувстви-
тельные нервные волокна, иннервирующие веретено, делятся на первичные и
вторичные афференты, а двигательные — на статические и динамические у-эф-
ференты. Веретено окружено наружной капсулой (1); 2 — статический двига-
тельный иерв; 3 — динамический двигательный нерв; 4 — вторичный чувстви-
тельный нерв; 5 — первичный чувствительный нерв (по Т.П.Саэие и др., 1989).
веретен. Б отличие от основных (экстрафузальных) мышечных
волокон интрафузальные волокна выполняют функцию на-
стройки рецепторов, но, будучи очень тонкими и малочислен-
ными, не создают внешнего двигательного эффекта. Интрафу-
зальные волокна имеют малый размер и в середине длины
теряют поперечную исчерченность. По расположению ядер эти
волокна разделяют на ядерно-сумковые (ЯС) и ядерно-цепочечные
(ЯЦ). В первых ядра располагаются в виде скоплений в средней
части волокна, а во вторых — распределяются цепочкой. В эква-
ториальной области эти волокна контактируют с чувствитель-
ными нервными окончаниями (рис. 17 а; рис. 17, б, в — см.
вклейку; рис. 18). Каждое интрафузальное волокно окружено
тонкой внутренней капсулой, состоящей из 1—3 слоев отрост-
чатых клеток периневрального "эпителия” (на схеме не изо-
бражены).
Мышечное веретено — это пучок нескольких интрафу-
зальных волокон, окруженных наружной капсулой. Все образо-
вание веретеновидное. У млекопитающих мышечные веретена
реагируют на скорость изменения длины мышцы и на степень
ее растяжения. Мышечные веретена находятся в близком со-
седстве с внутримышечными нервными стволиками и сухо-
жильными частями мышц. Протяженность мышечных веретен
37
Рис. 18. Поперечный срез мышечного веретена (МВ) крысы. Элек-
тронная микрофотография (фото М.М.Умновой).
К — наружная капсула; М — пучок миелинизированных нервных волокон;
Э — экстрафузальное мышечное волокно. Ув. 3000.
у крыс равна 1—2 мм, у кошек — 8—10 мм, у взрослого че-
ловека — до 8,2 мм.
В расширенной области веретена наружная капсула отходит
от мышечных волокон, образуя внутрикапсулярное (периакси-
алъное) пространство, заполненное мукополисахаридами и вяз-
кой гиалуроновой кислотой. На периферии капсула подходит
к интрафузальным мышечным волокнам. Наружная капсула
состоит из 8—12 слоев плотно лежащих отростчатых клеток
периневрального “эпителия”. В наружной капсуле веретена,
ближе к его полюсам, проходят кровеносные сосуды и нервные
стволы. Внутри капсулы параллельно друг другу располагаются
интрафузальные мышечные волокна, число которых у разных
животных различное (у рептилий — 1, у лягушек — 3—12, у
крыс — 4, у кошек — 2—13). В веретене у человека мышечных
волокон с ядерной сумкой 1—3, а с ядерной цепочкой 3—7.
Диаметр интрафузальных волокон колеблется от 6 до 28 мкм,
а длина — несколько миллиметров.
Ядерно-сумковые волокна находятся в центре веретена. Их
ядра плотно прилежат друг к другу. Эти волокна выходят за
пределы капсулы и прикрепляются к эндомизию. Ядерно-це-
почечные волокна не выходят за границу капсулы, содержат
больше митохондрий и относятся к быстрым волокнам, а
38
ЯС-волокна имеют больше миоглобина и соответствуют мед-
ленным мышечным волокнам. У крыс в мышечных веретенах
2 ЯС- и 2 ЯЦ-волокон.
Чувствительная иннервация интрафузальных мышечных во-
локон осуществляется двумя типами нейронов — первичными
и вторичными афферентами. Первичные афференты (нейроны
группы 1а) имеют аксоны диаметром 12—20 мкм. Они облада-
ют высокой скоростью проведения нервного импульса (120 м/с).
Их терминали образуют спиралевидные окончания на ЯС- и
ЯЦ-волокнах в экваториальной области веретена. Чувствитель-
ные окончания лежат под базальной мембраной интрафузаль-
ного нервного волокна в неглубоких канавках. Между мембра-
нами мышечных волокон и терминалями находится синапти-
ческая щель шириной 15—20 нм. Базальная мембрана интра-
фузального мышечного волокна не проникает в синаптическую
щель в отличие от базальной мембраны двигательного оконча-
ния (см. рис. 18).
Кроме первичных сенсорных окончаний, в мышечном вере-
тене имеются вторичные сенсорные окончания, образованные более
тонкими афферентными волокнами — диаметром 4—12 мкм.
Они располагаются в основном на ЯЦ-волокнах, дальше от
экватора веретена (см. рис. 17). Первичные сенсорные окон-
чания реагируют главным образом на скорость удлинения мышц,
а вторичные — на постоянное натяжение и малочувствительны
к скорости растяжения. Сенсорные волокна входят в спинной
мозг и направляются к тому а-мотонейрону, который иннер-
вирует скелетные экстрафузальные мышечные волокна той же
самой мышцы, вызывая ее сокращение через двигательные
окончания, расположенные в мышечных волокнах.
ЦНС не только получает информацию от мышечных вере-
тен, но и оказывает на них влияние через у-мотонейроны. Это
осуществляется с помощью тонких (2—4 мкм) двигательных
нервных волокон — фузимоторных, или у-волокон, вызывающих
сокращение интрафузальных мышечных волокон. Двигатель-
ные нервы интрафузальных волокон веретена настраивают чув-
ствительность мышечных веретен таким образом, чтобы они
могли работать при разной длине мышцы. Между двигатель-
ными окончаниями и плазмолеммой мышечного волокна су-
ществует синаптическая щель, в которую проникает вещество
базальной мембраны.
Чувствительные нервные волокна, иннервирующие веретено,
делятся на первичные и вторичные афференты, двигательные
же —на статические и динамические эфференты. Мышечные
волокна веретена в зависимости от типа их эфферентной ин-
нервации разделяют на динамические и статические.
У крыс веретено содержит одно статическое ЯС-волокно,
одно динамическое ЯС-волокно и два статических ЯЦ-волок-
на. Динамическими волокнами называются такие, у которых
39
1
2
Рис. 19. Гистогенез и дифференцировка скелетной мускулатуры.
а — схема гистогенеза: I — ранняя стадия: 1 — углубление нервной трубки, 2 —
сомиты; II — образование склсротома: 1 — хорда, 2 — сомиты; III — образова-
ние миотомов (1). Клетки миотома и будущие сателлиты (S), называемые
миобластами, дифференцируются по-разному. “Настоящие” миобласты М де-
лятся (IV), объединяются (V). их мембраны сливаются (VI) с образованием
мышечных трубочек. Миобласты S остаются неслившимися и недифференци-
рованными и образуют сателлиты, которые располагаются под базальной мем-
браной мышечных трубочек (VII). Некоторые сателлиты делятся (VH, VIII) и
передают ядра мышечным трубочкам (VIII), за счет чего число ядер в форми-
рующемся волокне увеличивается. Ядра перемещаются на периферию волокна
(IX); X—XIII — ультраструктура фрагментов клеток и волокон в процессе гисто-
генеза: X —миобласт, имеющий гранулярный эндоплазматический ретикулум
ГЭР (1), полисомы (2), миофиламенты (3) неупорядоченного расположения;
XI — фрагмент миосимпласта с ГЭР (I), гладким ретикулумом (2), миофила-
ментами (3), вдавленном плазмолеммы (4); XII — фрагмент незрелого мышеч-
ного волокна с саркоплазматическим ретикулумом (1), миофиламентами (2),
закладкой Т-каналов (3); XIII — фрагмент мышечного волокна с триадой (1).
при внезапном растяжении мышц из кольцеспиральных окон-
чаний на этих волокнах в спинной мозг поступает сигнал,
вызывающий резкое сокращение мышцы — динамический ре-
флекс на растяжение. Статическими волокна называются по-
тому, что при длительном их растяжении возникает стати-
ческий сигнал на растяжение, который поддерживает мышцу
в состоянии сокращения в течение нескольких часов.
ДИФФЕРЕНЦИРОВКА МЕЗОДЕРМЫ И ЕЕ ПРОИЗВОДНЫХ
Материал, из которого образуется мезодерма, в ходе эмбрио-
генеза первоначально скапливается в задней части зародыше-
вого щитка, формируя медиальный тяж в составе его наруж-
ного слоя — так называемую первичную полоску. Именно она
служит главным источником возникновения мезодермы. Осевая
часть мезодермы у всех позвоночных дифференцируется на
дорсальные массивные участки — сомиты, которые сегменти-
руются в краниокаудальном направлении, а далее на более
мелкие промежуточные участки — сегментные ножки (нефро-
гонотомы) и вентральные участки — спланхнотомы, остающие-
ся несегментированными, но расщепляющимися на париеталь-
ный и висцеральный листки. Клеточный материал мезодермы
приобретает эпителиоподобное строение. Параллельно с сег-
ментацией происходит дифференциация материала сомитов.
Каждый сомит, вначале однородный и состоящий из столбча-
тых клеток, затем подразделяется на дорсальный участок —
дерматом, подстилающий эктодерму, медиовеитральный
Рис. 19. Продолжение.
в — ультраструктура сателлитоцита, расположенного под гликокаликсом, на
плаэмолемме мышечного волокна ламантина (фото М.М.Умновой).
41
участок — с клер ото м, примыкающий к нервной трубке и
хорде, и промежуточный между ними — м и о то м. Склеротом,
разрыхляясь, образует мезенхиму, из которой в дальнейшем
формируются хрящевая и костная ткани осевого скелета. Клет-
ки дерматома, также разрыхляясь, формируют в дальнейшем
соединительную ткань кожи. Миотом формирует зачаток ске-
летной мускулатуры, и его клетки становятся миобластами
(рис. 19,а, в; рис. 19, б — см. вклейку).
ГИСТОГЕНЕЗ ПОПЕРЕЧНОПОЛОСАТОЙ
СОМАТИЧЕСКОЙ МЫШЕЧНОЙ ТКАНИ
(СГРИОМИОГИСТОГЕНЕЗ)
В мышечном волокне как структурно-функциональной еди-
нице имеется два разных по строению и судьбе компонента:
клеточный (миосателлиты) и симпластический (волокна), объ-
единенные общей базальной мембраной.
Развитие поперечнополосатой мускулатуры связано с суще-
ствованием стволовых клеток. Миогенные стволовые клетки
путем симметричного и асимметричного деления формируются
в коммитированные предшественники. Так, например, в muscu-
lus pectorals курицы коммитированные клетки проходят 4 де-
ления (детерминированного) с образованием 16 терминально
дифференцированных клеток (рис. 20). Представленная модель
объясняет асинхронное появление дифференцированных кле-
ток, в частности креатинкиназапозитивных [Le Bris S., Namer-
off M., 1986].
Выделяют следующие стадии стриомиогистогенеза: миоблас-
тическую (клеточную), миосимпластическую, стадию миотуб
(мышечных трубочек, миотубул), молодых и зрелых мышечных
волокон (рис. 21, а; рис. 21, б—г — см. вклейку).
Несмотря на единый источник образования в эмбриональ-
ном гистогенезе поперечнополосатой мускулатуры — стволо-
вых клеток, пути развития клеточной и симпластической по-
пуляций в стриом иогистогенезе различны. Клеточный компо-
нент — миосателлиты (миосателлитоциты, или сателлиты) —
это одноядерные малодифференцированные клетки, располо-
женные под базальной мембраной мышечного волокна или его
предшественников, способные к митозу и участвующие в об-
новлении мышечных волокон и их новообразовании путем
слияния с волокнами на разных стадиях гистогенеза (рис. 22 —
см. вклейку). В настоящее время выделяют две разновидности
сателлитов [Данилов Р.К., 1996]. Одни клетки имеют богатые
гетерохроматином ядра, узкую кайму цитоплазмы вокруг них
и филаментозные структуры из сократимых белков (тал 1). Эти
клетки рассматриваются как более дифференцированные. Дру-
гая разновидность сателлитов имеет более светлые ядра, более
42
Стволовая клетка
Симметричный митоз
| стволовой клетки
Асимметричный митоз
Кдыигпфоеж! ьм клетки
Коммитированная клетка
Крентинкиназапоэитиеиые клетки
Терминально дифферегамроеанные
мышечные клетки
Рис. 20. Модель миогенеза (по S. Le-Bris, M.Nameroff, 1986).
широкую кайму цитоплазмы и меньшее содержание сократи-
мых белков, а также выраженные гранулярный эндоплазмати-
ческий ретикулум (ГЭР) и аппарат (комплекс) Голвджи (тал 2).
Эти клетки считаются менее дифференцированными.
По прошествии нескольких митозов потомки стволовых кле-
Рис. 21. Онтогенез поперечнополосатого мышечного волокна.
а —схема [Blau М. et al., 1986]: I — тотипотентная клетка; И —стволовая
клетка; Ш — детерминированная клетка; IV — дифференцирующееся мышеч-
ное волокно; V—зрелое мышечное волокно.
43
ток — коммитированные полустволовые клетки, называемые
также промиобластами [Данилов Р.К., 1994, 1996], становятся
источниками обоих компонентов мышечного волокна и состав-
ляют пролиферативный пул соматической мышечной ткани.
Промиобласты формируют клоны первых терминально диф-
ференцированных клеток, не способных к синтезу ДНК, —
инициальных миобластов. Эти клетки становятся центрами фор-
мирования первых миосимпластов. Не способные к митозу
инициальные миобласты легко сливаются друг с другом и об-
разуют сначала симпласты> затем миотубулы (миотубы) и мышеч-
ные волокна.
Процесс слияния миобластов подробно описан В.С.Орло-
вым (1995) по данным электронной микроскопии и гистохи-
мии. Установлено, что на поверхности рядом расположенных
миобластов появляются дискретные частицы размером 8—9 нм,
богатые гликопротеидом — “белком адгезии”, образующие
своеобразные “мостики” между ними. Материал этих “мости-
ков” собирается в скопления, объединяющие контактирующие
клетки. Скопления имеют вид линз диаметром 60—65 нм, из
которых в дальнейшем формируются инвагинации в сторону
той из соседствующих клеток, которая является более диффе-
ренцированной. Инвагинации (кавеолы) превращаются в вези-
кулы, отрывающиеся в цитоплазму клетки, что приводит к
растрате мембранного материала, перфорированию мембраны
и ее разрушению. Этот процесс и лежит в основе слияния
контактирующих миобластов и образования миотуб.
С появлением симпластов и особенно миотуб вблизи них
становятся различимыми одноядерные клетки, представляю-
щие собой другой клон промиобластов, детерминированный
на формирование сателлитов. В период образования сарколем-
мы сателлиты оказываются в непосредственной близости от
симпластов, их плазматические мембраны сближаются, и оба
типа мышечных элементов оказываются покрытыми общей
базальной мембраной. Таким образом, в процессе эмбриогене-
за судьба промиобластов может быть разной: одна часть этих
клеток сохраняет способность к синтезу ДНК и митозам и
служит основным источником обновления мышечной ткани;
другая, утратив способность к синтезу ДНК, начинает актив-
но синтезировать специфические сократимые белки и стано-
вится инициальными миобластами; третья относится к по-
пуляции постмитотических промиобластов. Этот последний
тип клеток может либо вновь вступать в митоз, либо, перейдя
в фазу пролиферативного покоя, стать камбиальным резервом
и по мере необходимости сливаться с миосимпластами или
участвовать в образовании новых симпластов [Данилов Р.К.,
1996].
Со стадии поздних миотуб часть промиобластов, находясь
в С0-фазе и располагаясь под сарколеммой, приобретает боль-
44
шую дифференцированность и поэтому может быть отнесена
к категории сателлитных промиоцитов, превращающихся в
дифференцированные сателлитоциты.
Вблизи первой генерации мышечных волокон, сфор-
мированных при участии инициальных миобластов, начинает-
ся образование новых симпластов второй генерации из
промиоцитов. Последние находятся в состоянии пролифера-
тивного покоя и чувствительны к экзогенным воздействиям.
Количество ядер в симпластах нарастает не только за счет
слияния промиоцитов, но и в результате слияния с симплас-
тами сателлитоцитов. С возрастом количество сателлитоци-
тов уменьшается и снижается их пролиферативная актив-
ность.
Таким образом, при эмбриональном стриомиогистогенезе мор-
фологически идентифицируются немитозирующие миобласты и
промиобласты, способные делиться митозом. Из них образуется
два типа клеток: одни детерминированы на слияние друг с другом
с образованием симпластов, другие становятся миосателлитоми.
В результате слияния миобластов появляются миотубулы (13-й
день после оплодотворения — у эмбриона крысы в мышцах
конечностей). Их окружает соединительная ткань, способст-
вующая удлинению и дифференцировке миотубул. Этот ранний
процесс не зависит от иннервации, так как нервы проникают к
ним позднее. Такую генерацию миобластов и миотубул называют
первичной. Инициальные миобласты присоединяют к себе ран-
ние постмитотические промиобласты (не прошедшие критичес-
кого отрезка Gj) и формируют миосимпласты.
Вторичная генерация мононуклеарных клеток проникает меж-
ду соседними первичными миотубами, используя их стенки как
остовы, вокруг которых они удлиняются, сливаются и дифферен-
цируются с образованием вторичных миотубул. Последние закла-
дываются из промиоцитов, т.е. клеток в состоянии пролифера-
тивного покоя, в Gg-фазе митотического цикла.
Первоначально миотубулы располагаются в виде кластеров,
окруженных общей соединительнотканной оболочкой. В даль-
нейшем происходит разъединение миосимпластов, и каждый
из них покрывается своей базальной мембраной и эндомизием.
Первые синапсы появляются во время отделения первичных
миотубул друг от друга. Этот период совпадает с активацией
движения мускула. Вторичная генерация миотубул отделяется
от первичной, образуя независимые единицы сокращения, ок-
руженные базальной мембраной. Иннервация не только кон-
тролирует миогенез, но И1рает роль митогенов, способствуя
увеличению вторичных волокон [Данилов Р.К., 1994, 1996].
Установлено, что первичная генерация мышечных волокон
содержит медленную форму миозина и из нее в основном
развиваются медленные мышцы, а вторичная имеет как эмб-
риональный (медленный), так и неонатальный миозин, и из
45
нее образуются быстрые мышцы. Однако возможна трансфор-
мация быстрых мышечных волокон в медленные (например, в
musculus soleus).
РЕГЕНЕРАЦИЯ И ПАТОЛОГИЧЕСКАЯ ГИСТОЛОГИЯ
ПОПЕРЕЧНОПОЛОСАТОЙ МЫШЕЧНОЙ ТКАНИ
Способность мышц к регенерации как составных частей
органов была известна давно и у позвоночных, и у беспозво-
ночных. Считалось, что регенерационная способность по мере
повышения организации животных снижается, почти полнос-
тью исчезает у птиц и млекопитающих и что на месте повреж-
дения мышц образуется соединительнотканный рубец. Ле Гро
Кларку (1946) впервые удалось наблюдать регенерацию боль-
шеберцовой мышцы кролика после ее разрушения, вызванного
отсутствием кровоснабжения.
С 1949 г. изучением регенерации мышц начали заниматься
сотрудники лаборатории А.Н.Студитского на молодых петуш-
ках и крысах. Они рассекали мышцы поперек, вырезали фраг-
менты мышц, проводили ксено- и аутотрансплантацию и
трансплантацию измельченной мышечной ткани на место уда-
ленного мускула. Иссечение мышечного фрагмента выводит
мышцу из работы. Было установлено, что при этом происходит
образование миобластов, которые, сливаясь между собой, об-
разуют миотубы с постепенной их дифференцировкой в мы-
шечные волокна. При измельчении И мышцы и перемещении
“фарша” на место удаленного фрагмента мышцы вблизи нерв-
но-сосудистого пучка из клеток-сателлитов, расположенных
под базальной мембраной пересаженных мышечных фрагмен-
тов, образуются миобласты. Через 3—5 дней “потоки” интен-
сивно делящихся миобластов сливаются, образуя симпласты.
Процесс созревания вновь образованных миогенных элементов
направлен от краевой зоны трансплантата к центру. При этом
по периферии могут быть уже зрелые мышечные волокна, а в
центре даже через 2—3 нед наблюдаются еще миосимпласты.
Через 1—2 мес на месте пересаженной мышцы образуется
мышцеподобный орган, отвечающий сокращением на раздра-
жение нерва электрическим током.
В лаборатории А.Н.Стуцитского были выяснены условия,
необходимые для регенерации мышц:
1) натяжение, т.е. установление связи со скелетом;
2) восстановление кровоснабжения;
3) установление нервной связи. При отсутствии иннерва-
ции начавшееся развитие мышечных волокон сменяется
их атрофией.
А.Н.Студитский пересаживал также целую интактную мыш-
цу, пришивая ее к сухожилию для создания натяжения. При
46
такой аутотрансплантации мышца не просто приживляется, а
подвергается “трансплантационной регенерации”, сочетающей
деструктивные и пролиферативные процессы. Из тканей транс-
плантационного ложа в мышцу врастают кровеносные сосуды,
при этом стенки старых сосудов, по-видимому, служат карка-
сом для прорастающих новых. Старые мышечные волокна не-
кротизируются и фагоцитируются макрофагами, приносимыми
сосудами. Сателлиты, сохранившиеся под базальной мембра-
ной, активизируются и митозируют через 12—24 ч после пере-
садки. Базальные мембраны разрушившихся мышечных воло-
кон служат ориентиром для роста новых мышечных элементов,
формирующихся из миобластов. Наиболее зрелые миогенные
элементы в трансплантате располагаются на его периферии.
Через 7 сут на периферии трансплантата, где восстановилось
кровоснабжение, появляются миосимпласты и молодые мы-
шечные волокна, а также происходит фагоцитоз старых воло-
кон (рис. 23, 24,а,б — см. вклейку; рис. 24, в, г).
При пересадке небольших мышц сателлиты оказываются
жизнеспособными как по периферии, так и в центральных
частях трансплантата н участвуют в регенерации мышц. В транс-
плантатах крупных мышц их центральные участки некротизи-
руются вместе с сателлитами и масса вторичных мышечных
волокон составляет лишь около половины всей мышцы. При
подшивании нерва в пересаженную мышцу он прорастает в
формирующийся регенерат с образованием синапсов.
Способность мышцы к регенерации после повреждения и
трансплантации объясняется ее возможностью к самообновле-
нию, т.е. физиологической регенерации, осуществляемой в тече-
ние жизни организма. Сателлиты в обоих случаях служат ис-
точником образования миобластов.
Данными лаборатории А.Н.Студитского пользуются в хи-
рургической практике при параличе лицевых мышц, поднятии
опущенных углов рта и др.
Полагали, что регенерация поперечнополосатых мышц идет
не только за счет размножения сателлитов и их слияния, но и
путем образования наплывов цитоплазмы на концах перерезан-
ных мышечных волокон, содержащих много ядер. Однако мето-
дом радиоавтографии было показано, что в наплывах цитоплазмы
меченые ядра принадлежат сателлитам, которые сливаются с
волокном [Румянцев П.П., 1982]. Эти данные позволяют со-
мневаться в правильности распространенной ранее гипотезы.
Физиологическая регенерация осуществляется за счет раз-
множения сателлитов.
Патологические изменения соматической мускулатуры от-
части рассматриваются в последующих главах. Следует отме-
тить, что скелетные мышцы и миокард имеют много общих
морфоФизиологических черт и изменения их при патологичес-
ких состояниях во многом бывают сходными. Так, при различ-
47
IV
б
Рис. 23. Регенерация поперечнополосатой мускулатуры при незначи-
тельном (а) и более сильном (б) повреждениях.
I — через базальную мембрану (1) проходят макрофаги (2) в эону повреждения
волокна (3) и фагоцитируют разрушенный участок (4); II — спустя 3—4 дня в
зоне некроза накапливаются мышечные ядра (5). Они перемещаются в высту-
пы (6), направляясь навстречу друг другу, и волокна сливаются; III — сначала
ядра имеют центральное положение; IV — через 2 нед .ядра размещаются на
периферии волокна; V — сателлиты (5) после очистки макрофагами (1) зоны
повреждения не делятся; VI — через 3—4 дня сателлиты начинают митоэиро-
вать (5); VII — некротическая эона заполняется молодыми миобластами (са-
теллитами) (6), клетки сливаются; VIII — образование симпласта с ядрами
посередине (мышечные трубочки); IX —ядра перемещаются на периферию
волокна.
Рис. 24. Регенерация поперечнополосатой мускулатуры (микрофото
Е. И. Максименко).
в, г — образование мышечных трубочек (указаны стрелками) в ксенотранс-
плантате икроножной мышцы крысы, пересаженном монгольской песчанке,
через месяц после пересадки.
49
ных повреждениях (прекращение притока крови, травмы, вос-
паление и др.) могут возникнуть атрофические, дистрофичес-
кие и некротические изменения ткани.
При атрофии соматической мускулатуры, возникающей
вследствие гипокинезии, голодания или денервации (рис. 25 —
см. вклейку) мышечные волокна истончаются, исчезает по-
перечная исчерченность (продольная сохраняется дольше),
часто может происходить расщепление волокон. Межуточная
соединительная ткань в местах атрофии, как правило, разрас-
тается, иногда происходит замещение мышечной ткани жиро-
вой. Примерами наследственно обусловленной атрофии, вы-
званной нарушением иннервации, могут быть амиотрофичес-
кий латеральный склероз и злокачественная миастения.
При дистрофии обычно не вся мышца поражается па-
тологическим процессом, а степень выраженности изменений
бывает разной в различных частях мышцы. Возможна компен-
сация поврежденной ткани путем регенерации. Примером ди-
строфических нарушений скелетных мышц может служить мы-
шечная дистрофия Дюшенна (см. далее).
Некроз поперечнополосатой мускулатуры может быть от-
несен к коагуляционному или колликвационному. Вокруг
участков некроза часто можно наблюдать жировую дистрофию
и липоматоз (отложение жира в самой мышечной ткани), а
также отложение извести.
Гипертрофия соматической мускулатуры наблюдается
при ее тренировках, прекращение которых ведет к атрофичес-
ким изменениям и замещению мышечных волокон жировой
тканью. В мышцах нижних конечностей при венозном полнок-
ровии часто развивается гипертрофия мышечных волокон, ко-
торая затем может смениться атрофией.
Проблема морфоадаптации скелетных мышечных тканей в
процессе эмбрионального гистогенеза, при посттравматичес-
кой и посттрансплантационной регенерации, а также в усло-
виях экспериментальной патологии широко освещена в сбор-
нике “Морфоадаптация мышц в норме и патологии” под ред.
А.А.Клишова (Саратов, 1975).
ЭЛЕМЕНТЫ СРАВНИТЕЛЬНОЙ ГИСТОЛОГИИ
СКЕЛЕТНОЙ ПОПЕРЕЧНОПОЛОСАТОЙ
МЫШЕЧНОЙ ТКАНИ
Данные сравнительной гистологии позволяют считать, что
в процессе эволюции структура соматической мускулатуры под-
вергалась заметным изменениям, связанным с совершенство-
ванием и специализацией разнообразных двигательных функ-
ций организма в целом и отдельных его частей и адаптацией
животных к условиям существования.
50
СКЕЛЕТНАЯ ПОПЕРЕЧНОПОЛОСАТАЯ
МЫШЕЧНАЯ ТКАНЬ ПОЗВОНОЧНЫХ ЖИВОТНЫХ
КРУГЛОРОТЫЕ И РЫБЫ
У круглоротых в миотомах, расположенных вдоль тела, со-
держатся быстрые центральные мышечные волокна и вокруг
них — тонкие медленные (рис. 26, а, б — см. вклейку; рис. 26,
в, г). У рыб в большинстве случаев в миотомах находятся также
два типа фазных волокон: медленные (красные), расположен-
ные снаружи, не имеющие ПД и обеспечивающие ритмические
движения при длительном плавании, приспособленные к эко-
номному расходу энергии, а также быстрые (белые), включаю-
щиеся при совершении быстрого броска и находящиеся внутри
миотома. Диаметр красных волокон составляет 4—6 мкм, а
белых — 6—12 мкм. У водных позвоночных отсутствует тони-
ческая функция локомоторной мускулатуры, т.е. удержание
позы в гравитационном поле Земли. Миофибриллы в быстрых
и медленных волокнах часто лентовидные, радиально расхо-
дятся, а ядра располагаются центрально.
Рис. 26. Поперечный срез соматической мускулатуры низших позво-
ночных.
в, г — электронные микрофотографии поперечного среза мышцы рыбы на
уровне диска А (в) и линии Z (г). Гексагональное расположение толстых и
тонких филаментов. Стрелками показаны тонкие мостики между толстыми
миофиламентами иа уровне линии М. Видны каналы Т-системы между лен-
товидными миофибриллами иа уровне линии Z. Терминальные разветвления
саркоплазматического ретикулума СР подходят к Т-каналам (Т), но не слива-
ются с ними.
51
ЗЕМНОВОДНЫЕ
Выход позвоночных на сушу потребовал глубокой пере-
стройки двигательной системы для выполнения дополнитель-
ной функции поддержания тела в гравитационном поле Земли.
Развились конечности, совершенствовался центральный аппа-
рат управления движением, и, кроме быстрых и медленных
фазных мышц, появились еще тонические, которые обеспечи-
вают противодействие силе тяжести. По строению эти мышцы,
как отмечалось, отличаются утолщенными и зигзагообразными
линиями Z и отсутствием линии М, а также редкими и менее
правильно расположенными триадами или диадами. Вследст-
вие низкого уровня развития ЦНС медленные фазные мышцы
не смогли справиться с новыми задачами противодействия
силе тяжести, что и обусловило появление тонических мышц
(см. рис. 13).
ПРЕСМЫКАЮЩИЕСЯ
У сильно подвижных рептилий мышечный тонус поддержи-
вается не столько за счет ацетилхолинэстеразного механизма,
свойственного тоническим мышцам земноводных, но и за счет
суперпозиции, как при фазных движениях, т.е. тетанического
тонуса. У медленно двигающихся рептилий (черепахи) имеются
типичные тонические волокна, однако они способны генери-
ровать ПД в ответ на прямое раздражение. В таких волокнах
миофибриллы располагаются либо равномерно, либо полями.
Т-каналы находятся в таких волокнах на уровне линий Z.
ПТИЦЫ
Тонические мускулы птиц (передняя широкая мышца спи-
ны, верхней части крыла и шеи) отличаются от медленных
фазных мышц (грудной) рядом свойств и приближаются к
тонической мускулатуре лягушки. Иннервация тонических мышц
имеет вид виноградной кисти, миофибриллы располагаются
полями, линия Z неровная, слабо развиты Т-система и СР. Эта
мускулатура обладает затяжным одиночным сокращением, за-
медленным достижением максимального напряжения при те-
танусе и стойким поддержанием этого напряжения при дли-
тельном ритмическом раздражении. Особенностью тонических
волокон птиц является способность генерировать ПД. Таким
образом, они не чисто тонические. В мышцах такого типа
хорошо развит энергетический аппарат. Они красные и похожи
на медленные фазные волокна. Их относят к особому “птичье-
му” типу. Исключением служат красные мышцы колибри, ко-
торые относятся к быстрым. Фазные мышцы птиц ничем су-
щественным не отличаются от таковых мышц млекопитающих
52
МЛЕКОПИТАЮЩИЕ
Как отмечалось, в локомоторной мускулатуре млекопитаю-
щих нет тонических мышц. Функция поддержания позы у них
перешла к медленным фазным мышцам. Тоническая мускула-
тура у них обслуживает органы чувств. У низших млекопита-
ющих в скелетной мускулатуре превалируют красные мышцы
с длительным временем одиночного сокращения, т.е. обладаю-
щие тоническими свойствами. В них происходит контрактура
в ответ на деполяризующие агенты.
Итак, тонические мышцы в эволюции позвоночных животных
впервые появляются у земноводных, а у водных позвоночных они
отсутствуют. Уже у рептилий тоническая мускулатура подвер-
гается редукции и функцию тонуса начинают осуществлять
медленные фазные мышцы. У птиц хорошо развита тоническая
мышечная система, которая в отличие от таковой амфибий
имеет развитый энергетический аппарат. Тоническая мускула-
тура у птиц сохраняется в глазодвигательном аппарате.
Наружные глазодвигательные мышцы содержат два типа тоничес-
ких мышц: I — унаследованный от земноводных “лягушачий” в наруж-
ных и II — появляющийся у рептилий “птичий” — во внутренних мыш-
цах. В процессе эволюции II тип тонических волокон, вероятно, возник
заново из медленных фазных волокон, а не из тонических, которые
постепенно редуцировались [Магазаник Л.Г., Наслсдов Г.А., 1974}.
Возможно, что причина, по которой у низших позвоночных
тоническая функция перестала осуществляться тонической сис-
темой, а перешла к медленным фазным волокнам, состоит в том,
что тонические волокна не способны быть достаточно лабиль-
ными, быстро перестраиваться вслед за изменением положения
тела и поддерживать быстро меняющуюся позу. Кроме того,
меняется и сама функция тонуса, который не только удерживает
позу в гравитационном поле, но и может экстренно фиксировать
положение тела перед осуществлением быстрого движения огра-
ниченной группы локомоторных мышц. Таким образом созда-
ется опора для перемещения в пространстве частей тела. Эти
функции не могли осуществлять тонические мускулы с малой
скоростью проведения. У птиц тоническая мускулатура уже
используется только при полете для фиксации шеи и головы,
а фазные мышцы обеспечивают сам полет.
ЛОКОМОТОРНЫЕ МЫШЦЫ БЕСПОЗВОНОЧНЫХ
ЖИВОТНЫХ И НИЗШИХ ХОРДОВЫХ
НИЗШИЕ БЕСПОЗВОНОЧНЫЕ
Губки полностью лишены мышц, но могут производить
очень медленные движения, сокращения тела и устьиц, а также
53
Рис. 27. Мышечные клетки и волокна беспозвоночных.
а — эктодермальная эпителиально-мышечная клетка из продольной мышцы —
радиальной перегородки актинии; б — мышечная клетка дождевого червя; в —
мышечная клетка церкарии двуустки; г — косо исчерченная мышечная клетка
аскариды (поперечный срез); д — эпителиально-мышечная клетка гидры;
е, з — продольный и поперечный срезы гладкомышечной клетки брюхоногого
моллюска; ж — мышечная клетка турбеллярии; и — поперечный срез летатель-
ного поперечнополосатого мышечного волокна стрекозы; к — запирательная
мышца с двойной косой исчерченностью двустворчатого моллюска; 1 — сокра-
тительные элементы; 2 — жгут; 3 — ядросодержащая часть клетки.
замыкание поверхностных пор за счет сокращения пороцитов,
т.е. клеток, внутри которых проходят поровые каналы.
Кишечнополостные имеют эпителиально-мышечные клетки.
В эктодерме эти клетки располагаются вдоль тела животного,
а в энтодерме — поперечно. У гидры эти клетки имеют трофи-
ческую и сократимую части (рис. 27). В сократимой части
находятся миофибриллы, лишенные поперечной исчерченное-
ти. Возможно, что в этой части клетки содержатся только
миофиламенты, не собранные в выраженные миофибриллы.
У гидроидных медуз, сифонофор и сцифомедуз в сократимых
частях эпителиально-мышечных клеток наряду с гладкими
описаны косо и поперечно исчерченные миофибриллы. Кроме
сократимых отростков, эти клетки имеют тонкие, лишенные
сократимых филаментов выросты, называемые иннервацион-
ными. Именно на них образуются нервно-мышечные синапсы.
Для этих отростков характерно также наличие щелевых соеди-
нений, связывающих соседние клетки, что и объясняет рас-
пространение возбуждения от одной клетки к другой. Сокра-
54
тимые отростки контактируют с аналогичными структурами
соседних клеток путем образования “вставочных дисков”, по-
хожих на таковые у миокардиоцитов.
Гребневики характеризуются тем, что у них впервые диффе-
ренцируются настоящие мышечные клетки, а не эпителиаль-
но-мышечные.
ЧЕРВИ
Черви имеют кожно-мускульные мешки, состоящие из эпи-
телия и мышечных клеток (а не симпластов), формирующих
кольцевую и продольную мускулатуру. Особенно хорошо раз-
виты кожно-мускульные мешки у кольчатых червей, но они
имеются и у низших червей.
Плоские черви имеют наружную кольцевую и внутреннюю
продольную мускулатуру, а иногда и “косую”. Мышечные
клетки планарий обособлены друг от друга, вытянутой формы.
Ядро находится по одну сторону клетки, в средней ее части.
Сократительный аппарат состоит из толстых филаментов, по-
перечник которых 10—20 нм, и тонких — толщиной 5 нм.
Вокруг толстых нитей располагается 10—15 тонких. Разделения
на диски I и А нет. Иногда встречаются образования, подобные
линиям Z, но они имеют вид столбиков.
У круглых червей (нематод) кожно-мускульный мешок со-
держит один слой мышечных клеток, расположенных продоль-
но. Гиподерма этих червей образует 4 валика, которые разде-
ляют мышечные клетки на 4 ленты. В дорсальных и вентраль-
ных валиках проходят нервные стволы. Мышечные клетки
состоят из сократимой лентовидной части, перинуклеарной
части и иннервационного отростка — “руки”; отросток тянется
к вентральному или дорсальному нервному стволу. Эти клетки
у аскариды близки по организации к поперечнополосатой со-
кратительной системе и имеют на поперечных срезах регуляр-
ную полосатость (рис. 28—31). Под электронным микроскопом
видно, что в более светлых полосах находятся толстые миофи-
ламенты, различима полоса Н (светлая зона) с толстыми ни-
тями; полоса А, содержащая и толстые, и тонкие филаменты.
Латеральнее полосы А располагаются с обеих сторон по поло-
вине полосы I из тонких филаментов. Такая картина наблю-
дается потому, что филаменты, не формируя отдельных мио-
фибрилл, тем не менее располагаются упорядоченно, но со
смещением друг относительно друга. В полосе А каждая толс-
тая нить окружена 10—12 тонкими. На латеральных краях
полосы I тонкие филаменты собраны в своеобразные Z-пучки.
В этих мышечных клетках имеются трубчатые впячивания
плазмолеммы — аналоги Т-системы. Сократимая часть мышеч-
ной клетки содержит поля миофиламентов, смещенных отно-
сительно друг Друга, и поэтому на продольных срезах наблю-
55
Рас. 28. Мышечная клетка аскариды.
а — продольный срез. В сократимой части клетки видны толстые миофиламен-
ты, расположенные продольно и со смещением. Окраска железным гематокси-
лином по Гейденгайну; б — поперечный срез. Видны сократимые (темные) н
трофические (светлые) части клеток, содержащие ядра. Окраска та же.
дается косая исчерченность. Иннервационный отросток обра-
зует синаптические контакты с нервными волокнами большого
диаметра (J.Rosenbluth).
Мышечные волокна аскариды имеют как возбуждающую,
так н тормозную регуляцию. Возбуждающим медиатором слу-
жит ацетилхолин, а тормозным — у-аминомасляная кислота
(ГАМК). Эти медиаторы, однако, только регулируют моторный
ритм. Координация сокращений мышечных клеток происходит
благодаря наличию между ними щелевых контактов.
У кольчатых червей (полихет и олигохет), как отмечалось,
кожно-мускульный мешок развит сильно. Так, у олигохеты
(дождевой червь) мышечные клетки продольной мускулатуры
56
Рис. 29. Расположение исчерченности в мышечных клетках аскариды
в трех планах. Б YZ-плане филаменты располагаются как в попере-
чнополосатой мускулатуре, а в XZ-плане также видна исчерченность,
но косая. В XY-плане филаменты срезаны поперечно и образуют зоны
с тонкими, толстыми и окружающими друг друга филаментами (по
J.Roscnbhith).
Рис. 30. Электронная микрофотография. Продольный срез мышеч-
ной клетки аскариды. Видны параллельное расположение филаментов
и слабовыражснная спиральность. Толстые филаменты очень длинные
(4 мкм) и утолщены посередине (указано стоелками) (фото J.Roscn-
bluth).
лентовидные и одним краем прикрепляются к радиальным
соединительнотканным септам, а второй край оканчивается
свободно (рис. 32 —см. вклейку). Это одноядерные клетки,
имеющие удлиненную сократимую часть и трофическую, со-
держащую ядра. Как и у нематод, эти клетки имеют косую
исчерченность сократительного аппарата. Толстые и тонкие
нити не образуют миофибрилл, но располагаются со смеще-
нием. Аналоги Z-полосок имеют у них вид тяжей, расположен-
ных перпендикулярно филаментам. СР в виде трубочек, иду-
щих поперечно на уровне дисков I, чередуется с Z-тяжами.
У некоторых олигохет описаны миофибриллы ламеллярной
формы.
У полихеты нереис кожно-мускульный мешок имеет более
сложное строение. Продольные мышцы образуют два дорсаль-
ных и два вентральных пучка. Снаружи располагаются кольце-
вые мышцы, а изнутри — продольные. Эти клетки, как и у
олигохет, имеют косо исчерченную структуру сократимого ап-
парата. Ядро в такой клетке располагается в выпячивании,
отходящем от узкой сократимой ее части. СР имеет вид тру-
бочек, полоски Z в виде стержней или трубок.
У кольчатых червей, как и у круглых, имеется перифери-
ческая нервная регуляция двигательной активности с помощью
возбуждающего и тормозного медиаторов.
56
Рис. 31. Ультраструктура мышечной клетки аскариды. Поперечный
срез пучков и субпучков миофиламентов. Ув. 60 000 (фото J.Rosen-
bluth).
а — каждый плоский пучок, или “миофибрилла” (“мышечное волокно** — М),
имеет узкую центральную эону со срезами только толстых филаментов; по
бокам — субпучки, содержащие тонкие и толстые филаменты. С латеральной
стороны каждой “миофибриллы” имеется узкая полоска тонких филаментов.
Темные полосы D содержат мелкие пучки тонких филаментов (Z-пучки),
которые поддерживают фибриллы (указаны стрелками) в 4 местах: саркоплазме
(сердцевине — S), пространстве между сердцевиной и темными пучками, в
темном пучке и в середине “миофибрилл”; б — поперечный срез темной по-
лосы и прилежащих “миофибрилл” при большем увеличении. Плотная полоса
содержит ограниченные мембранами цистерны саркоплазматического ретику-
лума С, фибриллярные “плотные тельца” F и Z-пучки (Z). В кружках показано
взаимное расположение толстых и тонких филаментов.
У пиявок наружный слой кожно-мускульного мешка состоит
из кольцевой мускулатуры, а внутри животного мышечные
клетки расположены косо и продольно. Они удлиненные, с
заостренными концами. Ядро находится в середине клетки, а
по периферии располагаются сократимые филаменты. Эти
клетки имеют косо исчерченный сократимый аппарат (рис. 33,
34 — см. вклейку).
Итак, у всех червей соматическая мускулатура имеет кле-
точное строение и формирует кожно-мускульный мешок, а со-
кратимые миофиламенты, располагаясь упорядоченно, придают
клеткам косую исчерченностъ.
59
Рис. 33. Мышечные клетки пиявки; продольный срез. Трофическая
часть клеток с ядрами окружена сократимыми элементами. Окраска
железным гематоксилином по Гейденгайну.
МОЛЛЮСКИ
Моллюски имеют разнообразно устроенную мускулатуру в
разных органах.
У пластинчатожаберных мускулатура расположена в мантии
и ноге. Производными мантийной мускулатуры являются мыш-
цы аддукторов, которые при сокращении создают противодей-
ствие упругости лигамента, стремящегося раскрыть раковину.
Аддуктор состоит из двух частей: одна часть прозрачная, желтая
и мягкая, содержит быстро сокращающиеся миоциты; другая —
плотная, непрозрачная, белая, имеет медленно сокращающие-
ся тонические клетки. Во второй части аддуктора больше со-
единительнотканных прослоек. Особенно хорошо видна раз-
ница между этими двумя частями аддуктора у Pecten и Madiola.
Менее четкие различия у Муа, Mytilus, Pinna, а у Lima быстрые
и медленные волокна аддуктора перемешаны. Белая тоничес-
кая мышца способна поддерживать длительное напряжение
при малом расходе энергии. Она построена из гладких пара-
миозиновых волокон (рис. 35, 36). Прозрачная мышца осу-
ществляет быстрые движения и может быть гладкой (у Апо-
donta), косо исчерченной (Ostrea, Ensis) и даже поперечнопо-
лосатой (Pecten). Каждое волокно содержит одну миофибрил-
лу, разделяющуюся в центре у ядра.
Ретракторы биссуса состоят из гладкой мускулатуры, часто
бывают парамиозиновыми. Парамиозин (тропомиозин А) —
водонерастворимая форма тропомиозина. Этот белок находит-
ся в толстых миофиламентах. Вокруг парамиозиновых нитей
60
Рис. 35. Электронная микрофотография. Парамиозиновые изолиро-
ванные филаменты; негативный контраст (N.Garamvolgyi).
располагается миозин, поэтому диаметр толстых нитей бывает
шире, чем у толстых протофибрилл позвоночных. Длина толс-
тых филаментов достигает 3 мкм, а диаметр составляет
30—150 нм. Одну толстую нить окружает примерно 12 тонких
актиновых. Часто они расположены неупорядоченно. Некото-
рые гладкие мышцы моллюсков не содержат парамиозина, в
таких случаях они бывают похожи на гладкие мышцы позво-
ночных. В парамиозиновых волокнах ионы Са2+ реагируют не
с тропомиозином, как в миозиновых миофиламентах, а с лег-
кими цепями миозина (см. далее). После окончания стимуля-
ции в них сохраняется сокращение (“запирание”).
У этих животных описаны отдельные быстрые и медленные
мышечные пучки, состоящие из разных по структуре клеток.
К ним подходят быстропроводящие (толстые) и медленнопро-
61
Рис. 36. Электронные микрофотографии аддуктора беззубки (N.Ga-
ramvolgyi).
а — продольный срез. Видна поперечная исчерченность индивидуальных пара-
миозиновых филаментов; б — плотные тельца DB в мускуле.
62
Рис. 36. Продолжение.
в — поперечный срез. Многочисленные тонкие филаменты расположены меж-
ду толстыми парамиозиновыми нитями.
водящие (тонкие) аксоны. Оба вида аксонов у пластинчатожа-
берных, как и у головоногих моллюсков, образуют синапсы на
одних и тех же мышечных клетках (волокнах). Поэтому харак-
тер сокращений их зависит от получаемой нервной импульса-
ции. В большинстве случаев каждое мышечное волокно мол-
люсков несет на себе несколько синапсов [Магазаник Л.Г.,
1979].
У брюхоногих моллюсков миоциты ретрактора щупалец и
терки имеют поперечную полосатость.
У головоногих мышцы мантии гладкие, спирально закручен-
ные. Радиальные мышцы “рук” и плавников кальмаров и щу-
палец каракатиц поперечнополосатые.
Итак, у моллюсков все двигательные элементы очень тонкие
и представляют собой одноядерные клетки. Вследствие большой
длины эти миоциты иногда называют не клетками, а волокнами.
Фазные волокна моллюсков обычно тоньше тонических. Запира-
тельные мышцы устроены разнообразно и могут быть гладкими,
косо исчерченными и поперечнополосатыми, содержащими или не
содержащими парамиозин. СР имеет в мышечных клетках вид
пузырьков; Z-структуры, если и встречаются, выглядят плот-
ными тельцами. Синапсы не имеют складчатости постсинапти-
ческой мембраны.
Основной медиатор этих волокон — ацетилхолин, но может
быть и глутамат, а тормозным медиатором является ГАМК.
Уникальной особенностью парамиозиновых мышц считается
63
стюсобнссть поддерживать длительное высокое напряжение без
признаков утомления, что называется вязким "запирательным"
тонусом. На примере запирательной мышцы пластинчатожа-
берных моллюсков можно проследить разные стадии форми-
рования упорядоченного сокригителыното аппарата от гладких,
со случайно расположенными миоф^ламентами, до попере-
чнополосатых, со строго упорядоченным их распределением.
У моллюсков впервые появляются нервы, которые способ-
ны выделять в синапсах расслабляющий медиатор. Установле-
но, например, что стимуляция нервов, подходящих к ретрак-
тору бнесуса, вызывает как сокрахненне мышц, так и их рас-
слабление Последний акт, вероятно, связан с действием серо-
тонина, снижающего концентрацию кальция в миоплазмг, что
и вызывает расслабление.
ЧЛЕНИСТОНОГИЕ
Членистоногие имеют поперечнополосатые
мышечные волокна, содержащие миофибрнллы Миозиновые
филаменты имеют поперечник 15—22 нм, а актиновые —
7—8 нм. Есть и сверхтонкие нити, идущие без перерыва от
линия Z до Z, а в крыловых мышцах выявлены еще сверхтон-
кие нити, соединяющие толстые филаменты с линиями Z
В отличие от червей, у которых нет экзоскелета и мускульные
клетки локализованы в стенках тела, у пауков, насекомых и
ракообразных мышечные волокна присоединяются к кутикуле
зкзоскелета и включаются в движение сегментов тела, конеч-
ностей, крыльев и чувствительных волосков. Обычно в таких
волокнах ядра располагаются центрально.
Насекомые имеют разные по активности мышцы: медлен-
ные ~ ножные, быстрые — крыловые и очень быстрые — асин-
хронные ~ крыловые (рис. 37—42)
Первый тип мышц состоит из волокон диаметром 12—25 мкм
В центральной части находятся ядра, миофибриллы имеют
пластинчатый вид (трубчатые, или пластинчатые, мышцы)
Примером могут служить ножные мышцы пчелы, таракана,
осы Длина саркомеров у них 5—11 мкм Митохондрии в этих
мышечных волокнах располагаются в основном попарно и
вблизи линий Z. В них есть СР и аналоги Т-системы.
Разгибатоль голени (у саранчи}, относящийся к трубчатому типу
мышц, обладает бифугжшюналыюстъю. С одной стороны, эта мышца
участвует в прыжке, развивает усилие в 100 раз больше мощности
мышц человека (из расчета на площадь поперечного сечения) н
имеет морфологию фазной мышцы С другой стороны, сна участвует
в медленных ритмических актах при ходьбе и этим похожа на тони-
ческие мышцы На данном примере была впервые обнаружена воз-
можность структурной неоднородности волокон, входящих анатоми-
чески В ОДНУ МЫШЦУ
64
Рис. 2. Строение поосречжикотосатой мутикулягуры К с. 11.
6 — ткжхречж<юлосатая мускулатуре язика кролика на продольном к попере-
чном срезах. Окраска железным геметс*хлнллпкм по ГеДденгеГгну; в — попере-
числолосягая сомеигкхкая мускулатура Человека. Окраска гемвтскенчмном и
Рве. 8. Мостики, соединяющие линию Z миофибрилл друг с другом
и с ллазмолеммой К с. 18,
б — цитоскелет гюоерсчнсчххлоапсго мышечного волокна. 1 — октин и сг-их-
тинин во внутренней части Z-полоски (по Е Lasarides, J Capclanaki, с измене-
ниями) Красным обозначен мембранно-скелетный домен (спектрин, в НИКИ-
ТИН, онхирин к др), зеленым—трене UMTCirieJwnwecKM# домен (десмин,
внментнн, филамкн)
a
Ркс. 4. Гексагональное раслоюлснис толстых филаментов в миофмб-
оилле на уровне линии М (схема) К с. 16.
з — гихпцзечиъйс срез, 6 — продольный срез. Толстые филаменты соединяются
связующими НИТЯМИ (скреплены)
Рис. 10. Мнтохснлриалъмый ретикулум в поперечнополоезтой скелет-
ной мышце (по Ю.С Ченцову) К с. 23.
а —продольный срез Видны мелкие сечения митояондрП (зслсмыс), б —
поперечный срез. Мзгтсксоджн (М) имеют кц разветвленных сложных сетей,
МФ — мцофибриллы. ММК — межммтхшждрильмый контакт; в — схема
строения ММК I — внешняя мггоховдр^одъная мембрана, 2 — внутренняя
сцттохсндрслиад м парада, 3 — матрикс генточакорни, 4 — мАзвпибраазое
пространство. 5— межмктахоядр <ал«1ыи контакт
Рис, 17. Мышечное веретено крысы К с. 37
б, в — мышечные веретена крысы (микрофотографии): 1 — спиральные аффе
рентные волокна, 2 — ядре мышечных иятрафузвльных волокон. Серебрение
по Гросс—Бильшовскому
Рис. 21. Онтогенез гкжеречнолслсслтогс мышечного волокна. К г 42.
б — развитие гктерсчнстихтосатой ссжотпрдесксЛ м^с^лспуры у крысы, 1£-е
сутки эмбриогенеза Видны мышечные трубочки Окрасжа гематоксилином и
эозином, в — развитие ntmrpevxonojwcaTCft мускулатуры языка эмбриона СВИ
НЬИ. Видно гкиоалЕние поперечно нсчсрчс—ъгх миофибрилл в миобластах и
в косжмпластах Окраска ♦хлсятесм гемато) лином по Гейпокгайну, г — мио-
симпдасты в первичней культуре лстюрсчнснтолосатой муадщзтуры 10-днсвно-
го куриного эмбрюка. Окраска гематокьоллном Карачки
Рис. 19. Гистогенез и диффе-
ренцировка скеостной мускула-
туры К с. 41
б — микрофотография. Закладка мс-
зодермы у куриного эмбриона.
Видим эпителиоидные клетки (укз
заны стрелкой) миотома. Окраска
геиатоксттоояяи и эозином
Рис. 24. Регенерация пссеречнополослтой мускулатуры (микрофото
Е И Максименко) К с. 47
в, б—деструктивные и некрсгпсческие изменения мышечных волокон, сохра-
нившихся после травмы. Окраска гематоксилином и эозином.
Рис. 25. Атрофия поперечнопо-
лосатых мышечных волокон че-
ловека (указано стрелками) ОК'
раска гематоксилином и эози
ном. К с. 50.
Рнс. 22. С трисгенез I и И генерации (а) и взаимсрйсположгиис
элементов формирл/ющихся волокон (б) К с. 42.
1 — клетки | генерация^ 2 — клетки II генерации, 3 — мж?сателлягы| 4 — нерв
ныс терминали, 5 — схединтггЕтьная ткань.
Рис. 26. Поперечный срез соматической мускулатуры низших позво-
ночных. К с. 5!
а б — миноги. Видны “мышечные коробочки”, поверхность которых состоит
из криснъсс (1), & внутренняя часть — из белых (2) мышечных волокон. Окраска
голятс*хждитжм н эозином.
Рис. 32. Поперечный срез дожде-
вого червя Видна часть кожно-
мускульного мешка с поперечно
срезанными септами, с обеих сто-
рон которых расповагаютси мы-
шечные клетки, также срезанные
поперечно наподобие перьев (I)
Орлжа гематоксилином и эози-
ном К с. 58.
Рис. 34. Мышечные клетки пи-
явки, поперечный срез. Сократи-
мые элементы в виде радиально
расположенных згмоноокрашен-
ных полосок окружают со всех
сторон светлую трофическую
часть с ядром Окраска желез-
ным гематоксилином по Гейден-
гайну К с 59.
Рис. 50. Клетки Пуркинье сердца быка, А с. 82.
я» б — мпкрофтпхрйфии при разном увеличении Вианы свстлос»^раше«нал
цитоплазма, крупные светлые ядра, часто на одну клетку приходится по два к
более ядер Окраска гематоксилином и эихигсом
Рис. S3. Кардистлиоциты эмбриона крысы,
|5-е сутки онтогенеза Начало формирова-
ния мьофибрилл и многочисленные мито-
зы в этих клетках (указаны стрелками) Ок-
раска кармином К с. 89.
сердечная брыжейка
Рис. 51- Стадии (I—III) развития сердиа человека (схема). К с £5.
Рис. 54. Сердечная мускулатур3 эмбриона крысы, 17-е сутки онтоге-
неза. Видны трабекулы сердца, покрытые плоскими эндотелиальными
клетками эндокарда (1), удлиненные играиомиоциты (2) и их митозы
(3). Окраска гсмйгоксмяином и эозином К с. 89.
Рис. 56. Гигкрконтрекц1Ия кардиомисщнтов крысы после эксперимен-
тального инфаркта миокарда Видны извитые тяжи кадиомиоципж
(а, указаны стрелкой) и распадаюсцнеся фрагменты сверхсскращсн-
ных клеток (б, в, указано стрелками). Окраска фосфорно-вольфрамо-
вым гематоксилином (препараты Г Б Большаковой) К с. 95.
Рис. 55. Коатуляционный (ценке-
ровский) некроз (показано стрел-
ками) кардиомипиигов крысы
после Э1хперичгнтального ин-
фаркта миокарда. Окраска гема-
токсилином и эозином (пре-
парат Г Б.БольшакоиоЙ}. К с. 95.
Рнс. 57, Поперечный срез кар-
диомноцитов человека после
инфаркта миокатда. Видны раз-
волокнение ьпюфмбрилл и ваку-
ольная дистрофия. Окраска ге-
матоксилином и эозином (пре-
парат Г Б.Большаковой). К с. 95.
Рис. 58. Гипертрофия кг^щиоыиовдтов (указано стрелками) после
aKOKt^McHTaraiHDro инфаркта миокарда у крысы (препараты Г Б Боль-
шаковой) Окраска гематоксилином и эозином. К с 96.
в — продетый, й срез, б — поперечный срез.
Рис, 59, Отасженме тилофусцина в кар-
диомиоцитах человека после инфаркта
миокарда. Застой эритроцитов в капилля-
рах (1) Между кардиомиоцитами — мн
фильтрация лейкоцитами (2), в том числе
макрофагами, наполненными фагоцити-
рованным чилофушином Окраска гемато
ксилином и эозином (препарат Г Б.Боль-
шаковой) К с, 96.
Рис. 68. Гипотезы строения цитоскелета чейоыисцита К с 109.
а. I — нЕсс*фащенная клетка. II — сокращенная клетка. Сократимые филамен-
ты (1) закрепляются одним концам на шюзмолсаше, а другим — на несокра-
тимых (1<>сыелуточиьоо филаментах (2) через плотные тельца (3) цитоплазмы
(по Б Албертсу и др., с изменения <н)
Рис. 70. Гладкая мускулатура кат-
ки кошки Видны продолговатые
миоциты и митозы (указаны
стрелками) в них. Окраска гема-
токсилином и эозином, к с. 109.
Рве. 71, Гладкая мускулвзура мо-
чевого пузыря кошки Видны
пучки гладкомышечных клеток (1)
и прослойки соединительной тка-
ни (2). Окраска пз^акжег-отином
и эозином. К с. 109.
Рис. 72. Мышечные клетки -ра-
дужки (мионейралъиая мускула-
тура) с пигментными включе-
ниями (указаны стрелками) Ок-
раска ГСМатоКСИЛИНОМ и эози-
ном К с 109.
Рис. 73. Мышечные волокна,
поднимающие волосы, в коже
лошади (дермальная мускула-
тура) К с. 109.
а — малое увеличение Видны корни волос (1), направленные к ним мышечные
волокна (2) и коллагеновые фибриллы (3); 6 — большое увеличение. В мышеч-
ных волокнах просматривается поперечная гл^^сшюсть, Окраска гематокси-
лином и эозином. (У человека и более- мелких кигмпитжацих мышца, под-
нимающая волосы, относится к гладкой мускулстуре }
2^--------------------------------------Астмновый <}мтамрн»
-----------Миозии
>>> У 5 Л } У У)1 ---Акгикзеьм филамент
б
Рис. 75. Миофяладснты лейомиоцита. К с. 109.
6 — схема, показывающая, как бшкммретые агрегаты молекул немьшжчного
миозина вызывают жмажеине двух иоинсяых филаменте® ГфотявогтоЛоЖИсЛ
полярности (по Б Албертсу и др ).
Рис. 79- Поперечный срез ки-
шечника акссэшлн Видны про-
дольно респопожеиные чейомио-
циты с прОДПЛГОВЭТЫМИ дирами
и соединительнотканные про-
слойки между клетками (окраше-
ны в синий цвет). Окраска по
методу Мллюрн к с. 134.
Рио. 121- Строение изолированного кальмодулина (а) и его комплекса
с фрагментов киназы легкой цепи миозина (6) Две полусферы изо-
бражают N- и С-конисвые глобулярные домены ^чьмодттганл, соеди-
ненные центральной а-спиралью Глорофосные участки обозначены
сиреневым цветом При взаимопеАстеии с киназой легких цепей мио-
зина центральная спираль кальмодулина плавится и две гюталинки
молекулы кальмодулина обхватывают амфифильную спираль белка-
мишени [Kretsiiiger R., 1992]. К с. 212.
Рве. 10L Ленточная модель моторной части (головки) миозина ске-
тстных мышц курицы На модели указаны номера аминокислотных
остатков тяжелой цепи миозина. Номера аминежислотных остатков
реггипторной легкой цепи миозина (RLC1 начинаются с 2000, а но-
мера щелечной легкой цепи миозина (ELC) — с 3000 Центры связы-
вания АТР и актина пространственно удалены друг от друга. Ясно
видна щель, раздедикнцтя дес гю’ювины акп^сшоывающсгр центра
[Ravment I el al, 1993| К с 186
79,
Рне. 1 [fi. Строение двух Са2+-связываютих центров пареалъбумнна
Показан ход полипслтцдной цепи с обозначением номеров нминокмс-
лотных остатков Стрелками с буквами оатннского алфавита обозна-
чены а-спиральные участки. Два октаэдра в центре петель иэсбралают
координационные сферы ионов Са2* [Пермяков ЕЛ,, 1993 [ К с. 210
Рис. 119. Строение Са^-связывагащих петель.
а— двухмерное изображение Са2+-свяЕьгеак>шей петли. Показаны две п-спи-
рали, сараничиваюшме петлю с N- к С-КФНДа. Обозначены остатки (1, 3,5, 7,
9 и 123 WJtocpcuJcrecHHo вошечденмс в Сгялшанвс кальция; б — упрощенная
лрос^ нстве» _ я структ’-т С£г4’-с;- ывающей петли Жирмыьж линиями
выде.._.» код 1.„;«пепткД| — цели. Б,.иами латинского алфавита обозначены
вершили октаэдра, б которых расподэгикхмя тхвзшныс аигшокветотныс ос-
татки К с 210.
Рис. 37. Поп речиый срез летательной мышцы стрекозы (а) и отдель-
ной ммофкбриллы (6). Миофибриллы (светлые) располагаются ради-
ально, между ними — митохондрии (темные) (по Д.С5мигу). Ув. 10 000
(а) и 50 000 (б)
Второй тип — это крыловые мышцы прямокрылых и чешуе
крылых (плотттдковакные, или мшфо^шбрыяярныс мышцы)
Миофибриллы в них расположены тесно и на поперечных
срезах имеют полигональную форму. Д лина саркомера 3—4 мкм.
На долю области дисков I приходится J5—28 % от длины
саркомера Амплитуда сокращения в таких волокнах значи-
тельно меньше, чем у таковых I типа.
В крыловых мышцах прямокрылых и чешуекрылых, отно-
сящихся к смиренным, в области контакта толстых и тонких
филаментов находятся диады, а СР имеет вид пузырьков Ко-
бб
Рис. 38. Поперечный (а) и продольный (б) срезы миофибрилл (по
ДСмиту).
1 — миофибрилла поперечнополосатого волокна позвоночного; 2 — миофиб-
рилла синхронной мышцы насекомого; 3 — миофибрилла асинхронной мыш-
цы насекомого.
2
3
личество тонких филаментов, ориентированных во1фуг толс-
тых, может быть разным (см. рис. 39, 40, 42). В синхронной
мышце стрекозы в отличие от других синхронных мышц мио-
фибриллы располагаются радиально (см. рис. 37), что харак-
терно для миофибрилл туловища и ног других насекомых.
Синхронными эти мышцы называются потому, что сокраще-
ния наступают в ответ на импульсы той же частоты.
К типу III относятся наиболее быстрые мышцы перепонча-
токрылых, жесткокрылых и двукрылых насекомых, обслужива-
66
Рис. 39. Электронные микрофотографии поперечных срезов миофиб-
рилл человека (а) и пчелы (б). У позвоночных тонкие филаменты рас-
полагаются в центре мнимого треугольника, образованного толстыми
филаментами, а у насекомых (в летательной мускулатуре) тонкие фи-
ламенты находятся между двумя толстыми нитями (фото J. Auber).
ющих звуковой и крыловой аппараты. Миофибриллы у них
очень крупные, четко отграниченные друг от друга (фибрилляр-
ные мышцы). Диаметр мышечных волокон 100—1800 мкм. Час-
тота взмаха крыла у разных насекомых различна: у саранчи —
16—20 циклов в секунду, у шмеля и мухи — 200—300 циклов, а
у комара — 600—800 циклов в секунду. У двукрылых и перепо-
нчатокрылых эти мышцы относятся к асинхронным. Число со-
кращений у них за единицу времени в несколько раз превышает
число потенциалов действия, регистрируемых в моторных нервах.
В быстрых асинхронных мышцах перепончатокрылых, жест-
кокрылых и двукрылых насекомых, находящихся в основании
крыльев, и в звуковом аппарате цикад между миофибриллами
находятся ядра и трахейные трубочки. Вокруг одной толстой
нити располагается шесть тонких (см. рис. 39, 42). Саркомеры
короткие, с хорошо выраженной полосой Н. Длина диска А
(у продольной крыловой мышцы шмеля) 2,3 мкм, а диска I
значительно меньше и меньше, чем во всех других мышцах
(см. рис. 42), — всего 0,7 % от длины саркомера. Этот диск
можно видеть только на специально растянутых мышцах. На
рис. 38 не изображены линии М между миозиновыми прото-
67
Рис. 40. Электронные микрофотографии. Поперечный срез летатель-
ной мышцы Vanessa (а) и терготрохантеральной мышцы Calliphora (б).
Число тонких филаментов вокруг каждого толстого достигает 7—12
(фото N. Garamvolgyi).
фибриллами, видимые на электронных микрофотографиях. Ли-
нии М создают препятствие движению актиновых нитей, пред-
отвращая двойное перекрывание тонких нитей, что наблюда-
ется в саркомерах позвоночных. Это способствует более жест-
кой конструкции саркомера, что важно для осуществления
высокочастотных осцилляций фибриллярных мышц [Мандель-
штам Ю.Е., 1968, 1983], при которых сокращения происходят
без заметного изменения длины саркомера (всего на 2 %). На
один импульс эти волокна дают около 300 сокращений в се-
кунду. Максимальная сила сокращения мала и составляет
0,3 кг/см в отличие от других мышц с силой сокращения около
5 кг/см. СР в асинхронных мышцах не выражен. Концы мио-
зиновых нитей связаны с линиями Z тонкими нитями, а Т-ка-
налы развиты слабо. Митохондрии в этих волокнах у некото-
рых насекомых достигают гигантских размеров. Контакт акти-
новых и миозиновых филаментов имеет большую протяжен-
ность, причем актиновые нити короче миозиновых.
Все мышцы насекомых, как и других беспозвоночных, сход-
ны по иннервации с медленными мышцами позвоночных, так
как имеют по нескольку нервных окончаний в каждом мышеч-
66
Рис. 41. Электронная микрофотография. Летательная мышца мухи.
Видны широкие диски А и узкие диски I. Между миофибриллами —
разнообразные по величине и форме митохондрии. Ув. 20 500 (фото
К.Писцова).
ном волокне. При этом мышцы обладают полинейрональной
иннервацией, т.е. иннервируются несколькими двигательными
аксонами.
На медленных ножных мышцах тараканов обнаружены два типа
двигательных нервных волокон (быстрые и медленные аксоны).
Продольные мышцы крыльев получают только быструю иннер-
вацию. Для мышц насекомых, как и ракообразных, характерно
наличие тормозной иннервации. В пресинаптической области
терминалей наблюдаются синаптические пузырьки диаметром
30—50 нм. Постсинаптическая мембрана ровнвя, лишена склад-
чатости; такая мембрана характерна для позвоночных.
69
Рис. 42. Электронная микрофотография. Крыловая мышца шмеля;
поперечный срез (фото Ю.Е.Мавдельштама).
МФ — миофибриллы; Я — ядро; Тр—трахейные разветвления внутри мышеч-
ного волокна.
У насекомых гемолимфа не содержит дыхательных пигмен-
тов и кислород диффундирует через трахейные трубочки и их
разветвления к внутренним органам, в том числе к мышцам.
Поэтому в мышечных волокнах видны вдавления трахейных
веточек, которые, однако, остаются отделенными от мышеч-
ных волокон плазмолеммой (см. рис. 42). Эти трахейные ве-
точки представляют собой некий аналог Т-системы по морфо-
логии, но не идентичны по функции.
У ракообразных в мышечных многоядерных волокнах мио-
фибриллы крупные, неправильной формы. Вокруг одной тол-
стой нити располагается 8—10 тонких. СР образует диады.
В волокнах хорошо развит цитоскелет. В мышцах взрослых
крабов ядра в мышечных волокнах не выявляются. У мелких
крабов ядра обнаруживаются (рис. 43).
Ракообразным, как и насекомым, свойственна полинейрон-
ность, при которой одно мышечное волокно может получать
нервные влияния от нескольких нейронов. Для них также
характерна политерминальность: на одном волокне образуется
несколько синаптических окончаний каждого аксона. Иннер-
вация мышц у ракообразных, как и у других членистоногих,
кроме того, имеет полифункциональный характер, так как воз-
70
Рис. 43. Поперечнополосатая мускулатура краба на разных стадиях
сокращения. Окраска железным гематоксилином по Гсйдснгайну.
Ув. 900.
буждающие нервы делятся на “быстрые” и “медленные”. Су-
ществует и тормозная иннервация, также полинейронная и
политерминальная. При этом тормозящие нервы образуют си-
наптические контакты не только с мышечными волокнами, но
и с возбуждающими аксонами. Нервно-мышечные синапсы
членистоногих отличаются своей изолированностью от окру-
жающих тканей, будучи пшруженными в мышечные волокна
и замурованными специальными клетками, вероятно, глиаль-
ной природы. Возбуждающим медиатором в мышцах членис-
тоногих является не ацетилхолин, а глутамат, а тормозным —
ГАМК [Магазаник Л.Г., 1979].
Длина саркомеров у членистоногих сильно различается в раз-
ных мышцах — от 0,5 до 15 мкм, изменчивы соотношение и
расположение тонких нитей по отношению к толстым. В наи-
более быстрых волокнах это соотношение равно 3:1 (у позво-
ночных 2:1), но встречается и соотношение 5:1; 6:1; 10—12:1
(см. рис. 39, 40, 42). Варьирует и строение Z- и М-полосок.
Соматические поперечнополосатые мышечные ткани изменя-
лись в процессе эволюции высших первичноротых (членистоногих)
независимо от соматических мышечных тканей позвоночных, од-
нако в их организации много общего. Основной единицей поперечно-
полосатых тканей членистоногих является поперечнополосатое
многоядерное мышечное волокно, возникающее путем слияния в он-
тогенезе одноядерных клеток. У ряда представителей членисто-
ногих обнаружен класс сателлитов, играющих камбиальную роль.
71
Как отмечает А.А.Заварзин (1985), в основе сократительного
аппарата членистоногих лежат те же структуры, что и у позво-
ночных, но в отличие от последних у членистоногих в толстых
филаментах встречается окало 1 % парамиозина (см. рис. 42).
ВТОРИЧНОРОТЫЕ
(ИГЛОКОЖИЕ И НИЗШИЕ ХОРДОВЫЕ)
У иглокожих мышечная ткань строится из гладкомышечных
клеток. Так, у морских ежей мышцы жевательного аппарата
(аристотелев фонарь) представляют собой длинные гладкие
одноядерные клетки. Мышцы, двигающие иглы и амбулакраль-
ные ножки, также состоят из гладкомышечных клеток, содер-
жащих тонкие и толстые миофиламенты. У морских звезд
гладкая мускулатура описана в амбулакральных ножках и стен-
ке тела. У голотурий стенки тела содержат мощные продольные
ленты из гладкомышечных одноядерных клеток с прослойками
соединительной ткани между ними. Длина одиночной клетки
(мышечного волокна) достигает 240—550 мкм, а поперечник —
2,6—6,0 мкм. Эти клетки связаны отростками с другими мы-
шечными клетками, соединительной тканью и нервными тер-
миналями. Толстые филаменты в таких клетках имеют попере-
чник 20—50 нм, а тонкие — 7 нм. Толстая нить окружена
10—12 тонкими, в толстые филаменты входит парамиозин.
У оболочников имеется как гладкая, так и поперечнополо-
сатая соматическая мускулатура. У личинок оболочников по
бокам хорды, расположенной в хвосте, находятся мышечные
клетки, содержащие поперечнополосатые миофибриллы. У ап-
пендикулярий хвост с хордой сохраняется в течение всей жиз-
ни и мышечные поперечнополосатые клетки напоминают сер-
дечные миоциты. У взрослых сидячих форм (асцидии) вокруг
всего тела располагаются гладкие мышечные клетки.
У бесчерепных (ланцетник) мышечные волокна соматичес-
кого типа представляют собой пластинки толщиной около 1 мкм
и шириной до 100 мкм, содержащие по одной миофибрилле с
поперечной исчерченностью. Узкие мышечные пластинки бо-
гаты саркоплазмой, митохондриями и содержат включения
гликогена. Кроме узких пластинок, в мышце имеются и более
широкие, расположенные в глубине (рис. 44). Тонкими цито-
плазматическими отростками мышечные волокна контактиру-
ют со спинным мозгом, образуя моторные концевые пластинки
с отростками мотонейронов.
Мышечная ткань функционально неотделима от нервной и
представляет с ней единый нервно-мышечный аппарат, в кото-
ром осуществляются наиболее важные механизмы возбуждения,
проведения и сокращения. Этот аппарат формировался на ранних
этапах филогенеза многоклеточных. Дальнейшее совершенствова-
ние проходило на основе все тех же элементарных структур,
72
1
Рис. 44. Строение мышечных пластинок ланцетника и их связи со
спинным мозгом (по Флуду, с изменениями).
1 — поверхностные, богатые саркоплазмой мышечные пластинки; 2 — бедные
саркоплазмой глубокие мышечные пластинки; 3 — промежуточные пластинки
и их саркоплазматические отростки (4), идущие к дорсальному (5) и вентраль-
ному (6) отделам центральной моторной концевой пластинки и поверхности
спинного мозга; 7 — миосепта; 8 — ядро; 9 — митохондрии.
которые обнаруживаются у самых низкоорганизованных совре-
менных животных. Основные структуры сложились настолько
хорошо, что не претерпели существенных изменений в течение
всей эволюции животных. Прогресс заключался в совершенство-
вании скорости сокращения и проведения возбуждения. Развитие,
вероятно, шло не прямолинейно и зависело от условий двигатель-
ной деятельности животных, конкретного назначения мышечного
прибора и филогенетических отношений [Наследов Г.Н., 1974].
Глава 3
СЕРДЕЧНАЯ (ИСЧЕРЧЕННАЯ)
МЫШЕЧНАЯ ТКАНЬ
Сердечная мышечная ткань имеет клеточное строение, по-
перечную исчерченность и обладает спонтанным ритмическим
сокращением. У высших позвоночных различают сердечные
73
Рис. 45. Кардиомиоциты сердца лошади. Видна поперечная исчер-
ценность миофибрилл. Окраска железным гематоксилином по Гей-
денгайну.
1 — центрально расположенные ядра; 2 — “вставочные диски”.
миоциты (кардиомиоциты, КМЦ, миокардиоциты) желудочков
и предсердий, которые называют типичными, или “рабочими”
миоцитами, и атипичные сердечные миоциты проводящей сис-
темы, выявляемые хорошо у крупных взрослых млекопитаю-
щих (рис. 45, 46).
РАБОЧИЕ КАРДИОМИОЦИТЫ
Миоциты желудочков. Рассмотрим в качестве примера па-
пиллярную мышцу сердца кошки. Рабочие миоциты желудоч-
ков кошки детально изучены П.П.Румянцевым (1982). В этих
клетках отчетливо не выявляется отдельных миофибрилл, и
они относятся к Feldmuskulatur, т.е. содержат сплошную массу
миофиламентов. Последние располагаются гексагонально, так
что каждая толстая нить окружена шестью тонкими. В линиях
Z гексагональное расположение миофиламентов заменяется на
тетрагональное, как в соматической мускулатуре. Тонкие нити
не сразу переходят в линии Z. Между актиновыми филамен-
тами и Z-нитями располагаются “аксиальные” (осевые) нити
длиной 38 нм, что соответствует длине молекулы тропомиози-
на. Диаметр аксиальных нитей 8,5 нм, а не 6 нм, как у актина.
Таким образом, предполагают, что аксиальные структуры ли-
нии Z главным образом содержат тропомиозин, но, кроме того,
в Z-полосках найдены а-актинин, десмин, виментин и филямин
(подробности изложены в соответствующей главе). Возможно,
74
Рис. 46. Строение сердечной мышечной ткани.
а — объемная схема строения сердечной (рабочей) мускулатуры: 1 — кардио-
миоциты, 2 — микрокапилляры, 3 — эндомизий, 4 — митохондрии, 5 — “вста-
вочные диски” (по R.Krstic).
75
76
что соединительные Z-нити замыкаются сами на себя или
связывают аксиальные нити соседних саркомеров. Как и в
скелетной мускулатуре, линии Z оплетаются промежуточными
филаментами, проходящими в межфибриллярном пространст-
ве и скрепляющими группы миофиламентов между собой. На
уровне Z-полосок описаны еще лептомерные структуры (зебра-
тельца, или костомеры), находящиеся с внутренней стороны
сарколеммы. Они располагаются перпендикулярно по отноше-
нию к миофибриллам. Эти образования имеют поперечную
исчерченность с периодом 0,16 мкм и, возможно, являются
аналогами корневых нитей ресничек. Миофиламенты кардио-
миоцитов имеют принципиально ту же ультраструктуру, что и
миофиламенты соматической поперечнополосатой мускулату-
ры. СР кардиомиоцитов желудочков развит слабее, чем в ске-
летной мускулатуре (рис. 47). Вместе с Т-каналами цистерны
СР образуют преимущественно диады, а не триады. Мембраны
СР содержат в своем составе Са2+-активируемую транспорт-
ную АТРазу, обеспечивающую накопление ионов Са*+ внутри
цистерн СР. При релаксации миофиламентов ион Са2+ всасы-
вается в СР, достигая по его каналам терминальных цистерн.
В цитоплазме кардиомиоцитов всегда много митохондрий,
не образующих ветвящихся структур, как в скелетных мышцах.
Они связываются между собой специализированными межми-
тохоцдриальными контактами (ММК), объединяющими мито-
хондрии в единый функциональный комплекс [Бакеева Л.Е.,
Ченцов Ю.С., 1980[. Многочисленные ММК объединяют ми-
тохондрии в небольшие группы — кластеры, которые в свою
очередь при помощи ММК могут соединяться между собой.
ММК организуют в единую цепь потенциалы одиночных ми-
тохондрий, создавая единую энергетическую систему. Установ-
лено, что ММК являются обязательными структурами кардио-
миоцитов всех позвоночных, а также встречаются у некоторых
насекомых и моллюсков. Эти данные свидетельствуют о чрез-
вычайно важной биологической роли ММК, характерных для
митохондрий интенсивно и постоянно работающих клеток
сердца. Количество этих контактов возрастает при повышен-
ной нагрузке на сердце и уменьшается при ограничении по-
движности организма [Ченцов Ю.С., 1997].
Митохондрии в кардиомиоцитах можно разделить на три
субпопуляции — субсарколеммальную, межфибриллярную и
Рис. 46. Продолжение.
б — электронная микрофотография фрагмента кардиомиоцита крысы. Видны
три субпопуляции митохондрий: 1 — околоядерная, 2 — субплаэмолеммальная,
3 — межфибриллярная. Ув. 16 000 (фото М.В.Шорниковой); в — митохондриаль-
ная система кардиомиоцитов: ММК — межмитохондриальиыс контакты, Ф —
миофибриллы (схема Ю.С.Ченцова).
77
Рис. 47. Строение кардиомиоцитов сердца млекопитающего [Румян-
цев П.П., 1982].
а —фрагмент желудочкового миоцита с малым увеличением электронного
микроскопа; б, в — участки при большом увеличении электронного микроско-
па; г — кардиомиоцит предсердия с секреторными гранулами (СГ); Д — дес-
мосомы; Щ — шслсвые соединения (нексусы); fe — fasciae adherens (промежу-
точные контакты), обеспечивающие связывание конечных саркомеров сосед-
них клеток между собой; Т — каналы Т-системы; СР — саркоплазматический
ретикулум; Z — полоска Z; ТЦ — терминальные цистерны; ТР — триады.
околоядерную [Шорникова М.В. и др., 1994—1998]. В субсар-
колеммалыюй субпопуляции митохондрий у крыс большая часть
их неправильно-округлой формы и образует небольшие скоп-
ления под сарколеммой, названные “почками”. Последние
располагаются в местах наибольшего сближения кардиомиоци-
та с капиллярами. Как правило, количество таких скоплений
на продольном срезе одного кардиомиоцита не более 2—4.
Ббльшая часть митохондрий межфибриллярной зоны клеток
имеет цилиндрическую или овальную форму. Они ориентиро-
ваны вдоль продольной оси клетки и располагаются между
миофибриллами. Третья субпопуляция митохондрий, около-
ядерная, находится у полюсов ядер и образует скопления. При
тесном соприкосновении митохондрий, как правило, обнару-
живаются ММК (см. рис. 46, б).
Сарколемма кардиомиоцита включает в себя базальную
мембрану (гликокаликс толщиной 20—60 нм) и плазмо-
лемму. Со стороны цитоплазмы к сарколемме присоединяют-
ся тонкие филаменты цитоскелета, а с внешней стороны —
коллагеновые и эластические волокна, а также ряд других
внеклеточных белков.
Т-каналы желудочковых миоцитов диаметром 150—200 нм,
тогда как в скелетной мускулатуре — всего 40 нм. Они, веро-
ятно, имеют характер не трубок, а глубоких поперечных скла-
док на уровне линий Z, их продольных ветвей и анастомозов
вблизи дисков А (см. рис. 47). Таким образом, Т-система
развита в этих клетках значительно сильнее, чем в скелетной
мускулатуре. Объем Т-системы в желудочковых миоцитах со-
ставляет 27—36 % от объема цитоплазмы, в то время как в
скелетной мускулатуре всего 0,3 %. По каналам Т-системы у
кардиомиоцитов не только распространяется импульс, но и
поступают в клетку метаболиты.
Специализированными структурами кардиомиоцитов являют-
ся “вставочные диски", которые представляют собой комплекс,
состоящий из промежуточных соединений (fascia adherens), не-
ксусов {щелевые контакты) и десмосом (рис. 48; см. рис. 45—
47). “Вставочные диски" всегда находятся на уровне линий Z.
Они содержат плотный материал, в котором много липидов и
ряд белков, в том числе а-актин ин, виментин, спектрин,
винкулин, десмин, коннектин и др.
Десмосомы имеют обычное строение: их поперечник 400 нм,
а толщина около 20 нм. Нексусы располагаются преимущест-
венно вдоль продольной оси клетки. В этих образованиях мем-
браны контактирующих клеток сближаются на расстояние 2 нм
и образуют многочисленные коннексоны диаметром 7 нм, от-
стоящие друг от друга на 10 нм. Гидрофильный канал в них
диаметром 1 нм. Через него распространяется нервный им-
пульс и происходит обмен метаболитами между соседними
миоцитами. Промежуточные соединения, или полоски слипания
79
Рис. 48. “Вставочные диски” кардиомиоцитов.
а — объемная модель фрагментов двух кардиомиоцитов на уровне вставочного
диска. Видны пальцевидные выросты соседних клеток, которые на срезе ими-
тируют ступенчатый рисунок “вставочного диска” (по Ф.Шестранду и Е.Ан-
дерсону).
(fascia adherens), представляют собой уплотненные участки
плазмолемм контактирующих клеток. Они связывают конеч-
ные саркомеры соседних миоцитов. Вставочные диски соеди-
няют друг с другом продольно лежащие миоциты с образова-
нием тяжей или волокон. Часто плотные вставочные диски
имеют ступенчатый вад (см. рис. 47, 48).
Миоциты предсердий. У взрослых млекопитающих рабочие
миоциты предсердий в отличие от желудочковых содержат
секреторные гранулы. На примере предсердных кардиомиоци-
тов 1фыс П.П.Румянцевым была показана их способность к
митозу. Эти миоциты мельче, чем желудочковые, и часто име-
ют отростки. Миофибриллярных элементов в них меньше на
80
Рис. 48. Продолжение.
б — электронная микрофотография. Фрагменты двух кардиомиоцитов: 1 —
миофибриллы; 2 — митохондрии; 3 — Т-каналы Т-системы; 4 — канальцы сар-
коплазматического ретикулума; 5 — “вставочный диск”; 6 — нексус.
40 %, и реже наблюдаются лестничные структуры во вставоч-
ных дисках. Гранулярный эндоплазматический ретикулум (ГЭР)
и аппарат (комплекс) Гольджи развиты в этих клетках сильнее,
чем в желудочковых миоцитах. Характерно, что Т-система в
них почти совсем не развита, а если и присутствует, то каналы
идут вдоль, а не поперек продольной оси клетки.
В предсердных миоцитах находится пептидный гормон, со-
стоящий из 126 аминокислотных остатков и называемый кар-
диодилатином. Его производное — циркулирующий в крови
пептид, состоящий из 28 аминокислотных остатков (кардио-
натрин, или предсердный натрийуретический пептид — ПНУП),
вызывает сокращение гладких мышечных клеток артериол, уве-
личивает почечный кровоток, ускоряет клубочковую фильтра-
цию и выделение натрия [Форсман, 1986]. Секреторные гра-
нулы расположены главным образом в миоцитах передней
стенки правого предсердия и в ушках сердца. Диаметр гранул
около 2 мкм, плотность их различна. Возможно, что в пред-
сердных миоцитах синтезируются также ренин, регулирующий
тонус сосудов сердца, и ангиотензиноген. В предсердиях крыс
была выявлена энкефалинимертаза, регулирующая синтез эн-
кефалина и других нейропептидов.
81
Миоциты проводящей системы сердца. К проводящей систе-
ме относятся синусно-предсердный, предсердно-желудочко-
вый узлы, предсердно-желудочковый пучок (пучок Гисса), его
ножки и концевые разветвления последних, образованные
клетками Пуркинье (рис. 49, 50, а, б — см. вклейку). У грызу-
нов отличия клеток проводящей системы от рабочих миоцитов
выражены не сильно. У человека и особенно у крупных мле-
копитающих клетки проводящей системы разительно отлича-
ются по размерам и структуре от рабочих миоцитов.
Синусно-предсердный (синусный) узел содержит “ведущие”,
пейсмекерные клетки (pacemaker cells), иногда называемые
Р-клетками. Они занимают центральную часть узла, имеют
длину 20—30 мкм и ширину около 8 мкм. Эти клетки лежат
группами, бедны миофибриллами и митохондриями, почти
лишены предсердных гранул и имеют светлую цитоплазму.
Упаковка миофиламентов в составе миофибрилл бывает рых-
лой, сами миофибриллы могут ветвиться и изгибаться. Линии
Z имеют неправильную конфигурацию.
Пейсмекерным клеткам свойственна медленная диастолическая
деполяризация. Для них характерна спонтанная деполяризация с по-
стоянным переходом в фазу 0 и низким овершутом. Они генерируют
ПД. В проводящей системе преобладает анаэробный гликолиз, в сар-
коплазме много гликогена.
Другой тип клеток синусного узла, находящийся по его
периферии, называется переходным, или латентным. В таких
клетках больше миофибрилл и нексусов. В некоторых из них
есть Т-каналы. Они проводят импульс из узла к другим клеткам
предсердия.
Предсердно-желудочковый узел имеет клетки, очень похожие
на миоциты синусного узла. Оба узла обильно иннервированы
с преобладанием адренергических терминалей. Каждый мио-
цит имеет и афферентную, и эфферентную иннервацию.
Предсердно-желудочковый пучок представляет собой прямое
продолжение предсердно-желудочкового узла. Он покрыт чех-
лом из плотной соединительной ткани. Ножки пучка развет-
вляются под эндокардом, а также в толще миокарда желудоч-
ков и проникают в сосочковые мышцы.
Клетки пучка Гисса получили название “клетки Пуркинье”
У большинства млекопитающих клетки Пуркинье нерезко отли-
чаются от рабочих миоцитов желудочков. Только у копытных
отличия значительны (см. рис. 50 на вклейке). У человека и
собаки они менее резкие, а у грызунов почти не выражены.
Типичные клетки Пуркинье крупнее рабочих миоцитов: их длина
80—100 нм. Миофибриллы в них тонкие, малочисленные и рас-
положены главным образом по периферии клеток, а в центре
имеется 1—8 ядер. В цитоплазме много гликогена в виде агре-
гатов с белками — гликосом, содержащих де см о глико ген,
82
Рис. 49. Схематическое изображение ультраструктуры миоцитов раз-
личных отделов проводящей системы сердца взрослых млекопитаю-
щих (по П.П.Румянцсву и И.Л.Ерохиной).
Миоциты центральных (а) и периферических (6) зон синусно-предсердного (1)
и предсердно-желудочкового (3) узлов; в — миоцит пучка Гисса (4); г — клетка
Пуркинье сердца копытных; 2 — межузловые проводящие пути; 5 — волокна
Пуркинье. Размеры клеток даны в одном масштабе; Г —гликоген; ПФ —
промежуточные филаменты; МФК — комплексы миофиламентов.
83
Рис. 50. Клетки Пуркинье сердца быка.
в — объемная схема строения сердечно-мышечной клетки Пуркинье: А — мио-
фибрилла в продольном (1) и поперечном (2) сечениях, 3 — митохондрии,
4 — гликоген, 5 — сарколемма, 6 — сеть соединительнотканных волоконец,
7 —рабочая мускулатура, 8 —капилляр; Б — межклеточные контакты лате-
ральных участков кардиомиоцитов при большом увеличении: 1 — десмосома,
2 — нексус; В — межклеточные контакты на уровне “вставочных дисков” кар-
диомиоцитов при большом увеличении: 1 — “вставочный диск" с десмосомой,
2 — fascia adherens, 3 — нексус (по R.Krstic).
84
который резистентен к кислотам, щелочам и амилазе и нерас-
творим в воде. В клетках Пуркинье много промежуточных
филаментов, а Т-каналов почти нет. В начальных разветвлени-
ях пучка Гисса клетки Пуркинье более мелкие (длиной 20—
40 нм), чем в концевых разветвлениях, называемых волокнами
Пуркинье. Краткая характеристика кардиомиоцитов и их срав-
нение со скелетной мускулатурой представлены в табл. 3.
Пресинаптический аппарат в кардиомиоиитах синапсов в
целом имеет те же характеристики, что и в соматической
мускулатуре, но варикозные расширения нервов, подходящих
к миоцитам, могут отстоять от них на расстоянии от 30 нм до
нескольких микрометров. В связи с этим невозможно выделить
в миокардиоцитах локальные постсинаптические структуры,
что объяснимо, поскольку эффекторные влияния здесь имеют
не пусковой, а модулирующий характер.
Миокардиальная ткань состоит из отдельных клеток, однако
в функциональном отношении представляет собой единую
систему и электротонические влияния в ней распространяются
далеко за пределы одной клетки. Например, длина клетки
Пуркинье около 150 мкм, а константа длины колонки из кле-
ток (т.е. волокна Пуркинье), объединяющей клетки функцио-
нально, — около 2 мм. Это указывает на существование между
кардиомиоцитами высокого коэффициента передачи, что
может быть объяснено наличием между клетками электричес-
ких синапсов (щелевых контактов) [Беркинблит М.Б., Чайлах-
ян Л.М., 1979]. Автоматизм сокращения связан с передачей
импульса через щелевые контакты.
РАЗВИТИЕ СЕРДЦА И КАРДИОМИОГЕНЕЗ
Закладка сердца у человека происходит в начале 3-й недели
развития (у эмбриона длиной 1,5 мм) и представлена парным
скоплением мезенхимных клеток в задней части головного отдела
эмбрионального щитка, под висцеральным листком мезодер-
мы. Далее эти скопления превращаются в две удлиненные
трубки, вдающиеся вместе с висцеральным листком мезодермы
в целомическую полость. Они выстилаются эндотелием. Затем
эти трубки сливаются, образуя эндокард. Миокард и эпикард
формируются из висцеральной мезодермы — миокардиальной
пластинки, прилежащей к эндотелиальным трубкам. Из наруж-
ной части пластинки образуется эпикард, а из внутренней —
миокард. Перикард формируется из париетального листка ме-
зодермы (рис. 51 — см. вклейку). Клапаны возникают из эндо-
карда, а также из соединительной ткани мио- и эпикарда.
Зачаток миокарда (миокардиальная пластинка) сначала имеет,
как и весь остальной спланхнотом, отчетливую клеточную
структуру, причем клетки часто митозируют. Затем митотичес-
кая активность снижается, клетки удлиняются и в них появ-
85
Таблица 3. Сравнительная характеристика соматической и сердечной мышечных тканей позвоночных животных
Признаки Соматическая поперечнополосатая мускулатура Рабочие миоциты желудочков Рабочие миоциты предсердий Пейсмекерные клетки Клетки Пуркинье
Клеточное или симпластическое строение, распо- ложение ядер Симпластическое строение, ядра по периферии во- локна (у высших позвоночных) Клеточное строе- ние, центральное расположение ядер, крупные клетки Клеточное строе- ние, центральное расположение ядер, клетки сред- него размера Клеточное строе- ние, центральное расположение ядер, клетки мел- кие Клеточное строе- ние, центральное расположение 1— 8 ядер, клетки крупные
Наличие сателли- тов Есть Нет Нет Нет Нет
Поперечнополо- сатые миофиб- риллы Фибриллы широ- кие, изолирован- ные друг от друга, в саркомерах бы- стрых волокон отчетливые ли- нии Z и М Диаметр фибрилл меньше, частые “поля”, есть ли- нии Z и М Диаметр фибрилл меньше, чем в желудочках, есть “поля” и ветвле- ние клеток Фибрилл мало, расположены рыхло, непра- вильно; они вет- вятся Мало тонких, ветвящихся мио- фибрилл
Гранулярный эн- Развиты слабо Развиты средне Развиты хорошо Развиты хорошо Развиты средне
доплазматичес-
кий ретикулум
(ГЭР) и аппарат
Гольджи
Саркоплазмати-
ческий ретикулум
Т-каналы
Развит сильно,
образует вместе
с Т-каналами
триады
Развиты хорошо,
диаметр 40 нм;
составляют 0,3 %
от объема цито-
плазмы
Развит слабо,
ориентирован
продольно, обра-
зует диады
Развиты сильно,
диаметр ISO-
ZOO нм; составля-
ют 30 % от объема
цитоплазмы
Развит слабее,
чем в желудочках,
есть “окаймлен-
ные” пузырьки
Редкие или отсут-
ствуют
Развит слабо;
контактирует
с сарколеммой
Типичных Т-ка-
налов нет, есть
инвагинации сар-
колеммы
Развит слабо;
контактирует
с сарколеммой
Почти не встре-
чаются
Гликоген
Много в красных, Много гликосом
мало в белых мы-
шечных волокнах
Есть гликосомы
Много гликосом
Много гликосом
Вставочные
диски
Нет
Гранулы кардио-
дилатина
Нет
Есть (с нексуса-
ми, щелевыми и
промежуточными
контактами)
Есть только у эм-
брионов
Есть (с нексуса-
ми, щелевыми и
промежуточными
контактами)
Есть темные и
светлые
Меньше, чем в
рабочей мускула-
туре
Почти нет
Много, могут
располагаться
косо
Почти нет
Таблица 3. Сравнительная характеристика соматической и сердечной мышечных тканей позвоночных животных
Признаки Соматическая поперечнополосатая мускулатура Рабочие миоциты желудочков Рабочие миоциты предсердий Пейсмекерные клетки Клетки Пуркинье
Клеточное или симпластическое строение, распо- ложение ядер Симпластическое строение, ядра по периферии во- локна (у высших позвоночных) Клеточное строе- ние, центральное расположение ядер, крупные клетки Клеточное строе- ние, центральное расположение ядер, клетки сред- него размера Клеточное строе- ние, центральное расположение ядер, клетки мел- кие Клеточное строе- ние, центральное расположение 1— 8 ядер, клетки крупные
Наличие сателли- тов. Есть Нет Нет Нет Нет
Поперечнополо- сатые миофиб- риллы Фибриллы широ- кие, изолирован- ные друг от друга, в саркомерах бы- стрых волокон отчетливые ли- нии Z и М Диаметр фибрилл меньше, частые “поля”, есть ли- нии Z и М Диаметр фибрилл меньше, чем в желудочках, есть “поля” и ветвле- ние клеток Фибрилл мало, расположены рыхло, непра- вильно; они вет- вятся Мало тонких, ветвящихся мио- фибрилл
Гранулярный эн- Развиты слабо Развиты средне Развиты хорошо Развиты хорошо Развиты средне
доплазматичес-
кий ретикулум
(ГЭР) и аппарат
Гольджи
Саркоплазмати-
ческий ретикулум
Т-каналы
Развит сильно,
образует вместе
с Т-каналами
триады
Развиты хорошо,
диаметр 40 нм;
составляют 0,3 %
от объема цито-
плазмы
Развит слабо,
ориентирован
продольно, обра-
зует диады
Развиты сильно,
диаметр 150—
200 нм; составля-
ют 30 % от объема
цитоплазмы
Развит слабее, Развит слабо;
чем в желудочках, контактирует
есть “окаймлен- с сарколеммой
ные” пузырьки
Редкие или отсут-
ствуют
Типичных Т-ка-
налов нет, есть
инвагинации cap
колеммы
Развит слабо;
контактирует
с сарколеммой
Почти не встре-
чаются
Гликоген
Много в красных, Много гликосом
мало в белых мы-
шечных волокнах
Есть гликосомы
Много гликосом
Много гликосом
Вставочные
диски
Нет
Гранулы кардио-
дилатина
Нет
Есть (с нексуса-
ми, щелевыми и
промежуточными
контактами)
Есть только у эм-
брионов
Есть (с нексуса-
ми, щелевыми и
промежуточными
контактами)
Есть темные и
светлые
Меньше, чем в
рабочей мускула-
туре
Много, могут
располагаться
косо
Почти нет
Почти иет
ляются миофибриллы. В парной трубчатой закладке сердца
видна клеточная структура миокардиальной пластинки. Широ-
кое пространство между эндотелиальными трубочками и мио-
кардиальной пластинкой заполняется эндокардиальным гелем.
По мнению А.Г.Кнорре (1972), слой будущего эпикарда (его
мезотелиальное покрытие) нарастает на зачаток миокарда
позднее, со стороны венозного синуса. Поэтому первичную
закладку сердца правильнее называть не миоэпикардиальной
пластинкой, как это обычно принято в эмбриологической ли-
тературе, а миокардиальной.
Источником развития сердечной мышцы служит утолщенный
участок висцерального листка спланхнотомов — миокардиальная
пластинка. Ее формированию предшествует миграция презумп-
тивных клеток сердца — миобластов. Способность к миграции
определяется субстратом, по которому передвигаются клетки.
Индукция сердечней мышечной ткани осуществляется посредст-
вом средневентральной и латеральной глоточной энтодермы, что про-
слежено на развитии аксолотля. Прекардиальная мезодерма представ-
ляет собой скопление отростчатых и веретеновидных мезенхимных
клеток В период раннего формирования сомитов начинается образо-
вание целома и спланхнической мезодермы. В мезодерме появляется
щель, отделяющая дорсальный слой (соматическая мезодерма) от вент-
рального (с пл анх ни чес кая мезодерма). Перед тем как произойдет рас-
щепление, все примордиальные сердечные клетки мигрируют в вент-
ральном направлении и образуют эпителиоморфное утолщение вент-
ральной мезодермы, которое, как отмечалось, называется миокар-
диальной (кардиальной) пластинкой. Одновременно с развитием пос-
ледней из мезодермы образуется слой, дающий начало эвдокарду, —
ангиобласт. Каудальное этот слой образует кровяные островки, даю-
щие начало эндотелию, эритробластам и плазме крови. Тяжи ангио-
бластов опустошаются с образованием узких трубок — зачатка эндо-
карда. Замыкание передней кишки на уровне сердца способствует
сближению парных эндокардиальных трубок и их слиянию в одну.
Одновременно миокардиальные клетки, обволакивая эндокард, обра-
зуют непрерывный слой. Правая и левая целомические камеры сли-
ваются, формируя перикардиальную полость. Этот процесс хорошо
изучен у птиц. У млекопитающих, возможно, перикардиальные ми-
областы развиваются in situ вследствие дифференцировки мезотели-
альных клеток.
Беспорядочное сокращение в сердце наблюдается на стадии
9 пар сомитов у куриных эмбрионов, через 9,5 сут от начала
развития. Ритмические сокращения отмечаются на стадии 15
пар сомитов у куриных эмбрионов, а у эмбрионов крыс — на
стадии 10—11 пар сомитов, на 11-е сутки развития. До стадии
5 сомитов явных признаков фибриллогенеза не обнаруживает-
ся. Появление миофибрилл регистрируется в миобластах на
стадии 7 пар сомитов (у крыс), после чего эти клетки можно
называть кардиомиоцитами. Нитчатые элементы в этих клетках
сначала распределяются хаотично, затем собираются в пучки
88
Перикардиальная мезодерма
*
Миоциты стенки сердечной трубки
Миоциты в позднем эмбриогенезе
Миоциты в постнатальном периоде
Рис. 52. Кардиомиогеиез млекопитающих [Румянцев П.П., Еро-
хина ИЛ, 1981].
(рис. 52), а клетки удлиняются (рис. 53 и 54 — см. вклейку).
Сначала одиночные примитивные миофибриллы располагают-
ся под сарколеммой, потом перемещаются в глубь клетки.
Под сарколеммой находятся также “пятна” материала ли-
ний Z и промежуточные филаменты. На ранних стадиях мио-
генеза в миофибриллах линии (или полосы) Н и М не выяв-
ляются; у миофибрилл обнаруживаются свободные концы, к
89
которым подстраиваются новые саркомеры. Происходит также
наслоение новых филаментов на поверхность уже существую-
щих миофибрилл. Концы миофибрилл в дальнейшем закреп-
ляются в fascia adherens (промежуточных, или сцепляющих,
соединениях). На поздних стадиях развития появляются нексу-
сы, гладкая эндоплазматическая (саркоплазматическая) сеть
(СР) и Т-система.
Таким образом, миофибриллогенез скелетной и сердечной
мускулатуры сходен. В желудочковых миоцитах трубчатого
сердца происходит активация секреции кардиогеля, что сопро-
вождается развитием ГЭР и аппарата Гольджи. Кардиогель
содержит гликопротеиды и протеогликаны, которые распола-
гаются главным образом между миокардом и эндокардом.
На стадии 4—12 сомитов в развивающемся сердце человека
в кардиомиоцитах появляются миофибриллы. Сначала специ-
фические соединения между миоцитами отсутствуют и клетки
ведут себя как когезивный пласт. Вскоре образуются апикаль-
ные комплексы, которые развиваются во вставочные диски.
Примерно в возрасте 22 дней начинаются синхронизированные
сокращения мышечных клеток, причем электрическая связь
осуществляется через нексусы.
Формирование базальной мембраны начинается еще в пе-
риод образования прекардиальной мезодермы, но сначала она
имеет прерывистый характер. У крыс на 15-е сутки эмбриоге-
неза количество нексусов увеличивается, их протяженность
возрастает в 2—3 раза. Десмосомы появляются в миоцитах уже
на стадии трубчатого сердца, когда между мембранами сосед-
них клеток обнаруживается электронно-плотное вещество.
Промежуточные соединения всегда появляются на уровне
линий Z и бывают обогащены электронно-плотным вещест-
вом. Относительное содержание микротрубочек и промежуточ-
ных филаментов уменьшается в ходе дифференцировки, но при
этом возрастает число нитей, состоящих из скелетика и дес-
мина. Десмин участвует и в образовании линий Z.
Дифференцировка кардиомиоцитов предсердий отличается
от рассмотренного процесса, происходящего в онтогенезе же-
лудочковых миоцитов. Эти миоциты начинают дифференци-
роваться позднее желудочковых, сокращаются быстрее, и ПД
у них вдвое короче; быстрее идет и реполяризация. Фибрил-
логенез в предсердных миоцитах начинается позднее, чем в
желудочковых. Миофибриллы у них тоньше, число их меньше
к моменту рождения в 8 раз по сравнению с числом миофиб-
рилл желудочковых миоцитов. Секреторные гранулы у крыс
появляются в этих клетках на 13—15-й день развития.
Дифференцировка миоцитов проводящей системы у эмбри-
онов мыши начинается на 10—11-е сутки развития. При этом
клетки располагаются рыхло, имеют отростки и ие содержат
секреторных гранул. Цитоплазма в них электронно-прозрач-
90
ная, в ней мало миофибрилл и много включений гликогена,
промежуточных филаментов и лептофибрилл, а также “корне-
вых” пучков филаментов, связанных с центриолью. Между
светлыми клетками встречаются темные, содержащие большое
количество миофибрилл и митохондрий. Узлы окаймлены пе-
реходными клетками. Для пейсмекерных клеток характерны
выраженное развитие аппарата Гольджи и саркоплазматичес-
кой сети, малое количество миофибрилл. Клетки предсердно-
желудочкового узла появляются на 11-е сутки развития, а клет-
ки пучка Гисса — на 12-е сутки. В них также мало миофиб-
рилл, есть промежуточные филаменты и включения гликогена.
Детальные исследования гистогенеза сердечной мышечной
ткани изложены в монографии П.П.Румянцева (1982). Им же
была изучена проблема репродукции миоцитов сердца. Уста-
новлено, что миоциты в принципе способны к митотическому
делению (в том числе и клетки проводящей системы). По этому
признаку кардиомиоциты резко отличаются от поперечнопо-
лосатой мускулатуры, в которой обновление происходит только
за счет деления миосателлитов. Митозы наблюдаются особенно
часто в эмбриональном сердце (см. рис. 53, 54 на вклейке).
У крыс с 15-х суток эмбриогенеза до 15-х суток постнатального
развития включение меченого тимидина снижается в ядрах
кардиомиоцитов предсердий в 13 раз, а желудочков — в 100
раз. Во взрослом сердце метится радиоактивным тимидином в
2—3 раза больше ядер миоцитов предсердий, чем желудочков.
Наименьшей пролиферативной способностью обладают мио-
циты проводящей системы, особенно синусно-предсердного
узла. В отличие от поперечнополосатой соматической мускула-
туры в кардиомиоцитах велика полиплоидизация (формируется
G2-популяция).
Как отмечают В.Я.Бродский и И.В.Урываева (1981), в мио-
карде человека особенно много одноядерных полиплоидных
клеток с 16—32-кратным содержанием ДНК, но встречаются и
двуядерные КМЦ (13—14 %), преимущественно октопловдные.
У взрослых крыс и мышей, напротив, двуядерные кардиомио-
циты составляют 90 % от популяции этих клеток, причем
преобладают октопловдные. При гипертрофии сердца число
двуядерных КМЦ возрастает.
В процессе развития сердце человека увеличивается в объе-
ме в 16 раз по сравнению с сердцем новорожденного, при этом
в 15 раз возрастает объем кардиомиоцитов. Таким образом,
рост миокарда идет как за счет полиплоидизации ядер кардио-
миоцитов, так и за счет гипертрофии. Последний процесс
назван Д.С.Саркисовым (1970) внутриклеточной регенерацией,
т.е. умножением числа внутриклеточных структур и увеличе-
нием массы гиалоплазмы. Полиплоидизация и гипертрофия
обеспечивают не только рост миокарда в процессе развития,
но в какой-то мере осуществляют компенсационный рост в
01
ответ на повышенную нагрузку на сердце, когда может проис-
ходить небольшой всплеск митотической активности, но часто
без цитотомии.
Митотический цикл характеризуется своеобразными изме-
нениями миоцитов сердца. В профазе миофибриллы этих кле-
ток не изменяются по сравнению с миофибриллами в интер-
фазе. Прометафаза — период, когда происходит высвобожде-
ние хромосом из ядра и начинается частичная разборка
миофибрилл: исчезновение линий Z. В мета- и анафазе про-
должается резорбция линий Z и наблюдается смещение высво-
бождающихся саркомеров, при этом толстые миофиламенты
сохраняются полностью, а тонкие частично. Так же выглядят
саркомеры и в телофазе. Цитокинез иногда бывает абортивным
и заканчивается образованием двуядерных клеток [Румян-
цев П.П., 1982]. В Gj-фазе начинается реконструкция миофиб-
рилл.
В процессе развития сердечной мышечной ткани происхо-
дит инверсия митотического индекса: на ранних этапах разви-
тия максимальная пролиферативная активность наблюдается в
желудочках, а позднее более интенсивно митозируют миоциты
предсердий. Итак, кардиомиоциты представляют собой некам-
биальную, медленно растущую популяцию, не имеющую са-
теллитов.
РЕГЕНЕРАЦИЯ И ПАТОЛОГИЧЕСКАЯ ГИСТОЛОГИЯ
СЕРДЕЧНОЙ МЫШЕЧНОЙ ТКАНИ
Для сердца как органа характерна способность к регенера-
ции путем регенераторной гипертрофии, при которой масса
органа восстанавливается, а форма остается нарушенной. Так,
после перенесенного инфаркта миокарда масса сердца может
восстановиться как целое, при этом на месте повреждения
остается соединительнотканный рубец, но орган гипертрофи-
руется. Происходит не только увеличение размеров кардиоми-
оцитов, но и их, хотя и незначительная, пролиферация, глав-
ным образом в предсердиях и ушках сердца, что было показано
в экспериментах на животных — крысах и мышах [Сидоро-
ва В.Ф., 1976; Румянцев П.П., 1982; Большакова Г.Б., 1991].
В некоторых кардиомиоцитах предсердий после повреждения
наблюдается синтез ДНК, подготовка к делению этих клеток.
Однако процесс не всегда заканчивается цитотомией и возни-
кают полиплоидные кардиомиоциты. В сердечной мускулатуре
нет камбия, поэтому при регенерации делятся, вероятно, менее
специализированные миоциты. В отличие от скелетных мышц
в миокарде не происходит слияния миоцитов.
В кардиомиоцитах эмбрионов одновременно протекают про-
цессы сокращения, пролиферации и фибриллогенеза. В диф-
92
ференцирующихся кардиомиоцитах по мере возрастания функ-
ционального запроса прогрессирует развитие сократительных
структур. При этом высокоорганизованный контрактильный
аппарат препятствует завершению митоза путем цитотомии. В
кардиомиоцитах новорожденных и эмбрионов на стадии про-
метафазы происходят резорбция Z-дисков и частичная разбор-
ка миофибрилл, однако после цитотомии целостность мнофиб-
рилл восстанавливается. Этот процесс был отмечен в миокарде
крыс, цыплят, лягушек и тритонов, что позволяет предполагать
его раннее появление в филогенезе [Bori- sov А.В., 1998].
Долгое время считали, что дифференцировка кардиомиоци-
тов позвоночных является необратимым процессом, связан-
ным с полной потерей этими клетками способности к делению.
Однако в настоящее время многочисленные данные указывают
на то, что дифференцированные кардиомиоциты способны к
синтезу ДНК и митозу как in vivo, так и in vitro. В работах
П.П.Румянцева и его учеников показано, что после экспери-
ментального инфаркта миокарда левого желудочка сердца в
клеточный цикл возвращается 60—70 % предсердных кардио-
миоцитов, возрастает число полиплоидных клеток, но они все
же не компенсируют повреждение миокарда.
Наиболее высока способность к регенерации миокарда у
амфибий. Так, после измельчения верхушки желудочка трито-
на и подсадки ее в миокард хозяина происходят интенсивное
деление кардиомиоцитов и восстановление целостности сер-
дечной мышцы. Пролиферативная активность кардиомиоцитов
ящериц несколько ниже. У млекопитающих в клеточный цикл
входит незначительная часть (около 1 %) кардиомиоцитов пе-
ринекротической области и проводящей системы, т.е. в 15—20
раз меньше, чем у амфибий. Кардиомиоциты вовлекаются в
процессы гиперплазии, гипертрофии, и возрастает их плоидностъ,
однако уровень пролиферации клеток соединительной ткани в
области повреждения оказывается в 20—40 раз выше. В фибро-
бластах активизируется синтез коллагена, в результате чего
репарация происходит путем рубцевания дефекта. Биологический
смысл такой адаптационной реакции соединительной ткани объ-
ясняется жизненной важностью сердца, так как всякая задерж-
ка с закрытием дефекта может привести к летальному исходу
[Ямщиков Н.В., Габаин Л.И., 1975].
Принято считать, что в миокарде взрослого человека отсут-
ствует пролиферация кардиомиоцитов. Однако в последнее
время получены данные о том, что в здоровом сердце человека
14 миоцитов из миллиона находится в состоянии митоза, за-
вершающегося цитотомией, и, таким образом, количество кле-
ток увеличивается. Хотя такой уровень пролиферации невысок,
с течением времени он может обеспечить прирост кардиоми-
оцитов, что подтверждается простыми расчетами. Левый желу-
дочек содержит 5,8-109 миоцитов, и можно вычислить, что в
93
миокарде нормального сердца 81,2-103 миоцитов находится од-
новременно в состоянии митоза.
Применение современных методов клеточной биологии в
клинических и экспериментальных исследованиях позволило
перейти к выяснению клеточных и молекулярных механизмов
повреждения и регенерации миокарда. Особенно интересны
данные о том, что в перинекротических областях и в функци-
онально перегруженном сердце происходит синтез эмбрио-
нальных миокардиальных белков и пептидов, а также белков,
синтезирующихся во время клеточного цикла. Это подтверж-
дает положение о сходстве механизмов регенерации и нормаль-
ного онтогенеза.
Неожиданным оказалось и то, что дифференцированные
кардиомиоциты в культуре способны к активному митотичес-
кому делению. По-видимому, in vivo способность кардиомио-
цитов к возвращению в клеточный цикл не утрачивается, а
лишь подавляется. Для понимания сути этих процессов необ-
ходимо изучение межклеточных взаимодействий в миокарде.
Очевидно, невозможно рассматривать процессы репарации
мышечной ткани сердца отдельно от соединительной ткани, в
том числе от клеток воспалительного инфильтрата, продуци-
рующих факторы роста и митогены, и миофибробластов —
фенотипически измененных интерстициальных фибробластов,
ответственных, по-видимому, за обмен коллагена и формиро-
вание фиброзной ткани. О важной роли соединительной ткани
в заживлении миокарда свидетельствуют результаты экспери-
ментов по повреждению миокарда эмбрионов крыс. Несмотря
на высокий уровень пролиферации эмбриональных кардио-
миоцнтов, вследствие функциональной незрелости соедини-
тельной ткани не происходило ни заполнения дефекта миокар-
диальной тканью, ни быстрого образования рубца, характер-
ного для репарации взрослого миокарда. В результате площадь
некроза увеличивалась и развивалось хроническое воспаление.
Очень важной задачей теоретической и практической кар-
диологии является разработка способов стимуляции восстанов-
ления поврежденного миокарда, т.е. индукции миокардиаль-
ной регенерации и уменьшения рубца. Одна из стратегий ис-
следований — перенос регуляторных генов, которые превра-
щают фибробласты рубца в миобласты или трансфекция в
кардиомиоциты генов, контролирующих рост клеток. Другим
направлением является перенос в область повреждения феталь-
ных скелетных и миокардиальных клеток, которые могли бы
частично участвовать в восстановлении сердечной мышцы.
В настоящее время проводятся эксперименты по транспланта-
ции скелетной мышцы в сердце. Оказалось, что после транс-
плантации в миокарде образуются островки сокращающейся
ткани и улучшаются функциональные показатели миокарда.
Перспективным может быть лечение с применением факторов
94
роста, оказывающих как прямое, так и непрямое воздействие
на поврежденный миокард (например, улучшение ангиоге-
неза).
Скелетные мышцы и миокард во многом сходны структурно
и функционально, поэтому у этих типов мышц есть много
общего и в развитии патологических состояний.
Различные повреждающие воздействия на сердце (прекра-
щение притока артериальной крови, травмы, воспаления и др.)
вызывают некроз мышечной ткани: гибель мышечных клеток.
Некроз, возникающий при нарушении или прекращении кро-
вотока в артериях вследствие тромбоза, эмболии, длительного
спазма или в условиях недостаточного коллатерального крово-
обращения, более характерен для миокарда. Артериальная сеть
поперечнополосатых мышц богата анастомозирующими сосу-
дами, поэтому даже при полном закрытии артерий ишемии не
наблюдается. Дистрофические и некротические изменения в
мышцах развиваются только при длительном закрытии круп-
ных артерий.
Для миокарда и поперечнополосатых соматических мышц
характерны такие клинико-морфологические формы некроза,
как коагуляционный некроз, коагуляционный миоцитолиз, ко-
лликвационный некроз (рис. 55, 56, 57 — см. вклейку). В раз-
витии разных типов некроза участвуют различные биохимичес-
кие механизмы.
В основе коагуляционного (сухого) некроза лежат процессы
денатурации белков с образованием труднорастворимых соеди-
нений, которые могут длительное время не подвергаться гид-
ролизу. В сердечной мышце коагуляционный некроз (воско-
видный, ценкеровский некроз) является наиболее частым ви-
дом патологии. Одна из важных причин коагуляционного не-
кроза — потеря сократительной способности кардиомиоцитов
вследствие ацидоза, возникающего при повреждении мембран
мышечных клеток, и нарушения функций кальциевых насосов.
Наступает атония сердечной мышцы. При этом возрастает дав-
ление интерстициальной ткани, а тромбоз, вызывающий коа-
гуляционный некроз, уменьшает внутримышечное кровообра-
щение, что ведет к ишемии. Для этого вида повреждения
характерна релаксация кардиомиоцитов. В области поврежде-
ния (инфаркта) заметны ранняя ацидофилия цитоплазмы, уп-
лотнение ядер, инфильтрация полиморфно-ядерными лейко-
цитами и образование лейкоцитарного вала. Во внутренней
части некротической зоны кардиомиоциты утончены и удли-
нены. Их ядра постепенно исчезают, поперечная полосатость
миофибрилл некоторое время сохраняется. Этот вид некроза
может быть также назван атонической смертью миоцитов.
В настоящее время выяснилось, что в очаге инфаркта кар-
диомиоциты погибают путем некроза, а в широкой зоне, ок-
ружающей некротический очаг, — за счет апоптоза.
65
Коагуляционный миоцитолиз (гиперконтракция, дисковидное
расщепление) заключается в том, что в мышечных волокнах
появляется резко выраженная поперечная исчерченность, за-
канчивающаяся распадом мышечного волокна на отдельные
диски. Неравномерные поперечные полосы являются резуль-
татом коагуляции сверхсокращенных саркомеров (см. рис. 56).
Причиной коагуляционного миоцитолизиса является повыше-
ние содержания катехоламинов, так называемая симпатическая
стимуляция, при которой в мышечной ткани возрастает содер-
жание ионов Са2+. Этот вид гибели миоцитов нередко можно
наблюдать в миокарде краевой зоны инфаркта. Уничтожение
макрофагами участков некроза приводит к возникновению
альвеолярной структуры кардиомиоцитов. Гиперконтракция
может распространяться между кардиомиоцитами через щеле-
вые контакты.
Колликвяциовный некроз развивается в результате пропиты-
вания миокарда экссудатом из кровеносных сосудов. В клетках
возникают внутриклеточный отек и вакуолизация. Вакуольная
дистрофия мышц выражается в появлении внутри мышечных
волокон круглых или овальных полостей с прозрачной жид-
костью (см. рис. 57). Этот вид повреждения обычно выявляется
в периваскулярной и субэндотелиальной областях, сохранив-
шихся после инфаркта. Следует отметить, что в соматических
поперечнополосатых мышцах эта форма некроза возникает при
длительных отеках. Внутриклеточный отек вызывает разобще-
ние миофибрилл: наблюдается расслаивание мышечных воло-
кон, наряду с сохранившими свою структуру волокнами обыч-
но имеются атрофированные и извитые. В области колликва-
ционного некроза нередко появляется бурый пигмент, родст-
венный липофусцину (рис. 58 и 59 — см. вклейку).
Вследствие воспалительной реакции происходит рассасыва-
ние омертвевшей мышечной ткани, иногда с образованием
клеток инородных тел и последующим замещением ее рубцом.
При дистрофии не вся сердечная мышца поражается па-
тологическим процессом и степень его проявления в различ-
ных частях миокарда неодинакова.
Вокруг участка некроза сердечной, как и соматических
мышц, можно наблюдать жировую дистрофию и липоматоз, а
также отложение извести.
При атрофии миокарда тяжи кардиоцитов постепенно ста-
новятся тоньше. В случае значительной атрофии исчезает по-
перечная исчерченность, продольная исчерченность сохраня-
ется дольше. Иногда можно видеть разволокнение миофибрилл
или разрыв их на уровне линий Z (рис. 60, 61). Компенсаторно
вблизи атрофирующихся кардиомиоцитов появляются гипер-
трофированные (см. рис. 58 на вклейке). В местах атрофии
часто развивается воспалительный процесс, разрастается межу-
96
Рис. 60. Электронная микрофотография. Фрагмент миокарда левого
желудочка человека при митральном стенозе ревматической этиоло-
гии. Виден разрыв миофибрилл (МФ) в области дисков I. Ядро
кардиомиоцита (Я). Ув. 45 000 (фото Т. А.БслоусовоЙ).
точная соединительная ткань, иногда мышечная ткань замеща-
ется жировой.
Гипертрофия поперечнополосатой и сердечной мышцы час-
то относится к рабочим гипертрофиям. Обычно в основе ее
лежит лишь утолщение мышечных волокон и кардиомиоцитов,
обусловленное увеличением количества саркоплазмы и мио-
фибрилл. Установлено, что в миокарде гипертрофия является
реакцией на пролиферативные стимулы и гемодинамическую
нагрузку кардиомиоцитов, которые вышли из митотического
цикла. Она может быть вызвана экспрессией онкогенов.
Пусковым механизмом гипертрофии может быть ионный поток
через кальциевые каналы, открывающиеся при растяжении клетки.
Основу концепции о возможной связи физической нагрузки, сигнала,
передаваемого метаболическими путями и активирующего митогены,
и синтеза специфических белков составляет представление о том, что
определенные ионные потоки могут активировать онкогены или из-
менение активности белков-митогенов.
Детальные цитологические исследования гипертрофии кар-
диомиоцитов желудочков сердца крысы при частичном стенозе
аорты, гипобарической гипоксии и гипокинезии были выпол-
нены группой исследователей под руководством М.В.Шорни-
ковой и Ю.С.Ченцова (1991—1998). Было установлено, что при
экспериментальном частичном стенозе аорты развивается ги-
пертрофия сердца и его масса возрастает более чем на 40 %.
На 15-е и особенно на 30-е сутки эксперимента наблюдается
отчетливая гипертрофия кардиомиоцитов левого желудочка, их
97
Рис. 61. Электронная микрофотография. Фрагмент миокарда левого
желудочка человека при митральном стенозе ревматической этиоло-
гии. Видны разволокнение миофибрилл на миофиламенты (МФ)
отечной жидкостью, митохондрии (М), гранулы гликогена (ГГ). Ув.
16 000 (фото Т.А.Белоусовой).
абсолютная площадь поперечного сечения возрастает вдвое по
сравнению с площадью сечения кардиомиоцитов контрольной
группы животных. При этом выявляется морфологическая ге-
терогенность этих клеток. Часть их остается мало измененной,
тогда как другая характеризуется значительными изменениями:
тотальным отеком саркоплазмы, разволокнением и лизисом
миофибрилл, деструкцией отдельных линий Z. Некоторые ядра
гипертрофируются, приобретают неправильные очертания,
расширяются трубочки Т-системы, разрастаются элементы ап-
парата Гольджи, резко возрастает количество вторичных лизо-
сом. Митохондрии в таких клетках набухают, их матрикс про-
98
Рис. 62. Электронные микрофотографии кардиомиоцитов крысы. Ув.
16 000 (фото Д.Д.Проценко и М.В.Шорниковой).
а — контрольного животного. Видны миофибриллы, между которыми распо-
лагаются многочисленные межмиофибриллярные (1), а под сарколеммой —
субсарколеммальные (2) митохондрии; б — 30-е сутки после частичного стено-
за аорты. Субсарколеммальные митохондрии приподнимают сарколемму в
местах сближения кардиомиоцитов с капиллярами: 1 — капилляр, 2 — сарко-
лемма, 3 — скопления митохондрий под сарколеммой в виде “почки”.
99
светляется, что нередко сопровождается частичным разрывом
наружных мембран и появлением миелиноподобных фигур.
Под сарколеммой обнаруживаются большие скопления мито-
хондрий в участках кардиомиоцитов, прилежащих к капилля-
рам (рис. 62). Количество ММК возрастает в 1,85 раза по
сравнению с таковым в контрольной группе. В целом в дина-
мике развития гипертрофии возрастает масса митохондрий и
миофибрилл, подвергающихся расщеплению.
При гипобарической гипоксии также наблюдается
гипертрофия миоцитов, но правого желудочка сердца крысы с
увеличением относительного объема и площади поверхности
миофибрилл (в 1,4 раза) и двукратным возрастанием интен-
сивности синтеза РНК и белка. Изменения митохондрий при
этом не имеют плавного характера. Так, на ранних этапах
развития гипоксии (1—3-и сутки), еще до появления отчетли-
вых признаков гипертрофии кардиомиоцитов, количество ми-
тохондрий возрастает, появляются их конденсированные фор-
мы, увеличивается число крист и быстро снижается количество
ММК. На 5—15-е сутки гипоксии, когда площади поперечных
сечений кардиомиоцитов увеличиваются в 2 раза, возрастает
процент более 1фупных митохондрий. Число ММК уменьша-
ется у околоядерных и межфибриллярных митохондрий, тогда
как в субпопуляции митохондрий, под сарколеммой, их коли-
чество возрастает.
Гипобарическая гипоксия вызывает компенсаторное разрас-
тание капилляров, и именно поблизости от них в кардиомио-
цитах обнаруживаются скопления субсарколеммальных мито-
хондрий, приподнимающих сарколемму с образованием свое-
образных “почек”. Число последних возрастает по мере разви-
тия гипертрофии. Это явление можно рассматривать как про-
явление компенсаторной реакции в ответ на недостаток кис-
лорода и АТР и нарушение “электрического кабеля”, сформи-
рованного митохондриями. Он прерывается в участках хонд-
риома при разрушении ММК. По-видимому, ММК субсарко-
леммальных, расположенных вблизи сосудов митохондрий бо-
лее устойчивы к дефициту кислорода, а сами митохондрии
находятся в более благоприятных условиях д ля его получения
через плазмолемму.
Исследования миоцитов правого желудочка сердца крыс
при гипокинезии показали, что площади их поперечных
сечений возрастают в 1,5 раза по сравнению с площадью се-
чения этих клеток у контрольных крыс. В левом желудочке
миоциты увеличиваются в меньшей степени.
Предполагают, что увеличение площади поперечного сече-
ния кардиомиоцитов правого желудочка отражает не функци-
ональную гипертрофию, а, скорее, дистрофические изменения.
Эти клетки набухают, в них происходят разволокнение и ис-
тончение миофибрилл, правильная структура саркомеров на-
100
рушается, часть протофибрилл лизируется. Митохондрии на-
бухают, кристы фрагментируются, появляются уплотнения во
внутрикристном пространстве.
Такие изменения наблюдаются у подавляющего числа мио-
цитов правого желудочка, а в левом желудочке эти ультраструк-
турные изменения происходят лишь в некоторых клетках.
Число ММК в КМЦ правого желудочка снижается незначи-
тельно в отличие от числа этих образований левого желудочка:
в нем данный показатель уменьшается в 3,3 раза. Таким обра-
зом, реакция кардиомиоцитов на гипокинезию правого и ле-
вого желудочков не одинакова, что объясняется разной функ-
циональной на1рузкой на предсердия и желудочки сердца.
При ряде заболеваний, не связанных непосредственно с
воздействием на миокард: алкогольной интоксикации, панкре-
атите, перитоните, амилоидозе селезенки (рис. 63) и др. —
развиваются тем не менее значительные изменения в ультра-
структуре кардиомиоцитов. Они затрагивают организацию мио-
фибрилл, митохондрий, ММК и других органелл кардиомио-
цитов и отражают как деструктивные процессы, происходящие
в этих клетках, так и компенсаторно-приспособительные, на-
правленные на ликвидацию повреждений и энергетического
истощения их в условиях патологии.
В последние годы интенсивно проводятся исследования гипертро-
фии миокарда с целью анализа экспрессии генов, кодирующих раз-
личные сократимые белки. Установлено, что из двух изоформ тяже-
лых цепей миозина (а и р) у крупных млекопитающих, в том числе
человека, в желудочковых кардиомиоцитах содержится мало а-изо-
форм, а в предсердиях много обеих цепей. При повышенной нагрузке
на сердце человека как в предсердиях, так и в желудочках происходит
значительное снижение экспрессии генов, кодирующих a-цепи, и
активируется выработка p-цепей тяжелого миозина. При гипертрофии
миокарда у человека происходят изменения в экспрессии генов, ко-
дирующих легкие цепи миозина. Легкая a-цепь (ALC-1), выявляемая
в предсердиях в норме, появляется в гипертрофированном желудочке,
в то время как желудочковая легкая цепь (VLC-2) обнаруживается в
гипертрофированном предсердии. Экспрессия генов, кодирующих
другие сократимые белки, при этом не изменяется.
У нормальных крыс в желудочках миокарда содержатся только
тяжелые a-цепи изоформы миозина (а-МНС). В ответ на повышение
гемодинамического давления экспрессируются p-цепи (р-МНС), со-
держание последних в желудочках нарастает в динамике развития
гипертрофии. Таким образом, распределение двух типов цепей тяже-
лого миозина противоположно в сердцах крупных млекопитающих и
крыс в норме, но в условиях патологии содержание как тяжелых, так
и легких цепей миозина может изменяться как в предсердиях, так и
в желудочках.
Цитоскелет нормальных кардиомиоцитов состоит главным
образом из промежуточных филаментов, содержащих десмин,
101
Рис. 63. Электронная микрофотография. Набухание митохондрий (от-
мечено стрелками) в кардиомиоцитах мыши при амилоидозе селезен-
ки. Ув. 51 000 (фото В.А.Шахламова).
и микротрубочек, что было показано методами иммунозолоче-
ния. Эти образования располагаются вдоль миофибрилл, под
сарколеммой и вокруг ядер. Повышение гемодинамического
давления приводит к увеличению числа микротрубочек и дес-
миновых филаментов. Последние в некоторых участках клеток
утрачивают продольное расположение и начинают ориентиро-
ваться беспорядочно. В межклеточном пространстве при гипе-
ртрофии у крыс во!фуг кардиомиоцитов возрастает содержание
фибронектина и коллагеновых филаментов.
102
ЭЛЕМЕНТЫ СРАВНИТЕЛЬНОЙ ГИСТОЛОГИИ
СЕРДЕЧНОЙ МЫШЕЧНОЙ ТКАНИ
КАРДИОМИОЦИТЫ ПТИЦ, РЕПТИЛИЙ
И НИЗШИХ ПОЗВОНОЧНЫХ животных
Миоциты сердца птиц, рептилий и низших позвоночных
бывают мельче, чем у млекопитающих, уже и длиннее, особен-
но в желудочках. В этих клетках отсутствуют Т-каналы, мала
протяженность нексусов. У большинства рыб и амфибий СР
развит слабо и нет триад, щелевых контактов и ступенчатости
во “вставочных дисках”. Для миокардиоцитов ящериц харак-
терно, что каждый толстый филамент (в желудочках) окружа-
ется не шестью, а 7—9 тонкими филаментами, линии М вы-
ражены слабо и они непостоянны. В предсердных миоцитах
этих животных содержатся секреторные гранулы, которые
встречаются и в желудочках. У птиц есть каналы СР, которые
ориентированы поперечно, вокруг линий Z, т.е. располагаются
на месте Т-системы млекопитающих. У зябликов и колибри с
высокой частотой сокращений сердца СР очень интенсивно
развит, особенно вокруг Z-дисков. Субмикроскопическая ор-
ганизация миофибрилл кардиомиоцитов амфибий и птиц в
основном соответствует структуре миофибрилл млекопитаю-
щих. Следует отметить, что у них преобладает полевая органи-
зация (Felderstruktur), а не фибриллярная (Fibrillenstruktur), хо-
тя у низших позвоночных часто миофибриллы бывают обособ-
ленными. Проводящая система описана у птиц. У пойкило-
термных животных она не выражена, хотя в синусных узлах
содержатся светлые клетки с малым количеством миофибрилл.
Основная тенденция филогенетического развития мышечных
тканей состоит в усилении специализированных функций. На
ранних этапах филогенеза дивергенция трех основных типов кар-
диомиоцитов еще не достигла у позвоночных ясного выражения.
Специфические секреторные гранулы встречаются у низших по-
звоночных не только в предсердных, но и в желудочковых миоци-
тах. В ходе эволюции в миоцитах желудочков начинает преоб-
ладать монофункциональная дифференцировка, направленная на
увеличение силы сокращения. По мере эволюции происходит так-
же утрата протеогликановых гранул в миоцитах проводящей
системы и желудочков. В рабочем миокарде развивается макси-
мальная сократительная функция и совершенствуется пейсме-
керная функция проводящей системы.
КАРДИОМИОЦИТЫ НИЗШИХ ХОРДОВЫХ
И БЕСПОЗВОНОЧНЫХ ЖИВОТНЫХ
У всех животных сердечная мускулатура имеет клеточное
строение. У оболочников в сердце один слой миоэпителиальных
103
Рис. 64. Улыраструктура миоэпителиальной клетки сердца асцидии;
поперечный срез (по А.АЗаварзину).
1 — полость сердца; 2 — перикардиальная полость; 3 — поперечно
срезанные миофибриллы.
клеток. На стороне, обращенной к полости сердца, в мио-
цитах располагается 1—3 миофибриллы. У асцидий встреча-
ется сплошное поле миофиламентов в этих клетках (рис. 64).
В саркомерах видны диски А и I, линии Н и Z, у некоторых
представителей — и линии М. Терминальные структуры цис-
терн СР контактируют с сарколеммой, а Т-система не описана.
Концы миофибрилл закрепляются в этих клетках с помощью
fascia adherens со слабовыраженной складчатостью вставочных
дисков. У миоцитов описаны плотные контакты, имеющие
характер пояска, встречаются и нексусы.
У низших ракообразных кардиомиоциты располагаются в
стенке сердца продольно и наклонно по отношению к его оси,
содержат тонкие и разветвляющиеся миофибриллы. В них хо-
рошо выражены линии Z и отсутствуют линии М и Н. В ци-
104
Рис. 65. Электронная микроскопия кардиомиоцитов членистоногих,
а — продольный срез кардиомиоцита кузнечика иа уровне клапана сердца.
Ув. 6000 (фото М.В.Шорниковой и А.Степановой); б — продольный срез кар-
диомиоцнга дафнии. Ув. 6000.
топлазме, особенно под сарколеммой, располагаются крупные
митохондрии (см. рис. 65, б, в). Вставочные диски не описаны.
У высших ракообразных (речной рак) в цитоплазме кардиомио-
цитов наблюдаются многочисленные канальцы СР, окружаю-
щие миофибриллы. Взаимное расположение толстых и тонких
филаментов не столь упорядочено, как у позвоночных: 6—9
105
Рис. 65. Продолжение.
в — поперечный срез кардиомиоцита дафнии. Ув. 6000; г — поперечный срез
кардиомиоцита речного рака; 1 — миофибриллы; 2 — саркоплазматический ре-
тикулум (фото М.В.Шорниковой, Е.В.Стельмашук и М.А.Антимоновой).
тонких филаментов окружают каждую толстую протофибриллу.
В свою очередь толстые филаменты не всегда располагаются
гексагонально относительно друг друга (рис. 65, г).
106
Сердечная мускулатура десятиногих раков в отличие от сер-
дечных мышц всех других животных снабжена сателлитами.
Своеобразными признаками кардиомиоцитов у этих животных,
делающими эти клетки сходными с волокнами соматической
мускулатуры, являются их многоядерность, наличие Т-системы
и аналогичная иннервация. Возможно, возникновение у этих
ракообразных миокарда связано со смещением мезодермаль-
ных зачатков части соматических мышц при образовании мик-
соцеля. У некоторых ракообразных (крабы) саркомеры имеют
очень крупные размеры, превышающие протяженность их у
других членистоногих в 2—3 раза.
У головоногих моллюсков и членистоногих сердечная мус-
кулатура имеет наиболее высокий уровень развития.
У насекомых, например кузнечиков, стенка сердца и клапа-
нов состоит из одного слоя миоцитов, расположенных в ос-
новном циркулярно, перпендикулярно к длинной оси органа.
В базальных частях миоцитов, обращенных в полость органа,
находятся пучки миофиламентов, имеющих широкие диски А
и более узкие диски I. Линии Z не всегда четко выражены. Их
локализация совпадает с направлением складок базальной
плазмолеммы, напоминающих зачаточную форму Т-каналов.
Вблизи плазмолеммы, в цитоплазме кардиомиоцита, распола-
гаются митохондрии разной формы и величины. Выпуклая
часть клетки содержит ядро и обращена в полость тела. Ядро
имеет многочисленные инвагинации, направленные в сторону
скоплений мелких митохондрий, и одно крупное ядрышко (см.
рис. 65, а).
У некоторых насекомых, например стрекоз, в миофибриллах
линии Z распадаются на отдельные тельца или приобретают
вид перфорированных пластинок.
Кардиомиоциты членистоногих обладают нейрогенным
автоматизмом, при котором электрический импульс (ПД) вы-
рабатывается не пейсмекерами, а ганглиозными нейронами.
Однако у дафнии и перипланеты существует миогенный авто-
матизм, как и у большинства моллюсков.
У моллюсков сердечная мускулатура построена разнообраз-
но. У головоногих моллюсков толстые миофиламенты кардио-
миоцитов бывают очень широкими, достигающими в попере-
чнике 30—40 нм. Они располагаются гексагонально. Тонкие
нити имеют толщину 6—7 нм. Т-система у них хорошо развита,
нексусы отсутствуют. У брюхоногих и пластинчатожаберных
моллюсков часть сердечной мускулатуры не поперечнополоса-
тая, а косоисчерченная (Arenicola marina) или гладкая (Venus,
Ellipso). У некоторых моллюсков толстые миофиламенты со-
держат парамиозин. Косоисчерченная мускулатура сердца
также у червей и погонофор.
Таким образом, можно сделать следующее заключение.
107
1. Все первично- и вторичноротые имеют клеточное стро-
ение сердечной мускулатуры (кроме десятиногих раков с
симпластической организацией этой ткани).
2. У всех животных (кроме десятиногих раков) кардиомио-
циты не сопровождаются сателлитами.
3. Ультраструктура разных типов мускульных клеток сердца
и их контактов — пример далеко идущего параллелизма,
что выражается в дифференцировке саркомеров, сходстве
Т-системы и СР у головоногих, членистоногих и желу-
дочковых миоцитов млекопитающих. Однако имеются и
различия в интенсивности развития ряда структур: отсут-
ствие у некоторых животных в кардиомиоцитах Т-систе-
мы, нексусов, специфических гранул, а также промежу-
точных филаментов у беспозвоночных.
4. В процессе эволюции совершенствовалась сократитель-
ная система — от “гладкого*’ типа с неправильным рас-
положением толстых и тонких филаментов до строго
упорядоченного типа.
5. Проводящая система сердца начинает выполнять функ-
цию, аналогичную проведению возбуждения нервными
волокнами.
6. Прогрессивная дифференцировка миофибрилл включает
упорядоченную гексагональную упаковку толстых фила-
ментов, преобразование Z-телец в линии Z, а зон связы-
вания кардиомиоцитов в виде отдельных пластинок при-
крепления в fascia adherens. Увеличение складчатости
контактирующих мембран и их перпендикулярное распо-
ложение по отношению к миофибриллам, с одной сто-
роны, и развитие нексусов в продольных участках вста-
вочных дисков — с другой, а также накопление в линиях
Z специфических белков (а-актинина, десмина, вимен-
тина, спектрина и др.) являются также отражением про-
грессивной дифференцировки.
7. В процессе эволюции усложнился аппарат электромеха-
нического сопряжения сарколеммы, СР и миофибрилл.
Наиболее примитивной формой сопряжения является
контакт терминальных цистерн СР с сарколеммой без
инвагинаций клеточной поверхности. По мере увеличе-
ния числа миофибрилл у беспозвоночных и позвоночных
дифференцируются Т-система, диады и триады. В этом
также проявляется параллелизм.
8. У беспозвоночных типичные нексусы не дифференцируют-
ся. Это означает, что у этих животных кардиомиоциты не
объединяются в один “электрический синцитий” в отличие
от миокарда позвоночных. Каждый нейрогенный миоцит
беспозвоночных активируется индивидуально нервным
окончанием. Такие заключения сделал А.А.Заварзин (1985)
при анализе эволюции сердечно-мышечной ткани.
108
Глава 4
ГЛАДКАЯ
(НЕИСЧЕРЧЕННАЯ, ВИСЦЕРАЛЬНАЯ)
МЫШЕЧНАЯ ТКАНЬ
ГЛАДКАЯ МЫШЕЧНАЯ ТКАНЬ
ПОЗВОНОЧНЫХ животных
СТРОЕНИЕ ГЛАДКОЙ МЫШЕЧНОЙ ТКАНИ
И ЕЕ КЛАССИФИКАЦИЯ
Прежде всего следует отметить, что гладкая мышечная ткань
состоит из клеток (ГМК, гладкие миоциты, лейомиоциты),
различных по своему происхождению. Лейомиоциты представ-
ляют собой гетерогенную и изменчивую популяцию клеток.
Гладкая, непроизвольная мускулатура образует сократитель-
ный аппарат всех внутренних органов и кожи (рис. 66—67; рис.
68,а —см. вклейку; рис. 68,6; 69; рис. 70—73 —см. вклейку;
рис. 74, 75,а; рис. 75,6 — см. вклейку). Ее клетки веретеновид-
ные или отростчатые. Их длина колеблется от 20 до 200 мкм,
но в матке во время беременности может достигать 500 мкм.
Поперечник лейомиоцитов 4—8 мкм. Клетки обычно собира-
ются в пучки, являющиеся функциональными единицами
ткани. Механизм объединения гладкомышечных клеток много-
образен. На их концах имеются пальцевидные впячивания с
десмосомами и нексусами. Пучки объединяются коллагеновы-
ми и эластическими волокнами и гликопротеиновым проме-
жуточным веществом (с примесью протеогликанов). Все эти
вещества вырабатываются в основном самими лейомиоцитами.
На поверхности клеток находятся многочисленные мелкие
впячивания (кавеолы), а вблизи плазмолеммы — пиноцитоз-
ные пузырьки.
В клетках располагаются миофиламенты, содержащие актин
и миозин, образующие пучки, ориентированные вдоль или
косо по отношению к длинной оси лейомиоцита; есть плотные
тельца, аналоги линий Z, и пластинки прикрепления (плотные
пластинки), локализованные с внутренней стороны плазмолем-
мы (см. рис. 67, 68, а — на вклейке; см. рис. 68,6). Плотные
пластинки имеют вид длинных (возможно, непрерывных) “ре-
бер”, идущих параллельно друг другу вдоль лейомиоцита (см.
рис. 68,6). Периферическая часть этих пластинок, прилежащая
к сарколемме, образована филаментами иемышечного актина
(нмАКТ) и связана с трансмембранными белками — интегри-
нами посредством комплекса адгезивных белков (АБ), к кото-
рым относятся винкулин, талин, тензин. В глубоких слоях
плотных пластинок к молекулам немышечного актина при-
крепляются филаменты мышечного актина (мАКТ) с помощью
109
б
Рис. 66. Строение гладкомышечной клетки позвоночного (по Стео-
пое).
а — лейомиоциты при световом микроскопировании: 1 — ядро; 2 — миолемма
(сарколемма); 3 — миофиламенты; 4 — соединительнотканные волокна; б —
лейомиоцит при электронном микроскопировании: 1 — базальная мембрана;
2 — ядро; 3 — миофиламенты; 4 — электронно-плотные скопления; 5 — эндо-
плазматический ретикулум; 6 — митохондрии; 7 — поперечно срезанное нерв-
ное окончание с синаптическими пузырьками.
связующих белков (СБ), например филамина. Плотные тельца
(ПТ) располагаются в цитоплазме не свободно, как считалось
до сих пор, а в виде цепочек, соединяясь друг с другом (нитями
нмАКТ). Пучки филаментов мАКТ проникают в плотные тель-
ца под углом, а пучки промежуточных филаментов (ПФ) ок-
ружают их по периферии. Плотные тельца содержат в высокой
концентрации а-актинин, а в плотных пластинках обнаружи-
ло
Рис. 67. Лейомиоцит в расслабленном (а) и сокращенном (б) состоя-
нии (по R-Krstic).
1 — нить актина; 2 — миозин; 3 — микрофиламенты; 4 — закрепляющие плас-
тинки (плотные тельца). Промежуточные филаменты закрепляются на плас-
тинках, создавая внутриклеточную сетчатую основу, которая участвует в рас-
правлении после сокращения. Актиновые филаменты закрепляются там же.
вают также талин и винкулин. Сокращение клетки обеспечи-
вается взаимодействием филаментов мАКТ с филаментами ми-
озина в соответствии с моделью скользящих нитей.
Ядра ГМК имеют удлиненную форму (см. рис. 69—71, 73,
79), окружены цитоплазмой, содержащей обычные органеллы:
митохондрии, комплекс Гольджи, клеточный центр, элементы
агранулярной и гранулярной эндоплазматической сети.
Электронная микроскопия позволила обнаружить полимор-
физм гладкомышечных клеток.
Различают контрактильные, секреторные и промежуточные
111
пт
нмАКТ
Рис. 68. Строение цитоскелета лейомиоцита (гипотезы).
б — взаимосвязь элементов цитоскелета и сократительного аппарата: I — плот-
ные пластинки (ПП) вдут по внутренней поверхности сарколеммы (СЛ) вдоль
миоцита. Между ними располагаются кавеолы (К); II — ПП включает перифе-
рический и глубокий слои. Первый прилежит к СЛ и образован филаментами
немышечного актина (нмАКТ), связанного с интегринами (И) посредством
комплекса адгезивных белков (АБ). В глубоком слое филаменты мышечного
актина (мАКТ) прикреплены к филаментам нмАКТ связующими белками
(СБ); МКВ — межклеточное вещество, взаимодействующее с И; III — плотные
тельца (ПТ) соединены друг с другом посредством нмАКТ; IV — пучки фила-
ментов мАКТ проникают в ПТ под углом, а промежуточные филаменты (ПФ)
окружают их по периферии. Миозиновые филаменты (ММФ) взаимодействуют
с мАКТ [Быков BJI., 1999].
Рис. 69. Гладкая мускулатура тонкой кишки кошки. Окраска желез-
ным гематоксилином по Гейденгайну.
а —продольный срез; б —продольный и поперечный срезы. Крупные ядра
принадлежат нейронам межмышечного сплетения. Мелкие продолговатые и
круглые (поперечно срезанные) ядра относятся к лейомиоцигам.
Рис. 74. Ультраструктура гладкомышечных клеток (по R.Krstic).
1 — ядро; 2 — гранулярный эндоплазматический ретикулум; 3 — микрофила-
менты; 4 — закрепляющие пластинки; 5 — микропиноцитозные пузырьки; 6 —
мембраны гладкой эндоплазматической сети; 7 — базальная мембрана; 8 —
микрофибриллы; 9 — коллагеновые волокна; 10 — эластические волокна; II —
нексусы, продольный срез; 12 — нексусы, тангенциальный срез; 13 — нервные
волокна между клетками; 14 — нервная терминаль.
113
Рис. 75. Миофиламенты лейомиоцита.
а — электронная микрофотография; продольный срез лейомиоцита тонкой киш-
ки морской свинки. Видны тонкие и толстые филаменты (фото N.Garamvolgyi).
лейомиоциты. Фенотип этих клеток в значительной степени
определяется сократительными н цитоскелетными белками.
Контрактильные гладкомышечные клетки (“контрактиль-
ный” фенотип) специализированы на функцию сокращения,
хотя в определенной мере проявляют и секреторную актив-
ность. В них много элементов гладкой (агранулярной) эндо-
плазматической сети, пиноцитозных везикул, миофиламентов
(но не миофибрилл). Митохондрии мелкие, ГЭР развит слабо.
В расслабленном состоянии поверхность лейомиоцита бывает
ровной, а при сокращении становится складчатой (см. рис. 67).
В цитоплазме клеток многочисленны примембранные пластин-
ки прикрепления и цитоплазматические плотные тельца, бога-
тые а-актинином и винкулином. Хорошо развит цитоске-
лет, содержащий промежуточные филаменты, главным обра-
зом десминовые и виментиновые. Эти филаменты прикрепля-
ются к обоим типам плотных телец, образуя сложную трехмер-
ную сеть. Основная масса цитоплазмы занята актиновыми и
миозиновыми белками, которые, взаимодействуя друг с дру-
гом, образуют линейные структуры — “сократимые еди-
ниц ы”. Актиновые филаменты связываются на концах сокра-
тимых единиц с плотными тельцами (см. рис. 68), вследствие
чего каждая сократимая единица закрепляется в двух точках
114
поверхностного аппарата клетки. Предполагают, что примем-
бранные плотные пластинки расположены по спирали и поэ-
тому сократимые единицы оказываются под некоторым углом
к длинной оси клетки. При сокращении лейомиоцита вся
поверхность клетки приобретает бугристый и спиральный вид
благодаря образованию глубоких впячиваний в местах при-
крепления сократимых единиц. Каждая сократимая единица
представляет собой структуру, аналогичную миофибрилле по-
перечнополосатого волокна, но в ней нет правильного сарко-
мерного распределения тонких и толстых миофиламентов.
Протофибриллы лежат более или менее параллельно, однако
на поперечном срезе их расположение неупорядоченное (см.
рис. 74, 75).
Основу толстых филаментов составляют хвосты молекул миозина
в комплексе с другими дополнительными белками. Головки миозино-
вых молекул располагаются с внешней стороны этих комплексов, по
спирали, рядами, причем в соседних рядах они направлены противо-
положно. Взаимодействие их с актиновыми филаментами, вероятно,
происходит в разных направлениях. Одна миозиновая нить взаимо-
действует с 10—15 актиновыми. Миозин гладких мышц отличается от
миозина соматической мускулатуры. Он имеет в 10 раз более низкую
активность АТРазы головок, обладает большей чувствительностью к
pH, ионному составу и концентрации кальция. Актин тонких фила-
ментов лейомиоцитов также своеобразен и отличается несколько
иным аминокислотным составом. В тонких нитях этих клеток нахо-
дится тропомиозин, но также других аминокислотного состава и мо-
лекулярной массы, а тропонин в них не обнаружен. Подробности о
биохимических особенностях белков лейомиоцитов и специфике их
сокращения изложены в последующих главах.
По мере того как в цитологию внедряются методы иммуно-
морфологии, удается обнаруживать все большее многообразие
ГМК не только в разных органах, но и в одном и том же органе
и на различных стадиях онтогенеза. Так, выделено 6 изоформ
актина у млекопитающих, из которых две находятся в гладких
мышцах (одна — в ГМК сосудов и одна — в ГМК других орга-
нов).
В мускулатуре млекопитающих обнаружено 6 генов тяжелых цепей
миозина, экспрессирующих несколько изоформ миозина. Различия
между ними обусловливают скорость сокращения, его регуляцию,
степень ассоциации молекул миозина в клетке. Миозин гладких мышц
наиболее сходен с таковым немышечных клеток. Использование спе-
цифических моноклональных антител позволило в ГМК сосудов вы-
делить различные изоформы миозина, характеризующие разные ста-
дии их развития. С помощью моноклональных антител SM-E7 в
зрелых ГМК выявлены изоформы обоих тяжелых цепей мышечного
миозина (SM). В менее дифференцированных лейомиоцитах аорты
человека и животных выделены две изоформы тяжелых цепей немы-
шечного миозина (NM) при использовании моноклональных антител
(NM-G2 и NM-F6). У взрослых особей в среднем слое аорты большая
115
часть ГМК содержит “взрослый" миозин (SM), однако некоторые
лейомиоциты экспрессируют как “взрослый” тип миозина, так и
изоформу немышечиого (NM) типа, характерную для ГМК аорты в
раннем постнагальном периоде.
Гетерогенность ГМК обнаруживается не только по наличию
в них разных форм актина и миозина, но и по содержанию
промежуточных филаментов. Так, в артериях эластического и
мышечного типов человека содержатся десминнегативные ГМК,
в то время как в венозных сосудах всегда присутствуют десмин-
позитивные лейомиоциты. Десминсодержащие филаменты на-
ходятся также в ГМК пищевода и мочеточника [Нанаев А.К.,
1997]. Белок промежуточных филаментов виментин обнаружи-
вается во всех типах ГМК и на всех стадиях развития сосудов.
Итак, для “типичной”, или “взрослой”, формы лейомиоци-
тов аорты человека характерны наличие миозина (SM),
двух форм актина, виментина и отсутствие десмина. То же при-
суще мышечным клеткам коронарной артерии. Однако у детей
десмин выявляется во всех клетках коронарной артерии, а у
подростков — в части ГМК среднего слоя (Бабаев В.Р., 1995].
Секреторные гладкомышечные клетки ("синтетический” фе-
нотип) по улыраструктуре похожи на фибробласты, но содер-
жат по периферии пучки миофиламентов. В цитоплазме хоро-
шо развиты ГЭР и аппарат Гольджи, много митохондрий,
гранул гликогена, встречаются секреторные включения. По
степени зрелости секреторные лейомиоциты относят к мало-
дифференцированным. В них может постепенно увеличиваться
объем контрактильных филаментов, а доля секреторного аппа-
рата уменьшается. Эти клетки синтезируют протеогликаны, гли-
копротеины, фибронектин, проколлаген и проэластин, из которых
формируются коллагеновые и эластические волокна и вещест-
во межклеточного матрикса. Велико сходство этих клеток с
фибробластами, а сократимые единицы напоминают стресс-
фибриллы фибробластов, которые также состоят из актина и
миозина. Сходство объясняется общим происхождением лейо-
миоцитов и фибробластов из мезенхимы. Н.Г.Хлопин (1949)
рассматривал гладкую мускулатура позвоночных как развиваю-
щуюся дивергентно разновидность клеток волокнистой соеди-
нительной ткани.
Помимо того, что лейомиоциты разделяют по их основной
функции на конктрактильные и секреторные, их можно клас-
сифицировать и по другим физиологическим и генетическим
признакам. В настоящее время ГМК делят на фазные и тони-
ческие.
Фазные лейомиоциты, находящиеся в выносящих канальцах
семенников, матке, тонкой кишке и портальной вене, имеют
слаборазвитый СР и хорошо развитый ГЭР. Их миофиламенты
способны к довольно быстрому сокращению и имеют “бы-
стрые” изомеры легкой цепи миозина (LC 17а) и "вставку” из
116
семи аминокислотных остатков в тяжелой цепи миозина. Эти
клетки генерируют ПД.
Тонические лейомиоциты, находящиеся преимущественно в
стенках сосудов и сфинктерах полых органов, способны к
медленным сокращениям с низкой скоростью укорочения и к
выполнению “запирательной” функции. Они имеют другую
изоформу легкой цепи миозина (LC 17b) и не содержат “вста-
вок” из семи аминокислотных остатков в тяжелой цепи мио-
зина. Эти клетки не генерируют ПД.
Различают также лейомиоциты, способные к ритмическим
спонтанным сокращениям и не способные к такой ритмике. Пер-
вая разновидность ГМК осуществляет медленное ритмическое
сокращение мышечных стенок полых органов: желудка, моче-
точников, желчного пузыря, кишечника (см. рис. 69). Они
сохраняют спонтанную ритмическую деятельность при полной
денервации мышечного слоя (например, перистальтика в ки-
шечнике). Неритмически сокращающиеся лейомиоциты рас-
полагаются в сфинктерах полых органов: мочевого пузыря,
желчного пузыря, уретры, заднего прохода.
По происхождению из разных закладок гладкую мускулату-
ру можно разделить на мезодермальную (мезенхимную) и экто-
дермальную (мионейральную, миоэпителиальную и дермаль-
ную). Мезодермальная мускулатура преобладающая, образуется
путем миграции клеток из спланхнотомов. Это лейомиоциты
сосудов, стромы и оболочек внутренних органов (см. рис.
69—71). Мионейралъная гладкая мускулатура входит в состав
мышц, расширяющих и суживающих зрачок (см. рис. 72). Она
развивается из наружного листка глазного бокала, продолже-
ния пигментного эпителия. Лейомиоциты, суживающие зра-
чок, веретеновидные, а расширяющие — отростчатые, имеют
многочисленные митохондрии и содержат пигментные грану-
лы. Эти мышцы богато иннервированы. Миоэпителиальные
лейомиоциты располагаются под базальной мембраной конце-
вых отделов и протоков потовых, молочных и слюнных желез.
Они звездчатые или веретеновидные и содержат, кроме акти-
новых и миозиновых филаментов, промежуточные цитокера-
тиновые фибриллы, характерные только для эпителиальных
тканей, что подтверждает их эпителиальное происхождение.
Некоторые авторы [Данилов Р.К., 1994] относят эти клетки к
миоидным. Дермальные лейомиоциты образуют мышцы, подни-
мающие волосы (см. рис. 73).
К “особым” типам гладких миоцитов относят также юкс-
тагломерулярные (эндокринные) лейомиоциты, входящие в со-
став стенок артериол почечных телец. Они отличаются нали-
чием секреторных гранул, содержащих ренин, и редукцией
сократительного аппарата.
Такими “особыми” клетками считают и миофибробласты,
которые способны как к выработке волокон соединительной
117
ткани, так и к сокращению. Их обнаруживают в регенерирую-
щей соединительной ткани, где они участвуют в репаративных
процессах.
ИННЕРВАЦИЯ ГЛАДКОЙ МЫШЕЧНОЙ ТКАНИ
И ПЕРЕДАЧА ВОЗБУЖДЕНИЯ
Не все ГМК имеют нервно-мышечные синапсы. Те клетки,
которые снабжены синапсами, названы “ключевыми”. От них
потенциал передается другим лейомиоцитам через нексусы.
Миоциты активируются также медиаторами из варикозных
расширений терминалей, расположенных на расстоянии не
менее 100 нм, путем диффузии этих веществ. В отличие от
поперечнополосатых мышц в гладкой мускулатуре имеется и
возбуждающая, и тормозящая иннервация. Так, в гладких мыш-
цах матки, пищеварительного тракта и бронхов возбуждающим
медиатором служит ацетилхолин, а тормозным — норадрена-
лин. В гладкой мускулатуре сфинктера мочевого пузыря и
сосудов возбуждающим медиатором является норадреналин, а
тормозным — ацетилхолин. Он же оказывает тормозное дейст-
вие на пейсмекерные клетки сердца.
В зоне близкого контакта нервного волокна и миоцита в
варикозном расширении не обнаруживается шванновской обо-
лочки, но находится много пузырьков и митохондрий. Базаль-
ная мембрана в этом месте исчезает, а под плазмолеммой
миоцита выявляют скопления везикул — единственный при-
знак постсинаптической специализации.
В эфферентных нервных окончаниях находятся светлые си-
наптические пузырьки диаметром 30—60 нм, содержащие аце-
тилхолин и преобладающие среди терминалей на лейомиоци-
тах. В этих клетках в ряде органов (в том числе в бронхах)
очень редко встречаются терминали, богатые крупными вези-
кулами (100—200 нм), содержащими плотную сердцевину. В та-
ких везикулах обнаруживается норадреналин. Эти адренерги-
ческие эффекторы находятся на расстоянии 1000—3000 нм от
миоцита, что, однако, не является препятствием для их меди-
аторного воздействия. Описаны участки терминалей, находя-
щиеся на расстоянии 100—150 нм от плазмолеммы миоцита.
В таких терминалях много мелких овальных митохондрий. Это
чувствительные окончания, встречающиеся также в миокарде
и проводящей систоле сердца.
На основе разной иннервации ГМК была разработана клас-
сификация мышц, согласно которой их разделяют на три типа:
А, В и С (рис. 76) [Bumstock, 1968].
Для мышц типа А (цилиарной, выносящих канальцев семен-
ника) характерно, что все клетки имеют тесные нервно-мы-
шечные связи, электрические соединения. Эти клетки способ-
118
'ШИШ.
i Прямая иннервация ключевых клеток
Непрямая иннервация сопряженных клеток
| | Неиннереируемые клетки
I Низкорезистентный пуп»
>•> Варикозные нервные волокна
Рис. 76. Автономная иннервация гладкой мускулатуры [G.Bumstock,
1970].
А, В и С - типы мышечного волокна.
ны к быстрому одновременному сокращению, не генерируют
ПД. Миоциты таких мышц называют “ключевыми”.
Для мышц типа В (мочевого пузыря, семенного пузырька,
констриктора зрачка, кольцевой мускулатуры кишечника и
бронхов) характерно, что многие клетки (20—50 %) являются
“ключевыми”, остальные — “сопряженными” (coupled), не ин-
нервируемыми непосредственно, но связанными с “ключевы-
ми” клетками электротонически. Частично "сопряженные”
119
клетки возбуждаются медиаторами, выделяемыми нервными
варикозными терминалями. Все клетки этого типа деполяри-
зуются при нервном возбуждении и способны к генерации и
распространению ПД.
Для мышц типа С (продольная мускулатура пищеваритель-
ного тракта, матки, уретры, сосудов) характерно малое коли-
чество "ключевых” клеток. Основная масса таких клеток об-
ладает спонтанной активностью, ПД и имеет много межкле-
точных соединений, электротонические связи. Между клетка-
ми типов В и С существует много межклеточных соединений,
и вместе с “ключевыми” клетками они образуют эффекторные
пучки (см. рис. 76) [Bulbring Е. et al, 1970].
Классификация гладкой мускулатуры
I. По скорости сокращения
Фазная: в матке, тонкой киш- Тоническая: в сосудах и сфинкте-
ке, портальной вене, vas deferens pax полых органов
II. По ритму сокращения
Ритмическая: в желудке, ки- Неритмичсская: в сфинктерах мо-
шеннике, желчном пузыре чевого пузыря и желчного пузы-
и мочевом пузыре ря, уретры, заднего прохода
III. По происхождению
Эктодермальная:
1) нейральная (мионейральная;
гладкие миопигментоциты
радужки);
2) эктомезенхимная (дермальная,
в мышце, поднимающей волос);
3) эпидермальная (миоэпители-
альная; в слюнных, потовых
и молочных железах)
Мезодермальная (спланхноме-
зенхимная):
1) висцеральная (в оболочках
и строме);
2) сосудистая (в венах, артери-
ях, капиллярах)
IV. По тканевой организации
Образующие пучки: в мочевом Не образующие пучков: кольце-
пузыре, vas deferens вая мускулатура матки
V. По иннервации
Тип А
Все клетки “ключе-
вые”, с индивидуаль-
ной иннервацией, нет
распространения ПД
(в цилиарной мышце,
vas deferens)
Тип В
Преобладают “сопря-
женные” клетки с ще-
левыми соединения-
ми, распространяют
ПД (в мочевом пузы-
ре, кольцевой муску-
латуре кишечника,
констрикторе зрачка)
Тип С
Преобладают неин-
нервированные клет-
ки, мало “ключевых”
и “сопряженных”, рас-
пространяют ПД (в
продольной мускула-
туре пищеварительно-
го тракта, матке, сосу-
дах); спонтанно ак-
тивны
120
Следует отметить, что регуляция активности ГМК осущест-
вляется не только нервными факторами, но и воздействием
биологически активных веществ (серотонин, простагландины,
бомбезин, холецистокинин, ВИП, опиоиды и др.)- Во время
родов сокращение матки стимулируется гормоном окситоци-
ном. Спонтанная ритмическая деятельность лейомиоцитов
обусловливается их растяжением, вызывающим деполяриза-
цию сарколеммы и приток ионов Са2+, которые вследствие
ритмической активности кальциевых насосов ритмически про-
никают в клетку. Такой миогенный ритм с периодом около
1 мин особенно характерен для ГМК матки, кишечника и
мочевыводящих путей.
РАЗВИТИЕ ГЛАДКОЙ МЫШЕЧНОЙ ТКАНИ
(ЛЕЙОМИОГИСГОГЕНЕЗ)
Гладкомышечная ткань развивается главным образом из
спланхнотамов, дифференцирующихся из мезодермы. Из спланх-
нотомов происходит выселение мезенхимных клеток, дающих
начало эндотелию, клеткам крови, соединительной ткани и
гладкой мускулатуре. В дифференцирующихся лейомиоцитах
сначала появляются только тонкие филаменты. Сильно разви-
ваются ГЭР и аппарат Гольджи. Постепенно размер клеток
увеличивается, пучки миофиламентов начинают располагаться
более упорядоченно, появляются толстые нити и микротрубоч-
ки; хорошо заметны центриоли. Затем возрастает число фила-
ментов, тогда как объем других органелл снижается (рис. 77).
На каждой стадии миогенеза ультраструктура меченных ра-
диоактивным тимидином миоцитов соответствует среднему
уровню дифференцировки окружающих немеченых клеток.
При митозе сократительный аппарат лейомиоцитов почти не
изменяется, но все же уменьшается, особенно вокруг ядер, и
снижается количество плотных телец. В процессе гистогенеза
значительно (в 1,5 раза) возрастает длительность S- и Gi-пе-
риодов и увеличивается число клеток, выходящих в Go-фазу.
У взрослых животных малое число лейомиоцитов метится ти-
мидином (0,3 %), такие клетки относят к статической популя-
ции. При определенных условиях лейомиоциты могут возвра-
щаться в митотический цикл и делиться митозом. Такое явле-
ние наблюдается в миоцитах матки при беременности, а также
при травмах и атеросклерозе мышечной ткани других органов.
При этом процент меченных тимидином клеток возрастает до
10—30. Не исключено, что увеличение гладкомышечной ткани
может происходить за счет добавления новых клеток, диффе-
ренцирующихся не только из предшественников ГМК, но
также из фибробластов.
В лейомиогенезе, как и в кардиомиогенезе, дифференци-
121
Рис. 77. Клеточно-дифферонная организация гладкой мышечной тка-
ни бронхов (в онтогенезе мыши).
1 — индукция миогенеза бронхиальным эпителием, 13-е сутки эмбриогенеза;
2 — миобласты на 13—17-е сутки; 3 — подрастание нервов (Н), появление
прикрепительных полосок (ПП), везикул (В) и плотных телец (ПП) на 14—15-е
сутки эмбриогенеза; 4 — 17—18-е сутки эмбриогенеза. Происходят (не пока-
занное на схеме) врастание нервных стволов и образование синапсов с “клю-
чевыми” клетками.
рующиеся одноядерные клетки длительно совмещают синтез
ДНК и митоз с миофибриллогенезом. В эмбриональном гис-
тогенезе трудно отличить недифференцированный предшест-
венник фибробластов от лейомиоцитов. По мере развития раз-
меры ГМК и число миофиламентов в них возрастают. Проли-
феративная активность в ходе развития лейомиоцитов снижа-
ется, а продолжительность клеточного цикла увеличивается.
Напомним, что сателлитов в гладкой мускулатуре нет.
На примере лейомиоцитов бронхов мышей А.Л.Зашихиным
(1994) была предложена новая схема лейомиогенеза (см. рис. 77).
По мнению автора, гладкая мышечная ткань бронхов представ-
122
ляет собой единый дифферон, развивающийся из стволовой
мезенхимной клетки на основе детерминации и ранней интег-
рации лейомиоцитов в единую тканевую систему. Она образо-
вана лейомиоцитами различного уровня дифференцировки, раз-
ного метаболизма и различной степени реактивности на про-
лиферативные стимулы. В эмбриональном гистогенезе источ-
ником образования лейомиоцитов являются малодифференци-
рованные мезенхимные предшественники. В динамике специфи-
ческой дифференцировки лейомиоциты проходят этапы преми-
областа, миобласта, дифференцирующихся и дифференцирован-
ных миоцитов (лейомиоцитов). Дифференцировка миогенных
элементов у мышей индуцируется клетками бронхиального
эпителия на 13-й день эмбриогенеза. На 17—18-е сутки про-
исходят врастание нервных стволов и образование синапсов с
“ключевыми” клетками. С увеличением степени зрелости глад-
кой мышечной ткани процессы дифференцировки начинают
преобладать над процессами пролиферации (на 18—22-е сут-
ки). Дифференцировка проявляется в образовании у лейомио-
цитов сократительного аппарата (миофиламенты, кортикаль-
ные везикулы, прикрепительные полосы, плотные тельца), а
также межклеточных соединений,- обеспечивающих интегра-
цию лейомиоцитов в кластеры. Происходят изменение синтеза
белка в цитоплазме этих клеток, замена виментиновых фила-
ментов на десминовые (не во всех органах), появление миози-
новых филаментов. К кластерам подрастают нервные волокна.
В постэмбриональном гистогенезе гладкой мышечной ткани
происходит дальнейшее снижение индекса синтезирующих ДНК
клеток, относящихся к малым лейомиоцитам (малодифферен-
цированным предшественникам). Часть малых лейомиоцитов
представляет собой растущие, активно синтезирующие белок
клетки. Происходит увеличение средних размеров лейомиоци-
тов. Проявлением тканевой дифференцировки можно считать
формирование гетероморфии. К 6—7-му месяцу жизни мыши
происходят стабилизация морфометрических характеристик
лейомиоцитов и установление постоянного соотношения в ткани
разных субпопуляций лейомиоцитов. Первые примитивные
нервно-мышечные связи у лейомиоцитов формируются на 14—
15-е сутки эмбриогенеза путем врастания нервных терминалей
в зачаток легкого. Образование локальных нервно-мышечных
контактов происходит в постнатальном гистогенезе на 10—15-е
сутки за счет врастания отдельных безмиелиновых пучков
нервных волокон в промежутки между гладкими миоцитами.
В дефинитивной мышечной ткани различают субпопуляции
малых, средних и больших лейомиоцитов. Субпопуляция малых
лейомиоцитов характеризуется наиболее высокой пролифератив-
ной активностью. Часть этих клеток может быть отнесена к
малодифференцированным предшественникам. Другая часть
малых лейомиоцитов активно синтезирует белки и способна уве-
123
личиваться в размерах. Средние лейомиоциты в зависимости от
функционального состояния могут быть светлыми или темными.
Первые — релаксированные, а вторые — сокращенные. Это наи-
более представительная и стабильная популяция. Большие мио-
циты являются самыми малочисленными. В них не наблюдается
полиплоидии ядер. Они отличаются высокой чувствительностью
к повреждающим факторам, сохраняют способность к однократ-
ному делению и представляют собой терминальное звено мета-
болического дифферона. Интеграция миоцитов и их различный
уровень реактивности в популяции обусловливают высокую плас-
тичность всей системы.
Особый интерес представляет развитие ГМК у человека.
Рассмотрим гистогенез гладкой мышечной ткани сосудов и
миометрия, а также сопоставим этот процесс с изменениями
лейомиоцитов матки во время беременности, родов и в после-
родовом периоде. Анализ экспрессии цитоскелетных и сокра-
тительных белков выявил гетерогенность ГМК в сосудах на
всех этапах эмбриогенеза человека [Нанаев А.К., 1997]. У эмб-
рионов в ГМК аорты экспрессируется как мышечный (SM),
так и немышечный (NM) типы миозина. В самой незрелой
популяции лейомиоцитов преобладают NM-изоформы, выяв-
ляемые моноклональными антителами NM-F6. Эти данные
свидетельствуют, что миозин может быть использован как мар-
кер различных стадий дифференцировки ГМК и характеризо-
вать динамику изменений популяции ГМК сосудов в различ-
ных возрастных периодах, а также в условиях патологии.
При изучении локализации промежуточных филаментов в
ГМК было показано, что клетки эмбриональной аорты чело-
века на 18—20-й неделе развития эмбриона десминнегативны,
но содержат виментин. На 39—40-й неделе развития в аорте
наряду с преобладающими десминнегативными ГМК выявля-
ются десминположительные. В постнатальном периоде в аорте
и крупных артериях (бедренная, плечевая) характерно наличие
десминотрицательных ГМК в интиме и единичных десминпо-
ложительных ГМК в среднем слое. По многим улыраструкгур-
ным и биохимическим характеристикам фенотип ГМК внут-
ренней оболочки аорты приближается к эмбриональному. Для
вен на всех этапах эмбриогенеза и постнатального развития
характерны десминположительные ГМК.
Выявленные фенотипические особенности ГМК сосудов в
эмбриогенезе позволяют оценить их изменения в патологии,
например, при атеросклерозе.
В миометрии женщины популяция ГМК также гетерогенна
на всем протяжении онтогенеза, о чем свидетельствуют имму-
ноцитохимические исследования SM-актина, виментина, ядер-
ного антигена пролиферирующих клеток PCNA и др. [Безну-
сенко Г.В., Миронов А.А. и др., 1995].
В миометрии плода 12—14 нед ГМК расположены в межкле-
124
точном веществе и образуют 3 слоя: средний — с циркулярной
ориентацией ГМК, который иногда рассматривают как часть
наружного слоя, наружный и внутренний — с радиальной ори-
ентацией. Выражен полиморфизм ГМК (округлые безотрост-
чатые и звездчатые клетки). Длина этих клеток не превышает
10—12 мкм; ядерно-цитоплазматический индекс высокий
(около 0,5). Пролиферативная активность ГМК внутреннего
слоя выше, чем в других слоях. Клетки, экспрессирующие
PCNA, распределены в фетальном миометрии равномерно. Ти-
пичные (зрелые) ГМК не идентифицируются. Почти все клет-
ки дают отрицательную или слабоположительную реакцию на
SM-актин. О низкой дифференцированности ГМК свидетель-
ствует слабая реакция на виментин. Таким образом, в этот
период развития в миометрии преобладают малодифференци-
рованные ГМК.
На 20—22-й и 24—26-й неделе развития в миометрии плода
хорошо развиты два слоя — наружный и внутренний. В наруж-
ном слое выделяются 2 зоны: поверхностная субсерозная (5—
10 % от толщины миометрия) и сосудистая (40—50 % от тол-
щины миометрия) — зачаток будущего среднего (сосудистого)
слоя матки.
В поверхностной зоне содержатся в основном (86,6 %) ГМК удлинен-
ной формы с максимальным размером около 15—20 мкм. Ядерно-цито-
плазматический индекс в них понижен до 0,28, в цитоплазме орга-
неллы развиты незначительно, имеются филаменты. Второй тип ГМК
представлен более крупными клетками (20—40 мкм). В них ядерно-
цитоплазматический индекс снижен до 0,14. Филаменты более выра-
жены, имеют диаметр около 6—7 нм. Среди ГМК поверхностной зоны
имеются 2 субпопуляции клеток: PCNA-позитивные и PCNA-нега-
тивные. Первый тип клеток не имеет развитого сократительного ап-
парата, дает слабоположительную или отрицательную реакцию на
SM-актии. Это малодифференцированные формы. В более дифферен-
цированных ГМК SM-актин хорошо выявляется.
В сосудистой эоне среди ГМК имеются оба описанных типа клеток,
а также ГМК отростчатой формы — звездчатые и Y-образные. В послед-
них хорошо развит синтетический аппарат и слабо представлены фила-
менты, что позволяет отнести их к “синтетическому” типу ГМК PCNA-
положительные лейомиоциты располагаются преимущественно в пери-
васкулярных зонах миометрия. ГМК сосудистой зоны дают положи-
тельную реакцию на SM-актин и отрицательную — на виментин.
Во внутреннем слое миометрия ГМК сходны с клетками поверх-
ностной зоны наружного слоя, но имеют меньше сократительных
филаментов и чаще встречаются PCNA-положительные.
Субпопуляция ГМК сосудистой зоны обеспечивает основной пролифе-
ративный пул миометрия. Интенсивно пролиферирующие перициты но-
вообразованных сосудов являются источником формирования соедини-
тельнотканных клеток и, вероятно, лейомиоцитов миометрия.
Как отмечалось, при беременности увеличение массы матки
женщины происходит в основном за счет гипертрофии ГМК.
125
Тем не менее процессы, происходящие в этом органе, имеют
определенное сходство с явлениями, присущими миоцитам
матки в ее эмбриогенезе. Так, в начальном периоде (12—14 нед
беременности) наряду с гипертрофией ГМК выражены и про-
цессы гиперплазии. При этом большая часть лейомиоцитов
образуется из периваскулярных зон, где располагаются пери-
циты, экспрессирующие антигены пролиферации (2А-7). Ос-
новная масса ГМК в это время бывает собрана в труппы, и
миоциты отличаются полиморфизмом (веретеновидные, звезд-
чатые, Y-образные). Большинство ГМК дает положительную
реакцию на SM-актин, реакция на виментин отрицательная
или слабоположительная.
В сроки 20—26 нед беременности ГМК матки женщины
представлены “синтетическим” и “промежуточным” типами
(по классификации Campbell, 1985). Типичные ГМК не экс-
прессируют PCNA, в них в равной мере развиты синтетический
аппарат и актиновые филаменты. В увеличении массы миомет-
рия к началу II триместра беременности принимают участие
два механизма — пролиферация ГМК и их гипертрофия. В бо-
лее поздние сроки пролиферация снижается и мышечная масса
увеличивается почти исключительно за счет гипертрофии.
К концу III триместра беременности в миометрии преобладают
ГМК “сократительного” типа, являющиеся более дифферен-
цированными формами.
Таким образом, в процессе онтогенеза в миометрии плода
12—13 нед развития содержатся в основном мезенхимные (мало-
дифференцированные) клетки, в которых отсутствует специфи-
ческий для ГМК актин. В дальнейшем эти клетки дифферен-
цируются в ГМК “синтетического” и “сократительного” фено-
типов.
У беременной женщины к началу II триместра масса миомет-
рия увеличивается в основном за счет пролиферации ГМК “син-
тетического” типа в периваскулярных зонах. В более поздние
сроки (20—26 нед беременности) увеличение массы миометрия
происходит за счет выраженной гипертрофии ГМК, интенсивно
экспрессирующих специфический актин. Ядерный антиген проли-
ферирующих клеток (PCNA) при этом не выявляется, что сви-
детельствует об отсутствии пролиферации лейомиоцитов.
Целесообразно остановиться более детально на ГМК мио-
метрия небеременной женщины, поскольку матка является
хорошим объектом для рассмотрения морфофункциональных
особенностей лейомиоцитов в период относительного покоя
(матка небеременной), подготовки к активной функции (бере-
менность), интенсивного сокращения во время нормальных
родов и при слабости родовой деятельности [Персианинов Л.С.,
1975].
Число ГМК в матке небеременной женщины составляет
около 200 биллионов. Структура ГМК соответствует описанию
126
контрактильных миоцитов, среди которых электронно-микро-
скопически различают клетки с гладкой поверхностью (рас-
слабленные) и большим числом пиноцитозных везикул и ми-
оциты со складчатой поверхностью (сокращенные) и умень-
шенным числом пиноцитозных пузырьков. Первая разновид-
ность лейомиоцитов является преобладающей.
При беременности масса матки увеличивается в 12—18 раз
за счет новообразования ГМК путем деления малодифферен-
цированных клеток, но главным образом в результате гипер-
трофии лейомиоцитов. ГМК матки обладают способностью к
синхронизации сокращения, что обусловлено проведением
возбуждения по системе клеточных мембран, обеспечивающих
МП и ионную проводимость. Как отмечалось, ГМК матки
характеризуются спонтанной контрактильной активностью,
автоматической выработкой импульсов для периодических со-
кращений (ауторитмия). В генерации ПД главная роль принад-
лежит Са2+ и калий-натриевому насосу.
Проведение возбуждения осуществляется посредством специ-
ализированных щелевых соединений (нексусов). Функциональной
единицей проведения возбуждения служит группа параллельно
расположенных клеток. Генерировать потенциалы способны все
ГМК матки, но водителем ритма (пейсмекером) считают группу
клеток, в которых возникают локальные потенциалы. По мнению
большинства исследователей, водителем ритма в миометрии яв-
ляется группа клеток кольцевой мускулатуры в области дна
матки, вблизи прикрепления маточных труб, откуда импульсы
распространяются на все отделы матки.
ГМК миометрия имеют многочисленные рецепторы. Среди
них особую роль играют хеморецепторы для ацетилхолина,
катехоламинов, серотонина и гистамина. В настоящее время в
ГМК выявлены также а- и p-адренорецепторы и М-холиноре-
цепторы.
Во время беременности размеры ГМК в длину увеличива-
ются, достигая 500 мкм; возрастают объем ядер, число и раз-
меры органелл и включений. Значительно увеличивается со-
держание свободных рибосом, миофиламентов, пиноцитозных
пузырьков, элементов ГЭР и аппарата Гольджи.
Цитохимическими методами выявляется увеличение содержания
гликогена, РНК, повышение активности фосфорилазы, гликогенсин-
тетазы, сукцинатдегидрогеназы, кислой фосфатазы. Прн беременнос-
ти содержание сократительных белков в ГМК увеличивается с макси-
мумом к ее окончанию (почти на 50 %). Установлено, что в конце
беременности эстрогены, синтезируемые в плаценте из андрогенов
надпочечников плода, поступают в цитоплазму ГМК миометрия, где
образуют комплексы с белками и переносятся в ядра [De Sombre et
al., 1972). Под влиянием эстрогенов в ядрах синтезируется своеобраз-
ная РНК Уменьшение содержания такой РНК может привести к
нарушению синтеза сократительных белков.
127
При беременности в миометрии вдвое возрастает концентрация
полиаминов (спермина, спермидина) и снижается активность моно-
аминоксидазы, разрушающей амины, в том числе серотонин. Вслед-
ствие этого содержание серотонина в матке возрастает. Энергообес-
печение сократительной функции ГМК при беременности усиливает-
ся. Происходит накопление гликогена (в 10 раз по сравнению с
маткой небеременной женщины). Увеличивается активность глико-
генсинтетазы и фосфорилазы, возрастает концентрация аденозин- и
креатинфосфатов (примерно в 2 раза). К моменту родов увеличива-
ются содержание молочной кислоты, активность ферментов гликоли-
за и дегидрогеназ. Скорость распространения возбуждения возрастает
в 20 раз, а мембранный потенциал (МП) снижается вдвое.
В условиях нормальной родовой деятельности ГМК сильно
укорачиваются и увеличивается их поперечник. Поверхность
лейомиоцитов становится неровной, ядра складчатыми, а мио-
филаменты приобретают упорядоченное расположение. Отме-
чаются истончение, разрывы и лизис соединительнотканных
“чехликов”, окружающих ГМК, что создает возможность для
перемещения лейомиоцитов в миометрии. При сокращении
матки происходят деполимеризация сократительных белков (ак-
тина и миозина), снижение содержания гликогена и накопле-
ние липидов; усиливается активность ряда ферментов: АТРазы,
диафораз, кислой фосфатазы и ферментов пентозного цикла.
Содержание серотонина, усиливающего сокращение ГМК при
нормальной родовой деятельности в первом периоде родов,
становится в 2 раза больше, чем при беременности 37—38 нед.
В механизме сокращения миометрия при родах важную роль
играет растягивание стенки матки увеличивающимся в разме-
рах плодом. Гипертрофия и гиперплазия миометрия сопровож-
даются перераспределением спиральных пучков ГМК (раскру-
чиванием). В регуляции моторной функции матки участвуют
нервная и эндокринная системы. Рецепторы матки получают
импульсы от развивающегося плода, что приводит к измене-
ниям тонуса и моторики органа. В миометрии имеются сим-
патические (адренергические) и парасимпатические (холинер-
гические) нервные терминали. При беременности преобладает
тонус симпатического происхождения, усиливается содержа-
ние адреналина и норадреналина, вызывающих торможение
моторики матки. Во время родов повышается активность пара-
симпатической системы, увеличивается секреция ацетилхоли-
на, который стимулирует сильные сокращения. Ритмичность
сокращения матки при родах связана с тем, что накопившийся
ацетилхолин разрушается периодически ферментом ацетилхо-
линэстеразой.
В послеродовом периоде в миометрии наблюдаются разобще-
ние ГМК, нарушение их контактов. Фенотип ГМК варьирует
в широких пределах — от "синтетического” до "сократитель-
ного”, но процент ГМК "сократительного” типа выше, чем в
128
матке беременной женщины. В механизмах послеродовой ин-
волюции матки играет роль апоптоз. Увеличение интенсивнос-
ти апоптоза связано с ростом числа клеток с признаками их
терминальной дифференцировки (Busch W., Lancer В., 1984].
Результаты изучения фенотипов ГМК в матке при ее различ-
ных функциональных состояниях используются для анализа
популяции ГМК плода, сходной с ГМК и мезенхимальными
клетками матки. Эти клетки имеют звездчатую форму, “син-
тетический” или “промежуточный” фенотипы, т.е. сочетают в
себе черты как ГМК, так и фибробластов.
РЕГЕНЕРАЦИЯ И ПАТОЛОГИЧЕСКАЯ ГИСТОЛОГИЯ
ГЛАДКОЙ МЫШЕЧНОЙ ТКАНИ
Гладкая мышечная ткань способна к регенерации, что было
показано на примерах лейомиоцитов кишечника, желудка, мо-
четочника, мочевого пузыря, матки, сосудов, бронхов. При
этом лейомиоциты вступают в митоз, но в основном гипертро-
фируются. Так, на 3-й день после раздавливания мышц кишеч-
ника возрастает процент митозирующих клеток (до 1,5), а на
5-й день — до 2,5. В случае полного удаления мочевого пузыря
у кролика и помещения на его место пластмассового протеза
последний обрастал мышцами и начинал сокращаться. У жен-
щин, перенесших кесарево сечение, отсутствуют рубцы на мат-
ке вследствие восстановления мышечной ткани. Регенерирует
и мышечная ткань сосудов. Пролиферативная реакция мышеч-
ной ткани бронхов в условиях моделирования викарной гипер-
трофии легкого проявляется в активации пролиферации не
только в субпопуляции малодифференцированных предшест-
венников, к которым относятся малые лейомиоциты, но и в
популяции более дифференцированных лейомиоцитов [Заши-
хин AJL, 1994].
Встречаются заболевания, при которых ведущим патогене-
тическим звеном является изменение ГМК. К таким заболева-
ниям прежде всего относятся атеросклероз и гипертония, при
которых происходит нарушение размножения, дифференци-
ровки и сократительной деятельности ГМК сосудов. Другим
примером может служить нарушение деятельности миометрия,
приводящее к распространенной патологии — слабости родо-
вых сил.
Не пытаясь дать исчерпывающую характеристику особен-
ностей ГМК при этих патологических состояниях, что является
предметом патологической анатомии, мы коротко охарактери-
зуем изменения ГМК аорты при атеросклерозе и миометрия
при патологии родовой деятельности.
При гистологическом анализе атеросклеротических бляшек
аорты, кроме типичных десминнегативных лейомиоцитов, об-
129
наруживаются ГМК, содержащие десмин. Такие клетки лока-
лизуются в “покрышке” бляшки, имеют вытянутую форму и
экспрессируют миозин, две формы актина, виментин и фила-
мин. Кроме того, в бляшке выявляются клетки, которые не
реагируют с антителами к миозину. Эти миозиннегативные
клетки располагаются по краю бляшки, в зоне ее перехода в
нормальную Lintima. Они имеют вытянутую форму, не экс-
прессируют десмин и G-актин, но содержат виментин и F-
актин и связываются с антителами к ГМК.
Таким образом, в атеросклеротических бляшках аорты (и
коронарных артерий) находится по крайней мере три фенотипа
ГМК: десминнегативные (типичные), десмишюзитивные и мио-
зиннегативные. Десминпозитивные клетки имеют относительно
крупные размеры, просветленный матрикс цитоплазмы, содержа-
щий значительное количество везикул, разветвленный ГЭР и ком-
плекс Гольджи; обильные пучки миофиламентов распределены не-
равномерно и по периферии клеток. Миозиннегативные ГМК име-
ют сильно развитый ГЭР и КГ, множество пиноцитозных везикул
и отдельные пучки миофиламентов. Десминнегативные лейомио-
циты содержат SM-миозин, две формы актина и виментин.
Появление по крайней мере трех субпопуляций ГМК в
атеросклеротических бляшках связано с изменением фенотипа
ГМК с “сократительного” на “синтетический”. При этом ГМК
приобретают способность к пролиферации, миграции во вну-
тренний слой и экспрессии немышечного миозина. Такие яв-
ления рассматриваются как ключевые моменты патогенеза ате-
росклероза [Бабаев В.Р., 1992; Ros S., 1993]. Результаты иссле-
дований экспрессии разных форм миозина в атеросклероти-
ческих бляшках после воздействия на них антагонистов ионов
Са2+ позволили установить, что последние снижают экспрес-
сию немышечного миозина и способствуют восстановлению
популяции ГМК с гладкомышечным миозином, характерным
для зрелых лейомиоцитов (десминнегативных).
Так, антагонист Са2+ нифедипин предупреждает развитие атеро-
склеротических повреждений на экспериментальных моделях и у
больного. В превентивном эксперименте область утолщения внутрен-
него слоя аорты кролика уменьшалась в несколько раз, и этот слой
приобретал нормальный вид. Иногда в незначительных утолщениях
внутреннего слоя большинство ГМК хотя и имело двойную метку
антителами к SM и NM, ио абсолютное содержание таких клеток
было значительно снижено по сравнению с контролем (рис. 78). При
этом в средней оболочке аорты незрелый тип миозина исчезал, а во
внутренней значительно редуцировался [Nayler W.G., 1991; Pauletto Р.
et al., 1994|.
В культуре ГМК, изолированных из среднего слоя артерии под
влиянием нифедипина, наблюдалась трансформация ГМК с подавле-
нием миграции этих клеток.
Использование моноклональных антител SM-E7 и NM-G2 для
изучения первичной культуры ГМК из аорты кролика показало, что
130
Рис. 78. Распределение изоформ иммунореактивного миозина в атеросклеро-
тической аорте кролика (по P.Pauletto et al., 1994, с изменениями).
а — без воздействия нифедипина; б — при лечении нифедипином; I — внутрен-
няя оболочка; II — внутренняя эластическая мембрана (membrane clastica in-
terna); III — средняя оболочка; 1 — ГМК, содержащие как гладкомышечный,
так и немышечный миозин; 2 — клетки с немышечным миозином; 3 — ГМК
с гладкомышечным миозином. Видно, что при лечении нифедипином в сред-
ней оболочке исчезают миоциты с немышечным миозином и снижается число
клеток, содержащих как гладкомышечный, так и немышечный миозин.
большинство клеток связывает оба антитела. После инкубации куль-
туры ГМК с антагонистом Са2+ (нифедипином) почти все клетки
оказываются меченными только антителами к зрелым лейомиоцитам
(SM-E7), и лишь немногие имели двойную метку (SM-E7 и NM-G2)
или только NM-G2.
131
Итак, антагонисты ионов Са2+ участвуют в подавлении экс-
прессии немышечного миозина и усиливают дифференцировку ГМК.
Применение антагонистов ионов Са2+ и комплекса ионов Са2+ с
кальмодулином оказывает влияние на ГМК сосудов, приводя к фе-
нотипическим изменениям, ингибиции репликации ДНК, росту и
миграции этих клеток и подавлению синтеза коллагена в них.
С возрастом происходит диффузное утолщение внутренней
оболочки магистральных артерий человека, сопровождающееся
образованием в них мышечно-эластического и протеогликано-
вых слоев. Это связано с возрастанием в последнем количества
“синтетического” фенотипа ГМК. Такие клетки принимают
активное участие в развитии липоидоза внутренней оболочки.
Считают, что именно ГМК принадлежит основная роль в
трансформации липидных пятен в зрелую фиброзную атеро-
склеротическую бляшку, при этом мелкие липидные вакуоли
располагаются как в теле, так и в отростках ГМК.
Установлено, что в развитии атеросклероза важная роль
принадлежит также трансформирующему фактору роста р (trans-
forming growth factor — TGF-p). Этот фактор в отличие от боль-
шинства цитокинов не индуцирует, а, напротив, ингибирует
пролиферацию большинства клеток [Roberts, Spom, 1994].
TGF-p способен индуцировать в культуре образование компо-
нентов экстрацеллюлярного матрикса и тормозить его разру-
шение. Увеличение содержания экстраклеточного матрикса,
возможно, связано с ингибирующим действием TGF-p на
скорость синтеза клетками внутренней оболочки ферментов,
участвующих в деградации коллагена и эластина. В ГМК экс-
прессия изоформ TGF-p по мере развития атеросклероза имеет
тенденцию к повышению, что свидетельствует об участии этого
фактора в процессах фиброзирования атеросклеротических по-
ражений [Ходакова Т.Г., 1998].
Одной из частых патологий миометрия является слабость
родовой деятельности.
При слабости родовой деятельности происходят многие мор-
фофункциональные изменения в ГМК. В отдельных участках
глубоких слоев миометрия появляются удлиненные ГМК со
слабой окрашиваемостью ядер и цитоплазмы и заметными
признаками дистрофии. Под электронным микроскопом на-
блюдаются локальные повреждения плазмолеммы, уменьшение
числа свободных рибосом, элементов ГЭР и митохондрий.
Миофиламенты утрачивают правильную ориентацию. Наблюд-
аются набухание митохондрий и разрушение крист; резко сни-
жается число пиноцитозных впячиваний плазмолеммы и вези-
кул. В цитоплазме снижается содержание гранул гликогена и
появляются липидные включения. Очевидно, в миометрии
женщин при слабой родовой деятельности снижается актив-
ность синтетического аппарата лейомиоцитов, вызывающая
уменьшение синтеза сократительных белков и, как следствие,
132
слабости родовых сил. Одновременно в ГМК уменьшается
содержание эстрогенов, серотонина, гликогена, усиливается
гликогенолиз и прогрессивно снижаются окислительные про-
цессы, активность гликогенсинтетазы и лактатдегидрогеназы,
в миометрии накапливается молочная кислота [Персиани-
нов Л.С., Железнов Б.Н., Богоявленская Н.В., 1975].
Для усиления родовой деятельности в клинической практи-
ке используют введение серотонина. Таким образом, как при
нормальном развитии беременности и родов, так и при ослаблении
родовой деятельности происходят значительные изменения цито-
физиологии лейомиоцитов, которые обладают высокой способнос-
тью к адаптации в разных физиологических и патологических
условиях. Фенотипические изменения ГМК наблюдаются не толь-
ко в матке, но ив других органах. Это происходит и в мышечных
оболочках сосудов, где в течение онтогенеза и в условиях пато-
логии в ГМК изменяются как сократимые белки, так и белки
цитоскелета.
Гистологической особенностью миоматозных узлов является
усиление гетерогенности ГМК: возрастает количество отрост-
чатых миоцитов. В периферической зоне узла начинают пре-
обладать клетки “синтетического” типа, отмечается повыше-
ние пролиферативной активности ГМК “синтетического” и
"промежуточного” типов, а также фибробластов и перицитов.
Размеры клеток увеличиваются, в них появляются признаки
апоптоза. Увеличение массы миоматозных узлов обусловлено
главным образом повышенной пролиферативной активностью
ГМК, особенно в периваскулярных зонах поверхностных слоев
узлов, пролиферацией фибробластов и перицитов, а также
умеренной гипертрофией ГМК.
Таким образом, лейомиоциты представляют собой гетероген-
ную и изменчивую популяцию клеток, что особенно наглядно
проявляется в условиях развития, повышенной активности и при
патологических состояниях гладкомышечной ткани.
П.П.Румянцев (1982) на основе изучения взаимосвязи про-
цессов пролиферации и дифференцировки при миогенезе со-
ставил таблицу (табл. 4).
Из данных табл. 4 видно, что в мышечных тканях своеоб-
разное соотношение процессов пролиферации и дифференци-
ровки: в элементах поперечнополосатого волокна в целом
(в одноядерных миобластах и миосимпластах) синтез ДНК и
синтез специфических мышечных белков исключают друг дру-
га. В сердечных миоцитах и ГМК конкурентных отношений
между процессами синтеза ДНК и специфических белков не
наблюдается. Эти данные позволили П.П.Румянцеву высказать
предположение, что поперечнополосатая мышечная ткань воз-
никла в процессе эволюции раньше гладкой и целомической,
так как ядра мышечных волокон уже успели утратить способ-
ность к синтезу ДНК. Это отвечает представлению о наиболь-
шей древности поперечнополосатой мускулатуры.
133
Таблица 4. Взаимосвязь процессов пролиферации и дифференцировки
при миогенезе
Тип миогенеза Синтез ДНК Митоз Синтез миофиб- рилл или мио- фила- ментов Слияние клеток
I. Соматический миогенез
А. Одноядерные миобласты:
премиобласты + с—- —
миобласты — — ±
Б. Многоадерные симпласты — ++++
II. Кардиомиогенез
Одноядерные миоциты +++ —
III. Лейомиогенез
Одноядерные миоциты + 4- ++ —
ЭЛЕМЕНТЫ СРАВНИТЕЛЬНОЙ ГИСТОЛОГИИ
ГЛАДКОЙ МЫШЕЧНОЙ ТКАНИ
ВИСЦЕРАЛЬНАЯ МЫШЕЧНАЯ ТКАНЬ
ПОЗВОНОЧНЫХ ЖИВОТНЫХ
Гладкая (висцеральная) мускулатура позвоночных очень по-
хожа по своей морфологии на гладкую соматическую мускула-
туру многих беспозвоночных. Однако это сходство поверхност-
ное и ограничивается формой миоцитов (веретеновцдные),
одноядерностью и наличием гладких миофиламентов или их
пучков (рис. 79 — см. вклейку). Имеются и глубокие различия
между этими тканями. У беспозвоночных гладкая мускулатура
тела произвольная, снабженная анимальной иннервацией, а
гладкая висцеральная мускулатура позвоночных обладает не-
произвольной сократимостью и вегетативной (симпатической
и парасимпатической) иннервацией. В противоположность
миобластическому способу регенерации соматической гладкой
мускулатуры беспозвоночных гладкие миоциты позвоночных
при повреждении не восстанавливают утраченной части и от-
мирают. Их убыль восполняется митотическим делением уце-
левших клеток, а возможно, и за счет дифференцировки кам-
биальных клеток соединительной ткани, например находящих-
ся в интиме кровеносных сосудов. Следует отметить, что мы-
шечная ткань сосудов и ряда других органов появилась только
у позвоночных; филогенетически она моложе не только мы-
шечной ткани соматического, но и целомического типа [За-
варзин А. А., 1985[.
134
ВИСЦЕРАЛЬНАЯ МЫШЕЧНАЯ ТКАНЬ
БЕСПОЗВОНОЧНЫХ ЖИВОТНЫХ
Висцеральная гладкая мускулатура беспозвоночных постро-
ена из ГМК. В эволюции, как считает А.А.Заварзин (1985), она
произошла из эпителиально-мышечных клеток или оседлых
клеток первичных паренхим предков многоклеточных живот-
ных. Висцеральная мускулатура беспозвоночных представлена
клетками двух типов. У одного типа хорошо выражены плот-
ные тела (аналоги линий Z), к которым прикрепляются тонкие
филаменты. У клеток другого типа плотные тела не выражены.
Последний тип плохо изучен. У миоцитов I типа миозиновые
нити свободно лежат в цитоплазме, а актиновые закреплены.
На поперечных срезах миоцитов не видно расположенных по
окружности тонких нитей вокруг толстых; миозиновые нити,
по-видимому, могут взаимодействовать с разным числом акти-
новых филаментов. Часть толстых нитей имеет пармиозиновый
стержень, на который наслаивается миозин. Оформленные
миофибриллы и саркомеры у них отсутствуют. На боковых
поверхностях ГМК встречаются трубкообразные впячивания
(аналоги Т-системы), а также пиноцитозные пузырьки. Ядро
находится в центре клетки. При сокращении поверхность кле-
ток становится неровной, с выпуклостями вследствие сокра-
щения филаментов, закрепленных плотными телами наискось.
В этих клетках есть десмосомы и щелевые контакты. Клетки
объединяются в пучки. Таким образом, висцеральная мускула-
тура беспозвоночных имеет много общего с таковой позвоноч-
ных и демонстрирует параллельное развитие этой ткани в эво-
люции, но существуют и определенные отличия, в основном
приспособительного характера.
Завершая знакомство с мышечной тканью разного проис-
хождения и у разных животных, надо отметить высокую их
пластичность и в то же время почти отсутствующую способ-
ность превращаться в другие виды тканей в ходе эволюции.
Исключением являются электрические органы скатов, образо-
ванные из поперечнополосатой мускулатуры.
Пластичность эволюционной динамики мышечных тканей
проявляется и в многочисленных функционально обусловлен-
ных вариантах организации, не выходящих за пределы каждой
из ее разновидностей у разных трупп многоклеточных живот-
ных. Примерами таких модификаций могут служить синхрон-
ные и асинхронные мышцы членистоногих, клеточные волокна
проводящей системы и др.
Как отмечает АА.Заварзин, на системном уровне все много-
образие мышечных тканей укладывается в 4 разновидности:
135
Рис. 80. Эволюционная динамика мышечных тканей (по АА.Завар-
зину, 1985).
1—4 — основные варианты мышечных тканей; а—в — основные варианты над-
молекулярной организации миозиновых нитей: а — саркомерная, 6 — беспоря-
дочная, в — сборка миозиновых молекул поперек длинной оси нити.
• симпластические волокна с сателлитами;
• клеточные мышечные волокна со специфическими межкле-
точными контактами (миоциты сердечной мышцы);
• пучки мышечных клеток, объединенные межклеточным ве-
ществом (гладкая мускулатура);
• эпителиально-мышечные клетки.
Основные варианты надмолекулярной организации миози-
новых нитей сводятся к следующему:
136
▲ саркомерная организация поляризованных миозиновых
и миозин-парамиозиновых нитей (в поперечнополоса-
тых, парамиозиновых и косо исчерченных мышцах);
▲ беспорядочное распределение поляризованных миозино-
вых и парамиозиновых нитей;
▲ сборка молекул миозина в направлении, поперечном
длинной оси нити (немышечный миозин).
Пластичность мышечных тканей и их эволюционную дина-
мику А.А.Заварзин отразил в представленной схеме, на которой
демонстрируется паралеллизм дивергентно измененных тканей
(рис. 80). Как подчеркивает А.А.Заварзин, при сходном харак-
тере преобразований одних и тех же разновидностей мышеч-
ных тканей у разных групп животных и в первую очередь у
далеко отстоящих друг от друга первично- и вторичноротых
эти ткани хотя и похожи, и видоизменяются в одинаковых
направлениях, однако они далеко не идентичны. Мышечные
ткани представляют собой спектр модификаций со специфи-
ческими особенностями. Эти особенности могут касаться весь-
ма глубоких признаков и внутриклеточной, и системной орга-
низации.
Наличие модификаций, как подчеркивал АА.Заварзин, еще
более усиливает значение сравнительного метода и историчес-
кого эволюционного подхода к анализу данной тканевой сис-
темы.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Албертс Б. и др. Молекулярная биология клетки. Т. 3. — М.: Мир,
1987; 1995.
Анестиади В.Х., Нагорнев В. А. Морфогенез атеросклероза. — Кишинев:
Штиинца, 1982. — 300 с.
Безнусенко ЕВ. Гладкие миоциты миометрия в периоды его ускорен-
ного роста в пренатальном онтогенезе, при беременности и миоме
матки: Автореф. дис. ... канд. мед. наук. — М., 1997. — 30 с.
Большакова Г.Б. Межтканевые взаимоотношения в развивающемся
сердце. — М.: Наука, 1991. — 86 с.
Бродский В.Я., Урываева И.В. Клеточная полиплоидизация. Проли-
ферация и дифференцировка. — М.: Наука, 1981. — 259 с.
Гистология / Под ред. Ю.И Афанасьева, Н.А.Юриной. — М.: Медици-
на, 1999. - 743 с.
Гурфинкель В.С., Левик Ю.С. Скелетная мышца. Структура и функ-
ция. — М.: Наука, 1985. — 143 с.
Данилов Р.К. Очерки гистологии мышечных тканей. — Уфа, 1994. —
49 с.
Данилов Р.К. Гистогенетические основы нервно-мышечных взаимоот-
ношений. — СПб, 1996. — 150 с.
Заварзин А.А. Основы сравнительной гистологии. — Л.: Изд-во ЛГУ,
1985.— 400 с.
137
Клишов АЛ. Гистогенез и регенерация тканей. — Л.: Медицина. 1984. —
231 с.
Кроленко СЛ. Т систсма мышечных волокон. Структура и функция. —
Л.: Наука, 1975. - 260 с.
Магазаник Л.Г Передача в периферических синапсах. — В кн.: Общая
физиология нервной системы: Рук-во по физиологии. — Л.: Наука,
1979. - 287 с.
Мандельштам Ю.Е. Нейрон и мышца насекомого: структурная и
функциональная организация нейромоторных систем насекомого. —
Л.: Наука, 1983. — 168 с.
Морфоадаптация мышц в норме и патологии (Сборник научных ра-
бот) / Под рсд. АА.Клишова. — Саратов, 1975. — 178 с.
Мышечные ткани / Подред. Ю.И.Афанасьева. — М.: Изд-во ММА им.
И.М.Сеченова, 1993.
Панаев А.К. Фенотип сократительных клеток и экстрацеллюлярный
матрикс в эмбриональных сосудах и плаценте человека (иммуно-
морфологическое исследование): Автореф. дис.... д-ра мед. наук. —
М., 1997.-35 с.
Последов ГЛ. Тоническая мышечная система позвоночных. — М.:
Наука, 1981. - 187 с.
Орлов В. С. Механизмы везикулярного транспорта (теоретико-экспе-
риментальные и практические аспекты). — М.: Изд-во РУДН,
1995. - 140 с.
Персианинов Л.С., Железнов Б.И., Богоявленская Н.В. Физиология и
патология сократительной деятельности матки. — М.: Медицина,
1975. - 360 с.
Румянцев ПЛ Кардиомиоциты в процессе репродукции, дифферен-
цировки и регенерации. — Л.: Наука, 1982. — 288 с.
Саркисов ДС. Регенерация и ее клиническое значение. — М.: Меди-
цина, 1970. — 230 с.
Саэне Т.П., Умнова М.М., Новоселова И.Л. Функциональная микро-
морфология скелетных мышц. — Тарту: Изд-во ТГУ, 1989. — 50 с.
Смит Д. Летательные мышцы насекомых. — В кн.: Молекулы и клет-
ки. Вып. 2. - М.: Мир, 1967. - С. 92-106.
Струков А.И., Серов В.В. Патологическая анатомия. — М.: Медицина,
1979. - 528 с.
Физиология человека / Под ред. Г.И.Косицкого. — М.: Медицина,
1985.
Хэм А, Кормак Д. Гистология. — Т. 3, 5. — М.: Мир, 1983.
Ченцов Ю.С. Общая цитология. — М.: Изд-во МГУ, 1995. — 385 с.
Ченцов Ю.С. Ховдриом — совокупность митохондрий клетки // Соро-
совский образовательный журнал. — 1997. — Т. 12. — С. 10—16.
Шубникова ЕЛ. Функциональная морфология тканей. — М.: Изд-во
МГУ, 1981.-325 с.
Cardiac Growth and Regeneration / Eds. W.C.Claycomb, P. Di Nardo //
Ann. N. Y. Acad. Sci. — 1995. — Vol. 752.
Cell and tissue biology. A Textbook of histology. 6 th. edit. / Ed. L.Weiss. —
Baltimore-Munich: Urban & Schwarzenberg, 1988.
Fawcett D. W. A Textbook of histology. 12th edit.// Eds LCapman & Hall. —
N.Y., 1994.
Gabella G. Structure of smooth muscle. — In: Pharmacology of Smooth
Muscle / Eds. L.Szekeres, J.G.Pappo. — Berlin: Springer Verlag, 1994.
138
Garamvdlgyi N. The functional morphology of muscle. Department of
pathology postgraduate medical school. — Budapest, 1970. — 120 p.
Garther L.P., Hiatt Y.L., Sturm YM. Cell biology and histology. 2nd edit. —
Philadelphia: Harwal Publishing, 1993.
Krstic R. V. Human microscopic anatomy: An atlas for students of medicine
and biology. — Berlin—Heidelberg. — N.Y.: Springer, 1991. — 400 p.
Nayler W.G. Second generation of calcium antagonists. — Berlin: Springer
Verlag, 1991. — 226 p.
Pauletto P., Da Ros S., Loleo M. Impact of nifedipine on vascular smooth
muscle cell differentiation // Drugs Supplement. — 1994. — Vol. 48. —
P. 1-7.
Schmalbruch H. Sceletal muscle. — In: Handb. Microsc. Anat. — Bd 2,
Pt 6. — Berlin: Springer Verlag, 1985.
ЧАСТЬ ВТОРАЯ
Физиология мышечных тканей
В задачу данной части книги не входит рассмотрение общих
вопросов, относящихся к функционированию мышечных тка-
ней, поскольку они излагаются во всех учебниках общей фи-
зиологии. Мы попытались подробнее, чем это излагается в
учебной литературе, осветить одну из наиболее важных и со-
временных проблем физиологии мышц — клеточные механиз-
мы запуска мышечного сокращения.
Глава 5
КЛЕТОЧНЫЕ МЕХАНИЗМЫ
ЗАПУСКА МЫШЕЧНОГО
СОКРАЩЕНИЯ
Как хорошо известно, в физиологии принято разделять
мышцы на три основных функциональных типа: скелетные,
гладкие и сердечные. Клетки и волокна, составляющие раз-
ные типы мышц, существенно различаются по форме, разме-
рам, микроструктуре и метаболизму. Вместе с тем их объеди-
няет принципиальная общность функции — способность к
сокращению, представляющему собой укорочение клетки
или волокна в результате функционирования специфически
организованных сократительных белков — актинов и миози-
нов.
Общность функции накладывает отпечаток и на общность
ключевых этапов в механизме сокращения мышечных клеток
и волокон. Можно назвать три основных события, необходи-
мых для реализации сокращения любого мышечного элемента:
1) деполяризация мышечной мембраны и генерация потенциа-
ла действия (ПД); 2) повышение концентрации свободного
ионизированного кальция [Са2+]вн в саркоплазме вблизи со-
кратительных белков; 3) Са2+-зависимое взаимодействие бел-
ков актиномиозинового комплекса, приводящее к сокращению
клетки. Эти события происходят последовательно во времени
и причинно связаны между собой.
Деполяризация Повышение Взаимодействие
мембраны (ПД) ----> [Са2+]вн -------> миозина с актином
(сокращение)
140
Эти ключевые моменты действительно имеют место, одна-
ко они отличаются рядом особенностей у разных типов мышц.
Например, существенно различаются параметры и ионная при-
рода ПД, а также его роль в механизме повышения уровня
кальция в миоплазме. Различны могут быть и источники, из
которых ионизированный кальций поступает в миоплазму. Та-
ким образом, и сами ключевые события, и промежуточные
реакции, соединяющие одно ключевое событие с другим, спе-
цифические для разных типов мышечных клеток и волокон.
Сложный каскад реакций от момента деполяризации мембра-
ны до повышения уровня внутриклеточного кальция вблизи сокра-
тительных белков получил название электромеханического сопря-
жения (ЭМС).
Понять процесс ЭМС в трех основных типах мышц: скелет-
ной, сердечной и гладкой — невозможно без ясного представ-
ления о характере превращений и состоянии ионов Са2+ в
мышечных клетках.
ВНУТРИКЛЕТОЧНЫЙ МЕТАБОЛИЗМ
ионов са2+ и методы его анализа
УРОВЕНЬ ИОНИЗИРОВАННОГО КАЛЬЦИЯ В ПОКОЕ
Внутриклеточный кальций присутствует в мышечных клет-
ках в основном в связанном состоянии, и только небольшая
его часть находится в цитоплазме в свободном (ионизирован-
ном) состоянии.
Первые экспериментальные данные, свидетельствующие о
присутствии ионизированного кальция в миоплазме, были по-
лучены в начале 60-х годов нашего столетия. Изолированные
скелетные мышечные волокна жабы нагружали мюрексидом —
реагентом, приобретающим красноватую окраску при погло-
щении ионов Са2\ Оказалось, что волокно, нагруженное мю-
рексидом, в состоянии покоя имеет слабо-розовую окраску, а
в момент сокращения приобретает ярко-красный оттенок, сви-
детельствующий о повышении уровня ионизированного каль-
ция в миоплазме.
В 70-е годы в работах Эшли и соавт. были впервые исполь-
зованы так называемые ионоселективные микроэлектроды,
способные определять изменение концентрации ионизирован-
ного кальция в миоплазме мышечных клеток. Первые ионосе-
лективные микроэлектроды представляли собой стеклянные
микропипетки с диаметром кончика около 20 мкм. Самый
кончик такого электрода заполняют специальной Са2+-обмен-
ной органической смолой, остальную (верхнюю) часть — рас-
твором соли кальция. В результате перепада концентрации
кальция в верхней части электрода (10“! М) и в миоплазме на
границе возникает постоянный диффузионный потенциал, ко-
141
а б
Рис. 81. Экспериментальная установка для регистрации изменений
уровня иоиов Са2+ в миоплазме изолированного мышечного волокна
Balanus nubilus (а) и мембранного потенциала (б).
1 — МП от —56 до —26 мВ; 2 — световая эмиссия экворина миоплазмы, имп/с
(отражает изменение уровня ионов Са2+ в миоплазме); 3 — сократительный
ответ волокна; 4 — деполяризующий стимул, возбуждающий волокно.
торый можно измерить. Изменение концентрации кальция в
миоплазме будет приводить к появлению дополнительного
кальциевого потенциала. При этом электрод фиксирует актив-
ность ионов Са2+ в непосредственной близости от кончика в
диапазоне от 10“8 до 10“3 М. Метод имеет некоторые погреш-
ности, но он позволил в 80-е годы впервые определить пределы
концентрации ионов Са2+ в мышечных клетках разного типа
в покоящемся состоянии.
Первыми были изучены скелетные мышечные волокна мор-
ских ракообразных, в частности морского желудя (Balanus nu-
bilus), волокна которого оказались наиболее удобным объектом
в связи с их большим диаметром (до 2—3 мм) (рис. 81).
Впоследствии ионоселективные электроды были усовершенст-
вованы: удалось уменьшить диаметр их кончика до 1 мкм.
Благодаря этому был измерен уровень кальция в сердечных и
небольших по размеру гладкомышечных клетках (табл.5).
Таблица 5. Концентрация ионов Са2+ в покоящихся мышечных клет-
ках и волокнах
Животные Тип мышцы Са2+, мкмоль/л
Ракообразные Balanus Мышца-ретрактор 0,1
Лягушка Rana pipiens M.semimembranosus 0,16
Хорек Кардиомиоциты (желудочка сердца) 0,26
Овца Кардиомиоциты (волокна Пуркинье) 0,3
Жаба Bufo marinus Гладкая мышца желудка 0,14
142
Мышечные клетки и волокна, несмотря на принадлежность к
разным типам, имеют (в состоянии покоя) практически одина-
ковый уровень ионов Са2+ в миоплазме — 0,1—0,3 мкмоль/л, т.е.
1(Г7 М.
МЕХАНИЗМЫ, ПОДДЕРЖИВАЮЩИЕ
НИЗКИЙ УРОВЕНЬ [Са24]вн В ПОКОЕ
Ионы Са2+ в сокращении играют роль сигнальных молекул,
поэтому для работы такого кальциевого сигнального механизма
в цитозоле клетки должна стабильно поддерживаться низкая
концентрация кальция в покое, что достигается несколькими
способами. В мышечных и других клетках существует несколь-
ко специальных систем, поддерживающих низкий уровень
кальция в цитоплазме и способных при определенных условиях
эффективно изменять этот уровень.
Во-первых, это Са2*-зависимая АТРаза мембраны клетки,
или так называемый Са2+-насос. Молекула кальциевого насоса
представляет собой фермент — АТРазу, встроенную в плазма-
тическую мембрану. Молекула Са2+-АТРазы способна связы-
вать ионы Са2 , присутствующие в миоплазме даже в очень
низких концентрациях (порядка 10~8 М), после чего она осу-
ществляет перенос этих связанных ионов против высокого
концентрационного градиента ионов Са2+, т.е. из миоплазмы
в наружную среду, используя для этого энергию АТР. Мономер
Са2 -АТРазы, выделенный из мембраны кардиомиоцитов,
имеет мол.массу около 138 000. Аналогичная по функции Са2+-
АТРаза, удаляющая ионы Са2+ из миоплазмы, имеется и в
составе мембраны саркоплазматического ретикулума (СР) мы-
шечных клеток (рис. 82, а). Молекулы Са2+-АТРазы, встроен-
ные в мембрану СР, способны закачивать внутрь цистерн СР
большие количества ионов Са2+ против высокого градиента
концентрации даже тогда, когда уровень ионов Са2+ в цитозоле
невелик.
Во-вторых, у мышечных, а также нервных и других клеток,
использующих сигнализацию с помощью ионов Са2+, в плаз-
матических мембранах есть дополнительный механизм, кото-
рый осуществляет сопряженное выведение ионов Са2+ из клет-
ки с введением в клетку ионов Na+ (см. рис. 82,а). Работа
такого Na+-Ca2+-транспортера впрямую не связана с потреб-
лением энергии АТР, однако АТР оказывает, по-видимому,
какое-то каталитическое действие, возможно, увеличивая срод-
ство транспортного механизма к ионам Са2 . Этот Na+-Ca2+-
обменник обладает большей скоростью выведения кальция,
чем Са2+-АТРаза, но при этом относительно низким сродством
к ионам Са2+ и поэтому начинает действовать эффективно
только при 10-кратном и более превышении нормального
уровня ионов Са2+ в миоплазме. Такое наблюдается, как пра-
143
ПД
Рис. 82. Цепь ЭМС скелетного мышечного волокна.
а — схема механизмов, ответственных за передачу возбуждения от мембраны к
СР у скелетного мышечного волокна и выброс кальция из СР в миоплазму
через каналы РиР; б — соотношение во времени четырех последовательно
развивающихся процессов: 1 — генерация ПД на мембране мышечного волок-
на, 2 — повышение концентрации ионов в миоплазме, 3 — кинетика связыва-
ния кальция с тропонином С; 4 — собственно акт сокращения мышечного
волокна.
вило, лишь во время продолжительной сократительной актив-
ности мышечной клетки.
В-третьих, в мышечных клетках и волокнах имеются Са2+-
связывающие белки цитоплазмы (например, кальмодулин), так-
же играющие роль внутриклеточных буферов кальция.
В-четвертых, в мышечных клетках и волокнах есть большое
количество митохондрий, обладающих способностью закачи-
вать ионы Са2* внутрь полости митохондрии. Митохондрии
обладают достаточной емкостью для аккумуляции больших ко-
личеств ионов Са2+ (до 0,6-1(Г3 М), однако реально участвуют
в откачке лишь при угрожающе высоких скачках уровня каль-
ция в миоплазме (в том числе при гипоксии и других патоло-
гиях мышечного волокна).
ПОВЫШЕНИЕ УРОВНЯ (CA2+jBH ПРИ СОКРАЩЕНИИ
В покое концентрация ионизированного кальция в цито-
плазме клетки порядка 5-Ю”8 — 510-7 М, а в наружной среде —
10“3 М. Это означает, что существует очень высокий транс-
мембранный концентрационный градиент ионов Са2+ между
наружной и внутренней средой клетки. Во внутриклеточных
компартментах, запасающих кальций, концентрация ионов
Са2+ также очень велика по сравнению с его концентрацией в
цитоплазме (в ядре — 1 мМ, в митохондриях—0,6-10-3 М, в
цистернах СР — 0,3-10-3 — 0,4-10“3 М). Поэтому, когда какой-
то сигнал на короткое время открывает кальциевые каналы в
наружной мембране или в мембране внутриклеточных депо
кальция, ионы Са2+ “врываются” в цитозоль, резко повышая
свою локальную концентрацию.
Использование флюоресцентных и люминесцентных краси-
телей (типа фура-2, квин-2), которые испускают световые
волны или изменяют характер своего свечения при связывании
с ионами Са2+ внутри клетки, позволило определить, как
именно возрастает концентрация кальция при возбуждении
мышечной клетки. Оказалось, что для инициации сокращения
уровень кальция в цитоплазме должен возрасти на 1—2 поряд-
ка, т. е. от 106 до 10“5 М. На рис. 82,6 и 83 приведены
примеры соотношения между динамикой сокращения и “каль-
циевой волной” (возрастанием концентрации ионизированно-
го кальция) у трех разных функциональных типов мышечных
клеток и волокон при инъекции в клетки Са^-чувствительного
красителя экаорина. Скорость нарастания кальциевой волны
существенно (на 1—2 порядка) различается в разных типах мы-
шечных элементов при их сокращении. Однако и у скелетного
мышечного волокна, и у кардиомиоцита, и у гладкомышечной
клетки повышение концентрации ионов Са2+ в миоплазме пред-
шествует сокращению.
145
Скелетное мышечное
волокно
100 мс '
Сердечный миоцит
Гладкомышечная
клетка
Рис. 83. Одновременная регистрация “кальциевой волны”, т.с. подъ-
ема уровня ионов Са2+ в миоплазме, измеряемого по световой эмис-
сии экворина, и сократительного ответа у скелетного мышечного
волокна лягушки, предсердной трабекулы лягушки и крупной гладко-
мышечной клетки желудка жабы Amphiuma tridactylum. Обратить вни-
мание на различия в шкалах времени.
ИСТОЧНИКИ ПОВЫШЕНИЯ СОДЕРЖАНИЯ
ВНУТРИКЛЕТОЧНОГО КАЛЬЦИЯ В МЫШЕЧНЫХ КЛЕТКАХ
И ВОЛОКНАХ ПРИ СОКРАЩЕНИИ
В зависимости от типа мышечной клетки или волокна ко-
личество внутриклеточного кальция в миоплазме может увели-
чиваться за счет кальция, высвобождающегося из СР; кальция,
поступающего в миоплазму из наружной среды по кальциевым
каналам или неспецифическим катионным каналам; кальция,
проникающего в клетку по механочувствительным или так
называемым стреч-каналам (от англ, strech — растяжение), и
кальция, поступающего внутрь за счет инвертированной рабо-
ты Ка+-Са2+-транспортера наружной мембраны.
У скелетных волокон и сердечных мышечных клеток главным
источником прироста кальция, запускающего сокращение, яв-
ляется СР. СР —это особо структурированные и высокоспе-
циализированные внутриклеточные цистерны, содержащие
кальций. Ионы Са2+ хранятся в полости СР в состоянии сла-
бой ассоциации с Са2 -связывающим белком кальсеквестри-
ном, который обладает низким сродством к Са2+, но высокой
емкостью (около 50 ионов Са2+ на одну молекулу кальсекве-
стрина). Мембрана СР содержит крупные интегральные белки,
играющие роль особых высокопроводящих кальциевых кана-
лов, при открывании которых происходит быстрый выход каль-
ция из СР в миоплазму по концентрационному градиенту. Эти
Са2+-высвобождающие каналы, встроенные в мембрану СР,
получили название рианодиновых рецепторов (РиР) (рис. 84,
85; см. рис. 82,а).
Рианодиновые рецепторы представляют собой особый тип
внутриклеточных хемоактивируемых кальциевых каналов, имею-
щихся только в составе мембран СР. Открывание кальциевого
146
DHP-рецептор
Тетрамер РиР
1 и U субъединицы РиР
Мембраны акне
Т-СР-соединеиия
Рис. 84. Триада скелетного волокна. На врезке — модель РиР (попере-
чный разрез).
канала в составе молекулы рианодинового рецептора происходит
при действии на рианодиновые рецепторы ионов Са^+ (в мик~
ромолярных концентрациях) и АТР (в миллимолярных концент-
рациях).
Соответственно в молекуле рианодинового рецептора обна-
ружены специальные центры для связывания ионов Са2+ и
АТР. Кальций или АТР, связываясь с соответствующими цент-
рами в молекуле рианодинового рецептора, вызывают конфор-
мационную перестройку молекулы, сопровождающуюся от-
крыванием кальциевого канала в составе этой молекулы. В ре-
зультате ионы Са2+ поступают из полости СР в миоплазму.
Помимо ионов Са2+ и внутриклеточного Mg2-ATP, взаимодей-
ствие рианодиновых рецепторов с такими внутриклеточными
метаболитами, как циклическая ADP-рибоза и кальмодулин,
также может облегчать открывание кальциевого канала в со-
ставе молекулы рианодинового рецептора. (Более подробно о
структуре, свойствах молекулы рианодинового рецептора и
входящего в ее состав кальциевого канала см. далее.)
В скелетных волокнах позвоночных СР наиболее развит и
достигает 12—15 % от общего объема мышечного волокна.
У этих волокон единственным источником повышения уровня
ионизированного кальция, участвующего в сокращении, явля-
ется кальций, высвобождаемый из СР. В связи с этим скелет-
ное мышечное волокно является единственным типом мышеч-
147
Рис. 85. Устройство РиР скелетного мышечного волокна млекопита-
ющих.
Субъединицы I, II, III, IV РиР формируют тетрамерный комплекс Показана
цитоплазматическая часть молекулы (ножка) и 10 трансмембранных фрагмен-
тов: 1, 2 —участки возможных мутационных изменений молекулы, приводя-
щие к мышечным патологиям; 3 — участки фосфорилирования; 4 — участки
связывания кальмодулина; 5 — участки связывания нуклеотидов; 6 — участки
связывания ионов Са .
ных элементов, которые не нуждаются в притоке кальция
снаружи для развития сокращения и сохраняют способность к
полноценному сокращению при полном удалении кальция из
наружной среды.
В сердечных миоцитах акт сокращения также запускается за
счет высвобождения кальция из цистерн СР. Однако у кардио-
миоцитов система СР развита в меньшей степени, чем у ске-
летных мышечных волокон. Объем ретикулума достигает
6—10 % от общего объема клетки. Важным источником по-
вышения уровня кальция в миоплазме сердечных миоцитов
является его регулярное поступление из наружной среды внутрь
клетки по потенциалзависимым кальциевым каналам. Каль-
ций, входящий при каждом ПД внутрь сердечной клетки, ис-
пользуется по трем направлениям: 1) взаимодействует с риа-
нодиновыми рецепторами на мембране СР и запускает выброс
Са2+ из цистерн СР; 2) может частично активировать сокра-
тительные белки; 3) пополняет кальциевые запасы СР (рис. 86).
Без такого регулярного поступления наружного кальция, т.е. в
бескальциевой среде, сокращение сердечной мышцы становит-
ся невозможным.
148
Рис. 86. Механизм сокращения кардиомиоцита.
а — схема механизмов, ответственных за повышение уровня ионов Са2+. По-
казаны вход ионов Са2+ через потенциалактивируемые Са2+-каналы и акти-
вируемый выброс кальция из СР; б — временной ход последовательно разви-
вающихся процессов: генерации ПД (1) повышения уровня цитоплазматичес-
кого кальция (2) и сокращения сердечной клетки (3). При действии адреналина
увеличивается фаза плато ПД (отражающая вход кальция в клетку), что зна-
чительно усиливает амплитуду сокращения кардиомиоцита.
149
Рис. 87. Механизмы, способные повышать уровень ионов Са2+ в
гладкомышечной клетке.
а — поступление ионов Са2+ по хемоактивиотемым каналам; б — поступление
ионов Са2+ по пртенпиалактивируемым Са2*-каналам; в — 1п8Р3-зависимый
выброс ионов Са2+ из СР; г — механизмы удаления кальция из миоплазмы с
помощью Са -АТФаэы.
В гладкомышечных клетках система СР развита значительно
слабее, чем в сердечных миоцитах. Объем ретикулума в глад-
комышечных клетках, как правило, не превышает 2—4 %, хотя
в некоторых типах клеток, например в магистральных сосудах,
объем СР может достигать 6—10 %. Часть цистерн СР может
быть локализована в непосредственной близости от наружной
мембраны клетки, а часть рассеяна в цитоплазме, как правило,
вблизи сократительных белков. Вследствие этого повышение
концентрации кальция в миоплазме возможно из двух источ-
ников. Это прежде всего кальций, поступающий снаружи по
кальциевым каналам поверхностной мембраны клетки (рис. 87).
Проходя внутрь клетки, к ее сократительным белкам, этот
кальций является сигналом для активации кальмодулина, бел-
150
ков актинмиозинового комплекса и сокращения. Затем это
кальций, высвобождающийся из цистерн СР. Емкость СР в
большинстве гладкомышечных клеток очень невелика, поэтому
считается, что его возможности в повышении [Са2+]вн и под-
держании сокращения гладкомышечных клеток весьма ограни-
чены. Однако в ряде случаев, например в стенках коронарных
сосудов, аорты, артерий, сокращение гладкомышечных клеток
(при действии гормонов и ряда других метаболитов) вызыва-
ется преимущественно за счет выброса кальция из СР. Подроб-
но такой механизм запуска сокращения описан при рассмот-
рении особенностей электромеханического сопряжения в глад-
комышечных клетках.
Мышечные клетки — одни из первых объектов, в которых
были впервые обнаружены и изучены ионные каналы особого
типа — так называемые механочувствительные, или стреч-ка-
налы. В настоящее время механочувствительные каналы выяв-
лены практически во всех типах клеток. Молекула механочув-
ствительного канала представляет собой олигомер, состоящий
из нескольких (5—6) субъединиц. С внутренней (цитоплазма-
тической) стороны молекулы механочувствительных каналов
сцеплены с белками цитоскелета (актином, спектрином и др.).
Плотность механочувствительных каналов у разных типов кле-
ток колеблется от 1 до 10 на 1 мкм2. Хорошо известно, что
растяжение или увеличение объема гладкомышечной клетки
или кардиомиоцита вызывает ее сокращение. Это связано с
тем, что натяжение мышечной мембраны способствует откры-
ванию ионной поры в составе молекулы механочувствительно-
го канала. Такие каналы являются катионными, но, как пра-
вило, характеризуются низкой ионоселективностью. Внутрь
клетки поступают в основном ионы Na+, но возникающая при
этом деполяризация часто может приводить и к сопряженному
входу ионов Са2+ в мышечную клетку или волокно (по потен-
циалактивируемым Са2+-каналам). Особенно велика роль мс-
ханочувствительных каналов в регуляции уровня ионов Са2+ и
сокращении сердечных миоцитов и гладкомышечных клеток.
Наконец, установлено, что в гладкомышечных клетках и
кардиомиоцитах существует еще одна система, способная при
определенных условиях принимать участие в повышении внут-
риклеточной концентрации кальция. Эго сопряженный Na+-
Са2+-транспорт. Молекулы Ка+-Са2+-транспортера, встроен-
ные в наружную мембрану клеток и предназначенные для
откачки кальция, способны при определенных условиях (на-
пример, при повышении уровня натрия в клетке или снижении
уровня натрия в наружной среде) инвертировать направление
сопряженного натрий-кальциевого транспорта, т.е. не откачи-
вать, а, напротив, вводить кальций в клетку (и выводить натрий
наружу), тем самым способствуя повышению концентрации
ионов Са2+ в миоплазме (см. рис. 87).
151
Несмотря на важную роль СР в запуске сокращения, у всех
типов мышечных клеток первый сигнал, приводящий к выбро-
су кальция из СР и повышению уровня ионов Са2+ в миоплаз-
ме, возникает на наружной мембране клетки. В большинстве
случаев таким сигналом является деполяризация мембраны или
генерация ПД.
УЧАСТИЕ ЭЛЕКТРИЧЕСКОЙ АКТИВНОСТИ
МЕМБРАНЫ В СОКРАЩЕНИИ МЫШЕЧНЫХ
КЛЕТОК И ВОЛОКОН
Все типы мышечных клеток и волокон являются возбуди-
мыми, т.е. способны при возбуждении генерировать специфи-
ческий тип потенциала — ПД. У кардиомиоцитов и гладкомы-
шечных клеток нередко важным условием для генерации ПД
являются периодические колебания уровня мембранного потен-
циала (МП), или потенциала покоя этих клеток.
ОСОБЕННОСТИ ПОТЕНЦИАЛА ПОКОЯ
МЫШЕЧНЫХ КЛЕТОК И ВОЛОКОН
Микроэлектродные исследования МП в мышечных клетках
разных типов позволили установить точные значения потен-
циала покоя, а также природу пассивных ионных диффузион-
ных потоков и ионных насосов, вносящих вклад в потенциал
покоя. Значения МП варьируют от —80 до —90 мВ у скелетных
мышечных волокон высших позвоночных и от —55 до —60 мВ
у некоторых типов гладкомышечных клеток (табл. 6).
Таблица 6. Значения потенциала покоя у разных типов мышечных
клеток и волокон
Тил мышечных клеток Потенциал покоя, мВ
Волокна скелетной мышцы лягушки -80-90
Миоциты желудочка сердца лягушки -70-80
Волокно Пуркинье сердца собаки -80-90
Гладкомышечные клетки сосудов теплокровных -60-70
Гладкомышечные клетки желудка собаки -55 - 65
Более низкие средние значения МП у сердечных миоцитов
и гладкомышечных клеток обусловлены относительно более
высокой натриевой проницаемостью мембраны этих клеток в
покое. Важной особенностью этих клеток является то, что в
состоянии покоя отмечается спонтанная электрическая актив-
ность, а именно периодические колебания МП относительно
среднего уровня. У некоторых сердечных (пейсмекерных), а
152
также у гладкомышечных клеток матки, сосудов, пищевари-
тельного тракта и других висцеральных органов в состоянии
покоя наблюдаются периодические колебания уровня МП, ко-
торые достигают 10—20 мВ относительно среднего уровня,
тогда как скелетные мышечные волокна способны сколь угод-
но долго поддерживать стабильное состояние МП. В настоящее
время изучена причина колебаний МП у гладкомышечных
клеток и сердечных миоцитов. Важный вклад в генерацию
колебаний МП этих клеток вносит особый медленный натри-
евый ток (If№+)- Показано, что ритмические колебания МП
обусловлены сложным взаимодействием и координированной
работой ансамбля различных ионных каналов и ионных токов
(в частности, медленных и быстрых калиевых и медленных
натриевых) через мембрану. Колебания МП играют важную
роль в авторитмической активности сердечных миоцитов и
гладкомышечных клеток, обусловливая генерацию ритмичес-
ких серий ПД и сокращений этих клеток. Периодичность ко-
лебаний МП (и сокращений) может быть весьма различной в
зависимости от типа клетки. Например, интервал осцилляций
МП может составлять доли минуты (у кардиомиоцитов) и часы
(у спонтанно активных гладкомышечных клеток, ответствен-
ных за перистальтику пищеварительного тракта).
ОСОБЕННОСТИ ГЕНЕРАЦИИ ПОТЕНЦИАЛА ДЕЙСТВИЯ
В РАЗНЫХ ТИПАХ МЫШЕЧНЫХ КЛЕТОК И ВОЛОКОН
Долгое время, с момента описания в 50-е годы природы ПД
у аксона кальмара и скелетных мышечных волокон, считалось,
что в генерации I фазы ПД решающую роль И1рает натриевый
ток по потенциалакгивируемым натриевым каналам. Однако
результаты систематического исследования природы ПД у раз-
ных типов клеток позвоночных и беспозвоночных животных
позволили установить, что для большинства мышечных клеток,
а именно: гладкомышечных клеток, кардиомиоцитов из раз-
личных отделов сердца, скелетных мышечных волокон беспо-
звоночных (ракообразных, насекомых), мышечных волокон
примитивных хордовых (ланцетника) — характерна другая за-
кономерность. В указанных клетках I фаза ПД, т.е. входящий
в клетку и деполяризующий мембрану ток, создается преиму-
щественно ионами Са2+.
В скелетных мышечных волокнах позвоночных восходящая
фаза ПД обусловлена входящим натриевым током за счет от-
крывания быстрых потенциалактивируемых натриевых кана-
лов. Вторая — нисходящая — фаза ПД вызвана выходящим ка-
лиевым током по специальным потенциалакгивируемым кали-
евым каналам, которые часто называют калиевыми каналами
задержанного выпрямления (рис. 88,а). Благодаря участию
только быстрых натриевых каналов в генерации восходящей
153
Рис. 88. Токи, участвующие в генерации ПД в скелетном волокне (а),
гладкомышечной клетке (б) и кардиомиоците (в).
Сплошными линиями указан временной ход ионных токов, пунктирной —
временной ход ПД и сдвиг МП мышечных клеток; 1Нж+ — натриевый ток;
1К+ — калиевый ток задержанного выпрямления; 1^2+—быстрый кальциевый
ток (Т'ток); 1(3а2+ — медленный кальциевый ток (L-ток); — быстрый ка-
лиевый ток; 1к+/Са2+ “ Са2+-активируемый калиевый ток. Обратить внимание
на различия в шкалах времени.
фазы ПД самая большая скорость генерации и распростране-
ния возбуждения по клетке обнаружена в скелетных мышечных
волокнах. Длительность ПД в скелетных мышечных волокнах
млекопитающих составляет 4—6 мс.
Нарушения в механизме работы натриевых и калиевых ка-
налов мышечных волокон могут быть причиной серьезных
функциональных расстройств скелетной мускулатуры. Извест-
ны спорадические и наследственные заболевания мускулатуры
человека, называемые миотониями и параличами. Они обу-
словлены дефектами в работе натриевых, калиевых и некото-
рых других каналов скелетных мышечных волокон.
В кардиомиоцитах ПД может существенно различаться по
форме, длительности и вкладу ионных токов в зависимости от
того, к какой области сердца принадлежит миоцит. Во всех
154
сердечных миоцитах I (восходящая) фаза ПД и овершут обу-
словлены входящим быстрым Ка+-током, аналогичным Na -
току в скелетном мышечном волокне. Однако в восходящей
фазе ПД участвует и быстрый входящий Са2+-ток, который
отличается низким порогом активации и быстрой инактива-
цией. Это Т-ток (от англ, transient — кратковременный, или
преходящий). В сердечных миоцитах имеется особая фаза ПД,
которая наступает сразу после овершута и называется “плато”.
Особенно ярко плато выражено у волокон Пуркинье. В этих
волокнах длительность плато составляет 400 мс (см. рис. 88, в).
Фаза плато обусловлена протеканием через мембрану более
медленно активирующегося и долго сохраняющегося кальцие-
вого тока. Этот ток имеет более высокий порог для активации,
чем Т-ток, но зато более медленно инактивируется. Поэтому
такой кальциевый ток получил название L-ток (от англ, long
lasting — долго длящийся). Для активации L-тока в сердечных
миоцитах необходима предварительная деполяризация мем-
браны от —80 (т.е. от уровня потенциала покоя) до —30 — 35
мВ. Входящий кальциевый ток L-типа обусловлен открывани-
ем особых медленно активирующихся кальциевых каналов,
способных частично проводить и ионы Na+. Соответственно
длительность ПД здесь составляет величину около 300—400 мс,
что на два порядка больше, чем длительность ПД скелетного
мышечного волокна (2—4 мс), обусловленная быстрым входя-
щим натриевым током. Именно вход кальция по кальциевым
каналам L-типа играет решающую роль в электромеханическом
сопряжении у сердечных клеток. Реполяризация мембраны
сердечной клетки в ходе генерации ПД связана с закрытием
кальциевых каналов L-типа и доминированием выходящего
калиевого тока по особым Са2+-активируемым К+-каналам.
Амплитуда ПД является стабильной величиной у любой электро-
возбудимой клетки, тогда как длительность ПД (его II фазы)
изменяется при воздействии внутри- и внеклеточных факторов.
Так, возрастание силы сокращения кардиомиоцитов под
влиянием адреналина обусловлено увеличением длительности
фазы плато ПД. В свою очередь удлинение фазы плато ПД у
кардиомиоцита объясняется способностью гормона увеличи-
вать вероятность открывания Са2+-каналов L-типа наружной
мембраны и тем самым увеличивать продолжительность Са2+-
тока через мембрану (рис. 89; см. рис. 88). Таким образом, у
кардиомиоцитов смешанный натрий-кальциевый механизм ге-
нерации I фазы ПД, а фаза “плато” обусловлена соотношением
входящего Са2+-тока (L-типа) и выходящих калиевых токов
(в основном Са2+-активируемых К+-токов).
У гладкомышечных клеток свой механизм генерации ПД,
который отличается и по длительности, и по форме (см. рис.
88,6). Как и у кардиомиоцитов, у гладкомышечных клеток ПД
всегда имеет три фазы: деполяризации, плато и фазу реполя-
155
б
♦ Адреналин (1мкмоль)
*10мВ
I
— 50мВ
Деполяризация
1
Деполяризация
3 ^^Ч»М«ИЙ*вИ||^^
‘ tewiMr
Усредненный ток
Рис. 89. Регистрация активности одиночного потенниалактивируемо-
го Са2+-канала кардиомиоцита.
1,2,3,4 — четыре последовательных срабатывания (открывания) одного и того
же канала в ответ на одну и ту же предъявляемую деполяризацию от —50 до
+10 мВ; а — работа канала в норме; б — работа канала на фоне введения в
раствор адреналина (10 6 М). Внизу показаны интегральнме токи, представ-
ляющие собой алгебраическую сумму четырех последовательных открываний
канала. Калибровка тока: 0,24 пкА и 100 мс.
156
ризации. Как правило, длительность ПД (в разных типах глад-
комышечных клеток) колеблется в пределах 10—100 мс. Таким
образом, ПД имеет на 2—3 порядка более медленную скорость
нарастания (деполяризации) и скорость спада (реполяриза-
ции), низкие значения амплитуды (не более 50 мВ) и овершута,
чем ПД скелетных мышечных волокон. При этом натриевые
каналы и токи либо отсутствуют, либо не принимают значи-
мого участия в генерации I фазы ПД. В гладкомышечных
клетках I фаза ПД обусловлена быстрым входящим кальцие-
вым током Т-типа, а фаза плато — участием медленного вхо-
дящего кальциевого то-ка L-типа. Последняя фаза ПД — репо-
ляризация — происходит за счет закрытия кальциевых и одно-
временного открытия нескольких типов калиевых каналов, в
том числе Са2+-активируемых, и калиевых каналов задержан-
ного выпрямления.
У самых разных типов гладкомышечных клеток доминирует
кальциевый механизм деполяризации мембраны при генерации ПД
за счет работы быстрых и медленных потенциалзависимых каль-
циевых каналов.
Следует иметь в виду, что у гладкомышечных клеток гене-
рация ПД не всегда является главным и обязательным услови-
ем для инициации сокращения. Большинство гладкомышеч-
ных клеток принадлежат к тоническому типу, т.е. способны
длительно (часами) поддерживать определенный уровень мы-
шечного тонуса (сокращения) и так же медленно (в течение
секунд или десятков секунд) переходить на другой уровень
тонуса, т.е. сокращения. Поэтому генерация одиночного или
серии ПД в этих клетках может не иметь решающего значения
для их сокращения. В нормальных условиях ионной среды в
тонических типах гладкомышечных клеток сосудов, желудка и
других висцеральных органов способность генерировать ПД при
сокращении является скорее исключением, чем правилом. Здесь
тоническое сокращение отдельной клетки носит весьма продол-
жительный и градуальный характер, и величина тонического
сокращения определяется уровнем деполяризации мембраны и
спецификой взаимодействия сократительных белков клетки.
НАТРИЕВЫЕ И КАЛЬЦИЕВЫЕ КАНАЛЫ
МЫШЕЧНЫХ КЛЕТОК И ВОЛОКОН
Кальциевый канал. Наиболее детально изучена молекуляр-
ная структура кальциевых каналов L-типа мышечных клеток.
Эти каналы благодаря способности связывать дигидропириди-
ны были выделены из Т-трубочек скелетных мышц. Затем была
проанализирована их первичная структура. Установлено, что
белковая молекула кальциевого канала L-типа — это олигомер,
состоящий из нескольких субъединиц: alt a2, Y» 8 (рис.
157
Рве. 90. Молекулы натриевого и кальциевого каналов (схемы).
а — пространственная организация субъединиц (aj, aj, Рр ₽2» V» б)> Формиру-
ющих молекулы каналов; б —устройство a-субьединиц каналов. Показаны
четыре гомологичных домена: I, II, III, IV, формирующих а-субъединицу.
158
90). Наиболее крупной и важной в функциональном отноше-
нии является а!-субъединица, которая имеет мол. массу около
170 000 и способна при встраивании в мембрану образовывать
канал и обеспечивать кальциевый ток через мембрану, анало-
гичный L-току. a j-Субъединица состоит из четырех гомоло-
гичных по аминокислотному составу доменов (I, II, III и IV),
каждый из которых имеет 6 фрагментов (1—6), пересекающих
мембрану. На рис 90,а видно, что 4 домена а!-субъединицы
группируются в плоскости мембраны таким образом, что об-
разуют в середине проход для ионов Са2+.
Натриевый канал. Молекула Ка+-канала — также олигомер,
состоящий из нескольких субъединиц: a, и Наиболее
важной, способной выполнять функции Na -канала (т.е. из-
бирательно проводить ионы Na+ через мембрану) является
сх-субъединица. У этого канала а-субъединица имеет мол.
массу около 260 000. При анализе аминокислотной последова-
тельности оказалось, что а-субъединица Ыа+-канала имеет
большое сходство с cti -субъединицей Са2+-канала.
а-Субъединица Na -канала также построена из четырех по-
вторяющихся гомологичных фрагментов, каждый из которых
включает шесть трансмембранных доменов (см. рис. 90,6).
Более того, при сравнении первичной структуры выяснилось,
что степень идентичности аминокислотных последовательнос-
тей в составе а-субъединиц натриевого и кальциевого каналов
достигает 40—50 %. Таким образом, можно отметить, что в
построении молекул потенциалактивируемого натриевого и
кальциевого каналов природа использовала один и тот же
структурный мотив и, возможно, Na+-канал является резуль-
татом структурной модификации Са2+-канала. Гомология свой-
ственна в основном внутримембранным фрагментам молекулы
натриевого и кальциевого каналов. Внутриклеточные цито-
плазматические участки аминокислотной последовательности
значительно различаются в молекулах натриевого и кальцие-
вого каналов. Например, только в молекуле Са2+-канала обна-
ружены специфические участки, подверженные фосфорилиро-
ванию протеинкиназами. Предполагают, что именно фосфори-
лирование таких участков изменяет работу Са2+-канала. В по-
следние годы в составе молекулы этого канала (в его цитоплаз-
матических фрагментах) обнаружены центры связывания G-
белков, кальмодулина, протеинкиназы С и сАМР-зависимых
протеинкиназ, что обеспечивает высокие возможности эндо-
генной регуляции работы кальциевых каналов. Это касается не
только хемоактивируемых, но и потенциалактивируемых Са2+-
каналов L-типа. На рис. 89 показано, как увеличиваются ве-
роятность открывания потенциалактивируемых Са2+-каналов
кардиомиоцита и время его открытого состояния при действии
на клетку адреналина, запускающего внутриклеточный каскад
реакций, приводящих к модуляции свойств канала.
159
МЕХАНИЗМЫ ЭЛЕКТРОМЕХАНИЧЕСКОГО
СОПРЯЖЕНИЯ В РАЗНЫХ ТИПАХ
МЫШЕЧНЫХ КЛЕТОК И ВОЛОКОН
В скелетных мышечных волокнах существует сложный (до
конца не ясный) механизм ЭМС, который не встречается у
других типов мышечных клеток (рис. 91,а).
На рис. 82 и 84 схематически показана ультраструктура
мышечного волокна в области Z-дисков. Как отмечалось, от
поверхностной мембраны в глубь волокна отходят поперечные
углубления (трубочки), представляющие собой тонкие цилинд-
рические инвагинации поверхностной мембраны, которые по-
лучили название Т-системы, или Т-трубочек (от англ, transver-
sal tubules). Полость этих трубочек сообщается с внеклеточной
средой. Перпендикулярно системе Т-трубочек внутри волокна
вдоль миофибрилл располагаются продольные тубулы СР (про-
дольные, или латеральные, цистерны СР). На концах этих
тубулярных цистерн СР имеются расширения (см. рис. 82, 84).
Эти расширения — терминальные цистерны СР близко сопри-
касаются (но не сливаются!) с поперечными трубочками Т-сис-
темы и образуют так называемые триады. Терминальные цис-
терны СР (в области триад) содержат внутри большие скопле-
ния кальция, так как являются не чем иным, как разветвле-
нием полости СР мышечного волокна. Между мембраной
Т-трубочки и мембраной терминальной цистерны СР в области
триады существует очень узкая щель — около 15—18 нм. (Поэ-
тому триаду иногда называют внутриклеточным синапсом,
или Т-СР-соединением от англ. T-SR junction.) Электронно-
микроскопически в области Т-СР-соединения обнаружены
специфические перемычки, или мостики (чаще их называют
“feets” — “ножки”), выступающие из мембраны терминальной
цистерны СР и как будто бы переброшенные к мембране
Т-трубочки. Специальный улыраструктурный анализ Т-СР-со-
единения с помощью метода замораживания-скалывания по-
казал, что "ножки” являются частью очень крупной и сложно
устроенной молекулы — рианодинового рецептора, пред-
ставляющего собой особый тип внутриклеточного Са2 -канала.
В настоящее время молекулы рианодинового рецептора вы-
делены из мембран СР разных типов мышц, а также из эндо-
плазматического ретикулума других тканей. Соответственно
известны рианодиновые рецепторы трех типов: РиР] (скелет-
ных мышц), РиР2 (сердца) и РиР3 (мозга). Установлены высо-
кая степень гомологии молекулярной структуры 1-го и 2-го
типов рианодиновых рецепторов, а также принципиальное
сходство их функциональных характеристик. Например, про-
водимость одиночного Са2+-канала РиР] и РиР2 практически
одинакова — около 120 нСм. Однако РиР] и РиР2 различаются
160
Рис. 91. Механизмы ЭМС и фармакомеханическое сопряжение.
а — “электромеханическая” модель, характерная для ЭМС скелетных мышеч-
ных волокон. Деполяризация мембраны Т-зрубочки (Д V) приводит к конфор-
мации в молекуле DHP-рецептора, что передается (электррстатически или
механически) на молекулу РиР и вызывает открывание Са2+-канала РиР и
выход ионов Са2+ из полости СР; б — InsPj-зависимый механизм фармакомс-
ханического сопряжения, характерный для гладкомышечных клеток. Действие
медиатора или гормона на соответствующий белок-рецептор мышечной мем-
браны приводит к активации внутримембранных G-белков и фосфолипазы
(ФЛ) с образованием посредников InsP3. InsPj, действуя на InsP3-рецептор,
вызывает высвобождение ионов Са2+ из ретикулума; в — механизм Са -зави-
симого выброса ионов Са2+ из цистерн СР для сердечных миоцитов и глад-
комышечных клеток; I — наружные мембраны мышечных клеток и волокон;
II — мембраны СР.
своей чувствительностью к ионам Са2+ и рианодину. В составе
СР гладких мышц также найдены РиР 1-го и 2-го типов.
В функционировании сердечных и гладкомышечных клеток
важную роль играют не только внутриклеточные Са2+-каналы,
называемые рианодиновыми рецепторами, но и другой тип
кальцийвысвобождающих белковых молекул — так называемые
lnsPj-активируемые -каналы, или Хт^урецепторы. Эго мо-
лекулы, имеющие центр узнавания инозитолтрифосфата (InsP3).
Масса молекулы 1пзР3-рецептора почти в 2 раза меньше массы
рианодинового рецептора и составляет порядка 270 000. На
N-конце молекулы 1пзР3-рецептора имеется 1п8Р3-связываю-
щий участок, а С-конец, как и у рианодинового рецептора,
участвует в образовании поры для кальция. В отличие от риа-
нодинового рецептора 1п8Р3-рецептор не активируется риано-
дином или кальцием, но имеет высокоаффинный центр свя-
зывания lnsP3 и активируется только действием InsP3 (что
приводит к открыванию кальциевой поры 1пзР3-рецептора).
161
Структура РиР]. Молекула РиР] — олигомер, состоящий
из четырех идентичных субъединиц. Каждая субъединица пред-
ставляет собой полипептид с мол. массой около 450 000. Лишь
небольшая часть молекулы РиР] встроена в мембрану терми-
нальной цистерны СР. Значительно большая часть молекулы
выдается в цитоплазму (в пространство Т-СР щели) на 12 нм,
причем имеет латерально изогнутую форму — в виде цветочно-
го лепестка (см. рис. 84, 85). Внутримембранный фрагмент
субъединицы рианодинового рецептора представляет собой
а-спирализованную аминокислотную цепь, многократно пере-
секающую мембрану (от 4 до 10 раз, по данным разных авто-
ров). По-видимому, именно внутримембранный фрагмент спо-
собен (при определенных условиях) образовывать Са2+-канал,
по которому кальций поступает из полости ретикулума в ми-
оплазму. Цитоплазматическая часть молекулы РиР] также, по-
видимому, является частью канальной структуры и ориентиру-
ет направление выхода кальция. Са2+-канал, образуемый каж-
дой отдельной субъединицей РиР], называют латеральным ка-
налом в отличие от центрального канала, образуемого в резуль-
тате взаимодействия четырех одинаковых молекул (субъеди-
ниц) РиР] в центре такого комплекса.
Внутримембранный фрагмент рианодинового рецептора
имеет активные центры, связывающие кальций. Свое название
молекула РиР] получила благодаря способности связывать риа-
нодин — алкалоид, выделенный из корней американского
растения Ryania speciosa. Рианодин способен прочно связы-
ваться с молекулой рианодинового рецептора. Связывание РиР
с ионами Са2+ (в микромолярных концентрациях) приводит к
конформационным изменениям молекулы и открыванию
Са2+-канала рианодинового рецептора, что сопровождается
быстрым выходом ионов Са2+ из СР в миоплазму. Именно этот
кальций и поступает к сократительным белкам, вызывая со-
кращение клетки.
Непосредственно напротив молекулы рианодинового рецеп-
тора в мембране Т-трубочки расположены инте1ральные бел-
ковые молекулы, которые называют дигидропиридиновыми ре-
цепторами (DHP-рецепторы), поскольку в их составе имеется
центр связывания веществ дигидропиридинового ряда (нифе-
дипин, нитрендипин и т.п.). Прочное ковалентное связывание
дигидропиридинов с молекулой DHP-рецептора позволило вы-
делить эти молекулы из состава мембраны, а затем идентифи-
цировать. Молекула DHP-рецептора имеет мол. массу около
170 000 и высокую степень гомологии со структурой а]-субъ-
единицы Са2+-канала L-типа. Тем не менее, молекула DHP-
рецептора, по-видимому, не идентична Са2+-каналу L-типа, а
ее функциональное назначение иное (см. рис. 84, 91). Ультра-
структурные исследования позволили установить, что каждая
молекула DHP-рецептора расположена строго напротив моле-
162
кулы рианодинового рецептора — так, что они могут соприка-
саться в пространстве Т-СР щели. Предполагают, что молекулы
DHP-рецепторов способны функционировать не как типичные
потенциалзависимые Са2+-каналы, пропускающие кальциевый
ток, а как сенсоры напряжения. В составе этих молекул 2 типа
дипольных частиц. Имеются мобильные положительно заря-
женные группировки, высокочувствительные к деполяризации
мембраны, которые смещаются при деполяризации мембраны
в течение нескольких миллисекунд, т.е. значительно быстрее,
чем частицы активационных ворот (Са2+-канала), кинетика
смещения которых занимает десятки-сотни миллисекунд, судя
по анализу емкостных токов смещения в молекуле DHP-pe-
цептора. Такое специфическое, более быстрое смещение элект-
рически заряженных частиц — сенсоров напряжения внутри
молекулы DHP-рецептора может вызывать его конформацион-
ные изменения, что каким-то (пока неизвестным) образом,
например электростатически или механически, может переда-
ваться на близко расположенные “ножки” РиР. Такое воздей-
ствие на молекулу РиР приводит к “откупориванию” Са2+-ка-
нала этого рецептора и выходу кальция из СР.
Безусловно, детали электромеханического сцепления между
молекулами DHP-рецептора и молекулами рианодинового ре-
цептора еще нуждаются в дальнейшем исследовании. Однако
уже сейчас очевидно, что такой механизм способен обеспечить
самую быструю передачу сигнала к сокращению от поверхност-
ной мембраны к мембране СР. Любая диффузия веществ-по-
средников от мембраны Т-трубочки до близко расположенного
рианодинового рецептора терминальной цистерны не может
обеспечить аналогичную скорость передачи сигнала к выбросу
кальция из СР, а значит, и к сокращению (см. рис. 82,6; 91,а).
В гладкомышечных клетках, как известно, значительно мень-
ше развит СР, чем в сердечных и скелетных волокнах. Он
выгладит в виде небольших цистерн, расположенных в при-
мембранной, а иногда и в центральной части клетки. Вследст-
вие этого в большинстве гладкомышечных клеток активация
сокращения происходит главным образом за счет поступления
кальция из наружной среды по потенциал- и хемоактивируе-
мым Са2+-каналам. В частности, при действии медиаторов,
гормонов и других эндогенных метаболитов на рецепторные
белки мышечной мембраны происходит активация таких мем-
браносвязанных ферментов, как аденилатциклаза, фосфолипа-
за С. Эго, в свою очередь, приводит к запуску каскада внут-
риклеточных реакций, заканчивающихся активацией метабо-
лически активируемых Са2+-каналов (см. рис. 87,а). Кальций,
поступающий в клетку по этим каналам, диффундируя к внут-
риклеточным Са2+-связывающим белкам саркоплазмы, может
непосредственно запускать сокращение.
Еще одним механизмом сокращения определенных типов
163
гладкомышечных клеток может быть выброс ионов Са2+ из
внутриклеточных цистерн СР. Относительный вклад внутри-
клеточно депонированного кальция, выбрасываемого из цис-
терн СР, по сравнению с кальцием, поступающим из наружной
среды, как правило, невелик и зависит от типа гладкомышеч-
ных клеток. Тем не менее в большинстве гладкомышечных
органов (например, в кишечнике, матке и др.) описан специ-
фический механизм активации сокращения, который называ-
ется фармако-механическим сопряжением. В этом случае внеш-
ним сигналом, запускающим сокращение гладкомышечных
клеток, является действие на мембрану фармакологических
или биологически активных веществ (медиаторы, гормоны),
приводящих через каскад внутриклеточных реакций к выбросу
ионов Са2+ из внутриклеточных цистерн СР и активации со-
кращения. Гормон или медиатор, действуя на специфические
мембранные рецепторы, вызывает конформационные пере-
стройки в молекуле рецептора, способствующие активации пе-
риферического GTP-связывающего белка мембраны — G-бел-
ка. Активированные субъединицы G-белка в свою очередь
могут переводить в активное состояние другой внутримембран-
ный белок — фосфолипазу С. Фосфолипаза С — это фермент,
способный при его активации расщеплять фосфоинозитиды
мембраны с образованием двух продуктов — диацилглицерола
и инозитолтрифосфата InsP3. Образующийся InsP3 высвобож-
дается из состава мембраны, поступает в миоплазму и диффун-
дирует к цистернам СР (рис. 91,6). На мембране СР гладко-
мышечных клеток имеются 1п8Р3-рецепторы. При воздействии
InsP3 на соотаетствующий высокоаффинный участок молекулы
1пзР3-рецептора изменяется конформация этой молекулы. Это
изменение сопровождается открыванием Са2+-канала, находя-
щегося в составе молекулы 1пзР3-рецептора, и выходом каль-
ция из СР в миоплазму.
Как уже отмечалось, в составе мембран СР гладкомышеч-
ных клеток имеются не только 1п8Р3-рецепторы, но и РиР.
В последние годы проводились исследования на первичной
культуре гладкомышечных клеток аорты и других органов. Уда-
лось установить весьма специфическую роль РиР. Как извест-
но, у гладкомышечных клеток имеются многочисленные инва-
гинации поверхностной мембраны в глубь клетки, так назы-
ваемые кавеолы, которые можно рассматривать как некоторый
аналог системы Т-трубочек. Соответственно со стороны мио-
плазмы к мембране кавеол тесно примыкают цистерны СР, в
составе которых имеются рианодиновые рецепторы 1-го и 2-го
типов. В результате микроскопического исследования изоли-
рованных гладкомышечных клеток обнаружено такое явление,
как спонтанные локальные выбросы ионов Са2+ из примем-
бранных цистерн СР через рианодиновые рецепторы. Эти
“кальциевые вспышки” возникают нерегулярно, с частотой в
164
среднем 0,3 Гц, и лишь в определенных локусах клетки. Однако
оказалось, что таких “кальциевых вспышек” вполне достаточ-
но, чтобы постоянно подстегивать работу Са2+-активируемых
К+-каналов наружной мембраны, которые участвуют в поддер-
жании определенного уровня мембранного потенциала клетки.
При возбуждении, когда через мембрану клетки начинает идти
кальциевый ток, входящие ионы Са2+ прежде всего встречают
на своем пути РиР, встроенные в примембранные цистерны СР,
и активируют их, вызывая выброс ионов Са2+ из цистерн СР.
Этот процесс получил название Са2+-активируемый выброс
кальция из СР. Такое высвобождение депонированного каль-
ция может итрать двоякую роль в гладкомышечных клетках:
либо преимущественно активировать Са2+-зависимые К+-кана-
лы наружной мембраны, вызывая гиперполяризацию мембра-
ны и расслабление клетки, либо действовать на Са2+-зави-
симые белки саркоплазмы и запускать сокращение клетки.
Какой из механизмов будет преобладать, зависит от состояния
и строения СР, расположения РиР и типа гладкомышечной
клетки.
В гладкомышечных клетках в зависимости от особенностей
их специализации и физиологического состояния могут быть за-
действованы различные механизмы ЭМС и способы повышения
уровня внутриклеточного кальция: поступление ионов Са2+ по
Са?+-каналам наружной мембраны и выброс ионов Са2* из цис-
терн СР. Более того, в одной и той же гладкомышечной клетке,
как правило, возможно несколько разных способов повышения
уровня ионов Са2* и механизмов ЭМС.
В сердечных миоцитах, как известно, достаточно хорошо
выражен СР. В этом смысле клетки сердечной ткани занимают
промежуточное положение между гладкомышечными клетками
и скелетными волокнами. При деполяризации мембраны кар-
диомиоцита и генерации ПД запуск сокращения клетки обу-
словлен как поступлением Са2+ из внеклеточной среды через
поверхностную мембрану, так и освобождением их из внутри-
клеточных депо. Относительный вклад этих двух источников
кальция в сокращение клетки совершенно различен. С одной
стороны, показано, что активация медленных (L-типа) Са2+-
каналов (во время фазы плато сердечного ПД) и возникнове-
ние входящего кальциевого тока непосредственно определяют
силу сокращения кардиомиоцита (см. рис. 86). При устранении
ионов Са2+ из внеклеточной среды сокращение сердечных
миоцитов прекращается.
С другой стороны, расчеты показывают, что количества
кальция, входящего из внеклеточной среды во время одного
ПД, недостаточно для индукции сокращения сердечного мио-
цита. Поэтому были высказаны предположения, что значитель-
ную роль, очевидно, играет высвобождение кальция из СР.
Наружный кальций, входящий по Са2+-каналам, выполняет
165
лишь роль триггера, запускающего выброс ионов Са2+ из СР,
и активирует систему РиР. Действительно, сердечные мышеч-
ные клетки имеют развитую Т-систему, в мембранах их Т-тру-
бочек сосредоточены типичные Са2+-каналы L-типа. При каж-
дом ПД эти каналы Т-трубочки открываются и пропускают
кальций внутрь клетки, который и приводит к открыванию
Са2+-каналов РиР и выходу ионов Са2* из СР в миоплазму.
Таким образом, у кардиомиоцитов электромеханическое со-
пряжение представляет собой Са2+-зависимый выброс ионов Са2+
из СР (рис. 91,в).
Важно также иметь в виду, что у кардиомиоцитов обнару-
жена значительная зависимость вероятности открывания по-
тенциалактивируемых каналов (L-типа) не только от деполя-
ризации мембраны, но и от ряда внутриклеточных метаболитов
(вторичные мессенджеры типа сАМР, диацилглицерола). Это
создает широкие возможности для регуляции работы Са -ка-
налов и сократительной способности кардиомиоцита.
Таким образом, в данной главе были рассмотрены совре-
менные представления о механизмах электромеханического со-
пряжения в разных типах мышечных клеток и волокон. В лю-
бой мышечной клетке сокращение начинается с деполяриза-
ции и генерации ПД на наружной мембране. Затем этот сигнал
передается внутрь мышечной клетки, к сократительным бел-
кам. В качестве внутриклеточного мессенджера, сопрягающего
возбуждение наружной мембраны с активностью сократитель-
ных белков, могут выступать ионы Са2+. Это происходит либо
путем поступления ионов Са2+ из наружной среды по потен-
циалактивируемым кальциевым каналам (во время генерации
ПД), либо за счет высвобождения ионов Са2+ из цистерн СР.
Кинетика и сами способы поступления ионизированных ионов
Са2+ к местам расположения С а2+-зависимых регуляторных и
сократительных белков (кальмодулина, миозина, тропонина,
протеинкиназ и др.) во многом определяют скорость развития
сокращения клетки. Прн достижении критической (“порого-
вой”) концентрации ионов Са2+ вблизи этих белков запуска-
ется сложный каскад внутриклеточных реакций, приводящий
к собственно сокращению мышечной клетки. Детали Са2+-за-
висимых молекулярных превращений сократительных и сопут-
ствующих им белков подробно рассматриваются в следующих
главах.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Авдонин П.В., Ткачук В.А. Рецепторы и внутриклеточный кальций. М.:
Наука, 1994.
Албертс Б, Брей Д., Льюис Дж. и др. Молекулярная биология клет-
ки.—Т.2.—М.: Мир, 1994.
Костюк П.Г Кальций и клеточная возбудимость.—М.: Наука, 1986.
166
Рубцов AM., Батрукова М.А. Кальциевые каналы (рианодиновые ре-
цепторы) саркоплазматического ретикулума: структура и свойст-
ва//Успехи биол. химии.—1997.
Шуба М.Ф., Бурый В.А. Мембранные механизмы возбуждения гладко-
мышечных клеток//Физиол.журн.—1984,—Т.30.—С.545—558.
Физиология человека/Под. ред. Р.Шмидта и Г.Тевса.—Т.1.—М.: Мир,
1996.
Эккерт Р., Рэнделл Д., Огастин Дж. Физиология животных. Механиз-
мы адаптации.—Т.1.—М.: Мир, 1994.
Dudel J. (HrsgJ, Menzel R., Schmidt R. Neurowissenschaft: vom Molekul
zur Kognition.—Springer Verlag, 1996.
Kuriyama H., Kitamura K., Itoh T., Inoue R. Physiological features of
visceral smooth muscle cells, with special reference to receptors and ion
channcls//Physiol. Reviews.—1988.—Voi.78.—P.811—920.
Principles of Physiology//Ed. R.M.Beme, M.N.Levy.—C.V.Mosby com-
pany, 1990.
Melzer W., Herrman-Frank A., Luttgau H.Ch. The role of Ca2+-ions in
excitation-contraction coupling of skeletal muscle Fibers//Biochim. bio-
phys. Acta.-1995.—Vol. 1241 .-P.59-116.
Глава 6
ПАТОФИЗИОЛОГИЯ
СКЕЛЕТНОЙ МУСКУЛАТУРЫ
В данной главе рассмотрены патофизиологические измене-
ния только скелетной мускулатуры человека, что, несомненно,
важно для медицины.
Патологию скелетной мускулатуры принято объединять под
общим названием “нервно-мышечные болезни” [2]. В этих
болезнях выделяют три большие группы в соответствии с мес-
том первичного поражения.
Первую группу составляют болезни, изначально поражаю-
щие собственно мышечные волокна. Это так называемые идио-
патические, или первично-мышечные, миопатии. Они включают
многочисленные расстройства метаболизма и функциональных
свойств мышечного волокна, которые могут приводить к пол-
ной деградации мускулатуры:
♦ миодистрофии — заболевания, сопровождающиеся дегра-
дацией мышечных волокон и замещением их жировой
или соединительной тканью;
♦ миопатии — мышечные нарушения, обусловленные
сдвигом обмена веществ и нарушением работы эндо-
кринных желез человека;
♦ миотонии и периодические мышечные параличи — наруше-
ния возбудимости мышечных волокон;
♦ полиомиозиты — воспалительные процессы в мышцах.
167
Вторая группа нервно-мышечных болезней носит название
“нейрогенные, или вторично-мышечные миопатии”. Это заболе-
вания, первично поражающие периферические мотонейроны,
после чего “заболевают” и атрофируются мышечные волокна.
Относительно частая встречаемость и тяжесть этих заболе-
ваний делают их изучение весьма актуальной задачей совре-
менной медицины и патофизиологии.
ПЕРВИЧНО-МЫШЕЧНЫЕ МИОПАТИИ
Остановимся на двух формах идиопатических (первично-
мышечных) миопатий: миодистрофиях и миотонии.
МИОДИСГРОФИИ
Наиболее распространенными наследственными первично-
мышечными заболеваниями являются миодистрофии, в кото-
рых выделяют множество разновидностей. Все миодистрофни
вызваны сходной первопричиной — нарушениями в генетичес-
ком аппарате человека. Например, известны сцепленные с
полом, или Х-сцепленные, миодистрофии, обусловленные на-
рушениями в Х-хромосоме человека. Типичным клиническим
проявлением всех миодистрофий является мышечная слабость,
возникающая и прогрессирующая во времени в связи с посте-
пенной деградацией и гибелью мышечных волокон. Это при-
водит к дистрофии мышц и замене мышечных волокон раз-
растающимися соединительной и жировой тканями.
Миодистрофия Дюшенна. Наиболее подробно изучена мио-
дистрофия Дюшенна, названная так по имени описавшего ее
в 1868 г. французского врача Г.Дюшенна. Это самая распро-
страненная и злокачественная форма Х-сцепленной дистро-
фии. Она характеризуется ранним началом (в детском и юно-
шеском возрасте) и проявляется сначала в нарушении походки
ребенка, затем в прогрессирующей мышечной слабости, кото-
рая приводит к полной обездвиженности и, как правило, ле-
тальному исходу в J5—18 лет. Результаты комплексных микро-
скопического, гисто- и биохимического исследований биопта-
тов мышц больных дистрофией Дюшенна позволили устано-
вить, что одним из ранних, а может быть, и первым отклоне-
нием от нормы при этой болезни является изменение свойств
мембраны мышечных волокон. Именно структурные дефекты
сарколеммы приводят к ослаблению барьерной функции мем-
браны. Это в свою очередь вызывает постепенную потерю
мышечными волокнами ряда таких важнейших внутриклеточ-
ных компонентов, как ферменты (например, креатинфосфоки-
наза), углеводы, аминокислоты и др. Одновременно с этим в
мышечные волокна начинают проникать и накапливаться в
них вредные агенты.
168
Считают, что самым тяжелым последствием дефекта мы-
шечной мембраны при миодистрофии Дюшенна является по-
ступление в мышечные волокна избыточных количеств ионов
Са2+, которые образуют значительные кальциевые отложения.
Такое неконтролируемое повышение концентрации ионов
Са2+ в клетке способно стать мощнейшим триггером целого
каскада вредных для клетки реакций. Например, происходит
активирование нейтральных протеаз и повышается уровень
лизосомального протеолиза, что в свою очередь приводит к
распаду мышечных белков и некрозу самих волокон.
Исследования генома больных людей методами молекуляр-
ной генетики и биохимии позволили установить, что перво-
причиной дефекта мембраны является наличие генной мутации
в небольшом локусе зоны р21 Х-хромосомы. Дефектный ген,
названный дюшенновским геном, кодирует белок, получивший
название “дистрофин”. К настоящему времени дистрофин вы-
делен из здоровых скелетных мышц человека, мыши и цып-
ленка. Установлены его молекулярная масса (около 400 000) и
аминокислотная последовательность, которая демонстрирует
высокую степень гомологии у разных видов животных и чело-
века. У здоровых людей (с интактным дюшенновским геном)
дистрофин (и, видимо, еще некоторые “родственные” ему бел-
ки, кодируемые дюшенновским геном) — это важный струк-
турный компонент сарколеммы, он может быть отнесен к
семейству белков цитоскелета. Используя антитела к дистро-
фину, методы иммуноблоттинга, иммуногистохимического и
флюоресцентного маркирования мембраны, удалось устано-
вить, что у “здоровых” мышечных волокон дистрофин равно-
мерно распределен по ходу волокна на всем его протяжении,
за исключением зоны постсинаптической мембраны и мембра-
ны Т-трубочек в области триад, где его концентрация повыше-
на. Улыраструктурные исследования показали, что молекулы
дистрофина, переплетаясь между собой, образуют хорошо
структурированную ячеистую сеть, которая примыкает к плаз-
молемме с ее внутренней стороны. Одновременно своими
С-термннальными концами молекулы дистрофина сцеплены с
интегральными гликопротеинами мембраны, которые соединя-
ются с белком внеклеточного матрикса — ламинином. Пред-
полагают, что недостаток или полное отсутствие дистрофина в
составе цитоскелетного каркаса мышечного волокна у людей
с дефектным дюшенновским геном приводит к быстрому по-
вреждению мембраны при растяжениях и смещениях волокна.
Согласно другой гипотезе, дефицит дистрофина может нару-
шать функции специфических ионных каналов, активируемых
растяжением волокна, которые при активации высокопроии-
цаемы для ионов Са2*. Недавно показано, что у мышей линии
mdx (больных миодистрофией) значительно повышена актив-
ность этих каналов. Поэтому возможно, что первым патофи-
166
энологическим признаком развития миодистрофии является
избыточное поступление ионов Са2+ внутрь волокна по чувст-
вительным к растяжению ионным каналам (стреч-каналам),
что повышает уровень внутриклеточного кальция.
Следует отметить, что не только отсутствие дистрофина и
“родственных” ему белков, кодируемых дюшенновским геном,
И1рает существенную роль в детерминировании болезни Дю-
шенна. Значительный вклад в понимание патогенеза этой бо-
лезни внесли исследования, проведенные на мышах-мутантах
линии mdx. Эти животные имеют аналогичную дюшенновской
мутацию в Х-хромосоме. Соответственно в составе их муску-
латуры отсутствует дистрофин, и она сильно подвержена дис-
трофии. В отличие от классической болезни Дюшенна челове-
ка у больных мышей не наблюдается активной пролиферации
соединительной ткани; вследствие этого миодистрофия не
имеет злокачественной формы и не вызывает смерти живот-
ных. Поэтому считается, что наряду с отсутствием дистрофина
повышенная пролиферация соединительной ткани также имеет
важное патогенетическое значение для развития миодистрофии
Дюшенна.
Лечение миодистрофий в настоящее время ограничивается
симптоматической медикаментозной терапией, ортопедичес-
кими и хирургическими мерами временной коррекции мышеч-
ного “корсета” и двигательного аппарата человека.
Миотонии и периодические параличи. В отличие от миодис-
трофий миотонии — это группа первично-мышечных заболева-
ний, при которых не обязательно возникают видимая деструк-
ция мышечных волокон и мышечная слабость. Основным при-
знаком заболевания являются периодические тонические спазмы
скелетных мышц, затруднение расслабления после произволь-
ного сокращения, а также мышечные контрактуры либо пара-
личи, часто сопровождающиеся мышечными болями. Эти па-
тологические состояния мышц обусловлены нарушениями
электрической возбудимости и стабильности мембраны мы-
шечных волокон. Мембранные дефекты заключаются в нару-
шении работы ионных каналов и систем трансмембранного
ионного транспорта и могут сопровождаться как повышенной
(при миотониях), так и пониженной (при параличах) возбуди-
мостью мышечных волокон.
Существует много форм наследственных и приобретенных
миотоний. Примером врожденной миотонии является так на-
зываемая миотония Томсена (myotonia congenita), впервые опи-
санная в 1876 г. врачом А.Томсеном, который сам страдал этим
заболеванием. Болезнь относится к числу редких, но тяжелых.
Она проявляется уже в детском возрасте нарушениями нор-
мальных движений: после активного напряжения мышц воз-
никает тонический спазм с затруднением расслабления. Этот
спазм возникает только прн интенсивном произвольном дви-
170
жении. При повторных движениях миотонический спазм по-
степенно уменьшается [2]. Данные светомикроскопического
анализа не выявляют существенных изменений структуры мы-
шечных волокон, наблюдаются повышенная возбудимость и
реактивность мышечных волокон к ионам К+. Для болезни
Томсена характерен аутосомно-доминантный тип наследова-
ний, хотя конкретный локус геномного дефекта до сих пор не
установлен.
Сходна с миотонией Томсена по симптоматике, но отлича-
ется по характеру наследования рецессивная генерализованная
миотония Беккера (paramyotonia congenita). Эта болезнь встре-
чается более часто и поражает большее число скелетных мышц
человека, чем болезнь Томсена.
Довольно тяжелой формой миотонии является дистрофи-
ческая миотония, при которой наблюдаются не только харак-
терные для всех миотоний спазмы и затруднения расслабления
мышц, но и прогрессирующие дистрофические процессы в
мускулатуре. Характерный симптом — вовлеченность в патоло-
гический процесс эндокринной и вегетативной систем.
Уже более 100 лет известна довольно редкая форма — пара-
доксальная миотония, впервые описанная А.Эйленбургом в
1866 г. При этом наследственном заболевании миотонические
симптомы возникают только при купании в холодной воде или
долгом пребывании на холоде в зимнее время и сопровожда-
ются длительными холодовыми спазмами мускулатуры. Вне
охлаждения больные чувствуют себя здоровыми, у некоторых
хорошо развита мускулатура.
В последнее время достигнут прогресс в понимании харак-
тера мембранных дефектов и выяснении механизмов, ответст-
венных за развитие миотонического спазма мускулатуры у
больных разными формами миотонии. Эта стало возможным
благодаря внедрению в патофизиологию методов современной
микроэлектрофизнологии. В конце 80-х — начале 90-х годов
впервые на клиническом материале (биоптаты) in vitro были
успешно применены методы двухэлектродной и локальной
фиксации (patch clamp) потенциала на мембране для регистра-
ции ионных токов в мышечных клетках в покое при возбуж-
дении. Эти работы показали, что в зависимости от типа мио-
тонии наблюдаются изменения в разных типах ионных каналов
и систем транспорта ионов через мембрану, включая потенци-
алзависимые Na+-, К+-каналы, Са2+-активируемые калиевые
каналы, Na+- К+-АТРазу (табл. 7).
При миотонии Томсена обнаружено аномальное поведение
Na+-каналов: снижение их проводимости и изменение харак-
тера активационных и инакгивационных конформационных
переходов в молекуле самого канала в ответ на деполяризацию
мембраны. При генерализованной рецессивной форме миото-
нии Беккера, несмотря на принципиальное сходство симпто-
171
мов с миотонией Томсена, механизмы генерации миотоничес-
кого разряда, по-видимому, имеют другую природу. В данном
случае главная причина заключается в сниженной проводимос-
ти мембраны для ионов С1_. Уровень потенциала покоя “боль-
ных” волокон при этом не изменен и достаточно высокий, но
изменена форма ПД: генерация первого спайка после периода
покоя сопровождается длительной и хорошо выраженной сле-
довой деполяризацией мембраны. Механизм формирования
этой деполяризации состоит в следующем. Как известно, в
нормальных волокнах при генерации одиночного ПД ионы К+
выходят из мышечного волокна в наружную среду и способны
накапливаться в межклеточной жидкости в узком пространстве
трубочек Т-системы. Если пассивная проводимость ионов СГ"
нормальная (а значит, очень велика у мышечного волокна), то
реальная следовая деполяризация мембраны от избытка вы-
шедших иоиов не превышает 0,1 мВ (за счет хлорного тока,
стабилизирующего МП).
Таблица 7. Нарушение ионной проводимости мембран при разных
формах миотонии
Заболевание Тип наследования Тип нарушения мембраны
Миотония Томсена (myotonia congenita) Доминантный gNa4 gCFl?
Рецессивная генерализованная миотония Беккера Рецессивный gcri
Дистрофическая миотония Доминантный gCri?, gNa+t?
Парамиотония Эйленбурга (para- myotonia congenita) > gNa+T
Гипокалиемический паралич » gNa+/gK+?
Обозначения: gNa+ gCl , gK+ — проводимость натрия, хлора и калия;
Т проводимость повышена; 4 проводимость понижена.
У “больных” волокон пассивная проводимость иоиов СГ"
мембраной сильно снижена, поэтому ПД сопровождается зна-
чительно большим следовым калиевым током. При этом на-
капливается значительное количество калия в пространстве
трубочек Т-системы, так что на каждый ПД приходится до 1 мВ
следовой калиевой деполяризации. В начале произвольного
движения уже после первых 5—6 ПД такая следовая деполя-
ризация мембраны суммируется и возрастает до уровня, доста-
точного для инициации серии ПД, циклически повторяющихся
на фоне стойкой деполяризации мембраны. Эти процессы ле-
жат в основе длительного миотонического разряда, задержива-
ющего произвольное расслабление мышцы. Такой разряд пре-
кращается лишь благодаря наступающей инактивации Na+-Ka-
172
налов под действием длительной деполяризации. Окончатель-
ное снятие миотонического спазма, т.е. сброс деполяризации
мембраны, обусловлен тем, что повышение концентрации ка-
лия в наружной среде активизирует работу Na+/K+-nacoca
мышечной мембраны. Этот насос начинает усиленно закачи-
вать избытки калия внутрь волокна, что в конце концов при-
водит к реполяризации мембраны, т.е. восстановлению исход-
ного уровня потенциала покоя.
При парамиотонии Эйленбурга повышена проводимость
Ка+-каналов мембраны “больных” мышечных волокон. У во-
локон in vitro при охлаждении удалось зарегистрировать сни-
жение потенциала покоя до —40 мВ. При такой деполяризации
возникает длительная серия ПД, что и вызывает миотоничес-
кую холодовую контрактуру. В случае продолжающейся мы-
шечной работы или мышечных усилиях при низкой темпера-
туре среды контрактура и задержка расслабления мышцы еще
более затягиваются. Причиной этого, как считают, является
резкое нарушение механизма инактивации Ка+-каналов при
охлаждении, что сопровождается длительным гипервозбужде-
нием мышечного волокна.
Все перечисленные формы миотонии наследственно детер-
минированы. Вопрос о том, как первичный генный дефект
связан с нарушениями работы ионных каналов, остается от-
крытым. Есть основания считать, что генная мутация может
опосредованно влиять на свойства каналов, прежде всего на
липидное окружение канала. Известно, например, что мембра-
на эритроцитов больных paramyotonia congenita имеет изменен-
ный состав липидов и жирных кислот. Нельзя также исклю-
чить, что первичным продуктом мутантного гена являются
какие-то ферменты в составе цитоплазмы мышечного волокна,
влияющие на процесс построения молекулы канала еще до
момента ее встраивания в мембрану.
При лечении таких миотоний, как миотония Томсена, Бек-
кера, используют антиаритмические средства: дифенилгцдан-
тонин, токаинидин, способные снизить повышенную возбуди-
мость мускулатуры. Однако радикального патогенетического
лечения различных форм миотонии не существует.
ВТОРИЧНО-МЫШЕЧНЫЕ (НЕЙРОГЕННЫЕ)
МИОПАТИИ
Нормальное состояние и функционирование скелетной мус-
кулатуры невозможны, если имеются какие-либо нарушения в
системе ее двигательной иннервации. Это объясняется тем, что
нервная система управляет не только сократительным актом
мышцы, но и всей ее структурно-функциональной организа-
цией. Аксон мотонейрона служит проводником не только им-
173
пульсной активности, но и нейротрофических веществ, кото-
рые двигаются вместе с аксоплазматическим током от тела
мотонейрона к нервно-мышечному синапсу, поступают в мы-
шечное волокно и участвуют в его метаболизме, включая кон-
троль над работой мышечного генома.
Рассмотрим один из видов нейрогенных миопатий — денер-
вационный синдром.
Любое нарушение, будь то нарушение и дегенерация тел
мотонейронов передних рогов спинного мозга или их аксонов,
обязательно приводит к типичным изменениям мышечных во-
локон — денервационному синдрому. Денервационные пере-
стройки во многом выглядят как возврат к ювенильному со-
стоянию мышечного волокна, т.е. к морфофункциональному
статусу, характерному для мышечных волокон на ранних ста-
диях их онтогенетического развития. Первые постденерваци-
онные изменения — это снижение уровня МП и повышение
чувствительности мембраны мышечного волокна к медиатору
ацетилхолину. Последнее обусловлено появлением на мембра-
не так называемых внесинаптических холинорецепторов, кото-
рые в течение нескольких дней после денервации активно
синтезируются и встраиваются в мембрану на всем протяжении
мышечного волокна. Внесинаптические холинорецепторы —
это интегральные мембранные белки, способные при взаимо-
действии с ацетилхолином образовывать ионный канал, про-
пускающий преимущественно ионы Na+ и в меньшей степени
ионы К+ и Са2+. Открывание каналов холинорецепторов под
действием ацетилхолина приводит к деполяризации мембраны,
что может сопровождаться генерацией ПД и сокращением мы-
шечного волокна. Внесинаптические холинорецепторы рядом
свойств отличаются от синаптических: например, они менее
чувствительны к блокирующему действию d-тубокурарина и
а-бунгаротоксина, а их активация сопровождается более про-
должительным ионным током, чем при срабатывании синап-
тических холинорецепторов.
У денервированных мышечных волокон изменяются также
свойства электрогенных На+-каналов. По своей электропрово-
димости и хемочувствительности они становятся неотличимы-
ми от Ка+-каналов ювенильных мышц. Например, на целый
порядок уменьшается их чувствительность к блокирующему
действию специфического блокатора натриевых каналов тет-
родотоксина. Свойства К+- и С1_-каналов мышечной мем-
браны также оказываются видоизмененными вследствие дене-
рвации: проводимость обоих типов каналов уменьшается. Это
сопровождается снижением и нестабильностью потенциала по-
коя.
Существенными постденервационными изменениями, имею-
щими диагностическое значение, являются нестабильность и
осцилляции уровня МП покоя, которые сопровождаются гене-
174
рацией спонтанных залпов ПД и фибрилляциями мышцы. Эти
фибрилляции практически остаются незамеченными пациен-
том, но легко выявляются при злектромиографическом обсле-
довании денервированной мышцы в виде так называемых по-
тенциалов фибрилляций.
Морфологически денервационный синдром в скелетной
мускулатуре проявляется в основном снижением массы сокра-
тительных белков и уменьшением диаметра мышечных воло-
кон — это так называемый денервационный тип атрофии. Даль-
нейшая судьба денервированных волокон зависит от того, про-
изойдет ли восстановление их иннервации, т.е. реиннервация.
Если иннервация не восстановится, то мышечное волокно
обречено на полную атрофию и гибель. В настоящее время для
поддержания денервированной скелетной мускулатуры и сти-
муляции процессов прорастания нерва к мышце ведется ши-
рокий поиск биостимуляторов типа инсулиноподобных нейро-
трофических факторов роста нервов, фрагментов АКТГ и др.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Гехт БМ. Теоретическая и клиническая электромиография.—М.: Ме-
дицина, 1990.
Гехт Б.М., Ильина Н.А. Нервно-мышечные болезни.—М.: Медицина,
1982.
Гурфинкель В.С., Левин. Ю.С. Скелетная мышца: структура и функ-
ция.— М., 1985.
Кузин М.И., Гехт Б.М. Миастения.—М.: Медицина, 1996.
Механизмы нейрональной регуляции мышечной функции.—Л.: Наука,
1988.
Rudel R., Jerusalem F. Skelettmuskel.—In: FathophysyoJogy. — Munchen —
Stuttgard, 1992.
ЧАСТЬ ТРЕТЬЯ
Основы биохимии мышечных тканей
Глава 7
СОКРАТИТЕЛЬНЫЙ
АППАРАТ МЫШЦ
СТРУКТУРНАЯ ОРГАНИЗАЦИЯ СОКРАТИТЕЛЬНОГО
АППАРАТА ПОПЕРЕЧНОПОЛОСАТЫХ МЫШЦ
Как известно, сократительный аппарат поперечнополосатых
мышц высокоупорядочен. Основные сократительные белки
этих мышц — миозин и актин — упакованы в особым образом
сформированные толстые и тонкие филаменты, которые в
свою очередь определенным образом ориентированы друг от-
носительно друга. Под микроскопом поперечнополосатые
мышцы имеют характерную исчерченность. Тонкие активные
филаменты прикреплены к Z-дискам и формируют так назы-
ваемые изотропные диски — 1-диски. В центре саркомера, ог-
раниченного с двух сторон Z-дисками, располагаются так на-
зываемые толстые филаменты, основным компонентом кото-
рых является миозин. Толстые филаменты обладают большей
плотностью, чем тонкие, и формируют так называемые анизо-
тропные A-диски. Область перекрытия тонких и толстых фи-
ламентов имеет особо высокую плотность. В самом центре
саркомера, где располагаются только толстые нити миозина,
формируется менее плотная Н-зона, в центре которой распо-
ложена тонкая электронно-плотная М-линия. На поперечном
сечении видно, что каждый толстый филамент окружен шес-
тью тонкими филаментами (рис. 92).
Согласно гипотезе скользящих нитей, в основе сокращения
мышц лежит скольжение тонких и толстых филаментов друг
относительно друга, при этом соседние Z-диски сближаются,
а длины каждого саркомера уменьшаются (рис. 93). Такое
перемещение тонких и толстых филаментов приводит к сокра-
щению длины зоны Н и формированию в центре саркомера
еше более плотного образования. Гипотеза скользящих нитей
имеет много сторонников. Вероятно, наиболее убедительным
доводом в пользу этой гипотезы является зависимость силы
сокращения от длины саркомера. Известно, что перемещение
тонких и толстых нитей относительно друг друга обеспечива-
ется за счет периодического зацепления и расцепления попере-
176
Рис. 92. Расположение актиновых и миозиновых нитей на продоль-
ном (а) и поперечном (6) сечениях саркомера [Гурфинкель В.С.,
Лсвик Ю.С., 1985].
a
О
Рис. 93. Зависимость силы, генерируемой мышцей, от длины сарко-
мера (а) и схема укорачивающегося саркомера (б) [Гурфинкель В.С.,
Левик Ю.С., 1985].
а: на абсциссе — длина саркомера (мкм), на ординате — сила (% от максиму-
ма); б — цифры обозначают состояния, отмеченные вертикальными пунктир-
ными линиями на а.
чных выростов (поперечных мостиков или головок миозина) с
тонкими филаментами. Очевидно, чем больше таких мостиков
будет сформировано между нитями актина и миозина, тем
большую силу будет развивать мышца. В свою очередь число
способных к работе поперечных мостиков будет зависеть от
протяженности области перекрытия тонких и толстых фила-
ментов, т.е. от длины саркомера.
Действительно, обнаружено, что при сильном растяжении,
когда тонкие и толстые филаменты не перекрываются между
собой, мышца не способна генерировать натяжение. По мере
уменьшения длины саркомера и соответственно увеличения
области перекрытия филаментов происходит плавное возрас-
тание силы, генерируемой мышцей (см. рис. 93). При чрезмер-
ном сокращении длины саркомера, когда тонкие филаменты
одного и того же саркомера начинают перекрывать друг друга,
а толстый филамент своими концами упирается в Z-диски
177
(может быть, даже частично деформируется), уменьшается эф-
фективная для генерирования силы область перекрытия и даль-
нейшее укорочение становится невозможным. Следствием это-
го является ослабление силы, генерируемой сократительным
аппаратом (см. рис. 93). Таким образом, зависимость силы
сокращения от длины саркомера хорошо согласуется с гипоте-
зой скользящих нитей.
Несмотря на то что гипотеза скользящих нитей в настоящее
время является доминирующей, многие детали этой модели
остаются труднообъяснимыми. Ряд исследователей считают
спорными основные положения этой гипотезы и предлагают
иные объяснения молекулярного механизма сокращения
мышц. Так, Г. Поллак выдвинул гипотезу, согласно которой в
основе сокращения мышц лежит укорочение толстых филамен-
тов. Именно уменьшение длины этих филаментов обеспечива-
ет подтягивание друг к другу Z-дисков, укорочение отдельного
саркомера и всей мышцы в целом. Как бы то ни было, сокра-
щение мышц происходит за счет взаимодействия двух основ-
ных сократительных белков — миозина и актина. Рассмотрим
механизмы, обеспечивающие регуляцию взаимодействия мио-
зина и актина.
СТРУКТУРА И СВОЙСТВА МИОЗИНА
Вероятно, наиболее подробно изучен так называемые мио-
зин II — основной сократительный белок поперечнополоса-
тых, сердечных и гладких мышц. Миозин II (в дальнейшем для
простоты — миозин) представляет собой гетерогексамер и со-
стоит из двух тяжелых цепей (мол. масса 200 000—220 000), двух
регуляторных легких (мол. масса 17 000—21 000) и двух так
называемых щелочных (или существенных) легких (мол. масса
16 000—22 000) цепей. Эти шесть полипептидных цепей удер-
живаются между собой за счет нековалентных взаимодействий
и образуют прочный комплекс, который называется мономер-
ным миозином. Тяжелые цепи миозина имеют асимметричную
форму, при этом N-концевая часть формирует глобулярную
головку, в которой располагаются АТРазный и актинсвязываю-
щий центры, а С-концевая часть сворачивается в длинную
асимметричную а-спираль. Легкие цепи миозина располагают-
ся в области “шейки”, т.е. на переходе от головки к стержне-
вому хвосту, и играют в основном регуляторную и структурную
роль, стабилизируя правильную упаковку определенных частей
молекулы миозина (рис. 94).
Миозин практически нерастворим при низкой ионной силе,
что затрудняет исследование его структуры и ферментативных
свойств. Ограниченный протеолиз под действием папаина,
трипсина или химотрипсина позволяет “разрезать” большую
молекулу миозина на несколько фрагментов, часть из которых
178
-ч----------------- Стержень ’ — »
Рис. 94. Строение молекулы миозина. Стрелками указаны области,
наиболее чувствительные к воздействию протеолитических фермен-
тов: а — папаина, а и б — химотрипсина, б — трипсина с отщеплени-
ем указанных фрагментов. Центры связывания актина и АТР, нахо-
дящиеся в головках молекулы миозина, обозначены черными тре-
угольниками. Вверху слева показано, что суперспираль стержня моле-
кулы скручена из двух а-спиральных полипептидных цепей [Бэгшоу К„
1985].
обладает хорошей растворимостью и при этом сохраняет свои
основные свойства. Расположение основных фрагментов мио-
зина и некоторые их свойства приведены на рис. 94 и в табл.8.
Таблица 8. Некоторые свойства фрагментов миозина [Бэгшоу К.»
1985]
Белки Обо- значе- ние Мол. масса Длина, нм Способ- ность к само- сборке Цент- ры свя- зыва- ния актина и АТР
Миозин М 480 000 160 + 2
Легкий меромиозин ЛММ 140 000 100 + 0
Тяжелый меромиозин ТММ 340 000 60 — 2
Субфрагмент 1 S1 120 000 15 — 1
Субфрагмент 2 S2 60 000 40 — 0
Стержень 200 000 140 + 0
Оказалось, что глобулярная N-концевая часть молекулы ми-
озина [тяжелый меромиозин — ТММ и субфрагмент 1 (S1)
миозина] хорошо растворимы при низкой ионной силе и со-
179
храняют свои актинсвязывающие и АТРазные свойства. В то
же время С-концевые фрагменты миозина: легкий меромиозин
(ЛММ) и стержень (rod) — плохо растворимы при низкой ион-
ной силе и сохраняют способность к самосборке, т.е. способны
формировать правильно упакованные надмолекулярные обра-
зования.
Рассмотрим более подробно структурную организацию раз-
личных частей молекулы миозина. Как отмечалось, С-конце-
вая стержневая часть тяжелых цепей миозина (ЛММ и стер-
жень) представляют собой почти идеальную а-спираль. Эта
структуры имеют очень большую длину (например, длина стерж-
ня составляет около 140 нм). Известно, что длинные а-спирали
неустойчивы из-за того, что молекулы воды дестабилизируют
водородные связи, обеспечивающие поддержание правильной
упаковки а-спирали. Необычайная длина и устойчивость а-спи-
рали С-концевого участка молекулы миозина сохраняются за
счет того, что спиральные участки двух лежащих бок о бок
тяжелых цепей миозина закручены относительно друг друга и
образуют так называемую суперспираль (coiled-coil). Такая над-
молекулярная упаковка становится возможной в результате
своеобразной первичной структуры С-концевой части тяжелых
цепей миозина. В этой части молекулы миозина выявлены
псевдоидентичные повторяющиеся друг за другом семерки
(гептады) аминокислотных остатков. Если обозначить каждую
аминокислоту в такой гептаде буквами латинского алфавита,
то первичная структура С-концевой части тяжелой цепи мио-
зина может быть записана в виде abcdefga'b'c'd'e'fg'..., при этом
остатки а и а', b и Ь', с и с' и т. д. не идентичны между собой,
но по своим свойствам похожи друг на друга. В положениях а
и d располагаются гидрофобные остатки аминокислот, а в
положениях е и g — противоположно заряженные остатки (на-
пример, отрицательно заряженные остатки Asp или Glu в по-
ложении е и положительно заряженные остатки Aig или Lys в
положении g). В таком случае две параллельные а-спирали
С-концевых хвостов тяжелых цепей миозина, закрученные друг
относительно друга, будут формировать суперспираль, стаби-
лизированную за счет гидрофобных взаимодействий между ос-
татками and одной спирали с остатками d и а другой спирали
(рис. 95). В дополнение к этому противоположно заряженные
остатки е и g двух соседних спиралей будут также вносить свой
вклад в стабилизацию суперспирали (см. рис. 95). Если при
этом учесть, что описанные выше гептады аминокислот повто-
ряются на всем протяжении хвоста тяжелых цепей миозина, то
очевидно, что суперспираль оказывается стабилизированной
многочисленными гидрофобными и электростатическими кон-
тактами, которые, как в застежке “молния”, стабилизируют
жесткую суперспираль на большом ее протяжении. Такие су-
перспиральные структуры характерны не только для хвоста
160
Рис. 95. Схематическое изображение двойной спирали стержневой
части молекулы миозина; поперечный разрез, вид спереди со стороны
N-конца. Заштрихованы гидрофобные остатки в положениях а и d
[Левицкий Д.И. и др., 1995].
тяжелых цепей миозина, но и для некоторых других фибрил-
лярных белков мышц, таких, как парамиозин или тропомио-
зин, а также белков промежуточных филаментов: цитокерати-
нов, виментина, десмина, белков нейрофиламентов и ламинов.
Для хвостовой части тяжелых цепей миозина характерна не
только рассмотренная семичленная периодичность аминокис-
лотных остатков. Оказалось, что в стержневой части молекулы
миозина существует еще один тип периодичности с интервалом
в 28 аминокислотных остатков. Аминокислотные остатки, рас-
положенные на поверхности суперспирали (остатки в положе-
ниях Ь, с, f на рис. 95), образуют попеременно кластеры с
преимущественно отрицательными или преимущественно по-
ложительными зарядами (рис. 96). Подобная периодичность
позволяет двум соседним молекулам миозина взаимодейство-
вать друг с другом таким образом, что отрицательно заряжен-
ная область одного стержня оказывается расположенной рядом
с положительно заряженной областью другого стержня. Если
бы этот тип периодичности был идеален, то молекулы миозина
могли бы взаимодействовать между собой разными способами.
На самом деле величина этого периода несколько изменчива
по длине хвоста молекулы миозина, а в некоторых участках
этот период оказывается нарушенным. Вследствие этого суще-
ствует ограниченное количество возможностей для взаимодей-
ствия хвостов молекул миозина. Как правило, параллельно
расположенные хвосты двух соседних молекул миозина сдви-
нуты друг относительно друга на 14,3 нм.
Периодичность электростатического заряда по поверхности
хвоста молекулы миозина делает возможным взаимодействие
молекул миозина, ориентированных как параллельно, так и анти-
181
rod 1
Рис. 96. Миозиновый стержень (rod) несет на своей поверхности
чередующиеся между собой зоны с преимущественно положительны-
ми и преимущественно отрицательными зарядами. Два стержня-хвос-
та могут взаимодействовать между собой, если отрицательно заряжен-
ная зона одного стержня взаимодействует с положительно заряженной
зоной другого стержня [Pollack G.H., 1990].
Рис. 97. Агрегация молекулы миозина, приводящая к образованию
биполярных толстых нитей [Бэгшоу К., 1985].
параллельно друг другу (рис. 97). Этот факт объясняет форми-
рование биполярных толстых нитей миозина, характерных для
саркомеров поперечнополосатых мышц. При такого рода ук-
ладке хвосты молекул миозина образуют стержень, на поверх-
ности которого торчат головки миозина. При этом, судя по
всему, на каждом ярусе располагается три пары головок мио-
зина (рис. 98). Следующий ярус — на расстоянии 14,3 нм от
первого, он также содержит 3 пары головок миозина, которые
повернуты на 40* относительно первого яруса. Третий ярус
отстоит от второго на 14,3 нм и повернут относительно него
еще на 40*. Наконец, ориентация головок 4-го яруса совпадает
с ориентацией головок 1-го яруса, а большой период между 1-м
и 4-м ярусами составляет 42,9 нм (см. рис. 98). При таком
расположении головки миозина повернуты в 9 сторон (угол меж-
ду сторонами 40*), причем головки левой и правой половин
толстого филамента имеют противоположную ориентацию (см.
рис. 97).
Электронная микроскопия позволяет выявить поперечную
исчерченность толстого филамента. Это обусловлено, с одной
стороны, периодическим расположением головок миозина, а с
другой — наличием дополнительных минорных белков, связан-
ных с миозином и входящих в состав толстого филамента.
182
D-эона
Рис. 98. Модель расположения поперечных мостиков на толстой нити
миозина скелетных мышц позвоночных. Мостики лежат на трехзаход-
ной спирали [Бэппоу К., 1985].
С-эона Р-эона М-эона Р-эона С-эона
D-зона
М1
11 108 В 7 8 5 4 3 2 16'4'461
* 1 1 1 -Wrtf1 [“-2^44и7
145 нм
43 им
500 нм
ioie нм
V
Рис. 99. Расположение и периодичность полос минорных белков в
разных зонах толстой нити мышцы psoas кролика (Поддубная З.А.,
1987].
В составе толстого филамента выделяют 4 зоны (рис. 99).
Центральная М-зона не содержит головок миозина, потому что
в этой области молекулы левой и правой половин толстого
филамента взаимодействуют между собой посредством своих
суперспирализованных хвостов. Тем не менее в этой области
наблюдается поперечная исчерченность, обусловленная распо-
ложением в толстом филаменте комплекса белков М-линии.
В этот комплекс входят М-белок, миомезин, креатинкиназа, а
также несколько других недостаточно изученных белков. Все
эти белки участвуют в создании сложно устроенной системы
коротких продольных (расположенных параллельно нити мио-
зина) М-нитей, соединенных поперечными мостиками (фор-
мируются, по всей видимости, молекулами креатинкиназы) с
соседними толстыми филаментами. Таким образом, в центре
саркомера соседние толстые филаменты оказываются связан-
ными между собой за счет белков М-линии.
В проксимальной P-зоне, прилежащей к зоне М, удается
183
различить 4 периода по 44 нм (см. рис. 99). Исчерченность
обусловлена характерным расположением головок миозина и
тем, что в этой части толстого филамента располагаются
F-белок (фосфофруктокиназа) и Н-белок. Функциональная роль
этих белков пока не очень ясна. Высказывается предположе-
ние, что оба этих белка обеспечивают связывание молекул
миозина внутри одного толстого филамента. Кроме того, фос-
фофруктокиназа, являясь ключевым регуляторным ферментом
гликолиза, может участвовать в регенерации АТР, используе-
мой АТРазой миозина.
Следующая за проксимальной С-зона состоит из 6 периодов
по 43 нм (см. рис. 99). В этой части толстого филамента
располагаются С-белок, а также белки X и 86 К. По-видимому,
наиболее подробно охарактеризован С-белок, выделенный из
скелетных и сердечных мышц различных видов животных.
Этот белок имеет мол. массу около 140 000 и асимметричную
нитеобразную форму. Функциональная роль его до конца не
выяснена. Предполагают, что С-белок играет важную роль в
упаковке молекул миозина внутри одного толстого филамента
или благодаря своей асимметричной форме и достаточно боль-
шой длине может обеспечивать образование мостиков между
нитями актина и миозина.
Дистальная D-зона толстого филамента состоит из 7 пери-
одов (не показанных на рис. 99) по 43 нм и содержит лишь
небольшое количество минорных белков, среди которых сле-
дует выделить AMP-дезаминазу, обеспечивающую превраще-
ние АМР в IMP (инозинмонофосфат) и освобождающую в
этой реакции аммиак. Таким образом, каждая половина толс-
того филамента состоит из 17 больших периодов (по 43—44 нм):
4 периода в Р-зоне, 6 — в С-зоне и 7 периодов в D-зоне. Если
учесть, что в каждый большой период входит три малых пе-
риода по 14,3 нм и на каждом ярусе располагается по 3 моле-
кулы миозина, то окажется, что каждая половина толстого
филамента состоит из 17x3x3 = 153 молекул миозина. Другими
словами, в состав толстого филамента входит около 300 моле-
кул миозина.
Следует подчеркнуть, что описанный способ укладки моле-
кул миозина в толстый филамент характерен для быстрых
поперечнополосатых мышц высших животных. В других типах
мышц расположение и состав минорных белков могут сущест-
венно отличаться. Например, толстые филаменты мышц мно-
гих беспозвоночных содержат в сердцевине так называемый
коровый белок, роль которого может выполнять парамиозин или
одна из необычных форм миозина. Такой “коровый” белок
формирует своеобразную веретеновидную заготовку, на по-
верхности которой располагаются обычные молекулы миозина.
Миозин гладких мышц по ряду свойств отличается от миозина
поперечнополосатых мышц и обладает повышенной гибкос-
184
Рис. 100. Упаковка мономеров миозина гладких мышц в двусторон-
ний полярный филамент. Эта модель предполагает, что антипарал-
лсльное перекрытие двух соседних молекул миозина составляет 14,3 нм.
Для ясности показана только одна из двух головок миозина. В верхней
части рисунка молекула миозина изображена в сложенном (компакт-
ном) виде (так называемая lOs-конформация). Эта структура находит-
ся в равновесии с распрямленной, так называемой ба-конформаиией
белка [Trybus К.М., 1996].
тью. Вследствие этого хвост молекулы миозина гладких мышц
может изгибаться в области двух шарнирных участков и прини-
мать довольно компактную форму, так называемую 10 s-форму
(рис. 100, верхняя часть). Под действием ряда факторов сло-
женная компактная 10 s-форма может распрямляться и пере-
ходить в асимметричную вытянутую 6 s-форму, которая уже
может упаковываться в толстый филамент (см. рис. 100). Лю-
бопытно, что при таком способе упаковки каждая молекула
миозина сдвинута относительно соседней на 14,3 нм и пере-
крытие хвостов антипараллельных молекул миозина также со-
ставляет 14,3 нм (см. рис. 100).
Таким образом, наличие асимметричного хвоста с периодичес-
ким расположением определенных остатков аминокислот позво-
ляет упаковывать молекулы миозина несколькими различными
способами. Во всех случаях упаковка миозина приводит к созда-
нию центральной осевой структуры, поверхность которой покры-
та глобулярными*головками, способными взаимодействовать с
актином и гидролизовать АТР.
В 1993 г. появились первые сообщения о трехмерной струк-
туре субфрагмента 1 (S1) миозина скелетных мышц курицы, а
в 1995 г. был закристаллизован так называемый моторный
домен цитоплазматического миозина II Dictyostelium. Располо-
жение не всех частей молекулы моторного домена миозина
четко прослеживается на рентгенограммах (вероятно, из-за по-
вышенной подвижности не удается проследить ориентацию
остатков, входящих в состав двух петель, ограниченных остат-
ками 204—216 и 605—647 в миозине скелетных мышц курицы),
185
однако основной способ упаковки полипептидной цепи хоро-
шо виден (рис. 101—см.вклейку). Моторный домен миозина
имеет форму запятой, при этом сферическая часть запятой
образована компактно упакованной N-концевой частью тяже-
лой цепи миозина, а “хвостик” — длинной а-спиралыо тяже-
лой цепи, которая стабилизирована оплетающими ее щелоч-
ной (ELC) и регуляторной (RLC) легкими цепями миозина.
На поверхности моторной части молекулы миозина располага-
ются подвижные петли, ограниченные остатками 204—216 и
605—647. Эти участки легко подвергаются протеолитической
деградации, вследствие чего головная часть тяжелой цепи ми-
озина расщепляется на три фрагмента: N-концевой с мол.
массой 25000, центральный с мол. массой около 50 000 и
С-концевой с мол. массой 20 000. Эти фрагменты даже после
протеолиза продолжают удерживаться между собой за счет
нековалентных взаимодействий. Участки тяжелой цепи миози-
на с мол. массой 25 000, 50 000 и 20 000 на рис. 101 выглядят
соответственно зелеными, красными и фиолетовыми.
Главной отличительной особенностью модели головной час-
ти молекулы миозина является то, что активный АТР-связы-
вающий центр пространственно удален от актинсвязывающего
центра. Действительно, АТР проникает в щель, сформирован-
ную определенными участками фрагментов с мол. массой
25 000 и 50 000 и расположенную в самом центре сферической
части запятой. В то же время актинсвязывающий центр в
основном формируется двумя частями фрагмента с мол. массой
50 000, которые рассечены глубокой щелью (см. рис. 101).
Предполагают, что в ходе гидролиза АТР в активном центре
происходят существенные конформационные изменения, след-
ствием которых является изменение размера щели, разделяю-
щей две части актинсвязывающего центра, а также изменение
ориентации сильно спирализованного С-концевого участка тя-
желой цепи миозина с мол. массой 20 000. Некоторые детали
этого процесса, обеспечивающего перемещение тонких и толс-
тых филаментов друг относительно друга, схематически пред-
ставлены на рис. 102.
В отсутствие АТР две части актинсвязывающего центра
сближены между собой, щель во фрагменте с мол. массой
50 000 закрыта и миозин прочно связан с актином, при этом
хвостовая спирализованная часть головки ориентирована при-
мерно под углом 45‘ по отношению к актину (см.рис. 102,1).
После входа АТР в активный центр щель между двумя поло-
винами актинсвязывающего центра раскрывается, прочность
взаимодействия миозина с актином ослабевает и миозин дис-
социирует от нити актина (см. рис. 102,2). Гидролиз АТР до
ADP и фосфата в активном центре миозина протекает в не-
сколько стадий. Во-первых, изменяется ориентация хвостовой
спирализованной части головки миозина и она оказывается
186
1
Акт»
•+АТР-
Рис. 102. Одиночный шаг головки миозина по нити актина с иллю-
страцией конформационных изменений, происходящих в головке ми-
озина при гидролизе АТР. Актин изображен в виде гирлянды шари-
ков. В нижней части головки миозина видна щель, разделяющая две
части актинсвязывающего центра. В верхней части молекулы миозина
изображен нуклеотидсвязывающий центр. Аденозин обозначен А, а
фосфаты — в виде маленьких кружочков [Rayment I. et al., 1993].
расположенной перпендикулярно нити актина. Во-вторых, из-
меняется размер щели в актинсвязывающем центре миозина и
последний оказывается способным взаимодействовать с акти-
ном (см. рис. 102, 3 и 4). Изолированный миозин очень мед-
ленно освобождается от продуктов гидролиза ATP—ADP и
фосфата. В то же время взаимодействие с актином ускоряет
процесс удаления продуктов АТРазной реакции из активного
центра миозииа. Удаление фосфата и ADP сопровождается
187
изменением ориентации спирализованной С-концевой части
головки миозина: она из перпендикулярного по отношению к
актину положения переходит в положение под углом 45". Если
учесть, что головка остается связанной с нитью актина, а
хвостовая часть ее закреплена в миозиновом филаменте, то
изменение ориентации приведет к созданию тянущего усилия
(power stroke) и протолкнет нить актина иа один шаг относи-
тельно нити миозина (см. рис. 102, 4 и 5). Далее цикл повто-
ряется, при этом головка миозина после диссоциации и изме-
нения ориентации хвоста окажется способной прикрепиться к
другому (см. рис. 102, 4) мономеру актина и протолкнет нить
актина еще на один шаг относительно нити миозина.
Если эта модель верна, то в основе молекулярного механизма
сокращения оказываются конформационные изменения, происхо-
дящие в головке миозина при гидролизе АТР. Особую роль при
этом будут играть те шарнирные участки молекулы миозина,
которые обеспечивают передачу конформационного сигнала от
одной части молекулы миозина к другой его части.
В первую очередь это две петли, шраниченные остатками
204—216 и 627—646. Первая петля располагается вблизи АТР-
связывающего центра, а вторая — вблизи актинсвязывающего
центра. Первичные структуры этих петель сильно различаются
в молекулах миозина из разных источников. Молекулярно-
биологические эксперименты показали, что при замене петель
одного типа миозина на петли другого типа изменяются АТР-
азная активность миозина и скорость перемещения актина
относительно миозина. Эти экспериментальные данные хоро-
шо согласуются с описанной ранее гипотетической моделью
генерации движения отдельной головкой миозина.
Таким образом, в состав молекулы миозина входят два
функционально различных участка. N-концевая головная часть
содержит так называемый моторный домен, а С-концевая часть
участвует в сборке надмолекулярных структур. В настоящее
время, помимо подробно описанного миозина II, в литературе
накопились сведения о целом семействе миозинов. Выделяют
13 классов миозинов, различающихся по своему составу, лока-
лизации, а также функциям, выполняемым в различных орга-
нах и тканях. При всем разнообразии основные элементы
структуры сохраняются во всех классах миозинов. Все миозины
содержат достаточно консервативный моторный домен, кото-
рый в некоторых молекулах миозина имеет вставки или деле-
нии, часто расположенные вблизи описанных ранее поверх-
ностных петель. За моторным доменом следует “шейка”. Этот
элемент структуры имеет различную длину и способен взаимо-
действовать с разным количеством (от 1 до 6) молекул каль-
модулина или легких цепей миозина (рис. 103). Следотощий
за “шейкой” хвост может быть разной длины и сильно измен-
чив по своему аминокислотному составу. В некоторых типах
188
Тропомиозин
Кальмодулин
Рис. 103. Строение некоторых необычных типов "одноголовых” мио-
зинов. Нить актина изображена в виде гирлянды шариков, поверх
которой расположен тропомиозин. Миозин содержит в своем составе
головку — мотор, “шейку” со связанными с нею молекулами кальмо-
дулина или легких цепей миозина, а также хвостовую часть, способ-
ную взаимодействовать с белками и фосфолипидами биологических
мембран [Wolenski J.S., 1995].
миозина (II, V, VI, VII, VIII, X, XI) С-концевой хвост имеет
упорядоченное периодическое расположение аминокислотных
остатков, что делает возможным создание суперспирали (ана-
логичная представлена на рис. 95) и димеризацию тяжелых
цепей миозина. Очевидно, эти классы миозинов могут быть
отнесены к труппе "двухголовых” молекул. С-концевой хвост
других молекул миозина (классы I, III, IV, IX, XII) укорочен
и не содержит элементов первичной структуры, необходимых
для создания суперспирали (см. рис. 103). Вследствие этого
указанные классы миозина не склонны к димеризации и могут
быть отнесены к классу "одноголовых” молекул. Хвосты "од-
ноголовых” миозинов часто содержат специальные элементы
структуры, которые обеспечивают прикрепление таких миози-
нов к фосфолипидам или белкам биомембран (миозин I, V),
либо связывание ионов Zn2+ (миозин IX). Как “одноголовые”,
так и "двухголовые” миозины могут прикрепляться своими
хвостами к различным клеточным органеллам (мембранам, ни-
тям актина) и при помощи своего моторного домена переме-
щать нити актина относительно места своего закрепления.
В табл. 9 приведены примеры строения необычных типов ми-
озинов и описаны некоторые возможные функции, выполняе-
мые этими молекулами в различных органах и тканях.
189
Та б л и ца. 9. Строение и функция некоторых необычных вадов мнозжна
(по J.S.Wolenski, 1995) _____
Класс Структура Примеры Свойства и возможные функции
“Одиоголовый” миозин
2—6 легких цепей
Прикрепление актина к
мембране, перемещение
везикул и органелл
Миозин I
щеточной
каемки,
миозин
I печени
III
Drosophila
Nina С
“Одноголовый” миозин со
вставкой киназного доме-
на в головной части
Фототрансдукция, поддер-
жание структуры рабдоме-
ров
IX
Миозин V “Двухголовый” миозин с
кур; MYO 2, необычно длинной шей-
MYO 4 кой
дрожжей Сшивает нити актина;
транспорт органелл; при-
крепление к мембране
Миозин VI Уникальное соединение
свиньи, шейки и головки, глобу-
Drosophila лярный С-конеи
95F Перемещение ядер; транс-
порт цитоплазматических
гранул
Миозин IX
человека,
туг 5 крыс
Вставка в моторной голов-
ке, широкое распростра-
нение
Регуляция функциониро-
вания цитоскелета
Молекула миозина не только обеспечивает сокращение различных
типов мышц, но способна принимать участие в ряде таких внут-
риклеточных процессов, как перемещение органелл, прикрепление
нитей актина к мембранам, различные рецепторные процессы, фор-
мирование и функционирование цитоскелета. Практически во всех
случаях молекула миозина тем или иным способам взаимодействует
с актинам — вторым главным сократительным белком мышц.
СТРУКТУРА И СВОЙСТВА АКТИНА
Актин был открыт Ф.Б. Штраубом в 1942 г. и получил свое
название по способности активировать гидролиз АТР, катали-
190
Рис. 104. Трехмерная структура молекулы актина. Отмечены первые
и последние аминокислотные остатки в а-спиралях и Р-складках. Для
обозначения аминокислот использован однобуквенный код с указа-
нием номера данной аминокислоты в первичной структуре белка
[Левицкий Д.И. и др., 1995].
зируемый миозином. Актин может существовать в двух состо-
яниях: в виде мономера (глобулярный, или G-актин) и в виде
полимера (фибриллярный, или F-актин). Фибриллярный актии
представляет собой нековалентный линейный полимер глобу-
лярных молекул актина, поэтому для понимания процессов
полимеризации и деполимеризации необходимо вначале про-
анализировать структуру глобулярного мономерного актина.
В 1990 г. была установлена трехмерная структура глобуляр-
ного актина (рис. 104). В структуре актина различают так
называемый большой (на рис. 104 слева) и малый (на рис. 104
справа) домены. Эти домены отделены друг от друга глубокой
щелью, в которой располагаются центр связывания нуклеотида
(обычно АТР и ADP), а также центр связывания двухвалентных
191
Рис. 105. Стереоизображение структуры фибриллярного актина [Pol-
lard T.D. et а!., 1994].
В — тупой конец фибриллы актина; Р — острый конец нити актина; 1 — учас-
ток связывания ДНКазы; 2 — гидрофобная шпилька; 3 — положение фалло-
идина.
ионов (обычно ионов Mg2+ или Са2+). Каждый из доменов
содержит по 2 субдомена — компактно уложенных и отделен-
ных друг от друга участка полипептидной цепи. В состав суб-
домена 1 (в правом нижнем углу) входят остатки 1—32, 70—144
и 338—372, при этом N- и С-концы молекулы актина сближе-
ны друг с другом, субдомена 2 (в правом верхнем углу) —
остатки 33—69, субдомена 3 (в левом нижнем углу) — остатки
145—180 и 270—337. Наконец, субдомен 4 (в левом верхнем
углу) содержит остатки 181—269.
Добавление солей одно- или двухвалентных катионов к рас-
твору G-актина вызывает его полимеризацию. При этом обра-
зуется двухтяжевая правая спираль с шагом в 72 нм. На схемах
и рисунках эту структуру представляют в виде как бы двух
перекрученных относительно друг друга ниток бус (см. рис.
102,103). Взаимодействие между соседними мономерами акти-
на осуществляется за счет контактов между субдоменом 3 (ос-
татки 243—245, 202—204) лежащего выше мономера с субдо-
меном 4 (остатки 322—325, 286—289) расположенного ниже
мономера актина. Кроме того, гидрофобная петля (остатки
41—50) нижнего мономера контактирует с гидрофобной зоной
большого домена (остатки 166—169 и Phe—375) верхнего мо-
номера актина. Соседние тяжи мономеров актина связаны
между собой своеобразной шпилькой. Она состоит из гидро-
192
Рис. 106. Процесс полимеризации актина. Мономеры актина изобра-
жены в виде ромбов, содержащих в своем составе либо АТР (Т), либо
ADP (D). На начальной стадии мономеры актина подвергаются акти-
вации (изменяется форма ромба) и происходят так называемая нуклеа-
ция и формирование затравки. Далее наблюдается рост филамента, при
этом скорость процесса полимеризации на “заостренном” конце, где
преимущественно располагаются мономеры актина, содержащие в своем
составе ADP, существенно меньше скорости полимеризации на “опе-
ренном” (тупом) конце нити актина, где мономеры актина преиму-
щественно содержат в своем составе АТР [Фултон А., 1987].
фобных остатков 269—272 и принадлежит молекуле актина,
расположенной в одном тяже. Шпилька выступает из этого
тяжа и вклинивается в гидрофобный карман, образующийся
при взаимодействии мономеров актина, принадлежащих сосед-
нему тяжу (рис. 105).
Процесс полимеризации актина довольно сложен. Прежде
чем он станет возможным, мономер актина должен претерпеть
определенные конформационные изменения (происходит так
называемая активация) (рис. 106). Далее несколько мономеров
актина образуют своеобразное ядро, или центр полимеризации,
происходит так называемый процесс нуклеации. Только после
этого становится возможным собственно процесс полимериза-
ции и удлинения тонких филаментов (см. рис. 106). Впослед-
ствии тонкие нити актина могут подвергаться фрагментации
или реассоциации. Следует отметить, что два конца нитей
актина отличаются друг от друга. Это понятно, если учесть,
что на одном конце нити актина в сторону растворителя об-
ращены субдомены 1 и 3, а на другом — субдомены 2 и 4
молекулы актина и эти субдомены различаются по своей струк-
193
туре и свойствам. О том, что нити актина полярны, свидетель-
ствует то, что при декорировании нитей актина “головками”
миозина образуются так называемые стреловидные структуры,
т.е. возникает структура, похожая на оперенный конец стрелы,
в которой можно точно отличить заостренный (острый, poin-
ted) и “оперенный” (тупой, baibed) концы. Скорость полиме-
ризации на заостренном конце нити актина много меньше
скорости полимеризации на “оперенном” конце. Мономер
актина, присоединившийся к тупому быстрорастущему кон-
цу нити актина, как правило, содержит в своем составе АТР.
В связи с тем что нить актина постоянно подвергается обра-
тимым процессам полимеризации и деполимеризации и соот-
ношение скоростей этих процессов на остром конце сдвинуто
в сторону деполимеризации, новые мономеры актина будут
присоединяться к тупому концу, а старые мономеры актина
(содержащие в своем составе ADP) будут диссоциировать на
остром конце. Таким образом, мономеры актина как бы путе-
шествуют по нити. Вначале они прикрепляются к тупому концу
нити, далее, по мере добавления новых мономеров, перемеща-
ются в центр нити и, наконец, в ходе деполимеризации сва-
ливаются с заостренного конца нити актина. Этот процесс
получил название тредмиллинга.
АКТИНСВЯЗЫВАЮЩИЕ БЕЛКИ
Нить актина представляет собой очень динамичную струк-
туру. Регулируя тем или иным способом процессы полимери-
зации на тупом и остром концах нити, можно эффективно
влиять на длину нити актина. Изменить длину нити актина
можно путем “разрезания” или “склеивания” уже сформиро-
вавшихся нитей при помощи специальных актинсвязывающих
белков (рис. 107). В настоящее время описано очень большое
количество различных актинсвязывающих белков и предложе-
но несколько типов их классификации. Очень условно актин-
связывающие белки можно разделить на следующие 1руппы:
♦ белки, взаимодействующие с мономерным актином;
♦ белки, затыкающие, или копирующие, острый конец ни-
ти актина;
♦ белки, затыкающие, или копирующие, тупой конец нити
актина;
♦ белки, повреждающие или “разрезающие” нити актина;
♦ белки, “сшивающие” нити актина;
♦ белки, обеспечивающие прикрепление нитей актина к
мембране;
♦ белки, прикрепляющиеся вдоль нити актина;
♦ белки-моторы, перемещающиеся по нити актина.
194
Рис. 107. Влияние различных актинсвязывающих белков на свойства
фибриллярного актина. Актинсвязывающие белки могут связываться
с мономерами актина (профилин), влиять на нуклеацию (гельзолин),
повреждать (гельзолин), копировать (“затыкать”) тупые или острые
концы нитей актина, а также “сшивать” нити актина, формируя
жесткие пучки (виллин) или гибкие сети (филамин) нитей актина
[Wray М., Weeds А., 1990].
Белки, взаимодействующие с мономерным актином. Группа
таких белков не очень велика. В нее входят профилины (мол.
масса 12 000—15 000), ДНКаза I (мол. масса 33 000) и тимозин
04 (мол. масса 5000). Все эти белки образуют комплекс с
мономерным актином и делают невозможным встраивание мо-
номера актина в актиновый филамент. Например, профилин
взаимодействует с субдоменами 1 и 3 мономерного актина и
может влиять на скорость обмена нуклеотида, связанного с
G-актином. В присутствии фосфатидилинозитол-4-фосфата или
фосфатидилинозитол-4,5-дифосфата комплекс профилин—актин
диссоциирует и освободившийся мономерный актин оказыва-
ется способным встраиваться в состав актинового филамента.
Такой механизм регуляции доступности мономерного актина
для полимеризации может играть важную роль в различных
видах немышечной подвижности (формирование и выдвиже-
ние ламелоподий).
Белки, кепирующие острый конец нити актина. Эти белки
также не очень многочисленны. Среди них можно отметить
fi-актшшн (гетеродимер из субъединиц с мол. массой 35 000 и
37 000), акументин (мол. масса 65 000) и тропомодулин (гомо-
димер субъединиц с мол. массой 50 000). 0-Актинин и тропо-
модулин располагаются на обращенных к центру саркомера
острых концах нитей актина, а тропомодулин еще и на острых
концах коротких нитей актина, локализованных в примем-
195
бранном пространстве эритроцитов. Такое расположение ука-
занных белков стабилизирует острый конец и препятствует
деполимеризации нити актина.
Белки, хелирующие тупой конец нити актина. Эти белки
очень многочисленны и разнообразны. К ним относятся белок
capZ (гетеродимер из мономеров с мол. массой 32 000 и 36 000);
белки, входящие в гелъзолин-виллиновую группу: гельзолин (мол.
масса 90 000), бревин (мол. масса 93 000), виллин (мол. масса
95 000) — и белки фрагмин-севериновой группы (мономеры с мол.
массой 40 000—45 000). Гетеродимерные белки с мол. массой
32 000 и 36 000 (такие, как cap Z) обладают только Са-незави-
симой копирующей активностью и располагаются на тупых
концах нитей актина (в области Z-диска) в саркомерах мио-
фибрилл скелетных мышц. Белки гельзолин-виллиновой груп-
пы широко распространены и встречаются в гладких мышцах
(гельзолин), плазме крови (бревин) и щеточной каемке кишеч-
ника (виллин). Эти белки выполняют смешанные функции.
Они не только копируют тупой конец нити актина, но способ-
ны в присутствии иона Са*+ разрезать уже сформировавшиеся
нити актина и в определенных условиях обеспечивают нуклеа-
цию нитей актина. Виллин, кроме того, может “сшивать” нити
актина, формируя жесткие пучки фибриллярного актина, об-
разующие цитоскелет микроворсинок эпителия кишечника.
Белки фрагмин-севериновой группы могут в определенной сте-
пени считаться гомологами белков гельзолин-виллиновой
группы. Действительно, молекулярная масса белков фрагмин-
севериновой группы (около 45 000) примерно в 2 раза меньше
молекулярной массы белков гельзолин-виллиновой группы
(около 90 000), при этом в первичной структуре последних
как бы дважды повторяется мотив, характерный для белков
фрагмин-севериновой группы. Белки фрагмин-севериновой
группы не только копируют тупой конец нити актина, но, так
же как белки гельзолин-виллиновой группы, в присутствии
ионов Са2+ “разрезают” уже сформировавшиеся нити актина
и в определенных условиях способствуют нуклеации нитей
актина.
Белки, повреждающие или “разрезающие” тонкие актиновые
филаменты. К ним относятся родственные между собой белки
фрагмин-севериновой и гельзолин-виллиновой групп. У этих бел-
ков есть 3 (фрагмин-севериновая) или 6 (гельзолин-виллино-
вая группа) повторов, содержащих 125—150 аминокислотных
остатков (рис. 108). В этих участках локализованы актинсвя-
зывающие центры, причем некоторые из этих участков обес-
печивают преимущественное взаимодействие актинсвязыва-
ющего белка с мономерным, а другие центры — с полимерным
актином. Если анализируемые белки взаимодействуют с фиб-
риллярным актином, то в присутствии ионов Са2+ они оказы-
ваются способными “разрезать” нить актина и остаются за-
196
Рис. 108. Доменная организация некоторых Са2+-зависимых белков,
способных взаимодействовать с актином [Vandekerckhove J., 1989].
а — гельзолии; б — виллин; в — фрагмин; г — профилин Acanthamoeba; г —
профилин дрожжей. Сходные участки отмечены прямоугольниками. Внизу
приведена первичная структура первого актинсвязывающего центра в однобук-
венном коде. Идентичные остатки или консервативные замены отмечены рам-
кой. На С-конце вилл ина располагается глобулярный участок, содержащий
дополнительный (седьмой) актинсвязывающий центр, ответственный за обра-
зование пучков актина.
крепленными на тупом конце образовавшегося фрагмента.
В случае, если указанные белки взаимодействуют с мономер-
ным актином, они могут способствовать нуклеации нитей ак-
тина. Следует отметить, что фосфатвдилинозитолфосфаты мо-
гут взаимодействовать с гельзолином и северином, при этом
происходит диссоциация указанных белков от актина. Такой
механизм может играть важную роль в регулируемой фраг-
ментации и самосборке нитей актина при немышечных формах
подвижности и сократительной активности гладких мышц.
Белки, “сшивающие” нити актина. Эта группа очень обширна
и разнообразна. Филамин состоит из 2 мономеров с мол. массой
250 000—280000. Каждый из мономеров представляет собой
длинную гибкую молекулу, содержащую на N-конце актинсвя-
зываюший центр (“головку”), а на С-конце — “липкий” учас-
ток, обеспечивающий димеризацию 2 мономеров (рис. 109).
197
Рис» 109. Строение молекулы филамина [Kreis Т., Vale R., 1993].
Каждый мономер содержит актинсвязывающую головку, гибкий ствол и “лип-
кий” хвост. Ствол состоит из 23 повторов, в каждом из которых по 96 амино-
кислотных остатков. Шестнадцатому повтору предшествует вставка из 25 ами-
нокислот, которая формирует гибкий шарнир, обеспечивающий подвижность
двух актинсвязывающих центров. На С-конпе расположен центр димеризации.
Вследствие своей большой длины и гибкости шарнирного участ-
ка филамин может обеспечивать достаточно свободное пере-
мещение “сшитых” им нитей актина друг относительно друга.
“Сшитые” филамином нити актина могут формировать до-
вольно подвижный гель.
В отличие от филамина другой актинсвязывающий белок —
а-актинин способен формировать жесткие “сшивки” между
нитями актина. а-Актинин представляет собой гомодимер, каж-
дый из мономеров которого имеет мол. массу 100 000—110 000.
На N-конце каждого мономера расположен актинсвязываю-
щий центр (рис. НО), за которым следует 4 повтора. Каждый
повтор содержит около 110—120 аминокислотных остатков.
Первичная структура этих участков сходна со структурой ана-
логичных участков в спектрине и дистрофине. Наконец, на
С-конце некоторых изоформ а-актинина располагаются цент-
108
i~ I 2 I 3 I 4 c
c eol 4 I 3 I 2 I
Рис. 110. Строение димера а-актинина гладких мышц [Kreis Т.»
Vale R., 1993].
На N-концс расположен актинсвязывающий центр (большой черный кружок),
далее следуют 4 повтора, имеющих сходство с аналогичными повторами в
структуре спектрина (обозначены прямоугольниками с цифрами 1—4), на
С-конце — две Са2+-связывающие петли (EF-руки), обозначенные двумя ма-
ленькими заштрихованными кругами.
ры связывания ионов Са2+. Мономеры а-актинина ориенти-
рованы антипараллельно друг другу, вследствие чего на каждом
конце димера располагается актинсвязывающий центр, кото-
рый контактирует с Са2+-связывающим центром другого мо-
номера. Такая ориентация мономеров, с одной стороны, обес-
печивает возможность “сшивания” нитей актина, а с другой —
Са-зависимую регуляцию взаимодействия а-актинина с акти-
ном. а-Актинин вызывает "сшивание” нитей актина в струк-
туре Z-диска, при этом а-актинин "сшивает” между собой
нити актина, принадлежащие двум соседним саркомерам, и
является, таким образом, основным компонентом Z-диска.
Следует подчеркнуть, что а-актинин скелетных мышц не со-
держит в своем состава Са2+-связывающих центров, поэтому
структура Z-диска не подвергается существенным изменениям
при изменении концентрации ионов Са2+ внутри клетки. По-
мимо этого, а-актинин очень часто располагается в областях
прикрепления нитей актина к мембране, где вместе с другими
белками (интетрин, талин, винкулин, метавинкулин, кадгерин,
катенин) обеспечивает формирование контакта между цито-
скелетом и мембраной.
Большая группа актинсвязывающих белков может быть от-
несена к семейству спектрина. Спектрин и его аналоги (фодрин,
белки TW 240/260) представляют собой гетеротетрамеры, имею-
щие структуру а202; молекулярные массы а- и р-субъединиц
составляют 260 ОиО—280 000 и 220 000—250 000 соответственно.
Два гетеродимера спектрина ориентированы антипараллельно
Друг другу (рис. 111), при этом, так же как в а-актинине,
актинсвязывающие центры 0-субъединицы оказываются на-
против Са2+-связывающих центров, расположенных на С-кон-
цах а-субъединиц спектрина. Таким образом, на обоих концах
тетрамера спектрина локализуются актинсвязывающие центры,
которые обеспечивают “сшивание” нитей актина. Кроме того,
0-цепь спектрина содержит в своем составе участки связыва-
ния с периферическими мембранными белками — анкирином
и белком 4.1 (см. рис. 111). Таким образом, спектрин является
199
Анкирин
Рис. 111. Строение неэритроцигарного спектрина [Kreis Т.» Vale R., 1993].
В состав a-цепи спектрина входят около 20 повторов длиной 100—106 аминокислотных остатков (отмечены прямоугольниками с
соответствующими номерами), а также расположенные на С-конце молекулы два Са2+-связываюших центра (EF-руки). На
N-конце p-цепи спектрина расположены актинсвязывающий центр, а также центр прикрепления спектрина к белку 4.1. В середине
P-цепи имеется 17 повторов длиной 100—106 аминокислотных остатков (отмечены прямоугольниками с соответствующими
номерами). На С-конце располагаются центр связывания с анкирином (периферическим мембранным белком), а также участки,
подвергающиеся фосфорилированию (Р).
многофункциональным белком и способен не только “сши-
вать” нити актина между собой, но и прикреплять их к мем-
бранным белкам. Мутации спектрина, изменяющие его спо-
собность взаимодействовать с периферическими мембранными
белками или актином, сопровождаются существенным измене-
нием формы эритроцитов или их повышенной чувствительнос-
тью к механическим повреждениям.
Гомологи спектрина фодрин и белок TW 240/260 играют важную
роль в формировании цитоскелета микроворсинок эпителия кишеч-
ника. Каждая микроворсинка содержит пучок нитей актина, форми-
рующих своеобразный жесткий стержень. Отдельные актиновые нити
в этом стержне связаны между собой жесткими “сшивками”, которые
обеспечиваются фибрином и виллином. Актиновый стержень при-
крепляется к мембране за счет мостиков, образуемых “одноголовым”
миозином (белок с мол. массой 110 000 в комплексе с кальмодулином)
и интегральным белком мембран (мол. масса 200/140 кДа). Такая
структура создает жесткий каркас для каждой отдельной микровор-
синки. Связь между цитоскелетами отдельных микроворсинок и фор-
мирование своеобразной сети, соединяющей нити актина, принадле-
жащие различным микроворсинкам, обеспечивается за счет попере-
чных “сшивок”, формируемых фодрином и белками TW 240/260.
Таким образом, цитоскелет микроворсинок эпителия кишечника яв-
ляется ярким примером упорядоченной организации нитей актина и
иллюстрирует роль актинсвязывающих белков в формировании и
функционировании цитоскелета.
Белки, обеспечивающие прикрепление нитей актина к мембра-
не. Это многочисленная и разнообразная труппа. К данной
группе условно могут быть отнесены описанные ранее спект-
рин, а-актинин, а также “одноголовый” миозин с мол. массой
110000, обеспечивающий прикрепление пучка нитей актина к
мембране микроворсинок эпителия кишечника. Помимо этого,
к данной труппе белков относятся интегральные белки мембран
(интегрин, рецепторы фибронектина, кадгерины), периферичес-
кие белки мембран (талин, катенин, винкулин, метавинкулин),
а также описанные ранее копирующие белки, синапсин и а-ок-
тинин. Два примера прикрепления нитей актина к мембране
схематически представлены на рис. 112, 113. На рисунках вид-
но, что интетральные мембранные белки взаимодействуют ли-
бо с молекулами внеклеточного матрикса, либо с расположен-
ными на поверхности молекулами соседних клеток. Эти интег-
ральные белки с помощью молекул-посредников (талин,
катенины, плакоглобин) прикрепляются к самому актину или
к актинсвяэывающим белкам (винкулин, метаквинкулин, а-ак-
тинин) и таким образом обеспечивают прикрепление актино-
вого цитоскелета к мембране. Можно заметить существенную
аналогию между схемами, представленными на рис. 112 и 113.
Во всех случаях между интегральным белком мембран (интег-
рин, рецепторы, кадгерин, белок полосы 3, гликофорин) и
201
1989].
a — в основании ламелоподий нити актина “разрезаются” гельэолином (G).
В теле ламелоподий активность гельзолина подавляется фосфатидилинозитол-
дифосфатом (PIР2); б — в “головной” части ламелоподий обмен фосфатиди-
линозитидов приводит к диссоциации актина (А) от профилина (Р) Освобо-
дившийся мономерный актин встраивается в состав актиновых филаментов
(AF); в — специальные лиганды матрикса (М) иммобилизуют интсгрин (I) и
формируют область контакта. Такие белки, как а-акгинин (а) и винкулин (V),
обеспечивают реорганизацию актиновых нитей и их прикрепление через талин
(Т) к интегрину. “Сшивающие” (XL) и “пучкующие” (р) белки обеспечивают
формирование примембраниого скелета, собранного из актиновых филамен-
тов; г — растущие нити актина прикреплены к интегрину (I) через талии (Т).
Другие компоненты этого комплекса плохо охарактеризованы. Комплекс про-
филин — актин либо диффундирует к “головной" части ламелоподий, либо
передвигается в этом направлении в специальных подвижных частицах (МР),
перемещаемых по нити уже сформированного актина “одногаловым” мини-
миозином (ММ).
202
F-акпш
Рис. 113. Прикрепление цитоскелета к мембране в области межкле-
точных взаимодействий (Cown Р.» Burke В., 1996].
Димер Е-кадгсрина взаимодействует либо с плагоглобином (Pg), либо с р-ка-
тенином (Peat). Это взаимодействие регулируется с помощью фосфорилирова-
ния (фосфорилируемые участки кадгерина отмечены звездочкой). Плакоглобин
и р-катенин взаимодействуют с а-катенином (acat). Это взаимодействие регу-
лируется путем фосфорилирования остатков серина и тирозина Pg/Pcat (отме-
чено звездочками). а-Катенин взаимодействует с нитями F-актина и а-акти-
иииом (аА), который в свою очередь может взаимодействовать с винкулином
(V).
нитью актина имеется специальный белок-посредник (талин,
катенины, анкирин, белок 4.1). В настоящее время число бел-
ков-посредников заметно расширилось. Кроме перечисленных,
к ним относят эзрин, моезин и радиксин. Многие из белков-
посредников могут подвергаться фосфорилированию, что из-
меняет взаимодействие этих белков с интегральными белками
мембран или с филаментами актина. Следствием этого может
быть существенное изменение формы клетки либо ее способ-
ности закрепляться на субстрате или контактировать с сосед-
ними клетками.
Дистрофин ~~ еще один интересный белок, обеспечивающий
прикрепление нитей актина к мембране. Дистрофин и родст-
венный ему белок утрофин построены из трех основных блоков
(рис. 114). На N-концах молекул расположен актинсвязываю-
щий участок А. Далее следует центральная часть, состоящая из
24 (у дистрофина) или 22 (у утрофина) 100—110-членных по-
203
Утрофин
Рис. 114. Доменная структура дистрофина и утрофина [Winder S.J. et al., 1995].
В N-концевой части обеих молекул расположен актинсвязывающий центр (А). Далее следуют 22 или 24 повтора, каждый из
которых состоит из 100-110 аминокислот. На С-концс располагаются WW wui WWP домены, названные так из-за характерного
расположения остатков триптофана и пролина; участки связывания ионов Caz (EF-центры; обозначены на рисунке Са); участок,
богатый цистеином, обозначен Cys, спиральные участки — Hl, Н2.
Рис. 115. Гипотетическая модель примембраниого комплекса, форми-
руемого с участием дистрофина или утрофина. Дистрофин/утрофин
своим N-концом прикрепляется к нитям актина, а С-концсвым участ-
ком взаимодействует как с периферическим мембранным белком син-
трофином, так и с интегральными мембранными гликопротеидами
p-дистрогликаном и адгалином. Контакт p-дистрогликана с внекле-
точным матриксом (ламинин, мерозин, агрин) обеспечивается за счет
а-дистрогликана (a-distroglycan) (персональное сообщение проф.
М. С. Schaub).
второе, гомологичных повторам, описанным ранее в структуре
спектрина и tx-актинина. На С-концах молекул дистрофина и
утрофина находится участок, обеспечивающий взаимодействие
этих белков с периферическим мембранным белком синтро-
фином и интегральными белками мембран дистрогликаном и
адгалином. Дефекты гена дистрофина, приводящие к синтезу
мутантного белка или к полной неспособности клетки синте-
зировать дистрофин, вызывают тяжелые врожденные заболева-
ния — дистрофии Дюшенна и Беккера. Эти виды дистрофии
сопровождаются тяжелейшими поражениями скелетных мышц,
проявляющимися в практически полной деградации их. Пред-
полагают, что деградация мышц обусловлена механическим
повреждением мембран, возникающим в ходе сократительной
активности мышц. Мембраны нормальных мышц как бы арми-
рованы дистрофинактиновым цитоскелетом и выдерживают
механические нагрузки (рис. 115). В то же время мембраны
дистрофических мышц не содержат примембраниого цитоске-
лета и поэтому легко разрушаются. В последнее время в лите-
205
ратуре было описано несколько новых членов семейства дис-
трофина и утрофина. Эти белки, получившие обозначение
Dp260, Dpl40, Dpi 16, Dp71, Dp45, по всей видимости, явля-
ются продуктами альтернативного сплайсинга первичного
транскрипта гена дистрофина. Большинство из этих белков
утратило актинсвязывающий центр, но сохранило характерный
для дистрофина С-концевой домен и часть центральных по-
второв. Функциональная роль этих белков до сих пор подробно
не исследована.
Белки, прикрепляющиеся вдоль нити актина. Это довольно
разнообразная группа белков. Вероятно, наиболее распростра-
ненным представителем этой группы является тропомиозин.
Это димер, состоящий из одинаковых или очень похожих друг
на друга мономеров с мол. массой 30 000—40 000. Первичная
структура тропомиозина имеет много общего с первичной
структурой хвостовой части миозина. Действительно, оба мо-
номера тропомиозина формируют почти идеальную а-спираль.
В первичной структуре тропомиозина можно выявить гептад-
ные повторы аминокислотных остатков (см. анализ структуры
миозина). Мономеры тропомиозина закручиваются относи-
тельно друг друга и формируют стабильную суперспираль (coi-
led-coil). N- и С-концевые части молекулы тропомиозина не
спирализованы и способны вступать в “липкие” контакты с
соседними димерами тропомиозина по типу “голова к хвосту”,
образуя д линные линейные тяжи тропомиозина. Благодаря свое-
образной периодичности в первичной структуре на поверхнос-
ти суперспирали тропомиозина формируется 7 а- и 7 Ъ-участ-
ков связывания с актином. Молекулы тропомиозина уложены
в две канавки спирали актина на всем ее протяжении (рис.
116). В зависимости от положения в этой канавке молекула
тропомиозина контактирует с семью мономерами актина по-
средством своих а- или b-контактов. Перемещение тропомио-
зина в канавке актина играет важную роль в регуляции взаи-
модействия миозина с актином.
Ориентация тропомиозина внутри канавки актина опреде-
ляется комплексом регуляторных белков. В поперечнополоса-
тых мышцах этот комплекс представлен тропонином. Тропонин
состоит из трех компонентов: тропонина С (TN-C), тро-
понина I (TN-I) и тропонина Т (TN-T) (см. рис. 116).
Подробно свойства этих белков рассматриваются при описа-
нии механизма регуляции сократительной активности попере-
чнополосатых и сердечных мышц. В гладких мышцах и в
некоторых клетках, обладающих немышечной подвижностью,
на роль белков-регуляторов, расположенных на тонком фила-
менте, претендуют кальдесмон и кальпонин.
Гладкомышечный кальдесмон (мол. масса около 90 000) пред-
ставляет собой гибкую вытянутую молекулу, которая, по всей
видимости, располагается поверх нити тропомиозина в обоих
206
«Оперенным» конец
«Заостренный» конец
—1.1 мкм
Рис. 116. Строение тонкого филамента поперечнополосатой мышцы,
закрепленного своим “оперенным” концом в Z-диске и обращенного
своим “заостренным” концом к центру саркомера. “Заостренный”
конец нити актина изображен крупным планом на врезке. Димер
тропомиозина лежит в канавке актина. С периодичностью в 7 моно-
меров актина на тропомиозине располагается тропониновый комп-
лекс, состоящий из трех белковых компонентов TN-T, TN-C и TN-I.
На остром конце тонкий актиновый филамент кепирован димером
тропомодулина [Fowler V.M., 1996}.
канавках нити фибриллярного актина (рис. 117). Кальпонин
представляет собой сравнительно маленький белок с мол. мас-
сой 28 000—34 000, также способный взаимодействовать с ак-
тином и каким-то образом влиять на перемещение головок
миозина по актину.
К белкам, располагающимся вдоль тонкого филамента, мо-
жет быть отнесен и небулин. Этот гигантский белок (мол. масса
776 000) содержит 185 копий приблизительно 35-членных
аминокислотных повторов, которые, по всей видимости,
могут формировать актинсвязывающие участки. Судя по
всему, небулин располагается в центре нити актина и может
выступать в роли своеобразного шаблона-линейки, на кото-
ром формируется актиновый филамент строго определенного
размера.
Помимо структурных и регуляторных белков, с тонким ак-
тиновым филаментом способны взаимодействовать ферменты
гликолиза. Прочность связи этих ферментов с актиновым фи-
ламентом может регулироваться ионами Са2+. Обнаружено, что
на тонком филаменте могут сорбироваться фосфофруктокина-
за, альдолаза и глицералъдегидфосфатдегидрогеназа. Упорядо-
ченное закрепление указанных ферментов на тонком филамен-
те обеспечивает заметное ускорение протекания определенных
реакций гликолиза, что представляется важным для эффектив-
ного обеспечения сократительного аппарата АТР.
Белки-моторы, перемещающиеся по нити актина. Эти белки
составляют последнюю группу актинсвязывающих белков. В нее
207
б
Кжпвдесмон
Тропомиозин
Рис. 117. Модель упаковки вытянутой молекулы кальдесмона на ак-
тиновом филаменте [Marston S.B., Redwood C.S., 1991].
а — комплекс актина с тропомиозином (изображен в виде серой нити); б —
кальдесмон и тропомиозин; в — тонкий филамент, содержащий тропомиозин
и кальдесмон. Показано, что кальдесмон лежит поверх тропомиозина в канавке
актина и молекулы кальдесмона в двух канавках актина смещены друг отно-
сительно друга на одну молекулу тропомиозина. Изображены две проекции
тонкой нити актина, повернутые относительно друг друга на 180*.
входят различные изоформы миозина, описанные в предыдущем
разделе. Миозины различных типов выполняют не только “мо-
торные” функции, но могут обеспечивать прикрепление нитей
актина к мембранам или выезупать в роли своеобразных “сши-
вающих” белков, соединяющих две нити актина. Очевидно,
приведенная классификация актинсвязывающих белков очень
условна.
Один и тот же белок в зависимости от условий может
участвовать в нуклеации и разрезать нити актина, обеспечивать
“сшивание” нитей актина или их прикрепление к мембране, уча-
ствовать в регуляции перемещения миозина по актину и обладать
“пучкующей ” активностью.
Та или иная активность актинсвязывающих белков зависит
от того, связаны ли какие-то иные белки с нитью актина.
Например, повреждающая активность гельзолина заметно осла-
бевает, если нити актина покрыты тропомиозином. Калвдес-
мон в комплексе с тропомиозином в еще большей степени
увеличивает стабильность нитей актина к “разрезанию” под
действием гельзолина и способствует состыкованию ранее
“разрезанных” нитей актина. Следует добавить, что активность
многих актинсвязывающих белков может регулироваться иона-
ми Са2+, а также фосфолипидами биологических мембран. Все
это обеспечивает тонкую регуляцию как процесса самосборки
актинового филамента, так и создания более сложных струк-
тур, состоящих из системы тонких филаментов.
Движение может генерироваться за счет как минимум двух
процессов: путем обратимой полимеризации и деполимеризации
актина (см. рис. 112) и путем ATP-зависимого перемещения
белка-мотора по актиновому филаменту. Оба этих процесса в
той или иной степени регулируются ионами Са?+.
206
Глава 8
РЕГУЛЯЦИЯ ВЗАИМОДЕЙСТВИЯ
АКТИНА И МИОЗИНА НА УРОВНЕ
СОКРАТИТЕЛЬНОГО АППАРАТА
Как отмечалось, инициация мышечного сокращения или
генерация различных форм немышечной подвижности так или
иначе связаны с изменением концентрации кальция внутри
клетки. В состоянии покоя уровень ионов кальция внутри
клетки составляет 10“7— 1СГ6 М, а после стимуляции редко
возрастает выше 10-5 М. Мы не приводим анализ механизмов,
обеспечивающих изменение концентрации кальция внутри
клетки. Отметим только, что в принципе существует два ис-
точника повышения концентрации кальция. Кальций может
входить в клетку снаружи, где его концентрация составляет
10“3—10~4 М. Этот вход обеспечивается путем открывания
специальных Са2+-каналов, расположенных в наружной мем-
бране. Кальций может освобождаться и из внутриклеточных
резервуаров. Внутриклеточным хранилищем кальция является
саркоплазматический (эндоплазматический) ретикулум. Чтобы
стал возможным этот процесс, надо обратимо изменить про-
ницаемость мембран ретикулума для кальция и выпустить
кальций из депо внутрь клетки. После окончания стимуляции
необходимо восстановить проницаемость наружных или внут-
риклеточных мембран для кальция и либо закачать кальций
обратно внутрь ретикулума, либо вывести его из клетки нару-
жу. Соотношение вошедшего внутрь клетки “внешнего” и
“внутреннего” кальция различно в разных органах и тканях.
Также довольно существенно различаются механизмы, обеспе-
чивающие выброс кальция из депо или его вход через наруж-
ную мембрану. Тем не менее конечным результатом является
довольно быстрое и сравнительно резкое увеличение концент-
рации кальция внутри клетки.
Следует учесть, что концентрация магния внутри клетки
стабильно высока и составляет (5—10) • 10“3 М, а концент-
рация кальция, как отмечалось, колеблется в интервале от
КГ6—10-7 до 1(Г5 М. Это означает, что структуры, которые
обеспечивают инициацию сокращения, должны обладать вы-
сокой специфичностью к ионам Са2+ и отличать кальций от
магния. Помимо этого, указанные структуры должны обладать
высоким сродством к кальцию (константа связывания ионов
Са2+ этими структурами должна лежать в интервале 105—106
М-1). Собственно сократительные белки (актин и тяжелые
цепи миозина) не обладают этими свойствами и поэтому не
могут выступать в качестве рецепторов ионов Са2+. Именно
поэтому в мышцах и клетках, обладающих немышечиой по-
движностью, есть специальная группа Са2+-связывающих бел-
209
ков, обеспечивающих регуляцию взаимодействия миозина с
актином.
Большинство внутриклеточных белков, обладающих высо-
ким сродством к ионам Са2+, относится к группе так называ-
емых белков EF-руки. Такое странное название эти белки
получили за своеобразное строение Са-связывающих центров.
После кристаллизации первого Са2+-связываюгцего белка пар-
вальбумина было установлено, что Са2+-связывающий центр
устроен следующим образом. Ион Са2+ связывается 12-член-
ной аминокислотной петлей, которая с N- и С-конца ограни-
чена двумя, как правило 12-членными, «-спиралями. В про-
странстве такая структура напоминает правую руку, большой
и указательный пальцы которой соответствуют С- и N-конце-
вым спиралям, а Са2+-связывающий центр располагается
между ними (рис. 118—см.вклейку). В парвальбумине есть
шесть спиральных участков — от А до F, при этом спирали Е
и F ограничивают с N- и С-конца третий Са2+-связывающий
центр. Именно поэтому группа Са2+-связывающих белков по-
лучила название семейства белков EF-руки.
Как отмечалось, кальций связывается в центре 12-членной
аминокислотной петли, шесть лигандов которой прямо участ-
вуют в координации ионов Са2+. Са2+-связывающие петли
довольно консервативны по своей первичной структуре. Так,
в положении 1, как правило, располагается остаток Asp, а в
положении 12 — остаток Glu. Положения 4 и 6 часто заняты
остатками Gly, а остатки в положениях 3, 5 и 9 имеют в
боковой цепи атомы кислорода (Asp, Asn, Thr, Ser, реже Glu
и Gin). Кальций координируется шестью (или семью) лиган-
дами, расположенными в вершинах октаэдра (рис. 119—см.
вклейку) или в вершинах пентагональной бипирамиды. При
этом главную роль в связывании ионов Са2+ играют атомы
кислорода карбоксильных или спиртовых групп, кислород кар-
бонильной группы пептидной связи (лиганд в положении 7, -Y),
а также кислород молекулы воды. Связывание ионов Са2+ в
Са2+-связывающей петле сопровождается конформационными
изменениями, которые затрагивают как структуру петли, так и
структуру ограничивающих ее с двух сторон «-спиральных
участков. Следствием этих конформационных перестроек часто
является изменение (как правило, увеличение) «-спиральнос-
ти, ориентации а-спиралей относительно друг друга, а также
изменение гидрофобности молекулы белка. Все вместе это
влияет на способность Са2+-связывающего белка взаимодейст-
вовать с белками-мишенями и обеспечивает Са2+-зависимую
регуляцию многочисленных реакций, протекающих в клетке.
Ионы Mg2+ имеют меньший радиус, чем ионы Са2+. Вследст-
вие этого они менее прочно связываются в катионсвязываю-
щих центрах и вызывают заметно меньшие конформационные
изменения в общей структуре анализируемых белков.
210
Следует отметить, что в настоящее время в литературе не
описаны Са2+-связывающие белки, содержащие только одну
EF-руку. Это, вероятно, объясняется тем, что такая структура
не обладает достаточной устойчивостью. Са2+-связывающие
участки большинства Са2+-связывающих белков как бы сцеп-
лены друг с другом. Обычно две Са2+-связывающие петли
соединены друг с другом за счет водородных связей, образуе-
мых пептидными связями, принадлежащими 8-му и 9-му ами-
нокислотным остаткам каждой из петель. Такое сцепление
приводит к тому, что связывание ионов Са2+ в одном из
центров сказывается на параметрах связывания ионов Са2+ в
другом центре. В настоящее время известно огромное количе-
ство Са2+-связывающих белков, относящихся к семейству бел-
ков EF-руки. Эти белки можно условно разделить на группы,
члены которых содержат в своем составе 2, 3, 4 и 6 катион-
связывающих центров. Рассмотрим свойства некоторых из этих
белков.
Простейшие по строению Са-связывающие белки содержат
в своем составе только 2 EF-руки. К этой группе белков отно-
сится белок S-100 из мозга и родственные ему белки кальтропин
и калъгицарин, выделенные из гладких мышц, а также кальци-
клин и метастазин. Все эти белки являются димерами, моно-
меры которых имеют мол. массу около 10—12 кДа и содержат
2 Са2+-связывающие петли. Функции, выполняемые этими
белками, очень разнообразны и пока что не вполне ясны.
Например, кальциклин каким-то образом вовлекается в регу-
ляцию клеточного цикла, а метастазин обнаруживают в основ-
ном в злокачественно перерожденных клетках. Кальтропин и
кальгицарин, выделенные из гладких мышц, предположитель-
но вовлекаются в регуляцию сократительной активности (см.
далее), а белок S-100 может взаимодействовать с микротрубоч-
ками и регулировать процессы их самосборки. К этому же
классу относится витамин-Б-индуцируемый Са2+-связываю-
щий белок кишечника (кальбиндин). Этот мономерный белок,
имеющий 2 центра связывания кальция, каким-то образом
связан с транспортом кальция в кишечнике.
Самая обширная группа представлена белками, содержащи-
ми в своем составе 4 Са2+-связываюгцих центра К этой группе
относятся кальмодулин, тропонин С, регуляторные и щелочные
легкие цепи миозина, непосредственно связанные с регуляцией
сократительной активности различных типов мышц. У кальмо-
дулина и тропонина С во многом сходные трехмерные струк-
туры (рис. 120). Оба белка имеют вид гантели, при этом рас-
положенные на N- и С-концах молекулы глобулярные домены
содержат в своем составе по два кальцийсвязывающих центра.
Эти глобулярные домены соединены между собой длинной
а-спиралью, образующей ручку гантели. В определенных усло-
виях центральная а-спираль этих белков может плавиться и
211
Рис. 120. Структура пептидного скелета кальмодулина (а) и ленточная
модель строения тропонина С (б) [Пермяков Е.А., 1993].
Черные кружки — ионы Са2+; римские цифры и латинские буквы — соответ-
ственно Са2+-связывающие петли и ограничивающие их а-спирали.
глобулярные домены сближаются друг с другом. При этом
образуется V-образная структура и две половинки Са2 -связы-
вающего белка оказываются способными охватить и зажать
между собой амфифильный а-спиральный участок белка-ми-
шени (рис. 121—см.вклейку). По всей видимости, легкие цепи
миозина взаимодействуют с тяжелой цепью миозина аналогич-
ным образом (см. далее). Следует отметить, что описанный
способ взаимодействия Са2+-связывающего белка с белком -
мишенью не является единственным. Центральная а-спираль
тропонина С, вероятно, обладает большей жесткостью и не
подвергается плавлению при взаимодействии с белком-мише-
нью. Недавно опубликованные данные свидетельствуют о том,
что тропонин С взаимодействует с тропонином I в распрям-
ленной вытянутой конформации (рис. 122). В этом случае
тропонин I как бы закручивается вокруг центральной а-спи-
рали тропонина С, а насыщение кальцием катионсвязывающих
участков тропонина С влияет на прочность контакта между
этими двумя белками.
212
Рис. 122. Модель взаимодействия тропонина С и тропонина I. Тро-
понин С изображен в ваде ленты. Четко видна центральная «-спи-
раль, обозначены N- и С-концевые участки, а также спирали С, Е,
G в структуре тропонина С. Тропонин 1 изображен в виде пунктир-
ного контура. Видно, что тропонин I оплетает центральную «-спираль
тропонина С [Olah G., Trewhella J., 1994].
Как отмечалось, группа Са2+-связывающих белков, содер-
жащих четыре катионсвязывающих центра, очень обширна.
Помимо кальмодулина, тропонина С и легких цепей миозина,
к этой группе относят также рековерин (визинин), легкую цепь
Са2+-кальмодулинзависимой протеинфосфатазы (кальциней-
рин), легкую цепь внутриклеточной Са2+-зависимой протеазы
кальпаина, а также много других белков. Рековерин участвует
в процессах фоторецепции, а кальцинейрин и кальпаин могут
участвовать в передаче различных гормональных сигналов
внутрь клетки.
Группа Са2+-связывающих белков, содержащих в своем со-
ставе три катионсвязывающих центра, по-видимому, возникла
пу-тем делеции одного Са2+-связывающего центра у белков,
ранее имевших в своем составе четыре катионсвязывающих
центра. Три EF-руки четко прослеживаются в структуре парв-
альбуминов и онкомодулина. Первый центр этих белков поте-
рял способность связывать ионы Са2+, и только два С-конце-
вых участка сохранили способность связывать катионы двух-
213
валентных металлов. Несмотря на то что парвальбумины были
первыми наиболее подробно изученными Са2+-связывающими
белками, роль этих белков до сих пор остается во многом
загадочной. Содержание парвальбуминов особенно высоко в
быстро сокращающихся белых мышцах рыб. Учитывая высокое
сродство этих белков к кальцию, предполагают, что парваль-
бумины Moiyr выполнять функции растворимых факторов рас-
слабления, т.е. обеспечивают быстрое удаление ионов Са2+ от
сократительного аппарата.
Группа белков, содержащих в своем составе шесть и более
центров связывания кальция, немногочисленна. Предполагают,
что эти белки возникли путем утроения (или учетверения)
мотива, содержащего два Са2+-связывающих центра. Наиболее
подробно из этой 1руппы белков изучены витамин-В-индуци-
руемый Са*+-связывающий белок (кальбиндин) кишечника птиц
и калъретинин. Оба белка содержат в своем составе 6 EF-рук,
из которых только четыре способны связывать катионы двух-
валентных металлов. Любопытно, что кальбиндин млекопита-
ющих содержит в своем составе только 2 EF-руки, а кальбин-
дин птиц —6 EF-рук. Калъретинин обнаружен в нейронах
различного типа. Роль этого белка остается во многом загадоч-
ной.
Са2+-связывающие белки семейства EF-руки широко распро-
странены, встречаются в различных органах и тканях и выпол-
няют многочисленные и разнообразные функции. Все перечислен-
ные бедки являются своеобразными внутриклеточными сенсорами
кальция и в зависимости от его концентрации взаимодействуют
с различными белками-мишенями, регулируя их активность.
В ряде случаев мотив, кодирующий EF-руку, объединяется
с генами другого белка. Вследствие этого образуется своеоб-
разный химерный белок, функции которого могут регулировать-
ся ионами Са2+ за счет собственного, принадлежащего именно
этому белку катионсвязывающего центра. В настоящее время
можно привести довольно много примеров таких химерных
белков. В предыдущем разделе были кратко описаны строение
и свойства таких актинсвязывающих белков, как спектрин,
а-актинин и дистрофин (см. рис. ПО, 111, 114). Все эти белки
содержат в своем составе пару EF-рук, которые могут участ-
вовать в связывании кальция и влиять на активность белков.
К группе таких химерных белков относятся внутриклеточная
протеаза калъпаин, диацилглицеролкиназа, обеспечивающая син-
тез фосфатидной кислоты из диацилглицерола, а также люми-
несцирующий белок некоторых видов медуз оквеорин. Первич-
ные структуры всех этих белков имеют в своем составе специ-
ализированные каталитические центры или центры связывания
флюоресцирующих субстратов, а также две или более EF-руки,
которые связывают ионы Са2+ и регулируют функциональную
активность этих белков.
214
Таким образом, гибкая 12-членная петля, ограниченная с двух
сторон ^.-спиральными участками и обозначаемая как EF-рука,
способна формировать высокоспецифичные центры связывания
ионов Са2, обладающие высоким сродством к этому иону. Внут-
риклеточные белки, относящиеся к семейству EF-руки, могут
выступать в роли сенсоров кальция и регулировать активность
многих белков и ферментов. Именно белки семейства EF-руки
участвуют в регуляции сократительной активности мышц раз-
личного типа.
Ре1уляторные белки могут быть связаны с двумя основными
сократительными белками: либо с миозином, либо с актином.
Поэтому различают два типа регуляции. Миозиновый тип регу-
ляции связан с белками, ассоциированными с нитями миозина,
а актиновый тип регуляции обеспечивается белками, распола-
гающимися на нити актина.
В настоящее время известно два принципиально различных
механизма миозиновой регуляции сокращения. Первый, наи-
более простой способ регуляции основан на связывании ионов
Са2+ с миозином. Этот тип .регуляции характерен для мышц
некоторых видов моллюсков. Миозин двустворчатого моллюс-
ка морского гребешка, как и миозин высших животных, пред-
ставляет собой гексамер и состоит из 2 тяжелых и 4 легких
цепей (см. рис. 94). В то же время АТРазная активность мио-
зина гребешка активируется актином только в присутствии
ионов Са2+, а АТРазная активность миозина кролика — неза-
висимо от концентрации ионов Са2+ в окружающей среде.
Если учесть, что АТРазная активность актомиозина в той или
иной мере отражает процессы, протекающие в ходе сокраще-
ния мышц (см. рис. 102), то можно сделать вывод, что в
мышцах моллюсков регуляция сокращения обеспечивается
путем связывания ионов Са2+ со специальным центром, рас-
положенным на молекуле миозина.
В последнее время удалось получить и закристаллизовать
регуляторный центр миозина моллюсков (рис. 123). Оказалось,
что Са2+-связывающий центр формируется при участии 3 участ-
ков различных полипептидных цепей, принадлежащих двум
легким и одной тяжелой цепи миозина. С-концевой фрагмент
головки тяжелой цепи миозина с мол. массой 20 000 (см. рис.
101) начинается около акгинсвязывающего центра, проходит
вблизи ATP-связывающего центра и формирует “шейку” мо-
лекулы миозина, на которой закреплены легкие цепи миозина
(см. рис. 123). Участок тяжелой цепи миозина, расположенный
между двумя легкими цепями, образует плавный поворот.
Вблизи этого поворота располагается регуляторный Са2+-свя-
зывающий центр. Судя по всему, связывание иоиов Са2+ в
этом центре влияет на изгиб полипептидной цепи тяжелой
цепи миозина, передается на большое расстояние и затрагивает
как актин-, так и ATP-связывающие центры миозина. Любо-
215
Рис. 123. Общее строение регуляторного участка тяжелой цепи (НС)
миозина гребешка со связанными с ним щелочной (ELC) и регуля-
торной (RLC) легкими цепями миозина [Xie X. et al., 1994].
Обозначены N- и С-концы тяжелой цепи (НС) миозина (выделена в виде
жирной спирали, проходящей по диагонали), а также N- и С-концы легких
цепей миозина (тонкие линии). Тяжелая цепь имеет плавный поворот между
центрами связывания легких цепей и излом на С-конце вблизи центра связы-
вания регуляторной легкой цепи миозина. Регуляторная легкая цепь RLC
(видны только остатки 2—153) обвернута вокруг С-концевоЙ части тяжелой
цепи миозина. ELC оплетает N-концевую часть шейки молекулы миозина.
Ионы Mg2+ связаны в N-крнцевом первом центре регуляторной легкой цепи
миозина. Регуляторный Са2 -связывающий центр формируется путем специ-
альной укладки полипептидных цепей N-концевоЙ части ELC, С-концевой
части RLC и центрального участка тяжелой цепи миозина.
пытно отметить, что первый катионсвязывающий центр ще-
лочной легкой цепи миозина, так же как и С-концевые Са2+-
связывающие центры регуляторной легкой цепи миозииа, де-
фектны и не могут связывать кальций. Только контактируя
друг с другом и с определенным участком тяжелой цепи мио-
зина, эти центры оказываются способными формировать регу-
ляторный центр. Именно поэтому избирательное удаление ре-
гуляторной легкой цепи миозина моллюсков приводит к пол-
ной потере зависимости АТРазы актомиозина от концентрации
216
ионов Са2+. Миозин при этом оказывается в постоянно “вклю-
ченном” состоянии и даже при низкой концентрации ионов
Са2+ обладает высокой актинактивируемой АТРазной актив-
ностью.
В простейшем случае миозиновый тип регуляции основан на
специфическом связывании ионов Са2+ в области “шейки ” мио-
зина. При этом связывание ионов Са2+ вызывает конформаци-
онные изменения в актин- и ATP-связывающих центрах головки
миозина и регулирует способность миозина взаимодействовать с
актином.
Более сложный тип миозиновой регуляции характерен для
гладких мышц и некоторых клеток, обладающих немышечной
подвижностью. В основе такой регуляции также, по-вццимому,
лежат структурные изменения в области “шейки” молекулы
миозина. Однако эти изменения индуцируются не путем свя-
зывания ионов Са2+ (как это описано для миозина моллюс-
ков), а путем фосфорилирования определенных остатков в струк-
туре регуляторных легких цепей миозина. Регуляторные легкие
цепи миозина гладких мышц отличаются от соответствующих
легких цепей миозина моллюсков и имеют на N-коице остатки
Ser и Thr (Ser-19, Thr-18), которые могут подвергаться фосфо-
рилированию. На рис. 123 указанные остатки не ввдны, потому
что гомологичный Ser-19 остаток Ser-б ретуляторной легкой
цепи миозина гребешка располагается за шесть аминокислот-
ных остатков от участка, картированного на рентгенограммах.
Тем не менее N- и С-концы регуляторной легкой цепи мио-
зина сближены между собой. В связи с этим фосфорилирова-
ние Ser-19 и/или Thr-18 может привести к изменению ориен-
тации С-концевой части регуляторной легкой цепи миозина,
которая, как обсуждалось, располагается вблизи изгиба тяже-
лой цепи миозина и может влиять на способность миозина
гидролизовать АТР и взаимодействовать с актином. Таким
образом, и в миозине моллюсков, и в миозине гладких мышц
основу механизма регуляции составляет изменение ориентации
С-концевой части регуляторной легкой цепи миозина и свое-
образного шарнирного участка тяжелой цепи миозина.
Рассмотрим более подробно особенности белков и фермен-
тов, обеспечивающих фосфорилирование легких цепей миози-
на гладких мышц и тем самым участвующих в регуляции со-
кращения. В настоящее время из скелетных, сердечных и по-
перечнополосатых мышц, а также из большого числа клеток,
обладающих немышечной подвижностью (клетки мозга, тром-
боциты и многие другие), выделен специальный фермент —
киназа легких цепей миозина (КЛЦМ) (myosin light chain kinase,
MLCK). Этот фермент с высокой избирательностью и эффек-
тивностью фосфорилирует легкие цепи миозина. Киназа лег-
ких цепей миозина состоит как бы из двух участков (рис. 124).
В N-концевом участке КЛЦМ располагаются центры, обеспе-
217
Регуляторный домен
АТР- связывающий участок
Автоянгибигорный участок
SKDRMKKYMARRKWQKTGHAVRAIGRLs(s)
кальмодупинсвязывающий^
Домен
Рис. 124. Доменная организация киназы легких цепей миозина из
мускульного желудка кур [Walsh М., 1994J.
В N-концевой части располагается актиисвязывающий центр, вслед за ним —
три приблизительно 100-членных повтора (unc П-1, unc П-2 и unc 1-1), сходных
по своей структуре с определенными участками в структуре твитчина и фиб-
ронектина. Далее следует миозинсвязывающий центр, а также каталитический
и регуляторный участки. На С-конце располагается еще един мотив (unc П-3)
с первичной структурой, характерной для твитчина. В регуляторном домене
различают автоингибиторный участок и следующий за ним кальмодулинсвя-
зывакнций центр. Цифры —номера аминокислотных остатков. Первичная
структура АТР-связывающсго, автоингибиторного н кальмодулинсвязывающе-
го центра приведена полностью в однобуквенном коде.
чивающие прикрепление фермента к определенным внутри-
клеточным структурам. КЛЦМ может взаимодействовать как с
актином, так и с миозином. В С-концевой части располагается
каталитический участок. В этом участке есть центр связывания
АТР и центр связывания субстрата (регуляторной легкой цепи
миозина). В обычном состоянии субстратсвязывающий центр
занят автоингибиторным пептидом, имеющим структуру, сход-
ную с первичной структурой вблизи центра фосфорилирования
легкой цепи миозина (этот участок изображен в нижней части
рис. 124). До тех пор пока автоингибиторный центр распола-
гается в активном центре, фермент неактивен. При повышении
концентрации ионов Са2+ внутри клетки кальмодулин взаимо-
действует с участком, расположенным сразу после автоинги-
биторного центра. Кальмодулин как бы охватывает а-спираль-
ный участок КЛЦМ (см. рис. 121) и выталкивает автоингиби-
торный участок из активного центра фермента. После этого
активный центр фермента становится доступным для легкой
цепи миозина и начинается процесс фосфорилирования. Сни-
жение концентрации ионов Са2+ внутри клетки приводит к
диссоциации кальмодулина от соответствующего центра в ре-
гуляторном домене КЛЦМ; возвращению автоингибиторного
участка в свое первоначальное состояние и “выключению”
фермента. Взаимодействие КЛЦМ с кальмодулином регулиру-
218
ется не только ионами Са2+, но может зависеть от фосфорили-
рования определенных участков в кальмодулинсвязывающем
центре фермента (см. рис. 124). (Фосфорилирование КЛЦМ под
действием Са-кальмодулинзависимой протеинкиназы ослабляет
взаимодействие кальмодулина с регуляторным центром КЛЦМ.)
Описанная последовательность событий приводит к тому,
что при повышении концентрации ионов Са2* КЛЦМ фосфо-
рилирует легкие цепи миозина, что меняет ориентацию тяже-
лых и легких цепей миозина и делает возможным мышечное
сокращение. Удаление ионов Са2+ "выключает” КЛЦМ, но
при этом перенесенный ферментом остаток фосфата остается
связанным с регуляторной легкой цепью миозина. Чтобы стало
возможным расслабление, необходимо удалить остатки фосфа-
та с легкой цепи миозина. Этот процесс осуществляется фос-
фатазами легких цепей миозина. Две протеинфосфатазы спо-
собны дефосфорилировать регуляторные легкие цепи — проте-
инфосфатазу 1 и протеинфосфатазу 2А. Обе протеинфосфатазы
не обладают высокой специфичностью и, помимо легких цепей
миозина, способны дефосфорилировать иные белки-субстраты.
Оба фермента состоят из 2 или 3 субъединиц, при этом ката-
литическая субъединица с мол. массой 34 000—38 000 связана
с одной или двумя регуляторными субъединицами с мол. мас-
сами 20 000—60 000 и 100 000—130 000. Активность протеин-
фосфатазы 1 может регулироваться специальными белками-ин-
гибиторами, которые мотуг подвергаться фосфорилированию.
Кроме того, регуляторные субъединицы выступают в роли свое-
образных якорей и закрепляют каталитические субъединицы
фермента вблизи белков-субстратов, подвергающихся фосфо-
рилированию. Активность фосфатазы 1 и фосфатазы 2А не
зависит от концентрации ионов Са2+ внутри клетки. При ее
повышении активность КЛЦМ превосходит активность фос-
фатаз и легкие цепи миозина подвергаются фосфорилирова-
нию. После "выключения” КЛЦМ фосфорилирование легких
цепей приостанавливается, а фосфорилированные легкие цепи
миозина дефосфорилируются протеинфосфатазами.
Таким образом, в гладких мышцах и немышечных клетках
сокращение или перемещение в пространстве инициируется
при фосфорилировании легких цепей миозина, а расслабление
становится возможным после дефосфорилирования легких
цепей миозина (рис. 125).
В гладких мышцах фосфорилирование легких цепей миозина
является необходимым условием начала сокращения. Фосфорилиро-
вание легких цепей миозина гладких мышц сопровождается суще-
ственными изменениями в области "шейки ” молекулы миозина.
Хвостовая часть молекулы миозина гладких мышц обладает
повышенной гибкостью, вследствие чего могут образовываться
два излома и хвостовая часть оказывается способной контак-
тировать с головкой миозина (см. рис. 100). Образующаяся
219
4Са2ЧСаМ
Ct.’CaM
КЛЦМ
клц
СяМ-КЛЦМ
РАССЛАБЛЕНИЕ<= Миозин
ФЛЦМ
Р-миозин
J 4 L-Актин
1Г ^-АТР
Акто -P-миозин СОКРАЩЕНИЕ
<3/ X^*-ADP+P
кц 4 КП
Л Са*СаМ-ПК ||
р-кд р-кп
Рис. 125. Участие кальмодулина в регуляции сокращения гладких
мышц [Walsh М.» 1994].
Насыщенный кальцием кальмодулин (СаМ) активирует киназу легких цепей
миозина (КЛЦМ), которая фосфорилирует легкие цепи миозина и тем самым
способствует циклическому замыканию и размыканию мостиков между мио-
зином и актином, перемещению миозина относительно актина и сокращению.
Дефосфорилирование легких цепей миозина под действием фосфатазы легких
цепей миозина (ФЛЦМ) способствует расслаблению. Са-кальмодулинзависи-
мая прогеинкиназа (СаМ-ПК) может фосфорилировать расположенные на
тонком филаменте гладких мышц регуляторные белки кальдесмон (КД) и
кальлонин (КП) и тем самым обращать их ингибирующее влияние на взаимо-
действие актина с миозином. Фосфорилирование кальцесмона и кальпонина и
устранение их ингибирующего эффекта также будут способствовать развитию
сокращения.
компактная форма — 10s форма миозина не может быть упа-
кована в толстый филамент. Фосфорилирование легкой цепи
миозина разрушает контакт между хвостовой частью миозина
и его “шейкой” и тем самым сдвигает равновесие между 10s и
6s формами миозина в сторону распрямленной 6s формы.
Таким образом, фосфорилирование легких цепей миозина
гладких мышц может оказывать существенное влияние не толь-
ко на взаимодействие миозина с актином, но и на формиро-
вание миозиновых филаментов.
КЛЦМ была выделена не только из гладких, но также из
поперечнополосатых мышц. Кроме того, установлено, что лег-
кие цепи миозина поперечнополосатых и сердечных мышц
также могут подвергаться обратимым циклам фосфорилирова-
ния и дефосфорилирования. Следует, однако, отметить, что
структуры тяжелых и легких цепей миозина гладких и попере-
чнополосатых мышц довольно существенно отличаются друг
от друга. Поэтому характер и амплитуда структурных измене-
ний, происходящих в головке молекулы миозина поперечно-
полосатых мышц при фосфорилировании легких цепей миози-
на, существенно отличаются от аналогичных изменений в го-
220
ловке миозина гладких мышц. Фосфорилирование легких це-
пей миозина поперечнополосатых мышц может сопровождать-
ся изменением ориентации головок миозина относительно ство-
ла миозинового филамента и определенным образом модули-
ровать взаимодействие миозина с актином. (Предполагают, что
явление посттетанической потенциации, связанное с активацией
одиночного сокращения сразу после тетанической стимуляции,
обусловлено увеличением степени фосфорилирования легких
цепей миозина.) Тем не менее фосфорилирование легких цепей
миозина скелетных мышц не приводит к кардинальному изме-
нению взаимодействия миозина с актином и не может шрать
ключевой регуляторной роли, характерной для этого процесса
в гладких мышцах. Сокращение поперечнополосатых и сердеч-
ных мышц в основном регулируется специальной белковой
системой, расположенной на актиновом филаменте.
Существует два основных варианта так называемой актино-
вой системы регуляции. Первый, наиболее подробно исследо-
ванный механизм регуляции связан с тропониновым комплексом
и характерен для поперечнополосатых и сердечных мышц. Вто-
рой механизм изучен менее детально. Он связан с калъдесмоном
(и/или кальпонином) и характерен для гладких мышц и клеток,
обладающих немышечной подвижностью. В обоих типах регу-
ляции важная роль отводится тропомиозину, который под
действием регуляторных белков может перемещаться в канав-
ках актинового филамента и в ходе этих перемещений пере-
крывать определенные центры, расположенные на поверхности
актина и вовлеченные во взаимодействие миозина с актином.
Тропониновый комплекс состоит из трех компонентов. Са2+-
связывающий компонент — тропонин С (мол. масса около
18 000) содержит в своем составе 4 катионсвязывающих центра.
Центры, расположенные в N-концевой части молекулы белка,
специфически связывают ионы Са2+, а катионсвязывающие
центры, расположенные в С-концевой части, способны связы-
вать как ионы Са2+, так и ионы Mg2+. Установлено, что
катионсвязывающие центры, расположенные в N-концевой
части молекулы тропонина С, участвуют в ретуляции сокраще-
ния, в то время как центры, расположенные в С-концевой
части белка, играют в основном структурную роль и участвуют
во взаимодействии тропонина С с другими компонентами тро-
понина.
Второй, так называемый ингибиторный, компонент тропо-
нина (тропонин I; мол. масса 21 000—24 000) в изолиро-
ванном состоянии ингибирует АТРазную активность актомио-
зина. Тропонин I взаимодействует с тропонином С, при этом
полипептвдная цепь тропонина I оплетает центральную сх-спи-
раль тропонина С (см. рис. 122). Прочность взаимодействия
тропонина I с тропонином С возрастает в присутствии ионов
Са2+. Это связано с тем, что ионы Са2+ вызывают значитель-
221
C-Ca*
A ----- Тм
а
A------Тм
Рис. 126. Взаимодействие компо-
нентов тропонин-тропомиозинового
комплекса при низкой (а) и высо-
кой (б) концентрации ионов Са2+.
Компоненты тропонинового комплекса
обозначены буквами латинского алфави-
та (тропонин С — С, тропонин I •— I,
тропонин Т—Т); А —актин; Тм—тро-
помиозин. Сплошные линии — сильные,
пунктирные—слабые взаимодействия.
ные изменения в структуре тропонина С, при этом экспони-
руются определенные гидрофобные остатки, которые становят-
ся способными взаимодействовать с тропонином I. Такого рода
взаимодействие ослабляет способность тропонина I ингибиро-
вать АТРазную активность актомиозина. Таким образом, в
присутствии ионов Са2+ тропонин С оказывается способным
устранять ингибирующее влияние тропонина I на взаимодей-
ствие миозина с актином.
Наконец, третий компонент тропонина тропонин Т (мол.
масса 33 000—35 000) обеспечивает прикрепление полного тро-
понинового комплекса к тропомиозину и актину. Тропонин Т
играет ключевую структурную роль, взаимодействуя с двумя
другими компонентами тропонина, а также с актином и тро-
помиозином. Строение актин-тропонин-тропомиозинового
комплекса можно представить в виде схемы (рис. 126).
При низкой концентрации ионов Са2+ тропонин С слабо
взаимодействует с другими компонентами тропонина, а тропо-
нин I и тропонин Т, напротив, прочно взаимодействуют с
актином и тропомиозином, обеспечивая эффективное ингиби-
рование АТРазной активности актомиозина. При повышении
концентрации ионов Са2+ и насыщении Са2+-специфических
регуляторных центров тропонин С начинает прочно взаимо-
действовать с тропонином I и тропонином Т. Следствием этого
является ослабление взаимодействия этих компонентов тропо-
нина с актином и тропомиозином. Ингибирующий эффект
тропонина I на АТРазную активность актомиозина устраняет-
ся, и становится возможным мышечное сокращение.
Какие изменения структуры лежат в основе регуляторного
действия тропонин-тропомиозинового комплекса? Согласно
современным представлениям, в отсутствие ионов Са2+ тропо-
нин-тропомиозиновый комплекс располагается на поверхнос-
ти нити фибриллярного актина (рис. 127). Такая локализация
тропомиозина не препятствует взаимодействию миозина с ак-
тином, однако присоединиться к актину, находящемуся в та-
222
ком состоянии, может только головка миозина, содержащая
АТР или ADP-P. Другими словами, в отсутствие ионов Са2+
тропонин-тропомиозиновый комплекс не мешает так называ-
емому слабому присоединению головки миозина к актину. Для
генерации усилия необходимо, чтобы головка миозина пере-
местилась по актину, произошли бы освобождение фосфата из
активного центра миозина и переориентация “шейки’* миозина
относительно актинового филамента (см. рис. 102,4,5). Все эти
процессы невозможны, пока тропомиозиновый тяж располага-
ется на поверхности нити актина.
В отсутствие ионов Са2+ тропомиозин не препятствует сла-
бому присоединению миозина к актину, но делает невозможными
генерацию усилия и перемещение нити актина относительно
миозина. В присутствии ионов Са2+ тропонин С обращает ин-
гибирующий эффект тропонина I. Вследствие этого становится
возможным перемещение тропонин-тропомиозинового комплекса
внутрь канавки F-актина (см. рис. 127), при этом открываются
дополнительные центры на поверхности актина, миозин оказы-
вается способным перемещаться по поверхности актина, перехо-
дить из состояния "слабого” связывания в состояние "сильного”
связывания и тем самым генерировать напряжение.
Как отмечалось, гладкие мышцы не содержат в своем со-
ставе тропонин-тропомиозинового комплекса. Однако на тон-
ких филаментах гладких мышц располагаются кальдесмон и
кальпонин. Установлено, что кальдесмон располагается в
канавках фибриллярного актина и контактирует с тропомио-
зином. Одна молекула кальдесмона может перекрывать два
димера тропомиозина (см. рис. 117). Сравнивая рис. 117 и рис.
116, можно заключить, что кальдесмон и тропонин занимают
практически одинаковое положение на нити фибриллярного
актина и различаются лишь по стехиометрии связывания тро-
помиозина. Кальпонин также располагается на поверхности
актинового филамента и способен взаимодействовать с тропо-
миозином. Данные литературы свидетельствуют о том, что в
гладких мышцах есть две популяции тонких филаментов. Одна
популяция содержит в своем составе кальпонин и фила-
мин и, по-видимому, в основном выполняет цитоскелетную
роль. Вторая популяция актиновых филаментов содержит в
своем составе кальдесмон. Эта популяция филаментов рас-
полагается вблизи нитей миозина и, вероятно, участвует в
генерации сокращения.
Предполагают, что механизм функционирования кальдес-
мона во многом аналогичен механизму функционирования
тропонинового комплекса. В отсутствие ионов Са2+ кальдес-
мон смещает равновесие между двумя положениями тропоми-
озина на тонком филаменте в сторону такого положения, когда
тропомиозин блокирует генерацию тянущего усилия головкой
миозина, присоединенной к актину (рис. 128). При повышении
223
224
концентрации ионов Са2+ внутри клетки кальмодулин (или
другой Са2+-связывающий белок) взаимодействует со специ-
фическими участками в структуре калвдесмона. Это приводит
к тому, что меняется взаимодействие калвдесмона с актином
и тропомиозином.
Тропомиозин становится более подвижным, и головка ми-
озина оказывается способной вытолкнуть его из блокирующего
положения и начать генерацию тянущего усилия. Эта модель
мало чем отличается от модели регуляторного действия тропо-
нина (см. рис. 127). Предложенная гипотеза функционирова-
ния калвдесмона не является общепризнанной. Однако в ли-
тературе существует единое мнение о том, что регуляторное
действие калвдесмона так или иначе осуществляется либо
путем перемещения (или изменения подвижности тропомио-
зина), либо благодаря вызванному калвдесмоном изменению
структуры мономеров актина. Следует отметить, что кальдес-
мон может фосфорилироваться под действием различных про-
теинкиназ. '
Фосфорилирование калвдесмона сопровождается изменени-
ем его взаимодействия с основными сократительными и регу-
ляторными белками и может влиять на его регуляторные свой-
ства (см. рис. 125).
Механизм функционирования кальпонина до сих пор оста-
ется достаточно спорным. Как отмечалось, нити актина, со-
держащие кальпонин, как правило, располагаются в цитоске-
Рис. 127. Регуляторное действие тропонин-тропомиозинового комп-
лекса.
а и б — продольное изображение тонкого актинового филамента в отсутствие
(а) и в присутствии (б) ионов Са2+. В отсутствие ионов Са2+ тропомиозин
(черные перекрученные нити) располагается на поверхности актина. Тропонин
Т (ТпТ, заштрихованная структура в виде запятой) своим вытянутым N-koh-
цевым участком перекрывает две соседние пары нитей тропомиозина. Тропо-
нин I (Тп!) и тропонин С (ТпС) взаимодействуют с глобулярным С-концсвым
участком тропонина Т. Тропонин I слабо взаимодействует с тропонином С
только своим N-концсвым доменом (обозначен N), а ингибиторный и С-кон-
цевой участки тропонина I (соответственно I и С) взаимодействуют с актином
и тропомиозином и закрепляют весь тропонин-тропомиозиновый комплекс в
блокирующем положении. В присутствии ионов Са2+ ингибиторный и С-кон-
цевой домены тропонина I диссоциируют от актина и формируют контакт с
тропонином С. Тропонин I перестает фиксировать тропонин-тропомиозино-
вый комплекс в блокирующем положении, и тропомиозин перекатывается в
глубь канавки актина (Farah C.S., Reinach F.C., 1995]; в — поперечное сечение
актинового компонента. Показаны два сферических мономера актина. Поло-
жения тропомиозина обозначены в виде двух маленьких кругов. В отсутствие
ионов Са2+ (маленький пунктирный круг) тропомиозин мешает продуктивно-
му взаимодействию тяжелого меромиозина (ТММ) или головки миозина с
актином. В присутствии ионов Са2+ тропомиозин перемещается внутрь канав-
ки актина (сплошной маленький круг) и это делает возможными перемещение
головки миозина по актину и генерацию сокращения.
225
Актин-тропомиозиновый комплекс
«выключен»
Аггин-тропоммозииовый комплекс
«включен»
Рис. 128. Предполагаемый механизм регуляторного действия кальде-
смона [Marston S., 1998].
В отсутствие ионов Са2+ калвдесмон закреплен на актине тремя участками (В,
В’ и С). Такое взаимодействие влияет на структуру актина, способствует
фиксации тропомиозина (шарики на поверхности актина) в определенном
положении и, хотя нс препятствует присоединению миозина по участкам
слабого связывания, делает невозможными формирование прочного комплекса
миозина с актином и генерацию тянущего усилия. В присутствии ионов Са2+
кальмодулин или иной Са2 -связывающий белок взаимодействует с калвде-
смоном. Это приводит к диссоциации участков В и В’ калвдесмона от актина.
Вследствие этого изменяется структура актина (актин, изображенный в виде
квадрата, принимает форму квадрата с закругленными углами). Тропомиозин
(белые шарики на поверхности актина) приобретает большую подвижность и
головки миозина оказываются способными выталкивать тропомиозин из бло-
кирующего положения и генерировать тянущее усилие.
летном, а не в сократительном компартменте гладких мышц.
В связи с этим нельзя считать калыюнин белком, обязательно
участвующим в регуляции взаимодействия миозина с актином.
Экспериментальные данные последних лет свидетельствуют о
том, что кальпонин может каким-то образом регулировать вза-
имодействие 3—4 близлежащих мономеров актина с миозином.
Эффективность регуляторного действия кальпонина при этом
не зависит от присутствия тропомиозина. Так же как кальдес-
мон и тропонин, кальпонин не влияет на связывание головок
миозина с актином, но значительно ингибирует АТРазную
активность актомиозина. Ингибиторный эффект кальпонина
может быть обращен после взаимодействия кальпонина с на-
сыщенными ионами Са2+ кальцийсвязывающим белком. Об-
наружено также, что ингибирующий эффект кальпонина суще-
ственно ослабевает после его фосфорилирования под действи-
ем различных протеинкиназ (см. рис. 125). Этот эффект
обусловлен тем, что фосфорилированный кальпонин слабо
связывается с актином.
226
Таким образом, регуляторные системы могут располагаться
как на миозиновом, так и на актиновом филаментах. Миозино-
вый тип регуляции играет главную роль в мышцах моллюсков, а
также в гладких мышцах высших животных и в ряде клеток,
обладающих немышечной подвижностью. В поперечнополосатых
мышцах миозиновый тип регуляции (фосфорилирование легких
цепей миозина) может участвовать в тонкой подстройке (мо-
дуляции) сокращения.
Актиновый тип регуляции (тропонин-тропомиозиновый ком-
плекс) является основным в инициации сокращения поперечнопо-
лосатых и сердечных мышц. В гладких мышцах актиновый тип
регуляции играет вспомогательную роль и обеспечивает модуля-
цию взаимодействия миозина с актином.
РЕКОМЕНДУЕМАЯ ЛИТЕРАТУРА
Альберте Б., Брей Д., Льюис Дж. и др. Молекулярная биология клет-
ки.—М.: Мир, 1994.
Белки и пептцды/Под ред. В.Т.Иванова, В.М. Линкина.—М.: Наука,
1995.
Бэгшоу К. Мышечное сокращение.—М.: Мир, 1985.
Каппуччинелли П. Подвижность живых клеток.—М.: Мир, 1982.
Пермяков Е.А. Кальцийсвязывающие белки.—М.: Наука, 1993.
Поглазов Б.Ф., Левицкий Д.И. Миозин и биологическая подвиж-
ность—М.: Наука, 1982.
Структура и функции белков сократительных систем/Под ред.
Г.П.Пинаева.—Л.: Наука, 1987.
Фултон А. Цитоскелет. Архитектура и хореография клетки.—М.: Мир,
1987.
Biochemistry of smooth muscle contraction/Ed. M.BArAny.—Acad. Press,
1996.
Pollack G.H Muscles and molecules.—Seattle, Washington: Ebner & Sons
Publishers, 1990.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ*
Аквеорин 214
Активация сокращения в глад-
комышечных клетках 163
Актин 14, 115, 176, 190
— структура трехмерная 104
у-Актин 18
а-Актинин 16, 74, 79, 198, 201
Г-Актинии 195
Акументин 195
Аморфин 16
Аппарат Гольджи 23, 81
— сократительный поперечно-
полосатых мышц 176
Атрофия миокарда 96
— тип денервационный 175
Афференты первичные 39
Ацетилхолин 32
Белки актинсвязывающие 194
— взаимодействующие с моно-
мерным актином 195
— группа гельзолин-виллино-
вая 196
- —фрагмин-севериновая 196
— дополнительные 14
— EF-руки 210, 215
— кепирующие конец нити ак-
тина острый 195
----------тупой 196
— мембран интегральные 201
----периферические 201
— обеспечивающие прикрепле-
ние нитей актина к мембра-
не 201
— повреждающие или “разре-
зающие” тонкие актиновые
филаменты 196
— прикрепляющиеся вдоль
нити актина 206
- Са2+-связывающие 211, 213
— “сливающие” нити актина 197
— цитоплазмы Са2+-связываю-
щие 145
Белки-моторы, перемещающие-
ся по нити актина 207
Белки-посредники 203
Белок S-100 211
-TW 240/260 201
— химерный 214
Бляшки моторные 32
Бревин 196
Веретено мышечное 37
Виллин 196
Виментин 18, 74, 79, 116
Витам HH-D-индуцируемый
Са2+-связывающиЙ белок 214
Включения липидные 23
у-Волокна 39
Волокна мышечные 11
----интрафузальные 36
------строение 37
----многоядерные 64
----тонические 24, 29
----фазные 24, 29
----центральные 51
— нервные фузимоторные 39
— Пуркинье 85
— ядерно-сумковые 37, 38
— ядерно-цепочечные 37, 38
“Вспышки кальциевые” 164
Гсльзолин 196, 208
Гипертрофия сердечной
мышцы 97
Гипотеза скользящих нитей 176
Гликокаликс 11
Глицералвдегидфосфатдегидро-
геназа 207
Гормон пептидный 81
1 Цифры полужирным шрифтом — номера рисунков.
228
Дерматом 40
Десмин 18, 74, 79, 116
Десмогликоген 82
Десмосомы 79
Диацилглицеролкиназа 214
“Диски вставочные” кардио-
миоцитов 79, 48
Дистрофин 203
— структура доменная 114
Дистрофия мышечная Дюшен-
на 50
ДНР-рсцепторы см. Рецепторы
дигидропиридиновые
Домен цитоскелетный спектри-
новый 18
Единица двигательная 31
Изозим креатинкиназы 19
InsPj-peueirropbi 161
Калыицарин 211
Кальдесмон 223
— гладкомышечный 206
— механизм регуляторного дей-
ствия 128
Кальмодулин 211
— структура пептидного скеле-
та 120, а
Кальпаин 214
Кальпонин 223
Кальретинин 214
Калыропин 211
Кальций ионизированный 141
----концентрация в цитоплаз-
ме клетки 145
------во внутриклеточных
компартментах 145
— концентрация в мноплазме
142
----внутри клетки 209
Са2+-каналы InsPj-axTHBHpye-
мые 161
Кальциклин 211
Кальцинейрин 213
Канал кальциевый, структура
молекулярная 157
— натриевый 159
capZ 196
Кардиодилатин 81
Кардиомиогенез 85
— млекопитающих 52
Кардиомиоциты, аппарат преси-
наптический 85
— регенерация 93
Киназа легких цепей миозина
217
--------доменная организа-
ция 124
Клапаны сердца 85
Клетки гладкомышечные, ин-
нервация 118
--контрактильные 114
--секреторные 116
— миоидные позвоночных жи-
вотных, классификация 9
— мононуклеарные, генерации
45
— Пуркинье 82
— стволовые 41
— шванновские см. Леммоциты
Комплекс тропониновый 221
— тропонин-тропомиозиновыЙ
222, 126
--схема регуляторного дейст-
вия 127
Коннекгин 18, 79
Контакты межмитохондриаль-
ные 77
Ламинин 169
Лейомиогистогенез 121
Лейомиоциты 114
— дермальные 117
— десминпозитивные 116
— миоэпителиальные 117
— субпопуляции 123
— тонические 117
— фазные 116
— этапы дифференцировки 123
— экстагломерулярные 117
Леммоциты 32
Лизосомы 23
Магний, концентрация внутри
клетки 209
М-белок 19
Мезодерма, дифференцировка
40
Метастазин 211
Механизм сокращения кардио-
миоцита 149
229
Микроэлектроды ионоселектив-
ные 141
Миобласты 88
— инициальные 44
Миодистрофии 167
— разновидности 168
Миодистрофия Дюшенна 168
Миозин 14. 176
- II 178
— мономерный 178
— “одноголовый” 201
— организация структурная 180
— свойства фрагментов 179
— строение 188, 190
— функции 208
Миокард 85
Миопатии вторично-мышечные
168, 173
— идиопатические см. Миопа-
тии первично-мышечные
— нейрогенные см. Миопатии
вторично-мышечные
— первично-мышечные 167
Миосателлиты 42
Миотом 41
— генерализованная рецессив-
ная Беккера 171, 172
— нарушение ионной проводи-
мости мембран 172
— парадоксальная 170
— Томсена 170, 172
— Эйленбурга 173
Миотубулы 44
Миофибриллы И
Миофибробласты 117
Миофиламенты 14
— кардиомиоцитов 77
Миоцитолиз коагуляционный
96
Миоциты, гипертрофия при ги-
побарической гипоксии 100
— желудочков 74
--Т-каналы 79
— предсердий 80
— проводящей системы сердца
82
— сердечные 73
--проводящей системы 74
— смерть атоническая 95
Митохондрии 23
— субпопуляции в кардиомио-
цитах 77
Мускулатура висцеральная 9
— соматическая 9
— гладкая висцеральная беспо-
звоночных 135
------позвоночных 134
---классификация 120
---мезодермальная 117
---мионейральная 117
— поперечнополосатая, стро-
ение 13
— сердечная, строение у оболо-
чечников 103
— ракообразных высших 105
---низших 104
— кузнечиков 107
— моллюсков 107
— соматическая, атрофия 50
---гипертрофия 50
---дистрофия 50
--- некроз 50
— тоническая 28
Мышца человека, строение 1
Мышцы асинхронные 67
— медленные, деление по ха-
рактеру обмена 31
— микрофибриллярные 65
— ножные медленные 69
— тонические 24
---аппарат синаптический 35
— фазные 24
---аппарат субневральный 34
— фибриллярные 67
Насос кальциевый 143
Небулин 19, 207
Некроз колликвационный 96
— сердечной мышцы 95
Нексусы 79
Нифедипин 130
“Обхваты” 32
Окончания сенсорные вторич-
ные 39
Отложения гликогена 23
Перикард 85
Перимизий 11
Полимеризация актина 193, 106
Полость перикардиальная 88
230
Потенциал действия 140
— — в кардиомиоцитах 154
---генерация в гладкомышеч-
ных клетках 155
------скелетных мышечных
волокнах 153
— мембранный 152
---причины колебаний 153
— покоя, значения у разных
типов мышечных клеток и
волокон 152
— фибрилляций 175
Предшественники коммитиро-
ванные 42
Промиобласты 44
— постмитотические 44
Промиоциты сателлитные 45
Пузырьки синаптические 32
Пучок Гисса 82
— предсердно-желудочковый 82
Регенерация 46
— - физиологическая 47
Регуляция сокращения миози-
новая, типы 215
Рековерин 213
Ретикулум митохондриальный
23
— саркоплазматический 21
---в волокнах скелетных по-
звоночных 147
------клетках гладкомышеч-
ных 150
------миоцитах сердечных 148
— эндоплазматический грану-
лярный 81
Рецепторы дигидропиридино-
вые 162
— рианодиновые 146
---типы 160
---типа 1 (PuPj), структура
162
Рибосомы 21
Сарколемма 11
— кардиомиоцита 79
Саркомер 14
С-белок 19, 184
Сердце, закладка у человека 85
Симпласты 44
Синапс аксомышечный 31
“Синаптический отдел” 34
Синапсин 201
Синдром денервационный 174
----в скелетной мускулатуре
175
Система регуляции сокращения
мышц актиновая 221
Склеротом 41
Сомиты 40
Сопряжение фармакомеханичес-
кое 164
— электромеханическое 141
----в сердечных миоцитах 165
------скелетных мышечных
волокнах 160
Спазмы тонические периоди-
ческие скелетных мышц 170
Спектрин 79, 199
— неэритроцитарный, строение
111
Спланхнотом 121
Стреч-каналы 151
Стриомиогистогенез, стадии 42
Структуры лептомерные 77
а-Субъединица Na -канала 159
-Субъединица, строение 159
Терминали аксона 32
Ткань(и) гладкомышечная,
типы 118
— мышечная гладкая, измене-
ние в миоматозных узлах 133
--------при атеросклерозе 129
----_-----патологии родовой
деятельности 132
------развитие у человека 124
------регенерация 129
— -— строение 109, 66
----деление по физиологичес-
ким особенностям 9
----классификация генетичес-
кая 8
----позвоночник животных 10
--------классификация 9
----разновидности 136
----сердечная 73
------строение 46
----соматические (скелетные)
10
— — строение у земноводных 52
--------круглоротых и рыб 51
231
--------млекопитающих 53
--------пресмыкающихся 52
--------птиц 52
— — у вторичноротых 72
------гребневиков 55
----губок 53
----кишечнополостных 54
----моллюсков 60
----червей 55
----членистоногих 64
----целомические 7, 9
----нейродермалъные 9
----поперечнополосатая мио-
симпластическая 9
----сердечная 9
----гладкая 9
----пигментная 9
Тредмиллинг 194
Тропомиозин 14, 74, 115, 206,
221
Тропонин 14, 206
-С 211, 221
----модель строения 120, б
-I 221
-Т222
Тропомодулин 195
Титин 19
Ка+-Са2+-транспорг сопряжен-
ный 151
Т-система 21, 160
Т-СР-соединение 160
Узел предсердно-желудочковый
82
— синусно-предсердный 82
Утрофин 203
— структура доменная 114
Фасция 11
Ферменты гликолиза 207
Филамин 197, 223
— строение молекулы 109
Фодрин 201
Фосфофруктокиназа 207
Холинорецепторы внесинапти-
ческие 174
Центриоли 21
Цистерны терминальные 21
Цитоскелет кардиомиоциты 101
— лейомиоцитов 114
Эндокард 85, 88
Эндомизий 11
Энкефалининвертаза 81
Эпикард 85
Эпимизий 11
СОДЕРЖАНИЕ
Предисловие............................................. 5
Часть первая
Строение, развитие, сравнительная
и патологическая гистология мышечных тканей
Глава 1. Общая характеристика и классификация мышечных
тканей.................................................. 7
Глава 2. Соматические (скелетные) мышечные ткани..... 10
Общая характеристика соматической поперечнополосатой
(исчерченная, локомоторная, скелетная) мышечной ткани
позвоночных животных................................. 11
Ультраструктура поперечнополосатого мышечного волокна
и основные белки миофибрилл.......................... 14
Саркоплазматическая сеть и Т-система................ 21
Неспецифические органеллы мышечного волокна....... 21
Тоническая и фазная мышечные ткани позвоночных жи-
вотных ............................................. 23
Иннервация мышечных волокон....................... 31
Исчерченные мышечные ткани нелокомоторного аппа-
рата ............................................. 36
Интрафузальные мышечные волокна, или мышечные ве-
ретена............................................ 36
Дифференцировка мезодермы и ее производных...... 41
Гистогенез поперечнополосатой соматической мышечной
ткани (стриомиогистогенез)........................... 42
Регенерация и патологическая гистология поперечнополоса-
той мышечной ткани................................... 46
Элементы сравнительной гистологии скелетной поперечно-
полосатой мышечной ткани............................. 50
Скелетная поперечнополосатая мышечная ткань позвоноч-
ных животных........................................ 51
Круглоротые и рыбы............................... 51
Земноводные....................................... 52
Пресмыкающиеся.................................... 52
Птицы............................................. 52
Млекопитающие..................................... 53
Локомоторные мышцы беспозвоночных животных и низ-
ших хордовых........................................ 53
Низшие беспозвоночные............................. 53
Черви............................................. 55
Моллюски.......................................... 60
233
Членистоногие........................................ 64
Вторичноротые (иглокожие и низшие хордовые)...... 72
Глава 3. Сердечная (исчерченная) мышечная ткань....... 73
Рабочие кардиомиоциты.................................... 74
Развитие сердца н кардиомиогенез......................... 85
Регенерация и патологическая гистология сердечной мышеч-
ной ткани................................................ 92
Элементы сравнительной гистологии сердечной мышечной
ткани.................................................... ЮЗ
Кардиомиоциты птиц, рептилий и низших позвоночных жи-
вотных................................................ 103
Кардиомиоциты низших хордовых и беспозвоночных живот-
ных .................................................. 103
Глава 4. Гладкая (яеясчерченная, висцеральная) мышечная ткань 109
Гладкая мышечная ткань позвоночных животных.......... 109
Строение гладкой мышечной ткани и се классификация 109
Иннервация гладкой мышечной ткани и передача возбужде-
ния .................................................. 118
Развитие гладкой мышечной ткани (лейомиогистогенез)... 121
Регенерация и патологическая гистология гладкой мышечной
ткани................................................... 129
Элементы сравнительной гистологии гладкой мышечной ткани 134
Висцеральная мышечная ткань позвоночных животных... 134
Висцеральная мышечная ткань беспозвоночных животных 135
Рекомендуемая литература.......................... 137
Часть вторая
Физиология мышечных тканей
Глава 5. Клеточные механизмы запуска мышечного сокращения 140
Внутриклеточный метаболизм ионов Са2+ и методы его ана-
лиза ................................................... 141
Уровень ионизированного кальция в покое............... 141
Механизмы, поддерживающие низкий уровень [Са2+]вн в
покое............................................... 143
Повышение уровня [Са2*]^ при сокращении............... 145
Источники повышения содержания внутриклеточного каль-
ция в мышечных клетках и волокнах при сокращении... 146
Участие электрической активности мембраны в сокращении
мышечных клеток и волокон............................... 152
Особенности потенциала покоя мышечных клеток и воло-
кон .................................................. 152
Особенности генерации потенциала действия в разных типах
мышечных клеток и волокон............................. 153
Натриевые и кальциевые каналы мышечных клеток и воло-
кон ................................................. 157
Механизмы электромеханического сопряжения в разных типах
мышечных клеток и волокон............................... 160
Рекомендуемая литература......................... 166
234
Глава 6. Патофизиология скелетной мускулатуры......... 167
Первично-мышечиыс миопатии.......................... 168
Миодистрофии....................................... 168
Вторично-мышечные (нейрогенные) миопатии............ 173
Рекомендуемая литература....................... 175
Часть третья
Основы биохимии мышечных тканей
Глава 7. Сократительный аппарат мышц....... .......... 176
Структурная организация сократительного аппарата попереч-
нополосатых мышц.................................... 176
Структура и свойства миозина........................ 178
Структура и свойства актина......................... 190
Актинсвязывающие белки.............................. 194
Гл а ва 8. Регуляция взаимодействия актина и миозина на уровне
сократительного аппарата.............................. 209
Рекомендуемая литература....................... 227
Предметный указатель........................... 228
Учебное пособие
МЫШЕЧНЫЕ ТКАНИ
Зав. редакцией ТЛ.Осокина
Научный редактор Ю.С.Ченцов
Редактор издательства М.Г.Фомина
Художественный редактор СЛАндреее
Технический редактор Н.В. Сорокина
Корректор Л.Г. Воронина
ЛР № 010215 от 29.04.97. Сдано в на-
бор 30.03.2001. Подписано к печати
13.06.2001. Формат бумаги 60х90’Лб.
Бумага офс. № 1. Гарнитура Таймс.
Печать офсетная. Усл.печ.л. 16,0.
Усл. кр.-отт. 19,0. Уч.-издл. 15,87.
Тираж 3000 экз. Заказ № 0104690.
Ордена Трудового Красного Знамени
издательство “Медицина”. 101990,
Москва, Петроверигский пер., 6/8.
Отпечатано в полном соответствии с качеством
предоставленного оригинал-макета
в ОАО «Ярославский полиграфкомбииат»
150049, Ярославль, ул. Свободы, 97.
игла
ВНИМАНИЮ СТУДЕНТОВ!
Издательство “Медицина”
уделяет много внимания изданию
учебной литературы.
В каждом издании
находят отражение:
• новейшие достижения медицин-
ской науки;
• исчерпывающая информация по
изучаемой проблеме;
• опыт работы отечественных и
зарубежных специалистов;
• новые методы лечения и профи-
лактики болезней;
• новейшие эффективные препа-
раты.
Предлагаем Вашему вниманию
следующие учебники
Северин Е.С., Алейникова Т.Л., Осипов Е.В. Биохимия:
Учебник для студентов медицинских вузов.
Руководство к практическим занятиям по биохимии / Под
ред. Е.С.Северина: Для студентов медицинских вузов.
Биохимические основы патологических процессов / Под
ред. Е.С.Северина: Учебное пособие для студентов меди-
цинских вузов, аспирантов.
Гистология / Ю.И.Афанасьев, Н.А.Юрина, Е.Ф.Котов-
ский и др.; Под ред. Ю.И.Афанасьева, Н.А.Юриной. —
5-е изд., перераб. и доп.: Учебник для студентов меди-
цинских вузов.
На современном уровне изложены основы гистоло-
гии, цитологии и эмбриологии. Приведены новые
сведения о строении клетки и ее производных, стро-
ении, функциях тканей и органов в возрастном ас-
пекте.
Пальцев М.А., Аничков Н.М. Патологическая анатомия.
В 2-х томах: Учебник для студентов медицинских вузов.
В 1-м томе дано описание общепатологических про-
цессов: повреждения, воспаление, опухоли и т.д., а
также генетическая патология и патология воздейст-
вий окружающей среды. В обоих томах приведены
патоморфологические данные, сведения по гистоло-
гии и цитологии, биохимии, иммунологии, генетике,
патологической физиологии, клиническим и клини-
ко-лабораторным дисциплинам. Отражены новей-
шие данные, полученные благодаря применению со-
временных методов морфологического исследова-
ния, включая молекулярно-биологические.
Дедов И.И., Мельниченко Г. А, Фадеев В.В. Эндокрино-
логия: Учебник для студентов медицинских вузов, клини-
ческих ординаторов и интернов, эндокринологов и вра-
чей других специальностей.
Излагаются основы клинической эндокринологии,
анатомии, гистология и физиология эндокринных
желез. Рассмотрены различные методы исследова-
ния, применяемые при диагностике эндокринопа-
тий.
Детские болезни / Под ред. А.А.Баранова, Г.А.Лыскиной:
Учебник для студентов факультета высшего сестринского
образования.
Представлено описание основных заболеваний детей
разного возраста: болезней внутренних органов, ин-
фекционных болезней, неотложных состояний и др.
Руководство к лабораторным занятиям по фармацевтичес-
кой химии / Аксенова Э.Н., Андрианова О.П., Арзамасцев
АП. и др.; Под ред. А.П.Арзамасцева: Учебное пособие
для студентов фармацевтических факультетов медицин-
ских учебных заведений, преподавателей фармацевтичес-
кой химии.
Городкова Ю.И. Элементы латинского языка и основ ме-
дицинской терминологии. — 2-е изд., доп.: Учебник для
учащихся медицинских и фармацевтических училищ и
колледжей.
Представлены элементы латинского языка н основ
медицинской терминологии (анатомической, клини-
ческой и фармацевтической). Весь учебный матери-
ал изложен дифференцированно с учетом профиля
медицинских училищ. Рецептура приведена с учетом
применения ее в сестринской и фельдшерской прак-
тике.
Крупнейшее издательство медицинской литературы!
«Медицина»
Основано в 1918 году
38 научно-практических специализированных медицинских
журналов
официальный переводчик на русский язык литературы
Всемирной Организации Здравоохранения
150 книг ежегодно: учебники, руководства д ля врачей,
монографии ведущих отечественных и зарубежных авторов
многолетние связи с крупнейшими медицинскими центрами,
учебными заведениями, больницами и врачами России
— — наши издания — оперативная и надежная информация о новом
в медицине
АДРЕСА И ТЕЛЕФОНЫ ДЛЯ СПРАВОК
Продажа книг издательства без торговой наценки
для индивидуальных покупателей:
Петроверигский пер., 6/8,4 этаж, к. 478 (м. Китай-город)
Телефон: 924 7164. время работы: 9.30 - 17.00; обед: 13.00 - 14-ОС
для оптовых покупателей:
Лазоревый проезд., 3 (м. Ботанический сад)
Телефон: 189 76 85. Время работы: 9.00 - 17.30; обед: 12.30 - 13.3*
По вопросам размещения рекламы в изданиях издательства
«Медицина» обращаться по телефонам:
923 5140 (телефон);
923 20 74 (телефон/факс);
928 06 93 (телефон/факс)