Автор: Красильникова Л.А. Авксентьева О.А. Жмурко В.В. Садовниченко К.П.
Теги: ботаника химия биохимия молекулярная химия биохимия растений строение растений
ISBN: 966-670-203-7
Год: 2004
Л.А. Красильникова,
О.А. Авксентьева
В.В. Жмурко
К).А. Садовничепко
БИОХИМИЯ
РАСТЕНИЙ
ВЫСШЕЕ
ОБРАЗОВАНИЕ
Серия «Учебныепособия»
Л. А. Красильникова,
О. А. Авксентьева,
В. В. Жмурко,
Ю. А. Садовниченко
БИОХИМИЯ РАСТЕНИЙ
Под ред. к. б. н. Л. А. Красильниковой
Ростов-на-Дону, «Феникс»
Харьков, «Торсине»
2004
ББК 28.57
К 78
Книга издана при поддержке
Украинского Литературного агентства
тел. 10 380 572 174-906
www.bookagency.com.ua
Рецензенты:
ведущий научный сотрудник отдела генетикн и физиологии
растений Института растениеводства УААН,
д. б. и., профессор!В. С. Цибулько\;
доцент кафедры общей химии Харьковского национального
аграрного университета имени В. В. Докучаева,
к. б. и. Ю. Е. Колупаев
Учебное издание
Красильникова Лариса Алексеевна
Авксентьева Ольга Александровна
Жмурко Василий Васильевич
Садовниченко Юрий Александрович
БИОХИМИЯ РАСТЕНИЙ
Редактор Л. А. Седыкина
Корректор И. В. Подкопай
Компьютерная верстка Н. П. Червова
Подписано в печать 15.10.2003. Формат 84x108 '/зг.
Бумага газетная. Гарнитура Школьная.
Тираж 5000 экз. Зак. № 1464.
Издательство «ФЕНИКС»
344082, г. Ростов-на-Дону, пер. Халтуринский, 80
Отпечатано с готовых диапозитивов в ФГУИПП «Курск»
305007, г. Курск, ул. Энгельса, 109
Красильникова Л. А., Авксентьева О. А., Жмур-
ко В. В., Садовниченко Ю. А.
Биохимия растений / Под ред. к. б. н. Л. А. Кра-
сильниковой. — Ростов н/Д: «Феникс», Харьков:
Торсинг, 2004. — 224 с. Серия «Учебные пособия»
В пособии даны современные представления о свойствах и обмене основ-
ных групп растительных веществ, об их содержании, распространении в растени-
ях и практическом нспользоваиии. Рассматриваются углеводы, белки, липиды
растений, а также вещества вторичного происхождения (органические кислоты
алифатического ряда, фенольные соединения, гликозиды, терпены и терпенои-
ды, алкалоиды).
Пособие предназначено для студентов биологических специальностей, пре-
подавателей биологии.
ББК 28.57
ISBN 966-670-203-7
ISBN 5-222-03940-4
© Красильникова Л. А., Авксентьева О. А.,
Жмурко В. В., Садовниченко Ю. А., 2004
© «Торсинг», 2004
©Оформление «Феникс», 2004
Введение
Биохимия растений изучает химический состав
растительных организмов и химические процессы,
лежащие в основе их жизнедеятельности.
Биохимия растений и биохимия животных ос-
новываются на общих принципах, которые опре-
деляются общими свойствами живых организмов.
Действительно, у растений и животных много сход-
ного: химический состав большинства клеточных
структур, состав многих макромолекул, основные
метаболические пути, многие ферменты и т. д. Все
это свидетельствует о единстве органического мира.
В то же время биохимия растений имеет свои осо-
бенности, связанные с особенностями раститель-
ных организмов.
Основная особенность растений, отличающая их
от животных и других живых организмов, — их
автотрофность. Растения способны усваивать сол-
нечную энергию и осуществлять первичный син-
тез органических соединений из СО2, Н2О и других
минеральных веществ. Это накладывает отпечаток
на биохимию растений: она изучает химические
реакции фотосинтеза и минерального питания.
Однако влияние автотрофного способа питания
этим не ограничивается. Фотосинтез накладывает
отпечаток на строение и многие процессы жизне-
деятельности растений, что находит отражение
в биохимии растений.
Рассмотрим некоторые особенности растений,
определяемые автотрофностью, и их связи с био-
химией.
1. Растения имеют высокое отношение площа-
ди поверхности тела к его объему, что продикто-
вано необходимостью поглощения света листьями
и воды и минеральных веществ корнями. Такую
4
Введение
большую и разветвленную поверхность необходи-
мо поддерживать и укреплять. Для этого у расте-
ний имеются опорные (механические) ткани. Проч-
ность и твердость им придает специальное веще-
ство — лигнин, которое пропитывает клеточные
стенки. Лигнин, его строение и образование изу-
чает биохимия растений.
2. Для растений характерен неограниченный
рост, что дает им возможность все время увеличи-
вать поверхность тела и занимать все новые и но-
вые площади воздушного и корневого питания.
А это значит, что в растениях постоянно функцио-
нируют образовательные ткани с активным мета-
болизмом, что, в свою очередь, отражается на хи-
мизме и жизнедеятельности всего организма.
3. Растения не способны к активному передви-
жению. Они ведут неподвижный образ жизни. Ис-
ключение составляют лишь некоторые водорос-
ли, имеющие жгутики. При неподвижности расте-
ний им необходима защита от неблагоприятных
условий окружающей среды. К защитным приспо-
соблениям относятся прочная клеточная оболоч-
ка, покровные ткани, вещества, отпугивающие
вредителей и т. д. Химическая часть этих приспо-
соблений является объектом изучения раститель-
ной биохимии.
4. Благодаря процессу фотосинтеза у растений,
в отличие от животных, ассимиляция преобладает
над диссимиляцией. Результатом этого является,
во-первых, накопление растениями запасных ве-
ществ (углеводов, белков, липидов), во-вторых,
способность растений синтезировать большое раз-
нообразие соединений (гликозиды, алкалоиды,
фенольные соединения, эфирные масла, смолы и
др.). Все эти вещества и их метаболизм изучает
биохимия растений.
Введение
5
5. Растения очень экономно расходуют вещества
и энергию. В отличие от животных, они не выде-
ляют продуктов распада. Выделяемый ими угле-
кислый газ вновь используется в процессе фото-
синтеза. Правда, растения имеют выделительные
ткани (а не выделительную систему), но они боль-
ше похожи на запасающие или секреторные тка-
ни. Если растения выделяют наружу какие-либо
вещества, то это связано главным образом с при-
влечением насекомых-опылителей, с распростра-
нением семян или защитой от вредителей. Эти осо-
бенности метаболизма растений также отражают-
ся на изучающей их биохимии.
Поначалу в своем развитии биохимия растений
доставала от биохимии животных. Очевидно, это
Можно объяснить тем, что она была связана с сель-
ским хозяйством, в то время как биохимию жи-
вотных связывали, в первую очередь, со здоровьем
человека. Кроме того, исследования растений ока-
зались более трудоемкими и сложными. Растения
труднее подвергались измельчению из-за прочнос-
ти клеточных оболочек. Гомогенизация раститель-
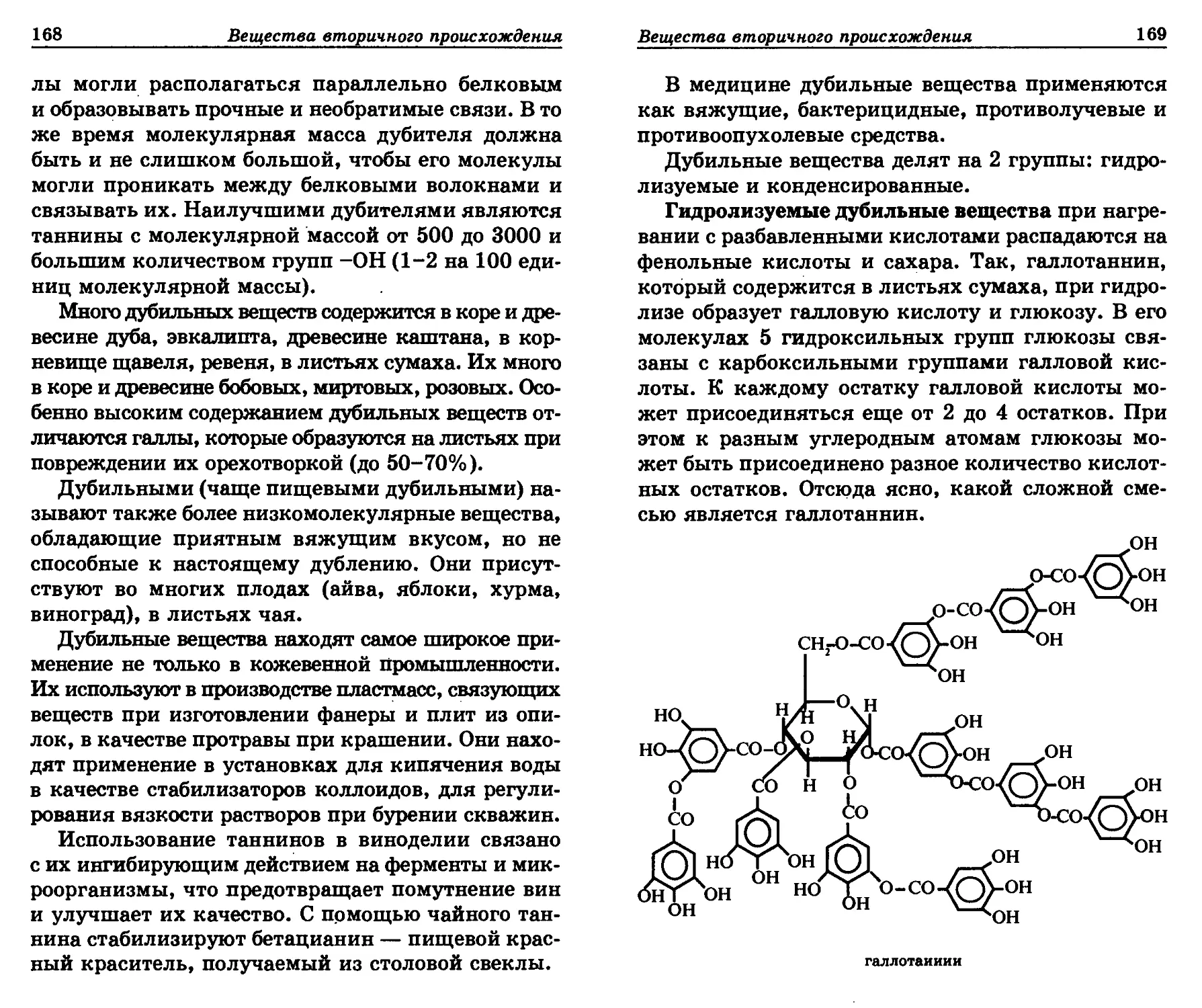
ных тканей приводила к разрушению вакуолей,
клеточный сок которых содержит вещества, инги-
бирующие активность ферментов и даже денату-
рирующие белки. Все это требовало разработки
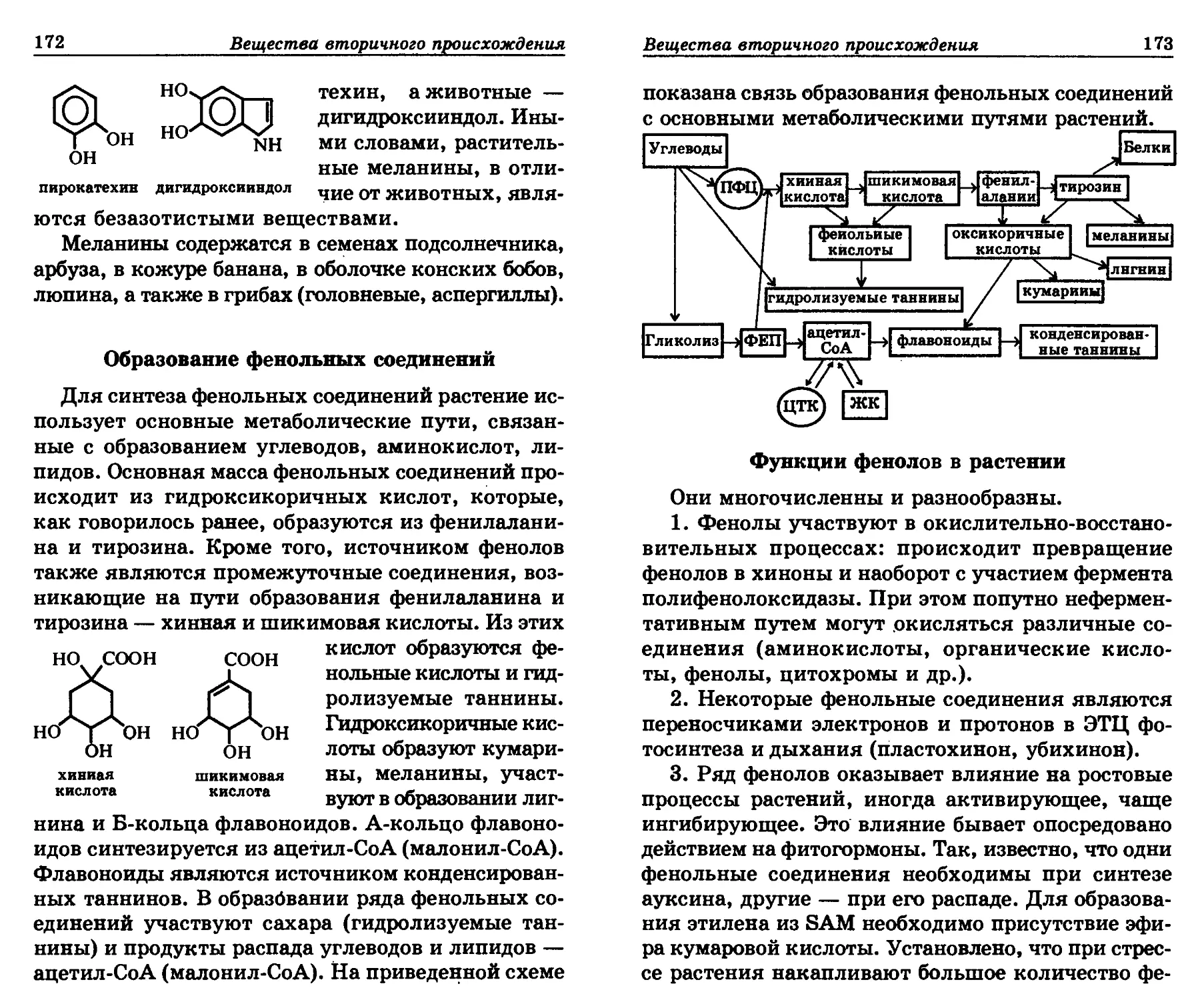
методов разрушения растительных тканей, связы-
вания ингибирующих веществ, дополнительной
очистки препаратов и т. д.
Бурное развитие биохимии растений началось
несколько десятилетий назад, когда пришло пони-
мание ее действительного значения. Оказалось, что
эта наука, как и биохимия животных, прежде все-
го, связана со здоровьем человека: составом и ка-
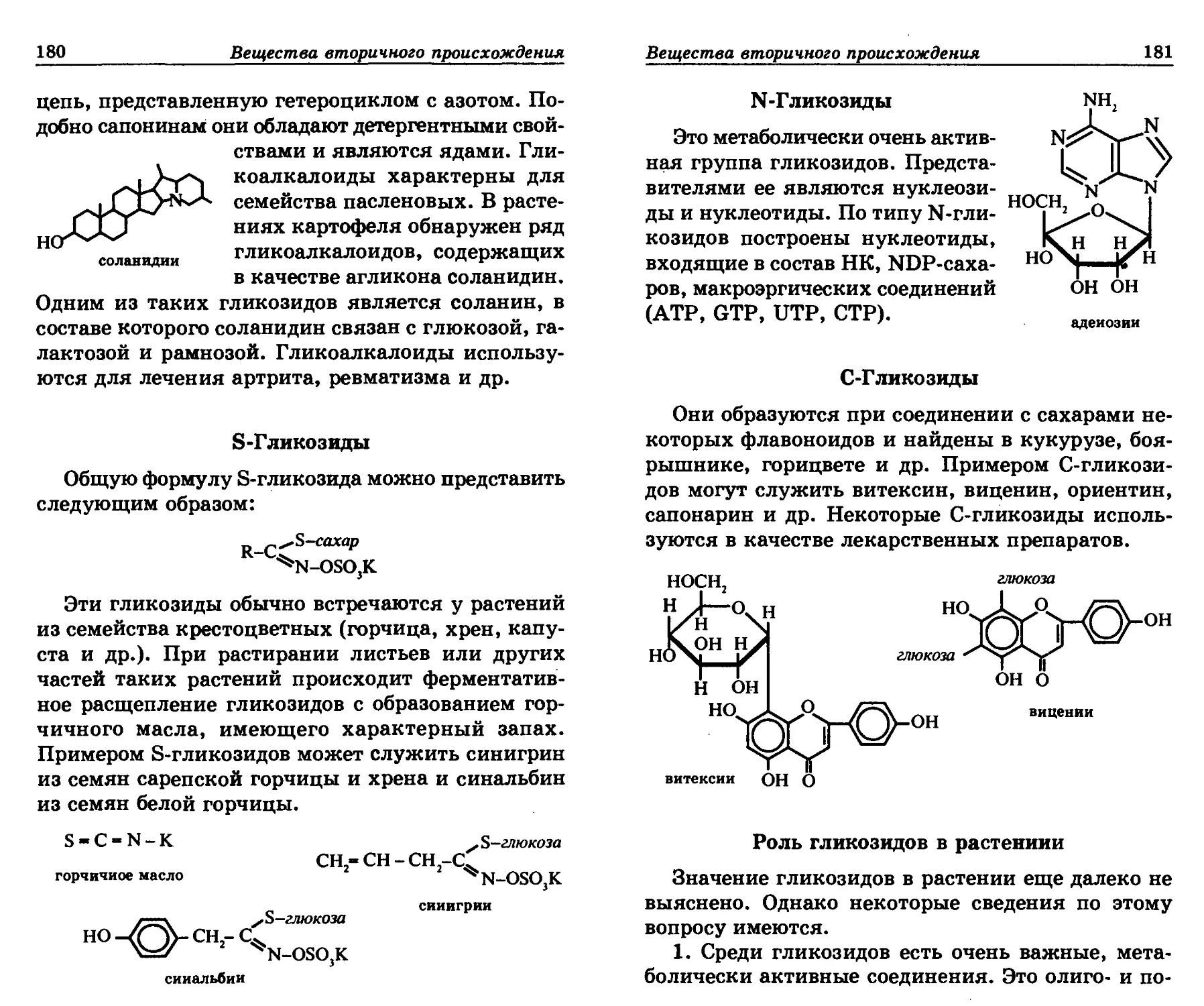
чеством нашей пищи, большим количеством ле-
карственных препаратов, созданных на основе ра-
6
Введение
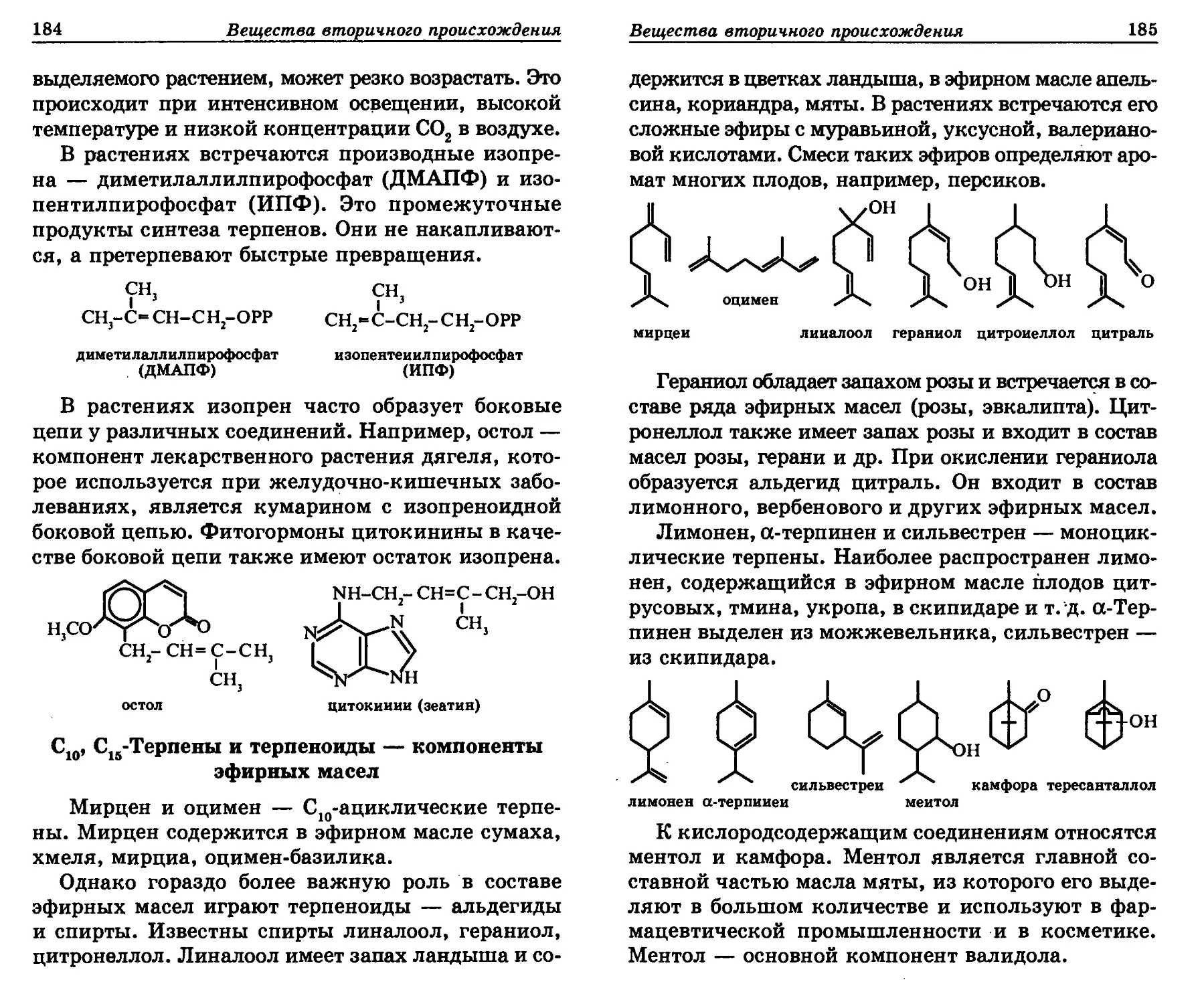
стительных веществ, использованием их в косме-
тике и парфюмерии. Поэтому усовершенствованы
и продолжают совершенствоваться методы биохи-
мических исследований растений.
Биохимия растений связана с другими наука-
ми, изучающими растительные организмы. Связь
ее с физиологией растений самая тесная и заключа-
ется в том, что все физиологические функции име-
ют биохимическую основу. В анатомии растений
необходимо знание химического состава и функций
анатомических структур. Биохимия нужна для изу-
чения генетики растений, поскольку многие свой-
ства генома изучают по проявлению биохимических
функций. Кроме того, ряд белков используется в
качестве маркеров отдельных генов. Знания в обла-
сти биохимии помогают в экологии растений изу-
чить и понять приспособления растительных орга-
низмов к условиям окружающей среды.
В систематике существует целое направление —
хемотаксономия, в которой используются в каче-
стве таксономических признаков не только морфо-
логические и анатомические, но и биохимические
(состав восков, алкалоидов, эфирных масел и др.).
Практическое использование биохимии растений
очень широкое: сельское хозяйство — растение-
водство и селекция, пищевая, фармацевтическая,
парфюмерная промышленность. Биохимия нужна
во всех отраслях промышленности, где идет пере-
работка растительного сырья (целлюлозно-бумаж-
ной, деревообрабатывающей, текстильной, хими-
ческой и др.).
Предлагаемое учебное пособие не претендует на
охват всех аспектов биохимии растений. В нем
приводятся сведения об особенностях строения,
основных химических свойствах, метаболизме уг-
леводов, белков, липидов, веществ вторичного про-
Введение
7
исхож дения, путях использования их в промыш-
ленности, фармации, медицине, сельском хозяй-
стве, о влиянии их на здоровье человека.
В пособии не повторяется материал курса об-
щей биохимии. Поэтому в соответствующих разде-
лах читатель отсылается к материалам курса об-
щей биохимии. Вместе с тем, в пособии, там, где
это необходимо, подчеркивается общность биохи-
мических процессов растений и животных. Это, по
мнению составителей, способствует углублению
представлений студентов о единстве органическо-
го мира.
Мы надеемся, что пособие поможет студентам
глубже усвоить отнюдь не простые сведения о био-
химических процессах растений и расширить зна-
ния в области биологической химии в целом.
1. Углеводы
1.1 ОБЩАЯ ХАРАКТЕРИСТИКА И ФУНКЦИИ
Углеводы — важный класс природных органи-
ческих соединений. Особенно высоким содержа-
нием углеводов отличаются растительные организ-
мы (до 85-90% от массы растения). Углеводы в
большом количестве накапливаются в запасающих
органах (семена, клубни, корни), оболочки рас-
тительных клеток целиком состоят из углеводов.
Ученые подсчитали, что в природе углеводов боль-
ше, чем всех других органических соединений,
вместе взятых.
Функции углеводов в растении важны и разно-
образны.
1. Энергетическая. Углеводы — главные про-
дукты фотосинтеза, в химических связях которых
запасается солнечная энергия. Эта энергия извле-
кается растениями при дыхании и используется
в процессах их жизнедеятельности.
2. Пластическая. В процессе дыхания из универ-
сального химического соединения — глюкозы обра-
зуются разнообразные метаболиты (углеродные ске-
леты), необходимые для синтеза разнообразных орга-
нических соединений живой клетки.
3. Опорная (структурная). Клеточные оболочки
состоят из углеводов. Они служат опорой как от-
дельным клеткам, так и растению в целом.
4. Запасная. Углеводы (крахмал, сахара, ину-
лин, гемицеллюлозы) — важнейшие запасные
Углеводы
9
вещества растений. Они накапливаются в семе-
нах, плодах, корнях, клубнях, корневищах и ис-
пользуются при прорастании семян, распуска-
нии листьев и т. д.
5. Осмотическая. Сахара, растворенные в кле-
точном соке, участвуют в создании его концентра-
ции, а, значит, и осмотических свойств раститель-
ной клетки.
в. Регуляторная. Например, связывание с саха-
рами снижает активность фитогормонов, регулиру-
ющих процессы жизнедеятельности растений.
7. Сигнальная. Полагают, например, что неко-
торые белки гликопротеины (лектины), в состав
молекул которых входят мойо- и олигосахара, вы-
полняют функцию узнавания патогена, проника-
ющего в клетку.
8. Защитная функция углеводов, например,
проявляется при стрессе. Растворимые сахара
связывают воду, удерживая ее в клетке, связы-
ваются с белками и нуклеиновыми кислотами,
стабилизируя их молекулы в неблагоприятных
условиях.
Термин «углеводы» ввел в 1844 году профессор
Юрьевского университета Карл Шмидт. В то время
считали, что все соединения этого класса состоят
из углерода, водорода и кислорода и что водород и
кислород в их молекулах содержатся в том же соот-
ношении, что и в воде, т. е. 2:1. Позднее выяснили,
что, действительно, такое соотношение водорода и
кислорода характерно для большинства углеводов.
Например, глюкоза — СвНХ2Ов, сахароза — C^H^Ojj.
Однако, оказалось, что существует целый ряд со-
единений, которые по своим свойствам относятся к
углеводам, но имеют иное соотношение водорода и
кислорода. Например, рамноза — СвНХ2О5, дезокси-
рибоза — свнХ0о4.
10
Углеводы
В 1927 году Международная комиссия по ре-
форме химической номенклатуры предложила за-
менить название «углеводы» термином «глюциды»
(или «глициды»), который подчеркивал первосте-
пенное значение глюкозы в образовании многих
биологически важных углеводов. Однако этот тер-
мин не получил распространения, и прежний тер-
мин «углеводы» сохраняется в науке как название
данного класса соединений.
Позже были обнаружены углеводы, в состав
которых, кроме углерода, водорода и кислорода,
входит также азот. Например, глюкозамин, га-
лактозамин.
1.2 КЛАССИФИКАЦИЯ
Все углеводы делят на 2 группы: моносахариды
и полисахариды. Последние, в свою очередь, так-
же делят на две группы: олигосахариды и высшие
полисахариды. Иногда в биохимии растений оли-
госахариды называют полисахаридами 1-го поряд-
ка, а высшие полисахариды — 2-го порядка.
Моносахариды — это простые сахара, молеку-
лы которых нельзя гидролизовать до еще более
простых сахаров. Моносахариды (монозы), соеди-
Углеводы
11
няясь друг с другом, образуют более сложные уг-
леводы — полисахариды (полиозы). Олигосахари-
ды содержат в молекуле от двух до десяти остат-
ков моносахаридов, высшие полисахариды де-
сятки, сотни и тысячи остатков.
Моносахариды и олигосахариды обычно раство-
римы в воде и имеют более или менее сладкий
вкус. Их объединяют в одну группу — сахара. На
этом свойстве основана еще одна классификация
углеводов.
К моносахаридам относятся глюкоза, фруктоза,
ксилоза, рибоза и др., к олигосахаридам — саха-
роза, мальтоза, трегалоза, рафиноза и др.
Высшие полисахариды — высокомолекулярные
соединения. Обычно они нерастворимы в воде или
образуют коллоидные растворы. Это крахмал, ину-
лин, целлюлоза, лихенин и др.
1.3 МОНОСАХАРИДЫ
Структура молекул
Моносахариды — соединения, которые содер-
жат одновременно гидроксильные группы (-ОН)
и альдегидную ( ~ сСц ) или кетонную (=С=О)
12
Углеводы
группу. Первые называют альдозами, вторые — ке-
тозами.
Моносахариды образуются в результате окисле-
ния многоатомных спиртов. При окислении пер-
вичной спиртовой группы (~СН2ОН) образуются
альдозы, а при окислении вторичной спиртовой
группы (-СНОН) — кетозы. Образование простей-
ших моносахаридов — триоз (глицеринового аль-
дегида и диоксиацетона) можно рассмотреть на при-
мере окисления (дегидрирования) трехатомного
спирта глицерина.
При окислении шестиатомного спирта сорбита,
содержащегося во многих плодах, получаются гек-
созы — глюкоза или фруктоза.
С
I
-*Н
н*сон
но*сн
Н*СОН
диоксиацетон
СН2ОН
Н^ОН
I
носн
н*6он
£н2он
глюкоза
неон сн2он
НСОН (1_о
^Н1°Н но*сн
сорбит |
н*сон
Н*Ь)Н
* — отмечены асимметрические I
атомы углерода СН2ОН
фруктоза
В названиях альдоз используется суффикс «оза»
(глюкоза, галактоза, рибоза, ксилоза), а в названи-
Углеводы
13
ях кетоз — суффикс «улоза» (рибулоза, ксилуло-
за, седогептулоза).
Большой вклад в изучение строения и превра-
щений углеводов, особенно моносахаридов, внес
великий немецкий ученый-химик Эмиль Фишер.
Линейные формулы моносахаридов также предло-
жил он.
Глюкоза, фруктоза и другие моносахариды содер-
жат асимметрические атомы углерода, у которых все
4 валентности замещены различными атомами и
группами. Это определяет их оптическую активность,
т. е. способность в растворе вращать плоскость поля-
ризации вправо (+) или влево (-), а также наличие
стереоизомеров, которые различаются по своим фи-
зическим и химическим свойствам.
Количество стереоизомеров данного моносахари-
да равно 2“, где п — число асимметрических ато-
мов углерода в молекуле. Глюкоза имеет 4 асим-
метрических атома и 24=16 стереоизомеров, а фрук-
тоза — 3 асимметрических атома и 23 = 8 стерео-
изомеров.
Среди стереоизомеров моносахаридов особенно
известны D и L, или, как часто говорят, моносаха-
риды могут иметь D- и L-конфигурацию. При оп-
ределении конфигурации того или иного моноса-
харида в качестве стандарта используют глицери-
новый альдегид, который содержит только один
асимметрический атом углерода, а значит, только
одну пару стереоизомеров — D и L.
pH
Н-*С- ОН
Ан2он
D(+) — глицериновый
альдегид
Ц-) — глицериновый
- альдегид
14
Углеводы
Глицериновый альдегид может существовать
в трех формах: в виде право- и левовращающих D-
и L-стереоизомеров и в виде смеси их равных ко-
личеств. Такая смесь называется рацемической, она
лишена оптической активности.
Моносахариды, у которых расположение -Н
и -ОН у ближайшего к первичной спиртовой груп-
пе углеродного атома такое же, как у D-глицери-
нового альдегида, имеют D-конфигурацию, а те, у
которых -Н и -ОН у того же углеродного атома
расположены, как у L-глицеринового альдегида,
относят к L-стереоизомерам.
Иначе говоря, для установления конфигурации
данного моносахарида определяют расположение
-Н и -ОН у ассиметрического атома углерода,
наиболее удаленного от групп =С=О или — .
Обычно этот углеродный атом ближайший к пер-
вичной спиртовой группе. Если углеродная цепоч-
ка сахара изображена сверху вниз и карбонильная
группа расположена вверху, то у D-стереоизоме-
ров группа -ОН у последнего ассиметрического
атома находится справа, а у L-стереоизомеров —
слева.
у-н
н*сон
I
но*сн
I
н*сон
н*сон
СН2ОН
D-глюкоза
Н
н*(!:он
I
но*сн
НО*(^Н
Ан2он
L-глюкоза
D- и L-стереоизомеры относятся друг к другу,
как предмет и его зеркальное изображение. Поэто-
Углеводы
15
му у L-глюкозы -Н и -ОН у всех асимметричес-
ких углеродных атомов имеют противоположное
D-глюкозе расположение, а место группы -ОН у 5-
го углеродного атома служит лишь признаком для
классификации стереоизомеров.
В растениях содержатся и растениями усваива-
ются в основном D-формы сахаров. L-формы встре-
чаются очень редко. Поэтому далее мы будем обо-
значать только L-формы, имея в виду, что все ос-
тальные моносахариды имеют D-конфигурацию.
На первых этапах изучения моносахаридов из-
вестные их свойства хорошо объяснялись форму-
лами Фишера. Позднее обнаружились новые свой-
ства сахаров, которые уже нельзя было объяснить
этими формулами. Например, было показано, что
моносахариды не всегда проявляют альдегидные
свойства (не дают реакции с фуксинсернистой кис-
лотой, не образуют бисульфитного соединения с
NaHSO3). При растворении моносахаридов наблю-
далось изменение удельного вращения, которое
лишь через некоторое время достигало постоянной
величины. Это явление назвали мутаротацией.
Кроме того, оказалось, что один из гидроксилов
молекулы моносахарида отличается более высокой
реакционной способностью.
Для объяснения этих и ряда других свойств
московский профессор-химик М. А. Колли в 1870 г.
выдвинул гипотезу, согласно которой моносахари-
ды существуют не только в альдо- и кето-, но и в
циклической форме. Это предположение подтвер-
дил и развил немецкий химик Б. Толленс в 1883 г.
По его гипотезе, моносахариды существуют не толь-
ко в форме альдо- и кетоспиртов, но и в виде цик-
лических полуацеталей. Полуацетали образуются
в результате реакции альдегидов со спиртами.
16
Углеводы
R.-C
'•'Н
+ r2— он
спирт
.он
----> R,—С—О —Rj
''н
полуацеталь
Подобная реакция между альдо- или кето-
группой и гидроксилом спиртовой группы мо-
жет происходить и внутри молекулы моносаха-
рида, в результате чего образуются циклические
полуацетали.
I----
н—*с—он
н*сон
I
но*сн
I
н*сон
н4>----
<Ьн2он
н*сон
I
но*сн
н*сон
н*сон
сн2он
I----
НО-*С-Н
H*ioH
I
но*сн
I
н*сон
н*с----
СН2ОН
о
а-глюкоза глюкоза
(а-глюкопираноза)
6-глюкоза
(Р-глюкопираноза)
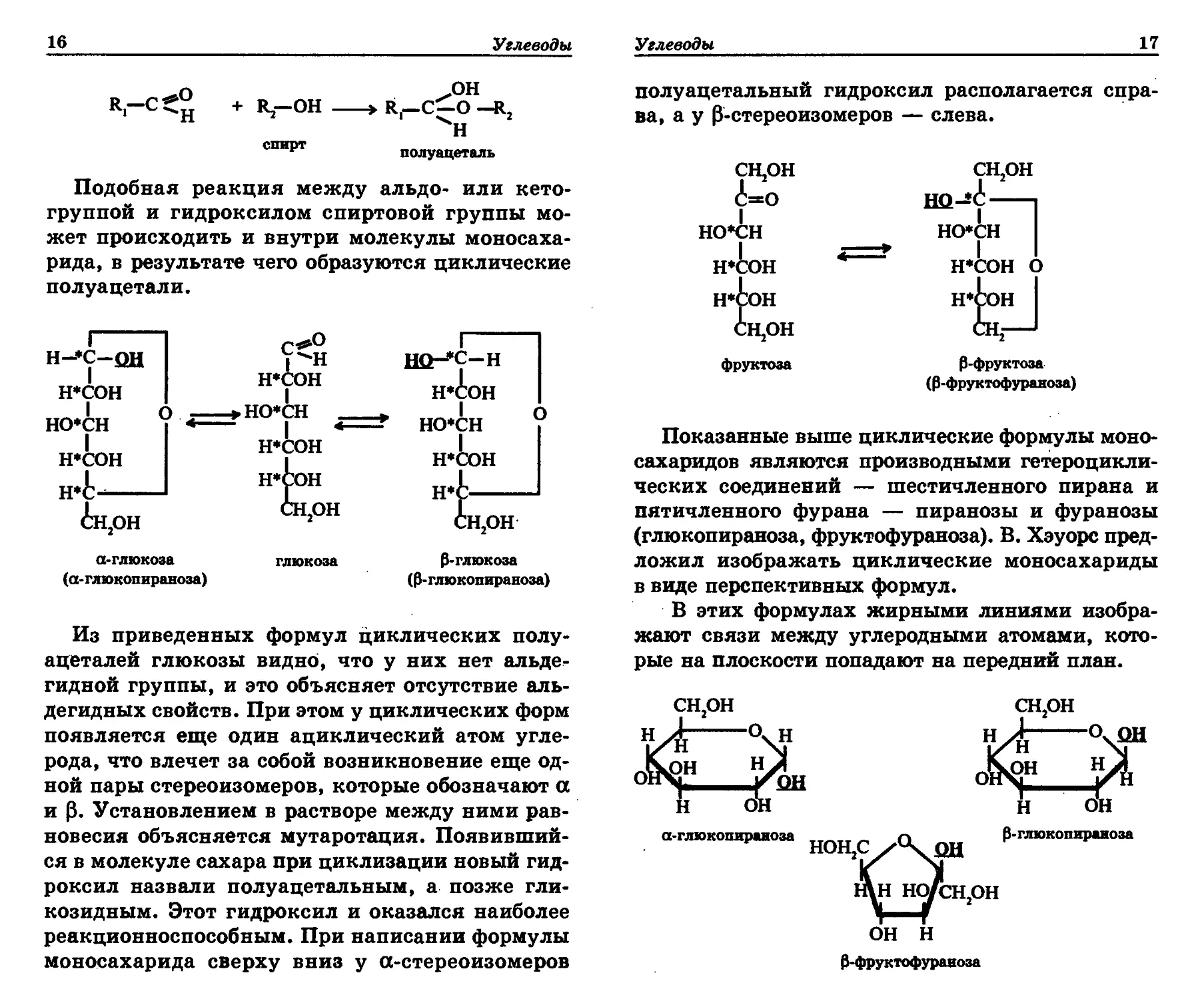
Из приведенных формул циклических полу-
ацеталей глюкозы видно, что у них нет альде-
гидной группы, и это объясняет отсутствие аль-
дегидных свойств. При этом у циклических форм
появляется еще один ациклический атом угле-
рода, что влечет за собой возникновение еще од-
ной пары стереоизомеров, которые обозначают а
и р. Установлением в растворе между ними рав-
новесия объясняется мутаротация. Появивший-
ся в молекуле сахара при циклизации новый гид-
роксил назвали полуацетальным, а позже гли-
козидным. Этот гидроксил и оказался наиболее
реакционноспособным. При написании формулы
моносахарида сверху вниз у а-стереоизомеров
Углеводы
17
полуацетальный гидроксил располагается спра-
ва, а у 0-стереоизомеров — слева.
СН,ОН
(*:=О
I
но*сн
н*сон
н*сон
снрн
фруктоза
СН2ОН
HQ—-------
НО*СН
I
н*сон о
н*£он
Р-фруктоза
(Р-фруктофураноза)
Показанные выше циклические формулы моно-
сахаридов являются производными гетероцикли-
ческих соединений — шестичленного пирана и
пятичленного фурана — пиранозы и фуранозы
(глюкопираноза, фруктофураноза). В. Хэуорс пред-
ложил изображать циклические моносахариды
в виде перспективных формул.
В этих формулах жирными линиями изобра-
жают связи между углеродными атомами, кото-
рые на плоскости попадают на передний план.
ОН Н
Р-фруктофураноза
18
Углеводы
Атомы углерода в кольце перспективных фор-
мул обычно не пишут, а- и (3-формы различаются
по положению -ОН (полуацетального гидроксила)
по отношению к плоскости кольца. У а-стереоизо-
меров -ОН располагается под плоскостью кольца,
а у (3-изомеров — над плоскостью.
В живых организмах молекулы моносахари-
дов всегда находятся в циклической форме, в та-
ком же виде остатки сахаров входят в состав по-
лисахаридов. В твердом состоянии сахара также
имеют циклическое строение. Только в растворе
появляются, кроме циклических, еще и нецик-
лические формы молекул. При этом последних
в растворе мало, до 1%.
В природе среди циклических форм сахаров в ос-
новном имеются пиранозы, фураноз очень мало
(фруктоза, рибоза).
Химические свойства
Моносахариды легко окисляются с образовани-
ем кислот. Причем окисление может происходить
как в кислой, так и в щелочной среде. У сахаров
легче всего окисляется альдегидная группа.
ССц СООН
неон НоАн окисление нАон * нАон 1 CHjOH неон ноАн нАон нАон 1 снон
глюкоза
глюконовая кислота
Углеводы
19
В щелочной среде моносахариды могут окис-
ляться оксидами металлов (меди, висмута, сереб-
ра). При этом сахар окисляется до кислоты, а ок-
сиды металлов восстанавливаются. Оксид меди
(II), восстанавливаясь, образует оксид меди (I) (за-
кись). Эта реакция используется для количествен-
ного определения сахаров по количеству образо-
вавшегося оксида меди (I). При взаимодействии
сахаров с оксидами висмута и серебра последние
восстанавливаются до свободных металлов. Реак-
ция «серебряного зеркала» используется для се-
ребрения ёлочных игрушек, колб сосудов Дюара
и термосов.
CuO + R-C --------» Си2О + R— СООН
Однако так, как написано, реакция идти не мо-
жет, потому что CuO — нерастворимый в воде по-
рошок. В связи с этим для реакции берут просто
соль двухвалентной меди — CuSO4. Поскольку окис-
ление сахаров идет в щелочной среде, к раствору
CuSO4 необходимо добавить щелочь.
CuSO4 + 2NaOH ----» Cu(OH)2 + Na2SO4
Но и в этом случае возникает препятствие:
Си(ОН)2 представляет собой студенистый осадок и
не может далее реагировать с сахаром. Необходи-
мо для дальнейшего хода реакции удерживать ка-
тионы двухвалентной меди в щелочной среде в ра-
створе. Для этого к щелочному раствору меди до-
бавляют сегнетову соль (К, Na-виннокислый), ко-
торая связывает ионы меди и удерживает их й ще-
лочной среде в растворе.
20
Углеводы
COOK
COOK
Cu(OH)2 + НО~ 9Н
НО-СН
ioONa
Cu"° J” + 2Н2О
'"О-СН
ioONa
сегнетова соль
Этот раствор синего цвета, содержащий CuSO4,
NaOH и сегнетову соль, называют фелинговой жид-
костью и используют для количественного опреде-
ления сахаров. Фелингову жидкость нагревают с
раствором сахара. При этом выпадает красный оса-
док Си2О, количество которого соответствует ко-
личеству сахара.
Фелингову жидкость восстанавливают сахара,
имеющие свободный полуацетальный (гликозид-
ный) гидроксил. Это — все моносахариды и неко-
торые олигосахариды. Их называют восстанавли-
вающими сахарами, в отличие от невосстанавли-
вающих, которые не содержат свободного полуаце-
тального (гликозидного) гидроксила и не способ-
ны восстанавливать фелингову жидкость.
у-н
неон
но£н
нЬэн
н^он
I
СН2ОН
+2Н
СН2ОН
н£он
I
носн
н^он
неон
СН2ОН
глюкоза
сорбит'
ГН пн
НОСН
I
неон
Н(^ОН
£н2он
фруктоза
При восстановлении моносахариды образуют
соответствующие многоатомные спирты. Так, при
Углеводы
21
восстановлении глюкозы и фруктозы образуется
шестиатомный спирт сорбит.
В растениях кислоты и спирты образуются из
моносахаридов ферментативным путем.
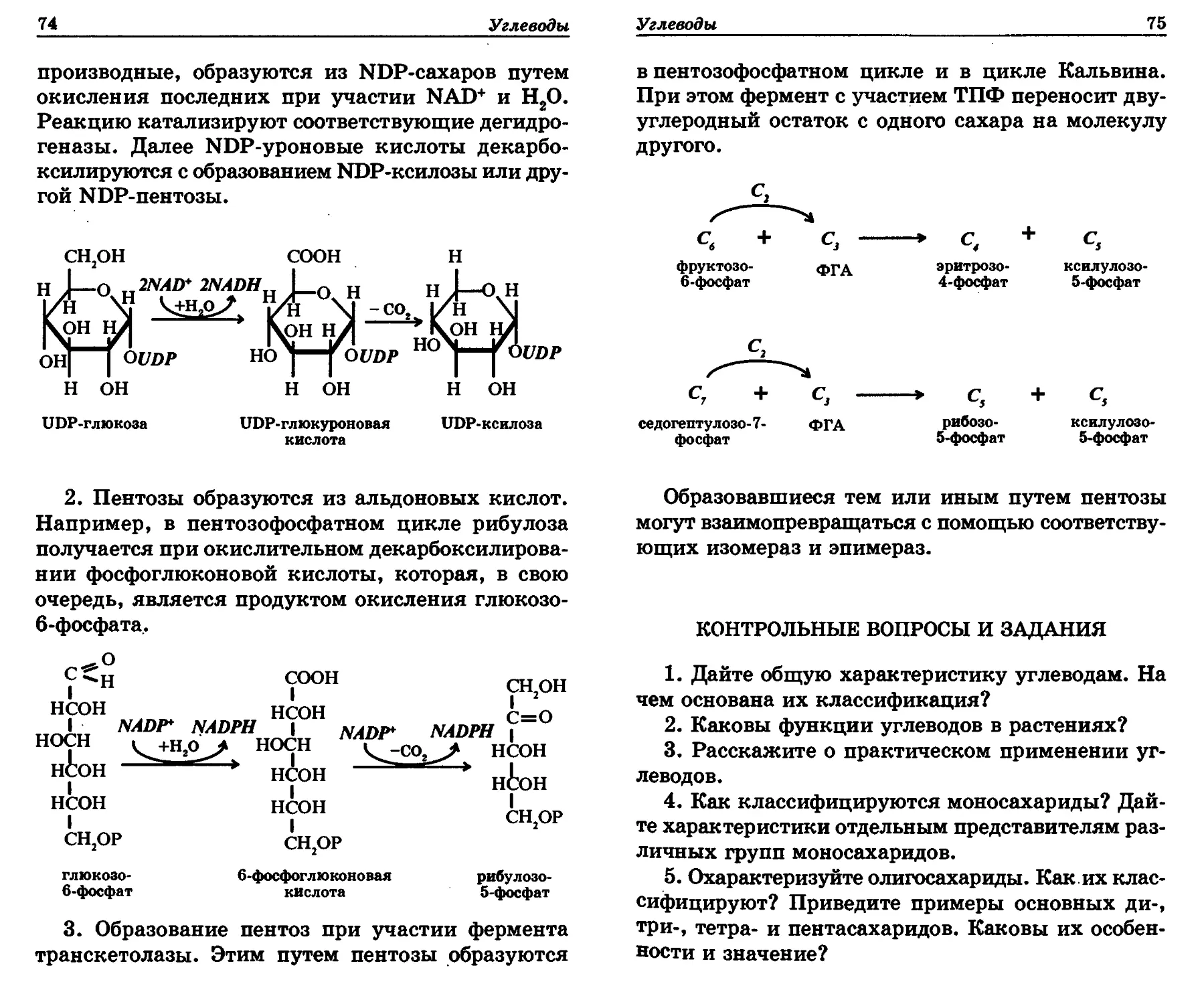
£^0 нАон" 1 носн 1 СН.ОР iJo носн Р^О С-Н неон 1 СН.ОР ё=о
неон нАон неон неон
нбон ^он СН,ОР=О "он н(к)н неон неон
СН2ОР СН2ОР СН2ОР
глюкозо- 6-фосфат фруктозо- бисфосфат рибозо- 5-фосфат рибулозо- бисфосфат
Моносахариды могут реагировать с кислота-
ми, образуя сложные эфиры. Особенно большое
виачение в живых клетках имеют сложные эфи-
ры сахаров с фосфорной кислотой — сахаро-
фосфаты.
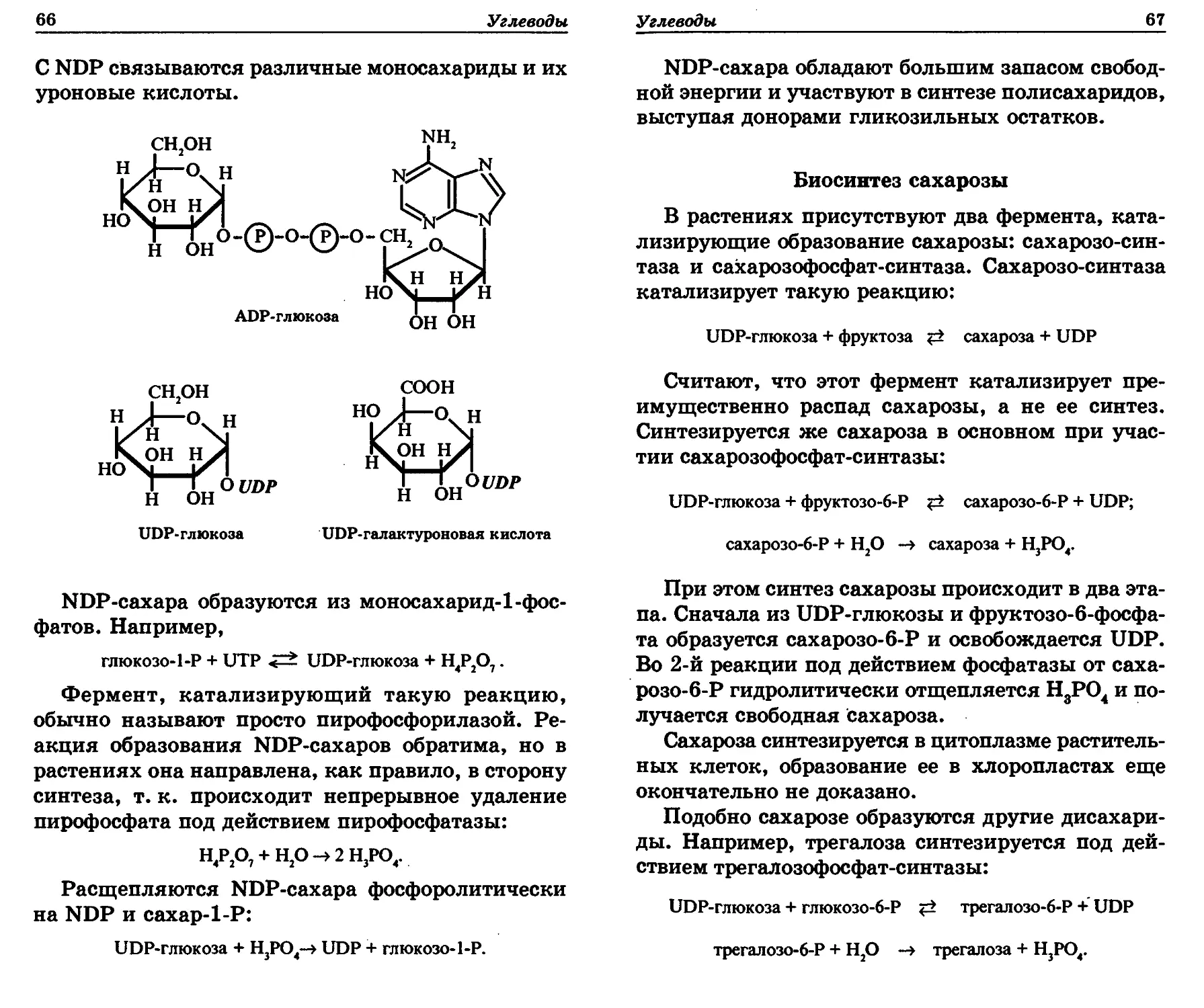
Сахарофосфаты являются активированными
моносахаридами, поскольку содержат богатую
энергией фосфорноэфирную связь. Поэтому они
легко вступают в биохимические реакции. По
сути, весь углеводный обмен в растении — это
реакции между сахарофосфатами или с непремен-
ным их участием.
Важным свойством сахаров является их способ-
ность образовывать гликозиды. Гликозиды — это
соединения, которые получаются в результате ре-
акции полуацетального гидроксила с каким-нибудь
соединением, чаще неуглеводной природы (агли-
коном). Отсюда второе название полуацетального
гидроксила —гликозидный, а- и 0-стерео изомеры
22
Углеводы
образуют, соответственно, а- и Р-гликозиды, на
которые действуют различные ферменты. В расте-
ниях чаще встречаются Р-гликозиды.
Одними из простейших гликозидов являются
метилгликозид ы.
Н ОН Н ОН
а-глюкоза
а-метилгликозид
Гликозиды широко распространены в растени-
ях. Их агликонами могут быть самые различные
вещества (спирты, кислоты, фенольные соедине-
ния). Сахара,- входящие в состав гликозидов, очень
разнообразны и часто в свободном состоянии не
встречаются. Гликозиды нередко имеют горький
вкус и специфический аромат.
В растениях петрушки содержится гликозид
апиин, в листьях и семенах крестоцветных — гли-
козид синигрин, который придает специфический
запах и горький вкус горчице. Известное аромати-
ческое вещество ванилин является агликоном гли-
козида коры ванильного дерева. В семенах расте-
ний из семейства розовых присутствует гликозид
амигдалин, содержащий в агликоне остаток си-
нильной кислоты. Именно этот гликозид придает
запах горького миндаля косточкам персиков, аб-
рикос, слив, вишен и т. д.
Некоторые гликозиды применяются в медици-
не, например, группа сердечных гликозидов. Они
положительно влияют на работу сердечной мыш-
Углеводы 23
цы. Сердечных гликозидов много, например, в на-
перстянке.
Характеристика
отдельных моносахаридов
Моносахариды — белые кристаллические ве-
щества, хорошо растворимые в воде и имеющие
более или менее сладкий вкус. Они очень распро-
странены в природе, особенно их много в расте-
ниях. Моносахариды в растениях находятся в сво-
бодном состоянии, в виде фосфорных эфиров, вхо-
дят в состав полисахаридов и других соединений
(гликозидов, гликолипидов, гликопротеинов).
Моносахариды классифицируют по числу уг-
леродных атомов в цепочке (С3—С9) на триозы,
тетрозы, пентозы, гексозы, гептозы, октозы и нан-
нозы.
Триозы. К ним относятся простейшие моноса-
хариды — глицериновый альдегид и дигидрокси-
ацетон.
В свободном состоянии они не встречаются,
а в виде фосфорных эфиров (ФГА и ФДА) являют-
ся важными промежуточными продуктами обмена
углеводов (фотосинтез, дыхание, брожение).
V-2 сн,он 1 2 | н сн,он 1 2
снон с=о снон с=о
4н2он 4н2он <Ьн2ОР £н2ор
глицериновый дигидрокси- ФГА ФДА
альдегид ацетон
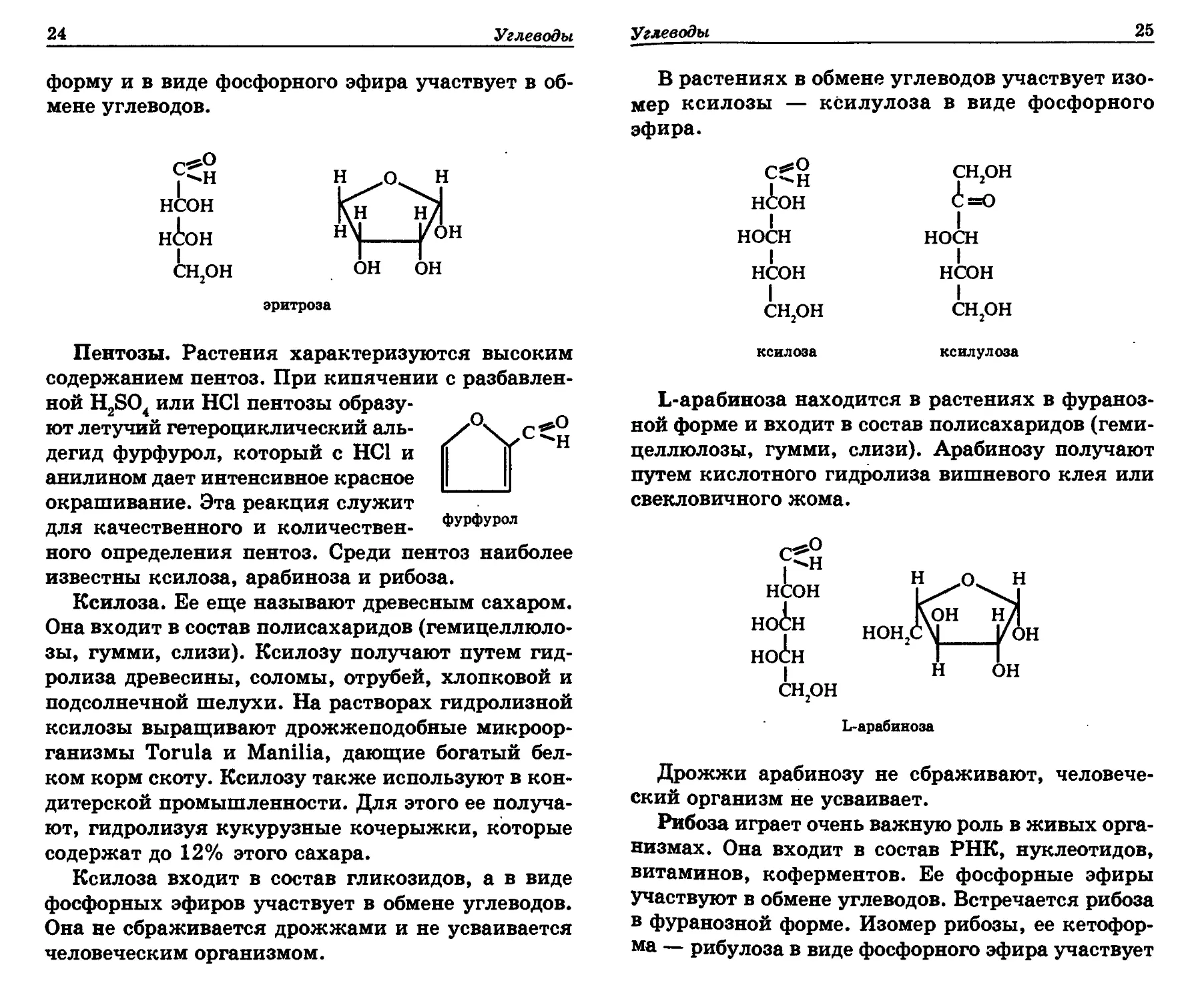
Тетрозы. Наиболее распространенная в растени-
ях тетроза — эритроза, которая имеет фуранозную
24
Углеводы
форму и в виде фосфорного эфира участвует в об-
мене углеводов.
I
неон
н<!:он
I
сн2он
он он
эритроза
Пентозы. Растения характеризуются высоким
содержанием пентоз. При кипячении с разбавлен-
ной H2SO4 или НС1 пентозы образу-
ют летучий гетероциклический аль- /°'\ХС
дегид фурфурол, который с НС1 и П ||
анилином дает интенсивное красное |___|
окрашивание. Эта реакция служит
для качественного и количествен- ФурФур°л
ного определения пентоз. Среди пентоз наиболее
известны ксилоза, арабиноза и рибоза.
Ксилоза. Ее еще называют древесным сахаром.
Она входит в состав полисахаридов (гемицеллюло-
зы, гумми, слизи). Ксилозу получают путем гид-
ролиза древесины, соломы, отрубей, хлопковой и
подсолнечной шелухи. На растворах гидролизной
ксилозы выращивают дрожжеподобные микроор-
ганизмы Torula и Manilia, дающие богатый бел-
ком корм скоту. Ксилозу также используют в кон-
дитерской промышленности. Для этого ее получа-
ют, гидролизуя кукурузные кочерыжки, которые
содержат до 12% этого сахара.
Ксилоза входит в состав гликозидов, а в виде
фосфорных эфиров участвует в обмене углеводов.
Она не сбраживается дрожжами и не усваивается
человеческим организмом.
Углеводы
25
В растениях в обмене углеводов участвует изо-
мер ксилозы — ксилулоза в виде фосфорного
эфира.
с**0
hcLoh
НОСН
неон
сн2он
сн,он
HOCH
I
неон
I
сн2он
ксилоза
ксилулоза
L-арабиноза находится в растениях в фураноз-
ной форме и входит в состав полисахаридов (геми-
целлюлозы, гумми, слизи). Арабинозу получают
путем кислотного гидролиза вишневого клея или
свекловичного жома.
I
сн2он
L-арабиноза
Дрожжи арабинозу не сбраживают, человече-
ский организм не усваивает.
Рибоза играет очень важную роль в живых орга-
низмах. Она входит в состав РНК, нуклеотидов,
витаминов, коферментов. Ее фосфорные эфиры
участвуют в обмене углеводов. Встречается рибоза
в Фуранозной форме. Изомер рибозы, ее кетофор-
ма — рибулоза в виде фосфорного эфира участвует
26
Углеводы
в обмене углеводов, а ее двойной эфир — рибуло-
зобисфосфат является акцептором СО2 при фото-
синтезе.
СН2ОН
рибоза
сн2он
с=о
неон
I
неон
I
он он
рибулоза
Гексозы, наряду с пентозами, — наиболее рас-
пространенные моносахариды в растениях. Это
глюкоза, фруктоза, галактоза, манноза.
Глюкоза (декстроза, или виноградный сахар) —
самый распространенный в природе моносахарид.
В свободном состоянии глюкоза содержится в зе-
леных частях растений, в семенах, ягодах, фрук-
тах, составляет половину от общего количества
сахаров нектара и меда. Глюкоза входит в состав
олигосахаридов (сахароза, мальтоза, рафиноза),
многих высших полисахаридов (крахмал, глико-
ген, целлюлоза, лихенин), гликопротеинов, неко-
торых липоидов, многих гликозидов. Фосфорные
эфиры глюкозы участвуют в метаболизме углево-
дов. Глюкоза сбраживается дрожжами и хорошо
усваивается животным организмом. Угол удельно-
го вращения глюкозы +52,5°.
Глюкозу получают путем гидролиза крахмала,
чаще кукурузного или рисового. Глюкоза нахо-
дит широкое применение. Она составляет часть
нашей пищи (фрукты, мед), используется в пи-
щевой промышленности, в медицине. Так, глю-
Углеводы
27
коза составляет большую часть патоки, которая
применяется в кондитерской промышленности.
Из нее в промышленных масштабах синтезиру-
ют витамин С. На глюкозе, полученной при гид-
ролизе древесины, выращивают кормовые дрож-
жи. Кроме того, сбраживая такую глюкозу, по-
лучают гидролизный спирт, используемый для
технических целей.
Фруктоза (левулоза, плодовый сахар) — наи-
более важный представитель кетоз. В природе
она встречается в фуранозной форме в основном
в виде 0-стереоизомера. Вращает плоскость по-
ляризации влево, угол удельного вращения —
-92,4°. Фруктоза — самый сладкий сахар. Она
содержится во всех зеленых частях растений, в
плодах, составляет половину сахаров нектара и
меда. Ее фосфорные эфиры участвуют в обмене
углеводов. Фруктоза входит в состав олигосаха-
ридов (сахароза, рафиноза), высших полисаха-
ридов (инулин), гликопротеинов, гликозидов.
Получают фруктозу путем гидролиза инулина.
Она сбраживается дрожжами и усваивается жи-
вотным организмом.
Галактоза в свободном состоянии в растениях
встречается крайне редко. Например, в кристал-
лическом виде выделяется на плодах плюща. В ос-
новном же она входит в состав олигосахаридов (лак-
тоза, рафиноза), высших полисахаридов (гемицел-
люлозы, гумми, слизи), гликопротеинов, гликози-
дов. Сбраживается дрожжами.
Манноза в свободном состоянии почти не встре-
чается. Обычно она входит в состав высших поли-
сахаридов (гемицеллюлозы, гумми, слизи), глико-
протеинов, гликозидов. Сбраживается дрожжами.
Гептозы. В растениях распространена в основ-
ном одна гептоза — седогептулоза.
28
Углеводы
Седогептулоза в значительных количествах со*
держится в растениях из семейства толстянковых.
Впервые ее получили из очитка (Sedum), отсюда
ее название. Фосфорные эфиры седогептулозы уча-
ствуют в превращении углеводов. Дрожжи седо-
гептулозу не сбраживают.
с^о Y-h неон с^° у-н НОСН сн2он с=о 1
1 НОСН НОСН НОСН 1
1 1 неон
НОСН 1 неон неон нЬэн 1 неон ।
сн2он галактоза £н2он манноза неон £н2он
седогептулоза
Октозы и наннозы. Эти моносахариды найдены
в плодах авокадо. Все они кетозы. Примером ок-
тоз может служить глицероманнооктулоза, а нан-
ноз — эритрогулонаннулоза.
СН2ОН
с=о
I
НОСН
но<!:н
нЬэн
I
неон
н^он
Ь12ОН
глицероманио-
октулоза
СН2ОН
с=о
I
НОСН
I
неон
I
НОСН
I
НОСН
I
неон
н^он
<J?H2OH
эритрогулонаннулоза
Углеводы
29
Моносахариды с разветвленной цепью. Обычно
моносахариды имеют неразветвленную цепочку.
Разветвленные сахара встречаются крайне редко
и, как правило, в связанном состоянии.
Апиоза — моносахарид, который входит в со-
став гликозида апиина, содержащегося в растении
петрушке.
L-стрептоза имеет в качестве разветвления аль-
дегидную группу. L-стрептоза входит в состав ан-
тибиотика стрептомицина. Еще одна особенность
стрептозы — отсутствие кислорода у 5-го углерод-
ного атома, т. е. это еще и дезоксисахар.
Гамамелоза в качестве боковой цепи имеет пер-
вичную спиртовую группу. Она входит в состав ряда
дубильных веществ.
неон
I
сон
нон// 'сн2он
апиоза
неон
°«*с-сон
I
НОСН
сн3
L-стрептоза
Дезоксисахара. В растениях встречаются моно-
сахариды, у которых при одном, реже при двух
углеродных атомах отсутствует кислород. Это —
дезоксисахара.
L-рамноза содержится во многих гликозидах,
в гумми, слизях, пектиновых веществах. В сво-
бодном состоянии рамноза встречается в листьях
сумаха.
Фукоза найдена в водорослях (фукус, ламина-
рия), в гликозидах.
30
Углеводы
Дигитоксоза — дважды дезоксисахар. Она со-
держится в гликозидах (наперстянка).
Дезоксирибоза в виде фосфорного эфира входит
в состав дезоксирибонуклеотидов ДНК.
у-н неон у-н неон "=”/J КО с«*о 1-н
неон носн 1 неон сн, 1
носн носн 1 неон 1 неон
1 носн неон 1 неон 1 неон 1
1 сн3 сн3 сн3 сн2он
L-рамноза фукоза днгитоксоза 2-дезоксирибоза
Аминосахара — это моносахариды, содержащие
аминогруппу. Например, глюкозамин, галактоза-
мин, в которых у 2-го углеродного атома вместо
гидроксильной содержится аминогруппа.
В природе аминосахара встречаются обычно в со-
ставе полисахаридов (хитин), гликопротеинов, гли-
козидов. Они обладают сильно выраженными ос-
новными свойствами и могут образовывать соли.
В растениях глюкозамин и другие аминосахариды
находятся в основном в виде N-ацетильных произ-
водных, т. е. в аминогруппе один водород замещен
ацетильным остатком.
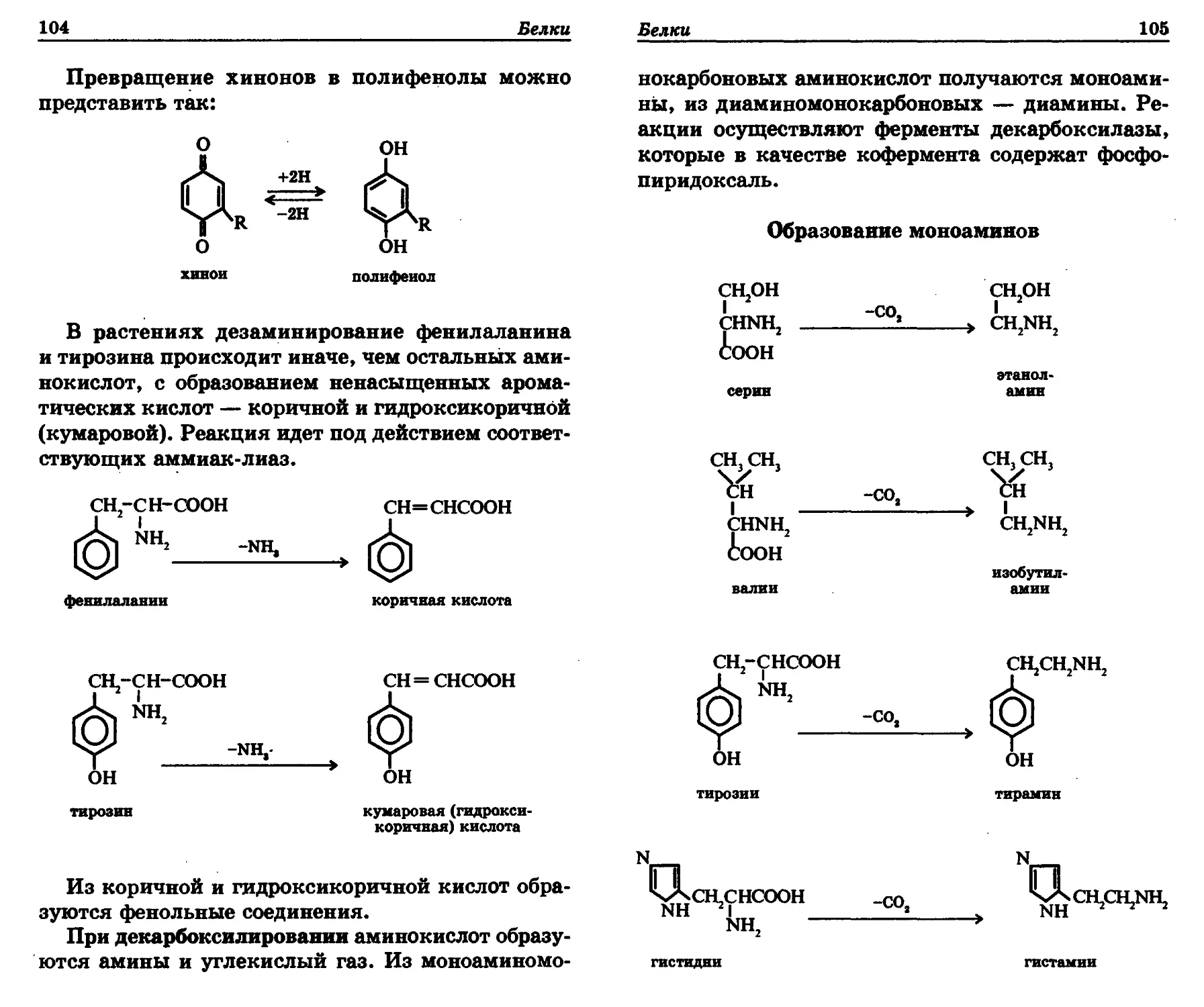
с*»о 1?Н нс—nh2 но<!:н с*»о |"и нс—nh2 но<!:н с*»о НС— NH—СО—СН3 НОСН
неон носн неон
1 неон 1 неон 1 неон
1 сн2он 1 сн2он 1 сн2он
глюкозамин галактозамин N-ацетилглюкозамнн
Углеводы
31
Некоторые производные моносахаридов
К ним относятся кислоты и многоатомные спир-
ты, которые образуются из моносахаридов, имеют
некоторые общие с ними свойства и участвуют в их
метаболизме.
Кислоты образуются при окислении моносаха-
ридов. В зависимости от того, какая группа в мо-
лекуле сахара окисляется, образуются кислоты
трех типов:
1. При окислении альдегидной группы до кар-
боксильной получаются альдоновые кислоты: из
глюкозы — глюконовая, из галактозы — галакто-
новая, из рибозы — рибоновая и т. д.
2. При одновременном окислении альдегидной
и первичной спиртовой групп образуются дикар-
боновые кислоты, которые называются альдаровы-
ми: из глюкозы — глюкаровая, из галактозы —
галактаровая и т. д.
3. При окислении только первичной спиртовой
группы получаются альдокислоты — уроновые
кислоты: из глюкозы — глюкуроновая, из галак-
тозы — галактуроновая, из маннозы — маннуро-
новая и т. д.
СООН
I
неон
но^н
неон
H<toH
I
сн2он
глюконовая
кислота
СООН
I
неон
но<!:н
неон
н^он
I
соон
глюкаровая
кислота
|"Н
неон
но^н
неон
н^он
I
соон
глюкуроновая
кислота
рн
неон
носн
hoLi
н^он
I
соон
галактуроновая
кислота
Все эти кислоты легко образуются в растениях
и участвуют в углеводном обмене, входят в состав
32
Углеводы
некоторых полисахаридов (гемицеллюлозы, гумми,
слизи), гликопротеинов, гликозидов.
Многоатомные спирты образуются в растениях
путем восстановления моносахаридов, их альдо-
или кетогрупп. Наиболее распространены в расте-
ниях сорбит, маннит, дульцит (галактит).
Сорбит образуется при восстановлении глюко-
зы и фруктозы. Он широко распространен в расте-
ниях. Много его в плодах — фруктах и ягодах (яб-
локи, груши, сливы, вишни, абрикосы, персики).
Особенно много сорбита в плодах рябины — до 7%,
откуда он и был впервые выделен.
Маннит получается при восстановлении манно-
зы или фруктозы. Его много в овощах и плодах
(морковь, лук, оливки, ананасы), в грибах (до 11%),
в водорослях (5-20%). Обычно маннит получают
из морской капусты (бурая водоросль). Часто он
выделяется на коре некоторых деревьев в виде
«манны» (оливковое дерево, некоторые виды ясе-
ня, тамарикса).
Дульцит (галактит) образуется при восстанов-
лении галактозы. Он содержится во многих расте-
ниях и в выделениях на коре и листьях некоторых
деревьев. Например, «мадагаскарская манна» пред-
ставляет собой почти чистый дульцит.
сн2он сн2он СН2ОН
неон 1 неон 1 НОСН 1
носн 1 носн 1 носн 1
неон 1 носн 1 неон 1
неон неон неон
1 1 1
сн2он сн2он сн2он
сорбит дульцит маннит
Углеводы 33
1.4 ПОЛИСАХАРИДЫ
Олигосахариды
Олигосахариды — это обычно белые кристал-
лические вещества. Они хорошо растворяются в
воде и имеют более или менее сладкий вкус. Они
находятся в растениях в свободном состоянии, в
составе высших полисахаридов, гликозидов, гли-i
копротеинов. В их молекулы входят от двух до
десяти остатков моносахаридов, но чаще встреча-i
ются сахара, содержащие 2-5 остатков. По числу
остатков олигосахариды делят на ди-, три-, тетра-,
пентасахариды и т. д.
Дисахариды. Это самая большая и распрост-
раненная группа олигосахаридов. Их молекулы
состоят из двух остатков гексоз, из двух пентоз
или из гексозы и пентозы. Чаще встречаются две
гексозы.
Дисахариды построены по типу гликозидов, т. е.
соединение двух молекул моносахаридов происхо-
дит за счет гликозидного гидроксила одного моно-
сахарида и одного из гидроксилов другого.
Наиболее важные дисахариды растений состоят
из остатков следующих моносахаридов:
глюкоза
сахарозах*
\ фруктоза
глюкоза
целлобиоза х*
\ глюкоза
глюкоза
мальтоза х*
\ глюкоза
галактоза
лактоза х*
\ глюкоза
глюкоза
трегалоза х*
\ глюкоза
2 Л А Красильникова
34
Углеводы
Из приведенного состава дисахаридов видно, что
разные сахара могут быть построены из одинако-
вых остатков. При этом различия в свойствах та-
ких дисахаридов обуславливаются, во-первых, тем,
что в их состав входят разные изомеры моносаха-
рида (а- или 0-формы), во-вторых, различными
связями между остатками.
Дисахариды делят на 2 группы: восстанавли-
вающие и невосстанавливающие. Восстанавлива-
ющие дисахариды имеют свободный гликозидный
гидроксил, т. к. связь между остатками моноса-
харидов осуществляется за счет одного гликозид-
ного, а другого обычного гидроксилов. У невос-
станавливающих дисахаридов в связи заняты оба
гликозидных гидроксила. Из перечисленных
выше дисахаридов невосстанавливающими явля-
ются сахароза и трегалоза, остальные — восста-
навливающие. Восстанавливающие дисахариды,
как и все моносахариды, восстанавливают фелин-
гову жидкость, могут существовать в виде а- и
0-стереоизомеров, а значит, проявлять в раство-
ре мутаротацию.
Сахароза (свекловичный, или тростниковый са-
хар) — наиболее распространенный и важный рас-
тительный дисаха^ид. Молекула сахарозы состоит
из остатков а-глюкозы и 0-фруктозы, связанных
(al—>02)-связью. Поскольку в связи участвуют
2 гликозидных гидроксила, сахароза не восстанав-
ливает фелингову жидкость.
Н ОН. ОН Н
сахароза
Углеводы
35
Сахароза хорошо сбраживается дрожжами
и усваивается человеческим организмом. Угол
удельного вращения раствора сахарозы +66,5°.
В небольших количествах сахароза содержится
во всех тканях растений. Она является основным
транспортным сахаром и движется по ситовид-
ным трубкам флоэмы. Кроме того, сахароза мо-
жет накапливаться в клеточном соке в плодах,
корнях, клубнях в качестве запасного углевода.
Больше всего сахарозы содержится в корнепло-
дах сахарной свеклы (14-20%) и в соке стеблей
сахарного тростника (14-25%).
Сахароза имеет наибольшее практическое зна-
чение среди других сахаров, т. к. она является ос-
новным сахаром, который используется человеком
в пищу. Сахарозу получают из сахарного тростни-
ка (65% мировой потребности) и из сахарной свек-
лы (30-35%).
Источником сахара в тропиках для местного
населения служат пальмы — кокосовая, сахарная
и винная. Перед цветением у пальм подрезают глав-
ную ось соцветия и собирают вытекающий сок. Его
выпаривают и получают коричневый сахар. Сок
также сбраживают в вино.
Сахарная кукуруза и сахарное сорго в стеблях
содержат 10-12% сахарозы. Использовать эти ра-
стения для получения сахара невыгодно, но из них
готовят сладкий сироп, который используют в кон-
дитерской промышленности.
В Северной Америке растет сахарный клен. Вес-
ной из подрезанного стебля получают сладкий сок,
содержащий около 4% сахара. Сок упаривают до
сиропа, напоминающего мед, который применяют
как общеукрепляющее средство.
Очищенная сахароза отрицательно действует на
кровеносные сосуды, вызывая их склероз, поэто-
36
Углеводы
му не рекомендуется употреблять больше двух сто-
ловых ложек сахара в день. Желтый и коричне-
вый сахар гораздо менее вреден, действие сахаро-
зы в нем смягчают примеси.
Сахароза легко гидролизуется при нагревании
с кислотами или под действием фермента саха-
разы, образуя смесь равных количеств глюкозы
и фруктозы. Эту смесь называют инвертным са-
харом, т. к. в результате гидролиза правое вра-
щение раствора меняется на левое. Угол удель-
ного вращения раствора сахарозы +66,5°, а обра-
зовавшихся глюкозы и фруктозы соответственно
+52,5’ и -92,4’. Отсюда угол удельного враще-
ния смеси будет отрицательным, равным -39,9’.
Кроме того, инвертный сахар более сладкий (на
30%), чем сахароза, поэтому в кондитерской про-
мышленности часто используют вместо сахаро-
зы инвертный сахар.
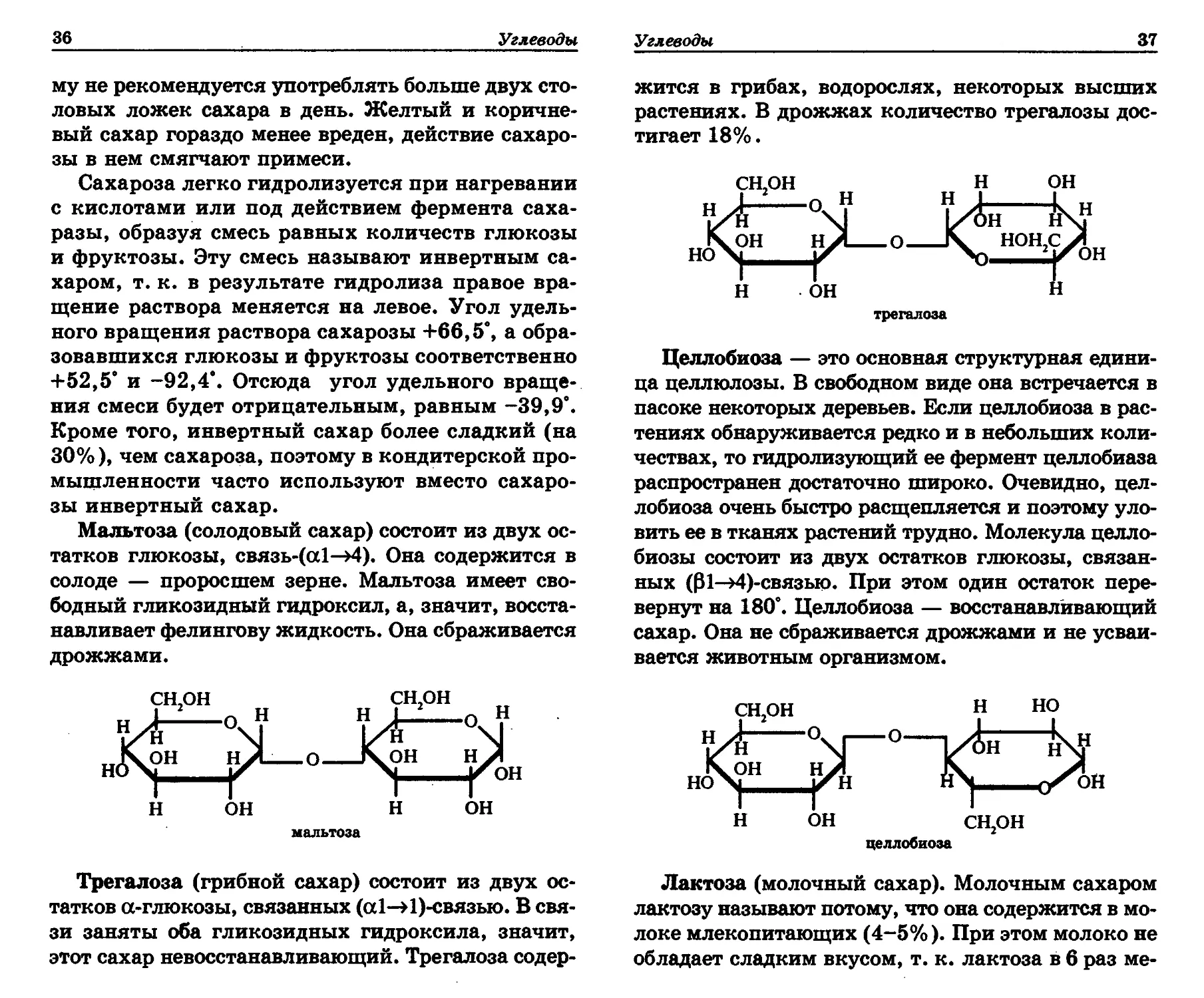
Мальтоза (солодовый сахар) состоит из двух ос-
татков глюкозы, связь-(а1—>4). Она содержится в
солоде — проросшем зерне. Мальтоза имеет сво-
бодный гликозидный гидроксил, а, значит, восста-
навливает фелингову жидкость. Она сбраживается
дрожжами.
н он н он
мальтоза
Трегалоза (грибной сахар) состоит из двух ос-
татков а-глюкозы, связанных (al—>1)-связью. В свя-
зи заняты оба гликозидных гидроксила, значит,
этот сахар невосстанавливающий. Трегалоза содер-
Углеводы
37
жится в грибах, водорослях, некоторых высших
растениях. В дрожжах количество трегалозы дос-
тигает 18%.
н ОН н
трегалоза
Целлобиоза — это основная структурная едини-
ца целлюлозы. В свободном виде она встречается в
пасоке некоторых деревьев. Если целлобиоза в рас-
тениях обнаруживается редко и в небольших коли-
чествах, то гидролизующий ее фермент целлобиаза
распространен достаточно широко. Очевидно, цел-
лобиоза очень быстро расщепляется и поэтому уло-
вить ее в тканях растений трудно. Молекула целло-
биозы состоит из двух остатков глюкозы, связан-
ных (01—>4)-связыо. При этом один остаток пере-
вернут на 180°. Целлобиоза — восстанавливающий
сахар. Она не сбраживается дрожжами и не усваи-
вается животным организмом.
сн2он н но
ЧАт °\1—0—l/iii н\н
н он сн2он
целлобиоза
Лактоза (молочный сахар). Молочным сахаром
лактозу называют потому, что она содержится в мо-
локе млекопитающих (4-5%). При этом молоко не
обладает сладким вкусом, т. к. лактоза в 6 раз ме-
38
Углеводы
нее сладкая, чем сахароза. В растениях лактоза
чаще находится в связанном состоянии (гликози-
ды, гликопротеины).
Молекула лактозы состоит из 0-галактозы и глю-
козы, (01—>4)-связь. Это восстанавливающий сахар,
сбраживается дрожжами.
ги пи си пи
Н ОН Н ОН
лактоза
На сыродельных заводах из сыворотки, кото-
рая является отходом производства, получают лак-
тозу. Ее используют для приготовления питатель-
ных микробиологических сред, в фармацевтичес-
кой промышленности в качестве наполнителя при
изготовлении порошков и таблеток. В Норвегии
из сыворотки, богатой лактозой, готовят сыр брю-
ност. Он коричневого цвета потому, что при дли-
тельном кипячении сыворотки происходит кара-
мелизация лактозы.
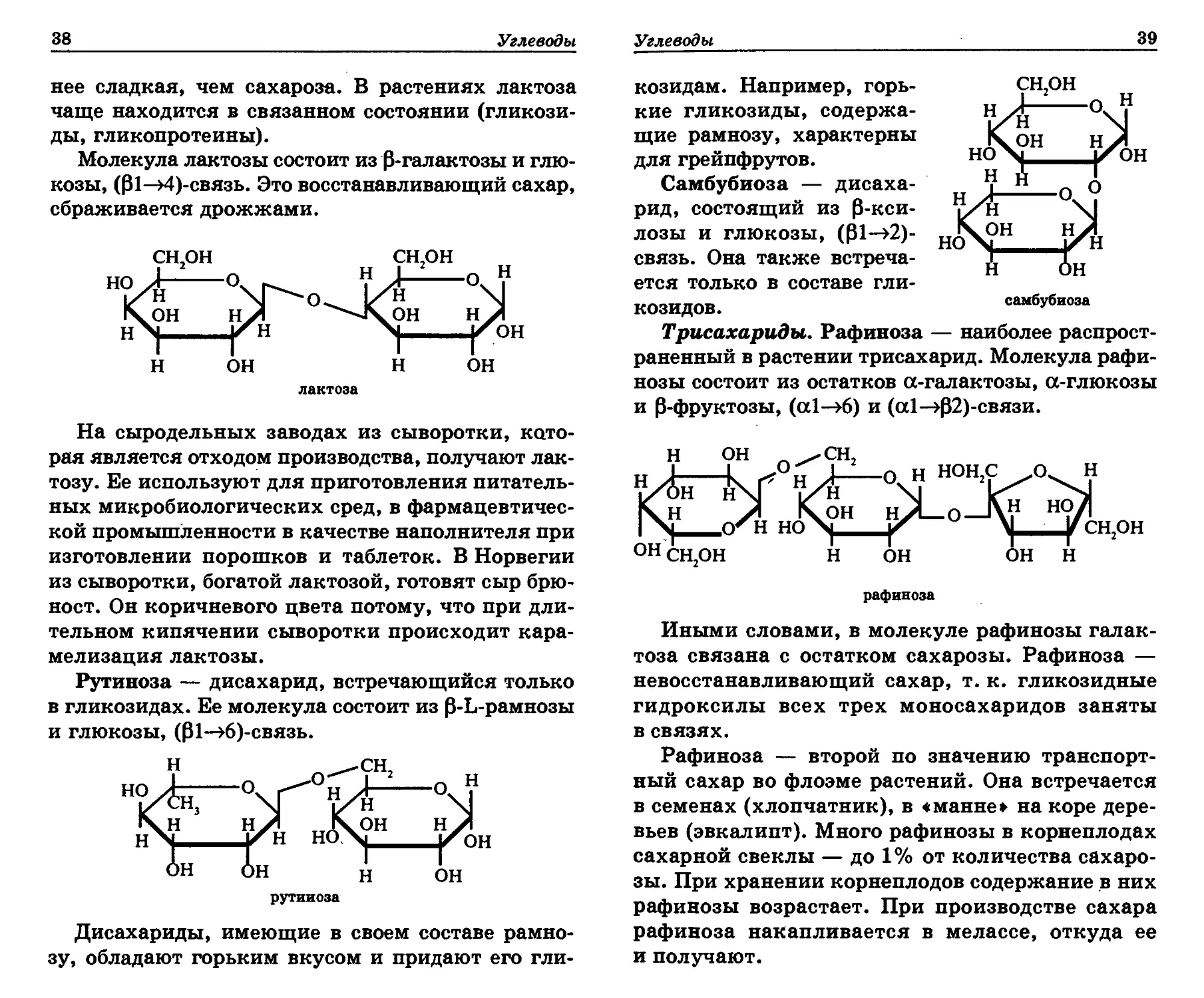
Рутиноза — дисахарид, встречающийся только
в гликозидах. Ее молекула состоит из P-L-рамнозы
и глюкозы, (01—>6)-связь.
рутиноза
Дисахариды, имеющие в своем составе рамно-
зу, обладают горьким вкусом и придают его гли-
Углеводы
39
козидам. Например, горь-
кие гликозиды, содержа-
щие рамнозу, характерны
для грейпфрутов.
Самбубиоза — дисаха-
рид, состоящий из 0-кси-
лозы и глюкозы, (Р1—>2)-
связь. Она также встреча-
ется только в составе гли-
козидов.
Трисахариды. Рафиноза — наиболее распрост-
раненный в растении трисахарид. Молекула рафи-
нозы состоит из остатков а-галактозы, а-глюкозы
и Р-фруктозы, (а1—>6) и (а1—>р2)-связи.
самбубиоза
Н он ^сн2
он сн2он н он он н
рафииоза
Иными словами, в молекуле рафинозы галак-
тоза связана с остатком сахарозы. Рафиноза —
невосстанавливающий сахар, т. к. гликозидные
гидроксилы всех трех моносахаридов заняты
в связях.
Рафиноза — второй по значению транспорт-
ный сахар во флоэме растений. Она встречается
в семенах (хлопчатник), в «манне» на коре дере-
вьев (эвкалипт). Много рафинозы в корнеплодах
сахарной свеклы — до 1% от количества сахаро-
зы. При хранении корнеплодов содержание в них
рафинозы возрастает. При производстве сахара
рафиноза накапливается в мелассе, откуда ее
и получают.
40
Углеводы
Тетрасахариды. Стахиоза — наиболее извест-
ный в растениях тетрасахарид. В состав ее моле-
кулы входят 2 остатка галактозы, остаток глюко-
зы и фруктозы. Связи — (al—>6), (al—>6), (al—>02).
Иначе говоря, к молекуле рафинозы присоединя-
ется еще один остаток галактозы.
сн2он Н СН о-СН, нон2с
н он '"сн, Н СН он н
стахиоза
Впервые стахиозу получили из корней чистеца
(Stachys), отсюда ее название. Этот тетрасахарид
содержится в семенах многих бобовых (соя, горох,
фасоль, чечевица, люпин), в «манне» некоторых
видов ясеня, в зернах ржи. Стахиоза является тре-
тьим по значению (после сахарозы и рафинозы)
транспортным сахаром в ситовидных трубках фло-
эмы.
Ряд пищевых продуктов содержит много стахи-
озы (до 1-1,5%) — ржаной хлеб, фасоль, горох,
бобы, а у некоторых людей отсутствует фермент,
расщепляющий этот сахар. При употреблении ими
пищи богатой стахиозой возникает дискомфорт
в кишечнике. В таких случаях следует воздержи-
ваться от употребления этих продуктов.
Пентасахариды. Вербаскоза впервые выделе-
на из коровяка (Verbascum). В ее молекулу входят
3 остатка а-галактозы, a-глюкоза и 0-фруктоза,
связи (al—>6), (al-»6), (al—>6), (al—>02). Значит,
в молекуле этого сахара к стахиозе присоединяет-
ся еще один остаток галактозы.
Углеводы
41
вербаскоза
Вербаскоза — тоже транспортный сахар, но ее
в ситовидных трубках мало, по значению она сле-
дует за стахиозой.
Сладость сахаров
Сладкий вкус — один из важнейших признаков
сахаров и их производных. Причем они различа-
ются по степени сладости. Составлены таблицы
сладости сахаров и их производных. При этом стан-
дартом для сравнения является сахароза, сладость
которой принята за 100 единиц. Ниже приводятся
показатели сладости некоторых сахаров и их про-
изводных
сахароза — 100 фруктоза — 173 инвертный сахар — 130 глюкоза — 74 сорбит — 48 глицерин — 48 ксилоза —. 40 мальтоза — 32 рамноза — 32 галактоза— 32 рафиноза — 23 лактоза — 16
Следует сказать, что сладкий вкус — не абсо-
лютный признак сахаров. Существует ряд соеди-
нений, которые не имеют ничего общего с сахара-
ми по химической природе, но в то же время обла-
дают сладким вкусом. Например, D-аминокисло-
ты, соли свинца.
Существуют природные вещества и химические
соединения, обладающие сильным сладким вкусом.
42
Углеводы
Некоторые из них не вредны для человеческого
организма и используются как заменители сахара
в кондитерской промышленности, при изготовле-
нии напитков и фруктовых вод, при лечении диа-
бета. Обычно сладкий вкус таких веществ во мно-
го раз превышает сладость сахарозы.
Сахарин — это имин сульфобензойной кисло-
ты, но чаще используется кристаллогидрат его
натриевой соли, который по аналогии с сахарами
называют кристаллозой.
Сахарин в 400-500 раз слаще сахарозы и не ус-
ваивается человеческим организмом, он использу-
ется в качестве заменителя сахара для придания
сладкого вкуса без увеличения калорийности пищи,
а также в тех случаях, когда употребление сахара
недопустимо, например, при диабете.
В растениях встречаются вещества неуглевод-
ной природы, сладость которых чрезвычайно ве-
лика. Примером может служить гликозид стевио-
зид, или, по аналогии с сахаром, его называют сте-
виозой. Он содержится в листьях южноамерикан-
ского травянистого растения стевии. Он в 300 раз
слаще сахарозы и используется как ее заменитель.
Другой гликозид — глицирризиновая кислота
в 100 раз слаще сахарозы. Он содержится в кор-
нях тропической лианы хекверити. Корень этой
лианы называют «индийской лакрицей».
Углеводы
43
Высшие полисахариды
Высшие полисахариды — высокомолекулярные
вещества, молекулы которых содержат от несколь-
ких десятков до многих тысяч остатков моносаха-
ридов. Изучение этих полисахаридов осложняется
трудностями их очистки и получения в чистом
виде, поскольку в клетке они обычно связаны с
другими углеводам, белками, минеральными ве-
ществами. При изучении высших полисахаридов
используют метод введения в их молекулы различ-
ных радикалов (-СН3, -СОСН3), что позволяет лег-
че очистить полученный препарат, изучить его стро-
ение и связи между остатками моносахаридов. Ис-
пользуют также метод мягкого кислотного или
ферментативного гидролиза полисахаридов, что
позволяет установить состав их мономеров.
Высшие полисахариды делят на 2 группы —
гомо- и гетерополисахариды. Молекулы гомополи-
сахаридов построены из остатков одного сахара.
Из остатков глюкозы состоят крахмал, целлюло-
за, гликоген, каллоза, лихенин, из остатков фрук-
тозы — инулин, леван. В состав молекул гетеропо-
лисахаридов входят остатки различных моносаха-
ридов и их производных — гемицеллюлозы, гум-
ми, слизи.
Молекулы высших полисахаридов могут быть
как линейными, так и разветвленными. Все поли-
сахариды этой группы не обладают восстанавлива-
ющими свойствами, т.к. в связях между остатка-
ми сахаров участвуют гликозидные гидроксилы.
Крахмал — главный запасный полисахарид ра-
стений, который откладывается в клетках запаса-
ющих органов в виде крахмальных зерен (семена,
плоды, корни, клубни, корневища, стебли). Осо-
бенно много крахмала в семенах риса (60-80%),
44
Углеводы
кукурузы (65-75%), пшеницы (60-70%), меньше
в клубнях картофеля (12-22%).
Крахмальные зерна не растворяются в воде,
а только набухают. Если взвесь крахмальных зе-
рен в воде постепенно нагревать, то может быть
достигнута температура, при которой крахмал об-
разует очень вязкий коллоидный раствор, называ-
емый крахмальным клейстером. Температура клей-
стеризации различна для крахмала разных расте-
ний. Крахмал картофеля клейстеризуется при тем-
пературе 55-65’, кукурузы — при 64-71’, пшени-
цы — при 60-80’, риса — при 70-80’.
Очень характерным свойством крахмала явля-
ется его способность окрашиваться в синий цвет
при добавлении раствора йода в йодистом калии.
Крахмал на 96-98% состоит из углеводов. Ос-
тальное составляют примеси — минеральные ве-
щества и жирные кислоты.
Углеводная часть крахмала представлена двумя
полисахаридами — амилозой и амилопектином.
Амилоза представляет собой длинную неразвет-
вленную цепочку из остатков а-глюкозы, соеди-
ненных (а1—»4)-связями. Цепочки амилозы обра-
зуют спираль, каждый виток которой состоит из
6 остатков глюкозы. В молекуле амилозы обычно
содержатся несколько параллельно расположенных
спиралей.
участок молекулы амилозы
Молекулярная масса амилозы от 100 000 до
1 000 000. При обработке амилозы раствором йода
Углеводы
45
его молекулы встраиваются в витки спирали, об-
разуя комплексное химическое соединение с по-
лисахаридом, которое имеет синюю окраску.
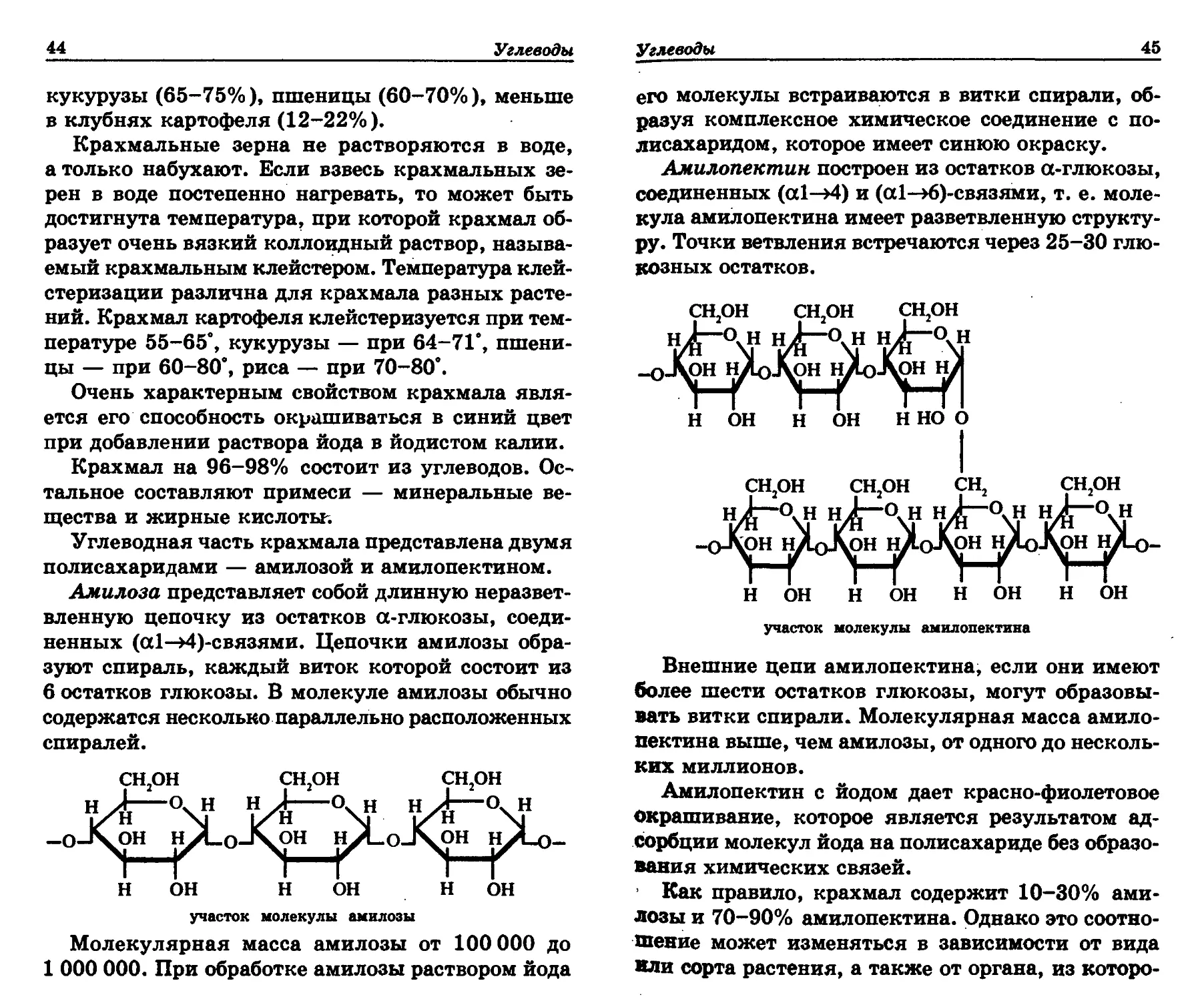
Амилопектин построен из остатков а-глюкозы,
соединенных (а1—>4) и (а1—>6)-связями, т. е. моле-
кула амилопектина имеет разветвленную структу-
ру. Точки ветвления встречаются через 25-30 глю-
козных остатков.
гм пн rw пн сн пн
Н ОН Н ОН Н НО О
СН2ОН СН2ОН СН2 СН2ОН
HJr%H dr%H HJr%H HJr%H
-o-frff н iyLo-\>H h^o^h нДо-
H OH H OH H OH H OH
участок молекулы амилопектина
Внешние цепи амилопектина, если они имеют
более шести остатков глюкозы, могут образовы-
вать витки спирали. Молекулярная масса амило-
пектина выше, чем амилозы, от одного до несколь-
ких миллионов.
Амилопектин с йодом дает красно-фиолетовое
окрашивание, которое является результатом ад-
сорбции молекул йода на полисахариде без образо-
вания химических связей.
Как правило, крахмал содержит 10-30% ами-
лозы и 70-90% амилопектина. Однако это соотно-
шение может изменяться в зависимости от вида
или сорта растения, а также от органа, из которо-
46
Углеводы
го получен крахмал. Так, в крахмале из клубней
картофеля содержится 22% амилозы, а из моло-
дых побегов — 46%. Крахмал из восковидных сор-
тов кукурузы, риса, ячменя состоит почти полнос-
тью из амилопектина и окрашивается йодом в крас-
но-коричневый цвет. В то же время крахмал неко-
торых сортов кукурузы, гороха и ряда видов ли-
лейных содержит больше амилозы — 50-70-80%.
Крахмал яблок состоит только из амилозы.
При кипячении с кислотами крахмал гидроли-
зуется до глюкозы. При более слабом воздей-
ствии — 7,5% НС1 при комнатной температуре в
течение 7 дней — образуется так называемый «ра-
створимый крахмал», часто применяемый в лабо-
раториях.
Крахмал находит широкое практическое приме-
нение.
Крахмал составляет большую часть пищи чело-
века (хлеб, крупы, овощи, фрукты, кондитерские
изделия) и кормов сельскохозяйственных животных.
Он используется во многих отраслях пищевой
промышленности.
Из него получают глюкозу, спирт, клей, пласт-
массы.
Его используют в текстильной промышленности.
Гликоген (животный крахмал) содержится в тка-
нях животных, в грибах, в ряде растений (зерно
сахарной кукурузы). В дрожжах гликогена до 40%.
По составу и структуре молекул он близок к ами-
лопектину, но отличается от него большей развет-
вленностью и компактностью молекулы, так как
точки ветвления у гликогена располагаются через
10-18 остатков глюкозы. Его молекулярная масса
также выше, чем у амилопектина. Гликоген ра-
створяется в горячей воде, образуя опалесцирую-
щий коллоидный раствор.
Углеводы
47
Гликоген играет важную роль в углеводном об-
мене животных, грибов, дрожжей при спиртовом
брожении.
Фруктозаны — полимерные соединения, состо-
ящие из остатков p-фруктозы. Существует 2 типа
фруктозанов — инулиноподобные и леваноподоб-
ные. Quit растворимы в воде и
точом соке вакуолей. У ину-
линоподобных фруктозанов
остатки фруктозы связаны
(р2—>1)-связями, а у левано-
подобных — (р2—>6)-связями.
Оба эти фруктозана в нача-
ле молекулы имеют остаток
сахарозы.
Инулиноподобные фрукто-
заны запасаются в корневи-
щах, корнях, клубнях расте-
ний из семейства сложноц-
ветных, колокольчиковых
(топинамбур,-георгины, ци-
корий, артишоки, одуван-
чик). Главным фруктозаном
этой группы является ину-
лин, содержащий 30-35 ос-
татков фруктозы. Инулин ча-
сто сопровождается более
низкомолекулярными фрук-
то за нам и. Они образуют го-
мологический ряд, в начале
содержатся в кле-
участок молекулы
инулина
которого находится дисахарид из двух остатков
фруктозы — р-левулин, а в конце — инулин. Из
инулина путем кислотного гидролиза получают
фруктозу.
Леваноподобные фруктозаны характерны для
однодольных, в том числе для растений из семей-
48
Углеводы
ства лилейных и злаковых. Леваны содержатся
в листьях, стеблях, корнях и семенах. У злаков
леваны функционируют как временные запасные
полисахариды.
В созревающих семенах злаков (рожь, пшени-
ца, овес, ячмень) леваны содержатся в больших
количествах (до 30% на сухое вещество), по мере
созревания они постепенно превращаются в крах-
мал, что свидетельствует о легкости превращения
в растениях фруктозы в глюкозу.
Леваны содержат меньше ос-
татков фруктозы, чем инулин
(от 7-8 до 13-24). Некоторые ле-
ваны слабо ветвятся. Их моле-
кулы состоят из 2-3 цепей.
участок молекулы левана
Если крахмал, гликоген, инулин — это запас-
ные полисахариды, то далее будет рассмотрена
группа полисахаридов, выполняющих в растении
структурную функцию, — компонентов клеточ-
ной оболочки. Это целлюлоза, гемицеллюлозы
и пектины.
Целлюлоза (клетчатка) — высший полисахарид,
который является основным компонентом клеточ-
ной оболочки, образующим ее каркас.
В растениях клетчатка всегда связана с други-
ми веществами — гемицеллюлозами, лигнином,
пектином, липидами, смолами и т. д. Для отделе-
Углеводы
49
ния этих веществ от клетчатки исходное вещество
обрабатывают смесью NaHSO3 и H2SO3. При этом
сопутствующие вещества переходят в раствор, и
остается чистая целлюлоза — белое волокнистое
вещество.
Основными источниками получения целлюлозы
являются волокно хлопчатника, лубяные волокна
прядильных растений (льна, конопли, джута,
рами), а также солома и древесина. Хлопковое во-
локно содержит 95-98% клетчатки, лен — 80-
90%, древесина — 40-50%.
Целлюлоза нерастворима в воде, в ней она толь-
ко набухает. Она является очень стойким веще-
ством: не изменяется под действием слабых кис-
лот и щелочей даже при кипячении, не растворя-
ется в большинстве обычных растворителей. Клет-
чатка растворяется только в реактиве Швейцера —
растворе комплексного соединения, которое обра-
зуется при растворении гидроксида меди в аммиа-
ке — [Cu(NH3)4]-(OH)2. Из этого раствора клетчат-
ка выпадает в осадок при подкислении.
Гидролизуется клетчатка до глюкозы при ки-
пячении с концентрированной НС1 или H2SO4.
Молекула целлюлозы состоит из остатков 0-глю-
козы, соединенных (£1—>4)-связями. Причем каж-
дый второй остаток глюкозы повернут относитель-
но предыдущего на 180’. Это способствует образо-
ванию водородной связи между гидроксильной
группой при С-3 одного глюкозного остатка и кис-
лородом пиранозного кольца соседнего. Это пре-
пятствует вращению расположенных рядом глю-
козных остатков вокруг связывающих их глико-
зидных связей и делает невозможным образование
спирали, подобной амилозе. В результате получа-
ется жесткая линейная структура, в которой все
пиранозные кольца располагаются в одной плос-
50
Углеводы
кости. Целлюлоза представляет собой смесь гомо-
логичных молекул с молекулярной массой от не-
скольких сотен тысяч до нескольких миллионов.
сн2он н он сн2он н он
н он СН2ОН н он сн2он
участок молекулы целлюлозы
В клеточных стенках молекулы целлюлозы со-
браны в пучки — микрофибриллы, в которых они
расположены параллельно друг другу и связаны
водородными связями. На поперечном разрезе мик-
рофибрилла имеет овальную форму.
В центре микрофибриллы молекулы (их пример-
но 50) составляют так называемое «ядро». В нем
молекулы расположены упорядоченно, образуя
кристаллическую решетку. Вокруг «ядра» пример-
но 100 молекул также расположены параллельно,
но не столь упорядоченно. Это паракристалличе-
ская область. В ней находится некоторое количе-
ство молекул матрикса оболочки, чаще гемицел-
люлоз. Причем содержание их увеличивается от
«ядра» к периферии паракристаллической зоны.
В эту зону могут проникать и молекулы воды.
Немногие молекулы целлюлозы проходят по всей
длине микрофибриллы. Поэтому в микрофибрил-
ле есть участки, где одни молекулы заканчивают-
ся, а другие начинаются. В этих местах нарушает-
ся кристаллическая решетка.
Целлюлоза находит самое широкое применение.
Ее используют в целлюлозно-бумажной промыш-
ленности. В текстильной промышленности из нее
изготавливают хлопчатобумажные и льняные тка-
Углеводы
51
ни. Целлюлозу растворяют в медно-аммиачном
растворе, а затем раствор продавливают сквозь сито
в кислую среду, где она выпадает в осадок в виде
тончайших нитей. Из них получают натуральный
шелк — вискозу. Правда, шелковые нити состоят
не из белка, а из углевода — целлюлозы.
В молекулы целлюлозы вводят различные ра-
дикалы и получают метил-, ацетил- или нитро-
целлюлозу, которые служат сырьем для многих
отраслей химической промышленности. Из них
изготавливают искусственные волокна и ткани,
кожу, пластмассы, краски, лаки, взрывчатые ве-
щества и т. д.
Целлюлозу начали использовать для изготовле-
ния целлюлозобетона, который получают смеши-
ванием цемента с волокнистым растительным сы-
рьем — рисовой соломой, бамбуком, сезалем, ко-
косовыми волокнами, коноплей, джутом. Из сме-
си готовят панели, которые обладают всеми каче-
ствами железобетона, но дешевле, легче и удобней
для строительства жилых домов.
Гемицеллюлозы (полуклетчатка) — это группа
высших полисахаридов, которые наряду с целлю-
лозой входят в состав клеточных оболочек, обра-
зуя их матрикс, и могут в семенах частично ис-
пользоваться в качестве запасных питательных
веществ. Много гемицеллюлоз в семенах, в соло-
ме, древесине, кукурузных кочерыжках, отрубях.
Гемицеллюлозы нерастворимы в воде, но раство-
ряются в щелочах и гидролизуются кислотами лег-
че, чем клетчатка. При кислотном гидролизе ге-
мицеллюлоз образуются глюкоза, галактоза, ман-
ноза, ксилоза, L-арабиноза и уроновые кислоты.
Молекулярная масса гемицеллюлоз — несколько
десятков тысяч. Они являются компонентами мат-
рикса клеточной оболочки.
52
Углеводы
Гемицеллюлозы делят на 3 группы, каждая из
которых различается по составу и структуре поли-
сахарида. Группы получили название по домини-
рующему в них моносахариду: маннаны, галакта-
ны, ксиланы. Все они гетерополисахариды.
Маннаны содержат Р-маннозу, ^-глюкозу
и Р-галактозу в отношении 3:1:1. Основная цепь
состоит из Р-маннозы и Р-глюкозы (отношение 3:1),
соединенных (Р1—>4)-связями. К некоторым остат-
кам маннозы присоединены (Р1—>6)-связями оди-
ночные остатки галактозы. Ряд остатков маннозы
ацетилирован по С-2, реже С-3. Такие маннаны
встречаются, например, в древесине хвойных и па-
поротников.
Галактаны в основной цепи имеют остатки
Р-галактозы, соединенные (Р1->3)-связями. К ос-
таткам галактозы по (Р1—>6)-связям присоедине-
ны остатки дисахаридов из двух Р-галактоз или
двух P-L-арабиноз. Галактаны обычно содержат-
ся в древесине.
Ксиланы разнообразны по структуре, в них пре-
обладает ксилоза, независимо от того составляет
ли она главную цепь или ее разветвления. Суще-
ствует несколько групп ксиланов.
1. Основная цепь состоит из Р-ксилозы, (Р1—>4)-
связи. 7 из каждых 10 остатков ксилозы ацетилиро-
ваны по С-3, реже по С-2. К некоторым ксилозным
остаткам присоединена галактуроновая кислота по
(al—>2)-связи, содержащая метоксильную группу у
С-4. Иногда такие ксиланы в виде ответвлений име-
ют a-L-арабинозу по (al—>3)-связи. Подобные ксила-
ны встречаются у хвойных и папоротников.
2. Другой вид ксиланов содержит ксилозу в ос-
новном в боковых ветвях. Такие ксиланы харак-
терны для клеточных стенок двудольных. Они под-
разделяются на следующие подгруппы:
Углеводы
53
а) основная цепь из остатков глюкозы, ($1—>4)-
связи. Ответвления — одиночные остатки ксило-
зы, (<х1—>6)-связи;
б) некоторые остатки глюкозы основной цепи
имеют ветвления в виде трисахарида из а-ксило-
зы, a-L-фукозы, а-галактозы. Связь с основной це-
пью через ксилозу, (al—>6);
в) некоторые остатки глюкозы основной цепи
имеют по 2 ответвления: указанный выше триса-
харид и L-арабиноза, (al—>2)-связь. Иногда этот кси-
лан связан через глюкозу с пектином.
Пектины — компоненты матрикса первичных
клеточных оболочек. Обычно они также являются
межклеточным веществом, образуют срединную
пластинку, которая склеивает стенки соседних
клеток. Содержание пектинов в клеточной оболоч-
ке обычно невелико — менее 5%.
Содержание пектинов в %:
яблоки 0,82-1,29
абрикосы 1,03
сливы 0,96-1,14
черная смородина 1,52
морковь 2,5
сахарная свекла 2,5
Характерным свойством пектинов является их
способность образовывать гели при низкой кон-
центрации. Поэтому их используют в пищевой про-
мышленности в качестве желирующих агентов при
изготовлении фруктовых желе, мармелада, пас-
тилы, джемов, фруктовых карамельных начинок
и в домашних условиях при варке варенья и по-
видла. Для образования пектинового желе необ-
ходимы определенные условия: 65-70% сахара
(сахарозы или гексозы), pH 3,1-3,5 и от 0,2 до
1>5% пектина.
54
Углеводы
В стеблях льна, как и у некоторых других пря-
дильных растений, лубяные волокна склеены пек-
тинами. Для их разделения пектин необходимо раз-
рушить, что достигается в процессе мочки. На ра-
стениях при этом развиваются бактерии, которые
выделяют ферменты, расщепляющие пектины.
В основе структуры молекул пектиновых ве-
ществ лежит пектиновая кислота. Она состоит из
остатков галактуроновой кислоты, соединенных
(<х1—>4)-связями.
СООН СООН соон
участок молекулы пектиновой кислоты
Пектиновая кислота может содержаться в кле-
точных стенках в свободном состоянии или в виде
солей и сложных эфиров. В свободном состоянии
пектиновая кислота желирующими свойствами не
обладает. Соли пектиновой кислоты чаще всего
являются пектатами Са и Mg. Причем связи кар-
боксильных групп с металлами могут образовывать-
ся в одной молекуле и в двух рядом расположен-
ных молекулах. Тогда связываются две цепи пек-
тиновых кислот.
Карбоксильные группы в пектиновой кислоте
легко образуют эфиры с метиловым спиртом. Ме-
тилированная пектиновая кислота называется ра-
створимым пектином. Именно растворимый пек-
тин и обладает желирующими свойствами. Его
получают в больших количествах и используют в
кондитерской промышленности. При получении
Углеводы
55
растворимого пектина избегают щелочной среды,
которая может вызвать омыление эфиров, а также
подавляют активность фермента пектиназы, рас-
щепляющего эфирные связи, т. к. и то, и другое
может привести к потере желирующих свойств.
участок молекулы растворимого пектина
Среди пектиновых веществ есть также рамнога-
лактуроны пектины, содержащие L-рамнозу.
Рамногалактуроны состоят из фрагментов, содер-
жащих 8 остатков галактуроновой кислоты, кото-
рые соединены трисахаридом из двух остатков га-
лактуроновой кислоты и рамнозы. Причем рамно-
за связана с галактуроновой кислотой (al—^-свя-
зью. Присутствие в полисахариде L-рамнозы зас-
тавляет цепь изгибаться.
В пектинах в небольших количествах встреча-
ются арабинаны и галактаны. Арабинаны состоят
из L-арабинозы, (al—>5)-связи. Основная цепь име-
ет единичные ответвления из остатков арабинозы
по (al—>3)-связи. Галактаны — линейные цепи из
0-галактозы, (01—>4)-связи. Обычно арабинаны и га-
лактаны связаны с рамногалактуроном.
Камеди (гумми) и слизи. Это полисахариды,
растворимые в воде и образующие очень вязкие
коллоидные растворы.
Камеди (гумми), например, выделяются на вет-
вях и стволах вишневых, сливовых, абрикосовых
деревьев при их повреждении, образуя так назы-
ваемый клей. Слизи содержатся в большом коли-
56
Углеводы
честве в семенах ряда растений (льна, ржи, клеве-
ра, люпина, люцерны и др.).
Строение этих высших полисахаридов еще не
установлено. Известно, что при гидролизе они об-
разуют глюкозу, галактозу, маннозу, ксилозу, ара-
бинозу и уроновые кислоты. Причем состав раз-
ных камедей и слизей значительно различается.
Так, полисахариды вишневого клея состоят из ос-
татков галактозы, маннозы, арабинозы, глюкуро-
новой кислоты и незначительного количества кси-
лозы. Слизи ржаного зерна почти на 90% состоят
из ксилозы и арабинозы и очень небольшого коли-
чества галактозы.
Именно наличием слизей объясняется высокая
вязкость отвара из льняных семян и водной бол-
тушки ржаной муки, которые используются в ме-
дицине как кровоостанавливающие и вяжущие
средства.
Каллоза — полисахарид, содержащийся в сито-
видных трубках флоэмы. Он откладывается на си-
товидных пластинках и в перфорациях, превращая
последние в узкие канальцы. К осени канальцы
полностью закупориваются и образуется наплыв
каллозы — каллюс. Если ситовидные трубки дан-
ного растения функционируют не один, а два-три
сезона, весной каллюс растворяется.
Каллоза состоит из остатков р-глюкозы, связан-
ных (pl—>3)-связями.
участок молекулы каллозы
Углеводы
57
Каллоза откладывается в стенках клеток раз-
вивающегося семени и пыльцевых зерен, когда
идет формирование генеративных ядер (яйцеклет-
ка, генеративная клетка пыльцевого зерна). При
этом каллоза выполняет защитную и изолирую-
щую функции до завершения формирования ге-
неративной клетки, а затем полисахарид гидро-
лизуется и исчезает. Откладывается каллоза и в
оболочке пыльцевого зерна, которое попало на
рыльце несовместимого с ним пестика. Каллоза
изолирует пыльцу и делает невозможным ее про-
растание. Она также образуется при заживлении
поврежденных тканей.
Лихенин — запасный полисахарид лишайни-
ков. Содержание его в некоторых видах достига-
ет 45-50% («исландский мох»). Молекулярная
масса лихенина около одного миллиона. Он ра-
створяется в горячей воде и обладает желирую-
щими свойствами. Мономером лихенина являет-
ся глюкоза. Предполагают, что остатки глюкозы
в полисахариде связаны (1—»4)-связями (73%)
и (1—>3)-связями (27%).
Лишайники и их полисахарид лихенин явля-
ются основным кормом северных оленей. Их же-
лудочно-кишечный тракт переваривает лихенин
благодаря присутствию в нем микрофлоры, выде-
ляющей специальные расщепляющие его фермен-
ты. Человеческий организм лихенин не усваивает.
Некоторые полисахариды водорослей
Речь пойдет лишь о полисахаридах, имеющих
большое практичекое значение.
Агар-агар — высокомолекулярный полисахарид,
содержащийся в некоторых водорослях, в основ-
ном в красных. Агар состоит по крайней мере из
58
Углеводы
двух полисахаридов — агарозы и агаропектина.
Считают, что агароза состоит из галактозы, связи
(al—»3) и (01—»4). Совсем мало известно о строении
агаропектина. Предполагают, что он состоит из
цепочек галактозы. Некоторые галактозные остат-
ки имеют сложноэфирные связи с остатками H2SO4.
Агар-агар растворяется в воде при нагревании,
а при последующем охлаждении образует гель. Этот
полисахарид в качестве желирующего агента ис-
пользуется в кондитерской промышленности при
изготовлении желе, пастилы, мармелада, джемов,
в парфюмерной промышленности при изготовле-
нии кремов, в хлебо-булочной — для предотвра-
щения быстрого черствления изделий, в микробио-
логической и биотехнологической — для приготов-
ления твердых питательных сред.
Альгиновая кислота — компонент клеточной
стенки многих водорослей, особенно бурых. Она,
по-видимому, является аналогом пектиновой кис-
лоты, но содержание ее в клеточной оболочке
выше — до 30%. Состоит альгиновая кислота из
остатков маннуроновой и L-гулуроновой (уроно-
вая кислота из глюкозамина) кислот, связанных
(01—»4)-связями. Альгиновая кислота и ее соли —
альгинаты, особенно натриевая, находят широкое
применение в качестве стабилизаторов эмульсий
при изготовлении мороженого, лаков, красок.
Хитин — главный полисахарид клеточных сте-
нок большинства грибов и основной компонент
панциря многих беспозвоночных. Молекулы хи-
тина представляют собой длинные неразветвлен-
ные цепи, состоящие из остатков N-ацетилглюко-
замина, связанных (01—>4)-связями. Цепочки хи-
тина, подобно целлюлозе, собраны в микрофиб-
риллы, где они связаны водородными связями и
имеют полукристаллическую структуру. Но мо-
Углеводы
59
лекулы хитина в микрофибрилле, в отличие от
целлюлозы, антипараллельны.
1.5 ОБМЕН УГЛЕВОДОВ
Образование углеводов при фотосинтезе
Углеводы (моносахариды) синтезируются в про-
цессе фотосинтеза, в темновой его фазе, или иначе
во вторичных реакциях. При синтезе углеводов
используются продукты световой фазы, или пер-
вичных реакций, — АТР и NADPH. Цикл реак-
ций восстановления СО2 до уровня углеводов, как
известно, называется циклом Кальвина, или вос-
становительным пентозофосфатным циклом.
Цикл Кальвина изучают в курсе физиологии
растений, но мы должны рассмотреть его реакции
и в курсе биохимии растений, поскольку они свя-
заны с первичным синтезом и превращениями мо-
носахаридов.
Цикл Кальвина возник на основе более древ-
него цикла реакций превращения моносахари-
дов — окислительного пентозофосфатного цикла
(ПФЦ), который протекает в процессе дыхания.
В цикле Кальвина реакции происходят в обрат-
ном направлении к реакциям ПФЦ. В нем по-
явились две реакции, которые в других метабо-
лических путях не встречаются, они характер-
ны только для процесса фотосинтеза. Это реак-
ция карбоксилирования и реакция фосфорили-
рования рибулозо-5-фосфата.
Рассмотрим реакции цикла Кальвина. Их — 13.
Ключевая реакция цикла Кальвина — карбо-
ксилирование, в которой СО2 реагирует с акцепто-
ром — рибулозо-1,5-бисфосфатом (РБФ).
60
Углеводы
CH,OP
t=O
HCOH + CO2
нЬон
I
CH2OP
рнбулозо-
1,5-бнсфосфат
СН2ОР ноос-с-он СН2ОР £нон 1
— — "4" — — СООН
нЙ? + ’ ► + СООН 1
1 снон
СН2ОР 1 СН2ОР
2-карбоксн-З-кето- 3-фосфоглнцерн-
рнбитол-1,5-бнсфосфат новая кислота
CO2 присоединяется к РБФ и образуется проме-
жуточное соединение из шести углеродных ато-
мов — сахар 2-карбокси-З-кето-рибитол- 1-,5-бисфос-
фат. Это соединение нестойкое и под действием
воды распадается на две триозы — 2 молекулы
3-фосфоглицериновой кислоты (3-ФГК).
Эту сложную первую реакцию цикла катализи-
рует фермент рибулозобисфосфат-карбоксилаза
(РБФК). Он составляет около 50% растворимых
белков листьев, и количество его в природе превы-
шает содержание всех остальных белков-фермен-
тов вместе взятых. Молекулярная масса РБФК
550 000. Молекула ее состоит из 16 субъединиц:
8 больших (мол. масса 51 000-58 000) и 8 малых
(мол. масса 12 000-18 000). В больших субъедини-
цах присутствует реакционный центр фермента, ма-
лые выполняют регуляторную роль.
Для протекания 1-й реакции необходимы ионы
Mg2+. Они активируют РБФК и стабилизируют
промежуточное соединение — 2-карбокси-З-кето-
рибитол-1,5-бисфосфат.
Во 2-й реакции 3-ФГК под действием фермента
фосфоглицераткиназы фосфорилируется при учас-
тии АТР с образованием 1,3-ФГК.
Далее 1,3-ФГК восстанавливается при участии
NADPH до 3-фосфоглицеринового альдегида
Углеводы
61
(3-ФГА). Реакцию катализирует триозофосфатде-
гидрогеназа.
СН2ОР СНОН ATP ADP СН2ОР Д24ДВД NADP* СН2ОР < снон < S-нро^ СНОН
СООН (D СОО-Р © сС2 г!
3-ФГК
1,3-ФГК
3-ФГА
Фосфоглицериновый альдегид изомеризуется
в фосфодигидроксиацетон (ФДА). Эту реакцию ка-
тализирует фермент триозофосфатизомераза. ФГА
и ФДА соединяются под действием фермента аль-
долазы. Он катализирует подобную реакцию в ПФЦ
и обратную в гликолизе. Этот фермент широко
распространен в растениях.
СН2ОР
СНОН
1^0
3-ФГА
СН2ОР
С=О
I
сн2он
ФДА
В результате альдолазной реакции ФГА и ФДА,
соединяясь, образуют гексозу — фруктозо-1,6-бис-
фосфат. Далее в 6-й реакции от фруктозо-1,6-бис-
фосфата гидролитически под действием фосфата-
зы отщепляется один остаток неорганического фос-
фата и получается фруктозо-6-фосфат. Часть мо-
лекул этого сахарофосфата выходит из цикла Каль-
вина в качестве его продукта, а часть остается в
Цикле и участвует в реакциях регенерации акцеп-
тора СО2 — РБФ. Установлено, что на 1 молекулу
фруктозо-6-фосфата, выходящего из цикла, при-
ходится 5 молекул, принимающих участие в реге-
нерации акцептора СОа.
62
Углеводы
СН,ОР СН,ОР СН,ОР СН,ОН
снон се° с^н + С=О сн2он "> С=О _|_ тт 0 (б) 1 НОСН ® носн
ФГА ФДА неон НСОН
1 НСОН 1 НСОН
СН2ОР СН2ОР
фруктозо-1,6- бисфосфат фруктозо- 6-фосфат
Далее в цикле Кальвина (7-я реакция) фрукто-
зо-6-фосфат взаимодействует с ФГА.
। СН2ОН
'с=° z
носн
h<Loh
I
неон
I
СН2ОР
I “
+ снон
СН2ОР
ФГА
ТПФ, Mg* неон
(7) НСОН
СН2ОР
сн,он
I
носн
неон
I
СН2ОР
фруктозо-
б-фо сфат
эритрозо- ксилулозо-
4-фосфат 5-фосфат
Реакцию катализирует фермент транскетолаза,
коферментом которого является тиаминпирофос-
фат (ТПФ). Транскетолаза при участии ТПФ пере-
носит двууглеродный остаток с кетогруппой (н)
с молекулы фруктозо-6-фосфата на ФГА. В резуль-
тате получаются эритрозо-4-фосфат и ксилулозо-
5-фосфат. Реакция активируется ионами Mg2+.
В следующей (8-й) реакции эритрозо-4-фосфат
и ФДА образуют семиуглеродный сахарофосфат —
седогептулозо-1,7-бисфосфат. Реакцию катализи-
рует альдолаза.
Углеводы
63
CHOP снон
CHOP с=о 1 с=о 1
НСОН 1 + НСОН 1 СН2ОР i-o . 1 сн2он —>НО?Н +ЦО (8) НСОН носн (9) H(LoH
НСОН НСОН
эритрозо- 4-фосфат ФДА 1 НСОН 1 СН2ОР 1 НСОН 1 СН2ОР
седогептулозо- 1,7-бисфосфат седогептулозо- 7-фосфат
От седогептулозо-1,7-бисфосфата под действием
фосфатазы отщепляется неорганический фосфат
и образуется седогептулозо-7-фосфат.
В следующей реакции (10-й) опять участвует
транскетолаза, которая переносит двууглеродный
. сн.он ч .
( д=о ) остаток с молекулы седогептулозо-7-фос-
фата на молекулу ФГА с образованием двух пен-
тоз — ксилулозо-5-фосфата и рибозо-5-фосфата.
|'сн,он41
\с=о 7 ~ 1 1 снон 1 2
носн снон с=о 1 1 НСОН
НСОН . 1 с=о ТПФ, Mg * носн > 1 + 1 НСОН
НСОН 1 CHOP НСОН 1 1 НСОН
НСОН 1 ФДА СН2ОР 1 СН2ОР
СН2ОР ксилулозо- рибозо-
5-фосфат 5-фосфат
седогептулозо-
7-фосфат
В следующих двух реакциях (11-й и 12-й) про-
исходит превращение образовавшихся в цикле пен-
64
Углеводы
тоз в рибулозо-5-фосфат. Сначала рибозо-5-фосфат
изомеризуется под действием рибулозофосфат-изо-
меразы в рибулозо-5-фосфат, а затем ксилулозо-5-
фосфат тоже превращается в рибулозо-5-фосфат при
участии фермента рибулозофосфат-эпимеразы, ко-
торый меняет положение Н и ОН у третьего угле-
родного атома.
ceS неон 1 СН.ОН с=о 1 сн,он А=О сн,он с=о 1
неон ; ► неон 1 НОСН 1 ► неон
неон ® нАон нАон ® нАон ।
СН2ОР 1 СН2ОР Ан2ОР СН2ОР
рибозо- рибулозо- ксилулозо- рибулозо-
5-фосфат 5-фосфат 5-фосфат 5-фосфат
Замыкается цикл Кальвина реакцией фосфори-
лирования рибулозо-5-фосфата в РБФ, т. е. окон-
чательной регенерацией акцептора СО2. Реакцию
катализирует фермент фосфорибулокиназа при
участии АТР.
сн,он А=О 1 НСОН AIP ADP нАон -А СН2ОР @ рибулозо-5-фосфат СН,ОР А=О нАон нАон 1 СН2ОР рибулозо-1,5-бисфосфат (РБФ)
Как сказано выше, первая и последняя реакции
характерны только для цикла Кальвина. Осталь-
Углеводы
65
ные же реакции встречаются и в других процессах
превращения сахаров (гликолизе, ПФЦ и т. д.).
Синтез, распад и превращение
углеводов в растении
Из фосфорных эфиров сахаров, образующихся
при фотосинтезе, получаются все остальные угле-
воды в растении. Из хлоропластов в цитоплазму
выходят различные моносахариды, синтезирую-
щиеся в цикле Кальвина. Однако в наибольшем
количестве из хлоропластов выходит ФДА, кото-
рый уже в цитоплазме изомеризуется в ФГА, а
затем они соединяются под действием альдолазы,
образуя фруктозо-1,6-бисфосфат. Последний, от-
щепляя Н3РО4, образует фруктозо-6-фосфат.
глюкоза
ФДА # ФГА
фруктозе-
1,6-5исфосфат
+н2о
-нро4 +нр
фруктозе- _> глюкозо- глюкозо-
6-фосфат <— 6-фосфат <— 1-фосфат
Изомераза превращает фруктозо-6-фосфат в глю-
козо-6-фосфат, а соответствующая мутаза перено-
сит фосфатный остаток в положение — 1, образуя
глюкозо-1-фосфат. Соответствующая фосфатаза
гидролитически отщепляет фосфатный остаток,
в результате образуется свободный сахар.
Важную роль во взаимопревращении сахаров
и в биосинтезе полисахаридов играют нуклеозид-
дифосфатмоносахариды (NDP-caxapa), в которых
сахар соединен гликозидной связью с концевым
фосфатным остатком: уридин-, цитозин-, аденозин-
или гуанозиндифосфата (UDP, CDP, ADP, GDP).
3. Л. А. Красильникова
66
Углеводы
С NDP связываются различные моносахариды и их
уроновые кислоты.
СООН
НО
сн,он
н
Н
н
он
о
OttOVDF
UDP-галактуроновая кислота
UDP-глюкоза
NDP-caxapa образуются из моносахарид-1-фос-
фатов. Например,
глюкозо-1-Р + UTP UDP-глюкоза + Н4Р2О,.
Фермент, катализирующий такую реакцию,
обычно называют просто пирофосфорилазой. Ре-
акция образования NDP-сахаров обратима, но в
растениях она направлена, как правило, в сторону
синтеза, т. к. происходит непрерывное удаление
пирофосфата под действием пирофосфатазы:
Н4Р2О, + Н2О -> 2 Н3РО4.
Расщепляются NDP-caxapa фосфоролитически
на NDP и сахар-1-Р:
UDP-глюкоза + Н3РО4—> UDP + глюкозо-1-Р.
Углеводы
67
NDP-caxapa обладают большим запасом свобод-
ной энергии и участвуют в синтезе полисахаридов,
выступая донорами гликозильных остатков.
Биосинтез сахарозы
В растениях присутствуют два фермента, ката-
лизирующие образование сахарозы: сахарозо-син-
таза и сахарозофосфат-синтаза. Сахарозо-синтаза
катализирует такую реакцию:
UDP-глюкоза + фруктоза сахароза + UDP
Считают, что этот фермент катализирует пре-
имущественно распад сахарозы, а не ее синтез.
Синтезируется же сахароза в основном при учас-
тии сахарозофосфат-синтазы:
UDP-глюкоза + фруктозо-6-Р сахарозо-6-Р + UDP;
сахарозо-6-Р + Н2О —> сахароза + Н3РО4.
При этом синтез сахарозы происходит в два эта-
па. Сначала из UDP-глюкозы и фруктозо-6-фосфа-
та образуется сахарозо-6-Р и освобождается UDP.
Во 2-й реакции под действием фосфатазы от саха-
розо-6-Р гидролитически отщепляется Н3РО4 и по-
лучается свободная сахароза.
Сахароза синтезируется в цитоплазме раститель-
ных клеток, образование ее в хлоропластах еще
окончательно не доказано.
Подобно сахарозе образуются другие дисахари-
ды. Например, трегалоза синтезируется под дей-
ствием трегалозофосфат-синтазы:
UDP-глюкоза + глюкозо-6-Р трегалозо-6-Р + UDP
трегалозо-6-Р + Н2О -> трегалоза + Н3РО4.
68
Углеводы
Расщепляется сахароза гидролитически с по-
мощью сахаразы, а также при обращении реакции
с участием сахарозо-синтазы:
сахароза + Н2О -> глюкоза + фруктоза
Биосинтез три-, тетра- и пентасахаридов
Синтез олигосахаридов (рафинозы, стахиозы,
вербаскозы) происходит в результате последователь-
ного присоединения остатков галактозы. Донором
галактозы является галактинол. Галактинол обра-
зуется из UDP-галактозы и лшо-инозита. Мио-ино-
зит — это циклический шестиатомный спирт.
сн2он он н
ОН/|—“ О н Н J—-к он
Н \/ Н НО
н\?н вЛ + hS\Ejh *-
OUDP
UDP-гал актозг сн2он hol^°x! н он 1 мио-инозит ОН Н LJ^H" • - ОН он галактинол
Далее остаток галактозы переносится от галак-
тинола сначала на сахарозу с образованием рафи-
нозы, затем на рафинозу с образованием стахиозы
Углеводы
69
и на стахиозу с образованием вербаскозы. Во всех
этих реакциях выделяется свободный .мио-инозит.
галактинол + сахароза рафиноза + лшо-инозит
галактинол + рафиноза ?2 стахиоза + лшо-инозит
галактинол + стахиоза <2 вербаскоза + лшо-инозит
Биосинтез высших полисахаридов
Высшие полисахариды в растениях синтезиру-
ются путем реакций трансгликозилирования, т. е.
переноса гликозильных остатков (остатков моно-
сахаридов). Перенос осуществляется от многочис-
ленных молекул-доноров к одному концу молеку-
лы-акцептора, которую еще называют затравкой
и которая при этом удлиняется.
пглюкоза-Х + акцептор (глюкоза) ^-акцептор + пХ
донор затравка
При этом гликозильный остаток присоединяет-
ся гликозидным гидроксилом к одному из гидро-
ксилов затравки. Многочисленные реакции пере-
носа катализирует один фермент, определяющий
идентичность гликозильных остатков и природу
гликозидной связи в данном полисахариде. Доно-
рами гликозильных остатков чаще всего выступа-
ют NDP-caxapa, а акцептором — часть молекулы
полисахарида, иногда очень небольшая, но имею-
щая связи, характерные для макромолекулы.
Биосинтез и распад крахмала
Крахмал, как известно, состоит из двух полиса-
харидов — амилозы и амилопектина. Поэтому его
биосинтез происходит в два этапа. Сначала образу-
70
Углеводы
ется цепочка амилозы, а затем часть ее образует
ветвления. Иными словами, сначала синтезируют-
ся (al—>4)-связи, а затем — (al—>6).
Образование амилозы катализирует фермент
крахмал-синтаза, находящаяся в хлоропластах и
амилопластах. Донором глюкозных остатков выс-
тупает ADP-глюкоза, а акцепторами могут быть
осколки крахмальной молекулы — амилозы или
амилопектина. В первом случае будет синтезиро-
ваться молекула амилозы, а во втором крахмал-
синтаза участвует в образовании амилопектина, его
цепей с (al—»4)-связями.
ADP -глюкоза + акцептор —> а-1,4-глюкоза-акцептор + ADP
Амилопектин образуется при совместном дей-
ствии крахмал-синтазы и 1,4-а-глюкан — ветвя-
щего фермента. Ветвящий фермент переносит оли-
госахаридный фрагмент от невосстанавливающего
конца цепи к шестому углеродному атому некон-
цевого остатка глюкозы, прикрепляя его (al—>6)-
связью.
| -О + ферм. -----> |---ферм. + | о
цепь-донор остаток цепи
|----ферм. + | О ---------►
акцептор
+ ферм.
невосстанавливающий конец
восстанавливающий конец
(1-»6)-связь
Донором олигосахаридного фрагмента и его ак-
цептором может быть как молекула амилозы, так
и наружная цепь амилопектина.
Углеводы
71
В расщеплении крахмала принимают участие
6 ферментов: 5 гидролаз и фосфорилаза. Причем
эти ферменты действуют по-разному: одни расщеп-
ляют (al—»4)-связи, -другие — (al—>6)-связи, одни
действуют на большие молекулы, другие — на их
мелкие фрагменты.
Очень активным и широко распространенным
в растениях является фермент a-амилаза. С ее ра-
боты начинается расщепление крахмала. Только
она действует на целые крахмальные зерна, рас-
щепляя (al—»4)-связи. После a-амилазы в процесс
вступают другие ферменты.
Конечными продуктами расщепления крахма-
ла являются глюкоза и глюкозо-1-Р.
Биосинтез и распад целлюлозы
В 1964 г. Хассид с сотрудниками впервые на-
блюдали синтез целлюлозоподобного соединения в
гомогенате из маша, а затем из гороха, кукурузы,
семян хлопчатника и др. Донором глюкозы в этих
реакциях выступала GDP-глюкоза:
п GDP-глюкоза + акцептор -> (глюкоза)п-акцептор + nGDP
В результате такой реакции образовывались не
молекулы целлюлозы, а более короткие цепочки
полисахарида, содержащие (р1-»4)-связи. Тогда пред-
положили, что сложные комплексы ферментов,
синтезирующих целые микрофибриллы целлюлозы
и встроенные в наружную поверхность плазмалем-
мы, разрушаются при получении бесклеточного фер-
ментного препарата. Очевидно, синтез целлюлозо-
подобных цепочек в этих условиях осуществляют
отдельные компоненты ферментного комплекса.
Позже появилось еще одно объяснение непол-
ного синтеза целлюлозной молекулы в бесклеточ-
72
Углеводы
ных ферментных системах. Дело в том, что NDP-
caxapa — водорастворимые соединения, а в мемб-
ране, где в клетке образуется целлюлоза, среда
гидрофобная, а, значит, и доноры сахаров должны
иметь гидрофобные свойства. Такими донорами в
мембране могут быть жироподобные вещества с
длинной углеводородной цепочкой — полипрено-
лы. Они, очевидно, принимают глюкозу от NDP-
сахаров и переносят ее на акцептор при синтезе
целлюлозы в плазматической мембране раститель-
ной клетки.
Распад целлюлозы происходит под действием двух
гидролитических ферментов. Целлюлаза расщепля-
ет молекулы целлюлозы до целлобиозы, а затем пос-
леднюю гидролизует целлобиаза до глюкозы.
+н,о * +н,о
целлюлоза--1—> целлобиоза-----—► глюкоза
Образование гемицеллюлоз и пектинов
У гемицеллюлоз и пектинов, составляющих мат-
рикс клеточной оболочки, общие пути синтеза.
Ферменты, катализирующие их образование, ло-
кализованы в аппарате Гольджи.
Взаимосвязь путей биосинтеза компонентов мат-
рикса клеточной оболочки можно видеть на следу-
ющей схеме.
Биосинтез гемицеллюлоз и пектинов начинает-
ся с UDP-глюкозы и UDP-галактозы, которые окис-
ляются до соответствующих UDP-уроновых кислот,
последние могут взаимопревращаться под действи-
ем соответствующих эпимераз. Далее при декар-
боксилировании 'глюкуроновая кислота образует
UDP-ксилозу, а галактуроновая — UDP-арабино-
зу, которые также способны эпимеризоваться.
Углеводы
73
UDP- _____> UDP-глю- > UDP-галак- -________ UDP-
глюкоза куроновая *-------- туроновая * галактоза
Гемицеллюлозы образуются из UDP-производ-
ных глюкозы, маннозы, ксилозы, арабинозы, га-
лактозы и уроновых кислот. Для синтеза пекти-
нов необходимы UDP-галактуроновая кислота и
UDP-рамноза. Кроме того, для образования раство-
римого пектина требуются метильные группы, до-
нором которых является S-аденозилметионин
(SAM). Метильные группы на полигалактуроновую
кислоту переносятся метил трансферазой.
Все реакции биосинтеза компонентов матрикса
клеточной оболочки доказаны опытами in vitro.
Например, в созревающих семенах кукурузы об-
наружена ферментная система, которая включала
ксилозу и L-арабинозу из их UDP-производных в
ксиланы. Кроме того, в ней была найдена эпиме-
раза, которая катализировала взаимное превраще-
ние UDP-ксилозы и UDP-арабинозы.
Образование пентоз
В растениях существуют три основных пути об-
разования пентоз — важных для растительного
организма моносахаридов.
1. Пентозы образуются из уроновых кислот.
Прежде всего уроновые кислоты, вернее их NDP-
74
Углеводы
производные, образуются из NDP-сахаров путем
окисления последних при участии NAD+ и Н2О.
Реакцию катализируют соответствующие дегидро-
геназы. Далее NDP-уроновые кислоты декарбо-
ксилируются с образованием NDP-ксилозы или дру-
гой NDP-пентозы.
UDP-глюкоза
UDP-глюкуроновая UDP-ксилоза
кислота
2. Пентозы образуются из альдоновых кислот.
Например, в пентозофосфатном цикле рибулоза
получается при окислительном декарбоксилирова-
нии фосфоглюконовой кислоты, которая, в свою
очередь, является продуктом окисления глюкозо-
6-фосфата,.
СООН
НСОН
I NADP*
НОСН
нЬэн
неон
сн2он
НСОН с-о
NADPH | NADP* NADPH ।
+н,0> носн С-со21>. неон
НСОН нЬэн
НСОН
СН2ОР
СН2ОР
СН2ОР
глюкозо-
6-фосфат
6-фосфоглюконовая
кислота
рибулозо-
5-фосфат
3. Образование пентоз при участии фермента
транскетолазы. Этим путем пентозы образуются
Углеводы
75
в пентозофосфатном цикле и в цикле Кальвина.
При этом фермент с участием ТПФ переносит дву-
углеродный остаток с одного сахара на молекулу
другого.
+ С}
фруктозо- ФГА
6-фосфат
эритрозо- ксилулозо-
4-фосфат 5-фосфат
С7 + С}
седогептулозо-7- ФГА
фосфат
* с, + с,
рибозо- ксилулозо-
5-фосфат 5-фосфат
Образовавшиеся тем или иным путем пентозы
могут взаимопревращаться с помощью соответству-
ющих изомераз и эпимераз.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАНИЯ
1. Дайте общую характеристику углеводам. На
чем основана их классификация?
2. Каковы функции углеводов в растениях?
3. Расскажите о практическом применении уг-
леводов.
4. Как классифицируются моносахариды? Дай-
те характеристики отдельным представителям раз-
личных групп моносахаридов.
5. Охарактеризуйте олигосахариды. Как. их клас-
сифицируют? Приведите примеры основных ди-,
три-, тетра- и пентасахаридов. Каковы их особен-
ности и значение?
76
Углеводы
6. Расскажите о сладости сахаров, природных
и синтетических заменителях сахара.
7. Дайте характеристику высшим полисахари-
дам. Каковы их общие свойства?
8. Назовите полисахариды, входящие в состав
клеточной стенки, запасные полисахариды. Оха-
рактеризуйте их строение, свойства, распростра-
нение.
9. Охарактеризуйте каллозу, гумми (камеди)
и слизи, их свойства, распространение и роль
в растении.
10. Какие высшие полисахариды водорослей
вы знаете? Дайте им характеристику. Что такое
лихенин?
11. В чем сходство и различия между хитином
и целлюлозой?
12. Как образуются углеводы в процессе фото-
синтеза? Расскажите о реакциях цикла Кальвина.
13. Дайте общую характеристику обмена угле-
водов в растениях. Какова роль NDP-сахаров в этом
процессе?
14. Расскажите о синтезе и распаде сахарозы,
три-, тетра- и пентасахаридов в растениях.
15. Расскажите о путях биосинтеза и распада
крахмала.
16. Что известно о синтезе и распаде целлюлозы?
17. Расскажите о путях синтеза гемицеллюлоз
и пектинов.
18. Каковы основные пути образования пентоз
в растениях?
2. БЕЛКИ
2.1 ОБЩАЯ ХАРАКТЕРИСТИКА И ФУНКЦИИ
БЕЛКОВ
Белки — важнейшие природные соединения
живой клетки как растительной, так и животной.
Основные функции белков в растительном орга-
низме те же, что и в животном.
1. Структурная функция. Белки участвуют в по-
строении всех клеточных органелл.
2. Каталитическая функция. Все ферменты —
белки.
3. Регуляторная функция. Например, гистоны
и ряд негистоновых белков регулируют транс-
крипцию.
4. Механо-химическая функция. Белки участву-
ют в осуществлении движений цитоплазмы и дру-
гих клеточных органелл.
б. Транспортная функция. Белки-переносчики
транспортируют различные вещества как через
плазматическую мембрану, так и внутри клетки.
6. Защитная функция. Например, гидролитичес-
кие ферменты лизосом и вакуолей расщепляют
вредные вещества, попавшие в клетку. Кроме того,
гликопротеины участвуют в защите растений от
патогенов.
7. Запасная функция. Эта функция характерна
в основном для растений. Запасные белки откла-
78
Белки
дываются в семенах и используются для питания
проростков в процессе прорастанйя.
В настоящее время функции многих белков еще
не выяснены. Кроме того, один белок может вы-
полнять две или более функций. Например, неко-
торые белки мембран могут выполнять структур-
ную и ферментативную функции.
Молекулы растительных белков, как и живот-
ных, содержат С, Н, О, N, а также почти всегда S
и некоторые — Р. У растений, произрастающих на
почвах, богатых селеном, этот элемент может за-
менять в белках серу. При этом растения растут
нормально, зато страдают поедающие их живот-
ные. У них, в первую очередь, нарушается синтез
белков шерсти, рогов, копыт.
Как правило, содержание белков в растениях
ниже, чем у животных. В вегетативных органах
количество белка обычно 5-15% от сухой массы.
Так, в листьях тимофеевки содержится 7% белка,
а в листьях клевера и вики — 15%. Больше белка
в семенах: у злаков в среднем 10-20%, у бобовых
и масличных — 25-35%.
Содержание белка в семенах (в %):
Пшеница — 15 Горох — 25
Кукуруза — 10 Фасоль — 23
Рожь — 12 Люпин — 35
Овес — 12 Горчица — 28
Просо — 12 Подсолнечник — 26
Рис — 7 Рапс — 30
Наиболее богаты белком семена сои — до 40%,
а иногда и выше.
В растительных клетках белки обычно связаны
с углеводами, липидами и другими соединениями,
а также с мембранами. Поэтому их трудно извле-
Белки
79
кать из растений и получать чистые препараты,
особенно из вегетативных органов. В связи с этим
в растениях лучше изучены белки семян, где их
больше и откуда они легче извлекаются.
Растительные белки по своим свойствам, моле-
кулярной массе и структуре молекул близки к бел-
кам животного происхождения.
2.2 АМИНОКИСЛОТЫ
Как известно, мономерами белков являются
аминокислоты. В составе белков как растительных,
так и животных, найдено 20 аминокислот:
Аланин Лейцин
Аргинин Лизин
Аспарагин Метионин
Аспарагиновая кислота Пролин
Валин Серин
Гистидин Тирозин
Глицин Трёонин
Глютамин Триптофан
Глютаминовая кислота Фенилаланин
Изолейцин Цистеин
Эти аминокислоты называют протеиногенными,
т. к. они входят в состав белка. Кроме того, они
могут находиться в клетке и в свободном состоя-
нии, образуя пул свободных аминокислот.
В молекулах аминокислот, как и моносахари-
дов, присутствуют асимметрические атомы угле-
рода, а значит, они оптически активны и имеют
стереоизомеры. Важной парой стереоизомеров яв-
ляются D- и L-изомеры. Стандартом для выясне-
ния принадлежности аминокислот к D- или L-ряду
80
Белки
является серин, который имеет только один асим-
метрический атом углерода и одну пару стерео-
изомеров.
сн,он H-C-NH, соон сн2он 1 СООН
D-серин L-серии
Все природные аминокислоты обычно относят-
ся к L-ряду. Однако в последние десятилетия в ра-
стениях, грибах и бактериях были обнаружены в
очень малом количестве D-аминокислоты. Они со-
держатся в свободном состоянии или в составе ко-
ротких пептидов. Например, D-фенилаланин обна-
ружен в составе антибиотика грамицидина, D-про-
лин — в алкалоидах спорыньи, несколько D-ами-
нокислот найдено в Bacillus mesantericus, D-аспа-
рагиновая кислота — в водоросли Chondria armata.
У высших растений D-аспарагин выделен из се-
мян вики, а D-триптофан — из семян караганы.
В настоящее время установлено, что D-аминокис-
лоты появляются в растениях в неблагоприятных
условиях произрастания.
В растениях, кроме 20 перечисленных выше,
обнаружено большое количество аминокислот (свы-
ше 250), которые не входят в состав белковых мо-
лекул, а содержатся только в свободном состоянии
или встречаются в составе коротких пептидов. Их
называют непротеиногенными. Эти аминокислоты
присутствуют в растениях в небольших количествах
и обычно характерны для небольшой группы рас-
тений (семейство, род).
Огромное количесвто непротеиногенных амино-
кислот требовало упорядочения. Их классифици-
Белки
81
ровали по сходству с протеиногенными, разделив
на 3 основные группы.
1. Сходство по изомерии. Непротеиногенные
аминокислоты являются изомерами некоторых
протеиногенных. а-Аланин — протеиногенная ами-
нокислота, р-аланин не входит в состав белка, а со-
держится в пуле свободных аминокислот.
си,
CHNHj
^обн
а-аланин
CH-NH,
*н.
соон
р-алаиин
Много его, например, в яблоках. р-Аланин вхо-
дит в состав пантотеновой кислоты и коэнзима А.
Он является также стимулятором роста дрожжей.
СН2—СН—СООН
NHj
гистидин
о
^\<N^CH,—СН—соон
N г ।
NHj
p-пиразол-1 -илалании
Гистидин входит в состав белка, а р-пиразол-
1-илаланин встречается только в свободном состо-
янии у растений семейства тыквенных.
2. Сходство по гомологии. Ряд непротеиноген-
ных аминокислот гомологичен протеиногенным.
82
Белки
СН2ОН CHNH, I 2 СН2ОН Ан | 2 NH C=NH NH C=NH
СООН серин chnh2 iooH 1 NH <Lh, 1 NH Ы
гомосерин iH, 1 CH2
CH,SH CH,SH ?** CH, 1
1 chnh2 CH, 1 2 chnh5 1 ' СИ,
iooH CHNH, i 2 COOH CHNH, | 2
цистеин СООН аргинин COOH
гомоцистеин гомоаргинин
Приведенные в качестве примера непротеино-
генные аминокислоты содержат в. углеродной це-
почке на один углеродный атом больше, чем соот-
ветствующие протеиногенные.
3. Сходство по аналогии. Аналогия может быть
двух типов.
а) Аналогия по замещению. В этом случае в мо-
лекуле протеиногенной аминокислоты один а'гом
водорода замещен какой-нибудь группой, в ре-
зультате чего получается непротеиногенная амино-
кислота.
CH2SH chnh2 ioOH цистеин CH2CHCOOH (^и. ch2s-ch3 chnh2 ioOH S-метил-цистеин CH2CHCOOH \>^COOH
карбокси-фенилаланин
фенилаланин
Белки
83
S-Метилцистеин распространен в растениях и мо-
жет выступать донором метильных групп в реак-
циях метилирования. Карбоксифенилаланин най-
ден в ирисах, резеде.
б) Аналогия по сходству в строении молекулы.
сн,-сн-сн,-сн-соон
3 I I
сн3 nh2
лейцин
сн,=с-сн-сн-соон
V I
сн2 nh2
а-метилеициклопропилглицин
Строение этих двух аминокислот похоже. а-Ме-
тиленциклопропилглицин — непротеиногенная
кислота, она выделена из семян съедобных плодов
личи китайской.
Непротеиногенные аминокислоты выполняют
в растениях целый ряд важных функций:
1. Некоторые непротеиногенные аминокислоты
участвуют в образовании протеиногенных. Напри-
мер, из гомосерина образуются треонин и метио-
нин, а из непротеиногенной диаминопимелиновой
кислоты — лизин.
СООН
chnh2 CHjNHj
1 си2 |н>
1 сн, - С02 _ СН,
1 си2 h
CHNH, CHNH, । £
СООН СООН
диаминопимелиновая кислота лизин
«4
Белки
2. Непротеиногенные аминокислоты могут слу-
жить запасной формой азота и серы. Аминокисло-
ты, в молекулах которых содержится два и более
атомов азота, могут накапливаться в семенах в виде
его запасной формы, а при прорастании отдавать азот
на образование необходимых проростку аминокис-
лот. Например, орнитин, цитруллин, гомоаргинин,
диаминомасляная кислота, р-пиразол-1 -илаланин.
CHjNHj NH2 CHjNHj
ь С=О сн 1 1 2
СИ, Nn chnh2
CHNH । 2 CH ' 1 2 соон
СООН орнитин сн2 диаминомасляная 1 кислота сн, chnh2 соон цитруллин
В качестве запасной серы в семенах могут от-
кладываться производные цистеина, например,
S-метилцистеин.
3. Ряд непротеиногенных аминокислот являет-
ся транспортной формой азота. Это, например, про-
изводные аспарагиновой и глютаминовой кислот
и их амидов.
СООН соон соон
1 снон I 1 снсн, с=сн2 1 * 1
1 сн, 1 сн2 сн2
chnh5 1 * 1 1 CHNH, CHNH2 1 £ 1 *
соон соон соон
у-гидрокси-глютами- иовая кислота у-метил-глютами- у-метилеи-глюта- новая кислота мииовая кислота
Белки
85
Они не накапливаются в семенах, зато встреча-
ются в проводящих тканях растений. Такой транс-
портной формой являются у-производные глюта-
миновой кислоты и глютамина.
4. Защитная фикция. Ее непротеиногенные
аминокислоты выполняют по-разному.
а) Орнитин и цитруллин участвуют в обезвре-
живании аммиака в орнитиновом цикле.
б) При неблагоприятных условиях образуется
ряд непротеиногенных аминокислот, которые свя-
зывают аммиак, накапливающийся при распаде
белков (диаминомасляная кислота).
в) В неблагоприятных условиях накапливается
«стрессовый» фитогормон этилен. Источником его
служит метионин, а промежуточным продуктом
биосинтеза является непротеиногенная аминокис-
лота аминоциклопропилкарбоновая. Она же слу-
жит транспортной формой этилена.
СН,
I
СН,
chnh2
соон
nh2
соон
аминоциклопропилкарбоновая
кислота
* СН2=СН2
этилен
метионин
2.3 ПЕПТИДЫ
Пептиды, или полипептиды, — это цепочки из
нескольких аминокислот, связанных пептидными
связями. В состав пептидов могут входить не только
протеиногенные, но и непротеиногенные аминокис-
лоты, часто связанные с глютаминовой кислотой.
86
Белки
Пептиды играют важную роль промежуточных
продуктов в обмене веществ, и многие из них яв-
ляются физиологически очень активными соеди-
нениями. Пептидами являются некоторые антибио-
тики (грамицидин, лихениформин), гормоны (ин-
сулин, окситацин, вазопрессин), токсины (амани-
тины). Некоторые пептиды представляют собой
замкнутую полипептидную цепочку, т. е. являют-
ся циклопептидами, а некоторые даже имеют би-
циклическое строение.
Известен трипептид глютатион, состоящий из
остатков глютаминовой кислоты, цистеина и гли-
цина. Имея в своем составе группу -SH, глютати-
он может участвовать в окислительно-восстанови-
тельных реакциях, активировать ряд ферментов,
например, протеазы.
-2Н~
2глютатион-8Н < > глютатион-Б-Б-глютатион
+2Н
Среди циклопептидов есть сильно токсичные
вещества. Например, ядовитый гриб бледная по-
ганка (Amanita phalloides) содержит по крайней
мере 10 токсичных циклопептидов — аманитинов.
ОН ОН
I I
СН-СН-СН2ОН
nh-ch-co-nh-ch-co-nh-ch2-co
NH СН
I /с 3
сн-сн
СО СН5
I
CO-CH-NH-CO-CH-NH-CO-CH-NH
ch2-co-nh2
а-аманитин
Белки
87
Все они имеют молекулярную массу около 1000.
Наиболее ядовитый из них а-аманитин подавляет
процесс транскрипции. Как ингибитор этого про-
цесса он используется в биохимических исследо-
ваниях.
2.4 КЛАССИФИКАЦИЯ БЕЛКОВ
Рациональной классификации белков пока не
существует, т. к. еще не изучены структура моле-
кул и функции многих белков.
Все белки как животные, так и растительные,
разделяют на две большие группы: простые белки
и сложные. Простые белки состоят только из ами-
нокислот, связанных пептидными связями, слож-
ные в своем составе, кроме белковой части, имеют
еще небелковый компонент — простетическую
группу.
Далее простые белки классифицируют по фи-
зико-химическим свойствам: растворимости в раз-
личных растворителях и величине молекулярной
массы, а сложные — по природе простетической
группы.
Полную классификацию белков изучают в кур-
се общей биохимии, а мы рассмотрим только те
группы, которые важны для растений.
Простые белки
Глобулины растворяются в растворах нейтраль-
ных солей (10% NaCl). Молекулярная масса их
100-300 тыс. Это главные белки семян бобовых и
масличных культур. У бобовых на долю глобули-
нов приходится 60-90% всех белков, у маслич-
ных — 50-60%. Среди глобулинов известны легу-
88
Белки
мин из семян гороха, фазеолин — фасоли, глици-
нии — сои, эдестин — конопли и др.
Жмыхи, остающиеся после извлечения масла из
семян масличных культур (подсолнечный, льня-
ной, хлопковый жмых), состоят в основном из гло-
булинов.
Проламины — белки, растворимые в семидеся-
типроцентном спирте. Название связано с тем, что
при их гидролизе образуется много пролина и ам-
миака. Проламины — это специфические белки зла-
ков. Содержание их в зерне составляет 20-50%.
Молекулярная масса проламинов 26-40 тыс. Сре-
ди проламинов известны глиадин из семян пшени-
цы и ржи, составляющий половину клейковины,
гордеин — ячменя, зеин — кукурузы.
Глютелины растворяются в слабых щелочах
(0,2%). Они содержатся в основном в семенах зла-
ков, где их может быть 25-40% от общего содер-
жания белков, а в рисе — 60-70%. Глютелины
представляют собой смесь различных белков, из
которой выделяют индивидуальные белки. Среди
глютелинов известны: глютенин из семян пшени-
цы, оризенин из семян риса и др. Глютенин со-
ставляет половину белков клейковины.
Сложные белки
Липопротеины входят в состав клеточных мемб-
ран. В качестве простетической группы они содер-
жат различные жироподобные вещества. В живот-
ных липопротеинах липидная часть представлена
в основном фосфолипидами и холестерином. Рас-
тительные липопротеины имеют более разнообраз-
ные небелковые компоненты. Кроме фосфолипи-
дов, в их состав входят гликолипиды, сульфоли-
пиды, разнообразные стероиды и терпеноиды. Осо-
Белки
89
бым разнообразием липидных компонентов отли-
чаются липопротеины мембран хлоропластов.
Гликопротеины имеют в своем составе углево-
ды и их производные — глюкозу, маннозу, галак-
тозу, глюкозамин, глюкуроновую кислоту и др.
Сахар обычно связан с остатками серина, треони-
на, оксипролина или аспарагиновой кислоты. При-
мером гликопротеинов могут служить запасный
белок бобовых — вицилин, ферменты — перокси-
даза и глюкооксидаза, ядовитый белок рицин из
семян клещевины. Рицин необратимо инактиви-
рует рибосомы.
К гликопротеинам относится группа раститель-
ных белков, которые называют фитогемагглюти-
нинами, или лектинами. Первое свое название
они получили потому, что вызывают агглютина-
цию эритроцитов. Они также способны агглюти-
нировать раковые клетки, связывать и осаждать
полисахариды и гликолипиды, стимулировать
митозы у некоторых типов клеток. Лектины ши-
роко используются в биохимических исследова-
ниях, поэтому их больше изучали биохимики
животных.
Роль лектинов в растениях еще далеко не выяс-
нена. Предполагают, что они участвуют в «узнава-
нии» клубеньковыми бактериями растения-хозяи-
на и в создании устойчивости растений к патоген-
ным грибам. Размещаются лектины под плазма-
леммой растительной клетки.
Хромопротеины — это белки, содержащие ок-
рашенную простатическую группу. К ним относятся
белки, связанные с хлорофиллом, каротиноидами,
фитохромами, а также цитохромы, ферредоксин,
пластоцианин. Хромопротеины участвуют в про-
цессах фотосинтеза, дыхания, в различных окис-
лительно-восстановительных реакциях.
90
Белки
Нуклеопротеины растений подобны таким же
белкам животных. Они сходны по строению, свой-
ствам и функциям.
2.5 АМИНОКИСЛОТНЫЙ СОСТАВ
РАСТИТЕЛЬНЫХ БЕЛКОВ
Растительные белки различаются по составу
аминокислот и их соотношению. В одних белках
некоторые аминокислоты могут отсутствовать или
содержаться в очень малых количествах, в других
их может быть очень много. Например, в зеине
кукурузы почти нет лизина и мало триптофана,
но, в то же время, много глютаминовой кислоты,
лейцина, пролина и аланина. В глиадине пшени-
цы мало триптофана, но очень много (до 50%) глю-
таминовой кислоты и глютамина. В белке клубней
картофеля много лизина.
Некоторые аминокислоты всегда содержатся
в растительных белках в большом количестве —
более 5-8%. Это аспарагиновая и глютаминовая
кислоты, их амиды, пролин, лейцин и изолейцин.
Других аминокислот в белках почти всегда мало —
до 3%. Это — лизин, триптофан, гистидин, метио-
нин и цистеин.
Как известно, ряд аминокислот в животном орга-
низме не синтезируется, поэтому они должны по-
ступать в организм вместе с пищей. Это так назы-
ваемые незаменимые аминокислоты:
валин
лейцин
изолейцин
лизин
триптофан
гистидин
треонин
метионин
фенилаланин
аргинин
Белки
91
Аргинин образуется в животном организме, но
очень медленно, поэтому требуется его поступле-
ние с пищей.
Белки делят на полноценные и неполноценные.
Полноценные белки имеют все незаменимые ами-
нокислоты в достаточном количестве. Принято го-
ворить, что у них сбалансированный аминокислот-
ный состав. Неполноценные белки не имеют в сво-
ем составе отдельных незаменимых аминокислот
или их содержание очень низкое. Эталоном сба-
лансированного аминокислотного состава служат
белки молока и яиц.
Животные белки в основном полноценные, тог-
да как среди растительных белков много неполно-
ценных. Белки зерновых культур бедны лизином
и триптофаном, у большинства бобовых в белках
недостает метионина. Однако и среди раститель-
ных белков есть полноценные. Это, например, бел-
ки картофеля и овощей (морковь, свекла, капуста,
огурцы, помидоры и др.). Белки некоторых бобо-
вых близки к полноценным, а белки сои имеют
уравновешенный аминокислотный состав.
2.6 ПРОБЛЕМА ПИЩЕВОГО БЕЛКА
И ПУТИ ЕЕ РЕШЕНИЯ
Проблема состоит в том, что в мире не хватает
пищевого белка, и почти половина населения зем-
ного шара испытывает белковое голодание. Осо-
бенно велик недостаток белка в тропических стра-
нах, где основной пищей местного населения слу-
жат плоды.
Ученые установили, что суточная потребность
человека в белке равняется 100 г. Однако это в сред-
нем. Молодым растущим организмам требуется боль-
92
Белки
ше белка, старым — меньше. При этом имеется
б виду полноценный белок, неполноценного же белка
необходимо больше для покрытия суточной потреб-
ности в незаменимых аминокислотах.
Недостаток белка в пище отрицательно сказы-
вается на здоровье человеческого организма, осо-
бенно молодого. В результате возникает болезнь
белковой недостаточности — квашиоркор. Она
выражается в недоразвитии костей скелета, мышц,
головного мозга, а в крайнем случае белкового го-
лодания наступает смерть.
Потребность человека в белке покрывается на 10-
30% животными белками, а на 70-90% — расти-
тельными. Причем в развитых странах население
потребляет больше животных белков (отношение их
к растительным 0,9-0,8), а в слаборазвитых намно-
го меньше (отношение — 0,5-0,4 и ниже).
Ученые всего мира заняты поисками путей бо-
лее эффективного использования традиционных
источников пищевого белка и новых его ресурсов.
Это касается как животного, так и растительного
белка.
Однако, как говорилось выше, основную массу
пищевого белка дают растения, и перспективы ре-
шения белковой проблемы связаны, прежде всего,
с увеличением массы именно растительного белка.
Тем более что растительный белок является пер-
вичным и его производство раз в 5 дешевле живот-
ного. Правда, многие белки растений неполноцен-
ны да и усваиваются они хуже животных. Если
усвоение наиболее полноценных белков молока и
яиц принять за 100%, то белки зерновых культур
усваиваются на 50%, бобовых — на 60-65%, ово-
щей и семян подсолнечника — на 70%.
Традиционные пути увеличения массы пищево-
го белка и его качества связаны с растениеводством
Белки
93
и селекцией: оптимизацией выращивания сель-
скохозяйственных растений с применением удоб-
рений, биологически активных веществ, эффектив-
ной борьбой с болезнями, сорняками, вредителя-
ми, подбором и рациональным размещением куль-
тур, а также с выведением новых сортов с повы-
шенной белковостью и улучшенным качеством бел-
ка. Подсчитано, что увеличение белковости зерна
пшеницы всего на 1% может дать дополнительно
1 000 000 тонн белка.
Рассматриваются новые технологии помола
зерна. При традиционном помоле основная мас-
са белка остается в отрубях. Это связано с тем,
что под семенной оболочкой зерновок находится
один слой клеток, содержащий белок (алейроно-
вый слой). Он вместе с семенной оболочкой и ока-
зывается в отрубях. Добавление отрубей к муке
при выпечке хлеба повышает его белковость.
Новые технологии помола направлены на то, что-
бы алейроновый слой зерновок отделялся от се-
менной кожуры и попадал в муку.
Источником дешевого высококачественного
белка являются водоросли. Они содержат 50-60%
белка, а после соответствующей обработки пере-
вариваемость его достигает 75-85%. В ряде стран
(США, Япония, ФРГ) культивируют хлореллу.
Ее употребляют в пищу после некоторой обра-
ботки, а также готовят из нее белковые добавки.
Считают, что хлорелла дает не только высоко-
качественный белок, но и другие ценные веще-
ства, необходимые человеческому организму.
Кроме того, считают, что она улучшает вкусо-
вые качества других продуктов (соевого творо-
га, колбасы, хлеба и др.). Однако культивиро-
вание хлореллы стоит дорого и требует больших
Энергетических затрат.
94
Белки
В некоторых странах в пищу используют сине-
зеленую водоросль спирулину, содержащую, кро-
ме ценного белка, много витаминов и других по-
лезных веществ. Например, в Африке местные
жители черпают спирулину из озера Чад плетены-
ми корзинами, сушат ее на солнце и готовят из
высохших водорослей различные блюда.
Ученые предложили новый источник полноцен-
ного белка — листья сельскохозяйственных расте-
ний. Они считают, что несмотря на низкое содер-
жание белка в листьях, извлечение его и примене-
ние является выгодным по ряду причин.
1. При поедании листьев жвачные животные
используют только 10-30% содержащегося в них
белка, а при экстракции можно получить 50-60%.
2. Белки первично синтезируются в листьях,
а затем в виде аминокислот транспортируются в
другие органы. В процессе передвижения часть
их теряется.
3. Белки извлекают из листьев молодых расте-
ний раньше, чем они повреждаются болезнями и
вредителями, что также предотвращает потери
белка.
4. После извлечения в оставшейся массе еще
имеются белки, и ее можно использовать на корм
скоту.
Белок из листьев предназначается для корма
сельскохозяйственным животным. Его в промыш-
ленных масштабах получают в ряде стран (США,
Франция), постоянно совершенствуют технологию
с целью повышения выхода белка.
В настоящее время особенно широко использу-
ются белки семян сои, которые имеют достаточно
сбалансированный аминокислотный состав и высо-
кую перевариваемость. Из сои готовят многочислен-
ные блюда с большим содержанием белка: соевое
Белки
95
молоко, творог, соусы, юбу, котлеты, паштет и др.
Кроме того, из сои получают белковые препара-
ты, которые добавляют в различные пищевые про-
дукты для повышения их белковости (колбасы,
сосиски, хлеб, кондитерские изделия и др.).
В связи с поиском источников белков и разра-
боткой новых технологий их получения и обра-
ботки возникла идея создания искусственной
пищи. Создавали искусственное мясо, рыбу, икру,
сыры. Эти продукты полностью состояли из рас-
тительных компонентов, но должны были иметь
вид, вкус и пищевую ценность животных. В 70-
80-е годы в США и других странах появилось ис-
кусственное мясо (главным образом, в консервах),
сыры. Однако широкого распространения эта идея
не получила. Оказалось, во-первых, что раститель-
ные компоненты и технология их обработки очень
дороги, и это делает искусственную пищу дороже
натуральной, во-вторых, опыты по изготовлению
искусственной пищи не всегда были удачными.
Например, искусственные сыры в США имели вид
и запах настоящих, а вкус оставлял желать луч-
шего: он был похож, как писали об этом газеты,
на вкус ластика.
2.7 ОБМЕН АМИНОКИСЛОТ И БЕЛКОВ
Ученые уже давно обратили внимание на то, что
органическому миру свойственна «поразительная
универсальность». На это указывает почти полная
идентичность компонентов, из которых построены
клеточные структуры, сходство путей синтеза и
распада многих химических соединений в клетке,
наборов ферментов, катализирующих реакции об-
мена, и т. д.
96
Белки
Мы уже обращали внимание на сходство в об-
мене углеводов растительных и животных организ-
мов. Далее еще не раз коснемся такого сходства.
Однако наша задача заключается в изучении био-
химических особенностей растений, на которых
в основном мы и будем останавливаться дальше.
Особенности азотного обмена растений
На синтезе, распаде и превращении аминокис-
лот и белков, прежде всего, отражаются особен-
ности азотного обмена растений в целом. Этих
особенностей две и связаны они с автотрофностью
растений:
1. Растения используют для питания, а значит,
для образования азотистых соединений минераль-
ные формы азота (NH4+ и NO3“). Правда, было ус-
тановлено, что растения могут поглощать и орга-
нические азотистые соединения (аминокислоты,
нуклеотиды, азотистые основания), но при этом они
их расщепляют с выделением аммиака, который
затем и используют.
2. Растения очень экономно расходуют азот. Они
не выделяют никаких азотистых продуктов распа-
да, а многократно реутилизируют азот. После рас-
щепления белков и аминокислот образовавшийся
аммиак вновь используется для синтеза азотистых
соединений. Кроме того, растение, где это возмож-
но, заменяет азотистые вещества безазотистыми.
Например, клеточная оболочка многих грибов со-
держит хитин, а клеточная оболочка растений це-
ликом состоит из безазотистых полисахаридов.
Коричнево-черные пигменты меланины у растений
в качестве мономеров имеют безазотистые феноль-
ные соединения, а у животных — содержащее азот
производное индола.
Белки
97
Общие пути синтеза аминокислот
Таких путей два — прямое аминирование кето-
кислот и переаминирование. Эти процессы сходны
у растений и животных.
При прямом аминировании аммиак присоеди-
няется к кетокислоте при участии восстановите-
ля — NADP-H и выделении воды. Реакцию ката-
лизирует соответствующая дегидрогеназа.
СН,
с=о
(Ьоон
пировиноградная
кислота
NADPH NADP*
сн,
chnh2
ioOH
аланин
Эту реакцию катализирует аланиндегидрогеназа.
У растений, кроме кетокислот, прямому амини-
рованию может подвергаться фумаровая кислота
под действием аспартат-аммиак-лиазы, которая
активируется Са2+.
СООН СООН
1 сн II + NH СН 3 Са,~ , Ан, * CHNH,
СООН СООН
фумаровая
кислота
аспарагиновая
кислота
При переаминировании происходит перенос
аминогруппы с аминокислоты на кетокислоту, в
результате образуются новые аминокислота и ке-
токислота. Реакция происходит под действием
аминотрансфераз, простетической группой кото-
рых является производное витамина Вв — фосфо-
пиридоксаль.
4. Л. А. Красильникова
98
Белки
С°°н СООН
сн2 СН3 ___________________ £н2 сн3
сн2 + с=о < > сн2 + chnh2
CHNH, СООН С=О ioOH
। 2 пировиноградная I
гплп кислота СООН алании
глютаминовая
кислота
а-кетоглютаровая
кислота
Наиболее активно участвуют в переаминирова-
нии дикарбоновые аминокислоты — аспарагино-
вая и глютаминовая и их амиды.
Образование аминокислот при фотосинтезе
Аминокислоты, наряду с углеводами, являются
продуктами фотосинтеза. В процессе фотосинтеза
образуются 5 аминокислот: серин, аланин, цисте-
ин, глицин, аспарагиновая кислота.
Непосредственно из 3-ФГК образуются серин
и аланин. Из серина путем замещения -ОН груп-
пой -SH получается цистеин.
СН2ОР <Lhoh 1 соон -2Н СН5ОР 1 2 £ q переамини* । ' рование СООН СН ОР сн,он Уп2иг +Н О 1 2
Г 2 -н.ро; । СООН СООН
3-«1 >гк фосфооксипиро- виноградная кислота фосфо- сеР серии ИИ
+R-SH
СН. <Lh 1 со< он □Р - эн -Н2О СН2 СН3 сн + 4-о-р iHNH, | ~Н3РО4 1 I СООН СООН со< SH мн2 эн
2-ФГК ФЕП алании цистеин
Белки
99
В С4-пути после карбоксилирования ФЕП обра-
зуется ЩУК, которая, подвергаясь переаминиро-
ванию, дает аспарагиновую кислоту.
сн2 £-О-Р соон соон
+СО, ФЕПК СН СН2 переамини- [
1 соон ФЕП +Н2О с=о ^оон ЩУК рование CHNH2 СООН аспарагиновая
кислота
В процессе фотодыхания из глиоксилевой кис-
лоты при переаминировании получается глицин.
се°
СООН
переаминц-
рование
сциц
соон
глиоксилевая
кислота
глиции
Из аминокислот, образовавшихся при фотосин-
тезе, могут возникать другие аминокислоты как
путем их превращения, так и путем переамини-
рования.
Механизмы обезвреживания аммиака
Исходным веществом для синтеза азотистых
соединений в растениях является аммиак. Он по-
ступает в растение из почвы, образуется при вос-
становлении NO3 и при распаде белков и амино-
кислот. Однако аммиак ядовит, и обычно он со-
держится в растениях в очень незначительных
количествах. Растение вынуждено обезвреживать
аммиак, не допуская его накопления.
100
Белки
Существует ряд механизмов обезвреживания ам-
миака в растениях. Основные из них — три: обра-
зование амидов, мочевины и аммонийных солей.
Образование и роль амидов в растении
Амиды синтезируются из аспарагиновой и глю-
таминовой кислот путем присоединения молеку-
лы аммиака. Реакции катализируют аспарагин-
и глютаминсинтетаза соответственно. В реакции
участвует АТР, т. к. для образования C-N-связи
требуется энергия, синтетазы активируются иона-
ми Mg2+.
СООН
I + NH.
chnh2
(Looh
ATP ADP
< Mg2* >-HPO
аспарагиновая
кислота
СООН
CH ЛТР ADP
I 2
CH2 + NH3 < »
CHNH2
COOH
глютаминовая
кислота
c*°
<£NH2
CH2
chnh2
ioOH
аспарагин
conh2
СИ,
chnh2
COOH
глютамин
Таким образом, каждая молекула дикарбоновой
аминокислоты может связать и обезвредить одну
молекулу аммиака. Амиды могут накапливаться в
больших количествах. Особенно много их образу-
ется при прорастании семян бобовых в темноте,
Белки
101
когда идет интенсивный распад запасных белков
и получается большое количество аммиака. К тому
же в темноте из-за недостатка углеводов снижает-
ся использование NH3 на синтез аминокислот.
Амиды играют в метаболизме растений очень
важную роль:
1) образуют важный механизм обезвреживания
аммиака в растении;
2) как и дикарбоновые аминокислоты, активно
участвуют в переаминировании, отдавая амидную
группу не только на образование аминокислот, но
и других соединений (глюкозамин, азотистые ос-
нования и др.);
3) представляют собой резерв дикарбоновых
аминокислот, которым принадлежит важная роль
в азотном обмене;
4) входят в состав многих растительных белков;
5) являются транспортной и запасной формой
азота.
Образование мочевины
Мочевина — безвредное для растений соеди-
нение и может накапливаться в заметных коли-
чествах, особенно в растениях, имеющих на кор-
нях микоризу. Используется мочевина, разлага-
ясь с выделением аммиака под действием фер-
мента уреазы.
NH - C-NH,+ Н,0 ----► 2NH+CO,
2 II 2 2 3 2
О
мочевина
Молекула мочевины обезвреживает 2 молекулы
аммиака. Образование мочевины происходит в ре-
зультате нескольких ферментативных реакций,
102
Белки
которые составляют орнитиновый цикл. Причем
орнитиновый цикл растений идентичен животно-
му, который изучают в курсе общей биохимии.
Образование аммонийных солей
Более просто обезвреживается аммиак у так на-
зываемых «кислых» растений. Это растения с кис-
лым клеточным соком (pH 1,2-1,5), содержащим
много органических кислот (щавелевая, яблочная,
изолимонная и др.), — щавель, ревень, осоки, хво-
щи, бегония и др. У таких растений аммиак свя-
зывается не ферментативным, а химическим пу-
тем в виде аммонийных солей.
СООН coonh4
Лн, сн2
I 2 + NH, -------> I
снон снон
ioOH СООН
яблочная яблочно-кислый
кислота аммоний
СООН coonh4
I + NH,------------> I
СООН СООН
щавелевая. щавелево-кислый
кислота аммоний
Это очень емкий механизм. «Кислые» растения
выдерживают в 4-5 раз более высокое содержание
аммиака, чем растения, у которых pH клеточного
сока близко к нейтральному.
Общие пути распада аминокислот
Таких путей два — дезаминирование и декар-
боксилирование.
Белки
103
Дезаминирование — это распад аминокислот на
аммиак и кетокислоту. Реакция происходит в два
этапа. На 1-м этапе от аминокислоты отнимается
2 атома водорода и образуется иминокислота. На
2-м этапе под действием воды из иминокислоты
образуется кетокислота и выделяется аммиак.
-2Н R-C-COOH
-------* II
NH
иминокислота
+НгО R-C-COOH+NH,
О
кетокислота
1 R-CH-COOH
nh2
аминокислота
2 R-C-COOH
NH
иминокислота
В растениях реакции 1-го этапа происходят ина-
че, чем в животных организмах. В них участвуют
2 фермента — дегидрогеназа и полифенолоксида-
за, а также полифенолы и хиноны, способные вза-
имно превращаться. Этап превращения аминокис-
лоты в иминокислоту можно представить в виде
следующей схемы.
R-CH-COOH
I
nh2
хинон H2O
V
полифенол
R-C-COOH
I
NH
дегидрогеназа
полифенолоксидаза
104
Белки
Превращение хинонов в полифенолы можно
представить так:
+2Н
-2Н
хинои
полифеиол
В растениях дезаминирование фенилаланина
и тирозина происходит иначе, чем остальных ами-
нокислот, с образованием ненасыщенных арома-
тических кислот — коричной и гидроксикоричнбй
(кумаровой). Реакция идет под действием соответ-
ствующих аммиак-лиаз.
сн-сн-соон
-NH,
фенилаланин
СН=СНСООН
6)
коричная кислота
СН,~СН~СООН
он *
тирозин
СН=СНСООН
ф
он
кумаровая (гидрокси-
коричная) кислота
Из коричной и гидроксикоричной кислот обра-
зуются фенольные соединения.
При декарбоксилировании аминокислот образу-
ются амины и углекислый газ. Из моноаминомо-
Белки
105
нокарбоновых аминокислот получаются моноами-
ны, из диаминомонокарбоновых — диамины. Ре-
акции осуществляют ферменты декарбоксилазы,
которые в качестве кофермента содержат фосфо-
пиридоксаль.
Образование моноаминов
СН.ОН СН.ОН
I -СО I
CHNH, _______2______> CHNH
СООН
серин
этанол-
ам ин
СН, СН,
^Н
I
CHNH,
iooH
-со.
сн, сн,
^н
> I
ch2nh2
валин
изобутил-
амии
СН-СНСООН
он
тирозин
N
xAcHjChcooh
NH, -----
ch,ch,nh,
он
тир амин
N
tlcH^NH,
гистидни
гистамин
106
Белки
Образование диаминов
ch2nh2 ch2nh2
СН, ^21 . Ан, си,
chnh2 ch2nh2
соон путресцин
орннтнн
CH.NH, сн2 CHL.NH, сн2
СН, Ан, , СН, СН,
<!:hnh2 CHjNHj
соон кадаверин
лнзнн
При декарбоксилировании моноаминодикарбо-
новых аминокислот образуются монокарбоновые
аминокислоты.
Амины — ядовитые вещества и могут вызвать
отравление как животных, так и растений. Они в
малых количествах найдены в грибах (рожки спо-
рыньи, мухоморы, дрожжи) и в растениях (дур-
ман, белена, омела, соя). Содержание аминов в
растениях может возрастать при неблагоприятных
условиях выращивания. Так, при резком недостат-
ке калия в растениях ячменя и льна наблюдалось
накопление путресцина и признаки отравления
этим амином.
Белки
107
СООН
I
си.
chnh2
(Look
аспарагиновая
кислота
-со,
------------>
CHjNH,
СООН
0-аланнн
СООН
I
си.
си.
CHNH,
СООН
CH.NH,
си.
-----------------> СН.
соон
у-амнномасляная
кислота
глютаминовая
кислота
Амины, образующиеся при декарбоксилирова-
нии аминокислот, обычно в растениях не накап-
ливаются, а вовлекаются в обмен веществ и пре-
терпевают различные превращения.
Основной путь превращения аминов — их окис-
ление. Окисление моноаминов происходит под дей-
ствием моноаминооксидаз с образованием альде-
гида и аммиака.
r-ch2nh2
амнн
+‘/2о2
> R—С Л, +NH,
Г1 3
альдегид
Окисление диаминов катализируют диаминоок-
сидазы. При этом окисление может идти двумя
путями — с образованием аминоальдегида или
диальдегида. Альдегиды затем легко окисляются
До соответствующих кислот.
108
Белки
аминомасляный у-аминомасляная
соон
I
ен.
сн,
СН^
о™
ей.
альдегид кислота
янтарный
альдегид
янтарная
кислота
Из диаминов в растениях синтезируются различ-
ные гетероциклы, а из них — гетероциклические
соединения, например, алкалоиды. Из путресцина
образуется гетероцикл пирролидин, а из него пир-
ролидиновые алкалоиды; из кадаверина — гетеро-
цикл пиперидин и пиперидиновые алкалоиды.
h2nnh2
путресцин
пирролидин
кадаверин пиперидин
Метилирование аминокислот
Аминокислоты в растениях могут подвергаться
метилированию. При этом метилируется азот ами-
ногруппы, одновременно превращаясь из трех-
Белки
109
в пятивалентный. Метилированные аминокислоты
называют бетаинами, т. к. впервые они были по-
лучены из сахарной свеклы (Beta vulgaris).
скж
СООН
+ 3(-снз)
сн,
ch2n+—сн,
COO- ^CHJ
глицин глициибетаин
пролин
+ 2(-СН,)
COO
пролиибетанн (стахидрии)
Бетаины содержатся в клеточном соке растений,
участвуя в создании его концентрации.
Донором метильных групп при образовании бе-
таинов может быть, прежде всего, SAM (S-адено-
зилметионин). Он образуется из аминокислоты
метионина при взаимодействии ее с АТР. При этом
сера переходит из 2-валентной в 4-валентную, к
ней присоединяется аденозил — остаток нуклео-
зида, состоящего из аденина и рибозы. Одна ва-
лентность серы остается свободной. При этом вы-
деляется неорганический фосфат и неорганический
пирофосфат.
сн, сн,
+S-аденозил
сн2 сн2 + Н,Р,О,
1 + АТР —> 1
си. си. + Н,РО4
CHNH 1 1 CHNH, 1 г
соон соон
метиоиин
S-адеиозилметиоиин (SAM)
110
Белки
SAM — основной метилирующий агент у рас-
тений. Но донорами метильных групп могут вы-
ступать и другие соединения, например, те же
бетаины. Перенос метильных групп от доноров к
акцепторам осуществляют ферменты метилтранс-
феразы.
SAM выполняет в растениях еще ряд функ-
ций. Например, из SAM образуется фитогормон
этилен.
Метилированию могут подвергаться не только
аминокислоты, но и их амины, которые при этом
теряют свою токсичность. Распространен в рас-
тениях холин — метилированный этаноламин,
который получается при декарбоксилировании
серина.
сн,он сн,он сн,он
chnh2 соон -СО, 1 +Х-СНЛ 1 ✓ нз — » CH2NH2 2 4- CH2N+—СН3 чсн3 этаноламин
серии (коламин) холин
Холин играет важную роль в метаболизме рас-
тительного организма.
1. Он входит в состав фосфолипидов — холин-
фосфатидов (лецитинов).
2. Он может выступать донором метильных
групп при метилировании ряда соединений.
3. У некоторых растений холин содержится
в клеточном соке, участвуя в создании его концен-
трации.
Этаноламин (коламин) и серин также могут вхо-
дить в состав фосфолипидов — этаноламин- и се-
ринфосфатидов.
Белки 111
Пул свободных аминокислот и их роль
в растении
Пул свободных аминокислот в растениях обыч-
но содержит 20-30 аминокислот, состав и соот-
ношение которых очень изменчивы и зависят от
возраста растений и условий окружающей сре-
ды. Пул, с одной стороны, пополняется амино-
кислотами в результате синтеза их de novo и рас-
пада уже «использованных» клеткой белков, с
другой стороны, он является источником амино-
кислот, необходимых для синтеза самых различ-
ных азотистых соединений клетки. Отсюда оче-
видно, что любое изменение в метаболизме клет-
ки тотчас же отражается на составе пула свобод-
ных аминокислот.
Все это указывает на чрезвычайно важную роль
свободных аминокислот в обмене веществ расти-
тельного организма. Действительно, функции сво-
бодных аминокислот в растительной клетке мно-
гочисленны и разнообразны.
1. Самая главная функция аминокислот — это
построение белковой молекулы. Ее выполняют
20 протеиногенных аминокислот.
2. Аминокислоты, протеиногенные и непротеи-
ногенные, образуют очень активные пептиды (глю-
татион, а-аманитин).
3. Ряд аминокислот участвует в образовании
пуринов и пиримидинов нуклеотидов, которые,
в свою очередь, входят в состав НК и макроэргов
(глицин, аспарагиновая кислота, глютамин).
4. Аминокислоты участвуют в механизмах обез-
вреживания аммиака. Аспарагиновая и глютами-
новая кислоты образуют амиды, а орнитин, цит-
руллин и аргинин обезвреживают аммиак в виде
Мочевины в орнитиновом цикле.
112
Белки
5. Некоторые аминокислоты принимают учас-
тие в синтезе витаминов и образовании кофермен-
тов. Из аспарагиновой кислоты синтезируется ни-
котиновая кислота, амид которой входит в NAD
и NADP. P-Аланин имеется в составе пантотено-
вой кислоты, входящей в коэнзим А.
6. Глютаминовая кислота является источником
образования хлорофилла.
7. Ряд аминокислот служит исходными соеди-
нениями для образования фитогормонов и других
биологически активных веществ. Так, фитогормон
ауксин образуется из триптофана, этилен — из
метионина. 0-Аланин является фактором роста
дрожжей.
8. Главный метилирующий агент растений — SAM
образуется из аминокислоты метионина.
9. Бетаины — это метилированные аминокис-
лоты. Они участвуют в создании концентрации
клеточного сока и могут также выступать донора-
ми метильных групп.
10. В образовании аминосахаров (глюкозамин
и др.) источником аминогрупп выступает глютамин.
11. Некоторые аминокислоты (серин) и их про-
изводные (этаноламин, холин) являются компонен-
тами липидов (фосфолипидов), которые, в свою
очередь, входят в состав липопротеинов.
12. Некоторые гликозиды образуются из амино-
кислот. Например, цианогенные гликозиды (амиг-
далин).
13. Все алкалоиды, как правило, образуются из
аминокислот (никотин, атропин, кокаин и др.).
14. Из аминокислот образуются не только азо-
тистые, но и некоторые безазотистые соединения.
Так, при декарбоксилировании фенилаланина и
тирозина получаются коричная и гидроксикорич-
ная кислоты, которые являются источником обра-
Белки
113
зования многих фенольных соединений (кумари-
ны, флавоноиды, меланины, лигнин и т. д.).
15. Велика роль аминокислот в защитных ре-
акциях растений при неблагоприятных услови-
ях. При стрессе накапливаются пролин, аланин,
аминомасляная кислота и даже могут появляться
D-аминокислоты.
16. Учитывая, что аминокислоты образуются из
углеводов при фотосинтезе и дыхании, а также их
многочисленные функции, вполне правомерно зак-
лючить, что они связывают в растении основные
пути обмена — обмен углеводов, белков, липидов,
нуклеиновых кислот, а также обмен витаминов,
пигментов и веществ вторичного происхождения.
Биосинтез белка
Биосинтез белка в растениях происходит точ-
но так же, как и у животных, на полисомах при
участии матричной и транспортной РНК.
Однако у растений существует дополнительный
путь синтеза белка, вернее, путь образования раз-
нообразных запасных белков. Это — образова-
ние белков с помощью транспептидаз. Фермен-
ты переносят пептиды от одной белковой моле-
кулы к другой. При этом образуются новые бел-
ки, но последовательность аминокислот у них со-
храняется от первоначальных молекул-доноров,
которые синтезировались на рибосомах. Значит,
просто идет перекомбинация участков разных
белковых молекул с заданной последовательнос-
тью аминокислот. В результате образуются новые
белки без больших затрат энергии и материала
на образования сложных структур (рибосом,
РНК). С помощью транспептидаз образуются не-
которые запасные белки.
114
Белки
Распад белков
Распад белков у растений, как и у животных,
происходит гидролитическим путем с помощью
протеолитических ферментов — ферментного ком-
плекса, который содержит протеазы и пептидазы.
Протеазы растений дезагрегируют молекулы
белка, расщепляя их на крупные фрагменты. Эти
ферменты действуют в кислой среде, активируют-
ся восстановителями и ингибируются окислителя-
ми. Это учитывают в процессе приготовления тес-
та, когда необходимо ингибировать протеазы, т. к.
дезагрегирование белков клейковины ухудшает
подъемистость теста и качество выпекаемого хлеба.
Пептидазы гидролитически расщепляют фраг-
менты белковых молекул до аминокислот.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАНИЯ
1. Каковы функции белков в растительном орга-
низме и каково их содержание?
2. Сравните аминокислоты растительных и жи-
вотных организмов. Чем отличаются протеиноген-
ные и непротеиногенные аминокислоты? Как их
классифицируют? Каковы их функции? Приведи-
те необходимые примеры.
3. Что вы знаете о пептидах растений?
4. На чем основана классификация белков? Рас-
скажите об основных группах простых и сложных
растительных белков.
5. Что вы знаете об аминокислотном составе
растительных белков? Что такое полноценные и не-
полноценные белки?
6. В чем заключается проблема пищевого бел-
ка? Каковы пути ее решения?
Белки
115
7. Каковы особенности азотного обмена рас-
тений?
8. Расскажите об общих путях образования ами-
нокислот в растениях. Как образуются аминокис-
лоты в процессе фотосинтеза?
9. Какие механизмы обезвреживания аммиака
существуют в растении? Расскажите об образова-
нии и роли амидов в растении.
10. Какие вы знаете пути распада аминокислот
в растении? Каковы отличия в механизме дезами-
нирования аминокислот растений от животных?
Расскажите о декарбоксилировании аминокислот
в растении и путях превращения аминов.
11. Что вы знаете о метилировании аминокислот?
12. Расскажите о роли аминокислот в метабо-
лизме растений.
3. липиды
Липиды — это большая группа природных со-
единений, разных по строению и функциям, но
близких по физико-химическим свойствам. Их ха-
рактерной особенностью является высокое содер-
жание в молекулах гидрофобных радикалов и
групп, что делает их нерастворимыми в воде. Од-
нако липиды хорошо растворяются в различных
органических растворителях: эфире, ацетоне, бен-
зине, бензоле, хлороформе и др.
Липиды делят на 2 группы: жиры и жироподоб-
ные вещества, или липоиды.
3.1 ЖИРЫ
Растительные жиры, как правило, жидкие, и их
называют маслами. Жиры выполняют запасную и
энергетическую функции и в небольших количе-
ствах содержатся во всех растительных клетках.
Обычно в вегетативных органах жира гораздо мень-
ше, чем в плодах и семенах. Так, в листьях, стеб-
лях и корнях количество жира редко превышает
5% от сухой массы. В то же время плоды и семена
некоторых растений отличаются высоким содер-
жанием жира и используются для промышленно-
го получения растительных масел.
Содержание жира в семенах и плодах некоторых
культурных растений (в % на сухой вес)
Горох, фасоль 2
Кукуруза 5
Соя, лен, хлопчатник 20-30
Липиды
117
Подсолнечник, горчица 30-50
Арахис, мак, маслины 40-50
Кунжут, клещевина 50-60
Кокосовая пальма 65
До 90% всех видов растений в качестве основно-
го запасного вещества откладывают в семенах мас-
ла, которые используются при их прорастании. От-
ложение в запас жиров для растений энергетиче-
ски «выгодно», т. к. при их распаде выделяется по-
чти в 2 раза больше энергии, чем при распаде угле-
водов или белков, а также образуется в 2 раза боль-
ше воды, что особенно важно при прорастании се-
мян в условиях недостаточного водоснабжения.
Растительные масла находят самое широкое
применение. Их используют в пищу, в пищевой и
парфюмерной промышленности, в медицине, в тех-
нике в качестве смазочных масел и при изготовле-
нии высококачественных лаков и красок.
Состав растительных масел
Жиры представляют собой смесь сложных эфи-
ров глицерина и высокомолекулярных жирных кис-
лот. Их называют глицеридами. В 1976 г. Между-
народной комиссией по биохимической номенкла-
туре было предложено новое название — ацилгли-
церины (ацилглицеролы). Однако старые и более
привычные названия продолжают использоваться.
В жирах содержатся в основном триглицериды.
CH2OR,
CHORj R|; К,; R3 — остатки высокомолекулярных
(^H 0g жирных кислот
триглицерид
Диглицериды и моноглицериды в жирах встре-
чаются очень редко.
118
Липиды
Растительные масла, полученные из семян, не яв-
ляются чистыми триглицеридами, а всегда содер-
жат некоторое количество примесей. На долю три-
глицеридов приходится 95-98%, остальное состав-
ляют примеси: свободные жирные кислоты (1-2%),
фосфолипиды (1-2%), стероиды (0,3-0,5%), а так-
же каротиноиды, растворимые в жирах витами-
ны, терпеноиды, фенольные соединения. Присут-
ствие примесей повышает пищевую ценность рас-
тительных масел. Многие из них оказывают ле-
чебное действие. Желтоватый цвет растительных
масел зависит от содержания в них каротиноидов.
Конопляное и лавровое масла, в составе которых
присутствует некоторое количество хлорофилла,
имеют зеленоватую окраску.
В качестве примера приведем состав облепихово-
го масла. Оно содержит, кроме триглицеридов, боль-
шое количество витаминов (каротиноиды, Вр В2, К,
Е, фолиевая кислота), флавоноиды и другие феноль-
ные соединения, стероиды, тритерпеноиды, полипре-
нолы, микроэлементы, дубильные вещества и др.
Многие из этих веществ являются лечебными.
Так, кумарины уменьшают свертываемость крови
и тем самым препятствуют образованию тромбов,
тритерпеновые кислоты и спирты стимулируют
сердечную деятельность, ситостеролы связывают
холестерин и тормозят развитие атеросклероза.
Жирные кислоты и триглицериды масел
Свойства жиров определяются составом жирных
кислот, образующих эфирную связь с глицерином.
Жирные кислоты, остатки которых входят в со-
став триглицеридов, могут быть насыщенными,
моно- и полиненасыщенными, содержать цикли-
ческие и полярные группы. Они почти все имеют
Липиды
119
четное число углеродных атомов (С6-С22) и нераз-
ветвленную цепь.
Важнейшие насыщенные жирные кислоты
растительных масел
Название Формула Где встречается
Капроновая СвН12О2 Кокосовое масло (до 1%)
Каприловая С8Н1вО2 Кокосовое масло (7%)
Каприновая W, Масло пальм
Лауриновая с.2н24о2 Масло лавра и пальм
Миристиновая С14Н28О2 Масло тропических растений
Пальмитиновая С .Н ,0 Широко распространена
Стеариновая с18нзво2 Широко распространена
Арахиновая ^20^40^2 Масло арахиса и др.
Бегеновая С22Н44О2 Масло арахиса, рапса и др.
Важнейшие ненасыщенные жирные кислоты
растительных масел
Название Строение
Олеиновая с18нмо2 СН3(СН2)7СН=СН(СН2)7СООН
Линолевая С18Н82О2 СН3(СН2)4СН=СНСН2СН=СН(СН2)7СООН
Линоленовая ^18^30^2 CH3CH2CII<MCH2CH=CIICH2CII==CH(CH2)7COOH
Ненасыщенные жирные кислоты имеют двойную
связь в цис-положении, а у полиненасыщенных
двойные связи разделены метиленовыми группами.
В растительных маслах ненасыщенных жирных
кислот гораздо больше, чем насыщенных, что оп-
ределяет их жидкую консистенцию. Ученые рас-
считали, что олеиновая и линолевая кислоты со-
ставляют более 60% всех жирных кислот расти-
тельных масел.
Линолевая и линоленовая кислоты не могут син-
тезироваться животным организмом. Они относят-
ся к незаменимым жирным кислотам и должны
ежедневно поступать в организм с пищей.
120
Липиды
Кроме перечисленных выше распространенных
жирных кислот, в растительных маслах встреча-
ются еще редкие кислоты, которые характерны для
той или иной небольшой группы растений. Прав-
да, в данной группе они могут содержаться в до-
вольно больших количествах.
Например, масла семян растений из семейства
крестоцветных (рапс, горчица) содержат от 42 до
55% эруковой кислоты. Это ненасыщенная жир-
ная кислота, имеющая 22 углеродных атома и одну
двойную связь.
СН3(СН2),СН=СН(СН2)1 .СООН
эруковая кислота
СН3(СН2)5СНСН2СН=СН(СН2)7СООН
он
рицинолевая кислота
Масло клещевины в своем составе имеет рици-
нолевую кислоту, которая является мононенасы-
щенной гидроксикислотой.
В масле некоторых тропических деревьев и кус-
тарников из семейства Flacourtiaceae (гиднокарпус)
содержатся циклические жирные кислоты — гид-
нокарповая и хаульмурговая.
СН=СН^
I / СН(СН, ),„СООН
сн2- сн/ 210
гиднокарповая кислота
сн = сн
I ;сн(сн,),,соон
сн2- сн/ 212
хаульмурговая кислота
С присутствием этих кислот связывают лечеб-
ные свойства масла указанных растений. Оно по-
давляет развитие туберкулезных бактерий, и, счи-
тают, лечит проказу.
Масло из плодов тунгового дерева содержит до
80% олеостеариновой кислоты, которая является
Липиды
121
изомером линоленовой, но имеет своеобразную кон-
фигурацию: ее две двойные связи находятся в
транс-, а одна двойная связь — в цис-положении.
Кроме того, двойные связи не разделены метиле-
новыми группами. Благодаря такому строению олео-
стеариновая кислота придает тунговому маслу спе-
цифические свойства — способность к полимери-
зации и затвердеванию при температуре выше
282°С, что делает его ценным сырьем для лакокра-
сочной промышленности.
СН3(СН2)3СН-СНСН-СНСН-СН(СН2),СООН
олеостеариновая кислота
Глицериды, входящие в состав масел, могут быть
однокислотными и разнокислотными. Однокислот-
ные триглицериды в своем составе содержат остат-
ки одной кислоты, разнокислотные — двух или трех.
Однокислотные триглицериды в жирах встреча-
ются редко, у немногих растений. Так, в оливко-
вом масле содержится до 80% триглицеридов, в
которых все гидроксильные группы глицерина эте-
рифицированы олеиновой кислотой, а в касторо-
вом масле — рицинолевой. Большинство же рас-
тительных масел представляет собой смесь разно-
кислотных триглицеридов. В состав масел обычно
входит 5-6 жирных кислот, которые образуют не-
сколько десятков в основном разнокислотных три-
глицеридов. В настоящее время изучено более 1500
различных триглицеридов.
Основные константы масел
Свойства жира характеризуются рядом физико-
химических констант. Мы рассмотрим три констан-
ты, которые важны для определения качества рас-
122
Липиды
тительных масел: температуру плавления, кислот-
ное число и йодное число.
Поскольку растительные масла в основном жид-
кие, то температура плавления имеет значение
лишь для немногих твердых масел. Твердыми при
комнатной температуре являются масло какао,
кокосовое, пальмовое и лавровое масла. Эти масла
в своем составе содержат много насыщенных жир-
ных кислот.
Масло какао получают из семян, которые со-
держат 45-55% жира. После его удаления остает-
ся какао-порошок, используемый для приготовле-
ния известного напитка и в кондитерской промыш-
ленности. Масло какао имеет желтоватый цвет и
приятный запах, температура его плавления 30-
34°С. В составе его триглицеридов найдены лаури-
новая, пальмитиновая, стеариновая, арахиновая и
олеиновая кислоты. Это масло применяется в кон-
дитерской и парфюмерной промышленности.
Из мякоти кокосовых орехов — копры получа-
ют кокосовое масло. В копре его содержится до
60-65%. Температура его плавления 23-28°С. При
комнатной температуре оно мягче сливочного мас-
ла, имеет приятный запах и вкус. В составе три-
глицеридов оно имеет в основном лауриновую, ми-
ристиновую кислоты, а также 2-3% капроновой,
каприловой и каприновой. Кокосовое масло исполь-
зуется в пищевой, парфюмерной, мыловаренной
промышленности, при изготовлении мазей. Мыло,
изготовленное на кокосовом масле, — единствен-
ное, пенящееся в соленой морской воде.
Масличная пальма содержит масло в семенах
и плодах. Это масло является твердым при ком-
натной температуре. Масло плодов несъедобно и
используется в качестве смазочного и для произ-
водства свечей и мыла. В семенах содержится съе-
Липиды
123
добное масло. Его используют в пищу и для приго-
товления мазей.
Лавровое масло, которое получают из семян лав-
ра благородного, только условно можно назвать
твердым: у него мазеобразная консистенция. Это
масло имеет зеленоватый цвет из-за содержащего-
ся в нем хлорофилла и своеобразный запах, кото-
рый зависит от присутствия эфирного масла.
Кислотное число — это количество миллиграм-
мов КОН, которое необходимо для нейтрализации
свободных жирных кислот, содержащихся в 1 г
жира. Это важный показатель качества масла.
Обычно масла содержат небольшое количество сво-
бодных жирных кислот (1-2%). Однако при хра-
нении масел их содержание увеличивается. Это
снижает качество пищевого масла, т. к. свободные
жирные кислоты придают ему неприятный запах
и вкус. Много свободных жирных кислот бывает
также в масле, полученном из недозрелых семян.
Йодное число — это количество граммов йода,
которое связывается 100 г жира. Поскольку йод
присоединяется по месту двойных связей, величи-
на йодного числа характеризует содержание нена-
сыщенных кислот в масле.
-СН =СН- +J ------> -СН-СН-
I I
J J
Схема связывания иода
Чем выше йодное число, тем более жидкий жир
и тем менее он пригоден в пищу, а чаще использу-
ется для изготовления олифы, лаков и красок.
По величине йодного числа масла делят на не-
высыхающие, полувысыхающие и высыхающие.
Невысыхающие масла имеют йодное число до 85.
Это животные жиры и твердые растительные мас-
ла. Величина йодного числа от 85 до 130 харак-
124
Липиды
теризует полувысыхающие масла. Они обычно яв-
ляются пищевыми (оливковое, миндальное, абрико-
совое, хлопковое, горчичное, рапсовое и др.). К вы-
сыхающим относятся масла с йодным числом выше
130 (льняное, ляллиманцевое, перилловое, конопля-
ное, тунговое и др.). Особенно высоким йодным чис-
лом отличается тунговое масло — 246. Оно, как го-
ворилось выше, является самым высококачествен-
ным сырьем для лакокрасочной промышленности.
Чем выше йодное число, а значит, больше двой-
ных связей в жирных кислотах, тем легче окисля-
ется данный жир. Под действием кислорода возду-
ха происходит окисление и высыхание раститель-
ных масел. В процессе высыхания образуются СО2,
вода, летучие альдегиды и низкомолекулярные
кислоты. Масло постепенно густеет и покрывается
тонкой эластичной и прочной пленкой. Именно это
свойство определило использование растительных
масел с высоким йодным числом при изготовле-
нии лаков и красок.
Прогоркание масел
При длительном хранении жиры и содержащие
их продукты портятся — прогоркают, приобретая
неприятный вкус и запах. Причиной прогоркания
может быть действие кислорода воздуха, микроор-
ганизмов и ферментов (липазы и липооксидазы).
Под действием фермента липазы происходит
разложение триглицеридов и накопление свобод-
ных жирных кислот, возрастает кислотное число,
что влечет за собой снижение качества масла.
Иногда прогоркание зависит от жизнедеятель-
ности микроорганизмов. В этом случае неприят-
ный вкус и запах масла зависит от кетонов, обра-
зовавшихся при окислении свободных жирных
Липиды
125
кислот. Однако такое кетонное прогоркание воз-
можно только при наличии в масле жирных кис-
лот с числом углеродных атомов от 6 до 12.
Наиболее распространенным является прогорко-
ние под действием кислорода воздуха. При этом
кислород окисляет ненасыщенные жирные кисло-
ты по месту двойной связи с образованием переки-
си или углеродный атом, соседний с двойной свя-
зью, с образованием гидроперекиси.
R.-CH = СН - R +0,----> R,- СН- СН - R,
22 1 I I 2
0 — 0
Схема образования перекиси
RrCH2CH = CHCH-R2+ 02---->R - CH2CH = CHCH-R2
О-О-Н
Схема образования гидроперекиси
Образовавшиеся перекиси и гидроперекиси разла-
гаются и получаются альдегиды и кетоны. Последние,
как было сказано выше, и придают жирам неприят-
ный вкус и запах. Прогоркание усиливается под вли-
янием влаги, света и повышенной температуры.
Поскольку без кислорода прогоркание не про-
исходит, жиры хорошо сохраняются в вакууме.
Кроме того, для предотвращения окислительного
прогоркания к жирам прибавляют антиоксидан-
ты. Антиоксидантами являются многие фенольные
соединения. К числу наиболее активных антиок-
сидантов относится витамин Е (токоферол).
Гидрогенизация масел
Жидкие растительные масла можно превратить
в твердые путем гидрогенизации. Для этого через
масло пропускают водород в присутствии специ-
ального катализатора. При этом водород присо-
126
Липиды
единяется к ненасыщенным жирным кислотам по
месту двойных связей, превращая их в насыщен-
ные, а жидкое масло — в твердое. Твердые расти-
тельные масла используются в пищевой промыш-
ленности для производства маргарина.
3.2 ЖИРОПОДОБНЫЕ ВЕЩЕСТВА (ЛИПОИДЫ)
К! жироподобным веществам относят:
Фосфолипиды
Сфийголипиды
Гликолипиды
Стероиды
Воска
Кутин и суберин
Растворимые в жирах пигменты
(хлорофиллы, каротиноиды, фикобилины).
Из перечисленных групп жироподобных веществ
мы будем рассматривать гликолипиды, стероиды,
воска, кутин и суберин. Фосфолипиды и сфинго-
липиды изучаются в курсе общей биохимии, а ра-
створимые в жирах пигменты — в курсе физиоло-
гии растений.
Гликолипиды
Гликолипиды — это жироподобные вещества,
в молекулах которых глицерин соединен сложно-
эфирной связью с двумя остатками жирных кислот
и гликозидной связью с каким-нибудь сахаром. Гли-
колипиды являются основными липидами мембран
хлоропластов. Их в фотосинтетических мембранах
примерно в 5 раз больше, чем фосфолипидов.
Существует две группы гликолипидов — галак-
толипиды и сульфолипиды.
Липиды
127
Галактолипиды содержат в качестве углеводно-
го компонента галактозу. Причем с диглицеридом
может связываться один, два, три и даже четыре
остатка галактозы. Из них наиболее важные р-мо-
ногалактозилдиглицерид (р-МГД) и дигалактозил-
диглицерид (ДГД), содержащие соответственно
один и два остатка сахара. Галактолипиды состав-
ляют 40% всех липидов мембран хлоропластов.
При этом МГД в 2 раза больше, чем ДГД. Жирно-
кислотный компонент галактолипидов представлен
в основном линоленовой кислотой.
Р-мгд
ДГД
Сульфолипиды — это тоже компоненты фото-
синтетических мембран. Но содержание их в хло-
ропластах невели-
ко, около 3% от
всех мембранных
липидов. Углевод-
ный остаток суль-
фолипидов пред-
ставлен сульфохи-
новозой, а жирно-
кислотные — в ос-
новном линолено-
вой кислотой.
CH.OR
I
CHOR
остаток
^сульфо-
хиновозы
Н
ОН
Р-сульфоглнкознлднглнцерид
128
Липиды
Стероиды
Основу стероидов составляют 4 конденсированных
карбоцикла: 3 шестичленных и 1 пятичленный.
В животных организмах стероидную природу имеет
холестерин и ряд гормонов. В растениях же стерои-
ды более разнообразны. Чаще они представлены спир-
тами — стеролами. Около 1% стеролов связаны слож-
ноэфирной связью с жирными кислотами — паль-
митиновой, олеиновой, линолевой и линоленовой.
В растениях, а также дрожжах, рожках споры-
ньи, грибах распространен эргостерол. Из него под
влиянием ультрафиолета образуется витамин D.
Из растений выделены различные стеролы: из
соевого масла — стигмастерол, из листьев шпина-
та и капусты — спицастерол, из кактуса — лофе-
нол, из многих растений — группа ситостеролов.
Различные стеролы отличаются друг от друга
расположением двойных связей в кольцах и стро-
ением боковой цепи. Отличительной особенностью
растительных стеролов является боковая цепь из
одного или двух углеродных атомов у С-24.
Стеролы входят в состав клеточных мембран
растений, предполагается их участие в контроле
проницаемости. Обнаружено, что основная масса
стеролов растительной клетки содержится в мемб-
ранах ЭР и митохондрий, а их эфиры связаны
с фракцией клеточных стенок.
Липиды
129
Воска
Воска содержатся в кутикуле и образуют тонкий
слой на ее поверхности. Восковой налет покрывает
листья, стебли и плоды, предохраняя их от высы-
хания и поражения микроорганизмами.
Воска — это жироподобные вещества, твердые
при комнатной температуре. В состав восков вхо-
дят сложные эфиры жирных кислот и одноатом-
ных высокомолекулярных спиртов жирного ряда.
Кроме того, воска содержат свободные жирные кис-
лоты и спирты, а также углеводороды парафиново-
го ряда. Жирные кислоты восков как в эфирах, так
и свободные, обычно более высокомолекулярны, чем
в триглицеридах — С24~Сзв и С25~С29 (карнаубовая,
монтановая, церотиновая). Высокомолекулярны и
спирты — С22~С32 (цериловый, мирициловый). Уг-
леводороды имеют нечетное число углеродных ато-
мов — С21~С37. В восках может присутствовать не-
которое количество альдегидов и кетонов.
Состав восков у разных растений различен. На-
пример, воск листьев капусты состоит главным
образом из Си-углеводорода и его производных,
содержащих карбонильную группу =С=О. Воск
виноградных ягод имеет эфиры пальмитиновой
кислоты, церилового и мирицилового спиртов.
Растительные воска используются при изготов-
лении свечей, помад, мыла, пластырей, шампуней.
Например, на поверхности листьев пальмы Coripha
ceriphera, произрастающей в Южной Америке,
выделяется значительное количество воска — до
5 мм. Этот воск называют карнаубским. Он твер-
дый и ломкий, имеет желтовато-зеленоватый цвет,
используется для производства свечей.
Уникальный воск обнаружен в плодах и семе-
нах симондзии калифорнийской, или хохобы, про-
5. Л. А. Красильникова
130
Липиды
израстающей на юго-западе США и северо-западе
Мексики. Этот воск жидкий. Долгое время его
принимали за масло. Издавна индейцы употребля-
ли его в пищу и использовали его лечебные свой-
ства (заживление ран и др.). И только сравнитель-
но недавно выяснили, что в его состав входят не
триглицериды, а эфиры высокомолекулярных кис-
лот и одноатомных спиртов. Кроме того, этот воск
пока единственный, который является запасным
питательным веществом и используется при про-
растании семян.
Изучение и использование воска хохобы оказа-
лось весьма перспективным. Во-первых, он имеет
приятный ореховый вкус и успешно может исполь-
зоваться в качестве пищевого масла. Во-вторых, не
имея в своем составе триглицеридов, он не разлага-
ется и не горит, как обычное масло, при высоких
температурах. Это дает возможность использовать
воск для смазки скоростных моторов, что удлиняет
время их работы в 5-6 раз. В-третьих, вечнозеле-
ный кустарник хохобы неприхотлив и произраста-
ет на беДных и засоленных почвах, а его плоды и
семена содержат до 50% жидкого воска. В настоя-
щее время плантации хохобы выращивают в раз-
ных странах и на разных континентах.
Кутин и суберин
Это жироподобные вещества, покрывающие
сверху или пропитывающие стенки покровных
тканей (эпидерма, пробка), увеличивая их защит-
ные свойства.
Кутин покрывает сверху эпидерму тонким слоем —
кутикулой, которая предохраняет нижележащие
ткани от высыхания и проникновения микроорга-
низмов. В состав кутина входят С1в~ и С18-жирные
Липиды
131
гидроксикислоты — насыщенные и мононенасыщен-
ные. Гидроксильные группы — от одной до трех —
располагаются в конце, а также в середине углерод-
ной цепочки кислоты. Эти группы связываются с
карбоксильными эфирными связями, и получается
сложная трехмерная структура кутина, очень стой-
кая к различным воздействиям.
О
О
£
'i он
?VvWMCOOH
О
N
о
-VAWA1
ОН
он
(VWMo
? о HO
i=ooJ/W^W|
Схема структуры молекулы кутина
Суберин — полимер, который пропитывает кле-
точные стенки пробки и первичной коры корня
после слущивания корневых волосков. Это делает
клеточные стенки прочными и непроницаемыми
для воды и газов, что, в свою очередь, повышает
защитные свойства покровной ткани. Суберин по-
хож на кутин, но есть некоторые отличия в соста-
ве мономеров. Кроме гидроксикислот, характерных
для кутина, в суберине встречаются дикарбоновые
жирные кислоты и двухатомные спирты. Связи
132
Липиды
между мономерами те же — сложноэфирные, ко-
торые образуются при взаимодействии гидроксиль-
ных и карбоксильных групп.
3.3 ОБМЕН ЛИПИДОВ
Синтез и распад жиров
Метаболические пути, связанные с синтезом
и распадом триглицеридов, у животных и расте-
ний во многом сходны, но есть и различия.
Синтез насыщенных жирных кислот с четным
числом углеродных атомов происходит путем пос-
ледовательного добавления двууглеродных остат-
ков к ацильной цепи, которая берет свое начало от
ацетил-СоА. Донором двууглеродных единиц яв-
ляется малонил-СоА.
СНЭ СООН
CO~S-CoA CH2CO~S-CoA
ацетил-СоА малоннл-СоА
Этот процесс катализируется многоферментным
комплексом, который называют синтетазой жир-
ных кислот. Конечным продуктом ее действия яв-
ляется С1в-пальмитиновая кислота.
В растениях имеются еще две синтетазы жир-
ных кислот, представляющие собой сложные фер-
ментные системы. Одна из них удлиняет углерод-
ную цепочку кислоты от С1в до С18, другая — от С18
до С30 и более.
Комплексы синтетаз жирных кислот в раститель-
ных клетках локализованы в цитозоле, в строме
хлоропластов и в сферосомах.
Превращение насыщенных жирных кислот в не-
насыщенные происходит с помощью десатуразной
Липиды
133
ферментной системы, которая вводит двойную связь
в молекулу насыщенной кислоты независимо от
длины ее углеродной цепочки. Однако чаще всего
субстратом десатуразы является С18-стеариновая
кислота, а продуктом — олеиновая кислота. В ре-
акции используется NADP*H и О2.
Десатуразы растений имеют ряд отличий от та-
ких же систем животных. Так, растительные де-
сатуразы локализованы в матриксе цитоплазмы и
в сферосомах, а животные — в мембранах ЭР. Кро-
ме того, растительные десатуразы могут принимать
электроны непосредственно от фотосистемы 1 при
фотосинтезе.
Дальнейшее превращение мононенасыщенных
жирных кислот в ди- и триненасыщенные изучено
еще недостаточно. Однако предполагают участие в
этом процессе специальных десатураз. Известно так-
же, что в этих реакциях требуются NADP’H и О2.
Существуют различия между десатуразными
системами, катализирующими образование поли-
ненасыщенных жирных кислот, у животных и ра-
стений. В животных клетках ферменты вводят
двойные связи между уже имеющейся ранее двой-
ной связью и карбоксильной группой, а в расти-
тельных — между имевшейся ранее и концевой
метильной группой.
ch.AAAAch.ch /VVy\ СООН
десатуразы десатуразы
растений животных
Поэтому у растений олеиновая кислота посте-
пенно превращается в линолевую и линоленовую,
а животные эти кислоты синтезировать не могут и
должны получать их с пищей. Действие же деса-
туразы на линоленовую кислоту у животных ведет
134
Липиды
к образованию арахидоновой кислоты, которая
имеет 4 двойные связи.
Недостаточную изученность механизма десату-
раций олеиновой кислоты в растениях объясняют
тем, что ферменты связаны с мембранами ЭР, хло-
ропластов и сферосом и поэтому трудно подверга-
ются выделению и очистке.
Жирные кислоты, которые отщепляются при
гидролизе триглицеридов под действием липазы,
далее подвергаются р-окислению с образованием
двууглеродных фрагментов — ацетил-СоА. Этот
процесс сходен у растений и животных. Фермен-
ты, катализирующие р-окисление жирных кислот,
сосредоточены в митохондриях растений.
Образовавшийся при р-окислении ацетил-СоА
может подвергаться далее различным превраще-
ниям. Основной путь его превращения — это пол-
ное окисление до СО2 и Н2О в цикле Кребса. При
этом выделяется большое количество энергии
(12 молекул АТР). Часть молекул ацетил-СоА мо-
жет снова использоваться на синтез жирных кис-
лот или на синтез других соединений — каротино-
идов, стероидов, эфирных масел и смол. Кроме того,
ацетил-СоА может идти на образование углеводов,
включаясь в цепь реакций, называемых глиокси-
латным циклом, а сам процесс превращения жи-
ров в углеводы носит название глюконеогенез.
Как говорилось выше, большинство растений в ка-
честве запасных веществ в семенах откладывает
жиры (масла). Жиры нерастворимы в воде и не мо-
гут транспортироваться по растению, поэтому при
прорастании семян масличных растений на питание
проростка используются сахара, образующиеся из
жиров в процессе глюконеогенеза. Это возможно толь-
ко через глиоксилатный цикл, который функциони-
рует в микротельцах — глиоксисомах. Глиоксисо-
Липиды
135
мы образуются и работают в семенах масличных ра-
стений при их прорастании. К концу прорастания,
когда проросток зеленеет и переходит к автотрофно-
му питанию, глиоксисомы постепенно исчезают.
В глиоксисомы поступают свободные жирные
кислоты. Здесь они подвергаются р-окислению.
В глиоксисомах присутствуют все ферменты, осу-
ществляющие этот процесс. Образуется большое ко-
личество ацетил-СоА, который вступает в глиок-
силатный цикл.
Глиоксидатный цикл состоит из 6 реакций. 4 из
них сходны с реакциями цикла трикарбоновых кис-
лот, а 2 реакции специфичны только для данного
цикла и в других процессах обмена не встречаются.
Первые три реакции глиоксилатного цикла иден-
тичны таким же реакциям цикла трикарбоновых
136
Липиды
кислот. Вначале ацетил-СоА конденсируется с ок-
салацетатом с образованием цитрата под действи-
ем цитрат-синтазы. Цитрат затем изомеризуется в
изоцитрат под влиянием аконитат-гидратазы. Про-
межуточным соединением в этой реакции являет-
ся цис-аконитат.
Четвертая реакция характерна только для гли-
оксилатного цикла: под действием фермента изо-
цитрат-лиазы молекула изоцитрата расщепляется
на сукцинат и глиоксилат. Сукцинат выходит из
цикла и далее превращается в углеводы, а глиок-
силат вступает в следующую реакцию цикла.
СООН с=о + СН3СО~ S-CoA -СоА НО соон 1 £н2 -С-СООН 1 -Н2О
+ н2о сн2 соон цитрат
соон ЩУК О
-н,о соон 1 сн, 1 2 СООН 1 сн, соон . L.
(2) ' С-СООН сн 1 соон цис-акоиитат 1 2 сн-соон -1— снон 1 соон изоцитрат (?) 1 + 1 н сн2 соон соон глиоксилат сукцинат
Глиоксилат реагирует с еще одной молекулой
ацетил-СоА с образованием малата. Малат-синта-
за, катализирующая эту реакцию, так же специ-
фична только для глиоксилатного цикла, как и изо-
цитрат-лиаза. В последней реакции цикла малат
под действием малат-дегидрогеназы и при участии
NAD+ окисляется до ЩУК. Эта реакция характер-
на и для последнего этапа ЦТК.
Липиды
137
СООН
СООН
С«2 .CH.CO-S-C»^ *н. ЛИО-ЛИО-»! >
соон + н,о -^t-CHOH С=о
© Аоон © Аоон
глиоксилат
малат
ЩУК
Продукт глиоксилатного цикла — сукцинат по-
кидает глиоксисому, т. к. в ней нет ферментов для
его дальнейшего превращения, и переходит в ми-
тохондрию. Здесь под влиянием ферментов ЦТК
он превращается в ЩУК. Сначала, подвергаясь
действию сукцинат-дегидрогеназы, сукцинат пре-
вращается в фумарат. Последний присоединяет
воду под влиянием фумарат-гидратазы, и образу-
ется малат. Малат-дегидрогеназа окисляет малат
до оксалоацетата. При декарбоксилировании пос-
леднего с участием АТР получается ФЕП.
СООН СООН
СН, FAD* FADH СН
I < J II +н2о
СН2 > СН ------►
СООН соон
СООН соон
СН2 NAD* №Н)-//£Н2
СНОН ------с=о
СООН СООН
сукцинат фумарат
малат ЩУК
СООН
Аи,
с=о
iooH
АТР ADP
СН,
II 2
С-О-Р
I
СООН
ЩУК
ФЕП
глюкоза < * | гликолиз~| с * ФЕП
ФЕП входит в гликолиз и превращается в глю-
козу путем его обращения.
138
Липиды
Таков путь глюконеогенеза в растениях: от 0-окис-
ления жирных кислот, через глиоксилатный цикл,
превращение сукцината и обращение гликолиза.
В то время как у животных распад насыщенных
жирных кислот происходит исключительно путем
0-окисления, растения имеют еще один путь рас-
щепления жирных кислот — а-окисление. При этом
происходит окисление а-углеродного атома жирной
кислоты, что приводит к удалению карбоксила в
виде СО2 и образованию кислоты, углеродная це-
почка которой короче исходной на один атом.
Каждый оборот а-окисления включает две ре-
акции. Первая реакция происходит под влиянием
пероксидазы жирных кислот и при участии пере-
киси — Н2О2. Продуктами реакции является аль-
дегид, содержащий на один углеродный атом мень-
ше, чем кислота, углекислый газ и вода. Обычно
а-окисление происходит в микротельцах — перо-
ксисомах, где в растительной клетке образуется
перекись, необходимая в этом процессе. Перекись
обычно получается при окислении гликолата под
действием гликолат-оксидазы.
r-ch2ch2cooh +н2о2------> r-ch2c*° +со2+н2о
жирная кислота альдегид
NAD
NAD-H
R-CH.C*
2 Г1
4-^0
r-ch2cooh
альдегид
кислота
Во второй реакции происходит окисление аль-
дегида. Здесь действует фермент альдегид-дегид-
рогеназа при участии NAD+ и воды.
Физиологическая роль а-окисления в растении
еще полностью не выяснена. Предполагают, что в
Липиды
139
результате этого процесса образуются жирные
кислоты с нечетным числом углеродных атомов.
Кроме того, обсуждается возможность окисления
таким путем редких жирных кислот, у которых у
p-углеродного атома имеется какой-нибудь за-
меститель (-СН3, -ОН), что исключает возмож-
ность расщепления данной кислоты обычным
путем р-окисления. После а-окисления углерод с
заместителем перемещается в a-положение и не
мешает действию ферментов р-окисления.
Энергетически а-окисление почти в 3 раза ме-
нее эффективно, чем р-окисление: в первом случае
может получиться лишь 6 ДТР против 16 во вто-
ром. Хотя при а-окислении происходит меньше
реакций и не требуется активация жирной кисло-
ты с помощью СоА.
Синтез и распад гликолипидов
Донором галактозных остатков при синтезе га-
лактолипидов является UDP-галактоза. Перенос
остатков осуществляют специальные галактозил-
трансферазы.
CHLOR, CHLOR,
I I
CHOR, + UDP-fy-галактоза---> CHOR, +UDP
I I
CH2OH CHjO-P-галак/иоза
диглицерид Р-АГГД
CHLOR, 1 CHOR2 + VDP-a-галактоза— CHfl-fi-галактоза Р-МГД CHLOR, 1 ->chor2 СН2О -галактоза-галактоза ДГД
Первый остаток галактозы присоединяется к ди-
глицериду, второй — к р-МГД.
140
Липиды
Распад галактолипидов осуществляют галакто-
липазы и галактозидазы. Под действием галакто-
липаз от гликолипида гидролитически отщепля-
ются остатки жирных кислот, и остается галакто-
зилглицерин.
CH.OR 1 CHjOH + R.COOH
CHOR2 + 2 Н2О — > снон 1 + R2COOH
СН2О -0 - галактоза СН2О—р-галактоза
fi-МГД галактозил- глицерин жирные кислоты
Отщепление остатков галактозы от галактолипи-
дов происходит под влиянием а- и р-галактозидаз.
ch2or, ch2or,
I „ а-галактозидаза |
CHORj + Н2О --------------------► CHOR2 + a-галактоза
СН2О-$-галактоза-галактоза СН2О—галактоза
ДГД &мгд
ch2or, ch2or1
CHORj + Н2О CHORj + Галактоза
СН.2О-$-галактоза <^Н2ОН
р-мгд
диглицерид
Образование восков
Сначала образуются исходные компоненты вос-
ков — жирные кислоты, спирты, углеводороды,
а затем сложные эфиры.
Жирные кислоты синтезируются комплексами
синтаз, о которых говорилось выше.
С1в Ci8 > Ci8 Сзо и более
Липиды
141
Спирты жирного ряда получаются путем восста-
новления ацил-СоА.
+2Н +2Н
R-CH2CH2CO~S-Ca4 — R-CH2CH2C^h---►R-CH2CH2CH2OH
кислота альдегид спирт
Углеводороды с нечетным числом углеродных
атомов получаются из свободных жирных кислот
при их декарбоксилировании.
- СО, _ со
R- СН2СН2СООН----R- сн2сн3 сз2 2 > С31
кислота углеводород
Сложные эфиры восков образуются путем пере-
носа остатка кислоты на спирт жирного ряда. До-
нором кислотного остатка может быть, во-первых,
какой-нибудь фосфолипид (например, фосфатидил-
холин), во-вторых, ацил-СоА.
Образование кутина
Синтез кутина, как и восков, начинается с обра-
зования его компонентов — мономеров. С1в~ и
С18-жирные кислоты гидроксилируются сначала
в конце молекулы (со-углеродный атом), а затем
в середине — С-9 и С-10.
Далее происходит включение мономеров в кутин.
Донорами кислотных остатков являются гидрокси-
ацилы-СоА, акцептором — растущая молекула ку-
тина. Перенос ацильных остатков осуществляет фер-
мент кутин-ацилтрансфераза. При этом карбоксиль-
ная группа одной кислоты реагирует с гидроксилом
другой кислоты, образуя сложноэфирную связь.
Биосинтез кутина, как и восков, у растений про-
исходит только в клетках эпидермы, наружные
стенки которых они и покрывают.
142
Липиды
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАНИЯ
1. Дайте общую характеристику липидам. Рас-
скажите об особенностях растительных жиров и их
содержании в растениях.
2. Каков состав растительных масел? Расскажите
о жирных кислотах растительных масел и их рас-
пространении.
3. Какие вы знаете основные физико-химиче-
ские константы жира? Каково их значение для ха-
рактеристики растительных масел?
4. Расскажите о твердых растительных маслах.
5. О какой особенности масла свидетельствует
величина его йодного числа?
6. Расскажите о прогоркании масел и его при-
чинах? Как предохранить масла от прогоркания?
7. Какие группы жироподобных веществ вам
известны? Что собой представляют гликолипиды
и сульфолипиды? Какова их роль в растении?
8. Дайте характеристику растительным стеро-
идам.
9. Расскажите о составе растительных восков
и их роли в растении. Что вы знаете о составе
и строении кутина и суберина?
10. Расскажите об особенностях синтеза насы-
щенных жирных кислот в растениях.
11. В чем отличия образования ненасыщенных
жирных кислот у растений по сравнению с живот-
ными?
12. Расскажите о глиоксилатном цикле и глю-
конеогенезе.
13. Что вы знаете об а-окислении жирных кис-
лот в растении? Каково значение этого процесса?
14. Как происходит в растении образование вос-
ков и кутина?
4. ВЕЩЕСТВА ВТОРИЧНОГО
ПРОИСХОЖДЕНИЯ
Уже говорилось о том, что растения способны
синтезировать большое количество разнообразных
веществ. Это в основном вещества чисто раститель-
ного происхождения, которые у животных, как
правило, не встречаются. Их называют вещества-
ми вторичного происхождения.
Эти вещества не имеют собственных путей син-
теза и для своего образования используют основ-
ные метаболические пути растений. Их биосинтез
происходит на ответвлениях метаболических пу-
тей белков, углеводов, липидов. Ученые считают,
что у растений на ответвлениях и окончаниях та-
ких путей функционирует широкий спектр фер-
ментов, что и позволяет им синтезировать разно-
образные вещества.
Среди веществ вторичного происхождения есть
очень важные физиологически активные соедине-
ния (гликозиды, терпены и терпеноиды и т. д.);
другие вещества могут накапливаться в клетке в
больших количествах, что является отличительной
особенностью ее метаболизма (фенольные соедине-
ния, эфирные масла и т. д.).
Вещества вторичного происхождения принято
делить на несколько групп.
1. Органические кислоты алифатического ряда.
2. Фенольные соединения.
3. Гликозиды.
4. Терпены и терпеноиды.
5. Алкалоиды.
144
Вещества вторичного происхождения
4.1 ОРГАНИЧЕСКИЕ КИСЛОТЫ
АЛИФАТИЧЕКОГО РЯДА
Органические кислоты алифатического ряда
в малых количествах присутствуют в цитоплазме
и могут накапливаться в клеточном соке в свобод-
ном состоянии, в виде солей и сложных эфиров.
Органические кислоты делят на 2 группы: лету-
чие и нелетучие.
Летучие кислоты
Летучие кислоты перегоняются с паром и обла-
дают запахом. К ним относятся муравьиная, ук-
сусная, пропионовая, масляная и валериановая
кислоты.
Муравьиная кислота найдена в малине, в ябло-
ках, семенах фасоли, крапиве, хвое. В растениях
она образуется при декарбоксилировании щавеле-
вой кислоты. Муравьиная кислота принимает уча-
стие в образовании пуриновых нуклеотидов и, воз-
можно, в образовании хлорофилла в.
СООН
I ---------> НСООН + СО,
СООН 2
щавелевая муравьиная
кислота кислота
СН3
СООН
уксусная
кислота
Уксусная кислота распространена в плодах, се-
менах. Ее много, например, в яблоках, а в зерне
пшеницы и кукурузы она составляет
до 85% от общего содержания органи-
ческих кислот. Уксусная кислота при-
меняется в пищевой промышленности.
В виде ацетил-СоА уксусная кисло-
та образуется при декарбоксилировании пирови-
ноградной кислоты под действием пируват-дегид-
Вещества вторичного происхождения
145
рогеназы, а также при 0-окислении жирных кис-
лот и некоторых аминокислот (валин, лейцин). Аце-
тил-СоА может расщепляться до СО2 и Н2О в ЦТК,
может поступать в глиоксилатный цикл и участво-
вать в глюконеогенезе (в превращении жиров в уг-
леводы). Из ацетил-СоА образуются также кароти-
ноиды, стероиды, эфирные масла, смолы. При от-
щеплении СоА получается свободная кислота.
СН
1 с=о 1 +СоА СН. > | 3 + со, СО-СоА
СООН
пируват
ацетил-СоА
Пропионовая кислота встречается в растениях
в малых количествах и обычно образу-
ется при 0-окислении жирных кислот
с нечетным числом углеродных атомов.
_ В-окисление , „ „
с„—--------С,
си.
си.
соон
пропионовая
кислота
Масляная кислота встречается в растениях ред-
ко и в малых количествах. Чаще обнаруживаются
ее производные: 0-гидроксимасляная, 0-гидрокси-
а-кетомасляная и ее изомер — изомасляная и др.
СИз сн, сн3 сн, сн,
СН, 1 2 . снон снон 3 3
сн, си2 с=о \?н
1 2 соон соон соон соон
масляная кислота 0-гид рокси-мас- ляная кислота 0-гид рокси-а-кето- масляная кислота изомасляная кислота
Валериановая кислота и ее изомер — изовале-
риановая встречаются у некоторых растений (ва-
лериана, гваюла).
146
Вещества вторичного происхождения
си,
си,
си,
си,
соон
валериановая
сн3 сн3
^сн
соон
кислота
изовалериано-
вая кислота
Летучие органические кислоты в виде сложных
эфиров содержатся в плодах. Эфиры обладают за-
пахом и придают плодам определенный аромат.
Сложный эфир Запах плодов
Амилацетат Октилацетат Метилбутират Изоамилбутират Изоамиловый эфир изовалериановой кислоты банан апельсин абрикос груша яблоко
СООН
НСОН
I
носн
неон
I
НСОН
^Н2ОН
глюкоаовая
кислота
Нелетучие органические кислоты
По количеству карбоксильных групп эти кис-
лоты делят на моно-, ди- и трикарбоновые.
Монокарбоновые кислоты
В этой группе мы будем рассматривать такие
кислоты: глюконовую, гликолевую, глиоксилевую,
пировиноградную, молочную.
Глюконовая кислота. Как говорилось
в разделе «Углеводы», глюконовая кис-
лота образуется при окислении глюкозы
и относится к группе альдоновых кислот.
В растениях она встречается в малых ко-
личествах, участвует в пентозофосфатном
цикле, где из нее образуются пентозы.
Получают глюконойую кислоту из куль-
туральной среды некоторых плесневых
Вещества вторичного происхождения
147
грибов, где она накапливается в достаточно боль-
шом количестве. Глюконовая кислота и ее соли,
особенно кальциевая, используются в медицине
как детоксиканты и антиаллергические средства.
Гликолевая кислота встречается СНОН
в растениях в небольшом количестве, cqqh
играет важную роль в процессе фо- глаколевая
ТО дыхания. кислота
Глиоксилевая кислота также находится в рас-
тениях в небольших количествах, но участвует в
важных метаболических процессах: в фотодыха-
нии, в глиоксилатном цикле. Из глиоксилевой
кислоты при переаминировании образуется глицин.
се°
I Н
СООН
С«^О рц NW
переамини- Т21 2
СООН СООН
глиоксилевая глиоксилевая
кислота
глицин
кислота
Пировиноградная кислота найдена во многих
растениях, но она не накапливается, а играет боль-
шую роль во многих процессах обмена.
пировиноградная
кислота ФЕП
+СО2;+Н2О
-Н,ро
соон
I
си,
с=о
I
соон
ЩУК
Она образуется при диссимиляции углеводов
в гликолизе и связывает обмен углеводов с обме-
ном белка и липидов. Из пирувата получается ами-
148
Вещества вторичного происхождения
нокислота аланин и ацетил-СоА. Кроме того, она
является источником молочной и щавелевоуксус-
ной кислот. Молочная кислота образуется при вос-
становлении пировиноградной кислоты под дей-
ствием лактат-дегидрогеназы, а ЩУК — после
фосфорилирования ее в ФЕП и карбоксилирова-
ния последнего.
Молочная кислота обнаружена во многих рас-
тениях, но в заметных количествах содержится в
листьях малины. Часто накапливается в растени-
ях в анаэробных условиях. Много мо-
сн лочной кислоты образуется при молоч-
I 3 нокислом брожении в молочнокислых
। продуктах, в тесте, при брожении ово-
СООН щей. Образуется она при восстановле-
молочвая нии пирувата. Применяется молочная
кислота кислота в текстильной и кожевенной
промышленности при обработке тка-
ней и кож в качестве протравы при крашении, в
медицине как носитель микроэлементов, в пище-
вой промышленности при изготовлении конфет,
безалкогольных напитков и т. д.
Дикарбоновые кислоты
К дикарбоновым органическим кислотам отно-
сят щавелевую, малоновую, янтарную, фумаровую,
щавелевоуксусную, яблочную, винную.
Щавелевая кислота очень широко распростра-
нена в растениях как в свободном состоянии, так
и в виде солей. Особенно часто в кле-
точном соке растений накапливается
щавелевокислый кальций. Он выпада-
ет в виде кристаллов и их сростков (ра-
фиды, друзы). Их можно видеть в стеб-
лях и листьях суккулентов, бегонии, щавля. Мно-
го щавелевой кислоты выделяют в культуральную
СООН
I
СООН
щавелевая
кислота
Вещества вторичного происхождения
149
жидкость плесневые грибы. Щавелевая кислота об-
разуется из двух молекул муравьиной кислоты или
при окислении глиоксилевой кислоты.
нсоон _2Н СООН -г> /\\ я о ' о, СООН
нсоон СООН СООН 1 СООН
муравьиная щавелевая глиоксилевая щавелевая
кислота кислота кислота кислота
Малоновая кислота найдена в листьях злаков,
бобовых, в плодах лимона, в цветках георгин. Свя-
занная с СоА малоновая кислота участвует в син-
тезе жирных кислот.
Янтарная кислота обнаружена в плодах красной
смородины, черешни, крыжовника, винограда, в яб-
локах, в незрелых вишнях. Янтарная кислота в ЦТК
последовательно превращается в фумаровую, щаве-
левоуксусную и яблочную кислоты. Кроме того, она
является продуктом глиоксилатного цикла.
Фумаровая кислота в заметных количествах
найдена в немногих растениях (мак, хохлатка), а
также в лишайниках и грибах. Присоединяя ам-
миак, фумаровая кислота образует аспарагиновую
кислоту. О связях ее с другими дикарбоновыми
кислотами сказано выше.
(jXXJH СООН СООН
СООН си2 си2
СН: сн, 1 2 с=о сн
СООН СООН СООН СООН
малоновая кислота янтарная кислота щавелевоуксусная кислота фумаровая кислота
Щавелевоуксусная кислота очень активна в ме-
таболизме растений и поэтому не накапливается.
Она участвует в реакциях ЦТК, глиоксилатного
150
Вещества вторичного происхождения
цикла, в фотосинтезе С4- и CAM-растений. При пе-
реаминировании образует аспарагиновую кислоту.
Яблочная кислота широко распространена в ра-
стениях, особенно в плодах косточковых культур —
рябине, барбарисе, кизиле, в яблоках, а также в
помидорах. Особенно много яблочной кислоты в
плодах барбариса (до 6%), в листьях табака и ма-
хорки (до 6,5%), в мясистых органах суккулентов
(до 8-10% ). Отсутствует она в плодах цитрусовых
и клюквы. Образуется яблочная кислота в ЦТК,
глиоксилатном цикле из ЩУК и при фотосинтезе
у С4- и CAM-растений. Она обладает приятным
вкусом и жаждоутоляющим свойством и исполь-
зуется при изготовлении безалкогольных напитков
и кондитерских изделий.
СООН СООН COOK COOK
си2 снон снон СНОН
снон снон снон снон
соон соон соон COONa
яблочная винная кремор- сегнетова
кислота кислота тартрат соль
Винная кислота встречается обычно у растений
южн&х широт. Ее много в плодах винограда. У дру-
гих растений ее очень мало или совсем нет. При
изготовлении и выдержке виноградных вин обра-
зуются отходы в виде осадка. Это винный камень,
который представляет собой монокалиевую соль
винной кислоты — кремортартрат. Винная кисло-
та и винный камень применяются при изготовле-
нии фруктовых вод, химических разрыхлителей
теста, протравы тканей и красок, в медицине. Ка-
лий-натрйевая соль винной Кислоты (сегнетова
соль) используется в радиотехнической промыш-
Вещества вторичного происхождения
151
ленности и при количественном определении са-
харов. Пути участия винной кислоты в метаболиз-
ме растений пока не изучены.
Трикарбоновые кислоты
К ним относят лимонную, изолимонную и цис-
аконитовую кислоты. Они взаимопревращаются
в ЦТК и в глиоксилатном цикле.
СООН соон соон
1 сн, 1 2 1 си2 1 си2
но-с-соон С-СООН и сн-соон
1 сн, 1 2 сн 1 снон
соон соон соон
лимоивая
цис-аковитовая взолвмоввая
кислота
кислота
кислота
Лимонная кислота распространена в растениях.
В плодах смородины, малины, земляники лимон-
ная кислота преобладает над яблочной. Особенно
много лимонной кислоты в плодах цитрусовых
(до 9%), в листьях махорки (до 7-8%). В промыш-
ленных масштабах лимонную кислоту получают из
культуральной жидкости плесневого гриба Asper-
gillus niger. Лимонная кислота применяется в пи-
щевой промышленности, а ее натриевая соль —
в качестве консерванта крови.
ifuc-Аконитовая кислота впервые была полу-
чена из листьев.аконита. Встречается она в не-
больших количествах во многих растениях (лис-
тья злаков).
Изолимонная кислота в значительных количе-
ствах содержится у некоторых растений. У сукку-
лентов ее содержание может доходить до 18%, а в
плодах ежевики она составляет 2/3 всех органи-
ческих кислот.
152
Вещества вторичного происхождения
Роль органических кислот в растении
1. Органическим кислотам принадлежит важ-
ное место в процессе фотосинтеза, особенно у С4-,
CAM-растений, а также в процессе фотодыхания.
2. Велика роль органических кислот в дыхании
растений (гликолиз, ЦТК, ПФЦ) и других процес-
сах обмена углеводов (глюконеогенез).
3. Велика роль органических кислот в обмене
липидов (образование жирных кислот, стероидов,
каротиноидов).
4. Многие органические кислоты являются ис-
точником аминокислот (ЩУК, фумаровая и др.).
5. Органические кислоты связывают обмен уг-
леводов с обменом белков и липидов в растении.
6. Органические кислоты участвуют в синтезе
терпенов и терпеноидов (эфирные масла, смолы,
АБК, гиббереллины и др.).
7. Органические кислоты обусловливают низ-
кое значение pH клеточного сока, а у «кислых»
растений участвуют в механизме обезвреживания
аммиака.
4.2 ФЕНОЛЬНЫЕ СОЕДИНЕНИЯ
Фенолы — это соединения, в молекулах которых
содержится ароматическое (бензольное) кольцо, свя-
занное с одной или несколькими группами -ОН.
Большое содержание фенолов характерно для расти-
тельной клетки.
В животном организме бензольные кольца не син-
тезируются, а могут только преобразовываться, по-
этому они должны постоянно поступать в организм с
пищей. Однако многие фенольные соединения в
животных тканях выполняют важные функции
(убихинон, адреналин, тироксин, серотонин и др.).
Вещества вторичного происхождения 153
В настоящее время в растениях уже найдено не-
сколько тысяч разнообразных фенольных соедине-
ний. Их классифицируют по строению углеродного
скелета. Мы будем рассматривать только некоторые
наиболее важные группы фенольных соединений.
1. С6-Фенолы.
2. Cg-Cj-Фенольные кислоты.
3. С6~С3-Гидроксикоричные кислоты и кумарины.
4. С6-С3-С6-Флавоноиды.
5. Олигомерные фенольные соединения.
6. Полимерные фенольные соединения.
Св*Фенолы
О
Соединения, бензольное кольцо которых связа-
но с несколькими гидроксильными группами, на-
зывают полифенолами.
ОН
фенол
пирокатехин гидрохинон пирогаллол
Свободные фенолы в растениях встречаются ред-
ко и в малых количествах. Так, фенол обнаружен
в иглах и шишках сосны, в эфирном масле черной
смородины, пирокатехин — в чешуе лука, в лис-
тьях бадана, гидрохинон — в коре и листьях гру-
ши, в листьях бадана. Чаще встречаются произ-
водные фенолов, где они связаны с какой-либо уг-
леродной цепью или циклом. Например, урушиол
и тетрагидроканнабинол.
Урушиол — это токсическое вещество из листь-
ев сумаха. Тетрагидроканнабинол является галлю-
циногенным началом конопли.
154
Вещества вторичного происхождения
тетрагидроканвабивол
При окислении фенолов об-
разуются хиноны (бензохино-
ны). В свободном состоянии
хиноны в растениях не встре-
чаются, зато распространены
их производные. Например, производными бензохи-
нонов являются переносчики электронов в ЭТЦ фо-
тосинтеза и дыхания — пластохинон и убихинон.
К производным бензохинона относятся также
жгучее вещество примулы — примин и красный
пигмент мухомора — мускаруфин.
С—С-Фенольные кислоты
О 1
В растениях распространены фенольные кислоты.
Чаще они находятся в тканях в связанном состоя-
нии и освобождаются при выделении и гидролизе.
Салициловая кислота содержится в корнях дуба
и выделяется в качестве аллелопатического агента
в окружающую среду. Кроме того, в настоящее
Вещества вторичного происхождения
155
время обнаружено ее регулирующее действие на
ряд физиологических и биохимических процессов
в растении (образование этилена, восстановление
нитратов и др.)- Протокатеховая кислота обнару-
жена в чешуях лука.
СООН
салициловая
кислота
протокатеховая
кислота
СООН
ванильная галловая
кислота кислота
Ванильная и галловая кислоты встречаются
в древесине. Последняя входит в состав некоторых
дубильных веществ и может образовывать диме-
ры — дигалловую кислоту, в молекуле которой
сложноэфирной связью соединены 2 остатка гал-
ловой кислоты.
дагалловая кислота
глюковааилиа
гликогалл ив
Обнаружены производные фенольных кислот —
альдегиды и спирты. Например, в коре ивы при-
сутствует салициловый спирт. Но особенно извес-
тен ванилин — ванильный альдегид. Он обладает
очень приятным запахом и в виде гликозида —
глюкованилина содержится в плодах и ветвях ва-
нильного дерева. Гликозид и сам ванилин широко
156
Вещества вторичного происхождения
применяются в кондитерской, мыловаренной и пар-
фюмерной промышленности.
Фенольные кислоты могут связываться слож-
ноэфирными связями с сахарами, чаще с глюко-
зой. Из ряда растений (ревень, эвкалипт) выделен
гликогаллин, в котором карбоксильная группа гал-
ловой кислоты связана с гликозидным гидрокси-
лом глюкозы.
Св—С3-Гидроксикоричные кислоты
и кумарины
Широко распространены в растениях гидрокси-
коричные кислоты. Обычно они находятся в свя-
занном состоянии, а в свободном, кроме кофейной,
встречаются редко.
сн-снсоон
ф
он
кумаровая
(гндроксикоричиая)
кислота
СН-СНСООН
он
кофейная
кислота
сн=снсоон
феруловая
кислота
СН-СНСООН
сииаповая
кислота
Для гидроксикоричных кислот характерна цис-
транс-изомерия. В растворе устанавливается рав-
новесие между транс- и цис-формами. Ультрафио-
лет сдвигает это равновесие в сторону образования
цис-форм.
Вещества вторичного происхождения
157
Показано, что цис-изомеры гидроксикоричных
кислот являются активаторами ростовых процес-
сов растений, а транс-изомеры такими свойствами
не обладают.
транс-феруловая цис-феруловая
кислота
кислота
В растениях встречаются гидроксикоричные
спирты — производные соответствующих кислот:
кумаровой — кумаровый спирт, феруловой — ко-
нифериловый спирт, синаповой — синаповый
спирт. Спирты обычно не накапливаются, а, оче-
видно, используются на образование лигнина, мо-
номерами которого они являются.
СН=СНСН2ОН
конифериловый сииаповый
спирт спирт
ОН
кумаровый
спирт
Гидроксикоричные кислоты могут образовы-
вать сложные эфиры с органическими кислота-
ми алифатического ряда. Так, кофейная кислота
образует эфиры с яблочной и винной кислотами.
Первый эфир называют фазеолиновой кислотой.
Она присутствует в листьях фасоли. Второй —
цикориновой кислотой. Она найдена в листьях
цикория.
158
Вещества вторичного происхождения
СООН
СН=СН-СО-О-СН
ОН
ОН
си.
соон
СООН
сн=сн-со-о-(Ьн
I
СНОН
I
он соон
фазеолииовая кислота
цикоривовая квслота
В растениях распространены эфиры гидрокси-
коричных кислот и сахаров, чаще глюкозы. Так,
в цветках петунии и львиного зева обнаружены эфи-
ры кофейной, кумаровой, феруловой кислот, а в
злаках вообще большинство гидроксикоричных
кислот представлены эфирами. Кроме того, гидро-
ксикоричные кислоты входят в состав полисаха-
ридов и белков. Например, феруловая кислота най-
дена в ксиланах пшеничной муки и в полисахари-
дах ананасов.
Кумарины — это лактоны, которые образуются
при замыкании кольца между гидроксильной и
карбоксильной группами в молекуле гидроксико-
ричной кислоты. При этом боковая цепь кислоты
должна находиться в цис-форме, а гидроксил —
в орто-положении.
транс-орто-
кумаровая кислота
цис-орто-
кумаровая кислота
кумарин
Кумарин — бесцветное кристаллическое веще-
ство с приятным запахом свежескошенного сена.
В свободном виде кумарин в растениях не встреча-
ется. Он обычно содержится в виде гликозидов (цве-
ты и листья донника). У травянистых растений в
клеточном соке присутствует гликозид, содержа-
Вещества вторичного происхождения 159
щий орто-кумаровую кислоту. При сенокосе рас-
тительные ткани повреждаются, нарушается про-
ницаемость мембран. Гликозиды из клеточного сока
соприкасаются с ферментами цитоплазмы. От гли-
козидов отщепляются сахара, и кумаровая кисло-
та после транс—>цис-изомеризации замыкается в
лактон-кумарин. При этом вянущая трава приоб-
ретает запах сена.
Кумарин и содержащие его гликозиды исполь-
зуются в парфюмерной промышленности и при
изготовлении некоторых сортов табака.
В растениях часто встречаются гидроксилиро-
ванные кумарины в составе гликозидов. Например,
эскулетин из околоплодника конского каштана и
скополетин из корней скополии японской. Оба эти
кумарина обладают Р-витаминной активностью и
используются в медицине как капилляроукрепля-
ющие средства.
эскулетии
скополетии
дикумарив
В доннике белом найден дикумарин, который
препятствует свертыванию крови. Этот и другие
дикумарины используются как лекарственные пре-
параты, предотвращающие образование тромбов.
Св-С,-Св-Флавоноиды
О О О
Это одна из наиболее разнообразных и распрос-
траненных групп фенольных соединений. В осно-
160 Вещества вторичного происхождения
8 q 22__3' ве строения молекул флавонои-
' дов лежит структура флавана,
V-у который состоит из двух бен-
5 4 зольных колец и одного гетеро-
флаван циклического (пиранового).
Группы флавоноидов различаются:
1) по степени окисленности или восстановлен-
ности гетероциклического кольца; 2) по природе
и расположению заместителей в кольцах А и Б
(-ОН; -СН3; -ОСН3); 3) по способности образовы-
вать гликозиды с различными сахарами.
Флавоноиды делят на несколько групп. Мы бу-
дем изучать 3 основные группы:
1. Катехины.
2. Антоцианы.
3. Халконы.
Катехины — наиболее восстановленные флаво-
ноиды. Они не образуют гликозидов. Катехин впер-
вые был выделен из древесины Acacia catechu, от-
сюда его название. Катехины найдены у более чем
200 видов растений. Среди катехинов наиболее
известны катехин и галлокатехин.
Они могут образовывать эфиры с галловой кис-
лотой — катехингаллаты и галлокатехингаллаты.
Катехины содержатся во многих плодах (яблоки,
Вещества вторичного происхождения
161
груши, айва, вишни, сливы, абрикосы, земляни-
ка, ежевика, смородина, брусника, виноград), в
бобах какао, зернах кофе, в коре и древесине мно-
гих деревьев (ива, дуб, сосна, пихта, кедр, кипа-
рис, акация, эвкалипт). Особенно много катехи-
нов в листьях и молодых побегах чая (до 30%).
Окислительные превращения катехинов играют
важную роль в чайном производстве и виноделии.
Продукты окисления, а это в основном димеры
катехинов, имеют приятный слабовяжущий вкус
и золотисто-коричневую окраску. Это определяет
цвет и вкусовые качества конечного продукта. При
этом катехины обладают высокой Р-витаминной
активностью, укрепляют капилляры и нормализу-
ют проницаемость стенок сосудов. Такой же ак-
тивностью обладают и димеры катехинов в чае.
Катехины в качестве мономеров входят в состав
конденсированных дубильных веществ.
Антоцианы — важнейшие пигменты растений.
Они окрашивают лепестки цветков, плоды, иногда
листья в голубой, синий, розовый, красный, фио-
летовый цвета с различными оттенками и перехо-
дами. Все антоцианы — гликозиды. Их агликона-
ми являются антоцианидины. Антоцианы раство-
римы в воде и содержатся в клеточном соке.
162
Вещества вторичного происхождения
Особенностью строения антоцианидинов явля-
ется наличие в гетероциклическом кольце четы-
рехвалентного кислорода (оксония) и свободной по-
ложительной валентности.
В настоящее время известно более 20 антоциа-
нидинов, но наиболее широко распространены 4:
пеларгонидин, цианидин, дельфинидин и мальви-
дин (метилированное производное дельфинидина).
Антоцианидины чаще гликозилированы по С-3,
реже в других положениях. Если гликозиды обра-
зуются присоединением двух сахаров, то это про-
исходит по С-3 и С-5. Например, гликозид пелар-
гонин, содержащий 2 глюкозы в С-3 и С-5 поло-
жениях, обнаружен в пеларгонии и астрах.
сн он
н он
софороза
НО
пеларгонин
О—глюкоза
О—глюкоза
В качестве моносахаридов в ан-
тоцианах встречаются глюкоза,
галактоза, рамноза, ксилоза, реже
арабиноза, а в качестве дисаха-
ридов — чаще всего рутиноза, со-
фороза, самбубиоза. Иногда ан-
тоцианы содержат трисахариды,
обычно разветвленные. Например, в ягодах сморо-
дины и малины найден антоциан, в котором с циа-
нидином связан разветвленный трисахарид.
НО
О—глюкоза .
ОН
О—рамноза
О—глюкоза
он
Вещества вторичного происхождения
163
Иногда к одному из сахаров антоциана эфирной
связью присоединяется остаток гидроксикоричной
кислоты.
п-со-сн=сн
— глюкоза
О—глюкоза
остаток
► феруловой
кислоты
Окраска антоцианов зависит от ряда факторов:
1) концентрации антоцианов в клеточном соке;
2) содержания в кольце Б групп -ОН и -ОСН3;
3) pH клеточного сока;
4) комплексообразования антоцианов с катионами;
5) копигментации — смеси антоцианов и при-
сутствия в клеточном соке других веществ феноль-
ной природы;
6) сочетания с окраской пластидных пигментов.
Рассмотрим эти факторы подробнее.
1. Концентрация антоцианов в клеточном соке
может меняться в широком диапазоне — от 0,01
до 15%. Например, в обычном синем васильке со-
держится 0,05% антоциана цианина, а в темно-
пурпурном его 13-14%.
2. Увеличение количества групп -ОН в молеку-
ле антоциана усиливает интенсивность синей ок-
раски, а групп -ОСН3 — красной.
3. В связи с тем, что в молекулах антоциана име-
ется свободная валентность, окраска может менять-
ся в зависимости от величины pH. Обычно в кислой
среде антоцианы имеют красный цвет различной
интенсивности и оттенков, а в щелочной — синий.
pH 4 pH 10
пеларгонидин
164
Вещества вторичного происхождения
Такие изменения в окраске антоцианов можно
наблюдать, добавляя кислоту или щелочь к окра-
шенному соку смородины, вишни, столовой свеклы
или краснокачанной капусты. В природе же резких
изменений pH клеточного сока не происходит, и этот
фактор в окраске антоцианов большой роли не игра-
ет. Можно только заметить, что некоторые розовые
и красные цветы при завядании синеют. Это указы-
вает на изменение pH в отмирающих клетках.
4. Большое значение в окраске цветков и плодов
имеет способность антоцианов к хелатообразованию
с ионами металлов. Это хорошо видно на примере
василька и розы. В их лепестках содержится один
и тот же антоциан — цианин. В лепестках синего
василька цианин образует комплекс с ионами Fe
(4 молекулы цианина связаны с одним атомом Fe).
В лепестках красных роз присутствует свободный
цианин. Другой пример. Если обычную гортензию
с розовыми цветками выращивать на минеральной
среде, содержащей алюминий и молибден, то цвет-
ки приобретают синюю окраску.
5. Обычно в клеточном соке многих цветков
и плодов присутствует не один, а несколько пиг-
ментов. При этом окраска зависит от их смеси, и
ее называют копигментацией. Так, окраска пло-
дов черники обусловлена копигментацией дельфи-
нина и мальвина. В фиолетовых цветках картофе-
ля найдено 10 различных антоцианов.
Цветовой рисунок лепестков многих цветков оп-
ределяется или локальным увеличением концент-
рации одного пигмента (наперстянка), или наложе-
нием дополнительного пигмента на основной (в цен-
тре цветков мака на общем фоне пеларгонина на-
кладывается высокая концентрация цианина).
На окраску влияет также копигментация анто-
цианов с другими веществами, например, с танни-
Вещества вторичного происхождения 165
нами. Так, пурпурные и темно-красные розы содер-
жат один и тот же цианин, но у темно-красных он
копигментирован с большим количеством таннина.
6. При сочетании синих антоцианов клеточного
сока и желто-оранжевых каротиноидов хромопла-
стов получается коричневая окраска лепестков не-
которых цветков.
Некоторые антоцианы растений
Антоциан Агликон Сахар Растения
Пеларгонин Пеларгонидин 2 глюкозы Пеларгония, астры
Цианин Цианидин 2 глюкозы Розы, васильки
Керацианин Цианидин Глюкоза, рамноза Вишни
Пруницианин Цианидин Рамноза, глюкоза Сливы
Идаин Цианидин Галактоза Брусника
Хризантемин Цианидин Глюкоза Астры, черника, бузина
Мальвин Мальвидин 2 глюкозы Мальва
Энин Мальвидин Глюкоза Виноград
Дельфинин Дельфинидин Рамноза, глюкоза Шпорник
Вигланин Дельфинидин Глюкоза, рамноза Мать-и-мачеха
Халконы, или антохлоры, — это флавоноиды
с раскрытым гетероциклом. Они придают лепест-
кам цветков желтую окраску. Их распространение
ограничено девятью семействами. Встречаются они
в виде гликозидов. Халконами, например, явля-
ются изосалипурпозид из желтых цветков гвозди-
ки, флоридзин из коры и листьев яблони. Флорид-
зин является ингибитором роста яблони. При при-
еме внутрь человеком он вызывает одноразовое
166
Вещества вторичного происхождения
интенсивное выделение глюкозы в кровь — «фло-
ридзиновый диабет».
изосалипурпозид
флоридзин
Олигомерные фенольные соединения
О некоторых олигомерных фенолах мы уже го-
ворили ранее, например, о дигаловой кислоте. Сюда
же относятся лишайниковые кислоты. Они обра-
зуются в лишайниках из двух и более остатков
орселлиновой кислоты. Леканоровая и эверновая
кислоты состоят из двух остатков орселлиновой
кислоты. Эверновая кислота — основной компо-
нент комплекса кислот эвернии («дубовый мох»),
который используется в парфюмерии как душис-
тое вещество и одновременно как фиксатор при
изготовлении лучших сортов духов.
СООН
СО-----О
ОН СООН
леканоровая кислота
Среди лишайниковых кислот есть окрашенные.
Они придают разнообразный цвет лишайникам —
желтый, оранжевый, красный, фиолетовый. Лишай-
Вещества вторичного происхождения
167
ник уснея содержит усниновую кислоту, которая
является эффективным бактерицидным средством.
Встречаются в коре, древесине, плодах и листь-
ях многих растений ди-
меры гидроксикорич-
ных спиртов. Образуют
олигомеры и флавонои-
ды, особенно катехины.
Димеры катехина най-
дены в яблоках, каш-
танах, боярышнике, бо-
бах какао, в древесине
эвкалипта. Соединяют-
ся димеры связями С-С
или С-О-С.
димер катехина
Полимерные фенольные соединения
К полимерным фенольным соединениям отно-
сятся дубильные вещества, или таннины, лигни-
ны и меланины.
NH
Дубильные вещества, или таннины
Свое название они получили благодаря способно-
сти дубить шкуру животных, превращая ее в кожу.
Дубление основано на взаимодействии дубильных
веществ с белком кожи —
коллагеном. При этом об-
разуются многочисленные
водородные связи между
белком и таннином.
Природные дубильные
собой сложную смесь близких по составу соедине-
ний с молекулярной массой 500-5000. Для луч-
шего дубления молекулярная масса дубителя дол-
жна быть достаточно большой, чтобы его молеку-
R
СО
вещества представляют
168
Вещества вторичного происхождения
лы могли располагаться параллельно белковым
и образовывать прочные и необратимые связи. В то
же время молекулярная масса дубителя должна
быть и не слишком большой, чтобы его молекулы
могли проникать между белковыми волокнами и
связывать их. Наилучшими дубителями являются
таннины с молекулярной массой от 500 до 3000 и
большим количеством групп -ОН (1-2 на 100 еди-
ниц молекулярной массы).
Много дубильных веществ содержится в коре и дре-
весине дуба, эвкалипта, древесине каштана, в кор-
невище щавеля, ревеня, в листьях сумаха. Их много
в коре и древесине бобовых, миртовых, розовых. Осо-
бенно высоким содержанием дубильных веществ от-
личаются галлы, которые образуются на листьях при
повреждении их орехотворкой (до 50-70%).
Дубильными (чаще пищевыми дубильными) на-
зывают также более низкомолекулярные вещества,
обладающие приятным вяжущим вкусом, но не
способные к настоящему дублению. Они присут-
ствуют во многих плодах (айва, яблоки, хурма,
виноград), в листьях чая.
Дубильные вещества находят самое широкое при-
менение не только в кожевенной Промышленности.
Их используют в производстве пластмасс, связующих
веществ при изготовлении фанеры и плит из опи-
лок, в качестве протравы при крашении. Они нахо-
дят применение в установках для кипячения воды
в качестве стабилизаторов коллоидов, для регули-
рования вязкости растворов при бурении скважин.
Использование таннинов в виноделии связано
с их ингибирующим действием на ферменты и мик-
роорганизмы, что предотвращает помутнение вин
и улучшает их качество. С помощью чайного тан-
нина стабилизируют бетацианин — пищевой крас-
ный краситель, получаемый из столовой свеклы.
Вещества вторичного происхождения
169
В медицине дубильные вещества применяются
как вяжущие, бактерицидные, противолучевые и
противоопухолевые средства.
Дубильные вещества делят на 2 группы: гидро-
лизуемые и конденсированные.
Гидролизуемые дубильные вещества при нагре-
вании с разбавленными кислотами распадаются на
фенольные кислоты и сахара. Так, галлотаннин,
который содержится в листьях сумаха, при гидро-
лизе образует галловую кислоту и глюкозу. В его
молекулах 5 гидроксильных групп глюкозы свя-
заны с карбоксильными группами галловой кис-
лоты. К каждому остатку галловой кислоты мо-
жет присоединяться еще от 2 до 4 остатков. При
этом к разным углеродным атомам глюкозы мо-
жет быть присоединено разное количество кислот-
ных остатков. Отсюда ясно, какой сложной сме-
сью является галлотаннин.
o-co/q\oh
О-СО-^Н-ОН '“^ОН
СНрО-СоЛЗу-ОН ' ^он
юн
галлотаииии
170
Вещества вторичного происхождения
Из коры каштана получен галлотаннин, в моле-
кулах которого остатки галловой кислоты связа-
ны с моносахаридом с разветвленной цепью — га-
мамелозой.
Галлотаннин используется для мягкого дубле-
ния, а также в медицине при ожогах и желудочно-
кишечных заболеваниях.
Конденсированные дубильные вещества. В от-
личие от гидролизуемых, эти таннины при нагре-
вании с разбавленными кислотами уплотняются с
образованием аморфных, нерастворимых в воде
полимерных соединений — флабофенов, которые
имеют коричнево-красную окраску. Строение кон-
денсированных дубильных веществ изучено недо-
статочно. Однако известно, что они представляют
собой линейные полимеры с большой молекуляр-
ной массой, мономерами которых являются кате-
хины и другие восстановленные формы флавонои-
дов. При окислительной полимеризации катехины
связываются С-С-связью. Кроме того, у некоторых
остатков может происходить разрыв гетероцикла.
Конденсированные дубильные вещества содер-
жатся в коре и древесине дуба, ивы, сосны, ели,
лиственницы, акации, каштана, эвкалипта, в кор-
невище бадана и др.
Лигнины
Лигнин входит в состав клеточных оболочек
тканей древесины. Он откладывается между мик-
рофибриллами целлюлозы, что придает клеточным
оболочкам твердость, прочность. Однако при этом
нарушается связь между клетками, что приводит
к отмиранию живого содержимого, поэтому лиг-
нификация является заключительным этапом он-
тогенеза клетки.
Вещества вторичного происхождения 171
Лигнин — аморфное вещество, нерастворимое
в воде, органических растворителях и даже в кон-
центрированной кислоте. Только обработка смесью
NaHSO3 и H2SO3 частично разлагает лигнин, пере-
водя его в раствор.
Лигнин имеет еще одно важное свойство: он ус-
тойчив к микроорганизмам. Лишь немногие мик-
роорганизмы, и то очень медленно, разлагают его.
Лигнин — трехмерный полимер, мономерами
которого являются гидроксикоричные спирты, со-
единенные связями С-С и С-О-С. В составе лиг-
нина встречаются в основном кумаровый, конифе-
риловый и синаповый спирты. Причем их содер-
жание и соотношение у различных растений раз-
лично. Так, у хвойных в лигнине преобладает ко-
нифериловый спирт, у злаков — кумаровый, у мно-
гих лиственных деревьев — синаповый.
В целлюлозно-бумажной промышленности и на
гидролизных заводах накапливается в качестве
отходов большое количество лигнина. Его исполь-
зуют для получения активированного угля, пласт-
масс, синтетических смол.
Меланины
Меланины — полимеры фенольной природы,
которые являются продуктом окисления тирози-
на. Их строение еще до конца не выяснено.
Меланины имеют черный или коричнево-черный
цвет. Их образованием объясняется быстрое потем-
нение поверхности разрезанного яблока, клубня кар-
тофеля, некоторых грибов. Меланины присутствуют
и в животных организмах, обусловливая окраску
шерсти и волос. Однако растительные и животные
меланины отличаются по составу мономеров. Расти-
тельные меланины при гидролизе образуют пирока-
172
Вещества вторичного происхождения
ОН
пирокатехин дигидроксииндол
техин, а животные —
дигидроксииндол. Ины-
ми словами, раститель-
ные меланины, в отли-
чие от животных, явля-
ются безазотистыми веществами.
Меланины содержатся в семенах подсолнечника,
арбуза, в кожуре банана, в оболочке конских бобов,
люпина, а также в грибах (головневые, аспергиллы).
Образование фенольных соединений
Для синтеза фенольных соединений растение ис-
пользует основные метаболические пути, связан-
ные с образованием углеводов, аминокислот, ли-
пидов. Основная масса фенольных соединений про-
исходит из гидроксикоричных кислот, которые,
как говорилось ранее, образуются из фенилалани-
на и тирозина. Кроме того, источником фенолов
также являются промежуточные соединения, воз-
никающие на пути образования фенилаланина и
тирозина — хинная и шикимовая кислоты. Из этих
кислот образуются фе-
нольные кислоты и гид-
ролизуемые таннины.
Гидроксикоричные кис-
лоты образуют кумари-
ны, меланины, участ-
вуют в образовании лиг-
нина и Б-кольца флавоноидов. A-кольцо флавоно-
идов синтезируется из ацетил-СоА (малонил-СоА).
Флавоноиды являются источником конденсирован-
ных таннинов. В образбвании ряда фенольных со-
единений участвуют сахара (гидролизуемые тан-
нины) и продукты распада углеводов и липидов —
ацетил-СоА (малонил-СоА). На приведенной схеме
Вещества вторичного происхождения
173
показана связь образования фенольных соединений
с основными метаболическими путями растений.
Функции фенолов в растении
Они многочисленны и разнообразны.
1. Фенолы участвуют в окислительно-восстано-
вительных процессах: происходит превращение
фенолов в хиноны и наоборот с участием фермента
полифенолоксидазы. При этом попутно нефермен-
тативным путем могут окисляться различные со-
единения (аминокислоты, органические кисло-
ты, фенолы, цитохромы и др.).
2. Некоторые фенольные соединения являются
переносчиками электронов и протонов в ЭТЦ фо-
тосинтеза и дыхания (пластохинон, убихинон).
3. Ряд фенолов оказывает влияние на ростовые
процессы растений, иногда активирующее, чаще
ингибирующее. Это влияние бывает опосредовано
действием на фитогормоны. Так, известно, что одни
фенольные соединения необходимы при синтезе
ауксина, другие — при его распаде. Для образова-
ния этилена из SAM необходимо присутствие эфи-
ра кумаровой кислоты. Установлено, что при стрес-
се растения накапливают большое количество фе-
174 Вещества вторичного происхождения
нолов, что приводит к ингибированию ростовых
процессов и повышению их устойчивости к небла-
гоприятным условиям.
4. Фенолы выполняют в растениях защитную
функцию. Фенольные соединения придают расте-
ниям устойчивость к заболеваниям. Например, ус-
тойчивость к ряду болезней лука с окрашенной ше-
лухой связана с присутствием в нем протокатехо-
вой кислоты. При механических повреждениях ра-
стительных тканей в клетках накапливаются фе-
нолы и, конденсируясь, образуют защитный слой.
Некоторые растения в ответ на поражение пато-
генными грибами образуют защитные вещества —
фитоалексины, многие из которых имеют феноль-
ную природу.
5. Многие фенолы являются антиоксидантами
и защищают липиды мембран от окислительного
разрушения. Некоторые из них используют в пи-
щевой промышленности для предохранения жиров
от прогоркания (эфиры галловой кислоты, флаво-
ноиды и др.).
6. Очень важна роль фенольных соединений
в процессе размножения растений. Это не только
связано с окраской цветков и плодов, но и с непос-
редственным участием фенолов в оплодотворении.
Так, в процессе оплодотворения водоросли хлами-
домонады и высшего растения форзиции прини-
мают участие флавоноиды.
7. Фенолы могут выступать у некоторых расте-
ний в качестве аллелопатических веществ. Напри-
мер, таким веществом у дуба может быть салици-
ловая кислота.
8. Некоторые фенолы действуют как активато-
ры или ингибиторы на отдельные процессы и фер-
менты (деление клеток, синтез белка, окислитель-
ное фосфорилирование и т. д.).
Вещества вторичного происхождения
175
4.3 ГЛИКОЗИДЫ
Это соединения, которые образуются при заме-
щении гликозидного гидроксила сахара какой-ни-
будь молекулой или группой. Отсюда произошло
их название — гликозиды. Часть молекулы гли-
козида, соединенную с сахаром, называют аглико-
ном, что означает «не-сахар». Агликонами могут
быть самые различные соединения (спирты, кис-
лоты, фенольные соединения, амины и др.).
В зависимости от атома, с помощью которого
агликон связывается с сахаром, гликозиды делят
на 4 группы:
1. О-Гликозиды. Связь между сахаром и агли-
коном в них осуществляется через атом кислорода
(С-О-С).
2. S-Гликозиды. В них связь сахара с аглико-
ном происходит через атом серы (C-S-C).
3. N-Гликозиды. В них агликон связывается с са-
харом через атом азота (C-N-C).
4. C-Гликозиды. Агликон в них непосредствен-
но связан с углеродным атомом сахара (С-С).
О-гликозид S-гликозид N-гликозид С-гликозид
Углеводные компоненты гликозидов очень раз-
нообразны. В большом числе гликозидов таким
компонентом является глюкоза. Но большинство
сахаров, входящих в состав гликозидов, нигде боль-
ше не встречается. Иногда в состав гликозидов
входят производные моносахаридов, например,
глюкуроновая кислота. Некоторые гликозиды со-
держат несколько остатков моносахаридов или
176
Вещества вторичного происхождения
олигосахарид. Иногда с сахарами в углеводном
компоненте могут связываться остатки гидрокси-
коричных кислот.
О-Гликозиды
Это самая многочисленная группа гликозидов.
В нее входят: сахарофосфаты, в молекулах которых
гликозидный гидроксил связан с остатком фосфор-
ной кислоты; олиго- и полисахариды; фенольные
гликозиды; цианогенные гликозиды; стероидные
гликозиды; гликоалкалоиды.
Сахарофосфаты (альдозо-1-
фосфаты) — одна из метаболи-
чески наиболее важных групп
0-гликозидов. Они участвуют,
как известно, в обмене углеводов.
Олиго- и полисахариды по
химическому строению являют-
ся он
н он
глюкозо-1 -фосфат
ся гликозидами: в связи остатков моносахаридов
всегда принимает участие гликозидный гидроксил.
Правда, здесь проявляется некоторое противоре-
чие: агликоном у таких гликозидов служит тоже
сахар или другой углевод. Значение этих углево-
дов-гликозидов хорошо известно.
Фенольные гликозиды содержат в качестве аг-
ликона различные фенольные соединения. О фе-
нольных гликозидах мы говорили в предыдущем
разделе. Это, например, антоцианы, халконы —
важнейшие пигменты растений, связанные с саха-
рами кумарины, ванилин и др.
Цианогенные гликозиды в составе агликона
содержат группу —C=N. В растениях их най-
дено больше 20. Они образуются из аминокислот:
।
группа —C=N происходит из CHNH2.
Вещества вторичного происхождения 177
Из валина образуется линамарин, из фенилала-
нина — амигдалин, из тирозина — дуррин.
СН} СН} ^-гентибиоза-О-СН-С = N
C-O-fi-глюкоза
isN
лииамарии
fi-глюкоза-О-СН-С = N
(Q)
дуррии ОН
амигдалин
Линамарин присутствует у многих растений. На-
пример, он найден у фасоли, льна. Амигдалин — это
гликозид растений семейства розовых. Он содержится
в семенах миндаля, яблок, рябины, слив, айвы, ви-
шен, персиков и др.. Именно с присутствием амигда-
лина связан специфический горький вкус и запах
горького миндаля, который характерен для семян
этого семейства. В качестве сахара амигдалин содер-
жит дисахарид гентио-
биозу, которая состоит
из двух остатков глюко-
зы, соединенных свя-
зью (01—>6). Гентиобио-
за встречается только
в гликозидах. Дуррин
найден в семенах сорго.
Наиболее важными
Р-гентиобиоза
реакциями превращения
цианогенных гликозидов являются те, которые
приводят к выделению HCN — дыхательного яда.
^О-^-глюкоза
R-CH —-2—> R-C
"\.(2=N -р-глюкоза
R-C + HCN
Г1
агликон
цианогенный гликозид
Особенно интенсивно это происходит при разру-
шении тканей, когда гликозиды, содержащиеся в
вакуолях, взаимодействуют с ферментом 0-глико-
зидазой, которая находится в цитоплазме, в резуль-
180
Вещества вторичного происхождения
цепь, представленную гетероциклом с азотом. По-
добно сапонинам они обладают детергентными свой-
ствами и являются ядами. Гли-
. коалкалоиды характерны для
семейства пасленовых. В расте-
ниях картофеля обнаружен ряд
Н соланидии гликоалкалоидов, содержащих
в качестве агликона соланидин.
Одним из таких гликозидов является соланин, в
составе которого соланидин связан с глюкозой, га-
лактозой и рамнозой. Гликоалкалоиды использу-
ются для лечения артрита, ревматизма и др.
S-Гликозиды
Общую формулу S-гликозида можно представить
следующим образом:
^N-OSOjK
Эти гликозиды обычно встречаются у растений
из семейства крестоцветных (горчица, хрен, капу-
ста и др.). При растирании листьев или других
частей таких растений происходит ферментатив-
ное расщепление гликозидов с образованием гор-
чичного масла, имеющего характерный запах.
Примером S-гликозидов может служить синигрин
из семян сарепской горчицы и хрена и синальбин
из семян белой горчицы.
S-C-N-K
горчичное масло
СН-СН-СНГС^
S-глюкоза
N-OSOjK
НО
у,3-глюкоза
СН2- С
XN-OSO,K
синигрин
синальбин
Вещества вторичного происхождения
181
N-Гликозиды
Это метаболически очень актив-
ная группа гликозидов. Предста-
вителями ее являются нуклеози-
ды и нуклеотиды. По типу N-гли-
козидов построены нуклеотиды,
входящие в состав НК, NDP-caxa-
ров, макроэргических соединений
(АТР, GTP, UTP, СТР).
адеиозии
С-Гликозиды
Они образуются при соединении с сахарами не-
которых флавоноидов и найдены в кукурузе, боя-
рышнике, горицвете и др. Примером С-гликози-
дов могут служить витексин, виценин, ориентин,
сапонарин и др. Некоторые С-гликозиды исполь-
зуются в качестве лекарственных препаратов.
Роль гликозидов в растениии
Значение гликозидов в растении еще далеко не
выяснено. Однако некоторые сведения по этому
вопросу имеются.
1. Среди гликозидов есть очень важные, мета-
болически активные соединения. Это олиго- и по-
178
Вещества вторичного происхождения
тате чего отщепляется сахар. Агликон, лишенный
сахара, может расщепляться с выделением HCN как
ферментативным, так и неферментативным путем.
В живых клетках происходит ферментативное
образование цианида, но медленно, и к тому же он
быстро связывается и включается в азотный об-
мен. HCN под действием Р-циано-аланин-синтета-
зы присоединяется к цистеину с образованием
Р-цианоаланина, который затем под действием воды
превращается в аспарагин.
CH2SH ^HNH, CH_C=N CH, 1 1 1 I + HCN ~H£ >CHNH + H;° > CHNH,
COOH COOH COOH
цистеин
Р-цианоаланин аспарагин
При неблагоприятных условиях (резкие коле-
бания погоды, засуха и т. д.) и обилии азота в поч-
ве у многих растений может накапливаться сво-
бодная синильная кислота и служить причиной
отравления животных (клевер, вика, манник, мо-
лочай, осоки, камыш и др.).
Стероидные гликозиды в качестве агликона
имеют соединения стероидной природы. Их делят
на две группы: сердечные гликозиды и сапонины.
1. Сердечные гликозиды оказывают фармаколо-
гическое действие на сердечную мышцу. Они ак-
тивируют К+/Ыа+-насос. Распространение сердеч-
ных гликозидов ограничено всего 14 семействами
(лилейные, ирисовые, лютиковые, бобовые и др.).
Агликоны этих гликозидов имеют стероидную
природу с пятичленным лактоновым кольцом в
качестве боковой цепи. Примером может служить
дигитоксигенин из наперстянки (Digitalis purpu-
rea), который является агликоном ряда ее глико-
зидов (дигитоксин). Сахарный компонент обычно
Вещества вторичного происхождения
179
Н
О
ОН
дигитоксигенин
НО
н
дигитогенин
вместе с
же, как
присоединяется к гидроксилу у С-3
и состоит из 5 остатков моносаха-
ридов. Причем обнаружено уже
около 40 моносахаридов, входя-
щих в состав сердечных гликози-
дов, большинство из которых ниг-
де больше не встречается (цимароза, дигитоксоза,
дигиталоза, теветоза, аковеноза, бонвиноза и др.).
2. Сапонины — гликозиды, агликоны которых
также имеют стероидную природу, но их боковая
цепь состоит из двух гетероцик-
лических колец — пяти- и ше-
стичленного. Агликоны сапони-
нов называют сапогенинами.
В наперстянке содержится са-
понин дигитонин, агликоном
которого является дигитогении. Агликоны сапо-
нинов связаны с пятью остатками обычных моно-
сахаридов (глюкоза, галактоза, ксилоза и др.).
Сапонины — ядовитые вещества. Они обладают
детергентными свойствами и разрушают липопро-
теиновые мембраны.
Сапонины часто присутствуют в тех же растениях,
что и сердечные гликозиды. Много сапонинов в цвет-
ках мыльнянки. Если растереть их в руках
водой, образуется пена, которая моет так
мыло. Отсюда название растения.
Корни женьшеня содержат са-
понины, у которых боковая цепь
агликона представлена шестичлен-
ным гетероциклом. Их называют
панаксозидами. Агликон обычно
связан с 3-6 моносахаридами (глю-
коза, рамноза, арабиноза, ксилоза).
Гликоалкалоиды — близкие к сапонинам соеди-
нения, имеющие стероидную основу и боковую
НО
НО
н
агликон
панаксозида
182
Вещества вторичного происхождения
лисахариды, сахарофосфаты, относящиеся к груп-
пе О-гликозидов, нуклеозиды и нуклеотиды, отно-
сящиеся к группе N-гликозидов. Их значение для
растений хорошо известно.
2. Ряд гликозидов придает цветкам и плодам
растений окраску (антоцианы, хал коны).
3. Возможна защитная роль гликозидов, т. к.
некоторые из них ядовиты (цианогенные гликози-
ды, сапонины, гликоалкалоиды).
Если еще мало известно о роли гликозидов в рас-
тении, то гораздо больше сведений о действии их
на организм животных и человека. Среди глико-
зидов много токсичных веществ (сапонины, гли-
коалкалоиды). Многие гликозиды используются
как лекарственные средства (сердечные гликози-
ды, С-гликозиды), витамины (эскулетин). Некото-
рые гликозиды определяют вкусовые качества пи-
щевых продуктов, т. к. часто обладают горьким
вкусом и специфическим запахом (горчица, хрен,
горький миндаль, ванилин и др.).
сн,
сн=с-сн=сн2
изопреи
4.4 ТЕРПЕНЫ И ТЕРПЕНОИДЫ
Терпены — это ненасыщенные углеводороды
с числом углеродных атомов, кратным пяти. На-
звание «терпен» происходит от слова терпентин —
скипидар, который представляет собой эфирное
масло хвойных. Терпены можно
рассматривать как производные
основной разветвленной едини-
цы — изопрена. Разветвленный ко-
нец молекулы изопрена называют «головой», а не-
разветвленный — «хвостом». Иногда «голову» обо-
значают буквой i, а «хвост» — р, тогда изопрен
можно записать так — ip.
Вещества вторичного происхождения 183
Терпеноиды — это кислородсодержащие терпе-
ны. Считают, что терпены и терпеноиды по чис-
ленности превосходят все другие вещества вторич-
ного происхождения. Их известно уже около 10
тысяч. Классифицируют терпены и терпеноиды по
числу С5-единиц в молекуле.
Число С-атомов в молекуле терпена или терпеноида Вещества, относящиеся к данной группе
с5 Изопрен
С10 Компоненты эфирных масел
С15 Компоненты эфирных масел, абсцизовая кислота
С20 Компоненты смол, гиббереллины
с25 Компоненты смол
С30 Компоненты смол, стероиды
С<0 Каротиноиды
Политерпены Полипренолы. Каучук. Гутта
Наиболее распространенный способ связывания
в терпенах С5-изопреновых единиц — «голова к
хвссту» — ipip, но встречаются и соединения, свя-
занные «хвост к хвосту» — ippi.
Терпены и терпеноиды, содержащие С10 и более
углеродных атомов, могут быть ациклическими и
циклическими. Причем последние могут иметь
в молекуле один, два, три и более циклов.
С5-Изопрен
Изопрен — газ. Он обычно содержится в растени-
ях в очень малых количествах, и обнаружить его мож-
но только с помощью очень чувствительных методов.
Но в определенных условиях количество изопрена,
184
Вещества вторичного происхождения
выделяемого растением, может резко возрастать. Это
происходит при интенсивном освещении, высокой
температуре и низкой концентрации СО2 в воздухе.
В растениях встречаются производные изопре-
на — диметилаллилпирофосфат (ДМАПФ) и изо-
пентилпирофосфат (ИПФ). Это промежуточные
продукты синтеза терпенов. Они не накапливают-
ся, а претерпевают быстрые превращения.
си3
СН,-ОСН-СН2-ОРР
диметилаллилпирофосфат
(ДМАПФ)
сн,
СН2=С-СН2- С Н2- ОРР
изопентеиил пирофосфат
(ИПФ)
В растениях изопрен часто образует боковые
цепи у различных соединений. Например, остол —
компонент лекарственного растения дягеля, кото-
рое используется при желудочно-кишечных забо-
леваниях, является кумарином с изопреноидной
боковой цепью. Фитогормоны цитокинины в каче-
стве боковой цепи также имеют остаток изопрена.
остол цитокииии (зеатин)
С10, С15-Терпены и терпеноиды — компоненты
эфирных масел
Мирцен и оцимен — С10-ациклические терпе-
ны. Мирцен содержится в эфирном масле сумаха,
хмеля, мирциа, оцимен-базилика.
Однако гораздо более важную роль в составе
эфирных масел играют терпеноиды — альдегиды
и спирты. Известны спирты линалоол, гераниол,
цитронеллол. Линалоол имеет запах ландыша и со-
Вещества вторичного происхождения
185
держится в цветках ландыша, в эфирном масле апель-
сина, кориандра, мяты. В растениях встречаются его
сложные эфиры с муравьиной, уксусной, валериано-
вой кислотами. Смеси таких эфиров определяют аро-
мат многих плодов, например, персиков.
мирцеи
линалоол гераниол цитронеллол цитраль
Гераниол обладает запахом розы и встречается в со-
ставе ряда эфирных масел (розы, эвкалипта). Цит-
ронеллол также имеет запах розы и входит в состав
масел розы, герани и др. При окислении гераниола
образуется альдегид цитраль. Он входит в состав
лимонного, вербенового и других эфирных масел.
Лимонен, а-терпинен и сильвестрен — моноцик-
лические терпены. Наиболее распространен лимо-
нен, содержащийся в эфирном масле плодов цит-
русовых, тмина, укропа, в скипидаре и т. д. а-Тер-
пинен выделен из можжевельника, сильвестрен —
из скипидара.
К кислородсодержащим соединениям относятся
ментол и камфора. Ментол является главной со-
ставной частью масла мяты, из которого его выде-
ляют в большом количестве и используют в фар-
мацевтической промышленности и в косметике.
Ментол — основной компонент валидола.
186
Вещества вторичного происхождения
Камфора относится к бициклическим терпенои-
дам и, в отличие от всех рассмотренных выше со-
единений, представляет собой не жидкость, а твер-
дое вещество. Она содержится в древесине и листь-
ях камфорного лавра, который поначалу был един-
ственным источником ее получения, позже была
обнаружена камфорная полынь. Теперь камфору
получают синтетическим путем из скипидара. Она
широко применяется в медицине в качестве сред-
ства, возбуждающего сердечную деятельность.
Трициклический С10-терпеноид тересанталлол
входит в состав эфирного масла сандалового дере-
ва. Из ароматной древесины сандаловых деревьев
изготавливают веера, статуэтки, посуду и др.
К С15-терпеноидам относятся ациклические спир-
ты фарнезол и неролидол. Фарнезол найден во мно-
гих растениях (цветки ландыша, липы и др.). Не-
ролидол содержится в эфирном масле цветков
апельсина, в перуанском бальзаме. Он широко при-
меняется в парфюмерной промышленности в ка-
честве фиксатора, понижающего летучесть смешан-
ных с ним ароматических веществ. Особенно це-
нятся фиксаторы с приятным запахом. Таким и яв-
ляется неролидол.
Из бергамотного, лимонного масел и из хвои
выделен терпен, содержащий в молекуле одно коль-
цо, — бесаболен. В масле эвкалипта содержится
гваякол. Его молекула состоит из двух колец. Из
масла багульника выделен ледол, который имеет
три кольца в молекуле.
С15- терпеновую природу имеет фитогормон абс-
цизовая кислота.
Вещества вторичного происхождения
187
Эфирные масла
Название это было дано в 18 веке, когда о хими-
ческом составе этой группы веществ еще ничего не
было известно. Эфирными их назвали за летучесть,
маслами, потому что они легче воды и не смеши-
ваются с ней. Несмотря на неточность, этот тер-
мин сохранился до наших дней.
Эфирные масла растений представляют собой
сложный комплекс веществ, в котором уже найдено
свыше 500 индивидуальных компонентов. Причем у
одного растения их может насчитываться до 270.
В эфирных маслах преобладают С10- и С15-терпены и
терпеноиды. Эти соединения находятся в свободном
состоянии, в виде сложных эфиров или гликозидов.
Кроме терпенов, в составе эфирных масел присут-
ствуют и другие вещества, обладающие ароматом.
Это сложные эфиры органических кислот алифати-
ческого ряда, а также бензойной, фенилуксусной и
коричной кислот, гликозиды (ванилин), альдегиды,
кумарины, горчичное масло, индол и др.
Эфирные масла содержатся в различных органах
растений (цветках, лепестках, цветочных почках,
плодах, семенах, листьях, коре, древесине, корнях,
корневищах и т. д.) и в различном количестве. Так,
в цветках фиалки содержится 0,004% эфирного мас-
ла, а в цветочных почках гвоздики — до 23%.
Некоторые эфиромасличные растения могут
выделять в воздух много летучих веществ. Напри-
мер, растение неопалимая купена (Dictamnus alBus)
188
Вещества вторичного происхождения
выделяет столько эфирных масел, что может вспых-
нуть, если близко поднести зажженную спичку.
Роль эфирных масел в растении
Их роль в растении еще до конца не ясна. Пред-
полагают, что эфирные масла прежде всего выпол-
няют защитную функцию. Они защищают растения
от болезней, вредителей, поедания животными, пре-
дохраняют их от колебания температур, регулируют
транспирацию, затягивают раны в коре и древесине.
Эфирные масла способствуют привлечению насеко-
мых-опылителей. Многие компоненты эфирных ма-
сел выполняют роль аллелопатических агентов.
Считают, что, изменяя поверхностное натяже-
ние, масла ускоряют движение воды по растению.
Кроме того, они влияют на отдельные фермента-
тивные процессы.
Получение эфирных масел
На основе летучести и растворимости в органи-
ческих растворителях эфирных масел разработаны
методы их получения из растительного сырья: пере-
гонка с водяным паром, экстракция органическими
растворителями, анфлераж, механическое выделение.
Экстракцию эфирных масел производят с помо-
щью органических растворителей (эфира, ацето-
на, петролейного эфира и т. д.) в аппарате Соксле-
та. Иногда ее осуществляют сжиженными газами
(СО2, бутаном, хладоном и др.). После отгонки ра-
створителя получают чистое эфирное масло или его
смесь с другими веществами (смолами, восками).
Анфлераж — это способ, основанный на погло-
щении эфирного масла из свежесобранного сырья
сорбентами, чаще твердыми жирами. На рамы,
Вещества вторичного происхождения 189
которые потом собирают в герметически закрытую
батарею, наносят слой в 3-5 мм твердого жира
(смесь свиного и говяжьего), а сверху помещают
свежее сырье и выдерживают с ним 48-72 часа.
Затем сырье меняют (до 30 раз) до насыщения жира
эфирным маслом. Из насыщенного жира масло
извлекают спиртом. Экстракт вымораживают, вы-
павшие примеси удаляют, спирт отгоняют и полу-
чают чистое эфирное масло.
Перегонка с водяным паром — наиболее распро-
страненный способ получения эфирных масел. Его
используют, когда сырье содержит много масла
и оно термостабильно.
Механический способ получения применяется
в тех случаях, когда эфирное масло содержится во
вместилищах (кожура цитрусовых). Тогда его из-
влекают прессованием.
Использование эфирных масел
Издавна эфирные масла использовались как ду-
шистые вещества и сейчас используются в парфю-
мерной промышленности для изготовления духов,
одеколонов, дезодорантов и других косметических
средств, а также в мыловаренной промышленности.
Широко применяются эфирные масла в пищевой
и кондитерской промышленности в качестве пря-
ностей и ароматических веществ, при изготовле-
нии безалкогольных напитков, в табачной про-
мышленности.
Известно разностороннее действие эфирных ма-
сел и их отдельных компонентов на человеческий
организм. Они оказывают антисептическое и спаз-
молитическое действие, повышают секрецию же-
лудочно-кишечного тракта и бронхов, возбуждают
дыхание, снимают боль в мышцах и суставах. Это
190
Вещества вторичного происхождения
определило их использование в медицине (эфир-
ные масла эвкалипта, хвойных, сельдерея, тмина,
аниса, кориандра, фенхеля, мяты и др.).
Среди эфирных масел особое место занимает
скипидар, который используют в медицине, в ряде
отраслей химической промышленности, в каче-
стве сырья для синтезов (камфора) и в качестве
растворителя.
Сэд-, С25-, С^-Терпены и терпеноиды —
компоненты смол
Смолы — это твердые вьаделения растений. Они
размягчаются при нагревании, а на воздухе легко
окисляются и становятся твердыми и прочными
(янтарь). Смолы выделяются при повреждении ра-
стений в составе бальзамов. Бальзамы — это полу-
жидкие вещества, состоящие из смеси эфирных
масел и смол. Примером бальзамов может служить
живица хвойных деревьев, которая на 1/3 состоит
из эфирного масла скипидара и на 2/3 — из смолы
канифоли.
Канифоль используется при паянии, при изго-
товлении клея, а также в качестве добавок для
увеличения трения.
Живица и ее компоненты известны и использу-
ются в наших широтах. В тропиках же получают
и используют другие бальзамы и смолы. Из тропи-
ческих растений получают смолы даммара, каури,
копал, элеми и др.
Смолы и бальзамы часто обладают своеобразным
запахом, и с давних времен использовались чело-
веком в качестве благовоний.
В растениях смолы часто содержатся в смеси
с дубильными веществами, камедями, стероидами,
каучуком и др. Обычно они накапливаются в спе-
Вещества вторичного происхождения
191
циальных вместилищах, чаще в смоляных ходах.
Смолы нерастворимы в воде, но растворяются в ор-
ганических растворителях.
В состав смол входят С20-, С25- и С30-углеводоро-
ды (резены), ациклические и циклические смоля-
ные (резиновые) кислоты и смоляные спирты (ре-
зенолы). Смолы различных растений отличаются
по составу. Например, резены составляют большую
часть некоторых смол. Их до 70% в янтаре, до 95%
в смолах некоторых видов молочая. Резены очень
стойкие и выдерживают действие кислот и щело-
чей. Особенно распространены в смолах С30-цик-
лические смоляные кислоты. Они составляют ос-
новную массу канифоли. Среди смоляных кислот
особенно известна абиетиновая кислота. В свежей
живице ее немного. Однако после отгонки скипи-
дара при повышенной температуре содержание ее
в канифоли значительно возрастает. Очевидно, аби-
етиновая кислота образуется в процессе обработки
из ее лабильных предшественников. Она широко
применяется при производстве лаков, пластмасс,
мыла. Из смоляных спиртов в смолах часто встре-
чается цикличекий спирт кафестрол.
абиетиновая кислота
О роли смол в растениях известно очень мало.
Можно предположить,что они играют защитную
роль, затягивая раны и препятствуя поеданию ра-
стений вредителями и животными.
192
Вещества вторичного происхождения
К веществам С20-терпеноидной природы относят-
ся фитогормоны гиббереллины, а к Сзо — стерои-
ды — жироподобные вещества, которые изучают
в соответствующем разделе.
Политерпены
К политерпенам принадлежат полипренолы, ка-
учук и гутта.
Полипренолы
К ним относятся политерпены, содержащие от
4-5 до 9-10 изопреновых остатков. Например,
спирт фитол состоит из четырех остатков изопре-
на. Фитол входит в состав молекул хлорофилла,
этерифицируя один из его карбоксилов. Другим при-
мером может служить соланезол, который содер-
жит 9 С5-остатков. Он выделен из листьев табака.
ОН
фитол
солаиезол
Многие полипренолы, в том числе и соланезол,
имеют двойные связи в транс-конфигурации. Од-
нако существует группа полипренолов со смешан-
ными (цис- и транс-) двойными связями. Напри-
мер, кастопренолы из конского каштана и бету-
лапренолы из березы серебристой.
В растениях присутствуют важные соединения,
в которых цис-полипренолы связаны с хинонами. Это
пластохиноны, убихиноны, витамин Кр токоферолы.
Производные полипренолов являются донорами
гликозильных остатков при синтезе целлюлозы
в плазмалемме растительных клеток.
Вещества вторичного происхождения
193
Каучук
Это линейный полимер изопрена с двойными
связями в цис-положении. В молекуле каучука со-
держится от 1000 до 5000 С5-остатков. Длинные
молекулы его беспо- \ \ \ \
рядочно свернуты и /=\ /=\ /=\
постоянно меняют —' '—' '—' '—' '—
СВОЮ форму, ЧТО Обу- часть молекулы каучука
славливает его эластичность. Каучук образуется
и накапливется в млечниках, основной паренхи-
ме, ассимилирующих тканях растений 300 родов.
Особенно высоким содержанием каучука отлича-
ются тропическое растение гевея и корни слож-
ноцветных кок-сагыза и тау-сагыза (30-40%).
В млечном соке каучук находится в виде микро-
скопических глобул, форма которых характерна
для данного растения.
Из всех известных каучуконосов только дерево
гевея используется для получения каучука в про-
мышленных масштабах. Одно дерево гевеи за год
может дать до 3,5 кг каучука. Каучук из гевеи добы-
вают, подрезая кору (подсочка). При этом млечный
сок (латекс) вытекает из большой зоны коры, т. к.
млечники связаны между собой перемычками.
Каучук находит широкое применение. Вулкани-
зированный (насыщенный серой) он используется для
изготовления резины, натуральный — в медицине
для изготовления пластырей, горчичников и др.
Гутта
Она имеет меньшую по сравнению с каучуком
молекулярную массу. Количество С5-мономеров в ее
молекулах около
100. Кроме того, 1111
гутта имеет транс-
конфигурацию. часть молекулы гутты
7 П А Кпяг.ипкниипвя
194
Вещества вторичного происхождения
Гутта накапливается в млечниках Palaguium
gutta или в замкнутых вместилищах (кора корней
бересклета, листья эвкомии).
Млечники Palaguium gutta не связаны между
собой, поэтому для сбора гутты приходилось сру-
бать деревья. Это привело к почти полному исчез-
новению ее главного источника. В настоящее вре-
мя гутту получают в небольшом количестве из гва-
юлы серебристой — пустынного кустарника, про-
израстающего в Северной Америке.
Из гутты получают гуттаперчу, которая являет-
ся прекрасным изоляционным материалом и ис-
пользуется, например, для покрытия подводных
кабелей.
Биосинтез терпенов и терпеноидов
Исходным соединением при синтезе терпенов
служит ацетил — СоА. При образовании ^-изоп-
реноидного соединения происходит конденсация
3 молекул ацетил-СоА с удалением одного углерод-
ного атома в виде СО2.
ЗС2-->с6 -^%с6
Промежуточным С5-соединением при синтезе
терпенов является изопентилпирофосфат (ИПФ),
который изомеризуется с диметилаллилпирофос-
фатом (ДМАПФ).
ИПФ <=* ДМАПФ
Из каждого из них может образоваться С5-изо-
прен.
При конденсации ИПФ и ДМАПФ получаются
С10-терпены и терпеноиды, которые являются ком-
понентами эфирных масел.
С5 + с5 -> с10
Вещества вторичного происхождения
195
С10-терпеноид может конденсироваться с С5-ИПФ
с образованием С15-терпенов, которые также вхо-
дят в состав эфирных масел.
с10+с5->с15
При биосинтезе всех этих терпенов и терпенои-
дов С5-изопреноидные остатки связываются «голо-
ва к хвосту» (ipipip).
После возникновения С15-терпеноидов дальней-
ший синтез может идти двумя путями.
1. С15 + С5 —> С20 — «голова к хвостуtfipipipip).
Так получаются терпеноидные компоненты смол.
2. С15+ С15 —> Сзо — «хвост к хвосту» (ipipippipipi).
В результате этой реакции образуются стероиды.
С20-терпеноиды далее могут превращаться так-
же двумя путями.
1. С20 + С5 —> С25 — «голова к хвосту».
Этим путем образуются терпены, входящие в со-
став смол.
2. С20 + С20 —> С40 — «хвост к хвосту».
В результате получаются молекулы каротиноидов.
С25-терпеноиды далее присоединяют остатки С5-
ИПФ с образованием С30 — компонентов смол и бо-
лее высокомолекулярных полипренолов и других
политерпенов.
С25 + С5 —> С30 — «голова к хвосту».
С30 + п С5 -> Сзо+5п — политерпены.
С5-изопреноидные остатки во всех реакциях пе-
реносят ферменты пренил трансферазы. В удлине-
нии цепи политерпенов принимают участие два
типа ферментов: один из них образует транс-, дру-
гой — цис-политерпены.
При синтезе циклических терпенов, по-видимо-
му, сначала возникает небольшое число цикличе-
ских структур, которые затем подвергаются раз-
нообразным вторичным изменениям. Это обеспе-
чивает образование множества известных в насто-
ящее время терпенов и терпеноидов.
196
Вещества вторичного происхождения
Функции терпенов и терпеноидов в растении
Функции большинства терпенов и терпеноидов
еще неизвестны и непонятно, чем объясняется об-
разование в растениях такого большого количества
родственных соединений (около 10 000).
Однако известно, что некоторые представители
этой группы играют очень важную роль в расти-
тельном организме. Это прежде всего терпеноиды,
обладающие фитогормональной активностью: гиб-
береллины, абсцизовая кислота и цитокинины.
В молекулах последних содержится боковая цепь
изопреноидной природы. К терпеноидам принад-
лежит ксантоксин — ингибитор роста растений.
Стероиды, каротиноиды являются терпеноида-
ми, хлорофилл содержит С20-терпеноид фитол, пла-
стохинон и убихинон имеют боковые цепи терпе-
ноидной природы. Функции всех этих важнейших
соединений хорошо известны.
Производные полипренолов участвуют в биосин-
тезе целлюлозы.
О роли эфирных масел и смол говорилось выше.
Каучук и гутта, очевидно, выполняют защитную
функцию, затягивая раны в коре и древесине рас-
тений, защищают их от вредителей.
Многие терпены и терпеноиды выполняют роль
аллелопатических веществ.
4.5 АЛКАЛОИДЫ
Алкалоиды — это гетероциклические соедине-
ния, содержащие в гетероцикле азот. Они распро-
странены в растениях, но в последнее время ряд
алкалоидов найден у бактерий, грибов и даже у на-
секомых.
Вещества вторичного происхождения 197
В настоящее время известно около 10 000 алка-
лоидов. Однако на алкалоидность исследовано все-
го лишь около 5% всех видов растений.
Алкалоиды привлекают к себе внимание специ-
алистов различных областей знаний, т. к. эти ве-
щества физиологически очень активны и находят
широкое применение в медицине, ветеринарии,
в пищевой промышленности и сельском хозяйстве.
Около 170 лет назад, когда были открыты пер-
вые алкалоиды, в медицине началась эра алкалои-
дов. Ученый Соколов очень образно определил зна-
чение алкалоидов для медицины. Он писал, что
«открытие алкалоидов для медицины означало то
же, что и открытие железа для мировой культу-
ры». Действительно, у алкалоидов много лечебных
свойств. Во-первых, у них слабее, чем у других
лекарственных препаратов, выражено побочное
действие. Во-вторых, действие алкалоидов прояв-
ляется быстро, что очень важно при ряде заболе-
ваний (сердечно-сосудистых, спазматических и др.).
В-третьих, у них отсутствует кумулятивный эф-
фект. Можно долго перечислять алкалоидные ле-
карственные препараты: хинин, морфин, кодеин,
папаверин, резерпин, эфедрин, платифиллин, рау-
натин, атропин, стрихнин, кофеин и др. и их про-
изводные: дибазол, но-шпа, новокаин, лидокаин,
диплацин, промедол и др.
В ветеринарии алкалоиды также используются
как лекарственные препараты.
Алкалоиды находят применение в пищевой про-
мышленности. Их содержит растительное сырье, из
которого изготавливают кофе, чай, какао, тонизиру-
ющие напитки. Вся табачная промышленность ос-
нована на алкалоиде никотине. В сельском хозяй-
стве алкалоиды используются для борьбы с вредите-
лями различных культур (никотин, анабазин и др.).
198
Вещества вторичного происхождения
Содержание и состав алкалоидов в растении ис-
пользуется в хемотаксономии в качестве таксоно-
мического признака.
Алкалоиды являются органическими основани-
ями и образуют соли с кислотами (яблочной, вин-
ной, лимонной, янтарной, малоновой, щавелевой,
уксусной и др.). Сами алкалоиды нерастворимы в
воде, а их соли растворимы и содержатся в клеточ-
ном соке. Поэтому алкалоиды появляются и накап-
ливаются в растительных тканях с появлением и раз-
витием вакуолей. Обычно алкалоиды накапливаются
в активно растущих тканях, в обкладках сосудис-
то-волокнистых пучков, в млечниках.
Часто алкалоиды синтезируются в одних тка-
нях, а затем транспортируются и накапливаются в
других. Это видно на примере никотина. Он обра-
зуется в корнях табака, а оттуда транспортирует-
ся в листья, где и накапливается.
Обычно в растении присутствует целая группа
алкалоидов, среди которых один или несколько
главных содержатся в большем количестве, а ос-
тальные часто являются их модификацией.
Алкалоиды по химическому строению — слож-
ные вещества. Часто их основной гетероцикл скон-
денсирован со многими карбо- и гетероциклами.
Алкалоиды делят на 3 большие группы в зави-
симости от строения и образования их молекулы.
1. Истинные алкалоиды. Они образуются из
аминокислот и содержат азот в гетероцикле.
2. Протоалкалоиды. Они образуются из амино-
кислот, но содержат азот не в гетероцикле, а в бо-
ковой цепи.
3. Псевдоалкалоиды, или терпеноидные алка-
лоиды. Они образуются из ацетил-СоА, а азот в
гетероцикл или в боковую цепь включается на пос-
ледних этапах синтеза.
Вещества вторичного происхождения
199
Истинные алкалоиды
Это самая большая и разнообразная группа ал-
калоидов. Внутри группы алкалоиды делят по при-
роде основного гетероцикла на производные пир-
ролидина, пиперидина, пиридина, хинолина, ин-
дола, пурина и т. д.
CHj^CH,
стахидрин
Стахидрин — один из немногих
простых алкалоидов. Он представля-
ет собой метилированное производное
пролина — пролинбетаин. Стахидрин
встречается в корнях и листьях та-
бака, в листьях буквицы и др.
Тропановые алкалоиды. Они содержатся во мно-
гих растениях семейства пасленовых (белладонна,
дурман, белена) и имеют более сложное строение.
Один из наиболее известных алкалоидов этой груп-
пы — атропин. Его молекула представляет собой
сложный эфир спирта тропина и троповой кислоты.
\-си\он О-СН-СООН
—' СН2ОН
тропин тро новая кислота
атропин
Атропин был выделен в 1833 г. Это один из
первых полученных из растений алкалоидов. Ат-
ропин снижает тонус гладкой мускулатуры, осо-
200
Вещества вторичного происхождения
бенно глаз, бронхов, органов брюшной полости.
В больших дозах он стимулирует кору больших
полушарий и может вызвать беспокойство, судо-
роги, галлюцинации. Атропин применяют при
бронхиальной астме, печеночной и почечной ко-
лике, в офтальмологии. Атропин и сопровожда-
ющие его алкалоиды относят к группе атропина.
Среди тропановых алкалоидов выделяют еще
одну группу — группу кокаина. Кокаин представ-
ляет собой сложный эфир спиртокислоты экгони-
на, бензойной кислоты и метилового спирта.
СООН
экговвв бензойная кислота кокаин
Кокаин — один из алкалоидов листьев кокового
куста (коки). Листья коки в древности индейцы ис-
пользовали для притупления чувства голода и повы-
шения мышечной силы. Однако листья коки очень
токсичны. При попадании в кровь кокаина сначала
наступает эйфория, а затем угнетение центральной
нервной системы. Он разрушающе действует не толь-
ко на нервную систему, но и на сердечно-сосудис-
тую, пищеварительную. Происходит привыкание к
алкалоиду (кокаинизм). Высокая токсичность кока-
ина ограничивает его использвание: его применяют
для поверхностной анестезии в офтальмологии.
Сам кокаин используется мало, но на его основе
синтезировали целый ряд лекарственных препара-
тов анестезирующего действия (новокаин, лидока-
ин, дикаин, совкаин и др.). Эти препараты широ-
ко применяются для местного обезболивания.
Никотин — важнейший алкалоид многих видов
табака. Анабазин тоже содержится в листьях таба-
ка. Причем различные виды отличаются по содер-
Вещества вторичного происхождения
201
жанию этих алкалоидов. У одних преобладает ни-
котин, у других — анабазин. Никотин — сильно
ядовитое вещество. Он действует на центральную и
периферическую нервную систему. При отравлении
никотином смерть наступает от паралича дыхания.
В чистом виде никотин представляет собой бесцвет-
ную маслянистую жидкость. Его получают из отхо-
дов табачного производства и применяют в сельском
хозяйстве для борьбы с насекомыми-вредителями.
Анабазин впервые был выделен не из табака,
а из среднеазиатского растения анабазис. Отсюда
его название. Анабазин так же, как и никотин ис-
пользуют для борьбы с вредителями сельскохозяй-
ственных растений.
Лобелии получен из разных видов лобелии. Он
действует на центральную нервную систему. Лобе-
лии и анабазин используют для устранения нико-
тинового голодания при отвыкании от табака.
Рицинин — ядовитый алкалоид семян клеще-
вины.
Алкалоиды мака снотворного называют опий-
ными алкалоидами, или опиатами. Опий — это сгу-
щенный млечный сок мака. Раньше алкалоиды вы-
деляли из опия, а в настоящее время их получают
из высушенных растений мака (маковой соломки),
что значительно уменьшает возможность соприкос-
новения большого числа людей с ядовитыми алка-
лоидами опия.
Главный алкалоид опия — морфин. Он был
выделен в 1833 г., и именно с него началась эра
202
Вещества вторичного происхождения
алкалоидов. Морфин является сильным болеуто-
ляющим средством. Механизм обезболивающего
действия морфина связан с угнетающим влиянием
на прохождение импульсов от рецепторов к коре
больших полушарий и понижением возбудимости
болевых центров. Морфин оказывает тормозящее
действие на нервную систему, в результате чего
создается особое благодушное состояние — эйфо-
рия. В связи с этим развивается пристрастие к мор-
фину, что приводит к наркомании.
Морфин очень токсичен и разрушающе действует
на человеческий организм. Он тормозит условные
рефлексы, повышает тонус гладкой мускулатуры
внутренних органов, понижает секрецию желудоч-
но-кишечного тракта, замедляет обмен веществ и
снижает температуру тела. Характерным для мор-
фина является угнетение дыхательного центра,
вплоть до остановки дыхания.
Вещества вторичного происхождения 203
В связи с высокой токсичностью и опасностью при-
выкания применение морфина в настоящее время
ограничено. Его используют обычно только при очень
сильных болях (после операций, травм и т. д.).
На основе морфина, как аналог части его моле-
кулы, содержащей действующее начало алкалои-
да— группу =N-CH3, создан синтетический пре-
парат промедол. Он оказывает сильное обезболива-
ющее действие, но не угнетает дыхательный центр.
В млечном соке мака снотворного наряду с мор-
фином содержатся и другие опиаты, которые пред-
ставляют собой его модификации. Наиболее важ-
ные из них — кодеин и этилморфин. Их также
получают из морфина синтетическим путем, заме-
щая функционально активную группу -ОН, при-
сутствующую в его молекуле, соответственно ме-
тильным или этильным радикалом. Болеутоляю-
щее и токсическое действие кодеина и этилморфи-
на в 6-7 раз меньше, чем у морфина. Их препара-
ты используются в медицине чаще как средство
против кашля.
При замещении активного гидроксила в моле-
куле морфина уксусной кислотой образуется силь-
нейший наркотик героин.
В мозге человека были обнаружены участки спе-
цифического связывания морфина и структурно
близких ему соединений, что указывало на воз-
можность синтеза человеческим организмом ве-
ществ, по действию подобных морфину. Такие ве-
щества — «эндогенные опиаты» были найдены.
Ими оказались пентапептиды. Они получили на-
звание эндорфинов. Эндорфины оказывают такое
же обезболивающее действие, как и морфин, а не-
которые даже более сильное.
Биологическому действию опиатов препятству-
ют антиморфинные препараты, например, налок-
204
Вещества вторичного происхождения
сон, который является антагонистом морфина и вы-
тесняет его из участков связывания в мозгу.
налоксон
В млечном соке мака снотворного содержится
еще один очень важный алкалоид, имеющий иную
по сравнению с морфином химическую природу.
Это — папаверин. Его содержание в опии невели-
ко, всего 1%. Папаверин понижает тонус и сокра-
тительную активность гладкой мускулатуры, ока-
зывает сосудорасширяющее и спазмолитическое
действие, особенно на сосуды мозга и сердца. В на-
стоящее время его получают синтетическим путем.
На основе папаверина созданы его аналоги — синте-
тические препараты но-шпа и дибазол. Но-шпа об-
ладает более сильной и продолжительной спазмо-
литической активностью, а дибазол стимулирует
функции спинного мозга и нормализует артериаль-
ное давление.
Алкалоиды раувольфии змеиной. В корнях ра-
увольфии змеиной содержится целый комплекс
алкалоидов. Их делят на несколько групп. Наибо-
лее известна группа резерпина и ее главный алка-
лоид резерпин. Резерпин оказывает успокаиваю-
щее действие, снижает артериальное давление, тем-
пературу тела, обмен веществ. В медицине широ-
ко применяются как отдельные алкалоиды, так и
их комплексы. Алкалоиды раувольфии содержат-
ся в таких известных препаратах как раунатин,
раувазан, кристепин и др.
Вещества вторичного происхождения
205
резерпин
Эрголиновые алкалоиды. В рожках спорыньи со-
держится ряд алкалоидов, которые получили назва-
ние эрголиновых. В основе их строения лежит ли-
зергиновая кислота. Соединяясь с одной или несколь-
кими аминокислотами, пировиноградной кислотой
или аминоспиртами, она образует различные алка-
лоиды. Из рожков спорыньи их выделено 12. Они
применяются в медицине, хотя и очень токсичны.
Причем различные алкалоиды оказывают различное
действие на человеческий организм: снижают содер-
жание сахара в крови, вызывают сокращение мат-
ки, угнетают сосудодвигательные и дыхательные
центры, усиливают сердечные сокращения и др.
Для получения алкалоидов спорынью культи-
вируют на специальных средах. Мука, полученная
из зараженного спорыньей зерна, ядовита.
Эрголиновые алкалоиды найдены и у высших
растений, например, в семенах растений из родов
Rivea и Ipomea. Из смеси их семян мексиканцы
готовят галлюциногенное зелье.
206
Вещества вторичного происхождения
На основе лизергиновой кислоты изготавлива-
ют сильные наркотические вещества с галлюцино-
генными свойствами. Например, LSD25 — это ди-
этиламид лизергиновой кислоты.
Кофеин содержится в растениях, которые ис-
пользуются для приготовления напитков — лис-
О тья чая, зерна кофе, бобы ка-
II N—СН3 као. Этот алкалоид является
H3C-Np метилированным производ-
ным пурина. Кофеин усили-
° N NH вает сердечные сокращения,
расширяет сосуды мозга, сер-
3 дца, легких. При этом проис-
кофеии ходит перераспределение кро-
ви в организме в пользу жизненно важных орга-
нов. Вследствие этого уменьшается чувство устало-
сти, повышаются возможности умственной работы.
Протоалкалоиды
Эфедрин выделен из ряда видов эфедры. По хи-
мическому строению и биологическому действию
он сходен с адреналином. Он входит в состав про-
тивоастматических препаратов. Эфедрин расширяет
бронхи и возбуждает дыхательный центр. Одно-
времено он сужает сосуды, повышает артериаль-
ное давление, повышает обмен веществ.
ОН СН3
CH-CH-NH-CH3
эфедрин
сн3
CH,-NH-C-(CH,)-CH=CH-CH-CH,
। 2 || ' 2'4 3
О
ОСН3
ОН капсаицин
Капсаицин содержится в плодах и семенах
стручкового перца и определяет их жгучий вкус.
Вещества вторичного происхождения
207
Различают плоды перца, содержащие мало капса-
ицина (сладкие сорта) и содержащие его много, до
2% (жгучие сорта). Для медицинских целей ис-
пользуются жгучие сорта. Настойка стручкового пер-
ца применяется для возбуждения аппетита и улуч-
шения пищеварения. В качестве местного возбуж-
дающего средства используют перцовый пластырь.
Колхициновые алкалоиды содержатся в безвре-
меннике. Главными алкалоидами этого растения
являются колхицин и колхамин. Последний отли-
чается от колхицина тем, что у него заместителем у
азота является метильная группа вместо ацетильной.
Колхицин и колхамин обладают антимитотиче-
ской активностью. Колхицин используют для по-
лучения полиплоидов. Оба препарата способны за-
держивать опухолевый рост, но чаще применяется
колхамин как менее токсичный.
Псевдоалкалоиды (терпеноидные алкалоиды)
В построении псевдоалкалоидов принимают уча-
стие терпеноиды с числом углеродных атомов 10,
15, 20 и 30. Это сложные соединения, молекулы
которых построены из многих конденсированных
колец. Они содержатся у растений всего несколь-
ких семейств. Многие терпеноидные алкалоиды ток-
сичны. Используются псевдоалкалоиды мало. Ветре-
208
Вещества вторичного происхождения
чаются алкалоиды этого типа у кубышки желтой,
актинидии, дельфиниума, аконита, буксуса и др.
Примером псевдоалкалоида может быть солани-
дин — агликон гликоалкалоида соланина, который
содержится в растении картофеля и других паслено-
вых. О нем речь шла ранее, в разделе «Гликозиды».
Биосинтез алкалоидов
Несмотря на большое разнообразие алкалоидов,
образование их происходит за счет одних и тех же
первичных предшественников через сходные про-
межуточные реакции.
Большинство из известных алкалоидов образу-
ется из аминокислот или их производных — диа-
минов (лизин, кадаверин, орнитин, путресцин, ар-
гинин, фенилаланин, тирозин, триптофан, гисти-
дин, глютаминовая кислота и др.).
На первых этапах биосинтеза алкалоидов, когда
предшественник имеет ациклическое строение, осу-
ществляются реакции, характерные для обмена
аминокислот — дезаминирование, переаминирова-
ние, декарбоксилирование. Метилирование играет
особо важную роль в образовании алкалоидов. Оно
часто происходит на стадии ациклического соеди-
нения и предшествует циклизации, направляя ее.
В молекулах алкалоидов метилироваться могут кис-
лород и азот, образуя группы -ОСН3 и =N-CH3. По
очереди обычно первым в молекуле метилируется
кислород, а затем азот. Метильные группы перено-
сятся с помощью ферментов метил трансфераз, до-
нором -СН3-групп чаще выступает SAM.
Далее происходит циклизация, а затем конден-
сация. Эти процессы идут с помощью трех реак-
ций. Две из них — это реакции между -NH2 и
=С=О группами. В результате образуются связи
Вещества вторичного происхождения 209
1 C-N, C=N или С-С. В третьей реак-
lOjN ции ПР°ИСХ°ДИТ окислительное соеди-
I нение фенольных колец. Примером
снз такого соединения может быть моле-
НИКОТИН
кула никотина.
Распад алкалоидов может происходить до СО2
с выделением энергии. Но считается, что чаще в
растениях их распад идет до образования амино-
кислот, из которых они синтезируются. Интерес-
но, что растение способно катаболизировать не толь-
ко эндогенные алкалоиды, но и экзогенные, не
характерные для данного растения и специально
введенные в него. К катаболизму алкалоидов спо-
собны даже безалкалоидные растения.
Необходимо еще раз вернуться к роли метили-
рования алкалоидов. Роль метилирования важна
не только для направления циклизации алифати-
ческих предшественников. Метильные группы,
введенные в молекулу алкалоида, стабилизируют
ее. Установлено, что при введении в растение эк-
зогенных алкалоидов быстрее распадаются неме-
тилированные формы. Кроме того, метилирован-
ные аналоги менее токсичны, чем алкалоиды, не
содержащие метильных групп. Следует вспомнить,
например, токсичность морфина и кодеина. Для
самого растения алкалоиды, если они накаплива-
ются в большом количестве, могут быть токсич-
ны. Очевидно, метилирование для растения — один
из способов интоксикации алкалоидов. Метилиро-
ванием алкалоидов растение создает разнообразие
их модифицированных форм.
Функции алкалоидов в растении
1. Азотистые вещества алкалоиды участвуют
в азотном обмене растений следующим образом:
210
Вещества вторичного происхождения
а) они могут выполнять роль запасной формы азо-
та, накапливаясь при усиленном азотном питании;
б) могут служить транспортной формой азота,
т. к. часто алкалоиды синтезируются в корнях, а за-
тем транспортируются в листья;
в) синтез алкалоидов в корнях может быть од-
ним из механизмов обезвреживания аммиака;
г) алкалоиды могут служить резервом амино-
кислот, которые образуются при их распаде.
2. Алкалоиды регулируют pH клеточного сока,
т.к. связывают органические кислоты с образова-
нием солей.
3. Алкалоиды, являясь хелатообразователями,
участвуют в поддержании ионного баланса в рас-
тении.
4. Алкалоидам приписывают важную роль в устой-
чивости растений к патогенным грибам. Например,
алкалоидные виды люпина более устойчивы к фуза-
риозу и мучнистой росе, чем безалкалоидные.
5. Алкалоиды влияют на различные реакции
и процессы метаболизма. Например, обнаружено,
что они ингибируют синтез белка, хлорофилла, фер-
менты гликолиза, глиоксилатного цикла и др. Не-
которые алкалоиды оказывают воздействие на про-
цессы дифференцировки и органогенеза.
КОНТРОЛЬНЫЕ ВОПРОСЫ И ЗАДАНИЯ
1. Что такое вещества вторичного происхожде-
ния? На какие группы их делят? Дайте общую
характеристику органическим кислотам алифати-
ческого ряда. Как их классифицируют?
2. Охарактеризуйте летучие и нелетучие орга-
нические кислоты, их особенности, распростране-
ние и основные пути обмена.
Вещества вторичного происхождения
211
3. Дайте общую характеристику фенольным со-
единениям. На чем основана их классификация?
Расскажите о фенолах, бензохинонах и фенольных
кислотах.
4. Расскажите о гидроксикоричных кислотах и
их особенностях. Как образуются кумарины?
5. Дайте общую характеристику флавоноидам.
В чем особенности строения этой группы феноль-
ных соединений? Расскажите о катехинах.
6. Расскажите об антоцианах. От чего зависит
их окраска?
7. Что вы знаете о халконах?
8. Что вы знаете об олигомерных фенольных
соединениях?
9. Дайте общую характеристику дубильным ве-
ществам. В чем заключается процесс дубления?
Расскажите о гидролизуемых и конденсированных
дубильных веществах.
10. Что собой представляет лигнин? Что такое
меланины? Чем растительные меланины отлича-
ются от животных?
11. Каковы основные пути образования фенольных
соединений? Каковы функции фенолов в растении?
12. Что такое гликозиды? На какие группы их
делят?
13. Расскажите об особенностях О-гликозидов
и их классификации.
14. Что собой представляют цианогенные гли-
козиды? Расскажите об их образовании и превра-
щении.
15. Расскажите о стероидных гликозидах — сер-
дечных гликозидах и сапонинах. Каково их строе-
ние и действие на человеческий организм?
16. Что вы знаете о S-, N- и С-гликозидах?
17. Расскажите о роли гликозидов в растении
и их практическом применении.
212
Вещества вторичного происхождения
18. Дайте общую характеристику терпенам и тер-
пеноидам. Как их классифицируют? Расскажите
об изопрене и его производных.
19. Расскажите о терпенах и терпеноидах —
компонентах эфирных масел.
20. Что такое эфирные масла? Каков их состав
и распространение? Каковы функции эфирных
масел в растении и их практическое применение?
Расскажите о способах получения эфирных масел.
21. Что такое бальзамы и смолы? Какие терпе-
ны и терпеноиды входят в состав смол?
22. Какие терпены и терпеноиды относятся
к группе полипренолов?
23. Расскажите о каучуке и гутте.
24. Как происходит биосинтез терпенов? Какое
соединение является исходным? Какие — проме-
жуточными?
25. Каковы функции терпенов и терпеноидов
в растении?
26. Дайте общую характеристику алкалоидов.
На чем основана классификация алкалоидов? На
какие группы их делят?
27. Каково значение алкалоидов в медицине,
в пищевой промышленности и сельском хозяйстве?
28. Дайте общую характеристику истинных ал-
калоидов. На какие группы их делят?
29. Что вы знаете о тропановых алкалоидах?
Расскажите о строении, распространении и ис-
пользовании никотина, анабазина, лобелина, ре-
цинина.
30. Расскажите об особенностях алкалоидов мака
снотворного. Где они применяются? Что такое эн-
дорфины?
31. Что вы знаете об алкалоидах раувольфии
змеиной? Каковы особенности строения, свойства
и применение эрголиновых алкалоидов?
Вещества вторичного происхождения 213
32. Каковы особенности строения кофеина? Для
чего его используют?
33. Что такое протоалкалоиды? Охарактеризуйте
эфедрин, капсаицин и колхициновые алкалоиды.
34. Что вы знаете о псевдоалкалоидах?
35. Каковы основные этапы и реакции в образо-
вании алкалоидов? Что вам известно о распаде
алкалоидов?
36. Каковы основные функции алкалоидов в рас-
тении?
АЛФАВИТНЫЙ УКАЗАТЕЛЬ
Абиетиновая кислота 191
Агар-агар 57, 191
S-Адеиозилметионин 73
Аконитат-гидратаза 136
цис-Аконитовая кислота 151
Аковеиоза 178
а-Аланин 81
0-Аланин 81, 112
Аланиндегидрогеназа 97
Альгиновая кислота 58
Альдоза 12
а-Аманитин 87, 111
Амигдалин 22, 112, 177-178
Амиды 90, 98, 100, 101, 111
а-Амилаза 71
Амилоза 44
Амилопектин 45, 70
Аминомасляиый альдегид 113
у -Аминомасляная кислота 113
Аминотрансферазы 97
Аминоциклопропилкарбоновая
кислота 85
Амииы 104, 106, 107, 110, 175
Анабазин 197, 200, 201
Антоцианы 160-165, 176, 182
Апиоза 29
Арабииаиы 55
L-Арабиноза 25, 51, 53
UDP-Арабиноза 162, 179
Арахииовая кислота 119
Аргииин 79, 90, 91, 111, 208
Аспарагин 79, 80, 100, 178
Аспарагиновая кислота 79, 80,
98, 111
Аспартат-аммиак-лиаза 97
Атропин 112, 197, 199, 200
Ацетил-СоА 132, 149, 150, 151,
159, 160, 162, 185, 206, 211
N-Ацетилглюкозамии 58
Бальзамы 190, 212
Бегеновая кислота 119
Бензойная кислота 187, 200
Бесаболен 186
Бетаины 109, 110, 112
Бетацианин 168
Боивииоза 179
Валериановая кислота 145
Валин 79, 90, 145
Вербаскоза 40, 41, 69
Винная кислота 150
Витексин 181
Виценин 181
Воска 126, 129, 130
Галактоза 12, 26, 27, 39, 41,
51, 139, 162, 165, 179
UDP-Галактоза 72
Галактаны 52, 55
Галактинол 68, 69
Галактит (дульцит) 32
Галактозамин 10
Галактозидазы 140
Глактозилглицерин 140
Галактозилтраисферазы 139
Галактолилаза 140
Галактолипиды 126, 127
Галактуроновая кислота 52, 73
UDP-Галактуроиовая кислота 73
Галловая кислота 155
Галлокатехин 160
Галлотаннин 169, 170
Гамамелоза 29
Гваякол 186
Гемицеллюлозы 8, 24, 25, 27,
32, 43, 48, 50-52, 72-76
Гентиобиоза 177
Гераниол 184, 185
Героин 203
Гидиокарповая кислота 120
0-Гид рокси-а-кетомасляиая
кислота 145
0-Гидроксимасляиая
кислота 145
Гидролизуемые дубильные
вещества 169
Гидрохинон 153
Гистидин 79, 81, 90, 208
Гликоалкалоиды 176, 179-182
Гликоген 26, 43, 46, 47, 48
Алфавитный указатель
215
Гликозиды 4, 21, 22, 38, 39,
112, 143, 159-162, 175-187,
181, 208, 211
Гликолевая кислота 147
Гликолипиды 23, 88, 89, 126,
139, 142
Гликопротеины 9, 38, 77, 89
Глиоксилатный цикл 134, 135,
138, 145
Глиоксилевая кислота 147
Глиоксисомы 134, 135
Глицериновый альдегид 13-14, 23
Глицероманиооктулоза 28
Глиции 79, 98, 99, 111, 147
Глициибетаин 109
Глицирризиновая кислота 42
Глобулины 87
1,4-а-Глюкаи-ветвящий
фермент 70
Глюкаровая кислота 31
D-Глюкоза 14-22
L-Глюкоза 14
ADP-Глюкоза 70
GDP-Глюкоза 71
UDP-Глюкоза 72
Глюкозамин 10, 30, 89, 101, 112
Глюкозо-1-фосфат 65
Глюкозо-6-фосфат 65
Глюконеогенез 134, 152
Глюконовая кислота 146, 147
Глюкопираиоза 17
Глюкуроновая кислота 72, 175
Глютамин 79, 111, 112
Глютаминовая кислота 79
Глютатион 86, 111
Глютелины 88
Гомоаргинии 84
Гомосерин 83
Гомоцистеин 83
Горчичное масло 187
Гумми (камеди) 24-32, 43, 55, 76
Гутта 183, 192-194, 196
Дезаминирование 102-104, 208
Дегидрогеназы 74, 136, 137,
144, 148
Дезоксирибоза 9, 30
Декарбоксилирование 102, 208
Дельфинидин 162, 165
Десатуразы 133
Диаминомасляная кислота 84, 85
Диаминопимелиновая кислота 83
Диаминооксидазы 107
Диамины 105
Дигалактозилдиглицерид
(ДГД)127
Дигалловая кислота 155
Дигиталоза 179
Дигитогенин 179
Дигитоксигенин 178
Дигитоксин 178
Дигитоксоза 30, 179
Диоксиацетои 12
Диоксииндол 96
Дикумарин 159
Диметилаллилпирофосфат
(ДМАПФ) 184, 194 184
Дульцит (галактит) 32
Дуррии 177
Живица 190
Жирные кислоты 44, 118-141
Жиры (масла) 117, 118,
132, 134, 142, 145, 174
- высыхающие 123
- невысыхающие 123
- полувысыхающие 123
- твердые 122
Изовалериановая кислота
Изолейции 79, 90
Изолимонная кислота 151
Изомасляная кислота 145
Изопетилпирофосфат
(ИПФ) 184, 194, 195
Изопрен 182-184, 194
Изосалипурпозид 165
Изоцитрат-лиаза 136
Инвертный сахар 36
Индол 96, 187, 199
jhuo-Ииозит 68, 69
Инулин 8, 11, 27, 43
Кадаверин 208
Каллоза 43, 56, 57
Камеди 55, 76
Камфора 185, 186, 190
216
Алфавитный указатель
Канифоль 190
Каприловая кислота 119
Каприновая кислота 119
Капроновая кислота 119
Капсаицин 206, 213
2-Карбокси-З-кето-рибитол-
1,5-бисфосфат 60
Карбоксифеиилалаиии 83
Карнаубовая кислота 129
Катехин 160
Катехиигаллат 160
Каучук 183, 192, 193, 196
Кафестрол 191
а-Кетоглютаровая кислота 98
Кодеин 197, 203
Кокаин 112, 200
Колхамин 207
Колхицин 207
Конденсированные
дубильные вещества 170
Коиифериловый спирт 157, 171
Коричная кислота 104
Кофеин 197, 206
Кофейная кислота 157
Крахмал 8, 11, 26, 43-48, 69,
70, 71, 76
Крахмал-синтаза 70
Кремортартрат 150
Кристаллоза 42
Ксилаиы 52, 73
Ксилоза 11-12, 24, 41, 51-52,
162, 179
Ксилулоза 13, 25
Ксилулозо-5-фосфат 62
Кумарин 158, 159
Кумаровая (оксикоричиая)
кислота 104, 112, 157
Кумаровый спирт 157
Кутни 126, 130, 131, 141
Лактоза 27, 37, 38, 41
Лауриновая кислота 119
Лрдол 186
Лейцин 79, 90, 145
Лекаиоровая кислота 166
Лектины 79, 90, 145
Летучие органические
кислоты 146
Лигиии 4, 113, 170-171, 211
Лизергиновая кислота 205
Лизни 79, 83, 90, 208
Лимонная кислота 151
Лимонен 185
Линалоол 184
Линамарин 177
Линолевая кислота 119
Линоленовая кислота 119
Лихеиии 11, 26, 43, 57, 76
Лишайниковые кислоты 166
Лобелии 201
Лофеиол 128
Малат-дегидрогеиаза 137
Малат-сиитаза 136
Малоиил-СоА 132, 172
Малоновая кислота 149
Мальвидии 162, 165
Мальтоза 11, 26, 36, 41
Маннаны 52
Маннит 32
Манноза 26, 27, 51
Масляная кислота 145
Меланины 96, 113, 167, 171,
172, 211
Ментол 185
а-Метилгликозид 22
у-Метил-глютаминовая
кислота 84
у-Метилеи-глютамииовая
кислота 84
у-Метилеициклопропил-
глиции 83
Метилтраисферазы 110
S-Метилцистеии 84
Метионин 79, 83, 85, 90
Механизмы обезвреживания
аммиака 99, 115
Миристиновая кислота 119
Мирициловый спирт 129
Мирцен 184
Молочная кислота 148
Моиоамииы 105
Р-Моиогалактозил-
диглицерид 127
Моносахариды (моиозы) 10-30,
34, 59, 65, 66, 76
Алфавитный указатель
217
Моитаиовая кислота 120
Морфии 197, 201-203
Мочевина 101
Муравьиная кислота 144
Мускаруфии 154
Мутаза 65
Налоксон 203
Нелетучие органические
кислоты 146, 210
Непротеииогеииые
аминокислоты 81-85, 114
Неролидол 186
Никотин 112, 197, 200-201
Нуклеопротеины 90
а-Окислеиие жирных кислот 138
Р-Окислеиие жирных кислот 134
у-Оксиглютамииовая кислота 84
Р-Окси-а-кетомасляиая
кислота 145
0-Оксимасляиая кислота 145
Олеиновая кислота 133
Олеостеариновая кислота 121
Олигосахариды 10-11, 20, 33, 75
Опий 201
Ориеитии 181
Ориитии 84-85, 111, 208
Орнитиновый цикл 102
Орселлииовая кислота 166
Остол 184
Оцимеи 184
Пальмитиновая кислота 132
Паиаксозиды 179
Папаверин 197, 204
Пектиновая кислота 54
Пектины 48, 53-55, 72, 73, 76
Пеларгонидин 162, 165
Пеларгонии 162, 165
Пептидазы 114
Переамииироваиие 97, 208
Пероксидаза 89
Пероксисомы 138
Р-Пиразол-1-илалаиии 84
Пиперидин 108
Пиридин 199
Пировиноградная кислота 147
Пирогаллол 153
Пирокатехин 153, 172
Пирофосфорилаза 66
Пирролидин 108
Полипренолы 72, 118, 83, 192
Полисахариды (полиозы) 10,
11, 33, 43, 48, 55, 56, 57,
69, 76, 89, 176, 181
Полифеиолоксидазы 173
Полуацеталь 16
Преиилтраисферазы 195
Примни 154
Проламины 88
Пролии 79, 80, 90, 113
Пролиибетаии (стахидрин) 199
Промедол 197, 203
Пропионовая кислота 145
Протеазы 86, 114
Протокатеховая кислота 155
Прямое амииироваиие 97
Пурии 111, 144, 199
Путресцин 208
L-Рамиоза 29, 38, 55
UDP-Рамиоза 73
Распад
- высших полисахаридов 69
- гликолипидов 139
- жиров 132, 134
- крахмала 69-71, 76
- целлюлозы 71-72
Растворимый пектин 54
Рафиноза 11, 26, 27, 39, 41, 69
Резеиы 191
Рибоза 11, 12, 18, 24, 25
Рибозо-5-фосфат 64
Рибулоза 13, 25, 74
Рибулозо-1,5-бисфосфат
(РБФ) 59, 60, 61, 64
Рибулозобисфосфат-
карбоксилаза (РБФК) 60
Рибулозо-5-фосфат 64
Рибулозофосфат-изомераза 64
Рибулозофосфат-эпимераза 64
Рицинин 201
Рицииолевая кислота 120
Рутиноза 38, 162
218
Алфавитный указатель
Салициловая кислота 154, 174
Самбубиоза 39, 162
Сапонарин 181
Сапонины 178, 179, 182
UDP-Caxapa 65-68
Сахараза 36
Сахарин 42
Сахароза 9, 11, 26-27, 34-38,
40-42, 53, 67-69, 76
Сахарозо-синтаза 67
Сахарозофосфат-синтаза 67
Сегнетова соль 150
Седогептулоза 13, 27, 28
Седогептулозо-1,7-бисфосфат 63
Седогептулозо-7-фосфат 63
Сердечные гликозиды 178-182
Серин 79, 80, 98, 110, 112
Сильвестрен 185
Синальбин 180
Синаповый спирт 157
Синигрин 22, 180
Синтез
- высших полисахаридов 69
- гликолипидов 139
- жиров 132, 134
- пектинов 72, 73
- пеитоз 73-74
- сахарозы 67
- трегалозы 37
- три-, тетра- и пентасаха-
ридов 68
- целлюлозы 71
Синтетазы жирных кислот 132
Р-Ситостерол 128
Скипидар 182, 190
Скополетин 159
Слизи 24-27, 32, 43, 55-56, 76
Сложные эфиры 21, 129, 140-
141, 157, 185, 187
Смолы 4, 145, 152, 190-191, 212
Смоляные (резиновые)
кислоты 191
Смоляные спирты (резенолы) 191
Солаиезол 192
Соланидин 180, 208
Соланин 180
Сорбит 21, 32, 41
Софороза 162
Спинастерол 128
Стахидрин 199
Стахиоза 40, 69
Стеариновая кислота 133
Стевиозид (стевиоза) 42
Стероиды 88, 118, 126, 128,
145, 183, 192, 195, 196
Стигмастерол 128
Стрептоза 29
Суберин 126, 130-131
Р-Сульфогликозилдигли-
церид 127
Сульфолипиды 88, 126-127, 142
Сульфохиновоза 127
Таннины (дубильные
вещества) 167, 168, 170, 172
Теветоза 179
Тересанталлол 186
а-Терпинен 185
Тетрагидроканнабинол 153
Тирозин 79, 208
Транскетолаза 62, 63
Транспептидазы 113
Трегалоза 11, 34-37, 67
Треонин 79, 83, 90
Триозофосфат-дегидрогеназа 61
Триозофосфат-изомераза 61
Триптофан 79-80, 90, 208
Тропин 199
Троповая кислота 199
Уксусная кислота 144
Уреаза 101
Урушиол 153
Фазеолиновая кислота 157-158
Фарнезол 186
Фенилаланин 79, 80, 90, 208
Фенолы 152, 153, 173, 174
Феруловая кислота 158
Фитогемагглютинииы
(лектины) 9, 89
Фитол 192, 196
Флаван 160
Флавоноиды 113, 118, 153,
159, 160, 165, 167, 172, 174
Флоридзин 165
Алфавитный указатель
219
Фосфатаза 65
Фосфоглицераткиназа 60
Фосфоглицерииовый
альдегид (ФГА) 23, 61-63, 65
Фосфоглицериновая
кислота (ФГК) 60, 98
Фосфодиоксиацетон (ФДА) 23,
61, 62, 65
Фосфоенолпируват (ФЕП) 99,
137, 148
Фосфоперидоксаль 97
Фосфорибулокиназа 64
Фосфосерин 98
Фруктоза 11, 12, 13, 18, 26-
27, 40, 41, 67, 68
Фруктозаны
- инулиноподобиые 47
- леваноподобные 47
Фруктозо-1,6-бисфосфат 61
Фруктозо-6-фосфат 61, 62, 65
Фруктофураноза 17
Фукоза 29
Фумаровая кислота 97, 149
Фурфурол 24
Халкоиы 160, 165, 176, 182
Хаульмурговая кислота 120
Хинолии 199
Хинная кислота 172
Хинон (бензохинон) 173, 192, 103
Хитин 30 58
Холин 110
Хромопротеины 89
Целлобиаза 72
Целлобиоза 37-40
Целлюлоза 37, 49, 50, 51, 59,
71, 72, 76, 170, 192, 196
Цериловый спирт 129
Церотиновая кислота 129
Цианидин 162
Р-Цианоаланин 178
РЦиаиоалании-синтетаза 178
Цианогенные гликозиды 181
Цикл Кальвина 59-65
Цикориновая кислота 158
Цимароза 179
Цистеии 79, 82, 84, 86
Цитокинин 184
Цитраль 185
Цитрат-синтаза 136
Цитронеллол 185
Цитруллин 84, 111
Шикимовая кислота 172
Щавелевая кислота 102, 144, 148
Щавелевоуксусная кислота 149
Эверновая кислота 166
Экгонин 200
Эндорфины 203
Эрголиновые алкалоиды 205
Эргостерол 128
Эритрогулонаннулоза 28
Эритроза 23
Эритрозо-4-фосфат 62
Эруковая кислота 120
Эскулетин 159
Этаноламин ПО
Этилморфин 203
Эфедрин 206
Эфирные масла 134, 145
Яблочная кислота 150
Яблочнокислый аммоний 150
Янтарная кислота 149, 198
Янтарный альдегид 149
РЕКОМЕНДОВАННАЯ ЛИТЕРАТУРА
Учебники
1. Кретович В. Л. Биохимия растений. — М.: Высшая
школа, 1980. — 503 с.
2. Плешков Б. П. Биохимия сельскохозяйственных рас-
тений. — М.: Колос, 1980. — 495 с.
3. Гудвин Т., Мерсер Э. Введение в биохимию растений. —
М.: Мир, т.1,2, 1986. — 393с; 342 с.
Дополнительная литература
Раздел «Углеводы»
1. Степаненко Б. Н. Химия и биохимия углеводов (моно-
сахариды). — М.: Высшая школа, 1977. — 237 с.
2. Степаненко Б. Н. Химия и биохимия углеводов (поли-
сахариды). — М.: Высшая школа, 1978. — 256 с.
3. Тарчевский И. А. Основы фотосинтеза. — М.: Высшая
школа, 1977, — 253 с.
Раздел «Белки»
1. Брей С. Азотный обмен в растениях. — М.: Наука,
1986. — 240 с.
2. Растительные белки и их биосинтез/Под. ред. Крето-
вича В. Л. — М.: Наука, 1975. — 335 с.
3. Пири Н. У. Белки из листьев зеленых растений. — М.:
Колос, 1980. — 192 с.
4. Источники пищевого белка. — М.: Колос, 1979. — 300 с.
5. Полякова Л. Л., Ковальчук М. И., Нижко В. Ф. Выде-
ление и характеристика белковых концентратов из сока зе-
леных растений // Физиология и биохимия культурных рас-
тений. — 1988. — Т. 20. — №1. — С. 79-82.
6. Стаценко А. П. О криозащитной роли аминокислот в ра-
стениях // Физиология и биохимия культурных растений. —
1992. — Т. 24. — №6. — С. 560-571.
Раздел «Липиды»
1. Беззубов А. П. Химия жиров. — М.: Пищевая промыш-
ленность, 1975. — 274 с.
2. Щербаков Б. Г. Химия и биохимия переработки маслич-
ных семян. — М.: Пищевая промышленность, 1977. — 168 с.
3. Негруцкий С. Ф. Липидный обмен растений. — Донецк,
ДГУ, 1976. — 95 с.
Рекомендованная литература
221
4. Бриттон Г. Биохимия природных пигментов. — М.:
Мир, 1986. — 422 с.
5. Верещагин А. Г. Биохимия триглицеридов. — М., 1972.
Раздел «Вещества вторичного происхождения»
1. Запрометов М. Н. Биохимия катехинов. — М.: Наука,
1964. — 295 с.
2. Запрометов М. Н. Основы биохимии фенольных соеди-
нений. — М.: Высшая школа, 1974. — 214 с.
3. Блажей А., Шутый Л. Фенольные соединения расти-
тельного происхождения. — М.: Мир, 1977. — 239 с.
4. Барабой В. А. Биологическое действие растительных
фенольных соединений. — К.: Наукова думка, 1976. — 260 с.
5. Муравьева Д. А. Тропические и субтропические лекар-
ственные растения. — М.: Медицина, 1983. — 336 с.
6. Максютина Н. П., Комисаренко Н. Ф., Прокопенко А. Г.,
Погодина Л. Н., Линкин Г. Н. Растительные лекарственные
средства. — К.: Здоровье, 1985. — 280 с.
7. Ловкова М. Я. Биосинтез и метаболизм алкалоидов в ра-
стениях. — М.: Наука, 1981. — 171 с.
8. Даниленко В. С., Родионов П. В. Острые отравления рас-
тениями. — К.: Здоровье, 1986. — 112 с.
9. Танасиенко Ф. С., Касимовская Н. Н., Шляпников В. А.,
Шляпникова А. П. Эволюция представлений об изменении со-
держания и состава эфирных масел // Физиология и биохимия
культурных растений, 1995. — Т. 27. — №3. — С. 123-129.
10. Лебедев Г. С., Сытник К. М. Пигменты растительного
мира. — К.: Наукова думка, 1986.
СОДЕРЖАНИЕ
ВВЕДЕНИЕ.........................................3
1. УГЛЕВОДЫ..................................... 8
1.1 Общая характеристика и функции.............8
1.2 Классификация.............................10
1.3 Моносахариды..............................11
Структура молекул..........................11
Химические свойства........................18
Характеристика отдельных моносахаридов.....23
Некоторые производные моносахаридов .......31
1.4 Полисахариды..............................33
Олигосахариды..............................33
Сладость сахаров...........................41
Высшие полисахариды........................43
Некоторые полисахариды водорослей..........57
1.5 Обмен углеводов...........................59
Образование углеводов при фотосинтезе......59
Синтез, распад и превращение
углеводов в растении ......................65
Биосинтез сахарозы.........................67
Биосинтез три-, тетра- и пентасахаридов....68
Биосинтез высших полисахаридов.............69
Биосинтез и распад крахмала................69
Биосинтез и распад целлюлозы...............71
Образование гемицеллюлоз и пектинов .......72
Образование пентоз.........................73
Контрольные вопросы и задания..............75
2. БЕЛКИ .......................................77
2.1 Общая характеристика и функции белков.....77
2.2 Аминокислоты .............................79
2.3 Пептиды...................................85
2.4 Классификация белков......................87
Простые белки .............................87
Сложные белки .............................88
2.5 Аминокислотный состав растительных белков..90
2.6 Проблема пищевого белка и пути ее решения.91
2.7 Обмен аминокислот и белков................95
Особенности азотного обмена растений.......96
Общие пути синтеза аминокислот.............97
Образование аминокисдот при фотосинтезе....98
Механизмы обезвреживания аммиака...........99
Образование и роль амидов в растении......100
Образование мочевины......................101
Содержание 223
Образование аммонийных солей ..............102
Общие пути распада аминокислот.............102
Образование моноаминов.....................105
Образование диаминов.......................106
Метилирование аминокислот..................108
Пул свободных аминокислот и их роль
в растении ................................111
Биосинтез белка............................113
Распад белков .............................114
Контрольные вопросы и задания..............114
3. ЛИПИДЫ.......................................116
3.1 Жиры......................................116
Состав растительных масел .................117
Жирные кислоты и триглицериды масел........118
Основные константы масел...................121
Прогоркание масел..........................124
Гидрогенизация масел ......................125
3.2 Жироподобные вещества (липоиды)...........126
Гликолипиды................................126
Стероиды ..................................128
Воска.................................... 129
Кутин и суберин............................130
3.3 Обмен липидов.............................132
Синтез и распад жиров .....................132
Синтез и распад гликолипидов ..............139
Образование восков.........................140
Образование кутина.........................141
Контрольные вопросы и задания..............142
4. ВЕЩЕСТВА ВТОРИЧНОГО ПРОИСХОЖДЕНИЯ .... 143
4.1 Органические кислоты алифатичекого ряда...144
Летучие кислоты............................144
Нелетучие органические кислоты ............146
Монокарбоновые кислоты.....................146
Дикарбоновые кислоты.......................148
Трикарбоновые кислоты......................151
Роль органических кислот в растении........152
4.2 Фенольные соединения .....................152
С6-фенолы..................................153
Св-С]-фенольные кислоты....................154
Св~С3-гидроксикоричные кислоты и кумарины .... 156
Св~С3-Св-флавоноиды........................159
Некоторые антоцианы растений...............165
Олигомерные фенольные соединения...........166
Полимерные фенольные соединения............167
224 Содержание
Дубильные вещества, или таннины............167
Лигнины....................................170
Меланины...................................171
Образование фенольных соединений ..........172
Функции фенолов в растении.................173
4.3 Гликозиды............................... 175
О-гликозиды ...............................176
S-гликозиды................................180
N-гликозиды................................181
С-гликозиды................................181
Роль гликозидов в растениии ...............181
4.4 Терпены и терпеноиды.................... 182
С5-изопрен.................................183
С10-, С15-терпены и терпеноиды — компоненты
эфирных масел..............................184
Эфирные масла..............................187
Роль эфирных масел в растении..............188
Получение эфирных масел ...................188
Использование эфирных масел ...............189
С20-, С25-, См-терпены и терпеноиды —
компоненты смол............................190
Политерпены................................192
Полипренолы ...............................192
Каучук ....................................193
Гутта......................................193
Биосинтез терпенов и терпеноидов...........194
Функции терпенов и терпеноидов в растении .196
4.5 Алкалоиды ................................196
Истинные алкалоиды.........................199
Протоалкалоиды.............................206
Псевдоалкалоиды (терпеноидные алкалоиды)..207
Биосинтез алкалоидов.......................208
Функции алкалоидов в растении .............209
Контрольные вопросы и задания..............210
АЛФАВИТНЫЙ УКАЗАТЕЛЬ...........................214
РЕКОМЕНДОВАННАЯ ЛИТЕРАТУРА.....................220
Copyleft ® San’ky incorporation
derevyaha + Q
В Москве книги
издательства
«Феникс»
Торговый Дом
еникс
можно купить:
Для КНИГОТОРГОВЫХ
организаций
В региональном представительстве, расположенном
по адресу:
1. ул. Маршала Новикова, 1, М. «Октябрьское поле» или «Щукин-
ская». Тел.: 196-0525, тел./факс (095) 196-0843;
E-mail: fenix-m@pike.net.ru
Директор — Моисеенко Сергей Николаевич
2. ул. Матеевская, 9/13, район метро «Новогиреево»
Тел.: 305-6767, 517-32-95; (Индекс 111399)
Директор — Мячин Виталий Васильевич
3. В Издательском Торговом Доме «КноРус» ул. Б. Переяслав-
ская, 46, М «Рижская», «Проспект мира». Т/ф: (095) 280-02-07,
280-72-54, 280-91-06, 280-92-13 E-mail: office@knorus.ru
В крупнейших магазинах:
ТД «Библио-Глобус»
ул. Мясницкая, 6 (тел. 925-24-57)
ТД «Москва»
ул. Тверская, 8 (тел. 229-66-43)
«Московский Дом книги»
ул. Новый Арбат, 8 (тел. 291-78-32)
«Молодая гвардия»
ул. Большая Полянка, 28 (тел. 238-11-44)
«Дом педагогической книги»
Большая Дмитровка, 7/5, строение 1 (тел. 299-68-32)
«Медицинская книга»
Комсомольский проспект, 25 (тел. 245-39-33)
Я Торговый Дом
еникс
В Санкт-Петербурге
книги издательства
«Феникс»
можно купить:
«дом книги»
Невский проспект, 28
Тел. 318-65-04, факс 311-98-95;
E-mail: noskova@hbook.spb.ru
Для оптовых покупателей
Региональное представительство
194100, г. Санкт-Петербург,
ул. Капитана Воронина, 8
тел.: 245-55-76, 245-06-57
E-mail: spbbooks@maiUanck.net,
phoenixspt@maii. ianck. net
Нарзиева Анжела Рустамовна
Представительство осуществляет доставку грузов
автотранспортом и почтово-багажными вагонами,
транспортные расходы делятся 50/50.