Текст
С.Ф. Негруцкий
С.Ф. Негруцкий
«вимопш
"био
XIMUN
НИЗШИХ
РАСТЕНИЙ
Допущено
Министерством высшего
и среднего специального
образования УССР
в качестве учебного пособия
для студентов университетов,
обучающихся по специальностям
«Биология», «Зоология
и ботаника»,
«Физиология», «Биохимия»
Киев
«Выща школа»
1990
ББК 28.57я73
Н41
УДК 581.1+581.19/07/
Рецензенты:
доктор биологических наук, профессор А. В. Капля
(Киевский госуииверситет),
доктор биологических наук, профессор Л. А. Сиренко
(Институт гидробиологии АН УССР)
Редакция литературы по биологии и географии
Редактор Н. И. Ромась
Негруцкий С. Ф.
Н41 Физиология и биохимия низших растений:
Учеб, пособие.— К.: Выща шк., 1990.— 191 с.: ил.
ISBN 5-11-002081-7
В учебном пособии приводится положение низших ра-
стений — грибов, водорослей, лишайников — в системе жи-
вых существ, показан их филогенез, присущие им особен-
ности питания, дыхания, синтетической деятельности, рос-
та. Рассмотрены отличия в реакциях обмена веществ по
сравнению с высшими растениями, пути образования уг-
леводов, белков и азотсодержащих веществ, липидов, ор-
ганических кислот, витаминов, вторичных метаболитов. Дан
анализ влияния различных факторов окружающей среды на
активность жизнедеятельности низших растений, изложены
перспективы все возрастающего использования низших рас-
тений в хозяйственных целях, в изучении молекулярной
биологии и развитии биотехнологии.
Для студентов университетов, обучающихся по специ-
альностям «Биология», «Зоология и ботаника», «Физиоло-
гия», «Биохимия».
1906000000—045
Н •---------------89—90
М211 (04)— 90
ББК 28.57я73
ISBN 5-11-002081-7
© С. Ф. Негруцкий, 1990
ВВЕДЕНИЕ
В курсе физиологии и биохимии низших растений
изучаются процессы жизнедеятельности и особенно-
сти обмена веществ у довольно обширной группы ор-
ганизмов, таксоны которой не только обособлены от
высших растений, но и отличаются между собой по
уровню эволюционной продвинутости.
Совокупность превращений, происходящих в про-
цессе жизнедеятельности организма, составляет био-
логический обмен, лежащий в основе жизни как био-
логической формы движения материи. Биохимия изу-
чает отдельные этапы обмена веществ и их связь с
физиологическими функциями организма, с условия-
ми, при которых возникает и развивется та или иная
физиологическая функция. Важной ее задачей явля-
ется изучение эволюции физиолого-биохимических
функций в процессе развития живой природы.
Уже на заре развития человечества понятие
«жизнь» неразрывно связывалось с понятием «душа».
Человек всегда считал, что он занимает в природе
не совсем обычное место, и пытался найти ответ на
вопрос о своем происхождении в различных религи-
ях. Казалось, естественно думать, что поскольку жизнь
каждого отдельного человека имеет начало и конец,
то у всего человечества в целом тоже должно быть
«начало» — акт творения, во время которого был соз-
дан человек (возможно, со всеми прочими формами
жизни).
Ч. Дарвин, создав теорию эволюции, основанную
на идее выживания наиболее приспособленных, серь-
езно поколебал эти представления. А. И. Опарин впер-
вые разработал материалистическую теорию возмож-
ного возникновения живой материи. В ней биологиче-
ские и философские исследования взаимно дополняют
Друг друга, объясняя сущность живого следую-
з
щим образом: особенностью, качественно отличаю-
щей жизнь как более высокую форму движения ма-
терии, является то, что в живых телах многочисленные
биохимические реакции, составляющие в своей сово-
купности обмен веществ, не только согласованы меж-
ду собой во времени и пространстве, не только соче-
таются в едином порядке непрерывности самообнов-
ления, но и весь этот порядок закономерно направлен
к постоянству самосохранения всей живой системы в
целом, исключительно совершенно приспособлен к ре-
шению существования организма в данных услови-
ях внешней среды. Дальнейший прогресс в изучении
закономерностей объективного мира, сущность живой
материи, жизни возможен только при использовании
диалектико-материалистического метода познания.
Растительные организмы в таксономическом и си-
стематическом отношении чрезвычайно разнородны,
что послужило основанием для разделения их на выс-
шие растения, у которых тело расчленено на лист,
стебли, корни, и низшие растения, не имеющие тако-
го строения и характеризующиеся слоевищным сло-
жением тела. Существует ряд систем классификации
низших растений. Например, по системе, приводимой
А. Л. Тахтаджяном и другими, к низшим растениям
отнесены бактерии, водоросли, слизевики, грибы, ак-
тиномицеты, лишайники. Единого мнения о количе-
стве отделов (классов) водорослей до сих пор нет:
максимальное их число 14, минимальное — 7. А. В. То-
пачевский и Н. П. Масюк делят водоросли на 11 от-
делов: синезеленые, динофитовые, золотистые, диато-
мовые, красные, желтозеленые, криптофитовые, хло-
ромонадофитовые, эвгленофитовые, зеленые. Однако
бактерии, синезеленые водоросли, актиномицеты, а
также грибы лишь условно относят к низшим расте-
ниям. Грибы Международным ботаническим конгрес-
сом выделены в отдельное царство.
Физиология и биохимия низших растений нераз-
рывно связаны с большим хозяйственным значением
этих организмов, их способностью синтезировать и
разлагать колоссальное разнообразие органических
соединений. Низшие растения, продуцирующие свы-
ше 200 аминокислот, сотни антибиотиков, ферменты,
органические кислоты, витамины, стероидные и многие
другие соединения, широко используются в микробио-
4
логической промышленности для получения лекарств,
в биосинтезе кормовых белков, пивоварении, хлебопе-
чении. Грибы вместе с бактериями играют важней-
шую роль как объекты биотехнологии. Им принадле-
жит первостепенное значение в минерализации орга-
нических веществ, благодаря которой осуществляется
круговорот веществ в природе. Многие грибы являются
опасными распространенными паразитами растений,
некоторые из иих вызывают заболевания человека и
животных.
Съедобные грибы — ценный пищевой продукт.
В лесах умеренного климата урожаи грибов оценива-
ются в 50—175 кг/га (сырая масса), хотя собирает-
ся и используется в пищу лишь от 1 до 5 % общего
урожая. Мировая продукция культивируемых шам-
пиньонов составляет 500 тыс. т/год. В зависимости от
запасов, культивирования и потребления съедобных
грибов США, Англия, ФРГ, Канада импортируют
их, а Франция, Нидерланды, Италия и другие страны
экспортируют. На душу населения в мире приходится
от 0,03 кг/год (Южная Корея) до 2,02 кг/год (ФРГ)
грибов.
Водоросли являются основными образователями
органического вещества в водоемах и служат сырьем
для производства многих продуктов. На их долю при-
ходится более 50 % фиксированного углерода (вод-
ные растения усваивают СОг 2-Ю11 т/год, а растения
суши 2-1010 т/год).
Низшие растения — прекрасные объекты для фи-
зиологических, биохимических и биофизических иссле-
дований. Использование их способности к быстрому
размножению открыло новую эпоху в развитии гене-
тики и естествознания. Огромная роль низших расте-
ний в природе и практической деятельности человека
вызывает необходимость все более глубокого изучения
их физиологии и биохимии, что непосредственно связа-
но с повышением продуктивности многих хозяйственно
ценных видов.
Настоящее пособие написано по программе спец-
курса «Физиология и биохимия низших растений», ко-
торый читается на биологическом факультете Донец-
кого университета для студентов, специализирующих-
ся на кафедре физиологии растений. При составлении
пособия преследовалась цель изложить современное
б
представление о положении низших растений в мире
живых существ, механизмах их питания, роста, раз-
вития и обмена веществ, влиянии внешних факторов
на процессы жизнедеятельности.
Предполагается, что студенты знакомы с основа-
ми курса низших растений, физиологией и биохимией
растений. Ограниченный объем не позволил изложить
в нем основы физиологии и биохимии всех таксонов
низших растений. Поэтому в настоящем издании рас-
смотрены представители эукариот (грибов и некото-
рых водорослей) и прокариот (синезеленых водорос-
лей), занимающие ключевое положение в лабиринтах
биохимической эволюционной схемы, а также лишай-
ники, представляющие своеобразный тип живых орга-
низмов, основанный на формативном симбиозе гри-
бов и водорослей.
Все указанные группы организмов значительно
различаются между собой (грибы — эукариоты, но ге-
теротрофы, а синезеленые водоросли — прокариоты,
но автотрофы). Поэтому материал курса излагается
отдельно по каждой группе организмов, что, на наш
взгляд, оправдано методически, так как облегчает
его усвоение. В пособии несколько больше внимания
уделено грибам, так как они являются основными
объектами экспериментальных работ студентов.
ГЛАВА 1
ФИЛОГЕНЕЗ НИЗШИХ РАСТЕНИЙ
И ПОЛОЖЕНИЕ ИХ В МИРЕ
ЖИВЫХ СУЩЕСТВ
Филогенез низших растений, как и всех других ор-
ганизмов, осуществляется с учетом общих закономерно-
стей. Так, в соответствии с законами адаптации изме-
нения организмов всегда являются приспособлениями
к окружающей среде, возникающими и развивающи-
мися на основе естественного отбора. Закон монофи-
лии предусматривает, что эволюционное развитие идет
от общих предков путем расхождения (дивергенции)
от одного ствола все большего количества эволюци-
онных ветвей. Закон корреляции констатирует, что
приспособительное к условиям среды изменение орга-
на вызывает коррелятивные изменения в других ор-
ганах, хотя у грибов и некоторых растений такая
взаимосвязь частей организма не абсолютна. Соглас-
но закону необратимости эволюции органы, изменя-
ясь в процессе эволюции, никогда не возвращаются
к прежнему состоянию, а исчезнувший орган никогда
не появляется вновь. Возможности химической эволю-
ции на первобытной Земле представлены на рис. 1.
Создание филогенетической системы низших ра-
стений непосредственно связано с данными эволюци-
онной биологии клетки. Еще со времен Аристотеля
(384—322 гг. до н. э.) биологи делили живой мир на
два царства — растений (Plantae) и животных (Ani-
malia). А ван Левенгук открыл мир микроскопичес-
ких существ, которые Э. Геккель выделил в отдельное
царство Protista. Последующее накопление данных о
строении клеток микроорганизмов повлекло за собой
деление представителей царства Protista на две груп-
пы: высшие и низшие протисты в соответствии с типа-
ми клеточной организации — эукариотным и прокари-
отным. К высшим протистам, имеющим эукариотное
строение клеток, стали относить микроскопичес-
ких животных (простейших), микроскопические водо-
7
sN,
Н I и
и
H-C=N
Н. ,Н ЛК
,С. Н I н
Н/$Н I
Абиотические синтезы в атмосфере
Н >
н-с-с-н
I I
Н Н I
Н\
Н-С=С-Н Л=С.
Л
"Н
н~н
Аминокислоты, пурины, пиримидины, сахара, липиды и др.
А биогенные „ органические" вещества, растворяющиеся
в воде оздр, морей и т. д.
ПарыНгО
Белки, нуклеиновые
кислоты
иИв®
ТКЦ =
Высых
Реакции 6„первичном бульоне'
Вулканы
вулканиче-
ское тепло
почвы
Горячие источники ,
Высохшие слои
абиогенных веществ
частично с фосфатами
> ниеи рас-
творение,
перекристаллиза-
ция __________________ ,
Фильтрация,хроматогра-
фическое разделение? агрегаты
Гамма-излучение горных пород
Рис. I. Возможности химической эволюции на Праземле
росли (кроме синезеленых) и микроскопические гри-
бы (плесени, дрожжи и др.). К низшим протистам
с прокариотическим строением клеток были отнесены
все бактерии и синезеленые водоросли, называемые
еще цианобактериями.
8
Таблица 1. Свойства прокариот и эукариот (по Д. И. Ники-
тину)
Признак Прокариоты Эукариоты
Ядерная ДНК, деле- ДНК не отделена Ядро отделено от
ние хромосомы мембраной; одна круговая хромосо- ма, гаплоидный на- бор протоплазмы мем- браной; более од- ной хромосомы, гаплоидный или диплоидный набор
Митохондрии, хлоро- пласты Нет Есть
Рибосомы 70-тнпа 80-тнпа
Полн-0-оксимасляная кислота Есть Нет
Фиксация N2 Есть Нет
Цитоплазматическая ДНК Плазмиды, эписомы Митохондрии, хлоропласты, нли центриоли, кине- тосомы, аппарат Гольджи
Жгутики Одна нли несколько фибрилл 20 фибрилл, соб- ранных по типу 2X94-2
Наличие мукопротеи- да, включающего ме- зодиамииопнмелино- вую и мурамовую кислоты в клеточной стенке Есть Нет
Чувствительность к лизоциму Есть Нет
Движение протоплаз- мы Нет Есть
Выживаемость До 70—80 °C До 55—60 °C
Газовые вакуоли Есть Нет
Клетки эукариот и прокариот имеют различия в
своем строении. У прокариот нет ядерной мембраны;
их клетки имеют одну внутреннюю полость с органел-
лами, образуемую клеточной мембраной. Эукариоты
имеют вторичные полости, их ядро окружено мембра-
ной, а ДНК отделена от цитоплазмы и связана с ги-
стонами. Различия между прокариотами и эукариота-
ми охватывают также и другие признаки (табл. 1).
Исходя из принципиальных различий в прокари-
отной и эукариотной организации клеток, Р. Mejрей
предложил все клеточные организмы разделить иа
9
два царства: Procaryota, куда отнесены все организ-
мы с прокариотным строением клетки, и Eucaryota,
включающие высшие протисты, растения и животные.
Этой схемы придерживаются некоторые биологи и в
настоящее время.
Согласно схеме Р. Виттэкера, все живые организ-
мы, имеющие клеточное строение, разделены на пять
царств, отражающих три основных уровня клеточной
организации живого мира. Царство Мопега представ-
лено прокариотными организмами с самым примитив-
ным уровнем клеточной организации. Царство Pro-
tista включает микроскопические, в большинстве своем
одноклеточные, недифференцированные формы жиз-
ни, сформировавшиеся в результате качественного
скачка в процессе эволюции, приведшего к возникно-
вению эукариотных клеток. Царства Pl antae (расте-
ния), Fungi (грибы), Animalia (животные) представ-
лены многоклеточными эукариотами, отличающимися
по способу питания. Абсолютное большинство расте-
ний характеризуется наличием фототрофного типа пи-
тания за счет процесса фотосинтеза, хотя есть виды —
повилика (Cuscuta), заразиха (Orobonche) и др., ли-
шенные хлорофилла, фотосинтез у которых отсутст-
вует. Грибы имеют в основном осмотрофный тип пи-
тания, т. е. питания растворенными органическими
веществами. Животных отличает голозойное питание,
заключающееся в заглатывании и переваривании пи-
щи. В ходе эволюции на уровне Мопега возникли ти-
пы питания, присущие растениям и грибам. Несмот-
ря на приведенные различия между царствами живых
организмов, их объединяет ряд биологических явлений
и прежде всего универсальность многих процессов, в
основе которых заложены одни и те же механизмы,
что отчетливо подтверждает поступательный харак-
тер эволюционного процесса развития жизни.
Схема Р. Виттэкера, как и схема Р. Меррея, не
являются общепринятыми. В царстве Protista сосре-
доточен гетерогенный набор групп, которые родствен-
ны более высокоорганизованным организмам в боль-
шей степени, чем степень родства между группами
этого царства. Более аргументированной является ги-
потеза разделения живого мира на 4 царства — од-
ного царства прокариот (Мопега) и трех царств эука-
риот (Plantae, Mycota, и Animalia), в которые вклю-
10
чены представители царства Protista. Такое деление
живого мира на царства находит все большее число
сторонников.
По схеме, предложенной Д. Фордом, эволюция жи-
вых организмов основывается на следующих посту-
латах: 1) предбиологический этап эволюции длился
дольше, чем биологическая эволюция; 2) первые жи-
вые организмы были прокариотами и современные их
представители сохранили все основные черты клеточ-
ной и генетической организации своих средков; 3) эу-
кариоты возникли относительно недавно из прокариот.
Первичные клетки (прокариот), образовавшиеся
примерно 3 млрд лет назад, дали две эволюционные
ветви, из которых возникли современные прокарио-
ты — бактерии и синезеленые водоросли. Эволюцион-
ная ветвь эукариот по схеме Д. Форда берет начало
от синезеленых водорослей около 1 млрд лет назад.
Предки первичных эукариот (типа Euglena) раздели-
лись на три эволюционные ветви, представленные цар-
ствами растений, грибов и животных. Таким образом,
по этой схеме, наряду с делением мира живых существ
на прокариот и эукариот, представлены царства жи-
вой природы и эволюция их образования.
Исследования последних лет показали, что возраст
самых древних остатков клеточных образований со-
ставляет 3,5—3,8 млрд лет, причем уже 3 млрд лет
назад существовали цианобактерии, относимые к си-
незеленым водорослям. Сравнение первичных струк-
тур рРНК и тРНК позволило обнаружить, что разли-
чия между прокариотами (включая цианобактерии) и
эукариотами (ядерные геномы) гораздо большие, чем
между прокариотами и автономными геномами пла-
стид и митохондрий. Кроме того, выполненный анализ
позволил обнаружить совершенно отличную как от
типичных прокариот, так и от эукариот группу орга-
низмов — архебактерии — включенных в «первичное
царство». Исходя из этого, Д, Вёзе с соавторами пред-
ложил деление эволюционного древа на три ветви.
Данные молекулярной эволюции указывают на
очень древний характер расхождения между этими
ветвями. Как полагает этот исследователь, современ-
ные организмы дивергировали на самом раннем этапе
эволюции органического мира, причем архебактерии,
эубактерии и предки ядерного ГСНбма пошли разными
11
Хордовые
Беспозвоночные
Высшие растения
Актнномицеты
Грибы
АТ-тип ГЦ-тип
А 1
Примитивные многоядерные (или многоклеточные)
Зеленые водоросли
Хлорофиллсодержащис одноклеточные
Простейшие
(возникновение ядра)
Вирусы
(вторичное упрощение)
Сипсзелсныс водоросли
Бактерии
Примитивные эукариоты
Примитивные безъядерные одноклеточные прокариоты
20 30 40 50 60 70 80 мол % ГЦ
Рис. 2. Распределение частот встречаемости ДНК различного ну-
клеотидного состава в крупных таксонах
путями, а именно: прокариоты избрали путь «удале-
ния лишней информации», а эукариоты сохранили ее
и приспособили для целей скачкообразной эволюции.
Д. Форд высказал предположение, что современные
эукариоты возникли в результате неоднократных ак-
тов симбиоза ядерных предков эукариот с эубакте-
риями.
В обогащении наших знаний о путях и формах эво-
люции живых организмов важное место принадлежит
результатам исследования процессов эволюции гено-
мов организмов. В сконструированной А. С. Антоновым
филеме (рис. 2) отражены важнейшие взаимосвязи
крупных организмон, показаны не только дивергенция,
12
расхождение ветвей, но и слияние некоторых из них.
Здесь механизм симбиоза позволяет лучше понять
пути возникновения отдельных крупных таксономи-
ческих групп, в том числе относящихся к низшим ра-
стениям. Из ее анализа вытекат, что характеристика
структуры ДНК как соединения, обладающего видо-
специфичностью нуклеотидного состава, позволяет
выявить гетерогенность тех или иных крупных таксо-
нов, а также определить их таксономический ста-
тус, уровень эволюционной продвинутости таксона.
А. С. Антонов высказывается за полифилетичность про-
исхождения от разных исходных форм — грибов, бак-
терий, актиномицетов и вирусов — в связи с наличи-
ем у этих таксонов двувершинного характера нуклео-
тидного состава ДНК-
Итак, филогенетическое развитие низших растений,
принадлежащих как к прокариотам, так и к эукарио-
там (а некоторые из них даже выделены в самостоя-
тельные царства), пока не может быть представлено
в виде всеохватывающей схемы.
Развивающиеся быстрыми темпами определения
последовательности расположения символов генети-
ческого кода и отдельных нуклеотидов в цепях ДНК
дают возможность в будущем читать полные тексты
генетических программ и это откроет блестящие пер-
спективы в изучении филогении низших растений.
Низшие растения представлены как гетеротрофны-
ми, так и автотрофными организмами, поэтому путь
извлечения энергии для непрерывного синтеза веществ
тела (анаболизма) у них различен (рис. 3). Гетеро-
трофы получают ее в процессе распада органических
веществ (катаболизма), а автотрофы — при распаде
глюкозы, образовавшейся в ходе фотосинтеза. В свою
очередь автотрофы используют продукты распада ге-
теротрофов (рис. 4). Таким образом, органические ве-
щества, необходимые субстраты для диссимиляции
или для построения новой живой материи, создаются
в ходе автотрофной ассимиляции и служат источником
энергии для гетеротрофной ассимиляции грибов и бо-
льшинства бактерий.
Органические вещества, образующиеся при асси-
миляции, частично диссимилируются для получения
энергии а частично используются для синтеза новой
живой материи. Эти два направления — анаболизм и
13
Рис. 3. Взаимоотношения между анаболизмом и катаболизмом у
автотрофных и гетеротрофных организмов
катаболизм — сложным образом переплетаются. Раз-
делить их нельзя, так как они черпают исходные ве-
щества из общего фонда —метаболитического пула.
Для получения энергии путем диссимиляции зеле-
ные автотрофные клетки могут вместо готовых ас-
симилятов использовать промежуточные продукты,
например водород, связанный с коферментом. У неко-
торых бактерий и синезеленых водорослей нет процес-
сов диссимиляции, поставляющих АТФ, они покры-
вают все свои потребности в энергии непосредственно
за счет фотосинтеза.
Таким образом, клетки как автотрофов, так и ге-
теротрофов представляют собой открытие системы,
т. е. они постоянно обмениваются С окружавшей сре-
дой веществом и энергией.
14
СО2, Н2О, NH3 СО2, Н2О, NH3
’Гетеротрофные клетки
Автотрофные зелёные растительные клетки
Рис. 4. Обмен веществ и энергии у автотрофных и гетеротрофных
клеток
Контрольные вопросы н задания. 1. На каких постулатах ос-
новывается эволюционное развитие организмов? 2. В чем состоят
главные отличия эукариот от прокариот? 3. Какие существуют
типы питания живых организмов? В чем отличие автотрофной от
гетеротрофной ассимиляции? 4. Назовите выделенные в настоя-
щее время царства живых организмов и дайте им характеристи-
ку. Какие организмы не входят в эти царства? 5. Объясните ги-
потезу о полифилетичности происхождения крупных таксономи-
ческих групп. 6. Что собой представляют анаболизм и катаболизм
в метаболическом пуле?
ГЛАВА 2
ФИЗИОЛОГИЯ И БИОХИМИЯ ГРИБОВ
Специфический путь развития грибов, тенденция к
упрощению полового аппарата, особые формы защи-
ты генеративных органов, какими являются плодовые
тела, не имеющие аналогов в растительном мире, су-
ществование наряду с общностью также и различий
в биосинтезе, осуществляемом растениями и живот-
ными, нитчатое строение таллома, отсутствие гормо-
нов и другие особенности грибов дали основание био-
логам, наряду с прокариотами, растениями и живот-
ными, выделить эту качественно своеобразную группу
в самостоятельное царство.
У большинства грибов вегетативное тело состоит
из сплетения гиф — мицелия, представляющего собой
многоядерную цитоплазму, зачастую разделенную пе-
регородками и окруженную клеточной стенкой. У не-
которых грибов вегетативное тело состоит из одной
клетки.
Процессы, одновременно протекающие в клетке,
объединены в общую сбалансированную систему, т. е.
содержащиеся в ней органоиды и микромолекулярные
комплексы действуют не изолированно, а в тесном
взаимодействии друг с другом, ибо только при этих
условиях возможна нормальная жизнедеятельность
клетки.
Главная роль в жизни принадлежит ядру, ДНК ко-
торого контролирует синтез белков-ферментов, осу-
ществляющих тесную связь между всеми компонента-
ми клетки. Общее число белков-ферментов в клетках
достигает 10 000, в то время, как количество нефер-
ментных белков не превышает 100. Значительные
изменения в содержании белков, необходимых для ре-
гуляции синтетических процессов в клетках грибов,
наступают в течение нескольких минут, т. е. значитель-
но быстрее, чем у высших растений. Существует
16
регуляция механизма индукции ферментов или ускорен-
ного его синтеза при адаптации гриба к соответствую-
щему субстрату (индуктору), а также к репрессии
(процессу, противоположному индукции). В репресси-
руемой системе репрессор блокирует синтез фермен-
та, а в индуцируемой фермент инактивируется, в ре-
зультате чего с определенного участка ДНК как бы
снимается тормоз, начинается синтез соответствующей
матричной РНК, и происходит синтез индуцируемого
фермента. Иными словами, наступают ускоренная ко-
ординация и регулирование обменных процессов, ре-
акций синтеза и распада органических веществ, вхо-
дящих в состав грибных клеток.
Клетки грибов синтезируют собственные белки, ну-
клеиновые кислоты, полисахариды, липиды и другие
вещества, используя при этом сравнительно немногие
метаболиты: пировиноградную кислоту, ацетил-КоА,
сукцинил-КоА, рибозу, глицин и др. Эти исходные про-
дукты имеют небольшую молекулярную массу. Их
образование сопровождается выделением доступной
для усвоения энергии. Следовательно, в живой клетке
постоянно идут процессы распада составных частей
цитоплазмы и органоидов и восстановление их за счет
веществ, поступающих из окружающей среды.
2.1. ПИТАНИЕ ГРИБОВ
Поглощение питательных веществ организмами
представляет собой сложный и многосторонний про-
цесс, в котором активно участвуют поверхностные мем-
браны — плазмалемма и тонопласт. Вещества, необхо-
димые организму и поступающие в клетку, способны
вступать с поверхностными участками цитоплазмы в
разнообразные связи. Природа этих связей определе-
на особенностями питания и общим состоянием цито-
плазмы, способностью ее к движению и быстро проте-
кающими процессами самообновления.
Дыханию принадлежит важнейшая роль в активи-
ровании поверхности цитоплазмы и насыщении ее
акцепторами поглощаемых из окружающей среды сое-
динений, в частности минеральных веществ. Энергия,
необходимая для фиксации минеральных соединений,
поглощаемых цитоплазмой из окружающей среды, до-
ставляется макроэргическими связями АТФ, образую-
17
щимися в ходе дыхания. Каждому минеральному эле-
менту свойствен специфический механизм взаимосвязи
с дыханием, т. е. единый механизм взаимосвязи между
дыханием и поглощением веществ отсутствует. Таким
образом, только в процессе дыхания создаются усло-
вия для непрерывного активного связывания на по-
верхности цитоплазмы минеральных и органических
соединений. У грибов проникновение минеральных и
других веществ происходит в результате действия
Н+-насоса, диффузии и пиноцитоза.
2.1.1. Усвоение углеродсодержащих веществ. Глав-
ная роль в питании грибов — бесхлорофилльных гете-
ротрофов — принадлежит органическим источникам
углерода, поскольку другие формы углерода для них
недоступны. Большинство грибов принадлежит к поли-
фагам, т. е. приспособлено к использованию разно-
образных органических веществ. Часть их относится
к монофагам с характерной узкой специализацией
(специализированные паразиты, а также некоторые
сапрофиты, например, различные дрожжевые грибы).
Для питания грибов в качестве источника углеро-
да наибольшее значение имеют углеводы, органичес-
кие кислоты, жиры и жирные кислоты, аминокислоты
и некоторые другие углеродсодержащие соединения.
Углеводы. В природных условиях большинство
грибов для питания обычно используют высокомоле-
кулярные полисахариды, которые гидролизуются соот-
ветствующими ферментами до простых сахаров. Пригод-
ность для питания тех или иных источников углерода
определяется по скорости роста мицелия, интен-
сивности спорообразования, количеству накапливаю-
щегося в среде определенного метаболита. Между тем
по степени усвоения моносахариды существенно раз-
личаются. Все грибы лучше усваивают глюкозу. Этот
сахар широко используется для приготовления пита-
тельных сред в качестве источника углерода. Фрукто-
за менее универсальна, хотя большинство грибов на
среде, содержащей фруктозу, растет так же хорошо,
как и на среде с глюкозой. Галактоза, также относя-
щаяся к гексозам, усваивается плохо. Несколько хуже
организмами грибов используются пентозы, из числа
которых наиболее охотно воспринимается ксилоза, со-
держащаяся в одревесневших клетках в виде ксила-
на. Поэтому некоторые дереворазрушающие грибы,
18
например Serpula lacrymans, Stereum frustulosum и
другие, ксилозу предпочитают всем остальным источ-
никам углерода. Из других пентоз они достаточно хо-
рошо впитывают арабинозу, значительно хуже — ри-
бозу. Очень хорошо усваивают многие грибы много-
атомные спирты, дающие при окислении соответствую-
щие сахара. Особенно пригоден для них маннит, хотя
некоторые грибы-дермафиты маннит не используют.
Это свойство является их систематическим признаком.
Сорбит и продукты его окисления усваиваются всеми
грибами. Предполагается, что маннит играет роль ос-
мотического агента, обеспечивающего тургур плодовых
тел. Одноатомные спирты (этиловый, метиловый и
др.) мало пригодны для их питания.
Дисахариды также используются для питания, од-
пако на средах, содержащих эти соединения, мицелий
в ряде случаев развивается хуже. Так, усвоение саха-
розы сдерживается тем, что у многих грибов инверта-
за является только внутриклеточным ферментом, поэ-
тому этот дисахарид в питательной среде не расщеп-
ляется. Однако на среде с сахарозой хорошо растут и
плодоносят многие дереворазрушающие, микоризные
и некоторые другие грибы, усваивая ее без предвари-
тельного гидролиза. Фактически все грибы использу-
ют мальтозу — продукт расщепления крахмала, а так-
же целлобиозу, состоящую как и мальтоза из двух
глюкозных остатков, но соединенных р-глюкозидной
связью. Некоторые грибы (Tricholoma fulvum) неспо-
собны расщеплять этот дисахарид до глюкозы.
Многие грибы хорошо усваивают трегалозу (гриб-
ной сахар), содержащуюся в большом количестве в
рожках спорыньи и дрожжах. Менее пригодна для их
питания лактоза, поскольку входящая в ее состав га-
лактоза усваивается плохо.
Трисахарид рафиноза используется грибами в ка-
честве источника углерода. Хорошо растут на среде
с рафинозой некоторые виды из родов Polyporus и
Chaethocladium.
Из полисахаридов самый лучший источник пита^
ния — крахмал. Причем для многих афиллофоровых,
агариковых и других грибов, вследствие более мед-
ленного гидролиза и накопления кислот, крахмал как
источник питания превзошел даже глюкозу. Вместе
с тем некоторые грибы, не содержащие амилазу, на-
19
пример, большинство дрожжей, крахмал не исполь-
зуют.
Целлюлоза, состоящая из молекул р-глюкозы, в
естественных условиях гидролизуется главным об-
разом дереворазрушающими грибами из родов Serpu-
la, Poria, Fomes и др. В разложении целлюлозы лес-
ной подстилки деятельное участие принимают многие
плесневые грибы — различные виды Penicillium, Fu-
sarium, Aspergillus, Trichoderma, однако мукоровые
грибы не могут использовать этот полисахарид.
Декстрины — продукты неполного расщепления
крахмала,— как правило, хорошие источники углеро-
да. На средах с декстринами некоторые грибы растут
даже лучше, чем на средах с другими углеводами,
однако виды Tricholoma используют декстрины зна-
чительно хуже, чем крахмал.
Пектиновые вещества — полисахариды, дающие при
гидролизе галактуроновую кислоту и содержащиеся
в большом количестве во фруктовых соках и слизях,—
используют для питания лишь немногие грибы. Это
связано с тем, что галактуроновая кислота, образую-
щаяся при окислении первичной спиртовой группы
галактозы, усваивается грибами, как и сама галак-
тоза, довольно слабо. Однако для некоторых грибов
(виды Tricholoma, Agaricus, Coriolus versicolor) пек-
тин хороший, а порой и самый лучший источник пи-
тания, что связано с наличием у них высокоактивной
пектиназы.
Одним из главных источников углерода для многих
дереворазрушающих и подстилочных грибов являет-
ся лигнин — высокомолекулярное вещество, находя-
щееся в древесине растений. Следует подчеркнуть,
что при выращивании культур на средах с чистым
лигнином далеко не все дереворазрушающие грибы
имеют удовлетворительный рост. Но общий выход
мицелия на среде, содержащей лигнин и глюкозу,
более высокий, чем на среде, содержащей лишь одну
глюкозу (виды Hirschioporus, Poria, Coriolus и др.).
Органические кислоты, образующиеся при дыхании
в результате неполного окисления сахаров, а также
в ходе метаболических процессов отличаются высокой
питательностью, хорошо усваиваются многими гриба-
ми. Как правило, с увеличением длины алифатической
цепи др шести атомов углерода усвояемость органу
ческих кислот повышается. Очень слабо поглощаются
щавелевая, муравьиная и уксусная кислоты, хотя не-
которые грибы используют их очень активно. Напри-
мер, уксусная кислота — лучший источник углеродного
питания для дрожжей Mycoderma aceti. Дикарбоновые
кислоты и оксикислоты более питательные, чем про-
стые одноосновные кислоты. Углерод, содержащийся
в карбоксильной группе, отличает наибольшая лег-
кость поглощения. Хорошо усваиваются грибами и
некоторые другие органические кислоты (винная, ли-
монная). При этом важное значение имеет простран-
ственная изомерия органических кислот. Так, соли
L-винной кислоты многие грибы усваивают лучше,
чем соли D-винной кислоты.
Жиры и жирные кислоты. Из большого числа три-
глицеридов жирных кислот с четным числом углерод-
ных атомов лучшие источники углерода для гри-
бов— стеариновая СНз(СН2)1бСООН, пальмитиновая
СНз(СН2)нСООН и олеиновая СНз(СН2)?СН =
= СН(СН2)?СООН кислоты. Усвоение их происходит
после ферментативного расщепления на жирные кис-
лоты и глицерин. Подавляющее большинство расти-
тельных масел состоит из смесей глицеридов разных
кислот. Из них хорошо усваиваются пальмитинодио-
леин и стеаринодиолеин. Для некоторых грибов, в ча-
сности, сапролегниевых (Leptoporus lacteus), жирные
кислоты являются в сравнении с сахарами лучшим
источником питания. Известно, что на среде с жир-
ными кислотами, особенно ненасыщенными, хорошо
произрастают пеницилловые грибы. Глицерин, обра-
зующийся при гидролизе жиров, отличается более вы-
сокой питательностью и усваивается многими грибами.
Относящиеся к жироподобным веществам фосфатиды,
воска, стериды — также хорошие источники углерод-
ного питания.
Аминокислоты — одновременно источники углеро-
да и азота, причем их питательные свойства в значи-
тельной степени зависят от состава и конфигурации
молекул. Грибы могут усваивать только естественные
изомеры L-аминокислот. Большинство их имеет более
высокий уровень роста на среде, содержащей смесь
нескольких аминокислот, хотя некоторые лучше ра-
стут на среде с одной аминокислотой. Степень усвое-
ния аминокислот по мере увеличения возраста мице-
*1
лия постепенно снижается и зависит от концентрации
аминокислот и pH среды. Не все аминокислоты
могут служить источниками углеродного питания; на-
пример, для некоторых видов (Penicillium и Fusa-
rium) таковыми являются аминокислоты с неразвет-
вленной цепью — норлейцин и лизин и серусодержа-
щие аминокислоты — цистеин и метионин. Некоторые
виды дрожжевых грибов существенно различаются
между собой по способности усваивать углерод, содер-
жащийся в аминокислотах.
2.1.2. Потребность в минеральных элементах.
У грибов на долю зольных элементов приходится до
10 % сухой массы. Наибольшую потребность они ис-
пытывают в фосфоре, кальции, магнии, сере, железе,
в меньшем количестве потребляют микроэлементы —
цинк, медь, марганец, кобальт, бор, никель и другие.
С помощью спектроскопических анализов в теле
грибов обнаружено свыше 50 минеральных элемен-
тов. Но это еще не доказывает необходимость ука-
занных элементов для жизнедеятельности грибов, так
как физиологическое значение многих из них пока не
раскрыто. Общее содержание минеральных элементов
в организме гриба зависит от его вида. Кроме того,
имеется большое различие в количестве элементов,
содержащихся в мицелии, спорах и плодовых телах.
Больше их в мицелии и меньше в шнурах. Поскольку
химический анализ грибов не дает достоверных дан-
ных о действительной необходимости тех или иных
элементов, для решения вопроса о влиянии их на гри-
бы используют метод культивирования на синтетиче-
ских питательных средах с исключением одного из
элементов. Потребность в данном элементе определя-
ют по скорости роста и пигментации мицелия, интен-
сивности спорообразования и другим признакам. Не-
которые грибы, особенно плесневые, очень отзывчивы
на содержание в среде минеральных элементов, что
послужило основой для разработки биологического
метода определения минеральных компонентов в
почве.
2.1.3. Потребность в витаминах. Витамины, синте-
зируемые растениями, играют огромную роль в об-
мене веществ организмов, главным образом из-за их
участия в катализе. Грибы также нуждаются в ви-
таминах и способны их синтезировать. Однако не все
22
они могут обеспечить себя витаминами в достаточном
количестве. Недостаточность может быть абсолютной,
когда грибы не могут синтезировать тот или иной
витамин, и относительной, при которой синтез вита-
мина не осуществляется из-за неблагоприятных внеш-
них условий (температуры, величины pH, состава
среды). Например, при температуре свыше 25 °C рост
Neurospora crassa на средах без рибофлавина очень
слабый. При более низких температурах этот гриб
способен синтезировать рибофлавин н его рост зна-
чительно ускоряется. На кислых средах (рН<4)
Sordaria fimicola не может нормально развиваться
без тиамина, а на средах с pH=4 и выше он в тиами-
не не нуждается. Некоторые грибы высокочувстви-
тельны к повышению концентрации витаминов. Так,
одна и та же концентрация инозита в среде при тем-
пературе 27 °C сильно угнетает рост Sclerotinia са-
melliae, а при более низкой температуре стимулирует
его рост.
К соединениям, обладающим витаминным воздей-
ствием, и необходимым для роста ряда грибов, отно-
сятся пуриновые и пиримидиновые основания, входя-
щие в состав ДНК и РНК, и нуклеотиды. Стимули-
рующее влияние этих оснований особенно проявляется
при внесении в среду органических кислот.
2.1.4. Специализация питания. Грибы относятся к
гетеротрофным организмам. В последние годы гете-
ротрофы принято подразделять по Р. Стейнеру на
органоавтотрофы (употребляющие органические веще-
ства как источник энергии), литогетеротрофы (исполь-
зующие органические вещества как источник углеро-
да) и органогетеротрофы, для которых органические
вещества — источник и углерода, и энергии. Среди
грибов есть представители всех названных групп. Они
создают органические вещества из органических со-
единений — остатков растительного и животного про-
исхождения. Некоторые нз них используют для пита-
ния другие живые организмы. Поэтому грибы под-
разделяют на паразитов и сапротрофов. Кроме того,
существуют промежуточные группы с различной па-
разитической активностью — облигатные и факуль-
тативные паразиты и сапротрофы.
Гетеротрофная фиксация грибами СОг при высоком
содержании мальтозы и глюкозы (20 и 10 г/л соот-
23
ветственно) в среде относительно низкая, однако она
заметно возрастает при уменьшении содержания маль-
тозы и глюкозы на 50 %. При уменьшении же содер-
жания этих моносахаридов на 75 % гетеротрофная
фиксация СОг возрастает в среднем в 4 раза. Наи-
больший уровень использования СОг (0,28 мг угле-
рода из воздуха на 1 г биомассы) при наименьшем
содержании названных моносахаридов наблюдался у
Fomitopsis pinicola и был в среднем в 5 раз выше, чем
у других испытанных грибов. Остальные грибы: Pip-
toporus betulinus, Daedalea quercina, Phaeolus schwe-
initzii, Heterobasidion annosum поглощают от 0,017
до 0,051 мг углерода на 1 г биомассы.
Установлено, что повышенная концентрация СО2
(до 10%) положительно влияла на активность фер-
ментов гриба Pleurotus ostreatus — лактазы и перок-
сидазы и, очевидно, стимулирует рост дереворазру-
шающих грибов. Доказано, что и представители Deu-
teromycetes также обладают способностью к фиксации
СО2 при выращивании на среде, содержащей 10 г
мальтозы и 5 г глюкозы/л. Наибольшая доля гетеро-
трофной фиксации СО2 в образовании биомас-
сы гриба наблюдалась у Gliocladium vermoeseni
(0,225 мг углерода на 1 г сухого вещества), за кото-
рым следовали Chrysosporium pannorum (0,15), Ре-
nicillium chrysogenum (0,084), Trichoderma viride
(0,014). Доказано усвоение радиоактивного углерода
из углекислоты воздуха грибом Cladosporium sp. на
свету и в темноте.
Обнаружено усвоение СО2 в темноте в процессе
длительного роста на среде без источника углерода
у грибов Cephalosporium sp. и Fusarium sp. Выска-
зывается предположение, что такие грибы, подобно
водородным бактериям, используют водород в качест-
ве источника энергии и СО2 в качестве источника уг-
лерода. Хемосинтез такого типа расценивается как
первая степень перехода к автотрофному способу
питания гетеротрофных микроорганизмов. Н. Н. Жда-
новой с соавт. проведено изучение автотрофного ус-
воения углерода из гидрокарбоната натрия или угле-
кислоты некоторыми меланинсодержащими грибами,
показавшее, что ряд грибов способен усваивать угле-
род нз этих соединений и их также можно отнести к
органогетеротрофам.
24
Сапротрофное питание. Сапротрофиые грибы ши-
роко приспособлены к разнообразным субстратам пи-
тания. Это дает возможность существовать на одном
и том же субстрате большому числу разных видов.
Нередко в итоге конкуренции подавляется рост одних
грибов и преобладает рост других. Некоторые сапро-
трофные грибы во избежание острой борьбы за суб-
страт питания в ходе эволюции приспособились ис-
пользовать органические вещества, малопригодные
для других грибов (уксусная и муравьиная кислоты,
этиловый спирт и др.).
Наиболее характерные сапротрофы — плесневые
грибы. Однако в природе четко разграничить сапро-
трофы и паразиты трудно, так как сапротрофиые гри-
бы нередко поселяются на живых растениях, ослаб-
ленных какими-либо факторами. Некоторые грибы
этого типа в процессе эволюции приобрели способность
поселяться на живых растениях на одной из стадий
индивидуального развития. Так, известны многие сум-
чатые грибы, ведущие в конидиальной стадии пара-
зитический образ жизни, а в сумчатой — сапротроф-
ный. Эти грибы выделены в специальную промежу-
точную группу полусапротрофов или факультативных
паразитов. Обычно они ведут сапротрофный образ
жизни, но в подходящих условиях на одной из стадий
своего развития могут переходить на живые растения.
Характерные представители этой группы — Armilla-
riella mellea, развивающиеся на пнях и способные за-
ражать молодые культуры хвойных и лиственных
пород, Botrytis cinerea, использующий травянистый
опад и поражающий всходы некоторых растений.
Вторую промежуточную группу составляют полу-
паразиты, или факультативные (условные) парази-
ты. Они обычно развиваются на живых растениях, но
при их отсутствии могут питаться сапротрофно. К ним
относятся некоторые трутовые дереворазрушающие
грибы из семейства Polyporaceae и многие сумчатые,
например, из рода Venturia, которые в конидиальной
стадии — паразиты, а в сумчатой — сапротрофы, раз-
вивающиеся на опавших листьях.
Паразитизм. Грибы, использующие для питания
только живые клетки растений или животных, насе-
комых или других типов организмов, с отмиранием
которых они также погибают, называются облигатны-
25
ми, или обязательными, паразитами. Это высший тип
приспособления грибов к строго определенному соста-
ву питательных веществ. Паразитические грибы на
растениях являются самой многочисленной группой.
В соответствии с условиями питания мицелий этой
группы большей частью разрастается внутри тканей
растений, реже — на поверхности того или иного ор-
гана. В связи с этим их подразделяют на эндопарази-
тов и экзопаразитов.
Эндопаразиты составляют основную массу пара-
зитических грибов. Их в свою очередь подразделяют
на внутриклеточные, межклеточные и промежуточные
паразиты. Первые развиваются только внутри клеток.
К ним относятся наиболее примитивные формы гри-
бов из класса Chytridiomycetes, не имеющие мице-
лия, вегетативное тело которых представлено голой
цитоплазмой или зачаточным мицелием. У межкле-
точных паразитов мицелий развивается только в меж-
клеточных пространствах. Он проникает в клетку при
помощи особых выростов — гаусторий, образуемых
гифами и снабжающих мицелий питательными веще-
ствами. Межклеточный паразитизм наиболе распро-
странен среди облигатных паразитов (Uredinales, Ре-
ronosporales и др.). Грибы, распространяющиеся как
внутри клеток, так и в межклеточном пространстве,
относятся к промежуточным эндопаразитам.
Мицелий эктопаразитов распространяется в виде
паутинного налета на кутикуле растений. Питатель-
ные вещества эта группа получает при помощи га-
усторий, проникающих вглубь клеток. У некоторых
представителей вида, например, у Erysiphales, ми-
целий проникает в ткани через устьица и таким об-
разом часть его оказывается эндофитной. У пара-
зитических грибов мицелий может быть местным и
диффузным. Для местного мицелия характерна ог-
раниченная распространенность от места внедрения
инфекции в ткани растения, не превыющая несколь-
ких сантиметров. Диффузный мицелий свойствен об-
лигатным паразитам и факультативным сапротрофам.
Иногда он пронизывает все растение. Если мицелий
многолетний, он сохраняется из года в год в кронах,
стеблях (стволах), листьях и с началом весны пора-
жает вновь образующиеся органы (ржавчинные, тру-
товые и другие грибы).
26
Питание клетбк рас-
тений соответствует ха-
рактеру приспособле-
ния гриба к тому или
иному растению. Обли-
гатные паразиты, отно-
сящиеся к Uredinales,
Ustilaginales, Erysipha-
les и др., проникая в
клетки растения-хозяи-
на, не вызывают быст-
рого их отмирания. Ги-
бель клеток наступает
Рис. 5. Внедрение гриба вовнутрь
растения
лишь после окончания роста мицелия и формирования
спор, что позволяет грнбу полностью завершить свой
цикл развития, поскольку на мертвом субстрате его
жизнедеятельность исключена.
Иная картина наблюдается при поражении расте-
ния факультативными паразитами. Внедряясь в здоро-
вую ткань, они выделяют токсичные для клеток
вещества, вызывающие быстрое их отмирание, и мице-
лий растет уже в мертвых клетках (Botrytis cinerea,
Heterobasidion annosum и др.) (рис. 5). В эту группу
по типу питания входят и хищные грибы. Среди них
есть как виды, приспособившиеся только к паразитиче-
скому образу жизни, поедая, например, нематод, так
и виды, которые развиваются на древесине, но могут
поедать и нематод, являющихся для них источниками
азота. Последнее особенно характерно для Pleurotus
ostreatus — ценного съедобного гриба и других пред-
ставителей этого рода. Эти грибы выделяют инакти-
вирующий токсин еще до проникновения в тело жерт-
вы, в результате нематоды теряют способность к дви-
жению. Гифы быстро проникают в тело нематоды и
через 24 ч их содержимое переваривается. У других
хищных грибов, например у Resupinatus silvans, на
гифах бразуются липкие клетки, к которым прилипают
нематоды, после чего гифы прорастают в их тела.
У некоторых грибов липкие выросты образуются на
конидиях, которые попав на тело нематоды, прораста-
ют и проникают в нее.
Симбиоз. В процессе эволюции некоторые грибы
приобрели способность к симбиозу — сожительству с
другими организмами. Отношения между двумя сожи-
27
телямн основаны, как правило, на обоюдной пользе и
характеризуются уравновешенным балансом, позволя-
ющим и грибу, и растению-хозяину получать преиму-
щества.
Если они полезны друг другу, имеет место муту-
алистический симбиоз, а если один из них начинает
паразитировать, взаимоотношения меняются. Во мно-
гих случаях грнбы-симбионты выполняют функции
снабжения растений водой и питательными вещест-
вами. Специализация питания грибов возникла в ходе
длительного периода развития и выработки опреде-
ленных приспособлений под влиянием факторов внеш-
ней среды. Свидетельство тому — грнбы, находящие-
ся на различных этапах эволюции. Для всех грибов
первичный способ питания — сапротрофный, однако
эволюционное развитие некоторых из них происходи-
ло так, что они полностью потеряли способность к
сапротрофной жизни.
Особенно часто наблюдается симбиоз грибов с во-
дорослями и высшими растениями. Эволюционно за-
крепленный симбиоз грибов с водорослями привел к
образованию нового своеобразного типа живых орга-
низмов — лишайников.
Симбиоз грибов с корневой системой высших рас-
тений называется микоризой. Микоризные грибы обво-
лакивают корень мицелием или проникают в клетки его
наружной ткани, вследствие чего происходит регене-
рация корневых волосков, изменяется анатомическое
строение, а на конечных разветвлениях корней иног-
да появляются особые образования. Отличительный
признак микоризных растений состоит в том, что
гриб-симбионт, находясь в контакте с тканями корня,
не только не вызывает заболевания растения, но спо-
собствует дополнительному его питанию. Под влия-
нием микоризных грибов корневая система сильнее
ветвится, и растение имеет возможность больше по-
глощать воды и минеральных элементов.
Микоризы бывают эктотрофные, эндотрофные,
эктоэндотрофные, перитрофные и псевдомикоризы.
Это разнообразие зависит от состава грибов в корнях,
физиологических особенностей грибов, свойств расте-
ний-хозяев, их анатомического строения н других
факторов.
Эктотрофная, или поверхностная, микориза харак-
28
тернзуется тем, что гифы гриба,
обволакивая корень, формируют
вокруг него хорошо заметный че-
хол и иногда проникают в меж-
клеточное пространство, образуя
там тонкое однослойное грибное
сплетение (перепонку), корневые
волоски постепенно исчезают
(рис. 6).
Эндотрофная, или внутренняя,
микориза, не имеет наружного
чехла из мицелия, и гифы ее рас-
полагаются преимущественно в
клетках коры питающегося рас-
тения внутриклеточно и меж-
клеточно. Семена растений по-
рядка орхидных (Orchidales) мо-
гут прорастать только при попа-
дании на них грибов Rhizoctonia
(свыше 20 тыс. видов), образую-
щих эндотрофную микоризу, до-
ставляющую органические веще-
ства и минеральные элементы за-
родышу. Эктоэндотрофная, или
смешанная, микориза, является
переходной формой и отличается
тем, что гриб располагается как
Рис. 6. Эктотрофная
микориза на корнях
сосны.
на поверхности корня, так и вну-
три клеток и в межклетниках. Перитрофная микориза
представляет собой сплетение гиф мицелия, находя-
щихся на поверхности или вблизи корней растений,
т. е. гифы не проникают в клетки корня и не связаны
с ним. Псевдомикориза характеризуется способностью
гиф гриба проникать глубоко в ткани, в центральный
цилиндр. В этом случае корни теряют корневые волос-
ки, но не покрываются чехлом из гиф.
2.2. ДЫХАНИЕ
Грибы отличаются чрезвычайно интенсивным ды-
ханием. У двухдневной культуры Aspergillus niger
интенсивность выделения СОг за сутки равна 350 %
массы мицелия. Столь активный обмен встречается
лишь у некоторых мелких птиц. С увеличением воз-
29
раста дыхательная активность мицелия значительно
падает, причем у погруженного в культуральную жид-
кость она в 2—4 раза ниже, чем у воздушного.
Высокая интенсивность дыхания объясняется преж-
де всего ускоренным ростом грибов и потребностью
в энергии для новообразования клеток. С другой сто-
роны, у грибов относительно мало так называемых
балластных веществ, в частности, жировых клеток,
не участвующих в дыхании, но влияющих на общую
массу гриба. Нельзя исключить и то обстоятельство,
что выделяемые грибами ферменты осуществляют ре-
акции гидролитического расщепления полисахаридов
и других веществ как в клетке, так и в окружающей
мицелий среде. Высокая интенсивность дыхания при-
водит к выделению значительного количества тепла
и к повышению температуры грибов.
Для поддержания жизни организм грибов нужда-
ется в постоянном и непрерывном притоке энергии,
источник которой — процесс диссимиляции, или рас-
щепления, питательных веществ. Энергия выделяется
в ходе окисления веществ молекулярным кислородом,
т. е. в процессе дыхания, или в результате превраще-
ния веществ без участия молекулярного кислорода,
осуществляемом в процессе брожения. Таким образом,
освобождение энергии, запасенной клеткой в виде
различных органических соединений для использова-
ния в метаболизме,— главное назначение биологиче-
ского окисления. Вещества окисляться могут и без
участия кислорода, путем изъятия водорода из суб-
страта, причем всякое биологическое окисление со-
пряжено с переносом электронов и выделением энер-
гии. Получение энергии тесно связано с активностью
ферментов (гексокиназы, фосфофруктокиназы, фос-
фоглюкомутазы, фосфоглюконатдегидрогеназы, сукци-
натдегидрогеназы, малатдегидрогеназы и др.).
В зависимости от среды дыхание грибов бывает
аэробное и анаэробное. Вместе с тем, строгих ана-
эробов очень мало, а облигатные анаэробы среди
грибов вообще неизвестны.
Важнейший диссимиляционный процесс — спирто-
вое брожение. Интенсивное спиртовое брожение вы-
зывают многие дрожжи, дрожжеподобные организмы
и мукоровые грибы. Многие грибы из разных систе-
матических групп ( в частности, плесневые и дерево-
30
Н3РО4
Глюкозо-6- фосфат
- . . + Н2О
|| (?) глюкозофосфатизомераза
Фруктозо-6-фосфат
Н.-РО.
1 молекула АТФ
уктокиназа
Фруктозо-1,6-дифосфат 1
/-х Альдолаза
Н2О
Фосфоглицери-
новын альдегид
Фосфодиоксиацетон
(5) Триозофосфат-
изомераза
@ Триозофосфатдегидрогеназа
1,3-дифосфоглицериновая кислота (2 молекулы)
| 2 молекулы АТФ || @ фосфоглицерат
З-фосфоглицериновая кислота (2 молекулы)
2-фосфоглицериновая кислота (2 молекулы)
фосфоенолпировиноградная кислота (2 молекулы)
+инозинтрифосфат (ИТФ)
-СО2
2 молекулы АТФ
щавелевоуксусная кислота
(16) пируваткиназа
+НАД
енолпируватвиноградная кислота (2 молекулы)
® самопроизвольно
+СО2
------------»• яблочная кислота
+НАДФ Н.
Пировиноградная кислота
(2 молекулы)
Рис. 7. Реакции анаэробного распада углеводов
разрушающие) слабо образуют спирты. Оба процес-
са — дыхание и брожение — не только источники
энергии, но и источники образования различных про-
межуточных продуктов, служащих исходным матери-
31
Глюкоза
АТФ -*| — АДФ
Глюкозо-6-фосфат (I молекула)
Глюкозо-6-фосфат (2 молекулы)
ЗНАДФ + —
ЗН2О —
— 13НАДФ-Н.,'
I_________2.1
Фосфоглюконовая кислота
ЗНАДФ - ЗНЛДФ Н*
-* ЗСО2
Рибулозо-5-фосфат (3 молекулы)
f I I -----------------1
Ксилулозо-5-фосфат Рибозо-5-фосфат Рибуюзо-5-фосфат
Седогептулозо-7-
фосфат
Фосфоглицериновый
альдегид
Фруктозо-6-фосфат
Эритрозо-4-фосфат
I
Глюкозо- Фосфоглицериновый
b-фосфат альдегид
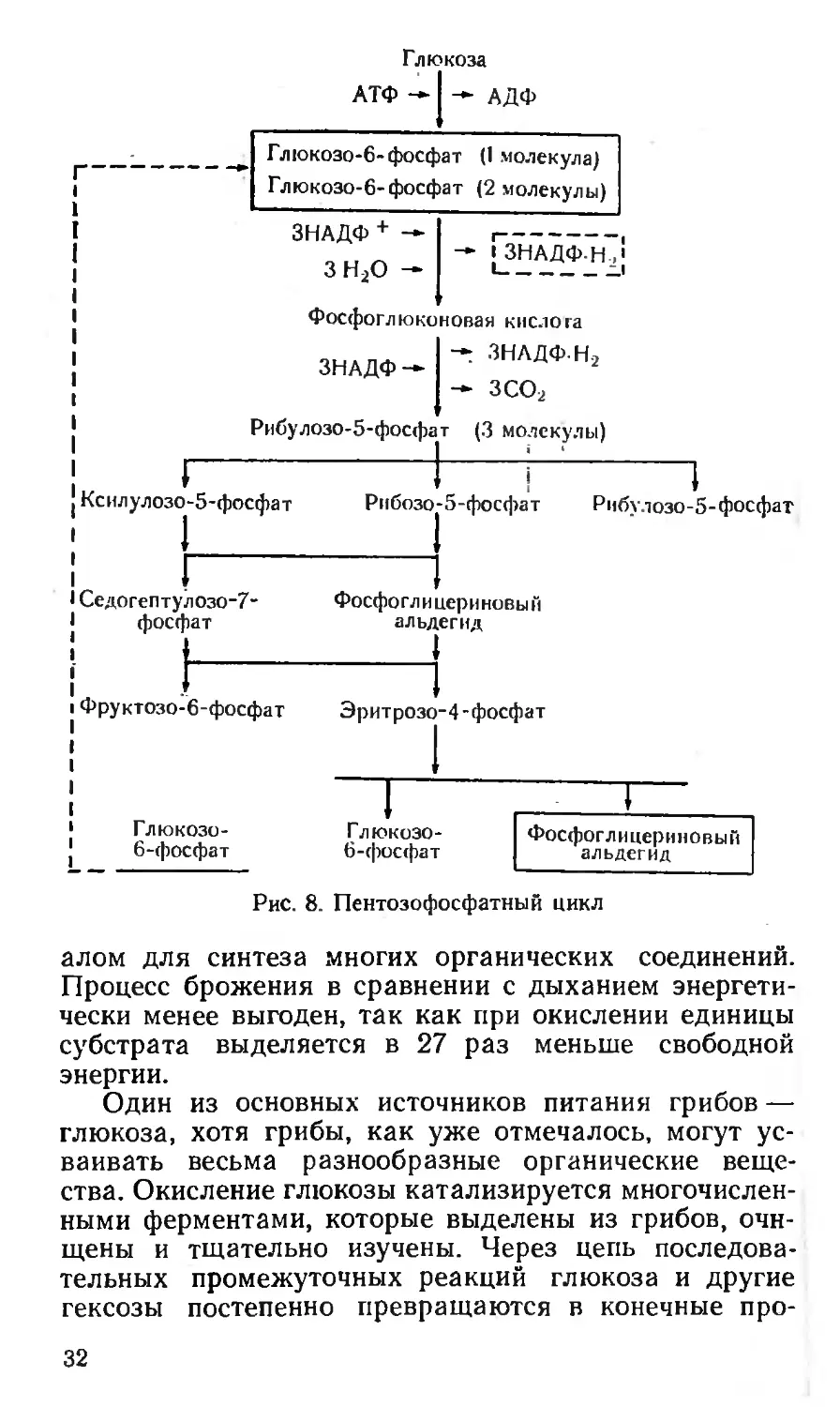
Рис. 8. Пентозофосфатный цикл
Глюкозо-
6-фосфат
алом для синтеза многих органических соединений.
Процесс брожения в сравнении с дыханием энергети-
чески менее выгоден, так как при окислении единицы
субстрата выделяется в 27 раз меньше свободной
энергии.
Один из основных источников питания грибов —
глюкоза, хотя грибы, как уже отмечалось, могут ус-
ваивать весьма разнообразные органические веще-
ства. Окисление глюкозы катализируется многочислен-
ными ферментами, которые выделены из грибов, очи-
щены и тщательно изучены. Через цепь последова-
тельных промежуточных реакций глюкоза и другие
гексозы постепенно превращаются в конечные про-
32
CH-jCOS-KoA
ЩавеЛевоуксусная крсйота
KoA-SH
Лимонная кислота
Н2О
Яблочная кислота
цнс -Аконитовая кислота
Фумаровая кислота
Изблимонная кислота
12Н
Янтарная кислота
2Н
ОС-Кетоглутаровая КИСЛоТа
|Ж]
Рис. 9. Цикл трикарбоновых кислот
дукты окисления — углекислый газ и воду. Основной
субстрат для процессов окисления — пировиноград-,
пая кислота СН3СОСООН. С изучения путей окисле-
ния гексоз до пировиноградной кислоты берет свое
начало современная биохимия.
Образование пирувата из гексоз идет двумя пу-
тями: гликолитическим Эмбдена — Мейергофа — Пар-
наса (рис. 7) и пентозофосфатным (рис. 8), причем
пентозофосфатный путь не является главным путем
окисления глюкозы. Его основное назначение в боль-
шей части клеток состоит в том, чтобы генерировать
в цитоплазме восстановитель в форме НАДФ-Н, а
также поставлять пентозы (в основном D-рибозу) для
синтеза нуклеиновых кислот и эритрозу для образо-
вания шикимовой кислоты — исходного соединения для
синтеза веществ ароматического ряда. Пентозофос-
фатное расщепление у грибов преобладает при доста-
точном количестве кислорода в среде. В анаэробных
условиях имеет место гликолитическое расщепление
глюкозы. В опытах с использованием для питания
Penicillium chrysogenum глюкозы, содержащей ме-
ченый углерод 14С, оказалось, что в клетках гриба
он находится в форме глюкозо-6-фосфата. Этот тип
окисления подробно изучен на примере ржавчинных
грибов, в частности, на уредоспорах стеблевой ржав-
2 783
33
Лцс гат
Щавелсвоуксусная кислота
Лимонная кислота
.Яблочная кислота
цис-Аконитовая кислота
Ацетат
Изолимонная кислота
Глиоксипевая Янтарная кислота
кислота
Рис. 10. Глиоксилатпый цикл
чины пшеницы обнаружены ферменты, катализиру-
ющие реакции пентозофосфатного цикла.
Окисление пировиноградной кислоты осуществля-
ется через цикл трикарбоновых кислот (рис. 9) и до-
полняющий его глиоксилатпый цикл, используемый
плесневыми грибами (рис. 10). Дрожжи н некоторые
микроорганизмы из пирувата образуют этанол
(рис. 11).
В клетках грибов, как и других организмов, осу-
ществляется огромное количество отдельных реакций
окисления. Большинство их не связано с фосфорили-
рованием, а реакции, сопряженные с этим процессом,
получили название окислительного фосфорилирова-
ния. Оно протекает по следующей схеме: AH2-|-fi+
АДФ+неорганический фосфат ------—АТФ.
Образование АТФ и АДФ происходит за счет энер-
гии переноса электронов от АН2 (донора) на Б (ак-
цептор).
К окислительному фосфорилированию способны
только митохондрии, причем процесс этот характерен
как для грибов, так и для других типов организмов.
°\ °" +
V V S°2 Н НАДН+Н+ НДД+ Н
С = О- >> »С = О ----►Н-С-ОН
1 I I
СН3 СН3 СН3
Пируват Ацетальдегид Этанол
Рпс. 11. Образование этанола из пирувата
34
фотосинтетическое фосфорилирование осуществляется
лишь в хлоропластах зеленых растений.
В состав дыхательной цепи митохондрий грибов вхо-
дят два цитохрома с и один цитохром в по сравнению
с тремя (а, в, с) у высших растений.
Окисление пировиноградной кислоты через цикл
Кребса не у всех грибов выражено одинаково. У выс-
ших сумчатых оно протекает более интенсивно, чем у
зигомицетов и дрожжевых клеток. В аэробных усло-
виях пировиноградная кислота подвергается ступен-
чатому декарбоксилированию и дегидрированию. Это
окисление сопровождается образованием ряда орга-
нических кислот, содержащих четыре и шесть атомов
углерода.
Основа цикла Кребса — дегидрирование уксусной
кислоты с образованием двух молекул СОа и четырех
атомов водорода по схеме:
CHSCOOH + 2НаО -► 2СОа + 8Н.
В грибах имеются различные ферментные системы,
катализирующие реакции цикла трикарбоновых кис-
лот. При культивировании грибов на жидких питатель-
ных средах в них накапливаются промежуточные про-
дукты окисления, в частности, лимонная, фумаровая,
яблочная и другие органические кислоты. Содержание
и соотношение их непостоянны и зависят от фазы раз-
вития гриба. Так, у Coniophora puteana количество
лимонной кислоты на второй месяц опыта составляло
1,1, а на четвертый — 4,9 % массы гриба. У Agaricus
campestris наибольшее количество яблочной кислоты
содержится в бесплодной части шляпки плодового
тела, а лимонной — в пластинках (в период, пред-
шествовавший образованию спор). Существует мне-
ние, что присутствие в растущих клетках грибов этих
и ряда других органических кислот, образующихся в
Цикле трикарбоновых кислот, стимулирует поглоще-
ние кислорода и таким образом имеет важное физи-
ологическое значение.
2.3. СИНТЕТИЧЕСКАЯ ДЕЯТЕЛЬНОСТЬ
Синтез углеводов. У *грибов, как гетеротрофных ор-
ганизмов, наиболее важным синтетическим процессом
является синтез глюкозы и других моносахаридов из
2*
35
более простых соединений-предшественников — пи-
ровиноградной, молочной кислоты и ряда аминокис-
лот. Центральное место в синтезе моносахаридов
занимает превращение пирувата в глюкозу. Грибы спо-
собны также превращать аминокислоты в органиче-
ские кислоты цикла трикарбоновых кислот, которые
в свою очередь являются продуктами для образования
глюкозы.
При участии соответствующих ферментных систем,
катализирующих реакции фосфорилирования и обра-
зования фосфорных эфиров, глюкоза превращается в
другие моносахариды. Реакция фосфорилирования
глюкозы и образования глюкозо-6-фосфата происхо-
дит под действием гексокиназы и АТФ, который най-
ден у грибов. В свою очередь, глюкозо-6-фосфат, под-
вергаясь дальнейшим ферментативным превращени-
ям, служит исходным продуктом для образования
свободных моносахаридов — фруктозы, седогептуло-
зы и маннита, который широко распространен у гри-
бов. Синтез моносахаридов из их фосфорных эфиров
идет при участии соответствующих фосфатаз. Ман-
нит образуется под действием фермента маннитдегид-
рогеназы из фруктозы:
Фруктоза + НАДФ • Н + Н+ -> Маннит + НАДФ.
Синтез важнейшего дисахарида грибов — трегало-
зы — происходит путем трансгликозирования при
участии уридиндифосфатглюкозы (УДФГ) по схеме:
УДФГ + Глюкозо-6-фосфат -► УДФ 4- Трегалозо-6-фосфат.
При помощи ферментативных реакций переглико-
зилирования осуществляется и синтез основного поли-
сахарида грибов — хитина — из уридиндифосфат-1-
ацетилглюкозамина. При участии нуклеотида гуано-
зиндифосфатманнозы синтезируется полисахарид ман-
нан, входящий в состав оболочек клеток грибов.
Основной запасной полисахарид грибов — глико-
ген— представляет собой полиглюкозу (рис. 12). На
долю гликогена приходится до 40 % сухой массы гри-
бов. В организме грибов гликоген легко превращается
в трегалозу. Синтезируется гликоген путем трансгли-
колизирования из уридиндифосфатглюкозы, причем
степень превращения мономера в гликоген превышает
90 %. В анаэробных условиях гликоген легко превра-
щается в маннит.
36
Рис. 12. Структура двух наружных ветвей гликогена:
R — остальная часть молекулы гликогена; а — связь между двумя остат-
ками глюкозы
Биосинтез аминокислот. Грибы способны синтези-
ровать 18 различных аминокислот и два амида, из
которых строятся белки. Опыты с мечеными атома-
ми показали, что в организме грибов аминокислоты
подвергаются довольно быстрым превращениям. Уг-
леродные скелеты аминокислот образуются из проме-
жуточных продуктов одного из дыхательных путей —
либо гликолитического цикла, либо цикла трикарбо-
новых кислот. Аминогруппы вводятся в углеродные
скелеты путем восстановительного аминирования ке-
токислот, причем единственным неорганическим сое-
динением азота, непосредственно используемым в
биосинтезе аминокислот, является аммиак. Так, амини-
рование а-кетоглутаровой кислоты приводит к обра-
зованию аминоглутаровой кислоты, которая затем
восстанавливается в глутаминовую при участии
НАД-Н и Н+ и фермента глутаматдегидрогеназы, вы-
Деленого в очищенном виде из грибов рода Neurospo-
Га- Из них выделены также ферментные препараты,
восстанавливающие нитраты до нитритов, гидрокси-
ламина и аммиака. Прямое аминирование кетокислот
аммиаком и образование аминокислот служит связую-
щим звеном между обменом углеводов и белков и
поэтому имеет исключительно важное значение в об-
мене веществ организма гриба.
К настоящему времени изучены пути синтеза всех
37
Пируват
Полуальдегид аспарагиновой кислоты
НООС
НООС
соон
СООН
НАДФ-Н
2,3-Дигидро-
ликолиновая
кислота
Тетрагидропико-
линовая кислота
Сукцинил-КоА
+NH3
СООН
H2N-CH
«U)5
CH—NH -Сукцинил
СООН
Н2О
М-Сукцинил-1_,1_-а,
£-диаминопимелино-
v „ вая кислота
Сукцинат
СООН
-Ч"
hc-nh2
соон
мезо-й, 6-Диаминопимелиновая
L.L-OC, €-Диаминопи—
мелиновая кислота
кислота
Сн2- nh2
<U
С|.П2
СН2
НС- NH2
СООН
L-Лизии
Рис. 13. Синтез лизина через диаминопимелиновую кислоту у гри-
бов классов Oomycetes и Hyphochytridiomycetes
gC-Кстоглутарат
I Ацетил-КоА
СООН
а-Аминоадипиновая
кислота
CH 2
6н2
но-с-соон
6н2
соон
Гомолимонная
кислота
соон
I Гомоизолименная
кислота
^Н2
СН2
н-с-соон
но-(рн
^оон
| Щавелево-
СН > глутаровая кислота
<Ьн2
н-с-соон
О=Ь
£оон
соон
а-Кетоадипиновая
СН.> кислота
<!:н2
6н2
o=i
СООН Трансаминирование
ОС-Аминоадипиновая кислота
АТФ НАДФ-Н
Полуальдегид
ОС'аминоадипиновой
кислоты
НАДФ-Н
Глутамат
Н
I
Н2С—NH —С —СООН
<Ьн2 <J:h2
сн2 <рн2
сн2 соон
н—с—nh2
соон
, НАД+
*СС -Кетоглута par
^h2-nh2
сн2
(Jh2
ун2
н—nh2
соон
L-Лизин
Рис. 14. Синтез лизина через “-аминоадипиновую кислоту у гри-
бов Chytridiomycetes, Zygomycetes, Ascomycetes, Basidiomycetes,
Deuteromycetes
Двадцати аминокислот. Это стало возможным благо-
даря применению радиоактивного углерода 14С и ис-
пользованию ауксотрофных мутантов грибов, утра-
тивших способность к образованию какого-либо фер-
мента, участвующего в синтезе. В этом случае для
Роста грибов необходим конечный продукт той фазы
39
биосинтеза, которая блокирована из-за отсутствия
необходимого фермента.
Значительный интерес представляет биосинтез ли-
зина. Имеется два основных способа его образования:
один — через диаминопимелиновую кислоту (у расте-
ний и грибов классов Oomycetes, Hyphochytridiomyce-
tes) (рис. 13) и другой — через а-аминоадипиновую
кислоту (у грибов других классов) (рис. 14).
Путь биосинтеза лизина через диаминопимелино-
вую кислоту начинается с альдолазной конденсации
полуальдегида аспарагиновой кислоты и пирувата с
потерей воды; в результате образуется циклический
промежуточный продукт — 2,3-дигидропиколиновая
кислота. На более поздней стадии образуется L, L-,
а, е-диаминопимелиновая кислота, превращающаяся в
мезо-форму и затем декарбоксилирующаяся с образо-
ванием L-лизина.
Путь биосинтеза лизина через аминоадипиновую
кислоту начинается с ацетил-КоА и а-кетоглутарата.
В качестве промежуточного продукта образуется го-
моизолимонная кислота, далее а-аминоадипиновая,
восстанавливающаяся в конечном счете в L-лизин.
Синтез белка из аминокислот у грибов, как и дру-
гих организмов, происходит в рибосомах. Энергию
для синтеза белка организм получает преимуществен-
но из АТФ, образовавшейся при дыхании или броже-
нии. Ферментативный синтез белка начинается с ак-
тивации аминокислот с участием специфических фер-
ментов и АТФ. Каждой аминокислоте соответствует
свой фермент. Образующийся комплекс активирован-
ной аминокислоты и аденозинмонофосфата (АМФ)
при участии транспортной рибонуклеиновой кислоты
(тРНК), также специфичной для каждой аминокис-
лоты, подвергается дальнейшим превращениям по
схеме:
Фермент +АМФ — Активированная аминокислота +
+РНК Фермент + РНК — Активированная аминокислота +
+ АМФ.
В результате этого превращения образуется ком-
плекс РНК с активированной аминокислотой, из ко-
торого в рибосоме происходит синтез белка. Молеку-
лярную же структуру белка определяет структура
ДНК, находящаяся в ядре. Зашифрованная в ДНК
40
З'ОН Место
Рис. 15. Последовательность оснований дрожжевой аланиновой
тРНК (по Р. Холли)
Модифицированные нуклеотиды (отмечены темным цветом) сокращенно
обозначаются следующим образом: инозин — I, метнлинозин — ml. днгн-
дроурндин — иН6, риботимидин — Т, псевдоуридии ф, метнлгуанознн —
niG и диметилгуаиозии — гпгО
информация через информационную, или матричную,
РНК (мРНК), передает в рибосому необходимую
информацию. В результате сложного механизма взаи-
модействия аминокислоты происходит удлинение по-
липептидной цепочки в точном соответствии с зашиф-
рованной в ДНК информацией. В свою очередь, синтез
нуклеиновых кислот осуществляется при участии спе-
41
о о носн3 о о
II II I I II II
hs—ch2-ch2-n-c-ch2-ch2-n-c-c-c-ch2-o-p-o-poch2
I I III I 8
н Н Н СН3 -О ~0
R-Меркапто- Пантотеновая кислота
г этиламин
NH,
I
О~
Рис. 16. Кофермент А
цифических белков-ферментов. Так, из дрожжей
выделены ферменты полинуклеотидфосфорилазы, ка-
тализирующие синтез РНК из нуклеозиддифосфатов.
Последовательность аминокислот в белках опреде-
ляется последовательностью кодов, т. е. три основания,
составляющие кодон, детерминируют одну аминокис-
лоту. Кодоны считываются последовательно молеку-
лами транспортных РНК (тРНК). Активизация ами-
нокислот и присоединение их к транспортным РНК
осуществляются под действием специфических синте-
таз. В свю очередь антикодон, т. е. участок узнавания
матрицы в тРНК, представляет собой комплементар-
ную последовательность из трех оснований в мРНК
Последовательность оснований дрожжевой аланино-
вой тРНК определил Р. Холли (рис. 15).
Биосинтез липидов. Липиды представляют собой
смесь сложных эфиров (глицеридов), трехатомного
спирта глицерина и высокомолекулярных жирных кис-
лот. В организме грибов они легко образуются из глю-
козы и продуктов диссимиляции углеводов, содержа-
щих два-три углеродных атома — уксусной кислоты,
этилового спирта, пировиноградной кислоты и др. Не-
42
которые виды Fusarium и Oidium энергично синтези-
руют жир из пентоз.
В синтезе жирных кислот ведущая роль принад-
лежит уксусной кислоте. КоА (рис. 16), после присо-
единения остатка уксусной кислоты образующий аце-
тил-КоА, вступает в синтетические реакции, являясь
донором активных ацетильных радикалов, необходи-
ных для осуществления реакции. Опыты с мечеными
атомами показали, что непосредственным предшествен-
ником синтеза жирных кислот у грибов является ма-
лонил-КоА, образующийся при участии фермента
ацетил-КоА-карбоксилазы, содержащего в качестве
простетической группы биотин и выполняющего функ-
ции промежуточного переносчика СОг-
о О
'll II
СН8С—S—КоА + СОа + АТФ -> СООН—CHaC—S—КоА +
+ АДФ + Фн.
Малонил-КоА представляет собой первый специ-
фический продукт синтеза жирных кислот, в присут-
ствии растворимых ферментов быстро превращающих-
ся в жирные кислоты. Последовательность реакций в
биосинтезе жирных кислот представлена на рис. 17.
В синтезе липидов (триацилглицеридов) непосред-
ственно реагируют между собой не глицерин и жир-
ные кислоты, а глицерол-3-фосфат и КоА-производные
жирной кислоты. Глицерол-З-фосфат образуется дву-
мя путями: из фосфодиоксиацетона, получающегося
в процессе гликолиза при участии глицеролфосфатде-
гидрогеназы, и путем фосфорилирования глицерина
под действием глицеролкиназы. Глицерол-З-фосфат
ацилируется двумя молекулами КоА-производного
жирной кислоты с образованием L-фосфатидной кис-
лоты. Фосфатидные кислоты, являясь промежуточными
продуктами синтеза сложных липидов, затем гид-
ролизуются определенными фосфатазами с образова-
нием диацилглицеридов. В свою очередь диацилгли-
цериды ацилир} ются молекулой КоА-производного
жирной кислоты и образуют триацилглицериды. Схему
синтеза жирных кислот можно показать на примере
биосинтеза линоленовой кислоты (рис. 18).
Синтетаза жирных кислот продуцирует насыщен-
ные кислоты с различной длиной волны, чаще всего
пальмитиновую кислоту, из кторой при участии спе-
43
о о
II II
Н3с-С —S — АПБ + С—СН2—С —S—АПБ
Ацетил-АПБ
Малонил-АПБ
АПБ+СО2
Конденсация
О О
II II
Ацетоацетил -АПБ... Н3С - С — СН2 - С - S - АПБ
НАДФ-Н
НАДФ+’>
Восстановление
D-3-Гидрокси-
бутирил -АПБ
Кротонил-АПБ
Бутирил-АПБ
Н О
I II
Н3С—С —СН2—С—S — АПБ
ОН
Дегидратация
I II
Н3С —С = С—С—S—АПБ
I
Н
НАДФ-Н
Восстановление
НАДФ+
О
II
н3с-сн2-сн2-с-б-апб
Рис. 17. Последовательность реакций в синтезе жирных кислот.
Указанные здесь продукты образуются в первом цикле синтеза
циальногр фермента образуется стеариновая кислота.
Полиненасыщенные кислоты формируются в ходе уд-
линения и дегидрирования насыщенных кислот. Син-
тез ненасыщенных жирных кислот происходит путем
постепенного увеличения числа двойных связей (ре-
акций at, аг, аз), аналогичная последовательность ре-
акций о’, а12, а’ показана и для кислот с 16 атомами
углерода. Г.Л.Клячко-Гурвич с соавт. полагают, что
реакция oj, < пределяет синтез линоленовой кислоты
только в фитооптической ткани.
Синтез терпеноидов (псевдолипидов) изучен менее,
44
Рис. 18. Схема биосинтеза линоленовой кислоты.
Широкие стрелки — хорошо доказанные реакции, тонкие — реакции, до-
казанные для отдельных случаев, пунктирные — недоказанные реакции.
Жирные кислоты: 16:0 — пальмитиновая, 16:1 — пальмитолеиновая. 16:
: 2 — гексадекардиеиовая, 16 : 3 — гексадепатриеиовая, 18:0 — стеариновая,
18:1 — олеиновая, 18:2 — линолевая, 18:3 — линоленовая
чем липидов. Среди этих веществ наиболее важны сте-
роиды, находящиеся в грибах в значительном коли-
честве и имеющие наиболее важное практическое зна-
чение. Синтез стероидов осуществляется из фернезил-
пирофосфата. При конденсации двух молекул этого
соединения образуется углеводород сквален (С30Н50),
или дигидротерпен. Опыты с радиоактивным 14С пока-
зали, что сквален является главным предшественни-
ком, из которого многие грибы (Fusarium, Rhizopus,
Trichotecium и др.) синтезируют стероиды.
Синтез органических кислот. В образовании гри-
бами органических кислот важная роль принадлежит
циклу трикарбоновых кислот и глиоксилатному цик-
лу, в ходе которого образуются продукты неполного
окисления сахара. Следовательно, процесс дыхания —
главный источник яблочной, фумаровой, янтарной, ли-
монной и др. органических кислот. Синтез органичес-
ких кислот у грибов изучен достаточно подробно, чему
способствовало важное промышленное и медицин-
ское значение органических кислот и особенно лимон-
ной кислоты как консерванта при переливании крови.
Организмы многих видов грибов — Aspergillus, Ре-
nicillium, Rhizopus, Laetiporus sulphureus, Inonotus
hispidus и др. способны к интенсивному образованию
46
лимонной кислоты при достаточном доступе молеку-
лярного кислорода. Наиболее подходящая среда для
образования лимонной кислоты — сахар, хотя исход-
ным веществом может служить этиловый спирт, а так-
же другие кислоты — аконитовая, яблочная, фумаро-
вая, янтарная.
В организме грибов с участием ферментов осущест-
вляются реакции конденсации двух молекул уксусной
кислоты с отнятием двух атомов водорода под дейст-
вием соответствующих дегидрогеназ. На первом этапе
этой реакции образуется янтарная кислота, а на вто-
ром — фумаровая:
—2Н —2H
СН3СООН-------► СНаСООН------> СНСООН.
+ I II
СН3СООН СН2СООН СНСООН
Некоторые плесневые грибы (Aspergrillus niger,
Penicllium chrysogenum и др.) могут при помощи фер-
мента гликозидазы осуществлять прямое окисление
глюкозы за счет кислорода воздуха с образованием
глюконовой кислоты по схеме:
СН2ОН(СНОН),СНО + 1/2 Оа -» СН2ОН(СНОН)4СООН.
Известна способность некоторых штаммов грибов
Aspergillus itaconicus, A. terrens к образованию ита-
ковой кислоты из цис-аконитовой путем ее декарбо-
ксилирования:
НООС-СН2-С-СООН -» СО2 + НООС-СНа-С-СООН.
II II
СНСООН сна
Несмотря на практическую значимость итаковой
кислоты, используемой для изготовления различных
пластических и синтетических препаратов, пока еще
не получены в чистом виде ферменты, катализирующие
приведенную реакцию.
Некоторые плесневые грибы способны образовы-
вать кодзиевую кислоту путем конденсации диоксиа-
цетона или глицеринового альдегида.
Продуктом жизнедеятельности очень многих гри-
бов, накапливающимся в культуральной жидкости, яв-
ляется щавелевая кислота. Образование ее стимулиру-
ется щелочной реакцией питательной среды и происхо-
дит путем конденсации двух молекул муравьиной кис-
лоты с участием фермента формиатдегидрогеназы.
46
Щавелевая кислота образуется также из уксусной
путем постепенного окисления ее до гликолевой, глио-
ксиловой и, наконец, щавелевой кислоты:
СН8 -» СН2ОН -* СНО -> СООН.
II II
СООН СООН СООН СООН
Образование молочной кислоты грибами Mucor
rauxii, Rhizopus orizae, Moniliata marii в анаэробных
условиях идет по формуле
СвН12О6 -* СН3СНОНСООН + С2Н6ОН + СО2.
Как показывают опыты с меченым 14С на примере
Rhizopus nigricans в аэробных условиях она образует-
ся путем восстановления пировиноградной кислоты
СООН СООН
СО НАДФН+Н+ СНОН + НАДф.
I I
СН3 СН3
При культивировании грибов на жидких питатель-
ных средах образуется смесь многих органических ки-
слот. Так, А. Н. Шиврина в культуральной жидкости
Laetiporus sulphureus обнаружила щавелевую, яблоч-
ную, уксусную, фумаровую, янтарную и лимонную
кислоты.
К карбоновым кислотам относятся агарициновая
кислота (С22Н40О7), выделенная из Fomitopsis offici-
nalis, норкаператовая (С2оНз607), полученная из пло-
дового тела Cantharellus floccosus, унгулиновая
(СггНгвОб), синтезированная в мицелии Ischnoderma
resinisum и др. Образование их связано с превраще-
нием более сложных по составу ароматических кислот.
Механизм биосинтеза этих кислот еще полностью не
раскрыт.
Синтез фенольных соединений. Пути биосинтеза
фенольных соединений грибов принципиально отли-
чаются от синтеза в высших растениях: у последних
фенольные соединения синтезируются через шикимо-
вую кислоту, у грибов — в основном ацетат-малонат-
ным путем (при участии лабильного комплекса фер-
ментов вступает в реакцию ацетил-КоА и малонил-
КоА) по следующей схеме:
Ацетил-КоА 4- 3 малонил-КоА + НАДФ-Н + Н*" -►
СвНз(ОН)(СН8)СООН + ЗСО2 + 4КоА + SH + НАДФ + Н2О.
Метилсалнцнловая кислота
47
Образование метилсалициловой кислоты изучено
с помощью использования экстракта Penicillium ра-
tulum.
Фенольные вещества образуются также путем кон-
денсации одной молекулы гексозы и одной молекулы
биозы. Полученное при этом соединение подвергает-
ся окислению, замещению или восстановлению в боко-
вых группах с образованием орселлиновой кислоты и
ее производных. Последующая конденсация ее дает
новые вещества фенольной природы. В опытах с Phy-
comyces blakesleanus эти вещества получены соедине-
нием седогептулозы и мелоинозита (этот путь харак-
терен и для высших растений).
Как показали исследования Д. Повера о соавт., в
культурах дереворазрушающих грибов, в частности,
Lentinus lepideus ацетат и тирозин не используются
для образования фенольных соединений, которые обра-
зуются через шикимовую кислоту с последующим син-
тезом производных коричной кислоты.
Для грибов — возбудителей белой гнили (Hetero-
basidion annosum, Phellinus pini, Inonotus hispidus) —
характерен особый способ образования фенольных со-
единений. Он заключается в использовании строитель-
ных единиц лигнина, ароматические ядра которых ор-
ганизм получает в готовом виде. На этом пути, как
установлено А. Н. Шивриной, помимо частичного де-
метоксилирования и возможного окисления белковой
цепи пропилфенолов, существует процесс вторичной
полимеризации, при котором возбуждающиеся струк-
турные единицы лигнина, соединяясь с продуктами раз-
ложения белков мицелия гриба, образуют гуммипо-
добные вещества.
Синтез антибиотиков. Большинство антибиотиков,
образуемых грибами, сложены из фрагментов уксус-
ной кислоты (например, гризеофульвин, микофеловая
кислота и др.). У некоторых грибов эти соединения
образуются из аминокислот, замкнутых в небольшие
циклы, со строением пиперидинов (глиотоксин, пепер-
гилловая кислота и др.) или пептидов (пенициллин,
ликомаразин и др.). Некоторые антибиотики состоят
из аминокислот, образующих небольшие кольца пи-
перидинового строения (антибиотик из видов Tricho-
derma — глиотоксин.).
Пути синтеза антибиотиков исследовались при уча-
48
стии меченых соединений — органических кислот (ук-
сусной, муравьиной, молочной, мевалоновой и др.),
аминокислот и различных серусодержащих соедине-
ний. В синтезе пенициллина важная роль принадле-
жит уксусной кислоте.
Синтез гуммиподобных соединений. Исследования
наростов стерильного мицелия Inonotus obliquus, из-
вестного в медицине и фитопатологии под названием
«чага» и содержащих до 16 % гуммиподобных соеди-
нений, позволили выяснить особенности их образова-
ния. Установлено, что гуммиподобные соединения пред-
ставляют собой продукт окислительной конденсации
строительных единиц лигнина, белка и углеводов. Вы-
свобождаемые грибом мономеры лигнина под влия-
нием фенолоксидаз соединяются с продуктами разло-
жения мицелия и углеводными цепочками, образуя
гуммиподобные комплексы. Хроматографические ана-
лизы показали, что при культивировании Inonotus obli-
quus и Phellinus igniarius на глюкозоминеральной
среде с опилками из древесины березы образуется гум-
миподобный комплекс, по составу сходный с натураль-
ными наростами грибов. В его состав входят кар-
бонильные соединения, сиреневая и ванилиновая
кислоты, 16 аминокислот. Замена лигнина на так назы-
ваемый биолигнин в два раза ускоряет синтез гумми-
подобного комплекса.
Почвенным грибам (Aspergillus, Alternaria, Sta-
chybotris Stemphylium, Cladosporium и др.) принад-
лежит важная роль в образовании гумуса, который
представляет собой сложное сочетание особых орга-
нических соединений, синтезируемых грибами и бак-
териями и присущих только почве.
Синтез хитина. Распространенный структурный
компонент клеточной стенки грибов лигнин синтези-
рован in vitro с использованием ферментативной фрак-
ции, полученной с помощью дрожжевой формы Mucor
rouxii. Образуемое вещество (а-хитин) было опреде-
лено на основании фракционной диаграммы в рентге-
новских лучах. Изучение механизма синтеза микро-
фибрилл хитина привело к обнаружению нового типа
микроорганелл — хитосом. Они представляют собой
микровезикулы диаметром 40—70 нм. Их можно изо-
лировать из цитоплазмы грибов различных системати-
ческих групп. Хитосомы имеют липопротеидную осно-
49
ву и расщепляются дигитонином. Входящий в клеточ-
ные стенки грибов хитин синтезируется путем реакции
ферментативного перегликозилирования из уридин-
фосфат-М-ацетилглюкозамина при участии хитинсинте-
тазы. Использование антибиотика поликсина-р, инги-
бирующего хитинсинтетазную активность, показало,
что синтез хитина — необходимая функция для растя-
жения мицелия. Этот антибиотик ингибирует синтез
хитина протопластов, но не ингибирует их рост. Рас-
щепление хитина до глюкозамина осуществляется при
участии фермента хитиназы.
2.4. РАЗЛОЖЕНИЕ ОРГАНИЧЕСКИХ ВЕЩЕСТВ
Существует три стадии освобождения энергии жи-
выми организмами при разложении органических ве-
ществ. На первой происходит расщепление крупных
молекул на более мелкие фрагменты. Так, жиры ги-
дролизуются на жирные кислоты и глицерин, полиса-
хариды на глюкозу и другие сахара, белки на амино-
кислоты (рис. 19). На второй стадии образовавшиеся
ранее малые молекулы распадаются до более простых
компонентов, в частности, до ацетильной части ацетил-
Рис. 19. Стадии извлечения энергии из пищевых веществ
50
КоА, играющего центральную роль в метаболизме.
Происходит также образование небольшой части
АТФ. На третьей стадии, которую представляют цикл
трикарбоновых кислот и окислительное фосфорилиро-
вание заканчиваются общие пути окисления органи-
ческих веществ. При участии ацетильных компонентов
ацетил-КоА происходит их полное окисление до СО2
и генерирование молекул АТФ, т. е. окислительное
фосфорилирование с выделением С2.
Распад веществ углеродной природы. Основная
масса моно- и олигосахаридов грибов разлагается в
ходе дыхания с высвобождением энергии, необходи-
мой для жизнедеятельности организмов.
Растения состоят в основном из целлюлозы, на до-
лю которой приходится до 70 % их массы. Распад
целлюлозы растений под действием грибов и бакте-
рий имеет первостепенное значение в минерализации
и круговороте углерода. Главную роль в разложении
целлюлозы играют Aspergillus, Fusarium, Chaetomium,
Rhizoctonia solani, Botrytis cinerea и др. Большая
группа дереворазрушающих грибов Serpula lacrymans,
Phaeolus schweinitzii, Poria vaillantii и др. участвуют
в разложении целлюлозы, инкрустированной лигнином
(древесиной), вызывая деструктивную гниль древеси-
ны, характеризующуюся темным цветом, трухлявостью
и Способностью легко рассыпаться в порошок.
Некоторые лигнинразрушающие грибы разлагают
составные части древесины одновременно или снача-
ла разлагают целлюлозу, а затем лигнин (Armillariel-
la mallea, Phellinus pini, Inonotus dryophilus, Gano-
derma applanatum и др.). В результате образуется так
называемая коррозионная гниль: волокнистая, мягкая,
с ямками и отверстиями в клеточных стенках. Интен-
сивность разложения различна не только у грибов раз-
ных классов, но и внутри вида. Основными фермента-
ми, участвующими в разложении целлюлозы, являют-
ся, очевидно, р-глюкозидазы. Разрушение лигнина
обычно коррелирует с лакказной активностью и сопро-
вождается увеличением количества фенольных гидро-
ксильных и карбоксильных групп при одновременной
потере метоксилов.
Почвенные грибы, в том числе и патогенные (Bot-
rytis cinerea, Fusarium oxysporum.Trichotecium ro-
zeum). под действием пектиназ (или полигалактуроназ)
Б1
разлагают пектины, образуя а-галактуроновую кисло-
ту. Этот процесс происходит при мочке льна и коноп-
ли, в результате чего пучки целлюлозных волокон от-
деляются от остальных растительных тканей.
Гидролитическое расщепление крахмала — главно-
го запасного вещества растений — осуществляется под
действием амилаз. При помощи а-амилазы из крахмала
образуется мальтоза и олигомеры из трех — семи ос-
татков глюкозы. Многие почвенные грибы Aspergillus
orizae, A. niger, A. wentii и др.— активные продуцен-
ты амилазы.
Расщепление фруктозанов до фруктозы осущест-
вляется при помощи ферментов, выделенных, в част-
ности, из A. niger.
Распад белковых веществ. Основной реакцией пре-
вращения азотистых веществ в безазотистые являет-
ся дезаминирование, или распад аминокислот на ам-
миак и соответствующие кетокислоты. В зависимости
от состава углеродного скелета аминокислоты деза-
минирование может происходить тремя основными пу-
тями. Первый — восстановительное дезаминирование,
при котором образуются соответствующая кислота и
аммиак:
+2Н
Я-СНСООН--------> Т?-СН2СООН + NHS.
I
NHa
Второй путь — гидролитическое дезаминирование
(приводит к образованию оксикислоты и аммиака):
+н.о
R—СНСООН--------> Д-СНОНСООН + NHS.
I
NHa
Наиболее важно окислительное дезаминирование,
при котором образуются кетокислота и аммиак:
+1/2 о,
к-снсоон---------->- я-сосоон + NHS.
I
NHa
Например, глутаминовая кислота при помощи глу-
таматдегидрогеназы превращается в а-кетоглутаро-
вую кислоту, причем реакция эта обратима и ей при-
надлежит важнейшая роль в аминокислотном об-
мене.
Происходящий при участии многочисленных гри-
Фумарат Аргинин Н2О
Аргининосукцинат Орнитин
О
II
h2n-c-nh2
Мочевина
ин
Аспартат
R' NH2
Карбамоил фосфат
R —С-NH,
II 2
О
со2 + nh4+
Рис. 20. Цикл синтеза мочевииы
бов и бактерий распад белков в почве приводит к ми-
нерализации азота, или аммонификации.
Некоторые аминокислоты расщепляются при помо-
щи реакции переаминирования (переноса аминогруп-
пы аминокислоты на кетокислоту) сопровождающего-
ся новообразованием аминокислот. Так, перенос ами-
ногруппы с глутаминовой кислоты на щавелевоуксус-
ную приводит к образованию а-кетоглутаровой и ас-
парагиновой кислот. Этот процесс хорошо изучен на
примере Neurospora crassa.
Распад сложных белковых молекул при помощи
протеолитических ферментов имеет важное значение
для питания всех типов организмов. Для этих фермен-
тов характерно почти полное отсутствие специфично-
сти. Например, выделенные из грибов протеиназы рас-
щепляют до 80 % содержащихся в белке пептидных
связей. В организме животных и грибов мочевина на-
ряду с аммиаком является конечным продуктом распа-
да белков и аминокислот (рис. 20). Однако животные
организмы мочевину не используют, выделяя ее в ок-
ружающую среду. Грибы же ее не выделяют, а содер-
жат в тканях в значительных количествах, особенно в
период формирования плодовых тел. В гимениальном
слое, где образуются базидиоспоры, содержание мо-
чевины у шампиньона (Agaricus bisporus) достигает
14 % массы сухого мицелия, у гастеромицетов — 11 %.
Гидролиз мочевины в организме гриба осуществляет-
ся ферментом уреазой:
NH,CONH2 + Н8О -» 2NHS + СО,.
53
Быстрое увеличение содержания мочевины в тка-
нях грибов сопровождается интенсивным ростом ми-
целия, т. е. мочевина выполняет роль запасного орга-
нического вещества подобно аспарагину и глутамину
у зеленых растений. Таким образом, если у животных
мочевина является отбросом, то у грибов — важным
промежуточным продуктом.
У базидиальных грибов — возбудителей белой
(коррозионной) и бурой (деструктивной) гнили син-
тез активных карбоксильных протеиназ является эво-
люционно закрепленным признаком. Более совершен-
ный ферментный аппарат грибов белой гнили свиде-
тельствует о большей эволюционной продвинутости
этой группы. Протеиназы дереворазрушающих гри-
бов имеют, вероятно, общие генеалогические корни с
ферментами животного и микробного происхождения.
Наличие в культуре базидиомицетов карбоксильных,
сериновых, тиоловых и металлозависимых протеиназ
отражает универсальность их жизненной системы, по-
зволяющей быстро осваивать природные субстраты.
Разложение углеводородов. Возможность разло-
жения углеводоров с длинной цепью, имеющих важ-
ное значение в круговороте углерода, выявлена на при-
мере дрожжей Candida lipolytica и С. tropicalis. Иссле-
дования показали, что использовать все высшие
гомологи углеводородов, начиная с С15-соединений, мо-
жет большинство видов Candida.
Окисление парафинов осуществляется при помощи
монооксигеназы (алканоксигеназы) в присутствии
молекулярного кислорода:
Парафин + О2 + НАД-Н'*’ —> Алифатический спирт+
+ НАД + Н2О.
Образующиеся алифатические спирты подверга-
ются дальнейшему характерному для жирных кислот
окислению, в результате которого накапливаются Сз-,
Cg- и Су-жирные кислоты.
Грибы способны расщеплять ароматические углево-
дороды в присутствии кислорода путем разрыва аро-
матического кольца. Пути распада ароматических сое-
динений очень разнообразны, что позволяет грибам
полностью или частично разлагать большинство при-
родных и искусственных соединений.
54
2.5. РОСТ И ВЛИЯНИЕ ВНЕШНИХ ФАКТОРОВ
НА РОСТОВЫЕ ПРОЦЕССЫ
2.5.1. Рост грибов. Процесс увеличения размеров
клеток, а следовательно, и общей массы характеризу-
ется понятием «рост». Он осуществляется у мицели-
альных грибов путем растяжения внутренней оболоч-
ки верхушечной клетки. Необходимое условие роста —
наличие питательных веществ и поступление к расту-
щей клетке цитоплазмы из соседних предверхушечньх
клеток. Не меньшее значение имеют активные процес-
сы синтеза, в ходе которых образуются ядро, клеточ-
ные органоиды и элементы клеточной стенки. У дрож-
жевых грибов рост новых дочерних клеток происхо-
дит неразрывно путем почкования или деления. Эта
способность характерна и для некоторых мицелиаль-
ных грибов.
Растущий участок гифы содержит повышенное ко-
личество цитоплазмы, белковых веществ, нуклеиновых
кислот, ферментов, т. е. он наиболее активен в физио-
логическом отношении. За растущими клетками рас-
полагаются вакуолизированные, цитоплазма которых
через поры поперечных перегородок под влиянием сил
осмотического давления выталкивается к верхушечной
клетке. В вакуолизированных предверхушечных клет-
ках содержатся запасные питательные вещества, в
том числе гликоген, используемые для образования
оболочки.
Скорость роста грибов, произрастающих на твер-
дых питательных средах, чаще всего определяют пу-
тем измерения диаметра или радиуса и общей площа-
ди колонии мицелия, а скорость роста спор — по уве-
личению объема их биомассы при набухании.
Ростовые процессы сильно зависят от генетических
особенностей, условий культивирования и действия
внешних факторов. Скорость роста разных грибов да-
леко не одинакова. В связи с этим их подразделяют
на быстрорастущие (Neurospora, Trichoderma, Muco-
rales, Aspergillus), отдельные представители которых
могут расти с высокой скоростью — до 3—6 мм/ч, и
медленнорастущие (Phellinus pini, Polystictus circina-
tus). Прирост быстрорастущих дереворазрушающих
грибов Femes fomentarius и Pleurotus ostreatus состав-
ляет 9—14 мм в сутки, а медленнорастущего Piptopo-
55
rus betulinus— лишь 1,5—3,0. E. В. Ветровой доказа-
но, что скорость роста гетерокарионов выше, чем го-
мокарионов.
Рост мицелия прекращается при полном исполь-
зовании питательной среды или при переходе гриба
в следующие стадии развития, связанные с размноже-
нием. Таким образом, вегетативный рост—подготови-
тельный этап, создающий благоприятные условия для
размножения. Микроскопические исследования мице-
лия позволили выделить у грибов ряд возрастных ста-
дий, характеризующихся определенными признаками.
I стадия — прорастание конидий (спор). Включа-
ет два этапа: первый — набухание конидий (длится
4—10 ч), второй — образование ростовых трубок и пер-
вичного мицелия из нескольких клеток. Цитоплазма
не дифференцирована, в клетке содержатся мелкие
вакуолярные пятна.
II стадия — разрастание мицелия и его ветвление
(лагфаза). Ядро приобретает характерный для грибов
вид. Образуются мелкие гранулы липидов.
III стадия — равномерный интенсивный рост, со-
провождающийся активными обменными процессами
и накоплением нуклеиновых кислот.
IV стадия — замедленный рост, старение мицелия,
спорообразование, накопление вторичных метаболи-
ческих продуктов.
V стадия — принята для условного обозначения
полного автолиза мицелия.
Применительно к отдельным грибам, в частности
к продуцентам пенициллина, детально описаны все
возрастные изменения. Так, у Penicillium chryzogenum
описано 7 возрастных стадий.
Продолжительность роста грибов в той или иной
стадии зависит от экологических факторов, генетичес-
ких особенностей, условий культивирования и др.
2.5.2 Влияние внешних факторов на ростовые про-
цессы. Условия окружающей среды — температура,
pH среды, свет, аэрация, влажность — на протяжении
всего жизненного цикла грибов постоянно оказывают
свое воздействие. Прежде всего они сказываются на
характере и особенностях ростовых процессов, т. е.
скорость роста — один из ведущих показателей ответ-
ной реакции грибов на влияние внешних факторов.
Температурные факторы. Достаточное количество
56
тепла — одно из основных условий жизни гриба. При-
чем активная жизнедеятельность каждого вида воз-
можна в пределах определенных температурных
границ. Наиболее гармоничное течение обменных про-
цессов наблюдается при температурном оптимуме. Воз-
действие слишком низких или слишком высоких тем-
ператур приводит к глубоким нарушениям в коорди-
нации процессов жизнедеятельности, к необратимым
повреждениям цитоплазмы. Если температура снижа-
ется и переходит в критическую, прекращается движе-
ние цитоплазмы, утрачивается полупроницаемость
мембран и клетка гибнет. Высокая температура также
приводит к гибели клетки вследствие нарушения мемб-
ран, наступающего в результате инактивации и дена-
турации белков и расстройства обменных процессов.
Нижний предел, при котором прекращается рост
клеток абсолютного большинства грибов,— 0—3° С,
а верхний — не превышает 40° С. Единственного тем-
пературного оптимума для грибов не существует, так
как потребность в температуре для роста мицелия,
образования плодовых тел и прорастания спор не оди-
накова. Например, оптимум температуры для прора-
стания спор у заборного трутовика Qloephillum seria-
rium составляет 30—34° С, а для роста грибницы —
36° С.
Снижение интенсивности роста или полное отсут-
ствие его у грибов при определенной температуре в
некоторых случаях вызвано неспособностью синтези-
ровать необходимые аминокислоты и витамины. В опы-
тах Д. Фриза культуры Coprinus fimetarius отлича-
лись хорошим ростом даже при температуре 44° С,
если в среде содержался гидролизат казеина, актив-
ным компонентом которого является метионин. Оче-
видно, блокировка синтеза этой аминокислоты при по-
вышенной температуре служит причиной прекраще-
ния роста мицелия. В зависимости от потребности в
температуре грибы подразделяются на три группы: хо-
лодолюбивые, тепловыносливые и теплолюбивые
(табл. 2).
Отсутствие роста у грибов при температуре ниже
нуля не означает, что они гибнут. Некоторые пло-
довые тела семейства Polyporaceae способны выдер-
живать пониженные температуры до —100° С, а мице-
лий Lentinus lepideus, Fomitopsis carnea выносит су-
57
Таблица 2. Максимальные, минимальные и оптимальные тем-
пературы для некоторых видов грибов
Группа гри- бов Вид Температура, °C
минималь- ная оптималь- ная макси- мальная
Холодолю- Phacidium infestans 3 15 27
бивые Phytophthora infestans 2 18—21 26
Ustilago avenae 2 10—20 28
Тепловынос- Ceratostomella pilifera 5 26—30 35
ливые Fusarium poae 2 24—25 34
Heterobasidion annosum 3 22—24 39
Тепл олю- Neurospora sitophila 4 36 44
бивые Saccharomyces quttulata 20 30—39 45
Phytophthora terrestris 12 31 36
Sterignatocystis niger 7—10 33-37 43
Aspergillus fumigatum 8—12 31—39 50
хой жар до 4-100° С, хотя увлажненный воздух вызы-
вает отмирание грибницы еще при 55° С. Вместе с тем
плодовые тела, имеющие мясистую или мягкую кожи-
стую консистенцию и относящиеся к однолетним (Ро-
lyporus, Polystictus и др.), зимой погибают от морозов.
В свою очередь, деревянисты и пробковые плодовые
тела грибов из родов Femes, Daedalea и другие отли-
чаются высокой устойчивостью к низким температу-
рам и с наступлением весны вновь начинают вегети-
ровать.
Показательны экологические модификации различ-
ного географического происхождения. Так, среднесу-
точный рост Fusarium sporotrichioides у северных куль-
тур (якутских) обычно ниже, чем у южных изолятов
(азербайджанских и краснодарских).
pH среды. Возможность развития каждого гриба
прежде всего определяется pH среды, или реакцией
субстрата в естественных условиях. Питательная сре-
да, содержащая все необходимые вещества, но приго-
товленная без учета необходимой кислотности (или
щелочности), может совсем исключить возможность
развития организма или не окажет на него сильного
ингибирующего действия. Это объясняется образовани-
ем аммиака и органических кислот, повышающих pH,
вследствие неодинакового поглощения компонентов
58
среды, усвоения катионов и анионов. При физиологи-
ческих исследованиях важно сохранять исходное зна-
чение pH среды, используя мел, щелочи или фосфат-
ный буфер.
Оптимальное значение pH для большинства гри-
бов ниже 7 (в пределах 5,0—6,0), что соответствует
слабокислой реакции среды. Вместе с тем есть грибы,
приспосабливающиеся к субстрату с более кислой ре-
акцией. К ним относятся дереворазрушающие, подсти-
лочные и микоризные грибы, образующие органичес-
кие кислоты. М. И. Бойко, определивший рост Hetero-
basidion annosum у 9 штаммов гриба, показал, что их
рост может осуществляться в диапазоне pH от 2,5 до
9,5, причем накопление биомассы при pH от 5,5 до 9,5
уменьшается. У некоторых представителей микоризных
грибов рода Boletus оптимум pH находится в преде-
лах 3.
Показано, что pH среды оказывает влияние на ак-
тивность протеаз. Так, у гриба Emericellopsis glabra
при изменении значения pH реакционной смеси от 6,0
до 12 активность протеаз увеличивается в 5,6 раза.
Рост грибов на питательных срезах в большинстве
случаев сопровождается изменением pH в сторону под-
кисления. Оригинальные опыты были проведены
И. Г. Коневской по опредлению изменения pH среды,
в качестве которой была взята бумага (сульфатная,
льняная, сульфитная, хлопковая и газетная), иноку-
лированная целлюлозоразрушающим грибом Chaeto-
mium globosum. После 60 суток опыта pH сульфатной,
хлопковой, льняной и сульфитной бумаги изменилась
в сторону подкисления, а газетной — в сторону под-
щелачивания.
Световые факторы и излучение. Солнечная ра-
диация оказывает существенное воздействие на про-
цессы жизнедеятельности грибов, хотя действие разных
участков спектра солнечного излучения неодинако-
во. Так, длинноволновое излучение вызывает актива-
цию тепловых рецепторов, мутагенный эффект ока-
зывают ультрафиолетовые лучи, а видимый свет влия-
ет на фотозащитные и фотохимические процессы.
Длины волн, соответствующие различным областям
спектра излучения, приведены на рис. 21.
Большинство грибов растет с примерно одинако-
вой интенсивностью на свету и в темноте. Однако под
59
Длина волны, мкм
10~5 1 ip'3 10 1 ° ip3 ip5 г 10! 1
Косми- ческое излу- чение Рентгеновское излучение Ультра- фиолето- вое излу- чение Вид! св Инфра- красное излучение 1МЫЙ ет Волны Герца
Рис. 21. Спектр электромагнитного излучения
влиянием яркого света наблюдается угнетение роста
мицелия и прорастания спор у представителей Tricho-
derma, Penicillum и других грибов, особенно с
бесцветными оболочками. Весьма значительно свет дей-
ствует на формирование органов плодоношения. Пло-
довые тела Heterobasidion annosum, Polystictus abie-
tinus, Armillariella mellea и многих других высших гри-
бов при выращивании на искусственных питательных
средах образуются только в условиях рассеянного ос-
вещения. Показательно, что различное действие света
на спорообразование можно обнаружить даже внутри
одного рода. Если Botrytis cinerea спороносит на све-
ту и в темноте, то В. gladiolorum — только на свету.
При одностороннем освещении наблюдается фототро-
пическая реакция спороносных органов в сторону ис-
точника света (рис. 22). Хорошо заметные положи-
тельные фототропические изгибы дают представители
Mucorales, в частности спорангиеносцы Pilobolus сгу-
stallinus, виды родов Phycomyces, Spinellus, Hirschio-
porus и др. Для некоторых пиреномицетов характерен
изгиб хоботка перитеция, у сумчатых аналогичным об-
разом изгибаются сумки, а у шляпочных базидиоми-
цетов — ножки.
Полное отсутствие света у одних грибов (Pilobo-
lus, Lentinus, Coprinus и др.) вызывает стерильность
грибницы, в то время как у других (Aspergillus, Ме-
rulius, Schizophyllum и др.) спороносные органы мо-
гут развиваться и в темноте. Нормальное развитие
плодовых тел у Lentinus edodes наблюдается при ин-
тенсивности освещенности от 5 лк и выше. При отсут-
ствии света образуются светлоокрашенные гипертро-
фированные плодовые тела. Под действием света в
60
Сбет
Рис. 22. Фототропизм спорангиеносца Pilobolus. Фотографирова-
ние через 5 мин
мицелии и спорах некоторых грибов образуются пиг-
менты.
Слово «пигмент» происходит от латинского pig-
mentum — краска. Благодаря «цветности» пигментов
они способны поглощать определенные лучи спектра.
Пигментация оболочек спор значительно повышает их
устойчивость к действию прямых солнечных лучей при
перемещении воздушными течениями. Пигменты гри-
бов подразделяются на несколько групп. 1. Пигменты,
образующиеся через шикимат в результате превра-
щения орилпирувата (терфенилхиноны и их произ-
водные — атроментин, полипровал, телефоровая, пуль-
виновая, вариегатовая кислоты и др.). 2. Пигменты,
происходящие по ацетатно-мевалонатному пути (ску-
тигерал, траметин, дермоцибин, дерморубин, дермо-
лютеин, эмодин и др.). 3. Пигменты, образующиеся по
мевалонатному пути (лактаровиолин, лактарофульвин,
различные каротиноиды, в первую очередь р-каротин,
а также лакопин, кантаксантин и др.). 4. Азотсодержа-
щие пигменты (циннабарин, трамесангвин), а также
ряд пигментов различной структуры и происхождения
(азахионы, индиго и др.).
61
Следует подчеркнуть, что свет не является необ-
ходимым условием для синтеза у грибов всех пигмен-
тов. Так, биосинтез синего пигмента индиго у гриба
Schizophylium находится в зависимости от образова-
ния яблочной кислоты, накапливаемой в мицелии по
мере его развития. Этот пигмент образуется лишь в
культуре, утратившей способность к синтезу яблочной
кислоты. В то же время при добавлении к среде ио-
нов меди содержание яблочной кислоты снижается и
увеличивается количество индиго.
Для некоторых дрожжей, в частности Candida pul-
cherria, характерен ярко-красный пигмент пульхер-
римин.
Многочисленную и широко распространенную у
низших грибов (Mucoraceae, Choanephoraceae, Мог-
tierellaceae и др.) группу пигментов составляют ка-
ротиноиды. Интенсивным синтезом каротина облада-
ют Blakesiea trispora и Choanephora cucurditarum,
которые могут быть использованы для получения
p-каротина. В опытах Е. П. Феофиловой, показано,
что на синтез каротиноидов сильное влияние оказыва-
ет дифениламин. У гриба Blakesiea trispora мицелий,
отмытый от дифениламина, синтезирует p-каротин зна-
чительно быстрее, чем в контрольной культуре, что
связывают с накоплением бесцветного предшествен-
ника, который далее используется на синтез р-каро-
тина. Если же мицелий не отмыт от дифениламина,
то в нем не происходит образования жировых вклю-
чений, накопленных оранжевыми гранулами кароти-
на (рис. 23). Наряду с этим изменяется и морфология
клеток мицелия. У других грибов дифениламин вызы-
вает накопление фитоина и фитофлуина, т. е. прояв-
ляется специфическое воздействие указанного соеди-
нения на биосинтез пигментов.
Каротиноиды — производные изопрена, представ-
ляющие собой ненасыщенные соединения терпенового
ряда, принадлежат к нерастворимым в жирах пигмен-
там. Найдены эти вещества у грибов всех системати-
ческих групп, хотя у многих они содержатся в неболь-
шом количестве. Например, у базидиомицета Clito-
cybe venutissima р- и у-каротины составляют 0,17 %
сухой массы плодовых тел. Повышенное содержание
каротина характерно для аскомицетов (порядки Taph-
rinales, Protomycetales и др.) и базидиомицетов, осо-
62
Рис. 23. Мицелий Blakeslea trispora, выросший на контрольной
среде (а) и на среде с дифениламином (б) (по Е. П. Феофиловой)
бенно ржавчинных грибов, имеющих желтую и оран-
жевую окраску. Каротиноидные пигменты найдены у
многих несовершенных грибов как темноокрашенных
(Cladosporium, Curvularia и др ), так и светлоокра-
шенных (Cephalosporium, Trichotecium и др.). Роль
их в организме грибов весьма разнообразна и прежде
всего связана с реакциями фототропизма и фототак-
сиса.
Грибы содержат много пигментов — производных
хинона (атрометин, лейкомелон, аураутиацин и др.),
антрахинона, бензохинона и нафтохинона. Большое
число разных типов хинонов содержится у несовер-
шенных грибов порядка гифомицеты (Penicillium, А1-
ternaria, Aspergillus и др.). Хиноны обладают анти-
биотическим и токсическим действием, окрашены в
фиолетовый или почти черный цвет. Пигменты грибов
имеют самую различную окраску — желтую, корич-
невую, красную, черную, зеленую, фиолетовую и др.
Они вызывают окрашивание не только мицелия и пло-
довых тел, но и питательной среды, на которой про-
израстают грибы.
Многие грибы содержат темные пигменты — мела-
нины, представляющие собой высокополимсрные сое-
динения, образующиеся при ферментативном окисле-
нии фенолов. Меланиновые ферменты придают ряду
видов грибов высокую устойчивость к экстремальным
условиям существования.
Из лучей солнечного спектра наиболее сильное, вли-
яние оказывают ультрафиолетовые, которые могут
63
Таблица 3 Влияние освещенности на рост мицелия Hirschio-
porus abietinus, образование плодовых тел и споруляцию (по
Л. П. Фильчакову)
Светофильтр Освещен- ность. лк Линейный прирост иииапип оо R путч* а я Масса плодовых тел в расчете на 1 про- бирку, мг Интенсивность спо- руляции, (Иср 10“ 7> Площадь гименофо- ра в расчете на 1 пробирку, мм < < < 4 с вых тел, шт. J
Белый 1600—1700 42,0 61,9 3,88 212,4 63
Сине-фиоле- 1000—1200 43,2 58,8 2,63 193,0 49
товый 460—490 42,4 54,7 6,30 186.2 39
300—350 22,3 52,5 3,69 162,2 34
1160—180 41,7 48,7 4,87 160,4 32
Темновой Контроль 0 44,7 — — — —
Примечание. Звездочкой обозначено число базидиоспор,
продуцируемых 1 см2 гимениального слоя за 1 сут.
вызывать мутации, а при высоких дозах облучения —
полностью подавлять жизнедеятельность грибов.
Имеются сведения о большой интенсивности дей-
ствия на некоторые грибы сине-фиолетовых лучей
(табл. 3).
У Aspergillus clavatis при воздействии синими лу-
чами формируются удлиненные конидиеносцы, под
действием же красных лучей размер конидиеносцев
резко уменьшается. Степень освещенности сильно вли-
яет и на скорость освобождения спор из плодовых тел.
У некоторых аскомицетов (Podospora curvula, Nectria
cinnabarina) — спорообразование наступает лишь в
дневные часы, у других (Hypoxylon fuscum) — только
в ночное время. В ряде опытов показано угнетающее
воздействие инфракрасных лучей на рост домовых (Ser-
pula lacrymans, Poria vaporaria, Coniophora cerebella)
и дереворазрушающих (Heterobasidion annosum) гри-
бов.
Сильное влияние на грибы оказывает ионизирую-
щее облучение, хотя темноокрашенные грибы выделя-
ются своей резистентностью к у-облучению (рис. 24).
Получены косвенные доказательства того, что ионизи-
рующая радиация вызывает повреждение ДНК. Особой
64
200
₽ 100
I 80
60
<ъ
*
<3 20
0_____i__i______i_____i______i_____i____________i____________
0,f 0,2 0,U 0,6 0,8 1,0 1,lf rp
Рис. 24. Выживание грибов Stemphylium и Alternaria при раз-
личных дозах у-облучения (по Т. Г. Мирчинк):
1 — Stemphylium botryosuni, 2 — Alternaria tenuis, 3 — S. botryosum, 4 —-
A. tenuis
чувствительностью к радиоизлучению обладают му-
танты Aspergillus nidulans, Coprinus lagopus и др.
Дозы, оказывающие летальное действие на грибы,
главным образом плесневые, используются для защи-
ты материалов от микодеструкторов, спасения ху-
дожественных ценностей и археологических доку-
ментов.
Свет оказывает влияние на половую и бесполую
репродукцию у грибов, что можно представить сле-
дующим образом:
свет свет
Организм------------► Вещество А------► Вещество В ->
или темнота
-*• Споруляция,
где вещество А — предшественник, который может
образовываться независимо от действия света; веще-
ство В — результат фотохимического превращения ве-
щества А и фоторецептора. Одним из соединений, ин-
дуцирующих репродуктивные процессы, является гор-
моноподобное вещество, получившее название Р310,
выделенное из мицелия Ascochyta pisi, подвергнутого
действию ближнего ультрафиолета и других несовер-
шенных грибов.
3 783
65
Аэрация. Среди грибов нет облигатных анаэробов.
Наиболее типичные факультативные анаэробы —
дрожжи. Потребность их в кислороде для нормаль-
ного развития далеко не одинакова, даже у грибов,
относящихся к одному и тому же роду. Так, Fusarium
oxyporus выживает в анаэробных условиях в течение
13 недель, тогда как F. eumartii погибает менее чем
через три недели.
Большой чувствительностью к недостатку кислоро-
да отличаются домовые грибы. Например, у Serpula
lacrymans и Coniophora cerebella допустимый мини-
мум прациального давления кислорода находится в
пределах 2,7 кПа (21 мм рт. ст.). Дереворазрушаю-
щие грибы — паразиты живых деревьев из родов Ste-
reum и Trametes менее чувствительны к недостатку
кислорода и нормально произрастают даже при пар-
циальном давлении 0,9—1 кПа (7—8 мм рт. ст.), а
максимальная активность дыхания у Aspergillus огу-
zae наблюдается при 13,6 кПа (105 мм рт. ст.).
Влажность среды. Большинство грибов для своего
роста нуждается в сравнительно высокой влажности.
Так, съедобные грибы обычно появляются в дождли-
вую теплую погоду. Развитие плесневых грибов также
возможно лишь на субстратах, отличающихся повы-
шенной влажностью. Дереворазрушающие грибы на-
ибольшую скорость роста имеют при абсолютной влаж-
ности древесины 30—80 %, хотя минимальная и мак-
симальная влажность, при которой они развиваются,
находится в пределах от 20 до 150 %.
Влажность древесины может служить фактором,
ограничивающим рост и разрушительную деятельность
ряда грибов. Эту особенность используют, в частно-
сти, для предохранения древесины от поражения гри-
бами, насыщая ее влагой методом дополнительного
увлажнения или дождевания. Этот прием применяют
для повышения сохранности свежесрубленной древе-
сины. Методика его подробно разработана А. Т. Ба-
киным.
Органы полового размножения обычно развивают-
ся в воздушной среде, и для них более благоприятна
несколько большая сухость по сравнению с оптиму-
мом для роста мицелия. Показательно также, что у
одних грибов, преимущественно плесневых, даже не-
большое снижение влажности воздуха задерживает
66
образование спор, в то время как у других, например
мучнисторосяных Erysiphales, число образующихся
конидий значительно увеличивается.
Споры грибов отличаются высокой устойчивостью
к неблагоприятным факторам и в условиях низкой
влажности длительно сохраняют жизнедеятельность.
Существуют грибы, преимущественно из гастеро-
мицетов, приспособившиеся к жизни в засушливых
пустынных условиях (виды родов Simblum, Podaxis
и др.). Они выносят полное обезвоживание, а в период
дождей восстанавливают свою жизнедеятельность.
Развитие грибов на растворах питательных веществ
может сдерживаться осмотическим давлением окру-
жающей среды, т. е. вода в этом случае становится
недоступной, повышение концентрации осмотически
деятельных веществ вызывает плазмолиз клеток и
полностью останавливает их рост. Вместе с тем ве-
личина переносимого клетками осмотического давле-
ния неодинакова и определяется как специфическими
особенностями грибов, так и природой находящихся
в растворе веществ. По данным В. Лилли и Г. Бар-
нет, гриб Rhizopus nigricans переносит осмотическое
давление глюкозы в 63,2-102 кПа (63,2 атм), сахаро-
зы—42,1-102 кПа (42,1 атм), KNO3 — 27,5-102 кПа
(27,5 атм). Сосущая сила клеток мицелия разных
штаммов грибов Trichoderma находится в пределах
(45—48) 102 кПа (45—48 атм). Высокой устойчивостью
к осмотическому давлению раствора отличаются фи-
топатогенные грибы, сосущая сила клеток которых
значительно выше, чем клеток растения-хозяина.
Загрязнение воздуха. Содержание в воздухе про-
мышленных отходов в повышенных концентрациях
оказывает отрицательное воздействие на ростовые про-
цессы грибов. Так, обработка сернистым газом 5-днев-
ной культуры Heterobasidion annosum в концентра-
ции 134 мг/л снижала рост мицелия в зависимости от
штамма на 75—95 %. При введении NOX в концент-
рации 66,7 мг/л в 7-дневную культуру рост мицелия
замедлялся на 45 %, а у некоторых штаммов вообще
прекращался. Примерно аналогичная зависимость об-
наружена и в накоплении биомассы под влиянием SO2
и NOX. В опытах с воздействием тяжелых металлов
найдено, что наибольшей токсичностью к Н. annosum
обладают соли свинца и никеля, в меньшей степени —
3*
67
соли меди и марганца, а соли цинка в испытываемых
концентрациях рост корневой губки не ингибировали.
Определение содержания фтора в плодовых телах
съедобных грибов порядка Agaricales показали, что
содержание фтора зависит от вида гриба, места и года
сбора и может достигать 1 мг на 100 г сухого вещест-
ва, т. е. свидетельствует о влиянии окружающей среды
на содержание фтора в плодовых телах. Как правило,
концентрация минеральных элементов в шляпках вы-
ше, чем в ножках.
Доказано, что плодовые тела съедобных грибов
способны аккумулировать кадмий и ртуть, меченные
радиоактивными изотопами. Так, у Pleurotus flabella-
tus обнаружено 75 % внесенного в субстрат кадмия
и 38,5 % ртути, в то время как у Agaricus bisporus
соответственно 1,27 % и 8,42 %. Таким образом, пере-
нос металлов в плодовые тела у различных видов про-
исходит с неодинаковой интенсивностью.
2.6. ХИМИЧЕСКИЙ СОСТАВ ГРИБОВ
Образующиеся в процессе обмена веществ белки,
углеводы, жиры, полифосфаты, биологически активные
соединения, разнообразные вторичные метаболиты, а
также поглощаемые грибами зольные элементы тесно
взаимосвязаны с процессами ассимиляции и диссими-
ляции, направленными на самообновление и самосо-
хранение организма. Отсюда важность познания хи-
мического состава грибов и определения количествен-
ного содержания продуктов обмена в их организме.
В плодовых телах съедобных базидиальных грибов
доминируют трегалоза, глюкоза, маннит, арабит. В су-
хих плодовых телах содержится до 20 % растворимых
сахаров, придающих им соответствующий вкус.
Характерная особенность грибов — содержание в
их теле большого количества воды. В плодовых те-
лах трутовых грибов оно достигает 50—80, а у шля-
почных— 79—80 %. Исключение составляют склеро-
ции, которые в связи с этим легко переносят неблаго-
приятные условия.
2.6.1. Зольные элементы. Мицелий грибов имеет
примерно следующий элементарный состав, %: кисло-
рода — 40, углерода — 40, азота — 7, водорода — 3 и
около 10 приходится на долю зольных элементов.
68
В золе грибов содержатся: фосфор, сера, калий, же-
лезо, кальций, магний, медь, цинк, марганец и другие,
в общей сложности свыше 50 элементов. Безусловно,
не все они необходимы для жизнедеятельности грибов.
Основная масса золы у грибов приходится на ка-
лий и фосфор. В среднем оксид калия занимает 50 %
массы всей золы, оксид фосфора — около 25 %, осталь-
ные элементы — примерно 25 %. Несколько процентов
приходится на долю кальция, магния, серы. Минераль-
ные элементы играют важную роль в обменных и рос-
товых процессах, а также в ферментативной активнос-
ти. Только в естественных условиях грибы полностью
обеспечивают свою потребность в зольных элементах.
При искусственном же их культивировании в питатель-
ные среды (субстраты) следует вносить требуемые ми-
неральные элементы.
Активным стимулирующим действием на рост и спо-
руляцию грибов обладает сера, особенно находящаяся
в коллоидном состоянии. Хорошее влияние оказывает
(NH4)2SO4, тогда как MgSO4, FeSO4 ингибируют раз-
витие большинства видов, кроме Botrytis cinerea и
Septoria cucurbitacea. Стимулирующим воздействием
обладают также органические соединения серы — ме-
тионин и глутатион. Цистин и цистеин в некоторых слу-
чаях стимулируют рост и развитие, но все же на боль-
шинство грибов оказывают ингибирующее влияние.
В грибах, произрастающих вблизи промышленных
предприятий, вследствие выбросов в атмосферу свинца,
меди, кадмия, ртути и других тяжелых металлов проис-
ходит поглощение и накапливание их в плодовых телах.
Вследствие этого следует воздерживаться от сбора и
употребления в пищу съедобных грибов, произрастаю-
щих вблизи промышленных предприятий и вдоль круп-
ных автострад.
2.6.2. Белки и азотсодержащие органические ве-
щества. Содержание белков. Большинство белков, со-
держащихся в грибах, относят к группе фосфорсодер-
жащих глюкопротеидов. У одних видов количество
белковых фракций одинаково в разных частях плодо-
вого тела, а у других существенно различается.
Высокое содержание белков характерно для плодо-
вых тел агариковых грибов (от 6,5 до 47,4 %). Отме-
тим, что количественное содержание белков в опреде-
ленной степени зависит от вида растения-хозяина, на
69
Таблица 4. Динамика образования белка в культуре труто-
вых грибов в зависимости от возраста мицелия (% на сухую
массу)
Внд гриба Возраст куль- туры, сут Содержание белка. %
Phlebiella tidiosa 6 28,1
7 31,9
8 31,9
Hyduellum aurantiacum 2 24.0
3 20,2
4 16,0
Heterobasidion annosum 2 44,7
3 38,8
4 18,1
Osmoporus odoratus 2 3 41,1 39,9
4 34,5
котором развивается данный гриб. Так, Climacodon
septentrionales, растущий на березе, содержит в пло-
довом теле 5,93 % белка, а растущий на клене —
10,90 %. У агариковых грибов в шляпках плодовых тел
белка содержится больше, чем в ножке, например у
белого гриба (Boletus edulis)—примерно на 10 %.
Количество белка у плодовых тел агариковых грибов
зависит от их возраста: на стадии закрытой шляпки
оно всегда выше, чем на более поздних фазах. В мице-
лии белки содержатся в большем количестве, чем в
плодовых телах. Образование белка в мицелии зависит
от возраста культуры (табл. 4). Как видим, у более
молодых культур содержание белка, как правило, яв-
ляется более высоким.
Содержание аминокислот. В организме грибов
аминокислоты, являющиеся структурными элементами
белка и входящие в состав активных групп ряда фер-
ментов и других соединений, весьма значительно отли-
чаются по количественному и качественному составу.
Даже в пределах одного вида различные штаммы гри-
ба могут содержать неодинаковое количество амино-
кислот. У всех грибов, как правило, с третьего на чет-
вертый день роста мицелия содержание аминокислот
начинает снижаться. Заметно разное содержание ос-
новных аминокислот в плодовом теле и в мицелии од-
ного и того же гриба. Так, плодовые тела Serpula 1ас-
rymans имеют в 5 раз больше глутаминовой кислоты, в
70
20 раз больше треонина и валина и в 2 раза больше
метионина, чем воздушный мицелий. У шампиньона
Agaricus campestris количество незаменимых аминокис-
лот в среднем не меньше, чем в мясе и молоке (% на
воздушно-сухую массу):
Триптофан — 2,9 Глнкокол — 1,0
Глутаминовая — 2,6 Пролин — 0,9
Аргинин — 2,2 Серин — 0,8
Лизин — 2,1 Валин — 0,7
Аланин — 2,0 Тирозин — 0,7
Аспарагиновая — 2,0 Гистидин — 0,7
Цистин — 1,9 Треонин — 0,6
Лейцин — 1,4 Изолейцин — 0,3
Фенилаланин — 1.1 Метионин — 0,1
В последние годы у грибов обнаружен ряд новых
аминокислот, в том числе j-аминомасляная кислота,
цитруллин, n-оксианилид, агаритин, g-оксилейцин.
Содержание нуклеиновых кислот. Нуклеиновые ки-
слоты — важнейшие биополимеры, входящие наряду с
белками в состав цитоплазмы живой клетки. Благодаря
им осуществляется синтез белка со строго заданной
последовательностью аминокислот, становится возмож-
ной передача наследственных свойств. При гидролизе
нуклеиновых кислот образуются пуриновые и пирими-
диновые основания, а также сахар (рибоза и дезокси-
рибоза) и фосфорная кислота. Э. Чергафф и Д. Дэвид-
сон доказали, что соотношение пуриновых и пиримиди-
А4-Т
новых оснований г ц- в дезоксирибонуклеиновой
кислоте — показатель ее видовой специфичности. Содер-
жание ДНК в любой клетке или организме строго по-
стоянно и не зависит от условий внешней среды, пита-
ния или воздействия внешних факторов, влияющих на
метаболизм клетки. В клетке грибов оно составляет
0,2—0,17 пг (1 пикограмм=10~12 г), а число нуклео-
тидных пар равно 20 млн.
Сведения о нуклеотидном составе ДНК некоторых
грибов приведены в табл. 5.
Исследования Л. М. Галимовой, А. С. Антонова и
других показали возможность использования данных о
первичной структуре ДНК как объективного критерия
различных таксономических групп.
Содержание мочевины. В грибах мочевина накап-
ливается при избытке азота или при недостатке угле-
71
Таблица 5. Нуклеотидный состав ДНК у некоторых грибов
(по А. Н. Шивриной)
Вид гриба Содержание оснований, моль % г+ц А+Т Пур Пир
гуа- нин аде- нин цито- зин тимин
Класс Zygomycetes
Phycomyces blakeslea- nus (—) 19,2 Ph. blakesleanus (+) 19,3 30,4 30,4 19,4 19,5 31,0 30,8 00,63 0,63 0,99 0,99
Класс Ascomycetes
Aspergillus niger Claviceps purpurea Gyromitra esculenta Sclerotinia libertiana 25,1 26,3 24,9 22,6 25,0 23,4 25,0 27,2 25,0 26,3 25,1 22,9 24,9 24,0 25,0 27,3 1,00 1.11 1,00 0,83 1,00 0,99 1,00 1,99
Класс Basidiomycetes Порядок Aphyllophorales
Romario flava Coriolus versicolor 25,38 28,0 25,51 22,3 24,02 28,4 25,09 21,3 0.97 1,20 1,02 1,02
Порядок Agaricales
Agaricus bisporus Amanita muscaria A. strobiliformis Boletus edulis B. scaber 22,6 23.52 29,6 25,9 25,04 28.2 29.27 22,4 2',3 25,28 21,8 23,0 18,6 21,9 24,37 27,4 31,9 19,4 26,0 25,30 0,80 0,71 1,39 0,97 0,97 1.03 0,97 1,08 1,03 1,02
родного питания, обезвреживая образующийся аммиак.
С помощью фермента уреазы происходит разложение
мочевины с образованием аммиака и углекислого газа.
Не все грибы способны к накапливанию мочевины. По-
этому некоторые микологи считают способность к об-
разованию мочевины таксономическим признаком. Ко-
личество мочевины в плодовых телах у представителей
различных родов неодинаково. Например, у Amanita
оно составляет 0,43—1,50 %, у Lepiota — 2,24—2,90, у
Tricholoma — 2,13—5,17%. Оно также зависит и от
возраста плодовых тел: у молодых Agaricus campestris
оно составляет 2,5, а у зрелых — 12,3 % на сухую массу.
2.6.3. Углеводы. В плодовом теле и мицелии грибов
содержится большое количество моно-, олиго и поли-
сахаридов.
72
Моносахариды представлены глюкозой, фруктозой,
седогептулозой, ксилозой, мальтозой, галактозой, рам-
нозой и др. Самый распространенный из них — глюкоза,
содержание которой в грибах колеблется от 0,04 до
2,16 % на сухую массу. В грибах достаточно много-
атомного спирта маннита (от 5,0 до 8,5 %), выполняю-
щего функции запасного питательного вещества. У рода
Lactatius он составляет 14,8—18,5 %, у рода Russula
от 15 до 23,2 %.
Олигосахариды у грибов представлены главным об-
разом дисахаридом трегалозой, называемым еще гриб-
ным сахаром, или микозой. Содержание трегалозы у
отдельных грибов довольно высокое, у Sparassis crispa,
например, превышает 11 %. Определение трегалозы на
разных стадиях развития плодового тела у Agaricus
bisporus показали, что количество ее остается практи-
чески неизменным. Наибольшее количество трегалозы
содержат споры этого гриба. Поэтому не исключено,
что этот олигосахарид может выполнять роль резервно-
го углевода на самых ранних этапах метаболизма.
Другие дисахариды, а также три- и тетрасахариды в
грибах практически отсутствуют.
Главным полисахаридом грибов является гликоген,
близкий по своим свойствам к крахмалу и выполняю-
щий функции основного резервного вещества. О хими-
ческом составе полисахаридов можно судить по угле-
водам, образующимся при кислотном гидролизе поли-
сахарида (табл. 6).
В составе плодовых тел и мицелия содержатся глю-
каны и целлюлоза, дающие при гидролизе 80 %-й сер-
ной кислотой глюкозу. Особенно велико их содержание
в плодовых телах дереворазрушающих грибов. Напри-
мер, у Fomes fomentarius оно составляет 25 %, а у
Piptoporus betulinus — 33,8 %-
2.6.4. Липиды. Вещества, экстрагируемые серным и
гидролизным эфиром, носят название «сырого жира».
К ним относятся жиры, жирные кислоты, пигменты,
воска и некоторые другие соединения.
Содержание жиров у большинства грибов составля-
ет 1—2 %, хотя у отдельных представителей оно выше
(в рожках спорыньи достигает 35, а у некоторых видов
дрожжей — 30 %). В составе трубчатых съедобных
грибов содержится 15—21 % липидов (от абсолютно
сухого вещества), пластинчатых—11—13 %. Группо-
73
Таблица 6. Химический состав полисахаридов, выделенных иЗ
искусственных культур некоторых грибов
Вид гриба % к массе полисахарида Углеводы, образующиеся при кислотном гидролизе полисахарида
Азот Фос- фор
Lenzites betulina 0,43 1,50 Галактоза, глюкоза, манноза, ксилоза, фрук- тоза, глюкуроновая ки- слота
Coriolus versicolor 0,32 3,03 Галактоза, глюкоза манноза, ксилоза, рам- ноза, глюкуроновая кис- лота
Amanita strobiliformes 0,34 0,10 Галактоза, манноза, кси- лоза, фруктоза Галактоза, глюкоза, манноза, ксилоза, рам- ноза, глюкуроновая кис- лота
Collybia dryophila
вой состав свободных и связанных липидов видоспеци-
фичен, общим является высокое содержание фосфо-
липидов, стеролов и восков.
Самое высокое содержание жира — в спорах (в ви-
де крупных капель). В ооспорах Achlya americana на
долю липидов приходится 37 % сухой массы. Из обще-
го количества липидов триацилглицерины составляют
88,7 %, а жирные кислоты — 9,7%; остальное — сте-
рины, эфиры стеринов, фосфолипиды, моно- и диацил-
глицерины. Стериновая фракция в спорах этого гриба
представлена фукостерином (72 %), холестерином
(22 %), метиленхолестерином (6 %).
В грибах содержится большое количество свобод-
ных насыщенных и ненасыщенных жирных кислот с
длинной цепью — от 12 до 28 углеродных атомов. По
мере старения культуры содержание жирных кислот
снижается. Например, в мицелии Polyporus rugulosus
в начале роста их содержится до 70, а с увеличением
роста снижается примерно в два раза.
В плодовом теле многих агариковых грибов (Ama-
nita muscaria и др.) содержатся в основном ненасы-
щенные жирные кислоты: теристиновая, пентадекано-
вая, пальмитиновая, стеариновая, олеиновая, линоле-
вая. В плодовых телах вешенки обыкновенной содер-
74
жится до 56 % олеиновой кислоты, т. е. более полови-
ны количества всех остальных ненасыщенных жирных
кислот.
2.6.5. Вторичные метоболиты. В грибах много сое-
динений, выполняющих важную роль в обменных про-
цессах, обычно именуемых веществами вторичного про-
исхождения. Среди них наиболее важны органические
кислоты, ароматические соединения, антибиотики, по-
лиацетилены и другие.
Органические кислоты. В грибах содержатся все
ди- и трикарбоновые кислоты, входящие в цикл Креб-
са, а также одноосновные карбоновые или летучие кис-
лоты. Так, в стерильных наростах Inonotus obliguus
содержание муравьиной кислоты составляет 0,078 %,
уксусной — 0,108 и масляной 0,076 % на сухую массу
гриба. В плодовых телах дереворазрушающих грибов
много щавелевой кислоты (от 0,25 до 2,78 % на сухую
массу).
Способность грибов к синтезу органических кислот
используют в практических целях. Так, фумаровую
кислоту получают путем выращивания Rhizopus nigri-
cans на среде, содержащей 5—15 % углеводов. При
этом выход кислоты составляет до 50 % внесенного
сахара. Глюконовую кислоту выделяют из штамма
Aspergillus niger, молочную из Rhizopus nigricans, для
получения итаковой кислоты используют штамм Asper-
gillus terreus, лимонной — Penicillium citricum.
Ароматические соединения. В плодовых телах и
продуктах метаболизма многих грибов содержатся
ароматические кислоты — бензойная и ее производные:
ванилиновая, сиреневая, а-оксибензойная. Повышенное
их количество в Fomes fomentarius, Heterobasidion an-
nosum, Phellinus igniarius и многих других грибах яв-
ляется следствием ферментативного разрушения лиг-
нина до составляющих его мономеров.
Запах плодовых тел обусловливает определенные
летучие вещества из группы алифатических альдегидов,
кетонов, спиртов, ароматических соединений (метил-
бензоат, этилбензоат, метилсалицилат, фенилэтиловый
спирт), изопреновых соединений, секвитерпенов и др.
Так, у кольцевика запах редиса обусловлен присутст-
вием в составе летучих веществ горчичных масел.
Биологически активные вещества. В грибах содер-
жатся многочисленные органические соединения, отли-
75
'Вариабельная группа
С=О
I Тиазолидиновое
H-N н s' кольцо
'х-Ч^СНз
Реакционноспособная пептидная связь
^-лактамного кольца
Рис. 25. Формула пенициллина
чающиеся высокой биологической активностью. Среди
них важнейшие — антибиотики и токсины. К настоя-
щему времени из грибов выделено свыше 150 антибио-
тиков. Однако в медицине и ветеринарии в качестве
лечебных используются сравнительно немногие из них,
так как наряду с чувствительностью микроорганизма’
к антибиотику учитывается безвредность его для че-
ловека и животных. Первым из таких веществ А. Фле-
мингом в 1928 г. был открыт пенициллин (рис. 25).
Гибель растущих бактерий пенициллин вызывает, ин-
гибируя синтез клеточных стенок, путем блокирования
реакции транспептидирования, сшивающей цепи про-
теогликана (рис. 26). Изучение и практическое приме-
нение пенициллина послужило мощным стимулом для
поисков и испытаний других антибиотиков.
Вырабатываемые патогенными грибами токсины,
выделенные с помощью хроматографического метода,
могут вызвать у растений такие же симптомы заболе-
вания, как и при заражении самим грибом. Так, аль-
терсоланол, выделенный из гриба Alternaria solani в
концентрации 100 мг/л и выше, вызывал четко выра-
Ингибирование
пенициллином
/?-Gly-NH2 + /?'—D—Ala —D—Ala —С—| |-/?-D-Ala-Gly-fl +
О
+ D-Аланин
Рис, 26. Ингибирование пенициллином, реакции транспептидиро-
вания
76
он
I
н3с сн-сн2он
Рис. 27. а-Аманитин (ингибитор РНК-полимеразы)
женный некроз тканей и увядание томатов и гороха, а
растения картофеля погибали при концентрации
1100 мг/л. Фомонозин и фомотоксин, выделенные из
культуральных фильтратов Heterobasidion annosum,
вызывали некротические повреждения корней, стеблей
и хвои сосны. В свою очередь, культуральные фильт-
раты грибов-антагонистов Н. annosum — Peniophora
gigantea и Hirschioporus abietinus, вызывают сильное
ингибирование роста мицелия этого гриба. Прораста-
ние спор Endocronartium harknesii активно подавляют
метаболиты Scytalidium uredinicola.
Токсины грибов нередко служат причиной заболе-
вания людей и животных. Токсины склероциев Clavi-
ceps purpurea, образуемые на злаковых культурах, ис-
пользуются в фармакологических целях (эрготоксин,
эргозин и др.). В последнее время выделены новые ток-
сины — радиагтин, дезоксирадицинол и радиантин из
культуральной жидкости Alternaria heliathi. Токсин
бледной поганки Amanita phalloides а-аманитин (рис.
27), являющийся ингибитором РНК-полимеразы, очень
ядовит и вызывает смертельный исход при отравле-
ниях.
Гиббереллины, или гиббереллиновые кислоты,—
специфические стимуляторы роста, продукты жизне-
деятельности Gibberella fujikuroi (половая стадия Fusa-
rium moniliforme) и других грибов. Используются для
обработки растений с целью повышения их урожайное-
77
ти (виноград, томаты
и др.) путем опрыски-
СН2 вания цветочных кис-
тей 0,01 %-м раствором.
Вызывают стимуляцию
цветения длинноднев-
ных растений. Нанесе-
ние гиббереллина на
Рнс. 28. Структурная формула некоторые генетические
гибберелловой кислоты (ГКз) (по карлики дает высоко-
Д. Галстону) рослые формы. Могут
индуцировать образова-
ние партенокарпических плодов. К настоящему време-
ни выделено свыше 50 различных гиббереллинов, раз-
личающихся главным образом по числу и местополо-
жению дополнительных групп (например — ОН), хотя
все они обладают основным тетрациклическим гиббере-
ллиновым скелетом (рис. 28). Доказано, что карлико-
вость растений обусловлена наличием гиббереллинов,
менее активных в стимуляции роста.
К вторичным метаболитам грибов относится и аб-
сцизовая кислота, являющаяся ингибитором (ретар-
дантом) роста растений. Образуется она по тому же
биосинтетическому пути (изопреноидный путь), что и
гиббереллины.
Чистые культуры фитопатогенных грибов (Botrytis
cinerea, Rhizoctonia solani, Ceratocystis coeruleum, Fu-
sarium oxysporum и др.) содержат абсцизовую кислоту
от 15,9 до 31,9 нг/г сырой массы, причем находится она
и в культуральных фильтратах (1,3—4,6 нг/мл).
Ряд грибов (Fusarium, Penicillium, Verticillium и
др.) способны продуцировать этилен — естественный
регулятор роста растений при культивировании в сте-
рилизованной почве с глюкозой и метионином. Наибо-
лее эффективными субстратами для образования эти-
лена являются метионин и этионин, но для максималь-
ного синтеза этилена необходима также глюкоза.
Стимуляторы роста высших растений — гетероаук-
син и индолилуксусная кислота — не вызывают уско-
рения роста грибов. Повышенные концентрации росто-
вых веществ значительно угнетают ростовые процессы
грибов.
В плодовых телах и мицелии содержится один из
характерных представителей группы высокомолеку»
78
лярных спиртов стеролов — эргостерол (С28Н43О4) и
его производные. В наибольшем количестве (до 2 %
на сухую массу) это вещество находится в дрожжах,
рожках спорыньи, в плесневых грибах, которые и ис-
пользуются для его промышленного производства и
последующего получения из него витаминов группы D
(при облучении ультрафиолетовыми лучами). Произ-
водные эргостерола, в частности фунгистерол —
С28Н48О, обнаружены в плодовых телах Fomitopsis pi-
nicola, Fomes fomentarius и др., анастерол — в Fomes
fomentarius, кетостерол — в Coriolus sanguinesus. За-
метим, что в бактериях стеролы не содержатся, а в
листьях высших растений находятся в очень неболь-
шом количестве.
Контрольные вопросы и задания. 1. Назовите основания, по-
зволившие выделить грибы в самостоятельное царство. 2. Пере-
числите вещества, являющиеся субстратами для питания грибов.
В чем проявляется специфичность в их питании? 3. Способны ли
грибы синтезировать витамины? В чем состоит абсолютная и от-
носительная потребность грибов в витаминах? 4. Охарактеризуйте
особенности симбиоза грибов с представителями других царств
живой природы. 5. Каким путем грибы получают необходимую
для жизни энергию? В чем особенности гликолиза, цикла трикар-
боновых кислот и пеитозофосфатного цикла? 6. Чем отличаются
механизмы биосинтеза лизина у грибов и высших растений? Есть
ли различия в биосинтезе лизина у грибов разных классов и в
чем они состоят?. 7. Объясните последовательность биосинтеза
белка. Где происходит этот процесс и какая энергия при этом
используется? 8. Синтез липидов начинается с реакции предшес-
твенников. Назовите их. Укажите пути образования глнцерол-3-
фосфата. 9. Грибы образуют много различных органических кис-
лот. Перечислите процессы, в ходе которых происходит их био-
синтез. 10. В чем различие синтеза фенольных соединений у гри-
бов и высших растений? Каковы особенности образования феноль-
ных веществ у дереворазрушающих грибов — возбудителей белой
гнили? 11. Большинство антибиотиков состоит из фрагментов син-
тезируемых грибами органических соединений. Назовите эти фраг-
менты. 12. Как используется способность организмов к биосинте-
зу хитина в систематике и филогении? Какую функцию выполня-
ет хитин у грибов? 13. Объясните, какие органические вещества
конденсируются в комплексе гуммиподобных соединений, в мице-
лии, известном под названием «чага». Какой гриб способен его
синтезировать и возможно ли искусственное получение этого ком-
плекса при культивировании мицелия? 14. Какие типы гнилей об-
разуются при разложении древесины и чем они характеризуются?
15. Назовите основные пути превращения азотистых веществ в
безазотистые с участием дезаминирования у грибов. 16. Какую
роль выполняет мочевина у грибов и используется ли животными?
17. Чем объяснить разную скорость роста грибов? На какие груп-
пы подразделяются грибы по скорости роста? Назовите возраст-
ные стадии грибов и их основные признаки. 18. Чем вызвана
79
Необходимость синтеза организмами более 50 различных гиббе-
реллинов? Почему карликовые формы растений реагируют на
обработку гиббереллином, а высокие нет? Вызывают ли ускоре-
ние роста грибов стимуляторы роста высших растений —
гетероауксин и индолилуксусная кислота? 19. Какие су-
ществуют группы грибов по потребности в температурных
факторах? К каким необратимым изменениям ведут слиш-
ком низкие и слишком высокие температуры? 20. Что позволяет
грибам противостоять сравнительно резким колебаниям темпера-
туры и влажности? 21. Чем объяснить, что развитие гриба возмо-
жно в пределах лишь определенных значений pH среды? В каких
границах находится оптимальное значение pH для грибов?
22. Влияет ли яркий свет на рост мицелия грибов и прорастание
спор? Чем вызвана фототропическая реакция спороносных орга-
нов в сторону источников света? Влияет ли свет на бесполую ре-
продукцию? 23. Какую роль выполняют пигменты в мицелии и спо-
рах некоторых грибов? На какие группы они подразделяются?
24. У каких грибов-сапротрофов или паразитов клетки имеют бо-
лее высокое осмотическое давление? Чем это объясняется? 25. По-
чему плодовые тела съедобных грибов, произрастающих вокруг
промышленных центров, не рекомендуется использовать в пищу?
26. Сколько минеральных элементов найдено в зольном остатке
грибов? Все ли они нужны? Как установить их необходимость в
жизнедеятельности грибов? 27. Какой полисахарид у грибов вы-
полняет роль основного резервного вещества? Назовите главный
дисахарид грибов. 28. Грибы как гетеротрофные организмы раз-
делены на ряд групп. Охарактеризуйте их. 29. Чем объяснить, что
токсины, вырабатываемые грибами для защиты от вредителей, не
влияют на протекающие обменные процессы? 30. Как понимать
термин «вторичные метаболиты»? Какую роль выполняют эти ве-
щества у грибов? 31. Назовите съедобные грибы, перспективные
для широкого культивирования. Почему они еще слабо использу-
ются как ценные продукты питания? 32. Какую роль выполняет
внеклеточная целлюлоза у грибов, произрастающих на других ор-
ганизмах? 33. Как ферменты ускоряют химические реакции? По-
чему фермент может расщеплять множество молекул субстрата,
а сам при этом не изменяется?
ГЛАВА 3.
ФИЗИОЛОГИЯ И БИОХИМИЯ ВОДОРОСЛЕЙ
Мир водорослей огромен и единого окончательного
мнения о количестве отделов еще нет. Особое место в
нем занимают синезеленые водоросли, резко отлича-
ющиеся от всех остальных. Поскольку у представителей
этого отдела отсутствует оформленное ядро, их, как и
бактерий, относят к прокариотам, а все остальные — к
эукариотам, т. е. к истинно ядерным. Одни ученые,
придавая этому признаку основное таксономическое
значение, объединяют синезеленые водоросли с миром
бактерий и называют их цианобактериями. Другие
также исключают этот отдел водорослей из числа соб-
ственно водорослей, но не присоединяют их к бактери-
ям, а выделяют в самостоятельное царство. И, наконец,
существует классификация, в которой синезеленые во-
доросли представлены отделом Cyanophyta. Причина
столь разного подхода к месту синезеленых водорослей
в системе живых организмов состоит в крайне своеоб-
разном строении их клеток, в отличительных чертах
их биологи, в большом филогенетическом возрасте, до-
стигающем 3 млрд лет.
Синезеленые водоросли — старейшая группа не
только среди автотрофных организмов, но и среди ор-
ганизмов вообще (рис. 29). В силу этих факторов, а
также учитывая, что синезеленые водоросли занимают
основное положение в лабиринтах биологической эво-
люционной схемы, они являются вершиной биохими-
ческой эволюции автотрофных прокариотов.
Синезеленые водоросли представляют самостоятель-
ную тупиковую ветвь растительной эволюции, о чем
свидетельствует примитивное строение их клетки, от-
сутствие полового размножения и жгутиковых стадий.
Древность происхождения этих водорослей отрицатель-
но не сказалась на их приспособленности к жизни в
современных условиях. Более того, нет, пожалуй, ни
81
Наземные растений
Каровые водоросли
Зеленые водоросли
ВцрМ ИоЗороии
Желтозеленые
водоросли
Эогленовые
водоросли
Золотистые
водоросли
Диатомовые
водоросли
Фотосинтезирующие жгутиковые эукариоты
▲ Синезеленые водоросли
Фотосинтезирующие дезжгутиковы^^^^^Т"^^^^^^
f Эукариоты п
и
Пинофитовые
Кристофито-
вые
Хлорононадофи-
тоВые
Прокариоты, имеющие морофил^ифот^нгоезирующие с выделением Ь2
Прокариоты, фотосинтезирующие дез выделения Ог
Рис. 29. Схема происхождения и эволюционного развития водо-
рослей (по Ю. Е. Петрову)
одного организма, который с такой скоростью мог бы
заселять места после ядерных взрывов, извержения
вулканов, а также произрастать в пустынях и пещерах,
в Арктике и Антарктике, в горячих и серных источни-
ках. С деятельности синезеленых водорослей началось
образование почвенного слоя. Они, в отличие от боль-
шинства водорослей, способны усваивать свободный
азот. Синезеленые водоросли вызывают «цветение» во-
ды, что ведет к снижению ее качества.
Синезеленые водоросли являются фотоавтотрофами,
т. е. могут использовать СО2 в качестве единственного
источника углерода. Вместе с тем для них характерна
способность усваивать углерод, содержащийся в других
органических соединениях. В силу этих особенностей
М. В. Гусев синезеленые водоросли подразделяет на
три группы.
1. Организмы, для которых источником углерода
является СО2, хотя многие из них могут ассимилиро-
вать на свету некоторые органические соединения. Од-
нако эти вещества являются лишь дополнительными
источниками углерода и не могут полностью заменить
СО2. Эта группа наиболее многочисленна и относится
к облигатным фитотрофам.
82
2. Организмы, для которых органические вещества
могут быть основным источником углерода, а свет яв-
ляется единственным источником энергии. Эта группа
способна к фотогетеротрофному образу жизни.
3. Организмы, растущие в темноте, использующие
органические соединения, которые обеспечивают по-
строение всех клеточных компонентов и дают энергию,
необходимую для роста. Эта группа малочисленна и
принадлежит к факультативным хемоорганогетеротро-
фам.
3.1. ОСМОРЕГУЛЯЦИЯ
Процесс осморегуляции заключается в создании и
поддержании постоянного тургорного давления в клет-
ках водорослей. Кинетика этого процесса связана с
транспортом и проявляется в водорослях, растущих как
в морской, так и в пресной воде. Транспорт подразде-
ляется на пассивный (по градиенту электрохимическо-
го потенциала) за счет энергии передвигающихся час-
тиц и активный — осуществляемый против градиента
электрохимического потенциала. В этом случае при-
нимают участие высокомолекулярные транспортные
белки, способные расщеплять АТФ с освобождением
энергии, что служит «двигателем» активного транспор-
та. Таким способом через мембрану переносятся про-
тоны (протонный насос) или неорганические ионы
(ионный насос), который широко распространен в рас-
тениях и включает Na/K-насос, перекачивающий калий
в клетку, а натрий — из нее. Впервые на роль молеку-
лярного механизма фотофосфорилирования указал
П. Митчелл, создавший хемиосмотическую теорию, по-
лучившую новые доказательства в опытах с водорос-
лями.
Клетки харовой водоросли Lamprothamnium succi-
netum, обладающей способностью произрастать в прес-
ной или солоноватой воде различной степени солености,
сохраняют одну и ту же величину тургорного давления.
При снижении осмотичности наружной среды клетки
восстанавливают исходный уровень тургорного давле-
ния в течение 2 ч. Однако в гиперосмотических услови-
ях регуляция тургора занимает 1 день. При замене
солей во внешней среде на сорбит, клетки сохраняют
способность к регуляции тургора, Это означает, что
83
для данного процесса существенным фактором явля-
ется осмотичность, не соленость среды.
В экспериментах, в которых методом трансклеточ-
ного осмоса были искусственно модифицированы осмо-
тическое давление и ионные концентрации внутрикле-
точной среды, продемонстрировано, что и в этих усло-
виях тургорное давление клетки возвращается к
исходному уровню, причем процесс тургорной регуля-
ции осуществляется за счет изменения внутриклеточно-
го осмотического давления, независимо от того, культи-
вируются клетки в пресной или соленой воде. Таким
образом, изменение тургорного давления служит сиг-
налом, запускающим процесс тургорной регуляции,
который локализован, как полагают, в плазмалемме.
Исследования электрических свойств плазмалеммы,
а также вариаций в содержании ионов К+, Na+, С1~ в
цитоплазме и вакуоли клеток данной водоросли в ходе
изменения тургорного давления показали, что в осмо-
тическое давление вакуоли Lamprothamnium основной
вклад вносят концентрации этих ионов. Однако сумма
концентраций последних в цитоплазме меньше осмо-
тического давления клеток и сохраняется постоянной
при различных концентрациях среды, причем остается
также неизменным объем цитоплазмы. Эти факты ука-
зывают на присутствие в цитоплазме органических со-
единений, которые участвуют в ее осмопегуляпии. Ус-
тановлено, «то изменение конпентпапии неорганичес-
ких ионов в воле во впемя тургорной пегупяпии
полностью компенсирует сдвиги внутриклеточного ос-
мотического давления. Мембпанный потенциал тоно-
пласта остается близким к осмосу во впемя тупгопной
регуляпии, хотя не исключена возможность его времен-
ного изменения при внезапных сдвигах осмотииности
спелы.
В ohbitav г о"иночными г.пстка'»и «опекой зеленой
волопосли Valonia macrophysa няйлено. что ппи пез-
ком понижении осмотического павления спелы (на 20—
25 %) тупгорное давление клетки восстанавливается в
течение 4 ч, а при эквивалентном повышении осмоти-
ческого лавления спелы — чепез несколько суток. Вос-
становление тупгопного давления ппи гипоосмотичес-
ком шоке обусловлено снижением суммарной «онпен-
трации К+, Na+ и С1~ в вакуолярном соке на 190 мМ
в результате микроразрывов протопласта. Обратимые
84
разрывы протопласта возникают при достижении кри-
тического уровня растяжения клеточной стенки. Воз-
никновение локальных разрывов протопласта проявля-
ется по ряду показателей (скачкообразному увеличе-
нию скорости выхода в клетки “Rb, ступенчатому
снижению внутриклеточного тургорного давления, рез-
кому уменьшению разности электрических потенциалов
между вакуолью и средой). Следовательно, механизм
регуляции тургорного давления с возникновением мик-
роразрывов обеспечивает адаптацию этой водоросли к
разбавлению солености среды в мелководных водоемах
в период дождей.
Определенный интерес представляет процесс осмо-
регуляции у некоторых вольвоксовых водорослей. Оли-
гогалобные водоросли рода Chlamydomonas обладают
положительным градиентом осмотического давления и
относятся к гиперосмотическим организмам в отличие
от гипергалобных видов рода Dunaliella и Pedinomo-
nas, характеризующихся отрицательным градиентом
осмотического давления среды и относящихся к гипо-
осмотическим организмам. Процесс осморегуляции у
первых заключается в откачивании в окружающую
среду избыточной воды с помощью пульсирующих ва-
куолей, а у вторых, не имеющих таковых, он осущест-
вляется, по-видимому, откачиванием в окружающую
среду через плазмалемму некоторых находящихся в
избытке ионов. Таким образом, наличие или отсутст-
вие пульсирующих вакуолей позволяет судить о типе
осморегуляции.
Клетки зеленой водоросли Dunaliella tertiolecta при
вариациях осмотического давления среды изменяют
свой объем таким образом, что по прошествии опреде-
ленного промежутка времени он возвращается к пер-
воначальному. Осморегуляция у данных организмов
сопровождается изменением внутриклеточной концен-
трации осмотически деятельного вещества — глицери-
на. Исследования изменений в содержании ионов Na+
и К+, а также глицерина и АТФ в ходе регуляции кле-
точного объема показали, что накопление в клетках
глицерина связано с изменением внутриклеточных кон-
центраций Na+ и К+. Механизм транспорта катионов
в клетках D. maritima представлен на рис. 30. Первич-
ным процессом является работа Н+-АТФазы, которая
транспортирует Н+ против градиента его электрохи-
65
Рис. 30. Схема транспорта
ионов в клетках зеленой во-
доросли Dunaliella tertio-
lecta
мического потенциала
из цитоплазмы в среду.
Градиент электрохими-
ческого потенциала Na+
направлен из среды в
клетку, а К+ до добав-
ления к суспензии КС1
находится в состоянии, близком к электрохимическому
равновесию. Внесение К+ активирует Н+-АТФазу. Ги-
пертонический шок приводит к быстрому увеличению
входящего в клетки потока Na+ и внутриклеточного
содержания этого катиона, после чего величина этих
параметров снижается до тех пор, пока не достигается
стационарное состояние (примерно через 30 мин после
помещения клеток в гипертоническую среду). Выход
Na+ из клеток во второй, регуляторной фазе эффекта
гипертонического шока на содержание данного катио-
на зависит от наличия во внешней среде ионов К+ или
Pb+. Na+, К+-насос функционирует у морских водорос-
лей, а Н+-насос — у пресноводных.
Красная водоросль Porphyra umbilicalis устойчива
к гиперосмотическому стрессу в морской воде 6-крат-
ной концентрации в течение 14 дней. Рентгеновский
микроанализ показал, что Na+ и С1~ накапливаются в
вакуолях, К+ — в цитоплазме и вакуолях.
Смена солености воды от 26 до 16 % приводила у
красной водоросли Gracilaria tikvahiae к временному
(в течение 48 ч) снижению скорости фотосинтеза и
кратковременному (до 4 ч) увеличению темнового ды-
хания.
Показательно, что в клетках Chlorella emersonii,
выращенных в среде с высоким осмотическим давле-
нием, характер накапливаемых осмотически активных
соединений зависит от того, культивируются ли эти
организмы на свету или в темноте. В синхронной куль-
туре клеток, полученной чередованием светового и тем-
нового периодов разной продолжительности, на свету
до высоких концентраций накапливается пролин, в то
время как в темноте — в основном сахароза.
86
12. УГЛЕРОДНОЕ ПИТАНИЕ
Большинство синезеленых водорослей способно за
счет энергии света осуществлять синтез органических
веществ. В своей основе фотосинтетические процессы,
происходящие в клетках этих водорослей, близки к
процессам фотосинтеза, осуществляющимся в других
организмах. Вместе с тем синезеленые водоросли мо-
гут синтезировать органические вещества не только в
ходе фотосинтеза, но и путем фотогетеротрофии и хе-
моорганогетеротрофии. Именно благодаря способности
к смешанному питанию они могут произрастать без
условий для автотрофной жизни.
3.2.1. Пигменты. Состав пигментного аппарата си-
незеленых водорослей очень пестрый, более того —
уникальный. У них найдено около 30 различных вну-
триклеточных пигментов, относящихся к хлорофиллам,
фикобилинам, каротиноидам. Разнообразие и своеоб-
разие пигментных систем позволяет синезеленым во-
дорослям быть устойчивыми к экстремальным воздей-
ствиям и действию продолжительного затенения и ана-
эробиоза.
Из группы хлорофиллов у синезеленых водорослей
найден лишь один хлорофилл а (рис. 31). Отсутствие
хлорофилла b является еще одним свидетельством то-
го, что синезеленые водоросли являются древнейшими
по происхождению, т. е. их эволюционная ветвь пошла
по самостоятельному пути развития еще до возникно-
вения в ходе эволюции хлорофилла Ь. Не у всех, одна-
ко, водорослей содержится этот хлорофилл. Например,
у диатомовых и бурых его нет, но зато имеется два
хлорофилла с (ci и с2), а у красных — хлорофилл d.
У бурых водорослей содержание хлорофилла а пре-
восходит содержание хлорофилла с более чем в 10 раз,
в то время как соотношение хлорофиллов а/b у зеле-
ных водорослей составляет 1,0—1,2. Содержание хло-
рофилла, слабо связанного с белковым компонентом
мембраны, возрастает по мере усложнения структур-
ной организации пигментного аппарата водорослей.
На глубине 50—100 м от поверхности располагает-
ся так называемый «нижний хлорофилловый горизонт».
В этом слое воды отмечено увеличение концентрации
хлорофилла. Интенсивность света составляет на этой
глубине 1 % интенсивности света поверхности. На эту
87
глубину доходят лучи света с максимальной длиной
волны 480 нм (синяя и зеленая часть спектра). При
освещении синей частью спектра содержание хлоро-
филла у Chlorella выше, чем при красном свете и от-
мечается увеличение фотосинтетической активности
(до 500 эрг/см2/с), а при освещении красным светом
увеличения фотосинтетической активности не происхо-
дит. Процесс фотосинтеза у водорослей, заселяющих
нижний хлорофилловый горизонт, происходит при на-
личии света с короткой длиной волны и низкой интен-
сивности освещения.
В клетках синезеленых водорослей хлорофилл а
находится в виде нескольких спектральных форм с
максимумами поглощения 673, 682, 692 нм, что объяс-
няется различным состоянием его агрегации. У неко-
торых синезеленых водорослей (Synechocystis-6701,
Phormidium-7376 и др.) обнаружено 7 полос поглоще-
ния до 700 нм и 4 полосы более 700 нм.
Заметим, что нормальное выполнение хлорофиллом
своих функций связано с достаточным обеспечением
водорослей азотом. В процессе азотного голодания на
88
Рис. 32. Структурная формула фикоэритробилина
первой стадии имеет место контролируемый переход к
переживанию неблагоприятных условий. В течение пер-
вых 10 ч происходит инактивирование большей части
фотосистем I и II. На следующей стадии, через 2 сут,
разрушается хлорофилл инактивированных фотоси-
стем, а последующая стадия сопровождается уменьше-
нием выживаемости клеток.
Для всех водорослей характерно наличие несколь-
ких билихромопротеидов — водорастворимых пигмен-
тов красного или голубого цвета с высоким квантовым
выходом флуоресценции. Наиболее часто и в больших
количествах встречаются три билихромопротеида: си-
ний С — фикоцианин с максимумом поглощения при
615 нм, красный С — фикоэритрин, имеющий максимум
поглощения при 562 нм, и аллофикоцианин с максиму-
мом поглощения 650 нм. У синезеленой водоросли Os-
cillatoria redekei, выращенной на слабом свету, отме-
чается повышение содержания хлорофилла и фико-
цианина, особенно последнего. Хромофорные группы
билихромопротеидов — фикобилины состоят из четырех
пиррольных колец в виде развернутой цепи (фикоби-
лины фикоэритринов называют фикоэритробилинами
(рис. 32), а фикоцианинов — фикоцианинобилинами).
Вопрос о структуре фикобилинов и их классификации
окончательно не решен. Фикобилины, ответственные за
синтез пигментов и фотоморфологические изменения у
синезеленых водорослей, названы фитохромами. На
примере зеленой водоросли Mougeotia доказано, что
фитохром, находящийся в физиологически активной
форме, запускает ориентировочное движение хлоро-
пластов, схематическое изображение которых показа-
но на рис. 33.
В хлоропластах, между тилакоидами содержится
множество элементарных мембран, наложенных друг
89
Рис. 33. Структурное изображение хлоропласта
на друга, иногда соединенных с оболочкой хлороплас-
та. Эти особенности структуры способствуют увеличе-
нию внутренней поверхности. Мембранная система хло-
ропластов водорослей существенно отличается от тако-
вой у высших растений, у которых четко обособлены
замкнутые уплощенные локальные скопления мембран-
ных структур — тилакоиды, формирующие граны хло-
ропласта. Так, у эвглены истинные граны хлоропласта
никогда не образуются и область контакта между ти-
лакоидами более рыхло организована (рис. 34), чем
у высших растений.
Физиологически активная форма фитохрома обра-
зуется в клетках под влиянием красного света, тогда
как свет в дальней красной области спектра вызывает
обратный переход фитохрома в физиологически неак-
а р
Рил 34. Ф агме'ты мембанной системы хлороп таста эвглены,
•ка ывающие общую а_хитекту~у хлоропласта (а) и областей
контактов соседних тилакоидов (показаны стрелками) крупным
планом (б); Т — тилакоид
90
Таблица 7. Основные каротиноиды в различных отделах водо-
рослей (по В. Ф. Гавриленко и др., 1986)
а-Каротин
Р-Каротнн
Эхиненон
Лютеин
Зеаксантин
Антераксантин
Неоксантин
Фукоксантин
Диаоксантин
Диадиноксантин
Перидинин
Аллоксантин
Миксоксантофнлл
Осциллоксанто-
филл
Виолаксантин
тивную форму. У водорослей находятся фитохромы а,
Ь, с. Фитохром а имеет две формы, поглощающие свет
при 590 и 630 нм, b поглощает свет при 510—570 нм,
с — при 650 нм.
Определение интенсивности фотосинтеза у морских
водорослей, обитающих на глубине 50—100 м от по-
верхности воды, куда проникает лишь синий и зеленый
свет крайне низкой интенсивности (~1 % интенсивно-
сти света, падающего на поверхность воды), показало,
что они содержат гораздо больше светособирающих
пигментов и обладают заметно большей фотосинтети-
ческой активностью, чем растения, культивируемые на
красном свете. Установлено, что сине-зеленый свет
стимулирует образование в клетках фотосинтетических
единиц. Об этом свидетельствует равенство скорости
выделения О2 (в расчете на содержание хлорофилла)
в клетках, выращенных на сине-зеленом и красном све-
те. Таким образом, имеет место адаптация фотосинте-
тической активности к особому спектральному соста-
91
ву, основанная на оптимизации способности к образо-
ванию хлорофилла на сине-зеленом свету.
В клетках водорослей находятся и каротиноиды,
основные из которых приведены в табл. 7, а структур-
ные формулы главных пигментов синезеленых водо-
рослей приведены на рис. 35
Окраска синезеленых водорослей зависит от соста-
ва и соотношения пигментов — хлорофилла, билихром-
протеидов и каротиноидов. Так, у Hapalosiphon fonti-
nalis всегда присутствует С — фикомицин, а С — фи-
Рис. 35. Основные каротиноиды цианобактерий (по В. Ф. Гаври-
ленко, М. В. Гусеву, К. А. Никитиной)
92
коэритрин никогда не обнаруживается, у Anabaena
variabilis С — фикомицин находится всегда, а С — фи-
коэритрин обнаруживается лишь при определенных
условиях культивирования. Клетки Nodularia sp. со-
держат как С — фикоцианин, так и С — фикоэритрин.
Содержащиеся в клетке органические субстраты
оказывают определенное влияние на образование хло-
рофилла. В опытах М. В. Гусева и соавт. с Anabaena
sp. показано, что лактоза, фруктоза, сахароза, глюко-
за, галактоза и маннит стимулируют образование хло-
рофилла при инкубации водоросли на свету. В свою
очередь, ксилоза, ацетат натрия, диоксиацетон, пиро-
виноградная кислота и сорбит уменьшают количество
хлорофилла. В темновых условиях эффективность дей-
ствия первой группы соединений на синтез хлорофилла
падала, а второй — усиливалась, причем вещества этой
группы стимулируют синтез каротиноидов на свету.
С увеличением интенсивности освещения содержа-
ние всех пигментов в клетках снижается, причем наи-
более сильно падает количество билихромопротеидов,
в меньшей степени хлорофилла а и еще слабее — ка-
ротиноидов.
У синезеленой водоросли Synechococcus elongatus
при увеличении освещенности концентрация пигментов
хлорофилла а, Р700 и фикоцианина уменьшается, т. е.
происходит выцветание пигментов (рис. 36), что мож-
но рассматривать как защитную реакцию на воздей-
ствие света. Важное значение имеет при этом также
относительная концентрация пигментов, т. е. отноше-
Рис. 36. Зависимость концентрации хлорофилла а (/), фикоциа-
нина (2) и пигмента Р700 (3) в сухой биомассе Synechococcus
elongatus от освещенности
93
ние хлорофилла а к пигменту Р700, отношение концен-
трации фикоцианина к хлорофиллу а.
Сказанное позволяет предположить, что окраска
синезеленых водорослей связана с их эволюционным
происхождением, с эволюцией цвета этих организмов.
У клеток зеленой водоросли Golenkinia sp. количе-
ство синтезированного хлорофилла пропорционально
длительности и интенсивности освещения. В первые
9—12 ч освещения синтезируется только хлорофилл а,
затем начинается синтез хлорофилла b и каротиноидов.
Среди водорослей-прокариот есть также и такие,
которые содержат как хлорофилл а, так и хлорофилл
Ь, т. е. являются зелеными водорослями. Пока в дан-
ной группе известен один род Procholoron и эти водо-
росли в чистой культуре не выделены, так как они об-
наружены только в качестве симбионта морских бес-
позвоночных.
Представители отдела Chrysophyta содержат хло-
рофилл и и многие из них хлорофилл с?. Показатель-
но, что отношение хлорофилла а к хлорофиллам Ci+
+с2 изменяется от 3 : 1 до 30 : 1, а у видов Mallomonas
и Synura от 3 : 1 до 65 : 1, т. е. хлорофилла а содер-
жится во много раз больше, причем на количество и
соотношение пигментов влияет возраст культуры, ре-
жим освещения и температуры.
3.2.2. Фотосинтез. Преобразование энергии света в
химическую энергию фотосинтеза у синезеленых водо-
рослей, как и у других фотосинтезирующих организ-
мов, осуществляющих расщепление воды и выделение
кислорода, представляет собой сложный комплекс ре-
акций. В первой реакции (фотофизической) происхо-
дит поглощение света пигментами и превращение его
энергии в пигментных структурах, во второй (фотохи-
мической) энергия электрона переносится в электрон-
транспортной цепи фотосинтеза, а в третьей (биохими-
ческой) она используется для восстановления СО2.
Поскольку клетки синезеленых водорослей содержат
большое число пигментов, то поглощение видимого све-
та осуществляется в широком диапазоне (от 400 до
800 нм), большем, чем у других водорослей (рис. 37).
Пигменты фотосинтетического аппарата организованы
в две фотосистемы. Фотосистема I является главным
местом превращения световой энергии в химическую.
Она, как и фотосистема II, содержит хлорофилл а и
94
Рис. 37. Сравнение поглощения лучей раствором хлорофилла а
и различными фотосинтетическими организмами
каротиноиды. Однако хлорофилл а у синезеленых во-
дорослей не является однородным пигментом. Фотоси-
стема I представляет собой комплекс хлорофилла а
и цитохрома f.
Согласно имеющимся в литературе данным, синий
свет может служить индикатором относительно содер-
жания двух фотосистем. В опытах с клетками Chlorella
vulgaris, автотрофно выращенных на синем свете, со-
держание хлорофиллов и каротиноидов на 25—30 %
95
выше, чем в водорослях, облучаемых красным светом.
Величина соотношения Ха/Хъ при этом составляла 2,9
и 5,0 для водорослей, выращенных на синем и красном
свете соответственно. Замена белого света, при кото-
ром соотношение Ха/Хъ было равным 2,9, на красный
приводит к увеличению через 20 ч этого параметра до
5,0. В таких клетках накапливалось до 80 % хлорофил-
ла а, в то время как в клетках, получающих после бе-
лого синий свет — 50 % хлорофилла Ь. Флуоресценция
водорослей, получивших в ходе роста синий свет, на
30 % больше таковых растений, выращенных на крас-
ном свете. Учитывая, что хлорофилл Ъ функционально
связан с фотосистемой II, синий свет служит у Chlorel-
1а существенным фактором формирования данной фо-
тосистемы и тем самым оптимального состава фотосин-
тетического аппарата.
В результате светового возбуждения, наступающего
у фотосистемы II, вызываются реакции фотоокисления
воды и переноса образовавшегося электрона в цепь
поступательных переносчиков, что приводит к их вос-
становлению. Возбуждение же фотосистемы I приводит
к окислению этих переносчиков и переброске электро-
на на молекулу НАДФ с последующим ее восстанов-
лением.
Электрон, образующийся в результате фотовозбуж-
дения как фотосистемы I, так и фотосистемы II, по
пути своего следования отдает содержащуюся в нем
энергию. Фотосистема II (коротковолновая, Х=680),
поглощая квант света, повышает энергию электрона
от уровня окислительно-восстановительного потенциа-
ла воды, являющейся внешним донором электронов, до
уровня с невысоким отрицательным потенциалом. Фо-
тоактивация фотосистемы I (длинноволновая, Х=700)
приводит также к образованию электрона с высокой
восстанавливающей способностью, который использу-
ется для восстановления ферредоксина или железофер-
мента дегидрогеназы. Под действием красного света
пигмент окисляет цитохром f и восстанавливает фер-
редоксин, который, окисляясь НАДФ-редуктазой, об-
разует восстановленный НАДФ-Н — один из самых
важных компонентов, образующих «восстановительную
силу» за счет энергии света.
В свою очередь, цитохром f, отдавший электроны,
восстанавливается электронами, отданными фотосисте-
96
мой II, т. е. объединяет обе системы. Между ними на-
ходится и пластоцианин — медьсодержащий белок,
участвующий в транспорте электронов.
С фотосистемой II связаны пластохиноны — соеди-
нения с наименьшим окислительно-восстановительным
потенциалом, участвующие в транспорте электронов.
Важное место в этом транспорте отводится и цитохро-
мам Ь, которых значительно больше, чем цитохрома f.
В частности, цитохромы Ь, содержащиеся в хлороплас-
тах, располагаются после фотосистемы I.
Энергия электрона используется на образование
макроэргической связи АТФ дважды. Одно из мест,
АТФ
в 562
Негемовый железопротеид
Ферредоксин, фитофлавин.
флавопротсид, фд-НАДф-
редуктаза, НАДФ
Метил виологен
Ферредоксин
НАДФ
АДФ
Пластохинон
'^•2" Трифснилтетразо-
лийхлорид (ТТХ)
Q_ Цитохромы Ь
Метиленовый
синий
О
в559
АДФ
Р700
С554 л Гф
Пластоцианин
Пигментная
система I
е_
Свет
Мп
ПиIмснтная
система II
Снег
+0,4- Феррицианид
Цитохромы с
+0,6-
+0,8-
----у Н о - ОН”
о,
Рнс. 38. Общая схема переноса электрона в фотосинтезе
4 783
97
где происходит фосфорилирование, связано 0 фотоси-
стемой II. Находится оно, как полагают, между плас-
тохинонами и цитохромом f. Второе место существует
предположительно между акцептором фотосистемы I
и НАДФ. На рис. 38 показана схема переноса элек-
трона, а также взаимосвязь световых и темновых реак-
ций в фотосинтезе.
Р. М. Бекина и М. В. Гусев показали, что на тила-
коидных мембранах цианобактерий наряду с фотоси-
стемой I фотосистема II способна восстанавливать О2
на уровне реакционный центр — первичный акцептор.
Вместе с тем функционирование двух систем совместно
или раздельно с О2 как акцептором электронов имеет
неравную энергетическую эффективность. Обнаруже-
но отклонение фотообмена О2 от нормы как при акти-
вации, так и при снижении поглощения О2, что оказы-
вает одинаково тормозящее действие на фотосинтез.
При введении в клетки органических кислот, облада-
ющих способностью активировать поглощение О2 в
фотосистеме II (яблочной, глиоксиловой, малоновой,
щавелевой) фотосинтез снижался на 50—70 %. Тормо-
зит фотосинтез и удаление выделяемой в среду пере-
киси водорода. При совместной инкубации синезеленых
водорослей и хлоропластов высших растений с актив-
ным фотопоглощением О2, обогащающим среду Н2О2,
также на 50—70 % ингибируется фотосинтез. Таким
образом, из этих опытов вытекает необходимость под-
(X < 700нм)
Свет
(X < 680нм)
Рис. 39. Взаимодействие фотосистем I и II при фотосинтезе (по
Р. М. Бекиной и М В. Гусеву)
98
СН2ОРОз
о
и—с—он
I
н-с-он
CH.2OPOf
О СН2ОРОа'
\\ I
с-с-он
~oz *-|
С=()
I
н-с-он
СН2ОРО*'
СН2ОРОз
Н-С-ОН
Рибулозо-1,5-ди-
фосфат
Промежуточное
переходное
соединение
СОО"
I
н-с-он
I 2.
СН2ОРОз
Две молекулы
3-фосфогл и церата
Рис. 40. Присоединение СО2 к молекуле рнбулозо-1,5-дифосфата
держания определенного уровня восстановленных
форм О2 для процесса фотосинтеза как начала общего
метаболизма клетки на свету. Взаимодействие фотоси-
стем I и II при фотосинтезе показано на рис. 39.
Е. Л. Барский с соавт. нашли, что фотосинтетичес-
кое выделение О2 интактными клетками синезеленых
водорослей зависит от поверхностного заряда мембран,
регулирующего стыковку пластоцианина с реакцион-
ными центрами фотосистемы I. Лаг-фаза в выделении
О2, очевидно, обусловлена трансмембранным перерас-
пределением катионов в ответ на образование электро-
химического потенциала Н+ при энергизации клеток
освещением. Перераспределение катионов приводит к
увеличению их концентрации в микроокружении плас-
тоцианина и стимуляции выделения О2.
Исследования М. Кальвина показали, что главный
путь ассимиляции СО2 — циклический процесс, в кото-
рый вводится СО2 и из которого выходит углерод
(рис. 40, 41, а).
Э. Либберт разделяет этот процесс на три фазы:
фаза карбоксилирования (рис. 41, б) СО2, связываясь
с рибулозодифосфатом, образует две молекулы фосфо-
глицерата при участии фермента рибулозодифосфат-
карбоксилазы. В фазе восстановления фосфоглицерат
при участии НАДФ-Н и АТФ восстанавливается до
3-фосфоглицеральдегидрида (рис. 41, в). Затем насту-
пает фаза регенерации, когда каждая шестая молеку-
ла фосфоглицеральдегида выходит из цикла (рис. 41, г)
и из этого вещества образуется фруктозо-1,6-дифосфат,
4'
99
из него, в свою очередь, синтезируются глюкоза, саха-
роза, крахмал и т. п. Из остальных молекул фосфогли-
церальдегида при участии новых молекул АТФ реге-
6С-,-----—---------[6С6]--------------- 12С.,
Рибулозодифосфат
Фосфоглицерат
Фосфоглнцеральдеги.д
Фруктозобифосфат
(енольная форма)
Рибулозо-1,5- дифосфат
cj:h2o-(p)
оос-^-он .
с=о
I
неон
I
СН2О-(Р)
СН2О-(Р)
ноос-сон
.н^ I
он
I
Т = о
н^он
сн2о-©
З-Фосфогл и церат
(2 молекулы!
Рис. 41. Фотосинтетический цикл Кальвина:
а — суммарная схема, б — фаза карбоксилирования, в — фаза восстанов-
ления, г — фаза регенерации (цифры в кружках — количество атомов уг-
лерода в соединении)
100
нерируется рибулозодифосфат (5С3—>ЗС5). В качестве
промежуточных продуктов образуются различные фос-
фаты сахаров (например, С4-эритрозо-С6-фруктозо-С7-
седогептулозодифосфат). С окончанием этой фазы
цикл замыкается. Процесс этот получил название «С3-
пути», и он характерен для большинства растений.
М. Хетч и С. Слэк, а еще раньше Ю. С. Карпилов
нашли, что у некоторых растений, преимущественно
тропических и субтропических (сахарного тростника,
кукурузы и др.), СО2 присоединяется к фосфоенолпи-
ровиноградной кислоте (ФЕП) при участии фосфо-
енолпируваткарбоксилазы:
СН2
II +со„ +н,о
СО ~Р------------►
I
СООН
ФЕП
СООН
I
СН2 + HSPO4.
I
со
I
соон
ЩУК
В результате образуется щавелево-уксусная кисло-
та (ЩУК), в которой содержится четыре атома угле-
рода. Такое присоединение СО2 получило название
«С4-пути» (рис. 42). Эта кислота преобразуется в яб-
лочную (в некоторых случаях в аспарагиновую), а по-
следняя затем подвергается трансдекарбоксилирова-
нию. При этом СО2 отщепляется и вступает в цикл
Кальвина, присоединяясь к рибулозодифосфату. Сле-
довательно, С4-путь включает две реакции карбокси-
лирования, что позволяет растениям создавать опре-
деленные запасы углерода в клетках. Растения, осу-
ществляющие фотосинтез по С4-пути, имеют два типа
хлоропластов: крупные пластиды, часто лишенные гран
Воздух Мезофильная клетка
Клетка обкладки
сосудистого пучка
Рис. 42. Основные этапы С4-пути
101
в клетках обкладки, окружающих сосудистые пучки;
мелкие гранальные пластиды в клетках мезофилла
листа.
Карбоксилирование фосфоенолпировиноградной
кислоты осуществляется в клетках с мелкими хлоро-
пластами. Образовавшаяся щавелево-уксусная кисло-
та передвигается в клетки обкладки, где протекает ре-
акция транскарбоксилирования и СО2 вступает в цикл
Кальвина. Ю. С. Карпилов назвал этот путь коопера-
тивным, поскольку в нем принимают участие два типа
клеток и два типа хлоропластов.
Фотосинтетическая фиксация углерода у синезеле-
ных водорослей осуществляется по Сз-пути с участием
рибулозо-1,5-дифосфаткарбоксилазы (РДФК) Но в
отличие от растений водоросли обладают активным
транспортцым механизмом, позволяющим накапливать
неорганический углерод внутри клетки в концентрации,
которая превышает концентрацию углерода во внеш-
ней среде. У высших растений РДФК находится в рас-
творенной форме в строме хлоропластов, а у синезеле-
ных водорослей большая часть РДФК локализована
в паракристаллических полиэдральных т^лах — кар-
бокси сом ах.
Опыты с использованием меченого углерода у Апа-
cystis nidulans показали, что на начальных стадиях он
включался в аспартат и глутамат, а затем в аланин,
треонин, изолейцин и глицинсерин, что характерно для
С4-пути фотосинтеза. При выдерживании культуры
A. nidulans в условиях фотоокисления (яркий свет,
низкая температура) происходят потеря фотосинтети-
ческих пигментов (хлорофилла а, фикоцианина, каро-
тиноидов) и обесцвечивание клеток, а также деграда-
ция мембран тилакоидов. Инактивация фотосистемы I
происходит быстрее по сравнению с фотосистемой II.
Уменьшение активности фотосистемы I шло параллель-
но с потерей клетками пигментов, вплоть до полной их
потери. После перенесения культур в оптимальные ус-
ловия роста происходил ресинтез пигментов и восста-
новление структуры фотосинтетического аппарата. Ак-
тивность фотосистем I и II нормализовалось одновре-
менно.
Клетки Chlamydomonas reinhardtii, как и другие
одноклеточные водоросли, обладают системой концен-
трирования СОг, обеспечивающей эффективную фото-
102
синтетическую ассимиляцию этого субстрата при низ-
ких концентрациях его в среде. Эта система, будучи
энергозависимой, запускается в действие на свету и
включает насыщаемый компонент транспорта неорга-
нического углерода, вероятнее всего, электрогенный
транспорт гидрокарбоната с участием карбоангид-
разы.
Показательно, что в клетках A. nidulans, выращен-
ных при высоких интенсивностях света, когда отноше-
ние хлорофилла к фикоцианину равно 1 :3, преобла-
дающее количество углекислоты фиксируется через
цикл Кальвина, а в клетках, выращенных при слабом
освещении или на красном свету, когда содержание
фикоцианина увеличивается, СО2 фиксируется по С4-
пути. Активность малатдегидрогеназы и рибулозо-1,5-
дифосфаткарбоксилазы в этих условиях уменьшается,
а активность фосфоенолпируваткарбоксилазы увеличи-
вается. Основными первичными продуктами являются
аспартат, глицин и серин, и содержание метки из СО2
в них увеличивается при инкубации клеток в атмосфе-
ре азота и переносах их из темноты на свет. У Anaba-
ena flos-aquae, Anacystis nidulans, Oscillatoria sp. ак-
тивность фосфоенолкарбоксилазы в 1,5—5 раз выше,
чем активность рибулозодифосфаткиназы, т. е. за счет
С4-пути эти водоросли могут фиксировать 65—70 %
СО2. У Spirulina platensis обнаружены как фосфоенол-
пируваткарбоксилазы, так и рибулозодифосфаткарбо-
ксилазы, что свидетельствует о фиксации углерода по
Сз- и С4-пути.
Фотосинтетическое выделение О2 интактными клет-
ками синезеленых водорослей зависит от поверхност-
ного заряда мембран, регулирующих стыковку пласто-
цианина с реакционными центрами фотосистемы I.
У облигатно-ацидофильной одноклеточной водорос-
ли Cyanidium caldarium скорость фотосинтетического
выделения кислорода зависит от pH среды и формы
неорганического углерода. При низком содержании не-
органического углерода (0,03 мМ) максимум фотосин-
теза наблюдался в нейтральной области pH; при вы-
соком (0,6 мМ) — фотосинтез не зависит от pH в об-
ласти величин 3—7 и падает до 0 при повышении pH
до 9. Длительная инкубация клеток при pH=7 пре-
кращает рост, приводит к падению скорости фотосин-
теза через 1 сут на 50 %.
103
В общей зависимости интенсивности фотосинтеза
от степени освещения у разных водорослей имеются
определенные отличия. У зеленых, синезеленых и одно-
клеточных зеленых водорослей показатель интенсивно-
сти протекания фотосинтеза, определяемый как отно-
шение числа молей выделяемого Ог к числу молей
поглощаемого СО2 зависит от количества поглощенно-
го СО2 в темновой фазе, предшествующей световому
периоду. А именно, величина интенсивности протека-
ния фотосинтеза тем больше, чем больше количество
поступившего в клетки СО2. На постоянном свету во
время светового периода скорость поглощения клетка-
ми СОг, как правило, возрастает со временем, хотя
скорость выделения О2 при этом снижается. Очевидно,
поглощаемый в темноте СОг сохраняется для исполь-
зования в фотосинтезе в следующих за темновой фазой
периодах освещения. Такая способности особенно важ-
на для водорослей, обитающих в мало забуференных
пресных водах, обычно содержащих низкие концентра-
ции СОг. Установлено, что разные вийы Chlorella по-
разному утилизируют неорганический углерод. Так,
клетки Ch. vulgaris и Ch. miniata в основном исполь-
зуют в качестве источника углерода СОг, в то время
как Chlorella sp. и Ch. ellipsoidea кроме СО2 до-
полнительно поглощают НСО~. Способ утилизации
углерода этими клетками не зависит от концентрации
в среде СО2 во время их роста. Напротив, клетки
Ch. pyrenoidosa, выращенные в среде с 1,5 % СОг, т. е.
обогащенные СО2, фиксировали главным образом СО2,
но при замене СО2 воздухом использовали наряду с
СО2 и нсо-.
Кроме того, фиксация СО2 может осуществляться
путем использования восстановительного цикла кар-
боновых кислот. Так, у Anacystis nidulans при сниже-
нии концентрации СО2 до 0,03 % возрастает активность
ряда ферментов цитрат-синтазы, аконитат-гидратазы,
изоцитратдегидрогеназы и глутаматдегидрогеназы.
Изучение первичных продуктов фотосинтеза с по-
мощью изотопного метода у нитчатой цианобактерии
Anabaena cylindrica показало, что через 5 с 90—95 %
14С включалось в промежуточные продукты цикла
Кальвина и только 1—4 % присутствовало в С4-дикар-
боновой кислоте, аспартате. Ингибиторы ФЕП-карбо-
ксилазы не влияли на скорость 14СОг-поглощения. Это
104
говорит о том, что в основном поглощение углекислоты
идет за счет РДФ-карбоксилазы. ФЕП-карбоксилаза,
хотя и присутствует в клетках, не играет такой роли,
как в С4-растениях. Скорее, она служит дополнитель-
ным источником углеродного скелета для биосинтеза
аминокислот.
Есть указания и на то, что зеленение Euglena gra-
cilis нельзя объяснить ни одной из фотосинтетических
реакций, это растение нужно перенести в новую груп-
пу растений, фиксирующих некоторое количество СО2
в С«-соединения, которые затем декарбоксилируются
для дальнейшего использования СО2 в цикле Каль-
вина.
Таким образом, синезеленые водоросли могут асси-
милировать СО2 различными путями, в зависимости
от их видовых особенностей и факторов окружающей
среды.
Ассимиляция СО2 имеет разный характер при осве-
щении и в темноте. В опытах с Anacystis nidulans на
свету 60 % меченой СО2 обнаруживается в фосфатах
сахаров, а после короткой световой переинкубации в
темноте — в 3-фосфоглицериновой кислоте, фосфоенол-
пирувате, аланине, аспарагине. В темноте происходит
накопление предшественников низкомолекулярной
РНК, окончательный синтез которой осуществляется
при освещении. Кроме того, у A. nidulans в темноте
синтезируется два новых вида РНК, дегидрирующие
на свету и 12 новых белков. Таким образом, облигатно-
фототрофные синезеленые водоросли обладают набо-
ром темновых энергетических процессов, т. е. период
их нахождения в темноте является покоящейся ста-
дией.
К. Я. Биль и соавт. высказали предположение, что
в клетках одноклеточной зеленой водоросли Chlamy-
domonas reinhardtii с достаточно высоким уровнем
темновой фиксации СО2, достигающим при 25 °C 16 %
от фотосинтеза, наряду с пентозофосфатным восстано-
вительным циклом протекает серия биохимических ре-
акций, которые позволяют с высокой эффективностью
ассимилировать СО2 не только в темновой период, но
и на свету при высоких температурах окружающей
среды.
Следует отметить, что состав низкомолекулярных
продуктов фотосинтеза, включающий моносахариды,
105
дйсахариды, глицерин и другие вещества, служит ха-
рактерным признаком отдельных таксономических
групп водорослей и может использоваться при уста-
новлении их систематического положения. Установле-
но, что у красных водорослей основным продуктом
фотосинтеза является флоридозид (глицерин-галакто-
пираноза), у харовых водорослей — сахароза, у зеле-
ных — сахароза и глицин, у бурых — маннит, у сине-
зеленых — глицерин-глюкопиранозид.
Активность фотосинтеза зависит от воздействия
внешних факторов. Изучение действия озона показало,
что концентрация его в 3 мМ на 50 % подавляет фото-
синтез и снижает выделение кислорода у Chlorella sp.
При более длительном воздействии (8—10 мин) про-
исходило полное разрушение пигментной системы кле-
ток. Высказывается предположение, что озон вызывает
отток осмотически активных материалов из клетки, на-
рушает ее энергетический режим ^разрушение прото-
пластов, т. е. действует на органеллы не прямо, а опо-
средованно, вероятнее всего, на плазмалемму, а не на-
правлено на хлоропласты.
Показательно, что для клеток морской диатомовой
водоросли Phaeodactulum tricornutum, находящихся в
равновесии с СО2, характерна зависимость фотосинте-
тического выделения кислорода от содержания натрия
в среде, который не может быть заменен калием, ли-
тием или аммонием и не влияет на дыхание. При по-
степенной концентрации СО2 ингибирующее действие
отсутствия натрия на фотосинтетическое выделение
кислорода менее заметно при pH = 6,5, чем при рН =
=8,0, когда неорганический углерод в среде преиму-
щественно находится в форме гидрокарбоната. Из это-
го следует, что натрий в данной водоросли является
существенным фактором утилизации гидрокарбона-
та — основного соединения, в форме которого осуще-
ствляется фотосинтетическая ассимиляция неорганиче-
ского углерода.
В опытах с Chlamydomonas reinhardtii показано,
что при выращивании клеток в присутствии СО2 основ-
ной утилизируемой формой неорганического углерода
является СО2, а в клетках, обедненных во время роста
СО2, роль такого соединения выполняет бикарбонат
НСО~. Механизм утилизации бикарбоната основан на
превращении НСО~ в СО2 благодаря действию карбо-
106
Рис. 43. Возможные механизмы действия различных форм карбо-
ангидразы (КА) мембранно-связанной и растворимой в фотосин-
тезирующих клетках.
Внизу указаны равновесные концентрации СО2/НСО3 в соответствующих
компартментах клетки при температуре 25 °C и физиологических значе-
ниях pH
ангидразы, локализованной на внешней поверхности
плазмалеммы. Возможные механизмы действия раз-
личных форм карбоангидразы — мембранно-связанной
и растворимой — в фотосинтезирующих клетках пред-
ставлены на рис. 43.
Темновая деструкция крахмала в водорослях Chla-
midomonas, адаптированных к анаэробиозу, сопровож-
дается образованием Н2 и СО2. Выделение СО2 на све-
ту происходит с постоянной скоростью, а выделение
Н2 — с максимальной скоростью в начальный период
освещения. Повышение интенсивности света в интер-
вале от 40 до 150 Вт/м2 сопровождается снижением
скорости выделения СО2 и ускорением выделения Н2.
Из этого следует наличие взаимосвязи процессов, ле-
жащих в основе образования СО2 и Н2 в клетках во-
дорослей,
107
При азотном голодании происходит разрушение
пигментов. У Chlorella vulgaris это разрушение идет
в две стадии: в течение первых двух суток разрушается
только хлорофилл а, а затем идет медленное разруше-
ние хлорофилла Ь и оставшегося хлорофилла а. Умень-
шение выживаемости клеток коррелирует с выцвета-
нием хлорофилла Ь. При добавлении нитрата содержа-
ние хлорофилла а начинает увеличиваться через 4 ч,
а хлорофилла b — через 6 ч, когда соотношение хло-
рофиллов а/b достигнет нормального значения — 3,2.
Предполагается, что при восстановлении фотосинтети-
ческого аппарата клеток водорослей скорость синтеза
пигментов светособирающего хлорофилл-а/й-белкового
комплекса, с одной стороны, и активных компонентов
фотосистем I и II — с другой, регулируется величиной
их отношения.
3.2.3. Фотогетеротрофность. Фотогетеротрофный об-
раз жизни, как доказано в опытах с радиоактивным
углеродом, характерен для многих видов водорослей,
усваивающих до 30 органических соединений. Так,
Anacystis nidulans легко поглощает мальтозу, пирови-
ноградную, уксусную, а-кетоглутаровую и молочную
кислоты. Существует также определенная избиратель-
ность к органическому субстрату у различных водорос-
лей, особенно при оптимальных условиях освещения.
Среди органических субстратов есть и такие, которые
оказывают ингибирующее действие на рост водорослей:
пропионат, цистеин и индол ингибируют Anacystis ni-
dulans, гистидин — Synechocystis aquatilis, а лизин,
валин, серин, гистидин — Anabaena variabilis. A. varia-
bilis может расти фотоавтотрофно, но может исполь-
зовать фруктозу как основной источник углерода в
в темноте и на свету. Рост культуры в среде без свя-
занного азота лимитирован СОг, хотя высокие концен-
трации СОг (>2 %) ингибируют рост водоросли. В то
же время фиксация СОг уменьшается до 75 % в при-
сутствии 20 мМ фруктозы, а скорость выделения Ог
увеличивается до концентрации 10 мМ, что связывают
с количеством в клетке продуктов фиксации углерода.
Рост A. variabilis в первые 10 суток под влиянием
глюкозы, аспарагиновой, глутаминовой кислот пример-
но такой же, как и в контроле. К 20-м суткам, когда в
контрольном варианте на минеральной среде культура
лизируется, рост на среде с органическими веществами
108
интенсивно продолжается, т. е. возраст культуры, оче-
видно, является определяющим фактором гетеротроф-
ности.
В опытах с использованием ацетата, меченного по
углероду, доказана его прямая фотосинтетическая ас-
симиляция клетками Nostos muscorum и др. Для То-
lypotrix tenuis характерен рост в темноте за счет окис-
ления глюкозы и потребления ее на свету. Усвоение
углеводов на свету сопровождается накоплением гли-
когена, образующегося также при автотрофном и ге-
теротрофном образе жизни у синезеленых водорослей.
Уменьшение концентрации СО2 увеличивает долю уг-
лерода, включенного в клеточный метаболизм из аце-
тата и глюкозы.
Изучение превращения глюкозы, меченной в раз-
личных положениях в клетках Anabaena cylindrica,
Anacystis variabilis и др., показало, что оно происходит
в основном окислительным путем и СО2 образуется из
положения Сь а не из положения Сб. Это также сви-
детельствует в пользу пентозофосфатного пути ассими-
ляции глюкозы. Перенос клеток со света в темноту ве-
дет к быстрому исчезновению фосфатов сахаров и
накоплению 6-фосфоглюконата (рис 44), что доказы-
вает превращение эндогенных углеводов гексозомоно-
фосфатным путем, обеспечивающим клетку большим
количеством НАДФ-Н (в то время как при гликолизе
и в реакциях цикла Кребса образуется в основном
НАДФ). В свою очередь, НАДФ-Н необходим для вос-
становительных синтезов основных веществ клеток из
низкомолекулярных предшественников С4- и С5-саха-
рами, служащими для синтеза нуклеотидов и некото-
рых аминокислот.
В пентозофосфатном цикле экзогенные или эндо-
генные углеводы могут окисляться до конца, хотя на
уровне фосфоглицеринового альдегида они могут ме-
таболизироваться по гликолитическому циклу.
Показательно, что хлоропласты, выделенные из фо-
тогетеротрофно выращенных клеток Euglena gracilis,
отличались от аналогичных препаратов хлоропластов
из шпината. Они были более устойчивы к высокой кон-
центрации ортофосфата в среде, неспособны к выде-
лению О2, зависимому от оксалоацетата, и отличались
низкой скоростью выделения О2 в присутствии 3-фос-
фоглицериновой кислоты. При хранении при 4 °C изо-
109
Гликоген
Аденозин-5-дифосфат-глюкоза
Гл юкозо-1-фосфат
Фруктозо-6-фосфат -* » Глюкозо-6-фосфат
НАДФ
Пентозофосфатный
ЦИКЛ
НАДФ Н+Н
З-Фосфоглице-
ри новый
альдегид
З-Фосфоглицерат
Рибулозо-1,5-дифосфат
6-Фосфоглюконат
Рибулозо-5-фосфат
НАДФ+
НАДФ++ Н
СО2
СО., [
Рис. 44. Схема светового и темнового метаболизма сахаров
у цианобактерий
лированные хлоропласты Euglena сохраняли свою ак-
тивность в 2—3 раза дольше, чем хлоропласты шпи-
ната, а через 8 ч хранения у хлоропластов эвглены
скорость выделения Ог составляла 80 % от исходной
величины.
Несмотря на недостаточное изучение фотогетеро-
трофного образа жизни, совершенно ясно, что в опре-
деленных условиях, близких к естественному сущест-
вованию синезеленых водорослей, такой путь усвоения
веществ является единственно возможным для размно-
жения, развития и препятствия лизису от фотоокис-
ления.
3.2.4. Хемоорганотрофность. Хемоорганотрофный
образ жизни присущ примерно 30 видам синезеленых
водорослей с нитчатым строением (Nostoc punctiforme,
Phormidium foveolarum, Oscillatoria sp. и др.). Обна-
ружен целый ряд этих растений, развивающихся в тем-
ноте на среде с глюкозой или сахарозой. У однокле-
ПО
точных водорослей темновое развитие встречается
гораздо реже, оно характерно для некоторых предста-
вителей родов Aphanocapsa и Chlorogloea.
В гетеротрофных условиях в темноте при добавле-
нии глюкозы хорошо растет Chlorococcum infusionum,
причем интенсивность роста пропорциональна концен-
трации глюкозы, хотя при 0,1—0,2 % глюкозы росто-
вые процессы отсутствовали. Такой же стимулирующий
эффект оказывает арабиноза. Вместе с тем Chlorococ-
cum не растет в присутствии уксусной кислоты, саха-
розы, желатина в качестве источников углерода и очень
слабо растет при добавлении в питательные среды аце-
тата натрия, глицерина и галактозамина.
Источником углерода для хемоорганотрофов явля-
ются углеводы (глюкоза, сахароза, рибоза, мальтоза,
манноза и др.), а источником азота — нитрат, NH4 или
аминокислоты. Время их перехода к размножению в
условиях темноты снижается в 3—5 раз, рост обычно
происходит в аэробных условиях. У представителей
Nostoc он может осуществляться без доступа воздуха.
Все это позволяет предположить, что среди синезеле-
ных водорослей существуют все переходные формы от
облигатных фототрофов до гетеротрофов. Так, у Nostoc
linckia при добавлении глюкозы, фруктозы, сахарозы,
мальтозы и лактозы стимулируется фотогетеротроф-
ный рост цианобактерий, увеличивается содержание
хлорофилла и белка, усиливается поглощение аммиач-
ного азота и нитрогеназная активность. Глюкоза, фрук-
тоза и сахароза также поддерживали слабый хемоге-
теротрофный рост, а ингибируют его кетоглутарат, пи-
руват, сукцинат, ацетат, сорбоза и формат.
Рост Nostoc muscorum блокируется в присутствии
диурона — известного ингибитора ассимиляции СО2 в
фотосинтезирующих организмах. Вместе с тем мутант
этой водоросли устойчив к 5-10-5 М диурона при фото-
трофных условиях роста, может использовать данное
соединение в качестве источника углерода и азота и
не способен расти фотоавтотрофно, т. е. мутант лишен
способности к фотосинтетической фиксации СО2.
Н. Г. Тихоновской и А. Д. Володарским выявлены
антигены, которые рассматриваются в качестве фено-
типических маркеров клетки Euglena gracilis в опреде-
ленных физиологических состояниях — фототрофном и
гетеротрофном (рис. 45). Наличие таких маркеров по-
111
Рис. 45. Антигенная структура фототрофа (а), гетеротрофа (б)
и мутанта (в) в двумерном иммуноэлектрофорезе (7) и в одно-
мерном иммуноэлектрофорезе (//) (по Н. Г. Тихоновской и
А. Д. Володарскому).
В лунках антигены: / — фототрофа, 2 — гетеротрофа, 3 — мутанта; в тран-
шеях антисыворотки против антигенов: 1' — фототрофа, 2' — гетеротрофа,
3 — мутанта
зволяет не только тестировать определенное функцио-
нальное состояние клетки, но и контролировать изме-
нение клеточного метаболизма при переходе клетки из
автотрофного в гетеротрофное состояние и обратно.
Продукты метаболизма глюкозы могут оказывать
токсическое действие на организм хемоорганотрофов
при гетеротрофном росте в темноте. Это, в частности,
относится к Plectonema boryanum, рост ее успешно
продолжается при непрерывном пересеве культуры
(диализе). В естественных условиях произрастания об-
разующиеся токсические продукты постоянно удаля-
ются и вреда не приносят.
Почти все синезеленые водоросли, способные к фо-
тогетеротрофному росту, для процессов метаболизма
нуждаются в кислороде, причем энергию они получают
за счет окислительного фосфорилирования. Скорость
этого процесса является основным моментом, ограни-
чивающим рост хемогетеротрофов в темноте.
П2
В условиях темнового развития происходит опреде-
ленное ингибирование синтеза мембранных структур и
пигментов. Так, ламеллы мембран принимают беспо-
рядочное расположение, в то время как в автотрофных
условиях они располагаются параллельно. В темноте
несколько теряется содержание хлорофилла, фикоэрит-
рина, фикоцианина и других пигментов.
Таким образом, более замедленный рост в темноте
при сохранении пигментной системы и ферментативной
активности позволяет организмам сохранять жизнеде-
ятельность и является, очевидно, приспособлением к
неблагоприятным условиям жизни.
3.3. БЕЛКИ И ЛИПИДЫ
Белки и липиды являются важными структурными,
запасными и функциональными элементами клетки.
3.3.1. Азотфиксация и биосинтез аминокислот. Си-
незеленые водоросли используют в качестве источника'
азота самые разнообразные соединения — минераль-
ные, органические и даже молекулярный азот для син-
теза аммония в аэробных условиях в процессе фотосин-
теза при использовании воды в качестве донора элек-
тронов. Физиологическая же роль NH4 — включаться
в аминокислоты. В настоящее время рассматривается
возможность промышленного использования синезеле-
ных водорослей для получения больших доз аммония
из N2 при использовании воды и света. К числу усваи-
ваемых азотсодержащих веществ относятся нитраты,
аммонийный азот, гидроксиламин, хотя не все исполь-
зуются в равной степени. Некоторые из них могут да-
же оказывать ингибирующее воздействие на ростовые
процессы. Для всех организмов этой группы самым
лучшим источником азота являются нитраты. Утили-
зация NO3- у зеленых и синезеленых водорослей, рас-
тущих в фотоавтотрофных условиях при норме СО2 в
воздухе и достаточном освещении, сопровождается вы-
делением в культуральную среду NO2~ и NH4+. Этот
процесс в заметной степени стимулируется синим све-
том, зависит от уровня фотосинтетической радиации
и коррелирует с фотоактивацией нитратредуктазы.
Усвоение же других источников азота определяется
спецификой видов, причем NH4 из-за его токсичности
усваивается слабо.
113
(Внутренняя
сторона
Wj
Внешняя к
сторона f •
WOt
NEM-N-
гнбнрует
Рис. 46. Предполагаемая схема регуляции
утилизации нитрата у диатомовой водорос-
ли Sceletonema costatum (по М. В. Гусеву
с соавт.):
Р — пермеаза, ответственная за транспорт нит-
рата; Р' — пермеаза, ответственная за освобожде-
ние нитрата, WO4-M — вольфрамат, NEM-N
— этиламнд, рНМВ — р.оксимеркурбензоат (ин-
три функции: две транспортные н восстановление, хотя дейс-
твует разными путями); СШ — циклогексамид
Амино-
кисло-
ты с
Ьелки
При азотном голодании у водорослей возникают
хлоротические явления: падает количество хлорофилла
и фикоцианина. Образование аммония, как правило, у
всех растений идет путем восстановления нитратов:
NO3 NO2 NH2OH -> NH4.
На утилизацию нитрата не влияют нитрит, амино-
кислоты и темновые условия. Образовавшийся аммо-
ний не влияет также на диффузионный транспорт и
действует как ингибитор только на поглощение нитра-
та, связанное с переносчиком. Предполагаемая схема
регуляции утилизации нитрата у диатомовой водоросли
Sceletonema costatum представлена на рис. 46, где
фермент пермеаза, ответственный за транспорт нитра-
та, обладает разным сродством к субстрату — большим
для нитрата на внешней стороне мембраны и большим
для нитрата на внутренней ее стороне. Этот фермент
возможно состоит из двух ферментов, которые вместе
с нитратредуктазой, видимо, составляют нитрат-транс-
портредуктазную систему.
При азотном голодании в клетках Chlamydomonas
независимо от источника азота активность аспараги-
назы в 6 раз, глутаминсинтетазы в 1,5—1,8 раз выше,
а содержание белка в 2 раза ниже, чем в клетках с
нормальным азотным питанием. Активность глутамин-
синтетазы, НАД-Н2 и НАДФ-Нг выше при нормаль-
ном питании, при использовании в качестве источника
114
азота аммония и аспарагина, а на нитратах — ниже.
Вместе с тем активность аспарагиназы и глутаматсин-
тетазы подавляется высокой концентрацией азота не-
зависимо от его источника через механизм, ответствен-
ный за внутриклеточное исчерпание азота.
Найдено, что процесс образования NH4 в суспен-
зии освещенных водорослей Scenedesmus obtusiuscu-
lus в отсутствии СО2 сопровождается выделением О2.
Поглощение клетками NO3 ускоряется при введении
СО2. Восстановление нитрата тесно связано с нецикли-
ческим транспортом электронов в цепи фотосинтеза.
Источником энергии для транспорта NO3 из среды в
цитоплазму служат триозофосфаты, образованные в
цикле Кальвина.
Синезеленые водоросли, обладающие способностью
усваивать молекулярный азот, широко распространены,
особенно в горячих источниках, пресных и солецых во-
доемах, реже в морях. Они часто находятся в симбиозе
с грибами, образуя лишайники. Азотфиксаторы из
числа синезеленых водорослей повсеместно находятся
в почвах, где обычно преобладают представители родов
Nostos, Anabaena, Cylindrospermum и другие — всего
около 40 видов. За один год они связывают в почвах
до 10 кг, а в океанах 10—40 кг азота на 1 га. Большое
значение имеют синезеленые водоросли в обогащении
азотом рисовых плантаций. Выделяемые ими в среду
аминокислоты усваиваются корнями риса. При насту-
пающем разрушении клеток водорослей фиксирован-
ный азот также поступает в растения. Азотфиксиру-
ющая деятельность синезеленых водорослей находится
в определенной зависимости от внесения азотных удоб-
рений. При внесении под рис 60 кг/га азота водоросли
фиксируют не более 10 кг/га. При высоких дозах азот-
ных удобрений (90—120 кг/га) роль водорослей как
азотонакопителей сводится на нет. В условиях непо-
ливного земледелия внесение небольших доз минераль-
ного азота (45—60 кг/га) увеличивает степень развития
водорослей и накопление ими азота. Дозы 150 кг/га и
более тормозят процесс азотфиксации. Еще более вы-
сокие дозы (200 кг/га) подавляют рост и способность
водорослей усваивать молекулярный азот. Таким об-
разом, минеральные удобрения подавляют азотфикса-
цию сильнее в условиях орошения, чем на богарных
полях.
ИЗ
Некоторые синезеленые водоросли (из родов Mic-
rocystis и Anabaena), вызывающие «цветение» воды,
образуют поверхностную пленку в определенных озе-
рах. Высказывается гипотеза, что пленка служит для
улавливания и удержания в замкнутых капсулах зна-
чительного количества атмосферного азота, что способ-
ствует удержанию его поверхностью воды. В водоемах,
где содержание этого органогенного элемента сильно
лимитировано, образование пленки помогает назван-,
ным водорослям выжить в таких неблагоприятных эко-
логических условиях.
Так, у водоросли Hapalosiphon confervaceus, выде-
ленной из почв рисовых полей, количество внеклеточ-
ного азота на 40-й день культивирования на безазотис-
той среде составляло 4,65 мг/100 г среды при 22,8 мг
сухого вещества, т. е. данная водоросль является силь-
ным азотфиксатором и может использоваться в сель-
ском хозяйстве.
Фиксация молекулярного азота на свету идет ин-
тенсивнее, чем в темноте, причем с увеличением интен-
сивности освещения возрастает и усвоение молекуляр-
ного азота. Показательно, что верхний порог силы
света для фиксации молекулярного азота лежит выше,
чем для ускорения роста. Оптимальная температура
для азотфиксации находится в пределах 40 °C, т. е.
выше оптимума роста. Процесс азотфиксации протека-
ет при наличии ряда микроэлементов, особенно кобаль-
та, молибдена, железа, меди.
У культуры Westiellopsis prolifica с возрастом воз-
растало общее количество фиксированного азота. За
42 дня водоросль фиксировала 12,67 мг азота. Коли-
чество внутриклеточного азота значительно больше,
чем внеклеточного. Содержание последнего возрастало
до 14-дневного возраста культуры, а затем непрерывно
уменьшалось. Полагают, что это является следствием
реутилизации экскретированного азота клетками водо-
рослей.
Синезеленые водоросли содержат гетероцисты —
специальные нефотосинтезирующие анаэробные клетки,
отличающиеся по морфологии и ультраструктуре
(рис. 47), не выделяющие кислород и не усваивающие
СО2. Такая структурная организация служит для изо-
ляции азотфиксирующей системы от кислорода, выде-
ляющегося в процессе фотосинтеза.
116
Рис. 47 Гетероцисты сиие-
зелеиой водоросли Anabae-
na cylindrica (по Д. Гал-
стоиу):
1 — мембраны тилакоидов, 2 —
оболочка, 3 — перегородка сле-
дующей клетки
Фиксация азота в
гетероцистах осущест-
вляется Fe+2- и Мо-со-
держащим ферментом
нитрогеназой в нес-
колько раз активнее,
чем в вегетативных
клетках, куда этот эле-
мент поступает из гете-
роцист, которые, в свою
очередь, получают из
вегетативных клеток
мальтозу, аланин, се-
рин. Установлено, что
в гетероцистах в аэробных условиях на свету
и в темноте происходит образование АТФ.
Облигатно-фототрофные синезеленые водоросли ос-
новную часть азота связывают в условиях освещения.
При освещении они выделяют газообразный Н2, кото-
рый является побочным продуктом ферментного вос-
становления N2 до NH3. Зависимость выделения Н2 от
действия света определяется тем, что на свету повыша-
ется содержание восстановленных продуктов, АТФ и
других высокоэнергетических интермедиатов. Способ-
ность к фиксации азота в темноте сохраняют только
виды, приспособленные к росту в гетеротрофных усло-
виях (Nostos muscorum, Chlorogloea fritschii, Anabaena
variabilis). Лучшим субстратом для них являются глю-
коза, фруктоза, сахароза.
Синезеленая водоросль Chlorogloeopsis fritschii,
растущая гетеротрофно в темноте, фиксирует азот,
используя в качестве источника энергии для темновой
азотфиксации дыхание, связанное с поглощением кис-
лорода. При переносе на свет гетеротрофной культуры
поглощение кислорода в течение 30—40 мин заменяет-
ся его выделением, в то время как активность нитроге-
назы достигает максимального светового уровня только
117
«ерез 20—24 ч освещения и зависит от интенсивности
света и добавления сахарозы. Таким образом, фотосин-
тез начинается сразу после освещения темновой куль-
туры, тогда как включение и перестройка системы
фиксации азота требуют значительного времени (рис.
48, 49). Предполагается, что начальное световое уве-
личение нитрогеназной активности связано с функцио-
нированием ФС-1 и зависит от присутствия запасных
веществ, тогда как дальнейшее возрастание активнос-
ти нитрогеназы на свету обусловлено поступлением
продуктов ассимиляции углекислоты из вегетативных
клеток в гетероцисты и требует участия двух систем.
Первичными продуктами фиксации азота являются
глутамин и глутамат. Схема включения молекулярного
азота у Anabaena cylindrica с помощью глутаматсинте-
тазной — глутаминсинтетазной реакции представлена
на рис. 50.
Глутаматсинтетаза у A. cylindrica локализована в
основном в вегетативных клетках, а глутаминосинте-
Рис. 48. Изменение нитрогеназной
активности культуры Chlorogloe-
opsis fritschii.
Культуру цианобактерий выращивали в
темноте, переносили на свежую мине-
ральную среду и освещали: а — белым
светом (контроль); б—белым светом в
присутствии диурона (10 мм), диурои
добавляли за 24 ч до начала опыта;
в — красным светом с длиной волны
более 700 нм
Рис. 49. Нитрогеиазиая актив-
ность культуры С. fritschii.
Культуру цианобактерии выращивали:
в темноте в хемогетеротрофных усло-
виях (/), на свету в фотоавтотрофных
условиях (2), на свету в фотогетеро-
трофных условиях (3)
1 2 3
118
Рис. 50. Схема включения молекулярного азота у Anabaena
cilindrica
таза — в клетках и гетероцистах. Эти данные, а также
опыты с мечеными аммонием и глутамином дают осно-
вание полагать, что именно глутамин, а возможно, и
аммоний являются переносчиками вновь фиксирован-
ного азота из гетероцист в вегетативные клетки. Глу-
тамат переносится из вегетативных клеток в гетероцис-
ты и превращается в аланин, аспарагиновую кислоту,
серин.
Другим путем поглощения аммония (например, у
Nostos sp.) является орнитиновый цикл, где СО2 вклю-
чается прежде всего в цитруллин, который затем пре-
вращается в аспарагин.
Добавление аммония в среду с зеленой водорослью
Botryococcus braunii, являющейся продуцентом терпе-
ноидов и жирных кислот, приводит почти к полному
ингибированию синтеза терпеноидов и других нераст-
воримых метаболитов. Вместе с тем в этих условиях
наблюдается значительная стимуляция синтеза алани-
на, глутамина и других аминоксилот, особенно 5-ами-
нолевулиновой кислоты. При добавлении аммония к
клеткам, находящимся в темноте, наступает усиленное
включение меченого углерода в соединения, образуе-
мые при карбоксилировании фосфоенолпирувата, такие,
как глутамин, глутамат и малат. Полученные данные
рассматриваются как указание на то, что в присутствии
119
аммония ацетил-КоА— ключевой метаболит, исполь-
зуемый в синтезе углеводородов, перестает включаться
в последовательность реакций, приводящих к образо-
ванию терпеноидов.
На примере безгетероцистного неазотфиксирующего
мутанта Nostoc muscorum изучена способность к ис-
пользованию а-изомеров 21 аминокислоты в качестве
источников азота и углерода при блокировании фото-
синтетической ассимиляции СО2. Глутамат, аланин, ти-
розин и цистеин — токсичны; глутамин, гистидин, аспа-
рагин, триптофан и серин используются в качестве ис-
точников азота, аланин, пролин и фенилаланин — в ка-
честве источника углерода, лейцин, изолейцин, лизин,
метионин, валин, цитруллин — в качестве источников
углерода и азота; аспартат, треонин и глицин не слу-
жат ни источником углерода, ни азота.
Следует отметить, что накопление белка и незаме-
нимых кислот в определенной степени связано с влия-
нием источника освещения. В опытах при облучении
Chlorella vulgaris синим светом 2400 лк содержание
белка повышается на 21—30 %. Высшие водоросли при
красном свете содержат белка на 15 % меньше, чем
при флуоресцентном. Качественный состав аминокис-
лот также зависит от спектрального состава света. При
выращивании этой водоросли на флуоресцентном свету
в белках наблюдается больше лизина и аргинина. Ука-
занное свойство белков используют для получения био-
массы водорослей. В этой связи следует назвать съе-
добную синезеленую нитчатую водоросль Spirulina
maxima, содержащую большое количество протеина,
включающего метионин, триптофан и другие амино-
кислоты в концентрациях, равных содержащимся в
казеине молока. Названная водоросль образует 50 т
сухой массы в год на 1 га, содержащей 35 % сырого
протеина, т . е. в 10 раз больше, чем образует его соя.
Водоросль легко переваривается, так как в ее клеточ-
ных стенках отсутствует целлюлоза.
Биосинтез аминокислоты лизина у грибов, как от-
мечалось, осуществляется двумя путями (см. рис. 13,
14). Эти же пути характерны и для водорослей в за-
висимости от степени их эволюционного развития;
через диаминопимелиновую кислоту, как у синезеле-
ных водорослей, или через аминоадипириновую кислоту,
как у эвгленовых водорослей. Определены также био-
120
Рис. 51. Биосинтетические семейства аминокислот. Незаменимые
аминокислоты обозначены звездочками
синтетические семейства аминокислот — их предшест-
венники, аминокислоты из которых синтезируют другие
аминокислоты (рис. 51). Судьба углеродных скелетов
аминокислот при их разложении представлена на
рис. 52.
Выявлено, что рост стерильных культур зеленых
водорослей Chlorella, Scenedesmus, Coelastrum и
Chlorococcum в среде, содержащей NO2~, сопровожда-
ется выделением N2O. Образование N2O не связано с
фотохимическим превращением NO2~ и наблюдается
только в интактных клетках водорослей. Процесс этот
не ингибируется диуроном, а в случае двух представи-
телей семейства Chlotrophyceae он стимулируется в
присутствии глюкозы, особенно в темноте, т. е. О2 мо-
жет включаться в регуляцию выделения N2O. Следо-
вательно, водоросли, очевидно, являются основными
продуцентами N2O в водных экосистемах.
3.3.2. Липиды. Особый интерес представляют липи-
ды синезеленых водорослей. В формировании фотосис-
121
Рис. 52. Судьба углеродных скелетов аминокислот
темы, ответственной за выделение кислорода, значи-
тельную, хотя еще не выясненную роль играют поли-
ненасыщенные жирные кислоты, особенно L-линолевая.
Однако некоторые виды синезеленых водорослей,
осуществляющие фотосинтез с выделением кислорода,
не синтезируют полиненасыщенные жирные кислоты.
Это наиболее простые представители Cyanophyta, не
способные фиксировать азот и расти гетеротрофно.
Преобладающими в их жирнокислотном спектре явля-
ются насыщенная пальмитиновая кислота и в несколь-
ко меньшем количестве моноеновые — пальмитолеино-
вая и олеиновая. В липидах синезеленых водорослей,
как и во всех фотосинтезирующих организмах, опреде-
лены галактолипиды — моногалактозилдиглицериды,
дигалактозилдиглицериды, а также сульфохиновазил-
диглицериды. Фосфолипиды представлены одним ком-
понентом — фосфатдиглицеридом, который также со-
держится в зеленых водорослях и хлоропластах выс-
ших растений.
122
Исследованиями Г. С. Калачева и И. Н. Трубачева
установлено, что в клетках термофильной синезеленой
водоросли Synechococcus elongatus содержание липи-
дов колеблется от 10,5 до 14,4 % на сухое вещество в
зависимости от способа выращивания. В условиях не-
прерывного культивирования водоросль синтезирует
несколько больше липидов, чем в условиях периодичес-
кого. Качественный состав при этом изменяется не-
значительно: омыляемые компоненты составляют
43,4—44,4 % общих липидов, неомыляемые — 6,2—
9,5, а гидрофильные — 47,7—49,1 %. Липиды этой во-
доросли представлены в основном полярными компо-
нентами, составляющими 57—59 % общих липидов.
Во фракции нейтральных липидов содержатся сво-
бодные жирные кислоты, триглицериды, стерины и их
эфиры. Основными жирными кислотами являются
пальмитиновая (50%), пальмитолеиновая (6,4—
14,8 %), олеиновая (25,4—29,7 %). Ненасыщенные кис-
лоты у S. elongatus представлены только олеиновой
кислотой. У пресноводных диатомовых водорослей
Stephanodiscus hantzschii и Melosira varians основны-
ми жирными кислотами являются пальмитиновая,
пентакозеновая, причем насыщенные жирные кислоты
представлены в меньшем количестве, чем ненасыщен-
ные. У морских водорослей Cystoseira harbata и Fucus
virsoides на долю пальмитиновой приходится 70 %
всех жирных кислот.
У морской одноклеточной водоросли Porphyridium
cruentum, как показали М. И. Юрьева и А. А. Темных,
наибольшая концентрация липидов (14,7 % сухой мас-
сы клеток) и жирных кислот (4,49 % сухой массы кле-
ток) имеет место при освещенности 50 лк. Освещен-
ность 25 лк лимитировала, а 150 лк ингибировала
процессы накопления общих липидов и суммарных
жирных кислот. С увеличением интенсивности света
происходило повышение степени ненасыщенности жир-
ных кислот. При всех исследованных световых режи-
мах в составе жирных кислот преобладают пальмити-
новая, арахидоновая и линолевая. Наиболее резкие из-
менения отмечены в содержании екозапентаеновой,
экозатриеновой и октадекатетраеновой кислот.
Освещение оказывает влияние на липидный обмен
хлоропластов. При снижении освещения адаптация
клеток хлореллы осуществляется в два этапа. На пер-
123
Рис. 53. Антибактериаль-
ная активность свето-
окисленных жирных кис-
лот: компонентов липид-
ного экстракта клеток
(о) и липидного экстрак-
та (б) Westella botryoi-
des (по О. А. Сидоровой
и И. В. Максимовой).
Пунктиром обведены зоны
угнетения роста бактерий
на свету (схемы хроматог-
рамм)
вом прекращается накопление
характерного для липидов хло-
ропласта жирных кислот:
транс-3-гекеадекатриеновой и
триеновых (линолевой и гек-
садекатриеновой), а на вто-
ром скорость накопления трие-
новых и особенно диеновых
кислот резко возрастает, пре-
вышая исходный уровень. Од-
новременно повышается содер-
жание хлорофилла и формиру-
ется хлоропласт с липидным
составом, характерным для
клеток хлореллы при понижен-
ной освещенности.
Светоокислепие свободных
жирных кислот приводит к
увеличению их токсичности.
О. А. Сидоровой и И. В. Мак-
симовой показано, что свобод-
ные жирные кислоты являются
предшественниками антибак-
териальных веществ у зеленой
хлорококковой водоросли. Ме-
тодом биоавтографии выявле-
но (рис. 53), что положение
хроматограмм липидного экст-
ракта клеток на твердые среды, засеянные Staphylo-
coccus aureus, вызывает зоны подавления роста бак-
терий вокруг пятен, содержавших свободные жирные
кислоты. В опытах с липидным экстрактом среды на
свету также выявлены зоны подавления роста бакте-
рий. Однако, как правило, они образовывались не
только вокруг пятна, содержащего свободные жирные
кислоты, но и, несколько сужаясь, охватывали об-
ласть с более низким Rf.
На содержание жирных кислот у водорослей ока-
зывают влияние условия культивирования. Так, при
автотрофном и гетеротрофном выращивании зеленых
водорослей возрастает в первом случае содержание
линоленовой кислоты, сопровождаемое соответствую-
щим уменьшением линолевой и олеиновой.
Показательно, что длительное затемнение вызыва-
124
ет у антарктических водорослей включение радиоак-
тивного углерода в липидную фракцию, а у водорослей
умеренных широт углерод ассимилируется фракцией
низкомолекулярных соединений. Влияние длительного
темнового периода на процесс включения углерода в
липидную фракцию возрастает, если водоросли куль-
тивировать при слабом свете, однако низкая темпера-
тура замедляет этот процесс.
3.4. МИНЕРАЛЬНОЕ ПИТАНИЕ
Неорганические питательные вещества поглощают-
ся водорослями активным и пассивным путями в форме
ионов, содержащихся в водных растениях. Активное
поглощение существует только для ионов питательных
веществ, а остальные ионы проникают в клетку пас-
сивно, в соответствии с градиентом их концентрации и
проницаемостью плазмалеммы. Поэтому способность
к избирательному поглощению ионов весьма ограни-
чена. Один отдельно взятый ион не поглощается, так
как при поглощении катионов возникает разница
электрических потенциалов, вызывающая одновремен-
но поглощение анионов и выход других анионов; то же
относится и к поглощению катионов. Неметаболическое
(пассивное) поглощение (адсорбция) не снижается
под действием температур или ингибиторов дыхания
и является неизбирательным. В основе его находится
процесс диффузии.
Исследования клеток пяти видов харовых водорос-
лей, проведенные Э. Б. Мютеюнене и Л. Н. Воробьевым,
показали, что клетки могут находиться в двух состоя-
ниях: высокоэнергетическом, когда в создание мем-
бранных потенциалов свой вклад вносит электрогенный
насос, и в состоянии пассивной проницаемости. Работа
электрогенного насоса хорошо заметна у клеток Nite-
llopsis obtusa, поэтому они являются наиболее удоб-
ным объектом для изучения влияния факторов среды
на энергообеспечение растительных клеток и состояние
транспортных АТФаз. Клетки N. obtusa после обработ-
ки высокими концентрациями хлоридов К и Na или в
неблагоприятных условиях внешней среды переходят в
состояние пассивной проницаемости.
Основной вклад в диффузионную компоненту раз-
ности потенциалов на мембранах харовых водорослей
вносят потоки ионов К+, Na+ и С1~.
125
Пресноводные водоросли чувствительны к NaCl в
концентрации 0,2 М, и устойчивость их увеличивается
при выращивании в присутствии NaCl в течение не-
скольких генераций. Активность фотосистемы II уме-
ренно чувствительна, а фотосистемы I, компоненты ко-
торой связаны с мембраной, устойчива к NaCl.
В плазмалемме клеток Nitella в состоянии покоя
существуют два типа каналов калиевой проходимо-
сти: Д- и Г-каналы. Потенциалзависимые Д-каналы
определяют проводимость мембран при гиперполяри-
зации свыше 100—120 мВ. Катионная селективность
общих видов каналов соответствует «биологическому
ряду»: К+, Rb+, Na+, Li+. Двухвалентные катионы и
ионная сила раствора вызывают сдвиг активационных
кривых Д-каналов и изменение тока, соответствую-
щее изменению величины поверхностного потенциала.
Кальций, изменяя величину поверхностного потенциа-
ла, переключает проводимость плазмалеммы с одного
вида каналов на другой. В цитоплазме важнейшие
ионы быстро вовлекаются в обмен веществ и в значи-
тельной степени подвергаются превращениям: NH+,
NO~, SO~ в аминокислоты, РО~ в АТФ, Са и Mg —
в фитин, Fe — в порфирины. В условиях подщелачи-
вания среды повышается проницаемость клеточных
стенок.
Показано, что у морских динофлагеллят Pyrocystis
noctiiluca, выращиваемых в проточной воде при раз-
личном содержании в среде азота и фосфора, скорость
поглощения неорганического фосфата на свету вдвое
выше, чем в темноте, и резко снижается при добав-
лении в суспензию диурона или цианида, причем по-
глощение же неорганического фосфата обеспечивает-
ся энергией дыхания и фотосинтеза.
Скорость поглощения 35SO2~ одноклеточными мор-
скими красными водорослями Rhodella maculata на
свету происходит в 3—4 раза быстрее, чем в темноте.
Полагают, что поглощение сульфата опосредовано
двумя транспортными системами, обеспечиваемыми
энергией за счет циклического и нециклического фо-
тофосфорилирования.
У некоторых синезеленых водорослей (Synechococ-
cus lecopoliensis) поглощение фосфата стимулирует
добавление к среде катионов NH+, Na+, К+> Са2+>
126
Sr2+, а катионы Mn2+ и Sn2+ не усиливают этого про-
цесса. Наибольшая стимуляция поглощения ортофос-
фата происходит под влиянием Са2+, причем этот ка-
тион снижает концентрацию полунасыщения для
ортофосфата и таким образом изменяет метаболиче-
ский транспорт ортофосфата в клетку, а ортофосфат
не влияет на характер поглощения ионов Са2+.
Уменьшение солености морской воды не сказыва-
ется на накоплении в водорослях К+’ и С1_, так как
эти элементы поглощаются против градиента электро-
химического потенциала. Однако зарегистрирован ак-
тивный поток СО2, NO~, НРО- в клетку, тогда как
Na+ активно выводится из нее как в гипо-, так и в
гипертонических условиях. Внутриклеточное содержа-
ние заметно зависит от внешней среды. Опыты, про-
веденные с Anabaena flos-aquae, указали на важную
роль накопления К+ в повышении тургорного давле-
ния клеток, так как оно более чем на 60 % связано
с накоплением калия. Некоторые пресноводные водо-
росли способны к значительному накоплению свинца,
который может составлять 20 % сухой биомассы. На-
копление его увеличивается при низких значениях pH.
В исследовании по солеустойчивости озерных сине-
зеленых водорослей (с колебанием солености воды
2—10 %) видов Microcystis firma (предел солеустой-
чивости 60 %) и Synechocystis aquatilis (предел
23 %) установлено, что устойчивость к сильным коле-
баниям солености не является генетически обуслов-
ленной характеристикой. Процесс адаптации водорос-
лей к высокой солености осуществляется в несколько
стадий. Начальная стадия у обоих видов протекает
одинаково и сопровождается резким замедлением
процессов роста и скорости деления клеток. Во вто-
рой стадии устанавливается динамическое равнове-
сие. Солевой стресс вызывает типичные приспособи-
тельные реакции клеток, которые отражаются на их
структурных и функциональных особенностях. У Mi-
crocystis firma происходит увеличение размеров кле-
ток с одновременным замедлением скорости роста,
у Synechocystis aquatilis рост клеток постоянен, но
их размеры уменьшаются. Причина этих различий
заключается в особенностях проницаемости клеточ-
ных оболочек для NaCl. В третьей фазе проявляются
127
экофизиологические последствия. S. aquatilis с низ-
кой границей солеустойчивости выживает при отно-
сительно узком диапазоне колебаний. Водоросли типа
Microcystis firma характеризуются галобной тенден-
цией и обеспечивают свое существование в широких
пределах солености. Оба вида выживают в исследо-
ванных водоемах, а различия в структуре популяций
объясняются их разной конкурентной способностью.
Клетки Nostoc muscorum также обладают способ-
ностью адаптироваться к соленой среде. Адаптирован-
ные к засолению NaCl клетки имеют размер 3,5Х
Х2,5 мкм, их объем вдвое превышает объем нормаль-
ных клеток. Клетки, которые выдерживались СЬ в
КС1, имели размер 2,5X2 мкм. У неадаптированных
клеток засоление вызывало наибольшие изменения в
структуре тилакоидов, которые меняли свою ориен-
тацию, располагаясь ближе к клеточной стенке, отме-
чалось образование пузырьков. У адаптированных
к засолению клеток тилакоиды располагались равно-
мерно во всем клеточном объеме. К осмотическому
стрессу, вызываемому маннитом, клетки N. muscorum
более чувствительны, чем к NaCl-засолению.
Для обозначения особенности морских синезеле-
ных водорослей адаптироваться к различным услови-
ям солености предложена новая терминология, под-
разделяющая водоросли на три типа: макрогалотоле-
рантные, микрогалотолерантные и мезогалотолерант-
ные. К первому типу относят организмы, способные
адаптироваться к широким границам солености (до
30 г/л), ко второму — микрогалотолерантные, расту-
щие в среде, содержащей до 10 г/л NaCl, к третьему —
промежуточные формы, растущие при концентрации
до 20 г/л. Среди рода Anabaena есть виды, относя-
щиеся ко всем трем типам, причем большинство из
них относятся ко второму.
Показательны опыты по смешанному культивиро-
ванию зеленых и синезеленых водорослей в условиях
увеличения концентрации Fe. Оказалось, что Fe изби-
рательно усиливает рост синезеленых водорослей.
Вызывается это, как полагают, несколькими причина-
ми: во-первых, Fe может связываться с хелатами,
выделяемыми синезелеными водорослями, и тем са-
мым уменьшать доступность железа для зеленых; во-
вторых, при недостатке NO3 синезеленые могут
128
усваивать N2 за счет азотфиксации, в процессе кото-
рой Fe требуется им в качестве кофактора для нитро-
геназы. В-третьих, между водорослями могут быть
различия в интенсивности поглощения и включения
его в белки.
Некоторые виды зеленых водорослей, в частности
U;lva rigida, обладающие способностью к концентри-
рованию тяжелых металлов и сравнительной устойчи-
востью к поллютантам, предлагается использовать
в системах доочистки среды и экологического монито-
ринга. Выявлена линейная зависимость накопления
меди от времени воздействия и концентрации ее в
среде. Процесс накопления меди протекает в ритми-
ческом режиме: период спада чередуется с возраста-
нием ее содержания в тканях. Период снижения со-
держания меди в тканях совпадает во времени с мо-
ментом увеличения в тканях калия или соотношения
K/Na, возрастные содержания меди — с уменьшением
внутриклеточной концентрации К+- В случае повреж-
дения растений, возникающего при этом изменения
активности фотосинтеза и дыхания и наступающего
уменьшения АТФ процесс накопления меди продол-
жается в возрастающем темпе без периодического
снижения ее содержания в тканях до момента полно-
го насыщения. В случае же высоких концентраций
меди процесс поглощения протекает пассивно по гра-
диенту концентрации.
Вместе с тем поглощение минеральных элементов
водорослями не всегда находится в прямой зависимо-
сти от их концентрации в окружающей среде. Для
иллюстрации этого положения можно указать на вы-
ращивание Euglena gracilis на среде с различными
концентрациями (3,5 и 10 мкг/мл) металлов, необхо-
димых (Си) и несущественных для обмена веществ
(Cd). Си даже в высоких концентрациях (10 мкг/мл)
не влияет на скорость роста, Cd заметно снижает ее
уже в концентрации 3 мкг/мл. Скорость роста водо-
рослей падает с увеличением концентрации Cd. Со-
держание Си в клетках всегда ниже, чем в среде, так
как содержание Cd в них постепенно начинает пре-
вышать содержание его в среде.
В опытах с Anabaena cylindrica кадмий в повы-
шенной концентрации (2-10-6) вызывает хлороз, кле-
точные деформации и разрушение нитей, а также
5 783
129
уменьшение частоты гетероцист. Он является наибо-
лее токсичным тяжелым металлом для морских орга-
низмов. Нормальная его концентрация в морской воде
составляет 0,02-10-6. Для зеленой водоросли Ulva
lactuca и бурой Laminaria sacharina токсическое дей-
ствие кадмия отмечено при 0,8—2,6-10~6, а при
4,5-10~6 водоросли быстро гибнут. Этот элемент акку-
мулируется в клетках, где его концентрация возрас-
тает в 100—150 раз. После помещения L. sacharina
в среду, свободную от ионов Cd, восстановления не
происходит, так как Cd образует в тканях водоросли
стойкие соединения. Ulva lactuca, напротив, отдает Cd
в окружающую среду и может сохранить жизнеспо-
собность после перенесения ее в чистую воду. В этой
связи обсуждается потенциальная возможность при-
менения указанных водорослей для регистрации кад-
миевого загрязнения в прибрежных водах. Повышен-
ная концентрация меди в питательной среде оказы-
вает почти полное ингибирующее воздействие на
деление клеток синезеленых водорослей. Для Micro-
cystis aeruginosa такой концентрацией является 25—
27 мг/л Си2+, а для Synechocystis minuscula —
30 мг/л Cu2+. Аналогичный эффект на деление клеток
оказывает никель в концентрации 11 мг/л.
Описан опыт практического использования различ-
ных водорослей! (Cladophora, Rhizoclonium, Hydro-
dictyon, Osciillatoria и др.) для очистки промышлен-
ных стоков в районах добычи и переработки свинцо-
вой руды. В этом случае свинец связывается с
клеточными стенками водорослей, вытесняя другие ка-
тионы, и, если не превышены допустимые пределы,
повреждающего воздействия водорослей не происхо-
дит.
Сравнительное воздействие тяжелых металлов на
морские водоросли можно показать на примере
Thalassiosira aestivalis — проявлении гранулирован-
ности и желтой окраски цитоплазмы, распаде хлоро-
пластов и нарушении мелких кремнеземных структур.
По степени токсичности тяжелые металлы делятся на
три группы. К первой относятся Си, Zn, Fe. Под их
влиянием не происходит нормального разделения кле-
ток, цепочковидные колонии укорачиваются, ингиби-
руется образование хитиновых тканей, соединяющих
отдельные клетки. Предполагают, что эти металлы
130
блокируют процессы кремниевого обмена. Вторую
группу составляют Hg, Cd, Pb, вызывающие распад
внеклеточных метаболитов. В результате формируют-
ся комкообразные колонии, клетки которых становят-
ся изогнутыми и удлиненными. В третью группу вхо-
дят Sr, Ni, Se, Sb, As. Они не вызывают заметных
нарушений в морфологии и физиологии водорослей
при концентрации до 1 мкм, но при большей концен-
трации дают эффект, аналогичный воздействию тяже-
лых металлов из первой и второй групп.
В опытах с диатомовой водорослью Navicula ince-
ria наиболее токсичным оказался кадмий, затем сви-
нец. Токсичность меди и цинка почти на порядок
ниже.
Для биотестирования проб воды на содержание
в них селена предлагается использовать динофитовую
водоросль Peridinium cinctum. Максимальная скорость
роста этой водоросли достигается при концентрации
50 нг/л. При избытке в среде основных питательных
элементов скорость размножения и фотосинтетическое
выделение О2 лимитируется концентрацией селена.
Согласно Н. Г. Кере, биотестирование с использова-
нием Р. cinctum позволяет определять эти параметры
в природных водоемах в диапазоне концентраций
5 нг/л.
В качестве индикаторов при загрязнении водоемов
токсичными металлами Си и Zn предлагается исполь-
зовать водоросли Sceletonema costatum и Nitzschia
longissima. Оптимальной концентрацией Си для их
роста является 10 мкг/л, а 25 мкг/л лимитирует их
развитие. При кратковременном воздействии обе во-
доросли могут выдерживать более высокую концен-
трацию Си — 50 мкг/л. Это связано с последующим
накоплением Си в клетках и его токсическим действи-
ем. По отношению к Zn обе водоросли проявляют по-
вышенную толерантность. При длительном экспери-
менте они выдерживают концентрацию 150 мкг/л,
а при кратковременном — до 300 мкг/л. Влияние вы-
соких концентраций сказывается на морфологии кле-
ток, в результате чего происходит распад колоний.
К перспективным и удобным объектам для определе-
ния токсичности металлов Мп и Zn в воде относится
Chlorella pyrenoidosa. При концентрации Мп 50 мг/л
летальный исход водорослей наступает при воздейст-
5'
131
вии на протяжении 96 ч. При таком же времени воз-
действия и концентрации 200 мг/л Zn организм гиб-
нет. В клетках накапливаются высокие концентрации
Мп, Zn, которые в сотни раз превышают содержание
этих элементов в контрольных вариантах. В клетках
хлореллы накапливается и уран, причем мертвые
клетки поглощают его больше, чем живые.
Диатомовые водоросли (Cylindrocheca fusiformes
и др.) очень нуждаются в боре. При дефиците его
в культуральной среде деление их клеток прекраща-
ется спустя 24—30 ч. Через 48 ч в клетках наступают
необратимые изменения: примерно в 2 раза увеличи-
вается их объем, повышается содержание белков, не-
растворимых углеводов, фенолов и хлорофиллов,
в 2 раза возрастает интенсивность темнового дыхания.
Некоторые морские водоросли, культивируемые на
искусственной среде при добавлении ванадия, увели-
чивают сырую массу. Так, у многоклеточной бурой
водоросли Fucus spiralis добавление 10 мкг/л ванадия
вызывает увеличение сырой биомассы на 400 %, а У
зеленой водоросли Enteromorpha compressa урожай
биомассы увеличивается на 90 %. Красные водоросли
не реагируют на внесение ванадия.
Таким образом, потребность в минеральном пита-
нии для каждого вида водорослей и устойчивость их
к повышенным концентрациям тяжелых металлов
строго индивидуальны. Это обстоятельство имеет и
определенное практическое значение.
Водоросли (например, синезеленые, бурые, зеле-
ные) способны аккумулировать значительное количе-
ство почвенных гербицидов — ордрама, изофоса-3
и др. Содержание их в клетках в среднем составляет
0,01—0,1 % сухой массы водорослей. Являясь концен-
траторами ядохимикатов, они могут представлять
серьезную опасность для растительных гидробионтов
и рыб.
3.5. ДЫХАНИЕ
Молекулярный кислород, выделяемый клетками
облигатно-фототрофных синезеленых водорослей, яв-
ляется неблагоприятным фактором для их развития.
Именно поэтому они часто произрастают там, где
кислород не накапливается (непроточная вода, соле-
132
ные озера, горячие источники). Возникло даже пред-
положение, что облигатно-фототрофные синезеленые
водоросли являются анаэробами. Однако впоследст-
вии опытами с использованием 18О2 было установлено,
что при низких концентрациях этого элемента (менее
0,5 %) на свету наблюдается фотоингибирование ды-
хания, а интенсивный свет стимулирует поглощение
кислорода. Обнаружено также, что фотодыхание
Anabaena cylindrica в двадцать раз превышает по ско-
рости темновое поглощение кислорода.
Исследования активности гидрогеназы и нитратре-
дуктазы у синезеленой водоросли Spiruiina platensis
на различных средах с N2 показали, что активность
гидрогеназы в среде с нитратом значительно ингиби-
руется, а нитратредуктазы — возрастает. В отсутствие
нитрата имела место противоположная ситуация. Мо-
чевина оказывает ингибирующее воздействие на ак-
тивность нитратредуктазы и усиливает выделение Н2,
что свидетельствует о конкуренции между гидрогена-
зой и нитратредуктазой за восстановители.
Для оценки влияния О2 на выделение Н2 водо-
росль, суспензированная в среде без связанного азота,
помещалась в сосуды с воздухом и N2 и инкубирова-
лась в темноте. При этом наблюдалось усиление вы-
деления Н2 в сравнении с вариантом, где присутство-
вал О2. Следовательно, О2 ингибирует выделение Н2.
Выделение Н2 клетками Spiruiina усиливалось при
увеличении освещенности, но фотосинтетическое вы-
деление О2 возрастало и достигало «компенсационной
точки» при освещенности 2000 лк. Самая низкая ин-
тенсивность выделения Н2 отмечалась в области
685 нм (максимальное поглощение фотосистемы II).
В анаэробных условиях на среде без нитрата вы-
деление Н2 и поглощение О2 в темноте прямо пропор-
циональны. На свету выделение Н2 прекращалось и
начиналось фотосинтетическое выделение О2. Добав-
ление сахарозы к клеткам, инкубированным 24 ч
в темноте (голодающие клетки), значительно усили-
вало выделение Н2. Из этого следует, что для выделе-
ния Н2 в темноте необходимы продукты фотосинтеза.
Исследования зависимых от дыхания потоков
ионов Н+ у ацидофильной одноклеточной водоросли
Cyanidium caldarium показали наличие в плазмалем-
ме системы активного выброса из клетки ионов Н+.
133
В присутствии ингибиторов дыхания, таких как роте-
нон или актиномицин А, а также при введении чисто-
го азота наблюдалось защелачивание среды, обуслов-
ленное пассивным транспортом протонов в клетку.
Возрастание степени поступления Н+ в клетку по ме-
ре снижения pH среды (до 2,9) свидетельствует
о том, что скорость входящего потока протонов кон-
тролируется pH-градиентом через плазмалемму. Ве-
личина pH среды инкубации клетки, увеличение ко-
торой наблюдалось в анаэробных условиях, возвраща-
лась к исходному уровню после аэрации клеточной
суспензии. Этот факт рассматривается как указание
на то, что зависимый от дыхания активный транс-
порт Н+ обеспечивает откачку из клетки избыточного
количества протонов, накопленных в ходе анаэробной
прединкубации. Изменение pH клеточной суспензии
зависит от внутриклеточного содержания АТФ. Пола-
гают, что система активного выброса Н+-ионов зави-
сит от окислительного фосфорилирования и функцио-
нирует в темноте таким образом, что поддерживает
постоянным внутриклеточный pH на фоне постоянной
пассивной утечки через плазмалемму протонов в
клетку.
В опытах с синезелеными водорослями обнаружи-
лись восстановление кислорода и образование пере-
киси водорода, интенсивно выделяющейся у некото-
рых видов на свету и в темноте, но более слабо. Обра-
зование перекиси увеличивается при высокой интен-
сивности света, голодании по СО2, образовании глико-
лата. Предполагается, что образуемый в фотосинтезе
восстановитель в случае невозможности расхода его
на фиксацию СО2 реагирует с кислородом. Окисление
двууглеродной гликолевой кислоты при участии гли-
колатоксидазы получило название фотодыхания. Этот
процесс связан с поглощением кислорода и приводит
к образованию глиоксилевой кислоты, которая, ами-
нируясь, превращается в глицин.
Дальнейшее превращение этого вещества приво-
дит к образованию серина, которое осуществляется
при одновременном декарбоксилировании одной из
молекул глицина. Выделяющаяся при этом углекис-
лота и является продуктом фотодыхания. Серин, в
свою очередь, превращается в глицерат, а глицерат
может идти в цикл Кребса (см. рис. 9) или через
134
фосфоглицерат вновь поступать в цикл Кальвина (см.
рис. 41). Гликолатоксидаза Anabaena cylindrica ло-
кализована в фотосинтетических мембранах.
Синезеленые водоросли, как и другие растения с
С4-путем, обладают низким уровнем фотодыхания.
Вредное же воздействие кислорода на развитие этих
водорослей объясняется, очевидно, их большей чув-
ствительностью к кислороду, выделяющемуся в про-
цессе разложения воды. Эта чувствительность нахо-
дится в связи с более ранним эволюционным разви-
тием синезеленых водорослей по сравнению с другими
растениями. Для них характерно разнообразие в ти-
пах взаимодействия с кислородом. Темновое дыхание
многих облигатно-фототрофных синезеленых водорос-
лей (Anacystis variabilis) является суммарным про-
цессом, слагающимся из разных реакций с участием
кислорода, закономерно сменяющихся по мере удале-
ния во времени от периода освещения.
С фотодыханием у Chlamydomonas связан цикл
превращения азота. Выделение NH3 в этом процессе
является светозависимым, чувствительным к измене-
нию рСО» и рО2 и подавляется ингибиторами фото-
системы II. Азот освобождается из белка, а не из
вновь синтезированного глутамата. Скорость распада
белка может обеспечить наивысшую величину осво-
бождения NH3.
Интенсивность фотодыхания, вычислявшаяся как
разница между видимым и истинным фотосинтезом
у зеленых и диатомовых водорослей, составляет от
10 до 28 % истинного фотосинтеза при количестве
кислорода, равном атмосферному. Снижение количе-
ства кислорода по 2 % приводит к снижению фото-
дыхания от 52 до 91 %. У синезеленых водорослей
(Coccochlorus и Phormidium) фотодыхание составля-
ет от 2,4 до 6,2 % истинного фотосинтеза, но умень-
шение кислорода не дало аналогичного результата.
У этих водорослей достаточно высоки уровень СО2
в клетке и другие соотношения ^омпентпаций, что
обеспечивает активный транспорт НСО~. Схема, ил-
люстрирующая обмен углерода в процессе фотодыха-
ния, приведена на рис. 54.
Опыты с Chlorella pyrenoidosa показали, что по-
вышение концентрации О2 от 2 % до 50 % в воздуш-
ной фазе оказывало относительно слабое влияние на
135
СООН -2HI СООН СООН 4°2 СООН
2 | -----2 I —------------— 21 -4-----► I
СООН СНО Переами- CH2NH2XNH, CH,NH,
пирование з । 2
СН2ОН
Гликолат Глиоксилат Глицин Серин
Рис. 54. Схема фотодыхания
Рибулозо-1,5-дисфосфат
<-О2
3-ФосфоглицераТ
СОО“
СН2ОРОГ
Фосфогликолат
^Н2О
Pi
соо~
I
СН2ОН
Гликолат
г" о2
Н2О2
соо-
I
фиксацию СО2 клетками хлореллы, выращенной в
равновесии с воздухом, но вызывало сильное подав-
ление ассимиляции СО2 у водорослей, выращенных
при избытке СО2. Скорость фотодыхания хлореллы,
выращенной при избытке СО2, значительно выше, чем
в контроле.
Подавляющее действие О2 на светозависимую фик-
сацию СО2 у водорослей, выращенных при избытке
СО2, обусловлено стимуляцией фотодыхания, а не тор-
можением фотосинтетического переноса электронов.
Следует подчерк-
нуть, что основным суб-
стратом дыхания яв-
ляется гликолат, кото-
рый образуется из фос-
фогликолата и кото-
рый, в свою очередь,
образуется из рибуло-
зо-1,5-дифосфата (рис.
55).
У клеток, находя-
щихся свыше 1,5 ч под
освещением при силь-
ном аэрировании, ин-
тенсивность дыхания
снижается более чем
на 50 %. Однако у кле-
ток, выдерживавшихся
в анаэробных условиях,
наступают некоторая
стимуляция дыхания и
снижение скорости по-
Глиоксилат
Рис. 55. Образование и
распад гликодата
13?
ГЛоЩеНИЯ кислорода При истощении ик в темноте И
на свету, при продувании воздухом, лишенным СО2.
Истощение находится в связи с происходящим расхо-
дом продуктов фотосинтеза, запасаемых на свету.
Свет оказывает определенное влияние на дыхание
и расщепление резервных углеводов. В опытах с Du-
nalielila tertiolecta синий свет вызывал выраженную
стимуляцию поглощения О2 после предварительного
3-часового пребывания клеток в темноте. Подобное
действие на дыхание оказывает и красный свет. Изу-
чение зависимости поглощения О2 от длины волны
падающего света показало, что спектр действия эф-
фекта не имеет при 370, 450 и 650 нм. Следовательно,
наблюдаемые светозависимые реакции клеток в дан-
ном примере опосредованы действием двух фоторе-
цепторов, один из которых улавливает синий, а дру-
гой — красный свет. Предполагается, что в роли по-
следнего фоторецептора выступает хлорофилл.
Ингибируемое светом поглощение кислорода сей-
час рассматривается в качестве важнейшей ступени
на пути к наиболее совершенному типу фотодыхания.
Как показал М. В. Гусев, воздействие света на про-
цесс эволюции микроорганизмов способствовало обра-
зованию хаотического калейдоскопа реакции воздей-
ствия с кислородом, в котором важнейшее место до
сих пор принадлежит синезеленым водорослям. Со
временем образовался и стабилизировался наиболее
совершенный тип дыхания, в котором реализуются
возможности окислительного фосфорилирования, яв-
ляющегося единым для всех высокоорганизованных
форм жизни среди растительного и животного мира.
3.6. РОСТ И ДЕЙСТВИЕ НА РОСТОВЫЕ ПРОЦЕССЫ
ФАКТОРОВ ОКРУЖАЮЩЕЙ СРЕДЫ
Рост водорослей — одно из наиболее ярких выра-
жений их активной жизни, тесно связан с совокуп-
ностью совершающихся в организме обменных про-
цессов. Эту связь не всегда можно выявить количест-
венными процессами, так как часть органического ве-
щества расходуется на каталитические процессы.
Рост водорослей, как и всех других живых организ-
мов, тесно связан с их развитием и процессом старе-
ния. Так, у красных водорослей в старых листовых
137
Рис. 56. Контакт цианобактерий A. variabilis с клеткой пасле-
на (а); смешанный агрегат клеток паслена и С. fritschii(6, в, г)
пластинках обнаружены кристаллические агрегаты
фитоферритина, что свидетельствует о связи наличия
этого вещества с процессом старения пластинок. Этот
процесс сходен с таковым у листьев высших растений.
Методом синхронных культур выделены соединения,
характерные либо для активно растущих, либо для
интенсивно размножающихся клеток. Синхронизация
процессов развития у автотрофных микроводорослей
вызывается чередованием светового и темнового пе-
риодов. В конце светового периода в культуре пре-
обладают клетки, готовые к делению. В темновой
период происходит высвобождение автоспор из мате-
ринских клеток. На основании четкой дифференциа-
ции клеток до и после споруляции можно выяснить,
на какой стадии развития находится культура.
138
О. А-. Горелова с соавт. сообщают, что при совмест-
ном культивировании клеток паслена Solarium laci-
niatum с азотфиксиоующими цианобактериями Апа-
baena variabilis и Chlorogloea fritschii формиоуются
смешанные агрегаты (рис. 56). Их образование стиму-
лирует деление клеток паслена и накопление ими
гликоалкалоидов при культивировании на безазоти-
стой среде, а также представляет интерес для модель-
ного изучения искусственных симбиотических систем.
Клетки женьшеня и С. fritschii, как показала
Р. Г. Бутенко с соавт., образуют ассоциации при их
культивировании в темноте, и к концу 3-й недели все
клетки цианобактерии оказываются связанными с аг-
регатами клеток женьшеня.
Совместная культура Nicotinia tabacum и Anacys-
tis nidulans растет в виде достаточно гомогенной
суспензии клеток. При этом наблюдаются стимуляция
клеток цианобактерии и замедление процессов старе-
ния клеток табака при росте каждого из партнеров
на неоптимальной среде.
Методом электронного измерения объема клеток
на примере культур Chlorellla vulgaris изучен темп
роста микроводорослей, характеризующийся типич-
ной сигмовидной кривой, где лаг-фаза быстро перехо-
дит в экспоненциальную. Иная картина наблюдается,
если в качестве показателя роста принимается общее
содержание хлорофилла. В этом случае лаг-фаза от-
четлива, а экспоненциальный рост незначителен.
Влияние окружающей среды. Главным условием
существования водорослей, как уже отмечалось, яв-
ляется наличие света, источников углерода и мине-
ральных веществ. Основной средой жизни для боль-
шинства из них служит вода.
В опытах с культивированием одноклеточной мор-
ской водоросли Dunaliella tertioflecta пои 16 °C и по-
стоянном освещении скорость ее роста была достаточ-
но низкой, но при переносе на яркий свет скорость
роста водоросли увеличивалась при одновременном
понижении концентрации хлорофилла. Таким обра-
зом, уменьшение концентрации хлорофилла, как от-
ветная реакция на яркий свет, происходит в резуль-
тате быстрого роста клеток. При слабом освещении
концентрация хлопофилла возрастает, а скорость рос-
та замедляется. При этом 50 % хлорофилла расхо-
139
дуется на рост клеток, а 50 % можно рассматривать
как темновую адаптацию. Происходящие в клетках
Dunaliella при переносе из темноты на свет и обратно
физиологические изменения нельзя рассматривать как
противоположные процессы.
Рост водорослей в культуре весьма зависит от их
специфических требований к питательной среде. Это
можно иллюстрировать результатами исследований
19 штаммов одноклеточных синезеленых водорослей,
относящихся к роду Synechococcus, Synechocystis,
Aphanocapsa, Aphanothece. Способность к росту опре-
делялась на средах с различными углеводами и мно-
гоатомными спиртами при умеренном освещении
(1200 лк) и умеренной концентрации органического
источника углерода в среде (0,5 %). Оказалось, что
у одних штаммов имеет место стимуляция роста, у
других — подавление, у третьих — отсутствие какого-
либо влияния. Поэтому испытываемые штаммы можно
разделить на три физиологические группы: глико-
фильные, гликофобные и штаммы, не реагирующие
на органический источник в среде. Различия в росте
могут служить одним из критериев в систематике си-
незеленых водорослей.
На жизнь водорослей большое влияние оказывают
физические и химические факторы внешней среды.
Несмотря на большую физиологическую пластич-
ность, водоросли разделены на земном шаре на раз-
личные экологические группировки, характеризую-
щиеся более или менее определенным составом.
Наступающие изменения условий существования не-
избежно влияют на их рост и жизнедеятельность. Изу-
чение действия факторов внешней среды имеет важное
практическое значение. Многие водоросли в настоя-
щее время уже используются для очистки промыш-
ленных стоков аммония, фосфатов и других отходов.
Синезеленая водоросль Spiruiina platensis при
выращивании на сточных водах с pH-7,8 растет мед-
ленно, а при разбавлении их очищенной водой — бы-
стрее. Наибольшая скорость роста наблюдается на
среде, содержащей 60 % сточных вод и 40 % чистой
воды с добавлением азота. Клетки этого вида, в от-
личие от других синезеленых водорослей, характери-
зуются высоким содержанием белка, стенкн их легко
перевариваются.
140
На рост водорослей оказывают влияние фитогор-
моны, которые обнаружены в их экстрактах. Показа-
тельны опыты с добавлением в основную среду
Scenedesmus quadricauda гиббереллина, индолилук-
сусной кислоты (ауксина) и кинетина отдельно или
в комбинациях. Установлено, что указанные вещества
стимулируют рост и накопление биомассы. Гибберел-
лин усиливает рост в концентрации 5-10-7 М, эффект
проявляется через 7—14 дней после посева водорос-
ли. Индолилуксусная кислота стимулирует рост в кон-
центрации 10-7—10-6 М. Эффект проявляется только
через 14 дней. Кинетин в концентрации 10-7 и
5-10-7 М увеличивает накопление биомассы на позд-
них фазах роста. Содержание белка под влиянием
регуляторов роста также возрастает. Однако добав-
ленные в различных комбинациях, они стимулируют
образование биомассы в меньшей степени, чем по от-
дельности, хотя содержание белка при этом увеличи-
вается значительно. Регуляторы роста оказывают
влияние и на другие водоросли. Гиббереллин в кон-
центрации 1,0 и 10,0 мг/л стимулирует рост и числен-
ность клеток Nephrochloris sailina.
В опытах с Ascophyllum nodosum гиббереллиновая
кислота положительно влияет на рост в концентрации
(10—20) 10~5 М, а индолилуксусная кислота — в кон-
центрации 10-6 М. Комбинированное же действие их
никакого эффекта не оказывает. Некоторые водорос-
ли, в частности Chlorella fusca, не являются проду-
центами абсцизовой кислоты. Внесение ее в среду
приводит к стимуляции поглощения нитрата, увеличе-
нию скорости темнового дыхания, а фотосинтетическое
выделение кислорода лишь слегка ингибируется при
высоких концентрациях фитогормона. В отличие от
высших растений, в зеленых водорослях этот фитогор-
мон может выполнять стимулирующие функции. Так,
абсцизовая кислота в количестве 10-6 мкг/мл усили-
вает рост и увеличивает общее содержание белка
в клетках ряда зеленых водорослей.
Показательны результаты опытов по действию
5 регуляторов роста (индолил-3-уксусная кислота,
индолил-3-масляная кислота, нафтилуксусная кисло-
та, 2-индолилпропионовая кислота, гибберелловая кис-
лота) на три пресноводные зеленые водоросли. Так,
почти все регуляторы роста в концентрациях 1—
141
20-10—* стимулировали рост Scenedecmus obliquus.
Высокие концентрации (>5-1,0-6) индолилуксусной и
индолилмасляной кислот ингибировали рост Ankistro-
desmus falcatiis. Только индолилуксусная кислота
стимулировала рост Chlorococcum sp. Совместное
воздействие ее и гибберелловой кислоты — на рост
S. obliquus мало эффективно. Индолилуксусная, гиб-
берелловая и индолилмасляная кислоты стимулиро-
вали активность пероксидазы и а-амилазы, а индолил-
уксусная ингибировала сс-амилазную активность S.
obliquus.
На водоросли также неравнозначно действует свет.
В опытах с Ascophyllum nodosum кусочки водоросли
(длиной 5 мм) выращивали при разных режимах
освещения. При светотемновом режиме 16 :8 расте-
ния, взятые из моря зимой, через год образовывали
только вегетативные боковые побеги, а при темносве-
товом режиме 8:16 все вновь появившиеся побеги
имели рецептакулы. Прерывание ночного периода
освещением в течение одного часа белым светом ин-
гибировало на 91 % развитие боковых побегов, тогда
как красный и синий свет задерживали заложение та-
ких структур только у 10 % растений. Таким обра-
зом, фоторежим является одним из основных факто-
ров, регулирующих заложение и развитие репродук-
тивных структур у морских макрофитов.
Ультрафиолетовые лучи оказывают губительное
воздействие на водоросли, причем вегетативные нити
более чувствительны к УФ-свету, чем споры.
При высокой интенсивности света синезеленые во-
доросли (Anabaena cylindrica) накапливают большое
количество каротиноидов и клетки их приобретают
оранжево-желтую окраску. Желтые нити при освеще-
нии образуют значительно больше водорода, чем зе-
леные, выращенные при низкой интенсивности света,
хотя нитрогеназная активность, ответственная за вы-
деление водорода, возрастает в меньшей степени.
Желтые нити выделяют больше О?, чем зеленые, так
как увеличивается активность фотосистемы II. Ряд
водорослей способен синтезировать и накапливать
большое количество каротиноидов, которые придают
этим организмам более или менее интенсивную крас-
ную окраску. Эти вторичные каротиноиды, отличаю-
щиеся от первичных, связанных с ламеллами хлоро-
142
Пласта, называются гематохромом, и главным факто-
ром, контролирующим их биогенез, является свет.
Облучение синезеленых водорослей интенсивным
белым светом (100 Вт/м2) в течение 2 суток приводит
к выцветанию клеток до желто-оранжевой окраски.
В процессе фотовыцветания происходит снижение
концентрации хлорофилла а и фикоцианина при отно-
сительном уменьшении содержания каротиноидов и
увеличении относительного содержания ксантофилла
до 35—65 %• Скорость фотосинтетического выделения
О2 при насыщенных интенсивностях света у обесцве-
ченных водорослей в расчете на сухую массу в 2,5 ра-
за выше, чем у зеленых клеток, а скорость фотосинте-
тического потребления СО2 несколько ниже, чем в
контроле. Фотовыделение Н2, полностью подавлявшее-
ся диуроном, у обесцвеченных водорослей обуслов-
лено нециклическим переносом электронов от воды
при участии обеих фотосистем. Высказывается мне-
ние, что фотовыцветание Anabaena сопровождается
активацией гидрогеназы, акцептирующей электроны
от фотосистемы I.
В опытах с красной водорослью Porphyra tenera
при выращивании в условиях слабого освещения рост
снижался до 20 °/о, но с добавлением в культураль-
ную среду сахаров, особенно арабинозы или солей
органических кислот, водоросли увеличивали темп
роста. Однако при выращивании в полной темноте
такие добавки не стимулировали рост талломов.
Освещение оказывает воздействие на степень ток-
сичности тяжелых металлов. Так, в опытах с Coelas-
trum proboscideum найдено, что влияние ионов цинка
на ингибирование водоросли опосредовано условиями
освещения. При непрерывном облучении в течение
24 ч при совместном присутствии ионов цинка и кад-
мия наблюдается стимулирование роста по сравнению
с контролем (рост в присутствии только ионов кад-
мия). Однако при дискретном режиме освещенности
(16-часовой световой и затем 8-часовой темновой
циклы) ионы цинка усиливают токсическое действие
ионов кадмия на рост водоросли. Исследование влия-
ния сине-зеленого света, являющегося основным при
освещении океанских водорослей, на их пигменты
у 20 видов, относящихся к 6 классам (диатомовым,
динофлагеллятам, хризомонадам, примнезиофитам,
143
зеленым водорослям и криптофитам), показали, что
при низкой интенсивности сине-зеленого света (мак-
симум поглощения — 480 нм) увеличивались концен-
трация хлорофилла (до 100 %) и число хлоропластов
по сравнению с воздействием белого света. Сине-зеле-
ные лучи повышают также фотосинтетическую фик-
сацию СОг и уменьшают распад хлорофилла в старых
клетках.
Температура воды — важнейший фактор общего
географического распределения водорослей и их се-
зонных циклов. Многие водоросли способны перено-
сить большой диапазон колебания температур и
встречаются в разных географических широтах во все
времена года. Однако зона температурного оптимума
для каждого вида ограничена небольшими отклоне-
ниями. Показательны в этом отношении исследования
термотрофных свойств термофильных, лизофильных
синезеленых водорослей. У термофила Mastigocladus
laminosus оптимальная температура роста +55 °C,
у мезофила PJectonema calothricoines +27 °C и у
психрофила Mastigocladus vaginatus----(-4 °C. Выра-
щивание этих водорослей при освещении 5000 лк, по-
стоянном пропускании О2 (95 %) и СО2 (5 %) пока-
зало, что верхний температурный предел для термо-
фила равен +75,8 °C, мезофила +58,7 °C, психрофила
+52,5 °C. Максимум продуктивности синезеленых во-
дорослей наступает во второй половине лета при тем-
пературе воды + 15 °C.
Повышение температуры среды от +20 до +38 °C
приводит к снижению скорости включения 14С в крах-
мал и к увеличению содержания 14С в сахарозе хло-
реллы. В течение 5—10 мин после повышения темпе-
ратуры резко стимулируется конверсия крахмала
в сахарозу. С увеличением продолжительности инку-
бации клеток при +38 °C от 10 до 30 мин наблюда-
лось быстрое накопление 14С-крахмала и относи-
тельно медленное накопление 14С-сахарозы. Крахмал,
синтезированный при +20 °C, лабилен и разрушается
при повышенных температурах, а синтезированный
при +38 °C, сохраняет стабильность как при +20 °C,
так и при 38 °C.
Почвенные водоросли способны переносить резкие
колебания температуры в почве. В опытах многие из
них оставались живыми при очень высокой (до
144
4-100 ЬС) и очень низкой (до —195 °C) температурах.
Наземные водоросли представляют важнейшую со-
ставную часть растительности Антарктиды. Они здесь
темного цвета и поэтому имеют несколько более вы-
сокую температуру, чем окружающая среда.
Опыты по культивированию хлореллы в условиях
космического полета показали, что при 7—10-суточ-
ной экспозиции на орбитальном комплексе никаких
отклонений от контроля не происходило. Однако кос-
мические полеты до 18 сут оказывают очень слабое
летальное действие на клетки развивающейся культу-
ры хлореллы. Невесомость несколько изменяет росто-
вые, морфологические и биохимические процессы.
В условиях полета скорость размножения клеток не
отличалась от скорости размножения на Земле, про-
исходил полноценный прирост биомассы без измене-
ния ее физиологической активности. При последую-
щем культивировании хлореллы, экспонированной в
невесомости, был обнаружен хороший рост, не усту-
павший по скорости от роста наземного контроля.
Обнаруженное увеличение клеток с пониженной жиз-
неспособностью в период лаг-фазы носило обратимый
характер и не сказывалось на росте и развитии куль-
тур водоросли.
Представляют интерес данные о возможности про-
должительной жизнеспособности спор водорослей.
Споры синезеленых водорослей, обнаруженные в дон-
ных осадках пруда на глубине до 60 см, хорошо про-
растают на минеральной среде в лабораторных усло-
виях. Поскольку возраст осадков составляет от 18 до
64 лет, можно считать, что жизнеспособность спор
водорослей исчисляется многими десятилетиями. Уче-
ным удалось оживить гербарный экземпляр синезеле-
ной водоросли (Nostoc commune) после 107 лет хра-
нения.
Водоросли способны выделять антимикробные ве-
щества подобно антибиотикам грибного и микробного
происхождения. Взаимоотношения между водоросля-
ми и бактериями характеризуются как антибиотиче-
скими, так и симбиотическими связями в сообществах
этих организмов. Обусловлены эти взаимоотношения
видовыми особенностями компонентов сообщества и
условиями внешней среды. Обнаружено также, что
наличие в культуральной среде фильтрата старой
146
Рис. 57. Влияние метаболитов некоторых водорослей на рост
Elodca canadensis (по А. И. Сакевич):
/ — Nostoc muscorum, 2 — Microcystis aeruginosa. 3 — среда Фитцжераль-
да, 4 — аквариумная вода
культуры подавляет рост этой же водоросли, т. е. про-
исходит автоингибирование ее роста.
В искусственно созданном сообществе, состоящем
из высших водных растений и культур водорослей,
в большинстве случаев наблюдается угнетение или
полное отмирание одного из компонентов. В опытах
А. И. Сакевич ветка элодеи, помещенная в колбу
с развивающейся культурой Nostoc muscorum, уже
через неделю имела побелевшие листья по всей длине
стебля, а еще через 2 недели ветка распалась на от-
мершие куски и в них развивались культуры ностока
(рис. 57). В контрольных колбах сохранялся нормаль-
ный рост элодеи. Развитие ностока в опыте и контро-
ле практически не отличалось. В то же время ветка
элодеи, помещенная в растущую культуру Microcystis
aeruginosa, губительно влияла на водоросль, которая
через 3 недели полностью отмерла. В местах разви-
тия высших водных растений, как показали Л. А. Си-
ренко с соавт., колонии синезеленых водорослей
встречаю! ся очень редко и в незначительном количе-
стве.
146
Взаимовлияние водорослей и высших водных рас-
тений обусловлено видовыми принадлежностями этих
организмов, их физиологическим состоянием и плот-
ностью популяции. При сравнительно больших биомас-
сах высших растений водоросли бывают угнетены, и
наоборот, при доминировании водорослей высшие
растения находятся в подавленном состоянии. По
мнению А. И. Сакевич, в этом взаимовлиянии глав-
ную роль играют внеклеточные биологически актив-
ные выделения, которые экскректируются растениями
не после их отмирания, а в период наиболее интенсив-
ных физиологических процессов. В единоборстве за
ареал побеждают наиболее активно функционирую-
щие популяции.
Аллелопатически активное воздействие на водорос-
ли оказывает целый ряд органических соединений —
фенолы, безазотистые карбоновые кислоты, органиче-
ские кислоты (аспарагиновая, янтарная, глутамино-
вая), способствующие росту тест-объектов, интенсив-
ности фотосинтетических и репродукционных процес-
сов. Новая теория аллелопатии, предложенная
А. М. Гродзинским и поддержанная рядом авторов,
исходит из способности высших и низших растений
«узнавать друг друга» в сообществе с помощью хими-
ческих веществ, выполняющих роль сигнала, а не сти-
мулятора, который вводит растение в состояние актив-
ной жизнедеятельности или покоя,
3.7. ВТОРИЧНЫЕ МЕТАБОЛИТЫ И ПЕРСПЕКТИВЫ
ИСПОЛЬЗОВАНИЯ
В водорослях содержится ряд веществ вторичного
происхождения, особенно стеринов, хотя и не накап-
ливающихся в большом количестве. Так, у водорослей
Rhodophyta из Чили от 75 до 100 % общей массы
стеринов составляет холестерин. У Ceratium, Gelidium,
Centroceras содержится и десмостерин (соответст-
венно 18, 4 и 1 % всех стеринов). У последней содер-
жится также стигмастерин и ситостерин (соответст-
венно > 4 и < 1 % всех стеринов). У Lessonia фрак-
ция стеринов состоит из фукостерина (89 %) и 2,4-
метиленхолестерина (11 %). Последний обнаружен и
у Gelidium (4 % всех стеринов). Высказывается мне-
ние, что содержание стеринов в водорослях можно
147
использовать в качестве одного из таксономических
признаков.
Разнообразен набор витаминов в водорослях: тиа-
мин, рибофлавин, пантотеновая кислота, цианокоба-
ламин, ретинол и др.
В 1985 г. состоялось Первое Всесоюзное совещание
по промышленному культивированию водорослей, на
котором рассматривались вопросы управляемого био-
синтеза как основы современных биотехнологий ис-
пользования водорослей, а также физиологические и
технологические основы этого процесса. Перспектив-
ным является получение белков (у хлореллы до 75 %
сухой биомассы) при массовом культивировании до
70—75 т/га в год по сравнению с урожаем зерновых,
составляющим для пшеницы 0,3 т/га, для риса —
0,2 т/га. Водоросли содепжат значительное количество
липидов, которое в зависимости от условий культиви-
рования изменяется как количественно (от 30 до
70 % сухой массы), так и качественно.
Разрабатываются аспекты применения водорослей
в питании человека и животных, причем в настоящее
время предпочтение отдается спирулине, синезеленой
водоросли, лишенной плотной целлюлозной клеточной
оболочки (в противоположность хлорелле.). Водоросли
незаменимы при очистке сточных вод промышленных
предприятий. Синезеленые водоросли анабена и но-
сток — фиксаторы атмосферного азота — являются
важным фактором обогащения почвы и стимулятора-
ми роста сельскохозяйственных культур. Бурую во-
доросль Undaria pinnatifida искусственно выращива-
ют устричные хозяйства в лагунах Средиземного моря
и на Дальнем Востоке.
Водоросли Spirulina fusiforma и S. platensis в ес-
тественных условиях интенсивно культивируются в
различных африканских государствах (Кении, Эфио-
пии, Судане, Чаде и др.), а также в ряде европейских
и азиатских стран (например, в ФРГ, Франции, Япо-
нии). Биомасса, богатая белками (50—55 %), амино-
кислотами, витаминами, используется как корм для
домашней птипы, рыб и как удобрение, а после до-
полнительной обработки употребляется в пищу. Эти
водоросли не содержат патогенных микроорганизмов,
могут использоваться для очистки сточных вод и при
вторичном использовании для орошения,
148
Рис. 58. Влияние экзометаболитов Pl. viridis на рост бактерий
(по А. И. Сакевичу):
1 — St. aureus, II — Е. coli, III — Ps. fluorescens; A — гексановая. Б—
бензольная. В — этилацетатная фракции
Многие водоросли содержат токсины (анатоксин а,
эндотоксины, алкалоиды и др.). Поэтому использова-
нию водорослей в пищу предшествуют эксперименты
149
с выделением токсинов и определением их фармако-
логического действия.
Изучение биологической активности экзометаболи-
тов одно1клеточных морских водорослей — зеленой
Piatymonas virides и желтозеленой Nephrochloris
salina проведено А. X. Тамбиевым с соавт. при помо-
щи последовательной экстракции культуральной жид-
кости рядом органических растворителей в порядке
возрастания их полярности. Полученные гексановая,
бензольная и этилацетатная фракция экзометаболи-
тов воздействовали на биотесты. На рис. 58 показано
влияние отдельных фракций экзометаболитов Pl. viri-
des на рост бактерий. Наибольшей активностью обла-
дают метаболиты активно растущей культуры водо-
рослей в логарифмической стадии (12-е сутки) и в
начале стационарной стадии (25—39-е сутки), причем
характер влияния названных фракций на рост бакте-
рий различен. Известны случаи, когда массовое «цве-
тение» в различных водоемах, вызываемое синезеле-
ной водорослью Microcystis aeruginosa, стало причи-
ной отравления крупного рогатого скота.
Некоторые водоросли могут служить хорошими
источниками для получения кальция, железа, иода
(Hydrochi atrus chlatratus, Acanthophora spicifera,
Laurencia papiillosa). Вместе с тем у одного и того же
вида содержание минеральных веществ может варьи-
ровать в зависимости от места произрастания, сезона
года, возраста таллома. Так, концентрация кальция
может достигать 17038 мг на 100 г водоросли, фосфо-
ра — 155 мг/100 г, железа — 224 мг/100 г. Многие ви-
ды несъедобных водорослей рекомендуется использо-
вать в качестве удобрений и для промышленных це-
лей.
Контрольные вопросы и задания. 1. Что отличает синезеленые
водоросли от водорослей других отделов? Какие существуют
взгляды на таксономию этих водорослей? На какие группы под-
разделяют синезелеиые водоросли? 2. Какова кинетика процесса
осморегуляции? Участвуют ли в этом процессе органические сое-
динения? 3. Как характер ионного транспорта влияет иа измене-
ние осмоса клеток? 4. Как влияет резкое повышение или снижение
солености воды иа физиологическое состояние водорослей? 5. На-
зовите хлорофиллы, находящиеся в клетках водорослей разных
отделов. С чем связано это различие? 6. Охарактеризуйте били-
хромпротеиды водорослей. Что представляют собой фикобилины?
7. Какую роль выполняют фитохромы? Чем вызвано образование
физиологически активной н неактивной форм фитохрома? 8. Как
150
влияют оргаиичёские вещества водорослей иа образование хлоро-
филла? В каких случаях под влиянием темновых условий эффек-
тивность синтеза хлорофилла падает, а в каких возрастает?
9. Покажите зависимость между интенсивностью освещения и
содержанием хлорофилла в клетках разных водорослей. 10. По-
чему в клетках водоросли хлорелла, выращенных иа синем свете,
содержание хлорофиллов выше, чем в облученных красным светом?
11. Охарактеризуйте движение электрона по фотосистеме I и фо-
тосистеме II. Какова роль цитохромов и пластохинонов в транс-
порте электронов? 12. В чем причина торможения фотосинтеза при
введении в клетки органических кислот? 13. Цикл Кальвина —
главный путь ассимиляции СО2. Из каких фаз он состоит?
14. Почему растения С4 могут накапливать повышенные запасы
углерода в клетках? Почему этот путь фотосинтеза называют ко-
оперативным? 15. Есть водоросли, фиксирующие углекислоту как
по циклу Кальвина, так и по циклу Хетча — Слэка. Чем объясня-
ется эта их способность? 16. Назовите основные продукты фото-
синтеза у водорослей разных отделов. 17. На чем основана ути-
лизация водорослями гидрокарбоиата вместо СО2? Какой фермент
участвует в этом процессе? 18. Через какие стадии происходит
разрушение хлорофиллов при азотном голодании водорослей?
19. Приведите примеры избирательности различных водорослей к
органическому субстрату. Какое влияние оказывают условия ос-
вещения иа этот процесс? 20. Назовите источники углерода и
азота, используемые хемоорганотрофами. 21. Может ли осущест-
вляться рост хемоорганотрофов в аэробных условиях? Как вли-
яют условия темноты на время перехода их к размножению?
22. Чем объяснить приспособленность хемоорганотрофов к небла-
гоприятным внешним факторам? 23. Как влияет внес ;нне азотных
удобрений иа азотфиксирующую деятельность сииезеленых водо-
рослей? 24. Покажите связь фиксации молекулярного азота с
условиями освещения и температурными факторами. Какие микро-
элементы необходимы для протекания азотфиксации? 25. Водо-
росли с каким типом питания обладают способностью к фиксации
азота в темноте? 26. Назовите аминокислоты, которые могут ис-
пользоваться в качестве источников азота, углерода, азота и угле-
рода, какие аминокислоты не могут служить ни источником уг-
лерода, ни источником азота? 27. Как зависит накопление белка
и аминокислот от спектрального состава света? 28. Назовите водо-
росль, содержащую во много раз больше белка, чем соя, и не
содержащую в клеточных стенках целлюлозу? 29. У водорослей,
как и у грибов, аминокислота лизин синтезируется двумя путями.
Чем они вызваны? 30. Как влияет интенсивность освещения и
спектральный состав иа соотношение жирных кислот и содержание
липидов? 31. Покажите влияние условий культивирования на
содержание жирных кислот. 32. Каковы механизмы и движущие
силы при активном и пассивном поглощении ионов клеткой?
33. Какие элементы являются необходимыми для питания. водо-
рослей, а какие оказывают токсическое действие? 34. В чем состоит
влияние освещенности на интенсивность дыхания? 35. Водоросли
обладают способностью адаптироваться к высокой солености воды.
Чем вызвана эта способность? На какие группы подразделяются
водоросли по этому признаку? 36. Различные водоросли можно
использовать для очистки промышленных стоков. На чем осно-
вывается эта способность водорослей? 37. Водоросли могут по-
151
глотать почвенные гербициды. К каким последствиям это приво-
дит? 38. С чем связано образование сииезелеными водорослями
перекиси водорода? 39. Водоросли С3 н С4 обладают разным уров-
нем фотодыхания. Объясните, с чем это связано. Какова интен-
сивность фотодыхания? 40. Как влияют красный и синий свет иа
дыхание? С чем связано их действие? 41. Чем вызвана синхрониза-
ция процессов развития у автотрофных микроводорослей? 42. При
ярком освещении ускоряется рост клеток с одновременным сни-
жением концентрации хлорофилла. Как объяснить эту закономер-
ность? 43. Назовите физиологические группы сииезелеиых водо-
рослей по отношению к органическому источнику среды. 44. По-
кажите влияние фитогормонов на рост и содержание белка в во-
дорослях. В чем отличие действия абсцизовой кислоты иа высшие
растения н зеленые водоросли? 45. Назовите «сырье> для цикла
Кальвина. На какой стадии происходит фиксация этого материала
и что является конечным продуктом цикла? 46. Скорость погло-
щения минеральных элементов иа свету выше, чем в темноте. Чем
объясняется это различие? 47. Какой опыт надо поставить, чтобы
определить тип углеродного питания — С3 или С4? 48. В чем сход-
ство и в чем различие процессов фотосинтеза и дыхания? 49. По-
чему при дыхании не происходит прямого окисления глюкозы?
50. Растение, использующее глюкозу для дыхания, получает
меньше энергии, чем содержится в этом веществе. Чем это объяс-
нить? 51. Чем объясняется тот факт, что глубоководные водоросли
значительно эффективнее используют энергию света низкой ин-
тенсивности, чем водоросли, произрастающие в верхнем слое воды.
52. Как влияет фрторежим на заложение и развитие репродуктив-
ных органов водорослей? С чем это связано? 53. При выращивании
красной водоросли в условиях слабого освещения добавление в
среду сахаров или органических кислот стимулирует ее рост, а
в условиях полной темноты эти добавки такого воздействия не
оказывают. Объясните причину этого явления. 54. Назовите опти-
мальные температуры для термофильных, лизофильиых и психро-
фильных синезеленых водорослей. Какова степень устойчивости
почвенных водорослей к высоким и низким температурам? 55. Как
влияют условия невесомости иа рост и прирост биомассы хлорел-
лы? 56. Перечислите витамины и вещества вторичного происхож-
дения, образующиеся в водорослях. Каковы перспективы хозяй-
ственного использования водорослей? 57. Какова природа солнеч-
ного излучения, достигающего Земли? Почему все растительные
организмы используют лишь небольшую часть лучистой энергии?
ГЛАВА 4
ФИЗИОЛОГИЯ И БИОХИМИЯ ЛИШАЙНИКОВ
Лишайники — своеобразная группа комплексных
растений. Тело их построено из двух различных орга-
низмов: гетеротрофного гриба и автотрофной водорос-
ли, находящихся в симбиотических отношениях. От-
крытие природы лишайников связано с именем немец-
кого ботаника С. Швенденера. Русские ученые
А. С. Фамицын и О. В. Баранецкий показали, что во-
доросли и грибы, входящие в состав лишайников, по
выделении из него могут расти и размножаться, а при
совместных посевах образовывать лишайники.
Проведенное сравнение природных и синтезирован-
ных слоевищ Usnea strigosa показало, что в искусст-
венных талломах выявлены вторичные лишайниковые
соединения, в частности криптостиктиковая и коннор-
стиктиковая кислоты, которые отсутствовали в при-
родных слоевищах этого лишайника.
Лишайниковое сожительство включает гетеротроф-
ный гриб (микобионт) и автотрофную водоросль (фи-
кобионт). Они находятся в постоянном, исторически
выработавшемся формативном симбиозе, приведшем
к формированию специфических морфологических
форм внешнего и внутреннего строения, т. е. не толь-
ко морфологические, но и физиологические свойства
партнеров получили значительные изменения по
сравнению с таковыми в свободном состоянии. Для
каждого компонента лишайника — гриба и водорос-
ли— характерен особый тип метаболизма (рис. 59).
На примере Peltigera aphthosa показано, что не-
благоприятные условия могут вызывать делихениза-
цию компонентов, которая сопровождается деструкци-
ей клеточных органелл и отмиранием компонентов ли-
шайника. Однако в некоторых пределах распад клеток
и делихенизация обратимы. Возобновление взаимодей-
ствия компонентов лишайника и функционирование его
как единого организма определяется не только обрати-
153
Рис. 59. Схема взаимосвязи ассимиляции и диссимиляции у ли-
шайников (автотрофного фикобионта и гетеротрофного мико-
бионта)
мостью деструкции и восстановлением фотосинтети-
ческой функции доминирующего компонента — фико-
бионта, но и обратимостью распада клеточных орга-
нелл второго, зависимого от него компонента — мико-
бионта. Таким образом, деструкция компонентов ли-
шайника с сохранением жизнеспособности является
одним из механизмов обратимой делихенизации ком-
понентов лишайника в талломе.
Из лишайников семейства Lechinaceae выделены
колонии фикобионта, которые перенесли на среды с
агаром. В основном клетки водоросли встречались по
2—4 и были пронизаны гаусториями гриба, деление
гаусториальных клеток происходило синхронно с де-
лением клеток водоросли.
Физиология и биохимия входящих в лишайник гри-
бов и водорослей во многом отличны от физиологии и
биохимии свободноживущих грибов и водорослей, сви-
детельством чего является синтез продуктов обмена в
лишайниках, отсутствующих у других групп организ-
мов.
Существуют также лишайники, у которых фико-
бионтом выступает не одна, а две водоросли, относя-
щиеся к разным отделам. Так, Peltigera apthosa вклю-
чает зеленые водоросли Соссотуха и синезеленые
Nostoc.
4.1. Взаимоотношения гриба и водоросли в лишайниках
Между микобионтом и фикобионтом (рис. 60) су-
ществуют сложные и еще полностью не выясненные
взаимоотношения. Микобионт лишайника Clodonia
154
Рис. 60. Фнкобнонты лишайников (по М. Н. Эль-Шарони):
1 — Nostoc: а — часть колонии свободиоживущей водоросли, б — водоросль
в слоевище лишайника; 2— Ryvulana: а — часть колонии свободноживу-
щей водоросли; б — водоросль в слоевище лишайника
cristatella в стерильной культуре формирует с десят-
ками видов фикобионта Trebouxia лихенизированные
структуры, образующие основной вторичный про-
дукт — барбатовую кислоту. Взаимоотношения между
компонентами такого искусственно созданного лишай-
ника имеют, очевидно, характер контролируемого па-
разитизма. При этом микобионт формирует лихенизи-
рованные структуры в основном с видами водорослей,
свойственными естественным лишайникам. Однако об-
разование лихенизированных структур происходит
далеко не во всех случаях. Так, этот же микобионт не
образует лихенизированных структур со многими изо-
литами фикобионта Pseudotrebouxia, а также со сво-
бодноживущей водорослью Pleurastrum terrestre. По-
казательно, что у водорослей Trebouxia, выделенных
из таллома лишайника Hypogymnia physodes, при
культивировании на минеральной среде происходит
резкое снижение интенсивности фотосинтеза, умень-
шается выделение фиксированного 14С в среду. Куль-
тивирование этих водорослей на средах с добавлением
лишайниковых кислот (физодовой и усниновой) и
водной вытяжки из лишайника Н. physodes прибли-
жает их физиологические характеристики к симбиоти-
ческому состоянию: наблюдается значительная стиму-
ляция фотосинтеза и выделение 14С в среду при фото-
синтезе. Аналогично действует лишайниковая вытяж-
ка на несимбиотическую водоросль Chlorella vulgaris
и штамм лишайниковой водоросли Trebouxia erici мно-
голетнего культивирования.
155
Существует несколько теорий, объясняющих взаи-
моотношения гриба и водоросли в лишайниках, хотя
еще нет ни одной окончательно доказаной. Согласно
первой, гриб паразитирует на водоросли, согласно
второй, в лишайнике имеет место двусторонний пара-
зитизм гриба на водоросли и водоросли на грибе. По-
явилась еще мутуалистическая теория, согласно кото-
рой гриб и водоросль находятся во взаимовыгодном
симбиозе.
Паразитизм гриба отличается, как правило, уме-
ренным характером, позволяющим нормально разви-
ваться определенной части клеток водоросли. Более
того, гриб проявляет себя как паразитический орга-
низм лишь до тех пор, пока не отомрет водоросль, а
потом переходит на сапрофитное питание, используя
остатки водоросли. Такие отношения гриба и водорос-
ли в лишайнике носят название эндопаразитосапрофи-
тизма. В свою очередь, водоросль получает от гриба
воду, минеральные элементы, азотистые соединения,
т. е. по отношению к грибу водоросль является пара-
зитом, но несравненно более слабым.
Микобионт лишайника Cladonia cristatella форми-
рует чешуйкообразные структуры с 5 видами Trebou-
xia. При этом взаимоотношения у искусственно синте-
зированного лишайника имеют характер контролируе-
мого паразитизма. Микобионт формирует лихенизи-
рованные структуры в основном с видами водорослей,
свойственными естественным лишайникам.
П. А. Генкель выдвинул концепцию симбиоморфо-
за, согласно которой основой симбиоза является об-
мен метаболитами между его компонентами, регули-
руемый лишайником как целым, т. е. подтверждена
теория Б. М. Козо-Полянского, считавшего, что ли-
шайник представляет одновременно ценоз и организм.
Наблюдения в природе и в опытах над образованием
некрозов при переувлажнении у Parmelia physodes и
Xanthoria parietina показывают, что на неблагоприят-
ные условия лишайники реагируют как целое. Во вре-
мя стресса для дыхания после исчерпания доступно-
го пула субстрата начинают использоваться конститу-
ционные вещества, в результате чего наблюдаются не-
крозы. На некотором удалении от некрозов в теле
лишайника наблюдаются картины типичного эндосап-
рофитизма и паразитизма. Гифы гриба внедряются в
156
коричневые уже отмершие гонидии, в более редких слу-
чаях в зеленые. Проявление этих процессов наблюда-
ется только у поврежденных лишайников. Концепция
симбиоморфизма подтверждается и тем фактом, что
выделяемые гонидиями метаболиты в лишайнике и
изолированных культурах различны.
Среди лишайников есть так называемые лишайни-
ковые паразиты. Так, Leciographa niuscigenae строит
свой таллом в талломе хозяина, лишайнике Physcia
musicigenae, где и произрастает в течение всей своей
жизни. Лишайник Lecidea verruca ведет паразитиче-
ский образ жизни на других накипных лишайниках.
Микобионт лишайника Chaenothecopsis consocista па-
разитирует на слоевище Chaenotheca chrysocephala.
Однако паразитический тип питания среди лишайни-
ков встречается редко.
Практическое значение лишайников состоит в том,
что они используются для приготовления медицинских
препаратов, красителей, в парфюмерной промышлен-
ности как обладающие ароматическими свойствами.
Они служат индикаторами загрязнения воздуха, име-
ют определенное кормовое значение, особенно для се-
верных оленей. Съедобны также некоторые лишайни-
ки, произрастающие в степной и пустынной зонах, на-
пример Aspicilia esculenta, содержащий до 55—65 %
оксалата кальция. У лишайника Romalina duriaci,
произрастающего на нижних мертвых ветвях деревьев
Acacia tortilis, содержание белка составляет 7,4 %, а
углеводы составляют более половины — 55,4 % сухой
массы лишайника, в том числе усвояемых — 28,7 %.
В литературе описана также ассоциация лишайни-
ка Usnea strigosa с насекомыми Lanelognatha theralis,
которая, видимо, строится на биологической роли ли-
шайниковых кислот.
4.2. Углеродное питание
В слоевищах лишайников на долю водоросли, яв-
ляющейся единственным источником снабжения орга-
ническими веществами, приходится до 10 % массы.
Процесс фотосинтеза обеспечивает возможность пи-
тания как водоросли, так и гриба. Учитывая, что в
лишайнике лишь небольшая часть тела представлена
водорослью, следовало бы ожидать, что фотосинтез
157
клеток водоросли отличается высокой интенсивностью.
На самом деле это не так. Фотосинтез у лишайников
намного ниже, чем у высших растений. Например, в
сравнении с картофелем интенсивность фотосинтеза
их ниже в 16 раз. Именно этой особенностью прежде
всего объясняется медленный рост лишаиников. кро-
ме того, лишайники большую часть своей вегетации
находятся в высохшем состоянии, когда обменные
процессы крайне подавлены.
Содержание хлорофиллов а и b в фикобионте ли-
шайника, ниже, чем у высших растений. Показатель-
но, что у фикобионтов водорослей рода Trebouxia до
60 % пигмента хлорофилльной природы представлено
феофитинами, образование которых, по-видимому,
связано с биосинтезом лишайниковых кислот. Так, в ли-
шайнике Р. peltigera, не образующем лишайниковых
кислот, феофитинизации пигментов водоросли не наблю-
дается. Однако у свободноживущих водорослей Trebo-
uxia из Physcia stellaris и Trebouxia, выделенных из
лишайников Hypogymnia physodes и Xantoria parien-
tina, наблюдается столь же высокая степень феофити-
низации, как и в лихенизированных водорослях. В тех
же условиях у Chlorella vulgaris и Stichococcus, а так-
же у Соссотуха, выделенной из Peltigera aphthosa,
феофитинизации не наблюдается. Установлено, что
феофитинизации в Trebouxia подвергается как хлоро-
филл а, так и хлорофилл Ь. Поскольку феофитиниза-
ция хлорофиллов присуща как свободноживущим, так
и лихенизированным водорослям рода Trebouxia, то она
может служить для них дополнительным таксономи-
ческим признаком.
Представляют интерес данные об интенсивности
фотосинтеза у лишайников и их изолированных водо-
рослевых компонентов. В перерасчете на содержание
хлорофилла (в миллиграммах) скорость фотосинтеза
у Peltigera leucophlebia и Ramalina farinacea состав-
ляет 30—40 % интенсивности фотосинтеза дисков на
листьях шпината и 20 % интенсивности фотосинтеза
свободиоживущей водоросли Chlorella. При изолиро-
вании фикобионтов из таллома фотосинтез возрастает
у Р. leucophlebia и снижается у R. farinacea. Состав
продуктов его зависит от взаимовлияния водоросли и
гриба. Водоросли, выделенные из талломов, обнару-
живают тенденцию к синтезу органических кислот.
158
Исследование компенсационных концентраций СО2
при фотосинтезе у некоторых видов облиственных и
кустистых лишайников свидетельствует о наличии
большого варьирования, амплитуда которого большая,
чем у сосудистых растений, что может быть связано
с дыханием грибов. Лишайники, содержащие циано-
бактерии или зеленые водоросли, имеют низкий уро-
вень компенсационной концентрации СОг, что опреде-
ляется высокой плотностью поверхности таллома.
Фотосинтетическая активность лишайников в зна-
чительной степени определяется условиями внешней
среды. Оптимум температуры для максимальной ин-
тенсивности фотосинтеза резко падает с возрастанием
географической широты. Обнаружено возрастание оп-
тимума температуры фотосинтеза с увеличением сол-
нечной радиации в июле, дневной температуры, дли-
тельности светового дня. Тепловой оптимум относи-
тельного влагосодержания тканей возрастает с повы-
шением годовой нормы осадков. Интенсивность .фото-
синтеза зависит от концентрации СО2, насыщение СО2
наступает при концентрации 400 мкл/л. Вместе с тем
при высокой оводненности линейная зависимость фо-
тосинтеза сохраняется при более высоких концентра-
циях СО2. Самое низкое значение углекислотного
компенсационного пункта составляет 5 мкл СО2/л.
Действие света на фотосинтез характеризуется кривой
с растянутой вершиной. Обычно максимальная интен-
сивность этого процесса имеет место при освещеннос-
сти от 4000 до 23000 лк. От более высокой освещеннос-
ти лишайники защищены темными пигментами, содер-
жащимися в их корковом слое.
Оптимальная температура для фотосинтеза нахо-
дится в пределах 10—25 ЮС. В отличие от других ти-
пов растений лишайники способны усваивать СО2 при
температуре —10°С и даже —25 °C. Причина этой
особенности еще не выяснена. Максимум температуры,
при которой возможен фотосинтез, составляет +35 °C.
Здесь лишайники явно уступают растениям, у которых
фотосинтез может продолжаться даже при темпера-
туре около +50 °C. Показательно, что предваритель-
ное экспонирование в течение 9 месяцев высушенных
растений при температуре — 25 °C не оказывает влия-
ния на фотосинтез, тогда как низкотемпературная об-
работка водонасыщенных растений может как вызы-
159
вать стимуляцию фотосинтеза, так и приводить к
серьезному повреждению растений в зависимости от
особенностей их экологии.
Лишайники способны также к темновой фиксации
СО2. Так, у Peltigera aphthosa она составляет 17—
20 % световой фиксации, чему способствует темновая
активность нитрогеназы. Изолированные как мико-,
так и фикобионты способны к темновой фиксации.
У дисков лишайников НСО2 в темноте наиболее интен-
сивно включается в оксалоацетат, аспартат, малат и
фумарат, а в фосфоглицериновую кислоту, аланин,
цитруллин замедленно или незначительно.
Необходимым условием для фотосинтеза является
достаточная обеспеченность водой. Поскольку у ли-
шайников отсутствует всасывающая и проводящая си-
стемы, воду они впитывают всей поверхностью своего
тела во время дождя, тумана, росы, причем в очень
больших количествах (от 100 до 3000 % сухой массы
слоевища). Однако эта влага быстро теряется. Нахо-
дящиеся на солнце лишайники в течение часа полнос-
тью теряют поглощенную ими воду, и их влажность
снижается до 2—15 % сухой массы, что ниже необхо-
димого минимума для фотосинтеза. Таким образом, пе-
риод активной фотосинтетической деятельности у ли-
шайников очень ограничен, если учесть комплексное
воздействие факторов внешней среды на процесс фото-
синтеза.
Эта особенность их жизнедеятельности сказывает-
ся на распределении энергии возбуждения между фо-
тосистемой I и II. Опыты С. Вьёрна и О. Гуннара по-
казали, что у высушенных образцов лишайников С1а-
donia trecha и зеленой водоросли Trebouxia pyriformis
изолированной из лишайника Cladonia squamosa, в
эмиссионном спектре флуоресценции заметно увеличи-
ваются полосы дальнего красного F—715 по сравне-
нию с полосами коротких волн F—685 и F—697, но
при этом соотношение между полосами коротких волн
не изменяется. После увлажнения этих видов восста-
навливаются их свойства нормальной флуоресцентной
эмиссии, что свидетельствует об их устойчивости к вы-
сушиванию.
У нелишайниковой водоросли Scenedesmus, взятой
в качестве вида, не переносящего высушивания, также
обнаруживается после высушивания увеличение поло-
160
сы флуоресценции дальнего крайнего по сравнению с
двумя коротковолновыми полосами, но при увлажне-
нии первоначальный спектр флуоресценции не восста-
навливается. Следовательно, у устойчивых видов высу-
шивание вызывает преимущественное распределение
энергии в фотосистему I, чем предохраняется деструк-
ция фотосинтетического аппарата в сухих условиях.
Это также позволяет организму избегать образования
сильнодействующих вредных оксидантов в фотосисте-
ме II при ингибировании фотосинтеза. Обезвоживание
у лишайников вызывает значительную потерю К и Mg,
причем при последующем инкубировании этих лишай-
ников во влажных камерах они полностью или частич-
но восстанавливают исходную локализацию катионов.
Низкая относительная влажность уменьшает пере-
нос энергии от хлорофилла b к хлорофиллу а, ингиби-
рует транспорт электронов, снижает способность вос-
становительной части фотосистемы II удерживать
электроны и ослабляет вызванную дальним красным
светом флуоресценцию. Энергия от дополнительных
пигментов (фикоцианина, фикоэритрина) к хлорофил-
лу а переносится лишь при относительно высокой
влажности. При высоком содержании воды в лишай-
нике поглощение СО2 подавляется, а после некоторой
потери влаги наблюдаемый фотосинтез увеличивается
до максимума, после чего снова снижается при после-
дующем высыхании таллома.
Исследования изменений фотосинтетической актив-
ности в течение года показали, что в зимний период в
искусственных условиях установлена малая скорость
истинного фотосинтеза и быстрое усиление его весной
с повышением температуры. Развитие древесного по-
лога над лишайником вызывает увеличение его фото-
синтетической способности. Скорость дыхания при
этом заметно снижается, т. е. интенсивность фотосин-
теза может быть высокой и в условиях очень слабой
освещенности. Это изменение в способности к фото-
синтезу связывается с синтезом дополнительных ме-
таболитов при низкой освещенности или затемнении.
Реакция фотосинтеза на влажность субстрата, тем-
пературу и освещенность у популяций лишайника Pel-
tigera из арктического климата постоянна, а у попу-
ляций из умеренного климата летнее повышение тем-
пературы и освещенности вызывает резкое усиление
6 783
161
фотосинтеза. Это изменение скорости фотосинтеза обя-
зано температурной акклиматизации и сезонным из-
менениям ферментативной системы в цикле Кальвина
(см. рис. 41).
Самая высокая интенсивность фотосинтеза (как и
дыхания) наблюдается в молодых, активно растущих
частях таллома. Так, у кустистого лишайника Cladina
stellaris у одногодичных веточек интенсивность фото-
синтеза равна 0,76 мг°/о/ч на 1 г сухого вещества, а у
пятнадцатилетних она составляет всего 0,02 мг%/ч.
У веточек старше 15 лет скорость фотосинтеза меньше
0,01 мг%. Вместе с тем наблюдается увеличение био-
массы веточек с возрастом, однако после 9-летнего
возраста биомасса остается более или менее постоян-
ной. Биомасса веточек в возрасте 5 лет составляет все-
го 18 % биомассы всего слоевища, но эти веточки от-
вечают за 50 % фотосинтетической активности. Наб-
людается определенная корреляция между изменени-
ем цвета слоевища и возрастом, сопровождающаяся
падением фотосинтетической активности, что находит-
ся в прямой зависимости от концентрации хлорофил-
лов а и Ь.
Характерно, что малые (1 %) концентрации О2 в
воздухе стимулируют скорость истинного фотосинтеза
соответственно на 45—55 %. Эффект стимуляции, вы-
зываемый подавлением фотодыхания, количественно
зависит от содержания воды в талломах лишайников.
Сопоставление скорости светового и темнового выде-
лений СО2 при дефиците О2 показывает, что 70 % СО2
рефиксируется внутри талломов лишайников. Отсутст-
вие эффекта стимуляции при малом содержании О2
в воздухе и высокой оводненности талломов являет-
ся результатом высокого сопротивления диффузии
СО2, поддерживаемого внутриталломной рефиксацией
СО2.
Для восстановления фотосинтеза у растений, хра-
нившихся в сухом состоянии в течение 5 недель, тре-
буется после увлажнения 2 ч. При ежедневном ув-
лажнении в течение 4 ч восстановление фотосинтеза
сокращается до 11 мин.
В лишайниках находится и большое число различ-
ных каротиноидов. По данным В. Кзекзуга, у лишай-
ников Peltigera содержатся: ликопин, а-каротин, р-ка-
ротин, С-каротин, p-каротинэпоксид, нейтроспорин,
162
р-ксантил, эхиненон, кантаксантин, любеинэпоксид,
антераксантин, ликофил, ликоксантил, зеаксантин, изо-
ксеаксантин, рубиксантин, астаксантин, эфир астак-
сантина, виолоксантин, ауроксантин, мутахром, мута-
токсантин, гидроксикаротин, дегидроксиликопин. Наи-
более часто встречаются p-каротин, зеаксантин, люте-
ин и астаксантин. Общее количество каротиноидов ко-
леблется от 1,33 до 8,05 мг/г сухой массы. Часть каро-
тиноидов синтезируется фикобионтами, часть — мико-
бионтами.
4.3. Минеральное и азотное питание
Минеральные элементы накапливаются в слоевище
лишайника в весьма значительных количествах. Так,
в напочвенном лишайнике Diploschistes scruposus со-
держание цинка в слоевище достигает 9,3 % сухой
массы. Высокое содержание в лишайниках серы, свин-
ца, олова, кадмия, железа, кальция, натрия, алюми-
ния, хлора и других элементов, количественный и ка-
чественный состав которых зависит от их природных
источников и обусловливается межвидовым варьиро-
ванием. У лишайников, произрастающих на марганце-
вых и железных рудах, обнаружены различные типы
кристаллов марганца, сопоставление которых с крис-
таллами синтетического оксалата Mapi анца показало
их рентгеноструктурную идентичность. Есть сведения,
что лишайники поглощают уран. Биологическое зна-
чение повышенного содержания минеральных элемен-
тов у лишайников не изучено.
Важное значение в их питании имеет азот. У ви-
дов, имеющих в качестве фикобионта зеленые водо-
росли, этот элемент поступает из водных растворов
при пропитывании слоевища водой. Не исключено, что
часть азота лишайники берут непосредственно из суб-
страта почвы, коры деревьев и т. д. Виды, имеющие в
качестве фикобионта синезеленые водоросли (Nostoc),
способны фиксировать и атмосферный азот. Как по-
казано в опытах с симбиотической ассоциацией Antho-
ceros—Nostoc он превращается в аммоний, а затем в
глутамин и глутамат при участии глутаминсинтетазы
и глутаматсинтетазы. Показательно, что в сравнении
со свободноживущими культурами Nostoc выделенные
из симбиотической ассоциации цианобактерии ассими-
6*
163
лируют лишь небольшую часть (20 %) аммония, обра-
зуемого из фиксированного азота. Непосредственно в
симбиотической ассоциации около 90 % этого аммо-
ния поступает в ткани Anthoceros.
Лишайники обычно произрастают на бедных азо-
том субстратах. Фиксированный водорослью, этот
элемент в своем большинстве направляется грибу, ко-
торый, как полагают, усваивает и распределяет азоти-
стые соединения. Лишайник Peltigera aphthosa, име-
ющий два фотосинтезирующих симбионта, имеет
определенные преимущества в освоении обитаний с низ-
кой освещенностью. У Peltigera aphthosa основной фо-
тосинтезирующий партнер — Соссотуха, выделяющий
рибитол, а мембранный потенциал мало отличается от
свободиоживущей водоросли, не выделяющей риби-
тол. Фиксированный Соссотуха СОг выделяется в ви-
де рибитола, который служит основным источником
питания микобионта. Второй симбионт — Nostoc так-
же фотосинтетически активен. Цефалодии лишайника,
т. е. выросты различной формы, содержащие Nostoc,
выделяют СОг; среди первичных продуктов фиксации
СО2 преобладает ФГК. Изолированные же цефалодии
мало выделяют фиксированного СО2. После изоляции
цефалодии фиксируют N2 в течение нескольких дней,
но менее интенсивно, чем без нарушения связи с тал-
ломом. Внутри основного таллома поглощенный N2
распределяется между Соссотуха и гифами гриба.
В темноте изолированные цефалодии поглощают N2 и
восстанавливают С2Н2 дольше, чем свободноживущий
фикобионт.
Лишайники способны накапливать в своем слоеви-
ще и радиоактивные элементы, причем в количествах,
губительных для высших растений.
Исследования азотного обмена у лишайников свя-
заны с целым рядом трудностей, так как из-за эко-
логических стрессов они весьма экономно относятся к
питательным веществам. Поглощают их лишайники
всеми доступными способами, но метаболизируют
крайне медленно. Поэтому активность большинства
ферментов у лишайников низка. И. А. Шапиро при
изучении способности восстанавливать нитраты уста-
новил, что нитратредуктаза индуцируется у них лишь
после инкубации на растворе нитрата и его актив-
ность составляет не более 0,4 мкг NO2 в 1 мин-1. Та-
164
кой же низкой оказалась активность глутаминсинте-
тазы — фермента первичной ассимиляции аммония.
Не исключено, что низкая активность ферментов азот-
ного обмена у лишайников частично объясняется при-
сутствием в их слоевищах уникальных соединений —
лишайниковых веществ.
В гидролизатах лишайников определено 20 неза-
менимых аминокислот, хотя у некоторых видов (Cet-
raria caperata, Cladonia rangi.rerina и др.) содержится
16 аминокислот, причем преобладающими являются
глутаминовая, аспарагиновая кислоты, аланин, трео-
нин, лейцин и валин. В биомассе лишайников связан-
ных аминокислот обнаружено в три раза меньше, чем
в биомассе зеленых, синезеленых, желтых водорослей
и шляпочных грибов. Содержание аминокислот в сво-
бодном виде соответствовало их содержанию в водо-
рослях. В биомассе лишайников не обнаружены Y-ами-
номасляная и орнитин, а в гидролизатах — пролин.
Водоросли, выделенные из таллома лишайников,
очень скоро после изоляции изменяют свои физиоло-
гические характеристики. Так, при культивировании
Trebouxia, выделенной из лишайника Hypogymnia
physodes, обнаружены органические кислоты, целый
ряд аминокислот, сахароза, глюкоза и рибит. После
7-дневного культивирования их на питательной среде
способность выделять вещества по сравнению с непо-
средственно выделенными из таллома водорослями
сильно уменьшается, особенно при 24-часовом пребы-
вании в воде, когда способность к выделению веществ
снижается в 4 раза (рис. 61).
В целом непосредственно выделенные водоросли
экскретируют 12—20 % от всего фиксированного угле-,
рода, а культивируемые — лишь 4—7 %.
Вместе с тем культивирование этих водорослей на
средах с добавлением вытяжки из лишайника или чис-
тых лишайниковых кислот приближает их физиоло-
гию к симбиотическому состоянию; у них значительно
усиливается фотосинтез, что представляет большой
интерес. Показательно, что аналогичным образом дей-
ствует лишайниковая водоросль и на несимбиотичес-
кую хлореллу.
Лишайники из семейства Parmeliaceae содержат в
основном низкомолекулярные легкорастворимые бел-
ки — до 8,27 % в пересчете на сухую массу. Высоко-
165
Метионин
Pulum
Сахарова
Органические кислоты
^Аланин
Глцтамино-
бая
кислота
Глицин
Аспараги-
ноВая
кислота
/Минин
Аланин
Рибит
Лизин
Органические кислоты
Глутаминовая
/с кислота
АспарагиноВая
" кислота
а
Рис. 61. Схема двумерной хроматограммы спирторастворимой
фракции Trebouxia из Н. physodes:
а — фотосинтетические продукты водоросли, выделенной из таллома; б —
соединения, выделенные из водоросли после пребывания в воде 24 ч
молекулярные белки имеются в незначительном коли-
честве— от 0,07 до 1,55 %. Согласно существующим
представлениям о преобладании у филогенетически
древних форм растений крупномолекулярных белков,
можно говорить об эволюционной продвинутости этих
лишайников.
- 4.4. Обмен веществ лишайников
Содержащиеся в лишайниках вещества подразде-
ляют на первичные и вторичные. К первичным отно-
сятся вещества, участвующие в клеточном обмене и
в строении тела, к вторичным — клеточные продукты
обмена веществ, называемые еще лишайниковыми
кислотами.
Первичные вещества в основном представлены угле-
водами, обмен которых протекает так же, как и у дру-
гих растений. В гифах лишайников обнаружены хитин
(характерен для большинства грибов) и полисахарид
лихенин, называемый еще лишайниковым крах-
малом.
В некоторых лишайниках (Cetraria islandica, Alec-
toria ochroleuca) количество последнего доходит до
45—50 % на сухое вещество. При его гидролизе обра-
зуется 98—99 % D-глюкозы, остатки которой связаны
166
Рис. 62. Смесь полимеров амилозы и амилопектина в лихеиине
в лихенине двояким образом — 73 % гликозидными
связями между 1-м и 4-м и 27 % —гликозидными свя-
зями между 1-м и 3-м углеродными атомами (рис. 62).
Синтез лихенина в лабораторных условиях еще не
осуществлен. Организм человека лихенин не усваива-
ет. Его можно использовать в качестве желирующего
вещества в кондитерской промышленности, в приго-
товлении ягодных киселей. Лихенин усваивается се-
верными оленями благодаря гидролизу бактериями,
находящимися в пищеварительном канале.
В оболочках гиф содержатся гемицеллюлозы, в
межклеточных пространствах — пектиновые вещества,
которые, впитывая воду, вызывают набухание слоеви-
ща. В относительно большом количестве (до 5 % воз-
душно-сухой массы) содержатся дисахариды (сахаро-
за, а-трегалоза) и полиспирты (маннит, эритрит, си-
фулин).
Лишайники содержат много ферментов — амилазу,
инвертазу, уреазу, каталазу, лихеназу и другие, в том
числе и ферменты внеклеточного действия.
Активность ферментов, участвующих в обмене ве-
ществ и находящихся в микобионте лишайников, не-
одинакова. Она зависит от их видовых особенностей.
Уреазная активность у лишайников весьма значитель-
на. Например, у Cladonia verticillata 75 % уреазной
активности сосредоточено в фикобионте. Протеолити-
ческая активность у лишайников с синезеленым фико-
бионтом выше в сравнении с видами, где фикобионтом
является зеленая водоросль. Нитрогеназная актив-
ность обнаруживается не у всех лишайников, где фи-
кобионтами являются зеленые водоросли. А у лишай-
ников с синезеленым фикобионтом она, в зависимос-
167
О — Na О—Na O-Na
I I I
Na—О —P--P-~P-O-Na
II II II
ООО
Рис. 63. Структурная формула
полифосфатов
ти от вида, колеблется
от 0,2 до 52 нмоль/г/
мин. У представителей,
фиксирующих азот, его
содержание всегда вы-
ше, чем у видов, не
фиксирующих этот эле-
мент. Активность каталазы лишайников проявляется в
диапазоне pH от 5 до 11, а оптимум находится при
значениях pH 6,5—8,5. Изменяется катализная актив-
ность прямо пропорционально содержанию воды в
слоевище.
У лишайников, фикобионтами которых являются
значениях pH 6,5—8,5. Изменяется каталазная актив-
ность полифосфокиназа, с участием которой осуществ-
ляется синтез полифосфатов, высоко энергетических
соединений низших растений (рис. 63).
У нескольких видов лишайников обнаружена нит-
ратредуктазная способность, причем наибольшая ак-
тивность характерна для эпифитного лишайника Lo-
baria pulmonaria. Его таллом состоит из трех симбион-
тов: гриба, который имеет то же название, что и весь
лишайник, зеленой водоросли Myrmecia и синезеле-
ной водоросли Nostoc. Способностью восстанавливать
нитраты обладает как грибной, так и водорослевый
компонент L. pulmonaria (рис. 64). При опрыскивании
лишайника нитратом активность нитратредуктазы в
первые 5 дней повысилась вдвое и до конца опыта ос-
тавалась на постоянном уровне (рис. 65). Таким обра-
зом фермент индуцируется у лишайника нитратом. При
опрыскивании лишайникового таллома водой нитрат-
редуктазная активность достигает почти того же уров-
ня с опозданием на 5 дней.
Богаты лишайники и витаминами, в числе которых
аскорбиновая и никотиновая кислоты, биотин, циано-
кобаламин и др.
Вторичные лишайниковые вещества, на долю кото-
рых приходится до 5 % сухой массы, представляют со-
бой безазотистые соединения фенольного характера,
близкие по своей природе к дубильным веществам рас-
тений, но более простого строения. Общее их количе-
ство достигает 270, из которых около 80 встречаются
только в лишайниках. Для определения содержания
и распределения лишайниковых веществ использует-
168
Рнс. 64. Распределение ак-
тивности нитратредуктазы
между симбионтами ли-
шайника Lobaria pulmona-
ria (по Л. Фризу):
а — интактный таллом; б —
фракция, обогащенная микобн-
оитом; в — фракция, обогащен-
ная фикобионтом
Рис. 65. Влияние нитрата иа
активность нитратредуктазы у
Lobaria pulmonaria по Р. Гои-
елу и М. Севарду):
а — опрыскивание водой; <0 — оп-
рыскивание 0,01 М KNO3
ся метод цветной катодной люминесценции. Так, нор-
соминовая кислота обладает оранжевой люминесцен-
цией, ксанторин — красной, лихексантин — желтой.
Вторичные лишайниковые вещества характеризуются
значительной пруроченностью к определенным ли-
шайникам. Так, у лишайника Rhizocarpon superficial
выделено 13 веществ, в том числе констиктовая, стик-
товая, морстиковая, исоромовая, гидрофоровая, ризо-
карповая, тетроновая кислоты, а также 6 неидентифи-
цированных веществ. У одного и того же вида есть
расы со значительным преобладанием той или иной
лишайниковой кислоты. На этом основании у лишай-
ника Cetraria olivetorum выделено 4 хематаксона, ко-
торые иногда рассматриваются как самостоятельные
виды: С. cetrarioides с преобладающей кислотой —
перлатовой, С. monochorum — имбрикаровой, С. chiei-
tae — алектороновой, С. olivetorum — оливеторовой.
Лишайниковые кислоты почти нерастворимы в во-
де, но растворяются в этиловом и петролейном эфире,
бензоле, ацетоне и щелочах. Одни из них бесцветны,
другие, напротив, окрашены в желтый, красный, бу-
рый, или черный цвета и почти все имеют горький вкус.
Хорошо изучена леканоровая кислота (CieHuOz),
содержащаяся в представителях рода Arthonia. Она
169
о
II
CH,
он
I
CHSCO-HC< --------^^С-СНз
I I
H C0-CH3
Рис. 66. Структурная формула усниновой кислоты (по В. Рипа-
чеку)
близка по своему строению к простейшим дубильным
веществам типа депсидов. Ее искусственно синтезиро-
вали из орселиновой кислоты, являющейся производ-
ной орцина. В лишайниках семейства Russulaceae со-
держится эритрин (С20Н22О10) — сложный эфир четы-
рехатомного спирта эритрита с леканоровой кислотой.
Протоцетратовая кислота (CigHuOg) содержится во
многих лишайниках обычно в форме соединения типа
эфира с двумя остатками фумаровой кислоты.
Некоторые лишайниковые кислоты ядовиты. К ним,
в частности, относятся вульпиновая (С19Н14О5) и хри-
зопетраровая (С19Н14О6). Усниновая кислота
(СгвН^О?) обладает сильным антибактериальным
действием и используется как антибиотик, угнетающий
рост туберкулезных бактерий (рис. 66).
Многие лишайники, произрастающие на древесине,
делают ее устойчивой к поражению дереворазрушаю-
щими грибами. Связано это с переходом лишайнико-
вых кислот в древесину. Опыты Н. Тихи и В. Рипаче-
ка с лишайником Parmelia physodes, собранным с ко-
ры сосны, показали, что при добавлении его в пита-
тельную среду, инокулированную затем деревораз-
рушающими грибами, происходило значительное ин-
гибирование их роста (рис. 67). Parmelia physodes со-
держит также фракцию аморфных лишайниковых ве-
ществ, представляющих гетерогенную смесь веществ,
не являющихся настоящими лишайниковыми кислота-
ми и обладающих высоким ингибирующим действием.
Так, относительная скорость роста гриба Heterobasi-
dion annosum на питательной среде, содержащей
аморфные лишайниковые кислоты, ингибируется на-
много сильнее, чем его рост на среде с физодовой ли-
шайниковой кислотой (рис. 68). Если аморфные ли-
шайниковые кислоты, находящиеся в агаровой среде
в концентрации 1 :800, полностью ингибируют рост
170
Рис. 67. Ингибирующее воздействие
лишайников на дереворазрушающие
грибы (по В. Рипачеку)
Рост гриба Serpula lacrymans за 7 дней
при t=23°C на агар-солодовой среде с
добавлением размолотого лишайника Раг-
melia physodes: /—0,25 г; 2— 0,5; 3 —
1,0; 4 — 2,0; 5 — 3,0 г на 100 мл среды
(ненумерованная чашка — контроль)
гриба, то физодовая лишайниковая кислота не оказы-
вает такого действия даже в концентрации 1 : 200, вы-
зывающей снижение скорости роста только на 22 % по
сравнению с контролем.
Отдельные виды
лишайников, в част-
ности Parmelia sul-
cata, не вызывают
заметного ингибиро-
вания роста дерево-
разрушающих гри-
бов, что связано с об-
Рис. 68. Зависимость относительной
скорости роста гриба Heterobasidion
annosum от содержания физодовой
кислоты (ф) и аморфных лишайни-
ковых кислот (а) в агар-солодовой
среде (по Н. Тихи и В. Рипачеку).
Абсцисса — концентрация кислоты в среде,
ордината — скорость роста грнба, выра-
женная в процентах скороостн роста кон-
трольной культуры гриба
разованием в ходе
метаболизма специ-
фических лишайни-
ковых кислот со сла-
бой токсичностью.
Лишайниковые кис-
лоты по своему стро-
ению принадлежат к
171
различным группам химических соединений, среди ко-
торых есть алифатические моно-, ди- и трикарбоновые
кислоты, дериваты пулвиновой кислоты и кумарона,
производные тиофаниновой кислоты, депсиды, депси-
доны и другие соединения. Практически каждый вид
лишайника имеет определенную типичную группу про-
дуктов метаболизма, определяющую степень его инги-
бирующего влияния на рост грибов и бактерий.
Синтез лишайниковых веществ связан с деятель-
ностью как фикобионта, образующего углеводы, так и
микобионта, превращающего углеводы в другие соеди-
нения. Показано, что некоторые лишайниковые кис-
лоты приближают физиологические характеристики
культивируемых водорослей к симбиотическому со-
стоянию, т. е. эти соединения, видимо, участвуют в ре-
гуляции взаимоотношений лишайниковых симбионтов.
Однако, учитывая отсутствие в настоящее время мето-
дов, позволяющих выделить из лишайника ненарушен-
ные гифы микобионта, свободные от водорослей, про-
ведение таких исследований затруднено. В этой связи
использование культивируемых микобионтов представ-
ляется перспективным как для познания биосинтеза
лишайниковых кислот, так и для выявления роли во-
доросли в формировании таллома лишайника.
Биологическая роль лишайниковых кислот до кон-
ца не изучена. Одни исследователи полагают, что
эти вещества предохраняют лишайники от поедания
животными, другие — что от поражения бактериями,
третьи считают их отходами обмена веществ. Кроме
того, высказывается предположение, что лишайнико-
вые вещества являются запасными соединениями. Спо-
собность некоторых из них подавлять рост грибов,
мхов, снижать всхожесть семян обеспечивает лишай-
никам преимущества в конкуренции за места обита-
ния.
Лишайниковые кислоты оказывают влияние на
проницаемость растительных мембран, в том числе
лишайниковых .водорослей. Высокой устойчивостью к
лишайниковым кислотам, в частности к усниновой кис-
лоте, которая является сильным антибиотиком, обла-
дает Trebouxia. Изучена динамика действия трех ли-
шайниковых кислот на вымывание органических
веществ из этой водоросли. Характерно, что это дейст-
вие проявляется достаточно быстро (уже после 3-ча-
172
совой экспозиции) и ярче всего у физодиевой кислоты.
На 8-е сутки, однако, все кислоты действуют практи-
чески одинаково.
Показательно, что лишайниковые кислоты влияют
на проницаемость водорослевых мембран селективно,
резко стимулируя выход органических веществ, необ-
ходимых грибу-симбионту. Этим они отличаются от
грибных токсинов, с помощью которых грибы- пара-
зиты получают питательные вещества из клеток расте-
ния-хозяина. В образовании лишайниковых веществ,
как полагают, ключевыми факторами являются темпе-
ратура и освещенность. Наличие сезонной динамики в
содержании лишайниковых кислот свидетельствует о
том, что эти соединения являются активными метабо-
литами. Подтверждением активного участия лишай-
никовых веществ в обмене может служить и тот факт,
что эти соединения не накапливаются с возрастом ли-
шайника. Образование некоторых лишайниковых ве-
ществ используется в таксономии лишайников. Содер-
жание одних лишайниковых веществ (вульпиновая
кислота) выше всего в самых молодых частях слое-
вища (до 5,7 % на сухую массу) и ниже всего в ста-
рых (до 1,7 % на сухую массу), а других (астронарин)
выше всего в старых базальных частях слоевища.
4.5. Рост и действие на ростовые процессы
условий окружающей среды
Ростовые процессы у лишайников протекают очень
медленно. Скорость роста у разных видов различна и
зависит от действия внешних факторов.
Наиболее медленно растут накипные лишайники. Их
ежегодный прирост составляет 0,5—1 мм. Кустистые
виды вырастают за год на 2—7 мм, крупнопластич-
ные — на 1—3 см. В начале развития лишайники рас-
тут более интенсивно, так как образуемые фикобион-
том органические вещества равномерно распределяют-
ся по всему слоевищу. Далее рост замедляется или да-
же прекращается. Нередко слоевище в центральной
части отмирает, а на периферии рост продолжается.
В связи с медленным ростом лишайники живут
очень долго, так как значительную часть своей жизни
они находятся в высушенном состоянии, аналогичном
состоянию покоя у высщих рсстений. Обычно их воз-
173
раст достигает 50—100 лет. Накипные лишайники до-
стигают возраста 1000 лет, возраст слоевищ Rhizocar-
pon geographicum до 4000 лет. Большая продолжи-
тельность жизни лишайников используется для опре-
деления минимальных возрастов субстратов. Лихено-
логия нашла наиболее широкое применение при да-
тировке моренных образований современных ледни-
ков, селевых потоков, обвалов, времени образования
осыпей, береговых валов и террас.
На рост лишайников оказывают влияние условия
освещенности, температуры, влажности. Эти факторы
прежде всего действуют на фотосинтетическую актив-
ность. Одним из показателей реакции организма на
изменение условий водного и температурного режимов
у экологически различных видов является изменение
каталазной активности. Активность каталазы лишай-
ников проявляется в диапазоне pH от 5 до 11, а ее
оптимум находится при значениях pH 6,5—8,5. Уста-
новлено, что каталазная активность лишайников из-
меняется прямо пропорционально содержанию воды в
слоевище.
Теплоустойчивость лишайников весьма различна и
зависит от их местообитаний, причем обнаружить ее
можно по активности фермента. Этот показатель ре-
комендуется использовать для экологической харак-
теристики видов.
Химический анализ коры деревьев и снеговой во-
ды, выполненный Л. Н. Мартиным и Е. Нильсоном, по-
казал, что в районе г. Таллина имеет место кислотное
загрязнение, а в Кохтла-Ярве — преобладает щелоч-
ное. В результате изменения pH коры деревьев уста-
новлены значительные различия во встречаемости ли-
шайников и в характере распространения различных
видов в этих районах.
Для лишайников характерна адаптация к услови-
ям их произрастания. Например, оптимум температу-
ры для фотосинтеза антарктических лишайников ле-
жит ниже 0 °C, а у лишайников, обитающих на поверх-
ности скал на южных склонах гор в Японии,— выше
+20 °C.
С увеличением влажности таллома темновое дыха-
ние и фотосинтез возрастают. Затем темновое дыха-
ние, вплоть до насыщения таллома .водой, остается на
постоянном уровне, а фотосинтез при дальнейшем уве-
174
личении влажности обнаруживает депрессию после
достижения максимального поглощения СО2, причем
повышенная температура вызывает более сильную
депрессию фотосинтеза.
Особой чувствительностью обладают лишайники к
загрязнению воздуха промышленными отходами, дей-
ствие которых обратно пропорционально расстоянию
от источника загрязнения. Лишайники накапливают
тяжелые металлы, содержащиеся в атмосферных
осадках в 2—5 раз больше, чем высшие растения, при-
чем эпифитные — интенсивнее, чем напочвенные. При
повышенной загрязненности, встречающейся не толь-
ко в промышленных центрах, но и в зеленых зонах,
окружающих города, в ботанических садах, парках и
скверах, рост лишайников прекращается и они исче-
зают. Первыми гибнут кустистые лишайники, за ни-
ми листовые, а затем и накипные.
Опыты по выращиванию лишайников в лаборатор-
ных условиях в течение 65 дней при различной кон-
центрации SO2 (от 0,3 до 300 мг/л) и H2S (10-мг/л),
показали, что при последующем их погружении в деи-
онизированную дистиллированную воду на 2 мин они
выделили в нее значительно больше электролитов, чем
контрольные растения, т. е. обнаружено значительное
увеличение проницаемости клеточных мембран для
электролитов.
Для выявления тенденций изменения состава ат-
мосферных загрязнений исследовали содержание свин-
ца в образцах лишайников, собранных в период с
1907 по 1980 г. в штате Мэриленд (США). Установле-
но, что в настоящее время содержание свинца у всех
лишайников значительно выше, причем очень сильное
влияние на концентрацию свинца оказывают выхлоп-
ные газы автомобилей. Наименьшая концентрация
свинца обнаружена у лишайника Cladina subtennis,
т. е. благодаря особенностям морфологической струк-
туры этот вид способен регулировать аккумуляцию
свинца тканями.
Для лишайников характерна различная чувстви-
тельность к тяжелым металлам в невысоких количест-
вах. Уже в концентрации 1-1Q-4 М раствора ZnSO4,
наблюдается подавление фотосинтеза у Peltigera ho-
rizontalis (фикобионт — синезеленая водоросль Nos-
toc). У всех видов с синезеленым фикобионтом ско-
175
рость фотосинтеза уменьшалась в пределах от 11 до
40 % после обработки раствором Zn концентрацией
1 • 10-3 ЛА. В то же время у лишайников с зеленым
фикобионтом наблюдалось после такой же обработки
только небольшое снижение или даже повышение
скорости фотосинтеза. Такая различная чувствитель-
ность лишайников не зависит от общей концентрации
цинка и других тяжелых металлов, содержащихся в
слоевище лишайников. Н( отличается высокой чувст-
вительностью и их грибной компонент, так как виды
одного рода, имеющие близкие метаболиты, но разные
фикобионты, например Lobaria pulmonaria и L. scro-
biculata, сильно различаются по чувствительности к
тяжелым металлам.
Накопление фторидов у лишайников Cladonia гап-
giferina и С. stellaris при максимальном загрязнении
атмосферы достигает 2830 мг/кг сухой массы расте-
ния, а в контроле — 6,4 мг/кг. Первые же симпто-
мы поражения (обесцвечивание) фторидами обна-
руживаются при концентрации 25 мг/кг. У лишайника
Xanthoria parietina содержание фтора колеблется от
158 мг/кг массы в 3 км от заводов до 1 мг/кг массы
в 22 км от источников загрязнения. Концентрация фто-
ра в талломах зависит от направления преобладающих
ветров. Визуальные повреждения лишайников наблю-
даются, если концентрация фтора превышает 68 мг/кг
массы. Внутриталломные повреждения обнаруживают-
ся при содержании более 90 мг/кг массы. При более
высокой концентрации фторидов побеление становит-
ся выраженным сильнее, затем появляется коричне-
вый оттенок и весь таллом приобретает коричневый
цвет.
Пагубно влияют на лишайники другие атмосфер-
ные загрязнители — сероводород, оксиды азота, оксид
углерода, соли тяжелых металлов. Многолетнее
воздействие промышленных эмиссий приводит к
образованию так называемых лишайниковых пустынь.
Последние оконтуривают промышленные узлы медно-
никелевой и алюминиевой промышленности, занимая
территории до 200 км2. В. В. Крючков относит эту тер-
риторию к первой зоне с полной деградацией экосис-
тем. Во второй зоне сильно разрушенных экосистем
встречаются наименее чувствительные к загрязнению
воздуха накипные эпифитные лишайники родов Leca-
176
nora, Haematomma и другие, а также некоторые на-
земные кустистые лишайники родов Stereocaulon, Cet-
raria и другие. Эта зона начинается обычно в 4—6 км
от промышленных узлов, занимая значительно боль-
шие площади, нежели первая (от 450 до 1000 км2).
В третьей зоне частично разрушенных экосистем рас-
тут все виды накипных лишайников на камнях и дере-
вьях. Напочвенные кустистые лишайники (Cetraria,
Clarionia, Stereocaulon) в этой зоне все еще угнете-
ны. Начинают встречаться эпифитные, преимущест-
венно листовые, лишайники родов Hypogymnia, Раг-
melia, Parmeliopsis. Площадь этой зоны — до
50000 км2.
Лишайники могут накапливать в своем слоевище
определенные вещества в довольно большом количест-
ве. Подобная особенность известна и для других ор-
ганизмов, например высших растений, но количество
токсических веществ в лишайниках гораздо лучше
коррелирует с таковым в атмосфере, чем, например,
в изучавшихся в этом плане свекле или кукурузе. Ус-
тановлено, что летальная доза сернистого ангидрида
для лишайиков составляет примерно 0,03 мг/м3 воз-
духа.
При исследовании влияния водных растворов суль-
фитов, сульфатов, нитритов и нитратов на культиви-
руемые фикобионты найдено, что при pH=4 нитраты
и сульфаты не оказывают токсического действия, но
вызывают четкие видоспецифические реакции у рас-
тений. У одних видов растений характер реакций фи-
кобиоита аналогичен реакции интактного таллома
лишайника, у других — наблюдается меньшая чувстви-
тельность или, наоборот, меньшая толерантность фи-
кобионта к загрязнителю.
Получены данные, свидетельствующие о том, что
загрязнение атмосферы двуокисью серы способствует
разрушению фонда хлорофиллов в лишайниках и из-
менению сотношения хлорофиллов а и Ь у лишайни-
ков в естественных условиях произрастания. Назван-
ные параметры состояния пигментной системы могут
служить тестами для установления степени загрязне-
ния среды.
При улучшении чистоты воздуха вследствие за-
крытия промышленных производств или переведения
их на работу по замкнутому циклу (т. е. с использо-
177
ванием отходов) наступает вторичная иммиграция ос-
новных эпифитных лишайников, которые заселяют
разнообразные субстраты. Происходит это лишь через
4—6 лет после прекращения загрязнения воздуха и,
видимо, связано с окончательным исчезновением за-
грязнителей из субстратов.
Под влиянием загрязнения воздуха наряду с на-
рушением физиологии развития лишайников происхо-
дит заметное изменение морфологоии таллома. На
участках с большой нагрузкой загрязнения становит-
ся очевидным, что нарушается не жизнеспособность
отдельных партнеров лишайника, а их способность
организовывать таллом. Особенно чувствительны края
таллома. Для каждого лишайника имеется определен-
ное значение нагрузки, при котором таллом нормаль-
но развивается. При увеличении загрязнения воздуха
сложное и взаимное равновесие партнеров в талломе
нарушается, так что только части лишайника, а не
организованный таллом могут существовать дальше.
Эта особенность лишайников — их чрезмерная чув-
ствительность к загрязнению атмосферы — в настоя-
щее время уже находит применение для определения
зон воздействия промышленных выбросов и, как след-
ствие, для создания новой технологии производства,
основанных на замкнутом цикле и активизации работ
по охране природы. В Швейцарии, например, выделя-
ют зоны чистоты воздуха по частоте встречаемости,
степени покрытия и устойчивости лишайников к дан-
ному типу загрязненности. В США установлен нацио-
нальный стандарт качества окружающего воздуха с
3 классами территорий по этому показателю. Этот за-
конодательный акт принят с учетом результатов про-
веденных лихенологических исследований, показав-
ших значительное ухудшение состояния окружающей
среды, Лишайники используются как биологические
индикаторы загрязнения и во Франции; на карты на-
носят результаты загрязнений в виде концентрических
зон вокруг источников загрязнения. В условиях горо-
да этот метод хотя и не .всегда дает удовлетворитель-
ные результаты, но позволяет делать важные фитоце-
нотические обобщения. Наиболее результативным вы-
ходом таких исследований загрязнения атмосферного
воздуха являются различного типа лихеноиндикацион-
ные картосхемы.
178
С помощью лишайников можно проследить, на-
сколько поддерживается контроль за загрязнением,
если проводить повторные исследования в тех же мес-
тах через определенные промежутки времени.
Вследствие большой кумулятивной способности ли-
шайники, накапливая токсические вещества, обнару-
живают морфологические изменения, которые легко
заметить. В последнее время широкое распростране-
ние получил метод инфракрасной фотографии для
оценки состояния лишайников. Разработаны также ла-
бораторные методы по оттоку калия и уменьшению
скорости фотосинтеза.
Большое значение имеет изучение загрязнения ли-
шайников радионуклидами, в частности радиоактив-
ным цезием и стронцием. Кроме того, лишайники час-
то применяют для изучения распространения и накоп-
ления редкоземельных элементов, а также для мони-
торинга загрязнения более чем 30 различными элемен-
тами.
Степень повреждаемости лишайников промышлен-
ными отходами с большой точностью определяется с
помощью флюоресцентной микроскопии. Так, для во-
дорослевых клеток лишайника Hypogymnia physodes,
инкубированных в растворах сульфитов в лаборатор-
ных условиях, или для растений, трансплантирован-
ных в естественные местообитания с различным уров-
нем загрязнения атмосферы, характерна следующая
флюоресценция. У неповрежденных клеток — красная
при освещении ультрафиолетовыми лучами или синим
светом. У поврежденных клеток последовательно ме-
няются коричневая, оранжевая и белая — в зависимос-
ти от степени повреждения. Метод флюоресценции по-
зволяет быстро, с высокой чувствительностью и на
малом количестве материала определить степень по-
вреждения клеток.
Действие SO2 на лишайники можно учитывать так-
же по проценту плазмолизированных водорослевых
клеток. У ряда лишайников степень влияния загрязне-
ности воздуха сернистым ангидридом можно учиты-
вать по двум параметрам, а именно — по степени
плазмолиза водорослевых клеток и по проценту пло-
щади клеток гиф, пораженных бактериями.
Электронно-микроскопические исследования позво-
лили установить происходящие под воздействием про-
179
мышленных отходов, в частности SO2 н соединений
азота, определенные изменения в клетках фикобионта
и микобионта. В клетках водоросли хлоропласты из-
меняют форму с дисковидной на округлую, у них зна-
чительно уменьшается количество цитоплазмы и по-
являются темные тельца внутри вакуолей. У повреж-
денных клеток микобионта отмечается ненормально
сильная вакуолизация, капли цитоплазмы значитель-
но уменьшаются или совсем отсутствуют. Грибные ва-
куоли часто содержат темные скопления, которые не
встречаются у неповрежденных лишайников.
У лишайников, подвергшихся комплексному воз-
действию поллютантов SO2, NOX, NH4, F, происходит
быстрая дегенерация клеточных органелл фико- и
мнкобионтов в результате плазмолиза клеток, хрони-
ческого нарушения формы хлоропластов, сморщива-
ния митохондрий, увеличения плотности водорослевых
клеток, возрастания .вакуолизации и появления тем-
ных вакуолярных скоплений в клетках мнкобионтов.
Внешние факторы обусловливают и морфологичес-
кие вариации лишайников, особенно кустистых, прояв-
ляющихся в форме роста, степени беловатого налета
оксалата кальция, числе водорослевых клеток на еди-
ницу сухой массы слоевища, толщине стенок гиф и в
других признаках.
Дейтвие озона на лишайники зависит от их видо-
вых особенностей. Так, при озоновом стрессе у Pseudo-
parmelia caperata наступает подавление фотосинтеза,
а у Ramalina manziesii ингибирование фотосинтеза от-
сутствовало. Повышенная концентрация озона в есте-
ственных условиях обитания является причиной мало-
го распространения некоторых лишайников.
Контрольные вопросы и задания. 1. Чем отличаются микоби-
оит и фнкобнонт от свободножнвущнх грибов и водорослей? По-
чему фикобионтом могут выступать в одном лишайнике разные
водоросли? 2. Выделенная из лишайника водоросль продолжает
фотосинтезировать. В какую сторону изменяется интенсивность ее
фотосинтеза? Чем это вызвано? 3. Охарактеризуйте теории, объ-
ясняющие взаимоотношения гриба и водоросли в лишайника/
В чем проявляется паразитизм гриба н паразитизм водоросли?
4. Какими критериями следует пользоваться при искусственном
создании лишайников? 5. Объясните концепцию симбиоза у ли-
шайников. Кто ее автор? 6. Что представляют собой лишайнико-
вые паразиты? 7. Охарактеризуйте хозяйственное значение ли-
шайников. 8. Почему интенсивность фотосинтеза у лишайников
намного меньше, чем у высшнх растений? 9. В чем состоит овд.
J80
чне лишайников от высших растений по составу и количеству
пигментов? 10. Каковы отлнчня лншайннков от высшнх растений
по нх потребности в кислороде, воде, температуре, освещенности?
11. Лишайники способны к темновой фиксации СОг. Объясните,
почему это происходит. 12. Как влияет высушивание лишайников
на деятельность фотосистемы I и фотосистемы II? Влияет лн
обезвоживание на содержание макроэлементов в лишайниках?
13. Назовите каротиноиды лишайников, в том числе наиболее
часто встречаемые. 14. Какие элементы накапливают лишайннкн
в своем слоевище? Каким путем поступает азот в лишайники?
15. Чем вызваны различия во встречаемости лншайннков в раз-
личных районах? 16. Лишайники часто растут на голых скалах.
Как в этом случае осуществляется нх минеральное питание? Могут
лн они участвовать в почвообразовании? 17. Какие параметры у
лишайников могут служить тестами для установления степени за-
грязнения среды? Как влияет загрязненность воздуха на способ-
ность организовывать таллом? 18. Какой метод можно использо-
вать для определения степени повреждения лншайннков промыш-
ленными отходами н в чем его достоинство? 19. Может ли воз-
никать плазмолиз в водорослевых и грибных клетках лишайника
и изменяться форма хлоропластов? Если да, то в каких случаях н
каковы последствия этого? 20. Каково содержание связанных
аминокислот в лишайниках в сравнении с водорослями и грибами?
Какие аминокислоты не обнаружены в биомассе лншайннков?
21. Как влияет на фотосинтез выделенной из лишайника водорос-
ли внесение лишайниковых кислот? 22. В лишайниках содержатся
первичные и вторичные лишайниковые вещества. Чем онн отлича-
ются? 23. Объясните, чем вызвано различие в активности фермен-
тов лншайннков. 24. Какова природа вторичных лишайниковых
веществ? В чем заключается биологическая роль лишайниковых
кислот? Чем отличаются онн от грибных токсинов? 25. Что под-
разумевается под покоем лншайннков? В чем отлнчие покоя ли-
шайников от покоя высших растений? 26. Как преодолевают
лишайннкн воздействие низких температур н засухи? 27. Охарак-
теризуйте лишайники как биологические индикаторы загрязнения.
Чем вызвана эта нх особенность?
ЗАКЛЮЧЕНИЕ
Низшие растения обладают уникальными полезны-
ми для человека свойствами. Однако в их познании и
широком использовании, несмотря на некоторые опре-
деленные успехи, сделано еще крайне недостаточно.
В одном грамме почвы существуют многие тысячи ви-
дов низших грибов и водорослей. Это поистине несмет-
ные сокровища. В медицине уже наступила эра новой
индустрии, без которой не обходится практически ни
одно лекарство, будь то антибиотики, витамины, гор-
моны, ферменты, антираковые препараты, средства для
повышения свертываемости крови.
Сложной и ответственной задачей, стоящей перед
физиологией и биохимией низших растений является
глубокое изучение особенностей обмена веществ на
разных этапах развития организмов, всестороннее по-
знание влияния на их жизнедеятельность различных
условий внешней среды. Выявление этих закономерно-
стей в теоретическом и экспериментальном подходах
позволит создавать для культивирования организмов
оптимальные условия, обеспечивающие получение наи-
большего количества хозяйственно ценных органиче-
ских соединений путем направленного изменения про-
цессов обмена веществ.
Здесь открыто широкое поле деятельности, ибо по-
лезные, нужные человеку свойства низших растений
выявлены еще очень слабо, а многие из них просто не
известны, поскольку громадное их большинство физио-
лого-биохимическими исследованиями не охватыва-
лось. Важно подчеркнуть и ту особенность, что для
многих низших организмов характерен чрезвычайно
высокий обменный процесс, в десятки и сотни раз пре-
вышающий обмен высших растений, т. е. ценные про-
дукты питания н фармакологические препараты можно
производить быстрее и дешевле. Так, главный путь
получения лимонной кислоты основан на использова-
182
нии штаммов плесневых грибов, культивируемых на
сахарных растворах по специальной технологии.
Большие перспективы открывают исследования ме-
ханизмов наследственной информации, роли мембран
в системах регуляции, т. е. углубление экспериментов
на субклеточном и молекулярном уровнях. Именно по-
этому резко ускоряются исследования по новым на-
правлениям биотехнологии — разработке технологии
слияния протопластов разных видов в целях получе-
ния высокопродуктивных гибридов, использовании им-
мобилизованных ферментов, способных к сверхсинтезу
антибиотиков, витаминов, коферментов, органических
кислот и других соединений. В перспективе интересные
исследования особенностей физиологии и обменных
процессов сконструированных методами генетической
инженерии новых организмов.
Развитие современной физиологии и биохимии низ-
ших растений находится в тесной связи с молекулярной
биологией, микологией, альгологией, микробиологией,
лихенологией, другими разделами биологии, что по-
зволяет решить многие важные, увлекательные зада-
чи. С еди них глубокое познание, расшифровка до мо-
лекулярного уровня всех основных процессов жизне-
деятельности с целью активного управления ими для
повышения продуктивности. В этой связи возрастаю-
щее значение приобретает выделение чистых культур
низших растений из всех возможных мест их произ-
растания, определение перспективных штаммов по ин-
тенсивности их роста, ферментативной активности,
содержанию органических веществ, в том числе спе-
цифических по своему строению и воздействию на дру-
гие организмы.
Надо сказать, что здесь мы встречаемся с залежа-
ми непочатой работы, ибо объектами исследований
физиологии и биохимии долгий период служили глав-
ным образом высшие растения и животные. И хотя
уже много сделано в познании физиологии и биохимии
низших растений, тем не менее уровень их изученно-
сти еще отстает. Вместе с тем сильное варьирование,
присущее одним и тем же низшим растениям зачастую
делает необходимым выполнение физиолого-биохими-
ческих исследований на десятках и даже сотнях штам-
мов данного вида. Важное значение приобрела охра-
на низших растений, в том числе занесенных в Крас-
183
ную книгу, устранение отрицательного действия на них
промышленных отходов, разработка быстрых и точ-
ных методов количественного определения продуциру-
емых ими органических веществ — продуктов питания
и лечебных препаратов.
Дефицит белка можно значительно снизить, выра-
щивая ценные съедобные грибы на отходах сельско-
хозяйственного и лесного производства — хлопчатника,
риса, льна, конопли, древесины, соломы, жома, сахар-
ной свеклы, сахарного тростника и т. д. Быстрорасту-
щие штаммы грибов перспективны для получения бел-
ковых кормов для животноводства.
Решение этой проблемы тесно связано с активным
развитием промышленного грибоводства. Переход на
интенсивные способы выращивания плодовых тел шам-
пиньона, вешенки, опенка зимнего или получение су-
хого мицелия позволяет круглогодично получать цен-
ные продукты питания. Наличие же у этих грибов ак-
тивного лигно-целлюлозолитического ферментного ком-
плекса делает возможной утилизацию трудноусвояе-
мых отходов. К примеру, отходы хлопка Орешек-5,
скапливающиеся на хлопчатобумажных комбинатах
могут служить, как показано донецкими, микологами,
Ценным субстратом для промышленного культивирова-
ния вешенки обыкновенной. Получаемые после сбора
урожая отходы являются ценной белково-витаминной
добавкой к корму сельскохозяйственных животных.
Разработка эффективной технологии выращивания
водорослей с учетом их способности к фиксации азота
и выделению водорода, а также очистки воды от орга-
нических и минеральных веществ, превращения пести-
цидов в неядовитые соединения даст огромный эконо-
мический эффект. В странах Европы, Америки и осо-
бенно на Востоке не менее 100 видов водорослей упо-
требляется в пищу и используется как весьма полезная
добавка к растительным кормам, дефицитным по не-
заменимым аминокислотам и витаминам. Ламинария,
хлорелла, спирулина содержат незаменимые амино-
кислоты в количестве, отвечающем лучшим белковым
стандартам, установленным ФАО и отличаются высо-
кой продуктивностью. Урожайность спирулины, куль-
тивируемой в замкнутой системе из полиэтиленовых
труб в расчете на год превышает выход пшеницы при-
мерно в 10 раз. Высокая практическая значимость во-
184
дорослей также свидетельствует об актуальности все-
сторонних физиолого-биохимических исследований
этих организмов.
Заслуживает пристального внимания применение
лишайников для охраны природы как индикаторов чи-
стоты атмосферного воздуха в городских условиях и
на промышленных предприятиях. Уникальная способ-
ность к симбиотическим отношениям между некоторы-
ми грибами и водорослями, приведшая к образованию
лишайников, продуцирующих специфические органи-
ческие вещества, имеет важное значение для глубокого
познания механизма обменных процессов, в том числе
связанных с получением лечебных препаратов.
На очереди интенсификация исследований взаимо-
отношений грибов, водорослей, лишайников и других
компонентов биоценозов, определяющих состояние эко-
системы в целом. Низшие растения — самый удобный
объект для всестороннего изучения молекулярной био-
логии и биотехнологии, повышения продуктивности
растительных организмов.
СПИСОК РЕКОМЕНДУЕМОЙ ЛИТЕРАТУРЫ
Энгельс Ф. Диалектика природы//К. Маркс, Ф. Энгельс.
Соч. — 2-е изд. — Т. 20. — С. 343—676.
Балнокин Ю. В., Медведев А. В. Транспорт Na+, К+
и Н+ через плазмалемму К+ дефицитных клеток галофильной
водоросли Dunaliella maritime // Физнол. раст.— 1984. — Т. 31,
№ 5. — С. 805—809.
Беккер 3. Э. Физиология грибов и их практическое ис-
пользование.— М.: Изд-во Моск, ун-та, 1963.— 193 с.
Биосинтетическая деятельность высших грибов /
А. Н. Шиврина, О. П. Мезковская, Н. Н. Фалина и др. — Л.,
Наука, 1969.— 112 с.
Боидарцев А. С. Трутовые грибы Европейской части
СССР и Кавказа. — Л.: Наука, 1953. — 725 с.
Вайнштейн Е. А., Тахтаджян Е. А. Физиологические
изменения у лишайниковой водоросли Trebouxia при культивиро-
вании//Фнзнол. раст. — 1981. — Т. 28, №5. — С. 1037—1044.
В а кин А. Т. Хранение круглого леса. — М.: Лесн. пром-сть,
1964, —98 с.
Влияние цианобактерий Chlorogloeopsis fritschii иа рост
и биосинтетическую активность клеток паслена в смешанной
культуре/О. А. Горелова, Ржержабек И., Корженевская Т. Г.
н др.//Физнол. раст.— 1985. — Т. 32, №6. — С. 723—730.
Водоросли, лишайника и мохообразные СССР/Л. В. Га-
рибова, Ю. К. Дундин, Т. Ф. Коптяева и др. — М.: Мысд., 1978.—
365 с.
Галимова Л. М., Антонов А. С. ДНК недрожжевидных
грибов//Молекулярные основы геноснстематики. — М., 1980.—
С. 112—120.
Гусев М. В., Никитина К. А. Цианобактерии.— М.: На-
ука. 1979.—232 с.
Гусев М. В., Корженевская Т. Г., Ягодина И. Б.
Ассоциированная культура клеток табака Nicotinia tabacum н
цианобактерии Anacystis nidulans // Физнол. раст. — 1982.— Т. 29,
№3, —С. 550—556.
Денисова Н. И. Природа и биологическая роль протеиназ
базидиальных грибов//Микология и фитопатология.— 1984.—
Т. 18, №2. — С. 116—121.
Жданова Н. Н., Василевская А. И. Экстремальная
экология грибов. — К.: Наук, думка, 1982.— 168 с.
Жизнь растений: В 6 т./Под ред. А. А. Федорова.— М.:
Наука, 1975—1977. — Т. 2. — 1975. — 478 с.; Т. 3. — 1976. — 488 с.
Избранные главы физиологии растений / В. Ф. Гаври-
186
ленко, М. В. Гусев, К. А. Никитина и др.—М.: Изд-во Моск,
ун-та, 1986. — 440 с.
Курс низших растений / Под ред. М. В. Горленко. — М.:
Высш, шк., 1981. — 520 с.
Биохимия/Н. Е. Кучеренко, Ю. Д. Бабенюк, А. Н. Васильев
и др. — К-: Выща шк. Изд-во Киев, уи-та, 1988. — 431 с.
Мартин Л. Н., Ннльсон Е. Воздействие загрязнения
воздуха на лишайники: кислотные и щелочные загрязнители//
Взаимодействие между леэкосистемами и загрязнителями: Тез.
докл. I Сов.-амер. снмп. по проекту 02.03—21.— Ленинград; Тал-
лин; Пущино; 1982. — С. 53—54.
Негруцкий С. Ф. Корневая губка. — М.: Агропромиздат,
1986.— 196 с.
Панкратова Е. М. Фиксация атмосферного азота сине-
зелеными водорослями в природных условиях // Ботанич. жури. —
1973. — Т. 58, № 3. — С. 628—635.
Плакунова В. Г., Власова Т. А. Ультраструктуриые
изменения при обратимой делихеиизации компонентов лишайни-
ка Peltigera aphthosa. — Изв. АН СССР. Сер. биол. — 1985,
№3. — С. 345—351.
Полевой В. В. Физиология растений. — М.: Высш, шк.,
1989. — 494 с.
Регуляция фотосинтетического выделения кислорода ка-
тионами у сннезелеиых водорослей / Е. Л. Барский, М. В. Гусев,
Н. В. Казеинова и др.//Докл. АН СССР.— 1983. — 3.—
С. 745—748.
Рост ассоциативной культуры клеток женьшеня и циано-
бактерии Chlorogloea fritschii иа свету и в темноте / Р. Г. Бу-
тенко, М. В. Гусев, Т. Г. Коржевская и др.//Физиол. раст.—
1982. — Т. 29, № 5. — С. 995—1001.
Рубин Л. Б. Свет и развитие низших организмов. — М.:
Знание, 1975. — 38 с.
Сакевич А. И. Экзометаболиты пресноводных водорос-
лей. — К.: Наук, думка, 1985. — 200 с.
Сиреико Л. А., Козицкая В. Н. Биологически актив-
ные вещества водорослей и качество воды. — К.: Наук, думка,
1988. —256 с.
Топачевскнй А. В., Масюк Н. П. Пресноводные водо-
росли Украинской ССР. — К-: Внща шк. Головное изд-во, 1984.—
334 с.
Фотосинтез облнгатноацидофильной водоросли Cyani-
dium caldarium: зависимость от pH и формы неорганического
углерода / О. Ю. Сеицова, Н. И. Романова, Л. И. Мииеева и др. //
Докл. АН СССР. — 1982. — 3. — С. 762—765.
Шапиро И. А. Нитратредуктазная активность лишайника
Lobaria pulmonaria//Физнол. раст. — 1985.—Т. 32, №3.—
С. 501—505.
А1 i о 11 a G., Р о 11 i о A. Long term effects of copper upon
physiological processes and growth of Chlorella saccharophila and
Cyanidium caldarium//J. Bot. ital.— 1982. — Vol. 116, N3—4.—
P. 123—129.
A n g a d i S. В.. В h a r a t i S. I. Nitrogen fixation and pro-
duction of extracellular nitrogen by Hapalosiphon confervaceus
187
and Nostoc microsporium// Beitr, Biol. Planz.— 1983. — Vol. 58,
N 2. — P. 205—209.
Birmingham В. C., Coleman J. R., Colman B.
Measurement of photozespiration on in algae//Plant Physiol.—
1982. — Vol. 69. N 1. — P. 259—262.
Cifferi O. Let them eat algae//New Sci.— 1981. — Vol. 91,
N 1212, —P. 810—813.
Davies F. B. Accumulation of fluoride by Xantoria parietina
growing in the vicinity of the bedfordshire brickfields//Environ.
Pollut. — 1982, —Vol. A29, N3. —P. 189—196.
Falkowski R. 1. Kinetics of adaptation to irradiance in
Dunaliella tertiolecta//Photosynthetica.— 1984. — Vol. 18, N 1.—
P. 62—68.
Ford D. Revolutionary concepts in evolutionary cell biology//
Trends Biochem, Science. — 1980. — Vol. 5, N 6. — P. 212—220.
Fries D. Studies in the physiology of coprinus // Svensk.
Bot. Tidsk. — 1976. — Vol. 50. — P. 183—190.
Fries L. Vanadium an essential element for some marine
macroalgae//Planta — 1982. — Vol. 154, N 5. — P. 393—396.
Goal R., Seaward M. R. D. Metal uptake in terricolous
lichent//New Phytop.—1981, —Vol. 89, N4. —P. 631—645.
Heath R. L., Frederick P. E., C h i m i к 1 i s P. E. Ozon
inhibition of photosynthesis in Chlorella sorokoniana // Plant
Physiol. — 1982. — Vol. 89, N 1. — P. 229—233.
Holopainen T. H. Ultrastructurel changes in epiphytic
lichens Bryoria capillaris and Hypogymnia physodes, growing
near a fertilizer plant and a pulp mill in central Finland//Ann.
bot. fenn. — 1983.— Vol. 20, N2. —P. 169—185.
Jones T., Morris 1. Effect of prolongen darkness on the
patterns of’photosynthesis in antractic diatoms//Antarct. J. US —
1983, —Vol. 18, N5. — P. 183—185.
Kremer В. P., К i r s t G. O. Biosynthesis of Photosynthetic
and Taxonomy of Algae//L. Naturforsch.— 1982. — Vol. C 37,
N9. — P. 761—771.
Krflger G. H. J., Eloff S. M. Effect of CO2 and HCO"
on photosynthetic oxygen evolution by Mycrocystis aeruginosa//
L. Pflanzen physiol. — 1983. — Vol. 112, N3. —P. 231—236.
Laczka L., Barabis K. Hydrogen evolution by photo-
bleached Anabaena cylindrica//Planta — 1981. — Vol. 153, N 4.—
P. 312—316.
Larsson M., Ingemarsson B., Larsson С. M.
Photosynthetic energy for NO3 assimilation in Scenedesmus//
Physiol. Plant. — 1982. — Vol. 55, N 3. — P. 301—308.
Levin R. A. Prochlorophyta // The prochiorophytes. Proka-
ryotes.—Vol. L —Berlin, 1981, —P. 257—266.
Matsuhiro B., Urzua A. Sterols of some Chilan algae//
Biochem. Syst. and Ecol.— 1984. — Vol. 12, N 2. — P. 145—147.
Millard R. E. V. Rhodella maculata Sulphate Uptake in
the Unicellur Marine Red Alga Rhodella maculata // Arch. Micro-
biol. — 1982.—Vol. 131, N 2. — P. 165—169.
Montalbini P., Buchanan В. B. Rates of photosynthe-
sis of two lichens and of their isolated algae components // G. bot.
ital.—1981. —Vol. 115, N23. —P. 77—82.
Nacamura V., Miyachi S. Change in Starch photo-
188
sinthesized al different temperatures in Chlorella // Plant Sci.
Lett — 1982. — Vol. 27, N 1. — P. 1—6.
Okazaki I., Shinmen T., Tazawa M. Turgor regula-
tion in a brackish Charophyte Lamprothomnium succinetum//Plant
and Cell Physiol. — 1984. — Vol. 25, N4. —P. 573—581.
Prasad P. V. Effect of some growth substances on three
freschwater green algae//Cryptogamie Alyol.— 1982. — Vol. 3,
N 4. — P. 315—321.
Rees T. F. Sodium dependent photosynthetic oxygen evolu-
tion in a marine diatom//J. Exp. Bot. •-1984.— Vol. 35, N 152.—
P. 332—337.
R i v к i n R. B., Swift E. Phosphate uptake by the oceanic
dinoflagellate Pyrocystis nostiluca//J. Phycol. — 1982. — Vol. 18,
N 1. —P. 113—120.
S a h u J. K-, A d h i к a г у S. P., P a 11 n a i к H. Effect of
organic substrates on chlorophyll and carotenoid production of
Anabaena sp. under light and dark conditions//J. Indian Bot.
Soc. — 1979. — Vol. 58, N 4. — P. 358—362.
Schiirmann P., Ortiz W. Photosynthetic activiti of iso-
lated chloroplasts from Euglena gracilis // Planta. — 1982. —
Vol. 154, N 1. —P. 70—75.
Tian-ching G., F a-z h u W. Spiruiina platensis. Studies
on H2 evolution by Spiruiina platensis // Hydrobiologia. — 1984. —
Vol. 116—117, —P. 467—470.
Ulrich S. Zur Salzresistenz limnischer Blanalgen // Wiss.
Beitr. M. Luther—Univ. Halle — Wittenberg. — 1982. — Vol. 17.—
P. 363—366.
Vaischampayan A. Amino acid nutrition in the blue-
green alga Nostoc muscorum // New Phytol. — 1982. — Vol. 90,
N 3. — P. 545—549.
Whittaker R. H. New concepts of kindoms of organisms//
Science— 1969, —Vol. 168, —P. 168—170.
ОГЛАВЛЕНИЕ
Введение ............................................... 3
Глава 1. Филогенез низших растений и положение их в
мире живых существ...................................... 7
Контрольные вопросы и задания...........................15
Глава 2. Физиология и биохимия грибов .... 16
2.1. Питание грибов...................................... 17
2.1.1. Усвоение углеродсодержащих веществ ... 18
2.1.2. Потребность в минеральных элементах ... 22
2.1.3. Потребность в витаминах......................22
2.1.4. Специализация питания........................23
2.2. Дыхание.......................................... 29
2-3- Синтетическая деятельность •......................35
2.4. Разложение органических веществ....................50
2.5. Рост и влияние внешних факторов на ростовые про-
цессы . . • • •..................................55
2.5.1. Рост грибов..................................55
2.5.2. Влияние внешних факторов на ростовые процессы 56
2.6. Химический состав грибов . . 68
2.6.1. Зольные элементы.............................68
2.6.2. Белки н азотсодержащие органические вещества 69
2.6.3. Углеводы.....................................72
2.6.4. Липиды.......................................73
2.6.5. Вторичные метаболиты.........................75
Контрольные вопросы и задания 79
Глава 3. Физиология н биохимия водорослей ... 81
3.1. Осморегуляция .....................................83
3.2. Углеродное питание .... .... 87
3.2.1. Пигменты................................... 87
3.2.2. Фотосинтез...................................94
3.2.3. Фотогетеротрофность ... . . 108
3.2.4. Хемоорганотрофность..........................ПО
3-3- Белки и липиды ....................................ИЗ
3.3.1. Азотфиксация и биосинтез аминокислот . . 113
3.3.2. Липиды....................................
3.4. Минеральное питание............................. 125
3.5. Дыхание . • • -...............................132
3.6. Рост и действие на ростовые процессы факторов окру-
жающей среды...................137
190
3.7. Вторичные метаболиты и перспективы использования 147
Контрольные вопросы и задания..........................150
Глава 4. Физиология и биохимия лишайников 153
4.1. Взаимоотношения гриба н водоросли в лишайниках . 154
4-2- Углеродное питание ...............................157
4.3. Минеральное и азотное питание.....................163
4.4. Обмен веществ лишайников ... - 166
4.5. Рост и действие на ростовые процессы условий окру-
жающей среды . . 173
Контрольные вопросы и задания.......................180
Заключение ..........................182
Список рекомендуемой литературы.......................186
191
Учебное издание
Негруцкий Сергей Федорович
ФИЗИОЛОГИЯ И БИОХИМИЯ
НИЗШИХ РАСТЕНИЙ
Обложка и художественное редактиро-
вание И. Г. Сухенко
Технический редактор Г. Б. Верник
Коректор И. Е. Бей
ИБ № 13637
Сдано в набор 25.05.89 Подп. в печать
08.12.89. Формат 84X108/s2. Бум. тнп. № 2.
Гарнитура литературная. Высокая печать. Усл.
печ. л 10,08. Усл. кр.-отт. 10,34. Уч.-изд. л.
10,06. Тираж 2900 экз. Изд. № 8150. Зак. 783.
Цена 35 к.
Издательство <Вьпца школа>. 252054, Киев-54,
ул. Гоголевская, 7.
Белоцерковская книжная фабрика, 256400.
Белая Церковь, ул. К. Маркса, 4.