Автор: Перельман А.И.
Теги: вспомогательные геологические науки геологические науки химия география геохимия
ISBN: 5-06-000472-4
Год: 1989
Текст
А.И. ПЕРЕЛЬМАН
ГЕОХИМИЯ
ИЗДАНИЕ ВТОРОЕ,
ПЕРЕРАБОТАННОЕ И ДОПОЛНЕННОЕ
Допущено
Государственным комитетом СССР
по народному образованию
в качестве учебника для студентов
геологических специальностей
высших учебных заведений
Москва Высшая школа 1989
ББК 26.301
Il 27
УДК 550 4
Рецензент
кафедра минерало! ни u leoxiiMiin Москов
скою 1еоюгор<пве точного института имени
С Ор I/Коники I ie (зав кафедрой проф Мн
неев Д 4 )
Перельман А. И.
П27 Геохимия: Учеб, для геол спец, вузов.—2-е изд., перераб
и доп. — М,- Высш, шк , 1989 — 528 с.: илл.
ISBN 5-06-000472-4
В учебнике освещены главные разделы современной геохимии В основу излоа»
ння положены представления о четырех типах миграции химических элементов
механической физнко химической биогенной н техногенной Особое внимание уделе,
но учению В И Вернадского о биогенной миграции и биосфере как теоретической
основе решения проблем окружающей среды Во втором издании (1 е — 1979 г ) р<»с
ширена характеристика ряда разделов, в том числе геохимических методов поисков
полезных ископаемых
Учебник может быть полезен геологам географам, почвоведам и другим сне
цналистам, интересующимся геохимией
П
1804020100(4309000000)—535
001(01)—89
134—89
ББК 26.301
552
Учебное издание
Александр Ильич Перельман
ГЕОХИМИЯ
Редактор И М Шагирова Младшие редакторы Е В Бурова, Е И Попом
Художник 3 А Марков Художественный редактор Т А Коленково
Технический редактор Г А Виноградова. Корректор С К Завьялова
ИВ № 8537
Изд № Е 564 Сдано в набор 15 03 89 ПоДп в печать 04 11 89 Т 17644
Формат 60X88*/i6 Бум офсетная № 1 Гарнитура литературная Печать офсетная
Объем 32,34 усл печ л +0 25 усл печ л форзац 32,83 усл кр отт 36,71 уч изд л -
+ 0 39 уч изд л форзац Тираж 7700 экз Зак 2022 Цена 1 р 60 к
Издательство «Высшая школа» 101430 Москва 1СП, Неглинная ул д 29/14
Московская типография № 4 при Госкомпечати СССР
129041, Москва Б Переяславская ул 46
ISBN 5-06-000472-4 © А И. Перельман, 198°
ПРЕДИСЛОВИЕ
Две важнейшие г роблемы нашей эпохи тесно связаны с геохимией.
Это проблемы сырьевых ресурсов и окружающей среды. Более 50 лет
главное внимание геохимиков было направлено на первую проблему,
особенно на вопросы генезиса месторождений полезных ископаемых.
Этим во многом определялись структура учебников по геохимии,
преобладание в них материала по физико-химической миграции эле-
ментов. В середине XX столетия приобрели большое значение геохи-
мические методы поисков полезных ископаемых. Для разработки их
теоретических основ наряду с изучением физико-химической мигра-
ции стал необходим анализ биогенной миграции. Наконец, в 60-е
годы стали особо актуальными проблемы окружающей среды, решение
которых требует изучения также техногенной миграции. Следователь-
но, практические потребности диктуют необходимость обстоятельного
освещения в учебнике по геохимии как физико-химической, так и био-
генной и техногенной миграций. Такую задачу и поставил перед собой
автор. Учебник в первую очередь рассчитан на студентов-геохимиков и
геологов разного профиля. Он может быть полезен географам и пред-
ставителям других специальностей, где используется геохимия или
ее использование перспективно.
Свыше 30 лет автор преподает геохимические дисциплины в Мо-
сковском университете и на курсах повышения квалификации геохи-
миков — специалистов по поискам рудных месторождений. Этот
опыт и побудил начать работу над предлагаемой книгой. Основная
трудность состояла в необходимости выделения главного из большего
массива знания. Требовалось установить несколько центральных поло-
жений, объединяющих комплекс рассматриваемых вопросов в целост-
ную логическую систему. В соответствии с принципами, утвердивши-
мися в геохимии (В. И. Вернадский, А. Е. Ферсман, А. А. Сауков и др.),
в основу изложения автор положил проблему миграции химических
элементов в земной коре. Подчеркивается и значение проблемы клар-
ков.
Автор разделяет взгляды А. А. Саукова и других геохимиков о
важной роли исторического принципа в геохимии, который использу-
ется при изложении многих вопросов. Важное значение придается и си-
стемному подходу — характеристике геохимии магматических, гид-
ротермальных, биологических, биокосных и техногенных систем.
Изложенные методологические принципы позволили выделить три
основных направления геохимии—геохимию процессов, систем и эле-
ментов. Это определило структуру книги, ее разделение на части и
главы.
3
В основе геохимии лежат современные представления о строе-
нии атома, кристаллохимия, химическая термодинамика и другие
разделы физики и химии. Данное обстоятельство, очевидно, приве-
ло к включению во многие пособия по геохимии краткой характе-
ристики соответствующих вопросов. Это, несомненно, имеет свои
преимущества, так как позволяет изложить данные разделы в том
ракурсе, который необходим геохимику. Однако автор отказался
от подобного плана построения книги. Включение разделов других
наук неизбежно ведет к сужению собственно геохимической инфор-
мации. Важна и принципиальная сторона вопроса: материал по
смежным наукам нарушает стройность изложения, не создает у чи-
тателя четкого представления о предмете и внутренней логике гео-
химии.
Важное значение автор придает связи геохимии с другими геологи-
ческими науками, рассматривая геохимию в системе наук о Земле.
Геохимия имеет самые тесные контакты с науками, изучающими ве-
щество Земли, — минералогией, литологией, петрографией, наукой
о рудных месторождениях, гидрогеологией и т. д. Важна также
связь с тектоникой, исторической и региональной геологией, гео-
морфологией, четвертичной геологией и другими науками геологи-
ческого цикла. Иначе говоря, для освоения геохимии необходима
широкая общегеологическая база, и вне этой базы автор не мыслит
преподавание геохимии. Сказанное ни в какой мере не умаляет ог-
ромное значение химии, которую геохимик должен знать. Однако
так же, как использование математической статистики в общест-
венных науках не делает их разделом теории вероятности, так ис-
пользование химии не делает геохимию химической наукой.
Граница между геохимией и другими геологическими науками
не всегда достаточно определенна. Так, во многих учебниках по
геохимии освещается магматическая дифференциация, которая в
том же аспекте излагается и в курсах петрологии в качестве пред-
мета данной науки. Оставляя в стороне общенаучный вопрос о том,
может ли быть одно и то же положение (например, реакционный
принцип Боуэна) предметом различных наук, отметим, что здесь
мы, несомненно, сталкиваемся с объективной реальностью, сложив-
шейся в науках о Земле. Четкие критерии, позволяющие относить
тот или иной вопрос к определенной геологической науке, часто от-
сутствуют. Поэтому автор при определении содержания книги ис-
ходил прежде всего из определения геохимии как науки об атомах,
для которой характерен «атомарный уровень исследования». Учи-
тывались также исторически сложившееся положение в науке и
другие критерии. Полагаем, что все важные геохимические пробле-
мы освещены на страницах книги.
Возник вопрос и о порядке изложения материала прикладной гео-
химии: выделять его в самостоятельную часть и излагать после тео-
ретических вопросов или совместить характеристику теоретических
положений с их практическим применением. Автор пошел по второму
4
пути, считая, что это дает возможность показать единство теории и
практики.
Второе издание книги выходит через 10 лет после первого. Геохи-
мия в это время быстро развивалась, появилось много публикаций,
среди которых следует особо отметить материалы XXVII сессии Между-
народного геологического конгресса, состоявшейся в Москве в августе
1984 г. На Конгрессе не только работала самостоятельная геохимиче-
ская секция, но данная тематика нашла широкое отражение в работе и
многих других секций. Все это потребовало существенной переработки
содержания книги, введения новых разделов. Обновлена и библио-
графия. Однако общая структура книги и ее объем остались без изме-
нения.
Нелегкий труд ознакомления с рукописью первого издания книги
взяли на себя сотрудники кафедры минералогии и геохимии геологи-
ческого факультета Киевского университета — доц. О. В. Зинченко,
проф. Ю. А. Русько и доц. В. Т. Латыш, а также доктор геолого-мине-
ралогических наук А. В. Щербаков. Их ценные замечания помогли
улучшить книгу. Изданию также помогло положительное отношение
со стороны академиков Е. М. Сергеева и Н. П. Лаверова, члена-кор.
АН СССР Л. Н. Овчинникова, профессоров С. В. Григоряна и
В. В. Щербины. На первое издание книги (1979) были опублико-
ваны рецензии в журналах «Известия высших учебных заведений.
Геология и разведка» (А. В. Щербаков, С. И. Смирнов, С. Р. Крайнов,
В. М. Швец), «Известия Северо-Кавказского научного центра высшей
школы. Естественные науки» (В.И. Седлецкий), «Известия АН СССР.
Серия геологическая» (Г. В. Войткевич, А. В. Кокин), «Геологический
журнал» (С. Л. Шварцев, И. Ф. Вовк, Н. М. Рассказов), «Известия
АН Молдавской СССР» (Н. К. Бургеля), «Узбекский геологический
журнал» (А. С. Хасанов, В. Г. Самойленко, Б. А. Бедер), «География
и природные ресурсы» (Т. Т. Тайсаев). Ценные замечания прислали
автору В. И. Лебедев и Я. Э. Юдович. В рецензии на рукопись второго
издания, принадлежащей профессору Д. А. Минееву, также содержатся
весьма ценные рекомендации. Наряду с положительной оценкой кни-
ги в целом рецензенты высказывали и критические замечания, пожела-
ния на будущее. Все это помогло автору в работе над вторым изданием.
Как и всегда, при обилии оценок порой то, что нравилось одному ре-
цензенту, вызывало замечания другого. Поэтому, а также из-за ограни-
ченности объема автор не в силах был выполнить все рекомендации,
но все же он учел значительную их часть.
Всем лицам, принимавшим участие в издании и обсуждении «Гео-
химии», автор выражает самую искреннюю признательность.
Проф. А. И. Перельман
5
Геохимия — история химических эле-
ментов нашей планеты.
В. И. Вернадский
ПРЕДМЕТ,
ИСТОРИЯ,
МЕТОДОЛОГИЯ
И ОСНОВНЫЕ
ПОНЯТИЯ
ГЕОХИМИИ
Как и все науки об атомах, геохимия быстро развивается. Геохи-
мические идеи и методы используются во многих науках о Земле, при-
кладное значение геохимии особенно росло в эпоху научно-технической
революции (НТР). Распространенность элементов в геосферах Земли
и планет, миграция элементов в природных и техногенных системах—;
основные теоретические проблемы геохимии.
I. ПРЕДМЕТ, ИСТОРИЯ, МЕТОДОЛОГИЯ
И ПРАКТИЧЕСКОЕ ЗНАЧЕНИЕ ГЕОХИМИИ
Как самостоятельная отрасль науки геохимия оформилась в пер-
вом десятилетии XX в. в России; ее основателем был В. И. Вернад-
ский. Однако сам термин «геохимия» предложен швейцарским хими-
ком Ф. Шёнбейном в 1838 г. для обозначения науки о химических про-
цессах в земной коре. Но эти процессы изучают также минералогия,
петрография и другие науки, в связи с чем еще одна наука, объединя-
ющая реально существующие отрасли знания, оказалась излишней.
Предложенный Ф. Шёнбейном термин был использован И. Вернад-
ским для обозначения созданной им науки — истории атомов Земли.
В 70-х годах космонавтика доставила прямую информацию о породах
Луны, атмосферах Венеры и Марса и т. д. Исследованием этих вопро-
сов занялись геохимики, стали употребляться словосочетания «гео-
химия Луны», «геохимия Марса». Поэтому теперь можно дать следую-
щее определение: геохимия изучает историю атомов Земли и других
планет земной группы.
6
XX в. нередко именуют «атомным», и это справедливо не только
потому, что в текущем столетии человечество овладело атомной энер-
гией, но и в связи с проникновением идей атомистики в самые различ-
ные отрасли естествознания, развитием особого атомистического под-
хода — исследования природных процессов на «атомарном уровне»,
с точки зрения поведения атома в данной природной системе. Хотя
корни этой методологии уходят в античную науку (Левкипп, Демокрит,
Эпикур, Лукреций Кар и др.),
инструментом активного познания
природы атом впервые стал в XIX
столетии после того, как Д. Даль-
тбн и другие разработали атоми-
стическую теорию строения веще-
ства. Развитие в XX в. представ-
лений о сложном строении атома,
об атомном ядре сделало физику
и химию признанными лидерами
естествознания и техники. Атомар-
ный уровень исследования проник
и в естественноисторические нау-
ки, определив появление в них
новых научных направлений, к
числу которых относится и геохи-
мия. Объектом ее изучения являет-
ся химический элемент, его рас-
пределение и миграция в разных
системах. Подобный подход выявил
новые научные задачи: определе-
ние среднего состава земной коры
(проблема кларков), изучение
В. И. Вернадский (1863—1945)
всеобщего рассеяния химических элементов, исследование немине-
ральной формы нахождения элементов в литосфере и др. Многие из
этих задач даже не возникали до появления геохимии.
Другая особенность XX в. — развитие наук на границе различных
отраслей знания. Подобные «гибридные науки» используют для реше-
ния стоящих перед ними задач идеи, понятийный аппарат и методы раз-
ных, часто достаточно далеких друг от друга разделов естествознания
(геофизика, биофизика, биохимия, молекулярная биология, биоки-
бернетика и т.д.). Геохимия — также гибридная наука, она возник-
ла на стыке химии и геологии.
Таким образом, в становлении геохимии нашли отражение две важ-
ные особенности современного естествознания: изучение природных яв-
лений на атомарном уровне и возникновение гибридных наук. Геохи-
мия — наука XX столетия.
Современная геохимия включает в себя ряд самостоятельных на-
ук, в связи с чем ее следует рассматривать как систему наук, как часть
еще более крупной системы — геологические науки.
7
История геохимии
Самые отдаленные корни геохимии уходят к Теофрасту, Плинию
и другим античным ученым. Однако это были лишь предположения,
на смену которым в XVII—XIX вв. пришли опытные данные о хими-
ческих процессах в земной коре и их осмысливание с позиций, кото-
рые мы теперь именуем геохимическими.
В XVII столетии англичанин Р. Бойль изучал химию атмосферы
и природных вод, а голландец X. Гюйгенс подошел к пониманию жиз-
ни как космического явления. В XVIII столетии М. В. Ломоносов обо-
сновал значение химии для геологии, дал объяснение процессам обра-
зования угля, нефти, торфа, рассмотрел ряд других геохимических
проблем в своих знаменитых книгах «О слоях земных» и «О рождении
металлов». Француз А. Лавуазье, покончив во второй половине столе-
тия с теорией флогистона, заложил фундамент геохимии газов атмос-
феры, геохимии природных вод. Близки к геохимическим идеям были
и французский натуралист Ж. Бюффон, русский минералог В. М. Се-
вергин, славянский мыслитель Р. Бошкович, немецкий химик И. Рей-
ли, польский врач и химик В. Снядецкий.
В первой половине XIX в. большое значение имел грандиозный
труд шведского химика И. Берцелиуса в области химического анализа
горных пород, руд, минералов и вод. Он открыл торий, церий, селен,
впервые получил в свободном состоянии кремний, титан, цирконий.
В этот же период немецкий натуралист А. Гумбольдт много внимания
уделял влиянию жизни на окружающую среду, а его соотечественни-
ки — химики К. Шпренгель и Ю. Либих и французы Ж. Дюма и Ж
Буссенго установили геохимическую роль растений. Эти работы по-
служили основой будущей биогеохимии. В середине XIX в. немецкие
ученые К- Бишоф и И. Брейтгаупт опубликовали крупные обобще-
ния по химии земной коры. Они вплотную подошли к геохимии, рас-
сматривали химический состав земной коры, круговорот веществ в ней.
«В этих работах,— писал В. И. Вернадский, — мы имеем уже ясные
и прочные корни основных данных геохимии. Если бы кто-нибудь мог
в то время, скажем в 1850 г., охватить весь этот материал сразу, он
дал бы нам уже тогда, в XIX веке, геохимию, сложившуюся, однако,
лишь в XX веке.
Никто не мог этого дать благодаря своеобразной атмосфере геоло-
гической работы в то время» Г
С разработкой Г. Р. Кирхгофом и Р. Бунзеном спектрального ана-
лиза в 1859 г. появилась возможность определения в горных породах
следов химических элементов. Этот метод сыграл исключительную роль
в геохимии. Огромное значение имело открытие в 1869 г. Д. И. Менде-
леевым периодического закона. В трудах великого химика содержит-
ся и ряд собственно геохимических построений.
1 Вернадский В. И. Избр. соч. М., 1954. Т. 1. С. 22.
8
Еще в 1815 г. английский минералог В. Филлипс пытался прибли-
женно определить среднее содержание в земной коре десяти химиче-
ских элементов. Его работы продолжили французы Эли де Бомон
и А. Добрэ, но в общем эти исследования не привлекали ученых XIX в.
Главное внимание их было направлено на дифференциацию природы,
изучение химического состава ее частей — горных пород, минералов
и т. д. В 80-е годы определением среднего состава земной коры стал
систематически заниматься Ф. У. Кларк (1847—1931) — руководи-
тель химической лаборатории американского геологического комите-
та в Вашингтоне. Отобрав 880 наиболее точных анализов горных пород,
Кларк в 1889 г. вычислил среднее содержание в них 10 химических
элементов. Он считал, что анализы дают представление о твердой зем-
ной коре мощностью 16 км. Кларк трактовал геохимию как совокуп-
ность сведений о химическом составе земной коры, развивая в этом от-
ношении взгляды ученых XIX столетия. «Эти данные—числа Кларка—
долгое время не оказывали влияния на научную мысль, встречали
возражения и их огромное значение оценено было лишь за последнее
десятилетие», — писал В. И. Вернадский. И далее: «Кларк не ставил
резко и определенно задачу геохимии как задачу изучения истории ато-
мов планеты; это течение геохимии возникло позже и вне его мысли
(в трудах Вернадского. — А. П.). Но благодаря тому реальному зна-
чению, какое возымели числа Кларка в новых учениях об атомах, то-
му влиянию, какое они оказывали на физическую и химическую
мысль XX столетия, его работа целиком вошла в представления, сла-
гавшиеся вне его кругозора» (Избр. соч. М., 1954. Т, 1. С. 28). Так,
Кларк наряду с Вернадским стал заслуженно включаться в число ос-
новоположников геохимии.
Становление геохимии и ее развитие в первой половине XX сто-
летия. Годы рождения геохимии 1908—1911, месторождения—ка-
федра минералогии Московского университета, которой с 1891 г. ру-
ководил В. И. Вернадский. Минералогию ученый трактовал как хи-
мию соединений земной коры и поэтому большое значение придавал
точному химическому анализу минералов. Вернадский широко исполь-
зовал спектральный анализ для определения ничтожных количеств эле-
ментов в минералах и горных породах. До его работ господствовало
представление о минеральной форме нахождения химических элементов
в литосфере. Считалось, что медь входит в состав халькопирита (CuFeS2)
и других медных минералов, цинк—сфалерита (ZnS) и т. д. Сколько
меди или цинка находится в гранитах или базальтах, т.е. породах, не
содержащих минералы этих элементов, было неизвестно, и сама по-
становка вопроса не представлялась актуальной. Методы анализа то-
же не всегда позволяли решать подобные вопросы. Поэтому, когда
Вернадский стал спектральным анализом определять в горных поро-
дах цезий, рубидий, индий, таллий, висмут и другие редкие элементы,
его работа оказалась новаторской. Философский склад ума, замеча-
тельное умение видеть в единичных фактах проявление общих зако-
нов природы позволили ученому создать представление о «немине-
9
ральной», «рассеянной» форме нахождения химических элементов.
Вернадский пришел к выводу о всеобщем рассеянии химических эле-
ментов, о том, что «все элементы есть везде». В 1909 г. на XII съезде
русских естествоиспытателей и врачей ученый говорил: «В каждой
капле и пылинке вещества на земной поверхности, по мере увеличения
тонкости наших исследований, мы открываем все новые и новые эле-
менты. Получается впечатление микрокосмического характера их
рассеяния. В песчиике или капле, как в микрокосмосе, отражается об-
щий состав космоса. В ней могут быть найдены все те элементы, какие
наблюдаются на земном шаре, в небесных пространствах. Вопрос свя-
зан лишь с улучшением и уточнением методов исследования. При их
улучшении мы находим Na, Li, Sr там, где их раньше не видели; при их
уточнении мы открываем их в меньших пробах, чем делали раньше.
История Ni, V, Au, U, Не, иттроцериевой группы и т. д. приводит нас
к одинаковым выводам. Они находятся всюду и могут быть всюду кон-
статированы, они собраны в состоянии величайшего рассеяния»
(Избр. соч. М., 1954. Т. 1. С. 401). В эти же годы внимание Вернадско-
го привлекли природные газы, явление радиоактивности. Он все бо-
лее преодолевает «минералогическое мышление», выбирая в качестве
объекта исследования химический элемент. Таким образом геохимия
выросла из минералогии. Ее становлению способствовали открытия
начала XX в., оформившие представление об атоме, как о вполне реаль-
ной и сложной системе.
Так на смену гениальным догадкам древности, отдельным геохи-
мическим построениям ученых XVIII и XIX вв. в трудах Вернадско-
го пришло четкое определение предмета науки, круга изучаемых ею
проблем. Завершилась предыстория и началась собственная история
геохимии.
Первый курс новой науки прочитал в 1912 г. для студентов Народ-
ного университета им. А. Л. Шанявского в Москве талантливый уче-
ник Вернадского, вместе с ним строивший здание геохимии, А. Е.
Ферсман.
После печально знаменитого разгрома в 19Ц г. Московского уни-
верситета царским министром просвещения черносотенцем Кассо
Вернадский и Ферсман перенесли свои исследования в Петербург, в
Российскую Академию наук, действительным членом которой Вернад-
ский стал в 1912 г., Ферсман — в 1919 г.
В начале первой мировой войны выявилась сырьевая неподготов-
ленность царской России. В связи с этим в Академии наук по инициа-
тиве В. И. Вернадского и других академиков в 1915 г. была создана
Комиссия по изучению естественных производительных сил (КЕПС).
В ее работе деятельное участие принимал А. Е. Ферсман. Многие ра-
боты КЕПС имели геохимическую направленность, однако их реаль-
ные результаты были незначительными. Подлинный сдвиг произошел
лишь в советскую эпоху, когда геохимия в нашей стране стала энер-
гично развиваться и СССР стал признанным лидером новой науки.
10
A. E. Ферсман (1883—1945)
Большое значение в 20-е годы для развития науки за рубежом играло
преподавание В. И. Вернадским геохимии в Праге и Париже.
Геохимические исследования А. Е. Ферсмана на Кольском полу-
острове в 20-х годах привели не только к выдающимся теоретическим
результатам, но и к открытию крупнейших месторождений апатитов
и другого сырья, а в дальнейшем и к созданию первого в мире горно-
промышленного центра за полярным кругом. Большое значение име-
ли экспедиции Ферсмана в Сред-
нюю Азию, на Урал и в другие
рудные провинции СССР. В ходе
этих работ создавалась замечатель-
ная школа геохимиков (К- А. Вла-
сов, А. А. Сауков, Д. И. Щербаков,
В. В. Щербина и др.). Ферсман
был основателем и директором Гео-
химического института Академии
наук СССР в Ленинграде (1930).
В 1933—1939 г. Ферсман опубли-
ковал четыре тома «Геохимии» —
первое систематическое изложение
этой науки.
Наибольшее внимание в этот пе-
риод геохимики уделяют миграции
элементов в растворах и расплавах,
в которых элементы часто находят-
ся в форме ионов. В связи с этим в
геохимии большое значение приоб-
рела ионная концепция, основопо-
ложником которой был В. М. Гольд-
шмидт. Ученый вычислил размеры ионных радиусов (1926), сформули-
ровал первый закон кристаллохимии и правила изоморфизма, зало-
жил основы геохимии минералов. Влияние его идей было столь вели-
ко, что основное развитие геохимии в 30-х и 40-х годах пошло по кри-
сталлохимическому направлению, основы которого заложил норвеж-
ский геохимик. Вместе с Вернадским, Ферсманом и Кларком Гольд-
шмидт— признанный основоположник геохимии *. В СССР крупный
вклад в ионную концепцию внес А. Е. Ферсман. К этим работам он
привлек молодого физико-химика А. Ф. Капустинского (впоследствии
члена-корреспондента Академии наук СССР), сформулировавшего
второй закон кристаллохимии.
1 Личная судьба ученого была тяжелой. Выдающиеся исследования послу-
жили основанием для приглашения его в 1929 г. из Норвегии в Геттинген, где
ему предоставили научно-исследовательский институт с новейшим оборудова-
нием. За несколько лет были выполнены ценнейшие исследования, начала фор-
мироваться научная школа. Приход гитлеровцев к власти вынудил Гольдшмид-
та в 1935 г. эмигрировать из Германии, прекрасная научная школа была обез-
главлена и разгромлена. Нацистский концлагерь подорвал здоровье ученого,
он скончался в 1947 г.
11
В. М. Гольдшмидт (1887—1947)
ние имели труды Вернадского
Много внимания в эти годы привлекала и проблема среднего содер-
жания элементов в земной коре и других природных системах (иссле-
дования Ф. У. Кларка с сотрудниками в США, В. И. Вернадского и
А. Е. Ферсмана в СССР, В. М. Гольдшмидта в Норвегии и Германии,
Ф. Панета в Англии, И. и В. Ноддаков в Германии).
В 20-х годах в СССР возникла региональная геохимия, основате-
лем которой был Ферсман. Тогда же в СССР начались исследования в
области геохимии осадочных пород
и руд, главным образом фосфори-
тов, медных и железных руд (Я. В.
Самойлов, Л. В. Пустовалов,
А. В. Казаков и др.). Важное зна-
чение приобрели в 30 — 40-е годы
исследования геохимии процессов
выветривания и коры выветрива-
ния. В СССР возникли две науч-
ные школы, одна из которых изу-
чала современную (Б. Б. Полы-
нов), а другая — древнюю кору
выветривания (И. И. Гинзбург).
В начале 20-х годов В. И. Вер-
надский заложил основы биогеохи-
мии—науки о геохимической роли
организмов. В 1923 г. в Академии
наук он основал небольшой отдел
(«Биогел»), который в 1929 г. пре-
вратился в «Биогеохимическую
лабораторию». Наибольшее значе-
«Биосфера» (1926), «Очерки геохи-
мии» (1927), «Биогеохимические очерки» (1940). Под влиянием тру-
дов Вернадского биогеохимические исследования стали проводиться
во Франции, США и других странах. Объем их был незначителен.
В 30-х годах в СССР в значительной мере под'влиянием моногра-
фии В. И. Вернадского «История природных вод» (1933 — 1936) стала
формироваться геохимия природных вод. Основанный в 1921 г. Гидро-
химический институт в первые годы занимался методами анализа вод и
грязей, но в дальнейшем стал много внимания уделять геохимическим
вопросам (О. А. Алекин, Г. С. Коновалов, А. М. Никаноров, Е.В. По-
сохов и др.).
В. И. Вернадский доказал, что все природные воды связаны между
собой и в совокупности представляют единую систему — гидросферу
Земли. Это положение послужило теоретическим основанием для раз-
работки указанного раздела геохимии, который пока не получил об-
щепринятого наименования. О. А. Алекин использовал термин «гид-
рохимия», он отметил его «двойственный» характер (раздел и геохимии
и гидрологии). Некоторые авторы в том же смысле используют тер-
мин «гидрогеохимия» (В. С. Самарина). Однако чаще к гидрогеохи-
12
мии относят только геохимию подземных вод (А. М. Овчинников,
Е. В. Посохов, П. А. Удодов и др.).
В качестве особого научного направления оформилось изучение
соляных озер и подземных рассолов на основе физико-химических
идей Я. Вант-Гоффа и Н. С. Курнакова. Этот раздел науки Ферсман
предложил именовать геохимией галогенеза.
В 20-х годах Ферсман начал заниматься геохимией техногенеза,
однако этот комплекс вопросов в то время не привлек внимания и не
оформился в самостоятельное научное направление.
Успехи теоретических исследований послужили толчком к разви-
тию в СССР в середине 30-х годов геохимических методов поисков по-
лезных ископаемых (Н. И. Сафронов, А. П. Соловов, В. А. Соколов).
Геохимия в эпоху научно-технической революции. В эпоху НТР
проблема минерального сырья приобрела исключительно важное зна-
чение. Выявилась потребность в германии, уране, бериллии, литии и
других редких элементах, которые ранее практически не использова-
лись промышленностью. Резко возросла добыча и распространенных
элементов.
В 60-е годы особо актуальной стала проблема загрязнения окружа-
ющей среды. Теоретической основой решения обеих проблем во мно-
гом явились идеи и методы геохимии. Поэтому во второй половине XX
столетия началось особенно быстрое ее развитие. Сильно расширился
фронт работ, началась подготовка специалистов-геохимиков разного
профиля.
В Академии наук СССР созданы крупный Институт геохимии и ана-
литической химии им. В. И. Вернадского в Москве и Институт геохи-
мии им. А. П. Виноградова в Иркутске. В республиканских академиях
наук также организованы институты геохимии (на Украине, в Бело-
руссии и др.). Геохимическая тематика занимает видное место в работе
других академических и отраслевых институтов [в Институте геоло-
гии рудных месторождений, петрографии, минералогии и геохимии
(ИГЕМ) и в Институте минералогии, геохимии и кристаллохимии ред-
ких элементов (ИМГРЭ) в Москве, во Всесоюзном геологическом ин-
ституте (ВСЕГЕИ) в Ленинграде и т. д.]. Геологическая служба СССР
располагает многими геохимическими партиями. В университетах и
Московском геологоразведочном институте (МГРИ) созданы кафедры
геохимии. В 1988 г. в Москве создан Государственный геологический
музей имени В. И. Вернадского.
Развиваются геохимические исследования в Чехословакии, ГДР,
Китае, Польше, Венгрии, Югославии, Индии и других странах.
Крупные исследования по геохимии проводятся в США (институ-
ты Карнеги и Скрипса, Гарвардский, Калифорнийский, Чикагский и
другие университеты, технологические институты, учреждения геоло-
гической службы и др.). Центры развития геохимии сложились в Анг-
лии, Канаде, Японии, ФРГ, Франции и других развитых капитали-
стических странах.
13
Геохимическая тематика стала играть видную роль в работах гео-
логических конгрессов, организованы международные ассоциации
геохимиков.
Быстро развиваются традиционные направления по геохимии
магматических, гидротермальных и гипергенных процессов. Все боль-
шую роль в исследованиях играют методы физической химии, особен-
но термодинамики. В качестве самостоятельного направления офор-
милась физическая геохимия.
Энергично развивается биогеохимия. Самостоятельными направ-
лениями стали органическая геохимия (геохимия рассеянного органи-
ческого вещества, геохимия нефти и газа), создается палеобиогеохи-
мия. Запросы практики привели к широким исследованиям по геохи-
мии редких элементов, которая уже начинает расчленяться на самосто-
ятельные направления. Геохимическими науками с большим объемом
фактического материала стали гидрохимия и гидрогеохимия. Выдели-
лась геохимия океана. На одно из первых мест выдвинулась геохимия
изотопов (радиогенных и нерадиогенных), изотопные методы ныне
применяются во многих науках о Земле. На стыке ландшафтоведения
и геохимии возникла геохимия ландшафта. Быстро развиваются все
разделы прикладной геохимии.
Как и в других науках, огромный рост фактического материала
вызвал в геохимии перепроизводство информации, особенно заметное
в прикладной геохимии. Общий объем информации в этой области за
30 лет превысил 1 млрд, данных о содержании химических элемен-
тов в различных образованиях земной коры. Эти данные еще не пол-
ностью осмыслены и интерпретированы. Однако, как показал автор,
перепроизводство информации относительно— оно возникло в резуль-
тате нарушения оптимального соотношения между накоплением факти-
ческого материала и его теоретическим осмыслением. Поэтому нараста-
ющей лавине фактов должен быть противопоставлен более высокий
уровень теоретического обобщения. Важную роль в обработке факти-
ческого материала теперь играют ЭВМ, наметилась также сильная тен-
денция к математизации геохимии — построению математических мо-
делей процессов, использованию кибернетических.методов.
Развитие геохимии происходит в тесной связи с другими геоло-
гическими науками, физикой, химией, биологией, математикой. Гео-
химия много получает от этих наук и в свою очередь помогает решать
задачи, стоящие перед ними.
Методология геохимии
В основе методологии всех наук лежат общие положения диалекти-
ческого материализма и науковедения. На этой базе разрабатывается
собственная методология геохимии. Главная ее особенность, установ-
ленная В. И. Вернадским и А. Е. Ферсманом, отмечена выше — изу-
чение миграции атомов в земной коре, других оболочках Земли, в пла-
нетах земной группы. Теперь уже можно сказать, -что использование
14
этой методологии полностью себя оправдало, так как позволило соз-
дать самостоятельную отрасль геологии с собственной теорией, поня-
тийным аппаратом, оригинальными методами исследования и много-
образными практическими приложениями. Этой науке принадлежит
важное место в системе наук о Земле. Принципиальные основы гео-
химии настолько глубоки, что обеспечат ее быстрое развитие и в даль-
нейшем.
Формы движения материи и виды миграции химических элементов.
В результате миграции происходит концентрация и рассеяние элемен-
тов. Учение о процессах концентрации — одна из теоретических ос-
нов науки о рудных месторождениях. Изучение рассеяния приобрело
наибольшее значение при геохимических поисках полезных ископае-
мых и в борьбе с загрязнением окружающей среды.
Миграция происходит под влиянием большого числа противоречи-
вых факторов, нередко носящих случайный характер. Это дает осно-
вание рассматривать процессы миграции как вероятностные и широко
использовать при их изучении теорию вероятности и математическую
статистику. В то же время многие явления миграции, особенно веду-
щие к концентрации элементов, являются детерминированными и при
их количественном анализе необходимо использовать другой матема-
тический аппарат, например дифференциальные уравнения. Правиль-
нее будет сказать, что в любом процессе имеется как вероятностная,
так и детерминированная составляющая, однако в одних случаях пре-
обладает первая («вероятностные процессы»), а в других — вторая
(«детер минированные п роцессы»).
Совокупность сведений о процессах миграции рационально выде-
лить в особый раздел геохимии — геохимию процессов миграции,
который состоит из самостоятельных направлений — геохимии маг-
матических, гидротермальных, гипергенных, техногенных и других
процессов.
Изучение противоположных сторон миграции — концентрации и
рассеяния элементов — составляет одну из важных особенностей
методологии геохимии. Автор предложил выделять виды миграции по
формам движения материи. Вопрос этот, как известно, дискутируется.
Предлагается выделять геологическую форму движения, географиче-
скую, ядерно-физическую и т.д. Ввиду сложности и неясности многих
положений в основу классификации миграции нами положены постро-
ения Ф. Энгельса — основоположника разработки данной проблемы.
Выделяется четыре основных вида миграции химических элементов:
1) механическая, 2) физико-химическая, 3) биогенная и 4) техноген-
ная.
Три аспекта анализа миграции: изучение изменения вещества, энер-
гии и информации. В первой половине XX в. полагали, что для по-
нимания любого процесса достаточно установить, как изменяются в
нем вещество и энергия, т. е. вести исследования на вещественно-энер-
гетическом уровне. В последние десятилетия выявился третий аспект
изучения миграции — информационный. Информация трактуется как
15
одно из фундаментальных научных понятий того же ранга, что и ве-
щество, энергия, пространство, время. Кроме социальной и биологи-
ческой информации говорят и об информации в неживой природе. Ана-
лиз геохимических процессов с информационных позиций приобрета-
ет большое значение.
Системный подход. К системам относятся Земля в целом, земная
кора, гидросфера, атмосфера, артезианский бассейн, почва, кора вы-
ветривания, живой организм, ландшафт, государство и т. д. Для сис-
тем характерны противоположные процессы, связывающие отдель-
ные их части в единое целое. Здесь несомненна связь с законом един-
ства и борьбы противоположностей. При системных исследованиях в
геохимии большое значение имеют методы общей теории систем, тео-
рии информации, кибернетики, использование ЭВМ. Для многих сис-
тем, в частности для биологических и социальных, характерны нели-
нейные соотношения, когда, как это подчеркнул бельгийский физико-
химик. И. Пригожин, незначительный по интенсивности сигнал при-
водит к крупным изменениям в системе (иногда катастрофическим).
Системы, изучаемые в геохимии, по формам движения материи раз-
деляются на четыре основных типа:
1. Абиогенные системы, в которых протекают только процессы ме-
ханической и физико-химической миграции. Это магматические, гид-
ротермальные и многие другие системы.
2. Биологические системы — живые организмы и их ассоциации,
например биоценозы.
3. Биокосные системы, для которых характерно взаимопроникно-
вение живых организмов и неорганической («косной» по Вернадско-
му) материи. В этих системах развиваются явления и физико-химиче-
ской миграции, но определяющее значение имеет биогенная миграция.
Таковы почвы, коры выветривания, природные ландшафты, моря и
океаны, реки и т.д. Самая крупная биокосная система — биосфера,
т. е. вся область планеты, населенная живыми организмами.
4. Техногенные системы характеризуются ведущим значением тех-
ногенной миграции, хотя в них имеют место и все остальные виды миг-
рации (промышленные предприятия, города, транспортные артерии,
агроландшафты и т.д.).
В результате миграции в системах формируется геохимическая зо-
нальность'. система расчленяется на химически различные части —
геохимические зоны, подзоны, горизонты и т. д. Зональность бывает раз-
ных рангов (12 — по Л. Н. Овчинникову): от грандиозной вертикаль-
ной зональности Земли как планеты (металлическое ядро — силикат-
ная кора) до зональности в пределах рудного месторождения, коры
выветривания, почвы и еще более мелкой («микрозональности») в
пределах отдельного минерала, конкреции и т.д. Различают латераль-
ную (субгоризонтальную) зональность, примером которой может
служить зональность осадков в водоеме в направлении от берега к его
центру, зональность околорудного изменения пород в гидротермаль-
ных системах, широтные геохимические зоны на земной поверхности,
16
и вертикальную зональность, связанную с изменением химического
состава и свойств е субвертикальном направлении (характерна для руд-
ных жил, коры выветривания, почв, илов, артезианских бассейнов,
озер, морей, океанов и т.д.). Изучение геохимической зональности —
важная задача геохимии систем, один из ведущих методологических
принципов этого раздела геохимии.
Геохимия изучает те же системы, что и другие науки о Земле,
ее специфика состоит в изучении систем на атомарном уровне. Эта
задача составляет содержание геохимии систем. И здесь обособились
самостоятельные научные направления — геохимия рудных месторож-
дений, океана, ландшафта, минералов и др.
При изучении систем необходимо исследовать их вещество, энер-
гетику, информацию. Информационный подход приобретает особенно
большое значение, так как с ним связаны обратная связь, центр, струк-
тура, сложность, упорядоченность, самоорганизация и другие важ-
ные характеристики систем.
Структура — это совокупность составных частей системы и спо-
соб связи между ними. Общая теория систем различает прямые и об-
ратные связи. Символ прямой связи: А В, т. е. управляющий про-
цесс А (причина) влияет на управляемый орган В (следствие). Приме-
ром такой связи служит влияние Солнца на процессы земной поверх-
ности, сульфидных руд на формирование зоны окисления месторожде-
ний, радиоактивного распада на концентрацию в земной коре свинце.,
аргона и других продуктов распада.
Символ обратной связи — А В, т. е. управляемый процесс
В также влияет на управляющий орган А. Обратная связь положи-
тельна, когда результат процесса усиливает его и система эволюцио-
нирует— удаляется от исходного состояния. Например, образование
ледников увеличивает лучеиспускание с их поверхности, способствует
дальнейшему охлаждению и увеличению площади оледенения. Здесь
часто действует экспоненциальный «закон лавины». Особенно харак-
терна положительная обратная связь для техногенных систем.
Обратная связь отрицательна, когда результат процесса ослабля-
ет его и стабилизует систему, восстанавливает ее исходное состояние.
Так, в эпоху вулканизма в атмосферу выделяется огромное количест-
во СО2, благоприятствующее потеплению климата и фотосинтезу. Это
усиливает углеобразование и карбонатообразование, приводит к
изъятию значительной части СО2 из атмосферы и восстановлению ис-
ходного состояния. В результате действия отрицательной обратной
связи развивается саморегулирование: всякое отклонение от стацио-
нарного состояния вызывает в системе процессы, возвращающие ее
в исходное состояние. В химии это положение обосновывается термо-
динамикой и носит название принципа тормозящего противодействия
Ле Шателье. Общая теория систем распространяет его на любые сис-
темы с обратной связью («обобщенный принцип Ле Шателье»).
Во многих системах существует структурный центр — главная ее
часть, определяющая своеобразие системы. К таким централизован-
17
ним системам относятся солнечная система (центр — Солнце), жи-
вотное (нервная система, мозг), ландшафт (центр — растительный по-
кров водоразделов), горнообогатительный комбинат (центр — управ-
ление ГОКа) и т. д. Известны и нецентрализованные, а также бицен-
трические и полицентрические системы. Исследование системы сле-
дует начинать с изучения центра («принцип централизации»).
Таким образом при изучении геохимии систем необходимо выяв-
лять их прямые и обратные связи (положительные и отрицатель-
ные), анализировать явление саморегуляции, оценивать целостность,
упорядоченность, централизацию и другие информационные показате-
ли.
Геохимия элементов. Это третий аспект геохимических исследова
ний, объектом которого служит конкретный химический элемент, его
миграция в разных процессах и системах. Данный раздел геохимии
включает несколько подразделов: геохимия редких элементов, газов
и др.
Различия трех аспектов геохимических исследований. В геохимии
процессов изучается миграция элементов в определенном процессе,
т. е. как он реализуется в разных системах. Например, выветривание
полевых шпатов развивается и в почвах, и в корах выветривания, и в
водоносных горизонтах, и в илах и т. д.
В геохимии систем изучается миграция элементов в определенных
системах, для которых характерны противоположные взаимосвязан-
ные процессы. Например, в гидротермальных системах протекают рас-
творение, осаждение, разложение вмещающих пород, диффузия и т.д.
В геохимии элементов изучается поведение конкретного элемента
в разных процессах и системах.
Принцип историзма. Это важнейший методологический принцип
геохимии. В былые геологические эпохи миграция протекала не так,
как сейчас. Например, для докембрия была характерна большая роль
вулканизма, иной состав атмосферы и гидросферы и т.д. Можно гово-
рить об исторической геохимии определенных процессов (особенности
миграции в прошлые эпохи), систем (геохимия океана в докембрии,
геохимия древней коры выветривания и т.д.), элементов (особенности
миграции фосфора в нижнем палеозое, своеобразие геохимии калия в
пермском периоде и т. д.).
Проблема систематики (классификации). Огромное разнообразие
процессов и систем, изучаемых геохимией, естественно выдвигает за-
дачу их классификации. Большое значение приобрели геохимические
классификации химических элементов, природных вод, рудных место-
рождений и т.д. Решение вопросов классификации связано с философ-
ским подходом и понятием о прерывности (дискретности) и непрерыв-
ности. Прерывность (дискретность) характерна для главных объектов
изучения геохимии — атомов химических элементов. Так, элемент
может быть или кальцием, или натрием, и никакие промежуточные фор-
мы, переходные между кальцием и натрием, невозможны. Классифи-
кация подобных объектов также имеет дискретный характер, и в этом
18
случае принцип систематики адекватен природе объекта. Именно в
данной области классификация достигла наибольших успехов, при-
мером чему служит периодическая система Д. И. Менделеева.
Однако для земной коры очень характерна и непрерывность—суще-
ствование между объектами исследования постепенных переходов.
Примерами могут служить pH и другие параметры вод (возможны лю-
бые значения, образующие непрерывный ряд), «типы» почв, горных
пород, вод, ландшафтов и т.д., для которых характерны постепенные
переходы в пространстве, промежуточные представители. Непрерыв-
ность характерна для электрического, магнитного и других геофизи-
ческих полей. Лучшее представление о распределении параметров
данных полей дает их изображение с помощью изолиний. Говорят и о
«геохимическом поле», которое, например, получают при опробовании
по определенной сетке какой-либо части пространства (планшета
съемки и т.д.). В этом случае также, как и при изучении геофизиче-
ских полей, возможно проведение изолиний (равные содержания эле-
ментов в почвах, породах, водах; растениях и т.д.).
Для систем с непрерывным распределением элементов использова-
ние дискретных понятий и терминов при классификации, т. е. выделе-
ние типов, классов, видов и т.д., содержит элемент условности. Лишь
крайние члены непрерывного ряда могут быть отнесены к определен-
ным таксонам классификации. Поэтому при изучении систем с непре-
рывным распределением признаков возникают затруднения с класси-
фикацией — отнесением систем к определенному виду, типу и т. д.
Приходится выделять промежуточные таксоны, вводить границы, не
вытекающие из природы явления. Так, при классификации природ-
ных вод по минерализации пресными считаются воды, содержащие до
1,0 г ионов на 1 кг воды, солоноватыми — 1—25 г и т. д. Следует под-
черкнуть, что причина затруднений связана не с субъективным факто-
ром — несовершенством классификации, а с объективной причиной —
природой объектов, непрерывностью их распределения. Иначе гово-
ря, принцип классификации, исходящий из существования дискрет-
ных единиц, здесь не адекватен природе классифицируемого объекта,
для которого характерно непрерывное распределение.
Матричный (табличный) принцип систематики геохимической ин-
формации. Один из распространенных и простейших способов систе-
матики информации состоит в компоновке сведений в таблицах, по-
строенных по двум координатам — горизонтальной (строчки) и верти-
кальной (столбцы). Этот способ, который автор предложил именовать
матричным \ широко применяется в естественных и общественных
науках.
Классическим образцом матричного принципа служит периоди-
ческая система Менделеева, которая построена по двум координатам—
1 В математике матрицами именуются прямоугольные таблицы чисел, со-
стоящие из строк и столбцов. Анализ этих таблиц привел к созданию особого раз-
дела алгебры — теории матриц, которая приобрела важное значение как в ма-
тематике, так и в электротехнике и других технических науках.
19
периодам (строки матрицы) и группам (столбцы матрицы). При этом
периодам отвечают квантовые слои К, L, М, N, О, Р, Q, характеризу-
емые главными квантовыми числами— 1, 2, 3, 4, и т. д. Группы
(I, II, III и т. д.) объединяют элементы с близкими химическими
свойствами, что связано со строением наружных квантовых слоев.
Каждый химический элемент может быть обозначен (закодирован) как
сочетание определенных периодов и групп (например, Li — 21, Na —
31, Cd — 3 II и т. д.). Гениальность Д. И. Менделеева в том, что,
не располагая современными представлениями о строении атома, ис-
пользуя только данные по атомным массам элементов (и в значитель-
ной степени корректируя их!), а также используя замечательную ин-
туицию, он расположил элементы в виде таблицы, которая не только
позволила систематизировать известные в то время химические эле-
менты, но и предсказать новые, — Ga, Sc, Ge, т. е. прогнозировать.
Путь, намеченный Д. И. Менделеевым, имеет общенаучное значе-
ние, ои важен и для геохимии, например для систематики процессов
водной миграции атомов, концентрации химических элементов на гео-
химических барьерах и др. (см. гл. 9). Рассмотрим правила матричной
систематики и прогнозирования. В первую очередь необходимо выде-
лить строки и столбцы будущей матрицы, т. е. два главных фактора
(параметра, две причины), определяющих формирование объектов ис-
следования — системы или процесса. Применительно к химическим
элементам это были две особенности элементарной структуры атомов.
Только при правильном выборе параметров систематика будет удачной,
в противном случае она направит мысль исследователя в ложном на-
правлении, прогноз окажется ошибочным. Если параметры выбраны
правильно, то все известные явления данного порядка займут места
в клетках матрицы и останутся пустые клетки для прогнозируемых
явлений. При этом возможны и такие сочетания факторов (парамет-
ров), которые реально не осуществимы и соответствующие явления
(процессы, системы) исключены. Почему все же речь идет именно о
двух факторах, не кроется ли здесь дело в чисто формальном моменте—
существовании двух координат на плоскости? Использование двух
координат, т.. е. двух факторов, мы связываем с раздвоением единого—
с законом единства и борьбы противоположностей. Иначе говоря,
несмотря на множество факторов, определяющих развитие тех или
иных процессов или явлений, необходимо выявлять два основных
противоположных фактора — причины, определяющие сущность изу-
чаемого процесса или явления. Опыт науки показывает, что в ходе ис-
следований таких два противоположных фактора действительно можно
установить (например, миграция химических элементов: концентра-
ция и рассеяние, биологический круговорот атомов в биосфере: обра-
зование живого вещества и минерализация органических веществ).
Отсюда вытекает правило матричной систематики информации: не-
обходимо вскрыть характерное для классифицируемого объекта внут-
реннее противоречие («раздвоение единого»), выделить два основных
противоположных фактора и использовать их для построения матри-
20
цы. Так, при матричной систематике процессов концентрации химиче-
ских элементов из природных вод необходимо выделить два главных
противоположных параметра (условия, факторы концентрации). Для
многих гидротермальных и гипергенных систем такими условиями
будут состав род, поступающих к геохимическому барьеру, и серия
барьера.
Значение периодического закона Менделеева для геохимии. «Труд-
но найти для геохимии среди обобщений природы другой закон, кото-
рый был бы столь плодотворным в ее исканиях, трудно найти другое
эмпирическое правило, которое бы заключало в себе так много глубо-
кого теоретического и практического смысла» \ — писал о периоди-
ческом законе А. Е. Ферсман. Этот закон используется в геохимиче-
ской классификации элементов, при анализе величин радиусов атомов,
ионов, других свойств элементов, при характеристике их технологи-
ческих свойств, геохимических особенностей отдельных процессов,
систем, регионов и т. д. Закон Менделеева — это подлинный компас
геохимика; анализ научных и практических проблем на базе периоди-
ческой системы — существенная особенность методологии геохимии.
Практическое приложение геохимии
(прикладная геохимия)
Теоретические представления геохимии используются при поисках,
добыче и переработке минерального сырья, при охране среды, в здра-
воохранении, сельском хозяйстве. К важнейшим понятиям приклад-
ной геохимии относятся «геохимическое поле», «геохимическая анома-
лия», «геохимический фон». Геохимическое поле, по А. П. Соловову,—
это пространство, характеризуемое количественными содержаниями
химических элементов. Среднее или модальное содержание химиче-
ского элемента в пределах геохимически однородной системы — уча-
стка, именуется геохимическим фоном данной системы (участка).
Геохимическая аномалия представляет собой область содержаний хими-
ческого элемента или численных значений других геохимических по-
казателей (pH, Eh и т. д.) на заданном уровне, отличающихся от гео-
химического фона. Аномалии могут быть глобальными, региональны-
ми, локальными, точечными и т. д. К геохимическим аномалиям при-
надлежат и рудные месторождения. Различают положительные (выше
фона) и отрицательные (ниже фона) аномалии.
Наиболее разработано применение геохимии при поисках полез-
ных ископаемых. Соответствующий раздел геохимии имеет все при-
знаки самостоятельной прикладной науки (большой объем фактиче-
ского материала, самостоятельный понятийный аппарат и оригиналь-
ные методы исследования, развитая теория).
Геохимические методы поисков полезных ископаемых. Месторож-
дения полезных ископаемых образуются в результате концентрации
1 Ферсман А. Е. Геохимия. М., 1937. Т. 3. С.18
21
элементов. Та часть поля концентрации, в которой содержание эле-
ментов достигает величин, допускающих их эксплуатацию, называ-
ется рудным телом или залежью полезного ископаемого, а само вещество
с кондиционным содержанием элемента — рудой. Остальная часть по-
ля концентрации именуется первичным геохимическим ореолом место-
рождения. Он, следовательно, образовался одновременно с рудным
телом и в результате тех же процессов. Реже для первичного ореола
характерны пониженные, по сравнению с рудовмещающими породами,
содержания рудных и сопутствующих элементов. Граница между руд-
ным телом и первичным ореолом определяется требованиями промыш-
ленности. Например, в конце XIX в. в США перерабатывались мед-
ные руды, содержащие более 5 % Си и прилегающие породы с первы-
ми процентами Си представляли первичный ореол. В середине XX в.
перерабатывались уже руды с 1 % Си, и то, что ранее считалось пер-
вичным ореолом, стало рудой. Протяженность первичных ореолов
измеряется десятками, сотнями и тысячами метров, причем нередко
ореол достигает земной поверхности, в то время как рудное тело рас-
положено на глубине (рис. 1).
На земной поверхности рудные тела и первичные ореолы подвер-
гаются выветриванию и денудации. В результате почва, кора вывет-
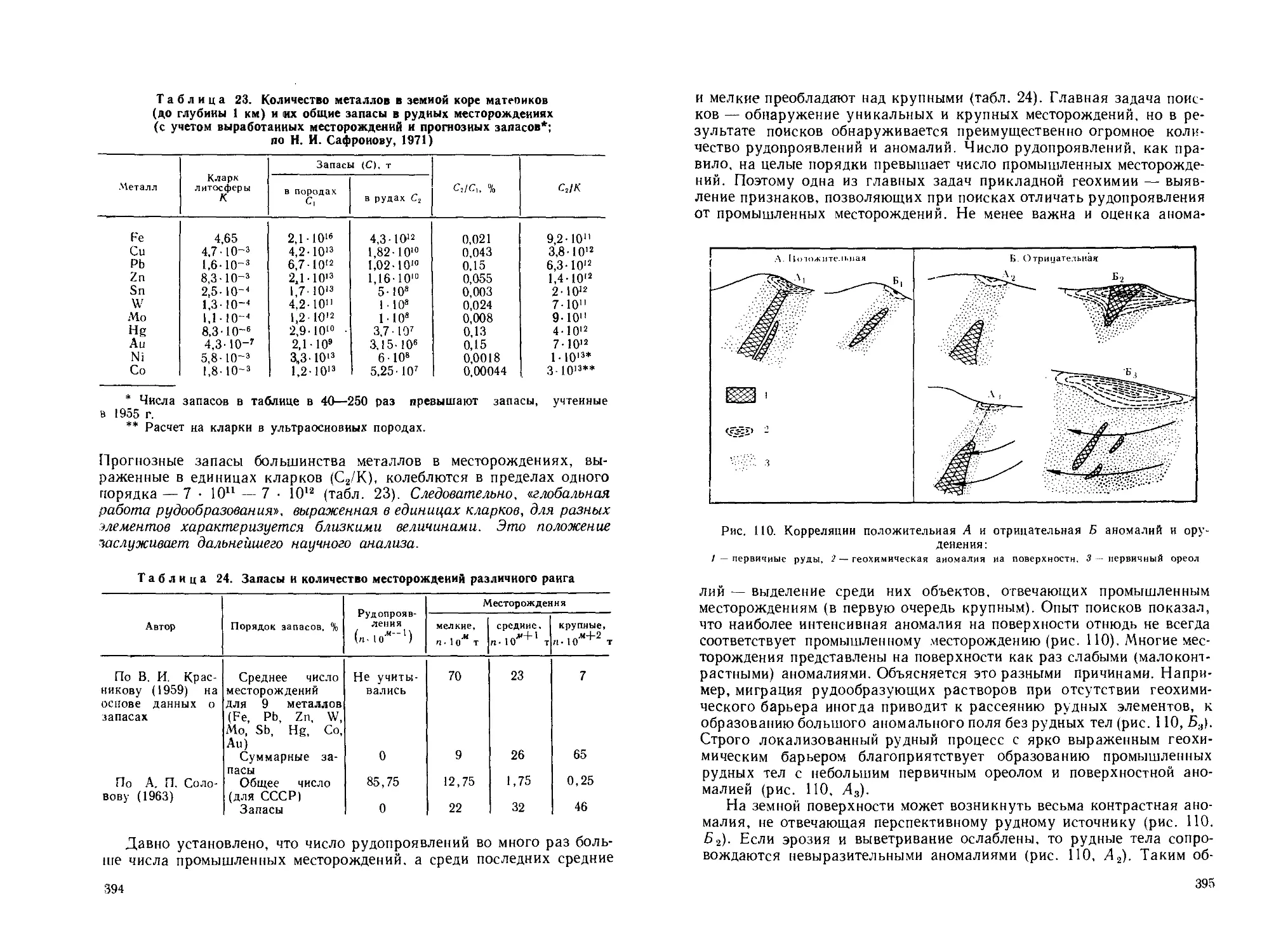
ривания, континентальные отложения, подземная и надземная атмос-
фера вблизи месторождения обогащаются индикаторными элементами
(рудными и их спутниками). При выщелачивании р'уд и ореолов
элементы поступают в поверхностные и подземные воды. Растения так-
же накапливают рудные элементы, повышается их содержание и в жи-
вотных. Так возникает повышенная концентрация элементов в ланд-
шафте, образующая вторичный (эпигенетический) ореол рассеяния.
Различают литохимические ореолы — в почвах, породах, гидрогео-
химические — в водах, атмохимические — в атмосфере, биогеохими-
ческие — в организмах.
Размеры вторичных ореолов достигают сотен и тысяч метров. Со-
держание индикаторных элементов в литохимических ореолах места-
ми лишь незначительно отличается от их содержания во вмещающих
породах, причем искомые элементы в подавляющем большинстве слу-
чаев находятся в неминеральной форме (адсорбированы глинами н т.д.).
Определяя содержание химических элементов в коренных горных по-
родах, во всех компонентах ландшафта — почвах, рыхлых отло-
жениях, водах, растениях, атмосфере, — можно обнаружить первич-
ный или вторичный ореол, а по нему и само месторождение. Подобные
методы поисков и получили наименование геохимических. По объек-
ту опробования они разделяются на литохимические, гидрогеохими-
ческие, биогеохимические и атмохимические (газовые) методы (см.
рис. 1).
Наибольшее распространение получили литохимические поиски,
основанные на исследовании закономерностей распределения химиче-
ских элементов в горных породах и почвах. Один из распространен-
ных вариантов этих поисков состоит в следующем: на площади по-
22
Природные и техногенные ореолы рассеяния
S
К
ф
3
S
а
23
исков разбивается сеть параллельных профилей (например, при по-
исках в масштабе 1:50 ООО через 500 м). На каждом профиле через 50 м
отбирается образец почвы, который анализируется приближенно-ко-
личественным спектральным анализом на 30—40 элементов. Для от-
дельных элементов составляются карты изоконцентрат, а обработка
данных с помощью математической статистики позволяет выделить гео-
химические аномалии (рис. 2). Последние разделяются на рудные
(связанные с оруденением) и безрудные (не имеющие связи с орудене-
нием). Если на основе комплекса признаков установлена рудная при-
рода аномалии, то она может быть вторичным ореолом рассеяния мес-
торождения. В СССР с помощью литохимической съемки масштаба
1:50 000 открыты многие рудные месторождения. Только в Казахста-
не в данном масштабе заснято свыше 600 000 км2, проанализировано
более 60 млн. проб. Литохимические поиски нашли широкое примене-
ние также в Австралии, США, Канаде и других странах. Менее
распространены гидрогеохимические, биогеохимические и газовые
поиски.
Использование геохимии при прогнозировании, разведке и эксплу*
атации месторождений. Одна из важнейших задач геологии состоит в
выборе района для поисков месторождений, т. е. в ответе на вопрос'
где искать? Эта задача решается комплексом методов, существенный
вклад в ее решение вносит и геохимия с помощью геохимических кри-
териев оруденения. Они весьма разнообразны и будут освещены в по-
следующих разделах. Геохимические идеи и методы используются
также при разведке и эксплуатации месторождений. В ряде случаев
они открывают принципиально новые возможности производства, как,
например, использование подземного выщелачивания при добыче руд
Геохимия и проблема окружающей среды. Человеческое общество
стало большой геохимической силой, по мощности и суммарному эф-
фекту вполне сопоставимой с самыми грандиозными силами природы.
Добыча полезных ископаемых, сжигание нефти, газа, угля, выплав-
ка металлов из руд, экспорт, импорт, развитие земледелия и животно-
водства, урбанизация оказывают столь сильное влияние на миграцию
химических элементов, что возникла необходимость выделения особой
категории геохимических процессов — техногенной миграции (тех-
ногенеза). Их изучение приобрело, очень большое значение в связи с
загрязнением окружающей среды. Однако медленное развитие дан-
ного раздела геохимии в прошлом не привело к разработке теории,
которая создала бы базу для решения практических вопросов. Но и
ожидать, когда такая теория будет разработана, было нельзя и естест-
венно, что наука пошла по хорошо известному пути аналогии, построе-
ния моделей, использования опыта других разделов геохимии. Так бы-
ло установлено, что моделью загрязнения окружающей среды от ло-
кального источника (предприятия, города и т. д.) может служить раз-
рушающееся рудное месторождение с характерными для него ореола-
ми рассеяния. Это позволило использовать при изучении техногене-
за хорошо разработанную теорию геохимических поисков. В резуль-
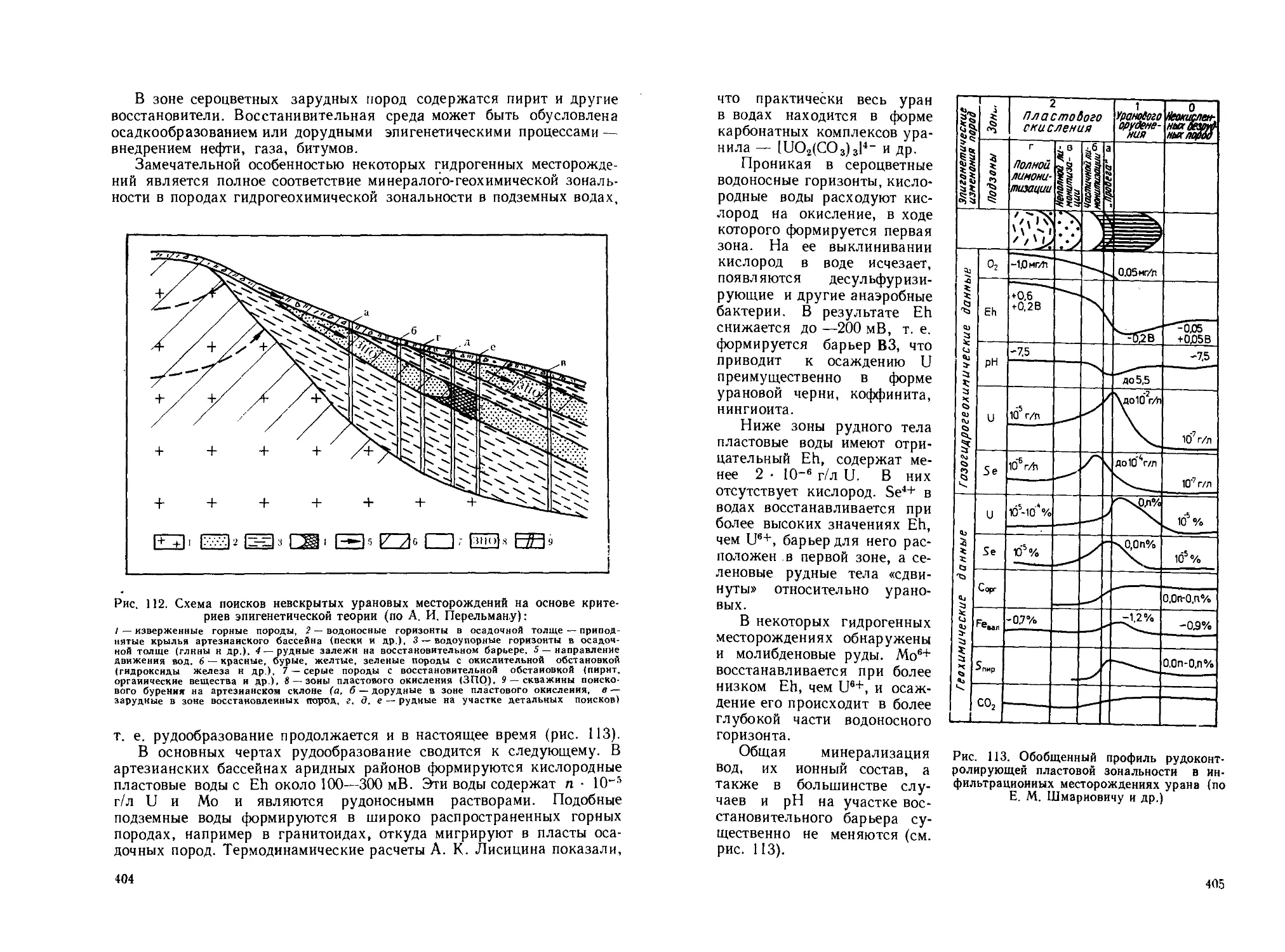
Рис. 2. Результаты литохимической съемки на участке Карашошак (по А. П. Соловову и А. А Матвееву):
/—содержание меди но пикетам в 10—*%; 2 — контур вторичного ореола рассеяния медн по июконцентрате 20 10-3%
24
тате возникли понятия о техногенных геохимических аномалиях (лито-
химических, гидрогеохимических, атмохимических, биогеохимиче-
ских), техногенных ореолах рассеяния, техногенных барьерах (см. рис.
1). Вторая модель техногенной миграции связана с геохимией ланд-
шафта, теория которой также детально разработана. Методологию
и конкретные методы изучения природных ландшафтов оказалось
возможным использовать и при изучении так называемых техноген-
ных (культурных, антропогенных и др.) ландшафтов. В геохимии тех-
ногенеза уже наметились самостоятельные направления, среди кото-
рых наибольшее практическое значение приобрела геохимия городов.
Геохимия и здравоохранение. Здоровье человека во многом опре-
деляется содержанием химических элементов в окружающей среде —
почве, воде, атмосфере, продуктах питания. Существуют оптималь-
ные содержания, нарушение которых приводит к заболеванию. Так,
при недостатке йода в ландшафте или пище развивается эндемиче-
ский зоб (особенно в горных районах), при дефиците фтора в питье-
вой воде — кариес зубов, при избытке фтора—флюороз, при избытке
молибдена в воде — подагра и т.д. Распространение многих болезней
подчиняется закону географической зональности (одни болезни более
распространены в зонах тайги и тундры, другие — в сухих степях
и пустынях и т.д.). Задача геохимии состоит в изучении законов рас-
пределения химических элементов в ландшафтах и, таким образом, в
предоставлении медицине исходных данных для выяснения причин за-
болеваний, разработки их профилактики и методов лечения. Подоб-
ные исследования развиваются с середины 30-х годов и в настоящее
время получили значительное распространение. Весьма перспективно
использование геохимии в курортном строительстве, при изучении дол-
голетия и других проблем медицины.
Геохимия и сельское хозяйство. Многие болезни культурных рас-
тений и домашних животных также связаны с дефицитом или избыт-
ком химических элементов в окружающей среде. Известны болезни
животных и растений, обязанные дефициту или избытку Са, Си, Со,
В, Pb, Se, Мо и других элементов. Как и люди, домашние животные
болеют эндемическим зобом, кариесом, флюорозом и т.д. Геохимиче-
ские исследования актуальны также в мелиорации (особенно при оро-
шении), при применении удобрений и минеральной подкормки живот-
ных, при решении других вопросов сельского хозяйства.
Геохимия и химическая технология. Изучая законы распределе-
ния химических элементов в горных породах и минералах, геохимия
изыскивает новые источники сырья для промышленности. Так, с по-
мощью геохимических методов были установлены источники Re (мо-
либденовые руды), Hf (цирконы), Cd и In (полиметаллические руды),
Ge (зола углей) и т.д. Выявляя ассоциацию элементов в определенном
типе руд, геохимик рекомендует технологу извлекать все компоненты
(а не только главные), намечает наиболее рациональные пути извле-
чения элементов из руд. Аналогия с природными процессами позволя-
26
ет в ряде случаев обосновать методику подземного выщелачивания
РУД-
Геохимия и строительство. Инженерно-геологические свойства
горных пород (грунтов) во многом определяются их геохимическими
особенностями, процессами миграции. Н. И. Кригером это показано
на примере формирования просадочных свойств лёсса. Данный автор
ставит вопрос о необходимости разработки особого научного направ-
ления — инженерной геохимии. В инженерной геологии нашли при-
менение и теория геохимических барьеров (С. Д. Воронкевич), другие
разделы геохимии.
Контрольные вопросы
1. Почему геохимия как самостоятельная отрасль знания возникла только
в X X в.?
2. Какие виды миграции элементов характерны для нашей планеты и каковы
принципы их выделения?
3. В чем состоит сущность системиого подхода, назовите виды обратной
связи.
4. На чем основана классификация систем, изучаемых геохимией?
5. В чем различия трех аспектов геохимических исследований?
6. В чем заключается матричный принцип систематики?
7. Какие проблемы решает прикладная геохимия?
2. РАСПРОСТРАНЕННОСТЬ ХИМИЧЕСКИХ ЭЛЕМЕНТОВ
В ОБОЛОЧКАХ ЗЕМЛИ
Изучение скоростей распространения сейсмических волн позволи-
ло построить «сейсмическую модель Земли», выделить земную кору,
мантию и ядро (рис. 3). Мантия и земное ядро недоступны для непо-
средственных исследований, и представления об их геохимии основа-
ны на косвенных, главным образом геофизических, данных. Большин-
ство построений в этой области носит характер гипотез, хотя исход-
ные геофизические данные бесспорны. Так, установлено, что средняя
плотность Земли составляет 5,52 г/см3, а пород земной коры —
2,8 г/см3. Отсюда следует вывод о высокой плотности земных глу-
бин. Это может быть связано как с изменением состава (например, с
увеличением количества тяжелых металлов — Fe, Ni), так и с фазо-
выми превращениями легких минералов. О возможности второго пути
свидетельствует открытие тяжелых полиморфных -разновидностей
SiO2 — стишовита с плотностью 4,35 и коэсита—2,93 (у кварца — 2,65).
Земная кора
В 1909 г. югославский ученый А. Мохоровичич, изучая распростра-
нение сейсмических волн Хорватского землетрясения, установил, что
на глубине нескольких десятков километров их скорость скачкооб-
27
разно увеличивается от 6,5 до 7—8 км/с. Дальнейшие исследования по-
казали, что в разных областях данный скачок происходит на неодина-
ковой глубине — на материках от 30 до 70 км, на дне океанов 5—15 км.
По имени ученого эту границу стали именовать ^границей Мохорови-
чича», или «Мохо», «М». Причина столь резкого изменения скорости сей-
смических волн окончательно не выяснена. Высказываются предполо-
Рис. 3. Оболочечное строение Земли (по разным авторам)
жения о смене на этой глубине химического состава пород, об изме-
нении их плотности и фазового состояния (образовании минералов с
более плотной упаковкой атомов и ионов при неизменном элементар-
ном составе), о совместном действии многих факторов и т.д. Границу
Мохо считают нижней границей земной коры. Наибольшую мощность
она имеет под горными хребтами (до 75 км), наименьшую — на дне
океанов (5—15 км). В некоторых структурных зонах, например в риф-
тах, граница М не выражена, в других установлено несколько поверх-
ностей М. Природа данного раздела на континентах и под океаном раз-
лична.
28
Ф. У. Кларк (1847—1931)
В земной коре скорость распространения сейсмических волн так-
же неодинакова. На континентах была выделена «граница Конрада»
(К), отделяющая верхний — «гранитный» слой коры от нижнего «ба-
зальтового» (рис. 4). Вопрос о границе «К» подвергается пересмотру,
так как она выражена не везде, а там, где есть, не всегда отделяет гра-
нитный слой от базальтового. Например, сверхглубокое бурение на
Кольском полуострове пересекло границу «К», но смену слоев не об-
наружило (изменение скорости сей-
смических волн было обусловлено
разуплотнением пород в резуль-
тате метаморфизма — формирова-
нием пористого коллектора «волно-
вода»), На платформах, по сейсми-
ческим данным, ниже осадочного
чехла выделяют не 2, а 3 слоя. Не-
которые авторы считают, что к
складчатым областям двухслойная
модель земной коры вообще не
применима, так как там выделяет-
ся несколько сейсмических слоев,
причем в каждой структуре — раз-
ные. В океанах гранитный слой
отсутствует. Там под осадками за-
легает слой, состоящий из покро-
вов базальтов с редкими прослоя-
ми осадочных пород, и третий
слой, состоящий из основных и в
меньшей степени ультраосновных
интрузивных пород.
Гранитный и базальтовый слои геофизиков не всегда тождествен-
ны по составу гранитам и базальтам. Они только похожи на эти поро-
ды по скорости распространения сейсмических волн. Многие исследо-
ватели полагают, что средний состав гранитного слоя близок к грано-
диоритам, его предлагают также называть «гранитно-метаморфиче-
ским». Состав базальтового слоя континентов наиболее гипотетичен.
Предполагается, что для него наиболее характерны породы гранули-
товой фации метаморфизма (амфиболиты и др.).
Количественную распространенность химических элементов в
земной коре впервые установил Ф. У. Кларк. В земную кору он вклю-
чал также гидросферу и атмосферу. Однако масса гидросферы состав-
ляет лишь несколько процентов, а атмосферы — сотые доли процента
от массы твердой земной коры, поэтому числа Кларка в основном от-
ражают состав последней. Продолжая исследования, ученый неуклон-
но увеличивал точность определений, число анализов, количество
элементов. Если его сводка 1889 г. содержала сведения о распространен-
ности 10 элементов, то последняя, опубликованная в 1924 г. (совместно
Г. Вашингтоном), — 50. Отдавая должное Кларку, свыше 40 лет
29
— слой воды, 2 — осадочный слой, 3 — второй (базальтовый) слой океанской коры, 4 — третий слой океанской коры
аннтно-метаморфический слой континентальной коры, 6 — гранулит-базнтовый слой континентальной коры, 7 — нормаль
мантия, « — разуплотненная мантия
посвятившему этим исследованиям, А. Е. Ферсман в 1923 г. предло-
жил термином «кларк» обозначать среднее содержание химического
элемента в земной коре, какои-либо ее части, Земле в целом, в планетах
и других космических объектах.
Современные радиометрические, нейтронно-активационные, атом-
но-абсорбционные и другие методы анализа позволяют с большой точ-
ностью и чувствительностью определять содержание химических эле-
ментов в горных породах и минералах. Представления о кларках не-
которых элементов изменились очень сильно. Так, И. Фохт в 1898 г.
считал кларк Ge крайне низким — п-10-10 %. Геохимия Ge в то вре-
мя не была изучена, практического значения он не имел. В 1924 г.
Кларк и Вашингтон все еще оценивали кларк Ge в п-10“®%. однако
вскоре положение изменилось. Ge был обнаружен в углях (до 0, п °о),
были усовершенствованы методы анализа. В середине XX в. Ge при-
обрел огромное значение в радиотехнике и других отраслях. Встал
вопрос о поисках германиевого сырья, началось детальное изучение
геохимии Ge, анализировались самые различные горные породы и ру-
ды. Огромный новый фактический материал показал, что Ge не так
уж редок в земной коре. Его кларк в литосфере —1,4-Ю-4 %, почти
такой же, как у As, Sn, давно уже хорошо знакомых человечеству. Ge
в земной коре много больше, чем Au, Ag, Pt. По сравнению с расчетами
Фохта кларк Ge вырос в миллион раз.
Со дня опубликования первой таблицы Кларка прошло 100 лет,
проделана гигантская работа и общая картина распространенности
элементов выявилась достаточно отчетливо. «Геохимия овладела но-
вой константой мира», — отмечал в 1944 г. Ферсман. Подтвердилось
гениальное положение Вернадского о рассеянном состоянии химиче-
ских элементов. Для I, Hf, Sc, Rb, In, Cs, Ra и некоторых других ред-
ких элементов оно является основным, так как они не образуют или
почти не образуют собственных минералов; для большинства элемен-
тов — преобладающим, и только для О, Si, Al, Fe, Са, Na, К и Mg
главной формой нахождения являются собственные минералы.
Итак все элементы есть везде, речь может идти только о недостаточ-
ной чувствительности анализа, не позволяющего определить содержа-
ние того или иного элемента в изучаемой системе. Это положение о
всеобщем рассеянии химических элементов Н. И. Сафронов предло-
жил именовать законом Кларка — Вернадского.
Кларки земной коры. Кларки самых распространенных извержен-
ных кислых пород установлены достаточно точно, много данных и о
кларках базальтов и других основных пород, осадочных пород. Слож
нее вопрос о среднем составе земной коры, так как неизвестно соотно
шение между различными группами горных пород, особенно под океа-
нами. А. П. Виноградов, предположив, что земная кора на 2/3 состоит
из кислых пород и на 1/3 — из основных, вычислил ее средний состав
(рис. 5). А. А. Беус установил кларки, исходя из соотношения мощно-
стей гранитного и базальтового слоев 1:2.
31
1 II III IV V VI VII VIII
1 1 0 10 H 0 10
2 3 3 2 10 3 2 0 10 3 Li 3 0 10 3 3 to 4 4 3 8 10 4 1 5 Ю 4 Be 2 5 10 4 3 6 10 4 5 1 2 10 3 7 10 * В 1 0 10 3 2 10 4
3 11 2 50 2 30 Na 2 20 7 10 ’ 12 1 87 2 40 Mg 1 20 14 0 13 8 05 8 t Al 80 1 30
4 19 2 50 1 80 К 2 7 85 Ю г 20 2 96 4 3 Са 2 5 1 40 21 1 10 3 2 4 10 3 Sc 1 1 10 3 8 10 4 22 0 45 06 Ti 0 33 5 10 2 23 9 10 3 1 9 10 2 V 7 6 10 3 7 10 3 24 8 3 10 3 1 2 10 2 Cr 3 4 10 3 2 5 10 1 25 1 10 1 9 10 2 Mn 7 10 2 2 10 1 26 4 65 5 7 Fe 36 250 27 1 8 10 3 3 4 10 3 Co 7 3 10 4 8 10 2
5 37 2 1 5 10 г 9 0 10 3 Rb 1 8 10 2 5 10 4 38 2 3 4 10 2 3 8 10 2 Sr 2 3 10 2 1 10 3 39 3 2 9 10 3 2 6 10 3 Y 3 6 10 3 8 10 5 40 1 7 10 2 1 3 10 2 Zr 1 7 10 2 3 10 3 41 2 10 3 1 9 10 3 Nb 2 0 10 3 3 10 5 42 1 1 10 4 13 10 4 Mo 1 3 10 4 6 10 5 43 Tc 44 Ru 1 10 4 45 Rh 19 10 s
6 55 3 7 20 С 38 1 to 0 4 0 4 1 0 4 5 56 6 5 10 2 4 5 10 2 Ba 6 8 Ю 2 6 10 4 57 2 9 10 3 2 5 10 3 La 4 6 10 3 3 10 5 72 1 10 4 2 6 10 4 Hf 3 5 10 4 5 10 5 73 2 5 10 4 1 0 to 4 Та 2 1 10 4 2 10 6 74 1 3 10 4 1 1 10 4 w 1 9 10 4 1 5 10 s 75 7 10 3 70 10 8 Re 7 0 10 8 8 10 8 76 Os 5 10 6 77 1 O-1O-® lr 4 8 10 5
7 87 Fi 88^ j Ra 89 Ac 104 Ku
Li Химические элементь известные в земной коре 87 Fr Порядковый номер Искус ствениые элементь 58 7 10 3 6 0 10 3 Се 8 3 10 3 5 10 5 59 9 10 4 5 7 10 4 Pr 7 9 10 4 I 10 5 60 3 7 10 3 2 4 10 3 Nd 3 3 10 3 6 10 5 61 Pm 62 8 10 4 6 5 10 4 Sm 9 0 10 4 2 10 5
32 10 3 2 0 10 3 Li 30 ю 3 3 0 10 * Кларки твердой земной корь по А П Виноградову литосферы континентальной (без осадочного чехла) по А А Беусу гранитной оболочки по А А Беусу каменнь х метеоритов по А П Виногрид&ыу 90 1 3 10 3 7 3 10 4 Th 1 4 W 3 4 10 • 91 Pa 92 2 5 10 4 1 5 10 T u 2 6 10 4 1 5 10 8 93 Np 94 Pu
Рис 5
VIII 1 II III IV V VI VII 0
2 He
6 23 10 2 1 7 10 2 c 3 0 10 2 4 10 2 7 1 9 10 3 2 0 10 3 N 2 6 10 3 J 10 4 8 47 0 46 0 О 48 1 350 9 66 10 2 6 0 to 2 F 7 2 10 2 2 8 10 3 10 Ne
14 29 5 27 7 Si 30 9 180 15 9 3 10 2 1 '0 ' P 8 10 2 5 10 2 16 4 7 10 2 Т7о~У s 4 10 2 2 0 17 Х2-Ш 2 1 10 2 Cl 1 7 10 2 7 10 3 18 _ Ar
28 5В 10 3 35 10 3 Ni 2 6 10 3 1 35 2Э <110 3 6 5 10 3 Си 2 2 10 3 1 10 2 30 8 3 10 3 8 7 10 3 Zn 5 1 10 3 5 10 3 31 1 9 10 3 1 7 10 3 Ga 1 9 10 3 3 10 4 32 1 4 10 4 1 3 10 4 Ge 1 3 10 4 1 to 3 33 1 7 10 4 I 9 to 4 As 1 6 10 4 3 10 5 34 5 10 3 1 0 10 5 Se 1 4 10 8 t 10 3 35 2 1 10 4 2 0 }0 * Br 22 10 4 5 10”8 36 Kr
46 1 3 10 G о 10 7 Pd п Ю 8 1 10 4 47 7 10 6 9 10 6 А9, 4 8 10 8 9 4 10 ® 48 1 3 10 5 19 10s Cd 15 10s 1 10 5 49 2 5 10 5 2 3 10 5 In 2 5 10 5 1 10 ’ 50 2 5 10 4 1 9 }0 4 Sn 2 7 10 4 1 10 4 51 5 10 5 20 >0 5 Sb 2 0 10 5 1 10 5 52 7 1 10 7 1 10 7 Те I to 7 5 10 8 53 4 10 6 50 10 5 1 5 0 10 6 4 10 5 54 Xe
78 Pt 2 10 * 79 4 3 >0 7 1 7 10 7 Аи 1 2 Ю 7 J 7 10 5 80 8 3 10 6 4 6 10 • Hg 3 3 10 6 3 10 4 81 4 1 10'4 7 10 5 Tl 1 8 10 4 1 10 7 82 3 1 6 10 3 S 10 4 Pb 1 6 10 3 2 10 5 83 9 10 7 8 10 7 Bi 1 0 10 ® 3 10 7 84 Po 85 At 86 Rn
63 1 3 10 4 1 0 10 4 Ей 1 4 10 4 ею® 64 8 10 4 6 5 10 4 Gd 9 10 3 4 10"5 65 4 3 10 4 1 0 10 4 Tb 1 4 10 4 5 10 ® 66 5 10 4 4 6 10 4 Dy 6 5 10~4 3 5 10"s 67 1 7 10 4 1 3 10 4 Ho 1 8 10 4 7 10"® 68 33 10 4 2 6 10 4 Er 3 6 1O~4 2 10-5 69 , 2 7 10"5 2-10 s Tm 3 4 1O“5 70 > 33 10"’ 3 6 10 4 Yb 3 6-10"4 2 1O"S 71 , a io"5 8 10"5 LU 1 vio'4 3 5*10"®
95 Ат 96 Ст 97 Bk 98 Cf 99 Es 100 Fm 101 Md 102 (No) 103 Lr
Кларки
2 Зак 2022
Представления о составе базальтового слоя весьма гипотетичны.
По А. А. Беусу, его средний состав (%) близок к диоритам (1-й вари-
ант расчета):
О — 46,0 Mg -3,0 К -1,4
Si — 26,1 Мп -0,1 Ti - 0,7
Al -8,1 Са -5,1 Н —0,1
Fe — 6,7 Na -2,4 Р -0,1
прочие — 0,2
Сумма — 100,0
Данные рис. 5 свидетельствуют, что почти половина твердой зем-
ной коры состоит из одного элемента — О. Таким образом, земная ко-
ра — это «кислородная сфера», кислородное вещество. На втором мес-
те стоит Si (кларк 29,5), на третьем — А1 (8,05). В сумме они состав-
ляют 84,55 %. Если к этому числу добавить Fe (4,65), Са (2,96),
Na (2,50), К (2,50), Mg (1,87), Ti (0,45), то получим 99,48%, т. е. прак-
тически почти вся земная кора. Остальные 80 элементов занимают ме-
нее 1 %. Кларки большинства элементов не превышают 0,01 —
0,0001 %. Такие элементы называются редкими. Если они обладают
слабой способностью к концентрации, то именуются редкими рассея-
нными (Br, In, Ra, I, Hf, Re, Sc и др.). Например, у U и Br кларки
почти одинаковы (2,5-10“4 и 2,1-10“4 %), но U просто редкий
элемент, так как известны его месторождения, а Вг — редкий рассеян-
ный, так как он почти не концентрируется в земной коре и известен
лишь один собственный минерал этого элемента. В геохимии употреб-
ляется также термин ^микроэлементы», под которыми понимаются
элементы, содержащиеся в данной системе в малых количествах (по-
рядка 0,01 % и менее). Так, А1 — микроэлемент в организмах и мак-
роэлемент в силикатных породах.
Итак, содержание элементов в земной коре колеблется в миллиарды
миллиардов раз (л-10—п-10_1в), причем представления, почерпнутые
из повседневного опыта, не всегда совпадают с данными геохимии. На-
пример, Zn и Си широко распространены в быту и технике, a Zr и Ti
для нас «редкие элементы». Вместе с тем Zr в земной коре почти в четы-
ре раза больше, чем Си, Ti — даже в 95 раз. «Редкость» Zr и Ti объяс-
няется трудностью извлечения их из руд, которая была преодолена
только в середине XX в., когда эти металлы стали широко использо-
ваться в промышленности.
Хорошо известно, что химические элементы вступают во взаимо-
действие друг с другом не пропорционально их массам, а в соответст-
вии с количеством их атомов. Поэтому и кларки важно рассчитывать
не только в массовых процентах, но и в процентах от числа атомов,
т. е. с учетом атомных масс (П. Н. Чирвинский, А. Е. Ферсман). При
этом кларки тяжелых элементов (например, U, Au) уменьшаются, а
легких — увеличиваются. Ниже приведены примеры легких элемен-
34
тов, атомные кларки которых больше массовых, и примеры тяжелых
элементов, атомные кларки которых меньше массовых (в скобках даны
массовые кларки):
Легкие элементы
О —58,0 (47,0)
Li — 1,9-10-з (3,2-10-3)
Be —1,2-10-3 (3,8-10-*)
Тяжелые элементы
U — 2 1Q-5 (2,5-Ю-4)
Au —510-8 (4,3-10~7)
Ra —9-Ю-12 (2-Ю-10)
Расчет на число атомов дает более контрастную картину распростра-
ненности химических элементов: выявляется еще большее преоблада-
ние 0 и редкость тяжелых элементов в земной коре.
Когда был установлен средний состав земной коры, естественно воз-
ник вопрос о причине столь неравномерного распространения элемен-
тов. Его стали связывать с особенностями строения атомов. Рассмот-
рим связь кларков с химическими свойствами элементов. Так, щелоч-
ные металлы Li, Na, К, Rb, Cs и Fr в химическом отношении близки
друг другу — у них один валентный электрон, но кларки их резко
различны: Na и К много (2,50), Rb — мало (1,5-10~2), Li — еще мень-
ше (3,2-10-3), Cs — очень редок (3,7-10-4), a Fr получен искусст-
венно.
Резко различны кларки у F, Cl, Вг и I, у Si (29,5) и Ge (1,4-Ю-4),
у Ва (6,5-10-2) и Ra (2-10-10). С другой стороны, различные в хими-
ческом отношении элементы имеют близкие кларки: Мп (0,1) и
Р (0,093), Rb (1,5-Ю-2) и С1 (1,7-10-2).
А. Е. Ферсман построил график зависимости атомных кларков для
четных и нечетных (по порядковому номеру) элементов периодической
системы (рис. 6). Выявилось, что с усложнением строения атомного
ядра, утяжелением его, кларки уменьшаются. Однако кривые оказа-
лись не монотонными, а ломаными. Ферсман прочертил гипотетиче-
скую среднюю линию, которая плавно понижалась по мере возраста-
ния порядкового номера. Элементы, расположенные выше линии, об-
разующие пики, ученый назвал избыточными (О, Si, Fe и др.), а рас-
положенные ниже — дефицитными (инертные газы и др.). Следова-
тельно, в земной коре преобладают легкие атомы, занимающие началь-
ные клетки периодической системы, ядра которых содержат небольшое
число протонов и нейтронов. Действительно, после Fe (№ 26) нет ни
одного распространенного элемента.
Другая особенность распространенности элементов установлена в
1914 г. итальянцем Г, Оддо и более детально в 1915—1928 г., амери-
канцем В. Гаркинсом. Они выявили, что в земной коре преобладают
элементы с четными порядковыми номерами и атомными массами. Сре-
ди соседних элементов у четных кларки почти всегда выше, чем у не-
четных (см. рис. 5,6). Для первых по распространенности 9 элемен-
тов массовые кларки четных составляют в сумме 86,43 %, кларки не-
четных — 13,03 %. Особенно велики кларки элементов, атомная мас-
са которых делится на 4. Это О, Mg, Si, Са и т.д. Среди атомов одного
2*
.35
и того же элемента преобладают изотопы с массовым числом, кратным
4, например у О и S:
|вО — 99,76 32S —95,01
,7О —0,04 “5 — 0,75
,8О — 0,20 34S — 4,22
36 S — 0,02
По Ферсману, ядра типа 4 q (q — целое число) слагают 86,3 % зем-
ной коры. Менее распространены ядра типа 4 </ + 3 (12,7 %) и сов-
сем мало ядер 4q -f- 1 и 4q + 2 (1 %). Отмечено также, что среди
Рис. 6. Логарифмы атомных кларков элементов (по А. Е. Ферсману)
четных элементов, начиная с Не, наибольшими кларками обладает
каждый шестой: О (№8), Si (№ 14), Са (№ 20), Fe (№ 26). Для нечет-
ных существует аналогичное правило (начиная с Н); N — № 7, А1 —
№ 13, К — № 19, Mg — № 25.
Итак, в земной коре преобладают ядра с небольшим и четным чис-
лом протонов и нейтронов.
Основные законы распространенности элементов в земной коре,
очевидно, заложились еще в первые этапы развития Земли как плане-
ты, так как в самых древних архейских породах, как и в самых моло
дых, преобладают О, Si, Al, Fe. Все же кларки некоторых элементов
изменились. Так, например, в результате радиоактивного распада ста-
ло меньше U и Th и больше РЬ — конечного продукта их распада («ра-
диогенный» РЬ составляет часть атомов РЬ земной коры). Известную
36
роль в изменении кларков некоторых элементов играла диссипация
легких газов, выпадение метеоритов и другие причины.
Геохимическая классификация элементов В, И. Вернадского.
Родственные по периодической системе элементы ведут себя в земной
коре далеко неодинаково. Так, К и Na, Fe и Ni, Cl и I, Сг и Мо — ана-
логи в химии, но в земной коре мигрируют по-разному. Это связано с
тем, что для геохимии часто основное значение имеют такие свойства
элементов, которые с общехимических позиций второстепенны и не
учитываются в классификации. Следовательно, необходима особая ге-
охимическая классификация элементов. В табл. 1 приведена класси-
фикация В. И. Вернадского, в которой учтены самые важные моменты
истории элементов в земной коре. Главное значение ученый придавал
радиоактивности, обратимости или необратимости миграции, способ-
ности элементов давать минералы, состоящие из нескольких разнород-
ных атомов. Вернадский выделил шесть групп элементов. Наиболее
крупная из них — «циклические элементы», участвующие в сложных
круговоротах. По массе они преобладают в земной коре, из них в основ-
ном состоят горные породы, воды, организмы. Б. А. Гаврусевич до-
полнил эту классификацию еще двумя группами: элементами, по-види-
мому, вымершими в земной коре, но известными в космосе, — Тс,
Am, Ст, Вк и Cf, и элементами, неизвестными в природе, но полу-
ченными искусственно, — Pm, Es, Md, No, Ku и др.
Таблица 1. Геохимические группы элементов по В. И. Вернадскому (1934)
Группа Состав группы Число элементов Процент от общего числа элементов (92) Абсолютная масса эле- ментов в земной коре, т Процент от общей массы земной коры
1. Благородные Не, Ne, Аг, Кг. Хе 5 5.44 ю14 5-Ю-4
газы
И. Благородные Ru. Rh, Pd, Os, Ir, Pt, Au 7 7,61 ю12 5-I0-”
металлы
III. Циклические элементы H, (Be), В, C, N. 0, F, Na, Mg, Al, Si, P, S, Ci; K, Ca, Ti, V, (Cr), Mn, Fe, Co, (Ni), Cu, Zn, (Ge)?, As, Se, Sr, (Zr)?, Mo, Ag, Cd, (Sn), (Sb), (Te), Ba, (Hf), (W), (Re), (Hg), (TI), (Rb), (Bi), . , Li, Sc, Ga, Br, Rb, Y, (Nb), In, I, Cs, Ta 44 47,82 2-101» 99,8
IV. Рассеянные элементы 11 11,95 1016 5-Ю-2
V. Сильно радио- Po, Rn, Ra, Ac, Th, Pa, U 7 7,61 10й 5-Ю-3
активные эле- менты
VI. Элементы ред- ких земель La. Ce, Pr, Nd, Pm, Sm, Eu, Gd, Tb, Dy, Ho, Er. Tm, Yb, Lu 15 16,30 Ю1в 5-Ю-2
37
Мантия и ядро Земли
Состав метеоритов как основа построения модели мантии и ядра
Земли. Метеориты состоят из трех основных фаз — металлической
(никелистое железо), силикатной и сульфидной (FeS и др.). Их клас-
сификации основаны на соотношениях этих фаз, на различиях элемен-
тарного и минерального состава, окислительно-восстановительных и
температурных условий образования. По соотношению металличе-
ских и силикатных фаз выделяют 3 основных класса метеоритов.
В железных метеоритах, или сидеритах, абсолютно преобладает ме-
таллическая фаза, состоящая из Fe и N1 с небольшой примесью Со,
S, Р, С и других элементов. Железо-каменные метеориты (сидеролиты)
состоят из никелистого железа и силикатов — оливина, гиперстена,
плагиоклаза и др. Каменные метеориты, или аэролиты, составляю-
щие около 90 % от общего числа падений (> 10 000), наиболее разно-
образны. Среди них преобладают хондриты, для силикатной фазы ко-
торых характерны «хондры» — шарики диаметром в несколько мил-
лиметров, состоящие из стекла или раскристаллизованного материала.
Хондриты наименее дифференцированы по составу. Наиболее распро-
страненные, так называемые обыкновенные хондриты состоят на 40 %
из оливина, 30 “о пироксена, 10—12 % Fe— Ni сплава, 10 % пла-
гиоклаза и 6 "о троилита (FeS). Редки так называемые углистые хонд-
риты, по внешнему виду напоминающие угли и содержащие органиче-
ские вещества и графит. Это наиболее окисленные и низкотемператур-
ные образования, резко отличающиеся от всех других метеоритов со-
держанием гидратированных силикатов, сульфатов, Fe2+ и даже Fe3+,
разнообразных органических соединений, включая аминокислоты, —
результат абиогенного синтеза. Редко встречаются и не содержащие
хондр ахондриты. Они относительно бедны металлической фазой и по-
хожи на земные изверженные породы. Среди более 100 минералов, ус-
тановленных в метеоритах, часть известна и в земной коре, другая
часть в ней отсутствует. Таковы осборнит TiN, синоит Si2N2O, доб-
реелит— Fe Cr2S4, ольдгамит CaS и др. Абсолютный возраст метеори-
тов в общем тот же, что и возраст Луны и Земли,—4,5—-4,7 млрд. лет.
Верхняя мантия. В середине XX в. английские геофизики
Г. Джеффрис и К- Буллен по сейсмическим данным разделили мантию
на верхнюю (до 400 км), переходную зону (400—1000 км) и нижнюю
(1000 — 2900 км). Верхняя мантия неоднородна. Например, в юго-
западной части Тихого океана на уровне поверхности Мохо темпера-
тура не превышает 300 °C, а на территории Альпийской складчатой
зоны юга СССР равна 800—1000 °C. В 6—7 раз меняется и давление.
Неоднородна верхняя мантия также по элементарному и изотопному
составу. Образование некоторых руд в земной коре связывают с посту-
плением металлов из обогащенных ими участков верхней мантии (на-
пример, руд Сг). Породы верхней мантии, обнажающиеся на земной
поверхности, — ультрабазиты, имеют разный состав в пределах плат-
форм и геосинклинальных областей.
38
В верхней мантии расположена астеносфера — вязкий пластич-
ный, частично расплавленный слой с пониженной скоростью сейсми-
ческих волн. В рифтах срединно-океанических хребтов астеносфера мес-
тами залегает на глубине 2—3 км от дна океана, на периферии океа-
нов — на глубине 80—100 км, на континентах еще глубже. На плат-
формах и щитах она местами не обнаруживается и на глубинах
150—200 км. Это дало основание некоторым геофизикам отрицать
сплошность астеносферы, говорить о существовании лишь «астено-
линз». В. Е. Хайн полагает, что астеносфера хотя и на разной глубине
распространена повсеместно. Известны и такие регионы, например
Памир, Гималаи, где выявлено несколько астеносфер.
Твердую оболочку выше астеносферы часто именуют литосферой.
Данный термин используется и как синоним твердой земной коры
(не включая в литосферу верхнюю мантию). Учитывая, что тектони-
ческие и магматические явления связаны с земной корой и верхней ман-
тией, В. В. Белоусов их объединил в тектоносферу.
При изучении верхней мантии наряду с геофизическими и петроло-
гическими методами используются и геохимические критерии — сос-
тав газов, поступающих по глубинным разломам. Индикаторное зна-
чение имеют также изотопные отношения Не, Аг, Хе, С, S, Sr, Nd,
Hf, Os. Глубинные газы, вероятно, мантийного происхождения, уста-
новлены в Исландии и других рифтовых зонах. Изучение изотопного
состава глубинных газов позволило установить «гелиевое», «аргоно-
вое», «неоновое», «ксеноновое» дыхание Земли.
Для глубинных газов характерны СО, Н2, СН4— показатели рез-
ковосстановительной среды.
Состав верхней мантии ряд авторов считает аналогичным хондри-
там. Так, по модели А. Рингвуда, составу верхней мантии отвечает
смесь трех частей ультраосновных пород и одной щелочного базальта.
Эту смесь он назвал пиролитом (пироксено-оливиновая порода).
Содержание основных металлов в пиролите (кроме Fe) соответствует
их содержанию в хондритах и солнечной фитосфере. При подъеме пи-
ролита к поверхности (например, в срединно-океанических хребтах)
он частично расплавляется, образуя базальтовую магму и остаточный
нерасплавленный перидотит. А. П. Виноградов предположил, что в
верхней мантии за счет радиоактивного распада существуют подвиж-
ные локальные очаги расплавленных пород. Если температура на верх-
ней и нижней границе такого очага различна, то в расплаве возникает
конвекция, легкоплавкие компоненты двигаются кверху, опережая
тугоплавкие. Механизм выплавления вещества базальтового слоя из
верхней мантии ученый считал аналогичным «зонной плавке», хоро-
шо изученной в металлургии. В опытах Виноградова и А. А. Ярошев-
ского последовательное расплавление на разных участках (снизу
вверх) цилиндра из хондритов (зонная плавка) привело к образова-
нию в нижней части цилиндра стекла, по составу отвечавшему ульт-
раосновным породам, а в верхней части — базальтам. Для объясне-
ния формирования базальтового слоя привлекаются и другие модели.
39
Имеются расчеты, согласно которым в образовании земной коры участ-
вовала 1/3 верхней мантии. В результате образовалась «обедненная»
верхняя мантия.
Переходная зона, нижняя мантия и земное ядро. При изучении пере-
ходной зоны, нижней мантии и ядра наряду с сейсмическими данными
большое значение имеют данные метеоритики, использование ультра-
звуковых и ударно-взрывных волн. Термодинамическую модель ман-
тии и ядра разработали О. Л. Кусков и Н. И. Хитаров.
Имеются представления о вертикальной конвекции вещества глу-
бокой мантии, о существовании астенолинз на глубинах 1000 км, о
глубинных каналах-разломах, соединяющих земную кору с нижней
мантией (Е. В. Артюшков, В. К- Кучай и др.).
Переходная зона (слой С) и нижняя мантия (слой Д), вероятно,
также имеют силикатный состав. Их большую плотность объясняют
образованием более плотной модификации минералов — стишовита,
шпинели, периклаза и др. По элементарному составу нижнюю мантию
(слой Д) обычно сравнивают с каменными метеоритами. Если эта гипо-
теза верна, то нижняя мантия сильно отличается от земной коры, хо-
тя в ней все еще преобладает О. Второе место принадлежит Fe и лишь
третье — Si. Высоки кларки Mg, Ni, S, сравнительно малы — Са и
AI:
0—35 Mg—14 Са —1,40 Сг — 0,25
Fe — 25 S —2,0 Ni — 1,35 Мп —0,20
Si—18 Al —1,3 Na —0,7 2 — 99,2%
По сейсмическим данным большая часть земного ядра жидкая
(внешнее ядро) и только на глубинах более 5 100 км расположено твер-
дое внутреннее ядро с плотностью около 12—13 г/см3. В основе гипо-
тезы о железо-никелевом ядре Земли лежит предположение о близо-
сти состава ядра к составу железных метеоритов, содержащих в сред-
нем 80,78 % Fe, 8,59 % Ni и 0,63 % Со. Эксперименты при высоких
давлениях, отвечающих ядру Земли (более 2,5-1011 Па), показали, что
сплав из 90 % Fe и 10 % Ni имеет свойства, близкие к свойствам зем-
ного ядра, определенным геофизическими методами. Отличие состоит
в несколько большей плотности этого сплава и несколько меньшей ско-
рости распространения упругих волн. В связи с этим считают, что в
ядре имеется примесь легких элементов — Si, С, А1, О. Их больше во
внешнем ядре и меньше во внутреннем, которое, по В. А. Руднику и
Э. В. Соботовичу, вероятно, на 99 % состоит из Fe (90,2) и Ni (9,04).
На основе различных данных (господство водорода в космосе и др.)
развиваются также представления о гидридном и карбидном ядре
Земли. По этой гипотезе внутреннее твердое ядро состоит из гидридов
и карбидов. Во внешнем ядре происходит их разложение с образова-
нием свободных металлов (Fe, Ni, Со), водорода и метана, которые миг-
рируют в мантию и определяют развитие там восстановительных про-
цессов. В нижней мантии господствуют свободные металлы или же они
сосуществуют с силикатами и оксидами. Водород и метан проникают
и в земную кору (В. Н. Ларин, Н. П. Семененко).
По гипотезе А.Ф. Капустинского, в земном ядре вследствие огром-
ного давления- нарушается электронная структура атомов, исчезает
их химическая индивидуальность и все элементы приобретают оди-
наковые металлизованные свойства (вещество состоит из ядер ато-
мов, находящихся в общей для всех ядер электронной плазме). Это
определяет однообразие земного ядра, отсутствие различий между хи-
мическими элементами (зона «нулевого химизма», «центросфера»),
В мантии под влиянием сильного давления изменяются химические
свойства атомов, так как электроны переходят на незаполненные
внутренние орбиты. Это зона «вырожденного химизма», или «интер-
сфера» (вещество близко к металлическому состоянию, хотя и имеет
силикатный состав). Химические свойства элементов, соответствую-
щие их положению в периодической системе, проявляются только в зо-
не «нормального химизма», или «перисфере», отвечающей земной коре
и верхам мантии.
Средний состав Земли. Геофизические данные о строении Земли
(кора, мантия, ядро), сведения о средней плотности планеты, о составе
метеоритов позволили рассчитать гипотетические кларки Земли в це-
лом. По В. Рама-Мурти и Г. Холлу, состав Земли соответствует смеси
40 % материала типа углистых хондритов, 50 % обычных хондритов,
10 % железных метеоритов. Однако по сравнению с хондритами Зем-
ля обеднена К и Rb относительно U, Sr и других тугоплавких элемен-
тов. Для Земли характерна очень сильная дифференциация: К, Rb,
Ba, U и Th сосредоточены почти полностью в земной коре, причем U и
Ва концентрируются в земной коре гораздо энергичнее, чем щелочные
металлы и другие легкоплавкие и летучие элементы. Эти и другие фак-
ты указывают на глобальное обеднение планеты летучими элементами.
Предполагается, что они были потеряны до образования Земли как
планеты или в начале ее истории.
Средний состав Земли впервые был намечен советским геохимиком
П. Н. Чирвинским в 1919 г. В. А. Рудник и Э. В. Соботович на основе
разработанной ими в 1982 г. модели вычислили следующие кларки
Земли:
Fe —41,67 Mg —10,68 Са—1,06
0 — 27,27 Ni —3,14 Al — 1,02
Si—12,23 S —1,41 К —0,74
2 = 99.22
Геохимическая классификация элементов В. М. Гольдшмидта.
Этот ученый сравнил дифференциацию элементов в расплавлен-
ной планете с выплавкой металла из руд, когда на дно металлурги-
ческой печи опускается тяжелый металл с плотностью около 7, а на
поверхность всплывает легкий силикатный шлак (аналог земной коры).
Между ними располагается слой «штейна» — сульфида Fe с примесью
сульфидов других металлов (аналог мантии). Распределение элементов
по оболочкам, по Гольдшмидту, зависело от их атомных объемов (рис. 7).
Элементы, занимающие минимумы на кривой атомных объемов, дают
40
41
томные объем
Рис. 7.
Кривая атомных объемов:
1 — атмофильиые элементы, 2 — сндерофнльиые, 3 - литофильные,
4 — халькофнльные
Рис. 8. Геохимическая классификация элементов В М. Гольдшмидта:
I атмофильиые, 2 - литофильные, Л - халькофнльные, 4 - сидерофильные
сплавы с Fe, в ходе дифференциации они образовали земное ядро
(сидерофильные элементы). Элементы, занимающие максимумы на кри-
вой и расположенные на нисходящих ее частях, обладают большим
сродством к кислороду. При дифференциации они образовали земную
кору и верхнюю мантию (литофильные элементы). Элементы с высо-
ким сродством к S, Se, Те (халькофильные) занимают восходящие части
кривой; они сосредоточены в нижней мантии, образуют сульфидно-
оксидную оболочку. Инертные газы относятся к атмофильной группе.
Гипотеза Гольдшмидта о строении Земли представляет лишь исто-
рической интерес, но вытекающая из нее классификация элементов
(опубликована в 1924 г.) сохранила свое значение. В классификации
учтено и строение атомов, атмофилы имеют атомы с 8-электронной обо-
лочкой (благородные газы), литофилы (54 элемента) — образуют ио-
ны с 8-электронной оболочкой (Na, Mg, Al, Si, К, Са и др.); халькофи-
лы (19 элементов) имеют ионы с 18-электронной оболочкой (Си, Zn
Pb, Ag, Hg, Sb, As и др.), а ионы сидерофилов (11 элементов) — 8—18-
электронную оболочку (Fe, Ni,Co, платиноиды и др., рис. 8). Класси-
фикация Гольдшмидта широко применяется в геохимии. Понятия
«литофилы», «сидерофилы» и «халькофилы» используются в большин-
стве геохимических работ. Принципы этой классификации получили
дальнейшее развитие в трудах венгерского ученого Е. Садецки-Кар-
доши, А. А. Беуса и других геохимиков.
Контрольные вопросы
1, Дайте определение понятию «кларк».
2. Назовите пять самых распространенных химических элементов в земной
коре и пять наиболее редких.
3, Чем «редкие рассеянные элементы» отличаются от «редких элементов»?
Приведите примеры тех и других.
4. Что мешает установить точные величины кларков земной коры?
В. / Как А. Е. Ферсман установил понятие о дефицитных и избыточных эле-
ментах?
6, Какова связь кларков элементов со строением их атомов?
7. На чем основаны гипотезы о кларках мантии и ядра Земли?
8. Охарактеризуйте геохимические классификации элементов В И. Вернад-
ского и В. М. Гольдшмидта.
3. ГЕОХИМИЯ ПЛАНЕТ ЗЕМНОЙ ГРУППЫ И КОСМОХИМИЯ
Геохимия Луиы и планет
Долгое время единственным источником прямой информации о ве-
ществе планет были метеориты, к которым в последние десятилетия
добавились породы Луны, сведения о составе литосферы и атмосферы
Венеры, Марса и других планет.
Луна. Ценная информация о геохимии Луны получена с помощью
аппаратов, совершавших мягкую посадку на поверхность Луны («Лу-
44
на-16,20», «Аполлон-11,12» и др.) и доставивших на Землю лунные
породы; 85 % лунной поверхности составляют «материки» и 15 % —
«моря». Материковые породы представляют собой брекчии из облом-
ков анортозитов, троктолитов и норитов, в меньшей степени базаль-
тов. Характерна микропримесь метеорного вещества. Породы образо-
вались из расплава и в дальнейшем испытали удары метеоритов, выз-
вавшие их раздробление, а возможно и частичное плавление (базаль-
ты). Материковые породы формировались в сильно восстановительных
условиях, так как содержат самородное Fe. Характерен дефицит ле-
тучих компонентов, в частности отсутствие минералов, содержащих
воду и СО2. Возраст пород очень древний — 4,4—4,6 млрд, лет, хотя
есть и более молодые — 3,9—4,1 млрд. лет. Лунные моря сложены
базальтами, излияния которых происходили 3,8—3,1, возможно,
2 млрд, лет назад. Они отличаются от земных базальтов повышенным
содержанием Fe2+, Ti и других тугоплавких металлов — Sc, Y, Сг,
Мп, Со, Ni, Zr, Nb, Mo. TR. Содержание Fe3+, Na и К, напротив, по-
нижено.
У Луны нет гранитного слоя, осадочных пород, атмосферы и гидро-
сферы. На поверхности развит слой мелкозема (реголит), образовав-
шийся, вероятно, за счет контраста дневных и ночных температур
(150 °C) и ударов метеоритов.
В реголите обнаружены изотопы 3Не, 20Ne, 22Na, 2вА1, образование
которых связывают с действием космических лучей. Возможно, что
этой же причиной объясняется присутствие в поверхностной части ре-
голита следов Fe, Al, Si и Ti в элементарной форме. А. П. Виноградов,
В. Л. Барсуков, О. А. Богатиков, Ю. П. Диков и другие открыли не-
окисляемость этих ультрадисперсных форм элементов, т. е. их пассив-
ность по отношению к газообразному кислороду.
В целом Луна значительно менее дифференцирована, чем Земля
ее средняя плотность равна 3,34 г/см3, а плотность поверхностных по-
род— 3,1—3,2 г/см3. Это говорит о том, что Луна почти нацело сло-
жена силикатным материалом, и, возможно, не имеет металлического
ядра (рис. 9). По сейсмическим и другим данным под анортозитовой
корой Луны выделяются верхняя и нижняя мантия, гипотетическое
ядро (неметаллическое?).
Важную роль в истории Луиы играла метеоритная бомбардировка
поверхности, с которой связано образование многочисленных кольце-
вых структур. Известно 300 000 кратеров диаметром более 1 км. Наи-
более интенсивны эти процессы были 4,2—3,8 млрд, лет назад. Малые
размеры Луны определили более быструю по сравнению с Землей ее
эволюцию: полагают, что ее тектоническая и магматическая актив-
ность также завершилась около 3 млрд, лет назад.
Вейера. По размерам и плотности Венера похожа на Землю; на ос-
нове их аналогии были высказаны различные гипотезы о природе пла-
неты. Однако, как правило, они не подтвердились при ее изучении со-
ветскими автоматическими станциями «Венера» и американскими кос-
мическими аппаратами «Маринер». Радиолокация поверхности плане-
45
ты установила на ней высокие плато, горные хребты, разломы, вул-
каны, депрессии. Венера имеет плотную атмосферу, состоящую из
СО2 (97%) и N (около 3 %). На остальные компоненты приходится
около 0,1 %. Это СО, SO2, Н2О, НС1, HF, H2S, COS, Н2, О2, Аг, Ne,
Кг, Хе.
Если бы карбонатные породы Земли были нагреты и отдали свою
СО2 в атмосферу, то Земля содержала бы столько же СО2, как и вене-
рианская атмосфера. С высоким содержанием СО2 в атмосфере Венеры
связан парниковый эффект — высокая температура ее поверхности
Рис. 9. Схема внутреннего строения планет земной группы (по
В. Л. Барсукову)
(около 500 °C). Сенсацией стало обнаружение облачного слоя на высо-
те 50—70 км, состоящего из капелек серной, а возможно, и соляной
кислот (С1 и S — продукты вулканизма). Горячая поверхность пла-
неты исключает существование жидкой воды, которая должна была
бы превратиться в водяные пары. Но их в атмосфере мало (0,05 %)
и это одна из загадок Венеры. Предполагают, что Н2О уничтожена в
ходе фотодиссоциации под влиянием солнечного излучения, причем
образовавшийся О израсходовался на окисление, а Н диссипировал в
космос. Необычным оказался изотопный состав Аг и Ne, не похожий
на земной. Так, первичного (нерадиогенного) звАг в атмосфере Вене-
ры в 200—300 раз больше, чем в земной атмосфере.
Отсутствие времен года на Венере, однородный климат поверхности
позволяют предполагать равновесие между атмосферой и горными по-
родами поверхности. На этой основе выполнено физико-химическое
моделирование минерального состава пород Венеры, установлены воз-
можные парагенные ассоциации минералов (В. П. Волков, И. Л. Хо-
даковский и др.).
46
На поверхности Венеры, как и на Луне, обнаружены древние «ма-
терики» с многочисленными кратерами (следами метеоритных бомбар-
дировок); имеются и депрессии, аналогичные лунным морям с базаль-
товым покровом.
По составу пород Венера, возможно, аналогична Земле. Это под-
тверждается гаммаспектрометрическими определениями U, Th и К
(близким к гранитоидам). На основе различных предположений созда-
ны модели строения Венеры, включающие силикатные кору и мантию,
металлическое ядро (см. рис. 9). Полагают, что в этом отношении Ве-
нера из всех планет больше всего напоминает Землю.
Марс. Данные по геологии и геохимии этой планеты также оказа-
лись далекими от имевшихся гипотез относительно марсианских кана-
лов, растительности и т. д. Космическими станциями «Викинг»,
«Марс» и другими заснята почти вся поверхность планеты, для которой
характерны грандиозные вулканы высотой до 27 км, рифты, каньо-
ны, извилистые долины, напоминающие речные. Поверхность покрыта
многочисленными ударными кратерами, чем Марс напоминает Луну.
Выделяется древняя кратерированная кора и базальтовые «моря» в
депрессиях.
Атмосфера Марса сильно разрежена (0,01 земного давления) и на
95% состоит из СО2, есть также Ar (1—2 %), N (2—3%), доли процен-
тов Н2О и О. Установлены различия изотопных отношений Аг и N
в атмосферах Марса и Земли и сходство этих отношений для С и О.
Климат Марса очень суров, характерны белые полярные шапки, со-
стоящие из льда (СО2, частично Н2О). Днем на экваторе температура
поднимается до Ч-30°С, ночью опускается до —100°. На Марсе наблю-
дались пыльные бури, характерны эоловые отложения. Предпола-
гается многолетняя мерзлота, а следовательно, и процессы криогене-
за. В прошлом планета, вероятно, имела более плотную атмосферу и
была богата водой. Цвет поверхности Марса оранжевый, что объясня-
ют пленкой гидроксидов Fe, облекающих песчаные и пылеватые час-
тицы (ландшафт красноцветной холодной пустыни). Средняя плот-
ность Марса 3,94 г. см3, т. е. много меньше, чем Земли и Вейеры, но не-
сколько больше, чем у Луны. Эти и другие данные позволили постро-
ить трехслойную модель планеты с небольшим металлическим ядром
(см. рис. 9). Для спутников Марса Фобоса и Деймоса характерны мно-
гочисленные кратеры ударного происхождения, что указывает на древ-
ность их поверхности.
Меркурий. Как показали телеснимки космического корабля «Ма-
ринер 10», эта самая близкая к Солнцу планета имеет лунный ланд-
шафт (за счет многочисленных кратеров). Обнаружены также узкие
долины и хребты. Согласно Д. Адамсу и другим ученым, у Меркурия
такая же анортозитовая кора, как и у Луны, возраст ее также очень
древний (3,9—4,4 млрд. лет).
Плотность Меркурия 5,45 г/см3, что указывает на высокое содер-
жание Fe, относительно большое ядро (см. рис. 9).
47
Меркурий повернут к Солнцу одной стороной и на освещенной сто-
роне температура около 430 °C, на неосвещенной — свыше 200° мо-
роза. Разреженная атмосфера Меркурия состоит из инертных газов.
Астероиды. Пояс астероидов в основном расположен между орби-
тами Марса и Юпитера и насчитывает свыше 2000 твердых тел различ-
ных размеров — от самой крупной Цереры диаметром 1003 км до не-
больших каменных глыб. Отражательная способность астероидов
такая же, как у метеоритов, причем более удаленные от Солнца тела
аналогичны углистым хондритам, расположенные ближе — обыкно-
венным хондритам и наиболее близкие — железокаменным метеори-
там. Имеются представления, что астероиды — главный источник ме-
теоритов.
Внешние планеты и их спутники. Юпитер, Сатурн, Уран, Нептун
и Плутон резко отличаются от планет земной группы малой плотно-
стью (0,7—1,7 г/см3), преобладанием в атмосфере Н и Не. Менее вели-
ка роль NH3, СН4 и других газов.
На основе различных астрофизических данных построены модели
больших планет, включающие газовую атмосферу и оболочки из моле-
кулярного и металлического водорода, водяного льда, каменного
ядра.
Неожиданными оказались сведения, доставленные «Вояджером»
о спутниках больших планет, особенно об Ио — крупном спутнике
Юпитера (/? ~ 1840 км). Это каменное тело красного, оранжевого,
желтого и белого цвета. Для Ио характерен интенсивный современный
вулканизм, причем лава представлена самородной серой. Источник
энергии Ио неясен. Другой крупный спутник Юпитера — Европа
(R = 1552 км) — покрыт ледяным панцирем, под которым предпола-
гается каменное ядро.
Происхождение Земли и других планет. По наиболее распростра-
ненным представлениям исходным веществом для образования Земли
и планет была раскаленная планетарная туманность (солнечный
газ), охлаждение которой привело к возникновению протопланетного
каменисто-пылево-газового облака. Оно состояло из газов (преиму-
щественно Н и Не — 98%), льдов (С, N, О, S, Cl, Ne и Аг — 1,5 %)
и каменистого вещества из оксидов Na, Mg, Al, Si, Ca, Fe, Ni — 0,5 %
(Гипотетический состав солнечного газа и образовавшегося из него
газово-пылевого облака рассчитан А. Гринвудом на основе аналогии
с фотосферой Солнца). Согласно теории О. Ю. Шмидта, Г. Юри и дру-
гих исследователей Земля образовалась около 4,6 млрд, лет назад
в результате агломерации частиц этого облака. Данный возраст, опре-
деленный на основе изотопных отношений 2овРЬ/2О7РЬ, совпадает с воз-
растом пород Луны и метеоритов.
Для решения многих вопросов образования Земли важное значение
имеет анализ изотопных аномалий метеоритов. Так, Хе метеоритов бо-
гаче земного Хе тяжелыми изотопами. В углистых хондритах обна-
ружено повышенное (против земного) количество 1вО, аномальное
содержание м Mg, изотопные аномалии Те, Ba, Sm, Nd, Si, Са и дру-
48
гих элементов. Эти данные свидетельствуют о гетерогенности того ма-
териала, из которого возникла Солнечная система. Сопоставив раз-
личные космохронологические методы, Ю. А. Шуколюков пришел к
выводу, что основная масса вещества Солнечной системы была синтези-
рована 4,6 млрд, лет назад, но имелся и более древний материал. «Толч-
ком», приведшим к конденсации газово-пылевого облака, многие ис-
Рис. 10. Главнейшие этапы эволюции протосолнечного газо-пылевого облака
(по В. А. Руднику и Э. В. Соботовичу):
/ этап — первоначальная протосолнечная газово-пылевая туманность и звезда, впоследствии
ставшая Сверхновой (более 4,7 млрд, лет назад), Л этап — протосолнечная туманность по-
пала в сферу действия Сверхновой (4,7 млрд, лет назад), Ш этап — в выделенной нз рав-
новесного состояния протосолнечной туманности начались процессы упорядочения, аккреции
«реликтового» вещества туманности н несколько позже конденсации вещества Свеохно
вой и «вторичного» вещества (4,7 млрд, лет назад). /V этап — центральное сгущение пре-
вратилось в Солнце, началось формирование Солнечной системы и, в частности, планеты
Земля, завершившееся примерно 4.6—4,5 млрд, лет назад
следователи считают взрыв сверхновой звезды, который, в частности
привел к образованию радиоактивных элементов Солнечной системы
(в результате облучения туманности потоком нейтронов и протонов от
сверхновой). Этой концепции придерживаются Б. Бербидж, П. Курода,
А. К. Лаврухина, В. Н. Ларин, В. А. Рудник, Э. В. Соботович и др.
(рис. 10).
Задаваясь определенными исходными величинами давления и со-
става солнечного газа, можно на основе методов термодинамики рас-
49
считать последовательность конденсации твердого вещества с пониже-
нием температуры (рис. 11). Как видно из данных рисунка, сначала кон-
денсируются наиболее тугоплавкие оксиды и силикаты, а также Fe и
Ni, в конце— Н2О и летучие металлы (Hg). Таковы несколько моде-
лей образования Земли.
А. П. Виноградов, Г. В. Войткевич, С. П. Кларк (мл.), К. К. Турекь-
ян, В. Л. Барсуков и другие полагают, что при аккреции сначала сфор-
Минерал
Ладение температуры и ЗаВления
Корунд А1г03
ЛероВскит СаТЮ5
Мелилит Ca2MgSl307
Шпинель МдА1204
Железо Fe(Nt)
Циопсид CaMq5i20{
Форстерит Мд2 5104
Анортит СаА1гЫ20в
Энстатит Mg5i.0j
Эсколаит Сг203
Алабандин Мп$
К-пол.шпат KALSijOg
Троилит FeS
Магнетит Fe30
Лед Н20
Ртуть Hg
2000 1500 1000 500 Т,
Рис. 11. Температуры коидеисации элементов и их соединений
при остывании солнечного газа (по Дж. Ларимеру и Л. Грос-
сману)
мировалось металлическое ядро, на которое позднее стали оседать си-
ликатные частицы. Из этих частиц образовалась мантия («гетерогенная
аккреция»). По расчетам С. П. Кларка (мл.) и др., становление Земли
протекало геологически быстро — не более 105 лет.
Возраст древнейших горных пород около 4,3 млрд. лет. С этого
времени началась геологическая история. Для выяснения особеннос-
тей первых 300 млн. лет, т. е. догеологического этапа (4,6—4,3 млрд,
лет), большое значение имеют данные сравнительной планетологии-
изучения Луны, Марса, Меркурия и Венеры.
50
Особенности конденсации различных участков протопланетной ту-
манности зависели от их расстояния до Солнца. Предполагается,
что более удаленные внешние планеты конденсировались быстрее и при
более низких температурах. С этим связывают различия в составе пла-
нет земной группы (каменистое вещество) и внешних планет (преобла-
дают Н, Не и льды).
Космохимия
Главными объектами космохимии служат звезды, в которых сосре-
доточено более 95 % массы вещества Вселенной. К другим объектам
относятся газовые и пылевые туманности, межзвездный газ, рассеян-
ная космическая пыль, кометы и др.
В 1929 г. впервые на основе спектрального анализа количественно
был определен состав солнечной атмосферы (для трудиолетучих эле-
ментов — данные по хондритам). В спектре солнечной атмосферы от-
крыто более 70 элементов, среди которых абсолютно преобладают Н
(около 70% по массе) и Не (28 %). На долю остальных элементов при-
ходится лишь 2 %. Особенно мало тяжелых элементов (после Fe).
Кларки солнечной атмосферы рассчитывают на 10е атомов Si или
Н. Для первых 13 элементов Л. Адлером и Дж. Россом в 1976 г. полу-
чены следующие величины:
Н - 106 N -87 Fe —32
Не-6,3104 Si — 45 S- 16
О-6.9-102 Mg — 40 Ca — 2,2
С — 4,2-102 Ne-37 Ni — 1,9
Ar — 1,0
Относительное содержание малолетучих элементов оказалось близ-
ким к углистым хондритам (рис. 12). Кларки солнечной атмосферы
принято рассматривать в качестве кларков космоса.
В центральных частях звезд высокие температуры сочетаются с
высокими давлениями. Это определяет особые формы существования
вещества. Так, в центре Солнца температура колеблется около 10’ К,
а давление достигает 101в Па. В этих условиях вещество состоит из
свободных атомных ядер и электронов, т. е. представляет собой полно-
стью ионизированную плазму. В центре звезд-гигантов температура
достигает 108 К. В целом для звезд характерно электронно-я дер ное со-
стояние вещества — это водородно-гелиевая плазма. Возможно и нейт-
ронное состояние с ядерной плотностью. К нейтронным звездам относят
пульсары (источники мощного пульсирующего радиоизлучения).
Астрофизиками установлены основные процессы необратимой эволю-
ции звезд, конечными членами которой служат белые карлики, нейт-
ронные звезды и «черные дыры».
Нуклеосинтез. В центральных частях звезд при температурах в де-
сятки и сотни миллионов градусов из протонов и нейтронов синтезиру-
ются ядра атомов. За счет «сгорания» ядер Н возникают ядра Не :
51
:4rH -► 4He. Эта реакция — одни из возможных источников солнеч-
ной энергии. Ядра тяжелых элементов возникают в результате раз-
личных ядериых реакций, в которых участвуют а-частицы (ядра Не),
протоны и нейтроны. Так, например, при «г -процессе» происходит за-
хват быстрых нейтронов с образованием ядер Cf. Это, возможно, имеет
место при вспышках сверхновых звезд, так как вспышка затухает в
течение 60 дней — времени полураспада Cf.
Углистые хондриты
Рис. 12. Сопоставление распространенности эле-
ментов в углистых хондритах I типа с распростра-
ненностью элементов в фотосфере Солнца. Все
данные приведены относительно Si=106 (по
Л. Адлеру и Д. Россу)
Наиболее вероятно и энергетически выгодно образование ядер, со-
стоящих из небольшого и четного числа протонов и нейтронов. Лег-
кие и четные ядра более устойчивы. Ядра, «переполненные» протонами и
нейтронами, часто неустойчивы. Так, (J, Th, Ra и другие радиоактив-
ные элементы разлагаются с образованием РЬ и Не. U и Th еще извест-
ны иа Земле, другие радиоактивные элементы (например, Тс) давно
распались. Одиако и среди легких элементов ие все обладают высо-
кими кларками. Например, Be имеет порядковый иомер 4 (в ядре четы-
ре протона), а его кларк в земной коре лишь 3,8-10~4 %. Мало Li
(3,2-10_3 %), В (1,2• 10~3), С (2,3-10~2). Полагают, что их ядра служат
ядериым горючим и уничтожаются в ходе ядериых реакций (рис. 13).
52
Ядра, содержащие 2, 8, 20, 28, 50, 82 и 126 протонов или нейтронов,
особенно устойчивы. Эти числа называются магическими. Наиболее
устойчивы дважды магические ядра, содержащие магическое число
и протонов, и нейтронов (*Не, О, *°Са и 208 РЬ). В земной коре
элементы с магическими ядрами обладают относительно высокими
кларками (за исключением Не).
Рис. 13. Относительная атомная распространенность химических эле-
ментов в Солнечной системе в зависимости от порядкового номера 2.
(по Л. Аллеру и Д. Россу). Черными кружками обозначены четные эле-
менты, светлыми — нечетные
Итак, в химическом отношении звезды являются довольно простыми
системами. Доступная для изучения часть Вселенной имеет в основ-
ном водородно-гелиевый состав. Космохимия оказалась однообразнее
и, пожалуй, проще геохимии. Сбылось предсказание английского астро-
физика А. Эддингтона, который в начале XX в. писал, что легче будет
разобраться в составе звезд, чем в процессах, окружающих нас на Земле.
Контрольные вопросы
1. Что общего и каковы различия геохимии Земли и Луны?
2. Что известно по геохимик Венеры и Марса, астероидов, внешних планет
Солнечной системы и их спутников?
3. Чем отличаются кларки космоса от кларков Земли и почему?
53
4. ФАКТОРЫ И ОБЩИЕ ХАРАКТЕРИСТИКИ МИГРАЦИИ ЭЛЕМЕНТОВ
Факторы миграции А. Е. Ферсман разделил на внутренние и внеш-
ние. Внутренние факторы — это свойства химических элементов, оп-
ределяемые строением атомов, их способность давать летучие или раст-
воримые соединения, осаждаться из растворов и расплавов и т. д.
К внешним факторам относятся параметры обстановки миграции —
температура, давление, кислотно-щелочные и окислительно-восстано-
вительные условия и т. д.
Основной геохимический закон В. М. Гольдшмидта. Согласно это-
му закону кларки зависят от строения атомного ядра; распределение
элементов, обязанное миграции, — от наружных электронов — хими-
ческих свойств элементов. Это глубокое обобщение нуждается в неко-
торых коррективах, так как кларки земной коры зависят не только от
строения атомного ядра, но и от химических свойств (строения элект-
ронных оболочек). Напомним, что кора является продуктом мигра-
ции— выплавления базальтов из мантии и других процессов. Все же ос-
новные закономерности кларков зависят от строения атомных ядер.
Миграция элементов в земной коре зависит не только от их химических
свойств, но и от кларков, которые во многом определяют содержание
элементов в растворах и расплавах, их способность к осаждению, мине-
ралообразованию и т. д. Роль кларка и химических свойств элемента
в его геохимии неодинакова для разных элементов. Многие элементы
с одинаковыми кларками ведут себя в земной коре резко различно
(Ga, N и Со, Sn и U и т.д.), а элементы с различными кларками —
сходно (S и Se, Са и Sr и т.д.). Поэтому геохимия элемента в земной ко-
ре определяется как его химическими свойствами, так и величиной
кларка.
Формы нахождения химических элементов. Способность элемен-
та к миграции во многом определяется формой его нахождения.
В земной коре В. И. Вернадский различал четыре основных формы
нахождения: 1) горные породы и минералы (в том числе природные
воды и газы); 2) живое вещество, 3) магмы (силикатные расплавы),
4) рассеяние. Несомненно, что каждая группа может быть расчленена
на типы, классы и т.д. Так, в первой группе резко различаются вод-
ные растворы и кристаллы (минералы). Е. М. Квятковский выделил
минеральный, безминеральный, концентрированный и рассеянный ви-
ды существования элементов.
Пока химический элемент находится в кристаллической решетке,
геохимик имеет дело с минералом как целым и индивидуальные свой-
ства элемента («внутренние факторы миграции») часто не проявляются.
Так, К и Na образуют легкорастворимые соединения, но если К вхо-
дит в состав ортоклаза, a Na альбита — минералов, устойчивых к вы-
ветриванию в сухом климате, то интенсивность миграции К и Na
в этих условиях будет определяться не растворимостью их простых
солей, а скоростью разрушения кристаллической решетки полевых шпа-
тов. В одной и той же системе, при одинаковых внешних факторах
54
(Р, т, pH и т.д.) интенсивность миграции Na альбита — Na2 Al2SileOe,
эгирина — Na, Fe [Si2Ofi], галита — NaCl различна. Аналогично раз-
лична интенсивность миграции сульфидной и сульфатной S, оксидного,
силикатного, фосфатного и прочего Fe и т. д. Входя в состав минера-
лов, элемент как бы теряет свои индивидуальные свойства. Поэтому
низкая миграционная способность часто зависит не от химических
свойств элемента, а от свойств минерала, например от податливости
кристаллической решетки к раз-
рушению. Следовательно, при изу-
чении геохимии систем необходимо
учитывать не только свойства •=
элементов и параметры среды миг- s-
рации, но и формы нахождения эле- о
ментов в системе. S
Законы распределения химичес-
ких элементов в системах. Если на
содержание химического элемента
в системе влияет большое число
равновероятных случайных, Неза- Содержание брома, сотые доли процента
висимых друг от друга причин, то
распределение элемента подчиняет-
ся нормальному закону, графиче-
ским выражением которого служит
кривая Гаусса. При нормальном
распределении наиболее вероятным
Рис. 14. Распределение содержания
брома в калийных солях аппроксими-
руется нормальным законом (по
И. П. Шарапову)
значением служит среднее ариф-
метическое х, которое совпадает с модой (наиболее распространенным
значением) и медианой (среднее значение в ранжированном ряде вели-
чин). Так, вхождение К в кристаллическую решетку микроклина за-
висит от большого числа факторов и распределение К здесь подчиня-
ется нормальному закону. По А. А. Шиманскому и Г. А. Базанову,
этому же закону подчиняется распределение Li в кварцево-биотитовых
сланцах, а по И. Шарапову, — распределение Вг в сильвинитах силь-
винитового месторождения. Правда, построения кривых на основе
опытных данных, как правило, позволяет говорить лишь о приближе-
нии к нормальному закону, т. е. об аппроксимации (рис. 14).
К параметрам нормального распределения кроме среднего арифме-
тического х относится также величина ст, или среднее квадратичное
отклонение, которое характеризует разброс изучаемой величины. Важ-
ным показателем является и коэффициент вариации v.
и = (ст/х)-100.
Например, если х Li в кварцево-биотитовых сланцах составляет
4,2-10-3 %, то о = ± 2,3-10~3 %, a v составляет 54 %:
2 3.10-э
у -----------юо.з 54%,
4,2-10—3
Когда ст = 12-6-10“3, и составляет 300 %.
55
вреднее арифметическое х содержания Вт на сильвинитовом место-
рождении (рис. 14.) равно 4,463-10-2 %, а ст = 1,357-10—2%, коэффи-
циент вариации равен 30 %.
Расчет по формуле Гаусса показывает, что при нормальном распре-
делении в пределах х ± ст находится 68,3 % значений. Если же поль-
зоваться величиной х ± 3 ст, то в ее пределах будет уже 99,7 % зна-
чений, т. е. можно быть уверенным, что из 1 000 значений за этим
пределом будет не более трех. Следовательно, если распределение эле-
ментов в системе подчиняется нормальному закону, то с вероятностью
99,7 можно считать, что все значения в пределах х ± Зо будут отно-
ситься к данной совокупности, данной системе и различия между ними
определяются случайными причинами. Значения, отличные от х±3ст,
будут относиться к геохимическим аномалиям (Са), т. е. принадле-
жать уже к другой совокупности, другой системе. Поэтому за нижний
предел аномальности Са нередко принимают величину Сф ± Зст («пра-
вило трех сигм»):
Са Сф ± Зст,
где Сф — фоновая концентрация (среднее арифметическое).
Нижний предел аномального содержания лития в кварцево-био-
титовых сланцах составит: Са = Сф + Зо = 4,2-10~3 4- 3-2,3 .
X 10~3 = 1,11-10~2 %. При Са > х 4- Зст аномалия положительна,
а при Са < х — Зст отрицательна.
Опытным путем установлено, что существуют геохимические ано-
малии, соответствующие и менее «жестким» критериям: Са > Сф ±
± 2 ст или даже Са > Сф ±ст.
Распределение химических элементов, аппроксимирующееся нор-
мальным законом, наблюдается в некоторых минералах, породах,
почвах, водах. Чаще, однако, распределение подчиняется логарифми-
чески нормальному (логнормальному) закону — нормальное распреде-
ление характерно не для самой величины, а для ее логарифма. Пара-
метрами в этом случае будет уже не среднее арифметическое, а сред-
нее геометрическое и сигма (ст) логарифмированных значений призна-
ка, обозначаемая символом е. Соответственно «жесткий» критерий ано-
мальности будет Са 4= Сф-s3, а более мягкие: Са Сф-е? и Са
> Сф-е,.
Советский ученый Н. К. Разумовский в 1940 г. доказал, что статис-
тическое распределение РЬ и Zn, Ni и Au в коренных месторождениях
подчиняется логнормальному закону, который имеет важное значение
для геологии. Позднее Л. Аренс (1954, 1957), очевидно, ие зная о ра-
ботах Разумовского, установил, что распределение многих редких и
рассеянных элементов в изверженных породах подчиняется логнор-
мальному закону, — по его мнению, основному для геохимии. Об-
суждение этого вопроса в СССР и за рубежом показало, что логнор-
мальный закон по своей значимости не может претендовать на роль ос-
новного закона геохимии.
56
Распределение разных элементов в одних и тех же объектах неред-
ко подчиняется разным законам. Так, если распределение К в некото-
рых микроклинах и мусковитах аппроксимируется нормальным зако-
ном, то распределение Li, Rb и Cs — логнормальным. Это объясняют
разной ролью элементов в решетке — К элемент «хозяин», a Li,
Rb и Cs — изоморфные примеси. Особенно убедительно это показано
для лантаноидов, среди которых наиболее распространенные в церие-
вых минералах (La, Се, Pr, Nd) распространены нормально, второсте-
пенные (Sm, Gd) — логнормально, а остальные, рассеянные (Ей,
ТЬ — Lu) — еще более асимметрично (Д. А. Минеев).
По Д. А. Родионову, распределение элементов в минералах чаще
всего подчиняется логнормальному закону. Этот же закон характерен
и для распределения в изверженных породах тех элементов, которые
концентрируются в одном минерале. Распределение элементов рас-
сеянных во многих минералах в приблизительно равных количествах
подчиняется нормальному закону.
Характеристика миграции с помощью коэффициентов. Этот Me i од
широко используется в геохимии. Так, например, по отношению SOL /
/С1_ можно отличать воды, связанные с зоной окисления сульфидов,
от вод континентального засоления. Отношение Fe/Mg и Si/Mg в уль-
траосновных породах несет информацию о глубине формирования по-
род. Весьма информативны изотопные отношения 129Хе/132Хе, 3Не/
4Не, 8eSr/87Sr, 12С/13С, 10В/11В и др. Применяются и более сложные ко-
Ba+Sr Pb2 Ag-Pb
V-^Сг Cu-Zn ’ Mo-Sn
Кларки концентрации. Отношение содержания элемента в данной
системе к его кларку в земной коре В. И. Вернадский в 1937 г. предло-
жил именовать кларком концентрации (КК). Во многих случаях КК
имеет преимущество по сравнению с массовыми и атомными процента-
ми и другими способами выражения результатов анализов. В частно-
сти, огромные различия в кларках определяют невозможность изобра-
жения распределения различных элементов на одном графике. Приме-
нение логарифмического масштаба сильно искажает реальные соот-
ношения и лишает график наглядности. Использование же К.К дает
значительно более контрастные данные. Если КК элемента меньше 1,
то для повышения контрастности распределения рационально пользо-
ваться обратной величиной — кларком рассеяния (КР) — отношением
кларка элемента в литосфере к его содержанию в данной системе. Дан-
ные о КК и КР определенного элемента помещают на схемах, иллюст-
рирующих строение изучаемой системы. На схеме, чтобы дать наибо-
лее полную картину распределения элемента, условно изображаются
все возможные составные части системы. Такую систему можно имено-
вать «идеальной» (рис. 15). Распределение элемента в различных систе-
мах можно также показывать на графиках. Часто необходимо сравни-
вать распределение нескольких элементов в разных системах. Разли-
чия в кларках в этом случае затрудняют оценку миграции, поэтому ра-
57
циональнее сравнивать отношение /(/(: ККХ1ККУ\ KKKIKKZ и
т.д.
В табл. 2 приведены КК Ва в разных системах и величина КК
Ва/КК Sr, КК Ва/КК Са и КК Ва/КК К. Выявились характерные
особенности геохимии Ва:
Таблица 2. Кларки концентрации бария
Система КК КК Ва КК Ва КК Ва
КК Sr КК Са ККК
Ультраосновные породы (маития?) 0,0015 0,05 0,006 0,15
Каменные метеориты 0,009 ‘ — — 0,3
Земная кора 1 1 1 1
Изверженные породы: основные 0,46 0,34 2 1,4
средние 1 — 0,7 1,08
кислые 1,27 1,4 2,54 0,95
Биосфера и ее производные: глииы и слайды 1,2 0,9 1,5 1,3
живое вещество 0,013 0,02 0,08 0,1
почвы 0,7 —. 1,5 1,4
гидросфера ЗЮ"5 0,0013 0,0023 0.002
пелагические известковые илы 2 0,6 4
то же, глинистые 3 1,5 —— 2,7
то же, кремнистые 1,5 2 — 2,5
Fe-Мп-коикреции океани- ческого дня 2,7 1,2 3—4 9
воды гумидных ландшаф- тов п-10-4— л -0,л 0,л 1 (?)
глубинные рассолы артези- анских бассейнов п-10-5 0,л—0,0л 0,л—0,0п 0,л—0,0п 1 (?)
воды зоны иитеисивиого во- дообмена в аридных райо- нах Л-10-5 0,00л —. —
1. Ва — элемент кислых магм. По степени накопления в них Ва
превышает Sr и особенно Са, но немного отстает от К.
2. Организмы концентрируют Ва слабее, чем Sr, Са, К.
3. Способность Ва концентрироваться в морской воде намного ни-
же, чем у Sr, Са, К.
4. Из почв Ва выносится слабее Sr, Са и К-
5. В глубинных рассолах Ва накапливается значительно слабее
Са и Sr, но примерно так же, как К.
Геохимические спектры. Для сравнения геохимии систем А. П. Со-
ловов и А.В. Гаранин предложили использовать геохимические спект-
ры. На рис. 16 показаны атомные кларки кислых пород, каменных
метеоритов и Солнца, причем для каждой системы число атомов крем-
59
Рис 16 Атомные кларки кислых пород I. каменных метеоритов 2 и Солнца 3. Содержание Si в каждой системе при-
нято равным 106
ния условно принято равным 10е. Линия 1 отвечает кислым породам и
элементы расположены в последовательности уменьшения их кларка,
в связи с чем кривая 1 монотонная убывающая. Линия 2 отвечает ка-
менным метеоритам, а линия 3 — Солнцу. Так как последовательность
элементов для линий 2 и 3 задана заранее, эти линии уже не монотон-
ны, для них характерны максимумы и минимумы. Отчетливо выявля-
ется преобладание на Солнце Н, дефицитность Li, избыток N. В ка-
менных метеоритах по сравнению с гранитоидами много Mg, Сг, но
значительно меньше щелочных металлов.
Ведущие элементы, принцип подвижных компонентов. Химичес-
кие элементы, ионы и соединения, определяющие условия миграции
в данной системе, именуются ведущими. Число их невелико. Напри-
мер, геохимия гидротермальных систем во многом определяется S,
SiO2, F, Cl, СО2, Н+ и ОН~ — ионами. Геохимическое своеобразие
океанов определяется О, растворенным в воде, Cl-, Na+ и небольшим
числом других элементов. В таежных болотах ведущими являются Fe2+,
Н+, Мп2+ и т. д. Химические элементы с низкими кларками не могут
быть ведущими из-за малых концентраций в системах—они вынуждены
мигрировать в той обстановке, которую создают ведущие элементы.
Различия в кларках определяют ведущую роль S и второстепенную Те,
ведущее значение Na и неведущее Rb, Li, Cs. Редкие элементы в
местах их концентрации (например, в месторождениях) становятся
ведущими (Hg, U, Мо и т.д.). Но ведущее значение элемента зависит
не только от его кларка и концентрации в данной системе. Важно,
чтобы элемент мигрировал и накапливался в системе. Распространен-
ные, но слабо мигрирующие элементы не являются ведущими. Один
и тбт же элемент в разных системах может быть и ведущим, и второ-
степенным. Например, Fe имеет ведущее значение во многих гидротер-
мальных системах, но его роль невелика в почвах пустынь, водах океа-
на. Наконец, если элемент энергично мигрирует, но не накапливает-
ся, он также не является ведущим. Так, Na и С1 энергично выщелачи-
ваются из кислой коры выветривания и не являются там ведущими.
Только в соляных озерах, где Na и С1 мигрируют и накапливаются, они
становятся ведущими.
Из сказанного следует принцип подвижных компонентов: геохими-
ческая особенность системы определяется ведущими элементами, т. е.
элементами с высокими кларками, наиболее активно мигрирующими
и накапливающимися (А. И. Перельман).
Парагенные и запрещенные ассоциации элементов. Понятие о
парагенезисе элементов ввел в 1909 г. В. И. Вернадский, имея в виду
их совместную концентрацию. Парагенная ассоциация элементов обу-
словлена единым процессом, она может быть как одновременной так и
неодновременной, связанной, например, с последовательным осажде-
нием элементов при постепенном охлаждении расплава или раствора.
В дальнейшем парагенезису элементов уделялось много внимания в
трудах В. М. Гольдшмидта, А. Е. Ферсмана, А. А. Саукова, В. В. Щер-
бины, А. С. Уклонского, К. А. Власова и других геохимиков, так как
61
одна из главных задач геохимии и состоит в изучении парагенных ас-
социаций элементов *. Чисто пространственную ассоциацию элемен-
тов и минералов, не связанную генетически, В. И. Лебедев именует
парастерезисом. Наиболее изучены парагенные ассоциации элемен-
тов в минералах. Парагенезис главных элементов, как правило, объ-
ясняется законами кристаллохимии (например, Fe и S в пирите, Fe,
Mg, Si, О в оливине и т.д,). Более сложны и разнообразны парагенезисы
элементов—примесей. Так, для оливина характерна примесь Ni,
Со, для халькопирита — часто Re, In, Se, Те, Ge, Au, Ni, Co, Ag,
Cd, Tl, As, Sb, Pt, Pd, для полевых шпатов — Rb, Cs, Li, Tl, Be, Ca,
Ba, Sr и др., для уранинита — Pb, Ra, He. Причины образования по-
добных ассоциаций различны: близость ионных радиусов, радиоактив-
ный распад, сорбция и т.д.
Хорошо изучены также парагенные ассоциации элементов в гор-
ных породах и рудах. Например, для ультраосновных пород характер-
на ассоциация Mg, Cr, Ni, Со, Fe, Мп, Pd, Pt, для пегматитов —
К, Rb, Li, Cs, Be. TR, Zr, Nb, Ta, F, В и др., для многих экзоген-
ных урановых руд — Mo, Se, V, Re.
Понятие парагенезиса элементов применимо и к более крупным си-
стемам — рудным месторождениям, корам выветривания, геологиче-
ским формациям, артезианским бассейнам, складчатым поясам, плат-
формам и щитам с их металлогенической специализацией, земным обо-
лочкам и, наконец, Земле в целом.
Кроме парагенных различают запрещенные ассоциации элементов
{отрицательный парагенезис), т. е. ассоциации, невозможные в дан-
ной системе. Примером отрицательного парагенезиса служат Ni и
Ва в минералах, Сг и U в рудах, Си и Мп в осадочных формациях.
Разнообразие миграции, способность к минералообразованию и
число минералов. Разнообразие миграции элемента характеризуют
число его минералов, генетических типов рудных месторождений и
т. д. Разнообразие миграции зависит от кларка и химических свойств
элемента. Для химически сходных элементов разнообразие миграции
уменьшается с уменьшением кларка (у Cs оно меньше, чем у К, у Se
меньше, чем у S, и т. д.).
От кларка во многом зависит способность элемента к минералооб-
разованию: число минералов уменьшается с уменьшением кларков.
По А. А. Саукову, для элементов с кларками от 1 до 10 % среднее
число минералов на один элемент составляет 239, а для элементов с
кларками 10~5— 10_в — только 23. Прямая пропорциональность
здесь, естественно, отсутствует в связи с влиянием химических свойств
* До работ Вернадского в течение 100 лет существовало понятие о парагене-
зисе минералов, основы которого были заложены В. М. Севергиным (1798) и
И. Брейтгауптом (1849). В дальнейшем в минералогии и науке о рудных место-
рождениях парагенезису минералов уделялось большое внимание. В истории
учения о парагенезисе минералов Ферсман особенно подчеркивал труды
В. Линдгрена, Я. Вант-Гоффа, Ф. Ю. Левинсон-Лессинга, П. Н. Чирвинского,
П. Ниггли.
62
элементов, но все же роль кларков очевидна. С уменьшением кларков
уменьшается активная концентрация элементов (при сходных хими-
ческих свойствах), труднее достигается произведение растворимости
и выпадение самостоятельной твердой фазы из вод и расплавов. Так,
высокие кларки Na, Са, Mg определяют большие их концентрации в
водах и возможность осаждения при испарении вод. Малые кларки
Cs, Ra определяют столь низкое их содержание в водах, что осажде-
ние и минералообразование данных металлов в процессе испарения не
осуществляется. Поэтому в природе известны легкорастворимые соли
Na, Са, Mg, К и не известны у Cs и Ra, хотя по химическим свойствам
и интенсивности миграции Cs и Ra вполне могли бы концентрировать-
ся при испарении.
Вторичные минералы U — элемента со сравнительно низким клар-
ком (2,5>10~4%)— встречаются на урановых месторождениях, где
содержание данного металла высокое. Только там обнаруживаются
фосфаты, арсенаты, молибдаты, ванадаты, сульфаты, карбонаты ура-
нила. Вне месторождений эти минералы отсутствуют или крайне ред-
ки. Если бы U имел кларк, как у Са или Fe, то его вторичные минера-
лы были бы распространены так же широко, как кальцит, гипс, лимо-
нит.
В группе щелочноземельных металлов растворимость сульфатов
уменьшается с ростом порядкового номера: наименее растворим RaSO4,
Вместе с тем известны минералы — сульфаты Mg, Са, Sr, Ва, но не
известны сульфаты Ra. Причина заключается в чрезвычайно малом
кларке Ra (около 2-Ю-10), определяющем его низкое содержание в
водах (п- 10~п г/л), исключающее достижение произведения раство-
римости для RaSO4 и образование самостоятельного минерала.
Таким образом, способность к минералообразованию, количество
самостоятельных минеральных видов у данного элемента, с одной сто-
роны, зависит от химических свойств элемента, а с другой — от его
кларка. Способность элементов к минералообразованию характеризу-
ет отношение числа минералов данного элемента к его кларку в земной
коре. Соответствующий показатель М приведен в табл. 3 [А. С. Пова-
ренных ведет расчеты на атомные кларки (коэффициент видообразова-
ния КВ)]. Мы ведем расчет на массовые кларки.
Наибольшей способностью к минералообразованию обладают Au,
Bi, Те, которые при очень низких кларках (п-10-7 %) все же образу-
ют единицы или десятки самостоятельных минералов. Если бы у Na
или Са были такие низкие кларки, то данные металлы не имели бы соб-
ственных минералов (в пользу этого говорят отсутствие самостоятель-
ных минералов у Ra и малое число минералов Cs). Коэффициент М
наиболее информативен для элементов с близкими кларками. Из табл.
3 следует, что из первых четырех элементов наибольшая способность
к мииералообразованию в земной коре у Ni, наименьшая—у Сг. В ги-
погенных условиях у Ni почти столько же минералов, как и в земной
коре в целом, т, е. гипергенных минералов мало. У 2п и Сг в гиперген-
ных условиях минералов больше, чем в гипогенных. Во второй труп-
63
Таблица 3. Способность к минералообразоваиию у элементов
с близкими кларками
Элемент Кларк в земной коре, К Число минералов по А. С. Поваренных, п Способность к минерало- образованию M — njK
в земной коре в гипогенных условиях в земной коре в гипогенных условиях
Сг 8,3-10-3 17 6 2-103 7-10=
Zn 8,3-19-3 66 29 8-Ю3 3,5-102
V 9-Ю-3 61 10 6,8-103 1,1-103
Ni 5,8-10-з 53 40 9,1-Ю3 7-Ю3
Мо 1,1 ю-4 15 4 1,36-105 3,6-104
и 2,5-10-’ 104 8 4,1 10s 3,2-194
11 1-ю-4 7 6 7-10* 6-Ю4
Hf 1-10“4 — — 0 0
Sn 2,5-10-* 24 23 9,6-104 9,2-104
Ge 1,4-10~4 9 5 6,4-104 3,5-104
пе наибольшая способность к минералообразованию у U (4,1-105).
Она почти в 5 раз больше, чем у Sn, втрое больше, чем у Мо. В гипо-
генных условиях у U и Мо минералов много меньше, чем в гипергенных,
у Sn и Т1 — наоборот.
Е. М. Квятковский элементы с большой способностью к минерало-
образованию именует минералофильными (Bi, Те, Se, И, S и др.),
а с малой — минералофобными (Ga, Rb, Sc, In, TI, TR и др.).
Различия в кларках определяют и некоторые законы минералооб-
разоваиия. Например, редкие анионы (СгО2~, SeO4~, МоО2- и т. д.)
связываются преимущественно с распространенными катионами (Са2+,
Mg2+, Fe2+ и др.), а редкие катионы (UO2 + , Li+, Cs+, Ag+, Cd2+,
Tl+ и т. д.) с распространенными анионами (СОз-, POI-, SO2- и т. д.),
Поэтому редкий аниои СгО2~ связывается с распространенными катио-
нами РЬ2+ (зона окисления сульфидных месторождений), Са, Mg, К.
Маловероятно образование Li2CrO4, Rb2CrO4, Cs2CrO4, SrCrO4 И т.д.
(редкие катионы и анионы). Конечно, концентрация ионов в растворах
и расплавах определяется не только кларками, но и химическими свой-
ствами элементов, одиако роль кларков выявляется достаточно отчет-
ливо.
«Химическое» и «геохимическое» мышление. Изучая геохимию,
всегда следует учитывать неодинаковую распространенность химиче-
ских элементов в земной коре — различия в кларках. Для химика при
работе в лаборатории подобная проблема, как правило, не возникает.
Действительно, исследуя поведение определенной группы элементов
(например, S и Se) , он может взять для опыта растворы с равными мо-
лярными концентрациями соединений обоих элементов. Это позволит
выявить близость свойств S и Se, их одинаковую поливалентность (S0,
S2-, s*+, Se+ и Se°, Se2~, Se4+ и See+), существование соединений аиа-
64
логов — сероводорода H2S и селеноводорода H2Se, сульфидов и селе-
нидов, сульфатов (солей H2SO4) и селенатов (солей H2SeO4) и т.д.
Вместе с тем в земной коре роль обоих элементов резко различна, и это
в первую очередь объясняется сравнительно высоким кларком S
(4,7-10-2) и очень низким Se (5-Ю-6).
Действительно, S—ведущий элемент многих процессов, Se —
нет. Сероводород играет огромную роль в земной коре, обусловли-
вая образование колчеданных руд, накопление пирита в осадках, фор-
мирование месторождений Pb, Zn, Си, Cd и других металлов. Селено-
водород не имеет существенного значения. Для S характерна мине-
ральная форма нахождения, для Se — неминеральная и т.д. Иначе
говоря, геохимия S и Se имеет меньше общих черт, чем их химия. То
же можно сказать о Na и Cs, Са и Ra, Si и Ge.
Следовательно, различная распространенность химических эле-
ментов в земной коре служит одной из причин, определяющих отличие
«геохимического» мышления от «химического», различия поведения эле-
ментов в природе и лаборатории.
Экстенсивные и интенсивные параметры миграции. Уравнение
интенсивности миграции. В термодинамике экстенсивными называют
параметры, обладающие аддитивными свойствами, зависящими от раз-
меров системы или фазы, от массы элементов (объем, энтропия, масса
и т. д.). Интенсивные параметры не обладают аддитивными свойства-
ми и не зависят от размера системы или фазы (сила, давление, темпера-
тура, химический потенциал и т.д.).
Миграцию химических элементов, как и всякую работу, можно вы-
ражать через произведение экстенсивных и интенсивных параметров.
Экстенсивные параметры миграции — это количество мигрирую-
щих веществ, расстояние миграции и т. д. Интенсивность миграции
элемента в данной системе (Рх) — это такое его количество, которое
переходит в подвижное состояние в единицу времени и отнесено к'еди-
ние количества вещества элемента «X» в системе. Если в изучаемой си-
стеме общее количество атомов «X» равна b и за время dt мигрировало
db, то скорость миграции составит db/dt. Однако она еще не характе-
ризует интенсивность миграции, так как не учитывает общую массу
атомов элемента X — Ь. Разделив скорость на Ь, получим интен-
сивность миграции:
Px=_L-.-^2L,
bx dt
Это уравнение было выведено автором в 1941 г. При характеристике вы
щелачивания элементов из горных пород Рх представляет собой ско
рость выщелачивания 1 г вещества данного элемента.
Величину dbx/bx можно рассматривать как самостоятельную бес-
конечно малую величину и обозначать du. Тогда формула интенсивно-
сти миграции примет более простой вид:
Px = du/dt.
3 Зак. 2022
65
Отсюда получаем du = Px-dt, т. е. du— произведение интенсив-
ности миграции на бесконечно малый промежуток времени dt, в тече-
ние которого интенсивность сохраняет значение Рх', du можно назвать
элементарным импульсом миграции, и — импульсом миграции. Он
представляет собой сумму элементарных импульсов миграции за про-
межуток времени /2 — tx.
I 2
U= J Px-dt.
G
Для определения и необходимо знать зависимость интенсивности
миграции Рх от времени, которая в большинстве случаев неизвестна.
Однако если принять, что в изучаемом процессе интенсивность мигра-
ции постоянна (Рх = const), то уравнение интегрируется:
и = Рх (tz—tj; Рх = «/(4—Д),
или, принимая tx =- О, Рх = ult.
Напомним, что du = db/b и и = [ г или и =- 1п .
I, Ь
Преобразовав формулу, получим:
Ь2 = Ьх • еи — Ьх • еРх
где Ьх — содержание элемента X в системе до начала изучаемого про-
цесса в момент времени tx; Ь.2 — количество элемента в системе к мо-
менту времени t2. Зависимость количества элемента X в системе от
времени передается экспонентой (рис. 17). Эту формулу можно исполь-
зовать для приблизительного расчета интенсивности миграции. Так
наши ориентировочные расчеты для коры выветривания влажных суб-
тропиков Аджарии показали, что если принять длительность выветри-
вания в 1 млн. лет, то ежегодно из коры выносились миллионные доли
от каждого грамма Si, Al, Са, Мп, К, Na, находящихся в этом году в
коре выветривания, и стотысячные доли от каждого грамма Mg. Ве-
/ , ь2\
личины импульса миграции^ = In ~ I колебались от — 0,75 для Mg
до — 4,37 для К.
Время миграции одинаково для всех элементов данной системы, по-
этому для элементов X и Y можно написать: PxIPy = uxluy. Следо-
вательно, для конкретной системы можно рассчитать интенсивность
миграции элемента X относительно элемента Y.
Уравнение интенсивности миграции применимо и для характери-
стики иммиграции — поступления химического элемента в систему,
его концентрации (в частности, рудообразования). При этом Рх
приобретает положительное значение, так как Ь2 > Ьх (напомним, что
все построения предполагают постоянство интенсивности миграции,
т. е. независимость Рх от времени).
В общем случае можно принять, что Ьх равно кларку, а Ь2— содер-
66
Рис. 17. Изменение содержания
элемента X в системе при по-
стоянной величине интенсивно-
сти миргациях Рх
жанию элемента в руде. Тогда отношение Ь2/Ьг будет представлять со-
бой КК. Поэтому для процессов, концентрации в ряде случаев импульс
миграции и будет равен натуральному логарифму КХ, а интенсивность
концентрации (в том числе рудообразования) — логарифму XX, де-
ленному на время рудообразования t\
РЛ = цд = In ККД.
Рассмотрим, например, интенсивность миграции Си при образо-
вании месторождений, принимая, что рудоносные растворы внедря-
лись в породы с кларковым содержанием металла (bt) 4,5-10—3 %.
Допустим что содержание Си в руде
достигает 2 % (Ь2). Импульс миграции
и = In КК = In 2/4,5-10-3 5,98,
т. е. составляет величину, близкую по
абсолютному значению к величине и для
коры выветривания, но обратную по зна-
ку. Если принять, что длительность
рудообразования и выветривания близ-
ки, то и интенсивность миграции в
обоих процессах совпадает.
Из уравнения интенсивности мигра-
ции следует, что Рх уменьшается с уве-
личением Ь, т. е. содержанием элемента
X в системе. Это легко объяснить, ис-
пользуя закон действия масс: чем ниже
содержание элемента в природных си-
стемах, тем меньше возможностей для
образования насыщенных растворов, самостоятельной минеральной
фазы, больше возможностей для миграции (конечно, при сравнении
элементов, обладающих близкими химическими свойствами). Иначе
говоря, редкие элементы мигрируют интенсивнее, чем близкие им по
химическим свойствам распространенные.
Геохимические барьеры. Этим термином автор в 1961 г. предложил
именовать те участки земной коры, в которых на коротком расстоянии
происходит резкое уменьшение интенсивности миграции химических
элементов и, как следствие, их концентрация. Аналогично макро- и
микроклимату, макро-, мезо- и микрорельефу выделяют макро-,
мезо- и микробарьеры. Так, в дельтах зона смешения пресных речных
вод и соленых морских представляет собой макробарьер шириной в сот-
ни и тысячи метров (при длине рек и морских акваторий в тысячи ки-
лометров). Рудные тела в водоносных горизонтах артезианских бас-
сейнов имеют ширину в десятки и сотни метров при длине (по падению)
водоносных горизонтов в тысячи и десятки тысяч метров (мезобарьеры).
К мезобарьерам относятся также краевые зоны болот, где накап-
ливаются многие элементы, выщелоченные из почв водоразделов
3*
67
и склонов. Рудные прожилки мощностью в несколько сантиметров
и миллиметров относятся к микробарьерам.
Явление, которое ныне именуется геохимическим барьером, прив-
лекало внимание исследователей и ранее, в частности при изучении
условий образования минералов и руд, при трактовке процессов осаж-
дения элементов из вод. Однако ранее оно рассматривалось изолиро-
ванно, как предмет разных наук — минералогии, литологии, почво-
ведения, науки о рудных месторождениях и т. д. Но в почвах, илах
морей и океанов, корах выветривания, водоносных горизонтах артези-
анских бассейнов, подземных водах зон разломов и других системах
земной коры протекают сходные процессы концентрации элементов.
Это и позволило установить общие типы таких процессов, сформулиро-
вать понятие о геохимическом барьере, которое мы относим к фундамен-
тальным понятиям геохимии. Главная особенность барьера — резкое
изменение условий и концентрация элементов. Это зона, где одна гео-
химическая обстановка сменяется другой. Между понятием «геохими-
ческий барьер» и «геохимическая обстановка», следовательно, имеется
глубокая связь: уменьшение пространства, занимаемого обстановкой,
приводит к переходу количества в качество, превращению обстанов-
ки в барьер (и наоборот).
На геохимических барьерах образуются рудные тела большинства
месторождений, понятие о барьерах является одной из методологиче-
ских основ изучения геохимических аномалий и, следовательно, оно
важно для разработки методики геохимических поисков. Изучение
барьеров также важно в борьбе с загрязнением окружающей среды,
при организации подземного выщелачивания руд, закреплении грун-
тов в строительстве, при решении других практических задач.
В земной коре происходит совмещение и комплексирование различ-
ных геохимических процессов, в связи с чем выделяются комплексные
барьеры, образующиеся в результате наложения двух или нескольких
взаимосвязанных геохимических процессов. Выделяются также
двусторонние барьеры, которые формируются при движении различ-
ных элементов к барьеру с разных сторон. На двустороннем барьере
происходит осаждение разнородной ассоциации химических элемен-
тов. Различаются также латеральные барьеры, образующиеся при дви-
жении вод в субгоризонтальном направлении, например на границе
фаций, и радиальные {вертикальные} барьеры, формирующиеся при
вертикальной (снизу вверх или сверху вниз) миграции растворов в
зонах разломов, корах выветривания и т.д. В зависимости от способа
массопереноса различаются диффузионные и инфильтрационные
барьеры. В. С. Голубев разработал понятие о подвижном геохимическом
барьере •— барьер перемещается медленнее фильтрации вод. При та-
ком механизме перед барьером в водах повышается содержание хими-
ческих элементов.
В основу классификации геохимических барьеров положены раз-
личия в миграции. Выделяется два основных типа барьеров — при-
родные и техногенные. Природные разделяются на три класса. Наибо-
68
обязаны
залежи,
миграции (угольные
гп<
2
лее простые — механические барьеры— участки резкого уменьшения
интенсивности механической миграции. К ним приурочены различ-
ные продукты механической дифференциации осадков. В местах рез-
кого уменьшения интенсивности физико-химической миграции форми-
руются физико-химические барьеры. Они возникают в местах измене-
ния температуры, давления, окислительно-восстановительных, щелоч-
но-кислотных и других условий. Биог
уменьшению интенсивности биогенной
торф, концентрации элементов в те-
лах организмов и т. д.).
Техногенные барьеры также раз-
деляются на три класса — механиче-
ские, физико-химические и биогеохи-
мические. Более сложные процессы
образования геохимических барьеров
обычно включают в себя менее слож-
ные. Например, в образовании тех-
ногенных барьеров могут участво-
вать механические, физико-химичес-
кие и биогенные процессы, но сущ-
ность данных барьеров не может быть
понята без учета особенностей соци-
альной формы движения, техноген-
ной миграции. Главное внимание
исследователей до сих пор привле-
кали физико-химические барьеры
(природные и техногенные).
Изменение геохимических показателей т ((, Р, Eh, pH и т.д.) в
направлении миграции химических элементов называется градиентом
барьера G (рис. 18):
dm „ т<—т«
G =---- или G = —1------,
dl I
Рис. 18. Параметры геохимиче-
ского барьера:
/ — направление миграции химических
элементов до барьера, 2 — после барье
ра, 3 — область концентрации элемен
тов на барьере (рудные тела, аномалии
и др ). т{ — геохимические характери
етики среды до барьера, т2— после
барьера, /— длина барьера
где т, — значение данного геохимического показателя до барьера,
т2 — после барьера, I — ширина барьера.
При изучении геохимических барьеров желательно строить функ-
ции т = f (/) и устанавливать тип кривой.
Контрастность барьера S характеризуется отношением величины
геохимических показателей в направлении миграции до и после
барьера:
S = CxjCx, = т^т2.
Интенсивность накопления элемента (например, рудообразования)
увеличивается с ростом контрастности и градиента барьера.
Метрологические основы геохимии. Прогресс аналитической
техники исключительно расширил возможности геохимии, позволил
69
определять содержание химических элементов с ранее недоступной
чувствительностью, в огромном количестве проб и самыми разнооб-
разными методами. Общий объем ежегодной аналитической информации
в СССР измеряется сотнями миллионов данных. В этих условиях боль-
шое значение приобрела проблема качества информации, для оценки
которой используют такие понятия, как истинность, обоснованность,
универсальность, результативность, экономичность и др. (А. И. Гав-
ришин). Для решения проблемы привлекаются методы математической
статистики, метрологии, теории классификации, теории ошибок и пла-
нирования эксперимента и др.
Международные и национальные контрольные эксперименты пока-
зали, что ошибки анализа нередко значительно превышают допусти-
мые пределы. Для борьбы с этим большое значение имеет создание си-
стемы геохимических эталонов пород, минералов, вод и других объек-
тов анализа. Первые шаги в этом направлении уже делаются.
Качество геохимической информации во многом зависит от погреш-
ностей, которые возникают на всех этапах геохимических работ: от
отбора образцов при полевых исследованиях, до их обработки и хране-
ния, анализа в лаборатории, обработки, передачи и хранения информа-
ции. Так, по А. И. Гавришину, 30 % погрешности при гидрогеохими-
ческих поисках на основе спектрального анализа сухих остатков вод
возникают на этапе опробования и хранения проб, 65 % — на этапе
приготовления сухого остатка и лишь 5 % — на этапе спектрального
анализа. Систематические и случайные погрешности накапливаются
на всех этапах формирования геохимической информации, причем
они существенно искажают представления о концентрации химических
элементов. В результате статистически обоснованные выводы могут
оказаться ложными, если погрешности не учтены. Поэтому большое
значение имеет контроль качества геохимической информации, вклю-
чающий разнообразные приемы внутреннего и внешнего контроля.
Так, ИГЕМ АН СССР (В. Г. Хитров и др.) организовал всесоюзный
контрольный эксперимент, в ходе которого четыре стандартных образ-
ца пород были разосланы на анализ в различные лаборатории. Прово-
дились и международные контрольные эксперименты. Все они позво-
лили выделить три уровня формирования погрешностей: локальный,
региональный и глобальный.
Многие выводы, полученные на основе анализа качества геохими-
ческой информации, имеют большое практическое значение. Так, вы-
яснилось, что межлабораторные систематические расхождения значи-
тельно превышают локальные погрешности. Существенно, что реаль-
ная воспроизводимость определений микроэлементов близка для ко-
личественных и приближенно-количественных методов анализа. От-
метим, что в оценке правильности информации определенная роль
принадлежит и учету геохимических закономерностей. Несоответст-
вие этим закономерностям данных анализов может иногда служить
косвенным указателем на ошибочность результатов или во всяком слу-
чае должно насторожить геохимика.
70
Наибольший объем геохимической информации до сих пор поступа-
ет при геохимических поисках рудных месторождений. Поэтому есте-
ственно, что проблема качества информации особенно актуальна в
этой области. Э. Ф. Жбановым разработаны методические рекоменда-
ции по управлению качеством и стандартизацией геохимических мето-
дов поисков.
Контрольные вопросы
1. В чем состоит основной геохимический закон В. М. Гольдшмидта?
2. В чем различия нормального и логнормального закона распределения
химических элементов?
3. Зачем необходимо рассчитывать кларки концентрации?
4. Как строятся геохимические спектры, в чем их преимущества?
5. Какие химические элементы относятся к ведущим?
6. От чего зависит способность к минералообразованию, как оиа определя-
ется?
7. В чем различия «химического» и «геохимического» мышления?
8. Охарактеризуйте уравнение интенсивности миграции.
9. Почему необходимо понятие о геохимических барьерах, назовите близ-
кие ему понятия в других науках о Земле.
10. От чего зависит качество геохимической информации?
1 к Каковы главные формы нахождения элементов в земной коре?
12. Что дает характеристика миграции с помощью коэффициентов?
13. Охарактеризуйте понятия о парагенезисе минералов и элементов.
14. В чем состоит различие экстенсивных и интенсивных параметров мигра-
ции?
МЕХАНИЧЕСКАЯ
МИГРАЦИЯ
Область механогенеза еще ждет гео-
химика для своего исследования, как
область геохимического влияния си-
лы тяжести.
А. Е. Ферсман
Механическая миграция (механогенез) обусловлена работой рек, те-
чений, ветра, ледников, вулканов, тектонических сил и других факто-
ров, детально изучаемых в динамической геологии, геоморфологии, вул-
канологии, океанологии, тектонике и других науках о Земле. Существу-
ет и специфический геохимический аспект вопроса.
5. ОСНОВНЫЕ ОСОБЕННОСТИ МЕХАНИЧЕСКОЙ МИГРАЦИИ
(МЕХАНОГЕНЕЗА)
Характерное явление механогенеза — раздробление горных пород
и минералов, ведущее к увеличению их дисперсности, растворимости,
развитию сорбции и других поверхностных явлений. При дисперги-
ровании резко увеличивается суммарная поверхность частиц, а следо-
вательно, и их поверхностная энергия. Так, при раздроблении песчин-
ки кубической формы, объемом 1 мм3, с суммарной поверхностью 6 мм2
до коллоидных размеров количество частиц возрастает до 1012, а их
суммарная поверхность — до 6-104мм2, т. е. в 60 000 раз. В конеч-
ном счете подобная дезинтеграция происходит за счет солнечной энер-
гии, поэтому П. П. Тимофеев, А. В. Щербаков и В. А. Ильин считают
данный процесс наряду с фотосинтезом могучим аккумулятором сол-
нечной энергии.
При диспергировании повышается и растворимость минералов. На-
пример, при уменьшении кристаллов гипса от 0,5 до 0,1 мк их раство-
римость увеличивается с 4 до 12 %, сульфата бария — до 80 %. Ди-
спергирование сопровождается также разложением многих минера-
лов: при истирании сульфиды частично разлагаются на металл и серу,
72
гидратные минералы выделяют воду и т. д., т. е. становятся возможны-
ми термодинамически невыгодные реакции. Роль таких механохими-
ческих явлений в земной коре изучена еще слабо. Весьма вероятно их
значение в зонах разломов при образовании бластомилонитов и дроб-
лении пород, при тектонических подвижках и образовании кливажа,
при землетрясениях и т. д.
При механогенезе тяжелые минералы ведут себя как частицы более
крупного размера. Поэтому важным фактором механогенеза служит
плотность минералов, которая колеблется значительно: от 7,8—
19,8 г/см3 у самородных металлов до 1,60—3,18 г/см3 у хлоридов и
фторидов.
Механическое перемещение минералов зависит также от их твердо-
сти и податливости к выветриванию. Циркон, касситерит, алмаз, мо-
нацит и другие твердые минералы, трудно поддающиеся истиранию
при водном переносе, хорошо сохраняются в осадках. Наоборот, мо-
либденит и другие минералы низкой твердости легко истираются.
Абразивная прочность, т. е. устойчивость минералов при переносе,
их сопротивление истиранию, зависит не только от твердости. По
А. А. Кухаренко, тяжелые минералы образуют следующий восходя-
щий ряд по абразивной прочности (на основании изучения россыпей и
лабораторных экспериментов): золото, киноварь, вольфрамит, шее-
лит, моноклинные пироксены, лимонит, колумбит, платина, эпидот,
обыкновенная роговая обманка, дистен, оливин, апатит, монацит,
ставролит, андалузит, железный блеск, пирит, ильменит, магнетит,
касситерит, хромшпинелиды, циркон, турмалин, осмистый иридий,
альмандин, топаз, рутил, шпинель, корунд, алмаз.
Дальность механической миграции минералов в основном зависит
от их податливости к химическому выветриванию и способности к ис-
тиранию. Для фракции более 0,1 мм А. А. Кухаренко установил ряды
относительной дальности механической миграции, в которых, напри-
мер, малая дальность миграции характерна для киновари и арсенопи-
рита, и большая — для хромшпинелидов и ильменита.
Механическая денудация. Ее показателем служит годовой расход
взвешенных частиц в данном створе реки в т/км2 площади бассейна.
В табл. 4 этот показатель обозначен символом Рм (в отличие от хими-
ческой денудации Р„ — годового расхода растворенных веществ).
Рм зависит от климата, геологического строения и рельфа: она мини-
мальна на гумидных лесных равнинах, где преобладает химическая де-
нудация (рис. 19).
В аридных горах с широким распространением рыхлых отложений
механическая денудация увеличивается в сотни раз, превышая
1000 т/км2. Для районов развития скальных пород Рм понижается
на порядок (Чирчик — 120 т/км2). В горных гумидных районах Рм
меньше, но и здесь механическая денудация опережает химическую.
Так, Р„/Рм составляет для Кубани 0,19, Риони 0,10, Амура 0,36 и
т. д. У равнинных рек лесной зоны это отношение больше 1 (у Онеги
5, у Днепра 4,25, у Западной Двины 4,1 и т.д.).
73
Отношение среднегодовой минерализации воды к среднегодовой
мутности также дает представление о соотношении химической и меха-
нической денудации. Для реки Афипс ((Западный Кавказ) оно равно
0,5, для Сейма (Русская равнина) — 8, Тургая — 60 (расчеты
В. Г. Лопатина).
В современную геологическую эпоху в целом механическая дену-
дация преобладает над химической. Если измерять денудацию еже-
годным снижением поверхности, то для СССР в среднем оно равно
27 мкм, из которых только 7 мкм приходится на химическую денуда-
Рис. 19. Соотношение механической I и химической II денудации (по Н. М. Стра-
хову, упрощено). Величина химической денудации показана крестиками, по ним
построена усредненная кривая II-.
1 — Нева. 2— Енисей. 3— Луга. 4 — Нарва. 5 — Днепр, 6—Онега, 7 — Обь. 8 — Западная
Двина, 9 — Колыма. 10 — Яна. // — Мезень, 12— Южный Буг. 13— Северная Двина, 14 —
Урал. /5 — Дои. 16— Волга. /7 — Печора. 18 — Индигирка, 19 — Амур, 20— Днестр. 21 —
Кума, 22—Калаус. 23— Сырдарья. 24 — Амазонка, 25 — Ла-Плата, 26 — Юкои. 27— Мисси-
сипи. 28 — Кубань. 29 — Кура. 30 — Амударья, 31 — Терек, 32 — Риони. 33 — Самур, 34 — Сулак
цию. Суммарное снижение поверхности суши за счет химической и ме-
ханической денудации, по Г. А. Максимовичу, 90 мкм/год.
Дифференциация материала в аллювии в основном зависит от
крупности, плотности и формы частиц. С этими процессами связано об-
разование россыпных месторождений тяжелых минералов, на опробо-
вании аллювия основаны минералогические (шлиховые) и геохимиче-
ские методы поисков. Ореолы рассеяния в аллювии именуются пото-
ками рассеяния.
В истории отдельных элементов механическая миграция играет раз-
личную роль: она значительна для Si, Ti, Zr, Hf и мала для Ni, Со,
Mg, Cl, Na и т.д. Для рек Н.М. Страхов приводит зависимости, пока-
занные на рис. 20. Существенные коррективы в эту схему вносят кли-
мат (влажный — сухой) и литология бассейна.
74
Таблица 4. Механическая денудация (Рм, т/км2) в различных ландшафтах
Типы ландшафтов Геологическое строение и рельеф
Равнины (низменности и возвышенности) Горные районы
сложенные легко размы- ваемыми рыхлыми отложениями сложенные скаль- ными породами
Влажные тропики и субтропики Амазонка — 60 Ориноко — 47 Конго (Заир) —18 Иравади — 850 Риони — 633
Лесные ландшафты без мерзлоты (широко- лиственные леса и тай- га) Северная Двина— 14 Западная Двина— 6 Нева — 3,9 Днепр — 5 Терек — 600 Рона — 320 По — 240
Мерзлотная тайга и тундра Колыма — 7,0 Обь — 6,0 Юкон — 103
Степи, саванны, пусты- ни Нил — 31 Дон — 18,3 Вахш—1850 Ганг—1040 Чирчик — 120
Эоловые процессы. А. П. Лисицын выделил три вида переноса ве-
ществ в атмосфере: стратосферный (на высотах 15—60 км частицы мо-
гут многократно огибать земной шар), тропосферный (на высотах до
8—12 км частицы могут мигрировать на сотни и тысячи км), локальный
(миграция на десятки и сотни километров).
Песок, пыль, соли поступают в атмосферу преимущественно за
счет развевания слабозакрепленных песков, глинистых и лёссовых
равнин, солончаков и т.д. Часть солей поступает с акваторий соленых
озер и морей. Например, «соляной шторм» 21—22/111 1933 г. поднял
тучи пыли с поверхности высохших соляных озер в Большом Бассей-
не США и перенес их через Скалистые горы. Восточнее этих гор соле-
ная пыль осела на равнинах, покрыв их поверхность белым слоем.
В аридных районах атмосфера нередко содержит много соляных
частиц. В условиях непромывного режима соли, поступившие из ат-
мосферы, постепенно накапливаются в почвах и грунтах. Так как од-
новременно происходит и частичное вымывание солей, то в покровных
отложениях возникает солевая эпигенетическая зональность (сверху
вниз), отвечающая растворимости солей: кальцит, гипс, легкораство-
римые соли (рис. 21). Данные явления выражены резче на участках
древней суши, где в течение десятков, сотен тысяч и миллионов лет
происходила эоловая аккумуляция. На молодых аллювиальных и при-
брежно-морских равнинах запасы эоловых солей незначительны.
С эоловой аккумуляцией некоторые авторы связывают образование
75
«известковой коры» на базальтовых плато Армении, кальцитизацию
верхних горизонтов пород на юге Австралии, огипсование суглинков
Устюрта и многие другие явления.
В аридных районах большое значение имеет аккумуляция эоловой
пыли. Многие лёссы, пески пустынь и другие отложения образова-
лись благодаря воздушной механической миграции и аккумуляции.
Рис. 20. Формы переноса в реках основных ком-
понентов осадков (по Н. М. Страхову):
/ — минералы глин, 2— минералы песков, 3— прочие
компоненты, а, — для горных рек и в условиях засуш-
ливого климата
В. В. Добровольский установил близость состава глинистых минера-
лов в покровных четвертичных суглинках Устюрта, Центрального
Казахстана и других аридных районов. Это позволило ему высказать
предположение об эоловом происхождении данных отложений.
При геохимических поисках важно учитывать возможность пере-
крытия ореолов рассеяния эоловыми отложениями. Это явление изу-
чено Э. Ф. Жбановым, Т. Т. Тайсаевым и другими учеными в Буря-
тии, где на склонах многих хребтов развиты плащи эоловых лёссовид-
76
них супесей мощностью в несколько метров (плащи полностью экрани-
руют ореолы). Супесчаные плащи распространены в условиях расчле-
ненного среднегорного рельефа, который обычно рассматривается как
область развития элювио-делювия, весьма благоприятного для опро-
бования при поверхностной литохимической съемке.
Эоловые процессы протекали во все геологические периоды Земли,
их роль была особенно велика в ледниковые эпохи с их сухим и холод-
Рис. 21. Принпнцнальная схема распределения элементов, поступающих нз атмо-
сферы в гумидных и аридных ландшафтах (при промывном и непромывном ре-
жимах) (по А. И. Перельману):
А — в почвах и коре выветривания гумндных ландшафтов, где преобладает транзитная ми-
грация, частичная задержка и аккумуляция в почвах I, F, Cl, SO<“". Са*+, Na+ и других
элементов без образования самостоятельных минеральных фаз, Б — в почвах и коре вывет-
ривания аридных ландшафтов (сухие степи и пустыни), где поступающие из атмосферы
элементы задерживаются в почве с образованием самостоятельных минералов — кальцита,
гипса и других; 1—5— минералы, образовавшиеся или накопившиеся в результате атмос-
ферной миграции (/ — отсутствуют. 2 — кальцит, 3 — силикаты, алюмосиликаты и другие
минералы. 4— гнпс частично с примесью легкорастворимых солей. 5 — легкорастворимые
соли)
77
ным климатом, сильными ветрами, а также в дочетвертичные эпохи с
аридным климатом. Пыльные бури установлены также на Марсе.
При вулканических извержениях в атмосферу поступают многие
кубические километры пепла, состоящего из частиц лавы. В 1883 г.
при извержении вулкана Кракатау в Зондском проливе в атмосферу
было выброшено около 18 км3 рыхлого материала. Облако пепла под-
нялось в стратосферу. Пыль и пепел распределились на площади
82 700 км2, мельчайшая пыль достигла Европы. В прошлые геологиче-
ские эпохи подобные явления были еще грандиознее, запыление ат-
мосферы, вероятно, оказывало большое влияние на климат, а через не-
го и на биогенную миграцию (похолодание и др.).
При ударе метеоритов о земную поверхность и образовании астро-
блем происходит запыление атмосферы метеоритным веществом.
С этим связывают глобальные аномалии платиноидов в отложениях
на границе мела и палеогена и другие явления.
Механические барьеры, зоны выноса. При резком уменьшении ин-
тенсивности механической миграции образуются механические барье-
ры, на которых концентрируются различные минералы. При удале-
нии легких частиц водой, ветром, льдом происходит относительное
накопление тяжелых устойчивых минералов. Так формируются элю-
виальные. аллювиальные, делювиальные, прибрежно-морские, эоло-
вые и ледниковые россыпи (руды Au, Hg, Sn, W, Zr, Ti и др.). В гольцах
Сибири на курумных (глыбистых) склонах Т. Т. Тайсаевым установлено
широкое развитие механической суффозии — вымывания и переотло-
жения на механических барьерах тонких частиц (в том числе Au).
Закономерности этих процессов важно учитывать при поисках золота.
Историческая геохимия механогенеза. В эпохи низкого стояния
материков, преобладания теплого и влажного климата, например в
нижнем карбоне, верхнем триасе, лейасе, палеогене, химическая де-
нудация преобладала над механической. Эпохи байкальского, каледон-
ского, герцинского, киммерийского и альпийского орогенезов в тек-
тоническом отношении аналогичны современной эпохе, т. е. и тогда
механическая денудация преобладала над химической. В прошлом в
связи со слабым развитием растительного покрова на материках (осо-
бенно в нижнем палеозое) преобладание механической денудации бы-
ло выражено еще резче.
6. СИСТЕМЫ МЕХАНОГЕНЕЗА
Механогенез определяет специфику геохимии некоторых систем.
Механическая дифференциация. Глинистые фракции почв и пород
по сравнению с песчаными обычно содержат больше Fe, Al, Мп, Mg,
К, V, Сг, Ni, Со, Си и меньше SiO2. Это объясняется тем, что в процес-
се выветривания соединения Fe, Al, Mg и К образуют глинистые ми-
нералы, которые сорбируют V, Сг, Ni, Со, Си, Zn и другие элементы.
78
К. Турекьян и К. Ведеполь определили средний состав глин и пес-
щников. Ниже приведен коэффициент концентрации элементов в гли-
iax относительно песчаников — Кк.
Элемент Кк Элемен: r Kk Элемент Кк
Со 63 Fe 4,8 Ge 2,0
Ni1 34 Li 4,4 Tl 1,7
Cl 18 P 4,1 Ga 1,5
Sr 15 Br 4 I 1,3
Hg 13.3 Al 3,2 W 1,1
Sc 13 Ti 3,0 Zr 0,72
As 13 Na 2,9 Hf 0,71
Mo 13 В 2,8 Th 0,7
Se 12 Pb 2,8 Y 0,65
S 10 F 2,7 Ce—Lu 0,66—0.58
U 8,2 К 2,5 Si 0,5
V 6,5 Rb 2,3
Zn 6,0
Эти данные получены на основе сравнения кларков, возможно, не
всегда точных. Все же они отражают основные закономерности. Так.
очень высокие Кк для Со и Ni можно объяснить их преобладанием в
ультраосновных и основных породах, легко поддающихся выветрива-
нию с образованием глин, а также способностью данных металлов сор-
бироваться глинами.
Высокие Кк для U объясняются его связью с органическим вещест-
вом, тяготеющим к глинам, а также сорбцией. Для Zn, Br, I, Li, Pb
главным фактором, вероятно, является сорбция глинами. К, А1 — основ-
ные элементы глин. Низкий Кк Si связан с аккумуляцией кварца в
песчаной фракции.
Естественно, что для конкретных районов, формаций, ландшаф-
тов соотношения различны. Все же пески, как правило, бедны Fe,
Al, Mg, многими редкими элементами и обогащены Si. Местами в пес-
ках концентрируются Ti (в виде рутила—TiO2), Zr и Hf (в цирконе —
ZrSiO4), Sn (SnO2), Pt, W (рис. 22). Поэтому за счет денудации од-
ного комплекса коренных пород (например, гранитоидов) в результате
механической дифференциации образуются отложения различного хи-
мического состава.
Математическая модель образования механического ореола рас-
сеяния. Процессы механической миграции относительно просты и лег-
че других поддаются математическому моделированию. А. П. Соло-
вов в 1957 г. разработал модель образования остаточного механиче-
ского ореола рассеяния тонкой вертикальной рудной жилы на гори-
зонтальной поверхности. Он полагал, что при замерзании и оттаивании
воды, расширении и сжатии рыхлой массы, деятельности червей, на-
секомых и других животных, механическом воздействии корней, гид-
ратации, кристаллизации солей и других процессах развивается бес-
порядочное перемещение рудных и жилых минералов, глинистых час-
тиц, которое подобно броуновскому движению молекул. Естественно,
79
что наиболее подвижны частицы вблизи поверхности, поэтому механи-
ческий ореол приобретает форму веера.
Учитывая, что формирование ореолов происходит в течение дли-
тельного времени, А. П. Соловов рассматривает в соответствии с тео-
рией подобия рыхлые породы как сплошную среду, аналогичную вяз-
кой жидкости, в которой развиваются явления диффузии. Приняв, что
движение каждой частицы носит случайный характер, а число частиц
бесконечно велико и движутся они в течение бесконечно большого
Фракция, мм ’ ’’
Шефши Псаммиты Пелиты
Рис. 22. Распределение пластических ми-
1ералов в гранулометрическом спектре
осадков (общая схема Н. М. Страхова
с изменениями Н Б Вассоевнча)
времени, ученый получил мо-
дель механического рассеяния,
для изучения которой использо-
вал законы рассеяния тепла от
источника нагрева (дифференци-
альное уравнение Фурье). Со-
гласно данной модели распреде-
ление рудных частиц в остаточ-
ном механическом ореоле тон-
кой вертикальной жилы подчи-
няется закону нормального рас-
пределения. Однако речь идет
лишь о математическом тожде-
стве законов, но не о тождестве
явлений. Модель А. П. Солово-
ва отражает детерминирован-
ную зависимость распределения
элемента в ореоле от его эпи-
центра. В случае нормального
распределения элемента в систе-
мах имеет место вероятностная зависимость. В дальнейшем Р. И. Дубов
установил математический закон образования остаточного механиче-
ского ореола рассеяния рудного тела любой мощности.
Механические ореолы отмеченного выше типа встречаются сравни-
тельно редко, чаще ореол образуется на склоне в результате сочета-
ния механической, физико-химической и биогенной миграции. Это
значительно усложняет расчеты и делает их менее точными, возникает
необходимость введения в формулы поправочных коэффициентов. По-
этому математический анализ механического ореола рассеяния в ос-
новном представляет интерес как идеализированная модель процесса.
Механические ореолы на склонах, потоки рассеяния в аллювии.
В переносе твердого материала на склонах большую роль играет мед-
ленное самопроизвольное движение рыхлых масс по типу дефлюкции
(сползания вязкого или пластичного течения), солифлюкции (тече-
ния переувлажненной массы на мерзлом основании), крипа (переме-
щении при совместном действии силы тяжести и других факторов).
Вопрос о способах образования механических ореолов на склонах
имеет большое практическое значение. По В. В. Поликарпочкину,
Ю. В. Шаркову и др., нижние части склонов в горно-таежных райо-
80
z
1Ж11 [~ГП2 |А д|3
Рис. 23. Разрез дефлюкциоиного ореола
(по В. В. Поликарпочкину):
/ — рудное тело, 2 — вмещающие коренные гор-
ные породы, 3 — рыхлые образования, 4 — де-
флюкционный орел рудного тела
нах Южной Сибири часто перекрыты солифлюкционными и дефлюкци-
оннын^и отложениями, которые полностью закрывают ореолы (рис. 23).
На основе более ранних представлений об элювиально-делювиальном
происхождении этих отложений перспективы литохимических поисков
в данных условиях считались благоприятными («открытые ореолы»).
С новых позиций считается, что нижние части склонов таким способом
опоисковать нельзя («закрытые ореолы») и ранее проведенные литохи-
мические съемки непредставительны. Так, в Байкало-Патомском на-
горье, где широко распро-
странена дефлюкция, почти
100 % известных месторож-
дений и рудопроявлений рас-
полагаются на вершинах во-
доразделов и в верхних ча-
стях склонов, т. е. там, где
образуются открытые ореолы,
которые легко было обнару-
жить.
В горах Восточного Забай-
калья на северных таежных
склонах развиты закрытые
ореолы (дефлюкционные и
др.), а на южных, степных—
открытые. Предполагают, что
закрытые ореолы преобла-
дают во влажных тропиках и
субтропиках.
В. В. Поликарпочкин раз-
работал упрощенную матема-
тическую модель образова-
ния механического потока рассеяния. Наиболее распространены пото-
ки рассеяния смешанного типа, в образовании которых участвовала
механическая, физико-химическая и биогенная миграция.
Шлихо-геохимические поиски руд. А. В. Костерин предложил до-
полнить обычный минералогический анализ шлиха его геохимическим
изучением. Он различает минералы-концентраторы и индикаторы.
К первым относятся гранаты, турмалин, пирит, пироксены, амфибо-
лы и другие тяжелые минералы, обогащенные рудными элементами,
особенно на месторождениях. Так, турмалин из кварцево-касситери-
товых жил содержит в 10—50 раз больше Sn, чем акцессорный турма-
лин из гранитов. Содержание Au в турмалине из золоторудных место-
рождений соответственно в 50—100 раз больше. В магнетите из золо-
торудных месторождений в 100—1000 раз больше Au, чем в акцессор-
ном магнетите изверженных пород. Поэтому, определяя элементный
состав шлихов и их отдельных фракций (магнитной, электромагнитной
и др.), можно искать рудные месторождения при отсутствии в шлихах
минералов соответствующих элементов (например, касситерита, золо-
81
та). К индикаторным относятся минералы, несущие косвенные геохи-
мические сигналы о месторождениях. В магнетите, ильмените, цирко-
не, монаците и других обычных минералах шлихов, которые могут и не
выделяться повышенным содержанием рудных элементов, часто нару-
шается соотношение главных и второстепенных элементов, меняется
изотопный состав, состав газово-жидких включений и т.д. Например,
отношение Zr/Hf в цирконах редкометальных пегматитов равно 3—20,
а в цирконах из карбонатитов и гидротермальных месторождений —
60—200. Изотопный состав углерода в графите из пегматитов и ме-
таморфических пород различен. На основе геохимического изучения
минералов-индикаторов можно искать месторождения, в шлиховых
ореолах которых нет искомых рудных минералов и минералов-концент-
раторов. Шлихо-геохимический метод дает информацию о коренном ис-
точнике — типе месторождения, глубине эрозионного среза, давле-
нии и температуре рудообразования и т.д. Результаты опробования
изображаются на особых шлихо-геохимических картах. Метод очень
чувствителен (до 10~7 % и более), что объясняется обогащением шли-
ха в процессе отмывки. Например, из пробы аллювия массой в 32 кг
получают 2 г тяжелой фракции (концентрация в 16 000 раз). Так соз-
дается возможность обнаружения рудных элементов в шлихе обычны-
ми методами спектрального анализа (даже в очень слабых аномалиях).
Перемешивание почвенной массы в мерзлотных районах и «ме-
дальонная съемка». Промерзание деятельного слоя приводит к крио-
генному перемешиванию материала, «вымораживанию» обломков, об-
разованию пятен-медальонов с мелкоземом, поступающим с глубины
первых метров. Поэтому опробование с поверхности пятен-медальо-
нов дает геохимическую информацию с глубины первых метров. Это
особый вариант литохимических поисков — «медальонная съемка».
Криогенное перемешивание материала наблюдается и в районах, где
многолетняя мерзлота отсутствует. Так, «языки» палеогеновых глин в
перекрывающих четвертичных песках в Атасуйском рудном районе
Центрального Казахстана мы считаем реликтом ледникового пери-
ода — в то время в этом районе была многолетняя мерзлота.
Контрольные вопросы
1. От чего зависит величина механической денудации, как она измеряется?
2. Каково геохимическое значение эоловых процессов?
3. Каков геохимический эффект механической дифференциации?
4. Чем отличается шлихо-геохимический метод от шлихового?
ФИЗИКО-
ХИМИЧЕСКАЯ
МИГРАЦИЯ
Сейчас мы на пороге слияния отдель-
ных звеньев громадной цепи природ-
ных процессов. Атом в сотнях своих
видоизменений, как своеобразный
кирпич мироздания, строит его, и
неумолимые законы физики и химии
управляют его судьбами.
А. Е. Ферсман
Использование законов физики и химии для познания миграции ато-
мов приобрело исключительное значение в геохимии. На этой основе объ-
яснена природа магматических и гидротермальных систем. Велика
роль подобного подхода и для характеристики систем земной поверх-
ности. Физико-химическому анализу процессов земной коры посвящено
большинство трудов А. Е. Ферсмана, В. М. Гольдшмидта и их много-
численных последователей.
7. ОБЩИЕ ЗАКОНОМЕРНОСТИ ФИЗИКО-ХИМИЧЕСКОЙ
МИГРАЦИИ
В земной коре распространены все основные типы химических свя-
зей: ионная, ковалентная, металлическая, молекулярная и водородная.
Развитие геохимии в первой половине XX столетия происходило пре-
имущественно в рамках «ионной концепции».
Ионы в земной коре
Ионы даже при низком содержании в системе могут играть в ней
важную роль. Так, при содержании в воде лишь 10-4 г/л водородного
иона (Н+) он определяет условия миграции других элементов в подоб-
ных «кислых» водах.
Современные методы спектроскопии твердого тела (мессбауэров-
ская, рентгеновская и рентгене-электронная спектроскопия, элект-
ронный парамагнитный резонанс ЭПР, ядерный магнитный резонанс —
ЯМР и др.) позволяют охарактеризовать состояние атомов и ионов
83
в минералах. Так, с помощью ЭПР удается отличать ионы, изоморфно
входящие в решетку минерала, от микровключений, диагностировать
валентность иона, его координацию, характер химической связи и т. д.
Разновалентные ионы одного элемента ведут себя в земной коре как
различные элементы. Например, Fe2+ похож на Са2+, Mg2\ a Fe3+ —
на А13+, Сг3+. Чем больше валентных состояний элемента, чем разно-
образнее его ионы, тем разнообразнее и его миграция.
Потенциал ионизации i и потенциал возбуждения /. Потенциалом
ионизации i называется энергия, необходимая для удаления электро-
на из атомной системы. Эта величина зависит от строения атома и мо-
жет быть определена экспериментально. Так, для отрыва электрона у
газообразного Н надо затратить 13,595 Эв, а у Не — 24,581 Э в,
что указывает на легкую ионизацию Н (Н->-Н+) и крайне трудную He x
X (Не->-Не+). Еще больше энергии требуется для отрыва второго
электрона у Не — i2 (Не+ -► Не2+) — 54,403 Эв. Для Li можно опре-
делить уже 1-й, 2-й и 3-й потенциалы ионизации (i4, i2, t3), для Be
1—4-й, для В 1—5-й и т.д. по числу электронов в атоме, причем отрыв
каждого последующего электрона требует все большей затраты энер-
гии, часто в количествах нереализуемых в земной коре. Например, от-
рыв 3-го электрона у Be (i3) требует столь большой затраты энергии,
что известен только ион Ве2+, но не Ве3+. Таким образом величи-
ны I во многом объясняют характер ионизации элементов в приро-
де, частично размеры ионов, существование инертных газов и другие
явления. Несмотря на то, что потенциал ионизации — важная кон-
станта химии, он имеет ограниченное применение в геохимии, так как
геохимик в своих построениях воспринимает химические свойства
элементов как исходные данные1. Более важны для геохимии потен-
циалы возбуждения (/ — разности между последовательными потен-
циалами ионизации (t2 — tj; i3 — i2 и т.д.). Г. С. Момджи показал,
что близость потенциалов возбуждения элементов различных групп
периодической системы нередко согласуется с близостью их геохими-
ческого поведения. Так, у Zn и Be t2 — ц равны 8,82 и 8,67 и для них
характерно вхождение в решетку структурно аналогичных силикатов
и алюмосиликатов — фенакита Be2SiO4 и виллемита — Zn2SiO4.
Ученый отметил также некоторые общие черты в геохимии Си и Ni,
для которых величины /2, /3 и /4 близки. Сходство геохимии Fe2+ и
Ge2+ также хорошо увязывается с близостью их потенциалов возбужде-
ния. А. Н. Литвинович показал, что размеры I объясняют одновален-
тность щелочных металлов и существование Ag2+, Cu2+ и Au3+;
двух-и четырехвалентность Sn и Ge, трех и пятивалентность Sb, As и
Bi и т. д. Интереснейшим геохимическим параметром, по Г. С. Момд-
жи, служит произведение потенциала возбуждения на радиус иона.
1 Гольдшмидт В. М. считал, что для оценки степени ионности связи следу-
ет использовать отношение величины потенциала ионизации к валентности ка-
тиона («ионный потенциал Гольдшмидта»). На значение этого параметра для гео-
химии обратил в 1981 г. внимание Л. С. Бородин.
84
Если эта величина превышает 20, 70, то ионизация атома химически-
ми средствами невозможна.
Ионные радиусы. Это понятие широко используется в геохимии.
Рентгено-структурный анализ позволил определять межатомные рас-
стояния (например, сумму радиусов ионов Na+ и С1_ в NaCl). Считая
ионы несжимаемыми шарами, кристаллохимики провозгласили
«принцип аддитивности», согласно которому межатомное расстояние
складывается из суммы радиусов катионов и анионов, слагающих кри-
сталл. Поэтому для определения размеров отдельных ионов необходи-
мо знать радиус хотя бы одного из них, и тогда по разности можно оп-
ределить размеры остальных. На основе рефрактометрических, рент-
геноструктурных и других измерений были определены размеры F-,
О2- и немногих других ионов. Это позволило вычислить размеры ос-
тальных ионов и построить систему ионных радиусов. В 1926 г. такую
задачу решил В. М. Гольдшмидт. Системы радиусов ионов разрабаты-
вали также Л. Полинг (1927), В. Захариасен (1931, 1954), Л. Аренс
(1952), Н. Белов и Г. Бокий (1952), С. Бацанов (1962), Р. Шеннон
(1976) и др. Все эти системы мало отличаются друг от друга, так как
исходная величина радиуса О2- принимается равной 0,132—0,140 нм.
С позиций квантовой химии ионы в каждом соединении приобрета-
ют специфические особенности в зависимости от типа, числа и располо-
жения окружающих ионов. Это исключает представление о радиусах
ионов как о константе. Данное понятие всегда определяется для пары
ионов, отмечает А. С. Марфунин. При оперировании величинами радиу-
сов ионов следует также учитывать координацию. Например, по Р. Шен-
нону, ион Са2+ в шестерной координации имеет радиус 0,1 нм, а в ко-
ординации 12 — уже 0,134 нм. Приводимые ниже величины Ri соот-
ветствуют шестерной координации. П. Хендерсон подчеркивает недо-
пустимость использования величин ионных радиусов для интерпрета-
ции структур с ковалентной связью.
Современные физические методы позволяют определять размеры
ионов по распределению электронной плотности в кристаллах, а кван-
товая механика — рассчитать «орбитальные радиусы электронных
оболочек» (А. А. Годовиков). Эти величины не совпадают с эмпириче-
скими радиусами Гольдшмидта и его последователей. В связи с этим
В. И. Лебедев в 1969 г. опубликовал новую систему «ионно-атомных ра-
диусов», в которой различаются радиусы по линии химической связи
и по линии отсутствия такой связи. В случае ионной связи, по В. И. Ле-
бедеву, катионы крупнее анионов, О2- имеет малые размеры
(0,045 нм). Это, по мнению автора, диктует необходимость перестройки
кристаллохимии, а также изменения многих представлений общей гео-
химии (земная кора не оксисфера, а сиаль и т. д.). Однако в большинст-
ве геохимических работ по-прежнему используются старые системы
ионных радиусов, которые хорошо объясняют многие явления геохи-
мии. Мы будем в основном пользоваться радиусами Белова и Бокия
(рис. 24, 25), хотя и радиусы Лебедева в ряде случаев объясняют те
же явления (например, изоморфизм) не хуже.
85
ЛАНТАНОИДЫ
АКТИНОИДЫ
Рис 24 Ионные радиусы (нм) (по Н В Белову и Г Б Бокию) В скобках приведены значения вычисленных радиусов.
Для благородных газов даны значения атомных радиусов
Пери- оды Подгруппы
1а Па Ilia IVa Va Via Vila Villa lb II b mb IV b Vb VIb Vllb vmb
1 H 0,046 He 0Д22
2 Li 0Д55 Be 0Д13 в 0,091 c 0/177 N 0,071 О F Ne 0Д60
3 Na 0Д89 Mg 0Д60 Al 0Д43 Si 0Д34 P 0ДЗ s Cl 'Ar 0Д92
4 К 0,236 Са 0Д97 Sc 0Д64 TI 0Д46 V 0Д34 Cr 0Д27 Mn 0Д30 Fe 0Д26 Co 0Д25 Ni 0Д24 Cu 0Д28 Zn 0Д39 Ga 0Д39 Ge 0Д39 A« 0Д48 Se 0Д6 Br Kr 0Д98
5 Rb 0,248 Sr 0,215 Y 0Д81 Zr 0Д60 Nb 0Д45 Mo 0Д39 Tc 0Д36 Ru 0Д34 Rh 0Д34 Pd 0Д37 Ag 0Д44 Cd 0Д56 In 0Д66 Sn 0Д58 Sb 0Д61 Те 0Д7 I -Xe 0(218
6 С» 0,268 Ва 0,221 La 0Д87 Hf , 0Д59 Ta 0Д46 w 0Д40 Re 0Д37 о» 0Д35 Ir 0Д35 Pt 0Д38 Au 0Д44 Hg 0Д60 TI 0Д71 Pb 0Д75 Bi 0Д82 Po At Rn
7 Fr 0(280 Ra 0(235 Ac t о,2оз J
t ce | 0Д83 Pr 0Д82 Nd' 0Д82 Pm Sm 0Д81 Eu 0(202 Gd 0Д79 Tb 0Д77 ОУ 0Д77 rio 0Д76 Er 0Д75 Tu 0Д74 Yb 0Д93 Lu 0Д74
It Th f} 0Д80 Pa 0Д62 U 0Д53 Np 0Д50 Pu 0Д62 Am Cm Bk Cf E Fm Mv
Рис. 25. Атомные радиусы (им) (по Г. Б. Бокию)
Размеры ионов закономерно связаны с положением элементов в пе-
риодической системе и в пределах групп растут с увеличением поряд-
кового номера:
Ионы................. Li+ Na* К+ Rb+ Cs +
Радиусы, нм.......... 0,068 0,098 0,133 0,149 0,165
В рядах радиусы уменьшаются с увеличением валентности, как,
например, в третьем ряду:
Ионы................. Na+ Mg2+ Al3+ Si4+
Радиусы, нм.......... 0,098 0,074 0,057 0,039
В результате по диагоналям периодической системы наблюдаются
близкие величины ионных радиусов, что имеет большое геохимиче-
ское значение («правило диагональных рядов» А. Е. Ферсмана — сход-
ная роль в гипогенных минералах Li и Mg, Be и Al, Na и Са, Са и Y,
Ti и Nb).
Наряду с простыми ионами (Na+, К+ и т.д.) в земной коре важную
роль играют комплексные ионы типа SOJ-, 1(UO2) (СО3)314_ и другие,
внутри которых связь между атомами ковалентная. Размеры таких ио-
нов часто значительны, их 4юрма особенно далека от шаровой.
Хотя ионные радиусы это не физические константы и необходимо
осторожно использовать их, опыт науки подтверждает справедливость
вывода А. Е. Ферсмана об огромном значении радиусов ионов для гео-
химии.
Атомные радиусы. Они разделяются на металлические (в метал-
лах, сплавах и др.) и ковалентные, характерные для неметаллических
соединений. Размеры ковалентных радиусов одного и того же элемента
меняются в зависимости от характера кристаллической решетки, по-
этому различают октаэдрические, тетраэдрические и прочие радиусы.
Изоморфизм. Под этим термином в геохимии понимается способ-
ность химических элементов (атомов, ионов), а также целых блоков
кристаллической решетки замещать друг друга в минералах.
В. М. Гольдшмидт доказал, что для вхождения химических элементов
в кристаллическую структуру минералов решающее значение имеют
именно размеры ионов и атомов. На основании этого положения уче-
ный объяснил совместное нахождение Mg и Ni в оливине, К и РЬ в ор-
токлазе и огромное количество других фактов. Появилась возмож-
ность предсказывать ассоциации элементов в земной коре, направлять
поиски, совершенствовать химическую технологию. По В. М. Гольд-
шмидту, изоморфные замещения возможны, когда радиусы ионов и ато-
мов различаются не более чем на 15 % (от размера меньшего, радиуса).
При температурах, близких к точке плавления минералов, эта величи-
на достигает 30 %, т. е. изоморфная смесимость возрастает. Поздней-
шие исследования показали, что изоморфная смесимость возможна и
при ЛА? — 40 %, для некоторых элементов даже 60 % [например, изо-
морфизм Si4+ (0,039 нм) и А13+ (% 0,057 нм) в алюмосиликатах при
88
AR = 46 % иЛи Si4+ и Ti4+ (0,064 нм) при AR = 64 %]. Изоморфная
смесимость также увеличивается, если количество замещающего иона
крайне мало («следы»).
Близость ионных и атомных радиусов — не единственное условие
изоморфизма. Необходима также химическая индифферентность (Ма-
каров Е. С.). Например, Zr4+ и Hf4+, Mg2+ и Fe2+, Si4+ и Al3+, Na+ и
Са2+ не образуют между собой химических соединений и в минералах
они изоморфны. Au и А1, несмотря на почти одинаковые атомные ра-
диусы (0,144 и 0,143 нм) и изоструктурность (кубическая гранецентри-
рованная структура типа меди), не изоморфны, так как химически не
индифферентны, образуют АиА12 и другие соединения. Ga3+ и As3*
имеют близкие радиусы (0,062 и 0,058 нм), однако не изоморфны в ион-
ных кристаллах, так как образуют ионногомеополярные соединения
типа GaAs.
Для изоморфизма необходимо также, чтобы заменяемые атомы име-
ли сходную природу межатомной связи. Так, галит NaCl и галенит
PbS кристаллизуется в кубических решетках с близкими параметра-
ми (а = 0,564 и а = 0,594 нм). Орбитальные радиусы Na и РЬ, С1 и
S близки, но изоморфизма нет, так как в NaCl химическая связь су-
щественно ионная, а в PbS — ковалентная.
Ион меньшего размера легче замещает ион большого размера, а не
наоборот, ионы с более высоким зарядом предпочтительнее замещают
ионы с более низким зарядом (Са2+ Na+ и т.д.). Эти явления по-
лярного изоморфизма Ферсман объяснил с энергетических позиций:
вхождение в кристалл иона более высокой валентности и малого ради-
уса «энергетически выгодно», так как сопровождается большим выде-
лением энергии, повышает энергию решетки.
Ферсман предложил составлять «звезды изоморфизма». Например:
Мп2+ Na
Cd К —Ba—Sr—TR
I I
Na—Са—Се—TR Rb
I I
Hg TI
Sr Cs
Максимальное количество изоморфных примесей в минерале со-
ставляет его изоморфную емкость. В зависимости от структуры мине-
рала, температуры, давления и других внешних условий она колеблет-
ся в значительных пределах. С понижением температуры изоморфная
смесимость уменьшается, поэтому, например, К+ и Na+, изоморф-
ные в магматических минералах, не изоморфны в гипергенных.
По Ф. В. Чухрову и Н. В. Петровской, результаты современных
физических методов анализа в ряде случаев заставляют пересматривать
ранее существовавшие представления об изоморфизме. С одной сторо-
89
ны, в минералах выявилось большее число элементов примесей (десят-
ки), а с другой, установлено, что часть их входит в состав собственных
минералов или газовожидких включений. Например, в касситерите
примеси Fe, Мп, Ti, W, Та и Nb в основном связаны с ультрамелкими
выделениями минералов, а V, Cr, In и другие элементы входят изо-
морфно в структуру минерала. Многие минералы — твердые растворы,
Рис. 26. Катионогенные и анионогенные элементы в земной коре:
/ —элементы, образующие только катионы. 2 —элементы, образующие только анионы,
3 — амфотерные элементы — катионогенные и анионогеиные (в том числе элементы, об-
разующие комплексные анионы), 4— элементы, у которых ионная форма отсутствует
или не характерна
при изменении условий распадаются с образованием самостоятельных
минеральных фаз. Все это меняет представление и о размерах изо-
морфной емкости.
Неструктурные примеси. Так именуются атомы и ионы, находящие-
ся в междоузлиях, на стыках кристаллических блоков, в микротре-
щинах и прочих дефектах кристаллов. Эти примеси не подчиняются за-
конам изоморфизма.
Энергетические характеристики ионов, атомов и кристаллов. Эле-
менты, образующие в земной коре катионы, называются катионоген-
ными, а образующие анионы — анионогенными. В зависимости от
внешних условий многие элементы могут быть и катионогенными и ани-
оногенными. Так V в магме находится в форме V®+ и является катио-
90
ногенным аналогом железа, а в резко окислительных щелочных усло-
виях пустынь пятивалентен и образует анион — VO|_. Катионоген-
ны и анионогенны Сг, Мо и другие элементы (рис. 26).
В. М. Гольдшмидт показал, что для ионов типа благородных га-
зов (с электронной конфигурацией, как у Не, Ne, Аг, Кг, Хе) катио-
ногенность и анионогенность зависят от соотношения валентности W
и ионного радиуса Ri. Соответствующее отношение в 1928 г. американ-
Рис. 27. Химический характер элементов в зависимости от
отношения валентности к радиусу иона (по В. М. Гольд-
шмидту с дополнениями В. В, Щербины)
ский химик К.Картледж назвал ионным потенциалом —J1. При ма-
лых его значениях элемент ведет себя как щелочной металл, а при
больших — как типичный неметалл (рис. 27).
С катионогенностью и анионогенностью связана электроотрица-
тельность атомов (ЭО), т. е. их способность при вступлении в соеди-
нения притягивать электроны. Наиболее электроотрицательны гало-
гены, наименее — щелочные металлы. Это понятие химии (Л. Полинг,
1932) применяется и в геохимии. Неоднократно делались попытки вы-
разить ЭО в единицах энергии или же в условных единицах. А. С. По-
1 Картледж, Гольдшмидт и другие ученые выражали радиусы ионов в анг-
стремах (1 А =0,1 нм). Поэтому формула ионного потенциала при оперировании
нанометрами для получения тех же величин изменяется. Она приобретает вил
/ = • «7/10/?.
91
варенных приводит следующие величины ЭО для щелочных металлов,
галогенов и некоторых халькофильных металлов в кДж/моль (1977):
Элементы . Li + Na+ K+ Rb+ Cs+ F7 + Cl7+ ВР+ P+
ЭО .... 504 502 419 398 377 2553 1925 1758 1571
Элементы . Zn2+ Cd2+ Hg2+ Cu2+ Ag+ Au+ Se+ Fe2+ Ni2+ Pb2+
ЭО .... 858 816 900 984 733 879 1571 774 879 733
Для магматических минералов с преимущественно ионным типом
связи, в частности для силикатов, Л. С. Бородин предложил прибли-
женную десятибалльную шкалу электроотрицательности. Основность
Si он принял за 1, а остальных литофильных катионов — в соответст-
вии с величиной их ионных потенциалов. В результате получился сле-
дующий ряд основности катионов: Si (1), Ti4+ (1,5), Fe3+, Ga (2), Nb,
Ta (2,5), Al (3), Be (3,5), Zr, Hf (4), Sc (4,5), Fe2+. Mn (5), Mg
(5,5), Y, TRy(6), TRce (6,5), La (7), Ca (7,5), Sr, Li (8), Na (8,5),
Ba (9), K, Rb (9,5), Cs, Fr (10).
Элементы с резко различной ЭО образуют ионную связь, а элемен-
ты с близкой ЭО — ковалентную. Поэтому галогениды щелочных ме-
таллов имеют ионные решетки (Na — 502, Cl — 1925), а сульфиды тя-
желых металлов — промежуточные, с большой долей ковалентной
связи (ЭО у S 1571, Си — 984, РЬ — 733).
Равная и значительная величина ЭО атомов в решетке алмаза оп-
ределяет ковалентный неполярный характер связи. Близкие, но ма-
лые величины ЭО приводят к образованию металлической решетки
(металлы, сплавы). Некоторые авторы подчеркивают качественный ха-
рактер понятия электроотрицательности, его внутреннюю противоре-
чивость или даже физическую необоснованность, возможность оши-
бок при решении геохимических задач (П. Хендерсон).
Развивая «ионную концепцию», А. Е. Ферсман установил новую
функцию, связывающую между собой IF и Ri. Он предположил, что
в ионных кристаллах аддитивны не только межатомные расстояния,
складывающиеся из размеров катионов и анионов, но и энергия крис-
таллической решетки. Ученый полагал, что каждый ион, входя в ре-
шетку, вносит в нее определенный пай энергии — ЭК (энергетиче-
ская константа иона). Поэтому энергия кристаллической решетки оп-
ределяется как сумма ЭК входящих в нее ионов. Используя уравне-
ние энергии решетки А. Ф. Капустинского, Ферсман вывел следую-
щие формулы [Ферсман использовал ангстремы):
ЭК аниона = W2/2R\ ЭК катиона = (W2/2R)-[0,75 (R + 0,20)].
При оперировании нанометрами:
ЭК аниона - IF2/2O R; ЭК катиона = (IF2/20 R)-[0,75 (10/? +
+ 0,20)].
Ферсман рассчитал ЭК большинства ионов. Они оказались связан,
ными с положением элементов в периодической системе. Например,
92
для щелочных, щелочноземельных
чены следующие ЭК'.
металлов и галогенов были полу-
Элементы ЭК Элементы ЭК
Li + 0,65 Са2+ 1,75
Na+ 0,45 Sr2+ 1,53
К4 0,36 Ва2+ 1,35
Rb+ 0,30 F- 0,37
Cs+ 0,30 С1- 0,25
Ве2+ 2,65 Вг- 0,22
Mg2+ 2,10 I- 0.18
ЭК выражается в условных единицах, умножив которые на
1071,74, получают килоджоули. Формула для вычисления энергии
решетки (м) предельно простая:
и = 1071,74 {а-ЭК} + b-Жг + с-Ж,9 + ••• - г п-Жп).
По А. А. Саукову, точность подсчета и для бинарных ионных реше-
ток ±6%, для других типов решеток значительно меньше. Ферсман
предложил также коэффициент ВЭК, равный ЗА, деленной на валент-
ность. Для анионов эта величина составляет половину ионного потен-
циала Картледжа, т. е. U7/20A.
Наименьшие ЭК у щелочных металлов и галогенов (одновалент-
ность, крупные радиусы). Этим определяются малые величины энер-
гии решеток галогенидов щелочных металлов, особенно йодидов.
С малыми ЭК Ферсман связывал легкую растворимость солей, высо-
кую миграционную способность галогенидов щелочных металлов.
ЭК POJ~ равен 1,50, СО2- — 0,78, а С1~ — лишь 0,25. Это в общем от-
вечает уменьшению растворимости и соответственно подвижности в
ряду хлориды — карбонаты — фосфаты.
На основе ЭК и ВЭК Ферсман в 30-х годах начал разрабатывать
геоэнергетическую теорию. Ученый стремился построить энергетиче-
скую модель физико-химической миграции ионов в земной коре. Он
отметил, что многие процессы (например, кристаллизация минералов
из магматических расплавов и водных растворов) протекают в направ-
лении уменьшения термодинамических потенциалов. Характеристи-
кой этих процессов служит величина энергии кристаллической решет-
ки образующихся минералов, так как последовательность кристалли-
зации в ряде случаев соответствует понижению энергии решетки. На
этой основе Ферсман объяснял последовательность кристаллизации
элементов из магмы, особенности некоторых гипергенных процессов.
Однако геоэнергетическая теория не стала основой для объяснения
главных закономерностей миграции. Об ЭК и ВЭК можно сказать то
же, что и о радиусах ионов: это не физико-химические константы, а
приблизительные, полуколичественные показатели. Для простых ио-
нов, особенно для элементов I, II, VI и VII главных групп периодиче-
ской системы (Na+, Са2+, С1~ и т.д.), они хорошо объясняют особен-
93
ности природных процессов в полностью диссоциированных системах
(например, в соляных озерах). Однако в большинстве природных сис-
тем элементы не образуют простых ионов (или образуют не только про-
стые ионы) и, следовательно, принцип аддитивности здесь еще менее
применим, чем при вычислении ионных радиусов. Например, в гидро-
термах халькофильные элементы образуют сложные комплексные ионы
или мигрируют в неионной форме. Уже поэтому к анализу гидротер-
мального рудообразования неприменимо представление об ЭК- По-
этому ЭК и ВЭК нашли несравненно меньшее применение в геохимии,
чем ионные радиусы. Однако сама идея Ферсмана о важности энерге-
тического подхода к миграции по-прежнему имеет большое методоло-
гическое значение. Ее дальнейшее развитие связано с исследованиями
Н. В. Белова, В. И. Лебедева, Д. С. Коржинского и его школы,
А. А. Саукова, В. М. Синицына, В. С. Урусова, П. П. Тимофеева и
А. В. Щербакова, В. С. Голубева, Г. А. Булкина и многих других
ученых, о трудах которых мы еще будем говорить в этой книге.
Радиационные электроино-дырочные центры
в минералах (свободные радикалы СР)
Осколки молекул, ионы, радикалы, захватившие или отдавшие
электрон, именуются свободными радикалами. Свободная валент-
ность (неспаренные электроны) сообщает СР высокую химическую
активность, окраску, парамагнетизм. Известно много органических и
неорганических СР, которые определяются различными физическими
методами, преимущественно по спектрам электронного парамагнитно-
го резонанса (ЭПР). При низких температурах СР, как правило, не-
устойчивы, хотя известны и стабильные СР. Многие СР образуются
при температуре в сотни и особенно тысячи градусов. В последнем
случае их концентрация в газах может достигать десятков процентов.
Поэтому СР — характерная форма нахождения элементов в системах
космоса, в том числе в верхних слоях Солнца. В земной коре СР обра-
зуются под воздействием радиоактивности, ультрафиолетового излу-
чения и других факторов. По А.С. Марфунину, в минералах обнару-
жены Ti8+, Zr8+, Hf8+, Мо6+, W5+, Nb4+, VO2+, COJ, SO2, SO3-,
Ni+ и другие СР, устойчивые в течение геологических отрезков вре-
мени, т. е. десятков и сотен миллионов лет. Все СР представляют со-
бой «электронно-дырочные центры» — заряженные дефекты атомной
структуры. Если вакансия аниона захватывает электрон, то образует-
ся электронный центр и электронейтральность восстанавливается.
К электронным центрам относятся и катионы с такой необычной ва-
лентностью, как Ti8+, Ni+ и др. При недостатке положительного
заряда возникает дырочный центр. В кварце, например, его появле-
ние связано с примесью А18+, замещающего Si4+. При этом принимает-
ся, что «дырка» ведет себя аналогично электрону с положительным за-
рядом (е+). Ионы, захватывая электрон (е-) или «дырку» (е+), стано-
вятся СР:
94
Pb2^
е+
---> Pb3+
*co3-
--->Pb+
e-
--►cor
e-
Метод ЭПР позволил изучить СР в кварце, полевых шпатах, каль-
цитах, баритах и других минералах. Например, в баритах и целести-
нах установлены центры SOt“, SO3, SO2, S2. Л. В. Бершов и А. С.
Марфунин обнаружили в битумах кремнеорганический СР. По их
мнению, это указывает (впервые) на «мостик», существующий в зем-
ной коре между неорганическими кремнекислородным миром и орга-
ническим углеводородным.
СР обусловливают многие особенности минералов. Например, зе-
леная окраска амазонитовых гранитов объясняется РЬ\ входящим в
положение К+ в полевых шпатах. С Ti3+ в кварце связана его розовая
окраска. Интенсивная синяя окраска лазурита вызвана S3.
Разнообразие СР в одних и тех же минералах позволяет на осно-
ве их диагностики расчленять массивы изверженных пород, опреде-
лять генетические типы месторождений, оценивать месторождения по
выходам и решать другие задачи. Так, благодаря СР различают акцес-
сорные апатиты различных типов магматических пород, континен-
тальных и морских фосфоритов. Эндогенные ангидриты огличаются от
осадочных примесью редких земель, содержанием дырочного центра
РО<_. По радиационным дефектам РД в кварце можно определять
возраст уранового оруденения, оценивать его перспективы на глуби-
не (когда U выщелочен с поверхности, а РД в кварце свидетельствует
о его былом присутствии).
В целом, исследования СР, начатые в середине 60-х годов, пред-
ставляют важный этап в развитии геохимии минералов.
Неионные формы нахождения элементов
в земной коре
В большинстве систем земной коры элементы мигрируют и в ион-
ной, и неионной форме. Именно поэтому свойства ионов не могут объ-
яснить все особенности физико-химической миграции. Для объясне-
ния некоторых процессов они вообще неприменимы. Использование в
подобных случаях понятий о радиусах и других характеристиках ио-
нов методологически несостоятельно.
Широко распространены в природных водах недиссоциированные
молекулы. Например, в насыщенном растворе гипса при 5 °C недис-
социированных молекул CaSO4 в 2,5 раза больше, чем ионов Са2+.
Полная диссоциация гидроксидов Fe3+ передается следующим урав-
нением:
Fe(OH)3 Fe3+ +ЗОН-
qs
Однако методы термодинамики позволили рассчитать, что в нейт-
ральных водах преобладают не ионы, а истинно растворенные моле-
кулы недиссоциированной Fe (ОН)3: на один ион Fe3+ приходится
3-105 ионов [Fe(OH)]2+, 6-106 ионов [Fe (ОН)2]+ и 9-106 [Fe(OH)3],
Истинно растворенные недиссоциированные гидроксиды являются од-
ной из важных форм миграции ряда металлов.
Многие элементы мигрируют в составе недиссоциированных мо-
лекул жидкостей и газов, коллоидных мицелл. Неионная форма
преобладает в органических соединениях, из которых многие раст-
воримы в воде (фульвокислоты и др.). В комплексе с органически-
ми веществами мигрируют и многие металлы.
В минералах чисто ионные связи распространены мало, для них
более характерны промежуточные — ионно-ковалентные связи.
Даже в таком классическом ионном кристалле, как NaCl, степень ион-
ности связей не достигает 100%.
Окисление и восстановление
Окислительно-восстановительные процессы чрезвычайно харак-
терны для земной коры, во многих системах они приобретают ведущее
значение. Окислителями могут быть все элементы и ионы, способные
принимать электроны, а восстановителями — отдавать их (рис. 28).
Важнейший окислитель — кислород (О2, Н2О2 и др.). Это связано
как с его высоким кларком, так и с химической активностью. К важ-
ным окислителям относятся S (в форме SO2-), С (СО2), N (NO3 , NOj
и др.), Fe (Fe3+), Мп (Мп4+, Мп3+). Менее велика роль Ti (Ti4+),
V (VO!' и др.), Си (Си21"), Сг (СгО2~, Сг3+), еще меньше (в связи с низ-
ким кларком) U (О6+), Mo(Mofib) и совсем ничтожна — Se (Se°,
SeO2-, SeO?-) и других рассеянных элементов.
Самый сильный восстановитель — «гидратированный электрон»
e-aq, который образуется, например, при радиолизе воды. Сильным
восстановителем служит и другой продукт радиолиза — атомарный
водород. Однако важнейшими восстановителями являются молекуляр-
ный водород (Н2), сероводород (H2S), соединения углерода (СН4,
СО, различные органические соединения), Fe (Fe2+), Мп (Мп2+, Мп3+)
и т.д.
Окисление обязательно сопровождается восстановлением, но в гео-
химии принято говорить отдельно об окислении и о восстановлении.
Так, в зоне окисления сульфидных месторождений происходит окис-
ление S, Fe, Си. При этом восстанавливается О2, но это, однако, не
нашло отражения в наименовании процесса.
Каждая система, в которой протекают окислительно-восстанови-
тельные реакции, может быть охарактеризована по уровню окислеи-
ности (восстановленности) среды. Говорят об окислительной среде,
слабоокислительной, резко восстановительной и т. д. С этой целью для
водных растворов используют количественный показатель — окисли-
96
о ЖЖ » и н я я it м-
> жж ЗОСкХх e-i’чл гХл °о . > <! 1^1
> °°ХХХХХХ И <© /у///// УШ г? / /у " о Ом со
> 1 о О я
> и » ^///// 'ш. 8 9^7
jW/7 -11
— ss/ST' W i” И "
* CM ^«МУХХ1 <© 7/// J У/ГО//
> ж
> Г5 * [О
> 9, ж ^Мо' Ж 8
> ^7 “ св Ом
> И
Щ И Й о
S •1 я
— “ Ш ' и О и и
см
Рис. 28. Элементы, участвующие в окислительно-восстановительных реакциях земной коры:
1 — как окислители, 2 — как восстановители, 3 — как окислители и восстановители (в зависимости от валентного состояния и
условий среды), 4элементы, не участвующие в окислительно-восстановительных реакциях, а — играющие важную роль в окислительно-
восстановительных реакциях в связи с большими кларками н высокой миграционной способностью, б — не играющие существен-
ной роли в окислительно-восстановительных реакциях (главным образом из за низких кларков и малой способности к концентрации)
4
Зак. 2022
97
тельно-восстановительный потенциал Eh, измеряемый в вольтах. Для
магмы используются парциальное давление кислорода и его летучесть.
Окислительно-восстановительные условия можно характеризовать
и по содержанию в системах ведущих элементов, ионов и соединений,
особенно таких, как О2, СО, Fe'24. Fe3, H2S и др. С этих позиций
можно выделить следующие окислительно-восстановительные обста-
новки миграции (в скобках — примеры):
1. Ультраокислительная — Сг6+, V5, Т13+, Мп4+, Fe3+. Со3+,
Se64, U6+, Мо6+, N5+, Cu2+ (щелочные почвы сухих степей и пустынь,
содовые озера).
2. Окислительная — Fe3+, Mn4+. U“+, Мо*' . Си’2+ (океаны, реки,
озера).
3. Слабоокислительная — Fe3\ Мп'2+. Мо6+, U“+, Cu'2+ (многие
трещинные воды скальных пород).
4. Слабовосстановительная— Fe3*’, Fe'2T, Мп'2-Г (магма).
5. Восстановительная — Fe'2+ (гидротермы с H2S. сероводородные
илы морей и соляных озер, породы Луны, болота тайги, тундры, влаж-
ных тропиков).
6. Ультравосстановительная — Fe". возможно, Si0 (земное ядро,
нижняя мантия, железные и каменные метеориты).
При изменении окислительно-восстановительных условий возни-
кают геохимические барьеры, для которых характерна концентрация
многих элементов с переменной валентностью (в том числе рудообра-
зование). При резком увеличении окисленности среды формируется
окислительный барьер А, для которого на земной поверхности особен-
но характерна концентрация Fe, Мп, Со, S, Se. Окислительный ба-
рьер может возникнуть и в условиях восстановительной среды,
например при смене ультравосстановительной обстановки на вос-
становительную, а также при смене слабоокислительной среды на
окислительную. При резком увеличении восстановленности среды
образуются восстановительные барьеры В и С, для которых также
характерно накопление многих элементов (Си, Au. Ag, S, Se, U, Мо, V
и т.д.). Эти барьеры также могут возникать как в восстановительных
условиях (слабовосстановительные—»- резковосстановительные), так и
окислительных (ультраокислительные —«-окислительные).
Термодинамика физико-химической миграции
При изучении обратимых реакций и равновесных систем или сис-
тем, стремящихся к равновесию, большое значение приобрела хими-
ческая термодинамика, методы которой позволили решить такие важ-
ные задачи, как определение форм нахождения элементов и условия
образования минералов. Первые опыты применения термодинамики в
геохимии связаны с именами В. М. Гольдшмидта, П. Ниггли, Я. Вант-
Гоффа и А. Е. Ферсмана, но широкое распространение эти методы полу-
чили лишь во второй половине XX столетия. В СССР большое значе-
ние имели исследования Д. С. Коржинского и его школы (В. А. Жари-
98
ков, А. А. Маракушев и др.). Соответствующий раздел геохимии неко-
торые ученые именуют физической геохимией. По В.А. Жарикову, она
изучает физико-химические процессы формирования земной коры и
мантии, минералов, горных пород и руд.
Константа равновесия реакции и формы нахождения элементов в
растворах и расплавах. Для каждой обратимой реакции можно опре-
делить константу равновесия /(, не зависящую от активных концент-
раций реагирующих веществ и меняющуюся только с изменением тем-
пературы и давления. Например, диссоциация комплексного иона
трикарбонатуранила в гипергенных условиях протекает так:
[(UO2) (СО3)3|4- иог +ЗСОГ
Большая величина константы равновесия этой реакции свидетель-
ствует об устойчивости данного комплекса и ничтожном количестве
ионов ПОГ в растворе:
[ (UOg) (СО3)з14~ __ д- __ JQ1 8,9
luori [со|_]:!
Константы равновесия вычисляются различными методами, в том
числе с помощью ЭВМ. их величины приводятся в справочниках. Зная
К нескольких реакций, можно составить систему уравнений и опре-
делить, в каких формах данный элемент находится в изучаемой при-
родной воде, расплаве, газе. Так, Г. А. Голева рассчитала, что в силь-
нокислых водах зоны окисления медных месторождений Си находится
в форме Си2+ (14—30%), CuHSO« (1—25%), недиссоциированной мо-
лекулы CuSO® (70—95 %). В щелочных хлоридно-гидрокарбонатных
водах зоны восстановительных процессов Си находится уже в формах
СиСО° (15—40%), Си (СО3)Г (5—20 %), Си (ОН)+ (5—10 %). В кис-
лых хлоридных водах нефтегазоносных структур преобладает анион
Си (ОН)з (45—65%), хотя имеются и катионные формы — Си+ (20—
—46%), СиС1+ (20—35%) и др. Для РЬ в сильнощелочных водах воз-
можны комплексные анионы НРЬО?, а в термальных водах — тио-
сульфатные комплексы типа [Pb (S2O3)3]4_, (РЬ (S2O3)1°, (РЬ (S2O3)212-.
Подобные расчеты применимы не для всех элементов из-за отсутст-
вия данных о константах равновесия многих реакций. Следует также
помнить, что эти методы пригодны только для определения истинно
растворенных форм и не могут быть использованы при определении
коллоидных форм.
Принцип Ле Шателье. Согласно этому принципу изменения в рав-
новесных системах происходят в направлении, противодействующем
внешнему воздействию. Например, при остывании магматического оча-
га кристаллизуются минералы, образование которых сопровождается
выделением теплоты, противодействующим понижению температуры.
Из вод соленого озера осенью при понижении температуры также осаж-
даются минералы, образование которых сопровождается выделением
теплоты. Весной при повышении температуры эти минералы раство-
ряются, так как растворение связано с поглощением теплоты.
4*
99
Следовательно, принцип Ле Шателье позволяет определить на-
правление процесса при изменении внешних условий — давления, тем-
пературы и концентрации. Он применим только к равновесным систе-
мам. Иногда данный принцип ошибочно применяют и к неравновесным
системам. Так, считалось, что минералы изверженных пород, об-
разовавшиеся при высоких температурах и давлениях, попав на зем-
ную поверхность, в условиях низких давлений и температур «по прин-
ципу Ле Шателье» должны выветриваться с выделением теплоты и
увеличением объема. Однако полевые шпаты и другие магматические
минералы образовались в условиях, отличных от земной поверхности.
При выветривании внешние факторы не действуют на равновесную си-
стему и в этом случае неприменим принцип Ле Шателье.
Химическое сродство и изобарный потенциал. При изучении мигра-
ции часто возникает вопрос о теоретической возможности реакции
в условиях данной температуры, давления и концентрации. В термоди-
намике эта задача сводится к определению химического сродства, т.е.
способности элементов (ионов, молекул) вступать в соединение друг с
другом. Качественная картина сродства между элементами достаточ-
но определенна. Например, на земной поверхности существует сродст-
во между О2 и пиритом, так как окисление пирита протекает самопро-
извольно. А между 0.2 и Au сродства нет — они не соединяются. Од-
нако отсутствие взаимодействия не всегда означает отсутствие сродства,
часто здесь играют роль кинетические факторы.
В 1867 г. французский химик М. Бертло пришел к выводу, что из
всех возможных в данной системе реакций самопроизвольно протекает
та, при которой происходит наибольшее выделение тепла. Таким об-
разом мерой химического сродства считался экзотермический эффект
реакции. Этот «принцип Бертло» оправдывается довольно часто, хо-
тя он и не универсален, так как известны реакции, протекающие са-
мопроизвольно с поглощением теплоты.
Проблему решили У. Гиббс (1878), Г. Гельмгольц (1884) и Я. Вант-
Гофф (1885). Они доказали, что мерилом химического сродства слу-
жит не тепловой эффект, а максимальная работа реакции, проведенной
в условиях изотермического и обратимого процесса. Эта величина А
зависит от природы реагирующих веществ, температуры, давления, ис-
ходных концентраций (активностей). При постоянных температуре и
давлении А характеризуется отрицательной величиной изменения тер-
модинамической функции Z, установленной Гиббсом. Ее именуют
«свободной энергией Гиббса», «изобарным потенциалом», «изотермно-
изобарным потенциалом».
Допустим, что в обратимой реакции, протекающей при постоянном
давлении Р и температуре Т участвует п молей вещества Ват молей
вещества С. В ходе реакции образуется k молей вещества R, I молей
вещества S:
пВ -f- тС kR -}- IS.
Количество вещества В, С, R, S в системе столь велико, что израс-
100
ходование в ходе реакции п молей вещества В, т молей вещества С не
отражается на составе и условиях существования системы. При наступ-
лении химического равновесия скорости прямой и обратной реакций
станут равными. Обозначим активные концентрации веществ в состоя-
нии равновесия через ав, ас, aR и т. д. Согласно химической термоди-
намике величина изменения изобарного потенциала реакции AZ
равна:
AZ = £Tln
Ср ' fl С Г. ГТ, О' R ’
—2- —/?7Нп -
ав ас J а в ас J
Первый член правой части уравнения включает неравновесные актив-
ные концентрации в начале реакции (а'), а второй член — те же кон-
центрации после достижения равновесия (а).
Если величина AZ отрицательна, то самопроизвольное течение ре-
акции возможно, если положительна — невозможно.
Выражение (ар • а|)/(ав-ас) представляет собой константу равно-
весия химической реакции при постоянном давлении, обозначаемую
символом kP. Поэтому уравнение для AZ может быть переписано сле-
дующим образом:
AZ = /?Tln [(a'^-as!)/(aBn-acm)] — /?Т1п kP,
где R — универсальная газовая постоянная, Т — абсолютная темпера-
тура. Если активности исходных веществ В, С, R, S равны единице,
первый член правой части уравнения равен нулю. Уравнение принима-
ет более простой вид, а величину изменения изобарного потенциала
при температуре 25 °C (298 К) и давлении 105 Па именуют стандарт-
ным потенциалом и обозначают AZ0. Таким образом, AZ°= —RT In kP,
где Т = 298°. Подставляя значение RT и переходя от натуральных
логарифмов к десятичным, получаем: AZ0 = — 1,364 1g Rp. Для не-
которых веществ AZ0 определяют, измеряя электродвижущую силу в
гальванических элементах. Эти данные служат для расчета AZ0 дру-
гих соединений. Величины AZ0 для различных минералов, выражен-
ные в ккал/моль, содержатся в справочниках. С их помощью можно оп-
ределить расчетным путем AZ0 реакции образования минералов из
простых ионов, т. е. химическое сродство между реагентами в стандарт-
ных условиях (Р = I05 Па, Т = 298° К). Рассмотрим для примера ре-
акцию осаждения CaF2 из раствора, содержащего ионы Саа+ и F~ :
Ca2++2f- CaF2
_________________
раствор твердый
По справочнику находим величины AZ0 для веществ, участвующих в
реакции:
AZ°Ca2+ = —132,18,
AZ°F_ = —66,08,
AZ°CaF2 =—277,7,
Твердый
101
Стандартный изобарный потенциал реакции осаждения CaF2
(AZ° реакции) равен: AZ° CaF2 — AZ° Са2+— 2AZ°F~ = —277,7—
— (—132,18) — 2 (—66,08) = — 13,36.
Отсюда следует, что при активных концентрациях (активностях)
Са2" и F-, равных единице, и Т = 25° С, CaF2 осаждается. Однако это
верно только для стандартных условий, которые, как правило, далеки
•от природных. Поэтому для оценки возможности образования минера-
лов надо использовать величины AZ, а не AZ°. Примем активную кон-
центрацию Са2+ равной 10"2 моль/л, a F- — 10“3 моль/л (соответст-
венно 0,4 г/л Са2+ и 9-10-3 г/л F~). Она характерна для грунтовых
вод степей и пустынь, обогащенных F-. Рассчитаем AZ реакции по фор-
муле
AZ ; RT In —--------- l д/о = ! з64 lg —[СаРг]---, д/о
[Са*+ ] [F- |2 [Са2-] (F~]2 '
Концентрацию CaF., как вещества, находящегося в твердой фазе,
считают равной единице, поэтому окончательная расчетная формула
имеет вид (для 25 ЭС): AZ = 1,364-lg [Са2+]-1 IF*]’2 — 13,36 или
AZ = 1,364 lg 102- 10“ — 13,36 = 8-1,364—13,36 ----2,45.
Таким образом, и в данных условиях реакция пойдет в сторону
осаждения CaF2. Для районов влажного климата и активного водооб-
мена с их слабоминерализованными водами условия осаждения иные.
Примем активную концентрацию Са2+10-3 моль/л, или 0,04 г/л, а
концентрацию F_ 10-5 моль/л, или 9-10~5 г/л, тогда
AZ = 1,364 1g [Са2-*-]-1-[F]-2—13,36= 1,364 1g 103-ID10— 13,36 =
= 13-1,364—13,36= 17,73—13,36= +4,37.
Следовательно, в данных условиях CaF2 не будет осаждаться. Та-
кие воды будут растворять флюорит. Приведенные расчеты условны.
При точных вычислениях необходимо учитывать формы нахождения
элементов в водах (комплексные ионы и др.), активные концентрации,
температуру. Однако полученный вывод в основном верен: в сухом
климате условия для осаждения флюорита благоприятны, во влажном —
нет. Этот простой пример показывает также, что для характеристи-
ки направления природных процессов надо использовать не AZ0,
отвечающие «стандартным условиям», а реальные изобарные потенциа-
лы AZ.
Итак, направление обратимой химической реакции, протекающей
при постоянном давлении, определяется знаком изобарного потенциа-
ла'. если его величина отрицательна, то самопроизвольная реакция воз-
можна, если положительна — невозможна (возможна обратная реак-
ция). Если потенциал равен нулю, то в системе достигнуто химиче-
ское равновесие. Из этого не следует, что в земной коре невозможны ре-
акции с увеличением изобарного потенциала. Однако такие реакции
протекают не соамопроизвольно, а за счет энергии, поступаю-
щей извне.
102
Между изменением изобарного потенциала AZ, энтропии AS, эн-
тальпии А// и абсолютной температурой Т существует зависимость:
AZ=A//-T-AS.
Отсюда понятна ошибочность принципа Бертло: в выражение мак-
симальной работы входит не только тепловой эффект реакции АТ/,
но и «энтропийный фактор» — Г-AS1. Его значение при низких тем-
пературах и в конденсированных системах (твердых телах и жидко-
стях) сравнительно невелико. Поэтому на земной поверхности AZ
часто близко к А//, т. е. оправдывается принцип Бертло. Однако вели-
чина Т-AS увеличивается с ростом температуры и в магматических и
гидротермальных системах ею пренебрегать не следует — в них тепло-
вой эффект может не определять направление реакции.
Так, по А. Булаху, реакция образования кальцита из оксидов экзо-
термична как при температурах земной поверхности, так и при 1273 К
(при давлении около 105Па). Однако для температуры 298 К AZ"
равен— 130-103 Дж/моль и реакция термодинамически возможна,
а для температуры 1273 К AZ0 = 18,85-103 Дж/моль, т. е. реакция тер-
модинамически невозможна (но не следует забывать, что этот резуль-
тат получен для давления земной поверхности, не характерного для
эндогенных систем).
При метаморфизме карбонатных пород возможно взаимодействие
доломита с водой:
CaMg(COa)24- Н2О Mg(OH)24-СаСО3
доломит брусит
В стандартных условиях AZ0 этой реакции положительно, т. е. ре-
акция при низких температурах термодинамически невозможна. При
давлении 1,5-10® Па и температуре 550 °C (обстановка регионального
метаморфизма) AZ° уже отрицательно и брусит может образоваться.
Термодинамические барьеры (Н). Эти барьеры широко распростра-
нены в гидротермальных и гипергенных системах. Они возникают в ре-
зультате изменения основных термодинамических параметров — дав-
ления Р и температуры Т. Н барьер, например, формируется в местах
резкого понижения давления СО2 в подземных водах, на нем осажда-
ются кальцит и другие карбонаты:
Са2+ + 2НСОJ СаСО3 + Н2О + СО2
раствор твердый газ
Так образуются кальцитовые гидротермальные жилы, травертины
в местах выхода на земную поверхность углекислых источников,
кальцитовые горизонты в почвах и осадочных породах. Понижение
давления СО2 обусловлено различными причинами — тектоничес-
1 ДЯ — приращение энтальпии Н, или «теплосодержания». Для реакций
при постоянном давлении ДЯ равно тепловому эффекту реакции &QP.
103
кими подвижками и раскрытием полостей на глубине, разгрузкой
вод на поверхности и т д., но геохимическая сущность явления
остается одной и той же. Местами аналогичен механизм
и концентрации карбонатов рудных элементов. Так, в Центральном
Казахстане на барито-полиметаллическом месторождении Жайрем
наблюдаются прожилки церуссита (РЬСО3) в зонах нарушений, секу-
щих кайнозойские осадочные глины. Последние перекрывают девон-
ские известняки с сульфидами. Л. Д. Кудерина предположила, что по
неотектоническим разломам поднимались гидрокарбонатные воды, со-
держащие РЬ2+. Высокое содержание СО2 в водах было связано с оки-
слением сульфидных руд на глубине и взаимодействием образующей-
ся H2SO4 с вмещающими известняками. В приповерхностной части раз-
ломов давление понижалось и карбонатное равновесие нарушалось-.
РЬ2+ + 2 НССК РЬСО3 + Н2О + СО2.
Произведение растворимости. Важной геохимической характе-
ристикой многих минералов служит произведение растворимости.
Рассмотрим снова равновесную систему: Са2+ + 2F_ CaF2. На ос-
новании закона действия масс можно написать (в скобках — актив-
ности):
[Ca2+i[F~i2
[CaF2] твердый 1
или
|Са2+] [F-]2 = К1 [CaF2] твердый
Но концентрация (активность) CaF2 как вещества, находящегося в
твердой фазе, постоянна, тогда:
|Са2+] [F-]2 = К
Произведение молярных концентраций (активностей) ионов мине-
рала в его насыщенном растворе — величина постоянная, именуемая
произведением растворимости — ПР. Оно постоянна для данной тем-
пературы и давления. Для CaF2 при температуре 25 °C ПР равно
10~9'8, т. е. ГСа2+] IF']2 = 10~9,s. Следовательно, как бы ни меня-
лось содержание ионов Са2+ и F" в растворе, насыщенном CaF2,
произведение молярной концентрации Са2+ на квадрат молярной кон-
центрации F~ будет при 25 °C постоянным (10"9’8). Если концентра-
ция Са2+ в воде составляет 10~2 моль/л (0,40 г/л), то концентрация
F~ 10~3’9 моль/л:
/1л-9,8
Когда содержание Са2+ уменьшается в четыре раза, концентрация
F- увеличивается в два раза и т. д.
Из правила произведения растворимости следует, что добавление к
раствору более растворимой соли, имеющей ион, одноименный с пер-
вой, понижает растворимость первой соли. Так, растворимость CaF2
понизится, если к его раствору прилить раствор CaSO4. Растворимость
104
англезита (PbSO4) в зоне окисления сульфидных месторождений осо-
бенно низка в связи с изобилием сульфатов (CuSO4, ZnSO4 и др.).
Последние как бы предохраняют англезит от растворения. После вы-
щелачивания других сульфатов растворимость англезита повышается.
Правилом ПР можно пользоваться при растворимости минерала в
воде менее 0,01 моль/л (ориентировочное менее 1 г/л). К хорошо раст-
воримым веществам оно не применимо, однако большинство минералов
обладает меньшей растворимостью, что и определяет значение этого
правила в геохимии. Ниже приведены произведения растворимости не-
которых химических соединений (при 25 °C):
Сульфиды
Bi2S3 —1,6-10-7«
HgS — 4-10-58
CuS —8-10-37
Cu2S —2,5-10-S0
Ag2S —bio-si
PbS — 1 10-2»
Sb2S3— 4-10-2»
Sb2S5-MO-3»
NiS* — l,-10-2i
CdS —МО’2»
CoS* —2-10-27
FeS* — 4-IO"1»
MnS* телесный-
1,4-10-15
Сульфаты
BaSO4 -1,1-10-1° SrSO4 —2,8-10-7
PbSO4 — 2.10-8 Ag2SO4 —7,7-IO-5
Hg2SO4 — 5-IO-7 CaSO4—6,1-IO”5
Карбонаты
Hg2CO3 —9-10-17
PbCO3 -1,5-10’13
CdCO3 -2,5-10-4
Ag2CO3-6,2-10-i2
CoCO3 — 1-10-12
ZnCO3 -6-10-и
FeCO3 -2,5-10-u
MnCO3 —1-10-1°
CuCO3— 1,4-10'1°
SrCO3— 1-10-»
CaCO3—4,8-10-»
BaCO3—8,0-10-»
NiCO3—1,4-10-7
MgCO3 '— 1 • IO-5
Li2CO3— 1,7- IO-3
Фосфаты, арсенаты
Pb3(PO4)2-8,2-10-13
Zn3(PO4)2-9,l IO"33
Ca3(PO4)2 —3,5-10-33
Ba3(PO4)2—1,3-10-2»
Ag3(PO4)2-1,3-10-2°
FePO4 —1,3 10-22
PbHPO4 -1-10-u
FeHPO4 —4-10-1°
CaHPO4 -5-10-°
A1PO4 -1-10-°
Ag3AsO4 -1-10-22
* При 18—20 °C.
Зная содержание в растворе одних ионов, с помощью ПР можно
ориентировочно определить концентрацию других. Конечно, данный
расчет условен, так как природные воды содержат разные анионы и ка-
тионы, в том числе комплексные, и в разных количествах, температу-
ра их непостоянна и т. д. Но и такие вычисления полезны при анализе
геохимических данных. Например, из расчетов ПР следует, что из при-
родных вод, содержащих около 1 г/л SOI-, многие металлы при их со-
держании 1-10-*—1-10~5г/л осаждаться не будут. Для осажде-
105
ния сульфатов необходимо, чтобы содержание иона Ag+ составляло
3,2 г/л; РЬ2+ — 2,7-10—4 г/л; Sr2+ — 6,6-10-3 г/л и т. д. Поэтому из
поверхностных и грунтовых вод с фоновыми содержаниями Си, Ni,
Со сульфат-ион (SO2-) не будет осаждать эти металлы, а сульфид-ион
(S2-) будет. Только в зоне окисления свинцовых месторождений,
где в воде повышается концентрация РЬ2+, может образоваться англе-
зит (PbSO4), a PbS может возникнуть почти везде, где имеется ион S2-.
Подтверждением этому служат находки галенита и сфалерита в уголь-
ных залежах, в которых трудно предположить высокие концентрации
РЬ2+ и Zn2+ в питающих водах. Отметим в этой связи, что многие чер-
ные морские глины обогащены сульфидами металлов, а сульфаты в
них отсутствуют. Расчеты показывают, что грунтовые воды, содержа-
щие 1-10~6 г/л иона РО3~, будут осаждать РЬ2+ и не будут осаждать
Zn2+ при содержании этих ионов 1-10-6 г/л.
Для точных расчетов необходимо знать реальные формы нахожде-
ния элементов в природных водах. В противном случае возможно не-
соответствие теоретических выводов природным данным.
Физико-химическое моделирование на ЭВМ. Новые возможности
применения химической термодинамики в геохимии появились на ос-
нове использования вычислительной математики и оптимального про-
граммирования. Метод минимизации свободной энергии Гиббса, разра-
ботанный в физической химии в конце 50-х годов, позволил с помощью
ЭВМ рассчитывать состав равновесных систем, включающих большое
число минеральных фаз. На этой основе могут изучаться и необрати-
мые процессы минералообразования. И. К. Карпов полагает, что изу-
чение моделей минералообразования на количественной термодина-
мической основе с помощью ЭВМ — ведущая тенденция развития фи-
зико-химического направления в геохимии, позволяющая решать такие
задачи, которые ранее были совершенно недоступны. С этой целью в
СССР были созданы программные комплексы (например, программа
«Селектор»), Отмечается простота и наглядность получения таким пу-
тем фундаментальных термодинамических соотношений в самых раз-
личных физико-химических моделях.
И. К. Карпов, С. А. Кашик и другие рассмотрели формирование ин-
фильтрационной зональности в коре выветривания, причем число фаз
при расчетах превышало 20, а число зависимых компонентов — 100.
Рассматривалось взаимодействие чистой дождевой воды с породами,
влияние парциального давления СО2, окислительно-восстановитель-
ного потенциала и других параметров на формирование зональности.
Были получены результаты, количественно объясняющие некоторые
важные особенности профиля выветривания.
В. А. Копейкин по программе «Селектор» выполнил физико-хими-
ческое моделирование выветривания и бокситообразования. В одной
из работ рассматривалась система, состоящая из 16 независимых пере-
менных (К, Na, К, Mg и т.д.) и 144 зависимых компонентов (NaCCTJ,
NOJT, NH4+ и др.). Используя значения свободных энергий соединений
и моделируя выветривание сиенита, автор получил латеритный про-
106
филь, в нижней части которого установил восстановительный геохими-
ческий барьер. А. А. Дроздовская моделировала на ЭВМ процессы эво-
люции состава атмосферы, океана, химического осадкообразования, на-
чиная с докембрия. При изучении эволюции атмосферы, например, бы-
ли учтены 13 химических элементов (независимые компоненты) и 63
растворенных форм этих элементов, 10 газов, 46 — твердых веществ
(зависимые компоненты). Р. П. Рафальский применил аналогичную
методику при изучении уранового гидротермального минералообразо-
вания.
Преимущество данного метода состоит в возможности анализа очень
сложных систем, включающих огромное число компонентов, что было
недоступно ранее. Большое значение имеет и быстрота расчетов. Вмес-
те с тем нельзя не отметить и ограничений данного метода, в том числе
и в тех случаях, в которых он уже нашел применение. Так, при изуче-
нии гипергенных систем фактически игнорируется роль разнообраз-
ных органических соединений, образующих сложные растворимые ком-
плексы со многими элементами. Не учитывается и роль микроорганиз-
мов, хотя и органические соединения, и бактерии в большинстве слу-
чаев определяют своеобразие процессов. Все это заставляет осторожно
относиться к выводам, получаемым на основе физико-химического мо-
делирования гипергенных процессов, на что обратил внимание и И.К.
Карпов. Более надежны такие методы при изучении магматических и
гидротермальных систем, а в области гипергенеза — солевых систем
(см. гл. 13).
Правило фаз. В 1876 г. У. Гиббс установил закон, согласно которо-
му в равновесной гетерогенной системе число термодинамических степе-
ней свободы (С) связано простой закономерностью с числом фаз (Ф)
и числом компонентов (А): С = К — Ф + п, где п — число внешних
факторов, влияющих на равновесие в данной системе (чаще всего —
температура и давление). При этом под термодинамической степенью
свободы понимается число условий (температура, давление, концентра-
ция}, которое можно менять произвольно (в известных пределах), не
изменяя числа или видов фаз системы.
В 1911 г. В. М. Гольдшмидт, изучая контактовый метаморфизм
глинистых сланцев и известняков в районе г. Осло, заметил, что про-
дукты метаморфизма — роговики включают не более четырех минера-
лов. С другой стороны, все породы состоят из четырех основных окси-
дов — SiO2, А12О3, MgO и СаО, которые ученый считал компонента-
ми. Степенями свободы являлись температура и давление. Отсюда сле-
довало, что для подобных систем число компонентов равно числу мине-
ралов (фаз), т.е. Фшах = К- Это простое выражение получило наиме-
нование минералогического правила фаз Гольдшмидта. В дальнейшем
выяснилось, что ему не подчиняется большинство минеральных пара-
генезисов метаморфических пород. Иначе говоря, использование пра-
вила фаз — закона физической химии — встречает затруднения в гео-
химии. Это относится, например, к понятию «компонент», которое для
природных систем не столь определенно, как для лабораторных усло-
107
внй. Отнесение к компонентам оксидов, как это делал Гольдшмидт, ча-
сто не правомерно.
Д. С. Коржинский сформулировал принцип дифференциальной под-
вижности компонентов, который, по мнению В. А. Жарикова, отража-
ет самые общие закономерности природных процессов и является од-
ним из главных н общих геохимических законов. Этот закон, по Жари-
кову, в корне изменил представления о геологических процессах. Сог-
ласно Коржинскому, компоненты в природных системах ведут себя
качественно неодинаково. Для инертных компонентов независимыми
являются экстенсивные параметры — масса, содержание в системе,
для вполне подвижных компонентов независимы интенсивные парамет-
ры — химические потенциалы компонентов, активности и т. д. Напри-
мер, при альбитизации ортоклаза инертными являются А1 и Si, а впол-
не подвижными — К и Na. При образовании известковых скарнов (на
контакте силикатов с известняками) инертными компонентами явля-
ются Са, Si, Al, а вполне подвижными — К, Na, Мп, Mg, Fe. Эти но-
вые понятия позволили Д. С. Коржинскому сформулировать правило
фаз для системе вполне подвижными компонентами. Имеются и другие
подходы к использованию правила фаз в геологии (В. А. Николаев
и др.). Многие положения в этой области являются предметом
дискуссии.
Стационарные процессы и термодинамическое равновесие. Для
многих систем термодинамическое равновесие не характерно. Это
особенно относится к земной поверхности с ее постоянным притоком
солнечной энергии. Резко неравновесны реки и озера таежной зоны,
тундры, влажных тропиков, воды которых всегда содержат сильные
восстановители — растворенное органическое вещество и сильный
окислитель — О2. Процессы здесь направлены к достижению равнове-
сия и О2 окисляет органические соединения, однако поступление новых
порций органических веществ из окружающих болот и О2 из атмосферы
делает систему устойчиво-неравновесной.
Равновесие нередко отсутствует и в земных глубинах, особенно в
тектонически активные эпохи на участках складчатых поясов, в обла-
стях вулканизма. Радиоактивный распад также препятствует термо-
динамическому равновесию. Все это не исключает устойчивости, неиз-
менности систем в течение геологического времени — многих миллио-
нов лет. Однако подобная устойчивость достигается не в.результате
термодинамического равновесия, при котором свободная энергия на-
ходится в минимуме, а потому, что система получает из окружающей
среды столько свободной энергии, сколько расходует. Подобные про-
цессы и системы именуются стационарными, их исследованием зани-
мается неравновесная термодинамика.
По Д. С. Коржинскому, система в целом может быть неравновесной,
и в ней могут протекать стационарные процессы, связанные с разли-
чиями в температурах, давлении, концентрациях. Но в каждой дан-
ной точке температура, давление и концентрация могут быть постоян-
ными. «Естественно, что в каждой точке должно в конце концов уста-
108
новиться химическое равновесие между сосуществующими фазами в
соответствии с условиями в этой точке. Локальное равновесие в каж-
дом отдельно взятом элементарном участке сохранится и в том случае,
если процесс не стационарен, но изменение параметров происходит
медленнее, чем устанавливается локальное равновесие. Таким обра-
зом, мы приходим к представлениям о возможности «мозаичного» или
«локального» равновесия в неравновесных системах», — писал уче-
ный. Следовательно, с термодинамических позиций, процессы физико-
химической миграции и соответствующие системы можно разделить на
четыре типа (по убыванию свободной энергии): 1) нестационарные
(неустойчивые), т.е. быстро меняющиеся; 2) стационарные (устойчи-
вые); 3) системы с «локальным» и «мозаичным» равновесием', 4) систе-
мы с истинным термодинамическим равновесием.
Принцип торможения химических реакций. Различия в кларках
определяют нестехиометричность большинства природных реакций.
Поэтому химические элементы (ионы, молекулы) в конкретных систе-
мах чаще всего находятся относительно других компонентов, способ-
ных вступать с ними в реакцию, или в избытке, или в дефиците. В слу-
чае избытка количество элемента достаточно для реализации всех воз-
можных реакций, после завершения которых остается часть реагента.
На земной поверхности, например, избыточен свободный кислород и
реакция окисления не лимитируется его содержанием. В поверхност-
ных и подземных водах избыточна вода, которая не лимитирует реак-
цию гидратации. В некоторых подземных водах избыточны H2S. СО,
SO|“ и т.д. В кислой магме избыточен SiO2, который при кристалли-
зации гранитоидов выделяется в форме кварца. Избыточны в основном
элементы с высокими кларками, способные давать газообразные и
растворимые соединения. Шире распространен дефицит элементов,
при котором их содержание в системе не обеспечивает реализацию всех
термодинамически возможных реакций. Дефицитны почти все редкие
элементы и многие распространенные. Например, свободный кислород
дефицитен в земных глубинах, поэтому там реализуются далеко не все
реакции окисления. В подземных водах местами дефицитны H2S, СО2
и другие реагенты, в ультраосновной и основной магме — SiO2, в
пустынях — Н2О. Именно дефицитом реагентов объясняется малое
число минералов и их редкость у элементов с низкими кларками.
Практически в любой природной системе наблюдается дефицит
реагентов и в них осуществляются далеко не все возможные по каче-
ственному составу реагентов реакции. Реализуются лишь те из них,
для которых характерно максимальное химическое сродство. В зоне
гипергенеза, где величина энтропийного фактора TAS мала, часто это
реакции с наибольшим тепловым эффектом.
В 1941 г. автор сформулировал принцип торможения химических
реакций: если в системе один из реагентов присутствует в количестве,
недостаточном для реализации всех возможных реакций, то осуществля-
ются лишь те реакции, для которых характерно максимальное хими-
ческое сродство. Эти реакции, расходуя «на себя» дефицитные реагенты.
109
препятствуют реализации других реакций — с меньшим сродством, а в
ряде случаев и меньшим тепловым эффектом.
Для труднорастворимых соединений химическое сродство часто
симбатно произведению растворимости, поэтому из всех возможных ре-
акций образования минералов в первую очередь протекают те, для ко-
торых характерна наименьшая величина ПР.
Дефицитные реагенты, как правило, поступают извне и общее их
количество может быть весьма значительным. Однако в каждый дан-
ный момент они дефицитны, что и обеспечивает действие принципа
торможения. Этот принцип давно применяется в лабораторной практике
при дробном осаждении. Например, если к раствору, содержащему
равные концентрации С1~ и I-, приливать по каплям AgNO3 (дефи-
цитный реагент), то сначала начнет осаждаться чистый Agl, так как
растворимость его ниже {ПР 1-Ю-16), чем у AgCl (1-Ю-10). Следова-
тельно, осаждение Agl будет «тормозить» осаждение AgCl (при от-
сутствии в растворе I- стал бы осаждаться AgCl). По мере расходова-
ния I- концентрация Ag+ в растворе будет расти, так как ПР Agl —
величина постоянная. Наконец, наступит такой момент, когда вместе
с Agl начнет осаждаться AgCl. Когда все ионы I- будут связаны в осад-
ке, начнется осаждение чистого AgCl.
В природе в условиях стационарного процесса израсходование ио-
нов может не произойти в связи с их постоянным поступлением извне,
например за счет притока новых порций подземных вод. Поэтому дина-
мическая обстановка здесь создает более благоприятные условия для
проявления принципа торможения, чем обстановка дробного осажде-
ния в лаборатории.
Дефицит реагентов определяет многие особенности физико-химиче-
ской миграции, ее отличие от лабораторных реакций. Некоторые пара-
генные ассоциации элементов в рудах, вероятно, связаны с действием
этого принципа.
Ограниченность термодинамического подхода к миграции. Несмот-
ря на большой вклад, который внесли термодинамические методы в
познание физико-химической миграции, их возможности, как и боль-
шинства методов, не универсальны. Например, значительная часть
реакций, особенно в зоне гипергенеза, относится к числу необратимых,
для которых нельзя рассчитать константу равновесия, изобарный по-
тенциал и другие функции равновесной термодинамики. Эта и ряд дру-
гих причин ограничивают возможности химической термодинамики при
решении части геохимических задач, заставляют обращаться к другим
разделам физической химии в частности к химической кинетике.
Кинетика и динамика физико-химической миграции
Химическая кинетика, изучающая механизм процессов, скорости
реакций, быстро внедряется в геохимию, в которой оформилось науч-
ное направление — кинетика и динамика геохимических процессов.
Состав вод, минералов во многих системах определяется не равновеси-
ем (или не только им), а главным образом кинетикой процессов.
ПО
Скорость химических реакций растет с температурой согласно фор-
муле
£
п кт
и = и0 • е ,
где и — скорость реакции, Т — абсолютная температура, и0 и Е —
постоянные параметры. В простых реакциях, имеющих одну стадию,
Е обозначает ту минимальную энергию (в расчете на 1 моль), которой
должны обладать реагирующие частицы, чтобы реакция началась.
В связи с этим Е называют энергией активации. В земной коре многие
термодинамически допустимые реакции не реализуются из-за того, что
не достигается энергия активации. Это одна из причин недостаточно-
сти термодинамического анализа, причин существования «термодина-
мически возможных», но реально не существующих процессов. Так. в
полярных районах нередко на поверхности встречаются невыветрелые
выходы сульфидных руд. В условиях кислородной атмосферы пирит и
другие сульфиды термодинамически неустойчивы, но они устойчивы
фактически, так как низкие температуры сильно замедляют окисление.
Конкретных данных о скоростях физико-химической миграции ма-
ло. В гипергенных системах в основном известен суммарный эффект
физико-химической и биогенной миграции. О скорости миграции дает
представление, например, показатель ионного стока Рн, равный годо-
вому стоку в т/км2 площади бассейна реки. Для Са в бассейне реки
Онеги этот показатель равен 9,47 т/км2, для Mg—3,77, Cl—1,50 т/км2
и т.д. По Г. А. Максимовичу, средняя химическая денудация поверхно-
сти суши (понижение земной поверхности за счет выноса растворенных
веществ с поверхностным и подземным стоком) составляет 12 мкм/
год, для СССР — 7 мкм/год. Очень медленна седиментация в централь-
ных частях океана, где местами за 1000 лет накапливается менее 3 мм
осадков (А. П. Лисицын). Близкие числа приводит Мак-Келви для се-
диментации морских нижнепалеозойских черных сланцев — 3—6 мм
за 1000 лет (но многие морские глины формируются в сотни раз быст-
рее — около 500 мм за 1000 лет). По подсчетам Е. Ф. Пошехонова, плас-
товые кислородные воды окисляли углеводородный ореол одной из неф-
тегазовых залежей со скоростью 1 мм/год, а все окисление заняло при-
мерно 40 млн. лет.
Научное направление — динамика геохимических процессов —
изучает физико-химические модели процессов и систем с учетом их
развития. Подобные модели строятся на основе закономерностей рав-
новесной и неравновесной термодинамики, химической кинетики. Боль-
шое значение имеет математический аппарат дифференциальных урав-
нений в частных производных. Наиболее детально исследованы кине-
тика и динамика метасоматоза и процессов образования ореолов рас-
сеяния рудных месторождений (литохимических, гидрогеохимиче-
ских).
В. С. Голубев охарактеризовал динамику основных геохимических
процессов. Много внимания уделяется динамике инфильтрационного
111
рудообразования, при котором металлы осаждаются на подвижном вос-
становительном геохимическом барьере. Проведены лабораторные
эксперименты, моделирующие этот процесс (Л. С. Евсеева), разработа-
на математическая модель (А. И. Германов, В. С. Голубев, Е. Ф. По-
шехонов, А. А. Ярошевский и др.).
Механизм массопереноса: диффузия и конвекция
Физико-химическая миграция осуществляется путем диффузии,
конвекции или их сочетаний (конвективная диффузия).
Диффузия — самопроизвольный и необратимый перенос вещества,
приводящий к установлению равновесных концентраций в результате
беспорядочного («теплового») движения атомов, ионов, молекул и кол-
лоидных частиц. Под влиянием градиента концентрации возникает мо-
лекулярная диффузия, вызывающая выравнивание концентраций.
Процесс ведет к уменьшению разнообразия, дифференциации и не тре-
бует затраты энергии извне, энтропия системы увеличивается. Но диф-
фузия возможна и при воздействии внешних факторов, создающих гра-
диенты температуры, давления, электрического потенциала (термодиф-
фузия, бародиффузия, электродиффузия). Скорость диффузии растет с
температурой.
Диффузия не имеет большого значения на земной поверхности, где
она развивается лишь в грунтах болот, илах (диагенез) и т. д. Ее роль
возрастает в земных глубинах, для которых более характерен длитель-
ный застойный режим (глубокие водоносные горизонты, поровые
воды осадочных пород, некоторые магматические и гидротермальные
системы). Диффузия зависит от тектонического режима: ее роль воз-
растает в спокойные эпохи, на щитах и платформах, при прогибании
и уменьшается в эпохи складчатости и тектонических поднятий.
Согласно закону Фика диффузионный поток 1Х пропорционален
градиенту концентрации dC/dx:
Ix = D~,
dx
где С — концентрация, х — расстояние. Коэффициент диффузии D мак-
симален в газах (п -10-1 см2/с), значительно меньше в водные раство-
рах и расплавах (п-10-5 — п-10-6 см2/с) и меньше всего —в твердых
телах (п-10-8 — п-10-50 см2/с).
Одни геохимики отрицают важную роль диффузии в миграции из-
за ее малой скорости, другие отводят диффузии большую роль. По
С. И. Смирнову, в осадочной оболочке происходит диффузионно-моле-
кулярное рассоление поровых вод, в связи с чем породы «обессолива-
ются». Молекулярно-диффузионные зоны мощностью в десятки метров
формируются за сотни и тысячи лет, причем не слишком мощные пла-
сты соли могут быть диффузионно растворены полностью. С диффузией
ученый связывает формирование высокоминерализованных подзем-
ных вод в глубоких частях артезианских бассейнов.
112
Диффузия протекает и в гидротермальных системах. Д. С. Коржин-
ский разработал, теорию диффузионного метасоматоза, который раз-
вивается в поровых растворах и распространяется на несколько мет-
ров. Так образуются первичные диффузионные ореолы гидротермаль-
ных месторождений.
Особенно мала скорость диффузии в кристаллах, где она часто рас-
пространяется лишь на микроскопические расстояния. Однако по жид-
ким включениям и тонким пленкам диффузия может сильно ускорять-
ся и в кристаллах. В последних диффузия нередко связана с дефекта-
ми кристаллической решетки, наличием в ней вакансий («пустых мест»).
Число вакансий растет с температурой и вблизи температуры плавле-
ния может достигать 1 % от общего числа атомов. Возможны и другие
причины диффузии в твердом теле (обмена соседних атомов, диффузия
атомов и ионов очень малых размеров через «междоузлия»). По Е. Г.
Куковскому, при образовании каолинита, гидрослюд и других слоис-
тых силикатов происходит «диффузионный дрейф» катионов из раствора
в твердую фазу и обратно. Н. В. Петровская установила диффузию Ag
в кристаллах самородного Au. Роль подобных реакций достаточно вели-
ка. Существенна роль диффузии и при распаде твердых растворов.
В целом диффузия в земной коре изучена недостаточно, ее истинное
значение, вероятно, больше, чем это обычно принято считать.
Конвекцией называется миграция массовых потоков газа или жид-
кости. В отличие от диффузии мигрируют не только растворенные
частицы (атомы, ионы, молекулы и т. д.). но и сам растворитель. Конвек-
ция характерна как для верхней мантии, так и для земной коры. В по-
ристой среде конвекция называется фильтрацией. Она значительно
быстрее диффузии и особенно характерна для верхней части земной
коры — зоны активного водообмена. Фильтрация развивается и в зем-
ных глубинах. Таково, например, «гелиевое и ртутное дыхание» пла-
неты, восходящая миграция гидротермальных растворов и многие
другие процессы.
Фильтрация усиливается в эпохи тектонической активности, склад-
чатости и горообразования. Она энергичнее в складчатых поясах и слаб
бее на платформах и щитах. Скорость фильтрации зависит от многих
факторов и сильно колеблется. Так, подрусловые потоки грунтовых
вод движутся со скоростью несколько сантиметров в секунду (кило-
метры в сутки). Максимальные скорости подземных вод артезианских
бассейнов в сотни раз меньше — п-10-2 см/с, а в глубоких горизон-
тах застойных вод они составляют лишь п-10-4см/с и менее. Все же
эти величины на порядок превышают скорость диффузии в жидких
средах.
При фильтрации воды взаимодействуют с вмещающими породами,
в которых развиваются явления выщелачивания, сорбции, ионного об-
мена, осаждения элементов на геохимических барьерах, в том числе
образование руд. Инфильтрационный метасоматоз распространяется
в горных породах на многие километры.
113
Радиоактивные процессы и ядерно-физические
методы исследования в геохимии
Выше освещена миграция, связанная с химическими свойствами
элементов, т. е. с электронным строением атомов. Радиоактивность -
результат превращений в атомных ядрах, которые не зависят от дав-
ления, температуры, окислительно-восстановительных, щелочно-кис-
лотных и прочих параметров миграции земной коры. Поэтому радиоак-
тивность протекает с неизменной скоростью, и эта ее особенность по-
зволила использовать радиоактивные элементы в качестве «геологи-
ческих часов» — для измерения абсолютного возраста пород и минера-
лов.
Важная геологическая и социальная роль радиоактивности выяви-
лась уже в начале XX в. Так, в 1910 г. В. И. Вернадский писал, что
изучение радиоактивности может могущественным образом отразить-
ся на общественной и государственной жизни, так как в явлениях ра-
диоактивности наблюдаются огромные эффекты ничтожных масс. Сово-
купность сведений о радиоактивных процессах в Земле должна состав-
лять, по Вернадскому, содержание особой науки — радиогеологии
В последние десятилетия оформилась ядерная геология, к которой от-
носят также изучение нерадиоактивных изотопов, ядерно-физические
методы поисков полезных ископаемых и другие вопросы. Предложено
и близкое понятие — «ядерная геофизика».
Для геохимии очень важны ядерно-физические методы определения
элементов, которые отличаются огромной чувствительностью. Один из
таких методов — нейтронно-активационный анализ. Его суть состоит
в облучении изучаемых образцов тепловыми нейтронами в ядерных
реакторах и определении искусственной радиоактивности, вызванной
образованием нестабильных изотопов. Высокая чувствительность мето-
да (10~6— КД11 % и более) позволяет использовать его для опреде-
ления многих редких и рассеянных элементов.
Ядерно-физические методы анализа расширили и перспективы гео-
химических поисков полезных ископаемых. Так, П. В. Комаров раз-
работал петрохимический метод поисков на основе определения петро-
генных элементов в шламе, порошковых пробах, при каротаже стенок
скважин; определяя SiO2, А12О3, СаО и MgO по их соотношению,
можно проводить петрохимическое расчленение геологических раз-
резов, выделять массивные рудные тела и зоны вкрапленности, решать
другие задачи поисковой геохимии.
Ядерная геология тесно связана с геохимией, граница между ними
не определена и практически многие проблемы ядерной геологии раз-
рабатываются в рамках геохимии.
Естественные радиоактивные элементы (ЕРЭ) в земной коре.
Из 17 известных долгоживущих радиоактивных изотопов наиболее ве-
лико геохимическое значение 238U, 235U, 232Th, 40К (рис. 29). Самый
распространенный в земной коре радиоактивный изотоп 87Rb. Его
кларк 4,16-10~3 %. Далее следуют 232Th (1,3-10“3 %), 40К (3-10~4 %)
114
ж
е(
О
а
Рис. 29. Естественные долгоживущие радиоактивные элементы (ЕРЭ) и ставили <ые продукты их распада-
лавные ЕРЭ литосферы, ' — стабильные продукты их распада .' — второстепенные ЕРЭ ли и ферм, 4 — стабильные ч|
их распада
и 238U (2,5-10-4 %). Кларки некоторых радиоактивных изотопов
ничтожны (123Те —1 • 10-9 %). За 4,6 млрд, лет (возраст Земли) коли-
чество радиоактивных изотопов сильно сократилось — 40К в 12 раз,
235U в 30 раз и т. д.
При радиоактивном распаде U и Th последовательно образуются
промежуточные продукты — различные радиоактивные изотопы, а
также конечные продукты — стабильные изотопы. В земной коре из-
вестно три «ряда распада», начальными членами которых являются
238U (ряд урана), 232Th (ряд тория) и 235U (ряд актиноурана). Конечны-
ми продуктами всех трех рядов являются нерадиоактивные изотопы
РЬ (206РЬ, 207РЬ, 208РЬ) и Не (4Не). Промежуточные продукты очень
разнообразны. Так, при распаде 238U образуются радиоактивные изото-
пы Ра, Th, Ra, Rn, At, Bi и т. д. Возможно, на Земле существовал ряд
нептуния, родоначальником которого служил 237Np с периодом полу-
распада 2,25-106 лет. Промежуточные радиоактивные члены этого ря-
да получены искусственно. Конечным членом является стабильный
изотоп Bi — 210Bi. Полагают, что значительная часть природного Bi—
продукт распада исчезнувшего Np.
Открытие трансуранов позволило предположить, что ряды урана и
актиноурана имели «вымерших родоначальников» с малым периодом
полураспада. Так, у 238U вымершим родоначальником был эйнштей-
ний — 254:
254Es 254Fm 25»Cf 246Ст А «2ри Л
Природный ядерный реактор (феномен Окло). В 1972 г. на урано-
вом месторождении Окло (Габон) были обнаружены руды с аномальным
отношением изотопов 235U и 238U. Некоторые образцы руды на 50 "о
были обеднены изотопом 235U, в то время как во всех других известных
урановых месторождениях мира отношение 235U: 238U стабильно. Это
удивительное открытие однозначно свидетельствовало, что около
2 млрд, лет назад на месторождении началась природная ядерная реак-
ция, которая продолжалась примерно 500 тыс. лет. В результате «выго-
рели» сотни килограммов 235U. Реакция протекала сравнительно
«спокойно» (без взрыва), периодически прерываясь и возобновляясь,
что было связано с испарением замедлителя нейтронов — воды (в ре-
зультате нагревания системы до 300—600 °C). В рудах Окло были об-
наружены и продукты цепной ядерной реакции — изотопы Хе, Nd, Sm и
Ru. По Ю. А. Шуколюкову, в результате работы реактора выделилось
столько же тепла, сколько за год дает мощная АЭС. Интересно, что
сама возможность существования подобного ядерного реактора на
урановых месторождениях была предсказана японским (позднее аме-
риканским) физиком П. Куродой еще в 1945 г. Но вплоть до 1972 г. все
исследования в этом направлении были безрезультатными, а открытие
феномена Окло — случайным. Сам феномен еще не полностью разга-
дан.
Вторичные радиоизотопы в атмосфере. В результате взаимодействия
космических лучей с атмосферой возникают нейтроны, которые участ
116
вуют в ядерных реакциях. Так, взаимодействие нейтронов с N приво-
дит к образованию ядер С и радиоактивного изотопа Н — трития
(3Н или Т):
«N + п ,2С + 3Н
Т претерпевает ^-распад и превращается в изотоп Не с массовым чис-
лом 3 (3Не). За 12,262 лет распадается половина атомов Т. Интенсив-
ность, его синтеза мала, и атомный кларк в атмосфере близок
4-Ю-15 %, в атмосферных осадках— 3-10-18 % (в сотни раз меньше
в глубинах океана). Казалось бы, при столь ничтожных кларках три-
тий не представляет какого-либо практического интереса. Однако, изу-
чая содержание Т в природных водах, можно установить скорость про-
никновения атмосферных осадков в земные недра, решать другие про-
блемы наук о Земле.
Под влиянием космических лучей N атмосферы превращается не
только в Т, но и в радиоактивный изотоп 14С. В этом случае в ядерной
реакции участвуют и нейтроны, и протоны. Содержание 14С в атмосфе-
ре больше, чем Т, но все-таки ничтожно — около 2-Ю-10 % (а нера-
диоактивного С. входящего в состав СО2, в 40 миллионов раз больше).
Под влиянием космических лучей в атмосфере протекают и другие ядер-
ные реакции с образованием радиобериллия (10 Be), радионатрия
(22Na), радиоалюминия (26А1). радиохлора (36С1) и других радиоак-
тивных изотопов.
Радиационно-химические явления. В результате радиоактивного
распада атомных ядер выделяется энергия, производящая химическую
работу. Происходит, например, разложение воды на Н и О — радио-
лиз. Его продуктами служат также Н2О2, гидроксоний (Н3О+), ОН-.
Так возникает резко неравновесная обстановка с сильными окислите-
лями и восстановителями. По И. Ф. Вовку, для образования заметных
количеств продуктов радиолиза в подземных водах необходимы сотни
тысяч и миллионы лет, а на участках месторождений радиоактивных
руд—сотни и тысячи лет. С действием О, выделяющегося при радиолизе,
связывают гематитизацию пород, окисление нефти. Выделяющийся
Н (особенно в атомарной форме) может быть мощным восстановителем.
Предполагают, что под влиянием радиации в подземных водах образу-
ются атомарные С1, Вг и I; растворенный в воде N дает нитриты, нитра-
ты, аммиак: в залежах калийных солей накапливается свободный водо-
род и т. д. Метан под воздействием a-излучения полимеризуется с об-
разованием сложных углеводородов. Бензол в результате радиолиза
превращается в фенол, в газовых залежах образуются СО2 и СО,
формальдегид, синильная кислота и другие соединения. По Вовку,
главным продуктом радиолитического расщепления органического ве-
щества в земных глубинах являются СО2 и СН4. По его расчетам таким
путем в палеозойских отложениях Днепровско-Донецкой впадины пре-
образовано 5 °о органических веществ.
Радиационно-химические явления изучены и во многих минералах.
В слюдах, роговых обманках, флюорите и других минералах а-части-
117
цы, продуцируемые микровключениями радиоактивных минералов,
приводят к образованию так называемых плеохроичных ореолов -
колец сплошного потемнения. Причина потемнения полностью не вы-
яснена. Предполагают, что радиолиз конституционной воды приводит к
окислению Fe2+, вероятны и другие реакции.
С радиационным воздействием (главным образом a-излучением U и
Th) связывает и частичную потерю минералами кристаллической струк-
туры — метамиктные изменения. Эти явления установлены в цирко-
нах, торите, браннерите и других радиоактивных минералах.
В природе при спонтанном делении ядер 238U образуются ядра
140Ва5в, 130Хе54 и других элементов, обладающие большой кинетической
энергией. Пути их следования в виде тонких каналов — треков при
травлении поверхности минерала различными реактивами видны под
микроскопом. Этот метод треков позволяет определять содержание U в
минералах, его пространственное распределение (Г. Н. Флеров, И. Г.
Берзина). При облучении минералов тепловыми нейтронами в ядер-
ном реакторе происходит индуцированное деление ядер 238U, осколки
которого также оставляют треки в самом минерале или же в специаль-
ном твердом детекторе, накладываемом на поверхность облученного ми-
нерала (пластинки слюды, стекла, лавсана и т. д.). Треки выявляются с
помощью микрорадиографии. Изучение треков, осколков, полученных
при индуцированном делении ядер, позволяет также определять Be
(чувствительность 2,6-10~12 г) и выявлять его пространственное рас-
пределение. Треки образуются также за счет космических лучей, они
обнаружены, например, в минералах метеоритов.
Абсолютная геохронология. В 1902 г. П. Кюри предложил исполь-
зовать радиоактивность для определения геологического возраста, а
в 1907 г. в Канаде В. Болтвуд уже установил возраст радиоактивных
минералов по содержанию в них урана и радиогенного свинца. Такой
уран-свинцовый метод показал, что возраст минералов более 1 млрд,
лет. Это резко контрастировало с представлениями о максимальном воз-
расте .геологических процессов около 100 млн. лет. Подобным же пу-
тем в 1926 г. ученик Вернадского К.А. Ненадкевич определил возраст
пегматитов Карелии — 1,6 млрд. лет. На основе данного метода опреде-
лен возраст Земли как планеты и лунных пород (около 4,6—4,7 млрд,
лет), возраст земной коры, многих месторождений и т.д. Особенно
большое значение приобрело определение U и РЬ в цирконах. Исполь-
зование микрозонда, масспектроскопии позволило, например, дока-
зать различия в возрасте ядра и периферии одного и того же зерна ми-
нерала (различия в сотни миллионов лет!), восстановить историю гео-
логического развития отдельных участков земной коры за целые геоло-
гические эры.
К.алий-аргоновый метод, разработанный в СССР Э. Герлингом, ос-
нован на определении в слюдах и других калийных минералах 40Аг—
продукта радиоактивного распада изотопа 40К. Рубидий-стронциевый
метод (87Rb-*87Sr) применяется для определения возраста наиболее
древних земных пород, метеоритов, лунных пород.
118
Самарий-неодимовый метод основан на том, что радиоагГде раз,
147Sm имеет огромный период полураспада — 1,06-1011 лет, бо.
в 2 раза превышающий возраст Солнечной системы. В результат,
пада этого изотопа образуется стабильный 143Nd. Замечательная елье?
бенность данного метода состоит в его независимости от последующ^,
процессов выветривания, осадкообразования, метаморфизма. Поэтох
метод особенно пригоден для датирования самых древних магматиче-
ских процессов, с его помощью были обнаружены породы древнее
4 млрд. лет.
Датирование по Ра и lo (230Th) позволило измерить скорость на-
копления океанических осадков. Например, выяснилось, что в железо-
марганцевых конкрециях Тихого и Индийского океанов за 1 млн.
лет нарастает слой всего в 3—7 мм.
Радиоуглеродный метод основан на использовании радиоактивного
изотопа 14С с периодом полураспада 5600 лет. При фотосинтезе он по-
падает в растения, а затем в гумус почв, торф, древесину. За 70 000 лет
,4С распадается полностью. Поэтому, определяя содержание 14С в
ископаемой древесине, в археологических памятниках, гумусе почв,
можно установить их возраст. Так было доказано, что еще 11 200 лет
назад ледник покрывал поверхность Эстонии, датированы другие со-
бытия четвертичного периода и человеческой истории.
Быстропротекающие современные процессы (десятки и менее лет)
датируются по радиоактивным изотопам 210РЬ, 7Ве и др. (скорость рос-
та озерных осадков, снежного покрова в Антарктиде и др.). Меньшее
значение имеют пока кальциевый, рениево-осмиевый и другие методы
определения абсолютного возраста.
По Ю. А. Шуколюкову, изотопная геохронология достигла высоко-
го совершенства, а масспектрометры позволяют определять изотоп-
ный состав из навесок до 10~9 г с погрешностью ±0,002 %. Ныне ус-
танавливают не только возраст пород, но и зерен минералов размером
в 0, п мм. Даже для глубокого докембрия (2—3 млрд, лет назад) точ-
ность измерения достигла 2 млн. лет — ±0,1 %.
В результате геохронологических исследований разработана аб-
солютная шкала геологического времени, стали определять возраст
рудных жил и вмещающих пород, сравнивать по абсолютному возрасту
массивы изверженных пород, сопоставлять возраст складчатости раз-
ных районов, расчленять немые толщи докембрия, решать другие за-
дачи.
Хотя абсолютная геохронология основана на твердо установлен-
ных физических законах, все же получаемые данные часто нуждаются
в дополнительной проверке и обосновании. Это связано с выносом ис-
ходных элементов (например, 239U), поступлением извне продуктов ра-
диоактивного распада (например, 40Аг) и другими причинами. Особенно
важно сопоставлять результаты абсолютного датирования с геологиче-
скими данными.
Радиоактивность и энергетика Земли. При полном распаде 1 г Ra
выделяется столько же тепла, как и при сгорании 500 кг угля. На
119
этом основании возникла гипотеза о важной роли радиогенного тепла
в энергетике земной коры. В начале XX в. Р. Стретт, Д. Джоли.
В. И. Вернадский и другие ученые предположили, что радиогенное теп-
ло является главным источником тепловой энергии земных глубин, и
тем самым отвергли представления об остаточном тепле ранее раска-
ленной планеты. Эти идеи были глубоко прогрессивными и позволили
в основу расчета теплового режима планеты положить реальные дан-
ные об энергии, выделяющейся при радиоактивном распаде. Оформи-
лось особое научное направление — «ядерная геотермика».
Основным источником радиогенного тепла служат 235U, 238U, 40К,
232Th. Зная содержание этих изотопов в горных породах, можно под-
считать интенсивность теплового потока из гранитного и базальтово-
го слоев, из мантии. Однако все попытки объяснить глубинное тепло
Земли исключительно на этой основе не дали положительных резуль-
татов. Имеются и другие источники тепловой энергии, как, например,
гравитационная дифференциация вещества, фазовые переходы мине-
ралов и т.д. Точный количественный учет их пока невозможен. Име-
ются предположения и о важной роли солнечной энергии в глубинных
процессах. Следовательно, радиогенное тепло является хотя и важным,
но не единственным источником внутренней энергии Земли (об этом, на-
пример, свидетельствует близость теплового потока на континентах и на
дне океанов, где отсутствует гранитный слой, обогащенный U и Th).
Радиогеохимический метод поисков рудных месторождений. Совре-
менные методы регистрации у-излучения позволяют выделить радиевую
ториевую и калиевую составляющую. Установленные на самолетах
и вертолетах датчики регистрируют содержание в горных породах
U (по Ra), Th и К. Аэрогаммаспектрометрия позволила эффективно опо-
исковывать огромные территории, открывать урановые месторождения
(по Ra). Большое индикаторное значение приобрело выделение пород
с ториевой и калиевой радиохимической специализацией, а также опре-
деление отношения Th/K, так как с каждой из этих характеристик свя-
зан определенный тип рудных месторождений. Например, околоруд-
ные зоны, обогащенные К, характерны для некоторых типов гидротер-
мальных месторождений Au, Ag, Мо, бескалиевые зоны — для руд
Be, Nb, Sn, TR. Для последних зон характерны аномалии Th и низкое
значение K/Th отношения. Аэрогеохимическая съемка приобрела важ-
ное поисковое значение, она также позволила с помощью ЭВМ состав-
лять карты прогноза полезных ископаемых.
Контрольные вопросы
1. Значение ионной концепции в геохимии, физико-химические и геохими-
ческие параметры ионов.
2. Значение проблемы изоморфизма в геохимии.
3. Геоэнергетическая теория Ферсмана.
4. Какие новые геохимические явления открыло изучение электронно-ды-
рочных центров в минералах?
5. Почему ионная концепция недостаточна для характеристики миграции
элементов в растворах и расплавах?
120
6. Назовите окислительно-восстановительные обстановки Земли. Где раз-
виты наиболее окислительные и наиболее восстановительные обстановки?
7. В чем значение химической термодинамики для геохимии?
8. Какие ошибки допускаются при применении принципа Ле Шателье?
9. Значение правила произведения растворимости для геохимии.
10. Какова роль трудов Д. С. Коржинского и его школы в изучении фи-
зико-химической миграции?
11. В чем состоит «принцип торможения химических реакций», как он ис-
пользуется в химии, его значение для геохимии?
12. Каковы механизмы массопереноса в земной коре?
13. Чем принципиально отличаются радиоактивные процессы от других
процессов физико-химической миграции?
14. Охарактеризуйте «феномен Окло».
8. МИГРАЦИЯ ГАЗОВ
Общие особенности миграции газов
Первоисточником атмосферы является дегазация мантии, которая
осуществляется и в современную эпоху. Данные изотопной геохимии
говорят о существовании гелиевого, аргонового, неонового и ксеноно-
вого «дыхания» мантии. Онако первичная атмосфера нашей планеты
не сохранилась — она была изменена различными процессами, проте-
кавшими в земной коре, сыграла роль и диссипация газов в космос
(особенно Н и Не).
Газы составляют лишь 0,0 п % массы земной коры и 0, л % гид-
росферы. Однако геохимическая роль газов не пропорциональна их
массе: решающее значение имеет высокая подвижность газов, которые
мигрируют интенсивнее, чем вещество в твердом и жидком состояниях.
В биосфере газы образуют преимущественно элементы правой час-
ти периодической системы, т. е. типичные неметаллы. В гидротермаль-
ных и магматических системах в газообразной форме мигрируют также
Si, Sn, Pb, Ge, щелочные металлы и другие элементы (рис. 30).
Роль газов в земной коре зависит от кларков и химической актив-
ности элементов. Активные элементы с высокими кларками образуют
ведущие газы — в первую очередь О2, СО2, водяной пар Н2О, H2S,
СН4 и Н2. Растворяясь в водах, они определяют условия миграции
многих элементов, становятся «геохимическими диктаторами». Поэто-
му по составу ведущих газов именуются важнейшие геохимические об-
становки в водах — окислительная, сероводородная и т.д. Большин-
ство газов в силу химической инертности (N2, Аг) или низкого содер-
жания (I2, H2Se и т.д.) не относятся к ведущим.
В. В. Белоусов в земной коре выделил газы воздушного, биохими-
ческого, химического и радиоактивного происхождения. Разработана
геохимическая классификация газов и для зоны гипергенеза
(А. И. Перельман)1:
1 Полужирным выделены ведущие газы.
121
ж в S в о л
> If в я ill in * !_
> в о S о Рч и
> в я
> н—а в СЛ Вй в
И ww
—< о / / z/. */Ь0Х
’ ьо КЙ
> 00 еч Z тз Рн 00 W Рн
й о О •О . Pi h>4
И = 2 м о
> 25 Мп tn * «> Г- ф Pi
> 04 О I'M ||р|
> “ ей р.
> J******* N еч д о “ X
и—• а еч Q СЮ 0> eo > 57-71 TR 0> “ U <
= S Ф •* Св О 00 « С/Э ° се рр 00 - Св Pi
I S 1и » 5 »- Ь
— CN № г>
Рис. 30. Химические элементы, для которых в земной коре характерны газообразные соединения:
j глубоких частях земной коры (гидротермальных, метаморфических и магматических системах), 2 — во всех системах зем-
ной коры (биосфере, гидротермальных, метаморфических и магматических системах)
А. Активные газы
I. Неорганические газы.
Окислители (некоторые влияют и на щелочно-кислотные условия);
02, О3, NO2, 12, Н2О2, NO.
Восстановители (некоторые влияют и на щелочно-кислотные усло-
вия): H2S, Н2, H2Se, NH3, N2, N2O, CO, Hg.
Полярные газы, влияющие преимущественно на щелочно-кислот-
ные условия среды (некоторые влияют и на окислительно-восстанови-
тельные условия): С02, Н2О, НО, HF, SO2, SO3.
II. Органические газы:
Углеводороды и их производные: СН4, С2Н6, С4Н10, С2Н4 и другие ор-
ганические соединения (в том числе элементорганические).
Б. Пассивные газы (инертные): Аг, Не, Ne, Кг, Хе, Rn.
Для магматических и гидротермальных систем необходима особая
классификация, так как при высоких температурах увеличивается
число газообразных соединений, СО2, Н2О являются окислителями и
т. д.
Образование газов. Автор выделил три основные группы процессов
образования газов: физико-химические, биогенные и техногенные.
Физико-химические процессы включают огромное число реакций
образования СО2, водяного пара, H2S и других газов. Эти процессы
господствуют в глубоких частях земной коры, но широко распростране-
ны и в биосфере. К данной группе относятся и радиоактивный распад,
генерирующий Аг, Не, Rn, радиолиз воды, а также ядерные реакции
в атмосфере, связанные с действием космических лучей и приводящие к
образованию 14С, 3Н и других радиоактивных изотопов.
Биогенные процессы характерны только для биосферы, где почти
весь О2, СО2, N2, H2S, СН4 и многие другие газы биогенны. С техноген-
ными процессами связано образование СО2 при сжигании горючих ис-
копаемых и другие явления.
Миграция газов в земной коре. Она осуществляется путем фильтра-
ции и диффузии. Основное значение имеет фильтрация, скорссть ко-
торой определяется проницаемостью пород и изменяется в сотни ты-
сяч раз. Огромное влияние оказывает трещиноватость, особенно текто-
нические нарушения, которые резко увеличивают фильтрацию. Ско-
рость диффузии газов через воду составляет 0,6 см3/м2 в сутки, а через
насыщенные водой горные породы 0,01—0,1 см3/м2. В земной коре наб-
людаются диффузия одного газа в другом, диффузия газов в воде или
нефти, диффузия газов в породах. В первом случае коэффициент диф-
фузии D колеблется от 0,08 до 0,23 см2/с (максимум для водорода в ге-
лии — 0,7). В воде D колеблется от 1,3 до 2,2-10-5 см2/с, т. е. диф)-
фузия резко замедляется. Диффузия через породы в 10—100 раз мед-
леннее, чем в воде; D понижается до 10~9 см2/с.
За геологическое время, по мнению некоторых исследователей, газы
могли диффундировать на многие километры.
123
Надземная атмосфера
Надземная атмосфера простирается на расстояние свыше 1000 км.
ее масса составляет сотые доли процента от массы земной коры. По-
стоянный приток солнечной энергии определяет исключительную ди-
намичность и неравновесность атмосферы. По термодинамическим ус-
ловиям она расчленяется на ряд оболочек: тропосферу, стратосферу,
мезосферу, ионосферу (термосферу) и метасферу (экзосферу). Около
80% газов сосредоточено в тропосфере, которая на экваторе простира-
ется до 16, а над полюсами до 8 км. На уровне моря сухой воздух (за
вычетом паров воды) содержит 78,09% N и 20,95 объемных процента
О, т, е. атмосфера имеет азотно-кислородный состав, и этим она прин-
ципиально отличается от атмосфер других планет. Третий главный
компонент тропосферы — Аг (0,93 %). В тропосфере также содержит-
ся водяной пар (0,021—4 %), СО2 (0,03 %). Значительно меньше окси-
дов N, NH3, О3, Н2, СН4, Не, Ne, Кг, Хе, Rn, Hg и т. д. Так, содер-
жание Ne равно 1 10~3, СН4 — 2- 10-3, Не — 5,2-10"4, Н2 — 5-10’5,
Rn—10~21 объемных процента. Для тропосферы характерны также
частицы коллоидных размеров (аэрозоли), живые организмы.
В формировании приземного слоя воздуха большую роль играют
почва и растительный покров. Микроорганизмы почвы, растения и
животные выделяют в приземную и почвенную атмосферу помимо СО2,
Н2О, N2, О2 (только растения), также разнообразные летучие органи-
ческие соединения, среди которых установлены как метан, этилен и
другие простые по составу, так и весьма сложные, вплоть до элемент-
органических соединений. Летучие органические соединения — фитон-
циды создают характерный аромат лесов, лугов, степей и других ланд-
шафтов. Многие фитонциды полезны для здоровья, некоторые — вред-
ны. Это первая линия обороны растений против болезнетворных микро-
организмов, насекомых, животных.
Американские геохимики в летучих выделениях хвойных деревьев
установили 25 элементов: Li, Be, В, Na, Mg, Ti, V, Cr, Mn, Fe, Со, Ni,
Си, Zn, As, Sr, Zr, Mo, Ag, Pb, Bi, Cd, Sn, Sb, Ba. Определение метал-
лов в составе органических паров атмосферы предложено использо-
вать для поисков рудных месторождений. Таким путем были открыты
руды Си, Pb, Zn, Ag, редких металлов (в том числе и слепые рудные
тела). По Л. Г. Бондареву, масштабы фитогенного выноса минеральных
веществ того же порядка, что вулканизм и сжигание минерального
топлива (рис. 31).
На состав атмосферы существенное влияние оказывает вулканизм,
поставляющий Н2О и СО2, а также Н2, СО, N2, SO2, Cl2, H2S, НС1,
В (ОН)3, NH3, СН4 и другие газы. В течение года действующие вулка-
ны выделяют в атмосферу миллионы тонн HF и НС1. В вулканических
районах идут «кислые дожди» с pH 2,4—2,5 и минерализацией до 250
мг/л.
Радиоактивные излучения, космические лучи и другие факторы ча-
стично ионизируют тропосферу, приводят к образованию положитель-
124
но и отрицательно заряженных частиц (групп молекул) размером око-
ло 10-7 см. Это так называемые легкие аэро ионы. Взвешенные частицы
воды и пыли размером около 10-5 см также несут электрические заря-
ды — это тяжелые аэроионы. Их обычно значительно больше, чем лег-
ких ионов (n-102 — п-105 в 1 см3 против п-10 — п-103 легких ионов).
Легкие, отрицательно заряженные ионы полезны для здоровья чело-
века. Этим частично объясняется благотворность пребывания на мор-
ском берегу, у водопадов, фонтанов, на берегах бурных горных рек,
Рис. 31. Вынос минеральных веществ в атмосферу в сравнении с некоторыми
другими потоками веществ (млрд. т). Растительность поставляет в атмосфе-
ру около 1 млрд, т минеральных веществ в год (по Л. Г. Бондареву)
где образуется много таких аэроионов. Высокое содержание положи-
тельно заряженных легких ионов для здоровья вредно.
Происхождение состава современной атмосферы в основном обяза-
но биогенной миграции (см. часть IV). Тропосфера — биокосная сис-
тема, однако ведущую роль в ней играют физико-химические и механи-
ческие процессы, особенно круговорот воды и движение воздушных
масс.
В стратосфере сосредоточено около 20 % массы атмосферы, а в
более высоких слоях не более 0,5 %. Плотность верхних слоев атмос-
феры крайне мала и на высоте 250 км составляет лишь 4-10-13 г/см3.
Частицы здесь движутся с большой скоростью и температура среды
местами превышает 100 °C (250° на высоте 180 км).
В стратосфере и мезосфере в результате фотохимических реакций
образуется озон: О2 + О-> О3. Его общая масса невелика и при нор-
125
мальном давлении (10s Па) составила бы слой мощностью лишь 1,7—
4,0 мм. Но и такое количество задерживает губительную коротко-
волновую радиацию Солнца. Поэтому жизнь на земной поверхности
могла развиться только после образования озонового экрана (в нача-
ле PZ?).
В последние годы установлено уменьшение концентрации озона
над Антарктидой, охватывающее грандиозную площадь — миллионы
квадратных километров. Менее выражено данное явление в Арктике.
Происхождение «озонной дыры» неясно: имеющиеся гипотезы отводят
ведущую роль фреонам (хлористым соединениям, входящим в состав
антропогенных аэрозолей), вулканизму, изменению солнечной актив-
ности. изменению атмосферной циркуляции.
В верхних слоях атмосферы под влиянием электромагнитного (осо-
бенно рентгеновского) и корпускулярного излучения Солнца происхо-
дит диссоциация газов с образованием свободных атомов. Так, выше
150 км преобладает свободный О, выше 300 км полностью диссоцииро-
ван N. На высотах 100—400 км газы ионизируются, этот слой получил
наименование ионосферы. Здесь протекают и различные ядерные реак-
ции, в том числе образование 3Н и 14С. На больших высотах обнаружен
также Na. Самые высокие слои атмосферы состоят из Н и Не, которые
медленно улетучиваются (диссипируют) в космос. Крайне разрежен-
ные ионизированные газы установлены еще на высоте 20 тыс. км.
Газы подземной атмосферы и гидросферы
В осадочных породах, по В. А. Соколову, содержится 2,14-1014 т
газов, среди которых преобладает СН4 (39 %). Далее следуют
СО2(27,4), N2 (26), тяжелые углеводороды (6,4), Н2 (0,2 % ) и H2S+
+SO2 (0,3 %). В магматических породах гранитного слоя заключено
1-1015т газов, главным образом СО2 (83,8%). На втором месте стоит
N2 (11 %), далее идут Н2 (3 %), H2S + SO2 (2%) и СН4 (0,2 %).
Растворимость газов в воде и нефти, газовые растворы. Большинст-
во газов в стандартных условиях плохо растворяется в воде и только
полярные газы — СО2, H2S, NH3, НС1, HF — растворяются хорошо
(сотни, тысячи, десятки тысяч и более см3/л).
С увеличением температуры растворимость большинства газов пони-
жается, с увеличением давления — растет. Влияние давления сущест-
веннее, поэтому на глубине 2—3 км воды содержат значительно боль-
ше газов, чем на земной поверхности. Так, в водах океанов и морей
лишь около 13 см3/л N2 и 3 см3/л О2. В подземных водах на глубине
1—4 км в среднем содержится 500 см3/л газов, но в Волго-Уральской
области, Предкавказье, Западной Сибири, по А. А. Карцеву, — до
1000—1500 см3/л газов (главным образом СН4).
Углеводороды лучше растворяются в нефти, чем в воде, и мигра-
ция газов с нефтью имеет важное геохимическое значение: в местах
повышения давления углеводороды растворяются в нефти, а в местах
понижения выделяются из нее. Однако в связи с большим масштабом
126
водной миграции с подземными водами мигрирует значительно боль-
ше углеводородов, чем с нефтью.
Глубинное бурение на нефть н газ в СССР расширило представле-
ния о газах подземной гидросферы. Обширная информация получена в
С.П1А и других странах. Выяснилось, что в подземных водах протекают
сложные экзогенные процессы формирования залежей газа и нефти. Ус-
тановлена также большая роль и эндогенных источников газов, в част-
ности СО2 (в районах современного или былого вулканизма и др.).
В ряде стран обнаружены промышленные залежи СО2 глубинного про-
исхождения. Подземная гидросфера часто является как бы гигантским
геохимическим барьером для газов. Местами на платформах глубокие
подземные воды предельно насыщены газами, струйная миграция кото-
рых приводит к их накоплению в ловушках. Много внимания привле-
кают АВПД — аномально высокие пластовые давления в подземных
водах, которые замедляют дегазацию земной коры. Растворенные га-
зы содержатся и в глубинных рассолах кристаллического фундамента
платформ (преобладают углеводороды, относительно высоко и содер-
жание Не).
По В. Н. Корценштейну, масса газов, растворенная в гравитацион-
ных водах подземной гидросферы, вполне достаточна для формирова-
ния промышленных газовых залежей, которые генетически связаны с
крупными водонапорными системами. Но одной газонасыщенности
подземных вод недостаточно — необходимы еще ловушки для газов
(например, неогеновые артезианские бассейны Японии богаты раство-
ренными газами, но отсутствие ловушек мешало формированию про-
мышленных залежей).
Выделение глубинных газов иногда приводит к катастрофическим
последствиям. Так, в 1986 г. на берегах озера Ниос (Камерун) погибло
более 1700 человек в результате выброса со дна озера удушливых га-
зов (в основном СО,). Придонные слои воды и после катастрофы были
насыщены СО2 (30%). Происхождение СО2 связывают с магматиче-
скими процессами.
При растворении в газах жидких и твердых веществ, а также и га-
зов образуются газовые растворы. Особенно значительно их образова-
ние при высоких давлениях, когда плотность газов сравнима с плотно-
стью жидкости. В сжатых газах механизм растворения принципиаль-
но не отличается от растворения в жидкости, здесь также имеет место
взаимодействие с молекулами растворителя. При давлениях и темпе-
ратурах, превышающих критические, водяной пар растворяет значи-
тельные количества солей, в том числе соединений Zn, W, Си, Мо и
других рудных элементов.
На больших глубинах в углеводородных газах растворяется мно-
го нефти, возникают газоконденсатные залежи. При миграции такого
газа к поверхности в результате понижения давления из него выделя-
ются жидкие углеводороды.
Сорбированные и окклюдированные газы. Газы, содержащиеся в
закрытых порах и кристаллической решетке минералов, называются
127
окклюдированными. Их извлекают с помощью тонкого измельчения по-
род и вакуумной откачки. Все горные породы содержат и сорбирован-
ный газ, количество которого в 1 кг осадочных пород обычно колеб-
лется от десятых долей до нескольких кубических сантиметров (глав-
ным образом СО2, N2, СН4).Сорбция зависит от природы сорбента, дав-
ления и температуры. Максимальной сорбционной емкостью облада-
ют каменные угли — при нормальном давлении до п-103 см3/кг, а при
давлении 5-10е Па на порядок выше.
Другие осадочные породы сорбируют не
более 600 см3/кг, причем глины сорби-
руют больше, чем пески и известняки.
Органическое вещество увеличивает
сорбционную емкость осадочных пород.
У изверженных и метаморфических по-
род сорбционная емкость меньше, чем
у осадочных.
Сорбция газов растет с их молеку-
лярной массой: у С3Н8 она, например,
в 10 раз больше, чем у СН4. С увеличе-
нием давления сорбция растет в соот-
ветствии с уравнением изотермы адсорб-
ции Лангмюра:
Х/т = (а-Ь-Р)/(\ + Ь-Р),
Интенсивность
нефтегазообразования
Рис. 32. Общая схема верти-
кальной зональности образова-
ния углеводородов в осадочных
породах (по В. А. Соколову)
где X — валовое количество газа, сор-
бированное т граммами горной породы,
Р — давление газа, а и b — кон-
станты.
С ростом температуры сорбция уменьшается, однако влияние дав-
ления существеннее и в глубоких зонах интенсивность сорбции увели-
чивается.
Миграция газов в различные геологические эпохи. В эпохи проги-
бания осадочных толщ в геосинклинальных зонах, передовых про-
гибах, синеклизах платформ в связи с ростом давления свободные га-
1Ы растворялись в воде и нефти. В подземных водах возрастала роль
диффузии и уменьшалась роль фильтрации. Органические вещества
осадочных пород, погружаясь на глубины 3—7 км, подвергались воз-
действию сильного давления и высокой температуры (до 250 °C).
В этих условиях развивались термокаталитические процессы, генери-
ровавшие жидкие и газообразные углеводороды (рис. 32). По мнению
некоторых авторов, образование углеводородов начиналось уже при
диагенезе осадков. В дальнейшем углеводороды мигрировали и накап-
тивались в антиклиналях и других структурных ловушках, образуя
залежи газа и нефти. Развивается и альтернативная «неорганическая
теория» генезиса нефти (см. с. 254—255).
128
В эпохи поднятий, особенно в складчатых областях, с ростом тре-
щиноватости, тектоническими подвижками, с формированием и под-
новлением разломов резко возрастало значение фильтрации газов. При
поднятиях в связи с уменьшением давления усиливалось выделение
свободного газа из подземных вод и нефти, а также выделение жидких
и твердых веществ из газовых растворов. С рифтогенезом связана миг-
рация глубинных газов к земной поверхности. Эпохи горообразования,
вулканизма, тектонических поднятий, рифтогенеза — это эпохи
энергичной дегазации земных недр.
В ходе геологического развития происходило разрастание плат-
форм и, следовательно, ослабление газовой миграции. При этом менял-
ся и качественный состав газов — возрастала роль углеводородов.
О2, H2S и уменьшалось значение СО2, НС1 и HF.
Атмохимические методы поисков и решения
других геологических задач
На месторождениях полезных ископаемых подземная атмосфера
обогащена различными газами, часть которых образовалась одновре-
менно с формированием месторождений, а часть — в процессе их раз-
рушения или в результате миграции из вмещающих пород и атмо-
сферы .
Высокая миграционная способность газов определяет их фильтра-
цию и диффузию далеко за пределы залежей и рудных тел. В резуль-
тате вокруг месторождений образуются газовые ореолы, размеры кото-
рых по вертикали достигают сотен и даже тысяч метров, т. е. значи-
тельно превышают литохимические и гидрогеохимические ореолы.
Содержание газов в ореолах, по В.З. Фурсову, колеблется от п до
и-10~20мг/л и менее. Известны как первичные, так и вторичные газо-
вые ореолы, на обнаружении которых основаны атмохимические (га-
зовые) методы поисков полезных ископаемых. Согласно А.И. Фридма-
ну, эти методы развиваются в трех основных направлениях: газовой
съемки по подпочвенному воздуху, газортутного метода, водно-гели-
евой съемки.
В начале 30-х годов В. А. Соколов установил, что почвенный воз-
дух иад нефтяными и газовыми залежами обогащен СН4 и тяжелыми
углеводородами, которые служат прямыми поисковыми признаками
залежей. Методика поисков основана на определении свободного, раст-
воренного и сорбированного газа. Объектом исследования служат как
почвы, так и более глубокие горизонты земной коры (глубинная съем-
ка, газовый каротаж по буровому раствору, керну, шламу). Исполь-
зование хроматографов с пламенно-ионизационным детектором повы-
сило чувствительность анализа (до 10-6 % и более). Поверхностная
газовая съемка с отбором проб до глубины 50 м обнаруживает газо-
вые и нефтяные залежи на глубине 1—3 км. Кроме СССР газовая
съемка применяется в Польше, Венгрии, Румынии, США и других
5 Зак. 2022
129
В почвенном воздухе зоны окисления сульфидных месторождений
повышено содержание СО2, SO2, H2S, СН4 и других газов, понижено
содержание О2. Рудоконтролирующие тектонические зоны на никеле-
вых месторождениях Кольского полуострова содержат N2 и СН4, по-
вышенное количество Не, СН4 обнаружено также в алмазоносных
кимберлитах Якутии и Южной Африки, и других эндогенных место-
рождениях. С термальным воздействием интрузий и гидротерм на ор-
ганическое вещество вмещающих осадочных пород связано генериро-
вание СН4, тяжелых углеводородов и Н2. Но генезис Н2 различен, его
потоки также связаны с глубинными разломами. Имеются представ-
ления о роли воды как окислителя минеральных веществ в литогенезе
и выделении при этом Н2. В генерации Н2 важное значение отводится
механическим процессам (В. И. Молчанов).
Газовая съемка по подпочвенному воздуху эффективна также при
поисках угольных пластов, залегающих под осадочным чехлом, при
поисках минеральных вод, при прогнозе землетрясений, обнаружении
зон разломов. Для отбраковки ложных аномалий предложено исполь-
зовать изотопный анализ углерода СО2 и СН4.
А. А. Сауков предположил, что вокруг ртутных и ртутьсодержа-
щих месторождений образуются газовые ореолы Hg. В дальнейшем
их изучали его ученики и последователи. На основе атомно-адсорбци-
онного анализа разработаны высокочувствительные методы определе-
ния паров Hg, которая фиксируется при содержании в породах до
п-10~8 % Hg, в почвенном воздухе — до п -10~9 мг/л (на два порядка
ниже кларка литосферы). Ртутные фотометры на автомашинах позво-
ляют быстро производить измерения на больших площадях. Имеются
и пешеходные варианты фотометров. Hg концентрируется в рудах всех
типов эндогенных и части экзогенных рудных месторождений. В орео-
лах Hg может быть в атомарном состоянии, в форме сульфидов, раз-
личных комплексов хлоридов, ртутьорганических соединений (ме-
тилртуть и др.) Газовые ореолы Hg формируются и в перекрывающих
аллохтонных отложениях. Поэтому поверхностные газортутные съем-
ки эффективны при поисках погребенных и скрытопогребенных руд
всех металлов (рис. 33). Эти методы могут использоваться и при по-
исках нефти.
Г. Б. Свешников и его соавторы разработали метод поисков руд и
нефти, основанный на оптическом атомно-адсорбционном определении
паров Hg в атмосфере (содержание Hg до п-10~в мг/л). Испытывался
самолетный вариант метода с высотой полета 200—300 м. Для опреде-
ления летучих веществ в атмосфере используются и лазерные анализа-
торы (лидары).
Подземная атмосфера оказывает влияние на эксплуатацию руд-
ников и шахт. Так, при отработке угольных залежей в шахтах накап-
ливается метан, смесь которого с воздухом в определенных пропорци-
ях взрывоопасна. Еще опаснее в шахтах смесь воздуха с водородом.
По зонам глубинных разломов, рифтам, через вулканы осуществ-
ляется миграция глубинных газов к поверхности. Основную роль в
130
современном «газовом дыхании земной коры» играют процессы, проте-
кающие в вулканогенно-осадочном и гранитно-метаморфическом
слоях.
Поступление газов из мантии наиболее энергично протекало в до-
кембрии, в современную эпоху оно играет незначительную роль, хотя
и не исключается полностью. Так, обнаружение Не с относительно вы-
соким изотопным отношением 3Не : 4Не (в 1000 раз выше, чем в гра-
Рис. 33 Результаты измерений паров ртути в почвенном воздухе А и разрез по
Узельгиискому месторождению Б (по В. 3. Фурсову):
I — суглинки и глины, 2 — андезитовые порфириты. «? —липариты. 4—кремнистые слан-
цы, 5 — известняки, 6 — дайки габбро-диабазов 7 •—медиоколчеданные рудные тела, 8 —
содержание паров ртути в почвенном воздухе; наблюдения 28—29/VI 73 г
Я О 100 200м
нитном слое) позволяет предполагать его «первозданное» (нерадио-
генное), мантийное происхождение (солнечный Не обогащен 3Не).
Полагают, что некоторые струи Н2 также имеют мантийное про-
исхождение (например, в глубинных разломах Исландии). По А. Н.
Еремееву, А. Д. Ершову, И. Н. Яницкому, для глубинных раз-
ломов характерны аномалии Не. Гелиевая съемка эффективна при про-
гнозно-металлогенических исследованиях и при поисках медно-колче-
Данных и других месторождений. При водно-гелиевой съемке Не опре-
деляется в подземных водах непосредственно у водопункта. Анома-
лии Не отражают тектоническое строение нижней части земной коры,
глубинные разломы в фундаменте, по некоторым представлениям —
на уровне базальтового слоя. Миграция Не усиливается при тектони-
ческих подвижках, поэтому гелиевая съемка может использоваться для
прогнозирования землетрясений. После Ташкентского землетрясе-
5* 1Я1
ния 1966 г. в термальных водах из скважин, расположенных в зоне
глубинного разлома, повышалось содержание Не и Rn. Концентрация
Rn возрастала при повторных толчках. В результате тектонических
подвижек во время Анапского землетрясения 1966 г. на рудных место-
рождениях Северо-Западного Кавказа в штольнях наблюдалось рез-
кое увеличение содержания СН4, СО2 и Не. Через два месяца после
землетрясения повторная газовая съемка установила, что содержание
газов вновь стало таким, каким было до землетрясения.
Региональные исследования В. 3. Фурсова в Средней Азии, Казах-
стане и европейской части СССР показали, что над зонами глубин-
ных разломов в почвенном воздухе образуются широкие (20—100 км)
аномалии Hg. Предполагается, что источниками служат мантия, маг-
ма, горные породы земной коры, из которых Hg возгоняется при на-
гревании.
Контрольные вопросы
1. Каков состав надземной атмосферы, факторы его формирования?
2. Геохимическое значение подземной атмосферы, ее состав.
3. Как используется анализ подземной атмосферы для поисков полезных
ископаемых и решения других прикладных задач?
9. ОБЩИЕ ЗАКОНОМЕРНОСТИ ВОДНОЙ МИГРАЦИИ
Вода — самая универсальная и самая важная среда миграции в
земной коре. Водные растворы пронизывают верхнюю часть литосфе-
ры, океаны и моря занимают 71 % земной поверхности. Вода — это
«кровь» земной коры. Все природные воды связаны между собой, на-
ходятся в постоянном движении, представляют единое целое — гидро-
сферу Земли. Постоянный приток солнечной, радиоактивной и прочей
энергии определяет непрерывность водной миграции, неравновесность
гидросферы в целом, существование различных круговоротов воды.
Даже самые глубокие подземные воды участвуют в общем круговороте
(рис. 34).
Вода как среда миграции
Структура воды. Теплоемкость, скрытая теплота плавления и ис-
парения, поверхностное натяжение, диэлектрическая постоянная у
воды аномальны и резко отличаются от других жидкостей. Это опре-
деляет многие особенности водной миграции. Особенно большое значе-
ние имеет исключительно высокая диэлектрическая постоянная воды—
при комнатной температуре она равна 80 (у этилового спирта — 25,
у уксусной кислоты — би т.д.). Поэтому в воде взаимодействие между
ионами в 80 раз слабее, чем в кристаллах. Этим объясняется легкая
132
ионизация растворенных веществ, образование Na+, С1~, Са3+ и
прочих ионов.
Своеобразие воды связано с особенностями ее структуры, которая
для жидкой воды еще полностью не установлена. Об этом свидетельст-
вуют десятки гипотез строения воды. Но хорошо известна структура
льда, для которой характерна водородная связь. Н — единственный
Ш Ш2 & И* ЕЗ? ЕЕ?
Н---I/O \^]l1 ||ЗЛ71|?2
Рис. 34. Круговорот воды в природе (по Ф. А. Макаренко и др.):
1—испарение воды, 2 — выпадение осадков, 3 — перенос водяного пара на расстояние, 4—
инфильтрация вод в ландшафте, 5 — поверхностный и грунтовый сток (выше местных ба-
зисов дренирования), 6 — осадочные породы (грунтовые и артезианские воды), 7 — «гранит-
ный» слой (трещинные и жильиые воды), 8 — «базальтовый» слой (трещинные и жильные
воды), 9— верхняя мантия и очаги магмы, 10— циклы водных круговоротов (С —сезонных
и других кратковременных, В и Г — вековых и геологических), // — первичные н другие
воды мантин н земной коры, /2—масса воды в геограммах (I020 г)
элемент, в атоме которого нет ни одной полностью заполненной элект-
ронной оболочки. Это накладывает резкий отпечаток на его поведение и,
в частности, создает дополнительную слабую связь в молекуле воды,
которая способна притягивать кислород соседних молекул (рис. 35).
В результате молекулы Н2О во льду связаны между собой водородной
связью и образуют ажурный каркас — огромную «полимерную моле-
кулу», в которой кислород как бы четырехвалентен (за счет двух водо-
родных связей). Именно с этой «ажурностью» связывают способность
льда плавать в жидкой воде (у подавляющего большинства соедине-
133
ний твердая фаза тяжелее жидкой). При таянии льда ажурная структу-
ра частично разрушается и талая вода становится плотнее льда.
Водородная связь «квазихимическая», значительно слабее ионных и
ковалентных связей (17—33 кДж/моль против сотен кДж/моль), но
сильнее межмолекулярных (ван-дер-ваальсовых) связей (около
2,5 кДж/моль). При плавлении и нагревании часть водородных свя-
зей уничтожается, но частично они существуют даже в горячих во-
дах. Поэтому вода отличается от других жидкостей значительной
структурностью, ее структура близка
«размытой» структуре льда.
Многие особенности жидкой воды опре-
деляются водородными связями. В связи с
этим еще раз подчеркнем глубину мысли
Вернадского, который много десятилетий
назад писал, что химический характер во-
ды явно определяется свойствами Н, а
не О.
Водородные связи характерны также
Qi 02 _________з -____4 для многих органических соединений, для
глинистых минералов, в которых они опре-
,, г деляют слабое взаимодействие между алю-
Рис. 35. Схема строения мо- J
лекулы воды (расстояние мосиликатными слоями.
между атомами кислорода Тепловое движение молекул в жидко-
даны в иаиометрах): стях имеет двоякий характер. С одной сто-
хН^н^РеОДсвяз7В4а-Рв°оАор3оГ Роны- это колебательные движения около
«ые связи положений равновесия. а с другой—скач-
кообразный переход из одного состояния
равновесия в другое. Такое движение называется трансляционным,
оно ослабляет структурность воды. Одни ионы ослабляют трансляци-
онное движение молекул воды (стрикторы), другие усиливают (де-
стрикторы), а третьи — индифференты в этом отношении (О. Я. Са-
мойлов). Стрикторы — многозарядные и небольшие однозарядные
ионы, т.е. ионы с относительно большими ЭК—Mg2+, Са2+, Ba2-fi, Na + ,
Li+, SO2-h др. Они связывают ближайшие молекулы Н20 (положи-
тельная гидратация). К дестрикторам относятся большие однозаряд-
ные ионы с малыми Эд — К+, Rb+, Cs+, I-, Br~, Cl~, NO;r, и др.
Они усиливают трансляционное движение молекул Н20, ослабляют
ее структуру (отрицательная гидратация). Влияние ионов на струк-
туру воды можно сравнить с влиянием температуры и давления (рост
температуры способствует ослаблению структурности воды, а рост дав-
ления усиливает ее). Дж. Бернал и Р. Фаулер в 1934 г. установили по-
нятие о структурной температуре раствора, при которой чистая вода
имеет ту же структурность (упорядоченность), что и данный ионный рас-
твор. А. В. Копелиович ввел понятие «структурное давление» (1961).
Он пришел к выводу, что в системах, где между твердой фазой и водой
наблюдается равновесие, рост внешнего давления по принципу Ле
Шателье должен приводить к растворению ионов с отрицательной гид-
134
ратацией — К+, Rb+, Cs+ и т. д. При понижении внешнего давления
в раствор преимущественно будут переходить ионы с положительной
гидратацией — Mg2+, Са2+ и т.д. Понятие о положительной и отрица-
тельной гидратации ионов, о структурном давлении используется для
объяснения ряда особенностей геохимии подземных вод.
ПоФ. А. Летникову, Т. В. Кащеевой и А. III. Минцису, нагретая
вода при охлаждении некоторое время находится в метастабильном
«активированном» состоянии — обладает, например, повышенной спо-
собностью растворять карбонаты и другие минералы.
Связанная вода, поровые растворы. Часть воды в литосфере нахо-
дится в свободной, т. е. капельно-жидкой, форме и занимает полости
размером более нескольких микрон. Это воды песчаных и галечных во-
доносных горизонтов, трещин в горных породах, карстовых полостей
и т.д. Как правило, они гравитационно подвижны. Другая часть вод
подвержена действию силового поля контактирующих пород. При этом
деформируются водородные связи, свойства воды изменяются тем силь-
нее, чем ближе молекулы к поверхности породы. Сильное влияние по-
роды сказывается на расстоянии в сотни нанометров, соответствующем
пленке из сотен мономолекулярных слоев воды. Подобная вода получи-
ла наименование связанной. Она разделяется на прочносвязанную и
рыхлосвязанную. К первой относится гигроскопическая вода, которая
взаимодействует с активными центрами на поверхности минералов.
Рыхлосвязанная вода образует пленку (пленочная вода), которая
удерживается ван-дер-ваальсовыми межмолекулярными силами. По
А.М. Блоху, изменения, происходящие при образовании рыхлосвя-
занной воды, направлены в ту же сторону, что и при нагревании (воз-
растает кислотность, уменьшается до первых единиц диэлектрическая
постоянная). Сильно понижается температура замерзания (до —70°).
Рыхлосвязанная вода находится в порах горных пород, капиллярах,
микротрещинах и т.д. Частично она удерживается и за счет замкну-
тости микрополостей. Подобные воды имеются в почвах, илах, горных
породах, их именуют «поровыми» растворами. Они удаляются из поро-
ды под давлением или каким-либо иным методом, например вытесне-
нием спиртом.
По химическому составу поровые растворы очень разнообразны и
часто сильно отличаются от гравитационных вод (известны как более,
так и менее минерализованные поровые растворы).
Исследования с помощью ядерного магнитного резонанса (flMP)
показали, что часть поровой воды в опале замерзает лишь при тем-
пературе — 73° С, часть — при — 200 °C, и последние порции — по-
чти при абсолютном нуле (минус 269 °C — 4,2 К). Это соответствует
размеру пор менее 1,2 нм, причем в отдельных порах находится лишь
Ю—15 молекул воды.
Большая часть подземных вод относится к поровым растворам,
только в глинах их количество приблизительно составляет 1,1 - 1022 г,
что соответствует слою воды на суше мощностью 66 м.
135
Поровые растворы относительно малоподвижны. Частично это за-
стойные воды, поэтому они длительное время взаимодействуют с вме-
щающими породами, активно участвуют в геохимических процессах.
Для них характерны как диффузия, так и фильтрация. При тектони-
ческих движениях, уплотнении пород и других процессах поровые во-
ды или отжимаются из пород, или засасываются в них. С этим связаны
многие явления формирования химического состава подземных вод,
рудообразования, нефте- и газообразования.
Тяжелая вода. Кларк тяжелого стабильного изотопа водорода —
дейтерия (D — 2Н) в гидросфере равен 0,0147 атомных процентов. Не-
измеримо меньше в водах радиоактивного изотопа — трития (Т —3Н).
Известны и тяжелые стабильные изотопы кислорода 18О и 17О. Это соз-
дает возможность существования девяти стабильных разновидностей
воды, среди которых абсолютно преобладают (99,73 %), далее
следует (0,20 %), Д,17 О (0,04 %) и 7HD 16 О (0,03 %). D2O
и HDieO называются «тяжелой водой», которая сильно отличается от
обычной воды: замерзает при 3,8° С, кипит при 101,42 °C, наиболь-
шую плотность имеет при 11,6 °C, скорость реакций и растворимость
солей в ней меньше. Тяжелая вода ядовита для организмов.
Вода океана обладает постоянным изотопным составом: среднее
атомное отношение 18О: 1вО составляет 0,002, a D : Н 0,000158.
На 1 млн. молекул Н21вО приходится 2000 молекул Н218О, 320 мо-
лекул HDO, 420 молекул Н217О.
Большие различия атомной массы дейтерия и протия (7Н) создают
возможность их разделения в некоторых природных процессах, осо-
бенно при испарении вод (Н2О энергичнее испаряется, чем D2O). По-
этому D считается одним из самых интересных в геохимическом отно-
шении изотопов.
Меньше всего тяжелой воды в атмосферных осадках полярных
стран, больше всего — в соленых озерах. На основе анализа изотоп-
ного состава изучается связь вод океана с поверхностными водами су-
ши, генезис глубоких пластовых вод, происхождение современных
гидротерм и т. д.
Разложение и синтез воды в земной коре
Количество Н2О в системах земной коры постоянно меняется. Так,
при фотосинтезе Н2О разлагается, причем Н входит в состав живого
вещества, а О выделяется в окружающую среду (см. гл. 14). По
С. Л. Шварцеву, при выветривании изверженных пород происходит по-
глощение образующимся каолинитом Н+ иона воды:
2Са [ Al2Si2O8l 4- 6Н2О = Al4 [Si4O10] (ОН)8 + 2Са3+ + 40 Н~
Гидроксил с СО2, растворенным в воде, дает НСОз":
он-+со2=нсо3-
136
Последний участвует в образовании карбонатов по примерной реак-
ции:
2НСОз +Са2+ СаСО3 + Н2О СО,
В результате О воды попадает в карбонатные породы. Хотя механизм
глинообразования может быть и иным, основной вывод Шварцева ве-
рен: в верхней части земной коры при взаимодействии воды с горными
породами происходит разложение ее молекул и связывание их частей с
глинами и карбонатами (глины поглощают Н, карбонаты — О). При
образовании глин разлагается и связывается не менее 15—30% Н2О
(от массы глин). При гидрослюдизации и хлоритизации глин так-
же связывается Н2О.
Другой распространенный процесс разложения воды — радиолиз.
Разложение воды, ее исчезновение необходимо учитывать при ана-
лизе многих явлений. Но в земной коре протекает и противоположный
процесс синтеза воды, особенно характерный для зоны метаморфизма.
Формирующиеся возрожденные воды обладают большой агрессивно-
стью и выщелачивают из вмещающих пород многие рудные элементы
(рудообразующие флюиды). В этой зоне происходит и выделение СОа
из карбонатов.
Интенсивность водной миграции и концентрации
элементов
Для оценки интенсивности водной миграции и концентрации эле
ментов используется коэффициент водной миграции Кх, равный от-
ношению содержания химического элемента в минеральном остатке-
воды к его содержанию в водовмещающих породах или к кларку зем-
ной коры (А. И. Перельман). Например, в трещинных водах гранито-
идов (табл. 5) Zn, Мо и Си много меньше, чем Si и Са, но из этого не
следует что Zn, Мо и Си мигрируют с меньшей интенсивностью. Опре-
делив Кх, устанавливаем, что Zn мигрирует намного интенсивнее Si
и Си. Интенсивность миграции Са почти такая же, как у Мо, и оба
элемента мигрируют несколько слабее Zn, т. е. ряды интенсивности
миграции следующие: Zn > Са > Мо > Си > Si.
Таблица 5. Интенсивность миграции элементов в трещиииых
водах гранитоидов с минерализацией (а) 0,5 г/л
Элементы Гранитоиды, %,лх Воды, тх, г/л т%- 100 Кх= а’пХ
Si 32,0 1,3-10-2 0,08
Са 1,60 7-Ю-2 8,7
Zn б-ю-3 3-10-" 10
Мо 1 •io-4 4-Ю-6 8
Си 2-Ю-3 2,6-10“6 0,26
137
Природные воды часто взаимодействуют с различными горными по-
родами. Таковы, например, крупные реки со сложным геологическим
строением бассейна, многие подземные воды. В этих случаях методи-
чески правильно в качестве величины пх использовать не состав кон-
кретной породы, а кларки земной коры или крупных групп пород (кис-
лых, основных и т.д.). Хотя полученные /<х будут приближенными, они
дадут ясное представление об интенсивности миграции и концентра-
ции отдельных элементов.
С. Л. Шварцев, используя тысячи анализов, вычислил среднее
содержание элементов в подземных водах зоны гипергенеза (клар-
ки). Естественно, в этом случае при расчете Кх в качестве величины
пх использовать кларки земной коры. В табл. 6 подсчитаны Кх для
некоторых распространенных и редких элементов (величина а —
средний минеральный остаток вод, — по Шварцеву, — составляет
0,43 г/л). Как видим, несмотря на резко различные содержания в во-
дах С1, Вг и I, они мигрируют с близкой интенсивностью. То же отно-
сится к Са, Mg, Na, Zn, Sr и Mo. Таким образом, Кх позволяет сравни-
вать интенсивность миграции распространенных и редких элементов.
Таблица 6. Интенсивность миграции элементов
в подземных водах зоны гипергенеза
Содержание элемен- Содержание элемен- Коэффициент
Элемент тов в водах (mx) тов в земной коре
по С. Л. Шварцеву, (по А. П. Виногра- водной
г/л дову), %
С1 4,7 -10-2 1,7-10-2 644
Вг 1,83-10-* 2,1-10-* 203
I 1,61 • 10-6 4-Ю-5 99
Mg 1,86-10'2 1,87 2,3
Са 4,3-10~2 2,96 3,3
Na 4,55-10-2 2,50 4,2
F 4,5-10—* 6,6-ю-2 1,6
Zn 3,4-10-s 8,3-10-3 0,94
Sr 1,85-10-* 3,4-10-2 1,2
Мо 2,06- 10_® 1,1-10-* 4,4
К 4,59-10-3 2,50 0,43
р 5,75-10-5 9,3-10-2 0,14
Мп 4,94-10-5 0,1 0,11
Ni 3,31-10-® 5,8-103 0,13
Си 5,58-10-® 4,7-10'3 0,27
Fe 5,47-10-* 4,65 0,02
Al 2,79-10-* 8,05 0,008
Ti 1,07-10-® 0,45 0,005
Cr 2,9-10"® 8,3 10-3 0,08
V 2,06-10-® 9-Ю-3 0,05
Zr 1,30- Ю-® 1,7- IO-2 0,017
Th 4,2-10-7 1,3-10-3 0,07
Использование Кх позволило модернизировать ряды водной мигра-
ции, впервые составленные Б. Б. Полыновым, дополнить их редкими
элементами, выразить результаты в более контрастной форме (табл. 7).
138
Таблица 7. Ряды миграции элементов в кислородных водах
зоны гипергеиеза (по А. И. Перельману)
Интенсивность миграции Коэффициент водной миграции Состав ряда в порядке убывания кларка земной коры
Очень сильная п-10—п-100 S, С1, В, Вг, I
Сильная п—п,-10 Са, Na, Mg, F, Sr, Zn, U, Mo, Se, Au
Средняя 0,л—п Si, К, Mn, P, Ba, Rb, Ni, Cu, Li, Co, Cs, As, TI, Ra
Слабая и очень слабая 0,0л и менее Al, Fe, Ti, Zr, Th и др.
Если для вод с активной циркуляцией Кх характеризует интенсив-
ность миграции, то для застойных вод Кх характеризует интенсивность
накопления, так как представляет собой кларк концентрации элемен-
тов (КК) в минеральном остатке воды. Поэтому Кх можно использо-
вать для определения степени концентрации элементов в морских и
озерных водах, глубоких горизонтах подземных вод и т.д. (табл. 8)
Таблица 8. Иитенсивиость концентрации и рассеяния элементов
в океанических водах (по А. И. Перельману и Е. Н. Борисенко)
Интенсивность концентрации н рассеяния Кх Состав ряда
Очень сильная концентрация Сильная концентрация Средняя концентрация Слабое рассеяние Сильное рассеяние 700—1 000 000 20—700 1—20 0,05—1,0 0,001—0,05 С1, Вт S Na, Mg, I. В Со, К, Sr, Li, Ag, Мо As, Se, Ni, Zn, Cd, Cu, Hg, Au, U, Rb, Cs, In, Sn, Ge, Sb, V, F, P, W, Bi
Ю. Ю. Бугельский, В. И. Дворов и Л. М. Лебедев изучили гидротер-
мы полуострова Челекен, где в красноцветной неогеновой толще сква-
жинами были вскрыты металлоносные рассолы с температурой от 40 до
98 °C. Для этих рассолов нами также рассчитаны ряды интенсивности
концентрации и рассеяния (табл. 9).
В рассолах Челекена сильнее всего концентрируются С1, Вг и I.
По сравнению с океаном здесь интенсивнее концентрируются Zn, Си,
Мо, РЬ и другие металлы.
Полученные величины Кх, несмотря на их ориентировочный ха-
рактер, дают представление об интенсивности накопления элементов
в гидротермах. Отметим, что и для вод зоны гипергенеза получаются
близкие величины (Kzn > АГрь; Дна > Лк; Ksr > Лв« и т. д.).
Для многих систем Кх пропорционален интенсивности миграции
Рх. Покажем это на примере коры выветривания, дренируемой речной
139
Таблица 9. Концентрация н рассеяние элементов в термальных рассолах
(по А. И. Перельману и Е. Н. Борисенко)
Интенсивность концентрации и рассеяния Кх Состав ряда
Очень сильная концентрация 700-1 000 000 С1, Вт. 1
Сильная концентрация 20—700 Na, Са, As. TI
Средняя концентрация 1,0—20 S, Mg, К, Ba, Мп, Zn, Мо, Си, РЬ
Слабое рассеяние 0,05—1,0 N1
Сильное рассеяние 0,001—0,05 Fe
Очень сильное рассеяние менее 0,001 Si, Al
сетью. В этом случае член уравнения интенсивности миграции dbldt
можно определить как ионный сток элемента X в течение одного года
(его вполне можно считать величиной бесконечно малой по сравнению
со стоком за все время выветривания и по сравнению с общей массой
элемента в породах района). Это позволяет написать уравнения:
db/dt-trix -Q,
где тх — среднее содержание элемента X в речной воде, Q — средне-
годовой расход реки, и
Ьх ~пх-М,
где Ьх — общая масса элемента X в горных породах, дренируемых ре-
кой, пх — среднее содержание элемента X в породах района, М —
масса пород. Сделав подстановку, получим
1 • db у тО
рх-=-----—.
bxat пхт
Величина Q/M — общая при определении интенсивности мигра-
ции всех элементов в изучаемых водах, в связи с чем для элементов
X и У существует зависимость
РХ mXnY
РY
Учитывая, что Кх и соответственно равны
, т х 100 mv 100 Кх = -Л и Ky = — , а • пх а-Пу
получаем Рх Кх Ру Ку '
Следовательно, коэффициенты водной миграции химических эле-
ментов Кх и Ky относятся как интенсивности их миграции.
140
Геохимическая классификация вод
Все воды содержат растворенные газы, ионы, недиссоциированные
молекулы, многие — коллоидные частицы. При геохимической клас-
сификации необходимо четко определить таксономическое значение
каждого компонента вод. Задача эта решалась по-разному. В. И. Вер-
надский считал воду особым минералом и выделил 485 ее видов, отме-
чал, что общее их число превышает 1500. Все воды ученый разделил
на три подгруппы: твердую воду (льды), газообразную (надземные и
подземные пары) и жидкую. В жидкой воде были выделены классы
пресных, соленых и рассольных вод. Вернадский считал, что классифи-
кация должна учитывать не только геохимические особенности вод,
но и физико-геологические параметры, характер водовместилищ. На
этом основании он выделял царства, подцарства и семейства вод. Так,
подгруппа жидкой воды включает царства поверхностных, подземных
и глубинных вод. Семейства выделяются по формам нахождения вод в
земной коре: семейства озерных, болотных, речных, пластовых и дру-
гих вод. Это все обыденные понятия, выработанные жизнью, подчерки-
вал ученый. Большое значение он придавал газовому составу вод, вы-
делял кислородные, углекислые, азотные, метановые, сероводород-
ные и водородные воды (таксономическое значение газов выше ионов).
Для каждого вида вод Вернадский приводил химический элементар-
ный состав в порядке убывания элементов. В 38-м семействе — «ре-
ки», например, выделены следующие виды:
95. О — Са — С
96. О — Na — Са — S
97. Обычные реки, смесь № 95 и 96
98. Воды приполярных (тундровых) рек — О — Са — С — N
99. Черно-бурые тропические реки — О — С — N — Са — Si —Na
100. Борсодержащие реки — О — Na —С — В
В классификации Вернадского нашли свое место и «радионосные во-
ды» нефтяных месторождений, и «черные тропические реки», и многие
другие воды. Данная классификация геологе-географо-геохимическая,
так как она учитывает не только геохимические особенности вод, но
и физико-географические и геологические условия их распростране-
ния и залегания. По широте охвата и глубине анализа классификация
Вернадского намного опередила свое время и сыграла выдающуюся
роль в развитии геохимии. Она не потеряла научного значения и в на-
стоящее время.
Возможна и чисто геохимическая классификация вод, основанная
на их свойствах, определяющих миграцию элементов. Развивая идеи
Вернадского о роли растворенных газов, А. М. Овчинников разрабо-
тал «гидрогеохимическую систему природных вод», в которой выделе-
ны воды с газами окислительной обстановки (N2, О2, СО2 и др.), воды
с газами восстановительной обстановки (СН4, H2S, СО2, N2 и др.) и
воды с газами метаморфической обстановки (СО2 и др.). Дальнейшую
систематику он проводит по соотношению катионов (Na+, К+, Са2+,
141
Mg2+) и анионов (SOI’, НСОг, Cl-). Большинство гидрохимиков и
гидрогеохимиков в основу систематики вод кладут их ионный состав.
За последние годы получен новый большой фактический материал
по геохимии природных вод, совершенствуется и методология науки.
Все это позволило автору разработать новую геохимическую классифи-
кацию вод, включающую 6 главных таксонов', группу, тип, класс, се-
мейство, род и вид вод.
Температура вод. Данный параметр — важнейший, он определя-
ет условия миграции и формы нахождения элементов в водах, скорость
химических реакций. Четко выделяется группа холодных и слаботер-
мальных вод, в которых возможна энергичная бактериальная деятель-
ность. Условно мы принимаем 40 °C ее верхней границей. Это так назы-
ваемая «.характерная температура Менделеева», при достижении ко-
торой происходит резкое изменение ряда физических свойств вод и, в
частности, ее электропроводности; 40 °C является приблизительной
границей зоны гипергенеза. Выше 40 °C начинается область гидротер-
мальных процессов, которая разделяется на несколько температурных
интервалов. Важным рубежом служит критическая температура, вы-
ше которой невозможна жидкая вода (несмотря на высокое давление).
Для чистой воды это 374,1 °C, для сильноминерализованных вод —
до 450 °C. При более высоких температурах существуют надкритиче-
ские растворы, т. е. газовые растворы, в которых мигрируют многие
элементы. Особенно характерны летучие хлориды и фториды металлов
При высоких давлениях сильно сжатый водяной пар ведет себя во
многом аналогично жидкой воде, молекулы Н2О в нем ассоциированы.
Такие газово-жидкие растворы именуют флюидами. Они играют важ-
ную роль в формировании многих изверженных пород и руд.
Л. Н. Овчинников и В. А. Масалович выделили семь особых темпе-
ратурных точек воды, отвечающих ее структурным превращениям:
4, 40, 85, 165, 225, 340 и выше 400 °C. Учитывая эти и другие построе-
ния, можно в первом приближении выделить четыре группы вод:
1. Холодные и слаботермальные воды верхней части земной коры.
2. Горячие и умеренно перегретые (40—200 °C).
3. Сильноперегретые (200—375 °C).
4. Флюидные (выше 375 °C).
Состояние знаний позволяет разработать геохимическую классифи-
кацию только для первой группы вод. К первой группе относились и
все предыдущие классификации.
Окислительно-восстановительные условия вод. Большое таксоно-
мическое значение этих условий объясняется огромным энергетиче-
ским эффектом окислительно-восстановительных реакции, коренным
образом меняющим геохимическую обстановку в водах. Каждая при-
родная вода характеризуется определенной величиной окислительно-
восстановительного потенциала Eh, который, как и pH, определяется
с помощью потенциометра или колориметрически. Eh может
быть определен и для условий окисления и восстановления определен-
ного элемента или иона.
142
Потенциалы окисления металлов определяют с помощью гальва-
нического элемента. Окислительно-восстановительная реакция в нем
в наибольшей степени приближается к обратимой, а производимая ра-
бота равна максимальной работе химической реакции А или ее изо-
барному потенциалу с обратным знаком (А = — AZ).
Работа, совершаемая в гальваническом элементе, равна произведе-
нию электродвижущей силы Е на количество прошедшего электри-
чества nF (где п — заряд иона, a F — постоянная Фарадея). Отсюда
AZ — — nEF, но
a'F as
kZ-=RT\n ? -s-------RT\nK
а1"-а1"1
D С
ИЛИ
"F а'£-а'ст nF
Если исходные активности равны единице, то первый член уравне-
ния превращается в ноль. Такая электродвижущая сила именуется
стандартной и обозначается Ео (стандартный потенциал):
nF nF
Каждый гальванический элемент состоит из двух «полуэлементов»,
включающих по одному электроду, однако разности потенциалов, ха-
рактерные для отдельных электродов, определять невозможно. Зная
электродвижущую силу всей цепи и принимая потенциал какого-либо
электрода за ноль, можно определить условный потенциал любого дру-
гого электрода относительно данного — стандартного. Таким стандарт-
ным электродом в физической химии принято считать водородный элек-
трод. Потенциал перехода газообразного водорода в ионную форму при
t = 25 °C и «нормальном давлении» — 101 325 Па — считается нуле-
вым: Н2—>-2Н+ + 2е, где е — электрон. Тогда, зная электродвижу-
щую силу гальванических элементов с водородным электродом, можно
рассчитать стандартный потенциал другого электрода. Рассчитаем для
примера стандартный окислительно-восстановительный потенциал оки-
сления металлического цинка Zn°—>-Zn2+ + 2 е. Стандартный изо-
барный потенциал этой реакции равен:
AZgeaK = AZ° Zn2+ — AZ° Znu
Из справочника по физической химии узнаем, то AZ 0 для Zn2+
составляет—35,184, AZ0 для металлического цинка равно нулю. По-
этому AZpeaK равно —35,184. Теперь определим Ео из формулы
AZ° = n-FE0, где п = 2, так как цинк двухвалентен:
£0 = — = ~35’-84 = —0,763 В.
nF 2.23,052
Таким образом, окисление Zn при температуре 25 °C и pH раствора,
143
равном 0, происходит при стандартном потенциале Ео — —0,763 В.
Ниже приведены стандартные электродные окислительно-восстано-
вительные потенциалы Ео для ряда металлов и ионов 1 (в вольтах):
Для условий сильнокислой среды (рН~0)
Ее
Са®-> Са2++2е —2,87 Cu+-*-Cu2+ + e ±0,167
Zn0-*- Zn2+ + 2e —0,763 Cu® ->Cu2+ + 2e +0,337
V3+ -> V4" +e +0,40
Cr°Cr3++ 3е —0,74 Cu°-*-Cu+ +e +0,521
U3+-»-U4+ + e —0,61 Fe2+->Fe3+ + e +0,771
Fe® -> Fe2+ + 2e —0,44 Ag®-*-Ag+±e +0,799
Cd®-> Cd2+ + 2e—0,403 Rh»->Rh3++e +0,8
In°-> ln3+ + 3e —0,342 Pd»->Pd2+ +2e+0,987
Tl«->Tl+ + e —0,336 Mn2+ -> MnO2 +1,28
Co»->Co2+ + 2e —0,277 V4+->Vs+e +1,24
Ni0-*- Ni2+ + 2e — 0,25 Cr3+-*CrO^- +1,33
Sn°->Sn2+ + 2e —0,136
Pb®->Pb2+ + 2e —0,126 Pb2+-*-PbO2 +1,45
H° ->2H+ + 2e ±0,00 Au°-> Au3++3e +1,51
Sn2+-*-Sn4+ + 2e + 0,15 Мп2+-*-МпО7 +1,52
Co2+ -> Co3+ + e + 1,82
Для условий сильнощелочной среды (pH = 14)
Eo
Са°±2ОН- -> Са(ОН), + 2е —3,03
А1® +4ОН- -> HjAlOj" + Н2О + Зе —2,35
Th°+ 4ОН- -> Th(OH)4 ±4е —2,48
Zn°+2OH- -*- Zn(OH)2±2e — 1,245
Сг°+ЗОН-->Сг(ОН)3±Зе — 1,3
Fe°±2OH- -> Fe(OH)2-±2e —0.877
Cd° + 2OH--» Cd(OH)2-±2e —0,809
Co» 4- 2OH- Co (OH) 2 ± 2e —0,73
Ni ±2OH" -> Ni( OH)2±2e -0,72
Fe(OH)2-±(OH)--^Fe (OH)3±e —0,56
Сг(ОН)3 + 5ОН-->СгО^--±4Н2О±Зе —0,13
Mn(OH)2 +2OH~MnO2 + H2O + 2e —0,05
Co(OH)2± OH- -> Co(OH)3±e +0,17
I-±6OH- ->lOj-+3H2O + 5e +0,26
MnO2±4OH- -> MnO-p±2H2O-±2e ±0,60
В земной коре окисление и восстановление, как правило, протека-
ют при значениях окислительно-восстановительного потенциала, от-
личных от £0. Нестандартные потенциалы Eh отвечают самым различ-
ным условиям давления, температуры, реакции (pH) и концентрации.
1 Приведенные знаки у величин потенциалов приняты в СССР и Европе.
В США принята обратная система знаков, что следует учитывать при чтении аме-
риканской литературы.
144
Их можно рассчитать на основе термодинамических уравнений. Хотя
Eh сильно отличаются от Ео, их соотношения для разных элементов
нередко выдерживаются. Например, Ео реакции Fe2+ Fe3+ в силь-
нокислой среде (+ 0,771 В) значительно выше, чем Ео реакции Си+ ->
Си2+ (+0,167 В), т. е. Си+ окисляется в менее окислительных
условиях, чем Fe2+. В нестандартных условиях, т. е. при различных
pH, температуре и концентрации, значения Eh для этих реакций будут
разными, но Си+ будет окисляться при более низком Eh, чем Fe2+.
Поэтому величины стандартных потенциалов Ео также используются
для геохимических построений. Так, щелочные и щелочноземельные
металлы (Na, К, Са) обладают низкими стандартными и нестандарт-
ными потенциалами Ео и Eh (значительно ниже водорода) и переходят
в состояние положительно заряженного катиона. Эти элементы являют-
ся сильными восстановителями, они разлагают воду, выделяя из нее
водород. В земной коре они легко вступают в химические соединения
и мы не знаем самородных Na, К, Са и т. д. Au и Pd, наоборот,
с большим трудом отдают свои валентные электроны, их потенциалы
положительные, они с трудом вступают в химические соединения и на-
ходятся преимущественно в самородном состоянии. Остальные эле-
менты занимают промежуточное положение.
С ростом температуры Ео изменяется, и в гидротермальных раство-
рах реакции окисления и восстановления протекают при иных значе-
ниях потенциалов. Например, если стандартный потенциал окисления
Fe2+ до Fe3+ при 25 °C равен +0,771 В (в сильнокислой среде), то
при 50 °C уже +0,800 В, а при 200 °C + 0,97 В. Следовательно, с по-
вышением температуры расширяется поле существования восстанов-
ленных форм элементов (Fe2+, Cu+ и др.) за счет окисленных (Fe3+,
Cu2+).
На величину Eh природных вод влияют свободный О2, H2S, Fe2+,
Fe3+, Mn2+, Mn4+, V3+, V5+, H+, органические соединения и другие
«потенциалзадающие компоненты»,
Данные о Eh природных вод позволяют судить о миграционной спо-
собности элементов, об условиях их концентрации и рассеяния. И на-
оборот, если установлена миграция хотя бы одного элемента с перемен-
ной валентностью, то можно говорить о величине Eh вод, а следова-
тельно, и о миграции в них других элементов. Так, низкая величина
Eh в северных болотах, некоторых подземных водах определяет воз-
можность миграции в них Fe2+, Со2+, Ni2+. Кислородные щелочные
почвенные и грунтовые воды степей и пустынь неблагоприятны для
миграции Fe2+ и Со2+, которые в них находятся в форме Fe3+ и Со3+,
образующих труднорастворимые минералы. Такие воды благоприятны
для миграции Se, Мо, U, входящих в состав комплексных анионов.
В природных водах Eh обычно колеблется от +0,7 до —0,5 В. По-
верхностные и грунтовые воды, содержащие свободный О2, чаще всего
характеризуются более узким интервалом Eh — от +0,150 до
+ 0,700 В. Трещинно-грунтовые воды изверженных пород даже на
глубине 250—300 м имеют Eh более 0. Для подземных вод, связанных
145
с битуминозными породами и нефтяными залежами, Eh значительно
ниже 0 (местами до — 0,5 В). В этих условиях развиваются процессы
восстановления SO’-, Fe3+ и других ионов.
Для каждого элемента окислительная и восстановительная среда
характеризуется различным Eh (имеют значение также концентрация
элемента в водах, их температура, pH и т.д.). Например, при Eh, рав-
ном 0,7 В, сильнокислая среда восстановительна для трехвалентного
железа (Fe3+ -> Fe2+) и окислительна для Си2+, так как для восста-
новления Си2+ в сильнокислой среде необходим более низкий Eh.
Электрохимические процессы. Они возникают при любой мигра-
ции вод через горные породы, осадки, почвы. Системы, в которых про-
текают электрохимические процессы, И. С. Гольдберг предложил име-
новать геоэлектрохимическими, а полюса поля, где концентрируются
химические элементы, — электрохимическими барьерами. В земной
коре известны различные локальные электрические поля — гальвани-
ческие, фильтрационные, диффузионно-адсорбционные и др. Наибо-
лее изучены первые, проводниками электронов в которых служат
сульфидные, марганцовые, магнетитовые и другие руды, соответству-
ющие зоны минерализации, углистые, графитизированные, шунгито-
вые и другие породы. Местами характерны крайне низкие концентра-
ции элементов в растворах, исключающие их осаждение на геохими-
ческих барьерах («безбарьерная миграция», «дальная миграция»).
Но при электрохимических явлениях в растворах возможны и значи-
тельные концентрации элементов.
Хорошо изучены электрохимические процессы в системах, содер-
жащих сульфиды и арсениды. Эти и некоторые другие минералы (маг-
нетит, графит и т. д.) обладают электронной проводимостью, на их гра-
нице с природными водами возникает скачок потенциала. Сульфид-
ные руды обычно содержат несколько минералов, имеющих разные
электродные потенциалы. При соприкосновении таких руд с водой об-
разуются микрогальванические пары, электродвижущая сила кото-
рых достигает 0,3—0,4 В. Минерал с более высоким потенциалом игра-
ет роль катода, а с меньшим — анода:
на катоде MeS + 2е ->• Ме° + S2~
на аноде MeS—2е -> Me2+ + S°
В зависимости от pH вод S2- трансформируется в H2ShHS~, а ионы
Ме2+ переходят в раствор.
По Г. Б. Свешникову, в нормальном растворе КС1 электродные по-
тенциалы сульфидов приобретают следующие значения (в вольтах по
отношению к нормальному водородному электроду и в присутствии
воздуха): Марказит +0,56
Пирит +0,48
Халькопирит +0,42
Пентландит +0,22
Сфалерит (марматит) +0,12
Молибденит +0,14
146
Поэтому в рудах, содержащих халькопирит и пентландит, кат<ь в
будет халькопирит, а анодом — пентландит. В результате гальван#е‘
ских реакций в первую очередь растворится Ni. На Норильском мес^
рождении, например, в надмерзлотных водах содержание Ni значу
тельно выше, чем Си, хотя в пирротин-халькопирит-пентландитовых
рудах преобладает Си. Если в рудах наблюдается ассоциация пирита,
халькопирита, галенита и сфалерита, раствор обогащается РЬ и Zn,
в то время как Си и Fe практически не растворяются (пирит и халько-
пирит являются катодом, а галенит и сфалерит— анодом). Подобное
«электрохимическое растворение сульфидов и арсенидов» возможно и в
бескислородной среде, т. е. глубже зоны окисления сульфидных руд.
В результате возникают «.электрохимические водные ореолы рассея-
ния металлов», обнаружение которых позволяет выявлять глубокоза-
легающие рудные тела, в том числе и не имеющие выхода на земную
поверхность. Электрохимическими процессами объясняют образова-
ние зоны вторичного обогащения сульфидных руд, различную подат-
ливость сульфидов к окислению.
Л. К. Яхонтова предложила использовать некоторые гипергенные
минералы в качестве «минералогических потенциометров и рН-мет-
ров». Так, сочетание железистые арсенит—арсенат указывает на
pH 5—6 и Eh 0,1—0,2 В и т.д.
И. С. Гольдберг и другие полагают, что электрохимические процес-
сы являются одним из важных факторов выветривания минералов ди-
электриков (не обладающих проводимостью), причем катионы выно-
сятся в определенной последовательности (Са энергичнее Mg и т.д.).
Представления об электрохимическом растворении положены в ос-
нову поисков руд путем частичного электрохимического извлечения
металлов под действием постоянного электрического тока (метод ЧИМ,
Ю. С. Рысс и др.). Сконструирована специальная передвижная стан-
ция, которая позволяет фиксировать на земной поверхности вторич-
ные ореолы рассеяния рудных месторождений при залегании рудных
тел под толщей перекрывающих аллохтонных отложений мощностью
более 100 м. Разработан и ряд других геоэлектрохимических методов
поисков и разведки рудных месторождений.
Изучение электрохимических процессов быстро развивается, ста-
вится вопрос об оформлении особого научного направления — «гео-
электрохимии», «электрогеохимии» и др.
Три типа вод по окислительно-восстановительным условиям. Эти
типы зависят от содержания в воде О2, Н2, H2S и других газов. Важ-
ную роль играют и Fe2+, Fe3+, S2-, HS“, H+, ОН- и другие ионы,
а также молекулы органических веществ.
Для типа кислородных вод (с окислительной обстановкой) харак-
терно присутствие в водах свободного кислорода или других сильных
окислителей. Многие элементы находятся в высоких степенях окисле-
ния — Fe3+, Cu2+, Se+ и т.д. В зоне окисления сульфидных месторож-
дений при pH 1—2 Fe может быть и в двухвалентной форме. Осадоч-
ные горные породы, сформировавшиеся в окислительных условиях,
147
обычно имеют красную, бурую и желтую окраску. В зоне гипергене-
за и при щелочной среде Eh может лишь незначительно превышать О,
обычно Eh > 0,15 В. В кислой среде нижний предел окислительной
обстановки превышает 0,4В (т.е. Eh 0,15—0,4 В, соответствует вос-
становительным условиям).
Приведенные величины Eh характерны для равновесных условий.
Однако в земной коре и особенно в зоне гипергенеза широко распро-
странены неравновесные системы, для которых характерны ассоциа-
ции окислителей и восстановителей (например, О2 и H2S в некоторых
источниках или О2 и органические кислоты в реках болотистых низ-
менностей). В этом случае показателем окислительной обстановки слу-
жит свободный кислород. Если О2 отсутствует на окислительные усло-
вия указывает трехвалентное железо.
Главным критерием восстановительных обстановок служит двух-
валентное Fe и отсутствие свободного кислорода. Eh в зоне гипергене-
за обычно ниже +0,4 В в кислой среде и ниже 0,15 В — в щелочной.
Существенно также присутствие других восстановителей, особенно
H2S и его производных. Если в водах имеется HS~ и S2-, то большая
группа халькофильных и сидерофильных элементов может осаждаться
с образованием нерастворимых сульфидов. При отсутствии H2S и его
производных (HS~, S2-) многие из названных элементов в кислой сре-
де легко мигрируют. Поэтому выделяют два основных типа вод с вос-
становительной обстановкой.
Тип сероводородных (сульфидных) вод характеризуется H2S, HS~,
местами S2“; Fe и многие другие металлы часто не мигрируют, так как
образуют труднорастворимые сульфиды. Величина Eh обычно ниже 0,
местами она понижается до —0,5;— 0,3 В. Цвет пород — черный, се-
рый, зеленый и т.д.
Тип глеевых вод (с восстановительной бессероводородной обстанов-
кой) также характерен для гипергенных систем. Показателями вос-
становительной среды служат СН4 и другие углеводороды, растворен-
ные органические соединения, Fe2+, Н2. В глеевой обстановке легко
мигрируют многие металлы, часто в форме органических комплексов.
Окраска горных пород белая, сизая, серая, зеленая.
Как видим, геохимические различия воде восстановительной обста-
новкой не столько связаны с величиной Eh, сколько с природой восста-
новителя — наличием или отсутствием H2S и его производных (HS-,
S2-). При одной и той же величине Eh и pH геохимические условия
могут быть резко различными.
При резкой смене восстановительных условий на окислительные
возникает окислительный барьер А (кислородный и др.). Он возникает
и при смене резковосстановительных условий слабовосстановитель-
ными или слабоокислительных — резкоокислительными, т. е. при
резком повышении Eh. Для А барьера особеннохарактерно образова-
ние минералов гидроксидов Fe и Мп, а также самородной S. При рез-
ком понижении Eh возникают восстановительные барьеры—серово-
дородные или сульфидные — Ви глеевые — С (рис. 36).
148
Сероводородные и сульфидные барьеры В играют огромную роль в
минералообразовании, так как на них концентрируются большое чис-
ло минералов, главным образом сульфидов (пирит, марказит, галенит,
сфалерит и т.д.), а также некоторые оксиды (настуран и др.) и само-
родные элементы (Au, Ag, Se и др.).
Для глеевого барьера С менее характерно минералообразование
(сидерит, вивианит, настуран, самородные Си, Au, Se и др.).
О типах вод второй группы — горячих и умеренно перегретых
(до 200° С), Вторая группа также может быть расчленена на три типа
Рис. 36. Схема формирования кислородного барьера в зонах разломов А и водо-
носных горизонтах Б (по А. И. Перельману, Ю. В. Проскурякову и др.):
I — сильное ожелезнение, 2 —слабое ожелезнение, 3 — оглееиие, 4 — водоупорные горизон-
ты (алевролиты), 5 — водоносные горизонты (пески), 6 —скальные породы, 7 — кислород-
ные воды. 8 — глеевые воды
149
по окислительно-восстановительным условиям. К первому типу от-
носятся воды с наиболее окислительной обстановкой, для которых ха-
рактерно окисленное состояние U, Mo, Se (U8+, Moe+, See+). Это не
только кислородные, но и некоторые бескислородные гидротермы.
Ко второму типу принадлежат сероводородные (сульфидные) гидротер-
мы. Имеются и гидротермальные аналоги глеевых вод, т. е. восстано-
вительные, не содержащие H2S. Восстановительная среда в них обус-
ловлена органическими соединениями, Н2 (см. гл. 12).
Щелочно-кислотные условия вод. Многие катионогенные элемен-
ты образуют более растворимые соединения в кислых средах и менее
растворимые — в нейтральных и щелочных (Са, Sr, Ba, Си, Zn,
Cd, Fe2+, Мп, Ni, Со и др.). Анионогенные элементы лучше мигрируют
в щелочных водах (Сг8+, See+, Мо8^, V5+, As5+ и т. д.).
Важное геохимическое значение имеет pH начала выпадения гид-
роксидов металлов из разбавленных растворов их солей и произведение
растворимости гидроксидов. Для t = 25 °C эти данные приведены в
табл. 10. Осаждение гидроксидов обычно заканчивается при pH на
0,5—1,5 единицы выше. Поэтому правильнее говорить об интервале
pH осаждения, который для Mg2+ составляет 10,5— 11, для Ni2+
6,7—8, для А13+ 4,1—6,5 и т. д. Осаждение зависит и от концентраций
металлов. Например, А13+ при содержании 1 г/л осаждается из раство-
ра с pH = 3,6, а при содержании 1 • 10~5 г/л — уже с pH = 5,3. При
осаждении могут возникать сравнительно устойчивые коллоидные
растворы металлов, повышающие их миграционную способность. Су-
щественные коррективы вносятся также сорбцией, образованием ком-
Таблица 10. pH начала осаждения гидроксидов из разбавленных
растворов солей и ПР гидроксидов (при 25 °C)
Гидроксиды рн ПР Гидроксиды pH ПР
Sn (ОН)4 2 1 10-57 La (OH), 8 1 - IO-20
Zr(OH)4 2 8-10-52 Be (OH)2 5,7 1-10-20
Th(OH)4 3,5 ЫО-и Ni (OH)2 6,7 8,7-10"1’
Со (ОН), — 2,5-Ю”48 Cu (OH)2 5,4 1,6- IO"18
Sb(OH)3 0,9 4. Ю-« Zn (OH), 5,2 4,5-ю-47
Fe (ОН), 2,48 4- IO"38 Fe (OH), 5,5 4,8-10-18
Ga (ОН), 3,5 5-10-37 Pb(OH), 6,0 7-10-18
Al (ОН), 4,1 1,9-IO'42 Co (OH), 6,8 l,3-10-15
In (ОН), 3,7 1-10-33 Mn (OH)2 9,0 4,10-10"14
Сг(ОН), 5,3 7-IO”3* Cd (OH), 6,7 2,3-10’14
Т1 (ОН)4 1,4—1,6 1 IO-33 Mg (OH), 10,5 5-IO-43
Bi (ОН), 4,5 1 IO-3» Ag (OH) 9,0 2-IO"8
Sn (ОН), 3,0 1-10-27 Ce(OH), 7,4 —
Sc (ОН), 4,9 1-10-2’ Nd (OH), 7 —
Hg(OH)2 7,0 3.IO-28 UO, (OH)2 4,2 —
Y (ОН), 6,8 1 10-24 NbO,OH 0,4 —
150
плексных ионов и другими явлениями. Все же данные о «pH осажде-
ния» во многих случаях объясняют особенности миграции элементов.
Например, концентрация Fe3+ в воде при pH = 4, равна 2-Ю-6 г/л,
т. е. очень мала. Поэтому катион Fe3+ существует лишь в очень кислых
водах (зона окисления сульфидных месторождений). При повышении
pH до 4 Fe3+ осаждается в виде гидроксида. А13+ также существует
только в сильнокислых водах, при pH = 5 его концентрация понижа-
ется до 5-10-5г/л. Со3+, Cr3+, Bi3+, Sn2+, Th4+, Zr4+, Ti4+, Sc3+
существуют только в очень кислых водах, мало распространенных в
земной коре, поэтому данные катионы легко выпадают из природных
вод и имеют низкую миграционную способность. Напротив, Ni2\
Со2+, Zn2+, Мп2+, Ag+, Cd2+, Pb2+ в значительных количествах мо-
гут находиться в растворе даже при pH = 8 (Ni2+— 9,3-10~3г/л;
Со2+ — 1,5- Ю-2; Zn2+ — 2,9-10~3 и т. д.). В природных водах их со-
держание, как правило, много ниже и поэтому гидроксиды не осажда-
ются. Осаждение этих металлов связано с образованием нераствори-
мых сульфидов, фосфатов, арсенатов, карбонатов и т.д. или с сорбцией.
Влияние pH может быть лишь косвенным.
Na, К, Са, Rb, Cs в земной коре не образуют гидроксидов и для
их осаждения pH вод имеет лишь косвенное значение как фактор, вли-
яющий на сорбцию, растворимость солей и т. д.
Таким образом, при оценке pH как фактора миграции металлов не-
обходимо учитывать растворимость гидроксидов и кларки элементов,
их содержание в природных водах. Для многих редких элементов роль
pH в осаждении гидроксидов незначительна, так как концентрация
этих металлов в водах ниже их содержания в растворе после осажде-
ния гидроксидов.
Образование комплексных анионов сильно изменяет условия осаж-
дения многих металлов. Так, например, pH осаждения UO2(OH)2
3,8—6,0 (в зависимости от концентрации иО|+ в растворе). Эти дан-
ные как будто бы исключают миграцию U в водах с pH > 6. Однако U
в этих водах мигрирует, так как образует растворимые карбонатные
комплексы, о которых уже говорилось. Для большинства металлов
образование комплексных ионов повышает pH осаждения гидроксидов
и вообще повышает растворимость.
С повышением температуры ионное произведение воды (1Н+1 х
ХЮН-]) растет и в водах с /= 100 °C в нейтральной среде соответст-
вует pH = 6,12, а при t = 400 °C — 5,5. Следовательно, pH = 7 бу-
дет уже характеризовать щелочные условия. При /=0 °C нейтраль-
ный pH равен почти 8,0 (7,97).
Классы вод по щелочно-кислотным условиям. Воды зоны гипер-
генеза автор разделил на 4 класса. К сильнокислому относятся воды
с pH < 3. Они распространены широко, но, как правило, на неболь-
ших площадях. Кислотность таких вод обычно обязана окислению
пирита и других дисульфидов, приводящему к образованию свобод-
ной H2SO4. В сернокислых водах легко мигрирует большинство метал-
лов, в том числе Fe, Си, Al, Zn и др. В вулканических районах и глу-
151
боких горизонтах артезианских бассейнов известны и солянокислые
воды.
К слабокислым относятся воды, pH которых колеблется от 3 до
6,5; чаще всего их кислотность обусловлена разложением органиче-
ских веществ, приводящим к поступлению в воду СО2, фульвокислот
и других органических кислот. Если в горных породах мало подвиж-
ных сильных катионов, то кислотность нейтрализуется неполностью и в
системе господствует слабокислая среда. В таких водах легко мигри-
руют металлы в форме бикарбонатов и комплексных соединений с ор-
ганическими кислотами. Подобные воды распространены исключи-
тельно широко.
Нейтральные и слабощелочные воды имеют pH от 6,5 до 8,5. Их ре-
акция часто определяется отношением бикарбоната Са к его карбона-
ту или же бикарбоната к СО2. Эти воды менее благоприятны для миг-
рации большинства металлов, которые осаждаются в форме нераство-
римых гидроксидов, карбонатов и других солей. Анионогенные эле-
менты, напротив, мигрируют сравнительно легко (Si, Ge, As, V, U,
Mo, Se и др.). Такие воды особенно характерны для морей и океанов,
аридных ландшафтов, вод известняков и изверженных пород. При раз-
ложении органических веществ в них тоже образуются СО2 и органи-
ческие кислоты, которые, однако, полностью нейтрализуются СаСО3
и другими минералами Са, а также Mg, Na, К, которыми богаты почвы
и породы.
Сильнощелочные воды с pH > 8,5, обычно обязаны своей реакцией
присутствию соды (NaHCO3, реже Na2CO3). В щелочных содовых во-
дах легко мигрируют кремнезем, гуматы, А1 (образующий растворимые
алюминаты Na), Мо. Большая группа элементов, соединения которых
трудно растворимы в нейтральной и слабощелочной среде, в содовых
водах обладает высокой миграционной способностью, так как в этих
условиях возникают карбонатные растворимые комплексы (Си, Zn,
Be, Y и редкие земли иттровой группы, Sc, Zr и др.).
Для каждого класса вод характерны подвижные и «запрещенные»
элементы. Так, в сильнощелочных кислородных водах легко мигриру-
ют Na, Li, F, Мо, U, Y, Be, В и многие другие элементы, но эти воды
«запрещены» дляСа, Mg, Ва, Sr, Fe. Температурные условия влияют на
свойства вод как среды миграции. Классы вод зоны гипергенеза в даль-
нейшем мы обозначаем арабскими буквами, а классы термальных вод—
— римскими (преимущественно для гидротерм 40—200 °C). В термаль-
ных водах также выделяются классы по величине pH, однако града-
ции для них еще не установлены.
Щелочно-кислотная зональность, щелочные и кислые геохимичес-
кие барьеры. Элементы, образующие сильные катионы (К+, Na+,
Са2+, Mg2+, Fe2+ и др.), имеют значительно более высокие кларки,
чем элементы, образующие сильные анионы (Cl, F, С, V, S, Р и др.).
Поэтому кислые воды, взаимодействуя с горными породами, усред-
няются. кислая реакция сменяется нейтральной и щелочной.
152
Кларки, катионогенных Кларки анионогенных
элементов элементов
Са —2,96 С1—1.7-10-2
Na —2,50 S —4,7-IO-2
Mg—1,87 Р —9,3-10-2
К —2,50 С —2,3-10-2
----------------------------------------------------------------------------------------F — 6,6 • 10”2
2 = 9,83 -
2 = 0,25
По влиянию на кислотность вод С. С. Смирнов разделил минера-
лы зоны окисления сульфидных месторождений на активные, полу ак-
тивные и неактивные. Эта классификация применима и к другим сис-
темам, причем минералы могут быть активными в одной системе и неак-
тивными в другой. Например, пирит активен в коре выветривания, где
его окисление приводит к появлению H2SO4, но этот же минерал неак-
тивен в глубоких горизонтах подземных вод, не содержащих О2.
Кальцит активен во влажном климате, где грунтовые воды слабо
минерализованы, имеют кислую реакцию и растворяют известняки.
В сухом климате кальцит часто неактивен, так как сильноминерализо-
ванные хлоридно-сульфатные воды здесь насыщены СаСО3 и не раст-
воряют этот минерал.
П. А. Удодов, И. П. Онуфриенок и П. В. Кристалев ввели понятие о
химической активности горных пород, характеризующейся величиной
изменения pH раствора при его взаимодействии с минералами и поро-
дами. Ими предложены два показателя: 1) химическая активность в
кислых растворах с pH == <3 (АК 3,0), 2) химическая активность в дис-
тиллированной воде с pH = 6,2 (АВ 6,2). Например, АК кальцита
равно 8,2. Это говорит о его высокой химической активности в кислой
среде. А пирит неактивен, так как при его взаимодействии с кислотой
pH не увеличивается (АК 3,0).
В результате смены кислых условий щелочными и наоборот в зем-
ной коре возникает кислотно-щелочная зональность, а в местах резко-
го повышения pH формируется щелочной барьер D. Он имеет особенно
большое значение для концентрации катионогенных элементов, интен-
сивность миграции которых в кислой среде выше, чем в щелочной.
Щелочной барьер возникает и там, где слабощелочная среда сменяется
резкощелочной, а также где сильнокислая среда сменяется слабокис-
лой. На D барьере образуются многие минералы — гидроксиды, карбо-
наты, фосфаты, арсенаты, ванадаты и др.
При резком уменьшении pH возникает кислый барьер Е, на кото-
ром концентрируются анионогенные элементы — Si, Ge, Мо и др.
Роль этого барьера в образовании минералов, руд и аномалий меньше,
чем щелочного. Как и щелочной, кислый барьер может проявляться
и в щелочных, и в кислых условиях — лишь бы понижался pH.Кис-
лые и щелочные барьеры характерны как для гипергенных, так и гид-
ротермальных систем.
Зоны выщелачивания. Процесс удаления из горных пород подвиж-
ных элементов называется выщелачиванием. Основной каркас породы
153
при этом сохраняется, порода обогащается менее подвижными элемен-
тами и минералами (кварцем, каолинитом и др.). Выщелачивание иг-
рает важную роль в формировании химического состава подземных
вод, в том числе рудоносных растворов. Ранее процессы выщелачива-
ния изучались представителями разных наук в зависимости от объек-
та исследования (почвы, коры выветривания, осадочные породы, мета-
соматиты и т.д.). Однако независимо от объекта во всех случаях имеет
место взаимодействие вод с литосферой, что позволяет рассматривать
зоны выщелачивания с общих геохимических позиций. Практическое
значение подобных исследований очень велико, в частности, при прог-
нозировании и поисках рудных месторождений, охране окружающей
среды, подземном выщелачивании руд, строительстве и т.д.
В соответствии с классами вод выделяется 12 классов гидротер-
мального и гипергенного выщелачивания (по четыре в каждом типе
вод).
Хорошо изучено сернокислое выщелачивание на выходах суль-
фидных руд, кислое выщелачивание в тропических корах выветривания
и гидротермальных метасоматитах. С кислым выщелачиванием свя-
зано удаление из пород преимущественно катионогенных элементов
(Са, Mg, Fe, Ni, Си, Со, Zn, Sr и др.). Для щелочного выщелачивания
характерен вынос анионогенных элементов (Si, Ge, Мо, V и др.).
Важное значение имеют также кислое глеевое, содовое и прочее вы-
щелачивание.
По И. С. Гольдбергу и др., в процессах выщелачивания играют
роль и электрохимические явления. В теллурических электрических
полях происходит перераспределение металлов, вынос их из вмещаю-
щих пород и осаждение на геохимических барьерах. В лабораторных
экспериментах электрохимическое выщелачивание было установлено
на порошках 20 пород и минералов — дунита с Полярного Урала, гра-
нитов и сланцев разных регионов, бокситов Тургая, песчаников, квар-
цитов и др. При этом в анолите накапливались анионогенные элемен-
ты и часть катионогенных (Si, Al, Mg, Fe, Pb, Си), а в католит посту-
пали Ca, Al, Mg, Fe и другие катионогенные элементы. Для микро-
элементов (в том числе рудных) степень извлечения достигала десят-
ков процентов.
На многих рудных месторождениях обнаружены отрицательные
аномалии во вмещающих породах. Эти зоны выщелачивания служат
источником элементов для рудообразования, причем масштабы выно-
са и накопления металлов (запасы руд) вполне сопоставимы. Отрица-
тельные аномалии служат также прямыми поисковыми признаками
руд. Электрохимическая природа таких зон выщелачивания в ряде
случаев не исключается.
Поля устойчивости минералов и ионов. Условия существования
минералов и ионов можно изобразить как функцию различных пара-
метров — Eh, pH, давления СО2 и т. д. Широкое распространение по-
лучили Eh — pH-диаграммы, на которых показывают соотношения
между компонентами после достижения термодинамического равнове-
154
сия. На рис. 37 показаны поля устойчивости ионов и гидроксидов ме-
таллов VIII и 16 группы периодической системы. Становится понят-
ной причина существования самородной Си (Eh до 0,2 В) и отсутствие
самородных Ni и Со (столь низкие Eh отсутствуют). Видно, что реак-
Рис. 37. Поля устойчивости ионов и гидроксидов ред-
ких металлов в группах VIII и 16 периодической си-
стемы Д. И. Менделеева. Температура 25°С, давле-
ние 101 325 Па, концентрация ионов редких металлов
10 7 моль/л (по К. Краускопфу)
ция Cu2+ -> Си+ осуществляется в более восстановительных услови-
ях. чем Fe3+->Fe2+, Мп4+->Мп2+, V4+->V3+. Поэтому такие вос-
становленные соединения, как FeCO3, MnCO3, V2O3 и др., встречаются
вместе с окисленными соединениями Си (CuSO4 и др.). Например, в бо-
лотах тайги и тундры наблюдается совместная миграция Fe2+, Мп2+,
Си2+.
155
Eh — pH-диаграммы наглядно показывают отмеченное ранее из-
менение границы между окислительной и восстановительной средами
в зависимости от pH: окисление в щелочных условиях протекает при
более низких значениях Eh, чем в кислых. Так, если в сильнокислой
среде зоны окисления сульфидных месторождений (при Eh + 0,5 В)
Fe находится в двухвалентной форме в виде FeSO4, то в почвах степей
при pH 7—8 подобный Eh уже определяет окисление Fe2+ до Fe3+.
Иначе говоря, в сильнокислых средах окислительно-восстановитель-
ная граница для железа лежит в пределах от 4- 0,4 до + 0,3 В, а в
щелочных средах она ниже нуля.
Большое значение при расчете полей устойчивости имеет третий
параметр — парциальное давление СО2 и других газов (О2, H2S). Из-
вестны Eh — pH —рСО2-диаграммы соединений U и других металлов.
В земной коре многие химические реакции неравновесны или про-
текают очень медленно (кинетический фактор), поэтому возможны от-
клонения от условий, изображенных на Eh — pH-диаграммах. С ни-
ми связаны ассоциации минералов, отличные от теоретически выве-
денных полей устойчивости (свежие сульфидные выходы в полярных
условиях и др.). Полевые шпаты термодинамически неустойчивы на
земной поверхности, но скорость их выветривания в сухом климате
очень мала, и аркозовые пески существуют неопределенно долгое вре-
мя. Сказанное ограничивает возможности использования Eh — рН-
диаграмм. Следует также учитывать отмеченную И. К. Карповым «не-
вольную фетишизацию условно выбранной системы координат, которая
ведет к перестановке причины и следствия». Напомним также об из-
менении полей устойчивости с изменением концентрации растворов,
температуры и давления.
Общая минерализация вод. По этому параметру выделяется сле-
дующий таксон нашей классификации—семейства вод, границы между
которыми носят искусственный характер. Условно выделено пять се-
мейств.
1. Ультрапресные воды ( </ 0,1 г/л) широко распространены в при-
роде, к ним относятся многие атмосферные осадки, поверхностные и
грунтовые воды материков в районах влажного климата. Эти воды не
насыщены практически всеми минеральными соединениями, поэтому
из них не осаждаются соли. Наоборот, они обладают большой раство-
ряющей способностью.
2. Пресные воды (0,1 — 1 г/л) характерны для большинства рек и
озер влажного климата, многих грунтовых, пластовых и трещинных
вод. Эти воды составляют главную базу питьевого и технического
водоснабжения.
3. Солоноватые воды (1—3 г/л) широко распространены в степях,
пустынях и сухих саваннах, в артезианских бассейнах. Они насыще-
ны СаСО3, MgCO3, и частично CaSO4. Поэтому растворяющая способ-
ность вод ослаблена, при небольшом повышении концентрации из них
осаждаются труднорастворимые соли, которые обусловливают карбо-
натизацию и огипсование почв и пород.
156
4. Соленые воды (3—36 г/л). К ним относятся океанические, многие
поверхностные и подземные воды материков. Это самые распростра-
ненные воды нашей планеты.
5. Рассолы (> 36 г/л). Они характерны для некоторых соленых
озер, глубоких горизонтов пластовых вод, глубоких трещинных вод
изверженных пород. Преобладают хлоридные рассолы. Е. В. Пин-
некер делит рассолы на слабые (36—150 г/л), крепкие (150—320),
весьма крепкие (320—500) и предельно насыщенные (> 500 г/л).
Самая детальная классификация вод по общей минерализации раз-
работана Н. И. Толстихиным. Ученый, например, выделяет сверхпрес-
ные воды с минерализацией менее 0,01 г/л, к которым относятся льды
и снега Центральной Антарктиды, высокогорий. Очень пресные воды
с минерализацией 0,01—0,03 г/л характерны для атмосферных осад-
ков районов влажного климата. Рассолы в этой классификации делят-
ся на семь типов — от весьма слабых до сверхкрепких.
Гидротермы по минерализации также расчленяются на семейства,
однако таксономическое значение данного признака для терм еще
требует обоснования. Число семейств неясно, ультрапресные воды не
характерны, но остальные семейства, возможно, существуют, хотя
их градации могут быть и иными, чем у холодных вод. Весьма харак-
терны для терм рассолы.
Растворенное органическое вещество (РОВ). Большинство вод
земной коры содержит РОВ. В нем выделяют вещества гумусового и
нефтяного ряда. В биосфере главный процесс образования РОВ —
микробиологическое разложение растительных и животных остатков.
При этом происходит и синтез новых специфических высокомолеку-
лярных соединений темного цвета — гумусовых веществ. По составу
и свойствам они резко отличаются от органических соединений орга-
низмов. Хотя гумус почв и вод изучается почти 200 лет, состав и про-
цессы образования его таят еще много загадок. В. И. Вернадский пи-
сал о гумусе, что это очень устойчивые тела в «природе» — в биосфере,
изменяющиеся химически лишь медленно и с большим трудом, что
они не могут быть изучаемы обычными методами химии, созданными в
ином порядке идей. Многие природные воды содержат и РОВ нефтя-
ного ряда — различные углеводороды и их производные. Обнаружены
в водах и органические соединения, характерные для живых организ-
мов, — белки, аминокислоты, углеводы, уксусная, масляная и другие
кислоты, жиры, эфиры, альдегиды и т.д. (рис. 38).
Реки и озера влажного климата содержат до 100 мг/л РОВ гумусо-
вого типа. Воды в этом случае приобретают цвет крепкого чая (реки
лесных районов Западной Сибири, Амазонии). Во многих случаях РОВ
преобладает над минеральными соединениями (в реках Амазонии РОВ
составляет до 70 % растворенных веществ). С 50-х годов в СССР сис-
тематически изучается РОВ подземных вод. Наметилось особое науч-
ное направление — органическая гидрогеохимия (В. М. Швец).
Среднее содержание органического углерода (Сорг) в грунтовых во-
дах влажного климата составляет 35 мг/л, в степях и пустынях —
157
20 мг/л. Значительно больше органических соединений в глубоких
напорных подземных водах: в нефтегазоносных провинциях среднее
содержание РОВ (Сорг) составляет 55 мг/л, в районах нефтяных и га-
зовых месторождений — многие сотни мг/л. В провинциях, где нефть
и газ отсутствуют, глубокие подземные воды в среднем содержат
40 мг/л Сорг. Общая масса органических веществ в подземных водах,
по В. М. Швецу, составляет 2,5- 1012т, т. е. более чем в 10 раз превыша-
Рнс. 38. Основные районы распространения поверхностных и грунтовых
вод, богатых растворенным органическим веществом (РОВ) иа территории
СССР
ет запасы нефти, в 2,5 раза — запасы торфа и лишь в 2 раза меньше за-
пасов каменного угля.
Среднее содержание Сорг в океане 1,6 мг/л, т. е. меньше, чем в реч-
ных и подземных водах, но общее количество Сорг в океане достигает
2,13-Ю12 т—примерно столько же, сколько и в подземных водах.
РОВ сильно влияет на миграцию, так как многие элементы образу-
ют растворимые соединения, в которых молекула органического ве-
щества захватывает неорганический ион (хелаты). Миграция элемен-
тов в такой форме имеет большое геохимическое значение. Например,
во многих водах минеральные формы Au малоподвижны, а органо-ми-
неральные хорошо растворимы. По Ю.Ю. Бугельскому, для никеле-
носной коры выветривания характерны никельорганические соедине-
ния. Эта форма часто превышает 50 % всего количества растворен-
ного Ni. В ультрапресных водах горной тайги Якутии РОВ составля-
158
ет от 10 до 75% общей суммы растворенных веществ; главным компо-
нентом РОВ являются фульвокислоты. Fe, Al, Ti, Мп, V, Cu, Ni и
другие элементы мигрируют в форме органических комплексов и
только Na+, К+, С1~ и SO‘f~— в ионной форме (И. Б. Никитина). По
Б. Ф. Мицкевичу, в обогащенных РОВ поверхностных водах Украин-
ского Полесья Be более подвижен, чем в бедных РОВ водах лесосте-
пи и степи.
РОВ имеется и в гидротермах. Установлено, что в горячих хлорид-
но-сульфатных водах Камчатки Cu, Zn, Аи и другие металлы мигриру-
ют в составе органических комплексов. В гидротермальных растворах
эта форма переноса элементов имеет важное значение. РОВ установ-
лено в газово-жидких включениях в минералах. На многих гидротер-
мальных месторождениях установлены рудоносные битумы.
Все эти данные существенно меняют теоретические представления
о водной миграции. Входя в состав органического соединения, элемент
как бы утрачивает свои индивидуальные химические свойства, и са-
мые различные элементы мигрируют с равной интенсивностью, опре-
деляемой интенсивностью миграции РОВ.
В качестве первого приближения автор предложил выделить по со-
держанию РОВ четыре рода вод:
1. Воды, богатые РОВ гумусового ряда, в соединении с которыми
мигрируют и многие рудные элементы.
2. Воды, богатые РОВ нефтяного ряда, особенно характерные для
глубоких подземных вод нефтегазовых месторождений. Среднее со-
держание Сорг в подобных водах, по В. М. Швецу, колеблется от
35 до 800 мг/л (максимум 4500 мг/л). В составе РОВ преобладают низ-
комолекулярные жирные кислоты, обнаружены также нафтеновые
кислоты, бензол, толуол, фенолы, спирты, сложные эфиры. Есть и
вещества гумусового ряда.
3. Воды, бедные РОВ. К ним относятся воды некоторых горных
рек, изверженных пород, аридных районов, высокогорных озер и т.д.
4. Воды, промежуточные по содержанию РОВ, к которым относят-
ся океанические и многие другие воды.
Ионный состав вод. Последний таксон предлагаемой классифика-
ции — вид, выделяется по этому параметру. Почти все химические
элементы мигрируют в иоиной форме, но систематическое значение
имеют только ведущие ионы, т. е. ионы элементов с высокими кларка-
ми — О, Са, Mg, Na, К, Cl, S и др. Редкие элементы из-за низкого
кларка содержатся в водах в ничтожных количествах — часто менее
п-10-5 г/л (до n-10~u г/л у Ra), что исключает существенное влияние
их ионов на геохимические свойства вод, т. е. на способность вод опре-
делять условия миграции элементов.
В зоне гипергенеза в водах наиболее распространены шесть ионов —
три катиона (Са2+, Mg2+, Na+) и три аниона (НСОГ, SOf-, С1_).
Реже ведущее значение приобретают карбонат-ион (СО§~), гидросуль-
фид-ион (HS-), сульфид-ион (S2-). В гидротермах возрастает роль и
других ионов, например фтор-иона (F~). Исключительно велико зна-
159
чение Н+- и ОН~-ионов, по содержанию которых выделяются крупные
таксоны — классы вод.
Большинство ионов металлов в водах представлены гидроксокомп-
лексами, полимерными ионами и комплексными соединениями с анио-
нами. Например, Нв+ в растворах образует сложный катион уранил
UO£ + , который нередко дает гидроксокомплексы или входит в состав
комплексных анионов. Поэтому в водах в зависимости от их свойств
могут присутствовать иО2+, UO2 (ОН)+, UO2 (СО3)2 (ЩО)!-,
иО2(СО„)з- и другие ионы (а также недиссоциированные молекулы
UO2 (ОН)2). Комплексные ионы очень характерны и для термальных
вод.
Анализ газово-жидких включений, изучение состава гидротермаль-
ных минералов, термодинамические расчеты свидетельствуют о боль-
шом разнообразии ионов гидротерм. Так, для Си приводятся ионы Си2+,
CuHSO4+, ГСи (СО3)2]2-, Си(ОН)+, Си+, СиС1 + ; для свинца — РЬС1+,
PbF+, Pb (ОН)+, [Pb (ОН)1Г, PbHS+, [Pb (HS)3]-t [Pb (S2O3)2P- и
т. д. He менее разнообразны и ионы Mo в термальных водах. По В. И.
Рехарскому, этот металл образует оксимолибдатные, кремнемолибде-
новые, молибден-урановые, молибдатные, гидросульфид-молибдатные
и другие комплексные ионы. Молибден-урановые комплексы, например,
имеют состав [UO2 (МоО4)2]2-, [UO2MoO4 (ОН)2[2-. В. Л. Барсуков
показал, что в переносе олова важное значение имеют фторгидроксиль-
ные комплексы типа Sn (F, ОН)!-.
Среди ведущих ионов в гидротермах большое значение придается
хлор-иону (С1~), многие гидротермы имеют хлоридный состав. Этот
ион образует растворимые комплексы типа МеС1+ с большинством ме-
таллов.
В связи с широким распространением в водах комплексных ионов
обычная форма выражения химических анализов вод в виде простых
ионов, как правило, не отражает реального ионного состава вод.
Ионный состав вод определяет их важные геохимические особенно-
сти, использование в народном хозяйстве и медицине — пригодность
для водоснабжения, орошения, лечения болезней и т.д. Поэтому опре-
деление в водах шести главных ионов выполняется при любых исследо-
ваниях вод. Объем информации по данному вопросу огромен. Это, ес-
тественно, вызвало необходимость классифицировать воды по ионному
составу, по преобладанию тех или иных ведущих ионов (при этом учи-
тывают не массовые, а эквивалентные количества ионов).
На основе соотношений между ионами построены классификации
вод О. А. Алекина, О. А. Бозояна, А. А. Бродского, М. Г. Валяшко,
К. Е. Питьевой, В. А. Приклонского, В. А. Сулина, Н. И. Толстихи-
на, С. А. Щукарева и др. Использовав математическую теорию соеди-
нений (комбинаторику) и введя ряд ограничений, О. С. Джикия выде-
лил 625 классов вод по ионному составу.
Большинство авторов выделяют по анионному составу гидрокар-
бонатные (карбонатные), сульфатные и хлоридные воды. Дальнейшее
деление проводится по катионам и соотношениям ионов. Число видов
160
вод как наиболее мелкой таксономической единицы велико. Возмож-
но, что рационально выделять виды по анионам, подвиды — по катио-
нам, разности — по их соотношению и т. д. Все классификации вод
по ионному составу относятся к холодным и слабонагретым водам.
В горячих и перегретых водах состав ведущих ионов существенно ме-
няется, в них большое значение приобретают анионы кремневой, фто-
ристоводородной и других кислот.
Ионный состав вод при всем его большом научном и практическом
значении все же часто не определяет геохимическое своеобразие вод.
Во многих случаях его роль отступает на задний план, так как в во-
дах химические элементы находятся как в ионной, так и в неионной
форме. Именно поэтому свойства ионов не могут объяснить все особен-
ности водной миграции. Для объяснения специфики некоторых вод,
например, богатых РОВ, они вообще неприменимы. Использование в
подобных случаях данных о шести компонентном составе, понятия о
радиусах и других характеристиках ионов в качестве главных харак-
теристик вод методологически несостоятельно.
Коллоидная миграция и сорбция
Миграция веществ в коллоидном состоянии характерна для мно-
гих систем земной коры, особенно для зоны гипергенеза. В районах с
влажным климатом большая часть Fe, Al, Мп, As, Zr, Мо, Ti, V, Сг,
Th и ряда других элементов мигрирует в коллоидной форме. Си, РЬ,
Zn, Ni, Со, Sn также частично мигрируют в коллоидной форме. Из кол-
лоидных растворов (золей) эти элементы осаждаются и входят в состав
богатых водой студенистых осадков — гелей. Гели образуются и при
осаждении элементов из истинных растворов.
Напомним, что, по А. А. Беусу, гранитная оболочка на 99,65 %
состоит'из 12 элементов, из которых Na, Са, К, Mg, Cl и S (8,65 %) в
процессе выветривания сравнительно легко покидают кристаллические
решетки минералов и образуют простые легко- и труднорастворимые
соли (СаСО3, Na2SO4 и др.). Часть атомов этих элементов в водах об-
разует простые или комплексные ионы (Na+, Са2+, SOI-, НСО-Г и
др.), часть поглощается организмами и коллоидными системами;
42,9 % гранитной оболочки состоит из Si, Fe, Al, Ti и Mn, которые в
земной коре образуют менее растворимые соединения. Их содержание
в водах и организмах ниже, они часто мигрируют в коллоидной фор-
ме. Эти элементы легко образуют гели, со временем теряющие часть во-
ды и приобретающие кристаллическую структуру. Если последняя
обнаруживается невооруженным глазом или под микроскопом, то та-
кие былые гели называют метаколлоидами. Рентгеноструктурный ана-
лиз и электронная микроскопия позволили установить «квазиколлоид-
ную» природу многих веществ, состоящих из ультрамелких кристалли-
ческих частиц.
В почвах и корах выветривания гумидных районов коллоидные ми-
нералы мигрируют в виде тонких взвесей. При осаждении оси ориенти-
6 Зак. 2022
16]
руются одинаково, образуя метакинематические микроструктуры
в виде тонких глинистых пленок на отдельностях почв, по трещинам,
порам и т. д. Геохимическая роль этих микроструктур изучена недо-
статочно, возможно, они сорбируют подвижные химические элементы
и влияют тем самым на формирование химического состава вод.
В почвах и континентальных отложениях аридных районов много
кальцита, воды имеют слабощелочную реакцию, не содержат или почти
не содержат органических кислот. Все это не благоприятствует колло-
идной миграции. Однако и в этих районах известны коллоидные раст-
воры, содержащие кремнезем, соединения А1 и других элементов (осо-
бенно в содовых водах). В болотах здесь мигрируют гумус и другие кол-
лоиды.
Таким образом, коллоидное и метаколлоидное состояние вещества
характерно для продуктов выветривания. При интенсивном выветри-
вании почти вся твердая фаза почв и кор выветривания находится в
коллоидном состоянии или же проходит через него. Таковы многочис-
ленные глинистые минералы, гидроксиды Si, Fe, Al и Мп, гумусовые
вещества. Известны коллоидные и мета коллоидные карбонаты (разно-
видности кальцита, магнезита, сидерита, смитсонита и др.), сульфаты
(барит и др.), фосфаты, ванадаты (Ф. В. Чухров).
По В. В. Добровольскому, в гумидных областях развит гиперген-
ный метасоматоз, в ходе которого коллоидные гидроксиды Fe и Мп
замещают глинистые минералы, обломочные силикаты и алюмосилика-
ты, а местами и кварц. В аридных районах метасоматоз распростра-
нен меньше — здесь кальцит замещает глинистые минералы, обломоч-
ные минералы изменены слабо. При гипергенном метасоматозе часть
замещаемых веществ поглощается коллоидами, образуя различные
примеси (SiO2, А12О3 и др.), часть переходит в подземные и поверхно-
стные воды.
Коллоидные явления характерны и для гидротермальных систем,
где в коллоидной форме мигрируют органические вещества битумного
типа (эмульсии), некоторые минеральные соединения. Например, из-
вестны термальные сероводородные хлоридные рассолы, представляю-
щие собой золи коллоидного FeS. Колломорфные формы и метакол-
лоидное состояние известно у пирита, сфалерита, молибденита, насту-
рана, агата, силикатов и других жильных и рудных минералов.
Сорбция. На раздробление вещества и образование коллоидов за-
трачивается энергия, которая частично превращается в геохимиче-
скую энергию сорбции. Поверхность отдельной коллоидной частицы
ничтожна, ничтожна и ее способность поглощать различные вещества
из окружающей среды (поверхностная энергия). Однако суммарная
поверхность 1 г коллоидной фракции в сотни тысяч и миллионы раз
больше поверхности 1 г частиц, видимых простым глазом (поверхность
1 г бентонитовых глин колеблется от 40 до 96 м2, каолиновых — от
17 до 65 м2). Поэтому значительна и поверхностная энергия природ-
ных коллоидов, проявляющаяся в сорбции и теплоте смачивания. Мно-
162
Рис. 39. Опыт, демонстрирующий об-
менную адсорбцию катионов, п и tn —
эквивалентные количества ионов
гие металлы сорбируются тонкодисперсными частицами и мигрируют
вместе с этими взвесями.
Неполярная сорбция состоит в поглощении из раствора целых мо-
лекул, например газов и паров, молекул органических веществ. В зо-
не гипергенеза многие глинистые минералы сорбируют из вод органи-
ческие молекулы. Велика геохимическая роль и полярной сорбции —
ионного обмена.
Еще в прошлом столетии было доказано, что цеолиты, почвы, илы,
глины способны поглощать из растворов ионы. Так, если промывать
дистиллированной водой на ворон-
ке незасоленную глину, то очень
небольшое количество ионов Са2+
и Mg2+ перейдет в фильтрат
(рис. 39) (не более 0,0 п% от массы
глины). Если вместо воды приме-
нить раствор соли, например NaCl,
то количество С1_ в фильтрате по-
чти не изменится, содержание Na+
уменьшится и появятся Са2+ и Mg2+
в количестве, эквивалентном исчез-
нувшему Na+. Следовательно, гли-
на поглотила Na+ и взамен выде-
лила в раствор эквивалентное ко-
личество Са2+ и Mg24, т. е. глины
способны обменивать ионы.
Правильное истолкование ион-
ного обмена и, что особенно важно,
его приложение к природным про-
цессам было дано выдающимся со-
ветским ученым К. К. Гедройцем( 1872—1932). В серии блестящих экс-
периментов он доказал, что каждая почва, глина, всякая мелкоземи-
стая порода содержит катионы, которые, не растворяясь в дистилли-
рованной воде, переходят в раствор нейтральной соли. При этом часть
катионов нейтральной соли в эквивалентных количествах поглощает-
ся твердой фазой. Количество аниона нейтральной соли в большинстве
случаев не меняется.
Катионы твердой фазы, способные обмениваться на катионы раство-
ра, Гедройц назвал обменными катионами. Они связаны преимущест-
венно с коллоидной частью почв и пород.
Наиболее энергично поглощаются многовалентные катионы (/?),
т. е. энергия поглощения R3+ > R2+ > R+. Среди ионов с одина-
ковой валентностью энергия поглощения растет с ростом атомной
массы и радиуса иона (Li+ < Na+ < К+ < Rb+ <2 Cs+ и т.д.). По-
этому К+ поглощается энергичнее Nar. Крупный катион уранил UOjp
легко сорбируется гидроксидами Fe, бурым углем, фосфоритами, као-
линитом и монтмориллонитом. Неминеральную форму нахождения U
во многих глинах, углях некоторые авторы объясняют сорбцией его из
6*
163
природных вод. Согласно венгерскому ученому А. Салаи, при pH 3 —
—7 гумус адсорбирует U из очень разбавленных растворов. Так. при
концентрации U 1-Ю-5 г/л его содержание в торфе может составить
0,01 %. Торф сорбирует до 10 % U.
Обменная сорбция подчиняется закону действия масс, она тем
интенсивнее, чем выше концентрация катионов в водах.
Обменные катионы появляются в породах и почвах либо при вывет-
ривании минералов, т. е. в результате перехода катионов из необмен-
ного состояния в обменное, либо за счет поглощения катионов из миг-
рирующих вод (при этом происходит ионный обмен и часть обменных
катионов породы переходит в воды).
Фракцию, способную к ионному обмену, Гедройц назвал по-
глощающим комплексом (иногда ее называют коллоидным комплексом).
Почвы и породы всегда содержат некоторое количество обменных
катионов. Общее их количество — емкость поглощения — обычно не
превышает 1% (60—70 мг-экв). При расчете на коллоидную фракцию
или отдельные минералы эта величина возрастает в несколько раз.
Ионный обмен связан со структурными особенностями минералов.
Играет роль и различное энергетическое состояние ионов на поверх-
ности частицы и в глубине кристаллической решетки. В отличие от
внутренних зон коллоидной частицы электрические заряды на ее по-
верхности не полностью нейтрализованы соседними ионами. В резуль-
тате поверхность частицы приобретает электрический заряд — отрица-
тельный или положительный.
В земной коре преобладают отрицательно заряженные коллоиды—
глинистые минералы, органические вещества гумусового ряда,
гель кремнекислоты, гидроксиды Мп и др. Они способны поглощать
из раствора катионы, которые сравнительно слабо связываются по-
верхностью и могут обмениваться на другие катионы. Помимо Са2+,
Mg2+, К+, Na+, Rb+, Cs+, Li+, Sr2+, Ba2+, Ra2+, сорбируются и тя-
желые металлы — Cu2+, Pb2+, Ag+, Hg2+ и др. Менее распростране-
ны положительно заряженные коллоиды, к которым относятся гидро-
ксиды Fe, Al, Ti, Zr и др. Они способны обменивать С1~, SOI-, РО®-,
VO®- и другие анионы. Так, в осадочных железных рудах нередко по-
вышено содержание Р, V, As, сорбированных положительно заряжен-
ными гелями гидроксидов Fe.
Рассмотрим некоторые реакции ионного обмена. Если сульфатно-
кальциевые (или магниевые) подземные воды мигрируют среди глини-
стых пород морского происхождения, обычно содержащих обменный
Na+, то наблюдается следующая реакция:
глина = 2Na+ + CaSO4 ч=ь Na2SO4 + глина = Са2+
глина = 2Na+ + MgSO4 ч=± Na2SO4 + глина = Mg2+
Символом глина = Са2+ обозначена глина, содержащая обменный
Са2+, глина = Mg2+ — Mg2+.
164
Постепенно весь обменный натрий глин переходит в раствор, воды
из сульфатно-кальциевых (магниевых) превращаются в сульфатно-на-
триевые, а поглощающий комплекс из типично морского натриевого
становится типично континентальным — кальциево-магниевым.
Возможны и обратные реакции: сульфатно-натриевые воды, миг-
рируя среди горных пород, поглощающий комплекс которых насы-
щен Са2+, обменивают Na+ на обменный Са2+ породы. Кальций, сое-
диняясь с SOF раствора, образует труднорастворимый гипс. Таково
происхождение некоторых гипсовых аккумуляций в глинах и почвах:
глина = Са2+ + 2Na+ 4- SOF Hr 2Н2О глина = 2Na+ + Са^гн^О
гипс
В земной коре широко распространены коллоидные гидроксиды
Мп в виде черных примазок, конкреций, порошков и т. п. (псиломела-
ны— МпО-МпО2-пН2О и другие минералы). Они нередко содержат
примесь Ni, Со, Cu, Zn, Hg, Au, Ва и других катионогенных элементов,
сорбированных гелем гидроксидов Мп, заряженного отрицательно.
В илах озер среди обменных катионов обычно преобладают Са2+ и
Mg2+. В воде соленых озер, отшнуровавшихся от моря, в процессе ис-
парения резко повышается содержание Na+ и С1~ и уменьшается со-
держание SOF за счет выпадения гипса. Наступает и такой момент,
когда Na+ озерной воды начинает вытеснять Са2+ и Mg2+ из озерных
илов:
ил = Са2+ 4- 2Na+ ил = 2Na++ Са2+
ил — Mg2+ + 2Na+ ?± ил= 2Na+ + Mg2+
В результате в иле накапливается обменный Na+, а Са2+ и Mg2~
поступают в озерную воду, состав которой становится хлоркальцие-
вым или хлормагниевым.
Следовательно, поглощающий комплекс является потенциаль-
ным источником катионов (реже анионов), которые в ходе различных
процессов сравнительно легко и быстро мобилизуются и переводятся
в раствор. Поэтому хотя обменные катионы и входят в состав твердой
фазы, они обладают значительно большей миграционной способно-
стью, чем необменные. Иначе говоря, в каждой глине в каждой поч-
ве необходимо различать две категории катионов: одни легко перехо-
дят в раствор и способны участвовать в реакциях —обменные катионы,
а другие прочно закреплены в узлах кристаллических решеток и могут
переходить в раствор лишь в результате разрушения минералов в хо-
де длительных процессов выветривания (переход в раствор К, Na,
Са полевых шпатов, К и Mg слюд и т.д.).
Между катионами вод и обменными катионами пород наблюдает-
ся определенное соответствие: по составу обменных катионов можно
судить о составе природных вод, и наоборот. Так, если поглощающий
комплекс насыщен Са2+ и Mg2+, то циркулирующие по таким поро-
дам воды будут иметь нейтральную или слабощелочную реакцию и
кальциевый состав (гидрокарбонатно-кальциевые или сульфатно-
165
кальциевые воды). Если поглощающий комплекс содержит Н+ или
А13+, то грунтовые воды имеют слабокислую реакцию, и содержание
Са2+ в них значительно меньше. Если породы содержат обменный
Na+ и не содержат легкорастворимые соли, то воды содержат некото-
рое количество соды. Кальциевые воды способствуют насыщению по-
глощающего комплекса Са2+, натриевые воды — Na+ и т.д.
Ионный обмен может быть и необратимым, если ионы поглощают-
ся поверхностью коллоида и образуют прочное химическое соедине-
ние {хемосорбция). В результате последующей кристаллизации воз-
никают минералы. Так, в бурых железняках, сорбировавших VO3-,
образуется ферванит. Аналогично происхождение ферримолибдита,
фосфатов железа и других минералов.
Ионный обмен характерен не только для коллоидов: он известен
и у макрокристаллических силикатов. Еще в XIX в. подобные свойст-
ва были обнаружены у анальцима, шабазита, гарматома, гейландита,
натролита и других цеолитов. В их кристаллической решетке часть
SP+ замещена А13+, недостающий положительный заряд компенсиро-
ван катионами щелочных и щелочноземельных металлов, которые не
связаны со строго определенным положением в решетке и способны к
обмену. По Н. Ф. Целищеву, в гидротермальных и надкритических ус-
ловиях к ионному обмену способны полевые шпаты, фельдшпатиды,
слюды, некоторые титано- и цирконосиликаты, танталониобаты, суль-
фиды и другие минералы. Эксперименты при t 400—500 С и давлении
105 кПа показали, что Na+ и К+ санидина (полевой шпат) и нефелина
могут взаимно замещаться. Максимальная обменная емкость калиевого
полевого шпата 347 мг-экв на 100 г. Ионный обмен К+, Na+, Li+,
Rb+, Cs+ экспериментально установлен у поллуцита, сподумена, слю-
ды. Возможность ионного обмена в этих условиях была доказана так-
же для апатита (Са2+, Na*, Sr2+, La3+, Y3+), пирохлора (Na+,
Ca2+, La3+, Y3+), сфалерита (Zn2+, Fe2+, Cd2+).
Предполагается, что для ионного обмена необходимы «активные
центры обмена», связанные с дефектами в кристаллической решетке,
существование в ней полостей и каналов, в которых и располагаются
обменные катионы.
Апатиты, слюды и глинистые минералы способны обменивать и
анионы.
С ионным обменом связывают альбитизацию калиевых полевых
шпатов, нефелинизацию, гранитизацию гнейсов и другие процессы
метасоматоза.
Итак, с ростом температуры ионный обмен возможен у таких
минералов, как полевые шпаты и фельдшпатоиды. Рост давления
уменьшает обменную емкость. Предполагают, что именно рост давле-
ния ограничивает возможность ионного обмена глубинами первых кило-
метров от земной поверхности.
Обмен ионов часто имеет изоморфный характер: ионно-обменный
изоморфизм развивается эпигенетически, в результате обработки мине-
рала термальными поровыми растворами (изоморфизм, о котором шла
166
речь в гл. 7, возникал в момент кристаллизации минерала из магмы).
Ионно-обменный изоморфизм наиболее выражен у каркасных алюмо-
силикатов, где часть ионов Si4+ заменена на А13+ (обменные катионы
компенсируют разницу в зарядах). К обмену способны крупные низ-
ковалентные катионы, т. е. катионы с низкими ЭК (Na+, К+, Са2+
и т.д.). Высоковалентные элементы с малыми радиусами (большими
ЭК) не участвуют в ионном обмене (Si4+, Al3+, Р5+, Ti4+, Та5+, Nb5+
и другие катионы, образующие устойчивые комплексные анионы с ки-
слородом).
Ионно-обменные свойства минералов используются в нефтепере-
рабатывающей, красильной, пищевой, энергетической и других отрас-
лях промышленности. Цеолиты и другие минералы являются хороши-
ми «молекулярными ситами», с помощью которых очищают сточные
воды, разделяют молекулы разного размера (например, бензины и
другие органические жидкости на фракции), смягчают воду и т.д.
Сорбционные барьеры G. Они возникают на контакте вод с сор-
бентами. Глинами и другими сорбентами поглощаются Са, К, Mg,
Р, S, Rb, V, Cs, Zn, Ni, Co, Cu, Pb, U, As, Mo, Hg, Ra и другие элемен-
ты. Сорбционные барьеры очень характерны для морских и озерных
илов, краевых зон болот, почв и кор выветривания, для контакта глин
и песков в водоносных горизонтах. Существуют сорбционные барьеры
и в гидротермальных системах, но там они изучены слабее, чем в зоне
гипергенеза.
Существенно, что коллоиды сорбируют ионы при их концентра-
ции в водах, не достигающей произведения растворимости. Li, Rb, Tl
и другие редкие элементы, как правило, не образуют насыщенных
растворов, и для них сорбция часто является важнейшим путем пере-
хода из раствора в твердую фазу (другой важный путь — поглоще-
ние живым веществом).
За счет сорбции происходит обогащение глин, гидроксидов Мп,
гумусовых веществ Си, Ni, Со, Ва, Zn, Pb, U, Tl и другими металла-
ми. Поэтому коллоидные минералы богаты примесями. Сорбция в зо-
не гипергенеза выполняет функцию, аналогичную изоморфизму, ко-
торый играет меньшую роль здесь, чем в магматических и гидротер-
мальных процессах. Искусственные сорбционные барьеры предложе-
но использовать при поисках рудных месторождений (В. К. Лукашев
и др.).
Вторичные сорбционные ореолы рассеяния. При фильтрации раст-
воров с рудными элементами через суглинки, глины и другие отложе-
ния, содержащие коллоиды, образуются вторичные сорбционные орео-
лы. рассеяния. При этом концентрация элементов часто не сопровожда-
ется образованием рудных минералов. Состав таких ореолов во многом
зависит от группы глинистых минералов. В каолинитовой группе сорб-
ция металлов ограничена. Минералы группы монтмориллонита легко
поглощают рудные элементы и в ореоле рассеяния возникают значи-
тельные их концентрации, обнаруживаемые при геохимических поис-
ках.
167
J
Важную роль в качестве сорбентов играют гидроксиды Fe и Мп.
На многих полиметаллических месторождениях наблюдаются безмине-
ральные формы Pb, Zn, Си, концентрирующиеся в гидроксидах (до
1 % РЬ, Си и т.д.).
Глинистые отложения, перекрывающие рудные тела Си, Mo, РЬ,
Zn и других металлов, иногда содержат с поверхности (в почвах) по-
вышенные количества сорбированных металлов. На Урале, Алтае и в
других рудных провинциях известны поверхностные ореолы Мо, Си,
Ba, Ag, Pb, Ni, Со и других элементов в почвах, кайнозойских глинах,
перекрывающих медно-колчеданные палеозойские руды, залегающие
на глубине нескольких десятков метров. Медно-никелевое орудене-
ние в докембрии Русской платформы обнаруживается даже при мощ-
ности перекрывающих отложений 100—140 м (рис. 40). При валовом
анализе почв такие «наложенные ореолы» часто не выявляются, но при
обработке почв слабыми кислотами, содой или другими реактивами
их удается установить (С. П. Албул, Л. В. Антропова, Г. Ф. Ларионов,
Ю. Е. Сает и др.). Разработаны особые варианты литохимических по-
исков — сорбционно-солевой метод, почвенно-гидрохимическая съем-
ка, МПФ (выделение из проб металлорганических соединений) и др.,
хотя сам механизм образования вторичных наложенных ореолов не-
достаточно ясен.
Концентрация элементов на физико-химических
барьерах
Концентрация элементов на физико-химических барьерах зависит
от серии барьера (А, В, С, и т. д.) и от состава вод, поступающих к
барьеру. Систематика видов • концентраций элементов показана в
табл. 11. Каждый вид обозначен индексом, включающим символ барь-
ера и класса вод (например, А6, В1). Систематика построена по мат-
ричному принципу, который позволяет выделять новые виды концент-
раций, еще не установленные в природе, т. е. прогнозировать. Поль-
зуясь таблицей-матрицей, можно наметить условия их образования и
сказать, где их можно искать (рис. 41; 42).
Рис. 40. Эпигенетические экзогенные ореолы суммы тяжелых металлов в пере-
крывающей толще полиметаллического месторождения Рудного Алтая (по
Ю. Е. Саету):
' Н ореолы в почвах (/ — в органо-минеральной форме, // солевые ореолы). III — соле-
вые ореолы в перекрывающих отложениях; I—4 — неоген-четвертичные отложения
(/—лёссовидный покровный суглинок. 2 — бурые легкие глины, 3 — шоколадные тя-
желые глины, 4 — сероцветные н зеленоцветиые глины, загипсованные), 5 — пере-
отложенные пестроцветные глинистые продукты древней коры выветривания, 6 — бухтар-
минская свита (известняки, алевролиты, песчаники, гравелиты), 7 — каменевская свита (гли-
нистые алевролиты с прослоями песчаников, туфов и туффитов кислого состава), 8 — Давы-
довская свита (кварцевые альбитофиры, лавобрекчии и вулканические брекчии альбитофи-
ров, туфы кислого состава), 9 — верхнеживетский. нижнефранский субвулкаиический комп-
лекс (кварцевые альбит-порфиры), 10 — окисленное рудное тело, // — зона развития пер-
вичных ореолов, 12 — тектоническое нарушение, 13 — ореолы с 85%-иой вероятностью, 14 —
ореолы с 99%-ной вероятностью, Л, В — почвенные горизонты
169
Рис 41. Геохимические барьеры в земной коре:
/ механические, 2 — физико-химические, 3 — биогеохимические, 4 — техногенные, 5— глубина проникновения кислородных вод в
литосферу, зависящая от климата и геологического строения, А — кислородные, В, С — восстановительные барьеры, приуроченные к
границе проникновения кислородных вод в литосферу
Испарительный барьер б пустыне
A6-G6
Восстанобительный барьер на Выкли-
нивании зоны пластооого окисления
Кислородный барьер на серных рудах
Рис, 42. Виды геохимических барьеров:
/ — геохимические барьеры, 2 — движение химических
элементов к барьеру. 3 — движение химических элемен-
тов oi барьера, 4 символ барьера, 5—-разломы
Воды с окислительной и восстановительной обстановками могут
быть слабоокислительными и резкоокислительными, резковосстано-
вительными и т. д. Поэтому из слабоокислительных вод возможна
концентрация элементов на резкоокислительном барьере (Al — А4),
из слабовосстановительных вод — на резковосстановительном (С5.
С8).
Таблицу 11 можно использовать для систематики видов концент-
рации элементов в гипергенных и гидротермальных системах. Кон-
центрации зоны гипергенеза обозначены арабскими цифрами, гидро-
термальных систем — римскими.
В гл. 14 для гипергенных систем приведены интервалы pH отдель-
ных классов вод, парагенные и запрещенные ассоциации элементов
в них, элементы, концентрирующиеся на отдельных видах барьеров.
Для гидротермальных систем подобные данные пока отсутствуют.
Гидрогеохимические методы поисков полезных ископаемых
и предсказания землетрясений
В основе методов лежит определение индикаторных элементов в по-
верхностных и подземных водах. Водные ореолы и потоки рассеяния
месторождений полезных ископаемых простираются на сотни и тысячи
метров, содержание индикаторных элементов в них обычно в несколь-
ко раз превышает фоновое. Местами коэффициент контрастности до-
стигает сотен и тысяч (рис. 43). При поисках учитываются геологиче-
ские, гидрогеологические и ландшафтные условия района, время по-
исков. Разработана методика для раскрытых горно-складчатых райо-
нов, для полузакрытых и закрытых структур, для районов развития
многолетней мерзлоты, сухих степей и пустынь и т.д. Существует и
подводный вариант метода при поисках газа и нефти на шельфе, при
поисках руд в районах средиино-океанических хребтов, рифтовых зон.
Поиски позволяют обнаруживать перспективные рудные районы
(при масштабе 1:200 000— 1:100 000), открывать зоны минерализации
(1:50 000—1:25 000), оконтуривать рудные участки в пределах руд-
ных полей (1:25 000 и крупнее). В ходе работ составляются специаль-
ные гидрогеохимические карты и профили.
Современные методы анализа позволяют определять в водах п-10-5—
— п-10~7 г/л элементов и менее. Часть анализов выполняется непо-
средственно у водопункта (ручья, источника, колодца, скважины),
а часть — в лаборатории. С помощью гидрогеохимических методов
открыты медно-никелевые, медно-колчеданные и другие месторожде-
ния. Эти методы эффективны также при поисках нефти и газа, калий-
ных солей и других полезных ископаемых.
Гидрогеохимические и гидродинамические аномалии зарегистриро-
ваны накануне многих крупных землетрясений в Средней Азии и дру-
гих регионах. Наряду с изменениями концентраций в подземных во-
дах Не, Rn, СО2 и других газов установлено также изменение общей
минерализации вод, содержания в них Н+, HCOjj", Cl-, F-, SOI-,
172
Таблица 11. Виды концентраций элементов на геохимических барьерах | Состав вод, поступающих к геохимическому барьеру 1 воды с восстановительной обстановкой сероводородные и сульфидные ЭПНЬО1ГЭЩ -оича*иэ -* х << 1 1 Gu 'и^о^яя-^ 1 ’
ЭПНЬОГЭЩ и эпи -qireditfSH - - ^х I ।-х -х~х~-х-Х-х = >< — х << 1 «у ааимУоаях--^^
эштэии -OpBIfO и ЭП1ГЭИИ о _ ОХ| । бх 2'х®Х2®Х2х2Х2Х
Э1Ч1ГЭИМ -ОИЧ1ГНЭ а> X <?>'* | |о>'* 1 1 - << 1 loy Qq 1 1Ьозя;-“ ' 1
бессероводородные воды I (в зоне гнпергеиеза— глеевые) ЭПКЬОЕЭУп -0НЧ1ГИЗ 00 — 00 — зо — то “ I 1 оо" — 9р 00 •— ос — об — 1 1 Г <>»>«> । Ш>М>Я>-> ' 1 < ВО Q UJ О Я -
эпньоггаТп и эпи -чувдщэи < BQ U “Q Ш О — _, Х
ЭП1ГЭИЯ -OpBlfO и ЭП1ГЭИМ
ЭП1ГЭИИ -ОНЧ1ГИЭ 10 > Sq 1 112^^1 i
воды с окислительной 1 обстановкой (кислородные и др.) dRHhOlfdtn -0НЧ1ГИЭ —• । UJ щ О q ® д; — 1 '
ЭПННОЕЭТп И эпи •ч1гвдхрэи То И- ТО|—То“"то“ То~со — ТО ТО ТО — т'— то — - <5<п£и5
ЭП1ГЭИМ -орвгэ И ЭВДГОИМ еч — сч~“еч — сч— — сч = сч"~ — << а Ии У ОДЩШи-ОфЯХУ- — if 2
ЭП1ГЭИИ -ОИЧ1ГИЭ <<совии С5<Э ' iu.qOx- — — I 1
Окислительно-восстановительные характеристики вод щелочно-кислотные характеристики вод в гипергенных системах в том числе бнокосных в гидротермальных си- стемах окислительный (кисло- родный н др.) А сульфидный (сероводо- родный и др.) В восстановительный без H2S (в зоне гипергенеза глеевый) С щелочной D Кислый Е Испарительный Сорбционный Термодинамический Н Сульфатный I Карбонатный К
tfoa яээвг» вдэч<1вд олоиэаьииихоаз ээвг»
173
Qi Ц]3 @4 S‘5 S6 07
Cgli Г+Ъ Pb EJs
Ca2+, Na+ и других ионов. Все эти
показатели предложено использовать
при прогнозировании землетрясений.
Контрольные вопросы
1. Чем поровые растворы отличаются
от «свободной» подземной воды?
2. Какие геохимические проблемы
связаны с изучением тяжелой воды?
3. Расскажите о разложении и синтезе
воды в земной коре.
4. Как определяется интенсивность
водной миграции элементов и почему о ией
нельзя судить только по содержанию эле-
ментов в водах?
5. Охарактеризуйте интенсивность
водной миграции элементов в коре вывет-
риваиия, Мировом океане. В чем сходство
и различия?
6. Каково значение электрохимичес-
ких процессов в земной коре?
7. Почему окислительно-восстанови-
тельный потенциал Eh недостаточен для
геохимической характеристики восстано-
вительной среды? Назовите два основных
геохимических типа этой среды.
Рис. 43. Гидрогеохимические аномалии (по
В. И. Красникову и др.):
А—гидрогеохимические аномалии, связанные сс
слепыми рудными телами в горном районе с глу-
боко промываемыми структурами: 1 — коренные
породы, 2 — аллювиальные отложения, 3 — слепые
рудные тела, 4 — метеорные осадки и фоновые во-
ды, 5 — ореольиые воды, 6 — гидрогеохимические
аномалии (выходы ореольных вод); Б— гидро-
геохимическая аномалия, связанная с перекры-
тым месторождением и его погребенным ореолом
в условиях расчлененного пенеплена: 1 — корей
ные породы, 2— рыхлые отложения, 3 — рудные
тела, 4 — погребенный ореол, 5 — метеорные осад-
ки и фоновые воды, 6 — ореольиые воды, 7 — вы-
ходы ореольных вод; В — гидрогеохимическая
аномалия, связанная с восходящими водами,
омывающими слепые рудные тела; 1 — кристал
лические породы, 2 — зона дробления, 3 — водо-
проницаемые породы, 4 — экранирующий водо
непроницаемый горизонт, 5 — рудные тела, 6 —
метеорные осадки и фоновые межпластовые во
ды, 7 — ореольиые напорные воды, 8 — гидрогео
химическая аномалия; Г — погребенный гидро-
геохимический ореол в межпластовых водах: I -
кристаллический фундамент, 2 — водоиепроиицае
мые осадочные толщи, 3 — водопроницаемые по-
роды, 4 — первичный рудный ореол, 5 — рудное
тело, 6 — метеорные воды, 7 — ореольиые воды-
Д — схема диффузионного гидрогеохимического
ореола над погребенным рудным телом: 1 —
рудное тело, 2 — коренные породы, 3 — рыхлые
отложения, 4 — диффузионный гидрогеохимиче-
ский ореол, 5 — выходы ореольных вод
174
8. Как устанавливаются классы вод зоны гипергеиеза в зависимости от ще-
л^чио-кислотиых условий?
9. Охарактеризуйте окислительио-восстаиовительиую и щелочио-кислот-
иую зональность биокосиых систем и связанные с ней геохимические барьеры.
10. Какие классы зои выщелачивания вы знаете, охарактеризуйте геохими-
ческое значение некоторых из них.
11. Каково геохимическое значение полей устойчивости минералов и ионов,
в чем сильные и слабые стороны этого метода?
12. Расскажите о геохимическом значении растворенного органического ве-
щества.
10. МАГМАТИЧЕСКИЕ СИСТЕМЫ
Основную информацию по геохимии магматизма дают изучение из-
верженных пород, данные эксперимента, осуществляемого при высо-
кой температуре и давлении, исследования современного вулканизма,
данные петрургии (науки о каменном литье), пирометаллургии (науки
о жидких шлаках). Многие магматические системы равновесны, что
позволяет широко применять при их изучении химическую термоди-
намику. Менее изучена кинетика магматизма.
Изверженные породы изучает петрология, или петрография, кото-
рая много внимания уделяет химическому составу горных пород,
эксперименту, использованию законов физической химии, в частности
изучению равновесий в расплавах на основе термодинамики. Возник
самостоятельный раздел петрографии — петрохимия. Основателем
химического направления в петрографии был Ф. Ю. Левинсон-Лес-
синг. Термин «петрохимия» предложил в 1944 г. А. Н. Заварицкий,
которому принадлежат крупные исследования в этой области. Петро-
химия не синоним «геохимии магматических пород». Однако в реаль-
ной научной деятельности петрологи успешно решают геохимические
проблемы, а геохимики — петрохимические. Так, много геохимических
данных содержится в учебнике петрографии, составленном под редак-
цией А. А. Маракушева (Петрография, М., 1976. Т.1; 1981. Т. 2; 1986.
Т. 3). Ниже рассмотрена собственно геохимическая проблематика
магматизма.
Б. Г. Лутц, С. Брукс, Л. В. Таусон и другие геохимики подчерки-
вают, что петрохимические различия магматических пород часто неве-
лики (например, у океанических и континентальных базальтоидов), а
геохимические различия (по содержанию микроэлементов) — значи-
тельны. Поэтому говорят о геохимических типах изверженных пород
и геохимических типах их массивов.
По участию в магматических и гидротермальных процессах А. Е.
Ферсман разделил все химические элементы на четыре группы
(рис. 44). Более подробна геохимическая классификация А. Н. За-
варицкого, который выделил 10 групп (рис. 45):
1. Благородные газы (от Не до Rn).
2. Элементы горных пород (Na, Mg, Al, Si, К, Са и др.).
175
X о
VIII © © gT Rh Rd^) 1г
VII Ma
> О © ©
> © © © ®
> © © ®
= © 0 © ©
= ® © /л\ f *в\ 1 «J ®
—1 0 0 ® СК.
VIII ® Ne < Ьй X ©
VII ® О @ СЕ) <К.
> 1 © / о \ \ Л / '(Те) f О 1 tiси )
> 1 Z о (asJ 1; Sb' , \ У ©
> 1 СЕ) © © ©
= 1 0 © 1 / х._ ✓
= 1 1 1 г <z
- 1 1 (Си) Г.£) ©
X Груп- г, \ПЫ' риодых^ - Г-
Рис. 44. Геохимическая таблица элементов (по А. Е, Ферсману):
н пневматолитов, 2 — сульфидных месторождений, 3 — средних магм. 4 — основных н ультраоснов-
s
co
S
3. Элементы магматических эманаций (В, F, Р, Cl, S и др.).
4. Элементы группы железа (Ti, V, Сг, Мп, Fe, Со, Ni и др.).
5. Редкие элементы (Sc, TR, Nb, Та и др.).
6. Радиоактивные элементы (Ra, Th, U и др.).
7. Элементы металлические рудные (Cu, Zn, Sn, Hg, Ag и др.).
Рис. 45. Геохимическая классификация элементов (по А. Н. Заварицкому)
8. Элементы металлоидные и металлогенные (As, Sb, Bi, Se и др.).
9. Элементы группы платины (Os, Ir, Pt и др.).
10. Тяжелые галоиды (Br, I).
Общие особенности магматической миграции
Магматические процессы охватывают земную кору и часть верхней
мантии. Наиболее характерны они для земных глубин, хотя при вул-
канических извержениях магма достигает земной поверхности.
Очаги гранитоидного магматизма (по оценкам разных авторов) зале-
гают на глубинах от 8 до 25 км. На- основе косвенных геологических и
геохимических данных предполагают, что становление и кристалли-
зация гипабиссальных гранитных интрузий возможны даже на глуби-
не 1—5 км. Для базальтовой магмы приводятся значительно большие
глубины — 50—500 км. В зависимости от глубины различают коровый
и мантийный магматизмы, хорошими индикаторами которых служат
отношения в изверженных породах изотопов 87Sr/86Sr, 3Не/4Не, 14sNd
/144Nd, а также отношения различных элементов — Rb/Sr, Lu/Hf,
Ва/Та и др.
Так, в породах мантийного происхождения отношение 86Sr: 87Sr
близко к 0,708, а в породах земной коры оно выше. Поэтому, опреде-
ляя данное отношение в изверженных породах, можно установить их
генезис.
В разных частях магматических очагов условия не одинаковы. При
определении абсолютного возраста гранитоидов часто получают боль-
шой разброс данных, свидетельствующий о длительности кристалли-
177
зации пород. Так, по Л. В. Таусону и др., формирование мезозойских
гранитоидов юго-восточного Забайкалья продолжалось около 30 млн.
лет.
Многие явления магматизма и, в частности, кристаллизация извер-
женных пород связаны с понижением температуры. По различным дан-
ным, температура ультраосновных и основных расплавов 1000—
1500 °C, кислых — 1250—550 °C. Давление в магме колеблется от
105 Па на земной поверхности до 10® Па в абиссальной области. Умень-
шение давления характерно для участков поднятий и растяжений.
Для магмы характерны два основных типа массопереноса — диф-
фузия и конвекция, причем последняя более универсальна. Важное
значение в массопереносе имеют газовые растворы — флюиды, про-
дукты дегазации мантии и коровой магмы (Д. С. Коржинский.
И. Д. Рябчиков, Ф. А. Летников и др.). Ф. А. Летников и его соавторы
подчеркивают огромное разнообразие состава газовых пузырьков в
магме, обязанное ее неоднородности. В связи с этим анализ газово-
жидких включений в породах и минералах еще не характеризует со-
став магматического флюида в целом. Необходима полная дегазация
породы, которая достигается с помощью газового хроматографичес-
кого анализа. Согласно Ф. А. Летникову, основой всех эндогенных
флюидных систем служат С и Н. В связи с этим он различает С-струк-
туры и Н-структуры. Перве характерны для наиболее глубинных раз-
ломов и зон с углеродной спецификой флюидов. В результате эволю-
ции подобных систем возникают карбонатиты, кимберлиты, щелочные
породы с высоким содержанием карбонатов, углеводородов и графи-
та. С С-структурами связаны месторождения алмаза, Та, Nb, Zr,
TR. Для Н-структур характерно преобладание Н2О в флюидах и
меньшая глубина залегания. С ними связаны многочисленные магма-
тические породы как основного, так и кислого состава и различные
рудные месторождения. В чистом виде оба типа структур не сущест-
вуют. Речь может идти лишь о преобладании одного из них. В. И. Ко-
валенко подчеркивает, что для летучих компонентов основных магм
характерен СО2, а для кислых — Н2О.
Концентрация химических элементов при кристаллизации магма-
тических пород решается с разных позиций и вызывает дискуссии.
Многие петрологи и геохимики ведущее значение придают кристал-
лизационной дифференциации, в ходе которой из магмы при пониже-
нии температуры последовательно кристаллизуются породы различ-
ной основности («реакционный принцип» Н. Боуэна и др.). Однако мне-
ния о значении кристаллизационной дифференциации расходятся.
В гипабиссальных условиях особенно большое значение придается
флотации пузырьков водяного пара, в котором растворены другие
газы и летучие компоненты, в том числе и рудные — Li, Be, Rb, Cs,
Sn, Nb, Та и др. Этот механизм массопереноса, особенно характерный
для апикальных частей магматических массивов, получил название
эманационной дифференциации или эманационной концентрации.
Наряду с кристаллизационной и эманационной дифференциацией в
178
петрологии выделяют концентрационную дифференциацию, ликвацию,
отжимание, ассимиляцию магмой вмещающих пород, смешение магм и
другие процессы, приводящие к магматической дифференциации.
Большую роль в магматической миграции играют размеры ионов,
которые определяют структуру образующихся минералов. В основе
кристаллохимии силикатов лежит принцип плотнейшей упаковки ка-
тионов и анионов, образующих преимущественно тетраэдры и октаэд-
ры (В. Л. Брэгг, Н. В. Белов). Согласно Н. В. Белову, основная роль
в силикатных структурах принадлежит катионам, находящимся в
центре кислородных октаэдров. К ним приспосабливаются силикатные
анионы, состоящие из кремнекислородных тетраэдров [SiOJ, диорто-
групп [Si2O7J, реже более сложных групп. Силикатные анионы обра-
зуют цепочки, ленты, листы, трехмерную вязь.
При кристаллизации главные минералы на основе законов изо-
морфизма захватывают из расплава атомы и ионы редких элементов.
Магматические минералы содержат много примесей, формулы их осо-
бенно сложны. Так как наиболее благоприятные условия для изомор-
физма создаются при высоких температурах, многие элементы (вер-
нее, ионы), изоморфные в условиях магматизма, не изоморфны на зем-
ной поверхности. Поэтому магматизм — основная область проявле-
ния изоморфизма в земной коре. На примере магматических минера-
лов были установлены главные законы изоморфизма.
Современный вулканизм. В изучение вулканов внесли вклад пред-
ставители многих наук о Земле. В XX в. оформилась самостоятель-
ная наука вулканология. В СССР большую роль в ее становлении сы-
грали труды А. Н. Заварицкого, В. И. Влодавца, Б. И. Пийпа, Г. С.
Горшкова, А.А. Меняйлова и других ученых. На Камчатке у подно-
жия Ключевского вулкана в 1935 г. была создана специальная Вул-
канологическая станция АН СССР, позднее в Петропавловске-Кам-
чатском — специальный академический вулканологический институт.
В последние десятилетия развивается и палеовулканология
(И. В. Лучицкий). Важную роль в СССР и за рубежом приобрело ге-
охимическое изучение современного вулканизма. В нашей стране боль-
шое значение имели труды К- К. Зеленова, Л. М. Лебедева, Е. К. Мар-
хинина, С. И. Набокои других исследователей. Изучение современного
вулканизма доставляет в основном косвенную информацию о магма-
тических системах, так как на земной поверхности магма попадает в
гипергенные условия. Температура и давление в ней резко понижают-
ся, происходит ее дегазация. Магма взаимодействует с атмосферой и
гидросферой, поверхностными отложениями. Так возникает особый
ряд переходных систем от чисто магматических до гипергенных. Тем
не менее изучение современных вулканов дает ценную информацию о
магматизме.
Е. К. Мархинин полагает, что вулканизм — это форма развития
Земли и планет, характерная сейчас или в прошлом также для Луны,
Марса, Венеры, Меркурия, спутника Юпитера и других небесных
тел. На Земле ведущая роль принадлежит подводным излияниям. С по-
179
зиции теории плит различают толеитовый вулканизм рифтовых зон,
т. е. зон спрединга (особенно срединно-океанических хребтов) и зон
субдукции, для которых наиболее характерны андезитовые лавы.
Первичные очаги вулканизма большинство авторов видит в астено-
сфере, т. е. на глубине многих сотен километров (до 350 км на Гавай-
ских островах). Выделяются и промежуточные очаги. Так, глубина
очагов Ключевской группы вулканов колеблется от 30 до 60 км, Га-
вайских островов — 45—60, Этны — 70 км. В Исландии при извер-
жении вулкана Крафла в 1975 г. установлен магматический очаг на
глубине 2—3 км.
Е. К- Мархинин в систему «очаг — вулкан» включает следующие
подсистемы: глубинный источник магмы (100 км и более), промежуточ-
ный очаг (десятки километров), периферический очаг (1 —10 реже до
20 км), дайки, жерла. Естественно, что по мере движения магмы меня-
ются физико-химические параметры системы, в первую очередь Р и
Т, а следовательно, и газонасыщенность магмы, ее флюидный режим.
Выделяющиеся на поверхности газы производят распыление свежей
лавы и образование вулканического пепла. Так образуются над вул-
канами многокилометровые пеплово-газовые столбы, являющиеся мощ-
ными химическими реакторами, в которых происходит синтез многих
неорганических и, что особенно важно, органических соединений.
Последние включают углеводороды и биологически важные молеку-
лы. В этих процессах, вероятно, важную роль играют электрические
разряды (молнии) и некоторые минеральные катализаторы. Обстановка
в пеплово-газовых столбах часто восстановительная. Е. К. Мархи-
нин высказал гипотезу, что в подобных столбах имела место предбио-
логическая стадия эволюции земной материи, а может быть и зарожде-
ние простейших форм жизни.
Ценнейшую информацию для изучения магматических систем дает
изучение вулканических газов, выделенных из лавы. Среди них преоб-
ладает водяной пар (более 90 %), установлены также СО2, СО, Н2,
N2, NH3, S2, H2S, SO2, COS, CS2, SO3, HC1, HF, углеводороды и
другие органические соединения, редкие газы, в том числё мантийный
3Не, борная и мышьяковистая кислота, хлориды и фториды металлов.
Вулканические газы определяются непосредственно из- жидкой лавы,
из застывшей лавы, из фумарол, путем вытяжек из пеплов. Состав
газов зависит от многих геологических и геохимических факторов, в
том числе и от строения земной коры и мантии.
С современным вулканизмом связано образование залежей серного
колчедана, железных руд, ртутно-сурьмяных осадков, металлонос-
ных осадков в подводных рифтах, возможно, также железомарган-
цевых конкреций на океаническом дне. Формирование многих рудных
месторождений некоторые авторы объясняют палеовулканизмом.
Выделяют и особый вулканогенно-осадочный тип месторождений, од-
нако этот вопрос вызывает дискуссии. Высказываются также пред-
ставления о роли вулканизма в образовании залежей нефти и газа
(в связи с обнаружением углеводородов в вулканических газах).
180
Состав магмы. Магма представляет собой гетерогенный расплав,
состоящий из тугоплавких и летучих компонентов. Это ионно-элект-
ронная микрогетерогенная жидкость. Ее главные катионы — Na+,
К+, Са2+, Mg2+, Fe2+. Многие факты указывают на существование в
магме так называемых сиботаксических групп или кластеров, т.е. уча-
стков с упорядоченным строением. Для них характерны комплексные
силикатные и алюмосиликатные анионы типа SiO*-, АЮ9-, AlSi2Oe'
и т. д. К сиботаксическим группам относятся, вероятно, и группиров-
ки, состоящие из Mg2+, Са2+, Na+, К+ и других катионов и кислоро-
да, образующие октаэдры (Н. В. Белов).
Следовательно, магма состоит в основном из обрывков полимерных
цепочек силикатных и алюмосиликатных анионов. Количество
цепочек и их относительная молекулярная масса зависят от темпера-
туры. Так, в расплаве кварцевого песка при 1250 °C имеются агрега-
ты, содержащие до 500 молекул, а при 1320 °C — только 43.
Большое влияние на полимеризацию оказывает вода: с увеличени-
ем ее количества вязкость расплава уменьшается. Следовательно, во-
да способствует деполимеризации кремнекислородных единиц. В том
же направлении влияет и F. Растворимость Н2О в силикатных распла-
вах изучалась экспериментально А. А. Кадиком, И. А. Островским,
Н. И. Хитаровым и др.
Меньшее значение по сравнению с силикатными и алюмосиликат-
ными анионами имеют ОН-, РО’-, ВО3-, S;>_ и другие анионы. Име-
ется и анион О2- — продукт диссоциации воды, а в безводных распла-
вах и оксидов:
К2О-^ 2К+ + О2-
MgO -► Mg2+ + О2~
Существуют в магме и молекулы, например MgO.
Важную часть магмы составляют летучие компоненты, растворен-
ные в расплаве благодаря высокому давлению. Газы увеличивают под-
вижность магмы и понижают температуру ее плавления. Главный ле-
тучий компонент большинства магм — водяные пары. На основе опре-
деления различными косвенными методами их содержание колеблется
от 0,5 до 8%.
По А. А. Кадику, при давлении 108 Па кислые расплавы могут раст-
ворить 3,3% Н2О, основные — 3, ультраосновные — 2 %. При 5-108
Па кислые магмы уже способны растворить 13 % Н2О, основные—8
и ультраосновные — 4—5 %. При 109 Па гранитная магма способна
растворить 22% Н2О, а базальтовая —14%. Часть воды, растворенной
в магме, диссоциирована, часть связана в соединениях типа Si (ОН)4_в,
ROH (где R — катион) и т. д., а часть находится в молекулярной
форме.
СО2 в магме приблизительно в 20 раз меньше, чем Н2О. По А. Кади-
ку и его соавторов, при давлении 3-108 — 5-108 Па растворимость СО2
в кислых и основных магмах достигает 0,1—0,6 %. Значительно мень-
ше в магме H2S, НС1, HF, N2, СО, Н2, СН4, F2, Cl2, GeO2, SiO2, Н3ВО3
181
и других газов. Следовательно, главные летучие компоненты большин-
ства магм — Н2О и СО2.
Л. В. Таусон приводит для гранитоидных магм ориентировочную
концентрацию главных летучих компонентов (в %):
Вода —3 Фтор — 0,1
Углекислота — 0,6 Сера — 0,06
Хлор — 0,2
Магма содержит и углеводороды. По представлениям И. А. Пе-
терсилье, основанных на термодинамических расчетах, СН4 образует-
ся по реакции
4СО J 8Н2 СО2 + 2Н,0 + СН4
Другие предельные углеводороды могут образоваться из метана:
СН4 + СН4 С2Н6 + Н2
СН4 + С2Нв ->• С3Н8 + Н2 и т. д.
Изверженные породы содержат дисперсное органическое вещест-
во, так называемый «остаточный углерод» (нерастворимый в органи-
ческих растворителях). Содержание битумов в породах составляет
С, On — 0,п % .
Многие тяжелые металлы образуют в магме летучие соединения,
что существенно для рудообразования.
Окислительно-восстановительные и щелочно-кислотные условия.
Их индикаторами в основном служат формы нахождения химических
элементов в горных породах и особенно отношение Fe3+/Fe2+, а также
состав газово-жидких включений в минералах (Н2, СО, СН4, H2S,
СО/СО2, Н2/Н2О и т. д.).
Прямой зависимости окислительно-восстановительных условий от
петрографического типа пород нет: в одном и том же типе встречаются
резко различные отношения Fe3+ к Fe2+. Например, в гранитах рапа-
киви Fe2+ )§> Fe3+, в обычных гранитах Fe2+ > Fe3+, в некоторых ще-
лочных гранитах Fe3+ > Fe2+. Показателем окислительно-восстано-
вительных условий магмы служит также фугитивность кислорода
(fOa)1, рассчитываемая методами термодинамики для различных рав-
новесных реакций, как, например:
12FeSi0,5O24-O2 -► 6FeSiO3 + 2Fe3O4
1 Фугитивность (летучесть) — функция, характеризующая способность
вещества покидать данную фазу; она выражается в единицах давления. В маг-
ме фугитивность связана с давлением насыщенного пара и становится равной
ему, если к пару применимы законы идеальных газов. Фугитивность по отноше-
нию к парциальному давлению газа аиалогичиа активности по отношению к кон-
центрации. При больших давлениях и низких температурах фугитивность силь-
но отличается от давления. Фугитивность также называют «исправленным дав-
лением», так как она отвечает тому давлению, которое должна производить дан-
ная реальная система, чтобы оказывать такое же действие, как и «идеальная си-
стема» (М. X. Карапетьянц).
182
фугитивность кислорода (/О2) этой реакции при 1150 °C, по И. Д. Ряб-
чикову, равна 10-12’66 Па. В магме /О2 зависит от отношения Fe2+/
/Fe3+; Н2О/Н2 и других буферных равновесий. Для магматических
пород (от ультраосновных до кислых) /О2 колеблется в 1О30 раз. Так, по
А. А. Маракушеву и Л. Л. Перчуку, /О2 для дацитов и андезитов (Т =
= 950 °C) равна 10~15,7 Па (среднее из 13 образцов), для базальта—
10-15’1 (Т = 1125 °C), для габбро Скаергаарда—10-19,3 (Т =
= 845 °C), для гранита Калифорнии—10-23,4 (Т = 600 °C), для эк-
логитов Урала — 10-42’5 Па (Т = 415 °C). Главной причиной колеба-
ния количества кислорода в магме, по И.С. Малахову, является дис-
социация водяного пара, которая, вероятно, происходит не только под
влиянием высокой температуры, но и в результате радиолиза.
Из верхней мантии в магму поступают восстановленные флюиды,
содержащие СН4, СО и Н2. Восстановителями в магме служат также
Fe2+, H2S и другие соединения и ионы. Важным восстановителем яв-
ляется водород, который обнаружен во многих изверженных породах
Е го образование объясняют различными реакциями, как, например
СН4+2Н2О=СО + 4Н2
СН4+ СО2 = 2СО + 2Н2
МеО + СН4 = Me + СО = 2Н2
СН4 = 2Н2 + С
СН4 + (О)=СО + Н2О + Н2
где (О) означает кислород в составе оксида.
В отличие от зоны гипергенеза в магме Н2О и СО2 могут быть окис-
лителями:
3FeO + CO2 Fe3O4 + CO
3Fe2O3 + CO 2Fe3O4 + CO2
3Fe2SiO4 4-3Mg2SiO4 + 2H2O 2Fe3O4 + 6MgSiO3+2H2
По окислительно-восстановительным условиям магмы занимают
среднее положение в системах земной коры и Земли в целом. Для них
не характерны столь восстановительные условия, как в земном ядре,
гидротермальных системах или болотах земной поверхности, и столь
окислительные, как в реках, морях, океанах, озерах, многих почвах
с их высоким содержанием свободного О2.
В магме нет и столь кислых и щелочных сред, как на земной по-
верхности, где pH колеблется от 0 до 12. Преобладание сильных кати-
онов (Na+, К+, Са2+, Mg2+, Fe2+) над сильными анионами (Cl~, F”,
ОН-, СОз-, О2- и др.) определяет господство в магме слабощелоч-
ной среды.
Систематика магматических пород. Этот вопрос специально раз-
рабатывается Петрографическим комитетом АН СССР, который пред-
ложил выделять среди магматических пород классы (плутонический и
183
вулканический), группы (по содержанию SiO2: ультраосновные — кис-
лые), ряды (по содержанию щелочей — Na.2O + К2О) и семейства
(по соотношению петрохимических параметров — SiO2, Na2O + К2О
и т.д.). Эта и аналогичные классификации магматических пород наш-
ли широкое применение в петрологии, они отражают и важные гео-
химические особенности пород. Систематические единицы магмати-
ческих пород, выделяемые в петрологии, могут быть обоснованы и с
чисто геохимических позиций на основе представлений о радиусах и
зарядах ионов, т. е. на основе идей В. М. Гольдшмидта, А. Е. Ферсма-
на и их последователей. Ниже приведены построения в данной обла-
сти автора.
Так как магма в основном представляет собой диссоциированную
систему в основу геохимической систематики магматических пород
можно положить соотношения между катионами и анионами. Естест-
венно, что таксономическое значение имеют только ведущие ионы, об-
разуемые элементами с высокими кларками. Силикатные и алюмоси-
ликатные анионы по увеличению радиусов и силы кислот образуют ряд,
отвечающий последовательности: ультраосновные — основные — кис-
лые породы. В этом же направлении усложняется структура силика-
тов — от изолированных кремнекислородных тетраэдров оливина и
других ортосиликатов до цепочек тетраэдров в пироксенах, лент
(двойных цепочек) в амфиболах, листов в слюдах и каркасов в полевых
шпатах. По Г. Г. Леммлейну, эта последовательность отвечает пони-
жению энергии кристаллической решетки минералов, рассчитанной
«на единицу скелета» (форстерит — 17 574, слюда — 12 560, полевые
шпаты — 10 048 кДж). Уменьшение энергии решетки вполне естест-
венно, так как при усложнении структуры силикатов увеличиваются
размеры силикатных и алюмосиликатных анионов и, следовательно,
понижаются ЭК. Ряд отвечает также возрастанию количества летучих
в магме, в том числе таких сильных анионогенов, как F иС1.
С увеличением содержания SiO2 в породах, как правило, изменя-
ется и катионный состав: уменьшается роль двухвалентных катио-
нов — Mg2+, Fe2+, Са2+ и возрастает роль одновалентных — Na+ и
К+. Растут и ионные радиусы, что свидетельствует об уменьшении
ионного потенциала и ЭК.
Таким образом, от ультраосновных пород к кислым увеличиваются
радиусы катионов и анионов, уменьшаются энергетические характе-
ристики ионов (ионный потенциал, ЭК), уменьшается энергия решет-
ки минералов (при расчете «на единицу скелета»). На рис. 46 приведена
петрохимическая систематика магматических пород в координатах
SiO2 -► (Na2O + К2О), построенная по матричному принципу и раз-
работанная большим коллективом авторов1. На нее нанесены петро-
химические группы пород по А. А. Маракушеву (1973), а в характе-
стику координат добавлены геохимические параметры по автору. С ге-
охимических позиций слабое место данной систематики (как и всех
1 Классификация и номенклатура магматических горных пород. М., 1981.
184
предшествующих) ориентация только на содержание оксидов и ионов
без учета газового состава магмы, ее окислительно-восстановительных,
щелочно-кислотных и других геохимических параметров, т. е. в зна-
чительной степени без учета флюидного режима породообразования.
Правда, этот режим находит выражение через состав пород (Fe2+/
/Fe3+ и т. д.), но соответствие не всегда адекватно, а часто и вообще от-
Увеличение размеров иолов, уменьшение энергетических характеристик
EZ5P С& EZ54 ЕЕЗ5
Рис. 46. Матричная систематика магматических пород в координатах SiO2
— (NasO-F К.2О):
/—область распространения химических составов магматических пород, 2 — границы
групп с «полями неопределенности:». 3 — нижняя граница распространения щелочных по-
род. содержащих фельдшпатоиды, 4 — нижняя граница распространения бесфельдшпато-
ндиых щелочиых пород, содержащих щелочные пироксены и амфиболы. 5—поля рас-
пространения субщелочны пород, 6 — граница распространения пород, содержащих
кварца. 7 — границы пород по щелочности (содержанию Na2O+K?O) (по А. А. Маракуше-
ну). Петрохимические группы пород по А. Д. Маракушеву (границы между группами схема-
тичны): Д. Ряд щелочноземельных пород: IA — дуниты и перидотиты, НА -- пикриты. IIIA
габбро и базальты, включая некоторые пнроксениты, IVA — габбро-диориты, аидезито-ба-
зальты. пироксениты. VA — днорнты и андезиты, VIA — кварцеаые диориты и андезито-
дациты. УПА — гранодиориты и дациты. VHIA - граниты и липариты Б. Ряд щелоч-
ных бесфельдшпатоидных пород и пород повышенной щелочности: !Б — группа ким-
берлитов и меймечитов. ПБ — щелочные пикриты, ШБ — щелочные габброиды и
базальты. /УБ — монцоииты и трахиандезитобазальты, УБ — сиениты и трахиты, VI Б —
щелочные сиениты и трахиты. УИБ — кварцевые сиениты н трахиты. У1НБ — щелочные
граниты н пентеллериты; В Ряд щелочных пород, содержащих фельдшпатоиды наряду с
полевыми шпатами: 1В -- плагиоклаз-иефелиновые якупирангиты н лимбургиты, ИВ — база-
ниты, ///В — тералиты и тефриты. /УВ — нефелиновые сиениты и фонолиты-. Г. Ряд щелоч-
ных фельдшпатоидных бесплагиоклазовых пород: !Г — турьяиты. ИГ, Н/Г — кйолнты н не-
фелиниты. / УГ— хибиииты
185
Таблица 12. Среднее содержание химических элементов в главных типах
изверженных пород (по А. П. Виноградову и А. А. Беусу)
1 Элементы 1 пр А П Виноградову (1962)' По А А Беусу (1975)
ультра основные породы (дуниты и др ) основные породы (базальты и др ) средние породы (диориты и андезиты) кислые породы (граниты ।ранодиорн ТЫ И ДР ) граниты гранодиориты
н — (0,12) (0,11) — 0,06 0,09
Не Li 5 IO-5 (0,2 10~3) 1,5 10~3 2 IO-3 (2,5 IO"3) 1,8 10-“ 4 IO"3 6 10“5 см3 н 3,8 IO’3 а 1 г породы 3,0 IO"3
Be 2 10~5 4 10 s 5*5 10-4 3,5 10-4 2,5 10-4
В 1 10~4 (0,3 10~3) 5 IO”4 1,5 IO’3 (0,9 IO-3) 1,5 IO"3 1,5 IO"3 1,2 IO"3
С 1 10~2 1 IO-2 (2 IO-3) 2 IO”2 (3 IO-2) 3 IO’2 3 IO-2 3 IO"2
N 6 10“4 (1 10-») 1,8 10-3 (3,5 10-3) 2,2 Ю-з (2-Ю-3) 2 Ю-з 2,7 IO-3 2 IO"3
О 42,5 (43,7) 43,5 (44,5) 46,0 (47,0) 48,7 48,7 48,00
F 1 10~2 3,7 10~2 (4 10-2) 5 IO"2 8 IO"2 8,3 IO-2 6,3 IO”2
Ne — — — — 7,7 10 8 см3 на 1 г породы
Ма 5,7 10 1 (0,18) 1,94 (1,90) 3,0 (2,60' 2,77 2,66 2,78
Mg 25,9 (20,50) 4,50 2,18 (2,20) 0,56 0,33 1,10
Al 0,45 (2,40) 8,76 (8,50) 8,85 (8,90) 7,70 7,40 8,60
Si 19,0 (20,0) 24,0 (23,0) 26,0 (27,5) 32,3 34,0 30,5
Р 1,7 10-2 (0,05) 1,4 10~1 (0,15) 1,6 10-1 (0,11) 7 IO-2 0,06 0,11
S 1 10~2 3 IO-2 2 IO"2 (4 IO-2) 4 IO"2 0,04 0,04
Cl 5 10~3 5 10—* (6 IO-3) 1 IO’2 2,4 IO"2 2 IO-2 1,3 IO’2
Аг К 3 10~2 8,3 10~1 2,3 — 2,2 IO"5 см3 на 1 породы
Са (0,05) 0,70 (0,70) 6,72 (1,50) 4,65 3,34 3,50 2,52
Sc (3,40) 5 Ю"4 (7,30) 2,4 10~3 (4,60) 2,5 10“4 1,58 1,12 2,40
Ti (1,5 10~3) 3 10~2 (3,0 IO”3) 9,10-1 (2 IO’3) 8 10-1 3 IO’4 0,7 10 3 1,4-IO-3
V Сг (0,35) 4 Ю"3 2 10-1 (8 10-1) 2 IO-2 (2,5 IO"2) 2 IO-2 (6 10-1) 1 IO’2 (1‘5 IO-2) 5 IO-3 2,3 10-1 4 IO-3 0,17 4,4 IO"3 0,38 8,8 IO"3
(1,6 IO"1) (1,7 IO’2) (5,5 IO’3) 2,5 Ю-з 0,1 IO"2 0,22 IO’2
Мп 1,5 IO"1 (1-Ю-4) 2 10-1 (1,2 10-1) 1,2 10-1 6 10-2 4 10-2 7,10-2
Fe 9,85 (8,70) 8,56 (8,40) 5,85 (5,50) 2,70 1,83 3,30
186
Продолжение табл 12
| Элементы | По А П Виноградову (1962)' По А А Беусу (1975)
ультра основные породы (дуниты и др ) основные породы (базальты и др ) средние породы (диориты и андезигы) кислые породы (граниты гранодиори ты и др ) граниты гранодиориты
Со 2 IO”2 (1,5 IO"2) 4,5 Ю-з (4,8 IO"3) 1 Ю-з (0 9 IO"3) 5 IO"4 1 10-4 7 IO"4
Ni 2 IO”1 1,6 IO"2 (1,3 IO’2) 5,5 10 з (5 10 з) 8 10-4 4,5 10-4 1,5 Ю-з
Си 2 IO'3 (1 IO"3) 1 IO”2 (8,7 IO”3) 3 5 Ю-з (4 IO"3) 2 IO-3 1 IO”3 2,6 IO-3
Zn 3 10 3 (5 IO’3) 1,3 IO-2 (1,05 IO-2) 7,2 Ю-з (7,5 Ю-з) 6 IO*3 3,9 Ю-з 5,6 IO”3
Ga 2 10-“ (1,5 ИГ4) 1,8 IO"3 (1,7 10-3) 2 10-з (1,7 IO’3) 2 Ю-з 2 IO'3 2 10-'
Ge 1 IO”4 (1,5 10-4) 1,5 10-“ (1,3 10-“) 1,5 10"“ (1,3 10-“) 2 4 10-“ (2 10-4) 1,4 IO”4 1,3 IO"4 1,3 IO”4
As 5 IO”5 (1 10~“) 2 10-“ 1,5 IO”4 1,5 10-4 1,9 IO”4
Se 5 IO-8 5 10-е (1,3 Ю-з) 5 IO”8 (1 4 Ю-з) 5 10-е 1,4 Ю-з 1,4 10-°
Br 5 IO"5 (1 10-“) 3 10“4 (3,6 10-“) 4,5 10-“ (4,5 10-“) 1,7 IO”4 1,3 IO’4 4 10-4
Kr Rb 2 10-“ (5 10-*) 4,5 IO-3 (5 IO”3) 1 IO-2 (1,1 IO"2) 8 IO"2 (4,5 IO-2) 2 IO'2 4,4 10~9 см3 2,1 IO”2 на 1 г породы 1,6 10-2
Sr 1 Ю-з (0,1 IO"3) 4,4 10-2 (4,7 IO’2) 3 IO"2 1,1 IO”2 4,4 IO”2
Y (л IO"5) 2 10-з (2,1 IO’3) (2,9 IO-3) 3,4 IO"3 4 10-з 3,4 Ю-з
Zr з io-3 (4,5 IO”3) 1 IO"2 (1,1 10-2) 2,6 IO"2 (1,4 IO-2) 2 Ю-з 2 IO'2 1,8 IO"2 1,6 IO’4
Nb 1 ю-“ (1,6 IO”3) 2 Ю-з (1,9 10-3) 2 10 з 2,1 IO’3 2 Ю-з
Mo 2 Ю-з (3 IO”5) 1,4 10-“ (1,5 10-“) 9 IO-5 (1,1 IO-4) 1 IO'4 1,3 IO”4 1,2 IO"4
Ru — — — — — —
Rh
Pd 1,2 IO”5 (5 10"’) 1,9 10-е (2 10-’) (л 10-’) 1 IO"» Л 10-8 Л 10-8
Ag 5 10-е (6 10-«) 1 Ю-з (1,1 10-3) 7 IO-» 5 IO"» 3,7 IO-» 5,1 10-е
Cd 5 10"« (1 10-в) 1,9 IO"5 (2,2 IO-5) (1,8 Ю-з) (2,2 10-5) (1,6 10-“) 1 IO'5 1,3 IO”5 1,6 10-5
In 1,3 IO”6 (1 10-») 2,2 Ю-з 2,6 Ю-з 2,6 IO"5 2,4 IO"5
Sn 5 IO”5 1,5 10-“ 3 10-* 3 10-* 2,5 10-*
Sb 1 IO”5 1 IO”4 (2 10-з) 2 Ю-з 2,6 IO”5 2 10-5 2 IO"5
Те 1 10~’ (л 10~«) ’ ю-’ 1 ю-’ 1 10-’ 1 10-’ 1 10-’
187
Продолжение табл. 12
1 Элементы 1 По А. П. Виноградову (1962)' По А. А. Беусу (1975)
ультра- основные породы (дуниты н др.) основные породы (базальты н др.) средние породы (диориты и андезиты) кислые породы (граниты, гранодиори- ты и др.) граниты гранодиориты
I 1•10“в (5 10“5) 5-Ю-5 3-10-5 (5-10-’) 4-10-5 5 10-5 5-10~5
Хе — — — — 3,4-10-10 см3 на 1 г породы
Cs 1 -10-5 (п-10-5) 1 10-* (1,1-10-*) (1,5-10-*) 5-10-* 5-10-* 2-10-*
Ва 1 • 10"* (0,4-10"*) 3-10-2 (3,3-10-2) 6,5-IO'2 (3,8-10-2) 8,3-10-2 8,4-IO"2 4,5-10-2
La (п-10-5) 2,7-10~3 (1,5-10-3) (ЗЮ”3) 6-10-3 5,5-10-3 4-Ю"3
Се (п-10-5) 4,5-10-* (4,8-10-3) (6,5-10'3) НЮ’2 9,2- IO"3 8-Ю-3
Рг (п-10-5) 4 10-* (4,6-10-*) (6,2-10"*) 1.2-10-3 8,8-10“* 7,5-10-*
Nd (п-10~5) 2-Ю-3 (2,7- IO"3) 4,6-Ю-з 3,7-10-3 3,2- IO 3
Pm — — — —
Sm (я-10~5) 5-10-* (5,3-10-*) (7,5-10-*) 9-10-* 10 10-* 8,5-10-*
Eu I•10-е (п-10-5) 1 ю-* (0,8-10-*) (1,2-10-*) 1,5-10"* 1,6-10-* 1,4-10-*
Cd (п-10"5) 5-10-* (5,3-10-*) (7,5-10-*) 9-10“* 10-10-* 8,5-10-*
Tb (п-10-5) 8-Ю-5 (1,2-10-*) 2,5-10"* 1,6-10-* 1,4-10"*
Dy 5-IO"» (я- 10~5) 2-10-* (3,8-10-*) (5,2-10-*) 6,7-10-з 7,2-10"* 6,1-10"*
Ho (п-10-5) мо-* (1,1-10-*) (1,5-10-*) 2-10-* 2-IO"* 1,8-10*
Er (п-10-5) 2-10"* (2,1-10-*) (2,8-10-*) 4 10* 4-10-* 3,2-10-*
Tm (п-10-») 2-Ю"5 (0,2-10“*) ЗЮ-5 0,3-10-* 0,3-10“*
Yb (п-10“5) 2-10-* (2,1-10-*) (2,8-10"*) 4-10-* 4-10-* 3,2-10"*
Lu (п-10-5) 6-Ю"5 (8-Ю-5) 1 •io-* 1,2-10-* 1 - ю-*
Hf 1-ю-5 (0,5 10-*) 1-10-* (2,2-10-*) мо-* (2,8-10-*) 1-10-* 3,9-10-* 3,2-10"*
Ta 1,8-IO”» (0,2-10-5) 4,8•10~5 (0,5-10-*) 7 10“5 (1,2-10-*) 3,5-10"* 2,5-10-* 1,8-10-*
W мо-5 (1 -10—5) 1-10-* (7-Ю-5) 1 ю-* (1,2-10-*) 1,5-10-* 2,2-IO-* 1,7-10"*
Re — 7,1 IO”8 — 6,7-IO'8 6,7-10-8
Os —
Ir — (2,2- IO"») — 6,3-10-’ 1-Ю-8 —
Pt 2-10-5 мо-5 — —— — —
188
Продолжение табл. 12
Элементы По А. П. Виноградову (1962)’ По А. А. Беусу (1975)
ультраос- новные породы (дуниты и др.) основные породы (базальты н др.) средние породы (диориты и андезиты) кислые породы (граниты, гранодио- риты и др.) граниты гранодиориты
Au 5-10"’ (6-10-’) 410“7 (3,6 10-’) (2,8-10-’) 4,510-’ 0,8-10-’ 1,2-10-’
Hg 1•IO"» (6,4-10“®) 9-10-» (6,5-10"») (2,11 10-») 8-10-» 3,9-10-» 2,9-10“»
Tl 1-ю-» (0,6-10“*) 2-10-» 5- IO-5 (110-*) 1,5 10-1 2,3-IO-4 1,5-IO’4
Pb 110“5 (1-10-*) 8 10-* (6 10-*) 1,510-з (1,2-10-3) 2-10-3 1,9-IO"3 1,5-10-3
Bi 1 -10“7 7-10-’ 1 • 10-») (8-10-’) 1 ю-» 1 ю-» 1 • Ю-»
Po — — — — — —
Rn — — — — — —
Ra — — — — — —
Ac — — —
Th 5-10-’ (4-10-’) 3- ю-‘ (4-10-*) 7-10“* 1,8 10-з 1,7-Ю-з 1,2-Ю-з
Pa — — 1 . 1 • — —
U 3-10-’ (1-10’) 5-IO"5 (МО"4) 1,8-10-‘ (2,0- IO 4) 3,510-4 (2,5-10-1) 310-1 2,510-‘
1 Для многих элементов числа Виноградова и Беуса одинаковы, в случае
расхождения в скобках приведены кларки по А. А. Беусу.
сутствует. Поэтому будущая геохимическая классификация магмати-
ческих пород должна быть основана на учете ионного состава магма-
тического расплава, растворенных в нем газов, физико-химических
параметров (Eh, pH и др.).
Ниже геохимическая характеристика магматических пород да-
на по петрологическим группам и рядам.
Кларки магматических пород. Широкое использование при петро-
логических классификациях пород их химического состава определило
практически всеобщее использование этих классификаций в геохимии,
в том числе при вычислении кларков.
В табл. 12 приведены кларки по А. П. Виноградову (1962) и
А. А. Беусу (1975). Как и следовало ожидать, для макроэлементов
расхождения, как правило, невелики, но для микроэлементов часто
значительны. Так, кларк Au в кислых породах по А. П. Виноградову
4,5-10—7 %, по А. А. Беусу 1,2-10“’ % (для гранодиоритов, грани-
тов еще меньше — 8-10~8%). Кларки многих элементов нуждаются в
уточнении. Для Ru, Rh, Os, Ra, Ac, Pa они вообще не известны.
Между кларками изверженных пород и положением элементов в
периодической системе В. И. Рехарский, П. П. Смолин и другие уста-
новили ряд зависимостей, в том числе периодичность кларков.
189
Ультраосновные и основные породы
Ультраосновные породы (ультрамафиты, ультрабазиты). Проис-
хождение пород этой группы связано с верхней мантией. В ультраос-
новных расплавах потенциал кислорода низок, они содержат углево-
дородные флюиды. В этих породах обнаружены Н2, недоокисленные
формы Ti (Ti3+), С, что указывает на восстановительные условия ульт-
раосновной магмы. В оливинах из кимберлитов был обнаружен даже
Сг2+ — показатель особо восстановительной среды.
Ультраосновная магма содержит сравнительно мало водяных па-
ров, она недосыщена Н2О. Формулы наиболее характерных минера-
лов оливина и пироксена — не содержат компонентов воды.
От типичных изверженных пород земной коры — гранитов и ба-
зальтов. ультрабазиты отличаются резко повышенным содержанием
(%) Mg (25,9), Сг (0,2) и Ni (0,2), пониженным содержанием Si (19),
низким — А1 (0,45). Na (0,57), К (0,03) и Ti (0,03).
Кларки концентрации элементов в ультрабазитах (по сравнению с
кларками земной коры) выявили «ряды мантийности».
Наиболее мантийны Ni, Cr, Mg, Со, Fe, Мп (а также Pt и платино-
иды, которые не попали в ряды из-за отсутствия точных данных об их
кларках), наименее (из включенных в расчет) — Pb, Ba, U, Th. В пе-
ридотитах, дунитах и других ультрабазитах среди катионов преобла-
дают Mg и Fe. В пикритах, кимберлитах, пироксенитах наряду с боль-
шим количеством Mg и Fe значительно также содержание Са. В неко-
торых из них повышено содержание щелочных металлов (Na или К)
и других элементов, характерных для щелочных пород, — Li, В, С,
Rb, Sr, Р, Ti, Zr, Nb, Cs, Ba, Ta, Pb, U. Th. Сультраосновными поро-
дами связаны месторождения хромита, платины, титаномагнетита, ал-
маза (в кимберлитовых трубках взрыва).
Основные породы (мафиты — базальты, габбро и др.). Происхож-
дение основной магмы связывают с выплавлением из мантии. Сравне-
ние кларков основных пород с кларками земной коры установило сле-
дующие ряды КК: Ni > (Sc, Сг, Со) > Mg (Са, V, Си) > (Ti, Мп,
Sb) > Fe > (Р. Zn, Cd) > (Вг, Mo, Pd, Ag) > Sr > I > As >
> (Al, Ge, Hg) > (Se, Те, Hf, Re) > (N, O, Ga, La, Au) > In, Si >
> (Na, W, Bi) > Y > S > Sn>Zr >F > (C, Pb) > Li > Ba >
> В > К > Rb > Cl > Cs > Th > (TI, U) > Ta > Be.
Для основных пород характерна концентрация Ni, Cr, Со, Mg, Мп.
что сближает их с ультраосновными. Специфичны Sc, Са, V, Си,
Ti. Sb, F, Р, Zn, Cd. Наименее характерны Be, Та, U, TI, Th, Cs, Cl, Rb,
K. B.
Л. В. Таусон выделил основные геохимические типы базальтоидов.
Большое информационное значение имеет коэффициент К, крайние
значения которого разняться в 52 раза (табл. 13).
По Л. С. Бородину, при фракционной дифференциации основных
магм вопреки ранее имевшимся представлениям соблюдается «прин-
цип когерентности», т. е. сопряженное изменение содержания петро-
190
Таблица 13. Геохимические типы базальтоидов по Л. В. Таусоиу
Геохимические типы Na К Rb Ва Sr Ni Со V Сг Ва-4-Sr К= VJ-Cr
% г/т
Толеитовый Андезитовый Латитовый 2,0 2,7 2,7 0,2 1,3 2,5 2 30 70 15 270 1470 но 385 1220 100 18 40 30 24 22 350 125 185 300 55 70 0,2 2,8 10,5
генных и редких литофильных элементов — Y, Zr, Nb, La, Се, Ba,
Rb и др.
Окислительно-восстановительные условия формирования толеи-
товых базальтов различны. Наиболее восстановленные, содержащие
только Fe2+, предположительно непосредственно связаны с верхней
мантией. В этих породах обнаружен Еи2+ — аналог щелочноземель-
ных элементов, резко отличный от большинства других редких земель
(TR3+). Eu2+— аналог Sr2+, что объясняется близостью Ri (0,125 и
0,121 нм). Yb также переходит в двухвалентное состояние и становится
аналогом Mg. Их Ri также близки (0,085 и 0,080 нм). Менее восста-
новленные базальты содержат и фаялит (Fe2SiO4), и магнетит (Fe3O4).
Наконец, для наиболее окисленных пород характерен только магне-
тит.
Хорошим показателем щелочности базальтов служит отношение
La3+/Lu3+.
Среди основных пород, как известно, преобладают вулканиты,
охарактеризованные выше, В числе плутонических их аналогов боль-
шое внимание привлекают анортозиты (О. А. Богатиков). Интерес к
этим породам связан как с их важным значением в геологической исто-
рии, так и широким распространением на Луне (где они отличаются
высокой степенью восстановленности и содержат самородное Fe).
С дифференциацией основной магмы связано образование медно-
никелевых (Норильск, Кольский полуостров), титано-магнетитовых с
V (Урал) и других рудных месторождений (Дистлер В. В. и др.).
Протокристаллизация. Этим термином Ферсман обозначил кри-
сталлизацию ультраосновных и основных пород. Многие характер-
ные элементы протокристаллизации (рис. 47) имеют четные порядко-
вые номера и валентности, малые радиусы ионов, большие ЭК.
В складчатых областях породы протокристаллизации слагают уз-
кие и длинные «офиолитовые пояса», простирающиеся на многие тысячи
километров. Таковы гигантские Тихоокеанский (Калифорния —
Япония — Австралия), Альпийский (Италия — Суматра), Ураль-
ский пояса. Подобные породы характерны и для зон спрединга средин-
но-океанских структур Атлантического и Индийского океанов. Поэто-
му офиолитовые пояса материков считаются реликтами океанической
земной коры.
191
= Не 10 81 on Аг 36 к 3 * Xe 86 a at CM
о у/' кч М ae <
к—« at о сл : '////. 9^ s. о Ач
> £ м Hl 8. 1^1 CM s TO
> о 0 /Ч, гх <ихх Ж. ;X=Z ” J3 Ач s X Я
’ d 0 fi >0 X X TO
Вж ZZ%48 li 80 Hg
w X X X TO TO X
5^0 TO u X
VIII и X о о Cl
s X
> 43 Tc 75 Re s o TO
> gl < 421 Mo X Ф
> Nb 73 Ta d 0ч TO TO X
> и < 40 Zr l : 4 72 Hf X. z° Th
Ч X м IV CI \ I1 1 S <y> > S*7^71 TR “ и < a.
ZZZZZZZ/ 38 Sr \ /6 Ba 8 if \
dZ L J < 37 Rb <nZ L 2 87 Fr
1 — сч TO" lC U5 C''» 1
Геохимия минералов. Для минералов протокристаллизации харак-
терны разнообразные элементы — примеси, накопление которых во мно-
гом объясняется законами изоморфизма. Так, в оливинах концентри-
руются Ni2+ и Со2+, способные изоморфно замещать Mg2+ и Fe2+.
Ni в магнезиальных оливинах больше, чем в железистых, что объяс-
няется равенством радиусов ионов Ni2+ и Mg2+. Мп больше концент-
рируется в железистых оливинах (до 1,3%), что также хорошо увязы-
вается с близостью ионных радиусов Fe2+ и Мп2+ (0,080 и 0,091 нм).
В пироксенах концентрируются Ni, Со, Сг, Мп, Sc, V и др., в амфибо-
лах — Мп, Sc, Ni, Со, V, Zn, иногда Сг и другие элементы.
Р. Моксхэм предложил вычислять коэффициент накопления микро-
элементов в минералах R. равный среднему кларку концентрации изу-
чаемой группы элементов в данном минерале. Д. Шоу приводит R
гиперстенов и оливинов габбро Скаергаардской интрузии Гренлан-
дии (в скобках показаны элементы, сильнее концентрирующиеся в
другом минерале):
Минерал
Плагиоклаз
Гиперстен Сг,
Оливин
Элементы R
Са, Sr, Ва 0,46
V, Sc. Zr, Mn(Ni, Со) 1,39
Mo, Ni, Со(Мп) 1,68
Для пироксена из базальта R = 2,73 (определялось 18 микроэле-
ментов — В, Be, Cr, Ga и т. д.). Для горных пород данные такие:
Породы Число элементов, включенных в подсчет R
Ультраосновные 12 3,41
Основные 29 1,18
Граниты 28 1,14
Таким образом, минералы основных и ультраосновных пород об-
ладают наибольшей изоморфной емкостью (напомним, что примеси
связаны не только с изоморфизмом, но и с образованием самостоятель-
ных минеральных фаз).
Гранитоиды и другие кислые породы
Гранитоиды полигенетичны. При погружении осадочных пород в
геосинклиналях происходит их переплавление с образованием кислой
магмы, из которой кристаллизуются граниты. По В. И. Вернадскому,
граниты — это «былые биосферы». Данный механим не исключает об-
разование гранитоидов в результате дифференциации основных или
средних магм. Наконец, важное значение придается «гранитизации». По
Д. С. Коржинскому, это инфильтрационный процесс, в ходе которого
трансмагматические растворы вызывают расплавление породы, т. е.
образование магмы. По Ф. А. Летникову, трансмагматические раство-
ры гранитизируют гнейсы. С помощью факторного анализа он пока-
7 35 к. 2022
193
зал, что К и Si приносят растворы, а остальные породообразующие
элементы входят в состав гнейсов и других пород, подвергающихся
гранитизации.
Важное значение приобрели геохимические исследования гра-
нитоидов, разработаны их геохимические классификации (Л. В. Тау-
сон, В. И. Коваленко и др.). Наибольшее индикационное значение
имеет распределение микроэлементов, а не минеральный состав и рас-
пределение петрогенных элементов. Для лейкократовых гранитов,
например, важны коэффициенты K/Rb и F: (§г43а')’ Резк0 Различ'
ные для палингенных, ультраметаморфических и других гранитои-
дов.
Е. В. Шарков считает, что необходима более тесная связь петро-
логии с учением о формациях. Он полагает, что в комплексе научных
направлений, изучающих магматические процессы, отсутствует «це-
лая научная дисциплина», которая изучала бы физико-химические
процессы на уровне макропроцессов, имела бы дело с реальными гео-
логическими телами. Эти идеи важны также для геохимии магматиз-
ма и региональной геохимии (см. ч. VI).
Огромные размеры многих гранитных батолитов определяют их
внутреннюю неоднородность. В частности, к их апикальным частям на-
правлен поток F, В и других летучих, а также связанных с ними щелоч-
ных и рудных элементов (эманационная дифференциация). Так.
А. А. Беус, Д. А. Минеев объясняют микроклинизацию, альбитизацию,
грейзенизацию апикальных частей некоторых гранитных массивов,
обогащение их литиевыми слюдами, бериллом, тантало-ниобатами.
топазом, циркониевыми и редкоземельными минералами. Подобные
породы А. А. Беус назвал апогранитами. Глубина их формирования
1—3 км. Источником редких элементов могли быть как магма, так и
глубинные растворы.
Однако как бы ни образовались кислые породы, к какому геохими-
ческому типу ни относились, они имеют ряд общих геохимических черт.
В отличие от пород протокристаллизации в кислых породах накапли-
ваются нечетные элементы, ионы с валентностью 1 и 3 (Na+, К+, Rb+,
Cs+, Cl-, F~, Al3+ и др.). Характерны большие радиусы ионов и, сле-
довательно, низкие ЭК, определяющие низкие значения энергии ре-
шеток минералов (по сравнению с минералами основной магмы; см.
таблицы на форзаце). Ряды кларков концентрации характеризуют
«гранитофильность» элементов: La > Т1 > Be>Cl>U>Th>
>(К, Cs) > Rb > Ва > С > (Pb, Li, В) > (Sn, F) > Zr > Y >
> W > (Na, Bi) > Si > (Ga, N, Au) > In > О >(Ge, Se, Nb, Mo.
Те, I, Hf) > (Hg, Al) > (As, Sr) > S > Вг > P > Zn > Ag > Mn>
> Fe > Ca > Sb > Ti _> V > Cu (Sc, Mg, Cr) > Co > Ni.
Геохимия минералов. Породообразующие минералы гранитоидов
обладают более низкой изоморфной емкостью и содержат меньше при-
месей, чем минералы основных пород. Для гранодиорита из Кали-
форнии Д. Шоу приводит такие значения R:
194
Минералы Элементы-примеси R
Плагиоклаз и кварц Sr, (Ga). (Zr), (Ba) 0,18
Калиевый полевой шпат Ba, (Ga). Sr, Rb 1,18
Роговая обманка Se. Z г, Y, La, (Ga), (Cr), (V). 1,97
(Ni). (Co), (Ba)
Биотит Rb, Li. Ba, (Ga), (Cr). (V), 2,38
(Ni), (Co), (Sc), (Zr)
Магнетит Ga, Cr. V, Mo, Ni, Co 7,11
По В. В. Ляховичу, носителем и концентратором большинства
редких и рудных элементов в гранитоидах является биотит (табл.
14). Изучение минералов гранитоидов, особенно биотита, помогает
выяснять генезис пород.
Таблица 14. Среднее содержание W, Мо, Sn, Nb, Та в биотите
послекембрийских интрузивных гранитоидов Советского Союза
по В. В. Ляховичу (п-10-*/», в скобках — число проб)
Элементы Гранодио- риты Граниты бнотитовые Граниты лейкократо- вые Граниты интрузивные (средине) Рудоносные граниты
W 1.5 (2) 6,8 (65) 13,7 (6) 7,2 (73) 10,0
Мо 4,4 (16) 5,8 (108) 9,8 (13) 6,0 (137) 82-310
Sn 41,5 (36) 66,8 (179) 71,0 (71) 76,5 (396) 150—400
Nb 93,4 (71) 168 (207) 198,2 (48) 143,6 (326) 234—2450
Та 9,8 (38) 16,8 (168) 14,2 (37) 15,2 (243) 24,0
В гранитоидах редкие элементы не только изоморфно входят в ре-
шетки главных минералов («изоморфное рассеяние»), но и образуют
микровключения собственных минералов («минеральное рассеяние»).
Подобные включения минералов U, Th, TR, Zn, Ti, Fe. Sn и других
элементов характерны и для биотита. Например, Sn в биотите может
изоморфно замещать Fen Ti. Однако с помощью электронно-зондового
микроанализатора установлено, что большая часть Sn в слюдах на-
ходится в форме микровключений касситерита и других акцессорных
минералов.
Геохимическая специализация гранитоидов. Во многих гранитои-
дах повышено содержание рудных элементов, поэтому они получили
наименования редкометальных, оловоносных, вольфрамоносных и т.д.
Детально изучена геохимия гранитоидов Забайкалья, Казахстана,
Украинского кристаллического щита и других рудных провинций.
Геохимию гранитоидов Украинского щита изучили Б. Ф. Мицкевич с
сотрудниками. На основе геохимических критериев Fe3+/Feo6ltt;
87Sr/8eSr, соотношения Ba, Sr и Rb и других авторы выделили гене-
тические типы гранитоидов («гранитоиды базальтовых серий», «па-
лингенные», «автохтонные»), охарактеризовали содержание большой
группы микроэлементов в них. Важное значение в накоплении микро-
элементов придается гидротермальному метасоматозу (см. гл. 12). По
7*
195
Л. С. Галецкому и др., граниты и мигматиты кировоградско-житомир-
ского комплекса Украинского щита обогащены Pb, Ni, Со, V, гранито-
иды осницкого комплекса — Yb, Со, Pb, Zn, граниты коростеннекого
комплекса — F, Se, Сг, Ti, Zr, Yb, Y, Sn, Mo, Ga, Pb, Li, Rb, Cs.
Часть исследователей полагают, что «геохимическая специализация
магмы» и кристаллизовавшихся из нее гранитоидов в целом благопри-
ятствует рудообразованию. Другие подчеркивают, что не всегда обо-
гащенные интрузии рудогенерирующие. Нередко необогащенные гра-
нитоиды — рудогенерирующие, а обогащенные — безрудные. Оцен-
ка по валовому содержанию микроэлементов оказалась слишком гру-
бой. Большое значение имеют формы нахождения элементов (напри-
мер, существование подвижных — легкоизвлекаемых форм), неодно-
родность распределения элементов (породы с более высокой дисперсией
местами более благоприятны) и т.д. По В. В. Ляховичу, рудоносными
являются породы, содержащие микровключения минералов рудных
элементов, а нерудоносными — породы с изоморфными примесями.
Термин «металлогеническая специализация магмы» в смысле по-
вышенного содержания в ней рудных элементов и благоприятности
для рудообразования, по Л. В. Таусону, может быть использован лишь
для Sn. Для большинства рудных элементов — Pb, Zn, Си, Hg, Мо,
U, Аи и т.д. — «металлогеническая специализация гранитоидов» в
этом смысле не существует. Основное значение при оценке потенциаль-
ной рудоносности гранитоидов ученый придает особенностям эмана-
ционной дифференциации элементов.
Щелочные породы
Основоположник геохимии щелочных пород А. Е. Ферсман с на-
чала 20-х годов приступил к систематическому изучению Хибинских
и Ловозерских тундр. Эти исследования привели к созданию школы
геохимиков и минералогов — специалистов по щелочным породам
(К. А. Власов, В. И. Герасимовский, Л. С. Бородин, М. В. Кузьмен-
ко, Е. И. Семенов, И. П. Тихоненков и др.).
Крупнейший в мире щелочной массив — Хибинский. Щелочные
породы известны также на Урале, в Восточной Сибири, Приазовье, Ту-
ве, а за пределами СССР — в Гренландии, Южной и Восточной Аф-
рике и других регионах.
Для щелочной магмы характерно высокое содержание Na и К (до
15 % против 5—7 % в гранитоидах и 3—4 % в базальтах). Количе-
ство SiO2 понижено, и породы не содержат кварца. Некоторые пред-
ставители этих пород не содержат и полевых шпатов, а только нефелин
и другие фельдшпатиды. По содержанию SiO2 одни щелочные породы
относятся к ультраосновным, другие — к основным и средним. Для
отдельных представителей щелочных пород характерна концентрация
Li, Rb, Cs, Са, Sr, Ti, Zr, Hf, Th, Nb и Ta, U, Ga, Tl, P, F и Cl
(рис. 48). Судя по резкому преобладанию Fe3+ над Fe2+, наличию
СеО2 (а не Се2О3) в некоторых видах щелочной магмы господствует от-
196
Рис. 48. Характерные элементы щелочных магм
носительно окислительная обстановка (уртит, луяврит, хибинит и др.).
Известны и щелочные породы, формировавшиеся в более восстанови-
тельных условиях, где Fe3 $ Fe2+ (нефелинит) или даже Fe2+ >
>Fe3 (ийолит, эссексит). По И. Петерсилье, многие щелочные породы
Кольского полуострова содержат повышенные количества углеводо-
родных газов (до 200 см3/кг), что также указывает на восстановитель-
ные условия породообразования.
Богатство магмы Na и К определили щелочную обстановку мине-
ралообразования. Ti, Zr и другие амфотерные элементы в этих услови-
ях, по Ферсману, образуют комплексные анионы с большим радиу-
сом (в более кислой гранитной магме они находятся в катионной фор-
ме, входят в состав циркона ZrSiO4, рутила ТЮ2, и других минералов).
Увеличение размеров ионов привело к понижению ЭК, а, следователь-
но, к уменьшению энергии решетки цирконосиликатов, титаносилика-
гов, эгирина и других минералов. Этим Ферсман объяснял агпаито-
вый тип кристаллизации многих щелочных магм (сначала кристалли-
зуются бесцветные минералы, а потом цветные, т. е. порядок кристал-
лизации прямо противоположен порядку кристаллизации из других
магм, где действует правило Розенбуша: сначала цветные, потом бес-
цветные). Для многих щелочных магм характерна высокая концентра-
ция F, С!, СО2, S, Р и других летучих (Л. Н. Когарко).
С коэффициентом агпаитности [(К2О + Na2O) : А12О3] хоро-
шо коррелируются отношения Се : Nd и Cs : Rb.
Важнейшая особенность щелочных пород — разнообразие мине-
ралов. Так, в Ловозерском массиве обнаружено около 300 минералов,
втомчисле40 новых (Е.И. Семенов, А. П. Хомяков). Главные минера-
лы щелочных пород—нефелин, пироксены, полевые шпаты, апатит.
Эти и другие минералы щелочных пород сложны по составу и содер-
жат элементы-примеси, входящие в решетку на основе изоморфизма;
редкие и рассеянные элементы сосредоточены в апатите (Sr, 15 ред-
ких земель), нефелине (Rb, Cs, Ga), сфене (Nb, Та), титаномагнетите
(V). Геохимические исследования в Хибинах позволили количественно
охарактеризовать их распространенность и распределение по минера-
лам (Е. А. Каменев, Д. А. Минеев, С. М. Кравченко).
Л.С. Бородин наметил три способа формирования щелочных пород.
1. Дифференциация базальтовой магмы с образованием существен-
но нефелиновых пород — уртитов.
2. Выплавка из мантии. Сюда относятся месторождения апати-
тов и щелочные породы с ниобиевыми, циркониевыми, редкоземель-
ными рудами, а также карбонатиты (см. ниже). В рифтах Восточной
Африки, судя по изотопному отношению 87Sr ; 86Sr, щелочные породы
имеют мантийное происхождение. Глубина образования магмы около
150 км.
3. Нефелинизация и альбитизация пород под действием мантий-
ных щелочных растворов и эманаций на гранитоиды и осадочно-мета-
морфические породы. В результате образуются нефелиновые сиениты и
альбититы, которые также местами обогащены редкими металлами.
198
С щелочными породами генетически связаны карбонатиты —
существенно карбонатные породы, состоящие из кальцита, доломита
и анкерита. Сначала их принимали за осадочные известняки или скар-
ны, затем доказали магматическое происхождение. Нередко они зани-
мают жерла древних вулканов.
В карбонатитах Восточной Африки кальцит кристаллизовался
при температуре 640—690 °C, апатит — при 690—700°, нефелин —
при 770—790 °C. В Танзании было извержение вулкана с карбонатито-
вой лавой. Образование столь необычного расплава возможно только
при насыщении его СО2 и щелочами. В карбонатитах известны апа-
тит-магнетитовые и редкометально-редкоземельные руды. Некоторые
карбонатиты содержат промышленные залежи флогопита. Особенно
ценен Nb, содержание которого достигает 0,1%, иногда целых про-
центов. Nb входит в состав пирохлора — (Na, Са)2 (Nb, Та, Ti)2Oe X
Х(ОН, F, О). Такие ниобиевые руды найдены в СССР, Восточной Аф-
рике, Канаде. С открытием карбонатитов Nb в экономическом смысле
перестал быть редким металлом.
Штоки и дайки карбонатитов обычно окружены мощным ореолом
щелочных пород — продуктом изменения вмещающих пород под влия-
нием глубинных щелочных терм. Ореолы возникли до внедрения кар-
бонатитовой магмы или одновременно с ней. Местами было и переплав-
ление пород, т. е. образование щелочной магмы.
В карбонатитах и их производных установлено свыше 70 минера-
лов, в том числе такие своеобразные, как бастнезит (CeCO3F), син-
хизит — [Са, Се (СО8)2], паризит — [СаСе2 (CO3)3FJ и др.
Карбонатиты характерны для зон глубинных разломов платформ
и щитов, особенно для рифтовых зон (в Восточной Африке и др.).
Полагают, что элементы мигрировали в щелочных растворах из ман-
тии с глубины 100—150 км. В этих условиях возникали анионные ком-
плексы Nb, Та, Zr, U и других металлов. По Ф. А. Летникову, восста-
новительные флюиды, поступающие из верхней мантии, окислялись
на небольших глубинах. Это благоприятствовало формированию кар-
бонатитовой магмы (СО—>-СО2, Н2—>-Н2О). По С. М. Кравченко и И. Т.
Расс, карбонатиты — продукт дифференциации кимберлитовой магмы.
Наряду с магматическими существуют и гидротермальные карбо-
натиты. Нередко те и другие образуют одну генетическую серию по-
род.
Пегматиты
Геохимические исследования пегматитов были начаты А. Е. Ферс-
маном. Ученый писал, что гранитный пегматит — это жильное тело,
в своей основе связанное с магматическим гранитным остатком, глав-
ная часть кристаллизации которого лежит в пределах 700—350 °C.
Решающее значение для минералообразования имело понижение тем-
пературы. На этом основании Ферсман разделил пегматитовый про-
цесс на пять этапов и одиннадцать геофаз и показал его завершающее
199
место в общем процессе эволюции магматизма. Позднее высказывались
представления о большой роли в образовании пегматитов процессов
перекристаллизации мелкозернистых магматических пород, гидротер-
мального метасоматоза, метаморфизма. Все эти процессы в отдельных
случаях играли свою роль, однако современная наука в основном сле-
дует за А. Е. Ферсманом, полагая, что главная масса гранитных пег-
матитов образовалась в результате кристаллизации остаточных маг-
матических расплавов.
Наиболее распространены и практически важны гранитные пегма-
титы — источники Та, Li, Cs, оптического флюорита, ювелирных кам-
ней, полевого шпата, слюды, пьезокварца и другого ценного сырья.
Пегматиты щелочной магмы содержат руды Nb и TR. Пегматиты ос
новных и ультраосновных пород значительно менее распространены,
практическое значение их невелико.
Анализ физико-химических условий образования пегматитов пока-
зал, что они формируются на глубинах от 2 до 15 км и более. В зависи-
мости от глубины формирования и других параметров выделяют фор-
мации гранитных пегматитов — мусковитовые, редкометальные, хру-
сталеносные и др.
Пегматитовый расплав богат Н2О, СО2, F~, Н3ВО3 и другими лету-
чими, а также К, Na, Li, Rb, поэтому он может быть в жидком состоя-
нии при довольно низких температурах (добавка в силикатный рас-
плав I % Li2O понижает температуру его застывания до 550 °C).
По валовому составу пегматитовый расплав близок к гранитной
магме, отличается от нее несколько повышенным содержанием О (по
Ферсману, в среднем 50,83 %), очень низким содержанием Mg
(0,06 %), накоплением летучих, ряда редких и рассеянных элемен-
тов. Особенно характерно накопление редких ионов больших (Cs+,
Rb+, TI+ и др.) и очень малых (Ве2+) размеров, которые не могли вой-
ти в решетки минералов протокристаллизации и гранитов. В гранит-
ных пегматитах содержание Li по сравнению с габбро возрастает в
1000 раз (до О, 15%), В — в 25 раз, Rb — в 100 раз. Резко растет ко-
личество Cs, Nb и Та, Be и других микроэлементов.
Элементы гранитных пегматитов, как правило, образуют ионы типа
благородных газов. Низковалентные катионы пегматитов обладают
большими радиусами и, следовательно, малыми ЭК. Многовалентные
катионы образуют крупные комплексные анионы, радиусы которых
также велики, а ЭК малы. По Ферсману, по сравнению с перидотитами
суммарная энергия катионов пегматитов, выраженная в ЭК, умень-
шается почти вдвое — от 80 до 45. Таким образом, пегматиты — это
преимущественно магматические системы низкого энергетического
уровня с малыми величинами энергии решеток минералов. В пегматитах
накапливаются элементы с резко контрастными свойствами: наиболее
сильные катионы (щелочные металлы) и наиболее сильные анионы (га-
логены), а также наиболее легкие (Н, Li, Be, В) и наиболее тяжелые
элементы (U, Th). Отчетливо выделяется преобладание (за исключе-
200
нием О и Si) элементов нечетных порядковых номеров с нечетной ва-
лентностью, особенно одно- и трехвалентных (см. рис. на форзаце).
Для формирования пегматитов характерна геохимическая эволю-
ция, в ходе которой содержание Mg, Fe, Ti, Sc, Ba, Zn убывало, a
Rb, TI, Cs, Ga, Ta, Pb, Bi, Sb — возрастало. При этом также законо-
мерно меняются отношения Nb/Та, Rb/Cs, TRCe/TRy, Zr/Hf, Ti/Nb,
Ва/Rb, Ва/Sr и т.д. (А. И. Гинзбург, Б. М. Шмакин).
Общее число минералов пегматитов превышает 300, характерны
крупные размеры отдельных кристаллов. Описаны кристаллы споду-
мена длиной 14 м, кварца — 7,5 м, пластины слюды площадью 7 м2,
полевого шпата массой до 100 т. Многие пегматиты используются в ка-
честве месторождений драгоценных камней. Их эксплуатация на Ура-
ле началась еще в XVII в. (знаменитая Мурзинка и др.).
Кроме преобладающих по массе кварца, полевых шпатов и слюд в
пегматитах содержатся также другие силикаты и оксиды — минералы
редких земель, ниобо-танталаты, цирконосиликаты и др. Характерны
также флюорит и апатит. Многие изоморфные пары элементов сходны
с теми, которые характерны для щелочных пород.
При метасоматической альбитизации и грейзенизации из пегмати-
тов выносятся К, Rb, Li и Cs, образующие широкие ореолы во вмещаю-
щих породах. Так формируются цезиеносные слюдипгы, биотит кото-
рых содержит до 10 % Cs (руда на Cs). Пегматиты наиболее характер-
ны для докембрийских гранитов, менее — для палеозойских и мезо-
зойских. еще менее—для кайнозойских. Среди докембрийских пег-
матитов известны мусковитовые и редкометальные, среди фанерозой-
ских — только редкометальные.
Гранитные пегматиты известны как на щитах, так и в складчатых
поясах, в которых пегматитовые поля с перерывом прослеживаются
на сотни и тысячи километров. Например, Кызылкумо-Туркестанский
редкометальный пегматитовый пояс протягивается на 1200 км. Уста-
новлены и региональные различия в составе пегматитов. В США,
в Техасе, по Мейсону, пегматиты обогащены только TR, а в Южной
Дакоте Li, Sn, но не TR. Пегматиты Южной Норвегии обогащены TR,
но не содержат Sn и редких щелочей. Причины подобных различий
недостаточно ясны.
Контрольные вопросы
1. Чем отличается геохимия изверженных пород от петрохимии?
2. Роль ионов в магматической миграции.
3. Сравните геохимию ультраосновных и кислых пород, геохимию их мине-
ралов.
4. Какие представления имеются о связи между геохимической специали-
зацией гранитоидов и рудообразованием?
5. Охарактеризуйте геохимию карбонатитов.
6. Какие элементы характерны для пегматитов?
201
II. МЕТАМОРФИЧЕСКИЕ И КАТАГЕНЕТИЧЕСКИЕ
(ЭПИГЕНЕТИЧЕСКИЕ) СИСТЕМЫ
К метаморфизму относятся процессы преобразования осадочных и
магматических пород под влиянием высоких температур и давлений
(Н. Л. Добрецов). Некоторые авторы относят к метаморфизму также
гранитизацию (гл. 10) и гидротермальный метасоматоз. Ниже рассмот-
рены процессы, протекающие без плавления пород, т. е. без элементов
магматизма и без глубокого метасоматоза. Однако в той или иной сте-
пени воды участвуют во всех процессах метаморфизма. Н2О и СО2 —
вполне подвижные компоненты метаморфических систем.
Эволюция метаморфизма нередко приводит к магмообразованию.
С этими процессами связаны такие понятия, как ультраметаморфизм,
палингенез, анатексис. В докембрии известны и переходные образова-
ния — мигматиты. Это еще один хороший пример в пользу того, что
за основу классификации метаморфизма, как и других процессов, сле-
дует принимать состояние системы, а не ее генезис (многие метаморфи-
ческие системы полигенетичны).
По А. Б. Ронову и А. А. Ярошевскому, метаморфические породы со-
ставляют 51,5% от объема гранитно-метаморфического слоя земной
коры.
Метаморфизм изучает петрология. Детально разработана система-
тика метаморфических процессов и соответственно классификация
метаморфических пород, подробно изучены их морфология, минераль-
ный состав, геологические условия залегания, физико-химические ус-
ловия образования на основе эксперимента и термодинамики. Граница
между петрохимией метаморфических пород и их геохимией не всегда
определенна (как и между петрохимией и геохимией магматизма).
Все же выявляется комплекс чисто геохимических вопросов, который
и будет рассмотрен ниже. Отметим, что в геохимическом отношении
метаморфизм и метаморфические породы изучены слабее магматизма.
Основные достижения петрологии в изучении метаморфизма, в том чис-
ле и понятийный аппарат, служат фундаментом для изучения геохимии
метаморфических систем.
А. А. Маракушев подразделяет метаморфизм на эндогенный, свя-
занный с недрами Земли, и космогенный, возникающий при ударе ме-
теоритов о земную поверхность и образовании метеоритных крате-
ров— астроблем. Образующиеся при таких ударах особые породы им-
пактиты испытали очень высокие температуры (тысячи градусов) и
давления и содержат сверхплотные минералы — алмаз, стишовит,
рингвудит и др.
Если при повышении давления и температуры элементарный состав
твердой фазы породы не меняется и характерен только привнес или
вынос газообразных продуктов (Н2О, СО2, О2 и др.), то такой мета-
морфизм именуется изохимическим. При аллохимическом метамор-
физме в систему поступают и выносятся из нее не только газообразные,
но и растворимые соединения (особенно К, Na, Са, Mg, Fe), порода
202
сильно изменяется, вплоть до полного метасоматического преобразова-
ния. Некоторые авторы считают гидротермальный метасоматоз и ал-
дохимический метаморфизм синонимами. Практически их изучение
развивалось разными путями (гидротермалиты будут рассмотрены в
гл. 12).
Наиболее изучен и распространен прогрессивный метаморфизм,
связанный с увеличением давления и температуры. На этой основе ус-
тановлены различные минеральные фации метаморфизма, в выделении
которых наряду с геологическими наблюдениями огромную роль сыг-
Р, '
МПа1'
5
300 400 500 600 700
^Аль6ит-зпи8от- РегоМманко-
•^мговикооая роговиковая
800 900 1000
Санидинитовая \Кантакто8ыи
(метаморфизм
’С too 200
Цеолитвая
Зеленых
сланцев
Глаукофанов а я
Ам/риЬалобая
Региональный
'метаморфизм
Гранулитовая
10
\ Эклогитовая
Рис. 49. Условия возникновения в координатах Т—Р различных мета-
морфических фаций по В. И. Смирнову (на основании данных П. Эско-
лы и др.)
рал термодинамический анализ. Со i емен В. М. Гольдшмидта, фин-
ского ученого П. Эскола систематика метаморфических фаций непре-
рывно совершенствуется. В нашей стране крупный вклад в изучение
метаморфических фаций внесли Д. С. Коржинский, В.С. Соболев, их
ученики и последователи (рис. 49).
Характерные продукты прогрессивного метаморфизма осадочных
пород — кристаллические сланцы (филлиты, слюдяные сланцы, параг-
нейсы), кварциты и мрамора. При метаморфизме магматических пород
возникают амфиболиты, эклогиты, ортогнейсы и другие породы.
Средние условия прогрессивного метаморфизма, по Н. Л. Добре-
чову, характеризуются температурой 600 °C и глубинами 15—30 км.
Но, например, для гранулитовой фации температура уже близка к
950 °C. При прогрессивном метаморфизме происходит дегидратация
пород, выделение СО2.
203
Метаморфизм, обусловленный понижением давления и температу-
ры, именуется регрессивным (ретроградным). Для него характерны
широкий интервал температур и щелочно-кислотных условий, гидра-
тация и карбонатизация пород, привнос В, F, Cl, SOI-, Au. U и дру-
гих рудных элементов. Повторный регрессивный метаморфизм назы-
вается диафторезом (породы — диафториты).
По геологическим и другим условиям различают региональный,
контактовый и дислокационный (динамометаморфизм) метаморфизм
Последний возникает в результате одностороннего давления (стресса)
при тектонических движениях. В таких зонах, особенно характерных
для регрессивного этапа, происходит дробление пород (катаклаз).
тонкое их перетирание (милонитизация), рост кристаллов (бластез)
и другие явления. Возможен и метасоматоз (но не обязателен). По
Ф. А. Летникову, для подобных зон характерны механохимические
явления. Подобные тектониты зеленосланцевой фации обогащены
также Pb, Hg, Cu, TR и другими элементами. Предполагается, что
они могли служить источниками для последующего рудообразования.
Интенсивный региональный метаморфизм всегда связан с областями
складчатости и прочих дислокаций. А. А. Маракушев различает
ранний (догранитный) метаморфизм собственно геосинклинального
этапа развития подвижных поясов и метаморфизм орогенического
этапа их развития. Возможно наложение разных этапов — поли-
метаморфизм. Микрозондовый анализ минералов показал широкое
развитие этого явления. В полиметаморфизме различают прогрессив-
ную (с ростом температуры) и регрессивную (с понижением темпера-
туры) ветви.
Флюидный режим метаморфизма. В изучении этого вопроса пет-
рология особенно тесно смыкается с геохимией. Это как раз тот слу-
чай, когда точно провести границу между науками невозможно. По
А. А. Маракушеву, специфика раннего (догранитного) этапа метамор-
физма определяется повышенной натриевой щелочностью растворов,
высокой их восстановленностью. Для данного этапа характерна по-
давленность дегидратации и особенно карбонатизации, высокая ус-
тойчивость минералов, богатых Са. Флюидному режиму метаморфиз-
ма еще в 1940 г. особое внимание уделял Д. С. Коржинский, анализи-
руя роль Н2О и СО2 в этом процессе. Роль СО2 по его представлениям
с глубиной повышается. Минералы, богатые Са, разлагаемые на глу-
бине СО2, ученый назвал абиссофобными, а минералы, устойчивость
которых растет с глубиной, — абиссофильными.
Различают флюиды окисленные (Н2О — СО2 SO2) и восстанов-
ленные (Н2 + СО + H2S + СН4), причем поступление последних
(«сквозьмагматических растворов» Коржинского) связывают главным
образом с мантией. Окислением восстановленных флюидов в земной
коре А. А. Маракушев и Л. Л. Перчук объясняют выделение энергии,
необходимой для магматизма и метаморфизма (имеются и другие
подходы к этому вопросу). Само орогенное воздымание складчатых по-
204
ясов некоторые авторы связывают с окислением флюидов, возрастанием
в них роли СО2 и Н2О, вызывающем разуплотнение глубинных зон.
Ф. А. Летников и соавторы применили при изучении флюидного
режима метаморфизма хроматографический анализ. Предполагается,
что до гранитизации в метаморфизме ведущая роль принадлежит флю-
идам пород, подвергшихся метаморфизму. И только при гранитизации
и мнгматизации ведущая роль принадлежит флюидам из нижних
горизонтов земной коры или мантии. Для них характерны К, Si, Al и
Na. Индикатором подобного метаморфизма служит К, входящий в со-
тав слюд и полевых шпатов.
Дегазация и дегидратация. При прогрессивном метаморфизме
происходит энергичная дегазация. А. М. Овчинников в классифика-
ции газов выделил «газы метаморфической обстановки», к которым в
первую очередь относил СО2. Аналогичное происхождение могут иметь
и углеводороды, возможно Н2 и другие газы. В «газовом дыхании зем-
ной коры» многие авторы важную роль отводят метаморфизму.
При прогрессивном метаморфизме осадочных пород освобождается
поровая, конституционная и кристаллизационная вода глинистых и
других минералов (метаморфические сланцы содержат меньше этих
форм воды, чем исходные глины и алевролиты). По подсчетам
А. А. Саукова, 1 км3 глинистых осадочных пород может выделить при
метаморфизме iOO млн. т. Н2О. Таким «метаморфогенным путем» по
Я. Н. Белевцову, В. С. Домареву, В. Мармо, А. А. Саукову. Н. Г.
Судовикову и другим, возникают гидротермальные растворы.
Изучение метаморфизма в породах щитов и кристаллических мас-
сивов СССР показало, что содержание петрогенных элементов, за ис-
ключением Na и К, на всех стадиях метаморфизма практически не ме-
няется. При этом снижается содержание СО2, Н2О, частично восстанав-
ливается Fe (Fe3+—>-Fe2+), выносятся Li, As, Pb, TR и другие элементы,
в том числе Au и Hg. По Н. П. Ермолаеву, при прогрессивном метамор-
физме из пород выщелачивается U, а на глубоких ступенях метамор-
физма и Th. В какой мере этот метаморфогенный U служит источни-
ком для рудообразования — предмет дискуссий.
Метаморфические и метаморфогенные месторождения. Месторож-
дения, возникшие в процессе метаморфизма в связи с перегруппиров-
кой минерального вещества метаморфических пород, т. е. в основном
«изохимическим путем», В. И. Смирнов именует метаморфическими.
Характер месторождений зависит от типа метаморфизуемых пород и
фации метаморфизма. Так, при метаморфизме известняков возникают
мрамора, при метаморфизме песчаников — кварциты, при низкой
степени метаморфизма глинистых сланцев образуются кровельные
сланцы. К фации зеленых сланцев принадлежат некоторые месторож-
дения асбеста, к амфиболовой — кианиты, наждаки и графиты, к гра-
нулитовой фации — месторождения граната, к эклогитовой — ру-
тила. В импактитах образуются месторождения алмаза.
Наряду с метаморфическими различают метаморфогенные место-
рождения, обязанные выносу рудных элементов в ходе метаморфизма
205
и их последующему осаждению на геохимических барьерах. С подоб-
ными процессами многие авторы связывают образование месторожде-
ний Fe, Мп, Pb, Zn, Си, Au, U, Р. Они залегают среди докембрийских
и нижнепалеозойских метаморфических толщ (Кривой Рог в СССР,
месторождения Мп в Индии и Бразилии, РЬ и Zn в Австралии, апати-
ты в Сибири).
Предметаморфические (катагенетические) системы. Осадочные по-
роды, погружаясь на глубину, попадают в зоны все более высокого
давления и температуры. Литологи детально изучили превращения по-
род при погружении вплоть до стадии их метаморфизма (А. В. Копе-
лиович, А. Г. Коссовская, Н. В. Логвиненко, В. Д. Шутов и др.).
Л. Б. Рухин (1912—1959) назвал данные процессы эпигенетическими.
причем (аналогично метаморфизму) различал прогрессивный эпиге-
нез, обязанный тектоническим опусканиям, росту давления и темпера-
ратуры, и регрессивный эпигенез, связанный с тектоническими подня-
тиями. В последние десятилетия большее распространение получил
термин «катагенез» со ссылками на А. Е. Ферсмана, хотя этот ученый
под катагенезом подразумевал другую группу явлений.
Прогрессивный катагенез (эпигенез) — стадия литогенеза, пред-
шествующая метаморфизму. Для него характерны дегидратация и
уплотнение пород. Пески и рыхлые песчаники преобразуются в плот-
ные песчаники, ракушечники в слоистые известняки, глины — в ар-
гиллиты, бурые угли — в каменные. По мере погружения пород изме-
няется минеральный состав обломочной части и цемента. Характерны
гидрослюдизация и хлоритизация, регенерация и коррозия зерен
кварца и полевых шпатов, образование цеолитов. Эти процессы особен-
но детально изучены на примере обломочных пород. Нижней границей
катагенеза Н. Б. Вассоевич считал температуры 300—-350 °C, верх-
ней— 25°. с чем вряд ли можно согласиться. Л. Б. Рухин и другие авто-
ры отмечали неопределенность границы катагенеза и метаморфизма,
ее разную глубину в разных районах (в Днепровско-Донецкой впади-
не еще на глубине 7 км развит катагенез, в орогенных зонах метамор-
физм проявляется на первых километрах).
Н. Б. Вассоевич выделил три подстадии катагенеза: 1) протока-
тагенез с температурой 50—75 °C и глубинами 1—3 км (соответствует
буроугольному этапу углефикации); 2) мезокатагенез — до 210—
-280 °C, глубинами 2,7—2.8 км, отвечающий стадии образования
каменных углей Донбасса от Д до ОС включительно; 2) апокатаге-
нез -— с глубинами до 5—15 км и температурами до 300—360° С, с из-
менением каменных углей до антрацита. Глубже развивается реги-
ональный метаморфизм. Некоторые авторы выделяют еще зону ме-
тагенеза, предшествующую зеленосланцевому метаморфизму. Де-
тально изучен катагенез нефтей — их осернение, превращение в би-
тумы и т.д. (В. А. Успенский, О. А. Радченко, Б. А. Лебедев и др.).
Катагенез изучают и с позиций инженерной геологии (Е. М. Серге-
ев, В. И. Осипов, В. Д. Ломтадзеи др.), гидрогеологии. По этому гео-
химия прогрессивного эпигенеза — синтез данных многих наук и.
206
конечно, собственно геохимической методологии (некоторые результа-
ты рассмотрены в гл. 16).
Регрессивный эпигенез (катагенез). Наиболее детально он изучен
на гидрогенных месторождениях урана (гл. 18). Хорошо изучены так-
же раздоломичивание, глубинный карст и другие процессы (гл. 16).
Большинство из них связано с деятельностью бактерий. Биогеохими-
ческие процессы не исключаются и в прогрессивном катагенезе, осо-
бенно после открытия бактерий в поровых растворах и бактерий, жи-
вущих при 300 °C.
Контрольные вопросы
1. Сравните геохимию прогрессивного и регрессивного метаморфизма.
2. Чем отличается изохимический метаморфизм от аллохимическогр?
3. Охарактеризуйте флюидный режим метаморфизма.
12. ГИДРОТЕРМАЛЬНЫЕ СИСТЕМЫ
Основную информацию по геохимии гидротермальных систем да-
ет изучение рудных месторождений. В этой области накоплен колос-
сальный фактический материал, сделаны ценные обобщения. Важным
источником сведений служит также изучение современных гидротерм.
Эти два направления исследований развивались и частично развива-
ются независимо друг от друга, на основе разной методологии и разных
методов, выводы их часто слабо увязаны между собой, а порой и проти-
воречат друг другу. Поэтому одна из задач геохимии гидротермальных
систем — разработка единой теории на основе синтеза данных геохи-
мии, минералогии, петрографии, науки о рудных месторождениях, гид-
рогеологии и вулканологии.
Гидротермальные системы — основной источник Си, Pb, Zn, Ag,
Hg, Sb, Mo и других цветных, редких и благородных металлов, а так-
же хризотил-асбеста, магнезита и другого нерудного сырья.
Современные гидротермы
Термальные воды особенно детально изучаются в связи с их ис-
пользованием в качестве источника тепловой и электрической энер-
гии, источника Li, Cs, Sr, В, Br, I и других элементов. В результате
представления о природе и распространении гидротерм сильно изме-
нились. Ранее термальные источники были известны преимущественно
в районах современного или молодого вулканизма, поэтому их происхо-
ждение связывали с магматизмом. Это был один из аргументов в поль-
зу постмагматического происхождения гидротермальных месторожде-
ний. Позднее гидрогеологи открыли в земной коре особый пояс
термальных вод. Выяснилось, что холодные воды образуют лишь «тон-
кую пленку» на основной массе нагретых и перегретых вод. Источни-
207
ком гидротерм во многих случаях оказались атмосферные осадки,
проникшие на глубину. Это доказано даже для районов современного
вулканизма.
Среди современных гидротерм известны маломинерализованные
воды и рассолы, кислые и щелочные воды; по газовому составу — уг-
лекислые, азотные, метановые, сероводородные. В гидротермах обна-
ружены разнообразные органические соединения, в том числе полицик-
лические углеводороды (ПАУ).
В табл. 15 приведена матричная систематика современных гидро-
терм, основанная на принципах, изложенных в гл. 9. Для них рассчи-
таны коэффициенты водной миграции и концентрации, построены ря-
ды миграции (табл. 16).
Таблица 15. Матричная систематика современных гидротерм
(в скобках— примеры вод)
Щелочно-кислотные условия Окислительно-восстановительные условия
Окислительные Восстановительные без H2S (термальные глеевые) Восстановительные с H2S и его произ- водными (сероводо- родные и суль- фидные)
Сильнокислые I. Сильнокислые кислородные (кис- лые термы обла- стей вулканизма) V. Сильнокислые глеевые (сильно- кислые хлоридные рассолы платформ и передовых про- гибов) IX. Сильнокис- лые сероводород- ные (кислые фума- ролы вулканиче- ских районов)
Слабокислые II. Слабокислые кислородные V.1 Слабокислые глеевые (слабокис- лые рассолы Че- лекена) X. Слабокислые сероводородные (сероводородные воды)
Нейтральные и слабощелочные Ш. Нейтральные и слабощелочные кислородные VH. Нейтраль- ные и слабощелоч- ные глеевые (азот- нокислые гейзеры Камчатки) XI. Нейтральные и слабощелочные сероводородные сульфидные (ис- точники Карловых Вар и др.)
Сильнощелочные IV. Сильноще- лочные кислород- ные VIII. Сильноще- лочные азотные термы гранитон- дов н других по- род ХН. Сильноще- лочные сероводо- ро дно-су льфндные (Тбилисские тер- мы)
Кислородные гидротермы (1—IV классы). Хорошо изучены серно-
кислые и солянокислые термы с pH 0,5—3,5, богатые Fe и А1, местами
208
Zn, Pb, Си. Они известны на п-ве Камчатка, Курильских, Зондских.
Японских и других вулканических островах. Определение изотопного
состава Н, О, С, Не, Аг показало, что большинство терм Курильских
островов и Камчатки вадозного происхождения. Нередко эти воды на-
ряду с О2 содержат и H2S, т. е. системы резко неравновесны. О2 в них
поступает из воздуха, поверхностных и грунтовых вод. Eh иногда до-
стигает + 1000 мВ и более (за счет HF и НС1).
Глеевые термы с восстановительными условиями, не содержащие
или содержащие мало H2S (V—VIII классы). Глеевые термы анало-
ги глеевых вод зоны гипергенеза. Они известны во всех альпийских
складчатых областях, на платформах и в передовых прогибах. По
газовому составу это углекислые, азотные и другие воды.
Для платформ и передовых прогибов характерны глубинные го-
рячие артезианские хлоридные рассолы, часто с сильнокислой реакци-
ей (pH 3,5, иногда до 2). Они относятся к V и частично VI классам
Происхождение рассолов многие авторы связывают с растворением за-
лежей ископаемых солей. Существует представление и об их магмати-
ческом источнике (см. гл. 13).
Кислые хлоридные рассолы способны выщелачивать из вмещаю-
щих пород Fe, Мл, Sr, Ва, Pb, Zn, Си и другие рудные элементы. Мно-
гие металлы образуют в этих водах растворимые хлоридные комп-
лексы. Например, хлоридные рассолы девонских отложений Волго-
Уральского региона (50—300 г/л) содержат (мг/л) Fe до 500, 700— Sr.
200 — Ва, 4 — Си и т. д. Температура их около 40 °C, сульфаты и
H2S в них отсутствуют.
Ценную информацию о гидротермах данной группы дало изучение
подземных вод, разгружающихся во впадинах морского дна, в назем-
ных рифтах, озерах. Особую известность приобрели металлоносные
хлоридные рассолы рифтов Красного моря, где в глубоких впадинах
Атлантис II, Дискавери и других разгружаются кислые (pH 5—6)
хлоридные рассолы с температурой около 50 °C, обогащенные Мп.
Fe, Zn, Pb, Си, Со (класс VI) (источником хлоридов служат залежи со-
лей на дне и в бортах впадин).
На п-ве Челекен в Закаспии в неогеновых красноцветах вскрыты
бурением хлоридно-натриевые рассолы с температурой около 100 °C,
минерализацией 200—280 г/л, pH 5,5—6,5 и Eh от + 0,15 до—0,35 В
(класс VI). Среди газов установлены СН4 и его гомологи, Н2, в мень-
ших количествах СО2 и H2S (не всегда). Воды содержат до 200 мг/л РЬ.
9—Zn, 15—Си, 8,5 — Cd, 1—As и т.д. (Ю. Ю Бугельский, В. И. Дво-
ров, Л. М. Лебедев, И. Б. Никитина). Предполагается, что в термаль-
ных рассолах Челекена содержатся следы сверхтяжелых элементов
(Г. Н. Флеров).
По Г. А. Голевой, для глубокопогребенных нефтегазоносных струк-
тур характерны углеводородные металлоносные рассолы. В Предкар-
патском прогибе такие рассолы залегают на глубине 5—6 км.
К классу VII относятся азотноуглекислые гидротермы в областях
современного и молодого вулканизма. Они тяготеют к глубинным раз-
209
210
Таблица 16. Ряды интенсивности миграции и концентрации элементов
в термальных водах (по А. И. Перельману, Е. Н. Борисенко)
Объекты исследования Интенсивность миграции и концентрации элементов по величине Кх
очень сильная I 000 ООО- ТОО сильная 700-20 средняя 20 !,[) слабая 1.0—0,05 очень слабая 0.05-0.001 НИЧТОЖНО малая -0.001
Термальные воды Гвинеи (Западная Аф- рика) С1, Вт, I Na, К , Ca, S, Ag Mg. Ba, Mn, Pb, Zn Cu, Si, Ti
П-ов Че- лекен бессерово- дородные термальные воды апшероиских отло- жений С1, Вт, I Na, Ca, Mg, Cs S, As. Li, Rb К, Fe, Си
термальные воды красноцветной толшн Cl, Br, I Na, Са, Sr, Li, As. TI S, Mg, K, Ba, Mn, Zn, Mo, Cu. Pb Ni, Rb Fe Si, Al
сероводородные воды крас- иоцветной толщи С1, Вт I S, Na, Ca, Li, Sr, As, B, TI Mg Ni, Cs К. Мп, Ba, Rb, Mo Fe, Cu, Al, Si
Термальные рассолы Калофорнин, Сол- тон-Си С1 Br, I, В, Li, Ag Na, Ca, K, Sr, Mn, F, Pb, Zn Ba, Ni, Cu, Fe S, Mg, Si, Cr
Гидротермы впадин Красного моря С1 Br Na, S Ca, Mg, K, Sr, Mn, Zn, Co, Pb Fe, Ni, Cu Si
П-ов Камчатка и Ку- рильские острова (бессе- роводородиые) кислые гид- ротермы Cl, Br, I S, As Na, Ca, Mn, Li, Cs, Zn, Pb, Sb, Cr K, Mg, Rb, Fe, Ni, Al, Cu, F, Si, Sr, Sc, Y, Zr, Ti, V, Co
щелочные гндротермы С1 As, Br, I, Cs S, Na, Sn, Li K, Mg, Ca, Rb, Mn, Pb, Cu, Zn, Co, F, Y, Sr, Si Ni, Fe, Cr Ti, Al
Япония (сероводород- содержащие) кислые гид- ротермы Cl, S, As, Ag Pb, V K, Na, Mg, Ca, Fe, Al, Si, Au, Cu, Zn, Mn, Mo, Li, Cs, Sr, F Sn, Sb, Ti, Cr, Co, Rb, Be Ni
щелочные гидротермы С1 Br, В K, Na, Li, Cs Pb, Zn, Mo, Mn, V, Ba, Sr, Rb Mg, Ca, Fe, Al, Si, Sn, Ti, Cr, Be, F S, Ni, Co
ломам, минерализация их невелика (п г л), воды часто обогащены As,
В, Li, Rb, местами Sb, Hg и другими микроэлементами, имеют нейт-
ральную или щелочную реакцию, на сравнительно небольшой глуби-
не температура превышает 200 °C. Таковы гейзеры п-ва Камчат-
ка, Джермук Армении, Шпрудель Карловых Вар и другие источ-
ники.
К VIII классу принадлежат азотные термы, не имеющие прямой
связи с вулканизмом. Они приурочены к кристаллическим породам,
имеют низкую минерализацию (до 1 г/л), высокую щелочность — pH до
10, сульфатно-гидрокарбонатно-натриевый состав. На выходах темпе-
ратура достигает 100 °C. Термы содержат много SiO2 (до 0,1 г/л и бо-
лее), обогащены Ge, Be, F, W и Mo. Источником данных элементов,
по С. Р. Крайнову, служат вмещающие породы, чаще всего гранитои-
ды. Содержание W и Мо достигает п-10~4 г/л, возможно, это типич-
ные рудоносные растворы. Воды местами имеют отрицательный Eh
(—80, —100 мВ).
Сероводородные и сульфидные гидротермы (классы IX—XII).
Они содержат H2S и его производные (HS-, реже S2-) и не содержат О2.
Такие термы часто образуются в передовых прогибах, в артезианских
бассейнах на участках брахиантиклиналей с нефтью и газом (классы
XI, XII). Известные Тбилисские термы содержат, например, 0,01 —
0.02 г/л H2S, имеют pH = 9,3 и являются азотными гидросульфид-
ными хлоридно-гидрокарбонатно-натриевыми водами (класс XII).
Близкое количество H2S содержат многочисленные термальные источни-
ки Копетдага и других горноскладчатых районов СССР. При не очень
высоких температурах H2S поступает в воды за счет восстановления
сульфатов бактериями. При большем нагреве этот газ образуется в ре-
зультате термического разложения органических веществ, обменных
реакций с сульфидами, химического восстановления сульфатов. Име-
ются представления и о глубинном источнике H2S — из магмы.
Важными компонентами сероводородных вод часто являются СО2
и СН4. В осадочной оболочке источником СО2 в основном служат тер-
мометаморфические процессы — разложение карбонатов осадочных
пород, органических веществ. В экспериментах больше всего СО2
выделяется при нагревании известняков до 360 °C и выше. Источником
СН4 являются бактериальные и неорганические процессы разложения
органических веществ.
«Черные курильщики». Так были названы на дне рифтов Тихого
океана продукты разгрузки сероводородных гидротерм черного цвета.
Это конусы диаметром в сотни и высотой в десятки метров, сложенные
полиметаллическими сульфидными рудами. Последние образуются на
геохимическом барьере — контакте горячих сульфидных терм (до
350 °C) с холодной (около 2 °C) морской водой.
Известные сульфидные месторождения о. Кипр (массив Тродоос,
сложенный офиолитами — былой океанической корой позднемелового
возраста) оказались полными аналогами черных курильщиков дна
Тихого океана.
212
Гидротермальный метасоматоз
Метасоматоз характерен для гидротермальных систем. «Метасо-
матическими, — пишет Д. С. Коржинский, — называются процессы
изменения химического состава породы, совершающиеся посредством
замещения одних минералов другими. Замещение совершается обыч-
но при участии поровых растворов, которые растворяют одни минера-
лы и немедленно отлагают другие, так что в течение замещения поро-
да в целом сохраняет твердое состояние»1. Гидротермальноизменен-
ные породы именуются гидротермалитами.
Основы теории метасоматических процессов разработаны iia тер-
модинамической основе Д. С. Коржинским и его школой (В. А. Жари-
ков, Л. Л. Перчук и др.). Физическую сущность метасоматоза изучал
Г. Л. Поспелов. С позиций физики граничного слоя (между твердой и
жидкой фазой) он разработал понятие о «функциональных микросис-
темах метасоматоза», об их микрозональности («забойная зона», «кон-
денсационная зона» и т.д.). Ученый рассмотрел и макросистемы ме-
тасоматоза. Направление Г.Л. Поспелова имеет большое значение и
для понимания геохимической стороны вопроса.
Е. В. Плющев особенно подчеркивает значение кларков и кларков
концентрации элементов для характеристики геохимии гидротерма-
литов и выделяет четыре градации элементов по их содержанию в этих
породах. Исходя из понятия об уровнях организации материи этот ав-
тор последовательно рассматривает геохимию гидротермальных мине-
ралов, пород и формаций. При анализе рудоносности формаций важ-
ное значение придается геохимическим барьерам (главным образом
D и Е по нашей систематике).
При метасоматозе реакции носят обменный характер, одновремен-
но осуществляются противоположные процессы привноса и выноса
элементов. Например, при образовании турмалиновых грейзенов
Казахстана привносятся Mg2+, В3+, Fe3+, А13+, О2-, ОН~, F- и С1“,
а выносятся Na+, К+, Si, Н2О.
Различают инфильтрационный и диффузионный метасоматоз.
Основное значение имеет первый, который охватывает большие толщи
пород, простирающиеся на целые километры. Диффузионный метасо-
матоз обычно распространяется на несколько метров. Часто при мета-
соматозе происходит сочетание инфильтрационных и диффузионных
процессов.
Взаимодействие термальных поровых растворов с породой приво-
дит к формированию метасоматической зональности — последова-
тельной смене метасоматитов (гидротермалитов) от наиболее изменен-
ной внутренней зоны к внешней зоне и неизмененной породе. Сово-
купность одновременно образовавшихся метасоматитов («зональная
колонка») называется метасоматической фацией, а совокупность фа-
Чий, возникшая в результате одного петрогенетического или генети-
1 Коржинский Д. С. Теория метасоматической зональности. М., 1969. С. 7.
213
Рис, 50. Условное подразделение гидро-
термально-метасоматических формаций
по характерным петрогенным элементам
внутренних зои (по Д. В. Рундквисту
и И. Г Павловой):
Apr — аргиллизиты, Бер березиты, Вт. кв—
вторичные кварциты. Грз — грейзены. Гумб—
гумбенты. Карб — карбонатиты. Пр — пропи-
литы, С рп — серпентиниты. Ск — скарны маг
незнальные н известковые. Т — хл — турма
линхлормговые метасоматнты. Фелд — фельд-
шпатотиты. Фен—феннты
чески единого геологического процесса, именуется метасоматической
формацией (В, А. Жариков). По Б. И. Омельяненко, для таких форма-
ций характерны признаки, выдерживающиеся в пределах крупных
провинций, повторяющиеся во многих районах со сходными геологи-
ческими условиями. К этим признакам относятся место формации в ис-
тории геологического развития района, связь с магматизмом (или ее
отсутствие), особенности минерального и химического состава, ме-
таллогеническая и геохимичес-
кая специализация, условия ло-
кализации, строение метасома-
титов. В аналогичном смысле
используется также термин «гид-
ротермально-метасоматиче с к а я
формация» (В. И. Рехарский,
Д. В. Рундквист). Помимо мета-
соматитов в нее включают пара-
генные с ними жилы и прожил-
ки. Д.В. Рундквист выделил 13
гидротермально-метасомати чес-
ких формаций, особенности ко-
торых определяются поведением
трех групп ведущих элементов:
К и Na; Fe, Mg, Са; Al и Si
(рис. 50). К ведущим элементам,
вероятно, следует отнести и С,
так как установлен особый тип
гидротермального метасомато-
за—углеродизация. К нему, на-
пример, относятся контролируе-
мые тектоническими наруше-
ниями, обогащенные графитопо-
добным веществом «черные
сланцы» и песчаники, окаймля-
1. И. Новгородова), Эпигенетич-
ность мглеродизации, ее связь с гидротермами в подобных случаях
очевидна.
Реакции метасоматоза экзотермичны и сопровождаются связыва-
нием воды в силикатах (хлоритизация, серицитизация, каолинизация
и т.д.). По Ф. А. Летникову, это приводит к росту концентраций руд-
ных элементов в растворах и их осаждению (метасоматоз часто пред-
шествует рудообразованию).
Большое влияние на метасоматоз оказывают щелочно-кислотиые
условия. Четко выявляются две группы процессов — кислотное вы-
щелачивание и щелочной метасоматоз. Грейзенизация, березитиза-
ция, пропилитизация, образование аргиллизитов, вторичных кварци-
тов и многие другие процессы связаны с кислотным выщелачиванием.
Наиболее ярко они выражены в кислых породах и слабее в основных.
214
ющие золотоносные метасоматиты
С этими процессами связано удаление из пород оснований. Воды отно-
сятся к V, VI, IX, X классам. Кислотность гидротерм обусловле-
на НО, HF, H2S, СО2 и другими кислотными компонентами. По
Б. И. Омельяненко, для березитов характерны интервалы температур
250—300°С, pH от 3,5 до 5,5, Eh от—0,2 до —0,36 В. Максимальная
активность кислот достигается при средних температурах; для высоко-
температурных и низкотемпературных процессов более характерны
щелочные среды.
Щелочные растворы вызывают альбитизацию, нефелинизацию, це-
олитизацию, магнезиальный метасоматоз и другие изменения пород.
Эго воды VII, VIII и XI
классов. Наиболее полно
данные процессы развиты
в средних и основных по-
родах. Весьма интересны
выделяемые Б. И. Омелья-
ненко низкотемпературные
щелочные натриевые мета-
соматиты — эйситы, для
которых характерна аль-
битизация. Вэйситизирую-
щих растворах содового
состава подвижны анионо-
Рис. 51. Схематическая кривая изменения
режима кислотности — щелочности раство
генные элементы, высока
подвижность Ti, Р, Zn, Si,
низка активность сульфид-
ной серы. Температура
растворов от 220 до 280° С,
pH, от 8 до 10, Eh от (—0,7)
до (—0,8) В. Воды при-
ров в процессах высокотемпературного по-
стмагматического метасоматоза при рас-
кристаллизации гранитов (по А. Беусу и
Н. Залашковой)
надлежат к VIII классу. Эго аналоги содовых глеевых вод биосферы
По Д. С. Коржинскому, по мере движения растворов происходит
закономерная смена трех стадий гидротермального процесса: ранней
щелочной, кислотной и поздней щелочной (рис. 51).
В развитии кислотных процессов Коржинский важное значение
придавал фильтрационному эффекту — отставанию катионов и раст-
ворителя от кислотных компонентов при фильтрации растворов через
пористые среды. Фильтрационным эффектом ученый объяснял «опе-
режающую волну кислотных компонентов», т. е. вторую — кислот-
ную стадию. Фильтрационный эффект подтвержден экспериментами,
однако природа явления трактуется по-разному. Его объясняют так-
же сорбцией, ионным обменом и другими процессами. По Л. Н. Ов-
чинникову, это суммарный результат ряда явлений. Геохимическое
значение фильтрационного эффекта также еще недостаточно ясно.
Для зон метасоматических колонок характерны парагенезисы ми-
нералов. Так, при березитизации во внутренних зонах происходит за-
мещение породообразующих алюмосиликатов кварцем, серицитом.
215
пиритом, карбонатами (обычно анкеритом). Во внешних зонах по по-
родам среднего и кислого состава формируется парагенезис: кварц,
серицит, альбит, ортоклаз, кальцит, хлорит, пирит. Для метасомати-
Рис. 52. Схема развития метасоматоза в системе интрузив—надинтрузивная зо-
на в контрастных средах (по В. А. Кудряшову и др.):
/ — известняки, 2 — доломиты, 3 — скарны, 4 — граниты, 5—7 продукты метасоматических
процессов (5 — калншпатязярованные граниты н каляшпатнты, 6 — альбитизированиые гра-
ниты, 7 —’ грейзенязяроваяные породы), 8—16 — грейзены (8 — слюдяно-кварцевый, 9 — квар-
цевый, 10— топазовый и топаз-кварцевый, // — слюдяной, турмалнн-слюдяной, 12 — топаз-
флюоритовый. 13 — слюдянофлюоритовый, 14 — флюоритовый, 15 — слюдяно-селлаит-флюо-
рятовый, 16 -- селлаят-флюорятовый), /7 — жилы выполнения
216
тов характерна и вертикальная зональность. Например, смена по вер-
тикали вторичных кварцитов, пропилитов и аргиллизитов.
Оруденение часто накладывается на метасоматиты или развивает-
ся одновременно с ними. Поэтому многие авторы рассматривают рудо-
образование как часть общего процесса метасоматоза («рудоносные
метасоматиты»). Например, на медно-молибденовом месторождении
Каджаран к березитовой формации приурочено свинцово-цинковое
оруденение, к кварц-серицитовой — медное и к полевошпат-кварцевой—
молибденовое. По В. И. Рехарскому, для последней формации ха-
рактерны привнос Mo > W > К > Zn > Си > Si > Sn и вынос
Pb > Al > Cr > Ni > Со > Na > Са > Ti > Fe > Mg > Мп. Эти
ряды составлены по отношению содержания элемента во внутренней
зоне метасоматитов к его содержанию в неизмененной породе. При
привносе коэффициент больше 1, при выносе — меньше. Для Мо ко-
эффициент равен 53,4 (сильный привнос), для Fe — 0,03, Мп — 0,01
(почти полный вынос!).
На гидротермальных месторождениях обычно устанавливаются
стадии метасоматоза: предрудиая, рудная и пострудная. Как правило,
наиболее резко выражена предрудная стадия, которая коррелируется
с определенными типами оруденения (однако генетические связи уста-
навливаются не всегда).
Состав гидротермально-метасоматических формаций определяется
поступающими растворами и типом изменяемых пород. Серпентини-
зация, например, характерна для ультраосновых пород, уралиты —
для основных, грейзены — для кислых и т.д. Однако у некоторых
метасоматитов строгая приуроченность к определенному типу пород
отсутствует (рис. 52). Известны и переходные типы метасоматитов, а
также наложение одних типов на другие.
В. И. Рехарский выделил три группы гидротермально-метасома-
тических формаций'.
I. Гидротермально-метасоматические формации,
связанные преимущественно с гранитоидными породами 1
Магнезнально-скарновая — Fe, В2, флогопит
Известково-скарновая — Fe, Cu, Со, V, Мп
Фельдшпатовая — Та, Nb, TR, U, Th, Ti, Be. Li, Zr, Hf
Полевошпат-кварцевая — Mo, W, Sn, Cu
Грейзеновая — W. Mo, Sn, Be, Li, Bi
Турмалнн-кварцевая (турма- — Sn, Cu, W, Bi, Au, As
лин-хлорнтовая) Пропилитовая — Au, Ag, Cu, As, Pb, Zn
Вторичнокварцнтовая —Cu, Zn, Pb, Au, Ag
Кварц-серицитовая —Cu, Mo, Zn, Pb
Березитовая (березиты, гум- — Pb, Zn, Au, Ag, U, Mo, Bi Sn, W, Be, Co,
беитых эйситы) As, Sb, Hg
Аргиллизитовая — Hg, Sb, Sn, Au, Ag, As, U, Mo, Zr, Pb, Zn, Cu
। Формации расположены сверху вниз от ранних высокотемпературных
к поздним низкотемпературным.
2 Полужирным шрифтом выделены главные рудные элементы.
217
II. Гидротермально-метасоматические формации,
связанные преимущественно с ультраосновными — основными породами
Серпентинитовая
Уралитовая
Тальк-карбонатная
Брусит-валлериитовая
Лиственитовая
—Сг, асбест
— Ni, Cu, Pt, флогопит
— Ni, Си, Аи, тальк, магнезит
— Си, Ni, Со, Pt
— Hg (?), Аи, Си, Zn, Pb
III. Гидротермально-метасоматические формации,
связанные преимущественно с ультраосновными — щелочными породами
Альбититовая —Zr, Hf, Nb, Та, TR, Th, L1
Камафоритовая (апатит-маг- —Fe, Ti, P, Zr, Ta, Nb, Cu
нетитовая)
Карбонатитовая —Nb, Ta, Zr, TR
Карбонат-флюоритовая (?) —флюорит
Проблема «метасоматоз и оруденение» привлекает большое внима-
ние. Многие положения в этой области являются предметом дискуссии.
Более общее значение метасоматоза (по сравнению с оруденением),
по-видимому, объясняется тем, что он обусловлен небольшим числом
ведущих элементов с высокими кларками — Na, К, S, Cl, F и т. д.
Отсюда известное постоянство типов метасоматоза, их устойчивость в
широком интервале pH, Eh, Т, Р и других условий. Например, аль-
битизация возможна и при pH 8, и при pH 10, т. е. при изменении кон-
центрации водородных ионов в 100 раз. Существенно, что миграция
многих ведущих элементов метасоматоза не зависит от pH и Eh (К,
Na, Cl и др.). Иные зависимости характерны для оруденения. Число
рудных элементов намного превышает число ведущих элементов мета-
соматоза. Рудные элементы, как правило, имеют низкие кларки и, сле-
довательно, характеризуются низкими концентрациями в растворах,
они не определяют физико-химические условия среды и вынуждены
приспосабливаться к той обстановке, которая создается Na, Cl, S, С и
другими ведущими элементами. Поведение рудных элементов часто
сильно зависит от щелочно-кислотных условий. Для некоторых важ-
ную роль играют и окислительно-восстановительные условия (напри-
мер, для U). Все это определяет разнообразие рудообразования. Имен-
но поэтому в зависимости от pH, Eh и других параметров в одной и
той же метасоматической обстановке происходит накопление различ-
ных рудных элементов. Поэтому растворы, различные по составу руд-
ных элементов, могут обусловливать один и тот же метасоматоз (аль-
битизацию, каолинизацию и т.д.).
Строение гидротермальных систем
Для формирования гидротермальных систем благоприятен свобод-
ный объем, поэтому они характерны для тектонически активных зон,
глубин, не превышающих 8 км. Постоянный объем определяет важную
особенность термодинамики гидротермальных систем, своеобразие мно-
218
гих реакций, их отличие от реакций, протекающих в зоне гипергенеза,
где объем часто меняется, а давление постоянно. По Г. Л. Поспелову,
гидротермальные месторождения возникают в застойных или полуза-
стойных условиях.
Л. Н. Овчинников подразделил гидротермальную систему рудно-
го месторождения на три области: мобилизации металлов и возник-
новения растворов (т.е. зону выщелачивания), движения растворов
(транзита) и рудоотложения. Последняя расположена в верхней части
литосферы и представляет собой геохимический барьер. Основные фак-
ты относятся к третьей области. Представления о двух первых во мно-
гом носят гипотетический характер. В этой связи интересны исследо-
вания В. Л. Барсукова, который обнаружил на кварц-касситеритовых
месторождениях выщелачивание Sn из гранита в нижней подрудной
зоне. При этом количество Sn уменьшалось от 2,6-10“3 % в неизменен-
ных гранитах до 5-10“4 % в зонах выщелачивания. Следовательно,
из гранита выщелачивалось более 80 % содержащегося в нем Sn. Но-
сителем Sn в граните в основном был биотит, который в процессе муско-
витизации потерял большую часть Sn (в биотите — до 3-10-2 %, в му-
сковите — до ЗЛО-3 %). Мобилизация Sn осуществлялась при аль-
битизации и мусковитизации гранитов. Существенно, что область ру-
доотложения (грейзены) сопрягалась на глубине с областью мобили-
зации рудного элемента. Обе области составили единую вертикаль-
ную зональность гидротермальной системы.
В последние годы мощные зоны выщелачивания металлов выявле-
ны на других гидротермальных месторождениях. Все же проблема ис-
точника рудных элементов является одной из наиболее дискуссионных.
Значительно лучше изучена область рудоотложения. Г. Л. Поспе-
лов разделил ее на три зоны: 1) зону ввода растворов, 2) рабочую зону.
т. е. геохимический барьер, и 3) дренажную зону (вывода).
Рудные элементы осаждаются из гидротермальных растворов в
больших объемах горных пород, намного превосходящих промышлен-
ные рудные тела. Поэтому в каждой рудоносной гидротермальной сис-
теме следует различать рудное тело и первичный геохимический оре-
ол, в котором концентрация элементов не достигает кондиций. По
Л. Н. Овчинникову, запасы элементов-спутников в ореолах всегда
бильше, чем в рудных телах. Нередко и по запасам главных рудных
элементов ореолы не уступают рудным телам. Например, на Гайском
медно-колчеданном месторождении (Урал) объем богатой части пер-
вичного ореола в 360 раз больше объема рудного тела, в котором со-
средоточено лишь 53 % запасов Си, 35% Zn, 10 % РЬ и 1,6 % Со.
Согласно Л. Н. Овчинникову и С. В. Григоряну, различные по соста-
ву, происхождению и геологическим условиям формирования сульфид-
ные месторождения сопровождаются однотипными ореолами главных
элементов-индикаторов. В ореолах наблюдается контрастная зональ-
ность в направлении движения гидротермальных растворов, причем
одни элементы образуют интенсивные и широкие ореолы в верхней
части околорудного пространства, другие — в нижней. Авторы под-
219
чсркивают стандартность, устойчивость, универсальность зональности
первичных ореолов. Так, для медных, свинцово-цинковых, золото-
рудных, вольфрамовых, молибденовых, медно-висмутовых, урановых,
оловянных, ртутных и других месторождений вертикальная зональ-
Рис. 53. Первичные (моноэлементные, аддитивные и мультипликативные) ореолы
вокруг рудных тел золоторудного месторождения (по С. В. Григоряну):
/- кварц-золоторудиые жилы, 2, 3 — содержание элементов в ореоле. % (2 — Bi—Ю,0001
-0,001, Си —0.01-0,1; Со—0.0005—0,001; W — 0,0003—0,001, Г — 10—100; 77—1—10; 3
Си - 0.1—0.5; Со — 0.001 —0,008; S — 100—1500; П — 10—720000). 4 — опробованные сечения
ность элементов в ореолах существенно одинакова. От надрудных сече-
ний к подрудным обобщенный ряд занальности имеет следующий вид:
Sb — As—Ba — Ag — РЬ — Zn — Си — Bi — W — Мо — Sn —
Со — Ni — Be
Эта зональность в основных чертах совпадает с зональностью рудных
тел по В. Эммонсу.
Несмотря на разнообразие геологических условий рудообразова-
ния и ореолообразования ряд зональности, по Овчинникову и Григоря-
ну, очень постоянен, отклонения от него невелики. Это свидетельствует
о стандартности физико-химических условий эндогенного рудообра-
220
зования и универсальности его механизма. Овчинников подчеркивает
постоянство анионного состава и свойств рудообразующего раствора,
отложение сульфидов из которого происходит при понижении темпера-
туры в результате разрушения хлоридных комплексов металлов, об-
ладающих разной устойчивостью.
Отмеченные закономерности геохимии первичных ореолов еще не
получили достаточного теоретического обоснования. В частности, по-
стоянство зональности ореолов не согласуется с многоэтапностью и раз-
нообразием гидротермальных процессов. Очевидно, в этой области не-
Рис. 54. Схематический разрез через рудное тепо и аргил-
лизироваииые гранит-порфиры (по Ю. В. Казицыну и
Г. В. Александрову):
/ — неизмененный гранит-порфир, 2 — зона слабой карбонатиза-
ции. 3, 4 — зоны серицитизации, 5 — зона преобладающей каолини-
зации, 6 — зона сплошной каолинизации и окремнения, 7 — зона
окремнения
обходимы дальнейшие исследования. Существенно практическое зна-
чение зональности: на ее основе при геохимических поисках опреде-
ляют уровень эрозионного среза, отделяют надрудную часть место-
рождения от подрудной, т. е. оценивают перспективы геохимических
аномалии. В верхней части рудных тел и в надрудном пространстве на-
иболее интенсивны ореолы левой части ряда, т. е. Sb, As, Ba, Ag и т.д.
Особенно контрастные результаты (рнс. 53) получаются при «муль-
типликации» — перемножении концентраций отдельных элементов
(«мультипликативные ореолы»). По В. Л. Барсукову и др., в около-
рудных метасоматнтах сульфидно-касситеритовых месторождений вы-
сокой информативностью отличается показатель зональности —
Li-Pb-K
~^а s , монотонно возрастающий от подрудных частей зон минера-
лизации к надрудным.
А. В. Канцель путем математической обработки данных опробова-
ния доказал, что первичные ореолы простираются далеко за пределы
221
распространения геохимических аномалий, т. е. в область фоновых
концентраций. Ореольная природа пространства характеризуется в
этом случае не повышенным содержанием индикаторных элементов,
а сильным разбросом значений фоновых концентраций — большим
средним квадратичным отклонением. Зоны, опоясывающие обычные
(аномальные) ореолы, были им названы «субфоновыми ореолами».
Их выявление повышает эффективность геохимических поисков.
Рудные тела и первичные ореолы обычно занимают лишь часть ме-
тасоматитов. Условно, следовательно, гидротермальную систему в об-
ласти рудоотложения можно разделить на следующие части: 1) руд-
ные тела, 2) первичные ореолы (обычные и субфоновые), 3) необо-
гащенные метасоматиты. Хотя эти части, как правило, изучаются спе-
циалистами разного профиля — геологами-рудниками, геохимиками-
поисковиками, петрографами, — они представляют единое целое —
компоненты одной системы (рис. 54).
Основные геохимические особенности
гидротермального рудообразования
А. Е. Ферсман первый дал глубокий геохимический анализ гидро-
термального рудообразования. По Ферсману, типичные элементы гид-
ротермальных руд занимают определенное поле периодической систе-
мы Менделеева (см. рис. на форзаце). Для них характерны ионы типа
«купро» с 18-электрониой оболочкой, преобладание четных элементов
над нечетными (60 и 40%). Многие элементы имеют сильное сродство к
S (халькофилы), низкие кларки (обычно ниже 1-Ю-2 %), двухвалент-
ны. ионы средних размеров. Последовательность кристаллизации
халькофилов выдерживается с замечательным постоянством и характе-
ризуется уменьшением валентности, постепенной сменой четных эле-
ментов нечетными.
Геохимия минералов. Важнейшие вопросы геохимии гидротер-
мальных минералов — количество элементов-примесей в твердой фа-
зе и состав газово-жидких включений.
Элементы-примеси (табл. 17). Многие минералы гидротермальных
руд богаты элементами-примесями, закономерности парагенных ас-
социаций которых в значительной степени объясняются изоморфизмом.
А. А. Сауков отметил неограниченную смесимость (изоморфизм в лю-
бых отношениях) у HgS и HgSe (киноварь — тиманнит), у CuS и
CuSe (ковеллин — клокманиит), у CoAs2 и NiAs2 (шмальтии — хло-
антит) и многих других минералов. Ограничена смесимость у CdS —
ZnS (сфалерит), FeS — ZnS и т.п.
По Н. А. Озеровой, концентраторами Hg служат сфалерит (до 35 %
Hg), блеклые руды (до 20 % Hg), антимонит и др. Hg входит изоморф-
но в решетку галенита, реальгара, пирита (до 2%Hg). Приведем (по
Е. С. Макарову) некоторые изоморфные пары:
222
Таблица 17. Средние содержания элементов примесей в рудных минералах
(минеральные кларки). В числителе — массовые проценты
(п-10~4), в знаменателе — кларк концентрации*
й 1 | 1 | 1 । 1
Nb 1 1 1 1 1 ОС о о о о о о т? ф 1Л 1Л — г- со г-
1 1 1 1000 400 95 38
Pd I 1 0'1 е 1 ! 1
Си 0,18 1 । 1 1
Ф X —• 1500 ... 00091
Ф 2,5 2500 со ог OOOZE бг оооог 29000
^Ф СО 256 30 1710 55 он ООН 2200
10,0 1 = 07 4,6 О ф 1,0
Ga 2,6 сч ' сч О Л 1.7 1 1 40 2,0
Ge 2,2 2,1 43 30 1 1 1 1
3 I 6,0 46 2705 27000 89 8 £ 00 720 1 1 1
— □О сч |< 3 196 12 —- 1 48 । 1 4 СО еч 00 s|$
Минерал 11ирит Сфалерит Халькопирит I аленит молиоденит Касситерит Вольфрамит
Из кн.: «Средние содержания элементов-примесей в минералах». М., 1-973. Содержания в пирите — по В. Г, Прохорову.
223
I. В сульфидах
Cd'2' — Zn‘24 Pb24 -T1 + Fe24 -Ti4
Cd2' — Pb2 + Pb24 — Ti34 Ga3 + — Zn24
Си'22 — Fe2* Pb44 — Tl4 Ge2+ -Zn2 +
Си2 + — Ni2' Pb44 — Tl34 Ge4 4 — Fe3’’
Си2 + — Zn2’ Pb2 + — Ag+ Ge4+ —As54
Си+ - -Fe'24 Sb34 — Bi34 Hg2+ — Zn24
Си4- - Ni24 Sb3+ -Bi5+ In34 - — Ga34
Си+ - — Zn24 Sb54 -Bi34 In34 -In24
Fe2’ — Ni'2+ Fe24 - Cd'24 In34- ~Hg24
Fe'2’ — Zn22 In34 -Fe34
Fe2’ - Си4 Mo2’ - Re4’
Fe34 - In21
Fe'2* — Ga34
Fe3' — Ge4'
2. В касситерите и других кислородных минералах,
в самородных элементах
Ga3' - Sn4 ’ MoBi—Wfi* In3*---Sn24
Ba'2" — Sr'2• In3' —Sn2' Pb2' - Ba2'
Th2' — 1’2t Ag — Au
Новые возможности исследования открыли физические методы ло-
кального элементного анализа — использование рентгеновского мик-
роанализатора, лазерной спектроскопии, метода треков и др. С их по-
мощью выявляется химическая неоднородность минералов, определя-
ется содержание элемента в данной точке, его распределение на мик-
ронных расстояниях. В результате обнаружены такие тонкие особен-
ности распределения элементов-примесей, как миграция части из них
к периферии зерен в ходе кристаллизации, включения самородного
золота в сульфидах и т.д.
Изучение элементов-примесей имеет важное практическое значе-
ние. Например, более 95 % Си на земле добывается из халькопирита
(Си Fe S2), в котором установлены повышенные содержания Re, In,
Se, Те, Ge, Au, Ni. Co. Ag, Cd, Tl, As. Sb, Pt, Pd, Rh и других элемен-
тов. Стоимость элементов-спутников в некоторых рудах в два-три раза
превышает стоимость самой Си. Вместе с тем нередко из руд извлека-
ется только Си.
Самородные металлы в гидротермальных рудах. В этих рудах дав-
но были известны самородные Au, Ag, Bi, Те, Sn, Sb, As и некоторые
другие элементы, присутствие которых не противоречило физико-хими-
ческим параметрам гидротермальных систем. Однако в последние годы
в рудах и гидротермалитах установлены другие самородные металлы,
явно неравновесные с условиями среды. Так, М. И. Новгородова обна-
224
ружила в золоторудных и некоторых других месторождениях такие
«экзотические» самородные металлы, как Al, Zn, Сг, Cd, In, Со, а так-
же карбиды и силициды металлов. Новгородова предполагает, что
осаждение металлов происходило из резковосстановительного флюида,
содержащего углеводороды. Об этом свидетельствует минеральная ас-
социация самородных металлов с карбидами, графитом и тонкодис-
персным рентгеноаморфным углеродом.
Газово-жидкие включения. Их исследованием занимается самосто-
ятельное научное направление — термобарогеохимия, которое ис-
пользует разнообразные методы (термометрия, декрепитация, водные
вытяжки, различные микроаналитические методы — электронный
микрозонд, микрогазовохроматографический анализ и др.). Изучение
ГЖВ стало широко использоваться в СССР с 50-х годов. Благодаря
исследованиям Н. П. Ермакова оно нашло приложение как в минерало-
гии, так и в геохимии, в том числе для решения прикладных задач (оп-
ределение эрозионного среза месторождений, оконтуривание первич-
ных ореолов и т.д.). Ценные геохимические выводы на основе изуче-
ния газово-жидких включений сделаны В. А. Алексеенко, В. И. Кова-
ленко, И. В. Мельниковым, В. Б. Наумовым, Д. Н. Хитаровым и др.
Аналив включений поставляет информацию о температуре, давлении
и составе гидротермальных растворов. Например, по В. И. Рехарскому
и др., на медно-молибденовом месторождении Каджаран молибден-
содержащие растворы полевошпат-кварцевой метасоматической фор-
мации имели температуру 250—360° С, минерализацию 50—80 г/л
(рассолы), давление около 8-107 Па. Среда была почти нейтральной.
Для медьсодержащих растворов того же месторождения (кварц-се-
рицитовая формация) установлена температура 190—280° С, давление
8—8,5-10~7Па, минерализация 600 г/л, состав существенно хлорид-
ный, реакция кислая.
Концентрация растворов жидких включений колеблется очень
сильно — от малоконцентрированных до хлоридных рассолов. Роль
последних в рудообразовании объяснима на основе представлений о ге-
охимических барьерах: из хлоридного порового раствора в застойных
условиях будут осаждаться преимущественно рудные элементы, но не
Na и С1 (в связи с хорошей растворимостью NaCl). Напомним, что
для концентрации необходимо, чтобы главные элементы раствора (Na,
Cl, Кит. д.) не осаждались на барьере, а рудные — осаждались.
В жидких включениях установлены Си, Pb, Zn, Мо, Fe, Ni, Со и
другие рудные элементы (до 0, п — 0,0п г/л); pH жидких включений
обычно колеблется от 4 до 9 (слабокислая — щелочная область). Жид-
кие включения содержат и «минералы узники» — галит, сильвин, ру-
тил и др. Газовая фаза включений в основном представлена СО2, но
имеются также СО, Н2, СН4, NH3, О2, N2 и другие газы.
Однако делать генетические выводы на основе изучения газово-
жидких включений часто затруднительно. Многие исследователи по-
лагают, что заключения о температуре рудообразования малонадеж-
ны, что состав включений не всегда является прямым свидетелем со-
8 Зак. 2022
225
става глубинных растворов (В. Ф. Барабанов). Ф. А. Летников подчер-
кивает, что состав включений часто не дает истинного представления о
флюидном режиме породообразования, так как сам механизм образо-
вания многих включений отличен от предполагаемого. По Летникову.
включения часто образуются через десятки и сотни миллионов лет
после образования кристаллов. Поэтому для выяснения состава флю-
сными ионами свинца в растворах, не
содержащих H^S, в зависимости от
pH при 150°C (Д) и 300°С (Б) (по
Н. Н. Барановой)
ида, захваченного кристаллом, не-
обходима особая методика хрома-
тографического анализа, позволяю-
щая определить весь флюид, при-
чем при тех температурах и давле-
ниях, при которых он сформиро-
вался. По И. Ф. Вовку, состав га-
зово-жидких включений зависит и
от радиолиза воды — образования
в результате этого процесса газо-
вой фазы и рассола (за счет раз-
ложения молекул растворителя).
Пэ его расчетам, с архея и проте-
розоя в минералах щитов могли об-
разоваться рассолы. Это предполо-
жение также не позволяет рас-
сматривать включения в качестве
рудоносных растворов.
Таким образом, с методологи-
ческих позиций, термобарогеохи-
мия разделяет судьбу многих дру-
гих методов геохимии — она не
универсальна, что не мешает ей
успешно решать многие задачи
теории и практики. Как и всегда.
следует учитывать возможности
метода, сопоставлять его результаты с данными других исследова-
ний, общегеологическими построениями, сочетать анализ с синтезом.
Формы нахождения металлов в гидротермальных растворах. Этот
вопрос привлекает большое внимание. Особое значение придается раз-
личным растворимым комплексам, состав которых устанавливается на
основе термодинамических расчетов и экспериментов, изучения вклю-
чений, анализа формул минералов (рис. 55,56).
Среди лигандов большое внимание уделяется С1“, так как многие
гидротермы имеют хлоридный состав. Хлор-ион образует растворимые
комплексы типа МеС1+ с большинством металлов (Hg, Zn, Pb, Ва и
т. д.). К другим лигандам, имеющим важное значение, относятся HS-.
CO’”, F“, ОН-. При высоких температурах устойчивы многие гидро-
ксокомплексы типа Zn (ОН)+, [BeOHFJ0, [Be(OH)2F]-, Zn (ОН)з'.
РЬ (ОН)Г, Sn (ОН) F? и др. (И. Л. Ходаковский). По В. Л. Барсуко-
ву, в переносе Sn велика роль фтор-гидроксильных комплексов типа
226
О w <u £ S <u г ". < <о m Ь< Ш ф X <о • С cd
> fe и и «5 мм ш оо
> °° о <о <Л «5 ф <Л еч Ш ф н оо Q Си
> г И и я л'77 ш
> мм <о и 9 ж в ж
м мм о
мн Ж
мм й| ft
м > >77/77/ 7/Т7
77,^' ft
Т'/// ////// s
> 9. * и я
> 77 и СЧ *
> 1S wl ® a CLi
> йч I» о S £
йч йч и s я Жж и О 00 Q
йч в 2 ьо 8 О ао «ч <Л to " 4 a oo • Л cd
мм аз в - Z О) м m cd m Л Q oo fe
— сч ео tn Гх
Рис. 56. Преобладающая устойчивость фторидных (1) и хлоридных (2) комплексов в геохимических процессах
(по В. В. Щербине)
8*
Sn (F, OH)e-, устойчивых в щелочных растворах, с pH от 8 до 11. От-
мечалась также роль гидросульфидных PbHS+, Pb (HS)!>, Pb (HS)^
и других комплексов (Na2MoS4, ZnS-nH2S, HgS-2 Na2S и т.д.). В грей-
зеновом процессе, по В. Ф. Барабанову, W мигрирует в кислых раство-
рах в форме полимерных ионов и гетерополикислот типа HJSi х
X(W3O10)4], которые при повышении pH распадаются на SiO4~ и
WO’”. По О. В. Брызгалину, в гидротермальных растворах W мо-
жет мигрировать и в форме [WO2F4]2-. Широко распространены и кар-
бонатные комплексы металлов, устойчивые благодаря огромному со-
держанию СО2 в растворах.
Формы миграции одного и того же элемента разнообразны. Напри-
мер, для полевошпат-кварцевых метасоматитов характерны молибдаты
и оксимолибдаты, при образовании грейзенов Мо мигрирует преимуще-
ственно в составе оксигалоидо-молибдатных и кремне-молибденовых
комплексов; в растворах, обусловливающих березитизацию и аргил-
лизацию, этот металл образует молибденурановые и молибдатные комп-
лексы. В нейтральных и слабощелочных растворах могут присутство-
вать также гидросульфид-молибдатные комплексы, в кислых низко-
температурных — окисно-закисные соединения Мо (В. И. Рехарский).
Еще детальнее изучены формы миграции U (И. В. Мельников,
Г. Б. Наумов, Р. П. Рафальский, И. Л. Ходаковский и др.). Анализ га-
зово-жидких включений, изучение парагенезиса элементов и минера-
лов в рудах, термодинамические расчеты показали, что в рудоносных
гидротермальных растворах U находился преимущественно в шести-
валентном состоянии в виде уранил-карбонатных и уранил-гидро-
ксильных комплексов типа [UO2 (СО3)2]2~, ГиО2СО3], [UO2OH+1,
[UO2 (ОН)2|. Замечательно, что и для зоны гипергенеза также наи-
более характерны уранил-карбонатные комплексы (хотя и несколько
иного состава). Для многих элементов вероятны и металлорганические
комплексы.
При исследовании редкометальных щелочных гранитоидов СССР,
МНР и других стран обнаружена геохимическая дифференциация эле-
ментов-аналогов (Nb — Та, Zr — Hf, Се — Y, Si — Al и др.) с суще-
ственным относительным накоплением наиболее дефицитных компонен-
тов. Эта дифференциация обусловлена комплексообразованием и эво-
люцией pH среды минералообразования (А. А. Беус, Д. А. Минеев,
Л. Н. Когарко).
Геохимические барьеры гидротермальных систем
Одним из наиболее сложных и практически важных вопросов гео-
химии гидротермальных систем служит причина осаждения рудных
элементов из растворов, в том числе образование сульфидных руд.
Гидротермальное рудообразование несомненно полигенетично, при-
чем, по мнению многих авторов, к наиболее важным факторам рудоот-
ложения относятся изменения pH и Eh растворов, приводящие к рас-
паду комплексов рудных элементов. Само изменение pH и Eh может
228
зависеть от многих причин — взаимодействия растворов с породами
(литологический контроль), смешения растворов, изменения темпера-
туры и давления и т.д., в том числе «автосмешения».
По автору, методологической основой решения данной проблемы
может служить понятие о геохимических барьерах. Первый анализ гид-
ротермального рудообразования с этих позиций был выполнен нами в
1968 г., когда были намечены основные классы барьеров гидротермаль-
ных систем и связанное с ними рудообразоваиие (на примере различ-
ных типов месторождений). В последние годы значительное внимание
этой проблематике уделяют и специалисты по геохимии гидротермаль-
ных месторождений (В. Л. Барсуков, Викт. Л. Барсуков, И. В. Мель-
ников, Г. Б. Наумов, Е. В. Плющев, В. Г. Прохоров, В. И. Фоми-
чев и др.). Изучение механизма действия геохимических барьеров
В. Л. Барсуков считает одной из первостепенных задач геохимии гид-
ротермального рудообразования.
В гидротермальных системах барьеры образуются в результате по-
нижения температуры, давления, смешения глубинных восходящих
растворов с водами верхних структурных этажей, влияния вмещающих
пород и действия многих других факторов. Интересные общие сообра-
жения о роли геохимических барьеров в рудообразовании высказал
В. Г. Прохоров. Он пишет, что вынося и транспортируя огромные мас-
сы элементов, гидротермальные растворы, переотлагают их в других
зонах. Если отложение идет за счет изменения термодинамических ус-
ловий (главное — понижения температуры и давления), происходит
постепенное выпадение рудных минералов с образованием обширных
площадей непромышленных вкрапленников. Если гидротермы встре-
чают участки пород, резко изменяющие химизм растворов или из-
бирательно осаждающие отдельные элементы, т. е. геохимические
барьеры, происходит образование месторождений.
Окислительные барьеры А. Окислительные реакции играют осо-
бенно важную роль в поверхностных гидротермальных системах. Со-
гласно Ф. В. Чухрову, на п-ве Челекен в местах выхода термальных
вод образуется ферригидрит, т. е. здесь возникает кислородный барь-
ер А VI. На о. Новая Британия (архипелаг Бисмарка) в море излива-
ются горячие источники с pH 2,5—4,0, содержащие много Fe и Zn и не
содержащие H2S. На кислородном барьере здесь также концентриру-
ются гидроксиды Fe (AV, AVI). Железистые осадки характерны и для
впадин Красного моря, где на подводном кислородном барьере также
отлагается ферригидрит. На фумарольных полях и в кратерных озерах
происходит окисление вулканического H2S в кислой среде (А IX?
АХ?). В результате осаждается элементарная сера, образующая
крупные «вулканические» месторождения Японии и других стран.
Сероводородные и сульфидные барьеры В. Современные термаль-
ные сероводородные барьеры формируются на дне впадин Красного
моря, в других морских и океанических районах, в районах вулканиз-
ма, зонах разломов и т. д. По составу изотопов S и другим данным
источником S часто служат осадочные сульфаты, сульфаты морских
229
и подземных вод (реакция SOi- H2S). По Л. М. Лебедеву, современ-
ные термальные металлоносные рассолы п-ва Челекен, Красного мо-
ря, Солтон-Си (Калифорния) содержат мало сульфидной S. На Челе-
кене местами она вообще отсутствует. Источники металлов и сульфид-
ной S, по его мнению, разобщены. Там, где пути их миграции пересе-
каются, т. е. на сероводородном барьере, формируются сульфидные
руды.
Во впадинах Красного моря горячие металлоносные растворы раз-
гружаются на сероводородном барьере с образованием черного пласта,
в котором преобладает сфалерит (но есть пирит и халькопирит). За
13—25 тыс. лет здесь образовалась рудная залежь, содержащая более
3 млн. т Zn, 800 тыс. т Си и 100 тыс. т РЬ. Это современное рудное
месторождение. Аналогичные явления обнаружены в рифтах Эфио-
пии, на Восточно-Тихоокеанском поднятии, в соленом озере Периэт-
ти-Лэгун (Южная Австралия).
В областях современного вулканизма также существуют сероводо-
родные барьеры. Так, по А. В. Зотову, на фумарольных полях Ку-
рильских вулканов сульфиды Fe образуются при смешении кислых
вод, богатых Fe2+. и щелочных терм, содержащих H2S (BV— BVI)'
В кальдере Узон на Камчатке по разломам разгружаются термаль-
ные воды с pH 1—8 и температурой до 90°С. В зонах разлома обнару-
жены реальгар, аурипигмент, антимонит, пирит, марказит, сфалерит,
киноварь, ковеллин, халькозин и другие сульфиды, а также барит,
опал, гипс, битумы. Изотопный анализ установил биогенную природу
сульфидной S (результат бактериальной сульфатредукции). Осадки по
составу близки типичным гидротермальным рудам. По В. И. Вино-
градову, в Карамазаре (Средняя Азия) гидротермальные руды содер-
жат сульфидную S, образовавшуюся из осадочных сульфатов, широко
распространенных в районе. Предполагается, что одной из предпосы-
лок формирования крупных рудных провинций служит распростра-
нение в них дорудных отложений осадочных сульфатов.
К аналогичным выводам пришла и Н. А. Озерова, изучавшая мес-
торождения Hg. Изотопный анализ показал, что сульфидная S ртут-
ных руд образовалась вблизи места рудоотложения за счет восстанов-
ления сульфатов осадочных пород. Hg поступала из глубин, возмож-
но из мантии, по разломам. Образование месторождений Hg происхо-
дило там, где пути миграции обоих компонентов скрещивались. О раз-
общенности источников металлов и S при образовании сульфидных
руд писали Д. Уайт, А.В. Щербаков и другие исследователи.
Таким образом, сероводородные барьеры играют и играли в геоло-
гическом прошлом важную роль в образовании сульфидных руд-, металлы
переносились углекислыми и прочими растворами, а осаждающим фак-
тором служила локальная концентрация сероводорода (местами био-
генного).
Глеевые барьеры С. Важным фактором восстановления в гидро-
термальных системах (помимо H2S и его производных), вероятно, слу-
жили органические вещества, содержащиеся во вмещающих породах
230
и водах. Контроль гидротермального оруденения графитизацией, би-
тумами, углистым органическим веществом установлен на ряде мес-
торождений. Гидротермальные руды часто образуются на пересече-
нии жил с битуминозными породами, которые могли играть роль вос-
становителя.
Восстановительные бессероводородиые (глеевые) барьеры С яв-
ляются аналогами глеевых барьеров зоны гипергенеза. Руды в этом
случае не содержат сульфидов или бедны ими. Агентами восстановле-
ния могли быть свободный водород, углеводороды и другие органиче-
ские соединения. На окисление органических веществ при гидротер-
мальном рудообразовании указывает большее содержание О и мень-
шее содержание углеводородов в битумоидах рудной стадии гидротер-
мального процесса. Н2 и СН4 установлены методами газовой хромато-
графии в газово-жидких включениях некоторых урановых руд. По
И. В. Мельникову, эти газы предположительно поступали из близ-
лежащих осадочных пород, но, возможно, и снизу, из глубоких гори-
зонтов земной коры. Восстановителями Au и Ag на глеевых барьерах
могут быть также Fe2+, Mn2+, Си2+.
Щелочные барьеры D. Д. С. Коржинский в 1957 г. наметил три
главных типа рудоотложения, обязанных изменению щелочно-кислот-
ных условий, из которых два связаны с повышением pH, т. е. с щелоч-
ным барьером. Первый тип — это рудоотложение при повышении pH
кислых растворов, их нейтрализации. Подобные явления связаны,
например, с внедрением кислых растворов в породы основного состава
(скарны с полиметаллическим и редкометальным оруденением и др.).
Для второго типа характерно рудоотложение при нейтрализации кис-
лых растворов в результате фильтрационного эффекта (многие жиль-
ные гидротермальные месторождения Си и Мо, других металлов).
Щелочные барьеры очень характерны для контактов силикатных
(особенно кислых) и карбонатных пород. Предполагается, что при об-
разовании рудоносных бертрандит-феиакит-флюоритовых метасома-
титов Be мигрировал в форме Na2 IBeFj и аналогичных комплексов.
При взаимодействии с известняками эти комплексы разрушались с об-
разованием флюорита и минералов Be. При этом выделялась СО2.
Барьер, таким образом, был совмещенным — и щелочным D и термо-
динамическим Н.
Обогащение кварцевых жил шеелитом в местах пересечения ими
известняков на Гумбейском месторождении также, вероятно, связано
с Щелочным барьером — повышением pH раствора на контакте с из-
вестняками. При взаимодействии кислотных растворов с магнезиаль-
ными скарнами происходит повышение pH и образование шеелит-мо-
либденового, шеелит-сульфидного, полиметаллического, полисульфид-
ного, золото-халькопиритового и прочего оруденения. Это классы
DX и др.
На щелочном, а также термодинамическом барьерах (D — Н),
возможно, отлагались сидеритовые руды Бакальского месторождения
на Урале, Абаильского в Казахстане, некоторых месторождений Юго-
231
славии и ГДР. В рудах месторождений преобладает сидерит, имеется
н примесь сульфидов (пирит, халькопирит, галенит и т.д.). Отложе-
ние сидерита и сульфидов часто относится к разным стадиям, т. е.
можно говорить о существовании в период сидеритообразования вос-
становительной среды (Fe2+) без активного H2S. Реакция гидротер-
мальных растворов, вероятно, была нейтральной или слабокислой
Рис. 57. Принципиальная схема рит-
ма автосмешения гндротерм (по
В. Л. Барсукову):
1—2 — вмещающие породы (/—хорошо
проницаемые, 2 — плохо проницаемые),
3 —линии тока гидротерм, 4 — ореолы ин-
фильтрационного околотрещииного измене-
ния пород, ТК — трещинный канал, А —
раствор исходного для ритма состава, В—
раствор, возникающий из порции раствора
А (А—В) при инфильтрации и взаимо-
действии ее с вмещающими породами
вплоть до получения равновесного с ними
состояния. С —раствор конечного состава,
возникающий при смешении растворов А
и В (А-гВ—>С) и покидающий пределы
ритма автосмешеиия
в них мигрировали Fe2+, а места-
ми и Мп2+, так как руды иногда
обогащены Mn (DVI—HVI или
DVII — HVII).
Исследования В. И. Рехарского
и других на Каджаране показали,
что осаждение сульфидов Си, РЬ,
и Zn происходило при нейтрали-
зации рудоносных растворов в ре-
зультате их взаимодействия с вме-
щающими породами.
Кислые барьеры Е. В качестве
самостоятельного типа Д. С. Кор-
жинский выделял рудоотложение
при понижении pH щелочных
растворов, их нейтрализации, т. е.
по нашей терминологии на кислом
барьере Е. Так образуются магне-
титовые, некоторые сульфидные и
карбонатные руды. Согласно В. Л.
Барсукову, из щелочных раство-
ров, содержащих оксифторидные
комплексы Sn, при понижении pH
до 8 в результате разрушения
комплексов происходит осаждение
касситерита.
С щелочным натриевым метасо-
матозом связано образование урано-
носных альбититов с повышенным
содержанием Р, Zr, TR, Th. Они
характерны для разломов докембрийского фундамента. Осаждение
рудных элементов, вероятно, было вызвано понижением pH раство-
ров от сильнощелочного до слабощелочного или нейтрального, т. е.
осаждение шло на кислом барьере. В связи с отсутствием или слабым
развитием сульфидов рудообразование относится к классу EVIII —
CVII1- К EVIII, вероятно, относятся и промышленные концентра-
ции Be, Та, TR, Nb, Li, Zr, W и Sn, характерные для альбитизирован-
ных гранитов.
Викт. Л. Барсуков, Н. П. Лаверов и А. А. Пэк разработали концеп-
цию «.автосмешения гидротерм», согласно которой движение гидротер-
мального флюида имеет поровую и трещинную составляющую (рис. 57,
232
58), причем интенсивность фильтрации в зависимости от проницаемо-
сти пород может меняться на несколько порядков. Поровые растворы
по составу сильно отличаются от трещинных вод. По эксперименталь-
ным данным поровый флюид, взаимодействуя с породами, становится
более щелочным, чем трещинный. Поэтому в участке стягивания поро-
вого раствора к трещинной зоне (например, над толщами малопрони-
Рис, 58. Изменение массовой концентрации ряда компонентов Ig2/n, (мольХЮ 3)
и pH в растворах, формирующих инфильтрационные колонки кислотного выщела-
чивания в граните и липарите при, просачивании их от стенок трещинного кана-
ла до внешнего фронта. Построено' по данным моделирования на ЭВМ процессов
инфильтрационного метасоматоза прн 300 (а) и 150°С (б) (по В. Л. Барсукову)
Кв кварц. Сц — серицит, Мк микроклин. Аб альбит. Кл каолинит
Наемых пород) будет происходить «автосмешение» растворов и форми-
роваться геохимический барьер. Подобное автосмешение возможно в
пределах щелочной среды, когда сильнощелочные поровые растворы
смешиваются с менее щелочными трещинными. По нашей терминоло-
гии возникающий геохимический барьер будет относиться к кислому
классу. Это преимущественно EVII и EVIII, хотя не исключаются
и другие варианты (EXI и т.д.). По В. Л. Барсукову, в слоистых тол-
пах возможны многократные ритмы растекания и стягивания раство-
ров к трещинной зоне, а следовательно, и целая серия геохимических
233
барьеров с рудоотложением. На участках растекания потока формиру-
ются метасоматиты, первичные ореолы рассеяния и вкрапленные руды.
Этот механизм рудообразован и я был детально изучен Викт. Л. Барсу-
ковым, Н. П. Лаверовым и другими на одном из уран-молибденовых
месторождений, по В. Л. Барсукову, ои характерен также для ряда
оловянных и свинцово-цинковых месторождений. В данных построе-
ниях большое значение приобрел гидродинамический анализ гидротер-
мальных систем, разработанный А. А. Пэком. Это хороший пример со-
четания геолого-структуриых, минералого-геохимических и гидроди-
намических исследований. Ои отвечает той методологии комплексно-
сти работ, о важности которой мы уже писали. Отметим также, что
для систем с автосмешением характерны самоорганизация и саморегу-
ляция.
Термодинамические барьеры Н. Гидротермальные процессы раз-
виваются в широком интервале температур и давления, поэтому тер-
модинамические барьеры играют здесь большую роль. Во многих кон-
цепциях рудообразования ведущее значение придавалось, а частично
придается и сейчас понижению температуры. Так, ранее очень попу-
лярна была «околобатолитовая теория» крупного американского уче-
ного В. Эммонса. Ои полагал, что по мере остывания гранитных батоли-
тов из постмагматических растворов сначала осаждались Sn, Мо, Bi
и другие элементы высокотемпературных месторождений, потом Си,
Zn, РЬ и другие элементы среднетемпературиых месторождений и, на-
конец, Hg и Sb — элементы низкотемпературных месторождений. Уче-
ный выделил 16 зои (снизу вверх по мере падения температуры), со-
ставляющих «зональность гидротермальных месторождений»: пустая
кварцевая, оловянная, вольфрамовая, мышьяковая (арсеиопирито-
вая), висмутовая, золотая, медная, цинковая, свинцовая, серебряная,
безрудная, серебряная, золотая, сурьмяная, ртутная, пустая. Ряд
Эммонса: Sn, W, As, Bi, Au, Cu, Zn, Pb, Ag, Au, Sb, Hg. Хотя ни на
одном месторождении все 16 зон и ие наблюдались, данная теория ока-
зала сильное влияние на научную мысль. Концепция Эммонса была
поддержана и развита с позиций геоэнергетической теории А. Е. Ферс-
маном. Ои полагал, что последовательность кристаллизации халько-
филов отвечает росту радиусов ионов, уменьшению их зарядов, т. е.
уменьшению ЭК и энергии решетки образующихся минералов. Сей-
час мы знаем, что эти выводы были ошибочными, но ие потому, что
подход с позиции р'адиусов ионов и ЭК неверен сам по себе, а потому,
что этими параметрами нельзя оперировать при изучении гидротер-
мальных систем, в которых нет простых ионов — Pb2+, Zn2+, Cu+ и
т. д. Для полностью диссоциированных систем с простыми ионами, на-
пример для систем галогеиеза, геоэнергетическая теория Ферсмана во
многом приложима (см. гл. 13).
В целом околобатолитовая концепция Эммоиса ие подтвердилась,
хотя установленная им последовательность элементов отражает ка-
кие-то глубокие геохимические закономерности, проявляющиеся (хотя
бы частично!) при образовании первичных ореолов.
234
Из сказанного, .конечно, не следует, что понижение температуры ие
может быть причиной формирования геохимических барьеров. Экспе-
рименты Ф. А. Летникова и соавторов показали, что «термоградиент-
ные системы» играют важную роль в гидротермальном рудообразова-
нни, так как термический градиент сильно влияет на массоперенос.
Вместе с тем образование многих минералов происходит в условиях,
близких к изотермическим. Широко распространены представления,
что гидротермальные системы являются «бароградиентными», в кото-
рых движущей силой флюида служит давление.
По Ф. А. Летиикову, роль бароградиеитности велика для откры-
тых структур, имеющих выход на поверхность или в крупные полости.
Однако часть гидротермальных систем Летников считает «квазиизоба-
рическими» и именно для них, по его мнению, характерна термогради-
ентность. Таким образом, рудообразование может быть обусловлено
как понижением давления, так и температуры и, конечно, совместным
влиянием обоих факторов.
На формирование Н-барьера при понижении давления указывают
многочисленные факты. Существенно, что при понижении давления
происходит распад многих комплексных ионов. Так, по Г. Б. Наумову
и А. ИГ Тугаринову, образовались низкотемпературные (100—200 С)
урановые руды. Изучение газово-жидких включений показало, что
восходящие растворы содержали много СО2, количество которого рез-
ко уменьшалось в направлении движения растворов (на одном из мес-
торождений от 80 до 5 г/л). СО2 в таких водах входил в состав уранил-
карбонатных комплексов. При быстром падении давления, обязанном
приближению растворов к поверхности, раскрытию трещин и т.д.,
карбонатное равновесие нарушалось, содержание СО2 в растворе па-
дало, комплексы разрушались и на барьере осаждались урановая смол-
ка (настуран) и кальцит. Возможно, играли роль и явления восстанов-
ления, т. е. барьер был совмещенным — восстановительно-термодина-
мическим. По геологическим данным месторождения формировались на
глубине от 0,5 до 3,0 км при максимальном давлении 1,2 • 108 — 7-Ю7
Па. При быстром падении внешнегг давления (и действии H2S?)
из раствора выпадали и элементы-спутники — РЬ (галенит), Мо (мо-
либденит) и др. Подобные концентрации принадлежат к типам HVII—
— BVII, HXI. В ряде случаев осаждение U происходило не только в
результате падения давления, но и понижении pH. В этом случае сов-
мещались термодинамический и кислый барьеры (HVII—EVII). По-
нижением давления при раскрытии трещин В. Ф. Барабанов объясня-
ет формирование многих рудных прожилков и продуктов осаждения
минералов из поровых растворов вмещающих жил.
При разгрузке углекислых термальных вод вблизи земной поверх-
ности дегазация СО2 приводила к отложению травертина. Таковы
мощные травертины Горячей горы в Пятигорске, в районе Казбека
л Ср)> в Карлови-Вари (Чехословакия) (главным образом НХ1).
Аналогично отложение некоторых карбонатов Fe и Мп (HVI и HV11).
235
В районах современного и молодого вулканизма известны гейзер-
ные азотноуглекислые термы с pH 8—9, содержащие сотни миллиграм-
мов SiO2 в литре. В местах их выхода на поверхность при интенсивной
дегазации образуются кремнистые туфы (гейзериты —HVH и др.).
Эти Н-барьеры могут быть названы и «дегазационными барьерами»
(И. В. Мельников).
Источники воды, газов и рудных элементов
в гидротермальных системах
Геохимия, наука о рудных месторождениях, гидрогеология и вул-
канология установили несколько источников гидротермальных
растворов. Д. Уайт и К. Б. Краускопф выделили в составе гидротер-
мальных растворов ювенильную, магматическую, метаморфогенную,
захороненную и метеорную составлящую. В общей форме это верно,
но не решает проблему. Необходимо выяснить роль каждого источни-
ка в каждом конкретном случае. Для многих летучих компонентов
(СО2, Н2О и др.) вероятен глубинный (мантийный) магматический гене-
зис, для многих металлов источником служат вмещающие породы.
Существенные коррективы вносит и геохимический тип месторожде-
ния, и геологические условия его локализации.
В первой половине XX столетия ведущее значение в формировании
гидротермальных растворов придавалось магматическим очагам, при
остывании выделяющим водяные пары и другие газы. При дальнейшем
охлаждении они формировали растворы, содержащие рудные элемен-
ты. Теперь различают подкоровые источники, связанные с мантией и
коровые, обязанные главным образом гранитной магме. Изучение
минеральных равновесий показало, что растворимость хлоридов в маг-
матическом расплаве очень мала (не более 0,3 % С1). Поэтому при кри-
сталлизации гранитных магм на небольших глубинах (до 5 км), по
И. Д. Рябчикову, должно происходить отделение водио-солевой жид-
кости, в которую переходит много Fe и халькофильных металлов. По
нашей терминологии — это горячие глеевые рассолы. Рябчиков пола-
гает, что для образования гидротермальных месторождений геохи-
мическая специализация интрузий не обязательна — источником ме-
таллов могут служить гранитные магмы с кларковыми их содержания-
ми. Концепция постмагматического рудообразования господствовала
в первой половине XX столетия. Среди геохимиков ее энергично под-
держивал и развивал А. Е. Ферсман. Однако магма не единственный, а
по мнению ряда исследователей, и не главный источник воды, газов и
рудных элементов гидротермальных систем.
Второй источник — метаморфизм осадочных пород, при котором ос-
вобождается поровая, конституционная и кристаллизационная вода
глинистых и других минералов (см. гл. И). Напомним, что таким
«метаморфогенным путем», по Я. Н. Белевцову, В. С. Домареву,
В. Мармо, А. А. Саукову и др., и возникают гидротермальные раст-
воры, извлекающие металлы из вмещающих пород. По подсчетам
236
В. П. Зверева, суммарное количество воды, выделившееся из осадочных
пород за время геологической истории превышает массу вод океана.
В. Ф. Барабанов подчеркивает значение в гидротермальном рудообра-
зовании и поровых вод изверженных пород, газово-жидких включений.
Третий источник — вмещающие породы, из которых вадозные тер-
мальные воды, выщелачивают рудные элементы. Эти положения в по-
следние годы получают наибольшее признание, так как размещение
рудных месторождений при региональных геохимических работах, т.е.
при составлении геохимических карт, хорошо коррелируется с рас-
пространением формаций, обладающих повышенным содержанием со-
ответствующих рудных элементов. Поэтому при установлении источ-
ника рудных элементов необходимо изучать геохимию формаций, вы-
являть в них зоны выщелачивания — источник рудных элементов.
По А. П. Лисицыну и соавторам, океанская вода в срединно-океа-
нических хребтах проникает в базальты на глубину 4—5 км и выщела-
чивает из пород многие элементы. Имеются представления о много-
кратном использовании морской воды в гидротермальном рудообра-
зовании на океаническом дне («.рециклинг»).
Роль вмещающих породе гидротермальном рудообразовании не сле-
дует понимать упрощенно, полагая, что рудные элементы были выще-
лочены из пород, прилегающих к рудным телам. Такая «латераль—сек-
реционная теория», игравшая важную роль в XIX столетии, справед-
ливо была отвергнута, так как с рудными телами обычно контактиру-
ют обогащенные зоны — первичные ореолы рассеяния.
Значение вадозных вод в гидротермальном рудообразовании осо-
бенно подчеркивают гидрогеологи. Так, по А. М. Овчинникову, боль-
шинство гидротермальных месторождений — это древние очаги раз-
грузки напорных вод сложных артезианских бассейнов. Однако высо-
кое содержание в гидротермах Cl, F, S и других элементов, по мнению
ряда авторов, нельзя объяснять их выщелачиванием из вмещающих
пород. Это противоречие снимается концепцией С. Л. Шварцева о раз-
ложении молекул воды при ее взаимодействии с породами. С. Л. Швар-
цев полагает, что при этом объем инфильтрационных вод, питающих
термы, уменьшается в десять, а в отдельных случаях и в сто раз и соот-
ветственно увеличивается концентрация Cl, F и других элементов
(рассолы). В ряде случаев, как было отмечено выше, источником хло-
ридов служили залежи солей.
По А. И. Германову, S некоторых сульфидных месторождений обя-
зана своим происхождением H2S — продукту восстановления сульфа-
тов на участках разрушающихся нефтяных месторождений. Этим он
объясняет пространственную связь битуминозных пород и гидротер-
мальных месторождений (Кансай в Карамазаре, Ачисай в Каратау и
т. д.). Связь рудообразующих флюидов с водами нефтяных и газовых
месторождений отмечает и А. Д. Щеглов. О немагматогенном проис-
хождении части гидротермальных месторождений высказывались
В. В. Иванов, Б. Ф. Маврицкий, А. А. Смирнов, Д. Уайт, В. М. Швец,
А. В. Щербаков и другие гидрогеологи.
237
При выяснении источников вод, рудных и сопутствующих элемен-
тов важную роль играет изучение изотопного состава Pb, S, С, О и
других элементов. Напомним, что изотопный состав сульфидной S во
многих гидротермальных месторождениях указывает на ее образова-
ние из осадочных сульфатов. S может поступать и из магматического
источника. Изотопными определениями также доказано, что РЬ гале-
нитов в ряде стратиформных месторождений заимствован из глубже-
лежащих более древних пород (например, в среднепалеозойских ру-
дах хр. Каратау РЬ имеет нижнепалеозойский возраст).
По А. И. Тугаринову, изотопный состав О, С, S, Sr и РЬ свидетель-
ствует о преимущественно первичноосадочном источнике рудного ве-
щества многих гидротермальных месторождений.
В гидротермальных месторождениях возможно сочетание магма-
тического, инфильтрационного и прочих источников вещества. Так,
изучение изотопного состава Pb, S, С и F гидротермальных место-
рождений Забайкалья показало, что РЬ заимствован из осадочных кар-
бонатных пород и гранитов, S имеет ювенильное происхождение, F —
эффузивный, С — возможно биогенный. По Д. И. Горжевскому, в по-
лиметаллических и медноколчеданных рудах РЬ заимствован из гра-
нитного слоя, Си — из базальтового, Zn — из обоих слоев.
Итак, гидротермальные системы полигенетичны, причем не толь-
ко разные системы имеют разное происхождение (магматогенное, ва-
дозно-гидротермальное, метаморфогенное и т.д.), но и в одной системе
ее компоненты могут быть связаны с различными источниками. Вмес-
те с тем гидротермальные системы представляют собой определен-
ную общность, их объединяют сходные термодинамические параметры
и водная среда миграции. По последнему признаку гипергенные и тер-
мальные растворы литосферы, вероятно, можно рассматривать как
части более сложной системы — подземной гидросферы. Намечается
следующая группировка систем земной коры-. 1) магматические систе-
мы — расплавы и их высокотемпературные производные (пегматиты и
др.), 2) водные системы — гидротермальные и гипергенные.
Контрольные вопросы
1. Что показало изучение современных гидротерм, в чем значение этих ис-
следований для познания гидротермальных месторождений?
2. Охарактеризуйте черты сходства и различия гидротермального метасома-
тоза и выветривания.
3. Охарактеризуйте геохимию какой-либо гидротермально-метасоматичес-
ской формации.
I. Каковы особенности первичных ореолов гидротермальных сульфидных
месторождений, характерной для них геохимической зональности?
5. Что такое субфоиовые ореолы?
6. Какие самородные металлы обнаружены в гидротермальных рудах?
7. Что изучает термобарогеохимия?
8. Как менялись представления о формах нахождения металлов в гидротер-
мальных растворах?
9. Охарактеризуйте геохимические барьеры гидротермальных систем, их
роль в рудообразоваиии.
10. Каковы современные представления о генезисе воды, газов и рудных эле-
ментов в гидротермалитах?
238
13. ГИПЕРГЕННЫЕ ФИЗИКО-ХИМИЧЕСКИЕ СИСТЕМЫ
Гипергенные условия благоприятны для жизни и большинство гп-
пергенных систем относится к биокосным (они будут охарактеризова-
ны в гл. 16), менее распространены в зоне гипергенеза чисто физико-
химические системы. Мы рассмотрим два типа таких систем.
Системы криогенеза. Процессы, протекающие при отрицательных
температурах, И. А. Тютюнов назвал криогенезом. Они образуют кри-
огенные геохимические поля (П. Ф. Швецов). Мощность многолетне-
мерзлых толщ (криолитосферы) достигает многих сотен метров, онп
распространены на 1/4 земной суши (в СССР на 10 млн. км2 — 45 %
территории).
Большая часть воды в криолитосфере превращена в лед, но некото-
рая часть воды не замерзает и при—70°С. Такая охлажденная «связан-
ная пленочная вода» сильно отличается от свободной гравитационной
воды. У нее выше удельная электропроводность и степень диссоциа-
ции, ниже диэлектрическая постоянная. Пленочная вода передвига-
ется под влиянием градиента температуры, влажности и концентрации,
она способна растворять химические соединения. Зимой ток пленоч-
ных вод направлен снизу вверх, что приводит к восходящей миграции
химических элементов.
Растворимость газов при низких температурах, как известно, увели-
чивается, поэтому в пленочных водах повышено содержание О., и
СО2, pH их довольно низкий. Это определяет окисление сульфидов и
других минералов, выветривание силикатов. В многолетнемерзлых
толщах возможны ионный обмен и коагуляция коллоидов. Это не
«зона геохимического покоя», как представлялось ранее, хотя миграция
элементов в целом затруднена.
При замерзании подземных вод и образовании льда происходит
криогенная метаморфизация вод, так как лед очень слабоминерализо-
ван. Незамерзшая вода минерализуется, из пресных вод осаждаются
СаСО3, а из соленых — сульфаты Са и Na. Вымораживание соленых
вод приводит к образованию рассолов. Известны переохлажденные
рассолы с температурой до— 10е (например, на шельфе и островах Се-
верного Ледовитого океана).
Углеводородные газы в криолитосфере могут соединяться с Н2О
и давать твердые газогидраты, по внешнему виду напоминающие спре-
сованный снег. Известны их крупные скопления, достигающие разме-
ров месторождений. (Газогидраты установлены и в глубоководных
впадинах океанов в условиях высоких давлений, на глубинах в сотни
метров от поверхности дна.)
В геохимическом отношении криогенные системы разнообразны.
Лучше изучен криогенез сульфидных месторождений. Еще в 30-х го-
дах С. С. Смирнов установил, что мерзлые зоны окисления сульфид-
ных руд на Северо-Востоке СССР содержат легкорастворимые сульфа-
ты Fe и других металлов. Позднее было доказано, что пленочные суль-
фатные воды здесь сильноминерализованы, богаты тяжелыми метал-
239
лами. По гипотезе В. М. Питулько, образование сульфатов произошло
в начале промерзания сульфидных руд, когда при замерзании воды из
нее выделился О2, обладающий сильными окислительными свойствами.
На сульфидных месторождениях в зоне многолетней мерзлоты возмож-
ны и электрохимические реакции. С ними связывают переход в раствор
Zn2+, Cu2+, Ag+ и других металлов сульфидов, осаждение вторичных
сульфидов Ag и Си и т.д.
Формирование многолетнемерзлых толщ началось в нижнем плей-
стоцене—Qv В эпохи оледенений криолитосфера распространялась
южнее современной границы — до широты Центрального Казахстана.
Поэтому геохимические реликты многолетней мерзлоты распростране-
ны во многих немерзлотных районах.
Криолитосфера пережила сложную геохимическую историю: для
нее характерны доледниковые реликты (оксидные зоны окисления
сульфидных руд с гидроксидами железа и др.), следы многократного
наступания и отступания мерзлоты.
Галогенез. Этим термином А. Е. Ферсман предложил именовать
концентрацию растворимых солей в результате испарения вод. Про-
дукты галогенеза В. М. Гольдшмидт назвал эвапоритами. Они рас-
пространены на i '3 поверхности материков.
Для галогенеза характерна ионная миграция, его закономерности
накопление ионов с наибольшими радиусами и наименьшей валент-
ностью, т. е. с низкими ЭК, — А. Е. Ферсман объяснил на основе гео-
энергетпческой теории:
Катионы...............Х’а К‘ Rb' Cs'
ЭК.................... 0,45 0,36 0,33 0,30
Анионы.................Cl- Br- I-
ЭК.................... 0.25 0,22 0.IH
На первых этапах галогенеза осаждаются в основном четные и бо-
лее высоковалентные ионы (Са2+, SOV', СО$~), а в растворе накапли-
ваются нечетные и маловалентные С1~, Вг~, 1 -, Na+ и т.д. Таким об-
разом, по Ферсману, в ходе галогенеза происходит переход от четных
элементов к нечетным, от середины таблицы Менделеева к ее краям,
от больших валентностей и ЭК к малым. По интенсивности накопления
при галогенезе нами установлены следующие ряды: Cs С Rb <; К <
< Na; Са <С Sr < Mg; F < Br <_' Cl.
Для характеристики галогенеза важны различные коэффициен-
ты -- бромхлорный и др. Некоторые редкие элементы замещают глав-
ные в соляных минералах на основе законов изоморфизма (Вг--*-С1- в
галите), для других изоморфизм невозможен. Геохимия тяжелых мик-
роэлементов — Mn, Pb, Cu, Zn, Ag, V, Mo, W, Sn и др. -- в соленос-
ных отложениях изучена И.Ф. Костенко. Одни из них накапливались
в рассолах (Mo, W, Ag и др.), другие «галофобные», связаны глав-
ным образом с нерастворимым остатком и областью сноса — их содер-
жание резко колеблется в разных регионах.
240
Галогенез играл важную роль в истории Земли. Помимо образова-
ния месторождений солей с ним связаны в той или иной степени фор-
мирование подземных рассолов, залежей нефти и газа и другие гео-
химические процессы.
Современный галогенез развивается в аридном климате, где испа-
рение превышает количество атмосферных осадков. Различают мор-
ской и континентальный галогенез. Соляные лагуны и озера представ-
ляют собой биокосные системы, однако накопление солей в них осу-
ществляется в результате физико-химических процессов, начало изу-
чению которых положили Я. Вант-Гофф (Голландия) и Н. С. Курна-
ков (СССР).
При испарении морской воды сначала выпадают в осадок наименее
растворимый гипс, потом галит, за ними следуют эпсомит, калийные
соли (сильвин и карналит) и бишофит. В наиболее концентрирован-
ных рассолах накапливаются В, Li, Rb, Cs, Br.
Главная масса галогенных пород возникла в водоемах морскою
происхождения. Наиболее характерны кембрийская, девонская, перм-
ская, юрская и неогеновая эпохи соленакопления.
Ранее полагали, что морское соленакопление происходило в мел-
ководных прибрежных лагунах типа Кара-Богаз-Гола. По А. Л. Ян-
шину, древнее соленакопление не похоже на современное: солеродные
бассейны имели огромные размеры, это были солеродные моря, а не
лагуны. Например, Кембрийский бассейн занимал почти всю Сибир-
скую платформу (около двух миллионов квадратных километров,
рис. 59), мощность соленосных отложений в нем достигала 3 км. Перм-
ские солеродные моря распространялись на сотни квадратных кило-
метров. Моря были достаточно глубокими, а этап соленакопления гео-
логически коротким. С морским галогенезом прошлых эпох связано
формирование залежей гипсов, поваренной и калийных солей, бора-
тов. Для соленакопления в рифтовых зонах («рифтовое соленакопле-
ние») определенную роль, вероятно, играл и эндогенный источник-
сильноминерализованные гидротермы (В. И. Седлецкий и др.).
По И. Ф. Вовку, радиолиз подземных вод, уничтожая молекулы
растворителя — Н2О, способствует концентрации солей. При геоло-
гической длительности радиолиза или высокой радиоактивности по-
род почти вся вода может разложиться на Н и О. В результате образу-
ется рассол, из которого может начаться садка солей. Подобное проис-
хождение могут иметь и рассолы во включениях в минералах.
На материках важнейшими системами галогенеза являются соле-
ные озера и засоленные почвы (солончаки и солонцы). На территории
СССР они распространены уже в лесостепи (Якутия, Западная Сибирь)
шире — в степях (Северный и Центральный Казахстан и др.) и на-
иболее широко—в пустынях (Средняя Азия, Южный Казахстан).
А. Е. Ферсман выделил пустынно-озерный пояс развития галогенеза
Соленые озера делятся на содовые, сульфатные и хлоридные.
Для каждого типа характерна особая парагенная. ассоциация макро- и
микроэлементов. По мере испарения из воды последовательно осаж-
241
даются все более и более растворимые соли (рис. 60). Наступление той
или иной стадии засоления зависит от многих причин, в том числе от
соотношения интенсивности питания озера и испарения. Например, в
западную часть оз. Балхаш впадает крупная река Или, и воды озера
в этой части озера пресные. В восточную часть впадают небольшие ре-
ки, и там вода солоноватая, на дие осаждается доломит. Следователь-
Рис. 59. Распространение на Сибирской платформе промышленных вод—хло-
ридных, существенно кальциевых рассолов с минерализацией 300—400 r/л н более
/ - граница Сибирской платформы. 2 — территория сплошного распространения рассолов в
галогено-карбонатных отложениях нижнего-среднего кембрия. 3 — зона заполнения рассо
лами всего осадочного чехла (кроме зоны подземных вод в твердой фазе). 4 — зона откры
той разгрузки рассолов. Содержание в рассолах Вг. В, К, Sr, Mg и редких металлов повсе
местно превышает минимальные промышленные нормы
но, в пределах одного озера сосуществуют воды разной солености.
Это хороший пример неравновесной, но стапионарной динамической
системы.
Геохимия континентального галогенеза тесно связана с геологи-
ческим строением района. Так, в континентальных рифтах, располо-
женных в аридном климате (Восточная Африка, Калифорния и др.),
разгрузка и испарение термальных вод в депрессиях рельефа приво-
дит к образованию промышленных месторождений В, Li, W, соды
(например, солончак Сёрлз в Калифорнии).
При близком залегании грунтовых вод от поверхности (4—5 м)
в аридном климате происходит их капиллярное поднятие и испаре-
ние. Так развивается засоление почв и континентальных отложений.
Важную роль играет и разгрузка на поверхности глубинных напорных
242
артезианских вод (Б. А. Бедер, Н. Ф. Глазовский и др.), а местами и
атмосферный принос солей. Вклад засоленных почв, соленых озер в
солевой баланс территории, очевидно, невелик. На территории СССР,
по Н. Ф. Глазовскому, в ландшафтах сосредоточено лишь 0,1% солей,
т. е. подавляющая их часть заключена в осадочных породах. Участки
концентрации элементов в горных породах и почвах, обязанные ис-
парению, называются испарительным геохимическим барьером — F.
В зависимости от состава вод.
поступающих к испарительно-
му барьеру, на нем формиру-
ются концентрации F1—F12.
F1 образуется при испарении
сернокислых вод вблизи зон
окисления сульфидных руд.
В таких кислых солончаках
накапливатся Cu, Zn и другие
металлы. Наиболее распро-
странены концентрации F.3
F7 и Fll (Na,Mg, Са, Cl, S). В
районах рудных месторожде-
ний с ними связано накопле-
ние Zn, Мо, U, Sr, В, Li и дру-
гих редких элементов. Виды
F4, F8 и F12 образуются при
испарении содовых вод. В них
накапливаются анионогенные
элементы «содовой миграции».
Накопление некоторых катио-
нов ослаблено (Са, Sr, Mg «за-
прещены»). Особенности испа-
рительных аномалий необхо-
димо учитывать при геохими-
ческих поисках рудных ме-
сторождений. Некоторые ано-
малии являются безрудными
(особенно Мо и Sr, частично
U), другие связаны с рудными месторождениями (F1 и др.). Их пра-
вильная оценка основана на учете особенностей геохимии галогенеза.
В степях и пустынях подземные воды нередко разгружаются по раз-
ломам, которые отмечены выходами источников, влаголюбивой рас-
тительностью, а часто и выцветами солей («разломное засоление»).
О1 Ш И5
Рис. 60. Общая схема галогенеза в совре-
менных озерах засушливой зоны: Кс — про-
центное содержание Na2CO3 в солевой мас-
се (по Н. М. Страхову):
/ — содовые озера (а — сильно содовые — КО
>30%, б —умеренно содовые —• Кс — 30—3%, в —
слабо содовые — Кс<3%), // — сульфатные озе-
ра (а — натриево-магнневые, а1 — магниево-натри-
евые, б — натрнево-магннево-кальцневые, в — маг-
ннево-кальцн.евые), /// — хлоридные озера с NaCl,
MgCI2 н CaCh; / — карбонатная стадия, 2 — суль-
фатная стадия, 3 —хлорндная стадия, 4 — суль-
фатные осадки, сильно загрязненные примесями
соды. 5— галнт. сильно загрязненный примесями
сульфатов натрия
Контрольные вопросы
1. Чем отличается криогенез от других гипергенных процессов?
2. Охарактеризуйте галогенез с позиции геоэнергетической теории Ферс-
мана.
3. Как образуются испарительные аномалии F1 — F12, расскажите об их
геохимии.
243
БИОГЕННАЯ
МИГРАЦИЯ
Прилагая новую мерку изучения жиз-
ни, совершенно отличную от обыч-
ной, мы подходим к явлениям и перс-
пективам до сих лор невиданным.
В. И. Вернадский
Понятие о живом веществе -- главное в гениальных построениях
В. И. Вернадского. С этим понятием связан переворот в науках о Зем-
ле. создание биогеохимии и учения о биосфере.
14. ОБЩИЕ ОСОБЕННОСТИ БИОГЕННОЙ МИГРАЦИИ
Науку о влиянии жизни на геохимические процессы Вернадский
назвал биогеохимией. В 20-е и 30-е годы она развивалась медленно,
встречала и возражения. Одна из причин была связана с исключитель-
ной дисперсностью жизни, ничтожностью геологической роли отдель-
ного организма по сравнению с работой рек, ледников, ветра, вулка-
нов, моря и т. д. Казалось, удел организмов — приспосабливаться к об-
становке, создаваемой этими могучими силами природы. Так думало
большинство натуралистов XIX и начала XX столетий. Чтобы оце-
нить геологическое значение жизни, понадобилось к работе организ-
мов подойти с другой меркой, рассмотреть жизнь в целом. Совокуп-
ность организмов планеты или какой-либо ее части, выраженную в
единицах массы, энергии, а сейчас можно добавить — и информации,
В. И. Вернадский назвал живым веществом. При таком подходе роль
организмов в земной коре предстала в совершенно новом — грандиоз-
ном свете.
Идеи Вернадского получили широкое распространение только в
современную эпоху — эпоху НТР в связи с остро вставшей проблемой
окружающей среды. Выяснилось, что биогеохимия — одна из теорети-
ческих основ решения данной проблемы. По В. И. Вернадскому, жи-
вое вещество, захватывая энергию Солнца, создает химические соеди-
244
нения, при распадении которых эта энергия освобождается в форме,
производящей химическую работу. В 1928 г. ученый сформулировал
понятие о биогеохимических функциях живого вещества: газовых
(кислородно-углекислотных, азотных, сероводородных и др.), концент-
рационных и биохимических.
Образование живого вещества
Геохимия фотосинтеза, происхождение свободного кислорода.
Образование живого вещества из неорганических соединений окружа-
ющей среды происходит преимущественно в результате фотосинтеза
зеленых растений по следующей суммарной реакции:
СО2 4 Н2О-1-световая энергияхл°р°Филл . [СН2О] + О2
Из СО2 и воды под влиянием хлорофилла или другого пигмента, иг-
рающего роль катализатора, и солнечной энергии зеленые растения
синтезируют углеводы и другие органические соединения, условно
изображаемые как [СН2О]. Поглощая из почвы и воды Са, Mg, К. F
и другие элементы, растения также используют их для синтеза орга-
нических соединений. Одновременно в результате разложения воды вы-
деляется свободный кислород. С позиций геохимии особенно сущест-
венно, что при фотосинтезе возникают сильный окислитель — свобод-
ный кислород О2 и сильные восстановители — различные органиче-
ские соединения, в то время как исходные вещества фотосинтеза —
СО2 и Н2О — на земной поверхности без участия организмов не
являются ни окислителями, ни восстановителями. При фотосинтезе
атомы О, С, Н заряжаются энергией, становятся геохимическими ак-
кумуляторами (термин предложил Н. В. Белов). Эта их роль в земной
коре грандиозна.
Свободный кислород Вернадский назвал самым могучим химиче-
ским деятелем на Земле. Это «геохимический диктатор», определяющий
миграцию и концентрацию многих элементов. По О. П. Добродееву,
растения ежегодно продуцируют 3,2-1011 т О. За 3700 лет создается
все количество О, содержащееся в атмосфере (1,18-1015 т). Другие гео-
химические аккумуляторы — С и Н — входят в состав органических
веществ, являющихся в земной коре сильными восстановителями. Так.
нейтральная с точки зрения окислительно-восстановительных условий
среда (СО2 + Н2О) в результате фотосинтеза разделилась на две про-
тивоположности — сильноокислительную среду со свободным кисло-
родом и сильно восстановительную с органическими соединениями. Сле-
довательно, с энергетической точки зрения образование живого веще-
ства — это процесс поглощения солнечной энергии, которая в потен-
циальной форме аккумулирована в свободном кислороде и органиче-
ских соединениях.
Рассмотрим образование живого вещества с информационных пози-
ций. В растениях синтезируется огромное количество различных орга-
нических соединений — углеводов, белков, жиров и др. Животные, не-
245
которые растения и большая часть микроорганизмов не способны синте-
зировать органические соединения из СО2 и Н2О. Используя белки, жи-
ры, углеводы и другие вещества растений, они создают новые белки,
жиры, углеводы своего тела. Так образуется огромное разнообразие
органических соединений, число которых измеряется сотнями тысяч.
Следовательно, образование живого вещества приводит к резкому
росту химической информации — «информационному взрыву». Для
сравнения отметим, что число известных природных неорганических
соединений — минералов измеряется тысячами « 3000) и вряд ли
со временем намного превысит 10 000. Но, пожалуй, еще важнее, что
при образовании живого вещества происходит качественное изменение
информации, возникает более сложный ее вид — биологическая инфор-
мация. Она еще более разнообразна, так как известны сотни тысяч ви-
дов растений и миллионы животных.
Итак, при образовании живого вещества происходит аккумуля-
ция энергии, увеличивается разнообразие, т. е. растет информация,
возникает новый более сложный ее вид — биологическая информация,
увеличиваются упорядоченность, сложность, организация природы,
растет негэнтропия, уменьшается информационная и термодинами-
ческая энтропия.
Для многих элементов в органических соединениях характерны
ковалентные и другие неионные связи, в то время как в неорганических
соединениях более типичны ионные связи. Поэтому поведение Са. Mg,
К. Fe, и других элементов в живом веществе и вне его резко различно.
За миллиарды лет растения практически очистили земную атмос-
феру от СО.,. В образовании О2 и поглощении СО2 и заключается
кислородно-углекислотная биогеохимическая функция живого вещества.
Важное значение имеет и биохимическая функция, связанная с процес-
сами, протекающими внутри организмов, например размножением,
в результате которого живое вещество быстро распространяется в про-
странстве, занимая все пригодные для жизни участки. Это явление
Вернадский назвал «давлением жизни» и сравнил его с давлением газа.
Скорость «растекания» жизни исключительно велика. Холерный виб-
рион, например, размножается со скоростью 33 000 см/с, и даже на-
иболее медленный слон — 0,1 смФ.
Хемосинтез. В 1890 г. микробиолог С. Н. Виноградский (1856—
1953) открыл микроорганизмы, способные окислять аммиак и не нуж-
дающиеся в органических соединениях как источнике энергии:
2NH3-j-3O2 = 2HNO2 , 2Н2О + 660,7 кДж
(N itrosomonas)
2HNO2 -O2 = 2HNO3+180,6 кДж
(Nitrobacter)
Энергия, выделяющаяся при окислении, используется этими мик-
роорганизмами для синтеза органических веществ из СО2 и Н2О, мине-
ральных солей. Позднее были обнаружены и другие автотрофные
246
микроорганизмы, окисляющие S и H2S, Fe2+, Mn2+, Sb3+, H2, CH4
Эти процессы названы хемосинтезом.
Ранее считалось, что жизнедеятельность микроорганизмов огра-
ничена температурой около 100°С. так как при более высоких темпе-
ратурах денатурируется белок — основа жизни. Однако в 1977 —
—1979 гг. на дне Тихого океана в местах выхода гидротерм были от-
крыты бактерии хемосинтетики, живущие при 300° С. Это открытие,
потрясшее биологов, исключительно важно и для геохимии. Оно раз-
двигает границы биосферы, по-новому ставит вопрос о роли бактерий
в гидротермальных системах, рудообразовании, происхождении ор-
ганических соединений гидротерм. В целом хемосинтез играет опреде-
ленную роль в круговороте ряда химических элементов, но его значе-
ние в образовании живого вещества по сравнению с фотосинтезом нич-
тожно.
Количество живого вещества. В живом веществе абсолютно преоб-
ладает фитомасса, много меньше роль зоомассы и микроорганизмов.
Например, в ландшафтах суши зоомасса обычно не превышает 2 %
от фитомассы и лишь изредка достигает 10 %. По Н. И. Базилевич и
др., общее количество фитомассы Б на Земле равно 2,4-1012 т сухого
вещества (без воды). Расчет сделан на «восстановленный растительный
покров», т. е. без учета вырубки лесов, распашки степей, орошения
пустынь и т.д. Подавляющая часть фитомассы сосредоточена на мате-
риках, где она распределена крайне неравномерно: ее много в тропи-
ческих лесах (650 т/га), меньше в тайге (около 300 т/га), еще меньше в
черноземных степях (около 10т/га) и совсем мало в пустынях (2,5 т/га).
Большая часть живого вещества представлена лесами (82% от фито-
массы суши), среди которых преобладают тропические леса (1,03 X
X 1012 т). Фитомасса океана составляет лишь 1,7 10а т. т. е. 0,007 % от
всей фитомассы, зоомасса и микробиомасса — 3,3-Ю9т. По количе-
ству живого вещества на 1 га океан близок к пустыням, но и в нем наб-
людаются сгущения жизни (коралловые рифы, Саргассово море, зона
апвеллинга — подъема к поверхности глубинных вод, богатых Р и
другими биоэлементами).
Важным геохимическим показателем является и ежегодная про-
дукция живого вещества П, которая для Земли в целом составляет
2,3-1011 т, причем на материках продуцируется 1,7-Ю11 т, в океане—
6-1010т. Хотя в океане и меньше живого вещества, но оно быстрее,
чем на суше, образуется и разлагается. В результате за год его суммар-
ное количество не намного меньше, чем на суше. Если на материках
средняя годичная продукция фитомассы равна 11,5 т/га, то в океане—
1,7 т (планета в целом — 4,5 т). Следовательно, в океане годичная
продукция живого вещества П в 3000 раз больше фитомассы Б (на
суше П < Б). Автор показал, что для тундры, тайги, черноземных
степей и других типов растительного покрова отношение логарифма
ежегодной продукции Г! к логарифму биомассы Б — величина по-
стоянная:
lg/7/lgfi=- К или П — Бк.
247
Гак, для тайги К = 0,54—0,55, для тропических лесов 0,65—
0,66, для луговых степей — 0,88 и т.д.
Масса живого вещества составляет ничтожную часть массы земной
коры; наглядно сравнение В. М. Гольдшмидта: если литосферу пред-
ставить в виде каменной чаши массой в тринадцать фунтов, то масса
поместившейся в ней гидросферы составит 1 фунт, масса атмосферы
будет соответствовать медной монете, а живого вещества — почтовой
марке. Однако живое вещество—очень активная, «действенная мас-
са», которая постоянно образуется из неорганических тел и вновь раз-
рушается. Если принять, что в течение последних пятисот миллионов
лет (с начала ордовика) годичная продукция живого вещества была
близка к современной (отклоняясь в ту или другую сторону), то про-
дукция за это время превысила массу земной коры.
Кларки живого вещества. При подсчетах кларков можно исклю-
чить животных, так как зоомасса по сравнению с фитомассой ничтож-
на. Среди растений на суше преобладают деревья, и задача во многом
сводится к определению среднего состава древесины. Кларки живого
вещества впервые наметил В. И. Вернадский, более точно — А.П. Ви-
ноградов (с дополнением по В. В. Добровольскому и др.):
Макроэлементы (п-10 3 — п- 10)
А. Воздушные мигранты (98,8%)
0-70, С—18, Н—10,5, N— 3-10-1
Б. Водные мигранты (1,20|%)
Са —5-10-1 Mg—4-Ю-2 Na—2-10-1
К —3.10-1 р —7.Ю-2 Cl —2.10-2
Si -2-Ю-1 S —5-Ю-2 Fe — НЮ"2
Микроэлементы (водные мигранты) (п-10-3 и менее)
Мп-9,6-10-3 Pb —i-io-* Cs —6-10-e
Al —5-10-3 Ni— 8-IO"6 Be—4-10~e
Zn— 2-10-3 Cr — 7-10-a Ga—2-10-’
Sr — 1,6-Ю-з V—6-10-5 Se—2-10-e
Ti —1,3-10-3 Li — 610-5 W — 1 10-”
B-1.10-3 Co — 4. IO-® Ag— 1,2-10-"
Ba -9- IO-4 La — 310-5 U—8-10-’
Cu —3,2-IO* Y—3-Ю-8 Hg—5.10-2
Zr —3-10-* Mo—2 10-s Sb—210-’
Rb—2-Ю-4 1-1,2-10~5 Cd —2-10"’
Br -1,6-10-« Sn— I-10-5 Au—10-8
F— 1,410-* As—6-10-e Ra —n-10'12
Обнаружены в организмах, но нет данных о среднем содержании Не, Ne, Ar, Sc
Kr.Nb, Rh, Pd, In, Те, Хе, Ta, Tl, Bi, Th.
He обнаружим с достоверностью в организмах Ru, Hf, Re, Os, Ir, Po, Ac, Tc
At. Fr (последние три не обнаружены в земной коре)
248
Кларки живого вещества уменьшаются с ростом атомной массы
элементов, однако, как и для земной коры, здесь нет прямой зависи-
мости. Живое вещество в основном состоит из четырех элементов —
О (70%), С (18 %), Н (10,5 %) и N (0,3 %), в сумме составляющих
98,8 %. Организмы — кислородные существа. Живое вещество бога-
то водой. Некоторые животные (медузы и др.) содержат почти 100 %
воды, менее богаты водой млекопитающие, но и в них ее более 60 %.
Кларк живого вещества
Рис. 61. Биофильиость элементов (по А. И. Перельману)
В живых организмах обнаружены почти все элементы периодиче-
ской системы, но кларки большинства из них очень малы. Так, Мо
в живом веществе 2-10-5 %; Ni—8-10-5%; Си — 3,2-10“4 и т. д.
Многие микроэлементы выполняют в организмах важные физиологи-
ческие функции. Например, I входит в состав гормона щитовидной
железы, который регулирует окислительно-восстановительные про-
цессы.
Нетрудно убедиться, что живое вещество в основном состоит из
химических элементов, подвижных на земной поверхности. Наиболее
распространенные (О, С, Н, N) образуют газообразные соединения
249
(воздушные мигранты). Главной особенностью истории живого веще-
ства Вернадский считал его образование из газов и превращение после
смерти снова в газы (СО2, NH3, N2, Н2О — водяной пар и т.д.). Эле-
менты малоподвижные слабо захватываются организмами. Напри-
мер, в литосфере много AI (8,05 %), а в живом веществе AI — микро-
элемент (5-10_3 %).
КОЭФФИЦИЕНТЫ БИОЛОГИЧЕСКОГО ПОГЛОЩЕНИЯ
100- п 10- п п 0,n 0,0 n — 0,00 n
ЭЛЕМЕНТЫ БИОЛОГИ- ЧЕСКОГО НАКОПЛЕНИЯ ЭНЕРГИИ - НОГО P,S,Cl,Br,I
сильного С а, N а, К , М g, S г, Zn, В, Se
ЭЛЕМЕНТЫ. БИОЛОГИЧЕСКОГО ЗАХВАТА СРЕДНЕГО Mn,F,Ba,Ni,Cu, Ga,Co,Pb,Sn,Ai, Mo,Hg, Ag,Ra
СЛАБОГО И ОЧЕНЬ СЛАБОГО Si,Al,Fe,Ti,Zr,R b, V,Cr,Li,Y, Nb,Th,Sc, Be,C«,T*,U,W,Sb,Cd
Рис. 62. Ряды биологического поглощения элементов (по А. И. Перельману)
Кларки концентрации элементов в живом веществе автор назвал
биофильностью. На рис. 61 по горизонтальной оси расположены клар-
ки земной коры, а по вертикальной — кларки живого вещества (и те
и другие в логарифмическом масштабе). Линия под углом 45° характе-
ризует равную биофильность. Наиболее энергично концентрируется
в живом веществе С (биофильность 780), слабее — N (160), Н (70),
О (1,5) и С1 (1,1). У остальных элементов биофильность меньше 1. На-
именее биофильны Al, Fe, Ti. В геохимии важно знать также состав
минеральной части живого вещества — «золы», так как организмы спо-
собны избирательно поглощать из среды и накапливать в золе некото-
рые элементы. Эта способность характеризуется коэффициентом био-
250
логического поглощения Ах, показывающим, во сколько раз содержа-
ние элемента X в золе больше, чем в литосфере в целом (или в кон-
кретной горной породе, почве). Такие расчеты впервые осуществил
Б. Б. Полынов. Анализ величин Ах позволил ему построить ряды био-
логического поглощения для главных элементов. На рис. 62 показаны
наши расчеты, включающие и микроэлементы. При их составлении ис-
пользованы средний химический состав золы живых организмов и
кларки твердой земной коры. Элементы с Ах > 1 «накапливаются»
живым веществом, причем Р, S, Cl, Br, I — энергично, а Са, Na, К,
Mg, Sr, Zn, В, Se — сильно. Остальные элементы, у которых Ах <
<Z 1, лишь «захватываются», причем одни —средне, другие слабо и
очень слабо. Конечно, это средние данные и у отдельных видов вели-
чины Ах сильно варьируют (см. гл. 15).
Концентрационная функция живого вещества. Все живые организ-
мы накапливают относительно литосферы С, Н, О и N. В производных
жизни — горючих ископаемых — С, Н и N больше, чем в литосфере в
целом. Велика роль живого вещества и в концентрации других эле-
ментов, хотя концентраторами являются не все организмы, а лишь не-
которые виды и роды.
Разложение органических веществ
При разложении органических веществ большая часть их минера-
лизуется, т. е. окисляется до простых минеральных соединений —
СО2, Н2О, минеральных солей. Минерализация протекает и в расте-
ниях, которые в процессе дыхания окисляют органические соединения.
Однако фотосинтез создает значительно больше органических веществ,
чем их разрушается при дыхании. В целом растения — накопители ор-
ганических веществ. Животные также минерализуют органические ве-
щества при дыхании и других физиологических процессах, но наиболее
велико значение микроорганизмов. Последние существуют в воздухе,
почве, коре выветривания, илах, поверхностных и подземных водах.
П. А. Удодов, Е. С. Коробейникова, Н. М. Рассказов и другие откры-
ли бактерии даже в поровых растворах осадочных пород. Особенно
э ергична деятельность бактерий в почвах и илах, где их число в 1 г
Д стигает нескольких миллиардов.
Минерализация органических соединений противоположна фото-
синтезу, она сопровождается освобождением энергии, поглощенной
при фотосинтезе. Энергия освобождается не только в тепловой, но и хи-
мической форме, носителями которой служат природные воды: обо-
гащаясь СО2, H2S и другими продуктами минерализации, воды стано-
вятся химически высокоактивными.
Разложение органических веществ — это процесс энтропийный,
количество химической информации резко уменьшается, так как все
огромное разнообразие органических соединений живых организмов
превращается в небольшое число простых минеральных соединений —
СО2, Н2О, NH3 и т. д. Хотя при этом образуются и сложные органи-
251
ческие соединения гумусового типа, но они все же менее разнообразны
и к тому же постепенно сами разлагаются до СО2, Н2О и т.д. Еще важ-
нее, что при разложении органических веществ уничтожается более
сложный вид информации — биологическая информация.
Если образование живого вещества из минеральных соединений
происходит почти исключительно на земной поверхности и в верхних
горизонтах моря, куда проникает солнечный свет и где возможен фо-
тосинтез, то разложение протекает и в глубоких частях литосферы и
гидросферы, которые являются зоной активной геохимической дея-
тельности микроорганизмов, разрушающих органические вещества по-
род и вод. Везде, где в породах имеются вода и органические вещества
(нефть, угли, битуминозные известняки, углистые сланцы и др.) и
температура не слишком высока, создаются условия для деятельности
микроорганизмов.
С разложением органических веществ связаны различные биогео-
химические функции живого вещества (преимущественно газовые).
Это прежде всего углекислотная функция, не зависящая от кислород-
ной. Все растения, животные, микроорганизмы дышат, выделяя СО2,
Особенно велика роль микроорганизмов, в результате деятельности
которых почвенный и грунтовый воздух намного богаче СО2, чем ат-
мосферный. Биогенный СО2, растворяясь в водах, оказывает огром-
ное влияние на pH вод, образование растворимых комплексов метал-
лов и другие параметры, определяющие миграцию большинства хими-
ческих элементов.
В результате накопления СО2 и других газов в жидкой фазе пород
возникает избыточное давление, с которым связывают образование
истинных плывунов, оползней, селей, подводных каньонов и т. д.
(В. А. Радина, Я. Л. Коган).
В бескислородной среде микробиологическое разложение органи-
ческих остатков часто приводит к образованию метана и других угле-
водородов. Эта углеводородная функция живого вещества реализуется
в почвах, илах и особенно в подземных водах. Углеводороды, возни-
кающие на глубинах в сотни и тысячи метров, мигрируют и накапли-
ваются в различных «ловушках», в форме газовых залежей. Поток уг-
леводородов направлен к земной поверхности, с ним связаны многие
геохимические процессы в подземных водах, эпигенетические измене-
ния в породах.
Сероводородная функция сульфатредуцирующих бактерий состо-
ит в разложении органических веществ и сульфатов с выделением СО2
и H2S. Отнимая кислород у сульфатов, бактерии окисляют им органи-
ческие вещества. Примерная схема реакции такая:
3Na2SO. + CeHl2Oe 3Na2CO3 - ЗН2О + ЗСО2 + 3H2S + Q кДж
Для бактерий эта реакция играет роль дыхательного акта. Выде-
ляющаяся энергия Q используется микробами для жизненных процес-
сов. Восстановленная сера выделяется в форме H2S, а окисленный
252
углерод — в виде СО2. Десульфуризация протекает там, где органиче-
ские вещества (уголь, гумус, торф, битумы и т. д.) разлагаются без до-
ступа О2 и в присутствии сульфатов: в засоленных почвах, илах морей
и соленых озер, в водоносных горизонтах. Геохимическое значение се-
роводородной функции живого вещества огромно, так как с ней связа-
но образование пирита и других сульфидов, в том числе образование
сульфидных рудных месторождений.
При разложении органических веществ в анаэробной среде места-
ми также происходит выделение Н2. Он обнаружен во многих подзем-
ных водах, является исключительно активным геохимическим аген-
том, осуществляет водородную функцию живого вещества.
Азотная функция связана с различными микробиологическими
процессами, она заключается в накоплении N2 в атмосфере и гидро-
сфере.
Окислительно-восстановительные функции живого вещества так-
же проявляются преимущественно при разложении органических ве-
ществ. Окислительная функция состоит в окислении свободным кис-
лородом органических веществ, пирита, сидерита, серы и т. д. В этих
процессах участвуют различные аэробные бактерии. Восстановите-
льная функция осуществляется различными микроорганизмами и за-
ключается в восстановлении Fe3+, Мп4+ и Мп3+, Си2+ и других
элементов.
Органическая геохимия. Не все органические остатки минерали-
зуются полностью, часть их преобразуется в органические вещества
осадочных пород, в том числе залежи торфа, угля и других горючих
ископаемых. Общая их масса много больше массы живого вещества
Однако главное количество органического углерода Сор1,. заключено
ие в залежах горючих ископаемых, а в осадочных породах в виде не-
больших примесей гумусовых и углистых веществ, капель битумов и
т.д.
Из осадочных пород, почв и вод выделены аминокислоты, угле-
воды и их производные, липиды, изопреноиды, стероиды, гетероцикли-
ческие соединения, фенолы, гуминовые вещества, углеводороды и дру-
гие органические соединения (всего свыше 500). Ископаемые биомо-
лекулы и их дериваты именуются хемофоссилиями, а раздел геохимии,
изучающий органические соединения горных пород и вод, — орга-
нической геохимией. В качестве самостоятельных научных направле-
ний оформились геохимия нефти и геохимия угля, поставлен так же
вопрос об особом разделе науки — молекулярной биогеохимии, изу-
чающей геохимическую историю биомолекул.
Главные превращения растительные и животные остатки претер-
певают в почвах и илах в период энергичной работы микроорганизмов.
В дальнейшем происходит более медленное их изменение под влиянием
подземных вод и термокаталитическим путем при прогибании осадоч-
ных толщ и росте температуры, а также в результате радиолиза.
При разложении одна часть органических веществ минерализуется
полностью, другая сохраняется, третья синтезируется заново (напри-
253
мер, черные высокомолекулярные органические соединения почв, уг-
лей, торфа).
Диагенез, прогрессивный эпигенез и метаморфизм определяют ста-
дийное изменение органических веществ, вплоть до образования конеч-
ного продукта — графита. Среди ископаемых органических веществ
различают вещества угольного и нефтяного (битумного) ряда. Те и
другие нередко обогащены рудными элементами, часть которых на-
капливалась еще при жизни организмов, а часть — из иловых и под-
земных вод в ходе диагенеза и эпигенеза.
Геохимия нефти. В недрах нефть состоит из смеси газообразных и
жидких углеводородов с примесью других органических соединений.
В нефтях установлены предельные (СпН2п+2) и непредельные (СпН2п,
СпН2п-2 и т.д.), алифатические и ароматические углеводороды. Нефти
содержат также N, S, V, Ni и другие макро- и микроэлементы.
Почти во всех осадочных породах в результате анаэробного разло-
жения органических остатков образуется незначительное количество
углеводородов. Это микронефть. В ее образовании участвуют глини-
стые минералы, которые, однако, не являются только катализаторами
данного процесса, как это казалось ранее. В ходе гидрогенизации ор-
ганических веществ глинистые минералы сами преобразуются (напри-
мер, происходит гидрослюдизация монтмориллонита). При этом улуч-
шаются коллекторские свойства пород, их проницаемость для газа,
нефти, воды. Следовательно, преобразование органических веществ и
глинистых минералов представляет собой единый процесс, обе ветви
которого тесно взаимосвязаны (И. Д. Зхус).
В 1934 г. А. Трейбс, в нефтях открыл гетероциклические соедине-
ния — порфирины, по своей структуре близкие к хлорофиллу и ге-
моглобину. Они нередко содержат V и Ni. Предполагают, что порфи-
рины образовались из хлорофилла, поэтому открытие порфиринов рас-
сматривается как одно из важных доказательств органического про-
исхождения нефтей. Имеются основания считать, что и многие другие
компоненты нефти образовались из белков, восков, стероидов, лиг-
нина и других органических соединений растений и животных.
В результате миграции микронефти образуются крупные скопле-
ния углеводородов — залежи макронефти. По Н. Б. Вассоевичу,
нефть — «детище литогенеза», для ее образования необходимы мощ-
ные толщи осадочных отложений. Основные залежи нефти и газа об-
разуются в осадочных бассейнах на глубинах 2—4 км при температу-
рах 60—150°С. Это главная зона нефтеобразования, а соответствующий
этап геологического развития бассейна называется главной фазой неф-
теобразован ия. От времени отложения нефтематеринских пород до
начала главной фазы нефтеобразования иногда проходят десятки и сот-
ни миллионов лет. Такова биогенная (осадочно-миграционная) тео-
рия происхождения нефти. В последние десятилетия установлены
факты, позволившие разработать и альтернативную теорию неоргани-
ческого происхождения нефти. Под многими крупными нефтяными за-
лежами обнаружены зоны разломов, углеводороды встречены в магма
254
тических породах, гидротермальных рудах, метеоритах, где их небио-
генное происхождение очевидно. Вероятно присутствие углеводородов
в мантии, предполагается оно и в ядре Земли. По глубинным разло-
мам происходит дегазация мантии, среди газов установлены и углево-
дороды. Все эти факты привели к дальнейшей разработке данной тео-
рии, основы которой были заложены еще в XIX в. Д. И. Менделеевым
и другими учеными.
Не исключено, что некоторые микроэлементы нефти, например
V и Ni, имеют глубинное происхождение (на это, например, указывает
пространственная связь особо обогащенных V и Ni нефтей Западной
Сибири с рифтогенными структурами в основании осадочного чехла).
Большинство геологов и геохимиков придерживаются осадочно-
миграционной теории. Углеводороды неорганического происхождения
также существуют, однако их роль в формировании известных залежей
нефти не выяснена.
Геохимия угля. Ее основоположником был В. М. Гольдшмидт.
По Я- Э. Юдовичу, по сравнению с осадочными породами в углях кон-
центрируются Ge, Mo, Cl, Hg, As, Se, возможно также W, В, I. Cd и
Sb. Много шире список элементов, концентрирующихся в золе углей
(не менее 50). В последовательности геохимической классификации,
приведенной на с. 262, это Sr, F, В, Be, Cs, TI, Ge, Sn, Sb, Zn, Ni.
Cu, Pb, Cd, Hg, Ag, Bi, V, Mo, U, Se, Au, Re, Co, TR, Ga, Sc, Nb.
Ta, W. Происхождение концентраций различно: во многих случаях
оно связано с восстановительными барьерами В и С в илах (особенно
для халькофилов, U, Se и др.). Геохимия каменных и бурых углей раз-
лична, что связывают как с эпигенетическими процессами (выщелачи-
ванием или привносом элементов с подземными водами), так и с разли-
чиями растений в палеоландшафтах (каменные угли в основном обра-
зовались в палеозое из растений морских побережий, а бурые — в
мезокайиозойских болотах и озерах). Среди минеральных элементов
углей практическое значение имеют Fe, Al, Ge, U, Ga, Pb, Zn, Mo,
Au, Ag, Hg.
Изучение угольных включений в осадочных породах позволило ре-
шать вопросы геохимии диагенеза и эпигенеза, стратиграфии, фаци-
ального анализа. Углефицированные стволы деревьев и другие не-
большие скопления угольного вещества представляют особый тип
концентрации Ge, Mo, As, U, Sb, Zr, V, Cr Ti, Ni и Co, иногда TR, Sc
Sn и других металлов. Их содержание часто выше, чем в пластах
угля. Содержание Ge в золе, например, превышает 7%, т. е. ДД 6000—
7000 и более. Предполагается, что обогащение происходило из ило-
вых и подземных вод в диагенезе и эпигенезе путем диффузии. Во
включениях установлен также дефицит В, Ва, Sr, Be, Mn.
По И. Ф. Вовку, в преобразовании углей важна роль радиолиза, на-
иболее интенсивного в ураноносиых углях.
Геохимия торфа и торфяных болот. Эти вопросы наиболее изуче-
ны в Белоруссии (К. И. Лукашев с сотрудниками). Так, В. А. Кова-
левым детально изучены минералого-геохимические системы торфя-
255
ников (кислород-гидроксильные системы, системы S, Р, SiO2, образо-
вание руд железа и др.). По В. Н. Крештаповой, в торфах европейской
части СССР содержание Ge, Си, Мо в сухом веществе торфа местами
превышает кларк. Слабее концентрируются Mn, Sr, Ni, Со, Pb и Yb.
Содержание элементов зависит от геологического строения и климата
областей питания торфяника. Например, накопление Ge связано с рас-
пространением глин мезозоя, накопление Си — с глинами и суглин-
ками любого состава, Sr — с пермскими отложениями. Мо и Мп кон-
центрируются в торфяниках лесостепи.
Биогенное минерало- и породообразование. Многие минералы обра-
ювались непосредственно в телах организмов (опал диатомовых водо-
рослей, кальцит и арагонит раковин, оксалаты, фосфаты и другие со-
ли в почечных камнях и т.д.). После смерти организмов часть этих ми-
нералов дает начало коралловым известнякам, диатомитам и другим
породам, биогенное происхождение которых устанавливается легко.
Но и многие минералы и породы, не имеющие органоморфной струк-
туры, также биогенны. Интересна в этом отношении идея Б.Б. Полы-
нова о генезисе глинистых минералов в почвах. Хорошо известно, что
в почвах С, Н, О, N, входившие в состав растений, образуют СО2, Н2О,
NH3 и другие простые минеральные соединения, а также частично гу-
мус. При разложении растительных остатков освобождаются также
А12О3, SiO2, Fe2O3, MgO, которые, по Б.Б. Полынову, вступают во
взаимодействие и образуют глинистые минералы. С этих позиций по-
следние не менее биогенны, чем гумус. Хотя эта теория подтверждает-
ся различными фактами, она все же нуждается в дальнейшем обоснова-
нии.
Формирование химического состава поверхностных и грунтовых
вод. В условиях влажного климата и малоактивных пород (не содер-
жащих карбонатов, гипса, растворимых солей и сульфидов) значи-
тельная часть растворенных веществ поступает в воды за счет деятель-
ности организмов как находящихся непосредственно в водной массе,
гак и населяющих область формирования вод, питающих данный водо-
ем или водоносный горизонт. Основное значение имеет разложение
растительных остатков в почвах. В ходе разложения из воды извлека-
ется О2, а в воду поступают СО2, HCOj", Са, Mg, Р, S, Na, гумусовые
вещества. Состав таких вод довольно однообразен и слабо зависит от
геологического строения района. Например, во многих гумидных ланд-
шафтах речные, почвенные и грунтовые воды имеют гидрокарбонатно-
кальциевый состав (Са2+ — НСОу). Преобладание в водах Са2+
объясняется тем, что это главный металл живого вещества, который
при разложении растительных остатков в наибольшем количестве по-
ступает в воды. Меньшее содержание в живом веществе Mg и Na оп-
ределяет и их меньшее содержание в водах. Накопление гидрокарбо-
нат-иона (HCOjy) обязано растворению СО2 — продукта минерализа-
ции растительных остатков. Б. Б. Полынов подчеркивал, что состав
речных вод обусловлен не абиотическими реакциями действия воды на
минералы магматических пород, т. е. гидролизом и растворением, а бо-
256
лее сложным, хотя и более быстро текущим процессом извлечения эле-
ментов из минералов организмами и растворением в воде зольной части
организмов при их минерализации.
Главной «фабрикой» формирования химического состава поверхност-
ных и грунтовых вод является, таким образом, та среда, где наиболее
энергично идет разложение растительных остатков—почва.
В подземных водах H2S, СО2, СН4 и другие газы также часто явля-
ются продуктами деятельности микроорганизмов. Эти газы во многом
определяют геохимические особенности вод (табл. 18).
В ландшафтах сухого климата химический состав вод формируется
в процессе растворения солей почв и горных пород, испарительной
концентрации и метаморфизации вод. В результате образуются раз-
личные типы вод (а не только гидрокарбонатно-кальциевые), в том чис-
ле хлоридные, сульфатные. Среди катионов часто преобладает не
Са2+, a Na+ или Mg2+, среди анионов — SO4- и Cl-, а не НСОу.
Следовательно, в сухом климате формирование химического состава
вод имеет преимущественно физико-химический характер, т. е. проте-
кает без ведущей роли живого вещества. Эти же процессы преоблада-
ют в районах влажного климата, сложенных карбонатными, соленос-
ными и гипсоносными толщами и породами, богатыми сульфидами.
В целом влияние живого вещества на формирование химического со-
става вод симбатно количеству живого вещества и интенсивности раз-
ложения его остатков.
Биологический круговорот элементов (БИК)
Образование живого вещества и разложение органических веществ
образуют единый биологический круговорот атомов — БИК (рис. 63),
который в биосфере протекает повсеместно, хотя и в разных формах
и с разной интенсивностью.
В ландшафте и верхних горизонтах моря в процессе фотосинтеза
образуется живое вещество, здесь же происходит и его минерализация.
Часть органических веществ минерализуется не полностью и захороня-
ется в илах. В морских и озерных илах, подземных водах фотосинтез
отсутствует, однако образование живого вещества там происходит,
но уже не из СО2 и Н2О, а за счет мертвого органического вещества или
других организмов. В отличие от ландшафтов в этих системах минера-
лизация преобладает над образованием живого вещества, здесь расхо-
дуются те органические вещества, которые были накоплены в верхних
частях биосферы.
К числу основных законов геохимии мы относим закон биологи-
ческого круговорота, согласно которому в биосфере в ходе биологиче-
ского круговорота атомы поглощаются живым веществом и заряжают-
ся энергией. Покидая живое вещество, они отдают накопленную энер-
гию в окружающую среду. За счет этой биогенной энергии осуществля-
ются многие химические реакции. Главными носителями энергии явля-
ются природные воды.
257
Таблица 18. Типы концентрации элементов иа
фиэико - MiuimccMu* iomj» состав ВОД, НОСТУ И Л ю
Окис.пнс и-НО н<|(< MtiOHlilf иные К ПСДОРОДНЫЕ воды Г Д Е
Щеточии-мклотные к Си H.UUMtC- тые II. Кислые и етлбокиспде 11! Нснтр.ии- иые И с i.'ihn- l(JC lO'IIIIJC IV. Сильно- щелочные (соловые) V. Силыю- кпслые
I р.шппы pH и тине пик |нсн<>1.1 о 3-6.5 6.3-В.5 >8.3 о
1 2 3 4 >
Ч II 41’11 П Г. ПОДПИЛ 11ЫС л RO.UlX Na. К-
HojHIfO COCT.1H.I
ПАРАГЕННАЯ АССОЦИАЦИЯ l.i.Tl.F.Mg.Ca. Ra.Mn.Fe.Co.Nl. Си.Zn.Cd.Hg.Se. A t.G a, In.Se, У, TR.Si.Ge.Sn.Ti, Zr.Th.Cr.Mo.W, U.P.A», V.Nb.T* b.Tl.F.Mg.Ca, Sr.Sa.Ra.Mn.Fe, Co.Ni.Cu.Zn.Pb, Cd.Hg.A g, An.Be, AI.Ga.ln.Sc.Y.TR. Si,Ca.Sn.Ti,Zr,Th, Cr, Mo.W.U.P.A», V.Nb.T* UTI.Mg.Ca, Se.Zn.Sa.Cr. Ma.W.V.Ra Li,F.R.Zn.Ca.Ag, «e.Al.Sc.Y.Si.Gc, Sn,Ti,2r.TbXr« Mo/W.U.Ra.V.Nb Li.TUF.Mg.Ca.Sr, Sa.Ra.MBtPa.Ca, Ni.Cu.Zn.Pb,Cd, l)g3g.Au,Bc,Al, Ga.Jn.Sc.Y.Si,Ge, Sn.Ti.Zr.Th.Cr,Ma, W.U.P.V.Nb,T*
| КЛАСС 1 1. О \ И М It ‘ItCKOI <> 1. \ I1 Ь 1 1‘ А кислогодный А Al fe A2 Fe.Mn.Co A3 Mn A4 A5
СУЛ!»ФИДНЬ!!’!(СЕ1,О’ водородный 11 ДР В Bl Tl.Ca.Hg.Pb. Cd.Bi.Sn.As. Sb.Mo.W.U B2 TI. Mn. Co.Ni. Cu.Zn. Pb.Cd.Hg.Sn. Cr.Mo.U B3 TJ.Cr.Mo.U, Se.Re.V B4 Cu.Ag.Zn.Cr. Mo.U.V, \j B5 H.Pb.Cd. RuSn
ГЛЕЕВЫЙ С Cl ( u.U,Mo, C2 Cu.U.Mo C3 Сч.Сс.и.М®. Re.Se.V C4 Ca.Ag.C'e.M©. U .Re.Se.V, A 5, C5 Cu.U.Mo
ЩЕЛОЧНОЙ D DI Mg.Ca.Sr. Ba.Ra.Mn.Fe.Co. Nl.Cu.Zn.Pb.Cd, Hg.Be, Al,G*. Y, TR,Cr.P.A»,U D2 Mg.c,. Sr.B».R*,Co. Ni.Cu.Zn.Pb. Cd.Hg.Be.(U) D3 D4 D5 Mg.Ca.Sr.* Ba.R a.M n. Fe. Co. Ni.Cu.Zn.Pb.Cd. Hg.Be, Al.Ga.Y. TR.Cr.P. A».(U)
КИСЛЫЙ в — E2 !• E3 Si.Mo E4 (Cn).(znj. Ag.Be.AJ.Ga.Sc. Y,TR.Si.(Ge),Zr. (Ti).Mo.Cr.V —
ИСПАРИТЕЛЬНЫЙ Г Fl N*,K,Rh, T1,Cl, Mg.Ca,Sr, S.Mn.Fe, Co.Ni, Cn.Zn.Pb.Cd, Al Ma.U F2 F3 L'.Na.K, Rb.TI.N.B.F. Cl, Br, t.Mg. Ca. Sr.S.Zn, Mo.U.V.Se F4 Li. Na.K.Rb.TI N'.S.F, Cl.Br,!, Cn.Zn.Mo.U, Sa F5 Na.K.Rb. TI.CJ.Mg.Ca.Sr, 5, Mn. Fe. Co.Ni, CM.Zn.pb.Cd.AL Mo.U
СОРБЦИОННЫЙ G G1 Al,Se,Св,Si, Ca.P.V,A G2 Si,B*.Zi»,Cd,N4 Co.Pb.Ca.U.Cl. •r, I.F.S.P.V, Mo.A» G3 l.i,Na.K,ko,C>, TUn.lCl.Br.!, F. B.S.P.V.Mo, Ar) G4 Li.Na.K.Rh.Ct. Ti. (Ci,Br,t,B,F, S.P.V.Mo.At) G5 Al.Se.Ga.Si, Ge.P.V.Aj
ТЕРМОДИНАМИ- ЧЕСКИЙ н Hl H2 Mg.Ca.br,Ba. Ma. Za.Pb.Co, Ni H3 (Li).Mg.Ca.Sr. 8a.Zn.Pb H4 Zn, Ca'. iU i H5
258
геохимических барьерах биосферы (по А. И. Перельману)
Щ И X К Г Г. О X 11 М И Ч 1 С К О М \ b X 1’ Ь Е Р у
1. К Ы Е в О Д U СН’ОВОДОРОДНЫГ. It СУЛЬФИДНЫЕ воды
X J Кшлыс л слаГ>ом1СЛ1.1с VII Неитрачь- пыс >i ciatio- iijeioMiuJe V1U ||цл1чиые '< oAUlll.ip'l l\. Сильны- ми , । i.r e X Kut'11.1c и < IMF XI Центрам- IH.1C И C7,l6<l rije j<»4iiiJc XII Сильно- щеют/ые 1содовые)
э-6.5 6,5-8.5 >8,5 <3 3-6,5 6,5-8,5 >8,5
h 7 8 9 10 11 12
Rb, Сч. X, Cl, Вг, I
f >.ri.F.Mg.Ca,Sr. Ba.Ra.Mn.Fe.Co, N>,Cu,Zn.Pb.Cd, Ilg.Ag.Ati.Be.AI, Ga.In.Sc.Y.Si.Ge, Sn.Ti.Zr, Fh.C r, Mo, W.U.I’.V, Sb,Ta l-i.l l.Mg.Ca.Sr, Ba,Mn,Fe,Co,Ni> Hg.Mo.W.U Li,B,F.B,Mn,Cu, Zn.Cd,Hg.Be,Al. Sc,G*,Y,Si.Ti,Ge. Zr,Sn.Mo,W,U Li. Tf.F,Mg,C*. Mn,Fe.Co,Ni,Zn. Cd,Hg.Be.Al,Ga Sc.Y.TR.Ge.Sn. Zr.Th,Cr.P.A> Li. F, T|, Mg.Ca.Sr, Ba S. Se Li,F,Be,B, A|,Se,Y,TM, Zr
A6 Ге,Мп,со A7 (Fe), Mn.Co A8 'М») A9 S.Se.(Fe) A10 S.Se All S.Se A12 S,Se
B6 TI.Fe.Co.N*. Pb.l'u./n.Cd. Hg.U B7 Tl.Fe.Co.Ni, Cu,7n,Cd.Hg, IMO).(U) B8 TI, Cu.Zn, Cd, Hg,Mn,{Fe,Co, NI.U) — — —
C6 ( u V.M« C7 Mo.U C8 Mo.U C9 CIO СП C12
D6 Mg(j.Sr. Ba Ra.Mn.H-.Co N >.Cu.Zn. Pb.Cd. Hg.Bt-.AJ.Ga У. iR.Cr.P.A* V' D7 M g Ca.Sr.Ba. Zn.Cd.Mn( o. Si — D9 Mg.Ca.Sr. Ba,Ra,Mn.Fc,Co N i.Zn.pb.Cd, Be. AI,Ga,Y,TR,Cr, P, А» DIO M g.Ca,Sr, Ba, Dll —
E6 E7 Si.Mo E8 C u).(Zn 1. Be .A I, Ga.Sc. У. ГЯ .S>. Zr. Til.Mo — E10 Ell S-.Ge E12 Be,A|,Ga,Sc, Y.TR.Si.Ge, Zr, (Ti)
F6 F7 J i.Na.K.Rb.n. N.B.Cl.Br.l. Mg.C'a.Sr.S./n F8 1 >.Na,K,Rb. 1 I.N.B.F.CI, Hr.l.Zn F9 I i.Na.K.Rb. F.Cl.Br.J.Mg, Ca, Sr.S F10 Fll 1 «.Na.K.Rb. F .Cl,В г.1,Mg, Ca.Sr.S F12 Li,N*,K.Rb, N.B.F.a.Br.f
G6 S, Ka./n.l d Ni. Cn.Pb.t u.U ( t Br l.l .S.P H-. Мл G7 I i.N* K.Rb. ( s.ll./n. Cl. Br.I.I.B.S.P) G8 t i Na.K.Rb. Cs.ll.\Cl.Br.(. B.F.S.P) G9 A l.Sc.Ga.Si. Ge,p,V,A« GIO Sr. Ba. C I, Br. 1. F.B.S.P] Gil I i.Na.K.Rb. C s. 'Cf.ftr.t. F.B.S.P) G12 U.Nt.K.Rb, Ca.(Cl.Br,(, F.B,P|
H6 Mg.( a Sr Ba M n./n I’b < о, Ni.Ft H7 l > Mg < a.Sr. Ha./n.Fb.Mn H8 ! n. ( u . 1 H9 H10 Mg.Ca.Sr.Ba Hll Mg.Ca.Sr. B* H12
259
Разработка основных положений данного закона связана с имена-
ми В. И. Вернадского, Б. Б. Полынова и В. Р. Вильямса. Однако сам
термин «круговорот» нельзя признать удачным — он создает впечат-
ление о развитии по кругу, о возвращении системы в прежнее состоя-
ние. В действительности биологический круговорот обратим не пол-
ностью: часть веществ постоянно из него изымается и захороняется
в толще осадочных пород в виде известняков, гумуса, торфа и других
геохимические аккумуляторы энергии
Рис. 63. Биологический круговорот атомов
пород и минералов. В результате биокосные системы не возвращаются
в прежнее состояние, для них характерно поступательное развитие.
Поэтому символом биологического круговорота служит не круг, а
циклоида — линия, описываемая точкой, находящейся на ободе движу-
щегося колеса (Б.Б. Полынов).
В результате биологического круговорота формируется окисли-
тельно-восстановительная зональность биокосных систем. Так, в верх-
ней зоне озер, где развит фотосинтез, водные растения выделяют в во-
ду О2, который насыщает ее полностью, а местами и пересыщает. В
глубоких частях озер фотосинтеза нет и там происходит только разло-
жение органического вещества, потребляющее О2. В результате его
количество уменьшается и одновременно в воде растет содержание СО2.
В илах местами О2 исчезает полностью и развивается восстановитель-
ная среда (глеевая или сероводородная). Так формируется в озерах
260
окислительно-восстановительная зональность: окислительная зона
вверху, восстановительная внизу. Озеро — наглядная модель зональ-
ности, развитой почти повсеместно в биосфере. Например, в ландшаф-
те окислительная среда почв склонов сменяется восстановительной в
болотах. И для биосферы в целом принципиально характерна та же
зональность: там, где развивается фотосинтез и где накопился О2 за
счет фотосинтеза, протекавшего в течение геологической истории, пре-
обладает окислительная среда, хотя и здесь имеются очаги восстанов-
Макрозональность М езоз опальное! ь
(вся биосфера) (ландшафт)
Рис 64. Окислительно-восстановительная зональность в
ландшафте и биосфере в целом:
/ — водоносные горизонты, 2 — окислительная среда, 3 — восстано*
внтельная среда
ления в илах и болотах. В глубоких горизонтах биосферы, где захоро-
нено органическое вещество, уже нет О2 или его не хватает для окис-
ления органического вещества, поэтому там развиваются анаэробные
процессы, создается резко восстановительная среда с H2S, сульфидами,
метаном и другими восстановленными соединениями.
Следовательно, работа живого вещества создала резко окислитель-
ные условия на земной поверхности и резко восстановительные в боло-
тах, илах и особенно в подземных водах (рис. 64).
Закон Вернадского
Суммарный эффект деятельности живого вещества за всю геологи
ческую историю огромен, так как живые организмы определили гео-
химические особенности верхней части земной коры (формирование
261
ВОЗДУШНЫ Е
Активные
МИГРАНТЫ
Пассивные
(не образуют химических соединений'
Аг Не Ne Кг Хе Rn
В о Д Н Ы Е
МИГ
н
ы
КатИОНО1 ениые <
Очень подвижные
(КхЧ0п~100п)
Подвижные с постоянной валентностью (K%~n"10nj
В ]
Слабоподвнжные (Ц* = fft fl-fjj
с нерешенной вален г ное 11. ю
с переменной валентностью
Ge | Sn Sb А»
Подвижные н слабоподвнжные в окислительной н глеевой обстаиовках(/0(£^, П~Г1) н ннертныс в
восстановительной сероводородной обстановке, <л \ осаждаются на сероводородном барьере.
Хорошо мигрируют в кислых водах окислите и.ной и
глеевой обстановок н осаждаются па щелочном барьере
ZnlCuINi Pb Cd
Мигрируют и в кислых и щелочим
окислительной обстановки
Hg Ag Bi
Подвижные и слабоподвижные в окислительной обстановке (K/-ZZ н инертные в восстановительных
(глеевой и сероводородной) обстановках, осаждаются на сероводородных н глеевых барьерах.
Re
Подвижные н слабоподвнжные в восстановительной глеевой средс^л/^Т?) н инертные в окислительной н
восстановительной сероводородных средах, осаждаются на кислородных н сероводородных барьерах.
He образуют или почти не образуют химических соединений, характерно самородное состояние
Oi Pd Ra Pt Rh Ir
О Биогенное накопление играет
существеннуюроль в истории влемента
Биогенное накопление oTcyiciBytri нлн
не существенно
Рис. 65. Геохимическая классификация элементов по особенностям гипергенной
миграции (по А. И. Перельману)
кислородной атмосферы и др.). Миграция химических элементов в био-
сфере осуществляется или при непосредственном участии живого ве-
щества (биогенная миграция), или же она протекает в среде, геохими-
ческие особенности которой (О2, СО2, H2S и т.д.) обусловлены живым
веществом как тем, которое в настоящее время населяет данную систе-
му, так и тем, которое действовало в биосфере в течение геологиче-
ской истории. Это положение автор предложил именовать законом
Вернадского.
Геохимическая классификация элементов
по условиям миграции в биосфере
В основу геохимической классификации элементов по условиям
миграции в биосфере, разработанной автором, положены формы, ин-
тенсивность и контрастность миграции химических элементов, их спо-
собность концентрироваться на геохимических барьерах, мигриро-
вать в природных водах в катионной или анионной форме (рис. 65).
В классификации отражены лишь наиболее характерные черты мигра-
ции элементов, часть элементов имеет «двойственную природу». Так,
Со вместе с Fe и Мп отнесен к одной группе, но некоторые особенности
поведения в биосфере позволяют объединить его с Ni, Си и Zn. Сг по-
мещен в группу малоподвижных элементов, но в пустынях он местами
приобретает значительную подвижность и аналогичен V, U, Мо и Se
Предлагаемая классификация учитывает наиболее распространен-
ную миграцию элементов в биосфере. В особых, сравнительно редких
условиях (сильнокислая, сильнощелочная среды и т.д.) может наблю-
даться более энергичная миграция элементов. Каждая выделенная
группа представляет собой парагенную ассоциацию элементов, осаж-
дающихся на геохимических барьерах. В пределах групп элементы
расположены по убыванию кларка, так как при сходных химических
свойствах чем выше кларк, тем больше геохимическая роль элемента.
Основным в классификации является разделение на воздушные и вод-
ные мигранты. Первые мигрируют как в газообразном состоянии в
виде летучих соединений, так и с водными растворами (О и Н в воде и
солях, С в виде Са (НСО3)2, N в виде различных нитратов и аммоний-
ных солей). Вторые, как правило, не мигрируют или слабо мигрируют
в газообразном состоянии. К ним относятся элементы, мигрирую-
щие в растворах преимущественно в виде ионов, не диссоциирован-
ных молекул и коллоидных частиц.
Контрольные вопросы
1. Чем отличается концепция Вернадского о геологической роли организ-
мов от ранее имевшихся представлений?
2. Дайте определение понятию «живое вещество», чем оно отличается от
«живого существа»?
3. Охарактеризуйте фотосинтез с геохимических позиций.
4. Каковы закономерности кларков живого вещества? Что такое биофиль-
ность?
264
5. Геохимическая роль хемосинтеза.
6. Каково значение процессов разложения органических веществ для фор-
мирования химического состава поверхностных и подземных вод на материках?
7. В чем состоит сероводородная функция бактерий?
8. Обоснуйте, почему разложение органических веществ — процесс энтро-
пийный.
9. Что является предметом органической геохимии, каково практическое
значение геохимии нефти, угля?
10. Расскажите об идеях Б. Б. Полынова о биогенном происхождении гли-
нистых минералов.
11. Охарактеризуйте биологический круговорот элементов.
12. В чем заключается окислительно-восстановительная зональность био-
косных систем?
13. Дайте определение «закону Вернадского».
14. Как построены геохимическая классификация элементов по особенно-
стям их миграции в биосфере?
15. БИОЛОГИЧЕСКИЕ СИСТЕМЫ
При изучении биологических систем геохимия в соответствии со
своей методологией главное внимание уделяет элементарному составу
организмов — задаче, которая в общем была чужда биологии. Можно
говорить о геохимии растений (фитогеохимии), животных (зоогеохи-
мии), микроорганизмов и, наконец, человека (антропогеохимии).
Элементарный состав каждого конкретного организма зависит от
его возраста, места обитания, индивидуальных особенностей жизни и
многих других причин, но в первую очередь — от систематической
принадлежности, так как в процессе эволюции миллионов поколений
состав организмов закрепился наследственностью и приобрел черты
относительных биогеохимических констант. Это позволяет ввести по-
нятие «геохимические особенности организмов» — содержание элемен-
тов в систематических единицах разного таксономического ранга.
Можно говорить о геохимических особенностях видов, родов, семейств
флоры, фауны, микроорганизмов. Можно говорить и о геохимической
классификации организмов, зачатки которой наметились еще в прош-
лом столетии.
Способность вида накапливать определенные химические элемен-
ты, выраженную в суммарных кларках концентрации, А. Д. Айва-
зян предложила именовать биогеохимической активностью вида, вы-
числяя ее отдельно для катионогенных (БХК) и анионогенных (ДХА)
элементов. А. А. Кист, С. М. Ткалич, У. Шоу и другие установили
связь биогеохимической роли элементов с их положением в периоди-
ческой системе. Возможен и надорганизменный уровень исследования
— геохимическое изучение сообществ растений и животных, биоцено-
зов в целом. Это направление тесно связано с геохимией ландшафта.
Согласно А. П. Виноградову, элементарный химический состав ор-
ганизма хранит признаки своего происхождения. Ученый предполо-
жил, что виды наземных животных и растений, обогащенные Na и
С1, сформировались на засоленных территориях прошлого, что грубые
265
почвы гор, пески, вулканические почвы — области первичного рас-
пространения злаков, богатых Si, что роды субтропической флоры,
богатой А1, возникли на латеритах. По А. Д. Айвазян, виды расте-
ний, сформировавшиеся в гумидных ландшафтах, где преобладают
кислые почвы, энергично накапливают катионогенные микроэлементы
(Pb, Zn, Cu, Ni, Со и др.) и слабее — анионогенные (Mo, V, Cr, As и
др.). Такие растения она предложила именовать гумидокатными.
В аридных ландшафтах почвы нейтральные и щелочные, в них легче
мигрируют анионогенные микроэлементы и слабее — катионогенные.
Поэтому виды, возникшие в аридных ландшафтах, энергичнее накап-
ливают анионогенные микроэлементы. Это аридонитные растения.
Закрепляясь наследственностью, гумидокатность может проявиться
и в аридных ландшафтах (при миграции гумидокатных видов), а ари-
донитность — в гумидных. Вероятно, рационально выделять также гу-
мидокатные и аридонитные виды животных.
Современная среда обитания также оказывает влияние на элемен-
тарный химический состав организмов. Зависит он от возраста, состоя-
ния организма и других внутренних причин.
Химические элементы, добавление подвижных форм которых в
среду увеличивает продукцию живого вещества, называются дефицит-
ными. К ним в разных условиях относятся О, N, Р, К, F, В, I, Си и
другие элементы. В большинстве случаев недостает именно подвижных
форм, в то время как общее (валовое) содержание элемента может быть
достаточно велико. Элементы, удаление которых из среды увеличивает
продукцию живого вещества, называются избыточными. К ним места-
ми относятся Cl, S, Na, Cu, Ni, Fe, F и др. Один и тот же элемент мо-
жет быть дефицитным в одной системе и избыточным в другой.
Резкий дефицит или избыток элементов в среде приводит к заболе-
ваниям животных, растений, а иногда и человека. Такие болезни
А. П. Виноградов назвал биогеохимическим эндемиями, а районы их
распространения — биогеохимическими провинциями. На территории
СССР изучены биогеохимические провинции с дефицитом I в почвах и
кормах, дефицитом и избытком F в питьевой воде, избытком В в кор-
мах, избытком и дефицитом Си, дефицитом Со в почвах и т. д. Учение
о биогеохимических провинциях нашло практическое применение в ме-
дицине и сельском хозяйстве. Развивая это учение, В. В. Ковальский
сформулировал понятие о геохимической экологии — разделе биогео-
химии и экологии. Ее задача состоит в изучении взаимодействия орга-
низмов и их сообществ с геохимической средой, а также организмов
между собой.
Биогеохимия растений (фитогеохимия). Информация в этой обла-
сти очень велика. Так, установлено, что сухое вещество морских водо-
рослей обогащено по сравнению с сухим веществом наземных растений
Mg, Na, К, S, Cl, Si, Fe, Sr, F, Ba, Br, I, Se, B, Li, Ti, As, Ag, W, Pb
и обедненоСа, Mn, Al, Rb, Cs. Многие из этих закономерностей легко
объясняются особенностями состава морской воды. Но и при более дро-
бной систематике четко вырисовывается своеобразие отдельных се-
266
мейств, родов и видов. Так, еще в прошлом столетии агрохимики разде-
лили культурные растения на накапливающие К (подсолнечник, кар-
тофель), Са (бобовые), Si (злаки). Позднее установили «алюминиевые
растения» (плауны, чай), «железные» (мхи), «иодные» (водоросли), со-
лянки (Na, Cl и др.), гипсофиты, селитрянки (NO3) и т. д. Установлены
отдельные виды, способные к гипераккумуляции Ni и других металлов.
Особенно большой способностью к поглощению редких элементов об-
ладают мхи и лишайники.
Отдельные органы растений также различаются по способности
концентрировать элементы. Например, у деревьев Забайкалья зола
листьев и хвои богаче Mg, К, Р, и S и беднее Са, Sr, Ва и Ra по срав-
нению с золой ветвей. Биогеохимия растений зависит и от фазы веге-
тации: от весны к осени в листьях многих деревьев увеличивается со-
держание Со, Ni, Cu, Ra, Si, Fe, Са, а в золе трав содержание К и Р
уменьшается.
Биогеохимия животных (зоогеохимия). Огромное видовое разнооб-
разие животных определяет еще большее разнообразие их биогеохи-
мии по сравнению с растениями. По Г. Боуэну, сухое вещество мор-
ских животных по сравнению с сухим веществом наземных животных
обогащено (как и в случае растений) Mg, Na, К, S, Cl, Fe, Sr, Br, I,
B, Si, Ti, Ag, но в отличие от растений также Мп, Со, Ni, Cu, Mo, Sb
и другими элементами. По сравнению с растениями животные в целом
обеднены большинством элементов и только Р содержат больше (при
расчете на сухое вещество). Но это средние величины, у конкретных
видов содержание элементов может значительно превышать средние
значения для растений. У животных также обнаружены концентраторы
и деконцентраторы элементов. Так, многочисленные группы сухопут-
ных и морских животных с известковым скелетом концентрируют Са
(моллюски, кораллы, форминиферы и др.). После их смерти скелеты
образуют известковые осадки — толщи озерных и морских известня-
ков. Губки, радиолярии, диатомовые водоросли и другие концентра-
торы SiO2 образуют огромные скопления кремнезема в озерах и морях
(трепел, датомиты). Известны животные, резко обогащенные Sr (радио-
лярии акантарии), V (асцидии), Си (моллюски, раки, пауки) и т. д.
Хорошо изучены явления дефицита химических элементов у жи-
вотных, соответствующие биогеохимические провинции. Дикие жи-
вотные частично уменьшают дефицит, поедая грунт или используя
воду минеральных источников. Такие места именуются «зверовыми
солонцами». В Приморье они приурочены к зонам разломов, рудным
месторождениям, гидротермалитам (А. М. Паничев).
Геохимия микроорганизмов. Бактерии наиболее разнообразны в
геохимическом отношении. Многие элементы накапливаются в их клет-
ках в огромных количествах (S в клетках серобактерий, Fe — в желе-
зобактериях и т. д.). Среди бактерий известны виды, накапливающие
также Си, Мп, Mo, Ва, Li, Ag, Pb U в значительно больших количест-
вах, чем растения и животные. Некоторые микроорганизмы концентри-
руют элементы в количестве, в сотни раз превышающем их содержание
267
в окружающей среде. Детально изучена роль микроорганизмов не
только в почвах, илах, поверхностных и подземных водах, но и в бо-
лее частных системах биосферы, например в зоне гипергенеза сульфид-
ных руд (Н. Н. Медведева).
Разделение изотопов организмами. Многие организмы разделяют
изотопы легких элементов. Возможно, что эта способность присуща
всем или почти всем организмам. При фотосинтезе растения отдают
предпочтения легкому изотопу 12 С, поэтому в организмах и их произ-
водных (углях, нефти) содержание тяжелого изотопа 13С понижено, а в
+10
—1_
-40 -50 -60 -70
__I_____I____।-----1----
Морские карбонаты
Углистые хондриты, алмазы,
карбонатиты
Растения морские, пустынь
и тропиков
Железные метеориты
Изверженные породы
У тли и сланцы
Живое вещество
{ Нефти
Битумы изверженных
пород
Природный газ (меган)
Рис. 66. Распределение изотопов углерода между зем-
ными объектами и метеоритами (по А. И. Тугари-
нову)
СО2 и морских карбонатах — повышено. Соотношение изотопов выра-
жают в виде показателя а13С:
а13С =
(13С: 12С) образец
(13С: 1«С) стандарт
-1-100%.
За стандарт принято отношение 13С : 12С в карбонате кальция ра-
ковины моллюска из меловых отложений США. При повышенном со-
держании тяжелого изотопа ст13С положительные, при пониженном —
отрицательные. Различные углеродистые вещества по величине ст13С
образуют закономерный ряд (рис. 66). Определение о13С позволяет де-
лать выводы о генезисе соединений углерода в земной коре. Напри-
мер, высокое отрицательное значение а13С для метана объясняют его
бактериальным происхождением.
Отношение 34S : 32S также колеблется довольно сильно. За стан-
дарт принято отношение в сульфиде железа из метеорита «Каньон
Диаболо» (США). Это отношение постоянно для всех метеоритов.
Установлено, что микроорганизмы, восстанавливающие сульфаты,
накапливают легкий изотоп 32 S, поэтому в осадочных сульфидах его
больше. Сера морской воды, эвапоритов, напротив, тяжелая (рис. 67).
268
Изучение отношений 34 S : 32 S в сульфидах позволяет установить ге-
незис S гидротермальных и других сульфидных месторождений. Для
многих из них доказан осадочный, а не магматический источник S
(В. И. Виноградов, В. А. Гриненко, Д. Калп, Ф. В. Чухров и др.).
Палеобиогеохимия. Использование геохимических идей и методов
в палеонтологии привело к обособлению палеобиогеохимии (Я- В. Са-
мойлов). Она изучает геохимические особенности организмов прош-
лых геологических эпох на основе химического анализа ископаемых
растительных и животных остатков (углефицированной древесины, ра-
ковин и т. д.). Хотя во многих случаях концентрация элементов про-
Осадки: песчаники,сланцы,
известняки
Колчеданные месторождения’*
(Урал)
Осадочные месторождения *
А гмосфера
Метеориты (троили г)
Основные породы
Г раннты
Рис. 67. Распределение изотопов серы между зем-
ными объектами и метеоритами (по А. И. Туга-
ринову)
изошла уже после захоронения в результате диагенеза и эпиге-
неза, все же удается установить и чисто биогенную составляющую
элементарного состава ископаемых организмов (Е. А. Бойченко,
Т. В. Дроздова, С. М. Манская, К- М. Султанов и др.). Так, доказано,
что в раковинах и других скелетных остатках организмов сохраняются
углеводы, жирные кислоты, даже белки. Для организмов прошлых ге-
ологических эпох была характерна концентрация определенных ме-
таллов: для синезеленых водорослей, господствовавших в архее и про-
терозое, — Fe, Со, Ni, для зеленых и бурых водорослей (начало палео-
зоя) — V и т. д. По А. П. Виноградову, способность к концентрации эле-
ментов уменьшалась от низших форм организмов к высшим. Так, сре-
ди беспозвоночных животных и низших растений известны концентра-
торы Si, Fe, Sr, I, V, Си, а среди позвоночных — неизвестны. Следова-
тельно, в ходе эволюции организмы освободились от многих свойствен-
ных им ранее геохимических функций, хотя соответствующие элемен-
ты продолжают выполнять в их телах физиологические функции (Fe
в гемоглобине, I в щитовидной железе и т. д.).
Таким образом, жизнь «пробовала» различные варианты, вовлекала в
миграцию многие элементы, пока в ходе эволюции не возникли опти-
269
мальные соотношения, свойственные наиболее высокоорганизованным
существам (рис. 68).
Биогеохимические методы поисков рудных месторождений. Эти
методы стали разрабатываться в конце 30-х годов в СССР (А. П. Ви-
ноградов, Д. П. Малюга, С. М. Ткалич) и Швеции (Н. Брундин). На
рудных полях установлены повышенные содержания в растениях Мо,
Cu, Pb, Be, Ni, Со, Zn, Cd, Ag, Au и других элементов. Опробование
^астения Животные
Mammalia
Anglosperm.d
Angiosperm, т
Ggmnospermae
Filicales
Eipjicetales
Luccpodiales
Bryophgta
Lichenes
Fungi
Rhodophyceae
Rhaeophyceae
Chlorophyceae
Charophyta
Conjugate
Biatomeae
Flagetlata
Cyanophyceae
Bacteriae
Aves
ReptlUa
Amphibia
Pisces
Crustaceae
Mollusc a
Vermes
Bryozoae
Brachcopoda
Tunicate
Echinodermata
Hexacorallla
Octocorallia
Catcareae
Sil leaspongia
Heli azo a
Radlolaria I
Foramlnifera
Элементы ^уровня SrEe Si N OHCa At ЙпВа
Элементы №уровня BrV P C Zn Mg Na
Рис. 68. Концентрация элементов организмами (по
А. П. Виноградову)
растений — «биогеохимическая съемка» позволяет обнаружить эти
ореолы, а по ним и сами месторождения. Биогеохимические методы осо-
бенно важны при поисках рудных тел, перекрытых моренами, эоловы-
ми песками и другими аллохтонными отложениями. Теория методов
разработана детально (Р. Брукс, А. Л. Ковалевский, Г. Уоррен и др.).
Так, хорошо изучены закономерности накопления растениями эле-
ментов-индикаторов рудных месторождений, особенности рудных био-
геохимических ореолов, способы интерпретации биогеохимических
аномалий, приемы составления биогеохимических карт. Доказана
важность выбора объекта опробования. Например, в степях Казахста-
на наиболее пригодны для опробования полыни и менее пригодны
270
злаки. Необходимо учитывать геохимические особенности ландшаф-
тов. Практическое значение данных методов пока невелико, хотя в
СССР накоплен значительный положительный опыт их применения
(А. Л. Ковалевский, В. П. Иванчиков, П. В. Ивашов, Р. М. Талипов и
др.). Анализ коры сосны, например, привел к открытию месторожде-
ний Мо и Sr. На основе анализа хвои и ветвей молибденовые месторож-
дения были открыты также в Канаде.
Контрольные вопросы
1. Дайте определения понятиям «гумидокатность», «аридонитноетьг де-
фицитные» и «избыточные» элементы.
2. Приведите пример разделения изотопов организмами.
3. Что является предметом палеобиогеохимии?
4. На чем основаны биогеохимические методы поисков руд?
16. БИОКОСНЫЕ СИСТЕМЫ
Во второй половине XIX столетия В. В. Докучаев (1846—1903)
открыл новый класс природных систем, в которых живые организмы и
неорганическая материя тесно между собой связаны, взаимообуслов-
лены и образуют единое целое. Первой такой системе ученый присвоил
наименование почвы, использовав термин, который существовал давно,
но применялся в разных смыслах (агрономы понимали под почвой
пахотный слой, геологи — кору выветривания, а врачи-гигиенисты
даже любую поверхность, вплоть до городской мостовой). Открытие
Докучаева привело к развитию новой естественноисторической науки
о Земле — почвоведения. В дальнейшем Докучаев открыл еще один
класс подобных систем — ландшафт. И опять термин «ландшафт»
существовал и ранее, но пониманию его как особой системы наука
обязана именно Докучаеву. Развивая идеи своего учителя, В. И. Вер-
надский сформулировал понятие о биокосных системах («телах» по
Вернадскому). Биокосные естественные тела характерны для биосфе-
ры, они состоят из косных и живых тел (например, почвы), их физико-
химические свойства иногда требуют чрезвычайно больших поправок,
если при исследовании не учтено проявление живого вещества, писал
ученый.
Геохимическое своеобразие биокосных систем определяется сочета-
нием биогенной, физико-химической и механической миграций. Сис-
темы различаются по уровням организации: к более низкому относят-
ся почвы, илы, коры выветривания, водоносные горизонты, к более
высокому — ландшафты, к еще более высокому — артезианские бассей-
ны, моря и океаны и к самому высокому — биосфера в целом.
Биокосные системы имеют много общих черт. Так, десульфуриза-
ция протекает и в почвах, и в водоносных горизонтах, и в морской воде
271
<в Черном море, фиордах Норвегии). То же можно сказать об оглеении,
окислении сульфидов, засолении, огипсовании, карбонатизации и
многих других процессах.
Во всех биокосных системах литосферы происходит взаимодействие
горных пород с природными водами в близких термодинамических усло-
виях. Это определяет некоторые общие особенности физико-химической
миграции, которая складывается из двух противоположных процессов
— выветривания и цементации. Миграция элементов при выветрива-
нии в свою очередь складывается из противоположных процессов:
выщелачивания из пород и минералов водных (Са, Mg, К, Na и др.)
и присоединения воздушных (в первую очередь О2, Н2О, СО2) мигран-
тов. Выветривание протекает в почвах, илах, корах выветривания, во-
доносных горизонтах. Даже в слаботрещиноватых изверженных поро-
дах, которые производят впечатление невыветрелых, О. П. Елисеева
и Б. И. Омельяненко установили тонкие пленки гидроксидов железа
и других вторичных минералов, образовавшихся за счет диффузии в
поровых растворах. Поэтому следует отличать продукты выветрива-
ния, которые образуются в разных геологических условиях, от коры
выветривания — определенной биокосной системы. Многие «древние
коры выветривания», фиксируемые в зонах разломов, водоносных го-
ризонтах и т. д., несомненно, представляют собой продукты выветри-
вания, но они далеко не всегда формировались в коре выветривания и
очень часто представляют собой результат геохимической деятельно-
сти подземных вод (т. е. эти «коры выветривания» никогда не были на
земной поверхности, не зависят от климата).
Для другой группы процессов — цементации, наиболее характер-
ны аккумуляция водных мигрантов на геохимических барьерах, умень-
шение пористости и увеличение объемной массы пород. В результате
образуются конкреции, плотные горизонты ожелезненных, карбона-
тизированных, огипсованных песчаников и т. д.
Выветривание и цементация — разные стороны единого процесса
миграции-, первый порождает второй. В каждой биокосной системе
литосферы развиваются оба процесса, однако соотношение между ни-
ми неодинаково. Выветривание особенно широко развито в почвах,
где почти все первичные минералы неустойчивы. В почвах возникают и
геохимические барьеры, приводящие к цементации и образованию кар-
бонатных, глинистых, гипсовых и других иллювиальных горизонтов.
В коре выветривания также преобладает выветривание, хотя наблюда-
ется и цементация в результате образования щелочных и других
барьеров с накоплением SiO2, СаСО3 и других соединений. В водонос-
ных горизонтах, особенно глубоких, выветривание выражено слабее,
иногда его именуют глубинным выветриванием. Весьма характерны для
водоносных горизонтов геохимические барьеры.
Все биокосные системы литосферы богаты свободной энергией и не-
равновесны, дифференцированы в пространстве (разделяются на гори-
зонты), в них формируется окислительно-восстановительная и щелоч-
но-кислотная зональность. Геохимическая систематика этих си-
272
стем имеет много общего. Изучение геохимии биокосных систем
привело к становлению геохимии почв, коры выветривания, осадоч-
ных пород, подземных вод (гидрогеохимии), ландшафта, поверхност-
ных вод (гидрохимии).
Почвы
Геохимические идеи проникли в почвоведение в начале XX сто-
летия (П. С. Коссович н др.). Основоположниками геохимии почв бы-
ли В. И. Вернадский и К- К- Гедройц. В дальнейшем значительный
вклад внесли труды Б.Б. Полынова, А. П. Виноградова, М. А. Глазов-
ской, В. А. Ковды, К- И. Лукашева, Г. В. и В. В. Добровольских,
А. Н. и Э. Б. Тюрюкановых и других советских ученых.
Почва — верхний горизонт литосферы, вовлеченный в биологиче-
ский круговорот при участии растений, животных и микроорганиз-
мов, область наивысшей геохимической энергии живого вещества. «Имен-
но здесь, в почвах, — писал Б. Б. Полынов, — наиболее сосредоточе-
на геологическая работа живого вещества; именно в почвах готовится
тот материал континентальных и морских отложений, из которого в
дальнейшем образуются новые породы. Но в то же время в почвах в
наибольшей степени сосредоточены и те процессы, совокупность кото-
рых обусловливает эволюцию органического мира. Здесь разыгры-
ваются многообразные формы борьбы за существование и приспособ-
ления организмов к изменяющимся условиям их жизни, создаются мно-
гообразные сообщества (биоценозы) и формируются новые виды много-
численных низших организмов и высших растений. Этим определяется
значение в естествознании и новой области явлений — почвенной плен-
ки и новой, посвященной ей науки — почвоведения» Г
Геохимическая сущность почвообразования заключается в разло-
жении органических веществ микроорганизмами. Эти процессы ин-
тенсивны во влажных тропиках, слабы в тундре.
Разлагая остатки растений и животных, микроорганизмы постав-
ляют в почвенные растворы СО2, органические кислоты и другие хими-
чески высокоактивные соединения. Чем больше разлагается органиче-
ского вещества, тем богаче почва химически работоспособной энер-
гией, тем дальше она от равновесия. Почвы — это особо неравновес-
ные, чрезвычайно динамичные биокосные системы.
Корни растений, как насос, «перекачивают» элементы из нижних
горизонтов почвы в верхние. Это относится к Р, S, Са, К, многим мик-
роэлементам, Ах которых больше 1. В результате такой биогенной ак-
кумуляции создается возможность обогащения этими элементами верх-
них горизонтов почв, улучшения среды существования растений. Био-
генное накопление Be, Со, Ni, Zn, Ge, As, Cd, Sn и других редких эле-
1 Полынов Б. Б. Основные идеи учеиия о генезисе элювиальных почв
в современном освещении /В кн.: Юбилейный сборник, посвященный 30-летию
Великой Октябрьской социалистической революции. М., 1947.
273
ментов в гумусовом горизонте лесной почвы впервые обнаружил в
30-х годах В. М. Гольдшмидт. Позднее эти явления были установлены
и в других почвах. Поглощая катионы, корни выделяют Н+, а погло-
щая анионы — ОН". Возможно, что в результате минерального пита-
ния растений в почву непрерывно поступает Н+ — важный фактор
ЛЕСНЫЕ ЛАНДШАФТЫ
ВЛАЖНОГО КЛИМАТА
ЧЕРНОЗЕМНЫЕ СТЕПНЫЕ
ЛАНДШАФТЫ
ПОЛЫННЫЕ ПУСТЫНИ
Рис. 69. Схема взаимопротивоположных
процессов — биогенной аккумуляции 1 и
выщелачивания 2, которые определяют
строение профиля элювиальных почв. Ши-
рина стрелок характеризует относительную
интенсивность процессов, длина — сравни-
тельную глубину проникновения процессов
выветривания (И. Н. Го-
голев).
Наряду с биогенной
аккумуляцией, направлен-
ной снизу вверх,в почвах
наблюдается и нисходя-
щая миграция водных рас-
творов? Поэтому реальное
распределение элементов
в почвах водоразделов и
склонов (элювиальных) оп-
ределяется не только био-
генной аккумуляцией, но и
выщелачиванием (рис. 69).
В черноземных, подзо-
листых, каштановых и
других типах почв биоген-
ная аккумуляция и выще-
лачивание протекают с раз-
личной интенсивностью, и
суммарный эффект расп-
ределения элементов раз-
личен. В верхней части
почвы может преобладать
или концентрация элемен-
тов, или вынос. В резуль-
тате почва расчленяется на
горизонты с особыми физи-
ко-химическими условия-
ми. Имеются почвы, в ко-
торых верхний горизонт
кислый, нижний — щелоч-
ной, в верхнем горизонте
господствует окислитель-
ная среда, в иижнем —
восстановительная и т. д.
Совокупность горизонтов
образует почвенный про-
филь, для которого харак-
терны зоны выщелачива-
ния и геохимические барь-
еры (рис. 70).
274
Иное распределение элементов в солончаках, болотных, луговых и
других супераквальных (надводных) почвах низин. В них наряду с
биогенной аккумуляцией и выщелачиванием происходит накопление
химических элементов из грунтовых вод. Эти почвы также расчленя-
ются на горизонты. В болотных почвах это торфяные и глеевые гори-
зонты, в солончаках — солевые.
Таким образом, почвообразование приводит к дифференциации эле-
ментов — однородная горная порода превращается в неоднородный поч-
Рис. 70. Строен и" профиля кислых дерново-подзолистых и кальциевых дериово-
карбонатных почв в таежной зоне:
/ — кислое выщелачивание (Fe. А! <-а. Mg, Mn. Na. Cu. Zn. Cl. S и т. д.). 2 — нейтраль-
ное и слабокислое выщелачивание (Са. Mg, Na. Мо, Мп. CI.S и т. д.), 3 — биогенная ак-
кумуляция. 4 — гумусовый горизонт — биогеохимический барьер (а — слабый, б — сильный),
5 — элювиальные горизонты (Л“Ая. б —А2/В1). б — иллювиальный горизонт, 7 —карбонат-
ная кора выветривания известняков. 8 - почвообразующие породы
венный профиль со многими горизонтами. Поэтому в почве накапли-
вается не только энергия, но и информация (рис. 71, 72).
Разложение органических веществ — это окислительно-восстано-
вительный процесс, так как С, Н и другие элементы, входящие в со-
став органических соединений, при их разложении окисляются до
простых минеральных соединений, а главный окислитель О2 восста-
навливается. Окислителями и восстановителями могут быть и Fe, Мп
и другие элементы, но суть процесса от этого не меняется. С геохими-
ческих позиций сущность почвообразования состоит в окислительно-
восстановительных реакциях. Поэтому и главные различия между поч-
вами связаны с этими реакциями.
Для всех почв характерна окислительно-восстановительная зональ-
ность, которая наиболее наглядна, когда в почве окислительная об-
становка сменяется восстановительной, — глеевой пли сероводород-
275
ной. Это характерно для многих болотных, луговых, солончаковых, со-
лонцовых и прочих супераквальных почв. Выражена такая зональ-
ность и в элювиальных почвах, особенно в таежной и тундровой зо-
нах. Главный элемент-индикатор зональности Fe (Fe2+ Fe3+).
Окислительно-восстановительная зональность может проявиться
полностью в восстановительной среде, когда, например, резковосста-
новительная обстановка в верхних горизонтах болотных почв книзу
Рис. 71. Зона содового глеевого выщелачивания в луговых солончаковых осо-
сменяется менее восстановительной. В этом случае по анализу распре-
деления химических элементов, а также замерами Eh нетрудно Дока-
зать, что окислительно-восстановительные условия по профилю меня-
ются и зональность существует. К микроэлементам-индикаторам окис-
лительно-восстановительной зональности на общем восстановитель-
ном фоне относятся Си, Мо, Ag, Sn, Au, Hg, U.
Во многих аридных почвах, особенно в сухих степях и пустынях,
господствует окислительная обстановка, и зональность выражается
в изменении Eh в пределах окислительной среды. В этих почвах окис-
лительно-восстановительная зональность может выражаться в смене
резкоокислительной обстановки на слабоокислительную. Например,
не исключено, что большую часть года в черноземах преобладает оки-
слительная обстановка по всему профилю, но в отдельные периоды
разложение органических веществ протекает в восстановительных ус-
ловиях (или в менее окислительных). В каштановых почвах более
окислительная среда, чем в черноземах, но и в них в отдельные перио-
ды возможно развитие более восстановительных (или менее окисли-
тельных) условий. Для почв пустынь характерна еще более окисли-
276
pH Солевой профиль
г мг-зкв
7 8 9 5 0 5
лоделых почвах (Северный Казахстан, по
Н. С. Касимову)
тельная обстановка. Однако сам факт разложения в них органических
веществ указывает на изменение окислительно-восстановительных ус-
ловий, на существование окислительно-восстановительной зонально-
сти в отдельные (очень кратковременные?) периоды года. Это может
быть и микрозональность, проявляющаяся не во всем почвенном гори-
зонте, а на строго локальном участке, например вокруг гниющего ко-
решка. Однако ее геохимическая сущность от этого не меняется. Инди-
каторами окислительно-вос-
становительной зональности
в пределах окислительной
среды служат многие элемен-
ты. Это в первую очередь
Мп, перераспределение кото-
рого в условиях преоблада-
ния Fe3+ указывает на сла-
боокислительную обстановку.
Другие характерные элемен-
ты — V, Сг, Se, I.
Итак, окислительно-вос-
становительная зональ-
ность-особенность всех почв,
она отражает важнейшие гео-
химические особенности этих
биокосных систем — процес-
сы разложения органических
веществ. Отсюда следует и
методологический вывод о не-
обходимости изучения окис-
лительно-восстановитель ных
процессов и отвечающей им зональности в профиле всех типов
почв.
Окислительно-восстановительная зональность в почвах является
моделью более грандиозных процессов, протекающих в других био-
косных системах, в том числе в биосфере в целом. Поэтому изучение
геохимии почв позволяет анализировать многие процессы, протекаю-
щие в корах выветривания, артезианских бассейнах и других систе-
мах. Преимущество почв как модели состоит в том, что окислительно-
восстановительная зональность в них проявляется в пределах 1—2-
метровой толщи, в то время как в коре выветривания зональность
распространяется на десятки метров, в артезианских бассейнах и био-
сфере в целом — на километры и десятки километров.
Геохимический анализ почвообразования позволяет выделить три
основных ряда почв. Почвы первого ряда — с окислительной обстанов-
кой. Они образуются там, где атмосферный воздух легко проникает в
почву, где глубоко залегают грунтовые воды. Это горные почвы, мно-
гие водораздельные почвы равнин. К ним относятся черноземы, крас-
ноземы, каштановые почвы, буроземы, большинство почв пустынь и
277
и
Z
о
е
х
Он
т. д. Еще В. В. Докучаев объединял их в особый класс «сухопутно-
растительных почв». Позднее были предложены термины «автоморф-
ные», «элювиальные» почвы. В них окислительно-восстановительная
зональность часто располагается в пределах окислительной среды.
Почвы второго ряда — с глеевой обстановкой пользуются огромным
распространением на заболоченных равнинах в районах влажного кли-
мата, как, например, на Западно-Сибирской низменности, в Белорус-
ском Полесье. В глеевых почвах часто содержится растворимое орга-
Рис. 73. Радиальные геохимические барьеры в основных типах почв Западной
Сибири и Казахстана (по А. И. Перельману, И. П. Гавриловой, Н. С. Касимову.
И, А. Павленко и И. Г. Победиицевой):
Ьарьеры- 1 — кислородный. ? —глеевый, 3 — щелочной, 4 — испарительный, 5 —сорбцион^
иый. 6 — направление движения растворов; А<. А? —индексы почвенных горизонтов: А7, G2...
индексы видов барьеров по табл. № 18. типы почв: Г —тундровая, П — подзолистая, Ч —•
черноземная, К — каштановая. Сн — солонец, Ск — солончак
ническое вещество, в том числе различные органические кислоты, ко-
торые образуются при неполном окислении растительных остатков.
Почвы третьего ряда — с восстановительной сероводородной обста-
новкой распространены не столь широко. К ним относятся многие со-
лончаки и некоторые другие почвы.
Может показаться, что различие почв глеевого и сероводородного
рядов не столь велики, так как в обоих случаях преобладает восстано-
вительная среда. Однако по ряду главнейших показателей глеевые и
сероводородные среды резко отличаются друг от друга. В глеевой сре-
де многие металлы подвижны и образуют легкорастворимые соедине-
ния (особенное органическими кислотами), а в сероводородной - они
малоподвижны и образуют нерастворимые сульфиды.
В пределах рядов выделяются черноземные, подзолистые, бурые
лесные, коричневые, сероземные, красноземные и другие типы почв.
Размещение их подчиняется климатической зональности. Типы почв
— это прежде всего типы разложения органических веществ, типы био-
генной аккумуляции химических элементов, типы окислительно-вос-
становительной зональности (рис. 73).
В зависимости от окислительно-восстановительных и щелочно-кис-
лотных условий могут быть выделены и более мелкие таксоны — клас-
сы почв (в соответствии с табл. 11). В тайге, например, преобладают
почвы 2-го кислого класса (подзолистые и дерново-подзолистые), но
есть нейтральные и щелочные (3-й класс) на известняках, кислые гле-
евые (6-й класс), карбонатные глеевые (7-й класс) почвы. Существу-
ют и переходные классы.
В разных горизонтах одной и той же почвы в результате окисли-
тельно-восстановительной и щелочно-кислотной зональности классы
водной миграции часто неодинаковы. В этом случае при определении
ряда и класса почв следует использовать понятие о центре почвы —
главном горизонте, определяющем своеобразие почвы в целом. Как
правило, центром служит верхний горизонт А, где наиболее энергич-
но разлагаются органические вещества, происходят наибольшие преоб-
разования минеральной части. Поэтому при классификации почв за
основу следует брать геохимические особенности ее центра — гори-
зонта А. Этот критерий позволяет в большинстве случаев при наличии
в почве геохимической зональности правильно оценить роль каждого
горизонта и классифицировать почву. В некоторых почвах главным
может быть другой горизонт. Например, в солонцах центром является
солонцовый горизонт В с обменным натрием.
Илы
В. И. Вернадский писал, что ил — это природное тело, аналогич-
ное почве, где гидросфера занимает место атмосферы. Как и почвы.
илы — неравновесные динамические биокосные системы, богатые сво-
бодной энергией. Сущность илообразования заключается в разложе-
нии органических веществ, в окислительно-восстановительных реак-
циях. И для илов характерен профиль, расчленяющийся на горизон-
ты, окислительно-восстановительная зональность, геохимические
барьеры (рис. 74, 75). Однако в отличие от почв илы растут снизу
вверх и, следовательно, не имеют «материнской породы». Для них ха-
рактерно постоянное увлажнение. В образовании илов, как правило,
не принимают участие высшие растения. Все это определяет меньшее
разнообразие илов, их большую однородность в пространстве.
В 1933 г. Л. В. Пустовалов сформулировал понятие о геохимиче-
ских фациях — физико-химических обстановках образования осадков.
Он различал сероводородную, сидеритовую, окислительную, латерит-
ную, пустынную и прочие фации. Нетрудно убедиться, что в основу
систематики здесь положены окислительно-восстановительные и ще-
280
лочно-кислотные условия, хотя этот принцип и не всегда строго выдер-
жан. В дальнейшем эти идеи развил Г. И. Теодорович, выделив боль-
шее число геохимических фаций. В. Крамбейн и Р. Гаррелс в 1952 г.
разработали геохимическую систематику фаций в координатах Eh—
pH на основе равновесной термодинамики. Они рассчитали равно-
весные фазы в илах и установили парагенные ассоциации минералов
для щелочной восстановительной среды (кальцит, органическое веще-
ство, пирит, фосфорит),
нейтральной окислитель-
ной (гематит, лимонит,
оксиды марганца, кремне-
зем, шамозит, кальцит,
фосфорит) и других обста-
новок. Однако неравно-
весность илов заставляет
осторожно относиться к
использованию законов
равновесной термодинами-
ки при их изучении. Соот-
ветствующие выводы часто
создают лишь видимость
объяснения, ошибки кото-
рого особенно трудно пре-
одолеваются в связи с
огромными, конечно, впол-
не заслуженным авторите-
том термодинамики. Глу-
бокий анализ этого вопро-
са содержится в трудах
М. Ф. Стащука.
Изменение минералов
под влиянием морской
воды именуется гальмиро-
лизом или подводным вы-
ветриванием. Для него
характерны обменные реакции, например замена Са2+ и К+ в монт-
мориллоните на Mg2, и Na+ морской воды. С гальмиролизом связы-
вают также гидрослюдизацию каолинита и другие процессы.
При геохимической систематике илов автор главное значение придает
особенностям верхнего горизонта — центра этой биокосной системы
(принцип централизации). Как и для почв, выделяются три ряда илов.
Окислительные илы образуются в океанах, морях, озерах и реках—
всюду, где господствуют кислородные воды, создаются условия для
перемешивания вод. В морях и океанах окислительная среда характер-
на для прибрежных песков, зоны волнений, а также для больших
глубин, где мало органических остатков, а холодная вода богата раст-
воренным О2. Около 50% дна Тихого океана покрыто красной глубо-
п
Формирование
минеральных
новообразований
Перераспределение
вещества в осадках
с образованием
цемента и конкреций
.(И нтенсивность
’ деятельности
бактерий и
их ферментов
IV
Уплотнение осадка
\ (литификация)
(Дегидрау
Гтация \
'.водных \
(минералов
|и пере- \
(кристалли^
(зация \
Рис. 74. Вертикальная дифференциация и
илах: /—IV — горизонты нла (по Н. М. Стра-
хову)
281
ководной глиной, которая осаждается на глубинах более 4500 м с очень
малой скоростью (за 1000 лет образуется лишь несколько миллимет-
ров ила). Окислительные илы имеют преимущественно желтую, бурую,
красную окраску, обусловленную гидроксидами трехвалентного железа.
Глеевые илы особенно характерны для озер районов влажного кли-
мата. Здесь разлагается много органического вещества, сульфатов в
А
Ml
Рис. 75. Окислительно-восстановительная зональность илов. Разрезы через океан
А и озеро Байкал Б (по Н. М. Страхову, упрощено):
О окислительная зона. В — восстановительная зона. 1 — слабо выраженная, 2 — сильно
выраженная, 3 — окислы железа, окрашивающие окислительную зону в бурый цвет, 4—уча-
стки, обогащенные железом и марганцем, 5 — железо*маргаицевые конкреции. 6- равно-
мерно окрашенные слабожелезистые ржавые пятна, 7 — марганцевые (черные) пятна, 8 -
вивианитовые пятна
водах мало. В результате развивается глеевая обстановка, Fe3+, Мп4+
восстанавливаются, илы приобретают сизую, зеленоватую, серую, ох-
ристо-сизую окраску. В глеевых илах не хватает О2 для окисления
органических веществ, их разложение замедляется. В лесной зоне по-
степенно на дне накапливается «гнилой озерный ил» — сапропель.
Он богат органическими соединениями (до 99%), среди которых обна-
ружены витамины и другие биологически активные вещества. Сапро-
пель используется как местное удобрение, подкормка для домашних
животных (белок, витамин В12), как лечебная грязь. Вместе с тем за
счет накопления сапропеля происходит заиливание некоторых озер,
282
их вода становится непригодной для водоснабжения. Добыча сапро-
пеля одновременно способствует очистке озер. Это хороший пример
мобилизации внутренних ресурсов ландшафта для улучшения окру-
жающей среды. Запасы сапропеля очень велики, используются они
пока слабо.
Сероводородные (сульфидные) илы широко распространены в морях и
океанах, озерах степей и пустынь, где преобладают сульфатные воды,
развивается десульфуризация, продуцируется H2S, образуются суль-
фиды Fe. Илы имеют серый, черный и синеватый цвет (за счет сульфи-
дов). Таков, например, синий ил океанов и морей, установленный еще
в XIX в. экспедицией Челленджера. Он распространен на глубинах от
200 до 5000 м, содержит рассеянное органическое вещество, пирит и
гидротроилит.
Присутствие во многих осадочных породах сульфидов Fe (главным
образом пирита), а местами и других металлов позволяет утверждать,
что в илах существовал сероводородный барьер В, на котором из слабо-
щелочной морской или иловой воды осаждались металлы (тип В 3,
отчасти В 7).
Сульфидные илы соленых озер степей и пустынь представляют
большую ценность в бальнеологическом отношении и используются как
лечебные грязи (оз. Саки в Крыму, Одесские лиманы и др.).
Илы, как и почвы, зависят от термической зональности климата.
Например, окислительные илы мелководий полярных бассейнов от-
личаются от окислительных илов мелководий тропиков с их теплыми
водами, глеевые илы тундры отличаются от глеевых илов влажных
тропиков. В них различны и скорость разложения органических остат-
ков, и состав самих остатков (иные флора и фауна). Это позволяет го-
ворить о типах илов холодного, умеренного и жаркого географических
поясов. К холодным илам относятся глубоководные илы морей и океа-
нов, районов многолетней мерзлоты. Поэтому размещение илов на
материках, несомненно, подчиняется зональности, хотя зоны илов
значительно шире почвенно-растительных зон.
Классы илов выделяются по тем же признакам, что и классы почв
(кислые, нейтральные и слабощелочные, содовые, кислые глеевые и
прочие илы).
Процессы превращения ила (осадка) в осадочную породу именуют-
ся диагенезом, подробно рассмотренным Н. М. Страховым, Н. В.
Логвиненко и другими геохимиками -литологами.
Концентрация элементов в илах в основном происходит из бассей-
нов с последующим перераспределением в диагенезе. С этим связано,
например, накопление U, Мп, Au, W, Sn и других металлов в черных
сланцах венда и нижнего палеозоя (см. гл. 26), U и TR — в фосфори-
тах и многие другие процессы. Менее изучено поступление элементов
в илы снизу — в результате разгрузки подземных вод, по зонам разло-
мов, участкам трещиноватых и закарстованных пород и т. д. Форми-
рование в таких местах геохимических барьеров было изучено
Н. Ф. Глазовским в Каспийском море, где установлено ожелезнение
283
илов, концентрация в ряде случаев Ва, Sr, Hg и других микроэлемен-
тов, изменение Eh.
Разгрузкой подземных вод в илы А. М. Лурье объяснил образова-
ние стратиформных медных руд в морских отложениях типа «меди-
стых песчаников и сланцев» (Мансфельдское месторождение в ГДР,
Уайт-Пайн в США, Любин-Серошовицкое в ПНР и др.). По модели
этого автора медь мигрировала в сероводородные илы из подземных
вод подстилающих континентальных красноцветов. По Д. И. Павлову,
при образовании свинцово-цинкового месторождения Сардана (Юж-
ное Верхоянье) рудоносные растворы мигрировали в зону диагенеза
карбонатных толщ венда с глубины 2—4 км из рифейских глинистых
толщ. С осаждением Fe2+ в местах разгрузки подземных вод на дне
бассейнов связывают образование железных руд рифейского Ангаро-
Питского и олигоценового Приаральского железорудных бассейнов.
Осадочные породы и осадочные формации
Большинство осадочных пород образовалось из озерных, речных и
морских илов. Важное значение имели и последующие эпигенети-
ческие изменения пород под влиянием подземных вод.
В табл. 19 приведены кларки основных типов осадочных пород.
На материках среди пород фанерозоя и верхнего протерозоя, по А.Б. Ро-
нову, по объему преобладают глины и глинистые сланцы (50%), мень-
ше карбонатных (24,3) и песчаных пород (23,6), много меньше эва-
поритов, солей, гипсов и ангидритов (1,1) и кремнистых пород (1,0).
В осадочную оболочку Земли — стратисферу помимо осадочных по-
род включают также слоистые вулканические породы. Средняя мощ-
ность стратисферы, по Ронову, 2,2 км (на дне океанов — 0,4 км, на
материках — 5, в том числе в геосинклиналях — 12,4 и на платфор-
мах — 2,4 км). Стратисфера составляет 9,5 % массы земной коры н
0,05% массы планеты. От пород гранитного слоя осадочные породы
отличаются более высоким содержанием Н2О, СО2 органического уг-
лерода, Са, S, Cl, F, 3 и других «избыточных» летучих. Накопление
одних элементов (например, С, N) объясняется биологическим круго-
воротом, других —• вулканизмом, поставляющим летучие элементы в
атмосферу и гидросферу.
Значительное внимание привлекает энергетика стратисферы, ко-
торой уделяли внимание еще В. И. Вернадский и А. Е. Ферсман. По-
стоянное поступление солнечной энергии, преобразованной живым
веществом в энергию геохимических процессов, делает стратисферу
открытой динамической неравновесной системой, энтропия которой
уменьшается в ходе геологической истории. Поэтому осадочная обо-
лочка — значительно более сложная и дифференцированная система,
чем залегающие глубже гранитный и базальтовый слои, верхняя ман-
тия.
П. П. Тимофеев, А. В. Щербаков и В. А. Ильин рассмотрели потен-
циальные источники тепловой энергии и тепловые эффекты различных
284
процессов в стратисфере. По их расчетам поверхностная энергия, на-
капливающаяся при дезинтеграции пород в зоне гипергенеза, являет-
ся важным фактором формирования осадочных пород.
Существенную информацию по геохимии осадочных пород Дает изу-
чение поровых растворов глинистых толщ и других водоупоров, в ко-
торых энергично работают микроорганизмы. Эти растворы участвуют
как в изменении осадочных пород, так и в преобразовании пластовых
вод (см. «водоносные горизонты»). Для поровых растворов, как и для
пластовых воД, характерны латеральная и вертикальная гидрогеохи-
мическая зональность. Предполагается, что поровые растворы участ-
вуют в выносе углеводородов из нефтематеринских глинистых толщ
и других процессах.
Обширна информация по геохимии отдельных типов осадочных по-
род СССР. Так, разнообразная геохимическая специализация установ-
лена для чехла молодых платформ. Например, морские битуминозные
глины поздней юры — берриаса обогащены Mo, V, Ni, Си, Р и други-
ми элементами, морские битуминозные глины и мергели эоцена —
миоцена с костями рыб — Mo, V, TR, Р и другими, морские фосфори-
тоносные песчано-глинистые отложения мела — палеогена — TR.
Sr, Zr и другими, аллювиальные пески и песчаники неогена с костями
позвоночных — TR, Р, Th и др.
Для осадочных пород отдельных регионов приводятся статистиче-
ски достоверные сведения о распределении больших групп элементов
Так, В.М. Гавшиным и другими изучена геохимия морских терриген-
ных отложений Западно-Сибирской плиты с подразделениями пород
по возрасту и литологии. Особенно интересна геохимия баженовитои
— юрских битуминозных аргиллитов, обогащенных Rb, Cs, Ва,
Sc, TR, V, Mo, Ni и другими микроэлементами. Не менее подробны
данные по геохимии осадочного чехла Русской платформы (А. А. Мигди-
сов, А. Б. Ронов, Я. Э. Юдович), Сибирской платформы (В. С. Певз-
нер), Казахстана (В. А. Алексеенко, В. Н. Казмин и др.), Таджикской
депрессии (Д. Н. Пачаджанов) и депрессионных структур востока
Туранской платформы (Г. М. Шор, А. А. Спиридонов), других терри-
торий.
Большое значение приобрела геохимическая характеристика оса-
дочных формаций. Установлено, что в чехле древних платформ СССР
углеродистые сланцы позднего протерозоя, кембрия, ордовика и дево-
на обогащены Cu, Pb, Zn, Р, V, Ni и другими, фосфоритоносные обра-
зования кембрия, ордовика, юры и мела — TR, F, Sr, Nb и другими,
красноцветы и пестроцветы позднего протерозоя, кембрия, перми —
Си.гпидр. Не менее геохимически специализированы осадочные фор-
мации складчатых областей, причем в разных регионах по-разному. Так,
Для флиша Алтае-Саянской складчатой области характерны халько-
фильные и сидерофильные ассоциации элементов (Cu, Pb, Zn, Ni, Со
и др.), для флиша Казахстана (Sn, TR, и др.) н Верхоянья (W, Sn)—
литофильные.
285
98о
Таблица 19. Кларки осадочные пород и глубоководных осадков
Элементы Осадочные породы Глубоководные «к-адки
глины и сланцы песчаники, по А. А. Беусу, 1975 карботанные породы, по А. А. Беусу, 1975 известковые, по Турекьяну п Ведеполю, 1961 глинистые, по Турекьяну и Ведеполю, 1961
по А. П. Ви- ноградову, 1962 глнны, по Турекьяну н Ведеполю, 1961 сланцы, по А. А. Беусу, J975
н Не Li Be В С N 0 F Ne Na Mg AI Si P S CI Ar К Ca Sc Ti V Cr Mn Fe Co Ni Cu Zn 6-10"’ з. 10-" 1-10-2 1,0 6-10-2 52,8 5- 10-2 0,66 1,34 10,45 23,8 7,7-10'2 3-10-1 1,6-IO-2 2,28 2,53 1-ю-3 0,45 1,3-10-2 1-10-2 6,7-10-2 3,33 2-Ю'3 9,5-10-3 5,7-Ю-3 8-10-3 л •_ в 6,6-I0-3 3-10-1 1 -10-» А А А 7,4-IO-2 В 9,6- 10-' 1,5 8,0 27,3 7- IO”2 2,4-10-1 1,8-10-2 В 2,66 2,21 1,3-io-3 4,6-10-1 1,3-10-2 9-Ю-3 8,5-10-2 4,72 1,9-10-’ 6,8-10-’ 4,5-10-3 9,5 10-3 0,40 6-10-5 см3 н а 6,6-ю-3 3,0-10-1 10- 10-'3 1,2 54,5- 10-’ 49,0 7,4-10-2 7,7-10-8 см3 0,98 1,50 8,65 27,5 0,07 0,24 1,8-10-2 2,2-10“6 см3 2,70 2,00 1,3-Ю-’ 0,38 13- io-3 0,9-10-2 0,08 4,80 19-IO'4 6,8-I0"3 4,5-Ю"3 9,5-I0"3 0,25 1 г породы 1,5-10_3 0,я-IO”4 3,5-10-’ 1,3 13,5- IO-3 51,5 2,7-10-2 на I г породы 0,92 0,73 2,90 34,7 0,04 0,02 0,1-10-2 ia 1 г породы 1,32 2,67 0,1-10-з 0,30 0,0-10-3 0,35- 10-2 0,04 2,80 0,3-io-4 0,2-10-’ о,1-ю-3 1,6-Ю-’ 0,09 0,5-10-3 0,n-10-i 2- IO”3 11,0 0,7- Ю-’ 49,2 3,3-10-2 0,25 4,60 0,96 3,4 0,05 0,12 1.5-10-2 0,28 32,5 0,1 io-3 0,12 2,0-10~з 0,11-10-2 0,04 0,86 0,1-10-1 0,2-Ю-'3 0,4-10-3 2,0-Ю-з А В 5-10-4 х- 10-5 5,5.Ю-3 А А А 5.4-IO'2 В 2,0 4-Ю-з 2,0 3,2 3,5-10-2 1,3- ю-1 2,0 В 2,9-Ю-1 31,24 2- IO"4 7,7-10-2 2-Ю-з 1.I-I0-3 I-io-3 9- IO-3 7- IO-4 3-Ю-3 3-10-’ 3.5-10-’ А В 5,7-10 3 2,6- 10-1 2,3-10-2 А А А 1,3- ю-1 В 4,00 210 8,4 25,0 1,5-10-1 1,3-Ю-* 2,0 В 2,5-10-' 2,9 1,9-10-’ 4,6-10-1 1,2-IO-2 9-10-’ 6,7-10-1 6,5 7,4-IO"2 2,25-IO”2 2,5-IO”2 1,65-IO2
Ga 3-JO-3 1,9-10-’ J.9-JO-з 1,2-10-’ 0,4-10-’ 1,3.10-’ 2-10-’
Ge 2- IO'1 1.6-I0-1 l,6-I0-i 0,8- IO-4 0,2-Ю-4 0,2-IO-4 2- IO-4
As 6,6- io-4 1,3 10-1 13,0-10-! 1,0-10-1 1,0-10-1 мо-4 1,3-10-’
Se 6- io-5 6- 10 5 5,0-IO-5 0,5-I0-5 0,8-Ю-5 1,7-Ю-5 1,7-Ю-5
Вг 6- io-4 4-10-1 4,0-10-1 i,o-io-i 6,2-10-1 710-’ 7-10-’
Кг В 4,2-IO"9 cm’ на 1 г породы В В В
Rb 2-IO-2 1,4- IO”2 14-I0-’ 6-10-’ 0,3-10-’ 1 • IO3 1, МО-2
Sr 4,5- IO-2 З-IO-2 3,0-10-2 0,2-10-2 6,1-10-2 2 10-1 1,8-IO-2
Y 3- io-3 2,6-10-’ 2,6-10-’ 4-10-’ 3,0-10-’ 4,2-10-’ 910-’
Zr 2- IO-2 1,6-10-2 1,6-10-2 2,2-IO-2 0,2-10-2 2-10-’ 1,5-10-2
Nb 2- IO'3 1,1-10-’ 1,1-10-’ n- IO-5 0,3-IO-4 4,6-IO'4 1,4-10-’
Mo 2-Ю-4 2,6-10-1 2,6-IO’4 0,2-IO-4 0,4-10-1 3-Ю-6 2,7-10-’
Tc c С С
Ru D Нет данных D D
Rh D » D D
Pd . D » D D
An I • 10-5 7-10-» 7- 10 е n-I0-s П-10-» х-Ю-« 1,1-10 5
Cd 3-10-« 3 io-5 з-io-5 0,rt-I0~5 0,4-10-5 х-10-“ 4,2-10-5
In 5-10-“ 6-IO-5 1,0-10-5 0,rt-10~5 О.л-Ю-5 х-Ю-’ 8. 10-’
Sn l.)0-3 6-Ю-’ 6,0-10-1 0.Я-10-1 0,n-IO”’ х-Ю-5 1,5-10-1
Sb 2-10-1 1,4-10-1 15-Ю-5 0,n-10~5 2,0-Ю-5 1,5-10-5 1-ю-4
Те I-10-“ D 10-IO’7 Нет данных D D
I 1-ю-4 2,2-I0-i 2,2-10-4 l,7-10-* 1,2-10-1 5-10-« 1-ю-«
Xe В 3,4-10-’° см3 на 1 г породы В В
Cs 1,2 10-’ 5-10-1 5,0-10-i п-10-5 п-Ю-5 4-Ю-5 6-10-1
Ba 8-Ю-2 5,8-10-2 5,8-IO-2 п-10-’ 1,0 10-’ 1,9-Ю-2 2,3-10-1
La 4- IO 3 9,2-10-’ 9,2-10-’ 3.0-I0-’ я-10-1 1 • 10-» 1.15-10-2
Ce 5-10-3 5,9-10-’ 5,9-10~’ 9,2-10-’ 1 2- 10-з 3,5-10-’ 3.45-10-2
Pr 5-10-1 5,6-10-1 5,6- IO-4 8,8-10 1 1,1-10-1 з.з-ю-1 3.3-10-’
Nd 2,3-10-3 2,4-10~3 2,4-10 ’ 3,7-10-’ 4,7-10’ 1,4-10-’ 1,4-10-2
Pm C — —- — С С
Sm 6.5-10-1 6,4-10-1 6,4-10-1 1,0-10-’ 1,3-10-1 3,8-IO-4 3,8-10-’
Eu 1 • io-4 i-io-i 1,0-10-1 1,6-10-1 0,2- IO-4 6-ю-5 6-ю-4
Gd 6,5-I0-i 6,4-10-1 6,4-I0-i 1,010-3 1,3-10-1 3,8-10-1 3,8- Ю-з
Tb 9-IO-3 i-io-i I ,o-io-‘ 1,6-10- ' 0,2-Ю-1 6-I0-5 6-ю-1
to 00
288
Большое внимание привлекает рудоносность формаций — связь
месторождений типа медистых песчаников с красноцветами, своеобраз-
ных тонкодисперсных руд Au — с черносланцевой формацией и т. д.
При геохимическом анализе формаций, как и при анализе пород,
главное внимание уделяется окислительно-восстановительным и ще-
лочно-кислотным условиям их образования. Элементы геохимической
систематики формаций характерны почти для всех литологоформаци-
онных исследований. Так, В. С. Ерофеев и Ю. Г. Цеховский парагене-
тические ассоциации континентальных отложений разделяют на сиде-
рофильные (гумидные) и кальциефильные (аридные). А.М. Данилевич,
Г. М. Шор и Л. В. Диордиенко показали, что в осадочном чехле Туран-
ской плиты терригенно-карбонатная формация неогена содержит в
среднем 1,2,-10-3 % Мо, такая же формация палеогенового возраста-
— уже 2,5-10-3, юрская терригенная, угленосная и карбонатная фор-
мации— 3-Ю-1, молассоидная терригенная пермотриассовая форма-
ция — 8-10-4 %. Не менее контрастны данные и по другим микроэле-
ментам — Y, V, РЬ и т. д.
Геохимическое изучение формаций включает выделение параген-
ных и запрещенных ассоциаций элементов, характеристику геохими-
ческих типов эпигенеза, классов геохимических барьеров и связанных с
ними концентрацией элементов (в том числе рудных месторождений).
Геохимическое своеобразие формаций зависит от многих причин, в
первую очередь от условий осадкообразования, особенностей области
сноса, последующих эпигенетических процессов под влиянием под-
земных вод.
Изучается геохимия и более сложных осадочных образований —
структурно-фациальных комплексов, включающих несколько форма-
ций. А. А. Смыслов, В. А. Рудник и другие по типу геохимической диф-
ференциации выделили на территории СССР 4 СФК осадочных пород
— салический, салическо-фемический, фемический и хемогенно-кар-
бонатный. Определено также содержание микроэлементов в СФК от-
дельных регионов. Для Туранской плиты, например, высчитано сред-
нее содержаниеи пределы колебаний Мо, Р, Si,Y, Zr, V, Mn, Ti, Cu, Ni,
Pb, Ag и Sn для терригенно-карбонатного комплекса неогенового и
палеогенового возрастов, для терригенно-угленосного и карбонатного
юрского комплекса, для терригенного молассоидного пермо-триасового
СФК.
Коры выветривания
Корой выветривания, или элювием, называются рыхлые продукты
изменения горных пород, образующиеся под почвой за счет поступаю-
щих из нее растворов. Термин «кора выветривания» употребляют и в
широком смысле, включая в него и отложения склонов, долин, озер и
т.д. Б. Б. Полынов различал остаточную (элювий) и аккумулятивную
кору выветривания (делювий, алювийит. д.). Среди современных уче-
Ю Зак. 2022
289
ных такой трактовки придерживаются К. И. Лукашев и др. Однако
в геологии преобладает представление о коре выветривания как об ос-
таточных продуктах (В. П. Петров, Д. Г. Сапожников, Ю. Ю. Бугель-
ский и др.). От почвы кора выветривания отличается отсутствием
биогенной аккумуляции элементов под влиянием растений. По осталь-
ным признакам кора выветривания близка к почве. Как и для почвы,
для нее характерны инфильтрация атмосферных осадков, выщелачива-
ние растворимых соединений, выветривание первичных силикатов с об-
разованием глинистых минералов, формирование профиля, расчленен-
ного на горизонты, окислительно-восстановительная и щелочно-ки-
слотная зональность, геохимические барьеры.
Биокосная природа коры выветривания проявляется в деятельности
микроорганизмов, окисляющих органические соединения, поступающие
из почвы. Наиболее благоприятные условия для формирования коры
выветривания создаются во влажном и жарком климате при равнин-
ном или холмистом рельефе и спокойном тектоническом режиме.
В этом случае ее мощность может достигать нескольких десятков, а
по трещинам и зонам дробления — сотен метров. В сухом климате
мощность элювия не превышает нескольких метров.
Основоположниками геохимии коры выветривания были Б. Б. По-
лынов (1877—1952) и И. И. Гинзбург (1882—1965).
Поведение элементов в коре выветривания определяется их химиче-
скими свойствами, типом ландшафта и особенностями пород. Мине-
ралы не одинаковы по податливости к выветриванию, и это во многом
определяет различную интенсивность миграции элементов. Так,ще-
лочные амфиболы выветриваются легче, чем альбит, поэтому Na ам-
фиболов обладает более высокой миграционной способностью, чем
Na альбита. Если U входит в состав трудноразрушаемого циркона, его
миграционная способность низкая, если в состав урановых черней —
высокая. Податливость минералов к выветриванию зависит от климата.
В аридном климате кальцит, гипс, доломит устойчивы в коре выветри-
вания, во влажном — неустойчивы.
Для коры выветривания характерны процессы окисления. Fe, Мп и
S в изверженных породах в основном находятся в двухвалентной фор-
ме (Fe2+, Mn2+, S2-), а в коре выветривания — в форме Fe3+,
Mn4+, S6+. Не менее характерны и процессы гидратации', почти все
вторичные минералы содержат воду (гидратную, кристаллизационную
и др.), в то время как в большей части первичных минералов ее нет.
В районах с засушливым климатом образуются также карбонаты, глав-
ным образом СаСО3.
При интенсивном выветривании большая часть твердых составных
частей коры находится в коллоидном состоянии или же прошла через
него (многочисленные глинистые минералы, гидроксиды Fe, Mn, А1 и
Со, гумусовые вещества и др.). Впервые в яркой форме эту мысль вы-
разил в начале XX в. австрийский минералог Ф. Корию, который пи-
сал, что подобно коре окружает земной шар царство гелей. Меньшая
часть твердых продуктов выветривания находится в виде простых со-
290
II РЕЗКОВОССТАНОВИТЕЛЬНАЯ ОБСТАНОВКА (H2S ) ТО'О ГО т 01 001 хн . - « 0 -° л 75 £ N z с* О •С г £ аз И" 05 «> - а! Ч я « >? 5 р О “> 5 °г — о * “О <20^
<e о 0* я» * 1 * - Л х aS н
Ca.Na, Mg.F, Sr
се и о ~
:тность чции X Л 1 X >0 СО 5 сл ч w S rt Z d о а' с сл Н
КОНТРАС МИГР. ее л 0 О с N Ви 4 СЛ о О О Z Z N Р 5.
I ОКИСЛИТЕЛЬНАЯ ОБСТАНОВКА’ кх 100 10 L 0.1 0,01 I f L 1 J > to -о U г ж N JE £ * р h в °. V й =2 fc. н и » - d Я < Z ь «
Si,К,Мп, P,Ba,Rb, Ni,Cu,Li, Co,Cs,As, Tl.Ra*
d- « ., J z Ч Э и, rt ьо - о я О S N S <
К О (Л CQ
ИНТЕНСИВНОСТЬ^ МИГРАЦИИ ОЧЕНЬ СИЛЬНАЯ МИГРАЦИЯ 1 1 1 1 1 СИЛЬНАЯ МИГРАЦИЯ СРЕДНЯЯ МИГРАЦИЯ СЛАБАЯ И ОЧЕНЬ СЛАБАЯ МИГРАЦИЯ
Рис. 76. Ряды миграции элементов в окислительной и восстановительной сероводородной обстановках (по А. И. Перель-
ману)
10*
лей. Некоторые формы коры выветривания практически их не содер-
жат.
Б.Б. Полынов установил ряды интенсивности выноса химических
элементов из коры выветривания, которые были дополнены автором
(рис. 76). Общая тенденция заключается в выносе наиболее подвижных
элементов и относительном обогащении коры наименее подвижными,
особенно Al, Fe, Ti. Часть Cl и S поступает в кору с атмосферными осад-
ками («циклические элементы»). Поэтому интенсивность их водной миг-
рации, определенная с помощью Кх, а также, вероятно, F, Br, I, В и
Рис. 77. Стадии развития коры выветривания изверженных пород (орто-
элювия)
некоторых других элементов, завышена. Однако поправки на атмосфер-
ный принос не меняют основной вывод: при выветривании интенсив-
ность выноса элементов колеблется в сотни и тысячи раз.
По Полынову, выветривание изверженных пород проходит ряд ста-
дий: от обломочной обызвесткованной (вынесены только С1 и S),
сиаллитной (вынесена значительная часть катионов) до аллитной
(вынесена большая часть катионов и SiO2 силикатов, в коре накап-
ливаются кварц, гидроксиды Fe и AI). Следовательно, тенденция вы-
ветривания едина, но скорость процесса и конечная стадия различны и
зависят от климата (в пустыне аллитная стадия не достигается,
рис. 77, 78). Полынов установил геохимические сопряжения коры
выветривания (элювия) и континентальных отложений. Так, в сухих
степях и пустынях кора содержит СаСО3 («обломочная обызвесткован-
ная»), а в континентальных отложениях накапливаются легкораство-
римые хлориды и сульфаты.
Многие коры выветривания погребены под осадочными породами,
другие, хотя и обнажаются на земной поверхности, находятся в резком
292
несоответствии с современным климатом (тропические коры в пусты-
нях Австралии и Казахстана и др., рис. 79). С такой древней корой
выветривания связаны месторождения богатых железных руд Кривого
Рога и КМА, бокситов, силикатного Ni Урала, Новой Каледонии,
Марокко. В Кривом Роге следы древнего выветривания прослежены
на глубину нескольких километров. Это зоны мартитизации магнети-
та (Я. Н. Белевцев и др.). Одновременно с окислением Fe2+ в них про-
исходило выщелачивание SiO2 и обогащение руд («богатые руды»).
Фазы развития элювия по Б.Б. Полымову
Климатические условия
Обломочная
Обызвесткован-
ная ( сиаллитная
и обломочная)
Кислая
сиаллитная(не-
иасыщенная)
Аллитная
Сухой климат сгеией и пустынь.
Испаряемость превышает осадки
промывание коры выверивания
с ia6oe'
Влажный климат умеренно! о нож а
осадки превышаю с испарение,
промывание коры выверивания
сильное,
В.шжнын Клима) /рицинов, суб-
। роппков и экваториальных стран
(осадки превышаю! испарение,
иромынднис коры выветривания
сильное)
Рис. 78. Стадии развития коры выветривания изверженных пород в за-
висимости от климатических условий
После завершения формирования профиля коры выветривания не-
редко подвергались эпигенетическим изменениям под влиянием под-
земных вод, эолового привнося солей и других процессов. В результа-
те на кору накладывались оглеение, карбонатизация, засоление и
другие процессы, существенно изменившие ее геохимию, исказившие
первоначальный профиль.
В основу геохимической классификации коры выветривания автор
положил особенности наиболее выветрелого горизонта («центра»),
т. е. верхней подпочвенной части элювия. Глубже процессы выветрива-
ния затухают и самые нижние горизонты обычно изменены слабо.
В коре выветривания помимо хорошо изученной минералогической
зональности установлена и геохимическая зональность — окислитель-
но-восстановительная и щелочно-кислотная (рис. 80).
293
В геохимической систематике коры автор выделил окислительный и
глеевый ряды, а для нижних горизонтов и сероводородный (сульфид-
ный). Классы коры выветривания в общем аналогичны классам почв и
илов.
Кора выветривания окислительного ряда широко распространена,
хорошо изучена и наиболее разнообразна.
Сернокислая кора (/) возникает при выветривании пород, богатых
дисульфидами (в первую очередь пиритом). Окисление дисульфидов, в
котором участвуют тионовые бактерии, приводит к появлению H2SO4,
понижению pH. Начинается «сернокислое выветривание», легкая миг-
рация Zn, Си, Cd и других металлов. Данный класс лучше всего изу-
чен на сульфидных месторождениях.
О 20 40км
Рис. 79. Профиль древией коры выветривания на гипербазитах и габбро-амфибо-
литах Кимперсайского массива (по В. П. Петрову):
I — выщелоченные серпентиниты. 2 — слабо нонтроннтнзированные серпентиниты, 3 — нон-
трониты, 4 — охры, 5 — габбро-диабазы, 6 — габбро-амфиболиты, 7 — монтмориллонитизнро-
ванные и каолинизированные габбро-амфиболиты, 8— сбросы
Для этой зоны окисления сульфидных месторождений характерны
различные геохимические барьеры и типы концентрации — Bl, D1.
ЕЗ и др. (рис. 81).
Сернокислые растворы, просачиваясь из зоны окисления вниз, ре-
агируют с первичными сульфидами:
MeS + HsSO4 -> MeSO4 J- H.2S
Так, в нижней части зоны окисления возникает сероводородный
барьер, на котором осаждаются металлы (В1). Образующиеся вто-
ричные богатые сульфидные руды местами представляют главную цен-
ность месторождений. Местами осаждение происходит и без H2S,
в результате других процессов, но с обязательным участием сульфидов.
Поэтому можно говорить о сульфидном барьере, частным случаем ко-
торого является и сероводородный барьер. Большое значение при этом
приобретают различные микрогальванические пары, т. е. электрохи-
мические явления.
Тип D1 формируется при окислении сульфидных руд в известня-
ках. Образующиеся при этом сернокислые растворы Fe, Си, Zn, Ni, Со
и других металлов, взаимодействуя с вмещающими карбонатами, ус-
294
редняются. В результате на щелочном барьере D1 осаждаются гидро-
ксиды и карбонаты металлов, как, например;
ZnSO4 + CaCO3- 2Н2О -+ ZnCO3 + CaSO4-2H2O
раствор твердая твердая
фаза фаза
Зона окисления в таких местах богата вторичными карбонатами метал-
лов, среди которых особенно выделяются малахит и азурит — зеле-
ные и синие карбонаты Си. Месторождения Си в аридном климате поч-
ти всегда на поверхности представлены этими минералами.
При окислении сульфидных руд в известняках образуются и кон-
центрации ЕЗ, так как гидрокарбонатные воды известняков имеют
МИНЕРАЛОГИЧЕСКАЯ ЗОНАЛЬНОСТЬ
ГЕОХИМИЧЕСКАЯ ЗОНАЛЬНОСТЬ
ка оли н итов а я зона
гидрослюдистая зона
гиббсит-гематит-каолимитовая зона
красная окислительная зона
пестрая и белая восстановительная
(глеевая) зона в верхней части <• пери-
одическим окислением (fj 1
КОРЕННЫЕ
ПОРОДЫ
О
Рис. 80. Профиль коры выветривания во влажных тропиках (по схеме
М. А. Глазовской с дополнениями автора)
слабощелочную реакцию и могут содержать повышенные количества
кремнезема. Последний осаждается при встрече этих вод с кислыми,
т. е. на кислом барьере ЕЗ. В результате происходит окремнение из-
вестняков, характерное для многих зон окисления сульфидных руд.
Здесь геохимический барьер работает в обе стороны: в сторону от руд
— это щелочной барьер D1, а в сторону руд — кислый ЕЗ. Такие
барьеры называются двусторонними. Для них характерны ассоциации,
включающие и катионогенные и анионогенные элементы. Сернокислые
коры образуются также при выветривании пиритизированных глин и
сланцев, серных руд.
Кислая кора выветривания (2) образуется во влажном климате.
Богатый растительный покров определяет здесь энергичное поступле-
ние в кору из почвы СО2, гумусовых кислот и других продуктов разло-
жения растительных остатков. Для нейтрализации кислых продуктов
в грунтовом растворе, как правило, не хватает катионов, и реакция вод
сохраняется кислой, разложение минералов происходит в кислой сре-
295
де, что определяет вынос большинства металлов и замещение Н+ об-
менных катионов в поглощающем комплексе. В кислой коре образуют-
ся каолинит, галлуазит и другие глинистые минералы. Наиболее энер-
гично кислое выветривание протекает во влажных тропиках (см. рис.
80).
В нижних горизонтах кислой коры в результате повышения pH
на щелочном барьере концентрируются некоторые элементы, выщело-
ченные из верхних горизонтов. Нейтральная или даже щелочная среда
Рис. 81. Концентрация элементов типа Bl, D1 и ЕЗ в зоне окисления суль-
фидных руд в известняках:
/—сернокислые растворы. 2— известняки, 3 — щелочной барьер. D. 4 — слабощелоч-
ные воды. 5 — кислый барьер Е
обусловлена как привнесенными сверху катионами, так и продукта-
ми разложения первичных минералов нижних горизонтов. Это осо-
бенно наглядно при выветривании ультраосновных пород: из верхних
горизонтов коры — зоны охр и нонтронитов — выносится Mg, там
господствует кислая реакция, а в нижних горизонтах — выщелочен-
ных серпентинитах и зоне дезинтеграции — Mg осаждается на щелоч-
ном барьере в форме магнезита, доломита и гидромагнезита, керолита,
магниевого монтмориллонита и даже брусита — Mg (ОН)2 (последний в
зоне дезинтеграции). Так, в результате привноса сверху в нижних го-
ризонтах возникает щелочной барьер D2.
Следовательно, кислое выщелачивание, удаляя катионы из верхних
горизонтов, приводит к развитию щелочной среды в нижних.
296
Концентрации D2 образуются и на контакте ультраосновных пород
с известняками в результате боковой миграции кислых вод, содержа-
щих Ni и Со. В карстовых полостях здесь происходит сорбция металлов
глинами, т. е. совмещаются щелочной и сорбционный барьеры (D2 —
G2). Так, вероятно, сформировались некоторые гипергенные месторо-
ждения Ni (рис. 82).
На гранитах во влажных тропиках кора содержит много каолини-
та — продукта выветривания полевых шпатов (каолиновая кора).
Рис. 82. Концентрация никеля и кобальта типа Д2 в результате боковой ми-
грации:
/ — ультраосновные породы. 2 — известняки. 3 — кислые воды, содержащие органи-
ческие комплексы металлов. 4—щелочной барьер
Иной минеральный состав имеет кора во влажном умеренном поясе.
Однако всем формам кислой коры присущи общие черты: отсутствие
легкорастворимых солей и СаСО3, бедность катионами, особенно Са,
высокая миграционная способность многих элементов, их концентра-
ция на щелочном и сорбционном барьерах в нижних горизонтах (D2—
-02).
Изучение профиля древней кислой коры выветривания гранитов
Барлакского массива (Колывань-Томская складчатая зона) показало,
что Al, Th, Hf, Sc, Се практически неподвижны. В нижней зоне дезин-
теграции энергично выветриваются плагиоклазы с переходом в раст-
вор Са, Na, Sr, Mg, с чем связано резкое повышение pH. Ортоклаз за-
мещается гидрослюдой, с чем связаны вынос К и Ва. В результате
полного замещения полевых шпатов каолинитом происходит выщела-
297
чивание большинства микроэлементов. Интересно, что вынесенные из
каолинового горизонта TR, В и Си концентрируются в зоне дезинтег-
рации, a Rb и Cs — в подзоне гидрослюд (G2 барьер. — А. П). Гид-
роксиды Fe в верхней части профиля сорбировали В, Со, Ni, Sb и дру-
гие микроэлементы (В. М. Гавшин, Б. Л. Щербов и др).
Нейтральная и щелочная кора выветривания (3) широко распрост-
ранена в сухом климате. Выветривание здесь проникает неглубоко,
и кора имеет малую мощность. На скальных породах она представлена
обломками пород, покрытыми корочкой СаСО3. Наиболее подвижный и
накапливающийся мигрант — Са, входящий в СаСО3 и поглощающий
комплекс (в виде обменного катиона). Богатство коры Са определяет
ее слабощелочную реакцию, низкую миграционную способность Fe
и А1. Во влажном климате такая кора характерна для первых стадий
выветривания известняков.
Кора выветривания глеевого ряда формируется под глеевыми поч-
вами, преимущественно на гумидных равнинах.
Для кислой глеевой коры (6) характерны кислая реакция среды, вы-
нос катионов и образование глинистых минералов, преимущественно
гидрослюдистого типа. Здесь высока миграционная способность Fe и
Мп, частично Р и некоторых редких элементов. Кислое глеевое вывет-
ривание широко распространено в северной части Западно-Сибирской
низменности, где кислая глеевая кора представлена подпочвенными
сизыми глеевыми горизонтами, обедненными Fe и Мп. В районах много-
1етней мерзлоты мерзлый горизонт является естественным водоупором,
вызывающим заболачивание, поэтому на границе с мерзлой толщей
также энергично развивается глеевое выветривание.
Нейтральная и щелочная глеевая кора выветривания менее распро-
странена. Миграция Fe здесь происходит на сравнительно небольшие
расстояния и с малой интенсивностью, Мп мигрирует энергично.
Кора выветривания сульфидного ряда на земной поверхности не обра-
зуется, но горизонты с сульфидами местами возникают в нижней части
коры окислительного ряда (зона вторичного сульфидного обогащения
и др.). Сульфидные горизонты известны также в низах коры выветрива-
ния углеродистых пиритизированных сланцев. В коре выветривания
медноколчеданных месторождений Мугоджар, по Ю. Е. Саету, нижние
глинистые горизонты с пиритом серо-голубые, в то время как верхняя
часть коры красная, с гидроксидами Fe. Аналогичные явления извест-
ны на месторождении Жайрем в Центральном Казахстане.
Водоносные горизонты
По своей сущности и уровню организации водоносные горизонты био-
сферы близки почвам, илам и корам выветривания. Это биокосные си-
стемы, их геохимия во многом связана с деятельностью бактерий.
К водоносному горизонту относятся не только породы с движущейся
водой, но и прилегающие части водоупоров, в которых развиваются
явления диффузии и изменения пород. Поэтому как и почвы и коры вы-
298
ветривания, водоносные горизонты дифференцированы по вертикали —
имеют профиль. Следует различать также «былые водоносные гори-
зонты» — участки литосферы, ныне лишенные подземных вод, но со-
державшие их в прошлом. Следы таких горизонтов обнаруживаются в
виде линейно вытянутых зон с оглеением, огипсованием, окремнением
и т. д. За геологическую историю осадочная толща сильно переработана
подземными водами. Об этом говорит и изучение подземного химического
стока. По расчетам В. П. Зверева, за фанерозой с подземным стоком в
океаны вынесено больше веществ, чем теперь содержится в стратисфере
в виде карбонатных, сульфидных и галогенных пород. По эффективно-
сти подземный химический сток вполне сопоставим с механической де-
нудацией.
К водоносным горизонтам приурочены многие полезные Ископае-
мые, которые образовались на геохимических барьерах (медистые и
ураноносные песчаники, серные руды и др.). Изучение следов былых во-
доносных горизонтов в породах позволяет восстановить химический
состав и другие особенности подземных вод, т. е. решить задачи палео-
гидрогеологии и палеогидрогеохимии.
Изменения горных пород под влиянием подземных вод именуются
катагенезом, эпигенезом, гидрогенезом. Они включают в себя явления
выветривания и цементации, которые приурочены не только к самому
водоносному горизонту, но и к его контакту с водоупорными породами.
Центральные части водоупорных горизонтов могут быть сравнительно
слабо изменены, т. е. в осадочной толще наряду с породами, сильно из-
мененными подземными водами, имеются «запечатанные» неизмененные
или слабоизмененные породы.
Геохимия подземных вод — гидрогеохимия зародилась в 30-х годах
в значительной степени под влиянием трудов Вернадского. Это наука
«гибридная», возникшая на стыке гидрогеологии и геохимии, на основе
синтеза различных идей и методов. Гидрогеохимия изучает все подзем-
ные воды земной коры, в том числе и не входящие в биосферу. Важную
роль в становлении гидрогеохимии имели труды А. М. Овчинникова
(1904—1969) — создателя крупной на 'чной школы.
К замечательным достижениям гидрогеологии относится учение о
связи химического состава подземных вод гидрогеологических структур
с интенсивностью водообмена. В яркой форме эти идеи развил в 40-х
годах талантливый советский гидрогеолог Н. К. Игнатович (1899—
—1950). Детально изучив подземные воды Русской платформы, он
показал, что в артезианских бассейнах с глубиной по мере ослабления
интенсивности водообмена закономерно меняется состав подземных вод,
формируется вертикальная гидрогеохимическая зональность.
Верхняя — зона интенсивного водообмена, где подземный сток тес-
но связан с поверхностным. Здесь подземные воды дренируются река-
ми, движутся сравнительно быстро, и водообмен осуществляется за де-
сятки, сотни и тысячи лет (в среднем 330 лет). В районах влажного кли-
мата воды пресные, в аридных районах местами солоноватые и соле-
ные. Мощность верхней зоны обычно не превышает 500 м, но в горных
299
районах может быть и более 1000 м. В геологическом смысле это «мо-
лодые воды», образующиеся за счет инфильтрации атмосферных осад-
ков, часто содержащие растворенный кислород. Эти воды — основной
источник питьевого и технического водоснабжения.
Глубже залегает зона замедленного водообмена, осуществляемого
за десятки и сотни тысяч лет. Воды второй зоны более минерализован-
ные, часто нагретые. Они длительное время соприкасаются с горными
породами и выщелачивают из них растворимые компоненты. Воды не со-
держат О2, характеризуются восстановительными условиями, обогаще-
Рис. 83. Схематический разрез через Волго-Камский артезианский бассейн
(по В. Н. Архангельскому):
I — зона с минерализацией воды до 1 г'л (интенсивного водообмена — А). 2 — зона с ми-
нерализацией воды до 10 г/л (замедленного водообмена — Б?), 3 — зона с минерализаци-
ей воды до 50 г/л (замедленного водообмена — В?), 4—6 зона весьма замедленного водо-
обмена Г)-3 (4 — с минерализацией воды до 100 г/л. 5 — с минерализацией воды до
27о г/л, 6— с минерализацией воды более 270 г/л), 7 — стратиграфические границы, 8 —
граница гидрохимических зон
ны СН4, СО2, местами H2S. Они широко используются в бальнеологии
(«минеральные воды») и частично как источник промышленного сырья.
Самая глубокая — зона весьма замедленного пассивного водообмена,
осуществляемого в масштабе целых геологических периодов, т. е. за
миллионы лет. Часто это глубокие (местами глубже 3 км) горячие воды
артезианских бассейнов, древние, сильноминерализованные (вплоть до
рассолов) с восстановительной средой. Частично они не принадлежат
к современной биосфере, относятся к области былых биосфер. Эти воды
служат источником I, Вг, различных солей и прочего сырья для про-
мышленности (рис. 83, 84).
В некоторых артезианских бассейнах вертикальная гидрогеохими-
ческая зональность носит иной характер, например, пресные воды за-
легают глубже соленых. Однако во всех случаях химизм подземных вод
тесно связан с их динамикой. Анализ гидрогеологии Азии и Африки
привел Н. А. Маринова к выводу, чю вертикальная гидрогеохимическая
зональность является планетарной закономерностью. Она характерна
не только для артезианских бассейнов платформ, но и для складчатых
300
областей, трещинных вод щитов, в которых на глубине также обнару-
жены хлоридные рассолы (например, при бурении сверхглубокой сква-
жины на Кольском полуострове).
О причинах вертикальной гидрогеохимической зональности нет еди-
ного мнения. Особенно много дискуссий вызывает происхождение глу-
Рис. 84. Гидрогеохимическая зональность и поясность артезианских бассейнов
(по Е. В. Пиннекеру). А —разрез, Б — план:
гидрогеохимические пояса: / — одиозоиальный (пресных вод), //—двухзональный (прес
иЫх н соленых вод), ///— трехзоиальиый (пресных, соленых и рассольных вод): /V—
гидрогеохимическая аномалия; гидрогеохимические зоны: / — пресных аод. 2 — соленых
вод, 3 — рассолов, 4 — очаг разгрузки соленых вод н рассолов, 5--рассоловыводящий
разлом. 6 — кристаллический фундамент
бинных хлоридных рассолов нижней зоны. Е. В. Пиннекер выделил три
группы гипотез: 1) магматогенные, 2) седиментационные (неразбавлен-
ной рапы бассейнов седиментации) и 3) седиментогенные—инфильтро-
генные (метаморфизованных вод различного генезиса). Генезис хло-
ридов связывали с газовой фазой магматизма (В. Ф. Дерпгольц и др.).
растворением залежей солей (И. К. Зайцев), метаморфизацией древ-
них седиментационных вод (А. Н. Бунеев, А. М. Овчинников и др.),
301
подземным испарением (М. Е. Альтовский), самодиффузией ионов
(Д. С. Соколов, О. Я. Самойлов), разложением молекул воды в ходе ее
взаимодействия с горными породами (С. Л. Шварцев), радиолизом
(И. Ф. Вовк) и другими процессами.
Гидрогеохимическим зонам соответствуют изменения во вмещаю-
щих породах, поэтому можно говорить о геохимической эпигенетической
зональности вод и пород в артезианских бассейнах и гидрогеологических
массивах в целом (рис. 85).
Геохимическая систематика водоносных горизонтов. В водоносных
горизонтах по вертикали нередко наблюдаются различные условия —
окислительно-восстановительная и щелочно-кислотная зональность.
№ fZJ* Е+И (ХЗ* ГГ17
Рис. 85. Принципиальная схема движения подземных вод в массиве
и бассейне (по Е. В. Пиннекеру) :
/ — зона интенсивной трещиноватости кристаллических пород. 2 — осадочные водоносные
породы. 3 — обводненные зоны разломов. 4— непроницаемые кристаллические породы, 5 —
осадочные водоупорные породы, б направление движения. 7 — выход подземных вод
Так, в примыкающих частях водоупоров, где происходит застаивание
капиллярной воды, обстановка часто более восстановительная, чем в
средней части горизонта, сложенной водопроницаемыми породами. По-
этому и при классификации водоносных горизонтов необходим прин-
цип централизации. Центром является та часть горизонта, в которой
наиболее энергично работают микроорганизмы, определяющие своеоб-
разие данной биокосной системы в целом. По простиранию и падению
геохимические условия также меняются, и нередко в одном и том же
горизонте на приподнятом крыле артезианского бассейна воды кисло-
родные, а в удалении от области питания — сероводородные или глее-
вые. Объектами классификации являются участки водоносных гори-
зонтов с определенными геохимическими условиями. В этом смысле
термин «водоносный горизонт» используется в дальнейшем изложении.
Автор выделил три основных ряда водоносных горизонтов.
Водоносные горизонты окислительного ряда. Вмещающие породы
имеют обычно желтый или рыжий цвет, обусловленный пленками гид-
роксидов Fe, покрывающих частицы пород. Кислородный состав вод
определяет возможность существования аэробных бактерий, энергич-
но окисляющих органические вещества.
302
В складчатых областях, в районах развития изверженных пород и
горного рельефа О2 по трещинам проникает на многие сотни и даже ты-
сячи метров (А. И. Германов, Б. А. Бедер, Я. Б. Смирнов). На заболо-
ченных равнинах Севера О2 местами отсутствует и в грунтовых водах.
На приподнятых крыльях артезианских бассейнов кислородные воды
из области инфильтрации могут глубоко проникать в водоносные гори-
зонты, содержащие восстановители (углистое и битумное органическое
вещество, пирит и другие сульфиды, сидерит и т. д.). В таком горизонте
развиваются окислительные процессы, серая окраска пород в связи с
лимонитизацией сменяется желтой, бурой, красной. Эта зона пластово-
го окисления (ЗПО) в форме языка вдается в сероцветные породы иногда
на десятки километров. Процессы пластового окисления имеют большое
практическое значение, так как с ними связано рудообразование (см.
гл. 22).
По гипотезе И. Ф. Вовка О2 в глубоких водоносных горизонтах
может возникать в результате радиолиза воды. Если во вмещающих
породах нет восстановителей, то О2 будет накапливаться и тем интен-
сивнее, чем выше радиоактивность пород.
Водоносные горизонты сильнокислого (1) класса установлены в
черных и серых пиритизированных песчаниках и алевролитах, кото-
рые, взаимодействуя с кислородными водами, окисляются и светле-
ют: на месте кристаллов пирита образуются бурые гидроксиды Fe.
Такие окисленные породы приобретают характерную пеструю зеле-
новато-ржавую окраску. Окисление может захватить и глинистые по-
роды, которые также изменяют серую окраску на пеструю. Данный
процесс энергично развивается при тектонических поднятиях, когда
оживляется деятельность подземных вод и поверхностные кислород-
ные воды проникают в глубь земной коры. Образующаяся серная кис-
лота легко нейтрализуется как за счет катионного обмена с породами
(вытеснения обменного кальция Н+ ионом), так и за счет взаимодейст-
вия с карбонатными и другими активными минералами. По А. В. Щер-
бакову, при окислении сульфидов туфолавовой формации Карпат рез-
ко возрастает минерализация вод (от 2 до50 г/л), pH их понижается до
1,0 и ниже, Eh колеблется от + 360 до 700 мВ, в водах растет содержа-
ние Fe, Al, Pb, Cu, As и т. д. Сернокислые воды изменяют алюмосили-
катные породы с образованием каолинита, алунита и других по-
лезных ископаемых. По периферии участков с сернокислыми водами на
геохимических барьерах D1 и D2 образуются вторичные рудопроявле-
ния сульфатов Fe (ярозит и др.), РЬ (англезит), Zn (госларит), Си (халь-
кантит). Существенно, что в окислении сульфидов важная роль при-
надлежит бактериям, в сотни раз увеличивающих скорость этого про-
цесса .
При незначительном содержании сульфидов или карбонатности по-
род сернокислый процесс, как правило, развит локально, вокруг зе-
рен пирита. В целом для водоносного горизонта характерно нейтраль-
ное окисление.
303
По И. Ф. Вовку, сернокислый процесс возможен и в глубоких водо-
носных горизонтах зоны затрудненного водообмена за счет окисления
сульфидов продуктами радиолиза воды (главным образом кислородом).
Образующаяся серная кислота выщелачивает из пород многие метал-
лы. Этим он объясняет повышенную сульфатность некоторых глубин-
ных пластовых вод, понижение в них pH, накопление Си и других ме-
таллов. Данные процессы характерны для участков с повышенной ра-
диоактивностью пород.
Водоносные горизонты кислого класса в зоне активного водообмена
могут формироваться до глубин 100 м и более. Общая направленность
изменения пород та же, что и в почвах и коре выветривания: вынос ка-
тионов, гидратация, образование гидроксидов Fe (лимонитизация).
Водоносные горизонты нейтрального и щелочного (3) класса разде-
ляются на два подкласса. Образование первого — кальциевого свя-
зано с миграцией кислородных, преимущественно гидрокарбонатно-
кальциевых вод невысокой минерализации. Кроме Са в водах легко миг-
рируют Sr, U, Mg, Na, S (в форме SO?-). Al, Fe, гумусовые вещества
обладают низкой миграционной способностью. Ведущими ионами яв-
ляются Са2+ (реже Mg2+) и HCOJ. Этот нейтральный карбонатный
процесс характерен для грунтовых вод умеренно-сухого климата —
лесостепного и степного. Он распространен также во многих толщах
известняков и изверженных пород в условиях расчлененного рельефа
и активного водообмена.
Растворение карбонатов известняков и доломитов приводит к раз-
витию карста, геология и география которого изучены очень хорошо,
геохимия — недостаточно. В СССР карст встречается как в северных
районах (Тиман и др.), так и в южных, в породах различного возраста
— от докембрийского до четвертичного. Наблюдается тесная его связь
с климатом и тектоникой. Наиболее интенсивно карст развивается в
районах влажного умеренного и теплого климата и значительно сла-
бее в полярных районах, сухих степях и пустынях. Тектонические под-
нятия обусловливают проникновение выщелачивания на глубину, об-
разование нескольких «этажей» карста. Опускание приводит к затуха-
нию карста. В тектонических структурах разного типа карст развива-
ется неодинаково: на платформах преобладает эрозионный карст, а в
Геосинклинальных областях — карст, связанный с разломами и зо-
нами тектонической трещиноватости.
В результате растворения СаСО3 в карстовых полостях образуется
глинистый нерастворимый остаток, нередко имеющий красную окрас-
ку.
Эпигенетическая карбонатизация песчаных, гравийных и прочих
проницаемых пород — это следы нейтрального карбонатного процесса
в горизонтах пластовых вод. Они часто встречаются в осадочных тол-
щах.
В прошлые геологические эпохи описанные процессы были широ-
ко распространены. Об их проявлении свидетельствуют древние карс-
ты, развитые во многих районах СССР и приуроченные к отложениям
304
различного возраста. Признаками карбонатного процесса являются
также красные глины в известняках, вторичная аккумуляция СаСО:(
в виде известковых конкреций, известковых туфов, прожилков гипер-
генного кальцита. Признаками, исключающими карбонатный процесс,
служат интенсивная миграция гумусовой органики, Fe и А1.
Так как гидрокабонатно-кальциевые воды благоприятны для миг-
рации U, Мо и F, то в водоносных горизонтах данного класса вокруг
рудных месторождений образуются значительные водные ореолы рас-
сеяния указанных элементов. Создаются благоприятные условия для
их гидрогеохимических поисков.
Ко второму подклассу относятся хлоридно-сульфатные водоносные
горизонты. В них интенсивно мигрируют Cl, S в форме SO2T, Na,
В, Sr, местами также U, I. Напротив, Fe, Al, Cu, Ti имеют низкую
миграционную способность. Данные водоносные горизонты приуро-
чены к ископаемым солям и положительным формам рельефа, для ко-
торых характерен активный водообмен. Выходы источников, а также
небольшие ручьи здесь отмечены отложениями солей. В результате
выноса солей в породах развивается соляной карст, известный в Сред-
ней Азии и Закавказье. Разновидностью этих процессов является
раздоломичивание'. сульфатно-кальциевые воды, дренируя гипсово-
доломитовые толщи, взаимодействуют с доломитом:
CaSO4-}-MgCO3-CaCO3 —2СаСОэ + MgSO4
В результате образуется вторичный кальцит, а в водах появляется
сульфат магния. Признаками раздоломичивания служат вторичный
кальцит, кавернозность известняков, возникающая за счет выноса
гипса и уничтожения доломита, обохренность известняков, обязанная
окислению пирита. К этому же подклассу относятся процессы рассоле-
ния соленосных глин, контактирующих с водоносным горизонтом.
Водоносные горизонты содового (4) класса содержат щелочные --
гидрокарбонатно-натриевые воды с общей минерализацией от 0,5 до
5г/л и pH 8,5—11. Важную роль в образовании этих вод играет вы-
ветривание натриевых полевых шпатов, нефелина и других натриевых
силикатов. Это распространенный природный процесс. Наиболее энер-
гично содообразование протекает в базальтах, туфах и других молодых
вулканических породах, которые легко выветриваются. В почвах и
осадочных породах содовые воды могут возникать, по К. К. Гедройцу.
за счет обменных реакций (Г — глина):
Г = 2Na+ + Са2+2НСО:? Г = Са2+ + 2Na+ + 2НСОз
твердая фаза раствор твердая раствор
фаза
Г— Na+4-H++ НСО3~ ч=ь Г —Н -г-Na+ + HCOj
твердая раствор твердая раствор
фаза фаза
Поэтому в районах развития солонцов, районах энергичного рассоле-
ния грунтовые воды часто имеют содовый состав. Так, по Е. В. Посо-
хову, в Прикаспийской низменности рассоление привело к об^азова-
30S
нию линз содовых вод в понижениях рельефа. Образование соды воз-
можно и за счет взаимодействия сульфатно-натриевых вод с карбоната-
ми кальция по реакции Е. Гильгарда:
Na2SO4 -j- СаСО3 Na2CO34-CaSO4
В обычных условиях реакция идет справа налево, для ее реализа-
ции необходим постоянный отток вод (просачивание сульфатно-нат-
риевых вод через известняки ит. д.). Реакции благоприятствуют высо-
кое содержание СО2 в водах, повышающее растворимость СаСО3.
Следовательно, генезис содовых вод различен, наибольшее значение име-
ют выветривание натриевых силикатов и обменные реакции.
Образованию содовых вод препятствует гипс, который реагирует
с содой по обратной реакции Е. Гильгарда (см. выше). В результате со-
довые воды превращаются в сульфатно-натриевые. Поэтому в районах
развития гипсоносных толщ содовый процесс не развивается. Од-
нако если в породах содержится лишь небольшое количество гипса, то
на взаимодействие с ним расходуется только часть соды, и содовый
процесс реализуется. В этом случае гипс замещается кальцитом.
В щелочных водах легко растворяются и мигрируют кремнезем,
гумус (гуматы Na образуют коллоидные растворы), Мо, V, Se, U. Мно-
гие элементы, соединения которых труднорастворимы в нейтральной
и слабощелочной среде, в содовых водах обладают высокой миграцион-
ной способностью, так как в щелочных условиях возникают раство-
римые комплексы. Так, по X. Дегенхардту, Zr входит в состав раство-
римого комплексного аниона (ZrO (СО3)212~. Аналогичные комплексы
образуют U, Ag, Sc, Си, Be, и иттриевая группа редких земель. Поэто-
му содовые воды могут извлекать из пород специфичную парагенную
ассоциацию элементов и переоткладывать ее на кислых барьерах. При-
мером может служить окремнение стволов деревьев в элювиальных
отложениях. Обломки древесины здесь, вероятно, длительное время
омывались щелочными водами, обогащенными кремнеземом. Микро-
биологическое разложение захороненной древесины приводило к вы-
делению СО2. Поэтому на участке гниения дерева вода подкислялась,
возникал локальный кислый барьер ЕЗ и Е4 (реже Е7 или Е8), на ко-
тором и осаждался SiO2, постепенно метасоматически клеточка за кле-
точкой замещавший древесину. Подобные процессы могли протекать
не только в речной долине и грунтовых водах, но и в глубоких пласто-
вых водах, через длительный промежуток времени после захоронения
древесины и прогибания песчаных пластов.
В содовых водах легко мигрируют в анионной форме А1 (АЮ-г и
др.) и Сг (СгО4~). При понижении pH даже в щелочной среде (силь-
нощелочные — слабощелочные) возможно осаждение этих металлов
совместно с кремнеземом и образование волконскоита (хромового
монтмориллонита). Волконскоит может синтезироваться на участках
локального понижения pH, например в местах энергичного разложе-
ния органических веществ (битумов, древесины и т.д.). Известны
псевдоморфозы волконскоита по древесине. При подкислении среды.
306
вероятно, Сг восстанавливается: Сгв+ ->• Сг3+, т. е. для Сг барьер так-
же восстановительный.
На Е барьере из содовых вод также, вероятно, осаждаются алюмо-
силикаты типа палыгорскита, аттапульгита, хризоколлы (Е 4, но воз-
можно и Е 8). С этими же процессами связана альбитизация пород.
Понижение pH может быть обусловлено взаимодействием соды с гип-
сом, чем и объясняется частый парагенезис палыгорскита и гипса. Барь-
ер относится к кислому классу, так как для него характерно пониже-
ние pH от сильнощелочного к нейтральному или слабощелочному. Из
сильнощелочных растворов возможно выпадение брусита Mg (ОН)2
(Е4, Е8). В Карпатах, по А. В. Щербакову, с содовыми водами флише-
вых отложений связаны процессы давсонитизации, анальцимитиза-
ции и ломонтитизации. Это, вероятно, также проявления барьера Е4.
В горизонтах окремнения, вторичного накопления гумуса концент-
рируется ряд химических элементов, подвижных в содовой среде (V,
Мо, иттриевая группа TR, Ag. Си и т.д.).
Водоносные горизонты глеевого ряда. Глеевые грунтовые воды ши-
роко распространены на равнинах тундры, тайги, влажных тропиков
и других районов с влажным климатом. Менее распространены они в
аридных районах. В глубоких пластовых и трещинных водах глеевая
среда преобладает. Так, в Днепровском артезианском бассейне, в
песках полтавского яруса подземные воды содержат до 28 мг/л Fe.
В глеевых водах Западно-Сибирского артезианского бассейна, по
Н. М. Рассказову, содержание Fe часто составляет 20—30 мг/л, мес-
тами и 100 мг/л. Глубинные воды гидрогеологических массивов, раз-
гружающиеся по разломам, также обычно относятся к глеевому ряду.
По минерализации и ионному составу глеевые воды могут быть прес-
ными гидрокарбонатными, хлоридными рассолами, содовыми и т.д.
В артезианских бассейнах оглеение часто обусловлено миграцией биту-
мов, нефти, газа, газоконденсата, соленых вод, обогащенных углево-
дородами.
По данным автора, Е. Н. Борисенко и Н. А. Шмельковой, на Рус-
ской платформе оглеение широко распространено в породах различно-
го возраста: от венда до четвертичного. В результате оглеения сильно
изменяется не только внешний облик пород, но и многие их свойства,
имеющие практическое значение. Так как при оглеении часто выносит-
ся Fe, этот процесс приводит к улучшению качества минерального
сырья или даже определяет возможность его практического использо-
вания. Это установлено для стекольных песков, белых каолинов, бок-
ситов, вероятно, и для других полезных ископаемых.
Наиболее отчетливо оглеение выражено в красноцветной форма-
ции, так как при этом резко изменяется окраска пород: на общем крас-
ном фоне появляются пятна красно-зеленой и полосы однородной сизо-
вато-зеленой, светло-серой или белесой окраски — следы былых водо-
носных горизонтов с глеевыми водами. Естественно, что водоносными
были пески, гравелиты и другие водопроницаемые породы, а водоупо-
рами — глины и алевролиты. В водовмещаклцих породах Fe3+ восста-
ют
чавливалось до Fe2+ и выносилось в форме Fe (НСО3)2. В результате
содержание Fe понижалось, «железистая рубашка» снималась с частиц
породы. Местами преобладали процессы синтеза алюмоферросиликатов.
R таком случае вынос Fe был небольшим.
Водоупорные породы, примыкающие к водоносному слою, частич-
но промачивались за счет капиллярного впитывания. В них также раз-
вивалось оглеение, Fe3+ восстанавли-
валось, мигрировало диффузионным
путем в водоносный слой песка, осаж-
далось там или выносилось за преде-
лы водоносного горизонта. Поэтому
глины и другие водоупорные породы
на границе с водоносными породами
также подвергались оглеению, при-
обретали сизую, сиреневую или зеле-
ную окраску, которая постепенно
языками через промежуточную пест-
рую зону переходила в неизменные
красные глины и алевролиты (рис. 86).
Пятнистые оглеенные зоны в осадоч-
ных породах обязаны деятельности
подземных вод.
Эпигенетическое оглеение широко
распространено в пермских красно-
цветах Приуралья и Поволжья, ме-
ловых и палеогеновых красноцветах
Средней Азии. По В. А. Шумлянско-
му, на Украине в киммерийскую ме-
таллогеническую эпоху глеевые грун-
товые и пластовые воды внедрялись в
красноцветные формации краевых
частей артезианских бассейнов. В хо-
де оглеения из пород выщелачивались
и концентрировались на геохимичес-
ких барьерах Fe, V, Сг, Ni и другие
элементы. Предполагается, что эти
Рис. 86. Былой водоносный гори-
зонт в верхнемеловых красиоцве-
тах долины р. Сох (Южная Фер-
гана) :
/, //, IV. V— водоупорные породы (/
и V — красный алевролит. II и IV —
оглееииый алевролит). III — водопрони-
цаемые породы — трещиноватый из-
вестняк
воды вместе с гидротермами участвовали в формировании ряда стра-
гиформных рудных месторождений и рудопроявлений.
Детально изучена минералого-геохимическая эпигенетическая
зональность горных пород, в которой последовательно сменяют друг
друга подзоны интеясивного оглеения, слабого оглеения, почти неиз-
мененных красноцветов (с пятнами оглеения). В некоторых регионах
оглеение было столь интенсивным, а число водоносных горизонтов столь
велико, что породы красноцветной формации чрезвычайно сильно из-
менились, почти все «пленочное» Fe перераспределилось. Лишь сред-
ние части алевролитовых и глинистых горизонтов сохранили свой пер-
воначальный цвет. В таких районах породы приобрели пеструю окрас-
308
ку, создающую впечатление хаоса красных, белых, охристо-ржа-
вых полос и пятен. И только внимательное исследование позволяет ус-
тановить строгую закономерность в распределении окраски: чередова-
ние в разрезе былых водоносных и водоупорных горизонтов. Подобные
породы нередко называются пестроцветными. Следовательно, часть
пестроцветов образовалась из красноцветов в результате их переработ-
ки подземными водами. Известны и такие случаи, когда при оглеении
красноцветы полностью утрачи-
вают «железистую рубашку» и
превращаются в сероцветы (бе-
лоцветы). Подобные изменения
могут быть связаны с диффу-
зионным эпигенезом, развиваю-
щимся из перекрывающих гу-
мидных (угленосных и др.) фор-
маций, с миграцией восстанови-
телей снизу от нефтяных и га-
зовых залежей. В этом заклю-
чается парадокс подобных серо-
цветов — они несут признаки
восстановительной обстановки
(оглеения), а причина, вызы-
вающая эту ибстановку (органи-
ческие вещества), в породах от-
сутствует. Отличие таких эпи-
генетических (оглеенных) серо-
цветов от сингенетичных аллю-
виальных сероцветов состоит
в отсутствии углистой орга-
I этап П этап
ЖЗ2 И3 И4 И5
Рис. 87. Характер движения растворов
в тепловом поле невскрытого интрузива
на разных этапах по мере остывания
(по Д. И. Павлову) :
1 — трещиноватые кристаллические породы,
2 — "юна повышенной проницаемости, 3 —
набнссальный габброидный интрузив, 4 — эк-
зогенные рассолы, 5 — ювенильные гндро-
термы
НИКИ.
В глеевом ряду устанавливаются те же классы водоносных гори-
зонтов, что и в окислительном.
Глеевые водоносные горизонты (5) сильнокислого класса харак-
терны для глубоких частей платформенных артезианских бассейнов,
где развиты кислые хлоркальциевые глеевые рассолы (pH до 2). По
Г. А. Голевой, для них характерны углеводороды, Eh ниже 0, накоп-
ление Sr, Ва, I, Вг, В, Li, Rb, Cs, Nb, Mn, Pb, Zn, Cd. Cu, Hg, Ag,
Sc, TI, La, Au и других элементов. Парагенетический тип месторожде-
ний — глубокопогребенные нефтяные и газоконденсатные залежи.
По Д. И. Павлову, такие воды участвовали в эндогенном рудообразо-
вании (рис. 87).
Водоносные горизонты кислого глеевого (6) класса формируются
в бескарбонатных породах, где разложение органических веществ
обогащает воды СО2 и органическими кислотами; pH может понизить-
ся до 4. Кислое оглеение весьма характерно для нефтегазоносных об-
ластей. Особенно энергична деятельность бактерий на водонефтяном
контакте, где они, окисляя органическое вещество нефти, продуци-
309
руютСО2 и органические кислоты К В результате pH вод понижается,
карбонаты водовмещающих пород растворяются, развиваются карсто-
вые явления.
Гидрокарбонатные растворы, содержащие повышенное количество
Са2+, Mg1 2+, Fe2+ и Мп2+, мигрируют в сторону от водонефтяного кон-
такта, где в водоносных горизонтах микробиологическая деятель-
ность развивается слабее и pH выше. Здесь на щелочном геохимическом
барьере D6 осаждаются эпигенетические карбонаты, цементирующие
пласт. Они описаны на нефтяных месторождениях Среднего Поволжья,
Кубани, Средней Азии. А. А. Разии и 3. Я. Сердюк установили широкое
распространение эпигенетической каолинизации и карбонатизации в
нефтегазоносных бассейнах Сибири. На глубине около 2500 м полевые
шпаты, слюды, хлориты превращены в каолинит, развиваются и вторич-
ные карбонаты. Эпигенетические изменения носят игольчатый харак-
тер, часто приурочены к зонам разломов, поэтому не исключается и
глубинный источник СО2. Изменения происходили в глеевых услови-
ях, так как среди вторичных карбонатов установлены не только каль-
цит, но и сидерит, анкерит (т. е. Fe мигрировало). Каолинизация воз-
можна только в кислой среде, а осаждение карбонатов — в нейтраль-
ной и щелочной. Это однозначно решает вопрос о последовательности
процессов — сперва кислая глеевая каолинизация, потом — окарбо-
начивание каолинизированных горизонтов на барьере D6.
Р. В. Королева и Б. А. Лебедев описали подобную кислотно-щелоч-
ную зональность в водоносных горизонтах триасовых песчаников Лено-
Вилюйской нефтеносной области на глубине 2,5—3,5 км:
Зона Состав цементов
Выщелоченная (кислая) Каолинит с примесью хлорита
Отложения вторичных минера- Карбонаты, кварц, альбит, цео-
лов (щелочная среда) литы, монтмориллонит, хлорит
Неизмененных пород Монтмориллонит, хлорит, гид-
рослюды, смешанно-слойные
минералы, каолинит
Эпигенетическая глеевая каолинизация в нефтеносных породах
известна также в Предкавказье, Волго-Уральской области, Прибал-
ханском районе, в США, Северной Африке. С этим процессом связано
формирование коллекторов для нефти и газа, так как при каолиниза-
ции пористость песчаников увеличивается. В карбонатных породах
коллекторы образуются за счет карста. Вторичные карбонаты откла-
дываются по периферии коллекторов (D6, D7), т. е. и здесь имеет мес-
то щелочно-кислотная зональность.
Кислая глеевая каолинизация характерна также для пород юрской
угленосной формации Средней Азии и Забайкалья. Парагенезис уг-
1 Местами образуется H2S, и тогда водоносные горизонты относятся уже к
сульфидному ряду.
310
лей и каолинов установлен еще в прошлом столетии и ныне обоснован
колоссальным фактическим материалом по многим угольным бассей-
нам. Известна как сингенетическая каолинизация, обусловленная кис-
лыми торфяными водами, так и эпигенетическая. Последнюю изучил
в песчано-гравийных породах юрской угленосной толщи Иркутского
бассейна В. И. Копорулин. Под влиянием подземных вод здесь в пес-
ках каолинизировались биотит, гидробиотит и частично полевой шпат.
Рис 88 Концентрации рудных элементов типа А6—G6 на кислородном
барьере-
I кислые и нейтральные глеевые воды. 2 — аккумуляция в болоте. 3 — аккумуляция
на дне озера, 4 — ожелезнение в зоне разлома
Глубинные восходящие глеевые воды, поднимаясь по разломам в
местах контакта с кислородными водами, встречают кислородный
барьер, на котором осаждаются гидроксиды Fe и Мп, в которых часто
наблюдается накопление Со, Мо, Zn, Ni и других металлов, так как гид-
роксиды — сильные сорбенты. В этом случае совмещается два класса
барьеров — кислородного (А6) для Fe и Мп и сорбционного (G6) для
остальных металлов. Ожелезнение в зонах разломов может быть
обусловлено также гематитизацией и окислением пирита сульфидных
руд («железные шляпы»), поэтому важно отличать «ложные железные
шляпы» типа А6 от истинных (рис. 88).
Во всех складчатых областях широко распространено слабое оже-
лезнение по трещинам в виде пленок гидроксидов Fe по граням от-
дельностей скальных пород. Это явление автор связывает с былым
существованием в породах зоны трещинных глеевых вод. Тектониче-
ские поднятия привели к осаждению гидроксидов Fe на кислородном
311
барьере А6. Геохимию такого пленочного ожелезнения в породах
Центрального Таджикистана изучила Т.К. Иванова.
Ожелезнение в породах часто связано также с щелочными барьера-
ми D6. Оно наблюдается в том случае, когда глеевый водоносный го-
ризонт с маломинерализованными слабокислыми водами перекрыт из-
вестняками, лёссами и другими породами, богатыми СаСО3. На кон-
такте с карбонатами pH повышается и Fe осаждается или в форме сиде-
рита, или в виде гидроксидов (окисление в щелочной среде осуществ-
ляется при более низких Eh). Миграция Fe осуществлялась путем диф-
фузии от средних частей водоносных оглеенных песков к их контакту
с карбонатными породами. Поэтому пески вблизи контакта имеют жел-
тый и красноватый цвет, ожелезнены (например, поН.А. Шмельковой,
кровля полтавских песков под лёссовидными суглинками в Белгород-
ской области). Иногда ожелезнение верхних частей песчаных пластов
неправильно диагностируется как «древняя кора выветривания».
Водоносные горизонты нейтрального и щелочного (7) глеевого
класса развиваются в породах, содержащих кальцит или доломит
Реакция вод здесь нейтральная или слабощелочная, реже слабокис-
лая, характерны вынос или перераспределение СаСО3. Интенсивность
выноса и аккумуляции Fe ниже, чем при кислом оглеении. Сравни-
тельно легко мигрирует Мп. Это объясняется различным pH осажде-
ния их гидроксидов: 5,5 для Fe2+ и 9,0 для Мп2+ (из разбавленных
растворов). Поэтому возможна глеевая среда, в которой Fe малопод-
вижно (осаждается в форме сидерита или феррогидрита). В таких ус-
ловиях на кислородном барьере А7 концентрируются преимуществен-
но гидроксиды Мп, содержащие примесь Fe. или во всяком случае роль
Мп резко возрастает. Аккумуляции класса А7 часто встречаются в тре-
щиноватых карбонатных породах, песчаниках и гравелитах современ-
ных и былых водоносных горизонтов.
Нейтральные и щелочные глеевые воды характерны для болот ле-
состепи и черноземных степей, для глубоких горизонтов трещинных
вод в изверженных породах, для пластовых вод красноцветов. По
Е. Н. Борисенко, в Приуралье зеленые оглеенные горизонты содер-
жат больше Cu, V, Сг, чем неоглеенные красноцветные (Р2). По ее
представлениям, кислородные щелочные подземные воды выщелачива-
ли эти металлы из вмещающих пород. В ходе тектонических опусканий
подземные воды теряли кислород и на границе кислородной и глеевой
обстановок в водноносном горизонте возникал глеевый геохимический
барьер С4 или С8, на котором осаждались Cu. V, Сг:
Си2+ -> Си+; УОГ -> V4+(V3+); СгОГ Сг3+
! I ;
По мере погружения пород глеевый барьер перемещался. Это опре-
деляло накопление Cu, V и Сг во всей толще оглеенных пород.
Водоносные горизонты содового глеевого (8) класса изучены слабо.
Возможно, с ними связано формирование родусита в мергелях Р;
Казахстана. По Ю. К. Андрееву и В. Н. Годовикову, родусит (щелоч-
312
ной амфибол с волокнистой структурой) нередко находится в пусто-
тах выщелачивания, в которых раньше располагался гипс. Местами
псевдоморфозы по гипсу представлены агрегатами зерен карбоната и
родусита. В полостях выщелачивания встречаются и новообразова-
ния альбита. Родуситовая минерализация выполняет небольшие жилы
и прожилки или же образует вкрапленники. Для жил характерна
опализация; образование родусита происходило синтектонично.
Тектонические движения, имевшие место после отложения пермских
пород, вероятно, оживили деятельность подземных вод. Двигаясь
по песчаным водоносным горизонтам, воды приобретали содовый
состав. Встречая на пути движения вкрапленники гипса, pH пони-
жался, воды становились менее щелочными и более сульфатными.
Уменьшение щелочности благоприятствовало осаждению из вод SiO2
и А), синтезу родусита на геохимическом барьере Е8. Вероятно, анало-
гичен механизм осаждения из содовых вод палыгорскита, широко рас-
пространенного в оглеенных пермских красноцветах Поволжья и При-
уралья (для него также характерен парагенезис с гипсом).
Водоносные горизонты сероводородного (сульфидного) ряда. Из-
вестны чисто химические реакции образования H2S, однако в биосфере
основное значение имеют микробиологические процессы восстановле-
ния сульфатов. Содержание H2S в водах, по А. В. Щербакову, достига-
ет 1000—2000 мг/л. Eh обычно ниже нуля, местами он понижается до
— 500 мВ. Там, где энергична деятельность бактерий, обычно происхо-
дит и наибольшее снижение Eh. Поэтому самый низкий Eh характерен
для водонефтяного контакта, где создаются особо благоприятные ус-
ловия для жизни бактерий. На водонефтяном контакте сульфатреду-
цирующие бактерии столь активно окисляют углеводороды, что в воды
поступает не только H2S, но и много СО2, pH их понижается, формиру-
ется кислый барьер ЕЗ, Е7, El 1. Происходит также окремнение извест-
няков, осаждение Й и Мо (в результате восстановления при более низ-
ком pH). Здесь совмещаются два барьера — восстановительный В и
кислый Е, концентрации имеют комплексный характер, например
ВЗ—ЕЗ.
На некоторых газовых месторождениях СССР, США, Канады,
Франции и других стран H2S поступает с больших глубин, на которых
десульфуризация невозможна из-за высокой температуры. Этот газ,
вероятно, образуется в результате термокаталитических процессов —
взаимодействия сульфатов с углеводородами (А. С. Уклонений), раз-
ложения сернистых нефтей (Л. А. Анисимов). Такой H2S имеет большое
практическое значение как сырье для получения S и H2SO4.
Сероводородные (сульфидные) водоносные горизонты формируются
также за пределами нефтегазоносных провинций: везде, где в подзем-
ных водах много сульфатов, есть органическое вещество и нет свобод-
ного кислорода. Нередко такие воды имеют важное бальнеологическое
значение, к районам их распространения приурочены курорты типа
Мацесты, Пятигорска и др. По Г. Н. Плотникову, в СССР имеется 12
областей сульфидных вод (четыре — в Средней Азии).
313
На контакте сероводородных вод с кислородными или с кислородом
воздуха серобактерии окисляют H2S с образованием элементарной
серы Такой кислородный барьер (Al 1 и А12) характерен для выходов
почти всех сероводородных источников. В прошлые геологические
эпохи в местах длительной разгрузки сероводородных вод на этом барь-
ере возникали месторождения S (Шорсу в Ферганской долине и др.),
(рис 89).
Рис 89 Кислородный барьер иа участке разгрузки сероводородных вод
(А 11)-
/ — водопроницаемые известняки, 2 — песчаники, 3 — водоупорные глины
В сероводородных водах биосферы практически неподвижны Си,
Zn, Pb и многие другие тяжелые металлы. Поэтому подземные воды,
связанные с сульфидным процессом, содержат мало халькофилов и
сидерофилов. Водные ореолы рассеяния вокруг рудных тел в ряде слу-
чаев при этом не образуются, и гидрогеохимические методы поисков
неэффективны.
В сероводородном (сульфидном) ряду известны все классы водонос-
ных горизонтов, наиболее распространен нейтральный и щелоч-
ной— 11. Известен и содовый сероводородный класс— 12 (гидро-
карбонатно-натриевые щелочные, сероводородные воды характерны для
Западно-Сибирского, Приташкентского и других артезианских бассей-
нов).
Былые водоносные горизонты сульфидного ряда легко диагности-
руются по серой или черной окраске, обязанной тонкорассеянному пи-
риту. К ним приурочены рудные тела многих сульфидных месторожде-
ний (типа медистых песчаников и др.).
П4
Биогенные ландшафты
В зависимости от ведущего типа миграции автор выделил три ря-
да ландшафтов', абиогенный (с физико-химической и механической миг-
рацией), биогенный (ведущее значение играет биогенная миграция) и
техногенный (все четыре типа миграции при ведущем значении техно-
генеза) .
Биогенные ландшафты — это сложные биокосные системы, в ко-
торых почва, кора выветривания, континентальные отложения, грун-
товые и поверхностные воды, растительность, животный мир, призем-
ный слой атмосферы тесно между собой связаны миграцией атомов и
образуют единое целое — таежный, тундровый, степной и прочие
ландшафты. Их изучением уже свыше 100 лет занимается география.
В 40-х годах XX столетия выявилось большое значение в их изучении
и геохимии, возникла геохимия ландшафта, основоположником кото-
рой был Б. Б. Полынов. В отличие от почв, илов, кор выветривания,
водоносных горизонтов в биогенных ландшафтах ведущее значение
имеет фотосинтез, в то время как в большинстве биокосных систем он
отсутствует, и их сущность определяется процессами разложения
органических веществ. В ландшафтах разложение также играет важную
роль, однако оно не определяет их главные особенности. Именно поэтому
самые крупные единицы геохимической систематики ландшафтов —
группы, выделяются по характеру фотосинтеза, т. е. особенностям рас-
тительного покрова, биомассе (Б) и годичной продукции (П). Так, раз-
личают группы лесных, степных и луговых, тундровых, пустынных и
прочих ландшафтов. Группы расчленяются на типы, типы — на
семейства. Например, в лесной группе выделяются типы влажных тро-
пиков, тайги и др., а в таежном типе — семейства северной, средней и
южной тайги. Типы и семейства различаются по годичной продукции
живого вещества. В пределах семейств главная роль в дифференциации
ландшафтов принадлежит водной миграции, по особенностям которой
выделяется следующая единица геохимической классификации ланд-
шафтов — класс. Различаются ландшафты сернокислого, кислого, со-
дового, кислого глеевого и других классов. Так как химизм вод в раз-
i ях частях ландшафта неодинаков (в почвах — один, коре выветрива-
I я — другой и т.д.), при выделении классов исходят из геохимических
особенностей горизонта А водораздельных почв (почвы центра ланд-
шафта) (рис. 90).
Геохимическая характеристика биогенных ландшафтов складыва-
ется из сведений об их биологическом круговороте, водной миграции,
геохимических барьерах, зонах выщелачивания, геохимических фор-
мулах и т.д.
Влажные тропики — ландшафты с наиболее энергичным биоло-
гическим круговоротом атомов. Тепло и влага — два главных условия
жизни — изобилуют во влажных тропиках, поэтому жизнь там про-
является во всем многообразии, число видов велико, деревья и травы
растут быстро. Если в северных лесах господствуют одна — две по-
315
роды, то в тропиках на небольшой площади встречаются сотни пород
деревьев. Следовательно, для влажных тропиков характерно исключи-
тельное разнообразие жизни — большое количество биологической ин-
формации. Биомасса здесь наибольшая на Земле — свыше 5 000 ц/га.
В. В Добровольский рассчитал содержание микроэлементов в фито-
массе влажных тропиков. Оно оказалось на порядок выше, чем в ле-
сах умеренного пояса. Разложение остатков организмов протекает
также быстро, микроорганизмы работают энергично, и биологический
Рис. 90. Схема типов связей в лесном ландшафте:
биокосные тела: П — почва. КВ кора выветривания, //— нл, ВГ ~ водоносный горизонт
КО континентальные отложения. ЛВ — поверхностные воды. .4 — приземная атмосфер».
Ф наземный биоценоз. Л — структурный центр ландшафта: типы связей: / — прямые
водные. 2- воздушные. 3 — обратные — биотические. 4 — биокосные. 5 - водные и воздушны*.
круговорот характеризуется невиданной в умеренном поясе скоро*
стью. В результате бурного разложения остатков организмов почвен-
ные воды обогащаются СО2 и органическими кислотами. В результате
кислого выщелачивания и на гранитах, и на базальтах, и на сланцах,
и даже на известняках формируются сходные кислые красные почвы и
коры выветривания. По В.А. Тенякову, именно во влажных тропиках
формируются латерит-бокситовые покровы. В депрессиях рельефа ши-
роко развивается оглеение, грунтовые воды нередко относятся к гле-
евому ряду и кислому классу. В местах, где глеевая обстановка сме-
няется окислительной (в краевых зонах болот, на дне озер и т.д.).
возникает кислородный барьер А6, на котором происходит окисление
Fe2+. В окислении важную роль играют железобактерии. Так обра-
зуются железистые аккумуляции в виде крупных конкреций и плит
316
латеритов (см. рис. 88). Но латериты образуются и элювиальным пу-
тем в почвах. В древних латеритах Танзании и Уганды В. В. Добро-
вольский установил накопление V, Сг, и Мо, в латеритах Кубы -
Со, Сг, Ni, Си.
Полного выноса подвижных элементов из почв тропиков, однако,
не происходит, так как часть их захватывается организмами и все вре-
мя «вращается» в биологическом круговороте. И все же ландшафт
очень обеднен Са. Это накладывает отпечаток на растительный и жи-
вотный мир. С дефицитом Са — важнейшим элементом скелета -- свя-
зывают небольшие размеры многих животных (в ходе эволюции живот-
ный мир приспособился к недостатку Са уменьшением размеров).
Кремнезем, образующийся при выветривании, выносится из почв и
коры выветривания. Почвенные, грунтовые и речные воды тропиков --
часто «кремнеземные» воды, поэтому высоко содержание кремнезема
и во многих тропических растениях, отдельные части которых как
бы «окаменевают» (болотный бамбук в полых стволах даже содержит
стяжения опала). В целом влажные тропики — ландшафты резкого
дефицита подвижных элементов. Организмы с помощью биогенной ак-
кумуляции лишь ослабляют эффект выщелачивания почв, но не могут
его предотвратить.
Во влажных тропиках преобладают ландшафты кислого класса,
ио известны и кислые глеевые (тропические болота), сернокислые,
кальциевые, соленосно-сульфидные (мангры).
Итак, главная геохимическая особенность влажных тропиков, от-
личающая их от других ландшафтов, — огромные биомасса и ежегод-
ная продукция, исключительно быстрый биологический круговорот, т.е.
большие скорости роста живого вещества и разложения остатков ор-
ганизмов. Большинство элементов периодической системы во влажных
тропиках включается в энергичную миграцию. Тяжелые металлы миг-
рируют вместе с органическими веществами в виде сложных органоми-
неральных комплексов. Характерна и коллоидная миграция, - обра-
зование коллоидных растворов и осаждение из них коллоидных осад-
ков — гелей.
Пустыни — ландшафты слабого влияния живого вещества на вод-
ную миграцию. Биомасса в пустыне в десятки и сотни раз меньше,
чем во влажных тропиках, число видов растений и животных также
много меньше. Почти полная минерализация органических остатков
до СО2, Н2О и простых солей определяет малое содержание восстано-
вителей в почвах и водах. В сочетании с малым количеством атмосфер-
ных осадков это обусловливает господство окислительной среды, высо-
кую валентность элементов (Fe3+, Se+, VB+, Ue+ и т. д.). Только в со-
лончаках развивается восстановительная среда, однако по сравнении'
с ландшафтами влажного климата очаги восстановления очень локали-
зованы.
Угольная и органические кислоты, образующие при разложении
органических веществ в пустыне, полностью нейтрализуются Са.
Na и другими катионами почв и пород, поэтому здесь преобладает ней-
317
тральная и щелочная среда. Кислая реакция наблюдается только на
участках окисления сульфидных и серных руд.
Малое количество органических веществ в водах определяет малую
роль коллоидной миграции, органомииеральных комплексов метал-
лов. Воды пустынь — это истинные растворы, в которых преобладают
ионы с низкой валентностью, часто с большими радиусами (элементы
I, II, VI, VII групп периодической системы). Из элементов III группы
в пустыне энергично мигрирует только В, образующий крупный ани-
он (ВОз~ и др.). Энергично мигрируют также Mo, Se, U, для которых
характерны крупные комплексные анионы — МоО-*, IUO2 (СО3)3)4-,
SeOl- и др. Местами подвижен и Сг (в форме CrOt~).
Следовательно, пустыня — это преимущественно царство низко-
валентных и крупных ионов. Элементы, образующие многовалентные ио-
ны небольших размеров, малоподвижны. Главная геохимическая осо-
бенность пустынь — слабое влияние живого вещества на водную мигра-
цию элементов.
Бедность вод органическими соединениями определяет бедность их
свободной энергией малую агрессивность. Нейтральные и слабощелоч-
ные, часто насыщенные растворы пустынь почти не обладают ни раст-
воряющей. ни разлагающей способностью, поэтому воздействие вод
на породы и почвы невелико (рис. 91).
Незначительное количество живого вещества косвенно определяет
и другую геохимическую особенность пустынь: растения слабо защи-
318
щают поверхность почвы от ветра, который является важным геохими-
ческим агентом и переносит огромные массы вещества. Даже в тихие
дни атмосфера запылена, а в дни бурь воздух насыщен пылью. Во вре-
мя одной из пыльных бурь пылевое облако только в пределах Туркме-
нии имело размеры 120x70 км, в воздухе было не менее 100 тыс. т пы-
ли. Даже дождевая вода содержала 10 г/л пыли, а каждый гектар зем-
ной поверхности за 10 мин получил 10 т пыли.
В сухом и жарком климате пустынь поверхностные и грунтовые во-
ды сильно испаряются содержание солей в них местами превышает
100 г/л (рассолы). Там, где такие грунтовые воды залегают на неболь-
шой глубине, они засоляют почву, образуются солончаки со специфи-
ческими растениями — солянками. Na, Cl и S — ведущие элементы
солончаков.
Геохимия ландшафта и проблема видообразования. По А. П. Ви-
ноградову, в химическом составе организмов запечатлены условия
формирования вида. Рассмотрим этот вопрос на примере основных
геохимических классов вод.
Сильнокислые воды (l-й класс) в прошлом, вероятно, были значитель-
но шире распространены, чем в современную эпоху, так как они харак-
терны для вулканических районов, которых ранее было больше. Фло-
ра и фауна таких районов была поставлена в очень своеобразные усло-
вия резкокислой среды (солянокислой или сернокислой), высокого
содержания в водах Fe, Al и ряда других элементов. С этими условиями
связано формирование особой «квасцовой флоры». В прошлом подоб-
ные ландшафты, вероятно, были центрами формирования видов орга-
низмов с весьма своеобразными геохимическими особенностями.
Другая разновидность сильнокислых вод формировалась в местах
выхода на поверхность сульфидных руд, окисление которых поставля-
ло в почвы и воды серную кислоту. Так возникли сернокислые ланд-
шафты, в которых, вероятно, энергично шел отбор на геохимической
основе, — они были центрами формирования видов организмов, обо-
гащенных Cu, Pb, Zn, Ni, Со и другими рудными элементами. Здесь
формировалась гумидокатная флора (и фауна?)
Кислые воды (2-й класс) в прошлом, как и в современную эпоху,
распространялись на огромных пространствах материков. Кислое
выщелачивание почв определяло эволюцию организмов в условиях рез-
кого дефицита многих важных биоэлементов, особенно Са, Mg, К и
других катионов. Вряд ли можно сомневаться, что подобные особенно-
сти среды, непрерывно существовавшие во многих областях на протя-
жении десятков миллионов лет, оказывали глубокое влияние на со-
став организмов, видообразование (гумидокатная флора). Организмы,
сформировавшиеся в этих условиях, приспособлялись к кислым водам,
низкому содержанию Са в среде, местами к повышенному содержанию
Fe, Al и Мп. Условия формирования известкового скелета были небла-
гоприятными, что способствовало уменьшению размеров животных.
Нейтральные и слабощелочные воды (3-й класс) преобладали в арид-
ных ландшафтах. Организмы здесь хорошо были обеспечены Са («киль-
319
циефильная флора»). Mg, К и другими катионами, местами наблюдался
их избыток. Условия для развития известкового и фосфатно-кальцие-
вого скелета были благоприятными. В щелочных водах легко мигри-
ровали аниоиогенные микроэлементы — V, Мо, Y, Sn, Ti, которые так-
же могли выступать в качестве факторов эволюции. Флора была аридо-
китной. Условия минерального питания организмов приближались к
оптимальным, в качестве важных геохимических факторов эволюции
приобретали значение дефицит воды и местами избыток солей.
Сильнощелочные (содовые) воды (4-й класс) характерны для ландшаф-
тов солонцов и содовых озер. Организмы здесь были поставлены в ис-
ключительно своеобразные условия сильнощелочной среды, дефицита
многих элементов (особенно Са, Fe, Mg, возможно также Ва, Со), по-
вышенного содержания непривычных для жизни редких элементов—
Си, Ag, TR, Zr, В, Мо, V и др. Биогеохимия многих из этих элементов
не изучена и можно только предполагать, какие своеобразные особен-
ности организмов обусловлены повышением содержания в них TR,
Y, Zr и других элементов. Следовательно, в этих ландшафтах также
был возможен отбор на химической основе.
Кислые глеевые воды (6-й класс) широко распространены в современ-
ную эпоху, много их было и в геологическом прошлом на заболочен-
ных тропических низменностях. Проблема влияния кислой глеевой
-среды на эволюцию жизни исключительно интересна. Особое внимание
следует обратить на роль растворенного органического вещества, так
как многие поколения животных пили здесь «коричневую воду», со-
держащую сотни различных органических соединений, многообраз-
ное влияние которых на жизненные процессы можно считать установ-
ленным (напомним, что в таких водах найдены и канцерогены, и веще-
ства типа витаминов, и многие другие физиологически активные сое-
динения).
Геохимия ландшафта и поиски рудных месторождений. В тундре,
тайге, влажных тропиках, пустынях и других ландшафтах вторичные
ореолы рассеяния образуются по-разному, фоновые и аномальные со-
держания элементов различны. Поэтому в начале поисковых работ про-
водится районирование территории по условиям поисков. На мелко-
масштабных картах районирования (1:500 000 и мельче) в первую оче-
редь отражается специфика конкретных геохимических методов по-
исков в отдельных районах, а также оптимальные сочетания методов.
На более детальных картах (вплоть до 1:50 ООО) отмечаются также фо-
новые и аномальные содержания элементов в различных ландшафтах,
геохимические барьеры и другие данные.
Успешный опыт такого районирования имеется для территории
Урала (М. А. Глазовская и др.), Украинского щита (Б. Ф. Мицкевич
и др.), Бурятии (Э. Ф. Жбанов, Т. Т. Тайсаев), трассы БАМ (И. А.
Морозова, В.Н. Макаров, В. 3. Тойбин и др.), Казахстана (А.Е. Са-
вадская, В. 3. Фурсов, Ю. А. Панков и др.), Северного Кавказа
(В. А. Алексеенко и др.).
320
Одна из наиболее сложных задач геохимических поисков — оцен-
ка аномалий. Устанавливая генезис аномалии, геохимия ландшафта
позволяет ее оценить. Особенно важно знать происхождение так назы-
ваемых «оторванных» аномалий, т. е. не связанных непосредственно с
рудным выходом. Пример такой аномалии типа В1 показан на рис. 92.
Если в гумидных ландшафтах на возвышенности располагаются суль-
фидные рудные тела, то их окисление приводит к образованию серно-
Рис. 92. Оторванная рудная аномалия В1 в краевой зоне болота:
1 — сернокислые грунтовые воды, обогащенные металлами, 2 — торфяное болото, 3
сероводородный барьер, 4 — сульфидный барьер в нижней части зоны окисления, 5 -
вторичные сульфидные руды
кислых грунтовых вод, обогащенных металлами. Двигаясь в сторону
депрессий рельефа, они могут встретить торфяное болото с глеевой сре-
дой, в которой возникают условия для бактериального восстановле-
ния SO1~ с образованием H2S. В результате в краевой зоне болота об-
разуется сероводородный барьер, не характерный для большинства гу-
мидных ландшафтов. Так появляется геохимическая аномалия, отор-
ванная от оруденения — В1 или В2, может быть также В6. Поэтому
накопление сульфидов в болотах, озерных и речных отложениях гу-
мидного климата может быть обязано окислению сульфидного орудене-
ния в области сноса.
Геохимия ландшафта и медицина. В. М. Мещенко показал, что
ландшафтно-геохимический анализ имеет большое значение для ре-
шения многих вопросов медицины, особенно для выявления природ-
ных факторов, благоприятствующих развитию болезней. На основе ге-
охимии ландшафта ученый выполнил медико-геохимическое райони-
11 Зак. 2022
321
рование территории СССР, установил зависимость распространения
многих болезней от типов и классов геохимических ландшафтов. Ланд-
шафтно-геохимические карты для медико-географической оценки се-
вера европейской части СССР составили В. В. Добровольский и
Г. А. Цветкова. Много данных о ландшафтно-геохимических условиях
локализации отдельных болезней. Так, по Т. М. Беляковой, очаги
эндемического флюороза в Казахстане приурочены к ландшафтам гра-
нитных массивов с высоким содержанием F. Этим исследователем с
А. В. Чаплиным показано значение геохимии ландшафта для онколо-
гии, а Л. М. Яновским — для стоматологии. Такого рода исследова-
ния, естественно, тесно связаны с учением о биогеохимических провин-
циях и геохимической экологией.
Поверхностные воды
Поверхностные воды различаются по уровням организации. Ручьи
и небольшие реки, маленькие озера являются частью ландшафтов или
же представляют собой самостоятельные ландшафты. Крупные реки н
озера включают много ландшафтов и относятся к биокосным системам
более высокого уровня. Еще выше уровень организации морей, океа-
нов.
В верхних горизонтах водоемов, куда проникает солнечный свет,
развивается фотосинтез (в основном за счет водорослей). Одновременно
происходит разложение органических веществ. Так, в освещенных го-
ризонтах поверхностных вод осуществляется биологический кругово-
рот — противоположные процессы образования и разложения орга-
нических веществ. Поэтому верхние горизонты водоемов близки к
ландшафтам. В глубоких водных слоях озер, морей и океанов, куда
не проникает солнечный свет, преобладает разложение органических
веществ, т. е. эти слои аналогичны почвам, илам, корам выветривания
и водоносным горизонтам.
Большинство поверхностных вод относится к окислительному ряду
и содержит растворенный О2, поступающий из атмосферы и за счет
фотосинтеза водных растений. К глеевому ряду относятся некоторые
зимние озерные и речные воды тундровой и таежной зон, свободный
кислород которых расходуется на дыхание рыб и окисление растворен-
ных органических соединений. Зимой его поступление из атмосферы
затруднено из-за ледяного панциря. В результате содержание О2
резко понижается, рыба начинает задыхаться, происходит ее «замор»,
известный на реках Западной Сибири, Белорусского Полесья и дру-
гих лесисто-болотистых низменностей. При вскрытии ледяного покрова
глеевые воды превращаются в окислительные. В целом такие воды от-
носятся к первому ряду. Воды сероводородного ряда известны в неко-
торых морях и заливах, где затруднен водообмен. Так, заражены H2S
глубокие горизонты Черного моря (глубже 200 м).
Геохимия поверхностных вод зависит от температурного режима.
Так, озера Арктики отличаются от экваториальных озер: раствори-
322
мость О2 на севере выше, скорость окисления органических веществ
меньше, так как в холодной воде бактерии работают медленнее, и т.д.
Все это позволяет, как и для илов, выделить холодные, умеренные и
теплые геохимические типы поверхностных вод в соответствии с тер-
мическими поясами. К холодным относятся также некоторые поверх-
ностные воды районов многолетней мерзлоты и водные массы океани-
ческих глубин. В пределах типов автор выделяет геохимические клас-
сы поверхностных вод, аналогичные классам почв, илов, кор выветри-
вания и водоносных горизонтов. Рассмотрим эти классы для кислород-
ных речных и озерных вод.
Воды сильнокислого (1-го) класса. Они известны в районах суль-
фидных рудных месторождений, где окисление пирита приводит к фор-
мированию сернокислых ручьев. Они имеют не только низкий pH,
но и обогащены металлами. Встречаются здесь и сернокислые («ку-
поросные») озера. Такое озеро вблизи Гайского медноколчеданного
месторождения на Южном Урале издавна использовалось с лечебны-
ми целями. В отработанных карьерах сульфидных месторождений ча-
сто возникают сернокислые пруды, на их берегах наблюдаются пест-
рые выцветы медных и других минералов. Сернокислые ручьи места-
ми образуются в результате «кислого водоотлива» из угольных шахт.
Следовательно, геохимическая деятельность человечества — техно-
генез — направлена к увеличению числа сильнокислых рек и озер. В вул-
канических районах в местах выхода на поверхность сильнокислых
термальных подземных вод известны кислые источники, озера, реки
(pH < 2), кислотность которых обязана растворению НС1, S02, и
других вулканических газов. В «солянокислых» реках растворено
много AI и Fe (К. К. Зеленое). В сильнокислых горячих источни-
ках Камчатки и Курильских островов обнаружены аминокислоты,
термофильные бактерии. Это биокосные гидротермальные системы.
Воды кислого (2-го) класса. Их формирование происходит в кислых
почвах при разложении растительных остатков. Воды содержат
мало растворимых минеральных веществ, обычно менее 100 мг/л («уль-
трапресные»). Чаще всего это гидрокарбонатно-кальциевые воды
(Са2+ — НСОз). Они богаты растворенным органическим веществом,
поэтому имеют коричневый цвет, напоминающий крепкий чай. Таковы
многие реки и озера районов влажного климата и равнинного релье-
фа— водоемы тундры, заболоченной тайги, влажных тропиков. В райо-
нах многолетней мерзлоты подобные воды встречаются и в горах.
К этому же классу относятся и черные тропические реки, например
приток Амазонки Рио-Негро (по-испански «черная река»). Под защи-
той органических веществ здесь мигрируют многие металлы. Это край-
не неравновесные системы, так как содержат и сильный окислитель
(О2) и сильные восстановители — растворенные органические вещества.
Вместе с тем эта биокосная система устойчива (стационарна).
Воды нейтрального и щелочного (3-го) класса. Нейтральные и ще-
лочные воды также распространены очень широко. Среди них выделя-
ются воды, богатые и бедные растворенным органическим веществом.
323
Первые встречаются в таежной и тундровой зонах в районах, сложен-
ных известняками или другими породами, содержащими растворимые
компоненты. Ведущее значение для формирования химического со-
става вод наряду с разложением растительных остатков имеет раство-
рение пород. Общая минерализация вод значительно выше, чем в кис-
лом классе, и составляет местами сотни миллиграммов на литр. Воды
гидрокарбонатно-кальциевые. Содержание органических веществ в
водах значительно, они имеют коричневый цвет, но все же светлее, чем
воды кислого класса.
Воды 3-го класса, бедные растворимым органическим веществом,
распространены в лесостепи, черноземных степях, горных странах.
Главное значение в формировании состава вод здесь имеет разложе-
ние растительных остатков и растворение карбонатов кальция в поч-
вах, корах выветривания, континентальных отложениях. Это воды
пресные, местами жесткие (в черноземных степях). Все же общее ко-
личество растворенных веществ обычно не превышает 1 г/л.
Для морей и океанов, соляных озер характерны сильноминерализо-
ванные (соленые) воды 3-го класса. Реже встречаются соленые ручьи и
реки. Летом при сильном испарении воды небольших рек сухих степей
и пустынь также могут осолоняться, а зимой и весной — опресняться.
Воды содового (4-го) класса. Наиболее характерны такие воды для
озер семиаридных районов (лесостепи и северные степи, саванны), но
известны и в пустынях. Классический район развития содовых озер в
СССР — западно-сибирская лесостепь (Барабинская низменность и
др.) В 1938—1939 гг. в штате Вайоминг (США) при поисках нефти и
газа были открыты ископаемые залежи троны (Na2CO3-NaHCO3 X
хЗН2О)— осадки эоценовых содовых озер. В 1964 г. из этих место-
рождений добывалось уже около 20 % соды, производимой в США.
Современные крупные содовые озера известны в Калифорнии, Восточ-
ной Африке и других местах. Процессы формирования содовых озер
разнообразны. Наряду с климатом большую роль во многих районах
играл вулканизм. Содовые реки редки.
Геохимия океана. Океан занимает почти 3/4 земной поверхности.
Это динамическая стационарная биокосная система, регулирующая со-
став атмосферы и литосферы. Океан составляет 80 % всей массы вод
земной коры — гидросферы, оставшиеся 20 % — поровые воды илов
и горных пород (18,8 %), ледяные покровы материков (1,2 %), реки и
озера (0,002 %), атмосфера (0,008 %).
Для характеристики баланса воды и вещества в океане использу-
ются геограммы — 1020 г и микрогеограммы — 10м г. Основным ис-
точником воды для океана служат атмосферные осадки над его поверх-
ностью (3,47 геограмм), примерно в 100 раз меньше дает речной сток
(0,32) и совсем ничтожен подземный сток (0,04). Главная расходная
часть — испарение с поверхности океана (3,83 геограмма). За 50 000
лет с речным стоком в океан поступает столько воды, сколько в нем
содержится в настоящее время. Определение в морской воде радиоак-
324
тивного изотопа 14С показало, что возраст водных масс — тысячи лет
(рис. 93).
Основную приходную статью баланса растворенного вещества в
океане, по Гаррелсу и Маккензи, составляет речной сток — 225 мик-
рогеограмм (рис. 94), с которым не могут конкурировать льды, под-
земный сток, глубины Земли (гидротермы и др.), морская эрозия, аэро-
золи, пыль, внеземные источники. Эти расчеты приблизительны. В по-
Рис. 93. Круговорот воды. Масса воды в геограммах (1020 г) (по Р. Гар-
релсу и Ф. Маккензи)
следние годы, например, пересмотрены представления о геохимической
роли подводных гидротерм — по А. П. Лисицыну и другим, они по-
ставляют в океан более 2/3 Mn, Li, Rb, от 1/3 до 2/3 Fe, Са, Si, Ва X
X(V, Со).
Если исходить из современного речного стока, то те соли, кото-
рые содержатся в океане, были привнесены в него меньше чем за
100 млн. лет. Для отдельных элементов эти числа еще меньше (для Si,
например, лишь 20 000 лет). Однако наряду с привносом происходит и
удаление элементов, главным образом в илы, а для Cl, Br, S, I и дру-
гих также в атмосферу при разбрызгивании, испарении, подъеме к по-
верхности пузырьков газа. Поэтому океан — не только аккумулятор
веществ, но и динамическая стационарная система. Существует гран-
диозная система динамического равновесия — донные отложения океа-
на, солевой раствор, живое вещество, газы атмосферы. Модель такой
системы разработал американский геохимик Р. Гаррелс.
325
В океанической воде растворены газы, ионы, органическое вещест-
во, минеральные и органические коллоиды, содержатся взвеси и жи-
вые организмы. Объем растворенных газов в океане в 3 раза больше,
чем объем самой воды. Это в основном СО2, в меньшей степени N2, О2
и Аг. Содержание других газов ничтожно (Ne— 1,8-10“4 смэ/л, Не,
Кг, Хе — еще меньше). Средняя соленость открытого океана 3,5 %,
она колеблется незначительно и только во внутренних морях и заливах
наблюдаются заметные отклонения.
Рис. 94. Круговорот веществ в океане. Масса веществ в микро-
геограммах— 10й г (по Р. Гаррелсу и Ф. Маккензи)
Еще более постоянно соотношение между ионами. В океанической
воде преобладают О (85,7), Н (10,8), С1 (1,94) и Na (1,07). В сумме
они составляют 99,5 %. Следовательно, океан представляет собой
раствор поваренной соли с незначительной примесью других элемен-
тов (0,5 %). Вместе с тем в океанической воде обнаружены почти все
элементы вплоть до Au (4-10’10 %) и Ra (1 • 10-u %). Важнейшая
форма нахождения элементов — ионная (рис. 95).
Кларки концентрации элементов в океане именуются талассофиль-
ностью (относительно кларков земной коры). Она велика у С1 (111),
Н (71) и Вг (30) и мала у Fe (4,3- IO'8), Si (6,8-10“6), Ва (3- Ю’5), Р
(6-10~5) (рис. 96). Элементы с высокой талассофильностью надолго
задерживаются в океане, с малой — быстро его покидают. Зная общее
количество элемента в океане и его ежегодный привнос реками, можно,
326
как это впервые показал Т. Барт, ориентировочно рассчитать «вре-
мя пребывания элемента в океане». Элементы, образующие ионы легко-
растворимых солей (Na+, С1~, Вг~ и т. д.), накопились в океане, их
«время пребывания» — сотни и десятки миллионов лет (С1—3,05-108
лет, Na — 1,93-108 лет и т.д.). Время пребывания многих металлов
меньше (Ti — 7,8-103 лет, Fe — 5,8-102 лет и т.д.), они не накаплива-
ются в морской воде.
Расчеты показывают, что большая часть катионов поступила в оке-
ан с речным стоком: они — продукты выветривания пород материков.
Однако выветривание не обеспечило большое количество С1 и других
анионогенных элементов. Действительно, отношение Na/Cl в литосфере
близко к 150, а в океане около 0,5. Если бы источником С1 были толь-
ко породы материков, то океан имел бы не хлоридный, а гидроксильный
состав, среди анионов преобладал бы ОН~, вода была бы сильнощелоч-
ной, а жизнь в современных формах невозможной. О различных источ-
никах катионов и анионов говорит и сравнение талассофильности: для
О — 111, для Na —0,42, т. е. для Na в 264 раза меньше. По
В. М. Гольдшмидту, важнейшим источником Cl, S, As, Br, I и других
неметаллов были вулканы, периодически извергавшие в атмосферу и
гидросферу (подводные вулканы) огромные количества НС1, СО2, HF
и других газов.
Фитомасса океана близка к 1,1-10* т, на 70% она состоит из диато-
мовых водорослей. Зоомасса океана составляет 2,89- 1010т, т. е. в отли-
чие от материков в океане животных в 30 раз больше, чем растений.
Хотя биомасса океана относительно мала, а в расчете на 1 га меньше,
чем в пустынях, скорость биологического круговорота здесь исключи-
тельно велика и роль его в геохимии океана очень значительна. Осо-
бенно это относится к С, О, N, Р, К, Са и другим макроэлементам био-
логического накопления.
Многие организмы концентрируют из морской воды и микроэле-
менты (при расчете на сухое вещество). Например, водоросли ламина-
рии накапливают I, радиолярии Acantharia — Sr, фораминиферы —-
Ва, некоторые моллюски — Ni, омары и мидии — Со, медузы — Zn,
Sn, осьминоги — Си, асцидии — V, некоторые другие виды оболоч-
ников — Nb и Та. Накопление микроэлементов привлекает внимание
специалистов по гигиене и химиков-технологов. Из ламинарий уже
давно извлекается в промышленных масштабах I, японские ученые
разработали технологию получения из асцидий V.
Главным источником СО2 для океана является атмосфера, причем
в океане растворено примерно в 60 раз больше СО2, чем его содержится
в атмосфере, поэтому океан — регулятор СО2 атмосферы. Это было ус-
тановлено в XIX столетии Т. Шлезингом. Содержание СО2 в океане
зависит и от биологического круговорота (фотосинтеза, дыхания), тем-
пературы, давления.
Биогенные процессы определяют и режим свободного кислорода в
океане. Важное значение имеет температура вод: холодные воды арк-
тических и антарктических морей способны растворить больше О2.
327
10.8 н Он' Н2О
0,18 Li 5,6-10"’ Be 8e(OH) + ’4,44 В H38O3
1.077‘10* Na Na* 1.29-103 Mg Mg2*' MgSO4 • 2-IO-3 Al AI(0h)3; AI(OH)'
3,8-103 К к* 4,12.10* Ca Ca3’ CaSO4 6-IO-7 Sc Sc(OH)3 T10"3 Ti ТЦОН)4 <> ’<4« Д < ?> o' I 2 > ° £ 3'10'* Cr Cro’- Сг(ОН>э 2'10“* Mn Mn’*;MnSO4; MntOH), MnCI+ 2-IO-3 Fe Fe(OH), 5-WB Co Coa*;CoCI*; CoSO4 CoCO3
0.12 Rb Rb* 8 Sr Sr2* ; SrSO4 1,3‘io-e Y(OH)3 3-1O'6 Zr Zr(OHt4 1-10~s Nb г-ю-3' Mo Mooj" Tc Ru Rh
4'10'* Cs Cs* 2-1<Г3 Ba Ba3* BaSO4 3-10"’ La La(OH)3 7'10"* Hf 2-10-’ Ta V10-* w . woj” 4'10“® Re ReO4 Os ir
Fr 7-10“” Ra Ra2* ; RaSO4 2-10",e Ac 1-10'5 Th Th (0H)4 S-IO"” Pa 3-10"3 и UO2(CO3)^
1-10-’ Ce 6-1O-7 Pr 3-10'e Nd Pm B-W* Sm 1'10“* Eu 7'10“’ Gd 1-10-7 Tb 9«10“7 Dy
Ce(OH)3 Pr(OH>3 Nd(OH)3 — Sm(0H)3 Evi (OH)3 Gd(OH)3 Tb(OH)3 Dv(OH)3
Рис. 95. Среднее содержание в мг/л химических элементов в морской воде
вовання элементов (по разным авторам). Ведущие элементы обведены
6,8-10'’ He He(r)
28 c CO3”;HCO3; H2CO3 органическ. соединен. 5«10"4 N N3(r); nhJ; NOJ;NO2; органическ. соединен. 85,7 О O2(r); H20; SO*~ и др. анионы 1.3 F F"; MgF* 1^-10”* Ne Ne |r)
2 si SHOH)4 : Si(OH)3O- 6-10'2 p HPoJ“; HaPO^PO?"; H3PO4 ; MgPo; ' 9,05-102 s so2' n.so; 1,94-10* Cl cr 0,43 Ar Ar(r)
1,7.10-» Ni ni1*: NiSO4 5«10“* Cu Ou^’CuCi*; CuSO4; CuOH* CuCO3 4.9-10"3 Zn Zn2* : ZnOH*: ZnSO4; ZnCO3 з-io-6 Ga Ga(OHi; 5-10"’ Ge Ge(OH)3O" 3.7-1 O'3 ' As HAsOj“ ; H2AsO7 ; H3A$O4 ; H3AsO3 2Ч0-* Se 67 Br er 2Ч0-4 Kr Kr(rt
Pd 4-lO~6 Ag AgClj ; AgCiJ” 1’10-* Cd Cd*.- CdSO.; Cd Cl2”"; CdlOH)2”" 1-10'2 In ln(OH|* 1-10”’ Sn SnO(OH}j 2,4’10”* Sb Sb(OH|“ fe HTeO3 8-10~2 J J': JO, 5-10'B Xe Xefrj
Pt I 4-10”’ Au AuCl^ 3-10”5 Hg HgCl3 : HgCtj 1-10'6 TI TI* 3-1 O'5 Pb Pb(OH)*: Pb2*;PbSO4; РЬС1*П Pb(OH)2 Pb(CO3); Pb(CO3)2' 2-1O“5 Bi BiO* 8t(0H)* P~o At 6-10'” Rn Bn(r)
2-1O”7 Ho 8* 10”7 Er 2-10-2 Tm 8’10”7 Yb 2-10'’ Lu
Ho(OH)3 Er(OH)3 Tm(0H)3 Yb(OH)3 Lu(0Hl3
(НиО в %) по П. Хендерсону (с дополнениями) и основные формы сусцест-
жирной линией
Хотя изотопный состав воды океана в целом постоянен, все же раз-
личные процессы несколько изменяют содержание тяжелых изотопов
Н(2 Н — D) и О (18О). При испарении удаляется больше легких изо-
топов, поэтому верхние слои океана обогащаются D и 18О. Опреде-
ление этих изотопов используют для изучения динамики вод. Ценную
информацию содержат данные по распределению радиоактивного изо-
топа Н — трития (3Н — Т).
Осаждение химических элементов из океанической воды происхо-
дит в результате механических, физико-химических и биологических
Ряс. 96. Талассофнльность элементов (по А. И. Перельману)
330
процессов. Главная форма нахождения взвешенного осадочного мате-
риала в центральных частях океанов—биогенная. А. П. Лисицын и
другие установили механизм транспортировки взвешенного материа-
ла на дно океана. Он связан с фильтрацией океанической воды через
зоопланктон в процессе питания. Объем наиболее заселенных вод оке-
ана (до глубины 500 м) зоопланктон отфильтровывает за 20 суток. При
этой биофильтрации органические и минеральные микровзвеси кон-
центрируются в фекальных комках — пеллетах размером от несколь-
ких десятков микрометров до 1—4 мм. Скорость оседания пеллетов на
3—4 порядка выше, чем у исходных частиц («фекальный экспресс»).
Такая седиментация, следовательно, не имеет ничего общего с меха-
нической дифференциацией — фракционированием речных взвесей
(рис. 97).
Согласно А. П. Лисицыну, Е. М. Емельянову и другим исследовате-
лям, океаническая седиментация зависит от климата, причем выделяют-
ся четыре основные широтные зоны осадкообразования (в направле-
нии от полюсов к экватору) — ледовая, умеренная гумидная, аридная
и экваториальная гумидная. Биогенное осадкообразование крайне ос-
лаблено в ледовой зоне, слабо проявляется в аридной и очень энергич-
но в гумидных зонах.
Основная масса терригенного материала, приносимого реками,
осаждается по периферии океана («лавинная седиментация») и участия
в пелагической седиментации не принимает. Эти новейшие построе-
ния литологов-геохимиков сближают геохимию океана и ландшафтов,
так как в обоих случаях ведущую роль играет биологический кругово-
рот.
Эксперименты и расчеты К. Краускопфа показали, что морская во-
да не насыщена большинством микроэлементов, поэтому главную роль
в удалении металлов из морской воды играют биогенная аккумуляция
и сорбция.
С деятельностью вулканов связан вулканогенно-осадочный лито-
генез, характерный и для материков и для океанов.
На океаническом дне открыты крупные залежи железо-марганце-
вых конкреций. В среднем они содержат 20 % Мп (от 8 до 40%).
16 % Fe, 0,33% Со (0,02—2,5%), 0,6% Ni (0,2—2,5 %), 0,35 % Си
(0,03—1,6 %) и т. д. Запасы конкреций (2,5-1012т) на два порядка
превышают суммарные запасы руд Fe и Мп на континентах. Грандиоз-
ны запасы Со, Ni и Си. Условия образования конкреций выяснены еще
недостаточно, в пелагиали океанов конкреции образуются не так, как
в краевых частях океанов, придаточных морях и озерах.
Е. М. Емельянов установил в Атлантическом океане многочислен-
ные геохимические барьеры («геохимические барьерные зоны» по авто-
ру — ГБЗ) — механические, физико-химические и биогеохимические
По размерам различаются макро-, мезо- и микрозоны. Выделяется во-
семь горизонтальных и девять вертикальных ГБЗ, которые характер-
ны как для шельфа, так и для материкового склона и глубоководных
частей океана. В качестве барьерных зон фигурируют и береговая по-
331
лоса (граница суша — море), и участки подъема к поверхности глу-
бинных холодных вод (апвеллинг), и область разгрузки гидротерм на
дне, и слой воздух — вода, и слой фотосинтеза, и многие другие барь-
еры. Для каждого из них характерны определенные процессы концент-
рации элементов, для многих — рудообразование. Например, при
подъеме из глубин холодных водных масс, богатых СО2, Р, и другими
биогенными элементами, на горизонтальной барьерной зоне апвел-
линга (II горизонтальная зона) энергично развиваются фитопланктон,
рыбы. С органическим детритом, скелетами диатомовых водорослей и
костями рыб концентрируются С, Si, Р, N, Fe, Си, Zn, Мп, Ni, Мо, Ва
и другие элементы, которые частично накапливаются в илах. Здесь
образуются аутигенные фосфориты. (Биохимический и физико-хими-
ческий механизм этого фосфоритообразования получил наименование
«Эффекта Батурина»), В зоне берег — море (VII горизонтальная ба-
рьерная зона — литораль) преобладает механическая дифференциа-
ция, накопление обломочного и песчаного материала, элементов рос-
сыпей (Ti, Zr и др.). Слой воздух — вода представляет собой I верти-
кальную барьерную зону, где в пленке воды мощностью 0,1 1 мм
происходит резкое изменение физико-химической обстановки, проте-
кают процессы сорбции и десорбции, обогащение взвеси Fe, A\n, Ni,
Pb и другими металлами (до 10—1000 раз), биохимическая дифферен-
циация элементов. К VI вертикальной барьерной зоне Е. М. Емелья-
нов относит верхний слой осадка на глубине от 0,1 до 5.0 м с различны-
ми биогеохимическими и физико-химическими барьерами, изменением
Eh и pH, энергичной сульфатредукцией.
Таким образом, теория геохимических барьеров позволяет с единых
позиций систематизировать все разнообразие процессов концентрации
элементов в водной массе морей и океанов и на их дне в ходе седиментоге-
неза и диагенеза.
К концепции океанических геохимических барьеров близки построе-
ния Т. А. Айзатуллина, В. Л. Лебедева и К. М. Хайлова, согласно кото-
рым физические, химические и биологические процессы в океане сосре-
доточены в сравнительно узких «зонах активной трансформации ве-
ществ и энергии», прилегающих к граничным поверхностям океана. Та-
кие поверхности часто служат геохимическими барьерами в нашем по-
нимании. Например, отмечается, что «своеобразным биогеохимическим
фронтом» служит контакт кислородных и сероводородных зон, т. е.
барьеры АП и В7 по нашей систематике. Большое значение придается
также поверхностям, образующимся при механическом дроблении час-
тиц. Эти «ювенильные» поверхности сорбируют микроорганизмы и фер-
менты, являются катализаторами многих процессов, в том числе синтеза
углеводородов. К числу самых активных границ авторы относят по-
верхность живых организмов в связи с их ролью в биофильтрации. Ав-
торы описывают «гидрофронты — жидкие границы в океане», «биогео-
химический фронт» и другие границы. Подчеркивается, что для погра-
ничных слоев характерны особые структуры, отличные от обеих гра-
ничащих сред. Здесь происходит «сгущение» всех свойств и появление
333
качественно новых свойств, растет упорядоченность энергии и вещест-
ва, самоорганизация. Эти построения существенны как для геохимии
океана, так и для общей методологии геохимии.
Биосфера
Элементы современной концепции биосферы были развиты в нача-
ле XIX столетия великим французским натуралистом Ж. Б. Ламар-
ком. В 1875г. известный австрийский геолог Э. Зюсс (1831—1914) на-
ряду с атмосферой, гидросферой и литосферой выделил в качестве са-
мостоятельной оболочки Земли биосферу — сферу жизни. Однако Зюсс
проблемой биосферы не занимался и в последующие 40 лет, вплоть до
работ Вернадского, биосфера не привлекала внимания исследовате-
лей *.
Биосфера — сложная динамическая система с огромным числом
случайных факторов и вероятностным характером многих процессов.
В ее состав входят тропосфера, Мировой океан, литосфера до слоев с
температурой, ограничивающей деятельность бактерий.
В формировании биосферы несомненна роль солнечной энергии»
поднятий и опусканий земной коры, горообразования, ледников и дру-
гих внешних факторов. Все они приводят в движение мощные внутрен-
ние механизмы биосферы, которая развивается по специфическим за-
конам.
Главный механизм, определяющий единство и целостность биосфе-
ры, —биологический круговорот атомов. Большую роль играет и круго-
ворот воды. Его до известной степени можно сравнить с биологическим
круговоротом, так как источником энергии в обоих случаях служит
Солнце. Только круговорот воды — главный агент механической ра-
боты, а биологический круговорот — химической. Правда, вода тоже
выполняет химическую работу (растворение, выветривание и т.д.), но
она в основном осуществляется при участии живого вещества — или
за счет организмов, находящихся в водах, или за счет таких продуктов
их жизнедеятельности, как СО2, гумус и другие химически активные
вещества.
О грандиозной энергетической роли живого вещества как аккуму-
лятора солнечной энергии уже говорилось. Аккумуляторами являют-
ся и сульфиды: чтобы восстановить серу (SOI- -► S1 2-) и железо
(Fe3+ -► Fe2+), надо затратить энергию, и она в скрытом виде содер-
1 Ниже биосферы на материках располагаются горные породы, формирова-
ние которых прямо или косвенно связано с жизнью. Это осадочные породы и
гранитный слой — область «былых биосфер», по Вернадскому, «метабиосфера»,
по Н. Б. Вассоевичу. Выше биосферы располагается безжизненная зона распро-
странения газообразных продуктов жизни — апобиосфера, по Вассоевичу. Со-
вокупность биосферы, метабиосферы и апобиосферы Вассоевич именует «мега-
биосферой» или «панбиосферой».
334
жится в пирите и других сульфидах. Пирит — наиболее распростра-
ненный сульфид и поэтому главный геохимический аккумулятор сре-
ди сульфидов. Меньшую роль играют сульфиды Cu, Zn, Pb, Ag и дру-
гих металлов. Но и они также «запаслись» энергией, которую отдают
окружающей среде при окислении на земной поверхности. Поэтому в
зоне окисления сульфидных руд повышается температура, в Сибири
тает вечная мерзлота, во многих странах на участках разработки суль-
фидных руд известны «колчеданные цожары». Энергия выделяется и в
химической форме, так как при окислении пирита образуется серная
кислота, разрушающая окружающие породы.
Богатство свободной химической энергией определяет неравнове-
сность биосферы, присутствие в ней веществ с противоположными свой-
ствами, как, например, сильных окислителей — свободного кислорода
и сильных восстановителей — органических веществ. В соответствии
с законами термодинамики в биосфере протекают окисление органи-
ческих веществ и другие процессы, направленные к достижению рав-
новесия, однако оно никогда не достигается, так как новые порции
активных соединений все время поступают в систему или образуются
в ней за счет солнечной и другой энергии. Особенно характерна не-
равновесность для живых организмов, поверхностных вод и почв.
Это не исключает существования равновесия, которое, однако, имеет
частное значение. Неравновесна биосфера и в механическом отношении,
так как в ней не прекращается течение рек, перемещение водных масс в
океанах, воздушных — в атмосфере.
Биосфера представляет собой гигантский «химический комбинат»,
на котором из смеси веществ (изверженные породы, морская вода и
т. д.) получаются простые и чистые соединения, состоящие порой из
двух-трех главных элементов. Продукцией этого «комбината» являются
и целые горы поваренной соли, образованной из двух элементов — Na
и Cl — и толщи известняков (Са, С, О), латериты (Fe, Al, О, Н) и т.д.
Следовательно, поступление в биосферу солнечной энергии и ее преобра-
зование в энергию геохимических процессов приводит к дифференциа-
ции химических элементов, росту разнообразия, накоплению информа-
ции, уменьшению энтропии.
Биосфера чрезвычайно разнообразна, ее единство как особой обо-
лочки Земли воспринимается не сразу. Что же позволяет рассматри-
вать атмосферу, почву, океан и другие природные системы как части
единого целого? Существуют ли «сквозные» природные процессы, ха-
рактерные для всех частей биосферы? Таким процессом является раз-
ложение органических веществ. Действительно, и в организмах, и в
почвах, и в илах, и в поверхностных водах, и в глубоких водоносных
горизонтах происходит разложение органических веществ, выделение
аккумулированной в них солнечной энергии. В результате в окружаю-
щую среду поступает химическая энергия, носителями которой по пре-
имуществу являются природные воды. Отсюда понятно геохимическое
сходство почв, илов, кор выветривания, водоносных горизонтов и по-
верхностных вод. Все эти биокосные системы характеризуются одина-
335
ковыми или близкими термодинамическими условиями — температу-
рой и давлением, в них развивается биологический круговорот, основ-
ной средой миграции служит вода. По существу, во всех случаях клас-
сифицируют одно и то же образование — природные воды в их различ-
ных формах. Поэтому, отмечая существование в биосфере отдельных
биокосных систем, необходимо учитывать не только их различия, но и
то общее, что их объединяет в одну категорию природных образо-
ваний.
Принципиально иными биокосными системами являются ландшаф-
ты суши и верхние горизонты океана, где протекает не только разло-
жение органических веществ, но и их образование из минеральных со-
единений — фотосинтез. Поэтому по процессам разложения органи-
ческих веществ биосфера едина, а по процессам их образования, как
показал автор, разделяется на две части. Верхнюю часть, куда прони-
кает солнечный свет и где возможен фотосинтез, Е. М. Лавренко пред-
ложил именовать фитосферой (фитогеосферой), а Н. Б. Вассоевич —
фотобиосферой. В нижнюю часть биосферы солнечный свет не прони-
кает, там фотосинтез невозможен и биомасса из минеральных соедине-
ний практически не образуется. Это область почвенных, грунтовых,
подземных вод на материках, темных глубин морей и океанов. Автор
предложил именовать эту зону редусферой, Н. Б. Вассоевич — афо-
тобиосферой, А. В. Лапо — мелонобиосферой.
Большой научный и практический интерес представляет вопрос
о центре биосферы, т. е. такой ее части, которая играет ведущую
роль, определяет своеобразие биосферы в целом, «управляет» этой
сложной системой. Нетрудно доказать, что таким центром служат
ландшафты суши, а точнее — лесные ландшафты. Это объясняется
тем, что именно здесь сосредоточена основная масса живого вещества
планеты — главного геохимического агента биосферы. Именно в ланд-
шафтах протекают процессы разложения органических веществ, фор-
мирующие химический состав поверхностных и грунтовых вод. Сток
этих вод оказывает глубокое влияние и на процессы, протекающие в
морях и океанах. Ландшафт — это «клеточка биосферы», для которой
характерны основные особенности этой системы. Вместе с тем ландшафт
не велик по размерам, легко доступен для исследования, что определя-
ет большое методологическое значение геохимии ландшафта для изу-
чения и других биокосных систем и биосферы в целом. Возможно, что
к центру биосферы следует отнести и верхние горизонты океана, где
протекает фотосинтез.
Контрольные вопросы
1. Что такое биокосная система, приведите примеры, кто ввел в науку это
понятие и когда?
2. Что такое биогенное накопление элементов в почвах, кто из геохимиков
впервые открыл и объяснил это явление?
3. Охарактеризуйте окислительно-восстановительную зональность в элю-
виальных почвах.
336
4, Что общего в геохимии почв, илов и коры выветривания, в чем отличия?
5. Охарактеризуйте геохимию конкретного класса коры выветривания,
6. Чем доказывается биокосиая природа водоносных горизонтов, на чем
основана их геохимическая систематика?
7. Расскажите о геохимии сильнокислых и сильнощелочных подземных вод.
'8. Приведите пример геохимического барьера в водоносуых горизонтах.
9. Чем занимается геохимия ландшафта, дайте геохимический анализ кон-
кретного типа или класса ландшафта.
10. Какова роль ландшафтно-геохимнческих исследований в повышении
эффективности геохимических поисков руд?
II. Приведите пример геохимической характеристики рек и озер.
12. Что такое «талассофильность», от чего она зависит?
13. Охарактеризуйте основные черты геохимии океана, роль живого веще-
ства в нем.
14. Дайте определения понятию «биосфера», охарактеризуйте ее важнейшие
геохимические особенности.
15. Какие процессы в биосфере характерны для всех ее частей?
16. Охарактеризуйте две резко различные группы биокосных систем био-
сферы.
17. Что понимать под центром биосферы?
18. Каково значение геохимии ландшафта для изучения биосферы?
ТЕХНОГЕННАЯ
МИГРАЦИЯ
«Человек геохимически переделывает
мир».
А. Е. Ферсман
Человечество, осуществляющее техногенную миграцию, еще плохо
знает ее законы, — те новые явления, которые стали возникать на
нашей планете. Что же принесла эта новая геохимия Земли? Что она
сулит в будущем? Эти вопросы затрагивают интересы всего населения
земного шара, тесно связаны с материальной и духовной жизнью людей,
с их здоровьем и долголетием. Геохимический анализ деятельности че-
ловечества исключительно важен.
17. ОБЩИЕ ОСОБЕННОСТИ ТЕХНОГЕННОЙ МИГРАЦИИ
Геохимическую деятельность человечества А. Е. Ферсман назвал
техногенезом. Ученый анализировал его с общих методологических по-
зиций геохимии, выяснял, как зависит использование элементов от их
положения в периодической системе, размеров атомов и ионов, клар-
ков. Та часть планеты, которая охвачена техногенезом, представляет
собой особую систему — ноосферу. В. И. Вернадский писал в 1944 г.:
«Ноосфера есть новое геохимическое явление на нашей планете. В ней
впервые человек становится крупнейшей геологической силой. Он
может и должен перестраивать своим трудом и мыслью область своей
жизни, перестраивать коренным образом по сравнению с тем, что было
раньше. Перед нами открываются все более и более широкие творче-
ские возможности».
В науках о Земле ноосфера рассматривается как планетное
явление, как особый этап развития планеты, как особая ее обо-
лочка, в которой проявляется деятельность человеческого общест-
ва. Изучение геохимии ноосферы и техногенеза составляет теоре-
338
тическую основу рационального использования природных ресур-
сов, охраны природы и борьбы с загрязнением окружающей сре-
ды. Эти исследования быстро развиваются. М. А. Глазовская раз-
работала теорию техногенеза на базе геохимии ландшафта.
В разработке проблем ноосферы особенно важен контакт с другими
науками, в частности с экономической географией, к чему неоднократ-
но призывал Ю. Г. Саушкин. Его идеи о преобладании территориаль-
ной концентрации над территориальным рассеянием, о поляризации
различных участков ноосферы и другие важны и для геохимии. Инте-
ресна мысль ученого о своего рода «нервных узлах» ноосферы — огром-
ных концентрациях ученых, студентов, библиотек, сокровищ культу-
ры в столичных и университетских городах, крупных промышленных
центрах.
В целом концепция ноосферы разработана слабо, хотя не вызывает
сомнений основной тезис В. И. Вернадского и А. Е. Ферсмана—чело-
вечество стало мощной геохимической силой. Согласно О. П. Добро-
дееву, по масштабам многие процессы техногенеза намного превышают
природные. Так, ежегодно из недр извлекается много больше метал-
лов, чем выносится с речным стоком (РЬ— почти в 70 раз, Сг—в 35,
Си — в 30, Р — в 20, Fe, Мп — в 10, Zn, — в 5, Al — в 3 раза и т.д.).
Только при сжигании угля освобождается больше металлов, чем вы-
носится с речным стоком (V — в 400 раз, Мо — в 35, Сг — в 20 раз и
т. д.).
В ноосфере происходит грандиозное перемещение атомов, их рас-
сеяние и концентрация. Ежегодно в мире перемещаются миллиарды
тонн угля, нефти, руд и стройматериалов. В течение немногих лет рас-
сеиваются месторождения полезных ископаемых, накопленные при-
родой за миллионы лет. С продукцией сельского хозяйства и про-
мышленности атомы мигрируют на огромные расстояния. Так, по рас-
четам М. А. Глазовской, с экспортом и импортом зерна в мире ежегод-
но мигрируют миллионы тонн К, сотни тысяч тонн Р и N, что лишь
в 10—100 раз меньше ионного стока рек в океан.
Ноосфере свойственны и механическая, и физико-химическая, и био-
генная миграция, но не они определяют ее своеобразие: главную роль иг-
рает техногенная миграция. В первобытном обществе ее эффект был
незначительным, но уже в государствах античного мира, коренным об-
разом изменивших природу долин Нила (Египет), Амударьи (Хорезм),
Тигра и Евфрата (Вавилония), Хуанхэ (Китай), техногенез стал важ-
ным геохимическим фактором. Поэтому этап геологической истории,
начавшийся около 8000 лет назад, В. А. Зубков предложил называть
технозойским или техногеем.
В XX в. техногенез стал главным геохимическим фактором на по-
верхности Земли. Ежегодно добывается около 100 млрд, т минераль-
ного сырья и каустобиолитов, горные и строительные работы переме-
щают на менее 1 км3 горных пород, что соизмеримо с денудационной
работой рек (Е. М. Сергеев). Происходит «диспергирование и эолиза-
ция вещества суши» (В. А. Ковда), которые ведут к возрастанию геохи-
339
мической роли поверхностей энергии и сорбции. Мощность производ-
ства удваивается каждые 14—15 лет. Следовательно, первое сущест-
венное отличие ноосферы от биосферы—огромное ускорение миграции.
В последние десятилетия интерес к геохимии техногенеза и ноосфе-
ры связан преимущественно с проблемой загрязнения окружающей
среды. Соответствующий раздел геохимии А. А. Кист предложил име-
новать ноохимией (геохимией ноосферы).
Две группы процессов техногенеза. Первая группа процессов унас-
ледована от биосферы, к ней относятся биологический круговорот, кру-
говорот воды, рассеяние элементов при отработке месторождений, рас-
пыление вещества и многие другие. При их изучении можно использо-
вать понятия и методы, разработанные для анализа природных про-
цессов. Техногенная миграция второй группы находится в резком про-
тиворечии с природными условиями. Так, характерное для ноосферы
металлическое состояние Fe, Ni, Сг, V и многих других элементов не
соответствует физико-химическим условиям земной коры. Человек
здесь уменьшает энтропию, ему приходится тратить много энергии,
чтобы получить и содержать данные элементы в свободном состоянии.
Ни в одной системе космоса мы не встречаемся с такими реакциями,
которые бы шли столь очевидно в разрез с законом энтропии, отмечал
А. Е. Ферсман. Во все большем количестве в ноосфере изготовляются
химические соединения, никогда в биосфере не существовавшие и об-
ладающие свойствами, не известными у природных материалов (ис-
кусственные полимеры, лекарства, краски, сплавы и т.д.). Новым для
земной коры является и производство атомной энергии, радиоактивных
изотопов, сверхчистых веществ.
Для характеристики процессов второй группы существующий по-
нятийный аппарат геохимии недостаточен. Необходимы новые подходы
к исследованию.
Использование химических элементов. В 1915 г. В.И. Вернадский
подсчитал, что в античную эпоху использовалось лишь 19 элементов,
в XVIII в. — 28, в XIX — 50, а в начале XX в. — 60. Теперь исполь-
зуются все 89 химических элементов, известных в земной коре. Нача-
лось также искусственное получение и частичное использование от-
сутствующих элементов — Pu, Np, Cf и др. (см. рис. на форзаце). Ха-
рактерна общая тенденция этого процесса: в начале использовались
преимущественно природные вещества — минералы, в том числе само-
родные элементы (S, Au, и др.). Позднее начался синтез новых соедине-
ний элементов, а также получение их в чистом виде (металлургия Fe,
Pb, Zn и др.). Наконец, в XX в. началось использование изотопов.
Технофильность и другие показатели техногенеза. Количество до-
бываемых элементов далеко неодинаково. Так, мировая ежегодная до-
быча С измеряется миллиардами тонн, Fe — сотнями миллионов, Си —
миллионами, Hg — тысячами, Pt — десятками тонн. Эти различия
обусловлены многими причинами. Несомненно, имеют значение свой-
ства элементов и технология получения. А1 и Ti, например, практиче-
ски не использовались до XX в., так как технология их извлечения
340
из минералов была слишком сложной и дорогой. Большую роль игра-
ет и способность элемента к концентрации в земной коре — образова-
нию месторождений. Так, Hg образует месторождения с большими за-
пасами, и этот редкий металл использовался еще в древности. У In
кларк выше, чем у Hg, но ои рассеян и его практическое применение на-
чалось лишь в XX в. Но есть еще один фактор — распространенность
элементов. Действительно, как бы Au ни было ценно для человечества,
его добыча никогда не сравняется с добычей Fe, так как кларк Au
4,3-10-’, a Fe — 4,65, т. е. в 10 миллионов раз больше. Si и Ge — хи-
мические аналоги, Ge похож на Si. Но Si — второй по распространен-
ности элемент, a Ge редок (кларки 29,5 и 1,4-10“4). Поэтому Si — ос-
нова строительства (кирпич, бетон, цемент и др.), a Ge добывается в
ничтожном количестве. Если бы кларк Ge равнялся 29, то и этот эле-
мент нашел бы огромное применение. Исключительная роль Fe (XIX
столетие — «железный век») связана не только с его свойствами, но и
с большим кларком. Поэтому добычу элементов рационально измерять
в единицах кларков. Эту величину автор назвал технофильностью—
Т. Она равна отношению ежегодной добычи элемента D к его клар-
ку в земной коре /С Рассмотрим химически родственные элементы —
Fe, Мп и Си, Ag. Они добываются в разных количествах, их кларки
различны. Расчеты технофильности дают следующие величины (Z) —
по Б. Мейсону на 60-е годы, К — по А. П. Виноградову):
TFe = .М.1О1. = 6,6-107; ТМп = -^ = 6-107;
4,65 0,1
тCu = A_L12L = 1 д. ю»; rAg = = 1,1.10».
4,7. Ю-3 S 710-е
Следовательно, в единицах кларков человечество извлекает из недр
Fe и Мп, Си и Ag с равной интенсивностью, пропорционально их расп-
ространенности в земной коре. Технофильность их одинакова.
Многие химические элементы-аналоги с разными кларками и раз-
мерами добычи обладают одинаковой или близкой технофильностью:
Cd и Hg, Та и Nb, U и Mo, Ti и Zr и т. д. Но есть и различия: С1 и F, К
и Na, Са и Mg и др.
Добыча элементов складывалась стихийно в зависимости от эконо-
мических условий, прогресса техники, находок месторождений и т.д.
И все же очевидна регулирующая роль кларка. В будущем зависимость
добычи от кларков, вероятно, станет еще более тесной, так как бога-
тые месторождения быстро отрабатываются, и со временем, как пред-
полагал А. А. Сауков, человечество перейдет к эксплуатации гранитов,
базальтов и других горных пород, в которых содержания элементов
близки к кларкам.
Технофильность можно рассчитывать для отдельной страны, груп-
пы стран, всего мира. Естественно, что она очень динамична. За 60 лет
в СССР добыча нефти, угля и железа увеличилась в десятки раз. По
Л. В. Таусону, за 1901 —1980 гг. в мире добыто 71% Au, 87 % Си,
341
86 % Fe, 90 % угля, 99 % нефти и бокситов и 100 % U от добытою
весь исторический период. Особенно выросла добыча за 1961 — 1980 гг.
На рис. 98 приведена диаграмма технофильности, для построения
которой использованы опубликованные данные по добыче элементов
в наиболее развитых странах или во всем мире в целом на конец 60-х
годов. Технофильность включает не только использование свободного
элемента, но и его соединений, однако расчет ведется на элемент.
Мировая добыча, д/ю v
Даже если не учитывать полезную растительную массу, а только
уголь и нефть, то и в этом случае самым технофильным элементом ока-
зывается С, у которого Т - 1,1-10й. Уголь и нефть в основном ис-
пользуются как источники энергии. Применение их в химической про-
мышленности по массе невелико. Следовательно, максимальная техно-
фильность С отражает огромную важность энергии: для того чтобы
переработать и использовать вещество, необходимо добыть энергию,
обеспечить опережающее развитие энергетики.
142
Наименее технофйльны Y, Ga, Cs, Th. Их низкая технофильность,
вероятно, — явление временное, и они будут использоваться так же,
как и другие химически сходные элементы.
Анализ технофильности позволяет прогнозировать и добычу эле-
ментов. Например, Mg по технофильности сильно отстает от других
щелочноземельных элементов — Са, Ва, его технофильность меньше,
чем у Na, Cl, Pb, Cu, Zn, Sn, Ni, Mo, Hg и т. д. Это свидетельствует о-
слабом использовании Mg и в ближайшем будущем оно, вероятно,
сильно возрастет.
Технофильность элементов колеблется в миллионы раз — от 1,1 • X
X Ю11 у С до 1 • 10® у Y, в то время как контрасты кларков составляют
миллиарды (м-101— п-10-10 и менее). Следовательно, техногенез ве-
дет к уменьшению геохимической контрастности ноосферы (по срав-
нению с биосферой и земной корой).
При техногенезе накапливаются наиболее технофильные элемен-
ты: человечество «перекачивает» на земную поверхность из глубин
элементы рудных месторождений. В результате по сравнению с при-
родным культурный ландшафт обогащается Pb, Hg,Cu, Sn, Sb и други-
ми элементами. О. П. Добродеев подчеркнул, что из недр ежегодно из-
влекается больше химических элементов, чем вовлекается в биологи-
ческий круговорот: Cd — более чем в 160 раз, Sb — 150, Hg — 110,
Pb—35, F — 15, U — 6, Sn — 5, Cu—4, Mo — в 3 раза.
Помимо технофильности предложено много других количествен-
ных характеристик техногенеза. Так, отношение технофильности эле-
мента (с учетом содержания его в углях) к его биофильности (на су-
ше) М. А. Глазовская назвала деструкционной активностью элемен-
тов техногенеза (D), которая характеризует степень опасности элемен-
та для живых организмов. Для Hg D = п-104 — п-10®, для Cd и F —
п-10®, для Sb, As, U, Pb — п-102, для Se, Be, В, Sn — м-10, для мно-
гих других элементов D < 1.
Количество элемента, выводимого ежегодно из техногенного по-
тока в природный, Н. Ф. Глазовский назвал техногенным геохимиче-
ским давлением, отношение его к единице площади — модулем техно-
генного геохимического давления, измеряемым в т/км2. Например, мо-
дуль Р на территории СССР колеблется более чем в 100 раз — от 7,6- х
X 10_® т/км2 в Дальневосточных районах до 8,2-10-1 т/км2 в Молда-
вии, где широко применяются фосфорные удобрения. Модуль К колеб-
лется от 8,2 • 10~® в Западной Сибири до 2,1 т/км2 в южных районах
СССР, т.е. в 250 раз. В бассейнах Черного, Азовского и Балтийского
морей техногенное давление К и S превышает речной сток этих эле-
ментов, на реках других бассейнов отношение обратное, но во всех слу-
чаях масштабы техногенного давления и речного стока сопоставимы.
Для всей поверхности суши наиболее велики модули техногенного
давления у Na, Cl, Са, Fe (0,5—1,0), наименьшие — у Li, Ag, W, Au,
Hg, TI (10*® — 10-7). Предложены также понятия о коэффициенте
техногенной трансформации — соотношении поступления элемента
в техногенный и природный ландшафты (В.П. Учватов), о показателе
343
пылевой нагрузки — соотношении количества пыли в техногенном и
природном ландшафтах (Е. П. Сорокина и др.), о модуле аэрального
поступления — поступлении веществ с атмосферными осадками и
пылью (П. В. Елпатьевский и В. С. Аржанова) и др.
Техногенные геохимические аномалии. Их размеры колеблются в
широких пределах. Глобальные аномалии охватывают весь земной шар
(повышенное содержание СО2 в атмосфере в результате сжигания уг-
ля и нефти, накопление 90Sr после ядерных взрывов и др.). Региональ-
ные аномалии распространяются на материки, страны, зоны, области,
провинции (применение минеральных удобрений, ядохимикатов и др.).
Локальные аномалии связаны с конкретным рудником, заводом, горо-
дом и т.д. (повышенное содержание металлов в почвах и водах вокруг
металлургических комбинатов и др.). Их радиус не превышает десят-
ков километров.
Техногенные аномалии делятся на литохимические (в почвах, поро-
дах, строениях}, гидрогеохимические (в водах), атмогеохимические
(в атмосфере) и биогеохимические (в организмах — фито-, зоо- и антро-
погеохимические). Совокупность техногенных аномалий от локального
источника (завода, рудника, города, дороги и т.д.) именуется техно-
генным ореолом и потоком рассеяния, которые, как правило, включают
в себя все виды аномалий. По влиянию на окружающую среду техно-
генные аномалии делятся на три типа:
1. Полезные аномалии, улучшающие окружающую среду. К ним от-
носятся повышенное содержание Са в районах известкования кислых
почв, добавка Nal и KI к поваренной соли в районах развития энде-
мического зоба, фторирование питьевой воды в городах с распростра-
нением кариеса, применение Мо, В, Zn и других микроудобрений,
подкормки домашних животных Со и т.д.
2. Вредные аномалии, ухудшающие («загрязняющие») окружающую
среду.
3. Нейтральные аномалии, не оказывающие влияния на качество
окружающей среды.
Техногенные зоны выщелачивания и геохимические барьеры. Из-
вестны зоны сернокислого, кислого и прочего техногенного выщела-
чивания. Их систематика основана на принципах, изложенных в гл. 9.
Выщелачивание приобрело большое значение прн добыче металлов.
Применяется выщелачивание под землей («подземноевыщелачивание»),
из руды, извлеченной на поверхность, из отвалов «былой добычи» —
хвостохранилищ («кучное выщелачивание»). Вопросы выщелачивания
изучает особая прикладная наука—геотехнология, которая во многом
основана на данных геохимии. Примерно шестая часть меди в мире до-
бывается методом подземного и кучного выщелачивания. В СССР
используется подземное выщелачивание урановых руд. Геотехноло-
гия эффективна при добыче Mo, Pb, Zn, Мп, Ni и других элементов.
С помощью закачивания в скважины воды извлекают каменную и ка-
лийную соли, другие легкорастворимые компоненты. Доказана эф-
фективность микробиологического выщелачивания Си, Аи, Мо и дру-
344
гих металлов. К 1995 г. предполагается на основе геотехнологии из-
влекать около 20 элементов.
Техногенные зоны выщелачивания образуются при орошении лёс-
совых грунтов (Н. И. Кригер), при промывках засоленных почв, при
многих других техногенных процессах.
Техногенный геохимический барьер — это участок, где происходит
резкое уменьшение интенсивности техногенной миграции и, как след-
ствие, концентрация элементов. Как и в биосфере, на них образуются
аномалии D 1, Е 3, А 6 и др. (см. гл. 14). Техногенные барьеры могут
быть полезными, нейтральными и вредными. Полезные техногенные
барьеры формируются при закачивании промышленных стоков в водо-
носные горизонты, при инъекционном закреплении (цементации) грун-
тов, в результате которого рыхлая масса превращается в твердый моно-
лит, и во многих других техногенных процессах. Примером вредного
техногенного барьера служит вторичное засоление почв в орошаемых
районах (F 3). На техногенных барьерах происходит техногенное ми-
нерал ообр а зован ие.
Энергетика техногенеза и проблема изменения климата. Часть ис-
пользуемой в ноосфере энергии производит работу, другая часть в соот-
ветствии со вторым законом термодинамики неизбежно обесценивается
и выделяется в виде тепла. Пока эффект техногенного разогрева неве-
лик — в 25 тыс. раз меньше солнечной радиации. Однако в крупных
городах техногенное тепло уже достигает 5 % от солнечного излуче-
ния. Главная причина — отопление жилых домов и промышленных
предприятий. По М. И. Будыко, увеличение производства энергии
от 5 до 10 % в год приведет к тому, что через 100—200 лет техногенное
тепло будет соизмеримо с величиной радиационного баланса поверхно-
сти Земли. При этом произойдут громадные изменения климата.
Месторождения угля, нефти и газа отрабатываются за десятки лет.
В результате С снова соединяется с О и входит в состав СО2. Ежегод-
ное потребление угля и нефти добавляет в атмосферу до 9-109 т СО2 —
7-10-5 %. При современных темпах через 50 лет содержание СО2
удвоится и температура земной поверхности за счет парникового эф-
фекта может повыситься на 4 °C. К техногенным парниковым газам от-
носятся также метай, закись азота, фреоны, озон и др. В результате
парникового эффекта возможно растопление льдов Антарктики и Арк-
тики, затопление приморских низменностей и другие положительные и
отрицательные последствия. Громадная скорость процессов ставит слож-
ные проблемы глобального воздействия на атмосферу с целью стабили-
зации климата.
Как и в биосфере, в ноосфере происходит раздробление вещества,
рост поверхностной энергии (распашка почв, дробление пород, руд и
т. д.). С этим связано запыление атмосферы, которое может способ-
ствовать похолоданию климата. В этом же направлении действуют и
другие процессы (вулканизм и др.). Поэтому имеются прогнозы и о
глобальном похолодании климата.
345
Информационные особенности техногенных систем. В этих системах
намного увеличивается скорость, расширяются способы хранения и
передачи информации (печать, радио, телевидение и т.д.). Происходит
«информационный взрыв», хотя биологическая информация часто
уменьшается. Например, в целинной черноземной степи сотни видов
трав, а на полях пшеницы их много меньше. Еще больше уменьшает-
ся биологическая информация при замене тропического леса планта-
цией ананасов или бананов. Однако потеря природной информации с
избытком компенсируется ростом социальной информации. Увеличе-
ние разнообразия происходит как за счет расходования современной
солнечной энергии, так и аккумулированной за миллионы лет в горю-
чих ископаемых. Следовательно, рост разнообразия в техногенных си-
стемах, уменьшение в них энтропии (увеличение негэнтропии) сопря-
жены с увеличением энтропии в земной коре (рассеяние месторождений
полезных ископаемых, сжигание углей, нефти, горючих сланцев и газов).
В техногенных системах огромное значение приобретает обратная
связь — это управляемые системы.
Нежелательные и непредвиденные последствия хозяйственной дея-
тельности. О таких последствиях писал еще Ф. Энгельс в «Диалектике
природы». В последние десятилетия проблема приобрела качественно
новый, более опасный характер, позволяющий некоторым западным
ученым говорить о «глобальном экологическом кризисе». Согласно
Б. Г. Розанову, антропогенные пустыни занимают 5 % суши, антропо-
генный бедленд — 3, города и промышленные зоны — 2% , а биоло-
гический круговорот атомов нарушен на 60 % биологически продук-
тивной поверхностью материков.
Ядерные взрывы и возможность «ядерной зимы». В середине XX в.
человечество столкнулось с новой грозной опасностью — в результате
ядерных взрывов в окружающую среду стали поступать высокотоксич-
ные радиоактивные изотопы — 87Sr, 187Cs, 181 I и др. Необходимо пол-
ное запрещение всех видов испытаний ядерного оружия. Ядерная вой-
на грозит глобальным похолоданием климата в результате сильного за-
пыления атмосферы («ядерная зима»), уничтожением цивилизации, а
возможно и биосферы. Поэтому и геохимический анализ проблемы при-
водит к концепции недопустимости ядерной войны, которую с начала
«атомного века» провозгласил СССР и ныне приняло все прогрессивное
человечество.
Вырубка лесов. По аэрокосмическим данным ежегодно в мире вы-
рубается от 7 до 20 млн. га лесов, тропические леса вырублены уже на
50% площади, леса умеренного пояса — на 30—40 %. Предполага-
ется, что при современных темпах вырубки тропические и субтропиче-
ские леса исчезнут к 2000—2025 г. (В. А. Ковда). Это нарушит глобаль-
ный круговорот воды, О2 и СО2, резко усилит эрозию почв, запыление
атмосферы. Количественный геохимический прогноз здесь затруднен,
но отрицательные последствия вырубки лесов несомненны.
Загрязнение среды. Изменение состава воздуха и воды в промыш-
ленных центрах и крупных городах, рост заболеваемости раком лег-
346
ких и других заболеваний составляет отрицательные следствия техно-
генеза. Загрязнение среды быстро увеличивается. Серьезную опас-
ность представляют ядерные взрывы и аварии на АЭС, техногенные
аномалии Hg, Cd, Pb, Cu, Sn, V, Cr, Mo и других тяжелых металлов.
Сернокислотные, суперфосфатные, медеплавильные заводы, котельные
ГРЭС, ТЭЦ, бытовые топки выбрасывают в воздух много SO2, который,
окисляясь и растворяясь в атмосферных осадках, дает серную кислоту.
«Кислые дожди» увеличивают число легочных заболеваний, осложняют
земледелие. Принос ветрами в Скандинавию SO2 из Англии и ФРГ при-
вел к вымиранию лососей (рыба исчезла в тех водоемах, pH которых
понизился до 4). В канадской провинции Онтарио из-за кислых дож-
дей, поступающих из США, стали безжизненными 148 озер. Полагают,
что в среднем около 30 % SO*- атмосферных осадков имеет техно-
генное происхождение (в умеренной зоне Северного полушария до
50 %).
Серьезную проблему представляет и загрязнение среды различны-
ми органическими соединениями, которые включают канцерогены
и мутагены (например, некоторые полициклические ароматические
углеводороды — ПАУ, которые известны и в природных ландшафтах).
ПАУ поступают из нефти, углей, горючих газов и продуктов их пере-
работки. Так образуются техногенные аномалии ПАУ вокруг промыш-
ленных предприятий, нефтяных промыслов, угольных шахт, автодорог
и т.д. (Т. М. Белякова, Ю. И. Пиковский, Ф. Я. Ровинский, В. Н. Фло-
ренская и др.) Опасны также аномалии ядохимикатов. ДДТ обнару-
жили даже в кишечнике пингвинов Антарктиды. Существенно, что
многие насекомые привыкают к ядам, а менее выносливые животные
от них гибнут. Чрезвычайно опасен диоксин (полихлорированное по-
лициклическое соединение), широко применявшийся в качестве герби-
цидов в ряде западных стран, а также американцами во время войны
во Вьетнаме в 1961—1972 гг. (диоксин входит в состав печально зна-
менитого «орандж эйджент»).
Важное значение приобрела техногенная миграция радионуклидов,
которая особенно опасна в связи с непрекращающимися ядерными
взрывами в атмосфере и под землей, авариями на АЭС и др. В геохими-
ческом отношении радионуклиды в основном ведут себя как соответ-
ствующие стабильные элементы, хотя чрезвычайно низкие концентра-
ции обусловливают и ряд отличий.
Для борьбы с загрязнением окружающей среды большое значение
имеет оценка геохимической устойчивости технических и природных
систем к техногенным нагрузкам. Эти вопросы рассмотрены
М. А. Глазовской, которая составила соответствующие карты для всей
территории СССР. Г. Б. Паулюкявичюс районировал территорию Ли-
товской ССР по устойчивости ландшафтов к загрязнению вод.
Загрязнение среды — серьезная проблема XX в. Катастрофические
экологические ситуации характерны для многих стран. Очень важна
эта проблематика и для СССР. В 1988 г. в составе Совета Минист-
ров СССР образован союзно-республиканский Государственный
347
комитете по охране природы. В 1989 г. на первой сессии Верхов-
ного Совета СССР в его составе был создан Комитет по вопросам
экологии и рациональному использованию природных ресурсов.
Роль геохимии в решении данных вопросов очень велика.
Оптимизация техногенеза. При современном уровне развития эко-
номики вполне возможно производство, исключающее загрязнение ок-
ружающей среды, расхищение и разрушение производительных сил,
обеспечивающее рост производительных сил до уровня, недоступного
в природе. Для этого необходима разработка теории оптимизации но-
осферы, т.-е. установление оптимальных техногенных систем для раз-
личных природных районов.
Для техногенных систем исключительно характерны положитель-
ные обратные связи, действие которых определяет быструю эволюцию
ноосферы. Однако в отдельных случаях, к сожалению нередких, по-
ложительные связи приводят к загрязнению среды и другим нежела-
тельным последствиям (эрозии почв, образованию оврагов и др.).
Преобладание положительных обратных связей над отрицательными
часто делает техногенные системы неустойчивыми, ослабляет их само-
регуляцию, в процессе развития системы удаляются от стационарного
состояния. Отрицательные обратные связи, напротив, стабилизируют
систему, делают ее саморегулируемой Естественно, что и отрицатель-
ные обратные связи могут быть нежелательными (когда они препятст-
вуют развитию системы, достижению поставленных целей). Таким об-
разом оптимизация техногенных систем требует такого диалекти-
ческого единства положительных и отрицательных обратных связей,
которое обеспечит и развитие, и временную устойчивость (стационар-
ность} систем.
По своей сущности техногенные системы еще более, чем биокос-
ные, относятся к управляемым. Для их функционирования необходим
центр, из которого осуществляется управление. Однако нередко тех-
ногенные системы не имеют центра управления и отдельные их части—
заводы, поля, транспортные артерии и т. д. — управляются из са-
мостоятельных центров. Это и приводит к ослаблению отрицательных
обратных связей, саморегулирования, загрязнению среды. Поэтому
с системных позиций, централизация техногенных систем — одна из
самых важных практических задач организации территории-, в каждой
системе должны быть центры управления, регулирующие взаимоотно-
щения между частями, решающие задачу оптимизации. Такие задачи
давно уже разрабатываются в экономической географии (начиная с
классических.работ Н. Н. Баранского и Н. Н. Колосовского). Их ме-
тодологию и опыт важно учитывать и геохимикам.
При решении поставленных задач огромное значение имеет матема-
тическое моделирование на ЭВМ. Для бассейна Нижнего Дона и Азов-
ского моря учеными Ростовского университета построена модель на
основе 840 параметров, среди которых видная роль принадлежала гео-
химическим характеристикам. Это позволило дать прогноз водного
348
режима и продуктивности Азовского моря, обосновать практические
мероприятия.
Геохимический мониторинг. Так именуется система геохимических
наблюдений, оценки и прогноза изменений окружающей среды. Мето-
ды геохимического мониторинга разнообразны: кроме традиционных
методов геохимии, используемых при изучении нетехногенных систем,
отметим такие специфические приемы, как анализ снега, верхового
торфа, волос, использование искусственных сорбентов для определе-
ния в почвах и водах тяжелых металлов, аэрокосмические съемки (с их
помощью, например, в КМА установлены техногенные ореолы рассея-
ния). Важное значение приобрело ландшафтно-геохимическое карти-
рование. Особенно крупные работы проведены на Нижнем Дону и
Северном Кавказе, где В. А. Алексеенко, В. И. Седлецким и другими
геохимиками Ростовского университета составлен атлас ландшафтно-
геохимических карт разных масштабов. Карты позволили выявить ге-
охимические барьеры, прогнозировать биогеохимические эндемии, да-
вать рекомендации по изменению потока автомашин в городах, по вы-
бору зон отдыха, подбору сельскохозяйственных культур, микроудоб-
рений, решать другие вопросы.
Геохимический мониторинг проводится во многих странах. С.В.
Григорян ставит вопрос о необходимости автоматической системы об
работки геохимической информации, создания «банка техногенной ин-
формации» («экогеохимической» по этому автору).
Одна из проблем геохимического мониторинга — определение того
содержания элементов в окружающей среде, которое было до техноген-
ного загрязнения, т. е. установление «фона». Только на этой основе
можно оценить степень техногенного загрязнения. Интересен в этом
отношении подход О. П. Добродеева, который предложил сравнивать
содержание элементов в глубоких горизонтах верхового торфяника,
возраст которых можно датировать («фон»), с их содержанием в самом
верхнем горизонте, т. е. в условиях техногенного загрязнения. С той
же целью А. М. Никаноров, А. В. Жулидов, А. Д. Покаржевский пред-
ложили сравнивать содержание тяжелых металлов в растениях из гер-
бариев («фон») с их содержанием в тех же видах в современных расте-
ниях. Подобный «исторический биомониторинг» возможен и при изу-
чении животных, человека (например, анализ древних костей).
Оптимизация биологического круговорота. Оптимальный биологи-
ческий круговорот должен характеризоваться энергичным фотосинте-
зом, высокой продуктивностью и разнообразием биологической продук-
ции. Для него должно быть характерно и быстрое разложение остатков
организмов с включением продуктов их минерализации в новый цикл
круговорота.
Необходим также минимальный «выход» химических элементов из
круговорота: N, Р, К и другие химические элементы должны все вре-
мя «вращаться» в круговороте и не включаться в водную миграцию, не
выноситься реками; избыточные элементы должны удаляться из систе-
мы, а дефицитные — привноситься. Наконец, важна мобилизация
349
внутренних ресурсов биосферы для усиления биологического кругово-
рота, например использование сапропеля для удобрений.
Исключительное внимание к загрязнению среды и другим негатив-
ным явлениям техногенеза нередко оставляет в тени огромные позитив-
ные возможности ноосферы, которые только частично реализованы че-
ловечеством. Примером может служить разрешение в ноосфере противо-
ВЫЩЕЛАЧИВАНИЕ
Рис. 99. В середине палеофита возникло противоречие в развитии ландшаф-
тов: изобилие тепла и влаги создавало возможность мощного накопления
органического вещества, разложение которого приводило к выщелачива-
нию из почв подвижных минеральных соединений, в том числе особенно
необходимых для растений
речий лесного ландшафта. Последние появились около 350 млн. лет
назад в позднем девоне. Накопление большой органической массы, т.е.
усиление биологического круговорота, знаменовало новый качест-
венный этап развития биосферы. Однако это привело к разложению
большого количества остатков растений и животных, энергичной ми-
нерализации (рис. 99). В почву поступало больше СО2, органических
кислот, почвенные воды стали более кислыми. В результате развилось
кислое выщелачивание почв, минеральное голодание растений. Чем
лучше растения обеспечивались водой, светом и теплом, тем сильнее
350
развивалось кислое выщелачивание, становилось хуже их минеральное
питание. Следовательно, биологический круговорот привел к противо-
речию между световым и минеральным питанием — растения сами
ухудшили условия своего существования. Это грозное противоречие
стало, вероятно, одной из движущих сил эволюции растительного ми-
ра: естественный отбор действовал в направлении разрешен::;, возник-
ших противоречий. Понадобилось почти 250 млн. лет, чтобы растения
выработали способность поглощать из почвы больше Са, Mg, Na, К
и других катионов. В результате в середине мелового периода голосе-
менная флора сменилась покрытосеменной, которая содержала боль-
ше зольных элементов и, следовательно, лучше противостояла кислому
выщелачиванию. Однако разрешить полностью указанное противоречие
растительный мир не смог. И в современную эпоху во влажном клима-
те происходит кислое выщелачивание почв, ухудшение минерального
питания растений. Противоречие, которое природа не смогла разре-
шить за сотни миллионов лет, быстро исчезло в ноосфере, где удобре-
ние полей и подкормка домашних животных обеспечивают богатое
минеральное питание растений и животных в условиях влажного кли-
мата. Появилась возможность невиданного повышения продуктивности
агроландшафтов, ускорения биологического круговорота. Огромное
разнообразие сортов культурных растений и пород домашних живот-
ных мы связываем не только с искусственным отбором, но и с благопри-
ятной геохимической обстановкой, которую сначала бессознательно,
а позднее и сознательно создавал человек для растений и животных.
Оптимизация круговорота воды. Она достигается орошением пус-
тынь, осушением болот, опреснением морских вод, использованием вод
артезианских бассейнов, внедрением в народное хозяйство оборотного
водоснабжения и т. д. Во многих регионах приобрела исключительно
важное значение проблема дефицита пресных вод. Чисто инженерная
сторона водоснабжения разработана хорошо и возможности человече-
ства в этом направлении велики (плотины, каналы, дамбы и т.д.).
Сильно отстает естественно-историческое, в том числе и геохимическое
обоснование ряда проектов, что и привело ко многим ошибкам («по-
ворот рек», перекрытие Кара-Богаз-Гола, проблема Аральского моря,
канал Волга — Чограй и т.д.)
В комплексной проблеме оптимизации круговорота воды важен и
геохимический аспект и, в частности, защита вод от загрязнения. На-
ша страна обладает огромными скоплениями пресной воды, которую
необходимо всячески сохранять и оберегать от загрязнения. Это отно-
сится не только к Байкалу, но и к другим озерам и рекам. Важна также
охрана от загрязнения морских и океанических вод.
В борьбе с загрязнением вод имеют значение техногенные барьеры,
которые необходимо создавать вокруг промышленных предприятий
(особенно с вредными выбросами) и таким путем локализовывать за-
грязнение, не давать ему распространяться на значительную площадь.
Если, например, на пути миграции сернокислых шахтиых вод поместить
карбонатный материал (известняки и др.), то на этом техногенном ще-
351
лочном геохимическом барьере D1 будут задерживаться вредные соеди-
нения кислой природы.
В Молдавии для борьбы с загрязнением окружающей среды Си, ис-
пользуемой для опрыскивания виноградников, предложено создавать
на пути миграции медного купороса техногенный щелочной барьер
(Н. Ф. Мырлян).
Комплексное использование сырья, проблема отходов. Исключитель-
ную важность этой проблемы подчеркивали еще в 20-х годах А. Е. Фер-
сман и Н. М. Федоровский. В настоящее время только 10 % сырья,
извлекаемого из недр, становится готовой продукцией, а 90 % со-
ставляют отходы, загрязняющие среду. При добыче некоторых полезных
ископаемых используется лишь 1 % массы руды, а 99 % идет в отва-
лы. Велики терриконы вокруг угольных шахт и карьеров. Идеалом
производства является безотходная технология, при которой утилизи-
руются все компоненты сырья. И здесь важна роль геохимии. Яркий
пример тому недавно открытая в Забайкалье новая горная порода —
сыннерит (калиевый аналог нефелинового сиенита). Все компоненты
этой породы могут быть использованы: К — для производства безхлор-
ных удобрений (особо ценных), А1 — для получения металла, Si —
для производства стройматериалов. Всеобщее внедрение безотходной
технологии дело будущего, а пока задача состоит в наиболее полном
использовании сырья. Нередко из руд извлекается только один-два
полезных компонента, а остальные (в том числе многие микроэлемен-
ты) не используются. Вместе с тем они представляют часто не мень-
шую ценность, чем главные компоненты. В СССР на передовых пред-
приятиях из руд извлекается свыше 10 элементов (на Лениногорском
комбинате в Рудном Алтае — 11 из 13, содержащихся в свинцово-цин-
ковых рудах).
Большое практическое значение имеют элементы примеси в углях.
В промышленных масштабах из углей извлекают Ge, U, Ga, разрабо-
тана технология извлечения Pb, Zn, Мо, ставится вопрос о поисках ме-
сторождений Au, Ag и Hg. В США из зол энергетических углей пред-
полагается получать около половины потребляемых в этой стране ред-
ких металлов. По Л. В. Таусону, в теплоэнергетике ежегодно обра-
зуется около 70 млн. т. золы, которая пока используется на 10—15%.
Золы каменных и бурых углей содержат мелкие сфероидальные выде-
ления, которые содержат до 70% Fe и легко сепарируются. Эти выде-
ления содержат примеси Ni, Mn, V и других редких элементов («легиро-
ванные руды»). Зола многих углей содержит 32—35 % А12О3 (руда на
А1). Велики перспективы использования золы в строительстве (пока
используется не более 10 % золы). Зола некоторых углей и горючих
сланцев во многих странах используются для известкования кислых
почв (в СССР — в Эстонии).
Если повсеместное внедрение безотходной технологии — дело бу-
дущего, то малоотходная технология возможна и необходима уже
сейчас (Б. Н. Ласкорин). Это один из важных путей ускорения научно-
технического прогресса.
352
Много вниманияпривлекает бытовой мусор, особенно в больших
городах (в Нью-Йорке ежегодно удаляется 8 млн. т мусора, в Токио—
4,5). Всего, по А. М. Рябчикову, ежегодно в мире создается около
20 млрд, т промышленных отходов, столько же сельскохозяйственных
и до 4 млрд. т. бытовых. В среднем количество мусора ежегодно воз-
растает на 2—3 % (в США — на 5 %).
Многие отходы содержат ценные компоненты. Из бытового мусора
получают удобрение, жидкое топливо для автомашин. В осадках очист-
ных сооружений гальванических производств большого города было
эпределено (%) Сг — 1,5, Си — 1,0, Zn — 0,9, Sn — 0,6, Ni — 0,3 и
г. д. Ежегодно образуется до 1000 т таких осадков. Обогащены цен-
ными металлами и твердые бытовые отходы (Ag, Cu, Sn, Cd, Zn и т.д.).
Эти и аналогичные образования можно рассматривать в качестве тех-
ногенных руд.
Отвалы рудников и эфеля обогатительных фабрик также рассмат-
ривают в качестве техногенных рудных месторождений в связи с по-
нижением со временем кондиций руд. Актуален вопрос и об использо-
вании техногенных геохимических барьеров для создания искусст-
венных месторождений. Так, уже в древности с помощью дамб отгора-
живали небольшие участки моря, в которых при испарении морской
воды осаждалась поваренная соль (F3). Не исключается возможность
создания искусственных рудных месторождений
Геохимия, история цивилизации и археология. Неоднократно вы-
сказывались представления об отрицательном влиянии техногенеза
на развитие целых цивилизаций (гибель государств Двуречья —
Месопотамии — в результате засоления почв и др.). Геохимический
анализ «культурных слоев» различного возраста, изучаемых археоло-
гами, может дать ценную информацию об особенностях исчезнувших
цивилизаций: особенностях производства, болезнях людей и домашних
животных (анализ костей), о хозяйственных связях с другими народа-
ми и т. д. Например, английские биохимики установили, что кости пер-
вобытных людей из погребений возрастом 5000 лет содержат в среднем
1,43-10~3 % РЬ, а кости современных людей — уже 3,45-10~3 %
(на массу сухой кости). Актуально геохимическое изучение культур-
ных слоев Москвы, Новгорода, Пскова. Бухары, Самарканда, Таш-
кента, Еревана и других древиих городов. Интересны и места былых
сельских поселений .
Здоровье человека и ноосфера (геохимический аспект). И примени-
тельно к человеку можно говорить об оптимизации среды — наилуч-
шем содержании химических элементов в продуктах питания, водах,
воздухе, которое полностью обеспечивает его потребности. В будущем
жители горных долин будут потреблять столько же 1, сколько жители
морских побережий, что улучшит работу щитовидной железы и ис-
ключит эндемический зоб. Население районов с влажным климатом
получит столько же F, сколько жители степей, и это ликвидирует или
ослабит кариес зубов. Появится возможность использовать благопри-
ятные геохимические особенности одних ландшафтов и исключить не-
35.3
благоприятные условия других. Иначе говоря, оптимальному куль-
турному ландшафту должны быть присущи положительные медикогео-
химические особенности многих природных ландшафтов. В нем можно
создать и такие сочетания, которые вообще отсутствуют в природе.
Практические пути решения проблемы оптимизации среды разнообраз-
ны и многое уже делается. Например, в районах распростренения эн-
демического зоба населению продают йодированную поваренную соль
(25 г К1 на 1 т NaCl). «Йодная» профилактика помогла ликвидиро-
вать эндемический зоб во многих районах СССР или же сильно умень-
шить заболеваемость. Вырисовывается перспектива улучшения каче-
ства овощей и фруктов при помощи подкормки их микроэлементами.
Специальная подкормка позволит успешно бороться с атеросклерозом
и другими болезнями.
С другой стороны, некоторые установившиеся нормы потребления
химических элементов завышены. Это, например, относится к поварен-
ной соли: привычка густо солить пищу оказалась не столь невин-
ной, как это могло показаться (фактор риска гипертонии). Поэтому
важно установить влияние на здоровье человека отклонений от сред-
него содержания химического элемента, которые не достигают уровня,
вызывающего явные симптомы болезни. Не связаны ли с этим предрас-
положения к различным болезням или хронические заболевания, объ-
ясняемые другими причинами? Наконец, нельзя ли, увеличивая или
уменьшая потребление определенных химических элементов, воздей-
ствовать на физическую природу человека, подойти к реализации дав-
нишней мечты человечества — долголетию?
Создавая оптимальный геохимический режим ландшафта, обще-
ство получает мощный фактор улучшения условий своего существова-
ния. Становится возможной реализация норм потребления элемен-
тов, установленных медициной. Развитие производительных сил в ус-
ловиях социализма позволит создать в любом районе столь благопри-
ятные условия, что улучшение физической природы человека, о кото-
рой мечтали И. И. Мечников, и другие великие биологи прошлого, ста-
нет реальностью.
Контрольные вопросы
1. Дайте определение понятиям «техногенез», «ноосфера».
2. Охарактеризуйте две группы процессов техногенеза.
3. Что такое «технофильность», как она изменяется?
4. Расскажите о техногенных геохимических аномалиях, зонах выщелачи-
вания, барьерах.
5. Каковы энергетика и информационные особенности ноосферы?
6. Рассмотрите геохимические аспекты проблемы загрязнения окружающей
среды. Что такое «ядерная зима»?
7. В чем состоит проблема оптимизации ноосферы?
8. Дайте определение «геохимического мониторинга».
9. Геохимический аспект проблемы комплексного использования полезных
ископаемых.
10. Геохимия и здравоохранение.
354
18. ТЕХНОГЕННЫЕ СИСТЕМЫ
Геохимическая классификация техногенных систем не разработа-
на. Их иерархия по уровням организации образует ряд — от техно-
генных почв, илов, кор выветривания, водоносных горизонтов до тех-
ногенных (культурных) ландшафтов и еще более крупных систем -
стран, океанов и всей ноосферы.
Техногенные (культурные) почвы. Примерами полностью техноген-
ных почв (которых не было в биосфере) служат осушенные торфяники
и поливные почвы оазисов. Чаще природный тип почв сохраняется и
происходит только окультуривание с помощью различных агротех-
нических и агрохимических приемов. Для окультуривания предложе-
но также добавлять в почвы местные горные породы, отходы горнодо-
бывающей и перерабатывающей промышленности, каменные и другие
угли, торф, металлургические шлаки, фосфоритоносные пески, пемзы,
туфы и т.д. (Ф. Я. Сапрыкин). В результате неумелого окультуривания
происходит ухудшение почв — их эрозия, засоление, заболачивание
и т. д.
Техногенные илы. Парагенные ассоциации элементов в техноген-
ных илах часто резко отличаются от ассоциаций природных илов
(РЬ и Ni, Сц и Sn и т.д.). Спектр элементов очень широк — Ag, Hg,
Cd, Pb, Ni, Cu, Zn, Sn. Sr, Bi, Mo, P и т.д. В городах, в прудах на тер-
ритории металлургических и химических комбинатов илы почти пол-
ностью техногенны, в крупных реках и озерах они изменены только
частично, в морях и океанах изменены в определенных районах (круп-
ных портах, заливах, проливах и т.д.). Во многих техногенных илах
повышено содержание битумов, металлов, появляются синтетические
продукты, неизвестные в биосфере, существенно изменяются микробио-
логические процессы. Например, в реках и каналах Ленинграда илы
обогащены органическими соединеними (до 30%), Zn и Си. В речных
илах белорусских городов фракция < 0,05 мм обогащена Pb, Ni, Сг,
V, Си. По Ю. Е. Саету и другим, донные отложения в реках и прудах
изученного ими крупного города обогащены Ni, Сг, Мо, V, Си, Pb, Ag,
Zn, Sn.
Техногенные коры выветривания. На рудниках, вскрывающих
сульфидные месторождения, кислород воздуха, проникая к сульфид-
ным рудам, значительно ускоряет (или вызывает заново) окисление
сульфидов. В результате pH вод местами понижается до 0, формирует-
ся искусственная зона окисления — техногенная кора выветривания
сернокислого класса. Изучение ее имеет большое практическое значе-
ние, так как за счет сернокислых процессов происходит частич-
ная потеря руды, меняется ее состав и это важно учитывать техно-
логам.
Техногенные водоносные горизонты. К ним относятся искусствен-
ные подземные водохранилища, горизонты, образующиеся при отра-
ботке рудных месторождений методом подземного выщелачивания, и
Др. При этом меняется состав подземных вод, развивается техноген-
12*
355
ный эпигенез пород (М. В. Шумилин, Н. Н. Муромцев, К. Г. Бровин,
В. А. Грабовников и др.; рис. 100).
Техногенные водоносные горизонты привлекают внимание и в свя-
зи с защитой подземных вод от загрязнения (Е. В. Пиннекер, А. Е. Ора-
довская, В. М. Гольдберг и др.). Так, при закачке промышленных сто-
ков (в основном химической промышленности) в глубокие водоносные
горизонты образуются качественно новые химические типы вод, не
»' ЕР ЕЗ1
Рис. 100. Добыча хлоридных натриевых рассолов выще-
лачиванием каменной соли через буровые скважины
(по А. Е. Ходькову):
методами: А — прямотока, Б — противотока; / — надсолевые и
подсолевые породы, 2— залежь каменной соли, 3 — направле-
ние движения пресной воды и рассола
известные в природе. Подземное захоронение применяется в СССР,
США, ФРГ и других развитых странах. По А. Я- Гаеву, на Урале и в
Приуралье техногенное загрязнение оказывает большое влияние на
состав подземных вод зоны активного водообмена. При этом возникают
различные техногенные геохимические барьеры, на которых осаждают-
ся кальцит, гипс и другие минералы (барьеры возникают и в буровых
скважинах, закупоривая их). Барьеры могут играть положительную
роль, способствуя самоочищению загрязненных вод и отрицательную.
Техногенные (культурные) ландшафты. Геохимическая система-
тика этих ландшафтов должна учитывать положения, разработанные
в общественных науках. С этих позиций автор предложил в основу
классификации положить понятие об общественно-экономической фор-
мации и на самом высоком таксономическом уровне выделить ландшаф-
ты рабовладельческого, феодального, капиталистического и социа-
листического общества. Этот таксон именуется порядком пгехноген-
356
ных ландшафтов. Порядки делятся на отряды, которые выделяются,
как и в антропогенном ландшафтоведении: селитебные (города и др.),
агроландшафты, пастбищные, лесохозяйственные, горнопромышлен-
ные, дорожные, рекреационные отряды. Хозяйственная деятельность
различается не только по специализации, но и масштабам, выражаю-
щимся в уровне изменения природных ландшафтов техногенезом. Эти
уровни можно именовать разрядом ландшафта, условно выделяя три
разряда, соответствующих слабому I, умеренному II и сильному Ill
воздействию техногенеза (4. И. Перельман, Н. Ф. Мырлян).
Таким образом, высшие таксоны систематики (порядок, отряд, раз-
ряд) устанавливаются по негеохимическим параметрам, хотя они и
различаются по техногенной миграции. В дальнейшем, вероятно, уда-
стся обосновать эти таксоны и с геохимических позиций. Низшие так-
соны — группы, типы, семейства, классы, роды и виды техногенных
ландшафтов — предлагается выделять по тем же признакам, что и в
систематике природных ландшафтов. Эти признаки обусловлены клима-
том, рельефом, геологическим строением местности и их производным —
биологическим круговоротом. Так, группы антропогенных ландшаф-
тов выделяются по величине биомассы Б и ее соотношению с ежегодной
продукцией П в соответствующих природных ландшафтах. Выделе-
ние группы важно не только при систематике агроландшафтов, но и
других техногенных ландшафтов. Например, города в тундре, тайге,
пустыне существенно различаются друг от друга, в том числе и по
геохимическим параметрам. Так, климатические различия влияют на
скорость геохимических процессов, а следовательно, и различный уро-
вень воздействия техногенных процессов на окружающую среду.
Типы и семейства техногенных ландшафтов выделяются по типам
и семействам природных ландшафтов, в которых сформировался тех-
ногенный ландшафт. Следует, например, различать города влажных
тропиков и тайги в лесной группе, города тропических и суббореаль-
ных пустынь — в пустынной. В пределах таежного типа различаются
семейства северной, средней и южной тайги.
Классы выделяются по особенностям водной миграции. Различаются
сернокислые, кислые, кислые глеевые, кальциевые и прочие классы. На-
пример, сернокислые ландшафты возникают во многих районах угле-
добычи, добычи и переработки сульфидных руд, где развит «кислый
водоотлив шахт» и другие нежелательные явления. Соленосный класс
характерен для районов вторичного засоления в оазисах, кислый гле-
евый — для лесисто-болотистых низменностей тундровой, таежной и
влажной тропической зон (например, в районах нефтедобычи).
Роды техногенных ландшафтов, выделяются по интенсивности во-
дообмена, определяемой рельефом, а виды — по особенностям геологи-
ческого строения. Вряд ли стоит доказывать, что города, агроландшаф-
ты, дороги существенно отличаются в горах и на равнинах или в райо-
нах развития лёссов, известняков, гранитоидов. Предложенные пост-
роения нуждаются в разработке. Не исключено, что число таксонов бу-
дет увеличено. Для проверки эффективности данных принципов систе-
357
матики составлена схема техногенных ландшафтов Центральной Мол-
давии (рис. 101).
Наибольшее влияние техногенеза (III разряд) здесь испытывают
многолетние насаждения (сады и виноградники), в которых глубина
вспашки достигает 1,5 м (плантаж). Большая часть садов орошается
что также отражается на физико-химических свойствах почв. По объ-
ему вносимых удобрений данные ландшафты не уступают землям с по-
левыми и техническими культурами. Главное же их отличие от дру-
гих агроландшафтов состоит в интенсивном применении пестицидов:
хлор-, фтор-, фосфорорганических соединений, а также органических
и минеральных соединений тяжелых металлов. Применение медьсодер-
жащих препаратов приводит к значительному обогащению Си основ-
ных компонентов ландшафта. Ее содержание в почвах под виноград-
никами достигает 2,5-10~2 %, в отдельных случаях — первых долей
процента. В золе листьев винограда присутствует до 0,5 % Си, в по-
верхностных водах — до 500 мкг/л. Перераспределение техноген-
ной Си приводит к ее накоплению в почвах.
В зависимости от положения верхней границы распространения
СаСОз миграция техногенной Си по профилю почвы либо затруднена,
либо не происходит. Поэтому в карбонатных черноземах почти вся
техногенная Си концентрируется в верхнем 5—10-сантиметровом слое
0(3) и содержание ее здесь при прочих равных условиях выше, чем
в лесных почвах. В современных аллювиальных отложениях образует-
ся техногенный малахит. Концентрация Си в горизонтах, обогащен-
ных этим минералом, достигает 1—2 %. Высокая плотность многолет-
них насаждений и интенсивное применение медьсодержащих препа-
ратов позволяют говорить об образовании в Центральной Молдавии
техногенной геохимической провинции с повышенным содержанием
Си в основных компонентах ландшафта. В ландшафтах карбонатного
глеевого класса Си осаждается на глеевом (СЗ) и кислородном (А7)
барьерах, а в ландшафтах карбонатного и кислого классов — на ще-
лочном (D3) и сорбционном (G3). Таким образом, класс во многом оп-
ределяет ответную реакцию ландшафта на загрязнение.
Описываемые ландшафты относятся ко второму роду. Виды ланд-
шафтов выделены на основании различий слагающих их горных по-
род. В ряде случаев приходится учитывать не только содержание мак-
ро-, но и микроэлементов. Так, культивируемый на плиоценовых крас-
ноцветах виноград содержит повышенное количество Rb, что опре-
деляет лучшее качество продукции. Эта закономерность может быть
использована при размещении плантаций винограда.
Изучение геохимии техногенных ландшафтов еще раз подтвержда-
ет, что техногенез как высшая форма миграции включает в себя и все
низшие формы — механическую, физико-химическую и биогенную
миграции, однако специфика техногенеза определяется общественной
деятельностью. Именно поэтому высшие таксоны (ряд, порядок, от-
ряд, разряд) следует выделять на основе социальных и экономических
критериев, а низшие — по особенностям биогенной (группа, тип, се-
358
Рис. 101. Схема геохимических антропогенных ландшафтов Центральной Мол-
давии (по А. И. Перельману и Н. Ф. Мырляну):
отряды — 1 — агрохозяйственный, 2 — пастбищный. 3 — лесохозяйственный. 4 — рекреацион
ный. 5 — селитебный. 6 — горнопромышленный; 7 — дорожный разряды: 8—1,9 11,10
III; группы, типы, семейства: 11 — лесная, европейский, кодрннское, 12 — степная, сухие
степи, южномолдавское, 13 — луговая пойменных лугов; классы; 14 — переходный от кис-
лого к кальциевому (Н+—Са2+), /5 — кальциевый (Са2+). /6 — кальциевый — глеевый
(Са2+—Fe2+), 17 — кальциевый — натриевый (Са2+—Na+); род — второй; виды: 18 — на сов-
ременном аллювии (Q1V)- 19 — на лёссовидных суглинках (Qi_.iv), 20 — на элювио-делювии
песчано-глинистых отложений (N J— Nj); границы; 21 — отрядов. 22 — разрядов, 23 групп,
типов и семейств, ’-/--видов, 25 — субаквальных ландшафтов
359
мейство), физико-химической и механической миграции (класс, род,
вид).
Геохимия городов. Исследования в данной области в СССР и за
рубежом растут очень быстро и практически оформились в самостоя-
тельное научное направление. Как и в природных ландшафтах, в го-
родах изучают биологический круговорот, водную и воздушную миг-
рации. Актуальна проблема оптимизации городов. В решении этой
проблемы имеются отдельные достижения (например, создание горо-
дов-садов в курортных зонах). Однако в целом проблема не решена.
Особо актуальны вопросы загрязнения среды в городах. Главные ви-
новники загрязнения городской атмосферы — автомашины и промыш-
ленные предприятия. На улицах с энергичным автомобильным движе-
нием воздух обогащается СО, оксидами N и другими вредными вещест-
вами. Техногенные ореолы вокруг промышленных предприятий рас-
пространяются на километры.
По А. Н. Сутурину, среди элементов-загрязнителей выделяется
«страшная троица» — Hg, Pb, и Cd.
Hg — элемент конца периодической системы (№ 80), кларк его
низок (4,5 • 10~6 %), в биосфере он не концентрируется и организмы
не приспособились к повышенным количествам этого металла. Место-
рождения Hg стали разрабатываться несколько тысячелетий назад, и
с тех пор на земную поверхность поступает с каждым годом все боль-
ше Hg. В отдельных ландшафтах концентрация Hg значительно по-
вышена (например, вблизи заводов, использующих ртутные препара-
ты и спускающих часть Hg в сточные воды). В результате Hg накапли-
вается в почвах, растениях, водах, поступает в организм человека. В
средние века отравление Hg получило наименование «болезни сума-
сшедшего шляпочника», так как ею заболевали мастера, применявшие
препараты Hg при изготовлении фетровых шляп. Теперь эта давно
забытая болезнь вспыхнула вновь. В Японии сброс отходов промыш-
ленности в р. Агано и залив Минамата привел к обогащению Hg рыб,
крабов, устриц. Потребление их в пищу вызвало болезнь людей. Воз-
рожденная болезнь получила название «болезни Минамата». Она пере-
дается по наследству
Cd — сосед ртути по периодической системе, также очень ядовит,
его кларк 1,8 • 10“5 %. Промышленные отходы, содержащие Cd,
привели к отравлению тысяч жителей района Тояма в Японии (119 че-
ловек погибло). Эта новая «техногенная болезнь» именуется «итай-итай».
Глобальный характер приобрело свинцовое загрязнение. Даже в
снегах Гренландии содержание РЬ с начала XX в. увеличилось в пять
раз. В центрах некоторых крупных промышленных городов Северного
полушария почвы и растения содержат в 25 раз больше этого металла,
чем на окраинах.
При изучении геохимии городов большое значение приобрело де-
тальное ландшафтно-геохимическое картирование и районирование.
Составлены геохимические карты Алма-Аты, Ростова-на-Дону, Ново-
360
российска и других городов. По Ю. Е. Саету, в городах накапливаются
преимущественно халькофилы и элементы группы Fe.
По данным американских геохимиков, в городах чаще, чем в сель-
ской местности, грозы, облачная погода, выпадает больше дождей и
и меньше снега. Атмосферной пыли в городах в 100 раз больше, отра-
ботавших газов — в 5—25 раз больше, чем в агроландшафтах. За-
грязненная атмосфера городов поглощает около 20 % солнечного све-
та, при низком стоянии солнца — более 50 %. Все это отражается на
здоровье населения, увеличивает число респираторных, сердечно-со-
судистых, раковых и других заболеваний. Число заболеваний резко
возрастает во время смога — специфического техногенного тумана
больших городов. Серьезную проблему представляет и загрязнение
среды во многих городах СССР. Так, В. Н. Макаров изучил геохимию
города, расположенного в зоне сплошной многолетней мерзлоты с арид-
ным климатом. Зимой здесь образуются особые техногенные туманы.
Опробование снегового покрова показало рост pH по сравнению с фо-
ном до 9, увеличение содержания в снеговой воде S в 1500 раз, Са —
в 600 раз, Сг — в 60 раз, Hg — в 10 раз и т. д. Общая минерализа-
ция увеличилась в 500 раз. В почвах установлены техногенные анома-
лии Hg, Pb и других металлов. Для города характерно сплошное ано-
мальное геохимическое поле сложного строения.
Загрязнение атмосферы отрицательно влияет и на памятники архи-
тектуры. Это было установлено в Мюнхене, Кельне и других городах
еще в начале XX в. Техногенное выветривание не пощадило и Афинс-
кий Акрополь, которому за последние годы нанесено больше вреда,
чем за тысячелетия.
Оптимизация среды городов исключительно сложная проблема.
Пути ее решения — внедрение безотходной технологии, строительство
очистных сооружений, уменьшение числа котельных, борьба с вы-
хлопными газами автомашин, озеленение и т. д.
Агроландшафты. Их изучение также становится предметом особо-
го научного направления, которое некоторые авторы именуют агро-
геохимией. Последняя не идентична агрохимии, данные которой она
широко использует. Различия состоят в объектах и атомарном уровне
исследования (агрогеохимия изучает также водную и воздушную
миграцию в агроландшафтах).
Ведущее значение в агроландшафтах играет биологический кру-
говорот, поэтому для их характеристики применимы такие понятия,
как биомасса Б, ежегодная продукция П, коэффициент биологического
поглощения Ах, избыточные и дефицитные элементы и др. (см. ч. IV).
В этих ландшафтах происходит интенсификация биологического кру-
говорота, так как человек старается усилить образование живого
вещества, т. е. фотосинтез, и другие полезные восстановительные и
окислительные процессы. Повышение биологической продуктивности
достигается двумя принципиально разными путями. Первый — моби-
лизация внутренних ресурсов ландшафта: распашка почв, усиление
окислительных процессов в почвах при осушении болот, орошение
361
пустынь и т. д. Второй путь — химизация: ландшафт получает из-
вне недостающие химические элементы. Применение минеральных
удобрений поднимает урожай в два-три раза. Кроме основных эле-
ментов плодородия — N, Р, К, Са — важное значение имеют В, Си,
Мо, Mn, Zn, Fe и другие микроэлементы, которые также вносятся с
удобрениями. Это выдвигает ряд новых проблем, как, например, на-
рушение баланса N в пищевых продуктах. (Высокие концентрации ни-
тратов вредны для здоровья. В продуктах они сравнительно легко пе-
реходят в нитриты, которые приводят к заболеваниям.)
При использовании минеральных удобрений необходим ландшаф-
тно-геохимический анализ, т. е. следует учитывать не только потреб-
ности растений, но и дальнейшую историю N, Р, К и других элементов
удобрений. Значительная часть их покидает ландшафт со стоком и за-
грязняет среду. В США около */3 N удобрений попадает в сточные во-
ды. В 1965 г. в мире половина Р и К удобрений ушла в ионный сток.
Важна и химизация животноводства. Природные корма часто бедны
Р, Са, Cu, I, Со, Мп и другими элементами, поэтому во многих райо-
нах необходима минеральная подкормка животных фосфатом Са, со-
лями Со, Си и другой продукцией химической промышленности.
На агроландшафтах сказывается и отрицательное воздействие
гехногенеза. Так, распашка почв усиливает водную и ветровую эро-
зию, т. е. механическую денудацию. В некоторых районах с эрозией
удаляется больше N, Р, К, чем вносится с удобрениями. Твердый сток
в агроландшафтах в десятки раз превосходит естественную величину.
Например, в Пуэрто-Рико к 1960 г. на половине площади было смыто
3/4 почв. В Латинской Америке «эрозионные пустыни» в 1963 г. охва-
тывали 40—50 млн. га. За сутки в мире эрозия съедает тысячи гектар
пахотных земель. Эти цифры дают основание говорить о «денудацион-
ном взрыве». По Л. Г. Бондареву, ежегодный минеральный сток на
Земле составляет около 16 млрд, т (твердый сток + ионный сток),
причем почти половина его техногенна (7—7,5 млрд. т). Активизиро-
валась и ветровая эрозия, увеличилась повторяемость и интенсивность
пыльных бурь, что также связывают с техногенезом. Техногенными
причинами объясняют увеличение пыли в ледниках, помутнение ат-
мосферы над морями и океанами и другие явления.
Важная проблема — загрязнение среды в агроландшафтах за
счет промышленных предприятий. Вокруг последних образуются тех-
ногенные ореолы рассеяния радиусом в несколько километров, в поч-
вах повышается содержание тяжелых металлов.
Вместе с тем ни водная, ни ветровая эрозия, ни другие отрицатель-
ные последствия техногенеза не являются неизбежными. Они лишь
следствие неумелого ведения сельского хозяйства, которое вполне
можно оптимизировать. И хотя до повсеместной оптимизации агро-
ландшафтов еще далеко, на этом пути имеются серьезные достижения.
Например, создание оазисов в пустынях. Недостаток воды подавляет
здесь биологический круговорот, хотя в пустыне много тепла, све-
та, плодородны почвы. Орошение вызывает «взрыв» его, возникает
362
оазис с новыми почвами, новым климатом, искусственными реками
и озерами (арыками и водохранилищами). Оазис — это новый тип
высокопродуктивного геохимического агроландшафта, в котором соеди-
няется высокое плодородие почв с достаточным увлажнением. Некото-
рые оазисы в пустынях СССР существуют уже тысячелетия (низовья
Зеравшана, Амударьи и Мургаба), другие возникли в последние годы
в результате строительства Каракумского и других каналов.
Развитие оазисов связано с решением ряда геохимических проб-
лем. Орошение может повысить уровень грунтовых вод, вызвать засо-
ление почв. Поэтому необходимо изучать солевой баланс оазиса
(В. А. Ковда). Химизация наряду с ирригацией — важное средство
увеличения продуктивности оазисов. Применение N и Р удобрений
резко повысило урожайность хлопка и других культур. Однако боль-
шие урожаи берут из почвы так много подвижных элементов, что начи-
нает сказываться дефицит микроэлементов. В условиях орошения
установлено благоприятное воздействие на различные культуры Zn,
I, В, Мп, Мо. В некоторых оазисах в кормах дефицитны Со, Си, Мп, Zn
и домашние животные получают минеральную подкормку.
Здоровье населения — также геохимическая проблема оазисов.
Запыление атмосферы, неблагоприятное изменение состава грунтовых
вод в связи с поступлением в них минеральных удобрений и различ-
ных химических препаратов — все это проблемы геохимии оазисов.
Поэтому при орошении пустынь и степей необходимы геохимические
исследования.
Геохимия курортов. Это чрезвычайно важная проблема, которая
пока не привлекла должного внимания. Здесь особенно необходимо
детальное ландшафтно-геохимическое картирование (до масштаба
I : 5000 — 1 : 2000 включительно) с изучением геохимии почв, расти-
тельности, вод, атмосферы. На этой основе возможно выявление до-
полнительных лечебных факторов, установление неблагоприятных
воздействий, загрязнения среды. В результате ландшафтно-геохимичес-
ких исследований можно выявить новые курортные зоны. Так, на
основе обследования торфяных болот, солончаков и соленых озер
возможно выявление лечебных грязей. Перспективно искусственное
создание таких грязей путем разгрузки в северные торфяники глу-
бинных соленых вод и т. д.
Ландшафты районов добычи и переработки полезных ископае-
мых. Их геохимия зависит как от специфики и масштабов про-
изводства, так и от природных условий. Особенно важно разли-
чать гумидные и аридные ландшафты, равнинные и горные. По
Н. П. Солнцевой и Е. М. Никифоровой, в гумидных районах угле-
добычи в ландшафт поступают тяжелые металлы, битуминозные
вещества, в том числе ПАУ, легкорастворимые соли, главным обра-
зом сульфаты Fe, Mn, AI. В результате засоляются почвы, возни-
кают латеральные сульфидные барьеры В1 —В2 (за счет восстанов-
ления SO?- вод), а также радиальные барьеры AI—А2, на которых
концентрируются гидроксиды Fe. В почвах накапливаются канце-
363
рогенные ПАУ, Bi, Sc, TR, Li, Be, Y, Hg, Cd, Се и другие микро-
элементы.
Весьма своеобразны техногенные ландшафты нефтепромыслов.
Так в Западной Сибири пресные грунтовые и пластовые воды энер-
гично используются для водоснабжения. В результате в миграцию
включаются соленые воды глубоких горизонтов. В подземных водах
уменьшается содержание Fe, Mn, H2S, гуминовых веществ, ряда
микроэлементов, растет содержание фенолов, NHi", некоторых
нефтепродуктов. Энергично развивается микробиологическая дея-
тельность, возникают сероводородные и карбонатные барьеры. При
этом изменяется не только ландшафт, но и глубокие горизонты
подземных вод за счет закачки в них соленых вод для поддержания
пластового давления и других мероприятий. На нефтепромыслах
других регионов установлено изменение почв под влиянием неф-
ти— формирование в тайге солончаков и т. д.
В. В. Батоян на основе геохимии ландшафта разработал прин-
ципы районирования территории СССР по устойчивости поверх-
ностных вод к загрязнению при добыче нефти.
В гумидных горах Дальнего Востока (Приморье) высоки мут-
ность рудничных вод (до 0,и г/л), содержание металлов в их взвеси,
интенсивна химическая денудация, которой, возможно, благоприят-
ствует азотная кислота, образующаяся при взрывных работах.
Вблизи комбинатов возникают новые геохимические системы —
шламовые поля — потенциальные техногенные месторождения.
Установлено резкое отличие природных и техногенных ландшафтов
по большому числу геохимических параметров (составу атмосфер-
ных осадков, кислотности почв, содержанию и формам миграции
тяжелых металлов, содержанию РОВ, типам геохимических барь-
еров и т. д.) (В. С. Аржанова, П. В. Елпатьевский).
В аридных районах особенно большое значение приобретает
атмосферная миграция, распыление руд и отвалов. В почвах здесь
в условиях щелочной среды большинство металлов мигрирует слабо.
По Н. Д. Давыдовой, техногенные ландшафты на участке Наза-
ровской ГРЭС (лесостепь — Канско-Ачинский буроугольный бас
сейн — КАТЭК) характеризуются следующей геохимической фор-
мулой:
Si, Сг, соРг
Са, СО2, SOV
Fe, Sr, Mn, Ba, Co, Ni, Cu, V, Cd
xMg, Na, Al, P, K, Pb ..,
В формуле слева от дроби — типоморфные элементы ландшафта, в
числителе — отрицательно аномальные элементы, в знаменателе —
положительно аномальные, справа от дроби — элементы в кларко-
вых количествах. По С. В. Николаеву и В. Ф. Ломову, в районе
одного из горнодобывающих комбинатов в лесостепи Южного Ура-
ла (медно-колчеданные руды) основными источниками загрязнения
364
служат рудный карьер, отвалы, обогатительная фабрика, склады
пиритных концентратов. Морфология техногенного ореола зависит
от розы ветров — радиус ореола колеблется от 5 до 20 км. Уста-
новлено загрязнение почв Cu, Zn, Pb, Ni, V и Сг. В радиусе 5 км
концентрация Си в самом верхнем горизонте почв достигает
0,04—0.1%, Zn — 0,06—0,2%. В Средней Азии в районе фосфатного
производства окружающая среда загрязняется S, F, As и тяжелыми
металлами, характерен дефицит Си и Zn у домашних животных,
обязанный избытку РЬ и S.
Рис. 102. Сернокислый ландшафт (по В. Г. Прохорову)
В районах добычи и переработки сульфидных руд в любом кли-
мате возникает сернокислый ландшафт (рис. 102). Техногенные
потоки рассеяния в долинах рек могут простираться более чем на
100 км (в Бурятии был установлен даже техногенный поток Мо,
W, Au и других элементов длиной более 200 км. Столь значительная
протяженность обусловлена размывом хвостохранилищ и аварий-
ными сбросами фабрики).
Наиболее сложен техногенез в природных районах с большим
интервалом высот и сочетанием гумидных, аридных и нивальных
ландшафтов. И. А. Авессаломова разработала методику исследо-
вания в подобных условиях. Она изучила фоновые ландшафты,
зону прямого воздействия горно-металлургического комбината
(район действия антропогенных селей, карьеры, хвостохранилища)
и зону косвенного воздействия (на 10 км), примыкающую к пром-
365
зоне. В каждом объекте определялся суммарный приход твердого
вещества со снегом (г/м2 в сутки), коэффициенты 7? Шоу, пара-
генная ассоциация элементов в снеге, горизонте А почв, лишайни-
ках, донных отложениях, гидрохимия речных вод.
Все большее значение приобретает оптимизация ландшафтов
былых рудников и карьеров, площадь которых в СССР составляет
миллионы гектаров. В результате рекультивации они превращают-
ся в агроландшафты, зоны отдыха и т. д. Важная роль геохимиче-
ских исследований при этом очевидна. Опыт рекультивации ланд-
шафтов Подмосковного каменноугольного бассейна, района КМА
и Никопольского марганцеворудного бассейна обобщен В. И. Фе-
дотовым.
Дорожные ландшафты. Автомобильная дорога с примыкающей
полосой— это ландшафт, в котором за счет выхлопных газов и дру-
гих воздействий автомашин меняется состав атмосферы, почв, рас-
тений и животных. Геохимия таких ландшафтов детально изучена
в СССР, США и других странах. Она зависит не только от интен-
сивности движения, но и от климата, рельефа, растительности и
почв. В США исследование полосы шириной 50 м по обочинам
шоссе № 1 и шоссе Балтимора—Вашингтон показало, что земля-
ные черви здесь обогащены Pb, Zn, Ni, Cd, причем птицы, поедаю-
щие червей, погибают от отравления РЬ и Zn. Геохимические осо-
бенности дорожных ландшафтов важно учитывать при сельскохо-
зяйственном использовании примыкающих садов, огородов, паст-
бищ, полей.
Техногенез в реках, озерах, водохранилищах. По данным
ЮНЕСКО, ежегодно реки сбрасывают в океан сотни миллионов
тонн техногенного Fe, миллионы тонн Pb, Мп, Р. В результате ион-
ный сток рек с каждым годом увеличивается. К началу 70-х годов
техногенная составляющая, по В. А. Ковде, колебалась от 30 до
60% от общего выноса солей. Речная вода содержит также техно-
генные жиры и кислоты, ядовитые вещества. Загрязнение изменяет
биологический круговорот: в реках и озерах исчезает рыба, вода
становится непригодной для питья. Некоторые реки превратились
в грязесточные канавы.
Большое внимание привлекает проблема водорослей. В связи
со строительством ГЭС на Волге, Днепре, Дону уменьшилась про-
точность воды в водохранилищах, возникли застойные зоны. Затоп-
ление плодородных пойм обогатило воду важными биоэлементами.
В результате вода стала «цвести», бурно развились синезеленые
водоросли. Избыток водорослей загрязняет водоемы, а разложение
их остатков уменьшает содержание в воде Ог, обогащает ее гни-
лостными продуктами, вредит рыбе, делает воду непригодной для
питья. Борьба с синезелеными водорослями затруднена исключи-
тельной их устойчивостью (они могут развиваться в воде урановых
котлов атомных реакторов, в эпицентре атомного взрыва вскоре
после испытаний, переносят силу тока около 10 А и напряжение
366
почти 20 - 30 кВт). Вместе с тем водоросли — ценное сырье, бога-
тое белком, витаминами, микроэлементами (содержит в 50 раз
больше Со. чем другие растения, и т. д.). Использование водорос-
лей в качестве ценного корма для домашних животных, удобрения
для полей уменьшает загрязнение водоемов. Разрастание водорос-
лей — частный случай эвтрофикации водоемов, т. е. увеличения их
биологической продуктивности в результате обогащения воды орга-
ническими соединениями, N, Р, К и другими биоэлементами и ее
нагревания (в районах тепловых электростанций). Основным факто-
ром эвтрофикации являются удобрения, которые поступают из почв
в реки и озера. Уже сейчас во многих речных и озерных водах
повышено содержание нитратов и нитритов. Они не только вызы-
вают эвтрофикацию, но и тяжелые заболевания людей, использую-
щих такую воду.
В СССР приняты постановления об охране вод бассейнов Волги и
Урала, Байкала и других водоемов, но в целом проблема все еще да-
лека от решения.
Велики перспективы использования озерных сапропелей. (Инте-
ресен опыт Японии, где высший сорт сапропеля идет в пищу населе-
нию, второй сорт — в корм скоту, третий — на удобрения.)
Технобиогеомы. Совокупность природных ландшафтов, сходных
по ответной реакции на техногенное воздействие, М. А. Глазовская
предложила называть технобиогеомой. Каждая технобиогеома обла-
дает определенной способностью к саморегулированию, в ней образу-
ются сходные техногенные аномалии. На территории СССР выделены
технобиогеомы, однородные по интенсивности химических преобразо-
ваний веществ в почвах и атмосфере, по вероятности растворения про-
дуктов техногенеза в водах и их осаждению на геохимических барье-
рах. Большое значение при таком районировании пробретают учет
зональности, выделение гумидных и аридных территорий.
Техногенез крупных регионов. Возможен и необходим анализ тех-
ногенеза в масштабе отдельных материков, стран, областей, изучение
с геохимических позиций межобластных экономических связей, им-
порта и экспорта. Элементы такого анализа намечены в трудах
А. Е. Ферсмана, но в целом проблема совершенно не разработана.
Здесь особенно плодотворна связь геохимии с экономической геогра-
фией.
Техногенез в океане. Наибольшее внимание привлекают три аспек-
та этой проблемы: биологический круговорот, минеральное сырье и
загрязнение.
Биологическая продуктивность океана не беспредельна, поэтому
необходимы мероприятия по сохранению рыбы и других даров моря.
Океан — важный источник химических элементов. Это в первую оче-
редь Н и О, т. е. сама вода (в том числе дейтерий 2Н — сырье для тер-
моядерной реакции). С помощью опреснителей получают из морей воду,
пригодную для питья. На восточном берегу Каспийского моря рабо-
тает мощная опреснительная установка, снабжающая пресной водой
367
г. Шевченко. Есть опреснители и за рубежом, особенно в приморских
пустынях на побережье Персидского залива. Из морской воды добы-
вают Mg, Na, К, Cl, Вг, ставится вопрос об извлечении U и других
элементов. Запасы их практически не ограничены, а технология извле-
чения часто проще, чем при обычной добыче, так как не надо строить
шахт, дробить руду, растворять ее в кислотах и щелочах. Более 40 %
потребности капиталистического мира в Mg удовлетворяется за счет
морской воды, стоимость его дешевле, чем Mg, добытого на суше. Роль
океана как источника минерального сырья растет с каждым годом.
Уже более 1/4 мировой добычи нефти получают за счет бурения на
шельфе. Прибрежно-морские россыпи содержат алмазы, золото, кас-
ситерит, ильменит, рутил, циркон, монацит, шеелит, янтарь и дру-
гие минералы. Добывают на шельфе фосфориты и серу. Разработаны
методы добычи железомарганцевых конкреций (Fe, Mn, Со, Ni). Постав-
лен вопрос об извлечении из металлоносных рассолов рифтовых впадин
Pb, Zn, Cu, Ni, Со и других металлов.
В связи со все большим использованием ресурсов океана возника-
ет серьезная опасность его загрязнения. Так, пленка нефти затрудняет
испарение и проникновение О2 в воду. Это грозит нарушением кру-
говорота воды и изменением климата, понижением биологической про-
дуктивности океана. Съемки из космоса показали, что 15—30 % по-
верхности океана содержат нефтепродукты. Нефтяное загрязнение
грозит рыболовству и птицам, образуются «черные приливы», на дне
возникают «подводные пустыни». В моря и океаны поступает и огром-
ное количество других техногенных загрязнителей. К ним относятся
металлы (Hg, Cd, Pb, Zn, Cu, As, Cr, Mn), хлорорганические токсикан-
ты (ДДТ и его метаболиты, полихлорированные бифенилы и др.), ра-
дионуклиды (80Sr, 13’Cs, 238Pu, 3Н, 144Се). Азот и фосфор минеральных
удобрений, приносимые речным стоком (нитраты и фосфаты), приводят
к гибели рыб и других животных. Несколько лет назад обогащение при-
брежных вод Флориды отбросами, содержащими Со, Р и Ni, привело к
быстрому размножению микроорганизмов, выделивших в воду ядови-
тые продукты обмена. «Нашествие» микробов, погубивших рыбу, про-
должалось полгода. Аналогичные явления наблюдались и у берегов
Калифорнии, где размножившиеся микроорганизмы привели к гибели
100 млн. рыб. Устрицами, зараженными токсинами, отравились сот-
ни потребителей. Ядовитые вещества мигрируют на большие расстоя-
ния. Так, в Карибском море обнаружен ДДТ, применявшийся в Аф-
рике. Все это делает особенно актуальным проблему мониторинга
морской среды. Разрабатываются и многочисленные технические сред-
ства защиты океана от загрязнения (очистка сточных вод, удаление
нефти биологическими методами и др.), а также соответствующие зако-
нодательства на национальном и международном уровнях.
Ноосфера и биосфера. Биосфера существует миллиарды лет, ноо-
сфера — тысячелетия, быстрое ее развитие началось лишь в XX в.
Как и биосфера, ноосфера неравновесна, причем неравновесность, не-
гэнтропийность здесь проявлены еще сильнее. Это объясняется тем,
368
что помимо солнечной энергии в ноосфере широко используется энер-
гия былых биосфер (уголь, нефть и др.), атомная и другие нетрадици-
онные виды энергии. Именно поэтому ноосфера богата химически актив-
ными веществами, которых не было или почти не было в биосфере.
Серная кислота в атмосфере (кислые дожди), взрывчатые вещества
и многие другие активные соединения убедительно подтверждают это
положение.
Биокосные системы неравновесны, но обычно стационарны. Тех-
ногенные системы часто нестационарны и эволюционируют на основе
механизма положительной обратной связи. В ноосфере произошел
«информационный взрыв», обеспечивающий развитие техногенных сис-
тем со скоростью, неизвестной биосфере. Поэтому для ноосферы харак-
терны больший динамизм, большое богатство свободной энергией и
информацией, чем для биосферы.
Весьма удачно сравнение техногенных систем с вулканами, кото-
рые также вносят в биосферу свободную энергию, высокоактивные ве-
щества, очень динамичны. По силе воздействия, катастрофическому
влиянию вулканы напоминают некоторые техногенные системы.
Для современной эпохи характерна постепенная замена биокосных
и физико-химических систем техногенными, поэтому на Земле распро-
странены все три типа систем, а сами техногенные системы часто да-
леки от оптимизации. Вместе с тем человечество в силах создать опти-
мальную, достойную себя ноосферу. В изучении проблем ноосферы
участвуют как естественные, так и общественные науки. Изучая ноо-
сферу, техногенную миграцию и техногенные системы, вносит свой
вклад в решение важнейших проблем человечества и геохимия.
Контрольные вопросы
1. Приведите примеры техногенных почв, илов, кор выветривания.
2. Что такое сернокислый ландшафт, где идут «кислые дожди?»
3. Осветите проблемы геохимии городов, агроландшафтов, районов добычи
полезных ископаемых, автодорог.
4. Что характерно для техногенеза в реках, озерах, водохранилищах?
5. Осветите проблему «техногенез и мировой океан»,
6. Сравните ноосферу и биосферу.
РЕГИОНАЛЬНАЯ
ГЕОХИМИЯ
Два основных момента определяют
геохимию каждой области — ее гео-
логическое прошлое и ее климатиче-
ское настоящее.
А. Е. Ферсман
Региональная геохимия изучает особенности миграции элементов
на конкретных материках, платформах, в складчатых областях, бас-
сейнах рек, морях, океанах, а также на территории государств, ад-
министративных областей, районов и т. д. Несмотря на ее практичес-
кое значение, трудов, посвященных геохимии отдельных регионов, пока
еще мало, нет и крайне необходимой «Геохимии СССР» (аналогичной
«Геологии СССР», «Географии СССР»),
19. ФАКТОРЫ РЕГИОНАЛЬНО-ГЕОХИМИЧЕСКОЙ
ДИФФЕРЕНЦИАЦИИ
Основоположником региональной геохимии был А. Е. Ферсман,
который в 1919 г. прочитал в Петроградском университете курс лек-
ций по геохимии России, изданный в 1922 г. В 1931 г. увидели свет
его «Основные черты геохимии Союза», в 19 >1 г. — «Полезные иско-
паемые Кольского полуострова». В 20-х годах региональной геохи-
мией стал заниматься ученик и помощник Ферсмана по многочислен-
ным экспедициям Д. И. Щербаков (1893—1966). Все же в первой поло-
вине XX столетия региональная геохимия в нашей стране развива-
лась медленно, за рубежом работы в этом направлении вообще не про-
водились. В настоящее время это недостаточно разработанный раздел
геохимии.
Главными факторами регионально-геохимической дифференциации
служат климат и геологическое строение. Противопоставление этих
факторов имеет в виду такой отрезок времени, на протяжении которого
климат и геологическое строение могут рассматриваться в качестве
370
независимых переменных. Производным от климата и геологической
истории является рельеф местности, также один из важнейших фак-
торов, влияющих на геохимические процессы.
Климатический фактор. Геохимическое своеобразие многих про-
цессов биосферы определяется климатом. Однако климат влияет, как
правило, не непосредственно, а через биологический круговорот ато-
мов. Чем влажнее и теплее климат, тем больше создается живого веще-
ства, энергичнее протекает его разложение, обогащающее воды С0.г,
органическими кислотами и другими соединениями, тем интенсивнее
протекают геохимические процессы. Влияние климата наиболее силь-
но в почвах, коре выветривания, грунтовых водах, реках, озерах, илах,
т. е. в ландшафтах, а также в поверхностных слоях морей и океанов.
Артезианские воды и глубокие слои морской воды зависят от климата
меньше.
Климат — важный фактор осадкообразования. Н. М. Страхов вы-
делил три основных «климатических типа» континентального лито-
генеза: гумидный, аридный и ледовый. Это самое общее деление. В
гумидном типе, например, необходимо различать осадки тропического,
умеренного и холодного поясов. Существуют и переходные семигумид-
ные и семиаридные типы литогенеза, отвечающие климату саванн,
лесостепи, муссонных областей. Неоднороден и аридный тип (тропи-
ческие пустыни — холодные пустыни Тибета и Памира).
В конце XIX в. В. В. Докучаев доказал, что климатическая зональ-
ность влияет не только на размещение растительности, что было уста-
новлено еще А. Гумбольдтом, но также на почвы и ландшафты, т. е.
на природу земной поверхности в целом («зоны природы»). Развитие
докучаевских идей установило проявление зональности в размещении
кор выветривания, озерных и речных илов, грунтовых вод, конкреций
и т. д. А. Е. Ферсман подчеркивал, что почвенные и прочие зоны — это
и геохимические зоны, что зональность — закон размещения многих
геохимических явлений на поверхности Земли. Действительно, для каж-
дой зоны характерны определенные парагенные и запрещенные ассо-
циации элементов. Особенно ярко эти закономерности выражены в
ландшафтах материков (рис. 103).
Хотя основная причина зональности — климат, зоны растительно-
сти, почв, кор выветривания, грунтовых вод не всегда совпадают друг
с другом, так как на размещение этих биокосных систем оказывает
влияние и геологический фактор. Чем ближе данная система к земной
поверхности, тем сильнее она зависит от климата и слабее от геологи-
ческого строения. Поэтому особенно четко зональность выражена в раз-
мещении растительности и почв (почвенно-растительные зоны). Зоны
коры выветривания и континентальных отложений значительно шире
соответствующих почвенных и растительных зон. Так, в пределах рас-
пространения нейтрального и щелочного (3) класса коры выветривания
умещаются черноземная, каштановая, бурая и сероземная почвенные
зоны. Зональность грунтовых вод местами сильно затушевана влия-
371
Рис. 103, Важнейшие типы ландшафтов с ведущими, дефицитными и избыточными элементами:
/—арктические пустыни, .2 — тундры и лесотундры, 3 — таежные ландшафты и ландшафтыемешаиных лесов, 4 —ландшафты широколис-
твенных лесов. 5 — лесостепные ландшафты, 6 — степи. 7 — горные степи, лесостепи, луга, 8 — полупустыни и пустыни, 9 — влажные суб-
тропики. Ю — ландшафты муссонных лесов, //— средиземноморские ландшафты (лесные и кустарниковые), /2 — субтропические степи.
саванны, редколесья, 13 — влажные тропики
нием геологических условий. Зональность наблюдается и в химическом
составе речной воды, и в составе многих продуктов гипергенеза.
Геологический фактор. На размещение биокосных систем материков
большое влияние оказывают химический состав пород, тектони-
ка, вулканизм и другие геологические факторы. Их роль возрастает
с глубиной. Наименее значительна она в почвах, больше в коре вы-
ветривания и грунтовых водах и еще больше в глубоких горизонтах
литосферы. Но и на земной поверхности в одном и том же климате ги-
пергенные процессы в гранитоидах, базальтах, известняках, сланцах,
соленосных и других породах протекают по-разному. Однако эти раз-
личия проявляются на фоне общих закономерностей, обусловленных
климатом. Реже в ландшафтах геологический фактор является веду-
щим, например в размещении зон окисления сульфидных месторожде-
ний: и во влажных тропиках, и в пустынях выветривание сульфидных
руд приводит к развитию сернокислого процесса. Размещение серно-
кислой коры выветривания подчиняется зональности, но она действует
на фоне более общих геологических закономерностей, определяющих
размещение складчатых поясов и сульфидных руд.
Осадкообразование в морях и океанах также зависит от многих гео-
логических причин, которые детально охарактеризованы в литологии.
Отметим связь с геологическим строением и рельефом области сноса,
тектоникой морского дна, подводным вулканизмом (вулканогенно-оса-
дочный литогенез) и т. д.
Геологический фактор полностью контролирует размещение эндо-
генных процессов. Так, важной особенностью многих рудных провин-
ций является накопление одних и тех же металлов на протяжении почти
всей геологической истории. Такие металлы В. И. Смирнов называет
типоморфными (для данной провинции). Для Кавказа типоморфны
Си, Мо и отчасти полиметаллы: медные и молибденовые месторождения
формировались здесь в каледонскую, герцинскую, киммерийскую и
альпийскую эпохи. В Забайкалье и Приморье типоморфно Sn, на
Северо-Востоке — Sn и Au, на Урале — Fe. Причины такой специали-
зации отдельных регионов полностью не выяснены. Отмечается роль
первичной неоднородности мантии, ассимиляции более древних место-
рождений и т. д. А. А. Сауков считал, что для объяснения горизонталь-
ной неоднородности земной коры необходим учет гипергенной диффе-
ренциации элементов, т. е. явления большого круговорота (см. гл. 25).
Эндогенные месторождения нередко вытягиваются в пояса, про-
стирающиеся на сотни и тысячи километров. Примером служит «Ве-
ликий серебряный пояс» на западе обеих Америк, отмеченный место-
рождениями Ag и других металлов. Он является частью еще более
грандиозного Тихоокеанского рудного пояса. Классические труды
С. С. Смирнова, Ю. А. Билибина и их многочисленных последователей
позволили установить геологические закономерности размещения по-
добных поясов. Возникла наука о региональной металлоносности —
металлогения, которая развивается в основном на геологической
373
(тектонической) базе. Одна из задач региональной геохимии — освое-
ние достижений металлогении, анализ их с геохимических по-
зиций.
По Ю. А. Билибину, фанерозойские подвижные пояса проходили в
своем развитии ряд стадий — начальную, раннюю, среднюю, позднюю,
и конечную. Начальные и ранние стадии знаменуют собственно гео-
синклинальный этап (прогибание); для средней стадии характерно фор-
мирование складчатого пояса, т. е. инверсия геосинклинали, орогенез;
для поздних и конечных стадий — консолидация, резкое преоблада-
ние разрывных нарушений, восходящие движения. Для многих поя-
сов характерны также последующая магматическая активизация и не-
отектоническая стадия. С развитием подвижных поясов закономерно
связана эволюция магматизма (от основного к кислому и щелочному)
и эндогенного рудообразования. По Билибину, с ранними этапами свя-
зано 100 % ресурсов Pt, Cr, Ti. V, 90 % Ni, со средними и поздними —
100 % ресурсов Sn, W, Li и Be, 76 % Au. А. Д. Щеглов подчеркнул,
что Билибин рассматривал свои построения лишь как общую схему и
ее дальнейшее развитие видел в выделении металлогенических типов
складчатых областей. Развивая это направление, А. А. Смыслов и дру-
гие исследователи в складчатых областях СССР выделяют области
сидеро-халькофильного профиля (Карпатская, Кавказская, Уральс-
кая, Алтае-Саянекая, Камчатская) и лито-халькофильного профиля
(Казахская и Средняя Азия, Забайкалье, Чукотка, Приохотье и др.).
Следует также учитывать, что каждый минеральный комплекс прояв-
ляется наиболее интенсивно лишь в определенных структурных зо-
нах — частях складчатого пояса.
Одновременно с концепцией эволюции подвижных поясов и в зна-
чительной степени в дополнение к ней развивались идеи о блоковом
строении земной коры и большой роли разломов в металлогении. Раз-
ломы хорошо выявляются на космоснимках. Особое внимание привлек-
ли глубинные разломы, корнями уходящие в верхнюю мантию
(рис. 104). Их протяженность измеряется сотнями и тысячами кило-
метров при ширине в десятки километров, а время существования —
геологическими периодами и эрами. Глубинный разлом связывает
верхнюю мантию и глубокие части земной коры с земной поверхностью.
В этих зонах развиваются магматизм и гидротермальные процессы,
такие структуры захватывают материки и океаны. Так, через всю
Западную Африку от Гвинейского залива до Средиземного моря на
несколько тысяч километров простирается глубинный разлом. На
всем протяжении для него характерны мезозойские массивы щелоч-
ных гранитоидов, обогащенные редкими элементами, Sn, W и т. д.
Подобные зоны нередко выявляются с большим трудом лишь косми-
ческими съемками и другими методами (например, грандиозный Ура-
ло-Оманский суперлинеамент был обнаружен космическим кораблем
«Союз-9»), По М. А. Фаворской и И. Н. Томсону, с такими разломами
(«рудоконтролирующими структурами») связаны крупнейшие руд-
ные месторождения.
374
На основе геофизических данных и опытов по разрушению горных
пород развиваются и другие представления о глубинных разломах.
По Ф. Н. Николаевскому, на глубине около 10 км разломы откло-
няются от вертикального направления и представлены мощной субго-
ризонтальной трещиноватой зоной (так называемые коровые волново-
ды, внутрикоровая астеносфера).
Важное геохимическое значение в фанерозое приобрели и процессы
тектоно-магматической автивизации, т. е. формирования на платфор-
мах и в консолидированных складчатых поясах подвижных структур
негеосинклинального типа. А. Д. Щеглов относит эти процессы к
постплатформенной континентальной стадии развития земной кори
Для подобных областей характерны зоны долгоживущих разломов и
рифты, блоковые движения, интенсивное проявление интрузивно-
го и эффузивного магматизма, в частности основного—щелочно-
го (карбонатиты и др.) По кинематическим параметрам (растя-
жение, поднятие материала мантии) рифтовые зоны противопо-
ложны геосинклинальным поясам, для которых характерны сжа-
тие, прогибание.
Тектоно-магматическая активизация энергично проявилась на
Балтийском щите, Алдане, в Забайкалье, Восточной Африке,
в Южном Китае и других регионах. С нею связано образование
месторождений Sn, W, Мо, Ba, Аи, Си, Pb, Zn, TR, F (флюорит)
и других элементов. Для подобных регионов характерна малая
мощность платформенного чехла, связь рудогенеза с глубинными
(подкоровыми) процессами.
На схеме «Региональной геохимической зональности территории
СССР» показаны основные структурные элементы земной коры с их
геохимической характеристикой (рис. 104).
Итак, для понимания геохимического своеобразия конкретной руд-
ной провинции необходимо учитывать все особенности ее геологичес-
кого развития, включая историю складчатых поясов, особенности бло-
ковой тектоники (в том числе роль глубинных разломов), явления тек-
тоно-магматической активизации, эволюцию климата, рельефа и т. д.
Регионально-геохимические исследования обычно проводятся от-
дельно для тектоносферы и биосферы. Примером первых могут слу-
жить работы В. В. Иванова, Г. М. Мейтува и других исследователей
в Восточном Забайкалье. В. А. Обручевым и его последователями уста-
новлено широкое распространение блоковой тектоники в Забайкалье.
Работы последних десятилетий показали, что одни блоки в PZ и MZ
испытывали преимущественно поднятия, другие—прогибание. Вы-
деляются и такие блоки, которые в PZ преимущественно поднимались,
а в MZ прогибались, и наоборот. С характером развития блока во
многом связана и его рудоносность. Так, меторождения Sn и W приу-
- рочены к областям, устойчиво прогибавшимся в доюрское время и
поднимавшимся в MZ. Флюоритовые месторождения характерны для
областей палеозойского и мезозойского воздымания.
375
Геохимические особенности изверженных пород Забайкалья также
зависят от истории геологического развития региона. С мезозойскими
поднятиями связаны более кислые породы, обогащенные Li, Be, Та и
W. В районах мезозойских депрессий характерны V, Сг, Со, Ni (в
прогибах сконцентрировано около 70 % основных и средних эффузи-
вов).
Геохимическое своеобразие рудных районов Забайкалья контро-
лируется различиями в строении земной коры: районам современных
поднятий соответствует большая мощность земной коры, причем гра-
нитный слой увеличивается, а базальтовый — уменьшается.
Интересны и важны в поисковом отношении закономерности регио-
нальной геохимии минералов. Например, в пределах зоны оловянно-
вольфрамовой минерализации от ее центра к периферии в биотите
увеличивается содержание V. Сг, Со, Ni. Си, Zr, Ва, Мо и уменьшается
Li, Rb, Cs, Та, Be, Sr, Zn. Изменяется содержание элементов-приме-
сей в полевых шпатах и кварце.
В. В. Иванов установил в Восточном Забайкалье пять геолого-гео-
химических типов эндогенных рудных районов, при выделении кото-
рых особое внимание он обратил на тектонические движения в пред-
рудное время.
В качестве примера геохимической характеристики биосферы рас-
смотрим геохимию осадочного чехла Туранской плиты, начало изу-
чения которого было положено в 1925 г. экспедицией А. Е. Ферсмана
в Каракумы. В последние десятилетия геохимия Туранской плиты
изучена весьма детально. Это область распространения морских и
континентальных мезокайнозойских отложений преимущественно
аридного типа (гумидные периоды только в J1+2 и К iapt + ait>)- А- М. Да-
нилевич, Г. М. Шор и Л. В. Диордиенко отмечают развитие на этой
Рис. 104. Региональная геохимическая зональность территории СССР (по
А. А. Смыслову и др.):
/—3— глубоко эродированные блоки, области размыва (/-—мафические щитов и кристал-
лических массивов с халькофильио-сидерофильиой специализацией, 2 — салические щитов
и кристаллических массивов с литофильной сндерофильно-лнтофильиой специализацией,
3 —• салические докембрийских щитов, кристаллических и срединных массивов фаиерозой-
ских складчатых областей с интенсивным развитием граиитоидов и с халькофильио-лито-
фильиой специализацией. 4, 5 —бассейны седиментации складчатых областей (4 — эвгео-
синклинальные — пояса и блоки с халькофильио-сидерофильиой специализацией, 5 — мио-
геосинклинальные с сндерофильио-халькофильио-литофильиой специализацией), 6—8 —
бассейны седиментации платформ со специализацией (6 — сидерофильиой, 7 — халькофиль-
ной. 8 — литофильной), 9. 10 —• зоны активизированных окраин платформ (9 — с сидеро-
фильно-халькофильной специализацией. 10 — с сидерофильно-литофильиоЙ специализацией);
11 — суборогенные зоны с халъкофилъно-литофилъной специализацией; 12 — зоны краевых
прогибов с литофильно-сидерофилъно-халъкофилъной специализацией; 13 ~ пограничные
вулканогенные пояса с сидерофильно-литофилвной специализацией, 14 — зоны глубинных
разломов, 15 — гранииы (а — геологические и геохимические, б — геохимические), 16 — гра-
ницы мегаблоков земной коры с различной геохимической специализацией. Сложные
типы геохимической специализации показаны комбинацией соответствующих знаков; /—
VI— геохимические мегаблокн (мегапровииции): / — Дальневосточный фемический сущест-
венно халькофильио-сидерофильиый, //-Восточно-Сибирский существенно салический ли-
тофильный и халькофильио-литофильный, /// — Сибирский салическо-фемический халько-
фильиый и сидерофильио-халькофильиый, /V — Казахстаиско-Западио-Сибирский салический
литофильный и халькофильио-литофильный, V’ — Урало-Восточноевропейский фемический
халькофильно-сидерофильный. И/ — Центральноевропейский салический литофильный и си-
дерофильно-литофильный
377
территории терригенной—молассоидной формации (Р — Т), терри-
генной—угленосной и карбонатной (J), карбонатно-терригенной (К) и
герригенно-карбонатной (палеоген, неоген). Для каждой формации
были рассчитаны пределы колебаний и средние содеражния Мо, Sr,
Y, Zr, V, Со, Ni и т. д. Блоковый характер тектоники определил разли-
чия в геохимической истории отдельных районов. Так, центральную
часть плиты пересекает Днепровско-Алайский линеамент, грабеновая
структура со специфической геохимией. Геохимическое своеобразие
Туранской плиты определяется нефтегазоносностью и битуминоз-
постью многих районов, широким распространением древнего и сов-
ременного галогенеза (поваренные, калийные соли, гипсы, соли Sr и
г. д.), формированием многочисленных артезианских бассейнов с во-
дами разного состава (в том числе с промышленными I — Вг водами).
Ряд осадочных толщ обогащен халькофильными и сидерофильными
элементами за счет их осаждения на сероводородных, сорбционных
и других геохимических барьерах как в ходе сингенетических, так и
эпигенетических процессов (последние особенно характерны для рай-
онов, примыкающих к Тянь-Шанскому орогену и испытавших текто-
ническую активизацию).
Ценные исследования по региональной геохимии выполнены также
на Дальнем Востоке (И. Н. Говоров, В. Г. Моисеенко), на Украине
(Б. Ф. Мицкевич, О. В. Зинченко, В. А. Шумлянский и др.), в Бело-
руссии (К. И. и В. К. Лукашевы, В. А. Кузнецов, В. Е. Бордон и др.),
на Алтае (Н. Н. Амшинский, Ю. Г. Щербаков), в Хибинах (А. Е. Ферс-
ман, В. И. Герасимовский и др.) и других регионах.
Важное значение для региональной геохимии имеет новая глобаль-
ная тектоника или тектоника плит, которая воскресила идеи А. Ве-
генера (1912) и других «мобилистов» о дрейфе материков. Длительное
время отвергнутый большинством геологов дрейф материков получил
подтверждение при изучении океанов. В отличие от Вегенера сторон-
ники новой конценпции оперируют понятием о литосферных плитах
мощностью около 100 км, включающих в себя не только блоки земной
коры, но и верхнюю мантию (до астеносферы). Плиты состоят из участ-
ков материковой и океанической коры, они двигаются по поверхности
астеносферы и проходят за геологическое время большие расстояния.
Предполагается, например, что Индостан за кайнозой сблизился
с Евразией на 2500—3000 км (Южный Тибет считают частью Индий-
ской плиты). Как и в концепции Вегенера, дрейфом плит объясняются
палеоклиматические изменения, сходство флоры и фауны удаленных
друг от друга материков (особенно палеозойской флоры Африки и
Южной Америки). Как и по Вегенеру, утверждается, что Индостан,
Австралия, Африка и Южная Америка представляли единый материк
Гондвану и только раздвигание плит, начавшееся в мезозое, отъединило
их друг от друга. Согласно этой теории в рифтах срединно-океанических
хребтов происходит раздвигание (спрединг) литосферных плитн подъем
расплавленной мантии, выплавление из нее базальтов, формирование
тонкой океанической коры (5—7 км). С этих позиций Красное море
378
представляет собой начальный этап формирования океанической коры,
Атлантический океан — пример значительного расхождения плит .
Плиты движутся в латеральном направлении к зонам сжатия (зонам
Заварицкого-Беньоффа), где происходит их столкновение с другой
литосферной плитой и «засасывание» (субдукция) в мантию. На таких
участках формируются гранитные магмы, континентальные коры, про-
исходит складчатость, горообразование и рудообразование. А. Митчелл,
например, пришел к выводу, что основные промышленные мес-
торождения Си — Мо, а также Sn приурочены к палеозонам суб-
дукции.
Как видим, теория дрейфа плит развивает представление о кру-
говороте веществ, связывающем земную кору и мантию, выделяет не
только вертикальную (в рифтах срединно-океанических хребтов и зо-
нах субдукции), но и горизонтальную миграцию (движение плит по
поверхности астеносферы). В целом данная теория объяснила огром-
ный массив фактов, в том числе полученный за последние 20—30 лет:
молодость и растекание дна океанов в районе срединно-океанических
хребтов, различия в намагниченности пород и др. Стало понятным
геохимическое сходство ряда удаленных районов, например оловян-
но-вольфрамовых зон Африки и Южной Америки, Африки и Европы.
Установлены факты, противоречащие новой глобальной тектонике:
существование корней континентов глубиной до 400 км и более, связь
рудных объектов с глубинными зонами мантии, прослеживающаяся
в течение многих сотен миллионов лет, и др. Поэтому разрабаты-
ваются альтернативные концепции — глубинного диапиризма и др.
20. ГЕОХИМИЧЕСКОЕ РАЙОНИРОВАНИЕ
И КАРТИРОВАНИЕ
К территориальным геохимическим единицам А. А. Смыслов и дру-
гие исследователи относят геохимические мегаблоки, пояса, провин-
ции, области и зоны. На территории СССР ими выделено несколько
мегаблоков (мегапровинций) субмеридионального простирания, ко-
т< 'ые отличаются друг от друга геохимической специализацией (см.
р с. 104). Например, Дальневосточный фемический мегаблок характе-
ризуется халькофильно-сидерофильной специализицией СФК —
структурно-формационных комплексов (земная кора переходного типа),
а Казахстанско-Западносибирский салический мегаблок — литофиль-
ной и халькофильно-литофильной специализацией (складчатые облас-
ти Средней Азии, Казахстана и фундамента западной части Западно-
Сибирской платформы). Предполагается, что геохимическая специа-
лизация мегаблоков связана с первичной гетерогенностью маитийно-
коровых блоков.
Примерами геохимических поясов служат Днепровско-Алайский.
Енисейско-Кызылкумский, Западно-Сибирский железорудный и дру-
гие пояса. Первый представляет собой крупную линейную шовную
379
тектоническую структуру—глобальный линеамент, секущий Русскую и
Скифско-Туранскую платформы. Для этого пояса, по А. М. Даниле-
вич, характерна региональная битуминозность (в том числе залежи
нефти и газа), литофильная и халькофильно-литофильная специали-
зация эндогенных иэкзогэнных концентраций элементов. В этом поясе
выделяется Мангышлакский регион (провинция?) с сингенетическими
(К — N), эпигенетическими (N —• Q) экзогенными аккумуляциями
Sr, Р, Mo, TR и других, преимущественно литофильных элементов.
Понятие геохимическая провинция предложено А. Е. Ферсманом
для геохимически однородных областей, характеризующихся опреде-
ленной ассоциацией элементов. А. А. Смыслов и соавторы геохимичес-
кой провинцией и областью именуют крупные геоструктурные образо-
вания земной коры с аномальными содержаниями химических эле-
ментов и (или) аномальной степенью их дифференциации.
В последние десятилетия создалась возможность выделения гео-
химических провинций по данным распределения локальных концент-
раций элементов, полученным при различных геохимических съем-
ках (например, с целью поисков рудных месторождений, расчленения
массивов изверженных пород и т. д.). В основу выделения провинций
при этом часто кладется геохимическая классификация элементов
В. М. Гольдшмидта. Так выделяются литофильные провинции (Юго-
Восточное Забайкалье, юг Буреинского хребта, часть Украинского
щита и др.), халькофильные (юг Таймыра, запад Сибирской платфор-
мы и др.). Существуют и провинции смешанной специализации: ли-
тофильно-халькофильные (большая часть Сибирской платформы), си-
дерофильно-халькофильные (большая часть Казахской складчатой
страны) и т. д. (рис. 105, 106).
Так как главными факторами регионально-геохимической диффе-
ренциации служат климат и геологическое строение, то границы гео-
химических территориальных единиц часто являются не только осо-
быми «геохимическими границами», а и петрографическими, климати-
ческими, почвенными и прочими границами. Поэтому геохимические
провинции нередко выделяются на основе негеохимических методов, в
то время как изучение выделенного пространства проводится метода-
ми геохимии. Это и дает основание говорить о геохимической провин-
ции. Например, существует геологическая (тектоническая) провинция
Балтийского щита, но можно говорить и об одноименной геохимической
провинции, имея в виду региональные кларки элементов, закономер-
ности миграции и концентрации элементов на данной территории. В по-
добных случаях вполне можно говорить и о геохимической характерис-
тике конкретных щитов, платформ, складчатых поясов, т. е. о харак-
теристике единиц тектонического, петрографического и прочего рай-
онирования. Аналогичные заключения можно сделать относительно
гидрогеохимических, ландшафтно-геохимических и других провинций,
так как часто речь идет о геохимической характеристике почвенных
зон, артезианских бассейнов и других территориальных единиц, вы-
деленных негеохимическими методами. Однако геохимические исоле-
380
дования позволяют провести в ряде случаев и новые границы, и тог-
да геохимическая провинция не будет точно соответствовать терри-
ториальным обособлениям, выделяемым на основе других критериев.
Если территориальные единицы иногда выделяются по неогеохи-
мическим признакам, то их характеристика всегда основана на специ-
фических геохимических показателях. Для этого используются регио-
нальные и локальные параметры распределения химических элементов,
которые могут существенно отличаться от глобальных параметров —
Рис. 105. Региональная геохимическая зональность Казахстанской складчатой
страны (по Е. В. Плющеву и В. В. Шатову):
А — граница Западного и Восточного геохимических блоков; Б — граница геохимических
поясов, провинций и районов (а — наблюдаемые, б — предполагаемые под чехлом рыхлых
отложений); В — 3 — Западный геоблок: В — провинции литофильного типа (/ —Кокчетав-
ская, 2 — Центральноказахстаиская), Г — провинция хальколнтофильного типа (3 — Токраус-
кая), Д — районы слабовыраженного литофильного типа (4 — Арганнтииский, 5 — Чуйскнй),
Е — фрагменты Каратау—Улутау—Джаркайиагачского и Джалаир—Найманского литоси-
дерофильных поясов (6— Джаркайнагачский, 7— Улутаускнй, S — Каратускнй, 9 — Севере-
Бетпакдалинский, 10 — Чу-Илнйский), Ж — провинции н районы слабовыраженного сидеро-
литофильного типа (11 — Калмыккольская, 12 — Сарысу-Тенизская, 13 — Бурунтауский, 14--
Жебаглинскнй. 15 — Анархайский). 3~ провинции н районы халькофильиого типа (16-
Каратауская, /7 — Джезказганский, 18 — Джаильмииский, 19 — Успенский. 20 — Тенизскнй».
И—О — Восточный геоблок: И — провинции сидерохалькофильного типа (21 — Зайсаи-Чяь
гиз-Тарбагатайская. 22 — Северо-Джунгарская), К — провинции и районы литосндерохаль
кофильного типа (23— Баянаульская, 24 — Западно-Калбинская, 25 — Кетменский). Л
провинции лнтохалькофильного типа (26 — Селеты-Степнякская. 27 — Восточно-Прибал
хашская, 28 — Южно-Джуигарская. 29 — Кендыктас-Заилийская), М — провинции лито-
фильного типа (30— Калба-Нарымская), Н — районы слабовыраженного литофильного типа
(31 — Центральноджунгарский), О — провинции халькофильиого типа со слабовыраженной
лнтофнльностью (32 — Рудно-Алтайская)
381
кларков. Так, среднее содержание Li в гранитах земного шара со-
ставляетЗ,8 • 10-3 %, в гранитах Украинского щита — 4 • 10~3, в
гранитах Восточного Забайкалья — 9 • 10-3 %. Важной региональ-
Рис. 106. Схема геохимическо-
го районирования Карело-
Кольского региона:
/—V7 — внутриблоковые геохимиче-
ские области (/ — недифференци-
рованная Мурманская, // — диффе-
ренцированная сндерофильно-ли-
тофильная Центральнокольская,
///— слабоднфференцированная ли-
тофил ьно-хал ькофильн а я Лапланд-
ская. IV — слабодифференцирован-
ная лнтофильно-сидерофильная Бе-
ломорская. V — дифференцирован-
ная халькофильно-литофильная
Центральнокарельская. V/ — диф-
ференцированная халькофильно-
литофильная Балтийске-Ладож-
ская); 1—4 — межблоковые и шов-
ные геохимические зоны (/ — лито-
фильная Воронье-Колмозерская,
2 — лнтофильно-халькофильная Пе-
ченга-Имандра-Варзугская, 3 — ли-
тофил ьио-хал ькофильна я Ветреного
пояса и Центральной Карелин. 4—
лнтофильно-халькофильная Саво-
Ладожская); 5—7 — секущие геохи-
мические зоны (5 — литофильная
Западно-Ладожская, 6 — лнтофнль-
но-халькофильная Онежская, 7 —
литофильная Юовуайв-Лнцевская);
Л—В — внутриблоковые геохимиче-
ские районы (Д — литофильный
Кейвскнй, Б — ендерофильно-лито-
фнльный Хнбнио-Ловозерскнй, Б—
лнтофнльно-халькофильный Онеж-
ский)
но-геохимической характеристикой яв-
ляется кларк концентрации элементов
в породах и рудах данной провин-
ции. Ценную информацию несут раз-
личные мультипликативные показате-
ли. Например, Э. Г. Ишевская для
Корсунь-Новомиргородского плутона
Украинского щита использовала муль-
типликативный показатель:
КК (Zr-Y-NbUYb-Be)
УУ(У2, Ni2, Ag2)
С его помощью в пределах плутона
выделились разности гранитов, показа-
но резкое отличие данного плутона от
Кировоградско-Житомирского комплек-
са (значения показателей колебались в
миллион раз).
Выделение геохимических террито-
риальных единиц разных рангов полу-
чило наименование геохимического райо-
нирования. Оно имеет важное практи-
ческое значение — используется при
прогнозировании и поисках рудных ме-
сторождений, решении вопросов охраны
среды, при медико-геохимической оцен-
ке территории, решении других при-
кладных задач. Чаще всего районирова-
ние проводится на основе геохимического
картирования.
Принципиальные основы геохимичес-
кого картирования были разработаны
А. Е. Ферсманом в начале 30-х годов.
В дальнейшем этими вопросами занима-
лись многие геохимики. Особенно боль-
шое значение имели геохимические по-
иски полезных ископаемых, которые
сопровождались массовым составлением
особой разновидности детальных геохи-
мических карт. В последние десятиле-
тия расширились работы по геохими-
ческому картированию с прогностичес-
кой целью на отдельные виды полез-
ных ископаемых. Разновидностью гео-
382
химических карт являются биогеохимические, гидрохимические, га-
зогидрогеохимические, ландшафтно-геохимические и другие карты
(рис. 107).
Большая работа по составлению мелкомасштабных геохимических
карт проводится в Ленинграде во Всесоюзном геологическом инсти-
туте (ВСЕГЕИ), который является главным научным центром СССР в
области геологического картирования.
Рис. 107. Газогидрогеохимическая карта подземных вод европейской части СССР
(по А. В. Щербакову):
/— кислородные, 2 — азотные, 3— сероводородио-азотные, 4 — в верхней части разреза —
сероводородно-азотные, в ннжней — сероводородно-углекисло-метановые, 5 —в верхней ча-
сти разреза — сероводородно-азотные, в нижней — сероводородно-углекнслые, 6 — в верх-
ней части разреза азотные, в ннжней — сероводородно-углекнслые, 7 — в верхней части раз-
реза— азотные, в ннжней — сероводородно-азотные, 8— в верхней части разреза — серово-
дородно-углекислые, в нижней — сероводородно-углекисло-метановые, 9 —в верхней части
разреза — сероводородно-углекнслые, в нижней сероводородно-азотные, 10— граница
кристаллических щнтов и горных складчатых сооружений
383
В соответствии с общей методологией геохимии геохимические карты
разделяются на три основных типа: карты элементов и их ассоциаций,
карты систем и карты процессов. Каждый тип составляется в разных
масштабах. Известны геохимические карты в масштабе 1 : 20 000 000
(например, для территории СССР) и 1 : 2000 (для отдельных рудных и
зномальных полей).
С поисковыми целями составляются карты первого типа разных
масштабов. Например, в Замбии по А. Левинсону была составлена
карта распределения Си в донных осадках в масштабе 1:1 000 000
(одна проба приходилась почти на 200 км2).
Задача прогнозных геохимических карт средних масштабов — от
I . 200 000 до 1 : 50 000 — заключается в расчленении изучаемой пло-
щади на участки по типам геохимической специализации. С этой целью
проводится площадное геохимическое опробование коренных пород.
Подобные работы получили распространение на Украине, в Забай-
калье, Казахстане и других рудных районах. Массовый характер
опробования позволяет использовать статистические методы и выде-
тять рудоконтролирующие структуры, потенциально рудоносные гео-
тогические комплексы, зоны, фации, метасоматиты, ореолы, расчленять
массивы изверженных пород и т. д. Важное значение при этом приоб-
р ела математическая обработка данных на ЭВМ с установлением раз-
личных оценочных параметров, в том числе мультипликативных пока-
зателей.
Для условий Дальнего Востока методика составления геохимичес-
ких карт масштаба 1 : 50 000 разработана в Ленинградском горном
институте Ю. Н. Капковым, Е. М. Квятковским и В. И. Яковлевым.
Они предлагают на геологическую основу наносить ведущие элементы
отдельных формаций, характерные для них кларки концентрации,
различные статистические параметры. Значительное распространение
геохимическое картирование в масштабе 1 : 50 000 получило в Цент-
ральном Казахстане (И. В. Орлов, В. Н. Казмин). На таких картах
отражают фоновые и аномальные содержания элементов в коренных
породах, показывают ореолы рассеяния, выявленные литохимической
съемкой, другие геохимические показатели.
Детальные литохимические карты составляются при геохимичес-
ких поисках в масштабе 1 : 50 000—1 : 10 000. Особенно подробные
карты составляются для отдельных аномальных полей.
На втором типе геохимических карт показывают размещение раз-
шчных систем, для которых прямо на карте или в условных обозна-
чениях приводятся геохимические характеристики. Образцом таких
карт служит Геохимическая карта СССР м 1 : 10 000 000, составлен-
ная во ВСЕГЕИ большим коллективом геохимиков под руководством
А. А. Смыслова (А. М. Данилевич, Е. В. Плющев, Л. А. Полунина,
В. А. Рудник, В. М. Терентьев, В. К. Титов, Г. М. Шор и др.). В осно-
ву ее составления положено понятие о структурно-формационных комп-
лексах — сочетании определенной геологической формации с типом
ее дислоцированности. Так выделены комплексы платформенных
384
чехлов и их деформированных частей, которые делятся на терригенные
и терригенно-карбонатные, угленосные терригенные, карбонатные и
другие комплексы. Далее выделяются структурно-формационные комп-
лексы щитов и кристаллических массивов, геосинклинальных и склад-
чатых областей, орогенных и активизированных областей. В каждой
из этих групп также выделяются комплексы по вещественному составу.
Например, в группе орогенных и активизированных областей — уг-
леносно-терригенные, терригенно-карбонатные, терригенно-вулкано-
генные и т. д.
Для каждого структурно-формационного комплекса приводится
геохимическая характеристика на основе классификации элементов
В. М. Гольдшмидта, т. е. выделяются литофильные, халькофильные и
сидерофильные комплексы с характерными для них ассоциациями
элементов. Выделяются и смешанные комплексы — халькофильно-ли-
тофильные, сидерофильно-халькофильные и др.
Структурно-формационные комплексы на карте изображаются цве-
том, характеризуются также коэффициентом накопления рудных эле-
ментов R по Д. М. Шоу с градациями К 1,5—2,5; 2,5—5,0; 5,0—10,0.
Штриховкой на геохимической карте СССР показаны преобладающие
геологические формации, разрывные нарушения, важнейшие астро-
блемы и прочие обозначения. На особой врезке помещена «Схема гео-
химической зональности по данным распределения локальных кон-
центраций», на которой показаны важнейшие геохимические провин-
ции и области, глубинные разломы, типы экзогенных и эндогенных
эпигенетических процессов (литофильных, халькофильных, сидеро-
фильных).
По глубине анализа и синтеза, а также по детальности данная
карта представляет крупный шаг вперед в геохимическом картирова-
нии, хотя, естественно, возможны и другие подходы в данной области.
Во ВСЕГЕИ составлены и другие геохимические карты СССР того же
масштаба — гидрогеохимическая, геохимической зональности гео-
криологических структур, специализированных геохимических комп-
лексов, ландшафтно-геохимическая, метасоматических формаций (гео-
химическая), категорий трудности геохимического опоискования,
геохимической специализации палеовулканических поясов и ареалов,
фосфороносности. Все эти карты взаимосвязаны и в совокупности
образуют особый атлас.
Ко второму типу относятся и ландшафтно-геохимические карты,
на которых изображается размещение ландшафтов с геохимическими
показателями и формулами. Большие работы по составлению таких
карт в масштабе 1 :500 000 проведены на Нижнем Дону и Северном
Кавказе (В. А. Алексеенко и др.). Ко второму типу относятся также
многие гидро геохимические, гидрохимические и другие карты, а так-
же карты районирования территории по условиям геохимических по-
исков, по медико-геохимической ситуации и т. д. (рис. 108). На них
выделяются районы, однородные по условиям решения практических
13 Зак. 2022
385
вопросов, а в условных обозначениях приводят геохимические харак-
теристики каждого района и условия поисков руд, профилактики раз-
личных биогеохимических эндемий и т. д.
Большое прикладное значение для борьбы с загрязнением среды име-
ет ландшафтно-геохимическое районирование территории. Имеется
Рис. 108. Районирование холмисто-увалистого таежного низкогоръя ио условиям
геохимических поисков (по Т. Тайсаеву):
открытые районы: 1 — останцовые горы и обрывистые склоны врезанных речных долин с
геохимическими реликтами — корами выветривания, зонами выщелачивания и омарганцева
ния разломов; на обнаженных участках — визуальные поиски и поиски по первичным орео-
лам; на участках с маломощным чехлом (0,5—1.5 м) склоновых отложений — поиски по
вторичным ореолам рассеяния. плоские водоразделы и пологие склоны, закрытые элюви-
альными и солнфлюкцнонными отложениями мощностью от 1.5 до 2.5 м: сочетание открытых
и неглубоко погребеных и ослабленных ореолов, поиски по вторичным ореолам рассеяния,
на склонах — отбор проб с глубины 0.5—1,5 м из копушей, шпуров, горных выработок; на
дузакрытые районы: 3 - верховые болота и озера; неглубоко погребенные ослабленные
ореолы, наложенные ореолы в торфах, торфометрические и гидрогеохимические поиски; •/
заболоченные склоны и днища речных долин и падей, закрытые склоновыми и аллювиаль
ными отложениями мощностью от 3 до 5 м. резкоослабленные и неглубоко погребенньк
ореолы, на геохимических барьерах — в торфах и железистых осадках наложенные ореолы
молибдена, мышьяка и т. д.; гидро- и биогеохимические поиски, опробование железистых
осадков; закрытые районы: 5 - площади развития неоген-четвертнчных песков, галечникоь
мощностью от 3 до 10—30 м: месторождения и их вторичные ореолы погребены; глубинные
геохимические поиски выборочно-биогеохимические; 6 — мел-палеогеновые терригенные <н
ложення. перспективные на осадочные руды и фосфориты мощностью 50—100 м и более; п<
заболоченным распадкам вблизи оруденения характерны наложенные солевые ореолы мм
лнбдена. месторождения, связанные с породами кристаллического фундамента и глубок»
погребенные; 7 — железистые осадки на кислородном барьере в болотах
опыт такого районирования для районов нефтедобычи (М. А. ва-
зовская, Е. М. Никифорова, В. В. Батоян, Ю. И. Пиковский и др.),
агроландшафтов (И. П. Гаврилова. Н. С. Касимов, И. А. Павленко.
И. Г. Побединцева и др.), городов (Ю. Е. Сает, Р. С. Смирнова.
Е. П. Сорокина и др.), горно-промышленных регионов (В. А. Сныт-
ко, Е. Г. Нечаева и др.).
386
На геохимических картах третьего типа показывают размещение
конкретных геохимических процессов. По своей сущности и методи-
ке составления они часто близки к картам второго типа. Примером слу-
жат карты типов засоления почв, их кислотности и др.
Контрольные вопросы
1. Какие два основных фактора, по А. Е. Ферсману, определяют геохимию
каждого природного региона?
2. Какое значение имеет металлогения для геохимии?
3. Назовите территориальные геохимич£ские единицы.
4. Чем отличается геохимическое картирование от районирования?
5. Назовите типы геохимических карт, расскажите об их практическом зна-
чении.
6. Каково информациоииое значение мультипликативных показателей?
7. Охарактеризуйте принципы построения геохимической карты СССР.
8. Каков масштаб и содержание прогнозных геохимических карт?
13*
ГЕОХИМИЯ
РУДНЫХ
МЕСТОРОЖДЕНИЙ
Учение о полезных ископаемых не
может дольше оставаться в циклах
наук чисто геологических и должно
быть связано с науками геохимиче-
скими.
А. Е. Ферсман
Рудные месторождения — это системы с такой концентрацией
химических элементов (преимущественно металлов) в земной коре, ко-
торая делает экономически целесообразным их извлечение из недр. На-
ряду с геологией месторождений, их минералогией, геофизикой, гидро-
геологией и другими науками геохимия рудных месторождений стала
важным разделом науки о рудных месторождениях. Одновременно это и
важный раздел геохимии.
21. ОБЩИЕ ВОПРОСЫ ГЕОХИМИИ
РУДНЫХ МЕСТОРОЖДЕНИИ
Геохимия рудного месторождения — это история концентрации н
рассеяния химических элементов в пространстве его рудного поля. Она
включает следующие важнейшие вопросы: 1) кларки концентрации
элементов на месторождении; 2) формы нахождения элементов в рудах
и ореолах, изотопные отношения; 3) парагенные ассоциации элементов в
минералах, породах, рудах, месторождениях и рудных поясах; 4) сов-
ременные и былые геохимические процессы (обстановки) на рудном поле
месторождения, геохимическая зональность; 5) геохимические барье-
ры; 6) историческая и региональная геохимия меторождений, рудных
районов и провинций; 7) геохимические основы генезиса, прогнозиро-
вания, поисков, разведки и эксплуатации месторождений.
Геохимическое изучение месторождений следует проводить в кон-
такте с другими геологическими исследованиями, оно должно быть
связано с минералогией, стратиграфией, тектоникой, литологией,
петрографией, геоморфологией и т. д. Практически почти каждая комп-
388
лексная характеристика месторождения наряду с описанием струк-
туры, минералогии и других особенностей содержит сведения о его
геохимии. Имеются исследования, специально посвященные геохимии
отдельных месторождений.
Кларки и рудообразование. Понятие о кларке долгое время не ис-
пользовалось при анализе рудообразования. Вместе с тем оно необхо-
димо при изучении рудных месторождений, так как от величины
кларка во многом зависят число минералов и генетических типов место-
рождений, их запасы, содержание металлов в рудах и т. д. В табл. 20
приведены КК элементов в рудах. Исключительно велики КК Hg, Au,
Sb. Например, при кларке Hg в литосфере 4,5 • 10-в % в богатых ру-
дах ее содержание достигает 4 %, что дает А А 880 000. Естественно, что
для элементов с высокими кларками (Fe, Mg, Al и т. д.) АА не могут
быть столь значительными, так как содержание элемента в руде не
может превышать 100 %. Для Al КК равен 5,5; для Fe — 7; для Mg —
4,6, Si — 1,6 и т. д. Но и для многих редких рассеянных элементов
КК невелики. Например, для Ga КК = 5,2 (К = 1,9 • 10~3 %); для
Се КК = 5,7 (К = 7 • 10~3 %); для Sc КК = 10 (К = 1 • Ю-3 %)
и т. д. Очевидно, Hg, Sb, Au, W, Sn и другие обладают большой спо-
собностью к концентрации, a Ga, Ge, Sc, In и другие редкие рассеян-
ные элементы — слабой. Они почти не образуют собственных место-
рождений, содержание их в рудах не намного выше кларка, собствен-
ные минералы отсутствуют или их число очень мало, а сами минералы
крайне редки.
Кларки концентрации в рудах колеблются в сотни тысяч раз, но
импульсы миграции, равные In КК, сравнительно меняются слабо —
в пределах одного порядка. Так, для Hg он равен 13,7; Си — 5,98
Таблица 20. Кларки концентрации элементов в рудах
Кларкя концентрации Бедные РУДЫ Богатые руды Импульс миграции u-ln К К Интенсивность рудообра зова ння Px=uft (t—W лет)
1-10 Fe Mg, к 0—2,3 0-2,3-10-6
10—100 Мп, Со, V Fe, Zr, Ti, Na, Ca 2,3—4,6 2,3-4,610-6
100-500 Си, Ni, Та, и Мп, V 4,6—6,2 4,6—6,2-106
500—1 000 РЬ Си, Ni, TR, Ge, Sr, Tl, Ba 6,2—6,9 6,2—6,9-10~6
1 000-10 000 Sn, Мо, W, Au, Pt Cr, Pb. Co, U, Ta, S, Cl 6,9—9,2 6,9—9,2 -10 6
10 000—100 000 Sb, Hg Sn, W, Mo, Au, Pt 9,2-11,5 9,2—11,5-10-6
Больше 100 000 Sb. Hg >11,5 > 11,5-10-6
389
Sc — 2,3; Fe — 1,9; Mg — 1. Это связано с тем, что кларки концентра-
ции входят в формулу и под знаком логарифма. Если принять условно,
что рудообразование продолжалось в течение 1 млн. лет, то интенсив-
ность рудообразования ult для Hg составит 1,37 • 10-5, для Си —
5,98 • 10“в, Sc — 2,9 • 10-в и т. д. Это означает, что на каждый грамм
металла, содержавшегося в данном объеме руды, ежегодно в процессе
рудообразования добавлялось 1,37 • 10~5 г Hg, 5,98 • 10-в г Си и
2,3 • 10-в г Sc. Конечно, это только пример порядка величины, ибо
неизвестно истинное время рудообразования, а все построения исхо-
дят из постоянства интенсивности миграции.
Минимальные содержания элементов в руде также обнаруживают
связь с кларками и химическими свойствами. Так, для черных метал-
лов минимальное содержание в руде равно 20—25 %, для цветных —
0,5—1.0, для редких — 0,1—0,2, для благородных — 0,0005 %.
С КК элемента в рудах связано и разнообразие генетических типов
месторождений. Существует много процессов, приводящих к увели-
чению концентрации элемента в несколько раз и мало — в десятки и
сотни тысяч раз. Так, КК Fe в рудах близок к 7. Процессы, приводящие
к семикратному накоплению Fe, осуществляются и при высоких тем-
пературах земных глубин, и на земной поверхности. Поэтому известно
много генетических типов месторождений Fe: железистые кварциты,
магматические титано-магнетитовые, скарновые контактово-метасо-
матические, гидротермальные месторождения, железные шляпы суль-
фидных руд, сидеритовые осадочные руды, остаточные латеритные
руды коры выветривания ультраосновных пород и т. д. Иные соотно-
шения для Hg, КК которой в богатых рудах равен десяткам и сотням
тысяч (до 880 000). В отличие от Fe для Hg неизвестны магматические
и гипергенные месторождения, руды этого металла образуются толь-
ко в гидротермальных низкотемпературных условиях. Если бы про-
мышленность использовала руды с КК == 7 (как у Fe), т. е. содержа-
щие 6 • 10-5 % Hg, то число генетических типов ртутных месторожде-
ний резко бы возросло. По той же причине ограничено число генети-
ческих типов месторождений Sn, Pb, Zn, хотя число природных тел,
в которых КК этих элементов близки к 10 (как у Fe), весьма велико.
Напомним, что интенсивность рудообразования зависит от КК'
Рх = \nKK/t. Из этой формулы следует, что интенсивность рудообра-
зования в основном зависит от времени рудообразования, так как
кларк концентрации входит под знаком логарифма и изменяется сла-
бо. Преобразуя формулу, можно в явном виде выразить зависимость
кларка концентрации элемента в руде от интенсивности рудообразо-
вания и времени:
КК = Px-t или КК ^еРх'.
Таким образом, кларк концентрации элемента в руде является экс-
поненциальной функцией от интенсивности рудообразования и вре-
мени. Этим подчеркивается роль длительности рудообразования. Воз-
можно, что данный фактор играл при образовании некоторых место-
390
рождений решающее значение. Давно уже установлено, что при по-
исках на открытие одного крупного месторождения приходятся де-
сятки открытий мелких, малоперспективных месторождений, сотни
и тысячи рудопроявлений. При этом геохимические условия нахожде-
ния руд существенно не меняются или даже оказываются идентичными.
Так, ив нашей стране и за рубежом открыты тысячи рудопроявлений
и непромышленных месторождений медистых песчаников в красно-
цветной формации, промышленные же месторождения единичны.
То же можно сказать и о месторождениях Zn, Pb, Ni, Со, Мо, Fe и др.
Весьма вероятно, что в этих случаях решающее значение имела именно
длительность рудообразования — длительность работы геохимического
барьера. Поэтому при прогнозировании месторождений необходимо
обращать внимание на продолжительность развития блоков земной
коры, к которым приурочены рудные месторождения.
Н. И. Сафронов ввел понятие об «энергии рудообразования», кото-
рая рассчитывается на 1 т или 1 м3 руды. Согласно идеализированной
термодинамической модели эндогенного рудообразования концентра-
ция элементов происходит по законам идеальных газов из рассеянно-
го состояния в результате сжатия их «атмосферы». В качестве источ-
ника рудных элементов принимается гранитоидная магма. Выведена
следующая формула:
Е = felnfe,
где Е — энергия рудообразования единицы объема, k — безразмер-
ная величина, показывающая, во сколько раз «атмосфера» данного
элемента сжата в единице объема руды относительно первоначальной
концентрации в гранитоидах. Величина k близка к кларку концентра-
ции, т. е. чем больше КК, тем больше энергия рудообразования. Из
формулы интенсивности рудообразования и формулы Сафронова вы-
водится связь энергии рудообразования Е и интенсивности рудообра-
зования Рх'-
E~KK-Px-t.
Следовательно, энергия рудообразования данного элемента равна про-
изведению его кларка концентрации на интенсивность и время рудо-
образования. С этими же идеями связан и коэффициент полезного дей-
ствия миграции, предложенный Г. А. Булкиным и равный отношению
числа концентрирующихся атомов к общему числу мигрирующих.
Использование термодинамической модели и ряда допущений поз-
волило вычислить этот коэффициент.
Используя зависимость энтропии от вероятности, Н. И. Сафронов
вывел формулу вероятных запасов руд разных кондиций. Хотя
предпосылки его построений условны (термодинамика идеальных га-
зов, гранитоиды как источник металла и т. д.), полученные выводы
хорошо согласуются со статистическими данными. Анализируя мате-
риалы по кварц-касситеритовым месторождениям, ученый показал,
что чем богаче руды, тем менее вероятно их образование (рис. 109),
а энергия рудообразования на единицу объема или массы руды выше.
391
При этом глобальные запасы руд металлов находятся в обратном
отношении к их концентрации и свыше 90 % запасов приходится
на бедные руды с содержанием металлов, близким к кларку.
При анализе рудообразования желательно определять не только
энергию, затраченную на образование тонны руды или металла (ин-
тенсивный параметр), но и «работу рудообразования», т. е. учитывать
и глобальные запасы его руд, запасы в отдельных провинциях, со-
держание элемента в руде. На основе пространственно-статистичес-
кого анализа Л. Н. Овчинников установил прямую зависимость меж-
Разрежеиие — Сжатие концентрации
Рис. 109. График вероятности распределения энергии
рудообразования 1 и относительных запасов олова 2
в зависимости от кларков концентрации олова в
кварц-касситеритовых рудах (по Н. И. Сафронову)
ду кларком элемента и этими параметрами. Исследования на Алтае
подтвердили данную зависимость как для главных элементов руд, так
и для элементов-спутников.
По величине запасов выделяют уникальные, крупные, средние, мелкие
и непромышленные месторождения (табл. 21), причем запасы, уникаль-
ные для одних металлов (например, для Hg), являются средними для
других (Си, РЬ) и мелкими для третьих (Сг). Здесь сказывается влия-
ние кларков (чем меньше кларк, тем менее вероятны большие запасы).
Показателем способности элементов к концентрации в земной коре
служит и отношение запасов к кларку литосферы (табл. 22). Наиболь-
шей способностью к концентрации обладают Sb и Hg (п 108 — п '<
х 10й), которые при очень малых кларках образуют месторождения с
запасами в сотни тысяч (Hg) и миллионы (Sb) тонн. Слабее концентри-
руются Со, Pt, несколько больше — Th, Та и т. д.
В месторождениях сосредоточена ничтожная часть общих запасов
элементов в земной коре (табл. 23.) Следовательно, для образования
месторождений требуется лишь небольшая часть химических эле-
ментов горных пород. Естественно, что образование руд вероятнее
за счет извлечения элементов из обогащенных ими пород и магм. По-
вышенное содержание рудных элементов в горных породах в ряде слу-
чаев служит региональным геохимическим поисковым критерием.
392
Таблица 21. Запасы (т) рудных месторождений (по В. И. Красникову)
Металл Место- рождения, не имею- щие само- стоятель- ного про- мышленно- го значе- ния Промышленные месторождения
мелкие средние крупные уннкалЬ' иые
Fe Al в нафелииах и алунитах, п-106 п-107 п-108 п-109 п-1040
Mg в карналите Mn, Ti в коренных место- рождениях, Сг, А1 (в бокси- п • 105 п-106 п-107 п-108 п-109
тах), Mg (в магнезитах) Ti (в россыпях) Cu, Pb, Zn, п-104 п-105 п - Ю6 п- Ю7 п-108
Ni Sn, W, Mo, Sb, V, Zr, Li, п-103 п- 104 п-105 п-106 п-107
Nb, TR цериевой группы п- 102 п-103 п- Ю4 п- 105 п-106
U, Th, Hg, Be, Co Ta, Ag, Bi, TR иттриевой п-10 п-102 п-103 п-104 п-105
группы Au, Pt п п-10 0, п и менее п-102 п-103 п-10 п-104 п-102
Таблица 22. Запасы месторождений в единицах кларков
(запасы в тоннах: кларк литосферы)
Элементы Промышленные месторождения
мелкие средние крупные уникальные
Sb, Hg п-108 п-109 п-1010 п-1011
Be, Cr, Fe, Mo, Ag, Sn, Pb п-107 п-108 п-109 п-1010
Li, Al, Cr1, Mn, Cu, Zn, Nb, Au, (J п-106 п-107 п-108 п-109
Mg, Ti, V, Ni4, Zr, Ce, (TR), Ta, Th п-105 п-106 п-107 п-108
Co, Y (TR), Pt4 п-104 п-105 п-106 п-107
1 Расчет на кларки а ультраосновных породах.
393
Таблица 23. Количество металлов в земной коре матеоиков
(до глубины 1 км) и их общие запасы в рудных месторождениях
(с учетом выработанных месторождений и прогнозных запасов*;
по Н. И. Сафронову, 1971)
Металл Кларк литосферы К Запасы (С), т СЛС,. % G/K
в породах с. в рудах С2
Fe 4,65 2,1 Ю16 4,3-1012 0,021 9,2-10"
Си 4,7-10-3 4,2-1013 1,82-1010 0,043 3,8-1012
РЬ 1.6-io-3 6,7-1012 1,02-10'° 0,15 6,3-1012
Zn 8,3-10-3 2,1-1013 1,16-10'° 0,055 1,4-1012
Sn 2,5- 10~4 1,7- 1013 5-10s 0,003 2- 1012
W 1,3 - ю-4 4,2-10" 1 10s 0,024 7-10"
Мо 1,1-ю-4 1,2-1012 1 • 10s 0,008 9-10"
Hg 8,3-10-6 2,9- 1О‘° 3,7-1'J7 0,13 4-1012
Au 4,3-10-7 2,1-10° 3,15- 10° 0,15 7-1012
Ni 5,8-10-3 ЗД-1013 6-10е 0,0018 1-10'3*
Co 1,8-10-3 1,2-10'3 5,25-107 0,00044 3-10'3**
* Числа запасов в таблице в 40—250 раз превышают запасы, учтенные
в 1955 г.
** Расчет на кларки в ультраосиовиых породах.
Прогнозные запасы большинства металлов в месторождениях, вы-
раженные в единицах кларков (С2/К), колеблются в пределах одного
порядка — 7 • 1011 — 7 • 1012 (табл. 23). Следовательно, «.глобальная
работа рудообразования», выраженная в единицах кларков, для разных
элементов характеризуется близкими величинами. Это положение
заслуживает дальнейшего научного анализа.
Таблица 24. Запасы и количество месторождений различного ранга
Автор Порядок запасов. % Рудопрояв- ления (п-Ю^-1) Месторожден н я
мелкие, и- 1 0 т средние, п« 10 т крупные, . лл<+2 п • 10 т
По В. И. Крас- Среднее число Не учиты- 70 23 7
никову (1959) на основе данных о запасах месторождений для 9 металлов (Fe, Pb, Zn, W, Мо, Sb, Hg, Со, Au) Суммарные за- вались 0 9 26 65
По А. П. Соло- пасы Общее число 85,75 12,75 1,75 0,25
вову (1963) (для СССР) Запасы 0 22 32 46
Давно установлено, что число рудопроявлений во много раз боль-
ше числа промышленных месторождений, а среди последних средние
394
и мелкие преобладают над крупными (табл. 24). Главная задача поис-
ков — обнаружение уникальных и крупных месторождений, но в ре-
зультате поисков обнаруживается преимущественно огромное коли-
чество рудопроявлений и аномалий. Число рудопроявлений, как пра-
вило, на целые порядки превышает число промышленных месторожде-
ний. Поэтому одна из главных задач прикладной геохимии — выяв-
ление признаков, позволяющих при поисках отличать рудопроявления
от промышленных месторождений. Не менее важна и оценка а нома-
Рис. НО. Корреляции положительная А и отрицательная Б аномалий и ору-
денения:
/ -первичные руды, 2 — геохимическая аномалия на поверхности. 3 — первичный ореол
лий — выделение среди них объектов, отвечающих промышленным
месторождениям (в первую очередь крупным). Опыт поисков показал,
что наиболее интенсивная аномалия на поверхности отнюдь не всегда
соответствует промышленному месторождению (рис. 110), Многие мес-
торождения представлены на поверхности как раз слабыми (малоконт-
растными) аномалиями. Объясняется это разными причинами. Напри-
мер, миграция рудообразующих растворов при отсутствии геохими-
ческого барьера иногда приводит к рассеянию рудных элементов, к
образованию большого аномального поля без рудных тел (рис. 110, Б3).
Строго локализованный рудный процесс с ярко выраженным геохи-
мическим барьером благоприятствует образованию промышленных
рудных тел с небольшим первичным ореолом и поверхностной ано-
малией (рис. 110, Д3).
На земной поверхности может возникнуть весьма контрастная ано-
малия, не отвечающая перспективному рудному источнику (рис. НО,
Б2)- Если эрозия и выветривание ослаблены, то рудные тела сопро-
вождаются невыразительными аномалиями (рис. ПО, Д2). Таким об-
395
разом, в особенностях рудообразования и денудации месторождении
заключены факторы, затрудняющие оценку аномалий. При этом воз-
можны соотношения: слабая аномалия — месторождение и контраст-
ная большая аномалия — рудопроявление. Конечно, известна и пря-
мая корреляция (рис. 110, At и однако с каждым годом все большую
роль играет оценка ситуаций типа Л2, Д3, В2, В3. особенно оценка
слабых малоконтрастных аномалий. Для решения этой задачи необ-
ходимо изучать законы образования геохимических аномалий.
Формы нахождения элементов в рудах и ореолах, изотопные отно-
шения. В геохимии месторождений главное внимание уделяется неми-
неральным формам нахождения элементов (изоморфным и сорбиро-
ванным примесям, органно-минеральным соединениям и др.), а также
геохимии минералов. Неминеральная форма характерна для ореолов
рассеяния, для редких элементов (Ge в углях и др.), В ряде случаев ра-
ционально говорить о подвижной форме — легкоизвлекаемой водной
вытяжкой, органическими растворителями, слабыми кислотами и щело-
чами.
Для решения различных генетических вопросов большое значение
имеет определение изотопных отношений в рудах — 206РЬ/204РЬ;
207Pb/204Pb; 238U/204Pb; 87Sr/8eSr и др. Так, по И. В. Чернышеву, РЬ
из алмазных кимберлитов Южной Африки и медно-порфировых руд
Монголии имеет мантийные изотопные характеристики, а изотопы
РЬ полиметаллических руд Центральной Европы и редкометальны.х
руд Монголии указывают на сиалический источник рудного ве-
щества.
Парагенные ассоциации элементов. Их выявление в минералах, ру-
дах и ореолах составляет одну из важнейших задач геохимии рудных
месторождений. Не все ассоциации представляют практический инте-
рес, но все они должны быть установлены, чтобы исключить пропуск
промышленно важных элементов. Для каждого рудного месторожде-
ния помимо парагенной ассоциации следует выделять и запрещен-
ные ассоциации в рудах и ореолах.
Геохимические процессы (обстановки) на рудном поле месторож-
дения. Геохимическая зональность и геохимические барьеры. В преде-
лах месторождений условия современной миграции и концентрации
элементов, как правило, неодинаковы: меняются Eh. pH и другие
параметры среды. Это позволяет расчленять месторождения на от-
дельные подсистемы, однородные по геохимическим условиям.
Большинство рудных месторождений представляет собой трехфаз-
ные системы, состоящие из твердой, жидкой и газообразной фаз. По-
этому при изучении современных геохимических обстановок огромное
значение приобретают гидрогеохимические исследования, которые про-
водятся сопряженно с минералого-геохимическими. Только такой
единый комплекс исследований позволяет понять, как образуются в
разрушаются рудные минералы. Основными гидрогеохимическими па-
раметрами служат окислительно-восстановительные и щелочно-кис-
лотные условия. Изучение современной геохимической обстановки вклю-
396
чает и газовый анализ. Такие исследования, с одной стороны, помогают
решать генетические вопросы, а с другой — внедрять в практику эф-
фективные газовые методы поисков руд.
Многие рудные месторождения содержат органические вещества
(хотя бы рассеянные), сульфиды и другие соединения — источник энер-
гии для микроорганизмов. Поэтому воды рудных месторождений часто
являются ареной их деятельности. Многие «чисто химические реак-
ции» в действительности являются биогеохимическими, их механизм
связан с деятельностью бактерий. Это в значительной степени отно-
сится к окислению сульфидов, образованию серных руд, осажде-
нию сульфидов на восстановительном барьере и т. д. В связи с этим
изучение современной геохимической обстановки должно включать изу-
чение органического вещества и микробиологию месторождений.
На большинстве месторождений образование руд в настоящее время
не происходит. Однако, изучая минеральные ассоциации в породах и
рудах, газово-жидкие включения в минералах, химический состав
пород и руд, можно восстановить былые геохимические обстановки.
Геохимические обстановки в пределах месторождения образуют
геохимическую зональность, которая особенно детально изучена на
эндогенных месторождениях. Много данных и по зональности первич-
ных геохимических ореолов, изучение которых позволяет выделить
надрудные и подрудные ореолы, т. е. оценить перспективность выяв-
ленного оруднения на глубину (С. В. Григорян. Л. Н. Овчинников.
Э. Н. Баранов и др.).
Геохимическая зональность — важный поисковый признак. Анализ
зональности необходим и для выяснения генезиса месторождений.
Нередко на одном месторождении развито несколько зональностей,
накладывающихся друг на друга, что затрудняет решение генетичес-
ких вопросов. В таких случаях особенно повышается роль историко-
геохимического подхода.
При геохимическом изучении месторождений необходимо анали-
зировать как устойчивые геохимические обстановки, так и геохимичес-
кие барьеры — контакты между ними. Геохимические барьеры —
самостоятельный и важный объект исследования. Руды, ореолы и руд-
ные минералы следует рассматривать как проявления определенных
барьеров и анализировать их с этих позиций.
Для большинства рудных месторождений характерны вторичные
ореолы рассеяния, для оценки которых необходимо изучать геохими-
ческий ландшафт рудного поля — его почвы, коры выветривания, кон-
тинентальные отложения, растения, воды, атмосферу.
При разрушении месторождений также возникают геохимические
барьеры, к которым часто приурочены вторичные геохимические ано-
малии, являющиеся важными прямыми поисковыми признаками руд.
При отработке месторождений создаются техногенные геохимические
обстановки и барьеры, которые также служат объектом изучения.
Историческая и региональная геохимия месторождений, рудных
районов и провинций. Для выяснения этих вопросов необходимо ос-
397
мыслить с геохимических позиций данные тектоники, геоморфоло-
гии, палеогеографии, исторической геологии. Каждый этар геологи-
ческого развития месторождения, рудного района и провинции дол-
жен получить геохимическую характеристику, а геохимические осо-
бенности месторождения и провинции — геологическое обоснование.
Региональная геохимия месторождений, рудных районов и про-
винций также тесно связана с геологической историей района, с его
металлогенией.
Месторождение может быть на длительное время «законсервиро-
вано» в земной коре, но может и разрушаться в результате окисления,
эрозии. Поэтому историческая геохимия включает и историю разруше-
ния месторождений, образования вторичных ореолов рассеяния. Послед-
ние процессы изучаются с позиций геохимии ландшафта.
Геохимические основы генезиса, прогнозирования, поисков и экс-
плуатации месторождений. Научным итогом изучения месторождения
является выяснение его генезиса. Это комплексная проблема, при ре-
шении которой используются данные всех геологических наук, в том
числе и геохимии. Важная практическая задача геохимических иссле-
дований— установление поисковых признаков: геохимик должен сказать,
где и как искать месторождение. Главное значение приобретают гео-
химические методы поисков по первичным и вторичным ореолам. Дан-
ные о геохимических обстановках, парагенных ассоциациях, геохими-
ческих барьерах, исторической геохимии позволяют выяснить условия
образования первичных и вторичных ореолов, объяснить их размеры,
форму, интенсивность, контрастность. На этой основе строится рацио-
нальная методика геохимических поисков. Ландшафтно-геохимичес-
кое картирование в масштабах от 1 : 50 000 до 1 : 500 000 и мельче
позволяет районировать территорию по условиям геохимических по-
исков, наметить рациональный комплекс поисковых методов, диффе-
ренцировать каждый метод в зависимости от условий района. При
оценке аномалий также используется геохимия ландшафта (ландшафт-
но-геохимические карты в масштабе 1 : 25 000— 1 : 5000).
Многообразны геохимические аспекты деятельности рудничной гео-
логической службы: наблюдение за оптимальным геохимическим ре-
жимом отработки, рациональная организация подземного выщелачива-
ния, предотвращение нежелательных последствий, обеспечение охраны
природы и здоровья людей (исключение из водоснабжения вод с по-
вышенным содержанием металлов, недопущение загрязнения атмос-
феры в результате распыления отвалов и руды и т. д.).
22. ГЕОХИМИЧЕСКАЯ СИСТЕМАТИКА РУДНЫХ МЕСТОРОЖДЕНИЙ
По термодинамическим параметрам все месторождения делятся
на эндогенные, образовавшиеся при высоких температурах и давлениях,
и экзогенные, образовавшиеся при температурах и давлениях, близких
к условиям земной поверхности.
398
Рис. 111. Геохимическая классификация эндо-
генных рудных месторождений Д. В. Руид.
квиста и И. А. Нежеиского. В скобках указа-
ны наиболее характерные сопутствующие ме-
тасоматические породы; 1—VII— группы ме-
сторождений:
Пр — пропнлнты, Вт. кв — вторичные кварциты, Арг —
аргнллизнты, Т. хл — турмалнн-хлорнтовые метасо-
матнты, Бер — березнты, Гумб — гумбенты, Серп —
серпентиниты. Ур— уралиты. С/с—-скарны известня-
ковые. Гр — грейзены. Фельд — фельдшпатолиты,
Фен — фениты. Карб — карбонатиты
Геохимическая систематика эндогенных месторождений. Д. В. Рунд-
квист и И А. Неженский разработали геохимическую систематику эн-
догенных месторождений по ведущим ассоциациям рудных элементов
(рис. 111). В основу геологе-геохимической систематики эндогенных
месторождений В. В. Ивановым положены парагенные ассоциации
элементов, направление тектонических движений, вероятный тип
земной коры (континентальный, океанический и др.). Выделяются
пять групп месторождений
(табл. 25). С помощью ста-
тистической обработки дан-
ных установлены средние
содержания рудных эле-
ментов в месторождениях
отдельных групп, а также
средние содержания эле-
ментов-примесей в мине-
ралах.
Геохимическая система-
тика экзогенных месторож-
дений. Экзогенные место-
рождения автор предложил
систематизировать по ха-
рактеру миграции элемен-
тов. Выделяются четыре
группы месторождений:
1. Месторождения, фор-
мируемые механической
миграцией (россыпи и др.).
2. Месторождения, фор-
мируемые физико-химичес-
кой миграцией, преиму-
щественно деятельностью
природных вод. Хотя
состав последних обус-
ловлен работой живого вещества (см. ч. IV), непосредственный
механизм рудообразования в основном подчиняется физико-химичес-
ким закономерностям. Эта группа на геохимической основе разделя-
ется на типы, классы и виды. Выделяются два типа: 1) остаточные мес-
торождения — элювиальные бокситы, железные и никелевые руды
коры выветривания, руды редких земель в коре выветривания щелоч-
ных пород, гипс («гипсовая шляпа») и др.; 2) месторождения, руды ко-
торых отложились на геохимических барьерах', этот тип делится на
классы:
А — месторождения на кислородных барьерах;
В — месторождения на сероводородных и сульфидных барьерах;
С — месторождения на глеевых барьерах;
D — месторождения на щелочных барьерах;
399
о
ex
X
я
• 2 з ' ф я е( х ® а? estx-^x.?* S'oagSgBg а£ * ° * н х ЕГ со*ез££*4' £HfHss 3 S Поднятие А Опус- кание Т>квозь стр>4^ турные зоны
Глубинность эндо- генных процессов, с которыми связаны месторождения (тип коры прн рудо- образованин) 1 Коровые. припо- верхностные (матери-1 ковые) Коровые средних и больших глубин (ма- териково-переходный) Коровые глубинные н подкоровые (пере- ходный океаничес- кий) Подкоройые (раз- личные)
Основные редкие и малые металлы Li, Rb. Cs. Та, Be, Sc, Hi, Ga, Ge. TI, Bi. U, TR Bi, In. Re, Ag, Cd, Ge. TI. Те, Se. Co, U Ag, Re, Ge, Cd, Co, Ga. TI. Bi. Те, Se, V V. Pd. Pt, Ru. Rh, Ir. Os, Se, Те Zr, TR, Nb. Та. Ga. Sr, Ru. Ir, Os. Pd, Pt, Be, U
Главные компоненты Si, K.Na, F, Sn, W, Mo Si, S, Fe. Mo, Sn, W, Pb, Zn. Au. As, Cu Ca. Mg, Fe, S. Cu, Pb. Zn, Sb. As, Hg, Ni, Sr Fe. Mg. S. P, Ti, Cr, Cu, Ni, Co Al, Mg, Ca. Na, K. Ti, Fe, P
Типы месторождений, входящих в группу i Редкометальные апограниты, гра- нитные метасоматиты (грейзены и др.), гранитные пегматиты, кварце- вые жилы Сульфидно- н силнкатно-сульфид- но-кастернтовые, вольфрамитовые, молибденитовые, фенакит-бертран- днтовые, бастнеэитовые, молибде- ннт-халькопирнтовые, свиицово-цин- 1 ковые, золоторудные, арсеиопирито- । вые Сульфидные н сульфосольные медно-цннковые, медно-свиицово- цннковые, евннцово-цинковые, ртут- ные, сурьмяные, золото-серебряные Медно- никелевые, медные, мед- но-железорудные, ванадиево- н ти- тано-железорудные, некоторые мед- но-цинковые Редкометальные карбонатиты, ло- паритовые, перовскитовые, бадде- ; лентовые, гатчеттолитовые и дру- i гие руды
Группа месторождений петрографи- ческая = & О' к go Я о. 5 s 2 я Редкоме- тально-суль- фидно-грани- тондная Сульфидно- । сульфосольно- базитовая Сульфндно- базит-гипер- базнтовая Редкоме- тально-щелоч- ная
геохимиче- ская 1 Литофиль- ная Литофильно- халькофиль- ная Халькофнль- ная Сидеро- фильная Щелочно- лнтофильная
нццЛба W - >
400
Е — месторождения на кислых барьерах;
F — месторождения на испарительных барьерах;
G — месторождения на сорбционных барьерах;
Н — месторождения на термодинамических барьерах;
/, К, L и т. д. — месторождения на других типах барьеров, а также
месторождения с комплексными, двусторонними и совмещенными
барьерами (В — G и т. д.).
В пределах А. В, С и других классов выделяются виды месторож-
дений по составу вод, поступающих к барьеру. В каждом классе выде-
ляется 12 основных видов в соответствии с геохимической систематикой
вод (А6, АН, ВЗ, Д1 и прочие виды).
III. Месторождения, формируемые биогенной миграцией, — каус-
тобиолиты, органогенные известняки, кремнистые породы, фосфаты и
нитраты (гуано) и др.
IV. Месторождения, формируемые техногенной миграцией,
искусственные месторождения солей и др.
В геохимическом отношении и эндогенные и экзогенные месторож-
дения изучены неравномерно. Наиболее хорошо изучены месторож-
дения U.
Геохимия урановых месторождений. В связи с использованием атом-
ной энергии за последние 50 лет выполнено много исследований по гео-
химии U и его месторождений. Кларк U в земной коре 2,5 • 10~4 %,
его больше в кислых (3,5 • 10-4) и осадочных глинистых породах
(3,2 • 10_4), чем в основных (5 • 10~5) и ультраосновных (3 • 10~7).
Это элемент биосферы, осадочной оболочки, гранитного слоя. С верх-
ней частью земной коры связано образование как экзогенных, так и
главнейших эндогенных месторбждений U.
В земной коре известны соединения четырехвалентного U4+ и шес-
тивалентного U6+ урана. Шестивалентный U образует комплексный
катион уранил (UOij + ), большие размеры которого определяют его
энергичную миграцию, а также адсорбцию глинами и гумусом. В гор-
ных породах часть U входит в кристаллическую решетку силикатов,
а часть находится в подвижной форме (до 90 % в некоторых гранитах)
и легко выщелачивается.
Кларк концентрации U колеблется от 100 в очень бедных рудах до
10 000 в наиболее богатых. Сравнительно небольшой КК в сочетании
с высокой интенсивностью миграции U и способностью к концентра-
ции определяет множество генетических типов уранового рудообразо-
вания. Он концентрируется в изверженных породах, пегматитах, гид-
ротермах, углях, битумах, песчаниках, торфяниках, фосфоритах,
глинах с остатками рыб, бурых железняках, углеродистых сланцах
и т. д.
По особенностям миграции четко выделяются четыре группы мес-
торождений U: механическая, физико-химическая, биогенная и техно-
генная. К месторождениям физико-химической группы принадлежит
большинство месторождений, в том числе магматические, гидротер-
мальные и гипергенные. К биогенной группе относятся месторождения,
401
обязанные концентрации U живыми организмами. Если подтвердится
концепция С. Г. Неручева о промышленном значении прижизненного
накопления U планктоном, то к биогенной группе будут отнесены не-
которые месторождения U в черных сланцах и других осадочных поро-
дах. К техногенной группе мы относим концентрации U, обязанные
промышленной деятельности. По механизму это преимущественно фи-
зико-химические процессы (переотложение U при подземном выще-
лачивании и др.).
Рассмотрим систематику второй, наиболее важной группы, кото-
рая разделяется на два порядка: первый порядок — магматические
месторождения, связанные непосредственно с дифференциацией маг-
мы. К ним относятся выделяемые за рубежом месторождения «порфи-
рового типа» — ураноносные алясковитовые граниты, уранонос-
ные карбонатиты и другие магматические породы. Второй порядок —
месторождения, обязанные концентрации U из поверхостных и под-
земных вод. К ним относятся как гидротермальные, так и гипергенные
(осадочные, эпигенетические и др.) руды.
Во втором порядке по температуре выделяются два типа: гипер-
генный и 2) гидротермальный. Возможно, что правильнее расчленить
гидротермальное рудообразование на низкотемпературное и высоко-
температурное, т. е. выделять три типа.
В зависимости от геохимического барьера выделяются классы мес-
торождений — на В, С, D, Е, F. G и Н барьерах. В зоне гипергенеза
известны все эти классы, в гидротермальных системах —только пять
(нет испарительного и сорбционного рудообразования).
Следующий таксон — вид месторождений U выделяется по составу
вод, поступающих к барьеру. В зоне гипергенеза выделяется восемь
видов в соответствии с систематикой вод (см. табл. 18, воды 1—8-го
классов). В гидротермах систематика вод существенно иная, иными
будут и виды месторождений.
Рассмотрим месторождения U, относящиеся к наиболее практичес-
ки важному и распространенному классу — В (руды, сформировавшие-
ся на восстановительном сероводородном или сульфидном барьерах).
Как в водах зоны гипергенеза, так и в гидротермах U преимущественно
мигрирует в шестивалентном состоянии, входя в состав различных
комплексных анионов, особенно карбонатных комплексов уранила.
В зоне гипергенеза — это ((UO2)(CO.j)2(H.2O)l2 и другие комплексы.
В гидротермах, по И. В. Мельникову, шестивалентный U мигрирует
в бикарбонатных, хлоридно- и фториднобикарбонатных растворах.
Соединения четырехвалентного U труднорастворимы. Отсюда выте-
кает основной закон миграции и концентрации U в водах земной коры:
U энергично мигрирует в окислительной и слабовосстановительной
обстановках, где он находится в шестивалентном состоянии и осаж-
дается из вод в резковосстановительных обстановках, в которых он
переходит в четырехвалентное состояние. Это определяет основную
роль в рудообразовании восстановительных — сероводородного и
глеевого (В и С) барьеров. Меньшую роль играют процессы дегазации,
402
сорбции, изменения величины pH, испарения (Н, G, Е и F барьеры).
Вывод об исключительной роли восстановительных барьеров в урано-
вом рудообразовании подтверждается всем опытом советских и зару-
бежных исследований. Восстановительные берьеры характерны как
для экзогенных, так и для большинства гидротермальных месторожде-
ний.
Гипергенный тип включает несколько видов, из которых рассмот-
рим В1 и ВЗ. Вид В1 можно назвать сернокислым — сульфидным (пер-
вое слово относится к водам, второе — к барьеру). Он возникает в тех
местах, где кислородные сернокислые инфильтрационные воды встре-
чают на своем пути сероводородный (сульфидный) барьер. Такие усло-
вия характерны для зоны окисления уран-сульфидных месторождений,
на выклинивании которой формируется зона вторичного обогаще-
ния с урановыми чернями. Эта зона детально изучена В. Г. Мелковым,
Л. Н. Беловой и др. В рудах В1 возможна ассоциация урана с Си,
Zn, Pb и другими халькофилами, с Fe, Мп, Со. Запрещенная ассоциа-
ция — Se, V (малоподвижные в кислых водах), комплекс элементов
содовой миграции.
Щелочной сульфидный вид ВЗ известен в морских илах и сформи-
ровавшихся из них осадочных породах, в элювиальных отложениях,
водоносных горизонтах артезианских бассейнов, трещинных зонах
гранитоидов и т. д. Однако геохимическая сущность рудообразовании
во всех случаях одна и та же — миграция U в кислородных слабоще-
лочных водах и его осаждение на сероводородном барьере В. Наиболее
изучены руды этого вида в песчаных водоносных горизонтах артезианс-
ких бассейнов, преимущественно в аридных областях. За рубежом по-
добные месторождения известны во многих странах, в США они име-
нуются «типом Вайоминга». В СССР в 60-х годах была разработана
эпигенетическая теория генезиса данных месторождений, получив-
ших название гидрогенных. Было показано, что рудные тела этих место-
рождений не подчиняются ни стратиграфическому, ни фациальному
контролю, их формирование связано с инфильтрацией кислородных
вод в сероцветные песчаные породы (рис. 112, 113). Образующаяся эпи-
генетическая зональность представлена тремя основными зонами (по
движению потока пластовых вод): 1) зоной пластового окисления,
2) зоной уранового и селенового оруденения и 3) зоной зарудных се-
роцветных пород. Первая зона возникает в результате инфильтрации
кислородных вод в сероцветные пески и песчаники, содержащие орга-
нические вещества битумного или угольного ряда, пирит, сидерит и
другие минералы. Окисленные породы приобретают ржавую, желтую,
пеструю окраску, пирит и сидерит превращаются в лимонит, органи-
ческие вещества полностью или частично окисляются.
Зона уранового оруденения представлена сероцветными породами,
обогащенными урановыми чернями и другими урановыми минералами,
местами сульфидами Fe и самородным Se. В разрезе эта зона нередко
имеет форму ролла («рогульки»), отражающего фронт движения пласто-
вых вод.
403
В зоне сероцветных зарудных пород содержатся пирит и другие
восстановители. Восстанивительная среда может быть обусловлена
осадкообразованием или дорудными эпигенетическими процессами —
внедрением нефти, газа, битумов.
Замечательной особенностью некоторых гидрогенных месторожде-
ний является полное соответствие минералого-геохимической зональ-
ности в породах гидрогеохимической зональности в подземных водах.
Рис. 112. Схема поисков невскрытых урановых месторождений на основе крите-
риев эпигенетической теории (по А. И. Перельману):
/—изверженные горные породы, 2 — водоносные горизонты в осадочной толще — припод-
нятые крылья артезианского бассейна (пески и др.). 3 — водоупорные горизонты в осадоч-
ной толще (глнны н др.). 4 — рудные залежн на восстановительном барьере, 5 — направление
движения вод, 6 — красные, бурые, желтые, зеленые породы с окислительной обстановкой
(гидроксиды железа н др.), 7 — серые породы с восстановительной обстановкой (пирит,
органические вещества и др.), 8 — зоны пластового окисления (ЗПО), 9 — скважины поиско-
вого бурения на артезианском склоне (а, б — дорудные в зоне пластового окисления, в —
зарудные в зоне восстановленных пород. г. д. е — рудные на участке детальных поисков)
т. е. рудообразование продолжается и в настоящее время (рис. 113).
В основных чертах рудообразование сводится к следующему. В
артезианских бассейнах аридных районов формируются кислородные
пластовые воды с Eh около 100—300 мВ. Эти воды содержат п 10"3
г/л U и Мо и являются рудоносными растворами. Подобные
подземные воды формируются в широко распространенных горных
породах, например в гранитоидах, откуда мигрируют в пласты оса-
дочных пород. Термодинамические расчеты А. К. Лисицина показали,
404
что практически весь уран
в водах находится в форме
карбонатных комплексов ура-
нила — [иО2(СО3)з14- и др.
Проникая в сероцветные
водоносные горизонты, кисло-
родные воды расходуют кис-
лород на окисление, в ходе
которого формируется первая
зона. На ее выклинивании
кислород в воде исчезает,
появляются десульфуризи-
рующие и другие анаэробные
бактерии. В результате Eh
снижается до —200 мВ, т. е.
формируется барьер ВЗ, что
приводит к осаждению U
преимущественно в форме
урановой черни, коффинита,
нингиоита.
Ниже зоны рудного тела
пластовые воды имеют отри-
цательный Eh, содержат ме-
нее 2 10~6 г/л U. В них
отсутствует кислород. Se4+ в
водах восстанавливается при
более высоких значениях Eh,
чем U6+, барьер для него рас-
положен в первой зоне, а се-
леновые рудные тела «сдви-
нуты» относительно урано-
вых.
В некоторых гидрогенных
месторождениях обнаружены
и молибденовые руды. Мо6+
восстанавливается при более
низком Eh, чем Ue+, и осаж-
дение его происходит в более
глубокой части водоносного
горизонта.
Общая минерализация
вод, их ионный состав, а
также в большинстве слу-
чаев и pH на участке вос-
становительного барьера су-
щественно не меняются (см.
рис. 113).
1 эпигенетические I изменения парад 1 2 Пластодого окисления 1 Урано1ого орудене- ния 0 ДОЯйфМ»- ньаоезруд нык пород
Подзоны Г Полной лимона' тизации Неполной ли- монитиза- а ции 4,6 || а а I
• j
Газогидрогеохимические данные ог -10 МГЛ1 0.05 нг/л
Eh *0.6 *0,2В ч-;Т5дёГ -'Яз.оо +0Д5В
рн -Z5 -7.5
до 5,5
и 1Q5 г/л \до102г/п Ю’7г/л
5е 10"6 г/л до10Чг/л 10’7г/л
Геохимические данные 1 и 105-1б‘% 10' %
Se то5 % %0,0п% 10s %
Сорт
0,0п-0,п%
рею„ -0.7% _^1.2 % -05%
5пир 0,0п-0,П%
со2
Рис. 113. Обобщенный профиль рудоконт-
ролирующей пластовой зональности в ин-
фильтрационных месторождениях урана (по
Е. М. Шмариовичу и др.)
405
Инфильтрация кислородных вод происходит непрерывно, и восста-
новительный барьер постепенно смещается по падению водоносного
горизонта. Это приводит к окислению передней части рудных тел и на-
ращиванию их хвостовой части.
Формирование гидрогенных месторождений связано преимущест-
венно с аридным климатом, где слабощелочной состав вод, а места-
ми и испарительная концентрация благоприятствуют накоплению в во-
дах U. Бедность ландшафта живым веществом создает возможность
проникновения кислородных вод на значительные глубины.
Так как в водах зарудной части месторождений содержится не бо-
лее п 10ь г л U (л равно 1—2), на восстановительном барьере прак-
тиче -ки осаждается более 90 % U кислородных вод.
Гидрогенные месторождения могут не иметь особого источника
металла: они формируются из фоновых вод аридных районов. В гумид-
ных районах фоновое содержание U в кислородных водах не превыша-
ет 2 • 10-в г'л, т. е. оно такое же, как в водах с восстановительной
средой. В результате на выклинивании зоны пластового окисления
восстановительный барьер для U не возникает. Поэтому в гумидном
климате фоновые кислородные воды не могут быть источником U для
образования месторождений. Однако рудообразование в гумидном
климате не исключается, но в качестве источника U необходимы воды с
повышенным содержанием U. Богатство гумидного ландшафта живым
веществом, восстановительная среда в почвах затрудняют проникнове-
ние кислородных вод на глубину.
Гидрогенные месторождения формируются в условиях дифференци-
рованных тектонических движений небольшой амплитуды. Слабые
поднятия оживляют гидродинамику и благоприятствуют проникнове-
нию кислородных вод в приподнятые крылья артезианских бассейнов.
При энергичных поднятиях эрозия опережает пластовое окисление и
рудообразование не развивается.
Надежным критерием поисков гидрогенных месторождений служит
выклинивание зоны пластового окисления. Оно позволяет на основе
направленного бурения обнаруживать месторождения, не имеющие вы-
хода на земную поверхность (рис. 112).
Гидротермальный тип также включает В класс и несколько видов.
Установлено, что в рудоносных гидротермах U мигрировал преиму-
щественно в форме различных комплексов уранила, в том числе карбо-
натных, т. е. соединений U6+. В рудах U находится в основном в че-
тырехвалентной форме, что однозначно доказывает существование вос-
становительного барьера. Наиболее характерен вид В VII щелочно-
сульфидный. Рудоносные растворы здесь имели щелочную реакцию,
благоприятную для миграции анионогенных комплексов U и Мо, отчас-
ти Си. К данному виду относится большое число уран-молибденовых
и других урановых месторождений. Для части месторождений по
И. В. Мельникову была характерна ранняя стадия кислотного выще-
лачивания. Предполагается, что U осаждался при смешении гидро-
термальных и вадозных растворов, причем вместе с U осаждались Мо,
406
Pb, Sb, As, в меньшей степени — Zn. Эти элементы мигрировали в гид-
ротермах вместе с U и осаждались при их подкислении (т. е. на барье-
рах BVII—EVII). Если же подкисления не было, то молибденит и суль-
фосоли As и Sb не отлагались. Для некоторых месторождений был
характерен только щелочной процесс с образованием титанатов (бран-
нерит) и силикатов U (коффинит), урансодержащих апатитов, реже
оксидов и4+ — уранинита и настурана.
Контрольные вопросы к главам 21 и 22
I. Сформулируйте основные задачи геохимии рудных месторождений.
2. Осветите проблемы «кларки и рудообразованне».
3. Каково соотношение аномалий на земной поверхности и запасов руд?
4. Какие существуют принципы геохимической систематики рудообразова-
ния?
5. Приведите пример геохимической характеристики рудного месторож-
дения.
6. В чем состоит основной закон миграции и концентрации урана в водах
земной коры?
7. Почему для образования гидрогенных месторождений урана благоприя-
тен аридный климат?
8. Как на основе эпигенетической теории ищут гидрогенные месторождения
урана?
9. О чем говорит соответствие минералого-геохимической и гидрогеохимичес-
кой зональности на гидрогенных месторождениях?
8
ГЕОХИМИЯ
ОТДЕЛЬНЫХ
ЭЛЕМЕНТОВ
Настоящая геохимия отдельных эле-
ментов будет построена только тогда,
когда можно будет нарисовать кар-
типу нх перемещения, концентрации
и рассеяния не как сумму эмпириче-
ски нанизанных фактов, а как необ-
ходимый и обязательный результат
тех физических н химических свойств
атомов н нонов. которые определяют
всю нх природу и все их поведение
в земной коре.
А. Е. Ферсман
Миграция элементов в системах исключительно разнообразна и
поэтому так непохожи атомы-спутники («.парагенные ассоциации эле-
ментов») на земной поверхности и в магме, атмосфере и гидро-
сфере, в живых организмах и рудных месторождениях. Проследить по-
ведение каждого элемента во всех системах планеты — сложная и во
многом еще нерешенная задача.
23. ГЕОХИМИЧЕСКАЯ КЛАССИФИКАЦИЯ ЭЛЕМЕНТОВ
ЗЕМНОЙ КОРЫ. ЭЛЕМЕНТЫ I и II ГРУПП
Геохимическая классификация элементов
Геохимия элементов во многом определяется их способностью да-
вать газообразные и растворимые соединения, литофильностью, халь-
кофильностью и сидерофильностью, катионогенностью и анионоген-
ностью. С учетом этих свойств построена геохимическая классифика-
ция автора (рис. 114).
В пределах классов элементы в основном расположены по убыванию
кларков, так как при сходных химических свойствах с уменьшением
кларка уменьшается и роль элемента в земной коре (исключение в по-
рядке расположения элементов сделано для некоторых близкородст-
венных элементов — Zr и Hf, Nb и Та и др.).
Геохимии отдельных элементов посвящено много исследований, на-
чиная с классических трудов Вернадского (О, Мп, Si, С, радиоактив-
ные элементы), Ферсмана и Гольдшмидта (все элементы). Крупные
4 OS
исследования посвящены геохимии Hg, Be, В, U и т. д. Анализ этих
работ позволяет наметить следующий примерный план характеристики
геохимии конкретного элемента:
1. Химические и физические свойства, определяющие миграцию эле-
мента: положение в периодической системе и строение атома, изотопы,
размеры ионов и атомов, растворимость соединений, плотность и дру-
гие физические свойства, типы связей в соединениях (ионные, ковалент-
ные и т. д.), электроотрицательность, потенциалы ионизации, окисли-
тельно-восстановительные потенциалы, pH осаждения гидроксидов и
т. д.
2. Кларки и кларки концентрации элемента в различных системах.
3. Миграция элемента в Магматических, гидротермальных, ги-
пергенных и прочих системах. Участие в механической, физико-хими-
ческой и биогенной миграции. Формы переноса и отложения. Пара-
генные и запрещенные ассоциации и их закономерности (изоморфизм
и др.). Геохимические барьеры. Геохимия месторождений и геохими-
ческие методы их поисков.
4. Историческая геохимия элемента.
5. Элемент в ноосфере (технофильность, защита среды, медико-гео-
химические, сельскохозяйственные и прочие аспекты).
Элементы I группы
К I группе относятся элементы, для которых характерна газообраз-
ная форма не только в земных глубинах, но и в биосфере, т. е. в земной
коре в целом (в отличие от щелочных металлов и других элементов,
которые образуют газообразные соединения только при высоких тем-
пературах). Водная миграция для них также характерна.
1. Элементы, образующие химически активные газы, —О, Н, S, С,
N. Эти элементы благодаря химической активности и высоким кларкам
играют особо важную роль в земной коре. Они типоморфны во многих
системах, определяют окислительно-восстановительные и щелочно-кис-
лотные условия растворов и расплавов, формирование важнейших гео-
химических барьеров (А, В, С, Е, Н). Это главные элементы живого
вещества, их роль исключительно велика в биосфере и ноосфере, все
они — геохимические аккумуляторы солнечной энергии, для них ха-
рактерна как ионная, так и неионная миграция в растворах и распла-
вах.
Кислород (О). Это самый распространенный элемент земной коры
(47 %), гидросферы (85,7 %) и живого вещества (70 %). Большая дей-
ствующая масса сочетается в О с высокой химической активностью,
что делает О «геохимическим диктатором» многих процессов. В зем-
ной коре преобладают кислородные минералы (1364).
Эволюция магматизма направлена в сторону увеличения содержа-
ния О, в биосфере происходит его резкая дифференциация, обязанная
биологическому круговороту атомов. Об этом говорят кларки кон-
центрации О:
409
о _-_-2 -Не- loo 1 и .1 ко 1 1 1 Ixrl ri< ю* । '71 11’1 Ill'll’) 1 ltel Л11 1 • . ,оо. CI 1 1 ^'11'1^!
ил 0>~ " ^ц.= 1 ->s III 11 9Е 13 Ж ши 85 At
> оо, • . • : - о-: со • • хг -см— 7~ . :СО= ф== :V>= а>— оэ О Н= 0.
> > ?:: 1II 19 1ЛГ «V g л__ ’S’+l- ,Q= -CO- •* —
> (О, • , • : р. ; •05/Л ж рРЬ: >
— ТГ I -gv--1! e;uz JJ—o--U- - u---°°- o> q::±EX: =
"IT iT Tt"
— -Ж Си: z z: :47: и_ _Ц—oj-XL- o>-- э*~ <E::E<:E
VIII об 1 >(О? сч-»»— ±±:S s?V$? >66X?QQ 2§g|g
°3 1££± IcvlBvbV 58008
-j-26- -Fe~ -Vys xcoxVS<5 Эю5чХ — л CE«£$oX
VII 4-?J ЬМп mJ 43 ° h
> TF -Сг- S1B
> IlS’2
> в /41/ ббЛ/ IL///
м ц
— см llll о hll об Й10 Л ШГ ' SI Ж m u in (О Ф Я СД III OQ II cc Ш1...Щ.1Ш 111 1Ш.
: • Z-: и ж Illi irit 1 (?| Illi II L* Ш 1 1 Гч •fl in м co u II ft “
Г" см со и 10 co | r*
co
CD
CO
1Л
СП
О)
Каменные метеориты
0.7
Изверженные породы земной коры и верхней мантии:
ультраосновные............................0,8
основные..................................0.8
средние...................................0.9
кислые....................................1,03
Биосфера и ее производные:
глины и сланцы...........................1,1
гидросфера...............................1,8
живое вещество...........................1,5
каменный уголь...........................0,3
нефть.....................................0,08
антрацит..................................0,02
В земной коре протекают различные реакции образования сво-
бодного О. Зеленый покров Земли это — грандиозная фабрика, на ос-
нове фотосинтеза разлагающая воду и выделяющая О в атмосферу и
гидросферу (для водных растений). Переходя в свободное состояние,
О аккумулирует солнечную энергию. Это и определяет его высокую
химическую активность («геохимический аккумулятор»), «Свободный
О — самый могущественный деятель из всех нам известных химичес-
ких тел земной коры», — отмечал Вернадский.
Количество реакций окисления, расходующих О, огромно. Они в
основном имеют биохимическую природу, хотя существует и чисто хи-
мическое окисление. При окислении выделяется энергия, погло-
щенная при фотосинтезе. В почвах, илах, водоносных горизонтах, вез-
де, где имеются органические вещества и вода, развивается деятель-
ность микроорганизмов, окисляющих органические соединения. Таким
образом, общая схема круговорота О в биосфере складывается из про-
тивоположных ветвей — образования свободного О при фотосинтезе и
его поглощения в окислительных реакциях.
Для земной коры в целом и для отдельных ее систем характерна
окислительно-восстановительная зональность, обусловленная солнеч-
ной энергией, приводящей к накоплению сильных окислителей (О2) и
сильных восстановителей (Cnpr, Fe2+ и т. д.).
Рис. 114. Геохимическая классификация элементов земной коры по А. И. Пе-
рельману:
Элементы / группы (литофильные, атмофильные и халькофильные): / — элементы, образую*
щие химические активные газы — О. Н. S. С. N; 2 — инертные газы — Аг. Не, Ne, Кг, Хе,
Rn. Элементы // группы (литофильные): 3 — типичные щелочные металлы — Na, К,
Rb. Cs; 4— типичные щелочноземельные металлы и литий Са. Mg. Ba, Sr. Li, Ra,
5 — галогены — F. Cl. Вг. I. Элементы 111 группы (литофильные, халькофильные
и сидерофильные): 6 — литофильные анионогенные элементы — Si, Р. В: 1 — литофиль-
ные элементы с постоянной валентностью, образующие н катионы, и анионы —
Al. Zr. Hf. V. TR. Sc. Th, Be; 8 — литофильные и сидерофильные элементы с переменной ва
лентностью. образующие и катионы и анионы — Ti. V, Nb и Та. U, W. Мо, Re; 9— сидеро-
фильные металлы группы железа — Fe, Мп. Сг, Ni. Со; 10 — платина и платиноиды (сндеро
филы) — Ru. Rh, Pd. Os, Ir. Pt: // — халькофильные металлы — Zn, Cu, Pb. In, Cd. Hg. Ag.
Bi, Au; 12 — халькофильные неметаллы — As, Sb. Se, Те: 13— литофильно-халькофильные
элементы — Ga, Sn, Ge. T!
41t
Помимо О2 в атмосфере при электрических разрядах и других про-
цессах образуются еще более сильные окислители —озон О3 и перо-
ксид водорода Н2О2, но их количество очень мало. Все же без озоново-
го экрана жизнь была бы невозможна.
В ноосфере при сжигании топлива ежегодно расходуются милли-
арды тонн атмосферного О. В некоторых развитых промышленных стра-
нах сжигают больше О, чем его получают за счет фотосинтеза.
Водород (Н). Это главный элемент космоса, но в планетах земной
группы его немного (кларк гранитоидов 0,15 %, гидросферы 10,72,
живого вещества 10,5 %). В земной коре большая часть атомов Н
входит в состав воды, углей, нефти, горючих газов, живых организмов,
глинистых и других минералов. Геохимия Н в биосфере тесно свя-
зана с историей воды и жизни.
Свободный Н в земной коре неустойчив, он быстро соединяется с О,
образуя воду, участвует в других реакциях, улетучивается в космос.
Но некоторое количество этого легчайшего газа постоянно образует-
ся в результате чисто химических реакций и деятельности бактерий,
разлагающих органические вещества.
В земной коре известен и глубинный Н, поступающий по зонам раз-
ломов. Предполагается его присутствие в мантии и ядре («гипотеза
гидридного ядра»). Исключительно велика в земной коре роль воды,
водородного (Н+) и гидроксильного (ОН-) ионов.
Сера (S). Поливалентность (—2; 0; +4; +6), способность давать
газообразные (SO2, H2S и др.) и легкорастворимые (SO«_ и др.) сое-
динения в сочетании с относительно большим кларком 1 (4,7 • 10“2 %)
определили важную роль S в земной коре, ее влияние на миграцию
большой группы элементов — халькофилов. По числу минералов
(369) S занимает пятое место после О, Н, Si и Са, а по величине кларка—
пятнадцатое. Это свидетельствует о большой способности S к минерало-
образованию (приблизительно как у Н, Р, Zn, Cl, Ni, V, Сг). В зем-
ной коре наибольшее значение имеют две валентности S: (—2) и
(+6). Это определяет большую роль окислительно-восстановительных
реакций в истории S, значение А и В барьеров. В биосфере подобные
реакции имеют биохимическую природу (хотя могут протекать и чисто
химическим путем). В земной коре местами нарушаются изотопные от-
ношения 32S/34S, на основе изучения которых решаются различные
геологические задачи.
Для S характерны как ионные, так и неионные связи (R,SO4-
0,295 нм.) Сульфаты щелочных металлов, Mg, Fe, Zn, Cu, Ni, Co, Cd
хорошо растворимы, a Ca, Sr, Ba, Ra, Pb — плохо. Это имеет большое
геохимическое значение. Огромную роль в геохимии земной коры игра-
еть плохая растворимость сульфидов тяжелых металлов.
В магме S преимущественно рассеяна, из гидротерм осаждаются
сульфидные руды Cu, Pb, Zn, Fe, Со, Ni и других металлов, имеющие
1 Здесь и ниже приведены кларки земной коры по А. П. Виноградову
(см. рис. 5).
412
важное промышленное значение. В гипогенных процессах образуется
209 минералов S. Кларки концентрации S контрастны:
Изверженные породы земной коры и мантии:
ультраосиовиые........................0,2
основные..............................0,6
средние...............................0,4
кислые................................0,8
Биосфера и ее производные:
глины и сланцы............... 6
гумусовый горизонт почв ... 6
живое вещество............... 1
гидросфера.................. 1,9
гипсолиты................... 200
серные руды................ 2000
соленые сульфатные воды . . . п-10—п >00
ИЙфть И уголь................. п—п: 100
Анализ КК показывает, что S — элемент земной Коры, в мантии
(ультраосновные породы) ее в 5 раз меньше. Она концентрируется в био-
сфере, осадочных породах, соленых озерах, углях, нефти. Кларк S в
живом веществе 5 • 10-г %, она — важный биоэлемент, входит в со
став белков и других органических соединений. Известны организмы —
концентраторы S (водоросли, бактерии и др.).
В биосфере широко распространено окисление сульфидов с образо-
ванием легко- и труднорастворимых сульфатов, которые в свою очередь
восстанавливаются с образованием вторичного сероводорода и сульфи-
дов. Известна в биосфере и элементарная сера. Реакции совершаются
при участии микроорганизмов. В биосфере образуется свыше 150
минералов S, главным образом сульфатов.
Для биосферы характерны круговороты S разных масштабов —
от круговорота в пределах ландшафтов до большого круговорота, свя-
зывающего материки и океаны (S приносится на материки с атмосфер-
ными осадками и возвращается в океан со стоком).
Важнейшим концентратором S является мировой океан, в котором
ее содержание достигает 8,9 • 10-2 %, т. е. несколько больше, чем в
земной коре. По талассофильности (1,9) S занимает четвертое место
после Cl, Н, Вг (близка к О — 1,8).
S — геохимический аккумулятор солнечной энергии, поглощение
которой происходит при восстановлении сульфатов, образовании H2S
и сульфидов, а выделение — при окислении сульфидов, H2S и эле-
ментарной S. Высокий кларк S определяет большие запасы солнечной
энергии в сульфидах.
В течение всей геологической истории источником S для биосферы
были в основном продукты извержения вулканов, содержащие H2S
и SO2 (меньше роль изверженных горных пород). Образование кисло-
родной атмосферы в докембрии привело к коренным изменениям в гео-
химии S — возникла сульфатная форма ее миграции, стали возможны
413
и процессы восстановления сульфатов. Появились сульфатные воды,
гипсы и другие сульфаты в озерах и лагунах, в то же время развивалась
десульфуризация в илах и подземных водах, накапливались гиперген-
ные сульфиды.
Многократно повторяясь, круговорот S приводил ко все большему
накоплению обоих полярных продуктов: окисленных соединений —
сульфатов и восстановленных — сульфидов. Современная эпоха отме-
чена наибольшим накоплением тех и других (учитывая сульфаты и
сульфиды, захороненные в породах палеозоя, мезозоя и кайнозоя).
В ноосфере миграция S ускорилась. По технофильности (4 • 108) S
сильно уступает С, С1 и не выделяется в этом отношении из большой
группы металлов и неметаллов — Pb, Cu, Sn, Са, Р, N и др. Окисление
сульфидов (главным образом пирита) привело к загрязнению окружаю-
щей среды (кислые дожди).
Углерод (С). При кларке земной коры 2,3 • 10~2 % С сильно накап-
ливается в биосфере (%): чистых известняках — 12, живом веществе —
18, древесине — 50, каменном угле — 80, нефти — 85 и т. д. Преобла-
дающая часть атомов С земной коры сосредоточена в известняках и
доломитах. Огромная геохимическая роль С в том, что он — аккуму-
лятор солнечной энергии, которая освобождается в ходе его кругово-
рота и совершает большую работу. Число собственных минералов
С 112, исключительно велико число различных органических соеди-
нений — углеводородов и их производных. С историей С связано на-
копление многих элементов — сорбированных органическим вещест-
вом, осаждающихся в виде нерастворимых карбонатов, или на восста-
новительном барьере, создаваемом разгалающимся органическим
веществом. Большую геохимическую роль в земной коре играют С0.2
и угольная кислота. Огромное количество СО2 выделяется при вулка-
низме — в истории Земли это основной источник СО2 для биосферы.
С — четвертый по распространенности элемент в космосе (после
Н, Не и О). Атмосферы Марса и Венеры богаты СО2, планет-гиган-
тов — СН4. Все метеориты содержат С, им обогащены углистые
хондриты, содержащие органические соединения.
В ноосфере С энергично извлекается из недр (уголь, нефть, горючий
газ, которые служат пока что основным источником энергии). Хозяй-
ственная деятельность существенно изменяет круговорот С.
Азот (N). В земной коре N разновалентен (—3, 0; +2, +3, +4, и
н-5), что определяет исключительное разнообразие его миграции. Ве-
дущее значение имеет биогенная миграция, хотя он образует газооб-
разные и растворимые соединения. По исключительной роли биоген-
ной миграции N занимает первое место среди элементов периодической
системы. Кларк N в земной коре 1,9-Ю-3 %, его история связана
преимущественно с биосферой. N накапливается в почвах (0,1 %),
живом веществе (0,3), каменном угле (1—2,5), нефти (0,02—1,5 %).
Больше всего N в атмосфере, где его содержание составляет 78,09 %
по объему (или 75,6 % по массе). При электрических разрядах в атмос-
фере N окисляется и с осадками поступает в почвы и воды (в виде
414
ДОз). Атмосферный N также поглощается некоторыми микроорганиз-
мами.
Природные минеральные соединения N — аммиак и различные нит-
раты (селитры) — растворимы и легко мигрируют (ЭК N'O^ очень ни-
зок — 0,19), накапливаются на испарительном барьере. А. Е. Ферсман
отмечал, что NO^ — ион исключительной подвижности и дискретно-
сти. Однако главное значение в истории N в биосфере принадлежит
живому веществу, в котором азот находится в виде различных органи-
ческих соединений.
В биосфере осуществляется круговорот азота, главную роль в ко-
тором играют растения и микроорганизмы — нитрифицирующие,
денитрифицирующие, азотфиксирующие и др.
В пустынях нитраты накапливаются при испарении грунтовых вод,
разложении гуано. Крупные скопления натриевой селитры (NaNO3)
известны в Чили.
По распространенности азот — пятый элемент космоса (после Н,
Не, О и С), он обнаружен в туманностях, кометах, атмосферах звезд и
планет, сравнительно много его в углистых хондритах.
Дефицит N характерен для земледелия и животноводства. Азотные
удобрения и белковая подкормка животных — важнейшее средство
подъема сельского хозяйства. Хозяйственная деятельность нарушает
круговорот N: сжигание топлива, взрывчатые вещества обогащают им
атмосферу, а заводы, производящие удобрения, связывают азот воз-
духа. Транспорт удобрений и продуктов сельского хозяйства перерас-
пределяет N в ноосфере.
2. Инертные газы — Аг, Не, Ne, Кг, Хе, Rn. Строение атомов
инертных газов определяет их неспособность к химическим реакциям
в земной коре (но в лабораториях получены фториды радона и другие
соединения). Химическая инертность и низкие кларки определяют ма-
лое влияние инертных газов на химические процессы в земной коре.
В космосе, напротив, распространенность инертных газов значитель-
на: Не занимает второе место, Ne — пятое или шестое (в атмосфере не-
которых звезд он занимает 3-е место после Н и Не).
Изучение геохимии изотопов инертных газов позволяет решать
многие вопросы истории земной коры и мантии, начиная с глубокого
Докембрия. Велико значение инертных газов и для определения абсо-
лютного возраста пород («гелиевый», «калий-аргоновый» и другие мето-
ды). Значение их в ноосфере также значительное, особенно Не, Аг и
Ne.
Элементы II группы
Ко второй группе относятся элементы, образующие простые ионы
типа благородных газов. При изучение их геохимии особенно примени-
мы понятия об ионных радиусах, ЭК и других характеристиках ионов.
Именно на изучении миграции и распределения элементов данной груп-
пы в значительной степени сформировалась ионная концепция в гео-
415
химии. Элементы второй группы во многом определяют щелочно-кис-
лотные свойства растворов и расплавов.
3. Типичные щелочные металлы — Na, К, Rb, Cs. Типичные ще-
лочные металлы — наиболее электроположительные элементы, харак-
терные катионогены. Их атомы легко отдают единственный валентный
электрон и превращаются в шаровые ионы типа благородных газов.
Подобные особенности определяют белый цвет солей, ионные связи в
минералах и нахождение в водах преимущественно в виде простых
катионов.
Натрий (Na). Хотя Na — типичный щелочной металл, по радиусу
иона, Кх и другим физико-химическим и геохимическим параметрам
он ближе к Са, чем К- Радиус Na+ 0,092 нм. Он определяет его изо-
морфизм с Саа+ в гипогенных условиях, образование кальциево-нат-
риевых плагиоклазов. В зоне гипергенеза этот изоморфизм не характе-
рен.
Общее число минералов Na — 222, большинство из них гипоген-
ные. Кларки концентрации следующие:
Изверженные породы земной коры и верхней мантии:
ультраосновные...................... 0,2
основные............................ 0,8
средние............................. 1.2
кислые.............................. 1,1
Биосфера и ее производные:
глины и сланцы................
галолиты (NaCl)...............
гидросфера ...................
живое вещество ...............
почвы ........................
морские водоросли ............
сухопутные растения...........
сухопутные животные . . . .
глубинные рассолы, грунтовые
воды аридных ландшафтов . .
поверхностные и грунтовые воды
гумидиых регионов.............
атмосферные осадки там же . .
0,26
8
0,4
0,008
0,25
0,2
~0,01
0,1
п
п-10-3—п-10-4
п-10-"—п IO-5
Кларк Na в земной коре 2,5 %, большая часть его атомов входит в
состав полевых шпатов, нефелина, амфиболов и других силикатов.
Na — типичный литофил, концентрируется в гранитном слое. В ульт-
раосновных породах его 0,57 %, в основных — меньше, чем в средних
и кислых. В биосфере происходит резкая дифференциация Na: осадоч-
ные породы в целом им обеднены (в глинах и сланцах 0,66 %), но в
соленосных породах Na накапливается.
Велика роль Na во многих гипогенных процессах, в которых он
является главным катионом, особенно в щелочных породах. В газово-
жидких включениях гидротермальных минералов из катионов преоб-
ладает Na — он ведущий элемент многих гидротерм. Сильнощелочные
натриевые гидротермы обусловливают альбитизацию и другие явле-
416
ния натриевого метасоматоза. Известны низкотемпературные цеоли-
ты — анальцим и др.
В биосфере по многим особенностям миграции Na напоминает С1:
он одновалентен, образует легкорастворимые соли, участвует в атмос-
ферной миграции (циклические соли), накапливается в конечных водое-
мах стока — Мировом океане, бессточных озерах, зоне замедленного
водообмена артезианских бассейнов. Поэтому во многих случаях мож-
но говорить об истории NaCl. Однако значительно более высокий кларк
(2,50) и катионная природа определяют и существенные отличия Na от
С1. Основной источник подвижного Na в биосфере — выветривание из-
верженных пород, а не вулканизм, как у С1. В отличие от С1 большая
часть Na на материках сосредоточена в горных породах и коэффициент
его водной миграции (л) в десятки и сотни раз меньше, чем у С1 х
X(п-10—п-100). Если бы Na по интенсивности водной миграции был
аналогичен С1, то в водах Мирового океана и аридных районов не хвати-
ло бы анионов Cl-, sor и СОГ Для его нейтрализации. Это привело
бы к изменению диссоциации воды, увеличению количества ОН- за
счет Н+. Воды стали бы резкощелочными.
В живом веществе в среднем 2- К)-2 % Na,T. е. меньше, чем Са, К,
Mg. Натрий выходит из биологического круговорота и в условиях
влажного климата уносится стоком за пределы ландшафта, который
обедняется Na. Воды также бедны Na, и среди катионов он занимает
третье место — после Са и Mg. Растения также бедны Na, однако де-
фицитность его не установлена. Животные нуждаются в повышенных
количествах Na (доказана необходимость подкормки NaCl). С натрие-
вым обменом связаны заболевания сердечно-сосудистой системы, по-
чек.
В сухом климате Na—-характерный элемент испарительной кон-
центрации. Он занимает первое место среди катионов грунтовых и
озерных вод и накапливается в солончаковых почвах и растениях, оп-
ределяя многие геохимические особенности пустынь. Таким образом,
для истории Na в ландшафтах характерна сравнительно слабая рол-
биологического круговорота и большое значение водной миграции.
В этом отношении он также напоминает С1. В целом Na теряется ланд-
шафтами и концентрируется в морях и океанах, а частично и в бес-
сточных областях суши.
В океанической воде 1,035 % Na. Он —характерный талассо-
фил (0,42), значительно превосходит в этом отношении Mg, Са, К и дру-
гие катионы.
В ноосфере история Na в общих чертах аналогична истории CI.
Основное значение имеет добыча NaCl, в меньшей степени — других
солей, например мирабилита, соды. Так как кларк Na значительно вы-
ше кларка С1, технофильность его намного ниже, но того же порядка,
что у Са — 1,3-108. Ранее использовались только соединения Na,
теперь в промышленности применяется металлический Na — вещество
крайне активное. Человек в основном рассеивает Na, извлекая его из
Месторождений солей. В культурных ландшафтах влажного климата
14
Зак. 2022
417
содержание Na увеличивается, однако и здесь он не задерживается,
легко выносится стоком. Орошение пустынь и сухих степей нередко
приводит к нежелательному вторичному засолению — накоплению Na.
Калий (К). Его кларк такой же, как у Na, — 2,50. В магматиче-
ских процессах они аналоги: оба накапливаются в кислых породах, в
которых К входит в полевые шпаты и слюды. В основных и ультраос-
новных (лишь 0,03) породах К мало.
Большие размеры К+ определяют возможности его изоморфизма с
Rb+, Sr2+, Ва2+, Pb2+, Т1+. Это характерная парагенная ассоциация
в магматических минералах. Особенности К+ определяют его накопле-
ние на поздних стадиях магматической дифференциации, в наиболее
кислых разностях пород. В гидротермах К+ играет меньшую роль, чем
Na+, хотя известны и калиевые процессы (грейзенизация, калиевый
метасоматоз, приводящий к микроклинизации и мусковитизации поле-
вых шпатов).
К — важный биоэлемент, его кларк в живом веществе 0,3 %, в от-
дельных видах до 1—2 % (например, в гигантских морских водорослях
макроцистис). Хотя почти все соли К легкорастворимы, в биосфере К
мигрирует слабо ^х=0, п), чем резко отличается от Na. При вывет-
ривании К переходит в воды, но он быстро захватывается организма-
ми и поглощается глинами. Поэтому реки бедны Кив океан его посту-
пает в несколько раз меньше, чем Na. Но и в океане К поглощается
организмами и донными илами (например, входит в состав гидрослю-
дистого минерала глауконита). В результате океанические воды содер-
жат лишь 0,038 % К — в 25 раз меньше, чем Na. В прошлые геологи-
ческие эпохи, на поздних стадиях испарения морской воды в лагу-
нах после осаждения Na происходило осаждение солей К вместе с со-
лями Mg (карналлит — MgCl2-KCl-6 Н2О и др.). Особенно энергич-
но эти процессы протекали в пермском периоде (Соликамское место-
рождение в СССР, Стассфуртское в ГДР и др.).
Хотя по химическим свойствам К — аналог Na, в биосфере по вод-
ной миграции он блиизок к Mg — оба входят в состав глинистых мине-
ралов, накапливаются в конечных стадиях галогенеза (в гипогенных
условиях геохимия К далека от Mg и близка к Na).
В ноосфере история К связана главным образом с сельским хозяй-
ством (калийные удобрения), его технофильность 4-106 — меньше, чем
у Na, Ba, Са, F.
Рубидий (Rb). Это типичный рассеянный элемент с более щелочны-
ми свойствами, чем К- Несмотря на сравнительно высокий кларк —
1,5-10~2 (больше, чем у Cu, Pb, Zn и многих других металлов),
Rb не образует собственных минералов, а на основе близости ионных
радиусов входит в качестве изоморфной примеси в полевые шпаты,
слюды и другие минералы К- В магматических процессах, как и К,
Rb накапливается в кислых изверженных породах и особенно в пегма-
титах, которые иногда содержат 1—3 % Rb. В ультраосновных и ос-
новных породах Rb мало(2-10~4 и 4,5-10—3 %). В биосфере Rb еще
больше рассеивается, биологические процессы в отличие от К не благо-
418
приятствуют его накоплению. В живом веществе 2-10~4 % Rb. Вводах
Rb мигрирует аналогично К, но еще легче сорбируется илами и гли-
нами. В ноосфере Rb используется слабо, технофильность его низ-
кая — 1 • Ю5.
Цезий (Cs). Это самый электроположительный элемент из извест-
ных на Земле. Cs — типичный редкий и рассеянный элемент, геохими-
ческий аналог Rb, в меньшей степени К и Ва. Кларк Cs 3,7-10~4 %,
он незначительно концентрируется в гранитоидах (5-10-4 %), более
рассеян в основных породах (1-10-4 %). Известно лишь два минерала
Cs, оба крайне редкие. Большая часть крупных ионов Cs+ изоморфно
замещает К+ и Rb+ в полевых шпатах и слюдах. Cs — слабый водный
мигрант, не накапливается и живым веществом (кларк — 6-10~3 %).
Основное значение в концентрации Cs имеют изоморфизм и сорбция
крупных катионов (R;Cs+ 0,165 нм). Технофильность Cs незначитель-
на, в ноосфере используется его исключительная электроположитель-
ность — способность к эмиссии электронов. При ядерных взрывах в
окружающую среду попадает радиоактивный 137Cs, опасный для
здоровья.
4. Типичные щелочноземельные металлы и литий — Са, Mg Ва,
Sr, Li, Ra. Как и типичные щелочные металлы, это характерные ка-
тионогенные элементы, которые, теряя валентные электроны, превра-
щаются в ионы типа благородных газов. Для них также характерен
белый цвет солей, ионные связи в минералах, нахождение в водах в ви-
де простых катионов. Однако в отличие от типичных щелочных метал-
лов они образуют как легкорастворимые, так и труднорастворимые со-
ли, что определяет меньшую интенсивность водной миграции, большую
роль геохимических барьеров в концентрации (преимущественно
щелочные — D, отчасти сорбционные — G, испарительные — F и тер-
модинамические — Н).
Кальций (Са). По распространенности Са занимает пятое место в
земной коре — после О, Si, Al и Fe, его кларк 2,96 %. Са энергично
мигрирует и накапливается в различных системах, образует 385 ми-
нералов (по числу минералов — четвертое место). Это характерный
элемент земной коры, в мантии его мало (в ультраосновных породах—
0,7 %). В магматических системах характерна связь Са и Na, оп-
ределяемая близостью размеров ионов. Отсюда изоморфизм альбита и
анортита. В анортите сосредоточена главная масса атомов Са. Важную
роль Са играет при контактово-метаморфических процессах, когда
магма взаимодействуете известняками и доломитами (скарнирование).
Кларки концентрации Са свидетельствуют о его сильной дифферен-
циации:
Изверженные породы земной коры
и верхней мантии:
ультраосновные........................ 0,23
основные............................ 2,3
средние.................................. 1^5
кислые.............................. 0,5
14*
419
Биосфера и ее производные:
глины и сланцы.......................... 0,8
карбонатные породы (мел, известняк) 13
глобигериновый ил....................... 8
живое вещество.......................... 0,17
«кальциевые организмы» . ... >3
кислые почвы........................0,1—0,01
гидросфера..............................0,012
хлор-кальциевые рассолы .... 1,5—3,0
грунтовые воды пустынь .... 0,05—0,1
реки................................0,ООп
В биосфере дифференциация Са во многом связана с карбонатным
равновесием:
СаСО3 4- Н2О + СО2 Са2+ 4- 2НСО3“
Поэтому при высоком содержании СО2 в водах Са находится в раст-
воре, а при низком — выпадает в осадок в виде кальцита. Огромную
роль в истории Са играет и биогенная миграция, он — главный металл
живого вещества (кларк — 0,5 %). Известны «кальциевые организмы»,
содержащие более 10 % Са (больше С), строящие свой скелет изСаСО3
(известковые водоросли, многие моллюски, иглокожие, кораллы, кор-
неножки и т.д.). Среди растений и животных известны как «кальцие-
филы» (например, бобовые, моллюски), так и кальциефобы (сфагновые
мхи, насекомые, грибы, хвощи, плауны и т.д.). У позвоночных живот-
ных скелет состоит из фосфата Са (в организме человека около 1,5% Са).
С захоронением остатков морских животных и растений связано на-
копление колоссальных масс водорослевых, коралловых и прочих из-
вестняков, которые, погружаясь и метаморфизуясь, превращаются в
мрамора.
Для огромных территорий материков с влажным климатом характе-
рен дефицит Са, который легко выщелачивается из почв. С дефицитом
Са связаны низкое плодородие почв, низкая продуктивность домашних
животных, малые их размеры, болезни скелета. Дикие животные также
испытывают дефицитСа — птицы несут мало яиц, у моллюсков тонкие
раковины, млекопитающие меньших размеров и т.д. Поэтому большое
значение имеет обогащение ландшафта Са — известкование почв, под-
кормка Са домашних животных и т. д. В сухом климате СаСО3 трудно-
растворим, поэтому ландшафты степей и пустынь богаты СаСО3,
в солончаках и соленых озерах часто накапливается гипс.
Реки приносят в океан много Са, но он не задерживается в океани-
ческой воде, входит в состав скелета организмов, осаждается на дно
преимущественно в форме СаСО3. Известковые илы широко распрост-
ранены во всех океанах до глубин 4000 м (на больших глубинах про-
исходит растворение СаСО3, организмы там нередко испытывают дефи-
цит Са). Особенно энергично осаждение кальцита идет в морях тропи-
ков, где теплые воды содержат малоСО2.
Важную роль в истории Са играют подземные воды. В известняко-
вых массивах они местами энергично выщелачивают Са. С этим про-
цессом связано развитие карста, образование пещер.
420
Помимо кальцита в морях прошлых геологических эпох широко бы-
ли распространены отложения фосфатов Са (фосфориты), доломита, в
лагунах — гипса. Геохимия Са изменялась в ходе геологической ис-
тории: росло биогенное карбонатообразование, а хемогенное уменьша-
лось. В докембрийских морях не было животных с известковым скеле-
том. Они начали широко распространяться, начиная с кембрия (корал-
лы, губки и т.д.).
Технофильность Са (2- Ю8) больше, чем Fe, Mg, Na, Al. Он важный
элемент строительства (известняки, мрамора, гипсы). В сельском хо-
зяйстве известняки и фосфориты играют большую роль в удобрении
полей и подкормке животных. Для металлургии важен плавиковый
шпат — CaF2, гидротермальные месторождения которого известны во
многих регионах.
Магний (Mg). Геохимия Mg отличается парадоксальными чертами.
С одной стороны, — это элемент глубин, накапливающийся в мантии
и базальтовом слое (кларк в ультраосновных породах — 25,9, основ-
ных — 4,5, земной коре — 1,87). Характерна связь Mg с Fe и его се-
мейством. С другой стороны, Mg накапливается в самых низкотемпера-
турных и дисперсных системах — океане и соляных озерах. И здесь
миграция Mg резко отличается от Fe, Са, Sr, Ва, она аналогична миг-
рации наиболее подвижных элементов — Na, Cl, К, Br, I. Эту двойст-
венность подчеркивал А. Е. Ферсман. Она связана с размерами иона
Mg2+ (0,074 нм), который намного меньше, чем ионы Са, Sr, Ва, К, Na.
По размерам Mg2+ идентичен Ni2+, близок к Fe2+ и Со2+. Это опре-
деляет изоморфизм Mg2+ с Fe2+ и Ni2+ в гипогенных силикатах. По-
этому в ультраосновных и основных породах Mg тесно связан с желе-
зом (Fe2+), он входит в состав оливина и пироксенов. В кислых поро-
дах Mg входит в состав слюд, отчасти амфиболов. Mg не очень характе-
рен для гидротермальных систем, хотя известны гидротермальные до-
ломитизация, серпентинизация, оталькование.
Кларки концентрации Mg подтверждают его энергичную миграцию
и дифференциацию:
Каменные метеориты................
Изверженные породы земной коры и
верхней мантии:
ультраосновные ...................
основные......................
средине ......................
кислые........................
Биосфера и ее производные:
глнны и сланцы...................
доломиты......................
гидросфера ...................
глубинные рассолы.............
живое вещество................
грунтовые и речные воды в гу-
мидных ландшафтах.............
то же, в аридных ландшафтах
соляные озера.................
7
13
2,4
1,1
0,3
0,7
5
0,07
2
0,02
п-10-3—п-10-4
— 0,1
<2
421
Гипергенная миграция Mg во многом связана с хорошей раствори-
мостью его сульфатов и хлоридов. Как и для Са, для него важно кар-
бонатное равновесие:
Mg2+ + 2HC(X MgCO3 + H2O + CO2
I
Однако из вод, как правило, осаждается не MgCO3 (магнезит), а ос-
новные или двойные карбонаты, среди которых наиболее распростра-
нен доломит CaCO3-MgCO3 (40% всех осадочных карбонатных пород).
Малые размеры позволяют Mg2+ входить в решетку глинистых ми-
нералов. Этим он резко отличается от других щелочноземельных и ще-
лочных металлов и близок к А1 (образование магнезиальных силикатов
и алюмосиликатов; подобных минералов нет ни уСа, ни у Na). Хотя
Mg — важный биоэлемент, его биофильность меньше Са. Известны
болезни растений и животных, обязанные дефициту и избытку Mg.
В гумидных ландшафтах история Mg аналогична истории Са, но
Mg менее подвижен. На путях его миграции возникают три основных
геохимических барьера; 1) биогеохимический (поглощение живым ве-
ществом); 2) силикатный (образование вторичных силикатов) и 3)
сорбционный (поглощение коллоидами глин и гумуса). Однако барье-
ры не в состоянии задержать весь Mg и он частично выносится со сто-
ком. Интенсивность выноса Mg меньше, чем у Са, для которого не дей-
ствует силикатный барьер и слабее проявлен сорбционный. Поэтому
в грунтовых и речных водах Mg занимает второе место после Са, его
Кх вдвое ниже — менее 5.
По миграции в аридных ландшафтах Mg сходен с Са, но в некоторых
из них и значительно отличается. Местами он ближе к Na, частично п
к А1. Здесь резко проявляется способность Mg входить в решетку гли-
нистых минералов и легкая растворимость сульфатов. В результате
грунтовые воды обогащаются MgCl2 и MgSO4, которые осаждаются при
испарении вод. Эти процессы наблюдаются преимущественно в пусты-
нях.
При испарении осолоняющихся лагун выпадение солей Mg про-
исходит на поздних стадиях их развития после осаждения поваренной
соли. При этом сначала осаждаются сульфаты Mg, а позднее и хлориды.
Поэтому магнезиальные соли обнаруживаются в верхних частях соля-
ных куполов в ассоциации с калийными солями ( К- Mg-стадия га-
логенеза, по Н. М Страхову).
В целом аридные ландшафты богаче Mg, чем гумидные, — его боль-
ше в почвах, водах, континентальных отложениях, растениях. На пу-
тях водной миграции Mg здесь возникает больше геохимических барь-
еров: 1) испарительный; 2) карбонатный (доломитизация); 3) сили-
катный (образование палыгорскита и других минералов); 4) сорбцион-
ный.
В океане в среднем 1,3-Ю-1 % Mg. Его талассофильность (0,07)
значительно выше, чем у Са, Sr, Ва, других щелочных и тяжелых
металлов (кроме Na — 0,42).
422
Воды океана не насыщены MgCO3 и Mg (ОН)2, из океанической во-
ды не происходит химического осаждения солей Mg. Основной постав-
щик Mg для океана — выветривание на материках, которое, по рас-
счетам В. М. Гольдшмидта, за время геологической истории поставило
12,6 г. Mg на каждый килограмм океанической воды. Однако в 1 кг
современной воды содержится лишь 1,3 г Mg, т. е. почти в 10 раз мень-
ше. Это объясняется отложением доломитов и других осадочных по-
род, сорбцией Mg коллоидами, многократным участием одного и того
же атома Mg в большом круговороте веществ, т. е. гранитизацией, па-
лингенезом и другими процессами.
За геологическую историю миграция Mg изменилась. Предполага-
ют, что основная масса Mg поступила в океан в ранние геологические
эпохи, так как в архее и протерозое на материках были шире распро-
странены богатые Mg базальты. Для докембрия характерно осаждение
доломитов в морях, это доломитные эпохи. В докембрийских известня-
ках Русской платформы, по А. Б. Ронову и др., в среднем содержится
12,6 % Mg, а в современных — 1 %. За геологическую историю пони-
зилось содержание Mg и в глинистых породах. Образование доломитов
в открытых морях прекратилось в конце палеозоя, в мезозое оно силь-
но уменьшилось и в лагунах. В современную эпоху доломит осаждается
лишь в некоторых озерах. Причины этого явления вызывают дискус-
сии.
В былых морях Mg концентрировался одновременно не только в до-
ломитах, но и в магнезиальных силикатах, так как в доломитовых по-
родах часто встречаются палыгорскит и сепиолит.
Вплоть до XX столетия практическое применение находили только
соединения Mg, главным образом магнезит и доломит. Технофильность
магния 1,5- 10е, такая же, как у А1, и значительно меньше, чем у Са, Na,
Cl, Cu, Pb, Zn, Ni, Mo, Sb, Hg, и других металлов. Это свидетельствует
о слабом использовании Mg в ноосфере; в будущем оно, вероятно, силь-
но увеличится. На это указывает все возрастающее значение металли-
ческого Mg в промышленности (особенно важна его легкость — в 1,5
раза легче А1). Известны сплавы, содержащие до 90 % Mg . Mg такж-
используется в металлургии V, Ti, Zr, U и других металлов. Источни-
ком служат залежи доломитов и магнезитов, морская вода, соляные
месторождения с карналлитом и бишофитом, рассолы соляных озер.
Дефицит Mg на легких почвах потребовал применения магниевых удоб-
рений. Mg в организмах растений является антагонистом К и поэтому
использование калийных удобрений может привести к дефициту Mg.
В целом в ноосфере происходит рассеяние Mg и в меньшей степени его
накопление в ландшафтах, бедных этим элементом (удобрения).
Барий {Ва). Кларк Ва6,5-10_2%, он слабо концентрируется в
кислых изверженных породах (8,3-10~2) и значительно в гидротер-
мальных рудах, содержащих важнейшие промышленные минералы —
барит (BaSOJ и витерит (ВаСО3). Накапливается Ва и в некоторых
осадочных породах. Кларк Ва в живом веществе 3-10-3 %, его боль-
ше в растениях, чем в животных. Известны травы, концентрирующие
423
Ва (некоторые астрагалы и др.). На породах, богатых Ва (баритовых
жилах и др.), почвы неплодородны, травы ядовиты, домашние живот-
ные болеют. У высших животных и человека органы, накапливающие
Са, концентрируют и Ва. Установлена высокая концентрация Ва в
пигментной оболочке глаза (до 10 % на золу). Технофильность Ва
почти в 10 раз меньше, чем у Са. О других особенностях геохимии Ва
см. гл. 4.
Стронций (Sr). Кларк Sr 3,4-10~2, в геохимических процессах он
аналог Са, ионные радиусы их близки. Известно около 30 минералов
Sr, большая часть которых образуется в биосфере (главный — целест-
ин SrSOJ. В магматических процессах Sr преимущественно рассеива-
ется и входит в виде изоморфной примеси в кристаллическую решетку
минералов Са, К и Ва. Кларки концентрации Sr следующие (в скоб-
ках — КК Са):
Изверженные породы земной коры и
верхней мантии:
ультраосновные.................... 0,03(7,98)
основные........................ 1,3 (1,7)
кислые............................ 0,89(0,58)
Биосфера и ее производные:
глины и сланцы................... 1,3(0,62)
живое вещество................. 0,05(3)
гидросфера...................... 0,023(0,12)
галолиты....................... 0,03
гипсолиты...................... 5,8
сульфатные озера............... 0,1
лагуны в сухом климате ... 4
глубинные рассолы.............. 3(0,44)
осадочные карбонатные породы 1,8
реки гумидных регионов .... 0,0007
то же, в аридных .... 0,01
Отсюда следуют общие черты геохимии Sr:
1. Дифференциация и накопление в ходе геологической эволюции:
мантия (ультраосновные породы)—► магма (изверженные породы зем-
ной коры)-*- биосфера (осадочные породы).
2. Накопление в осадках в результате испарительной концентра-
ции вместе с гипсом.
3. Накопление в водах, бедных сульфатами, — хлоридных рас-
солах глубин, хлоридных озерах.
4. Энергичная миграция в гумидных ландшафтах и сток в океан,
причем по интенсивности стока Sr опережает Са.
5. Меньшая биофильность и большая талассофильность по срав-
нению с Са.
Избыток Sr вреден для животных и человека, в районах распрост-
ранения пород, обогащенных Sr, известны тяжелые заболевания. Тех-
нофильность Sr низкая — в 1000 раз ниже Са.
Литий (Li). Это самый легкий металл. Обладая общими химически-
ми и геохимическими свойствами с другими щелочными металлами,
424
Li во многом отличается от них. Он сходен с соседом по диагонали —
Mg («правило диагонали»), что связано со строением атома Li —
близостью ионных радиусов Li и Mg, которое определяет сходство их
гипергенной миграции. Переходный характер Li (от щелочных к ще-
лочноземельным металлам) проявляется в слабой растворимости кар-
боната, фосфата и фторида Li. В природных водах Li аналог Na, в кри-
сталлах (минералах) — Mg и А1.
Li — типичный элемент земной коры (кларк 3,2-10—3 %), он на-
капливается в наиболее поздних продуктах дифференциации магмы
— пегматитах. В ультраосновных породах лишь 5-10~5 % Li (в основ-
ных породах— 1,5-10-3 %, средних — 2-Ю"3, кислых — 4-Ю-3 %).
По А. И. Гинзбургу, в эндогенных процессах для Li характерны
исключительная фторофильность и высокая хлорофильность — об-
разование флюидов с F и С1.
Близость ионных радиусов Li+, Fe2+ и Mg,2+ позволяет Li входить в
решетки магнезиально-железистых силикатов — пироксенов и амфи-
болов. В гранитоидах он содержится в виде изоморфной примеси в
слюдах. Только в пегматитах и в биосфере известно 28 самостоятель-
ных минералов Li (силикаты, фосфаты и др.). Все они редкие. В био-
сфере Li мигрирует сравнительно слабо, роль его в живом веществе
много меньше, чем у Na и К (кларк — 6-10-5 %). Из вод он легко сор-
бируется глинами, относительно мало Li и в воде океанов (1,5-10_5%).
Месторождения Li связаны как с магматическими процессами (пег-
матиты и др.), так и с биосферой (соляные озера и др.).
Li — дефицитный элемент космоса, служит ядерным горючим в
центральных частях звезд.
Технофильность Li быстро растет.
Радий (Ra). Самый стабильный изотоп 226 Ra имеет период полу-
распада 1590 лет. На Земле давно бы не было Ra, если бы он постоян-
но не возникал в результате радиоактивного распада. В породах и ми-
нералах Ra часто находится в равновесии с U, которое отвечает отноше-
нию Ra/U = 3,36- 10~7. Нередко наблюдается и нарушение этого рав-
новесия как в сторону Ra, так и в сторону U.
Вслед за своими прародителями — U и Th — Ra аккумулируется в
верхней части земной коры: в кислых породах (1,2-10-10) его больше,
чем в основных (2,7-10-11). Наиболее бедны Ra ультраосновные по-
роды (1-10-12) и каменные метеориты (3,4-10~12). На примере Ra осо-
бенно ясно видна зависимость минералообразования от кларка. По
химическим свойствам Ra — типичный щелочноземельный металл,
причем растворимость RaSO4 меньше, чем CaSO4. И все же в природе
радиевые аналоги барита, целестина и гипса неизвестны. Ra вообще
не образует самостоятельных минералов, что объясняется его крайним
рассеянием — сверхнизким кларком. При столь низких концентра-
циях действуют особые геохимические законы так же, как «особая хи-
мия» управляет поведением Ra в лабораторных условиях. И в природе
и в лаборатории осаждение Ra из растворов подчиняется законам сорб-
ции, сокристализации, соосаждения.
425
Своеобразие геохимии Ra связано с тем, что химически он щелоч-
ноземельный элемент (особенно близок к Ва), но в своем образовании
связан с U. В результате его миграция и распределение подчиняются
разным законам — в одних случаях основное значение приобретает
аналогия с Са и Ва, в других — связь с U. Последняя более важна, и
только в хлор-кальциевых рассолах решающую роль играет аналогия
с Са. Важнейшее значение для концентрации Ra в породах и почвах
имеет сорбционный барьер, меньшее — биогеохимический — погло-
щение живым веществом (морские организмы, гумусовые горизонты
почв). В биосфере радиоактивное равновесие часто нарушается, пути
миграции LJ и Ra расходятся.
История Ra в ноосфере полна превратностей. В начале XX в. Ra
извлекался из урановой руды главным образом с научными целями.
Вскоре, однако, обнаружилось его терапевтическое значение при ле-
чении некоторых форм рака. Технофильность Ra приблизительно со-
ставила 1,6-10 5, она не очень сильно отличалась от V(2-105), Mg
(1,5- 10е), Al (1,5-10®) — в единицах кларков человечество извлекало
Ra в тех же масштабах, что и другие элементы. Интерес к практиче-
скому применению Ra упал, когда были найдены способы использова-
ния ядерной энергии. Ra принадлежит к числу элементов, которые
природа рассеивает, а человек концентрирует.
5. Галогены— F, Cl, Br, I. Галогены — наиболее электроотрица-
тельные, типичные анионогенные элементы. Присоединяя электрон,
они превращаются в крупные ионы типа благородных газов. Это оп-
ределяет малые ЭК, хорошую растворимость большинства солей и ин-
тенсивную водную миграцию (за исключением F). Все галогены кон-
центрируются в гранитном слое и биосфере, участвуют в испаритель-
ной концентрации. Главным источником галогенов для биосферы
в истории Земли служил вулканизм.
Фтор (F). Как и другие начальные элементы групп периодической
системы (Li, Be, В и т.д.), F значительно отличается от последующих
членов — Cl, Br, I. Эти отличия двойственны. С одной стороны,
F — самый электроотрицательный элемент, химически чрезвычайно
активный, взаимодействующий даже с инертными газами (XeF2,
XeOF4 и другие соединения). С другой стороны, фториды менее раст-
воримы, чем хлориды и бромиды.
Кларк F 6,5-К)-2 %, его больше в кислых изверженных породах
(8-10~2 %), чем в основных (3,7-10-2 %) и особенно ультраосновных
(1-Ю-2 %). F энергично мигрирует при вулканизме в газообразной
форме, в гидротермах и водах биосферы (в ионной форме). В эндоген-
ных процессах сродство к фтору — фторофильность имеет большое ге-
охимическое значение. Важнейшим осадителем F является Са, с ко-
торым он образует труднорастворимый флюорит. Известны 86 собствен-
ных минералов F, часть атомов F изоморфно входит в решетку апатита
и других минералов, сорбируется осадками, поглощается живым ве-
ществом. F — важный биоэлемент, его кларк в живом веществе
1,4-10~4 %. Известны болезни людей и домашних животных, обязан-
426
ные дефициту и избытку F. В геологической истории важным источни-
ком поступления F в биосферу были вулканические дымы. Технофиль-
ность F — 2-107 — много ниже, чем у С1, но такая же, как у Na.
Хлор (СГ). В лабораторных условиях О разновалентен (от —1 до
+7), но в земной коре преобладающее значение имеет С1_, для которо-
го характерны высокое сродство к электрону и большая электроотри-
цательность. Большой радиус этого аниона (0,181 нм) в сочетании с од-
новалентностью определяет низкий ЭХ (0,25), хорошую раствори-
мость солей. Отрицательный заряд почти исключает поглощение С1*
коллоидами, заряженными, как правило, тоже отрицательно (глины,
гумус и др.). Поэтому для С1~ в зоне гипергенеза не характерны
физико-химические барьеры, он очень энергичный водный мигрант.
Только в сухом климате С1 накапливается на испарительном барьере.
В ультраосновных и основных породах кларк С1 5-10-3 %, в кислых
почти в 5 раз больше — 2,4-10~2. Важнейшим минералом О в извер-
женных породах является хлорапатит — Са5 (РО4)3С1. В гидротер-
мах С1~ образует растворимые комплексы со многими металлами (хло-
рофильность), возможна их миграция и в газообразной форме. Газо-
во-жидкие включения минералов представляют собой в основном хло-
ридные рассолы.
В биосфере самый распространенный минерал С1 — галит NaCl,
реже встречаются хлориды К, Са, Mg. Хлориды других металлов ред-
ки и очень редки. Общее число минералов О — 97. Весьма контраст-
ны кларки концентрации:
Изверженные породы земной коры и верх-
ней мантии
ультраосновные........................ 0,3
основные.............................. 0,3
средние............................... 0,6
кислые................................ 1,4
Биосфера и ее производные:
глины и сланцы........................ 0,9
галолиты............................ 1000 п
хлоридные рассолы................... 100 п
гидросфера............................ 111
живое вещество...................... 1,1
реки гумидных районов................. 0,0 п
атмосферные осадки гумидных районов 0,00 п
атмосферные осадки аридных районов 0, п
Анализ XX свидетельствует о связи С1 с земной корой, а в ее пре-
делах — с гранитным слоем (в основных и ультраосновных породах
XX = 0,3). Отчетливо выявляется и исключительная роль водной миг-
рации в истории С1, его накопление в морях, рассолах, солевых тол-
Щах.
Кларк О в живом веществе 2-10-2 %, биофильность его высокая—
М н близка к О (1,5), S (1), Р (0,75), В (0,83), Вг (0,71). Она
427
почти иа порядок выше биофильиости важнейших металлов Са (0,17)
и К (0,12).
В гумидиые ландшафты С1 поступает из горных пород и с атмосфер-
ными осадками. В биологическом круговороте и на физико-химических
барьерах ои не задерживается и с речным стоком выносится в моря
(циклический элемент). Реки и озера таких районов бедны С1, коэффи-
циент его водной миграции равен п-10 — п-100. Обогащение ланд-
шафта С1 здесь возможно в результате его привноса атмосферными осад-
ками с близлежащих морей. Однако большинство гумидных ландшаф-
тов бедно О, воды им ненасыщены, минералы не образуются.
Дефицит О у растений неизвестен, но животные испытывают его не-
достаток.
В аридных ландшафтах С1 нередко является ведущим элементом.
Большую роль в его миграции играет ветер, переносящий соленую
пыль с солончаков и акваторий морей и соленых озер. Огромен вынос
О с поверхности Каспийского моря, сухого русла Узбой и других за-
соленных территорий. С1 участвует в испарительной концентрации и
накапливается в озерах и грунтовых водах степей и пустынь.
При энергичном испарении (особенно в пустынях) он выходит на
первое место среди анионов, воды приобретают хлоридный и хлори-
дно-сульфатный состав (до 100 г/л С1). В депрессиях рельефа обра-
зуются солончаки. В этих ландшафтах растут солянки, поглоща-
ющие С1, он преобладает в водах, в воздухе много соленой пыли. Это
не только натриевые, но и хлорные ландшафты.
Круговорот С1 в аридных ландшафтах часто не замкнут, он ие
возвращается в океан, а накапливается в местных конечных водоемах
стока типа Аральского и Каспийского морей, озер Балхаш и Алакуль.
Важнейшим концентратором С1 служит Мировой океан, где его
содержание составляет 1,93 %. С1— наиболее талассофильный эле-
мент.
Периодически в геологической истории были эпохи соленакоп-
ления (см. гл. 13). Общая тенденция исторической геохимии С1 состоит
в его резкой пространственной дифференциации: во все большем на-
коплении в морях и океанах, соляных отложениях, аридных ланд-
шафтах.
Основным поставщиком С1 для биосферы на протяжении геологиче-
ской истории был вулканизм. В биосфере С1 концентрируется, в но-
осфере — рассеивается. Ежегодно в мире добывают миллиарды тонн С1.
Важнейшие месторождения С1 — залежи поваренной и калийной со-
лей. С1 добывается также из подземных рассолов, морской воды. В от-
личие от земной коры в ноосфере важную роль играют неионные связи
С1, характерные для хлорорганических продуктов, растворителей, ядо-
химикатов и др. Известен и свободный С1. В продуктах питания и во-
дах большинства ландшафтов мало О и человечество издавна воспол-
няет его дефицит потреблением поваренной соли. Во многих странах
скорее можно говорить об избытке С1, так как исторически сложившие-
ся нормы потребления пищевой соли не всегда оптимальны (благопри-
428
ятствуют гипертонии). В кормах домашних животных NaCl часто дефи-
цитен, в связи с чем в животноводстве его вводят в подкормку. При не-
правильном орошении сухих степей и пустынь возникает вторичное за-
соление.
Технофильность С1 высокая — 3-1010. В целом в ноосфере С1 рас-
сеивается, его миграция усложняется, создаются соединения, которые
в природе отсутствовали (хлорорганические и др.).
Бром (Вг). По химическим свойствам и особенностям миграции Вг
напоминаете!, однако более низкий кларк (2,1-10~4 %) определяет
его меньшую роль в земной коре: он не бывает ведущим элементом,
почти не образует минералов. Определение бромхлорного коэффициен-
та (Вг/Cl) систем имеет большое геохимическое значение (он колеблется
в сотни раз).
Способность Вг к концентрации очень мала, это типичный рассеян-
ный элемент, образующий всего несколько очень редких минералов—
бромидов Ag.
Вг — элемент земной коры, в ультраосновных породах его особен-
но мало. В магматических и гидротермальных системах Вг рассеян,
он накапливается в биосфере: при кларке 2,1-10-4 % в глинах и слан-
цах его содержание поднимается до 6-Ю-4 %, в гидросфере — 6,6х
Х10“3%. Это очень талассофильиый элемент (30). Вг также концен-
трируется в соляных озерах, галолитах, глубинных рассолах. Живое
вещество в целом не концентрирует Вг (кларк 1,6-10~4 %), но морские
животные обогащены им. Органические вещества легко сорбируют
Вг~, с чем связана его аккумуляция в торфяниках, морских и озерных
илах. Анализ коэффициента КК CAIKK Вг показывает, что Вг по срав-
нению с С1 энергичнее накапливается в почвах гумидных районов,
глинах и сланцах и слабее в гидросфере,рассолах, соленых озерах, га-
лолитах, живом веществе (менее биофилен и талассофилен).
Вг оказывает тормозящее действие на центральную нервную си-
стему. Автор предположил, что эволюция нервной системы живот-
ных морей докембрия и нижнего палеозоя замедлялась тормозящим
влиянием Вг. Выход животных в девоне на континенты привел к ос-
лаблению «бромного пресса на нервную систему», так как в ландшаф-
тах содержание Вг много ниже. Это создало условия для быстрой эво-
люции неравной системы (земноводные пресмыкающиеся —► млеко-
питающие).
Как и для С1, первоисточником Вг для биосферы служил вулка-
низм и в меньшей мере выветривание изверженных пород.
Технофильность Вг значительная, такая же, как у Zn, S, Мо. Ос-
новными промышленными источниками Вг служат морские и подзем-
ные воды, калийные соли, рапа соленых озер. В ноосфере усилилась та
тенденция, которая характерна для земной коры — Вг в ноосфере еще
больше рассеивается.
Йод (/). Положение I в седьмой группе периодической системы
вместе с F, С1 и Вг определяет его металлоидные свойства, а большой
заряд ядра, сложное строение атома (№53)—меньшую электроотрица-
429
тельность и сродство к электрону, чем у других галогенов. Присоеди-
няя электрон, I превращается в анион 1~ с устойчивой конфигураци-
ей инертного газа ксенона. Однако 1~ легче теряет приобретенный
электрон, превращаясь в молекулу 12. Это характерная форма нахож-
дения I в биосфере.
В геохимии I обычно рассматривается вместе с Вг в связи с общно-
стью тех их химических свойств, которые определяют водную мигра-
цию. Однако в биосфере миграция I существенно отличается от дру-
гих галогенов и, в частности, от Вг. В этом отношении I ближе к
об этом говорят существование газообразной формы /2 и ее важная
роль в круговороте I, вхождение I в состав белков, аналогия Ют
с NO^, легкое восстановление Юз до 12 (аналогично денитрификации),
накопление растворимых минералов I в пустынях (аналогично нитра-
там). Различия I и N связаны с более низким кларком I и меньшей
электроотрицательностью: I ведет себя как менее металлоидный эле-
мент. Аналогия с Вг оказала влияние и на изученность геохимии I —
менее известна его воздушная миграция (для Вг она не столь харак-
терна).
Кларк I 4-10-5 %. Это типичный редкий и рассеянный элемент,
довольно равномерно распределенный в земной коре (в основных поро-
дах 5- 10~5 %, в кислых — 4-10-5 %).
При образовании некоторых гидротермальных рудных месторож-
дений I и Вг энергично мигрируют в верхние части залежи и за их пре-
делы, образуют широкие надрудные ореолы рассеяния. Подобные осо-
бенности I = Br-ореолов делают их эффективными индикаторами глу
бокозалегающих месторождений разных металлов. Вг и I оказались на-
иболее «проницающими» элементами, их ореолы обнаруживаются в по-
родах, малодоступных для большинства рудных элементов (Б. А. Су-
дов, М. А. Лапп и др.).
История I в биосфере тесно связана с живым веществом и биоген-
ной миграцией. Его кларк в живом веществе — 1,2- 10-5 %. Характер-
ны конентрации I морскими организмами — водорослями, губками и
др. Зола водоросли ламинарии содержит до 1 % I. У животных I кон-
центрируется в щитовидной железе, входит в состав ее гормона тиро-
ксина. При недостатке I в пище развивается тяжелое заболевание —
эндемический зоб.
В биосфере известны восемь очень редких минералов I; в целом для
него характерна неминеральная форма. Кларки концентрации I сви-
детельствуют о его биогенном накоплении в некоторых почвах и илах,
испарительной концентрации в соляных озерах и солончаках. Огром-
ным резервуаром I служит океан, воды которого содержат 5-10~6 % I
(преобладает Юз, подчиненное значение имеет I-). Из морской воды 1
поступает в илы, где вероятно, имеет место как сорбция I, так и накоп-
ление его за счет осаждения богатых иодом органических соединений
(остатки водорослей и др.). При уплотнении илов освобождается раст-
вор, содержащий относительно много I и Вг. Таково, по мнению мно-
гих исследователей, происхождение глубинных пластовых иод-бром-
430
ных вод артезианских бассейнов. По Б. А. Бедеру, отношение BrzI
имеет поисковое значение: в нефтяных водах оно не превышает 80, в
ненефтяных — больше. Получение I из подземных иодоносных вод
было впервые разработано в СССР в 1930 г. Эти воды — основной ис-
точник добычи I в нашей стране.
Главным источником I для ландшафтов служат моря и океаны, от-
куда ветры переносят I (в атмосферных осадках). Поэтому местности,
удаленные от океана или отгороженные от морских ветров горами,
обеднены I; в таких районах у населения встречается эндемический
зоб. Заболевание было широко распространено в горах Средней Азии,
на Кавказе, в Карпатах, но теперь оно почти ликвидировано благодаря
иодироганию поваренной соли.
В ноосфере сжигание угля, нефти, торфа доставляет в атмосферу
«захороненный» I. Следовательно, его миграция ускоряется. Ускоре-
нию миграции способствует повышение окислительного потенциала
почв при осушении болот. Количественная сторона описанных явле-
ний не изучена. Заслуживает внимания вопрос о влиянии I в при-
морских и внутриконтинентальных областях на физическое развитие
населения.
24. ЭЛЕМЕНТЫ HI ГРУППЫ
Данная группа включает все халькофилы, сидерофилы и часть ли-
тофилов. Это элементы середины периодической системы, со средними
значениями электроотрицательности, с менее резко выраженной ка-
тионогенностью и анионогенностью, чем во II группе. Для большин-
ства элементов характерны не простые, а комплексные ионы. Ионная
концепция, в том числе понятие об ионных радиусах, при анализе миг-
рации элементов III группы часто менее применима или вовсе неприме-
нима в связи с образованием ковалентных и других неионных связей.
В зависимости от щелочно-кислотных условий многие элементы обра-
зуют как катионы, так и анионы, и это определяет важную роль в их
концентрации щелочных Д и кислых Е барьеров. Часть элементов
поливалентна, с чем связано большое влияние на их миграцию окис-
лительно-восстановительных условий (А, В, С барьеры).
Растворимость соединений третьей группы, как правило, меньше,
чем второй. Характерна также коллоидная миграция, образование ор-
ганоминеральных соединений. Все это определяет сложность и боль-
шое разнообразие миграции элементов III группы.
6. Литофильные анионогенные элементы (Si, Р, В).Геохимия этих
элементов достаточно разнообразна, их сближает анноногенность и по-
стоянная валентность.
Кремний (Si). Это второй после О по распространенности элемент
земной коры с кларком 29,5 %. Связь Si и О исключительно прочная н
почти не нарушается. Геохимия Si — это в основном геохимия крем-
431
незема — SiO2. Свободный кремнезем в форме кварца и его разновид-
ностей составляет около 12 % земной коры, 75 %, ее слагают полевые
шпаты, слюды, амфиболы и другие силикаты и алюмосиликаты. Общее
число минералов Si 432 (третье место после О и Н). В минералах Si
входит в кислородные тетраэдры, образуя группу SiO47, в которой Si
может замещаться Al. С этим связано существование большой группы
алюмосиликатов и геохимическая близость Si и А1, впервые обосно-
ванная В. И. Вернадским в 1891 г. (ранее А1 рассматривался как ана-
лог других катионов).
При магматических процессах происходит незначительная диффе-
ренциация Si: он накапливается в кислых изверженных породах (гра-
нитоиды — 32,3%, ультраосновные породы — 19%). При высоких
температурах и давлениях растворимость SiO2 повышается, возможна
его миграция и с водяным паром. Поэтому для гидротермалитов харак-
терны кварцевые жилы, с которыми нередко связаны рудные элемен-
ты (золото-кварцевые, кварцево-касситеритовые и другие руды).
В биосфере участие Si в биологическом круговороте и водной мигра-
ции значительно уступает таким менее распространенным, но более
активным мигрантам, как Са, Na, S. В живом веществе в среднем 0,2 %
Si, организмы обеспечены им. Известны организмы, строящие скелет
из SiO2 — диатомовые водоросли, радиолярии, кремневые губки и
др. Это все низшие формы; в ходе эволюции кремниевый склет сменил-
ся известковым и фосфатно-кальциевым. В биосфере значительно бо-
лее контрастна дифференциация Si, чем в магматических, метаморфи-
ческих и гидротермальных системах. Так, в холодных морях, озерах
полярных стран накапливаются диатомовые и другие биогенные илы,
обогащенные Si, а в тропических морях преобладают известковые илы,
в которых содержание Si низкое (в карбонатных породах 2,45 %).
Сильно обеднены Si галолиты, гипсы, доломиты, угли и другие осадоч-
ные породы. Обогащены Si пески и песчаники (в среднем 36,8 %).
В биосфере Si — сравнительно слабый водный мигрант (7<х=0, п),
так как его минералы труднорастворимы. Наиболее энергичен этот
процесс в щелочной среде, менее — в сильнокислой и меньше всего—
в нейтральной и слабокислой.
В морской воде лишь 3 мг/л Si. Природные воды, как правило, не
насыщены кремнеземом; здесь он мигрирует в истинно растворенных
или коллоидных формах. Si выпадает из раствора (частично биоген-
ным путем) в форме геля кремнезема — опала, имеющего отрицатель-
ный заряд. Это определяет адсорбцию коллоидным кремнеземом кати-
онов многих металлов, а также положительно заряженных коллоидов.
Со временем опал теряет воду и переходит сначала в халцедон, а по-
том во вторичный кварц. Соединяясь с гидроксидами Fe и А1, кремне-
зем образует вторичные синтетические глинистые минералы (каолинит,
монтмориллонит, палыгорскит и др.). В результате осаждения кремне-
зема из подземных вод развивается окремнение известняков, песчани-
ков, растительных остатков и т.д.
432
В ландшафтах Si энергично мигрирует во влажных тропиках, тунд-
рах и тайге, слабее — в степях и пустынях.
В ноосфере Si — основной элемент строительных материалов. Он
входите состав бетона, силикатного кирпича, цемента и др. Менее зна-
чительно его использование в металлургии, керамической, оптической
и другой промышленности.
Фосфор (Р). В химии известны соединения Р разной валентности
(+ 3, +5), но в земной коре преобладает Р5+, главным образом соли
•ортофосфорной кислоты. Последние, как правило, труднорастворимы.
Это ограничивает водную миграцию?, которая даже в абсолютном вы-
ражении много меньше, чем у С1 и S, несмотря на то что кларк Р (9,3 у.
X 10-2) больше, чем у этих элементов.
В основных породах Р больше (1,4- КУ1), чем в кислых (7- 10 -)
и ультраосновных (1,7-10-2%). С магматизмом и биогенной миграцией
связаны его крупные скопления, образующие промышленные место-
рождения апатита и фосфоритов. Известно 185 минералов Р, в основ-
ном это различные фосфаты. Среди них наиболее распространены фос-
фаты Са.
Р — исключительно важный биоэлемент, он дефицитен для куль-
турных растений и домашних животных. Поэтому лишь небольшая
часть Р поступает в природные воды, где его содержание составляет
п-10-4 — п-1(У5 г/л (Л> 0, п — 0,0 п). В морской воде 7- 1 (У5 г/л
Р. Из вод Р легко осаждается и входит в состав труднорастворимых ми-
нералов или захватывается организмами. Этим Р похож на К. Наиболее
интенсивно Р мигрирует в сильнокислых водах, например в зоне окис-
ления сульфидных руд, где он служит осадителем металлов. На щелоч-
ном барьере Д1 осаждаются пироморфит РЬ10 (РО4)6 С12, отенит
Са (UO2)2(PO4)2 10 Н2О и другие фосфаты. В биосфере редки ланд-
шафты, хорошо обеспеченные Р. Они приурочены к участкам развития
фосфоритов и других пород, обогащенных Р, и отмечены пышной фло-
рой. Такие ландшафты, вероятно, играли важную роль в эволюции ор-
ганизмов, были центрами видообразования, быстрого развития нервной
системы животных.
Важную роль в истории Р играет биогенная миграция на далекие
расстояния. Так, на островах Тихого океана в результате миграции
птиц, откладывающих большие массы гуано с высоким содержанием
фосфора, образовались крупные месторождения Р. Аналогично гео-
химическое значение миграции рыб.
Р дефицитен в большинстве ландшафтов от тундры до влажных
тропиков. С дефицитом Р связаны низкая урожайность и продуктив-
ность животноводства. В ноосфере Р мигрирует в составе фосфорных
Удобрений на огромные расстояния. Важная роль Р в развитии нерв-
ной системы определяет ряд проблем медико-геохимического харак-
тера.
Бор (В). Это самый легкий элемент III группы периодической систе-
мы, который несмотря на валентность +3 не проявляет металличе-
433
ских свойств и более похож на С, чем на А! (В — единственный кислот-
ный элемент и единственный неметалл в III группе).
Катион В3+ имеет очень малый радиус (0,02 нм) и в свободном виде
неизвестен — во всех соединениях В образует ковалентные связи. Бла-
годаря высокому сродству к кислороду в земной коре преобладают
кислородные соединения В, производные различных борных кислот.
По способности к полимеризации, образованию изополикислот В так-
же близок к С.
Хорошо растворимы в воде только некоторые бораты щелочных ме-
таллов, остальные труднорастворимы. В качестве осадителей важную
роль играют Са и Mg. Растворимость боратов растет с повышением тем-
пературы, и водная миграция В интенсивнее в гидротермах, чем в био-
сфере.
Бораты во многом напоминают силикаты, так как состоят из слож-
ных полимеризованных анионов. Основными структурными единица-
ми являются треугольники ВО3 и тетраэдры ВО4, которые могут объ-
единяться друг с другом через общие атомы О и образовывать цепи,
слои и каркасы. Для боратов характерны водородные связи, наличие в
структуре молекул Н2О, групп ОН~.
В космосе В — дефицитный элемент, так как он служит «ядерным
горючим». Поэтому несмотря на малый порядковый номер его космиче-
ская распространенность намного меньше, чем Н, Не, С (в каменных
метеоритах 5-10-4% В). Дефицит бора в космосе определил дефицит его
и в земной коре, относительно низкий кларк — 1,2-10~3 %. В земной
коре В накапливается преимущественно в гранитоидах и пегматитах.
Благодаря летучести соединений В принимает важное участие и
в вулканизме, в ходе которого его соединения выделяются в ат-
мосферу, накапливаются в термальных источниках, поступают в плас-
товые воды. Промышленные эндогенные месторождения В связаны
с постмагматическими процессами — скарнами, где накапливаются
боросиликаты — датолит (CaBSiO4OH) н борат людвигит — [(Mg, Fe)
Fe (ВО3) О2].
В — важный биоэлемент, его кларк в живом веществе — 1 • 10~3 %.
Это элемент биологического накопления (Ах п). Известны болезни
растений, связанные с дефицитом и избытком В. У животных избыток
В вызывает заболевания.
Главный концентратор В — океан, его кларк в морской воде
4,6-ICC4 %, талассофильность высокая — 0,4. Из морской воды В по-
глощается глинистыми илами.
Гумидные ландшафты, как правило, бедны В, здесь часто необхо-
димы борные микроудобрения. В грунтовых, речных и озерных водах
степей и пустынь содержание В повышено, он накапливается при ис-
парении (местами до 3—4-10-2 г/л), мигрирует главным образом в ви-
де анионов полиборных кислот, которые образуют труднорастворимые
кальциевые и магниевые соли. Поэтому наиболее благоприятные усло-
вия для миграции В в содовых водах, бедных Са и Mg.
434
В сухих степях и пустынях известны ландшафты, богатые В.
Это районы соленосных толщ, современного и древнего вулканизма.
Почвы здесь обогащены В, его много в соляных озерах и солончаках
(«боратные солончаки» Калифорнии, Тибета и других пустынь).
Так образуются экзогенные месторождения В. Они формировались и в
прошлые геологические периоды. Важнейшие минералы В в осадочных
галогенных толщах — бура (Na2B4O7-ЮН2О), ашарит (MgHBO3)
и др. В ходе геологической истории происходили прогрессивная диф-
ференциация и концентрация В в биосфере: все большие его количест-
ва накапливались в осадочной оболочке в виде месторождений и в
форме рассеянного В в глинах (А. А. Озол).
Технофильность В значительна — 6-10’, немного больше, чем у
Ni, Fe, Мп, и ниже, чем у Zn, Pb, Са, Hg, Sb, Мо. В отличие от земной
коры для ноосферы характерны не только кислородные соединения В,
но и бороводороды (бораны), фториды В и другие соединения, чуждые
биосфере и неустойчивые в ней. При этом главную ценность представ-
ляют именно неустойчивость, большие запасы химической энергии та-
ких соединений.
7. Литофильные элементы с постоянной валентностью, образующие
катионы и анионы—Al, Zr, Hf, Y, TR, Sc, Th, Be. Постоянная
валентность (за исключением четырех элементов редких земель) оп-
ределяет независимость, вернее лишь косвенную зависимость мигра-
ции этих элементов от окислительно-восстановительных условий.
В сильнокислых растворах онн ведут себя как катионы, а в сильноще:
лочных образуют анионные комплексы. В целом интенсивность вод-
ной миграции данных элементов низкая (Ах - 0, п — 0,On), минералы,
как правило, труднорастворимы. Участие их в биологическом круго-
вороте также невелико, для ряда элементов оно почти не изучено.
Алюминий (А1). Это самый распространенный металл в земной ко-
ре, его кларк 8,05 (в ультраосновных породах — 0,45%, в каменных
метеоритах — 1,30 %). Известно 328 минералов алюминия.
При кристаллизации магмы А1 аналог Si и входит в кристалличе-
скую решетку полевых шпатов, слюд и других алюмосиликатов. Гид-
ротермальные процессы не играют большой роли в геохимии алюминия.
В биосфере А1 мигрирует слабо, его мало в организмах (кларк —
— 5-10_3 %), поверхностных н подземных водах (Кх = 0,0п). В гу-
мидных ландшафтах А1 входит в состав органо-минеральных коллои-
дов почв, А13+ сорбируется глинами и гумусом. Под защитой органи-
ческих коллоидов А1 мигрирует н в болотных водах. Связь с Si здесь
частично нарушается — образуются гидроксиды А1, минералы — бе-
мит, гидраргиллит и др. Все же большая часть А1 входит в состав ка-
олинита и других глинистых минералов.
Слабая подвижность А1 определяет остаточное накопление его гид-
роксидов в коре выветривания влажных тропиков (за счет выноса бо-
лее подвижных элементов). Так образуются главные руды А1 — элю-
виальные и переотложенные бокситы. В прошлые эпохи бокситы на-
капливались также в озерах и морях тропиков (осадочные бокситы).
435
В нейтральных и слабощелочных водах степей и пустынь А1 поч-
ти не мигрирует. Наиболее энергична миграция А1 в сильнокислых во-
дах вулканических районов и зон окисления сульфидов (А13+). В силь-
нощелочных термальных и холодных содовых водах А1 интенсивно
мигрирует в анионной форме (AlOf и др.). С этими процессами связа-
но образование давсонита [Na А1(СО3) (ОН)2| и других минералов А1,
местами образующих крупные залежи.
В ноосфере А! играет исключительно важную роль не только бла-
годаря высокому кларку, но из-за ценных свойств. Технофильность его
все же пока невелика — п-106 — почти в 100 раз меньше, чем у Fe.
Кроме главных руд А1 — бокситов, имеют значение также нефе-
линовых сиенитов, давсонитовые озерные руды, алуниты, перспек-
тивны каолиновые глины, кианитовые сланцы.
Цирконий (Zr). Кларк Zr— 1,7-10-2 %, он накапливается в кис-
лых (2-10“2 %) и особенно в щелочных (6,8-10~2 %) породах. В ос-
новных породах Zr в 2 раза меньше (1 • 10-2 %), особенно мало в ульт-
раосновных (3-10~3 %). Zr слабо участвует в большинстве магматиче-
ских, гидротермальных и гипергенных процессов, слабо поглощается
организмами. Только в щелочных растворах и расплавах его мигра-
ционная способность повышается. С этими процессами связана и его
концентрация. Известно 19 минералов Zr, главный из них — циркон
(ZrSiO4), накапливается в пегматитах, россыпях. В морской воде
лишь 5- 1(Г9 % Zr, что дает исключительно низкую талассофильность—
3-10-7. Рассеяние в земной коре, трудности получения металла дела-
ли Zr долгое время «редким элементом», хотя его в земной коре бол ь-
ше Си, Zn, Sn и др. В эпоху НТР Zr приобрел важное значение, его
технофильность 6- 10е (больше, чем К, А1).
Гафний (Hf). Это химический и геохимический аналог Zr, радиусы
их ионов одинаковы. Собственных минералов Hf не имеет, образует
примесь в минералах Zr. Кларк Hf в земной коре — 1-Ю-4 %. От-
ношение Hf/Zr используется для геохимической характеристики маг-
матических и гидротермальных процессов. Технофильность Hf пока
небольшая — 5-105 (но больше Sr, Rb, TR).
Редкие земли — лантаноиды (TR) и иттрий (У). Химически и гео-
химически это очень близкие элементы, для которых все же уда-
лось установить ряд свойств, определяющих их разделение в земной
коре. Основное значение имеют закономерности, обусловленные раз-
личиями Ri. Обычно выделяют цериевую (La — Gd) и иттриевую
(ТЬ — Lu) подгруппы. Д. А. Минеев выделил три геохимические под-
группы: лантановую (La — Nd), иттриевую (Sm — Но) и скандиевую
(Ег — Lu). Ионные радиусы TR монотонно уменьшаются от La к Lu
(«лантаноидное сжатие»), поэтому TRy3 более тесно связаны с Sc+\
Mn2+, Zr4+, a TR£e — cSr2+, Ва2+, Th4+; Са2+ близок обеим группам.
На основе близости ионных радиусов характерен изоморфизм TRy с
U4+, a TRc.ecTh4+. TR и Y обладают высокой фторофильностью, об-
разуют различные комплексы с F“, (СО3)2-, РО4~, SO2~, органиче-
скими соединениями (более устойчивыми у TRy).
436
В щелочной среде Се3+ переходит в Се4+, в кислой Yb3', Snr4,
Eu3+ в двухвалентное состояние. Все эти особенности TR и Y опре-
деляют их миграцию, распределение и концентрацию. Известно свыше
300 минералов, содержащих TR и Y, из которых более 50 собственных.
Кларк суммы TR в земной коре, по Ю. А. Балашову, 1,12- 10“2 %,
причем по правилу Оддо-Гаркинса у четных TR он больше, чем у не-
четных. При магматических процессах TR и Y накапливаются в кис-
лых и особенно щелочных породах, а также в гранитных пегматитах,
карбонатитах. В основных и ультраосновных породах TR мало.
В биосфере TR малоподвижны, с чем связано их накопление в рос-
сыпях. Содержание TR в природных водах и организмах низкое, в
морской воде 3-10-8%Еа (талассофильность 1-Ю-5). Водная и
биогенная миграция TR изучены слабо. Установлено их накопление
в корах выветривания щелочных пород, в осадочных фосфоритах, в ис-
копаемых костях. С образованием металлоорганических комплексов
связано накопление TR в каустобиолитах и черных сланцах.
Технофильность TR пока около 2-106; они нашли применение в но-
вой технике; добывают TR как из эндогенных, так и экзогенных руд.
Скандий (Sc). Это типичный рассеянный элемент с очень слабой
способностью к концентрации. Кларк Sc 1 -10~3 %, в основных поро-
дах он более распространен (2,4-10-3), чем в кислых (3- 10-4). Извест-
но три собственных минерала Sc, все они редкие. Большая часть ато-
мов Sc находится в виде изоморфных примесей или адсорбирована.
В магматических процессах геохимия Sc во многом определяется бли-
зостью радиусов Sc3+ и TRy+, частично Zr4+, Fe2+ и Mg2+. Sc слабо
концентрируется в пегматитах, высокотемпературных гидротермах.
Биогенная и водная миграция Sc изучены плохо, в морской воде
4-10-9 % Sc, талассофильность Sc низкая —- 4-Ю-6' (но больше, чем
у Fe, Si). Характерны комплексы Sc с СОз~ (миграция в содовых во-
дах), слабое накопление в фосфоритах, бокситах, каменных углях.
Технофильность Sc пока низкая.
Торий (Th). Кларк Th 1,3- 10-3 %. Это характерный элемент гра-
нитной и осадочной оболочек земной коры, в которых его кларки близ-
ки (1,8-10“3 и 1,3-10"3 %). Меньше Th в основных породах (3- 10~4)
и еще меньше в ультраосновных (5- 10-7 %). Th — сравнительно сла-
бый мигрант, в основном он участвует в магматических и высокотем-
пературных гидротермальных процессах, накапливаясь в гранитои-
дах, щелочных породах, пегматитах, некоторых гидротермальных ру-
дах (вместе с U4+). Способность к концентрации у Th слабая, извест-
но лишь 12 его минералов, важнейшие из них торианит ThO., и торит
ThSiO4. Характерны изоморфные примеси Th4+ в уранините, цирконе,
апатите, ортите, монаците и других магматических минералах. Th -
слабый мигрант в биосфере, его мало в живом веществе и водах, в
морской воде— 1-Ю-9 % (талассофильность 1-10~6).
Важная геохимическая роль Th в земной коре связана с его радио-
активностью (выделение тепла, образование различных продуктов
радиоактивного распада, вплоть до «ториевого свинца» и гелия).
437
В ноосфере Th используется слабо, но после освоения руд Th в ка-
честве ядерного горючего его добыча, вероятно, сильно повысится.
Источник Th—монацитовые россыпи, известны и высокотемператур-
ные гидротермальные месторождения Th.
Бериллий (Be). Как и другие первые члены групп периодической
системы (Li, В), Be по химическим свойствам сильно отличается от Mg,
Са и других элементов своей группы, имеет ряд общих черт с элемен-
том III группы — А1 («правило диагонали»). Это связано с особенно-
стями строения атома — отсутствием у иона Ве2+ 8 электронной «нео-
новой» оболочки, которым определяется малый размер атома и иона
(RiBe2+ — 0,034 нм), исключающий изоморфизм Be с Mg и Са. Be об-
ладает более слабыми щелочными свойствами, чем Са и Mg, занимает в
этом отношении промежуточное положение между Mg и Al. В сильно-
кислых водах Be катионогенен, а в сильнощелочных ведет себя как
анионогенный элемент. Для Be характерны летучие и растворимые
комплексы с F_, (СО3)2-. Be — дефицитный элемент космоса — вместе
с Li и В он служит «ядерным горючим» в звездах. Известно 55 эндо-
генных и экзогенных минералов Be.
Кларк Be 3,8- 10"4 %. Он преимущественно связан с гранит-
ной и щелочной магмой, концентрируется в пегматитах и высокотем-
пературных гидротермалитах. В биосфере Be мигрирует слабо, кларк
его в живом веществе 4- Ю-” %, Кх 0, п — 0,0п. Талассофильность Be
1,5-10~7 — меньше, чем у Fe, TR. Основная часть Be, поступившая
в моря со стоком, поглощается илами. Установлена его концентрация
в некоторых углях, слабое накопление в глинах.
В ноосфере минералы Be использовались еще в древности (изумру-
ды, аквамарин), но металлический Be нашел применение только в
1950 г. Это характерный'метал-л атомной и другой новой техники. По-
ка технофильность Be мала.
В районе месторождений Be встречаются почвы с повышенным его
содержанием, травоядные животные болеют «бериллиевым рахитом».
Соли Be ядовиты для человека, при его производстве необходима
профилактика «бериллиоза».
8. Литофильные и сидерофильные элементы с переменной валент-
ностью, образующие катионы и анионы — Ti, V, Nb и Та, U, W, Мо,
Re. Переменная валентность, катионогенность и анионогенность оп-
ределяют важную роль в геохимии данных элементов как окислитель-
но-восстановительных, так и щелочно-кислотных условий, увеличива-
ют разнообразие миграции, число барьеров, на которых они концентри-
руются.
Титан (Ti). Элемент широко распространен в земной коре (кларк—
— 0,45 %), его больше в основных породах (0,9 %), чем к кислых
(0,23 %). Гипербазиты бедны Ti — 0,03 %. Основную роль в концент-
рации Ti играет магматизм — он накапливается в пегматитах основных
пород, щелочных породах (сиенитах) и связанных с ними пегматитах.
Известно 67 минералов Ti, в основном магматических. Важнейшие из
них — рутил TiO2 и ильменит FeTiO3. Титан входит в состав многих
438
силикатов, где он изоморфно замещает Si (Ti4+), AI и Fe(Ti‘+).
В биосфереТ} в основном рассеян. Он слабо участвует в биогенной
и водной миграции. Кларк Ti в живом веществе — 1,3 х 10*'1 %, изве-
стны растения-концентраторы Ti. В морской воде 1-10~7 % Ti, что
дает низкую талассофильность — 2,2-10~7. Титан накапливается в
россыпях, некоторых бокситах и глинах. Промышленные месторож-
дения Ti относятся к магматическому и осадочному (россыпи) типам.
В эпоху НТР Ti получил важное применение в промышленности,
но пока его технофильность невелика — 2-106 (близка к Mg и А1).
/Ванадий (V). В земной коре известны V3+, V4+ и V5+. V3+ мало
подвижен, аналогичен Fe3+, его Ri близок также к Ti4+. V5+ анало-
гичен Р, причем ванадаты растворимее фосфатов.
Кларк V 9-10~3 %, примерно в таких количествах он содержится
в изверженных и осадочных породах, несколько большё V в основных
породах — 2-10-2. Для изверженных пород характерен V3+, который
изоморфно замещает Fe и Ti в их минералах (особенно в титаномагне-
титах). Гидротермальные процессы не играют существенной роли в ге-
охимии V.
В живом веществе ванадия 6-10~5 %. Некоторые грибы, морские
животные асцидии и другие организмы концентрируют V. Соедине-
ния V ядовиты для большинства животных и человека.
В биосфере известны V3+, V4+ и V5+, их геохимия различна. Кис-
лородные воды гумидных ландшафтов содержат п-10-6 — п- 10~7 г л
V, что отвечает КхО, п — 0,On (на месторождениях известны воды, со-
держащие п-10~4 — п-10-5 г/л V). В целом V здесь малоподвижен,
возможна его сорбция лимонитами, которые наряду с фосфором часто
содержат примесь V. Это определяет некоторую концентрацию V в
озерных и болотных железных рудах, в железных шляпах сульфидных
месторождений. На восстановительных барьерах происходит осажде-
ние соединений V3+ (в некоторых торфах, битумах, нефтях, углях).
В щелочной окислительной среде степей и пустынь возможно оки-
сление V3+ и V4+ до соединений V5+, образующего VO3~ и другие ани-
оны. В степях и пустынях известны желтые и зеленые ванадаты К,
Са, U, Си и других металлов.
В морской воде 3-10-7 % V, что отвечает талассофильности
3-10~5. Известны осадочные породы, обогащенные V. Черные ванадие-
носные сланцы особенно характерны для конца докембрия и PZP
V широко используется в ноосфере, преимущественно в металлургии,
технофильность его — 2-106 (как у Ti, Al).
Ниобий (Nb) и тантал (Та). Размеры ионов Nb5+ и Та+5 одина-
ковы (0,066 нм), что во многом определяет близость их магматической
миграции, образование тантало-ниобатов. По А. И. Гинзбургу, по-
родообразующим аналогом обоих элементов служит Ti. В биосфере,
где роль их ионной миграции невелика, геохимия Nb и Та более кон-
трастна.
Кларк Nb в земной коре — 2-10~3 %, он довольно равномерно
распределен в изверженных породах (гранитоиды и основные породы
439
содержат кларковые концентрации Nb). Только в нефелиновых сиени-
тах и других щелочных изверженных породах содержание Nb повыша-
ется до п-10~-2 — п-10-1 %. В этих породах и связанных с ними пег-
матитах, карбонатитах, а также в гранитных пегматитах обнару-
жено 23 минерала Nb и около 130 минералов других элементов,
содержащих повышенные количества Nb. Это в основном сложные
и простые оксиды. В минералах характерна связь Nb сТа, Ti, TR,
Y, Са, Na, U, Th, Fe, Ba (тантало-ниобаты, титанаты и др.). Промыш-
ленное значение имеют только 6 минералов, главные из них — пиро-
хлор и колумбит.
Геохимия Nb в биосфере изучена слабо, установлена только его
миграция в районах щелочных пород, где Nb в ландшафтах влажного
климата мигрирует с органическими и другими комплексами. Извест-
ны минералы Nb, образующиеся при выветривании щелочных пород
(мурманит, герасимовскит и др.). В морской воде около 1-10~8 % Nb,
что свидетельствует о его низкой талассофильности и тенденции к осаж-
дению. Месторождения Nb связаны с массивами щелочных пород и
карбонатитами, их корами выветривания, а также с гранитными пег-
матитами. Важны и россыпи тантало-ниобатов. Технофильность Nb
6- 10е.
Кларк Та 2,5-10~4 %, в ультраосновных породах — 1,8-10~6 %.
В большинстве магматических пород и биосфере Та рассеян, его со-
держание в гидросфере и организмах не установлено. Известно 17
минералов Та, все они связаны с магматизмом. Руды Та (вместе с Nb)
известны в пегматитах, гранитах и щелочных породах, в карбонати-
тах, в некоторых гидротермальных жилах, а также в россыпях, кото-
рые имеют наибольшее практическое значение. Технофильность Та —
2-10е.
Уран (67). Это редкий, но не рассеянный элемент. Известны свыше
100 его минералов, многочисленные и разнообразные эндогенные и эк-
зогенные месторождения (см. ч. VII). Основное значение в геохимии U
играет физико-химическая миграция, он активный мигрант и в гидро-
термах и в зоне гипергенеза, концентрируется на барьерах многих
классов (В, С, D, Е, F, G и Н). В магматических системах U4+ — ана-
лог Th4+, Zr, TR и других малоподвижных элементов. В гидротермах
характерны связи U с Мо, Ti частично с халькофилами — Си, РЬ и др.
В биосфере миграция Ue+ в форме ПОг+ и его комплексов особен-
но разнообразна, она характерна и для кислых и для щелочных усло-
вий. Спутники U здесь — V, Se, Мо, Re, Р, TR, Са, К, Cu, Si, S,
частично Au, As, F.
Как и другие элементы конца периодической системы (Hg, Т1, РЬ
и т.д.), U ядовит, его содержание в живом веществе 8-10-7 %. Поэто-
му биогенная миграция в целом не играет существенной роли в геохи-
мии U, однако некоторые водоросли способны концентрировать U, с
чем связывают образование ураноносных глин и сланцев. В водах би-
осферы обычно содержится п-10-7 — п-10"5 г/л U, коэффициент его
водной миграции в коре выветривания, реках и других окислительных
440
обстановках п, реже •— 0, п. Здесь по интенсивности миграции U бли-
зок к Са, Na, Mg, F, Sr, Zn, Mo, Se, Au. В бескислородной среде, при
наличии органических веществ, H2S происходит восстановление U6+
до U4+, который аналогичен Th, Zr и другим инертным элементам. Это
позволило сформулировать основной закон миграции U в водах био-
сферы: U интенсивно мигрирует в окислительной среде, как Са, Mg
и другие двухвалентные металлы (Лл = п), и очень слабо в резко вос-
становительной, как Th, Zr и другие инертные элементы (Л/х = 0,0 п).
U отличается высокой контрастностью миграции и осаждается на вос-
становительных геохимических барьерах В и С.
В гумидных ландшафтах U выщелачивается из почв и коры вывет-
ривания, частично закрепляется в торфяниках и аллювиальных гли-
нах (U4+). Содержание U в водах низкое—п-10-7 — 2-10-6 г/л.
В степях и пустынях U, как и кальций, почти не выносится из почв и
коры выветривания, но кислородные грунтовые и подземные воды вы-
щелачивают его из горных пород, содержание U в водах достигает
п-10-5 — п-10-6 г/л. Возможна испарительная концентрация до
п-10-4 г/л.
На рудных полях урановых месторождений почвы, воды, конти-
нентальные отложения и отчасти организмы обогащены этим металлом.
В сухих степях и пустынях образуется много ярких желтых и зеленых
минералов уранила. Ядовитость U, высокая радиоактивность таких
ландшафтов, вероятно, сильно влияют на эволюционный процесс (от-
бор на химической и радиационной основе? Центры видообразова-
ния?). Данный вопрос заслуживает специальнх исследований биоло-
гов и биогеохимиков. Для поисков месторождений U используют все
геохимические методы.
В морской воде 3-10-7 % U, талассофильность его значительна
2-10~3 — близка к F и больше, чем у Cu, Zn, Pb. В ходе геологической
истории содержание в земной коре U уменьшилось за счет радиоактив-
ного распада. С этим процессом связано накопление в земной коре час-
ти атомов РЬ, Не, образование Ra. Радиоактивный распад U играет
важную роль в энергетике земной коры.
Использование U в качестве атомного сырья определило его боль-
шое значение в ноосфере, быстрый рост добычи за последние полвека
(технофильность довольно высокая — 1,2-10®, близка к Со, Р, Сг,
As, Se).
Молибден (Мо). Главные валентности Мо — +4, +6. Сое-
динения Мо6+ — производные молибденовой кислоты Н2МоО4 —
заметно растворимы, особенно в щелочной среде. В кислой среде ми-
грационная способность Мо может резко снижаться. Соединения Мо4+
плохо растворимы. Важнейшим осадителем Мо из растворов служит H2S
и его производные, главный промышленный минерал Мо — MoS2
(молибденит).
Кларк Мо 1,1-10-4 %, его содержание в породах земной коры до-
вольно постоянно, некоторое повышение наблюдается только в кислых
изверженных породах и особенно в осадочных породах, богатых ор-
441
ганическим веществом (угли, углистые глины и сланцы местами содер-
жат п-10-2%). В ультраосновных породах Мо мало — 2-10-5%.
В магматических процессах геохимия Мо во многом определяется
размерами иона Мо4+. По В. И. Рехарскому, характерна связь Мо и
W — оба элемента концентрируются в сфене, ильмените, магнетите,
частично со Sn и U. Как и W, Мо — характерный элемент гранитои-
дов.
Для гидротерм характерны различные комплексы Мо, главным об-
разом фтористые. Осаждается Мо в форме MoS2. Так образуются место-
рождения Мо, в которых он ассоциируется с W, U, Си, Pb, Zn. Для
молибденита характерна примесь Re.
В биосфере Мо также энергично мигрирует и концентрируется, его
геохимия здесь тесно связана с живым веществом и продуктами его
распада. Среднее содержание Мо в организмах 2-10-9 %, он важный
биоэлемент, известны явления дефицита (особенно у бобовых расте-
ний) и избытка Мо.
В кислородных водах биосферы содержится п-10-6 — п-10-7 г/л
Мо, что отвечает коэффициенту водной миграции 0,п — п (п не более 5).
Мо — сравнительно слабый водный мигрант, что подтверждается посто-
янством его содержания в большинстве почв (2-10-4 %), равномерным
распределением по их профилю. В гумидных ландшафтах со слабокис-
лыми водами Мо малоподвижен, так как легко адсорбируется гидро-
ксидами Fe и AI, фиксируется фосфатами, коллоидами. Воды подобных
ландшафтов обычно содержат не более 2-10-6 г/л Мо, часто n-10-7
г/л. В щелочных водах степей и пустынь Мо более подвижен. Здесь
происходит испарительная концентрация Мо, воды содержат n-10-6—
—1-10-5 г/л Мо, в солоноватых водах до n-10"3 г/л.
В гумидных ландшафтах с кислыми почвами известен дефицит Мо,
здесь применяют микроудобрения Мо. На участках месторождений Мо,
в районах осадочных пород, обогащенных Мо, известна его избыточ-
ность в кормах и болезни домашних животных. Высокое содержание
Мо в водах некоторых месторождений молибдена вызывает распрост-
ранение подагры у населения.
В речных водах Мо мало — n-10-7 — п-10-8 г/л; поступая со сто-
ком в океан, он слабо накапливается в морской воде (1-10"6 %), час-
тично уходит в илы (в глинах и сланцах в среднем 2-10-4). В илах с
сероводородным заражением местами происходит значительное на-
копление Мо. Эпохи накопления Мо в черных морских илах (вмес-
те с U, V, Си и другими элементами) повторялись неоднократно, осо-
бенно продуктивным был венд и нижний PZ. Характерные спутники
Мо в биосфере — U, V, Se, Re, частично W.
В ноосфере Мо стал широко использоваться в XX столетии, техно-
фильность его высокая — 6-108.
Рений (Re). Это один из наиболее редких и рассеянных элементов
земной коры с ориентировочным кларком 7-10-8 %.
Re был открыт сравнительно поздно — в 1925 г., но предсказан на
основе матричного принципа Д. И. Менделеева еще в 1871 г. По физи-
442
ко-химическим свойствам Re наиболее близок к Мо, менее — к W,
Pt и платиноидам, Си, U, Со, Ni. В земной коре Re имеет валентности
4-4 и +7, что определяет важную роль окислительно-восстановитель-
ных реакций в геохимии этого металла. Соединения Re4+ труднораст-
воримы, а некоторые перренаты — соли рениевой кислоты HReO4/
X(Re7+) — хорошо. В геохимическом отношении Re наиболее близок
к Мо. Это во многом связано с близостью радиусов ионовМо4+ и Re4+.
Как и Мо, Re энергично мигрирует в окислительных условиях и осаж-
дается на восстановительном барьере В, входя изоморфно в моли-
бденит и реже в другие сульфиды.
В магматических процессах Re в основном рассеивается, его кон-
центрации при высоких температурах связаны с гидротермами. Осо-
бенно характерно накопление Re в медно-молибденовых месторожде-
ниях (в молибденитах). Накапливается Re и в месторождениях типа
медистых песчаников, а на месторождении Джезказган был обнаружен
единственный его минерал джезказганит Си (Re, Мо) S4.
В биосфере геохимия Re более разнообразна. Он активно участ-
вует как в биогенной, так и физико-химической миграции. В золе мор-
ских водорослей определено 7,2-10_6 % Re, в золе морских раков и
рыб п-10~7 %, что дает высокий коэффициент биологического погло-
щения — п — 10 л. В районах гидрогенных урановых месторождений
США зола астрагалов обогащена Re.
Водная миграция Re в биосфере контрастна и аналогична Мо, U,
Se — он энергично мигрирует в кислородных водах (вероятный Кх=п)
и плохо в глеевых и сероводородных водах, осаждается, как и назван-
ные элементы, на В и С барьерах. Известен парагенезис U, Мо, Se,
V, Re в гидрогенных месторождениях (плато Колорадо в США и др ).
Установлены также следы Re в шахтных водах. Океаническая вода
содержит 4-10~10 %. Re (ReO?), следовательно, у него высокая талас-
софильность — около 0,6 (больше, чем у Na, Mg, I, U, Mo, F).
Характерна связь Re с органическим веществом — его содержание
повышено в углеродистых и горючих сланцах, бурых углях, битумах,
нефтях. Летучесть соединений определяет возможность воздушной
миграции Re при вулканизме (бурые угли вулканических районов на-
ш ;лее обогащены Re).
Re — металл новой техники, его добыча в капиталистических стра-
нах в 1975 г. составляла 6 т, что дает очень высокую технофильность—
8- 10е (выше большинства металлов).
9. Металлы группы железа — Fe, Мп, Сг, Ni, Со. По особенностям
строения атомов, положению на кривой атомных объемов, распределе-
нию и миграции в земной коре эти металлы тесно связаны с наиболее
распространенным элементом группы — Fe. Разновалентность оп-
ределяет важную роль окислительно-восстановительных условий в их
геохимии (особенно у Fe и Мп), важны и щелочно-кислотные условия.
В основном это сидерофилы, но Fe, Мп, Ni и Со проявляют и халько-
фильные свойства, а Сг и Мп — литофильные.
443
Железо (Fe). По кларку (4,65) Fe занимает второе (после AI) место
среди металлов и четвертое среди элементов земной коры. Велика роль
в его геохимии окислительно-восстановительной реакции: Fe2+ 5=±
Fe3+. Катион Fe2+ по свойствам близок к другим двухвалентным ка-
тионам своей группы — Мп2+, Сг2+, Ni2+ и Со2+, а также к Mg2+.
Миграционная способность Fe2+ высокая в кислых водах и низкая в
щелочных. Fe3+ подвижно преимущественно в сильнокислых средах
(аналогично А13+, Сг3+). В целом Fe энергично мигрирует в земной ко-
ре, играет большую роль в магматических, гидротермальных и гипер-
генных процессах, с которыми связаны его многочисленные концентра-
ции, в том числе и промышленные месторождения. Fe образует свыше
300 собственных минералов — оксидов, сульфидов, силикатов, карбо-
натов, фосфатов, титанатов и др. Fe — металл земных глубин, оно, ве-
роятно, господствует в земном ядре (~ 90%), его больше в мантии
(ультраосновные породы — 9,85 %), чем в земной коре. В последней
Fe накапливается в базальтовом слое (основные породы — 8,56 %,
кислые — 2,7 %).
В ультраосновных породах характерна парагенная ассоциация
Fe, Ni, Со, в основных — Fe, Ti, V. Железо-Сведущий металл многих
гидротермальных систем (пирит и другие сульфиды Fe). В них харак-
терны парагенные ассоциации Fe с Cu, Pb, Zn и другими халькофи-
лами.
Железо — важный биоэлемент, его кларк в живом веществе -
1 • 10-2 %. Однако в связи с высоким кларком Fe, как правило, не на-
капливается в растениях и животных, не аккумулируется в почвах би-
огенным путем. Исключение составляют «железобактерии», окисляю-
щие Fe2+ и накапливающие гидроксиды Fe3+. Большинство кислород-
ных вод континентов содержит п-10-4 — п-10-3 г/л. Fe, что отвечает
низкому коэффициенту водной миграции — 0,0 п. В глеевой среде ус-
тойчиво Fe2+, которое энергично мигрирует в кислых и нейтральных во-
дах (Fe (НСО3)2, органические комплексы и другие формы). Такие
условия характерны для болот влажного климата, многих подземных
вод артезианских бассейнов, где в породах развивается оглеение. Этим
путем переносятся огромные массы Fe, содержание его в болотных во-
дах повышается до п-10~3 г/л, им обогащаются организмы (например,
мхи).
При встрече глеевых вод с кислородом воздуха Fe2+ легко окисля-
ется и на барьере А6 образуются концентрации гидроксидов Fe3+.
Так образуются некоторые руды Fe. В степях и пустынях в условиях
щелочной среды Fe мигрирует слабо, его содержание в водах и орга-
низмах низкое.
Энергично мигрирует Fe2+ в зоне окисления сульфидных руд и пи-
ритоносных осадочных пород, где за счет окисления пирита формиру-
ются сернокислые растворы.
Геохимия Fe в осадочном процессе детально изучена Н. М. Страхо-
вым и другими учеными. Здесь возникает ассоциация Fe, Al, Мп, Р.
444
реже V. Речной сток поставляет в моря Fe в основном во взвешенной
форме.
В морской воде лишь 1-Ю-6 % Fe, талассофильность его ниже
большинства элементов.
Велика роль Fe в биосфере как хромофора, так как распространен-
ной формой соединений Fe3+ являются гидроксиды красной, бурой, ма-
линовой, оранжевой и другой окраски (в зависимости от кристалличе-
ской структуры, содержания воды и других причин). Именно с этим
связана красная окраска коры выветривания тропиков, красно-бурые
тона покровных и валунных суглинков, окраска красноцветов. Вынос
железа дает себя знать в светло-серых тонах северных полей, белесых
(оглеенных) песках многих осадочных толщ.
Роль Fe в истории цивилизации исключительна (XIX в. —«желез-
ный век»), причем в ноосфере, как и в земном ядре, преобладает метал-
лическое Fe. На его получение затрачивается огромная энергия, огром-
ных усилий стоит и его сохранение. Однако технофильность Fe
(1 • 108) меньше, чем у многих металлов. Это объясняется не малым
значением Fe в ноосфере, а его высоким кларком.
Переводя Fe из земных глубин на поверхность, человечество спо-
собствует «ожелезнению» ландшафтов (М. А. Глазовская).
Марганец (Мп). В земной коре известны соединения Мп2+, Мп3+
Мп4+. Это определяет сложность миграции Мп, ее зависимость от оки-
слительно-восстановительных условий. Мп2+ — типичный металл, ана-
логичный Fe2+, он образует многочисленные соединения. В кислой
среде окислительный потенциал реакции Мп2+->Мп4+ выше, чем у
Fe2+->Fe3+; pH выпадения Мп (ОН)2 также выше, чем Fe (ОН)2.
Поэтому возможности водной миграции Мп2+ шире, чем Fe2+: марга-
нец может находиться в растворе в форме Мп2+ и мигрировать в таких
водах, в которых Fe выпало в осадок в виде соединений Fe2+ или Fe3+.
В биосфере Мп — более энергичный мигрант, чем Fe, пути этих эле-
ментов часто расходятся. Многие системы, в которых Fe малоподвиж-
но, отмечены интенсивной миграцией марганца. Мп3+ и Мп4+ мало-
подвижны.
Кларк Мп в земной коре 0,1 %, в изверженных породах вместе с
Fe2+ он рассеян. Основные породы богаче Мп (0,2), чем кислые (0,06).
Мп концентрируется в гидротермальных процессах, но они не имеют
существенного значения в его геохимии. Из 179 минералов Мп 120 об-
разовались при высоких температурах и давлениях.
Кларк Мп в живом веществе 9-Ю-3 %, он важный биоэлемент.
Известны организмы манганофилы (некоторые железобактерии содер-
жат 6—7% Мп, желтые муравьи — 0,065). С недостатком или избыт-
ком Мп связаны болезни растений и животных.
В кислых и нейтральных водах ландшафтов с влажным климатом
Мп энергично мигрирует, в глеевых водах болот его содержание по-
вышается до п-10-2 г/л. В местах выхода таких вод на поверхность,
в озерах, на участках более окислительной среды происходит окисле-
ние Мп2+ и осаждение Мп3+ и Мп4+. Так образуются черные коллоид-
445
ные водные гидроксиды Мп из группы псиломелана (т МпО-МпО2х
X пН2О). Нередко Мп осаждается вместе с Fe (железо-марганцевые
конкреции). Растения подобных ландшафтов богаты Мп, местами он
избыточен (болезни растений). В этих ландшафтах Мп ведет себя ана-
логично Fe.
В системах биосферы с восстановительной нейтральной и щелоч-
ной средой (седьмой класс вод — см. табл. 18) пути миграции Мп и Fe
расходятся. Железо в этих системах (даже в болотах) малоподвижно
(pH выпадения Fe (ОН)2 — 5,5), марганец — мигрирует (pH выпаде-
ния Мп (ОН)2 — 8,5). Поэтому, например в болотах на карбонатных
породах, глубоких водоносных горизонтах в красноцветах, в услови-
ях карбонатного оглеения наблюдается значительная миграция Мп,
а на участках повышения окислительного потенциала — и его акку-
муляция. Образовавшиеся в таких условиях марганцевые конкреции
и руды бедны Fe.
В степях и пустынях в условиях щелочной окислительной среды
Мп малоподвижен, организмы часто обеднены им, культурные расте-
ния нуждаются в марганцевых микроудобрениях.
В речной воде мало Мп — п -10-6 — п-10“5 г/л (Кх = 0,п —
—0,0 п), еще меньше Мп в морях и океанах (2-10~7 %). Поступая в
морскую воду с речным стоком и в результате подводного вулканизма,
Мп осаждается в илах. На больших пространствах океанического дна
распространены железо-марганцевые конкреции, запасы которых
грандиозны, а добыча — перспективна. Главные промышленные ме-
сторождения Мп относятся к осадочному типу (пиролизит — МпО2,
браунит — Мп2О3 и другие рудные минералы).
В ноосфере использование Мп в основном связано с Fe (черная ме-
таллургия), технофильность их одинакова.
Хром (Сг). В земной коре преобладает малоподвижный Сг3+,
аналогичный Fe3+ и А13+, но в резкоокислительных щелочных усло-
виях биосферы Сг3+ окисляется с образованием подвижных хроматов
(СгОГ — похож на SO^'). Наиболее обогащены Сг каменные ме-
теориты (0,25%), меньше — ультраосновные породы (0,12), еще мень-
ше основные (0,02) и меньше всего кислые (2,5- 10-3).<Кларк Сг в зем-
ной коре — 8,3* 10-3 %. Известно 25 минералов Сг, важнейшие из
них — хромшпинелиды — хромиты [(Fe, Mg) (Сг, А1)2 ОД. Место-
рождения хромитов — основной источник Сг, они образовались в ре-
зультате дифференциации ультраосновной магмы. Для остальных
магматических систем, так же как и для гидротерм, Сг не характерен.
Кларк Сг в живом веществе 7-Ю-5 %, он не накапливается био-
генным путем. В гумидных ландшафтах преобладают малоподвижные
соединения Сг3+; Сг здесь аналогичен Fe3+, воды содержат п-10_в —
п-10-7 г/л Сг, что говорит о его слабой водной миграции (Кх—
= 0,п — 0,0 п). В элювиальных почвах степей и пустынь Сг3+ также
малоподвижен, но здесь в резкоокислительной щелочной среде воз-
можно окисление Сг3+ до Сг®+, который местами накапливается при
446
засолении. В пустынях известны легкорастворимые хроматы К и дру-
гие минералы. Все они редкие.»
Почвы на ультраосновных породах содержат до 1—3% Сг (Урал,
Индия, Новая Каледония и др.). Хром угнетающе влияет на расти-
тельность, вероятно, способствует формообразованию (характерна
особая «серпентиновая флора», обычно разреженная).
В речных водах основная часть Сг мигрирует со взвесями. В мор-
ской воде мало Сг — 2-10~9% и талассофильность его низкая —
2-10-’. Хром накапливается в некоторых глинах, образование ко-
торых связано с поверхностным выветриванием и деятельностью под-
земных вод (хромовые монтмориллониты и др.).
Технофильность Сг высокая — 2-108, вдвое больше, чем Fe, с ко-
торым Сг тесно связан в ноосфере (около 50 % добываемого Ci потреб-
ляет металлургия). Соединения Сг ядовиты, поэтому важное значение
имеют проблемы охраны окружающей среды в районах добычи и пе-
реработки руд Сг (вдыхание пыли, содержащей хромовые минералы,
способствует раку легких и др.).
Никель (Ni). Предполагается, что в земном ядре около 10% Ni, его
кларк в ультраосновных породах 0,2%, в земной коре 5,8-10~3 %
(в основных породах больше Ni, чем в кислых: 1,6-10-2 и 5,5-10~3 %).
В изверженных породах Ni изоморфно замещает Fe2+ и Mg2+ (в оли-
вине, пироксене и других минералах). Замещение объясняется бли-
зостью ионных радиусов этих элементов (у Mg2+ и Ni2+ 0,078 нм).
В биосфере тесные связи Ni, Fe, Mg нарушаются, и каждый из них миг-
рирует по-разному. Известно 53 собственных минералов Ni, большин-
ство их образовалось при высоких температурах и давлениях.
Никель энергично мигрирует в магматических, гидротермальных и
гипергенных процессах, с которыми связано образование его место-
рождений. При дифференциации базальтовой магмы возникают медно-
никелевые сульфидные месторождения, в гидротермальных системах
образуются сульфидные Ni = Со-месторождения, в биосфере образу-
ются силикатные месторождения Ni в коре выветривания ультра-
основных пород. Таким образом, Ni проявляет и сидерофильные (в
ультраосновной магме, земном ядре) и халькофильные (при дифферен-
циации основной магмы, в гидротермах), и литофильные (в биосфере)
свойства.
Кларк Ni в живом веществе 8-10-5 %, биофильность его довольно
низкая —как у Na, Со, но больше, чем у Fe. В речных водах, подзем-
ных водах зоны гипергенеза в среднем содержится 3-10~6 г/л Ni, Кх
его 0, п. Главная масса Ni в биосфере мигрирует с глинистыми взвеся-
ми. Во влажном климате Ni выносится из кислых почв, ландшафты
обеднены Ni, однако его дефицит здесь не установлен. В степях и пус-
тынях с характерными для них нейтральными и щелочными раствора-
ми Ni малоподвижен. Богаты Ni ландшафты на ультраосновных по-
родах, где его содержание в почвах достигает 0, п%, подземных во-
дах — 3-10-4 г/л. Некоторые растения здесь поглощают много Ni, это
приводит к появлению низкорослых уродливых форм, домашние жи-
447
вотные слепнут; повышенное содержание Ni в кормах приводит к уве-
личению продукции шерсти.
В морской воде 2-10—7 % Ni, его талассофильность довольно вы-
сокая — 5-10-5, т. е. такая же, как у F и Со, и значительно больше,
чем у V, Мп, Fe. Технофильность Ni, как у Fe и Мп.
Кобальт (Со). По химическим свойствам Со близок к Ni, он
также образует легкорастворимые хлориды, сульфаты, бикарбонаты
и практически нерастворимый сульфид. Однако в отличие от Ni в
биосфере возможно окисление Со2+ до Со3+, аналогичного по свойствам
Fe3+.
Кларк Со 1,8-10~3 %, он энергично мигрирует в магмах, гидротер-
мах и биосфере. Известно 28 минералов Со. Накапливается Со в ульт-
раосновных породах (2-10“2 %), меньше Со в основных породах
(4,5-10-3 %) и кислых (5-10-4 %).
В магматических процессах Со ведет себя аналогично Fe2+ и Ni.
В гидротермах Со концентрируется вместе с Ni, As, S, Си (линнеит
Co3S4, кобальтин CoAsS, смальтин CoAsS2 и другие минералы).
В биосфере Со мигрирует слабо и преимущественно рассеивается.
Наблюдается дифференциация Со — в глинах и сланцах (2-10—3), в
песчаниках (3-10~5), в известняках (1 • 10~5). Живое вещество обеднено
Со (4-10~5), но на участках месторождений Со известны растения-
концентраторы этого металла. Важную роль Со играет в организмах
животных и человека: он входит в состав витамина В12, влияющего на
кроветворение.
В гумидных ландшафтах Со выщелачивается из почв, его мало в
растениях. В Шотландии, Австралии, нечерноземных областях СССР
известны заболевания домашних животных из-за дефицита Со (тре-
буется подкормка и удобрения Со). Особенно бедны Со песчаные почвы
лесных районов. В сухом климате Со мигрирует в почвах слабо, в этих
ландшафтах дефицит Со наблюдается реже.
В поверхностных и грунтовых водах влажного климата содержится
ч-10~7 — п-10~6 г/л Со, в степях и пустынях — до п-10~5. Это отве-
чает коэффициенту водной миграции 0, п, который несколько меньше,
чем у Си и Ni. Большая часть Со мигрирует с глинистыми взвесями.
В резкоокислительных условиях происходит окисление Со2+ до Со3+
и накопление Со вместе с гидроксидами Мп. Черные гидроксиды Мп,
обогащенные Со, — асболаны — особенно характерны для кор вы-
ветривания ультраосновных пород во влажных тропиках, где асбо-
ланы имеют промышленное значение.
В Мировом океане лишь 5-10~8%Со, талассофильность его
такая же, как у Ni. Технофильность Со 1-Ю7 — на порядок ниже,
чем у Ni и Fe, но все же больше, чем у V, Ti, Al, Mg и многих других
металлов.
10. Платина и платиноиды — Ru, Rh, Pd, Os, Ir, Pt. Это очень
редкие металлы с точно не установленными кларками земной коры
порядка 10~7—10~8 %). Наиболее высоки их кларки в каменных ме-
теоритах (п • К)-4 — zi-10—5 %), ниже в ультраосновных породах
448
(для Pd и Pt — n-10~5 %). Сульфиды полностью извлекают платино-
вые металлы из основной магмы с образованием твердых растворов.
Практическое значение имеют магматические месторождения этих ме-
таллов, а также россыпи. Для земной коры характерно самородное со-
стояние Pt и платиноидов, известно около 50 их минералов (самород-
ные металлы и соединения с S, As и Sb). Все минералы образовались
при высоких температурах и давлениях — в магме и гидротермах.
В виде примеси Pt и платиноиды встречаются во многих сульфидах и
силикатах ультраосновных и основных пород.
Геохимия данных металлов в биосфере почти не изучена. Некоторые
осадочные марганцевые руды обогащены Pt (до 1 • 10“3), в углях наблю-
далась концентрация Pt и Pd (1 • 1О6 %), повышенное содержание пла-
тиноидов отмечалось в фосфоритах, в золе деревьев, растущих на мес-
торождениях Pt. По Ю. Ф. Погребняку и Э. М. Татьянкиной, среднее
содержание Pd в 52 пробах холодных и термальных вод Забайкалья
составляет 5,3,-10—10 г/л, что отвечает коэффициенту водной мигра-
ции 0, п.
Технофильность Pt и платиноидов такая же, как у многих других
металлов — Al, Mg, К, Со, Cs, Li (у Pt ~ 7-106).
11. Халькофильные металлы—Zn, Си, Pb, In, Cd, Hg, Ag, Bi,
Au. Это большая группа элементов, объединяемая общими особенно-
стями строения атомов, положением на кривой атомных объемов,
концентрацией в гидротермах, с которыми связано большинство их
промышленных месторождений. В соединениях для них часто харак-
терны ковалентные связи. Ионная концепция, понятие о радиусах
ионов для анализа миграции этой группы менее применимы, чем для
типичных литофилов.
Цинк (Zn). Кларк Zn в земной коре 8,3-10~3 % (в основных поро-
дах 1,3-10~2 %, в кислых — 6-Ю-3 %). В изверженных породах Zn
находится в форме тонкорассеянного сульфида, в виде изоморфной
примеси в слюдах, амфиболах (Ri Zn2+ = 0,083 нм определяет изо-
морфизм с Fe2+ и Мп2+). Известно 66 минералов Zn, важнейший —
сфалерит (ZnS).
Цинк энергично мигрирует в гидротермах, в которых он образует
различные комплексы и осаждается вместе с Pb, Ag и другими халько-
филами, образуя различные сульфиды (полиметаллические руды).
Низкотемпературные стратиформные Pb-Zn-месторождения в из-
вестняках некоторые исследователи считают осадочными или гидро-
термально-осадочными.
Цинк —важный биоэлемент, его кларк в живом веществе 2-10-3 %.
Известны организмы-концентраторы Zn, на его месторождениях растет
особая, «галмейная флора» (центр видообразования?). От избытка и не-
достатка Zn организмы болеют. Zn накапливается биогенным путем в
почвах.
В биосфере Zn энергично мигрирует с поверхностными и подзем-
ными водами, где его содержание обычно составляет п 10-5 г/л(Кх=п
вместе с Са, Mg, Na, Sr, F, U). В кислых кислородных и глеевых во-
15
Зак. 2022
449
(дах многие Соединения Zn растворимы, особенно хорошо — Zn SO4.
Сравнительна растворима и соль Zn(HCO3)2, аналогичная Са (НСО3)2
(также существует только в растворе); pH выпадения Zn (ОН)2—
6,8, поэтому нейтральных и слабощелочных растворах Zn малопод-
вижен (ZnCO? — труднорастворимая соль). Однако при повышении
pH Zn снова Переходит в раствор в результате образования раствори-
мых цинкато^ — солей цинковой кислоты. В сероводородной среде
Zn образует Практически нерастворимый сульфид.
С осаждением Zn на сероводородном барьере (ВЗ, В7 и др.) связано
его накопление в сульфидных илах, некоторых углях и других оса-
дочных породах.
В ландшафтах влажного климата Zn активно мигрирует в бикарбо-
натной или органоминеральной форме и частично выносится из ланд-
шафта. В аридных ландшафтах Zn менее подвижен, здесь возможна
его слабая испарительная концентрация в соленых озерах и солон-
чаках.
В морской воде содержится — 1 • Ю_в % Zn, талассофильность его
6- Ю'4 — намного выше, чем у Fe и Мп. Технофильность Zn высокая
(5-108), но все же немного ниже, чем у других цветных металлов. Прак-
тические проблемы геохимии Zn в ноосфере разнообразны — загряз-
нение среды, 1-еохимические поиски месторождений Zn, удобрения и т.д.
Медь (Си), Разная валентность Cu(Cu°, Cu+, Cu2+) определяет
большое влияние окислительно-восстановительных условий на ее
миграцию, роль восстановительных барьеров В иС в концентрации Си.
Важнейшими осадителями Си из вод служат H2S, СОз~, РО3-, VO3 ,
SiO2. Особенно трудно рстворимы сульфиды Си, что имеет огромное
геохимическое значение: с осаждением Си сероводородом связано
образование и крупных месторождений, и мелких концентраций Си.
Главными рудными минералами являются халькопирит CuFeS2.
ковеллин CuSt борнит Cu6FeS4 и другие сульфиды. Си2+ легко адсор-
бируется отрицательно заряженными коллоидами, что также огра-
ничивает миграцию этого элемента в биосфере. Известно 198 минера-
лов Си, преимущественно сульфидов, фосфатов, силикатов, карбона-
тов, сульфатов. Кларк Си 4,3-10—3 %, ее больше в основных породах
(1-Ю-2 %), Чем в кислых (2-10-3 %). С дифференциацией основной
магмы связано образование магматических Cu-Ni- и Cu-Ti-месторож-
дений.
В гидротермах Си мигрирует в форме различных комплексов Сит
и Си2+ и концентрируется на геохимических барьерах в виде халько-
пирита и других сульфидов (меднопорфировые, медноколчеданные и
другие месторождения).
Кларк Си в живом веществе 3,2-10-4 %, она участвует во многих
физиологических процессах, биогенно аккумулируется в почвах
(Ах> 1). Известны организмы-концентраторы Си; у многих беспозво-
ночных — моллюсков, пауков и других животных, красящий пигмент
крови гемоцианин содержит Си, кровь голубая. У растений и живот-
ных установлен дефицит и избыток Си.
450
В поверхностных водах обычно содержится п-10~6 г/л Си, что со-
ответствует коэффициенту водной миграции 0, п. Большая часть Си
мигрирует с глинистыми частицами, которые энергично ее адсорбиру-
ют. Возможна и коллоидная миграция, известны коллоидные минера-
лы Си. Наиболее энергично Си мигрирует в сернокислых водах зоны
окисления сульфидных руд, где образуется легкорастворимый CuSO4.
Содержание Си в таких водах достигает п г/л, на участках месторож-
дений возникают купоросные ручьи и озера. Однако такая миграция не-
продолжительна: при нейтрализации кислых вод на барьере Д1 осаж-
даются вторичные минералы Си, она адсорбируется глинами, гидрокси-
дами марганца, гумусом, кремнеземом. Так образуются повышенные
содержания Си в почвах и континентальных отложениях ландшафтов
на участках месторождений. Си здесь активно вовлекается в биологи-
ческий круговорот, появляются растения, обогащенные Си, крупные
размеры приобретают моллюски и другие животные с голубой кровью.
Многие растения и животные плохо переносят высокие концентрации
Си и болеют. Формирование вокруг месторождений Си ореолов в поч-
вах, водах и растениях позволяет использовать для поисков руд лито-
химические, гидрогеохимические и биогеохимические методы.
Значительно слабее миграция Си в ландшафтах влажного климата
со слабокислыми водами — в таежных, тропических и др. Си здесь ча-
стично выщелачивается из почв. Известны болезни животных и расте-
ний, вызванные недостатком Си. Особенно бедны Си пески и торфяни-
ки, где эффективны медные удобрения и подкормка животных. В сте-
пях и пустынях, с характерными для них щелочными растворами Си
малоподвижна.
Медь энергично мигрирует и в пластовых водах, откуда она осаж-
дается на восстановительном сероводородном барьере. Эти процессы
особенно характерны для красноцветной формации, к которой приуро-
чены месторождения и рудопроявления типа «медистых песчаников».
Приносимая речным стоком Си не накапливается в морской воде
(3-10~7), талассофильность низкая (4-10~*) и сравнительно быстро
осаждается. Глины и сланцы обогащены Си (5,7-10~3 %). В морях
прошлых геологических эпох происходило значительное накопление
Си в сероводородных илах (черные сланцы PZX, месторождения типа
Мансфельда в ГДР и др.).
Медь — один из древнейших и важнейших металлов цивилизации,
технофильность ее очень высокая (1 • 109).
Свинец (РЬ). Кларк РЬ 1,6-10~3 %, в магматических процессах он
рассеивается, несколько накапливается в гранитоидах; в основных
породах 8-Ю-4 %, в ультраосновных — 1 • 10~5. Крупный катион
РЬ2+ (0,126 нм) в силикатах изоморфно замещает К, Ва, Sr. Особенно
характерен РЬ для гидротерм, в которых он образует различные раст-
воримые комплексы и из которых осаждается вместе с Zn, Ag и дру-
гими халькофилами. Известно около 80 минералов-сульфидов РЬ.
В биосфере РЬ в основном рассеивается, его мало в живом вещест-
во (1-10~4 %), в морской воде (3-10~9 %). В гумидных ландшафтах
Pb преимущественно мигрирует в бикарбонатной форме (РЬ (НСО3)2-
сравнительно растворим), в органических комплексах, а также ме-
ханическим путем с глинистыми частицами. В водах содержится
п-10-6 — п-10~7 г/л РЬ, коэффициент водной миграции РЬ — 0, п.
Из почв РЬ выносится слабее, чем Си и Zn. Однако дефицит РЬ не из-
вестен и вряд ли имеет место. В степях и пустынях в почве и коре вы-
ветривания РЬ мало подвижен, но в водах его содержание может до--
стигать п-10-5 г/л.
Свинец ядовит для большинства животных и человека, причем низ-
шие животные менее чувствительны к нему, чем высшие.
На рудных полях месторождений РЬ образуются многочисленные
вторичные его минералы — сульфаты, карбонаты, фосфаты, оксиды и
др. В резкоокислительной щелочной среде степей и пустынь возмож-
но окисление РЬ2+ до РЬ4+ с образованием РЬО2 — платтнерита.
На рудных полях характерен избыток РЬ в почвах (до 1 %), водах и
растениях. С этим связывают частоту заболеваний рассеянным скле-
розом, эндемическими нервными заболеваниями (цефальгии, миалгии
и др.). Возможны заболевания и домашних животных. Ландшафты
свинцовых месторождений заслуживают детального геохимического
исследования как с медицинских, так и общебиологических позиций
(изучение отбора на химической основе, выявление центров видооб-
разования).
В ноосфере РЬ энергично извлекается из недр, технофильность его
очень высока — 2- 10е. В районах добычи и переработки РЬ, а также
в городах и дорожных ландшафтах происходит загрязнение окружаю-
щей среды РЬ.
Индий (In). Геохимически In близок к Zn, характерна также его
связь с Sn. Это типичный редкий и рассеянный элемент с кларком
1,4-10-5 % (кислые породы — 1,6-10-5, основные — 9-Ю-6).
Концентрация In связана с гидротермальными системами, где из-
вестно три крайне радких минерала In. In накапливается в сульфидах
Zn, Cd, РЬ, а также в касситерите, где его КК близок к 100. Собствен-
ных месторождений In не образует, его извлекают из цинковых кон-
центратов: в сфалерите содержание In достигает 0,1 и даже 1%. Обо-
гащение In характерно для сульфидных месторождений Тихоокеан-
ского рудного пояса. В биосфере In рассеивается. Технофильность его
значительна —1,6-10®.
Кадмий (Cd). Кларк Cd 1,3-Ю-5 %, в изверженных породах он
рассеян. Концентрация Cd связана с гидротермальными процессами, в
которых он является аналогом Zn, накапливается в сфалерите (до
0,5—1%, максимально до 5%). Известны и три собственных минерала
Cd.
В биосфере Cd в основном рассеивается, живое вещество его не на-
капливает (кларк 2-10-7 %), так как Cd ядовит. Однако отдельные ви-
ды концентрируют Cd, например моллюски, — в золе улиток до 0,04%
Cd. В поверхностных и грунтовых водах менее п-10-7 г/л Cd, в океа-
нической воде — 1-Ю-8 %. Известны концентрации Cd в сланцах,
452
песчаниках, в которых он также связан с Zn и другими халькофилами.
В биосфере известны три минерала Cd, все очень редкие. Технофиль-
ность Cd высокая — 1 • 10е (как у Hg, Pb и др.), он добывается из цин-
ковых концентратов. Большую опасность представляет загрязнение
окружающей среды Cd (новая болезнь «итай-итай» в Японии).
Ртуть (Hg). Кларк Hg 4,5- К)-6 %, примерно в таких количествах
она содержится в изверженных породах земной коры (в мантии воз-
можно Hg больше — кларк в каменных метеоритах 3-10~4 %). Важ-
ную роль в геохимии Hg играет миграция в газообразном состоянии и
в водных растворах. В подавляющем большинстве систем Hg рассеяна
и только в гидротермах происходит ее концентрация, образуются
гидротермальные месторождения Hg; КК Hg в рудах огромен —
п-105. Известны 16 минералов Hg, важнейший из них киноварь -
HgS. В биосфере Hg в основном рассеивается и лишь в незначитель-
ных количествах сорбируется глинами и илами (в глинах и сланцах
кларк 4-10-5 %). В природных водах п-10~7 г/л Hg (в морской воде-
3-10-8 %). Hg—сильный яд и не накапливается живым веществом
(кларк 5-10-7 %). Hg энергично извлекается из недр, ее технофиль-
ность 1-10®. В местах добычи и переработки Hg известно техногенное
загрязнение ноосферы и биосферы (болезни людей, диких и домашних
животных).
Серебро (Ag). Кларк Ag 7-10~6 %, в таких количествах оно содер-
жится в большинстве горных пород. Известно 54 минерала Ag, из ко-
торых 47 гидротермальные. С этими процессами связано и образова-
ние руд Ag.
Геохимия Ag в биосфере изучена плохо, его кларк в живом веще-
стве 1,2-10~6 %. Ag — энергичный водный мигрант, в подземных во-
дах зоны гипергенеза 2,9-10~7 г/л Ag, в морской воде — 3- 10 s %
(талассофильность значительная — 4,3-10~3, больше, чем у Cu, Zn,
Мо). Известны концентрации Ag в углях, глинах и других осадочных
породах.
Серебро — один из наиболее дефицитных элементов ноосферы, его
извлекают из гидротермальных месторождений — собственно сереб-
ряных и полиметаллических. Технофильность Ag высокая— 1-10®.
Золото (Аи). Кларк Аи — 4,8-10—7 %. Оно проявляет и сидеро-
фильные и халькофильные свойства, тяготеет к более глубоким оболоч-
кам планеты (в каменных метеоритах — 4,7-10-5 %). В магматических
породах Аи рассеяно, его концентрация связана с гидротермами
(кварцевыми золотоносными жилами и др.) и биосферой. В рудах Аи
в основном находится в самородном состоянии и лишь редко образует
минералы с Se, Те, Sb, Bi (в последнем случае проявляется халько-
фильность золота). Самородное Аи всегда содержит примеси Ag и дру-
гих металлов. Пирит и другие сульфиды часто содержат примесь Аи,
которое извлекается при переработке полиметаллических, медных и
других руд.
В кислородных водах Аи мигрирует энергично (Кх п — п-10, как
У Са, Na, Zn и др.), характерны различные растворимые комплексы
453
(в том числе с органическими соединениями). В морской и речной воде
содержится около 4-10~9г/л Au. На участках золоторудных место-
рождений подземные воды содержат уже до п -10~6 г/л Au. Au мигри-
рует в почвах и оттуда попадает в растения, среди которых встречают-
ся концентраторы Au (хвощи, кукуруза). Зола хвощей на месторожде-
ниях Au содержит до 6,5-10-2 % Au, повышено его содержание так-
же в животных. Разрушение эндогенных месторождений Au приводит
местами к образованию промышленных россыпей Au в долинах рек и
на склонах. Au — один из немногих элементов, который концентри-
руется в ноосфере (большая технофильность —3-109).
12. Халькофильные неметаллы — As, Sb, Se, Те. Поливалентность
определяет большое влияние окислительно-восстановительных усло-
вий на миграцию этих элементов. Все они рассеяны в магматических
системах и концентрируются в гидротермальных, частично в биосфере.
Мышьяк (As). Геохимия As во многом определяется летучестью его
соединений при высокой температуре, поливалентностью. Наиболее
распространены минералы трехвалентного (сульфиды и др.) и пяти-
валентного (арсенаты) As, но известны также самородный As и мине-
ралы двухвалентного As. Общее число минералов As — 177, из них 90
образовались при высоких температурах и давлениях. Основное про-
мышленное значение имеет арсенопирит FeAsS.
Кларк As 1,7-10—4 %, в ультраосновных породах — 5-10~5 %.
В связи с летучестью As не накапливается при магматических процес-
сах, для него характерна миграция в гидротермах, из которых осажда-
ются сульфиды и сульфосоли, содержащие As, а также и арсениды, об-
разующие гидротермальные руды As.
Кларк As в живом веществе 6-10_6 %, он важный биоэлемент, но
при значительном превышении кларка является сильным ядом.
As — энергичный водный мигрант, его кларк в реках 3-10~вг/л,
Кх = п. В окислительных условиях на участках месторождений об-
разуются арсенаты (As5+) и арсениты (As3+). На рудных полях место-
рождений As, в районах молодого вулканизма почвы местами сильно
обогащены As (до I %). С этим связаны болезни скота, гибель расти-
тельности, Данные явления особенно характерны для степей и пустынь
в почвах которых As малоподвижен. Во влажном климате As вымыва-
ется из почв.
Мышьяк, поступающий со стоком в океан, сравнительно быстро
осаждается и в морской воде лишь 1 • 10~6 гл As (талассофильность
ЗАО-3). As накапливается в некоторых железистых минералах
(осадочные железные руды, железо-марганцевые конкреции часто обо-
гащены As). Глинистые породы несколько обогащены As (кларк —
6,6-10-4 %). В геологической истории важным источником А>
для биосферы был вулканизм. Технофильность высокая — 2-10s
(как у Р, Са), ядовитость его соединений выдвигает ряд вопросов ох-
раны среды.
Сурьма (Sb). Кларк Sb 5- I0-5 %. В магме и биосфере Sb рассея-
на (кларк в живом веществе 2-10~7 %). Sb концентрируется из гидро-
454
терм. В рудах гидротермальных сурьмяных месторождений содержат-
ся целые проценты этого элемента (очень высокий КК)- Известны
собственно сурьмяные, сурьмяно-свинцовые, золото-сурьмяные, сурь-
мяно-ртутные месторождения. В них установлено 27 минералов Sb.
Главное промышленное значение имеет антимонит (Sb2S3). Благодаря
сродству к S примесь Sb часто встречается в сульфидах As, Bi, Ni,
Pb, Hg, Ag и других халькофилов. Сурьмяные и сурьмяно-ртутные
месторождения образуют рудные пояса, простирающиеся на сотни
километров (например, в Средней Азии). Sb энергично извлекается из
недр, ее технофильность I • 10®, такая же, как у Си, Ag, Pb.
Селен (Se). По химическим свойствам Se — аналог S, для него ха-
рактерны селеноводород (H2Se), селенистая кислота (H2SeO3), селе-
новая кислота (H2SeO4) — аналоги H2S, H2SO3 и H2SO4. Кислоты об-
разуют соли — селениды, селениты и селенаты, аналогичные сульфи-
дам, сульфитам и сульфатам.
В магматических и гидротермальных системах история Se аналогич-
на истории S и тесно с ней связана. Сульфиды изверженных пород и
гидротермальных руд обогащены Se—радиусы Se2- и S2- близки.
В биосфере миграция Se существенно отличается от миграции S, что-
объясняется более легкой восстанавливаемостью его соединений: во
многих системах, где S находится в сульфатной форме, Se может быть
только в малоподвижной форме элементарного Se или селенидов.
Селен обладает значительной способностью к концентрации и не-
смотря на низкий кларк (5-10*6 %) образует 38 самостоятельных ми-
нералов — самородного селена, селенидов, селенитов, селенатов. Ха-
рактерны примеси Se в сульфидах и элементарной сере. Se ядовит для
растений и животных, его кларк в живом веществе 2-10_6%. Соли Se
ядовитее солей As, Мо, V. Но в малых количествах Se необходим для
жизни. Относительно много Se поглощают бобовые растения, извест-
ны микроорганизмы, окисляющие Se° и SeO2- (аналоги серобактерий).
Известны болезни людей, обязанные дефициту Se.
Во влажном климате подвижный селен находится в форме SeOl-,
который адсорбируется гидроксидами Fe. Селениты в почвах легко
восстанавливаются до малоподвижного элементарного Se°, поэтому
в почве Se в общем малоподвижен. Слабая миграция Se определяет
его «задержку» на материке — Se слабо поступает с речным стоком в
океаны, пути его миграции с S расходятся. В степях и пустынях в ще-
лочной окислительной среде возможно окисление Se° и Se2- до SeO.V
и даже SeO2-, поэтому в отличие от гумидных ландшафтов Se здесь
аналогичен S. В районах развития пород, обогащенных Se (или
месторождений Se), известны селеноносные солончаки с селената-
мн Na.
Источником Se для биосферы служат не только изверженные гор-
ные породы, но и вулканические дымы, вулканические гидротермы.
Поэтому в районах современного и древнего вулканизма почвы и оса-
дочные породы нередко обогащены Se. Некоторые морские глины, фор-
мировавшиеся в эпохи интенсивного вулканизма, содержат доп- 10~3 %
Se.
455
В аридных ландшафтах, почвы которых обогащены Se до п-10-3 %,
произрастает особая «селеновая флора», накапливающая до 0, п % Se.
Питаясь такими травами, домашние животные болеют «щелочной бо-
лезнью».
В кислородных подземных водах Se мигрирует энергично, из вод
он осаждается на В и С барьерах вместе с U, Mo, V, Re (гидрогенные
месторождения). В морской воде содержится I-10-7 г/л Se, талассо-
фильность его высокая — 8-Ю-2. Технофильность Se значительна —
2-108, как у Са, Р, Cr, W. Источником Se служат сульфидные руды
(попутная добыча с Си и другими металлами), некоторые руды U.
Теллур (Те). Это один из наиболее редких элементов с кларком
I • I0-7 %. В магме и биосфере Те рассеян, геохимия его в большинстве
систем не изучена. Только из некоторых гидротерм Те осаждается
вместе с S, Ag, Au, Pb и другими халькофилами. Известны гидротер-
мальные месторождения Au и цветных металлов, обогащенные Те.
С ними связаны все 36 минералов этого элемента. Характерна примесь
Те в пирите и других сульфидах. Те извлекается из руд Cu, Ag, Pb,
Аи, технофильность его высокая 2- 10е (как у РЬ).
13. Литофильно-халькофильные элементы—Ga, Sn, Ge, Т1. В зем-
ной коре для Ga, Sn, Ge и Т1 более характерна литофильность, хотя
они проявляют и халькофильные свойства. Поливалентность Sn и
Ge (+4, 4-2) определяет важную роль окислительно-восстановитель-
ных условий в их истории. Ga, Sn, Ge в сильнокислых средах прояв-
ляют катионогенность, в сильнощелочных — анионогенность. Т1 —ка-
тионогенный элемент.
Олово (Sn). Кларк Sn 2,5-10~4 %, его больше в кислых породах
(3-10~* %), чем в основных (1,5-10-4 %) и ультраосновных (5-10~5%).
Концентрация Sn связана с магматическими процессами — с гра-
нитоидами и их производными. Известны «оловоносные граниты»,
пегматиты, обогащенные Sn. Олово концентрируется и в гидротер-
мальных системах. Известно 24 минерала Sn, 23 из них образовались
при высоких температурах и давлениях. Главное промышленное зна-
чение имеет касситерит SnO2, меньшее — станнин Cu2 FeSn4.
В биосфере миграция Sn изучена слабо, в морской воде
Sn 3-10-6 г/л (талассофильность, как у U, — 1,2-Ю-3). Намечается
слабая концентрация Sn в глинах (1-10~3 %), известны водные расте-
ния с повышенным содержанием Sn. Однако общая тенденция геохи-
мии Sn в биосфере — рассеяние.
Основное промышленное значение имеют россыпи касситерита,
менее важны сульфидно-касситеритовые гидротермальные месторожде-
ния, еще меньше роль кварцево-касситеритовых руд. Все это магма-
тогенные образования или их производные (россыпи). Характерны оло-
ворудные пояса, простирающиеся на сотни и тысячи километров (на-
пример, Тихоокеанский пояс — СССР, Малайзия, Боливия и т.п.).
Sn — один из древнейших металлов, оно добывалось еще за 4000 лет
до н.э. (сплав Си и Sn — бронза, «бронзовый век»), Технофильность
456
Sn высокая — 8-108 (больше, чем у Fe, S, Zn, Ni, но немного меньше
Cu, Pb, Hg, Sb).
Таллий(Т1). Это редкий и рассеянный элемент, наиболее тяжелый
металл III б подгруппы периодической системы, аналог Al, Ga, In.
Однако его высшая валентность (+3) не характерна для земной коры,
и Т1 в большинстве систем ведет себя как щелочной металл — аналог
Rb (их Ri одинаковы) и К, проявляя литофильность. В отличие от
щелочных металлов сульфид TI2S нерастворим (халькофильность).
Кларк TI 1-10~4 %, он концентрируется в кислых изверженных
породах (1,5-10-4 %). В ультраосновных породах Т1 мало (1-10-6 %,
по В. В. Иванову — 1-10-5 %). В изверженных породах почти весь
Т1 сосредоточен в полевых Шпатах и слюдах, где он изоморфно заме-
щает Rb и К- В гидротермальных системах TI концентрируется в суль-
фидных рудах вместе с Pb, Ag, Zn. Характерна его аналогия с РЬ24-
(близость Ri), сродство с As и Sb. Большая часть атомов Т1 рассеяна в
земной коре, все семь его минералов очень редкие. Реакция Т1+ ->
-* Т13+ протекает в столь же окислительных условиях, что и Мп2+ ->
-> Мп4+. Поэтому условия для существования Т13+ возникают только
в резкоокислительной щелочной среде, например в пустынях, где в
зоне окисления сульфидных руд обнаружен единственный гиперген-
ный минерал Т1 — авиценнит Т12О3.
Таллий ядовит, биогенная миграция не играет существенной роли
в его истории. Из природных вод TI сорбируется углями, глинами,
гидроксидами Мп, накапливается при испарении. В морской воде
лишь 1 • 10-8 г/л Т1, он извлекается из нее глинистыми илами, мар-
ганцевыми конкрециями. В ноосфере Т1 пока используется слабо, тех-
нофильность его низкая — 3-105. Опасно загрязнение среды TI.
Контрольные вопросы к главам 23 и 24
1. Какие принципы положены в основу геохимической классификации эле-
ментов?
2. Расскажите о понятии «геохимия конкретного элемента».
3. Охарактеризуйте геохимию нескольких контрастных элементов Перио-
дической системы Менделеева.
4. Какова внтенсивность водной миграции золота? Правильно ли считать ее
низкой на том основаннн, что золото накапливается в россыпях?
5. В чем двойственность геохимии радия?
6. Какие элементы наиболее опасны для загрязнения среды?
ИСТОРИЧЕСКАЯ
ГЕОХИМИЯ
Чтобы понять ход геохимических яв-
лений в прошлом, необходимо, оче-
видно, обратиться к изучению в исто-
рическом разрезе факторов миграции
химических элементов.
Л. А. Сауков
За 4 млрд, лет геохимия нашей планеты изменилась необратимо.
Изучение этих изменений необходимо для понимания эволюции лито-
сферы, гидросферы, атмосферы и биосферы. Велико и прикладное зна-
чение подобных исследований, в первую очередь для решения проблем ми-
нерального сырья. Историческая геохимия тесно связана с исторической
геологией, палеогеографией, металлогенией (особенно — с историче-
ской металлогенией).
25. ОБЩИЕ ЗАКОНОМЕРНОСТИ ИСТОРИЧЕСКОЙ
ГЕОХИМИИ
Необратимая эволюция земной коры. В ходе геологической исто-
рии разрастались платформы и сокращались геосинклинали, увели-
чивалась мощность гранитного слоя, уменьшался общий объем и мощ-
ность вулканогенных формаций, возрастала относительная роль
поднятий, континентального осадконакопления, наземного вулканиз-
ма, кислых интрузий и соответственно уменьшалось значение опуска-
ний, морского осадкообразования, подводного вулканизма и основных
интрузий (рис. 115). Эволюционировало и рудообразование. Так, по
В. И. Казанскому, Н. П. Лаверову и А. И. Тугаринову, в раннем и
среднем архее урановые месторождения не формировались; 2,8—
2,7 млрд, лет назад формировались знаменитые ураноносные конг-
ломераты Южной Африки, Канады и Бразилии. В протерозое формиро-
вались стратиформные золото-урановые месторождения в черных слан-
цах и ураноносные натровые метасоматиты (2,0—1,6 млрд. лет). Для
конца протерозоя и нижнего палеозоя характерны черные углеродисто-
458
Джеспилиты Эвапориты Известняки
100
75
50
25
О
“JHiuiUlllin!
Вторичные
аземно-вулка
AR, AR;
PR, PRLPZl 11
1 M2K1
-5000-4500—3500------2700—1900—1600-600235670
млн. лет
эквиваленты
пески
Аркоз
Грацвакки
ДалЬмй-
Кварцитовые
Подводно-дулка'-
ногенные породы
кремнистые ураноносные сланцы, а для среднего и верхнего палеозоя
разнообразные гидротермальные месторождения. С мезозойской тек-
тоно-магматической активизацией связаны особые гидротермальные
урановые руды. В кайнозое большое значение приобрели гидроген-
ные месторождения. Хотя причины эволюции уранового рудообразо-
вания недостаточно ясны, сам факт необратимого развития рудообра-
зования не вызывает сомнений. Эти данные позволили Н. П. Лаверову
сформулировать понятие
об исторической металло-
гении.
Наиболее резкие изме-
нения происходили в био-
сфере. Так, в докембрии
не было типичного угле-
образовани я, только в кай-
нозое известны лигниты,
в девоне появились лесные
ландшафты, в неогене —
степи, в четвертичном
периоде — тундры. Изме-
нялись и кларки осадоч-
ных пород, в которых рос-
ли содержание органичес-
кого вещества, отношение
Са/Mg, Fe3+ к Fe3+, S суль-
фатной к S пиритной. От
AR до PR в глинах росли
концентрации Fe, от AR до
нижнего PZ — К. В более
позднее время вплоть до
современной эпохи содержание К и Fe уменьшалось. В карбонатных
породах уменьшалась роль доломита (за счет кальцита).
По Д. В. Рундквисту, эволюция систем земной коры направлена в
сторону увеличения сложности, разнообразия. Он показал это на при-
мере эндогенного рудообразования: в более ранние эпохи, например в
докембрии, формировались преимущественно метаморфогенные и соб-
ственно магматические месторождения, в фанерозое весьма разнооб-
разные мезо-, теле- и эпитермальные месторождения с телескопиро-
ванными рудами. При этом усложнялись минеральный состав руд, па-
рагенезисы минералов, увеличивались кларки концентрации. Эта за-
кономерность прослеживается и в более частных случаях, например в
эволюции рудообразования, связанного с гранитоидами: с ранними до-
кембрийскими гранитоидами связаны пегматиты, с палеозойскими —
скарновые и грейзеновые месторождения, с мезозойскими —
более разнообразные сульфидно-касситеритовые, силикатно-кассите-
ритовые, сульфидно-вольфрамитовые и другие гидротермальные ме-
сторождения.
Рис. 115. Схема эволюции литологического со-
става и соотношений осадочных и вулканиче-
ских пород областей осадконакопления ма-
териков (по А. Б. Роиову)
459
Еще более характерен рост разнообразия для биосферы. Так, в сов-
ременную эпоху известны месторождения солей, известняков, желез-
ных руд и других осадочных полезных ископаемых, сформировавшие-
ся ранее 200 миллионов лет назад. Естественно, что в мезозое их не бы-
ло, дифференциация биосферы была меньше. По Е. В. Посохову, в хо-
де геологической истории росло также разнообразие химических ти-
пов природных вод.
В наибольшей степени рост разнообразия и сложности характерен
для биологических систем: организмы становились сложнее (водоросли
—►покрытосеменные, одноклеточные животные—► млекопитающие).
Число видов также увеличивалось. Если в силуре был только один
род растений, то в конце девона уже 21, в карбоне 60, в конце юры —
100, палеогене — 308, неогене — 344 рода (О. П. Фисуненко). Эволю-
ционировали и биокосные системы: разнообразнее и сложнее станови-
лись почвы, илы, ландшафты. Особенно резкое ускорение развития и
увеличение сложности характерно для ноосферы, где действуют зако-
ны общественного развития.
Развитие земной коры в сторону увеличения сложности и разнооб-
разия, уменьшения энтропии (роста негэнтропии) не происходит само-
произвольно, для этого необходим непрерывный приток в земную кору
энергии — солнечной, радиоактивной и др. Это и определяет неравно-
весность систем земной коры, увеличение их сложности и разнообра-
зия, богатство свободной энергией. Главный механизм, с помощью ко-
торого солнечная энергия превращается в химическую, — биологиче-
ский круговорот атомов (см. гл. 14).
Увеличение сложности и разнообразия не носит монотонный ха-
рактер: в отдельные эпохи происходили скачки в накоплении неорга-
нической и биологической информации. Так, в эпоху складчатости, об-
разования гидротермальных месторождений, дифференциации магмы
быстро росло разнообразие тектоносферы. Еще ярче «информацион-
ные взрывы» проявлялись в накоплении биологической информации.
Особое внимание привлекают «критические эпохи», в которые выми-
рали большие систематические группы растений и животных, сущест-
вовавшие в течение десятков миллионов лет, а также эпохи быстрого
развития отдельных систематических групп. Напомним, что в начале
кембрия в морях резко возросло число видов беспозвоночных живот-
ных, в конце палеозоя вымерли крупные земноводные и многие папо-
ротникообразные растения, в середине мела появились покрытосемен-
ные растения, в конце мела вымерли крупные ящеры, в начале палео-
гена бурно развивались млекопитающие. Вряд ли можно сомневаться
в роли геохимических условий среды в этих процессах, изучение кото-
рых составляет общую задачу геохимиков и биологов.
Периодичность развития земной коры. Повторение в геологиче-
ской истории складчатости, горообразования, влажного и сухого
климата придавало геохимическим процессам разных геохимических
эпох общие черты. Однако эти процессы развивались на фоне общего
необратимого прогрессивного развития земной коры и полной повтори-
460
емости не было. Поэтому символом периодичности служит не круг, а
спираль или циклоида (линия, описываемая точкой, находящейся на
ободе движущегося колеса). Такое развитие обычно называют цикли-
ческим, хотя вернее его называть циклоидальным (рис. 116).
Продолжительность каледонского, герцинского и альпийского тек-
тоно-магматических циклов в общем отвечает галактическому году —
времени обращения Солнца вокруг центра Галактики, равному при-
Рнс. 116. Последовательность образования месторождений различных типов и
отдельных тектоно-магматических циклов в геологической истории Земли (по
Д. В. Рундквисту):
7 — стратнформные осадочно-вулканогенные н магматические месторождения, 2— стратн-
формные осадочные месторождения, 3 — метаморфизированные стратнформные осадочно-
вулканогенные н осадочные месторождения, 4 — скарновые месторождения различных мор-
фологических типов, образующиеся на контакте рудоносных осадочных и вулканических
пород и граннтондных интрузий, 5 — гидротермальные месторождения различных морфо-
логических типов (жильные, штокверковые, трубообразные н др.) в связи с вулкано-плуто-
ническими поясами, 6 — месторождения кор выветривания, россыпи, 7 — осадочные место-
рождения континентальных впадин
мерно 180—220 млн. лет. В ходе геологической истории длительность
Циклов уменьшилась, по Н. Ф. Балуховскому, с 240 до 150 млн. лет.
С этими циклами коррелируется и периодичность в биосфере. Выде-
ляют и более короткие тектонические циклы продолжительностью
88 млн. лет ±22; 44 млн. лет ±11; 22 млн. лет ±5; 5,5 млн. лет ±2
и т. д. Установлены и периодические изменения климата 400 000 ±
50 000; 200 000±50 000; 45 000± 25 000; 11 000±8 000 лет.
По Д. В. Рундквисту, в каждом относительно коротком цикле
Устанавливаются те же основные особенности эволюции, что и в более
461
крупном цикле. Ученый показал действие этого геогенетического зако-
на на развитие формаций, магматизма, эндогенных месторождений.
В пределах одного цикла, как и в истории земной коры в целом,
наблюдается увеличение сложности и разнообразия. Так, общая тен-
денция развития магматизма заключается в эволюции от основных
магм, которые господствовали в AR, к кислым и щелочным. Но и в
развитии отдельных многофазных интрузий гранитоидов ранние фазы
являются более основными, а поздние — более кислыми. Эта же зако-
номерность характерна для отдельных вулканических циклов, напри-
мер для палеозойского вулканизма Казахстана и Урала, мезо- и кай-
нозойского вулканизма Дальнего Востока и Карпат. Интересно, что и
более молодые представители кимберлитов Сибирской платформы от-
носительно обогащены литофилами. Они также содержат больше
Fe, Ti и меньше Cr, Ni.
По А. Б. Ронову, каждый крупный цикл развития биосферы в фане-
розое характеризовался в начальных и завершающих стадиях регрес-
сиями морей, горообразованием, широким развитием аридных и семи-
аридных ландшафтов, сокращением биомассы, количества органическо-
го углерода в осадках, а также карбонатонакоплеиия в морях (нижний
кембрий, силур—нижний девон, верхняя пермь—средний триас, нео-
ген — четвертичный). По нашим представлениям в эти эпохи усилива-
лась динамика подземных вод, увеличивалась мощность зоны активно-
го водообмена и роль окислительных процессов. Широкое распростра-
нение сухого климата обусловливало большую роль нейтральных и ще-
лочных процессов. Роль живого вещества уменьшалась.
При тектонических поднятиях кора выветривания смывалась и на
земную поверхность выходили коренные породы, богатые Са, Mg и
Na, руды, содержащие тяжелые и радиоактивные металлы. Сухой кли-
мат не способствовал выносу подвижных элементов и организмы по-
добных ландшафтов находили в почвах и водах значительное количе-
ство металлов, подвергались более сильному радиоактивному облуче-
нию. Условия минерального питания резко менялись, и это не могло
не отразиться на эволюционном процессе. Высокое содержание в райо-
нах рудных месторождений Cu, Pb, Zn и других металлов могло быть
вредным. Роды и виды, приспособившиеся в условиях предшествую-
щей эпохи к бедному минеральному питанию, частично вымирали, ча-
стично приспосабливались к новым условиям. Таким образом, эпохи
горообразования, формирования карбонатной коры выветривания, ве-
роятно, были эпохами возникновения новых видов, родов и семейств,
«взрыва видообразования». Это были эпохи благоприятного минераль-
ного питания наземных организмов, высокого потребления ими Р,
К, Са и других элементов, хорошего развития скелета. Вместе с тем
это были эпохи резкого недостатка влаги, что также влияло иа эво-
люционный процесс.
Срединные стадии биосферных циклов были отмечены крупными
трансгрессиями морей, пеиеплеиизацией рельефа, смягчением и увлаж-
нением климата, ростом биомассы, накоплением органического угле-
462
рода в осадках, энергичным вулканизмом и поступлением СО.г в ат-
мосферу (ордовик, верхний девон — карбон, мел — палеоген), умень-
шением мощности зоны активного водообмена, усилением роли кислых
и кислых глеевых процессов. Эволюция организмов в срединные ста-
дии, вероятно, происходила качественно по-иному, чем в эпохи горо-
образования.
По С. Г. Неручеву, в фанерозое периодически накапливались мало-
мощные слои морских и озерных осадков, обогащенные органиче-
ским веществом — продуктом разложения синезеленых водорослей.
Эти слои очень бедны остатками фауны и обогащены U, Р, V, Мо, Си,
Zn, Ni, Cr, Pb, Re, Ag, Au, As, TR, Ir и Os. Высокая радиоактивность,
обогащенность тяжелыми металлами таких осадков определяла, по
его мнению, их роль в эволюции, литогенезе. Поэтому в такие относи-
тельно краткие эпохи происходила перестройка фауны, появлялись
как новые, более приспособленные, так и различные «уродливые» фор-
мы. Источником указанных элементов являлись зоны спрединга (риф-
тогенеза), в которых «мантийные элементы» (в частности, 1г) поступали в
биосферу. Таким образом эта интересная гипотеза с иных позиций, чем
Альварес, объясняет происхождение глобальных биологических ката-
строф и аномалий Ir. Однако и в данных построениях имеется много
неясного.
По Г. А. Пелымскому, в фанерозое было три главных максимума
накопления горючих сланцев: верхний девон — нижний карбон,
верхняя пермь, эоцен — олигоцен и три второстепенных —нижний и
средний кембрий, нижний и средний ордовик и верхняя юра (рис. 117).
Проблема «вулканизм и жизнь» издавна привлекала внимание. По
С. Аррениусу, прекращение вулканизма означало бы конец жизни на
Земле, по Г. Шухерту, обилие жизни коррелируется с количеством СО2
в атмосфере. Д. Н. Соболев считал, что энергичное поступление СО2 в
атмосферу в эпохи вулканизма вело к развитию растительности (усиле-
нию фотосинтеза) и накоплению углей.
Нами намечена следующая связь между вулканизмом и гиперген-
ной миграцией: поступление СО2 в атмосферу при извержении — уси-
ление фотосинтеза и энергичное разложение органических остатков —
формирование мощной коры выветривания и вынос из нее металлов-—
углеобразование в болотах — интенсивное оглеение в болотах и миг-
рация Fe — осаждение сидеритов и белых каолиновых глии — накоп-
ление карбонатных осадков в морях. Согласно основному закону кар-
бонатонакопления в фанерозое А. Б. Роиова, количество карбонатных
осадков прямо пропорционально интенсивности вулканизма и площади
внутриматериковых морей. М. И. Будыко, А. Б. Роиов и А. Л. Яншин
рассмотрели историю углекислого газа и кислорода в атмосфере фаие-
розоя. Изучение литологических формаций мира показало связь меж-
ду объемом вулканитов и карбонатных осадков. От массы последних за-
висело количество СО2 в атмосфере. Используя различные данные, до-
пущения и расчеты они построили кривую изменения содержания СО2
в фанерозое. Ойо преимущественно колебалось от 0,1 до 0,4 %, с чем
463
Рнс. 117. Изменение (%) во времени запасов углей, горючих сланцев и РОВ (А) и изменение скорости накопления запа
сов углей, горючих сланцев н РОВ (Б) (по И. Б. Волковой, А. В. Лапо, А. В. Македонову):
а — РОВ — рассеянное органическое вещество, б — угли, в — сланцы
связывают преобладание теплых климатов («парниковый эффект»).
В неогене произошло резкое уменьшение содержания СО2, началось
похолодание.
По М. И. Будыко, зная количество органического углерода в оса-
дочных породах континентов, можно рассчитать и содержание О2 в
былых атмосферах (рис. 118). Как видим, отчетливо выражена перио-
дичность в содержании СО2 и О2: в каледонском цикле максимальное
содержание обоих газов было в ордовике, в герцинском — в нижнем
карбоне, в альпийском — в верхней юре и нижнем мелу; соответствен-
тс
/О г
* 500мн.лЪг! 400 \ЗОд : ..200 / 100 \ О
°L[о,|о, 10,1 s,lsj d/dJoJ с,I ci?,l р, I pJtJiJtj li.lilajl к,I
Рис. 118. Изменения относительной массы углекислого газа тс и относи-
тельной массы кислорода (т0) в фанерозое (по М. И. Будыко, А. Б. Ро-
нову и А. Л. Яншину)
ио минимальные содержания падают на нижний кембрий, нижний де-
вон и средний триас. С изменением химического состава атмосферы
авторы связывают эволюцию организмов.
Отмечая цикличность развития природных систем, А. В. Жирмун-
ский и В. И. Кузьмин подчеркивают смену в пределах цикла двух раз-
личных фаз: длительной эволюционной фазы и относительно короткой
фазы резкой перестройки («критический рубеж», «скачки»). Фаза пере-
стройки сменяется новой эволюционной фазой. Существенно, что авто-
ры установили количественные закономерности такой перестройки: со-
отношение количественных характеристик последовательных крити-
ческих уровней развивающихся систем измеряется величиной е*.
Хотя эти построения основаны преимущественно на биологических
465
данных, они подтверждаются также геологическими и астрономиче-
скими фактами (фазы циклов трансгрессий и регрессий, стратигра-
фические рубежи фанерозоя, неогена, четвертичного периода и т.д.).
В ряде случаев речь может идти только об аппроксимации геологиче-
ских данных к формуле авторов. Хотя построения не лишены дискусси-
онности, они представляют большой интерес и для геохимии, где, как
и в других естественных науках, многие количественные зависимости
имеют экспоненциальный характер, т. е. связаны с числом «е».
Катастрофические космические факторы в геологической истории.
В Италии, Дании, Испании, Новой Зеландии, Китае, Гаити, США,
илах Атлантического и Тихого океанов и других регионах Л. Альва-
рес и другие обнаружили повышенные концентрации 1г в осадочных
породах, относящихся к границе мезозоя и кайнозоя (65 млн. лет на-
зад). С этой границей связана исключительно резкая перестройка фа-
уны, гибель около 75 % видов животных, в том числе динозавров.
Причина «великого мелового вымирания» давно уже привлекает вни-
мание, высказывались самые различные гипотезы, но ни одна из них
не была доказана.
Кларк 1г в литосфере континентов равен 2- 10_8%, но в погранич-
ном слое его содержание выше в десятки и сотни раз. Обогащены 1г и
каменные метеориты (4,8- 10-5 %). Это и послужило основанием для
гипотезы о столкновении Земли с астероидом диаметром 10 км на гра-
нице мела и палеогена. Полагают, что подобная космическая катастро-
фа могла привести к сильному запылению атмосферы, резкому кратко-
временному похолоданию и вымиранию фауны. Было также отмечено,
что с иридиевой аномалией в осадках в общем совпадает и формиро-
вание мировой рифтовой системы.
В адрес гипотезы Альвареса высказываются критические замеча-
ния: смена фауны происходит быстро только в геологическом смысле, в
действительности она охватывает миллионы лет, аномалии 1г обнару-
жены также в вулканических газах (Килауэа на Гавайских островах)
и т.д. Иридиевые аномалии обнаружены также на границе венда и
кембрия (570 млн. лет назад), перми и триаса (248 млн. лет), в туроне
(90 млн. лет), в среднем-позднем эоцене (40 млн. лет назад), в слоях
торфа, образовавшихся в 1908 г. в районе так называемой тунгусской
катастрофы. В некоторых погребенных слоях установлены аномалии
Os, изотопного состава О и С.
По В.Л. Масайтису, бомбардировка земной поверхности метеори-
тами имела место на протяжении всей геологической истории, ее сле-
дами служат астроблемы — кольцевые структуры типа кратеров, ко-
торые установлены в разных регионах Земли (Аризонский кратер в
США, кратеры на о. Саарема в Эстонии, Попигайская структура в
Восточной Сибири и др.). Образовавшиеся в астроблемах при ударе
породы —импактиты нередко также обогащены 1г. По Б. С. Зейлику,
большое число астроблем возникло в Казахстане в конце палеозоя.
С ними он связывает магматизм (плавление пород от удара). Д. Нор-
ман, Н. Прайс и другие зарубежные ученые полагают, что удары ме-
466
теоритов, которые достигали размеров астероидов, приводили к фор-
мированию крупных кольцевых структур с радиусом, превышаю-
щим 1000 км. С ними также связывают рудообразование. Ударные
кольцевые структуры хорошо выявляются космическими съемками.
Земная кора и верхняя мантия как особая система. Геохимический
цикл. Связь между глубокими частями земной коры и биосферой ранее
считалась прямой: полагали, что магматизм и вулканические эксгаля-
ции, складчатость, горообразование и другие эндогенные процессы вли-
яют на выветривание, осадкообразование, деятельность подземных
вод и другие экзогенные процессы. Обратное влияние экзогенных про-
цессов на эндогенные не рассматривалось. Однако за последние десяти-
летия установлено, что связи между этими процессами не прямые, а
обратные: биосфера влияет на состав гидротермальных растворов,
магматизм и т. д. Напомним в этой связи о роли вадозных вод в
питании гидротерм, о том, что многие граниты образовались за счет
переплавления осадочных пород, о субдукции, «засасывающей» в
мантию океанические осадки, о газовом дыхании земной коры, об оса-
дочном происхождении серы части гидротермальных сульфидов и т.д.
Следовательно, земную кору и верхнюю мантию следует рассматривать
как большую и сложную динамическую систему, развивающуюся на ос-
нове механизма положительной и отрицательной обратной связи. При-
мером последней служит связь вулканизма с биосферой: вулканизм
поставляет СО2 в атмосферу и гидросферу, а фотосинтез и карбонато-
образование изымают СО2, связывают С в карбонатах и органических
соединениях. В результате содержание СО2 в атмосфере и гидросфере
уменьшается, система саморегулируется и стабилизируется.
Единство земной коры находит выражение и в общих законах разви-
тия ее отдельных частей и коры в целом: необратимости эволюции,
периодичности развития (циклоидальности), негэнтропийности, гео-
генетическом законе.
Несколько важнейших геохимических факторов и процессов опреде-
ляют своеобразие большинства систем земной коры. Это в первую оче-
редь окислительно-восстановительные процессы, результаты кото-
рых особенно наглядно проявляются в биосфере, где фотосинтез, раз-
ложение органических веществ и многие другие процессы суть явле-
ния окислительно-восстановительные (гл. 14). Значение данных про-
цессов также велико в магме и гидротермальных системах (гл. 10,12).
Сказанное объясняется огромной ролью окисления и восстановления в
энергетике земной коры. Именно поэтому важнейшей геохимической
характеристикой большинства систем и земной коры в целом служат
окислительно-восстановительная зональность, отвечающие ей геохи-
мические барьеры — окислительные А и восстановительные Б, С, ти-
пы концентрации элементов А 6, А 7 и др. При дальнейшей дифферен-
циации геохимических условий во многих системах ведущее значение
приобретают щелочность и кислотность среды. Для большинства сис-
тем характерны щелочно-кислотная зональность, кислые Е, щелоч-
ные Д барьеры, типы концентрации Д 1, Д 2, Е 3, Е 4, и др.
467
Большую роль в земной коре играют круговорот воды и биологиче-
ский круговорот атомов.
Следовательно, для земной коры характерна не только дифферен-
циация, но и интеграция —общие черты, позволяющие рассматривать
ее с единых позиций как целостную систему. Проявление таких «инте-
гральных тенденций» получило яркое выражение в концепции «Гео-
химического цикла», рассматривающей тектонические процессы, маг-
Рис. 119. Геохимический цикл:
/--поглощение вещества и энергии из космоса и мантии, 2 — поступление вещества и энер-
гии в космос и мантию, 3 — выделение энергии в ходе большого круговорота, 4 —рост ин-
формации (разнообразия), 5—уменьшение информации (разнообразия), 6— начало нового
цикла круговорота
матизм, осадкообразование н эволюцию жизни как звенья единого про-
цесса развития. В. И. Вернадский в 1939 г. писал, что в земную кору
входят биосфера, стратисфера, метаморфическая и гранитная оболоч-
ки, которые генетически между собой связаны и взятые в целом пред-
ставляют одно явление. К «былым биосферам» ученый относил граниты,
которые, по его представлениям, образовались за счет переплавления
осадочных пород. Геохимический цикл, как и другие круговороты, сле-
дует понимать как форму поступательного развития — циклоиду или
спираль (рис. 119).
468
Если верны положения теории тектоники плит о субдукции, то в
геохимическом цикле участвует не только земная кора, но и мантия,
засасывающая в зонах Заварицкого-Беньофа осадочные породы, хими-
ческие элементы которых при магматизме и горообразовании снова
поступают в земную кору и биосферу. С и Н из СО2 и Н2О в биосфере
входят в состав органического вещества и являются геохимическими
аккумуляторами солнечной энергии. Они «зарядились» ею в ландшаф-
тах и верхних горизонтах моря. При участии микроорганизмов эти эле-
менты окисляются доСО2, Н2О и других соединений. Так, геохимиче-
ские аккумуляторы «разряжаются» и отдают заключенную в них
энергию. Часть ее рассеивается в виде тепла, а часть расходуется на
рудообразование и другие геохимические процессы.
По Н. В. Белову и В. И. Лебедеву, А1 и некоторые другие металлы,
входящие в состав глинистых минералов, также могут аккумулировать
солнечную энергию. В полевых шпатах — характерных магматиче-
ских минералах — А1 находится в центре кислородных тетраэдров.
Расстояние А1 — О составляет 0,16—0,175 нм. В то же время глинистые
минералы содержат часть А1 в шестерной координации, в которой рас-
стояние А1 — О уже 0,18—0,20 нм. Таким образом, в биосфере произо-
шли процессы, в ходе которых расстояние между А1 и О в кристалличе-
ской решетке увеличилось. На это должна была затратиться энергия.
Так солнечная энергия аккумулировалась в процессе превращения
полевых шпатов в глины. Последние с энергетической точки зрения яв-
ляются аналогами углей и других органических веществ. Опускаясь
на большие глубины и переплавляясь, глинистые минералы превра-
щаются в магму, из которой опять кристаллизуются полевые шпаты.
При этом А1 переходит из октаэдров в тетраэдры, расстояние между ним
и О уменьшается, выделяется энергия. Так, энергия, поглощенная в
биосфере, выделяется в магматических очагах и на ряду с радиоактив-
ной энергией служит причиной горообразования и других эндогенных
процессов. Глинистые минералы выступают в роли своеобразных «го-
рючих ископаемых», которые в отличие от угля отдают заключенную в
них энергию лишь при высоких температурах плавления пород. К со-
жалению, данная гипотеза еще не стала теорией, ее проверка затруд-
няется сложностью эксперимента.
Если гипотеза геохимических аккумуляторов верна, то понятие о
геохимическом цикле вещества дополняется понятием о переносе энер-
гии, который также связывает процессы земной поверхности и магма-
тизма. В. А. Ильин и А. В. Щербаков подчеркивают большое значение
поглощения солнечной энергии на земной поверхности при дезинте-
грации пород и ее выделение при метаморфизме.
В геохимическом цикле закономерно меняется и количество инфор-
мации. При переплавлении осадочных пород разнообразие уменьшает-
ся, так как возникает более или менее гомогенный расплав — магма
(см. гл. 12), увеличивается тепловое хаотическое движение атомов и
молекул — возрастает энтропия.
469
При остывании магматического очага и кристаллизации серии из
верженных пород (например, диориты—- гранодиоритыграниты)
разнообразие увеличивается, информация растет. Самое большое раз-
нообразие и уменьшение энтропии характерно для биосферы с ее мил-
лионами видов организмов, большим числом экзогенных месторожде-
ний, ландшафтов, почв и других биокосных систем. В биосфере возник
новый — биологический вид информации, увеличилось ее общее коли-
чество.
В земной коре и верхней мантии, следовательно, развиты две кате-
гории процессов: идущих с накоплением энергии, увеличением разнооб-
разия, дифференциации, сложности, уменьшением энтропии и ростом
информации и идущих с выделением энергии, увеличением энтропии,
уменьшением разнообразия, сложности и информации. Обе категории
процессов характерны как для биосферы, так и для земных глубин,
но первые явно преобладают в биосфере, а вторые — в очагах регио-
нального метаморфизма и магматизма.
В земных глубинах большое значение приобретают радиоактивный
распад и другие эндогенные источники энергии. Следовательно, для
земной коры и верхней мантии характерно взаимодействие солнечной
и глубинной энергии. Материя и энергия биосферы тем или иным пу-
тем взаимодействуют с внутренней энергией Земли, веществом глубин-
ного происхождения. Поэтому геохимический цикл не замкнут и в ниж-
ней части (так как продукты биосферы испытывают влияние эндоген-
ных факторов).
В 1955 г. автор писал о необходимости рассматривать с позиций цик-
ла процессы биосферы и магматизма, возможности установления при-
чинных связей между ними. Мы полагали, что при разработке общей
теории геологии нельзя игнорировать существование глубоких и об-
ратимых связей между развитием жизни на Земле, осадкообразовани-
ем, тектоническими явлениями и магматизмом. Именно в связях меж-
ду поверхностными и магматическими процессами автор усматривал
один из основных законов геологии, а сами процессы считал различны-
ми проявлениями единого грандиозного по длительности и сложноти
процесса развития земной коры.
За прошедшую треть века получены новые подтверждения существо-
вания геохимического цикла.Так, А. В. Сидоренко и другие писали о
большом круговороте газов: при осадкообразовании поглощаются СОг
(известняки и др.), Н2О (глины), О2, N2 (органическое вещество), ко-
торые снова превращаются в газы при погружении осадочных толщ,
их метаморфизме и переработке магматизмом (вулканизм и др.). Тако-
во грандиозное «дыхание» земной коры.
Итак, мы полагаем, что между тектоно-магматическими процес-
сами, процессами биосферы в том числе и осадкообразованием существу-
ет обратная связь, что в совокупности эти процессы образуют геохи-
мический цикл. Логично предположить, что осадочные породы образовав-
шиеся в докембрии и начале палеозоя, были метаморфизованы и грани-
тизированы в ходе каледонского магматизма и орогенеза, осадки, на-
470
копившиеся в девоне и нижнем карбоне, — в процессе герцинского маг-
матизма и орогенеза и т. д. Отсюда следует, что особенности осадкооб-
разования в протерозое могли найти отражение в байкальской метал-
логении, особенности докембрийского и нижнепалеозойского осадко-
образования — в каледонской, палеозойского — в герцинской и т.д.
Иначе говоря, причину своеобразия металлогении отдельных эпох
следует искать также и в своеобразии предшествующего осадкообразо-
вания. Эта концепция в последние годы находит все больше привер-
ценцев. Г. В. Войткевич пишет: «Осадконакопление в биосфере все бо-
лее подвергалось влиянию жизни. Это привело к резким концентра-
циям новых веществ в осадочной оболочке, в ее отдельных частях. Вов-
леченные впоследствии в процессы ультраметаморфизма древние тол-
щи осадочных пород становятся потенциально рудоносными. В этом
кроется одна из причин возникновения металлогенических провинций
в земной коре» С подобных позиций трактовал эндогенное рудообра-
зование и А. И. Тугаринов.
Так как в ходе геологического времени росла дифференциация оса-
дочных пород и биосферы в целом, то естественно, что в каждом после-
дующем тектоно-магматическом цикле перерабатывались все более и
более дифференцированные осадки, более богатые геохимическими аку-
кумуляторами. А это должно было усиливать энергию тектонических
процессов, рудообразования, увеличивать высоту воздымавшихся гор-
ных хребтов. Следовательно, первопричина увеличения сложности и
разнообразия эндогенных систем, которую установили Д. Рундквист и
другие исследователи, возможно, состоит в развитии биосферы, уве-
личении ее сложности и разнообразия, прогрессивном накоплении в
ней солнечной энергии. Объяснить прогрессивное развитие эндогенных
систем за счет глубинных источников энергии трудно, так как количе-
ство радиогенного тепла со временем не увеличивалось, а уменьша-
лось.
Своеобразие металлогении отдельных зон земной коры, общую про-
грессивную эволюцию эндогенной металлогении необходимо увязать с про-
грессивной эволюцией осадкообразования, ростом разнообразия биосфе-
ру, накоплением в ней солнечной энергии (угли, глины и т.д.).
Признание земной коры и верхней мантии динамической системой,
развивающейся на основе механизма обратной связи, ставит вопрос о
центре (или центрах) этой большой системы. Можно ли говорить о цент-
ре земной коры, т. е. о такой ее части, которая имеет ведущее значение,
определяет функционирование системы в целом? Существует один
центр или их два и больше, система яляется бицентрической или по-
лицентрической? Несомненно, одним из центров является биосфера,
которая уже несколько миллиардов лет поглощает солнечную энергию
и в процессе биологического и других круговоротов превращает ее в
энергию геохимических процессов. Другим возможным центром, уп-
равляющим механизмом земной коры, является верхняя мантия или
1 Войткевич Г. В., Закруткин В. В. Основы геохимии. М., 1976. С. 309.
471
нижние горизонты земной коры с очагами корового магматизма. Оче-
видно, что установление центров — частей земной коры, управляющих
ее механизмом, в частности выявление относительной роли поверхност-
ного (биосферного) и глубинного (мантийного и др.) центров, составля-
ет важную задачу наук о Земле, в том числе и геохимии.
Сказанное позволяет говорить о следующем законе прогрессивного
развития верхней оболочки нашей планеты-, земная кора и верхняя ман-
тия представляют собой сложную динамическую систему с обратными
связями-, непрерывное поступление в нее солнечной энергии, а также
глубинной энергии определяет направленное развитие тектоносферы и
биосферы, в ходе которого увеличиваются их сложность и разнообра-
зие, неравновесность, накапливается свободная энергия, уменьшается
энтропия. Прогрессивное развитие осуществляется через систему после-
довательных геохимических циклов, включающих в себя тектономагма-
тические и биосферные циклы.
26. ГЕОХИМИЧЕСКИЕ ЭПОХИ
Геохимическими эпохами А. Е. Ферсман назвал периоды специфи-
ческого накопления отдельных элементов или целой ассоциации эле-
ментов. При составлении геохимической карты СССР были выделены
литофильный, сидерофильный и халькофильный типы геохимических
эпох, которые неоднократно повторялись в геологической истории. Так,
по В. А. Руднику и другим, в докембрии первая эпоха значительной
концентрации литофильных элементов была около 3,5, вторая 3—2,6,
третья (самая значительная) 2,2—1,7 млрд, лет назад. Сидерофильный
тип геохимических эпох был наиболее характерен для катархея (ра-
нее 3,5-109 лет) и затем до 1,3-10® лет их роль ослабевала. Начиная с
этого рубежа и до 0,25-10® лет значение этих геохимических эпох в ге-
ологической истории вновь увеличилось. Установлен ряд эпох халь-
кофильного типа.
Автор в основу выделения геохимических эпох положил геохимические
циклы, которые именуются по характерным для них тектоно-маг-
матическим циклам, выделенным в исторической геологии и металлоге-
нии. При этом имеются ввиду не только эпохи магматизма, складчато-
сти и горообразования, нои предшествующие им эпохи прогибания гео-
синклиналей, накопления осадков, а также сопряженные процессы
развития жизни, выветривания и денудации. К данному геохимическому
циклу относятся и процессы на платформах, других структурах зем-
ной коры.
Геохимические циклы
Геохимия катархея (4,3—3,5 млрд.лет назад) проблематична. Эту
стадию развития земной коры именуют также «лунной» (О. А. Богати-
ков и др.). Молодая земная кора была сложена анортозитами и серы-
472
ми гнейсами. Магматизм был примитивным базальтовым, который по
гипотезе «непрерывной дегазации» У. Руби и других геохимиков оп-
ределял состав атмосферы и гидросферы. Атмосфера была восстанови-
тельной, содержала СО, СО2, N2, НС1, HF, Н2 и другие газы. Иным
был и первичный океан. Имеются гипотезы о его кислотности за счет
растворения НС1, HF и других кислых вулканических газов. Предпола-
гается, что большое значение имела метеоритная бомбардировка зем-
ной поверхности, приведшая к образованию астроблем, аналогичных
кратерам Луны, Меркурия и Марса. При ударах происходила «удар-
ная дегазация» земной поверхности, в ходе которой, как показали экс-
перименты М. В. Герасимова и Л. М. Мухина, из пород могли выделять-
ся Н2О, СО2, SO2,N2, О2, Н2, СО, H2S, COS,CS2, HCN и другие газы.
По мнению этих авторов, газы участвовали в создании ранней атмосфе-
ры и гидросферы планеты (О2 в ней не накапливался из-за участия в
окислительных реакциях, Н2— из-за диссипирования в космос).
В. И. Шульдинер к катархею предположительно относит гнейсово-
гранулитовые (глубокометаморфизованные) комплексы древних плат-
форм. По гипотезе Д. Шоу температура на поверхности ранней Земли
достигала 600 °C, давление превышало 3-107 Па.
Изучение углистых хондритов и лунных пород показало, что орга-
нические соединения в них возникли в космических условиях. Таким
образом, данные соединения могли быть и в ранней Земле. Они могли
синтезироваться и в первичной земной коре: СН4, NH3, СО2 и другие
соединения под влиянием нейтронов и протонов космических лучей,
электрических разрядов, коротковолнового ультрафиолетового излуче-
ния Солнца, радиоактивного излучения и других источников энергии
могли давать сложные органические соединения. В начале 50-х годов
С. Миллер (США), пропуская электрический разряд в системе СН4 -
NH3 — Н2О, синтезировал мочевину, муравьиную кислоту и фор-
мальдегид. Позднее были синтезированы аминокислоты — основа
жизни. Следовательно, ранее 4 млрд, лет назад гидросфера вполне мо-
гла содержать растворенные органические вещества. В этом «первич-
ном бульоне», по гипотезе А. И. Опарина и Д. Холдейна, зародилась
жизнь. Абиогенный синтез аминокислот и других органических соеди-
нений с последующим биогенезом, возможно, имел место и в гидротер-
мах (в связи с вулканизмом). Первые организмы питались готовыми
органическими соединениями и органического фотосинтеза в то время,
вероятно, не было, но за счет фотодиссоциации воды в атмосферу могло
поступать небольшое количество кислорода. У земной поверхности
синтезировался и озон. Однако эти сильные окислители все время рас-
ходовались на окисление минералов.
Наряду с «земной» гипотезой происхождения жизни давно уже была
высказана идея о ее зарождении в космосе и занесена Землю (в виде
спор бактерий и т.д.).
Важная особенность жизни — нарушенная зеркальная симметрия
в организмах. Все природные аминокислоты относятся к левым опти-
чески активным зеркальным стереоизомерам, а природные сахара -
473
к правым. На данную особенность жизни обращали внимание еще
Л. Пастер и В. И. Вернадский. В. И. Гольданский полагает, что возник-
новение жизни во Вселенной было связано с «Биологическим большим
взрывом» — разделением оптических антиподов (левых и правых изо-
меров). Этот аспект происхождения жизни привлекает большое внима-
ние физиков.
Геохимические циклы архейского—догеосинклинального этапа
(3,5—2,5 млрд, лет назад). В архее (AR) установлено не менее трех
крупных тектоно-магматических, а следовательно, и геохимических
циклов (колебания возраста в пределах ±100 млн. лет): белозерский
(3,5 млрд, лет назад), Кольский (3 млрд, лет назад) и родезийский, или
шамваянский (2,6 млрд, лет назад).
3 млрд, лет назад 40 К выделял радиогенного тепла в 5,3 раза боль-
ше, чем сейчас, a 235LJ — в 18 раз. Обилием радиогенного тепла
А. И. Тугаринов объяснял большую активность тектогенеза AR, от-
сутствие гигантских платформ и т.д. Расчеты показывают, что около
2,5 млрд, лет назад произошло резкое уменьшение выделения радиоген-
ного тепла, и этот перелом хорошо коррелируется с резким затуханием
тектоно-магматических процессов в начале протерозоя (PR).
Для AR характерны породы зеленокаменных и серогнейсовых комп-
лексов. Последние по элементарному составу близки к гранитоидам, но
отличаются от более поздних пород этого типа меньшим содержанием
Mg, Fe, Rb, Pb, U, Y, TR и большим содержанием Al, Na, Sr, Ba.
Весьма вероятно, что с каждым новым геохимическим циклом в него
вовлекалась все большая масса осадочных пород и земная кора стано-
вилась все более дифференцированной. В пользу этого говорит тот факт,
что последний шамваянский цикл отличался исключительно интенсив-
ным магматизмом. Основные породы были метаморфизованы и грани-
тизированы, возникли гранитогнейсовые толщи щитов, началось фор-
мирование гранитного слоя. Ф. П. Митрофанов и соавторы считают, что
в земной коре в то время существовал астеносферный слой, реликтом
которого являются гранитные мигматиты — породы со степенью плав-
ления 10—30 %.
В гипотезе П. П. Тимофеева, А. В. Щербакова и В. А. Ильина пред-
полагается, что формирование астеносферы — следствие отложения
тонких осадков на дне первичных океанов (осадки играли роль «теп-
лозапирающего слоя», благоприятствовавшего накоплению энергии в
верхней мантии).
Атмосфера AR, очевидно, была слабо восстановительной углекис-
лой (бескислородной или малокислородной). Об этом говорит состав
пород, руд и продуктов выветривания того времени. В этих условиях
в биосфере господствовала глеевая среда, контрастность окислительно-
восстановительных условий была меньше, чем в современную эпоху:
не было ни столь низких Eh, как в болотах, солончаках или глубоких
водоносных горизонтах, ни столь высоких, как в почвах, реках, коре вы-
ветривания. Интенсивный вулканизм обогащал атмосферу СО2, Fe и
474
Мп энергично мигрировали в форме Fe (НСО3)2 и Мп (НСО3)2. Суль-
фидная сера не окислялась и воды были гидрокарбонатными.
В породах возрастом около 3,5 млрд, лет обнаружены следы бакте-
рий и синезеленых водорослей. Свободное углеродистое вещество чаще
встречается в гнейсах и других продуктах метаморфизма глинистых
осадков, реже в карбонатных породах (мраморах и др.) и кварцитах,
что соответствует известной закономерности распределения органиче-
ского вещества, которое больше накапливается в глинистых и меньше
в песчаных осадках. Хотя С в докембрийских породах часто присутст-
вует в форме графита, с помощью изотопных соотношений, микроско-
пии и других методов установлена его первичная биогенная и седимен-
тогенная природа. Предполагается, что сотни миллионов лет жизнь
была строго ограничена в своем распространении: губительный ультра-
фиолет определял безжизненность и земной поверхноси, и самого
верхнего горизонта водоемов (до глубины 10 м). По представлениям
голландского ученого М. Руттена, жизнь в то время была представле-
на бентосными организмами, обитавшими в илах озер, в прибрежных
участках морей и океанов на глубине более 10 м.
На преобладающей части суши господствовали абиогенные ланд-
шафты. Это была биосфера без органического фотосинтеза. Обнаруже-
ние аминокислот и термофильных бактерий в горячих источниках
вулканических районов позволило предположить, что вулканизм играл
важную роль на первых этапах развития жизни (Е. К. Мархинин).
Земная кора AR отличалась однообразием, пространственная диф-
ференциация была относительно слабой. Архейские формации не по-
хожи ни на отложения платформенного чехла, ни на осадки геосинкли-
налей. Только во второй половине AR стали развиваться пологие де-
прессии — протогеосинклинали. Кремнистые, высокоглиноземистые,
железистые, карбонатные и другие илы той эпохи дали начало квар-
цитам, джеспилитам, мраморам и другим породам. Предполагается, что
осадки отлагались в неглубоких морях и крайне медленно, так как су-
ша была плоской (на это указывает отсутствие конгломератов). Кли-
мат был теплым и влажным, о чем свидетельствует разделение в оса-
дочном цикле Fe, Al и Si. Однако не исключаются и оледенения.
Продукты осадочного и вулканогенно-осадочного архейского лито-
генеза в ходе геохимического цикла были изменены метаморфизмом и
гранитизацией. Для архейских пород в целом характерно повышен-
ное содержание сидерофилов преимущественно группы железа. Отме-
чается также тесная корреляция Fe, Cr, Ni, Со, Ti и V.
По В. А. Руднику, для эпохи гранитизации конца архея и раннего
протерозоя были характерны также процессы натриевого, калиевого,
кремний-калиевого, фосфорного, железо-магнезиально-кальциевого и
прочего метасоматоза, который привел к миграции рудогенных, пре-
имущественно литофильных элементов — Zr, TR и др.
С Аг связано сравнительно небольшое число месторождений Fe,
Mn, Au, Cr, Ti, Ni, полиметаллов. Возможно, это частично объясня-
лось отсутствием восстановительных барьеров в биосфере. В связи с
475
этим металлы в осадках не накапливались. Последнее затруднило на-
копление металлов и в эндогенных процессах.
Геохимические циклы протерозоя (PR—2,5—1,7 млрд. лет).
Нижняя граница PR по тектоническим данным совпадает с важным
этапом развития биосферы — началом органического фотосинтеза. По
многим представлениям, окислительная атмосфера появилась около
2,2 млрд, лет назад (судя по накоплению окисных железных руд —
джеспелитов). В PR началось образование и высокоуглеродистых фор-
маций. С появлением О2 в атмосфере возникла возможность развития
аэробных организмов. В позднем протерозое (1,9—1,6 млрд, лет назад),
по Б. С. Соколову, появились эукариоты.
В PR уже формировались типичные геосинклинальные и платфор-
менные формации. Рельеф стал более расчлененным, появились грубо-
обломочные отложения. Широко был распространен и вулканогенно-
осадочный литогенез, с которым некоторые авторы связывают сидеро-
фильную геохимическую эпоху накопления железисто-кремнистых
илов, давших начало железистым кварцитам (джеспелитам). Эти поро-
ды формировались еще в AR, но наибольшее развитие получили в ран-
нем PR. Их генезис до сих пор не ясен, хотя имеются различные ги-
потезы: Н. М. Страхова, А. А. Саукова, Ю. П. Мельника, А. А. Дроздов-
ской и др. Железистые кварциты характерны для многих платформ
(на Русской платформе— Кривой Рог, КМА и др.). На платформах
PR формировались также месторождения Аи и U (золотоносные конгло-
мераты), Cu, Pb, Zn, Ag и других металлов. Многие исследователи раз-
вивают представления о первично-осадочной природе этих руд (с по-
следующим наложением метаморфизма и гидротермальных процессов).
В PR было два крупных тектоно-магматических цикла (±100 млн.
лет): беломорский (1900 млн. лет назад) и карельско-свекофенский
(1750 млн. лет назад). С ними связаны мощные процессы гранитизации
осадочных пород. В эти же эпох и формировались ультраосновные и ос-
новные породы, обогащенные Ni, Со, Cu, S, с которыми связаны Си-
N i - местор ожден и я.
В PR впервые возникли гидротермальные месторождения, формиро-
ванию которых, по А. И. Тугаринову, предшествовало осадкообразова-
ние с накоплением повышенных количеств металлов. Переработка та-
ких пород в ходе магматизма определила формирование гидротермаль-
ных растворов, из которых осаждались эндогенные руды. В PR около
1900 млн. лет назад впервые проявился и щелочной магматизм.
Таким образом, PR характеризовался большим разнообразием тек-
тоносферы и биосферы, чем AR; в это время возникли новые геохими-
ческие процессы, метаморфизм и вулканизм ослабли.
Протерозойские циклы отмечены исключительно энергичным рудо-
образованием. Для докембрия в целом (главным образом PR)
И. Г. Магакьян приводит следующие размеры рудных запасов (в %
от общих мировых запасов и с учетом отработанных месторождений):
Fe —75; Au — 70; Ni — 70; Ti — 80; Cu — 25; Pb и Zn— 10;
Cr — 20.
476
Характерны также крупные запасы руд U, Со и Pt. К докембрий-
ским платформам и срединным массивам приурочены и крупнейшие
эндогенные месторождения литофильных редких металлов — Li, Rb,
Cs, Be, Sr, Y и TR, Zr и Hf, Nb и Ta (H. А. Солодов).
Геохимические циклы рифея (RF — 1,7—0,7 млрд. лет). В начале
RF около 1500 млн. лет назад атмосфера все еще содержала много СО2,
но в ней накопился уже и О2 (по ориентировочным расчетам М. И. Бу-
дыко до 15—20 % от массы О2 в настоящее время). Предполагается,
что это способствовало появлению многоклеточных организмов в кон-
це рифея — начале венда, появлению в водах сульфатов, понижению
миграционной способности Ва (в результате осаждения барита) и Fe.
По В.С. Певзнеру и Ю. К. Буркову, граница с рифеем — «сульфатно-
кислородный геохимический рубеж».
В начале RF в окислительной среде Fe2+ стало переходить в Fe’*
появились красные почвы, красноцветные формации, окраска которых
свидетельствует об окислительной среде осадкообразования. Цвет этих
отложений обусловлен оксидами и гидроксидами Fe, пленки которых
облекают пылеватые и песчаные частицы. Общее с одержание Fe в крас-
ноцветах часто не превышает кларка. В RF началось и накопление
пластов и линз органического вещества (шунгиты и др.).
Кислородная атмосфера создала возможность для появления жи-
вотных, которые еще не имели скелетных форм (мягкотелые). В райо-
нах влажного климата формировалась кислая каолиновая или гидро-
слюдистая кора выветривания, остатки которой обнаружены во мно-
гих районах. В RF были крупные оледенения (940 и 770 млн. лет на-
зад), которые предположительно связывают с ослаблением вулканиз-
ма и уменьшением содержания СО2 в атмосфере.
В морях RF широко развились водоросли, которые почти полно-
стью освободили атмосферу от СО2. В результате их деятельности
сформировались мощные толщи карбонатных пород, близкие к доло-
митам. Для RF был характерен и вулканогенно-осадочный литогенез,
Хотя магматизм в целом сильно сократился.
Эпоха 1800—1100 млн. лет назад в тектоническом отношении была
относительно спокойной (медвежьеозерский— 1400 ± 100 млн. лет и
гренвильский—1000+100 млн. лет тектоно-магматические циклы).
В это время формировались уже все генетические типы эндогенных мес-
торождений, известные в фанерозое. Метаморфизм продолжал осла-
бевать (рис. 120, 121).
«Углекислое и углеводородное дыхание земной коры» в геохимических
циклах докембрия. По А. В. Сидоренко, в докембрии при метаморфизме
осадочных пород в атмосферу и гидросферу выделялось огромное ко-
личество СО2, которое во многом определяло характер климата, вывет-
ривания и осадкообразования. Захоронение СО2 в карбонатных поро-
дах и его выделение при метаморфизме было важным фактором разви-
тия биосферы и рудогенеза. При метаморфизме пород, содержащих ор-
ганические вещества, выделялись СН4 и другие углеводороды. В про-
477
межутках между эпохами метаморфизма происходило энергичное на-
копление осадков, поглощение СО2 из гидросферы и атмосферы.
Эволюция состава осадочных пород в докембрии. Вплоть до конца
протерозоя в осадочных породах росло содержание К и уменьшалось
Na, а позднее имела место обратная тенденция. В осадках докембрия
со временем уменьшалось отношение Mg/Ca и Mg /STR (но для эле-
ментов цериевой группы увеличивалось). В раннем докембрии осадки
были резко обогащены Fe.
Рис. 120. Эволюция состава осадочных пород
в докембрии (по А. И. Тугаринову):
/ — железистые кварциты, 2 — карбонаты, 3 — амфн-
боловые сланцы н глины. 4 — кварциты, конгломе-
раты, пески, 5 — граувакки, 6 — основные и ультра-
основные эффузнвы
Сингенетичные концен-
трации рудных элементов
в докембрии. Геохимичес-
кое картирование щитов
выявило крупные по объе-
му, но бедные по содер-
жанию массивы пород,
обогащенных Fe (железис-
тые кварциты КМА, Кри-
вого Рога и др.), А1 (киа-
ниты Кейв на Балтийском
щите), флогопитом, апати-
том, TR и Zr в конгломера-
тах, Си в песчаниках и
сланцах (Удокан); V, Р,
Мо в углеродсодержащих
кристаллических сланцах
И т. д.
Общие черты металло-
гении докембрия. Для это-
го времени особенно ха-
рактерно накопление сиде-
рофильных элементов, ко-
торое связывают с первич-
ным базальтоидным соста-
вом земной коры. Отме-
чается роль в рудообразовании дополнительного поступления ме-
таллов из мантии (р-н Печенги на Кольском п-ове и др.).
Фанерозойские геохимические циклы. В отличие от докембрия для
фанерозоя возможна характеристика отдельных циклов, расчленение
их на этапы по тектоническим условиям, составу атмосферы и другим
особенностям. Возможно, к фанерозою следует относить и венд (V—
700—570 млн. лет назад) и байкальский цикл, охватывающий венд и
кембрий. В. М.Синицин, В. Е. Хайн и другие исследователи на основе
геологических критериев относят V к фанерозою. В пользу этого го-
ворит и открытие обширной вендской фауны мягкотелых животных
(Б. С. Соколов).
В ходе байкальского тектоно-магматического цикла прекратилось
развитие большей части протерозойских геосинклиналей, возникли
478
и связывают вымирание /и;о ви-
С °! AZ I AR I PR. , I PR. | PZ
12 л К L
4500 3500 2700 1400 600 250 0
Абсолютное время, млн лет
Рис. 121. Изменение пропорций важнейших
групп пород областей эрозии континентов (по
А. Б. Ронову)
горные хребты — байкалиды. В Африке с этой эпохой связаны зна-
менитые месторождения Си, Со и V, в Забайкалье — колчеданные ме-
сторождения Zn. Широко был распространен пегматитовый процесс.
Некоторые байкальские складчатые системы развивались в кембрии,
ордовике и даже силуре. В венде было оледенение (650—610 млн. лет),
с которым некоторые иссле,
дов одноклеточных водо-
рослей, многих видов бак-
терий и одноклеточных
животных.
По А. Б. Ронову, соот-
ношение между осадочны-
ми формациями фанерозоя
было существенно иным,
чем в «позднем протеро-
зое». Так, морские песча-
но-глинистые формации
составляют лишь 45,5%
(против 75,3 % в позднем
протерозое), карбонатные,
напротив, увеличились до
19,9 % (против 11,4 %),
континентальные песчано-
глинистые — до 13,1 %
(7,6 %), вулканогенные -
до 15,8 %. Появились со-
леносные — 1 % и угле-
носные — 2,7 % форма-
ции. Количество крем-
нистых и ледниковых формаций (0,7 %) существенно не изменилось.
Приведенные соотношения говорят о большей дифференциации
стратисферы фанерозоя, а следовательно, и возможности боль-
шего разнообразия магматизма на основе механизма палингенеза и
анатексиса.
Каледонский геохимический цикл (570—410 млн. лет назад). В на-
чале цикла (кембрий) содержание О2 и СО2 в атмосфере было низким.
В результате энергичного вулканизма нижнего ордовика количество
СО2 резко возросло. В среднем и верхнем ордовике повысилось содер-
жание атмосферного кислорода, с которым связывают «взрыв видообра-
зования» (см. рис. 118). Здесь и в дальнейшем содержание О2 и СО2 в
палеоатмосферах приводится по М. И. Будыко, А. Б. Ронову и А. Л.
Яншину. В кембрии на суше уже существовали простейшие наземные
растения — псилофиты. Это были небольшие кустики, растущие по
сырым местам. Однако значительного накопления органического ве-
щества в континентальных отложениях не было, о чем свидетельствует
отсутствие углей этого возраста. Не было и геохимических барьеров,
задерживающих Мо, V, Си, Zn и другие металлы, осаждающиеся в
479
условиях восстановительной среды, т. е., как и в докембрии, это все
еще были примитивные пустыни со сплошной зоной окисления.
В начале кембрия произошел резкий скачок в эволюции морской
фауны: возникло большое число новых видов. Если в венде еще преоб-
ладали мягкотелые животные (без скелета), то начиная с кембрия про-
исходит быстрое развитие форм с известковым, фосфатным и кремни-
стым скелетом. О причине данного явления имеется много гипотез, в
том числе и геохимических. Так, по А. П. Виноградову, высокое со-
держание СО2 в морях RF определяло ненасыщенность воды Са, кото-
рый находился в растворимой формеСа (НСО3)2. В таких условиях жи-
вотным было трудно строить скелет из Са. Резкое понижение концент-
рации СО2 в атмосфере на границе кембрия привело к нарушению сло-
жившегося карбонатного равновесия, СаСО3 стал насыщать морскую
воду, и известковые скелеты стали устойчивыми. Эта интересная гипо-
теза, однако, не объяснила причину появления кремнистого скелета.
Все же предположение о резком понижении давления СО2 в конце вен-
да очень заманчиво и подтверждается новейшими расчетами. С этих
позиций можно объяснить появление известкового и фосфатного скеле-
тов, осаждение V, U и других металлов. Уменьшение содержания СО2
в атмосфере могло способствовать также похолоданию и оледенению.
Предполагают, что для начала кембрия было характерно повышен-
ное содержание О2 в атмосфере (см. рис. 118), которое оказало влияние
на формирование скелетных форм животных.
В морях каледонского цикла значительное распространение по-
лучили глинистые илы с сероводородной средой. Последующий мета-
морфизм превратил их в черные углеродистые сланцы, широко рас-
пространенные на всех континентах. Для черных сланцев характерны
рассеянное органическое вещество (или графит), высокое содержание
Si (кварц, халцедон), повышенное (против кларка) содержание Р, V, в
ряде случаев Au, Cr, Cu, Со, Ni, Mo, U. Содержание Fe, Al, Са, Mg,
Na и К часто ниже кларка. Механизм осаждения металлов на восста-
новительном и сорбционном барьерах, вероятно, был тот же, что и в
современную эпоху. Менее ясны причины накопления металлов.
В качестве таких причин выдвигались благоприятная область сноса,
исключительная медленность осадконакопления, накопление металлов
в морской воде в предшествующие эпохи и др. В последующие геохими-
ческие циклы накопление металлоносных илов сильно сократилось,
хотя и не прекратилось полностью (черные глины в олигоцене и др.).
Для каледонского цикла также характерно образование крупных
месторождений морских фосфоритов. Следовательно, это была не толь-
ко эпоха V — Мо — U, но и эпоха Р. Относительно протерозойских
осадков в этот цикл уменьшилось содержание Mg в карбонатах.
Каледонский цикл вызвал резкую дифференциацию климатов, по-
явление высотной поясности, обусловил включение в миграцию боль-
ших масс изверженных пород и руд металлов. В эту эпоху отчетливо
устанавливается горизонтальная климатическая дифференциация -
разделение на влажные и аридные области. Последние были на Сибир-
480
ской платформе, полуострове Индостан и в других районах. Кембрий —
первая эпоха соленакопления в истории Земли (соли Восточной Си-
бири и др.). Широкое распространение приобрели и красноцветные от-
ложения.
Основная фаза каледонской складчатости падает на силур, но из-
вестны и более ранние фазы — таконская (граница ордовика и силура)
и салаирская (в кембрии). Каледониды широко распространены в
Кузнецко-Саянской области, в Казахстане, на Урале, за пределами
СССР — в Скандинавии, Шотландии и других районах. Каледонская
металлогения сравнительно однообразна, для нее нехарактерны гидро-
термальные, грейзеновые и альбититовые месторождения цветных и
редких металлов и другие генетические типы эндогенных месторожде-
ний. Для территории СССР А. Д. Щеглов приводит следующие полез-
ные ископаемые этого времени: Fe, Мп, V, Ti, Сг, Ni, Pt, Со, Си, РЬ,
Zn, W, Mo, Sn, Au, Ag, Hg. Представляет интерес анализ особенностей
каледонской металлогении с позиций метаморфизма и гранитизации
осадочных толщ докембрия, кембрия и ордовика, в частности углеро-
дистых сланцев.
Герцинский геохимический цикл (410—200 млн. мт). Начало дево-
на (D) было отмечено регрессиями морей, широким распространением
аридных климатов и красноцветов, низким содержанием СО2 и О2
в атмосфере (но все же СО2 было значительно больше, чем в современ-
ную эпоху, —0,087 %). Усиление вулканизма в D2 — D3 и особенно
в карбоне (CJ привело к резкому повышению содержания СО2 в ат-
мосфере (наивысшему за весь фанерозой). Влажный климат D3-- С(
благоприятствовал фотосинтезу и максимуму О2 в атмосфере. С этим
М. И. Будыко и другие авторы связывают «взрыв видообразования» --
появление двух классов рыб, земноводных и рептилий. В дальнейшем
содержание СО2 колебалось, а количество кислорода постепенно
уменьшалось, достигнув наименьших за весь фанерозой значений в
Р2 — Т2 (см. рис. 118).
В D на материках в понижениях рельефа стало накапливаться ор-
ганическое вещество, развилась восстановительная среда. Следова-
тельно, единая слабовосстановительная глеевая среда AR сменилась в
PR и RF на окислительную, а в PZj — на резкоокислительную (в поч-
вах, реках, озерах и др.) и резковосстановительную (в болотах, илах).
В ландшафтах появилась окислительно-восстановительная зональность
(нетрудно убедиться, что эволюция окислительно-восстановительных
условий в ландшафтах отвечает диалектическому закону отрицания
отрицания: в PR отрицается восстановительная среда AR, а в D и
позднее развитие окислительной среды неизбежно привело к новому
отрицанию — появлению восстановительной среды. Однако это не по-
вторение архейских условий, а качественно новое, более сложное яв-
ление: сочетание восстановительной среды с окислительной).
В D, и D2 широко распространилась псилофитовая флора. В D2 это
были уже небольшие деревья. В конце D2 псилофиты вымерли, им на
смену пришли более высокоорганизованные папоротникообразные, на-
Зак 2022 481
чался палеофит. В D3 уже существовали настоящие леса. Эволюциони-
ровал и животный мир: продолжалось развитие рыб и беспозвоноч-
ных, на суше появились амфибии. В каменноугольном периоде широко
распространились палеофитные влажные тропики с «вестфальской фло-
рой» из плаунов, папоротников и хвощей. В лесных болотах захоро-
нялись деревья, давшие впоследствии мощные залежи угля. Однако
главный максимум угленакопления, по И. Б. Волковой, А. В. Лапо и
А. В. Македонову, падает на пермский период. Всего за С — Р обра-
зовалось 33,95 % разведанных запасов. В болотах С — Р интенсивно
развивалось оглеение — вынос Fe и Мп. Для континентальных отло-
жений были характерны оглеенные огнеупорные глины, сидериты, бе-
лые кварцевые пески, бокситы.
От современных влажные тропики С отличались не только видовым
составом растительности, но и составом атмосферы. С высоким содер-
жанием О2 связывают существование гигантских насекомых. Средняя
температура воздуха также значительно превышала современную, хотя
были и эпохи похолодания с материковым оледенением — среднепа-
леозойским (440—410 млн. лет) и позднепалеозойским в южном полу-
шарии (280—240 млн. лет).
В герцинском цикле существовали и аридные районы с красноцвет-
ными отложениями. D3 — вторая после кембрия эпоха мощного соле-
накопления. В С аридные ландшафты развивались в Гондване, но в
целом для С более характерны гумидные тропические и умеренные
ландшафты (арктической флоры не было). Резко усилилась аридиза-
ция в перми (Р), когда появились настоящие климатические пустыни,
интенсивно накапливались соли (третья эпоха соленакопления).
В Р большие пространства занимали красноцветные ландшафты. Гео-
химию красноцветов Р2 Русской платформы изучали А. Е. Ферсман,
Д. М. Миропольский, Л. В. Пустовалов и др. Красноцветные конти-
нентальные отложения неоднократно формировались и в послеперм-
ское время. Отсутствие в красноцветах органических остатков, резко-
окислительная среда указывают на экстрааридный пустынный климат
эпохи их образования, а обилие субаквальных отложений — иа более
влажный семиаридиый или даже семигумидный климат. Это противо-
речие автор объяснил тем, что в эпоху образования красноцветов на
суше не было растений, приспособленных к засушливому климату.
Поэтому в семиаридном климате, отвечающем современным степям и
саваннам, органического вещества было меньше и, следовательно,
были более развиты окислительные условия в почвах и водоемах. Ина-
че говоря, геохимические процессы протекали при меньшем количе-
стве живого вещества, как бы в пустынных условиях. Но испарение
и сток относились к семиаридному типу. Следовательно, по окисли-
тельно-восстановительным условиям красноцветные ландшафты при-
ближались к пустынным, а по стоку — к степям или лесостепям.
Аридные условия Р2 и Т1+2 не благоприятствовали фотосинтезу,
что, по мнениюМ. И. Будыко и других авторов, привело к низкому со-
держанию 0.2 в атмосфере этого времени, задержало эволюцию живот-
482
ных (в Р2—Т1+2 сократилось число таксонов ряда позвоночных живот-
ных). Для Tj характерен резкий минимум углеобразования.
Осадкообразование в морях герцинского цикла было разнообразно
и контрастно: широко распространились карбонатные и терригенные
формации, позволяющие предположить на основе метаморфизма и па-
лингенеза разнообразие магматизма и эндогенного рудообразования.
Герцинский тектоно-магматический цикл в большинстве регионов
охватывает С и Р. В это время существовали Урало-Монгольский и
другие гигантские геосинклинальные пояса, закончившие свое разви-
тие в Р и Т формированием складчатых поясов. Герцинская эндоген-
ная металлогения резко отличается от предыдущих эпох своим разно-
образием, формированием месторождений Fe, Ti, V, Cr, Cu, Pb, Zn, W,
Mo, Sn, Bi, Co, Au, Ag, Pt, Ta, Nb и других металлов. Металлические
богатства Урала, Казахстана и других рудных провинций СССР в зна-
чительной степени обусловлены герцинским геохимическим циклом.
Альпийский геохимический цикл (200 млн. лет. — современная
эпоха). Этот цикл изучен наиболее хорошо. Некоторые авторы выде-
ляют в нем два тектоно-магматических цикла — киммерийский и соб-
ственно альпийский. Как и у двух предыдущих циклов, начало аль-
пийского цикла ознаменовалось регрессиями морей, низким содержа-
нием О2 в атмосфере и сравнительно низким содержанием СО2 (см.
рис. 118). Энергичный вулканизм верхней юры — нижнего палеоге-
на определил резкий рост содержания СО2 (максимум в J 3). В дальней-
шем количество СО2 пони илось, но вплоть до N оно все же значит-
тельно превышало современное содержание (см. рис. 118).
В Т3 и J начался резкий рост О2 в атмосфере, с чем связывают по-
явление последних двух классов позвоночных — млекопитающих и
птиц. В Т3— Ki большую площадь занимали мезофитные влажные
тропики, в которых доминировали голосеменные, пришедшие в Р2
на смену папортникообразным. Особенно широко они распространи-
лись в конце Т3 и J,, когда на значительной части суши преобладал
жаркий и влажный климат, формировалась мощная кислая выщело-
ченная кора выветривания. В J2 — К2 был второй максимум углеоб-
разования (40,54 % разведанных запасов по подсчетам И. Б. Волко-
вой и др.). В палеогене был максимум накопления горючих сланцев
(95 % мировых запасов).
В конце Р вслед за сменой растительности произошла смена живот-
ного мира. В Р вымерли многие амфибии, насекомые. С начала мезо-
зоя сушу, воду и воздух завоевывают пресмыкающиеся. Поражают
гигантские размеры некоторых ящеров. В J появились птицы и первые
млекопитающие. Наряду с влажными тропиками в мезозое были и
влажные умеренные и аридные районы с красноцветными ландшафта-
ми (мел Средней Азии, Казахстана, Центральной Азии, Северной
Америки и др.).
В середине К часть голосеменных вымерла и им на смену пришли
покрытосеменные. В районах влажного тропического климата форми-
ровались кайнофитиые влажные тропики, особенно широко распро-
16* 483
странившиеся в палеогене и позднее. В корах выветривания и конти-
нентальных осадках этих ландшафтов происходило образование желез-
ных и алюминиевых руд, накапливались угли. Покрытосеменные стали
осваивать аридные районы, возникли степи и саванны.
С концом К связано «великое меловое вымирание фауны», которое
объясняют космической катастрофой — столкновением Земли с асте-
роидом (см. гл. 25).
В начале альпийского орогенеза развивался энергичный вулка-
низм, в атмосферу поступало много СО2. Так, в Nj атмосфера была при-
мерно втрое богаче СО2, чем современная (0,1 % против 0,03 %).
В водах содержание СО2 (и его производного — НСОз), вероятно,
также было повышено, что благоприятствовало карстовым процессам,
увеличению кислотности вод, кислому выщелачиванию почв и кор вы-
ветривания.
Основная закономерность размещения ландшафтов в начале Nj
была та же, что и в современную эпоху, — зональность (рис. 122).
Большую часть территории СССР занимала широкая зона влажных
лесных ландшафтов с теплым умеренным климатом и субтропическими
элементами во флоре. Даже в Восточной Сибири росли широколист-
веннохвойные леса с магнолией, секвойей, лавром, таксодиумом.
Южнее этой грандиозной лесной полосы в Приморье и Приамурье,
а также на Украине, по Нижнему Дону и низовьям Волги простира-
лись леса влажных субтропиков. Они преобладали на о-вах Кавказско-
го архипелага.
Рельеф Nj был расчленен слабее современного, преобладали низ-
менности и равнины, альпийские тектонические поднятия еще только
зарождались и, например, Урал представлял собой холмистую возвы-
шенность. Однако на юге Сибири и Дальнем Востоке уже поднимались
настоящие горы — невысокие предки Алтая, Саян, Байкальского и
других современных высоких хребтов с альпийским рельефом. Помимо
климата и рельефа, на формирование ландшафтов Nx большое влия-
ние оказывало также геологическое строение — состав пород (особен-
но их карбонатность или бескарбонатность), вулканизм.
Западнее Енисея в Nx преобладали лесисто-болотистые низменно-
сти с полноводными реками, широкими речными долинами, озерами.
В геохимическом отношении эти ландшафты напоминали низменности
современных влажных тропиков. Разложение большого количества
растительных остатков давало много растворимых органических ве-
ществ гумусового типа. Напомним, что в таких водах легко мигрирует
Рис. 122. Палеогеохимическая ландшафтная карта эпохи начала миоцена:
Классы геохимических ландшафтов: / — кислый (Н+); // — кислый и кислый глеевый (Н+,
Н+—Fe2+); /// — кислый, переходный к кальциевому (Н+—Са2*); IV — кальциево-иатрие-
вый, хлоридно-сульфатиый. содовый (Са2+—Na+, SO42*—Cl-); V — сернокислый, солянокис-
лый; / — гумидные субтропики, 2 — гумндные умеренные ландшафты с субтропическими эле-
ментами во флоре. 3 — семигумидиые и семнаридиые субтропики, 4 — субтропические лесо-
степи, саванны, степи, 5 — границы вулканических областей, 6 — древние речные долины,
’ — пресные озера
485
большинство химических элементов, образующих легкорастворимые
органо-минеральные комплексы. Поэтому почвы и континентальные от-
ложения подобных ландшафтов подвергались сильному выщелачива-
нию и почти целиком состояли из труднорастворимых минералов,
главным образом каолинита и кварца. Выщелачивание Fe приводило
к тому, что местами отложения Nj представлены почти чистыми квар-
цевыми песками и каолинами.
В болотах речных долин и озерных котловин накапливался торф,
впоследствии преобразовавшийся в уголь. Миоценовые бурые угли
известны в Белоруссии, на территории Башкирии и Оренбургской
области, на Сахалине. Еще шире было распространено углеобразова-
ние, не имеющее промышленного значения. Во многих речных отложе-
ниях («аллювиальных сероцветах») встречаются тонкие пропластки уг-
лей, углефицированные стволы деревьев и отдельные небольшие скопле-
ния органических веществ. Такие скопления часто обогащены редки-
ми элементами, для которых сорбция являлась единственным возмож-
ным механизмом концентрации. Грунтовые воды подобных ландшафтов
относились к глеевому классу, они были богаты растворимыми орга-
ническими веществами, соединениями Fe и Мп. Все это позволило от-
нести ландшафты лесисто-болотистых низменностей Nt к кислому гле-
евому классу (Н+ — Fe2+).
В местах выхода грунтовых вод на земную поверхность, например
в нижних частях склонов, на террасах и поймах рек, формировался
уже известный нам кислородный геохимический барьер А 6, на кото-
ром осаждались гидроксиды железа (Fe2+ -► Fe3+).
Интересна палеобиогеохимия лесисто-болотистых низменностей Nr
Их фауна в течение многих поколений существовала в условиях мине-
рального голодания, так как и растительная пиша, и воды были очень
бедны многими важными биоэлементами (следствие кислого выщелачи-
вания почв). Особенно был характерен дефицит Са, ограничивающий
развитие скелета и способствующий уменьшению размеров животных.
Дефицит Р, Na, К и других элементов сочетался с избытком Si, Fe,
Мп и Al. В течение многих поколений животные пили «коричневую во-
ду», богатую растворимыми органическими веществами, которая, как
сейчас установлено, содержит витамины, гормоны, канцерогены и т.д.
Столь своеобразные условия, вероятно, влияли на эволюционный про-
цесс. В ландшафтах мог происходить отбор на химической основе,
здесь, вероятно, были важные центры видообразования фауны и флоры.
Организмы должны были приспособиться к минеральному голоданию,
маломинерализованным водам, богатым органическими соединения-
ми и местами, относительно обогащенными Fe, Mn, A), Si («железная»,
«марганцевая», «алюминиевая» и «кремнеземная» флора).
На возвышенностях и в горах N1( где болот было меньше, преобла-
дали ландшафты с кислым классом водной миграции (Н+). Для них так-
же было характерно кислое выщелачивание почв, малая минерализа-
ция вод, однако растворимых органических веществ в водах было
меньше, Fe и А1 мигрировали слабее. Кислые лесные ландшафты пре-
486
обладали на Балтийской возвышенности, Урале, Кавказе, в горах и на
возвышенностях Южной Сибири и Дальнего Востока.
В Восточной Сибири, как и в настоящее время, были широко рас-
пространены породы, богатые Са, — различные карбонатные породы и
основные изверженные породы — траппы. В ландшафтах этих райо-
нов также развивалось кислое выщелачивание почв и континенталь-
ных отложений, но оно было слабее, ландшафт был богаче Са. Такие
ландшафты относятся к переходному классу (Н+ — Са2+). Организ-
мы здесь лучше снабжались Са, эволюционный процесс, вероятно, про-
текал качественно по-иному, чем в кислых и кислых глеевых ланд-
шафтах.
В начале Nj в Саянах, Забайкалье, на Сихотэ-Алине, Курилах
был распространен континентальный вулканизм. Здесь изливалась
базальтовая лава, горячие кислые источники давали начало сильно-
кислым ручьям и озерам. Геохимия таких сильнокислых ландшафтов
(Н+, SO?-, С1“) отличалась от окружающих районов. Отличался,
вероятно, и эволюционный процесс: здесь могли формироваться ви-
ды, приспособленные к очень кислым водам и высокому содержанию
А1 («квасцовая флора»).
Аридные ландшафты занимали территорию нынешнего Казахстана
и Средней Азии. Настоящих пустынь не было, отсутствовали и мо-
розные зимы, ландшафт относился к типу субтропических степей и
саванн. Информацию о геохимии этих ландшафтов получают, изучая
ископаемые миоценовые почвы и континентальные отложения. Мио-
ценовые степи и саванны — это «геохимические антиподы» лесисто-
болотистых низменностей. Биомасса была много ниже, растительные
остатки быстро разлагались, в связи с чем во многих районах преоб-
ладала окислительная среда, воды практически не содержали раство-
ренные органические вещества, в речных долинах и озерах накаплива-
лись красноцветные осадки, в междуречьях формировались почвы,
аналогичные современным почвам саванн Африки. По сравнению с лес-
ными ландшафтами воды были более минерализованными и щелоч-
ными.
'• Для многих красноцветных ландшафтов Средней Азии и Казах-
стана были характерны содовые воды и почвы. Это позволяет предпо-
лагать существование в то время своеобразной «содовой флоры» и
фауны, приспособленной к высокой щелочности среды, повышенному
содержанию Na и редких элементов, особенно хорошо мигрирующих в
содовых водах (Li, В, Y, Sc, Zr, и др.). В Каракумах автор обнаружил
ископаемые неогеновые солонцы, в которых происходил синтез палы-
горскита («палыгорскитовые солонцы»). Это вымершие почвы. Для
подобных ландшафтов местами также была характерна миграция Мп,
ио Fe в щелочной среде оставалось неподвижным, и организмам, воз-
можно, не хватало этого металла. Содовые ландшафты вероятно,
также были особыми центрами видообразования. Возможно, неблаго-
приятная для жизни сильнощелочная среда подавляла развитие фау-
ны и флоры, определяла бедность красноцветов их остатками, благо-
487
нриятствовала сохранению красной окраски. На низменностях Казах-
стана в Nx было широко распространено хлоридно-сульфатное засоле-
ние и огипсование почв (зеленые огипсованные глины аральской сви-
ты).
В N2 наступило похолодание, которое особенно усилилось в Q, ког-
да в умеренных широтах распространились покровные оледенения.
Некоторые исследователи объясняют их происхождение уменьшением
количества СО2 в атмосфере, содержание которого в пузырьках возду-
ха из древних льдов понижено до 0,02 %. В эпоху максимального оле-
денения, начавшуюся около 200 тыс. лет назад, мощные ледниковые
покровы распространялись почти до Днепропетровска и Волгограда.
На Кавказе, Тянь-Шане, Памире, Алтае, в Саянах и других горных
системах также было развито мощное оледенение. По сравнению с Nj
геохимия ландшафтов изменилась коренным образом. Широко распро-
странилисыюлярные пустыни, своеобразные тундростепи, неизвест-
ные в современную эпоху, холодные приледниковые (перигляциаль-
ные) степи с многолетней мерзлотой, в которых шло накопление лёс-
сов и лёссовидных отложений. Граница многолетней мерзлоты прохо-
дила много южнее современной, например в Центральном Казахстане.
Тайга была оттеснена на крайний юг Забайкалья, в Приамурье и При-
морье. Лесные ландшафты были на Кавказе, возвышенностях Цент-
рального Казахстана, в горах Тянь-Шаня. На равнинах Южного Ка-
захстана и Средней Азии по-прежнему господствовали аридные ланд-
шафты, но вместо неогеновых саванн распространились сухие степи и
пустыни.
В морях мезокайнозоя формировались в общем те же формации,
что и в палеозое. К числу специфических формаций относится писчий
мел, широкое распространение получил флиш. На дне мезозойских и
кайнозойских морей накапливались Р (меловые фосфориты Русской
платформы и др.), Мп, в аридных лагунах отлагались соли (J3 и N,
в Средней Азии и других районах). Продолжалось падение содержания
Mg в карбонатных породах (на Русской равнине и в Северной Амери-
ке известняки К2 — N2 характеризуются низким содержанием Mg).
С киммерийским и альпийским тектоно-магматическими циклами
связаны разнообразные гидротермальные месторождения. По И. Г.
Магакьяну, в месторождениях, образовавшихся в киммерийскую эпо-
ху, содержится 70 % запасов W, 60 % Sn, 30 % Pb и Zn (от общих
запасов). В собственно альпийскую эпоху в месторождениях накопи-
лось 90% Мо, 60 % Си, 95% Hg, 30% Pb и Zn. Для альпийского гео-
химического цикла характерны также месторождения Au, Sb, As, Fe.
Mn, Ti, Zr, Cr, Pt, Ni, Co, Ag, хотя в целом интенсивность рудообра-
зования была слабее герцинской (Т. А. Твалчрелидзе). По разнооб-
разию генетических типов руд альпийский цикл не уступает герцин-
скому, а может быть, и превосходит его. В течение альпийского цикла
энергично проявилась геохимическая деятельность подземных вод,
которая хорошо изучена. С этим связаны различные процессы измене-
ния осадочных пород, формирование рудных месторождений на гео-
488
химических барьерах в водоносных горизонтах. Так, например, на Ук-
раине, по В. А. Шумля некому, в киммерийскую металлоген ическую
эпоху (Т — Ki) с грунтовыми и пластовыми глеевыми водами связаны
эпигенетическое оглеение красноцветов, выщелачивание и накопление
на геохимических барьерах Fe, V, Сг, Ni и других элементов.
Многие геологи полагают, что последние 25 млн. лет (с Nj) тектоно-
сфера переживает новый этап развития — послегеосинклинальный, не-
отектонический. По В. М. Синицыну, для него характерно необычай-
ное усиление и ускорение всех геологических процессов: возникнове-
ние сверхглубинных разломов, активный вулканизм, дифференциация
рельефа, усиленная механическая седиментация (мощные толщи кон-
тинентальных моласс), понижение геофизических границ — Мохо,
астеносферы и т.д. Анализ неотектонического этапа необходим и с гео-
химических позиций.
Историческая геохимия океана
Проблема происхождения океана, эволюции его солевого состава
чрезвычайно сложна и дискуссионна. В результате различных круго-
воротов один и тот же атом химического элемента многократно посту-
пал в океан, осадочные породы, магму, изверженные породы и т.д.
Именно поэтому возраст океана, определенный по речному стоку,
сильно занижен.
В современном океане поступление веществ в общем уравнове-
шено процессами их удаления в осадки дна и атмосферу. Однако за
время геологической истории геохимия океана, несомненно, менялась.
Одна из причин — смена в докембрии восстановительной атмосферы
на окислительную. Это событие неизбежно привело к смене окисли-
тельно-восстановительных условий в океане: восстановительная глее-
вая обстановка в водах сменилась на окислительную. Уменьшение со-
держания СО2 в атмосфере влияло на карбонатное равновесие в океане.
Первичный океан, по гипотезе А. П. Виноградова, образовался в
результате дегазации мантии свыше 4 млрд, лет назад, когда возникла
и твердая земная кора — продукт выплавления из мантии основных
изверженных пород. Кислые вулканические дымы (НС1, HF и др.) в
Это время, растворяясь, определяли сильнокислую реакцию океаниче-
ских вод. Таким образом, первичный океан был кислым, хлоридным,
восстановительным. Существуют гипотезы и о щелочной реакции вод
первого океана. Развитие фотосинтеза коренным образом изменило ге-
охимию океана: он стал окислительным, щелочным, в нем появился
сульфат-ион. «Современный», по Виноградову, этап начался в палео-
зое, для него характерна ведущая роль живого вещества в геохимии
океана. Аналогичную концепцию развивал и Н. М. Страхов. Первич-
ный океан он также считал продуктом дегазации мантии, гидросферу
очень кислой с pH, близким к 1—2. Второй этап — археозойский —
продолжался приблизительно 2 млрд, лет — до начала фотосинтеза.
Океаническая вода стала хлоридно-карбонатной, менее кислой. Она
489
еще была восстановительной, так как свободного кислорода в атмосфе-
ре не было. Третий этап — протерозойско-рифейский, когда океан стал
содержать свободный кислород, в нем появились сульфаты, содержа-
ние углекислого газа понизилось, реакция вод приблизилась к нейт-
ральной, воды стали хлоридно-карбонатно-сульфатными. Четвертый
этап охватывает весь фанерозой и характеризуется еще большим влия-
нием живого вещества на геохимию океана. В океане понизилось со-
держание СО2 за счет извлечения его организмами (фотосинтез, осаж-
дение карбонатов), вода стала щелочной, хлоридно-сульфатной. Соле-
ность океана, по Н. М. Страхову, уменьшалась в эпохи галогенеза
(нижний кембрий, средний девон, пермь) и возрастала в эпохи ослаб-
ления галогенеза (нижний карбон, нижняя и средняя юра). Однако
зоологи считают, что соленость океана в фанерозое менялась незначи-
тельно, на что указывают особенности фауны.
На геохимию океана в фанерозое, вероятно, влияли изменение ин-
тенсивности вулканизма, оледенения, извлекавшие огромные массы во-
ды (в ледниковые эпохи четвертичного периода уровень Мирового оке-
ана понижался на 100 м), понижение содержания СО2 в атмосфере,
изменение температуры вод.
Историческая геохимия океана особенно привлекает внимание в
связи с проблемой эволюции океанского рудообразовании, так как
накопление морских железных руд, фосфоритов, углеродистых слан-
цев наиболее энергично происходило в определенные эпохи геоло-
гической истории. Важна эта проблема и в связи с изучением эволю-
ции жизни на Земле.
Историческая геохимия подземных вод. Палеогидрогеохимия
На протяжении геологической истории в осадочных породах на-
капливалось органическое вещество, разложение которого обогаща-
ло подземные воды СО2, СН4, H2S и другими активными соединениями.
В результате усиливалась геохимическая деятельность вод, для ко-
торой характерны две группы противоположных явлений. Первая свя-
зана преимущественно с изменением газового состава и выражается
в развитии восстановительных и окислительных процессов. Восстано-
вительные процессы часто связаны с поступлением в подземную воду
снизу по разломам или по пластам жидких или газообразных угле-
водородов. При этом возможно формирование нефтяных и газовых за-
лежей. Восстановительные процессы развиваются и в результате по-
гружения пород, анаэробного разложения сингенетического органи-
ческого вещества. Окислительные процессы часто связаны с тектони-
ческими понятиями и инфильтрацией кислородных вод.
Вторая группа явлений обязана преимущественно изменению ион-
ного состава вод и выражается в увеличении или уменьшении их мине-
рализации, изменении pH.
Понять закономерности формирования химического состава под-
земных вод, а также закономерности образования и размещения руд-
490
ных тел в водоносных горизонтах можно только на основе комплексно-
го изучения истории воды и породы как единой системы. Напомним,
что с деятельностью подземных вод связаны эпигенетические измене-
ния, изучая которые можно восстановить геохимические особенности
былых вод. В табл. 26 приведена гидрогеохимическая интерпретация
различных эпигенетических изменений в породах. Так как изучение
этих изменений не позволяет датировать возраст процессов, то подоб-
ные исследования желательно проводить в комплексе с методами пале-
огидрогеологии.
По А. М. Овчинникову, в 30-х годах на смену казавшемуся бесспор-
ным изречению эллинской науки—-«вода такова, какова порода, по ко-
торой она протекает» пришло новое: «вода такова, какова геологическая
история района, в котором она находится». Вскоре в СССР оформилась
палеогидрогеология, изучающая историю подземных вод 1. Палеогидро-
геологический анализ используется при изучении условий формиро-
вания и разрушения залежей нефти и газа, при оценке перспектив
нефтегазоносности, прогнозировании медных, урановых и прочих мес-
торождений, поисках и оценке ресурсов подземных вод и рассолов,
решении других теоретических и прикладных задач.
Успеху палеогидрогеологии способствовало совершенствование ме-
тодов определения возраста подземных вод. С этой целью широко ис-
пользуется определение отношения Не/Аг в растворенных газах. Аг в
подземных водах в основном имеет воздушное происхождение,
в связи с чем его содержание не зависит от возраста вод. Не — про-
дукт радиоактивного распада и постепенно накапливается в водах.
Поэтому чем больше отношение Не/Аг, тем древнее воды. Хотя сущ-
ность данного метода проста, его использование требует учета многих
факторов, что усложняет расчеты и в ряде случаев снижает их досто-
верность. Все же таким путем была получена ценная информация. На-
пример, оказалось, что возраст подземных вод часто меньше возраста
водовмещающих пород. В Прикаспийской низменности в отложениях
перми и триаса (около 200 млн. лет) возраст подземных вод не превыша-
ет 90 млн. лет, т. е. соответствует верхнему мелу. Возраст рассолов
Ангаро-Ленского артезианского бассейна, залегающих в отложениях
нижнего кембрия (около 550 млк лет), колеблется от 10 до 100 млн.
лет (верхний мел — миоцен). Возраст подземных вод и водовмещающих
пород совпадает, если воды формируются в результате отжатия поро-
вых растворов из глинистых пород (воды в породах верхнего мезозоя
Западно-Сибирской низменности и др.). Возможно и обратное явле-
ние: возраст вод по Не/Аг древнее водовмещающих пород. Это может
быть связано с подтоком древних вод из подстилающих отложений, с
подтоком Не из пород кристаллического фундамента и другими причи-
нами. Таким образом, использование физических законов для опреде-
ления возраста вод должно быть основано на геологическом анализе
Термин «палеогидрогеология» в 1929 г. предложил П. Н. Чирвинский.
491
Таблица 26. Палеогидрогеохимические реконструкции на основе изучения эпигенетических изменений в породах | Сульфидные воды содово* сероводо- родные о о о 3 х , х* • 3 О. Ч з се К 5 ¥ т <У О О Z д и "X гл ^* X X О =Х О ш О— н S’ х £ о 2 Ч О ш О J aoo-ooS^S»'4 Я О g Ч = х S
соленосно- сульфидные • ° 6 ' 3 1 3 CL X = К х Ч Л Ч 5 га 5 S
| Глеевые воды кислые 1 карбонатные глеевые 1 глеевые §°£'°§'= = = :а8£;=:а = §о°с£™5-£ iX - ,, г О х ffl “ s *5 :г о х rax 5/ я _ щ з г.
£Й4йч2ДЙбё|=‘|соО so^tu9-xSra = х шс<ига=ЙОм£ оц-^< 5 5 g = £-S s
Окислительные воды содовые 2 6*> з £ з сч 2 -e- = 3 ? cl x ra =r S 2 * *- A cq ° ° ж H о 4 =f ? 3 co 4 b. cu Q >» S X S H я ° e-o ° g
хлорндно- сульфатные лга^Г»ЗлЧо ш X x 5 S S § £ 5 8 3 S s § J« S § g&g|^g^§55|&=oS x S Q. “ Q О
нейтральные карбонатные Bg/aS^S-Ps Sg g&xj°4=4gg^c ^Ьзи°з^1йПя X 3 °- S CQ °
кислые 1 ' >O x (V ® sx x <u ra S g й'ё.ч хЛ< 0 S-x S S g -bS 4 3 § S.”
сернокислые cu , 0> _ ш ♦ cu га ® x «J о x “Z Хч^ О,Р=Ь>ХХ^’Х(-,ХК1>1» "'O"OE °5ЙО " = § 2 X 4 = s о °- S x £ q £ - u X -R ra 41 7> о ’ ^raS*eXX>.4_.a>LrL- K?s-Ob2*--ffl4J Zfrae(Q>>4> о. с <у X >’4 G. 1 _ к( - 4 H о x 4 . га xO ra «л s о 3 a x ra ra co яу) S e(U S у (J s 2^ о s c
CQ
скобках приведены примеры.
492
вопроса (истории развития района, данных литологии, тектоники и
т.д.).
Для определения возраста подземных вод используются также ко-
роткоживущие радиогенные изотопы, образующиеся в атмосфере под
влиянием космических лучей. Попадая в подземные воды, они распа-
даются. По оставшемуся их количеству можно определять возраст
вод. Срок жизни таких изотопов не превышает нескольких миллионов
лет, у наиболее короткоживущих — дней и недель. Таковы 3Н, 14 С,
32Si, 36С1, 10Ве и др. Наибольшее применение в гидрогеологии нашел
радиоактивный водород — тритий (3Н— Т). Изучение распределе-
ния Т в поверхностных и подземных водах позволяет установить
скорость природных процессов. Так, оказалось, что возраст горячих
вод в туннеле Теколоте (США) меньше девяти месяцев, что поверхност-
ные воды океана сравнительно быстро проникают на глубину, что в од-
ном из районов восьмиметровый слой подземных вод в течение несколь-
ких месяцев смешивается с эквивалентным количеством атмосферных
осадков. В долине р. Миссисипи ежегодно выпадает с осадками 520 мм
океанической воды, принесенной ветрами. Приблизительно 240 мм ис-
парившихся подземных вод возвращается через атмосферу в океан.
Следовательно, средняя продолжительность круговорота воды в вер-
ховьях долины р. Миссисипи около 15 лет.
Возможны два аспекта исторической геохимии подземных вод (па-
леогидрогеохимии).
1. Восстановление геохимических особенностей подземных вод
прошлых геологических эпох (палеогидрогеохимия докембрия, па-
леозоя, мезозоя и т.п.).
2. Изучение истории современных гидрогеологических структур.
Палеогидрогеохимия прошлых геологических эпох. Появление в
PR резкоокислительных условий на земной поверхности неминуемо
вызвало противоположные резковосстановительные условия в илах
озер и особенно в водоносных горизонтах. Следовательно, в резуль-
тате биологического круговорота единая слабовосстановительная сре-
да, господствовавшая в AR, разделилась на две противоположности—
резкоокислительную и резковосстановительную. Поэтому появление
в подземных водах H2S, осаждение сульфидов металлов явилось след-
ствием развития резкоокислительных условий на земной поверхности.
Сероводородные геохимические барьеры, сульфидные экзогенные руды
возникли на определенной стадии развития земной коры в связи с раз-
витием биосферы.
Анализ геологического развития региона, реконструкция былой
тектоники, рельефа, климата позволяют восстановить и палеогидро-
геохимию прошлых эпох. Для западных районов Средней Азии А. С.
Хасанов, Н. А. Филиповский и С. Е. Козорез восстановили геохимиче-
скую историю подземных вод в нижней юре. В то время западнее Сыр-
дарьи, на большей части Узбекистана, Туркмении и Казахстана пре-
обладали свободные безнапорные воды в трещиноватых и рыхлооб-
ломочных породах (зона интенсивного водообмена). Это были преиму-
493
щественно слабоминерализованные гидрокарбонатные воды (до 3 г/л).
На юге Туркмении, на территории современного Копетдага, Юго-Вос-
точных Каракумов, Бадхыза и Карабиля преобладали напорные пла-
стовые практически застойные хлоридные рассолы. Авторам удалось
восстановить направление движения былых подземных вод, очаги их
разгрузки, границы смешения вод разного типа, геохимические барь-
еры. Были выделены участки, благоприятные для скопления газа, не-
фти, озокерита, асфальтитов и других битумов, для образования руд
Аи, Си, РЬ и других металлов (на геохимических барьерах). Благо-
приятные условия для рудообразования были на Мангышлаке, в Юго-
Восточных Каракумах, Таджикской депрессии, для накопления биту-
мов — в Западной Туркмении и Бадхызе.
Палеогидрогеохимия гидрогеологических структур (гидрогеоло-
гических массивов, артезианских и вулканогенных бассейнов и др.).
А. Н. Семихатов разработал понятие о гидрогеологическом цикле,
которое в дальнейшем было развито А. А. Карцевым, С. Б. Вагиным и
др. (рис. 123). Свежеосажденные тонкодисперсные илы содержат до
90% воды, которая отжимается в пористые породы по мере уплотне-
ния илов, превращения их в глины, а затем и в глинистые сланцы. Этот
тип водообмена Н. Б. Вассоевич назвал элизионным\ он характерен для
первого элизионного этапа гидрогеологического цикла. Второй этап—
инфильтрационный, в течение которого инфильтрующиеся метеорные
воды постепенно вытесняют и замещают седиментационные воды. Та-
ким образом, для второго этапа характерен инфильтрационный водооб-
мен. С. И. Смирнов пишет, что подземные воды любого седиментацион-
ного бассейна — явление историко-геологическое, так как они изме-
няются в ходе геологического времени под влиянием планетарных, ре-
гиональных и локальных физических полей. Это термодинамически от-
крытые системы, и конечной, реально достижимой стадией их эволю-
ции является стационарное неравновесное состояние. Эволюция вод
осуществляется посредством необратимых неравновесных процессов
переноса энергии, массы и импульса, определяющих энергетическую
и динамическую историю подземных вод.
История артезианского бассейна охватывает порой несколько гео-
логических периодов. Так, по С. М. Мухамеджанову, южная часть
Западно-Сибирского артезианского бассейна с Ki до конца Nj и начала
Qj переживала элизионный этап. В это время происходило непре-
рывное погружение осадочных толщ и флюиды в основном двигались
от наиболее погруженной части бассейна к его периферии. В водонос-
ных горизонтах меловых и палеогеновых отложений формировались
сингенетичные осадконакоплению подземные воды (в настоящее время
это погребенные седиментационные воды). В начале N и Q начался ин-
фильтрационный этап. Развитые ранее региональные глинистые водо-
упоры — чеганские, аральские и павлодарские отложения — были
частично размыты и инфильтрационные воды проникли в глубокие во-
доносные горизонты. Первично-погребенные воды стали разбавляться
и оттесняться к центру артезианского бассейна. В результате в преде-
494
лах одного водоносного горизонта сформировалась горизонтальная
гидрогеохимическая зональность. Определение возраста подземных вод
показало, что он закономерно увеличивается от современных областей
питания к центральным частям бассейна (Q4 — К2).
Особенно сложна гидрогеохимическая история областей, где неод-
нократно сменялись артезианские бассейны и гидрогеологические мас-
Рис. 123.Схема гидрогеологического цикла (по А. А. Карцеву):
А — элнзноиный этап, Б — инфильтрационный этап, В — следующий элизионный этап; I —
илы, глины, образовавшиеся на этапе А и содержащие седимеитогеиные воды, 2 — коллек-
торы, содержащие седимеитогеиные воды, 3 — коллекторы, содержащие инфильтрационные
воды, 4 — ложе бассейна, 5 — илы н глины, образовавшиеся на этапе В, о — направления
движения вод
сивы (области развития трещинных вод в скальных породах). Напри-
мер, по Е. А. Баскову, в раннем RF на территории Алданской складча-
той области Восточной Сибири были распространены трещинно-жиль-
ные воды в кристаллических породах AR — PRlt т. е. это была си-
стема гидрогеологических массивов. В RF2 в центральной части области
существовал артезианский бассейн со слабосолеными пластовыми во-
дами в терригенных толщах. В RF3 произошло поднятие, и толщи
среднерифейского возраста сохранились лишь в отдельных грабенах.
495
В кембрии Алданская область заливается мелководным морем, в ко-
тором накапливаются карбонатные породы мощностью до 500— 600 м
с пластовыми солеными водами — образуется крупный артезианский
бассейн. В результате нового поднятия, вероятно, в конце ордовика —
начале силура, на значительной части Алданской области толщи кемб-
рия были уничтожены эрозией, и вновь до юры возник гидрогеологи-
ческий массив. В J — Ki происходила аккумуляция континенталь-
ных угленосных отложений, в которых сформировался артезианский
бассейн пресных и слабосоленых вод. В это же время проявилась ин-
тенсивная магматическая деятельность. С К2 по настоящее время раз-
вивались поднятия, и в большинстве районов угленосные толщи были
уничтожены эрозией. Современная Алданская область вновь представ-
ляет собой систему гидрогеологических массивов с подчиненными арте-
зианскими бассейнами во впадинах.
Большое значение палеогидрогеохимический анализ приобрел при
изучении рудных месторождений и рудных районов. А. В. Щербаков
рассмотрел с этих позиций Большой Донбасс и Большой Кривой Рог,
Е. А. Басков — Ангаро-Илимское железорудное, Джезказганское мед-
ное, Анзасское магнетитовое, Березовское железорудное месторожде-
ния, оловянные месторождения Кавалеровского рудного района. На
примере конкретных месторождений и рудных районов эти вопросы
рассматривали также А. И. Германов, Г. А. Голева, М. С. Гуревич,
Д. И. Павлов, П. А. Удодов и др.
Историческая геохимия ландшафтов СССР
Примерно на половине территории СССР формирование современ-
ных ландшафтов началось в N — Q (здесь и далее индексы характери-
зуют ландшафты, показанные на рис. 124). Таковы многие горные стра-
ны (АД, районы четвертичных морских трансгрессий, дельт и пойм
рек (А2 и Аз), районы последнего оледенения (Д4), хотя в них местами
и обнаруживаются следы ледниковой и послеледниковой эпохи (по-
гребенные торфяники, ископаемые почвы). К молодым ландшафтам,
бедным геохимическими реликтами, принадлежат также ландшафты с
эоловой аккумуляцией. Ветер, перевевая пески, создает все новые и
новые поверхности в Каракумах, Кызылкуме и других песчаных пус-
тынях (Д5).
Значительно сложнее история ландшафтов ряда районов Казахста-
на, Урала, Сибири, европейской части СССР, Средней Азии (Б).
Многие аридные низменности южной половины СССР сложены чет-
вертичными, преимущественно аллювиальными отложениями. В бы-
лых речных долинах близко залегали грунтовые воды, которые, ис-
паряясь, засоляли почвы и грунты. Позднее уровень грунтовых вод.
понизился, реки изменили свои русла, но солевые реликты — гипс,
сульфаты и хлориды — сохранились (fij). Загадочна геохимическая
история грандиозного пустынного плато Устюрт. Воды сарматского
моря покинули этот район десятки миллионов лет назад, здесь не было
496
речных долин, но почвы имеют мощный гипсовый горизонт. Возможно,
этот геохимический реликт — след былого близкого стояния грунтовых
вод (сейчас на Устюрте они залегают очень глубоко). Не исключено,
что гипс и соли были принесены ветром с Каспийского моря. Для дру-
гих древних пустынных плато, например Заунгузских Каракумов, ус-
тановлено былое близкое залегание грунтовых вод (Б2).
В северной половине СССР формирование ландшафтов в четвертич-
ном периоде протекало в гумидных условиях. На равнинах Белорус-
сии, Верхней Волги, Северной Двины и Печоры, Западной Сибири,
па аллювиальной равнине Колымы в прошлом близко от поверхности
залегали грунтовые воды (Б3). Во многих районах они стоят вблизи
поверхности и сейчас. Однако влажность климата определила здесь
иной состав геохимических реликтов, чем в пустынях; для ландшаф-
тов характерна концентрация С (торфяники), Fe, Мп, Р, связанная с
былыми болотами и озерами. Грандиозная Среднесибирская возвышен-
ность пережила чрезвычайно длительную и сложную историю (Б4).
Еще в PZ на ней установились континентальные условия, стали фор-
мироваться гумидные ландшафты. В дальнейшем они неоднократно
менялись, но некоторые общие черты оставались неизменными — теп-
лый влажный климат, лесная растительность, болота, аккумуляция в
почвах органического вещества, Fe, Мп, Р. В Q земная кора была про-
морожена на сотни метров, сформировались таежно-мерзлотные ланд-
шафты, которые господствуют и в настоящее время. Местами в ландшаф-
тах сохранились геохимические реликты доледникового времени, ха-
рактерны и реликты ледниковой эпохи (ископаемые льды).
Еще сложнее история таких районов, где на протяжении сотен
миллионов лет чередовались аридные и гумидные условия, одни типы
геохимических реликтов накладывались на другие. Подобная эволю-
ция характерна для многих районов Среднего и Южного Урала, Ка-
захстана (Б5). Например, в Центральном Казахстане и Мугоджарах к
концу Т герцинские горы были эродированы. Страна превратилась в
слабоволнистую равнину с множеством полноводных рек, озер, болот,
с густыми тропическими лесами на междуречьях, кислой выщелочен-
ной корой выветривания. Влажный и теплый климат во многих районах
господствовал длительное время, но тектонические условия не остава-
лись постоянными. На участках небольших поднятий верхняя часть
коры выветривания размывалась, на поверхности оказывались более
глубокие горизонты горных пород, которые также подвергались вы-
ветриванию. Так происходило омоложение кислой коры, молодые про-
цессы накладывались на древние. В местах опусканий кора перекрыва-
лась речными и озерными отложениями. Но поднятия и опускания в об-
щем были незначительными, поэтому те или иные горизонты древней
коры выветривания сохранялись во многих ландшафтах Казахстана
на протяжении юры — палеогена, т. е. свыше 100 млн. лет. Резкие
изменения наступили на большей части этой территории в неогене.
Тектоническая обстановка все еще была спокойной, поднятия иопуска-
ния характеризовались небольшой амплитудой, но климат изменился
497
гущественно стало значительно суше, место лесов заняли саванны.
Формирование кислой коры выветривания прекратилось, местами про
исходило засоление коры - наложение солевых горизонтов на каоли-
нитовые В Nj было много щелочных содовых озер, энергично мигри-
ровал Мп. Это была «марганцевая» и «содовая» эпоха В N2 началось
похолодание. В начале четвертичного оледенения ландшафтные зоны
сдвинулись на юг Северная часть Западной Сибири покрылась лед-
ником, южнее располагалась тундра, а на месте современных степей
сосново-березовая лесостепь Потом климат стал теплее и зоны
сдвинулись на север. Такое смещение зон происходило несколько раз
в ледниковые эпохи становилось суше и холоднее, в межледниковые -
теплее и влажнее Каждой эпохе соответствовали свои геохимические
ландшафты В четвертичное время (Q) в некоторых районах произо
шли небольшие поднятия, оживилась работа рек, стал формиро-
ваться мелкосопочник Неогеновые отложения и кислая кора вывет-
ривания были смыты, на поверхность вышли палеозойские породы
Ландшафт «омолодился», в нем почти не сохранились геохимические
реликты Там, где неотектонические поднятия почти не проявились,
ландшафты представлены слабо расчлененной равнинной с древними
континентальными отложениями, кислой корой выветривания пород
PZ. Для этих ландшафтов характерны геохимические реликты мезо-
зоя и палеогена (остатки кислой коры выветривания, местами углис-
тые и железистые осадки), миоцена (солевые реликты — гипс, кальцит,
легкорастворимые соли, часто также соединения Мп), четвертичного
периода (солевые реликты) Таким образом, в современных ландшаф-
тах равнин Казахстана к геохимическим pi шктам мезозоя и палеоге-
на относятся аккумуляции Fe и А1, местами Ni, Сг, Со, к реликтам
миоцена — S, Cl, Na, Са, Sr, Ва, Мп, четвертичного периода —S, С1,
Na, Са, Mg и другие элементы солей
Рис 124 Типы историке геохимического развития ландшафтов СССР
1— ио юдые ландшафты без существенных геохимических реликтов иги со слабым их раз
витием (4 — в условиях энергичных неотектонических поднятий и эрозионной деятельности
геохимические реликты на террасах рек и древннх поверхностях выравнивания Л2-— в об
ластях молодых трансгрессий 1 — в поймах и дельтах рек 14 — в областях последнего
оледенения с широким развитием ледниковых отложений местами распространены геохн
мические реликты ледникового периода 4g в областях эоловой аккумуляции)» Б — ланд
чшфты со сложной историей сменой июешмьшх и супераква юных режимов геохимиче
скими реликтами разного типа (Kt — молодые ландшафты сформировавшиеся в аридных ус
ловиях частично пережившие супераквальную стадию преобладают солевые реликты Б2 -
ландшафты формировавшиеся в течение длительного времени начиная с неогена в арид
ных условиях частично прошедшие через супераквальиую стадию преобладают солевые ре
ликты 5, — ландшафты сформировавшиеся в гумидных условиях частично прошедшие
супераквальиую стадию углеродистые и железомарганцевые реликты Б< — ландшафты с
длительной историей сменой гумидных теплых гумиднымн мерзлотными условиями прей
муществеиио с железо марганцевыми хглеродистымн и ледяными реликтами Бч — ландшаф
ты со сложной и длительной —с мезозоя — историей сменной гумидных и аридных элювиаль
ных и супераквальиых режимов солевые глинистые и железо маргаицевые реликты Бй
ландшафты со сложной и длительной — с мезозоя—-историей сменой гумндиых и аридных
элювиальных и супераквальиых режимов глинистые н железомарганцевые реликты сущест
венных долевых реликтов иет Бу- ландшафты с длительной историей частично пережив
шие супераквальиую стадию с реликтами разного типа)
499
Хотя большинство рудных месторождений Казахстана, Урала и
Средней Азии образовалось в PZ, на земную поверхность многие из
них вышли лишь в начале MZ. С этого времени рудные элементы
включились в гипергенную миграцию. Стали формироваться вторич-
ные ореолы рассеяния месторождений, которые впоследствии много-
кратно изменялись процессами кислого выщелачивания, засоления,
огипсования и т.д. Поэтому в современных ландшафтах эти важнейшие
поисковые признаки рудных месторождений часто сильно ослаблены,
изменены, деформированы, оторваны от рудных выходов. Так, в Му-
Рис. 125. Древние процессы засоления привели к испарительной концен-
трации Ag, Мо, Sr в железной шляпе сульфидного месторождения:
КК — кларк концентрации, АР —кларк рассеяния (по А. И. Перель-
ману)
годжарах многие железные шляпы сульфидных месторождений, сфор-
мировавшиеся в мезозое и палеогене, были засолены в N—Q. В резуль-
тате в верхних горизонтах зоны окисления накопился гипс, возросло
содержание Мо, Ag, Си. Если рассматривать такую железную шляпу
как чисто элювиальное образование, то можно неверно оценить пер-
спективы оруденения на глубину, в том числе продуктивность место-
рождения (рис. 125). Поэтому рациональная методика геохимических
поисков должна быть основана на знании истории ландшафтов рудных
провинций.
Контрольные вопросы к главам 25 и 26
1. Приведите доказательства необратимой эволюции земной коры.
2. В чем проявляется периодичность развития земной коры?
3. Приведите современные данные о роли катастроф в истории Земли.
4. Что представляет собой большой круговорот веществ в земной коре.
5. Охарактеризуйте гипотезу геохимических аккумуляторов.
6. Каково возможное влияние биосферы на эндогенные процессы?
7. Охарактеризуйте основные геохимические особенности докембрия.
8. Чем в геохимическом отношении отличался рубеж венда и кембрия?
9. Дайте характеристику четырем основным циклам фанерозоя.
500
ЗАКЛЮЧЕНИЕ
Геохимия приближается к своему столетию. За прошедшие годы,
повинуясь общему закону эволюции знания, она сильно дифференци-
ровалась. Многие разделы геохимии превратились в самостоятель-
ные науки и, например, специалисты в области геохимии магматических
пород часто не ориентируются в геохимии биосферы, и наоборот; изу-
чающие геохимию океана далеки от геохимии почв. Естественно,
возникает вопрос, естьли необходимость в изложении геохимии какедн-
ной науки? Оказывается, есть. Следуя тем же законам эволюции зна-
ния, растет и интеграция геохимии: установлены законы, позволяю-
щие рассматривать отрасли этой науки с общих позиций, в качестве
частей единой системы. Чем же обусловлено это единство? Прежде все-
го единством объекта исследования: во всех земных и космических сис-
темах геохимию интересует химический элемент, его распределение,
его миграция. Един и элементарный состав систем земной коры и верх-
ней мантии, близки величины распространенности элементов. Дейст-
вительно, и в гранитах, и в базальтах, и в морской воде, и в живом
веществе, и в других системах мы обнаруживаем все тот же набор хи-
мических элементов, причем во всех крупных системах их кларки
близки, т. е. кислорода много, золота мало и т.д. Напомним, что био-
сфера, глубокие части земной коры и верхняя мантия связаны между
собой миграцией элементов — большим круговоротом атомов — и это
также определяет единство рассматриваемой грандиозной системы
верхней части нашей планеты. Наконец, многие законы миграции еди-
ны для всех частей земной коры. В первую очередь это законы физиче-
ской химии, во многом определяющие концентрацию и рассеяние эле-
ментов, особенно в магматических и гидротермальных системах.
Если в разных частях нашей планеты — ив биосфере и в глуби-
нах земной коры — развиваются сходные (но не тождественные!)
процессы, то очевидно, что знание процессов земной поверхности долж-
но помогать изучению гипогенных процессов, а знание последних —
пониманию гипергенеза и техногенеза. Вместе с тем и в геохимии, и в
науках о Земле в целом в течение длительного времени изучение обе-
их групп процессов было слабо связано друг с другом, каждое направ-
ление развивалось самостоятельно, на основе собственной методологии,
оригинальных конкретных методов. Это, естественно, способствова-
ло неравномерности развития отдельных разделов геохимии. Выяви-
лось, например, отставание уровня исследований биогенной мигра-
ции от исследований физико-химической миграции. Последний, не-
сомненно, выдвинулся на первое место по научным и практическим
результатам, объему исследований, количеству геохимиков.
В то же время вряд ли можно сомневаться, что биогеохимия имеет
фундаментальное значение для современной геохимии. Она уже внес-
501
ла крупный вклад в развитие научной мысли и, несомненно, будет ос-
вещать путь еще многим поколениям ученых. И все же, несмотря на оп-
ределенные успехи, современная ситуация с внедрением биогеохимии
как в теоретические исследования, так и в практику народного хо-
зяйства не отвечает в полной мере потребностям ни науки, ни практи-
ки. Эта ситуация до некоторой степени напоминает ту, о которой пи-
сал Б. Б. Полынов. «Бывают случаи, — отмечал ученый, — когда ис-
тина не встречает возражений и как будто получила общее признание,
но в то же время остается как бы вне сознания и на каждом шагу со-
вершаются поступки, противоречащие ей» \ Действительно, если озна-
комиться со многими вузовскими руководствами в области наук о
Земле, то обнаружится, что имя В. И. Вернадского там упоминается,
но его биогеохимические идеи, о которых мы писали в IV части, не по-
ложены в основу трактовки проблем, т. е. имеет место ситуация, кото-
рую отмечал Б. Б. Полынов. Поэтому неудивительно, что основная
масса геохимиков все еще слабо знакома с биогеохимией, эта наука
не стала рабочим инструментом их мышления. Очевидно, необходимо,
чтобы новые поколения, которые сейчас еще обучаются в вузах и будут
обучаться в дальнейшем, освоили биогеохимические идеи как важней-
ший предмет своей специальности. Это требует определенной перест-
ройки учебных планов, изменения системы изложения существующих
курсов. Недостаточен и объем научных исследований в данной области,
и объем их практического приложения.
Сказанное о недостаточном развитии биогеохимии во многом от-
носится и к другим разделам нашей науки, например к региональной
и исторической геохимии. Слабая связь между отдельными разделами
геохимии, «отставание» в развитии некоторых из них не только мешают
решению практических задач, но и противоречат единству земной ко-
ры как особой системы. Именно поэтому необходима более тесная
связь между научными направлениями, особенно между направления-
ми, изучающими гипогенные и гипергенные процессы, выравнивание
фронта исследований. При изложении геохимии процессов и систем
необходимо также усилить использование общих методологических
принципов, единого понятийного аппарата, единых законов. Подоб-
ная тенденция в изложении основ геохимии наметилась уже в трудах ее
великих основоположников — В. И. Вернадского, А. Е. Ферсмана
и В. М. Гольдшмидта. Еще более усилилась она в наши дни. При со-
ставлении учебника автор в меру своих сил также придерживался
этого направления. Надеемся, что идеи единства земной коры и глубо-
кой связи между отдельными разделами науки заинтересуют читате-
лей, и это будет способствовать дальнейшим успехам в интеграции
геохимии, в ее практическом приложении, а также облегчит усвое-
ние этой науки.
1 По мнению Б. Б. Полыиова, в 40-х годах такое положение сложилось с
внедрением некоторых докучаевских идей в практику народного хозяйства. См.:
Полынов Б. Б. Учение о ландшафтах И Вопросы географии. М., 1953, № 33.
С. 31.
502
БИБЛИОГРАФИЯ
Общие вопросы библиографии по геохимии
Важное значение геохимии для наук о Земле определило большое число из-
даний, в которых публикуются геохимические труды. Почти все периодические
издания геологического профиля, а в последние годы и многие географические,
почвенные и другие сборники и журналы содержат статьи геохимического ха-
рактера. Ниже приведены важнейшие периодические издания, в названия ко-
торых входит слово «геохимия».
I. Вестник Киевского университета. Прикладная геохимия и петрофизика.
2. Геохимия. СССР. — Москва. — Журнал.
3. Геохимия и рудооб разовая ие. — СССР, Киев. — Сборник.
4. Chemical Geology. — Amsterdam — Oxford—New York. Международный
журнал.
5. Chemie der Erde. — ГДР. — Журнал.
6. Geochimica et cosmochimica Acta. — Oxford — New York — Paris — Frank-
furt. — Международный журнал.
7. Journal of Geochemical Exploration. — Amsterdam.
8. Geochemical Journal. — Tokyo.
9. Organic Geochemistry. —CILIA. —Журнал.
10. Applied Geochemistry. — Журнал Международной ассоциации геохимии
и космохимии. Издается в Англии.
II. Biogeochemistry — Нидерланды. — Международный журнал.
Во многих странах опубликованы библиографии по геологическим наукам,
в том числе по геохимии. В СССР с 1954 г. Всесоюзный институт научной и тех-
нической информации (ВИНИТИ) издает реферативный журнал «Геология» (пуб-
ликуется ежемесячно отдельными выпусками), в котором среди прочих имеются
разделы «Геохимия. Минералогия. Петрография», «Геологические и геохимиче-
ские методы поисков полезных ископаемых», «Методы разведки и оценка место-
рождений. Разведочная и промысловая геофизика».
В СССР опубликованы следующие важнейшие библиографические справоч-
ники по геохимии:
1. Библиография отечественных библиографий по геологии XVIII в. —
1973 г. Аннотированный указатель по общим вопросам геологии, минералогии,
петрографии, геохимии, полезным ископаемым, методам поисков и разведки.
Составитель Л. В. Бугельская. —М.: Наука, 1976.
2. Бугельская Л. В. Геохимические методы поисков рудных месторождений.
Библиографический указатель литературы (1925—1963). — М.: Наука, 1966,
вып. 1, 1967, вып. 2.
3. Редкие щелочные металлы (литий, рубидий, цезий). —М.: Изд-во АН
СССР, 1962.
Ниже приведены некоторые важнейшие труды по геохимии, опубликован-
ные преимущественно в СССР за последние годы. Как правило, они содержат об-
ширную библиографию, по которой читатель может познакомиться с историей
вопроса, литературой предыдущих десятилетий. Автор включил в списки также
классические исследования Вернадского, Ферсмана, Гольдшмидта, Кларка и
других геохимиков, имеющие основополагающий характер для науки в целом
или ее отдельных разделов:
503
История и методология геохимии. Труды классиков геохимии.
Учебные руководства и монографии по науке в целом.
Распространенность и общие особенности миграции элементов.
Прикладная геохимия (общие вопросы)
Алексеенко В А , Войткевич Г В Геохимические методы поисков место
рождений полезных ископаемых 4 , 1979
Барабанов В Ф Геохимия Л 1985
Беус А А Геохимия литосферы 4 1981
Булкин Г А Введение в статистическую геохимию Л 1972
Вернадский В И Избранные сочинения 4,1954—1960, т I—5
Вернадский В И Размышления натуралиста М , 1975, кн 1, М , 1977
кн 2
Вернадский В И и современность Под pel Б С Соколова и А Л . Ян
шина /сб М 1986
Виноградов А П Избранные труды 4 1988
Войткевич Г В . Закруткин В В Основы геохимии М , 1976
Гавришин А И Оценка и контроль качества геохимической информа
ции М , 1980
Геохимия и космохимия И Мат 27-ю 4еждународного геологического кон
гресса Секция С II Докл М , 1984, т 2
Гольдшмидт В М Главнейшие работы по геохимии и кристаллохн
мии Л , 1933
Добровольский В В География микроэлементов Глобальное рассе
яние М , 1983
Комов И Л , Лукашев А Н , Коплус А В Геохимические методы поисков
месторождений неметаллических полезных ископаемых М , 1982
Крайнов С Р Швец В М Основы (еохнмии подземных вод М , 1980
Краткий справочник по геохимии /Войткевич Г В , Мирошников А Е , Пова
ренных А С , Прохоров В Г Изд 2-е, М , 1977
Лукашев К И , Лукашев В К Геохимия зоны гипергенеза Минск. 1975
Овчинников А М Гндрогеохимия М, 1970
Основы гидрогеологии // Гидрогеохнмия Новосибирск, 1982
Проблемы радиогеологии М , 1983
Родионов Д А Статистические решения в геологии М , 1981
Сауков А А Геохимия М , 1966, 1976
Соловов А П Геохимические методы поисков месторождений полезных
ископаемых М , 1985
Справочник по изотопной геохимии Соботович Э В , Бортниикнн
Е Н , Цьонь О В . Копоиенко Л В М , 1982
Хендерсон П Неорганическая геохимия М , 1985
Ферсман А Е Избранные труды М, 1963—1959, т I—5
Щербина В В Основы геохимии М , 1972
Advances in Organic Geochemistry N Y, 1979
Clarke F W lhe Data of Geochemistry U S Geol
Surv Bull, 5 edition 1908, 1911, 1916, 1920 1924 № 770, 1963, 1964, 1971
1979 ’
Geochemie Praha, 1980
Goldschmidt V M , Geochemistry Oxford, 1954
Hahndbook of Geochemistry Berlin, Heidelberg, New York Medepoh)
К H editor, 1969, 1978 (2 тома)
International geochemical exploration symposium 10th Helsinki, 1983.
Levinson A. A Introduction to exploration geochemistry, 1980.
Mason В and Moore С В Principles of Geochemistry N Y , 1982
1 Отдельные выпуски разных авторов посвящены важнейшим геохимическим
проблемам
504
Механическая и физико-химическая миграция
Барсуков В Л Сравнительная планетология и ранняя история Земли //
Геохимия, 1985, № 1
Бородин Л С Геохимия главных серий изверженных пород М , 1981
Вовк И Ф Радиолиз подземных вод и его геохимическая роль М , 1979,
Волков В П Химия атмосферы и поверхности Вейеры М , 1983
Гаррелс Р , Крайст Ч Растворы, минералы, равновесия М , 1968
Геохимические особенности поровых растворов горных пород М, 1983
Голубев В С Динамика геохимических процессов М, 1981
Жариков В А Основы физико-химической петрологии М , 1976
Жузе Т П Сжатые газы как растворители М , 1974.
Зверев В П Роль подземных вод в миграции химических элементов М ,
1982
Карпов И К Физико-химическое моделирование на ЭВМ в геохимии
Новосибирск, 1981
Кислотно-основные свойства химических элементов, минералов, горных
пород н природных растворов М , 1982
Коваленко В И Петрология и Геохимия редкометальных гранитоидов
Новосибирск, 1977
Ко1ьская сверхглубокая М, 1984
Корценштейн В Н Растворенные газы подземной гидросферы Земли ,
М . 1984
Косчохимия н метеоритика/Отв ред Э В Соботович //Мат VI Всесоюзн.
симпоз Киев, 1984
Ларин В Н Гипотеза изначально гидридной Земли М , 1975
Лебедев В И Ионно-атомные радиусы и их значение для геохимии и хи-
мии Л , 1969
Лебедев Л М , Никитина И Б Челекенская рудообразующая система
М . 1983
Летников Ф А , Жотнуев Н С , Лашкевич В В Флюидный режим
термоградиентных систем Новосибирск, 1985
Летников Ф А . Леонтьев А Н , Гантимурова Т Л Флюидный режим
гранитообразоваиия Новосибирск, 1981
Летников Ф А . Савельева В Б , Балышев С О Петрология, геохимия
и флюидный режим тектонитов Новосибирск, 1986
Лутц Б Г Геохимия океанического и континентального магматизма.
М , 1980
Макаров Е С Изоморфизм атомов в кристаллах М , 1973
Марфунин 4 С , Бершов Л В Дефекты и электронно-дырочные центры
в минералах //В кн Геохимия, минералогия, петрология М , 1976
Мархинин Е К Вулканизм М , 1985
Наумов Г Б , Рычсенко Б Н , Ходаковский И Л Справочник термодинами-
ческих величии (для геологов) М , 1971
Никаноров А М , Тарасов М Г , Федоров Ю А Гидрохимия и формирова-
ние подземных вод и рассолов Л , 1983
Новгородова М И Самородные металлы в гидротермальных рудах М.,
1983
Омельяненко Б И Околорудные гидротермальные изменения пород М.,
1978
Пампура В Д Геохимия гидротермальных систем областей современного
вулканизма Новосибирск, 1984
Плющев Е В , Шатов В В , Геохимия и рудоносность гидротермальных
метасоматических образований Л , 1985
Принн Р Химия и химическая эволюция атмосфер Венеры, Сатурна и Ти-
тана поданным новейших космических исследований М , 1986
Рингвуд А Е Происхождение Земли и Луны М 1982
505
Рыженко Б. И. Термодинамика равновесий в гидротермальных растворах.
19 ^Рябчиков И. Д. Термодинамика флюидной фазы гранитоидных магм. М.,
Самойлов В. С. Геохимия карбонатитов. М., 1984.
Смирнов С. И. Региональная динамика подземных вод седиментационных
бассейнов. М., 1979.
Сонненфельд П. Рассолы и эвапориты. М., 1988.
Стащук М. Ф. Проблема окислительно-восстановительного потенциала в
геологии. М., 1968.
Сурков Ю. А. Космохимические исследования планет и спутников. М., 1985.
Таусон Л. В. Геохимические типы и потенциальная рудоносность гра-
нигоидов. М., 1977.
Термобарогеохимия в геологии//Мат. VI Всесоюзн. совещ. по термобароге-
охимии. Владивосток, 1982.
Урусов В.С. Энергетическая кристаллохимия. М., 1975.
Шуколюков Ю. А. Продукты деления тяжелых элементов на Земле. М.,
1982.
Щербаков А. В. Геохимия термальных вод. М., 1968.
Щербаков А. В., Козлова Н. Д., Смирнова Г. Н. Газы термальных вод. М.,
Щербина В. В. Миграция элементов и процессы минералообразования. М.,
1980.
Биогенная миграция, биологические
и биокосные системы
Алекин О. А., Ляхин Ю. И. Химия океана. Л., 1984.
Биогеохимия окаана / А. П. Лисицын, Л. В. Демина, В. В. Гордеев и др.,
отв. ред. член-кор. АН СССР Л. С. Монин, член-кор. АН СССР А. П. Лисицын.
М.. 1983.
Борисенко Е. Н. Геохимия глеевого катагенеза в породах красноцветиой фор-
мации. М., 1980.
Бугельский Ю. Ю., Витовская И. В. Никелеиосиые коры выветривания.
М., 1982.
Вернадский В. И. Проблемы биогеохимии. М., 1980.
Вернадский В. И. Химическое строение биосферы Земли и ее окружения.
М., 1965.
Виноградов А . П. Введение в геохимию океана. М., 1967.
Виноградов А. П. Химический элементарный состав организмов моря. М.,
1944.
Геохимия ландшафтов рудных провинций. М., 1982.
Геохимия платформенных и геосинклинальных осадочных пород и руд. М.,
1983.
Германов А. И. Кислород подземных вод и его геохимическое значение.
' Изв. АН СССР, сер. геол., 1955, № 6.
Глазовская М. А. Геохимические основы типологии и методики исследова-
ния природных ландшафтов. М., 1964.
Добровольский В. В. Гипергеиез четвертичного периода. М., 1966.
Емельянов Е. М. Геохимия осадочного процесса в Балтийском море. М.,
1986.
Емельянов Е. М. Седиментогенез в бассейне Атлантического океана. М.,
1982.
Железо-марганцевые конкреции мирового океана. М., 1984.
Зорькин Л. М., Старобинец И. С., Стадник Е. В. Геохимия природных
газов нефтегазоносных бассейнов. М., 1984.
Касимов Н. С. Геохимия ландшафтов зон разломов. М., 1980.
506
Карцев А. А. Основы геохимии нефти и газа. М., 1978.
Кист А. А. Феноменология биогеохимии и бионеорганической химии.
Ташкент, 1987.
Ковалев В. А. Болотные минералого-геохимические системы. Минск, 1985,
Ковалевский А. Л. Биогеохимические поиски рудных месторождений.
М., 1984.
Ковальский В. В. Геохимическая экология. М., 1974.
Ковда В. А. Биогеохимия почвенного покрова. М., 1985.
Крамаренко Л. Б. Геохимическое и поисковое значение микроорганизмов
подземных вод. Л., 1983.
Лапо А. В. Следы былых биосфер. М., 1978, 1987.
Лебедев В. Л. Граничные поверхности в океане. М., 1986.
Лисицын А. П. Процессы океанской седиментации. М., 1978.
Никитина А. П., Витовская И. В., Никитин К. К. Минералого-геохими-
ческие закономерности формирования профилей и полезных ископаемых ко-
ры выветривания. Некоторые вопросы методики их изучения. М., 1971.
Никитина И. Б. Геохимия ультрапресиых вод мерзлотных ландшафтов.
М., 1977.
Перельман А. И. Геохимия ландшафта. М., 1975.
Перельман А. И. Геохимия эпигенетических процессов (зона гипергенеза).
Изд. 3-е. М., 1968.
Пиннекер Е. В. Рассолы Ангаро-Ленского артезианского бассейна. М.,
1966.
Покоржевский А. Д. Геохимическая экология наземных животных. М.,
1985.
Полынов Б. Б. Избранные труды. М., 1956.
Поровые растворы горных пород как среда обитания микроорганизмов.
Новосибирск, 1981.
Роль микроорганизмов в круговороте газов в природе. М., 1979.
Романкевич Е. А. Геохимия органического вещества в океане. М., 1977.
Ронов А. Б. Осадочная оболочка Земли. М., 1980.
Смирнов С. И. Введение в изучение геохимической истории подземных вод
седиментационных бассейнов. М., 1974.
Тайсаев Т. Т. Геохимия таежно-мерзлотных ландшафтов и поиски рудных
месторождений. Новосибирск, 1981.
Успенский В. А. Введение в геохимию нефти. Л., 1970.
Фортескью Д. Геохимия окружающей среды. М., 1985.
Хант Дж. Геохимия и геология нефти и газа. М., 1982.
Химия океана. М., 1979, Т. 1. Химия вод океана. Т. 2. Геохимия донных
осадков.
Шварцев С. Л. Гидрогеохимия зоны гипергеиеза. М., 1978.
Швец В. М. Органические вещества подземных вод. М., 1973.
Юдович Д. Э. Геохимия ископаемых углей. Л., 1978.
Юдович Я. Э., Кетрис М. П., Мерц А. В. Элементы-примеси в ископаемых
у1лях. Л., 1985.
Яхонтова Л. К., Грудев А. П. Зона гипергенеза рудных месторождений.
М., 1978.
Техногенная миграция
Агрохимикаты в окружающей среде /Хайииш Э., Паукке Н., Нагель Г. Д. и
др. М., 1979.
Беспамятное Г. П., Кротов Ю. А. Предельно допустимые концентрации
химических веществ в окружающей среде. Справочник. Л., 1985.
Бондарев Л. Г. Ландшафты, металлы и человек. М., 1976.
Василенко В. Н., Назаров И. М., Фридман Ш. Д. Мониторинг загрязнения
снежного покрова. Л., 1985.
507
Геохимия тяжелых металлов в природных и техногенных ландшафтах. М., 1983.
Глазовская М. А. Теория геохимии ландшафтов в приложении к изучению
техногенных потоков рассеяния и анализу способности природных систем к са-
моочищению //В кн.: Техногенные потоки вещества в ландшафтах и состояние
экосистем. М., 1981.
Добыча полезных ископаемых и геохимия природных экосистем. М., 1982.
Израэль Ю. Л., Назаров И. Л., Пресман А. Я. Кислотные дожди. Л., 1983.
Израэль Ю. А. Экология и контроль состояния природной среды. Изд. 2-е.
Л., 1984.
Ландшафтно-геохимическое районирование и охрана среды //Вопросы гео-
графии. М., 1983, вып. 120.
Лукашев К. И., Лукашев О. В. Техногенез и геохимические изменения
в окружающей среде. Минск, 1986.
Мониторинг фонового загрязнения природной среды. Л., 1982, вып. 1.
Мур Дж., Рамамутри С. Тяжелые металлы в природных водах: Контроль
и оценка влияния. М., 1987.
Сапрыкин Ф. fl. Геохимия почв и охрана природы. Л., 1984.
Техногенные потоки вещества в ландшафтах и состояние экосистем. М., 1981.
Тяжелые металлы в окружающей среде. М., 1980.
Химия окружающей среды /Под ред. Дж. О. М. Бокриса. М., 1982.
Coates. D. К. Geology and Society. N. Y., 1985.
Региональная геохимия
Геохимическая карта территории СССР. Ml : 10 000 000. Л., 1982.
Геохимическая карта восточной части Балтийского щита. Ml: 1 500 000
/Отв. ред. А. А. Смыслов. М., 1979.
Глазовская М. А. Ландшафтно-геохимическое районирование суши Земли
//Вест. МГУ, сер. географ. 1967, № 5.
Иванов В. В., Мейтув Г. М. Геолого-геохимические исследования рудных
провинций. М., 1972.
Карта геохимических ландшафтов Ростовской области. М 1 : 500 000.
Авторы В. А. Алексеенко, В. И. Седлецкий и Вал. А. Алексеенко. Ростов-
иа-Дону, 1986.
Мицкевич Б. Ф.. Сущик Ю. И. Основы ландшафтно-геохимического
районирования. Киев, 1981.
Перельман А. И. Карта геохимических ландшафтов СССР. М 1:20 000 000,—
Физико-географический атлас Мира. М., 1964.
Принципы и методика геохимических исследований при прогнозировании и
поисках месторождений. Л., 1979.
Принципы и методы составления геохимических карт. Владивосток, 1981.
Ферсман А. Е. Геохимические проблемы Союза. Очерк первый. Основные
черты геохимии Союза. Л., 1931.
Ферсман А. Е. Геохимия России. Пг., 1922.
Юдович И- Э. Региональная геохимия осадочных толщ. Л., 1981.
Геохимия рудных месторождений
и методы их поисков
Алексеенко В. А. Геохимия стратифицированных свинцово-цииковых место-
рождений. Ростов-на-Дону, 1981.
Геохимия гидротермальных рудных месторождений. М.. 1982.
Геохимия процессов рудообразований. М., 1982.
Гидрогенные месторождения урана. М., 1980.
Говоров И. И. Термодинамика ионно-мииеральиых равновесий и минерало-
гия гидротермальных месторождений. М., 1977.
508
Григорян С. В. Первичные геохимические ореолы при поисках и разведке
рудных месторождений. М., 1987.
Жовинский Э. Я. Фторометрические методы поисков. Киев, 1985.
Зауташвили Б. 3. Гидрогеохимия рудных месторождений Грузии. Тбили-
си, 1984.
Иванов В. В. Геохимия рассеянных элементов в гидротермальных месторож-
дениях. М., 1966.
Инструкция по геохимическим методам поисков рудных месторождений,
М., 1983.
Карасик М. Л., Кирикилица С. И., Герасимова Л. И. Атмогеохимические
методы поисков рудных месторождений. М., 1986.
Комаров П. В. Поиски оруденения по петрогенным элементам, фтору, сере.
М., 1978.
Квятковский Е. М. Литохимические методы поисков эндогенных рудных
месторождений. Л., 1977.
Лисицын А. К. Гидрогеохимия рудообразования. М., 1975.
Мейнард Дж. Геохимия осадочных рудных месторождений. М., 1985.
Озол А. А. Осадочный и вулканогенно-осадочный рудогенез бора. М., 1983.
Павлов Д. И. Экзогенные хлоридиые воды и эндогенное рудообразование.
М., 1975.
Питулько В. М. Вторичные ореолы рассеяния в криолитозоне. Л., 1977.
Рундквист Д. В., Неженский И. А. Зональность эндогенных месторожде-
ний. Л., 1975.
Сафронов Н. И., Мещеряков С. С., Иванов Н. П. Энергия рудообразования
и поиски полезных ископаемых. Л., 1978.
Сает Ю. Е. Вторичные геохимические ореолы при поисках рудных место-
рождений. М., 1982.
Сыромятников Н. Г., Трофимова Л. А., Замятин Н. И. Стабильные изото-
пы и радиоэлементы как индикаторы рудообразования. Алма-Ата, 1978.
Стратегия геохимических поисков рудных месторождений. Новосибирск,
1980.
Теоретические основы геохимических методов поисков рудных месторожде-
ний. М., 1986.
Фурсов В. 3. Газортутиый метод поисков месторождений полезных ископа-
емых. М., 1983.
Syngenesis and Epigenesis in the Formation of Mineral Deposits. Berlin,
Heidelberg, New York, Tokyo, 1984.
Геохимия отдельных элементов
Анисимов Л. А. Геохимия сероводорода и формирование залежей высоко-
сернистых газов. М., 1976.
Барсуков В. Л. Основные черты геохимии олова. М.. 1974.
Беус А. А. Геохимия бериллия и генетические типы бериллиевых место-
рождений. М., 1960.
Борисенко Л. Ф. Ванадий. М., 1973.
Борисенок Л .А. Геохимия галлия. М., 1971.
Бурков В. В., Подпорина Е. К. Стронций. М., 1960.
Галимов Э. М. Геохимия стабильных изотопов углерода. М., 1968.
Геохимия, минералогия и генетические типы месторождений редких эле-
ментов. М., 1964, т. 1.
Геохимия процессов миграции рудных элементов. М., 1977.
Голева Г. А. Гидрогеохимия рудных элементов. М., 1977.
Гольдшмидт В. М. Сборник статей по геохимии редких элементов. М.,
1938.
Евсеева Л. С., Перельман А. И., Иванов К. Е. Геохимия урана в зоне
гипергенеза. М., 1974.
509
Зауташвили Б. 3. Геохимия микроэлементов глубоких подземных вод Гру-
зии. Тбилиси, 1978.
Крайнов С. Р. Геохимия редких элементов в подземных водах. М., 1973.
Лисицын А. П., Гурвич Е. Г. и др. Геохимия элементов-гидролизатов. М.,
1980.
Минеев Д. А. Лантаноиды в рудах редкоземельных и комплексных месторо-
ждений. М., 1974.
Озерова Н. А. Ртуть и эндогенное рудообразование. М., 1986.
Перельман А. И. Геохимия элементов в зоне гипергенеза. М., 1972.
Редкие элементы Украинского щита. Киев, 1986.
Рехарский В. И. Геохимия молибдена в эндогенных процессах. М., 1973.
Сауков А. А. Геохимия ртути. М., 1946.
Смыслов А .А. Уран и торий в земной коре. Л ., 1974.
Солодов Н. А., Балашов Л. С., Кременецкий А. А. Геохимия лития, рубидия
и цезия. М., 1980.
Хефс Й. Геохимия стабильных изотопов. М., 1983.
Холодов В. Н. Ванадий. М., 1968.
Историческая геохимия
Басков Е. Основы палеогидрогеологни рудных месторождений. Л., 1985.
Белов Н. В., Лебедев В. И. Источники энергии геохимических процессов/
Природа, 1957, № 5.
Будыко М. И., Ронов А. Б., Яншин А. Л. История атмосферы. Л., 1985.
Войткевич Г. В., Бессонов О. А. Химическая эволюция Земли. М., 1986.
Геохимия архея. М., 1987.
Жирмунский А. В., Кузьмин В. И. Критические уровни в процессах разви-
тия биологических систем. М., 1982.
Казанский В. И., Лаверов Н. П., Тугаринов А. И. Эволюция уранового ру-
дообразования. М., 1978.
Неручев С. Г. Уран и жизнь в истории Земли. М., 1982.
Палеогидрогеохимичесские исследования-, принципы и методы оценки рудо-
носности геологических формаций. Л., 1985.
Страхов Н. М. Типы литогенеза и их эволюция в истории Земли. М., 1963.
Шумлянский В. А. Киммерийская металлогеническая эпоха на территории
Украины. Киев, 1983.
Эволюция осадочного породообразования в истории Земли. Новосибирск,
1976.
ПРЕДМЕТНЫЙ УКАЗАТЕЛЬ
Абсолютная геохронология (мето-
ды) 118
------калий-аргоновый 118
------радиоуглеродный 119
------рубидий-стронциевый 118
------самарий-неодимовый 119
------свинцовый 118
Агрогеохнмия 361
Агроландшафты 361
Аддитивность ионных радиусов 85
Азот 414
Альпийский цикл 483
Алюминий 435
Апвеллинг 331
Аргон 415
Аридонитные растения 266
Артезианский бассейн 299. 495
----гидрогеохимия 299
— — историческая1 геохимия 495
Архей 474
Ассоциации элементов
----запрещенные 62. 289
----парагенные 61, 190, 196, 201,
216, 250, 258, 289. 396. 400
------в рудах 62. 396
Астеносфера 39, 474
Астероиды 48
Астроблемы 466
Атмосфера
— вторичные радиоизотопы 116
— надземная 124
— подзеная 126
Атмофильиые элементы 41
Атомные радиусы 87, 89
Ахондриты 38
Аэрогаммаспектрометрия 120
Аэроионы 125
Баженовиты 285
Базальтовый слой 29, 30, 34
Барий 58, 59, 423
Батурина эффект 333
Бериллий 438
Бертло принцип 100, 103
Биогенная миграция 244
Биогенное мииералообразование 256
Биогеохимическая! активность вида
265
Биогеохимические провинции 266
— функции живого вещества
---------------- азотиая 253
----------------биохимическая 246
—---------------кислородио-угле-
кислотная 246
------------- — концентрационная
251
----------------сероводородная 252
----------------углеводородная 252
---------------- углекислотная 252
— эндемии 266
Биогеохимия !?, 214. 253 266
— животных 267
— молекулярная 253
— растений 266
Биологический круговорот элементов
256
Биологические системы 265
Б ио молекулы 253
Биосфера 16. 244, 264 , 271, 277, 334,
368. 411—457, 459. 470, 502
Биофильность элементов 250
Биофильтрация 33Г
Большой круговорот элементов в
земной коре 467
Бор 433
Бром 429
Ванадий 439
Ведущие элементы 61
Венера 45
Вертикальная гидрогеохнмическая
зональность 299
Влажные тропики 315
Водные мигранты 262, 264
Водоносные горизонты 298—31'3
----былые 299
----геохимическая систематика 302
----глеевые 307
----кислые 304
---- нейтральные 304
----понятие 298
----сернокислые 303
----сероводородные 313
----содовые 305
---- соленосные 304
Водород 130, 136, 183, 412
Водородная связь 133
Воздушные мигранты 264
Восстановительные барьеры 148
Вулканизм 179
Выветривание 272
Выщелачивание 154
Г азово-жидкие включения в минера-
лах 225
511
Газовые растворы 127
Газогидраты 239
Газы 121, 123, 129, 180
— активные V23
— ведущие 121
— вулканические 180
— классификация 123
— месторождений полезных ископае-
мых 129
— пассивные 123
Галогеиез 240
Гафний 436
Гелиевая съемка 131
Гелий 415
Геогенетический закон 462
Геохимическая зональность
----- латеральная 16
----- вертикальная 17
Геохимическая классификация ланд-
шафтов 315
-----вод 1411
-----рудных месторождений 398
----- элементов 37
-----Вернадского 37
-----Гольдшмидта 41, 43
----- Заварицкого 177
—----по условиям миграции в био-
сфере 264
-----по условиям миграции в
земной коре 408, 410
-----Ферсмана 176
Геохимическая провинция 380
— специализация гранитоидов 195
-- экология 266
Геохимические аккумуляторы 245
— аномалии 21
-----безрудные 24
--- рудные 24
-----гидрогеохимические 74
----- и оруденение 395
Геохимические барьеры 67
- восстановительные 98
- гидротермальных систем 228
глеевые 149. 230. 312
- дегазационные 236
- двусторонние 295
испарительные 243
- кислые 153, 232, 306, 313
окислительные (кислородные) 98,
148, 229. 311, 314. 316
сероводородные 149, 229, 403, 406
- сорбционные 167, 297. 31'1 '*
термодинамические 103, 234
- щелочные 153. 231, 296, 303.^10
Геохимические зоны 37'1
— ландшафты 315
методы поисков полезных ископае-
мых 21, 81, 129, 169, 172, 270
-----------атмохимические 22, 129
-----------биогеохимические 22,270
-----------гидрогеохимические
22, 172
-----------литохимические 22
-----------сорбционио-солевые 169
-----------шлихогеохимическне 81
— особенности организмов 265
— пояса 373
— спектры 59, 60
— типы базальтов 191
— фации 280
— эпохи 472
Геохимический фои 21
— цикл 467, 472
Геохимических аккумуляторов гипо-
теза 469
Геохимическое картирование 382
— поле 21
— районирование 379. 382, 386
Геохимия 21, 24 26, 27
— библиография 505
— и защита среды 24
— и здравоохранение 26
— и поиски руд 21
- история 8, 163, 196, 236, 244, 271,
273, 290. 299, 334, 370, 502
— и сельское хозяйство 26
— и строительство 27
— и технология 26
— методология 14, 16 Г, 226
— минералов 193. 194, 2212, 377
— микроорганизмов 267
— нефти 254
— океана 324
— определение 6
— отдельных элементов 408
— предмет 6
— рудных месторождений 388
— торфа 255
— угля 255
— физическая 99
— формаций 285
Геохимия ландшафта
---- и медицина 321
---- и поиски руд 320
---- и видообразование 319
Геоэиергетнческая' теория А. Е. Ферс-
мана 93
Германий 31
Герцниский цикл 481
Гидратация ионов 134
Гидрогеиные месторождения урана
402
Гидрогенез 299
Гидрогеохимическая зональность
(вертикальная) 299
Гидрогеохимические аномалии 174
— карты 172
Гидрогеохимия 299
512
— органическая 157
Гидрослюдизация монтмориллонита
254
Гидротермалиты 213
Гидротермальное рудообразование
2122, 226
Гидротермальные процессы 214, 215(
218
— кислотные 214
— щелочные 215
Гидротермы современные 207
---глеевые (бессероводородиые)
209
---кислородные 208
---сероводородные 212
---геохимическая систематика 208
Гипергенные системы 238. 239
Главные зоны и фазы иефтеобразо-
вания 254
Глеевые барьеры 148, 149
— воды 148, 307
Горнопромышленные ландшафты 363
Города (геохимия) 360
Гранитизация 193
Гранитный слой 29
Гранитоиды 193—195
- апограниты 194
— геохимическая специализация 195
— геохимические типы 195
— геохимия минералов 194
Гумидокатиые растений 266
Давление жизни 246
Денудация механическая 73
— химическая 74, 111
Десульфуризация 252, 27 Г. 283, 313
Дефлюкция 80
Диафторез 204
Диоксин 347
Дискретность н непрерывность 18
Диссипация газов 126
Дифференциация магмы 178
Диффузия 112,'123, 1128, 213
Дорожные ландшафты (геохимия)
366
Европа (спутник Юпитера) 48
Емкость поглощения 164
Естественные радиоактивные элемен-
ты (ЕРЭ) 111
Железо 444
Железомарганцевые конкреции 331
Живое вещество 245
---кларки 248
--- масса 247
--- понятие 244
Загрязнение среды 346
Закон биологического круюворота
атомов 257
— Вернадского 261
— Гольдшмидта 54
— Кларка—Вернадского 31
— прогрессивного развития земной
коры 472
— распределения элементов в систе-
мах 55, 56
-----------логнормальный 56
-----------нормальный 55
Звезды изоморфизма 89
Земля
— кларки 41
— оболочечное строение 28
— происхождение 48
Земная кора 27
— кларки 31
Золото 453
Зона весьма замедленного водооб
мена 300
— выщелачивания 153
— замедленного водообмена 300
— интенсивного водообмена 299
— пластового окисления 403
Зональность первичных ореолов 220
Зонная плавка 39
Зоогеохимия 267
Избыточные элементы 35
Изобарный потенциал 100
---стандартный 101
Изоморфизм 88, 179, 193, 194, 198,
222, 224
— полярный 89
Изоморфная емкость минералов 89
Изотопы серы 268
— углерода 268
Илы 280—283
— геохимическая систематика 281.
283
— геохимическая сущность 280
— глеевые 282
— окислительные 281
— сероводородные (сульфидные) 283
Импактиты 202, 466
Иидий 452
Импульс миграции 66
Интенсивность миграции
--- водной 137
--- уравнение 65
Инфильтрацониый этап развития
артезианского бассейна 494
17 3ik. 2022
513
Информационные взрывы 160
Информация в геохимии 14
Иод 429
Ионосфера 126
Ионный обмен 163
— потенциал 91
— радиус 85, 86
Ионы
— в земной коре 83
— комплексные 99, 226, 228
— типа благородных газов 91
— типа купро 44, 222
Иридий 448, 466
Испарительные аномалии 243
Историко-геохимическая карта 499
Историческая геохимия 458
---ландшафтов 496
--- океана 489
---рудных месторождений 397
Историзма принцип 18
Исторический биомониторннг 349
Итай-Итай (болезнь) 360
Иттрий 436
Иодо-бромные воды 430
Константа равновесия 99
Контрастность миграции 291
— геохимического барьера 69
Концентрация элементов на геохими-
ческих барьерах 169
Кора выветривания 289—298
----геохимическая систематика 293
---- глеевая 298
---- карбонатная 298
---- кислая 295
---- сернокислая 294
---- стадии развития 292
Космохимия 51
Коэффициент биологического погло-
щения 250
— водной миграции 137, 140
— техногенной трансформации 343
Коэффициенты геохимические 57
Кремний 431
Криогенез 239
Красноцветные ландшафты 482
Криптон 415
Критические эпохи 465
Круговорот воды 133
Ксенон 415
Кадмий 360, 452
Каледонский цикл 479
Калий 418
Кальций 419
Каолинизация эпигенетическая 310
Карбонатиты 190
Катагенез 206, 299
Катархей 472
Кинетика и динамика физико-хими-
ческой миграции ПО
Кислород 245, 409
Кислородные воды 147
Кислотно-щелочные условия
--- вод 151
---магмы 183
Кислые дожди 124, 347
— почвы 280, 316
Кларки 31
- атомные 34, 35, 36, 53
- глин 286
— живого вещества 248
- изверженных пород 186
— н рудообразование 389
- карбонатных пород 286
— концентраций 57, 390
- океана 328
— осадочных пород 286
- рассеяния 57
— Солнца 51, 53
Кобальт 448
Когерентности принцип 190
Коллоидная миграция 161
Конвекция ИЗ
514
Ле-Шателье принцип 17, 99
Литнй 424
Литосфера (понятие) 39
— кларки 32
Литофильные элементы 41
Логнормальный закон 56
Луна 44
Магма 177, 178, 181—183
— глубина очагов 177
— давление 178, 181
- общие особенности 177
- окислительно-восстановительные
условия 182
- состав 181
- температура 178
— щелочно-кислотные условия 183
Магматические породы 184, 185
— — геохимическая систематика 184
185
Магний 421
Мантия 38, 40
— верхняя 38
— ннжняя 40
Марганец 445
Марс 47
Массоиеренос (способы) 112
Матричный принцип систематики ин
формации 19
Медальонная съемка 82
Медь 450
Меркурий 47
Метаколлоиды 161
Метамиктные изменения минералов
118
Метаморфизм 202—204
— аллохимический 202
нзохимический 202
- прогрессивный 203
- регрессивный 204
- флюидный режим 204
Метасоматиты 214, 215
— рудоносные 216
— типы 214
Метасоматоз 213
гидротермальный 213
- гипергенный 162
— диффузионный 113, 213
- инфильтрационный 113, 213
Метасоматическая зональность 213
Метасоматические формации 214,
216, 218
Метеориты 38, 60
Механическая дифференциация 78
- денудация 73
- миграция 72
Механические ореолы рассеяния 79
------ математическая модель 79
Механический барьер 78
Миграция химических элементов 15,
62, 110, 146
------ безбарьерная 146
------виды 15
----дальняя 146
------кинетика 110
------ разнообразие 62
Микрогальванические пары 146
Микронефть 254
Микроэлементы 34
Минеральные кларки 223
Минералы индикаторы 81
- - концентраторы 81
— узники 225
Молибден 441
Мониторинг геохимический 349
Мохо (граница) 28
Мультипликативные ореолы 221
Мышьяк 454
Натрий 416
Нейтронно-активационный аналн <
114
Необратимая эволюция земной коры
458
Неон 415
Неотектонический этап развития зем-
ной коры 489
Нефелинизация 198
Никель 447
11иобий 439
Ноосфера 339
— и биосфера 368
Нуклеосинтез 51
Оазисы (геохимия) 363
Обменные катионы 163
Обратная связь [7, 467
Оглеение 307—313
- карбонатное 312
- кислое 309
- содовое 318
Озон 125
Озоновый экран 126
Озонная дыра 126
Океан 324, 328
- геохимия 324
— кларки 328
Окисление и восстановление 96
Окислительная обстановка 98, 147
Окислительно-восстановительная зо-
нальность 260, 275
Окислительно-восстановительный по-
тенциал Ео 143
Окислительно-восстановительные ус-
ловия
------ вод 142
------магмы 182
------ систем Земли 98
Олово 456
Оптимизация техногенеза 348
Организмы-концентраторы 267
Органическая геохимия 253
Органические газы 123
Ореолы рассеяния 22, 92, 113, 167,
219, 222
----вторичное 92, 167
- — диффузионное 113
----первичные 22, 219
----субфоновые 222
Осмий 448
Оценка аномалий 395
Палеобиогеохимия 269
Палеогидрогеохнмия 490
Палладий 448
Параметры миграции интенсивные и
экстенсивные 65
Парастерезис 62
Пегматиты 199
Пеллеты 331
Пеплово-газовые столбы 180
Перепроизводство информации 14
Песчаники (кларки) 286
Петрохимический метод поисков 114
Петрохимия 175
Пнролнт 39
17
515
Платина 448
Поверхностные воды 256, 322—324
--- систематика 322
---кислые 323
---нейтральные и щелочные 323
---сернокислые 323
---сильнокислые 323
---содовые 324
---солянокислые 323
---формирование состава 256
Поглощающий комплекс 164
Подвижных компонентов принцип
61
Показатель зональности 221
Полициклические ароматические уг-
леводороды (ПАУ) 347
Полярные газы 123
Поля устойчивости минералов 155
Поровые воды 135
Постм агмати веского р удообразова ни я
теория 236
Потенциал возбуждения 84
— задающие компоненты 145
— ионизации 84
— ионный 91
Потоки рассеяния 74
Почвы 273—277, 280
— биогенная аккумуляция элементов
274
— геохимическая систематика 277
— геохимическая сущность 273
- неравновесность 273
— окислительно-восстановительная
зональность 275
- почвенный профиль 275
- ряды 277
— центр 280
Правило диагональных рядов 88
— Розенбуша 198
— фаз 107
— четности Оддо—Гаркинса 35
Принцип дифференцильной подвиж-
ности компонентов Д. С. Коржии-
ского 108
— подвижных компонентов 61
— торможения химических реакций
109
— централизации 18, 280, 281, 293,
315, 336, 472
Прогнозные геохимические карты 384
Произведение растворимости 104
Протерозой 476
Протокристаллизация 191
Прямая связь 17
Пустыни (геохимия) 317
Равновесие 108, 109
— локальное 109
— термодинамическое 108
Радиационно-химические явления 117
Радиационные дефекты 95
Радикалы свободные 94
Радиоактивность 114
— и энергетика 119
Радиогеология 114
Радиогеохимический метод поисков
120
Радиолиз 96, 117, 137, 255, 241, 302
Радий 425
Радон 415
Раздоломичивание 305
Разложение и синтез воды в земной
коре 134
Разложение органических веществ
251
Разломное засоление 243
Районирование по условиям поисков
385
Рассеяние химических элементов 10,
31
Рассолы 139, 157, 209, 225, 241, 300,
301, 309, 494
Растворенное органическое вещество
(РОВ) 157
Растворы трансмагматические 193
Региональная геохимия 370
---рудных месторождений 397
Регионально-геохимическая диффе-
ренциация 370
Редкие земли 436
Реголит 45
Редкие элементы 34
— рассеянные 34
Рифей 477
Рений 442
Родий 448
Ртуть 130, 360, 453
— загрязнение среды 360
- ртутометрические поиски 130
Рубидий 418
Рудные месторождения 388, 393, 396,
398
---геохимическая систематика 398
---геохимия (понятие) 388
--- запасы в единицах кларков 393
---формы нахождения элементов
в рудах 396
Рутений 448
Ряды биологического поглощения 250
— мантийности 190
миграции элементов в коре вывет-
ривания 291
интенсивности миграции и кон-
центрации элементов в термальных
водах 210
516
Саморегулирование 17
Сапропель 282, 350, 367
Свинец 360, 451
Связанная вода 135
Связь обратная и прямая 17
Седиментация лавинная 331
Сейсмическая модель Земли 27
Селен 455
Сера 412
Серебро 453
Сернокислый ландшафт 365
Сиботаксические группы в магме 181
Сидерофильные элементы 44
Системный подход 16
Системы земной коры 16, 19, 146,
271, 355
------абиогенные 16
------биокосные 16, 271
------геоэлектрохнмические 146
-- классификация 19
------ техногенные 355
Скандий 437
Современные гидротермы 207
Содовые воды 152, 305, 312, 314, 324
Солевая эпигенетическая зональность
75
Соленакоплеиия эпохи 241
Солифлюкция 80
Солнце 51, 60
Соляные озера 241
Сорбционный барьер 167
Сорбция 128, 162
Стационарные процессы 108
Стратосфера 125
Стронций 424
Структура воды 132
Сурьма 454
Талассофильность 326, 330
Таллий 457
Тантал 440
Тектоно-магматическая активизация
375
Тектоносфера 39
Теллур 456
Термобарогеохимия 225
Термодинамика в геохимии 98
Термокаталитические процессы (тер-
молиз) 313
Техиобиогеомы 367
Техногей 339
Техногенная миграция 338—348, 366,
367
---информационные особенности
346
--- в океане 367
--- в реках и озерах 366
--- оптимизация 348
--- энергетика 345
Техногенное геохимическое давление
343
Техногенные водоносные горизонты
355
— геохимические аномалии 344
-----локальные 344
----- региональные 344
- геохимические барьеры 345
— зоны выщелачивания 344
— илы 355
— коры выветривания 355
— ландшафты 356
— ореолы рассеяния 344
— почвы 355
— системы 355
Технофильность 340, 342
Титан 438
Торий 437
Треки 118
Тропосфера 125
Тяжелая вода 136
Углекислое дыхание земной коры 477
Углерод 414
Углеродизация 214
Углеродистые сланцы (геохимия) 480
Углистые хондриты 38
Ультраосновные и основные породы
190
--------геохимические типы 190
--------геохимия минералов 193
Уран (элемент) 116, 401, 440
— месторождения 401
Факторы миграции
---внешние 54
--- внутренние 54
Фанерозой 478
Физико-химическое моделирование на
ЭВМ 106
Фильтрационный эффект 215
Фильтрация 113
Фитонциды 124
Флюиды 142, 178, 204
Фосфор 433
Формы нахождения элементов 54
Фотосинтез 245
Фтор 426
Фторофнльиость 227, 425, 426
Фугитивность 182
Халькофильные элементы 41
Хелаты 158
Хемосинтез 246
517
Химическая активность горных по-
род 153
Химические элементы
---аниоиогенные 90
---катионогенные 90
---минералофильные 64
---минералофобные 64
---образование (нуклеосинтез) 51
--- способность к мннералообразо-
ванию 62
---формы нахождения 54
--- циклические 37
Химическое сродство 100
Хлор 247
Хондры 38
Хром 446
Цезий 419
Цезиеносные слюдиты 201
Цементация 272
Цикличность (цнклондальность) про-
цессов 461
Циик 449
Цирконий 436
Черные курильщики 212
Черные приливы 368
Шлихо-геохимические поиски 81
Щелочные извержения породы 196
Щелочно-кислотная зональность 152
Эволюция атмосферы 465
Эвапориты 240
Эвтрофикация водоемов 367
Эйситы 215
Электронно-дырочный центр 94
Электроотрицательность 91, 92
Электрохимические процессы 146
Электрохимический барьер 146
Элементы
— анионогенные 90, 91
— катионогенные 90, 91
Эоловые процессы 75
Элнзионный этап развития артезиан-
ских бассейнов 194
Эманациоииая дифференциация 178
Эндемический зоб 26, 354
Энергия рудообразоваиия 391
Эпигенез прогрессивный 206
— регрессивный 206
Ядерная геология 114
— геотермика 120
— зима 346
Ядерный природный реактор 116
Ядро Земли 40. 41
ИМЕННОЙ УКАЗАТЕЛЬ
Авессаломова И. А. 365
Адамс Д. 47
Айвазян А. Д. 265, 266
Айзатуллин Т. А. 333
Алекин О. А. 12, 160, 508
Алексеенко В. А. 225, 285, 320, 349,
385, 506
Альварес Л. 466
Альтовскнй М. Е. 302
Адлер Л. 51, 52, 53
Амшннский Н. Н. 378
Анисимов Л. А. 313, 511
Антропова Л. В. 169
Аренс Л. 56, 85
Аржанова В. С. 344 , 364
Аррениус С. 463
Артюшков Е. В. 40
Баддингтон А. 28
Базанов Г, А. 55
Базилевич Н. И. 247
Балашов Л. С. 512
Барабанов В. Ф. 226, 228, 237, 506
Баранов Э, Н. 397
Баранский Н. Н, 348
Барсуков В. Л, 45, 46, 50, 160, 219
221, 229, 232, 233, 234, 507, 511
Барсуков Внкт. Л. 229, 232
Барт Т. 327
Басков Е. А, 496, 512
Батоян В, В. 364, 386
Бананов С, С. 85
Бедер Б, А, 303, 431
Белевцев Я. Н. 205, 236, 293
Белов Н. В, 85, 86, 94, 179, 181, 245,
469, 512
Белова Л, Н, 403
Белоусов В. В. 39, 121
Белякова Т, М. 322, 347
Бербндж Б. 49
Берзина И, Г. 118
Бернал Д, 134
Берцелиус И, 8
Бершов Л, В. 95, 507
Беус А, А. 31, 34, 44, 161, 186, 189,
194 , 215, 228, 286, 506, 511
Билибин Ю. А. 373, 374
Блох А. М. 135
Бозоян О. А. 160
Богатиков О. А. 45, 191
Бойль Р. 8
Бокий Г, Б. 85, 86, 87
Болтвуд Б. 118
Бондарев Л. Г. 124, 125, 362, 509
Бордон В, Е. 378
Борисенко Е. Н. 139, 140, 210, 307.
312, 508
Борисенок Л, А, 511
Бородин Л. С. 84. 92, 190, 196, 507
Боуэн Г. 267
Бошкович Р. 8
Брейтгаупт И. 62
Бродский А. А. 160
Брукс С. 175
Брундии Н.270
Брэгг В. Л. 179
Брызгалин О. В, 228
Бугельская Л. В, 505
Бугельский Ю, Ю. 139, 158, 209, 290.
508
Будыко М. И. 345, 463, 465, 474, 479.
481. 482, 512
Булах А. Г. 102
Булкии Г. А. 94 , 391, 506
Буллей К. 28, 38
Бунзен Р. 8
Бурков В. В. 477, 511
Буссен! о Ж. 8
Бюффон Ж. 8
Вагин С. Б. 494
Валяшко М, Г, 160
Вант-Гофф Я. 13, 62, 98, 100. 241
Вассоевич Н. Б. 206. 254, 334, 336, 494
Вашингтон Г. 28
Вегенер А. 378
Ведеполь К. X, 79. 286
Вернадский В. И. 3. 6. 11, 37, 54, 61
114, 193, 244, 248, 259, 271. 280.
334. 340, 432, 468, 503
Виноградов А. П. 31, 39, 45, 50. 186.
248, 265, 270, 286, 319. 338. 480.
489, 506
Виноградов В. И. 230, 269
Виноградский С. Н. 246
Битовская И. В, 509
Власов К. А. 11, 61, 196
Влодавец В. И. 179
Вовк И. Ф. 117, 226, 302, 507
Войткевнч Г. В. 50, 471, 506. 512
Волков В. П. 46. 507
Волкова И. Б. 464, 482
Гаврилова И. П. 279, 386
Гавришин А, И. 70, 506
519
I авшин В М 285, 298
Гаев А Я 356
Галецкий Л С 196
Галимов Э М 511
Гаранин А В 59
Гаркинс Д 35
Гаррелс Р 281, 325, 326, 507
Гедройц К К 163, 273, 305
Гельмгольц Г 100
Герасимов М В 473
Герасимовский В И 196, 378
Герлинг Э К 118
Германов А И 112, 237, 303, 496,
508
Гиббс У 100, 107
Гинзбург А И 201, 320, 425, 439
Гинзбург И И 12, 290
Глазовская М А 273, 295, 339, 343,
347, 367, 386, 445, 508, 510
Глазовский Н Ф 243, 283, 343
Говоров И Н 378, 510
Годовиков А А 85
Годовиков В Н 312
Голева Г А 99, 209, 309, 496, 511
Гольдберг В М 356
Гольдберг ИС 146, 147, 154
Голубев В С 68, 94, 111, 112, 507
Гольдшмидт В М И, 28, 41, 54, 61
83, 85, 88, 91, 98, 107, 184, 203, 240,
248, 274, 380, 504
Грабовников В \ 356
Григорян С В 219, 220, 397, 511
Гросман Л 50
Гриненко В А 269
Гринвуд А 48
Гумбольдт А 8, 371
Гуревич М С 496
Гутенберг Б 28
Гюйгенс X 8
Давыдова И Д 364
Дальтон Д 7
Данилевич А М 289, 377, 380, 384
Дворов В И 139, 289
Дегенхардт X 306
Демокрит 7
Джеффрис Г 38
Джоли Д 120
Диков Ю П 45
Диордиенко Л В 289, 377
Дистлер В В 191
Добрецов Н Л 202, 203
Добровольский В В 76, 162, 248
273 316, 317, 322, 506, 508
Добровольский Г В 273
Добродеев О П 245, 339, 343, 349
Добра Г 9
Докучаев В В 271, 279, 371
Дроздовская А А 107, 476
Дубов Р И 80
Дюма Ж 8
Евсеева Л С 112, 511
Елпатьевский П В 344, 364
Емельянов Е М 331, 332, 508
Еремеев А Н 131
Ерофеев В С 289
Ермаков Н П 225
Ермолаев Н П 205
Жариков В А 98, 108, 213, 214, 507
Жбанов Э Ф 71, 76, 320
Жирмунский А В 465, 512
Заварицкий А И 175, 177, 179
Зайцев И К 301
Захариасен В X 85
Зауташвилн Б 3 511, 512
Зверев В П 237, 299, 507
Зеленое К К 179,323
Зинченко О В 378
Зотов А В 230
Зубков В А 339
Зхус И Д 254
Зюсс Э 334
Иванов В В 237, 375. 377, 399, 400
457, 510, 511
Иванова Т К 312
Иванчнков В П 271
Ивашов П В 271
Игнатович Н К 299
Израэль Ю А 510
Ильин В А 72, 284, 469, 474
Кадик А А 181
Казаков А В 12
Казанский В И 458, 512
Казицин Ю В 221
Казмин В Н 285, 384
Калп Д 269
Каменев Е А 198
Канцель А В 221
Капков Ю Н 384
Капустинский А Ф 11, 28, 41
Карасик М А 511
Карпов И К 106, 107, 507
Картледж Г 91
Карцев А А 126, 494, 496, 509
Каснмов Н С 276, 278, 386, 508
Кашик С А 106
Квятковский Е М 54, 384, 511
Кист А А 265, 340, 509
Кирхгоф Г Р 8
Кларк С П (мл ) 50
Кларк Ф У 9, 12, 29
Ковалев В А 255, 509
520
Ковалевский А Л 270, 271, 509
Коваленко В И 194, 225, 507
Ковальский В В 266, 509
Ковда В А 273, 339 346, 363, 366,
509
Коган Я Л 252
Когарко Л Н 198, 228
Колосовский Н Н 348
Комаров П В 114, 511
Комов И Л 506
Коновалов Г С 12
Копелиович А В 134, 206
Копейкин В А 106
Коржинский Д С 94 , 98, 108, 113,
178 193,203,204,213,215
Корню Ф 290
Королева Р В 310
Корценштейн В Н 127. 507
Коссович П С 273
Костерин А В 81
Коссовская А Г 206
Костенко И Ф 240
Кравченко С М 198, 199
Крайнов С Р 212, 506. 512
Крайст Ч 507
Крамаренко Л Б 509
Крамбейн В 281
Красников В И 174,393,394
Краускопф К 155, 236, 331
Крештапова В Н 256
Кригер Н И 27, 345
Кудерина Л Д 104
Кудряшев В А 217
Кузьменко М В 196
Кузьмин В И 465, 512
Кузнецов В А 378
Куковский Е Г 113
Курнаков Н С 13, 241
Курода П 49 116
Кусков О Л 40
Кюри П 118
Лаверов Н П 232 234 458 459, 512
Лаврухина А К 49
Лавуазье А 8
Ламарк Ж Б 334
Лаример Д 50
Ласкорнн Б Н 352
Лапо А В 336, 464, 482, 509
Лапп М А 430
Ларин В Н 40, 49, 507
Лебедев Б А 206, 310
Лебедев В И 62, 85, 94, 469. 507,
512
Лебедев В Л 333 509
Лебедев Л М 139, 179, 209, 230, 507
(евинсон А 384, 506
Левинсон Лессинг Ф Ю 62, 175
Левкипп 7
Лемлейн Г Г 184
Летников ФА 135, 178, 193, 199,
204 205 214 226 235, 507
Либих Ю 8
Линдгрен В 62
Тисицин А К 404, 511
Лисицын А П 75, 111, 237, 325, 331,
508 509 512
Литвинович А Н 84
Логвиненко Н В 206, 283
Ломоносов М В 8
Ломов 3 Ф 364
Ломтадзе В Д 206
Лукашев А Н 506
Лукашев В К 378, 506
Лукашев К И 255, 273, 290, 506,
510
Лукашев О К 510
Лукреций Кар 7
Лурье А М 284
Лутц Б Г 175, 507
Лучицкий И В 179
Ляхович В В 195, 196
Маврицкий Б Ф 237
Магакьян И Г 476
Макаренко Ф А 133
Макаров В Н 320, 361
Макаров Е С 222, 320, 507
Македонов А В 464, 482
Маккензи Ф 325. 326
Мак-Келви В 111
Максимовч Г А 74 111
Малахов И С 183
Малюга Д П 270
Манская С М 269
Маракушев А А 98, 175, 183 184.
202 204
Маринов Н А 300
Мармо В 205 236
Марфунин А С 85, 95, 507
Мархинин Е К 179, 180. 507
Масайтис В Л 466
Матвеев А А 25
Медведева Н Н 268
Мейнард Д 511
Мейсон Б 201, 341
Мейтув Г М 375, 510
Медков В Г 403
Мельник Ю II 476
Мельников И В 225, 228 229 'A3I
236, 402
Менделеев Д И 8, 20 442
Меняйлов А А 179
Мечников И И 354
Мещен ко В М 321
.Мигдисов А А 285
Мил дер С 473
521
Минеев Д. А. 57. 194. 198, 228, 436,
512
Мирошников А. Е. 506
Митрофанов Ф. П. 474
Митчелл А. 379
Мнцкевнч Б. Ф. 159. 195, 320. 378,
510
Моисеенко В. Г. 378
Моксхэм Р. 193
Молчанов В. И. 130
Момджи Г. С. 84
Морозова И. А. 320
Мохоровичич А. 27
Мур Д. 510
Мухин Л. М. 473
(Муромцев Н. Н. 356
Мухамеджанов С. М. 494
Мырлян Н. Ф. 352, 357, 359
Набоко С. И. 179
Наумов В. Б. 225, 229
Наумов Г. Б. 228. 235, 507
Ненадкевич К. А. 118
Неженский И. А. 399, 511
Неручев С. Г. 402, 512
Нечаева Е. Г. 386
Ниггли П. 62, 98
Никаноров А. М. 12, 349, 507
Никитин К- К. 509
Никитина А. П. 509
Никитина И. Б. 159. 209, 507, 509
Никифорова Е. М. 363
Николаев В. А. 108
Николаев С. В. 364
Новгородова М. И. 214, 224. 507
Ноддаки И. и В. 12
Обручев В. А. 375
Овчинников А. М. 13. 141, 205, 237,
299.301.491.506
Овчинников Л. Н. 16. 142. 215, 219,
392. 397
Оддо Г. 35
Озерова Н. А. 222. 230. 512
Озол А. А. 511
Омельяненко Б. И. 214. 215. 272, 507
Опарин А. И. 473
Орадовская А. Е. 356
Орлов И. В. 384
Осипов В. И. 206
Островский И. А. 181
Павленко И. А. 279, 386
Павлов Д. И. 284, 309, 496, 511
Панет Ф. 12
Паничев А. М. 267
Панков Ю. А. 370
Пастер Л. 474
Начаджанов Д. Н. 285
252
1 (аулюкявичюс Г. Б. 347
Певзнер В. С. 285, 477
Пелымский Г. А. 463
Нерельмаи А. И. 61, 121, 140. 210,
240, 258, 279, 330. 411
Перчук Л. Л. 183, 204, 213
Петерсилье И. А. 182, 198
Петров В. П. 290, 294
Петровская Н. В. 84, 113
Пиковский Ю. И. 347, 386
Пиннекер Е. В. 157, 301. 303. 356, 509
Питулько В. М. 240, 511
Плиний Г. С. 8
Плотников Г. Н. 313
Илюшев Е. В. 213, 229, 381. 384, 507
Побединцева И. Г. 279, 386
Поваренных А. С. 91, 506
Погребняк Ю. Ф. 449
Подпорина Е. К. 511
Покаржевский А. Д. 349, 509
Полинг Л. 85, 91
Поликарпочкин В. В. 80, 81
Полынов Б. Б. 12, 138, 251, 256, 259,
273, 289, 292, 315, 503, 509
Посохов Е. В. 12. 13. 305, 460
Поспелов Г. Л. 213
Пошехонов Е. Ф. 111, 112
Пригожин И. 16
Приклонский В. А. 160
Прохоров В. Г. 223. 229, 365, 506
Пустовалов Л. В. 12. 280, 482
Пэк А. А. 232. 234
Радина В. А. 252
Радченко О. А. 206
Разин А. А. 310
Разумовский Н. К. 56
Рама-Мурти В. 41
Расс И. Т. 199
Рассказов Н. М. 251, 307
Рафальский Р. П. 107
Рейли 8
Рехарский В. И. 160, 189, 214. 216,
225. 232. 442, 512
Рингвуд А. 39, 507
Ровинский Ф. Я. 347
Родионов Д. А. 57, 506
Розанов Б. Г. 346
Романкевич Е. А. 509
Ронов А. Б. 202, 284, 285, 423, 459,
462, 463, 465, 509, 512
Росс Д. 51, 52, 53
Руби У. 473
Рудник В. А. 40, 41, 49, 289, 384,
472, 475
Рундквист Д. В. 214, 399, 459, 461,
511
Рухин Л. Б. 206
Рыженко Б. Н. 507, 508
Рысс Ю. С. 147
Рябчиков И. Д. 178, 183, 236, 508
Рябчиков А. М. 353
Садецки-Кардоши Е. 44
Сает Ю. Е. 169, 298, 353, 361, 386.
511
Самойлов О. Я. 12, 134, 302
Самойлов Я. В. 269
Сапожников Д. Г. 290
Сапрыкин Ф. Я. 355, 510
Сауков А. А. 3, И. 61, 93, 130, 205,
222, 236, 341, 373, 458, 476, 506. 512
Саушкин Ю. Г. 339
Сафронов Н. И. 13, 391, 392, 511
Свешников Г. Б. 130, 146
Севергин В. М. 8, 62
Седлецкий В. И. 241, 349, 510
Семененко Н. П. 40
Семенов Е. И. 196, 198
Семихатов А. Н. 494
Сергеев Е. М. 206, 339
Сидоренко А. В. 470
Синицин В. М. 94, 478, 489
Смирнов В. И. 203, 205, 373
Смирнов С. И. 112, 494, 508, 509
Смирнов С. С. 239, 373
Смирнов Я. Б. 303
Смирнова Р. С. 386
Смолин П. П. 189
Смыслов А. А. 289, 374 377, 379, 380,
384. 510, 512
Снытко В. А. 386
Сняденкий Е. 8
Соболев В. С. 203
Соболев Д. Н. 463
Соботович Э. М. 40, 41, 49. 506, 507
Соколов Б. С. 476, 478
Соколов В. А. 13, 126, 128, 129
Соколов Д. С. 302
Солнцева Н. П. 363
Соловов А. П. 13, 21, 25, 59, 79 394
506
Солодов Н. А. 512
Сорокина Е. П. 344, 386
Спиридонов А. А. 285
Старобинеи И. С. 508
Стащук М. Ф. 281, 508
Страхов Н. М. 74, 76, 80. 281. 282.
283, 371, 422, 476, 489, 512
Стретт Р. 120
Судов Б. А. 430
Судовиков Н. Г. 205, 236
Султанов К. М. 269
Сутурин А. Н. 360
Сущик Ю. Я. 510
Сыромятников Н. Г. 511
Тайсаев Т. Т. 76. 78, 320, 509
Талипов Р. М. 271
Таусон Л. В. 94, 175, 178, 182. 190,
191, 196, 341, 352, 508
Твалчрелидзе Т. А. 488
Теняков В. А. 316
Теодорович Г. И. 281
Теофраст 8
Терентьев В. М. 384
Тимофеев П. П. 72, 94, 284, 474
Титов В. К. 384
Тихоненков И. П. 196
Ткалич С. М. 265, 270
Тойбин В. 3. 320
Толстихин Н. И. 157, 160
Томсон И. Н. 374
Трейбс А. 254
Тугаринова А. И. 235, 238, 268, 269,
458, 471, 474, 476, 512
Турекьян К. К- 50, 79, 286
Тюрюканов А. Н. 273
Тюрюканова Э. Б. 273
Тютюнов И. А. 239
Уайт Д. 230, 236, 237
Удодов П. А. 13, [53, 251, 496
Уклонений А. С. 61. 313
Уоррен Г. 270
Урусов В. С. 94, 508
Успенский В. А. 206. 509
Фаворская М. А. 374
Фаулер Р. 134
Федоровский Н. М. 352
Федотов В. И. 366
Ферсман А. Е. 3, 10, 21, 28, 34, 54.
61, 72. 83, 88, 29, 175, 184, 196,
199. 206, 284, 338, 352, 367, 378,
388. 408, 421, 472, 504, 506. 510
Филипповский Н. А. 494
Филлипс В. 9
Флеров Г. Н. 118. 209
Флоровская В. Н. 347
Фортескью Д. 509
Фохт И. 31
Фридман А. И. 129
Фурсов В. 3. 129. 131. 132, 320, 511
Хайн. В. Е. 30, 39. 478
Хайлов К. М. 333
Хант Д. 509
Хасанов А. С. 494
Хефс И. 512
Хитаров Д. Н. 225
Хитаров Н. И. 40, 181
Хендерсон П. 85, 92, 329, 506
Хитров В. Г. 70
Ходаковский И. Л. 46, 228. 507
523
Ходьков А. Е. 356
Холдейн Д. 473
Холл Г. 41
Холодов В. Н. 512
Цветкова Г. А. 322
Цеховский Ю. Г. 289
Чаклин А. В. 322
Челищев Н. Ф. 166
Чернышев И. В. 396
Чирвинский П. Н. 34, 41. 62, 491
Чухров Ф. В. 89, 229, 269
Шарапов И. П. 55
Шарков Е. В. 194
Шарков Ю. В. 80
Шатов В. В. 381. 507
Шварцев С. Л. 136, 138, 237, 302,
509
Швецов П. Ф. 239
Швец В. М. 157, 237, 506, 509
Шенной Р. 85
Шёнбейн X. 6
Шиманский А. А. 55
Шлезинг Т. 327
Шмакин Б. М. 201
Шмариович Е. М. 405
Шмидт О. Ю. 48
Шор Г. М. 285, 289, 384
Шоу Д. 193, 385. 473
Шоу У. 265
Шпренгель К. 8
Шуколюков Ю. А. 49, 116, 119, 508
Шульдинер В. И. 473
Шумилин М. В. 356
Шумлянский В. А. 308, 378, 489, 512
Шутов В. Д. 206
Шухерт Г. 463
Щеглов А. Д. 237, 374, 375, 377, 481
Щербаков А. В. 72, 94, 230, 237, 284,
303, 307, 313, 382, 469, 474, 508
Щербаков Д. И. 11, 370
Щербаков Ю. Г. 378
Щербина В. В. 11, 61, 227, 506, 508
Эддингтон А. 53
Эли де Бомон Ж. 9
Эммонс В. 220
Энгельс Ф. 15
Эпикур 7
Эскола П. 203
Юдович Я. Э. 255, 285, 509, 510
Юри Г. 48
Яницкий И. Н. 131
Яишии А. Л. 241. 463, 465, 479, 512
Ярошевский А. А. 39. 112, 202
Яхоитова Л. К. 147, 509
ОГЛАВЛЕНИЕ
Предисловие....................................................... 3
I
ПРЕДМЕТ, ИСТОРИЯ, МЕТОДОЛОГИЯ И ОСНОВНЫЕ ПОНЯТИЯ
ГЕОХИМИИ
1
Предмет, история, методология и практическое значение геохимии ... 6
История геохимии.............................................. 8
Методология геохимии........................................ 14
Практическое приложение геохимии (прикладная геохимия). ... 21
2
Распространенность химических элементов в оболочках Земли ....... 27
Земиая кора.................................................27
Маития и ядро Земли...........................................Зо
3
Геохимия планет земной группы и космохимия......................44
Геохимия Луны и плаиет........................................44
Космохимия....................................................51
4
Факторы и общие характеристики миграции химических элементов . . 54
2
МЕХАНИЧЕСКАЯ МИГРАЦИЯ.............................................72
5
Основные особенности механической миграции (механогенеза).........72
6
Системы механогенеза..............................................78
3
ФИЗИКО-ХИМИЧЕСКАЯ МИГРАЦИЯ................................... . 83
7
Общие закономерности физико-химической миграции.................83
Ионы в земной коре..........................................83
Радиациоииые электронно-дырочине центры в минералах (свободные
радикалы СР)............................................... 94
Неионные формы нахождения элементов в земиой коре ..........95
Окислеиие и восстаиовлеиие................................ 96
525
Термодинамика физико-химической миграции.......................98
Кинетика и динамика физико-химической миграции.................ПО
Механизм массопереноса: диффузия и конвекция..................112
Радиоактивные процессы и ядерно-физические методы исследования в
геохимии......................................................114
8
Миграция газов.................................................. 121
Общие особенности миграции газов..........................121
Надземная атмосфера...........................................124
Газы подземной атмосферы и гидросферы........................126
Атмохимические методы поисков и решения других геологических
задач ........................................................129
9
Общие закономерности водной миграции..............................132
Вода как среда миграции.......................................132
Разложение и синтез воды в земной коре........................136
Интенсивность водной миграции и концентрации элементов .... 137
Геохимическая классификация вод...............................141
Коллоидная миграция и сорбция.................................16!
Концентрация элементов на физико-химических барьерах..........169
Гидрогеохимические методы поисков полезных ископаемых и пред-
сказания землетрясений........................................172
10
Магматические системы.............................................175
Общие особенности магматической миграции......................177
Ультраосновные и основные породы.............................190
Гранитоиды и другие кислые породы............................193
Щелочные породы..............................................196
Пегматиты....................................................199
11
Метаморфические и катагенетические (эпигенетические) системы......202
12
Гидротермальные системы...........................................207
Современные ги дротермы......................................207
Гидротермальный метасоматоз..................................213
Строение гидротермальных систем..............................218
Основные геохимические особенности гидротермального рудообразо-
вания........................................................222
Геохимические барьеры гидротермальных систем.................228
Источники воды, газов и рудных элементов в гидротермальных си-
стемах ......................................................236
13
Гипергеиные физико-химические системы.............................239
4
БИОГЕННАЯ МИГРАЦИЯ................................................244
14
Общие особенности биогенной миграции..............................244
Образование живого вещества..................................245
Разложение органических веществ ........................... 251
526
Биологический, круговорот элементов (БИК)................. 257
Закон Вернадского...........................................26!
Геохимическая классификация элементов по условиям миграции в
биосфере....................................................264
15
Биологические системы...........................................265
16
Биокосные системы...............................................271
Почвы.......................................................273
Илы.........................................................280
Осадочные породы и осадочные формации.......................284
Коры выветривания...........................................289
Водоносные горизонты........................................298
Биогенные ландшафты.........................................315
Поверхностные воды..........................................322
Биосфера ................................................ 334
5
ТЕХНОГЕННАЯ МИГРАЦИЯ................................. ..........338
17
Общие особенности техногенной миграции..........................338
18
Техногенные системы.............................................355
6
РЕГИОНАЛЬНАЯ ГЕОХИМИЯ 370
19
Факторы регионально-геохимической дифференциации.............. 370
20
Геохимическое районирование и картирование ................... 379
7
ГЕОХИМИЯ РУДНЫХ МЕСТОРОЖДЕНИЙ...................................388
21
Общие вопросы геохимии рудных месторождений.....................388
22
Геохимическая систематика рудных месторождений .......... 398
8
ГЕОХИМИЯ ОТДЕЛЬНЫХ ЭЛЕМЕНТОВ 408
23
Геохимическая классификация элементов земной коры ..............
Элементы I и II групп......................................... 408
Геохимическая классификация элементов . . . ............. 408
Элементы I группы...................................... ° 409
Элементы 11 группы ........................................415
527
24
Элементы III группы............................................ 431
9
ИСТОРИЧЕСКАЯ ГЕОХИМИЯ 458
25
Общие закономерности исторической геохимии.......................458
26
Геохимические эпохи..............................................472
Геохимические циклы..........................................472
Историческая геохимия океана.................................489
Историческая геохимия подземных вод. Палеогидрогеохимия .... 490
Историческая геохимия ландшафтов СССР........................496
Заключение.......................................................501
Библиография ....................................................503
Общие вопросы библиографии по геохимии.......................503
История и методология геохимии. Труды классиков геохимии. Учеб-
ные руководства и монографии по науке в целом. Распространен-
ность и общие особенности миграции элементов. Прикладная гео-
химия (общие вопросы)........................................504
Механическая и физико-химическая миграция 505
Биогенная миграция, биологические и биокосные системы .... 506
Техногенная миграция.........................................507
Региональная геохимия...................................... 508
Геохимия рудных месторождений и методы их поисков .......508
Геохимия отдельных элементов.................................509
Историческая геохимия........................................510
Предметный указатель.............................................511
Именной указатель................................................519